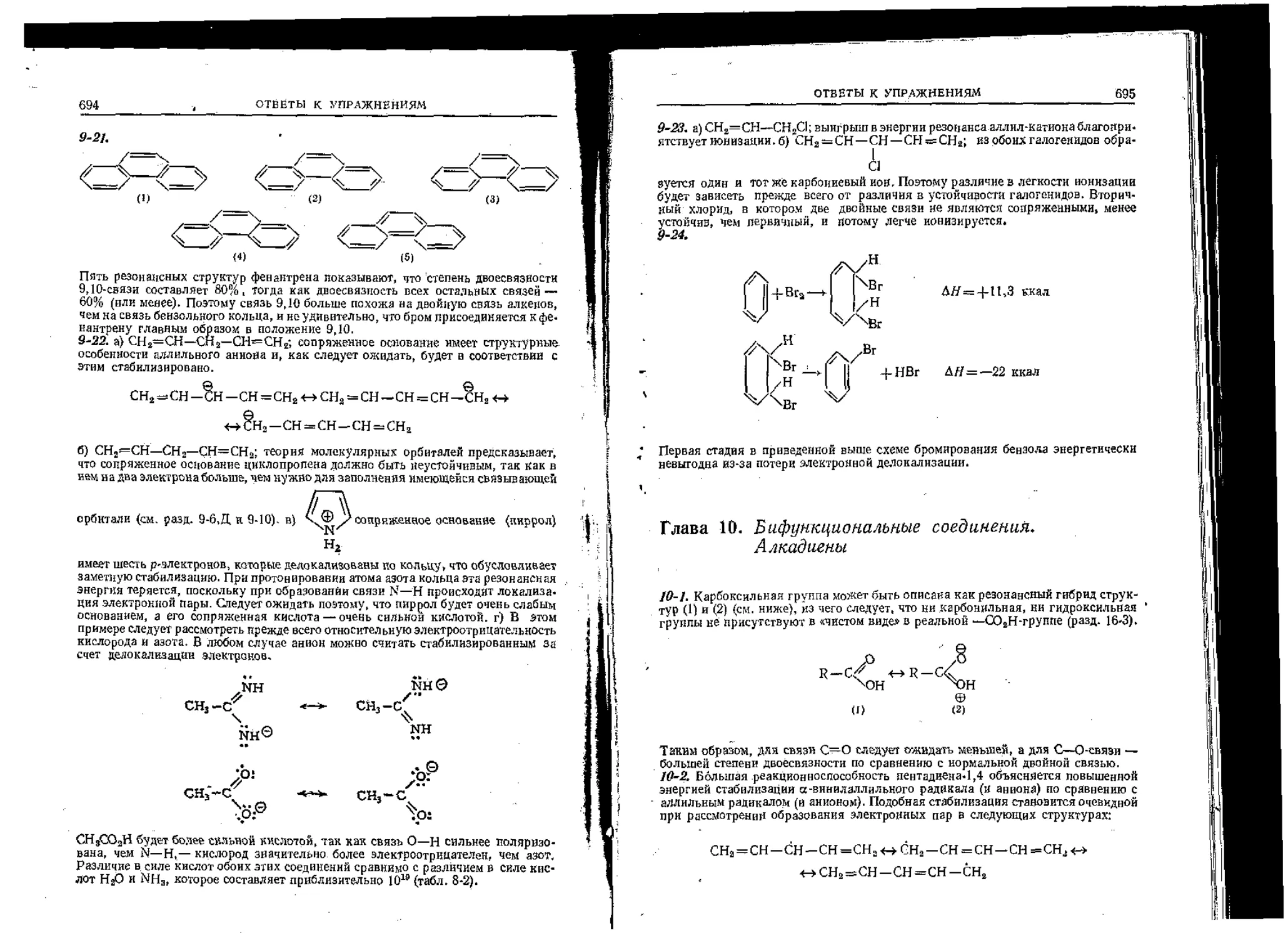
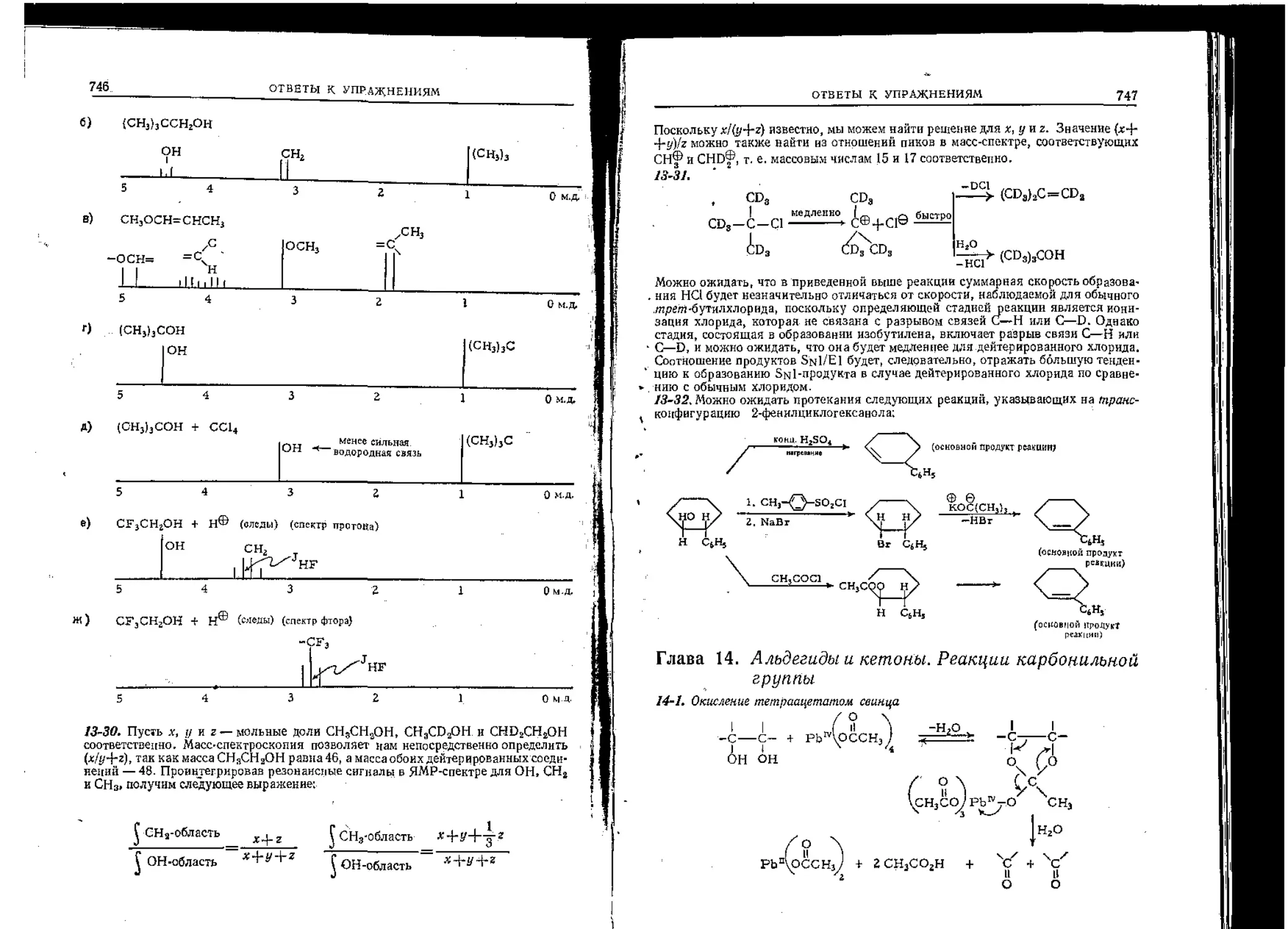
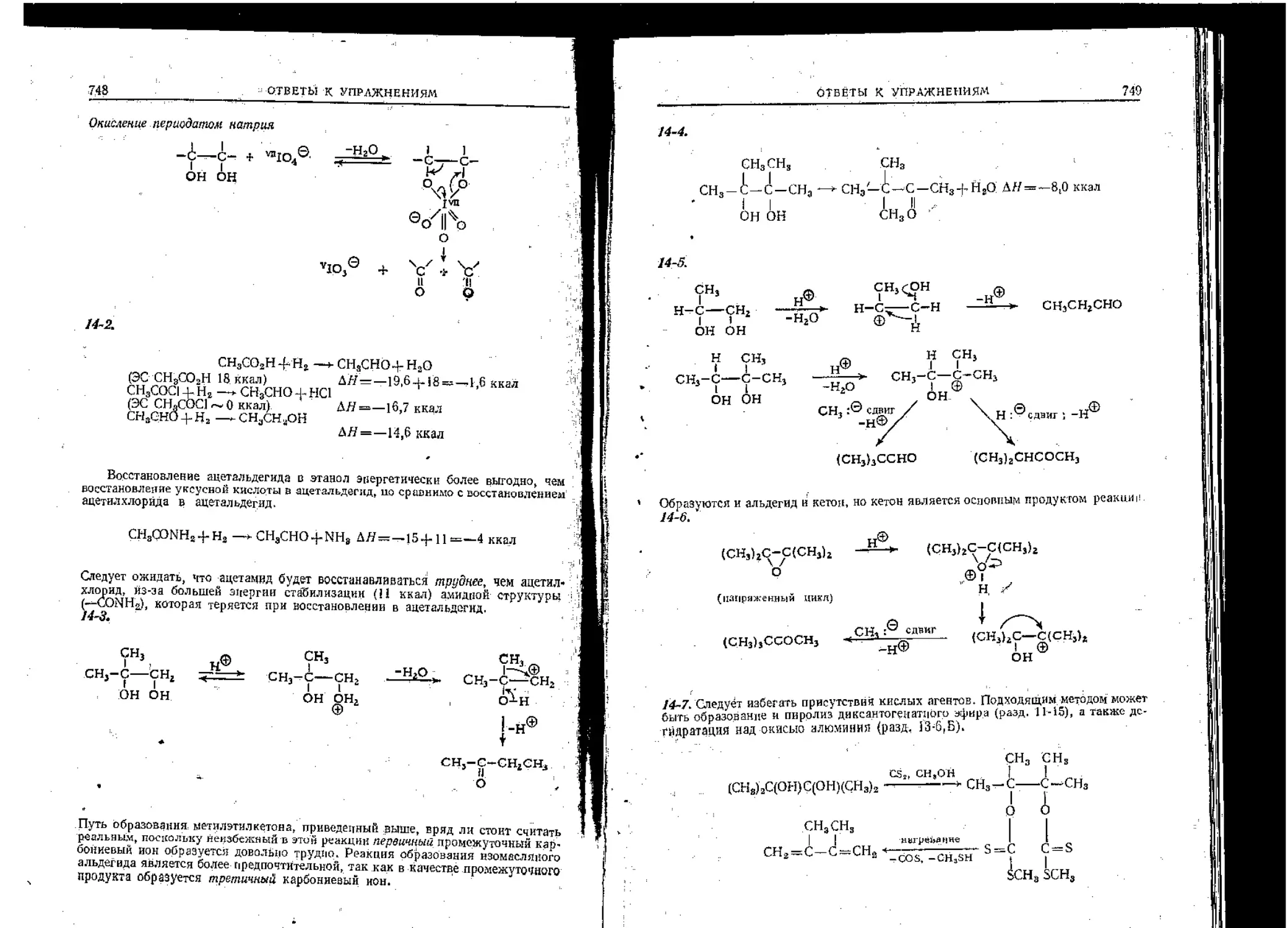
Текст
BASIC PRINCIPLES OF
organic chemistry
SUPPLEMENT
FOR BASIC PRINCIPLES
OF ORGANIC CHEMISTRY
by
JOHN D. ROBERTS
Professor
of Organic
Chemistry
and
MARJORIE C. CASERIO
Senior
Research Fellow
of Chemistry
California Institute Technology
W. A. Benjamin, Inc., 1964
New York — Amsterdam
Дж. Робертс,
М. Касерио
ОСНОВЫ
ОРГАНИЧЕСКОЙ
ХИМИИ
1
Издание 2-е, дополненное
Перевод с английского
доктора хим. наук
Ю- Г. Бунделя
Под редакцией
академика А. И. Несмеянова
Издательство чМиръ
Москва
1978
УДК 547
Один из лучших в мировой литературе учебников органи-
ческой химии. Профессор Дж. Робертс не только принадлежит
К числу наиболее выдающихся американских химиков, ио и
_ является опытнейшим педагогом. Учебник, написанный с большим
педагогическим мастерством, имеет целью подготовку химика-
органика нового типа, Свободна ориентирующегося во всех обла-
стях органической химии, лежащих между физикой и биохимией.
Второе издание дополнено новым материалом — а основном
это ответы на многочисленные задачи, помещенные в конце каж-
дой главы,
В русском переводе книга издается в двух томах. В томе 1
рассматриваются методы идентификации органических соединений,
алканы, алкены, алкины, металлоорганические соединения, аль-
дегиды и кетоны, карбоновые кислоты и оптическая изомерия.
Предназначена для преподавателей, аспирантов, студентов
химических и хкмяко-технологических вузов, а также для самого
широкого круга химиков-органиков.
Л 20504-093 _
₽ 041<0П-78 М"'78
Редакция литературы па химии
© Перевод на русский язык, Лир», 1978
От редакции
Предлагаемый вниманию читателей учебник органической химии
успешно выдержал испытание временем.
Как в США, так и в Европе, где он был переведен и издан во
многих странах, эта книга получила заслуженное признание и за-
няла важное место в арсенале преподавателей университетов. В на-
стоящее время общепризнано, что учебник Дж. Робертса и М. Ка-
серио — один из самых лучших современных учебников органиче-
ской химии.
За 10 лет, прошедших со времени появления 1-го издания на
русском Языке, эта книга заслужила признание и высокую оценку
и в нашей стране; она рекомендована в качестве учебного пособия
д ог университетов и химико-технологических вузов.
Настоящее издание учебника дополнено материалом, прислан-
ным авторами после выхода в свет 1-го русского издания.
Предисловие редактора
первого русского издания
Перед читателем один из наиболее замечательных современных
учебников органической химии, написанный профессором Кали-
форнийского технологического института Дж. Д. Робертсом и стар-
шим научным сотрудником этого института Марджори К- Касерио.
Дж. Робертс принадлежит к числу наиболее выдающихся современ-
ных химиков США. Он известен своими тонкими исследованиями
механизмов реакций и внес значительный вклад в развитие и попу-
ляризацию среди хим и ков-органиков как теоретических расчетных,
так и экспериментальных физических методов исключительной
важности. На русский язык переведены его книги, посвященные
методу молекулярных орбиталей для химиков-органиков иядерному
магнитному резонансу *. В сущности Робертс работает в области
физической органической химии. Тем интереснее и современнее
должен быть его учебник, как оно и есть в действительности.
Физическими методами исследования органического вещества,
особенно новейшими — ЭПР-, ЯМР-, ИК-, электронной и масс-
спектроскопией — пронизана вся книга, и обычно рассмотрение
определенного класса веществ начинается со знакомства читателя
с энергетическими и спектральным свойствами изучаемого класса.
В книге этим методам посвящена гл. 2. Конечно, большое внимание
автор уделяет механизмам реакций, этому знамению времени в хи-
мии, но, к счастью, делает это настолько тактично, что вещество,
его многообразная индивидуальность, не только не исчезает и не
расплывается, но ярко запечатлевается. В первых 26 главах, со-
ставляющих почти три четверти книги, систематически излагается
материал органической химии и методы органической (и физико-
органической) химии. Начиная с гл. 27, посвященной гетероциклам,
и далее этот материал приводится по необходимости выборочно.
Вместе с тем эта последняя четверть книги, включающая такие ярко
написанные н содержащие совсем новый материал главы, как «Кра-
сители, цветная фотография и фотохимия» (гл. 28), «Полимеры»
(гл. 29), «Химия природных соединений» (гл. 30), может быть, слиш-
ком лаконична.
* Робертс Дж., Расчеты по методу молекулярных орбит, ИЛ, М., 1963;
Робертс Дж., Ядерный магнитный резонанс, ИЛ, М., 1961; Робертс Дж., Введе-
ние в анализ спектров ЯМР высокого разрешения (сднн-спиновое взаимодействие),
ИЛ, М., 1963.
ПРЕДИСЛОВИЕ РЕДАКТОРА РУССКОГО ИЗДАНИЯ 7
этъемлемой частью учебника являются упражнения. Это не
1ение, служащее дЛя самоконтроля учащимися усвоения
‘.иного материала, а школа мысли, Часть материала, которая
6ье содержаться в данном разделе, не излагается авторами
разделе, а содержится в ответах на вопросы задач, на которые
йся должен ответить сам. Получается так, что вопросы, не
[ивая объема учебника, расширяют объем и горизонты дав-
леной форме материала. К недостаткам книги следует от-
ее внеисторичность. Авторы рассматриваЕОт органическую
в основном в современном аспекте. Они не стремятся дать
овательностн развития органической химии, не привязывают
зития к месту и лицам, делая это лишь эпизодически. Тем не
не приходится сомневаться, что учебник Робертса и Касерно
свое место в преподавании химии в высшей школе н сыграет
положительную роль.
А. Несмеянов
Предисловие авторов
к первому русскому изданию
Мы глубоко признательны за предоставленную нам возможность
обратиться непосредственно ко всем изучающим органическую хи-
мию в Советском Союзе. Органическая химия в СССР имеет долгую
и славную историю; нам самим много раз случалось обращаться
к интересным и основополагающим работам по соединениям с ма-
лыми циклами таких ученых, как Г. Г. Густавсон, Н. Я - Демьянов,
С, В. Лебедев и Н. Д. Зелинский.
В Соединенных Штатах Америки интенсивные исследования по
органической химии начались значительно позднее; очень большое
влияние на эти исследования оказали достижения в области физи-
ческой химии и химической теории, расцвет которых относится при-
мерно к 1930 г.
В нашем учебнике мы попытались по возможности точно воспро-
извести картину современного состояния органической химии —
все возрастающее внимание к физическим методам и механизмам
реакции, утонченные методы современной стереохимии, чрезвычай-
ную сложность строения природных соединений, ставшую для нас
теперь привычной, а также плодотворную и важную роль органи-
ческой химии в повседневной жизни. Проблемы, казавшиеся совер-
шенно неразрешимыми всего 10 лет назад, сегодня успешно реша-
ются, и наше представление о том, какие типы соединений (в том
числе обладающих минимальной стабильностью) могут быть синте-
зированы, меняется коренным образом.
Каково будущее органической химии? Опыт прошлого показыва-
ет, что научный прогресс распространяется подобно кругам на воде.
Новые концепции или методы играют роль камня, брошенного в
воду; распространяясь, они вызывают изменения в областях, ранее
находившихся в относительном покое. В последнее двадцатилетие
такими новыми волнами прогресса явились применение квантовой
механики к органическим соединениям, новые физические методы
установления-структуры и новые воззрения в фотохимии и органи-
ческом синтезе. Эти волны достигли весьма отдаленных областей
и в настоящее время оказывают глубокое влияние на биохимию, и
в особенности на область, пограничную между органической и не-
органической химией. Мы надеемся, что наша книга послужит проч-
ным фундаментом для изучения этих достижений.
ПРЕДИСЛОВИЕ АВТОРОВ К РУССКОМУ ИЗДАНИЮ g
В настоящее время начинают подниматься новые волны — при-
менение счетно-решающих устройств, использование :ион-циклотрон-
ного резонанса для изучения ионных реакций органических соеди-
нений в газовой фазе, органический синтез с использованием средств
автоматики, реакции в твердом состоянии, применение рентгено-
структурного анализа органических веществ в повседневной практи-
ке и т. д. Эти и другие новейшие достижения, несомненно, изменят
в будущем облик органической химии и характер деятельности в
этой области. Так, вполне возможно, что органическая химия в ее
современном понимании исчезнет вообще и возникнет новая, более
обширная область знаний — химия ковалентных соединений. Эта
новая область несомненно будет базироваться на тех принципах,
которые мы излагаем в настоящей книге, а также и на других поло-
жениях, и в частности на теории поля лигандов.
Мы надеемся, что наше изложение основ органической химии
представит интерес и окажется полезным для химиков Советского
Союза. Мы будем признательны за предложения, направленные на
улучшение содержания в последующих изданиях книги.
Джон Д. Робертс
Марджори Д. Дасерио
Говарду Лукасу посвящается
Предисловие авторов
к американскому изданию
Прогресс органической химии подобен распространению лесного
пожара — он происходит быстрее всего, когда его раздувают ветры
новых идей, и наиболее ярок, когда охватывает территории, покры-
тые девственными лесами. Несмотря на то что органическая химия
имеет возраст более чем 150 лет, ее огонь разгорается быстрее и ярче,
чем когда бы то ни было, нод настоящим ураганом новых теоретиче-
ских концепций и экспериментальных методов, поступающих из
других областей науки. Новые идеи формируют химика-органика
нового типа, сведущего во всех разделах химия — от химической
физики до биологической химии, который может быть назван хими-
ком-органиком только потому, что ему случилось работать в области
химии соединений углерода.
Постепенное уяснение того, что принципы физической химии име-
ют огромное значение для понимания и улучшения методов синтеза,
более всего способствовало расширению кругозора химиков-орга-
ников. Говард Лукас, профессор Калифорнийского технологического
института, одним из первых ввел термодинамику и квантовую меха-
нику в преподавание основ органической химии. Его учебник «Ор-
ганическая химия», опубликованный в 1935 г., намного опередил
свое время.: за истекшие годы не было опубликовано ни одной другой
книги, идущей столь же далеко, в частности, в отношении приложе-
ния термодинамики к органической химии.
Настоящая книга во многом обязала своим появлением профессо-
ру Лукасу, так как вначале она была задумана как переработанный
вариант второго издания его «Органической химии» и порядок изло-.
женин материала в эгид книгах до некоторой степени одинаков; кро-
ме того, в ней уделяется такое же внимание термохимии, поскольку
она многое дает для понимания органических реакций. Особое вни-
мание к этому вопросу на начальной стадии обучения обусловлено
тем, что постепенное повышение удельного веса квантовой механики
и статистической механики в преподавании основ физической химии
ведет к исключению многих областей применения термодинамики
из круга вопросов, рассматриваемых в начальном периоде изучения
химии.
Многое было сказано и написано о возможном порядке изложе-
ния материала в учебниках, содержащих основы органической хи-
ПРЕДИСЛОВИЕ АВТОРОВ К АМЕРИКАНСКОМУ ИЗДАНИЮ
II
мии. Следует ли излагать вместе химию алифатических и аромати-
ческих соединений, нужно ли углубляться в изложение теории стро-
ения органических соединений до рассмотрения органических реак-
ций — эти и другие аналогичные вопросы всегда были предметом
серьезных споров, но так и не получили четкого решения (если оно
вообще возможно). Подход к изложению материала в этой книге до
некоторой степени компромиссный, так как трудно, если не невоз-
можно, научить сразу всему, а частичное повторение материала при-
носит несомненную пользу. Так, мы вкратце касаемся электронной
теории органической химии в гл. 1 (структуры Льюиса), более под-
робно в гл, 5 (атомно-орбитальные модели), так же подробно в гл. 9
(метод резонанса и элементы теории молекулярных орбиталей),
в некоторой мере в гл. 28 (теория молекулярных орбиталей) и, на-
конец, кратко в гл. 31 (образование связей между углеродом и та-
кими элементами, как бор, кремний и фосфор).
В каждом случае мы обращали внимание на то, чтобы вводить
лишь такое количество новых идей, какое необходимо для понима-
ния обсуждаемого вопроса. В результате, например, гл. 6 и 7 охва-
тывают основные физические и химические свойства- алкенов, но
в них не включены методы получения алкенов по той простой причи-
не, что применяемые для их синтеза реакции нельзя в достаточной
мере понять на данной стадии изложения. Однако наличие указателя
дает возможность изучающему быстро навести справку о различ-
ных реакциях, с помощью которых могут быть синтезированы соеди-
нения данного типа.
Мы не можем утверждать, что нами сделано в этой книге что-то
из ряда вон выходящее в отношении изложения и размещения мате-
риала, но мы тем не менее полагаем, что наш подход к предмету со-
держит определенный элемент новизны, который заключается в не-
прерывном стремлении к проверке на практике важности как тра-
диционных, так и современных концепций. При этом в некоторых
случаях мы оказывались не в состоянии решить, какой из двух раз-
личных теоретических подходов считать наиболее полезным. В таких
случаях мы обычно не выносили однозначных решений, принимая
одну из альтернатив, а рассматривали их обе. Это может оказаться
затруднительным для начинающего, который ожидает, например,
последовательного изложения вопроса о валентных углах с точки
зрения либо гибридизации, либо отталкивания электронов (гл. 5)
или вопроса о строении ненасыщенных соединений с помощью либо
метода резонанса, либо теории молекулярных орбиталей (гл. 9 и 28).
Мы выражаем в связи с этим сожаление, но мы действительно были
не в состоянии решить, какой способ рассмотрения этих вопросов
наилучший.
Объем данной книги довольно велик — не столько потому, что
она содержит чересчур много фактического материала, сколько,
быть может, из-за очень подробного обсуждения многих основных
]1! ПРЕДИСЛОВИЕ АВТОРОВ К АМЕРИКАНСКОМУ ИЗДАНИЮ
идей. В некоторых случаях, например в гл. 14 (образование полу-
ацеталей и ацеталей), рассмотрение занимает гораздо больше места
чем этого требует значимость реакции для синтеза. Однако этот
вопрос заслуживает подробного обсуждения, поскольку он иллюст-
рирует принципы, имеющие общее значение,— в данном случае
вопрос о факторах, управляющих присоединением по карбонильной
группе, катализируемым как кислотой, так и основанием. Все же
число рассматриваемых тем так велико, что преподаватель, распо-
лагающий ограниченным временем для прохождения начального
курса органической химии, может оказаться в положении человека,
перед которым поставлен обильный ужин, но у которого нет аппе-
тита. Такая проблема возникает не только при чтении нашей книги.
Мы попытались решить ее, последовав совету доктора Кеслбу н
разместив все существенные темы по соответствующим разделам, от-
меченным номерами, что дает возможность преподавателю, ограни-
ченному во времени или Желающему опустить некоторые из наших
альтернативных подходов к вопросу, легко и быстро составить для
своих студентов соответствующее «меню».
Следует специально остановиться на двух особенностях настоя-
щей книги, и прежде всего на многочисленных упражнениях, при-
веденных не только в конце глав, но и непосредственно в тексте.
Ни одно из этих упражнений не относится к числу простейших типа:
«Напишите двенадцать реакций альдегидов». Такие задания вполне
могут служить для целей обзора материала, однако наша точка зре-
ния на значение упражнений совсем иная. Мы хотели добиться того,
чтобы студенты думали, заставить их «рыскать» по тексту в поисках
ответа и во многих случаях привести их в такие области, которые
выходят за рамки материала, охватываемого данной книгой. Неко-
торые упражнения могут вызвать затруднения как у студентов, так
и у преподавателей, поскольку у них пет однозначного и точного
ответа. Тем не менее упражнения такого рода полезны, так как они
оживляют дискуссию в ходе семинара. Книга содержит гораздо
больше упражнений, чем студент может проработать в течение года,
но цель здесь опять-таки заключалась в том, чтобы предоставить
преподавателю широкие возможности для выбора. Приведенные во
многих главах перечни реакций синтеза должны оказаться полез-
ными для решения задач по органическому синтезу.
Другая особенность книги, заслуживающая специального рас-
смотрения, состоит в большом внимании, уделенном применению
различных видов спектроскопии к проблемам органической химии.
В этом отношении гл. 2 вызвала особенно много споров — одним из
читавших ее она понравилась; некоторые считали, что ее следует
перенести в приложение; другие полагали, что ей вообще не место
в учебнике, излагающем основы органической химии. Важность
спектральных методов для изучения строения органических соеди-
ПРЕДИСЛОВИЕ АВТОРОВ К АМЕРИКАНСКОМУ ИЗДАНИЮ
J£
пений не вызывает сомнений. Несмотря на все тревоги по этому по-
воду представителей старшего поколения, вполне правомерно снять
спектр нового соединения прежде, чем определять его температуру
плавления,— с помощью спектра может быть получено гораздо
больше информации. Однако это не означает, что в начальный курс
органической химии необходимо или даже желательно включать
руководство по спектральным методам. Всегда существует предел,
ограничивающий объем материала, и может оказаться неверным с
педагогической точки зрения обучение студента вещам, которые не
имеют для него в данный момент существенного значения.
Материал, относящийся к спектроскопии, помещен в гл. 2 и
частично в других главах; он может быть использован или опущен
по усмотрению преподавателя. Мы считаем, что можно вообще опус-
тить весь этот раздел, если это покажется преподавателю более
удобным, за исключением, может быть, последней части гл. 28, по-
священной современным успехам органической фотохимии. Если
спектроскопия включается в изучаемый материал, то студенту долж-
но быть ясно, что ему вовсе нет необходимости прорабатывать сразу
весь материал гл. 2. Будет лучше, если он разовьет свое понимание
спектральных методов и затем сможет их использовать, возвращаясь
к этой главе за справками и для более глубокого усвоения материала,
г io мере того как при знакомстве с новыми классами соединений будут
появляться новые возможности применения этих методов. Мы широ-
ко использовали в изложении данные спектроскопии ядерного маг-
нитного резонанса; возможно, в этом слишком сильно сказалось
влияние наших собственных научных интересов. Тем не менее нам
кажется, что вряд ли следует отнести это.к недостаткам, поскольку
для качественного анализа ЯМР-спектроскопия приносит обычно
больше пользы, чем ИК-спектроскопия; она имеет еще и то преиму-
щество, что ее гораздо легче понять.
Эта книга задумана не только как вводный курс органической
химии. Она поможет получить более обширные сведения в этой об-
ласти студентам старших курсов, аспирантам и научным работни-
кам, для которых она, как мы надеемся, будет служить полезным
справочным пособием. Книга представляет собой в шестой раз про-
смотренный и расширенный вариант сборника мимеографированных
лекционных курсов, составленного в 1954 г. За прошедшие десять
лет многие наши коллеги и друзья приняли участие в его усовершен-
ствовании. В начальной стадии работы над книгой особенно большую
помощь оказал доктор В. Шомакер, направлявший подготовку мате-
риала по термохимии (гл. 3) и методу резонанса (гл. 9). На более
поздней стадии профессор К. Кеслоу высказал очень много ценных
пожеланий (в результате использования пятого издания сборника
в летнем курсе Университета Индианы). Очень подробный и ценный
обзор рукописи в целом сделан профессором Д. Эпплквистом, Г. Ба-
умгартеном и У. Нойесом. Много ценных замечаний по содержанию
14 ПРЕДИСЛОВИЕ АВТОРОВ К АМЕРИКАНСКОМУ ИЗДАНИЮ
отдельных глав высказали также доктор Е. Бухман и Л. Кли и про-
фессора В. БоКельхейд, К. Хэмон, К. Ниманн и Д. Ричардс.
Мы будем признательны за предложения, направленные на улуч-
шение этой книги в отношении фактического материала, интерпре-
тации данных и способа изложения.
Джон Д. Робертс
Марджори К. Касерио
Пасадена, шт. Калифорния
Март 1964 г,
ГЛАВА
СТРУКТУРА, ИДЕНТИФИКАЦИЯ
И НОМЕНКЛАТУРА
Данная глава преследует несколько целей. Прежде всего кратко
будут обсуждены причины, вызывающие различие в свойствах между
ковалентными органическими соединениями и неорганическими соля-
ми. Далее следует обсуждение способов изображения органических
соединений с помощью структурных формул и молекулярных моде-
лей .
Рассматриваются методы определения чистоты и способы иден-
тификации органических соединений путем анализа и хроматогра-
фии; затем некоторые методы, используемые при установлении
структуры, иллюстрируются на примере алкалоида никотина. На-
конец, будет затронута проблема номенклатуры органических сое-
динений — вопроса, который в некоторых отношениях "сух, как
пустыня» и превращается часто в бич для начинающего, несмотря на
то что суть дела заключается в облегчении обмена идеями и инфор-
мацией об органических соединениях и их реакциях.
Органическая химия определялась вначале как химия соедине-
ний, которые образуются живой материей. После открытия в 1828 г.
Вёлером возможности получения мочевины, считавшейся типичным
органическим веществом, при нагревании «неорганической соли»
цианата аммония это определение утратило силу, и в настоящее вре-
мя органическую химию правильнее всего рассматривать как хи-
мию углеродсодержащих соединений. Однако название «органиче-
ская» все еще сохраняет силу по той причине, что химия соединений
углерода более важна для жизни, чем химия любого другого эле-
мента. В приведенном ниже далеко не исчерпывающем перечне пред-
1G
ГЛАВА I
ставлены основные виды органических соединений, имеющие важ-
ное биологическое или промышленное значение:
Нефтяные продукты
Каучук и другие эластомеры
Душистые вещества
Антибиотики и витамины
Алкалоиды и гормоны
Сельскохозяйственные химикаты
(инсектициды и удобрения)
Взрывчатые вещества и реактив-
ное топливо
Пластмассы и синтетические во-
локна
Xладоагенты
Красители и пигменты
Сахара
Белки
Покрытия (краски)
1-1. Образование связей в соединениях
углерода
Одна из причин того, что столь обширная область химии бази-
руется всего лишь на одном элементе, заключается в значительной
прочности связи углерод—углерод, в результате чего становится
возможным образование длинных цепей соединенных между собой
углеродных атомов. Однако этого, еще недостаточно для того, чтобы
именно данный элемент дал начало единственной в своём роде и
разнообразной области химии, поскольку атомы многих других
элементов, например бора, кремния, фосфора и др., также образуют
прочные цепи из атомов этих элементов (в элементарном состоянии).
Уникальность углерода обусловлена в значительной степени тем
обстоятельством, что образуемые им углерод-углеродные связи проч-
ны и в тех случаях, когда атомы углерода одновременно связаны с
другими элементами. Действительно, в то время как приведенные
ниже углерод-водородные и углерод-фторные соединения высоко-
стабильны и в химическом отношении относительно мало реакцион-
носпособны, соответствующие производные бора, кремния, фосфора
и т. д. либо не могут быть получены, либо являются крайне реак-
ционноспособными веществами
Н н: f F
Н— <4—н и F—(4—(4—F
। 1 U
НН F F
Особые свойства углерода можно отнести за счет относительно
небольшого размера атома этого элемента, имеющего два электрона
на заполненной внутренней Д-оболочкё и четыре валентных элек-
трона на внешней L-обол очке. Для того чтобы образовать простые
электравалентные двухионные соли, подобные хлористому натрию,
углерод должен был бы либо отдать четыре валентных электрона с
/.-Оболочки (например, такому элементу, как фтор) и превратиться
к чстырехдарядный положительный ион С4®, либо заполнить свою
L-оболочку, получив электроны от такого элемента, как литий, и
СТРУКТУРА, ИДЕНТИФИКАЦИЯ И НОМЕНКЛАТУРА
17
образовать четырехзарядный отрицательный ион С40. Потеря четы-
рех электронов энергетически очень невыгодна, поскольку каждый
электрон должен при этом удаляться от положительного ядра угле-
рода, Принятие четырех электронов должно быть также очень не-
выгодным вследствие отталкивания между электронами. Такое меж-
электронное отталкивание должно быть значительно меньше в слу-
чае принятия атомом фтора одного электрона, приводящего к обра-
зованию F©, чем при принятии четырех электронов углеродом с об-
разованием С4©, поскольку, хотя общее число электронов на внеш-
ней электронной оболочке в случае обоих ионов одинаково, заряд
ядра фтора гораздо больше. Обычно углерод дополняет свою валент-
ную оболочку до октета, вступая в общее владение электронами с
другими атомами. В соединениях со связями, образованными за
счет обобществления электронов каждого из партнеров по связи
(«поделенные» электроны), подобных метану (СН4), этану (СаНа) или
четырехфтористому углероду (CFj), валентная оболочка углерода
заполнена, как это можно видеть из приведенных ниже формул Лью-
иса:
н н н : F:
Н: С :Н Н:С:С:Н :F:С:F:
Н Н Н : F:
метан Этан четырехфтористый
углерод
Упомянутое выше межэлектронное отталкивание, связанное с запол-
нением 1-оболочки, компенсируется в этих соединениях силами при-
тяжения электронов к положительно заряженным ядрам элементов,
соединенных с углеродом.
На примере ряда гидридов элементов второго периода периодиче-
ской системы можно проиллюстрировать влияние на свойства изме-
нений в характере связи, являющихся следствием возрастания атом-
ного номера при данной валентной оболочке. Гидрид лития (т. пл.
680 °C) можно рассматривать как солеподобное ионное вещество. Его
структура может быть написана как Li®: Н©, так и Н® : Li©
в зависимости от того, литий или водород является более сильным
акцептором электронов. Можно было бы ожидать, что литий ока-
жется более электроноакцепторным, поскольку заряд его ядра
больше (+3), однако этот эффект более чем уравновешивается его
большим атомным радиусом и «экранирующим» влиянием Двух элект-
ронов, находящихся на внутренней электронной оболочке лития.
В результате водород имеет большее сродство к электрону и пра-
вильна структура Li® : Н©. Сильное межионное электростатическое
взаимодействие обусловливает высокие температуры плавления и
кипения гидрида лития подобно хлористому натрию, фтористому
литию и др.
18
ГЛАВА i
Метан (СН4) кипит при —161 °C, что по крайней мере на 1000°
ниже, чем температура кипения гидрида лития. Одной из причин
такого различия в температурах кипения является почти сферичес-
кая форма молекулы метана, вследствие чего снаружи ее распола-
гаются атомы только одного вида; при этом сила притяжения между
соседними молекулами уменьшается, что позволяет им более легко
«улетать», переходя в газ. Оказывается, однако, что и посвоей спо-
собности оттягивать электроны углерод и водород близки друг дру-
гу. В результате этого электроны, образующие С — Н-связь, по-
делены почти точно поровну и связь обладает очень малой степенью
ионности. В противоположность гидриду лития метан может быть
охарактеризован как неполярное вещество.
Фтористый водород имеет температуру кипения на 200°С выше,
чем метан. Фтор с его большим зарядом ядра обладает значительно
большими электроноакцепторными свойствами, чем углерод, и,
соединяясь с водородом, образует частично ионную связь. Свя-
зывающая пара электронов в HF несколько сдвинута в сторону
е® Й0
фтора, что может быть изображено так: Н--F. В жидком фтори-
стом водороде молекулы имеют тенденцию образовывать линейные
и циклические агрегаты, причем положительный атом водорода
одной молекулы притягивается к отрицательному атому фтора
другой
6® &® 6® 6® Б® Б® 6® Бф
F----Н- • • -F Н- • ’F-Н- • -F-Н
При испарении жидкого фтористого водорода температура должна
-быть достаточно высокой, для того чтобы преодолеть эти межмо-
лекулярные электростатические взаимодействия; в результате тем-
пература кипения фтористого водорода выше температуры кипения
метана. Фтористый водород правильнее всего охарактеризовать как
полярное, но не ионное соединение. Хотя О—Н- и N—Н-связи в воде
и аммиаке имеют значительно менее ионный характер, чем связи
Н—F во фтористом водороде, эти соединения по своей природе также
относительно полярны.
Химические свойства гидрида лития, метана и фтористого во-
дорода соответствуют приведенным выше определениям. С таким сое-
динением, как вода, которое может как отдавать, так и принимать
протоны, гидр ид-ион гидрида лития взаимодействует, отрывая про-
тон и образуя молекулу водорода
® : 0 I m -®
Li | : Н + Н ] : О : Н -я- Li : О : Н + И : Н
'С другой стороны, фтористый водород отдает протон и превращается
.в соль, содержащую фторид-ион
СТРУКТУРА, ИДЕНТИФИКАЦИЯ И НОМЕНКЛАТУРА
19
н 6© ье н s
: ..
Н : О : + Н | : F: ----> Н: О : Н + : F;
( 6© и 6© означают частично ионную связь )
Метан с его ковалентными связями инертен по отношению почти
ко всем протонодонорным или протоноакцепторным соединениям в
любых условиях, за исключением самых жестких. Как и можно было
ожидать, метил-катионы СН® и метил-анионы (метид-ионы) СН^:
образуются с большим трудом и являются исключительно реакцион-
носпособными.
Н
Н:С: Н + Н:О:Н -----------> реакция не протекает
Н
Углерод образует связи, в состав которых входит электронная
пара, не только с водородом, но также и со многими другими эле-
ментами. Даже его соединения с элементами, находящимися в раз-
ных концах периодов периодической системы, например метилли-
тий (LiCH3) и фтористый метил (CH3F), являются относительно не-
полярными соединениями по сравнению с такими веществами, как
фтористый литий, хотя, разумеется, гораздо более полярными, чем
метан (CHJ.
Атомы углерода уникальны в отношении способности соединяться
между собой с образованием устойчивых цепей или циклов. Атомы
водорода и углерода, соединяясь в различных сочетаниях, да-
ют необычайно большое разнообразие гидридов углерода, или уг-
леводородов, как их обычно называют. В противоположность этому
ни один из элементов второго периода, за исключением бора, пе
дает таких семейств гидридов, а большинство гидридов бора очень
чувствительно к гидролизующим и окислительным агентам.
1-2. Структурная органическая химия
Строительным блоком структурной органической химии является
четырехвалентный атом углерода. За немногими исключениями сое-
динения углерода могут быть изображены формулами, в которых
каждый углерод связан четырьмя ковалентными связями независи-
мо от того, соединен он с углеродом или с каким-либо другим эле-
ментом. Двухэлектронная связь, примером которой может служить
связь углерод — водород в метане и этане и связь углерод — углерод
в этане, называется простой связью. В этих, а также во многих дру-
гих соединениях аналогичного строения каждый атом углерода сое-
20
ГЛАВА [
Линен с четырьмя другими атомами. Существуют, однако, соедине-
ния, подобные этилену С2Н4, в которых четыре электрона (до два
от каждого углеродного атома) находятся в общем владении, обра-
зуя четырехэлектронную связь, называемую двойной связью
н . н
; С :: С •
Н ‘ Н
этилен
Аналогичным образом в ацетилене С2Н2 шесть электронов, по три
от каждого углеродного атома, находятся в совместном владении,
образуя шестиэлектронную связь, которая называется тройной
связью
Н:С : ::с:Н
ацетилен
Разумеется, во всех случаях каждый атом углерода имеет запол-
ненный октет электронов. Углерод образует также двойные и трой-
ные связи с рядом других элементов, которые могут проявлять ко-
валентность, равную двум или трем. Двойная связь углерод — кис-
лород (или карбонильная связь) присутствует в двуокиси углерода
и во многих важных органических соединениях, таких, как формаль-
дегид и уксусная кислота. Тройная связь углерод— азот имеется
е синильной кислоте и ацетонитриле
:О : I С:;О;
Н
.'.С : : О :
Н
Н : С : С : О : II
Н
двуокись углерода
формальдегид
уксусная кислота
Н : С ::: N:
Н : С : С : : ; N:
Н
цианистый водород
(синильная кислота)
ацетонитрил
Принято, что одна прямая линия, соединяющая символы ато-
мов, обозначает простую (двухэлектронную) сяязь, две такие ли-
нии. обозначают двойную (четырехэлектронную) связь, а три —
СТРУКТУРА, ИДЕНТИФИКАЦИЯ И НОМЕНКЛАТУРА
21
тройную (шестиэлектронную) связь. Изображение соединений с по-
мощью этих символов называют структурной формулой.
Н н Н Н
Н—С—(i—Н SC=C// Н-С=С-Н н—Cs=N
|| / \ ацетилен цианистый
НН Н Н водород
этан этилен
нч н п н
О=с=0 С=о Н—С—Ct=»N
двуокись н/ I Vu I
углерода Н Н
формальдегид уксусная кислота ацетонитрил
Для экономии времени й места при изображении органических
структур на практике обычно используют «сжатые» (или упрощен-
ные) формулы, в которых не все связи выписываются полностью.
При использовании упрощенных формул всегда следует иметь в ви-
ду нормальные валентности атомов.
СНВСН3 СНаСН2 СНСН сн2о
этан этилен ацетилен формальдегид
СН3СОВН HCN CH3CN
уксусная цианистый ацетонитрил
кислоте йодород
Возможен также способ изображения, промежуточный между сжа-
тыми и структурными формулами. Он в большинстве случаев до-
статочно ясен и в то же время экономит место; этот способ будет ис-
пользоваться в дальнейшем изложении наиболее часто.
Действуя описанным выше способом, можно изобразить огром-
ное число соединений, содержащих простые, двойные и тройные
связи, в состав которых входит четырехвалентный углерод, однова-
лентные водород и галогены, двухвалентный кислород и трехвалент-
ный азот. На рис. 1-1 приведены простые соединения, относящиеся к
различным классам.
Упражнение i-i. Напишите формулы Льюиса для приведенных ниже соедине-
ний. структуры которых изображены на рис. 1 -1, Используйте четкие, правильно
размещенные точки для обозначения электронов. Поставьте на всех атомах, не
являющихся нейтральными, знаки зарядов
пропан
циклопропан
бензол
бромистый метил
метанол
в)
б)
в)
Г)
Д)
е)
ж) ацетат натрия (CH3CO©Na®)
з)
и)
к)
окись этилена
г) СаН4С|Р (два)
д) CSHSN (три)
е) СЯН4О3 (десять)
метиламин
ацетамид
нитрометан
Упражнение !~2. Напишите все возможный структурные формулы для различ-
ных ковалентно построенных изомеров, отвечающих приведенным ниже молеку-
лярным формулам; все содержащиеся в них атомы имеют нормальную валент-
ность.
а) С3Нв (два)
б) С3Н4 (три)
в) С,Н4О (три)
Углеводороды
СН4 СН3-СН3 СН3-СН2-СНЭ
метан этап
СН3—СН2-СНа-СНа
«’бугай
СН3
I
снз—С—сна
I
н
пропан
сн3
СНЭ—с-сн8
сн8
изобутан
неопентан
сн2
; нас^сн2
циклопропан
циклогексан
норборнан
Н2С=СН2
ьтилен
нс^сн
ацетилен
н
с
НС сн
! П
НС сн
н
бензол
СН3Вг
бромистый метил
CHj-OH
метанол
Г алоген иды
СОд
четырех хлористый
углерод
Спирты
СНв —сн2—он
этанол
CFaCl2
Д ифто Р Д И X J] о рмст it TI
Н3С—сн2
I I
он он
этиленгликоль
Простые эфиры
сна—О—снэ
диметил овый эфир
СН9-СН2—O-CH,-CHS
ДН ЭТИЛ о в ы Й эфир
Н2С-СН2
\/
о
окись этилена
Карбонильные ^^>С = О^ соединения
нх
у=о
Н/
формальдегид
СНЭЧ
сн/
ацетой
СН--ССн
уксусная кислота
^-с/
^О-СНз-СНз
этндацетцт
сн3—nh2
метиламин
Азотсодержащие соединения
СНа
I zO
СН3—N—СНа СНа-С^
тр«мет«лам<?к NHg
ацетамид
Ф zO
CH3N^
нитрометан
Рис. 1-1. Простейшие типы органических соединений.
СТРУКТУРА, ИДЕНТИФИКАЦИЯ И НОМЕНКЛАТУРА
23
Упражнение 1'3. Напишите распространенные структурные формулы соедине-
ний, изображенных ниже с помощью сжатых формул. Используйте линии для всех
связей (так, как в формулах, приведенных выше).
а) СН3СН(СН3)2 б) СН3СССНа г) (СН2)4 д) CH3CONHCHa
в) СН2СЮСН2СНО е) г5н2СН2ОСН2СНаО
1’3. Углы между связями
и шаростержневые модели <
Обычно атом углерода образует четыре связи в соединениях типа
СХ4 таким образом, что четыре связанных с ним атома располагаются
в вершинах правильного тетраэдра. Углы между связями X—С—X
составляют 109,5° — это значение рассматривается как нормальный
валентный угол углерода. Во многих случаях полезную информацию
о простраггсгвенных отношениях атомов дают «шаростержневые»
модели органических соединений. Для СХ4 стержни располагаются
так, что углы между ними составляют 109,5° (рис. 1-2). Органические
молекулы оказывают большое сопротивление деформационным воз-
действиям, которые изменяют нормальные значения углов между
валентностями; таким образом, шаростержневые модели в большей
степени соответствуют свойствам реальных молекул в том случае,
если стержни сделаны достаточно жесткими.
Шароетержневые модели многих органических соединений а
обычными валентными углами углерода, равными 109,5°, собираются
без труда. Однако для таких соединений, как этилен, ацетилен,
циклопропан, формальдегид или окись этилена, валентные углы
должны быть значительно меньше нормальных в том случае, если
использовать для обозначения связей прямые стержни. По сообра-
жениям удобства модели этих соединений обычно конструируют с
помощью шариков, в которых высверлены отверстия, расположенные
Рис. 1-2, Шаростержневая мо-
дель СХ4.
24
ГЛАВА I
Рис. 1-3. Шаростержневые модели углеводородов с изогнутыми связями.
под обычными тетраэдрическими углами, но используют достаточно
гибкие соединения (например, стальные пружинки) для образова-
ния «изогнутых связей» (рис. 1-3).
Соединения, для изображения которых требуется применение
изогнутых связей, обычно оказываются гораздо менее устойчивыми
(и более реакционноспособными), чём аналогичные вещества, моде-
ли которых могут быть собраны с помощью прямых стержней, рас-
положенных под тетраэдрическими углами.
1-4. Вращательные конформации
Для этана (СН3—СН3) возможно бесконечное число различных
расположений атомов в зависимости от того, каким образом атомы
водорода, находящиеся при одном углеродном атоме, располагаются
относительно атомов водорода при другом атоме углерода. Это можно
видеть наглядно, если использовать шаростержневые модели, в ко-
торых стержень имеет возможность свободно вращаться. Два пре-
дельных случая такого расположения, или конформации, представ-
СТРУКТУРА, ИДЕНТИФИКАЦИЯ И НОМЕНКЛАТУРА
25
Рис. 1-4. Две вращательные конформации этана.
лены ла рис. 1-4. В заслоненной (эклиптической) конформаций при
взгляде на модель сверху с конца атомы водорода при углеродном
атоме, находящемся впереди, располагаются точно над атомами
водорода при более удаленном атоме углерода. В заторможенной
(шахматной) конформации каждый из «передних» атомов водорода
располагается между парой более удаленных атомов водорода. По-
лучить индивидуальные образцы этана, соответствующие приве-
денным выше или промежуточным расположениям атомов, невоз-
можно, поскольку в реальной молекуле этана происходит почти
незатрудненное «свободное вращение» вокруг простой связи, соеди-
няющей атомы углерода. Свободное или по крайней мере очень
быстрое вращение возможно вокруг всех простых связей, за исклю-
чением некоторых особых случаев, когда группы, соединённые с
атомами углерода, настолько велики, что они не могут пройти одна
мимо другой, иди когда эти группы соединены химической связью
(как, например, в случае этилена или циклических соединений, та-
ких, как циклопропан или циклогексан). Для этана и его производ-
ных заторможенная конформация всегда несколько устойчивее за-
слоненной, поскольку у конформации первого типа атомы удалены
друг от друга на наибольшее возможное расстояние и взаимодей-
ствие между ними минимально.
В органической химии многие проблемы требуют рассмотрения
структур в трех измерениях; при этом большую помощь оказывает
использование шаростержневых моделей или сходных моделей Дрей-
динга (см. гл. 4); они делают более наглядным относительное распо-
ложение атомов в пространстве. К сожалению, очень часто прихо-
дится передавать трехмерные представления посредством изобра-
26
ГЛ ЛЕД 1
заторможенная заслоненная
с пунктирными линиями И ^КЛИНЬЯМИ '
заторможенная заслоненная
проекции Ньюмена
Рис. 1-5. Условные изображения заторможенной и заслоненной конформаций
этана.
В изображен ни типа «кбзел» у гл сродны й ато-м, показанный с.^ева внизу, всегда считается
направленным вперед. В изображении, где используются пунктирные линии н «клинья»,
клиньями обозначаются связи, направленные от плоскости бумаги к читателю; обычными
линиями — связи, лежащие в плоскости бумаги; пунктирными линиями — связи, на-
правленные от плоскости бумаги назад.
жения их в двух измерениях, и далеко не всем в одинаковой степени
удается выполнить или представить себе такие изображения в про-
странстве. Очевидно, что передача информации с помощью изобра-
жений, приведенных на рис. 1-4, практически невыполнима — она
слишком трудна и занимает много времени; необходима поэтому ка-
кая-то форма сокращенной записи. На рис. 1-5 приведены три спо-
соба упрощенного изображения заслоненной и заторможенной кон-
формаций этапа. Из их числа предпочтение отдается «козлам для
пилки дров», поскольку это единственный трехмерный способ изоб-
ражения, достаточно простой, чтобы его можно было использовать
в случае сложных природных соединений (хотя, возможно, его труд-
нее всего представить себе наглядно и нарисовать); его применение
иллюстрируется формулами в разд. 18-11 и 30-5А. При этом всегда
предполагают, что молекула рассматривается несколько сверху и
справа, точно так, как это показано на рис. 1-4.
Упражнение 1-4. Покажите, каким образом три способа изображения, приве-
денные на рис. 1-5, могут быть использованы для изображения различных возмож-
ных заторможенных конформаций следующих соединений:
а) хлористый этил (СН3СН2С1)
б) I-фтор-1,2-дихлорэтан (CHC1FCH.CI)
в) 1,2-дихлсрэтан (СН2С!СН2С1)
г) н-бутан (СНЭСН3П !SCH31
СТРУКТУРА, идентификация И НОМЕНКЛАТУРА
27
Рассмотрите вопросе том, как можно распространить каждый из способов изобра-
жения на систему из четырех атомов углерода.
1-5. П ространственные модели
Шаростержневые модели молекул очень полезны в том отноше-
нии, что они делают наглядным относительное положение атомов в
пространстве, но они перестают удовлетворять, как только хотят
показать, каков размер атомов. Действительно, атомные радиусы на-
столько велики по сравнению с длинами химических связей, что в
том случае, когда модель молекулы, подобной хлористому мети-
лу, конструируется с учетом реальных атомных радиусов и длин
связей, связи, соединяющие атомы, трудно увидеть. Тем не менее
масштабные модели такого типа, сделанные из усеченных шаров
(Стюарт, Фишер — Хиршфельдер и др.), соединяемых между собой
кнопками, широко используются для установления возможной сте-
пени сближения групп в молекуле и определения степени перекры-
вания атомов при их различном расположении (рис. 1-6),
1-6. Идентификация и установление
структуры
Хорошо известно, что данной молекулярной формуле может соот-
ветствовать более чем одно устойчивое вещество. Примерами могут
служить н-бутан и изобутан, каждый из которых имеет молекуляр*
Рис. 1-6. Изображение органических соединений с помощью моделей Стюарта.
28
ГЛАВА I
ную формулу С4Н10, или диметиловый эфир и этанол общей формулы
СаНйО.
chs
CHj—сна—сн2—сня сн3—d—СНа сн8—о—сн8 сня—сна—о—н
«-бутан [ димвтиловый эфир этанол
Н
изобутан
с4н„, сйнво
Соединения, в состав которых входят одни и те же атомы и в одина-
ковом количестве, называются изомерами. Известно только одно со-
единение, соответствующее формуле СН4, но можно получить 35
изомеров соединения с формулой СяНа0. Отсюда легко видеть, как
велико разнообразие органических соединений. Это разнообразие
порождает проблемы различения одного соединения от другого, ус-
тановления структур, а также задачу разработки системы номенкла-
туры, делающей возможным общение между исследователями, ра-
ботающими в этой области. В последующих разделах мы опишем эк-
спериментальные методы, применяемые для определения чистоты,
идентификации и установления структуры органических соединений.
А. Физические свойства и хроматография
Структура органического соединения определяется наиболее
легко в том случае, если можно показать, что его физические свой-
ства (температура плавления, температура кипения, показатель
преломления, плотность, растворимость, спектры поглощения элек-
тромагнитного излучения, масс-спектр, дифракция рентгеновских
лучей ит. д.) или его химические свойства идентичны свойствам ра-
нее полученного вещества с известной структурой. Отсюда следует,
что при идентификации соединений путем сравнения их свойств со
свойствами известных соединений чистота имеет первостепенное
значение. О чистоте данного вещества часто судят по его темпера-
туре кипения или плавления и растворимости — температура плав-
ления обычно оказывается наиболее чувствительной к примесям и
наиболее легко определяемой. В целом, однако, малые количества
примесей часто оказывается трудно определить этими способами.
В настоящее время становится обычным определение чистоты путем
применения различных методов «сверхочистки» (или «сверхразделе-
Нйя»); при этом выясняется, могут ли быть отделены какие-либо
примеси и изменяются ли при этом свойства образца.
Наиболее распространенные способы «сверхочистки» основаны
на хроматографии — разделении компонентов смеси путем исполь-
зования различий в их распределении между двумя фазами. При
хроматографии применяется сравнительно простая техника разде-
ления: в соответствии с приведенным выше определением сюда сле-
дует отнести даже такие способы, как разделение с помощью дели-
СТРУКТУРА, ИДЕНТИФИКАЦИЯ и НОМЕНКЛАТУРА 29
растворитель
Рис. 1-7. Простейшая колонка
для хроматографирования в си-
стеме жидкость — твердое ве-
щество.
О
I твердый адсорбент, в котором
[видны полосы, соответствую-
Г щие компонентам.присутство-
[ вавшим в образце
элюат
тельной воронки (двухфазная система жидкость — жидкость) и
фракционная перегонка (двухфазная система газ ~ жидкость).
Однако эти методы требуют довольно больших количеств веществ*
и степень разделения* достигаемая при этом, часто оказывается не-
достаточной. Невысокая степень разделения связана с тем, что про-
цесс разделения здесь происходит в одну (или несколько) стадий.
Методы сверхразделения включают процессы, которые происходят
в огромное число стадий с очень малыми количествами веществ (не-
сколькими миллиграммами или еще меньше); при этом может быть
достигнута необычайно высокая степень разделения. Наиболее ча-
сто используются комбинации фаз газ — жидкость и жидкость —
твёрдое вещество.
Хроматография в системе жидкость — твердое тело была вначале
разработана для разделения окрашенных веществ, откуда и про-
исходит название хроматография (от греческого «chroma» — цвет).
В типичном эксперименте окрашенное соединение, в котором воз-
можно присутствие окрашенных примесей, растворяется в. подхо-
дящем растворителе и раствор пропускается через колонку, на-
полненную твердым адсорбентом (например, окисью алюминия)*
как это показано на рис. 1-7. «Хроматограмма» затем «проявля-
ется» — через колонку пропускается соответствующий раствори-
тель, который смывает адсорбат вниз и далее вымывает его из ко-
лонки. В том случае, если компоненты адсорбируются твердой фазой
не в одинаковой степени — ив этом заключается вся суть данного
метода разделения,— образуются отдельные полосы (или зоны)
окраски. Полосы в верхней части колонки содержат Наиболее силь-
но адсорбирующиеся компоненты, а полосы в нижней части — ком-
поненты, которые удерживаются наиболее слабо. Зоны можно разде-
лить механически или можно добавить раствори гель для того,
чтобы вымыть, или элюировать, окрашенные зоны по отдельности
Рис. 1-8. Схематическое изображение устройства для газ о-жидкостной хромато-
графии.
j — подвод газа-носителя (возможно регулирование давления); 2 выход паров; 3 — де-
тектор; 4 — заполненная колонка; 5 — место ввода (впрыскивания) образца; £ — нагретый
термостат. С помощью детектора измеряют различья в каЕснх-либо свойствах одного только
газа-носителя и газа-носителя плюс образец (на выходе из колонки}. Различия в теплопро*
водности в особенности легко поддаются измерению и позволяют достичь высокой чувстви-
тельности при детектировании
из колонки для дальнейшего анализа. Если все попытки разделить
данный образец хроматографическим путем не приводят к успеху, то
этб свидетельствует, что имеют дело с индивидуальным чистым хими-
ческим веществом (хотя это и не всегда может быть так). Применение
метода не ограничивается окрашенными веществами, хотя, разуме-
ется, визуальное детектирование и разделение различных зон нельзя
использовать в тех случаях, когда некоторые (или все) компоненты
смеси бесцветны. Однако принципы разделения и в этом случае ос-
таются прежними.
В последние годы газо-жидкостпая хроматография (называемая
также парофазной хроматографией) открыла новые возможности
анализа летучих веществ. О важности газо-жидкостной хромато-
графии (ГЖХ) можно судить на основании того факта, что с ее по-
мощью легко проанализировать любые смеси соединений, структуры
которых приведены на рис. 1-1 (большинство из них представляет
собой низко кипящие жидкости). Обычный метод ГЖХ состоит в
том, что несколько микролитров анализируемой жидкости вводится
в испаритель и уносится потоком газа (обычно гелия) в длинную на-
гретую колонку, которая заполнена каким-либо пористым твердым
веществом (например, измельченным огнеупорным кирпичом), про-
питанным нелетучей жидкостью или маслом. Происходит распре-
деление вещества между газом и жидкостью, причем небольшие раз-
личия в таком распределении для компонентов смеси могут быть
резко увеличены вследствие большого числа повторных распреде-
лений, происходящих в длинной колонке. Детектирование обычно
производится путем измерения изменений теплопроводности газа
на выходе. Схематическое изображение аппаратуры для ГЖХ и ти-
пичный Пример разделения с егб помощью представлены на рис. 1-8
(I
СТРУКТУРА, ИДЕНТИФИКАЦИЯ И НОМЕНКЛАТУРА
3!
Рис. 1-9. Газо-жидкостная хроматограмма смеси изомерных бутиловых спиртов
С4НаОН.
и 1-9. Несмотря на то что обнаружение одного пика при анализе с
помощью ГЖХ является хотя и необходимым, но не достаточным
1 видетельством чистоты вещества, этот метод исключительно полезен
|.ля обнаружения малых количеств примесей в тех случаях, когда
। щи отделяются от основного пика. Метод ГЖХ может быть также с
, спехом применен для очистки веществ, Для чего количество образ-
i>.i и размер аппаратуры должны быть значительно увеличены. Па-
ры чистого вещества конденсируются при выходе их из колонки.
Б. Идентификация
После того как установлена чистота Какого-Либо соединения,
возникает задача его идентификации. При этом могут быть осно-
вания предполагать, что данное вещество, является соединением,
которое уже было ранее описано. Если это так, то наилучшим спосо-
бом установления идентичности исследуемого образца и вещества,
(.писанного ранее, будет сравнение их инфракрасных спектров, спек-
тров ядерного магнитного резонанса и масс-спектров*. Эти спектры
являются как бы «отпечатками пальцев» соответствующих молекул
п практически всегда достаточно индивидуальны для того, чтобы
можно было отличить неидентичные соединения друг от друга. Спек-
тральные методы анализа в настоящее время имеют стрль важное
Значение в органической химии, что заслуживают специального
рассмотрения (см. гЛ. 2).
* Более простым и более старинным способом идентификации является опре-
деление температуры плавления образца и смеси его с заведомым соединением.
ЧТО требует минимального количества вещества — Прцм. ред
34
ГЛАВА I
разрешение обычно достигается вплоть до масс, ранных 600. Моле-
кулярные массы соединений с очень большой молекулярной массой,
таких, как белки и. полимеры, обычно определяют путем анализа
на концевые группы, измерения осмотического давления, вязкости,
рассеяния света и скорости седиментации. Некоторые из этих
методов будут рассмотрены более подробно в последующих главах.
Упражнение 1-5. Образец жидкого вещества, содержащего углерод, водород и
кислород, массой 0,005372 г дал при сожжени i 0,01222 г СО2 и 0,00499 г НаО.
При определении по методу В. Мейера 0,0343 г соединения вытеснили прИ: 100сС
такое количество воздуха, которое, будучи собрано под водой при 27 °C (давление
паров воды 26,7 мм рт. ст.) и 755 мм рт. ст., заняло 15,2 мл.
Покажите, каким образом эти данные приводят к молекулярной формуле С3Н,;О.
Напишите по крайней мере 5 изомеров, соответствующих этой формуле при одно-
валентном водороде, двухвалентнои кислороде и четырехвалентном углероде.
Определение структурной формулы неизвестного соединения j
после установления его молекулярной формулы может оказаться ]
и легким и трудным делом. Обычно стараются получить возможно
больше спектральной и химической информации о природе присут-
ствующих в соединении групп. Если этого недостаточно для ус-
тановления структуры, то используют химические методы для то-
го, чтобы превратить данное соединение в соединение с известной
Структурой. Обычно при этом производится деструкция, т. е.
расчленение молекулы на части меныипх размеров. Характер полу- ; ;
ченных известных соединений и использованных для их получения :
реакций позволяет установить структуру .исходного неизвестного
вещества. Если для перехода к известным соединениям тре-
буется многостадийная деструкция, то определение строения ис-
ходного соединения напоминает подчас задачу установления' архи- >
тектуры здания по груде кирпичей, из которых оно было построено. *
В идеальном же случае с данным набором химических и физических
свойств согласуется только одна структурная формула. Этот иде- ;
ал часто оказывается недостижимым, и при решении сложных во-
просов строения для установления истинного положения атомов в
пространстве приходится прибегать к помощи рентгеноструктурно- i
го анализа и дифракции электронов. Окончательной проверкой пра- ;
вильности определения структуры служит обычно синтез данного
соединения каким-либо методом, однозначность которого не вызы-
вает сомнений. Если синтезированное таким образом и исследуемое i
соединения' оказываются идентичными, то предположенная струк-
тура считается правильной. Ниже приведен пример, иллюстрирую-
щий общий подход к проблеме установления структуры.
Никотин относится к важному классу природных соединений, :
называемых алкалоидами. Они представляют собой азотсодержащие |
соединения растительного происхождения, обладающие основным
характером. Сам никотин, содержащийся в листьях табака,— жид-
СТРУКТУРА, ИДЕНТИФИКАЦИЯ И НОМЕНКЛАТУРА
35
кость с т. кип, 265 °C. Анализ и определение молекулярной массы.
никотина соответствуют молекулярной формуле C1UH14N2. При
окислении хромовой кислотой никотин распадается на более мелкие
фрагменты. Один из таких фрагментов представляет собой вещество
кислого характера состава CsHsO2N; показано, что оно идентично
пиридин-3-карбоновой кислоте (I). Это свидетельствует о том, что
никотин содержит пиридиновый цикл, замещенный в положении 3
на группу C5H10N
НС^4 эС—CSH1ON
I II 9
HC^j »СН
N
НИКОТИН
окисление
------------>
Н
^С.
нс^" с-со»н
I II
НС. .сн
Циридин-З-карбоновая кислота
(I)
С целью определения строения группы Сф-ТюМ может быть про-
ведена серия превращений, изменяющих ядро пиридина таким обра-
зом, что атака окислителя направляется на это видоизмененное
кольцо, оставляя группу CSHMN незатронутой. Одним из выделяе-
мых при этом фрагментов оказывается кислота (CbHhOjN), идентич-
ная N-метилпролину (II), соединению с известной структурой
и
с
11- С-CSH1ON несильно стадий
J л -------->-
|1< хсн
""'N
1-нкиГИН
окисление _ „ ,,
-------->- H02C-CjHjoN
ивдентифицируется как
н.-сн-
НО2С~СН снг
I
CHj
Н -метилпродш
(П)
Соединив фрагменты I и П, получаем систему, которая вероятнее
всего должна соответствовать структуре никотина.
2*
= 36
ГЛАВА I
никотин
Соединение такой структуры было синтезировано по крайней мере
двумя не вызывающими сомнения способами, и поскольку оно ока-
залось идентичным природному никотину, предложенную выше
структуру можно считать правильной.
Упражнение !-в. Соединение, согласно данным анализа; имеет формулу
C5H^; при энергичном окислении оно дает бензойную кислоту.
Н
С со,н
/^/
нс с
нс du
бензойная кислота
Какие четыре структуры можно предложить дал этого соединения?
1-7. Номенклатура органических
соединений
Прогресс науки зависит от обмена фактами и идеями. Огромное
число, сложность и многообразие органических соединений прида-
ют проблеме номенклатуры первостепенное значение. В идеале
каждое органическое соединение должно иметь систематическое
название, которое позволяло бы написать для этого соединения
.только одну структурную формулу. В ряде современных систем но-
менклатуры этот идеал почти достигнут, что позволяет составлять
очень полезные указатели для обширных сводок фактических дан-
ных по органическим соединениям. К сожалению, истинно система-
тическая номенклатура, по-видимому, непригодна для целей уст-
ного общения или повседневного написания, и обычно, за исключе-
нием случаев строгого каталогизирования и индексирования, ис-
пользуется смесь тривиальных и полусистем этических названий.
Искоренение нежелательных или устаревших систем номенклатуры
Является необычайно трудных) делом, и для того, чтобы читать или
разговаривать в области органической химии, необходимо быть
.знакомым с различные системами номенклатур. Насколько это
СТРУКТУРА, ИДЕНТИФИКАЦИЯ И НОМЕНКЛАТУРА 37
возможно, следует избегать названий, вовсе не соответствующих
структуре. Однако очевидно, что это не всегда оправдано, поскольку
название, наиболее хороню соответствующее структуре, может ока-
заться очень громоздким. Нетрудно видеть, что 9-(2,6,6-триметйл-
н.иклогексен-1-ил)-3,7-диметилнонатетраен-2,4,6,8-ол-1 проигрывает
в фонетическом отношении при сравнении с обиходным названием
витамин А.
Полусйстематические и тривиальные названия органических со-
единений отшлифовывались в течение долгого времени: они широко,
используются и сейчас. Химики-органики по сравнению с исследо-
вателями в других областях науки были довольно объективны в
выборе названий для соединений и за 'немногими исключениями
игнорировали личные или националистические побуждения; Инди-
видуальные соединения неизвестной структуры назывались обычно
в соответствии с источником, из которого они впервые былй полу-
чены. Такие названия, как пенициллин, стрептомицин, стрихнин
и т. д., обычно удерживаются еще долго после того, как для них ста-
новится возможным использовать систематическое название, В ряде
случаев соединения новых типов могут называться в соответствии
с их цветом (если он характерен) или в соответствии с формой их
молекул» напоминающей известные предметы, например азулен
мшйй), коронен (корона) и т. д.
В данной книге максимально будет использоваться системати-
ческая номенклатура, но при- этом неминуемо смешение различных
। истем. Например, сравнительно простое соединение III имеет три
общеупотребительных названия: znpem-бутиловый спирт *, три-
четил карбинол и 2-метил пропанол-2. Первое название йспользует-
<.я наиболее широко, й поэтому здесь соединение III будет назы-
ваться mpem-бутилевым спиртом. Соединение IV лишь немногим
о южнее и имеет названия сс,<х-дпметплаллиловый спирт и 2-метил-
Ггутен-З-ол-2. Оба названия правильны и оба употребляются.
В подобных случаях мы будем часто использовать систематическое
СН3 сн=сна
СНз-С-Он СН3-(!-ОН
I 1
сн3 сна
III IV
название 2-метплбутен-3-ол-2 и указывать в скобках полусистема-
тнческое название а,а-дцметилаллиловый спирт. Например:
СН„ = СН—СН2—СН2Вг.
4‘бромбутги-1 (аллнлкарбинилбромид)
В настоящий момент нецелесообразно объяснять, каковы систе-
мы номенклатуры, к которым относятся оба; эти названия. Различ-
* Сокращение трет ставится вместо слова третичный, значение которого
будет определено позднее.
38
ГЛАВА t
ные вопросы номенклатуры будут рассматриваться в последующих
главах книги в качестве логического приложения к основной теме
обсуждения.
Дополнительные упражнения
1-7. (Данная задача в сущности является повторением элементарной неорганичес-
кой химии и может потребовать наведения справок в учебнике общей химии.)
Напишите структуры Льюиса Для каждого из приведенных ниже соединений. Ис-
пользуйте четкие, правильно размещенные точки для обозначения электронов.
Поставьте на всех атомах, которые не являются нейтральными, заряды соответ-
ствующего знака.
а) аммиак
б) нитрат аммония
в) цианистый водород
г) озон (угол О—О—О 120°)
д) окись углерода
е) хлорная кислота
ж) перекись водорода
я) гидрокси лам ин HONHe
и) трехокись серы
к) серная кислота
л) трехфтористый бор
м) Р4 (тетраэдрическая молекула)
н) окись азота NO
о) азотистоводородная кислота HN3
(угол N—N-N 180°)
п) закись азота N20
(угол N — N-0 180°)
1~8. Используя шаростержневые модели или соответствующие трехмерные рисун-
ки, установите, какие из приведенных ниже' формул изображают идентичные
соединения (предполагается, что «свободное вращение» возможно вокруг всех
простых связей, за исключением тех случаев, когда эти связи входят В состав
циклической структуры).
НН НН II CI
а)С1 — С—(i—Н Н—(!—(i—Н Н—С—(!—Н
11 11 I 1
НН НС] НН
СТРУКТУРА, ИДЕНТИФИКАЦИЯ И НОМЕНКЛАТУРА
39
1-9. Напишите структурные формулы дли каждого из перечисленных ниже соеди-
нений, используя четырехвалентпый углерод, двухвалентный кислород и однова-
лентный водород.
а) Три изомерных соединения общей формулы С3НвО.
б) Два изомерных соединения общей формулы С3НЛО, каждое из которых со-
держит двойную связь углерод — кислород и две метильные (СНа—) группы.
в) Соединение с формулой СЙН|0, в котором все атомы водорода находятся в
химически идентичных положениях,
г) Два изомерных соединения общей формулы С3Н|0, в каждом из которых две,
и только две, метильные группы (СН3—) находятся в химически идентичных поло-
жениях (целесообразно использовать модели).
1-10. Напишите распространенные структурные формулы (подобно формулам в
упражнении 1-8) для соединений, приведенных ниже в виде сжатых формул. В на-
писаИных вами формулах все атомы должны иметь нормальные валентности.
а) СНяСНВгС(СН;,)2ОСН3
б) [(СИ,)гСН]2СНОН
в) С(СИ2ОН)2(СНС|„)2
Г) CfCHL^CfCH^
д) (СН2)2СНС|
е) (СН2)ьС(СНО)г
ж) (CH3)bC(CN)CH2CI
а) СН5СОаСНэ
/-//.Рассмотрите возможность использования шаростержневых моделей для изо-
бражения структуры циклобутана (СН0)4, циклогексана и норбор пана. Опреде-
лите но этим моделям, какую степень искажения нормальных валентных углов
\ г,череда можно ожидать в данных соединениях.
ГЛАВА
СПЕКТРОСКОПИЯ
ОРГАНИЧЕСКИХ МОЛЕКУЛ
Современный химик-органик широко использует спектроскопию
J для целей структурного и количественного анализа. При получе-
нии нового соединения первоочередной задачей после определения
его температур плавления и кипения (или даже до этого) является
исследование его спектральных свойств, поскольку никакая серия ’=
химических проб не может дать столько информации в такой же
короткий срок. Поэтому в данной книге важнейшие спектральные
свойства каждого из основных классов Органических молекул будут
рассматриваться 'параллельно с их химическими свойствами. В нас-
тоящей. главе приведены основы наиболее широко используемых спек- '
тральных методов; они изложены несколько подробнее, чем это не-
обходимо для изучения начальных глав книги. Желательно, чтобы чи-
татель возвращался к материалу этой главы по мере того, как в
последующих главах будут излагаться новые спектральные данные.
Особое внимание уделено спектроскопии ядерного магнитного ре-
зонанса, несмотря на то что этот метод нашел широкое примене-
ние только' в последние десять лещ. Причина этого заключается-в
легкости интерпретации и предсказаний, основывающихся на спект-
рах ИМР и на, большей в целом пригодности данного метода для
характеристики веществ, открытия примесей и анализа простых
смесей ораганических соединений по сравнению с другими разновид-
ностями спектров.
Можно отложить изучение всей гл. 2 или некоторых ее частей
до ознакомления с гл. 5, посвященной описанию органических мо-
лекул в терминах атомных орбиталей,— вопроса, который сущест-
вен для понимания электронных спектров, или, наоборот, с мате-
риалом гл. 5 можно ознакомиться прежде, чем с гл. 2—4.
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
41
Практически все части электромагнитного спектра — от рент-
геновских лучей до радиоволн — находят применение при изуче-
нии органических молекул. Использование дифракции рентгенов-
ских лучей для определения структуры молекул в кристаллах имеет
особую ценность для органической химии, но, к Сожалению, этот
метод в настоящее время недоступен для повседневного использо-
вания. Даже с помощью быстродействующих электронно-вычисли-
тельных машин расшифровка Сложных структур обычно требует
от одного до двух лет работы. Дифракция электронов и нейтронов
может применяться в особых случаях, в частности если исследова-
ние с .помощью рентгеновских лучей либо затруднительно (когда
соединение представляет собой в обычных условиях газ или жид-
кость), либо не дает достаточной точности (для атомов, подобных во-
дороду, с очень малой способностью к рассеянию). Хотя, как уже
говорилось, дифракционные методы позволяют полностью уста-
новить структуру органических молекул, невозможность исполь-
зования в повседневной работе препятствует их широкому внедре-
нию в практику органической химии.
В данной главе внимание будет сосредоточено главным образом
на таких видах спектроскопии, которые либо пригодны для повсе-
дневного использования уже в настоящее время, либо смогут при-
меняться в ближайшем будущем. Как можно будет видеть, эти
методы используются химиками-органиками более или менее эм-
пирическим'путем. Каждый из этих методов основан на некотором
обратимом изменении, происходящем в атоме или молекуле при
возбуждении их под действием излучения. Основными видами спек-
тральных методов являются следующие:
Для атомов
Абсорбционная спектроскопия атомов (атомные или линейчатые
спектры) — возбуждение электронов.
Для молекул
Микроволновая спектроскопия — возбуждение вращательных
уровней.
Инфракрасная и комбинационного рассеяния света спектро-
скопия— возбуждение вращательных и колебательных уровней.
Спектроскопия в ультрафиолетовой и видимой частях спектра —
возбуждение электронов, сопровождающееся изменениями .колеба-
тельного и вращательного состояний.
Спектроскопия ядерного магнитного резонанса — возбуждение
атомных ядер, обладающих магнитными свойствами, под действием
радиочастотного излучения в магнитном поле.
Масс-спектроскопия :— бомбардировка молекул электронами
средних энергий и определение распределения й масс образующихся
заряженных осколков. Эти изменения необратимы.
42 ГЛАВА 2
2-1. Линейчатые, спектры
Поглощение электромагнитного излучения одноатомными га-
зами, например ларами натрия, приводит к высоиослециф.ччному
изменению электронной конфигурации. Если определить и нанести
на график поглощение как функцию длины волны, то получается се-
рия очень узких полос поглощения (линий).
Каждая линия поглощения соответствует изменению электрон-
ной энергии, которым сопровождается возбуждение электрона и
переход его с одной квантовомеханической орбитали на другую.
А
Энергия I
------1-------£)
В частности, для линий, которые появляются в результате перехода
из нормального, или основного, состояния (Ei) в состояние с более
высокой энергией (Е^), изменение энергии составляет ДЕ1>а. Разни-
це энергий ДЕ12 соответствуют частота (v, с-1) или длина волны
(X , см) поглощаемого излучения, связанные с ней уравнением
= у,
где h— константа Планка иг — скорость света. Поскольку, как
правило, интерес представляет изменение энергии, выраженное в
килокалориях (1 ккал = 103 кал) и сопровождающее поглощение из-
лучения 1 г-атомом (или молем) атомов (или молекул), можно пере-
писать приведенное выше уравнение в следующем виде,
. р 286 000
ДЕ, » =----—ккал,
1,8 Х,(А)
где X выражена в ангстремах (A=10~s см=0,1 нм). При таком оп-
ределении ДЕ\,2 соответствует 1 эйнштейну излучения.
Упражнение 2-1. Рассчитайте энергию (в ккал), соответствующую поглощению
1 эйнштейна света с длиной волны 5893 А (D-линия натрия) парами натрия. Ука-
жите, какое применение в химии может найти поглощение света парами натрия?
2-2- Микроволновая спектроскопия
Спектры даже простых двухатомных молекул гораздо сложнее,
чем спектры атомов. К энергии, связанной с силами электрического
притяжения и отталкивания в молекуле, в этом случае добавляется
кинетическая энергия вращательного движения молекулы или ее
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
43
частей, а также колебательного движения атомов в каждой химиче-
ской связи (одного относительно другого). Общая энергия молекулы
Е (помимо ядерной энергии) может быть выражена в виде суммы трех
энергетических членов:
Е = Г(электронная) + Е (вращательная) + ^колебательная)
Поглощение молекулой электромагнитного излучения может про-
исходить не только при электронном возбуждении того типа, кото-
рый был описан для атомов, но также при изменениях колебатель-
ной и вращательной энергий.
Как вращение, так и колебания молекул квантованы. Это озна-
чает, что возможны только определенные значения вращательного
углового момента или колебательной энергии. Мы называем разре-
шенные значения энергии вращательными и колебательными энер-
гетическими уровнями.
Вращательные энергетические уровни расположены обычно
очень «тесно», так что излучения весьма низкой энергии, например
такого, которое генерируется радиопередатчиками, работающими
в микроволновом диапазоне, достаточно для того, чтобы изменить
энергию молекулярного вращения. Поскольку электронные и коле-
бательные уровни энергии отстоят друг от друга гораздо, дальше
и изменения между ними вызываются излучением гораздо более
высокой энергии, микроволновое поглощение может быть охарак-
теризовано как почти чистый вращательный спектр. Микроволно-
вые спектры дают возможность получить сведения о вращательном,
моменте инерции и из них — значения длин связей и углов между
связями для простых молекул. Однако микроволновая спектроско-
пия требует применения довольно сложной аппаратуры, и интерпре-
тация спектров сравнительно трудна; по этой причине микровол-
новое поглощение до настоящего времени не используется в орга-
нической химии в качестве повседневного аналитического метода.
2-3. Инфракрасная спектроскопия
Инфракрасный спектрометр — прибор, наиболее широко исполь-
зуемый для исследования структуры органических соединений. Ин-
фракрасные спектры в диапазоне длин волн от 2 до 15 мк (1 мк=
=10“* см) представляют наибольший интерес. Промышленностью
выпускаются записывающие инфракрасные спектрофотометры,
обладающие отличным разрешением и воспроизводимостью.
На рис. 2-1 приведена принципиальная схема такого спектро-
метра. Кювета, в которую помещается образец, и оптическая часть
инфракрасных спектрофотометров сделаны из каменной соли' (NaCl)
или сходных материалов, поскольку стекло непрозрачно для ин-
фракрасного излучения. Можно использовать газообразные, жид-
кие и твердые образцы. Твердые вещества часто исследуются в виде
44
ГЛАВА 2
Рис. 2-L Схематическое изображение «двухлучевого» записывающего инфра-
красного спектрометра.
I —г самописец; J — детектор инфракрасного излучения (термопара, «болометр»); 3 кюве-
та с раствором образца; 4 — щелк; 5 — мотор; 6 — призма NaCI: Г — прерыватель луча)
8 ~ кювета с растворителем; S источник инфракрасного излучения (нить, нагреваемая
ТОКОМ).
Прерыватель 7 заставляет луч на пути к термопаре 2 проходить поочередно то через кювету
с образцом а, то через кювету е растворителем в, Этот метод позволяет определить различие
И поглощении растворённого вещества к растворителя п виде переменного электрического
тока, идущего от термопары. Получение ца выходе переменного тока особенно желательно
при электронном усилении. Приборы, выпускаемые промышленностью, работают по «нуле-
вому» при в ципу, при котором перо самописца механически соединено с «решеткой* (здесь не
показанной), позющецаой на путл луча, проходящею через кювету с растворителем, и двц.
жущейся с помощью сервомеханизма таким образом, чтобы повысить или понизить интенсив-
ность луча,, проходяще го через зту кювету. Сервомеханизм приводится в действие усиленным
сигналов, идущим от термопары; сто назначение — сделать рапным интенсивность луча,,
идущего через растворитель, и интенсивность луча, идущего через раствор, т. д, свести
сигнал, идущий от термопары, к нулю. Спектр может быть развернут по различным длинам
воли с помощью поворота призмы, синхро низв ров а н но го о движением барабана самописца.
Вместо призмы все чаще применяются дифракционные решетки.
тонких суспензий в различных маслах или растираются с бро-
мистым калием и прессуются с помощью гидравлического пресса
в табдетки. Между спектрами твердого вещества и спектрами его
растворов часто наблюдаются значительные различия.
На рис. 2-2 приведены типичные инфракрасные спектры ацетона
СН3—С—СН3 и метилэтилкетона СН,—С—СН2—СНа.
. Г : : -
В соответствии 6 современной практикой приведенные здесь ин-
фракрасные спектры построены в линейной шкале для волновых чи-
,сел ('V, см*1), связанных с частотами излучения (v, с-1) таким обра-
СПЕКТРОСКОПИЯ OP ГЛ НИМ ЕС КИ X МОЛЕ К УЛ 45
Длина волкьц ми
-1----1 ...I ' > ’ ’ V .............................. J_____I____I____I----L
3600 3300 2SOO 24№ 3000 3000 Г0<Ю 1600 1400 П00 > 000 ДО
Частота, см*1
Рис. 2-2. Спектры поглощения в инфракрасной области ацетона (а) и метил-
этилкетона (б) (в парах).
зом, что v=v/c. Приведена также дополнительно нелинейная шкала,
выраженная в микронах; для перевода волнового числа v в длину
волны X, выраженную в микронах, используют соотношение 1= 104/v.
Существует некоторая Непоследовательность в отношении единиц, используе-
мых для выражения длин волн или частот для различных видов спектров. В слу-
чае электронных спектров А чаще всего выражается в ангстремах (iO-*1 см) или
миллимикронах (10_? см). В случае инфракрасных спектров поглощенное излу-
Таблица 2-1
Некоторые характеристические частоты поглощения
в инфракрасной области
Си язь Соединение Частота, см-1 Интенсивность и характер полосы
-с-н 1 Алканы 2850—2960 Сильная
1 -C-D Алканы —2200
1 =с-н Алкены и арены 3010—3100 Средняя
эС-Н Алкины 3300 Сильная, резкая
1 1 -с-с- 1 1 Алканы 600—1500 а Слабая
1 1 i L Алкены 1620—1680 Переменная
' J -CasC- Алкины 2100—2260 Я
-C-=N Нитрилы 2200—2300 »
1 -C-O- Спирты — d—ОН, простые эфиры —С—О——.карбо- новые кислоты —С—ОН, II 0 1 сложные эфиры -С-О — С— А 1 1000—1300 Сильная
\c=o Альдегиды — С — Н 11 О 1720—1740 »
^c=o Кетоны —С—С—С — 1 й 1 1705—1725 £
>c=0 Кислоты —С—О—Н, сложные II ° д эфиры - С—О—С— II 1 О 1700—1750
а Как правила, валентные колебания простой С — С-связи не используются для идеи1
тйфикации.
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
47
I Продолжение табл, 2-1
* Связь Соединение Частота, ем-1 Интенсивность н характер полосы
—о-н Спирты — С—О—Н, фенолы =С-О-Н 3590—3650 'Переменная, резкая
-о-н — О—Н...О^, соединенные водородной связью (в спиртах и фенолах) 3200—3400 Сильная, широкая
-о-н — О—Н...О(/, соединенные водородной связью (в кисло- тах) 2500—3000 Переменная, широкая
-nh2 1 Амины —С—-NHj Н 1 1 1 3300—3500 (двойной пик) Средняя
I — N —Н 1 1 1 Амины —С—N—С— 1 1 3300-3500 (одиночный пик) »
чепие выражается через длины волныХ в микронах (10_4 см) или частотуv в волно-
иых числах (!04Д см-1).
В целом поглощение в диапазоне 5000—1250 см-1 связано с из-
менениями колебательных состояний различных связей и сравни-
тельно характеристично для различных типов присутствующих свя-
тей (табл. 2-1). Так, полосы в спектре ацетона (рис. 2-2, а) при
.5050—1740 см-1 обусловлены поглощением инфракрасного излуче-
ния, причем поглощенная’энергия вызывает переходы между энер-
гетическими уровнями валентных колебаний связей С—Н и С—О
соответственно. Полосы поглощения между 1250 и 675 см-1 обычно
связаны со сложными изменениями колебательной, и вращательной
энергии молекулы как целого и являются очень характерными для
каждой данной молекулы. Эту часть спектра часто называют об-
ластью «отпечатков пальцев»; она чрезвычайно полезна при опреде-
лении химической однородности исследуемого образца. Легко ви-
деть, что спектры ацетона и метилэтилкетона очень близки в обла-
сти от 4000 до 1250 см"1, но существенно различаются в области
1250—675 см"1.
Следует заметить (рис. 2-2), что инфракрасные спектры органи-
ческих молекул не содержат особенно узких линий поглощения.
Это вызвано тем, что изменения вращательной энергии могут про-
48
ГЛАВА 1
колебательные
переходы
вращательные
уровни энергии
Рис. 2-3. Схематическое изображение колебательных и вращательных уровней
энергии.
исходить одновременно с изменением колебательной энергии, что
наглядно изображено на рис. 2-3. Каждый из приведенных здесь
колебательных уровней £, и £г связан с расположенными близко к
нему вращательными уровнями. Переходы между £i и Е2 могут со-
провождаться также изменениями вращательных уровней. В этих
случаях наблюдается «полоса» очень тесно расположенных линий
для каждого изменения колебательной энергии. Для сложных моле-
кул-, особенно в жидком состоянии,^тонкая вращательная структу-
ра» данной полосы обычно не может быть разрешена.
Упражнение 2-2, Укажите приближенно положения и интенсивности характе-
ристических полос поглощения в ИК-спектрах, соответствующих валентным ко-
лебаниям следующих молекул:
HOD
а) ацетон-1,!,!•% H-^-C—i-D : -
Н D
. Н
б) мети л ацет плен Н—С—CsssC^-H
.1
И
Пропускание,
Длина мк,
3 4 5 5 ₽ 7 .3. 9 Ю 12 14
Рис. 2-4. Инфракрасные спектры к упражнению 2-3.
50
ГЛАВА 2
н н н
в) этилацетат Н—С—С —О—С—с! —Н
А А А А
н. ,н
г) акрилонитрил /С='Сб
н/ ХС = N
Н .0 о
। и J
д) пировиноградная кислота Н—С—С—С—ОН
I
Н
Н Н
е) этиловый спирт Н—А—А—О—Н (чистая жидкость и разбавленный
I I раствор)
И 1-1
Упражнение 2-3. На рис. 2-4, «ибприведены ИК-спектры соединений, имеющих
формулы С3НсО и С^Н^О, соответственно, Используя данные табл. 2-1 и молеку-
лярные формулы, выведите структуры каждого из этих соединений из сто ИК-
спектра. Точно укажите, какие линии в спектре к каким группам в написанных
вами структурах вы относите.
2-4. Спектры комбинационного рассеяная
(рамановская спектроскопия)
Спектры комбинационного рассеяния (КР-спектры) * часто ока-
зываются чрезвычайно полезным дополнением к И К-спектроскоп ин.
Аппаратура, используемая при снятии КР-спектров, в принципе
очень проста. Монохроматическое излучение, например от ртутной
лампы низкого давления, проходит через образец, и свет, рассеян-
ный под прямыми углами к входящему лучу, анализируется опти-
ческими спектрометрами, как это показано на рис. 2-5.
КР-спектры возникают в результате «захвата» на мгновение мо- .
лекулой легких фотонов и приобретения последними (или потери)
небольших количеств энергии вследствие изменения колебательной
или вращательной энергии молекулы; далее захваченные фотоны
излучаются в виде рассеянного света. Изменение колебательной и
вращательной энергии приводит к изменению длины волны падаю-
щего света; на фотопластинке спектрометра комбинационного рас-
сеяния это проявляется в виде дополнительных линий, расположен-
ных выше и'ниже длины волны падающего света. Положение линий
в КР-спектрах всегда выражается в волновых числах, Промышлен-
* Спектры комбинационного рассеяния, открытые одновременно Лаидсбер.
гом и Мандельштамом в СССР и Раманом в Индии, очень часто называют но имени
индийского ученого Раман-спектрами.—Прим. ред.
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
51
*- нерассеяииый
свет
ртутная
лампа
образец
Рис. 2-5. Принципиальная схема спектрометра комбинационного рассеяния.
постью выпускаются высокоэффективные записывающие спектро-
метры комбинационного рассеяния света.
Несмотря на то что изменения длины волны при комбинацион-
ном рассеянии света соответствуют поглощению или излучению в
инфракрасной области, ИК- и КР-спектры не всегда оказываются
идентичными. Так, часто при сравнении этих спектров может быть
получена ценная информация относительно симметрии молекул.
Причина заключается в том, что электрически симметричная связь
гг. е. связь, не имеющая дипольного момента) не поглощает в ин-
фракрасной области. Например, симметричные двухатомные моле-
кулы, подобные Hs и О2, всегда электрически симметричны и не
дают поглощения в инфракрасной области. Однако при комбинаци-
онном рассеянии происходит возбуждение симметричных колеба-
ний *. В такой молекуле, как этилен СН2=СН2, валентные колеба-
ния двойной связи симметричны, поскольку оба конца молекулы
одинаковы. В результате в ИК-спектре не проявляется поглощение,
обусловленное валентными колебаниями двойной связи; оно ока-
зывается слабым во всех этиленах, строение которых близко к сим-
метричному. Однако Это колебание сильно проявляется в КР-спект-
ре этилена и свидетельствует о симметричности структуры этилена.
В качестве общего вывода можно сказать, что молекула не имеет
существенных Свойств симметрии, если всем ее полосам поглоще-
ния в ИК-спектре соответствуют линии в спектре комбинационного
рассеяния. Для иллюстрации этих эффектов на рис. 2-6 и 2-7 ири-
* Это находится в полном соответствии со спектральными «правилами от-
бора», следующими из теоретических соображении, которые позволяют предекя-
:Н1 it,, какие переходы между вращательными и колебательными уровнями энергии
«разрешены;» и какие из них «запрещены».
52.,
ГЛАВА i
Рис. 2-6. ИК-спеКтры и спектры комбинационного рассеяния тетрахлорэтилена
(обратите внимание, что разметка горизонтальных шкал неодинакова).
ведены И К- и КР-спектры тетрахлорэтилена и циклогексена. По-
глощение, обусловленное валентным колебанием двойной связи в
тетрахлорэтилене.(1570 см"*), сильно проявляется в КР-спектре и
отсутствует в инфракрасном,.тогда как поглощение, обусловленное
, менее симметричной двойной связью циклогексена (165§ см"1),
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Пропускание, % Пропускание,
Гис. 2-7. И К-спектры и спектры комбинационного рассеяния циклогексена (об-
ратите внимание, что разметка горизонтальных шкал неодинакова).
слабо проявляется в И К-спектре й
Спектре.
несколько сильнее — в КР-
С|
тетрахлорэтилен
циклогексен
51
ГЛАВА 2
Упражнение 2-4. Классифицируйте приведенные ниже молекулы в соответствии
с основными особенностями их ИК-и КР-спектров.
а) С13 г) CF2=CH2 (только валентные колебания двойной связи)
б) НС! д) (СН3)2С=СНа
в) СО е) СН3СН=СНСН3 (только валентные колебания двойной
связи)
Упражнение 2-5. Двуокись углерода дает две полосы поглощения в ИК-области,
но только одну линию в КР-спектре; эти три полосы соответствуют различным ко-
лебаниям. Укажите три различных способа, которыми могут колебаться три атома
в О=С=О один относительно другого так, чтобы центр тяжести не изменял поло-
жения. Определите, какие два из этих колебаний активны в инфракрасной облас-
ти, т.е. делают молекулу электрически несимметричной (во время по крайней мере
части колебания), и какое активно в КР-спектре (т. е. происходит таким образом,
что молекула остается электрически симметричной в течение всего времени ко-
лебания).
2-5. Электронные спектры органических
молекул
Поглощение света в видимой и ультрафиолетовой областях при-
водит к изменению электронной энергии молекул, связанному с '
возбуждением электронов, приводящим к переходу их со стабиль-
ных орбиталей на нестабильные. Для большинства таких изменений
невозможно точно изобразить структуру возбужденного состояния
с помощью обычных связей, поскольку возбужденный электрон не
находится на нормальной связывающей орбитали. Переход электро-
на из основного состояния в возбужденное Е2 сопровождается
изменениями колебательной и вращательной энергии молекулы, как
это показано на рис. 2-8. Обычно оказывается невозможным разре-
шить получающиеся в результате полосы поглощения в такой сте-
пени, чтобы можно было увидеть тонкую структуру, обусловленную
колебательно-вращательными переходами. Вследствие этого полосы
поглощения, связанные с электронным возбуждением, оказываются
сравнительно широкими.
Ультрафиолетовый спектр ацетона приведен на рис. 2-9 *. Сла-
бое поглощение с пиком (т. е. с\а1!С) при 2800‘А является резуль-
татом перехода одного из неподеленных электронов кислорода на
более высокий энергетический уровень. Он называется n-4-я*-
переходом (часто Л'-^Л), где п означает, что возбуждаемый электрон
является одним из неподеленных п-электронов кислорода, и л*
* Аппаратура для снятия таких спектров обычно очень сходи? по своей кон-
струкции с инфракрасным спектрометром (рис. 2-1). Основное отличие заключается
в использовании водородной (1800—4000А) или вольфрамовой (3200—8000А) ’
лампы в качестве источника света; используются также кварцевые призмы и кю-
веты для образцов и фотоэлементы (а не термопары) для детектирования излуче-
ния. В этих спектрометрах призма помещается перед образцом.
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
55
1'ис. 2-8. Схематическое изображевис электронных, колебательных и вращатель-
ных уровней энергии.
Рис. 2-9.,Ультрафиолетовый спектр ацетона в циклогексане.
укатывает, что возбужденный электрон переходит на нестабильную
(Ин< называемую разрыхляющую) орбиталь двойной связи углерод —
Кислород (эти и подобные им обозначения получат более подробное
J4WJ1 А. X—...» >L. I . in' ” " |Ий|ППИИ^^^^Я
!
56 ГЛАВА 2
объяснение в дальнейших главах). Такой же тип /w-л*-перехода
при почти той же длине волны и интенсивности происходит во мно-
гих простых соединениях общей формулы RaCO и RCHO, где R —
углеводородная цепь, не содержащая двойных связей.
КгС::о: R2c::6*
В спектре ацетона имеется еще один вид поглощения с
\акс 1900А (максимум на рис. 2-9 ие показан), который обусловлен
возбуждением другого рода. Этот тип возбуждения может вызвать
переход электрона с одной из связывающих орбиталей (называемых
я-орбиталями, см. гл. 5) двойной связи углерод—кислород иа
я*-орбиталь. Такие переходы называются переходами л-жт*; они
происходят, как правило, в соединениях с двойными связями.
ЯГ-^-ТГ* „ -
rzc::o; ----------->- нгсл°-
В табл. 2-2 приведены длины воли в максимумах поглощения
для ряда типичных электронных полос поглощения простых моле-
направлений слева Направо).
ь
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
57
Таблица 2-2
Некоторые электронные переходы в простых органических молекулах
Соединение Переход ^макс» А a Раствори- тель 4
(СН3)аС = О * g « •Й к о 11 f st Й ct 2800 1900 1560 15 1 100 Сильная Циклогексан
СНг=СН3 Л мл* 1620 10000 В газовой фазе
сн3=сн—си=сня Л—к Л* 2170 20 900 Гексан
СН3—СИ = си - сн = сн - сн3 л—* л* 2270 22 500 В
сн2 = сн - сн 3 - сн3 - сн = сн2 л —>-л * 1850 20 000 Спирт
си3—CeiCH Л кЛ* 1865 450 Циклогексан
CHat=CH—с = о п—ш* 3240 24 Спирт
1 сн3 л —гл* 2190 3 600
сн4 а—»-а*г 1219 Сильная В газоной фазе
I—СНЭ о—^<т*г 1350 3 То же
И3~С1 л —ка*д 1725 Слабая » »
Ы3 —Вг п —+-а*д 2040 200 » в
1 нк-1 п ь0*д 2575 365 Пентан
п —> а*д 1835 150 В газовой фазе'
1 [,-,0-сн„ п —г <т*д 1838 , 2 520 То же
р HS)3N а —к о*'1 2273 900 > а
я Молекулярный коэффициент поглощения а является мерой эффект и ппоетп поглоще-
на i ггри длине волны У1а|щ • Поскольку степень поглощения пропорциональна концецт-
....и {с, моль/л). н толщине кюветы (I, см), в-выражается урацнеиием е is ~~f~ •
i f0'/ —отношение интенсивностей падающего света !0 к иитепсппностп выходящего
tn и /. Процент пропускания раствора равен (///„) 100, Вещества, для которых е не sa-
.....г от концентрации, называют подчиняющимися закону Бера (или закону Ламбер-
'н - Вера),
(1 Растворитель необходимо указывать, так как XHaKt и емакс несколько изменяются
в 1 ич1Симости от растворителя.
11 Такое отнесение не является вполне надежным.
1 Переходы <т —* О* соответствуют возбуждению электрона простой связи (обоавача-
РН"Й о) в разрыхляющее состояние с более высокой энергией (обозначаемое о’}.
А Переходы л ,—> о* соответствуют возбуждению электрона неноделевной (т. е. не
Унщтпующей в образовании связи) пары ДО разрыхляющего состояния (о*) о-связи
Молекулы.
кул (более сложные соединения будут рассматриваться в последую-
щих главах). Учитывая то, что поглощение при, больших длинах
ноли соответствует переходам меньших энергий, следует сделать
Пынод, что для возбуждения пеиоделенных (не участвующих в обра-
UUIHHii।и связи) электронов требуется меньше энергии, чем для воз-
58
ГЛАВА 3
буждения электронов двойной и тройной связей; в свою очередь для
возбуждения этих электронов требуется меньше энергии, чем для
возбуждения электронов простой связи (включая о-связи, разд. 5-2).
Эта последовательность энергетических уровней схематически пред-
ставлена на рис. 2-10.
Упражнение 2-6. Перечислите в порядке возрастания энергии таны электрон-
ных переходов, которых можно ожидать в метиленимиие (CH3=NH). Используя
данные табл. 2-2, предскажите (приближенно) длины волн, при которых будут
происходить три перехода с наименьшей энергией.
Упражнение 2-7. Рассчитайте, какая часть (в процентах) падающего света будет
поглощена 0,010 М раствором ацетона в циклогексане, помещенном в кварце вук;
кювету толщиной 0,1 см, при 2800 и 1900 А.
Упражнение 2-8. Объясните, почему полоса поглощения триметиламина при
2273 А исчезает в кислом растворе.
2-6. Спектроскопия ядерного магнитного
резонанса
Спектры ядерного магнитного резонанса (ЯМР) чрезвычайно по-
лезны для идентификации и анализа органических соединений.
Принципы, на которых основав этот вид спектроскопии, весьма про-
сты. Ядра определенного рода атомов действуют как крошечные
магниты, которые в магнитном поле поворачиваются все в одном на-
правлении. В ЯМР-спектроскопии мы определяем энергию, требую-
щуюся для изменения направления магнитных ядер в магнитном
поле. '
Очень простой вариант ЯМР'Спектрометра схематически изоб-
ражен ,на рис. 2-11. Если соединение, например этиловый спирт
СНя— СН3— ОН, в котором ядра водородных атомов обладают свой-
ствами магнитов, поместить в центр катушки, расположенной
между полюсами магнита, и постепенно повышать напряженность
магнитного поля, то при некоторой напряженности последнего обра-
зец начнет поглощать энергию и токч протекающий по катушке,
возрастет. В результате получают спектр, подобный изображенному
на рис. 2-12. Этот спектр содержит достаточное число деталей и
поэтому может служить в качестве удобного «отпечатка пальца»
этилового спирта. В то же время, как будет показано ниже, он до-
статочно прост для того, чтобы можно было установить происхож-
дение каждой линии.
В какого рода соединениях можно ожидать поглощения вслед-
ствие магнитного резонанса ядер? Магнитными свойствами всегда
обладают ядра с массой, выражаемой нечётным числом: !Н, riC,’6N,
17О, ,!>F, С1Р нт. д.,и ядра с массой, выражаемой четным числом, но с
нечетным атомным номером; аН, 1(1В, S4N и т. д. Ядра, подобные 12С,
1!iO, 32S и др., с массой, выражаемой четным числом, и с четным атом-
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
59
, Магнитное поле с напряженностью Н
Рис. 2-11, Принципиальная схема простейшего ЯМР-спектрометра.
ным номером не обладают магнитными свойствами и не дают сигна-
лов ЯМР. По различным причинам наиболее широкое использова-
ние в органической химии получили спектры ЯМР атомов Ш, 1DF
и 31Р. Здесь будут рассматриваться в основном ЯМР-спектры водо-
рода (’Н).
•ЯМР-спектры могут быть настолько простыми, что будут со-
держать лишь один пик поглощения, но могут также быть гораздо
сложнее, чем спектр, приведенный на рис. 2-12. Сложная структура
спектра имеет положительную сторону, так как это делает его более
индивидуальным и более удобным для использования в качестве
«отпечатка пальцев» органической молекулы. Однако эта сложность
может затруднить использование спектров ЯМР для целей , каче-
Р»с. 2-]2. ЯМР-спектр этилового спирта (содержащего следы соляной КИСЛОТЫ),
Химические сдвиги даны относительно тетр ам эти л с ил а н a (CHi)jSl (ТМС). сдвиг которого
Принимается равным 0,00 м. д. Ступенчатая линия представляет собой результат интегри-
рования резонансных пиков.
60
глава а
ствениого анализа и установления структуры. К счастью, с помощью
замещений на изотопы и радиоэлектронного метода, известного под
названием двойной резонанс, теперь оказывается возможным ана-
лизировать сложные спектры, содержащие сотни линий. Описание
этих способов выходит за рамки настоящей книги, однако -важно
уяснить, что независимо от сложности спектра он может быть про-
анализирован в терминах трех факторов: химических сдвигов, спин-
спинового расщепления и кинетических процессов (скоростей ре-
акций).
Применимость того вида ЯМР-спектроскопии, который будет
здесь рассмотрен, ограничена жидкостями или растворами. К сча-
стью, круг подходящих для этой цели растворителей достаточно
широк — от углеводородов до концентрированной серной кислоты,
и для большинства соединений обычно удается подобрать соответ-
ствующий растворитель.
А. Сравнение fiMP с другими видами спектроскопии
Приведенное ниже обсуждение позволит более четко уяснить связь между маг-
нитно -резонансиым поглощением ядер и другими типами спектроскопии. Многие
атомные ядра обладают свойствами заряженных вращающихся тел, причем вра-
щение заряда приводит к: магнитному моменту, направленному вдоль оси нраще-
ния. Ядра, которые представляют особый интерес для химиков-органиков (*Н,
WC, 15N h10F), имеют спин I. равный 1/2. Это означает, что величины их магнитных
моментов в данном направлении могут иметь только два значения, равные по вели-
чине, но противоположные по знаку, соответствующие спиновым квантовым чис-
лам +Vs и —1/2. Таким образом, если ядра-помещены в магнитное поде Н с на-
правлением г, то они могут быть расположены только по направлению поля (/»=
-=+1А>) или против него (,/г=—Va). Как и в случае стрелки компаса я магнитном
поле Земли, наиболее выгодным является направление, совпадающее с направле-
нием поля. Разность анергий между этими двумя состояниями ЛЕ доджи,ч быть
пропорциональна напряженности поля ff. действующего на ядро. равна
уй///2я, гдей — константа Планка, а у — константа пропорциональности, харак-
терная для каждого типа ядра (Щ, laC, IbN и т. д;), Диаграмма энергетических
уровней для системы магнитных ядер со спином Va приведена на рис. 2-13.
—Iz=~ г
AE=yhH/2it
hr*
Рис. 2-13. Энергетические уровни магнитного ядра со спином ’/а и магнитном поле
с напряженностью Н.
В ЯМР-спектроскопии, как и в других видах спектроскопии, основа}!пых-на
поглощении электромагнитного излучения, Л.Е связана с частотой v выражением
&E~hv. Разность Энергий i\E=yhHI2n, отсюда v=y///2ft, Для того чтобы обна-
ружить поглощение, обусловленное ядерным резонансом, можно сохранять v
постоянной и варьировать // сравнительно близко к точке, где ,у=уН/2п. При
этом энергия поглощается ядром й ток, идущий от генератора радиочастоты, воз-
растает, что может быть обнаружено с помощью амперметра. Дальнейшее увеличе-
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
61
няе Н приведет к v^yW/2n, й при этом величина тока понизится до своего перво-
начального значения. В результате кривая поглощения энергии в зависимости от
// имеет вид, аналогичный приведенному на рис. 2-14; максимум пика располага-
ется в точке, где у=у///2л .
Б. Химический сдвиг
В этиловом спирте СН.5—СН2—ОН содержатся атомы водорода
трех типов: метильные (СНЭ), метиленовые (СНг) и гидроксильный.
В магнитном поле для ядер водорода каждого типа (протонов) маг-
нитное окружение будет немного различаться; причиной этого явля-
ется сдвиг валентных электронов соседних атомов при действии
внешнего магнитного поля. Напряженность магнитного поля при
данном ядре обычно меньше, чем напряженность приложенного
внешнего магнитного поля, поскольку движение электронов при-
водит к эффекту экранирования (так называемому эффекту диамаг-
нитного экранирования). Наиболее существенно то, что эффект,
возникающий при движении электронов, будет различен в зависи-
мости от типа водорода, и вследствие этого резонансный сигнал от
водорода каждого типа будет наблюдаться при различных напря-
женностях поля. Кривая зависимости величины сигнала от На-
пряженности поля (см. рис. 2-12) в случае этилового спирта
обнаруживает три основные группы линий, причем площади пиков
соответствуют числу атомов водорода каждого типа.
Различия напряженностей поля, при которых, дают сигналы
ядра одного вида (например, протоны или 16F), но находящиеся в
различном окружении, называются химическими сдвигами.
Химические сдвиги всегда измеряются относительно какого-
либо стандарта. Для протонов в органических молекулах обычным
стандартом является тетраметилсилан (CH3)4Si, который удобен
тем, что дает сильный и узкий резонансный сигнал в области, где
поглощают только очень немногие другие виды протонов. Химиче-
ские сдвиги обычно выражают в герцах (Гц) по отношению к тетра-
метилсилану (ТИС). Использование таких единиц для напряжен-
ности магнитного поля может показаться странным, но, поскольку
резонанс происходит при v=yH/2n, могут использоваться как еди-
ницы частоты (Гц, рад/с), так я единицы магнитного поля (гаусс).
Большинство ЯМР-спектрометров, используемых в лабораторной
практике, работает на радиочастотах 40, 60 или 100 МГц. Посколь-
ку химические сдвиги точно пропорциональны частоте спектрометра,
Рис. 2-14. Кривая поглощения в мето-
де ЯМР.
н—»
62
ГЛАВА 2
линии, расположенные при 100 Гц для рабочей частоты 60 МГц, бу-
дут находиться при 167 Гц в случае рабочей частоты 100 МГц. Для
удобства сравнения значения химических сдвигов, измеренные при
различных рабочих частотах и выраженные в герцах, часто делят
на частоту; полученная единица измерения называется ьг.,д. (мил-
лионная доля). Таким образом, если сигнал протона находится при
100 Гц в более слабом поле (в области более высоких частот) отно-
сительно тетраметилсилана при рабочей частоте 60 МГц, то он может
быть выражен следующим образом: • Ю6—+1,67 м. д.
относительно тетраметилсилана. При частоте 100 МГц эта линия
Таблица 2-3
Величины типичных химических сдвигов протонов
(разбавленные хлороформные растворы)
Тип протона а Химический сдвиг 6 Тип протона ® Химический сдвиг &
и. д. Гц в м. д. ГЦВ
R-CH, 0,9 54 О = С-СНа 2,3 126
R —СН3—R 1,3 78 1
К3СН 2,0 120 К
{?2С=СНа -5,0 300 R —СНа—Ci 3,7 220
RaC-CH -5,3 320 R—СН2—Br 3,5 210
1 ц R —СН2—I 3,2 190
RCH(—С!)аг 5,8 350
нс/ Чс-н 7,3 440 R—О—CH3 3,8 220
\нг — сн/ 320
. X 1 1 о ! 11 * о 2,5 150 (R —О)аСНаг 5,3
RaC = C-CH3 -1,8 108 X 1 Ч “° O' 9,7 580
1 R
,сн—сн. ~5Д 300 л
НС/ ЧС-СНв ХСН=СН/ 2,3 140 .CH-CH, нс/ Чс-он -7 а 420 а
RC-OH —ид 660 а Vh^ch/
о
а Прогон, дающий резонансное'поглощение, выделен жирным шрифтом. Группа R —
насыщенная углеводородная цепь.
б Относительно тетраметилсилана, для которого принято 0,00 м. д.
в рабочая частота спектрометра КО МГц.
г Обратите внимание на то, что сдвиг, обусловленный двумя атомами хлора или
двумя группами RO —, больше (но никоим образом не в 2 раза), чем происходящий под
влиянием одного атома хлора или группы RO —.
Д Чувствителен к растворителю, концентрации и температуре.
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ 63
Рис. 2-15. ЯМР-спектр диацетонового спирта (СН;|)2С(ОН)СН2СОСН3 при 60 МГц
относительно ТМС (0,00 м. д.). Ступенчатая линия соответствует интегрированному
спектру.
будет находиться на 1,67 100' 10“ °- 10е = 167 Гц в более слабом поле,
чем тетраметилеллаи. Значения типичных химических сдвигов про-
тонов относительно ТМС приведены в табл. 2-3 *. Значения сдвигов,
приведенных для протонов каждого типа, могут на практике обна-
руживать колебания в пределах от 5 до 20 Гц. Это не является не-
ожиданным, поскольку химический сдвиг данного протона в неко-
торой степени зависит от природы данной конкретной молекулы, а
также от растворителя, температуры и концентрации.
Упражнение 2-9. На рис. 2-15 приведен ДМР-спектр протонов в
iCH 3) 2С (О Н) С Н 2СОС11 ;1 ио отно ше н и ю к тетр а мет и л с и л а п у и к ач естве ста 11 д а рт а.
Ступенчатая линия Представляет собой результат электронного интегрирования
площади ников.
а) Напишите химические сдвиги для каждого из протонов, выраженные в
м. д., и определите, основываясь на данных табл. 2-3 и графике интегралов пло-
щадей, тип протонов, соответствующих каждой из линий.
б) Укажите положения линий (в Гц) относительно тетраметилсилана, кото-
рые будут получены при рабочей частоте 100 МГц.
в) Приведите рисунок спектра и интегральную кривую для
CJIsCOC(CH3)aCHO при 60 МГц.
* Прекрасная ‘сводка химических сдвигов и большое число ЯМР-спектров,
1 iiifibix в стандартных условиях, приведены в каталоге ЯМР-спектров фирмы
♦Variant (NMR Spectra Catalog, Vari an Associates, Palo Alto, California).
64
ГЛАВА S
В. Спин-спиновое растепление
Выше уже говорилось о том, что органические молекулы, в ко-
торых протоны находятся у лежащих по соседству атомов углерода,
как, например, в этилпроизводных СН3СН2Х (Х=дН), дак5т основ-
ные резонансные сигналы протонов с различными химическими
сдвигами (см. рис. 2-12). Каждый из этих сигналов в действительно-
сти представляет собой группу линий, являющихся результатом
«спий-спинового расщепления». Типичным примером могут служить
протоны йодистого этила (рис. 2-16), в котором сигналы метильных
и метиленовых протонов дают две основные группы* линий. Эти
группы состоят из отстоящих друг от друга на одинаковом расстоя-
нии линий (эффект «первого порядка»); в первой группе содержится
три и во второй — четыре линии, обусловленные магнитным взаимо-
действием, которое носит название спин-спи нового взаимодействия.
Для некоторых из этих линий заметно дальнейшее расщепление в ре-
зультате спин-спинового взаимодействия «второго порядка».
Каким образом расшифровывают спектр в том случае, когда он
содержит так много линий? Прежде всего химический сдвиг легко
распознать, основываясь на том факте, что расстояние между основ-
ными группами прямо пропорционально рабочей частоте v. Если
удвоить v, то расстояние между группами также увеличится вдвое;
наоборот, расстояние между линиями в случае расщепления пер-
вого порядка не зависит от v и по этой причине его также легко рас-
познать. Наконец, расщепление второго порядка зависит от v до-
вольно сложным образом; при повышении v оно имеет тенденцию к
исчезновению.
Расщепление первого порядка обусловлено изменениями в результирующем
магнитном поле, возникающими вследствие влияния, которое оказывают на дан-
Рис. 2-16. ЯМР-спсктр йодистого этила СН3СН2! при 60 МГц относительно ТМС
(0,00 м. Д.)-
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
ное ядро магнитные моменты соседних ядер: оно передается посредством связываю-
щих: электронов. Рассмотрим систему, в которой при одном ядре находится един-
ственный соседний протон. Существует почти равная вероятность того, что этот
протон расположится в направлении приложенного магнитного поля или в на-
правлении, противоположном приложенному полю *, Вследствие этого примерно
в половине молекул протон ориентирован в направлении приложенного поля
(^=_bJAjt тогда как у другой половины молекул протон ориентирован противо-
положно приложенному полю (/2=—Vjj. Расположение протона по направлению
поля приведет к небольшому увеличению поля при ядре, поглощающем излучение,
вследствие чего для той половины молекул, в которой К протона равно Н-1/^
резонансный пик появится раньше. Обратное расположение для другой половины
молекул, где 1~ протона равно — %, будет уменьшать силу приложенного поля,
в результате чего резонансный пик появится позднее. Таким образом, данному
типу ядра вследствие влияния соседнего протона будут соответствовать два резо-
нансных пика. Расположение этих пиков не зависит от частоты т, так как от нее
не зависят магнитные моменты Соседних протонов.
С помощью изотопного замещения тяжелым водородом (дейтери-
ем, D) можно показать, что семейства из трех и четырех линий, на-
блюдаемые для спин-спинового расщепления в соединениях, со-
держащих этильные группы. (ХСН2СН3, рис. 2-16), возникают
вследствие магнитного взаимодействия одной группы протонов с
другой. Магнитные моменты дейтеронов гораздо меньше, чем маг-
нитные моменты протонов, и замещение одного водорода на дейтерий
в метиле этильной группы (XCH2CH2D) дает для метиленовой груп-
пы триплетный сигнал (в действительности несколько уширенный
из-за небольшого магнитного воздействия Дейтерона). Замещение
двух атомов водорода на дейтерий (XCH2CHD2) дает резонансный
сигнал в виде: дублета, обусловленного расщеплением под действи-
ем остающегося протона. Введение трех атомов дейтерия (ХСНгСО3)'
дает спектр содержащий одну линию (от группы ХСН2, рис. 2-17).
Таким образом, в данном сравнительно простом случае мультиплет-
пость линий равна (я*Н), где п-—число протонов при соседних
атомах углерода. Резонансные сигналы метиленовой группы этиль-
ного остатка: не усложнены (сверх наблюдаемого квартета) взаи-
модействием метиленовых протонов друг с другом вследствие того,
что протоны с одинаковым химическим сдвигом обычно не расщеп-
ляют линий поглощения друг у друга. Поэтому для Н2, СН4, С2Нв,
(CH3)4Si и т. д. наблюдается только одна резонансная линия.
В целом величина спин-спинового расщепления вследствие воз-
действия одного протона на другой (или на группу эквивалентных
Протонов) зависит от числа и типа разделяющих их химических свя-
зей и от пространственных отношений между группами, В случае
простых систем, не содержащих двойных связей и имеющих нор-
* Это верно даже в том случае, если состояние, в котором ядро имеет направ-
ление, одинаковое с полем, является более устойчивым. Причина состоит в том
<j, пределах достижимых значений Н\ что разница Энергий между состояниями
чрезвычайно мала и тепловое возбуждение мешает ориентации ядер. Можно про-
нести аналогию с поведением компаса, который испытывает влияние магнитного
in>,1 я Земли, но подвергается в то жё время воздействию сильных колебаний, из-
меняющих неустойчивую ориентацию стрелки компаса в направлении юг — север,
Й № 1640
бб
ГЛАВА Й
х—сн —сн, —I 11 1------------1—1 L
X— СН,—CH.D -1---1-----------1—Ь
X—СН,—CHDt----1----------:---1—1—L
X—СН,—CD,
СН,
СН;
Рис. 2-17. Схематическое изображение спектра дейтерированных этильных про-
изводных.
Группа линий, расположенная с правой стороны, во всех случаях (когда она наблюдается)
представ.1? я с-г собой триплет, так как обусловлен я двумя протонами группы X—СН®—.
мальные углы между связями, величина расщепления для неэкзи
валентных протонов (т. е. протонов с различными химическими сдви-
гами) составляет
I
н—С—н
V J
10-15 Гц
При затрудненном вращении или наличии групп, связанных двой-
ной или тройной связью, наблюдаются большие различия в харак-
тере расщепления. Так, хотя взаимодействие «через четыре связи»
в соединении, не содержащем двойных или тройных связей, практи-
чески равно нулю, в соединении СН3—C^sC—С=С—С=С—СН2Х
было найдено небольшое взаимодействие через девять связей. «Даль-
нее» взаимодействие для соединений с двойными связями часто имеет
большую величину; однако взаимодействие через две связи для двух
неэквивалентных водородов, расположенных на одном конце двой-
ной связи, т, е.
весьма мало — от 0 до 3 Гц.
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
67
Рис. 2-18. Я МР-спектр диметил ацеталя (СНэО)2СНСНа при 60 МГц относительно
ТМС (0,00 м. д.).
Распределение интенсивностей линий при спин-спиновом расщеп-
лении обычно подчиняется простым правилам в тех случаях, когда
химические сдвиги велики по сравнению с расщеплением. Один про-
юн дает симметричный дублет, два протона в группе — триплет с
распределением интенсивностей 1:2:1, три протона в группе —
цвартет 1 : 3 : 3 : 1, четыре протона — квинтет 1 : 4 : 6 : 4 : 1
и т. д. Легко видеть, что интенсивности подчиняются закону бино-
миальных коэффициентов.
Спектр (СН3О)2СНСН8 (рис. 2-18) может служить отличным
примером того, каким образом в ЯМР-спектрах обнаруживается
присутствие близлежащих протонов. Симметричный дублет и квар-
тет с распределением интенсивностей 1 : 3 :~3 : 1 характерны для
взаимодействия между одним протоном и соседней с ним группой
из трех протонов. Метильные протоны групп СН3О слишком удале-
ны от остальных протонов для того, чтобы-дать заметное спин-
епнновое расщепление.
Упражнение 2-Ю. Нарисуйте ЯМР-слектрм и интегральные кривые для приве-
денных ниже соединений (при 60 МГц, ТМС в качестве стандарта). Укажите поло-
жение линий в Гц; можно пренебречь спин-спиновым взаимодействием, меньшим
I -2 Гн, н всеми эффектами второго порядка. Учтите, что ядра хлора, брома и
иода (но не фтора) ие обладают магнитными свойствами.
а) СН3С( ' е) СНС12СНВг2
б) СН3СН2С1 ж) СН3СНС1СОСНЯ
в) (СН3)2СНС1 з) СН3СН2СО2СН2СНа
г) CH3CD2CH2CJ и) С1СН2СН2СНа1
Д) (СН3)3СС1 к) (С1СН2)3СН
68
ГЛАВА 2
Г. Использование спектроскопии ядерного магнитного
резонанса для качественного анализа
Решение с помощью ЯМР типичной задачи, связанной с качест-
венным анализом, может быть рассмотрено на примере спектра,
приведенного на рис, 2-19ДВ спектре соединения общей формулы
С3НаО имеются три основные группы линий: при 9,8, 2,4 и 1,0 м. д.
Относительные высоты главных ступеней интегрированного спектра
указывают на то, что эти группы обусловлены поглощением одного,
двух н трех протонов соответственно. Один протон при 9,8 м, д.
имеет, как видно из табл. 2-3, химический сдвиг, соответствующий
либо" RCHO, либо RCOaH. Последняя возможность, разумеется,
исключается, поскольку соединение содержит только один атом
кислорода. Единственная структура, которую можно написать для
СэНаО при условии, что она содержит группировку RCHO, представ-
ляет собой СН3СН2СНО (пропионовый альдегид), и эта структура
полностью соответствует характеру данного спектра. Действительно,
резонанс группы СН3 происходит при 1,0 м. д. (для CH3R должно
быть 0,9 м. д.) и резонанс группы СН2— при 2,4 м. д. (для CH3COR
должно быть 2,3 м, д.).
Характер спин-спинового расщепления согласуется с найденной
структурой, поскольку оно составляет ту же величину 7 Гц, ко-
торая характерна для групп линий (3—4) этильного остатка, ко-
торую мы видели в иодйстбм этиле (см. рис. 2-16). Раздваивание
каждой из резонансных линий группы — СН„— (несколько размы-
тое вследствие расщепления второго порядка) вызвано слабым вза-
имодействием (~2 Гц) между протонами групп —СНО и — СНа—.
Это взаимодействие вызывает также расщепление линий протона
1=Чц.- 2 20. 51МР-спектры. и интегральные кривые некоторых органических сое-
дллевин при 60 МГц относительно ТМС (0,00 м. д.); см. упражнение 2-11 <
70
ГЛАВА 2
Рис. 2-21. Спектр соединения С3Н8О2 при 60 МГц относительно ТМС в качестве
стандарта; см. упражнение 2-12.
группы —СНО в триплет с распределением интенсивностей 1:2:1,
как и следует ожидать на основании правила (п+1). Взаимодействие
через три связи между протонами группы — СНО и соседней груп-
пы —СН2— обычно гораздо слабее, чем взаимодействие —СНа—СН3.
Упражнение 2-111 На рис. 2-20 приведены ЯМР-спектры и интегральные кривые
трех простых органических соединений (при 60 МГц). Напишите структуры этих
соединений, согласующиеся с их молекулярными формулами и ЯМР-спектрами.
Объясните, как вы проводите отнесение каждой из линий ЯМР-спектра.
Упражнение 2-12. На рис. 2-21 приведен ЯМР-спектр соединения общей фор-
мулы С3НеО2. С какой из приведенных ниже структур более всего согласуется
этот спектр? Объясните.
СН3СН = СНСОйСНз СН2=С(0СН3)С0СНэ СН9 = СНСНВСО2СН9
СН3=СНСО2СН2СН3 (СН2)2СНСО3СН3 НСО2СН3СНаСН=СНа
. j I
СН2 = С(СН3)СО2СН3 ОСН3СН2СН2СН3С=О
Д. Усложненные случаи спин-спинового расщепления
В тех случаях, когда химические сдвиги ядер сравнимы с величиной расщеп-
ления, спин-сппиовое расщепление усложняется. Возможно два типа усложнения.
Первый заключается в том, что, как упоминалось в разд. 2-6, В, эффекты второго
порядка становятся в этом случае существенными и это может найти выражение в
появлении дополнительных линий, а также в отклонении положений линий от тех,
которые должны соответствовать одним только химическим сдвигам испин-спи-
новому взаимодействию. В предельных случаях, как, например, для протонного
спектра дейтеровинилацетилена (СНа—СН—GsCD), приведенного на рис. 2-22,
Пи одно из положений линий или расстояний между ними не соответствует непо-
средственна какому-либо химическому сдвигу или спин-спиновому взаимодейст-
Рис, 2-22. Наблюдаемый и рассчитанный ЯМР-спектры дейтеровинил ацетилена
(СН2=СН — С asCD) при 60 МГц.
Расчет спектра основывался на химических сдвигах при 300, 297 и 283 Гц и константах вза-
имодействия, равных 18,0, 11,5 и 2,0 Гц, Замещение на дейтерий было проведено для
того, чтобы упростить спектр, исключив взаимодействие па большом расстоянии, в котором
прннямист участи^ ацетил*«с>ий водород.
вию. Однако важно уяснить, что и такие спектры вполне поддаются анализу и,
как показано на том же рисунке, при использовании соответствующих химичес-
ких сдвигов и параметров спин-спинового взаимодействии,, было получено отлич-
ное совпадение вычисленных и экспериментально найденных положений сигналов
п их интейсивностей. Однако такие расчеты требуют большой вычислительной
работы и длл их выполнения наиболее целесообразно использование быстродейст-
вующих электронно-вычислительных машин.
Второй тип усложнений, приводящий к значительному изменению качествен-
ного характера спектра, заключается в том, что при сравнимых значениях хими-
ческих сдвигов и расщепления интенсивность линий имеет тенденцию отклоняться
от тех значений, которых следует ожидать, учитывая только эффекты первого по-
рядка. Как общее правило, при спин-СПииовом расщеплении интенсивность внут-
ренних линий возрастает, а внешних — уменьшается в том случае, когда величи-
на химического сдвига понижается относительно величины спин-спинового взаи-
модействия. Этот эффект иллюстрируется на примере двух взаимодействующих
ядер (рис. 2-23). Если химический сдвиг велик по отношению к с пни-с пи ново му
няанмодействию, то все линии имеют примерно равные интенсивности, но при ма-
лом значении такого отношения внутренние линии оказываются гораздо интенсив-
нее, чем внешние. При пренебрежимо «малом химическом сдвиге внешние линии
соответствуют спектрально запрещенным переходам и исчезают полностью, Асим-
метрию интенсивностей линий можно видеть на спектре йодистого этила (рис. 2-16),
Рис. 2-23. Влияние соотношения между химическими сдвигами и спи н-спи новым
взаимодействием йа. интенсивность линий.
а — ьелнчина химического .сдкигд--ь 30 раз больше величины взаимодействия; б — величина
Хи ми чес ко го сдё и га состава лет две тр етн от вел ичины р а еще плени я-
где в обеих группах распределения интенсивностей равны 0,7: 2,5:3,5: 1,3 и
1,2 : 2,0 : 0,8, а не I : 3: 3 : 1 и 1:2:1, которых следовало бы ожидать, учитывая
только эффекты первого порядка. Асимметрия здесь такова, как будто две груп-
пы линий, связанных спин-спиновым расщеплением, «тяготеют» друг к другу —
линии е «внутренней стороны» каждой группы оказываются интенсивнее, чем
предсказанные паосновании эффектов первого порядка, тогда как интенсивность
«внешних» линий ослабевает. Этот эффект может быть использован в практических
целях, как это показано в приведенном ниже упражнении.
Упражнение 2-13. Покажите, каким образом можно использовать интенсив-
ности линий спектра, приведенного на рис. 2-24, для того чтобы показать, какие
группы линий связаны между собой посредством спин-спинового взаимодействия.
Рис. 2-24. См. упражнение 2-S3. Спектр соответствует смеси двух соединений с
молекулярными формулами С4Н10О и С2Н3Втэ.
Напишите структурные формулы соединений, соответствующих этим спектрам и
удовлетворяющих наблюдаемому характеру расщепления и величинам хими-
ческих сдвигов.
Е. ^дерный магнитный резонанс и процессы, проте-
кающие во времени
ЯМР-спектромётр является необычным прибором для исследова-
ния молекул путем поглощения электромагнитного излучения в том
смысле, что он сходен с фотоаппаратом, имеющим сравнительно
малую скорость движения затвора. «Затвор» в этом методе движется
почти с. той же скоростью, как в обычном фотоаппарате, время эк-
спозиции .которого составляет одну сотую секунды или около этого.
При снятии ЯМР-спектра молекулы, претерпевающей какое-либо
быстрое движение или реакцию, результат несколько похож на тот,
который получается при фотографирований вращающегося колеса
со спицами. Если колесо делает толь.ко.один оборот в минуту или
около того, то фотограф за одну сотую секунды сможет воспроизве-
сти нгьфотографии спицы, причем изображение почти не будет сма-
зано. С другой стороны, если колесо .вращается со скоростью 100
или более оборотов в секунду, то фотограф вообще не сможет
74
ГЛАВА-е
снять отдельных спиц — на снимке будет виден только контур
колеса (обод и ступица, ограничивающие туманную зону, образо-
ванную быстро движущимися спицами). Смазанные изображения
отдельных спиц получаются в случае, если колесо движется не слиш-
ком медленно и не слишком быстро относительно скорости движения
затвора фотоаппарата.
Ярким примером использования ЯМР при изучении движений в
молекуле может служить резонанс фтора (19F) в 1,2-дифтортетрахлор-
этане. Эта молекула наиболее устойчива в трех заторможенных кон-
формациях (I—III), ЯМР-спектры конформаций II и III идентичны.
Однако в конформации I атомы фтора имеют иное окружение и их
химические сдвиги должны отличаться от сдвигов фтора в конфор-
мациях II и III. Таким образом, следовало бы ожидать в ЯМР-
спектре этих изомеров резонанс при различных частотах; однако при
комнатной температуре вращение вокруг связи С—С происходит
так быстро, что наблюдается только одна линия резонанса фтора.
Линия находится в некотором среднем положении, определяемом
временем, которое молекула пребывает в конформациях I, II и ПТ.
Скорость вращения вокруг связи С—С уменьшается с понижением
температуры, ц при —120 СС появляется резонансное поглощение,
обусловленное (порознь) резонансом в изомере I и в изомерах II и
Рис. 2-25. Я-МР-спектр 1,2-дифтортетрахлорэтаиа FCFC—CCLF при —120 °C и
56,4 МГц.
СПЕКТРОСКОПИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ
75
III (рис. 2-25). Изучение постепенного размывания ЯМР-спектра
1,2-дифтортетрахлорэтана при повышении температуры дает способ
оценки количества энергии, необходимой молекуле для того, чтобы
в ней имело место свободное вращение.
Унификация отдельных протонов вследствие быстрого процесса
вращения значительно упрощает спектры этильных, производных.
Рассмотрение шаростержневых моделей этильных производных в за-
торможенной конфигурации (см. рис. 1-4) показывает, что хими-
ческий сдвиг одного из водородных атомов группы СНз (поме-
ченного звездочкой) не должен быть равным сдвигу двух других.
Однако вращение вокруг простой связи происходит достаточно бы-
стро (10“’ с) для того, чтобы выровнять различия между протонами;
в результате наблюдаемая резонансная линия занимает некоторое
среднее положение.
Упражнение 2-14. В сравнительно концентрированных водных растворах
уксусная кислота выступает в качестве слабой кислоты (диссоциация составляет
менее 1%). Уксусная кислота дает две линии резонансного поглощения при 2й
И м. д. (относительно ТМС), тогда как сигнал протонов воды расположен при
5 м. Д. Однако найдено, что смеси уксусной кислоты й воды дают только две линии.
Положение одной из этих линий зависит от концентрации уксусной кислоты,
тогда как положение другой от нее не зависит. Объясните это и покажите, как
будет изменяться положение линии, зависящей от концентрации, в диапазоне
концентраций уксусной кислоты от 0 до 100%.
Упражнение 2-15. Резонансный сигнал ОН-группы в чистом сухом этиловом
спирте расщеплен в триплет вследствие влияния протонов группы СН8. Объясни-
те, каким образом быстрый обмен протонов ОН-групп между различными молеку-
лами спирта, вызываемый следами кислоты или основания, может вызвать слия-
ние этого триплета в одну резкую линию, как на рис. 242.
2-7. Масс-спектрометрия
Применение масс-спектрометрии для исследования органических
молекул основано на бомбардировке их пучком электронов средних
энергий в высоком вакууме и анализе образующихся при этом заря-
женных частиц и фрагментов -(«осколков»). Коммерческие масс-
спектрометры приспособлены для анализа положительно заряжен-
ных фрагментов, хотя ведется также активная разработка масс-
спектрометров, предназначенных для анализа отрицательных ионов.
Принципиальная схема масс-спектрометра приведена на рис. 2-26.
ГЛАВА 2
Рис. 2-26. Схема устройства масс-спектрометра.
/ — источник электронов; 2 — ускорительные iuiистины (отрицательный потенциал); 3 —•
магнит; 7 — щель; 5 — коллектор iiohod.
Положительные ионы, образующиеся при бомбардировке электро-
нами, разгоняются отрицательно заряженными ускоряющими пла-
стинами, и поток их, изгибаясь, попадает в канал анализатора,
где они рассортировываются анализирующим магнитом в зависи-
мости от отношения их массы к заряду (m/е). При хорошем разреше-
нии через щель проходят и попадают на коллектор только ионы
одной массы, даже в тех случаях, когда массы лежат в диапазоне
от нескольких сотен до тысяч. Заселенность каждого из диапазонов
масс может быть определена при построении графика зависимости
скорости поступления ионов в коллектор ионов от величины маг-
нитного поля анализирующего магнита.
Масс-спектры метилэтилкетона, пропионового альдегида и аце- '
тона приведены на рис. 2-27. Каждый пик отвечает одному из ти-
пов фрагментации молекулы при электронном ударе с образованием
таких ионов, как CH®, CH3CHf, СНзСО® и т. д. Характер расщеп-
ления является, разумеется, функцией энергии бомбардирующих
электронов и может служить в качестве необычайно характерного
«отпечатка пальцев» данной молекулы. Например, ацетон и пропи-
оновый альдегид изомерны друг другу, и тем не менее характер
фрагментации в них резко различен. Интенсивный пик, соответствую-
щий наибольшей из возможных для данной молекулы масс, в особен-
ности важен; в отсутствие каких-либо реакций комбинирования
фрагментов этот пик соответствует родоначальной молекуле за:вы-
Рис. 2-27. Масс-спектры ыетилэтилкетона (я), пропионового альдегида (б) и ацетона (в)-
78
ГЛАВА S
четом одного электрона; определение массы такого пика может слу-
жить очень точным методом измерения молекулярных масс.
В последние годы достигнуты значительные успехи в установле-
нии корреляций относительных количеств образующихся фрагмен-
тов различных масс со структурой молекул. Так, информация о
структуре молекул, подобных никотину (разд. 1-6В), может быть по-
лучена путем измерения масс фрагментов, образующихся в наи-
большем количестве; образование таких фрагментов соответству-
ет расщеплению молекулы по наиболее слабым связям. Такой тип
использования масс-спектрометрии будет рассмотрен в гл. 30.
Упражнение 2-16. Покажет, каким образом, основываясь на спектре, приве-
денном на рис, 2-27, можно определить молекулярное массы ацетона, метилэтилке-
тона и пропионового альдегида. Выскажите ваше мнение о возможном происхож-
дении интенсивных пиков с массой 57 в спектрах метилэтилкетона и пропионо-
вого альдегида. Объяснение должно соответствовать тому факту, что этот пик
практически отсутствует в ацетоне, но в то же время в спектре ацетона обнаружи-
вается интенсивный пик с массой 43.
Упражнение 2-17. Объясните, каким образом масс-спектрометр, способный
анализировать новы, отличающиеся по значениям т(е на 1 : 50 000, может быть
использован для ответа на вопрос, каким является ион с массой 29—С2Н®или
СНО®,
Библиография
Приведенные ниже книги очень полезны для справок как по основам методов,
так и по практическому использованию спектроскопии в органической химии.
Электронная спектроскопия
Гиллем А., Штерн Е., Электронные спектры поглощения органических молекул,
ИЛ, М., 1957.
Инфракрасная спектроскопия
Nakanishi К., Infrared Spectroscopy —Practical, Holden-Day, San Francisco, 1962.
Беллами Л., Инфракрасные спектры сложных молекул, ИЛ, М., 1963.
Pimentel О. С., «infrared Spectroscopy: a Chemist’s Tool», J. Chern. Educ., 37, 651
(1960).
Ядерный магнитный резонанс
Робертс Дж., Ядерный магнитный резонанс. Применение в органической химии,
ИЛ, М., 1961,
Jackman L. М., Applications of Nuclear Magnetic Resonance Spectroscopy in Organic
Chemistry, Pergamon, London, 1959.
Roberts J. D. «Nuclear Magnetic Resonance Spectroscopy», J. Chem. Educ,, 37, 581
(1961).
Робертс Дж., Введение в анализ спектров ЯМР высокого разрешения (спин-спи но-
вое взаимодействие), ИЛ, М., 1963.
Martin J. С., «NMR Spectroscopy as an Analytical Tool in Organic Chemistry»,
J. Chem. Ediic., 38, 286 (1961).
Масс-спектрометрия
Biefnann K., Mass Spectrometry. Organic Chemical Applications, McGraw-Hill,
New York, 1962,
Eliel E- L., Prosser T. J,, young <7. Й7"., «The Use of Mass Spectrometry in Organic
Analysis», J. Chem. Educ., 34, 72 (1957).
ч
ГЛАВА VF
АЛКАНЫ
Хотя эта глава касается химии только одного класса соедине-
ний — насыщенных углеводородов, или алканов, здесь излагаются
также некоторые основные принципы, которые широко будут ис-
пользоваться в последующих главах. Изучение этих принципов связы-
вают по традиции больше с физической, чем с органической хими-
ей. Они включены в настоящую главу, так как дают прочную осно-
ву для понимания ключевых вопросов, касающихся практического ис-
пользования реакций: настолько ли сдвинуто данное равновесие в
сторону образующихся продуктов, чтобы его можно было исполь-
зовать на практике; можно ли найти условия, в которых скорость
реакции приобретает практическую значимость; как можно пода-
вить нежелательные реакции.
В первую очередь будет рассмотрена номенклатура алканов.
Она особенно важна потому, что очень многие органические соеди-
нения представляю^! собой продукты замещения алканов и обычно
называются сходным образом. Затем излагаются физические свойст-
ва алканов, причем особое внимание уделено закономерному измене-
нию в свойствах по мере увеличения длины цепи углеродных атомов.
При обсуждении химических реакций алканов наибольшее внима-
ние обращено на горение и замещение при действии хлора. Эти
реакции служат иллюстрациями того, как можно предсказать и
использовать изменения энергии, в частности АН-—теплоту, выде-
ленную или поглощенную -реакционной системой, которую часто
очень легко оценить по таблицам энергий связей.
Проблемы, связанные с предсказанием скоростей, реакции, об-
суждаются на примере реакции хлорирования метана. Этот пример
хотя и сложен, но хорош тем, что может быть разбит на несколь-
80
ГЛАВА 3
ко простых стадий. Установленные при этом принципы применя-
ются далее к случаям образования смесей изомеров при реакциях
замещения.
Методы синтеза алканов будут рассматриваться в последующих
главах.
Соединения, состоящие из двух элементов — углерода и водоро-
да — носят название углеводородов. Существует несколько типов
такого рода соединений в зависимости от того, как соединены между
собой атомы углерода. Углеводороды с открытой цепью, или ацик-
лические углеводороды, которые не содержат двойных и тройных
связей, носят название алканов (насыщенных, или парафиновых, уг-
леводородов) и имеют общую формулу СгеН2п+2. Простейшим соеди-
нением ряда алканов является метан СН4. Другие типы углеводоро-
дов — это алкены, алкины, циклоалканы, циклоалкены и арены;
все эти типы соединений будут рассматриваться в последующих
главах. Настоящая глава посвящена главным образом алканам.
3-1. Номенклатура
Прежде чем начать рассмотрение химии органических соедине-
ний, необходимо выяснить вопросы номенклатуры. Отсутствие: удоб-
ных систематических и общепринятых правил номенклатуры привело
бы к огромным затруднениям. Наиболее законченная серия правил,
используемых в настоящее время, была выработана на ряде между-
народных конференций и носит название правил Международного
союза чистой и прикладной химии (правила ШРАС). К сожалению,
на практике никто точно не следует этим правилам, поэтомуне-
обходимо хорошо знать и другие системы наименований. Они обыч-
но бывают простыми и удобными применительно к несложным со-
единениям, но становятся громоздкими и неоднозначными в случае
более сложных структур. В настоящей главе рассматривается но-
менклатура алканов, а в последующих главах — номенклатура
ненасыщенных углеводородов с открытой цепью (алкенов и алки-
нов), циклоалканов, ароматических и полициклических углеводо-
родов.
Алканы могут быть с «веразветвленными углеродными цепями»,
если каждый из углеродных атомов цепи связан не более чем с
двумя атомами углерода, или с. «разветвленными углеродными це-
пями», если один или большее число углеродных атомов связаны
более чем с двумя другими атомами углерода.
СНЯСН3 сня
СН3-СНа—СН2-СНг-СН2-СН3 СНЭ-С-С-СН3 сня-с-сщ—сн3
углерод с неразгетвлеиной цепью j | t
II Н Cll;i
углеводороды с разветвленными'цепями
АЛКАНЫ
81
Первые четыре представителя ряда углеводородов с неразветв-
ленной цепью имеют несистематические названия
сн4 снэ-сн3 сн3—сн2—сн3 сн3—снй—сн2—снэ
метан этан пропан бутан
Последующие члены ряда, начиная с .пентана, именуются по оп-
ределенной системе; названия состоят из приставки, указывающей
число углеродных атомов (пент-, гекс-, гепт- и т. д.), и окончания
-ан, указывающего, что соединение относится к классу парафино-
вых углеводородов. В табл. 3-1 приведены примеры соединений
этого ряда. Эти названия могут относиться как к разветвленным,
Таблица 3-1
Алканы (СяН2д+2)
Число итомов углерода Название Число изомеров Число атомов углерода Название Число изомеров
1 Метан 1 7 Гептан 9
2 Этан 1 8 Октан 18.
3 Пропан 1 9 Нонан 35
4 Бутан 2 10 Дек ап 75 '
5 Пентан 3 20 Эйкозан 366 319
6 Г ексан 5 30 Триаконтан 4; 11-10*
так и к неразветвленным углеводородам, и для того чтобы указать
на неразветвленность цепи, обычно добавляется приставкй ненор-
мальный). Однако, как правило, в отсутствие специальной пристав-
ки углеводород рассматривается как «нормальный» (нёразветвлен-
ный). '
СНа—СН. -C1L-C1L-СП3
пентан или к-пентди
, Возможность существования углеводородов с; разветвленной
цепью, изомерных нормальным, углеводородам, впервые возникает
в случае бутана (м=4). Общее число теоретически возможных изо-
меров для алканов с га~1—10, 20, 30 приведено в табл. 3-1; как
можно видеть, это число очень быстро возрастает с увеличением п,
В 1946 г. было сообщено о синтезе всех 75 возможных парафиновых
у i деводородов с п От 1 до 9 включительно.
Приставка изо- используется для названия соединений, в кото-
рых две метильные группы находятся на конце нёразветвленной
цопн, приставка нео- указывает нД наличие трех метильных групц
82
ГЛАВА 3
на конце неразветвленной цепи. Так, изомерные бутаны и пентаны
носят следующие названия:
СН3
СНэ-СНа-СН2-СН3 СНз-^Н-СНз
«-бутан
СН3-СНа—СНз-СН^СНа
«-пентан
изобутан
сн3
СН3—СН-СН2-СН3
изопентан
CHg-C-CHj
I
сн3
неопентан
Изложенная выше система позволяет назвать только три из
пяти возможных изомеров гексана
сн0-сн2-сн2-сн2-сн2-сн3
н -гексан
сн3 сн3
I I
СНз— сн~сн2—сн2 — сн3 сн3—с—сн2-сщ
изогексац |
сн3
неогексан
При названии двух других изомеров гексана (и всех высших
алканов, за исключением н-алкапов) данный углеводород рассмат-
ривается как продукт замещения более простого углеводорода.
Замещающие группы (иногда называемые радикалами) называют,
заменяя окончание -ан в соответствующем алкане на -ил. Таким.
образом получают алкильные группы, простейшим представителем
которых является метильная (СН3—) и этильная (CHSCH3—) груп-
пы. Другие примеры приведены в табл. 3-2, где углеводороды
классифицированы, кроме того, в соответствии с тем, являются
они первичными, вторичными или третичными. Алкильная группа
называется первичной в том случае, если углерод в точке присое-
динения связан только с одним другим атомом углерода, вторичной,
если он связан с двумя другими углеродными атомами, и третичной,
если углерод связан с тремя другими атомами углерода.
Некоторые углеводороды удобно рассматривать в качестве про-
изводных метана или этана
снзч -СН3 СНзСНэ
ей I 1
гн Чн сн,-с—с-сн3
I II
>сн-с-н I I
СН/ I ЫТА-На
Qpj гексаметил этап
сн3\на
•грнизоп port ил мега к
Ниже приведены правила ШРАС для систематического наимено-
вания алканов.
АЛКАНЫ
83
Таблица 3-2
Типичные алкильные радикалы (CrtH2n+1)
Первичные (И — СН%
сн3- . метил СН3СНа- СНэСНаСН8- этил я-лропнл
сн3сн2снаснг- я^бугил сн3ч J/CHCHo'-* сн/ изобутнл СН3
СН3СН3СНаСНеСН4— леитил (N-isian) CHS | )СН—сн2—сна— сн3—с-сн2— сн/ ) Изо пентал (изоамил) СН3 неопентил СН3 СН3. „ ( л „
CH3CH2CHsCH2CHaCH2 - /н-снаснасн2— СН3-С-СН2СН2-
я-гексил . СН/ I изогексил СНз неогексил Вторичные (R2CH —) сн3
СНдч ;СН— сн/ изопропил 1 СН3СН2-Сн — ат ор-бутил Третичные (Rac“-)
сн3 СН. I s
сн3-с- СНаСН2-С-
сн3 ягрет-бутл сн3 ЛТ/7Й7?!-яеингл 1 трет* амил)
1. В качестве основы выбирается наиболее длинная нормальная
цепь атомов углерода; соединенные с ней алкильные группы рас-
сматриваются как заместители. Так, углеводород I является про-
изводным пентана, а не бутана, поскольку наиболее длинная цепь
состоит из пяти углеродных атомов
Ген?; chJchJ [СНз-СН-СН^СНэ
J
(пунктиром выделена наиболее длинная цепь углеродных атомов).
84
ГЛАВА 3
2. Лежащий в основе углеводород нумеруется, начиная от край-
него углеродного атома; замещающие группы получают номера в
соответствии с их положением в цепи. Направление нумерации вы-
бирается таким образом, чтобы сумма номеров боковых заместите-
лей оказалась наименьшей, Так, углеводород I должен быть назван
2,3-диметил пентаном, а не 3,4-диметилпентаном
6CHS 1СН3
сн34сн/ сн3 4н2
J I а н I I
»СН3—2СН-»СН—СН3 ,®СН3-4СН —=СН— сн3
2,3*ди метилпентан 3,4-днметнлпентан
:3. В том случае, если два одинаковых заместителя находятся
при одном и том же атоме углерода, как в соединений II, то номера
ставятся для каждого из них.
. СНаСН3
СН3—С—Ан —сн3
I
сн3
2 3' три мстя лбутан
II
4. Заместители с разветвленной цепью получают названия прос-
то путем распространения на них системы, используемой для раз-
ветвленных углеводородов. Наиболее длинная цепь в заместителе
нумеруется, начиная с углеродного атома, соединенного непосред-
ственно с углеводородной цепью, лежащей в основе. Для отделения
названия заместителя от названия основной углеродной цепи ис-
пользуются скобки.
2 з
сн3 сн3-сна ' i
XJ /
сн
123 4516 7 8 S !0
сн3—сна~- сн2—сн2—сн—снг—сн2—сна—сн2—сн3
5-{L -мет||лТ1|Юпцл)Дскан
(G -втор - бу тил декан)
Правила -ШРАС разрешают использовать для замещающих групп
названия, приведенные в табл. 3-2; таким образом, в данном при-
мере вместо названия (1-метилиропил) можно использовать назва-
ние шнор-бутил.
5, При наличии двух или большего числа различных заместите-
лей возникает вопрос, в каком порядке они должны упоминаться
в названии, соединения. Обычно используются две системы, в одной
из которых алкильные заместители перечисляются в порядке воз-
растания сложности. Ниже приведены примеры;
сна-сн2 сн3
СН3 — СНа - - СН 2 — Ай — СН — СНп — сна
7 6 5 4 3 2 1
З-метил-4-этилгептаи
; АЛКАНЫ
85
сн,
I
CHS—С-СН3
СН3—СН,—СН2 —С—СН,—СН2 — сн2—сн2—сна— снэ
I Ч 3 4)36 7 6 9 10
сн3—сн
сн3
4-изопренил-4-треш-бутил декан
В Chemical Abstracts * используется другая система, в которой
заместителя перечисляются в алфавитном порядке.
Производные парафиновых углеводородов, например галогенал-
каны R—CI и ннтроалкапы R—NO„ где R — алкильная группа,
также называются по системе IUPAC.- Если с углеводородной цепью
соединены два или большее число заместителей различных типов,
то им придается определенный порядок старшинства. Так, алканы
с галоген- и алкильными заместителями обычно называют галоген-
алкилалканами (не алкилгалогеналканами), алканы с галоген- и
питрозаместителями называют галогеннитроалканами (а не нитро-
галогеналканами). сн
1
СН—CHS
СН., -г СН2 - СН а - СНа—С1
1-хлорбутап
(к-бутнлхлорид)
СН,Х
>СН—СН2—В г
СН/
Ьбром-З-метилпропан
(и з об у тил б ро и ид I
СНа—СНг—СН-
NO,
3-Ш| тро-2 -мети лпентай
СН3
С] - ci Н - сн2—СНг — NOS
3-хлор-1-иитробутан
Упражнение 3-1. Назовите каждый из приведенных ниже углеводородов по си-
стеме 1UPAC, а также рассматривая их как -
СН3
а)
сн3.
'СН3
ал к и л замещенные метаны»
СН3-СНа СНЭ
в> ''сн—сн2—бн
'сна
б)
д)
сн3
СН3
CHe-i:-CH2-CH-CHa
снэ
(СНз-СНа-СНг)^
СН3ч /СН3
CH3-CHj
г) ''сн
СН3-^На
е) СН3—СН2—СН2—СН2-^Н —СН
СН3
I
* Двухнедельное издание Американского химического общества; содержит
рефераты текущих химических публикаций и указатели к ним.
86
ГЛАВА 3,
Упражнение 3-2. Напишите структуры всех семнадцати возможных моно хлор-
гексанов и назовите их по системе IUPAC.
3-2. Физические свойства алканов,
понятие гомологии
В ряду алканов с прямой цепью СН3(СН2)п_2СНа обнаруживает-
ся значительное изменение физических свойств (табл. 3-3 и рис. 3-1).
Каждая дополнительная группа СНЯ вносит довольно постоянный
вклад в температуру кипения и плотность и несколько менбший
вклад в температуру плавления. Это позволяет определить свойства
неизвестного члена ряда, основываясь на свойствах его соседей.
Например, температуры кипения гексана и гептана равны соответ-
ственно 69 и 98°С. Таким образом, различие в их структуре, состав-
ляющее одну группу СН2, приводит к разнице в температурах кипе-
ния, равной 29°. Это позволяет поместить температуру кипения сле-
дующего члена ряда — октана — при (98°+29°), т. е. при 127°С, что
близко к действительной температуре кипения октана, составляю-
щей 126°С.
Таблица 3-3
Физические свойства нормальных алканов CHs(CH2)n_2CH3
п Название Т. «нп., °C (760 мм) Т. пл.. «С -30 "d
1 Метан —16! ,5 — 183 0,424а
2 Этан —88,6 —172 0,546а
3 Пропан —42,1 — 188 0,501 6
4 Бутан —0,5 -135 0,579 s 1,33266
5 Пентан 36,1 — 130 0,626 1,3575
6 Гексац 68,7 -95 0,659 1,3749
7 Гептан 98,4 —91 0,684 1,3876
8 Октан 125,7 —57 0,703 1,3974
9 Нонан 150,8 -54 0,7.18 1,4054
10 Декан 174,1 —30 0,730 1,4119
11 Ундекан 195,9 —26 0,740 1,4176
12 Додекан 216,3 —10 0,749 1,4216
it' Пента дек ан 270,6 10 0,769 1,4319
20 Эйкозан 342,7 37 0,786в 1,4409 в
30 Триаконтан 446,4 66 0,810D 1,4536 в
® При температуре кипения.
б Под давлением.'
в Для переохлажденной жидкости.
Группа соединений, обладающих аналогичным химическим стро-
ением, сходными, постепенно изменяющимися физическими свой-
ствами и отличающихся друг от друга числом углеродных атомов
Рис. 3. 1. Зависимость температур плавления и кипения, а также плотностей
(dl°) алканов с нераэветвленной цепью СН3(СНа)п-аСН3 от числа углеродных
атомов л.
Рис. 3-2. Зависимость АТ (разность температур кипения и плавления для сосед-
них членов ряда нормальных алканов) от числа углеродных атомов ге.
88 ГЛАВА 3’ :
(например, н-алканы), образует гомологический ряд. Концепция
гомологии при использовании её для предсказания свойств неизвест-
ных членов ряда дает лучшие результаты в применении к членам
ряда с более высокой молекулярной массой, поскольку для послед-
них введение дополнительной группы СНг приводит к относительно
меньшему изменению в общем составе молекулы. Это наглядно вид-
но из рис. 3-2, на котором показано, как изменяется разница в
температурах кипения и температурах плавления (АТ) для следую-,
щих один за другим членов гомологического ряда н-алканов в за-
висимости от числа углеродных атомов и. -
Алканы с разветвленной цепью не обнаруживают столь опреде-
ленно выраженной систематичности в изменении физических свойств,
как н-алканы. Обычно в этом случае изменение характера молеку-
лярной структуры оказывается слишком большим для того, чтобы
могли проявляться четкие закономерности. Тем не менее для одного
семейства изомерных углеводородов летучесть возрастает с увели-
чением разветвленности. Это можно видеть из данных табл. 3-4,
где приведены физические свойства пяти изомеров гексана; наиболь-
шего внимания заслуживает разница температур кипения гексана и
неогексана, равная 20э.
Таблица 3-4
Физические свойства изомеров гексана
Изомер Структура Т . кик,, °C Т. СС <5° 4
н-Гексан Ш3(СН.)4СН3 СПз 68,7 -94 0,659
3 -Меги л пен тан СН3СН,СНСНаСН3 63,3 —118 0,664
2-Мет и л пей тан (изо- гексан) CH3CHCHaCHjCHB СНа сн3 сна 60,3 — 154 0,653
2,3-Диметилбутая сн3сн—снсн» сн. 58,0 — 129 0,661
2,2-Д й мети Лбу та и Г : сн3ссн3сн3 сн3 49,7 —98: : 0,649
Упражнение 3-3. Используя данные табл. 3-3 и'3-4, с и рёделитё температуры ки-
пения тетрадекана, гептадекапа, 2-метилгексана и 2,2-диметйл пентана.
Упражнение 3-4, Имея в виду, что летучесть определяется величиной сил при-
тяжения между молекулами, укажите возможную причину того, что неогексан
более летуч, чем гексан.
3
4 5 5
Длина волны, мк
6
а 9 10 12 14
а
3600 3200
___L____Т -----1____т..„ 1--------J----1-----1___1----<---Ы, -Л------1___i_
2400 2000 2000 1800 1600 1400 1200 1000 300
Частота, см-1
3
длина волны, мк
4 5 5______________S
5 9 10 12 14
1 Г”-1 I Г
-j-—[--г -]-1 - -7Г-- I I I'. I | г
11 “~П иГг
б
___t__1_ _____1— Г _____t
3600 3200 У 2400 2000 2000
1500 1600 1400 1200 1000 НОО
'Частота, см-1
Рис. 3-3. ’ Инфракрасные спектры я-октана (а) и 2,2,4-триметилпентана (б); (в виде
чистых жидкостей). /
90
ГЛАВА 3
3-3. Спектральные свойства алканов I
В ИК-спектрах алканов четко проявляются частоты валентных]
колебаний связи С—Н в области 2850—3000 см’1. Частоты валент-]
ных колебаний связи С—С переменны и обычно являются мало ин^
ния, обусловленного — С—Н-
АЛКАНЫ
9]
I тенсивными. Характеристические деформационные колебания связи
| С—Н в метильной (CHS) и метиленовой (СН2) группах обычно ле-
| жат в интервале 1400—1470 см’1, но метильная группа обнаружи-
; вает в спектре слабую полосу при 1380 см-1. ИК-спектры двух об-
разцов, иллюстрирующие эти особенности, приведены на рис. 3-3.
Чистые алканы не поглощают в ультрафиолетовой области выше
2000 А (см. табл. 2-2) и по этой причине часто оказываются отлич-
ными растворителями для снятия УФ-спектров других соединений.
ЯМР-спектры алканов обычно весьма характеристичны, но с тру-
дом поддаются интерпретации, поскольку химические сдвиги для
различных типов протонов в них невелики. Вопрос о том, развет-
влен алкан или нет, может быть решен сравнительно легко при
анализе отношения интеграла резонансного* поглощения группы
СН3 при 0,9 м. д. к интегралу поглощения СНа в районе 1,25 м. д.
(рис. 3-4).
Масс-спектрометрия является отличным методом анализа смесей
алканов и широко используется для этой цели.
ХИМИЧЕСКИЕ РЕАКЦИИ АЛКАНОВ
3-4. Горение алканов
В целом класс алканов характеризуется необычайно малой ре-
акционной способностью. Применяемое для этих углеводородов наз-
вание «насыщенные» или «парафины» [последнее буквально озна-
чает «не обладающие достаточным сродством» от латинского
«раг(игп)» — недостаточно и «aff inis» — сродство] обусловлено тем,
что их химическое «сродство» по отношению к наиболее часто встре-
чающимся реагентам может рассматриваться как «насыщенное». Так,
ни одна из связей С—Н и С—С в типичных насыщенных углеводо-
родах, подобных этану, не атакуется при обычных температурах
кислотами (например, серной кислотой) и окислительными агента-
ми (например, бромом в темноте, кислородом или перманганатом
калия). Этан в обычных условиях также весьма устойчив к дей-
ствию восстанавливающих агентов, например водорода, в присут-
ствии таких катализаторов, как платина, палладий или никель.
Однако все насыщенные углеводороды при повышенных темпе-
ратурах реагируют с кислородом, а в присутствии избытка кислорода
происходит поляре сгорание до двуокиси углерода и воды. Огромное
количество углеводородов нефти используется в качестве топлива
для получения тепла и энергии при сгорании. Хотя состав нефтей
различается в зависимости от месторождения, обычно-при перегон-
ке выделяются следующие фракции *:
Газовая фракция (температура кипения до 40 °C), содержащая
. нормальные и разветвленные алканыСх—С6. Природный газ обычно
* См.RossiniF.D., «Hydrocarbons in Petroleum», J.Chem. Educ., 37,554 (i960).
92
ГЛАВА 3
состоит!главным образом из метана и этана, тогда как «баллонный»
газ (сжиженный нефтяной газ) — в основном из пропана и бутана.. (
! Бензин (газолин) (т. кип. 40—180 °C) содержит углеводороды’:
Сп—Сю. В бензине обнаружено более 100 индивидуальных соеди- j
нений, в число которых входят нормальные и разветвленные ал-
каны, циклоалканы и алкилбензолы (арены). Присутствие развел-
вленных алканов более, благоприятно сказывается на качестве бен-
зина, чем. их изомеров с неразветвленной цепью, так как они имеют ’
гораздо более высокую антидетонационную характеристику. :
Керосин (т. кип. 180—230 °C) содержит углеводороды Си -и С12.
Большие количества его. используются в качестве топлива для ре-
активных двигателей, а также «крекируются» в более простые ал-
каны (и алкены).
Лёгкий газойль (легкое дизельное топливо, т. кип. 230—305 °C),
в состав которого входят углеводороды Ci3—Ci:, используется
как дизельное топливо ,и в больших масштабах «крекируется» в
алканы (и алкены) с меньшей молекулярной массой.
Тяжелый газойль и легкий дистиллят смазочного масла (т. кип.
305-405 “С), С,,—С26.
Смазочные масла (т. кцп. 405—515еС) С25—Сэа, из которых на- ;
иболее известны парафин и вазелин. Остаток после перегонки обыч-
но называют асфальтом. ’
3-5. Определение теплот сгорания.
Энергии связей
Горение полученных из нефти алканов служит основным источ- '
ником тепла и энергии..Следовательно, представляет практический ;
интерес возможность оценки количества тепла, выделяющегося
при сгорании углеводородов различного типа.. Это легко может
быть сделано с помощью таблиц энергий связей; метод определения
теплот сгорания очень важен, так как позволяет установить зна-
чения теплот многих других органических реакций.
При обсуждении теплот реакций внимание будет сосредоточено
на общем количестве тепла, выделяющегося или поглощаемого в
тех случаях, когда реагенты, и продукты реакции находятся при
одной и той же температуре, обычно при 25 °C- В случае сгорания
углеводородов эта теплота может быть измерена путем сожжения
смеси углеводорода с избытком кислорода в закрытом сосуде, по-
мещенном в баню с температурой до измерения 25 °C, и определения
количества тепла, которое нужно отвести от бани, чтобы ее темпера-
тура .вновь, стала равной 25°С. Температура внутри сосуда в ходе .
сожжения моЖет достигать 1000 °C или более, но это несущественно, J
поскольку общее количество выделенного тепла останется тем же
самым, коль скоро начальное и конечное состояния системы одина-
ковы. Так, очень медленное окисление при 25“^ приведет к выделе-
АЛКАНЫ
93
нию точно такого же количества! тепла, как и быстрое горение (в
предположении, что сгорание в обоих случаях полное).
Количество тепла, выделяющееся или поглощающееся в ходе
процесса, происходящего при. постоянном объеме (подобно описан-
ному здесь для случая сожжения углеводорода в закрытом сосуде),
отличается от количества тепла, выделяющегося или поглощающе-
гося в случае процесса,1 проходящего при постоянном давлении.
Поскольку большинство органических реакций проводится при по-
стоянном давлении, теплота реакции АН обычно определяется как
количество тепла, выделяющееся или поглощающееся при постоян-
ном давлении. Принято употреблять АН с отрицательным-знаком
в том случае, когда теплота выделяется (экзотермическая реакция),
и с положительным знаком, если теплота поглощается (эндотерми-
ческая реакция).
Экспериментально установлено, что при сожжении 1 моля ме-
тана при 25 °C (в случае необходимости вносят поправку дДя перехода
от постоянного объема к постоянному давлению) экзотермичиость
реакции составляет 212,8 ккал. Это может быть выражено в сокра-
щенной форме следующим уравнением:
СН, (газ) + 2О3 (газ) —> СО2 (газ)42НгО (жидк.) = —212,8 ккал
Обозначения (газ) и (жидк.) означают при этом, что для данного
значения АН реагенты и продукты находятся в газообразном состоя-
нии, за исключением воды, которая находится в жидком состоя-
нии. Если нужно получить АН для случая, когда продукт сгорания
(НаО) находится в газообразном состоянии, то следует внести по-
правку на теплоту испарения воды (10,4 ккал/моль при 25 42).
СН4 (газ)-Е 20а(газ) —СО, (газ)ф2Н2р (жидк.) = —212,8 ккал
2HaQ (жидк.) —s- 2НЙО (газ) А//==4-2X10,4 ккал
GH, (газ)42О2(газ) —>- СО2 (газ)42НаО (газ) Д// =— 192,0 ккал
Упражнение 3-5. Теплота сгорания 1 моля жидкого я-декана, приводящего к
образованию двуокиси углерода и жидкой воды, составляет 1620,1 ккал, Теплота
испарения н-декаиа при 25СС равна 1.1,7 ккал. Вычислите теплоту сгорания в том
случае,-если, бы все соединения находились в газовой фазе.
.Упражнение 3-6. Что даст больше тепла — сожжение 1 кг газообразного ме-
тана или 1 кг .жидкого «-декана (образуется жидкая вода)?
Для того чтобы определить теплоты сгорания из энергий свя-
зей, нспользуют разницу между теплотами, которые," согласно рас-
чету, требуются для разрыва связей в реагентах, и теплотами, тре-
бующимися для образования связей в продуктах, имея .при этом в
виду, что при разрыве связей тепло поглощается, а при образовании
связей тепло выделяется. Необходимые для расчета энергии связей
приведены в табл. 3-5. Эти энергии связей применимы только к
полной диссоциации газообразных, веществ до газообразных атомов
94
ГЛАВА 3
при 25°С- Они не могут также применяться без серьезных попра-
вок ко многим соединениям, которые, подобно бензолу, содержат
более одной двойной связи. Это ограничение будет рассмотрено в
гл. 9.
Таблица 3-5
Энергии связей (ккал/моль при 25°С)а
Двухатомные молекулы
н-н 104,2 F-F 36,6 H-F 134,6
О--0 119,1 Cl-Cl 58,0 H—CI 103,2
NsN 225,8 Вг-Вг 46,1 H —Br 87,5
с-о5 255,8 1-1 36,1 H-I 71,4
Многоатомные молекулы
с-н 98,7 C-C 82,6 C-F 116
N-H 93,4 C = C 145,8 С-С1 81
о-н 110,6 C = C 199,6 C—Br 68
S-H 83 C-N 72,8 C—I 51
р-н 76 C = N 147 C-S 65
N-N 39 Cts-N 212,6 C=SB 128
N = N 100 C-0 85,5 N-F 65
0—0 35 C-Or 192,0 N—Cl 46
S-S 54 с=од 166 0 —F 45
N-0 53 c=oe 176 O-Cl 52
N = 0 145 с=ож 179 0 —Br 48
а Энергии связей, приведенные о этой таблице, взяты из Книг: Cotlrell Т. L., “The
Strenghts of Chemical Bonds”, Butterworths, London, 2nd ed., 1.053 (есть русский пере-
вод первого издания. ИЛ, У!.. 1Э56) и Pauling L., “The Nature oi the Chemical Bonds”,
Come!! University Press. Ithaca, N. Y.. 3rd cd., I960 (есть русский перевод первого изда-
ния, госхнмиздат, 1947). ,
б Окись углерода.
в Для сероуглерода.
г Для двуокиси углерода
Д Для формальдегида,
е Для других альдегидов.
ж Кетоны.
Величину АЯ для реакции горения метана вычисляют следую-
щим образом: прежде всего при разрыве связи так, как э го изобра-
жено ниже, используют значение 98,7 ккал для энергии С—Н-связей
Н
Н: С : Н (газ)-»- »• С (газ),4Н .{газ} АЯ=+4 X 98, 7 ккал
Н = +394,8 ккал
и 119,1 ккал для энергии двойной связи в кислороде
АЛКАНЫ
95
1 2 ; 0•:0 :(газ) •* 4 ; О (газ)
ДЯ = + 2 X 119,1 ккал
= +23.8,2 ккал
Далее при образовании связи используют величину 192 ккал
для каждой связи О=С в двуокиси углерода
• С - (газ) + 2 :0 (газ)— :О :: С:: 6:(газ) ДН = -2 X 192, 0 ккал
= - 384,0 ккал
и 110,6 ккал для каждой из Н-С-связей воды
’ 2 ;6(газ)+ 4Н-(ш\-* 2 Н со: Н(газ) дЯ = - 4 х 110,6 ккал
= -442,4 ккал
В результате АЯ будет равно 394,84-238,2—384,0—442,4=
=—193,4 ккал, что довольно близко к значению 191,8 ккал для
теплоты сгорания метана, определенной экспериментально.
Таблица 3-6
Сравнение вычисленных и экспериментальных значений ЛЯ
и константы равновесия некоторых простых реакций а
Реакция дя К
ЭКСП. вычисли
сн4+Ch —* СГЦС1+НС1 —23,7 —27 - 1 10«
С(тв.)4-2Нг—>СН4 -17,9 —15й 7,9-10»
ЗС (тв,)-|- 4На —* С3НВ (пропан) —24,8 —23й 1,3-10*
6C(TB.)-f-7Ha~-*H-C(|Hi4 (гексан) —40,0 —35й 1,1
9С (тв.) -|- 10Н2—>н-СвНао (нонан) -54,7 —47й 4,3-10-й
Гексен-1 —-* Циклогексан —19,5 — 19,4 6,0-10»
СН4 + 2Оа СО, -f-2H2O -192 —192в 1Q1M)
/»Н4+’/аС1а—ЬНС1 —22,0 —22в 4,9 -101в
VsHj 4* 14 Na * NHa —11,0 —11 8,2-10»
С04-Щ0—►COs + Ha -9,7 —11 1-Ю5-
CHjOh+на —* сн3а+нао —7,3 —3,1 1,8-105
а Все реагенты а газообразном соетлнмно при 29S»2 К (если состояние специально
Не оговорено) и при постоянном давлении. Термохимические данные взяты из “Selected
Values of Chemical Thermodynamic Properties"» Rossini F. D. et aL (Circular of the Nati-
onal Bureau of Standards 500, Washington, D, C., 1952) я "Selected Value? of Physical and
Thermodynamic Properties of Hydrocarbon and Related Compounds”, Rossini F* D. et al.
(American Petroleum Institute Research Project 44)„ Carnegie Press» Pitlsburgh, 1953).
б Вычислено при использовании ДН=171.7 ккал/моль для С (тв.) -—кС (газ)
при 25 °C»
а Это значение не является независимым» поскольку энергия связи для продуктов была
вычислена нз экспериментальной величины АН.
96
ГЛАВА 3
Таким же путем можно определить значения А Я для многих 1
других типов реакций органических соединений в газовой фазе при .1
25 СС (табл. 3-6). Далее, если известны соответствующие теплоты ис- |
парения или растворения, то нетрудно вычислить АЯ для жидких, |
твёрдых или растворенных веществ. Особый случай представляет 1
собой взаимодействие Ионных соединений, которое рассматривается Ч
в гл. 10. .]
Упражнение 3-7, Используя таблицу энергий связей, вычислите Д/f приведен-
ных ниже реакций, происходящих в газовой фазе при 25 °C; ; j
a) CH3CHsCHs+5Oa ЗСОй + ДНгО г) СО-рЗН2 —>СН4+НаО
б) н-Декан + 31/2Ог —> 10СОЯ-|-11Н2О д) СН4 + С1а —*СНЭС1 + НС1
в) СН4+%0а -Ч- СО+2Н2О : е) CH4:+h — CH8l-f-Hl
Упражнение 3-8. Рассчитайте кН для перехода С(тв.) —* С(газ) из теплоты :
сгорания 1 г-атома углерода, равной 94,05 ккал, и энергий связей, приведенных
в табл. 3-5.
3-6. Дальнейшие замечания относительно
энергий связей
Весьма важно уяснить, что приведенные в табл, 3-5 энергии связей для всех
молекул, кроме двухатомных, представляют собой средние значения. То, что энер-
гия связи С--Н полагается разной 98,7 ккал, не означает, что при отрыве от ме-
тана одного атома водорода за другим для каждой стадии будет получаться одно
и то же значение, равное 98,7 ккал. В действительности экспериментальные дан-
ные указывают на совершенно различные энергии для каждой стадии диссоциа-
ции.
СИ, - сн3- + н- кН— 102 ккал
сн3- -сн2- + н- Д/7= 87 ккал
>снв- -» -сн + н- кН= 125 ккал
СИ. —» *С-(газ)-(- н« кН,= 81 ккал
сн( -» 'й’(газ) + 4Н- кН = 395 ккал 25’G
Следовательно, необходимо избегать использования энергий связей, приведённых
в табл. 3-5, !как меры АН для диссоциации только одной связи в многоатомной мо-
лекуле. В последнем случае следует оперировать величинами, носящими и аз в ан не
энергий диссоциации связен, некоторые из которых приведены в табл. 3-7 и рас-
сматриваются более полно в разд. 3-7. Различие экспериментальных методов,' -
используемых для. о пр оделен и я, энергий связей и энергий диссоциации связей,
иллюстрируется упражнением 3-11.
Несмотря па то что энергии связей в табл. 3-5 имеют вполне определенный
смысл и дают возможность проводить достаточно надежные, оценки Д/f, Следует
отдавать себе отчет в том, что они базируются на неверном допущений,: согласно
которому энергии всех С—С- и всех С—-Н-связей одинаковы независимо от: того,
находятся они в таких, например, соединениях, как Н—GsC—СН3, или в таких,
как СН8—СЬ1а—СН3. В действительности же простые связи при углероде, связан-
номдвойной связью (в общем случае X—С=С), приблизительно на4ккаЛ прочнее,
АЛКАНЫ
97
Таблица 3-7
11 Приведенные значения не следует путать с данными табл, 3-5: в то время как
энергии Связей, помещенные в этой таблице, относятся к О К, в табл. 3-5 они даны для
25 °C. Для грубой оценки энергий диссоциации Связей при 25 °C нужно прибавить I ккал
к значению, вычисленному для 0 Кг Более точные значения энергий диссоциации связей
см. в работе: Кпох В. Е.. Palmer И. В. Cbem. Rev.. Bl. 247 (1961).
чем обычные простые связи X—С—С, тогда как простая связь при углероде, свя-
занном тройной связью, приблизительно на 12 ккал прочнее, чем простые связи
типа X—С—С. Если это так, то каким образом таблица энергий связей вообще
может привести к сколько-нибудь точной оценке Д/f? Причина заключается в том,
что приведенные в таблице энергии связей О=С и CsaC приняты соответственно на
16 и 24 ккал большими, чем они должны были бы быть. Так, для диссоциации эти-
лена (СН,=СН2) АН окажется одинаковой и в том случае, если принять для четы-
рех связей С—Н значения162,7 ккал, а для двойной связи 129,8 ккал, и в том
случае, если принять для каждой из С—Н-связей значение 98,7 ккал и для двой-
ной связи — 145,8 ккал. Можно задать вопрос, почему в табл, 3-5 не' использу-
ются значения энергий связей, наиболее близкие к действительным? Ответ заклю-
чается в том, что эТо.не оказало бы существенного влияния на точность вычисле-
ния Д-У и очень сильно увеличило бы таблицу энергий связей.
4 1540
98
ГЛАВА 3
Упражнение 3-9. Диссоциации первой связи О—Н в газообразной воде при
25°С соответствует ДЯ, равная 4* 119,9 ккал. Чему равна ДЯ для диссоциации
второй О—Н-связи? г
Упражнение 3-/0. Условимся использовать следующие значения энергий
связей (ккал):
sC-H 1 110,7 СеС 175,6
1 =с— н 102,7 с=с 129,8
1 —с— н 98,7 с—с 82,6
I
Какие значения в соответствии с этим мы должны принять для связи С—Вт, если
значения ДЯ, вычисленные для реакций
НСя»СН+Вг2 —* ВгНС=СНВг и ВгНС=СНВг4-Вг2 —► Вг2НС — СНВга,
оказываются точно такими же, как вычисленные при использовании энергий свя-
зей, заимствованных из табл. 3-5. Приведите ваши соображения.
Упражнение 3-//. Метан медленно реагирует с атомарным бромом; из величи-
ны температурного коэффициента скорости бромирования метана было получено
значение ДЯ приведенной ниже реакции, составляющее 13 ккал.
СН4-1- Вг- —► СН3-+НВг ДЯ = 4- 13 ккал
а) Рассчитайте прочность связи С—Н в СН4, используя этот результат и лю-
бые другие энергии связей (по вашему выбору).
б) Теплота приведенной ниже реакции равна 192 ккал (в газовой фазе)
СН4-|-2О2 —► СОВ + 2Н3О (газ) &.Н = —102 ккал
Основываясь на &Н в любых других энергиях связей, приведенных в табл. 3-5,
рассчитайте значение энергии второй С—Н-связи в метане,
в) Рассмотрите вопрос о том, будут ли энергии двух С—Н-связей, полученные
в (а) и (б) различными методами, одинаковыми (теоретически или на практике).
Предполагается, что ошибка эксперимента мала.
3-7. Галогенирование алканов
и общие проблемы органического
синтеза
Простейшая реакция взаимодействия метана с хлором приводит
к образованию хлорметана (хлористого метила) и хлористого водоро-
да
СН4 + С1Й —► СНЭСЦ-НС1
Несмотря на.то что уравнение этой реакции выглядит очень прос-
тым, одно оно не дает возможности предсказать, будет ли эта ре-
акция иметь практическое значение для получения хлористого ме-
тила, Для этого требуется гораздо большее количество информации.
При этом возникают две основные теоретические проблемы, Во-
первых, нужно знать, может ли произойти такое превращение. Это
связано с вопросом о константах равновесия, и в целом качественное
АЛКАНЫ ‘ 99
предсказание констант равновесия простых органических реакций
обычно не представляет труда, как будет показано в следующем
разделе. Вторая проблема, которая доставляет больше затруднений,
заключается в ответе на вопрос (в том случае, если положение рав-
новесия данной реакции для нас благоприятно и превращение, та-
ким образом, может произойти), будет ли превращение протекать с
подходящей скоростью при данных условиях. Общее решение про-
блемы скоростей реакции до настоящего времени не достигнуто, хотя
был сделан ряд полезных корреляций, некоторые из которых будут
рассмотрены позднее, одновременно с указанием на основные встре-
чающиеся при этом трудности.
После того как будет выяснено, что данная реакция должна про-
исходить с удобной для нас скоростью, необходимо решить еще
ряд практических вопросов, нужных для выбора удовлетворитель-
ного способа действий, а именно учесть возможные побочные ре-
акции, дающие продукты, отличные от желаемого, легкость выде-
ления желательных продуктов из реакционной смеси и стоимость
материалов, аппаратуры и труда.
Некоторые из перечисленных проблем будут рассмотрены ниже
в связи с реакциями, имеющими важное синтетическое значение.
А. Константы равновесий
В принципе подобно тому, как метан может взаимодействовать
с хлором, образуя хлористый метил и хлористый водород, так и
хлористый метил может реагировать с хлористым водородом, об-
разуя метан и хлор. Если условия таковы, что обе реакции проте-
кают с конечной скоростью, то в итоге установится равновесие и
тогда скорости прямой и обратной реакций должны быть одинако-
выми,
CHi + Ch 5=t СН3С1 + НС1
К равновесию может быть применено хорошо известное уравнение
[СНЭС1] [НС1]
[СЙ4][С13|
Величины, заключенные в квадратные скобки, означают либо
концентрации (в случае жидких реагентов), либо парциальные давле-
ния для случая реагирующих газов. Если константа равновесия К
больше единицы, то при смешении равных объемов реагентов (все
они при температуре выше—24 °C являются газами) реакция будет
протекать слева направо. В том случае, когда константа равнове-
сия меньше единицы, реакция должна протекать справа налево.
Для случая хлорирования метана из экспериментальных данных из-
вестно, что К. гораздо больше единицы; однако с точки зрения пла-
нирования других органических синтезов чрезвычайно важно было
бы иметь возможность предсказывать величину К заранее.
4*
100
ГЛАВА, а
При сравнении тенденции реакции к той или иной степени прев-
ращения (определенной по ее константе равновесия) с количеством
выделяющегося при этом тепла обнаруживается четкий параллелизм.
Например, реакция водорода с кислородом, будучи инициирован-
ной, протекает чрезвычайно экзотермично и имеет константу рав-
новесия, равную 10 10 при 25 °C. Обратная реакция протекает в
сколько-нибудь заметной степени только при очень высоких темпе-
ратурах.
Ha-j-i/A — нго
(25 °C)
Из этого и подобных ему примеров можно сделать вывод, что,
чем больше количество выделяющегося тепла, тем больше тенден-
ция реакции к протеканию и тем больше значение Л. Однако эта
корреляция между константами равновесия и теплотами реакций не
является ни строгой, ни универсальной. Известны, например, эн-
дотермичные реакции, имеющие тем не менее константы равновесия
гораздо больше единицы. Очевидно, что константа равновесия долж-
на зависеть еще от каких-то факторов, помимо выделяющегося в
реакции тепла, так что при рассмотрении большого числа примеров
любая попытка установить точную корреляцию между К. и тепло-
той реакции будет ошибочной. Такой дополнительной переменной
является энтропия реакции AS, природа которой качественно рас-
сматривается в разд. 3-7.Б.
Точное термодинамическое соотношение между константой рав-
новесия реакции X, теплотой реакции АХ и энтропией реакции AS
выражается следующим уравнением:
—2.303RT lg (3-1)
где R — хорошо известная газовая постоянная (1,986 кал-град"1 •
моль"1) и Т—абсолютная температура .в градусах Кельвина,
Очевидно, что если можно вычислить для реакции АХ и AS, то
можно также вычислить для этой реакции константу равновесия
при любой температуре. К сожалению, определение AS далеко не
так просто, как определение &Н.
Значение АХ, вычисленное для образования хлористого метила
и хлористого водорЬда из метана и хлора, равно — 27 ккал (при ис-
пользовании энергий связей, приведенных в табл. 3-5). Несмотря на
то что существует уверенность в экзотермичности процесса, нельзя
сказать с определенностью, что реакция действительно произойдет
так, как это было написано (т. е. что Х>1). Тем не менее из опыта
известно, что X обычно больше единицы для болыиинстеа реакций с
&.Н, имеющей более отрицательное значение, чем ~1-5 ккал, и обычно
меньше единицы при &Н, имеющей более положительное значение,
|Ш1 \'1б ккал.
АЛКАНЫ
101
В дальнейшем это положение будет использоваться в качестве
«правила большого пальца» для предсказания того, больше или
меньше единицы будет константа /( для реакций в газовой фазе, про-
исходящих с участием простых молекул, Можно получить некоторое
представление о том, насколько успешно может применяться это
правило, ознакомившись с примерами табл. 3-6, в которой также
сравниваются некоторые экспериментальные значения ДЯ со зна-
чениями, вычисленными на основании энергий рвязей.
Б. Энтропийные эффекты
При попытке предсказать К трудности могут встретиться в тех случаях, когда
Долежит в интервале От —!5 до -[-15 ккал или когда энтропия реакции AS вели-
ка. Так, «правило большого пальца» не приносит пользы в случае образования
н-гексана из твердого углерода и газообразного водорода:
С(тв.)4-7На (газ) —*• н-СвН14 (газ) ДИ = —40 ккал
Д/7 этой реакции равна—40 ккал/моль, но константа равновесия тем не ме-
нее близка к единице (см, табл. 3-6). Причина заключается в том, что энтропий-
ный эффект в этом случае необычайно веляк. ,
Энтропия химической системы является в сущности мерой молекулярной не-
упорядоченности в ней, т. е. мерой вероятности данного состояния. Различные
виды молекул обладают различными степенями свободы — вращательными, коле-
бательными и поступательными — и, следовательно, различными средними степе-
нями молекулярной неупорядоченности. Для большинства химических реакций
степень молекулярной неупорядоченности не одинакова для реагентов и продук-
тов, так что имеет место изменение энтропии (т. е, AS^O). При прочих равных ус-
ловиях, чем более не упорядочено состояние системы, тем более оно выгодно. Ясно,
что изменения энтропии будут очень значительными во всех тех случаях, когда
продукты реакции резко отличаются в отношении степени связанности (организа-
ции) от реагентов (как в.сторону увеличения, так и в сторону уменьшения). Имен-
но таким случаем является образование н-гексана из твердого углерода и газооб-
разного водорода. Твердый углерод обладает упорядоченной жесткой структурой
с малой степенью свободы движений отдельных атомов. Степень связанности этих
углеродных атомов гораздо меньше в том случае, когда они входят в состав
н-гексана, вследствие чего Д5 для данной реакции оказывается более положитель-
ным, что В соответствии с уравнением (3-1) приводит к увеличению К. Однако этот
эффект, обусловленный AS, невелик по сравнению с разницей между степенью
неупорядоченности водорода в газообразном водороде и в н-гексаце. Молекулы во-
дорода в газообразном состоянии имеют значительную свободу поступательного
движения и высокую степень неупорядоченности, 66льшая часть которой теряется,
когда атомы водорода соединяются с цепью углеродных атомов. Это приводит к
большому отрицательному значению AS, что соответствует уменьшению К,.
Короче говоря, соединение твердого углерода с газообразным водородом, приводя-
щее к образованию углеводорода с длинной цепью, подобного н-гексану, плохо
подчиняется корреляции между Д/7 и: /( главным образом вследствие большого
изменения энтропии, связанного с необходимостью перехода водорода из газооб-
разного состояния в состояние с более высокой организацией, в котором он связан
с углеродом. Кай и следовало ожидать, образование н-прнана из твердого углеро-
да ц газообразного водорода дает еще более плохую корреляцию,
Такне же большие отрицательные энтропийные эффекты обычно наблюдаются
при реакциях замыкания цикла, подобных образованию циклогексана из гексе-
на-1 (Д5=—20,7 энтр. ед.), которое происходит со значительной потерей враща-
102
ГЛАВА 3
тельных степеней свободы (неупорядоченности), обусловленных вращением вокруг
С—С-связей.
сн2
снв—СНа—СНа—СН2—СН=СН8
гексен -1
циклогексан
При образовании циклогексана из этилена потеря энтропии еще больше
(—86 энтр, ед.), поскольку при ориентации трех молекул, приводящей к обра-
зованию цикла, теряется значительно ббльшая свобода движения.
СНа
CHS. ^Н2
II
СНг СНа
СН2
этилен (3 моля)
Упражнение 3-12. а) Рассчитайте &.Н для превращения гексена I в циклогексан
при 25 °C, основываясь на энергиях связей; используя это значение и приняв AS
равным —20,7энтр. ед. (кал моль-1-град-1)г вычислите константу равновесия К
по уравнению (3-1).Для сравнения вычислите константу равновесия, которой
следовало бы ожидать в том случае, если бы степени неупорядоченности для реа-
гентов и продуктов были одинаковы (т. е. при AS=0).
б) Какой была бы AS для этой реакции в том случае, если бы «правило ± 15
ккал» при 25 °C давало правильные ответы?
УпражпениеЗ-/З^Им^я в виду, что константа образования н-нонана из твердого
углерода и водорода равна 4,3-10~объясните, почему жидкий нонан не разла-
гается немедленно на составляющие его элементы.
В. Скорости реакций
Вычисленное значение ДЯ для хлорирования 1 моля метана сос-
тавляет —27 ккал, а константа равновесия X равна приблизительно
I0ls. Тем не менее метан и хлор не реагируют со сколько-нибудь за-
метной скоростью в темноте при комнатной температуре, хотя при
интенсивном облучении такой смеси фиолетовым или ультрафиоле-
товым светом может произойти взрывная реакция. Очевидно, что
свет способствует протеканию реакции хлора с метаном по очень
эффективному пути.
При любой попытке теоретически предсказать или объяснить
наблюдаемую скорость данной или какой-либо иной реакции неиз-
бежно приходится принимать во внимание детали процесса, по-
средством которого реагенты превращаются в продукты; другими
словами, необходимо знать механизм реакций. Один из возможных
путей, которым метан может реагировать с хлором, заключается в
столкновении молекулы хлора с молекулой метана таким образом,
АЛКАНЫ
103
Рис, 3-5, Четырехцентровое соударение хлора с метаном, изображенное с по-
мощью шаростержневых моделей.
что хлористый водород и хлористый метил образуются непосредст-
венно (рис. 3-5). Отсутствие реакции метана с хлором в темноте при
умеренных температурах служит серьезным доводом против такого
пути превращения. Существуют две причины, позволяющие ут-
верждать, что механизм простого столкновения не должен осущест-
вляться. Во-первых, согласно этому механизму, предполагается
очень точно ориентированное «четырехцентровое» столкновение мо-
лекулы хлора и метана, вероятность осуществления" которого мала
(т. е, сопровождается значительным уменьшением энтропии). Во-
вторых, он требует проникновения хлора довольно глубоко в моле-
кулу метана — настолько, чтобы один из атомов хлора достаточно
Рис, 3-6, Кривая зависимости потен-
циальной энергии двух атомов неона
от расстояния между ядрами. Значения
энергии приведены для моля атомов
неона.
104
ГЛАВА 3
Рис. 3-7. Модели, показывающие степень сжатия атомов, необходимую для до-
стижения молекулой хлора расстояния, при котором возможно образование связи
с атомами углерода и водорода, входящими .в состав метана.
близко подошел к атому углерода. Это необходимо для возникнове-
ния связи и образования в качестве продукта хлористого метила.
Вообще для сближения - несвязанных атомов на расстояния,
близкие к тем, при которых начинает образовываться связь (1,2—
1,8 А), требуется, как это видно из рис. 3-6, очень большая затрата
энергии. Силы межатомного отталкивания возрастают на коротких
расстояниях очень быстро, и для «вталкивания» молекулы хлора в
молекулу метана с тем, чтобы достигнуть расстояния, сравнимого с
длиной связи углерод — хлор в хлористом метиле (1,77 А), требу-
ется значительное количество энергии (рис. 3-7). Ценную информа-
цию относительно межатомного о’гталкивания можно получить с
помощью моделей Стюарта, в которых величина радиусов соответ-
ствует истинным эффективным радиусам атомов, т. е. тем расстоя-
ниям, при которых кривая, изображенная на рис. 3-6, начинает кру-
то возрастать. На таких моделях степень атомного сжатия, требую-
щаяся для сближения несвязанных атомов на расстояния, близкие
к длинам связей, видна более наглядно, чем на шаростержневых мо-
делях. Здесь следует заметить, что четырехцентровые реакции по-
стулированного выше типа встречаются крайне редко. Одним из
немногих хорошо доказанных примеров может служить медленная
тепловая реакция водорода с иодом, приводящая к образованию
йодистого водорода.
И----г.— I
I | 2HL
' Н— -----1
Все другие возможные механизмы образования хлористого ме-
тила и хлористого водорода из хлора и метана представляют собой
стадийные процессы. Такие процессы имеют аналогию с. последова-
тельностью воронок с различными диаметрами трубок, через которые
течет песок. Воронка с наиболее узкой трубкой будет играть роль
АЛКАНЫ
iO5
«горлышка бутылки», и в случае, если диаметр ее трубки значитель-
но меньше, чем у остальных воронок, она одна будет определять
скорость протекания песка. В; целом многостадийная химическая
реакция включает медленную стадию, определяющую скорость (ана-
логичную воронке с узкой трубкой), и другие, относительно бы-
стрые стадии, которые могут осуществляться как раньше; таки
позднее медленной стадии. Предсказание скорости реакции, проте-
кающей ,по стадийному механизму, должно включать в качестве
центральной проблемы выяснение того, какая из стадий определяет
скорость, и анализ факторов, определяющих скорость этой стадии.
Для хлорирования метана возможна следующая; последователь-
ность стадий:
(1) ~ медленна Giz -ч——► Z : CI -
(2) медленно СН4 » , сн5 + н.’
(3) :С1- + СН,- —.'-"А С,НЭС1
(4) ; С1 • + Н. НС1
Реакции (1) и (2) предполагает диссоциацию молекулы хлора на
атомы хлора й разрыв связи С—Н метана, дающий свободный
метильный радикал и атом водорода. Свободный радикал метил,
подобно атомам хлора и водорода, имеет один нечетный электрон,
который'не принимает участия в образовании связи. Атомы и свобод-
ные радикалы обычно высокореакционноспособны, так что образо-
вание хлористого метила и хлористого водорода вполне может про-
текать по уравнениям (3) и (4), Весь вопрос теперь заключается в
том, могут ли в данных условиях реакции осуществиться стадии (1)
и (2).
Постараемся убедиться в возможности протекания этих стадий,
определив энергию, необходимую для разрыва связей. Это окажет
нам помощь, поскольку в отсутствие каких-либо внешних воздей-
ствий энергия, нужная для разрыва связей, может быть получена
только вследствие столкновений, обусловленных обычным'тепловым
движением молекул. При температурах ниже 100 °C одно только теп-
ловое возбуждение лишь в очень редких случаях служит источни-
ком энергии, достаточной для того, чтобы разрушить Сколько-ни-
будь значительное число связей, более прочных, чём 30—35 ккал/
моль. Следовательно, можно отклонить как неверную любую ста-
дию, в том числе и реакции диссоциации (1) и (2), если Д/У для раз-
рыва этих связей больше 30—35 Ккал/моль. В отношении реакции
(1) вопрос может быть решен, основываясь на энергии связи С1—С)
(см. табл. 3-5), которая составляет 58,0 ккал и, очевидно, слишком
велика для того, чтобы сделать возможным разрыв этой связи в ре-
зультате теплового возбуждения при температурах до 100 °C. Для
106
ГЛАВА 3
реакции (2), при которой происходит разрыв связи С—Н метана, ис-
пользование значения энергии С—Н-связи, приведенного в табл.3-5
(98,7 ккал), нецелесообразно, поскольку эта энергия составляет
одну четвертую от энергии, требуемой для разрыва всех четырех
связей С—Н (разд. 3-5). Разумнее использовать энергии диссоциа-
ции связей, приведенные в табл. 3-7, поскольку они представляют со-
бой энергии, необходимые для разрыва только одной конкретной
связи в многоатомной молекуле. Энергия диссоциации связи в ме-
тане оказывается равной 101 ккал при 0 К или 102 ккал при 25 °C;
это, разумеется, означает, что связи С—Н в метане слишком прочны
для того, чтобы онн могли разорваться в соответствии со схемой
реакции (2) при 100°С или ниже. Теперь должно быть ясно, почему
смесь метана и хлора не реагирует в темноте при умеренных тем-
пературах.
Упражнение 3-14. Возможный механизм реакции метана с хлором мог бы за-
ключаться в столкновении, при котором молекула хлора отрывает водород в со-
ответствии с приведенной ниже схемой:
. медленно
СН3:Н+fCUCl: —> СНа- 4 Н: С1: + Сй
•• быстро _
СНа-4-:СЬ —4 С_На:С1>
Используя соответствующие энергии связей, оцените степень вероятности такого
механизма реакции. Что можно сказать о возможности такого механизма в слу-
чае элементарного фтора и метана?
Вообще говоря, инициирование хлорирования метана светом,
близким к ультрафиолетовому, могло бы быть следствием активации
либо метана, либо хлора, либо их обоих. Однако метан бесцветен,
а хлор имеет желто-зеленую окраску, откуда следует, что хлор, а не
метан взаимодействует с видимым светом. Квант близкого к ультра-
фиолетовому света, поглощаемый газообразным хлором, может дать
более чем достаточно энергии (около 70 ккал на 1 моль хлора, погло-
щающего моль фотонов) для того, чтобы расщепить молекулу на
два атома хлора (см. разд. 2-1).
•• •' фиолетовым сеет „ ,
: Cl: С1 г ----------------->- 2 : С1’
Альтернативная возможность разрыва молекулы хлора с обра-
зованием хлор-катиона и хлорид-иона в газовой фазе при действии
видимого света ие может осуществляться, поскольку для этого тре-
буется около 270 ккал/моль.
J Cl: С1: ----► : Cl:® + : С1® ДЯ = + 270 ккал
АЛКАНЫ
107
Рис. 3-8. Модели, показывающие степень сжатия атомов, необходимую для до-
стижения атомами хлора расстояния, при котором возможно образование связи
с атомом водорода в метане (ер. с рис. 3-7).
Образовавшийся атом хлора может оторвать атом водорода от
молекулы метана и дать метильный радикал и молекулу хлористого
водорода. Энергии связей в СН4 (102 ккал) и НС1 (103,2 ккал) поз-
воляют утверждать, что эта реакция окажется экзотермичной при-
мерно на 1 ккал/моль.
сн4 + :С1-
сн3 + НС1
ДЯ к -1 ккал
Атака атома хлора на водород метана, по-видимому, не требует осо-
бенно точно ориентированного столкновения, и межатомное оттал-
кивание должно быть при этом существенно меньше, чем при четы-
рехцентровом механизме, рассмотренном ранее для реакции моле-
кулярного хлора с метаном, поскольку в данном случае должны
сблизиться только два центра (рис. 3-8).
Свободный метильный радикал, образующийся при атаке атома
хлора на водород метана, может далее оторвать атом хлора от мо-
лекулы хлора и образовать хлористый метил и новый атом хлора.
си,* + С1»
СНЭС1 + : С1 •
ДЯ = -23 ккал
Согласно расчету, экзотермичность этой реакции должна сос-
тавлять 23 ккал; это достаточно большое значение для того, чтобы Л
была гораздо больше единицы. Атака метильного радикала на мо-
лекулу хлора потребует несколько более точно ориентированного
столкновения, но межатомное отталкивание не будет превышать
отталкивания при реакции атома хлора с-метаном.
Важной особенностью последовательности стадий в механизме,
сформулированном для хлорирования метана, является то, что
вместо атома хлора, расходуемого на первой стадии, появляется дру-
гой атом хлора на второй стадии.
J 08
ГЛАВА 3
CH, * : Cl ---► СН,- + HC1
CH, • + Cl, ----► CHjCl + :C1-
CH4 + Cl, -------► CHjCl + HC1
Такого типа процессы носят название цепных реакций, поскольку
в принципе один атом хлора может инициировать хлорирование
бесконечно; большого числа молекул метана, действуя через посред-
ство «цепи» или цикла превращений. На практике течение цепных
реакций ограничивается так называемыми процессами обрыва цепи,
при которых атомы хлора или метильные радикалы выбывают из
процесса, реагируя один с другим, как показано в приведенных
ниже уравнениях:
СН, • + .’Cl* -—► СН,С1
ген,- ——сн,сн,
2 : Cl • —► Cl,
Протекание цепных реакций может быть разбито на три фазы.
Первая заключается в инициировании цепи; для хлорирования мета-
на это стадия активирования и превращения молекулы хлора в атомы
хлора при действии света. Во второй фазе, включающей стадии
развития цепи, реагенты превращаются в продукты реакции, при-
чем атомы или радикалы в ходе этого процесса не исчезают. Со
стадиями развития цепи конкурируют стадии обрыва цепи, заклю-
чающиеся в исчезновении атомов или радикалов.
С1г > г • ci •
СН4 + -:С1- ---► СН, • + НС1
СН, • + С1г ----- CHjCi + : Cl
CH, + : Cl - -*- CH,C1
: Cl • + : Cl • -* С1г
CH, - + СН, • —* сн,сн.
инициирование цепи
развитие цепи
обрыв цепи
Следует заметить, что реакции обрыва цепи при хлорировании
метана должны протекать исключительно быстро, поскольку при
них происходит комбинирование нестабильных атомов или ради-
калов, приводящее к образованию устойчивых молекул. Если до
АЛКАНЫ
109
того, как стадии обрыва цепи приведут к исчезновению активных
промежуточных соединений, успевает произойти значительное раз-
витие цепи, то это означает, что стадии развития также должны
быть чрезвычайно быстрыми. Развитие цепи доминирует над обры-
вом в условиях, когда концентрация радикалов (или атомов) ма-
ла, поскольку при этом вероятность встречи двух радикалов (обрыв
цепи) гораздо меньше, чем вероятность встречи радикалов с моле-
кулами, присутствующими в относительно высокой концентрации
(развитие цепи).
Суммарные скорости цепных реакций обычно сильно снижаются в присутст-
вии соединений, которые могут взаимодействовать с атомами и радикалами и
превращать их в соединения, неспособные участвовать в стадиях развития цепи.
Такие вещества часто называют ловушками радикалов или ингибиторами.
Кислород действует как ингибитор при хлорировании метана, так как он быстро
взаимодействует с метильным радикалом, образуя сравнительно устойчивый
(менее реакционноспособный) радикал перекиси метила СН3ОО-. Это приводит к
эффективному обрыву цепи. В благоприятных условиях цепь хлорирования мета-
на может проитнот 100 до 10 000 циклов, прежде чем произойдет обрыв вследствие
рекомбинации свободного радикала или атома. Эффективность (или квантовый
выход) реакции, т. е. количества прореагировавших веществ относительно коли-
чества поглощенного света, является, таким образом, весьма высокой.
Упражнение 3~/5. Рассчитайте ДН для каждой из стадий развития цепи при
хлорировании метана по механизму приведенного ниже типа;
ftu
С12 —> 2СЬ инициирование цени
развитие цепи
Рассмотрите возможность осуществления таких стадий развития цепи с точки зре-
ния их энергетической выгодности и проведите сравнение с другими возможными
механизмами.
СЬ + СН^ — СН5С1 + Н- I
Н-+С1/ — HCI+CI. (
Г. Теплота активации
Рассмотренная выше реакция (так же, как и любая другая) имеет еще один
чрезвычайно важный аспект. Обратим, например, внимание на стадию отрыва
атома водорода от молекулы метана атомом хлора. Выше уже отмечалось, что эта
стадия экзотёрмична на I ккал й что фактор ориентации вряд ли действует в этом
случае особенно жестко. Тем не менее простого столкновения между реагентами,
в том числе и должным образом ориентированного, в общем случае недостаточно
для того, чтобы послужить причиной реакции. Необходимым условием эффектив-
ности столкновения в этом смысле является превышение энергией реагента некоего
среднего значения, необходимого для преодоления сил отталкивания, возникаю-
щих при тесном сближении несвязанных атомов (см. рис. 3-6 и 3-8). Эта дополни-
тельная энергия носит название теплоты активации Д/i* и может рассматри-
ваться как энергетический барьер между реагентами и продуктами, как это схе-
матически изображено на рис. 3-9. Можно принять, что на вершине барьера водо-
род связан частично с хлором, частично С углеродом, Именно такой тип связыва-
ния делает энергетическую кривую реагирующей системы отличной от кривой, ха-
рактеризующей столкновения, приводящие только к отталкиванию (см, рис. 3-6).
Температура играет решающую роль для скорости реакций, поскольку имен-
но от нее зависит, сколько молекул будет иметь энергию, минимально необходй-
110
ГЛАВА 3
Рис, 3-9. Энергетическая диаграмма реакции СН»+:С1—>СН3—(-HCI при посто-
янном давлении.
мую для осуществления реакции. Поэтому для определения теплоты активации ис-
следуется влияние температуры на скорость реакции.
Вообще говоря, нельзя ожидать, что Ай* и Дйбудутпаходиться втесной вза-
имосвязи (за исключением случаев, когда сравниваются реакции между очень сход-
ными реагентами, протекающие по близким механизмам). Можно ожидать хоро-
шей корреляции, когда в случае реакции
СН4 +* :Х*
СН3 + НХ
проводится сравнение Дй* и Дй для различных :Х- (атомов фтора, хлора, бро-
ма и иода). Корреляции должны быть гораздо хуже при сравнении суммарных
значений Дй* для хлорирования метана и горения метана с соответствующими
Дй, так как обе реакции протекают по различным и чрезвычайно сложным меха-
низмам. В любых реакциях Дй* либо будет равна Дй, либо будет иметь более
положительное значение.
Координатой реакции может быть любая величина, отражающая прохожде-
ние реакции. Часто оказывается удобным выбрать в качестве координаты сумму
расстояний С—Н и Н—-CJ, где Н — атом водорода, участвующий в реакции. Боль-
шое расстояние Н—С| рассматривается как отрицательное, а большое расстояние
С—Н — как положительное.
Упражнение 3-16. Вычислите Дй для реакций
СН4 + КВг< ----*- СН3* + НВг
сн4 + :*!• —сн3* + hi
11нч(’рт1|те энергетические диаграммы, аналогичные изображенной на рис. 3-9.
Что нм можете сказать о соотношении величин Дй* и Дй во сравнению с соответ-
СТИУкжгП рОйКЦИвй атома хлора?
АЛКАНЫ
111
Из приведенного выше изложения должно быть ясно, что предсказание ско-
ростей реакций может столкнуться со многими трудностями. В случае хлорирова-
ния метана скорость реакции зависит не только от длины волны, интенсивности
света, температуры, концентрации реагентов и скоростей отдельных стадий раз-
вития и обрыва цепи, но также от концентрации введенных извне соединений, ко-
торые могут служить ингибиторами реакции. Рассмотренный пример является
сложным, по он не представляет собой в этом отношении чего-то необычного.
3-8. Практика проведения галогенирования
Хлорирование насыщенных углеводородов может быть также
проведено в темноте при температурах около 300 °C. В этих усло-
виях механизм сходен с механизмом хлорирования, инициируемого
светом, с тем отличием, что атомы хлора образуются путем терми-
ческой диссоциации молекул хлора. Присутствие твердой поверх-
ности' углерода катализирует термическое хлорирование, возмож-
но, вследствие того, что на поверхности облегчается расщепление
молекулы хлора.
Прямое галогенирование насыщенных углеводородов проходит
удовлетворительно только с хлором и бромом. Для реакции, вы-
ражаемой общим уравнением
—i— Н-рХз — С—X-|-H—X
I I
X = F. Ci, Br, 1
рассчитанное значение ДД имеет очень большое отрицательное
значение в случае фтора, небольшую отрицательную величину
для хлора и брома и положительную в случае иода (табл. 3-8).
При реакции с фтором выделяется так много тепла, что она с трудом
поддается контролю; образуются продукты разрыва связей углерод—
углерод, а также связей углерод — водород. Косвенные методы
получения фторзамещенных углеводородов будут рассмотрены
Таблица 8-8
Вычисленные теплоты реакций галогенирования
углеводородов
—С—н+хг—>—х+нх
I I
X &Н, кк«м/модь
F CI Вт 1 — 115. —27 — 10 12
: П2
ГЛАВА 3
ниже. Бром обычно гораздо менее реакционноспособен по отноше-
нию к углеводородам, чем хлор, как при высоких температурах,
так и при активировании светом. Тем не менее насыщенные углево-
дороды обычно удается пробромировать. Иод нереакционноспособен
по отношению к ним.
Хлорирование метана не останавливается на стадий образова-
ния хлористого метила; можно получить также продукты более
глубокого4 хлорирования; дихлор метан (хлористый метилен), три-
хлорметан (хлороформ) и тетрахлбрметан (чётыреххлористый уг-
лерод). Практически в той или иной степени образуются все воз-
можные продукты замещения; относительные количества их зави-
сят от используемого отношения хлора к метдну. Если желательно
получить монохлорзамещенный продукт, то следует использовать
большой избыток углеводорода.
СНа —> CHsCl —* CH,Ci, —> CHCla —• СС1,
хлор мет an дн хлор yer ан трихлорметян тетрахлорметан
В случае пропана и высших углеводородов, где возможно обра-
зование более чем одного продукта монозамещения, могут возник-
нуть сложные проблемы разделения в том случае, когда желательно
получить какой-либо один из продуктов. Например, хлорирование
изопентана при 300 °C дает все четыре возможных продукта моно-
замещения (III—VI):
сн3 СН,, сня
I C1f | I
СНа— С—СН,-СН3--------, С1СН,—С—СН,—СН, |-СН3 — С—СН,—CH.CI4-
| 300=0 | ]
н Н Н
изопентан 1*хлар-2-метиУ1бутан (ПО I-хлор-3-метйлбутан
(иэоомнлхлорнд) (IV)
СН3 Сн3
+снь—с—chci—сн,+сня—d—сн,—сн,
н ii
3-хлор«2-метилбутав (V) 2-хлор*2-метилбутав
(адетп*амилхлорид) (VI)
Основываясь на чисто статистических соображениях, можно
ожидать, что отношение продуктов будет соответствовать числу
атомов водорода в различных положениях. Иначе говоря, соеди-
нения III, IV, V и VI должны были бы образоваться в отношении.
6:3:2: 1, Однако на практике состав продуктов существенно
иной, поскольку, водороды различного типа атакуются fie с оди-
наковыми скоростями. В действительности отношение скоростей
атаки атомов хлора на водороды, расположенные при первичном,
вторичном и третичном атомах углерода, приблизительно равны
1,0 : 3,3 : 4,4 (при 300 °C). Это отношение парциальных скоростей
почти не зависит от структуры углеводорода и может быть исполь-
зовано для расчета отношения изомеров в продуктах монохлориро-
вапия большого числа насыщенных углеводородов. Для изопентана
АЛКАНЫ
[13.
введение поправки на различную реакционную способность водо-
родов различного типа приводит к следующему распределению
изомеров, очень близкому к тому, которое определяется эксперимен-
тально:
СН3
(III) С1СНа—СН—СНа—СН3 б первичных водородов —JL? . [00=30%
Q . 1 Л
(IV) СНа—СН—СН2—СН2С1 3 первичных водорода ——100 = 15%
сн3;
(V) СНВ—СН—CHCI—СН8 2 вторичных водорода — [0=33%
। 20
СНа
сн,
(VI) СНа —С—СН2—СНа 1 третичный водород
I
а
) 00 = 22%
Эти результаты согласуются с тем фактом, что энергии диссоциа-
ции связей С—Н понижаются на 2—5 ккал (см. табл. 3-7) при пере-
ходе от первичного к вторичному и от вторичного к третичному
водороду (это может служить примером параллелизма между А//* и
&Н‘ разд. 3-7,Г). Однако отношение скоростей реагирования
различных С-—Н-связей при атаке хлором приближается к 1: 1:1,
если температура близка к 300 °C. При более высоких температурах
как атомы хлора, так и углеводороды становятся более реакционно-
способными вследствие увеличения энергии их теплового движения
и достигают состояния, при котором атом хлора отрывает первый
же атом водорода, с которым приходит в столкновение, независимо
от его положения в углеводородной цепи. В этом случае состав
смеси продуктов монохлорирования просто будет соответствовать
статистическому распределению. .
Упражнение 3-17. Рассчитайте отношение количеств изомеров, которого
следует ожидать при термическом (300 °C) моно хлорирован ни (а) пропана, (б)
изобутана и (в) неогексана. Подробно изложите метод расчета.
Атомы брома действуют гораздо более селективно, чем атомы
хлора,— бром атакует только третичные атомы водорода и то не
слишком эффективно. Так, фотохимическое (инициируемое светом)
монобромирование изопентана происходит медленно и дает почти
чистый трет-амилбромид. Большую селективность атомов брома
пр сравнению с атомами хлора можно предвидеть, поскольку рас-
смотрение энергий связей показывает, что процесс сушёсвенно
эндотермичен, тогда как соответствующая реакция с атомом хлора
экзотермична. Не удивительно поэтому, что бром отрывает только те
114
СЛАВА 3
атомы водорода, которые относительно слабее связаны с углеродной
цепью.
I - I
—С—Н-у-Вг- —* —С--у НВт.
Интересно, что селективность реакций хлорирования, прово-
димых в растворе, заметно возрастает в присутствии бензола (рис. 1-1)
или алкилбензолов. Причина этого заключается в том, что бензол
и другие арены образуют с атомами хлора непрочные комплексы,
вследствие чего реакционная способность атома хлора резко пони-
жается — атом хлора при этом приближается по своей активности
к атому брома.
Высокотемпературное хлорирование ряда парафиновых углево--
дородов проводится в больших масштабах в промышленности. Про-
дукты хлорирования находят важное применение в качестве раство-
рителей и как промежуточные соединения в химических синтезах.
Вместо хлора при хлорировании алканов может быть использо-
ван хлористый сульфурил (SOaCl2, т. кип. 69°С)
—С—H-PSO2CI2 —> —С—C1+SO2 + HCI
Реакция проходит по свободнорадикальному цепному механизму,
где цепи могут быть инициированы светом или перекисями (разд.7-6).
Стадии развития цепи, по-видимому, следующие:
I - I
-С-Н’. -Ci: ------► -С- + НС1
I • i
-С- + SO2C12 ------> -С-С1 + SO2 + :ci-
Как и следовало ожидать, хлорирование алканов, в,которых имеется
более чем один тип атомов водорода, дает при действии хлористого
сульфурила такую же смесь хлористых алкилов, которая полу-
чается при действии самого хлора.
3-9. Нитрование алканов
Другой промышленно важной реакцией является нитрование
алканов, приводящее к образованию нитропарафинов. Реакция
обычно проводится в газовой фазе при повышенных температурах
с использованием в качестве нитрующего агента азотной кислоты или
четырехокиси азота.
- 4ЯБ °C
RH-pHNOa------► RNO2-pH2O
АЛКАНЫ
115
Все имеющиеся данные указывают на свободнорадикальный меха-
низм нитрования (см. гл. 19), однако многие аспекты реакции выяс-
нены еще не полностью. В реакции образуются смеси продуктов—
нитрование пропана дает не только 1- и 2-нитропропаны, но также
нитроэтан й нитрометан.
' CHaCH2CHaNO2
I-нитропропан
<25%)
СНаСН2СН3-{-НЬЮ8 <
СНаСНСН,
I
NO2
2.нитропропан
(40%}
CH3CH2ITOa CH.NOa
нитроЭтан нитрометан
(10%) (25%)
При промышленном производстве выход и состав продуктов
нитрования алканов контролируется (в той мере, в какой это воз-
можно) добавлением разумных количеств катализаторов * (напри-
мер, кислорода и галогенов), что, как сообщалось, приводит к
увеличению концентрации алкильных радикалов. Смеси продуктов
разделяются фракционной перегонкой.
Дополнительные упражнения
3-18. Гептан имеет 9 изомеров. Напишите структурные формулы каждого из них.
Назовите каждый изомер, рассматривая его как проиэводное’метана и по системе
ШРАС. Однозначно ли название «неогептан»? Объясните.
3-19. Напишите структурную формулу для каждого из приведенных ниже со-
единений и назовите каждое из них по системе ШРАС.
а) шрегя-бутилизобутил-втор-бутил-н-бутилметап
б) изононан
в) изомеры монохлорпентана; назовите также эти изомеры (в той мере, в ка-
кой это возможно), рассматривая их как хлористые алкилы.,
3-20. Рассчитайте АЛ/ для приведенных ниже реакций в газовой фазе при 25 °C
а) 2СН4 + 7С12 —> СС1Э—СС13+8НС1
б) CHsCHj-p/A 2СО2+ЗНпО
в) СНэСН3-|-Н3 —> 2СН4
г) CHsCH3-f-Br2 —> 2СНаВг
д) СН4+2С1, —» С (газ)-)-4НС1
3-21, а) Больше или меньше оказалась бы АЛ/ в упражнении 3-20 (д) в том случае,
если бы продуктом реакций был С(тв.). Объясните.
б) Каким образом теплоты реакции, определенные в упражнениях 3-20 (в)
и (г), указывают на «насыщенный» характер этана?
3-22. Энергия связи С—F (см. табл. 3-5) была рассчитана по данным современного
термохимического исследования приведенной ниже реакции в газовой фазе.'
СН4-[-4Гг —> CF4-f-4HF Л.Н — —460 ккал
Покажите, каким образом значение АЛ/ в этой реакции может быть использовано
для расчета энергия связи С—F, если известны все остальные энергии связей,
требуемые для расчета.
* Скорее, инициаторов цепной реакции.— Прим. ред.
116
ГЛАВА 3
3-23. Объясните, почему корреляция между Д/У и константой равновесия К все
более ухудшается в применении к реакциям образования метана, пропана, н-,
гексана и н-цонана из твердого углерода и водорода (табл. 3-6).
3'24. Значения &Н для образования циклогексана из гексена-1 и хлористого водо-
рода из водорода и хлора различаются меньше, чем на 3 ккал, но соответствующие
константы равновесия различаются в I07 раз. Объясните.
3-25. Изменение энтропии AS для. реакции образования хлористого этила путем
хлорирования этапа равно +0,5 энтр. ед., тогда как для образования хлористого
этила путем взаимодействия хлористого водорода с этиленом AS равно —3,1
энтр. ед. Объясните.
СН9—СНа +С|г — СНаСН2С1 + НС!
СНа^СНг + НС! —> СНаСН2С1 '
AS ==Ц~5 энтр. ед.
Д$ = —31 энтр. ед.
3-26. Рассмотрите энергетические соотношения (А//) возможных цепных меха-
низмов инициируемого светом монобромнрования метана и сравните их с хлори-
рованием. Что можно в этой связи сказать о иодировании метана?
3'27. Теплота горения циклопропана (СН2)3, приводящего к образованию дву-
окиси углерода и жидкой воды, равна 499,8 ккал. Покажите, каким образом можно
использовать это значение для расчета средних энергии связей С—С в циклопро-
пане.
3'28. Напишите механизм реакции, ведущей к образованию гексахлорэтана, при-
веденной в упражнении 3-20 (а). (Эта реакция используется для промышленного
получения гексахлорэтана.) Механизм должен соответствовать обычно приводи-
мому для хлорирования углеводородов.
4
ГЛАВА
ЦИКЛОАЛКАНЫ
Многие важные углеводороды содержат кольца, состоящие из
углеродных атомов, связанных между собой простыми связями; они
известны под названием циклоалканов. Простые незамещенные цик-
лоалканы общей формулы (СНа)„ представляют собой особенно важ-
ный гомологический ряд, в котором химические свойства изменяются
гораздо более резко, чем для углеводородов с открытой цепью
СН8(СН5)?г^2СН8. Причины этого будут обсуждаться с привлече-
нием двух новых концепций — пространственных препятствий и
углового напряжения, понимание которых не составляет трудностей,
так как они имеют в основном механическую природу.
: Конформационная изомерия циклоалканов, в особенности цикло-
гексана, будет рассмотрена сравнительно подробно вследствие ее
важного значения для химии многих органических веществ природ-
ного происхождения. Циклоалканы с'небольшими кольцами пред-
ставляют особый интерес ввиду того, что их свойства являются
промежуточными между свойствами алканов (типично насыщенные
соединения) и алкенов (типично ненасыщенные соединения),
Понятие стереоизомерии, ‘характерной для соединений с одина-
ковой системой связей, но различным расположением атомов в про-
странстве, вводится в связи с цис—транс-изомерией. Глава заканчи-
вается кратким рассмотрением полициклических соединений, т. е.
таких, в состав которых входит более чем одно кольцо; при этом
особое внимание будет уделено циклам, имеющим два или большее
число общих атомов углерода.
118
ГЛАВА 4
4-1. Н оменклатура
В циклогексане, типичном циклоалкане, шесть метиленовых
(СН2) групп соединены между собой таким образом, что образуют
шестичленное кольцо. Циклоалканы (или циклопарафины) с одним
кольцом имеют общую формулу С?1НЗП; их названия образуются
, сн2
Н2С сн2
Н3С <^н2
циклогексан
путем добавления приставки цикло- к названиям соответствующих
алканов с тем же числом углеродных атомов. Заместители нуме-
руются в соответствии с их положением в цикле таким образом,
чтобы сумма номеров была минимальной.
СНЭ
СН
сн3
I
сн
НВС—СН
\н8
сна
1Т 4-диметил цик-
логексан
(не 3,С‘ДИМетнл-
циклогексан)
I *метил-3-зтнлцикло*
пентан
(не Ьмотцл-4-§тнЛ’
Ш1клопентан)
Замещающие группы, образованные из циклоалканов путем уда-
ления одного атома водорода, называют, заменяя окончание -да,
соответствующее углеводороду, на окончание -да; получается,
таким образом, название «циклоалкил», например циклогексил —
от циклогексана, циклопентил — от циклопентана и т. д.
СН2
нХ\
I снег
Н2С • /
цик л о пентил хл ор н д
ци к л опр опн л он ы й
спирт
(циклопропаяол)
Часто оказывается удобным изображать структуры цикличес-
ких соединений в сокращенной форме, как это показано ниже.
Каждая точка соединения линий означает углеродный атом; подра-
ЦИКЛОАЛКАНЫ
119
зумевается, что при каждом из них имеется нормальное число ато-
мов водорода*
Циклооктан
циклабутан
2- метил циклогексил бромид
О -бром-2- метилциклогексан)
Упражнение 4-1. Напишите распространенные структуры, показав связи С—С
для каждой из приведенных ниже сжатых формул. Назовите каждое из соедине-
ний по принятой системе.
а) „(СН 2)ю
б) (СН2)6СНСН3
в) . (Сн3)^С(СН2),зСНС2Нд
г) изомеры триметп л циклобутана
д) (СНа)еСНСН2С(СН3)аСН2С1
е) [(СН2)аСН]2С(СНд)СаНв
4-2. Физические свойства циклоалканов
Температуры плавления и кипения циклоалканов (табл. 4-1)
несколько выше, чем у соответствующих алканов. Характерная
для углеводородов с открытой цепью способность «изгибаться»
делает их упаковку в кристаллической решетке более трудной
(отсюда более низкая температура плавления), а также понижает
их тенденцию к взаимодействию с другими подобными себе молеку-
лами (в этом причина более низких температур кипения).
4-3. Спектральные свойства циклоалканов
Инфракрасные спектры циклоалканов сходны со спектрами ал-
канов; отличие заключается в том, что в отсутствие алкильных
заместителей в спектре не имеется характеристических частот
деформационных колебаний метильных групп при 1380“'. Срав-
нительно интенсивные частоты СН2-групп наблюдаются в интер-
вале 1440—1470 см-1; их положение зависит в определенной сте-
пени от размера цикла. Основные особенности ИК-спектров цнк-
лоалканов можно видеть на примере спектров циклооктана и метил-
циклогексана, изображенных на рис. 4-1.
Пропускание, %> _ Пропускание
Рис. 4-[. ИК-спектры циклооктана (а) и мета л цикло гекса на (б).
Эти спектры следует сравнить со спектрами, приведенными па рне. 3-3.
ЦИКЛОАЛКАНЫ
121
Таблица 4-1
Физические свойства алканов и циклоалканов
Соединение Т. кил., Ю Т* пл., сС “Г
Пропан —42 —187 0,580а
Циклопропан -33 —127 0,689а
н-Бутан —0,5 — 135 0,5796
Цнклобутан 13 —90 0,689б
н-Пеитац 36 —130 0,626
Циклопентан 49 -94 0,746
я-Гёксан 69 —95 0,659
Циклогексан 81 7 0,778
«•Гептан 98 —91 0,684
Циклогептан 119 —8 0,810
я,-Окт ан 126 —57 .0,703
Циклооктан " 151 15 0,830
я-Нонаа )51 —54 0,718
Циклононан 178 II 0,845
а При ~40 «с.
$ Иол Давлением
Подобно алканам, чистые циклоалканы не поглощают в ультра-
фиолетовой области выше 2000 А и часто используются в качестве
удобных растворителей при снятии УФ-спектров других соединений.
ЯМР-спектры простых циклоалканов содержат при комнатной
температуре одну узкую линию. Если присутствуют заместители,
то для водородных атомов кольца наблюдаются различия в химичес-
ких сдвигах, которые в случае алкильных групп невелики и при
спин-спиновом расщеплении дают линий, обычно расположенные
слишком близко для того, чтобы их можно было разрешить (рис. 4-2).
4-4. Конформации циклоалканов
А. Циклогексан
Сначала .рассмотрим циклогексан, так как На его примере можно
показать многие важные особенности конформационных отноше-
ний. Если бы циклогексан существовал в виде правильного плоского
шестиугольника с атомами углерода в вершинах углов, то углы
между связями С—С—С были бы равны ‘120°., Нормальные валент-
122
ГЛАВА 4
Рис. 4-2. ЯМР-сцектры циклооктана (а) и мети л циклогекса на (б) при 60 МГц
с ТМС в качестве стандарта (0,00 и. д.).
ные углы углерода составляют 109,5°. Таким образом, молекула
циклогексана, обладающего плоским строением, должна была бы
иметь угловое напряжение, равное 10,5° для каждого из углерод-
ных атомов. Естественно предположить, что это привело бы к не-
которому уменьшению стабильности по сравнению с молекулой
циклогексана, имеющей нормальные валентные углы. Точную ве-
личину напряжения, связанного с плоским строением, оценить
нелегко, поскольку в плоской структуре не только величины углов
между связями С—С—С отличаются от нормального значения,
но и атомы водорода должны находиться в невыгодном заслоненном
(эклиптическом) положении, как это показано на рис. 4-3 (см. также
разд. 1-4). Энергия, требующаяся для отклонения угла между свя-
зями С—С—С от его нормального значения, составляет 17,5 кал-
ЦИКЛО А Л КАНЫ
133
Рис. 4-3. Плоская напряженная конфигурация циклогексана; видно заслоненное
расположение атомов водорода.
град-®- моль"' *. Таким образом, можно рассчитать, что плоская
конформация гексана, изображенная на рис. 4-3, должна быть
неустойчивой по крайней мере на 17,5-10,52-10~3=1,9 ккал на
каждый угол, или на 1,9-6=11,4 ккал для всех шести углов. Пре-
небрегая различиями в энтропии, получаем, согласно уравнению
(3-1), что это соответствует К=10~2(| для равновесия между ненапря-
женной неплоской структурой циклогексана и напряженной плос-
кой.
Упражнение 4-2. Постройте кривую зависимости углового напряжения от угла
связи С—С—С в диапазоне отклонений с±20° от нормальных значений. Используя
этот график, определите угловое напряжение в килокалориях для: (а) плоского
циклопентана, (б) плоского циклобутана и (в) плоского циклогептана.
Рассмотрение молекулярных моделей показывает, что в том слу-
чае, если валентные углы углерода сохраняются равными 109,5°,
могут существовать две весьма различные конформации молекулы
циклогексана. Они известны как конформации «кресло» и «ванна»
(или «лодка») (рис. 4-4). Оказывается невозможным разделить
циклогексан на две эти изомерные формы, поскольку они при
обычных температурах быстро превращаются одна в другую; од-
нако конформация кресла существенно стабильнее и при комнат-
ной температуре состааляет более 99% равновесной смеси.
Неустойчивость формы ванны по сравнению с формой кресла
можно отнести за счет относительно менее выгодных взаимодей-
ствий между атомами водорода цикла, Если принять все углы между
связями нормальными и расположить атомы углерода цикла так,
* Это выражение имеет Силу, вероятно, только вплоть до величины отклоне-
ния не большей 20° по причинам, которые будут рассмотрены в разд. 4-5,В.
124
ГЛАВА 4
Г.'"
i;
Рис. 4-4. Две конформации циклогексана, в которых углы между связями равны *
109,5° (атомы водорода не показаны).
чтобы они образовали «крайнюю» конформацию ванны, изображен- 1
ную на .рис. 4-5, то два водорода в положениях 1 и 4 (так называв- j
мые флагштоковые водороды) должны оказаться сближенными .
настолько (1,83 А), что они попадают на восходящую часть кривой
отталкивания (как на рис. 3-6 применительно к водороду). Об ато-
мах, перекрывающихся таким образом, говорят, что они создают !;
пространственные затруднения (препятствия). Очевидно, что про- ?
странственные затруднения должны сделать молекулу менее устой-
чивой; сближение водородов на расстояние 1,83 А соответствует i
энергии отталкивания около 3 ккал. Существует еще один фактор,,
который делает «крайнюю» форму ванны невыгодной: восемь водо-
родов, расположенные по «бортам» ванны, заслонены, что делает их
находящимися гораздо ближе друг к другу, чем это было бы в за- f)
торможеиной „(«шахматной») конформации (около 2,27 А по срав- (
нению с 2,50 А). Это положение резко отличается от того, которое
имеется в случае формы кресла (рис. 4-6), где, как можно видеть, л
соседние водороды находятся в заторможенных положениях один
относительно другого на всем пути вокруг цикла. Таким образом, '
форма кресла должна быть более устойчивой, чем форма ванны, )
по той причине, что в ней отталкивание между атомами водорода
значительно меньше.
Упражнение 4-3. Энергетический барьер для вращения вокруг связи С—С в
этане составляет около 3 ккал, откуда следует, что энергия, требующаяся для
приведения одной пары водородов в заслоненное расположение, равна 1 ккал. ;
Рассчитайте, на сколько килокалорий должны быть менее стабильными плоская
форма и крайняя форма ванны в циклогексане по сравнению сформой кресла при \
учете заслоненного расположения водородов и флагштоковых взаимодействий. -•
В действительности форма ванны циклогексана напряжена в меньшей степе-
ни, чем предполагалось а предыдущем обсуждении. Рассмотрение модели показы-
вает, что форма ванны очень подвижна, и даже прн сохранении валентных углов
равными точно 109,5° одновременное вращение вокруг всех углерод-углеродных
связей позволяет кольцу изогнуться (двумя эквивалентными способами), что при-
водит к двум одинаковым в отношении энергии конформацням1:в которых флаг-
ЦИКЛОАЛКАНЫ
!25
Вид с конца
Рис. 4-5. Циклогексан в форме «ванны»; видно перекрывание и- заслонение атомов
водорода.
Вверху приведена масштабная модель, в середине — шар остер жневые модели н внизу —
изображение тала «кбзель
штоковые водороды отстоят дальше друг от друга и восемь водородов вдоль «бор-
тов» приближаются к заторможенному состоянию (но не достигают его полностью).
Такое расположение носит название искаженной ванны (иногда изогнутой ван-
ны) (рис, 4-7); можно считать, что она приблизительно на 5 ккал менее стабильна,
чем форма кресла.
Пространственные отношения (стереохимия) циклогексана и других органи-
ческих соединений могут с успехом изучаться при помощи моделей Дрейдинга,
126
ГЛАВА 4
Рис, 4-6, Циклогексан в форме кресла; вид;Гы экваториальные и аксиальные В]
атомы водорода. Я|'
Вверху приведена масштабная модель, в-середине рисунка — шаростержневая модель а
внизу — изображение типа екбзел». Обратите внимание на то, что эквивалентны все акси- Я|!
альные н все экваториальные положения, .Яг
в которых используются стандартные углы между связями и выполненные в масш-
табе длины связей. Связи изображаются стальными стержнями, которые могут
зажиматься в стальных муфтах. Вращение вокруг связен происходит легко, и мо-
дель обладает достаточной гибкостью для того, чтобы можно было воспроизвести
некоторое угловое напряжение. Конформация циклогексана, построенные с по-
мощью моделей Дрейдинга, приведены на рис. 4-8. Нетрудно видеть, что они очень
похожи на изображения в виде «козел», упоминавшихся ранее.
ЦИКЛОАЛКАНЫ
127
Рис. 4-7. Циклогексан в форме «искаженной ванны».
В форме кресла циклогексан содержит два различных вида
атомов водорода — шесть из них расположены почти точно в «сред-
ней» плоскости кольца (они называются экваториальными водо-
родами) и шесть (по три сверху и снизу) вне этой плоскости (они
носят название аксиальных водородов). В случае замещенных
циклогексанов возникает интересный вопрос: какой будет, напри-
мер, метильная группа в циклогексане — экваториальной или
аксиальной? Поскольку известен только один метилциклогексан,
метильная группа должна быть либо только экваториальной (е), либо
только аксиальной (а), либо, наконец, две формы могут превращать-
ся друг в друга так быстро, что их нельзя разделить. Оказывается,
что превалирует последняя возможность — цикл быстро переходит
из одной формы кресла в другую, причем один из концов кресла
поднимается, а другой опускается, как на качелях, что вызывает
Рис. 4-8. Изображение конформаций циклогексана с помощью моделей
Дрейдипга.
ГЛАВА 4
Рис, 4-9. Масштабные модели экваториальной и аксиальной форм циклогексил-
бромида в конформаций кресла.
переход заместителя из аксиального положения в экваториальное и
обратно.
снэ
(аксиальная) (экваториальная)
Такой процесс носит название инверсии цикла, и его скорость
обычно называют частотой инверсии. Для самого циклогексана
инверсия происходит настолько быстро, что молекула совершает
около 10е «качаний» в секунду, переходя при этом через энергети-
ческий барьер величиной примерно 11 ккал.
Метилциклогексан в равновесной смеси аксиальной и экватори-
альной форм содержится преимущественно в экваториальной форме
15). То же в большей или меньшей степени верно и для всех
монозамещенных производных циклогексана. Причину этого Можно
наглядно видеть при рассмотрении масштабной модели — в эквато-
риальной конформации замещающая группа располагается более
«просторно», чем в аксиальной конформаций (рис. 4-9). Она нахо-
дится ближе к двум аксиальным водородам (расположенным с той
же стороны кольца) в том случае, когда она занимает аксиальное
положение, чем к соседним аксиальным и экваториальным водо-
родам в том случае, когда она находится в экваториальном положе-
нии (рис. 4-10). Очевидно, что наиболее устойчивой конформацией
будет та, в которой взаимодействие несвязанных атомов минимально. :.(
Упражнение 4-4. Используя изображения типа «козел», нарисуйте нее возмож-
ные конформации циклогексилхлорида, где кольцо находится в форме кресла и в
форме ванны. Расположите их s порядке, возрастания устойчивости, Приведите
ваши соображения.
ЦИКЛОАЛКАНЫ
129
Рис. 4-10. Аксиальная (а) н экваториальная (б) формы монозамещенных цикло-
гексанов.
Пунктирными линиями показаны наиболее существенные взаимодействия непосредственно
не связанных атомов: в аксиальной конформации эти взаимодействия сильнее, чем в эква-
ториальной.
Рис. 4-11. Изменения спектра ieF в 1,1-дифторциклогексане в зависимости от
температуры при 56,4 МГц; см, упражнение 4-5.
Упражнение 4-5. ЯМР-спектр (на JfiF) 1,1-дифторциклогексана при 35, —40 и
—110°С (56,4 МГц) приведен на рис. 4-11. Объясните, почему этот спектр так
резко изменяется с понижением температуры, и укажите причины появления четы-
рех групп линий при — НО'С. (Используйте материал, приведенный в
разд, 2-6,Е,)
Б. Циоонентан
В циклопентане пять групп —СН3— могут образовать правиль-
ный пятиугольник (внутренние углы 108°) при очень небольшом
искажении нормальных углов между связями углеродных атомов,
В действительности молекула циклопентана не является такой
плоской, как можно было бы ожидать, учитывая только требование
минимального искажения нормальных валентных углов углерода.
В плоской структуре циклопентана все атомы водорода, так же
как в плоском циклогексане, находятся в заслоненном состоянии,
5 № 1540 -
130
ГЛАВА 4
Рис. 4-12. Неилоская конформа-
ция циклопентана.
что должно уменьшить стабильность плоского расположения при-
мерно на 10 ккал (см. упражнение 4-3). В результате этого молекула
приобретает неплоскую конформацию, являющуюся наилучшим
компромиссом между искажением валентных углов и заслонением
атомов водорода. В «компромиссной» конформации кольцо искажено
таким образом, что одна или две группы —СН,— значительно
выходят из плоскости, проведенной через остальные атомы углерода
(рис. 4-12). Подвижность цикла приводит к тому, что эти дефор-
маций быстро «обегают» вокруг него.
В. Циклобутан
Образование четырехчленного цикла из атомов углерода может
произойти лишь со значительным искажением нормальных валент-
ных углов углерода в случае как плоского, так и неплоского кольца.
Если принять, что валентные связи расположены так же, как пря-
мые линии,' соединяющие ядра углерода на приведенной ниже схе-
ме, то угол каждой связи С—С—С должен оказаться для плоского
СНг-г—сн2
'о;*
ч
сн2-—снг
циклобутан
цикла на 19,5° меньше, чем нормальный, равный 109,5°. Для неплос-
кого кольца искажение валентных углов должно быть, разумеется,
еще большим. Тем не менее проигрыш энергии за счет заслонения во-
дородов в циклобутане достаточен для того, чтобы, сделать кольцо
неплоским. Наиболее выгодным для заместителей является, по-
видимому, так называемое «квазиэкваториальное положение»
(рис. 4-13).
ЦИКЛОАЛКАНЫ
131
Рис. 4-13. Неплоская конформаций циклобутаиа, где заместитель R находится
в наименее пространственно затрудненном квази экваториальном положении.
Двугранный угол между двумя половинами «согнутого» цикла обычно составляет
25—30 , т. е. 25—30° отклонения от плоскости.
Г. Циклопропан
Три углеродных атома кольца циклопропана лежат в одной
плоскости, Можно ожидать, что угловое напряжение будет очень
большим, поскольку для каждого углерода валентный угол дол-
жен на 49,5° отклоняться от нормального значения. Возможно, что
напряжение, связанное с заслонением атомов водорода в циклопро-
пане, несколько понижается вследствие изменения углов между
связями Н—С—Н и Н—С—С.
снг
СНг----СНа
циклопропан
Д. Этилен
Двойную связь углерод — углерод при желании можно рассмат-
ривать как двухчленный цикл; в этом случае простейшим из всех
возможных циклоалканов окажется этилен С2Н4 («циклоэтан»),
и при таком рассмотрении валентные углы углеродных атомов в
нем равны 0°, а угловое напряжение для каждой группы СНг равно
109,5°.
снг==-снг
Как будет показано в гл. 6, этилен представляет собой плоскую
молекулу.
5‘
132
ГЛАВА 4
4-5. Напряжение в циклоалканах
А. Теория Байера
Концепция, согласно которой кольца в производных циклопро-
пана и циклобутана должны быть напряжены, так как углы между
связями С—С—С в них не могут принять нормального тетраэдри-
ческого значения 109,5°, была сформулирована Байером в 1885 г.
Тогда же было высказано предположение, согласно которому труд-
ности, встречающиеся при синтезе циклоалканов с числом углерод-
ных атомов больше шести, непосредственно связаны с угловым
напряжением, возникновения которого следовало бы ожидать в том
случае, если большие циклы представляли собой правильные плос-
кие многоугольники (табл. 4-2).
Таблица 4-2
Теплоты сгорания и напряжение о циклоалканах
□иклоалкац п Угловое на- пряжение на каждую СН2' группу. град Теплота его- рання* (ДЯ), ккал/моль Теплота его* рання на группу CHfl (Дп/л), ккал Общее напряже- ние^ ккал/моль
Этилен 2 109,5 337,23 168,6 22,4
Циклопропан 3 49,5 499,83 166,6 27,6
Циклобутан 4 19,5 655,86 164,0 26,4
Циклопентан 5 1,5 793 52 158,7 6,5
Циклогексан 6 (10,5)” 944,48 157,4 0,0
Циклогептан 7 (19,0)° 1108,2 158,3 6,3
Циклооктан 8 (25,5)в 1269,2 158,6 9,6
Циклононан 9 (,30,5)в 1429,5 158,8 11,2
Циклодекаи 10 (34,5)" 1586,0 158,6 12,0
Циклопентадекан 15 (46,5)в 2362,5 157,5 1,5
н-Алкан с рткры- 00 157,4
той цепью
:1 Для газообразных углеводородов, при сгорании которых образуется жидкая вода
при 25ОС, значения взяты из работ: Kaareemaker S., Coops J., Rec. trav. chitn., 7Г, £61
(1952) и Coops J., Van Kamp H., Lantbereis W, A., Visser B. J., Dekker H.., Rec. trav.
chim., 78, 1П6 (1960).
6 Получено вычитанием величины (n-157,4) из наблюдаемой теплоты сгорания.
в Угловое Напряжение рассчитано для плоского кольца п соответствии с теорией
Байера.
Теория напряжения Байера в применении к большим циклам
неверна, поскольку циклогексан и высшие циклоалканы представ-
ляют собой складчатые циклы, в которых валентные углы имеют
нормальные или близкие к. нормальным значения. Трудности
возникающие при синтезе больших циклов из соединений с открытой
цепью, обусловлены главным образом малой вероятностью того, что
реакционноспособные группы на значительно удаленных концах
длинной углеводородной цепи сблизятся, сделав, таким образом, цик-
JliilHrmiiO возможной (такие реакции сопровождаются.значительным
ЦИКЛОАЛКАНЫ
(33
уменьшением энтропии, разд. 3-7,Б), Как правило, взаимодейст-
вуют реакционноспособные группы, находящиеся на концах различ-
ных молекул, несмотря на то что реакции проводятся в очень раз-
бавленных растворах.
В 1890 г. Заксе указал на то, что соединения, содержащие боль-
шие циклы, не обязательно должны быть плоскими, поскольку на-
пряжение может быть устранено при нарушении плоского строения.
Это положение было развито Мором (1918 г.) иполучило название
теории ненапряженных больших циклов Заксе — Мора.
Упражнение 4-&. Образование пиклоалкана (СН^ по реакции
Br(CH2)„ZnBr->- (CH2)„~+ZhBr2 происходит конкурентно с другими реакциями
типа 2Вг (CI’LJnZnBr—»-Вг(СН2)п (СНг)п2пВг4-7пВг2.
а) Объясните, почему реакции циклизации такого типа при проведецци их в
разбавленных растворах дают лучшие выходы (СН2)„, чем в концентрированных
растворах.
б) Как должен зависеть выход циклоалкана от суммарного напряжения в об-
разующемся цикле (см. табл. 4-2) и от вероятности того, что реакцйоцвдепоербпые
концы цепи окажутся ориентированными благоприятно для циклизации? Нари-
суйте график зависимости выхода циклоалкана от числа атомов углерода в цйкле
п при изменении п от 3 до 15.
в) Объясните, каким образом факторы, рассмотренные в пункте (б), могут
уравновешивать (й той или иной степени) друг друга, чтобы даТь приведённые ни-
же выходы продуктов циклизации при различных размерах циклов: (СГ1а)а>80%;
(СН2)а 7%; (СН2)е 45%; циклы больших размеров <10%.
’ В. Теплоты сгорания циклоалканов
Напряжение в циклических соединениях может быть оценено
количественно путем сравнения тепл от сгорания в расчете на СН3-
группу (табл. 4-2). Эти данные показывают, что циклогексан прак-
тически свободен от напряжения, поскольку для него теплота сго-
рания на СН2-группу одинакова с теплотой сгорания для н-алканов
(157,4 ккал). Увеличение теплот сгорания для циклов меньшего раз-
мера с очевидностью указывает на увеличение в них. углового на-
пряжения, а также в некоторой степени на невыгодный характер
взаимодействия между несвязанными атомами. Для циклов с числом
углеродных атомов от 7 до 12 существует небольшое напряжение,
составляющее 1—4,5 ккал на СНг-группу. Эти циклы могут иметь
подвижные неплоские конформации с нормальными валентными
углами С—С-- С, но в диапазоне С,—Ci2 такая форма цикла приво-
дит к существованию пар частично заслоненных или берекрыБаю-
щихся атомов водорода. Интересно, что стабильная конформация
циклодекана представляет собой компромисс между небольшим
искажением валентных углов и несколькими очень короткими рас-
стояниями Н—Н (рис. 4-14). Наиболее устойчивая конформация
при наличии заместителя в циклодекановом кольце показана на
рис. 4-14; "наименее устойчивой будет та", при которой заместитель
занимает положение одного из шести приведенных на схеме атомов
134
ГЛАВА 4
н
н.
положение
заместителя,
приводящее
к наибольшей
стабильности
Рис. 4-14. Конформация циклодекана.
Затененная область- соответствует зоне наи-
большего взаимодействия непосредственно не
связанных атомов.
водорода, поскольку взаимодействие между несвязанными атомами
в этих положениях особенно значительно.
Циклические системы с очень большим числом атомов углерода,
подобные циклопентадекану, практически свободны от напряжения.
В. Напряжение в малых циклах
Можно ожидать, что суммарное напряжение в соединениях типа (СН2)П будет
быстро уменьшаться по ряду л=2>п=3>п=4. Тем не .менее данные табл. 4-2
показывают, что порядок о действитсльпости таков: 3~>4>2. Этот факт часто ус-
кользает от внимания, поскольку при делении тбнлот сгорания на число групп СНа
оказывается, что теплоты сгорания в расчете наСН2 располагаются примерно в том
порядке, которого можно ожидать на основании углового напряжения. Однако
такой способ действий не даст решения проблемы.
Важно уяснить, что при оценке напряжения по теплотам сгорания на СН3-
группу принимают, что прочность связи С—Н одинакова независимо от п. Сущест-
вуют, однако, экспериментальные данные, свидетельствующие о том, что в дей-
ствительности каждая из С—Н-связей этилена и циклопропана на 3—4 ккал проч-
нее, чем в алканах (см. разд. 3-6). Ясно, Что такое превышение обычной прочности
этих связей приведет к тому, что энергия напряжения будет казаться меньше, чем
она есть на самом деле Если принять, что связи С—Н на 0,5 ккал прочнее в цик-
лобутане, на 3,0 ккал прочнее в циклопропане и на 4,0 ккал прочнее в этилене,
то можно внести соответствующие исправления в энергии напряжения циклов
углеродных атомов. В таком случае для циклобутана напряжение, связанное с
валентными углами, будет равно 0,5-84-26,4=30,4 ккал; для циклопропана 3,0-
•64-27,6=45,6 ккал; для этилена 4,0-44-22,4=38,4 ккал. Эти данные обнаружи-
вают легко объяснимые различия в напряжении для циклопропана и циклобутана,
однако этилен при этом все еще оказывается особым случаем, как, по-видимому,
и должно быть, если учесть и другие его особые свойства (гл. 6).
4-6. Химические свойства
Выше уже говорилось о том, как влияет напряжение в цикло-
алканах с небольшими кольцами на теплоты сгорания. Вполне ве-
роятно, что другие химические свойства также будут изменяться
под влиянием углового напряжения. И действительно, циклопро-
пан и циклобутан значительно более реакционноспособны, чем угле-
водороды с открытой цепью, Так, они вступают в некоторые реак-
ции, характерные для соединений с углерод-углеродной двойной
связью, причем их реакционная'способность зависит от степени
углового напряжения и чувствительности атакующего агента к
ЦИКЛОАЛКАНЫ
136
прочности связи С—С. Результатом таких реакций всегда оказы-
вается раскрытие цикла путем разрыва связи С—С и образования
соединения с открытой цепью, в котором углы между связями имеют
нормальное значение.
Таким образом, устранение углового напряжения может рассмат-
риваться как основной вклад в движущую силу этих реакций. Ряд
реакций раскрытия цикла приведен в табл. 4-3. Реакционная спо-
собность этилена очень высока, тогда как для циклопропана она
меньше и еще меньше для циклобутана. Связи С—С в циклоалканах
большего размера, относительно свободных от напряжения, мало
реакционноспособны, и эти соединения по своим химическим свойст-
вам напоминают я-алканы. Реакции замещения, такие, например,
как. хлорирование циклопентана и циклоалканов большего разме-
ра, обычно имеют менее сложный характер, чем для соответствующих
алканов, поскольку возможность образования изомерных продук-
тов замещения в данном случае гораздо меньше. Так, циклогексан
дает только один продукт монохлорирования, тогда как н-гексан —
три изомерных монохлорпроизводных.
Упражнение 4-7. Используя данные табл. 4-2 и другие необходимые энергии
связей, рассчитайте ДЯ для приведенной ниже реакции в случае л=3, 4 и 5
(в газовой фазе при 25 °C):
(CH2)rt —► СНЭ(СН2)„_3СН = СН2
Какова устойчивость циклоалканов С м—З, 4 и 5 по сравнению с соответствую-
щими соединениями с открытой цепью, содержащими двойные связи (если вы оз-
накомились с разд, 3-7.6, то учтите также возможную роль энтропийных
эффектов)?
Упражнение 4-8, Используя теплоты сгорав и я (до жидкой воды), приведенные
в табл. 4-2, и соответствующие энергии связей, вычислите Д/7 (в газовой фазе)
раскрытия цикла цикло алканов при действии брома (для п—2—6).
(СНа)„ + Вг2 (СН2)„_2(СН2Вг)2
Упражнение 4-9. Определите термодинамическую выгодность и возможность
осуществления приведенных ниже стадий развития цепи для раскрытия цикло-
алкановых колец (при п—2—6) по свободнорадикальному механизму.
(СН2)„+Вг. —> ВгСН2(СН2)„_2СН2.
BiCH2(CH2)rt_2CH2»,+ Br2 ',СН2)д_3(СН2Вг)2-|-вг«
Используйте значение 83 ккал для энергии диссоциации нормальной С—С-
связи и 68 ккал для энергии диссоциаций связи С—Вг. (Проще всего эту задачу
решить следующим образом: вычислить сначала AJ7 каждой стадии для случая
циклогексана, в котором напряжение отсутствует, и затем внести соответствую-
щие поправки на напряжение, имеющееся при малых значениях и.)
Упражнение 4-10, Укажите, каким образом приведенные в табл. 4-3 реакции
можно использовать для ответа на вопрос о том, чем является углеводород с фор-
мулой С4Нв — метил цикло про па ном, циклобутаном или бутеном-1 (СН3СН5СН=
—CHi). Напишите уравнения используемых вами реакций.
Реакционная способность циклоалканов (СН„)
ЦИКЛОАЛКАНЫ
137
4-7. цис-транс-Изомерия замещенных
циклоалканов
В широком смысле стереоизомерия может быть определена как
изомерия соединений, имеющих одинаковые структурные формулы,
но различающихся по положению в пространстве групп, входящих
в их состав. Выше уже говорилось о двух примерах стереоизомерии:
формы кресла и ванны циклогексана, а также монозамещенных
циклогексанов, где заместитель может находиться либо в эквато-
риальном, либо в аксиальном положении, и различные вращатель-
ные конформации производных этана (разд. 2-6,Е). В обоих слу-
чаях стереоизомеры слишком легко превращаются друг в друга,
поэтому их невозможно выделить *. Однако существует другой
тип стереоизомерии, связанный с различным пространственным
расположением заместителей, соединенных с двойными связями (см.
гл. 6) или циклами; в этих случаях стереоизомеры не претерпевают
быстрого взаимопревращения. Такой тип стереоизомерии обычно
называют геометрической или цис—m/гаяс-изомерией. Например,
если цикло алкан замещен в двух различных положениях ядра
(как в 1,2-диметилциклопропане), то возможны две изомерные
СН2
, —^сн
/ \
СН3 СН3
i, 2-диметилциклопропан
структуры в соответствии с тем, находятся заместители по одну
(ijHC-изомер) или по разные (транс-изомер) стороны от плоскости
кольца, как это изображено на рис. 4-15.
Образование кольца придает молекуле жесткость, поскольку
вращение вокруг кольцевых С—С-связей исключается. В результате
цис- и транс-изомеры не могут превратиться один в другой без
разрыва одной или большего числа связей. Один из путей такого
превращения состоит в раскрытии кольца и последующем его
замыкании таким образом, чтобы заместитель оказался на стороне,
противоположной той, где он находился вначале. Кроме того, мо-
жет быть разорвана связь заместителя или водорода с данным
углеродным атомом и образована вновь (с этим же атомом углерода)
с другой стороны кольца. В последующих главах будут рассмотре-
ны примеры процессов обоих типов.
* Такой вид разной пространственной формы вещества одной и той же струк-
туры называется конформацией, а сами вещества— конформерами один другого.—
Прим- ред.
138
ГЛАВА 4
Рис. 4-15. Шаростержневые модели цис- и транс-изомеров 1,2-диметилциклопро-
панов.
Упражнение 4-11. Напишите структурное формулы всех возможных цис- и
транс-изомеров приведенных ниже соединений.
а) 1,2,3-триметилциклопропан
б) 1,3-дихлорциклопентан
в) 1,1,3-триметилциклогексан
г) (З-метилциклобутил)-З-метилцкклобутан
Упражнение 4-12. Какой из изомеров 1,2-диметилииклопропаиа — цис или
транс—будет более устойчив? Объясните.
Для цис- и транс-изомеров производных циклогексана сущест-
вует дополнительная возможность конформационной изомерии. На-
пример, 4-трет-бутилциклогексилхлорид теоретически может су-
ществовать в четырех стереоизомерных формах кресла (I—IV)
।
II
ЦИКЛОАЛКАНЫ
138
IV
in
И в структуре I и в структуре II заместители находятся в транс-
положении один относительно другого, но в I Они оба экваториаль-
ны, тогда как в II — оба аксиальны. В структурах III и IV замещаю-
щие группы находятся в ццс-положении, но в III трет-бутил эква-
ториален, а хлор аксиален, тогда как в IV mpem-бутил аксиален, а
Рис. 4-16. 1,3-Взаимодействия в циклогексане
с трет-бутильной группой в аксиальном поло-
жении.
СН,,
хлор экваториален. Из-за большого размера и объема трет-бу-
тильиой группы присутствие ее в аксиальном положении вызывает
значительное пространственное затруднение (рис. 4-16). По. этой
причине структуры I и III, в которых mpem-бутильная группа эк-
ваториальна, намного выгоднее, чем структуры II и IV.
В случае когда два заместителя находятся в циклогексановом
кольце в цис- 1,4-положении и ни одному из них не выгодно нахо-
С(СН^
Рис. 4-17. Конформация типа искаженной ванны в цис-1,4-ди-трещ-бутилцикло-
гексане. . ..
140
ГЛАВА 4
диться в аксиальном положении, наиболее выгодной, по-видимому, j
оказывается конформация искаженной (разд. 4-4,А) ванны
(рис. 4-17).
Упражнение 4-13, Нарисуйте возможные конформации кресла для транс-
и ф/с-1,3-диметилциклогексана. Какие изомеры должны быть более устбйчи- <
выми — цис или транс/ Объясните,
Упражнение 4-14, В то время, когда полагали, что цис-изомеры всегда менее :-
устойчивы, чем шрпис-изомеры, для- отнесения конфигураций цис- и транс-
изомеров в циклических системах применялось эмпирическое правило, известное
под названием правила Ауверса— Скита. Согласно этому правилу, цис-нзомер ,
всегда должен иметь более высокую температуру кипения, плотность и показа- !
тень преломления. Однако это правило неприменимо для 1,3-дизамёщенных цик- i
логексанов, у которых /прпне-форма имеет болеё высокую температуру кипения,
плотность и показатель преломления. Объясните, каким образом можно сформулн- i
ровать правило Ауверса Скита с тем, чтобы оно включало 1,3-системы подоб-
иого типа.
Упражнение 4-15. В какой форме окись циклогексена будет более устойчи-
вой — в цис- или транс-конфигурации? Приведите ваши соображения.
окись циклогексена
4-8. Полициклоалканы
Существует большое число углеводородов и их производных,
в которых кольца имеют два или более общих атомов углерода.
Одним из таких соединений является декалин, в котором десять
углеродных атомов образуют два шесгичленных цикла.
CHSCHB
! I I-’
Н-С сн сн2
^СН^На
декалин
(бнцнкло-[4 ;4,03"Дека1|, ’
деКаГйДрОНафталйн)
Систематические названия соединений этого типа образуются
путем добавления приставки бицикла- к названию углеводорода
с открытой цепью, имеющего то же число углеродных атомов, ка-,
кое содержат оба цикла. Так, декалин называется бициклодеканом.
Размер каждого из колец указывается числом .атомов углерода в
каждой из трех связей, которые соединяют два атома, являющиеся
общими. В декалине две такие связи содержат по четыре углерод-,
пых атома каждая, 'а третья — ни одного; поэтому декалин носит
ЦИКЛ0АЛК.АНЫ
141
название бицикло-14,4,01-декана. Заметим, что номера заключаются
в квадратные скобки и помещаются после приставки би цикло- и
перед названием углеводорода. Номера перечисляются, в порядке
их уменьшения и отделяются друг от друга запятыми или точками.
Ниже приведен ряд примеров.
бицик до -[2,2,11 тал ан
бицикдо-[3,1,1]-гептан
бишГкло-[1ДЩ-бутан
При нумерации таких полициклических систем в качестве С,
выбирается точка соединения циклов. Нумерация производится
вдоль наиболее длинной цепи между тоннами соединения циклов
от'Са до второй точки соединения, затем продолжается вдоль менее
длинной цепи и, наконец, вдоль наиболее короткой линии.
бицик ло -[ 3,2,11 - о кт ан
8 - х до р бицикло -[3,2,1 ] -октан
Построение названий трициклоалкаяов следует той же общей
схеме. Наибольший по размерам цикл и наибольшая по размерам
связь внутри него образуют бициклическую систему, а располо-
жение четвертой, или вторичной, связи указывается с помощью
верхнего индекса. Примером может служить систематическое наз-
вание интересного углеводорода адамантана, приведенного ниже-
(показана также его конформация):
3 7
трикикло-13,3,1,1 ’ ]-декан
(адамантан!
142
ГЛАВА 4
Упражнение 4-16. Назовите каждое из приведенных ниже соединений в соот-
ветствии с принятой системой.
Упражнение 4-17. Определите степень искажения углов между связями
С—С—С в бицикло-[1,1,0]-бутане в том случае, если молекула была бы плоской,
Какую конформацию и химические свойства могли бы вы предсказать для этой
молекулы?
4-9. Конформации декалина
Шестичленные кольца декалина подобно кольцу циклогексана должны быть
более устойчивыми в форме кресла. Однако возможны два способа соединения двух
кресел (рис. 4-18р водороды, расположенные в точке соединения колец, могут на-
ходиться либо оба но одну сторону молекулы (цос-декалин), либо по разные сто-
роны молекулы (транс-декалин), транс-Декалин соответствует соединению двух
щестичленных циклов двумя связями экваториального типа, тогда как аксиаль-
но-экваториальное соединение приводит к цнс-декалину. Известны оба изомера;
транс-изомер приблизительно Из 2 ккал устойчивее, чем цнс-нзомер, главным об-
т$ш<с -декалин
цис -декалин
Рис. 4-18. Кресловидные конформации декалипа,
ЦИКЛОАЛКАНЫ
J 43
разом вследствие невыгодного характера взаимодействий несвязанных атомов в
районе «вогнутости» ^uc-декалина (рис. 4-19).
Рис. 4-19. Изображение щ/с-декалина,
иллюстрирующее взаимодействие непо-
средственно цс связанных атомов (зате-
ненная область).
Нумерация атомов в декалина следует приня-
той в настоящее время системе, которая не со-
ответствует системе нумерации, применяемой
фля большинства бициклических соединений
(разд. 4-8),
Упражнение 4-18. Используя шаростержневые модели, оцените степень устой-
чивости декалина с аксиально-аксиальным способом соединения колеи и креслооб-
разной формой циклов.
Небезынтересно в историческом отношении то, что байеровская.теория напря-
жения плоских циклов предсказывала существование только одной формы дека-
лина с расположением водородных атомов, находящихся в точках соединений ко-
лец, по одну сторону молекулы. Концепция Заксе — Мора относительно неплос-
кого строения свободных от напряжения циклов допускала существование двух
изомеров. Так, Мор предсказал возможность существования двух'форм декалина
за несколько лет до того, как Хюккелю удалось выделить их (1925 г.). Обе формы
присутствуют я нефти.
Теперь читателю, возможно, целесообразно будет построить модели цис-
и трляс-декалинов для того, чтобы уяснить следующие особенности их строения:
1) соединения этих двух типов не могут превратиться друг в друга иначе,
как с разрывом связи С—С или С—Н;
2) трене-декалин представляет собой сравнительно жесткую систему, и в от.
личие от циклогексана два его кольца не могут переходить из одной формы кресла
в другую. В соответствии е Этим ориентация заместителя фиксирована в конфор-
мации отрдас-декалина типа «кресло — кресло»;
3) форма «кресло —- кресло» рлс-декалнна сравнительно подвижна, и одновре-
менная инверсна обоих циклов может происходить довольно легко. Заместитель,
таким образом, переходит от аксиального к экваториальному положению и обрат-
но (рис. 4-20).
Рис. 4-20. Обращение цикла в цис-декалине, сопровождающееся переходом за-
местителя из экваториального в аксиальное положение. В обеих конформациях
оба цикла имеют форму кресла.
144
ГЛЛ.8А 4
Конформационный анализ подвижных и жестких циклических систем имеет
вйжно*е значение для понимания устойчивости и реакционной способности таких
соединений. Это будет становиться все более ясным из дальнейшего рассмотрения.
Упражнение 4-19. Экваториальная форма метил циклогексана на 1,5 ккал ста-
бильнее, чем аксиальная форма, поскольку в аксиальной форме существует прост-
ранственное затруднение между метильной группой н двумя атомами водорода,
один из которых находится в положении 3, а другой — в положении 5. Имея в
виду, что цис-декалин примерно на 2 ккал стабильнее щ/юис-декалина, как вы
могли бы оценить относительные стабильности цис- и щранс-9-метилдекалилов
(нумерация соответствует приведенной на рис. 4-19)?
*
Пополнительные упражнения
4-20. Напишите структурные формулы соединений (по одному для каждого пунк-
та), удовлетворяющих приведенному ниже описанию. В случаях где возникают
конформационные проблемы, используйте изображения типа «козел»;
а) соединение с формулой C9H1S, обнаруживающее инфракрасное поглощение
при 1380 см-1 и имеющее только один узкий резонансный пик в ЯМР-спектре;
б) соединение с формулой СЙН1О, с полосами поглощения в ИК-спектре при
1380 и 1440 см-1 и двумя нерасщепЛенными никами в ЯМР-спектре;
в) соединение с формулой С4Н8, которое медленно реагирует с бромом н сер-
ной кислотой, но не реагирует с раствором перманганата калия;
' г) наиболее напряженный изомер С5Н10;
д) возможные продукты взаимодействия 1-этил-2-метилциклонрбпана с бро-
мом;
е) наименее устойчивые конформации кресла и ванны цис-1,4-дихлорцикло-
гексана;
ж) наиболее стабильный геометрический изомер 1,3-ди-трет-б утилциклоб у-
тана;
з) соединение с шестичленным циклом, более устойчивое в том случае, когда
цикл находится в форме ванны;
н) транс бицикло-[7,1,0]-декан;
к) наиболее стабильная ив возможных конформаций транс-1,3-ди-трет-
бутилциклогексана;
л) наиболее стабильная конформация цис-2-трет-бутнл-цис-декалина;
м) конформация ванна — ванна цпе-декалина;
н) /ирйнс,щранс,траяс-трицикло-[8,4,0,02,7]-тетрадекан.
4-21. Значение АТ/ для гидрирования циклопропана в пропан при 25°C в газовой
фазе составляет —37,5 ккал/моль. Используя это значение и любые другие энер-
гии связей, вычислите энергии связей С—С в циклопропане в предположении, что
все С—С-связи в нем одинаково прочны, а связи С—Н на 3 Оал прочнее нормаль-
ных. Следует иметь в виду, что по определению энергии связен должны дать пра-
вильное значение ДЯ для следующей реакции: /
(СН2)3 (газ) > ЗС (газ)4-5Н (газ)
Используя получен ное'вами значение энергии связи О-€в циклопропане, вычис-
лите значения AZ? следукяцих реакций: ।
а) (СН2)а —> *СНа—СН,—СНг« (нормальные связи С—С)
б) 2(CHS)3 —>- (СНг)в
4-22. Рассчитайте общее угловое напряжение в плоском циклобутане и в «склад-
чатом» циклобутане, где все длины связей С—С равны 1,54 А, а атомы углерода в
противоположных вершинах углов отстоят друг от друга на расстояние 2,04 А
(что соответствует двугранному углу, равному 120°; рис. 4-21); выразите величины
напряжения в килокалориях и сравните их между собой. Примите, что энергия
изменения угла между связями С—С—С составляет 17,5 ккал-град-2-моль-1.
ЦИКЛОАЛКАНЫ
145
Рис. 4-21. «Сложенный» цикл циклобутана.
Оцените уменьшение заслоненных взаимодействий водород — водород, обуслов-
ленное таким изгибом цикло бут а нового кольца (см. упражнение 4-3).
4-23. Напишите структурные формулы для каждого из приведенных соедине-
ний, избрав наиболее удачный угол зрения.
а) цис- и транс-изомеры бицикло-[3,3,0?октана
б) п1ране-трнцвкло,[3,1 До2!1}-гексап
в) трицикло-[3,],0,04’в]-гексан
г)'/л/>адс-2,6-дихлорбицикло-|2,2,2)-октан
д) квинквиникЛо-[414,С|,03|5,.()г,’'!,04Л].дёнау1
ГЛАВА
ОБРАЗОВАНИЕ СВЯЗЕЙ
В ОРГАНИЧЕСКИХ МОЛЕКУЛАХ.
АТОМНО-ОРБИТАЛЬНЫЕ
МОДЕЛИ
В предыдущих главах использовались структурные формулы, в
которых ковалентные химические связи изображались линиями или
парами точек, обозначавшими пары электронов. Такие формулы поз-
воляют изучить и понять многое в химии органических соединений;
но гораздо большего понимания можно достигнуть при более глубоком
рассмотрении того, каким образом химическая связь связана с элект-
ронным строением атома и электрическими силами, действующими
между электронами и ядрами. В результате становится возможным
объяснить величину валентных углов в органических соединениях и
предсказать их. Рассмотрение связей и валентных углов было отло-
жено до настоящей главы по той причине, что эти вопросы обычно
лучше воспринимаются после некоторого ознакомления с особенно-
стями пространственного строения органических молекул и кон-
цепциями углового напряжения и пространственных препятствий.
Возможно несколько качественных подходов к образованию связи в
многоатомных молекулах, но здесь будет рассмотрен наиболее
широко используемый и особенно популярный в настоящее время
метод; он предполагает формулирование для атомов соответствую-
щих атомных орбиталей и учет того, что каждая связь возникает
вследствие электрических сил притяжения между двумя ядрами и
парой электронов, «^странствующих» подвум перекрывающимся атом-
ным орбиталям, центры которых находятся на различных атомах.
П ринимается, что геометрия связей определяется геометрией ор-
биталей. Такой подход часто оказывается достаточно успешным, но
поскольку величины углов нередко отличаются от предсказанных,
для приведения в согласие теории и эксперимента оказывается не-
обходимым введение различного рода поправок.
Будет также приведен альтернативный и более простой способ
предсказания геометрии молекул, в котором внимание сосредото-
ОБРАЗОВАНИЕ СВЯЗЕЙ. АТОМНО-ОРБИтАЛЬНЫЕ МОДЕЛИ [47
чивается на силах отталкивания, действующих между валентными
электронами. В ходе рассмотрения каждого из этих методов будут
обсуждены способы формулирования связей различного типа и геомет-
рия ряда важных типов органических соединений.
В предыдущих главах электронное строение органических моле-
нул описывалось в терминах структур Льюиса, в основу которых
положен принцип принятия (или потери) электронов каждым
из атомов молекулы, принимающим при этом конфигурацию инерт-
, ного газа. Такой способ описания практически ничего не говорит
относительно геометрии молекул. Почему, например, в соединениях
типа метана и четыреххлористого углерода валентные углы состав-
ляют 109,5°, тогда как в воде угол между связями равен 104,5°, а в
сероводороде 92°? Структуры Лыоиса не дают также возможности
объяснить различия в прочности и реакционной способности раз-
личных связей, в частности углерод-углеродных простых, двойных
и тройных связей. Необходим более глубокий подход к рассмотрению
электронного строения органических молекул. В настоящей главе
мы покажем, как формулируются атомно-орбитальные модели
органических молекул, и проиллюстрируем некоторые из их до-
стоинств и недостатков.
5-1. Водородоподобные атомные орбитали
Согласно современным представлениям, в атоме водорода от-
сутствует электрон, движущийся вокруг атома по простой плане-
тарной орбитали. Говоря об атомной орбитали, имеют в виду ве-
роятность отыскания электрона в элементе объема на данном рас-
стоянии и в данном направлении относительно ядра. Границы такой
орбитали не определены точно, поскольку всегда остается конечная,
пусть очень малая, вероятность отыскать электрон даже на сравни-
тельно больших расстояниях от ядра.
Электрон в атоме водорода может занимать ряд дискретных
атомных орбиталей. Они различаются по энергиям, размеру и фор-
ме, и для каждой из них возможно точное математическое описание.
Ниже приведено качественное описание природы некоторых орби-
талей водорода.
Наиболее устойчивое, или «нормальное»,, состояние атома во-
дорода обозначается символом 1s*. Это такое состояние водород-
* В этом обозначении цифра относится к главному квантовому числу и соот-
ветствует «К-оболочке» — обозначению, которое также часто иепользуется для
электрона в обычном атоме водорода. Главное квантовое число 2 соответствует
L-оболочке, 3 — М-оболочке н т. д. Обозначения s, а также р, d, [, которые встре-
тятся в дальнейшем изложении, ведут свое происхождение от начального периода
развития спектроскопии атомов и представляют собой начальные буквы терминов,
применявшихся для описания спектральных линий: «sharp» — резкая, «principal» —
главная, «diffuse» — размытая, «fundamental» — основная. Эти названия в свое
время использовались Для описания переходов из различных атомных состояний.
148
ГЛАВА 5
Рис. 5-1, Изображение 1s-орбитали атама
водорода.
ного атома, при котором электрон в среднем находится на наимень-
шем расстоянии от ядра (иначе говоря, это состояние с наименьшей
атомной орбиталью). Орбиталь для is-состояния обладает сферичес-
кой симметрией. Это означает, что вероятность нахождения элект-
рона на данном расстоянии от ядра г не зависит от направления. Сле-
довательно, можно представить ls-орбиталь в виде сферы, в центре
которой находится ядро; радиус этой сферы принимается таким, что
вероятность нахождения электрона в пределах граничной поверх-
ности достаточно высока (0,8—0,95) (рис. 5-1).
2з-Орбиталь очень похожа на ls-орбиталь, за исключением
того, что Она больше и потому более диффузна и обладает более
Рис. 5-2. Форма и ориентация трех 2р-орбиталей водородного атома.
ОБРАЗОВАНИЕ СВЯЗЕЙ. А ТОМНО-OP ВИТАЛЬНЫЕ МОДЕЛИ 149
Рис. 5-3. Схематическое изображение энергий орбиталей водородоподобного атома.
высокой энергией. Имеются далее три орбитали с равной энергией,
которые называются 2р-орбиталями; геометрическая форма их
резко отличается от формы s-орбиталей. Они изображены на рис. 5-2,
из которого видно, что оси, проходящие через точку касания сфер
трех р-орбиталей, лежат под прямыми углами одна к другой н
каждая из орбиталей не является сферически симметричной отно-
сительно ядра.
Состояния 3$ И Зр сходны с состояниями 2s и 2р,'но обладают
более высокой энергией. Орбитали 3d, 4d, 4f и т. д. имеют еще более
высокую энергию и совершенно иную геометрию. 3d- и 4/-Орбитали
не играют существенной роли в образовании связей для большин-
ства органических соединений, по крайней мере тех, в состав которых
входят водород и элементы второго периода периодической системы.
Относительные энергии 1s—4р-орбиталей представлены на рис. 5-3.
Хорошо известный принцип исключения Паули гласит, что дан-
ную орбиталь могут занимать не более двух электронов, и то лишь
при условии, что они отличаются направлением электронного спина
(который может иметь только две возможные ориентации, изобра-
жаемые символами t и |). Два электрона со спаренными спинами
часто обозначают следующим образом: Такая,пара электронов
может занимать одну орбиталь. Символы ff (или Д) означают два
электрона, которые не могут совместно занимать одну орбиталь.
Если принять, что все атомные ядра обладают орбиталями, по-
добными орбиталям атома водорода, то можно рассмотреть вопрос
о том, как более сложные атомы могут быть построены путем раз-
мещения электронов на орбиталях, расположенных в порядке
уменьшения их стабильности. Для каждого атома необходимо до-
бавить соответствующее число электронов, необходимое для урав-
новешивания заряда ядра.
На рис.. 5-4 изображено построение энергетически наинизшего
состояния атома углерода. Два электрона с наивысшей энергией
150
ГЛАВА 5
Рис. 5-4. Диаграмма, показывающая наиболее устойчивую электронную конфи-
гурацию атома углерода.
Дальнейшее добавление электроне в в соответствия с правилом Гунда дает электронные кон-
фигурации других атомов, символы которых приведены иа схеме.
помещаются на различные 2р-орбитали с неспаренными спинами в
соответствии с правилом Гунда. Смысл правила Гунда очень прост.
Если имеются два электрона, которые могут располагаться на двух
орбиталях с одинаковой энергией (вырожденные орбитали), то
энергия их взаимного отталкивания будет меньше в том случае,
когда они будут иметь неспаренные спины (ft) и, следовательно,
не смогут находиться одновременно на одной и той же орбитали.
По этой причине можно ожидать, что электронная конфигурация
будет более стабильной, чем конфигурация
в том случае, если орбитали имеют одинаковую энергию.
Состояния, подобные изображенному на рис. 5-4 для углерода,
строятся следующим образом: в гелии два спаренных электрона
располагаются на ls-орбитали; его конфигурация может быть
описана символом (1s)2, где верхний индекс, вынесенный за скобки,
означает наличие двух спаренных электронов на ls-орбитали.
Если электроны не спарены, то наиболее стабильным состоянием
будет (ls)(2s). Таким образом,
ОБРАЗОВАНИЕ СВЯЗЕЙ. АТОМНО-ОРБИТАЛЬНЫЕ МОДЕЛИ
Не2®+20) “>Не (к)’
Не2® + (к)(2т)
[более стабильное состояние,
чем(Ь). (2j) или (2/01 и Т.Д.]
(наиболее стабильное состояние для
гелия при неспаренных электронах)
* Для Li8©+3e можно ожидать, что Li (Is)2 (2s) будет стабильным
состоянием, где (lsp-электроны спарены. Действуя таким образом,
получаем электронные конфигурации элементов первых трех пе-
риодов периодической системы, как показано в табл. 5-1. Можно
ожидать, что эти "конфигурации будут подчиняться правилу Гунда
для наиболее стабильного состояния.
5-2. Использование атомных орбиталей
при образовании связей
Приводя условные структуры Льюиса для молекул, полагали,
что ковалентная химическая связь между двумя атомами образуется
путем обобществления двух электронов, по одному от каждого атома.
На рис. 5-5 изображено, каким образом можно представить себе
участие атомных орбиталей в образовании связи. При этом постули-
руется, что простая связь образуется путем стягивания двух атомных
ядер за счет сил притяжения, обусловленных присутствием двух
электронов со спаренными спинами (Д) на перекрывающихся атом-
ных орбиталях. Поскольку две атомные орбитали могут вместить
максимально четыре электрона, естественно задать вопрос: почему
в образовании связи обычно участвуют не один, три или четыре элек-
трона, а именно два? Ответ заключается в том, что две перекрываю-
щиеся атомные орбитали комбинируются, образуя одну связываю-
щую орбиталь, обладающую низкой энергией, и одну разрыхляю-
щую орбиталь, обладающую высокой энергией (см. верхнюю часть
рис. 5-6) *. Об орбиталях, которые перекрываются таким образом,
как это показано на рис. 5-5, говорят, что они перекрываются по
о-типу, а связывающую орбиталь называют о-орбиталью, тогда
как разрыхляющая орбиталь носит название ст*-орбитали. Двух
спаренных электронов достаточно для заполнения сг-орбитали.
Любые дополнительные электроны должны помещаться на о-орби-
таль, обладающую высокой энергией, не увеличивая, таким обра-
зом, степени связывания, а увеличивая отталкивание между ато-
мами. Молекулярный ион водорода Н® может рассматриваться как
имеющий один электрон на с-орбитали. Он был изучен в газовой
фазе спектральными методами; найдено, что энергия его диссоциа-
ции на Н® и Н • составляет 61 ккал, тогда как энергия связи моле-
* Более подробно отличие между связывающими и разрыхляющими орбиталя-
ми рассматривается в разд. 28-2,Б.
Электронные конфигурации основного состояния некоторых атомов
ОБРАЗОВАНИЕ СВЯЗЕЙ. АТОМНО-ОРБИТАЛЬНЫЕ МОДЕЛИ
153
Рис. 5-5. Схема, •поясняющая образование связи Н — Н путем спаривания элек-
тронов, находящихся на перекрывающихся орбиталях.
кулы На равна 104,2 ккал. Ряд возможных размещений электронов
(от одного до четырех) на двух орбиталях водорода приведен в
нижней части рис. 5-6.
Упражнение &-1, Нал ищите электронные конфигурации Не£ и Не® таким же
образом, как на рис. 5-6. Существование иона Не® было обнаружено спектро-
скопически; объясните, почему этот ион устойчивее, чём Н®.
перекрывающиеся
Is-орбитали
разрыхляющая
б*-орбиталь
связывающая
б-орбиталь
Н ®
устойчив обычное
состояние
Энергия
связи 61лкал 1О4,2ккол
Н2 Н2Э Н=®
возбуж- иеустой- меустой
денное чиа чив
состояние
Рис. 5-6, Схематическое изображение образования связывающих (о) и разрыхля-
ющих /о*) орбиталей при перекрывании двух атомных Jj-орби талей и некоторых
из различных электронных конфигураций, возможных в случае этих орбиталей.
154
ГЛАВА 5
Упражнение 5-2, Напишите электронные конфигурации трех различных йоз-
бужденных состояний На. Расположите их в порядке возрастания устойчивости.
Приведите ваши соображения.
5-3. Направленные ковалентные связи
Для предсказания валентных углов можно использовать поло-
жение, согласно которому направление связей должно быть таким,
чтобы орбитали связывающих электронов при данном расстоянии
между ядрами перекрывались в максимально возможной степени.
Это положение неприменимо к связям, образованным одними
только s-орбиталями, поскольку s-орбитали обладают сферической
симметрией. Однако оно должно иметь важное значение при обра-
зовании связей с участием р-орбиталей. В том случае, когда водо-
род связан своей s-орбиталью с какой-либо р-орбиталью, ядро водо-
рода должно находиться на оси р-орбитали (рис. 5-7), поскольку
такое расположение приведет к максимальному перекрыванию
для данной величины отталкивания между ядрами.
Для атома X, который за счет своих р>орбиталей образует две
о-связи с водородом, угол Н—X—Н, как можно ожидать, должен
оказаться равным 90° (рис. 5-8). Орбитальные представления ока-
зываются при этом содержательнее, чем структуры Льюиса, по-
скольку они привносят концепцию направленности связей и дают
возможность предсказать углы между связями. Рассуждая прямо-
линейно, можно было бы впасть в преувеличение и решить, что,
поскольку в атомах элементов второго периода периодической
Рис. 5-7. Перекрывание ls-орбита.чи водорода с 2р-орбиталью, центром которой
является другой атом,
ОБРАЗОВАНИЕ СВЯЗЕЙ. АТОМНО-ОРБИТАЛЬНЫЕ -МОДЕЛИ
155
Рис. 5-8. Перекрывание 1 s-орбиталей водородных атомов с 2ру- и 2р,-орбиталями,
центром'которых является другой атом.
Форма р’орбита лей здесь несколько искажена для того, чтобы сделать рисунок более ясным.
системы, образующих обычные органические соединения, имеются
только s- и р-орбитали, все валентные углы в таких соединениях
будут либо неопределенными (для случая s-орбиталей, обладающих
сферической симметрией), либо равными 90° (р-орбитали). Эта ди-
лемма была разрешена благодаря введению понятия гибридизации
орбиталей, как будет описано ниже.
Другой полезный постулат заключается в следующем: наиболее
прочные связи образуются в том случае, когда перекрывание ор-
биталей максимально. Па этом основании можно ожидать различий
в способности к образованию связей для s-, р-, d- и f-орбиталей,
поскольку все они различны в отношении характера радиального
распределения. Относительные величины протяженности 2s- и
2р-орбиталей равны соответственно 1 и ]/3, как показано на рис. 5-9.
Форма р-орбиталей позволяет предположить, что они способны
перекрываться с другими орбиталями более эффективно, чем s-
орбитали, л, следовательно, что p-связи должны быть в целом проч-
нее, ч$м о-связи. Если существует выбор между образованием s- и
p-связей, то p-связи должны привести к более устойчивым соеди-
нениям.
156
ГЛАВА б
Рис. 5-9. Относительные размеры 2s- и 2р -орбиталей.
Молекула воды интересна в том. смысле, что она может послу-
жить пробным камнем для приведенного выше способа рассмотрения
связей и валентных углов. Как видно из табл. 5-1, атом кислорода
имеет электронную конфигурацию (1 s)2(2s)2(2p)4: Если произвольно
поместить два спаренных электрона на 2ру-орбиталь, то в образо-
вании связей с двумя водородными атомами смогут участвовать
орбитали 2рх и 2рг, на каждой из которых будет находиться по
одному электрону.
Такая картина образования связи приведена в полном, а также
в сокращенном варианте на рис. 5-10 (легко видеть, что прави-
ло октета при этом получается автоматически — оно соответствует
положению, когда все имеющиеся стабильные орбитали заполнены
электронами).
При такой постановке вопроса необходимо, однако, выяснить, почему угол
между связями Н—О—Н в воде равеи не 90°, а 104,5°, Основная проблема заклю-
чается в том, чтобы-выбрать одну из альтернатив: либо этот угол действительно
должен быть равен 90°, но какне-то дополнительные факторы (или фактор) увели-
чивают его до 104,5°, либо он в действительности должен быть тетраэдрическим
углом, но каким-то образом уменьшен до величины 104,5°. Этот вопрос можно сфор-
мулировать и иначе — действительно ли Н—О-связи в воде наилучшим образом
описываются с помощью р-орбиталей кислорода или возможно участие орбиталей
какого-либо иного типа.
Если принять описание, опирающееся па р-твязи, то разницу между наблю-
даемым углом Н—О—Н и 90° можно объяснить, допустив'существование элект-
ростатического отталкивания между атомами водорода (которые должны быть
частично положительными, так как электроноакцепторные свойства кислорода
больше, чем у водорода), которое стремится увеличить угол Н—О—Н, как это
показано на рис. 5-11. Угол 104,5° оказывается в таком случае компромиссом
между электростатическим отталкиванием и ослаблением связи вследствие от-
клонения от наиболее выгодного для перекрывания /?-орбителей угла, рав-
ного 90°.
Подтверждением такой гипотезы может служить угол Н—S—Н в сероводоро-
де, равный 92°; в последнем вследствие большего размера центрального атома и
менее ионного характера связей электростатическое отталкивание между атомами
Рис. 5-10. Описание молекулы воды в
терминах о-перекрывания 2рх- и 2р,-
орбиталей атома кислорода с ls-орби-
талями атома водорода.
Рис. 5-11. Возможное объяснение отклонения угла Н—О-т-Н в воде от значения
90°, соответствующего использованию ^-орбиталей атома кислорода.
158
ГЛАВА p
водорода должно быть меньше, чем в воде, Аналогичные соображения могут быть
использованы для объяснения того факта, что угол Н—N—Н в аммиаке равен
107,3°, тогда как угол Н—Р—Н в фосфине (РНЭ) составляет 93,3°, Однако в слу-
чае трехфтористого азота и трехфтористого фосфора эта схема рассуждений при-
водит к совершенно неверному выводу, посколькув этих соединениях, где связи
сильнее поляризованы, чем в аммиаке и фосфине, углы F—N—F и F—Р—F со-
ставляют 102,1 и 104° соответственно.
Другой способ подхода к решению проблемы предсказания валентных углов
изложен в разд. 5-7.
Упражнение 5-3. Нарисуйте атомно-орбитальные модели каждого из приведен-
ных ниже соединений. Все рисунки должны быть большими и четкими; укажите
ожидаемые валентные углы. Удостоверьтесь в правильности разметки орбиталей,
как занятых неподеленными парами, так и используемых при образовании свя-
зей.
a) F2 д) Н3О®
б) HF е) НгО2
в) NHa ж) H2N — NH2
г) Р2О з) Р4 (тетраэдрическая молекула)
5-4. Гибридные орбитали связей
Из сказанного выше можно было бы сделать вывод, согласно
которому углерод,- имеющий конфигурацию (ls)a(2s)а(2^)а, должен
образовывать только соединения, подобные :CR2, где угол R—С—R
равен 90s, или, если исходить из конфигурации, (ls)2(2s)(2p)3, сое-
динения типа CR4, где имеются p-связи, расположенные под угла-
ми 90° одна к другой, и одна s-связь, не имеющая фиксированного
направления. Поскольку, как было показано, СН4, CCid, и др., вне
всякого сомнения, имеют тетраэдрическую конфигурацию, простая
картина, основанная на рассмотрении орбиталей, в случае углерода
теряет силу.
Полинг и Слейтер разрешили дто противоречие между теорией
и экспериментом, введя понятие гибридизации орбиталей. Гибри-
дизация предполагает установление^ того, какие комбинации s-
и р-орбйталей (если такие комбинации имеются) могут привести к
образованию более эффективных связей, чем s- и р-орбиталив от-
дельности.
Для иллюстрации этого положим, что в распоряжении имеются
s- и р-орбитали, которые можно использовать для образования двух'
связей, как это изображено на рис. 5-12. Заметим, что ни s-, ни р-
орбитали не могут использовать все свои возможности перекрыва-
ния с s-орбиталью другого ядра при образовании связи по-оси х.
Очевидно, однако, что если бы удалось скомбинировать эти орбитали
таким образом, чтобы в большей степени использовать их способ-
ность к перекрыванию, то мы получили бы более прочные связи и
более устойчивые молекулы. Математическое рассмотрение вопроса
ОБРАЗОВАНИЕ СВЯЗЕЙ. АТОМНО-ОРБИТАЛЬНЫЕ МОДЕЛИ
159
Рис. 5-12. Схематическое изображение
атома, имеющего s- и р-орбитали, до
‘ гибридизации.
о гибридизации орбиталей позволяет сделать вывод, что s- и р-ор-
битали одного атома могут образовать две более - прочные кова-
лентные связи, если они комбинируются, образуя две новые орби-
тали, называемые sp-гибридными орбиталями (рис. 5-13). Каждая
sp-гибридная орбиталь обладает способностью к перекрыванию,
выражаемой величиной 1,93, тогда как для чистой s-орбитали
она ио определению принимается равной единице, а для чистой
р-орбитали равна КЗ. Можно ожидать, что в случае связей, обра-
зованных $р- гибридной орбиталью, валентный угол будет равен
180°.
В случае атомов,_ образующих три ковалентные связи, возможна
гибридизация типа sp2, как показано на рис. 5-14. Оси орбиталей
лежат в одной плоскости, так как при этом р-орбитали использу-
Рис. 5-13. Изображение двух s/J-гибридных орбиталей, образованньи из s- и
р-орбиталей. Одна из орбиталей (сплошная линия) имеет наибольшую протяжен-
ность в направлении -рх, тогда как другая (пунктирная линия) — в направле-
нии —х.
160
ГЛАВА 5
Рис. 5-14. Изображение трех зда-гибридных орбиталей, образованных из з-,
Рх- й Pv-орбиталей. Орбитали изображены с помощью линий различного типа.
ются наиболее эффективно. Ожидаемая степень перекрывания
составляет в таком случае 1,99.
Гибридизация одной $- и трех р-орбиталей приводит к 5р3-гиб-
ридным орбиталям, которые, как можно предвидеть, не будут
лежать в одной плоскости; действительно, расчет показывает, что
они должны быть направлены под углом 109,5° одна к другой. Спо-
собность к перекрыванию в случае spa-гибридных орбиталей должна
быть равной 2,00 (рис, 5-15).
Рис. 5-15, Изображение зр3-гиб|>идных орбиталей.
ОБРАЗОВАНИЕ СВЯЗЕЙ. АТОМ НО-ОРБИТАЛЬ НЫЕ МОДЕЛИ
161
5-5. Атомно-орбитальные модели
органических соединений
А. Насыщенные соединения
Алканы и их производные, имеющие нормальные тетраэдричес-
*кие углы для связей с углеродом, легко можно представить с по-
мощью атомных орбиталей, где углерод связан ар’-связями. На
рис. 5-16 приведен пример такого описания (в сокращенной за-
писи, подобно рис. 5-10).
Б. Соединения с двойными связями
В предыдущих главах уже отмечалось большое отклонение ва-
лентных углов в’ соединениях с двойными углерод-углеродными
связями, подобных этилену, от нормального тетраэдрического
значения 109,5°. Двойная углерод-углеродная связь может быть
описана с помощью атомных орбиталей несколькими способами.
Рис. 5-16. Упрощенная атомно-орбитальная модель этилового спирта СНаСН2ОН.
Показанытолькоэлектроны внешних оболочек.
6 № 1S4O
162
ГЛАВА 5
Рис. 5-17. а, л-Описание этилена.
Наиболее широко распространен способ описания, при котором
углеродные атомы в этилене считаются находящимися в состоянии
s/Агибридизании и образующими одну о-связь углерод — углерод
и четыре о-связи углерод — водород за счет перекрывания шести
s/Аорбиталей, как показано на рис. 5-17. Еще одна связь углерод —
- ! б-перекрьгвание щ-перекрывание
Рис. 5-18. Схематическое изображение а- и л-перекрывания /J-орбиталей.
ОБРАЗОВАНИЕ СВЯЗЕЙ. АТОМНО-ОРБИТАЛЬНЫЕ МОДЕЛИ 163
углерод возникает вследствие «бокового» перекрывания двух
р-орбиталей, по одной от каждого углерода, которые не были ис-
пользованы при образовании др2-гибридов. Такой тип перекрыва-
ния р-орбиталей называют л-перекрыванием в отличие от «-пере-
крывания, рассмотренного выше (рис. 5-18).
Такая модель этилена предполагает плоское строение его мо-
лекулы с углами Н—С—Н, равными 120°. Действительно, этилен
представляет собой плоскую молекулу, но углы между связями
Н—С—Н оказались в.нем равными 116,7°, а не 120°, как следовало
ожидать для зр2-связи. Пока еще не ясно, достаточно ли этого рас-
хождения для того, чтобы поставить под сомнение изложенные выше
представления.
Не следует думать, что о,л-модель этилена может служить «доказательством»
того, что между атомами углерода в нем действительно имеется два различных
типа связей. о,л-Описание двойных связей вовсе не следует рассматривать как
единственно возможное. Допустив 5р'--гибрндизацию углеродных атомов, приво-
дящую к образованию зр2-<т-связей с атомом водорода, можно далее взять sp2- н
р-орбитали, использованные для ст- и л-связещ регибридизировать их и получить,,
таким образом, новый набор орбиталей, перекрывающихся с образованием двой-
ной связи и приводящих к двум эквивалентным С—С-связям. Их называют свя-
зывающими орбиталями т-типа; они могут быть представлены,двумя орбиталями,
имеющими форму банана, которые соединяют углеродные атомы, образующие
двойную рвязь (рис. 5-19). Характер т- и сг, л-представлений таков, что они долж-
ны рассматриваться как эквивалентные. т-Опйсание имеет то преимущество, что
оно очень Хорошо воспроизводится с помощью шаростержневых моделей, тогда
как о, л-представление имеет особую ценность в качестве основы для количествен-
ных расчетов.
, На основании <т,л-модели двойной связи можно сделать вывод,
что повернутая конфигурация, изображенная на рис. 5-20, не
должна быть устойчивой. В этом случае рг-орбиталй не находятся
в положении, благоприятном для перекрывания по . л-способу.
В наиболее благоприятной конфигурации оси р—л-орбиталей.парал-
Рис. 5-19. Описание этилена с помощью т-связей..
6*
164
ГЛАВА 5
Рис. 5-20. Повернутая («скрученная»)
неплоская конфигурация этилена, в
которой степень л-перекрывания резко
понижена.
лельны. Для того чтобы разорвать р—л-двойную связь и сделать
возможным вращение вокруг оставшейся s/Лст-связи, необходимо
затратить значительное количество энергии; поэтому вращение
вокруг двойной связи затруднено и возможно существование цис-
транс- изомеров. К аналогичным выводам можно прийти также,
основываясь на т-модели двойной связи.
В. Соединения с тройными связями
Строение ацетилена (CSH2) обычно описывается с помощью пред-
ставления о sp-гибридных связях. Скелет, состоящий из атомов
углерода и водорода, образуется при этом путем о-перекрывания
двух sp-гибридных орбиталей, по одной от каждого атома углерода
(так образуется С—С-связь), и о-перекрывания оставшихся sp-
орбиталей с s-орбиталями двух атомов водорода, приводящего к
образованию С—Н-связей. Две другие углерод-углеродные связи
возникают вследствие «бокового» л-перекрывания чистых р-орби-
талей', как показано на рис. 5-21. Такая модель хорошо согласуется
со свойствами ацетиленовых связей; она предполагает линейность
молекулы (экспериментально найденные углы между связями рав-
ны 180° в соответствии с ожидаемым) и высокую химическую реак-
ОБРАЗОВАНИЕ СВЯЗЕЙ. ЛТОМНО-ОРБИТЛЛЬНЫЕ МОДЕЛИ
165
Рис. 5-22. Описание ацетилена и терминах а-перекрывания зр:|-орбиталей.
ционную способность (л-электроны легко доступны для атаки
извне).
Может возникнуть важный вопрос: почему строение ацетилена
нельзя описать с равным (или большим) успехом, используя яр'л-
свяЗи, как это показано на рис. 5-22, вместо sp-сг-связей, приведен-
ных на рис. 5-21? Против такого предположения свидетельствует
следующее. Прежде всего нельзя ожидать, что 8ра-связи будут
выгодны в том случае, когда линия, соединяющая ядра, находится
на большом расстоянии от осей перекрывающихся орбиталей.
В случае 8ра-орбиталей связям пришлось бы сильно «изогнуться»,
вследствие чего их прочность была бы гораздо меньше, чем обычно.
Во-вторых, связи С—Н в ацетилене отличаются от связей С—Н в
этилене и этане, о чем можно судить по частотам валентных и дефор-
мационных колебаний ацетиленовых связей С—Н в инфракрасном
спектре, а также на основании энергий связей. Далее, атомы водо-
рода в ацетилене обладают гораздо большей протонной подвиж-
ностью, чем в этане. Если на основании этих данных приходят к
выводу о том, что связи С—Н не относятся к 8ра-типу, то отсюда
неизбежно следует, что С—С-связи также не относятся к этому
типу.
Г. Циклопропан
Атомно-орбитальные модели для соединений с малыми циклами, например
для циклопропана, могут быть построены различными способами. В одном из них
молекула предполагается построенной их трех др'^-гибридизованиых атомов угле-
рода с «троекратно» перекрывающимися ,чр2-орбиталямя (по <т-рипу) в центре коло -
ца и л-подобным перекрыванием р-орбиталей на периферии цикла (рис. 5-23).
На центральной «тройной» о-связывающей орбитали располагаются два электро-
на, тогда как на периферийной л-нодобной системе перекрывания две связываю-
щие орбитали содержат четыре электрона. : 1 :|
166
ГЛАВА 5
Рис, 5-23. Атомно-орбитальная модель циклопропана (о,л-описание).
Альтернативный подход заключается в оценке того, какие комбинации гиб-
ридных орбиталей дают связи между атомами углерода, наилучшим образом соот-
ветствующие валентным углам 60°. Результатом такого расчета оказываются связи,
близкие к't-типу (стр. 163), соединяющие атомы углерода, тогда как С—Н-связи
должны быть близки к др“-типу (рис. 5-24).
Рассмотрение в рамках обеих моделей приводит к выводу, что СНэ-группы
сходны по характеру с аналогичными группами, связанными двойной связью, что
подтверждается опытными данными (разд. 4-6).
Рис. 5-24. Описание циклопропана е помощью т-связей.
ОБРАЗОВАНИЕ СВЯЗЕЙ. АТОМНО-ОРБИТАЛЬНЫЕ МОДЕЛИ [67
5-6. Орбитали связей для атомов,
имеющих неподеленные пары
электронов
Электронная конфигурация атома азота в его наиболее устой-
чивой! состоянии имеет следующий вид: (Is)2 (2s)2 (2рр. Когда азот
превращается в аммиак, может возникнуть вопрос, образуются ли
связи за счет трех р-орбиталей азота, или происходит гибридиза-
ция, приводящая к связям близкого к sp3 характера и непоДеленной
паре sp’-типа? В последнем случае электрон должен быть возбужден
из состояния sa на р-орбиталь, обладающую более высокой энергией.
(Р) OPV
(р) -N: (s)1 ------------> (sp3) -N- (sp3)
W (sp3)
Энергия возбуждения, необходимая для перехода азота из сос-
тояния (ls?(2s)a(2p)3 в состояние. (Is)2 (2s) (2р)4, составляет величину
порядка 200 ккал. Несмотря на то что переход от чистой р-связи
к связи зр3-типа может привести к увеличению прочности связи на
25—30 ккал, этого может оказаться недостаточно для того, чтобы
компенсировать возбуждение s-электрона. Согласно одной из точек
зрения, в аммиаке и сходных соединениях с неподеленными элект-1
ровными парами (например, воде) вряд,ли можно ожидать значи-
тельной гибридизации s- и р-орбиталей. Однако это не согласуется
с теоретически предсказываемым характером взаимодействия спи-
нов 14N—Н в ЯМР-спектрах. Величина такого взаимодействия
более сходна с той, которой следует ожидать в случае N—Н-связей
8р“-типа.
Для таких атомов, как углерод, энергия возбуждения ots- до р-
состояния компенсируется возможностью образования большого
числа более прочных связей. Так, C(2s)a(2px)(2pj,) может образо-
вать две p-связи (энергия каждой приблизительно равна 80 ккал)
с атомами водорода, причем выделяется Г60 ккал, тогда как С(2s)
(2рЛ) {2ру) (2рг) может образовать четыре sp’-связи (по 103 ккал
каждая) с атомами водорода с выделением 412 ккал. Очевидно, что
энергия этого последнего процесса достаточна для компенсации
энергии возбуждения электрона (96 ккал) при переходе
С (Is? (2s? (2р)а-ИЗ (ls?(2s)(2p)3; следует, таким образом, ожидать воз-
буждения и гибридизации, приводящей к образованию четырех проч-
ных связей.
Упражнение S-4. Нарисуйте атомно-орбитальные модели для каждого из при-
веденных ниже соединений. Все рисунки должны быть большими и четкими; ука-
жите ожидаемые валентные углы. Убедитесь в том, что орбитали, занятые депо-
168
ГЛАВА 5
деленными парами, так же как орбитали, используемые каждым атомом дли об-
разовании связей, правильно обозначены, а также в том, что на атомах, не имею-
щих характерного для них набора электронов, поставлены заряды.
а) фтористый метил CHSF
б) диметиловый эфир СН30СН3
в) формальдегид СН2 = О
г)
д) ацетонитрил CH3CssN
е) бензол
ж) графит
з) муравьиная кислота НСО2Н
и) СОа
к) BF3
л) (CHjjjMg
м) СНа\'Ьг
н) кетен СН2=С = О ;
о) диазометан CH2N2 (угол С—N —N
180°)
п) метили зоцианнд CH3NC (угол
C—N—С 180°)
р) СН® (может быть обнаружен в
масс-спектрометре)
Упражнение 5-5. Можно ли описать этилен с помощью ^//-гибридных орби-
талей точнее, чем с помощью ьуАгибридиых орбиталей? Приведите ваши сообра-
жения.
Упражнение 5-6. Как можно описать циклобутан с помощью атомных орби-
талей? -
i f
Упражнение 5-7. Какова гибридизация атома углерода, участвующего в обра-
зовании т-снязей этилена (иначе говоря, каково правильное значение п при
spn- описании орбиталей, используемых каждым из атомов углерода, обра-
зующих двойную связь), если С Н-связн образованы с участием зра-орбиталей?
5-7. Межэлектронное отталкивание
и углы связей
Простой альтернативой использованию гибридизованных орби-
талей для предсказания валентных углов ковалентных связей может
служить вполне естественное допущение, согласно которому свя-
зывающие пары электронов стремятся расположиться как можно
дальше друг от друга вследствие электростатического отталкива-
ния. Так, четыре электронные пары при одном атоме, как, напри-
мер, при атоме углерода в метане, будут находиться наиболее далеко
друг от друга в случае тетраэдрического расположения. При этом
отталкивание Электронов должно быть минимальным Такой под-
ход легко Может быть использован для предсказания геометрии ме-
тил-катиона, образующегося при удалении одного атома водорода
вместе со связывающей его электронной парой от молекулы метана.
Можно ожидать, что для того, чтобы сделать отталкивание электро-
нов минимальным, оставшиеся три электронные пары углерода
примут'плоское расположение с углами 120°.
Н _ * м
О н
Н:С: н ——Л—+. х С®
н - Н‘ •'»
тетраздрич ecici 1Й плоский метил- катион
ОБРАЗОВАНИЕ СВЯЗЕЙ. АТОМНО-ОРБИТЛЛЪП ЫЕ МОДЕЛИ
169
В метильном анионе :СН® наиболее выгодной должна быть
(практически так оно и есть) неплоская конфигурация, где непо-
деленная электронная пара расположена более или менее близко
к вершине угла тетраэдра, тогда как другие углы тетраэдра заняты
тремя электронными парами С—Н-связей
.Н _ н© .Н ©
Н :С’. Н ----------------> Н -.с:
Н Н
неплоский метил-анион
«
Очевидно, что метильный радикал CHS- должен представлять
собой некоторый средний случай.' Экспериментальные данные не
позволяют дать точного ответа на этот вопрос. Однако имеется
основание полагать, что конфигурация радикала в его наиболее
устойчивом состоянии весьма близка к плоской.
Многие отклонения от нормальных тетраэдрических валентных
углов в органических соединениях можно объяснить просто путем
рассмотрения межэлектронного отталкивания. Так, для соединений
типа СН3Х, где X — более электроноакцепторная группа, чем
водород, связь С—X поляризована следующим образом: Н3С6® —
X6® и ’характер углеродного атома должен в некоторой степени
приближаться к СН®. Углы Н—С—Н должны быть при этом боль-
ше 109,5°, и это действительно имеет место; например, в хлористом
метиле величина угла Н—С—Н близка к 111°.
Угол между связями Н—С—Н в этилене, равный 116,7°, может
быть объяснен следующим образом. Если взять тетраэдрический
углеродный атом и сблизить какие-либо две электронные пары, как
это происходит при образовании двойной связи, то отталкивание
между этими парами и двумя другими уменьшается. В результате
электронные пары, образующие связи С—Н, смогут отодвинуться
друг от друга на большее расстояние. Это, разумеется, приведет к
увеличению угла между связями Н—С—Н. Такого же эффекта
можно ожидать в циклопропане, и он действительно наблюдается —
углы между связями, примыкающими к кольцу, равны 112—118°.
Аналогичное рассмотрение можно пронести для объяснения валентных углов
в соединениях с неподелеиными парами электронов, таких, как вода и аммиак.
Пусть вода образуется из О2® и 2Н®. Наиболее вероятное расположение четырех
электронных пар иона О2® должно быть таким, при котором они будут находиться
в вершинах'Правильного тетраэдра. Электроны бу дут коррелировать свое движе-
ние таким образом, чтобы удерживать пары как можно дальше друг от Друга. Учас-
тие двух электронных пар иона О2® и образовании связей с 2Н® приведет к умень-
шению отталкивания между связями в непо деленными парами. Связанные лары
сдвинутся при этом на угол меньший, чем тетраэдрический, в то время как иепо-
деленпые пары раздвинутся на больший угол, как показано схематически на рич,
5-25,
170
ГЛАВА S
тетраэдрическое
расположение
Рис. 5-25. Схематическое изображение образования HSO из О3® и 2Н®, пока-
зывающее, каким образом изменения в отталкивании электронов должны привести
к углу Н — О — Н, значение которого будет меньше тетраэдрического.
На основании этого подхода нельзя предсказать точное Значение угла между
связями Н—О— Н, но имеется основание утверждать, что ои будет меньше, чем
тетраэдрическое значение 109,5°; наблюдаемый угол 104,5° выглядит поэтому во
всех отношениях приемлемым. Гораздо меньшее значение угла Н—S—Н в серо-
водороде может объясняться тем, что сера менее электро поакцепторна, чем кисло-
род, и поэтому характер Sa® в HjS выражен менее ярко, чем характер О2® в Н2О.
Это позволяет предположить, что угол И—S—II будет меньше, чем угол Н—О—Н,
как и есть на самом деле.
Аналогичный метод рассмотрения может быть применен к образованию ам-
миака из N3© и ЗН®; он позволяет предсказать, что угол должен быть ближе к
тетраэдрическому, поскольку в этом случае не существует отталкивания между
непо деленными парами.
Упражнение 5-8. УголН—С—Н в формальдегиде Н2С=О составляет ~125°.
Находится ли эта величина в соответствии с межмолекулярным отталкиванием?
Объясните.
Упражнение 5-9. Объясните с точки зрения межэлектро иного отталкивания,
почему валентные углы в NF3 и OFS равны 102,1 и 103,2° соответственно. Учтите,
ЧТО фтор более электроотрицателен по отношению к азоту, чем по отношению к кис-
лороду.
Упражнение 5-10. Пусть в соединении СНЭ.Х с углеродом связана электроноак-
цепторная группа X- Меньший или больший р-характер будет иметь орбиталь
связи С—Н по сравнению с sp°-орбита лью связи С-—Н в метане? Объясните.
Дополнительное упражнение
5-11. Неустойчивое соединение :СН2 может существовать в двух формах, соответ-
ствующих основному состоянию. R одной из форм угол Н—С—Н равен 180°, а в
другой — 103,2°. В одном из этих состояний электроны, не участвующие в обра-
зовании связи, спарены, а в другом:—не спарены. Постройте возможные атомно-
орбитальные модели этих состояний и используйте их для ответа на вопрос о том,
в каком из соединений электроны не спарены.
ГЛАВА
АЛКЕНЫ.
СТРУКТУРА, СПЕКТРЫ
И СТЕРЕОИЗОМЕРИЯ
В ранний период развития органической химии алканы была наз-
ваны «насыщенными», а алкены — «ненасыщенными» соединениями,
поскольку алкены в отличие от алканов, оказались способными всту-
пить в реакции присоединения при действии таких веществ, как
галогены, галогеноеодороды, серная кислота и окислительные агенты.
«.Химическое сродство» считалось вследствие этого «ненасыщенным».
Позднее было выяснено, что такие реакции присоединения в дейст-
вительности происходят путем раскрытия «наполовину» двойной
связи углерод — углерод. То, что такие реакции происходят гораздо
легче, чем с алканами, объясняется меньшей прочностью (большей
напряженностью) каждой из угле род-углеродных связей двойной связи
по сравнению с обычной простой связью углерод — углерод.
Огромное разнообразие и специфичность реакций присоединения,
в которых принимают участие соединения с двойными связями,
делает их чрезвычайно важными промежуточными веществами
в органических синтезах. Эти реакции будут рассматриваться в
гл. 7, а в настоящей главе обсуждены номенклатура, спектры и
цис—транс-изомерия алкенов. Последний вопрос приобретает осо-
бенно важное значение при рассмотрении механизмов реакций при-
соединения.
Использование дипольных моментов описано в связи с вопросим
установления структуры цис- и транс-изомеров. Принципы, лежащие
в основе экспериментального определения дипольных моментов, обсуж-
даются в специальном разделе в конце главы.
Существует огромное разнообразие соединений, содержащих
одну или большее число ненасыщенных двойных связей углерод —
ГЛАВА 6
72
ТЛерод; такая связь содержится в этилене. Углеводороды с откры-
ли цепью, содержащей одну двойную связь, имеют общую формулу
и называются алкенами. Двойную связь углерод — углерод
яси> называют олефиновой связью, а алкены — олефинами («об-
илующими масла»). Эти термины возникли вследствие того, что
а и юбразные алкены с- низкой молекулярной массой дают при
einтми хлора или брома «маслообразный» продукт.
-1. Номе нклатура
14 соответствии с правилами IUPAC при построении названий
,'11.('иов наиболее длинная непрерывная цепь, содержащая двойную
пип,, получает название соответствующего алкана, в котором
г,, .ичапие -ан заменено на -ен. Эта цепь далее нумеруется таким
Ьр.ком, чтобы положение первого углеродного атома, участвую-
1.1-1 ч н образовании двойной связи, получило наименьший из воз-
('.т.ных номеров.
; снг
: г и :
: з?н 4 3 6 1
-HCH-CHz-CH2-CHz-CHj
<321
GlljCH2CHsCHt CHj-CHz-CH2
бутен-1 _
cue бутен-3) ’ З-пропилгептси-1
ни Шрияя ЛИВИЯ охватывает наиболее длинную непрерывную цепь, в состав
которой входит двойная связь)
Для алкенов сравнительно простого строения часто применяют
тут не, менее систематические названия. В одной из систем алкены
шч-мятрнваются как замещенные этилены; в этом случае может
требоваться добавление приставки, указывающей на характер
смещения — симметричный (симм) или несимметричный (несимм)
СН3
сн2=снг сн3-сн=сн~сн3 , сн3-с=сн2
этилен силм^диметнл этилон * ш «лея .ди метил'
Некоторые наиболее часто встречающиеся, алкены называют
1К пленами, добавляя суффикс ен к названию углеводородного
щикала с тем же углеродным скелетом,
СН3
сн.. сн2 сн3 - сн = сн3 см3 - с; сн,
этилен пропилен изобутилен
АЛКЕНЫ. СТРУКТУРА, СПЕКТРЫ И СТЕРЕОИЗОМЕРИЯ
173
Углеводородные радикалы, образованные из алкенов, получают
суффикс енил (в общем случае алкенил), и нумерация в радикале
начинается от углеродного атома, имеющего свободную валентность.
Однако для нескольких алкенильных радикалов вместо системати-
ческих названий обычно используются тривиальные, а именно:
винильный, аллильный и изопропенильяый радикалы.
СН3=СН—
винил
(этенил)
СН2=СН—СН2—
аллил
(пропен-2-ил)
снэ
сн2=с—
язолропеннл
()-метилэте ннл)
Водородные атомы, непосредственно связанные с ненасыщенны-
ми атомами углерода, образующими двойную связь, часто называют
винильными водородами.
Циклоалкены называют по системе, используемой для алкенов с
открытой цепью; отличие состоит в том, что нумерация всегда
начинается от одного из атомов углерода, связанных двойной связью,
и далее ведется вдоль цикла через двойную связь так, чтобы сумма
номеров оказалась наименьшей.
5
сн2 ^сн2
J-C. 2 Jch
сн3 ^сн >СН3
1,3-диметил циклогексен
(а не 1,5-диметилниклогексен)
Многие соединения содержат две или большее число двойных
связей; они называются алкадиенами, алкатриенами, алкатетрае-
нами и т. д., причем суффикс указывает на число двойных связей.
Положение каждой двойной связи указывается с помощью со-
ответствующего номера, как показано ниже:
СНа=С=СН-СНЭ СНа=СН—СН=СНц сн2=с=с=сн2
бутадиен-1.2 бутадиен-[,3 бутЗтрией-Е, 2,3
Дальнейшая классификация производится в зависимости от
взаимного расположения двойных связей. Так, алкадиены-1,2 и
сходные соединения Содержат кумулированные двойные связи
СН2 = С=СН2
аллен
(пропадиен)
кумулированные
двойные связи
• Алкадиены-1,3 и другие системы с чередующимися двойными и прос-
тыми связями называются соединениями, содержащими сопряжен-
174
ГЛАВА б
ные двойные связи
CHS—СН = СН—СН = СН,
пентадиен-1,3
сопряженные
цпойные связи
сня
сн2=сн—с=снг
изопрен
(2-мётилбутадиен-1,3}
Системы, в которых двойные связи не являются ни кумулиро-
ванными, ни сопряженными, относятся к классу соединений, содер-
жащих изолированные двойные связи
СН2 = СН-СН2—СН = СН3 V=C-f -(J— ) — С=(/
Певтадиен-1,4 ' \ I /п
соединение с изолированными
двойными связями (п > Ц
Упражнение 6-1. Назовите каждое из приведенных ниже соединений но системе
IUPAC и (в том случае, если это не вызывает затруднений) рассматривая их, как
производные этилена.
а) (СН3),С=СНСНв
б) СиС=С(СНэ)2
в) (СНэ),5ССНгС(СН5)=СН;
г) (CH3)3C = C=-CHBi
Д) 1(СН3)2СН]2С = С[(СН(СН3)2)
сн
Ж)
сн.
сн
е) (СНЭ)2
Упражнение 6-2. Напишите структурные формулы для каждого из приведен-
ных ниже соединений:
,а) трифтор хлор этилен
б) лйгилж-динеопентйлэтилен
в) гексадиен-1,4
г) 1,1-ди-(циклогексен-1-ил) этен
д) тривин ил аллен
е) 7-хлорбиц,йкло-[2;2,1]-гептаДиен-2,5
6-2. Физические свойства' алкенов
Физические свойства алкенов в основном сходны с соответст-
вующими свойствами алканов. Данные, приведенные в табл. 6-1,
позволяют провести сравнение температур кипения, температур
плавления и плотностей для ряда алкенов и 'Соответствующих
алканов, имеющих тот же углеродный скелет. Подобно н-алканам,
алкены-1 образуют гомологический ряд, в котором наблюдается
закономерное изменение физических свойств по мере увеличения
длины цепи.
АЛКЕНЫ. СТРУКТУРА, СПЕКТРЫ И СТЕРЕОИЗОМЕРИЯ
175
Таблица 6-1
Сравнение физических свойств «-алканов и алкенов
Углеводород Формула Т, кип,, °C Т. пл,. СС ^0 .. 4
Этан сн3-сн3 —88,6 —183 4
Этилен- сна^сн, — 105 —169
Пропан сн3—сн2—сн3 —42,1 —187а 0,5016
Пропен сн3—сн=снг —47,8 - 185а 0,5!4е
н-Б у тан снэ—сн2—сн2—сн3 —0,5 —138 0,579 е
Бутен-1 сн3-сна-сн=сн2 -6,3 —185а 0,595 е
({ис-Бутен-2 сн3—сн=сн—сн3 3,7 —139 0,6216
транс-Бу ?ен-2 СН;,—СН — СН—CHS 0,9 — 106 0,604е
Пентан СН3 — CH 2—СН2 — СН 2—CHS 36,1 — 129 .0,626
Пентен-i СНд - CHj - сн3 - сн = сня 30,0 — 165 0,641
цас-Пентен-2 сна—сн3—сн=сн—сн3 37,9 -151 0,656
транс-Пентен-2 сн3—сн2—сн=сн-сн3 36,4 —J40 0,648
Гексан сн,-сна-сн2-сн2-сн2-сн3 68,7 -95 0,659
ГексеиЛ СНЯ—СН,—СНг—СИ., —сн = сн2 63,5 — 140 0,674
цис- Г<ксен-2 сн3—сн2—сн 2—сн =сн—сн 68,8 — 141 0,687
транс-Гексен-2 СИ., - СН 2 -ж-сн,—сн =сн—сн3 67,9 —133 0,678
цис-Гексен-3 сн3-сн2-сн=сн-сн2-сн3 66,4 —138 0,680
транс-Гексен-3 сн3—сн2—сн=сн—сн2—сн3 67,1 — ИЗ 0,677
а В тройной точке.
б При давлении насыщения.
6-3.
Спектральные свойства алкенов
А. Инфракрасные спектры
Инфракрасные спектры алкенов значительно отличаются от
спектров алканов, что позволяет, в большинстве, случаев надежно
констатировать присутствие двойной связи в соединении. Напри-
мер, в ИК-спектре бутсна-1 (рис. 6-1) полоса поглощения около
1650 см-' характеристична для валентных колебаний двойной
связи. Интенсивность и положение этой полосы зависят в основном ,
от структуры алкена; они изменяются в зависимости от степени
разветвления при двойной связи, присутствия второй ненасыщён-'
ной группировки, находящейся в состоянии сопряжения с первой
(например, ^С=С—С=с/" или \с=С—С=О), и симметричности
замещения при двойной связи (см. разд. 2-4). ЕЗо многих случаях,
однако, полосы поглощения, обусловленные различными типами
176
ГЛАВА 6
колебаний винильных С—Н-связей, оказываются более полезными
для обнаружения двойной связи и установления ее характера, чем
полосы поглощения, связанные с колебаниями связи С=С. В случае
бутена-1 полосы поглощения, обусловленные колебаниями связи
С—Н концевой группы =СН2, располагаются при 3100, 1420 и
915 см-1, а полосы, обусловленные группой —-СН = , находятся при
3020, 1420 и 1000 см-1. Как правило, полосы поглощения, соответ-
ствующие этим частотам, позволяют установить присутствие груп-
пы —СЬ^СНц. Полосы при 1420 см-1 связаны с колебаниями в
плоскости, тогда как полосы в интервале 915—1000 см"1 возникают
вследствие в неплоскостных колебаний. Другие интенсивные полосы
при 1460 и 3000 см-1 обусловлены С—Н-колебаниями группы
СН3СН3—. Это иллюстрирует другую особенность ИК-спектров алке-
нов, а именно: положение инфракрасного поглощения алкильных
С—Н-связей часто существенно отличается от поглощения виниль-
ных С—Н-связей.
Можно ожидать, что обнаружение с помощью инфракрасной
спектроскопии двойной связи в алкене, не имеющем винильных
атомов водорода, будет представлять трудную задачу. Часто это
оказывается верным, и в таких случаях большую пользу приносит
спектроскопия комбинационного рассеяния (разд. 2-4),
л
Инфракрасное поглощение бутена-1 при 1830 см-1 (рис, 6-1) попадает в диапа-
зон, где обычно наблюдаются валентные колебания. Однако эта полоса в действи-
тельности обусловлена обертонами (высшими гармониками) в не плоскостных коле-
баний при 915 см-1. Частота такого обертонного поглощения точно р^внэ удвоен-
ной частоте основного колебания; и во всех тех случаях, когда возникает погло-
Пропускание. % Пропускание, % Пропускание.
178
ГЛАВА 6
тонне, положение которого не согласуется с нормальными основными колебания-
ми, должна быть рассмотрена возможность того, что оно представляет собой обер-
тон.
Упражнение 6-3. Определите структуры соединений, ИК-спектры которых
приведены на рис. 6-2. Проведите отнесение возможно большого числа полос,
обусловленных деформационными и валентными колебаниями.
Б. Ультрафиолетовые спектры поглощения алкенов
Электроны двойной связи углерод—уФлерод в алкенах (и
именно те, которые называются л-электронами; разд. 5-5,Б) воз-
буждаются в состояние^ более высокой энергией (л*) светом с дли-
ной волны 1800—1000 А. Поскольку многие другие вещества также
поглощают в данном диапазоне (в том числе воздух, кварц, исполь-
зуемый для кювет, и большинство растворителей, применяемых для
растворения образца), снятие спектров простых алкенов представ-,
ляет собой трудную задачу. Однако в том случае, когда двойная
связь сопряжена с одной или с большим числом ненасыщенных
связей, как, например, в системах ^С=С—С=С^ или
рС=С—С=О, длины волн максимумов поглощения сдвигаются в
Z I i .
область больше 2000 Аи оказываются более легко и точно определи-
мыми с помощью обычных УФ-спектрометров; Примеры поглощения
систем такого типа приведены в табл, 2-2; они будут рассматри-
ваться подробнее в гл. 9.
Рис. 6-3. ЯМР -спектр 1-метил-1-фенилэтилена при 60 МГц.
Калибровки произведены па протонам (CH3}*Sb Нн.пета1п<ях гюклзаиы ивки при 32]. 307 и
119 Гц. записанные на растииугоА шкале* Интерпол между пиками дли пика 30» Гц состав-
ляет 1.5 Ги, « для пиков 321 н 119 Ги — 0J5 Г и
АЛКЕНЫ; СТРУКТУРА, СПЕКТРЫ И СТЕРЕОИЗОМЕРИЯ
179
В. Спектры ядерного магнитного резонанса
алкенов
Химические сдвиги винильных водородов (винильных протонов)
обычно попадают в область 4,6—5,3 м. д, относительно ТМС. Эти
сдвиги располагаются на 2,5—4,5 м. д. (150—170 Гц при 60 МГц)
в более слабом поле, чем сдвиги водородов простых алканов или
циклоалканов, откуда следует, что присутствие или отсутствие
винильных водородов в органических соединениях сравнительно
легко- установить с помощью ЯМР-спектров.
Рассмотрим в качестве примера ЯМР-спектр 1-метил-Ьфенилэти-
лена (1), приведенный на рис. 6-3. В этом соединении имеется два
винильных протона, три метильных и пять фенильных * протонов.
(стрелками показано
спим-слияовое взаимен
действие аинильных
протонов)
L-метил-1 - фенил эти лен
(1)
Два винильных протона, как можно видеть, имеют различные
химические сдвиги, причем оба они располагаются в значительно
более слабом поле, чем сдвиги метильных протонов. Сдвиги фениль-
ных протонов располагаются в еще более слабых полях. Расщепление
сигналов винильных и метильных протонов возникает вследствие
взаимодействия спинов двух винильных протонов и трех протонов
метила. Очень сложная группа линий в области 437 Гц обусловлена
спин-спиновым расщеплением сигналов пяти фенильных протонов,
взаимодействующих между собой.
Спи и-спи но вое расщепление винильных и метильных атомов водорода может
служить интересной иллюстрацией того, каким образом случайное совпадение ве-
личин взаимодействия может приводить к меньшему числу резонансных линий,
чем следовало бы ожидать. Рассмотрим два винильных водорода — назовем один
из них А, а другой В. Взаимодействие между А и В (обозначим его величину Jab)
должно привести к четырем линиям, показанным в верхней части рис. 6-4 (см. так-
же разд. 2-6,Б и 2-6,В). Взаимодействие между каждым из винильных водородов
и водородами метильнойгруппы (С) должно далее расщепить резонансные сигналы
винильных водородов в квартете распределением интенсивностей ! : 3 ; 3; : 1
см. рис. 2-17). Расстояние между линиями в квартетах, связанных с одним виниль-
* Термином фенил обозначают замещающую группу СвНа, образованную из
бензола С0Нв.
180
ГЛАВА 6
Рис. 6-4. Характер с пин-спи нов его расщепления, которое должны обнаружи-
вать ЯМР-сигналы двух винильных атомов водорода (обозначаемых А и В)
метилзвмещенного алкена типа
(В) н . сн, (С)
-C=G,
(А) Нх 'х
В верхней части рисунка величина константы взаимодействия между ванильными водоро-
дами Jдв предполагается большой по сравнению с константами взаимодействия каждого
из хгих водородных атомов с метильной группой (С), т. е ^^ВС или АС • ® ниж-
ней части рисунка Jдц предполагается равной JBC и в два раза большей, чем
ным водородом (Jac), будет отличаться от положений линий в квартете, соответ-
ствующем другому випильному водороду (7вс), если взаимодействие винильных
водородов с метилвными водородами неодинаково (JaC=Jbc)' Поскольку рас-
положение винильных водородов по отношению к метилу различно, на рис. 6-4
эти взаимодействия показаны неодинаковыми (JaCt^Jbc)-
Как можно видеть из рис. 6-4, следовало бы ожидать появления в спектре 16
резонансных линий, соответствующих винильяым протонам. Однако фактически
в спектре обнаруживается только I] линий (см. рис. 6-3). Он оказывается точно
таким, какого следовало бы ожидать при Jae=Jbc=2Jac=1.5 Гц. В нижней
части рис. 6-4 показано, каким образом это отнесение приводит к пяти совпадени-
ям линий в точном соответствии с наблюдаемым спектром, приведенным на рис.
8.0 6,0 4,0 2,0
0 м.д.
Рис. 6-5. ЯМР-спектры при 60 МГц относительно ТМС в качестве стандарта (О, О
м. д.); см. упражнение 6-5,
182
ГЛАВА 6
6-3. To, что Jдв оказывается равной /вс и в 2 раза больше /дс, в рамках совре-
менной теории спин-сп ивового расщепления должно рассматриваться как случай-
ность.
Упражнение 6-4. а) Покажите, каким образом соотношение jдв=^ВС=2/дс
позволяет предсказать наличие четырех расположенных на одинаковом расстоя-
нии и обладающих одной и той же интенсивностью линий в ЯМР-спектре 1-метил-
1-фенилэтилена.
б) Как выглядело бы расщепление винильного и метильного протонов в случае
3 3
/ав=^ас— /вс? В случае /ав=—/дс=у/вс? Объясните.
Упражнение 6-5. Определите структуры соединений, ЯМР-спёктры которых
приведены на рис. 6-5. Проведите анализ этих спектров (с такой степенью детали-
зации, какая окажется возможной) в рамках представлений о химических сдвигах
и спин-спиновом расщеплении.
6-4. Строение этилена
Как шаростержневая модель этилена, так и о, л-модель, по-
строенная с помощью атомных орбиталей (разд. 5-5; Б и рис. 6-6),
предполагают расположение всех шести атомов (двух атомов угле-
рода и четырех атомов водорода) в одной плоскости.
Наиболее точные физические измерения геометрии этилена
подтверждают это предположение. Однако углы Н—С—Н в этилене
(II), определенные методом электронографии, составляют 116,7°
в отличие от угла 109,5й, соответствующего шаростержневой моде-
ли, и угла 120°, следующего из модели, построенной с помощью
атомных орбиталей.
Н -- Н
II
Следует напомнить (разд. 1-4), что вращение вокруг простой
углерод-углеродной связи в этане практически не затруднено.
В противоположность этому шаростержневая модель этилена за-
ставляет предположить, что вращение вокруг двойной связи может
осуществляться только путем разрыва связи «наполовину» с прсле-
дуюгцим вращением двух частей молекулы вокруг оставшейся про-
стой связи. Описание двойной связи в терминах атомных орбиталей
приводит к. такому же выводу (разд: 5-5,Б).
С И —-г С Н , *
СНг-9гСНг
АЛКЕНЫ. СТРУКТУРА, СПЕКТРЫ И СТЕРЕОИЗОМЕРИЯ
183
Энергия, требующаяся для осуществления вращения, должна
быть ориентировочно равна разности энергий двойной и простой
углерод-углеродных связей, т. е. 63 ккал/моль (см. табл. 3-5).
Такое количество энергии не может быть получено за счет столк-
новения молекул при обычных температурах, и не удивительно
поэтому, что вращения вокруг двойной связи в этилене или другом
алкене в этих условиях не происходит.
6-5.’ цис—транс-Изомерия
Вследствие особых геометрических свойств двойной связи угле-
род — углерод и затрудненного вращения вокруг этой связи при
соответствующем характере замещения алкенов возникает возмож-
ность геометрической изомерии, сходной с той, которая была опи-
сана выше для цнклоалкаиов (разд. 4-7). Например, бутен-2 может
существовать в qwc-форме, где метильные группы находятся по
одну сторону .двойной связи, и в игранс-форме, где метильные груп-
пы расположены по разные стороны от двойной связи (рис. 6-7).
Эти две формы обычно вполне устойчивы, так как их взаимопре-
вращение по приведенной ниже схеме может осуществиться только
при сравнительно высокой температуре или при облучении светом
соответствующей длины волны, что будет рассмотрено в гл. 28.
ЦИС.:
вращение
/пране
184
ГЛАВА 6
Рис. 6-7. Шаростержневые модели цис- и транс-бутенов-2.
В целях большей ясности повторим определения некоторых стереохимических
терминов, введенных ранее. Изомерные вещества по определению имеют одну иду
же молекулярную формулу, но их изомерия может быть двух типов — структур-
ной изомерией и стереоизомерией. Структурные изомеры имеют различное строе-
ние в том смысле, что порядок связи между входящими в их состав атомами раз-
личен. Iак, бутен-1, бутён-2, цмилобутан и метилциклопропан являются структур-
ными изомерами
СН3СНаСН = СН2
бутен-I
СНаСН=СНСН3
бутен-2
НаС—СН4
I I
нас—сна
циклобутан
сн2
I >снсн„
сн/
метил цикло-
пропан
Стереоизомеры имеют одинаковый структурный остов, но различаются в от-
ношение пространственного расположения входящих в их состав групп, цис- и.
троя с-Из о меры бутена-2 стереоизомерны; они относятся к числу геометрических
изомеров, и пространственное расположение групп в этих соединениях называют
конфигурацией. Так, геометрический изомер бутена-2, в котором метильные
заместители расположены по разные стороны двойной связи, имеет транс-конфи-
гурацию.
При рассмотрении стереохимии этана (разд. 1-4) мы использовали не термин
конфигурация, а термин конформация. Конформацией целесообразнее называть
пространственное расположение, которое находится в динамическом равновесии
с другими пространственными расположениями (конформациями). Конформаци-
онный изомер по определению не представляет собой вещества, которое можно вы-
делить в индивидуальном виде при обычных условиях. Таким образом, различие
между конформационными и конфигурационными изомерами заключается в там,
что последние предполагаются устойчивыми и выделяемыми, тогда как для первых
эта не так.Прикбмнатной темпер ату ре з ато рможе и ные и з асло не н н ые конформа-
ции этана быстро превращаются друг в друга вследствие вращения вокруг связи
углерод — углерод; в противоположность этому цис- и трйнс-изо меры бутена-2 в
этих условиях стабильны. Очевидно, что возможно существование пограничных
случаев, когда провести различие между конформацией и конфигурацией будет
трудно, если не невозможно.
АЛКЕНЫ. СТРУКТУРА, СПЕКТРЫ И СТЕРЕОИЗОМЕРИЯ
185
Рис. 6-8. Взаимодействие между метильными
группами цис-сил-и-ди-трет-бутилэтилена
(2,2,5,5-тетрамети л-цис-гексена-3), приводя-
щее к отталкиванию^
опаливание между метильными
группами
I
сн,)[н,с
СН,^ / /\ \ /СН,
сн, С\ сн,
с == с
н н
С цис — транс-изомерией приходится встречаться очень часто.
Условно конфигурацию сложных алкенов считают соответствующей
конфигурации наиболее длинной цепи, включающей двойную связь.
Так, приведенное ниже соединение III представляет собой 3-метил-
4-этил-транс-гептен-З, несмотря на то что две идентичные группы
располагаются в цис-положении по отношению друг к другу, по-
тому что алкильные остатки при двойной связи занимают транс-
положение по отношению к наиболее длинной цепи, включающей
двойную связь.
СНЭ-СН2 СН3-СН3
Чс=с'/
^На ''сНа — СНа — СН3
3*ыетиЛ‘4‘5тил-траЛс-гептеН‘3 (П1)
«
mpawc-Изомеры простых алкенов обычно бывают более устой-
чивыми, чем соответствующие цис-изомеры. Метильные группы в
транс-бутене-2 отстоят значительно дальше друг от друга, чем в цис-
бутене-2. Масштабные модели, в которых отражён размер метильных
групп, позволяют обнаружить некоторое перекрывание между
метильными группами в цис-изомере. В цис-алкенах, содержащих
группы большого размера, между заместителями возникают весьма
значительные силы отталкивания (пространственные затруднения),
вследствие чего они гораздо менее устойчивы, чем соответствующие
транс-изомеры (рис. 6-8).
Упражнение 6-6. цис- и транс-Ал иены сппообны к взаимным превращениям
при нагревании их с иодом в жидкой или газовой фазе. Используя таблицу энер-
гий связей (табл. 3-5), оцените теоретически возможный механизм реакции такого
типа, протекающей через обратимое присоединение атома иода к одному из угле-
родных атомов двойной связи.
Упражнение 6-7. При каких обстоятельствах можно ожидать взаимного пре-
вращения цис-транс-изомеров иод действием электромагнитного излучения? Объ-
ясните.
Упражнение 6-8. транс-Алкены обычно бывай» более устойчивыми, чем ц«с-
алкены. Укажите один или несколько примеров ненасыщенных систем, для кото-
рых цис-форма должна была бы оказаться более устойчивой, и приведите сообра-
жения в подтверждение вашего выбора.
186
ГЛАВА б
Ю
cl ’*с - н
«9
т. С1
»э
транс
Л = 0
л:.
зЭ
циа
Р = 1,85Д
Рис. 6-9. Схематические изображения векторов моментов связей для цис- и транс- j
дихлорэтилена. В символе обозначающем диполь, стрелка направлена в сто- '
рону отрицательного конца.
6-6. Установление конфигурации J
цис- и транс-изомеров
Физические свойства цис- и транс-изомеров обычно очень сходны
(см. табл. 6-1), и выделение их из смеси с помощью таких методов,
как фракционная перегонка или кристаллизация, не всегда ока- ,[
зывается возможным; Обычно для разделения соединений, имеющих ';
физические свойства, близкие к свойствам цис- и транс-изомеров, •
приходится прибегать к хроматографическим методам (разд. 1-6,А). :
Данные, приведенные в табл. 6-1, показывают, что, за исключением 1
гексенов-3, температуры плавления цис-изомеров ниже, а темпера- J
туры кипения выше, чем у транс-изомеров; хотя обычно эти отличия !
невелики, они приносят некоторую пользу при установлении кон-Д'
фигурации цис- и транс-изомеров. -Более надежное решение, вопроса
обычно может быть достигнуто с помощью изучения дипольных
моментов, ЯМР- и ИК-спектров и характера химической, реакцион-
ной способности. ;
Например, ({ас-изомер салм-дихлорэтцлена имеет значительный ,
дипольный момент, тогда как для транс-изомера он практически i
равен нулю. Этого и следует ожидать, поскольку векторная сумма
диполей, образованных поляризованными связями углерод — га- ’
логен, в случае цис-йзомера не равна, а в случае транс-изомера 1
равна нулю (рис. 6-9). J
В целом, если для двух изомеров, согласно расчету, дипольные'^
моменты должны быть существенно различны, можно установить 1
правильную стереохимию каждого из изомеров; сравнивая экспери-
ментально найденный и вычисленный дипольные моменты. Дальней-
шее рассмотрение дипольных моментов приведено в разд. 6-7.
В случае дизамещенных этиленов типа (RHC=CHR') для раз- j
личения цис- и транс-конфигураций можно прибегнуть к помощи i
ИК-спектров. Для таких соединений в. спектре 'транс- изомер а *
появляется интенсивная полоса около 965 см-1,, тогда как в спектре
цис-изомера эта полоса отсутствует; К сожалению, 'установление
АЛКЕНЫ. СТРУКТУРА, СПЕКТРЫ И СТЕРЕОИЗОМЕРИЯ 187
таких корреляций невозможно в случае более высоко замещенных
двойных связей.
Спектры ЯМР 1,2-дизамещеиных этиленов также могут быть ис-
пользованы для того, чтобы различить цис- и транс-изомеры,
поскольку транс-винильные протоны взаимодействуют между со-
бой сильнее, чем ifнс-винильные протоны. Это взаимное влияние от-
ражается в большем значении константы взаимодействия (Jhh)
в случае транс-изомер а.
Н НН
ЧС=(/
/„„all—18 Гн ЦО4. J-ttt=6—14 Гц
Г1Г1 Г1Г1
Характерным примером могут служить цис- и транс-коричные
кислоты
Н СО^Н
сХ "н
коричная кислота
= 15,8 Гц
НН
цас-коричная кислота
•Jousl2,3 Гц
НН
Предпринимались попытки установления корреляций между
константой взаимодействия и конфигурацией в циклических си-
стемах и для более высоко замещенных этиленов, но до настоя-
щего времени сколько-нибудь удовлетворительных корреляций
не получено. Так, относительные, величины взаимодействий
между метильными и винильными протонами в системах приведен-
ного ниже типа имеют настолько несистематический характер, что
их нельзя использовать для установления того, какой из изомеров
представляет собой цис-, а какой — транс-форму.
Н
снв н
'с-/
транс
До сих пор упоминались только физические методы определе-
ния конфигураций. Существует также ряд химических методов,
которые оказываются более или менее полезными в зависимости от
исследуемой системы. Иногда уже сам метод получения стереоизо-
мера может служить указанием на его конфигурацию. Это особен-
но верно для. тех случаев, когда образуется только один изомер и
известен механизм реакции, в частности ее стереохимия.
Наиболее надежный химический метод установления конфигу-
рации заключается в реакциях, приводящих к замыканию пяти- или
188
ГЛАВА 6
шестичленных циклов. Как правило, ip/с-изомеры вступают в ре-
акцию замыкания цикла гораздо более энергично, чем соответствую-
щие транс-изомеры, поскольку невозможно получить пяти- и
шестичленные циклические соединения, содержащие в кольце
транс-двойную связь. Это различие в поведении хорошо иллюстри-
руется на примере малеиновой кислоты, которая содержит цис-
малеиновая кислота
малеиновый
ангидрид
фумаровая кислота
фумаровый ангидр
(не известен)
двойную связь и при нагревании до 150°С теряет воду, образуя малеи-
новый ангидрид. Соответствующий транс-изомер — фумаровая кис-
лота — не дает ангидрида при 150°С, и, более того, фумаровый ан-
гидрид, в котором должна была бы иметься транс-двойная связь,
входящая в состав пятичленного цикла, никогда не был получен.
Совершенно очевидно, Что из этих двух соединений малеиновая
кислота имеет цас-конфигурацию, а фумаровая кислота —• транс-
конфигурацию.
6-7. Определение дипольных моментов
Если молекулу поместить в электрическое поле, например между
противоположно заряженными пластинами конденсатора, то она
немедленно поляризуется в результате сдвига ее электронов и (в
гораздо меньшей степени) ядер под действием приложенного поля.
Этот эффект носит название индуцированной молекулярной поля-
ризации, и в единицах электрического поля ее среднее значение
обозначается а.
Если молекула, как, например, НС1, и в отсутствие приложен-
ного поля имеет несимметричное распределение зарядов то, помимо
того, что в ней происходит индуцированная молекулярная поля-
ризация, она будет стремиться повернуться под действием поля та-
ким образом, чтобы ее положительный конец был направлен к
отрицательно заряженной пластине, а отрицательный конец — к
положительно заряженной. Такому расположению будет, разуме-
ется, противодействовать тепловое возбуждение, так что можно
ожидать понижения степени упорядоченности молекул при повы-
шений температуры. Если принять дипольный момент (р) в качестве
меры несимметричности распределения заряда в молекуле, то сред-
няя молекулярная дипольная поляризация будет определяться как
величина упорядоченности, приходящаяся на единицу поля pa/3feT,
АЛКЕНЫ. СТРУКТУРА. СПЕКТРЫ И СТЕРЕОИЗОМЕРИЯ
189
где k— константа Больцмана и Т — абсолютная температура.
Общая поляризация в расчете на молекулу, производимая еди-
ницей поля, представляет собой сумму индуцированной и диполь-
ной поляризаций (а+р^/З&Т’). Отсюда следует, что в случае моля
вещества общая молярная поляризация Р может рассматриваться
как сумма двух членов: индуцированной молярной поляризации
Ра и дипольной молярной поляризации Рц, как это представлено в
уравнении (6-1), где AZ — число Авогадро.
= (6-1)
• \ \ Q / ОпС-1
Для определения дипольного момента газообразного или жидко-
го вещества измеряют его диэлектрическую проницаемость g, кото-
рая связана с молярной поляризацией Р уравнением (6-2), где М —
молекулярная масса, d — плотность вещества.
Р = (6-2)
После того как найдено Р, необходимо определить Рц отдельно
от Ра. Это может быть сделано несколькими способами. Например,
можно измерить Р как функцию температуры и затем отделить
друг от друга не зависящую от температуры составляющую Ра и
зависящую от температуры часть Р^. Величина Р может быть опре-
делена также в переменном электрическом поле как функция ча-
стоты изменения <о. По мере увеличения и> частота изменения поля
становится настолько большой, что у молекул не хватает времени
на то, чтобы начать принимать направление по полю до того мо-
мента, как это направление изменится. При этом снижается до
нуля и Р=Ра. В том случае, когда Р,д равно нулю, для оценки Р
удобно использовать в качестве быстро изменяющегося поля элект-
рический вектор светового луча. Согласно уравнению Максвелла,
е=п\ где п — показатель преломлениями можно определить ве-
личину (молярную рефракцию) как
„2-1-2 d *
Итак, если Ра оказывается связанным с RM, то нам нужно лишь
измерить показатель преломления, плотность и диэлектрическую
проницаемость для того, чтобы получить значение
Дипольные моменты часто определяют для веществ, растворен-
ных в неполярных растворителях (например, в бензоле). В этих
условиях молярная поляризация раствора оказывается суммой
вкладов, вносимых в поляризацию растворителем и растворенным
веществом [уравнение (6-3)]
Др.ра = }-р~ляРр-ля 4"/раст. в-ва-Ррает. в-ва, (6-3)
190
ГЛАВА 6
где /р.ля я ?раст, в-ва означают соответственно мольные доли раст-
ворителя и растворенного вещества. Поляризацию растворителя
определяют отдельно для чистого растворителя; тогда Рраст. в-ва
может быть вычислена из Рр.!)а и мольных долей с помощью урав-
нения (6-3). Найдено, что Р руст. в-ва ВО МНОГИХ Случаях СущвСТ-
венно изменяется в зависимости от концентрации раствора. Для
того чтобы избежать влияния молекулярной ассоциации на диполь-
ный момент, необходимо измерить Ррает. в.ва как функцию концент-
рации и использовать значение Рраст. в-ва, полученное путем экстра-
поляции к бесконечному разбавлению.
Упразднение 6-9. Вычислите ц (в единицах Дебая) для циклопропилцианида
(CH.j2CHCN, использовав (поляризация растворенного вещества при беско-
печном разбавлении), вычисленную из приведенных ниже значений Рраст. в-ва в
бензольном растворе при различных концентрациях, пц = 1,4188 и diB=0,8908
для циклопропилцианида как чистой жидкости.
Траста, в-ва*
CIH1CN. моли CJU1
0,0060 303,1
0,0129 295,0
0,0202 285,5
0,0278 278,8
0,0371 268,2
Если k = 1,380* !0“,в эрг* град _1* мин-1, то р выражается в Кл-см;
10-13 Кл-см равны одной единице Дебая (Д).
Вычислите в для раствора, содержащего 0,0202 М растворенного вещества,
зная, что Рбензоиа=26,636 см3 и плотность раствора равна 0,8741 г/см3. Объясни-
те, почему, в то время как R^ сравнительно нечувствительна к концентрации, Р
обычно оказывается настолько чувствительной к ней, что может быть применена
для вычисления р. только при экстраполяции к бесконечному разбавлению? Учи-
тывая определение а, данное в разд. 6-7, и приняв, что s=n2 для электрических
полей, меняющихся с частотой света, правильно ли считать Rm точно равной РгР
Если это не так, то каким членом уравнения, по вашему мнению, пренебрегают,
приравнивая Ра к R^'f
Дипольные моменты оказываются очень полезными при ориентировочном ус-
тановлении структуры органических соединений. Располагая таблицей моментов
связей (типа табл. 6-2) и сформулировав представление о геометрии молекулы,
можно путем векторного сложения моментов связей провести сравнение экспери-
ментально определенных моментов с вычисленными. Эта процедура (а также од-
но из возникающих осложнений) может быть проиллюстрирована на примере вы-
числения дипольного момента СН2С1а, где (в предположении, что Нее валентные
углы связей равны 109,5s) должны быть сложены следующие векторы;
АЛКЕНЫ. СТРУКТУРА, СПЕКТРЫ И СТЕРЕОИЗОМЕРИЯ J91
Таблица 6-2
Приближенные значения дипольных моментов связей с углеродом
Связь
Дипольный момент,
да
Связь
Дипольный момент.
Д а
*с—с
с—н«
С—N
C = N
C = N
С-0
0,0
0,4
и
1,5
4,0
1.5
3,2
2,3В
2,2 в
2,3 в
2,2 в
4 Основано главным образом на моментах этильных производных в растворе.
, б Углерод рассматривается как положительный, а водород — как отрицательный.
в Для винил галогенидов момент связи обычно на 0.7—0,3 Д меньше.
В результате получим [2- 2,2 cos (109,5°/2)—2-0,4 cos (109,5°/2)]=2,1 Д, тогда как
экспериментальное значение равно 1,6 Д. Совпадение оказывается не очень хоро-
шим, но было бы трудно ожидать, что моменты связей останутся неизменными в
том случае, когда с одним углеродным атомом соедннены две сильные электроот-
рицательные группы. Трудности должны также возникать при определении мо-
ментов связей в ненасыщенных молекулах вследствие важной роли, которую игра-
ют электронные взаимодействия между замещающей группой и двойной связью,
как это будет показано позднее. Дипольные моменты могут быть также использо-
ваны при определении степени полярности связи .Для этой цели сравнивают экспе-
риментально найденный дипольный момент с дипольным моментом, вычисленным
в предположении о полностью ионном характере связи, но при том же межатом-
ном расстоянии. Так, дипольный момент НО равен 1,03 Д, а длина связи равна
1,28 А; заряд электрона равен 4,80- 10“Я0 Кл. Таким образом, дипольный момент
должен быть равен 4,8- Ю-’0-1,28- Ю-0 &л-см=6,15Д в случае, если связь полно-
стью ионная. Степень ионности связи оказывается равной (1,03/6,15)- 100=17%.
Такого рода величины, хотя они и приносят пользу при сравнении, являются, ко-
нечно совершенно ненадежными, поскольку при их выведении делается допущение,
согласно которому центры тяжести электронных зарядов совпадают с атомными
ядрами, иначе говоря, что атомы, образующие связь, не вызывают взаимной поля-
ризации электронов.-
Упражнение 6-10, Используя данные табл. 6-2, определите величины дипольных
моментов CHjCl, С(3«, СН3СНаС|, СН2=СС1г, цис- и транс- !-хлор-2-иодэтилена и
цис-1,2-дихлорциклопропана. Укажите, из каких предположений относительно
геометрии молекулы вы исходите.
Упражнение 6-11, Дипольный момент 1,2-дихлорэтана при комнатной темпера-
туре равен 1,12 Д. Покажите, как можно использовать это значение для вычисле-
ния соотношения возможных конформаций (см. схему в разд, 2-6, Е).
Упражнение 6-12. Используйте молекулярные модели для ответа на вопрос,
может ли изучение дипольных моментов помочь в решении следующей проблемы:
в каком из изомеров 1,2-дихлорциклогексана атомы хлора расположены в цис-
положенин один относительно другого н в каком — в тр анс-поло жени и (обрати-
тесь к разд. 4-4,А и 4-7).
192
ГЛАВА 6
Дополнительные упражнения
6-13. Напишите структурные формулы для приведенных ниже соединений:
а) Для 13 изомеров гексана; назовите каждое нз них как производное этилена
й по системе ШРЛС. Покажите, использовав соответствующие формулы, какие
изомеры могут существовать в цис- и транс-формах, и правильна классифицируй-
те их.
б) Для полностью /пронс-i,18-ди-(2,6,б-триметилциклогексен-ЬилрЗ,?,!!,
15-тетраметилоктадеканонаенов-1,3,5,7,9,11,13,15,17 (СюНм).
6-14. Рассчитайте, основываясь на данных табл. 4-2 и любых других энергиях свя-
зей, минимальную тепловую энергию, необходимую для того, чтобы разорвать
одну из углерод-углеродных связей кольца и сделать возможным взаимопревра-
щение цис- и транс-1,2-диметилциклобутанов (см. разд. 4-5—4-")
ГЛАВА
АЛКЕНЫ.
РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-
УГЛЕРОДНЫХ СВЯЗЕЙ
; Двойные связи углерод — углерод вступают в разнообразные ре-
акции присоединения, при которых двойная связь разрывается ^на-
половину» и образуются две новые связи с углеродными атомами.
Важность таких реакций для синтетической органической химии
трудно переоценить.
Некоторые из реакций присоединения по двойной связи протекают
с промежуточным образованием свободных радикалов, в то время как
при других реакциях образуются промеж уточные соединения ионного
характера. Для некоторых реагентов присоединение приводит к
образованию обеих новых связей только по одну сторону разрываю-
щейся двойной связи (цис-присоединение), тогда как в случае других
реагентов одна из новых связей образуется по одну сторону двойной
связи, а другая — с противоположной стороны (транс-присоедине-
ние).
В настоящей главе будут рассмотрены факторы, управляющие
присоединением по двойным связям. Принципы, с которыми мы
при этом познакомимся, окажутся полезными для понимания боль-
шого числа реакций других типов. .Наиболее важно составить себе
четкое представление об условиях, при которых происходит присо-
единение по двойной связи. Это окажется особенно полезным при вы-
боре условий синтеза, в которых по желанию экспериментатора
можно будет либо осуществить присоединение, либо избежать его.
В данную главу включен также раздел, посвященный рассмот-
рению некоторых вопросов, возникающих при планировании наиболее
целесообразных путей синтеза органических соединений. Эта глава-
не содержит описания методов получения .алкенов. Важнейшие
1 № 1640
194
ГЛАВА 7
препаративные реакции получения этих соединений включены в
предметный указатель; соответствующие синтетические методы
рассматриваются в последующих главах.
7-1. Присоединение к алкенам.
Электрофильные и нуклеофильные
реагенты
Наиболее характерными реакциями алкенов являются реакции
присоединения, при которых двойная связь разрывается «наполо-
вину» и две новые группы присоединяются, образуя насыщенные
соединения
НН нн
C=Z 4-Х 4-Х —* н-с-с-н
/ н х х
Такого рода реакции, при которых происходит разрыв углерод-
углеродных связей, осуществляются с трудом в случае насыщенных
алканов; это не удивительно, если учесть различия в энергиях
связей, В соответствии с энергиями связей (табл, 3-5) разрыв угле-
род-углеродной двойной связи «наполовину» требует G3 ккал/тогда
как для разрыва простой углерод-углеродной связи необходимо
83 ккал. Таким образом, реакции присоединения к двойным связям
на 20 ккал более экзотермичны, чем соответствующие реакции раз-
рыва простых углерод-углеродных связей.
СНп— СНа-/Вга —> СН3—СН3 Д/7 = —27 ккал
'II
Вг Вг
СН3—СН34-Вг2 —s- 2СН3Вг Д77 = —7 ккал
Реакционная способность алкенов превосходит реакционную
способность алканов вследствие того, что электроны двойной связи
углерод — углерод можно считать более «доступными» (в смысле
большей уязвимости для атаки реагентов извне), чем электроны
простой связи углерод — углерод. Это особенно хорошо видно на
моделях этилена, построенных с помощью атомных орбиталей (разд,
5-5,Б). Электроны, образующие связи между двумя ненасыщен-
ными углеродами, «выталкиваются наружу» вследствие их взаим-
ного отталкивания. Таким образом, они в целом оказываются зна-
чительно более удаленными от оси связи, чем электроны простой
связи (рис. 7-1). При этом можно ожидать, что реагенты, действие
которых при химических реакциях сопровождается принятием элек-
тронов (электрофильные — «электролюбы»), окажутся наиболее
подходящими для инициирования реакций двойных связей. Это
в действительности так; с другой стороны, реагенты, обладающие
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 195
Область высокой элект-
ронной плотности
Др о с тол связь
относительно более диффузная
область высокой электронной
плотности
Двойная связь
-Рис. 7-1. Схематическое изображение среднего положения электронов в углерод-
углеродных простой и двойной связях.
электронодонорными свойствами (нуклеофильные— «ядролюбы»),
чрезвычайно мало подходят для того, чтобы начать реакцию с двой-
ной связью углерод — углерод, если только при fiefi не находятся
заместители, обладающие ярко выраженными электроноакцеп-
торными свойствами. Из всего сказанного следует, что если при
проведении реакции с сооединениём, содержащим двойные связи,
желательно избежать присоединения по двойной связи, присутст-
вие сильных электрофильных агентов должно быть исключено.
Упражнение 7-1. Учитывая, что ОН® имеет тенденцию взаимодействовать
с электрофильными агентами, Тогда как Н® склонен реагировать с нуклеофильны-
ми агентами, классифицируйте приведенные ниже соединения либо как силь-
ные (или слабые) электрофилы (соответственно нуклеофилы), либо как вещества,
нё обладающие Свойствами ни тех, ни других. Приведите ваши соображения.
a) HeSOd Д) Вгв и) NaNHa
б) NH3 е) СН4 к) А1С1В
в)' NaCI ж) HBF4 л) (СН2)Э
г) Н2О з) SO3 м) AgBF4
7-2. Гидрирование алкенов.
Гетерогенный катализ
Реакция водорода с этиленом обладает значительной экзотер-
мичностыо
СНа=СНа-|-Нг —ь СН3-СН, Дн = —30 ккал (вычисленное: значение)
&1Г=—32,8 ккал (экспериментальное, siia-
. ..... : • ( некие):.
Однако смесь водорода с этиленом вполне -устойчива при темпе-
ратурах вплоть до '200 °C (в стеклянных сосудах). В определенных
условиях термическое или фотохимическое гидрирование этилена
может протекать с имеющей практическое значение скоростью по
свободнорадикальному механизму, сходному с механизмом хлори-
396
ГЛАВА 7
рования насыщенных алканов (разд, 3-7,В), Однако такой свобод-
норадикальный цепной механизм оказывается энергетически
невыгодным (см. упражнение 7-2). В то же время этилен быстро
реагирует с водородом при низких температурах и давлении в при-
сутствии ряда металлов, таких, как никель, платина и палладий;
при этом достигается полное превращение. Такие реакции являют-
ся примером гетерогенного катализа, или катализа на поверхности.
Механизм гетерогенных реакций еще очень далек от выяснения,
однако о каталитическом гидрировании этилена получены некото-
рые интересные и полезные сведения.
Упражнение 7-2. Рассмотрите возможность осуществления гидрирования
этилена в газовой фазе при 25°C по свободнорадикальному цепному механизму,
включающему следующие стадии развития цепи:
CH3-CHa--f-Ha —> СНЯ—сн3 + н.
СНг = СНа4-Н- —+ снвсн2.
Рассмотрим характер связей в кристалле никеля (рис. 7-2).
Атомы цикеля, расположенные на поверхности, связаны с другими
атомами, находящимися внутри кристалла, но их валентности,
направленные из глубины кристалла наружу, насыщены не пол-
костью. Можно ожидать, что атомы, расположенные на поверхности,
окажутся в состоянии вступать в контакт с различного типа соеди-
нениями, образуя поверхностный слой, в котором их валентности
будут насыщены. Экспериментально было показано, что этилен вза-
имодействует с поверхностью никеля экзотермично (приблизитель-
но —60 ккал/моль) и обратимо. Хотя структура комплекса этилен —
никель неизвестна, в образовании связи с никелем должны участво-
вать электроны двойной связи, поскольку насыщенный углеводород,
например этан, не проявляет тенденции к взаимодействию с поверх-
ностью никеля. На рис. 7-3 приведена возможная структура такого
комплекса, в котором пунктирные линии означают частичные (пар-
циальные) связи; образование полной связи углерод — никель не
предполагается, а реакционноспособная «половина» двойной связи
является ослабленной, но, по-видимому, полностью не разорванной,
некомпенсированные валентности
Рис. 7-2. Схематическое изображение
кристалла никеля.
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 197
Рис. 7-3. Образование комплекса меж-
ду этиленом и поверхностью никеля.
. Водород также образует комплекс с поверхностью никеля; Д77
этой реакции равна —30 ккал. Связи водород—водород, присут-
ствующие в комплексе водород — никель, должны быть очень силь-
но ослабленными и, следовательно, способными легко разрываться;
так, показано, что газообразный водород н дейтерий быстро дости-
гают равновесия над поверхностью никеля
. ' NI
H2-}-Da 2Н—D
Если связь Н—Н ослаблена вследствие координации с никелем,
то гидрирование этилена можно представить себе как близкое к одно-
временному присоединение двух атомов водорода к двум углеродным
атомам в комплексе никель — этилен (рис. 7-4). Реакция осущест-
вляется вследствие того, что этан, как упоминалось выше, не об-
ладает сродством к поверхности никеля и десорбируется с нее.
Освободившиеся- места на поверхности занимаются далее новыми
молекулами этилена и водорода.
Как и следовало ожидать из постулированного выше механизма,
расположение атомов металла в кристаллической решетке чрезвы-
чайно важно для определения скоростей гидрирования. Некоторые
Из кристаллических граней кристалла металла, обладающие опти-
мальным расположением атомов, значительно более эффективны
при каталитической реакции гидрирования, чем другие грани с
иным расположением. Такой механизм согласуется с тем фактом,
Рис. 7-4. Схема, поясняющая
гидрирование, этилена на по-
верхности кристалла никеля.
198
ГЛАВА 7
что водород обычно присоединяется к алкену, образуя цис-иродук-: ,1
ты. Например, 1,2-диметилциклогексен восстанавливается в цис- ]
1,2-диметилциклогексан _ ' ' ।
1,2-дамепищиклогексен W -1,2-даметилцикло- tI
i, гексан : J
Для достижения максимума каталитического действия металл 1;
обычно приготавливают в высокодисперснбм состоянии. В случае j.
платины и палладия это достигается путем*восстановления окислов 'I
металлов водородом перед проведением гидрирования алкена. л
Особенно активную форму никеля (никель Ренея) получают из
сплава никель— алюминий; алюминий растворяют, действуя ед-
ким натром, и никель остается в виде черного пирофорного порошка ч
2Ni-A14-2OHG+2HaO —2Ni+2A10®+3Ha '!
> " л
Высокоактивные платиновые, палладиевые и никелевые катализа- i
торы могут быть также получены при восстановлении солей метал-
лов боргидридом натрия. )
Каталитическое гидрирование оказывается полезным не только ;
для синтеза, но и для целей аналитического и термохимического \
исследования. Анализ числа двойных связей в соединении проводит- *
ся путем измерения количества водорода, поглощенного навеской !,
образца, Использование гидрирования в термохимии основано на том
факте, что количество тепла, выделяющееся при гидрировании
алкенов, является удобной мерой относительной устойчивости ал- 1
кенов.
7-3. Теплоты гидрирования
Экспериментально полученные значения Д/7 гидрирования для
ряда алкенов приведены в табл. 7-1. Величина ДЯ, вычисленная из
энергий связей, равна ^30 ккал/моль. Разность между эксперимен-
тальными значениями и рассчитанной величиной ДЯ отражает
влияние структуры на прочность двойных связей. Можно сделать
два важных обобщения: во-первых,' чем больше степень замещения
при двойной связи, тем. меньше выделяется тепла, и, во-вторых,
выделение тепла в случае транс-изомеров 1,2-диз вмещенных. эти-
ленов меньше, чем в случае tjuc-изомеров. В той мере, в какой можно
коррелировать ДЯ с константой равновесия, эти результаты указы-
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 199
Таблица 7-1
Теплоты гидрирования газообразных алкенов (82 °C, 1 ат)
Алкен
Формула
— ДН,
ккал/моль
Этилен *
Пропен
Вутен-1
Пеп'тон-1
гд№-Бутен-2
транс-Бутен-Й. .
*
Три мети л эти лен
Тетрамети лэтилен
1{ис-Пеитен-2
/ир«яс-Пентед-2
цис-сим м -Цх-трет-
бутилэтилен
щрацс-сим.^-Цп-
Ирйн-бутплэти-
лен
СН3 = СН2
СН3СН = СНг
СНаСЩСН=СН.,
СН3СНаСНгСН=СНэ
СН3, /СНз
\р = с/
н/
(СНЭ)2С=СНСН3
(СН3)4С=С(СНа)а
СН3. /СНвСНц
32,8
30,1
30,3
39,1
28,6
27,6
26,9
26,6
28,6
27,6
36,2а
26,9
3
а В уксуснокислом растворе при 25 °C.
вают на то, что замещений на алкильные группы делает двойные
связи более стабильными и что транс-изомеры более устойчивы,
чем фто-изомеры (см. также разд. 6-5).
Упражнение 7-3, Вычислите АЯ для изомеризации цис-симм-лп-трет-йусил-
этй.тена в трико -изомер в уксуснокислом растворе. Положительное или отрица-
тельное. значение будет иметь AS (см. разд. 3-7,Б) для этой реакции изомери-
зации? Объясните.
V
200
ГЛАВА 7
7-4. Электрофильное присоединение
к алкенам
Такие реагенты, как галогены (С12, Вгг, 15), галогеноводороды
(НС) и НВг), хлорноватистая и бромноватистая кислоты, вода и
серная кислота, присоединяются к двойным связям алкенов, об-
разуя насыщенные соединения.
I (
Вг Вг
HOCI | I
----->--С-С-
ci сж
HaSO. J J
Г|“
Н OSOaH
НС1 I |
hso, н® | |
------> — С—С —
Н Ан
ч Механизмы этих реакций во многом сходны: они служили пред-
метом многочисленных исследований, посвященных установлению
причин такой общности. Эти реакции имеют также большое синте-
тическое и аналитическое значение. Присоединение воды к алкенам
(гидратация) особенно важно для получения ряда спиртов, имеющих
промышленное значение. Так, этиловый и mpem-бутиловый спирты
синтезируются в очень большом масштабе посредством гидратации
соответствующих алкенов (этилена и изобутилена) в присутствии
серной или фосфорной кислоты как катализатора.
СНа = СН3 СН3СН2ОН
240 °C Этиловый спирт
НгО, 10%-ная Н,ЯО1 CHS. /СН3
сн/ 25 Ю СН/ ^он
тргт-бутиловый спврт
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 201
А. Стадийный полярный механизм
В настоящем разделе особое внимание уделено реакции присое-
динения брома к алкенам. Эта реакция легко выполняется в лабо-
раторных условиях и иллюстрирует ряд важных особенностей, реак-
ций присоединения. Отличительные черты реакции бромирования
могут быть поняты наилучшим образом при рассмотрении ее меха-
низма. Весьма существенным с точки зрения изучения механизма
реакции является тот факт, что присоединение брома (а также дру-
гих реагентов, приведенных выше) происходит в темноте и в присут-
ствии ловушек свободных радикалов. Эти данные свидетельствуют
против свободнорадикального цепного механизма, аналогичного
тому, который осуществляется при галогенировании алканов. Это,
однако, ничего не говорит о том, что свободнорадикальные реакции
присоединения не могут осуществляться в других условиях. Действи-
тельно, „известны инициируемые светом и ингибируемые ловушками
свободных радикалов реакции алкенов с бромом и бромистым водо-
родом, которые будут рассмотрены ниже.
Альтернативой свободнорадикальной цепной реакции является
ионная, или полярная, реакция, в ходе которой электронные пары
разрываются гетеролитическим способом, чем она резко отличается
от обсужденного выше свободнорадикального, или гомолитического,
процесса.
X !: Y --------ь- X® 4- :Y® гетеролитическнй разрыв связи
Х -5- Y -------> X- + -У гомолитический разрыв связи
Большинство полярных реакций присоединения не должно пред-
ставлять собой простых одностадийных четырехцентровых процессов
по следующим двум наиболее важным причинам:
Во-первых, такой механизм требует, чтобы образование новых
связей происходило с одной и той же стороны двойной связи и при-
водило, таким образом, к ^ис-присоединению (рис. 7-5). Однако
имеются многочисленные данные, указывающие на то, что бром и
многие другие реагенты присоединяются по транс-чниу (рис. 7-6).
Например, бром и хлорноватистая кислота, присоединяясь к цик-
логексену, дают шрпнс-1,2-дибромциклогексан и транс-2-хлорцик-
логексанол. Аналогичным образом бромистый водород присоеди-
няется к 1,2-диметилциклогексену, образуя транс- 1-бром-1,2-
диметилциклогексан *. Практически мало вероятно, чтобы такое
трпяс-присоединение происходило путем простой четырехцент-
ровой реакции между молекулой алкена и одной молекулой при-
соединяющегося вещества X—Y, поскольку, для того чтобы сде-
* Современные данные указывают на то, что для некоторых других типов ал-
кенов возможно i{ ис-присоединен не бромистого водорода и хлористого водорода.
Предстоит показать, насколько общим является такой путь реакции.
т
ГЛАВА. 7
Рис. 7*5. Схематическое изображение процесса цис-присоединения* реагента
X—Y к этилену по четырехцентровому механизму.
Рис. 7-6. Продукт транс-присоединения реагента X—Y к этилену.
лать возможным одновременное образование связей С—X и С—Y,
связь X—Y должна была бы удлиниться на недопустимо большое
расстояние.
,сн2-снг
Вт*г + С^Ь ..СИ.
хн=сн
,сн,-снг
ВТ />Нг
’С— ст
И Вг
Сф он н хнг
МОС1 + СНг ^.СН,
~н=сн
I I
СН5 Вг
Во-вторых, против четырехцентрового механизма свидетельст-
вует то, что реакция присоединения, проводимая в присутствии
реагентов, действие которых связано с предоставлением пары элект-
ронов (нуклеофильные реагенты^ разд. 7-1), часто приводит к обра-
зованию смесей продуктов. Так, присоединенне брома к алкену в
растворе в ’метиловом спирте, содержащем хлористый литий, дает
не только ожидаемый дибррмалкан, но также продукты, образую-
щиеся при Зтаке хлорид-ионов и растворителя. Такое участие нук-
леофильных агентов, действующих «извне», в образовании продук-
АЛКЕНЫ, РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ £03
тов реакции служит серьезным доводом против одностадийного ме-
ханизма.
ci© 1 л
-----.С-Cl +В.г®
Вг—С—
I
сн,он I
-----С—О—СН3 + Н —Вг
I
Вг—С—
На примере присоединения брома к этилену можно рассмотреть
в несколько упрощенном виде двухстадийный механизм, объясняю-
щий большинство приведенных выше фактов. Кривым стрелкам, ис-
пользуемым в последующем изложении, не следует придавать ре-
ального значения в смысле указания на конкретный механизм;
они должны • прежде всего показать, какие атомы следует рас-
сматривать как нуклеофильные (дающие электроны) и какие — как
электрофильные (принимающие электроны); Острия стрелок направ-
лены к атомам, которые принимают электроны.
• Н Вг • л
<74 1 ! ..О
НгС : : СНг + :Вг:Вг: -----► Н—С —С —Н + : В г : аяектрофильяая
" © ' ‘' атака (7-1)
- 0 I ।
: Br : t Н—С—С—Н
Д
Н Вг
I I
> Н—С —С —Н крювофильная
| I ашаи’б (7-2)
Br Н . '
/.2-ЭиЙраизто«
( зтилен&идрвмий)
Первая стадия (на которой происходит электрофильная атака
по двойной связи и гетеролитический разрыв как углерод-углерод-
ной связи, так и связи бром — бром) приводит к образованию бро-
мид-иона и катиона; в последнем положительный заряд располо-
жен на атоме углерода, как показано в уравнения (7-1). Катион,
в котором положительный заряд .находится на углеродном атоме,
обычно называют карбонйевым ионом. Подобно промежуточно об-
разующимся свободным радикалам (например, при галогенирова-
нии насыщенных углеводородов), обычно нельзя ожидать, что про-
межуточный карбониевый ион окажется устойчивым. В нем имеется
дефицит электронов, , и юн должен быть поэтому чрезвычайно реак-
ционноспособным по отношению к реагентам, которые могут предо-
ставить электронную пару для образования ковалентной связи.
£04
ГЛАВА 7
Вследствие этого на второй стадии, представленной уравнением
(7-2), карбониевый ион быстро взаимодействует с каким-либо до
ступным нуклеофилом (например, :Вг:®), образуя продукт реакции.
Очевидно, если в растворе присутствуют другие нуклеофилы
(например, :С1:®, СН3ОН), то они могут конкурировать с бромид-
ионом за образование связи с ионом карбония, как показано в урав-
нениях (7-3) и (7-4), и в результате этого образуется смесь продуктов.
_ Н Вг Н Вт
..О it 11
;С1; + Н-С-С-Н ---► Н-С-С-Н (7-3)
”. © I г । -
4— Н Cl И
И Вг • Н Вт „га Н Вг
„ ) ) II -Нчз i t
СН11О: + и—С-С — Н —W Н-С—С-Н > Н—С-С—Н (7-4)
Н СНЭ:О:Й СНЭ-(Ь н
®н
траяс-Присоединение перечисленных выше реагентов к двойной
связи объясняется тем, что на первой и второй стадиях атака про-
исходит :с разных сторон двойной связи.
Б. Почему именно транс-присоединение?
Представление о промежуточном карбон йеной ионе того тина, который изо-
бражен в уравнении (7-1),не дает ответа на вопрос о причинах тддас-присоедмне-
ния. Прежде всего не ясно, почему вокруг связи С—С в катионе—С—С®, получен-
ном из алкена с открытой цепью, не может происходить вращения, которое, если
оно осуществится, должно привести к полной потере стереоспецифичности. Далее,
построение модели карбониевого иона с использованием атомных орбиталей
(разд. 5-4) позволяет предположить, что атом углерода, несущий положительный
заряд, образуетзр3тибрид[1ые о-связн, причем все они должны лежать в одной
плоскости. Прн таком расположении связей отталкивание между электронными
парами минимально. Следовало бы ожидать, что в случае присоединения брома к
циклоалкенам бромид-ион окажется способным атаковатьплоскость, в которой
транс
лежит положительно заряженный углеродный атом, с двух сторон, вследствие
чего образуется смесь цас- и транс-продуктов. Однако фактически присоеди-
нение происходит целиком по транс-направ.ченкю.
АЛКЕНЫ, РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 205
Для объяснения стереоспецифичности присоединения брома к алкенам было
выдвинуто предположение об образовании циклического промежуточного соеди-
нения, в котором бром связан с обоими атомами углерода двойной связи'. Такой
«мостиковый» ион получил название бромониевого иона, поскольку бром в нем
формально несет положительный заряд.
.. ©
+ : Вт:
бромониевый ион
Атака бромид-нона или другого нуклеофила на атом углерода со стороны, проти-
воположной той, где расположена мостиковая группа, приводит к образованию
продукта траис-дрисоединения.
Аналогично'для объяснения троне-пр и соединен и я к алкенам кислот, напри-
мер НВг, Н3О®, Н2ЗО4 и т. д., может быть использовано представление о проме-
жуточных соединениях с водородным мостиком. Такие промежуточные соединения
иногда называют протониевыми ионами. Может показаться, что их образование
противоречит общему правилу, согласно которому водород дает только одну ста-
бильную связь..
НА
©
протониевый
ион
Следует подчеркнуть, однако, что связь между мостиковым водородом и двумя
углеродными атомами не должна рассматриваться как обычная ковалентная связь,
образованная парой электронов. Она отличается в том отношении, что одна элект-
ронная пара осуществляет в данном случае связь между гремя атомными центра-
ми вместо обычных двух. Протониевые ионы с такой структурой могут рассматри-
ваться как примеры «образования связи в электроне дефицитных системах»,
где число электронов недостаточно для того, чтобы все связи были нормальны-
ми, т. е. образованными парами электронов. За последние несколько лет было
подробно исследовано значительное число относительно устойчивых веществ,
где водород участвует в образовании электронодефицитных связей. Простейшим
примером служит ион нФ, который может быть представлен как комбинация про-
тона и атома водорода'(разд. 5-2). Этот ион сравнительно устойчив в Газовой фазе,
где он был открыт и изучен спектроскопически. Другим весьма ярким примером
является устойчивый диборан (В2Нв), для которого была доказана структура,
включающая водородные мостики. Связи, образуемые в диборане каждым на мос-
тиковых водородов, подобно связям с мостиковым водородом в алкен-про тон йе-
ной ионе, являются примером трехцентровой связи, образованной парой
206
ГЛАВА 7
электронов. Такой тип образования связи будет рассмотрен в разд. 31-J5.
Н „Н, ’ Н
^в'—---Tsz/
Н '*Н'’ И
диборан
Вопрос о наилучшем способе описания промежуточных соединений типа мос-
тиковых бромониевых, хлорониевых или протониевых систем в реакциях присое-
динения к алкенам все еще является предметом споров. Действительно, многие
другие реакций, при которых происходит образование карбонйевых ионов, не об-
ладают сколько-нибудь заметной стереоспецифичностью, и вследствие этого мос-
тиковые ионы не могут быть единственным способом описания. Следует также на-
помнить, что все ионы, находящиеся в растворе, даже если время их существова-
ния ничтожно мало, сильно сольватированы, и это само по себе может иметь важ-
ные стереохимические последствия. В дальнейшем обсуждении чаще всего будут
использоваться формулы карбониевых ионов, в которых заряд полностью локали-
зован па одном углеродном атоме, однако следует иметь в виду, что этот способ не
всегда оказывается самым точным, а также наиболее желательным способом изо-
бражения.
В. Комплексы электрофильных агентов
с двойными связями.
Существует еще один аспект полярного присоединения к алкенам, который
необходимо обсудить,-— образование электрофильными агентами неустойчивых
комплексов с л-электронами двойных связей алкенов до реакции присоединения.
Такого типа комплексы называют комплексами с переносом заряда или
«-комплексами. Образование комплекса циклогексена с иодом демонстрируется
тем фактом, что в циклогексене иод растворяется, образуя коричневый раствор,
тогда как его растворы в циклогексане окрашены в фиолетовый цвет. Коричневая
окраска раствора иода в циклогексене медленно ослабевает по меретого, как про-
исходит присоединение, причем получается транс-1,2-дииодциклогексан,
Для комплексов с переносом заряда невозможно написать точные структуры
Льюиса, и их обычно изображают следующим образом:
80С1
8®Н
80 Вг
6® Вт
80<рН
6® С1
Здесь стрелки означают, что электроны двойной связи взаимодействуют с элект-
рофилом. Такие комплексы, вероятно, образуются па первой стадии при получе-
нии продуктов присоединения путем серии превращений, приведенных выше для
случая присоединения брома.
снг
| +
СНг
сн2 бф 60 Q
—4» ||-—>Вг—Вг —>' Вг +
' снг
® СНг . СИ* ::
Т |е>
СЩ-Br сн2
СНг“Вг
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 207
Г. Анализ алкенов с помощью реакции
присоединения брома
Поскольку большинство у г лер од-углеродных двойных связей присоединяет
бром быстро и количественно, эта реакция часто используется для качественного
и количественного определения алкенов. Качественно на наличие ненасыщенных
связей указывает хорошо заметное исчезновение окраски брома при добавлении
раствора галогена в четырех хлор истом, углроде или уксусной кислоте к раствору
органического соединения в том же растворителе. Удобным методом количествен-
ного определения числа двойных связей может служить прямое титрование
алкена бромом', Этот метод, однако, несколько неудобен вследствие того, что бром
может улетучиваться из стандартных растворов, а также из-за агрессивного харак-
тера брома. Отличным видоизменением этого способа является использование стан-
дартного раствора бромата калия—бромида калия, из которого при подкислении
серной кислотой выделяется точно определенное количество брома. Алкен Сме-
шивается с б ром ид-броматным раствором и добавляется серная кислота. После
того как реакция дойдет до конца, добавляется избыток иодйстого калия и про-
водится обратное титрование выделившегося иода тиосульфатом. Этот метод
наиболее удобен для определения летучих алкенов.
ВгО©4-5Вт®+6Н® —ЗВг2-рЗНаО
Упражнение 7-4. Вычислите Д17 (газ) реакции присоединения к алкенам фтора,
хлора, брома и иода. Какой вывод можно сделать из этих Данных относительно
характера трудностей, с которыми связана практическое использование каждого
галогена при синтезе 1,2-дигало ген и да?,
Упражнение. 7-5. Используя энергии связей, оцените возможность присоеди-
нен ня галогена к этилену н газовой фазе по следующему свободнорадикальному
цепному механизму (при 25°С):
Х.+СН3 = СН2 —► Х-СН2—СН2-
X—СН2—СНа. + Хв -+ X—СН2—СНй—Х+Х.
Что можно сказать относительно инициирования цепи при реакции галогена с
двойной связью?
х2+сн2=сн2 -+ х-снв-сн2-+х-
Приведите ваши соображения.
Упражнение 7-6. а) Напишите механизм транс-п рисоед мнения хлорноватистой
кислоты (НОС!) к циклопентену. Сделайте это по возможности наиболее подробно.
б) Используя таблицу энергий связей, вычислите Д// для присоединения HOCI
к этилену, приводящего к СН3СН2ОС1 и СН2(ОН)СН2С1. Каким образом тот факт,
что НОС1 является слабой кислотой (Л"д=7-1О-10 в воде), затрудняет образова-
ние СН3СНаОС1?
Упражнение 7-7. Вычислите tsti для присоединения воды к этилену в газовой
фазе при 25 °C, Почему алкены не гидратируются в водных растворах едкого нат-
ра?
Упражнение 7-8. Известны оба изомера циклодецена — цис и транс. Одина-
ковые или различные продукты даст иродс-присоединение брома к каждому из
этих изомеров? Объясните. (Здесь особенно полезными окажутся шаростержне-
вые модели.)
208
ГЛАВА 7
7-5. Направление присоединения к алкенам
А. Правило Марковникова
Присоединение несимметрично построенных соединений типа
НХ к несимметричным алкенам теоретически может привести к
двум продуктам:
(СН8>4С=СНа+НХ —* (СН3)аС—СНа и (или) (СН3)3С—СНа
i А Д А
«
Одним из наиболее важных обобщений, сделанных в раннем периоде
развития органической химии, было правило Марковникова
(1870 г.), которое может быть сформулировано следующим образом:
присоединение НХ к несимметричной двойной связи происходит та-
ким образом, что водород от НХ направляется к тому атому углеро-
да, который, несет наибольшее число атомов водорода (к наиболее
гидрогенизированному углеродному атому). Так, правило Марков-
никова позволяет предсказать, что хлористый водород, присоеди-
няясь к пропилену, даст хлористый изопропил, а при присоедине-
нии к изобутилену — трет-бутилхлорид.
СН3-~СН = СН2Ч-НС1 —> СН3—СН-СН3
I
С1
(CH3)2C=CH2-pHCi —* (СН3)2С-СНЭ
С!
присоединение происходит в соответствии с правилом Марковникова
Это правило не' универсально, но тем не менее оно может исполь-
зоваться с успехом, если ограничить сферу его применения поляр-
ными реакциями присоединения к углеводородам, содержащим толь-
ко одну двойную связь.
Б. Теоретическое обоснование правила
Марковникова
Для лучшего понимания причин, обусловливающих действие
правила Марковникова, целесообразно будет еще раз обсудить не-
которые принципы, важные для предсказания направления органи-
ческой реакции. Рассмотрим присоединение бромистого водорода к
изобутилену. Пр в этой реакции промежуточно могут образоваться
два различных карбониевых иона в зависимости от того, к какому
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 209
углеродному атому двойной связи присоединится протон.
С\г/^я
C^GHj + Н®
СН3/СН3
Сн/^Ег
трет -бутил-катион
трет - бутилбромвд
СИ,
+ Н®
сн»
СН3 Н
СИ, СН1®
изобутил-капюи
СН3 Н
CBj СНгВг
изобугилбромид
Последующие реакции образовавшихся таким образом катионов с
бромидщоном приводят к тра/лг-бутилбромиду и пзобутилбромиду.
В обычных условиях проведения подобных реакций присоединения
продукт оказывается почти чистым /прет-бутил бромидом.
Можно ли предсказать, какой из продуктов окажется основным?
Прежде всего необходимо решить, на чем будет основываться это
предсказание: либо на решении вопроса о том, какой из продуктов
является брлее устойчивым, либо на том, какой из двух продуктов
будет образовываться быстрее. Если принять в качестве основного
фактора стабильность продуктов, то к рассмотрению придется при-
влечь значение Д//, энтропийные эффекты и т. д., определив таким
образом константу равновесия Д’ между исходными веществами и
каждым из продуктов. Когда отношение продуктов определяется
отношением их констант равновесия, то говорят, что суммарная
реакция подчиняется термодинамическому контролю (или контро-
лю равновесием). Так будет обстоять дело в том случае, когда пре-
вращение проводится в условиях, которые способствуют прртека-
нию обратной реакции в значительной степени (обратимости про-
цесса).
В том случае, когда условия проведения реакции делают ее не-
обратимой, отношение продуктов определяется относительными
скоростями образования различных продуктов. О таких реакциях
говорят, что они подчиняются кинетическому контролю. При пред-
сказании относительных скоростей реакций следует принять во вни-
мание пространственные препятствия, устойчивость возможных
промежуточных соединений и т. д. с той целью (независимо от того,
формулируется она таким образом или нет), чтобы определять отно-
сительные энергии активации Д/7* (разд. 3-7,Г).
Присоединение бромистого водорода к изобутилену в соответ-
ствии с правилом Марковникова должно приводить к шрещ-бутйл-
210
ГЛАВА 7
бромиду. Константа равновесия между mpem-бутилбромидом и
изобутилбромидом равна 4,5 при 25 °C.
(трете-бутилбромид]_ ^ к
“ "| изобутил бромид! “ ’ ’
Отсюда следует, что, поскольку в действительности присоединение
бромистого водорода к изобутилену приводит в соответствии с пра-
вилом Марковникова к образованию mpem-бутилбромида с 99%-
ным выходом; правило Марковникова, по-видимому, относится к
кинетическому контролю й, как можно предположить, утратит силу
в условиях, когда присоединение оказывается обратимым.
Учитывая то, что правило Марковникова при полярном присое-
динении бромистого водорода к изобутилену обусловлено кинети-
ческим контролем над отношением продуктов, целесообразно по-
пытаться объяснить направление присоединения, исходя из легко-
сти образования двух возможных промежуточных карбониевых ио-
нов
«СН8+Н®
медленно
быстро
-бутил * Кати он
(«Чс/И
_СНа/ "'''СИ® .
изобутил-катион
Существуют серьезные основания считать, что алкильные груп-
пы обладают большими электронодонорными свойствами, чем водо-
род. Это означает, что, чем больше алкильных групп находится при
положитолыю заряженном атоме, углеродакарбояиевого иона, тем
более стабнльпым будет .карбонмевый ион..и тем легче он буд§т’об-
разовываться. Причина этого заключается в частичной компенса-
ции электрон кого дефицита положител ьно заряженного углерод-
ного атома электронодо.нррными группами. Поэтому можно пред-
сказать, что трет-бутил-катион, в котором при положительном
центре находятся три алкильные группы (т. е. третичный карбоние-
вый ион), будет образовываться легче, чем изобутильный катион,
в котором при положительном центре находится одна алкильная
группа (первичный карбониевый ион).
Такая постановка вопроса сводит теоретическую проблему,
выдвинутую правилом Марковникова, к предсказанию того, какой
из двух возможных промежуточных карбониевых ионов будет об-
разовываться наиболее легко..В случае простых алкенов можно ожи-
дать следующего порядка легкости образования: третичный >• вто-
ричный > первичный.
Правило Марковникова в применении его к алкенам можно объяснить сле-
дующим образом: в никлических протониевых вонах (разд. 7-4,Б) протон должен
быть прочнее связан с углеродным атомом, при котором находится'меньшее число
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 211
алкильных групп. В этом случае положительный заряд должен быть в большей
степени сосредоточен ня более замещенном атоме углерода. Для изобутилена мос-
тиковая структура будет иметь вид
СН3
Атака нуклеофила, например бромид-иопа, воды и т, д, должна, разумеется, ока-
'заться преимущественно направленной на атом углерода, несущий больший по-
ложительный заряд, что приведет к продукту присоединения, соответствующему
правилу Марковникова.
Упражнение 7-9, Если оставить трет-бутплбромнд стоять при комнатной тем-
пературе в течение долгого времени, то ЯМР-спектр укажет па присутствие в нем
примеси йзобутилбромида. Напишите возможный механизм образования изобу-
тилбромида и рассчитайте количество в процентах изобутилбромпда, которое
должно содержаться в смеси при 25°С.
Упражнение 7-10. Расположите этилен, пропилен И изобутилен в порядке
возрастания легкости гидратации в водном растворе кислоты. Приведите ваши
соображения.
Упражнение 7-11. Зная, что при растворении I моля газообразного бромистого
водорода в воде выделяется 20 ккал, определите, в каких условиях присоединение
бромистого водорода к этилену будет энергетически более выгодным — в газовой
фазе или в водном растворе? (Примите, что теплоты растворения в воде этилена и
бромистого этила малы по сравнению с 20 ккал.)
В. Присоединение других реагентов
к несимметричным алкенам.
Шкала электроотрицательности
Можно распространить правило Марковникова на присоединение
соединеной общего типа X—Y к несимметрично замещейным алке-
нам; при этом необходимо дать четкий ответ на вопрос о том, какой
из атомов X или Y—является более электрофильным. Если поля-
ризация связи X—Y такова, что X— положителен (Xs®—Ys®),
то X будет присоединяться к, алкену в виде X® таким образом, что-
бы образовался наиболее стабильный карбониевый ион. Эта стадия
будет определять направление присоединения. Например, если из-
вестно, что в НОВг связь О—Вг поляризована таким образом:
- й®
НО —Вт, то присоединение НОВг к изобутилену должно привести
212
ГЛАВА 7
к 1-бром-2-метилпронанолу-2
6ф 6©
Вг—ОН
-СНг-Вг
сн3 он
- X
СН, CHjBr
I-бро м-2-метилпро пано л-2
Поляризацию связей X—Y обычно можно установить, рассмат-
ривая степень электроноакцепторности, или электроотрицатель-
ности, различных элементов и групп.
Общая ’проблема определения электроотрицательностей различ-
ных элементов была поставлена Полингом. В шкале электроотри-
цательностей Полинга (рис. 7-7) элементы каждого периода перио-
дической системы располагаются в порядке возрастания электроот-
рицательности, или электроноакцепторных свойств (слева направо).
Для данного периода периодической системы электроотрицатель-
ность возрастает с увеличением атомного номера. С другой сторо-
ны, электроотрицательность уменьшается с возрастанием атомного
номера в пределах данной группы периодической системы.
Электроотрицательность углерода, определяемая по шкале По-
линга, такова, что он оказывается несколько более электроноак-
цепторным, чем водород. Однако можно ожидать, что электроидак-
цепторность углеродного атома (или атома другого элемента) будет
зависеть также от электроотрицательности групп, с которыми он
соединен. Действительно, многочисленные экспериментальные дан-
ные указывают на то, что углерод в метильной или других алкиль-
Возрастание электроотрицательности -
0 ‘ 0.5 1.0 1,5 2,0 2,5 3,0 3,5 4,0
______-Н
.....Mg-• АГ- Si — " - • Р " Г'”
Z
Iz
Рис. 7-7. Электроотрицательности элементов (по Полингу).
Пунктирными линиями соединены элементы одно!: группы периодической системы; точечные1
линия соединяют элементы одного периода.
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 213
ных группах оказывается значительно менее электронбакцепторным,
чем водород. Наоборот, CF3-rpynna, в соответствии с ожидаемым
оказывается более электроноакцепторной, чем водород.
Направление поляризации связей между различными элемента-
ми может быть предсказано с помощью шкалы электроотрицатель-
ности, изображенной на рис. 7-7. Например, связь О—С1 должна
быть поляризована так, чтобы кислород оказался отрицательным;
поляризация связи С—N должна приводить к частичному отрицав
тельному заряду на атоме азота.
SL—S )¥____________
Следовательно, можно предсказать, что при присоединении
НОС1 к алкену хлор должен направляться к наименее замещенному
углеродному атому.
Упражнение 7-12. Используя шкалу электроотрнцательиостей (рис, 7-7), пред-
скажите, какие продукты образуются в приведенных ниже реакциях Присоедине-
ния (в условиях, когда осуществляется кшгетическнй контроль),
а) пропилен с H2SO4
б) изобутилен с HOF (если его можно получить)
в) тримети.чэтилен с ICI
г) двойная связь углерод — азот с водой
д) изобутилен с H2S
Упражнение 7-13. Напишите механизм и укажите характер продуктов при
реакции брома с триметилэтиленом, растворенным в метиловом спирте, содержа-
щем хлористый литий (разд, 7-4,А).
Г. Присоединение к замещенным алкенам
Правило Марковникова в своей обычной формулировке применимо только к
незамещенным алкенам. Для алкенов, содержащих галогены ИЛИ другие сходные
группы, можно использовать тот же общий метод подхода, чтобы предсказать на-
правление присоединения; однако, как будет показано ниже, при этом возникают
осложнения. Рассмотрим соединение типа Y—СН=СНа. Если Y более электроот-
рицателен, чем водород, то галогеноводород должен был бы присоединяться та-
ким образом, чтобы протон из НХ направился к группе Y—СН=, а X—к группе
—СН3. Таким образом, предполагаемый результат оказывается в противоречии
с правилом Марковникова в его обычной формулировке.
Н
Y—СН — СНа + Н®~7 Y-(!h-$H2 \ Y-CH2-CH2-X
Y —более электроноакцепторный атом или группа, чем водород
Однако, если Y — очень сильный электроне акцепторный заместитель, то присое-
динение происходит в соответствии с таким предположением при условии, что
атом, непосредственно связанный с атомом углерода двойной связи, не имеет не-
2|4 ГЛАВА. 7
поделенной пары электрете. Так,
CFa—CH = CH24-HCi —» CFS—• СН2— СН»С1
СН3 СН3
© I ® I
СН3-М-СН=СН8 + НГ —> СНЭ—N—СНг~~СЫ8—.1
сна сн.
Такие заместители довольно редки, и большинство описанных реакций при-
соединения веществ тина Н—X было проведено с алкенами, содержащими У, в
состав которых входили такие элементы, как кислород и галогены, содержащие
пару электронов на атоме,'непосредственно связанном с атомом углерода двой-
ной.связи.
У-СН=СНг Y=R:O-, -.F-, :С1- И Т.П.
Такие заместители обычно Значительно электроотрицательнёе, чем водород,
и можно было бы ожидать, что присоединение протона приведет к тому, что боль-
шая часть положительного заряда окажется размещенной на группе СН2. Однако
электронеакцепторпость таких заместителей, по-видимому, более чем уравнове-
шивается их способностью подавать свои неподвленные электроны к соседнему по-
ложительно заряженному атому углерода, стабилизируя, таким образом, карбо-
ниевый ион
нФ Ф х® 1
F-CH=GH3 -----* ;Е«-СН-СН, —► F—у—СН3
Н
Электро но акцептор ное и электронодопорное влияния действуют, следовательно,
в противоположных направлениях; однако для направления присоединения эф-
фект стабилизации, обусловленный неподеленными электронами, играет, по-види-
мому, решающую роль.
Относительно влияния электронных эффектов на реакционную способность
двойных связей при электрофильном присоединении можно сказать следующее;
влияние, которое повышает электронную плотность двойной связи, будет увели-
чивать ее реакционную способность, тогда как влияние, понижающее электрон-
ную плотность, будет уменьшать реакционную способность-.Это легко понять, по-
скольку электрофильная атака зависит от степени «доступности» л-электронов.
Так, общая реакционная способность фтористого винила понижена вследствие
электро но акцептор по го эффекта фтора, и фтористый винил оказывается менее ре-
акционноспособным по отношению к Н—X, чем этилен, хотя электроноакцептор-
ное действие заместителя недостаточно для того, чтобы определить направление
присоединения. ।
Упражнение 7-/4. Назовите продукты,преимущественнообразующиесйвре-
зультате присоединения хлористого водорода к каждому из приведенных ниже
алкенов. Приведите ваши соображения (ссылок только па правило Марковнико-
ва недостаточно).
а) СН2=ССк
б) (СН3)2С=СС1а .
в) CF3—СН=СН—Q
г) CH-pCH-CHF
АЛКЕНЫ; РЕАКЦИИ. ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 215
-------------------- ___________ -----------------
7-6. Присоединение несимметрично
построенных реагентов, происходящее
против правила Марковникова
Ранние литературные данные относительно присоединения бро-
мистого водорода к несимметричным алкенам были по меныпей мере
противоречивы, и в некоторых случаях для одних и тех же алкенов
сообщались результаты, говорившие о присоединении как по пра-
вилу Марковникова, так и против этого правила, причем условия
проведения реакций были в значительной степени сходны. Многие
из неясностей, возникших в вопросе о присоединении бромистого
водорода, были устранены в результате классических исследований
Караша и Майо (1933 г.), которые показали, что для данных реак-
ций возможны два различных механизма, которые приводят к раз-
личным продуктам. Караш и Майо установили, что в условиях,
благоприятствующих полярной реакции, бромистый водород при-
соединяется к пропилену довольно медленно, образуя чистый изо-
пропилбромид
медленно
СНРСН=CHS 4- HBr -----* сноснснл
„полярные" условия ।
Вг
При действии света, перекисей, свободнорадикальных инициаторов
в отсутствие ловушек свободных радикалов осуществляется быст-
рая свободнорадикальная цепная реакция присоединения, приводя-
щая к н-пропилбромиду с 80%-ным или большим выходом:
СН3СН=СН2 + НВг “Ы-‘ТР° > CHsCH2CHaBr
- перекиси i
Аналогичные эффекты были отмечены для хлористого водорода,
но никогда не наблюдались в случае йодистого или фтористого во-
дорода, Некоторые соединения присоединяются к алкенам только
по свободнорадикальному механизму и всегда дают продукты при-
соединения против правила Марковникова.
Полярное присоединение бромистого водорода, рассмотренное
в разд. 7-5, не будет здесь обсуждаться. Специального рассмотрения
заслуживают два вопроса, связанные с.так называемым аномальным
присоединением. Во-первых, почему свободнорадикальный меха-
низм должен приводить к образованию иных продуктов, чем при
полярном присоединении, и, во-вторых, почему свободнорадикаль-
ное присоединение легко происходит,в случае бромистого водоро-
да, но не характерно'для других галогеноводородов (см, упражне-
ние 7-16).
Аномальное присоединение бромистого водорода эффективно ка-
тализируется перекисями, имеющими структуру R—О—О—R,
•>
216
ГЛАВА 7
которые разлагаются при нагревании, образуя свободные радикалы
R“O:O-R ---> 2R-O- ДЯ = + 35 икал
Радикалы RO • могут далее реагировать с бромистым водородом
двояким образом:
ROH + Br- Д/7——23ккал
RO- + НВг —Ч
l_^ROBr + H- Д.Я=+39ккал
Очевидно, что образование ROH и атома брома энергетически более
выгодно. Процесс распада перекиси и образования атома брома мо-
жет инициировать свободнорадикальное цепное присоединение бро-
мистого водорода к алкену.
развитие цепи: fCH3CH~CH2-f-Br- —► СНаСН—CHsBr ДЯ = —5 ккал
(СН3СН—СН<>Вг4- НВг --+ СН3СН2СНаВг+ Вг- &fi——! 1ккал
• обрыв цепи: R'--pR'- —> R' — R* П'-=атом-или радикал
Стадии развития цепи, вместе взятые, экзотермичны на 16 ккал,
и энергетический баланс для отдельных стадий также вполне удов-
летворителен. Действительно, цепи в этой реакции оказываются;
по-виднмому, сравнительно длинными, поскольку присоединение
сильно тормозится ловушками радикалов и для реакции требуются
лишь следы катализатора — перекиси.
Упражнение 7-15. Напишите два различных свободнорадикальных цепных ме-
ханизма присоединения хлористого водорода к алкенам и обсудите энергетиче-
скую выгодность каждого из них.
Упражнение 7-16. Вычислите значения &Н для стадий инициирования и разви-
тия цени при свободнорадикальном присоединении к алкенам фтористого водоро-
да, хлористого водорода и йодистого водорода. Можно ли ожидать, что эти реа-
генты будут легко присоединяться к двойным связям по такому механизму?
Очевидно, что направление радикального присоединения бро-
мистого водорода к пропилену зависит от того, какой конец двойной
связи будет атаковаться атомом брома. Направление атаки будет
в свою очередь зависеть от того, какрй из двух радикалов, образо-
вание которых возможно в этой реакции, окажется более устойчи-
вым— 1-бром-2-пропил-радакал (I) или 2-бром-1-пропил-радикал
(II).
CHS—CH-CHS—Вг снэ—сн-сн3.
Из энергий диссоциации связей С—Н в алканах (см. табл. 3-7)
следует, что легкость образования и стабильность свободных ради-
калов со свободной валентностью на углероде изменяются по ряду:
АЛКЕНЫ. РЕАКЦИЙ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 217
третичный > вторичный >первичныЙ. Рассуждая по аналогии,
можно ожидать, что вторичный 1-бром-2-пропил-радикал (I) будет
более стабильным и более легко образующимся, чем первичный
2-бром-1-пропил-радикал (II). Таким образом, продуктом радикаль-
ного присоединения должен быть (и так оно и есть в действитель-
ности) н-пропилбромид. Однако тип ориентации не во всех случаях
указывает на образование более стабильного радикала, поскольку
на ориентацию оказывает определенное влияние природа атакующе-
го радикального агента.
Структура, подобная (111), может быть предложена для бромпропилыюго
радикала по аналогии с мостиковой структурой катиона, подобного этилеппрото-
ннеаому иону (разд..7-4,Б). Однако в данном случае три атомных центра связы-
ваются тремя электронами; такая структура, по-видимому, не является стабиль-
ной, что следует, например, жз того факта, что обычно присоединение к двойным
связям по свободнорадикальным механизмам не происходит чисто трпнс-спосо-
бом (см. упражнение 7-29).
СН3-СН“СН*
Er
ш
Упражнение 7-17. Бромтрихлорметан СВгС13 присоединяется к октену-1 по
свободнорадикальному механизму при нагревании в присутствии перекиси как
катализатора. Используя таблицу энергий связен, предложите наиболее вероят-
ный механизм этой реакции. Какую структуру вероятнее всего будет иметь про-
дукт? Приведите ваши соображения.
7-7. Присоединение гидридов бора
к алкенам
Диборан (В2Н0) легко присоединяется в виде ВН3 к большинству
алкенов, образуя триалкилборы. В случае этилена получается
триэтилбор
0"С
6СН2 = СНз + В2Нв —* 2(СН3СНг)3В
Эта реакция называется гидроборированием. Она .протекает в три
стадии, но промежуточные моно-и диалкилбораны, как правило,
не могут быть выделены, так как они быстро реагируют далее, при-
соединяясь к алкенам:
2СНв = ОН3-|-ВгНв -* 2СН8СНйВН8
СН!2=СИя-|-СН5СН2ВН2 —> (СН3СНа)аВН
CH2 = CH! + (CH3CH!!)SBH —* (СН3СН2)3В
С несимметричными алкенами, например пропиленом, гидробо-
рирование происходит такум образом, что бор атакует менее за-
218 ГЛАВА 7
мещенный: конец двойной связи; в случае пропилена образуется
три-н-пропилбор
6СН3СН = СН8 + В2Н^ 2(СН3СНгСН2)зВ
Упражнение 7-18. Основываясь на шкале электроотрнцательиостей (рпс. 7-7)
и общих закономерностях присоединения к двойным связям, определите, соответ-
ствует ли направление присоединения В2Н9 к пропилену полярному механизму
реакции.
Гидроборирование необходимо проводить с осторожностью, так
как диборан и алкильные производные бора — высокореакционно-
способные вещества, самопроизвольно воспламеняющиеся на воз-
духе *. Для синтетических целей можно обойтись без выделения про-
дуктов присоединения, а диборан можно получать либо in situ,
либо вовне по реакции трехфтористого бора с боргидридом натрия;
3®а§Н4-|- 4BF3 —*- 2B2H3-J-3^a§Fj
Трехфтористый бор удобно использовать в виде его стабильного
комплекса с диэтиловым эфиром (C2H5)2O-BF3. 'Реакции проводят-
ся также обычно в растворителях эфирного характера: диэтиловом
эфире (С2НЙ)2О, диглиме (CHsOCH2CHa)2O или тетрагидрофуране.
Наиболее известными синтетическими реакциями образующихся
триалкилборов являются окисление щелочным раствором перекиси
водорода до соответствующих первичных спиртов и распад при дей-
ствии водного раствора кислоты (или, лучше, безводной пропионо-
вой кислоты СНзСН2СО2Н), приводящий к алканам. Так, для три-н-
пропилбора
он®
(CH3CHsCHs)sB + 3HsOa --у- 3CH3CH2CH,OH + B(OII)S
i С-—k_,
• н®
(СН3СНйСН2)аВ J- ЗНаО------------- 3CH3CH„CHS + В(ОН)Э
1 кипячение с " 4
обратным
холодильником
По первому из этих процессов удается провести (в результате двух
стадий) присоединение воды к углерод-углеродной двойной связи
против правила Марковникова. Вторая реакция служит методом
восстановления углерод-углеродных двойных связей без примене-
ния водорода и металлического катализатора.
Гидроборирование алкена и дальнейшие реакции продукта —
триалкилбора —»как с перекисью водорода, так и с кислотой ока-
зываются высокостереоспецифичными. Например, 1-метилцикло-
пентеп при гидроборировании и последующей реакции со щелочным
раствором перекиси водорода дает исключительно /пра«с-2-метил-
* И крайне ядовитые.— Прим. ред.
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 2!9
циклопентанол; это указывает на то, что суммарным результатом
реакции является цис-присоединение воды к двойной связи.
1, ВгН6
2, НгОя,®ОН
ОН
_1-метилцикдопентен-1
транс -3-метилциклопе!П^10л-1
Упражнение 7-19. Напишите уравнения и укажите, какие продукты образу-
ются при реакции 1-мети л цикло гексен а а) с водным раствором серной кислоты
и б) к: дибораном при последующем действии перекиси водорода.
7-8. Окисление алкенов
А. Озонирование
Большинство алкенов даже при низких температурах реагирует
с озоном; при этом разрывается двойная связь и образуются цикли-
ческие перекисные производные, известные под названием озони-
дов, •
О
О» z \
СН3СН =СНСН9 СНзСН СНСНз
о -о
бутен-2-озонид
Есть основание поЛагать, что в целом реакция включает три ос-
новные стадии, на первой, из которых происходит цпс-цикл«присое-
динение, приводящее к неустойчивому продукту, называемому
мольозонидом:
СН} СН,
СН J-С Н= С Н=С Н j ----------- И -СН
О .О® 0 4)
>;'О
© .
мольозонид (неустойчив)
СН, , ?сн. си, ^сн3 'хок
снусн сн сн +• II ’ — > СНэ-СН ipH-CHj
Ь ох/ >о •Ъ° и о Л® °-о® 0—0 озонид
1У > V
220
ГЛАВА 7
Убедительным доводом в пользу последовательных стадий диссоциации —
рекомбинации служит тот факт, что озонирование в присутствии карбонильного
соединения (т. е. соединения, содержащего двойную связь углерод — кислород),
отличающегося от соединения IV, образующегося при диссоциации мольозонида,
часто приводит к смеси озонидов.
О
' сн3сн=снсн3+сн3 —ti:—снэ
.О, .0. О
Z \ сн3 / \ Z
—> СН,-СН СН-СН3 + Х СН-СН3-(-СНа-СН
\ / сн/ \ /
О—О 0—0
Кроме того, обычно при реакции двух молекул соединения V между собой’
образуется некоторое количество диперекиси VI
/ Ч. /
СН3-СН НС-СН3 —>СН3СН снсн3
^0-6 \>...
в® 69
v vr
Озониды, подобно большинству соединений, содержащих пере-
кисные (О—О)-связи, могут взрываться с большой силой и совер-
шенно неожиданно. Озонирование вследствие этого необходимо
проводить с осторожностью. Озониды обычно не выделяют в чистом
виде, а разлагают, гидролизуя водой и восстанавливая цинком;
при этом образуются карбонильные соединения, которые, как пра-
вило, легко удается выделить и идентифицировать.
z°\ 00
Z X HtQ
СН3СН СНСН3 -+ СН3С + ССН3Н-Н2О4
* \)—б ь/
НаО-{-^-Оа
Эта последовательность реакций предоставляет отличную воз-
можность установления положения двойных связей в алкенах. При-
менимость этого метода может быть проиллюстрирована на примере
различных продуктов реакции в случае бутена-1 и бутена-2.
ьо, ,;0
сн>™=снсн> TKisr \
ацетальдегид
н\ J
СНЭСН3СН==СН, -----------> CHsCHaC С^О :
2.Zn.H,O \н н/ ’
пр о п ион ок ый форма ль дсги Д _•
альдегид
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГ.ПЕРОД-УГЛЕРОДНЫX СВЯЗЕЙ 221
Упражнение 7-20. Двум изомерным углеводородам Л и Б, выделенным из бен-'
зипа, соответствуют следующие физические свойства и аналитические данные:
Т. kun.. °с т. пл., °с с, % И, %
А 68,6 —141 85,63 14,34 Z
Б 67,9 —133 85,63 14,34
Как А, так и Б быстро обесцвечивают бром и раствор перманганата и при
озонировании дают одинаковые продукты. Укажите возможные структуры А и Б,
Какое исследование вы считаете необходимым предпринять для установления стру-
ктуры и конфигурации А и Б?
Б. Гидроксилирование
Ряд окислительных агентов реагирует с алкенами в мягких ус-
ловиях; конечным результатом реакции оказывается присоединение
перекиси водорода в виде НО—ОН. Особое значение имеют перман-
ганат и четырехокнсь осмия; оба эти вещества реагируют на первой
стадии по механизму цис-циклоприсоединения подобно озону.
неустойчив
НО ОН
+ MnOJ®
росстановпени&
й мягких
условиях
(NajSOj)
Н'+ 05
он он
устойчивый эфир
осмиевой кислоты
Оба эти реагента, взаимодействуя с циклоалкенамн, приводят
к образованию цис- диокси соединений (диолов).
35%-ная HZOZ
HCOZH, 25°С
транс .циклопентан дно л-1,2
Другой тип окисления алкенов — действием перекиси водорода
в муравьиной кислоте — отличен д том отношении, что приводит к
222
ГЛАВА 7
транс-присоединению. Причины такого стереохимического резуль-
тата реакции будут рассмотрены в гл. 13 в связи с получением и реак-
циями окисей алкенов (эпоксисоединений).
1. OsO4, 25*С
г. Na,SO,
-------—:———
(или КМпО4, Н2О)
Ж -циклопентапдиол-Ц
7-9. Полимеризация алкенов
Одной из наиболее важных в промышленном отношении реакций
алкенов является их превращение в соединения более высокой мо-
лекулярной массы (полимеры). Молекула полимера представляет
собой длинную цепь с повторяющимися одинаковыми структурными
единицами. Полимеризация пропилена дает полипропилен, где пов-
торяющейся единицей является —СН (СН3)—СН2.
riCH3CH==CH„
пропилен
СН,
^сн-сн,-
полипропилен
ДЯ =—л-20 ккал
Большинство реакций полимеризации алкенов, имеющих промыш-
ленное значение, протекает по цепному механизму и может быть от-
несено к анионным, катионным и свободнорадикальным реакциям
в зависимости от характера соединения, обусловливающего рост
цепи. В каждом случае на основных стадиях процесса (рост цепи)
происходят последовательные реакции присоединения к молекулам
алкена — различие же заключается в числе электронов, которое
предоставляется атакующим агентом для образования новой угле-
род-углеродной связи. В целях большей наглядности эти стадии
иллюстрируются ниже на примере этилена, хотя он не полимери-
зуется сколько-нибудь легко ни по одной из этих реакций,
, - pi еэ
R-СНг-СНг» + СН2=СН2—► R—СН2-~ СН2-СН2-СН2: ит.д.
R-CHj—СЯг + СН2=СН2 —h R—СН2—СНг-СН2-СНг и т.д.
R—CH2-CH2’/r+^CH2i^CH2 —> R-СНг-СВг—СНг-СНг • и т.Д
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД ,'УГЛЕРОДНЫХ СВЯЗЕЙ 223
А. Анионная полимеризация
При анионно-цепном механизме полимеризация алкена иници-
ируется атакой: нуклеофильного агента по одному из концов двой-
ной связи, что приводит к образованию карбаниона
Y ?'7‘снл£&н2 -------► Y; СН2-СНг Р
карбанион
*
Атака образовавшимся карбанионом другой молекулы алкена
приведет к аниону, содержащему четыре углеродных атома, а даль-
нейшие реакции присоединения его к следующим молекулам алкена
будут приводить к аниону все более высокой молекулярной массы.
Э Э
Y;CH-CH2; + СП2=СНг —к У:СНг-СНг-СНг-СНг'. —....»
Н(СНг-СИ»^ у:СНг-СНг4-СН2-СНг-^СН2-СН2:®
Растущая цепь может оборваться при любой реакции (например,
присоединении протона), которая приведет к исчезновению анион-
ного центра на конце цепи.
н®
У:СНг—CHS —(-СН2—СН2—)„—СН2СН®:------->•
—>- Y:CH3—СН„— (—СН2—СН2~)Я—СНа—СН3
Анионная полимеризация алкенов осуществляется с большим
трудом, так как лишь немногие анионы (или нуклеофилы) способны
легко присоединяться к двойным связям алкенов (разд, 7-1). Анион-
ная полимеризация осуществляется легко только для алкенов, за-
мещенных группами, электроноакцепторные свойства которых до-
статочно сильны для того, чтобы сделать возможной нуклеофильную
атаку.
Б. Катионная полимеризация ,
Полимеризация алкена при действии кислых агентов должна
протекать по механизму, сходному с механизмом присоединения га-
логеноводородов по двойной связи. На первой стадии протон кис-
лоты присоединяется к алкену, образуя карбониевый ион. Далее,
в отсутствие какого-либо другого достаточно сильного нуклеофиль-
ного агента следующая мбЛекула алкена вступает в реакцию за
счет электронной пары двойной связи, и образуется катион с более
длинной цепью. Многократное повторение этого процесса может
224
ГЛАВА 7
привести к катиону высокой молекулярной массы. Обрыв цепи про-
исходит в результате потери протона.
и®
CHt=CH2 сн,-сн2® + сн2=сн2 --------->-
CHj-CHi-CH2-CHi® —-Н* CHj-CHz-t-СЩ-СИ^-^СНх-СНг® ►
-и®
---> сн5-сн2-ссн2-сн2^-сн=сн2
Этилен полимеризуется с трудом по катионному механизму,
так как в нем нет групп, обладающих электронодонорностью, до-
статочной для того, чтобы сделать возможным образование проме-
жуточного катиона растущей цепи. Изобутилен содержит электро-
нодонорные алкильные группы и полимеризуется по катионному
механизму намного легче, чем этилен. В качестве катализаторов
при катионной полимеризации изобутилена обычно используются
серная кислота, фтористый водород или комплекс трехфтористого
бора и воды. В условиях, близких к безводным, образуется поли-
мер с очень длинной цепью, называемой полиизобутиленом
СН3
пСн2=с/
СН3
BF.-H.O
•сн3
СНэг 1 СНЭ- сн,
С - —СПз -С- -сн,—с
1 CHS снэ_ Л-2 . сн
3
полвнзобутилен
Пол и изобутилен определенной молекулярной массы представляет
собой очень липкий продукт и применяется в качестве адгезионного
материала для Печатных лент.
В присутствии "60%-ной серной кислоты изобутилен не превра-
щается в -полимер -с длинной цепью, а дает смесь димеров (алкенов
с восемью углеродными атомами). Механизм этого процесса подобен
механизму описанной выше реакции полимеризации, за исключе-
нием того, что обрыв цепи происходит после соединения всего лишь
двух молекул изобутилена. Малая длина цепи обусловлена высокой
концентрацией воды: промежуточный карбониевый ион теряет про-
тон, отдавая его воде, прежде чем он успеет прореагировать со сле-
дующей молекулой алкена.'
СНЭ
,80%-ная HsSO,
7.0 СС
СН3 СНг СН3 СНЭ
СН3—С—СНг—СНЭ-,С~СН=(^
СН, СН3
80%
„ дннзобути лец“
20%
Поскольку -отрыв Протона может происходить из двух различ-
ных положений, образуется смесь изомерных алкенов. Такая смесь
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 225
алкенов известна под названием диизобутнлена и находит различ-
ные промышленные применения. Гидрирование диизобутилена
приводит к 2,2,4-триметилпептану (который часто ошибочно назы-
вают изооктаном), используемому в качестве топлива для бензино-
вых двигателей внутреннего сгорания и имеющему стандартную
«антидетонанионную» характеристику (октановое число), равную
100.
- .СН(,
/сн3 /СН3 CH"=c<CHt
СН2 =С 4- H,SO4 снэ —с ©-----------
хсн3 х:нэ
. ?На /Отз -н®
—> сн3—с—сыа —с © ------»
СН» 4013
сн8 сн3
I zCH2 | /СН3
-н-СНэ-С—CH2-Qf -4-СН3—с—сн=с<
1 ^СН3 I Чн»
сн3 сн8
сн3 сн3
Hs(Nl) t I
, изомерные диизобутилены ~~^тСН3—С—СН2—СН—СН3
Ан3
2.2.4 -т р ймети л пента н
Упражнение 7-21. а) Напишите механизм димеризации триметнлэтилена под
действием серной кислоты и назовите продукты, образования которых можно
ожидать.
б) Озонирование смеси олефинов, которая в действительности получается в
таких условиях, дает (наряду со смесью других альдегидов и кетонов) значнтель-
0
II
ное количество бутанона-2 (СНа—С—СН2—СН3). Напишите структуру и меха-
низм образования олефина С1о, получение которого возможно при реакции диме-
ризации; при озонировании этот олефин дает бутапон-2 и карбонильное соедине-
ниссшестыо углеродными атомами. (Обсудитевопросотом, каким образом серная
кислота: может вызвать изменение,положения двойной связи в триметилэтилене.)
В. Свободнорадикальная полимеризация
Этилен может полимеризоваться в присутствии перекиси как
катализатора при высоком давлении (1000 ат или более) и при тем-
пературе выше 100 °C. Стадия инициирования состоит в атаке сво-
бодными радикалами, а рост цепи происходит путем последователь-
8 № 1640
226 ГЛАВА 7
ного присоединения радикалов к молекулам этилена.
2 R:O* .
Рост J К:Й‘ + СН^СЯ —> П'.б:СН,-СНг‘
«е™: I К:О.-СНг-СН< + п(СНг=СНг) —> КОУСН2-CHz^C^-CHj.
; 2 НО№СНг^СНг-СНг- —> [нОНСН^СНЛ^СНг-СНг^.
рекомбинация
КОЛ'СН2-СН2^СН=СН2 + ЙО^СНгСЦ^С^-СНз
диспропорционирование
Обрыв цепи может быть обусловлен любой реакцией, приводящей
к рекомбинации или диспропорционированию свободных радика- \
лов. Полиэтилен, получаемый таким образом, содержит в углеводе-
родной цепи 100—1000 звеньев этилена. Такой полимер обладает .
рядом ценных свойств и широко используется для электрической ’
изоляции, в производстве упаковочной пленки, для изготовления
труб и большого числа изделий, получаемых методами литья и фор-
мования. Очень низкая стоимость этилена делает полиэтилен впол- ;
не конкурентоспособным материалом, несмотря на технические
трудности, связанные с проведением процесса полимеризации. Про-
пилен и изобутилен с трудом полимеризуются по свободнорадикаль-
ному механизму.
Упражнение 7-$2. Напишите возможный механизм обрыва цепи при полимери-
зации этилена в результате диспропорционирования. Вычислите значение ДЯ
для обрыва цепи путем диспропорционирования и рекомбинации.
Г. Координационная полимеризация
Полимеризация этилена может быть осуществлена при сравни-
тельно низких температурах и давлении в присутствии катализато-
ра, представляющего собой смесь окислрв алюминия и молибдена,
который требует периодической активации водородом. Этилен также
полимеризуется весьма быстро при атмосферном давлении и комнат-
ной температуре в растворе алкана, содержащем суспензию нераст-
воримого продукта реакции триэтилалюминия с четыреххлористым
титаном (Циглер). Оба эти процесса дают полиэтилен очень высокой
молекулярной массы с исключительно ценными физическими свой-
ствами. Характерные особенности-этой реакции указывают на то,
что в ней не участвуют обычные анионы, катионы или свободные
АЛКЕНЫ, РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 227
радикалы. Можно полагать, что катализатор координируется с мо-
лекулами алкена; это напоминает в некоторой степени действие ка-
тализаторов гидрирования, также вступающих во взаимодействие
с алкенами (разд. 7-2). Механизм полимеризации такого типа рас-
сматривается более подробно в гл. 29. _
Полимеризация пропилена под действием катализатора цигле-
ровскрго типа приводит к получению пластического материала с осо-
бенно ценными свойствами, из которого можно изготавливать вьг-
сокопрочное волокно. Путем формования из него могут быть также
подучены изделия разнообразной формы. Сополимеры (полимеры,
содержащие два или более типов мономерных звеньев в полимерной
цепи) этилена и пропилена, полученные под действием катализато-
ров Циглера, обладают чрезвычайно ценными каучукоподобными
свойствами и в перспективе могут оказаться наиболее дешевыми из
используемых эластомеров (эластичных полимеров). В 1963 г.
Циглеру и Натта была присуждена Нобелевская премия за ра-
боты в области полимеризации алкенов.
Свойства и использование полимеров рассмотрены более подроб-
но в гл. 29.
7-10. Алкилирование алкенов
Присоединение насыщенного углеводорода (R—Н) к алкену,
приводящее к насыщенному углеводороду большей молекулярной
массы, носит название алкилирования и используется в нефтехими-
ческой промышленности для производства углеводородов средней
молекулярной массы из молекул меньшего размера.
R_H + 'c=c/ —► R—(2-Н
/ \ II
алкилирование
Наибольшее значение имеет присоединение изббутана к изобу-
тилену в присутствии серной кислоты или безводного фтористого
водорода, приводящее к 2,2,4-триметилпентану:
сн3 сн, сн,
| /СН3 HF | I
СН»-С-Н4-СНа=С< —•— GHS—С—СН3—С—CHj,
I ХСНО ~23 с: | |
сн, CHS н
По своему характеру эта реакция отличается от любой до сих пор рассмотрен-.
ной, поскольку при Этом .происходит присоединение неполярного агента (RH)
к двойной связи. 4
Установление механизма алкилирования углеводородами стало возможным
после работ Бартлета (1940 г.), показавшего, что карбокатион может быстро взаи-,
модействовать с углеводородом, имеющим третичный атом водорода, вследствие
чего образуется новый карбокатион и новый углеводород. Некоторые из таких
В*
228
ГЛАВА 7
реакций «переноса водорода» происходят исключительно быстро и могут завер-
шаться в течение нескольких секунд или меньшего времени.
ч.
СН3-С® + Н:С-СНг-СН3
сн3 сн3
На основании этого механизм алкилирования изобутилена изобутаном можно
сформулировать следующим образом: сначала происходит полимеризация двух
молекул изобутилена под действием серной кислоты как катализатора, в резуль-
тате чего образуется тот же октильный катион, который участвует в димеризации
/СН3
2СН2=С/
ХСН
СН3 сн3
СН3~С-СН2-С—сна
I ф
сн3
изобутилена. Затем октильный катион может вступить в реакцию переноса водо-
рода с изо бута ном, что приводит к 2,2,4-триметилпептану и трещ-бутил-катиону
снз СН3 СНз
I I I
GH3—С—СНг—С —СНЭ4-СН3—G—-Н
I Ф |
СН3 in3
сн3 сн3 сн3
I I I
СНЯ-С - СН3—С—сн3+сн3—С Ф
сн3 н (*?н3
Атака трет-бутил-катиона на другую молекулу изобутилена приведет к другому
октил-катиону и далее к другой молекуле «алкилата».
СН3
I
СНа — С ф
СН3
сн3 сн3
СНЭ I | н т. д.
—>• СН3—С—СНг—С—сн3------•
•сн, I Ф
сн3.
сн3
Упражнение 7-23. Сообщалось, что смесь 2-мет ил пропан а-2-'гН (СН3—С—СНЭ)
I
D
и2-мегилпропана-1-13С(СН3—С—/,7СН3), гдегзС—стабильный изотоп углерода
- I
И
смассой 13, лишь очень медленно превращается при действии серной кислоты в
смесь, состоящую из двух исходных веществ обычного изобутилена и 2-метилпро-
пана-1-13С-2-2Н.
Реакция очень сильно ускоряется При добавлении небольших количеств
||Побутилена. Объясните этот факт. Можно ли ожидать значительного образова-
нии D»SO* при проведении реакции в присутствии изобутилена? Почему? ' "
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 229
7.11. Синтезы органических соединений
Упражнение 7-24 — первое из большого числа содержащихся в
зтой книге упражнений, имеющих целью развитие способности к
планированию практически осуществимых синтезов данных конк-
ретных веществ. Важность этого трудно переоценить, поскольку син-
тез —- главное, с чем приходится иметь дело в практике органиче-
ской химии. Цели, которые ставятся при проведении синтезов, мо-
гут быть весьма различными; так, при этом можно стремиться под-
твердить путем «встречного» синтеза структуру вещества, встречаю-
щегося в природе (разд. 1-6,В), и в то же время разработать спосо-
бы получения аналогов этого вещества для того, чтобы провести
сравнение их химических свойств и физиологического действия.
С другой стороны, цель может заключаться в получении не описан-
ного ранее соединения, которое, как можно ожидать по теоретичес-
ким соображениям, должно иметь необычные свойства вследствие
аномальных пространственных или электронных эффектов; в каче-
стве примеров таких соединений, до настоящего времени не получен-
ных, могут быть приведены тетра-щрет-бутилметан, циклопропин
и тетрацианметан C(CN)4. Многочисленные исследования выполня-
ются также с целью разработки или усовершенствования методов
синтеза соединений, имеющих промышленно важное значение
(очевидно, что в работах такого рода экономические соображения
играют первостепенную роль).
Независимо от цели, для которой синтезируется соединение,
задача заключается в том, чтобы получить его из доступных исход-
ных веществ наиболее эффективным и экономичным способом. То,
что целесообразно и экономично в лабораторных условиях, естест-
венно, может оказаться совершенно неприменимым в промышлен-
ном производстве; поэтому в настоящей книге внимание концентри-
руется на лабораторных методах, хотя для ряда практически
важных соединений указываются способы промышленного получе-
ния.
Весьма существенное различие между промышленными и лабо-
раторными методами состоит в том, что большинство процессов в
промышленности почти всегда носит.непрерывный характер—ис-
ходные вещества непрерывно подаются в реактор и продукты непре-
рывно выводятся из него. В противоположность этому исследова-
тельская работа в лаборатории обычно не направлена на длительное
получение одного-единственного вещества; поэтому лабораторные
синтезы обычно проводятся отдельными «порциями». Другое раз-
личие относится к использованию побочных продуктов синтеза. Так,
если н лабораторных условиях такой, например, побочный продукт,
как серная кислота, используемая при гидратации алкена, попрос-
ту выбрасывается, то в промышленности проблема удаления или
регенерации израсходованной загрязненной кислоты в количестве
сотен тысяч тонн в год вполне может оказаться помехой для внедре.-
230
ГЛАВА 7
ния синтеза, во всех других отношениях вполне удовлетворитель-
ного.
Для приводимых в данной книге упражнений мы попытались
отобрать такие примеры практически осуществимых синтезов, ко-
торые исходят из реально доступных исходных веществ. При этом
старались избегать (в большинстве случаев) включения синтети-
ческих превращений, которые, представляя, возможно, педагоги-
ческую ценность, не имеют серьезного практического значения.
Это должно научить пониманию того, какие соединения являются
легкодоступными.
При написании предлагаемого синтеза очень важно по возмож-
ности точно указать реагенты и примерные условия реакции, в
особенности потому, что Для многих комбинаций реагентов воз-
можны несколько путей протекания реакции в зависимости от при-
роды растворителя, температуры и т. д. Присоединение бромистого
водорода к алкеНам (разд. 7-6) может служить убедительным при-
мером того, каким образом изменение условий приводит к измене-
нию направления реакции.
Большинство синтезов включает более чем одну стадию; так,
при получении сложных природных соединений нередко осуществ-
ляется 30 или большее число отдельных стадий. Планирование таких
синтезов может превратиться в поистине головоломную задачу,
поскольку суммарный выход является произведением выходов па
отдельных стадиях. В том случае, если выход целевого продукта
на каких-либо трех стадиях тридцатистадийного синтеза состав-
ляет только 20%, суммарный выход не может превысить (0,20)3х
X 100=0,8%, даже если все остальные стадии дадут 100%-ный вы-
ход. Если на каждой стадии удается .достигнуть выхода 90%, то сум-
марный выход все-таки окажется равным лишь (0,90)30-100=4%.
Очевидно, что при такой ситуации планирование синтеза должно
предусматривать использование наименее надежных реакций на
самых ранних стадиях синтеза.
Данное исходное вещество может быть превращено в данный ко-
нечный продукт практически бесконечным числом способов. Проб-
* лема заключается в том, чтобы выбрать путь, наиболее целесообраз-
ный в отношении как числа требующихся стадий и возможного
конечного выхода, так и использования реагентов, для получения
которых не требуется многостадийных синтезов.
Наиболее разумно планировать многостадийный синтез в об-
ратном порядке —от продукта к исходным веществам. Если ни од-
но из исходных веществ не имеет такого же углеродного скелета,
как цел срой продукт, то первоочередная задача заключается в оп-
ределении пути построения такого скелета. Далее, каждый способ
построения скелета рассматривается с точки зрения возможности
расположения нужных функциональных групп в соответствующих
местах. Почта всегда оказывается важным использовать реакции,
которые приводят к индивидуальным соединениям, чтобы избежать
АЛКЕНЫ. РЕАКЦИЙ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 231
таким образом необходимости проводить разделение изомеров.
Проиллюстрируем некоторые из вышеприведенных соображений
на конкретном примере, основанном (подобно всем упражнениям)
преимущественно на реакциях, затронутых в данной главе; он
может, однако, включать также стадии, обсуждавшиеся в преды-
дущих главах.
Этот пример заключается в разработке плана синтеза 2-хлор-
2,4,4-триметилпентана из исходных веществ, приведенных в упраж-
нении 7-24: этилена, пропилена, изобутилена, изобутана и неорга-
нических реагентов,
CHS сн3
.. - II
снэ—с—сна—с—снв
.. ci iii3
2 -хл op 2.4.4 -тр имети лпе нта н
Углеродный скелет целевого продукта отличается от скелета лю-
бого из данных исходных соединений; однако легко видеть, что его
можно разбить на два изобутановых фрагмента;
С {'с
С—С-С-гС-С
। I
Используя только те реакции, которые уже были рассмотрены выше,
можно построить такой скелет двумя различными способами. Изо-
бутилен при действии серной кислоты димеризуется в смесь, содер-
жащую 8% 2,4,4-триметилпентена-1 и 20% 2,4,4-триметил пентена-2
(разд. 7-9, Б), а изобутилен и изобутан взаимодействуют в присут-
ствии фтористого водорода как катализатора, образуя 2,2,4-три-
метилпентан
60%-ная HsSO*
2СНа=С(СНа)а
СН3 CHS С11а СН3
—К CH2«C-CHa—C-CH3-f-CH3-C=CH—ci—сн8
* сн3 сн3
' * 80% 20%
CHS сня
HF I !
СНа=С(СН3)а + (СН3)3СН СН3—-С—СН3—С—СН3
н сн8
I
232 ГЛАВА 7
Можно ожидать, что проведение этих реакций в лабораторных ус-
ловиях окажется сравнительно удобным.
Введение хлора в определенное положение октана может быть
осуществлено путем присоединения хлористого водорода к изоме-
рам триметилпептена, которые, к счастью, согласно правилу Мар-:
ковникова, должны дать один и тот же продукт (разд. 7-5,А).
Другой способ состоит в свободнорадикальном хлорировании
2,2,4-триметилпентана либо действием хлора (фотохимически или
термически, разд. 3-8), либо с помощью хлористого сульфурила
(стр. 114).
СН3 СН3 СН, СН3
сн2=с-сн2—сн3+ сн,—г с=сн—с—сн,
сн3 сн3
КОНЦ. HCI, 25 °C
г
сн3 сн,
сн,—i-cn2-c—сн,
ti сн,
СИ, сн3 t
I [ CIS, ftv
СН,—СН—СНа—С—СН,------------1
сн.
Второй метод получения менее удачен вследствие того, что хло-
рирование не происходит исключительно в третичное положение.
Действительно, расчет ожидаемого отношения изомеров при терми-
ческом хлорировании по методу, описанному в разд. 3-8, позволяет
предсказать, что выход требуемого изомера составит только-17%.
Таким обрдзом, этот синтез оказывается в высшей степени непрак-
тичным, поскольку есть все. основания предполагать, что выделе-
ние нужного изомера из смеси окажется чрезвычайно трудным. Син-
тез соответствующего 2-бром-2,4,4-триметилпентана посредством
бромирования углеводорода должен иметь гораздо большее практи-
ческое значение, поскольку атака атомов брома на третичный угле-
род наиболее благоприятна (ср. с разд. 3-8). Таким образом, самым
целесообразным путем синтеза 2-хлор-2,4,4-триметил пентана .ока-
зывается димеризац,ия изобутилена с последующим присоединением
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ 233
хлористого водорода.
2СН„ = С(СНа)3
60%-ная HjSO4
70 'С
СН, СНа сн, сн,
(I II
—> СНа=С—СНа—С—СН3+СН3—С=СН—С—СН3
' (Lh, СНэ
конц. НС[
25 °C
СИ, СН3
—* СН3—С-СНо-^-СНз
ti (J:Ha
Приведенный пример не отличается особой сложностью; он име-
ет целью проиллюстрировать принципы разработки различных спо-
собов построения нужного углеродного скелета из доступных исход-
ных веществ и дальнейшего введения различных функциональных
групп. Окончательный выбор способа синтеза будет зависеть от его
эффективности в целом, т- е. выхода, числа стадий, удобства прове-
дения и т> д.
Упражнение 7-24. Укажите, каким образом можно синтезировать приведенные
ниже соединения, использовав в качестве исходных этилен, пропилен, изобутилен
или изобутан, а также любые неорганические реагенты. Определите реагенты и
условия реакций и оцените практическую целесообразность выделения того или
иного изомера; Если разделение изомеров трудно осуществить, то определите со-
держание нужного соединения в конечной смеси продуктов.
СН3
а) СН,—(t—СН,
ОН
СН,
б) СИ,—с!—СН,
F
в) СН3СН— СН,
I I
ОН Вг
СН,, сн,
г) снв—ё—снй—<L—сн3
сн, I
сн, о
I II
Д) сн3-с-сн,—с—сн,.
сн3
сн,
е) СН,—(!—СН,Вг
А
СН3 снз
ж) С1СН,—ft—сна—Ан—СН,
сн,
з) СН,—СН,—CHSOH
сн, сн,
и) НОСНа—(2Н—СН,—t—СН,
in,
сн3 сн,
к) СИ,—-СНа —с—сн3
СНЭ , QH ОН
2.34 ГЛАВА 7
Дополнительные упражнения 1
7-25. Расскажите о методике и аппаратуре для количественного анализа смеси Я
гексена-1 й н-гексана путем добавления избытка раствора бромистого калия— 1
бромата калия и серной кислоты с дальнейшим прибавлением избытка йодистого, I
калия и обратным титрованием раствором тиосульфата. Напишйте уравнения
всех реакций (уравняв коэффициенты) и по возможности полнее опишите методи- ’
ку определения, Имея в виду, что смеси гексан —г гексен очень летучи (т. кип.
около 60 °C), упругость паров брома высока к иодидгион в кислых растворах очень
чувствителен к окислению при действии воздуха.
7-26. Вычислите теплоты (—Д/f) Следующих реакций в газовой фазе при 25 °C-
Н2О2 + (СН2)2 НО—СН2—СН2—ОН
Н2Оа + (СН2), —и НО—(—СН2—)в—ОН
а) Какие выводы относительно скоростей приведенных выше реакций могут ,.
быть сдела!1Ы на основании значений Д/f? Объясните.
б) Какого изменения в значениях теплот реакций можно было бы ожидать в
том случае, если реакции проводились в жидкой фазе? Почему?
в) Какие агенты должны вызывать эти реакции в жидкой фазе? Почему?
Объясните.
7-27. Используйте таблицу энергий связей для того, чтобы исследовать возмож-
ность присоединения воды к пропилену при катализе перекисью (R—О—О— R).
Известно, что у-излучение 6 “Со приводит к разложению воды на Н- и НО-.
Может ли это излучение инициировать цепную реакцию присоединения воды к
пропилену? Сможет ли произойти нецепная реакция (т. е. один у-фотон на одну ,
молекулу реагирующего пропилена)? Какое соединение должно было бы образо-
ваться в случае нецепного механизма — пропанол-1 или пропанол-2? Какие
еще продукты могли бы быть получены при не цеп ной реакции? Подробно аргумен-
тируйте ваши ответы.
7-28. Определите возможность того, что приведенная ниже реакция даст указан-
ный продукт (приведите ваши соображения).
РгО
Если вы считаете, что данный продукт не образуется в сколько-нибудь существен-
ном количестве, то напишите структуру соединения (или соединений), образова-
ние которого (которых) будет, по вашему мнению, наиболее вероятно.’
7-29. Сообщалось, что свободнорадикальное присоединение H2S к 1-хлорцикло-
’гексену дает в основном цис -2-хлор цикло гексантио л (CeH1(1CISH) и некоторое ко-
личество соответствующего трдас-изомера. Относительное количество цис-пзо-
мсра црз растает при повышении концентрации H2S. Напишите механизм реакции
присоединения сероводорода, указав по возможности подробно, каким образом
концентрация H2S должна влиять на отношение цис- и транс-продуктов. Для
решения этой задачи окажутся полезными модели (см. разд. 4-4,А, 4-7 н 5-7).
7-,'10. Рассмотрите энергетические соотношения для присоединения аммиака
(К'Н3) к алкену ио свободнорадикальному механизму в присутствии перекисного
(R—О—О—R) катализатора. Будет ли при таком механизме происходить присо-
единение по правилу Марковникова? Почему? Какие трудности могут встретиться
при попытке осуществить на. практике присоединение аммиака к изобутилену в
присутствии серной кислоты как катализатора?
АЛКЕНЫ. РЕАКЦИИ ДВОЙНЫХ УГЛЕРОД.УГЛЕРОДНЫX СВЯЗЕЙ 235
7-31. Вычислите значении йй для приведенных ниже реакций в газовой фазе на
1 моль основного реагента (используйте таблицу энергий связей).
а) я(СН3=СН2) —> -(-СНг-СН2-)„-
СН, СН3 СН3 СН3
б) СНз-С—Н4-СНа—С —► СН3—С-СН,—С—сн9
* сн3 сна сн3
/°\
в) СН^СН.+О* —СН^ /СН3
(используйте значение ДЯ=—34,5 ккал для реакции 03~>3/20а).
уО— ----->-2СОй + 2На
г) СНа СН,-
Nj— q/ -----------у 2СО + 2Н2О
Такие реакции разложения, возможно, осуществляются при взрыве этой пере-
киси.
7-32. Показано, что можно получить два изомерных цнклоалкена с формулой
CSHU. Оба .эти соединения реагируют с водородом в присутствии платины, обра-
зуя циклооктан, а при озонировании и последующем восстановлении дают
О О
I! II
• Н-С—СН2—СН2—СНа—СН2—СН,—СН2-С—Н
а) Каково строение этих двух соединений?
б) Дадут ли эти два соединения один и тот же продукт при гидроксилирова-
нии под действием перманганата калия?
7-33. Изобутилен конденсируется с этиленом й хлористым водородом в полярных
условиях, образуя 1-х лор-3,3-ди мети л бу тан. Предложите механизм этой реакции,
согласующийся с характером реагентов, условиями реакции и образующимся про-
дуктом.
7-34. Нзобутан (содержащий следы изобутилена) при действии большого избытка
дейтеросерной кислоты D2SO4 довольно быстро превращается в изобутан, содержа-
щий девять атомов дейтерия (изрбутан-Г)в).
а) Напишите для этой реакции водородного обмена полярный механизм, со-
гласующийся с известными химическими свойствами серной кислоты; механизм
должен сделать ясным, почему из десяти водородных атомов изббутана обмени-
вается только девять.
б) Объясните, каким образом в начальных стадиях реакции изобутан-D^ мо-
жет образоваться быстрее, чем изобутан-Pn (при ге<9).
ГЛАВА
АЛКИНЫ
Алкины, представляют собой углеводороды, содержащие тройные
углерод-углеродные связи. Простейший представитель этого класса
ацетилен С2Нг — одно из наиболее важных соединений, лежащих в
основе синтетической органической химии, особенно при проведении
синтезов в промышленном масштабе.
Большое значение алкинов в синтезах обусловлено, с одной стороны,
тем, что тройная связь вступает в самые разнообразные реакции
присоединения, и, с другой стороны, тем, что водород, соединенный
с ацетиленовой группой —С=СН, обладает слабокислыми свойствами
и может отщепляться при действии сильных оснований с образова-
нием ацетиленидов. Кислотные свойства ацетиленовых водородов
очень невелики по сравнению с обычными минеральными кислотами,
но их кислотность по крайней мерее 10й раз больше, чем кислотность
водородов е. алканах.
Основная цель настоящей главы состоит в том, чтобы показать
сходство и различия между реакциями присоединения ацетиленов и
алкенов. Рассматривается также вопрос о том, как можно объяс-
нить кислотные свойства ацетиленовых водородов на основании пред-
ставлений, развитых выше.
В углеводородах, носящих название алкинов, или ацетиленов,
между атомами углерода содержится тройная связь, С помощью раз-
личных физических методов показано, что ацетилен СаНи, простей-
ший представитель этого класса углеводородов, представляет собой
линейную молекулу, в которой длина углерод-углеродной тройной
АЛКИНЫ
237
Рис. 8-1. Шаростержневая модель соединения, содержащего тройную углерод-
углеродную свянь. На модели видно, что атомы углерода и соединенные с ними
группы должны располагаться на одной прямой.
связи равна 1,20 А и две связи углерод—водород имеют длину
1,06 А.
^-1, 20 А
Н----CSC—Н
^-1,06 А
В соответствии с описанием в терминах атомных орбиталей
(разд. 5-5,В) связи С—Н в ацетилене относятся к числу гт-связей,
образованных путем перекрывания s-орбитали водорода с зд-орби-
галью углерода; в молекуле имеется одна С—С о-связь (образован-
ная перекрыванием двух sp-орбиталей углерода) и две С—С я-связи
(результат перекрывания двух взаимно перпендикулярных пар р-
орбиталей). Валентные углы, ожидаемые на основании этой модели,
равны 180°’. 1
Каи атомно-орбитальные, так и шаростержневые модели алки-
нов указывают на их линейную конфигурацию, что делает невоз-
можной цмс — mpaw-изомерию при тройной связи; действительно,
такой изомерии не наблюдается (рис. 8-1).
8-1. Номенклатура
Согласно системе ШРАС при построении названия алкинов ис-
пользуют окончание -ин вместо окончания -ан в названиях соответ-
ствующих полностью насыщенных углеводородов.
Н-СеС-Н CHS—CsC-CHa
этин бутиц-2
(ацетилен) (диметил ацетилен)
Система нумерации, применяемая для указания положения трой-
ной связи и замещающих групп, аналогична той, которая использу-
ется для соответствующих алкенов.
СН3 СНз
I I
СН,—С—CsC—С—CHS
1Т ’ СНз
2,2,5-трцметнлгекснц-З
(из о п ро п ил- тр ет бутил а цет и яе н)
238
ГЛАВА 6
Многие алкины при построении названия рассматриваются как
продукты замещения ацетилена, что иллюстрируется приведенными
выше примерами (названия в скобках).
Углеводороды е открытой цепью, содержащие две иди больше
тройных связей, называют алкадиинами, алнатриинами и т. д. в
зависимости от числа тройных связей. Углеводороды, содержащие
одновременно двойные и тройные связи, носят названия алкенинов,
алкадиенинов, алкендиинов и т. д, в соответствии с числом двойных
и тройных связей. Атомы цепи должны иметь наименьшие номера
из всех возможных; если существует возможность выбора, то мень-
шие номера должны иметь атомы двойной связи.
НС^С—С = СН
бутадиин
НС = С—сн = сн—сн=сн2
гексаднен-зг5-н к-1
НгС=СН7-С^СН
бутеми
НС «> С*-С = С—СН=СНа
гексеи-5-диин-1,3
Углеводородные заместители,
ются алкинильными группами.
образуемые из алкинов, называ-
йся С
этииил
НСеэС—СНа —
лролин-2-ил
(пропаргил)
Упражнение 8-1. Назовите каждое из приведенных ниже соединений по сис-
теме ШРАС, а также рассматривая их как замещенные ацетилены (названия заме-
щающих групп см. в разд. 3-1, 4-1 и 6-1).
а) СН3С^СС1 е) (СН2)аСа
б) (CHs)3CC = CCH2C(CHa)a
в) CHs = CHCH2CsCCH = CHa
г) . НС S3 ССН3С е» С— С(СНа) = сн 3
хсна—СН ^СН-СН2
д) H2C( Sc-CsC-C^ Ъсна
ХСН2-СН2 чсн2-сн2
8-2. Физические .свойства алкинов
Температуры кипения и плавления и плотности простых алки-
нов обычно несколько выше, чем у соответствующих алканов или
алкенов. Алкины-1, Подобно «-алканам (разд. 3L2) и алкенам-1
(разд. 6-2), образуют гомологические ряды, в которых по мере воз-
растания длины цепи наблюдается закономерное изменение фи-
зических свойств. Физические свойства некоторых представителей
класса алкинов и их теплоты сгорания приведены в табл, 8-1.
АЛКИНЫ
239
Таблица 8-1
Физические константы и теплоты сгорания алкинов
Название, по системе 1UPAC, а Общеупотреби- тельное название Формула Т. кип,,. °C Т. пл.. “С м Т» ЛИ сгора- ния а, ккал/иоль
Этин Ацетилен HCsCH —84 —81 310,6
Пропин Метилацетилен СН3С^СН —23,2 —ЮЗ 0,65« 463,1
Бутин-1 Этилацетилен СН3СН2Се^СН 8,1 —126 620,6
Пентин-1 я-Пропилацети- * лен CH3(CH2)SC=CH 40,2 —106 0,690 778,0
Гексин-1 н-БутнлацетИ" лен СНЭ(СН„)3С^СН 7,3 — 132: 0,716 935,5
Гептин-1 я-Пентилацети- ленв СНВ(СН2)ЛС S сн 99,7 —81 0,733 1092,9
Октин-1 я-ГексилаиетИ" лен СН3(СНДаС^СН 126,2 —79 0,746 1250,3
Нонин-1 . я-Гептиланети- лён СНэ(СН2)сС = СН 150,8 —50 0,757 1407,8
Децнн-1 я-Октилацети- лен СН3(СН2),С^СН 1.74,0 —44 0,766 1565,2
Бутин-2 Диметил ацети- лен сн3с=ссн, 27,0 —32 0,691 620,6
Пентнн-2 Мети лэти ла де- тален CH3CHsCsaCCH, 56,1 —109 0,711 774,3
Гексин-2 Мётнл-я-проиил-! ацетилен СН3(СН2)2С = ССНЭ 84,0 —88 0,732
Гексин-3 Ди этилацетилен CHjCH^sCGHoCHj. 81,8 —105 0,724
а Для газообразных углеводородов л₽н 25 ‘С- {При сгорании образуется жидкая вода.)
6 Под давлением.
в Или н-амил ацетилен.
8-3. Спектральные свойства алкинов
Инфракрасный спектр монозамещенного алкина, например фе-
нил ацетилена СЯН6С=СН (рис. 8-2), содержит интенсивную полосу
при 3300 см"-1, характерную для валентного колебания связи угле-
род — водород в группировке =С—Н. При более низких частотах
(больших длинах волн) около 2100 см-х присутствует полоса, обус-
ловленная валентным колебанием тройной связи. Таким образом,
наличие в молекуле группы —CssC— Н легко может быть обнару-
жено с помощью ИК-спектроскопии. Однако тройная связь в диза-
мегценном алкине R—С=С—R обнаруживается с большим трудом,
240
ГЛАВА 8
Рис. 8-2. ИК-сиектр фенила цетиле на в растворе четыреххлористого углерода.
поскольку отсутствует поглощение —Н при 3300 см-1 и, кроме
того, С=С-поглощение иногда имеет такую низкую интенсивность,
что его бывает трудно зафиксировать. В таких случаях для установ-
ления присутствия тройной связи должна использоваться спектро-
скопия комбинационного рассеяния (разд. 2-4) или химические
методы.
Алкины, подобно алкенам, интенсивно поглощают ультрафиоле-
товое излучение только при длинах волн, расположенных в трудно-
доступном диапазоне — ниже 2000 А. Однако в тех случаях, когда
тройная связь сопряжена с одной или несколькими ненасыщенными
группами, поглощение происходит при больших длинах волн. На-
пример, ацетилен поглощает при 1500 и 1730 А, тогда как бутен-3-
ин-1 (СНа=СН—С=СН) поглощает при 2190 и 2275 А. Влияние
такого сопряжения на спектры обсуждается более подробно в гл. 9
(разд. 9-9).
ЯМР-спектр фенилацетилена приведен на рис. 8-3. Пики при
435 и 185 Гц соответствуют резонансному поглощению фенильных и
=С—Н протонов соответственно.
Различне'химических сдвигов для этих двух типов протонов зна-
чительно больше, чех! различие между сдвигами винильных и аро-
матических протонов (ср. рис. 8-3 с рис. 6-3), и в целом резонанс-
ное поглощение ацетиленовых протонов происходит при более силь-
ных магнитных полях (иначе говоря, они подвергаются большему
диамагнитному экранирбванию; разд. 2-6,Б), чем для винильных
АЛКИНЫ
241
Рис. 8-3. Я МР-спектр и интегральная кривая фенил а нети ле на при 60 МГц отно-
сительно ТМС (0,00 м. д.). Этот спектр превосходно иллюстрирует возможность
использования метода ЯМР для обнаружения загрязнений — маленькие пики
между 300 и 400 Гц обусловлены присутствием примесей, содержащих алкеновые
атомы водорода. Интегрирование показывает, что отношение алкеновых и ацети-
леновых водородных атомов составляет величину порядка ! : 15. Примесь, вероят-
нее всего, представляет собой стирол (фенилэтилен СаН3СН=СН2), и если это
так, последний присутствует в количестве приблизительно 2%.
и ароматических протонов. Фактически химические сдвиги ацетгп
леновых протонов приближаются по величине к сдвигам алкильных
протонов.
Упражнение 8-2. Воспроизведите на рисунках основные особенности ИЦ- и
ЯМР-спектров приведенных ниже соединений (целесообразно обратиться за
справками к разд. 3-3 и 6-3, а также к разд. 2-6,Б и 2-6,В).
а) СН3С = ССН3
б) СН3С = СН
в) CH3CH3CsCCH,CH3
г) HCssC—СЦ=СН—С^СН (ч«с и транс)
Д) (СНя)8Сг
8-4. Ацетилен
В промышленном масштабе ацетилен (этин) получают путем гид-
ролиза карбида кальция СаС2 или (с низким выходом) путем высоко-
температурного крекинга, а также при частичном сгорании нефтя-
ных газов (например, метана). Карбид кальция получают по реак-
ции окиси кальция с углеродом при температурах около 2000 °C
2000 :с
СзО + ЗС
CaC;+CQ
242
ГЛАВА 8
и разлагают водой (действующей, как кислота); получая ацетилен
и гидроокись кальция
СаС2-'-2Н2О —, НС —СН-}-Са(ОН)2
Не все карбиды металлов дают при. гидролизе такие же продук-
ты. Карбид алюминия реагирует с водой с образованием метана и
гидроокиси алюминия, тогда как карбид магния дает смесь аллена
(пропадиена-1,2) и пропина, а также гидроокись магния
АЦСз-Ь 12НаО —ЗСН44-4А!(ОН)3
н н
Mg2C34-4HaO —* >С^С=С< +CH3C=CH-J-2Mg(OH)s
Н/ хн
Ацетилен гораздо менее устойчив в отношении распада на эле-
менты, чем этилен или этан:
НСгаэСН(газ) —> 2С (тв.)Д-Н2 (газ)
Н2С = СН2 (газ) —» 2С (тв.)4-2Н3 (газ)
Н3С—СН3 (газ) —>- 2С (тв.)4-ЗН3 (газ)
Д Я——54,2 ккал
ДЯ==—12,5 ккал
&Н = 4-20,2 ккал
Взрывное: разложение ацетилена на углерод и водород может
произойти при сжатии газа До давления в несколько десятков ат-
мосфер. Осторожность должна соблюдаться даже при работе с
жидким ацетиленом (т. кип. —83 °C). В промышленности ацетилен
не подвергают действию высоких давлений, если только он не
смешан с инертным газом и не находится в реакторах с минималь-
ным свободным объемом.
Для транспортировки сжатого ацетилена применяются трубы
большого диаметра, которые часто заполняют металлическими
прутьями для уменьшения свободного объема. Ацетилен, применяе-
. мый для сварки, растворяют под давлением 14 ат в ацетоне (СНЯССНО,
О
т. кип. 56,5 °C) и хранят в баллонах, заполненных кизельгуром.
Сгорание, ацетилена в чистом кислороде дает пламя с темпера-
турой 2800 °C- Интересно, что температура ацетиленового пламени
выше, чем температура, развиваемая при горении этилена и этана,
хотя теплота сгорания ацетилена значительно ниже, чем у этих уг-
леводородов. Более высокая температура ацетиленового пламени
по сравнению с пламенем этилена или этана обусловлена тем, что,
несмотря на меньшую теплоту сгорания, теплоемкость продуктов
5
С2Н2 (газ)у О2 (газ)~+2СО2 (газ)4-НгО (жидк.) ДЯ——311 ккал
С2Н4(гаэ)4-ЗОа(газ)—>2СО2 (газ)4-2Н2О(жидк.) ДЯ==—337 ккал .
7
С2Нв (газ) 4--^- О2 (газ) —2СО2 (газ) 4- ЗН2О (жидк.) АН — —373 ккал
относительно невелика; образуется меньшее количество * воды и
меньшая часть теплоты реакции затрачивается на то, что чтобы до-
вести температуру продуктов сгорания до температуры пламени.
АЛКИНЫ
243
8-5. Реакции присоединения к алкинам
Алкины ведут себя в некоторых отношениях как типичные не-
насыщенные соединения с двумя двойными связями. Например,
бром присоединяется к ацетилену в две стадии: на первой образует-
ся транс-1,2-дибромэтилен (ацетилендибромид), а конечным про-
дуктом является 1,1,2,2-тётрабромэтан (ацетилентетрабромид)
Вг Н< /Вг Вг
НСваСН -Х /С=с/ -4 СНВг2—СНВг,
Вг/ хн 1. 1г2, 2 тетрабром-
. транс-], 2-дибром- , ^таи* ....
• . этилен {ацетилентетрабромид)
(ацети лен дн б ром и д)
Алкины быстро взаимодействуют с перманганатом калия, при-
чем окраска исчезает и образуется двуокись марганца. Безводный
фтористый водород присоединяется к тройной связи ацетилена с об-
разованием фтористого винила и в качестве конечного продукта —
1,1-дифторэтана.
HF HF
HCsaCH —* H2C = CHF—>СНа—CHFa
внивлфторид
Вода присоединяется к ацетилену в присутствии серной кислоты
и сульфата двухвалентной ртути *. Продукт присоединения к аце-
тилену-одной молекулы воды неустойчив и перегруппировывается
в карбонильное соединение• —ацетальдегид
н so. /й 1 /Р
СН = СН4-Н2О ——> СНа = С< —* СН3—Cf
Hgso4 [ XOHJ ХН
виниловый спирт ацетальдегид
(неустойчив)
В случае алкилзамещенных ацетиленов присоединение воды
всегда происходит в соответствии с правилом Марковникова
Г ОН ’I О
СН3—C sCH-J-H2O —|_СН3 —i=CH2_ —Н снэ—с—снв
пропин HgSO. ацетон
Ацетилен димеризуется при действии водного раствора хлорида
одновалентной меди в аммиаке. Эта реакция формально аналогична
димеризации изобутилена под действием серной кислоты (разд. 7-9,
Б), однако механизм ее подробно не исследован.
- ' , II
2НС а= СН -Cu (NHa)?CI^ К\с—i—С - СН
Н< бутепмн
(винилацетилен)
* Реакция М. Г. Кучерова.— Прим. ped.
244
ГЛАВА 8
Ионы меди, ртути и никеля часто оказываются специфическими
катализаторами для реакций алкинов—возможно, вследствие их
способности образовывать с тройной связью комплексы, сходные с
теми, которые описывались ранее для случая -галогенов и алкенов
(разд. 7-4,В). Образование таких комплексов вызывает увеличение
растворимости алкинов в воде в присутствии ионов металлов.
Hg2®
Р—С =; С —R-R Hg“® —R—С ic-R
В некоторых реакциях, например в реакций гидратации, соеди-
нения со связью металл — углерод, образующиеся путем присое-
динения к тройной связи, могут быть важными промежуточными
веществами
tgHSO, HgHSOa н
нс® CH + HgHSO©—* H-cic-H—'/С=с/
-н® н с>Н
н®
-HgHSO®
Н. ZH
>с=с/
н/ Х)Н
HgHSO4
о Н1
н-с---с/
) Хн -HgHSO©
И “4
Алкины, подобно алкенам, реагируют с гидридами бора, присое-
диняя ВН3 по тройной связи углерод— углерод (разд. 7-7). Напри-,
мер, для бутина-1
СН3СН3—С ® С— Н+ >В - Н
Rz
СН3СН2
Н
первоначально образуется моноалкенильное производное бора, при-
чем направление присоединения для алкипа-1 не соответствует пра-
вилу Марковникова, Дальнейшее присоединение может происхо-
дить по двойной связи моноалкен ильных производных бора, одна-
ко если R2BH (или RBHJ содержит объемистые группы R, как-,
например, в соединениях I и II, то пространственные препятствия
затрудняют вторую реакцию присоединения и реакция может при-
АЛКИНЫ
245
водить к хорошим выходам моноалкенильной группы,
н
ф f щ
(CH;0hN-B^C(CH3)9
А
трти-ти лам ин - трет -б утнл борли (If)
Н
СН3СН2С = СН + (СН3)^1—В®—С(СН8)3
н
—> (CHa)3N + (СН3СН2СН =СН)аВС(СНв),
трат-бутилди-(бутен-1-ил (бор (65%)
НВС СНЙ\
Н-£~С- \вн
X Н3С Н /а
Ли-(3-мет1тл-2-буП)л.'боран (I)
бутин-I
(CHj)4O
60 °C
Реакций такого типа особенно важны для синтезов, поскольку
моноалкенильные производные бора могут быть окислены щелоч-
ным раствором перекиси водорода в альдегиды (если в исходном ал-
кине тройная связь находится на конце цепи) или в кетоны (если
тройная связь неконцевая).
Йч /й н,о„ §н
С4НвС а=5СН4- >В —НС4Н0—СН = СН—В< ----—>
й/ хй
—> {С(Н9—СН = СН—ОН] —+ С4Н„СН2СНО
к-гекса льде гид (88%)
йч в,о„
СДОе ССаН6+ >В — н—>С,Н6СН = СС2Н6-----------------
гекснн-3 R' I
/вч
й/ ХЙ
C2HsCH=CCaH&'
он
о
II.
—► с8н6снсс2н6
гексанон-3
Моноалкенильные производные бора легко реагируют с уксус-
ной кислотой в мягких условиях, образуя алкеньй Весь этот про-
цесс полностью стереоспецифичей, поскольку дизамещенные аце-
тилены дают только цис-алкены. Очевидно, что гидрид бора присое-
диняется к тройной связи цис-способом и образующийся моноал-
кенилбор реагирует далее с кислотой, образуя цмс-алкен.
СН,СНг R R
с—.——в
ill + I
С.....н
СН3СНг
R
СН3СН2 в.
хс
СН3СНг Н
СН^СОгН
' оч; *
сн3сн2/н
хс
д
СН3СНг н
гексин-3
йис-гексен-3 (90%) .
246
ГЛАВА 8
Упражнение 8-3. Покажите, каким образом каждое из приведенных ниже со-
единений может быть синтезировано из указанных исходных веществ и необходи-
мых неорганических реагентов. Приведите условия реакций, назовите наиболее
важные побочные процессы и оцените практическую целесообразность разделения
смесей изомеров.
у СНЭч /СНз
а) СН2 = СН—С=СНа из ацетилена д) С = С из бутина-2
' ц/ ХН
б) CH3CFHCH2Bt из метил ацетилена
в) СН3СН2СОСНЭ из бутина-1
г) CHgCHjCHnCHO из бутина-1
СН3СН2х н из бутана-1
3 / и дейтеро-
е) С = С уксусной
н/ кислоты
н U (CH3CO2D)
8-6. Кислые свойства алкинов-1
Характерной для ацетилена и алкинов-1 является реакция об-
разования солей (или ацетиленидов) при действий очень сильных
оснований: эта реакция имеет важное синтетическое значение,
В таких реакциях алкин проявляет свойства кислоты (в том смысле,
что он отдает протоны достаточно сильным основаниям).
Ф © жидкий NH, Й©
R —С = С1Н4-К = МН: , —с S C:K4-:NH3
(К~Н или а лк к л) ацетиленид
калия
Основные свойства воды слишком слабы, чтобы она могла при-
нять протон от алкина, и вследствие этого в разбавленных водных
растворах ионизация алкина не происходит в такой степени, чтобы
создать измеримую концентрацию ионов водорода. Едкое кали,
практически не содержащее воды, превращает в значительной сте-
пени ацетилен в ацетиленид калия, однако превращение происхо-
дит гораздо более эффективно при действии амида калия в жидком
аммиаке,
В табл. 8-2 приведены приближенные значения констант диссо-
циации для ряда веществ, обнаруживающих свойства кислот. Ес-
тественно, что соли наиболее слабых из этих кислот, имеющих кон-
станты диссоциации, значительно меньшие, чем константа диссоциа-
ции воды (10-1С), будут практически полностью гидролизованы в
водных растворах.
К® А©4-НйО НА+ КФОН©
Следовательно, равновесие ионизации для очень слабых кислот
должно определяться в растворителях, обладающих менее кислот-
ными свойствами, чем вода, таких, как аммиак, простые эфиры или в
АЛКИНЫ
247
Таблица 8-2
Приближенные значения констант Диссоциацйи КА для различных кислот
« Соединение
НС1О4 > 1 СП»
* Z0
СНзС,^ Х)Н (протон группы ОН) 2-10-5
Н2О : ю-10 6
СН3СН2ОН (протон группы ОН) 10^18
н-с«е- -Н J0-S3
nh9 I0-8S
Н. ‘ / Н
н/с=с< Н — 10-«
сн3-сн8 < ю-«
а Константы Диссоциация относятся к водному раствору независимо от того, нзме-
римы лД они в действительности в этих условиях, и являются кд «ста «там и реакции
НА +Z* Н®+А® КА =[.Н®] [A®J/[HA]
НгО
6 Константа диссоциации, приведенная здесь для воды, является обычным значением
ионного произведения [HJ [О Н]= ] 0 ~|4, поделенным ha концентрацию боды в чистой
воде (55 М). , _ , .. . ...
некоторых случаях даже углеводороды, Обычно не удается найти
растворитель, в котором очень слабые кислоты (Кл<10“211) были
бы диссоциированы в сколько-нибудь существенной степени, поэто-
му константы подобных кислот (например, НА£ и НА2) определяет-
ся одна относительно другой путем установления положения равно-
весия следующего типа:
HAj + K^A® ZZT К®А^-рНА»
Такие измерения относительных кислотностей, проведенные в со-
ответствующих растворителях, позволяют для последовательных ря-
дов кислот установить приближенные, костанты диссоциации, даже
в случае чрезвычайно слабых кислот, совершенно аналогично тому,
как если бы их можно было определить непосредственно в водном
растворе.
Упражнение 8-4. Константа диссоциации ацетилена как кислоты (Кл) равна
приблизительно 10"аа.
а) Вычислите концентрацию адетилеиид-иона, которую можно ожидать для
0,01 М раствора ацетилена в 14 М растворе едкого кали (в предположении, что рас-
творы идеальные).
б) Предложите практический, метод (или методы), который, по вашему мне-
нию, должен быть пригоден для экспериментального определения приближенного
значения КА ацетилена, имея в виду, что К а в°Ды равна приблизительно 10“’s.
в) Можно ли ожидать, что HC=N будет более сильной кислотой, чем ацети-
лен. Почему? ...
248
ГЛАВА В
Ацетилен обладает менее кислыми свойствами, чем вода, но он в
101а раз более сильная кислота, чем аммиак, и по крайней мере в
1018 раз сильнее как кислота, чем этилен или этан, Большая кис-
лотность ацетилена и алкинов-1 по сравнению с другими углеводо-
родами находит простое объяснение при учете отталкивания между
электронной парой связи С—Н и другими электронами атома угле-
рода (разд. 5-7). Сравним С—Н-связи в ацетилене и алкане. Прежде
всего заметим, что шесть электронов тройной связи ацетилена за-
ключены в пространстве между двумя ядрами атомов углерода.
В результате эти электроны располагаются в среднем дальше от
электрон ной пары С—Н-связи, чем шесть электронов насыщенного
тетраэдрического углерода.
Поэтому можно ожидать меньшего отталкивания между элект-
ронной парой связи С—Н и другими шестью электронами углерод-
ных атомов в случае ацетиленовой связи С—Н по сравнению с на-
сыщенной связью С— Н. Далее, электронная пара связи С—Н в
ацетилене оказывается сдвинутой ближе к ядру углерода, чем в
случае насыщенного углеродного атома, и вследствие этого водород
становится более положительным и способным легче отрываться
при действии акцептора протонов, чем водород в алкане.
В количественном отношении значительно большую кислотность
ацетилена по сравнению с алканами легко понять, вспомнив, что
электростатические силы обратно пропорциональны квадрату рас-
стояния. Небольшой суммарный сдвиг электронов вызовет значи-
тельный электростатический эффект ня том коротком расстоянии,
которое соответствует диаметрам атомов.
Второе (в сущности очень сходное) объяснение более кислых
свойств алкинов-1 по сравнению с алканами основывается на опи-
сании С—Н-связей с помощью атомных орбиталей (разд. 5-5,В),
Чем большим s- и чем меньшим р-характером обладает зр“-гибриди-
зовапная орбиталь, тем в большей степени форма этой орбитали
приближается к сферической; в последней электроны располагаются
относительно ближе к ядру и удерживаются относительно более
прочно. Вследствие этого можно ожидать, что электронная пара свя-
зи С—Ы алкина-1 должна быть в большей степени сдвинута в сторо-
ну ядра углеродного атома по сравнению с парой электронов связи
С—Н в алкане, поскольку s-характер С—Н -связи в алкине больше,
чем в алкановой С—Н-связи (связь с водородом образуется в алки-
нах-1 sp-орбиталью углерода, а в алканах — зр3-орбиталью углеро-
АЛКИНЫ
249
да). Соответственно сдвиг электронов в направлении углерода вы-
зывает относительное увеличение кислых свойств водорода в =СН.
Простой и удобной пробой на тройную связь, при которой имеет-
ся атом водорода, служит реакция с аммиачным раствором серебра.
Ацетилены с концевой тройной связью дают твердые ацетилениды
серебра, тогда как дизамещенные ацетилены не вступают в реак-
цию. В ацетиленидах серебра связь углерод — металл имеет, по-
видимому, в значительной степени ковалентный характер, и эти
соединения в действительности не являются истинными солями,
подобно ацетиленидам кальция, натрия и калия.
. R„CssCvH4-Ag(NHs)3 —> R-C = C-Ag + NH3+®H4
* (R = H или алкил} ацетиленид
серебра
г
Аммиачные растворы серебра можно использовать для осажде-
ния ацетиленов с концевой тройной связью из смесей с дизамещен-
ными ацетиленами.
Монозамещенные ацетилены легко регенерируются из осадка,
содержащего серебро, при действии минеральных кислот. Следует
иметь в виду, что ацетилениды серебра в сухом состоянии чрезвы-
чайно чувствительны к удару и могут разлагаться со взрывом.
Дополнительные упражнения
8-5. Напишите структурные формулы каждого из перечисленных ниже соедине-
ний. Приведите возможные геометрические изомеры.
а) циклопропендибромид
б) гексадиен-2,4
в) циклооктин
г) дибром ацетилен
д) гексадиен-1,5-ин-З
8-6, Используя таблицу энергий связей (гл. 3), вычислите значения ДЯ для сле-
дующих реакций в газовой фазе при 25 °C:
а) НС зСНфВга сНВг = СНВг г) СН2=СНОН\—* СН3С^
б) СНВТ=СНВг-(-Вг2—*СНВг2—СНВг2
в) нс„сн+нго-+ СНа = СНОН
д) 2НС СН —>
Н2С=СН—СэСН
е) СНЧ —CesC — Н—*
—> сн3=с=сн2
ж) Рассчитайте также значение 5Н для реакции (е), исходя из эксперимен-
тально найденных значений.Дй приведённых ниже реакций;
СН3С^СН4-2Нг —► СН3СН3СНа Д//>= — 69,7 ккал
сн2 = с = СН2 4~2Н2 —* СН3СН3СНа &И = — 71,3 ккал
Объясните, почему значение ДЯ, вычисленное на основании энергий связей,
может оказаться для последней реакции ненадежным.
8-7. Предложите механизм гидратации пропина, включающий промежуточное
образование оксимсркурзамещенного пропена (разд. 8-5). Можно ли ожидать, что
структура конечного продукта гидратации будет соответствовать правилу Мар-
ковникова? Если да (или нет), то почему?
250
ГЛАВА 8
8-8. Рассчитайте максимальные температуру и давление, которые могут быть до-
стигнуты при взрыве в условиях постоянного объема 1 моля ацетилена, находив-
шегося первоначально при 25 °C и 10 ат давления. Реакция приведена ниже.
HCsCH (газ) —*2С (тв,)4-Нг (газ) ' ,Д#= —54,2 ккал (25°С)
Примите, что вся теплота реакции идет на нагревание продуктов взрыва и что
этотребуетбкал- г-1-град-' для нагревания С (тв.) и (6,5-{-0,009 Т) кал- моль_1Х
Хград-тдля нагревания водорода, где Т — абсолютная температура. Подробно
опишите ваш метод расчета.
8-9. Производное ацетилена типа RC=CH реагирует со щелочным раствором
хлорноватистокислого натрия, образуя хлорацетилены R—Cs=C—CI.
а) Напишите механизм этой реакции хлорирования.
б) Можно ли ожидать осуществления аналогичной реакции в случае этилена
или этана? Почему?
8-10. Предположим, что вы имеете четыре сосуда (без этикеток), причем каждый
нз сосудов содержитодно из следующих соединений: н-пентан, пентен-1, пентин-2
и пентин-1. Объясните, какие простые качественные пробы (желательно проби-
рочные реакции) вы используете дал идентификации содержимого каждого
сосуда (имейте в виду, что все четыре соединения — низкокипящие жидкости),
8-11. Каким образом вы можете различить соединения в каждой из приведенных
ниже пар, используя: I) химические пробы (желательно пробирочные реакции) и
2) спектральные методы.
а) СНЭСН2С = СН
б) СН3СН3С в СИ
в) сенвС= сс,н8
г) CHaCz^CCHfCHg),
и СНаС!=ССН3
и СНг = СН—СН=СН.
и С6Н5СН2СН2С0Н;,
и СН3СН2С =ССН^СН;
ГЛАВА
МЕТОД РЕЗОНАНСА
И НЕКОТОРЫЕ ЕГО
ПРИМЕНЕНИЯ.
МЕТОД МОЛЕКУЛЯРНЫХ
ОРБИТАЛЕЙ
Теория строения в органической .химии возникла и развивалась на
основе представления о тетраэдрическом строении углеродного ато-
ма. Она получила мощный стимул для своего развития в электронной
теории валентности, основные положения которой рассматривались
в гл. 5. Теперь можно выражать строение большого числа органичес-
ких соединений с помощью простых схем, описывающих связи; они
легко могут быть преобразованы в трехмерные модели, отвечающие
разнообразию молекулярных свойств. Однако существует большое
число соединений, для которых обычная структурная теория не дает
исчерпывающего описания, поскольку используемые структуры не от-
ражают в достаточной мере действитёльноео строения молекул.
В ряду таких соединений особое место занимают ароматические уг-
леводороды, или арены, и в частности бензол СеНв) который заслу-
живает наибольшего внимания. Несмотря на то что эти соединения
напоминают полисным том отношении, что они содержат меньше
(2п+2)/п атомов водорода на атом углерода, их химическая устой-
чивость приближается к устойчивости алканов.
Попытки увязать структуру аренов с их реакционной способ-
ностью (или с ее отсутствием) заставили классическую структур-
ную теорию исчерпать все свои возможности и в сущности, завели
ее в тупик. Возник новый подход, который, постепенно развиваясь,
привел к созданию метода резонанса; применение последнего позво-
лило с успехом преодолеть многие существовавшие ранее трудности.
Этот метод имеет также то достоинство, что в его основе лежат
простые схемы связей. В данной главе после рассмотрения некоторых
аспектов образования химической связи для очень простых молекул
будет качественно описан метод резонанса, а также некоторые его
252
ГЛАВА 9
применения к вопросам стабильности, реакционной способности и
спектров органических соединений.
Альтернативный способ описания и предсказания строения и
свойств органических соединений,_ метод молекулярных орбиталей,
кратко рассмотрен в этой главе и описывается более подробно в гл. 28.
9-1. Связи., образованные двумя
электронами
Энергия типичной связи между двумя атомами (Y : Y), образо-
ванной двумя электронами, сильно зависит от межъядерного рас-
стояния, как показано на рис. 9-1. Минимум на кривой соответству-
ет нормальной равновесной длине связи (г<.) и энергии связи (£>г)
для стабильной нёвозбужденной молекулы Y—Y. На значительно
более коротких расстояниях энергия очень быстро возрастает вслед-
ствие отталкивания между ядрами, а на значительно больших рас-
стояниях энергия системы приближается к энергии двух вполне сво-
бодных атомов. Расстояние ге, соответствующее длине связи при
минимуме энергии, возрастает с увеличением атомного номера для
элементов одного периода периодической системы, по мере того как
размер атома становится больше. Оно уменьшается для элементов
одного ряда периодической системы, по мере того как электроотри-
цательность атомов возрастает и электроны внешних оболочек при-
тягиваются к ядру все сильнее. При прочих равных условиях, чем
прочнее связь, тем короче должно быть Причина заключается
в том, что, чем прочнее связь, тем в большей степени силы притяже-
ния преобладают над силами отталкивания между ядрами, в резуль-
тате чего ядра могут располагаться ближе друг к другу. В случае
связи между углеродными атомами г, обычно лежит между 1,20 и
1,55 А, и если рис. 9-1 (или подобный ему) отнести к связям между
атомами углерода, то не следует ожидать значительного образова-
ния связей при межъядерных расстояниях, больших чем 2 А.
Помимо электростатического отталкивания между атомными яд-
рами, в простой молекуле Y : Y существует также отталкивание
между двумя электронами, образующими, связь. Каким образом в
таком случае вообще можно объяснить образование связи между от-
дельными атомами Y-? Можно утверждать, что энергия, необходи-
А
Рис. 9-1. Кривая потенциальной Энер-
гии для двухатомной молекулы Y—Y.
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕИ
253
мая для образования связи, возникает вследствие притяжения меж-
ду электронами и ядрами следующим образом. Электроны, участ-
•вующие в образовании связи между двумя ядрами, расположенными
на расстоянии, близком к ге (рис. 9-1), эквивалентны и неразличи-
мы. Это означает, что нельзя рассматривать какой-либо из них при-
надлежащим данному атому в большей степени, чем другому. Зна-
чение спаривания электронов состоит в том, что оно предоставляет
каждому из них максимально возможную свободу движения по ор-
биталям двухатомной системы вместо «локализации» на отдельных
атомах (разд. 5-2). Квантовомеханические расчеты указывают нд_то.
что свобода..движения электронов является -Чрезвычайно важным
Фактором,-.Это видно из того, что пять шестых энергии связи в. моле-
куле водорода может быть отнесено .за счет делокализации электро-
нов между двумя ядрами. Данная глава посвящена в основном рас-
смбтренТПО-Проблем, возникающих в связи с существованием чрез-
вычайно большого числа соединений, в которых электроны делока-
лизованы по более чем двум атомам, и в соответствии с представле-
нием о происхождении энергии образования связей такие молекулы
обладают дополнительной стабильностью сверх той, которую можно
было бы ожидать для молекул с той же геометрией, но таких, где
электронные пары связаны только с двумя атомами,
9-2. ' Проблема бензола
Бензол представляет собой наиболее яркий пример молекулы,
в которой делокализация электронов имеет важное значение, и, по-
скольку нельзя распределить все его электроны попарно между свя-
зями, соединяющими отдельные ядра, оказывается невозможным
написать для него такую структуру с обычными связями, которая
находилась бы в соответствии с его реакционной способностью и
формой его молекулы. Для того чтобы полностью оценить проблемы,
связанные со строением бензола, необходимо познакомиться с его
свойствами.
Согласно данным рентгеноструктурного анализа и спектральных
измерений, бензол представляет собой плоскую молекулу, в которой
шесть углеродных атомов объединены в правильный шестиугольный
цикл, причем расстояния между атомами равны 1,397 А. Шесть ато-
мов водорода, связанные по одному с каждым из углеродов, лежат
на радиусах, направленных от кольца, причем расстояние до коль-
ца составляет 1,09 А. Все углы Н—С—С и С—С—С равны 1203.
Н Н
/-1,09 А
н-с 1м° с—н
V—сА-------1,397 А
l/ Н
254
ГЛАВА Я
В этой формуле все валентные электроны каждого из углеродных
атомов, кроме одного, входят в состав связей, каждая из которых
образована двумя электронами; Возникает вопрос, имеющий чрез-
вычайно важное значение: следует ли рассматривать оставшиеся
шесть электронов локализованными в парах, как в классической
структуре «циклогексатриена», предложенной для бензола Кекуле
в 1865 г.? На этот вопрос следует ответить отрицательно, поскольку
такая структура не согласуется со свойствами бензола.
предложенное Кекуле изображение
бензола как циклогексатриена-1,3,5
Так, если свойства бензола соответствовали бы ожидаемому для
циклогексатриена, то связи С—С не должны были бы иметь одина-
ковую длину и реакционная способность соединения была бы близ-
кой к реакционной способности гексатриена-1,3,5
сн2=сн —сн=сн -сн=сн2
Ни то, ни другое не имеет места. Так, гексатриен высокореакцион-
носпособен по отношению к широкому кругу реагентов, и его свой-
ства резко отличаются от поведения бензола при действии тех же
реагентов, как это иллюстрируется реакциями, приведенными в
табл. 9-1. Реагенты, которые обычно присоединяются (в темноте)
к двойным связям алкенов (например, НВг, CL, НОС), H2SOJ,
атакуют бензол относительно медленно, замещая водородные ато-
мы, но Не дают продуктов присоединения. Однако не; может возник-
нуть сомнение в том, что бензол действительно ненасыщен, по-
скольку он может быть прогидрирован (в более жестких условиях
по сравнению с простыми алкенами) в циклогексан и на солнечном
свету присоединяет хлор или бром, образуя 1,2,3,4,5,6-гексагало-
генциклогексан. Бензол атакуется также озоном, и продукты озо-
нирования оказываются теми самыми, образования которых следо-
вало бы ожидать, основываясь на структуре циклогексатриена Ке-
куле.
Большую стабильность бензола по сравнению с ожидаемой для
«классической»'структуры циклогексатриена-! ,3,5 можно оценить
полуколичественно по разностям между теплотами гидрирования
(или теплотами сгорания), наблюдаемыми для бензола и ожидаемыми
для циклогексатриена-1,3,5. При рассмотрении в первом приближе-
нии гидрирование циклогексатриена-1,3,5 должно приводить к вы-
делению в три раза большего количества тепла, чем гидрирование
циклогексана, поскольку в структуре Кекуле предполагается на-
Таблица 9-1
Сравнение свойств Бензола и гексатриена-1,3,5
нг/СН = СИх HCV.h-c.h^ch СН,=СН-СН=СН-СН=СН1 гекеатриен-1,3,5
> бензол :
реагенты | продукты | реагенты продукты
HNOs/H3SO4 ZHC=CH4 HNO3/HaSO4 Одновременные по-
нс< >c-no2 димеризаций и окне-
хнс-снх ление
нитробензол
Вг3 (необхо- /СН=СН< Вг2 (в СНС!3, Вг-СНа-СН = СН
дим бромид металлами а- Hog >С—Вг ^нс-сн^ ниже 13 °C) 'Вг—СНа—СН =(Ь
честв^ ката;- бромбензол 1,6дибромгексадиен•
лизатора; FeBre) - 2,4
Вг2 (на сол- Вгч zBr
печном све- >сн-сн<
ту; . Вг-СН< )СН- Вг >сн-сн<
Вг/ хВг гексабромциклогексан Н2/РЮ2 как снэ-сна-сн3
Н2/РЮ, в zCHa-CH24 сн/ /н2
качестве ка* катализатор сн8-сн2-^на
тализатара в XHs—СН/ в уксусной
уксусной циклогексан кислоте в те* «гексац
кислоте в те- чение 1—2 ч
чение 25 ч при 25 °C
при 25 °C или H2/Ni при
200 =С И 200 ат
Озон (О3) Триозонид Озон (Оа) Триозонид
l.Zn/H2O —-1 Zn/H3O
О. /О з хс-с/ н/ ХН + C4z и 1 X сч
глиоксаль О„ ZO
4-:2 Чс-с/ н/ хн
Малеиновый В темноте реакции не идет ,о сн>=сна
ангидрид уО НС—С/ 11 >0 СН „0
нс—с/ II >0 НС—С<£ : ^0 сЙ^н/^Х
нс-с<^ (в бензоль- II 1 >0
ном раство- сн снч /
Ре) ' Vh.2 ^0
продукт реакций Дильса—Альдера (см. гл. )0)
256
ГЛАВА 9
личие трех двойных связей, тогда как в циклогексене содержится
только одна.
сн2 сн2
н2с/\:н н2с/\:н2
Н1 гм +Н* мс йЯ=—28,6 ккал/моль
циклогексен циклогексан
сн сн2
нс/^сн н2с/\зна
и | + 3HS—* I | iff=3-(—28,6)=—85,8 ккал/моль
НС^СН HA^CHj
СН сн2
«циклогенсатриен-1,3,5»
В действительности при гидрировании бензола выделяется лишь
49,8 ккал, или на 36 ккал/моль меньше, чем ожидается для цикло-
гексатриена.
СН2
н2с/\сн2
СвНв4-ЗН2—► j | Aff=.—49,8 ккал/моль
бензол HjC^/CHj
сн2
Сходным образом теплота сгорания циклогексатриена Кекуле
(до жидкой воды), вычисленная из средних энергий связи, состав-
ляет 827 ккал/моль, тогда как экспериментально определенная теп-
лота сгорания равна 789 ккал/моль, что на 38 ккал/моль меньше
вычисленной для циклогексатриена. Эти 38 ккал можно назвать
энергией стабилизации бензола. Их часто называют также энергией
резонанса, но этот термин будет использоваться для той части ста-
билизации, которая является следствием делокализации электро-
нов (разд. 9-7).
СеНв (газ)-|- [5/2Оа (газ) —>- 6СО2 (газ)-|-ЗНаО (жидк.) iff — —789 ккал/моль
бензол
9-3. Атомно-орбитальная модель бензола
Ни одна из многих структур, предлагавшихся для бензола как
до, так и после Кекуле, не может считаться удовлетворительной..
Однако представление об атомных орбиталях позволяет дать для
бензола приемлемое описание. Каждый атом углерода в кольце мо-
жет рассматриваться как находящийся в состоянии з/Агибридцза-
ции и образующий три копланарных 5/г-гибридных о-связи с ва-
лентными углами, равными 120°. На образование трех связей (двух
С—С я одной С—Н) каждый углеродный атом затрачивает три из
МЕТОД РЕЗОНАНСА, МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
257
Рис, 9г 2. Атомно-орбитальная модель бензола, показывающая, каким образом
рг-электрон на каждом из углеродных атомов может быть спарен с р,-элекгро-
нами соседних атомов углерода.
четырех своих валентных электронов. Оставшиеся шесть электро-
нов углеродных атомов располагаются на р-орбиталях — по одно-
му у каждого атома углерода. Можно сконструировать три л-связи,
рассматривая перекрывание соседних р-орбиталей, занятых элект-
ронами с аптипараллельными спинами; каждая из образованных та-
ким образом связей должна быть сходной сл-связью в этилене (разд.
5-5,Б),
Однако особенность бензола состоит в том, что в нем л-электроны
могут быть полностью спаренными вдоль всего пути вокруг кольца
(рис. 9-2). Предпочтительнее поэтому считать, что в бензоле имеет-
ся шесть л-связей, и рассматривать л-систему как непрерывную,
где л-электроны должны быть связаны со всеми шестью углерод-
ным!! атомами в области над атомами цикла и под ними. Как упоми-
налось выше, делокализация электронов по всем шести центрам (как
в бензоле), приводящая к их неразличимости, должна давать более
стабильное распределение электронной плотности, чем любое дру-
гое, при котором электроны рассматриваются попарно локализо-
ванными между соседними углеродами (как в циклогексатриена
1,3,5).
9-4. Схемы спаривания электронов
(валентные схемы). Метод резонанса
Рассмотрим теперь строение бензола с точки зрения возможных
способов спаривания шести электронов в локализованных связях.
Использование атомных орбиталей сразу же приводит к двум эк-
9 № 1540
2Б8
ГЛАВА 9
вивалентным структурам Кекуле I и II. Структуры III, IV и V,
как можно видеть, также представляют собой возможные способы
спаривания электронов в плоском шестиугольном остове молекулы.
Ясно, однако, что эти последние структуры энергетически менее вы-
годны, чем структуры Кекуле, так как атомы С±—С4 (или С3—Св,
или С5—С„) отстоят слишком далеко друг от друга (>2А), для того
чтобы образование связи было эффективным (см. рис. 9-1). Пунктир-
ные линии между удаленными углеродными атомами в структурах
III—V имеют значение лишь постольку, поскольку они удовлетво-
ряют схеме спаривания. О таких линиях иногда говорят, что они
изображают «формальные» связи.
DI V
Согласно методу резонанса, отдельные схемы спаривания (ва-
лентные схемы) считаются вносящими вклад в реальную структуру
бензола. Величины вкладов должны быть такими, чтобы привести
’ к наиболее стабильной из всех возможных молекул с данной гео-
метрией. Бензол рассматривается как «гибрид» валентных схем I,
II, III, IV и V. Такие структуры часто называют резонансными струк-
турами; взятые порознь, они не представляют физической реаль-
i ности, и им нельзя приписывать независимое существование. Дей-
ствительно, энергия реальной молекулы меньше, чем энергия любой
I из вносящих вклад структур. Двусторонние стрелки (е->) между
j структурами используются для того, чтобы показать, что они изоб-
। ражают различные схемы спаривания электронов, но не различные
I соединения, находящиеся в равновесии.
! При использовании метода резонанса необходимо иметь в виду,
। что величина вклада, вносимого каждой из набора структур, должна
i отвечать степени образования связи, которая осуществлялась бы в
i том случае, если данной структуре соответствовала реальная моле-
j куда со своей геометрией.. Так, следует считать, что две формулы Ке-
| куле вносят равный и преимущественный вклад в гибридную струю
i гуру бензолЩ Их вклад равен, поскольку они энергетически экви-
! валентны, и преимуществен, так как они вносят в общее образование
' . связи гораздо больше, чем структуры III—V. Отсюда следует, что
। структуры III—V практически могут игнорироваться при рассмот-
рении свойств нормального состояния реальной молекулы бензола.
При использовании методе резонанса предполагают, что прост-
’ ранственное расположение атомов для всех резонансных структур)
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ 259
вносящих вклад в данный резонансный гибрид, совершенно одинако-
во, но схемы спаривания электронов различны. Вследствие этого
структуры III, IV и V нельзя считать эквивалентными бициклогек-
садиену (VI) (хотя бициклогекСадиен имеет такую же схему спари-
вания электронов), поскольку бициклогексадиен представляет со-
бой известную (хотя и неустойчивую) неплоскую молекулу, в которой
валентные углы и длины связей совершенно иные, чем в бензоле.
Структуры III, IV и V соответствуют чрезвычайно сильно искажен-
ной молекуле бициклогексадиена, в которой каждый из углеродных
атомов расположен в вершине правильного шестиугольника, а фор-
мальная связь занимает место простой связи углерод — углерод.
VI
Очевидно, что неудобно и трудоемко выписывать формулы резо-
нансных структур для того, чтобы показать строение резонансного
гибрида. Желательно поэтому использовать сокращенный способ
записи. Часто в тех случаях, когда связывающие электроны делока-
лизованы по нескольким атомам, вместо непрерывных линий исполь-
зуют пунктирные. Для бензола такой способ описания приводит
вместо структур I и II к формуле VII.
или
vn
Однако па практике в настоящее время для изображения бензо-
ла используют (желательно это или нет) одну из структур Кекуле
(I или II), полностью учитывая при этом, что все связи £—Сэквива-
лентны. В последние годы бензол часто изображают в виде шести-
угольника со вписанным в него кружком. Это на редкость простой
п удобный способ в случае самого бензола, но для многих других
углеводородов он оказывается бессодержательным и даже ведет к
9* -
260
ГЛАВА 9
ошибкам.
9-5. Дальнейшие замечания о методе
резонанса
Несмотря на искусственность концепции резонанса, она чрезвычайно полезна
при обобщении фактического материала органической химии. Важно понять, что
не было бы необходимости использовать метод резонанса, если бы располагали
практически применимым математическим методом решении точных и сложных
уравнений, описывающих распределение электронов и свойства молекул, содержа-
щих более одного электрона. В отсутствие строгого математического решения ме-
тод резонанса позволяет распространить идеи привычной нам теории валентности
на соединения, подобные бензолу, приближенно описывая реальную молекулу с
помощью всех валентных схем, которые могут быть для нее написаны. С каждой
схемой будут ассоциироваться определенные свойства. Если для соединения (на-
пример, этилена) можно написать только одну приемлемую валентную схему, то,
видимо, свойства молекулы будут соответствовать тем, которые, как подсказывает
опыт, должны быть присущи такой схеме. С другой стороны, если можно паписать
ряд таких схем, то свойства молекулы будут соответствовать не какой-либо одной
из них, а некоторому «наложению^ (суперпозиции) из всех — короче говоря, гиб-
рндной структуре; Однако такая суперпозиция ни н коем случае не приводит к
простому усреднению, как это можно видеть на примере энергий, которые для гиб-
рида всегда оказываются ниже, чем та энергия, которой следовало бы ожидать для
гипотетических молекул, соответствующих любой из отдельно взятых резонансных
структур.
Иногда говорят, что реальная молекула занимает по отношению к резонанс-
ным структурам то же положение, что мул по отношению к лошади и ослу. Эта ана-
логия неудовлетворительна, поскольку в ней для описания реального животного
приплекаются реальные же животные, тогда как метод резонанса использует для
описания реальной молекулы некоторые гипотетические системы. Более близкой
аналогией явилось бы описание реального животного путем сопоставления его с
животными заведомо мифическими, подобными единорогу, грифону, птице рух
и т. д. Имея в виду такой характер отношений, легко понять, каким образом ре-
альная молекула может иметь свойства, сходные с теми, которые можно было бы
приписать отдельным резонансным структурам; однако предположение о том, что
молекула осциллирует между отдельными структурами, было бы ошибкой.
Упражнение 9-1. Обсудите на каком-либо конкретном примере смысл и поло-
жительные стороны следующего утверждения: «Соединение X резонирует между
формами А иБ».
9-6. Правила применения метода резонанса
Обсуждение применимости метода резонанса к бензолу (разд.
9-3) можно свести к сравнительно сжатым рекомендациям, имеющим
общее значение'-для оценки свойств ненасыщенных систем:
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
261
1. Все резонансные структуры должны содержать одинаковое
число спаренных электронов и расположение атомов в пространстве
. для всех резонансных структур должно быть идентичным.. Если при-
сутствуют элементы с резко различными электроноакцепторными
свойствами, то следует также учитывать ионные структуры,
2. Относительные энергии различных структур оцениваются с
.учетом следующих факторов: а) энергий связей (считается, что фор-
мальные связи не вносят вклада в стабилизацию); б) степени откло-
нения от геометрически наиболее выгодного положения атомов,
-в) способности атомов к оттягиванию электронов (для ионных струк-
тур). Если известна геометрия реальной молекулы, то пространст-
венное расположение атомов во всех резонансных структурах можно
•принять совпадающим с ней.
3. Следует ожидать, что электронная стабилизация будет на-
ибольшёй в том случае, когда имеется две (или большее число).Экви-
валентных структур, обладающих наиболее низкой энергией. Пбг
этому естественно, что в том случае, когда для молекулы можно на-
писать две (или большее число) энергетически эквивалентные и об-
ладающие наинизшей энергией структуры, то её строение будет
наименее удовлетворительно описываться формулой, построенной
по обычным правилам валентности.
4, Если имеется только одна структура с низкой энергией, то в
первом приближении можно ожидать, что свойства резонансного
гибрида будут подобны свойствам “этой структуры.
А. Бутадиен-1,3 и циклобутен
Возможные схемы спаривания для бутадиена-1,3 и циклобутена
описываются формулами VIII и IX. Положение атомов в этих фор-
мулах приближенно соответствует конфигурациям, являющимся,
согласно данным эксперимента, наиболее устойчивыми. .
Vllia VTII6
262
ГЛАВА 9
Рис. 9-3. Различные конформации бутадиена-1,3; см. упражнение 9-2.
Эти соединения представляют собой физически различные струк-
турные изомеры, но не резонансные структуры, так как их геометрия
неодинакова. Для обоих соединений могут быть написаны две ва-
лентные схемы— Villa и VIII6 и 1Ха и 1X6. В случае бутадиена
структура VIII6 содержит формальную простую связь длиной около
4 А; следовательно, вряд ли эта структура внесет значительный
вклад в структуру бутадиена, строение которого, таким образом,
лучше всего описывается как Villa, Для циклобутена структура
ГХб совершенно неудовлетворительна, так как она соответствует
чрезвычайно сильно Искаженной молекуле бутадиена и должна по-
этому иметь слишком высокую.энергию. Наиболее правильным при-
ближенным описанием циклобутена является классическая струк-
тура 1Ха, но в действительности вследствие углового напряжения
в малом цикле молекула менее стабильна, чем следует из энергий
связей для классической структуры.
Упражнение 9-2. Оцените относительную стабильность реальных молекул бу-
тадиена для каждой из трех форм, приведенных на ряс. 9-3, С точки зрения прост-
ранственных эффектов и метода резонанса. Приведите ваши соображения.
Упражнение 9-3. Рассмотрите возможные резонансные формы для гексатрие-
на-1,3,5. Напишите структуру с пунктирными линиями, которая должна отра-
жать вклад различных форм.
Упражнение 9-4. Рассмотрите возможное значение- резонанса приведенного
ниже типа для циклобутена (подробно изложите вагин соображения).
СН2—СН сн3 сн
I II и +и„
сн2—сн ; сна сн
Укажите, каких отличий в геометрии можно ожидать для гибрида таких структур
по сравнению с геометрией, принятой для циклобутена.
I *ЛЫМ|*|
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТЛЛЕИ
263
Б. Акролеин
Акролеин (СНа=СН—СНО) хорошо аппроксимируется струк-
турами Ха — Хг
|-----------1
СНг=СН-СН=Ю : ч—* СНг-СН=СН-О : >
» «
Ха Хб
© ..© © ©
—Сн—О ф —“►* сн2~сн~сн-ю»
Хв Хг
Гибридная структура может быть сокращенно записана в виде
формулы XI, где ненасыщенность указывается частичными связями,
б© • 5© 2 6©
СНг~-СНи-^СН--Ю
XI
изображенными с помощью чередующихся штрихов и точек. Точки
означают, что структуры Хб и Хг вносят небольшой вклад в гибрид-
ную структуру и, следовательно, степень двоесвязности централь-
ной связи должна быть небольшой; Наибольший вклад вносит струк-
тура Ха, однако при наличии элементов, резко отличающихся по
тлсктроноакцепторным свойствам, особое внимание должно быть
уделено ионным структурам; вследствие этого структуры Хв и
Хг нельзя недооценивать. Они играют значительную роль при воз-
буждении молекулы энергией света, как будет показано ниже.
Структуры, где кислород положителен, а углерод отрицателен (ХПа
и XI16), для нормальной молекулы могут не рассматриваться, по-
скольку углерод значительно слабее притягивает электроны, чем
кислород.
© Ф © ф
СНг=С Н—СН—О; •++• С Щ—СН=С Н—О;
ХПб ХПа
t
невыгодные структуры
Упражнение 9-5. Дипольный момент пропионового альдегида СН3СН2СНО ра-
вен 2,73 Д (единип Дебая, разд. 6-7), тогда как для акролеина он равен 3,04 Д.
Соответствует ли эта разница гибридной структуре XI для акролеина (см. разд.
ti-7)? Приведите ваши соображения.
264
ГЛАВА 9 :
В. Карбоксилат~анион
/у
Классическая структура R—с<у
применяемая для изобра-
жения анионов К СО®, образующихся при реакциях карбоновых кис-
лот RCOaH с основаниями, неудовлетворительно описывает их стро-
ение. В анионе такого рода существуют особенно благоприятные
возможности для резонанса, поскольку для него можно написать
две энергетически эквивалентные схемы (ХШа и ХШб) и анион
описывается наилучшим образом как гибрид обеих структур:
ХШб
Дополнительные структуры XlVa и XfVo должны иметь меньшее
значение, поскольку они соответствуют электростатическому, а не
ковалентному характеру образования связи. Из этих двух структур
структура XlVa, несомненно, должна быть более выгодной, так как
в X1V6 одинаковые заряды расположены на соседних атомах и
полярность связи углерод — кислород обратна по отношению к
нормальной полярности.
XlVa XIV6
Упражнение 9-6. Напишите резонансные структуры, аналогичные XIII и XIV,
для енолят-анионаСНг=СН—О®. Оцените относительное значение этих структур
и напишите соответствующую гибридную структуру. Укажите наиболее вероятное
расположение атомов аниона в его наиболее стабильной конфигурации.
Упражнение 9-7. Напишите возможные валентные схемы, аналогичные XIII и
XIV, для фтористого винила СН2—CHF и укажите, больше или меньше будет ди-
польный момент фтористого винила по сравнению с дипольным моментом фтори-
стого этила. Приведите ваши соображения.
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
265
Г. Аллил-катион
Аллил-катион СН2=СН—СН^ относится к числу карбон иевых
ионов, имеющих очень важное значение. Этот ион может быть опи-
сан двумя эквивалентными структурами XVa и XV6.
© © "7.® ‘Л©
СН2 = СН —СН, СН,—СН=СН!—СН3 =01==^
XVa XV6
Следует поэтому ожидать, что аллил-катион окажется значитель-
но более устойчивым, чем карбониевые ионы, структура которых
хорошо описывается с помощью только одной классической формулы
(например, СН3СН^).Это действительно имеет место, поскольку ре-
акции, при которых образуются промежуточные соединения, имею-
щие характер катионов, обычно протекают гораздо легче в тех слу-
чаях, когда может образоваться катион аллильного типа, чем в слу-
чае образования этил-или я-пропил-катиона (разд. 7-5,Б).
Гибридная природа аллильного катиона служит также объяснением кажуще-
гося аномальным поведения сопряженных алкадиенов, например бутадиена-1,3,
при реакциях электрофильного присоединения. Так, бутадиене 1 молем хлора дает
как «нормальный» продукт 1,2-дихлорбутен-З, так и «аномальный» продукт 1,4-ди-
хлорбутен-2
СН,=СН-СН = СН,+С1,—>СНг-СН-СН = СНг+СН,-СН=СН—СН,
I I I I
С] С] Cl С]
Отношение количеств образующихся изомеров изменяется в зависимости от
условий реакции. В соответствии с механизмом, описанным для присоединения к
простым алкенам (разд. 7-4,Л), молекула хлора атакует одну из двойных связей
бутадиена, причем реакция происходит по стадиям, на первой из которых обра-
зуется катионоидное промежуточное соединение. Это промежуточное соединение
является стабилизированным замещенным аллильным катионом, строение кото-
рого описывается как гибрид структур XVIa и XVI6.
ci, Ф ®
СН8=СН-СН =СН8 —> С]СН2-СН — СН=СН2 ч->С1СНЕ-СН=СН-СНа
XVIa XVIa
или
в® е©
C!CH3-CH==^CH СН,
В результате оба атома углерода в положениях 2 и 4 обладают частичным
электронным дефицитом и у хлорид-иона имеется выбор — Либо атаковать С2,
образуя 1,2-д их лор бутен-3, либо Q, что приведет к 1,4-л ихлорбутену-2
С1СНг-СН=СН-СНгС1
],4-дихлорбуген-2
С1СНг-СН—СН=СНг
1,2-дихлорбутен-З
266
ГЛАВА 9
Бром и хлорноватистая кислота реагируют аналогично, образуя смеси про-
дуктов 1,4- и 1,2-присоединения
СНг = СН —СН = СН,—->
Вг,
------*-СН2 = СН —СН—СН2 + ВгСН2-г-СН=СН—СНаВг
__ t.r Вг
НОС!
------>СНа^СН-СН— CH2-i-HOCH2-CH^CH-CH2CI
<5)Н CI
Д. Циклопентадиенил-анион
Водородные атомы группы —СН2— циклопентадиена-1,3 об-
ладают кислыми свойствами; они оказываются значительно более
кислыми, чем ацетиленовые водороды в алкинах-1 (разд. 8-6). Это
означает, что циклопентадиен примерно в 103“ раз более сильная
кислота, чем обычные алканы. Объясняется Это тем, что потеря од-
ного из протонов группы —СН3— в циклопентадиене приводит к
образованию чрезвычайно стабильного аниона.
-н® .
' +н®
Строение этого аниона может быть представлено в виде резонанс-
ного гибрида плоти энергетически эквивалентных структур XVIIa—-
ХУНд. Неподелепная пара электронов делокализуется, таким обра-
зом, на пяти углеродных атомах. Можно ожидать, что такой дело-
кализованный анион окажется гораздо более стабильным, чем лю-
бая одна из эквивалентных делокализованных структур.
й
СН-СН СН=СН СН=СН ©СН-СН СНтСН
И А ©/ \ / \е А //
НСх , >Н •*+ НС: ^сн ** НС J.CH ** НС СН -- НС СН
сн СН ХСН СН 'сн"
XVIIa ' XV1I6 XVIIb XVlIr XVIta
НИИ
Учитывая успешное применение метода резонанса для объясне-
ния высокой кислотности циклопентадиена, может показаться уди-
вительным, что в циклопентадиенил-катионе такой стабилизации не
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
267
наблюдается. Для этого катиона можно написать пять резонансных
форм XVIlla—ХУШд, вполне подобных XVIIa—ХУПд, и тем не
менее этот катион оказывается настолько неустойчивым, что до сих
пор все попытки установить его существование (хотя бы в виде ко-
ротко живущего промежуточного соединения) не привели к успеху.
Причина состоит в том, что в циклических системах такого типа,
помимо делокализации электронов, чрезвычайно важным является
еще и другой фактор — общее число п-электронов. При наличии в
моноциклической сопряженной системе двух, шести, десяти, четыр-
надцати и т. д. л-электронов ее стабильность оказывается гораздо
больше, чем в аналогичных системах с четырьмя, восемью, двенад-
цатью ит. д. л-электронами. Следовательно, такие системы, как при-
целенные ниже, обладают относительной стабильностью.
число я-электроиов 2 6 6 6
В то же время ни одно из приведенных ниже соединений не спо-
собно к устойчивому существованию (за исключением последнего,
получить которое гораздо труднее, чем циклопентадиенил-анион).
число rt-электронов 4 4 4 8
Все эти факты затрудняют применение простого метода резонанса
в органической химии. v
Упражнение 9-8. Оцепите значение резонанса в приведенных ниже системах
(может оказаться полезным использование шарастержйевых моделей).
268
глава а
Н
б) нс^ \:н
I ' и
нсч .сн
ЧУ
н
сн
сн
НС
в} сн,=сн—о®«-»(?не—сн=о
СН ,С
\'хсн2 /
сн2-снг
• Л) СН
УХСНг «-> / \
<-Н2 СН,—СИ,
е) СНа ?Н2
chs—сн—^н2 *-> <!:н2—сн=сн2
F рб
। а
ж) F—С—О® «-> F—С = О
I I
F Г
9-7. Стабилизация и энергия резонанса
Выше было показано, что теплота сгорания бензола на 36—
38 ккал меньше, чем вычисленная для гипотетической молекулыцик-
логексатриена-1,3,5. Эту разность энергий называют энергией ста-
билизации (ЭС) бензола. Можно считать, что основная часть этой
энергии обусловлена тем фактом, что л-электроны в бензоле локали-
зованы в меньшей степени, чем следовало бы ожидать для циклогек-
сатриена-1,3,5. Стабилизация, обусловленная делокализацией элект-
ронов, может быть названа энергией резонанса (ЭР), однако стаби-
лизация и энергия резонанса не обязательно должны быть равными,,
поскольку стабилизация представляет собой суммарный результат
всех эффектов, как стабилизирующих, так и дестабилизирующих.
Значения ЭС, полученные из теплот сгорания, рассчитываются обыч-
но с помощью набора энергий связей, при получении которых пре-
небрегают различиями в' прочности связей, обусловленными их
окружением (ср. с разд. 3-6). Полагают, например, что первичные,
вторичные и третичные, винильные и ацетиленовые С—Н-связи
имеют одинаковые энергии; простые связи С—С считаются одинако-
выми независимо от того, простыми или кратными являются другие
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРВИТЛЛЕЙ
269
связи при рассматриваемых углеродных атомах; пренебрегают раз-
личиями в энергиях моно-, ди-, три- или тетразамещенных двойных
связей, а также часто встречающимся понижением энергий связей
вследствие пространственного напряжения (разд, 4-5,В). Энергии
связей могут применяться вполне строго только для таких молекул,
длины связей в которых имеют нормальную величину. Для бензола,
где связи С—С имеют длину, промежуточную между длинами обыч-
ных простой и двойной связей, по-видимому, не существует общего
согласия относительно того, каким образом учитывать длины связей
при вычислении энергии резонанса. Однако, несмотря на эти недо-
статки метода, энергии связей и, следовательно, энергии стабилиза-
ции можно использовать для качественных оценок значения делока-
лизации электронов в органических молекулах.
В табл. 9-2 и 9-3 приведены энергии стабилизации для ряда соеди-
нений, которые описываются наилучшим образом с помощью гибрид-
ных структур; легко видеть, что для этих соединений значения ЭС
настолько велики, что роль резонансной стабилизации не вызывает
сомнения. Структура многих соединений, приведенных в табл, 9-2,
сходна со структурой бензола, и, поскольку их стабильность
резко отличается от стабильности сопряженных полиенов с откры-
той цепью, химические свойства этих соединений обычно рассмат-
риваются отдельно от свойств полиенов. В соответствии с этим химия
таких соединений, называемых ароматическими, рассматривается
в основном в последующих главах этой книги.
В табл. 9-4 приведены энергии стабилизации ряда сопряженных
полиенов. Они существенно меньше, чем значения ЭС в табл. 9-2,
и нет уверенности в том, что в этих молекулах резонанс имеет боль-
шое значение. Может показаться удивительной малая энергия ста-
билизации в циклооктатетраене, поскольку естественно было бы
ожидать, что л-электроны будут делокализованы в восьмичленном
Рис. 9-4. Атомно-орбитальная модель п-электронной системы неилоского цикдо-
октатетраевд.
Таблица 9-2
Энергии стабилизации (или приближенные энергии резонанса),
вычисленные из теплот сгорания некоторых ароматических углеводородов
Соединение Структура (в общепринятом написании) Д««ЫЧИСЛ' ккал/моль й^набл нкал/моль ЭС, ккая/моль
Бензол |^| 827 789 38
Толуол 0 983 944 39
Бифенил >0 1597 : 1514 83
Бифенилен IX»; 1540 1481 59
Нафталин об 132J 1250 71
Азулен 1321 , 1279 42
Антрацен пзп 1816 1712 104
Фенартрен z\/0 00 1816 ; 1705 111
Пиридин 696 675 21
Анилин 865 824 41
Фенол О-он 789 749 40
а Вычислены воды, которая при 13 энергий связсйт приведенных нйтл равной [0 ккал/моль. и табл. 3-5, из теплоту испарения
Таблица 9-3
Энергии стабилизации производных карбоновых кислот, вычисленные
из теплот сгорания
Соединение Структура (в общепри- нятом написании) а/Чы<1йсл • ккал/моль ^набЛ’ ккал/моль ЭС. ккал/моль
Уксусная кислота О II сн3-с-он 238 220 18
Метил ацетат О 1! СН3-С-О-СНВ 404 389 15
Уксусный ангид- рид О О II II сн,-с-о-с-сна 467 44! 26
Ацетамид О II СНа—С— nh2 314 303 11
ДиметнЛкарбонат О II СНа —О —С-0 —сн3 375 350 25
Мочевина 0 II HaN —С-NHa 195 (72 23
а Вычислены из энергий связей, приведенных в табл, 3-5, п нэ теплоты испарения
воды, которая принята равной 10 ккал/моль.
Таблица 9-4
Энергии стабилизации, вычисленные из теплот сгорания
некоторых сопряженных полиенов
Соединение Структура л W ВЫЧНСЛ’ ккал/моль й^иабл' ккал/моль ЭС, ккал/моль
Бутадиен-1,3 сна=сн—сн=сна 608 608 —
Пентадиен-1,3 снв=сн— сн=снсн3 765 762 3
2-Метилбутади- снв=сн-с=сн, 765 762 3
ен-1,3 (изопрен) Цнклооктатетраец 1 Сп3 1103 1095 8
Бензохинон 677 672 5
272
ГЛАВА 9
цикле по крайней мере в той же степени, как в случае шестичлен-
ного цикла бензола. Однако данные электронографии и рентгено-
структурного анализа показывают, что циклооктатетраен не явля-
ется плоской молекулой — он имеет форму ванны или «трубы» с
чередующимися углеродными связями, имеющими длину 1,334 и
1,462 А. Поскольку в неплоской конформации (рис. 9-4) перекрыва-
ние р-орбиталей не может быть эффективным, сколько-нибудь зна-
чительная делокализация становится невозможной. По-видимому,
угловое напряжение в плоском кольце циклооктатетраена оказы-
вается слишком большим для того, чтобы его мог уравновесить
достигаемый при этом выигрыш энергии резонанса. Это может
рассматриваться как один из многочисленных примеров пространст-
венного подавления резонанса (при котором гибридная структура
имеет по пространственным причинам настолько невыгодную гео-
метрию, что резонанс делается невозможным). Помимо этого, уве-
личение стабилизации вследствие делокализации электронов долж-
но быть невелико, поскольку соединение представляет собой
сопряженную моноциклическую систему с восемью л-электронамн
(разд. 9-6,Д).
Упражнение 9-9. Вычислите энергии стабилизации приведенных ниже соеди-
нений из их теплот гидрирования и теплот гидрирования бутена-1 (30,3 ккал/моль)
и циклогексена (28,6 ккал/моль).
Соединение ДЯ (гидрирова- ние), ккал/моль Соеди иен не ДЯ (гидрирова- ние), ккал/моль
Бутадиен-1,3 Пентадиен-J ,3 Пентадйен-1,4 —57, i —54,1 —60,6 Цик логек саднен-1.3 Фенилэтилен (стирол) —55,4 -77,5
Можно ли полагать, что эти энергии стабилизации окажутся более надежными
чем те, которые получены из теплот сгорания? Объясните.
Упражнение 9-10, а) Экспериментальное значение —ЛЯ (25°C) для сгорания
газообразного цикло пента диен а-1,3 до жидкой воды и двуокиси углерода состав-
ляет 707,7 ккал. Вычислите из этого значения (и любых других необходимых энер-
гий связей) энергию стабилизации циклопентадиена. Поясните ваш метод. Рас-
смотрите вкратце затруднения, которые могут возникнуть при определении
энергии резонанса циклопентадиена и не возникают в случае бутадиена.
б) Рассмотрев геометрию возможных резонансных структур, приведите наи-
более обоснованную оценку значения резонанса в бутадиене-1,3 и циклопептадие-
пе-1,3.
Упражнение 9-11. Теплота сгорания бензола до жидкой воды составляет
789 ккал/моль. Вычислите энергии стабилизации бензола, находящиеся в соответ-
ствии: а) с энергиями связей. Приведенными в табл. 3-5, .и б) с энергиями связей,
приведенными в упражнении 3-10 (разд.3-6), в предположении, что энергия про-
стой углерод-углеродной связи (90,6 ккал), расположенной между двумя углерод-
ными атомами, образующими двойные связи =(i—(i=, на 8 ккал больше, чем для
обычной С—С-связи (см. разд. 3-6).
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРГ.ИТАЛЕИ
273
Задача настоящего упражнения состоит в том, чтобы показать, каким образом
на энергию стабилизации бензола оказывают влияние различия в энергиях связей
в том случае, если принимается, что последние зависят от характера гибридизации
углеродного атома, но выбираются таким образом, чтобы они находились в соот-
ветствии с теплотами сгорания алифатических соединений. !
Упражнение 9-12. Укажите причины, вследствие которых а) энергия стабили-
зации бифенилена меньше удвоенной энергии стабилизации бензола и 6} теплота
сгорания нафталина меньше, чем теплота сгорания азулена.
Упражнение 9-13. Вычислите теплоты следующих реакций (в газовой фазе при
25rfC), использовав энергии связей и значения энергий стабилизации, приведен-
ные в табл.'9-2 — 9-4, s
а) СН3СН2ОН+Оа —- СН3СО2Н + Н2О
б) СН3—С(ОСН3)34*2СН8СОгН —ЗСН3СОаСН3 + Н8О
О
II
в) 2СН3ОН+СОг — СНЯ-О—С—СН3+НаО
9-8. Длины связей и степень двоесвязности
Длины связей часто рассматриваются как подтверждение или свидетельство
против резонансной стабилизации в молекуле. Однако в этом вопросе должна со-
блюдаться некоторая осторожность. Например, если гибридная структура бензола
рассматривается как суперпозиция двух структур Кекуле, то каждая связь угле-
Таблица 9-~>
Длины простых у г лерод-углеродных связей
Тип связи Длина связи, A Тип СВЯЗИ Длина свяуи. A
sp3 — spa sp3—sp3
CHS—СН3 1,543 CHa —CH = CH-CH., 1,54
сна-снг-сн3 1,54 0
Алмаз 1,544 II СНЭ —C—CH3 1,52
sp3— sp СН3-С-СН 1,459 CH3-Q 1,52
z fl 1 z U El 1 и о 1 1 » я PC I 1,458 1,458 sp3—sp2 CH2=CH-CH=CHS 1,483
sp2 — sp H
CHa = CH-C®CH сна=сн—c=»n 1,446 1,426 CH3-CH = CH-C=O 0 0 1,46
O^CH-CsCH 1,445 II II
CHSC—CCHg 1.47
a sp—sp HCbC-Ce=CH Г ,379
HC^C-CsN 1,378
N = C—C —N 1.380
274
ГЛАВА 9
род — углерод должна быть чем-то средним между простой и двойной связями.
Другими словами, эти связи должны иметь на 50% характер двойной связи (иметь
50% двоесвязности). Таким образом, можно ожидать, что длины углерод-углерод-
ных связей в бензоле будут средним арифметическим между длинами простой и
двойной связей. Однако средняя величина между длинами С—С-св язей в этане
(1,543 А.) и в этиленеД 1,337 А) составляет 1,441 А, что заметно отличается от экс- -
периментально определенной длины связи С—С в бензоле, равной 1,397 А. Причи-
на расхождения кроется главным образом в сделанном при этом ориентировочном
расчете допущении, согласно которому в отсутствие резонанса все простые связи
С—С должны быть равны 1,54 А. Совершенно очевидно, что это допущение не обос-
новано, поскольку, как уже говорилось, энергии связей зависят от окружения, а
вследствие того, что существует зависимость между энергиями связей и их длинами
(см. рис. 9-1), последние также должны изменяться в зависимости от окружения.
Это можно видеть из данных табл. 9-5, где приведены длины простых углерод-
углеродных связей для ряда соединений. Простые связи становятся короче при
увеличении ненасыщенности других связей, образованных данным атомом угле-
рода, т. е. при изменении гибридизации углеродного атома от зр3 до зр. Можно
предположить, что в некоторой степени (но не полностью) это укорочение обуслов-
лено резонансом.
Упражнение 9-14. В кристаллах графита содержится углеродный скелет, со-
стоящий из плоских шестиугольных колец; эти плоские остовы лежат параллель-
ными слоями. Расстояние между плоскостями слоев равно 3,35 А, а все длины
С—С-связей в шестиугольниках равны 1,421 А.
а) Нарисуйте углеродный скелет графита.
б) Каково состояние гибридизации углерода в графите?
' в) Вычислите процент двоесвязности в графите.
г) Постройте график степень двоесвязности — длина связи для этилена, бен-
зола и графита.
д) Определите из этого графика длину простой связи между ар“-гибридизован-
иыми углеродами. Каково это значение по сравнению с длинами связей sp!— spa,
приведенными в табл. 9-5? Какой вывод можно сделать на этом основании относи-
тельно роли резонанса в бутадиене-1,3?
Упражнение 9-15. Нарисуйте возможные структуры типа структур Кекуле для
бпфецилспа (пять) h нафталина (три). Предполагая, что вклад этих структур может
быть одинаков, определите степень двоесвязности и длины связей для обоих соеди-
нений. Укажите, какие связи в этих углеводородах должны преимущественно ата-
коваться озоном.
9-9. Резонанс и спектры поглощения
Электронные спектры органических молекул кратко рассматри-
вались в гл. 2; напомним, что поглощение ультрафиолетового излу-
чения этиленом при длине волны около 1800 А. соответствует воз-
буждению одного из электронов двойной связи на орбиталь с бо-
лее высокой энергией (так называемый л—л*-переход). Рассуждая
упрощенно, можно было бы прийти к выводу, что для алкена с двумя
или большим числом двойных связей спектр поглощения будет схо-
ден со спектром этилена, но интенсивность его будет больше, по-
скольку число двойных связей увеличено. Это более или менее вер-
но для таких соединений, как пентадиен-1>4 (Н!!С=СН—СНВ—СН =
/ 'X \
=СНа) и 1,3-диметиленциклобутан Х=снг I
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
275
где двойные связи изолированы, но неверно для такихсоединепий, как
бутадиен-1,3 (СН2=СН—СН=СН.,) и стирол (\ СН ^СН2"),
которые содержат сопряженные двойные связи. В целом сопряжен-
ные системы поглощают свет при больших длинах волн и более ин-
тенсивно, чем сходные системы с изолированными двойными связями.
Например, в то время как этилен не поглощает выше 2000 А,
бутадиен-1,3 интенсивно поглощает при 2170 А. Отсюда можно сде-
лать вывод, что по крайней мере в отношении поглощения света со-
пряженные двойные связи в бутадиене не являются независимыми
друг от друга и возбуждение электронов при поглощении около
2170 А связ'ано с системой двойных связей в целом. Далее, посколь-
ку бутадиен поглощает при больших длинах волн, чем этилен или
пентадиен-1,4, различие энергий между нормальным и возбужден-
ным состояниями в нем должно быть меньше, чем в этилене или пен-
тадиене-1,4 *. Очевидно, что если возбужденный электрон в бута-
диене делокализован на четырех углеродных атомах вместо двух,
возбужденное состояние будет относительно стабильным, что дей-
ствительно имеет место. Энергия электронного возбуждения в слу-
чае бутадиена или любого сопряженного полиена сравнительно не-
велика, прежде всего вследствие резонансной стабилизации возбуж-
денного состояния.
Возникает вопрос: почему резонанс проявляется в большей сте-
пени в возбужденном состоянии сопряженного полиена, чем в его
основном состоянии, и какова гибридная структура возбужденного
состояния (или состояний)? Эти два вопроса очень тесно связаны,
но, к сожалению, для них трудно найти простое объяснение. За-
труднения возникают вследствие того, что нельзя выразить сколько-
нибудь точно структуру возбужденных состояний молекулы с по-
мощью обычных валентных схем. Однако из многих возможных схем
спаривания, которые могут быть написаны для бутадиена (три из
них — XIX, XX и XXI — приведены ниже), только одна — XIX —
имеет достаточно низкую энергию для того, чтобы вносить основной
вклад в нормальное состояние бутадиена,
© ® I..................—4
СНг=СН-СН=СНх CHjr-CH^CH-GHj СНг-СН=СНСНг
XIX XX XX)
Вследствие этого для основного состояния бутадиена резонанс
не иирает существенной роли. Тем не менее, когда молекула воз-
* Разность энергий &Е нормального и возбужденного состояний связана с
частотой (v, су1) поглощенного излучения выражением A£=/iv, где h — кон-
станта Планка; в свою очередь частота связана с длиной волны (X.. см) выраже-
нием v=c/A, где с — скорость света. Таким образом, возбуждение электронов при
низких частотах или больших длинах волн означает, что ДА' мало (т. е. что воз-
бужденное состояние близко к основному, или нормальному, состоянию).
276
ГЛАВА 9
Длина волны, А
Рис, 9'5. УФ-сиектры метил-
этилкетона (а) и метилвинилке-
тона (б) в растворе циклогекса-
на.
буждена настолько, что ее энергия становится ближе к энергиям
структур XX и XXI, чем к XIX, резонанс приобретает важное зна-
чение, поскольку структуры XX и XX], а также другие структуры
со сравнимой энергией могут теперь вносить существенный вклад
в гибридную структуру возбужденного состояния. Действительная
энергия возбужденного состояния оказывается при этом ниже, чем
энергия любой отдельно взятой структуры с высокой энергией.
Чем больше протяженность системы сопряжения, тем меньше
различие энергий между нормальным и возбужденным состояния-
ми. Так, в ряду дифенилполиенов СД15—(CH=CH)n—СвНе погло-
щение света происходит при все больших длинах волн по мере увели-
чения п, что проявляется в окраске этих соединений, которая изме-
няется от бесцветной (п=1) через желтую и оранжевую (п=2—7)
до красной (п—8) по мере возрастания длин волн при переходе от
ультрафиолетовой к видимой части электромагнитного спектра.
Резонанс в возбужденном состоянии пе ограничивается соединени-
ями g сопряженными.двойными связями углерод— углерод, посколь-
ку в спектрах соединений с сопряженными связями C=N и С=О
обнаруживаются аналогичные эффекты. В качестве иллюстрации
/ О \
на рис. 9-5 приведены УФ.-слектры метилэти л кетона XCH^CCH.>CHS)
7 ° \
и метилвинилкетона \,СН3ССН=СН2/ в области 2000—3500 А. Полоса
при 2770 А для метилэтилкетона обусловлена возбуждением элект-
рона одной из неподеленных пар кислорода (так называемый
я*-переход, см. гл. 2). В метил винил кетоне эта полоса сдвинута в
сторону больших длин волн (3240 А) и обладает большей интенсив-
ностью. В спектре метилвинилкетона имеется также интенсивное
поглощение при 2190 А, связанное с возбуждением одного из п-
электронов сопряженной системы /C = <i— С=О (т_ п—
переход). Аналогичная полоса для карбонильной группы метилэтил-
МЕТОД. РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
277
кетона не показана на рис. 9-5, поскольку, она расположена при бо-
лее коротких длинах волн (около 1850 А), которые находятся за
пределами рабочего диапазона использовавшегося спектрометра.
Сопряжение оказывает также влияние на инфракрасные спект-
ры поглощения. Полосы, связанные с валентными колебаниями свя-
.ей С=С и С--=О, при наличии сопряжения становятся более интен-
сивными и несколько сдвигаются в сторону меньших частот (боль-
ших длин волн) по сравнению с полосами для систем, где двойные
' вязи изолированы. Так, если бутен-1 (СНЭСН2СН=СН;,) погло-
тает при 1650 см-’ (см. рис. 6-1), то соответствующая полоса в бу-
тадиене. 1,3- (СЩ=СН—CH=CHJ расположена при 1597 см-’.
9-10. Теория молекулярных орбиталей
Метод молекулярных орбиталей стал в последнее время широ-
ко применяться вместо метода резонанса для качественного объяс-
нения и предсказаний свойств ненасыщенных систем. Основное по-
южение теории молекулярных орбиталей весьма просто и заключа-
। гея в том, что молекула описывается с помощью молекулярных ор-
тталей, обладающих различной энергией; метод при этом аналоги-
чин построению атомных орбиталей водорода.. Электроны далее
। '.(определяются по этим орбиталям в соответствии е энергиями ор-
। шталей и правилом Гунда (в тех случаях, когда есть основания для
' । о применения).
На практике молекулярные орбитали в целях построения луч-
ших моделей аппроксимируются линейными комбинациями атомных
орбиталей с центрами на различных ядрах. Такое построение назы-
вают линейной комбинацией атомных орбиталей (методом ЛКАО).
1(ля бензола может быть использован точно такой же набор атомных
орбиталей и о-связей, как в случае метода резонанса (разд. 9-3).
Оказывается, что шесть молекулярных орбиталей могут быть скон-
пруированы из различных независимых и обладающих соответст-
нующей симметрией линейных комбинаций шести 2р-орбиталей уг-
лерода, перпендикулярных плоскости бензольного кольца. Шесть
имеющихся в распоряжении «ненасыщенных» электронов помещают-
ся далее попарно на три орбитали, обладающие наиболее низкой
энергией, образуя электронную «конфигурацию», которая может
быть представлена схематически так. как изображено ниже
энергии
разрылЛЯющие
орбитали
278
ГЛАВА 9
Верхние (на данной схеме вакантные) орбитали обладают настоль-
ко большой энергией, что электроны, находящиеся на них, не будут
вносить вклада в образование связей между ядрами; они являются
разрыхляющими орбиталями.
Упражнение 9-16. ЛКАО-модель системы циклопентадиенил-аниона (С5Н5),
описанная в разд. 9-6,Д, в схематическом выражении для энергий выглядит сле-
дующим образом:
Возрастание
энергии
разрыхляющие
орбитали
связывающие
орбитали
Покажите, каким образом, из теории молекулярных орбиталей может следовать
различие свойств С5Н® иС5Н®.
Метод ЛКАО значительно легче поддается расчету с целью полу-
чения числовых данных *, чем метод «валентных связей», который
является математическим дополнением теории резонанса. Теория
молекул я piibix орбиталей часто используется в качественной форме;
при этом электроны размещаются по системам л-орбиталей так, как
было рассмотрено для случая бензола. Для полного изображения
полученных представлений со всеми их компонентами требуется
по меньшей мере художественное дарование, поэтому обычно на-
иболее тонкие детали опускают и переводят описание в терминах
молекулярных орбиталей в графическую форму, используя простые
структуры с пунктирными линиями аналогично тому, как это дела-
ется для резонансного гибрида (разд. 9-4). Для бензола это выгля-
дит следующим образом:
\ 6® /бензол, в котором три\
остове-связей молекулы у | \ и *'
бензола С шестью I +6 электронов —*- I связывающие молекуляй = h
свободными р -атомными | 1ные орбитали содержат!
орбиталями / \ шесть электронов /
Такой метод изображения содержит чрезвычайно мало информа-
ции и может, в сущности, привести к Совершенно ошибочным вы-
водам. По мнению авторов, теория молекулярных орбиталей
гораздо менее пригодна для качественного рассмотрения органиче-
ских молекул, чем метод резонанса. Проиллюстрируем возникаю-
щие при этом трудности на двух примерах; следует подчеркнуть,
что эти трудности возникают только при качественном рассмотрении.
Рассмотрим л-электронные системы бутадиена и триметиленме-
тила, которые имеют одинаковую формулу С4Н0 (рис. 9-6). Если
* Робертс Дж.. Расчеты по методу молекулярных орбит, ИЛ, М., 1963.
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
279
Рис. 9-6. Атомно-орбитальные модели бутадиена.-1,3 и гримети.тенметила.
принять, что, каждая система имеет четыре молекулярные орбитали,
на которых размещены четыре «ненасыщенных» электрона, и про-
вести далее пунктирные линии между соседними углеродами, то
окажется, что нет причин, по которым эти два расположения суще-
ственно отличались бы друг от друга. С другой стороны, рассмо-
трение возможных схем спаривания электронов (по методу резо-
нанса) сразу же приводит к выводу о том, что бутадиен должен быть
Рис. 9-7. Схемы спаривания электронов в бутадиене- i ,3 и три мети лепметиле.
280
ГЛАВА 9
Рис. 9-8. Атом но-орбита ль на я мо-
дель л-электронной системы ал-
ии л-кати он а.
резко отличен от триметил енметил а (рис, 9-7). Если на атоме угле-
рода должен находиться в среднем один электрон и если каждый
электрон должен быть спарен с электроном, находящимся на сосед-
нем углеродном атоме, то триметиленметил будет представлять собой
бирадикал. Более подробно рассмотрение триметиленметила но ме-
тоду ЛКАО приводит, аналогично простому методу резонанса, к
выводу, что это вещество должно быть бирадикалом; однако этот
вывод трудно передать в качественной форме.
Трудности, связанные с качественным применением теории
молекулярных орбиталей к простым системам, можно видеть также
на хорошо известном примере аллил-катиона, который был рас-
смотрен в разд. 9-6,Г с помощью метода резонанса. В данном слу-
чае имеем л-систему из трех р-орбиталей и два электрона (рис. 9-8).
Качественная картина молекулярных орбиталей предполагает, что
два электрона распределены более или менее равномерно по трем
орбиталям, причем, очевидно, на каждом углеродном атоме должен
находиться частичный положительный заряд. Это не соответствует
экспериментальным фактам (а также более подробному расчету по
методу ЛКАО), из которых следует, что заряд расположен главным
образом, если не целиком, на конневых атомах углерода. Метод ре-
зонанса сразу же дает правильную картину, поскольку две основные
Рис, 9-9. Схемы спаривания электронов в аллнл-катионе.
МЕТОД РЕЗОНАНСА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
281
н эквивалентные схемы спаривания имеют заряд только на конце-
вых атомах углерода (рис. 9-9).
Дополнительные упражнения
9-17. Напишите три структуры дляС4Н2, где углерод четырехвалентен, а водород
одновалентен. Установите геометрически наиболее благоприятную конфигурацию
и оцепите энергию резонанса для этой конфигурации.
9-18. Пропилен реагирует с хлором при 300 °C, образуя хлористый аллил.
а) Напишите два цепных механизма для реакции хлорирования: в первом слу-
чае должна про и с ходит в атака атома хлора на водород СН3-труппЫ. а во втором —
атака ат^мй^хлора ца двойную связь.
б) Сравните относительную вероятность осуществления этих двух механиз-
мов, основываясь на энергиях связей. Подробно рассмотрите встречающиеся за-
труднения, которые могут сделать такие расчеты ненадежными.
9-19. Для 1,4-присоедицения хлора к бутадиену возможен следующий механизм:
НС '—’’Cl
к z| —► С1СНгСН=СНСНгС1
нс J 4 Ci
снг
Как это может быть согласовано с тем фактом, что продукт 1,4-присоединения
представляет собой главным образом транс-изо мер? Объясните.
9-20. Используя теплоты сгорания циклооктатетраена (табл. 9-4) и циклооктана
(табл. 4-2); а также любые требуемые энергии связей, вычислите теплоты гидриро-
вания циклооктатетраена в циклооктан в газовой фазе при 25еС.
9-21, Напишите пять резонансных структур фенантрена (типа структур Кекуле)
и покажите, как с помощью этих структур можно объяснить, что фенантрен в от-
личие от бензола присоединяет бром, но только в положении 9,10.
9 10
9-22. Укажите, какое соединение в каждой из приведенных ниже пар должно быть
более сильной кислотой. Аргументируйте ваш выбор.
а) СН3СН2СНгСН0СН3. СН2 = СН —С112 — СН = СН2
б)
СН»^СН —"СН^-* СН= CHj
282
ГЛАВА 9
Г)
zNH
СН3-С^
ХМН2
/О
СН3-СС
хон
9-23, Какой хлорид в каждой из приведенных ниже пар должен легче терять хло-
рид-ион, образуя ион карбон и я? Объясните.
а) СНа=СН—CHb-CHjCJ и СН2 = СН—СНаС1
б) СН2=СН—СН—СН ==СН2 и СН3=СН—СН=СН—CH,Ci
Cl
9-24, Рассчитайте Д/7 для каждой стадии в приведенной ниже последовательности
реакций (в газовой фазе при 25°Q, предполагая, что энергии стабилизации бен-
зола и бромбензола одинаковы, Что вы можете сказать относительно вероятности
того, что бромбснзол образуется из бензола н брома путем присоединения с даль-
нейшим отщеплением бромистого водорода?
ГЛАВА
БИФУНКЦИОНАЛЬНЫЕ
СОЕДИНЕНИЯ.
АЛКАДИЕНЫ
Изучение органической химии для начинающего будет значи-
тельно облегчено, если он уяснит, что большинство органических
соединений можно рассматривать как комбинацию насыщенного
углеводорода с открытой цепью (или циклического углеводорода) с
функциональными группами. В огромном большинстве органических
реакций участвуют только функциональные группы, причем углево-
дородная часть молекулы остается «в стороне от развития событий»
и оказывает влияние на результат реакции главным образом косвен-
ным путем — через посредство пространственных затруднений,
изменение характера растворимости и т. д.
Первая часть данной главы посвящена рассмотрению функцио-
нальных групп с точки зрения классификации с их помощью орга-
нических соединений. Далее будет рассмотрена химия алкадиенов,
которые впервые дают нам возможность детально ознакомиться
с классом соединений, содержащих две функциональные группы,—
в данном случае две двойные связи. Особое внимание будет уделено
алкадиенам-1,3 и алкадиенам-1,2, в которых двойные связи располо-
жены одна по отношению к другой таким образом, что их свойства
отличаются от свойств двойных связей в простых алкенах.
10-1. Классификация
органических соединений
с помощью функциональных групп
В гл. 1 (см. рис. 1-1) ряд простых органических соединений
был классифицирован в соответствии с их типом на углеводороды,
галогениды, спирты, простые эфиры и карбонильные соединения.
284
ГЛАВА 10
Свойства, характерные для органических соединений данных, а
также других типов, в значительной степени определяются заме-
стителем, или функциональной группой, общей для ряда соединений.
Так, различные спирты, например СН3ОН, СН3СН2ОН, (СН3)2СНОН
и (СИССОН, обладают более или менее одинаковыми свойствами,
поскольку все они содержат гидроксильную группу (—ОН). Ана-
логичным образом алкены рассматриваются как особый тип, или
класс, углеводородов, поскольку их наиболее важные химические
свойства связаны с наличием в них углерод-углеродных двойных свя-
зей.
Более полный перечень основных классов органических соеди-
нений и их функциональных групп приведен в табл, 10-1. Класси-
фикация на основе функциональных групп имеет то преимущество,
что она дает возможность охватить свойства огромного числа из-
вестных органическик соединений. Логично и удобно подразделять
органических соединения на семейства со сходными свойствами так
же, как классификация элементов по периодам подразделяет их на
группы, или семейства, обладающие сходными свойствами. Важно
сознавать, однако, что истинное понимание органической химии
предполагает нечто гораздо большее, чем просто знание свойств
отдельных классов соединений с различными функциональными
группами. Действительно, часто оказывается полезным и поучи-
тельным рассмотрение типов реакций, а не только типов соединений,
Так, например, реакции присоединения не ограничиваются углерод-
углеродными кратными связями алкенов или алкинов, но вообще
происходят с соединениями, содержащими ненасыщенные связи, та-
кими, как альдегиды
<4 \ /Ч X /R4 X
Х=О или кетоны )C=Ol имины) ;C=N-R'|,
\ь/ / \R/ 7 \R' /
нитрилы (R—С=1Х), азосоединения (R—N—N—R) и т. д. Для ис-
черпывающего рассмотрения таких реакций присоединения необ-
ходимо сравнить поведение при этих превращениях соединений с
различными функциональными группами. В настоящей книге ор-
ганическая химия рассматривается главным образом с точки зрения
свойств функциональных групп, однако мы надеемся, что такой под-
ход не приводит к недоооценке типов реакций.
При рассмотрении перечня функциональных групп, приведенно-
го в табл. 10-1, возникает вопрос, почему карбоксильная функция
— С< не отнесена ни к спиртам, ни к кетонам, хотя в ней име-
Х)Н
ются и гидроксильная и карбонильная группы. Причина заключа-
ется В том, что свойства одной группы часто коренным образом из-
меняются в присутствии другой, особенно в тех случаях, когда груп-
пы соединены общей связью, как в карбоксильной группе; поэтому
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ АЛКАДИЕНЫ 285
Таблица 10-1
Классификация органических соединений по признаку
функциональных групп
Пример
Клася Функциональна: группа формула | найменопание
ллкен Алкин ' ' —Св=С“ CHjCHiCH^CFk СН„СсаСН Бутен-1 Метилаиетилец
Спирт —ОН 1 1 он Циклобутанол
Простой эфир Галогенид. Альдегид Кетон - О— F, С1, Вг или I — С—н СН3ОСН2СНЭ ( /~с| \/ СНЯСН2СНО 0 II СН3ССН2СНЭ Метилэтиловый Эфир Циклолентил- хлорид Пропионовый альдегид Бутанон-2
Карбоновая кислота Амин Нитросоедине- ние Нитрил ф ®г 1 X О О и О =О ’ z V X W и О Z ©Z и - III 1 СН3СН2СН,СНгСО2Н chsnh2 СН3СН-СНЭ 1 no, GH3CN Пентановая кислота Метиламин 2-Нигропропан Ацетонитрил
Мета лл о органи- ческое соеди- нение —С—металл 1 CH^HuCHuCHsLi я-Бутиллитий
наилучшим способом классификации такого сочетания оказывается
выделение его в особую группу.
Упражнение 10-1. Рассмотрите возможные способы, которыми могут влиять
друг на друга или взаимодействовать группы —ОН и С=О карбоновой ки-
слоты, например CHSCH2CH2CO2H, с тем, чтобы такая комбинация приобрела
снойгтая, которыми не обладают изолированные группы —ОН в С=О (как в
НОСН,СНгСН,СНО).
286
ГЛАВА Ю
Ниже приведены некоторые примеры пол «функциональных соеди-
нений (содержащих две или большее число функциональных групп),
в которых группы расположены настолько близко, что свойства, ха-
рактерные для каждой, существенно изменены.
Q—СН2-С1
дихлорметан
(метнленхлорид)
снэ-с^°
ацетамид
снэ—
этила цстат
СН, = СНС1
винилхлорид
ацетилхлорид
ноос—соон
щавелевая кислота
Если функциональные группы разделены двумя или большим
числом атомов углерода насыщенной углеводородной цепи, то это
обычно исключает сколько-нибудь сильное их взаимодействие.
Свойства таких групп в большей степени напоминают типичные
свойства изолированных функций. Ниже приведен ряд примеров.
С1СНеСН3СНвС1
1,3-дйхлорпропан
о
II
СНЯССН2СН2С1
4-хлор6утанон-2
О
II
сн8сснаснеснгос9н#
5 -этой сипе нта н он - 2
иооа:н2сн3соон
янтарная кислота
О
Л
CHsCCHaCHjNHjs
4 -амянобута нон. з
СНо = СНСН2СН2СН2С1
5-хлорпентеи-1
10-2. Алкадиены
В настоящей главе в основном рассматриваются свойства важ-
ного класса бифункциональных соединений — алкадиенов.
При наличии в углеводородной цепи двух или большего числа
двойных связей свойства соединения будут существенно зависеть
от их относительного расположения, иначе говоря, оттого, являются
они кумулированными, сопряженными или изолированными (опре-
деления и номенклатуру см. разд. 6-1).
Свойства соединений с изолированными двойными связями (на-
пример, пентадиена-1,4 СНЙ=СН—СНа—СН—СН8) в целом сход-
ны со свойствами простых алкенов, поскольку двойные связи в них
отделены друг от друга дополнительными СН^-группами. Однако
сопряженные алкадиены (например, пентадиен-1,3 СНЯСН=СН—
—CH=CHS) и кумулированные алкадиены (например, пентадиен-1,2
СН3СН3СН— С=СН2) существенно отличаются от простых алкенов
а также друг от друга и поэтому заслуживают специального рассмо-
трения.
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ. АЛКАДИЕНЫ
287
Упражнение J0-2. Одно из отличий с химических свойствах пентадиена-1,4 и
пропилена состоит в том, что Отрыв водорода из положения 3 пентадиена-1,4 при
паке свободными радикалами или сильными основаниями происходит гораздо
чегче, чем отрыв водорода от метильной группы пропилена. Объясните.
10-3. 1,3-Диены или сопряженные диены
Реакции бутадиена-1,3 весьма характерны для класса сопря-
женных диенов. Это соединение вступает в такие обычные для алке-
нов реакции, как каталитическое гидрирование и свободнорадикаль-
ное или полярное присоединение, но эти реакции протекают легче,
чем для большинства алкенов или для диенов с изолированными
двойными связями. Кроме того, продукты часто образуются в ре-
зультате конкурентного 1,2- и 1,4-ирисоединения. Эти свойства
были.кратко рассмотрены в разд. 9-6,Г для случая электрофильного
присоединения хлора; они могут быть объяснены образованием ре-
зонансно-стабилизироваиного карбониевого иона. В промежуточном
соединении положительный заряд находится главным образом на
двух атомах углерода и любое из этих положений может атаковаться
хлорид-ионом, что приводит к продуктам 1,4- и 1,2-присоединения.
Ниже приведена схема протекания аналогичной реакции бутадие-
на-1,3 с хлористым водородом:
CI
I
—<• СН3-СН-СН = СН2
—СН3-^СН =СН—СН2С1
н®
Н,С=СН—СН=СНа —
ф
сн3—СН— сн=сн3
С1
СН3—СН = СН — Н
Рис. 10-1- Энергетический профиль для двух возможных вторых стадий пря
реакции
„ед ед
СН2 =СН—СН =СН2 + Н® — [СН, Cl 1_ ^С11—:СН2]—
CI
cie j
^СНЭСН-СН =СН2+СН3СН=СНСН2С1
(Здесь сделано допущение, согласно которому энтропийные эффекты дчя 1,2-И
|,4-присоедйнения одинаковы.)
288
ГЛАВА 10
В связи с такого типа реакциями присоед нения следует указать еще на одно
важное обстоятельство. Относительные количества образующихся 1,2- и J,4-про-
дуктов зависят от условий реакции, т, е. от температуры, природы растворителя и
продолжительности процесса. При обычных условиях реакции равновесие дости-
гается сравнительно быстро, и в равновесной смеси 1,4-соединение оказывается ос-
новным продуктом, что указывает на его большую стабильность по сравнению с
продуктом 1,2-присоединения. Тем не менее 1,2-продукт образуется быстрее; он
преобладает в том случае, если реакция проводится при низких температурах.
Следовательно, наиболее устойчивый изомер необязательно является тем, который
образуется наиболее быстро. Здесь опять сталкиваются с таким случаем, Когда не
существует соответствия между константой равновесия /< данной реакции и ее
скоростью (см. разд. 3-7,В и 3-8,Г), что в рассматриваемом примере приводит к
различным продуктам в случае термодинамического и кинетического контроля
(разд. 7-5,Б).
«Энергетический профиль» реакции хлорид-иона с промежуточным ионом кар-
бония представлен rsa рис. 10-1. Он поясняет факторы, управляющие такого рода
процессами. Возможны две конкурирующие реакции, которые дают в конечном
счете продукты .1,2- или 1,^присоединения соответствен но *.
|сн3-сн — сн=chj®4-ci®j^
СН3-СН—СН=СНа сна—СН = СН-СНаС1
CI
Продукт 1,4-присоединения энергетически выгоднее продукта 1,2-присоеди-
нения, откуда следует, что теплота реакции должна быть более отрицатель-
ной, чем однако тот факт, что 1,2-Присоединенне протекает с большей ско-
ростью, может считаться результатом меньшего значения теплоты активации
Дй*,2 по сравнению с Д/Л,4. (При обсуждении данного вопроса может оказаться
полезным вернуться к вопросу о теплотах реакции ДЯ и теплотах активации Д/7*,
рассмотренному в разд. 3-5, 3-7,В и 3-7,Г).
Если бы оказалось возможным достигнуть в эксперименте осуществления
полного кинетического контроля (т, е. полностью избежать того, чтобы 1,2-продукт
вновь давал карбониевый иоц), то продукт 1,2-присоединения был бы основным,
Однако в обычных условиях присоединения, где термодинамический контроль
является главенствующим (имеющейся в распоряжении энергии достаточно для
того, чтобы оба продукта «перевалили» через энергетический барьер, вновь обра-
зовав карбониевый ион), 1,4-нродукт накапливается За счет 1,2-продукта, по-
скольку переход от 1,2- к 1,4-нродукту в конечном счете сопровождается выигры-
шем энергии (——ДЯ1-2).
Упражнение 10-3. Начертите энергетические диаграммы, аналогичные при-
веденной на рис. 10-1, для присоединения И® к пентадиену-1,3 и пентадиеиу-1,4,
приводящего к наиболее стабильным из возможных карбониевых ионов. Следует
учесть при этом, что 1,3-изомер одновременно более реакционноспособен и имеет
большую энергетическую стабильность. Объясните, каким образом можно исполь-
зовать эти данные для определения относительных стабильностей карбониевых
ионов, образующихся из указанных диенов,
* В ходе всего дальнейшего обсуждения будем предполагать, что изменения
энтропии, происходящие при процессах, связанных как со скоростями, так нс
равновесиями, для реакций 1,2- и 1,4-присоединения таковы, что могут полностью
компенсировать друг друга.
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ. АЛКАДИЕНЫ 289
A пражпени£Л0~4. Как можно объяснить тот факт, что свободнорадикальное
Ч и;«соединение к сопряженным диенам часто приводит к смеси продуктов 1,2- и
i I 4-присоединения.
У Упражнение 10-5. Качкой из двух приведенных ниже путей присоединения
। рома к стиролу должен, по вашему мнению, осуществляться на практике? Объ-
1 сннте. ..
СН—СНаВг СН=СН2 СНВгСНаВг
стирол
iO-4. 1,4-Циклоприсоедин.ение к диенам.
Реакция Дильса—Альдера
Одной из наиболее важных реакций синтетической органической
iiMHH является 1,4-присоединение алкена к сопряженному диену *.
'на известна как реакция Дильса — Альдера по имени открывших
е исследователей. Значение ее для синтеза циклических соединений
^казалось чрезвычайно большим, признанием чего явилось прису-
ждение Дильсу и Альдеру в 1950 г. Нобелевской премии по химии.
Простейшим примером является .присоединение этилена к бу-
шдиену-1,3, приводящее к образованию циклогексена
I
СН
сна
'ЧсНа Д1!еноФ1,л
диен
СНг
200 °с. н<5сня
• Ан
аддукт (30%)
* Прототипом реакции диенового синтеза явилась димеризация изопрена
(и бутадиена), открытая С. В. Лебедевым, в которой одна молекула диена служит
диенофилом
10 № 1340
290
ГЛАВА 10
Таблица 10-2
Реакционноспособные диенофилы
Наименование Формула Наименование Формула
Тетрацианэти- (CN),C=C(CN)3 Акрилонитрил CH2 = CH-CN
леи СН3СН = СН-СНО Акролеин СН£ = СН-СНО
Кротоновый Этилакрилат CH2 = CHCO,C2Hj
альдегид Коричная кис- СеН6СН = СНСО2Н N-Фенилмале- инимвд х°
лота (цис и нс/ \
транс) II >N-CeHs
Малеиновый /£> НС\ /
ангидрид
нс/X
II >0 НС // Ди мети л фу Ма- рат Н^уСОаСНз
^0 II
Диметилмзлёат H^COXHg С сн3огс/хн
II рНитростирол CuH-u-CH=CHNOa
С
ц/ХОаСНо
1-Нитропропен СНЭСН = СН —NOa
Однако данный пример неудачен, так как эта реакция дает низ-
кий выход и проводится в жестких условиях. Присоединение про-
исходит гораздо легче в том случае, если алкен (обычно на-
зываемый диенофилом) содержит электроноакцепторные группы 1
О
—СОйн, — с— R, c^N и нм подобные. Наиболее реакционно-
способные диенофилы приведены в табл. 10-2.
Одна из причин, вследствие которой реакция приобрела столь
важное значение, особенно при синтезе природных продуктов, за-
ключается в ее высокой стереоспецифичности. Прежде всего, и это
наиболее важно, диен реагирует в такой форме, при которой его
двойные связи находятся в s-цис*-конформации, поскольку двой-
ная связь в продукте (шестичленном цикле) неизбежно должна иметь j
* Обозначение s-цис означает^ что двойные связи лежат в плоскости по
одну сторону (цис) от соединяющей их простой связи. Противоположную, обычно
несколько более стабильную конформацию называют s-транс.
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ. АЛКАДИЕНЫ
291
фи-конфигурацию.
СТГ2 .Н
^CZ
сн2 н
*cz
С
сн2 н
с
НХ ^сн2
s~i(uc -конформация
s-тране -конформация
СН2=СН2
СНг=СНг
•Н
СНг
н
с===с
СН; „С. '
VCH2
стабильная ;
t/ue -двойная связь
^СНХ
выссконапряженная
йддаг-двоиная связь
11 |1кличесцие диены с пяти- и шестичленными кольцами обычно реа-
: и руют легко, так как они фиксированы в 5-з{ш>конфигурации.
н
С(СМ)г
С(СМ}г
25’С
р.горая причина заключается в том, что конфигурация диена и дие-
цнфила сохраняется в аддукте. Это означает, что способ сближения
реагентов (аддендов) таков, что он приводит к цае-присоединению.
Ниже для иллюстрации приведены два примера; использованный
при этом способ изображения должен продемонстрировать, каким
образом происходит цис-присоединение. В первом примере диме-
гилмалеат, в котором сложноэфирные группы (—СОЯСН3) находятся
в ц попал ожени и, присоединяется к бутадиену-1,3, образуя цш>за-
мещенный циклогексен
(кгиострируст
сохранение
конфигурация
Диенофила)
ю*
292 ГЛАВА io
Во втором примере цис-присоединение диенофила к, транс-транс- .
рексадиену-2,4 дает продукт, в котором две метильные группы рас--
полагаются по одну сторону кольца циклогексена
(иллюстрирует сохранение
конфигурации )
Метильных групп диена)
цис
Упражнение 10-6. Образования каких продуктов можно ожидать при реакции
Дильса — Альдера между тетрапианэтнленом и а) цас,транс-гексадиеном-2,4 и
б) (щсщис-гексадиеном-2,4? Объясните.
Реакция Дильса Альдера имеет еще одну особенность, от-
носящуюся к стереохимической ориентации аддентов. Для присо-
единения малеинового ангидрида к циклопентадиену существует;
два возможных пути соединения диена и диенофила, которые при- ,•
водят к различным
(10-1) и (10-2).
продуктам, что иллюстрируется уравнениями;
.(10-2)
экад-аддукт
Практически аддукт с эяОо-конфигураиией *• почти всегда ока-
зывается основным, если нё исключительно образующимся. Как
правило, присоединение по Дильсу — Альдеру протекает таким
* Обозначение ждо" (внутри) означает, что заместитель (в дачном случае ан-
. гидридный цикл) направлен вовнутрь (в направлении выпуклости) ванны цикло-
"БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ АЛКАДИЕНЫ 293
образом, что благоприятной оказывается ориентация, соответст-
вующая наиболее близкому расположению двойных связей диена
и ненасыщенных заместителей в диенофиле. Это означает, что при-
соединение в соответствии с уравнением (10-1) предпочтительнее
присоединения по уравнению (10^2).
Упражнение /0-7. Начертите схему двух возможных взаимных ориентаций
диена и диенофила для присоединения малеинового ангидрида к Тиране,транс.
гексадиену-2,4. Какой аддукт должен образовываться преимущественно?
Существуют исключения из приведенного выше, общего правила для стерео-
химии реакций Дильса — Альдера. В большинстве случаев эти исключения свя-
щны о-обратимостью реакций; значение диссоциации возрастает при повышении
температуры. Условия, способствующие диссоциации, могут также привести к гео-
метрической изомеризации как диена, так и диенофила. Обычно экзо-конфигурация
оказывается при этом более стабильной, чем эяйо-конфигурация, и если время ре-
акции достаточно для достижения равновесия, то экзо-изомер может оказаться ос-
новным продуктом. Таким образом, стереохимическое правило применимо только
I; том случае, если при реакции осуществляется кинетический контроль (см.
разд. 7-5.Б и 10-3).
Что касается механизма реакции Дильса — Альдера , то обыч-
ные радикальные или полярные механизмы, подобные ранее рас-
смотренным, в данном случае маловероятны. Одна из возможностей
включается в том, что реакция представляет собой процесс, при
котором связи между диеном и диенофилом образуются более или
менее одновременно.
С другой стороны, адденды могут вначале быть взаимно ориентиро-
ваны и. их взаимодействие приведет к образованию одной связи.
гексанового кольца, а. экзо (вовне) означает, что заместитель ориентирован в на-
правлении внешней (вогнутой) стороны ванны. Ниже приведены еще два примера:
дайо-норборнилхлорид эюо-иорборисилорцц
(ммг-хлорбицикло-й 2,1]- гептан) (лхм-2-хлорбицнмо-12,2,1]-гептан)
При изображении экз^- и дадо-изомеров желательно возможно точнее: воспроизво-
дить истинное пространственное расположение атомов. В приведенном примере
циклогексановое кольцо показано в форме ванны, поскольку такая конфигура-
ция закреплена метиленовой группой, образующей мостик между положениями
1 И 4. ' - .SV -К.- ’ " > ' .
294
ГЛАВА 10
Это должно создать в молекуле два радикальных центра; в дальней-
шем между ними возникает вторая связь. Представляется разумным
предположение, согласно которому нечетные электроны «бирадика-
ла» остаются спаренными (имеют противоположные спины) в тече-
ние всего времени реакции.
Рассмотрим применимость стадийного механизма к присоедине-
нию, например, ццс-коричной кислоты к транс-ииперилену. По-
скольку известно, что реакция стереоспецифична, необходимо Сде-
лать вывод, что вращение вокруг связей С—С при радикальных цен-
трах не происходит до образования второй связи.
СНЭ Н
/С=С
и сн=сн2
транс -пентадиен-!.3
(транс .пиперилен)
ОД согн
X /
цис -3- фенилпропеновая
кислота
(цис -коричная кислота)
Это означает, что замыкание цикла в результате образования второй
связи должно быть гораздо быстрее, чем скорость вращения угле-
родного атома, связанного, с фенильной (С5Н6) или метильной груп-
пой, вокруг простой С—С-связи,
Хольца
+
г- , продукт реакции не образуется
Основанием для утверждения, согласно которому две связи образуются по-
следовательно, а неодновременно, служит ярко выраженное влияние заместителей
(как в диене, так и в диенофиле) на скорость и ориентацию присоединения. Более
реаациоыаоспособнымй диенами или диенофилами сказываются те, которые со-
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ. АЛКАДИЕНЫ
295
держат заместители, приводящие к относительно более стабильным промежуточ-
ным соединениям радикального характера. Далее, осуществляется та ориентация,
нрп которой образуется наиболее стабильная комбинация радикалов. Это можно
пояснить, рассмотрев в качестве примера такой ориентации присоединение цис-
i-.оричной кислоты к транс-пнпернлену. Из четырех возможных путей образования
онрадикалов 1—IV наиболее выгодной комбинацией, как можно ожидать, окажет-
я I, поскольку в ней возможности стабилизации для каждого из нечетных элек-
। ронов наиболее благоприятны.
। габилыюстд. бирадикала I в диенофильном фрагменте следует из рассмотрения
> клада резонансных структур приведенного ниже типа
' । абилизирующее действие метильной группы в диеновом фрагменте на радикаль-
ный центр становится понятным, если учесть обсуждение этого вопроса в разд. 3-8
и 7-6. В действительности продукт присоединения соответствует промежуточному
ы (единению I.
Упражнение 10-8. Напишите резонансные структуры бирадикалов II, III и IV
в покажите, почему они должны быть менее стабильными, чем I.
Упражнение 10-9. Обсудите вопрос о том, может ли образование ионных (а не
Бирадикальных) промежуточных соединений отразиться на доводах, приведенных
к пользу двухстадийного механизма реакции Дильса — Альдера. Какую инфор-
мацию относительно предпочтительности свободнорадикального механизма по
t равнению с ионным можно почерпнуть из того факта, что типичные реакции при-
। осдинеиия по Дильсу — АльДеру могут происходить в газовой фазе?
10-5. 1,2-Циклоприсоединение к диенам
Хотя сопряженные диены, как правило, реагируют с диенофила-
ми, образуя шестичленные циклические соединения путем 1,4-
ирнсоединения, известны также реакции 1,2-присоединения, при-
водящие к образованию четырехчленных циклов. Решающим фак-
тором для направления реакции но пути 1,2- или 1,4-присоединения
является, по-видимому, природа диенофила. Так, если этилен при-
соединяется к бутадиену по 1,4-типу (разд. 10-4), тотетрафторэтилен
ГЛАВА 10
296
100 °C
присоединяется к этому диену по типу 1,2
сн,—сн
СН2=СН—СН=СН„ 1(10оС /
+: - сн—сна
FaC=GFa
Однако присоединение тетрафторэтилена к циклопентадиену |
дает смесь 1,2- и 1,4-цнклоаддуктов - г
190°С
+ КаС=СКг -
Резко различное поведение тетрафторэтилена и этилена в реак-
циях циклоприсоединения до настоящего времени не получило
объяснения. ~
Кетен (СНа=С=О) в отношении реакции с диенами напоминает”?
тетрафторэтилен. Он присоединяется к циклопентадиену, образуя •»
производные циклобутанона
О
СН,
10 0 °C
толуол
Упражнение 10-10. Предполагая, что механизм 1,2-цикло присоединен и я сходен
с механизмом 1,4-диклоприсоединения (т. е. с реакцией Дильса — Альдера),
: можно ли считать, что продукт, полученный при реакции циклопентадиена с кете-
ном, соответствует ожидаемому? Объясните.
С диенами, содержащими кумулированные двойные связи (как
в аллене), аддукты должны образовываться только путем I ^-при-
соединений. Действительно, молекула аллена присоединяется ко
второй молекуле аллена, образуя 1,2-диметиленциклобутан (такой
тип присоединения называется «голова к голове»)
нас=с=сна нл-с/1^
’ 1 10 V Чи I I
'аС=С=СНа
Hs
ХНа
Возможен другой путь присоединения («голова к хвосту»), при-
водящий к 1,3-диметиленцнклобутану, однако последний образу-
ется в количестве лишь нескольких процентов
/уСНа
НаС=С=^СНа Н£С—(X
НаС=^=СНа
:н,
i
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ. АЛКАДИЕНЫ 297
Преимущественное протекание димеризации аллена но типу присоединения
«голова к голове» полностью соответствует представлению о бирадикальном меха-
низме; нз трех различных путей димеризации аллена по этому механизму — V, VI
и VII — предпочтительным оказывается V, поскольку в промежуточном соедине-
нии оба неспаренных электрона содержатся в радикалах аллильного типа. Таким
। оразом, направление присоединения издесь определяется образованием наиболее
стабильного бирадикала.
"н2С—^«СНг
HjC—с»снг
hzc=c-9hs‘.
НгС—С=СНг
VI
V
VII
Упражнение 10-U. Предскажите структуру преимущественно образующегося
1,2-циклоаддукта аллена и акрилонитрила (СН3=СН—C^N).
10-6. ’ Полимеризация сопряженных диенов
Общие закономерности полимеризации алкенов по радикально-
му и ионному механизму были кратко рассмотрены в разд. 7-9.
К алкадиенам применимы те же основные принципы, но особенность
их реакций состоит в дополнительных возможностях образования
связей между мономерными звеньями. Полимерная цепь может расти
путем либо 1,2-, либо 1,4-присоединения мономера к мономеру,
В последнем случае возникает возможность либо цис,-, либо транс-
приедединения
тип присоединения
транс-1,4
298
ГЛАВА 10
Упражнение 10-12. Укажите стадии инициирования, роста и обрыва цепи при
полимеризации бутадиена в присутствии перекисного катализатора. Внимательно
рассмотрите возможные структуры радикала растущей цепи. Приведите ожидае-
мую структуру полимера; вычислите ДН для этой реакции.
Полимеры, образованные из идентичных повторяющихся моно-
мерных звеньев, называются гомополимерами; если мономерные
звенья не идентичны, как в случае сополимеризации различных мо-
номеров, то продукт носит название сополимера. Строго говоря, если
мономер полимеризуется не стереоспецифично (образуя цепи в слу-
чае сопряженного диена путем 1,2- и цис- и трйнс-1,^присоедине-
ния), то продукт является уже не гомо-, а сополимером.
Многие из полимеров, полученных из сопряженных диенов, об-
ладают эластическими свойствами и используются при производ-
стве синтетических каучуков. Сырые полимеры обычно являются
липкими, и непосредственное их применение ограничено; они ис-
пользуются лишь как адгезивы и связующие вещества. Эти полиме-
ры превращаются в материалы, обладающие большей эластичностью
и прочностью, путем вулканизации, которая состоит в нагревании
полимера с серой и различными катализаторами (ускорителями);
в результате этого процесса полимерные цепи оказываются «сши-
тыми® между собой связями углерод — сера. Часть поперечных
(«сшивающих») связей возникает вследствие присоединения к двой-
ным связям, однако количества добавляемой серы обычно недоста-
точно для того, чтобы полностью насытить полимер. При большом
относительном содержании серы образуется твердый каучук, по-
добный тому, который используется для изготовления корпусов
аккумуляторных батарей.
Поскольку в полимере имеется большое число двойных связей,
диеновые каучуки обычно чувствительны к окислению воздухом;
для ингибирования окисления добавляются антиоксиданты.
Наибольшее значение для производства синтетических каучу-
ков имеют бутадиен-1,3, 2-хлорбутадиен-1,3 (хлоропрен) и 2-ме-
тилбутадиен-1,3 (изопрен).
С! СНВ
I I
сна=сн— сн=сн2 сн.2=с-сн=сна сн2=с—сн=сна
бутадиен-1.3 2-хлорбутадиен-1,3 2-метилбутадней-I,3
(хлоропрен) (изопрен)
i '
В табл. 10-3 перечислены различные каучуки, обладающие ценными свойст-
вами — эластичностью, гибкостью, прочностью на истирание и химической стой-
костью. Однородность полимеров в основном зависит от способа их получения, в
частности от Использованного катализатора полимеризации. Синтетический кау-
чук, практически идентичный натуральному, добываемому из гевеи, получают из
изопрена, используя тонко измельченный металлический литий или катализатор
циглеровского типа. При этом образуется почти исключительно продукт цис- 1,4-
присоединения. Как упоминалось в разд. 7-9,Г, катализаторы циглеровского
типа могут быть получены из триалкиладюминия и галогенида металла, обычно
Синтетические каучуки
300
ГЛАВА Ю
четырех хлор исто го титанaJ
натуральный каучук (цис-1,4-полииэопреа)
СН2 СН СН3СН СН2 СН
снв (!:ня снэ
гуттаперча (транс-1,4-полиизопрен)
Интересно, что гуттаперча, транс-1,4-изомер природного каучука, при ком-
натной температуре является твердой и хрупкой. Причина такого различия в свой-
ствах цис- и тр днс-изомер о в. становится легко понятной при рассмотрении молеку-
лярных моделей. Цепи с т/мяс-двойными связями могут располагаться одна вдоль
другой, причем такая упорядоченность приводит к полукристаллическому строе-
нию, как показано на рис. 10-2. В то же время при цис-расположении двойных свя-
зен пространственные затруднения препятствуют расположению цепей в такой же
упорядоченной структуре, и значительная часть вещества находится в аморфном;
состоянии со случайной ориентацией цепей. При растяжении цис-полимера цепи
выпрямляются и возникает тенденция к ориентации, однако, поскольку такая
структура неустойчива, при снятии натяжения вещество быстро возвращается в
прежнее аморфное состояние. Эластические свойства полимеров рассматриваются
более подробно в гл. 29.
Полимеризация изобутилена в присутствии небольших количеств изопрена
дает сополимер, число* двойных связей в котором достаточно для образования по-
перечных связей между полимерными цепями при вулканизации. Такой продукт
представляет собой механически прочный и химически стойкий каучук, называе-
мый бутилкаучуком. Он чрезвычайно мало проницаем для кислорода и широко
используется при производстве камер для шин.
Рис. 10-2. Схематическое изображение
конфигурации цепей в гуттаперче
(тданс-1,4-полииэопрёне).
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ. АЛКАДИЕНЫ
301
10-7.. 1,2-Диены, аллены
А. Структура и стереоизомерия
1,2-Диены, в которых двойные связи кумулированы, обычно на-
ывают алленами. Их простейшим представителем является сам
мен
сна=с=снй
пропадиен-1,2 (аллен)
Рассмотрение шаростержневой модели аллена показывает, что
о двойные связи, а следовательно, и концевые метиленовые
ч ппы должны лежать в различных плоскостях, пересекающихся
д прямым углом (рис. 10-3).
Такая же стереохимическая картина следует из описания ал-
ия с помощью атомных орбиталей (рис. 10-4). В этой модели цен-
; ч,льный атом1 образует две коллинеарные sp-tb связи с концевыми
- гибридизованными атомами углерода. Два электрона, остаю-
тся у центрального углеродного атома, занимаютр-орбитали, рас-
। и 10-3, Шаростержиевая модель
аллена.
Рис.. 10-4. Атомно-орбитальная модель аллена.
302
ГЛЛВЛ 10
Рис. [0-5. Стереоизомерные формы замещенного аллена типа RR'C=C=CRR'.
положенные под прямым углом одна к другой. я-Связи образуются
путем перекрывания р-орбиталей центрального атома и р-орбиталей
концевых атомов углеродов. Таким образом, можно ожидать, что
метиленовые группы будут располагаться во взаимно перпендику-
лярных плоскостях.
При такой геометрии молекул аллены типа RR'C==C=CRR' должны сущест-
вовать в двух стереоизомерных формах, каждая из которых является зеркальным
отражением другой и не может быть с ней совмещена (рис. 10-5). Стереоизомеры
такого типа носят название оптических изомеров вследствие того, что они по-раз-
ному взаимодействуют с поляризованным светом (более подробное рассмотрение
приведено в гл. 11 и 17). Подтверждение предсказанной стереохимии алленов было
получено, когда соединения типа RR'C=C=CRR' удалось впервые разделить на
оптические изомеры.
Б. Спектральные свойства алленов
Спектры алленов довольно сильно отличаются от спектров ал-
кенов и алкинов, вследствие чего их можно использовать при ка-
чественном анализе. Поглощение, обусловленное валентными коле-
баниями двойной связи, проявляется в ИК-спектре как полоса
средней интенсивности в области 1950 см"1, тогда как соответству-
ющие полосы для алкенов и алкинов расположены при 1650 и
2200 см-1 соответственно. Такой тип поглощения вообще, по-види-
мому, характерен для кумулированных систем, поскольку оно об-
наружено также в спектрах кетенов (R2C=C~O), изоцианатов
(R—N=C=O) и карбодиимидов (R—N=C=N—R). Поглощение
в ультрафиолетовой области происходит при длинах волн, близких
к тем, при которых поглощают сопряженные диены, но интенсив-
ность поглощения обычно несколько ниже. Удлинение цепи куму-
лированных двойных связей, подобно увеличению цели сопряжения,
приводит к сдвигу полос поглощения в сторону больших длин волн.
Особенность ЯМР-спектров алленов заключается в относитель-
но большом значении константы спин-спинового взаимодействия
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ- АЛКАДИЕНЫ
303
(,/) для атомов водорода при двойных связях, разделенных четырь-
мя связями.
\ и /
с=с=с
\ имические сдвиги алленовых водородов в целом сходны со сдви-
t (МИ винильных водородов.
1 пражнение 10-13. Нарисуйте ДМР-спектры (включая спин-спиновое расщеп*
... пие, если оно имеется), ожидаемые для следующих соединений:
а) ВгСН=С = СН2
б) СНЕСНгС es СН
в) (СН3)3ССН=С=СНСНаОСНэ
В. Химияалленов
Химические свойства алленов исследовались мало, возможно,
in бедствие того, что чистые соединения часто оказываются трудно
ц.и гупными и не обладают неограниченной во времени стабильно-
< н,ю. Аллены вступают во многие из обычных реакций двойных
нязей — они легко гидрируются, присоединяют бром и реагируют
t раствором перманганата калия. Несимметричные реагенты, по-
добные НС1 и НЙО, обычно присоединяются в соответствии с Пра-
ги глом Марковникова. Однако, как и в случае гидратации ацетилена,
первоначальный продукт присоединения неустойчив и быстро лере-
। руппировывается в кетон.
СН8=С=СНа—'"-Н "" г
CHg-C=CH, ^3. СНз-С-СН^
in о
енольная форма ацетона ацетон
СН3С^СН -??’ нФ t
Аллены менее стабильны, чем диены с сопряженными или изо-
лированными двойными связями. Данные по теплотам гидрирова-
ния (табл. 10-4) показывают, что порядок стабильности следую-
/
304
ГЛАВА: 10
Таблица 10-4
Теплоты гидрирования некоторых алкадиенов
Соединение Формула АН (25 Я2), ккал/моль
АлЛен сна=с=снэ —71,3
Метилацетилен СН3—Се«СН —69,7
Бутадиен-1,3 СНа = СН-СН=СНа —57,1
Пентадиен-1,3 СН8 - СН = СН—СН СНа —54,1
ПентаДиен-1,4' СНа = СН-СН2-СН = СН, -60,8
щий: сопряженные диены > диены с изолированными связями >
^кумулированные диены. Относительная неустойчивость алленов,
возможно, отражает дополнительное напряжение, возникающее в
результате того, что один углеродный атом образует две двойные
связи. Аллен несколько более напряжен, чем метилацетилен — его !
теплота гидрирования приблизительно на 2 ккал больше. Не уди-
вительно поэтому, что аллен изомеризуется в метилацетилен. Это
происходит при контакте аллена с сильноосновными веществами типа ;
амида натрия в жидком аммиаке или едкого кали в этиловом спирте. ;
Так, одна из трудностей, возникающих при синтезах алленов и аце- 1
тиленов (которые часто проводятся в присутствии сильных основа-
нии), состоит в конкурентном образовании изомерных продуктов.
Na®MH®, NH3
сна=с=сн2----------:—_сн3с еэсн
KOH, CsHtOH
(СН3)2С=С=СНа —-------------► (CHs)aCHCsCH
3-метилбутадиен-1,2
Полагают, что действие;основного катализатора при изомеризации алленое в
ацетиленьГ (а также при обратной реакции) заключается в отрыве протона от угле-
водорода. Образующийся анион имеет гибридную структуру и в условиях термоди-
намического контроля отщепляет протон от растворителя, образуя продукты,
наиболее устойчивый из которых в конечном счете оказывается преобладающим.
В зависимости от условий деакции термодинамический' контроль может привести
к различным продуктам; так, мётилаллен в присутствии этилат-иона как основ-
ного катализатора изомеризуется в диметилацетйлен. Однако, если использовать
бодёе сильное основание (например, амид.натрия), то Основным продуктам будет
этилацетилен, несмотря на то что он несколько менее стабилеЩ Чем диметилацети- :
лен. Это происходит вследствие того, что различные равновесия, устанавливаю-1
щиеся при изомеризации, смещаются в присутствии амида натрия, так как по-)
БИФУНКЦИОНАЛЬНЫЙ СОЕДИНЕНИЯ. АЛКАДИЕНЫ
305.
следниЙ эффективно удаляет1 этил ацетилен в виде натриевой соли *.
CHjCHsC=GHj
основание /у*
‘-“У
0 0
CHjCI-I=C=CH ** CHjCH-C=CH
СН,С=С=СНг ** СН,СаС-СН,
' (+Н®)
раиворитель
' сн?сн2с=сн
NHjf :NH2®
Т
СН3СН2С-С :®
. соль эгилацетилена
(подкисление дает
эгилацетилен)
(+НФ) 1
ритаорнтель ’
I
сн,с₽ссн,
дймепиаиетяпеи
(продукт катализа
этилат-ионаци)
Дополнительные упражнения
/0-/4.-Учитывая механизм, принятый для реакции Дильса -- Альдера, объясните
следующее:
а) Малеиновый ангидрид не присоединяется к бутаднину-1,3.
* СН3 hi
б) Метакролеин (СНа=ССНО) димеризуется с образованием
VIII, но не IX.
О О
соединения
; VIII
НС сн.
Ц*ск«
/\/ХСНО
СН3 СНа
IX
в) Изменение энтропии (AS) при реакции Дильса — Альдера обычно велико И
имеет отрицательный знак.
10-15. Напишите структуры всех возможных 1 . 1-аддуктов изопрена (2-метилбу-
та диен а-1,3) и тетр афторэти лен а. Какие аддукты, по вашему мнению, должны обра-
зовываться преимущественно?
* Описанные здесь превращения носят название ацетилен-аллен-диеновой
перегруппировки. Они открыты А. Е. Фаворским. — Прим. ред.
306
ГЛАВА 10
10-16. Какой тип присоединения — 1,2 или 1,4 — будет осуществляться при ре-
акции тетрацианэтилена (CN)aC=C(CN)a с приведенными ниже соединениями?
СНг
метилендаклогексен . ^жетшейцикло^уш
10-17. Назовите продукты приведенных ниже реакций; изложите ваши соображе*
НИЯ.
а}
б)
+ ^®^с4н,сн=снсо4н
сн£=сн-сн=сн.
г) цис, тра«с-гексадиен-2,4
, и малеиновый ангидрид,
е) СН, —С=СН„4-малеиновый ангидрид
ж) СвН6С вг СНF,C = CF2
з) CFsCF = CF2-t-CFaCF = CF2
и) CBHbC(CHa) = CHa-f-CH9 = C = CHa
к) CH3 = C = O-J-| О
V
л) (CeHs)2C=C = O+CeH6CH^CH1
10-18. Укажите последние стадии при синтезе каждого из приведенных ниже со-
единений (опишите приблизительно условия реакций):
а) СН9 = СНСНВгСН3 СН2
г) сн.
О
»)
снг чсн£Нд
сн, ^нг
хсн
I
L-ch2-c=ch—сна
БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ. АЛКАДИЕНЫ
307
10-19. Объясните, почему свободнорадикальные инициаторы вызывают полиме-
ризацию стирола (CeHsCII=CH J по типу «голова к хвосту», приводящую к обра-
зованию
С„Н6 CsHfi
сна—(Lh—сн,—сн —
10-20. Аллен присоединяет хлористый водород в соответствии с правилом Марков-
пикова, образуя 2-хлорпропен. Однако существует возможность того, что, атака
протона на первой стадии приведет к аллил-катиону (разд. 9-6,Г), который далее
при реакции с хлорид-ионом даст хлористый аллил. Используя правила примене-
ния метода резонанса (разд. 9-6) и атомно-орбитальную модель аллена (рис. 10-4),
объясните, почему аллил-катион не может легко образоваться путем прнсоедине-
имя протона к аллену и почему фактически образуется 2-хлорпропен.
10-21. Сколько геометрических изомеров должно быть у каждого из приведенных
ниже соединений? Изложите ваши соображения и напишите соответствующие
структурные формулы.
а) изобутилен
б) пентадиен-1,4
в) пентадиен-1,3
г) циклобутен
д) циклодецен
е) 1,2,3-триметилциклопропан
ж) октатриен-2,4,6
в) 1,3-дихлораллен
и) 1,4-дих лорбутатриен-1,2,3
10-22. Напишите структурные формулы продуктов, ожидаемых для каждой из
приведенных ниже реакций:
а) аллен и хлорноватистая кислота (1 моль)
б) пентадиен-1,3 и хлористый водород (1 моль)
в) озонирование бутадиена с последующим восстановлением при действий
цинка
г) бутадиен и хлорноватистая кислота (2 моля)
д) бутадиен и акриловая кислота (СН1=СНСОаН) с последующим действием
бромом..
ГЛАВА
11
РЕАКЦИИ НУКЛЕОФИЛЬНОГО
ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ.
АЛКИЛ-, ЦИКЛОАЛКИЛ-,
АЛКЕНИЛ-
И АЛКИНИЛГАЛОГЕНИДЫ
Число основных типов органических реакций относительно не-
велико, и из них наибольшее значение имеют замещение, присоеди-
нение и отщепление. Выше уже были рассмотрены реакции замеще-
ния водорода на галоген, а также реакции присоединения к алкенам и
к циклоалканам с напряженными кольцами. Данная глава посвяще-
на в основном замещению групп, связанных с углеродным атомом, при
действии нуклеофильных агентов и образованию углерод-углеродных
двойных связей при реакциях отщепления. /1а эта реакции обычно
оказывают сильное влияние кажущиеся небольшими изменения струк-
туры реагентов, растворителя и температуры. Будет показано,
каким образом могут быть поняты причины таких влияний и в ка-
кой степени их можно предсказать, основываясь на принципах, уже
рассмотренных выше.
В конце главы сопоставляется реакционная способность раз-
личных типов галогенидов с их структурой. Кратка рассмотрены
физические и химические свойства органических фторпроизводных.
В число представителей этого класса соединений входят как наиболее
реакционноспособные, так и наиболее инертные соединения, многие
из которых имеют важное промышленное значение.
Настоящая глава посвящена в основном теоретическим вопро-
сам, а также проблемам, связанным с практическим осуществле-
нием двух чрезвычайно важных реакций органических соединений —
нуклеофильного замещения и отщепления. Однако сначала будет
полезно ознакомиться с классификацией и номенклатурой встре-
чающихся при этом органических реагентов и продуктов. Чита-
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 309
гель, который уже знаком с этой системой номенклатуры или счита-
*?т нужным познакомиться с ней позднее, может перейти сразу к
разд, 11-7.
11-1. Органические производные
неорганических соединений
В гл. 10 рассматривались некоторые преимущества классифи-
каций органических соединений в соответствии с их функциональ-
ными* группами. Другим способом классификации различных типов
оединений является рассмотрение их как замещенных на: органи-
ческие остатки производных воды, аммиака, сероводорода, азот-
ной или азотистой кислоты и т. д. Во всех этих соединениях на ор-
i аническую группу замещен один или большее числб атомов во-
дорода. Из табл. П-1 видно, каким образом спирты, простые эфи-
ры, карбоновые кислоты, ангидриды и сложные эфиры можно рас-
матривать в качестве Производных воды; меркаптаны и сульфиды —
; ак производные сероводорода; амины и амиды—какпроизводпые
дшика; алкилнитраты ™ как производные азотной кислоты; ни-
роалканы и алкилинитриты — как производные азотистой кислоты;
щкилеульфаты — как производные серной кислоты. В целях пол-
юты описания включены также алкилгалогениды, которые выше
классифицировали как замещенные алканы, но Которые Могут рас-
>. матриваться и как производные галогеноводородов.
11-2. Номенклатура спиртов
и алкилгалогенидов
В соответствии с системой TUPAC при построении названия спир-
। а к названию родоначального углеводорода добавляется оконча-
ние -ол. В качестве такого углеводорода выбирается наиболее
длинная неразвётвленная цепь углеродных атомов, в состав которой
входит атом углерода, связанный с гидроксильной группой; если
соединение является ненасыщенным, то в эту цепь включается так-
же двойная Связь. Следует заметить, что при определении суффикса
в названии гидроксильная функция обычно имеет преимущество
перед двойной связью, галогеном и алкилом. При нумерации угле-
родный атом, связанный С гидроксильной группой, получает номер 1,
если он находится в конце цепи, или наименьший возможный номер,
если гидроксильная группа соединена не с концевым атомом угле-
рода.
Oil сй2сн3
сн3он сн3снаон с8н8снвснснасн8 асн»сн=Асн»он
метанол этанол 1-фенил бутанол-2 4-хлор-2-атилбутен-2-ол-1
Органические соединения как производные простых неорганических веществ
Таблица 11~1
Исходные соеди- нения Органические производные
класс соединены я 1 пример
м—©—и R—О—Н R —О—R" О II R-C-O-H О (1 спирт простой эфир СН3ОН СН3—О—СН3 О 11 СН3СОН О II СН3СОСН3 О О If 11 СН3СОССН3 метанол диметилов ый эфир
карбоновая кислота уксусная кислота
я я 1 1 п=о о= 1 1 о о 1 1 9= о я 1 я сложный эфир ангидрид карбоновой кнслоты мети л ацетат уксусный ангидрид
H-S-H Я я я я я я я 1 zzZ I II Л= О I» О= О <Л сл 1 III Z «ЯД iF* ' “ к тиол (меркаптан) тиоэфир (сульфид) CH3SH CHsSCH3 О л CH3CSH CHsNHa (CH3)2NH (CH3)3N О II CH3-C~NHa метантио л (метилмеркап- тан) метилтиометан (диметил- сульф ид)
NH3 тиокислота первичный амин вторичный амин третичный амия тиоуксусная кислота метиламин диметиламин * триметиламин
ациламин (незамещенный амид) ацетамид
О R—C-NHR О R—С—NR® монозаме щен ный амид дизамещенный амид О СН3- С—NHCHS О и СНа—С—N(CHj)a N-мет ил ацетамид N,N- ди мети л ацетамид
/ н— О NO, 1 О 1 Z о, алкилпитраг СН3—ONOa метилнитрат
(азо-аая кислота) и—О NO (или H-NOs) ( азот истая кислота) R—ONO R—NOa алкилннтрит нитроалкан СНЭ—ONO СН3—NO3 СН3—NO метилнитрит нитрометан натрозометан
Н —NO (азотноватистая кис- R-NO нитрозоалкан
лота, иономер)
О О О 11 CHs--O-S—он II О
II В —О— S—ОН II R-0-S-OH кислый алкилсульфат кислый метил сульфат
II II
О О О О CHa-O-S-O-CHj II
я 1 О 1 сл= О 1 Я' диалкилсульфат диметилсульфат
II О II О
Н-Х (X = F, Cl, Вг, I) R —X а лк ил галогенид (гало- СН3—F метилфторид (фторметан)
1\ -ЛЬ- ген а лк ап)
312 / ГЛАВА II
Наиболее широко употребляемая система номенклатуры спир-
тов (и галогенидов) использует название соответствующего углево-
дородного радикала в сочетании со словом спирт (или галогенид).
Эта система очень удобна во всех тех случаях, когда название ра-
дикала является простым и легко конструируемым.
СН3 СН8 СН2=СН -СНа-С!
il еллилхлорид
—ОН СН3-С-СН2-0Н -
cJhs и
трет- бутиловый из о бутиловый спирт '
спирт
Употребительная, но не официальная система рассматривает j
спирты как продукты замещения карбинола СН3ОН (карбинол — 1
синоним метанола). Многие спирты, названия которых по. системе i
ШРАС выглядят громоздкими, могут иметь структуры, более легко ,
описываемые с помощью карбинольной системы. '
СНв Н СНв
I J I
СН8СН-С-СНгСНаСНСНа
dn
из опроп и ли з оами лк арбя во л
(2 ,6 ? ди мет и лг е ггм н ол - 3
по системе lUPAC)
н
СеЩ-^-СЩСН^СЩ
<]н
аллилфенилиарбииол
(1 -фенилбутен-3-ол-1
по системе lUPAC)
Карбинольная система может быть распространена и на другие
производные. Например, алкилгалогенйды й алкиламины часто на-
зывают карбинилгалогенидами и карбиниламинами.
/ \ СНаС1 —СН — СНг - СН j
х 7 kia
циклогексилкарбинилхлррвд этвлфенвлкарбнниламин
11-3. Номенклатура простых эфиров
Симметричные эфиры (где группы R в К—О—R одинаковы) на-
зываются просто диалкйловыми, диалкениловыми или диариловы-
мн эфирами. Приставка ди-, указывающая на двойное замещение,
иногда опускается, однако в. последнее время такую приставку счи-
тают желательной, так как она помогает избежать ошибок. Очевид-
но, что если эфир несимметричен, то должны быть включены назва-
ния обеих групп.
СН3СН2-О-СН2СН3 СНз^О—СН = СН2 СвН6—О—свн6
д в этиловый эфир метилв ин иловый эфир дифениловый эфир
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 313
1.1- 4. • Номенклатура карбоновых кислот
В соответствии с системой ШРАС карбоновые кислоты называ-
ются алкановыми кислотами. Суффикс -овал добавляется к назва-
нию углеводорода с наиболее длинной цепью, в состав которой вхо-
дит углеродный атом, соединённый с карбоксильной (—СО2Н) груп-
пой. Отметим, что карбоксильная функция обычно имеет преиму-
щество ‘перед гидроксильной.
- CI
сн3сн2(?:нсойн
2-хлорпеятановая
кислота
СНЭ ОН
СН^НСН = СН^НСО2Н
3$ -окси -5 -метилгск сев 3 -свая
кислота
Простые алкановые кислоты были известны в течение долгого
времен# под выразительными, но нс систематическим# названиями,
соответствующими различным их свойствам, например запаху, ис-
точнику Получения из природных продуктов и т. д. Маловероятно,
чтобы эти названия были в ближайшем будущем вытеснены систе-
матическими, особенно для приведенных ниже кислот.
НСО„Н
СН3СО2Н
СН3СН2СО2Н
CH3CH2CHsCOaH
сн3
ДСНСО.Н
сн/.
муравьиная кислота (от лат. formica—муравей)
уксусная кислота (от лат. acetum—уксус) '
пропионовая кислота [proto-{-pion (греЧ.)—жир]
масляная кислота (от лат. butyruiii—масло)
изомасляная Кислота
В случае сложных эфиров карбоновых кислот добавляется суф-
фикс -оат, заменяющий суффикс -овал (или ат в сочетании с латин-
ским корнем тривиального названия кислоты, например —
— формиат).
СН9СН2СС>ОСН3 CeHsCHiCOOCHjCHs СНа = СНСН(С1)СООСН2СНэ
метиллросионат втвлфеаи ацетат этил-2-хлорйутеи-З'оат
11-5. Использование букв
греческого алфавита для указания
положения заместителей
Буквы греческого алфавита — а, р, унт. д.— довольно широко
используются для обозначения положений заместителей угле-
водородной цепи. Углерод, непосредственно связанный со старшей
функциональной группой, обозначается буквой а, второй — р и
т, д. Вообще говоря, употребление таких названий нежелательно,
314
ГЛАВА It
однако, поскольку оно широко
такой системой необходимо.
распространено, познакомиться с
СН2 = СНС(СН3)ВОН
а, а -димет и л ал л илов ы й сперт
(2-метилСутед - 3-ол- 2)
Вг3СНС(СН3)(Вг)СО4Н
а,0,£-трибромизомаеляная кислота
(2,3,3-трабром '2 -метил пропановая
кислота)
11-6. Названия, состоящие из одного
или нескольких слов
При построении названий химических соединений большие за-
труднения вызывает вопрос о том, при каких обстоятельствах
названия соединений пишутся в одно’слово (например, метиламин,
триметилкарбйнол) или в два или большее число слов (например,
метиловый спирт, метилэтиловый эфир). Если при построении наз-
вания соединение рассматривается как производное таких веществ,
как метан, аммиак, уксусная кислота или карбинол, то его название,
образованное путем замещения атома водорода на какой-лйбо атом
или группу, пишется в одно слово.
(C6Hfi)3CH
трифен и л метан
СНа = СН—СН2—С(СН3)2
дим ети ля л ли л ка рб и н о л
CH3MgI
мети лма гн ий н оди д
СНа —NH—СЙНЙ
метилэтнламин *
сн2=сн—СНаСО2Н
внннлуксусная кислота
CeHjLi
фениллиthft
Отсюда следует, что такие производное метана, как (С0Н5)3СН,
следует называть трифенилметаном, а не трифенил метаном.
С2НЬ1
Втилиодид
в
1)
СНа—С-ОСНЭ
метплацетат
О
и
снас—оп
уксусная кислота
О
II
СН3 —С —СН2СН3
метилэтилиетон
(СН.,),СН — ОН
изопропиловый спирт
CH3SCH3
диметилсульфид
CHDOCHaCHs
метилат иловый эфир
О
(снДо
уксусный ангидрид
* Амин— сокращение от аммиака.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
315
Упражнение 11-1. Назовите каждое из приведенных ниже соединений по при-
нятой системе:
СНЭ
а) СН,—(j—СН,—СН,ОН
I
СН,
г) ВгСН2СН2ОСН=СН,
-В) СН3-СН-СН—со,сн,
i
СИ,
I
д) СН,—СН = СН —СН—SH
СНз
е) “Ч-d—СН,
|
NO
Упражнение 11-2. Напишите структуры (обозначив связи) для каждого из
приведенных ниже соединений:
а) диметилвиииламин
б) аллилкарбннилтриметилацеит
в) Ы-мстил-Ы-этилформамид'
г) смешанный ангидрид муравьиной и уксусной кислот s
д) а-фенил эта пол
е) изоамил нитрит
РЕАКЦИИ НУКЛЕОФИЛЬНОГО
ЗАМЕЩЕНИЯ
11-7. Общие положения
В широком определении реакция замещения состоит в замене
одной функциональной группы (X) на другую (Y)
RX + Y—RY4-X
В данном разделе будут рассматриваться реакции нуклеофиль-
ного замещения в алкильных производных. При этих ионных (или
полярных) реакциях происходит атака нуклеофила (т. е. реагента,
предоставляющего электронную пару) на атом углерода. Типичным
примером может служить реакция гидроксил-иона с бромистым ме-
тилом, приводящая к замещению бромид-иона. Можно считать, что
электронная пара, за счет которой образуется связь С—О, предо-
ставляется гидроксил-ионом, тогда как электронная пара разры-
Н:О^®^СН31 '---->- GHj.-O.H + :Вг;@
Таблица }Т2
Типичные SN-реакции замещения алкилгалогенидов
Нуклеофильный агент Продукт Название продукта (Й«СЙ.) - Используемый растворитель
I) R:;X-LY:®- >R:Y-|-X;e
Cl® RC1 Метилхлорйд Ацетон, этанол
Вг® RBr Метилбромид
I® Rl Метил иодид » >
®он ROH Метиловый спирт Вода, водный ди-
оксан
®осн3 ROCH, Диметиловый эфир Метиловый спирт
eSCH3 RSCH9 Диметилсульфид Этиловый спирт
/О
СНз- СЖ _ RO-Cf Метиланетат Уксусная кислота,
XCH3 этанол
®:Cs N RCN Ацетонитрил Ацетон, даметил-
НС^С:е сульфоксид
RCseCH Метила цетил ей Жидкий аммиак
b:CH(COjCaH5)a RCH(CO2C2H5), Диэтилметилмало- Этиловый; спирт
и ат
RNHa Метиламин Жидкий аммиак
© © ©
1N = N = № RNg Метилазйд Ацетон
/6 Ox y
^c— N.N-Диметилфор-
I R-N<p 1 || N-Метилфталимид
L Я—c<( мам ид
V % o/'
Nd® RNOa Нитрометан
2) Rl:X + Y: — —>R:Y®H-x-.9
(CH3)SN: Ф. . r> RN(CH3)3Xy Тетрамети ламмо- Эфир, бензол
нийхлорвд
(QH6)aP; Rp(C^H&)ax9 ; Трифенилметил-
фосфонийхлорйд
(CH3)aS: R§CH3),X® Триметилсульфо- » »
нийхлорвд
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ S17
Продолжение табл. П-2
Нуклеофильный агент Продукт Название продукта (R^CH3J Используемый растворитель
3) R;.-X--HY: > R. ?: Н-Х:9 —->R:Y: -f-H:X
!,0 1Г3ОН ' HSCO5H .Hs ' ROH ROCH3 О RoJcHs rnh2 Метиловый спирт Диметиловый эфир Метилацегат А1етиламин Вода, водный ди оксан Метиловый спирт Уксусная кислота Аммиак, метанол
нающёйся’ связи С—Вг удаляется вместе с уходящим бромид-ионом.
Для названия реакций такого типа используют сокращение S^,
еде S —* замещение (substitution) и N-нуклеофильное (nucleophilic).
В табл. 11-2 приведен ряд нуклеофильных агентов, обычно уча-
ствующих в реакциях Sn, а также названия продуктов, образую-
щихся в тех случаях, когда эти агенты реагируют с хлористым ме-
тилом. Нуклеофилом может быть как анион (¥©)> так и нейтраль-
пая молекула (Y: или HY:); характер действия каждого Из них
иллюстрируется приведенными ниже общими уравнениями для
случая замещения в соединении RX
9 9
RX-rY: _RY + X:
RX + Y: —► Я?-(-Х:е
RX4-HY: —► R^H-pX:® -п» RY.-4-HX
Большое разнообразие продуктов, приведенных в табл. П-2,
иллюстрирует возможности синтетического применения <SN-peaK-
ций. Результатом замещения может быть образование связей меж-
ду углеродом и хлором, бромом, иодом, кислородом, серой, угле-
родом, азотом и фосфором.
Реакции нуклеофильного замещения далеко не ограничиваются
алкилгалогёнидами. Другими алкильными производными при этих
реакциях могут быть спирты, простые и сложные эфиры и «оние-
вые соли» *. Примеры реакций некоторых алкильных производных
различного типа с различными нуклеофилами приведены в табл. 11-3.
* Примеры ониевых катионов;
RjN.®: : ... '• R4P® RaO9
тетр ??лкил аммоний , тетр аалкялфосфо кий трналкилоксониЙ
'' ф:
. R3S® ‘
триалиилсульфопнй алкнлдиазоний
318
ГЛАВА 11
Таблица. 11-3
S^-Реакции замещения различных типов соединений RX
Тнп соединения
Реакция
Алкилхлорид
Алкилбромид
Алкялисдвд
Диалкилсуль-
фат
RI+С1®
Ш + СНгОе--->ДОСНд4-1®
R-OSCkOR +СН3Ое-----> ROCH34-9OSOaOR
Эфир бензол-
сульфокисло-
ты
О
11 /;
R —О—S—
:2o —> roh+ho-s —<
О
О
О
Эфир уксусной
кислоты
R - ОССНЭ 4- HjO-> ROH + НОССНа
Спирт
Простой эфир
Аммониевый ион
Ион иодоння
Диазониевый
ион
ROH+HBr---->₽Вт4-НгО
R-OR'4-HBr---->RBr + R'OH
R - NR j + HO®-> ROH 4- NR3
R_?_R'4-HOe---->ROH4-R'I
R — NsN4-H2O--->ROH4-H®4-Na
Как будет показано ниже, механизм реакций Sn и реакционная ,i-
способность данного алкильного производного RX по отношению к ;
нуклеофилу Y зависят от природы R, X и ¥, а также от природы •<
растворителя. Для того чтобы реакция шла с приемлемой скоростью, (i'
очень важно подобрать такой растворитель, в котором растворя- i
лись бы как алкильное соединение, так и нуклеофильный агент; ;
для разрыва слабополярной связи С—X может потребоваться су- ,
шественное содействие как со стороны растворителя, так и со сторо- ;
ны нуклеофила. Однако наиболее часто используемые агенты (на- (
пример, NaBr, NaCN, Н2О) редко оказываются растворимыми в раст- ;
ворителях, которые лучше всего растворяют малополярные органи- >.
ческие соединения. На практике умеренно полярные растворители
или смеси растворителей, такие, как ацетон, водный ацетон, этанол, i
водный диоксан, оказываются наилучшим компромиссом для ре- >
акций между алкильными производными и солеобразными нукле- \
офильными агентами. В табл. 11-2 приведен ряд растворителей, при- ;
годных для типичных SN-реакций. '
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
319
11-8. Термохимия реакций замещения
Ионные (или полярные) реакции алкилгалогенидов не протекают сколько-ни-
будь легко в газовой фазе, поскольку энергия, необходимая для гетеро литической
ассоциации связи углерод — галоген, настолько высока, что практически исклю-
чает такую возможность. Например, в то время как теплота диссоциации хлори-
стого метила на метил-радикал и атом хлора составляет 80 ккал/моль (табл. 3-7),
диссоциация на метил-катион и хлорид-ион требует около 227 ккал/моль *.
CHj Ц С1(газ)— СНу{газ) + С1-(газ)
, СН> ’[ :С1 (газ) - СН»®(газ) + С1® (газ)
AHs-i- 80 ккал
ДЯ S +227 ккал
Для вычисления теплоты ионизации хлористого метила в водном растворе надо
пять теплоту растворения хлористого метила и обоих ионов в воде. Используемый
. 1ри этом метод приведен в табл. 11-4.
Таблица 11-4
Реакция &Н, ккал Источник получения данных
11-.C1 (газ)—ьСН®(гаа)-|-С1^(газ) 113С1 (водн.) —»• СН3С! (газ) > 11®(газ)—гСН®(водн.) i 1® (газ)—>С1° (водн.) 4-227 4-1 *—80 -85 См. выше Теплота растворения (оце- ненная приблизительно) Оценено на основании энер- гий сольватации ионов метал- лов приблизительно того же размера Энергия Гидратации иона
• НЯС1 (водн.) —*СН® (водн.) 4-С1® (водн.) ккал
Из данных табл. 11-4 очевидно, что реакция ионизации более выгодна в воде,
чем в газовой фазе, причем различие составляет приблизительно (227—63)=
164 ккал. Это обусловлено значительным выигрышем энергии за счет сольвата-
ции ионов. Тем не менее ионизация настолько эндотермнчна, что в воде при обыч-
* Вычислено из следующих данных:
СН8С1 (газ) —> СН.)>(газ)+СЬ(газ) Дл = Ц- 80 ккал
С!]3« (газ)—>СН^ (газ)-4-е ДЯ = ф- 234 ккал
С1«(газ)4-е—>С1е (газ)
Aff^-87 ккал
4-227 ккал
(энергия диссоциации
связи)
(потенциал ионизации,
полученный .из данных
масс-спекТрометрии)
(сродство к электрону по
данным масс-спектромет-
рии)
320 „ ГЛАВА 11
иых температурах она является практически невероятной (по крайней мере в слу- J
чае хлористого метила). К сожалению, большая часть термохимических данных I
того-типа, которые были использованы в приведенном выше расчете, с трудом под- 1
дается вйсперимеита.тьному определению ИЛИ хотя бы оценке; поэтому вычислен- j
ныезначения ДЯ ионных реакций в растворах, в которых участвуют органические г
молекулы, не всегда доступны, а также и не всегда Надежны, Вследствие этого го- )
рай до труднее оценить термодинамическую вероятность отдельных стадий поляр- д
ных реакций, протекающих в растворе, Чем в случае свободнорадикальных про-
цессов, проходящих в газовой фазе. ' V
Упражнение 11-3, Теплота ионизации хлористого метила
СН3С1 (водн.).—ьСН® (водн.)+С1® (води.), f
согласно приведенной выше оценке, составляет 63 ккал. Какой будет теплота
ионизации mpem-бутилхлорида — большей, меньшей или приблизительно равной j
теплоте ионизации хлористого метила? Объясните.
Упражнение 11-4. Какими данными нужно располагать (помимо энергий
связей) для того, чтобы вычислить теплоту реакции S
СН3ОН (врдн.) + НС! (води.) —» СН3С1 (водн.)-(-НгО (жидк.) ,,
и из Нее получить ДЯ для реакции
СН36Н (водн.) + NaCI (водн.)—ьСНэС1 (водн.)-|-КаОН (водн.)?
11-9. Механизмы реакций замещения типа S#
Для реакции хлористого метила с гидроксил-ионом в водном
растворе можно написать два механизма, различающихся положе-
нием во времени момента разрыва и момента образования связи.
В одном из них (А) принимается, что реакция происходит в две ста-
дии, первая из которых представляет собой медленную и обратимую
диссоциацию хлористого метила на метил-катион и хлорид-ион;
вторая стадия заключается в быстром взаимодействии мётил-кати-
она с гидроксил-ионом (или водой), приводящем к метанолу.
Механизм А;
медленно
СН3С1 -----kCH®+Ci9
СН®4-0Н® СНсОН
ИЛИ
НаО —> СнЖ2 он9 СНзОН + НаО
Согласно другому механизму (Б), реакция протекает в одну
стадию. Атака гидроксил-иона на углерод происходит одновремен-
но с уходом хлорйд-иона. Это означает, что связь углерод—кисло-
род образуется одновременно с разрывом связи углерод — хлор.
Механизм Б:
*****\|
HO:Q ЧЗН3:С1: СН3ОН + ;С1:®
РЕАКЦИИ нуклеофильного замещения и ОТЩЕПЛЕНИЯ 321
Механизм А предполагает, что скорость реакции определяется
только скоростью первой стадии (ср. с обсуждением в разд. 3-7,В).
•)то означает, что скорость образования метанола (измеренная в
•юлях на единицу объема в единицу времени) будет зависеть от кон-
центрации хлористого метила, но не от концентрации гидроксил-
чона, поскольку гидроксил-ион расходуется в ходе второй быстрой
еакции.. Наоборот, согласно механизму Б, скорость должна зави-
сть от концентрации обоих реагентов, поскольку на медленной
гадии происходят столкновения между ионами гидроксила и моле-
кулами -хлористого метила. Количественно скорость реакции v
южет быть описана уравнением (11-1) в случае механизма А и урав-
нением (11-2) в случае механизма Б
и==Л[СНвС1] (1J-1)
и=k |СН3С1] [ОН®] (11-2)
Обычно v выражают в молях образовавшегося продукта на 1 л
раствора на единицу времени (чаще всего в секундах). Выражения
1,ля концентрации [СН3С11 и [0Н6] даются тогда в молях на литр, а
константа пропорциональности k (называемая константой скорости)
имеет размерность с-1 для механизма А и л-моль-1-с”1 для механиз-
ма Б.
Удобно рассматривать как порядок реакции по каждому из реа-
гентов, так и суммарный порядок реакции. Порядок реакции по
данному реагенту представляет собой степень, в которую нужно
возвести концентрацию, чтобы получить прямо пропорциональную
зависимость между концентрацией и скоростью реакции. В соот-
ветствии с уравнением (11-2) скорость реакции - хлористого метила
с гидроксил-ионом имеет первый порядок по каждому из реагентов.
В уравнении (ГМ) реакция имеет первый порядок по хлористому
метилу. О порядке реакции по гидроксил-иону говорят, что он ра-
вен нулю, поскольку [ОН@]“=1. Суммарный порядок реакции яв-
ляется: суммой порядков по соответствующим реагентам. Так, урав-
нения (11-1). и (11-2) описывают скорости реакций первого и второ-
го порядка соответственно. _
Таким образом, располагают кинетическим методом, позволяю-
щим различить два возможных механизма, А и Б. Опытные данные
показывают, что скорость образования метилового спирта пропор-
циональна концентрациям как хлористого метила, так и гидроксил-
иона. Реакция имеет общий Второй порядок и правильно описыва-
ется уравнением (11-2). Отсюда можно сделать вывод, что механизм
реакции соответствует одностадийному процессу Б. Этот тип реак-
ции обычно классифицируется как нуклеофильное замещение второ-
го порядка. Его часто обозначают символом Sn2 (S — замещение,
N — нуклеофильное, 2 — второй порядок). Альтернативный двух-
стадийпый процесс, соответствующий механизму А, является Sn-
реакцией первого порядка и обозначается символом S«L
11 X» 1640
322
ГЛАВА 11
Упражнение 11-5. Хлористый этил (0,1 М) реагирует с подпетым калием
(0,1 М) в ацетоновом растворе при 60 °C со скоростью 5,44- 10~7 моль-л-1-с-1; об-
разуются иодистый этил и хлористый калий,
а) Если реакция протекает по механизму SN2, то какой должна быть скорость
реакции при концентрациях обоих реагентов, равных 0,01 М? Приведите ваш
метод расчета.
б) Предположим, что скорость пропорциональна квадрату концентрации
йодистого калия и первой степени концентрации хлористого этила (SN3). Какой
была бы скорость при концентрации реагентов 6,01 М?
в) Если начальная концентрация растворов обоих реагентов равна 0,1 М, то
начальная скорость образования йодистого этила равна 5,44-10-7- моль- л~1-с~1,
но уменьшается по мере протекания реакции и расходования реагентов. Постройте
графики зависимости скорости образования йодистого этила от концентрации
хлористого этила в ходе реакции (имея в виду, что на одну молекулу хлористого
этила расходуется одна молекула йодистого калия) в предположении, что скорость
реакции пропорциональна первой степени концентрации хлористого этила и 1) ну-
левой степени, 2) первой степени и 3) второй степени концентрации нодистого
калия.
г) Какого типа Экспериментальными данными нужно располагать для того,
чтобы определить, подчиняется ли скорость реакции хлористого этила с иодистым
калием уравнению первого порядка по каждому из реагентов или второго порядка
по хлористому этилу и нулевою порядка по иодистому калию?
При многих реакциях SN в качестве нуклеофильного агента
используется растворитель. Такие реакции носят название реак-
ций сольволиза; при использовании в качестве растворителя воды,
этанола, уксусной и муравьиной кислот происходят реакции гид-
ролиза, этанолиза, ацетолиза и формолиза соответственно. Ско-
рости всех реакций сольволиза с необходимостью следуют первому
порядку, поскольку растворитель присутствует в таком большом
избытке, что его концентрация не изменяется сколько-нибудь за-
метно в ходе реакции и, следовательно, не изменяется его вклад в
скорость процесса. Однако это не означает, что реакция обязательно
должна протекать по механизму S>|1, в частности, в таких раство-
рителях, как вода, спирты и амины, которые являются весьма эф.
фективными нуклеофильными агентами.
Одна из возможностей установить различие между сольволизом S^l - и SN2-
типа в нуклеофильных растворителях состоит в добавлении к реакционной смеси
веществ, которые являются более сильными нуклеофилами, чем растворитель (в
относительно малой концентрации). Если скорость нуклеофильного замещения
остается при этом практически неизменной *, то обычно оказывается возможным
утверждать, что реакция протекает по механизму SN1. Если же скорость замеще-
ния существенно возрастает, то механизм реакции относится к5н2-тнпу. Напри-
мер, измеряемая скорость образования mpem-бутилового спирта из т/зеет-бутил-
* Можно ожидать некоторого изменения суммарной скорости в том случае,
если добавленное соединение является солью, поскольку соли независимо от того,
нуклеофильны они или нет, изменяют физическое окружение реагирующих моле-
кул. Изменение скорости, обусловленное именно реакцией добавленного нуклео-
фила, может быть наилу чптим образом установлено при сравнении этого изменения
с эффектом, оказываемым ненуклеофильным веществом, подобным перхлорату
лития,
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
323
х лорида пропорциональна только концентрации галогенида. При добавлении гид-
роксил-иона скорость замещения не возрастает. Это служит свидетельством того,
что трет -бутил хлор ид гидролизуется по механизму SN1.
медленно
(СНЭ)ЭСС1 (СН3)3С®+С1е
(СН3)3С+ Н3О —(СН3)3С-ОН + н ©
(CH3).,C®+OHQ^±X(CH3)3C-OH
Если, при SN 1-реакции в сфере реакции присутствует более од-
»го нуклеофила, то их конкуренция за карбониевый ион приведет
образованию смеси продуктов. Отношение продуктов (но не общая
корость их образования) определяется относительной концентра-
ией нуклеофилов. Так, реакция SN1-сольволиза галогенида в воде
присутствии такого нуклеофила, как азид-ион, приводит к обра-
щайте органического азида и спирта
о
медленно «. быстро -
RBr~i^-~R®-—N@
—-^RNS
•1-10. ' Стереохимия 8к2-замещения
Рассмотрим теперь два возможных пути осуществления S^2-
। акции хлористого метила с гидроксил-ионом, отличающиеся на-
бавлением сближения реагентов (рис. 11-1). Гидроксил-ион может
Рис. 11-1. Атака с тыла (приводящая к обращению конфигурации) и фронтальная
щвка (не приводящая к обращению) хлористого метила гидроксил-ионом, пока-
занные с помощью шаростержневых моделей.
324
ГЛАВА 1 i
атаковать хлористый метил с той же стороны,, где находится атом
хлора (так называемая фронтальная атака); другая возможность
заключается в приближении гидроксила к молекуле «со спины»,
что приводит к выбросу хлорид-иона с противоположной стороны
(так называемая атака с тыла).
Результаты фронтального замещения и замещения с тыльной
стороны в стереохимическом отношении различны. В случае цикли-
ческих соединений два типа замещения приводят к различным про-
дуктам: например, 8^2-реакция между qac-З-метил цикл опентил-
хлоридом и гидроксил-ионом должна дать ^ис-спирт при фронталь-
ной атаке, но транс-спирт при атаке с тыла. В действительности
образуется транс-спирт, откуда можно сделать вывод о том, что
реакция происходит путем замещения с тыла,
Фронтальная
атака
СНЭ ОН
* цис- спирт
(не образуется)
атака с тыла
транс- спирт
Для соединений с открытой цепью факт замещения с тыла может
быть надежно установлен с помощыо оптических изомеров; как бу-
дет показано в гл. 17, оптические изомеры являются неидентичными
зеркальными изображениями, относящимися друг к другу так же,
как правая и левая перчатка. Для целей настоящего обсуждения
нас будет интересовать такой тип оптической изомерии, при кото-
ром четыре различные группы связаны с одним углеродным атомом.
Примером может служить втор-бутил хлорид, в котором четыре раз-
личные группы — хлор, метил, этил, водород — соединены со
вторым углеродным атомом цепи и который поэтому может быть по-
лучен как в «левой», так и в «правой» формах (рис. .11-2).
н
I
СН3СН2 — С — СНз
CI
йтлд-б утя л хлорид
Оптические изомеры втор-бутилхлорида обладают идентичными
физическими свойствами за одним существенным исключением: при
прохождении плоскополярйзованного света через раствор одного
из изомеров происходит поворот плоскости поляризации вокруг оси
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
325
Рис. Ji-2. Оптические изомерывтор-бутилхлорида.
Эти формы являются мркальными отображениями одна другой; они не идентинни.
распространения луча в каком-либо одном направлении, тогда как
другой изомер вызывает поворот плоскости на такой же угол, но в
противоположном направлении (рис. 11-3).
Обратившись к изображенным на рис. П-2 формулам оптических
изомеров втор-бутилхлорида, увидим, что фронтальное замещение
хлорид-иона гидроксилом приведет к втор-бутиловому спирту с той
нее самой конфигурацией, что и у исходного хлорида, тогда как за-
мещение с тыла даст спирт с противоположной, или обращенной,
конфигурацией. Результаты опытов, проведенных с одним из двух
оптических изомеров, показывают, что гидроксил-ион атакует
втор-бутилхлорид с тыльной стороны, что приводит к втор-бутило-
ному спирту с обращенной конфигурацией. Аналогичные исследова-'
ния, проведенные для широкого круга реакций замещения, позво-
лили установить, что 5ц2-реакции всегда протекают путем атаки с
Рис. 11-3. Схематическое изображение вращения плоскости поляризации пол яри-
; зованного света оптически активным веществом (а — угол Вращения).
326
ГЛАВА II
тыла с обращением конфигурации. Такой стереохимический резуль-
тат реакции обычно называют вальденовским обращением *.
Упражнение 11-6. Уравнения 11-3 и 11-5 иллюстрируют метод, использован-
ный Кеньоном и Филлипсом для доказательства того, что З^г-замещение сопро-
вождается обращением оптической конфигурации. Объясните, каким образом этот
вывод может быть сделан на основании уравнения 11-5. Знаки (+' и (—) указы-
вают для каждого соединения на направление вращения плоскости поляризации
света. Знак вращения сам по себе не может быть использован для ответа на вопрос
о том, «правым» или «левым» изомером является соединение. Так, «правый» изо-
мер алкилхлорида может иметь вращение со знаком (—), тогда как соответст-
вующий «правый» изомер спирта может иметь вращение со знаком (+).
О О
О О
II II II II
(+)-RO: j Н+СН3СОССНЭ —► (+)-ROCCH3-j-CH3COH
(Н-З)
(+).RoH h _l^^(+).RO-SOaR‘ s (II-4)
(+)-R
О О
И о II о
-.OSOjR'+CHjC—0е—к ROCCHg +®OSO2R'
(11-5)
Упражнение 11-7. Объясните тот факт, что в присутствии бромид-ион а оп-
тический изомер втор-бутилбромида рацемизуется (этот термин означает, что
его оптическое вращение уменьшается до нуля).
Упражнение 11-8. Какой вывод можно сделать из того факта, что любой из
оптических изомеров а-дейте роб ромбу тан а при нагревании в присутствии брпмид-
нопа теряет свою оптическую активность почти в 2 раза быстрее, чем радиоак-
тивный бром (Вг*), вступает в молекулу при нагревании а-дейтеробромбутана с
большим избытком радиоактивного бромид-иона в точно таких же условиях.
CH3CH2CHSCH DBr + Вг®* -* CH3CH3CHaCHDBr* Br®
Упражнение 11-9. Используя соответствующие рисунки (рис. 11-2) (или моде-
ли), определите стереохимический результат 5м2-реакции гидроксил-иона с «пра-
вым» изомером 1-хЛор-2-метилбутана.
И-11. Стереохимия S^l-реакций
Если SN1-реакция проводится с одним чистым оптическим изо-
мером, например, emop-бутилхлорида, то продукт обычно представ-
ляет собой смесь обоих оптических изомеров, в которой несколько
преобладает изомер с обращенной конфигурацией. Теоретически
свободный карбониевый ион более устойчив в плоской конфигура-
ции (разд. 5-7) и потому должен привести к точно одинаковым ко-
* То, что оптически активные соединения могут реагировать, образуя про-
дукты с противоположной оптической конфигурацией, впервые установил Валь-
дев в 1895 г. Причины этого оставались, однако, непонятными до тех пор, пока
механизм нуклеофильного замещения не был выяснен в тридцатых годах благо-
даря работам главным образом Хьюза и Ингольда, Впоследствии было установле-
но. что продукты с обращенной конфигурацией образуются при 5^2-замещении
(см. упражнение 11-6).
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 327
Рис. 11-4. Изображение плоского карбониевого иона с помощью шаростержневой
модели (Rj, R3 и Rs — различные алкильные группы). Схема иллюстрирует веро-
ятность образования «правого» и «левого» продуктов замещения при реакции с Y©.
личествам двух оптических изомеров независимо от оптической кон-
фигурации исходного вещества (рис. 11-4).
Степень обращения конфигурации, происходящего при реакции
S^l, должна зависеть, однако, от того, насколько «экранирован»
реагирующий атом углерода с фронтальной стороны уходящей груп-
пой и ассоциированными с ней молекулами растворителя. Если
уходящая группа не успевает удалиться от карбониевого иона до
стадии, определяющей характер продуктов, то можно ожидать, что
нуклеофильная атака с тыльной стороны окажется несколько более
предпочтительной, что приведет к преобладанию продукта с об-
ращенной конфигурацией,
При прочих равных условиях степень обращения уменьшается
при увеличении стабильностй промежуточно образующегося иона
карбоння, поскольку, чем стабильнее ион, тем больше его время
жизни и тем больше вероятность того, что он станет сравнительно
«свободным» ионом.
Растворитель должен оказывать и действительно оказывает
влияние на стереохимический результат З^Ьреакции, так как ста-
бильность и время жизни карбониевых ионов зависят от природы
растворителя (разд. 11-12,Г).
Упражнение 11-10. Какие выводы о механизме ацетолиза п-бутплпроизводных
можно сделать на основании приведенной ниже реакция?
Н
I ; снэсо,н
CHgCHaCH3—С—О— SOs—"._______Вг------------
D
D О /
1 11
—*СНаСНаСН,—С—ОС—СНв
й
(обращение конфигурации)
328 ГЛАВА 11 -
И-12. Влияние структурных ‘факторов
и природы растворителя
при SN-реакциях
Рассмотрим сначала соотношение между структурой алкильных
производных и скоростью взаимодействия с данным нуклеофилом.
Далее обсудим относительную реакционную способность различных
нуклеофилов по отношению к данному алкильному производному.
Наконец, будет охарактеризована роль растворителя в реакциях
SN.
А, Структура алкильной группы _
Скорость реакций 5м2-замещения простых алкилпроизводных
RX следуют порядку: первичный Р>вторичный Р>третичный R.
При практическом проведении синтезов, в которых осуществляются
5ы2-реакции, первичные соединения, как правило, реагируют очень
гладко, вторичные — хуже, а в случае третичных изомеров такие
реакции дают совершенно неудовлетворительные результаты.
При определении скоростей 5м2-реакций пространственные эф-
фекты играют особенно важную роль, и низкая скорость реакций
третичных галогенидов наилучшим образом объясняется простран-
ственными препятствиями, создаваемыми алкильными группами при
а-углероде для приближения атакующего нуклеофила с Тыльной
стороны. Неопентил галогениды весьма мало реакционноспособны
в реакциях SN2, и масштабные модели показывают, что это является
результатом пространственных препятствий, создаваемых метиль-
ными группами при р-углероде.
СНЭ
I
СН3-С—СН2Вг
I
сн3
неопентнлбромид
(медленно реагирует в реакциях 5^2-типа)
В табл, 11-5 приведены данные, которые показывают, каким обра- ; ?
зом алкильные группы в а- и ^-положениях оказывают влияние на ..
реакционную-способность алкилбромидов пр отношению к иодид- *
иону.
Скорости SN 1-реакций алкильных производных в полную про- s
тивоположность скоростям Sn2-реакций следуют порядку: третич-
ный РР>вторичный Р>первичный R. Это хорошо видно из данных :
табл. 11-6, где приведены относительные скорости гидролиза нёко- ?
торых алкилбромидов. -
; Таблица 11-5
Относительные скорости SN 2-замещения в алкилбромидах
при действии иодид-иоиа в ацетоне
RBr-f-J® RI + Br@
R (а-замещение) : Относительная 1 скорость 1 R (р-аамещеаие) Относительная скорость
н3- н3сщ- - . н3—сн- 145 I 1 0,0078 снэсна-^ снэснгсн2- сн3 ! 0,82
1 сн, • СН, СНз-СН-СЩ- сн3 0,036
Нз-С- <0,00051 СНз-С^СН,- 0,000012
in. СНз
Таблица 11-6
Относительные скорости SNl-гидролиза алкилбромидов
в воде при 50 “С
_ Н,0
RBr—*R®+Bre——'“ROH + HBr
R Относительная скорость
СН3- 1,05а
СНдСНз — 1,00а
снэ
см8-сн — 11,6
сна
СН8-С— - - : 1,2-10е
СНз
а Механизм реакция почти Наверняка относится к типу $№ б случае раство-
рителя, действующего к эк нуклеофил, поскольку добавление гидроксил-иона выяы»
вает заметное увеличение скорости реакции (разд, Н-9). Приводимые относитель-
ные скорости могут рассматриваться лишь как верхний предел по отношению
к истинным значениям для S^l-реакций, которые могут быть по крайней мере в
|04 рвз меньше '
330
ГЛАВА 11
Пространственные препятствия при реакциях SNI имеют срав-
нительно небольшое значение, поскольку скорости не зависят от
природы нуклеофила. Более того, при сольволизе сильноразветв-
ленных алкилгалогенидов возможно пространственное ускорение
вследствие уменьшения пространственного сжатия при образовании
плоского катиона.
<гн4?нз х@
снг^—-С—х ------------—и
сн, |сн,
"*------пространственное
перекрывание
<?Н, СН,
СН,—С-^—С^®
СН, V СН,
снятие напряжения
Последовательность реакционной способности — третичный^
~р>еторичныир> первичный—является той, которой и следовало ожи-
дать, так как известно, что электрояодефицитяые центры Стабили-
Таблица 11-7
Зависимость скорости SN -реакций от природы уходящей
группы 'X
5м2-реакция; CHsCHaX-f-
л СгН(ОН
J-CsHjO®--------► CH3CH2OCHaCH3-i'-Xy
25 °C
X Относительная скорость
— OSOoCgHj 5,8
I— 1,9
Вт— 1,0
Ci — 0,024 (при 40°C}
SN!-реакция: (СН3)2СНХ4-
80%-ИЫЙ CjH.OH
_ -1-CjH5OH----------------- (CHs),CHOCHaCHs + HX
X Относительная скорость
.. - OSOsCeH5 I- Вг- CJ- 76.3 1.00 0,00135
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 331
шруются алкильными группами в большей степени, чем водородом,
вследствие меньшей способности алкильных групп к оттягиванию
>лектронов (см. разд. 7-5,Б),
Б. Уходящая группа '
Реакционная способность данного алкильного производного
кХ при реакциях как SnI, так и SN2 отчасти определяется приро-
1,ой уходящей группы X (табл. 11-7). В целом наблюдается опреде-
1енная корреляция между реакционной способностью RX и силой
кислоты НХ, где группа X, соответствующая наиболее сильной
। «слоте, одновременно является наилучшей уходящей группой.
Гак, поскольку HF — относительно более слабая кислота и HI —
чень сильная кислота, обычно порядок реакционной способности
1лкилгалогенидов оказывается следующим: RI>-RBr>>RCl>»RF.
Вбльшая легкость разрыва связи С— |—OSO2CeHsno сравнению со
вязью С—С1 в случае SN2-реакций при атоме углерода соответству-
ет большей силе кислоты H0SO2CeH5 по сравнению с НО.
Спирты относительно мало реакционноспособны в отсутствие ка-
1ализатора — сильной кислоты. Причина заключается в том, что
। руппа ОН®— очень «плохая» уходящая группа. Функция кислоты
заключается в передаче протона кислородному атому спирта, что
превращает гидроксильную функцию в относительно более легко
\ ходящую группу (Н2О вместо ОН®). Кислотный катализ при ре-
акциях простых и сложных эфиров объясняется той же причиной.
ROH + Вг® -$-* RBr + он
Н л
r:o:h + Н® юо;н®
rJkkH + Вт® ---------> RBr + нр
н © _ п ©
r!:o:h —ь я® + нр RBr
s№
V
Упражнение 11-Н, Взаимодействие спиртов с бромистоводородной кислотой,
приводящее к алкилбромидам, представляет собой равновесную реакцию. Алкил-
бромиды обычно образуются из спиртов и концентрированной бромистоводородной
кислоты с хорошими выходами, тогда как в нейтральном водном растворе алкил-
бромиды гидролизуются почти нацело. Определите изменение относительных ко-
личеств алкнлбромида и спирта в равновесной смесн при переходе от раствора
10 М бромид-иона в буферной смесн с pH 7 к 10 М бромистоводородной кислоте.
Соли тяжелых металлов, в частности серебра, ртути и меди, ка-
тализируют SN1-реакции алкилгалогенидов в основном так же, как
332
ГЛАВА 1)
кислоты катализируютSN-реакции спиртов. Функция иона тяжелого
.металла заключается в образовании комплекса за счет неподеленных
электронов галогенида, вследствие чего уходящей группой стано-
вится галогенид металла, а не галоген ид-ион. На таком ускорении
реакций галогенидов основана качественная проба на галогенид-ион,
проводимая с нитратом серебра в растворе этилового спирта. Галоге-
нид серебра осаждается со скоростью, которая зависит от структуры
алкильной группы: третичная > вторичная > первичная.
•• - ", . © медленно © HY^
r:x: s=±=± R-.x: ......Ag^ —R —* RY 1 H
Третичные галогениды обычно реагируют при комнатной тем-
пературе немедленно, тогда как для первичных требуется нагрева-
ние..
Указанием на действительное образование комплекса между
органическими галогенидами и ионом серебра служит возрастание
растворимости в воде в присутствии иона серебра таких галогени-
дов, которые медленно образуют карбониевые ионы.
В. Нуклеофильный агент
Реакционная способность данногд агента по отношению к ал-
килпроизводным при реакции SN2 может быть определена как его
нуклеофильность, т. е. способность к взаимодействию за счет своей
электронной пары с атомом углерода. Нуклеофильность агентов не
всегда изменяется параллельно .их основности — способности свя-
зывать протон за счет своей электронной пары. Отсутствие паралле-
лизма можно видеть из данных табл. 11-8, где приведены значения
реакционных способностей различных нуклеофильных агентов (по
отношению к бромистоМу метилу в воде) и соответствующих основ-
ностей. Из данных таблицы видно, что сильные основания (напри-
мер, ОНУ) являются хорошими нуклеофилами; тем не менее ii
очень сЛабые основания могут быть хорошими нуклеофилами (на-
пример, Г©).
Почему ряд реакционной способности 1®>Вг9>С1© противо-
положен тому, которого следовало бы ожидать, исходя как из проч-
ностей., образующихся связей (G—Ci>C—13г>С—-1), так и из ве-
личин основностей (С1©>Вг©>-1©)? По этому вопросу общее сог-
ласие отсутствует, однако наиболее вероятно, что доминирующим
фактором являются различия энергий сольватации ионов в соот-
ветствии с приведенными ниже уравнениями:
Р®(газ)—*Р©(водн.) Дй =—: ] 17 ккал
С1© (газ)—> Ci© (волн.) АН ——Ябкклл
Вг® (газ) —* Вг© (волн.). Д// = —78 ккал
: , !®(гйз)—• 1® (годи.) А// ——68 ккал
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 333
Таблица 11-8
Реакционная способность различных нуклеофилов по отношению
к бромистому метилу в воде при 50 °C
Нуклеофил Полупериод реакции, ч* Скорость fiO OTHQ' щенню к воде Кд
НгО 1100й (0 io-fl
сн3со® • 2,1 5,2.10* 10-“
С1® 1 1,1103 ~ю-20
Вг® 0,17 7,8-103 < 10-а
0,1Г 4,0.10* 10-“
НО® 0,07 1,6.10* 10°
QHf.NHs, 0,04 3,1.10* 10-10
SCN® 0,02 5,9-10* (0-14
1© 0,01 1,1 НО6 <10-22
а Время в часах, необходимое для того; чтобы Прореагировала половина бро-
мистого метила при постоянной (1М) концентрации нукЛеОфиЛа.
б Рассчитано из Данных дли чистой воды (считая, что концентрация воды
55 М).
Энергий сольватации для меньших по размеру ионов с более кон-
центрированным зарядом всегда больше, чем для ионов большего
размера, где заряд более диффузен.
При нуклеофильной атаке па атом углерода ион должен осво-
бодиться от части молекул растворителя, стабилизирующих его в
растворе, так как в противном случае он не сможет приблизиться
к атому углерода настолько близко, чтобы началось образование
связи. Для иона небольшого размера этот процесс менее выгоден,
чем для большого, и на этом основании можно ожидать, что С Iе
будет менее реакционноспособен, чем 1®. Серьезным доводом в
пользу такой точки зрения может служить то, что хлорид-ион ока-
зывается действительно более реакционноспособным, чем иодид-
ион, в таких растворителях, где энергии сольватации анионов малы
(см. разд. 11-12,Г).
Упражнение 11-12. Sjjl-реакции многих соединений типа RX, образующих
сравнительно устойчивые карбоииевые ионы, значительно тормозятся добавлени-
ем ионов X®. Однако такое торможение уменьшается для данной концентрации
X® при добавлении другого нуклеофила, такого, например, как М^. Объясните.
Упражнение 11-13; Относительная реакционная способность воды и при
взаимодействии с бромистым метилом составляет 1 10*, Каково ваше мнение об
относительной реакционной способности этих соединений при взаимодействии
их с mpem-бутил-катионом? Будет ли она больше, меньше или приблизительно той
же самой? Почему? -
334
ГЛАВА !}
Упражнение 11-14. Реакция л-бутилхлорида с едким натром, дающая «-бути-
ловый спирт, катализируется подпетым натрием.
а) Напишите механизм, объясняющий причину катализа иодид-иовом.
б) Опишите стереохимию, которой следует ожидать для катализируе-
мой и неката лизируемой реакций «правого» изомера 1-хлорбутана-1-б
Н
I
(СНзСН2СНа—С—С1); приведите ваши соображения.
I
D
в) Позволяет ли сохранение оптической конфигурации, являющееся конеч-
ным результатом реакции SN2, автоматически исключить действие обычного меха-
низма инверсии? Объясните.
Г. Природа растворителя
Скорости большинства SN 1-реакций очень чувствительны к
изменению растворителя. Это понятно, так как ионизирующая спо-
собность растворителя играет решающую роль в легкости образо-
вания ионов R®---------Х@ из RX.
Что касается ионизирующей способности растворителя, то два
фактора заслуживают особого внимания. Прежде всего ионизи-
рующая способность возрастает при увеличении диэлектрической
проницаемости, так как при этом становится более эффективным
разделение ионов — силы, действующие между заряженными части- '
цами, находятся в обратной зависимости от диэлектрической про-
ницаемости среды (разд. 6-7). По этой причине вода, диэлектриче-
ская. проницаемость которой равна 80, должна быть гораздо более
эффективна, чем углеводород с диэлектрической проницаемостью 2.
Сходным и возможно более важным фактором является способность
растворителя сольватировать разделенные ионы. Катионы наиболее
эффективно сольватируются соединениями элементов первого пе-
риода периодической системы, имеющими неподеленные пары элек-
тронов. Примерами могут служить аммиак, вода, спирты, карбо-
новые кислоты, сернистый ангидрид и диметилсульфоксид (CH9)2SO.
Анионы сольватируются наиболее эффективно растворителями, в
которых атомы водорода соединены с сильно электроотрицательны-
ми элементами Y, так что связь Н—Y значительно поляризована.
В случае таких растворителей водородные связи между растворите-
лем и уходящей группой способствуют ионизации примерно таким
же образом, каким ирн серебра катализирует ионизацию ал кил га-
логенидов (разд. 11-12,0).
н ®
Ю; — № — :of
аОб® 0 бфб©
Y—И — :С1:~ H-Y
сольватация катиона
растворителем с неподеленной
парой электронов
сольватация аниона ттем
образования водородных
связей с растворителем
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
335
Наиболее эффективно ионизирующим растворителем будет тот,
который в наибольшей степени сольватирует и анионы и катионы.
Вода оказывается в этом отношении наилучшим компромиссом, так
как особенности ее структуры приводят к значительной величине
диэлектрической проницаемости и способности к сольватации, а
следовательно, к большой ионизирующей способности. На основа-
нии вышеизложенного можно предполагать, что трет-бутилхлорид
будет гидролизоваться быстрее в водно-спиртовых смесях, чем
в смесях спирта с эфиром, поскольку эфир эффективен только при
сольватаций катионов, тогда как вода может сольватировать как
анионы, так,и катионы.
Что касается Зм2-реакций, то влияние на них изменений в раст-
ворителе зависит от «типа заряда» данной реакции, т. е. от тога,
образуются ли при реакции ионы из нейтральных молекул [урав-
нение (11-6)1 или нейтральные молекулы из ионов [уравнение
Д1-7)], или, наконец, не происходит, ли изменения общего числа
участвующих в реакции ионов [уравнение (11-8)].
RX + Y—>RY-pX (ii-6)
^Х дЛ —> RY+ X (11-7)
RX + Y^RY + t (Н-8)
Для того чтобы предсказать влияние характера растворителя на
эти реакции, полезно обратиться к рис. 11-5, из которого видно, что
для превращения реагентов в продукты должен быть преодолен
энергетический барьер (см. также разд. 3-7,Г и рис, 3-9). Промежу-
точная стадия реакции, соответствующая вершине энергетического
Рис. 11-5. Энергетическая диаграмма реакции.
336
ГЛАВА Н
барьера^ обычно рассматривается как переходное состояние, В пе-
реходных состояниях для каждой из реакций, представляемых урав-
ед ед б© в®
нениями (Н-6) и. (П-7) (Y-*- :--------R-------—X и Y — ——R
— -----*Х соответственно), имеет место большое изменение степени
разделения зарядов по сравнению с исходными реагентами. Поэтому
можно ожидать, что на такие реакции будет оказывать большое (но
противоположное) влияние диэлектрическая проницаемость раство-
рителя. В то же время 3^2-реакции типа, представленного уравне-
нием (11 -8), менее чувствительны к изменению характера раство-
рителя, поскольку в переходном состоянии tY-------—R------------Х)6
не происходит значительного разделения зарядов. В переходном
состоянии происходит некоторое рассредоточение заряда по X
и Y, вследствие чего понижение диэлектрической проницаемости
растворителя вызывает небольшое увеличение скорости реакций.
Упражнение 11-15. Возрастет или уменьшится скорость каждой г'.з приведен-
ных ниже реакций при увеличении ионизирующей способности растворителя?
Укажите, относительно большим или малым будет это изменение. Приведите ваши
соображения,
® sn’ Ф
а) (СНд)3СОН2 “-* (CHg)gC + Н2О
s№
б) CHjOSOsCeHs+^OH------->,CH3OH-i-eOSO!!CeH6
® s s№
в) CHaSfCHJs+^OCsH,------’•CH3OC!He-|-S(CHs)2
r) CH8CHsi-i-(CH,CHa)sN —(CH3CH2)^+le
Упражнение 11-16, Классифицируйте приведенные ниже растворители в соот-
ветствии с их эффективностью при сольватированнн катионов или анионов,
а) ацетон
б) четырех хлор истый углерод
в) безводная фтористоводородная кислота
г) хлороформ
л) триметиламин (CH3)9N
е) окись триметиламияа (CH3)aN®—О®
Упражнение 11-17. Какой будет скорость 5^2-реакции цианистого натрия с
бромистым метилом при проведении ее в диметилсульфоксиде по сравнению со
скоростью этой же реакции в этиловом спирте — более быстрой, более медленной
или примерно такой Же? Объясните,
РЕАКЦИИ ОТЩЕПЛЕНИЯ
Отщепление представляет собой процесс, обратный присоедине-
нию к двойным связям алкенов, При определенных условиях алкиль-
ные производные могут отщеплять НХ, где X чаще всего бывает
галоген ид ионом, гидроксилом, Дчожноэфирной или ониевой функ-
t=
E- ©
C3 зс
и
V a W <d
s
£ g
s
я и
Я я га й g
s о в Й L) S
и 1 ru cn
Е « О S 10 § л В
СЗ о
ЕС «S £
Е. р_ А
с Е fi
Ф
р й
§5 S.S
Й .s = 5
3 0 ., о
и tS х й
5 о»
а -
4) л 4> —
S S S' _
ЕС г; V о к? X * н 9 В
р а к = § § и *Й
Л е Cl ° ~ а t О Е
ЛГ ©
сч
5ГХ W ах
eg о X
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 330
s
цией, а водород располагается при атоме углерода, соседнем с тем,
при котором находится функция X.
\ /
— С—С-----> >с=с< 4-НХ
II / х
Н X
о
Х = С1, Вг. I, - О—21— снэ, — Да, — ^r9, — Вна
Важнейшие реакции отщепления приведены в табл. 11-9. Из
таблицы видно, что исходными веществами при реакциях отщепле-
ния могут быть соединения с весьма разнообразными функциональ-
ными группами. Следует обратить внимание на то обстоятельство,
что в некоторых из Приведенных в табл. 11-9 реакциях участвуют
реагенты, уже упоминавшиеся ранее в качестве систем, в которых
происходит нуклеофильное замещение (см. табл. 11-2 и 11-3). Ре-
акции замещения и отщепления для алкильных производных обычно
протекают конкурентно, и при проведении синтезов важно иметь
возможность в максимальной степени осуществлять контроль над
отношением образующихся продуктов. Механизмы замещения и
отщепления имеют много общего, что делает такой контроль зна-
чительно более трудным, чем в том случае, если бы механизмы были
существенно различными, поскольку при этом возможности для
варьирования экспериментальных условий уменьшаются.
11-13. Реакции Е2
Рассмотрим реакцию хлористого этила с едким натром
CHsCH,C14-OHe —
—>СН3СНаОН4-С1е SNa
—+CH2 = CHa + HilO-|-Cle
Е2
Отщепление, в результате которого образуется этилен, конку-
рирует с замещением, приводящим к этанолу. Далее, скорость от-
щепления, как и скорость замещения, пропорциональна концен-
трациям хлористого этила и гидроксил-иона; следовательно, от-
щепление в данном случае является реакцией второго порядка, что
сокращенно обозначается символом Е2. Механизм этой реакции
заключается в том, что атакующее основание ОН© отрывает протон
от p-углерода одновременно с образованием двойной связи и ухо-
дом хлорид-ион а от «-углеродного атома.
340
ГЛАВА 11
Упражнение I1-I& Альтернативный механизм отщепления Е2 заключаете^'на-
следующем: '
© быстро © медленно ©
сн3сн2а+он ~^сн8снаа+нго-т—-*сна=сн2+С1 ’
а) Может ли этот механизм привести к кинетике первого порядка в отношении ;1,
концентраций ОН© и хлористого этила- Объясните.
б) Этот механизм для ряда галогенидов был отвергнут в результате проведе- ;j
пня реакции в дейтерированных растворителях, таких, как DSO и C2H5OD. Пояс-
ните, каким образом эти опыты могли быть использованы для выяснения мехациз- ;г
на данной реакции.
Влияние структурных факторов на Е2-реакции было предметом
внимательного изучения. Для органических галогенидов с данной
группой R скорость отщепления изменяется в зависимости от X
в следующем порядке: I>Br>Cl>F. При фиксированном X ско- |
рость отщепления следует порядку: третичный R > вторичный t
R > первичный R, Пространственные препятствия оказывают на ?
Е2-реакции лишь очень слабое влияние по сравнению с реакциями ;
SN2, и отщепление в случае третичных галогенидов происходит »
легко.
Для проведения Е2-реакций обычно требуются сравнительно
сильные основания. В ряду оснований эффективность изменяется
параллельно их силе. Для реакций Е2 наблюдается следующий по-
рядок: N.H2>OCgHs>§H>Oj!CCHs. Это весьма важно при плани-
ровании синтезов, поскольку в случае сйльноосноёных и слабопо-
ляризуемых агентов, подобных амид-ио ну ©NH2 или этил ат-иону
©ОС2Н5, существует тенденция к преимущественному протеканию
Е2-рсакцнй. С другой стороны, Эк2-реакциям благоприятствуют сла-
боосновные реагенты, подобные иодид- или ацетат-иону. Отщепление
преобладает также над замещением при повышенных температурах.
Упражнение //-Ж а) Почему тре/тг-бутилат калия К.ОС(СН3)3 служит отлич-
ным основанием для проведения реакций отщепления е алкилгалогенидамн, тогда
как этилами и CH3CH.,NH2 сравнительно мало подходит для этой цели?
б) Эффективность треш-бутилата калия как отщепляющего агента в диметил-
сульфоксиде на много порядков превышает его Эффективность в трет -бутиловом
спирте. Объясните.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
341
В случае ал кил галоген вдов с различными алкильными остатками, как, на-
пример, в mpem-амилхлориде, существует возможность образования двух или
большего числа различных алкенов в зависимости от того, какой из Р-водородных
помов отщепляется на стадий, определяющей скорость. Для большинства реак-
ций отщепления типа Е2 действует тенденция к образованию наиболее стабильного
|.1кена, которым обычно оказывается наиболее высоко замещенный алкен
(разд. 7-3). Однако в том случае, когда уходящая группа имеет большой объем
i’.tii обладает сильными электроноакцепторными, свойствами, а также если ата-
кующее основание: имеет больщой объем, может оказаться более благоприятным
.бразоваиие наименее стабильного (наименее замещенного) алкена.
ССН3
ГСН3— cL — еСН3+ он—
а
сн3
—Д СН3 - (J =. СН—СН, + Н аон- С1е
сн.,
—*СН» = (L-CH$CH3 -ьН2Оп С19
14%
'(.энные, иллюстрирующие это положение, приведены в табл. 11-10; можно видеть,
каким образом направление отщепления зависит от природы уходящей группы. Из
[энных табл. 11-10 следует, что чрезвычайно большой объем; занимаемый алкиль-
ными группами в соли тетраалкил аммония, служит причиной образования наиме-
нее замещенного алкена, поскольку основание атакует наиболее доступный атом
водорода d-метилъной группы.
Таблица 11-10
Состав продуктов Е2-реакции 2-пентильных производных
при использовании К0С2Н3 в' С2НЙОН
X Количество, %
пентена-! невтена,2
-Вг •. 31 69
„1 30 70
—OSOaR 48 52
Ф — S(CH3)2 87 13
ф — N(CHa)3 98 2
В табл. ! 1-11 показано, каким образом изменение размера атакующего осно-
вания (алкоголят-нопа) сказывается па направлении отщепления в трещ-амилбро-
миде: чем больше размер основания, те,м брльше относительное количество наиме-
нее замещенного алкена,
11-14. Реакции Е1
Многие вторичные и третичные алкилгалогениды в нейтральных
или кислых растворах вступают в реакции отщепления Е1 конку-
рентно с реакциями SnI. Например, при сольволизе mpem-бутил-
342
ГЛАВА 1!
Таблица 11-11
Состав продуктов реакции третп-амилбромида
с алкогопятами калия при 70—75 °C
Количество, %
А л кого л ят-ион
сн3-снао9
сн3
сна-(!:-о9
сн„
сн3
сна—СНа—С-о®
^Нэ
CH3-CHS
СН3—СН2—О9
I
СН3 —СН2
22,5 77,5
11,5 88,5
хлорида в 80 %-ном водном этаноле при 25 °C образуется 83%
mpem-бутилового спирта (по реакции замещения) и 17% изобутиле-
на (по реакции отщепления)
СН,
I
СН3-С—СН8
С1
СН3
Е1 |
—*сн3—с=сн2
80%-иый С4Н5ОН ,
17%
- 83%
Отношение замещения и отщепления остается постоянным на
всех глубинах .реакций, откуда следует, что оба процесса имеют
одинаковый кинетический порядок относительно концентрации
трет-бутлгалогенида. Обычно, но не всегда, S^l- и Е1-реакции
имеют общую стадию, определяющую скорость, а именно стадию
медленной ионизации галогенида. Далее перед растворителем ока-
зывается выбор — либо атаковать промежуточно Образующийся
карбониевый ион по атому углерода, либо' атаковать его по р-во-
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
343
дородному атому, осуществляя, таким образом, отщепление.
СНЯ
I ЩО
С-СН3—------►
। медленно
О
Н,0
сн, —
I быстро
сн3-с—сн3-----
ф ___
н,о
сн,
сна-(!=сне4- Н3В
сн,
сн,—d—сн, + н3§
Е1
SN1
Упражнение 11-20. Можно ли ожидать в случае приведенной выше реакции, что
тиошение количеств трет-бутило во го спирта и изобутилена будет существенно
изменяться в зависимости от природы уходящей группы в mpem-бутильном произ-
водном 1например, Cl, Вг, 1, jF(CH,)2J. Почему?
Можно ли ожидать, что отщепление будет протекать аналогичным образом
ври осуществлений механизма Е2 и выполнении растворителем функции основа-
11 ия? Объясните.
Упражнение 11-21. Реакция mpem-бутил хлор и да с водой сильно ускоряется
едким натром. Как изменяется при этом отношение продуктов отщепления и за-
мещения?
Упражнение 11-22. Напишите уравнения реакций и механизмы образования
всех продуктов, которые могут быть получены при реакции втод-бутилхлорида о
раствором едкого кали в этаноле?
Упражнение 11-23. Почему апо камфил хлор ид практически инертен л<? отно-
шению к действию гидроксил-иона?
Влияние структурных факторов на реакции Е1 сходно с их влия-
нием в реакциях для различных X в RX скорости изменяются
по ряду Х = I>Br>Cl>F и для различных R по ряду третичный
И,>вторичный R ^первичный R. Для галогенидов, таких, как трет-
амилхлорид, которые могут в зависимости от направления отщепле-
ния дать различные алкены, показано, что при El-реакциях преиму-
щественно образуются наиболее стабильные (наиболее замещенные)
алкены. сн3 1 н.о СН —С-СН,—СНа * । медленно С1 сн3 СИ® ’CH!=d—04,—04, 1 быстро 20% —>СН,—С—СН,—СИ, Ф СН, -f-HCi 1 С1$ —*04,-С = 04 -04, ' Б0%
344
ГЛАВА II
Наиболее замещенные алкены не всегда, однако, оказываются 1
самыми стабильными. Примером такого эффекта могут служить
реакции El-типа для неопентилдиметилкарбинилхлорида. Менее;
замещенный алкен преобладает в продуктах реакции, так как во i
втором изомере пространственные затруднения, связанные с пере-
крыванием алкильных групп, весьма значительны.
сн3 сня
I I Cie
CHe—С—СНг—С—.С)
СН3
сн3
СНЭ (
„ . I® —н
СНа-С-СНа—С -
| быстро
сн3
СНа
,Ф
СН3
:СНг
сн,
сн3
-сня-с-сня-
с!н3
(преобладающий продукт реакции)
СИ,
сна
(небольшое количеств)
Упражнение П-24, Покажите, каким образом могут быть осуществлены при-
веденные ниже превращения (укажите реагенты и условия реакций; учтите, что
может потребоваться несколько стадий). Напишите механизм для каждой из ис-
пользованных вами реакций. (Учтите, что некоторые па стадий описаны в преды-
дущих главах.)
СН3 СН3
: а) СН3—J—СН3—СН3 —► СН3 —С—СН—СН3
Вг " _ . (in Вг
ЧН2СН3 :
сн3 сн3
в) СН3._С-СН3 ^ сн9-с~сн,
I 1
Ci I
сн, сн3
г) СН3— А— С.Н3 CHS- с—CHjl
А ' J
Ы . п
Другая особенность реакций Е1 (а также5м1-реакций) заключа-
ется в тенденции первоначально образовавшегося карбонневого иона
к перегруппировке, особенно если в результате этого образуется
более стабильный ион; Например, очень медленная SN 1-реакция
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 345
формолиза неопентилиодида приводит главным образом к 2-метил-
бутену-2.
сн3 q сн3
СНа-(!-СНв1 *сн,-с-?н2
1 lllAJsti ।
СНЙ СНа:
Ф . -г н®
+. сн3-с—снв-сна------- сня-с=сн-снв
• i I
CHS , !СНв
В атом случае ’ионизация сопровождается миграцией метиль-
ной группы с ее парой электронов от 0- к а-углероду и образованием
из нестабильного первичного карбониевого нона относительно ус-
тойчивого третичного иона. Реакция завершается отщеплением'про-
тона.
Если имеется возможность образования более стабильного кар-'
бониевого иона, то сравнительно легко происходят также пере-
группировки путем миграции водорода (в виде Н:@). Так,
сн,н
। ।
С Н С^-С Нз
Н Вт
© 7Н’
~Р- > СНз-С-СН-СН. -*
’ Д Ф
П j
сн,
СН,-С=СНСН,
СН, "н /
I z
сн,-с-снгсн,
© \
НгО\ СН,
СН,-С-СНгСН,
он
Перегруппировки такого типа рассматриваются более подробно в
гл. 13.
Упражнение Л-25. Объясните, каким образом можно использовать соединение
(GHa)2CDCHBrCH3 для того, чтобы выяснить, образуется ли тримётилэтилен не-
посредственно из бромида по реакции Е1 или путем перегруппировки и отщепле-
ния, как это показано в приведенных выше уравнениях.
Упражнение Л-26. Укажите продукты, образующиеся в приведенных ниже
реакциях:
а} СНаСН2СВг(СНя)СН2СН3 7V?!
то
6J (СН3)аССН(СНа)С1 Г—
V’ Е1
346
ГЛАВА il
СН2
/\ Н,о
в) СНа СИ—СНаВг '>
\/ N’
CHg
11-15. Стереохимия реакций отщепления
Реакция Е2 происходит наиболее легко в том случае, когда мо-
лекула, участвующая в превращении, может принять конформа-
цию (1а), где уходящие группы (атомы) Н и X расположены в
транс- положен ин одна относительно другой и связи Н—Се—Са—X
лежат в одной плоскости. В таком случае происходит транс-отщеп-
ление и образуется алкен со структурой II,
Конфигурация 1а имеет то преимущество перед конфигурацией
16, что в ней уходящие группы не расположены в гош положении,
как в 16, поскольку в последней группы А, В,С и D вынуждены сдви-
нуться одна относительно другой для того, чтобы образовать двой-
ную связь.
Отщепление возможно и в заслоненной конформации (1в), где
Н и X находятся в цис-положении, так как в этом случае расцоло-
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
347
женив группы А, В, С и D благоприятно для образования алкена:
Однако такой механизм оказывается значительно менее выгод-
ным, чем транс-отщепление, поскольку обычно образуется алкен
Н1), в котором А и £> находятся в транс-положении, а не Ш, где
\ и D находятся в положении цис. Исключения наблюдаются в
циклических системах, таких, например, как циклопентилгалоге-
ппды, в которых Н и X не могут принять транс-конфигурации.
гщс-Отщепление обычно происходит также в тех случаях, когда X
одновременно является уходящей группой в основанием, акцеп-
тирующим протон; так, при отщеплении в окисях аминов (табл. 11-9)
благоприятным является образование алкена со структурой III.
Случай Е2-механизма, благоприятного для транс-отщепления,
особенно тесно связан с механизмом 5^2. Это становится ясным, если
обратить внимание на то, что при транс-отщеплении электронная
пара, освобождающаяся после удаления протона, атакует «-угле-
родный атом с тыла, выталкивая X© с фронтальной стороны. В про-
тивоположность этому цас-отщепление следовало бы считать ана-
: з-^
ГЛАВА ! [
логичным фронтальной реакции ,3^2.
Упражнение 11-27. Напишите асе возможные заторможенные конформации для
каждого из изомеров 2,3-дибромбутана (IV и V), изображенных ниже.
Приведите структуры алкенов, которые могут образоваться из каждой конформа-
ции при транс-Е 2-отщеплен и и 1 моля бромистого водорода под действием гидро-
ксил-иона. Какой из алкенов будет легче вступать в дальнейшую реакцию отщеп-
ления. приводящую к'диметилацетилену? Объясните.
Для'таго чтобы отщепление в циклических системах происходило легко, ухо-
дящие группы должны не только располагаться в транс-по ложен и и одна относи-
тельно другой, но и находиться также в диаксиальной конформации, поскольку
только в этом случае атомы, участвующие в реакции, лежат в одной плоскости.
Это иллюстрируется ниже на примере циклогексил хлорида.
Однако н том случае, когда диаксиальная транс-конформация невозможна из-за
жесткости циклической : системы или вследствие отсутствия транс-(3-водорода,
транс-отщепление не происходит. Если при этом отщепление вообще возможно,
то оно протекает с гораздо меньшей скоростью и должно быть чис-отше плен нем в
соответствии с рассмотренным выше.
Сравнение реакционных способностей двух стереоизомерных хблестерилди-
бромидов (VI и VII) по отношению к иодид-иону может служить ярким примером
различия в легкости цис- и транс-отщепления. Реакция представляет собой де-
бромирование 1,2-дибромида иодид-ионом, протекающее по Е2-типу, для которого
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 349
может быть написан следующий механизм:
холестерил дибромид (VI)
(фрагмент)
Системы декалина, образованные циклами А и В, отличаются для днух изо-
мерных транс-холестерилдибромидов тем, что в соединении VI циклы соединены
по троне-типу, тогда как в VII — по цне-типу (см. разд. 4-9). щранс-Диаксиальное
отщепление брома может осуществляться только в дибромиде со структурой VI.
Стереохимия Е Г-отщепления часто оказывается сложной и может изменяться
в зависимости от условий,и типа реакции; одвско преимущественно осуществи
ляется транс-отщепление.
Упражнение 11-28. Напишите структуры алкенов, образование которых воз-
можно при EJ- и Е2-реакпиях производных циклогексилхлорйда Vi 11 и IX. Ука-
жите, какие реакции должны быть быстрыми и какие медленными и какой алкен
должен оказаться основным продуктом в каждом случае. Приведите ваши сообрц-
350
ГЛАВА ll
жени я (можно посоветовать обратиться к разд. 4-4 и 4-7, а также использовать
модели).
IX
Некоторые реакции отщепления, имеющие важное значение для препаратив-
ного получения алкенов, сходны с пиролизом окисей аминов (где X играет роль
одновременно уходящей группы и основания, отрывающего протон, см. выше) и
протекают по цис-направлению:
0е
[ Q нагоеванне
СНаСНа - N—СН3------------* СН, = СН2 + (CHa)sN - ОН
I этилен диметилгидрок-
СНЭ силамин
окись цииетвлэтиланииа
О О
II нагревание ||
СН3СН2-О-С—СНЭ---------------->СН2 = СН3 4-СНа-С-ОН
этилацетат этилен уксусная кислота
- S
II нагревание
CHjCHo—О-С-SCHs----------------г СН2 = СН24-COS -f-CHsSH
S-метил-О-этилкслнтогенат • этилен серо- метантвол
ОКнСЬ
угле-
рода
* Алкилметилксантогенаты можно рассматривать как сернистые аналоги
алки.чкарбонатов. В случае несимметричных ксантогенатов указывается, какая
группа связана с серой, какая — с кислородом
НО-^/ОН
С
0
О
угольная
кислота
цн метил ка рбо н ат
CH3sx оснэ
с
||
S
ди метил и са н тог еи ат
CH3CH2S .осн,
II
S
О-мет кл*5-эти лксэ итоге нат
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИИ И ОТЩЕПЛЕНИЯ
351
АЛКИЛ-, АЛКЕНИЛ-
И ЦИКЛОАЛКИЛГАЛОГЕНИДЫ
11-16. Алкмлгалогениды
Многие важные вопросы, относящиеся к химическим свойствам
алкилгалогенидов, были уже обсуждены в настоящей главе в связи
с реакциями замещения и отщепления. В табл. 11-12 кратко сум-
мированы методы; с помощью которых могут быть получены алкил-
Таблица 11-12
' Методы получения алкилгалогенидов
Реакция
Примечание
I Спирты -i-галогеноводороды
ROH Я- НВг *—* REr -f- НВО
ZnCI,
ROH + НС1-------► RC14- H2O
l. Спирты-}-галогениды фосфора
пиридин
3ROH +РВгэ-------- 3RBr + НаРОэ
3. Спирты-}-тионилхлорид
пиридин
ROH + SOCla----—* RC1 -f-SOa + НС1
4. Серебряная соль карбоновой кислоты + галоген
(реакция Хунсдиккера)
RCO2Ag -j- Br2 R Вг + СО2 -f- AgBr
78 'С
5. Галогенирование углеводородов
RH-| Cla^>-RCl-f-HCl
6. Присоединение еалогеноводородов к алкенам
НХ
RCH=CHa—
-------Л?СН—СНа
НХ, перекись
--------Л?СН2СН2Х (X = Вг)
Порядок реакционной
способности: тре тн ч н ы й >
> вгорн чный > первичный;
при получении хлоридов
необходимо применение
ZnCi2 в качестве катали-
затора (гл, 13); обычно
сопровождается пере-
группировкой
Легче всего протекает
с первичными ROH; пи-
ридин (слабое азотистое
основание) поддерживает
кислотность низкой, что
позволяет уменьшить сте-
пень перегруппировки
Аналогично методу 2
(см, гл. 13)
Свободнорадикальная
реакция (см, гл. 16)
Свободнорадикальная
реакция; обычно приво-
ди! к смеси продуктов
См. гл. 7
I
352 ГЛАВА II
галогениды. Некоторые из них будут рассмотрены в последующих!
главах. !
Физические свойства алкилгалогенидов в основном соответст-
вуют ожидаемым: летучесть их уменьшается:, а) по мере возрастания I
! молекулярной массы в гомологическом ряду, б) при увеличении-
' атомного номера галогена и в) в зависимости от структуры алкиль-
i ной группы в следующем порядке: третичная >• вторичная > .•
| >• первичная. Хлористый метил, бромистый метил и большинство^
1 низших фторидов газообразны при комнатной температуре. Темпе--
, ратуры кипения многих галогенидов приблизительно равны тем-1
пературам кипения углевородов с той же молекулярной массой; од-:
нако при этом встречается много исключений. Например, йодистый,
| метил (мол. масса 142) имеет т. кип. 42 °C, тогда как для н-декана/
’ (мол, масса 142) т. кип. 176 °C; температура кипения тетрафтормФ
тана (мол. масса 88), равная—128 °C, лежит между температурами
кипения метана (мол. масса 16, т. кип. —162 °C) и этана (мол. масса
30, т. кип. —89 °C). ,,
Ультрафиолетовые и ЯМР-спектры простых алкилгалогенидов
рассмотрены в гл. 2. В ИК-спектрах число полос, характерных
только для алкилгалогенидов, сравнительно невелико. Однако:
связи С—F дают очень интенсивные полосы поглощения в области
1350— I000 см"1; связи С—С1 интенсивно поглощают в области
800—600 см"1, тогда как связи С—В г и С—I поглощают при еще
более низких частотах, которые находятся вне диапазона, доступ-
ного для спектрометров с оптикой из хлористого натрия.
11-17. Алкенилгалогениды
А. Винилгалогениды
Наиболее доступным из в и пил галогенидов является хлористый
винил, который можно получить рядом способов:
СН=СН+НС1—| J—СНй = СНа+С1а
СНг=СНС1
®он ®он
СНг=СН24-С12—*СН3С1 —СН2С1~-ГТ- СН3СНС12
По-видимому,-самый удобный способ получения, хлористого винила
основан на высокотемпературном хлорировании этилена.
Другие винилгалогениды обычно могут быть синтезированы по
аналогичным методам, однако прямое высокотемпературное хлори-
рование алкенов, кроме этилена, осуществить; на удается. .
Характерной особенностью химического поведения винилгалоге-
нидов является их инертность в реакциях SN1 и SN2. Так, хлори-
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 353
стый винил даже при длительном нагревании с раствором нитрата
серебра в этаноле не образует хлорида серебра, не реагирует с йоди-
стым калием по SN2-THny и при действии едкого натра лишь очень
медленно образует ацетилен по реакции Ё2. Для галогенацетиленов
типа RCssC—Cl характерна такая же инертность в реакциях SnI и
Sn2. Одна из причин низкой реакционной способности винилгалоге-
нидо.в заключается в относительно большей прочности связи угле-
род— галоген по.сравнению с алкилгалогенидами (см. разд. 3-6 и
габл. 3-7). Далее, tqt факт, что этилен и ацетилен являются более
сильными кислотами, чём алканы (см. табл. 8-1), указывает на более
ярко выраженные электроноакцепторные свойства ненасыщенных
атомов углерода по сравнению с насыщенными углеродными атома-
ми в алканах. Таким образом, можно ожидать, что, чем легче будет
осуществляться удаление протона, тем более трудным будет отрыв
галогенид-ион а от винил- или этинилгалогенидов в реакциях как
SN1, так и 5^2.
Фенилгалогениды СвН5Х подобны винил- и этинилгалогенйдам
в том отношении, что они чрезвычайно мало реакционноспособны в
Sn1-h 5к2-реакциях. Химические свойства этих соединений рассмо-
трены в гл. 23.
Б. А ллилгалогениды
Хлористый аллил получают в промышленном масштабе путем
хлорирования пропилена при 400 °C. В этих условиях 1,2-дихлор-
пропан образуется лишь в незначительном количестве.
400 °с
СН2=СН-СН3+С12 —г-> СНа-=СН-СНаС1-рНС1
Хлористый аллил является промежуточным соединением при про-
мышленном синтезе глицерина (1,2,3-триоксипропана) из пропилена
CI, Н.О HOCI
СНа=СН-СН3 —> СН8=СН-СНаС1 —->сна=сн-сн2он —*-
Н,0
-*сн1-сн-сна—*сн1-снй-сна
он а он он <Ан
глицерин
Общий метод получения аллилгалогенидов заключается в при-
соединении галогеноводородных кислот к сопряженным диенам, в
результате чего обычно образуется смесь продуктов 1,2- и 1,4-при-
соединения (разд. 9-6,Г и 10-3). .•
СНа - СН - СН=СНа + НС1 —
а
—>'СН;! - СН -СН =СН2 4- СН3СН=СН—СН2С1
3-хлорбутеи-1 1-адорбутен-2
(а-мети л а л.ли л- (Кротилхлорад)
хлорид)
12 № 1540
354
ГЛАВА [ [
Вторым общим методом является бромирование алкенов N-бром-
сукцинимидом (реакция Воля — Циглера). Между N-бромсукцин-
имидом и алкеном происходит свободнорадикальная цепная ре-
акция, которая обычно инициируется светом, перекисями и другими
катализаторами и дает бромиды аллильного типа. Ниже приведена
возможная последовательность стадий этой реакции для случая
циклогексена
стабилизирован-
ный свободный
радикал
бром циклогексен
Вг
Отрыв водородного атома от углерода, соседнего с двойной
связью, оказывается наиболее выгодным, поскольку образующийся
при этом аллильный радикал стабилизируется путем делокализа-
ции электронов (см. также энергии связей в табл. 3-7). Современные
данные указывают на то, что механизм в действительности может
быть таким, при котором в качестве носителя цепи выступает Вг,, а
не N-бромсукцинимид. Если это так, то функция N-бромсукцини-
мида заключается только в образовании брома, концентрация ко-
торого поддерживается низкой. В связи с этим интересно, что мед-
ленное пропускание паров брома через раствор циклогексена в че-
тыреххлористом углероде также приводит к образованию 3-бром-
циклогексена.
Упражнение 1 ]-29. Установите структуры двух соединений, ЯМР- и НК-спект-
ры которых приведены на рис. Г1-6. Проведите отнесение максимального числа
полос И К-спектр а и проанализируйте ЯМР -спектр в терминах химических сдвигов
и спин-спинового взаимодействия.
В противоположность винилгалогенидам, характерным свойством
которых является инертность, аллилгалогениды очень реакцион-
носпособны как в SN1-, так и в Зк2-реакциях— намного больше,
чем соответствующие насыщенные соединения. Другие аллильные
производные, помимо галогенидов, также проявляют необычно ввг-
сокую активность в реакциях замещения и вытеснения, связанную с
тем, что двойная связь облегчает разрыв связи с функциональной
Рис. 11-6. ИК- и ЯМР-спектры соединений С4Н?Вг и СйНеВг2 (см. упражнение 11-29).
12*
356
ГЛАВА 11
группой. Тройная связь оказывает сравнимое по силе влияние;
показано, например, что хлор в З-хлорпропине-1 очень подвижен.
HC==C-CH;Ci
З-хлорпропиЮ! (пропаргилхлррид)
Значи.тельная активность хлористого аллила в SN1-реакциях по
сравнению с н-пропил хлоридом находит объяснение при сравнении
значений электронных энергий промежуточно образующегося кар-
бониевого иона и исходного, галогенида, что показано на рис. Г1-7.
В разд. 9-6,Г уже говорилось о том, что для аллильного катиона мо-
гут быть написаны две эквивалентные схемы спаривания электронов,
откуда следует, что гибридная структура, в которой электроны су-
щественно делокализованы, обладает высокой стабильностью.
Сна=СН—снаС1 —>
(одна валентная схема
с яиекой анергией)
@ % —g
—*1СНа=СН-СН2 е>сн3-сн = сна~сн3^сн^.снг) 4-С1®
(Две валентные схемы (гибридная
с низкой анергией) структура)
Таких стабилизированных гибридных структур нельзя написать для
яфропил-катйрна.
CHjCHjCHjCI —* СН,СНаСН® + С1°
(ОДМЯ. ВЯ.ЛйЙТЙЭЯ
схема с низкой
энергией)
(одна валентная
схема с низкой
энергией)
Таким образом, энергия, аллил-катиояа ниже, чем энергия н-про-
пцл-катиона; из рис. 11-7 очевидно, что для образования аллил-ка-
jCH.CHiCHz®
[сих-*сн==ед®
Л77яр0ПЙД
Й " &#млйл
-1сН,=СИ~СНгС1
СНаСНгСНаС1
Рис. Л-7. Схема иллюстрирует связь между высокой реакционной способностью
аллилхлорида в реакциях ShI по сравнению с «-нропилхлррцдом и НИЗКОЙ анер-
гией образования аллил-катиона.*.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 357
тиона из аллилхлорида требуется меньше энергии, чем для образо-
вания н-пропил-катиона из н-пропил хлор и да. При этом важно иметь
в виду, что легкость протекания реакции определяется различием
энергий карбокатиона и исходного галогенида, но не различием
энергий карбокатионов друг относительно Друга.
Sn 1-Реакции аллильных производных почти всегда сопровожда-
ются перегруппировками. Так, гидролиз хлористого кротила (или
изомерного а-метилаллилхлорида) приводит к смеси аллиловых
спиртов, образующихся при атаке растворителя по одному из двух
положений промежуточного гибридного метил алл и л иного катиона,
несущих частичный положительный заряд/
H8O mHiO
СН3СН =CH-CHjCl —' [СНЭСН СН пгСН2)®— сн3сн-сн = сн3
хлористый |
кротил С1
а.иетилаллилхлорид
СНЭСН—СН = СН а+СНзСН = CHCH SOH
ОН
ю-метилаллилолый кротиловый спирт
спирт
Этот катион уже встречался выше как промежуточное соединение
при присоединении хлористого водорода к бутадиену (разд. 10-3).
Упражнение Н-ЗО. Предположим, что чистый цпс-дротилхлорид может быть
гидролизовав исключительно либо по SN1-, либо по 5^2-ме.ханизму. Какие кроти-
ловые спирты образуются^ каждом случае — цис-изомер, трайс-изомер или их
смесь? Объясните.
Упражнение 11-31. Карбониевый нон, образующийся при ^реакции как ад-,
так и у, у-диметилаллилхлорида, реагирует с водой, образуя смесь а,а- и у,у -ди ме-
тилаллиловых спиртов. Преобладания какого спирта можно ожидать в условиях
термодинамического контроля? (Целесообразно обратиться к разд. 7-3, 7-5, Б и
10-3), Учитывая пространственные затруднения, распределение зарядов в катионе
И т. и., преобладания какого спирта.в смеси можно ожидать в условиях кинетичё,-
ского контроля?
Б ряде случаев вступающий в реакцию хлористый аллил изомеризуется,
в. ходе SN l-реакции по механизму, включающему так называемый внутренний
возврат; Подобный тип изомеризации осуществляется наиболее часто в таких.рас-
тво ригелях, в которых Ионизация галогенида приводит не непосредственно к дис-
социированным ионам, а к внутренним ионным нарам, в которых катион и анион
ассоциированы и располагаются близко друг к другу; Ионная пара может диссо-
циировать на относительно свободные сольватированные коны, из которых обра-
зуются продукты, или может «сомкнуться», дав либо исходный аллилхлорид,
358
ГЛАВА ! [
либо изомер аллильного строения.
СН3
СНг=СН-С-С1
«, а * диметилаллил-
хлорид
СЦ; ® '-.CtCHjk
©
внутренняя
ионная пара
у, у-диметилаллмл-
<хлормд
[CH^CHaCfCHjJJ® + Cl®
диссоциированные ионы
ROH
СИ,
CH2=CH-G-OR + 9И,-Сн=С(СН3Ь
CHj OR
Внутренний возврат происходит, очевидно, и в большинстве других SN1-реакций,
но обычно не может быть обнаружен, если только он не приводит к перегруппиров-
ке исходного вещества.
Упражнение 11-32. Объясните, каким образом оптически активный а-метил-
аллнлхлорид может в условиях реакции SN1 рацемизоваться быстрее, чем обра-
зовывать продукты сольволиза. Где такая рацемизация будет происходить бо-
лее эффективно — в воде (диэлектрическая проницаемость 80) или уксусной
кислоте (диэлектрическая проницаемость 6)?
Упражнение 11-33. Можно ли ожидать, что внутренний возврат будет иметь
такое же значение при сольволизе а,а-диметилаллилдиметнлеульфонийхлорида
СН,
I Ф /СН3
СН3 = СНС -S< Cl®,
I ХС1-18
СНз
как при сольволизе аллилхлорида? Объясните,
Причина того, что реакционная способность аллильных соеди-
нений и при S.x-2-реакциях превышает реакционную способность
алкилпроизводных, еще не выяснена до конца. Одна из возможно-
стей заключается в том, что наивысшая точка энергетического барье-
ра (разд. 3-7,Г), или переходное состояние меязду реагентами и
продуктами, может быть достигнуто легче в том случае, когда имеет
место стабилизация, обусловленная делокализацией электронов
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 359
ДВОЙНОЙ СВЯЗИ
СН, = СН - СН,С1 + он9
ю
он -
СНг—сн — сн,
й96 -
переходное состояние
CH2=CH-CH2OH+Ci9
Упражнение H~34.fi) Напишите резонансные структуры для переходных со-
стояний реакций аллил-и н-лропилхлоридов с гидроксил-ионом и покажите, как
с их помощью можно объяснить большую реакционную способность аллилпроиз-
водных.
б) Какие заместители при у-углероде в аллилхлориде будут повышать реак-
ционную способность аллилхлорида в 5ы2-реакциях— электроноакцепторные или
электронодонорные? '
В. Реакции Sn2'
Существует еще один механизм нуклеофильного замещения в аллилгалогени-
дах, который может протекать конкурентно или даже заменять собой замещение
типа Sn2. При этом механизме происходит нуклеофильная атака не по насыщенно-
му а-углероду, а пр ненасыщенному углеродному атаму в у-по ложен ни — при
этом происходит одновременный сдвиг электронов двойной связи И выталкивание
галогенид-иона, Такие реакции имеют второй порядок и обозначаются символом
S№'. В случае несимметричных аллильных производных образуется продукт
перегруппировки.
(CHpjN; СНа=СН^СН^С1 -+• (CHjJjN-CHjrCHsCHCH, + С1°
Обычно реакции Sn2 проходят настолько быстрее 5^2'-реакций, что последние
не играют существенной роли. Однако в тех случаях, когда протекание Зм2-реак-
ций затруднено наличием заместителей при а-углеродных атомах, роль реакций
Sbj2'' может стать существенной или даже доминирующей. Ниже приведены два
примера реакций Sn2'.
L1 С Н О® f1
СНд=СН-СН-С1 CHZ=CH-CH-OCZH5 + C.HjO-CHi-CH^CH-CL
30% Sn2
C;HSQ9
.1007»
Стереохимия 8№'-реакций весьма интересна; они стереоспецифичны, так как
вступающая группа Y: подходит с той же стороны молекулы, с которой уходит
Uipnh'C
(П-9)
Упражнение //-35. Изобразите структуру переходного состояния S№'-реакции,
приведенной в уравнении (1 Г-9), Покажите образующиеся и разрывающиеся связи.
Сделайте то же для реакции, в которой Y: будет образовывать цнс-саязь по отно-
шению к R. Объясните, почему первый механизм является более выгодным, ис-
пользовав соображения, сходные с теми, которые приводились а пользу транс-
отщепления (разд. И-15).
Упражнение П-36. Предполагая стереохимическое протекание 8^2'-реакции
таким, как показано в уравнении (1 !-9), определите, к одинаковым или различным
продуктам приведут механизмы $№ и Sn2; при проведении реакции с оптически
активными формами указанных ниже соединений (при решении этой .задачи очень
полезным окажется использование моделей).
Упражнение 11-37, Покажите, каким образом ЯМР-слектроскопия в сочетании
с использованием меченных дейтерием соединений может быть использована для
доказательства Зы2'-замещеиия в реакциях хлористого аллила.
ll-'IS. Циклоалки л галогениды
Физические и химические свойства циклоалкилгалогенидов в
основном сходны со свойствами вторичных галогенидов с откры-
той цепью; способы их получения обычно также имеют много обще-
го (см., табл. 11-42). Все циклоалкилгалогёнвды вступают в S^-2-
реакции довольно медленно, и в .случае нуклеофилов, являющихся
сравнительно сильными основаниями (ОН®, ©OC2H5t ,©C^N й
т. п.), можно ожидать преобладания реакции Е2, Скорость обра-
зования карбониевых ионов; приводящего к реакциям Sjil и El,
существенно зависит от размера цикла, но, за исключением циклоал-
килгалогенидов с небольшими циклами, реакции карбониево-ион-
ного типа протекают нормально.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 361
Циклопропилгалогениды занимают особое место, так как они
в гораздо большей степени подобны винилгалогенидам, чем вторич-
ным алкилгалогенидам. Так, циклопропилхлорид вступает в реакции
SN1 и Sjj2. на' много порядков медленнее, чем изопропил- или ци-
клогексилхлорйды. Такое’ сходство между реакционной способ-
ностью циклопропилхлорида и хлористого винила, разумеется, не
удивительно, если учесть далеко идущее сходство между кольцом
циклопропана и двойными связями (разд. 4-6, 5-5, В, 5-5, Г). Это
сходство распространяется также на циклопропилкарбинильные
соединения. Поведение циклопропилкарбинилхлорида и аллилхло-
рида в реакциях как S^l, так и Sn.2 имеет много общего.
СН,
- j >СН-СН8С1
сн/
циклопропилкарбииилхлорнд'
11-19. Полигалогенпроизводнме
Полихлорирование метана представляет собой дешевый и эффек-
тивный способ получения ди-, три- и тетрахларметана.
СН,С13
дихлорметан
(метиленхлорнд),
т. кип; 4 О ‘Q
СНС1,
трихяорметай
(хлороформ),
т. кип. 61 'С
ссц
тетрахлорметан
(четырех* лорнстый
углерод), т. кип. 77 “С
Эти соединения служат отличными растворителями для неполяр-
ных и слабополярных веществ. Хлороформ ранее широко использо-
вался как анестезирующее средство (при вдыхании), однако он
вредно действует на сердце и медленно окисляется кислородом
воздуха, образуя высокотоксичный фосген (СОС!,). В продажном
хлороформе содержится около 1 % этанола, который добавляют для
разрушения образующегося при окислении фосгена.
Четыреххлористый углерод широко используется как раствори-
тель при химической чистке; его значительная токсичность при не-
осторожном использовании представляет некоторую опасность.
Четыреххлористый углерод используется также как эффективное
средство для сбивания огня при горении нефти, хотя способность к
образованию фосгена делает нежелательным его употребление в
закрытых помещениях. Используемый обычно в лабораториях спо-
соб удаления следов влаги из растворителей действием металличе-
ского натрия неприменим к галогенсодержащим соединениям. Смесь
четыреххлористого углерода и натрия способна к детонации и чув-
ствительна к удару.
Трихлорэтилен («триклен»), т. кип. 87®С, широко используется
в качестве растворителя при сухой чистке одежды. Он может быть
362
ГЛАВА 11
получен как из этилена, так и из ацетилена.
НС - СН 4- 2С12 СНС13 - CHCis -a-~)s- н Cl
—> /С=с/
сна=сна+ЗС12 СГ а
Хлористый метилен реагирует с гидроксил-ионом по Sn2-mc-
ханизму значительно менее энергично, чем хлористый метил. При
реакции образуется хлорметанол, который претерпевает быструю
реакцию Е2-отщепления, образуя формальдегид — вещество, ко-
торое существует в водном растворе главным образом в виде диок-
симетана.
СНгС1г
®он & Н
-----* снг
медленно \
SNZ L(Ci J
он®
------>
быстро
£2
НгС=О
Снегро
ОН'
<н2
. он.
Четыреххлористый углерод еще менее реакционноспособен, чем
хлористый метилен. Можно было бы ожидать, что хлороформ по
своей реакционной способности будет занимать промежуточное по-
ложение между хлористым метиленом и четыреххлористым углеро-
дом, однако хлороформ оказывается весьма активным в реакции с
гидроксил-ионом и дает в конечном счете окись углерода, формиат-
и хлорид-ионы. Отсюда можно сделать заключение, что механизм
этой реакции иной. По-видимому, сильное основание, например
гидроксил-ион, атакует молекулу хлороформа по атому водорода
намного быстрее, чем по атому углерода. Существуют серьезные
основания полагать, что полученный таким образом карбанион
С13С:© может отщепить хлорид-иои, в результате чего образуется
высокореакционноспособное промежуточное соединение с двухва- 1
лентным углеродом :CCi2, получившее название днхлоркарбена.
В этом соединении при углероде находятся только шесть валентных
электронов (две ковалентные связи), и, несмотря на свою электро-
нейтральность, оно обладает сильнейшими электрофильными свой-
ствами. Быстрая атака растворителя приводит к конечным продук-
там. ’’
। О
С13С;|Н + ОН
С13С:е
<*-----
медленно
©
С13С: + НгО
;СС1г + Ci®
СО + 2С1®
Р е
НС т zci”
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
363
Отметим аналогию между таким механизмом гидролиза хлоро-
форма и механизмом отщепления, упоминавшимся в упражнении
11-18. В обеих реакциях участвует промежуточный карбанион, но
последующее отщепление от [J-углеродного атома приводит к алкену,
а от а-углерода — к карбену-. Образование карбена, таким образом,
является результатом 1,1- или а-отщепления.
Электрофильная природа дихлоркарбена :СС1В и других карбе-
нов, включая сам карбен ;СН2 (иногда называемый метиленом),
может быть с успехом использована в синтетических целях. Двой-
ные связи алкенов могут служить донорами электронов, вследствие
чего карбены реагируют.с алкенами по типу цис-присоединения,
образуя производные циклопропана. Такой тип присоединения мо-
жет быть назван цис- 1,2-циклоприсоединением по двойной связи.
Таким образом, уже рассмотрены случаи 1,1-, 1,2- (разд. 10-5),
1,3- (разд. 7-8,А) и 1,4-циклоприсоединениЙ (разд. 10-4).
+ ;СС12 ----->-
C1
Активированные карбены, образующиеся, например, при инду-
цируемом светом разложении диазометана CH„N2, реагируют даже с
электронами связи углерод — водород, в результате чего углерод
карбена «внедряется» между углеродом и водородом. При этом
—С—Н превращается в —С—СН8.
- С:Н + :СНа —-С<-СН,-К
Карбен :СНИ, образующийся при индуцируемом светом разложении
диазометана,— один из наиболее реакционноспособных реагентов,
известных в органической химии. Можно осуществить более се-
лективные реакции карбенов (получая последние путем отщепле-
ния йодистого цинка нз подпетого иодметилцинка ICHjZnI), кото-
рые в случае простых алкенов приводят только к образованию цик-
лопропанового кольца.
+ СНДа 4- Zn
+ Znlz
Упражнение 11-38. Какие продукты должны образоваться ири реакции бро-
моформа СНВГз с трет-бутилатом калия в mpm-бутидовом спирте в присут-
ствии; (а) транг-бутена-2 И (б) 1щс-бутена-2?
Упражнение 11-39. Скорость образования бицикло-[4,1,0]-геитана из иодме-
тилциикиодида и циклогексена имеет первый порядок по каждому из реагентов.
Предложите механизм, согласующийся с этим фактом.
364 ГЛАВА Н
11-20. Фторированные алканы
А. Фторхлорметаны
Замещение одного или двух атомов хлора в четыреххлористом
углероде на фтор легко можно осуществить с помощью трехфторис-
той сурьмы, содержащей некоторое количество пятифтористой сурь-
мы. Реакция останавливается на замещении двух атомов хлора.
Трехфтористая сурьма может непрерывно регенерироваться из
хлорида сурьмы (III) добавлением безводного фтористого водорода,
ЗСС14-f-SbF3 3CFCi3+SbCla
т, кип. 25 °C
SbCl,
3CCr4-p2SbF3 3CF2Cl8+2SbCJs
Т; КИЛ-— 30 сС
Оба продукта под торговым названием «фреон» находят широкое
применение в качестве хладагента, в частности для домашних холо-
дильников и кондиционирующих устройств. Дифтордихлорметан
(фреон 12) используется также в качестве распылителя при изго-
товлении аэрозольных бомб, в тюбиках с кремом для бритья и т. д.
Он нетоксичен, не имеет запаха, негорюч и не реагирует даже с
концентрированными минеральными кислотами и металлическим
натрием. Такое отсутствие реакционной способности чрезвычайно
характерно для дифторметиленовой группы, если только атомы фтора
не находятся при ненасыщенном атоме углерода. Присутствие фтора
при углеродном атоме, соединенном с одним или большим числом
атомов хлора, понижает реакционную способность хлора по отно-
шению к действию'реагентов почти любого типа.
Б , Фторуглероды
В ходе второй мировой войны возникла необходимость в пласти-
ческих материалах и смазочных средствах, обладающих необычной-
химической и термической стабильностью. Такие материалы требо-
вались для многих целей, в частности для изготовления насос-
ных устройств, использовавшихся при отделении SB°U от “S“U путем
диффузии гексафторида урана, обладающего сильными корродиру-
ющими свойствами, через пористые мембраны. Естественно было
попытаться использовать для подобной цели вещества, состоящие
только из углерода й-фтора (фторуглероды), и это заставило по-
тратить немало усилий на разработку методов получения соединений
типа ( CF2—),г.
Такие способы, синтеза фторуглеродов, как прямое фторирова-
ние алканов или обмен хлора в хлоруглеродах на фтор при дейст-
ипн фторидов сурьмы, не всегда дают удовлетворительные резуль-
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ
365
та ты.
ф2Щ=2 —► — (—CFS—)„ — f2«HF ДЯ = -2а-115 ккал
iuci, SbF,
-(-СН,-),,-------> — (—CCia—% — — ( —CFa),.—
Прямое фторирование— реакция чрезвычайно эндотермичная и ис-
ьлючительно трудно контролируемая; что касается второго способа,
го ни перфорирование .алкана, ни обмен хлора на фтор в хлор-
углероде не могут быть доведены до конца.
Очень хорошие результаты дает непрямое фторирование углево-
дородов с использованием фторида кобальта(Щ) в качестве про-
межуточного фторирующего агента, поскольку этот фторид дейст-
вует более умеренно, .чем элементарный фтор. Фторид кобальта(Ш)
получают, пропуская фтор через слой фторида кобальта(П):
2CoF2 г2 — 2CoF.) , АН ——58 ккал
Далее через фторид*кобальта(Ш) пропускают углеводород; до тех
пор, пока не останется лишь фторид кобальта (II). Трифторид мож-
но затем вновь регенерировать газообразным фтором. Теплота фто-
рирования углеводорода фторидом кобальта(Ш) составляет при-
мерно половину теплоты прямого фторирования,
_(-CH2-)„-+4nCoFs —> — ( —CF2 —)п—-r2nHF'4-4nCoF2
ДН = — 2гр57 ккал
Но реакции такого типа из н-гептана получается около 90% пер-
фторгептаца C-F,e (перфтор означает, что все водороды замещены на
фтор) и около 70% фторуглеродного масла из парафинового масла.
Стоимость этого процесса высока вследствие трудностей, связанных
с получением элементарного фтора, и неудобства обращения с ним,
а также потому, что половина фтора вновь переходит в дешевый фто-
ристый водород.
Разработка электролитического процесса позволяет надеяться
на то, что многие производные фтора окажется возможным получать
сравнительно дешевым способом. Этот метод (так называемый про-
цесс Саймонса) состоит в электролизе раствора органического соеди-
нения в жидком безводном фтористом водороде прн напряжении более
низком, чем то, которое требуется для получения фтора путем элек-
тролиза фтористого водорода. Примером может служить фторирова-
ние уксусной кислоты
электрияеский ток ДО
CHsCOaH + HF (Избыток) --- CF3-C<f
у Lj f DO
трифторацетвлфторид
Трифтор ацетилфтор ид (т. кип. 20 °C) .может быть удален с помощью
перегонки, и при реакции с водой дает трифторуксусную кислоту
CF3c/° а. Н2О —> СГ'аСф ° н,.-
; XF 'ОН
366
ГЛАВА I I
Аналогичным образом могут быть профилированы другие соедине-
ния, хотя для таких соединений, как парафиновые углеводороды,
нерастворимые в безводной плавиковой кислоте, результаты ока-
зываются малоудовлетворительными.
Пластики типа —(—CF2—)„—получают в значительных количе-
ствах путем свободнорадикальной полимеризации тетрафторзтилена.
R.
»CF2+CF2 —> -—(—CFa—CF2—)п—
Продукт (тефлон) представляет собой твердое, химически очень
инертное вещество, устойчивое вплоть до 300°C. Он обладает от-
личными электроизоляционными и уплотняющими свойствами, а
также свойствами самосмазывающегося материала, что использует-
ся при изготовлении поверхностей со слабыми адгезионными свой-
ствами и трущихся поверхностей для работы в нежестких условиях.
Тетрафторэтилен получают в промышленном масштабе следую-
щим способом:
sbci,
3CHCfs-}-2SbFa--> CHClRj,
700—SOO ’С
2CHClFa —г--------> CF3 = CFa+2HCt
J 90%-ный выход ‘ J
Весьма вероятно, что последняя реакция происходит с участием
дифторкарбена (:CF2)
CHC1F2 —► :CF34-HC1,
2:CFS —«- CF.,=CF3
В присутствии перекисей тетрафторэтилен полимеризуется в полимер
с длинной цепыо. В отсутствие перекиси с хорошим выходим проис-
ходит .1,2-циклоприсоединение, приводящее к октафторциклобутану
cf2-cfs
2CF2=CFa —► | j
CFa — CF2
Сходные реакции происходят с трифторхлорэтиленом и 1,1-дифтор-
2,2-дихлорэтиленом (см. также разд. 10-5).
Свободнорадикальная полимеризация трифторхлорэтилена дает
полимер (Кель-F), сходный с политетрафторэтиленом (тефлоном).
Отличный эластомер с высокой химической стойкостью может
быть получен при сополимеризации гексафТорпропйлена с 1,1-ди-
фторэтиленом. Этот продукт устойчив вплоть до 300 °C и не взаимо-
действует с дымящей азотной кислотой.
В. Свойства фторуглеродов
'Фторуглероды имеют необычайно низкие температуры кипения
по сравнению с углеводородами близкой молекулярной массы;
как видно из рис. 11-8, их температуры кипения почти равны или
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 367
Рис. 11-8. Температуры кипения фторуглеродов с неразветвленяыми целями
CnF:n^2 (-----------------) и углеводородов СпН2п+2 (--------).
даже ниже, чем у алканов с тем же числом углеродных атомов. Ок-
тафторциклобутан кипит на 17° ниже циклобутана, несмотря на то
что его молекулярная масса на 350% больше. Высокая устойчивость
и низкие температуры кипения октафтор циклобутан а должны при-
вести к широкому использованию его при упаковке пищи под дав-
лением.
СН2—СН2 CFj—CF2
^-Ah2 Af2- (Jf.j
т< ВНП- -Н2сС т. кип, —5flC
мол. вес. Sf> мол» вес 200
Фторуглерода почти нерастворимы в большинстве полярных
растворителей и лишь слабо растворимы в алканах керосиновых
фракций. Фторуглероды высокой молекулярной массы не смешива-
ются во всех отношениях даже со своими гомологами, имеющими
меньшую молекулярную массу.
Физиологическое действие фтороргавических соединений варь-
ирует в чрезвычайно широких пределах^ Дифтордихлорметан и на-
сыщенные фторуглероды, по-видимому, совершенно нетоксичны.
С другой стороны, церфторизобутнлен исключительно токсичен —
в большей степени, чем фосген (COCL). Фторацетат натрия
(CH2FCO2Na) и 2-фторэтанол представляют собой токсичные фтор-
производные кислородсодержащих органических соединений. Фтор-
ацетат натрия применяется в качестве родентицида. Интересно, что
трифторацетат натрия не обладает токсическим действием.
Дополнительные упражнения
Л-40. Напишите структурные формулы для каждого из приведенных ниже сое-
динений:
а) изоамиловый спирт
б) 2-мети л бутен-З-о л-2
в) динеопентилкарбинол
Г) -дибромпропионовая кислота
д) метилвилилкарбиниловый эфир
е) 9-(2,6,6-триметилциклогексен-1-ил)-3>7-диметилнонатетраен-2,4,6,8-бл-1
368
ГЛАВА 11
11-41. Назовите каждое на приведенных ниже соединений по системе IUPAC
и в тех случаях, когда это возможно, пр карбинольной системе (или рассматривая
их как замещенные кислоты).
а) НСйзС—СНгОН
сн,
б) CHj-J — CH-CHs
<!нз
сн,
I
г) СНЭ-С-СН,СО,Н
- г
сн,
• он
д) сн,—сн—сн—сн—со,н
Ji (Ь,
е) ГП
1——сн.он
11-42, ЛИ ионизации трет-бутил хлор и да до трет-бутил-каткона ихлорид-иона
равна примерно 4-20 ккал/моль в водном растворе при 25 °C. Покажите, каким об-
разом эта величина может быть использована для вычисления значений ЬН приве-
денных ниже реакций в разбавленных водных растворах, если известны энергии
"связей (табл. 3-5) и теплоты растворения газообразных соединений в воде. Отметь-
те все необходимые данные и любые требующиеся допущения.
СН3 СН3
а) СН3-<!Ф-4-Н2О СН3-С-ОН-|-Н®
^н„ £н3
СН3^
/СН, |
б) СН;=С< +HI —> СНа-С®+1®
ЧСНЭ 1
СН,
сн, сн,
U УСН, I /СН,
в) СН3-С®4-СН3=С/ —> CH.-C-CH.-Cf 4-Н®
1 ^СН, ' I \снэ •
сн,- сн,
/
11-43. Имеется водный раствор, 0,01 М по бромистому метилу и ] ,0 М по ацетату
натрия при 50 ‘С. В воде константа скорости 5№-реакцни гидроксил-иона с броми-
стым метилом при 50 °C равна 30-10~* л-моль~1-с-1, тогда как для анетат-ибна
она равна 1,0-Ю”4 л-моль-1-с*1. Константа ионизации указанной кислоты при
50 °C равна 1,8-10"У Примите в дальнейшем, что растворы идеальны, и пре-
небрегите скоростями реакций бромистого метила с водой или уксусной кислотой'
и какими-либо последующими реакциями метнлацетата.
а) Рассчитайте концентрации гидроксил-иона в исходном растворе.
б) Вычислите начальные скорости образования метилацетата и метанола.
в) Рассчитайте состав смеси органических продуктов, образующейся после
завершения рёакции.'Приведите ваши соображения и обоснуйте сделанные допу-
щения.
г) Какая информация необходима для предсказания характера продуктов,
образующихся в растворе бромистого метила и едкого натра в метаноле? Объяс-
ните.
11-44, Укажите, каким путем можно синтезировать приведенные нижесоединения
из указанных исходных органических веществ и любых других необходимых орга-
нических и неорганических реагентов. Укажите реагенты и условия реакций.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ И ОТЩЕПЛЕНИЯ 369
а) диметилацетилен из ацетилена
б) 3-х.чорпропилацетат из З-хлорпропеда-]
в) метилэтиловый эфир из этанола
г) метил-трет-бутиловый эфир из изобутилена
Д1 1-иод-2-хлорпропан из пропилена
11-45, Какие из приведенных ниже пар соединений должны реагировать более
энергично (А) с иодистым: калием в ацетоне, (Б) с концентрированным раствором
едкого натра в этаноле и (Б) с нитратом серебра в водном, растворе этанола? На-
пишите уравнения всех реакций и приведите ваши соображения относительно
предлагаемого порядка реакционной способности.
а! хлористый метил й хлористый изобутил с А, Б и В
6} хлористый метил и mpem-бутилхлоркд с А, Б и В
в) -бутил хлор ид и 1-фтор-2-хлор-2-метилпропан с Б и В
г) аллилхлорид и алл и лкарбинйл хлорид с А, Б и В
11-46, Какие выводы относительно стереохимии Е2-реакции могут быть Сделаны,
если известно, что дегидрогалогенирование соединения А при действии основания
протекает исключительно медленно по сравнению с дегидрогалогенированием со-
единения Б.
, А Б
11-47. При нагревании неопентилиодида с амидом калия образуется !,1-диметил-
цнклопропан. Напишите механизм реакции, согласующийся с характером реаген-
тов и продукта реакции.
11-48. Охарактеризуйте приведенные ниже реакции как хорошие, плохие или
умеренно пригодные синтетические методы получения указанных продуктов при
данных условиях реакций. Учтите при этом возможные выходы, побочные реакции
и скорости реакций. Приведите ваши соображения и опишите наиболее важные
побочные реакции.
CHS СН8 СН3 СН3
a) СН3—J—С]-|-СН3—С—ONa CH3-d-O-d:—CHs + NaCl
с!нэ сна <1н8
СН3 СПз
I 55 'с ।
б) CH31-J-CH3-C—ОН "CHj + CHe—С—0-1
СН. (!hs
370
ГЛАВА II
снэ сн3
д) CHS—С—СНаС!Ц-СНаС—СН3-А-СН3—О-С-СНа
I II I II
СН3 О СН8 О
СН3 СН8
1 35°С I
е) СН3-С~С1+СНзСН20СНгСН3--<-CH8-C-O-CHaCH34-CHsCH8Cl
Анэ СНа
ж) CH2=CHCl-|-CH8C-§Ag--^ СН2=СН—О-С-CHs4-AgCl
А А
1 50’С |
з) CH3«CH-CH2C14-i.SbFs-► CHa=CH-CH2F<4-SbCle
d d.
П-49. Опишите лабораторные способы получения каждого из приведенных ниже
соединений из указанных исходных веществ;
а) СН—CFa из ацетилена и СНС18
II J
СН—cf2 -
б) СНд = СН—СНг—О—СН2—СН=СНа из пропилена
в) СН,=:С=СН2 из пропилена (напомним, что аллилхлорид легко реагирует
по S№-механизму). Укажите, каким образом можно отделить продукт от образую-
щегося одновременно СН3С^СН.
11-50. Пусть приведенные ниже соединения помещены в сосуды без этикеток.
Предложите, для каждой пары соединений качественную химическую пробу
(желательно пробирочную реакцию), которая позволила бы отличить эти два
соединения,
Сосуд А
a) (СН3)аССНаС1
б) BrCH=CHCH2Ci
в) (СН^СС! -
г) СзНСН=СНС1
д) (СН3)2С=СНС1
е) СН,СН2СН -СНС1
Сосуд Б
СН3СНаСНаСН2С1
С1СН—СНСНаВг
(СН3)2СНСНаС1
СНг=СНСНаС1
СН3СН2СН=СНС1
сн2«Снсн2сн2а
11-51. Укажите, какимобразом можно различить соединения в приведенных выше
парах (упражнение 11-50) с. помощью спектральных методов.
ГЛАВА
МЕТАЛЛООРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
Исследования в области химии металлоорганических соединений
быстро развиваются в последние годы. Ряд металлоорганических
производных магния, алюминия и лития выпускается в настоящее
время промышленностью и используется в большом масштабе, не-
смотря на свою исключительную реакционную способность по отно-
шению к воде, кислороду и почти ко всем органическим раствори-
телям, кроме углеводородов и простых эфиров *. Эта высокая ак-
тивность является одной из причин возросшего интереса к химии
металлоорганических соединений, так как высокореакционноспособ-
ные соединения обычно могут участвовать в широком круге реакций
и представляют поэтому большую ценность с точки зрения их ис-
пользования в синтезе. Однако не менее интересен и даже более
важен тот факт, что металлоорганические соединения весьма часто
оказываются высокоселективными в своих реакциях. Прекрасным при-
мером этого может служить реакция полимеризации этилена. Ка-
тализатор Циглера, упоминавшийся в гл. 7, который может быть
получен из триалкилалюминия и четыреххлористого титана, прев-
ращает этилен в полимер высокой молекулярной массы. С другой
стороны, триэтилалюминий вызывает полимеризацию этилена,
приводящую лишь к алкенам-1 со сравнительно короткими цепями
(Cj, Св, Cg, Cjo и Сд2).
В этой главе сопоставлены химические и физические свойства
ряда важных типов металлоорганических соединений; очень важной
* Все перечисленные металлоорганические соединения отнюдь не инертны
к простым эфирам, но экзотермически присоединяют ил. Лнтийалкллы, кроме
того, медленно расщепляют Эфир,— Прим, ред.
ATI
,ЛЛВЛ 12
общей характеристикой при этом является степень ионности свя-
зей углерод — металл. Применение магнийорганических соедине-
ний (реактивов Гриньяра) в синтезе и возникающие при этом ос-
ложнения будут обсуждены подробно. Наконец, будет рассмотрена
стереохимия реакций металлоорганических соединений — вопрос,
который в настоящее время вызывает особый интерес.
Металлоорганические соединения могут быть определены наибо-
лее просто как соединения, содержащие связь углерод—металл.
Такое определение исключает вещества, подобные ацетату и мети-
лату натрия, поскольку они содержат связи кислород—металл.
К числу обычных металлов, образующих относительно устойчивые
органические производные, относятся щелочные металлы I группы
периодической системы (литий, натрий и калий), щелочноземельные
металлы II группы (магний и кальций), алюминий из III группы,
олово и свинец из IV группы и переходные металлы, такие, как
цинк, кадмий, железо, никель, хром и ртуть. Органическими ос-
татками могут быть алкил, алкенил, алкинил или арил. Ниже при-
ведены некоторые типичные примеры.
I группа
(щелочные
металлы)
CHs = CHLi
ънниллидий,
CH8CH2Na
этилнатрий
(CjHjJgZtl
диэтцлниик
// группа 111 группа /V группа
(щелочноземельные металлы)
e<HsMgBr [(Снщве]я CHjSnClj
фепилмагний бромид диыетидбернллий (полимер) треххлористое метилолойо
(СН5)А [(CH3)jAIJa (СН3СН8)4РЬ
диметнлкальцпй триметялалюмиянй (димер) тетрдзтидсшшед
Переходные Металлы
CHsCdCJ CjHgHgCi (GHjGH^g
метилкадмийхлорид фенилмеркурхлорвд дмэтилртуть
Элементы, являющиеся менее ярко выраженными металлами (ме-
таллоиды), такие, как бор, кремний, германий, селен, мышьяк
И т. д., также образуют органические производные; некоторые из
них имеют весьма важное значение, однако они занимают среднее
положение между металлоорганическими соединениями и органичес-
кими производными неметаллов. Их лучше всего рассматривать от-
дельно, и они не включены в настоящую главу,
12-1. Общие свойства металлоорганических
соединений
Физические и химические свойства металлоорганических соеди-
нений изменяются в чрезвычайно широком диапазоне и могут быть
сопоставлены со степенью ионности связей углерод — металл. Эти
связи могут быть как преимущественно ионными, например в слу-
чае ацетиленида натрия HCssC:®Nа®, так й в основном ковалент-
МЕТАЛЛООРГАНИЧЕСКИЕ1 СОЕДИНЕНИЯ
373
ними, как в тетраэтилсвинце (CsHfi)4Pb. Чем больше электрополо-
жительность металла, тем больше ионность связи углерод — металл;
углерод при этом является отрицательным концом диполя.
—О металл
I
Шкала электроотрицательности (рис. 7-7) может быть использована
;ля качественной оценки степени полярности данной связи угле-
род— металлу для этой цели служит также таблица ионности (в
процентах) связей углерод ~ металл (табл. 12-1).
Т аблица 12-1
Ионный характер Связей металл — углерод3
Связь ИсГняость, % Связь Иояносгь, % Связь Иолпость. %
с-к 51 C-Mg 35 C-Sn 12
С—Na 47 С—“Al 22 С—РЬ 12
С-LI 43 C-Zn IS C-Hg : 9
С—Са . ,43 С-Cd 15
а Pewiing.L., The'Nature of the Chemical Bond, Cornell University
Press, IftCO, Chap, 3,
Реакционная способность металлоорганических соединений воз-
растает с увеличением ионности связи углерод— металл. Не уди-
вительно поэтому, что натрий- и калийорганические соединения
оказываются в числе наиболее реакционноспособных металлоорга-
нических соединений. Они самопроизвольно воспламеняются на воз-
духе, вступают в бурную реакцию с водой и двуокисью углерода и в
соответствии с их солеобразным характером нелетучи и плохи раст-
воримы в неполярных растворителях. Наоборот, более ковалентные
соединения типа ртутноорганических (CH9)2Hg гораздо менее ре-
акционноспособны; они сравнительно устойчивы на воздухе, ле-
тучи в гораздо большей степени и растворимы в неполярных раст-
ворителях.
То, что металлоорганические соединения .содержат лишь час-
тично ковалентные связи металл— углерод, означает, что атом ме-
талла не обладает своей обычной заполненной оболочкой валент-
ных электронов. Так, атом алюминия в триметил алюминии формаль-
J 374 ГЛАВА 12
: но имеет на внешней оболочке Шесть электронов.
i снэ
‘ Al
сн, сн,
триметилапюминий
Некоторые, но далеко не все металлоорганические соединения
такого типа проявляют значительную тенденцию к существованию
в виде димеров или даже полимеров, где в образовании связи между
атомами металла участвуют алкильные группы или галоген, если
последний присутствует в молекуле, например
СН, ,СН, СИ, \ ЯЬ ,CIJ1
'Al ,?£ X®
cib \н, Z ''ей, Чй, ''ей, Хсн',
триметил алюминий ДИметил бериллий (полимер)
(димер)
СН, £1 /СН,
CH, \:f ^СН,
^хлористый диметилали миний (димер)
Подобные вещества увеличивают число примеров электронодефи-
цитных соединений, аналогичных диборану В2Н„, рассмотренному
в разд. 7-4,Б. В растворителях типа простых эфиров, имеющих не-
поделенные пары электронов, димеры могут разрушаться в резуль-
тате преимущественной координации металла с растворителем
СН, ,СЬГ, сн,
'ун +
снз 'сн, \н,
СН, сгн5
2 С2Н;-О-СгН5 -5* 2 CHj-Al—.-O;
СН, СгН5
Некоторые основные свойства ряда металлоорганических соеди-
нений, имеющих наибольшее синтетическое значение, приведены в
табл. 12-2. Для иллюстрации использования многих металлоорга-
нических соединений в органических синтезах на рис. 12-1 приведе-
ны реакции между метиллитием и всеми реагентами, перечисленны-
ми в табл. 12-2. Легко видеть, что для каждой из этих реакций ха-
рактерна атака электрофильного агента на отрицательно заряжен-
ный углеродный атом связи углерод — литий. Далее, в результате
каждой реакции (за исключением последней) литий оказывается свя-
занным с более электроотрицательным атомом, чем углерод. Все
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
375
Таблица 12-2
Физические свойства и реакционная способность типичных
металлоорганических соединений
Соедипение T. пл.. ‘С Т.кип.. °с Растворимость в алканах Реакционная способность
и к нго о О 11 и Я о и о и *> *1 (J и и и
Увеличение t &HsNa Раз л. + +а + + + -j-6
ялектропоак- ' CH,Li » — ± + 4- -р +' + i +б
цепторных свойств ме- (CH3),Mg ? ±в — + + +а + + — —
талла . (CH9),Zn —40 46 + + +а + — — —
(CH3),Hg < 0 96 + +
а хЗамопроиавольно воспламеняется на исэдухс»
б Реакция может происходить Б случае некоторых представителей класса и при доста-
точно активных двойных углерод-углеродных связях.
3 Слегка летуч при повышенных температурах,
реакции, кроме двух последних, происходят с исключительно боль-
шой скоростью даже при —80 °C и могут протекать очень бурно при
быстром смешении реагентов.
а®
СН,:
Н® С1® -------* СН4 + Li® Cl®
Ьф 6© Я) Л
НВД О-Н ------->• СН4 + Li® ОН°
CHj-6-О ;® Li®
CHjLi
ген,о® Li®
2 6ф
О=С=О
Ь© 6©
сн,
-----> CHj-C-O® Li®
СН,
о
—> СИ,-С
Чоф Li®
Н/снГ-СН^-СгН, —> СИ4 + CH,= CHj + СгН,О® Li®
\ СН^СН, —СН,-СНа-СН>:® Li®
Рис. 12-1. Реакции метиллития с различными реагентами.
376
ГЛАВА 12
12-2.
Получение металлоорганических
соединений
А. Взаимодействие металлов
с органическими галогенидами
Взаимодействие металла с органическим галогенидом представ-Е
ляет собой удобный метод получения производных умеренно актив-
ных металлов, например лития, магния и цинка. Диалкиловые эфи-
ры, в частности диэтиловый эфир, служат инертной и слабополяр-
ной средой, в которой металлоорганические соединения обычно-
растворимы. Необходимо принимать специальные меры, чтобы ис -
ключить присутствие влаги, кислорода и двуокиси углерода, кото-
рые реагируют с металлоорганическими соединениями; это обычно
достигается проведением реакции в атмосфере инертного газа —
азота или гелия.
(СН3СНг),О
CH3Br + 2Li —--------* СН8Ы | LiBr
иегиллитий
(СИасн,),о
CHaCH2Br+Mg--------------► CHsCH2MgBr
этилмагнийбромид
Порядок реакционной способности различных галогенидов еле- !
дующий: I>Br>Cl>F. Фтористые алкилы не реагируют с литием
и магнием. Что касается металлов, то цинк хорошо реагирует с >
бромидами к иодидами, тогда как ртуть реагирует удовлетворительно
лишь в том случае, если она амальгамирована натрием. '
CH3I4-Hg(Na) (CHs)aHg-f-2NaI '
Особую проблему представляют иатрийорганические соединений
вследствие высокой реакционной способности по отношению к
эфиру и органическим галогенидам. С диэтиловым эфиром реаги- :
руют алкильные производные как лития, Так и натрия, но если
литийорганические соединения реагируют медленно, то натриевые
производные вступают в реакцию настолько быстро, что при их
получении диэтиловый эфир нельзя применять в качестве раство-
рителя. Вследствие этого обычно в качестве растворителей исполь-
зуют углеводороды. Однако даже в таком случае нужна специальная
методика проведения синтеза, так как натрййорганическое сседИ'
некие сразу же после .образования может реагировать с органиче-
ским галогенидом, давая углеводороды. Эта последняя реакция
может протекать как по механизму 3^2-замёщения, так и Е2-от-
щеплення в зависимости от того, атом углерода или р-йбдородный i
МЕТАЛ ЛООР ГАНИЧ ЕСК.ИЕ СОЕДИНЕНИЯ_____ 377
атом алкилгалогенида атакуется натрийорганическим соединением.
Sw2 -замещение:
СН3С^>:'Ма®Т"сН^СНг | Щг —> CHjCHjCHjCH, + Na® Br®
Г
_Е2 -отщепление:
СНэС^Гм^^Н^СН^г ~ь СН»СН, + СНг=СНг + Na® В г®
Такогорода реакции замещения, проводимые с натрием и орга-
ническими галогенидами (часто называемые конденсацией Вюрца),
имеют лишь ограниченное синтетическое применение. Некоторые
родственные и. более употребительные реакции рассмотрены в
разд. 12-3, Е.
Упражнение 12-J. Образования каких продуктов можно ожидать при попытке
синтезировать гексаметялэтан из трет-бутилхлорида и натрия? Напишите урав-
нения протекающих реакций, _______
Побочные реакций отщепления и конденсации мешают получению
винилмагнийгалогенидов (CHa=CHMgBr) из винилгалогенидов и
металлического магния при использовании в качестве растворителя
диэтилового эфира. Однако такие соединения могут быть получены
с хорошим выходом в тетрагидрофуране (СНа)4О
н^-сн,
Н,С^ ^сн,
чо
СНа = СН — Br~pMg ------!—>- СНа=СН—MgBr
Б. Обмен галогена на металл
Некоторые типы металлоорганических соединений легко реаги-
руют с органическими галогенидами, при этом происходит обмен
галогена на металл^ Часто оказывается удобным использовать
такие реакции для получения металлоорганических соединений,
RBr+R‘Li RLJ + R'Br,
которые трудно синтезировать прямым ’Взаимодействием металла и
галогенида.
Эти реакции представляют собой равновесные процессы, при
которых преимущественно образуются продукты, где металл ока-
зывается связанным с относительно более электроотрицательным R;
они дают удовлетворительные результаты в случае бромидов и
иодидов, но не фторидов и хлоридов. Они применяются в основном
при синтезе литийорганических соединений, производных сравни-
тельно мало реакционноспособных галогенидов, таких, как арил-,
винил- или этинилгалогениды.: Эти галогениды не во всех случаях
легко реагируют с металлическим литием, но могут гладко взаимо-
378
ГЛАВА 12
действовать с бутиллитием.
Cl-/~ ^~Br4-CH3CHaCHaCH3Li
-* Ь - Li+СН3СН аСНаСН3Вг
п-хлорфениллигий
В. Замещение металла на металл
Замещение одного металла на другой служит общим методом
получения реакционноспособных металлоорганических соединений
из их менее реакционноспособных аналогов. Примером такого
превращения может служить синтез метилнатрия из диметилртути
(CH3)aHg+2Na —> 2CH3Na-yHg
Эта реакция в определенной степени сходна с обычным вытес-
нением меди из ее солей, при действии металлического цинка. На-
правление протекания реакции зависит от отношения окислительно-
восстановительных потенциалов металлов.
Zn°-|-CuSO4 —> ZnSC^-f-Cu0
Упражнение 12-2. Допишите приведенные ниже уравнения и определите, исхо-
дя из окислительно-восстановительных потенциалов, какие из написанных реак-
ций осуществимы. Назовите реагенты и продукты.
(C2Hs)8Hg4-Mg —»
(CH3)aZn4-Cd —*
(CeH6)4Sn + Li
(СНЭ)4РЬ + Zn -*
(СН2 = СН—CHaJaMg-pLi —*
Г. Взаимодействие металлоорганических
соединений с галогенидами металлов
Малореакцнонноспособные металлоорганические соединения мо-
гут быть наиболее успешно синтезированы из реактивов Гриньяра
и галогенидов металлов
CH3MgC[-f-HgCla —> CH3HgCl + MgCia
-2CHsMgCl+HgCla -> (CHsJjHg+MgCl,
Эти реакции, которые можно представить протекающими и в
прямом и в обратном направлении, в действительности происходят
таким образом, что в продукте с галогеном оказывается связанным
наиболее электроположительный металл. Основываясь на этом,
можно с уверенностью сказать, что хлористый натрий не будет реа-
гировать с диметмлртутью, образуя метилнатрий и сулему.
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
379
Д. Металлоорганические соединения
и углеводороды с подвижным водородом
Наиболее удобным способом получения некоторых металлоорга-
нических соединений является реакция алкильных производных ме-
таллов с такими «кислыми» углеводородами, как ацетилен и цикло-
нентадиен *
CH3MgBr 4-CHsC^CH —> CH4 + CH3CssCMgBr
Эти реакции могут рассматриваться как взаимодействие солей
слабых кислот (для метана ЯдСЮ-10) с более сильными кислотами
(для' метил ацетилена КА?&10~22).
Е. Присоединение металла и водорода к алкенам
Алюминийорганические соединения могут быть синтезированы
непосредственно из алюминия, водорода и алкена в соответствии
с приведенным йиже уравнением (реакция с изобутиленом выбрана
в качестве примера)
з / снЯч \
3(CH3)aC=CHa + Ai + -2-H2 —И )CH-CHS Al :
2 \СН/ А
трилэобутилалюминий
Упражнение /2-3. Рассмотрите возможные механизмы приведенной выше ре-
акций получения триязобутил алюминия, имея в виду, что алюминий оказывается
связанным с первичным атомом углерода.
Реакционноспособные металлоорганические соединения редко выделяют ив
растворов, в которых они получаются; эти растворы обычно не сохраняются дол-
гое время, а сразу же вводятся в последующие реакции. Однако эфирные растворы
некоторых магннеорганических галогенидов (фенил-, метил- и этилмагйийгало-
генидов) являются продажными продуктами. я-Бутиллитий также выпускается
в продажу в виде раствора в минеральном масле или парафине. Все операции с
металлоорганическими соединениями необходимо всегда проводить с осторож-
ностью ввиду их чрезвычайной активности и во многих случаях значительной ток-
сичности (последнее особенно относится к органическим соединениям ртути, свин-
ца н цинка).
Упражнение /2-4. Напишите уравнение (уравняв коэффициенты) для получе-
ния приведенных ниже металлоорганических соединений; используйте для каж-
дого соединения два различных способа синтеза, исходя из соответствующих ал-
килгалогенидов и неорганических реагентов. Опишите условия реакций и укажите
растворители. Для каждого случая укажите, какой пз методов получения вы счи-
таете предпочтительным с точки зрения в.,.хода, удобства проведения и т. д.
a) (CH3)sZn в) (СН3СН8),ЯРЬ
б) CH3MgC! г) (CH3)sCHLi
* Реакция ацетилена с грипьяровым реактивом
С2Н2 -у- 2CH3MgX -н- X MgC CMg X + 2СН4
открыта Ж. Иоцичем, широко использовавшим полученный им «реагент Иоцича»
в синтезе.— Прим. ред.
380
ГЛАВА 12
12-3. Магнийорганические соединения
Наиболее важным в синтетическом отношении типом металлоор-
ганических соединений являются магнийорганические галогениды,;
или реактивы Гриньяра^ Они названы так по имени В. Гриньяра,
открывшего их и разработавшего метод их синтетического примене-
ния, за что ему в 1912 г. была присуждена Нобелевская премия.
Как уже упоминалось, эти соединения обычно получают в растворе
сухого эфира из магниевых стружек и органического галогенида
эфир
CHjI+Mg----1-CHsMgI
выход 95%
Хлориды часто реагируют вяло и, кроме того, могут давать не-
желательный осадок хлористого магния, который в отличие от бро-
мистого и йодистого магния лишь оч:ень слабо растворим в эфире.;
Магнийорганические фториды не известны.
До сих пор мы изображали" гриньяровские реактивы в виде
R—Mg—X, где X — хлор, бром или иод; есть основания считать,
что такое изображение для этих соединений в эфирном растворе
неверно. Более правильным изображением может быть мостиковая
структура
представляющая собой комплекс состава 1 : I между диалкилмаг-
нием и галогенидом магния. В целях большего удобства при написа-
нии реакций с участием магнийорганических соединений будет
использоваться формула RMgX; однако следует отдавать себе отчет
в том, что группа X может быть более сложной, чем галоген. То,
что структура R—Mg—X, по крайней мере в некоторых случаях,
может быть правильной, было продемонстрировано изучением кри-
сталлического соединения C«HjHgBr4O(CaHs)J3 методом рентге-
цоструктурного анализа.
Упражнение 32-5. Было предположено существование равновесия между ал.
килмагнийгалоген адом (реактивом Гриньяра) и соответствующим диалкилмагни-
ем в эфирном растворе, выражаемого приведённым ниже уравнением:
2 RMgX 7^ R.M6-|-MgXa
Когда эфирные растворы диметилмагния и радиоактивного бромистого маг-
ния Mg*Br3 смешивали и оставляли стоять в течение нескольких, часов, то осаж-
.СЩ—СН2
денный добавлением диоксана О< jO бромистый магний оказался
(по крайней мере для’грнньяровскнх реактивов, приготовленных из некоторых
порций магния) содержащим почти всю исходную радиоактивность. Какие выводы
можно сделать из этих результатов?
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
381
По-видимому, хотя связь углерод-г магний в магнийорганиче-
ских соединениях и обладает определенной полярностью, обратимой
ионизации до R: 9 не происходит, поскольку образовавшийся та*
кнм образом карбанион быстро атаковал бы эфир, аналогично тому
как это происходит в случае высокополярного натрийорганического
соединения.
«е с® * © ф
R -.-.Mg-X *- R:+MgX
Хотя реактивы Гриньяра, полученные в эфирном растворе, не
атакуют растворитель, они чрезвычайно сильно ассоциируют с
ним. Не весь эфир может быть удален после реакции получения
чагнийорганического соединения даже при пониженном давлении
и умеренно высокой температуре; оставшееся, твердое вещество со-
держит один или большее число молей эфира на каждый моль маг-
иийорганического соединения. Молекулы эфира, по-видимому,
координируются с магнием за счет неподеленной пары электронов
кислорода
Сгн5
Р-Сгн5
Mg >lg
ЯГ Г)—СгН5
СгН5
Такого рода координацией объясняется высокая растворимость
реактивов Гриньяра в эфире.
12-4. Реакции .гриньяровских реактивов
А. Соединения с подвижным, водородом
Реактивы Гриньяра взаимодействуют с кислотами, даже такими
слабыми, как спирты, ацетилен и первичные и вторичные амины.
Эти реакции можно рассматривать как нейтрализацию сильного
основания (R;9 в составе RMgX). Продуктами являются углево-
дород и соль магния
СНэ—MgI+СНэСНгО СН4+СН3СНг0Мй1
Реакции такого типа оказываются удобным способом замены
галогена, связанного с углеродом, на водород, как, например, в
синтезе циклобутана из циклобутилбромида
СН4—СН —Вг Mg CHS—СН—MgBr н,о СН2—СН2
сна—СНа СНа—СНа GHg-cbj
382
ГЛАВА 1Я
Они служат также аналитическим методом определения числа под-
вижных водородов в соединении (так называемый метод Церевити-
нова). В качестве реактива Гриньяра используется метилмагний-
иодид; измеряя объем метана, выделившегося при взаимодействии
определенного количества соединения с подвижным водородом,
можно вычислить число молей активного водорода в образце. Если
известна молекулярная масса, то можно определить число активных
врдородов в молекуле.
Упражнение 12-6. Избыток метилмагнийиодида и 0,1776 г соединения, имею-
щего формулу С^НрОз, дают при реакции 84,1 см3 метана, собранного над ртутью
при 740 мм и 25 °C. Сколько активных водородов содержит соединение С4Н10О3?
Предположите возможную структуру для этого соединения, зная, что в его ПК-
спектре не обнаруживается карбонильного поглощения и ЯМР-спектр указывает
на присутствие только трех типов водородных атомов с площадями соответствую-
щих пиков, относящимися как 1:2:2.
Б. Кислород, оера и галогены
Реактивы Гриньяра взаимодействуют с кислородом, серой и га-
логенами, образуя соединения, содержащие связи С—О, С—S и
С—X соответственно:
RMgX н„о, н®
RMgX + Оз —> R —О—О—MgX---------* 2ROMgX--------► 2ROH
HjO, н®: ‘ *
... ...... 8RMgX-J-S8 —+ 8RSMgX-------Г 8RSH.... ,
RMgX-pia RI+MgXI
Эти реакции обычно не имеют существенного синтетического зна-
чения, поскольку соединения типа ROH, RSH и RX, как правило,
могут быть получены более удобным и прямым способом из алкил-
галогенидов по реакциям замещения S^l и Sn2, как описановгл. И.
Однако в тех случаях, когда Sf<l - и 5к2-реакции протекают медлен-
но или неудобны по каким-либо другим причинам, как( например, в
случае неопентильных производных, реактивы Гриньяра могут ока-
заться очень полезными.
СН3 СН, СН,
! Mg | -f, I
СН3—С—СН2С! —* СН3—С—CHsMgC] --> СН3—C-CHJ
I. I I
сн3. сн, сн3
неопентил хлорид неонентилио ди д
Окисление реактивов Гриньяра молекулярным кислородом при
низких температурах может также служить методом синтеза гидро-
перекисей
—70 °с н®
RMgX-pO,------> ROOMgX —> ROOH
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
383
Для предотвращения образования спирта нужно проводить «об-
ратное» добавление (т. е. добавлять раствор реактива Гриньяра
к эфиру, через который барботируется кислород, а не барботи-
ровать кислород через раствор гриньяровского реактива вэфире).
В. Присоединение к карбонильной группе
В синтетическом отношении наиболее важным является исполь-
зование реактивов Гриньяра для создания новых связей углерод —
углерод путем присоединения к кратным связям, в частности к кар-
бонильной группе. Во всех подобных случаях магний перемещается
от углерода к более электроотрицательному элементу. Примером мо-
жет служить присоединение метилмагнийиодида к'|формальдегиду.
Б© 6Ф БФ Б©
Н2О
н®
CHjCHjOH
CHj:MgI + н2с=о
CHjtCHj-O-Mgl
новая связь углерод-углерод
Выходы Продуктов присоединения в этих реакциях обычно высо-
ки, и при соответствующем подборе карбонильной компоненты из
соединений с меньшим числом углеродных атомов может быть по-
строен широкий круг соединений с большим по размерам углерод-
ным скелетом. Продукты, образующиеся из различного рода кар-
бонильных соединений при реакции с реактивами Гриньяра, пере-
числены в табл. 12-3. (Номенклатура карбонильных производных
рассматривается в разд. 13-1.)
При реакциях образуются смешанные магниевые соли — алкого-
ляты, из которых необходимые продукты выделяются путем кислого
гидролиза
на
ROMgX-j-HOH —> ROH + HOMgX----> H2O-f-MgXCl
Если продукты чувствительны к действию сильных кислот, то
гидролиз удобно проводить насыщенным раствором хлористого ам-
мония; основные соли магния выпадают в осадок, тогда как органи-
ческий продукт остаётся в эфирном растворе.
Взаимодействие двуокиси углерода с реактивом Гриньяра при-
водит сначала к 'RCO^MgX
Z.O
. RMgXq-COa —<- R-C<
>OMgX
Это соединение представляет собой соль карбоновой кислоты; оно
содержит двойную связь углерод — кислород и потому может далее
реагировать с магнийорганическим соединением
OMgX
RCO2MgX-[-RMgX R-i-OMgX
R
Таблица 12-3
Продукты, образующиеся при взаимодействия реактивов Гриньяра (RMgX) !
с карбонильными соединениями
Реагент Продукт Продукт гидролиза Обычно получа» , •СМЫЙ яыгод
нх Формальдегид /=0 н/ RCHaQMgX Первичный спирт R£H2OH Хороший
К\ Альдегид )С= О ТИ r* R-(!-OAJgX Н Вторичный спирт R-CHOH 1 R' №
R\ R' Третичный спирт От хоро-
Кетон )С = О Я"7 R —С—OMgX k‘ R* R-eUoH L шего до низкого
Двуокись углерода СОа RCO^MgX к" Карбоновая кислота RCO2H Хорошей
Карбоновая кислота r\ Л >с=о нс/ R'COsMgX-|-RH Карбоновая кислота RrCOaH 2
Эфир карбоновой кисло- R' Третичный спирт От хор 6-
ТЫ i R' шего до
н\ >С=О R-с—OMgX 1 R—С—ОН низкого
R\ Ацилхлорид }С=О СИ R' R—<!—OMgX Третичный спирт R’ То же
R-ti-OH 1
К,М-Диметилкарбокса- МИД ’ о (СН,»/ R' R- (i- OMgX K(CHab К , R'\^ л Кетон >С = О RZ » *
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
385
На практике вторая реакция оказывается медленной даже при ком-
натной температуре, и ее протекание легко предотвратить, выли-
вая раствор реактива Гриньяра на тоикоизмедьченную и перемеши-
ваемую твердую двуокись углерода («сухой лед»)., - .
Ацилхлррйды, например ацетилхлорид СН3СОС1, обычно взаи-
модействуют с 2 молями реактива Гриньяра, образуя третичные
спирты. Очевидно, первая стадия состоит в присоединении по кар-
бонильной группе
OMgX
СНЭС^ -{-RMgX —► CH3-t-Cl
J
R
Образующееся таким образом промежуточное соединение неустой-
чиво и немедленно разлагается на кетон и галогенид магния. Кетон
далее реагирует еще „с одной молекулой реактива Гриньяра и дает
алкоголят третичного спирта
о,
СНз-Й-R + RMgX
СН,-С-К * MgXCl
Упражнение /2-7. Можно ли ожидать, что продукты были бы теми же, если
вместо присоединения по карбонильной группе ацилгалогениды реагировали бы
путем обычного 5№-замещенкя галогена (реактив Гриньяра служил бы, при этом
источником R :©)? Объясните, почему простое замещение вряд ли сможет быть пра-
вильным механизмом, основываясь на том факте, ипз аирлфторнды реагируют с ре-
активами Гриньяра быстрее, чем ацилхлориды, которые в свою очередь (реагируют
быстрее, чем Ьцилбромиды.
Взаимодействие RMgX с ацилхлоридами не может быть исполь-
зовано для синтеза кетонов, так как RMgX обычно быстро присоеди-
няется к кетонам сразу же после их образования. Однако проведе-
ние синтеза при низких температурах, позволяет во многих случаях
уменьшить скорость присоединения до такой степени, что кетоны
могут быть выделены. Хорошие выходы кетонов получаются также,
если гриньяровский реактив вначале перевести в кадмийорганиче-
ский хлорид. Кадмийорганические соединения достаточно хорошо
реагируют с хлористыми, ацилами, но лишь очень медленно присое-
диняются к карбонильным Группам кетонов. Реакция, таким обра-
13 М 1540
386
ГЛАВА 12
зом, может быть остановлена на стадии образования кетонов
RMgC! 4-CdCla—^RCdCl + MgCl8
z>0
СН3- C<4-RCdCl
OCdC)~>
снэ-с-а
R _
о
it
—> СН,С-R+CdCb
Реакции магнийоргэпических соединений со сложными эфирами
сходны с реакциями хлористых ацилов; они очень удобны для син-
теза третичных спиртов, в которых две одинаковые группы оказы-
ваются связанными с углеродным атомом, входившим в состав кар-
бонила
I
CH3-Cf +2RMgX —^CHj-C-OMgX+MgXfOCHs)
ХОСН3 |
R
Специфическим случаем является синтез 1-метилциклогексанола
из пентаметиленового димагнийорганического соединения и метил-
ацетата. [Заметим, чтодимагнийорганические соединения могут быть
получены из некоторых ди галогенидов, если галогены далеко от-
стоят друг от друга. Если галогены расположены близко друг к дру-
гу, то происходит реакция, отличная от образования реактива
Гриньяра,^- отщепление в случае 1,2-дигалогеиидов (см. разд. 11-15)
и образование циклопропана в случае 1,3-дигалогенидов (см. уп-
ражнение 4-6)1.
Mg I.CH(COaCHs
Вг(СН2)БВг —* BrMg(CHa)5MgBr —--------—+
2. нао, и®
СНа—СИ, СНЭ
CHs-
N.N-Дизамещенные амиды, например Ы,\’-днметилацетамид
ЛЭ
СНаС^ часто реагируют лишь с 1 молем реактива
N(CHa)a
Гриньяра, образуя довольно устойчивые аддукты, которые при гид-
ролизе водным раствором кислоты дают карбонильное соединение
+ RMgX
(CH,j
г
OMgX сн,
-О- СНу-С----N
& чсн,
OMgx^cH, у—-ff--------
-с---N
I \ х Н,О. НС1
R tH, ---------------->-
О
и
CHy-C-R + XMgN(CMj)z
ф
GHj-C-R + MgXCl +
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
387
Эти реакции отличаются от присоединения RMgX к хлор ангидридам и слож-
ным эфирам кислот, в результате которого образуются неустойчивые аддукты,
|, излагающиеся до кетонов без помощи кислоты. Разница в стабильности этих ад-
дуктов связана с основными свойствами входящих в их состав элементов. Разло-
жение комплексов в случае хлористого ацила и сложного эфира приводит к кетону
и । алогениду магния или алкоголяту магния соответственно. Тот же тип разложе-
ния комплекса в случае амида должен был бы привести к образованию амида маг-
и ня, вследствие чего этот процесс оказывается гораздо менее выгодным. Стабиль-
и 1сть комплекса амида поэтому достаточно высока, и он способен к существованию
। тех пор, пока не будет разрушен добавлением воды и кислоты (НО), в резуль-
its чего образуется карбонильное соединение и соль амина, Таким образом, реак-
ция МЛ’-дизамещекных амидов с реактивами Гриньяра (или, лучше, литийоргани-
ческими соединениями) может служить достаточно удобным методом синтеза кето-
нив.
Упражнение 12-8. Напишите структуры продуктов приведенных ниже реакций,
происходящих с участием реактивов Гриньяра. Укажите формулы как промежу-
точных соединений, так и соединений, образующихся после гидролиза разбавлен-
ной кислотой. В отсутствие специальных указаний примите, что реактив Гриньяра
используется в количестве, необходимом для завершения реакций (легко проте-
кающих при комнатной температуре).
a) CeH6MgBr-FC6HeCHO
б) CH3MgI+CH3CH2CO2CaH5
в) (CH3)3CMgCl+CO2
Г) CH3CH2MgBr + ClCO2CaH5
д) CHaMgl-i-CH3COCH2CH2CO2C2Hs
(I моль) (1 моль)
о
tl
е) CeH3MgBr-|-CH3O-C-OCHs
О О
II II
ж) (CH3)3CCH2MgBr-|-CH3C—о—с—сн
Упражнение 12-9. Покажите, каким образом каждое из приведенных ниже со-
единений может быть получено по реакции, протекающей с участием реактива
Гриньяра.
а) Н2с/ ^Н-СН2ОН (два пути)
ХСН/
б) СН2=СН— С(СНЭ)2ОН
в) СН3СНаСН(ОН)СН3 (два пути)
г) (СН3СНа)3СОН (три пути)
СН2ч
д) | )СНОН
сн/
е) С6НвСН2СНаСОСН3 (два
пути)
ж) СйН6Се=С—СН2ОН
з) (СН3)4СНСНО
Упражнение 12-10. В некоторых случаях реакция такого амида, как
CH3CON (СН3)3, с гриньяровским реактивом , RMgX может дать некоторое коли-
чество CH3CR2N (CHs)2. Объясните, каким образом могут образоваться такие
продукты?
Г. Присоединение к двойным
угле род-угле родным связям
Вряд ли можно ожидать, что реактивы Гриньяра будут присое-
диняться к двойным углерод-углеродным связям столь же энергич-
но, как к карбонильным группам. Двойная связь углерод — угле-
13*
ГЛАВА IS
род не только менее уязвима к нуклеофильной атаке R: © из RMgX,
но она также труднее атакуется электрофильной ©MgX-группой
RMgX.
- : • • R MgX .
\з-с/4-Р?-Хх та,Е0,_с
/ x II
R MgX
к б© а© а© а© быстро I I
>C = О -|- Г- • • Mg X —_ c - о
z I
Различие в реакционной способности связано, очевидно, с боль- ...;
шей электроотрицательностью: кислорода по сравнению с углеродом,
вследствие чего карбонильная труппа оказывается более полярной ;
, (а следовательно, и более реакционноспособной), чем двойная связь ,
углерод — углерод. Однако присоединение к двойным связям воз-
можно, особенно в тех случаях, когда двойная: связь активирована
соседней элёктроноакцепторной группой (см. разд. 16-10, В о при-
соединении по Михаэлю). В приведенном ниже примере взаимодей-
ствий RMgX са. ₽-ненасыщенным сложным эфиром осуществляется ;
\ ^-присоединение к сопряженной системе, приводящее в конечном
счете к насыщенному эфиру.
\&Ф I 6©
'с=с—с=о
А г i
s© 6©
+ R---MSX
' Н®, Hi О
бистро
неустойчивая енольная,
форма сложного эфира
Такого типа реакции присоединения могут происходить также в
случае а, p-ненасыщенных альдегидов и кетонов — обычно конку-
рентно нормальному 1,2-присоединению. Например, в случае пен-
тен-З-она-2 отношение продуктов 1,4- и 1,2-присоединёния состав-
ляет 3:1
2. н®, нао
О
II 1..с,н,мвХ
снасн=сн—С-СН3
пентен-3-он-2 '
О он
- II I
—>СняСН~.СН2—С—СНз+СН8.-~СН = СН~С-СН4
I 1
С2н6 С2Н5
Г5% 25%
Соотношение 1,2- и 1,4-присоединения весьма чувствительно к про-
странственным препятствиям; так, в противоположность реакции
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
389
пентен-З-она-2 в случае взаимодействия этилмагнийбромида с кро-
тоновым альдегидом 1,4-присоединения практически не происходит.
К такому же результату приводит введение. второй Р-метильной
i руппы, как, например, в 2-метилпентен-2-оне-4
Н С,Н3
CH3CH=cH~c=O4-c-H6MgBr —> сн3сн=сн—<:—он
кротоновый альдегид 1
о
4-мегияпентен-4-ов -3
I. C,H,MrX
2. Н®, Н,О
ген сен - 4 -о л-3
С2Й5
сн3 I
)С=СН-С—сна
3.5 - диметилгексен-4 - ои 3
Упражнение 12-11. Укажите продукты реакций между этилмагнийбромидом и
приведенными ниже соединениями.
-О
а) СНг-СНСОСеНв
О
б) СеН6СН=СНСОаСН3
в) СвН8СН=СНСО,С(СН3)я
В пунктах (г) и (д) примите во внимание геометрию переходных состояний для
атаки этила по углероду й магния по кислороду в случае Г,2* и 1,4-присоединёнйя.
Д. Присоединение к тройным связям углерод—азот
Азот более электроотрицателен, чем углерод, и нитрильная груп-
6® ое
па поэтому поляризована следующим образом: —C=?N. В соответ-
ствии с этим реактивы Гриньяра присоединяются к нитрильной груп-
пе в основном так же, как к карбонильной группе
6© 69 00 fi© R\ .А,
R'-C^N4-R---MgX—*• )C=N— MgX
Rz
Гидролиз таких аддук-тов приводит к кетиминам, которые в условиях
проведения реакций неустойчивы и быстро гидролизуются до кето-
нов
R\ н®. н,о Г R\ 1 нго R\
}С=№— MgX-—;" X=NH-----------------> >С=О-|-КНй
Rz |_ Rz J: RZ
JWTHMHIJ
390
ГЛАВА 12
Е. Реакции замещения
В принципе реактивы Гриньяра могут принимать участие в ре-
акциях SK2 в качестве источника нуклеофила R: ©. Выше уже упо-
минался такой общий тип реакций под названием конденсации
Вюрца (разд. 12-2,А). Однако в случае реактивов Гриньяра подоб-
С*. б©бф
снг=сн-снд: ci: + к—Mgx
—► СНг-СН—CH,-R + MgXCl
ное замещение не дает хороших результатов для алкилгалогенидов
и гладко протекает только с аллил галогенидами, а также с такими
алкильными производными, как алкил сульфаты, алкилсульфонаты
и сложные а-хлорэфиры, т. е. с соединениями, которые проявляют
особенно высокую 5^2*активность. Конденсация может быть серь-
езным затруднением при получении аллилмагнийгалогенидов из
аллилгалогенидов; в этих случаях для сведения к минимуму реак-
ций конденсации необходимо использовать большой избыток маг-
ния и разбавленные растворы галогенида.
Упражнение 12-12. Допишите приведенные ниже уравнения:
a) CjHjCHsCHjMgBr (CH3)3SO4 —*
в) CsH6MgBr4-CH3CssC—CHaBr —►
в) СНа=СН—СН2и+СНв=СН—СНгС] —>
г) CHjCHsCHjMgBr-l-CICHsOCHs —>
В смесях реактива Гриньяра и алкилгалогенидов, не вступающих в реакцию
в обычных условиях, быстрая конденсация может быть вызвана добавлением
каталитических количеств хлорида кобальта(Н)
CoClg
RMgX-|-R'X * RR'-J-MgXj
Продукты конденсации образуются также просто при добавлении хлорида ко-
бальта (11) к раствору реактива Гриньяра
CoCit
2RMgX---------->RR
Детально механизм этих реакций не выяснен, однако почти не вызывает сомнений
то, что в них принимают участие промежуточные соединения свободнорадикаль-
ного характера, Образующиеся продукты типичны для свободнорадикальных
процессов, поскольку, помимо продуктов конденсации, в различных количествах
образуются и другие углеводороды (вследствие диспропорционирования промежу-
точных свободных радикалов и отщепления водорода от растворителя). Нижевка-
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
391
ч сотне примера приведена реакция фенилмагнийбромида и бромистого этила
СоС1а
C0H5MgBr ——[СеН6СоС1] — СсН6. + .СоС1
“ » Г Li I
С2Н6Вг + -CoCi —* СЙН4. +СоС1Вг
2СвН6-—-*С0Н6—СВНВ
бифенил
СЙН6 +CHSCH2- —ь С,НВСН2СН3
атилбензол
СН3СН3*+СН3СН2- —>-СН3—СН3-|-СН2=СН2 (диспропорционирование)
растворитель
СН3СНа. —-------_—*СНЭСН3 (отрыв водорода от растворителя)
(рекомбинация)
Реактивы Гриньяра реагируют с большинством циклических
|фиров с небольшими кольцами по типу Sn2-замещения. Угловое
напряжение в трех- и чётырехчлеиных циклах облегчает раскрытие
ь.ольца, тогда как свободные от напряжения пяти- и шестичленные
циклические простые эфиры не атакуются реактивами Гриньяра.
RMgX-j-CHa—СН2 —> RCH2-CH2OMgX
окись этилена
сн,
RMgX +Н2С/ \О —> RCHaCHaCH2OMgX
СН2
окись триметялена
Ж. Побочные процессы при присоединении
реактивов Гриньяра к карбонильным соединениям
Во многих случаях присоединение реактивов Гриньяра к карбонильным со-
(точениям происходит с почти количественным выходом, однако иногда продукт
присоединения не образуется вообще. Наиболее вероятно возникновение ослож-
нений при синтезе третичных спиртов с объемистыми алкильными группами, так
как при этом группа R магнийорганического соединения встречает препятствия
при атаке карбонильного углерода кетона и конкурентные побочные реакции могут
играть большую роль.
Наиболее важными побочными реакциями являются енолизация и восстанов-
ление. Еполизация может иметь место, если в кетоне присутствует хотя бы один
водород в одном иза-положений. Примем, что начальная стадия как для присоеди-
нения, так и для енолнзации состоит в координации магния с карбонильным
кислородом кетона. Присоединение приводит к тому, что группа R за счет своей
пары электронов образует связь с карбонильным углеродом.
П рисоединение:
R6®
L 6®
“g
X
— С—R
Г
OMrX
Если R — объемистая группа, то скорость присоединения уменьшается и мо-
жет осуществиться конкурентная реакция енолнзации. При реакции енол из а щш
R;9 отрывает протон от а-углеродного атома, образуя R:H, и одновременно осво-
392
ГЛАВА IS
'f-
бождающаяся пара электронов а-углерода замыкает двойную углерод-углеродную
СВЯЗЬ;
Енолизация:
Этот процесс носит название енрлизацин, поскольку образуется MgX-соль а,fl-не*
насыщенного спирта (ен-{-ол=еяол). Гидролиз приводит к неустойчивому енолу,
и после изомеризации регенерируется исходный кетоц (см. разд. 8-5)
При енолизации кетон действует как кислота и отдает водород от одного из а-
углеррдных атомов группе R магнийорг эпического соединения. Енолизация нет
возможна, если в кетоне отсутствуют а-водородные атомы.
Восстановление может происходить в том случае, если в группе R реактива
Гриньяра имеется водород при Р-углеродном атоме,
Н
Г I
В промежуточно образующемся комплексе в качестве восстанавливающего
агента выступает магннйорганическое соединение — его ^-водородный атом пере-
ходит в виде гидрид-нона (Н:®) к карбонильному углероду.
Восстановление:
Группа R грнньяровскоро реактива превращается в алкен, и гидролиз реакцион-
ной смеси приводит к тому же спирту, который образовался бы при восстановле-
нии кетона водородом.
\с=О 4. Н j —*—L—О Н
7 I
Н
Если в реактиве Гриньяра отсутствует Р-водородный атом, то восстановления
обычно не происходит.
Упражнение 12-13. Напишите стр у ктур ы про дуктов п рисо единен ия, енолиза-
ции и восстановления, образование которых возможно при следующих ре-
акциях:
a) CHeCOCH8+(CH3)sCMgX
б) CeHeCOCeH6+CH8CHaMgX
в) CeH6CH = CHCOaCaH5-|-CeH5MgX
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
393
Таблица 12-4
Продукты, образующиеся при реакциях диизопрол и л кетона с RMgX
R Присое- дине- ние а, % End Лива- дия3, % Восста- новле- ние а, % Число и тип 0-нодород- ных атомов
' н3 (Н3—CHS — 95 77 0 2 0 21 0 3 (нерв.)
< и3—сн2—сна— 36 2 60 2 (втор.)
1 ^ЗЧусн 0 29 65 6 (нерв.)
/н-сн2— * * 8 11 78 1 (трет.)
( н/ • сн3 1 СНЭ-"С— 0 35 65 9 (перв.).
сня сн3 СН3—С—сна— СН3 4 90 0 0
а Приводятся выходы продуктов, практически выделенных и идентифицированных.
В табл. 12-4 приведены результаты конкурентных реакций присоединения,
енолнзацни и восстановления при взаимодействии диизопропилкетона с различ-
ными реактивами Гриньяра RMgX.
СНЭ. ,СН3
/>СН-С-СН<
СК,/ И чЗНз
О '
динзопропилкетон
Из данных таблицы очевидно, что присоединение происходит неудовлетвори-
тельно во всех тех случаях, когда R в граньяровском реактиве не является ни
метильной, ни этильной группой
Енолизация какого-либо из а-водородев кетона не имеет существенного значе-
ния, если R не является вторичной или третичной (изопропильной или трет-
бутильной) или какой-либо другой высоко разветвленной (неопентильной) группой.
Для алкильных магнийорганических соединений легкость восстановления сущест-
венно зависит от числа р-водородных атомов в радикале R и от того, являются
ли они первичными, вторичными или третичными. В соответствий сбжидаемым
(учитывая легкость: удаления хлорид-иона из алкилхлоридов, разд. 11-12,А)
перенос гидрид-иона к кетону наиболее.легко осуществляется из третичного поло-
жения и наиболее трудно — из первичного положения. Отметим, что в случае
394
ГЛАВА IS
метил- и неопентилмагнийгалогенидов, не имеющих р-водородных атомов, восста-
новление не происходит.
Из вышеизложенного следует тот важный вывод, что при синтезе третичных
спиртов для получения наибольших выходов наименьшую по размерам группу
следует вводить на последней стадии. Так, при получении диметил изобутил карби-
нола оптимальным будет добавление мети л маги и иг а логе и и да к мети л и зоб ути л ке-
тону, а не изобутилмагнийгалогенида к ацетону, поскольку в последнем случае
возможно значительное восстановление кетона изобутильным реактивом Гринь-
яра. Таким рбразом,
СН3 О СН3 СН3
II! I I
CHs-C-CHs-C-CH3+CH9MgX—>CH5-C-CH2~C-CHS
н A <Lwgx
имеет преимущество перед
СН3 О СН3 СН3
I II II
CHa-C-CHsMgX+CHs-C—сн,—►сн,-с-сн«—с—сн8
I II
Н Н OMgX
Упражнение 12-14. Какие продукты должны преимущественно образовываться
в приведенных ниже реакциях?
О
СН3. || /СНз
a) CeHBMgBr4- >СН—С-СН<
сн/ хсн3
О
II
6) CHjMgBr+fCHi^C-C-CfCH,),
/СН9
z____< ZO
в) CHsMgBr4/____7~с\
---/ XLHg
хсн3
12-5. Натрий- и лигпийорганические
соединения
Свойства алкильных производных натрия и лития во многом
сходны со свойствами магнийорганических соединений, но для про-
изводных щелочных металлов характерна большая реакционная спо-
собность. Как упоминалось выше, они очень чувствительны к ки-
слороду воздуха и влаге и реагируют с простыми эфирами, алкилга-
логенидами, соединениями с подвижным водородом, а также с крат-
ными связями углерод — углерод, углерод — кислород, углерод —
азот. При их присоединении к карбонильным группам восстановле-
ние и енолйзация имеют гораздо меньшее значение, чем в случае
магнийорганических соединений, что делает возможным синтез
очень высоко разветвленных третичных спиртов. Триизопропил кар-
бинол может быть получен из диизопропилкетона и изопропиллития,
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ !
395
но не с помощью соответствующего реактива Гриньяра.
СНз СНЯ
сн3. ,сн3 СН. сн. I / 3
’\сн-с-сн/ + )CH-Li —► >сн-с-сн
СН3/ 11 СНз СНг СНз' I \гм
о он Пэ
три и з on р о пилкарбинол
Три-трет-бутилкарбинол может быть синтезирован из ди-т/ит-
бутилкетона, трет-бутил хлор и да и натрия. В этом соединении ме-
тильные группы создают чрезвычайно высокую степень простран-
ственной затруднённости, вследствие чего при попытке получения
соответствующего хлорида действием хлористоводородной кислоты
это соединение претерпевает значительный распад на фрагменты
меньшего размера.
СНЭ
СНЯ—С—сн3
СНЯ СН3 СНа снз I СНз
СНз—с—с—<!—СН3+СНЭ—(i—Cl-1-Na—>-СНз—с!—с—<i—СН3
inaO £н3 <Lh3 Jh3ohch3
ди-m pem -бути л кетон три-тргт-бутилкарбикол
12-6. Алкильные производные цинка.
Реакция Реформатского
Как правило, применение алкильных цннкорганическнх* соединений для
синтетических целей не имеет преимуществ перед использованием реактивов
Гриньяра; существует, однако, одно исключение; это взаимодействие реакционно-
способных органических галогенидов, обычно а-бромзамещенных сложных эфи-
ров, с альдегидами или кетонами, происходящее в присутствии металлического
пинка. Вначале из бромзвмещенного эфира образуется промежуточное цинкорга-
иическое соединение, которое далее присоединяется к карбонильной группе аль-
дегида или кетона. Продукт представляет собой fJ-оксизамещенный сложный эфир,
который обычно можно дегидратировать, получив таким образом ненасыщенный
* Открытые Франкландом цинкалкнлы были введены в синтетическую прак-
тику Л. М. Бутлеровым и его учениками — А, М. Зайцевым, Е. Е. Вагнером
ц С. И. Реформатским. Реакции P2Zn с карбонильными соединениями в общем
такие же, как реакции позднее введенных в практику Гриньяром магнийоргани-
ческнх соединений.— Прим. ред.
396 ....... u - ГЛАВА 12
эфир.
СН3 СН3
i бе изо л—толуол |
НСО2С3Не + Zn у---—BrZhCHCO2C2Hs
: этил-«-бромпро пион ат: ' илн ® Г!
j О СН3 OZnBr
. _ jl I I
CH3-/ 4-C-CH34-BrZnCHCOsCsHs—CH,-/ C—CHCO2C2H5
л-Д1етилацетофецон H C CH
H3C CHS
_ //------I I “H>°
сн3-/__^-с=с-соасгн5 -j—
эти Л 2 -метил-3 -n-тол илб утен-2 -дат
Иногда приходится активировать цинк, добавляя маленький кристалл иода,
бромной ртути или меди. Цинк имеет то преимущество перед магнием, что в случае
магнийорганического производного а-брбмэфнра существует тенденция к атаке
этим соединением карбонильной группы другой молекулы сложного эфира, тогда
как в случае ци и ко рг эпического производного такая реакция не происходит.
12-7. Применение металлоорганических
соединений в промышленности
Из металлоорганических соединений наибольшее промышленное
значение имеет тетраэтилсвинец (т. кип. 202 СС). Он резко улучшает
антидетонационную характеристику бензина при концентрациях
порядка 0,2—0,6 см3/л. К этилированному бензину добавляют эти-
лендибромид для превращения окиси свинца, образующейся при
сгорании, в летучий бромид свинца с тем, чтобы уменьшить таким
образом отложения в цилиндрах. Основное количество тетраэтил-
свинца получают по реакции хлористого этила со сплавом свинца с
натрием. Избыток свинца вновь превращают в сплав с натрием.
Использование тетраметил свинца оказывается более предпочтитель-
ным в случае двигателей, работающих с большой нагрузкой.
4C,HSCJ -р 4PbNa —у (C^He)4Pb -р 4NaC] -р ЗРЬ
Некоторые алкилмеркургалогениды, например этилмеркурхло-
рид, применяются в качестве фунгицидов для протравливания семян.
Алюминийорганические соединения присоединяются к алкенам
более энергично, чем реактив Гриньяра. При реакции с триэтил-
алюминием последовательные стадии присоединения этилена дают
смесь три-н-алкильных алюминийорганических соединений, содер-
жащих 2, 4, 6, 8 и т. д. углеродов в каждой алкильной группе.
сн,=сн2
СН2СН2А:1(С2Н6)2 ----у СН3СНаСН3СН2Л1(СЕН6)2 ^у
СН,=СНг CHs=CHa
-------> CH3CHaCHjCH2CH2CH2Ai(CsH5)2--!--<-
CH»(CH2)tAl(CHaCH2CH2CHa) ;и т. л.
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ 39?:
В случае алкильных групп с еще более длинной цепью проис-
ходит обратимое отщепление диалкил алюмин ийгидрида
СН3СНйСН3СН2СН2СН2А!1?2 ^i CH3CH2CHaCHsCH = CH2-pHAlR2
В присутствии этилена эта реакция сдвигается вправо, так как
гидрид присоединяется к этилену, образуя этилдиалкилалюмйний
HA.].Rs+CH2==CHs —► CHBCHsA!Ra
Дальнейшее внедрение фрагментов этилена между этой этиль-
ной группой и алюминием е последующим отщеплением диалкил-
алюминийгидрида и образованием новой этильной группы приводит
к полимеризаций этилена в смесь алкенов-1
* (CjH,),Al
иСНа=СН2------СН3СН2(СНгСНа)п„2СН = СН2
С помощью такого процесса алкены-1 в большом масштабе синте-
зируются в промышленности.
Упражнение 12-15. Каковы температура, давление этилена и концентрация
триэтилалюмииик, которые, по вашему мнению, наиболее благоприятны для
превращения этилена в бутен-1? В децен-1? Объясните.
12-8. Реакции электрофильного замещения
при атоме углерода
Поскольку многие из реакций металлоорганических соединений
могут быть отнесены к типу Электрофильного замещения SE, в
настоящем разделе целесообразно рассмотреть данный тип пре-
вращения. В противоположность нуклеофильному замещению
(гл. II) в Se-реакциях углерод атакуется электрофильным, а не
нуклеофильным агентом
R!; X + Y: ------> R:Y + X: S„
1 N
нуклеофил
R :’:Х т Y —ч- R:Y + X 3_
Ь.
электрофил
Ниже приведены некоторые типичные примеры электрофильного
замещения у атома углерода:
CHjifMgBr + ;Вг|:Вг: —* CHjBr + MgBr2
398
ГЛАВА 12
C2Hs:;'HgC2H5 + ClHg;:Cl
СН2=СН-СНг: i Li + H'-OH —* СН2=СНСНЭ i LiOH
C2H5HgCl + C2HjHgCl
При реакциях, сопровождающихся образованием углерод-угле-
родной связи, возникает определенная неоднозначность в употреб-
лении обозначений SN и SE- Например, при конденсации Вюрца,
протекающей по полярному механизму, происходит нуклеофильная
атака на углеродный атом алкил галогенида и электрофильная атака
на атом углерода металлоорганического соединения. В связи с ха-
рактером рассмотрения в настоящем разделе сосредоточим внимание
на электрофильном аспекте реакций такого типа.
Е © , е©
CHjIsBr + ХН3; I Na -з- СН3СН3 + NaBr
электрофил
нуклеофил
Очевидно, что по аналогии с нуклеофильным замещением при
электрофильном замещении возможно осуществление двух типов
механизмов. Согласно первому из них, реакция протекает в две ста-
дии: сначала происходит ионизация с образованием промежуточного
карбаниона, за которой следует реакция с электрофилом, приводя-
щая к образованию продуктов (SE1):
R:iXz^R:0+X©
R;©+Y® —> R:Y
Второй механизм представляет собой одностадийную реакцию,
при-которой образование связи со вступающей группой происходит
одновременно с разрывом связи с уходящей группой (SE2):
У®^Ц;Х --------* R:Y + X©
Механизм электрофильного замещения изучен значительно ме-
нее полно, чем механизм реакций типа Sn, отчасти потому, что ре-
акции электрофильного замещения не имеют столь же первосте-
пенного значения, а отчасти по той причине, что металлоорганиче-
ские соединения далеко не всегда оказываются удобными объектами
для кинетического и стереохимического исследования. Несмотря
на это, было выполнено значительное число работ с целью установ-
ления SeI- и Se2-механизмов и стереохимии этих процессов.
А. Стереохимия замещения SE2
Располагая оптически активной формой металлоорганического
соединения, можно судить о характере атаки (фронтальной или
атаки с тыла) при реакциях SE2 в зависимости от того, сохраняется
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
399
Г'ис. 12-2. Применение ша росте рж невых моделей для описания процесса электро-
|||цльного замещения в оптически активном металлоорганическом соединении пу-
тем фронтальной атаки и атаки с тыла.
или обращается конфигурация продукта (рис. 12-2, см. также
разд. 11-10).
К настоящему времени получено лишь относительно небольшое
число оптически активных металлоорганических соединений. Син-
тез гриньяровских реактивов из оптически активных галогенидов
почти всегда приводит к рацемизации (это означает, что реактивы
Гриньяра содержат равные количества двух оптических изомеров).
Однако менее активные металлоорганические соединения удалось
разделить на изомеры (см. упражнение 12-16), с их помощью было
установлено, что электрофильное замещение при атоме углерода,
как правило, протекает путем фронтальной атаки с сохранением
конфигурации.
Упражнение 12-16. Оптически активный втор-бутилмеркурбромид (оптически
активная emop-бутильная группа обозначена R*) реагирует с оптически неактиа-
иьем ятор-бутнлмагнийбромидом (оптически неактивная стар бутильная группа
обозначена R), образуя RHgR* (ди-в/пор-бутИЛртуть)
R*HgBr + RMgBr —> R*HgR + MfiBr2
Обработка R*HgR бромидом ртути (II) дает emop-бутилмеркурбромид
R*HgR + HgBr2 —> R*HgBr-f-RHgBr
Объясните, почему последняя реакция представляет собой ЗнЗ-эвмещение,
протекающее с сохранением конфигурации. Исходите из следующих фактов: во-
первых, скорость реакции прямо пропорциональна первым степеням концентраций
дв-емор-бутилртути и бромида ртути(П); во-вторых, после окончания реакции
втор-бутнлмеркурбромнд содержит ропно ппловину оптической активности, содер-
жащейся в R*HgBr, использованной для получения R*HgR.
Б. Стереохимия реакций, протекающих
с образованием карбанионов
Известны реакции, в ходе которых разрыв связей углерод —
углерод, углерод — водород или углерод — металл приводит к
образованию промежуточного карбаниона. Такне реакции относят
к классу Sgl, Какова дальнейшая судьба карбаниона, после того
400
ГЛАВА 12
Рис. 12-3. Изображение
взаимопревращений опта- ::
чески активных карбани-
снов, сопровождающихся
обращением. При равно- V'
беси и имеются равные
количества обеих форм и
оптическая активность от-
сутствует.
как он образовался? В тех случаях, когда можно ожидать, что кар- (
банион окажется наиболее устойчивым в неплоской конфигурации /
(разд. 5-7), следует предвидеть образование оптически активных
продуктов, если только не происходит инверсии между двумя воз-
можными неплоскими конфигурациями (рис. 12-3),
Такая инверсия должна привести к оптически неактивным про- ?
дуктам, если карбанион был первоначально асимметричным. В боль-
шинстве изученных к настоящему времени реакций электрофильного
замещения образуются стабилизированные карбанионы такого типа,
для которых следует ожидать плоской или почти плоской конфигу-...
рации, Примером может служить анион, образующийся при уда-
лении а-водорода от оптически активного а-фенилпропионитрила
под действием сильного основания, например амид-иона.
Такой анион значительно стабилизирован вследствие делокализации ’
неподеленной пары электронов на нитрильной и фенильной группах
в соответствии с валентными схемами I—III. Такая делокализация
может быть существенной только в том случае, если анион имеет
плоскую (или очень близкую к плоской) конфигурацию при а-угле- ..
родном атоме (разд. 9-6,А).
Упражнение 12-17. Нарисуйте атомно-орбитальные модели аниона а-фенилпро-
шюнитрила, имеющего (а) плоскую н (б) неплоскую конфигурацию при а-углерод-
ном атоме. Покажите, каким образом плоская конфигурация может привести к бо-
лее эффективному л-связыванию, чем неплоская конфигурация (см, разд. 5-5
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ 40f
Вопрос о том, к какому результату приведет реакция плоского
карбаниона, полученного из первоначально асимметричного соеди-
нения, с электрофильным агентом, т. ё. образуются ли продукты с
, обращенной или с сохраненной конфигурацией или их рацемическая
смесь,; по-видимому, в значительной степени зависит от природы
растворителя.
Растворители с высокой ионизирующей способностью, например
диметилсульфоксид, приводят, Как было показано, к рацемическим
продуктам, тогда как растворители с низкой ионизирующей способ-
ностью, образующие водородные связи, например mpem-бутиловый
спирт, приводят к продуктам, в которых конфигурация преимуще-;
ственно сохраняется. По-видимому, в днметилсульфоксиде карба-
нион является сравнительно долгоживущим и эффективно отделен
от ассоциированного с ним катиона молекулами растворителя. До
того как произойдет атака электрофила, он имеет достаточно вре-
мени для симметричной сольватации. Естественно, что при этом об-
разуется рацемический продукт.
СН, сн3
I I нх |
O=S--- с©--'- s=o —ь—с—н .
Ан8 /х сн3 1
симметрично сольватированный рацемический
плоский карбанион продукт
В трет-бутиловом спирте карбанион, по-видимому, тесно ассо-
циирован со своим катионом и сольватирован вследствие обраэова-
вания водородных связей с фронтальной стороны. Такое состоя-
ние карбаниона делает весьма вероятным отщепление водорода от
связанных водородными связями молекул растворителя, что должно
привести к продуктам с сохраненной конфигурацией. Хорошим при-
мером может служить катализируемая основанием реакция изо-
топного обмёна водорода на дейтерий приведенного ниже типа:
R,
R; -“Р—D
Rj
ф © :
К ОС(СН,)э
R2 R3
несимметрично сольватированный
плоский карбанион
R‘
+
R,
сохранение
конфигурации
|| (СН8)3С-ОН
Ф0
К ОС(СН3)3
С(СНЭ)3
402
ГЛАВА 12
Тенденция к обращению конфигурации проявляется в сравни- I
тельно кислых полярных растворителях, (таких, #ак этиленгли- |
коль и метанол), где атаке с тыла благоприятствует экранирование 1
фронтальной стороны карбаниона уходящей группой аналогично
тому, как это происходит при реакциях типа S^l (разд. 11-11). ]
Упражнение 12-18. Обращение, сохранение конфигурации или рацемизация ;
будут стереохимическим результатом приведенной ниже реакции декарбоксили-
рования при использовании в качестве растворителя: а) диметилсульфоксида с 'i
небо л ьшо й доб авко й трет -бу т н ло во го с п и рта, б) трет-а м и ло во го сп и рт а и в) во ды.
Объясните.
Rf
Ri л Л*
к® + со»
Дополнительные упражнения
12-19. Напишите уравнения реакций (уравняв коэффициенты), осуществления ко-
торых можно ожидать яри действии 1 моля «-амилнатрия па приведенные ниже
соединения (1 моль). Приведите соображения, которыми вы руководствуетесь,
делая выбор между несколькими возможностями.
а) вода
б) диэтиловый эфир
в) трет-бутил .хлор ид
г) н-амилиодид
Д) пропилен
е) алл ил хлорид
ж) уксусная кислота (добавляемая медленно к н-амнл натрию)
з) уксусная кислота (к ней медленно добавляется я-амилнатрий).
12-20. Сообщалось о следующих Экспериментально полученных данных:
1. трет-Б ути л хлор ид был прибавлен к металлическому литию в сухом эфире
при 25°C. Произошла энергичная реакция, сопровождающаяся выделением газо-
образного углеводорода. После того как весь металлический литий прореагиро-
вал, смесь была вылита на сухой лед. Оказалось возможным выделить (с неболь-
шим выходом) единственный продукт кислого характера — 4,4«диметилпентано-
вую кислоту.
2. mpem-Бутилхлорид был добавлен к металлическому литию в сухом эфире
при —40 °C. После того как весь литий прореагировал, реакционная смесь была
карбопиэована и образовалась с хорошим выходом триметилуксусная кислота.
3. mpem-Бутнлхлорид был добавлен к металлическому литию в сухом эфире
при —40 С. После того как весь литий вступил в реакцию, этилен барботировали
через реакционную смесь при —40 °C до тех пор, пока не прекратилась реакция с
его участием. Карбонизация этой смеси дала с хорошим выходом 4,4-диметилпен-
та новую кислоту.
а) Подробно проанализируйте полученные результаты и предложите меха-
низм происходящих реакций (насколько это окажется возможным).
б) Можно ли ожидать аналогичных реакций для хлористого метила? Объяс-
ните.
в) Можно ли ожидать, что в случае 3'образуется сколько-нибудь значитель-
ное количество 6,6-димстилгентаповой кислоты? Объясните.
12-21. Укажите, какие продукты образуются в каждом из приведенных щнке
гриньяровских синтезов (до и после гидролиза). Приведите для каждого случая
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
403
наши соображения или известные вам аналогии.
a) CHgMgl НСО2С2Н; —>•
6) СН3СН2СН (MgBr) СН3 + диизопропилкетон —*
в) CH3CH,MgBr+CS2 —>-
г) CH5CH3MgBr+NHs —+
12-22. Укажите пути синтеза приведенных ниже соединений из данных исходных
гсществ таким образом, чтобы по крайней мере в одной стадии участвовали метал-
лоорганические соединения.
а) (СН3)3С—D из (СН3)3СС1
б) СН3С^С—СО3Н
изСН^СН .
СН3
в) СН3—А—СН.,1 из (СНЭ)4С
Ан3
сна
г) СНЭ—L-CH (СНв)з
cLh
(три способа)
е) СНЭ-С—СН8СН3СН3СНаОН
<1н3
из (СН3)3ССН2С1
ж) гексадиец-i,5 из пропилена
12-23. Действие амида калия на неопептилиодид приводит к 1,1-диметилциклоцро-
i^iну. 2,2-Диметил-1,3-дииодпропан с металлическим цинком в этаноле дает тот
-г.е продукт. Приведите ваши соображения относительно сходства механизмов этих
лпух реакций. Что должно произойти, по вашему мнению, при действии цинка
в этаноле на 2,3-дибромбутан? Напишите механизм этой реакции.
12-24. Приведенные ниже уравнения описывают «возможные» грииьяровские син-
тезы. Обсудите каждое уравнение и решите, будет ли реакция идти удовлетвори-
тельно. Приведите ваши соображения и для тех случаев, когда реакция не должна
давать хороших результатов, укажите ожидаемые продукты или, когда это необ-
ходимо, напишите; «Реакция не идет».
а) трет-бутилмагнийбромид-]-диизобутилкетон->->трега-бутилдиизобутил-
карбинол
б) неопентил магн и йбромид+ди-трв/п-бутил кетон-»- —>неопентилди-трет-бу-
тилкарбинол
в) метилмагнийиодид-]-бутирилхлориД“> -»-метил-я-нропилкетон
СН3
г) метилмапшйиоднд+СНаСН = N—СН3 —> —> СН3СН2—г!—СН$
Mg НгС=о
д) 2-бромэтилацетат —* реактив Гриньяра -»- 3-оксипропилацетат
эфир
е) тргт-бутилмагнийхлорид+триметилацетилхлорид->-»-триметилацеталь-
дегид
ж) аллилмагнийхлорид+бромистый этил->-пентен-1
12-25. На рис. 12-4 приведем ЯМР-спектр аллилмагнийбромида в;эфире. Основы-
ваясь на материале, изложенном в разд. 6-3,В и 6-6, и имея в виду, что сигнал СН2
в этилмагнийбромиде расположен на 38 Гц в более сильном поле, чем сигнал тетра-
метилен лана, нарисуйте ЯМР-спектр, ожидаемый для CHa=CHCH2MgBr. Обсу-
дите возможность согласования этого спектра со спектром, приведенным на
рис. 12-4 (используйте, в частности, материал, приведенный В разд. 2-6,А — Е).
Рис. 12-4. ЯМР-спектр аллилмагиийбромида в растворе диэтилового эфира при
60 МГц с татраметилсиланом в качестве ста адарта.
Зашкаленные полосы принадлежат диэтиловому эфиру; сигналы, обозначенные СеН(0, от-
носятся к гексадиену. 1,5 (продукту конденсации).
/2-Ж Какие продукты образуются в каждой из приведенных ниже реакций (до
и после гидролиза).
.?)
(CH3)2Cd
Эфир
-70’0
Zn_ бензол —эфир
б) Н2С = О + (СНэ)2СВЮЭаСаН5
кипячение с обратным
холодильником
сня
| I.H'C,H(Li
в) CsH;C-CsN ----------и
] эфир
2,СО.
н
1. Mg, эфир
г) НСазССНаВг-----------
2. НС =ССНгВг
1. Mg. эфир 2. и!( —70 СС
д) (СНэ)вСВг --------г -----:-----и
е) £ CH2MgBT + CH3-^<f ^j-CHjBr ~
>.— 1 - ' > эфир
ж) СНзОл
8фир
12-27. Если ди изо пр опил кетон (0,1 моля) добавляют к эфирному раствору атил-
магнийбромида (1 моль), то выход продукта присоединения составляет больше
90% (считая на введенный в реакцию кетон); при добавлении раствора, содержа-
щего 0,1 моля этилмагннйбромида, к 1 молюдинзопропилкетона на 35% происхо-
дит восстановление, на 15% — енолизация (считая на введенный в реакцию реак-
тив Гриньяра) и только на 50% — присоединение. Какому строению реактива
Гриньяра в большей степени соответствуют эти результаты ~ обычной формуле
RMgX или RoMgX-Mg (разд. 12-3)? Объясните.
ГЛАВА
13
СПИРТЫ И ПРОСТЫЕ ЭФЙРЫ
Спирты ROH и простые эфиры ROR можно рассматривать как
продукты замещения водородных атомов воды. Из реакций спиртов
интерес представляют, с одной стороны, такие, которые протека-
ет по связи О— Н без затрагивания связи С—О или органического
радикала, и,, с другой стороны, процессы, при которых происходит
разрыв связи С—О или изменение в органическом радикале. Можно
ожидать, что реакции, затрагивающие связь О—Н, окажутся
входными с соответствующими реакциями воды.
В простых эфирах отсутствуют связи О—Н. Большинство ре-
акции, в которые они вступают, затрагивают замещающие группы.
Циклические эфиры с небольшими циклами обнаруживают повышен-
ную реакционную способность вследствие напряжения, существую-
щего в циклах; как будет показано, такие эфиры являются цен-
ными промежуточными соединениями в органических, синтезах.
К числу характерных реакций спиртов, в которых участвует
связь О-^Н, относится образование солей (алкоголятов) и сложных
эфиров. При каждой из этих реакций связь С—О остается незатро-
нутой.
Образование солей:
CHsoH+HBr до: сна—о®- н Вге
2СН3ОН-;-2Ха 2СНа - 0®Na® ф На
Образование сложных эфиров:
О а О
li н® I!
CSHSOH+CHS—С-ОН СгН^О—С~СН3-)-Н2О
406
ГЛАВА 13
Типичными реакциями, происходящими с*участием связи С—О
и органического радикала, являются 'образование алкилгалогени-
дов и окисление.
Образование алкилгалогенида:
(СНа)9С—OH4-HCI (СНэ)зСС1-рНгО
Окисление:
его,
(СН3)2СНОН------>- (СН3)аС = О-}-Н2О
Очевидно, что простые эфиры лишь в ограниченной степени всту-
пают в реакции приведенных выше типов и в целом их химия зна-
чительно менее разнообразна, чем химия спиртов. Это обстоятельство
имеет свою положительную сторону — простые эфиры широко ис-
пользуются в качестве растворителей и реакционной среды для са-
мых разнообразных органических реакций, что было показано в
гл. 12 на конкретном примере реактивов Гриньяра.
13-1» Номенклатура карбонильных
соединений
Карбонильные соединения будут иметь весьма важное значение
при рассмотрении синтеза и реакций спиртов и потому'желательно
ознакомиться с номенклатурой этих соединений. Поскольку способы^
наименования карбонильных соединений следуют правилам, описан-
ным выше для других типов соединений, наиболее широко исполь-
зуемые системы номенклатуры приводятся в табл. 13-1 без дальней-
шего обсуждения. Нередко встречаются несистематические назва-
ния карбонильных соединений, например окись мезитила для
(СН3)гС—СНСОСНд (4-метилпентен-3-он-2) или пинаколин для
(СНз)зССОСНя (3,3-диметилбутанон-2); они будут приводиться в
ходе изложения.
Упражнение 13-1. Напишите структурные формулы для каждого из приведен-
ных ниже соединений;
а) гексаналь
б) дивиннлкетон
в) фенилацетилхлорид
г) З-фсннлбутеи-2-аль
д) циклогексилдиметилкарбичилкар-
бонилбромид
е) бицикло-12,2,1]-гептанон-2
Упражнение 13-2. Назовите приведенные ниже соединения в соответствии с сис-
темами, рассмотренными в табл. 13-1,
а) СН3СН=СНСНО б) N = CCHaCOCl в) СсН5СОСН2СОС6Н5 г) CFaCOCF„ д) СН3СН(ОН)СН(СН3)СНО е) (CH3)sC(CH2)3CHCOBr
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
407
Таблица 13-1
Системы номенклатуры карбонильных соединений
Альдегиды R —
Ml
Формула Название по системе 1UPAC (наиболее длинная ‘ неразветвленная пепьа + +суффикс -дли) Название, при построении которого соединение рас- сматривается как производ- ное карбоновой кислоты (т- е- карбоксальдегид)
1ЦС = О С1СН2СН2СНО снесено 4нз С6Н6СН2СНО Метаналь З-Хлорпропаналь 2*МетйЛпропеналь 2-Фени л этана ль Формальдегид З-Хлорпропиональдегид Метакролеин (метакрил- альдегид) * 6 Фенилацетальдегид
Кетоны
• !к
>С = О
R'z
Формула Название по системе 1UPAG (наиболее Длинная иеразветвленная цепь3 + 4-суффпкс -он} Название, при построении которого соединение рас- сматривается как замещенный кетон
(CHS)SC=O О Пропанон Диметилкетон (ацетонв)
СН8ССНгСН = СНа о dZ^“ С-СНа <~~>О Пентен-4-он-2 Мети ла л л и л кетон
фенил эта нон Циклогексанон Метилфенил кетон (ацето- фенон ®)
а Имеется в виду Наиболее длинная неразпетвлепная цепь, в которой содержится
функциональная Группа,
6 Пропеновую кислоту обычно называют акриловой кислотой, a Й-метилиропеновую
кислоту — -четакриловой кислотой,
в Названия, ври построении которых кетопы рассматриваются как производные кар-
бочояых кислот, употребляются лишь в отдельных случаях. Такого рода названия осно-
вываются на синтезах (реальных' или воображаемых! кстояов по реакциям типа
RCO,H + ft-COsH —с RCOR' + СО, + И,О.
408
ГЛАВА 13
Продолжение табл. 1S-1
. /О '
Ацил галоген иды R —Се"
^Х
О
Формула
Название по системе IUPAC
скаиболее длинная
нерязветвлейиая цепь 2 4-
+ суффикс -w + название
галогенида)
Название, при построении
которого соединение рас-
сматривается как производ-
ное карбоновой кислоты
(т.е. карбонйлгалогсиид)
СН3—С—С1
о
Этаноилхлорид
Ацеталхлорид
(СН,)аСН— С—Вг
О
2-Мётил пропанойлбромйд
Изобутир илбромид
СН,=СН—СНг-С-С1
З-Бутеноилхлорид
Винила Цетилулорвд
О
С—Вг
Циклопропилметаноял-
бромид
ЦйклопропанкарбОнил-
бромид
13-2. Физические свойства спиртов. '
Водородная связь i
Сравнение физических свойств спиртов со свойствами углево- Д
дородов близкой молекулярной массы обнаруживает ряд резких А
различий, особенно для низших членов ряда. Спирты значительно
менее летучи, имеют более высокие температуры плавления и лучше ; !
растворимы в воде, чем соответствующие углеводороды (табл. 13-2);
однако эти различия прогрессивно уменьшаются по мере возраста- А
ния молекулярной массы.
Эти различия физических свойств связаны с высокой поляр-
иостью гидроксильной группы, которая, находясь в углеводород- .
ной цепи, определяющим образом влияет на полярный характер мо-
лекулы. Результатом этого является значительное притяжение
между молекулами, Особенно ярко выраженное в твердом й Жид- ; '
ком состояниях. Оно приводит к ассоциации молекул спирта за счет у
взаимодействия положительного атома водорода одной гидроксиль-
ной группы с несущим соответствующий отрицательный заряд кис-
лородом, другой гидроксильной группы,
6© ь© t© 6© 6© ь© 6© s©
о—н-—о—н-
R А
водородная снт
R
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
409
Таблица 13-2
Сравнение физических свойств спиртов и углеводородов
Спирт Углеводород Молеку- лярная масса Т» кип.. ГС Т. пл., °C
СН3ОН : 32 65 -98
сн3сн3 30 —89 —172
СН3СН2ОН 46 78,5 —П7.3
СН3СНаСНз 44 -е.42,2 —189,9
СН3СНаСНяОН 60 . 97,2 —127
СН3СН2СН2СН3 58' —0,6 —135
СН3(СНа)3СНаОН 88 138 —79
СН3(СН2)4СНЭ : 86 69 —95
СН3(СНг)йСН2ОН 158 228 6
СН3(СН2)9СН3 156 196 —26
Такой тип ассоциации носит название водородной связи, и хотя
прочность таких связей гораздо меньше, чем прочность большин-
ства обычных химических связей, она все же довольно существенна
(5—10 ккал на связь). Отсюда ясно, что более высокие температуры
кипения спиртов по сравнению с температурами кипения соответ-
ствующих алкилгалогенидов, простых эфиров или углеводородов
обусловлены необходимостью разрыва водородных связей при пере-
ходе молекул в газовую фазу, для чего требуется дополнительная
энергия. С другой стороны, ассоциация за счет водородных связей
может рассматриваться как существенное увеличение молекулярной
массы, что приводит к уменьшению летучести.
Упражнение 13-3. цкс-циклопентандиол-1,2значительно более летуч (т. кип.
1243Спрн29мм), чемтрпнс-циклопевтандиол-1,2(т. кип. 136°Спри 22 мм). Объяс-
ните это различие.
Спирты с низкой молекулярной массой хорошо растворимы в во-
де, что понятно, если учесть возможность образования водородных
связей с молекулами воды (сама вода ассоциирована в очень боль-
шой степени). В метиловом спирте гидроксильная группа составляет
почти половину массы молекулы; не удивительно поэтому, что ме-
6© в© ед ед
------О—Н -О-Н- О—Н—----------
[-------------------------------------I-I
Н R Н
танол смешивается с водой во всех отношениях. По мере увеличения
размера углеводородной цепи в спирте вклад гидроксильной груп-
пы в молекулярную массу прогрессивно уменьшается и соответст-
410
ГЛАВА 13'
Рис, 13-1, Зависимость температур плавления, температур кипения и раствори-
мости в воде первичных спиртов с неразветвленной цепью (С,1Н2л+еО) от числа
атомов углерода (л).
венно понижается растворимость в воде (рис. 13-1). Физические
свойства спиртов с высокой молекулярной массой оказываются уже
очень сходными со свойствами соответствующих углеводородов
(табл. 13-2).
13-3. Спектральные свойства спиртов.
Водородная связь
Связь кислород — водород гидроксильной группы дает харак-
теристическую полосу в II К-спектре, и в соответствии с ожида-
емым на это поглощение оказывает существенное влияние водород-
ная связь. Например, в газовой фазе (где водородная связь практи-
чески отсутствует) в, ИК-спектре этанола имеется сравнительно
резкая полоса поглощения при 3700 см-1, указывающая на наличие
свободной (неассоциированной) гидроксильной группы (рис. 13-2, о).
Наоборот, эта полоса с трудом различима (при 3640 см-1) в спектре
10%-ного раствора этанола В четыреххлористом углероде
(рис. 13-2, б). Однако в этом спектре присутствует относительно
широкая полоса-при 3350 см-1, характерная для гидроксильной
группы, связанной водородной связью. Сдвиг частоты приблизи-
тельно на 300 см-1 неудивителен, поскольку водородная связь ос-
лабляет связь О—Н; поэтому поглощение должно происходить при
более низкой частоте. Уширение полосы обусловлено тем, что гид-
роксильные группы ассоциированы в агрегаты различного размера
и формы; вследствие различных типов ассоциаций существует боль-
Длина волны, мк
3 4 5 Б 6 7 а 9 10 12 14
> Г' j "1 ' J 1 “~Г 1 I “ i 'Г
Пропускание,
3600ЗЮТ №0(3 2000 2000 1800 1601) I4UQ J20Q . ЮС О iSUQ
Частота, см-' _____
Рис. 13-2. НК-спектры этанола в газовой фазе (я) и 10%-ного раствора этанола
В четыреххлористом углероде (б).
412 : ГЛАВА 13
шое разнообразие видов водородной связи, и поглощение приводит к :]
спектру, состоящему из тесно расположенных полос, обусловленных
ОН-группами. i
В очень разбавленных растворах спиртов в неполярных раство-
рителях образование водородных связей минимально; однако по /
мере увеличения концентрации все большее число молекул Стано-
вйтся ассоциированным и интенсивность полосы, обусловленной ас-
социированной гидроксильной группой, возрастает за счет полосы ж)
свободного гидроксила. Частота полосы, связанной с ассоциацией,'
может служить мерой прочности водородной связи. Чем больше
сдвинута частота ассоциированного гидроксила в сторону низких
частот относительно положения свободной гидроксильной группы,
тем прочнее водородная связь. Как будет показано в гл. 16, гидрок- -
/ лО \
сильная группа в карбоновых кислотах I J образует более ['
прочные водородные связи, чем в спиртах, и Поглощает соответствен^ J
но при более низких частотах (приблизительно на 400 см-1).
Инфракрасные спектры некоторых 1,2-диолов (гликолей) интё- ;
ресны в том отношении, что в них обнаруживается поглощение,
обусловленное внутримолекулярной водородной связью. Оно обычно
имеет вид сравнительно узкой полосы в области 3450—3570 см-1,
которая в противоположность поглощению межмолекулярной во- <
дородной связи не изменяет своей интенсивности с изменением кон-
центрации. Рассмотрение молекулярных моделей показывает, что,
за исключением соединений, где стереохимические отношения не-
благоприятны, ассоциация между соседними гидроксильными труп- ,•
нами в пределах одной молекулы геометрически легко осуществима. г
Типичным примером может служить ^цс-циклопентандиол-1,2 :
цис - Пи К л оп с нт ан диол-1 т 2
Упражнение /3-4, Какого ИК-паглощений, обусловленного гидроксильной
группой, можно ожидать для трек-цикл обутанд иол а-1,2 и б у тан диол а-1,2 (а) в
очень разбавленном растворе, (б) в растворах умеренной концентрации и (в) в виде
чистых жидкостей?
Если учесть приведенное выше обсуждение влияния, оказывае-
мого водородной связью на инфракрасные спектры спиртов, то не
удивительно, что аналогичные эффекты имеют место и в ЯМР*
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ : 413
спектрах гидроксильных протонов в. спиртах. Так, химический сдвиг
протона гидроксила зависит от степени молекулярной ассоциации
за счет водородной связи и от прочности водородных связей. Хими-
ческий сдвиг протонов ОН сильно изменяется (за.исключением спир-
тов, образующих внутримолекулярные водородные связи) в зави-
симости от температуры, концентрации и природы растворителя.
При увеличении прочности водородной связи резонансный сигнал
появляется'при более слабых магнитных полях (химический сдвиг
относительно ТМС имеет бблыную величину). Так, химические сдви-
ги ОН-протонов простых спиртов (в виде чистых жидкостей) обыч-
но составляют 4—5 м. д. в более слабое поле по сравнению с тетра-
метилсиланом, но при уменьшении степени образования водородных
связей вследствие разбавления четыреххлористым углеродом ОН-
сигнал сдвигается в сторону более сильных полей. Для этилового
спирта различие сдвигов для чистой жидкости и сильно разбав-
ленного раствора в четыреххлористом углероде составляет 3 м. д.
Возникает вопрос, почему в ИК-спектрах наблюдается серия по-
лос поглощения, соответствующих свободным и связанным водо-
родной связью гидроксильным группам, тогда как в ЯМР-спектре
имеется лишь один сигнал, соответствующий протонам ОН? Ответ
заключается в том, что время жизни одной какой-либо молекулы в
свободном (неассоциированном) состоянии достаточно велико для
того, чтобы она могла быть обнаружена с помощью инфракрасного
поглощения, но слишком: мало для спектров ЯМР. Вследствие этого
можно видеть лишь усредненный резонансный сигнал ОН для всех
видов молекул, присутствующих в веществе (обсуждение ЯМР в
связи с процессами, протекающими во времени, разд, 2-6,Е и
13-5, А).
Упрпзкиенче 73-5., Предложите структуру для соедвиёнкя с молекулярной,
формулой С4Н6О. ИК- и ЯМР-спектры которого изображены на рйс. 13-3, а.
Приведите ваши соображения. Сделайте то же для соединения С3НвОг, спектры
которого приведены на рис. 13-3,5 (стр. 418).
13-4. Получение: спиртов
Многие, из обычных лабораторных методов получения спиртов
обсуждались в других главах, и, чтобы избежать повторений, они
не будут рассматриваться здесь подробно, К их числу относятся гид-
ратация : (разд- 74) и гидроборирование (разд. 7-7) алкенов, при-
соединение хлорноватистой й бромнрватистой кислот к алкенам
(разд. 7-4) и алкадиенам (разд. 9-6,Г), S^jl- и 5^2-гидролиз алкил-
(разд. 11.-9) и алкенилгалогенидов (разд. 11-17), присоединение ре-
активов'Гриньяра к карбонильным соединениям:(разд. 12-4,Б) и вос-
становление карбонильных соединений (разд. 14-6). Все эти методы
суммированы в табл. 13-3. ‘ ' |: ?
Таблица 13-3
Реакция
Общие методы получения спиртов
Примечание
1. Гидратация алкенов
нФ. н.о
RCH - СН г----R —СНСН3
I
ОН
HtSO„ HSO
GH3CH =.С(СН9)г--------> СНэСН2С(СН3)а
2-кетйлбутеп-2 I
ОН
m pern-амиловый
спирт (7 4%)
2. Гидроборирование алкенов а
I. в,н,
RCH=CH2 —RCHaCH3OH
а. нго.
сГ
НктияЦИКЛО-
гексен
tKpatK-1 -мегилцикло-
гехс анол
(90%)
Легкость получения спиртов убывает в ряду
третичный > вторичный > первичный; легкость
дегидратации следует такому же порядку. Про-
цесс часто осложняется перегруппировками.
Направление присоединения соответствует пра-
вилу Марковникова (см. разд. 7-4, 13-4 и
13-6, Б)
Ди бор ан наиболее удобно получать in situ
из NaBH4 и BF3 (разд. 7-7). Триалкилбор мож-
но окислять действием Н2О2 без предваритель-
ного выделения. Присоединение происходит
против правила Марковникова; реакция стерео-
специфична — происходит t; wc-присоединение к
двойной связи с наименее пространственно за-
трудненной стороны н окисление перекисью
водорода происходит с сохранением конфигу-
рации
3. Реакции металлоорганических соединений с карбонильными соединениями
а. Получение первичных спиртов из формальдегида
/ MgCI+CH2=0 СН2ОН
Циклогексил- форм д ль- циклогекенлкар-
магии йхлорид дегид бннэл (69%)
См. гл, 12
Формальдегид и RMgX дают первичные спир-
ты (за исключением тех случаев, когда R—арил)
б. Получение вторичных спиртов из альдегидов
(СН3)2СНСН0+CH3Mgi —+ (CHa)gCHCI-ICHa
изомас ляный |
альдегид ОН
иетилизопропилкар-
биаол (56%)
в. Получение третичных спиртов из кетонов
и :' |.>.!Гх1.1:ЯЧЦ ЯВЛЯ-
ЮТСЯ еполнзация карбонильного соединения и
восстановление RMgX; они приобретают суще-
ственное значение в случае пространственно
затрудненных кетонов и объемистых гриньяров-
ских реактивов "(разд,. )2-4,Ж)- При получении
третичных спиртов для предотвращения дегид-
ратации реакционную смесь гидролизуют хло-
ристым аммонием. Получение высокоразветв-
ленных третичных спиртов осуществляется с
большим успехом при применении литийорга-
нических соединений вместо RMgX (разд. 12-5)
О
P>G-CH3 4. CHjMgl
Ы етилциклоп р о пил кетон
СП3
I J>-C-OH
сн3
динети лцнк лопроп илкарби ней
' (687.)
г. Получение третичных спиртов из сложных эфиров, ацилгалогенидое
и ангидридов
CeH^CO^Hs+CsH^gBr^CCeH^C-OH
этилбензоат фенплмаг.чий- -грифе вилка рби-
бремнд нол (93%)
4, Взаимодействие реактива Гриньяра с циклическими простыми эфирами
СН3СН - СНа+CeHbMgBr —>СН3СН—СН2СвНе
он
окись п р опилена 1 - фенил пр о па но л- 2
(60%)
5. Окисление реактивов Гриньяра
RMgX ROH
Применение метода ограничено трех- и четы-
рехчленными циклами. Реакция относится к за-
мещению 5^2-типа (разд. 12-4, Е). Окись эти-
лена часто используется для увеличения длины
цепи на два углеродных атома в одну стадию
См. разд. 12-4,Б
Продолжение табл. 13-3
Реакция
6, Восстановление карбонильных соединений гидридами металлов
а. Получение первичных спиртов из альдегидов, кислот, ацилгалогенидов
и сложных эфиров
LiAiH.
СН3СН = СНСНО ——>СН3СН=СНСН,ОН
Эфир 1
кротоновый альдегид кротиловый спирт (85%)
СН-ОН
Примечание
Превосходные результата дает использование
1лА1Н4 (разд. 14-6, А), обладающего значитель-
ной селективностью й не восстанавливающего
обычно связь С=С. Натрийборгидрид „ NaBHt
более селективен и не восстанавливает карбо-
нильной группы в кислотах и их производных.
Он может также использоваться в водных и
спиртовых растворах, тогда как для LsA1H4
это Исключено
циклопропанкарбоновая кислота
циило пр on и л ка рбинол
i77^f
б. Получение вторичных спиртов из кетонов
JLiAlHj
а<рир
ОН
ариклобутанон
циилобутаиол (90%)
7. । Восстановление циклических простых эфиров гидридами металлов
LiAiH,
-----ьС6Н5СНСН3
эфир I
СеН4СН—СИ
О
окись стирола
8. Каталитическая гидрогенизация карбонильных соединений
Ni-Репея, Н,
сс-фенилзгидовый спнрт
/-—ч NL Ренея
/ у- СОСНз------------------>
\-----/ Н2. 53 ат
3 -ци клогекси лметал-
кетон
Наиболее широко используется в случае
эпокси со единений. Направление раскрытия цик-
ла таково, что Н.-6 из LiAIH4 атакует наиме-
нее затрудненное положение. В присутствии
А1С!3 направление присоединения изменяется,
приводя к ^-фенилэтиловому спирту
Каталитическое восстановление неселективно
и приводит к восстановлению /С—(разд.
14-6; ср. с методом 6)
- С0СН3
J 120 СС, 10Б ат
14 № 1540
цн к логексилмет ял кар-
бинол (96%)
Восстановление альдегидов и кетонов по Меервейну—П°нндорфу—
Оипенаузру—Верлею
А1[(СН(),СНО],
СН3СН=СНСНО+(СНз)2СНОН — .ТТГ
кротоновый альдегид (—CH(COCHj)
СН3СН =снсн»он
кротиловый спирт
(«0%)
10. Получение 1,2-гликолей из алкенов
Н®х
н/э
тр п нс -циклогексан-
диол-1,2
- цик л иге кс а н лиоп-12
11, Гидролиз алкил- и аллилгалогенидов
12. Гидролиз сложных эфиров
13. Альдольная конденсация и реакция Реформатского
14, Расщепление простых эфиров
а См. Brown Н. С., Hydroboration, Benjamin, New York, 1962.
См. разд. 14-6, А. Восстанавливающим аген-
том обычно служит изопропилат алюминия;
образующийся ацетон удаляется отгонкой,
вследствие чего равновесие сдвигается вправо.
Двойные связи углерод—углерод не затраги-
ваются
Окись, образующаяся из алкена и надмуравь-
иной кислоты (в виде Н2О2+НСО2Н), расщеп-
ляется присутствующей в сфере реакции НСО2Н,
образуя транс-риал (разд, 13-12, Б и 7-8,Б),
С другой стороны, может быть применена четы-
рехокись осмия в трет-бутиловом спирте, дей-
ствие которой приводит7 к цдо-диолу (разд.
7-8,Б). Перманганат калия в нейтральной сре-
де также можно использовать для получения
цис- гликолей
См. гл, II
Находит ограниченное применение, поскольку
сложные эфиры обычно получают из спиртов
Приводит к fi-оксикарбонильным соединениям
(разд. 12-6 н 15-2)
См. разд. 13-10
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ 419
Некоторые из реакций, приведенных в табл. 13-3, лежат в основе
промышленных процессов. Например, этанол производится в боль-
ших количествах путем гидратации этилена; используется избыток
пара, действующего под давлением и при температурах около 300 °C
в присутствии фосфорной кислоты
300 °C, HjPO,
, СН3=СН2+ НаО > СН8СН2ОН
При stqm получают разбавленный раствор этанола, который
концентрируют перегонкой до кипящей при постоянной температуре
смеси, содержащей 95,6% этанола (по массе). Удаление оставшихся
нескольких процентов воды с целью получения «абсолютного» спирта
обычно проводится либо химическим путем, либо перегонкой с бен-
золом, при которой преимущественно удаляется вода. Этанол полу-
чают также в больших количествах путем брожения, однако этот
способ в меньшей степени пригоден для промышленного использо-
вания, чем гидратация этилена.
Изопропиловый и mpcm-бутнловый спирты также получают в
промышленности путем гидратации соответствующих алкенов. Про-
мышленный синтез метилового спирта основан на гидрогенизации
окиси углерода. Несмотря на то что эта реакция имеет выгодное зна-
чение Д/7, равное —28,4 ккал, для ее осуществления требуются вы-
сокие давление и температура, а также соответствующий катализа-
тор; наибольшая степень превращения достигается при использо-
вании катализатора окись цинка — окись хрома. Различные методы
синтеза других спиртов путем восстановления карбонильных
соединений обсуждаются в разд. 14-6,А.
400 °C. 200 ат
СО-|-2Н2--------► СН3ОН ДЯ = —28,4 ккал
ZnO — СгО,
ХИМИЧЕСКИЕ РЕАКЦИИ СПИРТОВ
13-5. Реакции с участием связи
О — И спиртов
А. Кислотные и основные свойства
Во многих важных реакциях спиртов участвует только связь
кислород — водород, а связь углерод — кислород остается неза-
тронутой. Важным примером такого рода реакций служит образо-
вание солей при действии кислот и алкоголятов при действии осно-
ваний.
Спирты, подобно воде, амфотерны и обычно не являются нк
сильными основаниями, ни сильными кислотами. Константа кислот-
ной диссоциации (Ад) этанола составляет около 10-1Э — несколько
14*
420 / ГЛАВА 13
меньше, чем уводы. Этанол может быть превращен в алкоголят дей- ?
ствием соли более слабой кислоты, например аммиака (Хд«10“®8),:
но обычно удобнее использовать натрий или гидрид натрия, реакции
с которыми происходят бурно, но в большей степени поддаются .У
контролю, чем аналогичные реакции с водой.
CaHsOH+Na®NHf C2H6O°Na®+ "
амид этилат
натрия натрия
C;.H,O.H-L.\'a^He —С2НлОе.\'а®---Н2 j
Порядок, в котором убывают кислотные свойства спиртов, имеет ;
следующий вид: первичные > вторичные > третичные; трет-бу--
тиловый спирт, таким образом, существенно менее кислое вещество, ;
чем этанол. Анионы спиртов называют алкоголят-ионами (алкоксид-
ионами, алкокси-анионами).
СН3О9 С2Нй09 (СНОСНО0 (CHs)sC09
метилат этилат изопропилат mpem-бутилат
Спирты представляют собой основания, сравнимые по силе с
водой; при действии сильных кислот они превращаются в более
или менее устойчивые соли. Примером, такой реакции служит вза-
имодействие метанола с бромистым водородом, приводящее к обра-
зованию бромида, метилоксония
н»
СН3:О:Н + НВг 5=* СН/рГн + Вг®
бромид метилоксония
Реакция бромистого водорода с водой происходит аналогичным
образом
Н:0:Н 4 НВг
Н® ©
Н:О:Н + Brw
бромид гидроксония
Изменения температуры плавления смеси бромистого водорода
Рис. 13-4. Температуры плавления смесей метзноЛа' и бромистого водорода.
СПИРТЫ И ПРОСТИТ ЭФИРЫ
421
Рис. 13-5. ЯМР-спектры этанола в отсутствие1 кислоты (а) и в присутствии сле-
дов кислоты (б).
вывод о существовании продукта' взаимодействия этих соединений,
имеющего состав 1 : 1. Температура плавления достигает макси-
мума при 50 мол. % каждого из: компонентов.
Амфотерная природа спиртов обнаруживается также в их ЯМР-спектрах.
Протоны гидроксилов в чистом спирте претерпевают быстрый межмолекулярный
itdmch. в результате автопротолиза в..соответствий с уравнением
CHjCHj-dt---и—о;
Н сн2сн
: -О
CHjCHz-O: Н + CHjCHj-O :
Обычно такой обмен происходит далёко не мгновенно; действительно, в секунду
происходит менее 10 актов обмена, как это следует из ЯМР-спектров чистого спир-
та, например этанола (рис. 13-5, я), где сигнал гидроксильного протона является
у ширен н мм триплетом. Это означает, что протон:остается связанным с кислородом
и течение времени, достаточного для спин-спинового взаимодействия с протонами
соседней группы СНа (см. также разд. 2-5, В). Увеличение скорости обмена может
быть вызвано как повышением температуры, так и присутствием сйедо'в'сйльйой
42^ Ч ГЛАВА 13
кислоты или основания, что ярко проявляется в ЯМР-спектре; протоны гидро-
ксила и а-водороды более не взаимодействуют друг с другом и спектр существенно
упрощается (рис. 13-5, б). В этих условиях межмо л окулярный обмен гидроксиль-
ных протонов происходит со скоростью, достаточной для того, чтобы взаимное
магнитное влияние протонов гидроксила и «-протонов было полностью усреднено
и оказалось в итоге равным нулю.
Б. Образование простых эфиров
Образование алкоголят-ионов имеет важное значение как способ
генерирования сильного нуклеофила, легко вступающего в SN2-
реакции. В то время как этанол лишь очень медленно реагирует с
иодистым метилом, образуя метилэтиловый эфир, этилат натрия в
спиртовом растворе реагирует с большой скоростью.
медленно
СН31+СаНвОН :-------> СНа0С»Н»4-Н1
быстро
CHJ+CaHBOwNa®-------► CHsOCsHe+NaI
Так, реакция алкоголятов с алкилгалогенидами или алкилсульфа-
тами является важным общим методом получения простых эфиров,
известным под названием синтеза Вильямсона. Осложнения могут
возникать вследствие того, что увеличение нуклеофильности, свя-
занное с превращением спирта в алкоголят-ион, всегда сопровожда-
ется еще большим увеличением способности к отщеплению по ме-
ханизму типа Е2. Взаимодействие алкилгалогенида с алкоголят-ио-
ном может, таким образам, привести преимущественно как к реак-
ции замещения, так и к реакции отщепления в зависимости от тем-
пературы, структуры галогенида и алкоголят-иона (разд. 11-13).
Например, если хотят получить метилизопропиловый эфир, то наи-
лучшие выходы могут быть достигнуты при использовании йодисто-
го метила и изопропилат-иона, а не изопронилиодида и метилат-
иона, так как при последнем сочетании реагентов доминирует от-
щепление Е2-типа.
СН31-НСН3)2СНО9 —”“-+ (СН3)аСНОСН3-Н°
(СН3)2СН1+СН3О° СН3СН=СНа + СНэОН + 1е
mpem-Бутилат калия часто оказывается отличным реагентом
для проведения Е2-отщепления, так как, будучи сильным основа-
нием, он в то-же время имеет настолько большой объем, что вступа-
ет в реакции 5^2 с трудом.
Упражнение 13-6. Укажите, какие продукты образуются в качестве основных
в приведенных ниже реакциях:
a) (CHs)sCCHaI-|-CsH&09 X-
б) (CHs)3CBr-j- СН3О9 —
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
423
в) / ^-С1 + (СН3)ЯСО9 —►
г) ^~^-СН2Вг+(СН3)£СНСН2О°
д) (СН3)2СНСНйВг+СвН,СН£О9
• В. Образование сложных эфиров
Не только протоны, по и другие акцепторы электронных пар _
могут образовывать связь за счет неподелениой пары кислорода в
спирте. Одним из таких соединений является трехфтористый бор;
атом бора содержит на внешней электронной оболочке только шесть
электронов и проявляет поэтому значительную тенденцию к коор-
динации с неподелениой парой электронов и дополнению, таким
образом, внешней оболочки до октета.
CHj:O;H +
CHS;O':B:F
:F:’*
Процессы координации такого типа играют большую роль в механиз-
мах образования сложных эфиров из спиртов и хлористых ацилов,
карбоновых кислот и их ангидридов. Например, в ацилгалогенидах
углеродный атом карбонильной группы имеет частичный положи-
тельный заряд вследствие поляризации связей углерод — кислород
и углерод — галоген. Присоединение агента, способного, подобно
кислороду спирта, отдать свою электронную пару, происходит
весьма легко.
«О
СН3:О:Н
снэон
ф
Йф 6©
I
В комплексе I содержится как кислотная ( сн,—о—Н 1, так и ,
/ О® \
основная I I группы, вследствие чего протон переходит от одно-
\ 1 /
го атома кислорода к другому, образуя комплекс II, который далее
быстро теряет хлористый водород по реакции отщепления, в резуль-
424 ГЛАВА 13
_ : ! -
тате чего образуется сложный эфир.
о©
CHj-C-Cl
CH.OI-I
®
СН3О
CHj-C-O-CHj + НС1
Суммарная реакция напоминает замещение SN2; однако ее механизм
совершенно . иной — он представляет: собой процесс присоедине-
ния — отщепления.
Аналогичная реакция происходит между уксусной кислотой и
метанолом, однако в этом случае обратимость выражена в большей
степени.
О о9 он
[! „ I I
СНВ—С?—ОН-}-СНэ:О:Н СН#-С~ОН СН3—С—ОН
СНЭ-А-Н СН3—А
О
и
СН3—С—OCH3-J- Н2О
В отсутствие минеральной кислоты реакция и в прямом и в об-
ратном направлении -происходит медленно. Сильные кислоты ката-
лизируют образование сложных эфиров из спиртов в том случае,
если они присутствуют в сравнительно небольшой концентрации.
Причину такого «затруднения от избытка» нетрудно понять из рас-,
смотрения механизма реакции. Сильная кислота, подобная серной,
может отдавать протон, присоединяющийся к нелоделенным парам
электронов уксусной кислоты или метанола
CHa-C<f -t-HgSO* ^2: 4-HSO?
Х)Н ХОН
ill
н
± СНа—6®— H4- HSO?
СНа-О—H+H2SO4
Очевидно, что-образование бисульфата мётилоксония может при-
вести только к понижению реакционной способности метанола по
отношению к карбонильному атому углерода уксусной кислоты.
Однако этот антикаталитйческий эффект более чем уравновешивается
(при низких.концентрациях Н25О4) протонированием карбонильного
кислорода карбоновой кислоты III, так как последнее резко уве-
личивает способность карбонильного углерода к взаимодействию с
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
425
электронной парой.
®ОН ОН I * ОН
СН3-С-ОН w СН3-^-ОН +СНЭ—О-Н^СН8—С-ОН
ф J : I
сна—о—н
III ф
IV
Возникающее промежуточное соединение IV находится в равно-
весии со своим изомером V, который теряет молекулу воды, образуя
оксониевук5 соль сложного эфира (VI)
СНз-САЖ
сн3о
ф?н
С1-13-С-ОСНз + И:О
IV
VI
____II ф
... »• CHj-C-OCHj + HjO
м етилацетат
Перенос протона от соединения VI к воде дает конечный продукт
реакции.
При высоких концентрациях кислоты практически весь метанол
может быть превращен в инертный ион метилоксония и скорость
этерификации может стать очень малой, несмотря на присутствие
оксониевого иона уксусной кислоты.
Упражнение 13-7. Примем, что константа равновесия для присоединения про-
тона к метанолу в 103 раз превышает константу присоединения протона к уксусной
кислоте и что метанол реагирует с Соединением 111 в !06 раз быстрее, чем С уксус-
ной кислотой. Вычислите отношение скоростей катализируемой и пекатализируе-
мой реакций этерификации для раствора с концентрацией, равной 1 молю по ме-
танолу и уксусной кислоте и 0,5 моля по серной кислоте (которая здесь рассмат-
ривается одноосновной и полностью диссоциированной).
Упражнение 13-8. Каким образом, используя тяжелый кислброд. (15о) в.каче-
стве метки, можно отличить разрыв связи С—О от разрыва связи О—Н спирта при
его этерификации кислотой? ;
СНзО-
0
II ;
— H4-RC—J—OH
О
н® -II'
—Т RCOCHg !• Н2О
ИЛИ
О О
I . II. Н® I
СН3 ОН !• RCO- Н —> КСОСНаф-НоО
426
ГЛАВА 13„
Для какого типа спиртов можно с достаточным основанием ожидать разрыва связи
С—О при реакции и какие побочные реакции могут происходить в случае таких
спиртов?
Как упоминалось выше, образование сложных эфиров — про-
цесс обратимый; в случае этанола и уксусной кислоты константа
равновесия при комнатной температуре составляет величину около
4, что соответствует 66% превращения в эфир
О О
II II
СН3С-ОН-)-СаН5ОН СНдС-О—C2H5-J-H2O
[CH3COaC2HJ [НаО J _
A“[CHaCO2HJ[C2HsOHJ ~ *
Реакция может быть доведена до конца путем удаления эфира
и (или) воды по мере их образования.
Скорости этерификации очень сильно зависят от пространствен-
ных препятствий; сложные эфиры с высокоразветвленными группами
независимо от того, находятся последние в спиртовой иликислотной
частях молекулы, образуются медленнее и имеют меныпую кон-
станту равновесия, чем их менее разветвленные аналоги. В целом
скорости этерификации для спиртов различного строения (данной
карбоновой кислотой) располагаются в следующий ряд: первич-
ный > вторичный >» третичный. Дальнейшее рассмотрение реак-
ции образования сложных эфиров приведено в гл. 16.
13-6. Реакции с участием связи
С —О спиртов
А. Образование галогенидов
Одним из наиболее важных примеров реакций, при которых в
спирте разрывается связь С—О, может служить образование алкил-
галогенида из спирта и галогеноводорода
p-i—OH-j-HBr Z2 RBr-j-H3O
Реакция обратима, и преимущественное направление ее проте-
кания зависит от концентрации воды (см. упражнение 11-11). Наи-
лучшим способом получения первичных бромидов часто оказыва-
ется пропускание сухого бромистого водорода в спирт, нагретый
почти до температуры кипения. Реакция происходит со значитель-
ной скоростью только в присутствии сильных кислот, что может
быть достигнуто применением избытка бромистого водорода или
серной кислоты (последняя используется чаще, и ее применение
более экономично). Спирт присоединяет протон кислоты, образуя
ион алкилоксония, который более активен при последующем заме-
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
427
щении на бромид-ион, чем спирт, так как отрыв от него нейтральной
молекулы воды происходит легче, чем отрыв гидроксил-иона от
спирта (разд. 11-12,Б)
___* н
Ф
>. RBr + HSO
SN2
ИЛИ
н
R-(J-H
Ф
{-н,О) Вг9
------ 1?Ф—* RBr
Sat!
Осуществление реакции замещения по механизму SN1 или Sn2
зависит от структуры спирта. Для иллюстрации на рис. 13-6 схе-
матически представлены относительные скорости реакций с бро-
мистым водородом ряда первичных, вторичных и третичных спир-
тов в сравнении с относительными реакционными способностями,
ожидаемыми для SnI- и Sk2-механизмов.
Наблюдаемая последовательность реакционной способности не
соответствует ни SN1 -, ни 5м2-ряду. Наиболее правильная интерпре-
тация такой последовательности состоит в принятии для первич-
ных спиртов механизма SN2, а для вторичных и третичных спиртов —
механизма S^l-
Реакционная способность хлористого водорода по отношению
к первичным спиртам меньше, чем бромистого водорода; в случае
НС1 требуется участие катализатора — хлористого цинка. Раствор
хлористого цинка в концентрированной соляной кислоте (реактив
Лукаса) широко используется в удобном методе различения низших
первичных, вторичных и третичных спиртов. Третичные спирты ре-
агируют очень быстро, образуя при комнатной температуре нераст-
Рис. 13-6. Схематическое изображение реакционной способности ряда спиртов
при взаимодействии с бромистым водородом в сравнении с обычным порядком ре-
акционной способности в реакциях Sjjl я Sn2.
Точки, соответствующие Sjsjl-реакционной способности метанола и 3^2-реа[щионйой способ*
ности от дог-бутилового спирта, найдены путем экстраполяции и могут представлять собой
лишь верхние пределы.
428
ГЛАВА 1'3:
воримый слой хлористого алкила. Вторичные спирты реагируют в
течение нескольких минут, тогда как первичные спирты образуют
хлориды только при нагревании. Такой порядок реакционной спо-
собности характерен для Зк1-реакций. Хлористый цинк, по-видимо-
му, способствует разрыву связи С—О в спирте, действуя во многом
сходно с ионом серебра При ионизации RX (разд. 11-12,Б)
А А
- [HOZnClJ^ _ СП
ROH + ZnCU R-O---ZnCt2---------------* R® -+ RC1
I
Н
Удобно использовать для получения хлористых алкилов хло- -
ристый тионил SOCi2, особенно в тех случаях, когда применение
хлористого цинка и соляной кислоты нежелательно. Взаимодействие
1 моля спирта с 1 молем хлористого тиснила приводит к нестойкому
алкилхлорсульфиту, который обычно разлагается при слабом на-
гревании, образуя хлористый алкил и сернистый ангидрид
о
-НС1 II
.ROH + SOGIa-------*- R—О—S—C! —> RCl-|-SOg
алк илхлорсульфит
Стереохимия образования алкил хлорида, как это следует из поведения опти-
чески активных спиртов при действии хлористого тионила, решающим образом
зависит от условий реакций. При практическом проведении синтеза часто добав-
ляют один эквивалент основания (обычно лиридинардля .нейтрализации образую-
щегося хлористого водорода; в этом случае осуществляется главным образом .меха-
низм инверсии очевидно, путем 5№-атаки хлорид-иона на хлорсульфит
С£Н* - С\4Н*
H<£—ОН + SOClj + И 1 --------► н OSOC1 + И ] С1®
СИ? сн/
н
а-фенилэтанол пиридин
+ SO. + Cl®
а- ф е ши р i илх лор и д
Однако в отсутствие основания условия становятся гораздо более благоприят-
ными для сохранения конфигурации. Сохранение считается результатом внутри-
молекулярного замещения, при котором хлор хлор сульфитного остатка действует
в качестве нуклеофила. Такой тип реакций обозначают символом Si\i (замещение
нуклеофильное внутримолекулярное или интрамолекулярное).
Механизм реакций SRi выяснен не полностью. Наиболее вероятно, что моле-
кула сернистого ангидрида «вытесняется» из хлорсульфита, и после ее удаления об-
разуется ионная пара, в которой хлорид-ион располагается сфронтальной стороны
молекулы. Если образовавшаяся ионная пара смыкается таким образом, что хло-
рид-ион «не обходит молекулу вокруг», чтобы атаковать атом углерода с тыла, то
результатом является сохранение конфигурации. В случае если ионная пара рас-
СПИРТЫ Й ПРОСТЫЕ ЭФИРЫ
429
издается на свободные ионы, должна произойти рацемизация.
С<Л5
с—
CHJ s—о
С1Х
(-SOI)>
а-фенилэтилхлорсульфит
(не выделяемый)
ионная пара
Если учесть разнообразие путей превращения такой ионной пары, то не удиви-
тельно, что стереохимия процесса чрезвычайно чувствительна к структуре и экс-
периментальным условиям.
Особый интерес представляют реакции хлористого тионила с аллиловыми
спиртами. Взаимодействие в эфирном растворе без добавления основания приводит
к полной аллильной перегруппировке. Такая реакция может быть отнесена к типу
Sn’i' (замещение нуклеофильное внутримолекулярное с перегруппировкой) по
аналогии с Sn2'-реакциями (разд. 11-17,В).
SOClj ( 9 (-SOJ
СН3СН=СНСН2ОН -------и. \\У » СН,СНСН=СНг
СНз“СН* *~-чЗ=О С1
СГ
кротиловый спирт крртилхлорсульфит ct-метилаллилхлорид
В этом случаев реакции также могут принимать участие ионные пары; однако
1 еометрия кротилхлорсульфита такова, что он может перейти в перегруппирован-
ный хлорид путем синхронного процесса перераспределения связей. Реакция кро-
тилового спирта с хлористым тионнлом в присутствии оснований происходит ис-
ключительно по механизму S№ и дает хлористый кротил.
SOCU. эфир
СН8СН=СНСН2ОН -------------ь СН3СН = СНСН2С1
Упражнение 13-9. Укажите распределение метки 14С (отмечен звездочкой) в
хлористом аллиле, полученном в результате следующих реакций:
# ZnCt,
а) СНв=--СН-,СН,0Н4-НС1-----1-
* „ эфир
б) СНа = СН-СН8ОН-ф-5ОС1а-----г
» . эфир
в) СН.»СН-СНаОН+5ОС!а ------>
Упражнение 13-10. Реакций аПокамфанола-1 с хлористым тионнлом не дает
апокамфанил хлорида. Объясните,
апо кам фа нол-1
430
ГЛАВА 13
Б. Эфиры, серной кислоты. Дегидратация спиртов
Образование кислых алкилсульфатов из спиртов и концентри-
рованной серной кислоты происходит путем реакции, весьма сходной
с образованием алкилгалогенидов
ROH4-H2SO4^± R^Hj + HSO© —ROSO3H4- HaO
кислый
алкилеульфат
Превращение кислого сульфата оксония в кислый алкилсульфат
протекает, по-видимому, по механизму SN2 в случае первичных
спиртов и по механизму Sjq 1 в случае третичных спиртов. В 100%-ной
дымящей серной кислоте действует другой механизм, состоящий в
присоединении серного ангидрида к ОН-группе
ROH + SO.,
—R —О-SO3H
В принципе диалкил сульфаты могут образоваться по SN2-pe-
акции между солью алкилоксония и алкилеульфат-ионом
ROH*PROSO3H rBhs-|-R0S09 —* R0(S02)OR4-H20
ди алкилеульфат
Диметилсульфат (CH3O)2SO2 получают, нагревая метанол с
дымящей серной кислотой; однако другие спирты с большим успе-
хом переводятся в алкилсульфаты путем окисления соответствую-
щих ди ал кил сульфитов, полученных взаимодействием 1 моля тио-
нилхлорида (SOCU) с 2 молями спирта
КМпО4
2«-С4НвОНSGC1, —> («-C4HeO),SO ----*- (и-С4Н9О)а5О3
ди-л-бутилсульфит ди-к-бутилсульфат
При нагревании кислых ал кил сульфатов легко отщепляется
серная кислота и образуются алкены; при реакции спирта с го-
рячей концентрированной серной кислотой, приводящей в конеч-
ном счете к дегидратации спирта, кислый сульфат, очевидно, явля-
ется основным промежуточным веществом. Эта реакция обратна
катализируемой кислотой гидратации алкенов, рассмотренной вы-
ше (разд. 7-4, см. также разд. 13-5).
(—HjOt too -с
СНЭСН2ОН4- HaSO4 ~~* CH3CH3OSO3H ZZZt СН2=СНафНа5О4
Реакция доходит до конца, если образующийся'алкен отгоняется из
реакционной смеси. Отщепление серной кислоты из кислого алкил-
сульфата происходит, вероятно, по Е2-механизму, причем в каче-
стве основания выступает вода или бисульфат-ион. Альтернатив-
ным механизмом может быть Е2-реакция бисульфат-иона или воды в
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
431
оксониевой солью спирта.
HSOt® <• ^Н^-СНг-^Нг -Ь.
Нг5О4 4- СНг=СНг + НгО
При более низких температурах кислый алкилсульфат может
реагировать с избытком спирта в реакционной смеси по механизму
замещения, образуя диалкиловый эфир. На таком процессе осно-
вано получение диэтилового эфира в промышленности. Хотя каждая
стадия этого процесса обратима, образованию эфира способствует
его отгонка* из реакционной смеси сразу же после образования.
Н
1зоч: I а
CH3CH2OSO3H + CH3CH2OH ---> CH3CH2-O-CH8CH3-J-HSO®
CH3CH^)CH2CH3 4- H2SO4 >
Большинство спиртов также дегидратируется при сравнительно
высоких температурах в присутствии твердых катализаторов, та-
ких, как силикагель или окись алюминия; при этом образуются
алкены и (или) простые эфиры. Превращения этанола, суммиро-
ванные в приведенных ниже уравнениях, характерны для первич-
ных спиртов.
СН2СНаОН
AljO,
---->СН2=СН2 + Н2О
37 5 “С
AIjO,
---->- CHSCH2OCH2CH3 + Н2О
300 °C
Третичные спирты реагируют с серной кислотой при значительно
более низких температурах, чем большинство первичных спиртов.
Для взаимодействия mpem-бутилового спирта и серной кислоты •
может быть написана следующая серия S^l- и El-превращений:
СН3 CHS
I HiSO, | ®
' СН,—С—ОН “ZXCH3-C-OH2
Ан, сна
-н,о 11
Н мяо®
I (СИССОН f
(CHS)SC - 6® -С (СНЭ)3 СНЭ - С® —П
Н®Iсн,
—м ||
(СН3)^-О-С(СН3)3 -н®
сн3
СН3—с— OSO3H
I
СНз
сн3
сн3—с=сн3
!
полимер
432
ГЛАВА 13
Ди-трет-бутиловый эфир неустойчив в растворе в серной кислоте
и никогда не был обнаружен в такого типа реакционных смесях.
Его низкая стабильность может быть связана с пространственным
перекрыванием алкильных групп.
СЬТС о. .СН,
Л /X
СН* CHjUMCHj СН»
пространственное отталкивание .
Изобутилен удаляется из-реакционной смеси путем отгонки, и,'С
при соответствующем: подборе условий реакции'он легко может ,
стать основным продуктом. Если изобутилен не удаляется по
мере его образования, то основным конечным продуктом является
полимер. Серная кислота часто оказывается слишком энергичным
агентом для дегидратации третичных спиртов; с целью получения ч
лучших результатов используют бисульфат калия, сульфат меди, ;
йод, фосфорную кислоту или пятиокись фосфора; эти агенты в
меньшей степени вызывают полимеризацию и окислительную дест-
рукцию, которая в случае серной кислоты приводит к образованию
сернистого газа. т
Вторичные спирты реагируют с серной кислотой по механизмам,: -
пограничным между SN2 и 1, а также Е2 и Е1, Получение ди-етор-
алкиловых эфиров часто наталкивается на трудности вследствие у
дегидратации вторичных спиртов.
Упражнение 13-11. Какие продукты образуются в результате перечисленных
ниже реакций? Приведите ваши соображения.
коиц. HtSO,
а) (СН3)3СОН+СН3ОН-------<
нн
I I 75%-ная H,S04
б) Н — С—С—Н —------—т
I I 100 ’С
ОМОН
сн»
в) сн3—С—сн2—ОН—
(Lh
ьмз
95%гная HjSOi
25 =С
100%-ная Нг5О4:
25 Ю
ЁНЭ. СН»
I I КОНЦ. H.SO.
г) СН»—С—О—С—ОН» ——-—-*
I ) 0 °с
сна сн»
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
433
При дегидратации спиртов часто происходят перегруппировки,
особенно в присутствии серной кислоты, которая весьма сильно
способствует образованию карбониевых ионов. Ниже приведены
' типичные примеры, иллюстрирующие миграцию метильной группы и
водорода
СНз СНз. СН3
СНэ—С^СН—СН3———
. U сн/ сн‘
* СН8 СНЭ
I Нг5О. 1
CH^-C-CHj-CHiOH-----:-^СН3-С=СН-СН3
н
Главной стадией при этих перегруппировках является изомериза-
ция карбониевого иона, основные особенности которой обсужда-
лись в гл. 11 (разд. 11-14). За исключением отдельных случаев, в
которых термодинамический контроль играет основную роль и при-
водит к результатам, отличным от тех, которые дает кинетический
контроль, конечные продукты всегда соответствуют перегруппиров-
ке менее стабильного карбониевого иона в более стабильный кар-
бониевый ион.
R
I Ф
реагирующие—— С —С —
вещества j |
менее стабильный
карбопиевый ион
R
Ф А
•— С—С —> —> продукты
| | реакции
более стабильный
карбопиевый ион
Для конкретного случая дегидратации метил-тре/п-бутилкарби-
нола последовательность превращений следующая:
9Нз H2SO4
CHj-C—CH-CH, '
3 I 1
сн, он
вторичный карбопиевый ион
СНЭ ;/сн,
C-C
сн, сн.
третичный карбониевый ион » .
Чрезвычайно интересен в теоретическом отношении и очень важен в практи-
ческом плане тот факт, что соответствующие перегруппировки в случае промежу-
434
ГЛАВА 13
точно образующихся радикалов и анионов встречаются редко,
менее стабильнее
промежуто чипе
соединения
Срлее стабильные
промежуточные
соединения
По-видимому, это обусловлено природой переходного состояния перегруппировки
(разд. 11-12, Г), в котором группа!? в большей или меньшей степени связана с дву-
мя атомами углерода.
переходное состояние
при перегруппировке
Такие переходные состояния можно описать с помощью метода ЛКАО
(разд. 9-10) следующим образом: имеются три молекулярные орбитали, построен-
ные из линейных комбинаций трех взаимно перекрывающихся атомных орбиталей,
две из которых имеют своими центрами углеродные атомы, а одна связана с R.
Расчет показывает, что молекулярные орбитали обладают такими энергиями,
которые соответствуют изображенному на рис. 13-7: одна орбиталь оказывается
эффективно связывающей и две — разрыхляющими.
При перегруппировках карбониевых ионов два электрона, связанные с мигри-
рующей группой, размещаются на орбитали с низшей энергией, что должно при-
вести к энергетически весьма выгодному переходному состоянию (по крайней мере
на основе электронных представлении). При перегруппировках свободных ради-
калов или карбанионов неспаренный электрон или дополнительная электронная
пара должны быть помещены на низшую разрыхляющую орбиталь и, следова-
тельно, должны привести к гораздо менее выгодному переходному состоянию пе-
। разрыхляющие орбитали
Увеличение
энергии ~ — — — — — —
связывающая орбиталь
Рис. 13-7. Схематическое изображение молекулярных орбиталей, соответствую-
щих переходному состоянию при 1,2-перегруппировке группы R от одного атома
углерода к другому. >
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
435
finруппировки. В противоположность приведенному выше рассмотрению каче-
[ [|11’1шый метод резонанса оказывается бесполезным при объяснении большей
ъ-I пости перегруппировки карбониевых ионов по сравнению с перетруппиров-
111МИ анионов и свободных радикалов. Причина заключается в том, что между
* <1 кптными схемами, которые можно написать для соответствующих переходных
.и гояний, нет сколько-нибудь существенных различий.
13-7. Окисление спиртов
Помимо сгорания до двуокиси углерода и воды, возможно окис-
н.'ние первичных и вторичных спиртов до карбонильных соединений
Фсредством дегидрирования, Первичные спирты сначала дают аль-
и гиды и затем карбоновые кислоты, тогда как вторичные спирты —
1. стоны
[oj d г/° о
rch2oh К - <н К - (<он
[°] R.
>снон—> )С=О
Третичные спирты окисляются со значительным трудом и окис-
ление сопровождается деструкцией, приводящей при разрыве свя-
п1 углерод — углерод к фрагментам меньшей величины. Аналогич-
ным образом окисление вторичных спиртов (более глубокое, чем
до стадии кетонов) протекает с трудом и приводит к деструкция.
Здесь будет рассмотрено только окисление спиртов до альдегидов
и кетонов, которое может быть легко осуществлено над медным
катализатором при 300°C без добавления окислительного агента.
Превращение этанола в ацетальдегид представляет типичную реак-
цию дегидрирования
Си
СНаСНаОН---------- СНЭСНО ч- Н3 ЛЯ (25 °С)= +15 ккал
300 °C
Реакция эндотермична; в газовой фазе при комнатной температуре
константа равновесия составляет приблизительно 10-22. Образо-
вание альдегида может стать весьма экзотермичным (Ка; 10е’) при
использовании кислорода, соединяющегося с водородом.
CH3CH3QH 4. VaOs —> СН3СНО+Н2О ДН = - 43 ккал
436
ГЛАВА 13
। Эта реакция, в сущности, частичное горение и ’требует чрезвы-
чайно тщательного контроля для предотвращения слишком глубо-
кого окисления. Такого типа реакции особенно удобны для внед-
рения в качестве промышленных процессов, поскольку они обычно
могут проводиться в реакторах, где используется принцип непре-
рывного потока, и позволяют применять дешевый окислительный
агент (как Правило, воздух).
Окисление спиртов в лабораторных условиях чаще всего осу-
ществляется с помощью хромовой кислоты (Н2СгО4), которую обыч-
но по мере надобности получают из трехокиси хрома (СгО3) или из
бихромата натрия (Na3Cra0,) в сочетании с серной кислотой. В” ка-
честве наиболее удобного растворителя для таких реакций обычно
используется уксусная кислота.
СНЭ. СНа
3 Ъсн—ОН4-2СгО34-6Н®—>-3 ЪС = О4-2Сгэ®4-6Н3О
СН, СН3'
Механизм окисления изопропилового спирта до ацетона при
действии хромовой кислоты был исследован весьма тщательно;
он очень интересен D том отношении, что показывает, каким образом
изменения уровня окисления могут происходить с участием типичных
неорганических и типичных органических соединений. Начальная
стадия заключается в обратимом образовании кислого изопропил-
хромата (VII), который очень неустойчив и обычно не выделяется
из реакционной смеси (хотя его и удается выделить при низкой
температуре и быстром проведении реакции).
СН, снЭх
>СН-ОН4-СгО3^П >СН-0-СгОэН
асн/
VII
На следующей, наиболее медленной стадии происходит атака
основания (воды) на а-водородный атом эфира, конкурирующая с
отщеплением остатка НСгО®. Существует очевидная аналогия
между этой стадией й реакциями типа Е2 (разд. П-13).
сн,
СН, ~ -
к! л ® е
^С=о + HjO + HCrOj
wn> о—A.rv3H СН,
Превращение хромовой кислоты (ЩСгОД в Н3СгО8 сопровож-
дается восстановлением хрома из состояния 4-6 до 4-4. Быстрое
диспропорционирование Сг*ф приводит к производным Сга® и Сг6©.
ЗН3СгОз 4- 6Н® —> СгО, 4- 2Сг3®4- ОН., О
Образование в процессе окисления изопропилового спирта хро-
ма в окислительном состоянии, промежуточном между 4*6 и +3,
н
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
437
было подтверждено окислением добавляемого иона двухвалентного
марганца (Мп8®) в двуокись марганца — этот процесс может про-
исходить с участием Сг4®, но не Сг6® или Сг3®.
Е2-Характер стадии образования ацетона был доказан двумя
‘способами. Во-первых, скорость разложения кислого изопропилхро-
мата до ацетона и Н2СгО3 сильно возрастает в присутствии эффек-
тивных акцепторов протонов. Во-вторых, очевидно, что удаление
водорода от карбонильного углерода является медленной реак-
цией это следует из семикратного понижения суммарной скорости
окисления при'замене а-водорода на дейтерий. При замещения на
дейтерий водородных атомов метильных групп сколько-нибудь
существенного понижения скорости не наблюдалось.
СН3 '
УСН-ОН
сн/
отвоенгельная
скорость окис- i.O
леиия. хромо-
сой кислотой
сня
>CD-OH
снэ/
0.16
CD3.
>СН”ОН
1,0
Связи углерод-—дейтерий обычно разрываются медленнее, чем
связи углерод — водород; этот так называемый кинетический изо-
топный эффект служит весьма общим методом установления того,
разрываются ли данные связи углерод — водород на стадии, опре-
деляющей скорость реакции.
Различие между скоростями разрыва связи С—Н и соответствующей связи
C—D не связано с различиями кривых потенциальной энергии (см, рис. 9-1); оно
обусловлено тем, что колебательная энергия связей С—Н при обычной темпера-
туре больше, чем связей С—D, Следовательно, для разрыва связей С—Н требуется
меньшая энергия, чем для разрыва C—D-связи, т. е. Дй* (разд. 3-7, Г) при этом
оказывается меньше. Различие колебательных энергий связей С—Н и C—D умень-
шается при возрастании температуры, и вследствие этого кинетический изотопный
эффект также должен уменьшаться при повышении температуры.
Образование кетона из эфира вторичного спирта и хромовой кислоты может
происходить при определенных условиях и по другому механизму. При этом а-
водород может быть удален «внутримолекулярно» при действии атома кислорода,
связанного с хромом.
АЯ0Н|
А
—>С=О + Н!СгО,
Rz
Ненасыщенные спирты могут быть окислены в ненасыщенные ке-
тоны хромовой кислотой, поскольку обычно этот реагент довольно
438 -
ГЛАВА 13
медленно атакует двойные связи.
СН
( I
Н2С С=О
\/
снг
В противоположность этому нейтральный раствор перманганата
калия окисляет ненасыщенные группировки быстрее, чем спирто-
вые группы.
СН СНОН
н/ffl КМпО. н/>нон
Hgc снон рн ? H2i снон
Однако следует ожидать осложнений в тех случаях, когда двой-
ные связи высокореакционноспособны или спирт легко перегруппи-
ровывается в сильнокислой среде.
Разработано применение более селективных окислительных агентов, чем
хромовая кислота; например, хромовый ангидрид в виде комплекса с пиридином
состава I; J в пиридиновом растворе может применяться для окисления групп ОН
в ацидофобных соединениях до альдегидных и кетоновых групп в отсутствие силь-
ных кислот.
| CrOa:N у_____> |
(С2Н6)2 ССН2ОН------------------>(С2Н6)2ССНО
2-метил-2-этил бутанол-1 мети лдизтилацета ль дегвд
(88%)
Окисление хромов ой’кислотой в ацетоновом растворе по не выясненным до
настоящего времени причинам происходит исключительно быстро и весьма селек-
тивно. Особого упоминания заслуживает использование этого метода в химии
природных соединений, и прежде всего стероидов. Одно из таких превращений
приведено ниже (показана лишь часть структуры); в отсутствие ацетона реакция
приводит к глубокому окислению двойной связи.
Один из методов окисления спиртов состоит в использовании
ацетона (или циклогексанона) в качестве дегидрирующего агента
(в присутствии слабоосновного катализатора, обычно изопропилата
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
439
алюминия, в бензольном или толуольном растворе).
AW ОСН j
\ чсн,4<
RCHSOH+CH3COCH3 ,--------*• RCHO + (CH3)2CHOH
Механизм этой реакции подробно рассматривается в гл. 14 (разд.
14-6,А), она называется восстановлением альдегидов и кетонов
по методу Меервсйна — Понндорфа — Олпенауэра — Верлея.
Поскольку реакция представляет собой быстро устанавливающееся
равновесие, она может также использоваться для окисления спиртов;
в этом аспекте она более известна как окисление по Оппенауэру.
Положение равновесия можно контролировать путем изменения
количества ацетона, присутствующего в смеси: его избыток способ-
ствует окислению спирта.
Упражнение 13-12. Структура X встречается во многих природных соедине-
ниях, называемых стероидами; ее конформационное изображение приведено на
схеме XI. D связи с характером обсуждения п данной главе рассмотрим соединение
। двумя вторичными гидроксильными группами в положениях С3 и Сп, как в со-
единении XI.
Объясните, почему относительные реакционные способности этих двух гидрок-
сильных групп при получении эфиров С3>СП, при окислении хромовой ки-
слотой СП>С3 и при окислении по Оппенауэру С3>СП.
13-8. Многоатомные спирты
Простейшим представителем спиртов с двумя или большим чис-
лом гидроксильных групп является метиленгликоль HOCHSOH,
Термин «гликоль» — синоним «.диола», т. е, соединения с двумя
спиртовыми гидроксильными группами. Метиленгликоль сравни-
тельно устойчив в водных растворах, однако попытки его выделения
приводят только к продукту дегидратация — формальдегиду
• НО-СНа^ОН^±Н;.С=О + Н2О
440
ГЛАВА 13
Такое свойство типично для гем-диолов [гем (геминальный)
означает, что два гидроксила находятся при одном атоме углерода];
лишь очень немногие ге.и-диолы способны к существованию не в
растворенном состоянии— к их числу относятся соединения, со-
держащие сильные электроноакцепторные заместители, например
хлоральгидрат и гидрат гексафторацетона
ОН
Cl3C-d-0H
хлоральгидрат
ОН
CFS—J—CFa
ОН
гидрат гексафторацетона
Многоатомные спирты, в которых гидроксильные группы нахо-.
дятся у различных атомов углерода, сравнительно устойчивые и ।
в соответствии с ожидаемым для соединений с большим числом по-
лярных групп имеют высокие температуры кипения, сравнительно
хорошо растворимы в воде, но плохо растворимы в неполярных
растворителях.
СН2СН2
H(L он
этиленгликоль
(этап диол* 2,2)
кип. 197 °C
СН2СН2СН2СН2
ОН С^Н
тетр аметиленгликоль
(буга11диол-1,4),
т. кип. 230 °C
СН2 —СН —СНВ
с^н Зн он
глицерин
(про паитр но л-1,2,3 j,
т. кип. 290 °C
1,2-Диолы обычно получают из алкенов путем окисления та-
кими реагентами, как четырехокись осмия, перманганат калия
или перекись водорода (разд, 7-8,Б). Однако этиленгликоль син-
тезируют в промышленном масштабе из окиси 'этилена, которая
в свою очередь получается из этилена путем окисления кислородом
воздуха при высоких температурах над катализатором — окисью
серебра.
н,о, н®
сн2—сн2--------> сна—сн3
ОН <^н
СН2 —-СН2 VаО2’
Ag„O
300°
оквеъ этилена
Более подробно последняя стадия рассмотрена в разд, 13-12,Б.
Этиленгликоль находит важное применение в промышленности.
Он смешивается с водой во всех отношениях, и его 50%-ный раст-
вор в воде (т. пл. —34 °C) используется в системах охлаждения
автомобилей в качестве превосходного постоянного антифриза.
Этиленгликоль применяется также в качестве растворителя и как
промежуточное соединение при производстве полимеров (поли-
эфиров) и других продуктов (разд, 13-11).
Трехатомный спирт, глицерин, представляет собой нетоксич-
ную водорастворимую, вязкую гигроскопичного жидкость, которая
широко используется в качестве увлажняющего агента. Он яв-
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
441
ляется важной составной частью многих пищевых продуктов, а
’ также косметических и фармацевтических препаратов. В свое время
/ глицерин производился в промышленном масштабе только в ка-
честве побочного продукта при получении мыла путем гидролиза
жиров, которые представляют собой сложные эфиры глицерина и
алкановых кислот с длинной углеводородной цепью (гл, 16); однако
в настоящее время основным источником глицерина служит синтез
ia основе пропилена, описанный в разд. 11-17,Б. Сложный эфир
1лицерина и азотной кислоты — трйнитрат, содержащий три слож-
|(оэфирные группировки (нитроглицерин), представляет собой важ-
ное взрывчатое вещество, обладающее, однако, высокой чувстви-
тельностью к удару. Пропитывая нитроглицерином пористый
материал, например опилки или инфузорную землю, получают
значительно более безопасное и в большей степени поддающееся
контролю взрывчатое вещество — динамит, Бездымный порох пред-
ставляет собой тринитрат глицерина, желатинизированный нит-
роцеллюлозой,
CH2ONO2
CHONOe
CHeONO2
нитроглицерин {гр и нитрат глицерина)
Глицерин играет важную роль в обмене веществ животного
организма, поскольку он входит в состав жиров и липидов.
13-9. Ненасыщенные спирты
Простейший ненасыщенный спирт — виниловый — неустойчив
и превращается в ацетальдегид; он никогда-не был выделен в ин-
дивидуальном состоянии.
Н. „ ,ОН
нХн
/£>
CH3-Cf
виниловый спирт ацетальдегид
Другие виниловые спирты также претерпевают аналогичное пре-
вращениев карбонильные соединения. Известны, однако, простые
и сложные эфиры виниловых спиртов; они могут быть получены
путем присоединения спиртов и карбоновых кислот к ацетиленам.
Сложные эфиры виниловых спиртов находят применение при полу-
442
ГЛАВА 13
чении многих промышленно важных полимеров.
О
hsmo.cch,), /О—С—СНв
НС-СН+СН.СО.Н -iij— н/с=с<н
винилацетат
н®,
НСеэСН+СН3ОН---
метил ви иилоаый эфир
о-снэ
н
Упражнение 13-13. Используя энергии связей и энергии стабилизации, пред-
скажите положения приведенных ниже равновесий (разд, 9-7),
/£> /ОН
а) СН8-С< ^СН2=С/
ХН ХН
Аллиловый спирт легко может быть получен гидролизом хло-
ристого аллила как по SK1-, так и по 5^2-реакции (хлористый аллил
получают хлорированием пропилена; разд. 11-17,Б).
н,о
СНг = СН—СН2С1----► СН2 = СН - CHjOH
аллиловый спирт
Он вступает в большинство обычных реакций двойных связей и в
соответствии с ожидаемым на основании химических свойств ал-
лилгалогенидов оказывается значительно более реакционноспособ-
ным, чем насыщенные первичные спирты по отношению к реаген-
там, подобным реактиву Лукаса, расщепляющим связь С—О.
Двойная связь не оказывает влияния на реакционную способ-
ность гидроксильной группы в том случае, если они разделены
двумя или большим числом групп СНИ, как d бутен-З-оле-1
СН2 = СН-СН2-СН3ОН
буген-З-ол-!
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
443
ПРОСТЫЕ ЭФИРЫ
13-10. Типы простых эфиров и их реакции
Замещение водорода гидроксильной группы в спиртах на угле-
водородный остаток приводит к соединениям, известным под на-
званием простых эфиров. Последние могут быть далее подразделены
на простые эфиры с открытой цепью, циклические, насыщенные,
ненасыщенные, ароматические и т. д.
СН3СНаОСН2СН3
СН3ОСН = СНа
диэтиловый эфир»
|_т. кип, .35 сС
)>-ОСНв
метиллиниловыft эфир,
т. кии, 12 °C
снй-сн2
тетр а гидрофуран,
т- кип. 65 “С
метнлфсн иловый эфир
{анизол}, т> кип.
155 °C
сна-сна
чо'
окись этилена»
т, кип. 11 °C
о
Hoc/^CHs
I I
н2с сна
Y
М-Дяоксаи,
т. кнп, 101,5 °C
Наиболее общие методы получения простых эфиров уже были
рассмотрены в связи с реакциями спиртов (разд. 13-5,Б) и сумми-
рованы в табл. 13-4.
В целом простые эфиры мало реакционноспособны, поскольку
расщепление связи углерод — кислород происходит с трудом. По
этой причине эфиры часто используются при органических синте-
зах в качестве инертных растворителей. Наиболее важными в этом
отношении являются диэтиловый эфир, диизопропиловый эфир,
тетрагидрофуран и 1,4-диоксан. Моно- и диалкиловые эфиры эти-
ленгликоля и диэтиленгликоля находят применение в качестве
высококипящих растворителей. Они получили, к сожалению, ни-
чего не говорящие названия — полиглимы, целлозольвы и карби-
толы: целлозольвы представляют собой моноалкиловые эфиры эти-
ленгликоля, карбитолы — моноалкиловые эфиры диэтиленгликоЛя
и пили гл им ы — диметиловые эфиры ди- или трнэтвленглнколя (со-
ответственно диглим и триглим)
СН8ОСН2СН3ОН С4НВОСН2СН„ОСН2СН2ОН
мет н Ли ел л о э о лье , б ут и лк а рб и то л,
т- К НИ. 124 °C т. кип, 231 °C
СН3ОСНаСН,ОСНаСН2ОСН3
.диглим,
т. кип. 16j tfс
В отличие от спиртов простые эфиры не обладают кислыми
свойствами и, как правило, не реагируют с основаниями. Однако
реагенты, обладающие исключительно сильными основными свой-
ствами, в частности ряд алкильных производных щелочных метал-
Общие методы получении простых эфиров
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
445
лов, взаимодействуют со многими простыми эфирами, расщепляя
их (см. также разд, 12-1).
СИ,® Na® + Н:СН2— СН2^Ь-СНгСН3 >
0 Ф
____г СЯ4 + СН2=СНг + CHjCHjO Na
Подобно спиртам, простые эфиры обладают слабо выраженными
основными свойствами и при действий сильных кислот (например,
1 T2SG>4, НС1О4 и НВг) превращаются в неустойчивые оксонкевые
I. оли, Действие кислот Льюиса приводит к образованию относи-
тельно устойчивых координационных комплексов (например, с
BF3 и RMgX).
н Ф -
+ НВг <. . -1~ + Вг0
' бромид
диэтилоксония
сан5ос2н5 + BF3
F
F. 1 .F
В
CiHjbCjH,
эфират трехфто-
pистого бора
Ири одновременном действии трехфтористого бора и фтористого
метила диметиловый эфир превращается в борфторид 3-мётилоксо-
":я СН3
CH3OCH3+CH3F+BF3 —^СН3-®0-СН3 BF?
Ионы диалкилоксония более реакционноспособны в реакциях
нуклеофильного замещения и реакциях элиминирования, чем нейт-
ральные молекулы простых эфиров; причина этого та же, что в
с лучае активирования спиртов сильными кислотами (разд, 11-12, Б).
Вследствие этого для более легкого протекания реакций расщепле-
ния эфиров требуется сильнокислая среда.
Н
_ I Вг©
С2Н6- О - CjHj+Н®^ C,H5-d - С2Н5~у CaH6Br 4-CaH6OH
- . v ® х
и
(СН3)3 С— О-С (СН3)Й+Н® (СН3)3 С-О-С (CH3)S
тс. ф ' '
' ©HSoJc I
(CH3)^!C^CH2^(CH3)3C-OH + (CH?)2C=CH2 + HaSO4 • '«
446
ГЛАВА 13
Упражнение /3-/4. Укажите, образования каких продуктов можно ожидать
при расщеплении приведенных ниже простых эфиров б роми сто водородной кис-
лотой.
СН2
а) СН2 = СН—СН,—О—СНЭ г) Н2С/ЧП
I 7
л нХ/ ?
б) сн3сн2—о—сн=сн2 сн2
в) (СН3)3 ССН2ОСН3 д) ^_^-о-сн3
Простые эфиры вступают в реакцию со свободными радикалами и по этой:
причине не могут служить хорошими растворителями при проведении реакций
свободнорадикального характера. Потенциально простые эфиры представляют со?
бой опасные химические вещества, поскольку в присутствии кислорода воздуха
может происходить радикальноцепной процесс, приводящий к образованию пере-
кисей — неустойчивых и взрывоопасных соединений. Такой процесс носит назва-
ние автоокисления и происходит не только в случае простых эфиров, но также со
многими альдегидами и углеводородами. В общем виде эта реакция может быть
представлена приведенными ниже стадиями инициирования (I), развития цепи (2i
и 3) и обрыва (4).
(1) RH—>R« (Н* связывается инициирующим агентом)
(2) R.+O2—+ROO.
(3) ROO. + RH—>ROOH + R.
(4) R.-pR.^RR
Стадии инициирования и обрыва цепи могут: осуществляться рядом способов и не
во всех случаях изучены достаточно подробно. Суммарный результат деструкции
соединения обусловлен стадиями развития цепи (2) и (3). Широко используемые
простые эфиры, такие, как тетрагидрофуран и диоксан, часто оказываются загряз-
ненными перекисями, которые образуются в результате автоокисления при дли-
тельном хранении и контакте с воздухом, а также на свету. Перед использованием
простых эфиров часто оказывается необходимой очистка от перекисей; при пере-
гонке эфиров всегда должна соблюдаться осторожность, поскольку остаток после
перегонки может содержать взрывчатые перекиси в опасной концентрации.
13-11. Циклические простые эфиры
Простейший циклический эфир — окись этилена — служит ис-
ключением из сделанного выше обобщения, согласно которому боль-
шинство простых эфиров устойчивы к расщеплению, В этом соеди-
нении трехчленный цикл, подобно циклопропану, является »высоко-
напряженным и легко раскрывается в мягких условиях, Важное
значение окиси этилена связано с легкостью, с которой он пре-
вращается в другие важные соединения, например этиленгликоль,
диэтиленгликоль, целлозольвы и карбитолы, диоксан, этиленхлор-
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
447
тдрин и полимеры (карбовакс),
сн
HtO
НОСН3СН2ОН
этиленгликоль
—— (НОСНаСН2)2О
н®
ди этиленгликоль
СН.Ч .
< Ча—СНг—
СН4ОН
------► носн2сн2осн.
——* снэо (CHS)2 О (СН2)г он
н®
метилцеллозольв
метилиарбитол
3
Н®
,сн2-снзх
уО
СНз-CHZ
диоксан
на
-----> С1СН2СН2ОН
этилснхлоргидрин
основание
--------> но-(-CHjj-СН2 —О —н
карбовакс
Ченее известный четырехчленный циклический эфир, окись три-
метилена (СНа)зО, также расщепляется легко, однако труднее,
чем окись этилена. Окись тетраметиЛена (тетрагидрофуран) пред-
। тавляет собой сравнительно устойчивое соединение, которое
смешивается с водой и обладает ценными свойствами в качестве
органического растворителя, Он часто используется вместо диэтило-
вого эфира в реакциях Гриньяра и при восстановлении литийалю-
мннийгидридом (разд. 12-2,А).
13-12. Оксираны
А. Получение.
Трехчленные циклические простые эфиры имеют важное зна-
чение в. качестве реакционноспособных промежуточных соединений
при органических синтезах, как уже отмечалось в случае окиси
этилена. Такие соединения часто называют окисями алкенов, Как
класс, они носят название оксиранов или эпоксисоединений.
СН3 Н
окись пропилена
(ыети.чоксиран)
Сен6 н
С-С
/х/\
н о н
окись стирола
(феннлокснран)
СН3 СНз
окись циобутена-2
(2,3-димстилоксиран)
448
ГЛАЗА 13
Наиболее важный метод получения эпок си соединений основан
на окислении, или «эпоксидировании», алкенов при действии над-
карбоновых кислот RCOQOH*. Конечным результатом реакции
является присоединение кислорода по двойной связи; этот процесс
происходит только цис-способом.
три нс-бутен-2
О Н СН3
+ CF3C00H —s- ЧС-(/ + CF3COOH
трифторнад- /\/\
уксусная СН= О Н
кислота .
окись транс-бугена-2
Упражнение /5-/5, Напишите механизм взаимодействия щрпмс-бутена-2 с три-
фторнадуксусной кислотой; механизм должен соответствовать тому факту, что
скорость имеет первый порядок но каждому из реагентов и приводит к продукту
нс-присоединения.
Оксираны могут быть получены также из хлор- или бромгид-i
ринов в присутствии оснований
Эта реакция может служить примером нуклеофильного замещения такого ти-
па, при котором нуклеофил является частью той же молекулы, в состав которой
входит уходящая группа. Внутримолекулярное $ м2-замещен не происходит значи-
тельно быстрее, чем аналогичное замещение с участием алкилгалогенидбв. и алко-
голят-нонов, действующих извне; причина этого, несомненно, заключается в благо-
приятной для реакции близости нуклеофила.
Существует большое число других интересных примеров увеличения скорости
Sh-реакций, обусловленного замещением при действии соседней нуклеофильной
группы. Такие реакции не Во всех случаях приводят к циклическим продуктам,
поскольку последние часто оказываются неустойчивыми и разрушаются в ходе вто-
рой реакции замещения/Ярким примером такого процесса служит замещение бро-
* Реакция'Н. А. Прилежаева,— Прим, ред.
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
449
яа на аиетаттИон ;в,1)ирци транс-2-бромциклогексил ацетатах (XII цХШ).
CHjCO^Ag®
ficSfl.CHjCOiH
ХЦ
CHjCO,® леф
беэв. CHjCOjH
ХП1
транс-Изомер (XII) не только реагирует гораздо,быстрее, чем цис-изомер
(XIII), но и стереохимия этих реакций совершенно различна! цис-Изомер реаги-
рует нормально и дает с обращением конфигурации транс-ди ацетат (XIV), в то
цремя как транс-изомер также реагирует, образуя XIV, откуда следует, что реак-
ция этого изомера происходит с сохранением Конфигурации. Эти факты служат
серьезным свидетельством в пользу того, что атом брома в соединении XII заме-
щается с участием Ag® и соседнего ацетатного остатка с образованием промежу-
точного иона«ацетоксония» (XV); этот последний атакуется далее ацетат-ионом из-
вде, что дает конечный продукт реакции. Эта последовательность превращений
XII
. ф
Ая
1-АдВг)’
включает две стадии инверсии, суммарным результатом которых является сохра-
нение конфигурации. В противоположность этому ццс-изомер реагирует с меньшей
скоростью, поскольку соседняя ацетатная группа не оказывает содействия в ходе
замещения (для осуществления такого содействия атака должна была бы происхо-
дить с той же стороны кольца, с которой удаляется бромид-ион).
Упражнение13-16,Прк проведении реакция как цис-, таципгранс-З-бромцикло-
гекс ил ацет ата с.,ацетата м, серебра во .влажной уксусной к ис лоте обр азу огея сме сь
моно- и диацетатов, .которая при гидролизе дает'только-ч«с-цйкл6гександйбл-1,2.
Объясните, каким рбразоьгэтот процесс ‘может-'йроисходить.с:участием соедине-
ния XV в (качестве промежуточного соединения.
15 W 1640
4'50
ГЛАВА 13
Упражнение 13-17. Какое из соединений в приведенных, ниже парах будет, по
вашему мнению, реагировать быстрее с гидроксил-ионом?
в) НОСНгСНгС1
но С1
И
и
и
НОСНгСН-СН=СН2
продуктов, образования которых
(воспроизведите стереохимию про-
Упражнение 13-18. Напишите структуры
можно ожидать s приведенных ниже реакциях
дуктов).
СН}СО2® Ag®
беэв.СН3СОгН
(оптически активный)
Б. Раскрытие кольца оксиранов
В отличие от большинства простых эфиров оксираны реагируют
со многими сильными нуклеофильными агентами. Эти реакции не
отличаются от ранее описанных случаев нуклеофильного замеще- •
ния (гл, И), за исключением того, что уходящая группа, в данном;
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
451
случае кислород окисного кольца, является частью молекулы,
претерпевающей замещение, Стереохимия этого процесса -нахо-
дится в соответствии с 8к2-механизмом — в месте атаки происходит
обращение конфигурации. Так, окись циклопентена.дает продукты
транс-конфигурации.
окись циклопентена
На практике реакции расщепления большинства эпоксидных
циклов проводят в кислой среде. При этом сначала образуется ион
оксония; одна из возможностей дальнейшего его превращения со-
стоит в атаке нуклеофила, происходящей по типу 5к2-замещения.
Это следует не только из данных по стереохимии процесса (резуль-
татом которого обычно является обращение конфигурации), а также
из того фзкта, что скорость зависит от концентрации галогенид-
иона. .
Упражнение 13-19. Напишите выражение для скорости реакции раскрытия
кольца окиси этилена в ацетоновом растворе, содержащем НВг и NaCl,
При раскрытии эпоксидных циклов в водном растворе в присут-
ствии кислоты образуются 1,2-гликоли. Как упоминалось выше,
этиленгликоль получают этим способом в больших количествах из
окиси.этилена.
Vfi2 — ип а-г ' к>П2—^па
\/ X/ ‘-н >4 6н
О -.-Q©
А
Некоторые катализируемые кислотами реакции сольволиза
эпоксисоединений протекают, по-видимому, по SN1 -механизму о
15*
452
ГЛАВА !,Ч
СПИРТЫ И ПРОСТОЕ ЭФИРЫ
453
промежуточным образованием карбониевых ионов, Это лучше всего
видно на примере реакций несимметричных а-окисей. Например,
можно ожидать, что окись пропилена будет атаковаться по пер-
вичному углероду в случае реакции SN2 и по вторичному углерод-
ному атому при реакции Ssl.
И® CfHsOH СН3СН-СН2ОСаН(
сн3сн—сн2 СН3СН-сн2 ——Ь
X / -ч / 01’1
о®
I
н
окись пропилена
снэ -сн —сн. снаен -сн2он
@ I 1
Он °CjHs
(основной продукт
• реакции)
Поскольку приведенная выше реакция
нолем приводит главным образом
ричиом углеродном атоме, можно
окиси пропилена с эта- 1
к продуктам замещения при вто- )
, ____сделать вывод, что в этом случае !
преимущественно осуществляется механизм 5>-1-типа, .1
Упражнение /3-20. Напишите структуры продуктов, образования которых
можно ожндйть.в приведенных ниже реакциях (укажите в тех случаях, когда эта
необходимо, стереохимию продуктов).
а) СН3СН-СН3+СЩО®~ь
ч • *
. И1
в) о с
Р-ЗС-
+ СН3О®
Дополнительные упражнения
/3-2/. Напишите структурную формулу для каждого из приведенных ниже со-
слинений;
ж а) брбмметил-1,2-днмети л циклопропил кетон
б) дивинилметилкарбин ил кетон
в) 4^бром-2-метйлбутиН-Э*аль
г) дианетнлацетилен
д) смешанный ангидрид а.Р-диметил масляной и уксусной кислот
е) 31аиетилццклогексен-2-он
,13-22, Реакция метилацетата с водой, приводящая к образованию метилового
спирта и уксусной кислоты, катализируется сильными минеральными кислотами,
например серной кислотой. При проведении гидролиза в воде, содержащей 1в0,
пбмеи приведенного ниже типа происходит быстрее, чем образование метанола,
н® ‘J°
СН3-се 4-Н’е0^±СНа-С^ J-H.o
О-СНа
При гидролизе в этих условиях сспсршенно Ееббразуется метанола-^О (CHalsOji).
а) Напишите стадийный механизм, согласующийся с фактом кислотного ката-
тиза и результатами опытов по проведению гидролиза в’вода-18О. Укажите мед-
|снные и быстрые стадии реакции.
б) Почему в данной реакции превращению подвергается метилацетат, хотя в
отношений легкости присоединения протона свойства его и воды сравнимы? рас-
। мотрите возможные пути присоединения протона к метилацетату'и определите,
какой из них наиболее предпочтителен. Приведите ваши соображения,
в) Объясните, каким образом высокая концентрация серной кислоты может
[Снизить скорость реакции.
(3-23. Укажите, каким образом можно синтезировать каждое из приведенных
ниже соединений, основываясь на указанных исходных органических веществах
н любых необходимых органических й неорганических реагентах. Укажите ре-
агенты и условия реакций.
а) СН3СН2СНЙ(СН3)2С1 из СН3СНгСН,ОН
б) CHsCHsCHCHaCH3 из CHjCHjQH
А—С—сн3
н сн,
сн3
в) CHS
с-.сннодон и®
в) (СНМН-СЩВг из (СИССОН
г) СН3СН2СНСНа из СН3СН2СН2СН2ОН
dso3H
д) СН3СНЙС(СН3)2СНО нэ (СН3)3С(ОН)СНаСНэ
е) CH3OCHsCH2OCHa из этилена
; + НВг
Д) Н0СН,СНаСН3СНэС1 —'NaaC<^
цис
СН3
а) СН3 — С— СН2
сн3
транс
сн8
СН* из CHS—С—ОН
1
сн*
454
ГЛАВА 13
и) СНа - СН - СН3 ИЗ CHSCH,CHL.OH
\о/
к) (СН2==СНСНг),0 из CH3=CHCHSC(
/3-24, Ди-трет-бутиловый эфир неустойчив при действии кислых агентов. Опи-
шите синтез этого соединения, который, но вашему мнению, имеет наибольшие
шансы на успех. Приведите ваши соображения.
/3-25. Какова должна быть степень отщепления в направлении метильных групп
но сравнению с отщеплением в направлении метиленовых групп в случае Ei- и
Е2-реакций 2-мет и л-2-бут ил хлор и да и 2-метил-2-бутил-3-О-хлорида? Приведите
подробное объяснение,,
13-26. Укажите для каждой из приведенных ниже пар соединений химическую
пробу (желательно пробирочную реакцию), которая позволит различить эти два
соединения. Напишите уравнения для каждой реакции.
СН3 СН3
I I
а) СН3—С—СНЭ и СНЯ—С—СН„ОН
С)Н А
б) СН3 = СН-СН2СН2ОН и СНаСН=СН-СНгОН
СН3 снэ
в) СН3-С-СНЕОН и СНз-СН-СН2СНгОН
' I
Снэ
г ) CH3CH2-O-S03-0-CH2CH3 и СН3СН3СН3СН3-0—SO3H
о а
II Ji
д) СН3-С-С( и CfCH2C-OH
WQ о
II II
е) СН8 — С -ОСН3 И СН3-С-,8ОСН3
сн3 сн3
5K)CH3-(i-O-CrOsH и СНа—С—СН2—О—СгОэН
СН®- н
з) СН2—СН—СН3 И сн2—СН2—СН2
JI' I Е
он он он он
сн3
и) Нзс/ /О и
сн/
снэсн-сн2
455
СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
сн3 сн3
I 1
к) СН3—С—СН2—О—СНа—С—СНа и
Агя сн3
СНЭ СН3
СНа —С—О—СН2—СН2 — С—СН3
* . - СН3 Лз8 ,
/3-27. Пусть вы имеете сосуды (без этикеток), в каждом из которых содержится
одно из следующих соединений; пентанол-1, пентанол-2, трет-амиловый спирт,
пентен-3-ол-1, пентин-4-ол-1, ди-н-бутиловый эфир и i-пентилацетат. Укажите,
каким образом можно, используя простые химические пробы (ограничиваясь толь-
ко пробирочными реакциями), установить содержимое каждого из сосудов.
/3-28. Как трет-бутиловьги спирт, так и изобутилен при обработке концентриро-
ванной серной кислотой и перекисью водорода дают смесь двух жидких соедине-
ний (А и Б), отношение количеств которых Зависит от того, что присутствует в из-
бытке — перекись водорода или исходное органическое вещество. Оба соединения
достаточно устойчивы; формула соединений А — С^Н10О2, тогда как Б — СаН13О2.
Взаимодействие А и Б с водородом над никелевым катализатором приводит
к количественному превращению каждого из этих соединений в mpem-бутилозый
спирт. Соединение А реагирует с галоген ангидридами и ангидридами кислот, тогда
как Б инертно по отношению к этим реагентам. При взаимодействии 1 моля А с из-
бытком метил маг ний ио ди да в растворе диэтиловбго эфира образуются 1 моль ме-
тана и по 1 молю трет-бутилового спирта и метанола. 1 моль Б с избытком метил-
магнийиодида дает1 моль метил-трет-бутилового эфира и 1 моль mpem-бутилового
спирта.
При нагревании Б с хлористым винилом последний полимеризуется. Если на-
гревать один только Б, то получаются ацетон и этан, а при нагревании его в при-
сутствии кислорода образуются метанол, ацетон, формальдегид и вода.
Установите, исходя из приведенных выше данных, структуры А и Б, Напиши-
те уравнения для всех упоминавшихся реакций, указав для каждой механизм и
имеющие существенное значение промежуточные соединения. Напишите по край-
ней мере по одной структуре для А и В, которые изомерны установленным вами
структурам, и укажите, как должны вести себя эти вещества в каждой из перечис-
ленных реакций.
/3-29, Опишите в основных чертах ЯМР-спектры приведенных ниже соединений
н укажите (приближенно) величину химических сдвигов.
а) изобутиловый спирт-}-следы Н®
б) неопентиловый спирт
в) мет и л-fl-мети л в ин иловый эфир
г) трет-бути левый спирт
д) трет-бутиловый спирт в четыреххлористом углероде
е) 'СР3СН2ОНф-следы Н® (спектр протонов)
ж) CFaCH2OH4-следы Н® (спектр атомов фтора)
/3-30, Укажите, каким образом Для смеси СН3СН2ОН, CH3CD2OH и CHD2CH2OH
вы можете установить, в какой пропорции присутствуют эти соединения, исполь-
зовав ЯМР- и масс-спектроскопию (при их совместном применении).
/3-3/. Рассмотрите ЗлБ и ЕI -сольволиз дейте ро - трет ^б у тил хлор и да (CDa)3CC!
в водном растворе. Какой, по вашему мнению, должна быть общая скорость об-
разования хлористого водорода в случае дейтерированного хлорида по сравнению
с обычным хлоридом? Что можно сказать об отношении продуктов SnI- и Е1-реак-
ций? Объясните,
ГЛАВА 13
4;
13-32. Гидроборирование Ьфенилциклогексена с последующим окислением про-
межуточно образующегося борана перекислю водорода приводит к соединению,
структура которого, как можно ожидать; должна быть следующей;
Каким образом эы можете убедиться в том, что предложенная структура является
правильной?
ГЛАВА
14
. АЛЬДЕГИДЫ И КЕТОНЫ.
РЕАКЦИИ КАРБОНИЛЬНОЙ
ГРУППЫ
Химия карбднильных соединений представляет собой «становой
хребет» синтетической органической химии. Эти соединения рас-
сматриваются в трех главах. В данной главе будут рассмотрены
методы, синтеза, простых альдегидов и кетонов и затем реакции
альдегидов и кетонов, которые затрагивают только их карбонилы
ную группу. В гл. 15 основное внимание уделено способу, которым
карбонильная функция активирует группы при соседних углеродных
атомах. В гл. 16 будет обсуждена роль карбонильной группы в
реакциях карбоновых кислот й их производных. В ходе всего обсуж-
дения будет уделяться внимание различию в свойствах карбонильных
групп различных типов и корреляции свойств с электронными, а
также пространственными эффектами.
14-1. Получение альдегидов и кетонов
В предыдущих главах был рассмотрен ряд реакций, являющихся
удобными методами получения альдегидов и кетонов, в том числе
реакции озонирования алкенов и гидратаций алкинов. Эти, а также
другие'методы получения суммированы в табл. 14-1 и 14-2. Здесь
будут упомянуты только1 немногие, сравнительно общие методы,
которые ранее не рассматривались.
А. Окисление 1,2-диолов и алкенов
Альдегиды и кетоны во многих случаях могут быть получены
путем окисления алкенов до 1,2-диолов (разд. 7-8,Б) с последующим
окислительным расщеплением 1,2-диолов тетраацетатом свинца
Таблица 14-1
Реакция
Общие методы получения альдегидов а
Примечание
1. Окисление алкенов озоном
f. О,
RCH = CH2---->RCH04-H2C=0
3. н,
I оа, CHsCOtG,H;. -20 °C /''run
----------------------- сно
2. Н,—Pd I CHO
адипиновый
Диальдсгнд
2, Окислительное расщепление гликолей
ь №Ю,
МН* РЬ.оеосна/ «сно+н.с-о
но он
ЦИКЛО
гексен
См, разд. 7-8,А; имеет ограниченное синте-
тическое применение; используется для уста-
новления положения двойных связей при ис-
следовании структуры
См, обсуждение в разд, 14-1,А
С НГМ ГНГЫ рь<ососн>)<
CeHsCH^HCHj ---------------> CeHsCH2CHO-J-H2C=O
< I Фенил ацетальдегид
но но
3-фенилпропан-
днол-1,2
3. Окисление первичных спиртов
• [О]
rch2oh —’ RCHO
а) хромовой кислотой
сн3сн2сн,он
пропанол-I
tta2CrtO7
H,SO,
CH3CHaCHO
пропионовый
альдегид
См, гл, 13; используется для получения ле-
тучих альдегидов, так как дальнейшее окис-
ление может быть предотвращено путем от-
гонки продукта из реакционной смеси
б) алкоголятами алюминия (окисление по Оппенауэру)
' Al(Ai3₽-ObfHf}s ч
(СН ХС= снсн 2сн,сн „он + свн ьсн = снсно-------------------------------
1 5-метял гекеен-4-ол коричный альдегид
—*.(CHa)eC==CHCHsCHaCHO+C«HsCH=CHCHaOH
б-’метилгексен- 4 -аль
См. разд. 13-7 и’ 14-6,А; часто используется
в случае низкокипящих альдегидов, которые
можно отгонять по мере их образования, чтобы
избежать реакций конденсации, В качестве
катализаторов используются изопропил ат или
mpem-бутилат алюминия; двойные углерод-уг-
леродные связи не подвергаются атаке
4, Восстановление ацилхлоридов па Розенмунду
RCOCI =—> RCHO
H„Pd-BaSO4
Г H ГН«С С1 "—► СвНбСН2СНО
6 6 2S толуол, 125 °C фенилацеталь-
Дегид
1-фенилацетил-
хлорид
См. обсуждение в разд, 14-1,Б; катализа-
тором служит палладий на BaSO4 в присут-
ствии серы
5. Восстановление литийалюминийгидридом
См. обсуждение в разд, 14-6,А
а) нитрилов
1L1A1H,,
2. Н®, НгО
c.Hs -
сно
1-феиилцнклонропаИ‘
карбонитрил
1 -фе нн лцикл опронан-
карбоксальдегвд
.реакция
Продолжение табл, /4-1
Примечание
б) амидов
О
< >-С~К(СНЛ
NrN -днметнлциклогексан-
к арбоксаыид
LiAlH^ 2С,НЙОН
эфир
Циклогексаякярбокс*
альдегид
Эффективным восстанавливающим агентом
является Li [А1Н2(ОС2Н5)2], который действует
более мягко и не восстанавливает альдегид в
спирт; амид должен быть третичным
в) ацилхлоридов
О
LIAIH[OC(CH,).J,
—78 ‘С
—GHO
Восстанавливающий агент получают из LiAiH4
й wpem-бутилового спирта; он более мягкий
восстановитель, чем LiAlH4 (см. метод 5, б);
наиболее подходящим растворителем является
диглим (CHSOCH2CH2)..O
11
—с—а
хл о ранги ДР ид
циклогексаикар-
€ю повой кислоты
6. Присоединение реактивов Гриньяра к зтимртоформиату
СН3(СН2)4М8Вг4- НС(ОС2Нб)э —- СН3(СН2)4СН(ОСгНв)24-С2Н5ОМбВг
н-амнлмагнийбронид дизтилацеталь я-гексанали
HCI, Н,0
WCHjhGHfOq.Hs);. —----------► СН3(СН2)4СНО
н-гексаналь
См. гл, 13; продукт присоединения представ-
ляет собой ацеталь, который гидролизуется
разбавленной кислотой: до альдегида
7. Присоединение лзета.мооргшишео.и’с соединении к диметилформамиду
ft н® но
Г \\ . Г ЙЙ -н Г Н1М». / у
8. Гидратация алкинов
НС=СН4-Н;О —-— ---------->- lHs,G—СНОН] * СН3СНО
ацетальдсп
ацетилен
9.
сульфита, ацфгали,"охсииы~осяовапия Шиффа, 'гидразоны и еемикар-
бизоны
См. обсуждение в гл. 12 (разд, 12-4,В):
основными продуктами присоединен к я RMgX
к HCON(CH3)„ часто являются третичные амины
R2CHN(CH;,)/
•Промышленный способ' получения ацеталь-
дегида; см. гл, 8
Более пригоден для очистки, чем для полу-
чения альдегидов
10 Окисление первичных галогенидов или зфиров п-толуолсулъфокислоты
AgGTs (СПз),*0. !50 “С.Змак
STS CH.™.OTS --------------------------’ “.(СНЛСНО
1епт11Л11ОД>1Д
NaHCO,
Галогенид превращается в эфир птолуол-
сульфокислоты (сокращённо OTs), который окис-
ляется диметилсульфоксидом
а Получение ароматических альдегидов описано ъ тя. ДО.
Таблица 14-2
Общие методы получения кетонов
Реакция
Примечав ве
1. Окисление вторичных спиртов
[О]
R*CHOH R3C=O
См._ гл. 13
а) хромовой кислотой
\-сн-сн3
он
мети л цм к л оге ксил -
карбинол
NajCrjOy
H.SO*
о
Он
-С-СН-,
мети лц и к л о гекр и л-
кетон
б) окисление по Оппенауэру
ОН О
I II
i rr Al (uao-OCjF,),
- ^J+fCHACHOH
сс-деканол ацетон ci-декал он
(избыток)
2. Окисление алкенов
[OJ
RoC—CR3™-> Ro^=0
а) озоном
СН,
I 1.О., СН.С1-, —78 “С „
CHaCH2CH2CHaC = CHa-----------------н СН3СН,СН2СН2ССН3+СН2 = О
2. Zn. Н,0 II
о
б) через 1,2-еликоли
/СН*\ оюТ /СН2х/0Н
но2с-сн с=сн,—* но,с-сн с
VhZ L 'чсн2/"чсн2он_
3-мети ленци к л обутан к а р-
боновая кислота
/СНз^
----► HOSC—СН С=О
'чсн,/
NalO.
3- кетоцикл обута нка рбрнов а я
кислота
3. Расщепление $-кетоэфиров
? и®, н,о
сн3соснсо2с2н5;---------- снэсосн^+соа+сан6он
алкнлацетоуксусный
эфир 1
4. Присоединение металлоорганических соединений к кратным связям
а) к нитрилам
сн, сна сна сн, о
СеН6СНС •>N CeHjcH—С=NMgBr СвН^Н—CCH,
2-фенилпрооио* З-феинлбутанов-2
нитрил
См. разд. 7-8, А и метод 1, табл. 14-1
См. обсуждение в разд. 14-1, А и ме-
тод 2, табл. 14-1
j
к
। Этот важный метод основан на рас-
щеплении р-кетоэфиров; см. гл. 16
I Обсуждение этой реакции см. в гл, 12
Продблжн йе табл. 14-2
Получение ароматических альдегидов и кетонов описано в гл. 22 п 26.
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ 465
ЭИ РЫОгССН,),
ЗН2ОН Naioj *
+
СНгаО
или перйодатом; натрия. Например:
н2о2,
нсо,н
I ..
(WQ1 нейтраль -
НЫй КМп%)
Расщепление гликолей при действии: этих реагентов обычно про-
исходит ’с хорошим выходом; стехиометрические отношения при
этом следующие
^>С-С <4 Pb(O2CCHs)4 — 2^>С=о+ РЬ(ОаССН3)2 +• 2СНэСОгН
онАн
J ^-~C<^+Nal0*—*2^>C = 04-Naip8+-Ha0
ОнАн
Изящная Модификация ДвухстаДийного метода, при которой не требуется вы-
деления Глйколя, состоит в следующем: в качестве катализатора используется
перманганат-калия, что> приводит к окислению алкенов при действии перйодата
натрия непосредственно в карбонильные соединения. Этот метод основан на сле-
дующем: перйодат натрия, несмотря на то что он,является достаточно си.-ышу.
окислительным агентом, приводящим к окислению маргайца из более низкого
окислительного состояния до перманганата, не реагирует с двойными связями.
Сначала под действием перманганата (в низкой концентрации) двойная связь ги-
дроксилируется, а затем образовавшийся диол расщепляется перйодатом, что
приводит также к регенерированию перманганата из восстановленного соеди-
нения марганца. В аналогичном методе используется четырехокись осмия и
перйодат натрия; приэтом четырехокись осмия гидроксилирует двойную связь
и затем регенерируется перйодатом. Ниже приведен типичный пример такого
превращения.
НО2С-< >СНг
NaiOx
(ОзО0
Упражнение 14-1, Напишите, механизм окислительного расщепления 1,2-дио-
лов тетраацетатом свинца и перйодатом, натрия (учтите рассмотрение механизма
окисления хромовой кислотой, разд. 13-7). *
Б. Восстановление карбоновых кислот
до альдегидов.
Превращение карбоновой кислоты в альдегид путём прямого
восстановления осуществляется с трудом, поскольку кислоты .обыч-
но' восстанавливаются труднее, чем альдегиды. Таким образом,
проблема заключается в том, чтобы предотвратить при реакции
слишком глубокое восстановление.
Наиболее широко используемые методы основаны на превраще-
нии кислоты либо в производное, которое восстанавливается легче,’
466
ГЛАВА 14
чем альдегид, либо в соединение, из которого может быть получен
альдегид. В так называемом восстановлении по Розенмунду осу-
ществляется первая из этих схем: кислота превращается в ацил-
хлорид, н последний восстанавливается водородом над. палладие-
вым катализатором в альдегид; выходы достигают 90%. Скорость
восстановления альдегида в соответствующий спирт поддержи-
вается низкой, что достигается отравлением катализатора серой.
SOC1, н,
RG02H----> RCOC! —•* RCHO + НС1
Упражнение 14-2. Рассчитайте значения &-Н для восстановления СН3СОаН
и СН3СОС1 водородом (с образованием СН3СНО) и восстановления СН9СНО
в СН3СН2ОН (используйте любые необходимые данные, приведенные в табл, 9-3);
сравните эти значения. Как будет, но вашему мнению, восстанавливаться
СН3СОЬ1Н2 в альдегид — легче или труднее, чем СН3СОС1? Почему?
Восстановление кислоты в соединение, которое может быть
превращено в альдегид, удобно проводить с помощью литийалю-
минийгядрида; в реакцию восстановления при этом вводится нитрил
соответствующей кислоты. Приведенная ниже схема иллюстри-
рует последовательность осуществляющихся при этом синтезе
реакций (начиная с кислоты).
SOClj NH3 РОС!,
RCOoH---i- RCOC1 —* RCONH»--
Н н ' н
L1AIH, | Н,О I Н®. Н,О I
RCisN----4R—C=N~Li)-------R-C=NH---------> RC=O
Стадия восстановления обычно дает хорошие результаты только
в том случае, если используется обратный порядок добавления
реагентов, т. е. раствор литийалюминийгидрида добавляется к
раствору нитрила в эфире, желательно при низких температурах.
циклопропан
Карбоиш рил
LiAlHj И®, НгО
(СгН5)гО, -50’С
циклопропанкарбокс-
альдегид
" (70%)
При добавлении нитрила к литийалюминийтидриду продуктом
восстановления оказывается первичный амин RCHaNHa (разд.
16-7,В). *
Б, Перегруппировки 1,2-гликолей
Удобным способом синтеза многих карбонильных соединений
могут служить катализируемые кислотой перегруппировки 1,2-
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ 467
гликолей, так называемые пинакон-пинаколиновые перегруппи-
ровки
R д.- R 1
- I I н® I
* —С-С----к-с-С— 4-н2о
R = алкил, арил или водород
•Реакции этого типа в своих, основных чертах сходны с пере-
группировками карбониевых ионов (разд. 11-14 и 13-6,Б). Функ-
ция кислоты заключается в протояировании одной из групп ОН
и превращении ее таким образом в более легко удаляющуюся
группу. Образующийся карбониевый ион может затем перегруп-
пироваться путем миграции соседней группы с ее парой электронов,
что приводит к новому, более стабильному соединению, содержа-
щему двойную связь углерод — кислород.
Примером может служить имеющая важное значение перегруп-
пировка пинакона в пинаколин
\ 3 -да<«ълбугандиол-2,3
(ПВДакоц)
СН3
-----> CHj-C-C-CHj
О СН,
СН3 СИ, СЩ СП,
СНу-е^—С-СН, ''ВД- ->
ОН OHj <он ®
ф
-нФ
сн,
СН3-С-----i-GH,
фон ё:нг
3,3 - дим етилбута н он.2
(пинаколин)
Алкены могут быть превращены в карбонильные соединения с
тем же числом углеродных атомов путем гидроксилирования с
последующей перегруппировкой. Таким образом, изомасляный
альдегид получают из изобутилена в промышленном масштабе
сн3 сн9 сн3 сн3
I ci, | и,о j и® I
СНз — С=СН3 —СН,—С—СНз —• сна—с—сня —>сн3—с—сно
II II I
Ct Cl он он н
Упражнение /4-3. 'Катализируемая кислотами перегруппировка изобутилен,
гликоля в том виде, как она приведена выше, приводит к изомасляному альдеги-
ду. Можно ли ожидать в качестве сопутствующей реакции образования некоторого
количества мет ил этил кето на? Объясните.
Упражнение 14-4. Вычислите Д/Г для перегруппировки пинакона в пинаколин
в газовой фазе при 25 °C.
Упражнение /4-5, Образования каких продуктов можно ожидать в результате
катализируемых кислотой перегруппировок пропанднола-1,2 и 2-метн лбу тан ди-
ола-2,3?
468
ГЛАВА Г4
Упражнение 14-6. При действии кислоты на окись тетраметйлэтнлена 1
(СН»)2С —С(СН»)2 образуется пинаколин. Объясните, : 1
Упражнение 14-7. Каким образом можно дегидратировать нинакоя в 2,3-диме-'
тилбутадиен-1,3, избежав образования при этом процессе значительного количе-
ства пинаколина? !
Упражнение 14-8, Сильная кислота превращает 1,1-дифенилэтандиол-1,2 сна-
чала в дифенил ацетальдегид и затем (более медленно) в бензилфенилкетон (1,2-
дйфёнвлэтанок). Объясните, почему можно ожидать, что кинетический и термоди-
намический контроль в этом случае приведет к различным'продуктам.
Г, Перегруппировки гидроперекисей
Метод получения карбонильных (и гидроксилсодержащих) сое-
динений, приобретающий все большее значение, особенно для
промышленного производства; заключается! в перегруппировке
гидроперекисей алкилов
I н® \
R—С—О—О—Н —*R—ОН 4- ^С=О
.[ / ч
R = алкил, арил или водород
В некоторых случаях перекиси могут быть получены прямым
окислением углеводородов кислородом воздуха, а в других слу-
чаях — путем происходящего под действием серной кислоты при-
соединения перекиси водорода (Н—02Н) к двойным связям. (Сле-
дует заметить, что в муравьиной кислоте перекись водорода реа-
гирует иначе и присоединяется в виде НО—ОН; разд. 7-8,о.)
сн» ' :: сн3 ’ '
: ^^X-d-H^Os^^VJ-O-O-H
сн» сн»
сн» сн» сн» ; сн»
СН» - С1-СН»--С~ СН» -Г Н»02 СН» - i-CHs- t-сн»
1 сн» СН» 6-0-Н
Перегруппировки гидроперекисей катализируются кислотами; они анадо-
гичнь! перегруплиройкам карбониевых исков, но на промежуточной стадиа вместо
положительно зйрйжейногб углерода образуется положительно заряженный кно
АЛЬДЕГИДЫ И КЕТОНЫ, РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ 469
В принципе к положительно заряженному кислороду может мигрировать как
фенильная, так и метильная группа, однако в данном случае происходит миграция
только фенила. В родственных по характеру перегруппировках, при которых фе-
тильная группа может мигрировать конкурентно с метильной группой, также пре;
обладает миграция фенила. '
Упражнение 14-9. Напишите уравнение для катализируемой кислотой neper
группировки гидроперекиси 4,4-диметил-2"пептнла н укажите, какие продукты
преимущественно образуются при этом.
14-2. Карбонильные группы альдегидов
п кетонов
А.- Сравнение с двойными связями .
углерод—углерод ;
Связь углерод — кислород является одновременно более проч-
ной и более реакционноспособной двойной связью. Энергия- этой
связи (179 ккал) значительно больше, чём энергия двух простых ’
связей’ углеродкислород (2-85,5 ккал), в противоположность
двойной связи углерод — углерод (145,8 ккал), прочность которой
меньше прочности двух простых , связей' углерод — углерод
(2-82,6 ккал) *. Различия в реакционной способности хорошо иллю-
* Возможно, что большая прочность связи С==О объясняется более сильным
отталкиванием между неподеленными электронами в случаекислорода, связан-
ного простыми1 связями, по сравнению с кислородом, входящим в состав двойной
связи; Соображения, которые можно привести в пелиту такого объяснения, сходны
в определенной степени с теми, которые йспользовалйёь ранее при объяснений
кислотных свойств ацетилена (разд. 8-6}. : . J, ’
470
ГЛАВА 14
стрируются на примере реакции гидратации I
CHa = 0+H2O^ZtCHa-O I
Jh а I
СН3=СНа + Н2О^СНа-СНа I
Ан I1! 1
Формальдегид быстро присоединяет воду при комнатной темпера- j
туре без добавления катализатора (эта реакция обратима); в то же я
время присоединение воды к этилену в отсутствие очень сильных ]
катализаторов кислотного характера не происходит, несмотря 1
даже на то, что константа равновесия этого процесса существенно
больше. |
Повышенная реакционная способность карбонильной связи !
обусловлена прежде всего различием электроотрицательностей '
углерода и кислорода, приводящим к значительному вкладу резо- :
нансных биполярных форм, где кислород заряжен отрицательно, s'
а углерод — положительно. ’
у=о , , Ф. n g>
/3=0 <—► о;v - /С—О
Можно ожидать, что полярность карбонильной связи сделает более
легким присоединение к ней воды и других полярных реагентов
И «6 «6 ед :
типа Н—X и R—MgX по сравнению с присоединением этих же реа- ;
тентов к двойным связям алкенов. Однако следует всегда иметь :
в виду возможность того, что, несмотря на большую скорость при-
соединения по карбонильной группе, константы равновесия этих .
реакций могут быть небольшими вследствие прочности карбонильной
связи.
Полярность карбонильной группы обусловливает многие из
свойств альдегидов и кетонов. Температуры кипения для низших .
членов этих рядов на 50—80° выше, чем для углеводородов той же
молекулярной массы; это можно видеть из данных табл. 14-3 (фи- •;
зические свойства альдегидов и кетонов) и табл. 3-3 (физические
свойства н-алканов). Дипольные моменты большинства альдегидов
н кетонов близки к 2,7 Д, что соответствует 40—50% ионного
характера связи в карбониле. Для альдегидов и кетонов с низкой
молекулярной массой характерна большая растворимость в воде.
Б. Спектральные свойства
Колебательные частоты карбонильных групп альдегидов и
кетонов в инфракрасных спектрах обычно лежат в интервале 1705—
1740 см-1, и в соответствии с полярностью карбонильной двойной
связи интенсивность поглощения оказывается гораздо большей,
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ
471
Таблица 14-3
Физические свойства альдегидов и кетонов
4 Соединение Формула Т» пл,, «С Т. кип., °C d^, г/смэ
* Формальдегид СН2О —92 -2! 0,815"»
Ацетальдегид снэсно —121 21 0,79511Q
Пропионовый а ль де- CH3CHSCHO -81 49 0,79664
гид
Акролеин (пропен-2- аль) СН2 = СНСН0 -87 52 0,8410»
Кротоновый альдегид СН3СН = СНСНО —69 104—105 0,85754.
Масляный альдегид СН,СНгСН2СНО —99 76 0,8170»
Изомасляный альде- гид (СН3)2СНСНО —66 64 0,7938»
бензальдегид СеН6СНО —26 179 1,05044
Ацетон снэсосн3 —94 56 0,7899»
Метилэтилкетон СН3СОСаН9 —86 80 0,8054»
Мети л вини л кетон Цнклобутанон CHjCOCH^CH. 80 99 0,8636?° 0,9548°
Циклопентанон —58,2 130 0,9480»
Циклогексанон <_ >=° —45 155 0,9478»
Окись мезитила (4-ме- (СНэ)аС=СНСОСН3 —59 130 0,8653»
тнлпентен-З-он-2)
Ацетофенон СеН9СОСН3 —20,5 202 1,0236»
Ди ацетил снасососн3 88 0.9904»
Ацетнлацвтон СН3СОСНаСОСН3 —23 139/746 мм 0,9721»
Бензил (дибензоил) С,НвСОСОС3Нь 95 346
чем в случае двойных связей углерод — углерод (ср. разд. 2-4),
Ультрафиолетовые спектры простых карбонильных соединений были
рассмотрены ранее (разд. 2-5).
Особенности строения карбонильной группы приводят к тому,
что ЯМР-поглощение протонов альдегидных групп (RCHO) про-
исходит в, очень слабом поле. Как видно из данных табл. 2-3, это
поглощение смещено на 4 м. д. в более слабое поле, чем поглощение
синильных водородов. По-видимому, такое различие во многом
обусловлено полярностью карбонильной группы. В гораздо мень-
шей степени это влияние сказывается на водородах в а-положении —-
3«Й ПОО 2ЖЮ 1400 TOCO MOO 1W0 IMO 1400 1390 WOO MO
Частота, ем-1
474
ГЛАВА 14
СНЭ-С—R
сигналы протонов типа расположены на 0,3 м, д.
CHS-C = CR2.
в более слабом поле, чем сигналы протонов
Упражнение 14-10. Какие структуры можно приписать четырем соединениям,
ИК- и ДМР-спектры которых приведены на рис. I4-L стр. 472 и 473.
В. Дальнейшее рассмотрение реакционной
способности
Для наиболее важных реакций карбонильных групп харак-:
терно присоединение, осуществляющееся на той или иной стадии 1
процесса. В гл. 12 уже обсуждались реакции- присоединения,
происходящие при действии гриньяровских реактивов. Следует
напомнить, что для соотношения реакций присоединения и других
конкурирующих реакций важную роль играют пространственные >
факторы. Для широкого круга других реакций отмечены аналогич- j
ные эффекты. Можно ожидать, что на реакционную способность
карбонильной группы в реакциях присоединения будет оказывать
влияние размер заместителей, расположенных при карбониле,
поскольку в результате присоединения замещающие группы едки- ;
гаются более тесно. По этой причине можно ожидать понижения ।
реакционной способности при увеличении объема заместителей
в соответствии с приведенным ниже рядом. !
При обсуждении такого рода вопросов термин «реакционная способность»
используется'зачастую несколько неоднозначно. Он должен, очевидно, относиться
прежде всего к рассмотрению скоростей реакций, но широко используется также
в связи еконстантами равновесия, иначе говоря, в связи свопросомотом, насколь-
ко глубоко проходит реакция, а не С тем, как быстро она происходит. Как пра-
вило, можно ожидать, что в тех случаях, когда пространственные препятствия
велики, равновесные реакции не будут идти пн со значительной скоростью, ни
на значительную глубину. Для присоединения к карбопилу такое предположение
в общем оправдывается, однако существуют исключения, о которых речв пойдет
ниже.
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ
475
Циклические кетоны почти всегда реагируют в процессах при-
соединения быстрее, чем их аналоги с открытой цепью
Причина этого заключается в существенно большей свободе дви-
жения алкильных групп в соединениях с открытой цепью, что
создает значительно большие пространственные препятствия в
переходном состоянии реакции присоединения.
Электронные эффекты также оказывают влияние на легкость
присоединения к карбонильным группам. Электроноакцепторные
группы облегчают присоединение нуклеофильных агентов к угле-
родному атому карбонила, увеличивая на нем частичный положи-
тельный заряд. Так, соединения, подобные приведенным ниже,
чрезвычайно легко присоединяют нуклеофильные агенты.
О
" II
СС1Э—сно НО2С—с—СО2Н
трихлорацетальдегид кето малоновая кислота
(хлораль)
Упражнение 14-11. Расположите соединения в приведенных ниже парах в соот-
ветствии с их реакционной способностью по отношению к присоединению обычных
нуклеофильных агентов (например, гидрокевл-иона) К карбонильной связи. При-
ведите ваши соображения.
О О
II К
а) СН3—С—СИЭ и СН3-С-СС13
О о
II II
б) (СН3)3С— С-Н и сн3-с-сн3
о о
. II II
в)СН3-С-ОСН3 и Сн3-С--СН4
о о
- и II
г) СН3 — с—С1 и СН3 — с-сн3
/СН’ уСНз
pi с \ \
д) 2| ^:С = О и HsC<f С = О
н,с. / W
хсна -
476 ГЛАВА 14
14-3. Некоторые типичные реакции
присоединения к карбонильной группе.
Реактивы Гриньяра, литийорганические и аналогичные им сое-
динения обычно присоединяются к альдегидам и кетонам быстро
и необратимо. Однако это не имеет места в случае многих других
агентов, для присоединения которых может потребоваться при-
сутствие кислых или основных катализаторов. Константы равно-:
весйя для реакций таких агентов соответствуют относительно
небольшой степени превращения. В данной главе не приводится
перечень реакций присоединения, но сделана попытка подчеркнуть
принципы, на которых будет основано обсуждение ряда примеров,
и эти примеры рассмотрены сравнительно подробно.
А. Образование циангидринов
Цианистый" водород присоединяется ко многим^ альдегидам и
кетонам, образуя а-цианзамещенные спирты, обычно называемые
циангидринами.
О ОН
[| основание |
СНЭ-С-CHs-pHCN—:------»СН3-С-СН„
----- I
C=N
Эти соединения находят синтетическое применение, например при
получении цианалкенов и оксикислот
CHS
он <-н,о) | > CHS = C—CsN
СН3 —С —СН8—- а-метнлакрилоннтрял _ он
1 C=N ацетонциангидрин н,о, нф | ’гжг снэ~с-сн, СО8Н
2-окси «2-метил п рол по но-
вая кислота
(диметилгли иол евая
кислота)
Важной особенностью реакции образования циангидринов яв-
ляется необходимость основного катализа. В отсутствие основания
реакция либо не происходит, либо протекает очень медленно.
В принципе основной катализатор мог бы оказать активирующее
действие как на карбонильную группу, так н на цианистый водо-
род. При использовании гидроксил-иона в качестве основания одной
из возможных реакций будет обратимое присоединение гидроксила
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ 477
к карбонильной группе
СН\5флЮ ® _ С\3/°
С=О + он Jt' . -± с
* сн/ ‘ СНз он
’ I
< |.1нако ’ такое присоединение йе должно облегчать образований
циангидрина, так как оно представляет собой конкурентную воз-
1жносъь насыщения; карбонильной двойной связи. Действительно,
। ти бы константа равновесия для такого присоединения имела
цачительную величину, то избыток гидроксил-ионов мог бы по-
• |влять образование циангидрина, связывая ацетон в аддукт I.
В самом цианистом водороде отсутствует неподеленная пара
iCKTpoHOB на атоме углерода, и он не может поэтому образовать
। лерод-углеродную связь с карбонильным атомом углерода.
11 In же будет показано, что цианистый водород, реагируя в качестве
11 - клеофила с углеродным атомом, образует не С—С-, а С—N-связи.)
Чсно, однако, что гидроксил-ион может действовать активирующим
‘разом, превращая цианистый водород в цианид-ион, который
|.[ступает в качестве’ нуклеофила по отношению к углеродному
тому. Полная последовательность реакций для получения циан-
1 ндрина выглядит при этом следующим образом:
Н — С s N р- §Н
СН3х а© ед а
у С*= О -4й-С N
сн/
iC^N-t-HaO
сн3х zo9
Ch/^CssN
СНЭч^/09
сн/
+нао
СН»Ч ’ он
сн/
+§н
На последней стадии основной катализатор регенерируется. Все
<. гадии суммарной последовательности обратимы, но для альде-
г пдов И большинства пространственно не затрудненных кетонов
образование циангидрина оказывается более предпочтительным.,
При практическом проведении синтезов циангидринов удобно
добавлять сильную кислоту к смеси цианистого натрия и карбо-
нильного соединения, так что цианистый водород образуется in
situ. Количество добавляемой кислоты должно быть недостаточным
для связывания всех цианид-ионов ~ этим обеспечивается под-
держание щелочности, -необходимой для быстрого присоединения.
Упражнение 14-12, Одним иа возможных способов синтеза циангидринов (с
гем, чтобы избежать применения, цианистого водорода) могло бы явиться исполь-
зование карбонильного соединения и цианистого натрия. Обсудите вопрос о том,
более или менее выгодной окажется константа равновесия образования циангид-
рин а в случае ацетона и цианистого водорода в водном растворе по сравнению
<. ацетоном и цианистым натрием в тех же условиях.
478
ГЛАВА Н
Таблица 14-4
Положение равновесия при образовании циангидринов в растворе
в 96%-ном этаноле при 20’ С
Карбонильное соединение Константа райновесия, л/моль Количество циангидрина Яри равнове- сии ah %
СН3СОСН3 32,8 84
СНзСОСЩСНз 37,7 85
СНаСОСН(СН3)2 81,2 90
СН3СОС(СН3)3 СНй—сн2 32,3 84
Хс=о снг-сн^ СНа—СН2 67 89
к- ЬЗ Ж щ ja ьЭ 1 1 'Q nN с/ в “ и о II 000 ~100
Н2С с=о \н-СН СНз с!н3 | сн3 ментон Н 15,3 78
а Исходные концентрации карбонильного соединения и цианистого
водорода равны 1 М.
В табл. 14-4 приведены данные по глубинам превращений для
ряда простых карбонильных соединений. Из данных таблицы оче-
видно, что введение изопропильной группы в положение 2 цикло-
гексанона оказывает значительное влияние на константу равно-
весия, которое, вероятно, обусловлено пространственными при-
чинами, Однацр в других случаях, когда можно было бы ожидать
значительного проявления пространственных влияний, эти эффекты
отсутствуют. Так, для ацетона и метил-пгрепг-бутилкетона были
найдены практически одинаковые константы равновесия> Эти
факты с трудом поддаются объяснению и свидетельствуют: о том,
что закономерности, обусловливающие образование циангидринов,
требуют дальнейшего изучения.
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ
479
Упражнение 14-13. Какому закону долина была бы подчиняться скорость об-
разования ацетонциангидрина по механизму, приведенному в разд, 14-3, А, при
медленной первой стадии и быстрых остальных? При медленной второй стадии
и остальАнх быстрых?
Упражнение 14-14. а) Рассчитайте ДН для образования ацетонциангидрина из
п. и ан истого, иодо рода и ацетона в газовой фазе при 25 °C и днметилэтинил карбинола
на ацетилу а и ацетойа.
б) Каковы возможности осуществления реакции присоединения ацетилена
к ацетону по методу, применяемому в случае цианистого водорода? Объясните.
Упразднение 14-15. Ацетон реагирует с хлороформом в присутствии едкого
кали, образуя 1,1,1-трихлор-2-метилпропанол-2. Какого механизма можно ожи-
дать для этой реакции? Какие дополнительные данные могут быть полезными при
установлении механизма?
Упражнение 14-16. Объясните, почему константа равновесия образования циан-
гидрина гораздо больше в случае циклогексанона, чем в случае цикло пент ано на
Ггябл. 14-4). Чего можно было бы ожидать для случая циклобутаяона?
Б. : Присоединение бисульфита к карбонильным
^соедининениям,
Ряд других реакций присоединения по карбонилу сходен в
основных чертах с образованием циангидринов. Типичным при-
мером может служить присоединение бисульфита натрия, которое
легко происходит в водном растворе для большинства альдегидов,
метилкетонов (CHSCOR) и незатрудненных циклических кетонов,
приводя к образованию связи углерод— сера. Катализатор в этой
реакции не требуется, так как бисульфит — достаточно эффек-
тивный нуклеофильный агент.
СН3 SOjH
сН3 он
СН3 O'-'Na
CHjSOjH
CH3\>0Na®
CH3 SO3°Na®
CH3 O-H
. продукт присоединения бисульфита натрия х ацетону
(i-м ет ил-1-оксиэтансульф онат натрия)
Продукты присоединения часто оказываются отлично кристалли-
зующимися твердыми веществами, нерастворимыми в избытке раст-
вора бисульфита натрия. Как растворимые, так и нерастворимые
продукты присоединения широко используются для отделения кар-
бонильных соединений от веществ, с которыми бисульфит натрия
не вступает в реакцию. .. . . .
480
ГЛАВА Ы
Упражнение 14-17. Продукты присоединения бисульфита натрия при обра-
ботке слабойщелочью или слабой- кислотой разлагаются, образуя исходные кар-
бонильные соединения. Напишите уравнения происходящих при этом реакций и
объясните, почему бисульфнтные производные неустойчивы и в кислой и в щелоч-
ной среде.
Упражнение 14-18. Объясните, каким образом бисульфит натрия может быть
использован для полного .отделения .циклогексанона (т. кип. 156 °C) ст цйклоГек-
санода (т. кип. 161 °C).
В. Присоединение аммиака к альдегидам
Аммиак энергично присоединяется ко многим альдегидам,
например
СН»^-----фии, ынг
0=0 + :NHj СНг-С-О® —г CHj-i-OH <
н н н
ацеталь дети д-амм нах,
т.пл. 97°С
Такие аддукты (альдегид-аммиаки). обычно малоустойчивы и легко
подвергаются реакциям дегидратации и полимеризации. Подобные
соединения образуются в качестве промежуточных веществ в ряде
важных реакций.
Формальдегид и аммиак реагируют иначе, образуя гексаметилентетрамин,
или уротропин *
>
гексаметиле нтетр амин
Продукт предстайЛяетсобдй^выЬокоплавкЬе соединение (т. пл. 230сС, с разл.),
структура которого была установлена ^методом, рентгеноструктурного .анализа.
Это вещество было первым органическим соединением, строение которого устано-
в и л и подобным обр азом. Очевидно, что высо к а я темпер ату ра плав ления связана
с шнмметричпсстыо молекулы и жесткостью ее структуры, относящейся- к типу
«клетки». Соответствующее целиком углеродное соединение .адамантан (разд, 4-8)
* Открыто А. М. Бутлеровым.— Прим. ред.
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИЙ КАРБОНИЛЬНОЙ ГРУППЫ 481
также имеет высокую температуру плавления (253 °C).
адамантан
Действие азотной кислоты на гексаметилентетрамин в уксусном ангидриде
приводит к эффективному взрывчатому веществу — циклониту *, которое часто
обозначают RDX; это соединение широко использовалось во время второй миро-
вой войны.
NOa
Н.С СНЯ
C«Htl!N4+3HNOs —> I | +[3CH2O4-NH3]
N N
циклонит
Формальдегид и аммиак, отщепляющиеся от структуры «клетки» в ходе реак-
ции с азотной Кислотой, при производстве циклонита в промышленном масштабе
не теряются, а переводятся в гексаметилентетрамин и вновь включаются в цикл
превращений.
Упражнение 14-19. Сколько изомеров может быть у монометилзамещенного
гексаметилентетрамина?
Г. Образование полуацеталей и ацеталей
Полуацетали и ацетали представляют собой продукты присое-
динения спиртов к альдегидам. Так, b случае .ацетальдегида и
метанола
СН$Х сн3он СНа. .ОН сн,он.-нго
н>0— „/ С<ОСН.==
СНЭЧс/ОСНа
н/ хосна
полуацеталь
(1 -метокс натай од)
диметнлацеталь
ацетальдегида
(1,1 -Диметокси эт ан)
* Иначе — гексоген.— Прим. ред.
16 № 1340
482
ГЛАВА 14
Сначала будут рассмотрены реакции образования полуацеталей,
которые катализируются как кислотами, так и основаниями.
Основной катализ сходен с тем, который имеет место при обра-
зовании циангидрина. В данном случае медленная стадия заклю-
чается в присоединении алкоголят-иона к карбонильной группе
0
сн3он + он
снэо° + нао
о-сн3
н
медленно
сн3 осн3
нх о©
снэ осн.
быстро
сн3 осн3
+ он©
Z\ „
н он
Кислотный катализ при образовании полуацеталей может быть
следствием активирования как спирта, так и карбонильного сое-
динения. Однако единственной простой реакцией, которой можно
ожидать для взаимодействия между спиртами и донорами прото-
нов, является образование оксониевых солей, что вряд ли может
способствовать повышению активности спирта при нуклеофильной
атаке по карбонильной группе альдегида. С другой стороны, об-
разование оксоииевой соли (сопряженной кислоты) * карбоннль-
Н
СН3ОН-!-Н® сн3-(^-н
ион метилоксоция
ного соединения должно привести к увеличению эффективности
образования полуацеталя вследствие увеличения положительного
* Термины сопряженная кислота и сопряженное основание очень удобны в
применении к соединениям, которые трудно охарактеризовать просто как осно-
вания или кислоты. Сопряженной кислотой X будет НХ®, а сопряженным осно-
ванием соединения HY будет Y®. Таким образом, Н3О® представляет собой со-
пряженную кислоту боды, тогда как ОН® является сопряженным основанием
воды; сама вода — одновременно сопряженное основание относительно Н30® и
сопряженная кислота относительно ОН®,
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ
483
заряда карбонильного углеродного атома.
С^®
с=он
н
сопряженная кислота ацетальдегида
СН, О—СН,
+ н®
О Т П
н он
полуацеталь
В водном растворе большинство альдегидов образует гидраты.
Эта реакция аналогична образованию полуацеталей; она Катали-
зируется как кислотами, так и основаниями.
FL и® R. ,ОН
)С = О+Н2О >4
®ОН
Положение равновесия при образовании гидратов зависит как от
пространственных, так и от электронных факторов.
Упражнение /4-20. Константа равновесия гидратации в особенности велика
для формальдегида, трихлор ацетальдегида и циклопропанов а. Объясните.
В противоположность образованию полуацеталей образование
ацеталей катализируется только кислотами. Присоединение про-
тона к полуацеталю может происходить двояким образом, давая
соединения II или III:
Н
НЕ
Соединение II может терять СН3ОН, образуя сопряженную кислоту
ацетальдегида. Эта реакция является обратной по отношению к
16*
484 ... : . . ГЛАВА 14
катализируемой кислотой реакции получения
. снэ
: : < с\’ ®
ХС =»=fc. с=он +
£он н
полуацеталя.
CHjOH
п
Соединение III может Отщепить НаО и дать новое соединение —
метилоксониевый катион альдегида (IV)
СН3
\ ©
С-О-СН3 + Н2О
н
Ш IV
Взаимодействие соединения IV с водой вновь дает III, но реакция
со спиртом приводит к сопряженной кислоте ацеталя (V). Отрыв
протона от V дает ацеталь
И\4
с=о-сн3 + о-сн3
/ * I
н н
СН, ОСНз
V -
н7 осн;
IV
Упражнение /4-2/. Медленной стадией альтернативного механизма образова-
ния ацеталя может быть приведенная ниже реакция.
Каким образом экспериментально можно отличить этот механизм от описан-
ного выше?
Упражнение 14-22. Хлораль (СС1аСНО) быстро реагирует с метанолом, образуя
полуацеталь, но лишь очень медленно образует соответствующий ацеталь. Объ-
ясните.
Естественным следствием того факта, что ацетали образуются
только путем кислотио-катализируемых реакций, является их ус-
тойчивость к действию оснований, Эго оказывается весьма полез-
ным в синтетическом отношении, как можно видеть на примере
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИЙ КАРБОНИЛЬНОЙ ГРУППЫ 485
приведенного ниже синтеза глицеринового альдегида из легкодо-
ступного акролеина (СН2=СН—СНО), Хлористый водород в эта-
ноле присоединяется к акролеину против правила Марковникова
(см, . гл, 15), образуя трихлорпропионовый альдегид, который
далее, реагируя с этанолом, дает ацеталь.
Уг: СН2-СНСНО-|-НС1 —► CiCH-CIkCHO
C1CH2CH2CHO + 2C2HjOH —> С1СН2СН2СН(ОС8Н6)Й
Ключевой стадией в этом синтезе является' дегидрохлорирование
хлорацеталя по типу Е2, происходящее без разрушения устойчивой
к действию основания апетальной группировки:
ClCH2-CHa^CH(OC2Hft)s + KOH СН2 = СН-СН(ОС2НВ)2
Последующее гидроксилирование двойной связи действием нейт-
рального раствора перманганата приводит к диэтилацеталю глице-
ринового альдегида. Осуществить такую стадию с самим акролеи-
ном было бы невозможно, так как альдегидная группа вступает
в реакцию с перманганатом так же легко, как двойная связь.
, СН2=СН-СН(ОС8Н6)2 —СН2-СН-СН(ОС2Н.)2
Ан он
Наконец, кислотный гидролиз ацетальной функции, проводи-
мый в мягких условиях, Дает глицериновый альдегид
н®
СНЙ-СН-СН(ОСЙН8)2^-Н8О---------->- СН2-СН-СНО-Ь2С2Н6ОН
Ан он Ан он
глицериновый
альдегид
1 Положение равновесия при образовании ацеталей и полуаце-
талей „весьма чувствительно к пространственным препятствиям.
Группы большого размера, присутствующие как в альдегиде, так
и в спирте, делают реакцию менее выгодной, В.табл, 14-5 приведены
типичные примеры превращений для случая образования ацеталей
в условиях, когда достигается равновесие при реакции 1 моля
альдегида с 5 молями Спирта.
Кетали обычно не могут быть получены с удовлетворительными
выходами путем прямого взаимодействия спиртов с кетонами вслед-
ствие невыгодного положения равновесия в этом случае. Хорошие
результаты получают, проводя реакции кетонов с этилортофор-
миатом СН (ОСЙН6)3. Этот процесс протекает в присутствии кислого
катализатора.
О О
|] Нх >ОС2Н5 и® СвНе .ОС8НВ И
CeHsCCH3 + , ----* z^x -4-HCOC2HB
ваетофеиоп. С2НВО/ Х)С2Н6 СН/ 'ОС2НВ
диэтилкеталь
ацетофенона
486
ГЛАВА 14
Таблица 14-5
Превращение альдегидов в ацетали при действии различных спиртов
(1 моль альдегида на 5 молей спирта)
Альдегид Превращение в ацеталь, %
этанол ЦИИлогсК- санол изопропило- вый спирт трет-бути- ловый спирт
СН3СНО 78 56 43 23
(СНз)зСНСНО . 71 23
(СНВ)3ССНО 56 16 11
СвН6СНО 39 23 13
Упражнение 14-23. а) Вычислите А// для реакции (СН3)2С=О4-
-фНС(0С2Нй)3->(СНз)2С(ОСаН5)2+НО1СС2Н5 в газовой фазе, используя соответ-
ствующие энергии стабилизации (табл. 9-3).
б) Напишите механизм этой реакции в жидкой фазе, соответствующий ха-
рактеру реагентов и необходимости участия кислого катализатора.
Можно было бы предположить, что ацетали и кетали окажется легко синте-
зировать из 1,1-дигалогенидов типа R3CX2 путем 5№-замещения с алкоголят-
ионами, например
R3CC]2 “Ь 2NaOC3H3 ——> RnC^OCjH^J^-^SNaCi
Однако обычно эти реакции не дают хороших результатов. Хлористый метилен
реагирует с трудом, прочие i, I-дигалогениды дают продукты отщепления. Взаимо-
действие хлороформа с этилатом натрия представляет собой исключение — в этом
случае с хорошим выходом образуется этилортоформиат, возможно, через дихлор-
карбен '.СС12 (разд, 11-19).
CHCI3 + eOCaHJ ^2 :?C1S + C2HSOH
:СС|3 :СС12+С1®
:СС12 +2§С2Н6 —* :С(ОС3Н5)2 + 2С]е
:С(ОС2Н6)2 + С2Н6ОН -• HC(OC2HS)3
Д, Полимеризация альдегидов
Полимеризация альдегидов имеет много общего с образованием
ацеталей. Образуются как линейные, так и циклические полимеры;
например, формальдегид в водном растворе полимеризуется в
твердый полимер с открытой цепью, называемый параформальде-
гидом или полиоксиметиленом;
пСНа = О + Н2О —+ НО-СН8-(-О-СН2~)„_2-О-СНг-ОН
парафо рмальдсгид
Это вещество при сильном нагревании регенерирует формальдегид,
поэтому оно является удобным источником газообразного формаль-
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ
487
дегида. При нагревании с разбавленной кислотой параформ обра-
зует твердый тример триоксиметилен (т. пл, 61 °C). Известен также
циклический тетрамер.
* СНа
/'о
’ Had (!на
. V"
гриокси метилен
Полимеры формальдегида с открытой цепью в последние годы
приобрели весьма большое значение в качестве пластических ма-
териалов. Низкая стоимость параформальдегида является в этой
связи чрезвычайно благоприятным фактором, но неустойчивость
полимера к действию повышенных температур и разбавленных
кислот служит помехой использованию его в качестве пластика.
Однако «защита» концов полиоксиметиленовых цепей путем об-
разования сложных или простых эфиров приводит к значительному
повышению устойчивости, н такие модифицированные полимеры
представляют собой хорошие пластические материалы. Дельрин
(фирма «Дюпон») представляет собой стабилизированный полимер
формальдегида, обладающий исключительной прочностью и легко
формующийся.
Ацетальдегид полимеризуется под действием кислот в циклический тример
(паральдегид) и циклический тетрамер (метальдегид). Паральдегид использовал-
ся в качестве относительно мало токсичного снотворного (гипнотического) средст-
ва. Метальдегид находит применение для уничтожения улиток и слизней («сиа-
рол»). Кетоны в отличие от альдегидов оказываются неспособными к образованию
устойчивых полимеров.
CHS
СН-0
'сн—сн8
CHS—сн о
о—сн
, паральдегид
сна
метальдегид
Упражнение 14-24. Напишите возможный механизм полимеризации формаль-
дегида в водном растворе при действии основного катализатора. Можно ли ожи-
дать, что основной катализатор приведет к образованию некоторого количества
триоксиметилена? Почему?
Упражнение !4-25. Сколько различных геометрических изомеров может быть
у паральдегида? Нарисуйте для каждого изомера наиболее устойчивую конфор-
мацию.
488 ГЛАВА 14 "
14-4. Конденсации карбонильных соединений
’ с соединениями типа
Многие вещества, имеющие группы NHa, конденсируются с
карбонильными соединениями, образуя воду и производные, со-
держащие группу /C=N—. Для этих, реакций обычно требуется
кислый катализатор.
X н® .
^>c=o-ph2n-r----> \C=N-R + H2O
В табл, 14-6 суммирован ряд важных реакций такого типа и при-
ведена номенклатура реагентов и продуктов реакций.
Зависимость скоростей подобных конденсаций от концентрации
кислоты проливает свет на механизм реакции и иллюстрирует
Таблица 14-6
Реакции конденсации карбонильных соединений
с соединениями типа R — NH2
Реагент Типичный продукт К,лзссг к которому относится продукт
Амин H2NR (Е = алкил, CH3CH=N-CH3 Имин а (основа-
арил или водород) Гадраэия NHa—NH2 метил ими и ацетальдегида СН3 \C-N-NHa сн; гидразон ацетона снэ. ,сн3 )С—N —N=C( сн</ Vhs азин ацетола ние Шиффа) Гидразон Азин
Замещенный гидразин КРг Замещенный
H2N—NHR(R = ал- кил, арил или водород) Семикарбазид HaNNHCNHa ^^sN-NH-^yl-NOi н о z х 1 Н гидразон ®
II О ^__^>-CH=N-N-C-Nh2 семикарбазон бензальдегида Семикарбазон 6
Гидроксиламин НО— NHS CHa = N—ОН формальдоксим Оксим®
а Большинство незамещенных иминов (R= H) являются неустойчивыми и полимеры-
зуются.
® Обычно эти производные представляют собой твердые вещества и с успехом исполь-
зуются для выделения в идентификации альдегидов и кетонов.
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ 489
Рис. J4-2, Схема изменения скорости
конденсации RNH3 с карбонильным
соединением в зависимости от pH,
ряд важных моментов, относящихся к кислотному катализу. Для
скоростей этих реакций характерен максимум при определенном
значений pH; положение максимума зависит главным образом от
природы R в RNH2. На рис. 14-2 схематически показана типичная
зависимость скорости от pH. Наличие максимума скорости стано-
вится понятным при рассмотрении возможных равновесий, вклю-
чаюи&х RNH2 и карбонильное соединение.
RNHa4-H® RNH3
(СНз)2С=о + Н® (СН3)гС = ОН
При протонировании неподеленной пары азота в RNH2 атака по-
следнего на углерод карбонильной группы становится невозмож-
ной. С другой стороны, протонирование карбонильной группы
увеличивает ее реакционную способность по отношению к нуклео-
фильным агентам. Наиболее выгодным оказывается сочетание реа-
гентов, приведенное в уравнении (14-1).
NHz-R
(14-1)
Если эта стадия реакции является медленной, то можно видеть,
что.скорость окажется максимальной при наибольшей величине
произведения концентраций [(CH3)2C==OHllRNH2l. Как видно из
рйс. 14-3; влияние pH на концентрации этих двух соединений
противоположно по Своему характеру.
Оптимальным будет значение pH, при котором не всё колйчё-
.. е
ство RNHB превращено в RNH3 и в то же время концентрация со-
пряженной кислоты карбонильного соединения достаточна, для
того, чтобы скорость реакции была значительной.
490
ГЛАВА 14
Рис. 14-3, Схема изменения концентра-
ции (СН3)2С=§Н и RNHs в зависимо-
сти от pH.
------RNH,;--------(СН.).С=^Н.
Упражнение 14-26. Рассчитайте pH, при котором скорость реакции будет наи-
большей для карбонильного соединения, Кя которого равна 10-м, и RNH3 с
Кв=Ю_11. Примите, что концентрации реагентов равны 1 М и медленная стадия
та же, что в уравнении (14-1). Во сколько раз больше будет скорость при данном
pH, чем при pH 0? Чем при pH 7?
Остальные стадии при образовании ^C=N—R обычно быстрее,
чем приведенная в уравнении (14-1); они относятся к рассмотрен-
ным ранее типам превращений.
СН3х z®H2R [ СНзх -NHR -Н,о СНзх ^^Н _-н^_
СНд/С^ОН СН/ХШ;, CH3/C^N^R “
СН3
>C = N-R
сн/
Важной особенностью таких реакций конденсации, особенно хорошо изучен-
0
II
нои для случая образования семикарбазонов (R— =NH2CNH—), является ката-
лиз недиссоциированными кислотами, присутствующими в реакционной смеси.
Экспериментально это обнаруживается при измерении скорости реакции в раство-
рах, забуференных до одинакового pH, но содержащих различные концентрации
неднссоциированпой кислоты. В случае ацетатного буфера (уксусная кислота —
ацетат-йон) pH остается постоянным до тех пор, пока отношение концентраций
уксусной кислоты и ацетат-иопа сохраняет постоянное значение; таким образом,
при данном pH можно получить существенно различные концентрации недиссо-
циированной уксусной кислоты. График зависимости константы скорости от кон-
центрации недиссоциированной кислоты при постоянном pH,, приведенный иа
рис. 14-4, характеризуется углом наклона, равным нулю, в случае если недиссо-
циированная кислота не обладает свойствами катализатора, и положительным зна-
чением угла, если она обладает каталитическим действием, В обоих случаях отре-
зок, отсекаемый на оси скоростей, обусловлен каталитическим действием иона во-
дорода. Если оба — и ион водорода, и недиссоциированная кислота — проявляют
каталитическую активность, то реакцию называют подчиняющейся общему кис-
лотному катализу. Механизм каталитического действия недиссоциированных кис-
лот не всегда легко установить. При образовании семикарбазона естественно пред-
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ
491
Рис. *14-4. Метод установления факта
общего кислотного катализа путем ис-
следования изменений скорости реак-
ции в' зависимости от концентрации
недисСОциироваиной кислоты, присут-
ствующей при постоянном pH.
— — — общий кислотный катализ;* — ,
общий кислотный катализ отсутствует.
[недиссоциироваиная кислота]-----^-~
положить, что кислота ассоциируется с карбонильной группой за счет водородной
связи, в результате чего облегчается атака RNH2,
СН\5© 60
^С=О + Н-А С=О-----Н-А
CHj CHj
С\б ©*""б©
. ^С=Оу-Н-А + :NH2-R
СН3
СН, NHj— R
V
7 \ ©
СИ, О—Н-А
Явление общего кислотного катализа имеет исключительно важное значение при
катализируемых кислотами реакциях, особенно в неводных органических раство-
рителях. где диссоциация кислот происходит с трудом.
14-5. Присоединение галогеноводородов
и замещение на галоген
Присоединение галогеноводородов к карбонильной группе на-
столько легко обратимо, что выделение продуктов оказывается
невозможным.
СН3.
СНЭ ,С1
Однако многие альдегиды взаимодействуют со спиртами в присут-
ствии-избытка хлористого водорода, образуя й-хлорэфиры
снзх снзч ,о-снэ
}C=O + HCI + CH3OH >С< +Нго
Н7 н/ ХС1
Упражнение 14-27. Напишите возможный механизм реакции хлористого водо-
рода и метанола с формальдегидом, приводящей к образованию метилхлорметнло •
вого эфира. Механизм должен соответствовать тому факту, что реакция происхо-
492
ГЛАВА:И
дит в условиях, при которых не образуется ни хлористого метила, ни хлористого
метилена.
Замещение карбонильной функции на два атома хлора проис-
ходит при действии пятихлористого фосфора в эфире
Эта реакция в сочетании с отщеплением Е2 удобна для получения алкенилга-
логенидов, алленов и ацетиленов. В случае циклических соединений циклбалке-
ниягалогениды получаются без труда, но циклоалкины и цикло аллены с числом
углеродных атомов в цикле меньше восьми не могут быть получены вследствие
углового напряжения.
( \ >С1
[СН2)5 С
Ч_снг
кон,
"Е2
кон>;
EZ
(СНг)5 /С
V_ch
Упражнение 14-28. Циклопентанон-i -,4C при последовательном действии пяти-
хлористого фосфора и щелочи дает I-хлорилклопентен-1-,4С. Это соединение при
обработке фенил литием (120 °C) превращается в меченный ,4С 1-фецилиикло пентен,,
который при энергичном окислении дает бензойную кислоту (С^Н5СО2Н), содержа-
щую в углероде карбоксильной группы ровно половину общей активности Ьфенил-
цнклойентена. Напишите уравнения для всех упомянутых реакций и приведите
механизм замещения при действии фениллития, отвечающий найденному распре-
делению 14С.
.Замещение кислорода карбонильной группы на атомы фтора, находящиеся
в ге,и-положен ни, может быть осуществлено с помощью четырехфтористой серы.
Этот же реагент превращает карбоксильную функцию в трифторметйльну|д
группу.,..
/—\ /—\ /F
\ ч /х 4-SOFa
s >---/ к--_/ >р
СН3СН2СН2СО2Н + 2SF4. CHsCHaCHaCF9 + 2SOF„ -j- HF
Упражнение 14-29. Рассмотрите возможный механизм реакций пятихлористого
фосфора и четырехфторйстОй серы с карбонильной группой. Возможно, что первая
стадия реакций с и яти хлор истым фосфором заключается в диссоциации на РС1® .
и ,С1е.
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ 493
14-6. Восстановление карбонильных
соединений
А. Образование спиртов
Наиболее простым методом восстановления альдегидов и ке-
тонов с целью превращения их в спирты (в больших масштабах)
является каталитическое гидрирование.
Нг, 70 ат
NI. 50 СС
\нон
95-100%
Преимущество этого метода перед большинством реакций хими-
ческого восстановления заключается в том, что продукт может
быть 'получен просто путем отфильтровывания катализатора и
последующей разгонки. В качестве катализатора обычно приме-
няются никель, палладий, хромит меди, а также платина, промо-
тарованная ионол; двухвалентного железа. Гидрирование карбо-
нильных групп альдегидов и кетопов происходит гораздо медленнее,
чём гидрирование двойной связи углерод — углерод, и требует
значительно более жестких условий. Это не удивительно, по-
скольку гидрирование карбонильных групп, согласно расчету,
менее экзртер.мичная реакция, чем гидрирование двойных связей.
ДЯ = —ЗО ккал
Д/7 =—12 ккал
Отсюда слёд'ует невозможность, как правило, восстановления кар-
бонильной группы в присутствии двойной связи без одновременного
насыщения последней,
В последние годы исключительно важное значение при вос-
становлении карбонильпЫх соединений приобрели неорганические
гидриды— литийалюминийгидрид LiAlH4 и натрийборгйдрйд
\aBH-. Эти реагенты находят широкое применение, особенно в
случае неустойчивых и дорогостоящих карбонильных производ-
ных. Хорошим примером может служить восстановление циклобу-
494
ГЛАВА 14
танона в циклобутанол
90% ' 1
При действии гидридов металлов ключевая стадия состоит в пере- I
носе гидрид-иона к карбонильному углероду восстанавливаемого ]
вещества. 1
т> и © Ф I
V© 5© ф R .OAlHj Li
С==О 4 Н:А1-Н Li -------->- V I
f К У I / \ i
R \H RZ H
Перенос гидрид-иона аналогичен передаче :R© от металлоорга- .<
нического соединения карбонильной группе (гл. 12). ;i
Способ применения литийалюминийгидрида во многом сходен с использова-
нием реактивов Гриньяра, так как LiAlHa растворим в эфире и чувствителен к дей-
ствию кислорода и влаги. (Гидрид лития нерастворим в органических растворите- .'i
лях и не является эффективным восстановителем органических соединений.) Могут
быть использованы все четыре водорода, связанные с алюминием.
Н - ,_О-СНЭ
(Й ® ®1 Н,о, HsSOx
Li® Н: А’ Н + 4СНг=О ----*- Li® СН3-0-А1-О-СН3 ----
И О-СН3
----->• 4 СН3ОН + A12(SO4)3 + Li2SO4
Продукты реакции аналогично гриньяровским комплексам необходимо разло-
жить, действуя водой и кислотой. Присутствующий в избытке литийалюминийгид-
рид разлагается при действии воды и кислоты с выделением водорода
LiAlH4+2HaSO4 —+ ]/гЬ!г5О4 + ’/гА12(504)3 + 4Нг
Литийалюминийгидрид обычно восстанавливает карбонильные группы, не
затрагивая двойные углерод-углеродные связи. Он, кроме того, является эффек-
тивным восстановителем карбонильных групп карбоновых кислот, сложных эфи-
ров и других производных кислот, что будет описано в гл. 16.
Натрийборгидрид — более мягкий восстанавливающий агент,
чем литийалюминийгидрйд; он восстанавливает альдегиды и ке-
тоны, но не кислоты и сложные эфиры. Он сравнительно медленно
реагирует е водой в нейтральном или щелочном растворе, что по-
зволяет проводить восстановление (если оно происходит со значи-
тельной скоростью) в водном растворе без сколько-нибудь значи-
тельного гидролиза восстанавливающего агента.
NaBH44-4CHa = O+3H2O —> 4CH3OH+NaHaBOe
АЛЬДЕГИДЫ И КЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ 495
Источником гидрид-иона может также служить алкоголят-ион,
соответствующий первичному или вторичному спирту. Можно ожи-
дать,* что эта реакция будет обратимой, поскольку продуктами
являются другой алкоголят и другое карбонильное соединение.
Для использования такого равновесного процесса в качестве
практического метода восстановления должны весьма тщательно
соблюдаться точно 'определенные условия. Прежде всего многие
карбонильные соединения, особенно альдегиды, чувствительны
к действию алкоголят-ионов; в присутствии последних они пре-
вращаются в интенсивно окрашенные полимерные продукты. Далее,
важно иметь возможность достичь глубины превращения, доста-
точной для получения значительного выхода продукта восстанов-
ления. Если использование алкоголята натрия в качестве вос-
станавливающего агента исключено, то хорошие результаты обычно
удается получить с помощью соответствующих алкоголятов алю-
миния, также обладающих достаточной активностью, Алкоголяты
алюминия значительно менее полярны, чем алкоголяты щелочных
металлов; связи алюминий — кислород близки к ковалентным,
тенденция их к диссоциации с образованием свободных алкоголят-
ионов невелика. Обычно используемый в качестве восстановителя
изопропилат алюминия представляет собой относительно низко-
плавкое твердое вещество (т. пл. 118 °C), перегоняющееся при 140—
150 °C (12 мм). Применение лзопропилата алюминия дает также
возможность сдвигать равновесия вплоть до практически полного
завершения восстановления путем отгонки образующегося ацетона.
Суммарная реакция выражается следующим уравнением;
3R2C = O+AI[OCH(CH3)2]3 (К2СН—О)3А1 -f-3(CHa)2C=Ot
*
Механизм этого вида восстановления (известного как метод
Меервейна — Понндорфа —Оппенауэра — Берлея) включает, по-
видимому, в качестве первой стадии ассоциацию карбонильного
кислорода с алюминием и дальнейший перенос гидрид-иона в ци-
клическом переходном состоянии. Так, для восстановления RCHO
сн,
Н н:с-сн5
п-сОЛ,- -
7
О-3-А1[ОСН(СН,)г]л
Н
R-C-H + (СН,)гС=О
ОА1[ОСН(СН,)г]г
Отличные результаты получают даже в том случае, если R яв-
ляется ненасыщенным или содержащим галоген остатком.
496
ГЛАВА' 14
Упражнение /4-30. Оптически активный втор-б ути левый спирт ire медлен но
теряет оптическую активность при нагревании с мети лэтил кето ном й сильным ос-
нованием. Объясните.
Упражнение /4-3/. Пусть «-масляный альдегид-1-3Н (CHSCH2CH2CDO) восста-
навливается три-втор-бутилатом алюминия, полученным изоптически активного
втор-бутилового спирта. Приняв в качестве, механизма восстановления цикличе-
ское переходное состояние, могли бы вы ожидать, что первые 10% образующегося
втор-бутиловогр-1-2Н спирта окажутся оптически активными? Объясните. Ка-
кими будут продукты реакции после установления равновесия?
Б. Восстановление карбонильных соединений
до углеводородов
Существует ряд методов превращения ^)С=О в ^)СН2. В не-
которых случаях оказывается удобным использовать приведенную
ниже последовательность реакций:
Такой путь долог, требует присутствия водородных атомов в а-
положенни к карбонильной функции и может сопровождаться
перегруппировками на стадии дегидратации (разд. 13-6, Б).
В зависимости от характера группы R в карбонильном соеди-
нении могут применяться более прямые методы. Если группа R
устойчива к действию широкого круга реагентов, то . такое вос-
становление не представляет трудностей, но в случае легко уязви-
мых групп R не все методы применимы в равной степени. Если
группа R устойчива к действию кислот, но чувствительна к дей-
ствию оснований, то вб многих случаях очень хорошие результаты
даёт восстановление по Клемменсену амальгамированным цинком
в соляной кислоте
О
/===Х „ Zn(Hgj /--------X i
/ >-C-CH2COsC2H6 ———> < >-CHsGHsCOaCiHe
Ху у- rid X /
59%
Механизм восстановления по Клемменсену не выяснен в достаточ-
ной степени, Во многих случаях очевидно, что спирт не является
промежуточным соединением, так как в условиях реакции Клем-
менсена восстановления спиртов в углеводороды не происходит.
Если группа R в карбонильном соединении устойчива к дей-
ствию оснований, но не кисЛот, то часто оказывается полезной
АЛЬДЕГИДЫ И КЕТОНЫ, РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ 497
.♦ сна
/X КОН 150 “С
НаС /C=O + NJ42-NH2-———
модификация Хуанг — Миилона метода восстановления по Киж-
нёру —Вольфу. При этом карбонильное соединение нагревается
в высокркипящем полярном растворителе, подобном этиленгли-
колю, с.гидразином и едким кали; реакция доходит до конца вслед-
ствие удаления образующейся воды путем отгонки.
сна
HjC^CHa + Na-j-HsO
'с'Щ
90%
Механизм этой реакции включает образование гидразона (ср. с разд.
14-4), которое в присутствии КОН происходит медленно и завершается при уда-
лении воды;
СН2 СНа
7 H,c/ Xc=o-j-.\'H2Nn2 7=; h2c//4'c=n-nh2+hso
'chj 'с'н.
Гидразон представляет собой слабую кислоту и при реакции с едким кали даёт
стабилизированный анион
у СН, ~
/X уон
Н2С C = N-NH2 “ДДГ
SZ Н®
СН2
' /X ©
Н2С C=N-K’H
CHS
/\ ©
НаС C-R = NH
'сна
а
сн, сн2 н
/X /X/
Н,С СН,-г .\'2— н,с с
сп, .
Присоединение протона к авиояоидно^у атому углерода дает группировку1
—С—N=N—Н. Все соединения такого типа неустойчивы и разлагаются на
2, возможно, по свободнорадикальному или карбанионному механизму.
Упражнение 14-32. ЛИ для превращения в
RC.H31-\2. Напцщите возможные свободнорадикальный (цепной) и карбанион-
ный механизмы-этой реакции.
< В том. случае, если восстанавливаемое карбонильное соединение чувствитель-
но к действию как кислот, так и оснований или по другим причинам дает плохие
результаты при восстановлении по Клемменсену и Кижнеру Вольфу, последним
выходом из положения может оказаться восстановление соответствующих тиоаце-
498
ГЛАВА 14
талей * или тиокеталей * никелем Ренея, насыщенным водородом (разд. 7-2).
к Н® к /S—СаН6 Hj/N! v /Н
)C=O + 2HSCaHB —)С< >С< -j-2CsHe
Z -Н,о / \s_C2l[(> (-NIS) /\Н
Тиокетали в отличие от обычных кеталей легко образуются из кетонов и тиолов
(RSH) в присутствии кислых катализаторов. Процесс десульфурирования обычно
происходит гладко, но продукт с большим трудом отделяется путем экстрагирова-
ния от избытка никеля Ренея, необходимого для достижения оптимальных выхо-
дов. Хорошим примером использования десульфурировання является, в частно-
сти, восстановление бициклического дикетона VI, в случае которого ни метод
Клемменсена, ни метод Кижи ер а — Вольфа не приводят к успеху, В данном
случае для получения кеталя применяют пропандитиол-1,3 (HSCHaCHaCHaSH),
70%
14-7. Окисление карбонильных соединений
Альдегиды легко окисляются влажной окисью серебра или раст-
вором перманганата калия в соответствующие кислоты. Механизм
окисления перманганатом в определенной степени напоминает
окисление спиртов хромовой кислотой (разд. 13-7).
X) Х)Н
Упражнение 14-33. Бензальдегид (С8НЬСНО) окисляется кислым раствором
перманганата в бензойную кислоту (С6Н5СО2Н). Скорость окисления пропорцио-
нальна концентрациям Н®, бензальдегида и МпО®. Реакция с CeH5CD0 проис-
ходит намного медленнее, чем с С,НВСНО. При проведении окисления СвН6СНО
действием МпО® в H*21SO продуктом оказывается С3Н5СОаН. ЕР случае применения
СвН6СНО, Н3О и МпиО© в СвН6СО,Н содержится 18О. Напишите механизм реак-
ции, согласующийся со всеми приведенными выше фактами. (Учтите, что труппа
C8HS не затрагивается.) Приведите ваши соображения.
* Приставка тт указывает на то, что соединение является сернистым ана-
логом соответствующего кислородного соединения (см. гл, 21).
АЛЬДЕГИДЫ И ДЕТОНЫ. РЕАКЦИИ КАРБОНИЛЬНОЙ ГРУППЫ
499
Многие альдегиды легко окисляются кислородом воздуха по
свободнорадикальному механизму. Наиболее хорошо изучено окис-
ление бензальдегида; при этом процессе происходит образование
в качестве промежуточного соединения надбензойной кислоты и в
конечном счете бензойной кислоты.
л® //0
Инициирование: СеНвС< +R* —► CeHBC- 4- RH
« ХН
Развитие
цепи:
Z .0 .
С(НвС*4-Оа —► СвНвС^
X)—о-
.0 /О /О
свнес< +ceHtc< ^С»Н6-С^ Ц-W
Х0—О- ХН ХО—О—Н
иадбеизойиая
кислота
Надбензойная кислота взаимодействует с бензальдегидом, образуя
две молекулы бензойной кислоты:
, /Р /Р /Р
СвНвС< +СвН6С^ ~^2С9Н6-С<
Х)-0Н ХН чЖ
Упражнение /4-34. Напишите механизм взаимодействия надбензойной кисло-
ты с бензальдегидом, включающий присоединение к альдегидной группе и после-
дующую реакцию, аналогичную разложению гидроперекисей, описанному в
разд. 14-1.Г.
Упражнение 14-35.-Некоторые альдегиды при нагревании в присутствии пере-
кисей разлагаются на углеводород и окись углерода
ROOR
(СН,)аСНСНаСНО-------► (СНэЬСНСНа-КО
Напишите возможный механизм этой реакции.
Кетоны окисляются по карбонильной группе намного труднее,
чем альдегиды. Кетоны с а-водородными атомами могут быть окис-
лены в кислом или щелочном растворе вследствие образования
енолов, что будет рассмотрено в гл. 15. Так,
О §н(йлин®) °Н
СН;,—С—СНз +-------- СН3—C=CHg
кетон енол
Енолы, будучи ненасыщенными соединениями, легко атакуются
реагентами, окисляющими непредельные молекулы.
500
ГЛАВА 14
1.4- 8; Реакции Канниццаро
<•. Реакцией, характерной для альдегидов, в которых отсутствуют ;
«-.водородные атомы, является окисление— восстановление в при-
сутствии сильного основания. Для случая формальдегида
2СН 8 - ОД- NaOH CHSOH -j- Н -С/°
н(о \).\;
Если в альдегиде имеются а-водородные атомы, то другие реакций
могут происходить с большей скоростью.
Механизм реакции Канниццаро сочетает в себе многие особен-
ности других процессов, рассмотренных в данной главе. Первой,
стадией является обратимое присоединение гидроксил-иона к
карбонильной группе
^O-f-OH©'—;
Fk ZOQ
н/ хон
Образовавшийся таким образом окси ал коксил- аннон может высту-
пать в качестве источника гидрид-монов подобно изопропилату
алюминия (разд. 14-6, А) и восстанавливать молекулы формальде-
гида в метанол
н о
нгс«о + с/
иг он
медленно
°
Н3С-0 + н-/
чон
//
СН3ОН + НС
Упражнение /4-36, Пусть эквимолекулярная смесь формальдегида и'трнметйл-
ацетальдегида (каждое из этих соединений способно к автоконденсации по реакции
Канниццаро) нагревается с раствором едкого натра. Напишите уравнения всех со-
четаний, возможных при реакциях Каннинцаро в данных условиях. Как будет,
по вашему мнению, и ре имущественно реагировать формальдегид, имеющийся в из-
бытке,— восстанавливать или окислять триметилацетальдегид? Почему?
Дополнительные упражнения
/4->37, Напишите уравнения синтезов приведенных ниже соединений из указан-
ных исходных веществ. По возможности точно укажите условия реакций.
а) (СН^СНСНО из (СН3)2СНСНаСН2ОН Д'
О
I!
б) сна—сн— с—сна
^Н-р-СНа
в),СНа-СНО
СИ»-СНО
из СНа—СНСОаН
сн,-сн2
из
/СНа
и«у /с~°
Н2С—СНз
АЛЬДЕГИДЫ Й КЕТОНЫ. РЕАКЦИИ, КАРБОНИЛЬНОЙ ГРУППЫ 50(
г) CH2-CHS СНа-С=СН3:
I I из | [ >
СНа—СН_. СНа —СН2. ' .
д) СС^С—О-СН..СС), из CCJSCHO
‘.Il '
Р
е) циклопентен-Ькарбоновая кислота из никлопснтанона. v
14-38. Напишите возможные механизмы для каждой из приведенных ниже реак-
ций, Приведите в той мере, в какой это окажется возможным, аналогии в поддерж-
ку ваших предложений.
00
II l| HjO
a) H-C-C-H + NaOH -----" HOCHjCOjNa
NajCOj
б) CHsCOCHj+NHsOH —«-* CH3C(NOH)CHaНаО
н н
1 1 Ast®
в) CHS—С—С—CHS —-5—»-CHS—С—CHS—CHe
i ) H.o li
Br H 0 ,
г) гексаметилентетрамин из формальдегида и аммиака. (Рассмотрите возмож-
ность участия имина формальдегида в качестве промежуточного соединения в ста-
дийном процессе1 образования соединения приведенной ниже структуры, за кото-
рым следует катализируемая кислотой конденсация последнего с аммиаком.)
сн»он
H3c/Nx<Ha
I i
HOCHj-N N-CH..ОН
\нг
14-39. Приведенные ниже реакции описывают «возможные» синтетические про-
цессы. Внимательно рассмотрите каждую из них и определите, может ли процесс
происходить так, как это изображено. Приведите ваши соображения. Если побоч-
ные реакции должны, по вашему мнению, иметь существенное значение, напишите
для них уравнения.
a) СНаСН(ОС2Нв)1 -}- 2NaOCH$ CHSCH(OCH,)2 J- 2NaOCsHB
Н,0
б) ри>ССОСИвСВа + КМпО1—(СНОСОМ-ИН/-Н2СО2К
снаон
в) .СНвСС1(СН,)СН2С14-2ЫаОСН8 —-*CHsC(GH,)(0CHg)CHs0.CH,+2NaCi
50 G
г) СС13СН0 + LiAlH4 —СС1»СН20Н
CHSOH
д) Os=CH-CO8H + NaBH1-—^О=СН-СН2ОН
е) CH3-O-)-CHsCOsCH94NaOH —*• HCOiNa-J-CHaCHaOH-bCHaOH
502
ГЛАВА 14
14-40. Назовите приведенные ниже соединения по принятой системе.
а) СН3ОСН4С(ОСНа)з б) СНа—СН—SO3Na г) £(СНэ)8СО]3А1 д) CHB(CH3CO3)C(CN)(CHS)
Ан в) CHsC(0CHs)a е) (CH3)3C=N-N(CH,)a ж) (CH3)aCHC(CH3)NOH
14-41, Напишите механизм окисления формиата натрия до двуокиси углерода
при действии перманганата калия; механизм должен соответствовать следующим
фактам:
а) и=А[НСО©ЦМпО©];
б) при окислении действием ??т’<1804 образующаяся СО,. не содержит 1ЙО;
в) DCO® окисляется в 7 раз медленнее, чем НСО®. Сравните предложенный
вами механизм с общепринятым механизмом реакции Канниццаро.
ГЛАВА
*
15
АЛЬДЕГИДЫ И КЕТОНЫ.
РЕАКЦИИ С УЧАСТИЕМ
ЗАМЕЩАЮЩИХ ГРУПП.
НЕНАСЫЩЕННЫЕ
И ПОЛИКАРБОНИЛЬНЫЕ
СОЕДИНЕНИЯ
Карбонильная группа, как правило, оказывает чрезвычайно
сальное влияние на реакционную способность связанных с ней за-
местителей. Это особенно очевидно в тех случаях, когда замести-
тели содержат атом водорода или галогена при углеродном атоме
в а-положении к карбонильной группе или если в а, ^-положении
находится двойная связь. В настоящей главе будет рассмотрен
ряд наиболее важных синтетических реакций, протекающих с
участием а-воборода, а также реакции ненасыщеннь1х и поликар-
бонильных соединений.
15-1. Галогенирование альдегидов и кетонов
Галогенирование насыщенных альдегидов и кетонов обычно
происходит исключительно путем замещения водорода в «-поло-
жений к карбонильной группе
О О
II II
CHjCCHs+Cij —* С1СНгССН3 + НС1
' хлора цетон
/Вг
’^ОЦ-ВГа —+ =0 + НВг
2-бромциклогексаноя
Эти реакции по своему характеру резко отличаются от гало-
генирования алканов (гл. 3). Галогенирование ацетона, наиболее
хорошо изученное, энергично протекает при действии хлора,
брома и иода.
504
ГЛАВА 15
Важная особенность данной реакции состоит в том, что ацетон I
реагирует со всеми галогенами с одинаковой скоростью. Действи- I
тельно, скорость образования галогенаамещенного ацетона не I
зависит от концентрации галогена, даже если последний ирисут- 1
ствует в весьма малых концентрациях. Далее, галогенирование I
ацетона катализируется как кислотами, так и основаниями. Вы- |
ражения для скоростей образования галогенированного ацетона Д
в водном растворе имеют следующий вид: d
d—ft [СН8СОСН8] [ОН®] при умеренных концентрациях ОН® ;
v=kr [СНЭСОСН3] [Н®] при умеренных концентрациях Н®
Отношение k к k' равно 12 000, откуда следует, что гидроксил- :.i
ион гораздо более эффективный катализатор, чем ион водорода.,
Упражнение 15-1. Подробное изучение скорости бромирования ацетона в воде
в присутствии ацетатного буфера привело к следующему выражению:
!0-в-|-5,6. [0-а[наО®]+ 1,3- 10-e[CH3CO2HJ +
4-7[0H®] + 3,3-J0-6[CH0CO®]+3,5.;0-efCH3CO2Hj[CH3CO®]}[CH3COCH3],
где скорость при концентрациях, выраженных в моль/л, выражается в моль-л-1-
•С’Х.
а) Вычислите скорость реакции для i М раствора ацетона в воде при pH 7
в отсутствие уксусной кислоты и аце.тят-иона.
б) Вычислите скорость реакции для 1 М раствора ацетона в растворе, полу-
ченном Нейтрализацией ] М уксусной кислоты таким количеством едкого натра,
которого достаточно для получения рН5,б уксусной кислоты равна 1,75-
10-?).
в) Объясните, каким образом числовые значения коэффициентов в выражении
для скорости могут быть получены из данных по скоростям реакций При различных
pH и концентрациях буфера (обратитесь к разд. И4).
Для того чтобы объяснить роль катализа и независимость ско-
рости от концентрации галогена, необходимо допустить, что ацетон
медленно превращается при действии катализатора в промежу-
точное соединение, которое быстро реагирует с галогеном, образуя
конечные продукты. Этим промежуточным соединением является
а-метилвйниловый спирт, неустойчивая енольная форма ацетона.
е он ®он
гн глги Н® (или ОН) r u Вг. rtr Ji п_ , ,9
С?г1^ч.ОС-г1 .—'1 > С* V1 xjFig । «« ji Crlg С“* Вг *
медленно бистро
енол (ех*меггилви>;
валовый спирт)
о
±L\i£X снэсснаВт.-рн®+Вт©
Если скорость первой стадии меньше, чем скорости второй и треть-
ей стадий, то скорость галогенирования не будет зависеть ни от
АЛЬДЕГИДЫ И КЕТОНЫ
505
концентрации галогена, ни от его природы, будь то хлор, бром или
иод.
Теперь рассмотрим каждую из стадий более подробно. Прежде
всего возникает вопрос, в чём состоит действие катализатора, пре-
вращающего кетон в енольную форму* *?
А. Енолизсщия, катализируемая основанием
«
При основном катализе первая стадия заключается в отрыве
протона от a-положения, что приводит к образованию енолят-
аниона (I)
медленно
СН3-С-СНг: Н••+ ОН ^7.. -т!
о®
©
СНз-С=СН2 -***- СН3"С-СН; :
+ н2о
о
н
Обычно связи С—Н в высокой степени устойчивы к атаке ос-
новных агентов; однако удаление водорода, расположенного в
a-положении по отношению к карбонильной группе, приводит
к образованию существенно стабилизированного аннона, в кото-
ром значительная часть отрицательного заряда сосредоточивается
на кислороде. В результате водородные атомы в а-положении
приобретают кислый характер (протонную подвижность) и могут
быть удалены в виде протонов. В отличие от диссоциации многих
слабых кислот (например, CH,COSH, HSBO3, HF и др.) подвижный
протон, связанный с углеродом, удаляется медленно, и скорость
установления равновесия между кетоном и его енолят-анионом (I)
мала. Это означает, разумеется, что поскольку удаление протона
от углерода происходит медленно, то и обратная реакция также
должна быть медленной *, В результате енолят-анион имеет до-
статочно времени, чтобы присоединить протон по кислороду и дать,
таким образом, енол (этот процесс происходит по крайней мере в
10w раз быстрее, чем превращение в кетон) , i
Г 0 Iе я
|; . бЫСТрО
_CH3-C^CH2J
он
I
-,с=сн,
Как енол, так и енолят-анион могут быстро взаимодействовать
с галогеном,, образуя а-галогенкетон
* Г о 1© О
11 быстро ||
_СН3—С— CH,J +Вгг—"->CHs-C-CH!—Вг+Вг©
он §н. о
I быстро II _(-HBr) II
СН3— С = СН2<Вг,——-6Н»—С—СН8Вг+Вг©-------*СНЯ—С—СН2Вг
* При равновесии скорость превращения кетона в енол и скорость обратной
реакции одинаковы.
506
ГЛАВА 15
Наиболее медленная стадия всей последовательности превра-
щений— образование енолят-аниона, и суммарная скорость ре-
акции не зависит поэтому от концентрации галогена.
Б. Енолизация, катализируемая кислотой
При катализе енолизации ацетона кислотами вначале образуется
оксониевая соль, а затем при действии воды или других акцепторов
протонов удаляется а-протон.
, О
сн3—с—сн3 + н®
быстро
®он
и
СН3-С-СН5
f ОН х-------
М k'-s SX
+ НгО
медленно
ОН ~
I ©
CHj—С—СНг + Н3О
Этот процесс отличается от енолизации, катализируемой осно-
ванием, в том отношении, что енол образуется непосредственно,
а не через стадию енолят-аниона. Присоединение протона к кисло-
роду карбонила резко увеличивает легкость отрыва протона от
а-углеродного атома вследствие большой электроноакцепторности
положительно заряженного кислорода. Скорость енолизации (или
галогенирования) определяется скоростью последней стадии.
Закономерности катализируемой кислотами и основаниями
енолизации, установленные для галогенирования ацетона, харак-
терны также для широкого круга других, обычно более сложных
реакций. По этой причине реакция галогенирования рассмотрена
подробнее, чем этого требовала бы ее значимость в качестве син-
тетического метода.
Упражнение 15-2, Оптически активный втор-бутилфснилкетои при действии
разбавленной кислоты превращается в оптически неактивную форму. В присут-
ствии брома с той же скоростью образуется 2-б ром-2-бутилфен ил кетон. Объясните.
Упражнение 15-3, а) Равновесная концентрация енола в ацетоне оценивается
величиной 0,00025% , Пусть скорость превращения 1 М ацетона в енол в нейтраль-
ном водном растворе в отсутствие уксусной кислоты или ацетат-иона является та-
кой, какая может быть рассчитана в упражнении 15-1; вычислите скорость, кото-
рую должна была бы иметь обратная реакция в случае, если бы енол присутство-
вал в концентрации 1 М.
б) Енол или енолят-ион будет более реакционноспособным по отношению к
брому (в предположении, что оба они присутствуют в одинаковой концентрации)?
Почему?
в) Больше или меньше, по вашему мнению, окажется для ионизации енола
в соответствии с уравнением:
енрлт^еполят-аниои+Н®, чем Кд ионизации .этанол а: С3Н6ОН^^СаН50®-|-Н®?
Почему?
г) Можно ли ожидать существенного различия скоростей галогенирования
СНаСОСНэ и CD3COCH3? Объясните. >
АЛЬДЕГИДЫ И КЕТОНЫ
507
д) Предложите механизм, объясняющий присутствие члена
3,5- 10~e[CH3CO2H][CH3CO@]
в выражении для скорости енолизации ацетона в смеси водной уксусной кислоты
и ацетата.
Упражнение 15-4. Метилэтилкетон галогенируется в присутствии кислого ката-
лизатора преимущественно в этильной части молекулы, а в присутствии щелоч-
ного катализатора — по метильной группе. Объясните эти факты (при ответе по-
лезно обратиться к разд. 7-3 и
В. Галоформная реакция
Приведенное выше обсуждение галогенирования кетонов тре-
бует дополнения в одном важном вопросе, относящемся к галоге-
нированию, индуцируемому основанием, а именно: если обра-
зуется а-галогенкетон, то прочие водородные атомы при данном
углероде приобретают вследствие электроноакцепторного действия
галогена более кислый характер и удаляются гораздо быстрее,
чем первый водород.
О О
* || медленно -|| *. быстро
СНз-С-СНз-------->СН3-С—СН3Вг-------►
О О
|| быстро ||
—> СНа — с— СНВг2--> СН3—С—СВг,
Таким образом, если стремятся получить монобромкетон, то
реакцйю следует проводить в присутствии кислого, а не основного
катализатора. Катализируемое основаниями галогенирование ме-
тилкетонов осложняется также тем, что образующийся тригало-
генкетон легко атакуется основанием, что приводит к расщеплению
углерод-углеродной связи.
/Я
CHj—с +
он
о'
о
0 быстро
CHj-C-C&T, + ОН ^—77*
. I х медленно
CHj-C^^CBr, ---------►
О ГТ
о
: СВгз9 ^=±7 CH3CZ/ * НСВг,
-
бромофцрМ
Такую последовательность превращений часто называют гало-
формной реакцией, поскольку в результате ее образуется хлоро-
форм, бромоформ или йодоформ в зависимости от галогена, исполь-
зуемого при галогенировании. Галоформная реакция служит удоб-
ной качественной пробой на присутствие метилкетонов, особенно в
случае иодирования, так как йодоформ представляет собой чрез-
508 ГЛАВА 15
пычайно мало растворимое твердое вещество, ярко-желтого цвета.
Реакция оказывается также удобной для синтеза карбоновых
кислот в том случае, когда метилкетон более доступен, чем соот-
ветствующая кислота.
\ I)
Ъ-с-сн,
1. Бгг, ОН®, Нгб
2. Н® .
СОгН + СНБг3
85%
Галоформная реакция происходит быстро и поэтому может быть
в некоторых случаях использована для получения ненасыщенных "
кислот из ненасыщенных кетонов, причем этот синтез не ослож-
няется сколько-нибудь существенно присоединением галогена по
двойной Связи.
О
и
>с=снссн3
сн/
1.
С1,. он9, Я,О СН3ч
а. я® СН/
C=CHCOsH4-CHCls
Что касается’ свойств! а-^алогенальдегидов и а-галогенкетонов,
то в реакциях SN1 «-галогены оказываются чрезвычайно инертными,
тогда как при Sf.-2-замещении они исключительно подвижны по
сравнению с галогеном в алкилгалогенидах, сходных в отношении
пространственных факторов. а-Галогензамещенные карбоновые ки-
слоты обладают аналогичными свойствами, которые обсуждаются
подробно в гл. 16.
Упражнение 15-5. Объясните, почему fl-галогенкетоны весьма легко вступают
в реакции Е2-отщепления. Для какого типа Р-галогенкетонов эта реакция не мо-
жет происходить так легко?
Упражнение /5-6. Хлороформ в свое время получали в промышленном масшта-
бездействуя гипохлоритом на этанол, Какие реакции могут при этом осуществ-
ляться? Какого типа спирты, помимо этанола, могут давать хлороформ при дейст-
вии галогенов и оснований?
Упражнение 15-7. Значения ДЯ, вычисленные из энергий связей для двух
приведенных ниже реакций в газовой фазе, имеют одинаковую величину!—9ккаЛ).
H2o+CHs-c-cas—► сн3—с—он-j- неси
А А
нао/сан^с-сн3 —> сс13-с-он+сн4
А А
Объясните, почему первая (но не вторая) из этих реакций при участийедкого
натра происходит с большой скоростью? Можно ли ожидать, что уксусная кислота
будет давать галоформную реакцию? Объясните.
АЛЬДЕГИДЫ И КЕТОНЫ S09
15-2. Реакции енолят-анионов
А. Альдольное присоединение
Йнолят-анионы принимают участие во многих важных синте-
тических реакциях карбонильных соединений— они либо присое-
диняется по двойным связям, либо .выступают в качестве атакую-
щих агентов при нуклеофильном замещении. Если присоединение
происходит по двойной связи карбонильной группы, то эта реак-
ция *,носит название альдольной конденсации (альдольного при-
соединения). Присоединение к двойной связи (в достаточной сте-
пени активированной) называют конденсацией Михаэля (присоеди-
нением по Михаэлю) — она будет рассмотрена в гл. 16. SN-Pe-
акции енолят-анионов обсуждаются в разд. 15-3 с точки зрения
принципов, лежащих,в их основе, и в гл. 16 — в плане их синте-
тического применения. ,
Характер протекания альдольной конденсации можно видеть
на примере реакции ацетальдегида с основанием, которая при
проведении ее в сравнительно мягких условиях дает fl-оксимасля-
ный альдегид (ацетальдоль)
разб. NaOH
' 2CHSCHO—---------’-СНэСНСН.СНО
ОН
При нагревании реакционной смеси продукт дегидратируется
в кротоновый альдегид (бутен-2-аль)
®ОН (или н®)
СНяСНСН2СН0-------------- СН3СН = снсно
он
Легкость .такой дегидратации (даже в щелочной среде) согла-
суется с легкостью близких по характеру реакций отщепления,
в которые вступают р-замещенные карбонильные соединения (см.
упражнение Т5-5).
На первой стадий альдольной конденсации при отрыве а-во-
дорода основанием образуется енолят-аннон
НО + Н:СН2-С-Н
О0
I :
снг=с-н *+
е ?
: СНг- С-Н
Затем анион присоединяется, к карбонильной связи аналогично
цианид-иону при образовании циангидрина (разд. 14-3,Л). Рас-
смотрение двух резонансных форм енолят-анирна позволяет пред-
положить, что присоединение может происходить по одному из
двух путей: атака аниона приводит либо к образованию .углерод-
углеродной связи, в результате чего образуется альдоль II, либо
к образованию связи углерод — кислород и получению а-окси-
510
ГЛАВА IS
,1
!
этилвинилового эфира III.
о го® о -
I! I S i!
СНЭ-С-Н + [СНа=С-Н<-»:СИ3-С-Н.
О® о
I II н®
CHj-C-CHj-CH
н
он
I
СН3-СН-СН2СНО
II
о®
он
сн3—с—осн=сн,
k
III
Хотя образование эфира III возможно с точки зрения механизма,
оно оказывается гораздо менее вероятным по термодинамическим
соображениям. Действительно, в то время как суммарное значение
ДЯ (для газовой фазы), вычисленное по энергиям связей, для
образования альдоля равно —4 ккал, для образования эфира Ш
оно составляет +20,4 ккал *,
Упражнение 15-8. Если Получать ацетальлоль в D2O, содержащей OD®, ис-
пользуя недейтерирояаиный ацетальдегид в умеренной концентрации, то в про-
дукте, образующемся на малых глубинах превращения, не содержится дейтерия,
связанного с углеродом. Если приведенный выше механизм правилен, то какая из
стадий должна быть, по вашему мнению, наиболее медленной? Каким должно
быть при этом кинетическое выражение, описывающее реакцию? Как, по вашему
мнению* отразится на кинетике и характере продукта, образующегося в D,O,
использование очень малых концентраций ацетальдегида?
Упражнение 15-9. Какие продукты образуются при проведении альдольной
конденсации с пропионовым альдегидом, триметилацетальдегидом и смесью этих
двух альдегидов?
Константа равновесия при альдольной конденсации ацеталь-
дегида имеет благоприятное значение, так же как и для большин-
ства других альдегидов. В случае ацетона в равновесной смеси
присутствует лишь несколько процентов продукта присоедине-
ния — «диацетонопого спирта» (IV). Это становится понятным при
Од ОН О
II он J II
2сн3ссн3 -—+ сна - с - он 3 - с - сн4
СН3
IV
учете пространственных препятствий и того факта, что карбониль-
ная связь в кетоне приблизительно на 3 ккал прочнее, чем
* Это значение, возможно, завышено на 3—4 ккал, поскольку энергия стаби-'
лизацин виниловых эфиров обычно близка к такой величине.
АЛЬДЕГИДЫ И КЕТОНЫ
511
ацетон
пористый патрон,
• содержащий
Рис. 15-1. Прибор для получения диацетонового Ва(ОН)г
спирта.
в альдегиде. Несмотря на невыгодное значение константы равно-
весия, диацетоновый спирт можно получить с хорошим выходом,
использовав прибор, изображенный на рис. 15-1.
Ацетон нагревают до кипения; при этом горячий конденсат
стекает из обратного холодильника, проходит через пористую
гильзу, содержащую твердую окись бария, и устанавливается
равновесие с диацетоновым спиртом. Окись бария остается в гильзе,
а жидкая фаза возвращается в колбу/где ацетон (кипящий на 110°
ниже диацетонового спирта) селективно переходит в газовую фазу
и возвращается в зону реакции, чтобы вновь частично превратиться
в диацетоновый спирт..
Упражнение 16-10, В какой момент в системе, изображенной на рис. 15-1, пре-
кращается дальнейшее образование диацетонового спирта? Что произойдет, если
некоторое количество гидроокиси бария пройдет через отверстие в гильзе и попадет
в колбу? Почему гидроокись бария больше подходит для этого синтеза, чем едкий
натр?
Соединения, участвующие в ключевой стадии при альдольной
конденсации, должны быть, как правило, одно — донором пары
электронов, а другое—ее акцептором. При образовании ацет-
альдоля й днацетонового спирта обе роли выполняют одинаковые
молекулй, однако это вовсе не является необходимым. Возможны
смешанные реакции присоединения самых различных типов. Рас-
смотрим пару формальдегид — ацетон: формальдегид не может
образовать енолят-аниона, так как у него отсутствуют а-водороды,
но можно ожидать, что он окажется особенно хорошим акцептором
электронной пары. Последнее связано с тем, что он свободен от
пространственных препятствий, а также с тем, что прочность кар-
бонильной связи в нем необычно низка (166 ккал, ср. с 179 ккал
для ацетона). Ацетон легко образует енолят-анион, но сравни-
тельно плохо подходит для роли акцептора. Следовательно, при-
512
ГЛАВА 15
стеклянные бусы
холодный раствор
формальдегида,
: к которому добавлен
разбавленным едкий
натр
летучее карбонильное
соединение с добавкой
слабой нелетучей
органической кислоты
Рис, 15-2. Прибор для получения" моко-
оксиметиленового продукта ал [.дольной
конденсации из формальдегида и карбо-
нильных соединений, содержащих более
одного а-водородного атома.
соединение ацетона к альдегиду должно происходить (и происходит
в действительности) с большой легкостью.
О «О
II бн II
сн9—с—СН3 4- снв - о —>- CI13—с—спаснаон
Проблема заключается не в том, чтобы достичь такого при-
соединения, а скорее в том, чтобы не дать ему пройти слишком
глубоко. Действительно,, в конечном счете на группы —СН2ОН
легко могут быть замещены все шесть а-водородов.
0 д О
II II
СН3ССН34-6СН2О —> (НОНаС)3С—С—C(CHSOH),
Для получения высоких выходов моноокси мети лен производных обычно необ-
ходимо использовать прибор, подобный изображенному на рис. 15-2. Назначение
прибора — сделать возможным проведение конденсации в присутствии большого
избытка ацетона, что обеспечит преимущественное образование продукта мояокон-
денсации. В определенный момент реакция должна быть прервана, ацетон отделен
и использован повторно. Это достигается кипячением ацетона, содержащего избы-
ток нелетучей слабой органической кислоты, подобной янтарной (СНг)й(СО2Н)2,
Пары ацетона конденсируются и затем смешиваются сочень медленно добавляемым
щелочным раствором формальдегида. Присоединение происходит во время мед-
ленного стекания смеси по колонке, наполненной стеклянными бусинками, и (по-
скольку ацетон присутствует в большом избытке) приводит к моноаддукту. Реак-
ция прекращается, и обратная реакция предотвращается вследствие нейтрализа-
ции щелочи кислотой, содержащейся в колбе. Избыток ацетона вновь испаряется
и вступает в реакцию со следующей порцией формальдегида.
Важной в промышленном отношении реакцией смешанного
присоединения является конденсация ацетальдегида с избытком
формальдегида в: присутствии гидроокиси кальция. Происходит
АЛЬДЕГИДЫ И КЕТОНЫ
513
тройное, присоединение, ’ и образующийся триокси метиленацеталь-
дегид (в котором отсутствуют «-водороды) вступает в «перекрест-
ную» реакцию Канниццаро (См. упражнение 14-36) еще с. одной
молекулой формальдегида, что приводит к четырехатомному спирту,
известному под названием пентаэритрит.
СН3ОН _ СН2ОН
Э | So |
CHsCH0 + 3CH,0 -X НОСНа-С-СНО —HOCHS-C-CHSOH
. . | сн.о j
. сн,он сн2он
пентаэритрит
Пентаэритрит широко используется при изготовлении покры-
тий, а также для производства сложного эфира: азотной кислоты —
пентаэрйтриттетранитрата (ПЭТН) C(CH2ONO2)4, представляющего
собой взрывчатое вещество,
С помощью рассмотренных выше реакций из продуктов альдоль-
ной конденсации могут быть получены различные соединения.
Особо важное значение, имеет дегидратация альдолей в «^-нена-
сыщенные карбонильные соединения, протекающая наилучшим
образом в условиях кислотного катализа. Образование кротонового
альдегида путем дегидратации ацетальдоля упоминалось в начале
данного раздела. Другим примером может служить дегидратация
диацетонового спирта в окись мезитила
СН3
сн3—i—сн2—с—сн3
I II
он о
Нф> СНзч
(-ЩО) сня/
С=СН-С—СН3
II
пентен-3-он-2
(окись мезитила)
Упражнение !5-П. Укажите, образования каких основных продуктов следует
ожидать в каждой из приведенных ниже реакций. Аргументируйте ваши сообра-
жения.
NaOH
а) СН3СНО + (СН3)аСО----*
NaOH
б) (СН3)2С(ОН)СН2СОСН3 *
NaOH
в) СНаО + (СН8)8ССНО—--*
Са(ОНЦ
г) СН8О + (СН9)аСНСНО—-----
Упражнение 15-12. Покажите, каким образом приведенные ниже соединения
могут быть синтезированы из указанных ьеществ с использованием в ходе синтеза
продуктов альдольной конденсации.
а) ;СН3—.СН—СН3 — СН2 из ацетальдегида
ОН ОН
б) СН8СН,= СН—СИаОН из ацетальдегида
в) i'CHs'iА.ИСК,СН2С11 э из аце юн а
О .
и
г) СН3СН — С—СН2СН3 из пропионового альдегида
I
СН8
17 №1В40
514
ГЛАВА 15
Упражнение 15-13. Альдольная конденсация происходит также в присутствии
кисльгх катализаторов. Например, ацетон в присутствии сухого хлористого водо-
рода медленно образует (СН;3),С=СНСОСНа (окись мезитила) и (СН3)аС=
=СНСОСИ=С(СНЯ)2 (форон). Напишите механизмы образования этих продук-
тов, уделив особое внимание тому, каким образом возникают новые углерод-угле-
родные связи.
Б. Нуклеофильное замещение с участием
енолят-анионов
Енолят-анион может быть с хорошим выходом получен из кетона
(если последний содержит а-водородный атом) при действии силь-
ных нуклеофильных агентов, по’добных амидам натрия или калия.
Образовавшийся таким образом енолят-анион теоретически может
вступать в Sx-реакции с ал кил галогенидами двумя различными
способами. Так, в случае mpem-бутилметилкетона и йодистого
метила возможны следующие реакции, отличающиеся только по-
ложением, в которое направляется атака: '
сняо
сн.-М-сн,-^
|* (-NH,)
сн3
СН» о сна о©
СН3— С-С-СН©: ч->СНа-С —С=СН,
I I
сн3 сн8
СН,1
(-КО
к®
С-а лк н л и р о ва Цие
сна о
I II
СН3 —С —с-сна -сн»
СИ»
О-алкилиро ванне
Выше в связи с альдольной конденсацией рассматривалась воз-
можность протекания реакций енолят-аннойа таким образом, как
если бь1 заряд был в значительной степени сконцентрирован либо
на атоме углерода, либо на атоме кислорода. Существует, однако,
глубокое различие между альдольной конденсацией и рассматри-
ваемыми здесь реакциями, поскольку в первом случае реакция
по кислороду, как указывалось, весьма невыгодна термодинами-
чески (Д#=-)-20 ккал) по сравнению с реакцией по углероду
(ДЯ=—4 ккал). В то же время (как будет видно из упражнения
15-14) и О- и С-алкилирование аниона термодинамически выгодно.
Кроме того, алкилирование в отличие от альдольного присоеди-
нения в обычных условиях необратимо, и поэтому продукт О-алки-
АЛЬДЕГИДЫ И КЕТОНЫ
515
I лирования не может перейти в продукт С-алкилирования, несмотря
| на то что последний на 24 ккал более стабилен.
s ---------------------------------------------------------------------------
I Упражнение 16-14. а) Вычислите iW для каждой из приведенных ниже реак-
I цин, исходя из энергий связи;
( СНЭ—С—СН3 (газ)4-СН31 (газ)—> СН3 —С —СНа—СН3 (газ)-рШ (газ)
I • * И . »1
/ОСН.,
СН.—С—СНа (газ)Ц-СН31 (газ) —*-СНв~С^ (газ)ЦЛ-П (газ)
II
о
Приняв, что АЯ для HI (газ)->-Щ (водн.) и Ш (водн.)-}-NaOH (водн.)->
->NaI (водн.)4-НаО равны —19,6 п —13,3 ккал соответственно, вычислите ДЯ
для следующих процессов:
СН3—С—СН3 (газ)-) СН31 (газ)4-МаОН (води.) —»
—>-СНЭ—С—CHSCH3 (ra3)4-H2O4-NaI (води.)
СН3—С—СНЭ (газ)4-СН31 (газ)-(-НаОН (водн.) —ч-
0
/ОСН,
—-СН8 —сС (саз)+HaO-|-NaI (води.)
; Этн результаты делают возможной грубую оценку термодинамической выгод-
1 ности осуществления С-и О-алкилирования с помощью основных агентов, хотя и в
I весьма искусственных условиях, как можно видеть из пункта (б).
I б) Приняв, что для ацетона ~10~ао, оцените возможность получения
I метилэтилкетона из ацетона и йодистого метила в 1 М NаОН. Какая реакция будет
• доминирующей в такой смеси?
Упражнение 15-16. Виниловые эфиры (простые эфиры енолов) более устойчивы
В отношении перегруппировки, чем вин ильные спирта (енолы). Почему? Какие
условия, но вашему мнению, должны благоприятствовать перегруппировке вини-
ловых эфиров?
Реакционная способность галогенида часто оказывается определяющей для
протекания алкилирования по С- и Q-направлению. Решающим фактором, по-ви-
димому, является степень образования новой связи углеродом в галогениде в пере-
ходном состоянии, отделяющем исходные реагенты от продуктов реакции. Если об-
разование новой связи произошло в значительной степени (это обычно оказывается
необходимым для того, чтобы «вытолкнуть» уходящую группу из галогенида, реак-
ционная способность которого в 5м2-реакциях невелика), то следует ожидать пре-
имущественного алкилирования ио углероду, В такой ситуации переходное состоя-
цие оказывается в большей степени сходным с продуктами реакции, и С-алкилиро-
17*
518
ГЛАВА 15
вание соответствует более устойчивому продукту.
,о jy
g<© +Rx-+R’-c<>e в©
Х?Н2 ХН. ... R-.-X.
переходное состояние при С-алкилпроиании
,0
R'—с/ 4-Х0
ch.r
Если же реакционная способность галогенида велика, то образование новой
связи .в переходном состоянии осуществляется в гораздо меньшей степени и пере-
ходное состояние поэтому весьма сходно с исходными реагентами. При этом может
произойти О-алкйлирование, так как заряд енолят-аниона в большей степени скон-
центрирован на атоме кислорода, чем на углероде.
6© ее
' /,0 ,0 ...R---X
R'~-C<© +RX*~>R'—СК
^СН2 \ЧСН2
переходное состояние
При О-ЭЛКИЛИрОВЭБИП
Алкилирование простых кетонов алкилгалогенидами в присут-
ствии амида натрия (алкилирование по Халлеру — Бауэру) имеет
ограниченное синтетическое применение, по может с успехом ис-
пользоваться для синтеза высокозамещенных кетонов, подобных
гексаметил ацетон у, получение которых с помощью других методов"
затруднительно.
(СНЭ)3С—C-CHs4-3NaNH2+3CH/ —» (CH9)sC-C-C(CHs)3-L3NaI+3NH8
А А
Более удобные методы алкилирования, используемые для син-
теза а-замещенных кетонов, будут рассмотрены в гл. 16.
Упражнение /5-/6. Учитывая то, что при взаимодействии йодистого метила с
еиолят-аиионом ацетона образуется в основном продукт С-алкнлирования, ука-
жите, какие из приведенных ниже галогенидов должны реагировать по типу 0-
адкилирования; трет-бутил хлор ид, хлористый ацетил, аллилхлорид, неопеитил-
хлорид?
Упражнение 15-17. а) Алкилирование по Халлеру — Бауэру в случае эти л гало-
генидов и высших алкилгалогенидов происходит намного хуже, чем в случае ме-
тнлгалогенндов. Объясните, почему в этих случаях особенно важную роль могут
играть конкурирующие процессы?
б) Что, по вашему мнению, должна произойти с ацетальдегидом в условиях
реакции Халлера Бауэра?
15-3. Енамины
Виниламины («енамины»), как правило, неустойчивы в том случае, если при
азоте имеется атом водорода, и перегруппировываются в соответствующие имины.
Это превращение аналогично перегруппировке виниловых спиртов’ в карбонйль-
АЛЬДЕГИДЫ И КЕТОНЫ
517
Подобно виниловым эфирам, виниламины, у которых при азоте отсутствует
водородный атом, устойчивы в отношении перегруппировки и вступают во многие
важные в синтетическом.отношении реакции, весьма сходные с реакциями енолят-
анионов, Такпе енамины во многих случаях без труда могут быть получены в при-
сутствии кислого катализатора из кетонов, содержащих а-водородный атом, и
вторичных аминов, таких, как пирролидин (Cn2)4NH.
Реакция обычно доводится до конца путем отгонки воды по мере ее образова-
ния. Для большинства альдегидов енамины устойчивы в несколько меньшей сте-
пени, но могут быть получены теми же методами. Образование енаминов — легко
обратимая реакция, и карбонильное соединение может быть регенерировано путем
гидролиза в кислом растворе.
' Упражнение /5-18- Напишите механизм образования енамина, соответствую-
щий природе реагентов и катализатора.
В енаминах, как и в еполят-аиионах, имеется два реакционноспособных поло-
жения, ив принципе возможны как ЬР, так и С-присоединепие и алкилирование.
Различие между этими двумя возможностями, по-иидимрму, меньше, чем для ено-
лят-анионов аналогичного строения, поскольку С-алкилирование приводит к раз-
делению зарядов, а также потому, что двойная связь азот —• углерод не настолько
прочнее простой связи углерод — азот, насколько двойная связь углероду— кис-
лород прочнее соответствующей простой связи. Однако, хотя приведенный выше
енамин, полученный из циклогексанона и пирролидина ^’-(циклогексен-Ьил)пир-
ролидйна), при алкилировании алкилгалогенидами может Дать С-производные, луч-
шие результаты Достигаются в случае галогенидов, обладающих большей реакци-
онной способностью в реакциях 5№,.навримрр ял'лилгалогенидов, а-галогепзаме-
щенных сложных эфиров и т. д. В случае этилбромацетата после обработки про-
дукта алкилирования водой получают2-карбэтоксиметилциклогексан6н с выходом
70%. Этот метод часто: оказывается превосходной альтернативой алкилированию
518
ГЛАВА 15
по Халлеру — Бауэру, поскольку он требует значительно более мягких условий.
Интересно, что К,-(циклогептен-!-ил)пирролидян дает с алкилгалогенидами в
основном продукты N-алкилирования.
При взаимодействии с ацилхлоридами енамины гладко дают продукты С-аци-
лирования. Эта реакция удобна для получения 1,3-ди кето нов, химия которых бу-
дет рассмотрена ниже.
Упражнение 15-19, Что, но вашему мнению, должно произойти при смешении
/-----------------------\ ® ct
йодистого метила и / N(CH3)3IW в соответствующем инертном раство-
рителе?
Упражнение 15-20, Объясните, почему в случае М-(циклогептен-1-иЛ)пирроли’
дина С-алкилирование происходит в меньшей степени, чем в случае соответствую-
щего циклогексенильного производного?
НЕНАСЫЩЕННЫЕ КАРБОНИЛЬНЫЕ
СОЕДИНЕНИЯ
Присутствие в одной молекуле карбонильной функции и двой-
ной связи придает соединениям особые свойства, но только в том
случае, если группы расположены близко друг к другу. Наиболь-
ший интерес представляют кумулированные и сопряженные си-
стемы. Рассмотрим сначала сопряженные или а, fj-ненасыщенные
карбонильные соединения, так как их химические свойства имеют
много общего с химией соединений, уже рассмотренных в этой
главе и в гл. 14.
АЛЬДЕГИДЫ И КЕТОНЫ
• 519
15-4. а,^-Ненасыщенные альдегиды и кетоны
^Наиболее общим препаративным способом получения а,р-не-
насыщенных соединений является дегидратация продуктов альдоль-
ной' конденсации, описанной в разд. 15 2,А. Сопряжение карбо-
нильной группы и двойной связи сильно сказывается на спект-
ральных свойствах, особенно на ультрафиолетовых спектрах, вслед-
ствие стабилизации возбужденных электронных состояний, в ко-
торце при л->л*-переходах важный вклад вносят полярные резо-
нансные структуры (см. также разд. 9-9).
К II х । 1 ' х । । 1
Х=С-С=О w >С-С-С = О W }С-С=С-Ю
/ /ф S / Ф Q
Резонанс такого типа в основном состоянии играет значительно
меньшую роль, но выражен все же достаточно сильно для того,
чтобы с его помощью можно было объяснить сравнительно неболь-
шое отличие дипольных моментов насыщенных и- а,0-ненасыщен-
ных альдегидов, например:
СН3СНгСНО СН3=СН—СНО
р.хх2,7 единицы Деб;1Я ц — 3,0 единицы Дебая
Влияние сопряжения сказывается также на частотах карбониль-
ной группы в ИК-спектрах (разд. 9-9) и спектрах ЯМР. Что каса-
ется последних, то было найдено, что сигналы протонов при 0-
углеродном атоме а,0-ненасыщенных карбонильных соединений
обычно лежат на 0,7—1,7 м. д. в более слабом поле, чем сигналы
протонов обычных олефинов. Для «-протонов этот эффект выражен
• слабее.
Упражнение 15-21. Интерпретируйте ЯМР-спектры, изображенные на
рис. 15-3, имея1 в виду, что они относятся к соединениям, имеющим молекулярные
формулы СвН10О и СэНвО. Во втором соединении содержится фенильная груп-
па (ЦНа).
а, 0-Ненасыщенные карбонильные соединения могут вступать
в обычные реакции присоединения и конденсации по карбонильной
группе, такие, как образование циангидринов и гидразонов и
присоединение металлоорганических соединений, Эти реакции,
однако, мог>т осложняться (если не перекрываться полностью)
1,4-присоединенйем. Выше уже было показано, что реактивы
Гриньяра могут взаимодействовать либо по типу 1,2-присоединёния
(с карбонильной группой), либо по типу 1,4-присоединения, в
которое ‘вовлекаются как карбонильная группа, так и двойная
связь; (разд. 12-4,Г). Условия баланса между двумя направле-
ниями реакций .настолько чувствительны к различным воздей-
ствиям, что сравнительно небольшие изменения характера прост-
ранственных препятствий оказываются достаточными для того,
чтобы сделать один из процессов доминирующим.
Д20
ГЛАВА IS ’
В случае цианистого водорода образование циангидрина обычно
происходит быстрее, чем 1,4-присоединение, й если положение
равновесия выгодно (как для большинства альдегидов), тонаблю-
даегся только 1.,2-присоединение. .
он
I
СН8—СН==СН—СНО-р HCN —I СН3-СН-СН-С--Н
Образование циангидринов кетонов менее выгодно, и в резуль-
тате 1 ^-присоединение приводит к р-дианкетону.
О й °
II Зн II
СН2= СН—G-СН3 4- HCN —N » С - CHS - СН3 - С-СН»
АЛЬДЕГИДЫ И КЕТОНЫ
521
Упражнение 15-22. Рассчитайте АЯ(в газовой фазе) для 1,2- и 1,4-присоедине-
ния цианистого водорода к метил винил кетону. Напишите механизм 1,4-присовди-
нения, согласующийся с катализом основаниями и с тем фактом, что цианистый
водород не присоединяется к изолированной у г лер од-у г ле родной двойной связи.
Присоединение галогеноводородов к «,0-ненасыщенным аль-
дегидам я кетонам приводит к тому, что галоген вступает в по-
ложение. Если винильная группа сопряжена с карбонильной
функцией, то образование продукта происходит против правила
Маркбвникова.
О О
ii . и
СНг = СН-С-Н4-НС1 -^-С1СН2^СНа-,С-Н
Направление присоединения к а,0-ненасыщенным кислотам
имеет аналогичный характер: продукты соответствуют реакции
1,4-типа. Причины этого будут рассмотрены более подробно в гл. 16.
О О
)1 Г /ОН] ||
СН,=СН—С-ОН+НС1—> С1СН2—СН=С< —+С1СЩ—сн2—с—он
L он]
Упражнение 15-23. Образования какого продукта можно ожидать в результате
присоединения брома к метилвинилкетону? Более или менее быстрой должна, по
вашему мнению, быть эта реакция присоединения по сравнению с присоединением
брома к бутецу-1? Почему?
Для многих а,₽-ненасыщенных альдегидов и кетонов взаимо-
действие с гидразином приводит вследствие двух последовательных
реакций 1,2- и 1,4-присоединения к образованию циклических
продуктов, называемых пиразолинами.
о
CH^CH-C-CiHj + NHjNHj ~Н£>.
H.N'"’
З-фенцлпиразопин
Упражнение 15-24. В результате разложения 3-фенилпйразолина при нагрева-
нии сто с едким кали, нанесенным на платинированный асбест, образуются фенил-
циклонропан и-азот. Напишите возможный механизм этой реакции, которая, по-
види.ному, сходна с восстановлением по Цпжнеру — Вольфу (разд. 14-6,Б).
522
ГЛАВА 15
Синтез |3, у-ненасыщенных альдегидов и кетонов обычно пред-
ставляет определенные трудности; они легко перегруппировыва-
ются в а,р-ненасыщенные изомеры, в частности, в присутствии
реагентов основного характера
основание
сн3=сн—снг—СНО ----------► снэсн=снсно
Упражнение 15-25. Напишите возможный механизм происходящей при дейст-
вии основания перегруппировки бутен-3-аля в бутен-2-аль. Почему бутен-2-аль
более стабильный изомер?
15-5. Кетены
Кетенами называются соединения с кумулированными карбо*
килькой и углерод-углеродной двойными связями (
С=С=О).
Они, как и следует ожидать, обладают интересными и необычными
свойствами. Сам кетен СН2—С—О и его монозамещенные произ-
водные типа 1?СН=С=О, где 1?=алкил или арил, носят название
альдокетенов, тогда как дизамещеипые кетены R3C=C=O назы-
вают кетокетенами.
Существует сравнительно небольшое число общих методов по-
лучения кетенов. Простейший из них заключается в действии
цинка на а-бромацилбромид, но выходы при этом синтезе не во
всех случаях достаточно высоки.
К , К
R-с-С<^° -J-Zn R-<i = C=O + ZnBra
ir Вг
Сам кетен может быть получен с помощью ряда специфических
методов. В наиболее удобном лабораторном способе пары ацетона
пропускаются над металлической спиралью, нагреваемой током
до темно-красного каления. Присутствие воздуха должно быть
исключено во избежание обычного сгорания ацетона.
750 °C
СН3 —С—СН3------► СН2 —С = Оц-СН4
|| кетен,
О т. кип.— 56 ®С
Наименее прочными связями в ацетоне являются связи С—С,
и при 750 °C в результате фрагментации образуются метильный
радикал и радикал ацетил
сн8—С-СН3 —* СНаС- + -СНэ —* СН3=С=ОфСН4
АЛЬДЕГИДЫ И КЕТОНЫ
523
Переход водородного атома (т. е. диспропорционирование) при-
водит к метану и кетену.
Наилучшим промышленным способом синтеза кетена является
дегидратация уксусной кислоты
Л1РО,
СН3 —С—он —7^ сн2=с = 0 + н20
j) I и U
о
Эта реакция легко обратима, вследствие чего для достижения боль-
шой степени превращения вода должна быстро удаляться из сферы
реакции. Удобно проводить процесс таким образом, чтобы вода
конденсировалась в охлаждаемой камере и уксусная кислота,
образующаяся в результате обратной реакции, возвращалась в
цикл превращений.
CHjCOjH
реактор
охлаждаемая
камера
—* CHj=q-0
-Н2О
GHjGOjH+HjO
Кетен — чрезвычайно полезный ацилирующий агент для сое-
динений типа ROH и RNH2. Он реагирует быстро, и, поскольку
в ходе реакций происходит только присоединение, не возникает
необходимости отделения от побочных продуктов.
Упражнение Р5~26. Напишите возможные механизмы для реакций кетена со
спиртами и аминами. Можно ли ожидать, что эти реакции будут катализироваться
кислотами и (или) основаниями?
Достоинства кетена в качестве ацилирующего агента сделали бы его превосход-
ным (потенциально) продажным продуктом, пригодным для использования в бал-
лонах (т, кип. —56°C), если бы не его склонность к образованию димера, извест-
ного под названием дикетеца. Этот димер в свою очередь является высокорсакци-
онноспособным веществом; свойства его настолько необычны, что его строение не
было надежно установлено вплоть до 1945—1955 гг. (спустя 38—48 лет после того.
524
ГЛАВА 1'5
как он был впервые получен).
! сна = с=о
i I
сн,=с=о
дикетеи
(ви н илаЦето-0-лактон)
Этот димер сам может быть с успехом использован в синтезах; в частности,
при его взаимодействии со спиртами или аминами образуются производные ацето-
уксусной (3-кето масля пой) кислоты.
О о
И II
СНа—С—СНг—С—О—СН3
метил ацетоадётаг
О О
Cir3-C-CH^-C-NHCH3
N -метил ацетоацетамид
Пиролиз Ди кете на дает кетен, аллеи и двуокись углерода
2 СН;=С=О
4- с Од
Упражнение /5-27. Напишите механизм катализируемой кислотами реакции
метанола с дикетеном, соответствующий природе участвующих в превращении
реагентов.
Упражнение 15-28. Для дикетена предполагались или могли предполагаться
приведенные ниже структуры. Покажите, каким образом можно использовать ИК-,
ЯМР-, КР- и УФ-спектроскопию для того, чтобы различить все эти возможности
(обратитесь в случае необходимости к гл. 2).
НО.
ХС = СН
4
5
6
АЛЬДЕГИДЫ И КЕТОНЫ
525
/Д
сн2—ex
I I
СМ = Q
ОН
,он
СН=с/
о
II
сн3—-с—сн=с==о
S
(последняя структура в
течение многих лет счи-
талась наиболее вероятной)
Уимия следующих членов ряда кетенов широко не исследована. Мётилкетсн,
димеризуясь, даёт два различных изомера, тогда как кето кетены образуют только
цик лобутандионы-1,3.
СН3СН.
—>0
2СНаСН = С=0 —> | |
сн3-сн—с-
X)
H0.v усн3
ХС=С'
ch3-cA-L
^0
о,
СН:!, ^С-С(СН3)2
2 >С = С=О —| |
СН/ (СНз)2С-СХ
ПОЛЙКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
15-6. / ,2-ДикарбонильНые соединения
Ниже приведены структуры некоторых типичных и наиболее
важных представителей этого класса:
О О
II II
и—С—С—н
глиакспль
(эта иди аль)
о о
Il II
сн3-с-с-сн3
диацетил
(бу таид ион-2» 3)
о о
II II
CeHs—С—С—СдН3
реазпл
(дифенил ди кетон)
Большинство' 1,2-Дикарбонильных соединений окрашено в
желтый цвет. Особенность глиоксаля состоит в том, что, будучи
желтым в жидком состоянии, в газовой фазе он становится зеленым.
Альдегидные группы в нем очень реакционноспособны, на. чем
основано его использование в производстве пластических материа-
лов и в качестве консервирующей жидкости, действие которой
состоит в отверждении белков путем соединения их аминогрупп с
обрайЬванием иминных связей.
0 0
. II II
2Н/—(молекула белка] — NHa*pНС—СН —
Н Н
II
—у =N—[молекула белка] — N —С—C = N—[молекула белка]—N=
526
ГЛАВА 15
В присутствии щелочи глиоксаль вступает во внутримолеку-
лярную реакцию Канниццаро, образуя гликолевую кислоту
0 0 он О ОН О
if и е | н н® I II
Н-С-С-Н4-0Н ^Н-С-С JUh-C-C
IL II
НО® н он
С бензилом происходит аналогичная реакция, приводящая к пере-
группировке углеродного скелета. Эта перегруппировка — одна
из очень немногих, происходящих при действии основных реаген-
тов,— известна под названием перегруппировки бензиловой ки-
слоты.
0 0 ОН О ОН О
п И © © 1 л ©ф н® I и..
CeH6-C-C-CeH6-j-NaOH -*С,Н4~С-С~№а---------- СвН6-С-С-ОН
бензил [ |
с,н6 С6Н6
бензиловая
кислота
Упражнение 15-29. Каким образом можно было бы экспериментально подтвер-
дить (или опровергнуть) приведенный ниже механизм перегруппировки глиоксаля
в гликолевую кислоту?
еон
о о®
II © I
Н—С— С = 0 «-> н—с=с—о
он
он о
н—с—^-он
I
н
Упражнение 15-30. Напишите механизм превращения бензила в бензиловую
кислоту, аналогичный механизму реакции Канниццаро. Можно ли ожидать, что в
случае диацетила будет осуществляться тот же тип превращения? Если да (или
нет), то почему? -
Упражнение 15-31. Цикло цеп тан дион-1,2 существует в значительной мере как_
мрпоенол, тогда как диацетил существует в кето-форме. Предложите объяснение
этих фактов, учитывающее возможные конформационные различиядмежду двумя
соединениями. Какова долита быть легкость енолизации диана V? Почему?
V
АЛЬДЕГИДЫ И КЕТОНЫ
527
15-7. 1,3-Дикарбо пильные соединения
Большинство наиболее важных свойств 1, З-д и альдегидов, аль-
дегидокетонов и дИкетонов, характерных для 1,3-р аспол ожени я
карбонильных групп, могут быть с успехом рассмотрены на при-
мере ацетилацетона (центандиона-2,4)
О О
II : II
- СН3 - с —I— сна - с - снэ
ацетилиде юн
Это соединение необычно тем, что оно на 85% состоит из енольной
формы
0 0 ОН л
II И 1 ||
СН3-С-СН2-С-СН3^± /Л
снэ <н/ Vh3
15% 85%
ЯМР-спектр ацетилацетона (рис. 15-4) служит хорошим источ-
ником информации о характере соединений, присутствующих в-
' чистой жидкости. Резонансное поглощение кетонной и енольной
форм легко можно различить. Резонансные сигналы групп СН2
и СНа кето-формы расположены при 218 и 120 Гц, тогда как сиг-
налы групп СН3 и винильной СН-группы енольной формы харак-
теризуются величинами НО и 334 Гц соответственно. Протоны
енольной ОН-группы дают сигнал в очень слабом поле (910 Гц
относительно тетраметилсилана). Обе формы, присутствующие в
смеси, могут наблюдаться порознь; это свидетельствует о том, что
при комнатной температуре равновесие между ними устанавли-
вается более чем за 0,1 с (разд. 2-6,Е). Однако при добавлении ос-
Рис. 15-4. ЯМР-спектр ацетилацетона СН3СОСН2СОСН3 при 60 МГц относительно
тетраметилсилана.
528
ГЛАВА 15
ровного катализатора линии существенно уширяются, а при на-
гревании смеси линии сливаются и дают усредненный спектр в
соответствии с ожидаемые для быстро устанавливающегося ^рав-
новесия.
Очень большая величина химического сдвига протона енольной
ОН-групны обусловлена образованием внутримолекулярной, водо-
родной связи Между этим гидроксилом и карбонильной группой.
О
„ s—водорудная связь
’Г1-ь.ь Г
''о
СНз сн3
Водородная связь такого типа имеет важное значение для стабили-
зации енольной формы, о чем свидетельствует увеличение содер-
жания енольной формы в растворителях (например, гексане), ко-
торые не могут эффективно сольватировать кетбнные группы ке-
то-формы.
Енольная форма существенно стабилизирована также вслед-
ствие делокализации электронов в соответствии с приведенными
ниже резонансными структурами:
/н’>, ‘ /н\
О О ®С) 0е
I II о II I
с с с с
сй^'аСсня
Такая стабилизация, разумеется, невозможна в случае кето-
формы.
Термин «конформер» применяется для обозначения одной из
двух или большего числа стереохимических конформаций, находя-
щихся в равновесии, скорость установления которого настолько
велика, что в обычных условиях нельзя говорить об отдельно
существующих и выделяемых веществах (разд. 6-5).
.Термин «таутомер» используется точно в таком же смысле, но
применительно к. структурным изомерам, находящимся в быстром
равновесии, ..подобно кетонной и енольной формам ацетил ацетон а.
Если при таутомеризации происходит только перемещение протона,
то такую реакцию Называют прототропным превращением. Хотя
в принципе единственное Отличие между взаимопревращениями
ацетилацетона и его енола и пейтадиена-1.,4 и пентадиена-1,3 за-
ключается в относительных скоростях реакций, термин «тауто-
мерное превращение» применяется только к более быстрому про-
цессу.
АЛЬДЕГИДЫ И КЕТОНЫ
529
Енольная форма ацетил ацетон а обладает умеренно кислыми
свойствами ср. с КА уксусной кислоты, равной 10~6,
и Кд этанола, равной 10-1в). Еноляты щелочных металлов могут
быть проалкилированы алкилгалогенидами, достаточно реакцион-
носпособными в 5к2-реакциях; при этом, как правило, происходит
С-алкилирование. Выходы лучше, чём при алкилировании по Хал-
леру — Бауэру, так как анионы с более слабыми основными свой-
ствами реагируют по типу Ё2-отщеплёния (разд. 1.1-13). Ряд важных
в синтетическом отношении реакций алкилирования других 1,3-
дикйрбонильных соединений будет рассмотрен в гл. 16.
Катионы поливалентных металлов часто образуют с ацетилаце-
тоном весьма стабильные и малополярные еноляты, более извест-
ные под названием хелатов. Особенно эффективным хелатообразую-
щим агентом является ион двухвалентной меди
н
CHs /С1Г’
''С‘* ‘‘С
Г: ;1
°-. .°
JX,
О'" ‘‘О
CHS сн3
н
ацетилацст.онат меди
(темно-сипий)
: Другим примером металлсодержащего хелата может служить
ацетилацетонат бериллия; он плавится при 108 °C, кипит при 270 °C
и. растворим во многих органических растворителях.
Упражнение 15-32. Бицикло42,2,2]юктанднон-2,6 (VI) не обнаруживает
свойств-енола. Объясните.
VI
Упражнение 15-33, Объясните значительную величину К л енола ацетилаце-
тбна по сравнению с этиловым спиртом. Основываясь на содержании енольной и
кетон ной,форм в равновесной смесиi скажите, какая из форм является более силь-
ной кислотой? Объясните.
Упражнение 15-34. Расшифровав структуру соединений, интерпретируйте
приведенные на рис. 15,5 (стр, 533) ЯМР-спектры протонов. Одно из соединений
имеет брутто -формулу СмН[0Ог, а другое — формулу (СН3СН=С=О)2.
530
ГЛАВА IS
15-8. 1,4-Дика.рбонильные соединения
Большинство реакций 1,4-дикарбонильных соединений — это
обычные реакции, характерные для изолированных карбонильных
групп. Важное исключение представляет собой образование про-
изводных пиррола из 1,4-дикарбонильных соединений и аммиака
или первичных аминов
СН.
4- NHS —
СНЯ
С=О
I
сн3
гексан ди он Л, 5
(вцегонилацетон)
снэ
д
Н(7 \
! ЫН+2ЩО
Н%/
I
сн3
2,5-днметйЛПИррол
Эти реакции имеют весьма общее значение и могут применяться ; г
также для получения соединений, где кислород и сера входят в / j
состав пятичленного цикла (разд. 27-5). ' : i
Упражнение 15-35. Исходя из известных вам аналогий, напишите возможный
механизм катализируемой кислотой дегидратации ацетонил ацетона до 2,5-ди-
метилфурана (VH). ,
2,5-диметилфуран (VII)
15-9. Трикарбонильные соединения
Свойства трикарбонильных соединений по большей части не со-
держат в себе ничего специфического, за исключением тех случаев,
когда три группы расположены рядом, как в дифеиилтрикетоне.
В подобных соединениях центральная карбонильная группа ока-
зывается чрезвычайно реакционноспособной; при действии кислых
катализаторов, таких, как хлористый алюминий, она отщепляется
в виде окиси углерода; она также легко присоединяет воду, образуя
моногидрат.
О О
АЛЬДЕГИДЫ И КЕТОНЫ
531
Гидрат циклического трикетона (VIII), нингидрин, будет рассмот
.рен ниже в .связи с анализов аминокислот.
VHI нингидрин
Упражнение 15-36. Предложите Способ синтеза дифен плтр и кето на из дибензоил-
метана (С6Н5СО)2СН2. Каким образом можно установить, какая из карбониль-
ных групп — центральная или одна из боковых — отщепляется в виде окиси уг-
лерода при действии хлористого алюминия?
Упражнение 15-37. Какими свойствами должен обладать циклогексантриоп*
1,3,5?
Дополнительные упражнения
15-38. Приведенные ниже реакции описывают «возможные» синтетические пре-
вращения. Внимательно рассмотрите каждое из них и определите, может ли реак-
ция происходить так, как это написано. Приведите ваши соображения. Если, по
вашему мнению, побочные реакции должны иметь существенное значение, то
напишите уравнения для каждой из них.
a) CHsCOCHa4-6Br2-b8NaOH —> 2CHEr3 + Na2CO3 +6NaBr + 6H2O
б) CH3CHO + NaNH2 + (CH3)3CCi —ь (CH3)eCCHsCHO + NHs+NaCl
Ca{OH)j
в) (CH3)2CHCOCH3+CHa=:O---------► (CHa)3C(CHaOH)COCH3
еон
г) СН3СНО-|-СН3СО2С2Нв ---->CHS—СН —CH2COaCsH6
Ан
о
II
д) СН3СОСН2СОСНз4-СН2=С = О —*СН3С-0 о
aici,
е) СНг=С=О4-СН, = О —СН3 —С = О
°G I I
сн2-о
15-39. Напишите уравнения для'препаративных лабораторных синтезов приве-
денных ниже соединений, образующихся из указанных исходных веществ (воз-
можно, в несколько, стадий). Укажите реагенты и условия.
б) СН2=СНСОСНв из СН3СОСНЯ
в) (СН3)эССОаН из (СН3)аС(ОН)С(СН3)аОН
532 : ГЛАВА iS
г) (СН3)3ССОС(СН3)в из СН3СН2СОСН2СН3
/СО.
д) (СН3СН2)2С^^С(СНгСН3)2 йэ (СН3СН2)аСНСОВг
е) (СН3)2СНСН2СОСНаВг из СНЭСОСН3
ж) CHsCHjCH(OH)CN из СН3СНО
з) (CH3)SCHCH£CH(CH3)2 из сн3соснэ
и) СН3СНаСНСНО из сн3сн2снасно
' !
сн3
к) CH3C(CH2ONOJ3 из сн3сн2сно
л) (СН3)эСОНаСН2СН3 ИЗ (СН3)ЭССОСН3
15-40. Укажите для каждой из приведенных ниже пар соединений качественную
пробу (желательно Пробирочную реакцию), которая позволит сделать выбор
между этими веществами.
a) CH3COCH„CH„COCHS и СН3СОСН2СОСН3
б) (СН3СН2СН2СН2)2СО и [(СН3)3С]2СО
в) (СН3)2С(ОН)СН2СОСН3 и (СН3)2СНСН(ОН)СОСН3
г) C3H5COCOCeHfi и CeH5COCH2COCeHj
СН2
д) CH3==C<Qc = O и сн3оосн=с=о
о
е) СН3СН=С = 0 и СН2=СН-СН=О
в) дСН2СНаСОСН3 И СН3СН(С1)СОСНа
15-41. Каким образом можно использовать спектральные методы для того, чтобы
различить два изомерных соединения в приведенных ниже парах?
а) СН3СН=СНСОСН3 и СН2 = СНСН2СОСН3
б) СН3СН2С-ОН и CHsCOCHaOH
А-
г) СвНЕСОСН2СОСсН3
д)СН3СЙ=С=О и
и CsHeCHgGOCOCeHj
CH2-CH-CHO
АЛЬДЕГИДЫ' и кетоны
533
СН3СОСНгСН3
и
ж) СН3СОСНСОСН3 и CH3COCH = C-CH3
СН» * А-СН3
Г
1-5-42. а) Вычислите процентное содержание енола в бен зоил ацетоне, основы-
ваясь па сго-ЯМР-спектре, приведенном на рис. 15-5.
Рис. 15-5, ЯМР-спектр протонов при ВД МГц относительно тетраметилсилана
(см. упражнение 15-34).
534
ГЛАВА IS
б) Оцените степень ецолизации, которую можно ожидать для каждого из
приведенных ниже соединений.
1. С6Н5СОСНгС6Н3
2. СН3СОС(СН3)гСОСНэ
15-43. Напишите для каждой из приведенных ниже реакций промежуточные ста-
дии, показав возможный механизм превращений.
КаСО,
а) (СвН6)аСНСН0+СНя=0-------► (С0Н6)аС(СН„ОН)а
б> (CHj)2C = CM-N
1. (СН,)г€=СН-CHjBr
2. НгО
СНЭ СИ,
СНЭ-С-СН,-СН=С
СНО СНз
эфир
в) CeH6OOCH(CN)3-|-CHaNa.-> CeH6-C=C(CN)2
OCHS
I. LlAlH*
Г) (CeHs)3C=C = O——(СвНв)гСНСНО
4, Fl jxJ
15-44, Объясните, почему окисление соединения А по Оппенауэру (см. гл. 13 и
14) приводит к а, ^-ненасыщенному кетону Б,
СН»СОСНв (избыток)
А1(гио-С,Н,0)а
АЛЬДЕГИДЫ И КЕТОНЫ
535
Рис. 15-6. ЯМР-спектры протонов при 60 МГц относительно тетраметилсилана
(см. упражнение 15-45).
/5-43. На рис. 15-6 приведены ЯМР-спектры двух соединений с формулами
С4Н7ОС1 и С4Н7ОВг. Предложите для каждого соединения структуру, соответст-
вующую его спектру. Приведите ваши соображения. Дайте краткое описание
химических свойств, которых можно ожидать для каждого из этих соединений.
ГЛАВА
16
КАРБОНОВЫЕ КИСЛОТЫ
И ИХ ПРОИЗВОДНЫЕ
В данной главе рассмотрена химия карбоновых кислот ‘RCOSH
и некоторых их функциональных производных типа RCOX. Кар-
боксильная функция
представляет собой сочетание
гидроксильной и карбонильной групп, но эти группы расположены на-
столько близко, что свойства одной из них зависят от присутствия
другой. Можно ожидать поэтому, что свойства гидроксильной и
карбонильной групп в карбоновых кислотах не будут типичными для
соответствующих групп в спиртах, альдегидах или кетонах. Однако
существует значительное сходство и аналогия в свойствах, так что
можно будет провести ряд полезных сравнений поведения гидроксиль-
ных групп в кислотах и спиртах и карбонильных групп в кислотах,
альдегидах и кетонах.
Карбоксильная
группа
карбоновых кислот вследствие
ионизации карбоксила дает в воде кислую реакцию.
RC(XH 4-11.0^ RCOT*] H3O®
Ч. .. !
В целом карбоновые кислоты являются слабыми кислотами—
они ионизированы далеко не полностью. Соответствующие карбо-
новым кислотам соли в водных растворах в значительной степени
гндролизова! 1ы.
СН3СО8Н+Na®o н© СН3С0®1Х'а® + Н20
уксусная апетат натрия
кислота
•КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
.537
СН2=СНСО2Н
акрилопая кислота
(пропеновая)
Н2СЧ
щснсссн
Н2с/
цн клоп р оп а нкар б он ов а
кислота
CHsCHCOaH
он
молочная кислота
(а-оксип роли о нов а я)
О
‘II
CHSCCH2COSH
ацетоуксусная
кислота
сн = ССО2Н
лройяолопая кислота
(пропионовая)
\~/""С02Н
бензойная
кислота
NCCHaCO?H
циануксуспая
кислота
СН2СО2Н
ii-ijCOjH
янтарная кислота
На рис. 16-1 приведены некоторые типичные карбоновые кисло-
ты с различными группами R; ряд общих методов получения кар-
боновых кислот суммирован в табл. 16-1 и 16-2. Номенклатура кар-
боновых кислот была рассмотрена выше (разд. 11-4).
СН.СНХОоН
пропионовая кислота
(пропановая)
СН3СНаСИ3СН2СН3СО2Н
Капроновая кислота
(гексановая)
BiCH*CO2H
бромуксусная кислота
CHSCHCO2H
алапип
(а* ам и ri о п р oii ио нов ая
кислота)
Рис. ]6Ч. Представители ряда карбоновых кислот.
Карбоновые кислоты RCO2H, где R представляет собой алкиль-
ную или алкенильную группу, называют также жирными кислота-
ми, но этот термин применяют обычно в более узком смысле, к
встречающимся в природе насыщенным и ненасыщенным алифати-
ческим кислотам онеразветвленной цепью, которые в форме слож-
ных эфиров входят в состав жиров, восков и масел растений и живот-
ных. Наиболее распространенными жирными кислотами являются
пальмитиновая, стеариновая, олеиновая и линолевая кислоты; в
природе они встречаются в виде глицеридов — сложных эфиров
трехатомного спирта глицерина.
СН<,(СН2)МСО2Н СНз(СН2)7СН~СН(СН2)7СОяН
пальмитиновая , олеиновая кислота (цис)
СНв(СН3)16СОаН СНз(СНа)4СН = СНСЩСН == СН(СН2)7СОаН
стеариновая кислота линолевая кислота
Щелочной гидролиз жиров приводит к солям жирных кислот;
соли щелочных металлов применяются в качестве мыл,
О
I!
cm.ocr
О
II
СН —OCR
NaOH
: Q
' J
CH2—OCR.
жир
(s форме
глицерида)
CH,-- OH
CH - OH 4- aRCO^Na® 3RCOaH
I мыло жирная
CH2—UH кислота
глицерин
Г с-акция
Методы получения карбоновых кислот3
Таблица 16-1
Примечание
1. Гидролиз нитрилов
Н,0 И,О
PCN RC0NH* “©—RC0*H
Н~ или ОН Н® или ИО Н
2. Гид релиз сложных эфиров, хлорангидридов и амидов кислот
Н.о
RCO2R' ------> RCo2h +R'OH
Н® или WO Н
Н2О
RCOC1------► RCO2H+HCI
HSO
RCONH2 —--------> RCO2H + NH3
H“ или ®OH
3. Карбонизация металлоорганических соединений
СО, н,о
RMgX —> RCO^MgX ——> RCO2H
н®
СО, нг0, н®
RLi ----> RCOaLi -------> RCOaH
Катализируется кислотой или основанием; пер-
воначально образуется амид, который гидроли-
зуется до кислоты; лишь в редких случаях амид
устойчив к гидролизу; удобный лабораторный ме-
тод (если нитрил доступен)
Поскольку исходные вещества обычно получают
из кислоты, этот метод не имеет большого значе-
ния, за исключением особых случаев
Обычно раствор металлоорганического соедине-
ния вливают в измельченный сухой лед при энер-
гичном перемешивании; удобная реакция с широ-
кими возможностями применения (ем. гл.’ 12)
4. Синтезы с малоновым эфиром
„ WNa 1. Н.о, н®
RX +СНа(СаС2Н6)я---------> RCH(CO2C2H6)2----—------
2. нагревание
RCHsCO2H
Реакция важна для синтеза алкил- и диалкил-
уксусных кислот (RX и R'X —первичные или
вторичные алкилгалогениды), для синтеза дикар-
боновых киСлот (RX—гало ген замещенный эфир),
ненасыщенных кислот (RX —ненасыщенный галоге-
C.HjONa
R'X 4- RCHtCQsCjHjh---► RR'C(CO2C2H5)2 —►
1. н.о, н®
------- RR'CHCOaH
2* нагрева цие
5. Синтезы с ацетоуксусным и циануксусным эфирами
* C2H5ONa
РХЧ-СНзДОСН2СО2С2Нв—:—>
1, ©он
’ —>сн3соснсо2с2н6—RCH2CO2H
| Й. н®
R
C,HsONa
R*X +CH3COCHCO2C2Hj----->•
R
R” ft
I i.“oh
->CH3COCO2C2H5 ---RR'CHCO2H
I 2. H®
R
CjHsONa I
rx+ncchsco8c2h6-------> ncchco2c2h5—*
1, H® или eOH RCHgCo2H
2. нагревание
6. Реакция Арндта—Эйс me рта
НЕО
RC0Ci + CH2N2-^RC0CHN2 —RCI-I2CO2H
нид, лучше*всего аллил гало ген ид), кетокислот
(RX — ацилхлорид); вторая группа (R') обычно
вводится е большим трудом, чем первая группа
(R), особенно в тех случаях, когда R либо R'—.
объемистые группы (разд. 16-18,В)
Этот метод не имеет преимуществ по сравнению
с методом 4; кислоты при синтезах с ацетоуксус-
ным эфиром образуются обычно конкурентно с
кетонами (разд. 16-8,В)
Используется для получения высших гомолбгоа.
кислот из низших (разд- 19-8)
ди а до-
метан
диазо-
кетон
Продолжение табл. 16-1
Реакция
Примечание
7. Окисление первичных спиртов или альдегидов
[О] (О]
RCHaOH —•> RCHO —► RCOaH
8, Окисление алкенов
[О]
RCH = CH2 —►.RCOaH
9. Окисление метилкетонОв (галоформная реакция)
Вг^ NaOH i
RCOCHg ----— [RCOCBr3]—> —RCHEOH + CHBrs
2. H®
10. Реакция Канниццаро
NaOH
RCHO ——>RCH2OH+RCOjH
Jf, Окисление кетонов надкислотами no Байеру—Виллигеру
RCOR+ R'C-O—O—Н—► RCOaR+ R'CO-H
li I H®, H,O
u 1-------» RCQjH+ROH
Окислительные агенты: KMnO4 (H® или ®ОН),
CrOg, HNOS и Ag3O. Возможность использования
сильных окислительных агентов при этой реакции
ограничена, так как нередкб происходит расщеп-
ление на меньшие фрагменты
Окислительные агенты: КМпО< (Н® или ®ОН),
СгО3, HNO3; используется главным образом для оп-
ределения структуры; часто происходит дальней-
шее расщепление
Вместо Вг2 и NaOH можно использовать гипо-
хлориты; метод имеет ограниченное значение
вследствие возможного замещения на галоген в
радикале R (разд. 15-1,В)
Используется только в том случае, если в аль-
дегиде отсутствуют а-водороды и он не может
поэтому вступать в альдольную конденсацию
(разд. J4-8)
Используется в случае алифатических и арома-
тических кетонов, не содержащих двойных связей;
в качестве окислителя обычно применяют надбен-
зойную (С3Н5СО3Н), надуксусную (СН3С03Н) и
три фтор надуксусную (CF3C03H) кислоты; послед-
нюю получают из ангидрида трифторуксусной
кислоты и Н2О3 и используют в присутствии
NaHgPOj как буфера
а Специфические истоды получения ароматических кислот обсуждаются в гл. EG.
Таблица 16-2
Примеры получения карбоновых кислот
Метод I
.в.йгабл,
16-1 |
Реакция
a) CeH5CH2CN ——£ С„Н5СН2СОаН +NH®
фсни^ ацетонит рил фенил уксусная кислота
®ОН, HtO О н®
б) CH3(CH2)3CN----:СН3(СН2)ЯСО»+ЫН3 -н
в а л ер о нитрил
Mg с
а) (СН3)3СС1 — (CH3)3CMgCl
•* 2. НгО,
трнмстилуксусиая кислота
СОг
СН3СН —CHCH2MgBr -------—*•
5. И®, Н,О
COS
СН3(СН2)3СОгН
валериановая кислота
(СН3)3ССО-Н
трет - бути л х л ар и Д
Mg
: б) СНзСН=СНСНзВг
• бромистый кротил
СН, = СНСНСО2Н
I
сн3
2- метнлбутен- 2-овая
кислота
Выход,
%
78
81
70
75
в)
Li
циклon р о пилбром ид
1. СО;
2. Н®, Нг0
цйклопропанкарбомовая кислота
L-07/-TT с тт r^nlT-ONa I L Н' , HjO
5SSS С.Н.СН(СОЛН,)2 с,нЛсо,сгн,), ——1-г с,н,снсо,н
сн3 ,
мет нлэт и луксу с-
нам кислота
Продолжение табл. 15-2
Метод
в табл.
16-1
Реакция
Выход,
%
„ I- CHfCOjC.HsJj / 8
б) С1СН2СНаСО2С,НЕ-------------------->(СН2)3
этил-fi-хлор про- 2. Н . Н2О и
пионат 3. Нагревание д-'-'йг1
глутаровая
кислота
1. ^СН(СО,С,НЬ)
в) СН2=СН-СН2С1 —---------------->• CHs=CHCHsCH2COaH
алл ил хлорид 2. Н . Н.О аллилуксусная кислота
3. нагревание
а-нафтоРная а-нафтилуксусная
кислота . кислота
80
70
74
КМпО4> ОН
а) С,Н5СНСНоОН---------------> СаН5СНСОгН
I |
С4Н4 С4Н9
2~этнл гексанол 2-этилгексановзя кислота
AgaO
б) СгНSCH = С(СН3)СНО > СоН6СН = С(СН3)СО2Н ,
Н|О
2-метилпентен-2-аль 2-метилпентен-2-овая кислота
74
60
9
10
11
Х$Н ^СНСО/Г
СН, I КаМпО,. СО2 СНг \-,д
| СИ» Н Л « J4HJCIX tub.- СН. /
CJ^I JCH С^снсог11
СН ejiT -|[ик.|юнсн1 лм-
кислота.
J
Br8f NaOH
(СНа)3ССОСН3-----------> (СН3)3ССО2Н
метил-яо^т- тримет «л уксусная
бутылке?он * кислота
фуриловый спирт
лироелизеиая кислота
74
63
CH.CI. (СГ3СО)тО Г\_о.ССНз |>-со2н
Нг0г,№Нг1’О4 V ' v
544
ГЛАВА 1G
ФИЗИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ
кислот
16-1. Водородная связь
На физических свойствах карбоновых кислот сказывается зна-
чительная степень ассоциации вследствие образования водородных
связей. С такого рода связями мы встречались выше (разд. 13-2)
на примере спиртов; однако кислоты образуют более прочные водо-
родные связи, чем спирты, вследствие того что связи О—Н в них в
в©
большей степени поляризованы по типу —О—Н. Кроме того, у кар-
боловых кислот имеется возможность образования водородных свя-
зей с кислородом карбонильного диполя, обладающим значитель-
ной электроотрицательностью, а не только с кислородом другой
гидроксильной группы. Действительно, в твердом и жидком со-
стояниях карбоновые кислоты существуют в основном в виде цикли-
ческих димеров.
SQ
Ь©^° ' ‘ Н °\ 6©
R---С С---R
\ //
О---Н---О
6©
Такие димерные структуры сохраняются в некоторой степени
даже в газообразном состоянии и в разбавленных растворах в угле-
водородах. 1
Физические свойства ряда типичных карбоновых кислот приве-
дены в табл. 16-3. Обращают на себя внимание высокие температу-
ры плавления и кипения кислот по сравнению с температурами
плавления и кипения спиртов и хлоридов; они, по-видимому, обус-
ловлены прочностькнводородных связей и зависят от степени их об-
разования. Различия в летучести показаны более четко на рис. 16-2,
где приведены графики зависимости температур кипения от п для
Рис. 16-2. Температуры кипения
кислот СН3(СН2)„_..СО,Н, спиртов
СНа(СН2)„^2СН3ОН -и : хлоридов
СНа(СН2)п„2СН2С1,
—— кислоты; — —• — спирты: *>»•
хлориды.
Физические свойства некоторых типичных карбоновых кислот
Терчаи «сильная кислота» означает полную диссотгнаиию ягодном растворе.
18 Л 1640
546
ГЛАВА f6
гомологических рядов СН3 (СН,)п_аХ, где X представляет собой |
-СО..Н, — СНаОН или—СНаС1. . :
//
R----С
Н---О
н
о Н---О—Н---0
н
//с R
О • • н—о
Водородной связью объясняется также высокая растворимость , )
низших алифатических кислот (муравьиной, уксусной, пропионо-
вой и масляной) — молекулы воды могут сольватировать карбо-
нильную группу посредством образования водородных связей. Од-
нако по мере увеличения длины цепи и степени разветвленности уг-
леводородного остатка R растворимость значительно понижается.
16-2. Спектры карбоновых кислот
В инфракрасных спектрах карбоновых кислот образование во-
дородных связей находит четкое проявление. Это можно видеть из
рис. 16-3, где приведен спектр уксусной кислоты в растворе четырех-
хлористого углерода, а также спектры этанола и ацетальдегида
(в целях сравнения). В спектре этанола имеются две полосы погло-
щения, характеристичные для О—Н-связей; первая представляет
собой узкую полосу при 3640 см-1, соответствующую свободным (не-
ассоциированным) гидроксильным группам, а Вторая — широкую
полосу при 3350 смобусловленную присутствием групп, связан-
ных водородными связями. В спектре уксусной .кислоты не обнару-
живается поглощения, связанного со свободными гидроксильными
группами, но, так же как в спектре этанола, имеется очень широкая
интенсивная полоса поглощения, относимая за счет ассоциирован-
ных О—Н-групп. Однако поглощение при 3000 сьГ1 существенно
сдвинуто по сравнению с соответствующей полосой этанола —
это отражает большую прочность водородных связей в уксусной
кислоте. Полоса, обусловленная поглощением карбоксильной груп-
пы уксусной кислоты (1740 см*1), уширена, но не сдвинута сколько-
нибудь существенно по сравнению с соответствующей полосой по-
глощения в ацетальдегиде.
Карбоксильная функция может поглощать ультрафиолетовое из-
лучение, но длины волн, при которых это происходит, значительно
меньше, чем в случае таких карбонильных соединений, как альде-
гиды и кетоны,— они оказываются вне рабочего диапазона боль-
шинства ультрафиолетовых спектрометров, имеющихся в продаже.
Некоторое представление о том, каким образом гидроксильный за-
меститель изменяет характер поглощения карбонильной группы в
карбоновых кислотах, можно получить из табл. 16-4, гделриведены
Длина волны, мк
а
Длина. волны» мк
5
-—। I1 „ ।-------1 j—
3400 330© 2000 2400 2000 7000/
у,
С=О
в
Рис. 16-3, ИК-спектры этанола (а), уксусной кислоты (б) и ацетальдегида (а);
10% -ные растворы в четыреххлористом углероде.
3400 3200 2300 2400 2000 20Q0 1800 |600 1*00 1200 14Э00 ДО
Частота, см"1
а
'г,£СС0ЦиироЬаннь1е ОН
Частота, см"1
3400 3200 2300 24OQ 2QOQ 2000 I &О0 1600 1
____ Частота» см*1
Длина волны, мк
18*
Рис. 16*4. ЯМР‘Спектры фенилу ксу с ной кислоты (п.) и Сризилевого спирта (б)
в растворе четы рек хлор истого углерода при 60 МГц относительно тетраметил-
силана.
длины войны максимумов поглощения (ХМП1!(.) и коэффициенты по-
глощения в точках максимума (eB,Bj(l.) ряда карбоновых кислот,
альдегидов и кетонов.
ЯМР* спектры карбоновых кислот показывают, что протон кар-
боксильной группы поглощает в необычно слабом магнитном поде.
Это иллюстрируемся рис. 16*4, где приведены спектры фенилуксус-
ной кислоты C(HjCHaCO8H и бензилового спирта СВН5СН2ОН. Сиг-
нал протона карбоновой кислоты смещен на 5,5 м.д. в область более
слабого магнитного поля по сравнению с сигналом протона гидрок-
сильной группы спирта. Эта особенность спектра аналогична тем,
которые Наблюдаются в случае енольных водородов 1,3-дикарбо-
пильпых соединений (разд. 15*7 и рис. 15*6), и обусловлена, вероят-
но, также образованием водородных связей.
КАРВОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ .. 54g
Таблица 16-4
Поглощение карбоновых кислот, альдегидов и кетонов
в ультрафиолетовой области
Соединение ^iiakC’ мц емаис Растворитель
Уксусная кислота 204 40 Вода
с 197 60 Гексан
Ацетальдегид .293 12 э
Ацетон 270 16 Спирт
МасляКая кислота 207 74 Вода
Масляный альдегид 290 18 Гексан
Упражнение 16-1. Объясните, почему химический сдвиг кислотного протона
карбоновой кислоты, растворенной в неполярном растворителе типа четыреххло-
ристого углерода, в меньшей степени изменяется в зависимости от концентрации,
чем химический сдвиг протона группы О—Н спирта в тех же условиях (см, также
разд. 13-3).
Упражнение 16-2. Нарисуйте ДМР-спектр, которого можно откидать для 2 : I,
1 :1 и 11 2 моляльных смесей уксусной кислоты и воды (обратитесь к разд. 2-6, Е
и 13-5,А).
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ
КИСЛОТ
Большинство реакций карбоновых кислот может быть отнесено
к одному из четырех основных типов:
о Реакции, сопровождающиеся разрывом О-^-Н-сйязей,
r—с , например кислотная диссоциация, сольволитическне
: I н реакции
6© Реакции по карбонильному углероду— большинство
бф/^51 из них включает атаку нуклеофила : Y по углероду
2- к—с карбонильной группы последующим разрывом
Zoh С—О-связц (образование сложных эфиров, обрйзо-
С.у вание ацилхлоридов и восстановление гидридами)
Г"о"^ Декарбоксилирование, например электролиз по
[ // ! Кольбе и реакции Хунсдиккера
3_ R.T““C >
! о4-п
О Реакции по а -углероду, например реакция Гелля—
4, RCH2c Фольгарда — Зелинского и реакции а-замещенных
/ "он карбоновых кислот
550
ГЛАВА 16
При последующем обсуждении внимание будет обращено на то,
чтобы показать, каким образом можно применить к $имии карбо-
новых кислот те принципы, которые были изложены в предыдущих
главах.
16-3. Диссоциация карбоновых кислот
* 4
А. Резонансный эффект
По сравнению с минеральными кислотами, такими, как хлорис-
товодородная, хлорная, азотная и серная, жирные кислоты
СН3(СНг)га_2СО.,Н являются слабыми. Степень их диссоциации в
водном растворе относительно невелика— константы кислотности
К а равны приблизительно 10“6 (см., табл, 16-3).
J?CO2H + H2O X. RCO^4-HbO®
[>СО©1 [hsO®]
TRCOaHJ ~ - 10~~ ДЛЯ R~CHa(CH3)„-
Однако, даже будучи слабыми кислотами, жирные кислоты на
много порядков сильнее, чем спирты СН3 (СН2)П_2СН3ОН. Так,
Кд уксусной кислоты СН3СО.Н в 1010 раз больше, чем 7G этанола
СН3СН,0Н.
Кислые свойства карбоксильной группы объясняются, по край-
ней мере отчасти, полярностью карбонильной группы, которая мо-
жет быть отнесена за счет вклада структур
\ - \© л
0=0 W с—О;0.
f *• * й'
Для карбоксильной группы эти структуры, а также дополнитель-
ные возможности показаны на схемах 1а, 16 и 1в.
V-
он
‘о:
®с/ •
он
о;.
-с
\\
он
о6©
/
5®
1
Структура 1а, не содержащая зарядов, имеет наибольшее значе-
ние, но структуры 16 и 1в также вносят существенный вклад.
Можно ожидать, что энергия стабилизации карбоксилат-аниона
будет больше, чем энергия стабилизации кислоты, так как анион
может рассматриваться как резонансный гибрид двух энергетически
1г
16
I в
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
551
эквивалентных структур Па и Пб, в то время как кислота представ-
ляет собой резонансный гибрид неэквивалентных структур 1а и 1в,
Па Пб , п
~ При обсуждении резонанса в органических соединениях (гл. 9)
подчеркивалось, что наибольшая стабилизация достигается в тех
случаях, когда структуры, вносящие вклад в резонансный гибрид,
энергетически эквивалентны. В применении к рассматриваемому
случаю это позволяет сделать вывод о том, что резонансная энергия
карбоксилат-аниона должна быть больше, чем для кислоты. Вслед-
ствие этого можно ожидать, что должна существовать движущая
сила (выигрыш в стабилизации), способствующая диссоциации кар-
боновых кислот. То, что спирты — гораздо более слабые кислоты,
чем карбоновые кислоты, может быть отнесено за счет отсутствия
в. алкоголят-ионах стабилизаций, имеющей место в случае карбо-
ксил ат-анионов. Действительно, разность энергий, соответствую-
щая диссоциации карбоновой кислоты по уравнению (16-1), превы-
шает соответствующую величину для диссоциации спирта примерно-
на 10 ккал.
(16-1)
Б. Индуктивный эффект
Кислоты, приведенные в табл. 16-3, значительно отличаются по
своей силе. Муравьиная кислота и почти все а-замещениые уксус-
ные кислоты, приведенные в табл. 16-3, сильнее, чем уксусная кис-
лота. Так, трифторуксусная кислота сравнима по своей силе с соля-
ной кислотой. Очевидно, что природа групп, находящихся побли-
зости от углеродного атома карбоксила, оказывает чрезвычайно
большое влияние на силу кислоты. Это явление обычно называется
индуктивным (или индукционным) эффектом и обозначается ±Z.
Индуктивный эффект отличается от резонансного эффекта рассмот-
ренного выше типа тем, что он связан с замещением при насыщенных
углеродных атомах цепей жирных кислот. Принято считать его от-
рицательным (—7), если присутствие заместителя приводит к уве-
личению кислотности, и положительным (+/), если заместитель
уменьшает кислотные свойства.
552
ГЛАВА 16
Высокая кислотность а-галогензамещенных кислот (например,
хлоруксусной) по сравнению с уксусной кислотой обусловлена
большей электроноакцёпторностью (электроотрицательностью) за-
местителя — галогена по сравнению с атомом углерода, при кото-
ром находится заместитель. Способность к оттягиванию электронов,
(электроноакцепторность) трех таких атомов галогена должна быть;
разумеется, больше, чем для одного атома галогена, поэтому три-
хлоруксуеная кислота (К А 3,0-10“1) значительно сильнее, чем хлор-
уксусная кислота (Кл 1,4- 10“я). Полярный эффект связей углерод —
галоген : может передаваться карбоксильной группе двумя раз-
личными путями. Согласно одному из них (часто принимают, что
такой способ передачи влияния и заключает в себе весь индуктив-
ный эффект), заместитель вызывает сдвиг средних, положений элект-
ронов, образующих связи, вдоль цепи атомов. Это приводит к после-
довательности сдвигов электронов, Которая в случае электроноак-
цепторных заместителей увелич.ивает диссоциацию вследствие ста-
билизации карбоксидат-аниона.
zO Стрелки показывают, каким образом
СЬ—СН2ч— происходит сдвиг электронов от сред-
Ч)—Н него положения в сторону хлора
С другой стороны, возможен способ передачи индуктивного эф-
фекта, чисто электростатический по своей природе, который иногда
называют эффектом поля. Согласно такому представлению, диполь
(или диполи) заместителя создают при протоне карбоксила элект-
ростатическое поле, благоприятствующее ионизации. Эффект поля,
как полагают, действует через пространство независимо от связей,
за исключением того влияния, которое оказывают на локальную
диэлектрическую проницаемость электроны, образующие связь,
В принципе эти два способа передачи индуктивного эффекта можно разли-
чить, исследуя влияние заместителя (например, хлора), находящегося на конце
дугообразной молекулы, структура которой жестко закреплена, как это показано
на приведенной ниже схеме.
Если влияние хлора может распространяться только Через пространство, результа-
том должно быть уменьшение силы кис.чоты, поскольку отрицательный конец ди-
поля С—О будет направлен в сторону карбоксила и электрическое:' поле около
этой группы окажется более отрицательным. С другой1 стороны, можно ожидать,
что влияние, распространяющееся Исключительно по связям, не будет зависеть
от формы молекулы и в случае электроотрицательного заместителя, подобного
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ 553
хлору, приведет только к увеличению силы кислоты, Попытки разрещить этот
вопрос экспериментальным путем ие дали однозначного ответа; представляется
вероятным, чтр при передаче электронных эффектов заместителей в насыщенных
молекулах оба способа распространения имеют существенное значение,
В соответствии с ожидаемым (при любом способе интерпретации
индуктивного эффекта) влияние последнего на /<л быстро убывает
по мере увеличения расстояния от заместителя до карбоксильной
группы. Это легко можно видеть из большого различия значений
‘ К а для а-, Р- и у-хлор масля пых кислот (см. табл. 16-3).
Кроме галогенов, многие другие группы также оказывают повы-
шающее кислотность электронооттягивающее действие (—/-эффект).
К их числу относятся нитрогруппа (—NOS), метоксил (СН3О—),
карбонил (^С=О, как в альдегидах, 'кетонах, кислотах, сложных
эфирах и имидах), циан (или нитрил—С—N) и три ал кил аммоний
(R3N—). Алкильные группы (метил, этил, изопропил и т. д.) —
единственные из перечисленных в табл. 16-3, которые по сравнению
с водородом оказывают влияние, ослабляющее силу кислоты (это
можно видеть из сравнения значений К а соответствующих кислот
со значениями К а для уксусной и муравьиной кислот). Можно счи-
тать 'это следствием сдвига электронов в сторону карбоксильной
группы от алкильных групп, которые, таким образом, проявляют
-(-/-эффект. Величина электронного влияния алкильных групп су-
щественно не меняется при переходе от метила к этилу, далее к про-
пилу и т. д. (сравните значения Кл уксусной, пропионовой, масля-
ной и валериановой кислот). + /-Эффекты алкильных групп упоми-
нались выше в связи с объяснением ориентации при присоеди-
нении несимметричных реагентов к алкенам (разд. 7-5,Б и В).
Помимо своих кислых свойств, карбоновые кислоты могут : про-
СНэ->
Стрелки указывают на сдвиг среднего поло-
жений электронов, образующих связь, от
метильной группы в сторону карбоксильной
группы (-[-/-эффект)
являть свойства слабых оснований, причем карбонильный кис-
лород присоединяет протон от сильной "кислоты типа Н2ЗО4или
НС1О4 [уравнение (16-2)1. Такое протонирование— важная стадия
при катализируемом кислотой получении сложных эфиров, как это
рассматривалось в разд. 13-5.В. Протон может также присоединять-
ся к кислороду гидроксила [уравнение (16-3)1. Образующаяся сопря-
женная кислота обычно менее выгодна, чем ее изомер, в котором про-
тон связан с карбонилом, но она тем не менее участвует в процессе
получения сложных эфиров в тех случаях, когда группа R особенно
объемиста: и обладает к ТОму же электронодонорными свойствами;
такое протонирование Способствует Ионизации с образованием ацил-
554
ГЛАВА IB
карбоииевого иона [см, уравнение (16*4), а также ^разд. 16-4,А],
R-C-OH4-HsSO4~iR-C-OH-|-HSO© (16-2)
II II
0 ©ОН
R - С - ОН.4- H-.SO 4 R - С - ОН2+HSO© (16-3)
r-C-§Hs?±:R—С©+Н2О (16-4)
ацилкарбо-
нневый нон
Упражнение 16-3. Объясните, почему равновесие, приведенное в уравнении
(16-2), более выгодно, чем равновесие, изображаемое уравнением (16-3).
16-4. Реакции с участием карбонильного
углерода карбоновых кислот
При многих важных реакциях карбоновых кислот происходит атака нуклео-
фильного агента па углеродный атом карбонильной группы. Эти реакции часто
катализируются кислотами, поскольку присоединение протона или образование
водородной связи с кислородным атомом карбонила придает карбонильному угле-
родному атому большую электроположительность и, следовательно, большую
уязвимость к нуклеофильной атаке. Приведенные ниже уравнения иллюстрируют
катализируемую кислотой реакцию с участием отрицательно заряженного нук-
леофила (;Y©)
О
II «3
R-C-OH + Н®
ОН
R-C-OH
Y
Последующий разрыв связи С—О и потеря протона приводят к продукту заме-
щения
ОН А ©ОН да О
| -°Н II “н II
r-c-oh “ZR-c-y~2:r-c-y
V
Важным примером такого типа реакций служит образование сложных эфи-
ров, рассмотренное ниже. Аналогичный механизм присоединения — отщепления
осуществляется во многих реакциях производных кислот, происходящих с уча-
стием карбонильной группы. Менее изученная реакция присоединения к карбок-
сильной группе — действие гидрид-иона (Н©:), происходящее при восстанов-
лении карбоновых кислот литийалюмипийгидридом (разд. 16-4,В).
Упражнение 16-4. Используя энергии связей и данные табл. 9*3, рассчитайте
ДЙ для присоединения воды к уксусной кислоте, приводящего к 1,1,1-триоксиэта-
ну; сравните Это значение с Д// для гидратации ацетальдегида в газовой фазе.
КАРВОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
555
Можно ли ожидать, что скорость или константа равновесия или обе эти величины
для гидратации уксусной кислоты в водном растворе будут возрастать в присут-
ствии сильной кислоты, например серной? Объясните.
А. Образование сложных эфиров
R—С—О — R*
Сложные эфиры [I образуются при взаимодействии
карбоновых кислот со спиртами в присутствии сильных минераль-
ных кислот
‘ Н,ЗО4
СН3СНаСОН + СН3СНаОН СНаСН2—С—0СНоСН3 + Н20
If II
о о
пропионовая этанол этилпропионет
кислота *
Одна из последовательностей превращений при катализируемом
кислотой образовании сложных эфиров была довольно подробно
рассмотрена в разд. 13-5, В; здесь она будет обсуждена лишь вкрат-
це. Функция кислого катализатора, например концентрированной
серной ’ кислоты или сухого хлористого водорода, заключается в
протонировании карбонильного кислорода; карбонильный атом уг-
лерода становится при этом более положительным и более «уязви-
мым» к, атаке нуклеофильного агента, которым в данном случае яв-
ляется молекула спирта
н®
R-С—ОН'Л2
®ОН
ОН
R'O H
R —С—ОН R —С—ОН
ОН
r-J-oh
R'Ah
ffi J
О
HI
Промежуточный продукт присоединения III может быстро и обра-
тимо перейти во второй промежуточный продукт IV, для чего тре-
буется лишь перенос протона
г он
I
R—-С —он
R'Ah
L © J
он
R—d—он2
I ®
L R'O
III IV
Отрыв молекулы воды от IV, за которым следует потеря протона^
дает Сложный эфир V,
г ОН
. I
R-C-OH„
I ©
L R'O
IV
-Н2О
R—С=ОН
- R'O
НЕ0
—21 R-C-OR' + H3O®
II
О
V
556 ГЛАВА 16
ОН СНз ОН
I I I
Рис. 16-5. Масштабные модели СНЭ—О—С—СНе и СН2—С—О—С—СНа,
1 ' I I
ОН СНз ОН
промежуточно образующихся при этерификации уксусной кислоты метанолом
и трет-бутиловым спиртом соответственно^
Все приведенные выше реакции представляют собой равновес-
ные процессы, вследствие чего избыток одного из реагентов, обычно
спирта, благоприятствует образованию сложного эфира.
Применимость метода прямого образования сложных эфиров из
спиртов и кислот ограничена, разумеется, такими спиртами и кисло-
тами, которые в присутствии сильных кислот не претерпевают в за-
метной степени побочных реакций. Кроме того, если спирт содержит
объемистые радикалы, то реакция обычно не дает удовлетворитель-
ных результатов, поскольку промежуточные соединения III и IV
оказываются нестабильными вследствие пространственного перекры-
вания замещающих групп. Это положение можно пояснить с по-
мощью масштабных моделей: (рис. 16-5).
Объемистые группы, содержащиеся в этерифицируёмой кислоте,
также затрудняют реакцию. Классическим примером служит ме-
зитойиая кислота, которая с трудом поддается этерификации в обыч-
ных условиях, так как метильные группы, находящиеся в кольце в
соседних (орто) положениях к карбоксильной группе, препятству-
ют приближению молекулы спирта, делая, таким образом, проме-
' КАРВОНОВЫЕ КИСЛОТЫ Й ИХ ПРОИЗВОДНЫЕ 557
жуточное соединение VI неустойчивым.
• (2,4)6-твиметилбепзойпая
кислота)
Этерификация мезитойной кислоты может быть осуществлена по схеме, вклю-
чающей образование ацильного карбониевого иона VII
ИОН
VII
мезитаяльный карбоиисвый
ион (атака по положительному
центру может беспрепятственно
Происходить сверху или снизу
от плоскости кольца)
На практике меэитойяую кислоту превращают в эфир, растворяя ее в концентри-
рованной серной кислоте (при этом ацилкарбониевын ион VII образуется почти
количественно) и затем выливая полученный раствор в избыток охлажденного
спирта.
Упражнение 16-5. Определит^, к какому результату приведет попытка про-
вести этерификацию уксусной кислоты тдет-бутиловым спиртом в присутствии
сухого хлористого водорода.
упражнение 16-6. 4tos по вашему мнению, произойдет с кислородной меткой
1вО в смеси уксусной кислоты, НС1 и Н^’О?
Упражнение 16-7. Бензойная кицчота не может быть этерифицнрована с
помощью метода, применяемого для мезитойной кислоты, поскольку при растао-
t рении бензойной кислоты в серной кислоте она в отличие от мезитойной кислоты
,не дает ацилкарбониевого иона, а образует сопряженную кислоту. Объясните,
почему мезитоильный карбон иевый ион ок азываетс я ст аб и льне е со п р я жен ноф
' кислоты мезитойной кислоты в большей степени, чем бензоильный карбониевыи
нон по отношению к сопряженной кислоте бензойной кислоты (средн остальных
факторов учтите геометрию различных участвующих в этих превращениях соеди-
нений).
558
ГЛАВА 10
Б. Образование ацихлоридов
Карбоновые кислоты реагируют с пятидлористым фосфором,
треххлористым фосфором и хлористым тионилом, образуя в резуль-
тате замещения ОН на С1 ацилхлориды (хлорангидриды кислот)
RCOC1
SOClj
(CH3)SCHGHSCOSH -----> (CH.,)2CHCH2COCI4-SO2 + HCl
нэов алернановая * из ов а л ер ил хло ри д
кислота
Хотя механизм этих реакций во всех деталях не установлен,
, Ъюжно с достаточным основанием полагать, что первая стадия пред-
ставляет собой образование неустойчивого смешанного ангидрида
VIII, который далее «смыкается», причем происходит атака хлор ид-
иона по углеродному атому карбонильной группы. Аналогичный
механизм имеет место при образовании алкилхлоридов из спиртов
'и хлористого тионила (разд. 13-6,А).
R-CZ -Г SOC12 ——*
он
R-C + SOa --------------
Хс1
смешанный ангидрид
карбоновой и хлор-
сульфиновой кислот
(VIII)
Формил хлорид HCOCI неустойчив и быстро разлагается при
обычных температурах на окись углерода и хлористый водород.
В. Восстановление карбоновых кислот
В целом карбоновые кислоты с трудом поддаются восстановлению
как путем каталитического гидрирования, так и при действии нат-
рия в спирте, но восстановление до первичных спиртов при дейст-
вии литийалюминийгидрида происходит энергично
Ь!АШ, Н®, Н3О
ДСО2Н------>-------► RCH.OH
LIAIH, Н®, Н£О
СН, = СНСн2СО3н------ю--------- СН2 = СНСН2Сн2ОН
бутен-З'Овая кислота бутеи-3-ол
(вииялуксусная) (аллилкарбинол)
Первая стадия при восстановлении карбоновых кислот действи-
ем литийалюминийгидрида заключается в образовании комплекс-
60
е
* HCI
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
559
ной алюминиевой соли кислоты и выделении 1 моля водорода
R —С^° +ЫА!Н4-> R-сЛ) ф+Щ
хон N)Ajh3Li
Далее восстановление происходит путем последовательных пере-
ходов гидрид-ионов Н:© от алюминия к углероду, как это схемати-
чески представлено в уравнении (16-5). В результате первого такого
“перехода соль кислоты восстанавливается до окислительного уров-
ня, соответствующего альдегиду; однако восстановление не останав-
ливается на этой стадии и быстро идет дальше, до спирта
„ н,© н©
RCOO© —RCHO ——> RCH2OH
соль альдегид спирт
(16-5)
Недостаточность сведений не позволяет сколько-нибудь точно
описать структуру промежуточных соединений при восстановлении
карбоновых кислот литийалюминийгидридом. Продукт реакции
представляет собой комплекс алкоголята алюминия, из которого
’ при гидролизе освобождается спирт.
4RCO2H-(-3LiAiH4 —» [(RCHaO>4Al ] 1Л + 4На4~ 2LiA10a
I НаО, НС1
4RCH2OH + A JC1 э + LiCl
16-5. Декарбоксилирование- карбоновых
кислот
Легкость, с которой карбоксильная группа теряет двуокись уг-
лерода, в чрезвычайно большой степени зависит от природы кисло-
ты. Для некоторых кислот требуется нагревание их натриевых солей
в присутствии натронной извести (в целом, однако, это не является
хорошим препаративным методом).
CHj-t-C7 i д, —aOH.'-^aO-». СН4 + со2
: i Na®
ацетат натрия
550
ГЛАЗА I в
Другие кислоты отщепляют двуокись, углерода просто при на-
гревании.
✓Ж " АЮ,
Z-— —к нагревание z—
OgN-^ У-СОгН-----------------> O,N~< : 4-COs
4NOa \\OS
23»6-трмцитробензойная 1» 3,Б -трннитробензол
кислота
,со2н И0_160ОС
СН2 —----------> СНВСО2Н+ СО2
^СО3Н уксусная кислота
малоновая кислота
Термическое декарбоксилирование кислот происходит с большей
легкостью в тех случаях, когда с сх-углеродом связана сильная
элёктроноакцепторная группа (заместитель —/-типа), как в при-
веденных ниже примерах.
O2N—CHh-COOH
HOOC-CHj-COOH
NC—CH2—СООН
GH3 - СО—СН2— СООН
CCIsCOOH
СН4=СН—CHS—СООН
нитроуксусная кислота
малоновая кислота
цвапуксусная кислота
ацетоуксусная кислота
трихлоруксусная кислота
винилуксусная кислота
декарбоксилирование
легко происходит при
температурах1100—150 °C
декарбоксилирование ни-
же 200 °C происходит ме-
дленно
Механизм термического декарбоксилирования, по-видимому, не
во всех случаях одинаков; декарбоксилирование р, у-ненасыщен-
ных кислот может представлять собой циклический процесс отщеп-
ления, в котором важную роль играет образование водородных свя-
зей.
малоновая кислота
ОН о ~
но—с + с —> сн,соон + со,
!1
сн, о
г уксусная
кислота :
еполытя форма
уксусной кислоты
Упражнение 16'8. Определите, какой продукт образуется при декарбоксили-
ровании 2-метилбутен-3-овой кислоты.
Упражнение 16'9. Объясните, почему декарбоксилирование ау/.-диметилаце-
тоуксуспой кислоты СН3СОС(СН8)3СОаН в присутствии брома дает а-бромизо-
про пил мети лкетон CHsCOC(CH3)2Br.
Декарбоксилирование может происходить также постадийно,
р частности, в тех реакциях, при. которых образуется карбоксилат-
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ 561
радикал (RCO2*). Этот радикал может далее распадаться на радикал
углеводорода R* и С02. Конечный продукт декарбоксилирования
зависит от того, с чем реагирует -R. Если присутствует хороший
донор атомов водорода, то образуется RH, а в присутствии донора
галогена, подобного Вг„, получается RBr
rco2.—^r.-co,
R* + R'H —♦ RH-pR'.
R• 4-Br2 —> RBr-pBr*
Упражнение /6-10. Какими данными нужно располагать для того, чтобы рас-
считать АЯ реакции СН3СОа—кСО2+ СН3?
Карбоксил'ат-радикалы могут генерироваться рядом способов.
Один из них заключается в термическом разложении перекисей диа-
цилов, которые представляют собой соединения,; содержащие весь-
ма слабую О—О-связь
ООО
' II л : II II
R —С —О —; — О —С—R —> 2R —С —О*
В другом методе используется электролиз натриевых или калие-
вых солей карбоновых кислот. При этом процессе, известном под
названием электролиза по Кольбе, карбоксил ат-радикалы обра-
зуются при переходе электронов от карбоксилат-ионов к аноду. Де-
карбоксилирование может происходить одновременно с образова-
нием карбоксил ат-радикалов или вслед за ним. Оно приводит к по-
лучению углеводородных радикалов, которые далее димеризуются.
RCO®—> RCOj- -J-е реакция на аноде
кФ-ре+ЩО ~*+ КОН4--^- На реакция на катоде
RCO2. ,R- !СО,
R._pR.—>RR
i .
Упражнение 16-17. Почему электролиз по Кольбе не приводит к RH согласно
реакции
-СО- Н,0
RCO2----*R---—>RH?
Упражнение 16-12. При высокой плотности тока электролиз солей карбоновых
кислбг в гидрокси л содержащих растворителях-дает (на аноде) спирты и сложные
эфиры тина ROH и RCO3R. Объясните/ :
Декарбоксилирование серебряных солей карбоновых кислот
в присутствии брома или хлора (реакция Хуисдиккера*) часто ока-
* Эту реакцию первым осуществил А. П, Бородин.-т Прим. ред.
562
ГЛАВА 16
зывается полезной для синтеза алкилгалогенидов.
сулой CCI 4
CaH&CH,CO,Ag-р-Вгд * СеН6СНаВг-|-СОаф-AgBr
серебряная соль бромистый бензил
фенилуксусной кислоты
Механизм этой реакции полностью не установлен, но, по-видимому, он вклю-
чает образование к ар бокс ил ат радикалов при разложении промежуточного ацил-
гигсбромита IX.
-AgBr /О >0
RCO2Ag+Bra-------->R-C^ —* R-Cjf ф. Вг-
IX Х)Вг X).
I
'I
R-+COa + Br-~+RBr+CO2
Реакция Хунсдиккера имеет ряд недостатков, прежде всего связанных с
трудностью стадии получения сухих солей серебра. Однако в ряде случаев отлич-
ные результаты могут быть достигнуты при использовании самих кислот и избытка
красной окиси ртути вместо серебряной соли.
COSH + Вгг
циклопропан-
карбоновая
красная Нйо,
СС14 , 76°С
^>-Рг+ СОг + НВГ
кислота
циклолропил-
бромид
16-6. Реакции а-углеродных атомов
карбоновых кислот
А. Реакция Гелля — Фольгарда — Зелинского
Бром энергично реагирует с карбоновыми кислотами в присут-
ствии небольших количеств фосфора, образуя а-бромкарбоновые
кислоты.
р
СНаС00Н + Вг, —> СИ,ВгСООН ф НВг
а-бромуксуспая
кислота
Эта реакция в отсутствие фосфора происходит медленно; функция последнего,
по-видимому, заключается в образовании трехбромистого фосфора, который,
реагируя с кислотой, приводит к ацилбромиду.
2РфЗВг2 —ь 2РВгз
СН8СО2НфРВг3 —> СН3СОВгфРОВгфНВг
ацетилбромид
Это ускоряет реакцию, так как катализируемая кислотой енолиаация ацил-
бромида происходит намного легче, чем енолизация исходной кислоты. Бром,
по-видимому, реагирует с енолом бромистого ацила так же,-как с енолами кето*
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
563
нов (разд. 15-1.А).
,О
ff
СНз“С +
Вг
/а”
сн,-с
V
Вг
©
Н: силе
Вг
он
снг»с
Вг
енол.
о
,.В^. BrCH2~CZ + НВ г
Вг
оО Йромадетид*
rfptjwg
Конечная стадия состоит в образовании tz-бромкислоты по реакции обмена
бромом между «-бромацилбромидом и исходной кислотой; таким образом регене-
рируется ацилбромид, необходимый для продолжения процесса.
О О
Л II
ВгСНаСВг4-СНаСО,Н —> еН3СВг+ВгСНаСО2Н
Реакция Гелля — Фольгарда — Зелинского приводит исключи-
тельно к «-замещению, и сфера ее применения ограничена поэтому
карбоновыми кислотами, содержащими «-водородные атомы. Хлор
в присутствии следов фосфора реагирует аналогичным образом, ио
в целом менее селективно, поскольку конкурентно может происхо-
дить свободнорадикальное хлорирование во все положения цепи
(как при галогенировании углеводорода, разд. 3-8).
СН3СИ2СОгН
Clf, Р
-----> CH3CH(Ci)COaH
—> СИ3СН(С1)СОгН+С1СНаСНаСОйН
<Х’ХЛорп Родионов а я р-хлорпропиоиовая
кислота кислота
Упражнение 16-13. Используя соответствующие энергии стабилизации, объяс-
ните, почему стабильность енольной формы бромистого ацетила относительно аце-
тцлбромида должна быть больше, чем стабильность 1,1-диокс«этилена относитель-
но уксусной кислоты.
Б. Реакции замещения а-галогенкислот
Галоген в «-галогенкислоте легко замещается при действии ну-
клеофильных агентов, подобных CN©, НО©, I© и NH3. Так, широ-
кий круг «-замещенных кислот может быть получен с помощью
Легкость замещения галогена в а.-лоложении обусловлена, по крайней мере
частично, электроноакцептораыми свойствами соседйей карбоксильной функции,
которая делает а-углеродный атом, слегка положительным и более «гостеприи.м-
ншй по отношению к атаке реагента, стремящегося поделить свою пару электро-
нов.
1 ? ©
—С—С + Вгу
CN ОН
6©
. J3r О
ie©//
s* ' х°н
i'—:CHQ
Можно также ожидать увеличении реакционной способности галогена, распо-
ложенного по соседству с карбонильной группой, основываясь па аналогии с
аллил галоген идами (ср. разд. 11-17,Б).
Ранее подчеркивалась уязвимость карбонильной" группы по отношению к
атаке нуклеофильными агентами. Поэтому может показаться удивительным, что
углеродный атом карбонила яге подвергается атаке. Однако при взаимодействий"
карбонильного углерода с реагентами рассматриваемого Здесь типа не образуется
никакого стабильною продукта. Так. при действий. циапйд-иона константа рав-
новесия для присоединения к карбонильной группе будет иметь, как можно ожи-
дать, в высшей степени неблагоприятноезначение вследствие потери энергий ста-
билпаации карбоксильной группы,
О® -он® ®
. /> й - I - И
R-CZ 4-CN R-C-OH _______; R-C~G»N
। 9
GN + 0M
карбоновые КИСЛОТЫ и их производные
365
Реакционная способность а-галогенкислот в замещении SNI-
типа особенно низка. Это понятно, так как образование карбоние-
вого иона с положительным центром в «-положении должно быть
затруднено, если учесть положительный характер углеродного
атома карбонильной группы. Делокализация электронов может по-
мочь при этом лишь в очень малой степени (если Это вообще возмож-
но), так как в соответствующих резонансных структурах X присут-
ствует положительно заряженный, связанный простой связью кис-
лород.
х
Аналогичные соображения могут быть применены к S^l- и
5м2-рсакциям а-галогеналь дегидов и сс-галогенкетонов (разд;
15-1, Б). .
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
КАРБОНОВЫХ КИСЛОТ
Функциональные производные карбоновых кислот представляют
собой вещества, образующиеся при замещении гидроксильной груп-
пы кислоты на какую-либо другую группу X; эти вещества могут
быть в соответствии с уравнением (16-6) вновь гидролизованы в кис-
лоту.
/> /Р
R-C< 4-наО —► R-C< -рнх (i6-6)
\\ хон
Согласно этому определению, амид RCONH, представляет собой
функциональное производное карбоновой кислоты, тогда, как
кетон RC0GH3 йм не является. В табл. 16-5 приведено несколько
типов производных кислот; методы их получения суммированы в
табл. 16-6 и 16-7-
Общим элементом структуры приведенных в табл. 16-5 соедине-
ний служит ацильная группа . Однако нитрилы RCs^N
также часто рассматриваются как производные кислот (хотя в них
ацильная группа как таковая й не присутствует), поскольку гидро-
лиз нитрилов приводит к карбоновым кислотам. Химия нитрилов
будет рассмотрена в гл. 19.
н®, н,о
CHaC<=iN-----------СНЛСООН
пц<|ТОпнт[Жл укеусгпих кислотш
Таблица 16-5
Функциональные производные карбоновых кислот
Пример
Пример
Производное Структура
Сложные эфиры ,0 R — XOR'
Га ло гена н ги д р ид ы (ацилгалогени- ды) R — \х X-F, Cl, Вг, 1
Ангидриды О О С ^/\Z и и 1 1 ar X
Амиды (первичные) ,0 я-с/ тШ2
Амиды (вторичные и третичные) О R-CNHR'
О II RCNR'R'
Имиды »• я 1 1 о о : О £ о д
Ацилазиды /О R—се
Ацил гидр азиды ,0 R — XNHNHS (
Гидроксамовые ки- слоты R-C/ \nhoh
Лактоны (цикли- ческие эфиры)
^V-NH
структура наименование
Этил ацетат
сн3-с^° хос2н5 Бензоилбромид
\=7 ^\Вг Р Уксусный ангид*
сна~с/ >0 : рнд
сн3-с<С -
Бензамид
\=/ Z0 N-Метил ацетамид
сн3-с^ 4NHCH3 /° Н-С^ N, N-Диметилфор-
мамид
чжнэ)а Сукцинимид
Нгс/ \ 1 >NH Н‘\с/ хо Ацетилазид
сн3-с/ м Пропионил гидра-
C2H5-C<f ^NHNHa зид
>О Хлорацетилгвдро-
С5СНаСС ксаморая кис-
XNHOH лота
zC^° у-Бутиролактон •
Hsc/ \ Hacx /
CHS
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ , 5S7
П родолжение табл. 16-5
Производное Структура Пример
структура наименование
Лактамы (цикличе- ские амиды) /р (CH^I 3 я 8 « -z О ? 1 6-Капролактам
Упражнение 16-14. Какими должны быть относительные летучести уксусной
кислоты, уксусного ангидрида, этилацетата и ацетамида? Приведите ваши сооб-
ражения.
Карбонильная группа играет доминирующую роль в реакциях
производных кислот, так же как в реакциях самих кислот- Здесь
будут рассмотрены два основных типа реакций производных кислот,
а именно; замещение X при атаке нуклеофила ;Y© по карбониль-
ному атому углерода с последующим разрывом связи С—X [уравне-
ние (16-7)] и активированное карбонильной группой замещение
при а-углеродном атоме [уравнение (16-8)1.
О Р
R~(/ + :Y® —► R—С-^Х *- R-с/ + :Х® (16-7)
X Y Y
о о
// //
КСНг-С + YZ ------> RCH-C + НХ (16-8)
X Y X
16-7. Реакции с участием углеродного атома
карбонильной группы
А. Реакции замещения производных кислот
К числу наиболее важных реакций замещения относятся сле-
дующие:
1. Гидролиз производных кислот до самих кислот; обычно в ус-
ловиях катализа кислотой или основанием, Ацилхлориды, как пра-
Таблица 16-6
Методы получения эфиров карбоновых кислот
Реакция
Примечание
L. из карбоновых кислот и первичных спиртов
н8
RCOSH +R’OH =«==ь RCOaR'n-HaO
„ * H2SO,
CHgCO^H-f-CsHjOH => CHsCOjCjHj^ Н3о
- атялацетат (90%)
2. На хлористых ацилов и спиртов
RCOCI + R'OH —> RCO2R'-f-HCl
CHsGOCi-HCHs)3COH -* CHjCO2C(CH3)3-r НС)
mpe m-бутил ацет ат (68%)
3.
4,
Из ангидридов и спиртов
нФ
(₽СО)йО+ R'OH —> RCO2R’H-RCOsH —-----? RCO»R‘
нФ
СНСО нг50„ СНСОаСН8
" /°+2СН*0Н-------->|(! + 2НгО
СНСО/ - снсоасн3
малой нов ыП димети л малеат
ангидрид •
Переэтерификац ая
нФ или Фон
RCO.R' г R"OH /•. RCO3R"+ R'OH
R'OH
Метод применим только к первичным спиртам;
в число кислых катализаторов входят H2SO4, НС1,
BF3; подробное описание и механизм см, в разд.
13-5,В. и 16-4,А.
Реакция имеет широкие возможности применения,
хорошие результаты даёт с первичными, вторичными
и третичными спиртами; может оказаться иеобходи-,
мым использование оснований для удаления НС1, так
как в случае третичных алифатических спиртов воз-
можно образование алкенов и /нрет-алкилхлоридоа
Реакция имеет широкие возможности примене-
ния; катализируется кислотами
Реакция катализируется кислотами и основания?
ми; применима, как правило, в случае первич-
ных спиртов (обсуждение см. в разд. 16-7,А)
сн2 = СНСОаСН<,+ н-С4Н9ОН
метилакрилат t
СН8ОН +
+ CHa=CHCOaCJHil
н-бутилакралат (94%)
ая
5, Из солей карбоновых’ кислот, тирнилхлЬрида и спиртов
R'OH+SOCb —> R'OSOCl 4-НС1
идкилхлррсулъфнт
RCO2Na4-R'OSOCl RCO2R'+..SO2+NaCt
/CH3 i.
z---d h-C1H»OSOC1
H3C-< >-CO7 ——------------>
XCH3
2,4,6-гри&стилбензаат
ZCH3
—> НзС-^”^—COAHirbSOs+Cl0
хсня
х-бутил-2,4.6‘Триметилбензоат (71%)
6. Из солей карбоновых кислот и алкилхлоридов
RCO3Na + R'X —> RCO2R’-|-NaX
CH3COaNa 4- C2HS ~V- CH2C1 —>• CH3COsCHa -C3H 5
л-этилбенэилхмюрид л-этнлбензилацетат
7. Алкоголиз нитрилов
нФ, HjO
RCN—R'OH --------->- RCOjR*
yCN ' д, : ,СОаС2Нь
/- С,н*он, Нго, нФ / 326
С.Ц., --------> CH2
XCN \CO2C2HS
малонятрил дизтилмалоиат (62%)
8. Диазонетан,карбоновые кислоты
RCOJi + CH^2 -* RCdjCH, + n2
^>-С1ГгСО;Н + CH-X2 ^>-CHzCO2CH3
метилциклопропилацетат (79%)
Метод применим только к первичным спиртам;
представляет собой 5^2-замещение хлорсульфит-
ной группы карбоксилат-ионом; пространственные
затруднения в карбоксилат-ирие не имеют боль-
шого значения
Метод применим только к первичным галогени-
дам с высокой 5н2-активностъю
Аналогичен гидролизу нитрилов [метод 1, табл-
16-1J
Дает высокие выходы. Реакция протекает глад-
ко, но диазометан является высокореакционноспо-
собным и токсичным соединением. Метод псполь-
зу'ется для получения метиловых эфиров трудно-
доступных (гл и чувствительных к действию кислой
среды кислот
Таблица 16-7
Методы получения ацил галогенидов, ангидридов и амидов кислот
Реакция
Примечание
( А ци л гало ген иды
I. Из тионилхлорида и‘карбоновой кислоты
RCOJl+.SOCAi —* RCOCl + Ha + 5Oa
2, Из галогенидов фосфора й карбоновых кислот
3RCO2H+ РВг3 —+ 3RCOBr+ НЯРО3
RCO3H+PCf5 —>- RCOCi + POCJa-FIICI
Л цн.ъх л op иды получают обычно этим
методом; в качестве побочного продукта
иногда образуются ангидриды
Вследствие образования HSPO3 и РОС13
иногда возникают затруднения при раз-
делении реакционной смеси
3. Из хлористого тиснила и ангидридов
80С1г
фталевый
аягц/Грнд
/х/СОС!
(а
\СОС1
фталоил
хлорид
Применяется только в тех случаях,
когда ангидрид более доступен, чем со-
ответствующая кислота
4. Получение ацилфто радов, ацилбромидов и ацилиодидов из хлорангидридов
RCOG + HX -+• RCOX+HC1
где HX=HF, НВг и HI
Иногда оказывается единственно воз-
можным методом получения фторидов,
бромидов и иодндов
5. Из оксалилхлорида
СОС1
1<СОаН+ —> RC0Cl+C0+CO34-HCI
Превосходный метод
1,
Ангидриды
Из ацилгалогенидов и карбоновых кислот
пиридин RCO.
RCOsH+R'COCl---------> AO-f-HCI
Метод используется наиболее часто;
могут быть получены простые или сме-
шанные ангидриды
2.
Из ацилгалогенидов и солей карбоновых кислот
RCO
RCO.Na + R'COCi
NaCl
3,
Из кетена и карбоновых кислот
RCO
CH2=C=O+RCO2H — >О
Амиды
Из ацилхлоридов и аммиака или аминов
RCOC1 + 2NH3 RCONHs+NH4C1
RCOCI + ’R'NH, —* RCONHR'-j-R'NH^CJ
2. Из карбоновых кислот, и аммиака или аминов
нагревание
RCO2H+NH3 RCOaNHt —-----------* RCONHj+H2O
нагревание
RCQ>H+R'NH2 —* RCO2NH3R---------> RCONHR+HaO
3. И а ангидридов и аммиака или аминов
иагреЕзипе
(ROOa)2O4-NH3 —> RCO2NH4+RC0NH2---------- RCONHa
4. Гидролиз нитрилов
нФ
RCN+HaO ------------ RCONHa
I н,ог. он© t
Промышленный способ получения ук-
сусного ангидрида (разд. 15-5)
1,
Амиды обычно получают этим методом
Важный метод получения циклических
ангидридов, например фталимида, сук-
цинимида
Гидролиз останавливается на стадии
амида в том случае, если R—третичный
алкильный остаток или если Н2О3 исполь-
зуется для ускорения реакции (см. уп-
ражнение 19-36)
Продолжение табл. J6-7,
RCOCI + NaN3 —+ RCON3+NaCl
ааид
йатрня
карбоновые кислоты и их производные 573
вило, гидролизуются быстро в отсутствие катализатора
.0 Н® или ОН- /О
R-C^ 4-Н2О.--------:---> R-—С< 4-НХ’
ХХ ХОН
X ——OR, галоген, — N'lLuR — С<^
ч0-
'. 2. Переэтерификация; обычно проводится в присутствии кис-
лого или основного катализатора.
X* Н® или OR '.О
СНз-СХ +СН3СН2ОН - CHs-Gf +сн3он
хосн3 чосн,сн3
метил ацетат этанол этила цетат метанол
» . р •
3. Образование эфиров из ацилхлорйдов и ангидридов
4. Образование амидов из сложных эфиров, хлористых ацилов
и ангидридов
NH,
R-C •+ R'OH
w
R-CZ + NH4® Cl®
О
I R-CZ + RCOj® NHj®
4NHj
Все эти реакции имеют много общего; принципы, лежащие в их
основе, будут пояснены главным образом на примере реакций слож-
ных эфиров, поскольку такого роДа превращения изучены наиболее
полно. Катализируемый кислотой гидролиз сложных эфиров явля-
ется реакцией, обратной катализируемой кислотой этерификации,
574
ГЛАВА 16
которая была рассмотрена выше (разд. 13-5,Б и 16-4,А). В противо-
положность этому происходящий под действием щелочи гидролиз
(омыление) практически необратим. Начальная стадия последнего
заключается в атаке гидроксил-иона на электронодефицитный угле-
род карбонильной группы; в результате образуется промежуточ-
ный анион XI, который может либо отщепить ОН© и превратиться
в исходный эфир, либо отщепить СН3О© и перейти в кислоту.
6©
СНу-С—осн,
(6©
''''-ОН9
Э
CHj—OCHj
он
хг
В целом реакция необратима, так как кислота, образовавшись, не-
медленно переходит в карбоксилат-анион, который уже не атакуется
основанием. В результате превращение идет в сторону гидролиза и
доходит до конца.
О®
СН3—(!—осн3
I
_ ОН I
о
II
CHSC-OH4-CH3O
л0
СН3-(Х q+CHsOH
XI
Упражнение 16-15. Почему карбоксил ат-ан ио и в меньшей степени подвержен
атаке нуклеофильных агентов тинаСНаО©, чем соответствующий сложный эфир?
Катализируемая основанием переэтерификация аналогична ре-
акции омыления, за исключением того, что вместо щелочи в катали-
тических^ количествах используется алкоголят-ион. Однако кон-
станта равновесия при этом намного ближе к единице, чем в случае
омыления (соль кислоты не образуется).
.0 R°X
СН3~С< +СН3СНаОН CHsC<f +СН30Н
ХОСН3 \оСНаСН3
Механизм приведен в уравнении (16-9).
zO ©
сна-с< +сн3снЕо
хосн3
Метила цетат
о9 -
СН3-{!-ОСНаСН8
осн3
+сн3о®
1» -
CH3-C<f
ХОСН2СН
этилацетат
(16-9)
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
575
В качестве катализатора могут быть использованы как метилат-,
так и этилат-анионы, поскольку равновесие, приведенное в уравне-
нии (16-10), устанавливается быстро.
СНэое+СН9СНаОН СН»СНаОе+СНаОН (16-10)
Катализируемая кислотой переэтерификация полностью анало-
гична катализируемой кислотой этерификации и кислотному гидро-
лизу и не требует дальнейшего обсуждения.
. Упражнение 16-16. По аналогии с гидролизом сложных эфиров предложите
'.механизм для каждой из перечисленных ниже реакций:
н®
a) C^HsCOaCHs+CsH6OH — СвН6СОйС2Нй+СН3Он
б) СН3СОСЬрСНаСНаОН —> СН8СОаСНаСНэ+НС1
н®
в) (СН3СО)2О4-СНэОН —> СНэСОаСН3+СН3СООН
, г) CH3CONH2+ Нэо® CH3COaH + NH®
. А 9
Д) CHgCONHj + OH0 —СН,СО3 +NH3
’ е) СН3СОС1 -р SNH3 —> CHSCONHS + NH4C1
Упражнение 16-17. Какой вывод вы можете сделать о механизме катализируе-
>мого кислотой гидролиза 0-бутиролактона на основании приведенного ниже урав-
нения?
Н«О, Н® /ОН
сн,-с=о---------- >. сн,-с/
I I I 'О
СН2—о сн4он
R—с—NHj
Упражнение 16-16. Амиды типа представляют собой гораздо бо-
лее слабые основания (и более сильные кислоты), чем амины. Почему?
— Упражнение 16-19. Напишите возможный механизм приведенной ниже реак-
ции.
/О н®
CH3-Cf ; 4-СН3ОН СНэСОаН + СН3ОС(СН3)э
ЧОС(СН,)а
Упражнение 16-20. Объясните, почему катализируемый основанием гидролиз
метилмезнтоата происходит необычно медленно. Напишнте механизм быстрого
гидролиза метилмезнтоата, происходящего в том случае, если раствор сложного
эфира в концентрированной серной кислоте вливается в смесь льда и поды (см.
разд. 16-4,А).
/СН3 О ,СН3
z---< II 1, Н35О, А---С Л)
СН3-< х--------С-ОСН3---------nCH3-;f >----------cf 4-СНзОН
'=< 2- USO, о ес Х=/ хон
ХНз ХСНг
метилмеэитоат 4 мсзнтоййая кислота
576
ГЛАВА 16
; Б. Реакции с металлоорганическими ,
соединениями ,
.Реакции ряда производных карбоновых кислот с магний- и ли-
тийорганическими соединениями были описаны в гл, 12. Ключевой
стадией Этих реакций является присоединение органического ос-
татка металлоорганического соединения (в виде карбаниона) к кар-
бонильному атому углерода; металл при этом соединяется с карбо-
нильным атомом кислорода
Z
R-С-OMgX
R'
z - ci. ok, rco2
Реакция обычно не останавливается на этой стадии. В приведенной
выше реакции отщепляется MgXZ, и образующийся кетон реагирует
со второй молекулой металлоорганического соединения. . В резуль-
тате гидролиза образуется третичный спирт
R-C^OMgX ЧС=О + MgXZ k RffiX*R-C-OH + Mg(OH)X
I / 2, H»O I
R‘ R' R'
Упражнение 16-21. Укажите возможную причину того, что гриньяровекие
реактивы присоединяются к N.N-диалкиЛамидам RCONR2, образуя кетоны, но
не присоединяются к первичным и моноалкил замещенным амидам RCONH, и
RCONHR'.
В. Восстанавлемце. производных кислот
Сложные эфиры, ацилхлориды и ангидриды восстанавливаются
с помощью литийалюминийгидрида по общей схеме, описанной для
карбоновых кислот (разд. 16-4,В). Различие заключается лишь в
том,, что не происходит выделения водорода; в результате реакции
образуются первичные спирты.
,0 l.LiAIHj
R-Cf —-г----------
V 2. Н®, Н2О
ЙСН2ОН
Z=CI, OR, RCO2 ч
Нитрилы могут быть восстановлены в амины литийалюминййгид-
ридом, В качестве промежуточного продукта образуется соль ими-
на; если реакция проводится в соответствующих условиях, то эта
соль оказывается основным продуктом и притидролизе дает альде-
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ 5?7
гид (см. разд. 14-1,Б),
. LIA1H, И LIAIH, Н®, HjO
R—CN -------+ R-C=NLi :——> ~----------> RCHaNHa
(имин)
Н,О Н®
’Амиды восстанавливаются в первичные амины, а N-замещёнйые
амиды — во вторичные и третичные амины
RCONHa '
RCONHR'
RCONRa ,
LIA1H,
H®, HtO
' RCHjNHa
; RCHoNHR'
, RCHjNRa
Несмотря на то что литийалюминийгидрид — чрезвычайно удоб-
ный восстанавливающий агенту он иногда, оказывается слишком
дорогим, что препятствует его использованию в широком масшта-
бу. В таких случаях могут оказаться необходимыми другие методы
восстановления, наиболее важными из которых являются восста-
новление эфиров натрием в спирте* (кислоты реагируют медленно)
’ Г..Н.ОИ Q д,
РСОаР' + 4Ка + 4С2ЩОИ ------> RCH2OH + R'OH4-4CaHJ1O Na®
и гидрогенолиз над катализатором — хромитом меди, проводимый
под высоким давлением
200 С
RCO2R'-| 2Н2-----> RCH2OH + R'OH
Cu(Cr)
16-8. А Реакции, производных карбоновых кислот
по .а-угле родному атому
А. Кислотные свойства сложных эфиров,
содержащих <х-водородные атомы
Многие важные в синтетическом отношении реакции, при кото-
рых образуются связи С—С, происходят с участием1 сложных эфи-
ров и осуществляются при действии реагентов основного характера.:
Это-оказывается возможным вследствие того, что а-водородные ато-
мы сложного эфира типа RCH2CO,C2HB обладают слабыми кислот-
ными свойствами; и сильное основание; например этилат натрия,
может создавать в равновесной смеси значительную концентрацию
* Реакция Буво.— Прим. ред.
19 № 13-40
578
ГЛАВА 16
аниона сложного эфира
РСНгСО2С,Нв + с2н}ое
©
RCHCO2C2H5+ C2HsOH
Кислотность а-водородных атомов связана отчасти с—/-индукцион- )
ным эффектом кислородных атомов эфира и отчасти с резонансной
стабилизацией аниона, образующегося при удалении протона. / J
.. .©
О ’
/ -
R-C=C
R-C-C
Н ОС2Н5
ОС2Н3
В тех случаях, когда a-углеродный атом сложного эфира связан
со второй электроноакцепторной группой, кислотность а-водородов
возрастает в очень большой степени. Примеры таких соединений
приведены ниже.
O2NCH2CO2C2HS
этвлнитроацетат
С2Нр2ССН2СО2СаН5
ди Этвлиялонат
NCCHaCOsC2H5
этмлцианацетат
CH3COCH2CO2C2Hj
этил ацето а цет ат
Стабилизация анионов этих в особенности сильно активирован-
ных эфиров больше, чем в случае анионов обычных эфиров, так как
отрицательный заряд в них может быть рассредоточен более чем по
двум центрам. Так, в случае аниона этилацетоацетата можно счи-
тать, что все три резонансные структуры (XПа—ХПв) вносят су-
щественный вклад в гибрид XII
о о
II н //
CHj-C-C-C
'"н' ЧОСгН3
|-н®
О © О :О: О О 'О
II // I // || /
сн3-с-сн-с ** сн3—с=сн—с ** см3-с-сн=с
осгн5 'bcjHg bCjH,.
?Иа ХЯб ХПв
г»
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
579
или
СН,-С-СН-С
\
ОС2Н5
XII
Анион XII обладает значительной стабильностью: 7<л сс-водорода
этил ацетоацетата в водном растворе составляет около 10-11.
Этил ацетоацетат (ацетоуксусный эфир), подобно ацетилацетону
(разд. 15-7), при комнатной температуре обычно существует в виде
равновесной смеси кетонного и енольного таутомеров в отношении
92,5 к 7,5. Это может быть обнаружено при быстром титровании
бромом, но более отчетливо видно из ЯМР-спектра (рис. 16-6), содер-
жащего сигналы гидроксильного, винильного и метильного прото-
нов енольной формы наряду с сигналами, соответствующими кето-
форме.
Н
О о
II II
СНа-С с—ОС2НЬ±^
снг
кето-форма (92.5%)
(/\
CHs-Lzct-OCjsHi
СН
енольная форма (7,5%)
Взаимопревращение енольной и кетонной форм ацетоуксусного
эфира чрезвычайно чувствительно к катализу основаниями (в
этом процессе принимает участие анион XII) и, в меньшей степени,
кислотами (через сопряженную кислоту кето-формы, в которой
протон связанно кетонным атомом кислорода).
о 9
СН3-С._ 0
II II I Й
СН3-С ^.C-OC2HS сн3-с. ^С-ОС2И.
СН2 СН
кето-форма ®°Н О формл
, II II
! CHj-C C-OC2HS
Однако в том случае, если контакт с веществами кислого или ос-
новного характера полностью исключен (для этого, в частности, ре-
комендуется использовать кварцевую лабораторную посуду вместо
стеклянной, так как поверхность стекла обычно обладает слабыми
19*
580
ГЛАВА 1'6
12,6 !ij,0 8.0 6,0 4,0 2,0 0 м.Д.
Рис. 16-6. ЯМР-спектр этилацетоацетата при 60 МГц относительно тетраметил-
силана (0,0 м. д.).
ПИКИ, л, б и й, относятся к соответствующим протонам енсмъной формы, тогда,
как лики гиб обусловлены соопгетствеино <х-СНл и метильными протонами кето-формы.
Квартет линий при 4.2 м- д. и триплет при 1,3 м. д. относятся к этилышм группам как
кето-, так и енольной форм,
основными свойствами), скорость взаимного превращения снижает- J
ся настолько, что оказывается возможным отделить более низкоки- ;
пящий енол от кето-формы путем фракционной перегонки при пони- .Л-
женном давлении. Разделенные таким образом таутомеры устойчивы Л
в течение сколь угодно долгого времени при хранении в кварцевых у
сосудах и температуре —80 °C.
Упражнение ]6~22. Укажите причину того, что содержание енола в ацетилаце-
тоне (при равновесии) намного больше, чем в этилзцетоавдтате. Какого содер-
жания енола вы могли бы ожидать для диэтилмалоиата? Для ацетилацеталь- : 1
дегида? Объясните,
Упражнение 16-23. Исходя из того, что можно регулировать отношение С- и
О-алкилирования енолят-анионов (разд. 15-2, Б), покажите, как можно решить,
будет ли реакция натриевой соли ацетоуксусного эфира с сильной кислотой да-
вать в качестве первоначального продукта главным образом либо енольную форму,
либр кето-форму, либо равновесную смесь этих двух форм.
Б, конденсацияКляйэена
Одной ид наиболее важных в синтетическом отношении реакций
сложных эфиров, происходящих под действием оснований, являет-
ся автоконденсация эгилацетата, вызываемая этилатом натрия и
приводящая к ацетоуксусному эфиру. Эта реакция, носящая на-
звание конденсации Кляйзена, интересна тем, что она, как .можно
о________*
CH,c4-QC2Hs + н4сН2СОгС2Н5 - сн3соснгсогс2Н5 + СИДОН
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
581
ожидать на основании энергий связей и стабилизации, должна быть
термодинамически невыгодной [А// (газ)==6 ккал/мель]. Такое пред-
положение оправдывается на практике. Было приложено немало
усилий для того, чтобы отыскать условия, при которых выходы про-
дукта конденсации имели практическую значимость. 1
Механизм конденсации Кляйзена в некоторых своих чертах на-
поминает как реакции альдольного присоединения (разд. 15-2,А),
так и рассмотренные выше нуклеофильные реакции производных
кислот (разд. 16-7, А й Б). Первая стадия [уравнение (16-11) ] пред-
ставляет собой образование аниона этилацетата, который, будучи
чрезвычайно сильным нуклеофилом, атакует карбонильный атом
углерода второй молекулы сложного эфира [уравнение (16-12)].
Элиминирование этилат-иона приводит далее к эфиру fl-кетокисло-
ты, этиЛацетоацетату [уравнение (16-13)1.
С2Н5О® + H-CH2CO2C2HS ^=* ®:СН2СО2С2Н5 + C2HSOH (16-11)
+ :СНгСОгС2Н5 : CHj-C-CHjGO^Hs (16-12)
чосгн5 ОС2Н5
СН3-С-СН2СОгСгН5 CH3-C-CH2CO2C2HS + С2Н5О® (16-13)
С*осгн5 х
Все эти стадии в итоге приводят к невыгодному положению
равновесия, и удовлетворительные выходы р-кетоэфиров получают
только в том случае, если оказывается возможным сдвинуть равно-
весие, удаляя один из продуктов. Это может быть достигнуто от-
гонкой этилового спирта; может, однако, оказаться трудным дове-
сти эту отгонку до завершения, а если исходный сложный эфир
имеет низкую температуру кипения, то этот метод, естественно,
неприменим.
С другой стороны, можно применять большой избыток этила-
та натрия. Этот метод оказывается эффективным, так как этанол —
более слабая кислота, чем енол сложного эфира, и избыток этилата
сдвигает равновесие вправо вследствие превращения.,^-кетоэфира в
соль енола [уравнение (16-14)].
О О
II Q li S
Сн5ССНаСОгС3Нв4-СгНьО- СН3-С—СНСОаС2Н5фБ2НйОН (16-14)
Очевидно, что продукт конденсации необходимо получать из соли
енола и выделять в условиях, предотвращающих обратную реакцию
распада на исходные реагенты. Наилучшйм методом оказывается
582
ГЛАВА 16
«замораживание» реакционной смеси, для чего ее вливают в избыток
холодной разбавленной кислоты.
Упражнение 16-24. Другими возможными продуктами конденсации этил аце-
тата по Кляйзену могут быть
О
О О [|
II II /ОССНд
CHS-C-CHCOC2H5 и сн2=с/
СН3—С=О ОСцНь '
Объясните, как могут образоваться эти продукты и почему они фактически не
образуются в сколько-нибудь существенных количествах.
Для протекания конденсации Кляйзена необходимы следующие
условия: исходный сложный эфир должен иметь один а-водородный
атом для того, чтобы могли осуществиться реакции, описанные
в уравнениях (16-11)—(16-13), и два а-водородных атома для того,
чтобы оказалось возможным установление выгодного положения
равновесия, включающего ионизацию согласно уравнению (16-14).
Не удивительно поэтому, что этил изобутират не вступает в при-
сутствии этилата натрия в реакцию автоконденсации — причина
заключается в том, что в продукте конденсации отсутствуют сс-
водородные атомы.
сн, , /-и сн,
2 z™CoiC!H, >НСО?СО.С1Н, СЙОН
’ - си’ сн,
этнлюобутират _
этил из обутпр из обутират
Однако если использовать вместо этилата натрия избыток значи-
тельно более сильного основания [например, трифенилметилнатрня
(СвНй)яС©Ф№а], то такая конденсация происходит и дает удовлетво-
рительные выходы. Причина заключается в том, что основание в
данном случае оказывается достаточно сильным для того, чтобы пол-
ностью связать образующийся в ходе реакции спирт, чего, разумеет-
ся, этилат натрия сделать не может.
2 СНэЧ)СНСО3С2Н5 GH^CHCOC—CO2CaHE4-C2HEOH
СН/ СН/ ^СНд
C/sOH-HQH^C9 Г* С2НьОе+(СвНй)3СН
сн сн СНз
2 ЯЧ)СНСОгС2Нб+(СвН5)3С®—ь Э/СНСОССО;С2Н5+СгНь09+(СвНЕ,)3СН
сн3/ СН< | 1
СНд
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
533
Конденсация Кляйзена может быть проведена между двумя различными
сложными эфирами, но, поскольку при этом возможно образование четырех раз-
личных продуктов, в результате реакции часто получают сложные смеси. Этого
удается избежать, если один из сложных эфиров не содержит «-водородных ато-
мов и легко реагирует с карбанионом в соответствии с уравнениями (16-12) и
(16-13). Реакция в этом случае во многом напоминает смешанную альдольную
конденсацию, рассмотренную в разд. 15-2,А. К числу применимых для этой
цели сложных эфиров, не содержащих а-водородов и обладающих необходимой
электрофильной активностью, относятся эфиры бензойной, муравьиной, щаве-
левой и угольной кислот. В уравнениях (16-15) — (16-17) приведено несколько
примеров препаративных синтезов, основанных па смешанной конденсации Кляп-
вена.
1. C.HjO®
С^ЦСОАУв + СНзСОАН.,------------->- СвН&СЮСН2СОАНй + С2Н&ОН (16-15)
этнлбевзоат 2, н® этглбензонлацегат (55%)
НСО2С8Н5+С,Н5СНаСО AHS
этилформнат этн л фенил ацетат
о
1.С,НьОи
---------- Св’НьСНСОаСаН5 —* С,НВС—СОоСоНв
2. Н® । II
СНО СНОн
эти лфо рми лфе н ил-
ацетат (90%)
(16-16)
1 сгнао®
(СОАН5)г + СНяСН2СНаСО2С2Нь--------------> СН3СН,СНСОаС2Нь (16-17)
этялокеалат этилбутира-г у и® I
COCOsC2Hs
1 диэтил-а-оксалил-
бутират
В одном из важных вариантов конденсации Кляйзена в качестве аиноиоид-
ного агента используется кетон. Это в некоторых случаях дает хорошие результа-
ты вследствие того, что кетоны обычно обладают более кислыми свойствами, чем
сложные эфиры, и катализируемая основаниями авто конденсация кетонов (аль-
дольная конденсация) термодинамически невыгодна (разд. 15-2,А). В этом отно-
шении типична конденсация циклогексанона с этилоксалатсм [уравнение (16-18)]
(СО2СаН5)2 -{-
этилоксал ат
е I’ COCOAHs
I. СйНлО f ।
-------> -J-C2H5OH
2. H® \/
(16-18)
цикло-
гексанон
2 - {3 th jiok салил )ци к ло
гексанон
Оксалильные, производные, подобные приведенным в уравнениях (16-17) И
(16-18), находят синтетическое применение вследствие того, что они аналогично
другим а-кетоэфирам при сильном нагревании теряют окись углерода. В опреде-
ленной степени сходная реакция декарбонилирования упоминалась выше для слу-
584
ГЛАВА. [6
чая дифенилтрикетона (разд. 15,9).
150'С
СН,СН8СНСОЙС2НЬ —CHjCHaCHCOAHs.+CO.
СОСО2С,Н5 СО.С2115
днэти Лэти ЛМЗ.П0 н ат
О:
2-карбэто кс Нинк*
логексан
-рСО
Упражнение 16-25. Напишите структуры всех продуктов конденсации Кляй-
зена, образования которых можно с достаточным основанием ожидать при ис-
пользовании смесей приведенных ниже соединений и этилата натрия.
а) этилацетат и этилпропионат
б) этилкарбонат и ацетон
в) этилоксалат и этилтримети л ацетат
Упражнение 16-26. Покажите, каким образом приведенные ниже соединения
могут быть синтезированы с помощью конденсации кляйзеиовского типа при ис-
пользовании указанных исходных веществ. По возможности точно опишите реа-
генты и условия реакций:
: а) этйл-а-прояионилпропионат из этилпропиопата
б) этил-2,4-дмкгтопентанбат из ацетона
в) диэтилфенилмалонат из этилфенил ацетата,
г) ацетилацетон из ацетона
д) 2,2 Дб-тетр ацетил гепт ан дио и-3,5 из пинаколина (гпреш-бутилметилкетона)
е) этил-а-бен зо ил изобутират из этил изо бутирата
Упражнение 16-27. Какие достоинства и, недостатки может иметь применение
гидрида натрия (NaH) в качестве конденсирующего агента при конденсации
Кляйзейа?
В. Алкилирование ацетоуксусного:
и малонового эфиров
Анионы сложных эфиров типа этилацетоацедата и диэтилмалона-
та могут быть проалкилированы ал кил галогенидами. Эти реакции
имеют важное значение для синтеза карбоновых кислот и кетонов
и в основных чертах сходны с рассмотренным выше алкилированием
кетонов по Халлеру — Бауэру- (разд. 15-2,Б). Сложный эфир пре-
вращается при действии сильного, основания в енолят-анион [урав-
нение (16-19)1, и последний далее алкилируется по, Sм2-реакции.
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ 585
ал кил галоген и дом [уравнение (16-20)]. Обычно преобладает С-ал-
килирование.
СН3СОСН2СО2С2Н3 + С2н,ое СН,СОСНСО2С2Н5 + С2НЬОН (16-19)
е д
CHjI+CH3COCHCO2C2He —> СН3СОСНСО2С2Н6 + 1И (16-20)
сн3
- Сложные эфиры малоновой кислоты можно алкилировать аналогич-
' ным образом [уравнение (16-21)]
уСО2С2Нк >СОаСаНя
/ 2 2 5 GsHsOWa СНаСН,Вг / 2 'а 6
Н2С >--------к СИ3СН2 —СН
Ч''СО2С2Н5 Чч'СО2С2Нь
(16-21)
К сожалению, моноалкилирование редко происходит так одно-
. значно,вКак это представлено уравнениями (16-19) и (16-20) или (16-
21), в тех случаях, когда в продукте моноалкилирования имеются
a-водородные атомы, расположенные таким образом, что оказывает-
1 ся возможным диалкилирование. На практике реакция ацетоук-
сусного эфира (или диэтилмалоната) с 1 молем этилата натрия и
1 молем йодистого метила дает трудноразделимую смесь исход-
ного эфира и продуктов его моно- и диметилирования. Лучшие
результаты достигаются в тех случаях, когда вводятся-алкильные
группы большого размера, так как физические свойства исходных
веществ и продуктов моно- и диалкилирования при этом сущест-
венно различны. Ди алкилирование обычно подавляется вследствие,
‘ большого объема продукта моноалкилирования.
Алкилацетоуксусные и .алкилмалоновые эфиры могут быть гид-
ролизованы в кислых условиях До соответствующих кислот, которые
при нагревании легко декарбоксилируются (см. разд. 16-5). Из
алкил ацетоуксусных эфиров при этом образуются метилалкилке-
тоны, а из алкилмалоновых эфиров -- карбоновые кислоты.
СНз © СИ,
[ Н537 НаО I язгревэнне
CHjCOCHCOAHj--------—> СН3СОСНСО2Н -----------CH3C.OCti.CII3
—МСТНЛЭТНмТКСтОВ
/СО2С2Н5 zgo2h
СНаСНаСН н И-° СНзСНгСН ' нагревание
хсохди N:o2h ~coj
ch3ch2ch2cq2h
я-масляиая кисло га
С сильным»! щелочами ал кил ацето уксусные эфиры взаимодействуют иначе,
образуя карбоновые кислоты. Ключевая стадия в этом превращении представляет
собой реакцию, обратную конденсации Кляйзена, как это можно видеть из срав-
585
ГЛАВА 16
нения уравнений (16-22) и (16-23) с уравнениями (16-12) и (16-13).
СН3С^СНСО2С2Н5 4- ОН ^=5. СН3С—снсогсдн3
----------------Ан
(16-22)
<о9 снэ
сн}с—снсого2н3
он
*/ *
ОНз-С + <‘СНСО2С2Н,
Ан.
он0
СН.СО.Н - СН.СН.СО.Н Jil СИ./ + СН.СН./ (I6-a>
уксусная пропионовая <у® Vi®
кислота кислота и
Упражнение /6-28. Почему приведенная ниже реакция не может быть исполь-
зована для получения этилпрдпионата?
< NaOCjHj
СН3СОгСгН5 4- СН31 ----------7/—=---«- СН3СНгСОгСгН5
Упражнение /6-29. Покажите, каким образом из этил ацето ацетата можно по-
лучить 3 -эти л пент анон -2, Каковы преимущества этого пути синтеза перед алки-
лированием пентанона-2 действием амида натрия и йодистого этила?
Упражнение /6-30. Каким образом можно получить диэтилметилмалонат,
свободный от примесей диэтилмалоната и диэтилдиметил мал оНата?
Упражнение /6-3/. Покажите, каким образом, используя в качестве исходных
веществ диэтилмалонат и соответствующий дигалогенид, можно получить цикло-
бутанкарбоновую кислоту?
В. Ацилирование ацетоуксусного
и малонового эфиров
Анионы сложных эфиров, подобных этил ацето ацетату и диэтилмалонату,
взаимодействуют с ацил тал о ген идами или ангидридами, образуя продукты ацили-
рования. Эти реакции осуществляются с наибольшим успехом, если использовать
для получения соли енола не этилат натрия, а гидрид натрия, так Как в этом случае
не происходит образования спирта, способного реагировать с ацилгалогенидом
или ангидридом.
CHaCOCHaCO.,C,HB+NaH —> [cH3CO?HCO3CaHjNa®+Н2
9 Q
СН3СОСНСОгС3Н6 + СвН5СОС1 —Ь СНэСОСНСОаСгН3-|-С1ь
бензоил- I *
хлорид СОС6НБ
КарБОновыё кислоты и ик производные
58?
Реакции ненасыщенных
КАРБОНОВЫХ КИСЛОТ И ИХ
ПРОИЗВОДНЫХ
Свойства ненасыщенных карбоновых кислот типа RCH=CH—
—(СН2)ПСООН в тех случаях, когда п велико и функциональные
группы удалены на большое расстояние, обычно соответствуют свой-
. ствам изолированных двойных связей и изолированных карбоксиль-
• ных групп. С особенностями в химическом поведении, как правило,
• приходится сталкиваться тогда, когда группы расположены доста-
' точно близко, чтобы оказывать друг на друга сильное воздействие,
(«) (Р)
как это имеет место в аф-ненасыщенных кислотах RCH=CHCOaH.
* Такие специфические свойства будут отмечаться особо в ходе по-
следующего изложения.
. 16-9. Миграция двойной связи
В присутствии сильных оснований аф- и 0,у-ненасыщенные
“кислоты Обнаруживают тенденцию к взаимопревращению путем миг-
. рации двойной связи.
, NaOH
’ RCH=CH-CHaCOOH RCHSCH=CHCOOH
|3 .^ненасыщенная a, fj-не насыщен нал
кислота кислота
Соответствующие сложные эфиры RCH=CH—CH2COOR',
а также ненасыщенные альдегиды и кетоны RCH=CH—CHaCOR/
склонны к этому типу перегруппировки в еще большей степени,
чем кислоты.
Упражнение 16-32, Напишите механизм катализируемого основанием равно-
весия аф- и (3,у-ненасыщенных эфиров. Какой изомер будет, по вашему мнению,
преобладать в смеси? Почему этот тип изомеризации осуществляется в случае
кислот с большим трудом, чем в случае сложных эфиров? Будут ли у,6-ненасы-
щенные эфиры легко перегруппировываться в аф-ненасыщенные эфиры? Если
да (или нет), то почему?
16-10. Реакции присоединения по двойной
связи
А. Гидратация и присоединение бромистого
водорода
Подобно алкенам, двойные связи аф-ненасыщенных кислот
могут присоединять бром, гидроксилироваться, гидратироваться и
гидробромироваться, хотя эти реакции часто оказываются сравни-
тельно медленными. В случае присоединения несимметричных аген-
588
ГЛАВА 1(5
тов направление присоединения противоположно тому, которое наб-
людается в случае алкенов, т. е. происходит против правила Мар-
ковнйкова. Так, в результате присоединения бромистого водорода
и воды к акриловой кислоте образуются fJ-бр.сМ- и р-оксипропионо-
вые кислоты
НВг
------
СН2 = СНСООН—
акриловая
кнмота ^О, н@:
ВтСН2СН2СООН
0-б ₽ ОНПрои ио н ова я
кислота
СН,—СНаСООН
1
он
Эти реакции присоединения весьма сходны с присоединением гало-
генов и. галогеноводородных кислот к бутадиену (разд. 9-6,Г и
10-3). На первой стадии протон присоединяется к кислороду кар-
бонильной группы; образующаяся сопряженная кислота может рас-
сматриваться как резонансный гибрид структур ХШа—XIII г>
Ф
уоН /Он-
сн2=сн-с ** сн,=сн-с **
v
ОН ОН
ф
ХШа ХШ6
ф/он
сн2=сн-с
\)Н
ф /он
** сн2—сн=с
он
ХШв ХЩг
или
CH/-CH-G
чон
XIII
На второй стадии нуклеофил (например, В г© или молекула воды)
атакует электронодефицитный углерод. Атака на углеродный атом
карбоксила может осуществляться, но не приводит к устойчивому
продукту. В то же время атака по ^-углероду приводит к енольной
форме Р-замещенной кислоты, которая затем быстро таутомеризует-
ся в обычную форму.
он 3
BtCH2“CH=C быстро ВгСНг-СН.-С7
он хон
р- бромпропиоиовая кислота
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
589
Б. Образование лактонов
Если двойная связь в ненасыщенной кислоте расположена в
углеродной цепи дальше, чем между а- и' 0-положениями, то
сопряженное присоединение оказывается невозможным, Тем не
менее двойная связь и карбоксильная группа в присутствии кислых
катализаторов зачастую вступают во взаимодействие, так как кар-
бониевый ион, возникающий в результате присоединения протона
по двойной связи, содержит в этой же молекуле нуклеофил (кар-
• боксильиую группу), который может атаковать катионный центр,
;образуя циклический сложный эфир (лактон). Получение лактона
-легко происходит по этой схеме только в тех случаях, когда может
образоваться пяти- или шестичленный цикл.
' н® © -н®
СНп -СНСНаСН2С —> СН3СНСНКСН2С —►
хон Чэн
аллилуксусная кислота
Т-валеролактон
Пяти- и шестичленные лактоны образуются также путем внут-
римолекулярной этерификации при нагревании соответственно у-и
б-оксикислот. В этих условиях 0-оксикнслоты дегидратируются
до а, 0-ненасыщенных кислот, тогда как <х-окси кислоты дают в ре-
зультате бимолекулярной этерификации соединения с шестиаден-
ным дилактонпым циклом, которые называются лактидами.
нагреваянс
носласн2снгсо2н-------------*-
Т^оксимасляная
кислота
V-бутиролактон
нагревание
СНэСНСНгСОаН---------->- СН3СН = СНСХЭаН-фНаО
Ан
^окенмасдяная
кйслота
2СН,СНСОгН
I
ОН
а-оксппрС|Пнд-
. новая кислота
нагребание
СН;?О О
¥нУ
лактнД
590
ГЛАВА 16
Упражнение 16-33. Можно ли ожидать, что винил уксусная кислота даст лактон
при нагревании с каталитическим количеством серной кислоты?
В, Присоединение нуклеофильных агентов
к сопряженным системам, конденсация Михаэля
Во всех рассмотренных выше примерах присоединения по двой-
ным связям ненасыщенных кислот и.мела место активация при дей-
ствии электрофильных агентов, подобных Н®. Сопряженное при-
соединение * может происходить также при взаимодействии произ-
водных кислот с нуклеофильными агентами; наиболее важными из
этих реакций являются катализируемое основанием присоедине-
ние по Михаэлю и 1,4-присоединение металлоорганических соедине-
ний (разд. 12-4,Г). Во всех таких реакциях нуклеофильный агент,
обычно карбанион, атакует двойную связь производного «,р-не-
насыщенной кислоты или, в более общем случае, «^-ненасыщен-
ного карбонильного соединения, а также любого ненасыщенного сое-
динения, в котором двойная связь сопряжена с Сильной электроотри-
цательной ненасыщенной группой (например, —CN, — NO, и т. д.)
и активирована ею. В конденсации Михаэля роль карбаниона обыч-
но выполняет соль енола.
Суммарная реакция'иллюстрируется ниже на примере присоеди-
нения диэтилмалоната к Этилциннамату (этиловый эфир коричной
кислоты)
С6Н5СН = СНСО2С2Н5 -рСН,(СО2С,Нь)2
ЭТИЛОВЫЙ
эфир
коричной
кислоты
—-----ь СеН6СНСН2СО2С2НЕ (16-24)
<Ь(СОаС2НЕ)2
Механизм такого рода превращения, в котором присоединяющим-
ся агентом является диэтилмалонат, приводится в уравнениях
(16-25) и (16-26). Роль основного катализатора (который здесь обо-
значен :В), необходимого при конденсации Михаэля, заключает-
ся в активировании присоединяющегося агента путем превращения
его в соответствующий анион.
е ©
:СН(СО,С2НЬ)2 + В:Н (16-25)
CHgfCOsCjHj^-pB: ч
ч й©I I «9 9 г
\c=C-C=O+;CH(COaCjHe)s—-
CH(CO2C2H5)2_j СН(СО2С2Н6)3
(16-26)
* Здесь и в ряде других случаев авторы используют термин «сопряженное
присоединение» вместо более строгого «присоединение по сопряженным связям».—
Прим. ред.
КАРВОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
591
Помимо аниона малонового эфира, можно использовать широ-
кий круг нуклеофильных агентов. Примерами таких веществ могут
служить малонитрил, ацетоуксусный и циануксусный эфиры; все
они образуют относительно устойчивые карбанионы и легко вступа-
ют в реакции конденсации по Михаэлю. Однако если карбанион
слишком стабилен, то тенденция его к атаке двойной связи произ-
водного а,(3-ненредельной кислоты будет слишком мала или может
вовсе отсутствовать. Во всех случаях атака направляется на конец
сопряженной системы, что приводит к енолят-аниону [^)С—С—~О]®,
который в конечном счете присоединяет протон к углеродно-
му атому, образуя продукт конденсации. Некоторые примеры, ил-
люстрирующие использование присоединения по Михаэлю в орга-
нических синтезах, приведены в упражнении (16-37).
Енамины (разд. 15-3) энергично присоединяются к двойной свя-
зи во многих реакциях типа конденсации Михаэля. Характерным
примером может служить присоединение N-(циклогексен-1-ил)-
пирролидина к метилметакрилату
нсотцся3)г
киг|ячсрие с обратном
молоди 1тьцМ ком
- сн3
О | 3
CMj-CH-COjCHj
н
80%
(16-27)
Упражнение 16-34. Вычислите ЛН (газ) для присоединения диэтилэдалоната к
этилциннамату. исходя из энергий связей и учитывая все факторы, которые могут
сделать полученное значение менее надежным, чем обычно в такого рода расчетах.
Упражнение 16-35. Объясните, почему трудно ожидать, что присоединение по
Михаэлю диэтилмалоната к коричной кислоте окажется успешным.
Упражнение 16-36, Продукт присоединения по Михаэлю, образующийся из
этилциннамата и диэтилмалоната (уравнение (16-24)!, !может в принципе быть
получен также при катализируемом этилатом натрия присоединении этилацетата к
этил-(2-карбэгокси)-Э-фенилпропенату. Рассмотрите протекание этой реакции
[обратитесь к уравнениям (16-25) и (16-26)] и объясните, почему вероятность того,
что она будет происходить с успехом, меньше, чем в случае присоединения дн-
этилмалоната к этилциннамату-Следует сравнить различные катализируемые кис-
лотой равновесия, осуществление которых возможно при Двух различных путях,
ведущих к одному и тому же продукту конденсации по Михаэлю.
592
ГЛАВА 1.6
Упражнение 16-37. Покажите, каким образом приведенные ниже соединения
могут-быть получены с помощью присоединения по Михаэлю. В некоторых слу-
чаях могут понадобиться дополнительные превращения.
а) 3-фенилпентандиовая кислота из этилциннзмата
б) 4^бензоил-3-феннлбутиронитрил из бе из аль ацетофено на (1-бензоил-2-фе-
иилэтилева)
в) 3,3-(дикарбэтокси)гептанодинитрил из акрилонитрила (пропенонитрила)
из
и мег и «ви ни л кетона
Упражнение 16-38. Объясните, каким образом, учитывая пространственные
препятствия, можно прийти к выводу, что продукт переноса протона при присое-
динении Ы^циклогексОе.-ЬилЩирролидина к метилметакрилату должен иметь
структуру, приведенную в уравнении (16-27), а не изображенную ниже.
СН3
CHz-CH-CO2CH;
ДИКАРБОНОВЫЕ КИСЛОТЫ
Кислоты, в которых две карбоксильные группы разделены
цепью из шести или более углеродных атомов («->-5), в большинстве
случаев не обладают какими-либо специфическими свойствами — в
этих случаях свойства карбоксильных групп долее или менее неза-
висимы друг от друга
СО2Н
\о2н
Если.же карбоксильные группы расположены ближе одна к дру-
гой, то возможности их взаимодействия увеличиваются. Нас бу-
дут интересовать-здесь прежде всего кислоты Такого типа. Ряд важ-
ных дикарбоновых кислот перечислен в табл. 16;8, где приведена
также краткая сводка их физических свойств, методов получения и
практического применения.
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
595
16-11. Кислотные свойства дикарбоновых
кислот
Можно ожидать, что индуктивный эффект одной карбоксильной
группы приведет к увеличению кислотных свойств другой, и в со-
ответствии с ожидаемым из данных табл. 16-8 очевидно, что сила
дикарбоновых кислот (на основании первой константы диссоциа-
ции Кд выше, чем сила уксусной кислоты (7(л = 1,5-10_ь), и умень-
- шается при увеличении расстояния между двумя карбоксильными
• группами. Вторая константа диссоциации (К2) меньше, чем К а
. уксусной кислоты (за исключением случая щавелевой кислоты),
по той причине, что отрыв протона оказывается более трудным из-за
электростатического притяжения к расположенному поблизости
' -карбоксилат-апиону (+/-эффект).
, 16-1'2. Поведение дикарбоновых кислот
при нагревании
Характер превращений, происходящих при нагревании дикис-
лот, решающим образом зависит от длины цепи, разделяющей кар-
> боксильные группы. Циклизации обычно способствует возможность
образования пяти- или шестичленных циклов. Так, адипиновая и
пимелиновая кислоты декарбоксилируются и циклизуются в цик-
лопентанон и циклогексанон соответственно
СООН
(бн2)4
\оон
адипипо*
кислота
сн2
зоо сс <hZ \
-----с f С = 0+СОа4-НаО
HSC /
\н2
цнклопеитанон
СООН СНа-СНа
/ зоя =с / \
(СЫ2)з------> Н2С С = О4-СОа-|-Н2О
СООН ^СНз-бНа
пимелнно-
ЬаЯ
кислота
циклогексанон
Янтарная и глутаровая кислоты реагируют иначе. Вместо того,
чтобы образовать напряженные циклические кетоны и циклопропа-
нон (неизвестен) и циклобутанон,— обе кислоты образуют цикличе-
ские ангидриды (янтарный и глутаровый), содержащие соответствен-
но пяти- и шестичленные циклы. Фталевая и малеиновая кислоты
ведут себя сходным образом, образуя пятичленные циклические
59S
ГЛАВА 1G
ангидриды
СО2Н
(бнй)2
^ССШ
янтарная
кислота
300 °C
янтарный
ангидрид
/Ч/С02Н /WCCK
III SHI >°
^NsOjjH Ч'^Ч'Со/
фталевая фталевый
кислота ангидрид
СО2Н
(ЙН?)з
СО2Н
глутаро-
вая
кислота
300 'С
Н8С О
малеиновый
ангидрид
глутаровый
ангидрид
О
Малоновая и щавелевая кислоты реагируют своеобразно — при
нагревании происходит декарбоксилирование (разд. 16-5).
СО8н
/ ! 40—160 °C
СН2------------> СН3СОаН4-СО3
?ЬоаН
•малоно-
ъая
кислота
СООН юо—180 °с
[ -----—». СО2 + HCOGH
СООН
щаве-
левая
кислота
Упражнение 16-39. Фумаровая и малеиновая кислоты дают при нагревании
один и тот же ангидрид, но при этом фумаровая кислота должна быть нагрета до
более высокой температуры, чем малеиновая кислота. Объясните. Напишите
возможные механизмы обеих реакций.
16-13. Производные дикарбоновых кислот
А. Циклические имиды
Циклический ангидрид янтарной кислоты взаимодействует с
аммиаком как типичный ангидрид, однако при сильном нагрева-
нии образуется циклический имид (сукцинимид). Фталевый ангид-
карбоновые кислоты и их произ водные
597
рид реагирует аналогично, образуя фталимид.
.фталевый ангидрид
фталимид
.Имиды в отличие от амидов не обладают основными свойствами
в водном растворе; электронная пара азота отчасти делокализована
по' карбонильным группам, как это показано с помощью структур
XlVa—XIVb, и достигаемая таким образом стабилизация утрачи-
вается, если протон присоединяется к азоту, образуя сопряженную
кислоту XVa. Возможно, что присоединение протона к одному из
кислородных атомов имида XV6 окажется более выгодным, однако
не настолько, цтобы имиды в водном растворе обнаруживали основ*
ные свойства.
.. Q
Ю:
/
СНг /
i
26©
XIV:
XlVa.
X1V6
О
XlVa '
и / или,
он
/
СнГЯ®
& г
XVa XV6
598
ГЛАВА 16
Сукцинимид и фталимид обладают четко выраженными кислыми
свойствами и легко растворяются в водных растворах щелочей, об-
разуя соли щелочных металлов: Кислотность имидов, так же как
карбоновых кислот и 1,3-дикарбонильных соединений, обязана
своим происхождением тому, что анион стабилизирован сильнее,
чем кислота. Это можно видеть из сравнения резонансных структур,
которые могут быть написаны для имида XIV, со структурами для
аниона XVI. Разделение положительного и отрицательного зарядов,
показанное 'в структурах XIV6 и XIVb, приводит к увеличению
энергии этих структур, вследствие чего их вклад в гибрид XIV не
может иметь существенного значения. В анионе разделения зарядов
нет, и все структуры XVIa — XVIb вносят значительный вклад в
гибрид XVI.
, он6^
сн7С\..0
СНг Л1
^-с
снЛ
СН^
-с
XIV
XVIa xvi£
XV/в
XVI
Соли сукцинимида и фталимида имеют важное значение для син-
теза аминов по методу Габриэля, который во многом сходен с ал-
килированием анионов малонового и ацетоуксусного эфиров. Сущ-
ность этого метода состоит в реакции 5ы2-замещення между анио-
ном имида и первичным или вторичным алкилгадогенидом; как
правило, эта реакция приводит не к О-, а к N-алкилированию. Гид-
ролиз или гидразинолиз продукта дает амин. Гидразинолиз имеет
то преимущество, что он проводится в более мягких условиях, чем
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
599
щелочной гидролиз.
^N®K®+RBr
Х^Х^/
X)
фталимид калия
фталгидраэнд
/X С009
II LcooS+rnh’
X/
Б. Конденсация Дикмана
(Эфиры многих дикарбоновых кислот (за исключением малоно-
вого эфира) вступают в конденсацию Кляйзена в основном таким же
образом, как эфиры манокарбоновых кислот (разд. 16-8.Б). Однако
может происходить внутримолекулярная конденсация, носящая
название конденсации Дикмана; она приводит к получению цикли-
ческого р-кетоэфира, если при реакции может образоваться нена-
пряженный пяти- или шестичленный цикл. Реакция ограничена,
таким образам, дикарбоновыми кислотами с шестью или семью уг-
леродными атомами в цепи и тем не менее имеет существенное зна-
чение для синтеза циклических соединен!
^,.сн2со2сги;
*рНл NaOC,H,
снг
'''СН2СО2С2Н,
диатиладнпннат
©
^CHCO2C2ri5
СН2 \
''СП.С
ос2н5
^СО2СгН,
^сн
?Нг $=о
С^~СН2
Ккароэтоксиниклопснтанон
COjC^
<\х°@
^GH?OC^
600
ГЛАВА 16
Дополнительные упражнения
16-4р. Напишите уравнения для препаративного получения в лабораторных
условиях- каждого из приведенных ниже соединении, использовав указанные
исходные вещества (возможно, в несколько стадий). Укажите реагенты и условия
реакций.
а) н-масляная кислота из «-пропилового спирта
б) три метил уксусная кислота из m/им-бутил хлорида
в) изомасляная кислота из изобутилена
г) а-бром-а-трет-бутилуксусная’кислота из mpe/н-бутил хлорид а
д)циклобутил к арб ино л-а-14С (СН2)3‘СН11СН;>ОН из пикдабутапкарбоновоЙ :
кислоты и Ва’^СОд
е) а-ал л ил ацетамид из аллилхлорида
ж) неопентилтриметил ацетат из /дре/п-б у талового спирта
16-41. Напишите возможный механизм для каждой из приведенных ниже реакций.
L NaOH, 106 СС
а) грш-СНзСН == СНСОгН------—-------шра«с-СН3СН = СНСО2Н
2. н®
СН2-СН2
НОВг / X
б) Сн3 = СНСН3СН2СО211---ВгСНа—СН С=О
I. Избыток NaOH
в) сн3сн—со,н-------------------* СН3СН—СО2Н
Г 2. Н® I
Вг ОН
(оптически активная) ' {оптически активная)
При ответе на пункт (в) следует принять во внимание следующее; во-первых,
в кислом растворе реакция не происходи?, во-вторых-, в разбавленном щелочном
растворе скорость реакции'имеет первый порядок по бромпроизводному и не за-
висит от концентрации едкого натра после того, как добавлен I моль NaOH на
I моль бромзамещенной кислоты. Образующаяся в этих условиях а-оке и кислота
имеет ту же стереохимическую конфигурацию, что и исходная бромзамещенная
кислота. В-третьих, в силыгощелочном растворе скорость реакции пропорцио-
нальна концентрации NaOH, и конфигурация образующейся 2-оке и кислоты про-
тивоположна конфигурации исходной бромкислоты. Можно ли ожидать, что за-
мещение брома на гидроксил в этил-а-бромпропионате будет происходить анало-
гичным образом (в предположении, что Сложноэфирная группа не гидролизуется-'
щелочью)?
0 ж °
II Н® .. II '
г) СН3СОСН34-СН3СНеСО2Н СН3СН2СОСН34- СН3СО2Н
Порядок реакционной способности для CH3CO2R следующий:
R = СН3 — > СН3СН3 - > (СНзЬСН -
16-42. Было найдено, что 4-брбмбицикло-[2,2,2]-октая-1-карбоиовая кислота
(А) значительно сильнее, чем 3-б ром пента новая кислота )Б). Объясните, (Советуем
КАРВОНОВЫЕ КИСЛОТЫ И. ,ИХ ПРОИЗВОДНЫЕ. 601
рассмотреть возможные способы передачи электронного влияния диполя С—-Вг.)
Вг—СН2—СН2—СН2—СН2-СО2Н
А Б
16-43. трет-Бу тилацетат превращается в метилацетат при- действии, мети Лата-
натрия в метаноле со скоростью, составляющей IV10 от скорости превращения
амилацетата вмети л ацетат втех же: условиях. Действие разбавленного раствора-
хлористого водорода в метаноле приводит к быстрому превращению трет-бутил-
ацетата в mpem-бутилметиловый эфир: и уксусную кислоту, тогда как этилацетат
в этих условиях более медленно переходит в-этанол и метилацетат.:
• а) Напишите наиболее вероятные механизмы для каждой реакций и пока-
жите, каким:;образом, данные по относительным скоростям согласуются- с этими;
механизмами.
б) Каким образом можно использовать 13О в качестве метки для того, чтобы
подтвердить предложенное вами описание механизма превращений.
16-44. Было показано, что сложные э^иры (RCO.,R') в воде-18О, содержащей
едкий натр, превращаются в R—конкурентно ео< щелочным- гидроли-
зом. -Скорости обеих реакций—обмена1 и гидролиза — пропорциональны кон-
центрации ОН®. Объясните,-что означают эти факты с точки зрения механизма
гидролиза сложных эфиров.
16-46. Напишите уравнения для препаративных лабораторных синтезов каждого
из приведенных ниже соединений, исходя из указанных веществ (возможно, в
несколько стадий). Укажите реагенты и условия.
а) ^-хлорэтилбромацетат нз этанола и (или) уксусной кислоты
б) а-мето кси изо б ути рам ид из изомасляпой кислоты
в) 3,'5,5-триметилгексаиол-З из 2,4,4-триметилпентена-1 (промышленный
способ)
Г) d-mpem-бутилацетадьдсгид из трет-бутилуксусной кислоты
д) 2,3,3-триметилбутанол-2 из тетраметилэтилепа-
/°^1
е) диэтнленкеталь цикло пентанона у из адипиновой кислоты
</V
16-46. Укажите для каждой из Приведенных ниже пар соединений химическую
пробу (желательно, пробирочную реакцию), которая нознолиг различить эти два
вещества.
а) HCO.FI п СН3СО2Н
б) СНзСО2СаНа и СН3ОСНаСОгН
в) СН2=СНСО2Н и СН3СН2СОЙН '
г) СНэСОВг и ВтСНХОаН
д) ВгСН3СН2СНгСОгСЙя и CHaCH^HBrGOjCHj.
Clb-CIL :
с) (С.НэСН„С.О)а0 и О.= (^ о
602
ГЛАВА IS
НО2СЧ ZCO2H но,с. ,н
ж) X—С< и /С^С<
Hz хн н< ХСО2Н
з) НС —ССО2СН3 и сн2=снсо2сн,
и) CHaCO2NH4 И CH3CONHS
к) СНа = СН—СН2СН,СО2Н и сн3сн2сн=снсо2н
л) (CH»COhO и СН-вСОгСН.СНэ
16-47. Объясните, каким образом вы можете различить приведенные в упражне-
нии 16-46 вещества, входящие в каждую пару, используя спектральные методы.
16-48. Пусть вы имеете четыре сосуда, в каждом из которых содержится один из
изомеров (а, Р, у или б) оксипентановой кислоты. Подробно расскажите о том,
каким образом с помощью химических реакций можно установить, какой из
изомеров содержится в каждом из сосудов.
16-49. Соединение A (C^HgOg) оптически активно, хорошо растворимо в воде
(дает раствор, имеющий кислую реакцию по лакмусу) и при сильном нагревании
переходит в соединение Б (С4ЙйОг), которое не обладает оптической активностью,
умеренно растворимо в воде (дает кислую реакцию на лакмус) и намного энергич-
нее реагирует с 1\МпО4, чем соединение А. При окислении А разбавленным раство-
ром хромовой кислоты оно превращается в летучую жидко сть*В (С3Н3О), которая
не взаимодействует с КМпО4 и при действии 12 в растворе едкого натра дает жел-
тый осадок.
Напишите наиболее вероятные структуры соединений, обозначенных буквами,
и приведите уравнения для всех упомянутых реакций. Достаточно ли однозначно
определяется структура соединения А приведенным выше описанием? Объясните.
16-50. Назовите каждое из приведенных ниже соединений по принятой системе.
СН3-СНаСО2СНэ
а) Н.</
'сн.— СН?СО,СН3
б) СН3СОСН[СН(СН3)2|СО2С8Не
в) CHsCHsCOC(CHs)sCON(CHa)s
г) НОСН = СНСО2СгНе
д) С2НйОСОСОСНгСО.С,Н4
е) С2Н5О2ССН2СН(СО2С2Нв)СОСОаСгНв
сн.
ж)
I С=О
Н2С /
х^со.сн3
<tbJ3
сна=сн—сна
з) VhcOjH
сн2=сн—сн2
и) СН3СН.СОСН(СН3)СН.СН3СН(СН3)а
к) СНаСНаСНаСН(СНаСН=СН2)СОаН
л) СНдСОСН(СО2С2Нь)2
16-51. Напишите уравнения реакций получения каждого из приведенных выше
соединений из веществ с меныпИм Числом углеродных атомов. Используйте кон-
денсации Кляйзена и синтезы с малоновым и ацетоуксусным эфирами.
ГЛАВА
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Стереоизомерия в наиболее широком смысле представляет, собой
изомерию соединений, имеющих одинаковые структурные формулы,
но различное расположение групп в пространстве. Существует два
основных типа стереоизомерии — геометрическая (цис-транс) и
оптическая. Различие между ними хорошо видно на примере оптиче-
ских изомеров втор-бутилбромида (разд. 11-10) и цис-транс-изоме-
ров бутена-2 (разд. 6-5), но менее четко проявляется для соединений
типа 1,2-бромхлорциклогексана, изомеры которых отличаются тем,
что группы, в них расположены в цис- или транс-положении и в то же
время каждый из этих изомеров не идентичен своему зеркальному изо-
бражению.
,В данной главе рассмотрена оптическая изомерия, которая может
быть определена как изомерия, связанная с различиями во вращении
плоскости поляризованного света. Важно, однако, уяснить, что оп-
тическая изомерия совершенно не зависит от явления оптического
вращения: молекулы могут существовать в «.правой» или. «левой»
формах независимо от их способности вращать плоскость поляризо-
ванного света. Обычно для обнаружения оптической изомерии изме-
ряют оптическое вращение, но, как будет показано, для этой цели
могут служить и другие, более эффективные методы.
Предмет оптической изомерии представляет особую важность
для биохимии. Некоторые из причин этого обсуждаются в настоя-
щей главе, а также в гл. 20.
В своей простейшей форме оптическая изомерия проявляется в
тех случаях, когда соединение может существовать в двух стерео-
изомерных модификациях, строение молекул которых таково, что
604
ГЛАВА 17
их зеркальные изображения не могут быть совмещены одно с дру4
гим. Помимо различия, в структуре молекул (которое относится к
тому же типу, что и различие между левой и правой перчатками)^
все обычные* физические свойства таких изомеров идентичны*;
исключением является До, что они вращают плоскость плоскополя-!
ризованного света на одинаковую1 величину, но в противоположных
направлениях. Смысл этого утверждения может стать более понят-
ным в результате приведенного ниже краткого рассмотрения при-
роды плоскополяризованного света (см. также разд. 11-10). С
17-1. П лоскополяризованный свет и причины
оптического вращения * р
Электромагнитное излучение — это распространение электро-
магнитных волн. В каждой точке света присутствуют компоненты
и электрического и магнитного полей; обе они колеблются во всех
направлениях перпендикулярно друг другу и направлению pacnpO-j
странения луча. В плоскополяризовапном свете компонента элект-
рического поля колеблется так же, как в обычном свете, но направо
ление колебаний лежит в одной определенной плоскости. Аналогич-
ным образом составляющая магнитного поля колеблется в плоско-
сти; эта и упомянутая выше плоскость взаимно перпендикулярны)
На рис. 17-1 приведено схематическое изображение электрической
составляющей плоскополяризованного света и ее взаимодействия
с оптическим изомером. Луч поляризованного света XY имеет со-
ставляющую электрического поля, которая колеблется в плоскости
ABD. В точке О колебание направлено по линии ОЕ. Если в точке О
луч проходит через прозрачное вещество, которое способно вызвать
поворот направления колебаний электрического поля на угол а й
Рис. 17-1. Схематическое изображение электрической компоненты плоскополя-
ризованного света и оптического вращения.
Предполагается, что луч распространяется в направлении от X к. Y. °
* Строго говоря, это справедливо лишь в отсутствие других оптически ак-
тивных соединений.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ : 605
придать колебаниям новое направление ОЕ' в плоскости CBD, то о
таком веществе говорят, что оно обладает оптической активностью.
При повороте по часовой стрелке (если наблюдатель смотрит
навстречу лучу) вещество называют правовращающим (т. е. повора-
чивающим плоскость вправо) и углу <х придается положительное
значение (+). Если поворот происходит против часовой стрелки, то
вещество считают левовращающим (вызывающим поворот влево)
и угол: а будет отрицательным (—).
Естественно, возникает вопрос, почему некоторые вещества
*' взаимодействуют с поляризованным светом подобным образом,тогда
"как другие вещества таким свойством не обладают? Мы приведем
здесь крайне упрощенное объяснение этого явления, так как более
строгое рассмотрение требует применения довольно сложного мате-
матического аппарата. Тем не менее нетрудно понять, что электри-
ческие силы светового луча, падающего на молекулу, вступают в не-
которое взаимодействие с электронами, содержащимися в молекуле.
Хотя поглощение энергии излучения молекулой, сопровождающееся
переходом в энергетически более высокое электронное состояние,
может фактически не происходить (см. гл. 2), возможно возмущение
электронной конфигурации молекулы. Этот процесс можно нагляд-
но представить себе как поляризацию электронов, происходящую
под Действием колеблющегося электрического поля, связанного с
Излучением (разд. 6-7). Это взаимодействие имеет важное значение в
связи с рассматриваемым вопросом, так как оно заставляет элект-
рическое поле излучения изменить направление колебаний. Влия-
ние, оказываемое одной молекулой, чрезвычайно мало, но при дей-
ствии большого числа молекул суммарный эффект может быть из-
мерен как результирующее вращение плоскости поляризации
поляризованного света. Молекулы, которые подобно метану, эти-
лену и ацетону достаточно симметричны для того, чтобы каждая
‘ из них была идентична своему зеркальному изображению, не вызы-
вают вращения плоскости поляризации. Причина отсутствия у них
оптической активности заключается в таком характере симметрии
каждого из этих веществ, что поворот плоскости колебаний В одном
направлении уравновешивается равным по величине Поворотом
в противоположном направлении. Однако, если атомы, в молекуле
расположены таким образом, что симметрия недостаточна для сов-
мещения молекулы с ее зеркальным изображением, молекула ока-
жет влияние на .поляризованный свет —результирующая электро-
магнитных взаимодействий в этом случае не будет равна нулю.
Такие вещества называются оптически активными.
Для объяснения оптического вращения полезна модель, в которой луч плоско-
поляризованного света рассматривается как результирующий вектор двух; вра-
щающихся.в противоположных направлениях лучей циркулярного) ляризованного
(поляризованного ио кругу) света. Это должно стать более понятным, если учесть,
что поляризованный по .кругу свет имеет компоненту электрического поля, изме-
няющуюся по направлению (но-не по величине) таким образом, что поле при
60S
ГЛАВА 17
Рис. 17-2. Циркулярнополяризованный свет.
Спираль представляет собой путь, который проходит компонента электрического поля све-
тового луча XY; спираль может быть направлена как по часовой стрелке (о), так и против
нее (б).
поступательном движении описывает спираль, отвечающую движению либо по
часовой стрелке, либо против ное, как это показано на рис. П-2.
Результирующая двух вращающихся в противоположных направлениях элек-
трических векторов лежит в плоскости, и ее величина изменяется, как в синусои-
дальной волне, что показано на рис. 17-3. Это соответствует плоскополяризоваа-
вому свету.
Рис. 17-3. Плоскополяризованный свет как векторная сумма двух вращающихся
в противоположных направлениях лучей циркулярнополяриэоваяного света.
Два вектора электрического поля к их результирующая показаны отдельно для точек А, В,
С, В в Е для того, чтобы сделать более ясным тот факт, что результирующий вектор колеб-
лется ь форме синусоидальной волны.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
607
При прохождении циркулярнополяризованного света через скопление асим-
метрических молекул одного типа показатель преломления для одного направле-
ния круговой поляризации отличен от соответствующего показателя для другого
направления поляризации. Это легко понять, так как независимо от ориентации
асимметричной молекулы ее присутствие по-разному сказывается на циркуляр-
но поляризованном свете с различным направлением вращения. Разным показа-
телям преломления соответствует различная скорость света; следовательно, если
результирующая электрических векторов двух поляризованных по кругу лучей
первоначально лежит в плоскости и лучи встречают на пути среду, в которой их
скорости различны, то один луч будет все время опережать другой. Это приведет
к повороту плоскости, в которой расположена их результирующая, и такое вра-
щение будет происходить вплоть до того момента, когда лучи достигнут среды, в
которой их скорости равны (и равны также показатели преломления).
17-2. Удельное вращение
Угол вращения плоскости поляризованного света а зависит от
числа и типа молекул, которые встречает свет на своем пути. Най-
дено, что величина а зависит от концентрации раствора (или плот-
ности чистой жидкости) и расстояния, которое проходит свет в дан-
ной среде. Третьей важной переменной является длина волны падаю-
щего света, которая всегда должна быть оговорена, даже в том слу-
чае, когда, как это обычно бывает, используется D-линия натрия
(5893 А). В меньшей степени величина а зависит от температуры и
природы растворителя (если он используется); последние также
должны быть указаны. Таким образом, удельное вращение [а]
вещества обычнр выражают следующими формулами:
Для растворов:
г -i/o 100а
м.=—
Для чистых жидкостей:
Их - ,
где а— наблюдаемая величина вращения в градусах; 1°— темпера-
тура; X — длина волны света; I ~~ длина пути, проходимого светом
через раствор; с— концентрация образца в граммах на 100 мл раст-
вора; d — плотность жидкости в граммах на 1 мл.
Например, если для соединения указывается [а]р°с——100
(с— 2,5, хлороформ), то это означает, что удельное вращение вещест-
ва направлено влево и составляет 100° при концентрации 2,5 г на
100 мл раствора в хлороформе при 25СС; раствор помещается в труб-
ку длиной 1 дм, вращение измеряется для линии D натрия с длиной
волны 5893 А.
Часто вместо удельного вращения используют молекулярное
вращение [М], связанное с удельным вращением следующим урав-
нением.'
И=тг'
608.
ГЛАВА 17
где М— .молекулярная масса оптически активного соединения. Ис-
пользование такого’ выражения дает возможность непосредственно
сравнить оптическое вращение’ различных соединений, поскольку
при этом учитываются различия в величине вращения, обусловлен-
ные разными молекулярными массами.
17-3. Оптически активные соединения
с асимметрическими углеродными
атомами ' - -
А. Соединения с одним асимметрическим
атомом углерода
Рассмотрим теперь условия, необходимые для возникновения
асимметрии, вызывающей оптическую активность соединения.
Непременное условие оптической активности состоит в следующем:
геометрия молекулы должна быть такой, чтобы молекула не могла
быть совмещена со своим зеркальным изображением. Если это усло-
вие не выдерживается, то молекула не может существовать в опти-
чески активных формах.
Упражнение 17-}. Многие хорошо известные предметы, например перчатки,
ботинки и винты, не идентичны своим зеркальным, изображениям. Можно ли
ожидать, что эти предметы будут обладать оптической активностью (если предпо-
ложить, что бии- проницаемы для света) или для этогсг необходимы некоторые
дополнительные условия?
Существует ряд элементов структуры, которые могут сделать
молекулу асимметричной и неидентичной со своим зеркальным
изображением. Наиболее часто встречающимся и наиболее важным
из них является асимметрично: замещенный атом углерода, т. е.
атом углерода, связанный с четырьмя различными атомами или
группами. Если в молекуле присутствует такой асимметрично
замещенный, атом, ^то она будет нейдентична своему зеркальному
изображению и будет проявлять оптическую активность. Простым
примером может служить, щжр-бутиловый спирт (I), В котором,
карбинольный углеродный атом является асимметрическим, по-
скольку он связан с четырьмя различными: группами: водородом,
гидроксилом, метилом- и этилом..
сн3< ,н
CHSCH/ ОН
t.
Однако smop-бутиловый спирт в том виде, как он получается,
из оптически неактивных соединений (например, при восстанов-
лении метйлэтилкетоиа Мтийалюминийгидридом), не обладает
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
60S
оптической активностью.
ЫЛН14
СН3СОСН2СН8-------------------* СН3СН(ОН)СНаСНз
Он представляет собой смесь двух изомерных форм II и HI, кото-
рые относятся друг к другу, как предмет к своему зеркальному
изображению.
Химические и физические свойства этих двух форм одинаковы
во веем, за исключением того, что эти формы вращают плоскость
поляризации плоскополяризованцого света в равной степени,
но в противоположных направлениях. Две формы одного соеди-
нения, являющиеся, подобно II и III, зеркальными .изображениями
одна другой, называют энантиомерами. в/пор-Бу.тиливый спирт,
образующийся при восстановлении неактивного метилэтилкетона,
не обладает оптической активностью по той причине, что он пред-
ставляет собой смесь: равного числа молекул одного и другого
энантиомеров. Суммарное оптическое вращение равно вследствие
этого нулю. Такую смесь называют рацемической.
Отделение одного из энантиомеров, входящих в состав рацеми-
ческой смеси, называют разделением (расщеплением), а превраще-
ние молекул одного энантиомера в рацемическую смесь обеих форм
называют рацемизацией.
Несмотря на то что обычные физические свойства чистых энан-
тиомеров (помимо их оптических свойств) идентичны, они часто
отличаются от физических свойств рацемической смеси. Это ука-
зывает на образование рацемического соединения, или рацемата,
имеющего иную кристаллическую структуру, чём чистые энантио-
меры, и этим обусловлено различие температур плавления, раст-
воримостей и плотностей. Одним из таких примеров может служить
ДО М 1040
610
ГЛЛВА 17
Таблица 17'1
Физические свойства винных кислот
Винная кислота Удельное вра- щение в Н3О, град T. пл., °О Удельный вес Растворимость в Н2О при 25 °C, г/100 г
Мезо а 140 1,666 120 (15 °C)
(“) —11,98 170 1,760 147
(+) 4-11,98 170 1,760 147
(±) 1 205 1,687 25
Мезоввнная кислота рассмотрена ниже».
винная кислота; физические свойства различных ее форм приведены
в табл. 17-1. Рацемическая винная кислота имеет значительно
более высокую температуру плавления и меньшую растворимость,
чем входящие и ее состав энантиомеры, откуда следует, что кри-
сталлическая структура рацемической кислоты обладает большей
стабильностью. Другими словами, упаковка кристаллов смеси
энантиомеров состава Г: 1 плотнее, чем упаковка каждого из
Стереоизомеров, отдельно взятых. Положение при этом аналогично
тому, которое наблюдается при упаковке в коробке «правых» и
«левых» предметов — смесь таких предметов упаковывается более
компактно, чем одни только «правые» или «левые» предметы.
Б. Проекционные формулы
Выше два энантиомера втор-бутилового спирта (II и III) изо-
бражали с помощью пространственных моделей, стремясь при
этом показать тетраэдрическое расположение групп при асиммет-
рическом углеродном атоме. Очевидно, что это неудобно, особенно
для более сложных примеров. Необходимо поэтому располагать
простым способом изображения, отражающим различие между
оптическими изомерами. Для этой цели широко используются так
называемые проекционные формулы Фишера; с их помощью энан-
тиомеры вшор-бутилового спирта изображаются так, как это пред-
ставлено формулами IV и V.
сн3 сн,
-1 I
Н—С—ОН НО—С—н |
СНгСНд <^НгСНй СеВер
IV V
Система построения фишеровских проекций такова, Что «за-
падные» и «восточные» связи, образуемые асимметрическим атомом
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
611
углерода, считаются направленными вперед от плоскости бумаги,
а «северные» п «южные» связи — за плоскость бумаги.
На структурах VI и VII, а также VIII и IX это демонстрируется
более наглядно. Структуры-ll, IV, VI и VIII соответствуют одному
энантиомеру, тогда как III, V, VII и IX — другому.
снЛ <?нз
н-с-он но-с-н
СНгСН3 сн2сн3
VI VII
СН2СЯ3
VIII IX
. Конфигурация, отражаемая проекционной формулой, обра-
щается (т. е. один энантиомер переходит в другой) каждый раз,
когда два атома или две группы, связанные с асимметрическим
атомом (или асимметрическим центром, как его часто называют),
меняются местами. Легко видеть, что, поменяв местами водород
и гидроксил в формуле IV, получим энантиомер V. Менее оче-
видно, что обмен местами метила и водорода в IV даст X, который,
согласно приведенной схеме, эквивалентен V. (Если результаты
этих операций не вполне ясны, то может оказаться полезным рас-
смотрение моделей.) '
Н
сн3—с—ОН
CH3CH<j
X
Следует заметить, что X, строго говоря, не является . фише-
ровской проекционной формулой, поскольку, согласно системе
Фишера, цепь углеродных атомов всегда располагается по верти-
кали. Заметим также, что поворот фишеровской проекционной
формулы на 180° в плоскости бумаги оставляет конфигурацию
неизмененной.
СН3 СН3СН3
н—i—он — но—с—н
I I
снвснв сн3
20*
,3|2 *“т : ГЛАВА 17
В. Соединенияс двумя асимметрическими «
атомами углерода
Выше было рассмотрено, каким образом соединение; содержа-
щее один асимметрический' атом углерода, может существовать i
в двух оптически активных формах. Однако было бы неправильным 1
сделать на этом основании заключение, что для проявления опти-
чёской активности необходим асимметрический углеродный атом,
так как существует большое число соединений,; не содержащих
асимметрических атомов, но обнаруживающих тем не менее явление
оптической изомерии (см. разд. 17-4, А—В). Было'бы ошибкой
также утверждать, что если в молекуле имеется два или большее
число асимметрических атомов, то оно обязательно должно быть
Оптически активным.
Рассмотрим, например, молекулу с двумя асимметрическими
атомами 1 и 2, структура и конформация которой приведены на
схеме XI. Группы, связанные с атомами 1 и 2, одинаковы, и струк-
тура ориентирована таким образом, что атом 2 находится позади
атома 1... Можно видеть, что :Х1 идентична своему зеркальному;
изображению XII, для этого надо просто повернуть XI так,/чтобы
атомы 1 и 2 поменялись местами; таким образом получим XIII,
которая после поворота на 180° в направлении, указанном стрелкой,
совпадет с XII."Молекула, имеющая такую структуру, будег оп-
тически неактивной, несмотря на присутствие двух асимметриче-
ских углеродных атомов, Вследствие того что она совместима со
своим зеркальным изображением; ?
Можно было бы возразить, однако, что это условие выполняется
не для всех конформаций соединения XI. Действительно, конфор-
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
613
мация XIV несовместима со своим зеркальным изображением XV.
Тем не менее молекула, описываемая схемой XIV, не будет опти-
чески активной, так как асимметрическая конформация XIV бы-
стро переходит в свой энантиомер XV при вращении, вокруг связи,
’соединяющей два асимметрических центра. Оптическая активность
была бы возможна только в том случае, если бы удалось «заморо-
зить» молекулу в одной из асимметрических конформаций (разд.
17-4,Г).
Можно видеть, что в заслоненной конформации XVI этой же
системы имеется плоскость симметрии, делящая молекулу на две
половины, каждая из которых представляет зеркальное изобра-
жение другой. Молекулы, для которых характерна такого рода
асимметрия, часто называют внутренне компенсированными, по-
скольку вклады, вносимые в оптическое вращение каждой из асим-
метрическйх половин, равны по величине, но противоположны по
"знаку и суммарное вращение равно, таким образом, нулю.
616
ГЛАВА 17
В общем случае соединение, содержащее п асимметрических угле-
родных атомов, будет иметь 2й возможных оптических изомеров
(в предположении, что отсутствуют изомеры с плоскостью сим-
метрии, обусловленной одинаковыми заместителями при асиммет-
рических углеродных атомах, подобно тому как в мезо-формах).
Структуры, приписанные эритрозе и треозе, были установлены с
несомненностью на основании того факта, что (—)-эритроза (встре-
чающийся в природе сахар) при окислении азотной кислотой дает
мезовинную кислоту, тогда как (+)-треоза, которая в природе не
встречается, дает (+)-винную кислоту.
сн СО2Н СНО СО2Н
н—G—ОН HNO, И С —ОН 1 н-с-он HNOo и—с—он 1
HO—С—н но-G—Н н—с—он н—с—он
СН,ОН со2н СН2ОН С02Н
(+)-треоза (+)-винвгая кислота (-)-зритроза мезонинная кислота
Упражнение 17-4. Напишите проекционные формулы (-р)-эритрозы и (—)-
треозы. Какие винные кислоты дадут они при окислении?
Упражнение 17-5. Напишите' проекционные формулы всех возможных опти-
ческих изомеров 2,3,4-триоксипептановой кислоты.
УпраЖненпе 17-6. В камфоре содержатся два асимметрических углеродных
атома, ко известны только два ее оптических изомера. Объясните этот факт (по-
лезно использовать модели).
камфора
Диастереомеры соединений, в которых содержатся два связан-
ных между собой неодинаковых асимметрических углеродных
атома, часто различают, придавая им приставки трео- и нршпро-
(по аналогии с треозой и эритрозой). Так, 2-бром-З-фенилбутан
имеет две диастереомерные конфигурации XXIV и XXV. Струк-
тура X-XIV соответствует зритро-2-бром-З-фенилбутану, поскольку,
аналогично тому как эритроза превращается в мезовйнную ки-
слоту, замена брома на фенил или фенила на бром должна при-
вести к мезо-продукту. Аналогичным образом структура XXV
соответствует mpaj-2-бром-З-фенилбутану. Таким образом эршпро-
ОПТИЧЕСКАЯ,изомерия 617
диастереомер — это такой диастереомер, в котором по крайней
э'ршпро
XXIV
" трео
t. XXV
мере две пары одинаковых (или сходных) заместителей при соседних
атомах углерода расположены так, что в одной из трех возможных
заслоненных конформаций одинаковые (или сходные) заместители
находятся один над другим.
Упражнение 17-7. Нарисуйте проекционные формулы и структуры типа
«кбзел», аналогичные XXIV и XXV; с помощью этих изображений должны быть
показаны конфигурации трео- и э/штдо-форм приведенных ниже соединений
(можно ограничиться одним энантиомером для каждого диастереомера).
а) 1,2-днфснилпропаиол-1
б) 8-фен ил пентанол-2
в) 2,3-дибром масляная кислота
17-4. Оптически активные соединения,
не содержащие асимметрических
атомов углерода
А, Аллены и спираны
Многие соединения не содержат асимметрических атомов уг-
лерода, но обнаруживают тем не менее явление оптической изо-
мерий. Услов’ия для изомерии такого типа возникают в случае
затрудненного вращения. Например, в молекуле аллена (XXVI)
две плоскости, в которых лежат концевые метиленовые группы
СНа, занимают взаимно перпендикулярные положения, что обус-
ловлено жесткостью и фиксированным положением в пространстве
618
ГЛАВА 17
системы кумулированных двойных связей.
XXVI
Вследствие этого аллены типа XYC=C=CXY, где X и Y раз-
личны, асимметричны и могут существовать в двух несовместимых
оптически активных формах (XXVIIa и XXVII6).
плоскость зеркала
г
I
XXVIIa
XXVII6
Упражнение 17-8. Могут ли структуры СНа=С=СВга и ВгНС=С=С=СНВг
обладать оптической активностью?
Оптическая изомерия алленов была предсказана Вант-Гоффом,
но лишь спустя 60 лет его предположение нашло эксперименталь-
ное подтверждение. Причиной такого отставания эксперимента
от теории явились практические трудности расщепления асим-
метрических алленов. Первыми алленами, разделенными на оп-
тические изомеры, были соединения XXVIIJ и XXIX.
XXVIII
XXIX
Изомерия такого же типа возможна в спиранах — бицикличе-
ских соединениях, в которых один (и только один) атом является
общим для обоих циклов. Простейшим примером может служить
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
619
спиро-[2,2Ьпентан (XXX).
ххх
В любом спиране, так же как в соединении XXX, два кольца
не могут лежать в одной плоскости. Вследствие этого если каждый
дикл замещен таким образом, что плоскость асимметрии в нем
отсутствует, то соединение может существовать в виде пары опти-
чески активных энантиомеров. Соединения XXXI и XXXII пред-
ставляют собой примеры спиранов, которые были разделены на
оптические изомеры.
XXXI
XXXII
Упражнение 17-9, Можно ли разделить приведенные ниже соединения на
оптически активные изомеры? Приведите структуры возможных изомеров.
CPU ZCHS-CH2 >Н
а) >С< >С = С<
Hz ХСН2-СН/ XOjH
СНЗХ ,СН2—СНг. ,СН2-СН2. .CHj
б) X у=с=с/ ХС<
н/ ХСН2—Сн/ М2На—СН/ ХН
Б. Оптически активные бифенилы
В противоположность случаю асимметрических алленов опти-
ческая активность в ряду бифенила была открыта до того, как она
смогла получить правильное объяснение. К тому времени, когда
были разделены первые производные бифенила (1922 г.), сущест-
660
ГЛАВА 17
вовала значительная неясность в отношений строения бифенильных
производных и причины асимметрии казались'непонятными. Лишь
позднее было установлено (с помощью измерения дипольных мо-
ментов и методом рентгеноструктурного анализа), что бензольные
кольца в бифенилах коаксиальны.
- общая ось
С учетом этих данных существование устойчивых оптических
изомеров ощ'-динитродифеновой кислоты (ХХХШ) могло быть
объяснено только при допущении того, что вращение вокруг цент-
ральной связи не происходит и, кроме того, оба кольца лежат в
различных плоскостях. В молекулах вещества ХХХШ эти тре-
бования выполняются; они несовместимы со своими зеркальными
изображениями и проявляют поэтому оптическую активность.
Отсутствие вращения вокруг «осевой» связи обусловлено про-
странственными препятствиями, возникающими между объеми-
стыми opmo-заместителями. Об этом свидетельствует невозмож-
ность разделения бифенильных производных, не содержащих за-
местителей в орто-положениях; разделение же орто-замещенных
производных может быть достигнуто только в том случае, если
размер заместителей достаточно велик. Так, р,о'-дифтордифеновая
кислота (XXXIV), подобно соответствующему динитрбпроизвод-
ному (ХХХШ), может быть разделена, но рацемизуется легче,
чем ХХХШ. Это связано с меньшим размером атомов фтора по
сравнению с нитрогруппой, и, поскольку перекрывание между
opmo-заместителями меньше, бензольные кольца могут с большей
легкостью проворачиваться вокруг центральной связи; так как
при этом они проходят через плоскую конформацию, асимметрия
утрачивается и происходит рацемизация.
XXXIV
плоская
ОПТИЧЕСКАЯ: ИЗОМЕРИЯ
621
Все четыре орто-положения не обязательно должны быть за-
мещены. Необходимое условие появления оптической активности
включается только в том, чтобы, во-первых, заместитель (или
шместители) был достаточно велик для того, чтобы свободное
вращение оказалось невозможным, и, во-вторых, каждый цикл
был замещен асимметрично. Так, были разделены соединения XXXV,
XXXVI и XXXVII, Однако соединение XXXVIII разделить не
удается. Причина этого состоит не только в том, что орто-заме-
стители слишком малы по величине, но также в том, что одно из
колец, замещено симметрично; вследствие этого при взаимно нер-
'непдикулярном положении циклов молекула имеет плоскость
симметрии.
хххуш
Легкость рацемизации оптически активных бифенилов определяется це только
пространствен ныли требованиями заместителей в орто-положениях, о чем свиде-
тельствует влияние па/лт-заместктелей. Заместители в «ара-положениях отстоят от
центральной свяам слишком далеко, чтобы принимать непосредственное участие
в каких-либо пространственных взаимодействиях. Тем не менее относительные
скорости рацемизации соединений XXXIX, XL и XLI составляют приблизи-
тельно 190 : 9:1. Вопрос о том, почему нитрогруппа в пара-положении (как в
соединении XL) вызывает увеличение оптической стабильности по сравнению с
XXXIX, до настоящего времени не ясен. Увеличение оптической активности
соединения XL1 более понятно, поскольку можно ожидать, что мета-нитрогруппа
будет оказывать «поддерживающее» влияние на орто-заместитель. Под этим име-
ется в виду то обстоятельство, что заместителю будет труднее «отогнуться» при
повороте вокруг центральной связи.
мп гюи
СОаН
XXXIX
XL,
XLI
622
ГЛАВА Г7
Упражнение 17-10. Какое из приведенных ниже бифенильных производных
должно, по вашему мнению, дать наиболее устойчивые энантиомеры? Приведите
ваши соображения.
В. Оптически активные циклоалкены
Одним из наиболее интересных результатов, достигнутых в
стереохимии органических соединений в последние годы, явилось
открытие того, что транс-<мо не ч«с)-циклооктен может быть раз-
делен на устойчивые оптически активные формы. Вообще говоря,
a priori нельзя было бы ожидать, что трцнс-циклоалкен удастся
разделить, поскольку в нем возможно существование плоскости
симметрии, проходящей через двойную связь и другие углеродные
атомы цикла (рис. 17-4, а). Однако в том случае, когда цепь, сое-
диняющая концы двойной связи, сравнительно-невелика, как в
циклооктене, пространственные препятствия делают невозможным
Рис. 17-4. Схематическое изображение плоской (а) и неплоских (б и в) конформа-
ций траис-циклоалкеиов на примере циклооктена.
В случае циклооктена плоская форма является очень сильно напряженной.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
623
образование незатрудненной плоской конформации и две формы,
представляющие собой зеркальные изображения (рис. 17-4, б и в),
существуют в индивидуальном состоянии.
Упражнение 17-11, Модели Стюарта (разд. 1-5) показывают, что трпнс-цик-
лопентадецен не должен обладать оптической стабильностью. Как и где должен
быть замещен траме-цикл о пентаде цен для того, чтобы дать устойчивые зеркально
изомерные формы, не содержащие асимметрично замещенных атомов углерода?
Г. Затрудненное вращение и молекулярная
асимметрия в замещенных этанах
Выше в этой главе было показано, что оптическую активность в соединениях
типа мезовииной кислоты (XVII) невозможно наблюдать вследствие быстрого
.вращения вокруг связи, соединяющей два асимметрических центра, которое де-
лает энантиомерные конфигурации настолько легко взаимопревращающимися,что
разделение оказывается невозможным. Однако было отмечено, что если вращение
будет заторможено до такой степени, что молекулы окажутся «замороженными»
(фиксированными) в асимметрической конформации, то разделение станет возмож-
' иым, подобно тому как это имеет место в о,о'-дизамещенных бифонилах и транс.
циклоалкенах. До настоящего времени это не удалось осуществить ни в одном
Случае для молекул типа замещенного этапа, но существует серьезное основание
полагать, исходя из данных ЯМР, что в ряде случаев разделение может оказаться
“возможным. Рассмотрим в качестве одного из примеров три заторможенные
j
'XLIla ХШб XLIIb ’
F Вг
конформации — XLIla, XLII6 и XLIIb— соединения F—С—Вг.
Вг С6Н6
Несмотря на то что в этом соединении отсутствует асимметрический углеродный
атом, конформеры XLIla и XLII6 являются зеркальными изомерами.
Это означает, что окружение одного нз’атомов фтора в XLIla или XLII6 от-
лично от окружения другого атома фтора. В результате эти атомы фтора будут
неэквивалентны в отношении не только стереохимических, но и магнитных свойств.
В противоположность этому в конформере XLIIb имеется плоскость симметрии,
что делает оба атома фтора эквивалентными в отношении магнитных я стереохи-
мических характеристик. Эквивалентность или неэквивалентность атомов фтора
может быть установлена с помощью ЯМР-спектра фтора в этом соединении. При
комнатной температуре скорость вращения вокруг С—С-связи настолько велика,
что наблюдается только один усредненный резонансный сигнал фтора. Однако при
температуре —84°C спектр (рис. 17-5) может быть безошибочно интерпретирован
как соответствующий смеси всех трех конформаций (главным образом в смеси
содержится энантиомерная пара XLIla и XLII6). Это означает, что при темпера-
Рис. 17-5. ЯМР-спектр 1,1-дифтор-1,2,2-трибром-2-фенилэтаиа при 56,4 МГц и
—84’С. i
Квартет пиков; обозначенные 1,3,3 и 4, обусловлен резонансным поглощением двух неэк-
вивалентных атомов фтора (^’.-конформаций (XLHa и XL! 16) с / = 153 Гц: пик 5 соответст-
вует эквивалентным атомам фтора относительно невыгодной конформации XLIIb. Тонкая
структура, обнаруживаемая никами 3 и 4,- связана с дальним взаимодействием одного на
атомов фтора е водородными атомами фенильной группы.
туре —84 °C скорость вращения вокруг углерод-углеродной связи относительно
невелика и конформации XLMa и XLII6 устойчивее., чем XLIIb, возможно, вслед-
ствие меньшего пространственного взаимодействия между атомами брома при
соседних углеродных атомах.
. Упражнение 17-12, Спектр атомов фтора в 1,1-Дифтор-1,2-дибром-2-фенилпро-
пане при комнатной температуре содержит квартет резонансных линий, соответ-
ствующий пикам 1, 2, 3 и 4 на рис, 17-5. Г[ик, аналогичный пику 5 (рис. 17-5),
не наблюдается. Нарисуйте структуры конформеров этого соединения и объясннте,
почему атомы фтора магнитно неэквивалентны при комнатной температуре. Как,
по вашему мнению, должен выглядеть спектр при—84 °C?
17-5. Абсолютные и относительные
конфигурации
Знак вращения плосконоляризованного света энантиомером не
находится в простой связи ни с абсолютной, ни с относительной
конфигурациями. Это верно даже для соединений, имеющих очень
сходные структуры. Так, оптически активные производные кислот,
знак вращения которых Одинаков со знаком йращёппя исходных
кислот, не во всех случаях имеют ту же конфигурацию. Зная, что
удельное вращение молочной кислоты СНаСНОНСОаН и метиллак-
тата СН3СНОНСО2СН3 равно +3,82 и —8,25° соответственно,
нельзя сказать, основываясь только на характере вращения, оди-
наково или различно расположение групп при асимметрическом
центре в кислоте и сложном эфире. Относительные конфигурации
приходится устанавливать другими методами.
При превращении (+)-молочной кислоты в ее метиловый эфир
можно с достаточным основанием полагать, что конфигурация
эфира будет той же, что у кислоты, поскольку этерификация не
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
625
затрагивает конфигурации при асимметрическом углеродном атоме.
Полученный таким образом метиловый эфир оказывается левовра-
щающим; отсюда следует, что относительная конфигурация (+)-
молочной кислоты и (—)-метил лактата при асимметрическом угле-
родном атоме одинакова, хотя знак оптического вращения этих
веществ различен. Однако ещё не известна их абсолютная конфи-
гурация; иначе говоря, нельзя сказать, какая из двух возможных
конфигураций молочной кислоты — XLilia или ХЫПб — соот-
ветствует правовращающей (+)-кислоте и какая — левовращаю-
щей (—J-кислоте.
XLIIla
XLHI6
До недавнего времени с достоверностью не была известна аб-
солютная конфигурация ни одного оптически активного соедине-
ния. Вместо этого проводилось отнесение конфигураций к стан-
дартному веществу — глицериновому альдегиду, который был пер-
воначально выбран в качестве, основы для отнесения конфигураций
углеводов, но был связан также со многими другими: классами
соединений, включая а-аминокислоты, терпены и стероиды, а также
ряд других важных в биохимическом отношении веществ. Право-
вращающему глицериновому альдегиду была произвольно придана
конфигурация X L1V, и он обозначается как г>-(4-)-глицериновый
альдегид. Левовращающий энантиомер XLV называют t-(—)-
глицериновым: альдегидом. В этих наименованиях знак, заключен-
ный в скобки, относится только к направлению вращения, тогда
как буква d или ь указывает на абсолютную конфигурацию. Для
указания знака вращения вместо (+) иногда применяют букву d,
626
ГЛАВА 17
вместо (—) — I, а вместо (±) — dl.
D -(Т)-гл и пера.чь дегид
оно
Н^—С—-ОН
СН2ОН
(
СН2ОН
XLV
L -(-(-глицеральдегид
Упражнение 17-/3. Определите, какая (или какие) из приведенных ниже кон-
фигураций глицеринового альдегида d и какие и
Абсолютная конфигурация заместителя при асимметрическом
центре указывается путем написания проекционной формулы, при-
чем углеродная цепь располагается вертикально и углеродный
атом, имеющий наименьший номер, располагается вверху. Тогда
о-конфигурация будет такой, в которой связь с некоторым заме-
стителем располагается справа от асимметрического атома угле-
рода, тогда как в ь-конфигурации эта связь располагается слева,
Ri Ri
R2-C-X X—C~Ra
I 1
Rs R3
D-конфигурация L-конфигурация
Соединения, конфигурация которых соотнесена с о-(Ц-)-глице-
риновым альдегидом, рассматриваются как принадлежащие к d-
ряду, а связанные с ь-(—).глицериновым альдегидом — как при-
надлежащие к г-ряду. Один из методов отнесения конфигураций
иллюстрируется схемой, изображенной на рис. 17-6, где показано,
каким образом конфигурация (—)-молочной кислоты может быть
связана с конфигурацией d-(+)-глицеринового альдегида. Оче-
видно, что (—(-молочная кислота принадлежит к D-ряду и имеет
конфигурацию, приведенную на схеме XLIIIa, Второй энантио-
мер— ь-(+(-молочная кислота — описывается структурой XLIIIв.
Конфигурации многих природных «-аминокислот были связаны
с глицериновым альдегидом путем серий превращений, подобных
приведенной на рис, 17-7, где показано установление связи природ-
ного аланина с ь-(+)-молочной кислотой и, таким образом, с ь-
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
627
СНО СО2Н
Н-С—ОН —Н—(i-OH
I I
СН2ОН СН-.ОН
С-( + )-глииери- (-(-глицерино-
новый альдегид идя кислота
СО2Н СО2Н
I Na-Нг i
н—с—он X—: н—с—он
СН3 СН2Вг
(-)-молочная
кислота
HNOS
соан
I
н—с — он
CHaNHa
(+(-изосерин
NOBr
Рис. 17-6. Схема химических превращений, показывающая, каким образом кон-
'фигурация (—)-молоЧ1[0Й кислоты была связана с о-(+)-глицериновым альдеги-
дом. Ни одно из этих превращений не приводит к каким-либо изменениям конфи-
гурации при асимметрическом атоме углерода.
-(—)-глицериновым альдегидом. Аланин, следовательно, принад-
, лежит к ь.ряду; с помощью такого отнесения конфигураций было
‘показано, что все «-аминокислоты, входящие, подобно аланину, в
состав белков, относятся к ь-ряду. В состав других важных в
биологическом отношении веществ входят многие D-аминокислоты,
Если в молекуле присутствует несколько асимметрических угле-
родных атомов, то конфигурация при одном из центров связывает-
ся — прямо или косвенно — с глицериновым альдегидом, а кон-
фигурации при других центрах определяются относительно первого
центра. Так, в альдегидной форме важного сахара (+)-глюкозы
имеется четыре асимметрических центра и возможно существо-
вание 16 стереоизомеров (24=16). Проекционная формула изомера,
соответствующего природной глюкозе, изображается формулой
XLVI. Согласно системе, принятой для сахаров, к глицериновому
альдегиду относят конфигурацию асимметрического углеродного
СО2н СО.,н
I он9 I
НО—С—н+—— Н—С—Вг
I N L
сн3 сн.
К9
V
Ь-(+)-молочная
кислота
(+ )-сС“бромцропяо<
новая кислота
соан СО2Н
I Pt, Hi I
Nj—С— H-------->-H2N-с-Н
CHs £lls
(+}-аланин
Рис. 17-7. Схема превращений, показывающая, каким образом конфигурация
природного (+)-адацина была связана с !.-(+)-молочной кислотой и, следова-
тельно, с ь-(—)-глице.рйновым альдегидом (см. рис. 17-6).
Превращения включают две 5^2-рсакции, являющиеся стереоспецифическими и приводящие
к обращению конфигурации (гл, И), Восстаповлевие азидогруппы не изменяет конфигура-
ции.
628
ГЛАВА 17
атома, имеющего наибольший номер, и это определяет отнесение
конфигурации молекулы в целом к о- или L-ряду. Для глюкозы
таким атомом является С-5, следующий за группой СН2ОН; гид-
роксил при этом : атоме направлен вправо. Распространенная в
природе глюкоза принадлежит, таким образом, к о-ряду, и ее
следует называть в-глюкозой.
’СНО
L
н—7с— он
но—’с*—н
н—4С*—ОН
; н—Jc*— он в >
6снгон
Ш
С другой стороны, -конфигурации а-аминокислот, содержащих
два и большее число асимметрических центров, определяются по
асимметрическому углеродному атому, имеющему наименьший
помер; им является атом, находящийся в «-положении по отно-
шению к карбоксилу. Следовательно, несмотря; на то что природная
а-аминокислота — треонин— имеет точно такое же расположение
заместителей, как природный сахар трёоза, он (треонин), согласно
системе, принятой для аминокислот, оказывается принадлежащим
к г-ряду, тогда как треоза по системе, принятой для сахаров,
относится к о-ряду.
н—-с—он
СНз
L -треонин
СНО
I
но—с—н
; н—с—он о
сн2он
-(-)-треоза
Серьезные затруднения возникают в случае соединений, подоб-
ных оптически активным винным кислотам. Если пользуются
аминокислотной системой классификации, то (+)-винная кислота
(XXа) попадает в P-ряд. В то же время по системе, принятой для
сахаров, она должна описываться как имеющая ь-конфигурацию.
Один из выходов из такого положения состоит во введении индексов
s и g для указания на использование соответственно либо амино-
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
629
кислотной, либо углеводной системы классификации. Тогда аб-
солютная конфигурация (+)-винной кислоты может быть передана
либо обозначением ся-(+)-вйнная кислота, либо ь^-(-}-)-винная
кислота.
5 то время, когда принималась абсолютная конфигурация гли-
церинового альдегида, не существовало возможности выяснить,
какой в действительности является конфигурация (+)-глицерино-
вого альдегида — XLIV или XLV. Однако любой из двух вариантов
имел 50% вероятности оказаться правильным; в настоящее время
известно, .что конфигурация XLIV, т. е. d-конфигурация, дей-
ствительно представляет собой истинную конфигурацию (-^-гли-
церинового альдегида. Это было определено с помощью особого
способа кристаллографического исследования методом рентгено-
структурного анализа, позволившего установить абсолютное рас-
положение в пространстве атомов (-Ь)-тартрата натрия и рубидия.
Ранее химическими методами было показано, что конфигурация
(+)-вннной кислоты (ХХа) сходна с конфигурацией (Ч-)-глицери-
нбвого альдегида. Таким образом, в настоящее время может быть
найдена абсолютная конфигурация любого вещества, если только
она связана, прямо или косвенно, с глицериновым альдегидом.
Упражнение 17-14. Нарисуйте проекционные формулы Фишера для каждого
из приведенных ниже соединении, имея в виду (в тех случаях, когда это необходи-
мо), что d- и L-изомеры с двумя иди большим числом асимметрических углерод-
ных атомов всегда представляют собой нс диастереомеры, а энантиомеры.
Используется система глицеринового альдегида во всех случаях, за исключением
специально оговоренного.
а) ь-аланин
б) D-бу тан диол-2,3’
в) D-треонин
г) ь-глюкоз а
д) о^-лч(сео-2,3-дирксимасляная кислота
е) монометиловый эфир ь-эрцшро-бутандис>ла-2,3
ощ-Сйстема. Использующая проекционный формулы Фишера для указа-
ния конфигураций при асимметрическом центре, имеет определенные недостатки;
выше было показано (стр. 628), как возникает неоднозначность в случае винных ки-
слот. Более систематический способ обозйачения конфигураций (известный как
система Кава—> Ингольда—Прелога), который может со временем заменить
ц,Ь-систему, основан на ряде правил, устанавливающих последовательность
старшинства заместителей при асимметрическом центре. Пусть углеродный атом
связан с четырьмя различными заместителями А, В, С и D, которым мы при-
дадим следующий порядок старшинства: А старше В, В старше С, С старше D.
Конфигурация будет определяться тем, как располагаются эти группы при взгля-
де на тетраэдр, образованный заместителями, со стороны, наиболее удаленной от
младшего заместителя (П),.так, как это показанона рис, 17-8; если последователь-
630
ГЛАВА 17
R.-конфигурация
Рис. 17-8. Описание конфигурации при асимметрическом центре в соответствии
- с R,S-системоЙ.
Старшинство заместителей понижается в ряду А, В, Си D.
госледоьательиость, соответствующая
движению против часовой стрелки
S-конфигурация
йость A-^-B->C-s-D следует движению по часовой стрелке, та конфигурацию обоз-
начают буквой R, а если против часовой стрелки — буквой S. Символы R и S
соответствуют латинским словам rectus и sinister, что означает соответственно
«правый» й «левый».
Опишем теперь порядок старшинства, в котором располагаются заместители.
Старшинство отдается атомам, имеющим наибольший атомный номер; так, гало-
гены располагаются в следующий ряд (по убыванию); 1, Вг, Cl, F. То же правило
применяется н в случаях, когда заместителями являются группы атомов, например
СН3, NH2, ОН, SO3H; старшинство отдается группам, в которых первый атом
имеет наибольший атомный номер. Общая последовательность упомянутых здесь
заместителей будет, следовательно, такой; I, Вг, Cl, SOaH, F, ОН, NH2, СНЯ.
В тех случаях, когда в двух или большем числе заместителей первые атомы оди-
наковы, преимущество отдается тем заместителям, в которых второй атом имеет
больший атомный номер. Кроме того, карбоксильная группа СО2Н имеет преиму-
щество перед альдегидной группой СНО, поскольку сумма атомных номеров вто-
рых атомов в СО2Н больше (три связи с кислородом=48), чем в СНО (две связи с
кислородом и одна с водородом=33). В том случае, когда первые и вторые атомы
для двух или большего числа заместителей одинаковы, необходимо сравнить
атомные номера третьих атомов цепи и т. д.
Упражнение 17-15. Расположите приведенные ниже группы в порядке умень-
шения старшинства в соответствии с описанными выше прав илами!"ОСНЯ, МНСН3,
CCi3, CONHa, СНаОН, СНаОСНа, SCHs, SCH2CHs, NO3, NHOH, OOCHS, Вг,
ZCH
H, SO3H, ООаН, СвЫ& (рассматривая его как — С/-С ) и СНЙ
ХСН
Применяя эти правила к некоторым хопоШо известным оптически активным
соединениям, получим, что ртлицериновыи альдегид может быть назван R-гли-
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
631
церииовым альдегидом и
СНО
I
.С<-Н
НО^ ^СНаОН
ь-алании—S-алацином.
С ЦО
Н—С---ОН
СН2ОН
В -глицеральдегид
или
Р -глицеральдегид
СО2Н
СО2Н
I
h2n—-с—н
снэ
8 -аланин или г падании
, Если присутствует два или большее число асимметрических центров, то
конфигурация каждого из них указывается символом R или S вместе с номером
^симметрического атома. Так, конфигурация (Ч-)-внивдй кислоты описывается
следующим названием: 2((?),3(1?)-(4-)“Винпая кислота,
н СОгН СО2Н
I s f 5 н-<~—он -
hojC^^oh но^^н но—9—н
* СО2Н со2н
2(К),3(й)-(+)-винная кислота 1,Е*(4-)-винная кислота
£ ИЛИ
й5-(+)-винная кислота
- Упражнение 17-16. Опишите конфигурацию каждого асимметрического угле-
родного атома в приведенных ниже соединениях как по d,l-, так и по
Ц,8-системам.
н 1 СНО
а) СН3—С—СцНв 1 г) НО—С-Н J
^г н—с—он
СНгОН । 1 н—с-он
б) HSN—C-COJ4 £н2он
Н
в) н—С—ОН
Н— (1 —Вг
' ' (*:hsch5
С1
632
ГЛАВА 17
Упражнение 17-17. Нарисуйте изображения типа «кбзел» и проекционные фор-
мулы для приведенных ниже соединений и укажите, дем является каждый из
энантиомеров — apumpo, mpeo, ццс или транс.
а) 3(8)-бром-2(8)-бутанол ,
б) 2(Е)-амнно-3(8)-оксибутан ,j
в) щиклогёксан-1(5),3(8)-диол (
г) [2-(R)-метил-1 (8)-цикЛопропил]-(8)-метилкарбипиламин J
tr
17-6. Дисперсия оптического вращения
Оптическое вращение обычно измеряется только при одной длине волны
(5893 А) по той простой причине, что лампы с парйми натрия служат наиболее
удобным источником монохроматического света. Измерения при других длинах с'
волн без специальных приборов произвести значительно труднее. В настоящее я
время такими приборами оборудовано сравнительно небольшое число лаборато-
р и й, о д н ако есть все о снов а I г и я по л аг ать, что тако е по ложен не измен ится, посколь-
ку измерения оптического вращения как функции длины волны (т. е. дисперсии
оптического вращения) уже дали к настоящему времени и обещают дать в будущем
много информации относительно структуры, конформаций и конфигураций орга-:
нических соединений.
Подобно другим явлениям, включающим взаимодействие электромагнитного
излучения и органических молекул, например, при инфракрасной, ультрафиоле- i
тогой и ЯМР-спектроскопии, кривые дисперсии оптического вращения часто
оказываются чрезвычайно чувствительными к небольшим изменениям структуры. \
Примером могут служить кривые дисперсии вращения цис- и трапе-10-метилде- .л
Рис, 17-9, Кривые дисперсии опти-
ческого вращения цис- н транс-10-
метнлдекалонов-2 (XLVit й
XLVJII). (Из книги; Джерасси К.,
Дисперсия оптического вращения,
ИЛ, М., 1962.)
оптическая’ изомерия
633
калонов-2 (XLVH и XLVIII), приведенные на рис. 17-9.
XLVII XLVIII
Для обоих соединений наблюдается лишь очень небольшая величина враще-
ния при длине волны линии натрия 5893 А. по сравнению с величиной вращения в
диапазоне 2700—4000 А. Если вращение в этой области при движении в сторону
меньших длин волн проходит через максимум и далее меняет знак, как в случае
транс-изомера, то говорят, что соединение проявляет положительный эффект,
Коттона; противоположное направление измерений, как в случае ^да-изомера,
называют отрицательным эффектом Коттона,
> Центр области очень быстрого изменения вращения вещества XLVIII лежит
при 3000 А, что соответствует максиму му по г лощен и я карбонильной группы в
УФ-спектре поглощения этого же соединения. Таким образом, возбуждение карбо-
нильной группы вследствие поглощения УФ-излучен и я и сильно выраженная
дисперсия вращения поляризованного света взаимосвязаны. Действительно, если
вещество обнаруживает эффект Коттона, то свет, циркулярно поляризованный в
направлении часовой стрелки и против часовой, стрелки, не только проходит
через вещество с различными скоростями (разд. 17-1), но последнее и поглощает
эти две формы света в неодинаковой степени.
' В большинстве выполненных к настоящему времени рабст в области диспер-
сии оптического вращения исследовались оптически активные кетоны, поскольку
(голоса поглощения карбонильного хромофора при 3000 А имеет малую интенсив-
ность. Соединения, хромофоры которых сильно поглощают свет в ультрафиолето-
вой области, обычно оказываются неудачными объектами для измерения дисперсии
оптического вращения, поскольку степень пропускания света через вещество
оказывается недостаточной для измерения оптического вращения. Слабые полосы
аис- соединение
колец
XLIX
траяс-соединение
колец
L
поглощения в области ниже 2100 А не используются ввиду экспериментальных
трудностей, связанных с выполнением необходимых измерений.
Кривые дисперсии оптического вращения были получёны для оптически актив-
ных кетонов — производных стероидов и трйтерпенов, моно- и бициклических сое-
динений и соединений ерткрытой целью. Накопленные данные позволяют сделать
вывод, что форма и интенсивность кривых характеристичны для определенных
фрагментов структуры. Хорошей иллюстрацией этого могут служить кривые дис-
персии оптического вращения цис- и траио-8-метилгидринданонов-5 (XL1X и L),
приведенные на рис. 17-10. Значительное различие этих кривых обусловлено изме-
нением в окружении карбонильных групп, что в свою очередь связано с различ-
ными конфигурациями атомов Водорода в месте соединения циклов. Поскольку
кривая дисперсии оптического вращения очень близкого по структуре соединения
634
ГЛАВА- 17
Рис. 17-10. Кривые дисперсии i
оптического вращения цис- и
транс-8 - метилгидринданонов -5 i
(XLIX и L) и В-нор копр оста но- :
иа-3 (LI) (Из книги: Джерасси
К., Дисперсия оптического вра-
щения, ИЛ, 14. । 1962.)
LI чрезвычайно сходна с кривой дисперсии чис-гидринданона (XLIX), циклы,
помеченные буквами А и В, также должны быть ннс-ориснтироваппыми (см.
рис. 17-10).
LI
Кривые дисперсии оптического вращения часто оказываются полезными при
установлении конфигураций. Так, относительные конфигурации соединений
XLIX и LI должны быть одинаковыми, поскольку если бы они различались, то
ЬЛа
LII6
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
635
соответствующие кривые должны были бы напоминать зеркальные изображения
одна другой. Следонательно, если абсолютная конфигурация цшг-гидршгданона
соответствует XL1X, то соединение Ы должно иметь конфигурацию Lila, а не
LU6.
Интересно, что кривые дисперсии оптического вращения транс-гидр и нда нон а
(Ь)*и транс-дека лона (XLVIII) чрезвычайно сходны, так же как и кривые для
соответствующих Ц ис-со един ей и й, откуда следует, что изменение величины цикла,
не содержащего карбонильной группы, от шести- до пятичленного практически не
оказывает влияния на дисперсию оптического вращения.
17-7. Разделение энантиомеров
; Физические свойства энантиомеров тождественны, поэтому они
не могут быть разделены физическими методами, например фрак-
ционной кристаллизацией или перегонкой. Энантиомеры ведут
себя различным образом только в присутствии другого оптически
активного вещества. Почти все методы разделения * (и асимметри-
ческого синтеза) основаны на этом факте.
•- Наиболее общим методом разделения является, по-видимому,
приучение неидентичных производных энантиомеров путем пре-
вращения нх в диастереомеры. Например, если рацемическая или
d,l-смесь кислоты превращается в соль при действии оптически
активного основания, имеющего о-конфигурацию, то соль пред-
ставляет собой смесь двух диастереомеров (о-кислота+ D-основа-
ние и ь-кислота+п-основание). Эти диастереомерные соли не-
идентичны и не являются зеркальными изображениями друг друга;
их физические свойства вследствие этого различны, и в принципе
оказывается возможным разделение с помощью физических ме-
тодов, например кристаллизации. Кислоты, регенерируемые из
солей после их разделения, представляют собой чистые d- и l-
знантиомеры.
D, L-кислота I—► (D-кислота 4-D-основание) —>• D-кислота
D-осгюваицс ।—> ( L-кислота + D-осцование) —> ь-кислбта
Разделение оптически активных кислот, основанное на полу-
чении диастереомерных солей, с необходимостью требует наличия
подходящих для этой цели оптически активных оснований. Чаще
всего используются бруцин (Lilia), стрихнин (LIII6). и хинин
(LIV), так как эти соединения являются легкодоступными встре-
* Часто разделение рацемата или рацемической смеси на энантиомеры на-
^ываютрасщеплением.— Прим.ра),
636
ГЛАВА 17
чающимися в природе оптически активными основаниями.
бруцин, R=OCH, (LH[a)
стрихнин, R=H (UII6)
Для разделения рацемических оснований применяются оптиче-
ски активные кислоты, например (+)-винная, (—)-яблочная, (—)-
миндальная и (Ч-)-камфор-Ю-сульфоновая.
снгсогн
снон
согн
яблочная кислота
с«н»
снон
I
СО2Н -
Миндальная кислота
камфор-10-сульфоновая
кислота
При разделении спиртов оптически активные кислоты могут
быть использованы для превращения спирта в смесь диастереомер-
ных сложных эфиров. Предпочтительно использование кислот
высокой молекулярной массы (—'400), поскольку в этом случае
наиболее вероятно образование кристаллических эфиров, которые ;
обычно удается разделить без особого труда посредством фрак-
ционной кристаллизации.
С другой стороны, спирт может быть превращен в полуэфир
дикарбоновойн кислоты по реакции с соответствующим ангидридом.
В образующемся полуэфирё присутствует свободная карбоксильная
функция, и он может поэтому быть разделен с помощью оптически
активного основания.
СН3
*снон
i ч
сна
СН з
T>,L -втер*
бутиловый
спирт
янтарный
ангидрид
сна о
1 11
: ’СНО-С-СН2
Ана СНаСОаН
I
сн3
ПОл у-эфир янтарной
кислоты
разделение при
помощи бруцина
гидролиз
оптически активные
спирты
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
637
Этот метод имеет довольно общее значение; он ограничен только
легкостью разделения: соответствующих диастереомеров и легко-
стью : регенерирования чистого энантиомера без сопутствующей
этому процессу рацемизации. Разделение с помощью физических
Методов„часто бывает трудоемким, и полное, разделение не во всех
случаях оказывается возможным для данной пары диастереомеров,
В подобных случаях может оказаться необходимым получение
диастереомеров других типов с помощью иных оптически активных
агентов, применяемых для разделения.
Возможно также применение более специальных методов раз-
деления. В одном из методов (который в тех случаях, когда он
применим,: дает отличные результаты) используется различие в
скоростях реакций энантиомеров с оптически активными соедине-
ниями. Один из энантиомеров может реагировать с большей ско-
ростью; при этом постепенно накапливается другой энантиомер.
Например, рацемическая винная кислота может быть разделена
спомощью определенных штаммов некоторых плесневых грибков,
Которые усваивают правовращающий энантиомер быстрее, чём
левовращающий. В результате из смеси может быть получена
почти чистая (—)-вйнная кислота.
( ± )-винвая кислота-р плесневый грибок —► ( —)-винная кислота 4-
\ -J-большее количество плесневого грибка
Аналогичным образом частичное разделение производного цик-
лобутена (LV) может быть достигнуто благодаря различию в ско-
ростях взаимодействия энантиомеров этого соединения с бруцином.
бруцин
(|моля)
{*)
LV
Недостаток этого метода разделения состоит в том, что более ре-
акционноспособный энантиомер обычно не удается, выделить , из
реакционной смеси.
Вариант метода кристаллизации, использованный Пастером в
его классической работе по разделению d, ь-винной кислоты, ог-
раничен очень небольшим числом случаев. Возможность его при-
менения связана с образованием индивидуальных' кристаллов каж-
дого энантиомера. Так, если кристаллизацию смешанной натрий-
аммониевой соли винной кислоты проводить ниже 27 сС, то вместо ;
обычной рацемической соли образуется смесь кристаллов р- и
ь-солей. Кристаллы двух различных типов, которые относятся
друг к другу как предмет к его зеркальному изображению, могут
638
ГЛАВА 17
быть разделены вручную с помощью микроскопа и затем переве-
дены в энантиомеры винной кислоты действием сильной кислоты.
Вариант этого метода разделения заключается во внесений кри-
сталлов чистого энантиомера в насыщенный раствор d, ь-смеси
в надежде вызвать немедленную кристаллизацию этого энантио-
мера, в то время как другой энантиомер должен остаться в раст-
воре. Этот метод позволил достигнуть практического разделения
лишь в очень небольшом числе случаев.
Ограниченное применение находят также хроматографические
методы. Обычный способ разделения состоит в пропускании раст-
вора рацемического соединения через оптически активный адсор-
бент, в результате чего один из энантиомеров может адсорбиро-
ваться более эффективно, чем другой. Если происходит избиратель-
ная адсорбция, то осторожное элюирование может привести к ча-
стичному или даже полному разделению.
17-8. Асимметрический синтез
и асимметрическая индукция
Если бы при синтезе а-оксипропионитрила из ацетальдегида
и цианистого водорода в отсутствие какого-либо оптически актив-
ного соединения удалось получить один из энантиомеров в пре-
обладающем количестве, то это означало бы осуществление абсо-
лютного асимметрического синтеза, т. е. создания оптически ак-
тивного соединения в симметричной среде из симметричных реа-
гентов.
CN
I
но-с-н
CHj
L - а -оксипропионитрил
Ф ।
Ц- Н-С-ОН
о -о:-ойеипропио нитрил
Очевидно, что в данном случае такого результата ожидать не
приходится, так как нет никаких причин, вследствие которых
атака цианид-ионом по одному из направлений сверху или
снизу от плоскости молекулы ацетальдегида — могла бы оказаться
предпочтительной; образуется, таким образом, равное число моле-
кул каждого из энантиомеров.
Однако в том случае, когда второй асимметрический центр
создается в молекуле, где уже присутствует асимметрический
центр, нельзя ожидать образования смеси двух возможных изо-
меров (которые теперь уже являются диастереомерами) точно в
отношении 1:1. Оптически активный альдегид LVI и метилмагнйй-
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
639
иодид могут дать два диастереомерных спирта LVIIa и LVII6.
Действительно, получаются оба спирта, но LVII6 преобладает
(отношение количеств образующихся спиртов составляет примерно
2:1).
Возможное объяснение стереохимического контроля (стереоспе-
цифичности) приведенной реакции заключается в следующем. По
пространственным соображениям наиболее выгодной конформацией
альдегида, которая и вступает в реакцию, является LVI, где кар-
бонильная группа экранирована двумя наименьшими по размеру
.заместителями (т. е. СН3 и И). При взаимодействии реактива Гринь-
яра с этой конформацией метильная группа магнийоргагшческого
'соединения будет испытывать меньшие пространственные затруд-
нения в том случае, если она будет приближаться к карбонильному
атому углерода со стороны, экранированной наименьшим по раз-
меру «-заместителем (т. е. Н). Это приводит к преобладанию спирта
LVII6 над LVIIa.
Образование неодинаковых количеств диастереомеров в тех
случаях, когда второй асимметрический центр создается при на-
. личии в молекуле асимметрического центра, носит название асим-
метрической индукции. Степень стереоспецифичности, обусловлен-
ной первым асимметрическим центром, обычно зависит от того,
насколько близко этот центр расположен к возникающему центру:
чем дальше они отстоят друг от друга, тем меньше проявляется
стереохимический контроль. Другим фактором является степень
асимметричности при первом асимметрическом центре. Ярко вы-
раженный стереохимический контроль маловероятен, если все
640
ГЛАВА 17
группы при этом центре в высокой степени сходны в электрон-
ном й пространственном отношениях, ч
Упражнение 17-18. Напишите структуры, показывающие, каких конфигураций
следует ожидать для каждого из возможных продуктов в приведенных ниже реак-
циях. Какой из диастереомеров преимущественно образуется в каждом случае,
если принять, что размер заместителей убывает по ряду CcHs>C2H6>CH3>OH>
сн3 СН3
с=о с=о
1 а) СвН5~-С-Н-|-СвН5М61 1 в) Н-С-СН, т1_!А1Н4
с3н6 С = О сн3 1 с=о
б) И -i-OH-4- А! [(СНа)2СНО]э 1 г) (CH2)a-J-CeHcMgBr
С6н6 H-C-CHS I ceHt
Даже в тех случаях, когда асимметрические центры находятся
близко друг к другу, асимметрическая индукция для простых ;
молекул редко достигает 100%Однако в биохимических системах
асимметрический синтез осуществляется с высокой степенью эф-
фективности, Фотосинтез глюкозы (XLVI) в растениях из двуокиси; ,
углерода и воды дает исключительно Е>-энантиомер. ь-Энантиомер
не встречается в природе и не усваивается животными организ-
мами. Аналогичным образом все входящие в состав белков а-ами-
нокислоты, которые могут обладать асимметрией, имеют ь-конфи-
гурацию. о-Аминокислоты обычно не встречаются в природе,
СОаН
К
L а - Ами но кисл ота
Стереоспецифичность биохимических .реакций обусловлена тем, что во всех j
случаях они катализируются ферментами — большими белковыми молекулами ср :
многими асимметрическими центрами, обладающими вследствие этого высокой
степенью а симметричности. Стереоспецифичность живых организмов имеет решаю-
щее значение для эффективности их функционирования. Причина состоите том, что
практически Невозможна такая конструкция организма, при которой он оказался
бы.в состояний функционировать на базе всех теоретически возможных изомеров,
молекул, содержащих большее число асимметрических центров. Так, если в моло-
ку.те б елка имеется. 100 различных асимметрических центров (это вполне обычное ..
й даже не слишком большое число), то до лжно существовать 2ми или 1030 возмож- ;
НЫХ: оптических изомеров. Сосуд, способный вместить все возможные стереоизо-
мерные молекулы такого типа, ни одна из которых, не идентична другой, должен
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
641
. ногс—сн.ж
Рис, 17-11. Схема, показываю-
щая, каким образом группы
—СН2СО2Н В лимонной кис-
лоте становятся химически
неэквивалентными в резуль-
тате взаимодействия с асим-
метрическим ферментом, роль
которого здесь выполняет
правая рука.
С*О,Н
иметь объем порядка 10’ л. Организм, построенный таким образом, чтобы оказа-
ться в состоянии функционировать, используя каждый из этих изомеров, должен
был бы, как нетрудно видеть, иметь большие размеры.
.Экономичность конструкции ферментативных систем настолько велика, что
они действуют асимметричным образом даже по отношению к оптически неактив-
ным молекулам. Это было продемонстрировано путем такого введения изотопных
Mfe'TOK, при котором обычные симметричные молекулы приобретают асимметрию.
Дыло найдено, что один из энантиомеров лимонной кислоты (LVIII), стереоспеци-
фически меченный радиоактивным углеродом (14С) по одной карбоксильной группе,
превращается при действии ферментов, полученных из печени крыс, в сс-кетоглута-
ровую кислоту, в которой 100% метки содержится в карбоксиле, соседнем с кето-
группой.
СО2Н СО2Н 1 со2н 1
сна 1 1 С-0
но-с-со2н - 1 СНЙГ но не СНг 1
сн3 i=o 1 сна 1
1 *СО2Н LV111 •COSH: *соан
Наглядно это можно представить в том случае, если принять, что тип асим-
метрии фермента аналогичен асимметрии правой руки. Используя .эту аналогию,
допустим, что фермент катализирует превращение изомера меченой лимонной
кислоты, изображенного проекционной формулой. LVI 1.1, в а-кетоглутаровую
кислоту, захватывая сначала центральную карбоксильную группу (которая долж-
на быть отщеплена) своими «пальцами» таким образом, чтобы «большой палец»
фермента оказался' расположенным вдоль'связи С—ОН. При этом, как можно
видеть из рис. 17-11 меченая карбоксильная группа будет направлена в сторону
«руки» фермента, тогда как немеченый карбоксил будет направлен в свободное
пространство. Таким образом, две группы—СНЯСО2Н, химически эквивалентные
в лимонной кислоте, становятся неэквивалентными прй их сочетании описанным
выше образом с асимметрическим ферментом. Можно ожидать, что в результате
этого синтез d-кетоглутаровой кислоты должен происходить с высокой степенью
стереоспецифичности.
21 № 1В40
642
ГЛАВА 17
Упражнение 17-19. Каким образом можно получить асимметрично меченную
14С лимонную кислоту, изображенную проекционной формулой LVHI, из D,L-a-
(бромметил)-а-оксиянтарной кислоты?
Аналогичным образом было показано, что один из двух энантиомеров «-
дейтероэтилового спирта биохимически окисляется до дейтероацетальдегида, тогда
как другой —- до обычного ацетальдегида
Р никотинамидадевая- Р
I нуклеотид [
CHS —С—ОН ------------------- СНз—С=о
/l
н н
. ннкотинамидадеяий-
I нуклеотид
сн3—с—он ----------> сн3-с=о
I
D
Строение никотинамНдадениннуклеотида — акцептора водорода при этом
окислительном процессе — рассмотрено в гл. 20, где обсуждается также более
подробно механизм действия ферментов.
Упражнение 17-20. Каким образом можно превратить один энантиомер а-дейте-
роэтилового спирта в другой, для того чтобы удостовериться в том, что два изоме-
ра ведут себя при биохимическом окислении по-разному?
17-9. Рацемизация
Оптически активные производные бифенила (разд. 17-4,Б)
рацемизуются в том случае, если два ароматических кольца
при вращении вокруг центральной связи в какой-либо момент
проходят через плоскую конфигурацию. Это может произойти (с
большей или меньшей легкостью) при нагревании, если орто-
эаместители сравнительно невелики.
Способ, которым рацемизуются соединения с асимметрическим
углеродным атомом, более сложен. Оптически активные карбониль-
I I
ные соединения типа —*СН—С=О, в которых асимметричным
является а-углеродный атом, рацемизуются как под действием
кислот, так и под действием оснований, и, учитывая обсуждение
механизма галогенирования карбонильных соединений (разд. 15-1),
с уверенностью можно утверждать, что этот процесс связан с ено-
лизацией. Образование енола (или енолят-ан иона) приведет к
исчезновению асимметрии при а-углеродном атоме, так что даже
в том случае, если енол присутствует в каждый данный момент
времени лишь в виде следов, рацемнзованным с течением времени
окажется все количество вещества. Однако этот механизм рацеми-
зации предполагает как наличие а-водородного атома, так и рас-х
положение центра асимметрии при том же а-углеродном атоме;
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
643
в противном случае кислоты и основания не оказывают сущест-
венного влияния при катализе рацемизации.
Енализаччл, катализируемая осноеаиием;
£н(>лизауилТ кат авизируемая кислотой;
дг ОН
м
К. R
Рацемизация оптически активных вторичных галогенидов (на-
пример, втор-бутил хлорида) может происходить в растворе, и
обычно чем более полярным и ионизирующим является раство-
ритель, тем легче рацемизуется вещество. За этот процесс, не-
видимому, ответственна ионизация галогенида по механизму SN1-
типа, которой, разумеется, должны способствовать полярные раст-
ворители (разд. 11-12,Г). Все имеющиеся данные указывают на
то, что алкил карбониевый ион после удаления соответствующего
аниона приобретает плоскую конфигурацию; когда этот ион вновь
соединяется с анионом, образование о- и ь-энантиомеров про-
исходит с равной вероятностью.
H-C-CJ —
^наснэ
Г сн. И Д CHj
I I
®С С1-С-Н
_}/Хсн3сн3._ ^н2сн8
Оптически активные галогениды могут также рацемизоваться
по механизму Sn2. Растворение оптически активного втор-бутил-
хлорида в ацетоне, содержащем растворенный хлористый литий,
приводит к образованию рацемата. При замещений хлора в галоге-
ниде на хлорид-иод происходит обращение конфигурации (разд.
11-10). Второе замещение вновь приводит к исходному энантио-
меру. Конечным результатом этого обратимого процесса будет
образование равного числа молекул d- и ь-форм; таким образом
происходит рацемизация исходного соединения.
СН3 „ Сн3
I CI 1
H-C-CJ Г2- С1-С-Н
I г>®' 1
снасна с‘ CH3CHS
D L
21*
644
ГЛАВА 17
Асимметрические спирты рацемизуются при действии сильных
кислот. Несомненно, при этом имеет место ионизация; дальнейшая
рекомбинация карбониевого иона с водой приводит либо к одному,
либо к другому энантиомеру.
СНЭ
н -С—ОН
СНаСН5
D
сн,
I ®
н-с-он.
снвсн3
с-н,о)
сн3
I
но—с-н
СН<.СНа
L ’
' сня
с®
н,о |
сн,
на8-с-н
сн2сна
В отличие от галогенидов, спиртов и карбонильных соединений
углеводороды в большинстве случаев рацемизуются с трудом. Это .
в особенности верно для соединений, содержащих четвертичный
асимметрический центр, таких, как метилэтилпропилбутилметан >
(LIX). В таких соединениях нет «уязвимых мест», которые, позво- \
лили бы перевести асимметрический углеродный атом в симмет- .J
ричное состояние г. помощью простых химических методов.
С3Н7
снв— (i—c3Hs
С4НО
LIX
Однако: углеводороды, в которых при асимметрическом углеродном т:
атоме находится атом водорода, могут рацемизоваться, если воз-
можно их превращение либо в ионы, карбонця, либо в карбанионы. -
Легкость рацемизации карбанионного типа будет зависеть от кис-
лотной подвижности водорода pi стереохимической стабильности "
промежуточно образующегося карбаниона.; Если происходит об-
ращение конфигурации кррбаниона, то результатом оказывается
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
645
рацемизация (см. также разд. 12-8,Б).
Ri Ri Ri Ri
основание | j н“’ I
R2—С—Н . Ra—С ; ^—2. :С—Ra 5—2 Нт-С—-Ra
• I I Г I
Rs Rs Rs Rs
Карбониево-ионный тип рацемизации оптически активных угле-
водородов может осуществляться при реакциях обмена, описанных
в разд. 7-10.
Дополнительные упражнения
17-2L Какие из приведенных ниже формул соответствуют одним и тем же опти-
ческим изомерам? Напишите для каждого изомера 3-аминобутанол а-2 правильную
рроекционную формулу Фишера.
СН9 Н ОН Н
Н—ОН СНЭ-С —ОН CHS-C—Н СН3—(i-NH,
н—i-NHa CHs-(i-NHa H.N-l-H H-ti-OH
ilia h tn» М»
CHS : H
HO-C.-H CHg-(i-OH
H-i-NHa HaN-i-CHa
i i
CHa H
/7-22. Напишите фишеровские проекционные фермулы для всех возможных
оптических изомеров приведенных ниже веществ.
а) 1,2,3,4-тетр ахлорбутан
б) метилэтилпропилбор
в) 2,3-дибррмпронионовая кислота
г) триизо про п и лметан
д) З-бромгександиол-2,5
COaCHg
СНОЧ
е) | >СНа
: CHOZ
J
COaCHg
ж) монометнлтартрат
з) emop-бутиллактат
17-23. Предскажите стереохимические конфигурации продуктов каждой из при-
ведённых ниже реакций. Напишите проекционные формулы исходных веществ и
продуктов.
aj d -втор-бутиловый спирт с уксусным ангидридом
б) Ь-метилэтилизопропилкарбинол с соляной кислотой
в) D-Моноацетат глицерина с водным раствором едкого натра
г) D-атор-бутнлбромвд с калийсукцинймидом
д) d-втор-бутил-mpcm-бут ил кетон с бромом и разбавленной щелочью
е) d -втор -бут нлэти л кетон с метил маг нийб ром идо м
17-24. Напишите проекционные фермулы для перечисленных ниже соединений,
а) трео-1,2-дифенил-1 -бром-2-хлорэтан :
:!б); ер«mpo-З-дейтеробутано.ч-2 (или бутанол-2-[3-Нг])
в) мезо-2,3-диметилянтарная кислота -- ' :
646
ГЛАВА 17
г) диастереомеры соли, образованной из D, L-a-фенилэтиламина и d-яблоч-
ной кислоты (оксиянтарной)
17-25. Объясните, как можно экспериментально установить, по какому типу —
цис или транс—происходит присоединение перекиси водорода в муравьиной
кислоте к циклопентену (если предположить, что возможные продукты присое-
динения не известны заранее).
17-26. Предложите схему реакции для установления относительной (по глице-
риновому альдегиду) конфигурации (+)-бутанола-2. Предлагая схему, внима-
тельно продумайте механизм входящих в нее реакций.
17-27. Рассмотрите возможные способы разделения этил-о.ь-лактата (этил-а -
оксипронионата, т. кип. 155 °C) на этил-d-лактат и этил-l-л а кт ат.
17-2S. При обработке тронс-бутена-2 бромом образуется 2,3-дибромбутан, из
которого в результате реакции с цинком в этаноле регенерируется /лраяс-бутен.
С другой стороны, ((«с-бутен-2 дает 2,3-дибромбутан, который при действии цинка
в этаноле превращается в цгю-бутен-2.
а) Напишите проекционные формулы всех возможных стереоизомеров 2,3-
дибромбутана.
б) Основываясь на известном вам механизме присоединения брома к алке-
нам, предскажите, какой из изомеров бутена-2 образуется при реакции оптически
активного 2,3-дибромбутана с цинком. Подробно приведите ваши соображения.
в) Напишите механизм реакции цинка с2,3-дибромбутаном, согласующийся с
ее стереохимическим результатом.
17-29. Мезо-2,3-дибромбутан при действии иодида калия в ацетоне превращается
в совершенно чистый транс-бутен-2, в то время как реакция р,ь-2,3-дибромбу-
тана с тем же реагентом приводит к ^«с-бутену-2. В противоположность этому
мезо-1,2-дибром-1,2-дидейтероэтан при реакции с иодидом калия в ацетоне дает
исключительно цис-1,2-дидейтероэтилен. Объясните, как можно согласовать эти
результаты. Следует принимать, что механизмы стадии отщепления в каждом
случае существенно не отличаются друг от друга.
17-30. Найдено, что мезо- н D.L-бутандиолы-2,3 при действии серной кислоты
дают смеси с различным содержанием метилэтилкетона и изомасляного альдегида.
Рассмотрев влияние пространственных препятствий на механизм реакции, пред-
скажите, какой из диастереомеров бутандиола дастбольшеметилэтилкетона, (Су-
щественной стадией реакции должна быть, по-видимому, та, при которой мигри-
рующая группа занимает положение, среднее между начальным и конечным.)
17-31. Утверждалось, что (-)-)-винная кислота (XX а) полностью определяется
термином w-конфигурация», поскольку, если один из двух асимметрических ато-
мов углерода восстановить в СН2-группу, образуется D-яблочная (а-оксиянтар-
ная) кислота. Какую конфигурацию можно было бы приписать (+)-винной кисло-
те, восстановив одну из карбоксильных групп до метильной, восстановив далее
соседнюю с оставшимся карбоксилом иксигруппу до СН2 И сравнив полученный
продукт с d- и L-P-оксимасляными кислотами?
17-32. Соединение А быстро рацемизуется при нагревании до 100°С, однако при-
сутствие хлорид-ионов не влияет на скорость процесса ни в хлороформе, ни в уксус-
ной кислоте. Рацемизация, проводимая в дейтероуксусной кислоте (CH3CO2D),
дает рацемическое соединение А, совершенно не содержащее дейтерия. Предло-
жите механизм рацемизации, согласующийся с экспериментальными фактами,
С1
А
17-33. Каким путем можно определить, является ли оптически активное вещество,
имеющее в хлороформном растворе вращение —100°, действительна левовращаю-
щим (с вращением около —100°) или правовращающим (с вращением +260°)?
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
647
/7-34. Раствор оптически активной 2 т2'-ди ио дбифе ни л-5,5'-дикарбо но вой кислоты
при нагревании рацемизуется с измеримой скоростью. Рацемизация активной
2,3,2',3'и,еграиодбифенил-5,5'-дикарбоноаой кислоты протекает во много тысяч
раз медленнее. Сделав масштабный рисунок переходного состояния рацемизации
(оно является плоским), установите, исходя из этого рисунка, причину чрезвы-
чайно медленной рацемизация тетраиоддикислоты, Используйте следующие длины -
связей (помните, что бензольное кольцо имеет правильную гексагональную струк*
туру);
С—С (в бензольном кольце) 1,40А
С—С (между кольцами) 1,47А.
С— Н 1.07А.
С—I I.63A
Эффективные радиусы иода и водорода равны 2,15 и 1,20 А соответственно.
17-35. Было обнаружено, что соединения приведенного ниже типа можно рас-
щепить на две оптически активные формы. Объясните.
-СО2Н
СНа’СНя
17-36. Рассмотрите следующие превращения,- циклогексанон- 1-Си ——>
NaBH, разделение
Й-хлорциклогексанон-х^С-----•-> транс-2-хлорциклогексанод-х-14С ------>
NaOH HCI
-> R-mp анс-2-хлор циклогекс ано л-х-14С-> окись циклогексен а-14С —* трам.
разделение
2-хлорциклогексанол-х>мС — — —> Н-тронс-2-хлорщ1КЛогексанол-х-иС. На-
пишите структурные формулы, соответствующие каждому веществу, четко обозна-
чая положение “С (х) в каждой. Если окажется необходимым, обратитесь к разд.
13-2 и 17-5.
ОТВЕТЫ К УПРАЖНЕНИЯМ
Г
Глава 1. Структура, идентификация и номенклатура
я ,н
.6)
н н
н и н
а) н;с:с-:с.:н
й н н:
н
Н:сЛ ' с‘-И
в) - ::
н. с. . с;н
‘с •
н
н
А) Н:С:(5‘.Н
Н "
Н .Я=
ж) Н:с:с-. q @
й '.О. Na
Н /6;
и)
Н ’.N.
Н • н
/-2.
а) Н3С~СН = СНа Нгс/С-2ЬсНа
/CHjk
6):HsC=C = CHa, НСеэС-СНз hcz .. хсн
в) Н3С—C'f Н2С=СН0Н нЕс—сн2
. н \/
н _
О н.-с;йк
н ”
и и
а). н:с:с:н
;о;
н
з) н:с:и:й
н ii
н) н;с&:7’
н
о
^ОТВЕТЫ К УПРАЖНЕНИЯМ
649
Н Н F . Н
г) f-c-(!-ci H-ci-ci-H
II н Cl h
Д) НвС-СНя-СНа-ИНа, Hsc—СН—СН3, HjC-CHs-N-CHs
I I
„ NHa Й
HO-CH=CH-OH H2C=CHOOH
I
H
1-4.
с пунктирными линиями
и «клиньями"
проекции Ньюмена
С1
н
1
650
ОТВЕТЫ К УПРАЖНЕНИЯМ
= 0
СН3.
сн/
СН3-О-СН=СН3
ОТВЕТЫ К УПРАЖНЕНИЯМ
651
is.
и
. a) h:n:
Н
•) h:c:::n:
:С::о:
н:р‘:о:н
з) h;o:n:H
ii
н) н:р:8:б‘.н
9.;q
)
«) :е^Л7-
!—р.
, 0 © .. © Q
с) h;n;n;:;n; или h:n::n-"n;
* * а
1-8. а) Идентичны, б) 1 и 4 идентичны; 1,2 и 3 различны, в) 1, 2 и 4 идентич-
ны' I и 3 различны, г) 2, 3 и 4 идентичны; 1 и 2 различны.
Ъ52
'ОТВЕТЬ! К УПРАЖНЕНИЯМ
/-Я
и) CHjCHiCHjOH, СН3СНаОСН8, (СН3)2СНОН
о
б) НЭС-^С~С—СН8
СНз-СеэС-С—сн3
СНа СН2 СНз
1-10.
СН8
в) сн8-(!:-сн8
!зн3
О
Ответы к упражнениям
653:
/-//. Циклобутан 19 ;5°. Циклогексан 0°. В действительности структура норбор-
нана, если, подходить к ней строго, представляет собой довольно сложный пример.
.Приведем здесь относительно простой способ оценки степени углового напряже-
ния, необходимого для образования метиленового мостика в i,4-положениях цик-
логексана (в форме ванны). Здесь и далее будем считать, что все связи С—С имеют
одну и ту же длину I. Тогда расстояние между атомами углерода в положениях 1
и 4 будет равно Ц-)-2/ sin 19,5°)= 1,666 t
Для того чтобы соединить мостиком эти атомы с помощью двух связей длиной I,
требуется угол 113®, и, следовательно, угловое напряжение при мостиковом угле-
родном атоме — только 3,5°.
Это еще далеко не все, так Как направления (70,5° по отношению к горизонтали)
внутренних связей 1 г и 4-углеродных: атомов кольца ни в коей мере не совпадают
с точной величиной угла, необходимой для образования метиленового мостика без
654
ОТВЕТЫ К УПРАЖНЕНИЯМ
Если бы мы построили связи с СЩтруппой с углами 70,5° по отношению к гори-
зонтали, угол в вершине должен был бы равняться 180°—2- 70,5°—39°, что соот-
ветствует напряжению 109,5—39,0= 70,5°! Резонно допустить, что это напряже-
ние «размазывается» за счет сближения друг с другом 1- и 4-углеродных атомов и
изменения направления боковых 1- и 4-связей по сравнению с 70,5°. Если при-
нятая, величина напряжения 70,5° распределяется более или менее равномер-
но по семи углам, напряжение в расчете на один угол будет составлять 10°.
Угловое напряжение в 70,5° можно легко представить себе, если при рас-
смотрении модели обратить внимание на то, насколько далеки направления
связей при 1- и 4-углеродных атомах от образующих угол в 109,5°.
Глава 2. Спектроскопия органических молекул
2-1. 46,4 ккал. Энергетические требования многих химических реакций близки к
этой величине, следовательно, энергия, поглощенная парами натрия, может
привести к протеканию химической реакции.
2-2. а) 1705—1725 см-1 (сильная); С—Н 2850—2960 см-1 (сильная); С—D
2200СМ-1 (сильная), б) 2100—2260 см-1; 3300 см-1 (сильная); 2850 — 2960 см-’
(сильная);600—1500 см_1(слабая). в) 1700—1750 см“1(сильная); 1000—1300 см-1
(сильная); 2850—2960см(сильная); 600—1500 см-1 (слабая), г) 2000—2300 см-1
(сильная); 1620—1680 см-1; ЗОЮ—3100 см-1 (средняя); 600—1500 см-1 (слабая).
Д) 1705—1725 см-1 (сильная); 1700—1750 см-1 (сильная); Ю00—1300 см-1 (силь-
ная); 2500—3000 -См-1 (широкая); 2850—2960 см-1 (сильная); 600—1500 см-1
(слабая), е) Чистая жидкость; 3200—3400 см-1 (широкая); 2850—2960 см-1
(сильная); 600—1500 см-1 (слабая); 1000—1300 см-1 (сильная). Разбавленный
раствор: 3590—3650 (резкая); слабое или отсутствие образования водородных
связей.
2-3.
CPU
a) CaHeO, СН4 =СНСН1ОН. б) С4Н,Оа, I J)CHCO2H _
ОТВЕТЫ К УПРАЖНЕНИЯМ
655
2-4.
Молекула И К -спектр К Р-спектр
а) С1а б) НС1 в) СО г) CF3=CH3 д) (СНя)аС=СН2 е) СНаСН=СНСН3 Нет Сильные валентные колеба- ния Н—С1 Валентные колебания С=О Сильная полоса Средняя полоса Отсутствуют валентные коле- бания двойных связей Сильные валентные коле- бания Cl—С! Сильные валентные коле- бания Н—С1 Валентные колебания С=О Сильная полоса » _ * » »
активны в КР-спектре,
неактивны
в ИК-спектре
активны
в ИК-спектре
;о=с=о(
активны
в ИК-спектре
2-6. п-э-Л*; прибавление 435 А [разности длин волн поглощения, соответствующих
п-нт*-переходу для СНзОСН3 и (CH)aN] к длине волны поглощения при 2800 А,
отвечающего л-»-я*-переходу для (СН3)аС=О, дает величину —3230 А.
прибавление 435 А к длине волны 1560 А, предположительно соот-
ветствующей п—мт*-не ре ходу для ацетона, дает —2000 А.
л—>-л*; если л—-пе ре ходу для (СН3)2С=0 и СН2=СНа отвечает поглоще-
ние при 1900 и 1620 А соответственно, можно ожидать, что длина волны погло-
щения при л->л*-переходе для СНа=МН будет промежуточной, т..е,—J750A.
2-7, Поглощение 3,5% при 2800 А; погдрщение 92% при 1900 А.
2-8. Поглощение триметиламина при 2273 А обусловлено л-мт*-переходом, кото-
рый затруднен в кислом растворе, так как электронная пара на атоме азота вклю-
чена в образование связи с протоном. Аналогичное превращение должно проис-
ходить и в случае гг-xj* -перехода.
2-9. а) 3,85 м. д., ОН; 2,6 м. д.,—СН.,—; 2,15 м. д.,—СОСНЯ; 1,2 м. д., (СН3)аС.
б) 385 Гц, ОН; 260 Гц, — СНг~; 215 Гц, -СОСН3; 120 Гц, (СН3)аС.
2-!0. а) Синглет -3,3 м. д. б) (ЗН) триплет -—1,0 м. д,; (2Н) квартет —3,7 м. д.
в) (6Н) дублет —1,0 м.д.; (1Н) септет—4,4 м. д. г) (ЗН) синглет (широкая)
656
ОТВЕТЫ К УПРАЖНЕНИЯМ
~!,0 м. д.; (2Н) синглет (широкая) ~3,7 м. Д. д) синглет ~ 1,0 м. д. е) (1Н) дуб-
лет —5,5 м. д.; (1Н) дублет ~5,8 м. д. ж) (ЗН) дублет ~1,0м. д.; (ЗН) синглет
~2.3 м.д.;(1Н1 квартет ~4,4 м. д. з) (6Н), наложение двух триплетов при
~1,0 м. д.; (2Н) квартет -—2,7 м. д.; (2Н) квартет •'4,2 м. д. и) (2Н) триплет
~3,7 м. д,; (2Н) триплет: -—3,2 м.д.; (2Й) мультиплет (вероятно, 5 линий)
~1,8м. д. к) (6Н) дублет -—3,7 м. д.; (IH) септет -—2,0 м. д.
2-11. а) С4Н 8 Вт=(СН3)аСНСНаВп(СН3)аС дублет при 1,0 м. д.; (СН) мультиплет
при 2,0 м. д.; (СНа) дублет при 3,3 м. д, б) C3HeBrI=BrCHsCHaCHsT :• (ВгСН2—)
триплет при 3,65 м. д.; (1СНа) триплет при 3,55 м. д.; (СНа) мультиплет прибли-
зительно из пяти линий при 1,8 м. д. в) CaH3G13=sClaCHCHaCI: (С1СНа—) дублет
при 3,9 м. д.; (CLGH—) триплет при 5,7 м. д.
2-12.Соотношение интенсивностей пиков при 6,1, 5,5, 3,7 и 1,8 м. д. равно L: I :
: 3^3 соответственно, а химические сдвиги отвечают группам =СН—, =СН—,
—ОСН3 и —С—СН3. Поскольку расщепление винильных протонов мало (0—3 Гц),
пики при 6,1 и 5,5 м. д. соответствуют СНа— (см, разд. 2-6, В). Пики при 3,7 и
1,8 м. д. по существу являются синглетами. Поэтому спектр лучше всего отвечает'
соединению СН2=С(СН3)СОгСН3.
2-12. Мультиплеты при 5,8 и 4,1 м. д.. связаны между собой спи и-с пи новым вза-
имодействием.: Это следует из несколько больших значений интенсивностей трипле-
та, находящегося в сильном поле при 5,8 м. д_, и дублета при 4,1 м. д. в слабом
поде, по сравнению с предсказанными на основании эффектов первого порядка.
Аналогичным образом взаимосвязаны пики при 3,4 и 1,1 м. д.
С2Н3Вг3=>ё ВгаСНСНаВг
С4Н10О вя (CH3CH2)SO '
2-14. Положение линии, зависящей от концентрации, изменяется от 5 м. д.
(100% Н2О) до 11 м. д. (100% СН3СО2Н) по мере того, как концентрация уксусной
Кислоты изменяется от 0 до 100% . Магнитная эквивалентность гидроксильных
протонов воды и уксусной кислоты обусловлена быстрым обменом,
2-15. См. разд. 13-5, А.
2-16- Высокая интенсивность пиков и максимальное значение массовых чисел в
масс-спектрах метилэт ил кетона (а), пропионового альдегида (б) и ацетона (в) при
72, 58 и 58 единицах соответственно отвечают молекулярным массам этих соеди-
нений. Массовые числа 57 в (а) и (б) и 43 в (в) соответствуют СНЭСН3СО® и
СН 3СО® Высокая и нте и си в ность эт и х п и ко в у к аз ыв ает, что и а ибо л ее в еро ятао й
является диссоциация типа R--СО-f-R'.
2-17. Точная масса C2HS® (на основании 13С= 12,000000) равна 29,039125, а точная
масса СНО® составляет 29,002740. Разница в массах составляет 0,036385 и мо-
жет быть легко измерена прибором с разрешающей способностью 1 ; 50 000.
Глава 3. Алканы
3-1. а) 2,5-Диметил гексан; изопропил изобутил метан, б) 2,2,4-Триметилпентан;
изо пр опил-трет-бутил метан. в) 2,4-Диметилгексан; изопропил-втор-бутилме-
тан. г) 3-Метилиентап; днэтилметилметая. д) 4,4-Ди-к-пропилгептан; тстра-н-
пронилметан. е) 2-&утил-5-изобутилнонаи; й-бутилизобутил1 (З-метилбутил)ме-
тан и «-бутилизобутилйзоамилметан.
3-2.
CH3(CHajtCHaCl СН3(СН,)8СН(С1)СН# СНэСН^СН(С1)€Н,СНаСН3 '
I- хлор гекса it 2-хлиргексан 3-хлоргексзн
(СН3)аСН(СНй)аСНаС1 (CHs)aCHCHsCH(Cl)CH3 (СН3)аСНСН(С1)СНаСН3
i-Xлор.4-Метилиеитан 2-ХЛОр-4-метилпектан " 3-хлор.2-метилг>ЯПап
ОТВЕТЫ К УПРАЖНЕНИЯМ
657
(СН3)зС(С!)(СН2)2СНз СН3СН(СН2)аСНя
СН3С1
2-хлор-2-метили ентан 1-хлор-2-мети л пентан
СН3СН3СН(СН3)СНгСН2а СН3СНаСН(СН3)СН(С1)СН3 CH3CHaC(Clj(CH3)CHaCH3
i -хлор - 3 -мети л пента и
CHsCH^CHCHsCHi,
: с!нЕа :
3-хлорметиллеитаа
' (СН3)3ССНаСНаС1
1хлор3,3 - днметилбута в
2-хлор-3-металле втан З-хлор-З-метялаеатан
(СН,)аС(С1)СН(СН#), С1СНаСН(СН3)СН(СН8)а
3-хлор-2,3-диметплбутан I-хлор-2,3-дни стал бутан
(снэ)ас(снаа)снаснв (CH3)sccH(Ci)CH3
I • ХЛ op 2,2 - Диметилбута и 2 -хло р • 3,3 • диметелбута н
5-3. .Тетрадекан, 252’С; гептадекан, 299 °C; 2-метилгексан, 93 °C; 2,2-диметил-
пейтан, 80 °C.
3-4, Форма молекулы неогексана более сферическая по сравнению с молекулой
гексана; следовательно, эффективная площадь поверхности неогексана меньше,
Ито уменьшает силу притяжения между соседними: молекулами.
3-5. —1517,4 ккал.
3-6. При сгорании 1 кг газообразного метана выделяется 13 300 ккал; сожжение
1 кг жидкого н-декана, дает 11 410 ккал.
3-7. а) "г-486,5 ккал, б) —1430ккал, в) —124,7 ккал, г) —47^6 ккал, д) —27,5 ккал,
е) +12,4 ккал.
’3-8. + 170,85 ккал.
3-0. 221,2—119,9=101,3 ккал.
'3-10. =С—Вг, 72 ккал; — С—Вг, 67 ккал.
3-11. а) 100,5 ккал, б) 99,05 ккал, в) Энергия связей, полученные в (а) и (б),
не должны быть одинаковыми (ни теоретически, ни на практике). Энергия связи;
полученная в (б), является средним значением из энергий связи четырех связей
С—Н. Соответствующая величина, рассчитанная в (а), представляет собой энер-
гию диссоциации первой С—Н-связи.
3-12. а) ДЯ=—19,4 ккал; K=5,0-10e; K=l,7U0«, если А$=0. б) Д$=
=—50 энтр. ед.
3-13. —47,5 ккал; Д5=—179 энтр- ед. Спонтанного разложения и-нонана
не происходит, так как для начала процесса необходим избыток анергии (ЛЯ*)
47,5 ккал. Простого механизма разложения без диссоциация прочных связей йе
* существует. ' -
3-14. Для первой стадии величина ДЯ=+53,5 ккал, что является неприемлемо
~ высоким значением; следовательно, эта первая стадия маловероятна. Соответст-
вующая реакция с фтором более вероятна, так как ДЯ=+0,7 ккал.
3-15. Инициирование возможно (ДЯ=+58,0 ккал), так как действие света, близ-
кого к ультрафиолетовому, обеспечивает необходимую энергию (разд. 2-1). Раз-
витие цепи (стадия 1, ДЯ=+17,7 ккал,- стадия 2, ДЯ=—45 ккал) маловероятно
нз^за высокой энергии первой стадии развития цени. Стадии развития цепи
. (разд. 3-7, В) энергетически более выгодны.
3-16.
НВг
+.11,3
ДН^СЬ) < ДН*(Вт<) < ДН"(1‘),
ДН#(Вг‘или !•) > АН
653
ОТВЕТЫ К УПРАЖНЕНИЯМ.
3-17.
a) CH3CH4CHSC1: СНаСН (С1)СН3= 10; 11, или 47,6 : 52,4 . 6) (СН3)аСНСНаС1;
(СНЭ)3СС!=45 : 22, или 67,2:32,8, в) (CHs)3C(CaH6)CH2Cl: (CHs)sCCH2CHaC!:
(СН3)ЭССН (С1)СН3= 15:5:11, или 48,5:35,5:16
3-18.
С—С—С-С—С—С—с
с—с-с—с-
и-гептан
2-метилгексан
(дииетил-к-бутилметан)
2,4-диметилпентаи
(диизопропилнетав)
—С—С—С
2, 3-диме тилле итак
(мети лэти лизопропилмета к)
3-метилгексан
(мети лэтил-н- п роли лмета н)
3,2-диметилпентав
(трямстил-я-пропилметан)
2,2,3-триметилбута н
(диметил -т ргт-бутплмотав)
С-С с
с—с—с—С—с С—С—С—С—С
I
с
3-этвлпеитан 3,3-дииетилпентан
(триэтилметан) (дпметнлдиэтилметан)
Название «неогептан» является однозначным в такой же степени, как и название
«изо гептан и соответствует гептану с тремя метильными группами на конце цепи,
тогда как изогептан имеет две метильные группы на конце цепи. Тем не менее
название «неогептан» не используется; вероятно, это объясняется малой извест-
ностью этого соединения, а также возможными неясностями в номенклатуре.
СН3
СН3—СНЯ— CHS—СН3
Ан3
неогептан
сн.,
>снснаснаснасн3
сн/
изогептаи
3-19.
-С
С С
а) С—С—С—С—С—С—С
с—с—с-с-с
-с
С
! -мети л- 4 -т раи-бутил - 4 •вт ср-в утилоктан
2-метилоктан
ОТВЕТЫ К УПРАЖНЕНИЯМ
659
в) с—С—С—С—С—С1
н-пентвлхлорид
(хлорпентан)
/С-С1
с-с—
атер-бутилметил хлорид
(1 -хлор - 2-мешлбутан)
с—с-с-с—с
I
С1
2-пектилхлорид
(2-хлорпентан)
С
С—С—С-С
С1
т ре т-ами л хло ри д
(2 -х ло р 2 -метн лбу та н)
С-с—С—С—С
А
3-пентил хлорид
(3-хлорпентан)
С-С1
с-£-с
мети ли з оп ропи лиети лх ло ри д
(2 • хлор-3 «метн лбу та н)
неопонтилхлорнд
{I -хлор- 2, 2-днметилпропан)
изоамилхлоряд
(I -хлор-3-метнлбутан)
3-20. а) — 98.5 ккал/моль метана, б) —340 ккал, в) —10,8 ккал, г) —7,4 ккал,
д) +98,0 ккал.
3-2/. a) iff——73,7 ккал, если при реакции образуется С (тв.). б) Величины ДН
для гидрирования и бромирования этана указывают, что связь G—С в этане насы-
щена не полностью, по крайней мере в том смысле, что К для этих реакций, веро-
ятно, больше единицы.
3-22. Для С—F ДЯ=116 ккал, при использовании для связи С—Н метана АН=
—99 ккал,
3-23. Энтропия AS для реакции образования углеводородов резко снижается
(становится все более отрицательной) при переходе от метана к нонану,
3-24, Образование циклогексана из гексена-] сопровождается более значитель-
ным уменьшением энтропии, чем образование хлористого водорода.
3-25. Большое уменьшение энтропии для реакции образования хлористого этила
из этилена и хлористого водорода объясняется главным образом тем, что две мо-
лекулы вынуждены расположиться таким образом, чтобы реагировать и дать одну
молекулу, теряя тем самым много степеней свободы.
3-26.
Вг3—► 2Вг-
СН4 - Н + Вг- —► СНЭ - + Н Вг
СНз- + Вгг —> СН3Вг+Вг.
ДЯ= 46,1 ккал (может происходить при
освещении)
Д/7 = +1 ] ,2 ккал (гораздо более поло-
жительное значение,
чем с С1а>
ДЯ = — 22 ккал (сравнимо с CJ3)
СНа —Н+Вг3 —* СН5Вг+НВг ДН=—10,8 ккал (К, вероятно, >1)
Другая последовательность цепи имеет еще более неблагоприятный баланс ве-
личин ДЯ для каждой стадии.
СН3—Н + Вг-—*CHsBr+H- ДН= +30,7 ккал
Вга+Н-—>НВг + Вг- Д/1 — — 41,4 ккал
660 ОТВЕТЫ К УПРАЖНЕНИЯМ
В случае иода замещение неблагоприятно, так как 7(, по-видимому, <1, а зна-
чение ДН для одной стадии большое и положительное. Л
1а—^21- АЯ=4-Зб,1 ккал (очень легко при освещении)
СНЭ-НЦ.I..—» СН».4-НГ ДЯ = 4*27,3 ккал
СН»-]» —*СН»1 -!*!•: ДЯ = —15 ккал
СНз-Н-На—>-CHsI-i-Hi ДЯ== 4-12,3 ккал
3-27. Среднее значение энергии связи С—С в циклопропане составляет, согласно
расчету, 72,9 ккал в предположении, что связи С—Н являются нормальными.
3-28.
. Лу
С1»-*2С1,; СЩЦ-СЬ—>СНЭ.4-НС1
СН3- + С!» —> СН3С14-С1-~* СНаС]. + но
СНаС1.4-С1а-*СНвС1г+С1. —*СНС12. + НС1
СНО». 4*С1Й-+СНС1» + С1-—> CC1S; 4-НС]
2СС13-—>СС|3 — СО»
Глава 4. Циклоалканы
4-J. а) Циклодекаы. б) Метнлцикдогексан. в) 1,1-Диметад-2-этилциклоокт ан.
2,2-диметил-3-циклоГыпиЙ«
проиилхлорад
(только структурные изомеры)
сн3
Hai-CHaCl»
CHj
СНз ;
е) ;Г>—С^СНгСН3 ~ метилэтилдициклопропилметан
(2,2-дйциклопролилбутан):
I
4-2. а) 0,20 ккал, б) '27 ккал, в) 45 ккал,
^3.12 ккал: для плоского циклогексана; 4 ккал для ванны плюс флагштокоаое
взаимодействие, которое составляет, по-вндилому, 2—3 ккал.
ОТВЕТЫ К УПРАЖНЕНИЯМ
661
4-4.
а б а
г Д е
Порядок устойчивости: а>б>г>е~д>в.
4-6. При комнатной температуре инверсия цикла происходит оыстро, поэтому
атомы фтора магнитно эквивалентны. Но мере того как температура понижается,
скорость инверсии уменьшается. При—110°С инверсия становится настолько мед-
лашой, что атомы фтора перестают быть магнитно эквивалентными, Наблюдае-
. мыё четыре группы линий соответствуют паре дублетов, обусловленных спин-спи-
’ незь:м рас!це|-лением одного атома фтора на другом. Далее каждый пик расщепля-
ется вследствие И—F- спи нового расщепления (величина которого гораздо меньше,
\ чем величина F—F-спинового расщепления).
4-6. а) Вероятность циклизации увеличивается в разбавленном растворе, так как
число бимолекулярных столкновений, приводящих к присоединению, уменьшается.
р) Высокий выход (СН^з означает, что благоприятная ориентация преодолевает,
большое напряжениецикла; для (CHja действующие;в противоположных направ-
лениях эффекты ориентации и напряжения почти сбалансированы — отсюда н
низкий выход; для циклогексана выход почти целиком определяется эффектами
ориентации; для больших циклов ориентация играет весьма существенную
роль, в; то время как напряжение является относительно маловажным фак-
тором. ' ". ?
4-7. Если, принять, что суммарное напряжение в алкенах с открытой цепью
таксе же, как в этилене, ТО мы можем рассчитать желаемые величины щз
данных -табл. 3-4. вычитая суммарное напряжение в циклоалкане из такового
для, этилена (22,4 ккал/моль). Тогда
662
ОТВЕТЫ К УПРАЖНЕНИЯМ.
Я ДЯ для (СН2)Я------------>СН3(СНг)Л-эСН = СН3
3 —5,2
4 —4.0
5 —15,9
Есть и другие пути решения. Например, можно рассчитать ДЯ сгорания алкенов
с различными значениями я и взять разность между ними и величинами ДЯ сгора-
ния циклоалканов, которые приведены в табл. 3.4 (отметим, что эти величины
даны для образования жидкой воды).
Рассчитанная
АТ/ сгорания
алкеиа (жид-
кая иода)
&.Н из онер я-
ванн и
2 333,3 —.
3 490,2 —9,6
4 647,2 —8,7
5 804,1 4-10,9
Несовпадение значений ДН для реакции изомеризации сданными, приведенными
выше, объясняется тем, что рассчитанная из средних значений энергий связи теп-
лота сгорания этилена недостаточно хорошо совпадает со значением, полученным
экспериментально (333,3 ккал/моль по сравнению с 337,3 ккал/моль). Ио всяком
случае па основании этих значений АН можно ожидать, что циклоалкены с п=3
или 4 должны быть менее устойчивы, чем алкены. В том же направлении должны
изменяться и энтропийные эффекты, а атомы в алкенах с открытой цепью должны,
как правило, быть менее напряженными, чем в циклоалканах, В случае пропилена
(п=3) это различие, по-андимому, незначительно, однако оно должно становиться
все более существенным при переходе к п=4 и 5,
4-8. й=2, —49J ккал; п=3, —35,0 ккал; п=4, —33,8 ккал;п=5, —13,9 ккал;
/1=6, —7,4 ккал.
4-9. АН первой стадии; п=6, + 15 ккал; п=5, +8,5 ккал; 4, —11,4 ккал;
ге=3, —12,6 ккал; п=2, —27,2 ккал. ДЯ второй стадии: —22 ккал. Реакция
возможна только при п=2, 3 и 4. В действительности она происходите измеримой
скоростью только в случае п=3.
4-10. При помощи Вг а можно отличить метилциклопропан и бутен-1 от цикло бу-
тана; выбор между метилциклопропаном и бутеном-1 можно сделать с помощью
КМпО4.
4-11.
4-12. -Следует ожидать, что транс-1,2 - димет йлци клоп рои ан будет более устойчив,
чем «ас-изомер, из-за отсутствия несвязывающих взаимодействий между «цс-ме-
тильным группами.'1
ОТВЕТЫ К УПРАЖНЕНИЯМ
663
ф«>Изомер, вероятно, будет более устойчивым, так как он может существовать в
-экваториально-экваториальной конформации.
4-14. И аиболее устойчивым изомером из пары цис- и транс-изомеров производных
I циклогексана является тот, который может существовать В экваториально-эква-
ториальной конформации. Этот изомер будут иметь также более высокую темпе-
1 ратуру кипения, плотность и показатель преломления. Такими изомерами яэля-
'ются транс-1,4-, транс-1,2- и ц«с-1,3-дизамещенные циклогексаны.
4-15. Модели показывают, что транс-окись может существовать только в транс-
е,е-конфигурации, которая является более напряженной, чем цос-е,а-окись.
4-16. а) Бицикло-[3,1,0]-гексан. б) 8-Хлорбицикло-[4,2,0]-октен-2. в) 2,3-Ди-
б ромб и цикло-12,2,2]-о кт ан. г) 4-Б ром-9-мет и л три цикло-[5,3,0,02’eJ декан, д) Тет-
рэцикло-[7,3,1,03>130,’13]-тридекан.
4-17.
нения см. J. Am. Chem. Зое., 85, 2530 (1963).
4-18, Весьма напряженный изомер; нельзя построить с помощью шаростержне-
вых моделей?
4-19. ifnc-9-Метилдекалии стабильнее транс-9 мет и л де к ал ин а на (2-ф1,5) ккал=
=3,5 ккал.
4-20. Ответы на эти задачи в определенной степени служат лишь для иллюстра-
ции. Во многих случаях возможно несколько ответов, а) Цнклононан. б) 1,1-Ди-
метилциклопропан, в) Метилциклопропан, г) цис- 1,2-Дйметилциклопропан.
д) СН3СН (Вг)СН2СН (Вг)СйН6, СНаСН (Вг)СН (СаНБ)СНаВг.
664 ОТВЕТЫ к УПРАЖНЕНИЯМ
BrCHaGH (CHj)CH (С;>Н6)Вг,
ж) г(гл:-1,3-Дв-«рен:-бутйлциклобутан, если цикл деформирован (рис, 4-15),
как это, по-видимому, и имеет Место (ср. J. Am. Chem. Soc., 84, 4982 (1962)].
Это одна из основных конфигураций стероидного кольца.
4-2!. &Н связи С—С циклопропана 67,7 ккал, а) 4-55,9 ккал, б) —53,4 ккал на
1 моль образующегося циклогексана (или —26,9 ккал на 1 моль исходного цик-
лопропана).
4-22. Углы связи С—С—С в складчатом циклобутане можно рассчитать из сле-
дующего треугольника:
Рассчитанное угловое напряжение для плоского циклобутаи а составляет 17,5- 4Х
Х(109,5—90)3==26,6 ккал (что близко к величине, рассчитанной йэ теплоты сгора-
ОТВЕТЫ К УПРАЖНЕНИЯМ
665
нйя). Рассчитанное угловое напряжение для складчатого цяклобутана равно
17,5-4» (109,5— 83j'2—49,2 кхгл. Такое значение само по себе, очевидно, неприем-
лемо; однако невероятно, чтобы величина 17,5 ккал-моль-’граД”2 сохранялась
при величине угла, значитально меньшей 90°, поскольку при этом рассчитанное
напряжение для циклопропана было бы равно 17,5- 3- (109,5—60)2= 129 ккал/моль.
Уменьшение Н— Н заслоненного напряжения, ожидаемое для складчатого цик-
лобутана, должно составлять 8-1=8 ккал, так как в плоской форме число противо-
лежащих Н—Н равно восьми. Большинство из экспериментально изученных
циклобутанов изогнуты приблизительно на 30°, что соответствует углам связей
С—С—С 88е; рассчитанное угловое напряжение составляет 32,4 ккал, и это на
5,8 ккал больше чём рассчитанное для плоского циклобутана. При величине углов
Н—С—Н 109,5® подобный изгиб приводит к значительно большему отклонению
связи.с аксиальным водородом от направления, параллельного оси кольца, чем
для циклогексана; тем не менее это должно существенно уменьшить заслоненное
напряжение.
циклогексан (изгиб 60°)
666
ОТВЕТЫ К УПРАЖНЕНИЯМ
Глава 5. Образование связей в органических молекулах.
Атомно-орбитальные модели
5'1' Не, Не2®
ls<r* (fj) (Т)
О ф
Заряд ядра в Не® равен 4, заряд ядра в Н® составляет 2. Следовательно, оттал-
кивание электронов в Н® в значительно меньшей степени компенсировано притя-
жением атомного ядра, чем в Не®.
0Hs(T*(t) ls<r( t) ls<r*( I) (ls<r*)2
уменьшение устойчивости------>
5-3. Здесь будут использованы только скелетные изображения. Все ожидаемые
значения углов определены для случая наиболее благоприятного перекрывания
только самих орбиталей без поправки на межэлектронное отталкивание и т. д.
Д F—O-F==90e
ОТВЕТЫ К УПРАЖНЕНИЯМ
657
д) Так же как для NH3, но с положительным зарядом на центральном атоме,
ж) Так же как для Н«О2, исключая
a-связи со всеми р-орбиталями азо-
та.
Z Н—О—0=90°
все сг-связи включают Зр-ор-
битали
5-4.
сомглаемьга углы;
Z Н-С-Н = 109.5“
ZH-C-F = 109- 5*
ожидаемый
угол:
£ с-0—С = 90’
668
ОТВЕТЫ К УПРАЖНЕНИЯМ
д)
Здесь представлена только локализованная структура,
ж)
(2 s рг- 2s рг) f св язи
ожидаемый угол;
2 С—С—С = 120»
ОТВЕТЫ К УПРАЖНЕНИЯМ
669
а)
ожидаемые угльк
Z Н—С—О я 120’
Zo-C-O = 120’
ZC-O-H.a 90е
2р (свободная)
ьсе атомы фтора одинаковы
СН3
Mj
СН3
(2spJ-3sp)<r Зр^ (свободная)
ожидаемые угдь!:
Z c-Mg-ceiao’
Z Й-С—н = 109. 5*
670
ОТВЕТЫ к УПРАЖНЕНИЯМ
ожидаемые углы!
Z С—N—О = 120°
Z О—N-O = 180°
Z Н—С—Н = 109. 5"
н)
Z Н-С-С = 120°
(ру~Ру)к
ожидаемый угол;
(Z С—N—С = 180°)
ОТВЕТЫ К УПРАЖНЕНИЯМ
671
ожидаемые углы;
2 Н(0 С~Н(3)= 1ао°
z н(зТс-н(4}= ио-
Z Н(0 С“Н(эГ 90*
Это возможная структура, в которой рх-орбиталь углерода используется дважды.
<£-<?, Если бы атомы углерода в этилене были связаны эр3-орбиталями, гибридиза-
ция его связей С—И должна была бы быть такой же. Однако атомы водорода эти-
лена отличаются по своим спектральным свойствам и прочности связи от атомов
водорода типичных насыщенных углеводородов (гл. 2 и 4). Отсюда следует, что
.если связи с водородом не могут иметь sp3-гибридизации, то и связи С—С не могут
быть зр3-гибридизованы.
15-6, Существует несколько возможностей. Одна из них заключается в том, что
все связи С—С образуются с помощью р-орбиталей, давая ненапряженные углы в
,.90°.
-Тогда для С—Н-связей осталось бы более двух 2sp-орбиталей, что привело бы к
предсказанию угла Н—С—Н 180°, что заметно отличается от эксперименталь-
ного значения, близкого к 109,5°. Очевидно, это дает возможность построить более
прочные связи С—С с гибридизованными орбиталями (а не чистыми р-орбитглями),
даже если направление перекрывания пе очень благоприятно. Другие модели
циклобутана можно построить, используя рис. 5-23 и 5-24. Одна из них, аналогич-
ная 5-23, должна иметь четыре 2sp2-орбитали, перекрывающиеся в центре кольца,
В кольцах, больших, чем цикло пропановое, эти орбитали из-за пространственных
причин вряд ли эффективно перекрываются. Следовательно, лучше всего, по-
видимому, изобразить циклобутан так, как на рис. 5-24, но только с более близ-
кими к sp3 п-связями между атомами углерода.
5-7. Если две связи С—Н в этилене образованы с участием sp$-орбит ал ей углеро-
да, то при этом используются 2/3 s-орбитали и 2/3 двух из трех р-орбиталей, имею-
щихся у каждого углеродного атома. Следовательно, для образования т-связи
остается более 1/3 s-орбитали и (i-f-2/З) p-орбитали; следовательно, т-орбитали бу-
дут слагаться из s и р в соотношении 1/3: 5/3=1 : 5. Таким образом, их можно
назвать зрБ-орбиталями, причем каждая образуется с участием 1/6 s-орбитали и 5/6
р-орбитали.
5-9. Да, так как. кислород удерживает две из связывающих пар с углеродом
672
ОТВЕТЫ К УПРАЖНЕНИЯМ
о —
гораздо ближе друг к другу, чем в случае, например, Н^-С-^О—, где электро-:
‘ I
Н
вы связей С—Н могут располагаться гораздо дальше.
5-9. В связи с межэлектронным отталкиванием углы в NFa и OFS меньше тетра- ;
эдрических пр той причине, что стягивание фтором связывающих электронов от
азота и кислорода сообщает центральному атому характер №® и 0s® соответст-
венно. Это приводит к размазыванию неподеленных электронов и уменьшению
углов связей. Этот эффект должен быть более значительным для 01%, где имеются
две неподёленные пары, чем для NF3 с одной неподелениой парой- Однако ком-
пенсирующим фактором является бблыпая злектроноакценторная способность ,
фтора по отношению к азоту, а не к кислороду.
а-10- р -Электроны легче притягиваются электро но акцептор ной группой X, чем
s-электроны. Поэтому можно предполагать, что С—Н-связывающие электроны В
соединении CHS—X будут иметь больший s-характер, а С—X-орби.'глj — боль-
ший ^-характер.
8-11, Линейный :СНЯ
по одному электрону может находиться на каждой из орбиталей р„ и р2 углерода
и, согласно правилу Гуида, они должны быть неспарены. у ।
Лнгулярный :СНа 1
Если аигулярный :СНЯ имеет р-свяэи с углеродным атомом, оба неподеленных
электрона могут находиться на 2з-орбиталн углерода и, если это так, они должны
’быть спарены.
Глава 6. Алкены. Структура, спектры и стереоизо-
мерия
6-1. а) 2-Мети лбу ген-2; -триметилэтллен, б) 1,1-Днхлор-2-метнлпропёя; симм*.
дяхлордиметялэтилен (довольно неоднозначное название), в) 2,4,4-Триметп л пен-
тен; метил неопентилэтн лен (неоднозначное название). г),1-Бром-3-метилбутадИ'
ОТВИТЫ К УПРАЖНЕНИЯМ ' 673
ен-1,2. д) 2,5тДиметил-3-изопропилгексен-3; тетраизопропилэтилеп. е) 1,1-Ди-
метилциклопропен. ж) 3,5-Ди метилцикло гекс адиен -1 3.
6-2.
а)! F^C^GEGl. б); [(CH^CCHjljC^CI-L в): СН2-.СНСЯ.2СН^СИСН8
Д)1 (CHi ==СН}аС’=С=CHCFbs СНа.
6^3. QH10 — пентен-5; СеН1г — циклогексан; СДТи —2-метилбутен-2.
15-4.
химический сдвиг
JBC
JAG = *JBC
0) Г"
/лв = JBC — АС
(Резонансные сигналы синильных атомов водорода: две.
группы из пяти линий, расположенных на равном рас-
стоянии, с соотношением, интенсивностей* i : 4 :6 : 4 : Г
Резонансные сигналы метильных атомов водорода: трип-
. лет с соотношением интенсивностей I ; 2 : 1
( Резонансные сигналы ванильных атомов водорода: две
I группы из двух перекрывающихся квартетов с соотнО-
1 щением интенсивностей в каждом 1;: 3; 31
J АВ = J-J В С — ~2 J А С {
х у X у X у
Резонансные сигналы метильных атомов водорода: триплет
соотношением интенсивностей 1:2:1
'12 № 1540
674
ОТВЕТЫ К УПРАЖНЕНИЯМ
.СНЭ
I
6-5. СН3—С = СН—СН3: винильиый протон расщепляется на 1:3:3: 1-квар-
тет на соседнем метильном протоне, но расщепление в значительной степени за-
маскировано рядом эффектов. Половина дублета, ожидаемого для концевых ме-
тильных протонов, накладывается на (СН3)а-сигНал; другая половина маски-
руется боковыми сигналами в сильном поле при 1,8 м. д.
СН3
СНа=^—СНаСН3: типичный пример спектра этильной группы (триплет —
квартет), содержащий сигналы при 1,1 и 2,0 м. д.; другие сигналы но существу не
расщепляются.
СН«=СН—О—СНаСН3: мультиплеты .(триплет — квартет) от протонов
этильной группы находятся при 1,1 и 3,5 м. д. Другие сигналы обусловлены ви-
нильной группой. Пик при 6,5 м, д. отвечает =СН~О— протону, неодинаково
расщепляющемуся на двух других винильных протонах. КонпевыеСН ..-протоны,
лишь незначительно взаимодействующие Друг с другом, приводят к появлению
семи линий в интервале от 3,8 до 4,4 м. д. (см. разд.'2-6,В).
6-7. Если электроны1 двойной связи поглотят энергию (под действием электро-
магнитного излучения); достаточную для разрыва половины двойной связи и об-
разования бирадикала (R2C—С^г), станет возможным свободное вращение во-
круг связи С—С. Необходимые 63 ккал (разд. 6-4) могут быть обеспечены при по-
глощении алкеном света с длиной волны 4500 А.
6-8. а) Цикло ал йены с малым гГ’среднпм размером цикла.
ОТВЕТЫ К УПРАЖНЕНИЯМ
675
б) Соединения типа
(СН3)аС СНз
Хс=с/
СН3СН2СН3СНа ЧС(СН3)з
которые, согласно правилам (разд. 6-5), называются ^«с-алкеиами.
6-9, Рот=309мл, Ра= 19,32 мл; ц=3,76 Д, в=2,66 (мольная фракция, 0,0202).
Р и, следовательно, Рц изменяются с изменением концентрации, что связано с
ассоциацией молекул в растворе, которая исчезает при бесконечном разбавлении.
- Дипольный момент очень чувствителен к этому эффекту, так как тенденция моле-
кул к упорядоченности в прилагаемом электрическом поле в значительной сте-
пени определяется ассоциацией. С другой стороны, Rm представляет собой поля-
ризуемость самих электронов в молекуле и в гораздо меньшей степени зависит от
ассоциации. Приравнивать Rm к Ра неверно, так как атомы в электрическом поле
л могут двигаться так же, как и электроны; а поскольку это движение при частоте,
' используемой при определении Rм, по-видимому, медленное, величина Rm вклю-
' чает поляризацию электронов, но не атомов. Строго говоря, Ра должна быть эк-
страполирована к бесконечной частоте, для того чтобы она отражала как атом-
ную,. так и электронную поляризацию. Однако обычно атомная поляризация не
очень велика.
6-10, СО,, (тетраэдрический), О Д; СН3С! (тетраэдрический), 1,8 Д; СНаСНаС!
; (тетраэдрический), 1,8 Д; CHg=CCIa (<120°), 1,1 Д (с поправкой па ванильную
группу) цнс-С1СН=СН1 (<12Gj. 1,1 Д (с поправкой иа вин ильную группу); транс-
, C1CH=CHI (<i20°), 0 Д. Для дис-1,2-дихлорциклопропана дипольный мо-
' мепт определяют следующим образом. Сам циклопропан имеет Ц=0. Поэтому, если
мы удалим один водород, результирующий момент вдоль оси связи С—Н будет
составлять 0,4 Д. Если затем заменить водород на хлор, момент будет равен 2,2—
0,4= 1,8 Д (при условии, что момент связи С—С обычный). Если мы заменим два
1,2^£щ-водорода на хлор, получим два момента связи 2,2—0,4=1,8 Д с углом 6
между ними (0 еще следует определить). Если принять, что связь Н—С—С1 —
тетраэдрическая, то угол между связью С—С1 и вертикальной осью кольца состав-
ляет (180—109,5): 2=35,25°. Обозначив длину связи С—С через %, получил», что
расстояние от атомов углерода до точки пересечения моментов связи С—Ci равно
(Х'2)ЛСО5 30° sin 35,25°)=^, и поэтому 0=60° (равнобедренный треугольник).
Рассчитанный момент молекулы будет тогда равен 2-1,8 cos 30°=3,1 Д, В дей-
ствительности момент связи С—-С1 в циклопропане, по-видимому, меньше 2,2 Д
из-за ненасыщенного характера циклоиропанового кольца.
676
ОТВЕТЫ К УПРАЖНЕНИЯМ
6-/7. 64% А с ц=0 и 36% Б с (1=3,1 Д.
А
Б
6-12. Следует ожидать, что цис-изомер будет иметь больший дипольный момент
(5,1 Д), а дипольный момент транс-изо мер а будет 0=3; 1 Д в зависимости от
процентного содержания аксиально-аксиальной и экваториально-экваториальной:
конформаций; Вопрос будет более сложным, если конформер типа ванны будет :
присутствовать в заметных количествах,
6-13.
а) С—С—С-С = С==С
М-бутнлэтнлен
гексен-i
С-С-С-С=С—С
1 -нети л-2-Пропил Этил ей
гексен-2
цис й транс
С-С — С=:С —С—С
сим м. дизтй л эти лея
гексен-3
цис и транс
>-с-е-с
1.Г-днмётпл-2-этилэтилен
2-мет11лпенТёН-2
1 -Метил- 1-пропилэтнЛен
2-метилпентен-1
-С=С-С
1-изопропил -2-метилэтилен
4-метилНейтёй-2
цис и nipatic
нэобутйлётяЛен
4-металпентен-1
smop бутйлэт йл е й
3-метилпентен1
С
С=С—С=С—С
1-этил-1,2-дямеТйлэтилен
З-метилпентек-2
цис к транс
С
I!
С-С-С—С-С
тетраметилэтилеи
2.3-диметилбу тёп.2
1-изоп роиил-t-Метйлэтилен
2,3 - димсти л бу те а-1
1,1-дйэтилэтнлен
2-этил бутен-1
С
С—С—С=С
i
трет -бутйлэтиле н
3,3 -диметилбутен -1
б) СН.
/Чк Н н Н Н Н Н: Н Н Н
I I СНзс1 J- X X . £ t 1 СН; CHS
GH’ H : £h, li ^_CH, H CH. li CH. A; |j | ;
ch./x'
ОТВЕТЬ! К УПРАЖНЕНИЯМ
677
6-/4.. Минимум энергии для процесса взаимопревращения цис — транс равен
АН* (разд..3-7,Г). Приемлемая величина получается из (82,6—26,4—3,0)—53,2
ккал, где 82,6 ккал — энергия
£Н3 СН3 разрыва обычной С—С-связи, 26,4
\ >—// / 2 уг ккал — напряжение в самом никло-
го У СН3—СН СН—СН бутане и приблизительно 3,0 ккал—
’ ' это энергия, которая требуется для
того, .чтобы метильные группы в
Час-изомере были незасловенными.
Глава 7. Алкены. Реакции двойных углерод-углеродных
связей
7-1. Сильные электрофилы: H2S04, HBF4, SO3, А1С1 3, Ag®; сильные нуклеофилы:
®NH2; Слабые электрофилы NH3, Н2О, Вг,; слабые нуклеофилы; NHS, Н,О, Вг,,
С1®; не обладают ни свойствами электрофилов, ни свойствами нуклеофилов:
Na®, CHi, (СН2)3, BF4.
7-2. С использованием данных табл. 3-7
СН3СН2- 4-Н2 —> CHSCH3-|-H. АН = -f-8,2 ккал
СНз = СН»+Н----->-СН8СН2. АН й-3б: ккал
Во второй стадии выделяется большое количество энергии, но первая стадия
невыгодна, и при комнатной температуре эта реакция не происходит, несмотря
на то что суммарное значение АН благоприятно для" реакции (—28 ккал).
7-3.—9,3 ккал; AS положительно вследствие большей свободы вращения метиль-
ных групп в транс-изомере.
7-4. F2 —132,2 ккал; С! у— 40,8 ккал; Вг2 —26,7 ккал; 12 —2,7 ккал, При при-
соединении фтора выделяется энергия, достаточная для разрыва связей С—С и
С—Неприсоединение 1а представляет собой энергетически пограничный случай
в смысле возможности протекания реакции.
7-5. Первая стадия: F—о2,8 ккал; О—17,8; Вг—4,8; I +12,2. Вторая стадия:
F —79,4; С1 —23; Вг —21,9; 1—14,7, Этот путь реакции выгоден для всех
галогенов, кроме иода, хотя в случае фтора могут преобладать другие реакции.
Xs+CHa=CHa —t- ХСНаСНа.4-Х. ДЯ.=—16,2 для X=F
Приваденная выше реакция инициирования возможна только в случае фтора.
7-6.
Об© 6®
. НО—С1
б) СН3СН2ОС1. ДН=—10,4 ккал; СН,ОНСП2С1, Д//=-51 ,3 ккал. Слабая кис-
лота, такая, как FI0C1, .не протонирует двойные связи. Она более эффективна как.
донор С1®.
7-7. ДН=—10,4 ккал; концентрация Н3О® в водном растворе NaOH так мала,
что эффективного протонирования алкенов не происходит.
7-8. Различные продукту; Ц нс-дибром ид из трапе-цикло децен а и транс-дибром ид,
дз if ис-цик до децен а,
678
ОТВЕТЫ К УПРАЖНЕНИЯМ
7-Р.
СН3 СНз ®сн2
СНЭ—С—Вг Z- СНЭ- С® В г® Д. СН8-СН-ЬВг9
I 1 ।
СНа СН3 СНз
(СН3)2СНСН2Вг
£=4,5; таким образом, количество изобутильного производного при равновесии
составляет 18%.
7-/0. (СН3)2С=СНа>СН,СН=СН3>СНа=СН2, что находится в согласии с ожи-
даемым на основании устойчивости карбо лиевых ионов; трет-бутил^изопро-
пил>этил.
7-11.
СН2 = СНа (газ)4*НВг (газ) —► СНаСНаВг (газ) Д//= —16 ккал
______НВг (води) —* НВг (газ)+вода__________ДЯ=-|-20 ккал
СН2 = СН2(газ)+НВг (води)—>СН3СН2Вр (газ) + вода ДЯ=Ц-4 ккал
7-/2.
a) (CH3),CHOSO2H. б) (CH3)2C(F)CH2OH. в) (СНз)аС(С1)СН(1)СН3.
г) HO-(i-N-H. Д) (CH3)sCSH.
7-/3.
(СНэ)3С = СНСН34-Вга (СНг)^-СН(Вг)СН8
В г®
--------> (СН3)2С(Вг)СН(Вг)СНа
Ci®
--------> (СН3)аС(С1)СН(Вг)СНз
(СН3)2С(ОСНз)СН(Вг)СН3
7-/4.
(СН3)Д-СН(Вг)СН3
а) :С1-С(СЦ=СНг -<------>
|hci
CljC-CH,
® &
:С1=С(С1)-СНг
НС1
б) (СН3)2С=СС1г —> С(Н9)аС(С1)СНС12
Совместное действие индуктивных эффектов метильной группы и хлора должно
привести к ориентации, описапнпой выше.
© ©
в) CF3-CH=CH-Ci: -<—*- CFj-CH-CH=cr.
|HC1
CFJCHaCHCl2
ОТВЕТЫ К УПРАЖНЕНИЯМ
679
CF3 является сильной электроноакцепторной группой.
, Ф © © Ф
г) CH3O-GH=CHF -*—*- CH3O=CH-CHF -«—> CHj-O-CH-CH=iF
|НС1 (1] [21
CH3OCH(C11CH2F
Можно предположить, что структура [ 1] является более существенной, чем струк-
тура [2].
7-/5.
a) RO- + HC1 —► ROH+C1. ДЯ=-7,4 ккал
/С=С<^+СЬ —>- —С—С—С1 ДЯ= —17,8 ккал
—C-C-Cl-f-HCl —► Н-С—С-С1+С1. ДЯ= 4-4,5 ккал
б) RO- + HC1 ROC1 + H- ДЯ= 4-51,2 ккал
^С=С(^4-Н- —> H—<i—С— Д#=— 35,5 ккал
Н—С-С—4-НС1 —> Н—c-i— С14-Н. ДЯ= 4-22,2 ккал
Очевидно, что инициирование и вторая стадия развития цепи в механизме (б) не-
благоприятны. Отметим, что обе стадии для присоединения НС1 в соответствии с
механизмом (а) имеют отрицательное значение АН. Поэтому вряд ли свободно-
радикальное присоединение НС1 будет благоприятным, и, действительно, оно про-
исходит только в немногих случаях.
7-/5.
RO-4-HX —ROH4-X.
I
с-х
I I I
_С—С —Х-|-НХ —н-с—с~х
I I 11
ДЯ=4-24,0 (F)
АН= — 7,4 (С1)
ДЯ=—39,2 (I)
ДЯ=—52,8 (F)
АН= —17,8 (CI)
АН= 4-12,2 (1)
ДЯ= 4-35,9 (F)
АН = 4-4,5 (С1)
АН = — 27,3 (I)
Энергетика реакции, протекающей по такому механизму, неблагоприятна в случае
фтористого водорода вследствие большой несбалансированности энергий отдель-
ных стадий, обусловленной в‘ особенности большим положительным значением
АН инициирования. Присоединение хлористого водорода относительно благопри-
ятно. Не следует ожидать легкого присоединения по этому механизму йодистого
водорода из-за положительной величины АН первой стадии развития цепи.
680
ОТВЕТЫ К УПРАЖНЕНИЯМ
7-17.
• RO-4-CBrCJ3—*- ROBr-{--CClj ДЯ=-{-20 ккал
(CH9)(CHS)5CH:=СНа 4- • ОСЬ ts*. СН3(СНг)5СНСН2СС1 я. ЛЯ = — 19.4 ккал
(Chs)(Chs)5ciich2(:<:i3-'; свгсц —н сн3(снг)йсн(Вг)а1гсс1п г-са3
&Н=0 ккал
Альтернативный процесс инициирования:
RO«4-S>C=C</ —-.RO—С-С- Д//.-=—22,3 ккал
7 4 • II
RO—С—Ь-ф-ВгСС^ —> RO—d—(5—Вг+..qCJ^. А//.= 0 ккал
Направление присоединения определяется местом атаки • СС13—. благоприятным
положением является конец цепи, что приводит к образованию вторичного ради-
кала. '
7-18. Как видно из рис. 7-7, бор более электроположителен, чем водород. Следо-
вательно, мощно, ожидать, что боргидрид будет, присоединяться к алкену как
© © 4
В:—Н, Направление присоединения к пропилену должно бьЛъ таким,, чтобы
образовался СНаСН2СН„—в/, что и происходит в действительности-.
7-19.
б)
+ Вгн6
7-20. Для углеводородов А и Б на основании элементного анализа и температур
кипения можно предположить формулу CaHJ2 (см. рис. 3-1). Эта формула, а также
реакции с бромом, перманганатом и озоном дают основания считать, что А и.Б ।
представляют собой цис- и транс-изомеры гексена-2 или: гексена*3;
- Н. ,СНаСН2СНа
CHaCHs/C
н\з /Н
CHS CII2CH2CtIg
СНВСИВЧ лСНаСН»
>с=с<
н/ N1
Соединение А является, вероятно, ^we-изомером, так как оно имеет более низкую
температуру плавления и более высокую температуру, кипения (см. упражнение
4-14). Это предположение для гексена-2 можно подтвердить данными ЯМР-сиект-
рбв углеводородов А и В,; а именно константами; расщепления цис- и, тррнр.-вррр-
родов, однако для изомеров гексена-3 такой метод неприменим, поскольку в этом
случае протоны эквивалентны. Продукты озонирования будут идентифицированы
как ацетальдегид н масляный или про плановый альдегид.
ОТВЕТЫ К УПРАЖНЕНИЯМ 681
7-21.
©
,а) (СН3)2С=СНСН8 —> (GH8)2GCH2CH3+HSO?
® © - н®
(CH3)jCCHjCH34-(CH3)aC=CHCH3: —> (CH3)aCCHG(CH3)2CHaCH3------
Jh8
— (СН3)2С=С(СН3)С(СН3)аСНаСН3 Ч-СНа:=С(Ьн3)СН(СН3)С(СН3)аСНаСНа
Ни один из этих продуктов не даст при озонировании бута в он-2, как это
описано в пункте (б),
н® © -п®
б) (СН8)2С^СНСН8 ш '(Сн3)асена’сн3 “Z2 СН2 = С(СН3)СН2СН3
(СНв)2ОЗНаСН34-СНа=С(СН3)СН2СНэ --* (СН8),ССН2С(СН#)СНаСНв >
(!н2СН3
ъ,
—> (СН3)2ССН=С(СН3)СНаСН3 —ь (€Н3)аС —СНО-{-СНгСОСНэСН8
снзсн» chx'h3
7-22.
Л{СНг)лСНаСН3-' + --«-
н
-----»- R(CHa)„CHaCH3 + R(CHa)nCH=CH3 AH = -63, Z ккал
2К(СНа)ЛСНгСКг- ~-^4- R{CHJJrt + tR АЙ = -82,3 ккал
Рекомбинация гораздо более предпочтительна, но это весьма неподходящий при-
мер для демонстрации параллелизма между скоростью и ЛН (раза- 3-7Г).
7-23. Присоединение протона;
н®
(СН3)2С=СНа (СН'з),С®
ТйДрйдный пёреНос;
(CHjhCH^’CII, + (CITjhC® ; -4 *'
4- (CiysCD ;
Ф '
(CH3)!1C-lJCHi
+ (СН3ЙС®
В присутствии изобутилена не должно происходить образования сколько-нибудь
значительного количества так как перёнос протона между кислородом и
третичным углеродным атомом очень незначителен или не происходит вовсе. Та-
кой 'Перенос осуществляется между кислородом н первичным атомом углерода,
Это в особенности ийтересйый результат, -поскольку для реакций углеводородов
в соответствий с приведенной выше закономерностью следовало бы ожидать об-
мена изобутана с D2SO4 при третичном атоме углерода; в действительности же
682
ОТВЕТЫ К УПРАЖНЕНИЯМ
обмен происходит гораздо быстрее при первичных атомах углерода, см. упражне-
ние 7-34.
7-24.
a) (CHsJjC—СНа
Н2О, HjSO4 (10%)
---------;----У (СНа)3СОН
2Б "С
HF
_____►. (CHS)3CF (при низкой температуре полимериза-
- во °C Ния уменьшается)
Вг„ NaOH
--------+ Сн3СН(ОН)СНаВг
25’С
1. 60%-ная H2SO4, 70 °C
--------------ь (CHs)sC(I)CHaC(CHJ0#
2, HI “
60%.ная H2SO4
> СН8 — С(СНз)СН2С(СНд)3-|-
70 ’С
л В0%
О,
-)-(СНа)гС=СНС(СН3)8 —* СН3СОСНаС('СНа)а -{-более низкокипящне карбо-
20% , нильные соединения Ci—C5
е) (СНэ)2С=СНа + НВг -е—LHCI1>. (СНа)аСНСН2Вг
25 °C
HF SOC1,
ж) (СН3)яС = СНа+(СН3)3СН —* (СН3)3ССНаСН(СН3)2----------
—С1СНаС(СНа)аСНгСН(СН3)а (около 35%)
1. в,н,
з) СН3СН=СН,------------- СН3СНаСНаОН ‘
2. н,о,
и) СНа = С(СН3)СНаС(СН3)а [из реакции (д)]
—к НОСНаСН(СН3)СНаС(СН,)э
/<МпО4, НгО
к) СНа=С(СНэ)СНаС(СНа)в -----:------- HOCHaC(OH)(CHj)CHsC(CHa)s
б) (СН3)3С=СНа
в) СНаСН=СН8
г) (CHa)sC=CH3
д) 2(СНа)аС=СН2
1. в,н4
2. 1^0,
Измеренный объем стан-
дартного раствора КВг—
КВгОз помещают в колбу.
К нему прибавляют не-
большое количество сер-
ной кислоты, а затем не-
большое количество смеси
гексана и гексена до тех
пор, пока желтая окраска
раствора, обусловленная
бромом, не станет заметно
светлее. Процедуру пов-
торяют до тех пор, пока
не будет прибавлено нуж-
ное количество смеси гек-
сана и гексена, объем ко-
торой отмечают. После
этого к раствору КВг—
КВгОа добавляют избы-
ток KI и НаЗО4, и выде-
ОТВЕТЫ К УПРАЖНЕНИЯМ
683
ляющийся иод определяют обратным титрованием, используя стандартный раствор
тиосульфата натрия; последний добавляют из бюретки, помещенной вместо той,
в которой содержалась смесь углеводородов. Рассчитывают вес прибавленного
гексана и, зная вес прибавленной смеси, определяют процентный состав.
Другая методика, которая сводит к минимуму влияние кислорода, состоит
в следующем. Колбу снабжают небольшой капельной воронкой с двухходовым
краном. Аликвотное количество стандартного раствора КВг — КВгО3 (избыток по
отношению к рассчитанному количеству) помещают в колбу, которую затем отка-
чивают на водоструйном насосе. Взвешенный об- <—।
разец, если он очень летуч, сначала можно помес- I
тить в колбу в ампуле — или же в эвакуирован- 1 1
ную колбу через воронку, Затем из воронки
добавляется кислота, причем в Это время необхо-
димо соблюдать осторожность, чтобы исключить Я
возможность попадания воздуха. Если образец
находится в ампуле, его освобождают, резко V 7
встряхивая колбу. Реакцию лучше проводить \I
в темноте, чтобы избежать реакций замещения. [к
Когда прибавление заканчивают, добавляют рас- / \
твор KI и иод оттитровывают тиосульфатом, / \
лучше в атмосфере азота. • / \
7-26. / \
HaOj -MCHsh —* НОСН2СН2ОН ( )
ДЯ=—72,8 ккал <
Н2Оа + (СНа)в —+ НО(СНа)вОН ампула с образцом
Д//=—-53,4 ккал
а) Никакие, б) Должны быть учтены теплоты испарения реагентов и продуктов
реакции, в) Кислоты (например, НСО2Н) содействуют распаду Н2Оа по типу
Q ©
HQiiOH, как это представлено ниже;
н® ® © CHS=CH, © н,о
НООН —> НаООН —>- НаО+ОН--------------> НОСНаСИ2------->
—> НОСНаСНэОН + Н®
7-27.
HOH + RO- —ь ROH+HO- ДЯ=0 ккал
CH3CH=CHa4-I-IO- —> СН8СНСН4ОН &Н=~22,3 ккал
CHsCHCHaOH4-HOH —>- CHSCHSCHSOH+HO. ДЯ= + 1Г,9 ккал
При присоединении воды к пропилену энергетический баланс двух стадий разви-
тия цепи таков, что цепи, по-видцмому, не будут очень длинными, и нецепной ме-
ханизм будет более вероятен, поскольку каждая отдельная стадия развития цепи
для процесса присоединения сильно зкзотермична.
СН3СН = СН3
н. . но.
----►CH3CHCHS ------> (СН3)аСНОН
ДЯ= —35,5 ДЯ = —85,5
НО- . н-
---> СН3СНСНаОН —ь сн3сн2снаон
ДЯ=-22,3 ДЯ=—98,7
Первоначальное присоединение Н • должно привести к образованию пропанола-2,
а присоединение НО —к пропанолу-1. Кроме пропанола-1 и пропанола-2, мож-
но ожидать образования пропана и пропандиола-1,2.
= 1584 ОТВЕТЬ! К УПРАЖНЕНИЯМ
7-28. Указанный продукт не образуется в сколько-нибудь заметном количестве,
так как атака D®на третичный атом углерода в, сравнении с вторичным вряд ли
предпочтительна, Вероятные продукты реакции будут образовываться по следую:
щей схеме; '
По-видимому, атака радикала • SH приводит к аксиальной SH-грудпе и экватори-
альному хлору. Образования ^-продукта следует ожидать и том случае, если
атака Н-S произойдет, раныре, чем конформационный переход, который дает более
устойчивое экваториальное расположение SH, трдас-Продукт может образовать-
ся из радикала с экваториальным SH и экваториальным хлором. Если концентра-
ция IfaS высока, То прежде чем произойдет конформационный переход-, образуется
значительное количество нле-продукта[см. Gering Н. L.. Reli/ea.D. 1. LarsenD
IF.,J. Am. Chem. Soc„ 78, 3.48 (1956)11 ,, " ’ "
ОТВЕТЫ, К УПРАЖНЕНИЯМ
685
7-30.
RO-
NH3----с -NHj + ROH ДЯ= —17,2 ккал
")-C=c/+ -NH2 —f-^C—i—NH2 ДЯ= — 9,6 ккал
/ 7 I
\з—c—NHa4-NHs —* HC—6— NHa+ -NH2 ДЯ = —5,3 ккал
7 I I !
Энергетический баланс между стадиями развития цепи таков, что реакция, по-
видимому, возможна (суммарное значение: ДЯ-—-14,9 ккал). Если реакция про-
изойдет, будет происходитьпреимущественио присоединение против правила Мар-
ковникова, так как ориентация определяется главным образом структурой сво-
бодного радияалд, образующегося на стадии присоединения, При.полярном при-
. соединений аммиака к изобутилену в присутствии серной кислоты в качестве ката-
лизатора почти весь аммиак и ббльшая часть катализатора будут связаны в ионе
, аммония, и поэтому скорость присоединения будет (в практическом плане) нич-
тожной.
' 7-31. г)—49,4 п ккал, б)—19,4 ккал, в) —87 ккал, г) —169,4 ккал (СО2) й
—147,2 ккал, (СО)-
7-32, и тронс-Циклооктен. б) Нет; при ijwc-гидроксилированин цис-изоме-
ра образуется чпс-двол, в то время как /лрдас-изомер даст традс-диол.
КМпО4 у
нго
г/ьс
(CH3)3-fCHs-C.Ha . (СН3),С-СН2СН^ (CHs)3CCH2CH2Ci
Образование первичного катиона - - не очень благоприятный процесс. Альтерна-
тивным механизмом будет следующий:
(CHjJjC® + CJT2=CH2
(CHj)j
.с
О
С1 *
(CHjJjCCHjCHjCI
686
ОТВЕТЫ К УПРАЖНЕНИЯМ
7-34.
D® ®' ~нФ
а) (СНа)4С=СНа TZt (СНэ).,ССН,0 ---* (CH3)2C = CHD и т. д.
© ф
(CHa)2CCH2D + (CH3)3CH (CH3)2CHCH2D4-(CH3)3C
Ь® ф
(CH3)2C=CHD (СН3),ССНО2
(CH.3)„?CHD, J-(CH3)3CH (CHs)2CHCHD2 и t. д.
Отметим, что водород при третичном углеродном атоме изобутана претерпевает
межмолекулярный обмен и не обменивается с дейтерием из D2SO4.
б) Это может происходить из-за того, что обмен протонов трёт-бутил-катиона
с дейтерием из растворителя осуществляется быстрее, чем реакция переноса про-
тона между изобутаном и mpem-бутял-катионом.
D® © “D® ф “и®
(СН3)2С = СНа ^Z±(CH3)3CCH„D ;-*-(CH,hC=CHD ^±(CHS),CCHD3 --*
(CH3)2C=CD2 и т. д.-ч- (CDa)sC®+(CHs)3CH Z2 (CD9)3CH+(CH3)3C®
Глава 8. Алкины
8-1. а) 1-Хлорпропин; хлорметилацетилен. б) 2,2,6,6-Тетраметилгептин-З; трет-
бутил неопентил ацетилен, в) Гептад иен-1,6-ин-З- алл ил винил апетилен. г) 6-Метил-
гептен-6-диин-1,4; про пар Г ил-(2-про пен и л) ацетилен. д) Ди-(1-циклогексс[1нл)аце-
тилен. е) Циклодецин.
8-2. а) В И К-спектре единственными идентифицируемыми полосами будут по-
лоса вблизи 2900 см-1 (СН валентные колебания) и полоса в области 1400 см~*
(СН деформационные колебания) (см. разд. 3-3). Валентные колебания связи С=С
будут отсутствовать вследствие симметрии (См. разд, 2-4). В ЯМР-спектре имеется
только один сигнал приблизительно при 1,0 м. д. б) И К-спектр: полосы =С—Н
3300 см-1 (сильная); С=С ~210() см-1 (средняя), ЯМР-спектр: квартет (7^3 Гц)
при 2,5 м. д. и дублет (J~3 Гц) при 1,0 м. д. в) Как в (а), за исключением того, что
в ЯМР-снектре будет присутствовать набор линий триплет — квартет, типичный
для этильной группы, г) чпс-Изомер: =СН 3300 см-1 (сильная); =СН 3100 см-1
(средняя); Сн=С 2100 см-1 (сильная) или при более низких частотах; С=С
1020 см-1 (сильная) или при более низких частотах. В ЯМР-снектре сигналы,
обусловленные двумя эквивалентными цивильными протонамй (~5,3 м. д.) и эк-
вивалентными ацетиленовыми водородами (-~2,5 м. д.), скорее всего, будут слож-
ными из-за «дальнего» взаимодействия (см, разд. 2-6,В). транс -Изомер; спектр
подобен спектру ^щ:-изомера с тем отличием, что валентные колебания связи С=С
при 1620 см-1 будут, вероятно, очень слабыми или отсутствовать вовсе, д) Харак-
терные полосы в НК-спектре такие же, как в (а) и (б). В ЯМР-спектре должен
присутствовать уширенный мультиплет от протонов СНа-группы.
8-3.
Си®(МН,),С1® НС1
а) 2СН^СН----------->-Н2С=СН—С^СН —>Н4С=СН—С(С1)=СНа
беэв. HF НВг _
б) СН8С = СН--------> CH3C(F) = CHa-------> CHaCH(F)CH2Br
перекиси
HgSOj
в) СН3СНгС^=СН+Н2О ——<- СН3СН2С(ОН)=СНа —> СНаСН2СОСН3
HsSO4
ОТВЕТЫ К УПРАЖНЕНИЯМ
687
R,0H Нг0г. ОН
г) CH3CH,CsaCH-----СН3СН2СН = СН- BR2-------------
сн3сн2сн=снон —снаснгсн2сно
[К-ди-(3-метил-2-бутил)боран]
Н„ Pt
д) СН3С = ССНд----->• СНаСН = СНСН3 {цис)
сн3сн3 н
RSBH X z CHjCOjD
е) CHsCHgCe»CH ------- С«С( --------------—►
У BRS
8-4.
а) НА+®ОН Н2О + А9
!на^е-1.|н.о)[^]1н<в1=!н^:_[Н,0|10-,
(НЛДОН] [H®][OH]fHA]
[*9]
[НА||ОН|
= Ю“® -------------------- 10-а
Х= 1 >4 10“® моль/л.
б) См. текст, разд. 8-6. в) Большая электроотрицательность азота по сравнению
с углеродом придает цианид-иону большую стабильность по сравнению с ацети-
лен ид-но ном-
8-5.
Н Вт НН
НЛ /С=С
С=С сн3
н н
г) Вг-С=С—Вг
А) Н2С=СН-СйС-СН=СНг
8-6. а) —36 ккал, б) —26,7 ккал, в) —20 ккал, г) —15,4 ккал, д) —28,8 ккал,
е) —9,4 ккал. ж) +1,6 ккал. Значение АН в случае (е) ненадежно, так как оно по-
лучено в предположении, что энергия связи С--С в аллене равна энергии обычной
С=С-связи. Величина же, полученная из теплоты гидрирования, показывает, что
в действительности эта связь менее прочная.
8-7. Да, Катион ртути действует подобно кислоте Л ьюиса и атакует ненасыщенный
углеродный атом алкена в такое положение, чтобы промежуточно образующийся
карбониевый ион был наиболее устойчив.
ОТВЕТЫ К УПРАЖНЕНИЯМ
688
8-9.
RC CCi + НО®
а) R-СэС-H-|-0He -J_ RC =
298
PS = 2I,7 атм
8-8. Пусть Т — конечная температура,
Г
Выделяющаяся теплота~-С(г) \ (кал*г“,-град~’)аТ'-}-
298
Т
4-Н (моли) (кал моль ~Х- град"1) d7*
298
Т ~
54 200 = 24 J МТ 4-1 J (6,54-0,0097) dT
29Й 298
!= 144 (7 — 298) 4- 6,5 (Т—298) 4~^р (73—2983)
= 0,00457’4-150,57—99 449
7 = 648#
МГ n,t3
р P>ViX3T2 10" Г-648 v,
д—Гт. г7~ --- И!®*!)
б) Нет. В случае этилена атомы водорода являются недостаточно КИСЛЫМИ для
образованияйниоиа ивместо замещения происходитприсоединеиие.ЭТан -является
насыщенным по отношению к этим реагентам-. •
8-10.1) н-Пентан можно легко идентифицировать по его неспособности обесцвечи-
вать растворы KMnO4.H Вг2 вСС14.2) Пентин-1 даст осадок соли серебра с аммиач-
ным раствором серебра, 3) Пентен-1 можно отличить от пентин,з-2 по количеству
Вга, взятого в расчете на известные количества каждого.
8-11.
Химическая проба Спектральные методы
a) Ag(NHe)f
б) См. (а)
в) Проба на ненасыщенность (Вга
в СС14; КМпО4)
г) Почти единственным надежным
методом является окислитсль-
ное расщепление
а) валентные колебания С—Н и С=С
концевой ацетиленовой группы
б) См. (а), а также валентные колеба-
ния связи G= С сопряжённого диена
в) В ЯМР-спектре должны проявиться
алифатические -водороды
г) В ЯМР-спектре одного, соединения
будет присутствовать не расщепленный
метил и сигнал (дублет—с ейтет) от
изопропила; в спектре другого—сиг-
нал (триплет—квартет) от этильной
группы
Глава .9. Метод резонанса и некоторые его приме-
нения. Метод молекулярных орбиталей
9-1. См. текст-
9-2. В принципе плоская цнс-флрма бутадиена является наиболее стабильной (с
точки зрения метода резонанса) из трех форм, так как C-i л С-4 рйёполбжёнь! ;;о-
ОТВЕТЫ К УПРАЖНЕНИЯМ
689
стяточно близко друг к другу. Однако в ней имеется также наибольшее простран-
ственное взаимодействие между несвязанными «внутренними» водородами
Для транс-формы резонанс имеет 'несколько меньшее значение из-за длины фор-
мальной связи, однако меньшее пространственное взаимодействие будет обуслов-
ливать большую стабильность транс-формы пр сравнению с цис -формой.
*Для твист -формы будет характерна лишь незначительная резонансная стабили-
зация.
9-3.
Пун ктн р ИЫс линии ЪТр ажлюттогф Ййт, что в кл ад трех по сл СдЦ н х'форм о пю с Н’ГСЛ ь •
Но невелик.
.9-4, РёзонанС tie Titter сущсстеСниого зпачекия. ИЗображеНные-структуры соот-
ветствуют этилену и ацетилену в очень 1-:апряяс<’Н1Гыхкон1[юрмпийй'х относительно
их обычных устойчивых структур Действительно, ёсЛй бы'р&бнанс бйл важен,
цн клбб у теноТюе КО Л ьцо с о держало бы о тносите льно Длин ные Д.,4 - й 2,3 -связи, пр и -
чем вин ильные, йтбмы водорода стремились бы расположиться гиа одной прямой с
Умильными углородными атомами. Спязи С—Н и С—С обеих мйчйеноаых групп
имели бы тенденцию расположиться в плоскости, перпендикулярной плоскости
кольца.
Н-С=С-Н
Н. >Н
’С—
H-C^esC-H
9-,5. Да. Биполярные резонансные формы Хв и Xг при «сдут к увеличению диполь-
него момента акролеина, как это .представлено в основной структуре Ха.
690
ОТВЕТЬ! К УПРАЖНЕНИЯМ
9-6.
©
:с№
CsO
HZ
9-7,
Следует ожидать, что резонансный момент будет действовать в направлении, про-
тивоположном индуктивному эффекту, поэтому дипольный момент фтористого ви-
нила будет меньше дипольного момента фтористого этила.
9-8. а) Не имеет существенного значения, так как нарушено правило об одинако-
вом расположении всех ядер в структурах, вносящих вклад в резонансный гиб-
рид, б) Не имеет существенного значения (см. упражнение 9-4). в) Ни одна из форм
не является особенно предпочтительной — структура с положительным кислоро-
дом относительно неблагоприятна. Резонанс будет иметь некоторое значение, даже
если не предполагается, что данная структура будет очень стабильной, г) Не имеет
существенного значения по пространственным причинам. Двойная связь при атоме
углерода в голове моста бициклической структуры будет очень сильно напряжена,
д) Не имеет существенного значения, так как одна форма представляет собой силь-
но искаженный аллил-катион н не будет вносить заметного вклада в структуру
циклопропил-катиона. е) По-видимому, имеет существенное значение, так как
включает резонансную стабилизацию первичного катиона. Постулируемый здесь
резонанс является весьма сходным с резонансом в аллильном катионе, ж) Возмо-
жен, если исходить из соображений электроотрицательности. Менее приемлем на
основании пространственных факторов, ибо структура, приведенная справа, в
благоприятной геометрической конфигурации будет содержать два фтора, углерод
и кислород, расположенные в Одной плоскости.
9-9. Бутадиен-J,3 3,5 ккал; певтадиен-1,3 6,5 ккал; пентадиен-1,4—0,2 ккал;
циклогексади ей-1,3 1,8 ккал и стирол 38,6 ккал. Значения энергии стабилизации,
определенные из теплот сгорания, обычно менее надежны, чем те же данные, полу-
ченные из теплот гидрирования. Причина этого состоите том, что они вычисляются
по разности между двумя очень большими значениями, и, кроме того, рассчитан-
ную теплоту сгорания находят из набора значений энергий связи, в какой-то сте-
пени условного.
9-10.
а) С6Н54- 13/2О2—-5СОа4-ЗН2О (жидк.)
ДЯсгор = 6(С-Н)+2(С=С)+3(С-С)+б1(0 = 0)-10(С=0)™6(0-Н)—
—3(ДЯнспН2О) = 6-98,7-^2-145,8 4-3-82,6+6,5-119,1 —10-192,0—
—6-110,6 — 3-10,4 = 709,1 ккал
Рассчитанная энергия стабилизации составляет 1,4 ккал; при расчете энергии
резонанса для циклонентадиена возникает значительная неопределенность в опрё-
ОТВЕТЫ К УПРАЖНЕНИЯМ
691
делении энергии напряжения структуры с двумя двойными связями в пятичлен-
ном цикле; для бутадиена-1,3 этот фактор отсутствует, б) Резонанс должен быть
более значительным в цикло пента диене, чем в бутадиене, поскольку диклопента-
диен вынужденно имеет цисоидную конфигурацию (см. упражнение 9-2).
9-11.
а) СвНв4-15/2Ог—>6С02+ЗНаО
Расчитанная ДЯсгор = 6-98,7 +3-145,8 + 3.82,6+
+7,5-119,1— 12-192,0 —6-110,6 —3-10,4+—828,2 ккал
Рассчитанная энергия стабилизации — 39 ккал
б) 6-102,7+3.129,8+3.90,6+7,5-119,1 — 12-192,0 —
—6.110,6 —3-10,4 = —828,2 ккал
Определение энергий связи способом, приведенным в разд. 3-6, дает ту же самую
суммарную величину энергии резонанса для бензола.
9-/2. а) Величина энергии стабилизации бифенилена меньше удвоенной энергии
стабилизации бензола из-за углового напряжения в четырех член ном цикле, б) Азу-
лен менее устойчив, чем нафталин; меньшее число схем, образованных по типу
формул Кекуле с электронами, локализованными в парах, которые можно напи-
сать для азулена по сравнению с нафталином (2 против 3), указывают на то, что
делокализация электронов для азулена менее значительна.
ви/3.а)ДЯ=2(С-Н)+(О=О)-(С=О)-2 (О—Н)—3C(RCO2H)=2-98,7+119,1—
—179—2-110,6—18= 101,7 ккал (здесь использована величина 179 ккал для С=О
в карбоксильной группе кислоты; ЭС— энергия стабилизации), б) Д//=2 (С—О)—
—(С=О, кетон) + 2-3C(RCO2H)—3.9C(RCO2R')= 2-85,5—179 + 2-18—3-15=
=—17 ккал.
в) ДЯ=2(С=О, СО2)—(С=О, кетон)—2(С-0)—ЭС(карбонат)=2-192,0—179—
-2-85,5—25—+9,0 ккал.
9-14.
ответь: к упражнениям
Длина, святи, А ,
д) 1,46 А; довольно хорошо согласуется с длиной простой связи между тр3—ар3-
углеродами (табл. 9-5); это подтверждает тот факт, что, как бы ни был важен резо-
нанс в бутадиене, он де оказывает существенного влияния на длину связи.
Ддина.связщ
А'
•Нафталин с Степень
* - дв несвязности, %
66,6
333
33.3
33,3
Озон должен .преимущественно атаковать связь «а®, так как; степень ее двоесвяз.
Коста наибольшая, v
бифенилен Связь Степень Длииадвязд.
.. . двоесвязности, % А ( .
60 1,39
40 1,41
40 1,41
40 I ,'41
20 1 „43
Связь «ат должна быть наиболее реакционноспособной по, отношению к. озону.
9-16. Сравнение ИКАО молекулярных орбиталей для и С5Н® показывает,
что два неспареиных электрона будут находиться на наивысшей орбитали (если
OTPJ/ГЫ К УПРАЖНЕНИЯМ G93
действует правило Гунда), тогда как в С5Н® все связывающие орбитали заполне-
ны. Поэтому относительную неустойчивость QH® можно объяснить его биради-
кальным характером;
Первая структура имеет наиболее благоприятную геометрическую конфигурацию,
' так как это линейная структура с нормальными значениями углов связи. Обе
. циклические структуры будут сильно напряженными, так как их образование
< потребует чрезвычайно сильного искажения углов связей по сравнению с наиболее
благоприятными. Энергия резонанса структуры алкадиина будет больше, чем для
। бутадиена-1,3, поскольку вращение вокруг центральной связи не отражается на
возможности спаривания электронов через эту связь.
< ..............
i. i
НСеэС-С^СН<->НС=С=С=ОН
9-18.
а) С12—е2С1- Инициирование
СНг=СН—СНз4-СЬ—нСНа = СН—СНа-+НС1 ДЯ=.-т4,5 ккал
СНа=СН-СНа-+С1а^.СНа=СН^СНаС1+СЬ 23 ккал
ДЯ для обеих реакций приведены без поправки на энергию стабилизации аллиль-
ного радикала.
Или СНа=СЯ-СН, + С1* ---►. ClCHfCH-CHj АН =>-17,8 ккал
ClCHr-CH^CM/Н + С1г -* С1СНг-СН=СНг + HCL + С1* ДН = - 9,7 кмл
б) Если исходить из данных по энергиям связей, атака хлора по двойной связи
пропилена приблизительно па 13 ккал более благоприятна, чем атака по водородам
СНд-группы. Однако рассчитанные величины Д/f нецадежны из-за того, что энер-
гия резонанса аллильного радикала не принимается в расчет. Если мы используем
(как и следует делать) энергии диссоциации связей для CHs-группы в пропилене
(табл, 3-7), тогда для первой стадии атаки по СН8-группе ДЯ=—24,5 ккал, а для
- второй — 4,0 ккал.
9-19. Указанный механизм никак не .может объяснить преобладание, транс-
изомера. Для того чтобы транс-нзомер действительно образовался, реальный ме- ,
ханизм.должен- представлять собой постадийный процесс (см. разд. 9-6,Г),.
9-20'.При гидрировании циклооктатетраена в циклооктан- должно выделиться
(120— 8—9,6)— 102,4 ккал, где 120 кксл — теплота гидрирования, рассчитанная
из энергий связи, 8 ккал — потеря в энергии стабилизаций циклооктатетр аена и
... 9,6 ккал — угловое напряженне е циклодктановом кольце.
694
ОТВЕТЫ К УПРАЖНЕНИЯМ
Пять резонансных структур фенантрена показывают, что степень двоесвязности
9,10-связи составляет 80%, тогда как двоесвязность всех остальных связей —
60% (или менее). Поэтому связь 9,10 больше похожа на двойную связь алкенов,
чем на связь бензольного кольца, и неудивительно, что бром присоединяется к фе-
нантрену главным образом в положение 9,10.
9-22. а) СН2=СН—СИ о—СН=СН2, сопряженное основание имеет структурные
особенности аллильного аниона и, как следует ожидать, будет в соответствии с
этим стабилизировано.
СН2 =*СН -?Н - СН=СН2 СН3 = СН—СН = СН—СН, w
<->?Н2-СН = СН-СН = СН2
б) СН2=СН—СН,—СН=СН2; теория молекулярных орбиталей предсказывает,
что сопряженное основание циклопропена должно быть неустойчивым, так Как в
нем на два электрон а больше, чем нужно для заполнения имеющейся связывающей
орбитали (см. разд. 9-6,Д п 9-10). в) / сопряженное основание (пиррол)
н2
имеет шесть р-электронов, которые делокализованы по кольцу, что обусловливает
заметную стабилизацию. При протонировавии атома азота кольца эта резонансная
энергия теряется, поскольку при образовании связи N—Н происходит локализа-
ция электронной пары. Следует ожидать поэтому, что пиррол будет очень слабым
основанием, а его сопряженная кислота — очень сильной кислотой, г) В этом
примере следует рассмотреть прежде всего относительную электроотрицательность
кислорода и азота. В любом случае анион можно считать стабилизированным за
счет делокализации электронов.
NH
СН3-С^
NH©
NH0
СЙ’-<"
NH
-
СН/С
^6:
сн3-с
^о:
СН9СО2Н будет более сильной кислотой, так как связь О—Н сильнее поляризо-
вана, чем N—Н,— кислород значительно более электроотрицателен, чем азот.
Различие в силе кислот обоих этих соединений сравнимо с различием в силе кис-
лот НаО и NH3, которое составляет приблизительно 101в (табл. 8-2).
ОТВЕТЫ к упражнениям
695
J5-.23. а) СН2=СН—CHjCl; выигрыш в энергии резонанса аллил-катиона благопри-
ятствует ионизации, б) СН2 = СН—СН—СН = СН2; из обоих галогенидов обра-
зуется один и тот же карбониевый ион. Поэтому различие в легкости ионизации
будет зависеть прежде всего от различия в устойчивости галогенидов. Вторич-
ный хлорид, в котором две двойные связи не являются сопряженными, менее
устойчив, чем первичный, и потому легче ионизируется.
9-24.
• Первая стадия в приведенной выше схеме бромирования бензола энергетически
н евыгодна из -з а потер и эле ктро н н о й дело к ал из а ц ни.
Глава 10. Бифункциональные соединения.
Алкадиены
10-1. Карбоксильная группа может быть описана как резонансный гибрид струк-
тур (1) и (2) (см. ниже), из чего следует, что ни карбонильная, ни гидроксильная ’
группы не присутствуют в «чистом виде* в реальной —СО2Н-группе (разд. 16-3).
''ЮН
И
(I)
ф
(2)
Таким образом, для связи С~О следует ожидать меньшей, а для С—О-связи —
большей степени двоВсвязности по сравнению с нормальной двойной связью.
10-2. Большая реакционноспособность пентадиена-1,4 объясняется повышенной
энергией стабилизации а-винил аллильного радикала (и аниона) по сравнению с
аллильным радикалом (и анионом). Подобная стабилизация становится очевидной
при рассмотрении образования электронных пар в следующих структурах:
СНа = СН—СН—СН=СН„<-> СН,—СН = СН—СН=СН, <->
^СН,=--СН-СН=СН-СН2
Координата реакции
Для того чтобы пслта'дисн-1,3 был более реакционноспособным и более
стабильным соединением, чем пентадиен-1,4, карбониевые ионы из 1,3-Изомера
безусловно должны быть более 'усРэйчквымй бгйос'йтельнб исходного диена,
чем карбониевый нон из пектедиена-1 ,'4. Это означает, что | > |Д//01
(см. диаграмму; подобную диаграмму можно построить для образования
[CHjCHaCH— СН СН3]® из пента диена-1,3).
10-4. Рассуждения аналогичны описанным в разд. 10-3 для Мектрофилыюго
присоединения к сопряженным диенам.
10-6. Поскольку лриссединёние’брома к стиролу по механизму 1,4/прйсоё'Дннения
привело бы к потере практически всей стабилизации ЗрЙматкческого ядра, этот
путь приблизительно на 39 ккал менее выгоден, чем 12-присоединение.
10-8. Очевидно, структуры II и III менее стабильны, чем структура I, ибо их
стабилизация не включает стабилизацию, связанную со структурой бензильного
радикала СдНьС^ (разд. 26-5). Бблыпая стабильность структуры I по сравнению
с IV связана с большей; устойчивостью CHS-4^H—СН=СН—обусловленной
метильной, группой, ко сравнению с’-СН2—СН=СН—.
10-9. Отсутствуют данные, которые полностью исключали бы' двухстадийный
ионный механизм реакции Дильса —г Альдера в пользу бирадикального. В боль-
шинстве случаев, ориентации присоединения по Дильсу —Альдеру можно объ-
яснить с точки зрения, либо’радикального, либо ионного механизма. Однако тот
факт, что многие реакции Дильса — Альдера происходят в газовой фазе, застав-
ляет предположить, что ионный механизм является менее важным.
10-10, Четыре возможных: продукта (I—IV) приведены ниже:
ГП tV
Образующиеся в действительности продукт Г соответствует ожидаемому, так как
он может образоваться из наиболее устойчивого бирадикального интермедиата,
в котором возможно взаимодействие неподеленного электрона аллильного типа
с двойной связью. Можно ожидать, что соединение I будет, более предпочтитель-
ным, чем IV, поскольку —ДЯ; >—A//lv.
698
ОТВЕТЫ К УПРАЖНЕНИЯМ
Альтернативными промежуточными продуктами могут быть следующие:
10-11.
CH2=CH-Cs N
+
н2с=с=сн2
СН2 - СН - С S3 N СН2 - CHCN
Н2С = С-СН2 ”*НаС=С--------
10-12.
(RO)2 —*2RO-
RO-4-СН2 = СНСН=СНя—> ROCH3CHCH =СН2 (инициирование цепи)
Обозначим ROCHoCHCH—СНа через X-
X- 4-СНа=СНСН=СН2 — ^ХСНгСПСН = СН2
СН = СН2
хсн2 - <!нсн2снсн=сн2
ХСНа Н
: ХСН2СНСН = СН2+СНг = СНСН=СМ2----> /С=С<^
(развитие цепи) Н СНаСН2СНСН = СН2
транс
хсна CHaCHaCHGH=CHa
н н
l(UC
Могут образоваться полимеры какого-либо одного, либо всех приведенных
ниже типов: виннлзамещенная углеводородная цепь, цис-полиен или транс-
полнен. Процесс может заканчиваться димеризацией, диспропорционированием
или реакцией отрыва. —19 я ккал/моль полимера с п. мономерными
- единицами при условии, что реагирует только одна двойная связь на поли-
мерную единицу,
10-13.
Нвч /Ид
а) >С-Х=Ц
Вг7 ’
Нв (4-5 м.д.) Нд (5-6 м.д.)
Jab> 5-1огц
(-' I Ч '1
ОТВЕТЫ К УПРАЖНЕНИЯМ
699
б) CH,CH2CsCH
sCH(Z,35MJt. } —СН,—(1,25мл ) СИ,-(0,9мл)
в) (СН3)3ССН=С=СНСН2ОСН,
СН=С=СН (~5 МЛ 1-ОСНз (3, 3 МЛ ),-СНг- (2,1 мл ],-С(СН3)3 (0,9 мл)
\ у
5 Гц
10-14. а) Для того чтобы бутадиин-1,3 образовал аддукт Дильса — Альдера,
молекула должна была бы претерпеть искажение из устойчивой линейной конфигу-
рации в чрезвычайно сильно напряженную цисоидную конформацию, б) Димер [3]
будет образовываться из бирадикального промежуточного продукта димеризации
[ 1] метакролеина, который, как следует ожидать, является более устойчивым, чем
альтернативный интермедиат [2]
СНОСНО /О- ?но
нс'" \ нс с-сн,
I II — II I
/<4 сн, с снг
СН, СН, СН, CH;
1 I II *
I LcHO II ‘ | XCHO
CH, CH, >1H3 Ch/Sch^Sch,
[Z]
700
ОТВЕТЫ К УПРАЖНЕНИЯМ
в) Уменьшение энтропищ которым сопровождается реакция Дильса — Альдера,
объясняется потерей поступательной, вращательной и колебательной степеней
свободы в том случае, когда две молекулы располагаются таким образом, чтобы
образовать одну циклическую молекулу.
✓СНа уСНд
СНа=С< 4-FaC=CFa^CH3=C< . 4-
Х-СН=СНа \сн-сн2
F2C —CF3
FaC----CF2
<!;на-с—сн3
I
CH = CH2
IU 12]
Обычно тетрафтор этилен дает продукты 1,2-присоединения, из которых более
предпочтительным является, по-видимому, [2J, так как бирадикальный интермеди-
ат при образовании соединения [2] имеет вторичный аллильный радикальный
центр.
10-16, Только 1,2-присоединение, так как жесткость циклической структуры не
позволяет метилен циклогексену находиться в цисоидной диеновой кбнформации;
для 1,2-диметиленцйклобутена 1,4-присоединение также невозможно, так как
привело бы к Производному циклобутадиена. В действ итёЛьнбсти образуются
следующие соединения:
10-17. Продукты приведенных реакций можно предсказать на основе стереохимии :
и механизмов, описанных для реакций циклоприсоединения (разд. 10-4 и 10-5). .
CtH5CH
+ II
ЦССО2Н
(вер пятно .основной
продукт реакции)
CFy-CF-CFz
61 2 CFjCFaCFi 'v—*• | |
CFy-CF-CFa
«)
Н»
=CHj + Н2С=С=СНг
СЛ-
702
ОТВЕТЫ К УПРАЖНЕНИЯМ
СНд=С=О
л) (С$Н5)гС=С=О + C6HSCH=CH2
10-18.
НВг
а) СНа = СН -СН =СНг — ----> СНа = СН—СНВг— CHj
‘ ‘ * 0 °C или виже
СН2
II
снг
СНг=С№-СН=СНг + СГг=СС12
Д) 2пСНг«С»СНг ------► Л
150-20О°C
150-200’С
О
RO- ( I )
е) nCHa=CF-CH=CH2 -\-СН2-С=СН-СНй-/„
10-19. Радикальная атака стирола происходит исключительно по метиленовой
группе двойной связи, так как атака в это положение приводит к особенно устой-
чивому радикалу; стабилизация обусловлена сопряжением с ароматической
л.-электрониой системой. Фактическим продуктом радикальной атаки является
поэтому полимер с ориентацией «голова к хвосту».
СвНвСН = СНа + R• —*С6Н6СН-CH.,R.C-‘C_H-C2U
COHS - CsHb C6H5
I . C,HtCH=CHl I I
—> RCHaCH-CH2-CHCeH6----------------RCHaCHCH2CHCHaCHCeH4
И T. Д.
10-20. Геометрия, а также орбитальные модели аллена и аллил-катиона изобра-
жены ниже; очевидно, что, пока вокруг связи С—С происходит вращение, прото-
ййрование центрального углерода аллена ле даст аллил-катиона. Поэтому первич-
ОТВЕТЫ К УПРАЖНЕНИЯМ
703
но образующийся катион будет относительно неустойчивым первичным катионом,
и не следует ожидать его легкого образования. С другой стороны, протонирование
концевого углеродного атома даст непосредственно вторичный катион.
Н
—снэ
кручение
и изгиб
Р ©
К
не требуется
гручения,
t изгиба
©
10-21.
4
СНз
)с=СНа5
СИ,
CHz^H-CHr-CH^Hj
5)
В)
с и,
<Z=sC
сн=сщ
кие
транс
д)
транс
до
е)
сн3 сн=снг
/ X
и н
Hj
СНЗХ /И
ж) /С —
н< X
Н'
/Н
СНа, zH
;€=С<
-Н
-СН,
н
is
транс, транс, транс
транс.транс.цио
СН3
СНз
Н.
Сн/
.11 Нч /Н
>С=С{
£=С( VHs
н
Н
н
н
н
цис^пранс.цис
цис,цис, цис
i
10-22.
Г OH 1 О
I II
a) [CHS=C—СНаС1] —>СНЭ—С—СН2С!
б) СНЭСН(С1)СН = СНСН8, СН3СНгСН(С])СН=СН31 СН3СНаСН=СНСНяС1,
в) 2СНаО + (СНО)3. г) С1СН2СН(ОН)СН(ОН)СН2С1,
/ ClCHaCH(CljCH(OH)CH2OH, CICHECH(OH)CH(C1)CHSOH,
Глава 11. Реакции нуклеофильного замещения и от-
' щепления. Алкил-, цикло.алкил-,. алкенил-
и алкинмлгалогениды!
11-1. а) Неопентнлкарбинол, 3,3-диметилбутанол. 6} Циклогексилциклопевднл-
карбннол. в) Метил-2,3-дпбромбутират. г) р-Бромэтнлвлниловый эфир, д) Пентен’
З-тиол-2. е) Диметалфенилнитрозометан.
11-2.
CHs.
а) >М-СН=СНа :
CHS'
о
11 уСН^
в) H-C-W
хСН2£И3
СНк
е) >CH-CHsCHaONO
СН/
б) (СНа)8СттС—осн2снасн=сна
о о
II II
г) CHsC-O^-C-H д) CH8(CeHj)CHOH
ОТВЕТЫ К УПРАЖНЕНИЯМ
705 i
11-3. Рассмотрим ионизацию трет-б ути л хлорида как состоящую из следу юнцах ;
стадий:
(СН3)3СС1 (газ) —t-(CHs)3C- (газ)4-С1- <80 ккал
(СН3)3С-(газ) —*-(СН3)3С® (газ)-}-е < 234 ккал
С1 ( газ) ~|-е —>-С1®(газ) —87 ккал
(СНа)3СС1 (газ) —>.(СН3)3С® (газ)-~с1е (газ) < 227 ккал
Энергия диссоциации связи С—С1 в mpem-бутилхлориде меньше,:чем для хлори-
стого метила, а потенциал ионизации mpem-бутил-радикала меньше, чем Для ме-
тил-радикала. Следовательно, при прочих равных условиях теплота ионизации
mpem-бутилхлорида в газовой фазе и водном растворе будет меньше, чем для хло-
ристого метила. Это обусловлено бо л ьше й стаб и л ьно стью (СН 3)3С • и (СН3) SC® по
сравнению с СН3- и СН®.
11-4-
- дя
СН80Н (газ) + HG1 (газ) —>-СНяС1 (газ)-(-Н2О (газ) энергии связей
СН3С1 (газ) —->СН9С! (води,)
Н2О (газ) —* НгО (жидк.)
СНаОН (води,) —СНаОН (газ)
НС1 (води.) —*-НС1 (газ)
теплота растворения
тецлота испарения
теплота растворения
теплота растворения*
СН3ОН(водн.)-}-НС[(водн.)—+-СН3С1 (водн.)-}-НгО(жидк.)
ДЯ1 равна сумме приведенных' выше значений ДЯ.
(Д^! — теплота, рассмотренной выше реакции.) Обозначим ДЯ2 теплоту реакции
СН3ОН (водн.)4-С1® (води,) —*СН3С1 (водн.)-}-ОН® (водя.).
Она может-быть рассчитана следующим образом;
NaCl (водн.)4-Н20—>-НС1 (водн.) + NaOH (води.) теплота нейтрализации
водной HCI водным раствором NaOH
СН3ОН (водн,)-f-NaCl (водн.)—>СН8С1 (води.) Ц- NaOH '(водн.)
ДЯ2=ДЯ!теплота нейтрализации
11-5. a} CKopocTb=fetC2HsCl][Kll=A[0,l][p,11=5,44-10-7, или А=5,44-IO-i.
При 0,01 М скорость=5,44-10_5 [0,01][0,01]=5,44-10“’. б) Скорость ==
5 44-10-’-
=fe[CeFUClJIKI]s, где ;
=5,44-10“*- (0,01)’=5,44-10"“ ’
в)
.........=5,44-10-’.
5,44-10-4. При 0,01 М скорость
Скорость
(логарифмическая
шкапа)
23 м> 1640
700
ОТВЕТЫ к УПРАЖНЕНИЯМ
г) При изменении концентрации именно KI скорость будет оставаться неизменной,
если мы имеем дело с нулевым порядком по KI; но она будет значительно изме-
няться (acJKlJ) в случае первого порядка по иодистому калию.
/Л6. В реакциях (11-3) и (11-4) не происходит обращения конфигурации, так
как атака происходит не по асимметрическому атому углерода оптически актив-
ного спирта, а по кислороду. Поэтому эфиры (+)-ROCOCH3 и (+)-RO—SO3R'
должны иметь одинаковую конфигурацию. Следовательно, реакция замещения
(11-5) должна протекать с обращением конфигурации, поскольку из сульфоната
(-4-)-ROSO2R' образуется ацетат (•—)-ROCOCHs.
П-7. Каждый обмен бромом между бромид-ионом и emop-бут ил бромидом вызывает
обращение конфигурации, давая молекулу, идентичную исходной, но с противо-
положным знаком вращения, поэтому первоначальное оптическое вращение будет
уменьшаться. В момент, когда концентрации обоих оптических изомеров окажут-
ся равными, вращение будет равно нулю и, конечно, останется таковым, поскольку
концентрации обоих изомеров одинаковы и скорости обращения конфигураций
каждого из изомеров не отличаются друг от друга.
11-8. Скорость вступления радиоактивного бромида есть мера скорости, с какой
бромид-ион вступает в реакцию нуклеофильного замещения с алкйлбромидом.
Если при каждом замещении Происходит полная инверсия, скорость замещения
будет составлять половину скорости потери оптической активности, поскольку
0,5 моля обращенного продукта будет погашать вращение именно 0,5 моля исход-
ного .вещества. Можно сделать вывод, что в этом случае замещение Вг на Вт* про-
исходит с «чистым» обращением.
//-Я Цель этого упражнения — показать, что реакция 5^2 при неасимметриче-
ском атоме углерода не приводит к какому-либо изменению конфигурации, не-
смотря даже на возможное наличие в другом месте молекулы асимметрического
углеродного атома. Можно ожидать образования, правого^ изомера 1-хлор-2-ме-
тилбутана.
/1-11, Введение одного атома дейтерия в метиленовую группу алкилпроизводного
RCH2X превращает метиленовый углерод в асимметрический, но сохраняет его в
качестве первичного атома углерода. Тот факт, что указанная реакция замещения
приводит к обращению конфигурации, означает, что стереохимия реакций Sjq2
при первичном атоме углерода такая же, как и при вторичном углеродном атоме.
Следовательно, это реакция 8^2, в которой уксусная кислота выступает в качестве
нуклеофила,
//-//.
ROH+ll -lrzk RBr+HaO
; „ [RBr][H3O]
Если прадположить, что НВг полностью ионизирована и концентрация воды по-
стоянна, а также вспомнить, что!&]=10 М, то
[RBr]
[ROH]l0MHBr [Н®]1омнвг ю
[нФ] е“10-г"1-
1 J ю мвг
[RBrJ
[ROH] a
- lOMBr
11-12. Торможение ионом X® 5ы1-реакций соединений типа RX объясняется эф-
фектом «действия масс», где карбониевый ион возвращается в исходное соединение
вследствие взаимодействия с введенными ионами X®. Чтобы это произошло,
ион карбония должен быть достаточно устойчив, иначе он будет реагировать с пер-
вой же молекулой растворителя, которая с ним столкнется, Добавление нуклео-
фила N® приводит к уменьшению торможения ионами X®, так как N® успешно
ОТВЕТЫ К УПРАЖНЕНИЯМ
707
конкурирует с X® при взаимодействии с R®, уменьшая тем самым повторное об*
разование RX.
N®
быстро z
медленно - —
RX-----------* R©Xe-
RX
В этом случае продуктом реакции будет азид RN3. ।
11-13, Отношение реакционных способностей воды и N®, равное 1: 10000,
относительно СНяВг отражает относительную реакционную способность двух
нуклеофилов по отношению к первичному углеродному атому при реакции 5ц2.
Не следует ожидать той же самой реакционной способности по отношение к трет-
бутил-катиону, так как mpem-бутил-катцон гораздо более реакционноспособен, чем
бромистый метил, и, следовательно, гораздо менее селективен в своих реакциях (ср.
.с аналогичным поведением Вг-, соответствующего СН3Вг, и СЬ, соответствующего
дарст-бутил-катиону, разд. 3-8). Соотношение селективностей mpem-бутил-кати-
оиа по отношению к воде и азид-иону может быть равным I ; 2 соответственно.
CtHBCl + Ie^±C4H9I + Cl9 (Г)
С4На14-НОе—*С4НвОН-}-19 (2)
с4нвс1 -р но® —► с4нвон+а® (3)
Каталитическое действие I® в реакции (5) — это результат реакций (/) и (2), ко-
торые протекают быстрее, чем (3), когда последняя проводится в отсутствие ионов
I®. б) Некатализируемая реакция (3) приведет к «левому» изомеру бутанолa_-l-z
(l^Hj (СН3СН2СНг—СН —ОН) так как она является обычной реакцией ну-
I
D
клеофильного замещения, при которой происходит обращение конфигурации;
Катализируемая реакция приведет к «правому» изомеру бутанола-1?(1-2Н'
(СН3СН3СН2—СН — ОН), так как она включает две реакции замещения с обра-
. 1
щением конфигураций (J) и (2), и продукт- реакции должен иметь ту же конфи-
гурацию, что и исходное соединение. Если реакция
CHSCHSCHSCHDI („левый" изомер)-}-?—► CHgCHjCHaCDHl („правый"
изомер)-}-?
будет быстрой в сравнении с (2), вопрос осложнится. Если она по сравнению С (2)
очень быстрая, образуется рацемический спирт (см. упражнение 11-7), а если
очень медленная, то спирт образуется в виде «правого» изомера, в) Ответ в пункте
(б) ясно показывает, что реакции типа Sn2, приводящие в конечном итоге к обра-
щению конфигурации, не исключают автоматически действия обычных механизмов
инверсии.
11-15. а) Небольшое уменьшение; в переходном состоянии заряды разделены лишь
немногим больше, чем в исходном соединении, б) Как в (а), в) Большое уменьше-
ние; разделение зарядов в переходном состоянии существенно уменьшается,
г) Большое увеличение; в переходном состоянии происходит существенное разде-
ление зарядов.
11-16. а) Ацетон относительно мало приемлем для обоих случаев, но все же лучше
для катионов, б) Четыреххлористый углерод очень мало эффективен для обоих.
23*
ТО8 ОТВЕТЫ К УПРАЖНЕНИЯМ
в) Безводный HF превосходен для обоих, г) Хлороформ, приемлем для анионов, 1
неэффективен для катионов, л) Трйметиламйн хорош для катионов и неприменим I
для анионов, е) Окись триметиламина очень хороша для катионов, но значительно . I
хуже для анионов. :
11-17. Реакция будет про Исходить значительно быстрее в диметил сульфоксиде/
чём в этиловом спирте, поскблькуди метил сульфоксид является значительно луч- ;.
Шим сольватирующим агентом для катионов, чем этиловый спирт. Это уменьшает у.
ассоциацию типа Na--§H?N и делает <§=N значительно более ре акционно способ-
ным в качестве нуклеофильного агента. /
11-18. а) Да.
’ скорость ;=>[?НаСНаС1][НаО] =ьАХ[СНэСНаС1][ОНе],
гдеЛ= [tHsCH^CllfHjOj/tCHsCHjCljtOH®]
б) Если бы промежуточный карбанион образовался в первоначальной быстрой рав-
новесной стадий, следовало бы ожидать обмена с дейтерированным растворителем
^CH^CHsCl + DiOiziDCHsCHjCl-i-SD
Вступление дейтерия в исходный галогенид было бы доказательством такого
механизма; отсутствие дейтерия вызвало бы сомнение в этом механизме. В не-
скольких: благоприятных случаях такой обмен происходит, но в большинстве
случаев подобный механизм, по-видимому, не является верным.
11-19. а) mpcm-Бутилат калия используется в Ё2-реакцнях алкилгалогенидов
в качестве основания по той причине, что здесь не возникает проблемы конкурент-
ной Ss'2-атакн из атом углерода из-за большого размера аниона. Этил амин в по-
добных Ё2-реак11Иях неудовлетворителен в качестве основания, поскольку из-за
его меньшего размера может происходить конкурентная 5м2-атака, и, кроме того,
этиламин является довольно слабым основанием. 6) трет-Бутилат-ион значитель-
но хуже сольватирован в диметилсульфоксиде, чем в mpem-бутиловом спирте; это
увеличивает реакционную способность mpem-бутилата в качестве основания,
уменьшая ассоциацию с растворителем; поэтому он гораздо более реакционноспо-
собен. Обычно растворитель, который слабо сольватирует анионы, является пло-
хим растворителем и ДЛЯ солей, таких, как mpem-бутилат калия; однако диметил г
сульфоксид, будучи прекрасным сольватирующим агентом для катионов, компен-
сирует этим свой недостаток.
11-20. В реакциях ионизации rn/мт-бутилпронзводного трст-(СН3)эСХ в водных
растворителях отношение mpem-бутилозого спирта к изобутилену не должно за-
висеть от природы уходящей группы X®, так как эти продукты образуются после.
ионизации из обычного интермедиата (СНв)аС^. Дело будет обстоять иначе,
если продукты образуются в конкурирующих реакциях Е2 hSn2, таккак можно
ожидать, что отношение скоростей атаки растворителя на углерод и: водород будет
зависеть от природы группы X.
11-21 Изобутилен становится преобладающим продуктом реакции; ион гидро?
ксила должен действовать как основание, отрывая протон от трст-бутилхлорида
и вызывая Е2-элнминированиё. Реакций-Sn2 мешает, пространственный фактор.
: -сИк пз- сн ;
НО?+СН8-С—С1—-Н204-СНа^с/ 4-С1^
CHj/ ; Х<-На
ОТВЕТЫ К УПРАЖНЕНИЯМ
709
//-22.
С3Н6ОН+§Н Сгщ§ 4- нао
0,2
©Гч
ос2н8----►СН8СН2СНСН3 —и
С1 (Зон) ОСаН6(ОН)
Е2
—> сн,сн=снсн3+сн,сн2сн=сна
- - с>н>0« е
СН3СНгСНСН8 7 •" GHjCH ^СНСНз+СГ
d - ,_н®/ \с.н,он
СН„СН=CHCHg 4- СНаСН2СН = СНа ' и,° СНзСНХНСНз 4- Н®
снэсн4снсн,
он
11-23. Замещению хдора апокамфилхлоридав реакции Sn2 мешают пространств
венные препятствия, так как обращение конфигурации при атоме углерода, пре-
терпевающем замещение (в голове моста), не может происходить без разрыва свя-
зи С—С. Е2-реакция также затруднена из-за высокого напряжения, связанного С
образованием двойной связи при углеродном атоме, находящемся в голове моста.
j, сильно напряженная
//-24.
СН3 СНз
I Е1 | ИОВг
а) СН3-С-СН2-СН8 ЙЪ7Го^сСНз"С~СНСН»~’*
' I 1 (образуется 80%
Вг алкенов)
СН3
I
— СНз-С-СН-СН, ч !
Ju Аг
в темноте Н.О
б) СНа =С(СН3)СНаСНа4- НВг------ (CH,)sC(Bi-)CHsCH,
(е I)
(СНЯ)3С = СНСНа + СНг ==: С(СН3)СНаСНа
во% 20%
%н Ш
в) (СН3)8СС1 — СН2^С(СН9)2 —-> (СН-)3С1
в TdtyHvT'w
А
^ОН НВг К!
г)(от,«а--сн,^с(сн,),л-;^<сн,)1сн-сн,в.=г
—. (сносная,I
710
ОТВЕТЫ К УПРАЖНЕНИЯМ
11-25. Если триметилэтилен образуется по реакции EI из (СНа)2СОСНВгСН3,
он не должен содержать дейтерия. Если происходит элиминирований с перегруп-
пировкой, должно присутствовать приблизительно 50% исходного дейтерия (мы
пренебрегаем здесь кинетическим изотопным эффектом, разд. 13-7).
СНЭ СНЭ
CHj-C—jjC—H
D ®
(СН3)гС=СНСН3 + (CH3)2C=CDCH3
50ft
50ft
1I-2S.
СНЯ Sn'- B1
а) CH3CHS - С - CH4CHB - —>
| MgU
Вг
CH,
—* сн,снг- с—сн2—chs+ch3ch=C(ch3)c4hs+(ch,ch4)sc=chs
I (главным образом)
ОН
СНа СН,
I J миграция CHs-rpynnM
б) СН,—С—"С—-С1 —
с!на н
—* (СН,)3С = С(СН3)2 + (СН3)аСНС(СНэ)3ОН
(главным образом)
цист2-бромбут ев-а
(три нс-Ё2-проду кт)
IV
ОТВЕТЫ К УПРАЖНЕНИЯМ
711
Вг Вг Вт
( трине -Е2-продукт)
V
сн3 н
СНз-СЕС-СН,
Bi>? 'сН3
Следует ожидать, что транс-2-бромбутен-2 легче, чем quc-изомер, будет выделять
НВг с образованием диметил ацетилен а.
J1-28.
(образуется при гидридном сдвиге)
предпочтительный продукт реакции
(основной продукт
реакции)
в приведенной выше
Ё1-реаищи соединения
vm
11-29, C4HrBr: полосы в ИК-спектре при 3000, 1650 и 930 см-1 соответствуют
группе В ЯМР-спектреобнаруживаются сигналы протонов трех различ-
ных типов с соотношением интенсивностей 2:2; 3. Четкий синглет при 1,85 м. д.
Представляет собой сигнал метильных водородов аллильной группы С=С—СНа;
синглет при 3,9 м. д, отвечает группе С=С—СНаВг; мультиплет (300 Гц) обуслов-
712 ОТВЕТЬ! К УПРАЖНЕНИЯМ
лен группой СН.2 =. Соединение имеет структуру
СН2
zCH2Br
с/
\:н3
, C6HsBra: в ЯМР-спектре обнаружены сигналы только двух типов водородов
с соотношением интенсивностей 1:1, которые проявляются в виде четких сингле-
тов. Пик при 3,4 м. д, характерен для группы—СН2Вг, пикпри 0;85 м. д. отвечает
атомам водорода циклопропановрго кольца. ИК-спектр мало информативен для
идентификации, за исключением поглощения при 1430 см-х, обусловленного груп-
пами —СН2—СНа—• (разд. 3-3 и 4-3). Структура, согласующаяся со спектрами,
следующая:
CH!vZCHaBr
//-М
CHs. ,СНЕС! S 1
>С = С<
н/ ХН
Н,о : SN3
СН^ /СН8ОН
н/ “%
С1е
н,о
; (-Н®)
СН3. ZCH2OH
нХн
а) Следует ожидать, что SnI-гидролиз приведет преимущественно к цис-спирту,
поскольку вращение вокруг центральной связи С—С кротил-катион а затруднено:
эта связь имеет характер, промежуточный между простой и двойной связями,
б) Sм2-гидролиз не должен изменять стереохимию двойной связи, поэтому можно
ожидать образования исключительно цис-спирта,
Н2С=СН - С(СН3)аС1 (СНЛ)2С=СН - СНЕС1
[(СН^С^СН ^СНЕ]®С1°
(CH3)'aC(OH)CH=CH2 (СНв)2С-СН—снаон
Можно предполагать, что большая часть положительного заряда в промежуточном
катионе будет локализована на третичном атоме углерода. Тогда в условиях кине-
тического контроля преобладающим продуктом реакции будета,а-диметилаллило.
вый спирт. В условиях термодинамического контроля более благоприятным будет
образование у, у-дйметил алл илового спирта, который из двух возможных ненасы-
щенных спиртов имеет более замещенную двойную связь..
СН2=СН—CH(CHS)-CI—i.[CH2 — CH—CH(CHs)]®Cie—
ионная пара
——СН(СН3)]®л-С1® —* продукты реакции
диссоциированные иоцы ,
ОТВЕТЫ К УПРАЖНЕНИЯМ
713
Если скорость образования ионной пары больше, чём скорость диссоциации на
раздельно существующие ионы, которые реагируют с растворителем, давая про-
дукты реакции, ™ рацемизация бу дет.про исходитьбыстрее, чем сольволиз. Такая
ситуация более вероятна в растворителе с низкой диэлектрической проницае-
мостью (например, в уксусной кислоте), где диссоциация ионной пары будет, не-
видимому, мёнее благоприятна, чем в растворителе с высокой диэлектрической
проницаемостью (например, в воде),
/1-33. Нет. При сольволизе сульфонйёвой соли RjS® у ходящей группой является
нейтральная молекула R 2S. Поэтому образования ионной пары не происходит, и,
следовательно, не может быть й речи о внутреннем возврате; однако это не так
для соответствующего галогенида.
СНа = СН~С(СН2)2—f(CHe)a — |CH2^CH.«=C(CHs)sJ®+S(CHe)g
//-34.
а , ОН а
' 90Н | ф еон
a) СН3 = СН—СН2 СНг = СН—СНа<-»СН3—СН=СНа
I 9 Й-
С1 С1 “С1
ОН
©ОН |
СН3—CH3-CHs<->CHs-CHa-CHa
d 9С1
Ъолее высокую реакционную способность аллилхлорида по сравнению с пропил-
.хлоридом, следует объяснить участием двойной связи в переходном состоянии
Sn2-замете пня аллилхлорида, б) Электр о иодо норные; такие заместители, как
следует ожидать, будут стабилизировать частичный положительный заряд в у-по-
ложении. В некоторых случаях реакционную способность повышают электроно-
акцепторные группы; по-видимому, образование связи С—ОН в этих случаях будет
осуществляться в переходном состоянии в большей степени, чём разрыв связи С—С.
//-3,5.
Атаку Y:® на ненасыщенный углерод можно рассматривать как реакцию 5^2,
в которой уходящей группой является пара электронов. Эта пара электронов
уходит со стороны, наиболее удаленной от Y, и атакует углерод, несущий замести-
тель X, со стороны, противоположной X, ^приводя, таким образом, к транс-про-
714
ОТВЕТЫ К УПРАЖНЕНИЯМ
дукту. (Это равноценно двум одновременно протекающим инверсиям, приводящим
к сохранению исходной конфигурации.) Для того чтобы образовался цис-изомер,
хорошо известные принципы Замещения с обращением конфигурации должны быть
нарушены.
11-36, a) Sn2 — обращение конфигурации; S№' — «правый» изомер исходного
соединения-млевый» изомер продукта реакции, б) S^2 — цис-продукт; 3^2' —
транс-продукт с противоположной конфигурацией, в) S м2 — инверсия при а-уг-
леродном атоме, отсутствие изменений при двойной связи; при Sn2‘ строение
продукта реакции зависит от конформации, в которой реагирует галогенид.
СН3^
с—сб
| ^С—СНэ
ОН. нХ
[11
он
СИ,. | ХН
jx—с
Нх ^с-н
СНэ
[2]
Продукт реакции [ 1] — транс-двойная связь, оптическая конфигурация, противо-
положная конфигурации исходного соединения, тот же продукт, как при обычном
Sn2; продукт реакции [2] — ц ос-двойная связь, та же оптическая конфигурация,
что и у исходного соединения, если двойную связь в каждом из них восстановить
водородом. Следует ожидать, что отношение продуктов реакций будет зависеть от
скоростей Sn2'-реакции для каждой конформации, г) Рассуждения аналогичны
приведенным в пункте (в).
II-37. 3 5
СНа =CH-CDa- X 4- С1°
s№'
----*-CD»=CH—CHjX-f-Cl©
Появление резонансного сигнала метиленовых протонов в спектре ЯМР (—CHSX)
продуктов замещения аллилхлбридаЛа-^Нз] будет служить указанием на £№'
атаку.
11-38.
СНВгэ
СНа = СН -CDa - Cl + Xе -
:СВга
а)
(—НВт)
сн,-
н сн3
н
(который приводит к цис-присоединению)
Вгг -
+ :СВг3
транс
н
Г ' d
транс
СН3
ОТВЕТЫ К УПРАЖНЕНИЯМ
715
СН3 СН3
\ /
б) С=С + :СВгг
Н \1
цис цис
11-39. Образование:СН2 не может быть лимитирующей стадией реакции (как это
показано ниже), так как тогда скорость не будет зависеть от концентрации цикло-
гексена (разд. 11-9),
И«ДЛСННО
ICHjZnl ----------► СНг:
СНг: +
быстро
Реакцию можно считать бимолекулярной и представить ее в виде следующей схемы:
I—СН2—Znl
вистро
(CH2=ZnI2
© е
CH2-ZnI2)
медленно
;сн2 + zni2
Аргументы в пользу первого порядка по каждому из реагентов следующие;
|CHs = ZnIa]
[CH8 = ZnIa|
[ICHj>ZnI|
и, таким образом,
[ICHjZnl]
Возможны также и другие механизмы.
//-4ft
СН3.
а) )СН-СНЙ—СНЕОН б)
сн/
щс=сн
СНз
-С-СН,
СН3 Н CHg
в) СНз-^-СНя-Ь-СН8 - i-CH3
c!hs in с!н3
д) СНа-О-СНа-СН=СН3
н н
716
ОТВЕТЫ К УПРАЖНЕНИЯМ
гн СН3 СН8
I 31 J I
Л уСН=СН - С = СН - СН = СН - С= СНСН2ОН
е)| |/СН3 . . .
Х/ХСН:1
11-41. а) Пропнн‘-2-ол-1, пропаргиловый спирт, этинилкарбннбл. б) 3,3-Димегил-
бутанол-2, mprm-бутилметилкарбинол, в) 4,4-Диметилциклогексадиен-2,5-ол-1.
г) 3,3-Диметилмасляная кислота, mpem-бутилуксусная кислота, д) 4-Хлор-2-бк-
си-3-метил валериановая кислота, е) Циклобутилметанол, циклобутил к арб и но л.
11-42.
а) (СН3)8С1 (водн.)—► (СН8)3С®(водн.)4-С1 (водн.) ДД=20ккал
Впредь будем считать все реагенты (води.), ес!ли не сделано1 других оговорок.
.(СН^С® + ?1(СН3)3СС1 ДЯ=—20 ккал
(СНа)3СС1 (газ)+Н2О(газ) —> (СН3)3СОН (газ)Ц-НС1 (газ) ДЯиз энергии связи]
(CH3)SCC1 + Hso —> (СН3)3СОН4-Н®+С1е из ДЯ, приведенных вы^
ше, и соответствующих
теплот испарения
(СН3)3С® + НаО (СН3)8СОН + н®
сумма вышеприведенных
значений
б) (СНВ)3СС1 —* (СН3)8С® + С1© ДЯ = 4-20 ккал
Г . /СН-‘
СН2 = С/ (газ)Ц-НС! (газ) —-+• (СН8)3СС1 из анергий связи
ХН3
-ЧСНД3СС1
из вышеприведенных ДЯ
и теплот1растворения
,СН3
CHS = С/ 4- Н® -> (СН8)3С®
Х2НЭ
сумма вышеприведенных
значений '
В разбавленном водном растворе теплота реакции для I® и Ct® одинакова;
/СН8 в) 2СНа^С< сн8 i т сы -^СН —С—СН — -13 ’“ергай связи И * S ^СН8 тепл°т растворения
(CH3)SC® —> СНа ,СН3 ==C<f Ц-H® из ответа „б“ ^СН8
(ОНа)3С®4-СН2 = СН8 сумма ХСНЭ 1 ,СН3 выше- =С< —> СИ» -С-.СН2 - 4-Н® приве- ^СН, ) ХСНЭ денных . сн4 .значений
ОТВЕТЫ К УПРАЖНЕНИЯМ
717
11-43.
а) СН3СО,Н H®+CH3CC)f TG^l.MO-S
н®+©он^±н2о ih^hShj^w-11
СН3СО2Н+©ОН Н2О+сн3со? к
(H2O][CH3COf | 1,8. Ю-6[НаО1
~ [СН3СО2Н]НО@]~ *O-1J
Пусть количество гидроксил-иона.
1=£-= 18.40»
х1
х = 2,2> 10-5 моль/л
б) Начальная скорость образования метилацетата:
A'|CH3Br)[CH3CO2Na] = l,0-i0-4-10--'.!,0 = l-10*(! моль-л"1^-*
Начальная скорость образования метанола: '
' й'[СН3ВгП§Н] = 30-10-1-10-г-2,2.10-5=6,6.10"» моль.д-1-с-1
в) Если предположить, что отношение скоростей реакция СН3Вг с СН3СО® и
г НО© остается постоянным и равным начальной скорости (отметим, что СН3СОО©
присутствует в большом избытке по сравнению с СН81), тогда
' [CHjC02CHsl_ 1-10-в .-„и
[CHjOH] “6,6,10-1“
г! Необходима следующая информация; 1) положение равновесия СН3ОН+
4-NaOH^:CH8ONa4-H3O, 2) константы скорости для реакций
СН3Вг + СН,ОН —Ь СНаОСН3 + НВг
СЩВг + NaOH —ь CH3OH + NaBr
СН3Вг+СН3ОМа —> СН3ОСН3 Ц- NaBr
3) начальная концентрация едкого натра.
11-44.
йЬ —33 ДС Q
а) НС = СН4-Na \Н2 ~НС йэ С Na +NH3
HC^?fL+CH3I HC~C-CH3 + NaI
НС s С—CH8 + ^a NHa^CH3C ^ац-NHj
' CHSC « .(^a + CHSI —* CH3C = CCH3 Ц-Nal
:6)ClCHiCH=CHa+HBr С!СНаСН3СНаВг'
сн,СООН Й
C!CH2CHaCH2Br+CH3COaNa ----ClCH2CH2CHaOCCHs+№Br
(l мель)
B) C2H3OH + NaH -и-C2HjO©Na®4-Ha
CsHsOeNa®+CH3l -C2H6aCHs+NaI
r) (CH3)2C = CHa + HsSO4 (CH3)3C®+©HS04
: (CH3)3C®+CHSOH —► (CH8)8COCH3 + H®
718
ОТВЕТЬ! К УПРАЖНЕНИЯМ
д) СН8СН = СН2+аг—>СН3СН(С1)СНаС1
СНаСН(С1)СНаС1 4- Nal CHSCH(CJ)CHJ
(I моль}
11-45.
СН3С1 + KI -----anff-nH > CH3I + KC1 A
SN2
CH3C1 + NaOC2H5 -------CH3OCZHS + NaCl 6
CH3 „ N CH3
CHj-C-CHrGl + Ag® ---------—an'' > снэ- C-CH3 + AgCl в
H ®
-H®
> (CHj)3C-OCiHs
+ (CH3hC=CHz
Реакции Au Б не должны проходить одинаково быстро с хлористым изобутилом
и хлористым метилом, так как метильные группы при 0-углеродном атоме изобу-
тилхлорида создают некоторые'пространственные препятствия Sn2-атаке, Следует
ожидать, что реакция В для хлористого изобутила будет протекать с несколько
большей скоростью, так как гидридный сдвиг приводит к образованию более ус-
тойчивого промежуточного карбониевого иона.
б) СНВС14-К1 “-г* СН31-|-КС1 А
(СНа)дСС14-N’aOCiHb (СНВ).1С=СН»+ НаС14-СаНьОН Б
® сан,он _
(СНЭ)3СС1 + Ag®-------г (СН3)3СОС2Н5 + AgCi 4- Н® В
-----------г (СН3)2С = СНа
Реакция А более энергично протекает с хлористым метилом, а В— с трет-
бутилхлоридом по причинам, приведенным в пункте (а). Скорости взаимодействия
этилат-иона с обоими хлоридами, по-видимому, сравнимы, но хлористый метил
реагирует по механизму Sn2, а mpetn-бутидхлярид — но механизму Е2.
СН3
в) СН9-С-СНаР4-МаОСаН3—»-(CH3)2C=CHF4-C2H6OH4-NaCl Б
С1
Реакция Б с обоими хлоридами приведет к алкенам, но фгорсодержащёе соедине-
ние будет реагировать, по-йидимому, быстрее, поскольку его индуктивный эффект
будет делать водороды более кислыми.
(СН3)3СС14- Ag®+С2Н6ОН (СН3)3СОСаНв 4- AgCl + Н®
---^(СН3)аС=СН2
В
Реакция В должна быть более медленной с фтор содержащим соединением, так как
третичный карбониевый ион дестабилизируется электронооттягивающим Дейст-
вием F-заместителя.
ОТВЕТЫ К УПРАЖНЕНИЯМ
719
г) (См. разд. 11-17,6.)
зцетой
СНа = СН - СН2С! + KI ---► СН2=СН—СН214- КС1
скорости, по- (CH2=CH-CH2-Cl + NaOC2Hs—►СНа = СН—СН2ОС2Н6 Б
видимому, \СН2=СН-СН2-СНв-С1+НаОС2Нв—>СНа=СН-СН=СНй Б
сравнимы
СН2=СН—CHS-Cl-f- Ag®4-C2HbOH —>CH4=CH-CHt—OC^H^^gCHH® В
11-46. Все атомы .хлора в соединении А находятся в фщ-положении но отношению
-к атомам водорода соседних углеродных атомов. Поэтому возможность Е2-отщея-
ления НО от транс-а,а-конформации исключена.
В соединении Б только один водород может находиться в транс-а,а-конформации
с соседним атомом хлора. Легкость отщепления НС1 свидетельствует о том, что
Е2-отщеиление протекает только в случае транс-а,а-конформации.
11-47.
СН3
СНз-С-СНг-1 + ®nh2
сн3
CHj-tjl-CHjI + NH3
СН3
OTsxT ♦ i
сн/ хсн2
720
ОТВЕТЫ К УПРАЖНЕНИЯМ
11-48,
Выход
Скорость
Побочные реакции
а) 0; SN 2-а так а объемистого
нуклеофила на третичный
, атом углерода не пропс-
! ходит.
б) 0; энергетически невоз-
можна
в); Низкий; вода не является
достаточно сильным 'осно-
ванием, чтобы вызвать-
Е2-отщепление
г) ~50%
0 Ё2-отщеп лен и е HCI с обр азован нем
изобутилена
0 Никакие быстрые реакции, по-вн-
димому, не происходят
Медленная Гидролиз по механизму SN1 дает
(СНэ)аС=СНСНэ и
(СНэ),ССНаСН3
Небольшая Обращение конфигурация при об-
(втор-гало- :мене
генид)
д) 0; SN2-aTaKe ацетата с
тыла мешают метильные
группы, поэтому ; она
практически не происхо-
дит
е) 0; диэтиловый эфир очень
слабый нуклеофил, а
СН3СН^—исключительно
плохая уходящая Группа
ж) Низкий; замещение ва-
нильного хлора происхо-
дит с трудом
з) Низкий
0 Нёт
и) Высокий
к) Низкий
Медленная Очень медленная реакция Е2 с об-
разованием НС =СН
Быстрая По-видимому, в присутствии 5ЬГ3
и SbCl3 будет происходить поли-
меризацияс участием двойной
связи
Довольно Конфигурация позволяет происхо-
быстрая ди ть трсмс-Е 2-о тще плен ню чё р ез
плоское четырех центровое пере-
ходное состояние
Медленная Конфигурация циклопента нов о го
; а ' кольца с заслоненными водоро-
i дами не позволяет проходить
(нрояс-Е2-отщсплению через пло-
ское чётырехцентровоё переход-
ное состояние. При транс-эли-
минировании можно ожидать об-
разования значительных коли-
честв
CHS
ОТВЕТЫ К УПРАЖНЕНИЯМ
721
11-49. -
a) CHCh-HSbF^ C^=eF*
300 °C
HCsCH4-CFs = CFs —-* CH —CFS
11 1
CH-—CFa
40оч:
6) CHa = CHCH3+Cls----- CH2=CHCHaCl-pHCl
CHS ^CHCH3Ci 4- NaOH —+ CH2 =CHGHSOH -^NaCl
CHa = CHGHaOH4-NaH —> CHa = CHCHsONa + Ha
CH^CHCH2Cl-4-CH,=CHCH2ONa—*-СН2=СНСН,ОСН2СН=СН2Ц-МаС!
400 °C
в) СН2.^СНСН,4-С1а ——► CHa=CHCHsCl4-HCl
основание
СНа==СНСНаС1+С1,—>CHj—СЙ—CHs —--------•"
A A A
—* CHa = C - CHS + CH = C - CH2
Cl Cl A k Cl
основной продукт
реакции
Zn
СН2 = С-СНа —> сна=с = сня
А А
К®§С(СН,),
или СН2 - СН—СНЭ + С12 —* СН, - СН—СН,--------------
I 1
С1 С1
—Г СН2 = СН — СН2С! + СН - сн —снэ + СН2 - С - CHg 1 —*
А А
—и CHs=с=сн2+ НС 2S ссна
Образующийся НСsC~CHa можно удалить аммиачным раствором нитрата
серебра.
СН3С — СН.+ Ag(NHs)aNOs —»- СН3СCAg + NH4NO3 + NH3
//-АЛ
Сосуд А Сосуд Б
а) Реакция со спиртовым раствором
AgNO3 не происходит даже при
нагревании. Не реагирует с КГ в
ацетоне
б) Немедленное осаждение AgCi со
стартовым раствором AgN’Oa
в) Быстрое осаждение AgCi из AgNOa
Отсутствие реакции с Ki в ацетоне
г) Не происходит реакции ни со спир-
товым AgNO3, ни с К1 в ацетоне
д) Реакция в условиях Е2-отщепле-
ния не происходит
При нагревании со спиртовым ра-
створом AgNO3 будет осаждаться
AgCi. Реагирует с KI в ацетоне
Немедленное осаждение AgBr со
: спиртовым раствором AgNO3
Медленное выпадение в осадок
АеС! при нагревании с AgNO3.
Медленная реакпия с KI в аце-
тоне
Немедленное выпадение AgCi. Бы-
страя реакция с KI в ацетоне
Образование CHSCH2C СН в усло-
виях Е2-отщепления
722
ОТВЕТЫ к упражнениям
е) Реакция со спиртовым раствором
нитрата серебра не происходит.
Реакция с KI в ацетоне не проис-
ходит
11-51.
Сосуд А
а) В ЯМР-спектре два сигнала (не-
расщепленных) с соотношением
интенсивностей 9:2
б) В ЯМР-спектре химический сдвиг
СНгС!-протонов около 4,36 м, д.
в) В ЯМР-спектре только один сигнал
г) И К-спектр указывает на
— НС=СН —. В ЯМР-спектре
сигналы двух винильных протонов
д) В ЯМР-спектре только два сигнала
с соотношением интенсивностей 6:1
е) ИК-спектр указывает на
— НС=СН —, В ЯМР-спектре
сигналы двух винильных протонов
При нагревании со спиртовым
AgNO.j AgCl будет выпадать в
осадок. Реагирует с KI в ацетоне
Сосуд Б
Спектр ЯМР будет сложным
В ЯМР-спектре химический сдвиг
CHsBr-протонов около 4,26 м. д.
ЯМР-спектр относительно слож-
ный
В ИК-спектре имеются полосы,
соответствующие группе
СНа=СН, В ЯМР-спектре сиг-
налы трех винильных протонов
ЯМР-спектр относительно сложный
z сигналами двух винильных
протонов
ИК-спектр содержит полосы, соот-
ветствующие группе СН3 =СН —.
В ЯМР-спектре сигналы трех
винильных протонов
Глава 12. Металлоорганические соединения
12-1.
(СИ»)3С-С1 +2Na —> (CH3)3CNa4-NaCl
(CH3)3CNa + (СН3)ЯСС1 —► (СН3)3СН + (СН3)2С = СН2 4- NaCI
Продукт сдваивания, гексаметилэтан, не будет образовываться из-за пространст-
венных препятствий атаке на третичный атом углерода.
12-2.
(CaHs)2Hg+Mg —>- (C2H6)2Mg4- Hg
дизтвдртуть диэтилмагниН
(CH3)2Zn-J-Cd—^-реакция не происходит
диметилцинк
(C3H3)4Sn4* Li ——4C3H3Li 4- Sti
тетрафепилолоно февиллитий
(СН3)4РЬ 4- 2Zn —» 2(CHs)2Zn4- Pb
тетраметилсвинец днметилцинк
(СНа == СН-CH4)2Mg4-2Li —> 2СН2 = CH-CHaLi 4-Mg
диаллнлиагний аллиллитий
12-3.
2А1 + 3 Нг -----► 2А1На \
х—=^5®'6<Э
(СНэ)гС=СНг + AlHj ------> (CH^CH-CHjAlH,
(СНЭ)2С=СН2 + (СН3)2СНСН2А1Н2 —[{СН3)гСНСНг1гА1Н
(СН3)2С=СН2 + [(СН3)2СНСНг]2А1Н. ’ --> [(CHj)jCHCH2]jA1
ОТВЕТЫ К УПРАЖНЕНИЯМ
723
Эти реакции присоединения подобны таким же реакциям гидридов бора, об-
суждавшимся в гл. 7 и 8.
12-4,
a) 2CHS1 27п —ь (CHa)aZn -rJ-Znig
или 2CHaI-|-Hg(Na)—b(CHa)aHg+2NaI
(CH3)aHg+Zn (CH3)aZn 4- Hg
Первый метод более удобен, поскольку он включает только одну стадию и
позволяет избежать промежуточного образования высокотбксичного (CHa)aHg.
В качестве растворителя может быть использован эфир; доступ воздуха и влаги
должен быть исключен.
б) CH3Ci4-Mg^CHsMgCl
или CH3C14-2Li—>CH3I_i4-LiCl
CHsLi+MgGla —ь CH3MgCl + LiCl
Следует предпочесть первый метод. Он состоит только из одной стадии, его удобно
осуществлять при низкой температуре (т. кип. СНаС1 —24°C).
в) 4(C2Hs)Cl + 4Pb(Na)^(C3H6)4Pb + 4NaCl + 3Pb
или 2СаНЕС1+ Hg(Na) —+-(CaHE)aHg-|-2NaCl
2(CaH6)2Hg-|-Pb —b(C2HB)4Pb4-2Hg
Следует предпочесть первый метод по причинам, указанным в пункте (а).
г) (СН3)аСНВг4- 21Л —> (CH3)aCHLi Ц- L i Вг
или (CH3)2CHBr + Mg—»-(CHs)sCHMgBr
(CH3)aCHMgBr4-2Li —>(CHa)aCHLi +Mg+LiBr
Первый метод является более прямым.
12-5, Если существует равновесие между алкнлмагнийгалогеиидом RMgX и со-
ответствующим ди ал к ил магнием R2Mg и галогенидом магния, то при использова-
нии радиоактивного галогенида магния радиоактивный магний должен распреде-
литься между обоими магиийоргапическими соединениями.
R2Mg-p.AigX2^±RMgX-L.RAgX^i/2R2Mg + 1/2R2Mg4-1/aMgXS! + Y2AgX2
То наблюдение, что радиоактивный хлорид магния не приводит к образованию
радиоактивных магнийорганических соединений, ставит под сомнение предложен-
ное равновесие и структуру реактивов Гриньяра в общепринятом написании
—RMgX. Существует, однако, серьезное сомнение в надежности эксперименталь-
ных результатов. При использовании некоторых марок магния (включая чистей-
ший) обмен происходит нацело.
12-6. C4H1(1O34-CH3MgI—ьСН4 (84,1 см®, 740 мм, 25 °C)
(0,1776 г, или 0,00168 моля)
740-273
Объем (см®) метана при стандартных условиях — ?^ -84,!
v , ч 740-273.84,1
Количество метана (моли) = 760.298-22 =0.00335
Следовательно, соединение С4Н10О3 (А) содержит два активных водорода. Возмож-
ная структура для А, в которой содержится три типа водородов в отношении
1:2:2, два активных водорода и нет карбонильной группы, следующая: НО—
-СН гСНЛ-СН зСН2-ОН.
12-7, Возможно, первая стадия в реакции реактивов Гриньяра с ацил г ало ген ида-
ми могла бы состоять в непосредственном замещении галогена
____ -О л О
М /V . 11
R-MgX + В-'-С-Х ----> К’-С-К + MgX2
724
ОТВЕТЫ к УПРАЖНЕНИЯМ
(С»На)аСНОН
он
CHsCH2t(CHa)!i
(СН3)3С-С0яН
Тогда второй стадией, ар и но.тятей к образованию третичного спирта, было бы
присоединение RMgX к карбонильной группе кетона. Полученные соединения
были бы идентичны продуктам реакции, в которой обе стадии состоят в присоеди-
нении по карбонилу. Такой механизм замещения неприемлем, так как ожидаемый
порядок реакции RCOBr>RCOCl>.RCOF был бы проти во наложным^ наблюдае-
мому (разд. 11-12, Б). .
12-8.
н®
Промежуточные соединения продукты реакции
а) (С,н$)гСИ—OMgBr
OMgl
б) CHS—СН2—с—OCaHs,
СН3
OMgl
СН3СНЯСОСН3, СН8СНа(^(СН8)а
О
в) (СН3)3С—C-OMgCf
OMgBr
г) CJ-C-ОСаНь,- СНаСНаСОС1,
(!н2СН8
OMgBr
(СНаСН4)аС-С1, (СНЭСНЯ)ЯС= О,
(CHsCHt)aCOMgBr
OMgl
I
д) (СНа)аССНаСН8СОаС«На
OMgBr
е) СН3О-с5—ОСН8, С6Н8С0аСН3,
(СН»СНа)#СОН
ОН
(СН8)9С- СНЁСНаСО2СаН5
OMgBr
СеН5- (J-OCH,,: (С4НЬ)2С = о,
(СвН5)8С—OMgBr
OMgX О
1 ;
ж) СНз-С-О— С-СНа
сна
он3—(!;—сн3
(СеН5)8СОН
О
II
(CHa)aGCH?C-СНд+СН£ОаН
(вероятно, будет слишком про-
странственно затрудненным,
чтобы участвовать в дальней-
шем присоединении)
-и, -= .
ОТВЕТЫ К УПРАЖНЕНИЯМ
725
12-9, Конечно, для ряда упражнений существует несколько возможных решений.
Некоторые из них приведены ниже в качестве иллюстрации:
а) /Z\-MgBr -J’„298° .
X/ * \Z 2. H®\
' <Q>-CH,OH
CHjMgBr
0 CH3
II I
6) CHa-CH — C-OCH3 + 2CH3MgI -*CH2=CH—C-OH
Ан3
В) CH3CHO+C2HsMgBr^
Xh3CH(0H)C2Hs
CH3CHaCHO 4-CHgMgl/*
СНЭСН2СО2СНЭ + ZCH2CH2MgBr
о
CHjO-C-OCHj + 3CHjCH2MgBr
о
Cl-C-OCHj + JCHjCHaMgBr
(СН3-СНг)2С=О + CH3CH2MgBr
(CHjCHJjCQH
1- ог ,
2. H2O
Удобнее получать циклолропанол с помощью следующей реакции:
СН2-СН-СН2С1
возможный механизм:
CH2-CH-CH2C1
А / C2HsGl
о
1, CaHjMgBr^
2. Н2О
СН2-СН-СН2: MgBr
СН
| ^CH-OMgBr
сн/
е) CH.MgCl+CdCU -^CHsCdCl + MgCi,
C(HsCHaCHaCOCj 4-CHsCdC! —> QHtCH3CHaCOCH3+CdCla
:: или
- 1. CH,MgCl
СаН6СН2СН2СО!Ч(СН3)2-------- CeHeCH/HjCOCHs
2, H®
726
ОТВЕТЫ К УПРАЖНЕНИЯМ,
ж) CSH6C = CH4'CH3MgCi — CeHjC es CMgCl 4-CH4
1. сн,о
C«H*C - CMgCl — C6HbC ы C-CH2OH
I!, rigU
s’)
/2-/Л
о
11
4- HCNtCHjJa
CHj-'C-N(CH3)e + RMgX --------
OMgX
CHj—C—N(CH3)3
R
_____ Ф ©
5=*: сн3-c=n(ch3)z + OMgX
R
V ©
CHj-CeNJCHj)* * RMgX ----->- CHj— C-N{CH3)3 + MgX
R R
©. ©
MgX * OMgX —*• XMgOMgX
12-1 J. . '
a) CHaCHaCH2C77sCOCcH6
6) CeH6CH =CH—C(CH2CH3)S 4-некоторое количество
CeH6CH(C2Hs)CH2COsCH#
в) С.НьСН(С,Не)СН8СО4С(СИ3)#
5©,О- 6®
>gx
'-R
5©
1,4-присоединение прост-
ранственно неблагоприят-
но в этом случае
Д)
6©
^O^S©
"' MgX
sS©.A s©
х-с,
н2
н3о
/2-/2.
Н,0
a) 2C,H3CHsCHjMgBr+(CHs)aSO4— -2CeHbCM2CH2CH3 + MgSO4 4- MgBra
б) CsHbMgBr+CHaC=C-CH2Br СНаС^С-СН^Н^ + МйВ^
в) CHt = CH-CHaLi+CHa=CH-CH3Cl~*CHa=CH-CH3-CHs—СН=
= CHa + L‘Cl
г) CHsCHaCHsMgBr+CJCHsOCH3 —<-CHeCH3CHaCHsOCHa4-MgBrCl
О
ОТВЕТЫ К УПРАЖНЕНИЯМ
727
12-13.
Продукт присоединения П роду к
енолиза
а) (СН3)аС(ОН)С(СНЛ СН,СС
(СНВ)3<
б) (СдН6)аС(ОН)СНяСНз
в) С„НЬСН=СНСОС6Н6
(СдН^СНСНдСОАНб
12-14.
ОН
а) (СН3)аСН—СН(СН,)г и
iaHj
он
б) (CHJ)3C-C-C(CH3)S
СНй
* ,СН3 он
' X /-----------С{СНэ)а но гла
^CHj
Продукты
восстановления
(СНзЬСНОН
(СН3)дС^= СН3
(Cy-I^CHOH, СН2=СНа
О
II
CaHe + fCHshCHCCHfCH»),
(образование продукта восстановления
невозможно)
(невозможно образование ни продуктов
восстановления, ни продуктов енолиза-
цни)
(образование продукта восстановления
Невозможно)
.12-15. Чтобы добиться малой степени полимеризации, как в случае превращения
этилена в бутен-1, следует предпочесть низкое давление этилена и невысокую
концентрацию трнэтил алюминия. Образованию децена-1 до.иии благоприятство-
вать более высокое давление этилена и большая концентрация триэтил алюминия.
В‘равновесных условиях высокая температура будет способствовать образованию
децена-i, так как уменьшение энтропии тем больше, чем длиннее образующаяся
цепь. Однако, если требуется получить преимущественно бутен-1 в условиях ки-
нетического контроля, следует предпочесть низкие температуры. Ясно, что отно-
сительные скорости различных реакций будут иметь существенное значение.
12-16. Оптически активная группа R* не участвует непосредственно в первой ре-
акции; следовательно, конфигурация R* не меняется.
R*Hgj — Br-p R —: MgBr
ё L
R*HgR4-MgBrs
Кинетика второй реакции согласуется с механизмом Se2, и разрыв может проис-
ходить с равной вероятностью но обеим связям R— Hg
R*—; HgR + HgBra —> R*HgBr+ RHgBr
R*Hg 1 - R + HgBr3 —> R*HgBr+ RHgBr
Если реакция происходит с обращением конфигурации R, продукт реакции не бу-
дет обладать результирующей оптической активностью; если она происходит с ра-
цемизацией, продукт реакции будет иметь одну четвертую первоначальной опти-
ческой активности R *.MgBr; если она происходит с сохранением конфигурации,
продукт реакции будет содержать половину начальной оптической активности
R*MgBr.
728
ОТВЕТЫ к УПРАЖНЕНИЯМ
12-17.
В неплбской конфигурации (вверху) нитрильвая и фенильная группы не участву-
ют в перекрывании л-Ррбиталей, помехой служит s/r-тибри дизр в энный тетраэдри-
ческий атом углерода. В плоской конфигурации (внизу) этот углерод представлен
в виде s^-гибриднзованного, и становится возможным л-свяэывание между CN- и.
С3Н5-групаамй через р-орбиталь центрального атома углерода.
12-18. а) Рацемизация; возможно, что промежуточный карбанион становится сим-
метрично сольватированным, б) Сохранение конфигурации; ситуация должна не-
сколько отличаться от реакции в «трет-бутиловом спирте в качестве растворителя
с асимметрически сольватированным карбанионом как промежуточным .продуктом,
в) Возможно; с некоторым обращением из-за экранирования и относительно кис-
лого характера воды.
Н
~ r> е r2
К3 н
. Ki
но® + н-с-кг + к® -
- . .. \ .. . . .
12-19. .
а) СгНнХаЛ-НгО С.Н..2-|-X'aOii
5 б) CsHnNa • С:Н5ОС„Н5 - -C-,Ht2-Г СН,-Cl-Io i Ql-I.ORz
ОТВЕТЫ К УПРАЖНЕНИЯМ 729
в) СбНцНа4-(СН3)эСС1 —’'CjHig-)' (СН$)2С—CH2-j-NaCl
г) CjHiiNa+.CjHnI —*-С3Нц;—CjHu-f-Naf
C6HHNa+CjHnI ^CH3CH2CH2CH = CH2+C5Hla + NaI
д) С6НцМаЦ-СН9СН = СН2 —>-С5Н12 -[-CHa —CH — CH2Na
e) CjHuNa+CHg=CH—CH?C) —>-CH2=CH-CHS—CsHn^NaCi
CsHuNa+CHa = CH~CHaC!—bCsH12CI+CHs=CH-CH2Na
ж)СеНпЫа-ЬСН8СО2Н —^СвН1г-|-СЙ300аКа
CbH1TNa 4-CH3CO2Na —> CH,COCBH1X + Na2O +
4.CH„C(ONa)(C6Hll)i!
3) C£HuNa + CHeCO2H —>CsH{a + CH3CO3Na
12-20, а) Последовательность реакций, соответствующая данным пункта (1):
(СН3)3СС1 + 2U —(CHj)3CLl + ЫС1
(CH3)jCLi + Н-СН^-СНг-О-СН^СНз --► (СН3)3СН + СНг=СНг
+ CH3CHiOLl
(СН3)3СЫ +^СН2=СНг —* (СН3)3ССН3СНгЫ (низкий вькод]|
(CH3)3CCH2CH3Li > (СН3)3ССН2СН2СО2Н
2. НгО
Последовательность реакций, соответствующая данным пункта (2):
Эфир
(СН3)3СС1 + 2 Li -40,->
(CH3)3CLi. + О=С^О
(CH3)3CLi + L1C1
—* (CHjJjC-C
OLi
Атака на эфир при этой температуре не происходит.
Последовательность реакций, соответствующая
эфир
(CHs)8CCl+2Li
- 40 °C
н®
(СН3}3ССО2И
данным пункта (3):
_4о с (Cl-ra)sCLl -1-LiGl
.. . l.co,
(CH3)sCLi+сн2=СНа------------ (CHshCCHiCH^i — (СН3)5ССН5СНгСО2Н
б) Металлитий, образующийся из лития и хлористого метила, не расщепляет
эфир при комнатной температуре;так что не следует.ожидать ни одной Йэ специфи-
ческих реакций, описанных в пункте (Г). Метилхлорид будет вести себя подобно
тргт-бутилхлориду [см. пункт (2)]. Метнллйтий является первичным металлоор-
ганическим, соединением и гораздо менее склонен присоединяться к этилену, чем
третичное металлоорганическое соединение, так что не следует ожидать образова-
ния сколько-нибудь значительного количества пропионовой кислоты в пункте (3)
при использовании хлористого метила, в) Образования заметных количеств 6,6-ди-
метилгептановой кислоты не будет наблюдаться, поскольку неогексиллитий яв-
ляется первичным соединением, и не следует, ожидать, что он будет реагировать с
этиленом, подобно трет-бутиллитию.
12-21.
CHS снв
I н,о I ,
а) СН9—С—OMgl ------—> СНа—С—ОН (расходуется 2 моля CHsMgI)
н2О
730
ОТВЕТЫ К УПРАЖНЕНИЯМ
OMgBr
I Н,0
б) (СН8)аС=С^СН(СН3)з + СН9СНаСН3СН3----> (путем енблизации)
. —> (CHs)aCHCOCH(CHs)a4-CH3CH3CHaCH3
и
Н
I и,о
(СН3)ЙСН —С—СН(СНэ)аЦ-СНа=СНСНаСНа-----е(при восстановлении)
OMgBr
—► (CH,)aCHCH(OH)CH(CHs)a4-CHa=CHCHaCHj
По-видимому, продукты присоединения либо получаются в небольших количест-
вах, либо вовсе не образуются, так как размер и строение алкильных групп де-
лает возможным протекание других, более быстрых процессов, в) Аналогично ре-
акции с СО2:
V- - zS И,о zS
CH3CHa-C<f ---------»CH3CHa-Qf
xSMgBr XSH
г) По аналогии с соединениями, содержащими активные водороды, можно
ожидать образования
Hso
CHaCHg4-HaN-MgBr ------► CHsCHa+HoNgBr^NH,
12-22.
мг d.o
a) (СН9)ЯСС1 ---► (CH,),CMgCl--► (CHs)aCD
Эфир
6) CHsCH4-NaNH2 —> HC = CNa + NH3
CH=CNa + CHaI —»- HCsC—CHg-pNal
CHjC^CH + CHjMgBr —к CH3C^CMgBr+C3He
l. СО(медленно)
CH»CsGMgBr----------------»• CH3C=sC—COaH
2. H,0
B) (CH,)4C+Cla —> (CHa)sCCH,Cl (
Мк Ь
(CH3)3CCHaC[----> (CHs),CCHaMgCi (CHs)aCCHaI
ьфир I
CH„
r) 1. (CH#)2CHMgCl+CHsCOCHj —► (СН8)аСН-С-СНй
Ьн
CHd
I
2. (CH3)aCHCOaCaHs+2CHaMgI —♦. (CH9)aCH-C-~CHj
OH
HCI
3. (CH3)2C=C(CH3)2 -> (CH3)aC-CH(CH3)a
Mg
(CH3)aC—CH(CH3)a ——*—> (CH3)aC-CH(CH3),
I эфир J
Cl MgCl
ОТВЕТЫ К УПРАЖНЕНИЯМ
731
Д)
Mg
е) (СН,)3ССН2С1--> (СН3)эССНаМёС1
эфир
/СН2Ч
• (CH5),CCHaMgCl + Hac/ XCHj —> (СН3)эССНаСН3СН2СН2ОН
\о/
С1г
- ж)СН3СН =СН2 ——ь СН2'=СНСН8С1
400 сС
Mg
\ СН2=СН—СН2С1-------<- CH2=CHCH2MgCl
эфир
CHs=CHCHsMgCJ4-CH3=CHCH,Cl —> СН2=СНСН2СН2СН=СНЯ
/2-2?.
CHj-C-CHJ
сн,
кын2
-NHj
cHj ^CHji
C'H, - CH2I
Zn
C,H5Oli *
9
H>C
I >
CH3-C-CH2-I
CH3
5© 6©
CH, ^CH2yZnI
XX
CK, CH8-I
-I®
CH3 /CHj
z\l
сн, снг
Обе приведенные выше реакции можно классифицировать как внутримолекуляр-
ное Sk2-замещен не, в котором карбанион выполняет функцию нуклеофила.
Zn
СН3 СН- СНСНз - СНгСН"Г-С.НСИэ-^а»-СНэСН=СНСН3
| । u2H5un । — (--I
Вг Вг tf®2nBr »Вг
12-24. а) Образование продукта присоединения маловероятно, поскольку из-за
присутствия объемной mpem-бутильной группы реакция будет очень медленной.
Главным направлением реакции будет восстановление, приводящее к диизобутил-
карбинолу и изобутилену. Возможна также енолизация дииэобутилкетона, кото-
рая приведет к превращению реактива Гриньяра в изобутан.
(СН3)2СНСН2ч
;С=Оф
(СН,)2СНСН2/
восстановление
-j- (CH3)3CMgBr
енолизация
| (CI 13)гСНСН 2]:СНОН | (СН3)аС - СН2
l(CH3)3CHCHs]sC-O + (CH3)aGH
; 732. ОТВЕТЫ К УПРАЖНЕНИЯМ
б) Присоединение не будет .происходить по пространственным причинам, Образо-
ванне продуктов восстановления й ендлизации невозможно. Поэтому реакция про-
исходить не будет, в) Очень возможно, что реакция будет протекать и дальше (чем.1
написано), так как «-пропил метил кетон может легко реагировать сметилмагмий-!
иодидом, давая диметил-н-пропилкарбинол. г) Маловероятно, чтобы реактив '
Гриньяра присоединился к связи С==Ь1 таким образом, чтобы образовался указан -
ный продукт реакции. Вероятный ход реакции таков:
ад ад ад ад н,о
:CHsCH = NCH34-CHa-MgI (CHj)sCH-N(CH,)MgI —
—* (CHa)aCHNHCHj4-Mg(OH)I
д) Не следует ожидать образования 3-окцшропилацетата. Наиболее вероятно,
что реактив Гриньяра из 2-бромэтнлацетата будет распадаться с той же легкостью,.!
как й образуется, давая этилен, ацетат магния и бромистый магний:
? л
^.CHjC-O-CHa-CHr-MgBr -------*- ZCH2eCH2 + (CHjCO2)2Mg + MgBr2
е) Восстановление тримётилацетилхлорида до три метил ацет альдегид а тре/п-бу- !
тилматнийхлоридом должно протекать удовлетворительно, ж) Пёнтен-1 является
лишь одним из нескольких ожидаемых продуктов реакции аллилмагнийхлоридй
и бромистого этила. Можно ожидать образования и других углеводородов.
CH2“CHCH2Mg3r 4- Н^СН^-С11г-^г СНг=СНСН2 + СН2=СН2
CH2-CHCH2MgBr ,+ CHjCH2Br --* CH2=CHCH2Br + CH5CH2MgBr
СНг=СНСН2Зг 4- CH2=CHCH2MgBr . СН2=СНСН2СН2СН=СНа
12-25. Ожидаемый спектр ЯМР для СН2=СН—CH2MgBr будет содержать дублет
(J ^7 Гц) группы —CHaMgBr, расположенный приблизительно .на 16. Гц в бо-
лее слабом поле, чем сигнал тетраметил силана, и.мультиплет группы СН2=СН— 1
между 300 и 320 Гц, лежащий в более слабом поле по сравнению с сигналом тетра-
метилсилана,
Наблюдаемый спектр показывает; что в аллилмагннйбромиде имеются лишь
два магнитно-неэквивалентных типа протонов. Очевидно, обе СН2-группы являют-;
ся эквивалентными и приводят к дублету (J ~7 Гц) при ]48 Гц, причём расщепле-
ние возникает из-за спин-спинового взаимодействия с =С—Н-протоном, который
в свою очередь дает квинтет при 377 Гц. Можно полагать, что магнитная эквива-
лентность метиленовых групп является результатом следующего равновесия, ко-
торое должно устанавливаться менее чем за 0,001 с, чтобы привести к наблюдае-
мому спектру.
СН СН
j: бистро /X
СН2СНа СН2 СНа
Mg/ ^Mg
. I I <
x -• X -
12-26. -
Продукты
(до гидролиза)
OCdCHj
>- С-Cl
/ I
' CHj
Продукты
(после гидролиза)
ОТВЕТЫ К УПРАЖНЕНИЯМ
733
СН ^yCOjCgH 5
j CH,/^CHsOZnBr
СН3^ ,С^.\ CHg^yCssN
С6н/чЛ ’ Свн/ VOjLi
г) неясен„MgBr, HGsCCH-jCHjfeCH
д) (CH3)3CMgBr, (CHs)3COOMgBr
е) (СвН6СН2)г, (л-СН,С,Н*СН3)г,
л-СНАН4СН±СНгСвНЕ,
СНзч yCOsCeHi
>с<
сн/ ХСН,ОН
СН3^ /CseN
С.н/^СОеН
HC<=CCHgCHsCsCH
(СН8)ЭСООН
Те же, что и до гидролиза
к-СН3С(|Н4СНа
С1
*>. С гС1г -сТн» сн*
Li
-LiCl
:сн,
12-27. Если принять, что правильный описанием реактива Гриньяра является
' комплекс RaMg-MgXj, то очевидно, что реакции присоединения1 должны будут
.происходитьв две стадии: одна, в которой от магния удаляется первый радикал R,
и другая, когда удаляется второй радикал R. Если к избытку реактива Гриньяра
добавить небольшое количество динзопропилкётона, преимущественно будет проте-
' кать реакция с первым R. Обратный порядок прибавления приведет к реакции по
обе «л* группам R. То, что в этих случаях образуются различные продукты, согла-
суется с представлением о существовании RaMg-MgXa. Реакция RMgX должна
, привести к той же смеси продуктов при любом методе прибавления.
Глава 13. Спирты и простые эфиры
13-1.
а) СН3СН2СЫгСН2СН2СНО; б) С1Д=СНСОСН=СН,; в) CsHsCH,COCL
сн/ ' : сн,
г> ЧС=СНСНО; д) /s\-A-COBr; «)
• С4Н? сн, ‘
13-2. а) Бутеналь-2, кротоновый альдегид, б) 2-Циаиоэтаионлхлорид, цианацетил.
хлорид, в) 1,3-Дифенилпропандион-1,3, дибензоилметан. г) Гексафторпропанон,-
гексафтор ацетон, ди (трифтор метил) кетон, д) З-Окси-З-метилбутаналь, З-окси-2-
метилмасляный альдегид, е) (3,3-ДиметилпиклобутиЛ)карбонилбромид. '
13-3, ц ис-Диол болеелетуч.чем транс дио л, поско л ьку о н об р аз у ет до во л ьн оп роч -
ные внутримолекулярные водородные связи, я поэтому не может быть сущест-
венно ассоциированным с соседними молекулами. транс-Диол по пространствен-
ным причинам не способен образовывать устойчивые внутримолекулярные водо-
родные, СВЯЗИ, но он заметно ассоциирован посредством межмолекулярных йодо-
734
ОТВЕТЫ к УПРАЖНЕНИЯМ
родных связей,
4IW
/3-4. а) В очень разбавленном растворе в ИК-спектре для обоих диолов наблю-
даются четкие полосы, обусловленные неассоциированными гидроксильными груп-
пами (~3600 см-1); видимо, в спектре бутандаола-1,2 также будет проявляться
полоса, обусловленная внутримолекулярно ассоциированными гидроксильными
группами (—3500 см-1). Этот тип внутримолекулярных водородных связей будет
неблагоприятным для тронс-циклобутавдиола-1,2. б) В растворе умеренной кон-
центрации интенсивность полосы 3600 см-1, присутствующей в очень разбавлен-
ном растворе обоих соединений, будет уменьшаться и будет появляться новая,
интенсивная широкая полоса (—3300 см-1), характерная для межмолекулярно
ассоциированных гидроксильных групп. В спектре бутандиола-1,2 полоса
35Q0 см-1 не будет исчезать, в) Длд обоих соединений а виде чистых жидкостей
ИК-спектр будет показывать интенсивную широкую полосу около 3300 см-1,
обусловленную межмолекулярно ассоциированными гидроксильными .группами.
Помимо этого, спектр бутандиола-1,2 будет содержать интенсивную, четкую
полосу при 3500 см-1, характермукУдля внутримолекулярных водородных связей.
13-5. а) В ЯМР-спектре соединения С4НаО имеются сигналы протонов четырех
типов с соотношением интенсивностей 1 : 2: 2 : 1. ИК-спектр показывает, что
один из этих протонов принадлежит гидроксильной группе (широкая полоса с
центром при 3350 см-1), а другой является ацетиленовым водородом (сильная
четкая полоса при 3300 см-1 и слабая полоса при 2200 см-1). Ацетиленовому во-
дороду в ЯМР-спектре отвечает триплет при 2,1 м. д., а ОН-Протону — широкий
сигнал при 4,3 м. д. Триплет при 3,8 м. д., очевидно, соответствует —CHS—ОН-
метиленовым протонам. Поэтому правильная структура соединения С4Н6О такова:
НС=ССН2СН2ОН. Сигнал при 2,4 м. д. является'сигналом Р-СН2-группы, кото-
рый представляет собой секстет линий Из-за спин-спинового взаимодействия с <х-
метиленовыми и ацетиленовым протонами. Сигнал, обусловленный последним,
расщепляется соответственно в триплет, б) В ЯМР-спектре соединения CsHsOa
присутствуют сигналы трёх различных типов протонов с соотношением интенсив-
ностей 1:4:3. Один из них (соответствующий сигналу при 4,3 м. д.) является
протоном гидроксильной группы, так как ИК-спектр ясно указывает на наличие
гидроксильной группы (четкая полоса при 3600 см-1, широкая полоса около
3400 см-1). ИК-спектр не содержит дополнительных данных, которые указывали
бы на присутствие других функциональных групп. Однако четкий синглет при
3,3 м. д. в спектре Я.МР свидетельствует о присутствии —ОСН3-группы. Таким
образом, вероятная структура соединения С3Н8Оа следующая: СН3О—СНа—СН3—
—ОН (монометиловый эфир гликоля, метил целлозольв). Мультиплет при 3,5 м. д.
соответствует четырем протонам метиленовых групп.
13-6.
/СН,
a) (CHshCQu б) (СН3),С = СН2
в) \ '^> г) (СН3)2СНСН8ОСН2С6Нк
Д) (СНз)5С==СНг + СвН6СН3ОН н немного (eH3)jCHCHsOCHjCjH-
ОТВЕТЫ К УПРАЖНЕНИЯМ
735
/3-7. Задача этого упражнения — показать, что катализируемая реакция будет
протекать во много раз быстрее, чем некаталиэируемая, несмотря на то что мета-
нол значительно превосходит уксусную" кислоту по основности.
скорость катализируемой реакции = feKal[CH3OH]^CH3CO2H?J
скорость некатализируемой реакции = AHeKaT[CHa0H][CH3C0,HJ
Ю“ГСН3СОаН®1
отношение скоростей = —------------
[СН3СОаН]“ ‘ Так КаК *кат/*некат-10
©
+ н® сн3он2
0,5—х—у х
ф
+ н® СН3СО2Н2
0,5—х—у у
СНЭОН
1-х
СН3СО2Н
—=10э; 0,5-х-у =0,
у
если вся серная кислота использована.
Поэтому t/ = 5'10-4M.
„ 10»^ 10е.5. J0-4 „„
отношение скоростей =pZ^= t_5 ц>-4 й 500
I
/3-#.Прн использовании меченного180 метилового спирта для этерификации кар-
боновой кислоты метка будет содержаться в метиловом эфире, если во время реак-
ции происходит разрыв связи О—И, или в образующейся воде, если рвется С—О-
связь. Разрыв связи С—О возможен в таких спиртах, алкильная группа которых
может образовать особенно устойчивый карбоииевый ион (например, ц трет-
. бутиловом или аллиловом спирте). Можно ожидать, что побочные реакции для та-
ких спиртов приведут к образованию алкена и эфира.
m -н®
(СНЭ)9С®-->- (СН3)2С=СНа
_ н®
СН^СН-СНф+СН^СН-СНцОН---------(СНа=СН-СНа)2О
/3-9.
а) СН2=СН-*СН2С1 (50%) и *СН2=СН-СН3С1 (50%).
Эти продукты образуются из симметричного аллил-катиона, в котором обе мети-
леновые группы неразличимы.
Н® "
сна=сн-сн,он —>- [сна=сн===сна]®
-н„о
б) СН2=СН-СН2ОН 4- SOC12
Эфир
-НС1
ХН2
сг о
С1СНг~СН=СИ2 + SO2
il
736.
ОТВЕТЫ К УПРАЖНЕНИЯМ
эфир *
в) CHe=CH-*CH.OH+SOCl. —----------ь CHt=CH-CHs-O-SQCI 4-
(H-CJi.JjN
4-(h-C4HsJ®NHC10
' * A * ci
CH2 - CH - CHa - О - SOC1 4- Clb--CH4 = CH — CH2Cl+S0s+Clw
13-10, Апокамфанол-1 не образует апокамфанйлхлорнда с хлористым тионилом,
так как реакция должна включать нуклеофильную атаку с обращением конфигу-
рации, которая в данном случае невозможна по пространственным причинам, по-
скольку атакуемым атомом является углерод в голове моста.
13-11.
•а) (СН3)3СОН + И® (СН3)3СОНг (GH3)3C® + Н2О
(СН3)3С® + CHjOH
б) НОСН^СНгОН 4- н®
- (CHjJiCOCHy
V-~A -Н,О®
2: H-G-CH, S СН,~СН, простые эфиры
НС?"ОНг \/ ит’^
® '‘и.
}с—сн»
о*
СН3
100%-ная H,SO. J
---„ CHa-C-CHE-0S03H
йз -с |
СН3
сн3
в) CHg-C -CHj-
сн3
95%-ная
H.SO..
25 °с
СИ»
cH.-<Lch.-8h,+ h&. д‘"ь“в“а”
СН3
коиц. HtSO(, б °C
г) (CH3)3COQCH3)34-H® " т~ ——Т
н® •• • . е
(СНа)аСОС(СНа)3 (СНЭ)3СЦ-НОС(СН3)3
^Н®
(СН3)аС® (СН3)2С = С.Н2 —» полПмер
13-12. Этерификация очень чувствительна: к размеру и форме молекулы атакую
' щето спирта (разд. 16-4). Гидроксильная группа при С-Г1 в соединении XI гораз-
до более экранирована, чем гидроксильная группа при С-3 (С-11—ОН — это ак-
сиальная группа, которая находится с той же стороны молекулы, что и аксиаль-
ные метильные группы). Следовательно;'можно ожидать, что этерификация по
С>11 будет медленнее, чем по. С-3. Скорость окисления в случае хромовой кислоты
определяется атакой на связь С—Н, которая является экваториальной приС-11,
но аксиальной при С-3. Потому менее затрудненная экваториальная связь С—Н
при С-Г1 атакуется быстрее, чем связь С—-Н при С-3, При окислении по Оппенау-
еру алкоголят алюминия-образуется раньше переноса водорода. Скорость образо-
ОТВЕТЫ К УПРАЖНЕНИЯМ
737
вания алко гол ята для более затрудненного ОН при С-11 меньше, чем при С-3.
Следовательно, суммарная скорость окисления при С-11 меньше. .
13-13.
/Р /0Н
а) СН3-СС —»-СН2=С<
ХН Хн
А/7 = +15 ккал
(если пренебречь энергиями
стабилизации)
Даже если принять в расчет энергию стабилизации винилового спирта (~3 ккал),
рассчитанная величина &.Н должна равняться приблизительно +12 ккал. Следо-
вательно, константа равновесия скорее всего будет значительно меньше единицы.
Н< /Н
—ОН А//== + 18 ккал
Приняв величину ЭС для фенола равной 40 ккал, а для цикло гексадиено на —
. 5 ккал, получим All=+l8—40+5——17 ккал. Поэтому равновесие должно быть
значительно сдвинуто в сторону образования фенола.
АН = +18 ккал
Считая, что величина ЭС производного цяклобутадиепа равна нулю, а циклобуте-
вона — 2 ккал, получим АН—+20 ккал. Тогда равновесие будет сдвинуто в сто-
рону цйклобутенола.
13-14.
НБг
а) СНзОН +СН2=СИСНаВг-----> СН3Вг+СН8=СП—СН2Вг
б) СН3СН8Вг-|-СНяСНО в) (СНЯ)3ССНаОН+ СП3Вг
г) НОСИ3СНйСНйС1-1.аВг —> Вг(СН2)4Вг
д) С„Н0ОН+СНгВг
13-15.
н< ' /СНз
Csj=G
/ £ А
СНЭ Я
CF3COZH^ mjoHCi-OKHCb
Реакция не должна быть пбстадинпой, так как стерео химически она совершенно
однозначна. Очевидно, надкислота служит поставщиком ®ОН, присоединяющего-
ся по двойной связи. ‘
24 № 1Б40
738
ОТВЕТЫ к УПРАЖНЕНИЯМ
13-16.
цис- или транс -2-бромциклогексилацетат
CH3CO2Ag
СН3СО2Н, н2о
Н2О,
Ключевой стадией является реакция соединения XV с водой по ацетатной
группе, в результате чего образуется предшественник ццс-соединения. В безводной
уксусной кислоте реакции этого типа обратимы, и в результате соединение XV
взаимодействует с ацетатной группой, расположенной по другую сторону кольца,
давая тряиг-продукт.,
13-17. а) Следует ожидать, что транс-хлоргидрин будет реагировать значительно
быстрее, чем цис, вследствие участия соседней —0®-группы,
е
он
б) Цикло пентильное производное должно реагировать быстрее, чем циклобутиль-
ное; причина состоит в том, что для циклобутильного соединения участие соседней
группы менее благоприятно-вследствие того, что промежуточно должна образо-
ваться очень напряженная окись, в) Следует ожидать, что хлор в соединении
HOCHjCH (С1)СН=СН2, являясь заместителем в аллильном положении, будет
замещаться быстрее, чем первичный заместитель в НОСНаСНаС1.
НОСН2СН(С1)СН=СН2
< Л, / \
ОН I ' / \
---> СНг-СН-СН=СН2 -> сн2-сн-сн=сн2
<С1
еон т-т о
---‘> НОСНгСН(ОН)СН^СН2
ОТВЕТЫ К .УПРАЖНЕНИЯМ
739
13-18.
(оптически неактивен, поскольку промежуточный продукт XV не обладает опти-
ческой активностью)
13-19
быстро СН3 —СН3
CH2-CHa + H®z=i \о/ к
®Н
сн2ч®
I /ОН
сн/
медленно
Cl®, fe,
Вг9,
НОСН3СНаС!
НОСН/НаВг
скорость = й/ ЦСН2)гО][ Н® ][ Cl®] ЙК) (СНг)аО][ Н®][Вг®]
13-20.
а) СН3СН(ОН)СН2ОСН3;
13-21.
а) СНЯ CHj
| /С\ уСН2Вг
СН3СН с/
СНЭ
в) СН3“С-СНгОН
осгн5
сн*-снг
снг снг
Х''СУ
о
II
б) СНв4=СН-СН-С-СН-СН==СНг
CHs <^Н3
24*
740
ОТВЕТЫ К УПРАЖНЕНИЯМ
в) ВгСзяС—ОН—сно
I
сн3
о о
II II.
г) CHjCCsaCCCHj
д) СН3 сн3
I I
сн3-сн -сн—с=о
/°
сн3—d=o
Л?-22.
а)СН.,х//О
С
медленно
HlsOH
-он,
быстро |
1Г?^:СНя-С-18он
I
оспя
I
осн3
мсдяенпо
-HjO, - н®
ОН
СН3-С-ОН®
осн3
СН3\У*О
с
I
ОСН3
сн3
он он
j быстро J
С— ‘8ОН® СН3—-С— 18ОН
I aJ
ОСНя ®осн3
н
белее медленно
-снаон, -и®
сн^о
с
!
JSOH
б) Если бы метил ацетат вел себя как очень слабое основание (гораздо слабее
воды), то катализатор — серная кислота — протонировал бы исключительно воду
п совеем не протонировал метилацетат. Кислый катализ в таком случае не наблю-
дался бЫ.
I
осн3
он
®осн3
Более вйррятао, что кротон иржоедкижтет, не. к метокеизьному кнлпс.роЭТ, т> к
карбонильному вследствие возможности ’'стабилизации протонированной формы
за счет электронной делокализации, соответствующей двум почти эквивалентным
схемам спаривания электронов, в) При высокой концентраций кислоты как метил-
ацетат, так й вода, присутствующие в смеси, будут в большой степени протониро-
ваны. В то время как протопирование эфира оказывает каталитическое
действие, протонирование воды приводит к торможению реакции, поскольку
эффективная концентрация воды понижается превращением в Н3О®, который
вовсе не обладает нуклеофильными свойствами. t
ОТВЕТЫ к УПРАЖНЕНИЯМ
741
13-23.
SOClj Mg
a) CH9CH4CHSOH-----—>CH3CH2CHSC( —*
. пиридин эфи₽:
I. CHjCOCH,
----- ......... ->CHgCHBCHaC(CH3)aOH—►
-> CH3CH2CHsMgCi ——
2. М4О
НС1
* CH3CH2CHsC(CHs)2a
дымящая НВг
б) СНаСН2ОН —‘---------»-СН3СН!Вг
;Р
+ 2CH3CHaMgBr
ОСН3
Mg
----> СНэСН,МйВг
эфир
и,о
СН3СН2СНСН„СН3
СН,СОС1
---—Г* СН3СН2СНСН2СН3
“MCI ।
ососн3
К®§С(СН,),
й) (СНЭ)3СОН _н.л (СН3)2С--СН,
НВг
„ л -----2 ~~—>(CH3)3CHCH2Br
— Н(О ' перекиси
горячая кони.- H;SO4
г) СН3СНаСН2СНаОН ---------------кСн3СНаСИ = СН2
-Н3о
вй%-ная НЛО
СНзСЩСН = сн2---------
100%-мая HeSO.
СН3СН2СНСН5-----:--------
СИ3СНгСНСН8
iso3H
сн3
сн3
I Mg
CH3-C-Br-—-►
I Эфир
* СНаСН2
СНЭ
| СНзО. J
-^СН3—С—MgBr----kGHs—с—снаон—►
CH3iH2
| 4**<{|-йая НВт
д) СН3-С-ОН -———>
снэсн2
сн3
СН3СН2
сна
HjCrOi |
--->CH3~C-GHO
сн2на
. CFBcosH сн«Он Н®
е) СН2=СНЯ—77~*CHg-CH2 .8. —>
г -или O!t AgaO \ i ,
СН2-СН2
I I
снэо осн3
742
ОТВЕТЫ К УПРАЖНЕНИЯМ
ж)
н1
СНз - Р СН^Л-SO С1 V NaC1'
I CHr^SO2Cl . c2HsOH
l,r “Hci lx________A
OH ZOSO2C6H4CH3
н
НВг Mg
з) (СН3)3С-ОН------► (СН3)3С- Вг — — (CH3)3CMgBr -
эфир
(СН3)3ССНаСН2ОН —(СН3)3ССНаСН2Вг
CjHjONa Н,
---—(СН3)3ССН =СН2 (СН3)3ССН2СН3
С. £ HI
вв%-ная HsSO4 CFSCOSH
и) сн,сн2сн2он------------->СН3СН=СН2 —--------<
' 3 “ iso °C 2 бензол
—>-снэсн-сн2
NaOH
к) CHa=CHCH2Ci-----*-CHa=CHCH2ONa
-NaCl
сн3
СНВг3
К® ®ОС(СН3)3
“(СН3)3СОН
- е
5 CBr3
:СВт2 + Вт • ;
(СН3)3СОМ + : СВг2
(сн3)3сААс-!-Вг —»
{СН3)3С® + (СН3)3СО®°
* (Сн3)3С-О-С-Вт + Вг
JCH3)3C® + СО + Вг®
(СН3)3СОС(СН3)3
Z
или
(CH3)3CMgCl + RC- О-ОС(СНа)3 —ж RC-OMgCl + (СН3)3СОС(СН3)Й
или
Ag,COs
2(СН0)3СС1—(CH3)3COC(CH3)9+COa+2AgCl
ОТВЕТЫ К УПРАЖНЕНИЯМ
743
13-25. Следует ожидать, что для реакций Е2-отщепления CH3CH2C(CH3)S и
С!
СН3СОаС(СНэ)2 для соединения, меченного дейтерием, по сравнению с недей-
С1
тарированным аналогом отщепление в направлении метильных групп будет более
благоприятным, чем в направлении метиленовых групп. Это объясняется тем, что
скорость образования продуктов определяется скоростью разрыва связи С—Н
(или С—D), а поскольку скорость разрыва связи С—D меньше, чем С—Н-связи,
отщепление с участием CD2-группы будет более медленным. В случае Е1-отщепле-
ния сохраняются те же аргументы, несмотря на то что в наиболее медленной ста-
дии реакции связи С—Н или С—D непосредственно не затрагиваются. Однако
стадии, на которых происходит образование конечного продукта, должны проте-
кать с участием этих связей, и влияние дейтерия будет сказываться на распреде-
лении продуктов, как это описано для Е2-отщепления.
13-26.
ZllCIg
а) (СН3)3СОН 4- НС1 —(СН3)3СС| 4- Н2О (быстро)
(СН3)аСНС1'13ОН 4-НС! г5 ос’ без нагревания реакция не происходит
ZnCla
б) СН2 = СНСН2СН2ОН4-НС1—-^-СН2=СН—СН3—СН2С1 (медленно)
ZnCIs
CHgCH = CH—СЩОН4-НС1 —^-СН3СН=СН-СН2С1 (быстро)
H.SO4
в) (СН3)аСНСН2СН»ОН---------НСН3)2СНСН=СН2
' й нагревание ' '
С неопентиловым спиртом реакция не происходит.
.г)СН3СНаСНаСН3—О—5ОЯН является очень сильной кислотой, в то время как
CH3CFla—О—SO2—О—СНа'СН3 практически нейтрально.
Д) CH3Cf 4-СаН6ОН^-СН3-С<
XI Х)С2Н5
С С1СН2с/°
Х)Н
никакой реакции в аналогичных условиях не происходит.
is0 10 О
II н®, н,о II
е) СН3—С—ОСН3------->СН3—С—ОН4-СН3ОН
0 щ °
J Нф, н,о II
сн3—С — 18ОСН3----► СН3С—ОН 4- сн 38он
Быстра
Наличие или отсутствие 18О в метаноле должно определять положение метки 1SO
в метилацетате.
СИ, Н*~°Нг
СНз-С----i-O^CrOjH
Н Н
© ©
(CHjljCHCHO + НЭО + HCrOj
744 ОТВЕТЫ К УПРАЖНЕНИЯМ
Для соответствующего треяг бутилыюго эфира хромовой кислоты подобная реак-
ция не происходит из-за отсутствия д-Н.
ZnClj
з) СН.,-СН-СН3—-- СН2-СН-СН3
]• I HCt I I
ОН ОН ОН С1
С пропандиолом-1,3 реакция идет гораздо медленнее.
НС]
и) СН3СНСНа — —+СН3СН —СНа-ОН
у
Раскрытие цикла окиси триметилена происходит труднее.
СН3 СН,
I I . НВт . .
к) СН8—С—ОСНаСНа —С—-СНа”-------ЦСН3)3СОН + (СН3)3ССН2СНаВг
н3 сн3
В динеопентиловом эфире эфирная связь в подобных условиях не будет разры- :
ваться из-за пространственных препятствий, создаваемых неопентильными грУп-;-
нами для 3,^2-атак и.
13-27.
CH3CH2CHsCHaCHaOH
СН3СНаСН2СНСН3
Ан
(СН3)2С-СНаСН3
он
СН3СН:= СНСН2СнаОН
НСэзС-СНаСНаСН2ОН
(CH«CHeCHaCHs)sO
о
: |!
СН3СОСНаСН 2СН аСНаСН3
тификация которого описана выше
13-28. Структура А — (СН3)3СООН, структура Б — (СН3);,С(Х)С(СН3)3.
Реакция с водородом
2И„ NI
Д; (СН8)3СООн J---«- (СН3)3СОН4-НЯО
нг, Ni
Б: (СН3)ЯСООС(СН9)3 ——> 2(СН3)8СОН
Реакция с ацилирующими агентами
О
СНаСОС1 П -
А: (СН3)3С00Н---(СН3)аСОО-С-СН8
—ПС[ '
реагирует с реактивом Лукаса (ZnCI^HCI)
только при нагревании
медленно реагирует с реактивом Лукаса
при комнатной температуре
мгновенно реагирует с реактивом Лукаса
при комнатной температуре
обесцвечивает ДМпО4; реагирует с реакти-
вом Лукаса только при нагревании
дает осадок с AgNO3; реагирует с реактивом
Лукаса только прп нагревании
никакой реакции с реактивом Лукаса
реагирует с раствором едкого натра с обра-
* зованиём ацетата натрия и пентанола-L идеи-
ОТВЕТЫ К УПРАЖНЕНИЯМ 745
С Б реакция не происходит из-за отсутствия гидроксильной группы.
Реакция с метилмагнийиодидом
CHjMgl
А: (СН3)3СООН ——> (CHs)3COOMgI 4-СН,
CH3Mgl HSO
(CHa)sCOOMgl ----—» (CHs)sCOMgI+CH5OMgI----->
—> (CH5)SCOH+CH5OH
CH,MgI
Б: (CH3)3COOC(CH3)E----> (CHs)aCOMgI 4-CH30C(CH3)3
(CH)3COH
Полимеризация винилхлорида
нагревание
(CH3)SCOOC(CH3)3 ----------------------► 2(СНя)аСО.
(CH3)8CO. +СНг=СНС1 —т (СН3)3СОСН2СНС|
- (СН3)3СОСН3СНС1 + СН3=СНС1 —Т (СН3)3СОСНаСН(С!)СН2СНС| и т. Д.
s Термическое разложение Б
(CHj)jCOOC(CHjb —> 2(СНД,С0*
СН, О
СН»-С—О’ —> снэ-с-сн3 + сн3*
‘ сн3
сн3- + сн3- -—*- сц,сн3 *
Термическое разложение Б на воздухе
СНг+Ог —* снаоо.
СН300- -|-Н —R —* CH,fO,H + R-(HR—любой донор водорода)
снДн —+СН2О+Н2О
Альтернативные структуры
СН3
А: СНаО-Л~бН Б: (СН3)аСНОСН2СН2ОСН(СН3)3
(1н3
(так как каждый студент, по-видимому, предложит свои альтернативные струк-
туры для А и Б, нет смысла обсуждать, как будут вести себя в данной серии
реакций соединения со структурами А и Б, предложенными выше).
/3-29.
a) (CHjhCHCHzOH + Н® (следы)
ОН СНг сн I(СНз5г :
1 п ____________________________XJ____________________
S 4 ”3 2 1 ОВД.
746
ОТВЕТЫ к УПРАЖНЕНИЯМ
б) (СНЭ)3ССН2ОЦ
он сн,
______II
5 4 3 2
(СН,Ъ
в) СН3ОСН=СНСН3
ZCH3
ОСН, =СЧ
3 2 I
О (СНЭ)ЭСОН
он
(СНзЬС
5 4
д) (CHjijCOH + ССЦ
__ менее сильная
водородная связь
(СН3)3С
е) CFjCHjOH + Н® (следы) (спектр протона)
он СНг
5 4 3 2
О м.д.
Ж) СГэСНгОН + Н® (слепы) (спектр фтора)
5 4
О МД
/3-30. Пусть х, у и z— мольные доли СН3СНаОН, CHaCD2OH и CHD2CH2OH
соответственно. Масс-спектроскопия позволяет нам непосредственно определить
(x/p-J-z), так как масса СНЯСН2ОН равна 46, а масса обоих дейтерированных соеди-
нений — 48. Проинтегрировав резонансные сигналы в ЯМР-спектре для ОН, СНг
и СН3. получим следующее выражение:
J СН2-область
\ ОН-область
л-]- г
x-^-y+z
J СН3-область
J ОН-область
. । 1
x-j-y-j-—г
ОТВЕТЫ К УПРАЖНЕНИЯМ
747
Поскольку х/(у 4" г) известно, мы можем найти решение для %, у иг. Значение (х-ф-
4-р)/г можно также найти из отношений пиков в масс-спектре, соответствующих
СН® и CHD®, т. е. массовым числам 15 и 17 соответственно.
/5-3/.
CD3 CD3 -~-РС> (CD3)2C=CDa
С —Cl медленно^ быстро
io3 do3 cd3 (Cd3)3coh
Можно ожидать, что в приведенной выше реакции суммарная скорость образова-
ния НС! будет незначительно отличаться от скорости, наблюдаемой для обычного
mpem-бутилхлорида, поскольку определяющей стадией реакции является иони-
зация хлорида, которая не связана с разрывом связей С—Н или С—D. Однако
стадия, состоящая в образовании изобутилена, включает разрыв связи С—Н или
С—D, и можно ожидать, что она будет медленнее для дейтерированного хлорида.
Соотношение продуктов Sn1/E1 будет, следовательно, отражать большую тенден-
цию к образованию ЗыЬпродукта в случае дейтерированного хлорида но сравне-
нию с обычным хлоридом.
13-32, Можно ожидать протекания следующих реакций, указывающих на транс-
коцфигурацию 2-фен и л циклогекс а но л а;
(основной продукт
p€5K(CHfi)
Глава 14. Альдегиды и кетоны. Реакции карбонильной
группы
14-1. Окисление тетраацетатом свинца
748
ОТВЕТЫ к УПРАЖНЕНИЯМ
Окисление перйодатом натрия
-4-4- , »Ю)в, ^B£L.
I I ’
он он
vio3Q +
14-2.
СН3СО2Н ± Нг —+ СН3СНО4- Н2О
(ЭС СН8СО2Н 18 ккал) ДН——19,64-18——1,6 ккал
СН3СОС| Д- Н2 —- СН3СНО 4- НС1
(ЭС СН3СОС1~0 ккал) Д/7 =—16,7 ккал
СН3СНО 4- Н, — СН3СН2ОН
Д/7=—14,6 ккал
Восстановление ацетальдегида в этанол энергетически более выгодно, чем
восстановление уксусной кислоты в ацетальдегид, по сравнимо с восстановлением1
ацетилхлорйда в ацетальдегид.
CH3CONHa4-H3 —+CH3CHO4-NHS Д/7——154-11 =—4 ккал
Следует ожидать, Что ацетамид будет восстанавливаться труднее, чем ацетил-
хлорид, из-за большей энергии стабилизации (!1 ккал) амидной структуры
(•—CONH»), которая теряется при восстановлении в ацетальдегид.
си3
CHj-C—сн2
он он
сн3
снэ-с—сн2
I I
он он2
-H2o v
сн,-с-сн,сн, :
5 11 1 3
б
Путь образования, мет ил этил кетон а, приведенный выше, вряд ли стоит считать
реальным, поскольку неизбежный в этой реакции первичный Промежуточный кар-
бониевый ион образуется довольно трудно. Реакция образования нзомасляного
альдегида является более предпочтительной, так как в качестве промежуточного
продукта образуется третичный карбониевый ион.
ОТВЕТЫ К УПРАЖНЕНИЯМ
749
14-4.
СН3СН3
СНз
СН3-С—С—СН3 —> СНЭ— i—C— CH3-|-H,0 ДН=—8,0 ккал
I II ж
СН3О
ОН
ОН
14-5.
СНз
Н-С—СН2
ОН ОН
н®,
-нго
снэ<1он
Н-С—- С-Н
-н®
СН,СНгСНО
н сн,
сн,-с—с-сн,
11
он ОН
Н® х
-н2о
СН, :® сдвиг
-Н®У
н
I
СН,—С—
1 I
„ он
СНЭ
с-сн,
ф
Н ®сдвиг i -Н®
(СН,)3ССНО
(СН,)гСНСОСН,
Образуются и альдегид н кетон,
14-6.
но кетон является основным продуктом реакции
(СН,)2^-С(СН,)2
о
(СН,)гС—С(СН,)г
„.© I
(напряженный цикл)
(СН3),ССОСНЭ
СН,;0
-н®
сдвиг
(СН3)2С—С(СН,)2
! ®
ОН
14-7. Следуёт избегать присутствия кислых агентов. Подходящим методом может
быть образование и пиролиз диксантогенатпого эфира (разд. 11-15), а также де-
гидратация над окисью алюминия (разд, )3-6,Б),
(CHs)2C(OH)C(OH)(CHs)2
сн3 сн3
сн,он I I
-——> СН3-С-—С—СНз
СН3СН3
I г
сн2=с-с=снй
-COS, -CH3SH
s=c
c=s
SCH,
750
ОТВЕТЫ к УПРАЖНЕНИЯМ
14-8. °р7н CiHs-? ?Н* он он н н® W®tl-H® -н,о Ц н 'г ? С6Н5-С—СН2 СьН^-С с-н ^он н |-и® С6Н,СОСН,С6Н,
Из двух возможных продуктов бензилфеиилкетои более устойчив и образуется
медленнее. По сравнению с дшренилацетальдегидом он более устойчив вследствие
большей резонансной стабилизации, связанной е сопряжением карбонильной
группы с фенильной. Однако он медленнее образуется, поскольку соответствую-
щий ему промежуточный карбониевый ион менее устойчив по сравнению с интер-
медиатом, приводящим к образованию дифенилацетальдегида.
14-9.
СН, н - сн, н
} I Н® I I
СН,-С-СН,-С-СН, —2-------- СН3-С-СН2-С-СИ,
3 1 г I 1 -н,о I s I ’
СН, о—он 2 сн3 о®
СН, ф /СН, ?Н, ф СН, СН,ф
СН}-С-СНг-О=:С^ сн3-с-сн2-с=о-сн, сн3-с-сн,-с=он
СН, Н СН, Ж сн,
| нго, -н® | НгО, -н® |-н®
СН, л СН, СН, сн,
СН,—С—СН,—ОН -В CHjCHQ СН3-С-СНг-С=О + снрн СН3—С—СН,—С=О
СН, СН, i ^н,
Вероятно, наиболее благоприятным будет сдвиг неопентильной группы, поскольку
он максимально уменьшит пространственные затруднения. Однако гндридный
сдвиг приведет к наиболее устойчивому продукту — кетону.
14-10. С,Н1()О: ИК-сиектр указывает на наличие карбонильной группы
('-1720 см-1). В ЯМР-снектре имеются сигналы двух типов протонов с соотно-
шением интенсивностей 2 ; 3; триплет — квартет характеризует этильную группу
(СН3СН,—). Структура, согласующаяся со спектрами, следующая:
СН3СН 2СОСН gC Н 2.
ОТВЕТЫ К. УПРАЖНЕНИЯМ
751
С4НВО: ИК-спектр указывает на наличие карбонильной группы (~ 1720 см-1),
а в ЯМР-спектре обнаруживаются сигналы трек типов протонов с соотношением
интенсивностей 1 : 1 : 6 и химическими сдвигами, характерными для водородов
в группах СНО, —СН и СН3. Дублет от водорода альдегидной группы и дублет
1 Р
от метила согласуются со структурой (СНЯ)3СНСНО. Протон —СН расщепляется
на,семь линий шестью метильными протонами, и каждая из линий расщепляется
далее на альдегидном протоне (разд. 2-6,В).
С3Н(,О: в ЯМР-спектре обнаруживаются сигналы двух типов протонов с соот-
ношением интенсивностей 1 : 2; триплет и квинтет могут быть обусловлены спин-
спиновым расщеплением двух эквивалентных протонов на четырех эквивалентных
протонах. ИК-спектр показывает, что функциональная группа с кислородом не
является ни карбонильной, ни гидроксильной. Эти факты согласуются со следую-
щей структурой:
С1-12—СН2
I I
СН2-0
С4НеО: в ЯМР-спектре имеются сигналы четырех различных типов протонов
с соотношением интенсивностей 1 : I : I :3 и химическими сдвигами, характер-
ными для протонов альдегидной (9,5 м. д.), винильной (^6,5 м. д.) и аллильной
(1,9 м.д.) групп. ИК-спектр указывает на присутствие карбонильной группы
(1690 см-1) и двойной углерод-углеродной связи (1650 см-1). С такими спектрами
согласуется следующая структура: СН3СН=СНСНО (цис, транс или оба изо-
мера), Сложность резонансного сигнала винильной группы объясняется спин-
спиновым расщеплением вйнильпых протонов друг на друге, на альдегидном и ме-
тильных протонах.
14-11. а) СН3СОСС13>СН3СОСН3; индуктивный электроноакпепторный эффект
группы СС!3 увеличивает электроположительность карбонильного атома углерода,
делая его более чувствительным к нуклеофильной атаке, б) СНЯСОСНЯ>
>(GH3)3CCHO; объем щрещ-бутильной группы затру денег присоединение .нуклео-
фила к карбонильному углероду, в) СНЯСОСН3>СН3С02СН3; присоединение к
эфирной карбонильной группе приводит к потере всей энергии стабилизации кар-
боксильной группы; кроме того, карбонильный атом углерода в эфире не так элек-
троположителен, как в альдегиде, вследствие вклада приведенных ниже структур:
г) СН3СОС1>СН3СОСН3; индуктивное влияние хлора дедает карбонильную груп-
пу более реакционноспособной по отношению к нуклеофильной атаке [см.
пункт (а)], д) Циклобутанон более реакционноспособен, чем пиклопентанон. Обще-
принятое объяснение состоит в следующем: реакционная способность в случае
циклобутанона является следствием уменьшения углового напряжения, которым
сопровождается присоединение по карбонильной группе; в кетоне угловое напря-
жение составляет 120—90=30°, а В продукте присоединения оно равно всего
лишь 109,5—90=19,5°. Реакционная способность цикло пентанона уменьшается,
поскольку угловое напряжение в этом случае, по-видимому, не играет существен-
ной роли сравнительно с напряжением, обусловленным заслоненным взаимодей-
ствием между несвязанными атомами у соседних атомов углерода; при переходе от
цикло пент ано и а к продукту присоединения добавляются четыре таких взаимодей-
752 ОТВЕТЫ К УПРАЖНЕНИЯМ
6 заслоненных взаимодействий 10 заслоненных взаимодействий
(при плоской структуре) (при плоской структуре)
14-12. Образование циангидрина при взаимодействии ацетона, цианистого натрия
й воды проходит через следующие стадии;
CHj. Н(О СН- ,ОН
">с=о+®С№ с •;—- с +ОН
СНз CH8/\:n CHa/^CN
Если гидроксильный ион не удаляется помере его образования, положение равно-
весия будет неблагоприятным для образования циангидрина. Таким образом, до-
водом в пользу применения HCN вместо NaCN. является то, что он выводит из ре-
акции НО® по схеме; HCN4- НО®£ Н ,0+CN®.
14-13. Если наиболее медленной стадией является образование CN®, скорость
не будет зависеть от концентрации ацетона;
скорость — k [HCN] [ОН®]
Если наиболее медленная стадия состоит в атаке СМ® на карбонильную группу,
скорость будет подчиняться следующему закону;
скорость =fe[CHaCOCHs][CN@]=ft^[HCN][OH®][CHaCOCH3],
г№ К — константа равновесия для первой стадий.
14-14.
a) CHaCOCHs+HCN —* (CH3)aC(OH)CN ДЯ=-1,0 ккал
CHsCOCHs 4-HCas СН —> (СН3)2С(ОН) Cs СН ДЯ =— 1,0 ккал
б) Сила ацетилена как кислоты так мала, что требуется очень сильное основание
для того, чтобы образовалось хотя бы незначительное количество дцегилеиид-
иОна. Тогда некоторые реакции такого типа становятся вполне возможными,
14-15.
СНС134-КОН^±К®?С)34-Н20 .
СС.1О СС1а
1 н/3 ... |
’ СН3СОСН3-ЬеСС1я СН3-С-СН9 СНа~6-СН8
О® -он© in
Дополнительные свидетельства в пользу приведенного выще механизма могли бы
быть «случены при изучении скорости реакции (чтобы установить Йкон, которому
она подчиняется) и экспериментов по обмену в СиО; если первая равновесная ста-:
дия существенна, то возвращенцыйьиэ: реакций хлороформ должен содержать дей-
терий.
14-16. Образование циангидрина для циклогексанона более благоприятно, чем
для случая цйклопецтанона, поскольку все заместители, связанные с углеродными
ОТВЕТЫ; К УПРАЖНЕНИЯМ
753
атомами циклогексанового кольпа, находятся в заторможенных конформациях;
в ни клонен та но не все они находятся в заслоненном1 положении в плоской кон'фор-
мации кольца, и эта конформация дестабилизирует продукт присоединения при-
близительно на 4 ккал по сравнению с неплоским шестичленным циклам. Образо-
вание циангидрина на циклобутанона предпочтительнее, чем из циклопентанона,
поскольку решающим фактором является уменьшение углового напряжения при
превращении кетона в аддукт (т. е. sps^-snB) (см. упражнение 14-1J, д).
14-17.
снэ он.
CH3 XOSOZ® Na®
СНЭ zoh
)C
CH, XOSOt® Na®
H®
CH3/O,-H
zc<7
CHj OSO2H
CHj
ZC=O + H2O + so2
CH3
®OH
CH, уз®
V у-.
CH, XOSO2® Na®
CH,
zC=O + so,®
CH,
При разложении в кислом растворе одним из продуктов является сернистая кис-
лота, которая неустойчива и дает SO2-4-HaO, тем самым сдвигая равновесие в иа-
' правлении разложения. В основном растворе бисульфит превращается в сульфит,
‘ который не присоединяется к карбонильной группе, что также приводит к сдвигу
равновесия.
*’ 14-1th Если смесь циклогексанона и циклогекеанола встряхивать с насыщенным
раствором бисульфита натрия, а затем проэкстрагировать эфиром, цвКлогексапол
растворится в эфирном слое, тогда как циклогексанон останется в водной суспен-
t Зии в виде продукта присоединения бисульфита натрия. Фильтрование и обработ-
ка продукта присоединения водной кислотой или основанием с последующей экст-
ракцией эфиром приведут к переходу циклогексанона в эфирный раствор.
14-19. Одно соединение С—СН3 (которое может существовать в оптически актив-
ных формах) и одно соединение —N®—СН5.
14-20. Вследствие биполярной природы карбонильной группы В альдегидах и ке-
тонах присоединение воды происходит относительно легко- Константа равновесия
гидратации особенно велика в случае: а) формальдегида, поскольку энергия связи
карбонила необычно мала (166 ккал по сравнению с 179 ккал для кетонов); б) три-
хлорацетальдегида, поскольку электроне акцепторный индуктивный эффект ато-
мов хлора повышает полярность карбонильной связи, делая её более реакционно-
способной по отношению к атаке водой и аналогичными реагентами; в) цикло про-
панона, поскольку при превращении кетона в гидрат происходит уменьшение угло-
вого напряжения. Угловое напряжение в кетоне составляет (120—60)=60 , а в
гидрате — (109,5—60)—49,5°. Следовательно, при гидратации кетона изменение
гибридизации углерода цикла от spl к sps сопровождается уменьшением углового
напряжения на (60—49,5)—10,5Ч.
14-21. Если образование ацеталя будет следовать этому альтернативному меха-
низму. то будет происходить разрыв связи С—О метанола. Поэтому, если в реак-
ции использовать меченный “О метанол, метка будет обнаруживаться исключи-
тельно в воде Н318О. Механизм, в. котором определяющей скорость стадией яв-
ляется атака соединения IV метанолом, предполагает, что метка 1ВО из метанола
будет целиком находиться в ацетале и будет отсутствовать -в воде.
14-22. Метанол быстро присоединяется к .карбонильной группе хлораля, давая
полуацеталь, по причинам, приведенным в упражнении 14-20. Отсюда следует,
что образование ацеталя происходит медленно вследствие того, что равновесие,
включающее выделение воды из полуацеталя, сильно сдвинуто в сторону полуаце-
таля. Это обусловлено электронным эффектом группы СС1Я, который делает катион
1
754
ОТВЕТЫ К УПРАЖНЕНИЯМ
неустойчивым.
CCi3
СС1;
н/^ОСНз
14-23,
а) (СН3)аС=О+НС(ОСгН6)8—p(CHs)2C(OC2Hs)s-bHCOaCjHs
Если предположить, что энергия связи карбонильной группы в ацетоне такая же,
как в этилформиате, то ЛЯ реакции будет равна ЭСэтилформиата (т. е. приблизи-
тельно —15 ккал).
5)
(СНэ)гС=О + Н®
©
(СН3)2С=ОЯ
, л®
(СН3)2С=ОН
/'
с2н,ох ОС2Н3
/С
Н ЧЬСгН5
я
/°
о—сн
Сгнь ОС2НГ3
он ®сгСдНз
/ II
(СН3)2С * дн
о-сгн5 осгн3
fa ?-СЛ
сосгн5 О-С2Н3
(СН,)2С о7сн
®ОСгН5 осгн.
?с^ ©
(СН3)гс + но=сн
ОС2Н3 ОС2Н3
По-видцмо.му, не является существенной ни одна из стадий, включающая разрыв
связи О—С2Н5.
14-24.
п /°®
Н8С«О-р.®ОН Н2С<
Х)Н
НаС< +Н2С«О —± Н2С —О—сн3 —о©
-ОН I
он
лСНгО
—>-Нй-С-О-СНй-О-(-СН2-О-)п_1-СН3О0 Л’2-^
I —он© л
- ОН jt;
-^НйС-О-(-СН2О-)„+8~СНаОН ;
I
он
Образование триоксиметиЛ'ена должно обязательно включать разрыв связиС—О,
который не осуществляется в основном растворе по тем же причинам, по которым
в основном растворе не происходит образования ацеталя.
ОТВЕТЫ К УПРАЖНЕНИЯМ
755
14-25.
14-26.
Пусть А = [(СН3)3СО);
н=[нф];
АН = _(СН3)3С§н]
BH = [RNH®]
он=[но®]
Скорость реакции, согласно уравнению (J4-J), равна
о=й-ЛН.В
„ ВН-ОН DIT „
=, и так как ВНд-В = 1М, то
„ (1~В),ОН (.1-В)Яда пн_ А'®
лв=-----§---=~В-Н"’ 0Н“н“*
так что
Д~ ~ ОН > и Taii АН А — 1 М, то
АН.Л^ _ (Х'в/А^Н
Кн = 71 .H- u , так что АТ] = , ;Т7
В (1 — АН) Н 14_(Л'В/ЛЩ)Н
Поэтому
(К'в/ЦН 1
° 1+(^в/Мн‘ >-HWH
Отметив, что Ав = 10-п, 7<в = 10-14, Д'к, = 10-и, мы можем записать
<. юзн Ю’Н
v~Й (1-1- H)(1 + W’H) 1 + 103Н+ 103Н2
Теперь примем для максимального (и минимального) значений v do/dH=Q
[можно также построить график в координатах Н — (v/k)]
Л (1 + !03Н-Ь 103Н2)103— 103Н(103 + 2- 103Н)
0-fc (I +ю3н-нозна)а
0=1— IO3HS
Н= /ЙП = 3,2-10-а = рН1,5,
756
ОТВЕТЫ К УПРАЖНЕНИЯМ
ti(pi-n,5) _32/ го3
и(рНО) ~33) 2-103
14-27.
о (pH 1,5)
й (pH 7)
32/10~4
зз/ I
в=104
«о+на Н\с—Sh+ci®
н/
-н*о к ей
)С=бСН3
н/
14-28.
слн5ы
-С6Н5С1
C$HS СОгН + С6НьСОгН
50% 50%
Механизм реакции фенилЛития с 1^хлорциклопентеном-1-^С
14-29. Реакция с Р21$
РС15 РСЦ® + Ci®
R;.C=O + РС14® КгС=О~РС14 - -» ---►
КгС-О-РС14 R^C-O-PCL, + С1Ы ------> RjCClj t POClj
, Cl Cl
ОТВЕТЫ К УПРАЖНЕНИЯМ
757
Реакция с SFt
tt1 (Z1 <
R2C=O + SF4 -----* RjCsOSFj .+ F^ -----»- R*C-OSF3
F
Z">® A
-* R2C-O-SF, + F'-J > R2CFj + SOF,
F
/4-30. В присутствии сильного основания между мет илэтил кето ном и етор-бутн-
. ловым спиртом устанавливается равновесие, которое при использовании оптиче-
ски активного втор-бутилового спирта приводит к рацемизации.
CHjCHj
СН3
СН3СН3
оптически
активный
CHj Н
СН3СН2 '''о®
СН3
+
о снгсн3
ОПТИЧ6Ски
Псактиьш
14-3/. Можно ожидать, что первые 10% н-бутанола-1-3Н окажутся оптически ак-
тивными, поскольку скорости реакции для альтернативных конформаций реаген-
тов, вероятно, не могут быть идентичными.
D СНЭ СН3СН2СНг сн3
A Lc С Lc
СН3СН2СНг 'Ч'СНгСН, <?СН2СН3
бистро медленно
Я-бутацол-г1-гН и Лугано П-1-2Н
В равновесии следует ожидать образования только рацематов.
/4-32.
RCH, — N=.N — Н—с RCHB + NS ДН =—53,3 ккал
Сеободнорадикальный цепной механизм
О,
Инициирование (предположительно): RCH2 —N = N — Н —RCHa--j-Ns
ё RCHs-N=N~H + RCHa- —*-RCH2-N=N- + RCH3
Развитие цепи: j &Н— —5,3 ккал
I RCHa — N=;N- —>RCH2-4-N'2 Д/7 = —53,0 ккал
карбанионный механизм
A f
RCHz-N=NH + ^ОН -—RCH2-N=N: + НгО
© Д'
RCH3-N=N_: -->- RCH2:w + N2
. Q ©
RCHZ. + H2O ----► RCH3 + OH
758
ОТВЕТЫ К УПРАЖНЕНИЯМ
14-33.
СЙ быстро
С^СНО + Hw —Т
/ быстро
C6HsC^ 4- MnO4w
ОН
н
еда'
он
н .о.
. ( )| ®
* : '£ C6HsC-O-Mn=OH
он о
iy /ЧП ®
CtHs-C-O-Mn=OH + нго
он о
медленно
ф
CaHjCOjH + M11O3H 4- Н3О
Согласно приведенному выше механизму, скорость медленной стадии будет про-
порциональна (Н®), {MnO®J и }СсН5СНо]. Кроме того, скорость для CeHbCDO
будет меньше, чем для С3НЬСНО, поскольку медленная стадия идет с разрывом
связи С—Н, Вхождение 18О в бензойную кислоту из Мп18О®, а не из воды Н3,аО
также согласуется с этим механизмом.
14-34.
н о-он
еда + еда'
о о
н о
। Л
с6н5с-о-о-сс6н^
он
-СаНрСО,® _ (?) ® /1 -и® $
----“3 ► С6Н5С-ОФ ------------->- С$Н^С-ОН —S—► CjHjjC
ОН он он
/4-35.
. нагревание
Инициирование: ROOR--------»- 2RO
/Н
(CHs)sCHCHaC< + RO- —>• (СН8)4СНСНг - С=О + ROH
х0
Развитие цепи: (СН3)3СНСН2—С=О —> (СН3)2СНСН2• 4-СО
,Н
(СН8)гСНСНа. + (CH3)2CHCHSC< -
^о
—► (СН3)гСНСНв+(СН3)аСНСН8СО
сдан + нсогн
14-36.
г снго
2^СН,)3ССНО ------(СН3)3ССНг0Н + (СН3)эССОгН
(снесено +• СН2О - и->- (СНэ)3ССНгОН + нсогн
®он •
(CHj)jCCHO 4 снго - у/—» сдан + (СНЭ)3ССО2Н
ОТВЕТЫ К УПРАЖНЕНИЯМ
759
Можно ожидать, что формальдегид будет скорее восстанавливать триметилацеталь*
дегид до неопентилового спирта, чем окислять его в триметил уксусную кислоту.
Причина этого в том, что НО® легко присоединяется к карбонильной группе фор-
мальдегида вследствие малой прочности связей в последней. Пространственные
препятствия, создаваемые метильными группами в триметилацетальдегиде, будут
затруднять атаку, если она происходит по карбонильной группе. Тогда восстанов-
. ление триметил ацетальдегида будет происходить путем гидридиого переноса от
продукта присоединения Н2С=О и НО®.
14-37, Здесь приведены только некоторые из большого числа возможных путей
’ синтеза.
А 1дОз *
а) (СН8)2СНСН2СН2ОН-----> (СП8)2СНСН = СН2 —>
нагревание
1. о,
---- (СП3)8СНСНО
г. Zti, н,о
б) СН2—СНСОоН сан,он, it® СН2 — СНСО2СаН5
£н3-СНз ” сна~сн2
cHsMgCi СН3—CHCOCHj
cacl, £н2—СН2
LiAlH4
H;SO4
нагревание
СН2-СНО
1.0, J
2. \1г
сщ-сно
г) СН8—С=СН2 1.0, СН8—С=0 zn, hci СН2 —СН8
tns-CH2 г-Zn, iho ch2-Jh3 (Lii2-CHa
LiAIH,
CC13CHO-----> CC13-CH2OH
MnOj PCI,
I---->- CClsCOgH--> CC13-COC1
—* CClj—CO2CHjCCI3
HCN
СОдН
14-33,
*) н-с-с-н —2^* н-с-с-он —
н
(внутримолекулярная реакция Канниццаро)
НО О
I I’ Я
Н-С-С-Ои
Н
ОТВЕТЫ к УПРАЖНЕНИЯМ
б) NHjOH + ОН : N—ОН
0
СН3____ :NH-OH „ :NHOH
С=Ъ + CNHOH CH3“C-O® CH3-C-OH
/ I (
CH, CH, CH3
СН3-С-^Нг® (CH,)jC=NOH
CH,
В этом случае конденсация карбонильных соединений с производными RNH2
катализируется основанием
Ы Ft
В) CHj-C—С-СН3 ---------- >- CH3“C—G —СН3
-а*Вг
СН3-СНг-ССН3
ФОН
CH3CCHZCH,
II 3
О
(пинакопиновая
перегруппировка)
!-) ’снг=о —сна=мн
—HjO
НгМ-СНг-ЫНг
^NH
CHz=Or СНг NH3 r ^Нг '"‘СНг
-НгО ’ N ^NHZ СНДО HN /Н
чсн2 хснг
CH2OH
ЗСНг^О, СНг СНг
N
HOCH/ 4'cif2"CH2OH
я®.
-Нг0
HOCHf
СНг ^СНг NH3
N N -н®
''СН^ ХСНгОН НОСНг
СНг-NHa
СНг СНг и
I I -------
N N
ХСНг СНгОН
14-39. а) Реакция не происходит; в основных условиях ацетали устойчивы.
®он
б) (CHafoGCCHgGHtf^—(СНаЬСС =СНСН3
!! I
О ОН
КМпО,
нао
(СН8)»ССО2Н -С.НзСНО
Окисление будет протекать в направлении, указанном выше. Окисление в основ-
ных условиях не приведет к разрыву связи (СН3)3С—С, так как при этом а-угле-
ОТВЕТЫ К УПРАЖНЕНИЯ^
761
роде нет атомов водорода, способных к енолизации.
СН3
I щосн,
в) СН3—С—СН3 (СН3)ЙС—СН3С] -|” (СНз)3С—СН3ОСН5
I I ~С1кон
a ci -cP
Можно ожидать, что отщепление будет более быстрой реакцией в этих условиях,
г) Не следует ожидать восстановления связей С~-С1 в Н—С, если условия доста-
, точно мягкие.
илш4
СС13СНО------+CCi3CHaOH
д) Боргидрид натрия будет восстанавливать альдегидный карбонил, но не карбо-
ксильный
Cl'lO NaBH, СНаОН
со2н соан
е) Можно предполагать, что восстановление карбоксильного карбонила будет про-
исходить очень медленно по сравнению с восстановлением карбонила формаль-
дегида
СН2О-{-НаС
/ОН
—>СН3ОН4-НСО©
14-40. а) Диметил мето ксиацсталь. б) 1-Оксиэтан сульфо пят натрия, в) Эти лор то -
ацетат, г) 'трещ-Бутилат алюминия, д) Диметил циан мети л ацетат, е) Днметилгид-:
разон ацетола, ж) Циклоиропилметилкетоксим.
М-41.
0 х---х ° ®
М11О4 + н—с-^о
медленно
НМ11О4 + СОг
Здесь гидридный перенос происходит в определенной степени сходно с реакцией
Канниццаро;
н ОН
H-G-0
н н
н он
®о-с-н + с=о
А н
Глава 15. Альдегиды и кетоны. Реакции с .участием
замещающих групп. Ненасыщенные а поли-
карбонильные' соединения
15-1. а)’ »=(6- 10~в+5,6-10~4- 10-7-Ь7.10-7)-1=7,06- |0-’ моль-л-’-с-1.
б) При pH 5 [Н®]= 10“5, —1,~ —1 >75- Н)~а- Обозначим (CH3CO2©J
IVjri^COsri J
762
ОТВЕТЫ К УПРАЖНЕНИЯМ
через х
Ю-6т
-7- = 1,75-КМ; х=0,636; 1—я=0,364
1— X ’
v=(6.i0’'»4-5,6.I0-i.10-6+I,3.10-s-0,364+7.]0-B4-
+ 3,3.10“fl. 0,636 + 3,5.10-°. 0,364-0,636) =
=3,4.10-е моль-л-1.с-1;
в) В отсутствие уксусной кислоты и ацетата скорость будет равна:
v =/г+k ф [Н3О®]+* q [НО®]
Г1дМ пи
В кислом растворе скорость становится равной о=£+& ф[Н3§1, в то время как
« Hs°
в основном растворе v—k-}-k q(H0). Таким образом, график зависимости скоро*
ОН
ф
сти от [НаО] будет представлять собой прямую линию с наклоном k m, отсекаю-
н,0
щую отрезок k, при низких значениях pH. Подобно этому при высоких pH график
зависимости скорости от [НО®] будет прямой линией с наклоном k q, отсекаю-
но
щей на ординате отрезок k, В присутствии уксусной кислоты СН3СОгН и ацетат-
иона скорость равна:
1СН3соаН}+АСНзСО0[снв СО®]+
+г 1СН3СОгН] [снасо®]
Измеряя скорость при постоянном pH (т. е. при постоянном буферном отношении
ICHSCO®[/[CH9COSH1), но изменяющихся концентрациях ацетата и уксусной
кислоты, можно оценить вклады значений скоростей в уксусной кислоте и ацетате.
15-2, Лимитирующей стадией рацемизации и бромирования emop-бутилфен ил ке-
тона является енолизадия, что и объясняет, почему обе реакции протекают с оди-;
паковой скоростью.
СНгСН8 сн3ч /CI-LjCHa НФ
сн3-с-н НФ ''(У ► рацемический кетон > || — снгсн3
свн6-с=о медленно /С. Вт? 1 СОНВ' Х)н ! г СН8-С—Вг енол | (асимметрия при а-у г- СяНк—С = О ' ле роде исчезает) °
15-3. а) При равновесии скорость прямой реакций (аиетон->енол) равна скорости
обратной реакции (еиол->ацетон). Если при равновесии концентрация енола рав-
на 0,00025%, или IM, концентрация ацетона будет равна 1=4- №.
Следовательно, скорость прямой (или обратной) реакции в нейтральной воде
(pH 7) равна 7,06- |0~г-4-10^=0,282 моль- л~1-с-Ч б) Енолят-анион; плотность
заряда и, следовательно, реакционная способность метиленовой группы гораздо
выше в анионе, чем в еноле.
®:СНа-С = О
I
СН3
ч-->СН2 = С — 00
I
СН8
ОТВЕТЫ К УПРАЖНЕНИЯМ
763
в) Сл еду ет ожидать, что Д енол а б удет б о л ь ш е Д д эта н о л а, по скольку обр азо в а -
иие резонансно стабилизированного енолят-аниона энергетически более выгодно,
чем образование этокси-аниона, для которого такая резонансная стабилизация не-
возможна. г) Медленная стадия енолизации ацетона, катализируемая либо кис-
лотами, либо основаниями, состоит в разрыве связи С—Н. Поэтому в одних и тех
же условиях еволизапия CD3C0CD3, при которой разрывается связь С—D, будет
медленнее, чем енолизация СН3СОСН3. д) Одно из объяснений состоит в том, что
происходит постадийнын процесс, в котором уксусная кислота образует комплекс
с группой С=О, и С—Н-связь рвется при атаке ацетат-иона.
о-.нооссн, он
быстро || СНзСОО® |
CHgCOCH, + СНаСООН СН3ССН3---------------- СНа - С = СНв
“ а 1 3 а медленно
15-4.
_ ®ОН
н® ||
СН8СОСН2СН3 -+ CHSCCH2CHS
он о
-н® I Вг! II
-----СНа - С =СНСНЭ —»- СНоС-СНВгСНз
© о
ОН Q II Bli
----► СН2-С-СН2СНЯ —> BrCHaCOCHjCHs
По-видимому, п основном растворе главную роль играют электронные факторы.
Можно заранее предсказать, что из двух возможных енолят шпионов менее устой-
чивым и, следовательно, менее быстро образующимся будет вторичный, а не пер-
вичный енолят-анион из-за индуктивного электронного эффекта метильного за-
местителя во вторичном енолят-анионе, который приводит к дестабилизации.
В кислом растворе фактором, определяющим соотношение енолов, будут, по-ви-
димому, относительные устойчивости енолов. Можно предполагать, что енол с
максимально замещенной двойной связью будет более устойчивым и, следователь-
но, его образование будет предпочтительнее.
15-5.
R
R
| основание |
ВгСНа - СН-» - С = О-------> СН3 = СН - С = О
—НВг
Во-первых, кислотность а-водородных атомов в галоген кетонах выше, чем в алкил-
галогенидах, из-за электронооттягивающего эффекта карбонильной группы. По-
этому можно ожидать, что атака основания на а-водородные атомы будет проте-
кать достаточно легко. Во-вторых, отщепление НВг из fi-бромкетона приводит
к образованию сопряженного или а, [1-не насыщен него кетона, для которого суще-
ствует некоторая энергия стабилизации вследствие резонанса. Для того чтобы
произошло отщепление, необходим хотя бы один сг-водород и соответствующая
стереохимия. Таким образом, можно предполагать, что ни один из следующих 0-
галогенкетонов не будет легко отщеплять НВг.
15-6,
NaOCJ
СН3СН2ОН----> CHCia
764
ОТВЕТЫ К УПРАЖНЕНИЯМ
Возможные стадии:
ОН ОС1
СН3-СНг + NaOCl -NaOH сН3-СНг
О-^С1 ст О © О
СНэ-С^Н^ТоЙ ----------> GH3-CZ - CClj-CZ
. > VH ОН® V
Г1 Г1 Г1
/Sr © СТ
CljC : + НСОгН —-* CijjCH + HCOj
Ход реакции, приведенный выше, позволяет предположить, что для спиртов с
Н
группировкой CHg—С—ОН галоформная реакция возможна.
!5-7. Атака гидроксильного нона на карбонильный углерод три хлор ацетон а дает
промежуточный продукт (1)
© ..
_ /У ©
CHj-c-ccij —>- CHjCOjH + :ссц
он
(О
Расщепление связи С—С в этом интермедиате с образованием уксусной кислоты
и трихлорметид-аниона выгодно из-за стабилизации карбшшона электроне, акцеп-
торными хлор-заместителями. Альтернативное, отщепление ®;СНЯ гораздо менее
благоприятно, поскольку це происходит сколько-нибудь сравнимой стабилизации
карбаниона. Поскольку уксусная кислота неспособна к Катализируемому основа-
нием галогенированию & водном растворе, она не может давать галоформной ре-
акции, несмотря на легкость декарбоксилирования промежуточного трихлораце-
тат-яопа в основном растворе, как это показано ниже;
CljC - 4- СО3
ч
-С13СН + он
NaOH
CWjCOjH + Cl2 СС13СОгН
Причина состоит в том, что а-водородпый атом ацетат-иона устойчив к атаке ®ОН
в условиях галоформной реакции.
15-S. Так как в яцетальдоле, первоначально образующемся из ацетона в D2O
,,и ©OD, не содержится связей С—D, скорость образования ецолят-аниона должна
быть меньше, чем скорость атаки ацетальдегида анионом. Тогда кинетическое вы-
ражение для реакции должно выглядеть следующим образом;
скорость = k [CHgCOHj [НО®]
При очень низкой концентрации ацетальдегида медленной стадией реакции стано-
вится стадия атаки альдегида ецолят-анионо.м, причем в этом случае дейтерий
ОТВЕТЫ К УПРАЖНЕНИЯМ 765
должен присутствовать в продукте, ибо первая стадия обратима. Тогда скорость
будет пропорциональна квадрату концентрации альдегида-
ми. „т
®он ©
а) СН3СНаСНО£=Г2:СН3ЙН-СНО
ОВД
© н® . . f ,
CH3CHjCHO+CH3CHCHO —► СНдСН.СНСНСНО
но®
б) (СНЛ)3ССНО---* реакция не происходит (енолизация невозможна)
в) Атака еполят-аниона на тримстилацеталъдегид также возможна, хотя сущест-
вуют пространственные препятствия, создаваемые метильными заместителями.
СН3 m CHjOHCHO
L е н® ill
‘ СН3—С—СНО 4- СН3СНСНО —* —► СН3 - С - С - С- СН3
I III
снэ сн3 н н
Л5-10. Реакция прекратится, когда температура паров поднимется настолько, что
содержание в них диацетонового спирта будет больше равновесной концентрации.
Если гидроокись бария попадет в колбу, начнется быстрое разложение дна цетано-
вого спирта до тех пор, пока ле образуется равновесная смесь. Использование гид-
роокиси бария предпочтительнее по сравнению'с едким натром, поскольку его рас-
творимость меньше.
15-11. а) СН3СН (OH)CHsCOCHa. Можно ожидать, что ацетальдегид будет лучшим
акцептором электронной пары, поскольку его карбонильная связь слабее и менее
пространственно затруднена, чем карбонильная связь в ацетоне, б) СНЛСОСН3.
Исходный продукт при получении диацетонового спирта; при равновесии реакция
сильно сдвинута в сторону ацетона, в) (СН3)3СС|-12ОН+НСО2Н; перекрестная ре-
акция Канниццаро. г) (СНЯ)»ССНО
СН30Н
15-12.
®ОН LiAIHj
а) 2СН3СНО---> СН3СН(ОН)СН2СНО---СН3СН(ОН)(СНа)4ОН
®он н®
б) 2СН3СНО:---> СН3СН(ОН)СН5СНО----СНаСН==СНСНО -*
- Н4О
LiAlH,
----гСН3СН=СНСН3ОН
®он н®
в) 2СН3СОСНа-->(СН8)аС(ОН)СНвСОСН3—-->(СН3)аС=СНС0СН3
-:I2O
О
Н-, Pt 11 Zn. HCl
----> (CH3)3CH - CHS—С—CH3----*
—> (CH3)2CHCHsCHsCH3
766
ОТВЕТЫ К УПРАЖНЕНИЯМ
®ОН | I • C,HtSH
г) 2CHSCHSCHO----> CHaCHaCHCHCHO ---------*
। , 2, NJ
СНз
он
„ I КгСг.О„ Н®
СНзСН8СНСН(СН3)а---------->• CI-I3CHsCOCH(CHa)3
/5-/3.
н®
CHjCOCHj 3=
®он
II
CHjCCHj
ОН
I
сн3-с=снг
СНз-С-СН,
он фон
СН3-С-СН2-С-СН,
СН,
I 11 н®
CHj—С—СН^—С—СН> ->
I “J1AJ
СН,
(СНэ)гС=СНСОСН,
те иск Мезитила
+ CHj«G-CJ&
Я н®
(СН3)2С=СНССН3 5=
н^ ^он
CHj-G-CHj +XGt^=C-CHsC(CH3)J
он
I
(СН3)гС=СН-С=СНг
он ®он
----> (CHj )гССН4ССН=С(СНэ)г
„„и®» zB£>. {сн3)гс=снсосн=с(сн3)г
форон
/5-/4.
о о
II ' II
з) СНЯ-С-СН3 (газ)+СНа1 Оаз) -^СНа -С-СН2-СНЯ (газ) +
HI (газ) ДЛ = — 4 ккал
О
СНя-^С—СН3 (газ)-)-СНэ1 (газ)—►
/ОСН3
—*СНз—CZ (газ) 4-НГ(газ) ДЯ=Д-20ккал
(5Н для О-алкилирования включает 3 ккал, обусловленные стабилизацией вини-
лового эфира.) Сумма величин Д/7 С-алкилирОвания в газовой фазе, теплоты рас-
творения HI, теплоты нейтрализации HI и NaOH равна (—4—19,6—13,3)=
=—36,9 ккал,
СН3СОСН3 (газ)-)-СНэ1 (газ)-)-NaOH (водн.)—►
=*СНвСОСНаСН3 (ra3) + HsO-|-NaI (водн.) ДН= -36,9 ккал
ОТПЕТЫ К УПРАЖНЕНИЯМ
767
А сумма величин АН для О-алкилирования равна (+20—19,6—13,3)=—12,9 ккал.
СН3С0СН3 (газ) 4- СНЯ1 (газ) + NaOH (водн.) —>
,ОСН3
—>СН3С( (газ)4-НгО+Ка! (водн.) ДЯ=—12,9ккал
^СН2
О
б) chscoch3^*ch3c-ch^+h® /fA=io-ao
[енолят-анион]___10~аа
[ацетон] [н®]
В I М растворе едкого натра [Н®|=10-14, следовательно:
[енолят-аннон]_1О~ар___ в
[ацетон] —
Если бы мы имели 1 М ацетоновый раствор, алкилирование вряд ли было бы опре-
деляющей реакцией, поскольку концентрация енола в нем была бы мала (10-8 М).
В этом случае более вероятна реакция йодистого метила с едким натром
СН31 + NaOH —> СНаОН + Nal
15-15, Виниловые спирты (енолы) легко перегруппировываются в карбонильные
соединении вследствие кислой природы протона гидроксила. Подобная перегруп-
пировка для виниловых эфиров не наблюдается из-за трудности разрыва связи
О—С. Она происходит лишь при очень высоких температурах
СНа =. СН — 0СН3 —► ]СН2 = СН - О СН3 - СН = О] +
4-СН3. —>СН3СН2СЦО
а также для аллил вин иловых эфиров при умеренных температурах
^сн=снг
:СН, О
\ //
СНгСН
15-16,
СНЭСОСН2+СН31 —>-СН3СОСНаСНв+?
Из следующего ряда галоген идо л — трет-бутил хлорид, ацетилхлорид, аллил-
хлорид, иеопентилхлорид—скорее всего будут реагировать с ацетоном по типу
О-алкилирования аллил- и ацетилхлориды.
15-17, а) Алкилирование кетонов по Халлеру — Бауэру в случае этилгалоге-
нидов и высших первичных галогенидов может привести К нежелательным реак-
циям типа Е2-отщепления в присутствии амида натрия.
СИ,
б)
е снэ
;NH2—*
Н
Очень вероятно, что основной катализатор будет присоединяться к карбонилу аце-
тальдегида.
по-видимому, не будет реагировать непосредственно с СНЯГ, так какего двойная
связь обладает очень слабыми нуклеофильными свойствами по сравнению с ена-
мином- Возможно, соль будет постепенно перегруппировываться и взаимодейст-
вовать с атомом, углерода по следующей схеме:
15-20, В циклогептен ильном производном пространственные препятствия атаке
алкилирующего агента более сильны, и продукт С-алкилирования в случае семи-
членного цикла испытывает более сильные несвязывающиё взаимодействия, чем
в случае шести член но го.
15-21. а) С3Н10О: в спектре имеются сигналы трех типов протонов с соотноше-
нием интенсивностей 1:6:3 и химическими сдвигами, характерными для ва-
нильных, ацетильных (СН3СО) и метильных (в аллильной группе) протонов. Под-
ходящей структурой будет следующая: (СНя)2С=СНСОСНа (окись мезитила).
Синглет при 2,1 м. Д. обусловлен протонами СН3С0-груплы, а два дублета в об-
ласти 1,8 и 2,1 м. д.— протонами (неэквивалентными) аллильных метильных
групп, каждый из которых расщепляется на дублет вин ильным протоном:
б) СЙН3О: основные группы сигналов имеют соотношение интенсивностей 1:6; 1
и химические сдвиги, характерные для альдегидных, фенильных и финальных
протонов. Спектр представляет собой спектр коричного альдегида (С6Н;,С11—
=СНСНО) и усложняется следующими обстоятельствами; 1) .химические сдвиги
р-винильного и фенильных протонов очень близки и проявляются в виде мульти-
плета с центром 7,3 м. д- и 2) величина спин-спиновогб расщепления" между
а- и р-винильными протонами близка к разности их химических сдвигов и приво-
дите появлению двух линий неравной интенсивности для а-протонов (разд. 2-6, Д),
каждый из которых далее расщепляется вследствие спиц-спинового взаимодейст-
вия с альдегидным протоном.
ОТВЕТЫ К УПРАЖНЕНИЯМ
769
16-22.
он
о
II
снассн=сн2 —
Л2^сн.,-с-сн=сн5
о
&Н = — 1 ккал
HCN Н
—> ch3-cch2ch2cn
Ш — ~ 19,4 ккал
Очевидно, что 1,4-присоединение более благоприятно. Механизм:
HCN + ОН
'--II z—х №Э
сН}-сА:н=снг + см
ОЭ
и
СЯ5-С^СН-СН2СМ
Н.О
-ОН®
С^Н
CHj“Ci=CH-CH2CN
о
СИ3ССМгСН2СК
16-23. Не следует ожидать, что электрофильное присоединение брома к углерод-
углеродной двойной связи метилвиинлкетона будет столь же благоприятным, как
процесс присоединения брома кбутеиу-1, из-за электроноакцепторных свойств со-
седней карбонильной группы. На основании энергий сэязи очевидно, что 1,4-
присоединение является неблагоприятным процессом.
О ОВг
II I
СНЭССН - CHS + Br j —<- СН3 - С=СН - СНаВг ДН=*= +-24 ккал
16-24.
Кри
~н®
нго
-он©
/чн»
сн.-сн
/ \
сн.
'N
ДН»
^сн
GHj
I
Civ
сн/
/5-25.
CHZ=CH-CH2-CHO
-нго
CH.-CH=CH-CHO <
-OH®
®
СН2йСН-ЙЙ-СЙ=О
$ •• G
снг=сн-сн=сн-о:
0 $
: CHZ-CH=CH-CH=O
25 Ks 1540
770
ОТВЕТЫ К УПРАЖНЕНИЯМ
Бутен-2-аль более стабилен, чем бутен -3-аль, поскольку в отличие от бутен-3-
аля его карбонильная группа и двойная связь сопряжены,
15-26. Реакция кетена со спиртами:
Реакция кетена с
СН2 = С =
СН2 = С=О+РОН—*
Реакция со спиртами будет ускоряться кислотами и основаниями, так как в при-
сутствии основания устанавливается равновесие, способствующее образованию
RO®(ROH+©OH->Rp®+H2O), тогда как в присутствии кислот можно ожидать
протонирования карбонильного кислорода. Можно предполагать, что реакция с
аминами будет зависеть от pH. При низких pH она будет медленной, так как амин
будет связываться в соль. При некоторых промежуточных pH скорость будет оп-
тимальная вследствие протонирования карбонильного кислорода. В действитель-
ности большинство реакции ацилирования кетенов являются достаточно
быстрыми.'
15-27.
/°\ н®
снг=с ^с=о -а—
ОН
снг=\ X®
СНг ОСН,
л
/°\ ©
снг=с ^с=он
® СОн
снг==с
^CHj бен,
СН3ОН
о
о
он
-н®
о
и ,,
СНг=С-СНг-С-ОСН3 ---------*- СН3ССНгСОСН3
15-25. Если в дикетене естьенольяая ОН-группа, как, например, в структурах
3,4,7 я 8, ее можно легко определить с помощью ИК- и ЯМР-спектров. Если ди-
кетен является а, р-ненасыщенным карбонильным соединением, как 3, 7 и 9, это
легко будет установить по его УФ-спектру. Кумулированные двойные связи
структуры 9 можно также легко идентифицировать с помощью ИК-спектроскопии.
Присутствие карбонильной группы можно установить по ИК-спектру (исключив,
таким образом, структуры 4, 5 и 5). Присутствие углерод-углеродной двойной свя-
зи можно определить по ИК-спектру, а число виннльных водородов — по ЯМР-
спектру. Таким образом, структура 1 окажется единственной структурой, согла-
сующейся со спектральными данными.
15-29. Во-первых, в случае глиоксаля, меченного дейтерием, должен иметь место
дейтерообмен
о о
DC—С— Н
ОТВЕТЫ К УПРАЖНЕНИЯМ
771
Во-вторых, перегруппировка в присутствии D2O должна приводить к дейтериро-
ванной гликолевой кислоте HDC(pH)CO2H. В-третьих, перегруппировка в при-
сутствии других реагентов, обычно' присоединяющихся к кетенам, должна приве-
сти к производным гликолевой кислоты
ОН ОН
Н-С^о/^ .Н^СОаСН,
15-30.
„ «И И
С6Н5-С-С-<ОД С(Н5-С—с-он
од
о® о _ он б
I w® i //
•—*• ОД.,--с—'-Д- -> CfcHj—с—с
<ОД ОН ' CtHs/oH
В принципе этот же тип реакций может осуществляться для диацетила
(СНаСОСОСН3Е Однако этого не происходит отчасти из-за того, что метильная
группа (в виде :СНа) не так легко мигрирует, как фенильная (:СОНЬ)'По-видимо-
му, более важным является тот факт, что7реакция Канниццаро для соединений с
a-водородами нетипична, поскольку она сопровождается другими реакциями.
Диацетил имеет а-водородпые атомы н может давать енолят-анион (в присутствии
основания), который может затем участвовать в конденсации типа альдольной
СН3СОСОСНа -^Н —СН2 = С - С- СН3
is-ai.
РаНйовссне сдвинуто в сторону моноенола циклопентадиепона-1,2, поскольку,
во-первых, в еноле имеется меньше заслоненных Н—Н взаимодействий, чем в ди-
кетоне. Во-вторых, при образовании ено л а уменьшаете я электростатическое от-
талкивание между карбонильными группами. В: случае диацетила свободное вра-
щение дает возможность карбонильным группам принять более устойчивую s-
транс-конформацию, в которой взаимодействие между ними сведено к минимуму.
25*
772
ОТВЕТЫ К УПРАЖНЕНИЯМ
Можно считать, что бицйкло-|2,2,1]-гептавдион-2,3 (V) не будет енол изоваться
из-за слишком большого напряжения, которое существовало бы в еноле с двойной
связью при углероде в голове моста.
/6-32. См. предыдущее упражнение.
/5-33. а) Енол ацетилацетона — гораздо более сильная кислота, чем этиловый
спирт, поскольку енолят-анион резонансно стабилизирован, а этилат-ион — нет.
% О О ®О
I II II I
СНа-С=СН-С—CHS<->CH3-C-CH = C-CHS
0 0 н !
Тот факт, что ацетилацетон в значительной степени существует в енольной форме,
указывает, что кето-форма является более сильной кислотой, чем ено^. Это легко
вывести из следующего кислотно-основного равновесия, где Хксг0— константа
диссоциации кето-формы, a Keil(W) — константа диссоциации енольной (формы:
Ккето = 1ел°ля1-анион] [Н®]/[ кетон]
Кеиоя = [енол ят-а нион |! [ Н® |/[енол]
После деления:
{енол]
Кевои [кетон]
Следовательно, поскольку [енол]>|кетон], Кке10Жеиол-
/6-34. а) СюНюОа'. имеются сигналы четырех основных типов протонов с соотно-
шением интенсивностей приблизительно 1 :-5 :-1 ;3 и химическими сдвигами, ха-
рактерными для енольных, фенцльцых, винильных и ацетильных протонов. Оче-
видной структурой является енольная форма бёнаоил-ацетона
Метиленовые и метильные группы кето-формы можно увидеть в вида небольших
сигналов при 3,9 и 2,1 м. д. соответственно, б) (СН-/2Н=С=0)а: в спектре имеется
четыре основные группы линий с соотношением интенсивностей 1 : ! ; 3:3;
химические сдвиги характерны для енольных, аллильных СН, аллильных СН3
и метильных протонов. Дублет около I м. д. указывает на группировку СН3—СН.
Наиболее подходящей структурой будет следующая:
ОН
СН,
н
чсн,
ОТВЕТЫ К УПРАЖНЕНИЯМ
773
Характер сигналов, обусловленных протонами СН и СН3—С=, указывает на на-
личие между ними небольшого «дальнего» взаимодействия.
15-35.
CH3COCHZCH2COCH3
®н
®он
CHj-C
ZC-CH,
CHr-CHj
ОН'
-Н®
й - * сн3-с,
С-СЙ5
!сн-снг
ОЙ Фбн
СНз-С —►С-СНз
сн3-с с.
-н,о,
.о.
сн3-с с-сн3
СН-СН2
сн—сн
образованию полукеталей
Механизм аналогичен кислотно-кагализируемому <
'(разд. 14-3,0 и кислотно-катализируемой дегидратации спиртов (разд." 13-6,Б).
15-36.
О Вг о
гвг, ||
С6Н 6СОСН гСОСеН в свнБ—с
ООО
—> CeH6-C-C-C-CeHs
Необходимо пометить одну из карбонильных групп 14С для того, чтобы устано-
вить, какая из них будет отщепляться в виде окиси углерода при обработке
хлористым алюминием.
15-37. О
он
Н2С CHj
о" сн2" Ъ но' он
Циклогексантрион-1,3,5 должен существовать исключительно в енольной форме
Из-за большого выигрыша в энергии резонансной стабилизации при образовании
бензольного кольца.
15-38. а) Образуется только CH3CO2Na, который дальше не реагирует.
NaNH,
б) (СН3)аСС1 —(СН,)» С=СН£
”-г1ЧЛ
в) Бо.чее вероятно, что в присутствии основания ен о лизания метил изопропил кето-
на происходит по метильной группе
еон сн.=о
(СН3)3 СНСОСНз —г—> (CHjhCHCOCH, —> (CIIa)3CHCOCHsCHsOH
—НаО
[с избытком Н«С=Ои основания—► (CHSJ3 С (СНгОН) СОС (СН2ОН)3]
о
о
с н
ОТВЕТЫ К УПРАЖНЕНИЯМ
г) Существенное значение будут иметь альдолизация и омыление
Он®
2СН3СНО —* СН3СН(ОН)СН3СНО
СНаСО2С»Нб + О^ —> СНяСО^+СаНеОН
д) Реакция происходит так, как это написано, ё) Происходит вполне удовлетвори-
тельно.
15-39.
а>Г>-СОСН3 N_aPH> Г^>-СОгН SP-Ii—► ГЪ-СОС!
I/ I/ 4 -SO2, -НС1 I/
^>-согн Ji®» ^>-сн2ои
®он н® .
б) CHsCOCHs+CHsO-----К СН2(ОН)СНгСОСН3 —>сн«=снсосн3
СН8СНа сн3
II н® . J
BJ СН3-С-С-СН8------> СН3-С-С0СН3 —>
II I
ОН ОН СНЙ
сн3
BfJ; NaOH н® I
------- сн8-с-со2н
I
сн3
г) CH3CH3COCH2CH3+4NaNHa + 4CH3f
-* (CHe)9CCOC (CH8)8 + 4NaI + 4NHs
Brt Zn
д) (СН3СНг)йСНСОВг -ч- (СН3СН2)2 СНСОВг —*
—> (СН3СН2)2С=С=О —>•
/СО.
(СН3СН3)2 с/ р-С (СН.2СН3)г
Ва(ОН), —HjO
el 2СН3СОСН3 =----ь (СН3)а ССНаСОСНа ---------
Ь
ОН
Н2, Pt Вг
—> (GM,), С - СНСОСН,----------- (СН3)2СНСНаСОСН3------х
CH3COO®
—► (СНй)3СНСН/?.ОСНгВг (низкий выход)
ОТВЕТЫ к УПРАЖНЕНИЯМ
775
/X н® /\
»)CHsCH04-HNCH, = CH-N | —>
l. CH.l нем
-----—+ СН3СН2СНО ----> CH3CH2CH(0H)CN
2. На0, Н®
Ва (ОН)а -н,о
з) СНдСОСНд -----» (CHS)2 ССНаС0СН3 ——i
Ан
—* (СЙд)гС=СНСОСНд —+
сн3
н,, Pt CHjMg! I
———к (CHs)fCHCHsCOCH, --------- (СН3)гСНСНвС-СНг —*
I
OH
-НгО Hi. Pt
----->• (СНВ)ЙСНСН=*С(СНЭ)2----- (CH8)sCHGH2CH(CHa)2
и) Путем образования енамина с последующим алкилированием СН31, как в (ж).
СНаОН
®он.сн,о J
к) сн3снасно—;—* сн3с-сн2он _>
Са(ОН)( I
СН2ОН
HNO,
——* CHaC(CH2ONO2)3
-NH,
л) (СН3)3 ССОСНз + NaNH2 + СН31 ---►
—Nal
Zn, HCI
(СН8)а ССОСНаСН3 -------> (СН8)3ССН2СНаСНй
/5-40. а) Бромирование: ацетил ацетон благодаря высокому содержанию в нем
енольной формы будет реагировать мгновенно; образование-солей Си® и г. д.
б) Следует ожидать, что ди ~н-бути л кетон даст 2,4-дннитрофенилгидразон, а ди-
трет-бутил кетон слишком пространственно экранирован, чтобы легко вступать
в реакцию, а) Обработка диацетонового спирта разбавленным основанием приведет
к его расщеплению с образованием ацетона, г) Проба на образование енола в слу-
чае днбензоилметана будет положительной, а для диацетила — отрицательной,
д) Озонирование дикетена даст GHa=O. е) Обработка водой, а затем — КМпОу
СН3СН=С=Он2?СН8СН2СО2Н,- никакой реакции с КМпО4;. СН2=СН—СН=О
реагирует с КМпО4. ж) Енамин будет реагировать с кислыми хлоридами с образо-
ванием после гидролиза 1,3-дикетона (разд. J5-3). Он также будет гораздо легче
гидролизоваться разбавленной кислотой, чем основание Шиффа, з) Обработка
разбавленным основанием вызовет отщепление НС! в случае Р-хдоркетона
®он
С1СНаСН2СОСН3 ------► СНа-СНСОСН3
-HCI
/5-41. а) УФ-спектр укажет на присутствие Хромофорной группы С—С—С—О.
ИЮ и ЯМР-спектры дадут возможность подтвердить наличие или отсутствие груп-
пы СНг=СН. б) Карбоксильную группу можно идентифицировать по наличию
в ИК-спектре интенсивной полосы, обусловленной водородной связью ОН (2500—
3000 см-1), и по ЯМР-спектру (химический сдвиг ОН-протона -•'9,2 м. д.). в) По-
776
ОТВЕТЫ К УПРАЖНЕНИЯМ
ложен не полосы поглощения карбонила в ИК-спектре циклических кетонов аз- М
меняется с изменением размеров кольца. Циклопентаноны поглощают около Я
1745 см-1, а циклобут аноны — вблизи 1780 см-1. г) В ИК-спектре дибензоилме- В
тана в отличие от изомерного 1,2-дикарбонильного соединения можно ожидать Я
интенсивного ОН-поглощения. Спектры ЯМР также будут четко отличаться для
этих изомеров присутствием или отсутствием енольного ОН-поглощения, д) ЯМР-
спектр ясно будет показывать наличие или отсутствие альдегидного протона
(~9,6 м. д.). В случае соединения с кумулированными двойными связями С=С=О /
в ИК-спектре будет присутствовать полоса в области 1950 см-1, е) Различить эти ;
два соединения можно по наличию или отсутствию в ИК-спектре поглощения,
обусловленного карбонильной группой, ж) Можно ожидать поглощения, характер. I
кого для двойной связи, в ИК-спектре и сигнала, обусловленного винйльными про- '
тонами, в ЯМР-спектре СН3СОСН=4С (СН3)ОСН3. Можно предположить, что
альтернативная структура СНаСОСН (СН3)СОСН9 является в значительной сте- Д
пени енольной по аналогии с ацетилацетоном, что должно проявляться в ИК- и I
ЯМР-спектрах (енольный ОН). ,1
15-42. а) Содержание кето-формы составляет 6—7%, что определено интегрирова- ; I
нием сигналов метильных протонов енольной и кето-форм, б) 1 — около I% енола =•
из-за сопряжения с группами С3Н6; 2 — 0% енола; 3 — 90—100% моноенола; Я
4 — 0% енола; 5— 100% моноенола. |1
/ \ J
15-43.
к,со, §
а) (СвН3)2 СНСНО---> (C,HS),CCHO_—►
-и®
1. СН,0 90Н
-------► (CaHs)2CCHO----►
, I сн,о
сн2он
—t (СвНв);С(СНаОН)а (реакция Канниццаро)
б) (СН3)гС=О1~/^]. + (CHj^C^CHCHzBr
---► (СНз)аС-СН2СИ=С(СЫ3)2 ..гЩ9й.
CH=n] Вг®'
(СНэ)гССНгСН=С(СН3)2 + HgN I Вт®
СНО
CH,N,
в) С8Н6С—CH(CN)„ C,HeC=C(CN)2----СеНьС = C(CN),
о (ki Асня
I. LIA1H, , Н.О
Г) 05^0=0-0------------ (СвН6)2С —СП — О,—А1Ф--*•
—► (C„HS,'2C=CHOH —> (С3Н6)2СН-СНО
ОТВЕТЫ К УПРАЖНЕНИЯМ
777
/5-44. Окисление ноОппенауэру проводится а основной среде (алкоголяты алю-
миния), и в этих условиях ^.^-ненасыщенный кетон будет перегруппировываться
в более устойчивый а,р-ненасыщенный кетон через промежуточное образование
енолят-ан ион а.
15-45. C4H7OCI: в спектре имеются сигналы трех типов протонов с соотношением
интенсивностей 2 : 2 : 3. Синглет при 2,2 м, д. отвечает нерасшепленным протонам
метильной группы, а два триплета в более слабом поле указывают на наличие
группы —СН3—СНа—. Триплет около 3,7 м, д. может быть приписан группе
778
ОТВЕТЫ К УПРАЖНЕНИЯМ
CJ—СН2—; синглет метальных протонов при 2,2 м. д.— группе СН3СО; триплет
при 2,9 и. д.— группе — СНг—-СО—.. Структуру можно изобразить следующей
формулой; СН5СОСНаСИ2С1. Можно ожидать, что это соединение, будучи Р-хлор-
кето ном, в основном растворе будет легко отщеплять НС].
©ОН
CHjCOCHj-CH, —СНэСОСН=СНг
* |-->1 -НС1
Н 6с1
С4Н.ОВг; в спектре имеются сигналы трех типов протонов с соотношением интен-
сивностей 1 : 3:3. Синглет при 2,3 м. д. можно отнести к группе СН3СО—; дублет
при 1,7 ы. д. и квартет при 4,5 м. д.— группе СН3(!;Н. Структурой, согласующейся
со спектром, является CH3C0CH (Br)CHs. Можно ожидать, что, поскольку это
соединение является d-бромкетоном, оно будет Чрезвычайно реакционноспособ-
ным по отношению к нуклеофильным агентам в реакциях 3^2 и быстро енолизую-
щимся по а-бромэтильной группе в основном растворе.
Глава 16. Карбоновые кислоты и их производные
16-1. Как было рассмотрено в разд. 13-3, химический сдвиг ОН-протонов спирта
зависят от прочности водородной связи, которая в свою очередь изменяется с из-
менением концентрации спирта, особенно в неполярных растворителях, таких, как
четыреххлористый углерод. В противоположность этому ОН-протоны карбоновых
кислот не обнаруживают такой зависимости химического сдвига от концентрации,
поскольку водородная свяЗь в карбоновых кислотах гораздо прочнее, и обычно они
существуют в растворе в виде димеров. Эти димеры с трудом диссоциируют при
разбавлении; следовательно, химический сдвиг ОН-протонов не будет заметно из-
меняться с разбавлением,
16-2,
li 1, СН3С0гН:н2О
1 : 2, CHjCOjH : Н2О
11,0 9,0 7,0
3,0 1, 0 О м.д.
Быстрый обмен дает единичный усредненный сигнал ОН-протонов.
16-3. Обычно протонирование карбонильного кислорода карбоновой кислоты —
более выгодный процесс, чем протонирование гидроксильного кислорода вследст-
вие стабилизации кислоты, сопряженной карбоновой кислоте.
©ОН /ОН
СН3-С^ w СНя-С/
Ч)Н 4)1!
©
Приведены две эквивалентные схемы спаривания электронов.
ОТВЕТЫ К УПРАЖНЕНИЯМ
779
/6-4.
СНЯСО2Н+Н20 СН3С(ОН)5 ДЯ = 4- 26 ккал
(в предположении, что энергия связи С=О равна 179 ккал, а ЭС уксусной кислоты
составляет 18 ккал).
СНэСНО-)-НаО -£± СНаСН(ОН)2 ДЯ -- +5 ккал
Очевидно, что гидратация уксусной кислоты гораздо менее выгодна, чем гидрата-
ция ацетальдегида. ОднакО можно ожидать, что скорость гидратации уксусной кис-
лоты будет увеличиваться в присутствии серной кислоты, так как протонирование
карбонильного кислорода (быстрый процесс) облегчает атаку воды на углеродный
атом.
®ОН ОН
R-c/° 4-Н® _б^_тр2_> R-С—ОН R-d-OH
г°н «
Uris
Кислый катализатор не будет влиять на положение равновесия, так как константа
равновесия определяется не направлением реакции, но которому образуются
продукты, а термодинамической устойчивостью реагентов и продуктов реакции.
16-5. Образование лчрст-бутилацетата невозможно; продуктом реакции будет
трет-бутил хло р ид.
(СНВ)3СО11 -J- HCt — (CHs)ftCCi -р. НаО
/6-6.
СН
Н«О
ОН
сна-<!:-Он
18^на
-8н,
CHs—он
13он
-тио, -н
сн3—
снэ- с^
\l8OH
Метка 1SO окажется рассредоточенной между кислородными атомами воды, кар-
бонильной и гидроксильной групп уксусной кислоты. В данном случае мда ведет
себя аналогично молекуле спирта при этерификации.
плоский катион
Равновесие в случае равенства (I) более благоприятно, чем для (2), поскольку;
а) пространственное экранирование в кислоте, сопряженной мезитойной, исчезает
в ацилкарбонневом ионе с линейной группой СД-С—Д), б) электронодонорный
эффект метильных заместителей стабилизирует ацилкарбониевый ион в (1); в) ра-
венству (2) не благоприятствуют ни пространственные, ни электронные факторы,
и поэтому протоннрование карбонильного кислорода бензойной кислоты является
выгодным процессом.
16-8. Если декарбоксилирование является вполне согласованным циклическим
процессом, то 2-метилбутен-З-оновая кислота даст бутен-2.
,.-Н.
СН2 О -сг>
CHl ------** С»зСН=СНСН1
СН цис я транс
СН,
В случае карбанионного механизма можно ожидать образования смеси бутена-1
и бутена-2
у 1*3 /
сн2=сн-сн-с _~с2г». [снг-сн-сн(сЛ,}]® '!
*
н® I
• > сн3сн-снсн, + снг=снсн2сн, J
R действительности продуктами являются бутены-2. I
16-9. Декарбоксилирование а,а-диметилацетоуксусной кислоты по согласован-
ному циклическому механизму приведет к енольной форме мётилизопропилкетона,
ОТВЕТЫ К. УПРАЖНЕНИЯМ
78 Г
который будет быстро реагировать с бромом, давая а-бромизопропилметилкетон
16-10.
-СО2
СН3С
^.С(СН,)г
_В£г_
-НВг
СНэСОС(СН3)2Вг
сн, • + cot
Чтобы рассчитать А/У для приведенной выше реакции, необходимо знать, кроме
данных, приведенных в табл. 3-5, энергию стабилизации карбоксил ат-раднкала.
16-11. Рассчитанная величина &.Н для процесса R-4-H3O->-RH+-OH в газовой
фазе составляет +12 ккал. Поэтому образование углеводорода таким путем энер-
гетически невыгодно.
16-12. При высокой плотности тока углеводородные радикалы, образующиеся на
аноде при электролизе но методу Кольбе, могут в некоторых случаях окисляться,
отдавая электрон, с образованием карбониевых ионов; последние реагируют с гнд-
роксилсодержашим растворителем и с карбоксилат-анионами, давая спирты и
эфиры.
RCOj. т- R-4-COj
R. —R®4-e
-н®
Р®-)-Н4О —г ROH
R®4-RCO® —> RCOjR
Л уОН
16-13. сн„— се сн2=с<
>Вг ^Вг
ЭС — 3 ккал
,0 /ОН
CHg-C^ z± сна=с<
4>н юн
ЭС —13 ккад ЭС —6 ккал
Приняв, что величина ЭС винилового спирта составляет приблизительно 3 ккал,
1,1-днокснэтилсна — 6 ккал, ацилбромидов — 0 ккал, уксусной кислоты —
18 ккал, получим, что енолизация ацетилбромида более благоприятна по сравне-
нию с енолизацией уксусной кислоты на (18—6)—-3=9 ккал.
16-14. Летучесть уменьшается в ряду этил ацетат> уксусная к и слота > уксусный
ангидрнд>ацетамнд. Уксусная кислота (т. кип. 118°С) менее летуча, чем этил-
ацетат (т. кип. 77°C), поскольку она является более полярным соединением и ас-
социирована за счет водородных связей. Уксусный ангидрид (т. кип. 140 ПС) менее
летуч, чем уксусная кислота, поскольку его молекулярная масса (102) гораздо
больше молекулярной массы уксусной кислоты (60). Наименее летучим соедине-
нием в этом ряду является ацетамид (т. кип. 222°С), что обменяется его высокой
полярностью; это иллюстрируется следующими резонансными структурами:
/О9
сна-се wCHs-C4
XNH Ю1На
” ф
782
ОТВЕТЫ К УПРАЖНЕНИЯМ
Биполярные схемы спаривания электронов объясняют высокую степень.межмоле-
кулярной ассоциации.
16-15. Атака нуклеофильного агента на углерод карбоксилат-аннова менее благо-
приятна, чем атака на карбонильный углерод соответствующего сложного эфира,
поскольку в случае карбоксилат-аниона продуктом должен быть дианион, образо-
вание которого приводит к потере всей энергии стабилизации исходного аниона,
которая в сравнении с эфиром больше.
00
R-C09 + CH309 *• R —(!—О®
большая ЭС ।
00
RCO2CHs+CH8o9 R — (i-ОСНз
меньшая ЭС |
осн3
16-16. ,
®он
a) C$HSCO2CH3 + Н® С.Н.В-ОСН,
?н <ОН ф
CbHs-C-OCHj 5=fc CbHji-C-^OCHj ^-.Н С^СО2СгН5
®ос2н5 осД
и
б) CHjCOCl + С2Н^ОН СН3С-С1 —НС1> СН3СОгСгН,
ФОС2Н5
л.
®он
В) (CHjCOJjO + Н® CHj-C-QCOCHj q“=z==t
-Н®
CHj-G-OCOCHj ------> СН3СО2СН3 + СН3СО2Н
®ОСН,
®ОН / о л X
L Ф ____Н ( II ® I
г) CHjCONHj + Н® -5=t CH3C-NH2. \илиСН,С-ЫНэу
- ОЙ /-РН1.
но I ® zis
CHj-G-NHj CHj-C-NH3 СН3СбгН + NH|
®ОНг ' он
ОТВЕТЫ К УПРАЖНЕНИЯМ
783
А) СНэСОМНг + ОН
.-О©
<-—1 />
ch3-c-nh2
СН,-С-NH,
о-н
0
О
II -
СН3С-О + NH3
е)
CHjCOCl + NH3
CHjC-Cl
0NH3
CH3CONH2 + НС1
NH^>- CHjCONHj + NH^Cl
16-17. Тот факт, что метка WO появляется исключительно в гидроксильном кисло-
роде карбоксильной группы, 'означает, что должен происходить разрыв связи
ацил — кислород, а не 5ы2-атака по —СНг—О— с разрывом связи алкил — кис-
лород.
CH>-G=°
GHj-O
18он2®
СНг-С-гО1?
I I?
сн2-он
ф
d2o
-н®
1«ОН
ТЛ
СН2ОН
а не
СНа-С=О _гН®
снг-согн
.01 ----СНг-£Н н1во-сн2
н ®
16-19. Основность азота в амидах низка по сряпнению с аминным азотом, посколь-
ку присоединение протона к азоту должно приводить к потере всей стабилизации
/О
R-C^
XNHa
'^NHs
Ф
НФ
.О
Н3
Н
Большая кислотность объясняется тем, что амид-апион, образующийся при отрыве
протона от азота, стабилизирован за счет делокализации электрона
“ /°9
R-C<f„ й .w
ЧПНЫ - ^NH
76-79
О ® о
// и // -СН3СОгН.
сн,-с 5=± сн,~схи < " —
ОС(СН3)э ФО-С(СН3)3
(СНЭ)}С® (CHJjCOCHj
7М
ОТВЕТЫ К УПРАЖНЕНИЯМ
16-20. Причиной медленного гидролиза метилмезнтоата в основных условиях
являются пространственные препятствия образованию промежуточного продукта
гидролиза при атаке ®ОН на карбонильный атам углерода. Однако катализируе-
мый кислотой гидролиз протекает быстро в соответствии со следующей схемой;
16-21. Реактивы Гриньяра взаимодействуют с водородом первичных н вторичных
амидов, образуя соли амидов. При этом амид настолько Дезактивируется по отно-
шению к дальнейшей атаке RMgX по карбонильной группе, что никаких продук-
тов присоединения не образуется. Поскольку N.N-диалкиламиды не могут обра-
зовать подобных солей, присоединение к карбонильной группе происходит обыч-
ным образом: '
О О 19
li -RH lj _
R—С—NHR4-RMgX---------> [R-C™NRJ MgX®
16-22. Енольная форма этил ацето ацетата менее стабильна относительно кето-
формы, чем енол ацетилацетона по отношению к его кето-форме. Причина этого
состоит в том, что В ацетоуксусном эфире стабилизация енольной формы за счет
сопряжения НО—(i=CH—C=O понижена вследствие наличия этоксн-группы
эфира, которая участвует в конкуренции за электроны карбонильной группы
эфира.
На этом же основании можно предсказать очень низкое содержание енольной фор-
мы для диэтнлмалоиата, ибо энергия стабилизации обеих эфирных групп должна
уменьшаться при енолизации
О О
II II
СгНЕО-С-СН2-С-ОС2Н8
ОН о
СгН8О - С -> СН - С - ОС2На
С другой стороны, при енолизации ацетилацетальдегида достигается только вы-
игрыш в энергии и отсутствует какая-либо потеря.
li ___. ) Л
СН,—С— CHjCHO "ТТЛ СН,—С^С—Н
ОТВЕТЫ К УПРАЖНЕНИЯМ
785
а
16-23.
он
н®
CHsC=CHC0AH5
[СНаС0СНСО2С2Н6]<Э-
н'
об :
.О$
гпБД
,ОСОСНа
26 № 1540
Можно ожидать, что О-ацилирование при конденсации Кляйзена не будет иметь
существенного значения по тем же причинам, из-за которых в альдольном присо-
единении не происходит О-алкилирован Йе енблят-анионов (разд, 15-2).
CHjCOCHjCOAHs
,аНа :
O-G-GHS
j 1 -С,! 1,0°
С) СН^СРаСА: *—*: ®СН3С^
СН/ХЦС.Н,
----------CHa = G
Рассматривая отношение G и О-алкилироваиия енолят-анионов, можно предпола-
гать, что удельный вес О-аллидирования будет увеличиваться по мере того, как
.алкилирующий агент RX будет становиться более реакционноспособным, что в
свою очередь зависит от легкости разрыва связи R—X, Если распространить это
рассуждение на прртонирование енолят-анионов сильными кислотами, можно ожи-
дать, что перенос протона от сильной кислоты в переходном состоянии будет про-
исходить в незначительной степени И, следовательно,1 протоннрбваийе будет про-
текать преимущественно йо кислороду с образованием енола.
16-24.
CtH„ONa _
a) 2CHaCO2C2Hs ---г JCHaCOCHCOAHjFNa©
СНаСОСНС03СаНа
CHjCO^CX I -c3hs<
—--------с снэ-с-осан6 —-----
, сн9соснш3с4на
CHa-<L=O
Маловероятно, что приведенная выше побочная реакция, которая возможна при
конденсации по Кляйзену, имеет сколько-нибудь существенное значение. Действи-
тельно, можно ожидать, что атака натриевой соли этилацетоацетата на этилацетат
будет очень медленной вследствие пространственных препятствий и того, что ено-
лят-аниой этилэцетоаиетата является менее мощным нуклеофилбм, чем анион
этилацетата.
<0
^ОС,Н6
786
ОТВЕТЫ к УПРАЖНЕНИЯМ
16-25.
СНЭ
а) СН3СОСН2СО2С;Л6 и СНзСНоСОсНСО/^Нб, а также СНаОЗСНСО^Н»
СН3
и CHsCH2CoCh2CO^CoHs.
6) CHsCOCHjjCOaCaH^. в) Реакция Кляйзена невозможна.
16-26.
CtH.ONa «Н®
a) SCHsCHaCOjQsHs-------f [СНаСН2СОС (СН3) CO2CaHs]w
—* СН3СНаСОСН(СН3)СО2С2Нв
CjHjONa q (СО.С.Нд^
б) СН3СОСН3-------->СН3СОСН2И---------g СНэСОСН2СОСОАНй
-с,н,оу
CtHsONa е (С,Н,О)(С=О'
в) С6НБСН„СОаСаН5-------> СеН^НСОАН»------------g->
-С2Н,ОИ
—-СвН6СН (СО2С2Н6)г
NaOCjHj _ CHsCOsCiHs i
г) СН3СОСН3--------- СНаСОСН©--------^СНаСОСН,СОСНа
-C,H,OW
1. Bri, NaOH
д) (СНа)3ССОСНа------------->(CHs)3CCOsCtH»
г. Н®, c,HsOH -
CjHjONa _
(CHs)3CCOCHa-------(СН3)3ССОСН®
(CH,)SCCOCH® + (СН3)3СС0АН6~-С1Н/О-> (СН,)9ССОСН»СОС (СНа)а
е) (СНя)2СНСОАНл------------►
Н®
* (СНз^СНСОлСгНа
ctoceHs
« C.HjCOiQH
(CHjJ^CCOaCaH^ “ “Г"
-C.HjO®
16-27. Недостатки применения гидрида натрия следующие: выделение водорода,
нерастворимость гидрида натрия в органических растворителях, неприменимость,
его в гидрохсилсодержащял (или протонных) растворителях. Достоинства этого
реактива таковы: доступность, ббльшая основность, чем CaH6ONa, отсутствие
нежелательных продуктов (подобных СаН6ОН из CaH6ONa).
16-29. В принципе приведенная реакция может происходить. Однако в данных
условиях наиболее быстрой реакцией будет взаимодействие CaH6ONa с СН3! с об-
р азов а н и ем С Н зОСН аСН s.
16-29.
1. CjH.ONn
CHaCOCHsCOAH6--~—-^CHaCOCHCO^H, —
CHSCHS
CH2CH3
CH3COCCO2CaH6
. I
CH2CH9
1. C.H.ONa
: 2. CH,CH,1
1. H®, H.O
- - - - —•—*
2. нагревадн^—COj
—>CH3COCH (CH2CH3)2
ОТВЕТЫ К УПРАЖНЕНИЯМ
787
Альтернативный синтез З-этвдпентанона-2 этилированием пентаиона-2 в присутст-
вии амида натрия неудовлетворителен, поскольку атака NaNH2 будет происхо-
дить в основном по СН3-группе с, образованием, таким образом, гептанона-3.
Кроме того, в присутствии NaNH2 более вероятна, чем с енолят-андоном, реак-
ция Е2.
J6-3O.
снлснгсо3с,н5
tCO,C,Hal,
с,Ньое
C2H5ONa Я
—------>СН8СНСО3СгН5 —
itarpenaHHe, 150 °C
СН3СНСО2С2Н5---------
СОСО2С2 Н 5
—*-СН3СН(СОгСаНб)а
76-3/..
C,HsOKa Q BrCHjCHjCHjBr
CHj (СОАНд)г----------:CH(CO2C3HB)2-------------------
C8HbONa
’-HBr ’
/CH2X
ВгСНгСН2СН2СН(СО2С3Н5)2
с/СНа^су'СО/У'15 л®, HtC>
ХСО2СгНа 2.
/6-32.
rch=ch-ch2cq2r'
r />Г
RCH-CH-CH^C 7
н®,
КСН2-СН=СНСОЛ<(
®OH
Можно ожидать преобладания «, ft-нон асмщеякото эфира, а котором карбонильная
группа и двойная связь сопряжены. В случае соответствующих кислот в основных
условиях образуются карбокси лат-анноны. Изомеризация между a,ft- и (^-нена-
сыщенными анионами осуществляется гораздо труднее, чем в случае эфиров,
вследствие трудности удаления протона от отрицательно заряженного иона
(разд. 16-11). Перегруппировка у.б- в a, ft-ненасыщенный эфир невозможна, по-
скольку удаление протона из a-положения у,6-ненасыщенного эфира не приводит
к стабилизированному аниону типа I—С—0}9, наличие которого яв-
ляется необходимым условием перегруппировки.
/6-33. Образование лактона винилуксусной кислоты в присутствии серной кис-
лоты согласно правилу Марковннкова привело бы к напряженному четырехчлен
иому циклу.
-н®.
сн,-сн-снд
Is“-C«0
!яф
26*
788
ОТВЕТЫ К УПРАЖНЕНИЯМ
В действительности образуется продукт присоединения против правила Марков'
иикоаа — у-бутнролактон
. : -• - НФ
< сн-сн,
7/. \
СЙг- С=Р
гН
-н®
/СН,
СНг ХСЙа .
16-34.
о
СвН6СН=СЦСОаСаНв+СН?(СОаС2Н6)2 ---------
-* CjHjCH-C^CpjCyj,
J Д/У = — 19,4 ккал
CH(COaCsH6)a
Величина ДЯ, рассчитанная из энергий связи, вероятно, имеет слишком большое
отрицательное значение, поскольку энергия стабилизации этидциннамата не была
принята so внимание.
16-35. Присоединение диэтйлмалоната к коричной кислоте по Михаэлю невозмож-
но, поскольку в основных условиях реакции будет образовываться анион корич-
ной кислоты. Атака карбаниона по р-углероду привела бы к дианиоиу с относи-
тельно низкой энергией стабилизации.
О®
C4HSCH=CH^-C
N© °
/°®
С6Н5СН-С=С
N
16-36.
C,H,ONa Q
CHaCOaCaHs----—>Р:СН2СО2СгН5
СгНвСН == С(СОаСаН5)а 4- 0;СН3СОаСаН5 -*
•-* СвН5СН-С(С’ОаСвН»)а -1L* СвН5СНСН(СО2С2Н.Л
^НаСО^С^Н^ СНдСО3С2Нв
Конденсация этил ацетата по Кляйзену, вероятно, будет побочной реакцией, а бо-
лее важным будет присоединение QbL.ONa к ненасыщенному эфиру с образова-
нием заметно стабилизированного малой ат-аннон а
C,HbONa : О
: : с,щсн=С(соаеай^1с,н?-сн-С(со2с2н5)а
(*)С,Н5
Эта реакция гораздо менее вероятна с этнлиицнамдгом цо сравнению с обра-
зованиемдиэт и л малой ат-ан ио на ,
c,h»on» е
СеНьСН=СНСОаСаНь —C4lUC.H^-CH-C.O1Ci!Hi
16-37.
NaOH
a) CiHsCH^.CHCOjGjHjfCHafCOsCgH^s ---->
I.H®,-н.о
—> СаНе€НСН4СОДН5 7"^—^ С6Н6СНСН3СО2Н
CHjtCOAH^ - " * СН2СОаН
ОТВЕТЫ К УПРАЖНЕНИЯМ
789
NaOH
б) CeHsC6CH = CHCeHs+CH2(COiC1!H5)CN '
QH{ л : 9“Hs
I i:. н , H,0 i
— С,НВСОСН,СНСН(СОАН»)СЫ a нн- ан--; с9нвсосн2снсн,сы
af * nQl pcbaHnc
C,HjONa
в) CHa^CHCN+CH^COjCsHfi), —;-----*
CH2CH5.CN " CjHjONa, CH,=CHCN
CH(CO2CaH5)3
COgCgHg
NCCfisCH^CHsCHaCN
CO2C3H6
Эта схема является комбинацией присоединения по Михаэлю и альдольного при-
соединения.
16-38. Продуктом переноса протона при присоединении Н-(циклогексен-1-ил) пир-
ролидина к метилметакрилату не является соединение, изображенное ниже, по-
скольку его образованию мешают пространственные препятствия между замести-
телями по обе стороны двойной связи.
пространственное
экранирование
В реально образующемся продукте оба заместителя кольца пространственно не
мешают друг другу.
790
ОТВЕТЫ К УПРАЖНЕНИЯМ
/6-39. Малеиновая кислота->-малеиновый ангидрид
нагревание
Фумаровая кислота-жалейновый ангидрид
Л
,С^
ногс н
ФОН} он
Н''С>С'ЧОН К^он
f *-*
HOzC' ''Н ногсх хн
вращение вокруг
ослабленной
двойной связи
Н (ЧГР’ИЧЧ*
Ф
QH
I!
он
<•
,С.
и со?н
НЧсХСОгН
и
H^COtH
Для того чтобы фумаровая кислота образовала малеиновый ангидрид, она прежде
всего должна изомеризоваться в малеиновую кислоту, а эта изомеризация требует
сильного нагревания и автокатализируется фумаровой кислотой, действующей в
качестве кислоты.
16-40. Следующие схемы иллюстрируют решения этих синтетических задач:
SOClj Mg
а) СН3СН2СНаОН-----^СНзСНаСН,С!~---
1. СО,
—* CHsCH„CHsMgC!-----£ СН8СНаСН8СОгН
э-. н®
Mg I .СОд
б) (CH3)SCC1----- (CH3)3CMgCI---- (СН3)ЭССО.,Н
эфир 2 _
1. BjH* КМпО<
В) (еНз),С==СНг--------(СН3)аСНСН2ОН--------> (СН3)аСНСО3Н
2. HjO» о
rig 1.(*я,^сн,
F) (CH8)sCCi —(CH3)3cMgCi--------~
К.МвО4
—> (СНя)3ССНгСН,0Н--------» (СНа)»ОСНгСОгН —*
р. Ег*
-----»- (СН3)3ССН(Вг)СОаН
ОТВЕТЫ к УПРАЖНЕНИЯМ
791
LiALHt
14снгон
е) СН2 = CHCHaCi + Na® ?Н(СО2С2Н,)а—► СНа = CHCH2CH(COsCsHs)a —►
1. н®, нг0 I. sock
---------* СНа = СНСНаСНаС02Н------------ CHs = CHCHaCHaCONHa
2, нагревание 2.NH,
НО 1. М? LJAJH,
ж) (СН8)аСОН------- (СНа)аСС1 —(СН8)аССОаН--------►(СН3)3ССН2ОН
SOClj (CHj^CCHjOH
----*' (СН3)3ССОС1---------> (CHs)3CCO2CHaC(CHs)2
(СН3)8ССО2Н
16-41.
е
а}
сн, усо2н
н
-нф,
СНг ,согн
с~с
,н
СН.
%~СНгСОгН
н
б)
-н®.
‘н
)с-с
сйг 'н
,согн
н
\я>С
сн, 'н
согн
сн,=снснгсн2со2н
НОВт
ф
ВгСН2-СНСН2СНг
Н
0
н
ВгСН2СН-СН2
но® снг
II
о
-н®
ВтСНгСН-СНа
с
к
Q
8>
/'®О
СН,-СН-СО,Н CHj-GH-C.
i ‘ Z-1 \\
Вг <-Вг О
-Вт®'
СН,-СЯ-С=О
'/ \ ©
СН,-СН-С=О + “ОН
о®
CH3CH-q
6н
СН,СНСОгН
он
792
ОТВЕТЫ к УПРАЖНЕНИЯМ
Два обращения конфигурации-хохранениеконфигурации
С концентрированным NaOH обычная реакция Sn2 происходит с обращением кон-
фигурации. Этил-а-б ром про пион ат не образует карбокси л ат-ан иона, если только
не про исходит гид рол из. Можно ожидать, что он будет реагировать (и действитель-
но реагирует) по типу Sn2 с обращением конфигурации, г) Порядок реакционной
способности для различных групп R согласуется с разрывом связи ацил — кис-
лород, а -не алкил — кислород. Таким образом,
Сон®
снэ-с С ;
//
CHjC ___ , ________
XO-R %
не является .правильным механизмом. Более вероятна следующая схема;
ОН О
Н II
+ н®
b'R®
Фон С,Н,СО,Н'
CHaCO2R - Н® 7=2 СН8С^ ’
X)-R
он о
: сн,—с—О—с—cshs
I
HOR
®
О
-ROH
сн8 — с. с —С2Н
НО®
„ " о
ROH ц..
3-сч ,с-с2н6 Z“—: сн3-с
он
-СЯН( Z:
О
О
II Л
CHsCO2H + RO-C-CsH#-|-H®
Низкая скорость реакции в случае объемистых групп R обусловлена, вероятно,
пространственными препятствиями.
J6-42. Возможны два объяснения того, почему 4-бромбициклот[2,2,21-октан-1-кар-
боновая кислота (А) является более сильной кислотой в сравнениггс 5-бромпен-
тановой кислотой (Б). Во-первых, в А имеются три цепи, через которые может
передаваться индуктивное электро но акцептор ное влияние брома, тогда как в Б
такая цепь только одна.
вг
СО2Н
(А) трипути (Б) одинпуть
Во-вторых, вращение вокруг связей С—С кислоты Б, по-видимому, дает основа-
ние предположить ослабление кислых свойств конформеров подвлиянием эффекта
поля брома. Это, конечно, невозможно для А, имеющего жесткое расположение
углеродных атомов.
&Э
Вг
бфЛ |СОЙН
ОТВЕТЫ К УПРАЖНЕНИЯМ
793
16-43.
а) СНаСОгН +
ло®
^*1 л
CH3-C-OR
ОСНЛ
®OR,
СН,СО2СН, (1)
Если R—mpem-бутил, первая стадия изображенной выше реакции является чрез-
вычайно медленной из-за пространственных препятствий, обусловленных трет -
бутильной группой. Когда R —, этил, препятствия намного меньше и скорость
реакции больше.
И® || ffi медленно
CH3CO2R СН3С—OR —--------------к CH3COSH-|-R®
н
-н®
R® + CHSOH--->- ROCHS
(2)
Эта реакция протекает с большой скоростью в случае, когда R — mpem-бутил,
т ак к а к этот зам естнте л ь об р азует относ ительно усто й ч и выйк а р бо н иевы й ио н R® .
Когда: R — этил, образование соответствующего карбониевого иона крайне не-
благоприяпю, и реакция протекает по другому направлению:
С)Н ОН
н® || СН,ОН | -ROH
CH3CO3R CHg^-C-OR “СНЭ—С—OR ;-----------------* СНэС03СН3 (3)
НОСНЭ
б) При использовании меченного ИО метанола в случае реакций (1) и (3) метка бу-
дет находиться исключительно в метоксильном кислороде метилацетата, а в случае
реакции (2) — целиком в эфирном кислороде.
16-44.
О® Дч он
,0 I н® I
R-C< 4-ls0H® R-t—OR" R-C-OR" ~
®0R" I | -R'OH
’SOH , 180H
[U
le0
R-C^
OR*
”0 О
R-e<{ + R'-C^
OH “OH
Тот факт, что фир RCO2R' превращается в
.^О
\OR'
конкурентно с гидролизом
в Нги0+1в01Ч®; означает, что нейтральный эфирный интермедиат |И теряет
®0Н конкурентно с отщеплением ®0R.
794
ОТВЕТЫ К УПРАВЛЕНИЯМ
/6-4,5.
Вг,, Р
а) СН3СО2Н-------> ВгСН2СОВг
конц. H,SO. HOCI
сн3снаон-------------->-сна=сна--------► носн2снаа
нагревание
Вг€Н2СОВг4*НОСН2СНаС1 —> ВгСНаСО2СНаСНаС1
Br3, Р
б) (СН3)2СНСО2Н ----->- (СН3)аС(Вг)СОВг —*
®ОСНЭ NH,
------- (СН3)аС(ОСН3)СОаСН3 --> (CH3)2C(OCHa)CONH2
1. О, _ 1. CHjCHjMgBr
в) (СНЭ)3ССН2С(СН3) =СН3--------► (СНВ)ЭССН2СОСНВ---------------
2. Zn, H$Q 2 дф
—* (СНа)3ССН2С(СНа)СН2СНа
&н’
LIAIbJ, НВг NaCN
г) (СН3)3ССО2Н------->- (СН3)3ССНаОН------(СН3)3ССН2Вг--------►
1. L1AIH3 (обратное присоединение)
—(CH3)3CCH2CN-------------------------------- (СН3)3ССН2СНО
2. Н®
' СН3 сн3
KMnO. I I Н®
д) (СН3)2С=С(СН3)2 -----► снэ-с — с-сн3 —-
Р 6н
сн3 о
I. II
—>сн3-с—с-сн3
СН3
1, CHjMgBr
2. Н®, Hso
сн3 сн3
I I-
СН3-С-----С-СНЭ
I I
сн3 он
хснасогн
сн2
''CHaCOiH
-Нао
-сог
НОСНгСНгОН
—! ‘
16-46. а) Нагревание муравьиной кислоты с хлористым тионилом даст окись угле-
рода. Уксусная кислота будет превращаться в ацетилхлорид
HCO2H4-SOCla —> СОЦ-2НС1-*-5Оа
CH3CO2H + SOCIa —> CH3COC1 + SO2+ HCI
б) Кислота при обработке холодным разбавленным раствором основания перейдет
в раствор
СНаОСН2СО2Н + NaOH —> CH3OCH2CO2Na+ Н3О
в) Проба на присутствие ненасыщенных соединений с КМпО4 или бромом в воде
КМпО,
СН2 = СНСО2Н-----СН2—СН—СОаН
(J)H
ОТВЕТЫ К УПРАЖНЕНИЯМ
795
г) Холодный этанол при взаимодействии с ацетил бромидом даст этил ацетат, аса-
бромуксусной кислотой не будет реагировать
СН3СОВг+СаНаОН ч- CH3CO2C2H6-i-HBr
д) Нуклеофильные агенты (например, ®ОСН3) быстрее реагируют с а-галоген-
эфирами, чем с первичными ал к илг ало ген идами
\ быстро
СН3СН2СНВгСОаСН3--------> СН3СН2СН(ОСН3)СОаСН3
CHSO®
е) При гидролизе в водном растворе образуются белые кристаллы янтар[юй кисло-
ты, тогда как уксусный ангидрид даст раствор уксусной кислоты, ж) Малеиновая
кислота в отличие от фумаровой будет легко образовывать ангидрид при нагрева-
нии
,СО,Н
НС/ -н,о
|| —--------->
НС
ХСО2Н
з) Выпадение в осадок производного ацетилена в виде ацетиленида серебра
Ag®{NHs),
CH^CCOSCH3--------> AgC = CCO2CH3
и) Щелочь на холоду приводит к выделению аммиака из аммонийной соли, но не
из амида
CH3CO2NH4 + NaOH —н CH3CO2Na4-H2O + NH3
к) В присутствии сильной кислоты в случае у,<5-ненасыщенной кислоты будет лег-
ко происходить образование лактона
СН3
HsS04 \
CHs = CHCHaCHaCOaH-------» CH-CHi
л) Ангидрид при нагревании будет реагировать с этанолом, давая уксусную кисло-
ту и этилацетат
(CH3CO)2O+CHSCH2OH —* СНаСО2СНаСН3-|-СН3СО2Н:
16-47. а) ЯМР (СН3-группа). б) ЯМР (С2Н;,-группа) и ИК (ОН-поглощение карбо-
ксильной группы), в) ЯМР (винильные протоны) и ИК (валентные колебания
С=С). г) ЯМР (СН3- и СОгН-протоны) и ИК (ОН-поглощенне карбоксильной груп-
пы). д) ЯМР (группы — ВгСН2 и —СНВг—•). е) ЯМР (группы СНЯСН,— и
—СН2СН2—) и ИК (С=О циклического ангидрида), ж) ИК (разд. 6-6). з) ЯМР
(НС= и Н3С=СН—) и ИК (валентные колебания С^С и С=С). и) ЯМР (®МН4
в отличие от —NHa) и ИК (водородная связь, валентные колебания NH). к) ЯМР
(СН2—СН— в отличие от — СН—СН—) и ИК (валентные колебания СН2—С, а
также валентные и деформационные колебания Н2С=). л) ЯМР (С2Н6-группа), ИК
(карбонил ангидрида).
796
ответы к упражнениям
- 2HjO
2СНаСН2СН2СН(ОН)СО2Н
16-48. Действие нагревания на изомерные окей пен таковые кислоты: ::
/°\
СН3СН2СНаСН С=О
O=(L <^НСН2СН2СНЭ
СНаСН2СН(ОН)СН2СО2Н
СН3СН2СН = СНСО2Е
-HSO СН3-СН-СН2
СН3СН(ОН)СН2СНаСО2Н > | I
О СН,!
о
СН2
-Н,о О СН2
CHj(OH)CHsCH2CH2CO2H ——> ] I
о=с сн2
16-49. Соединение А — СН3СН (ОН)СН2СО2Н (С — асимметрический атом угле-
рода); соединение Б •—СН3СН=СНСО2Н; соединение В —СН3СОСНЭ.
нагревание
СН3СН (ОН)СН2СО2Н------> СНаСН := СНСОЙН
— н ао
CrOj. Н® -сог NaOH,],
СНЕСН(ОЕ)СН2СОгН ----------- СНаСОСН8СО2Н—снэСосн9 —-------------
—»-CHsCO2H-j- сша
.йодоформ
(желтый)
Соединение А достаточно однозначно определяется приведенным выше описанием.
Никакая другая ок сиб утаи оная кислота не может быть оптически активной и де-,
гидратироваться при нагревании в а, 0-не насыщенную кислоту (соединение Б).
1б-о0. а) 1,1-Дикарбметдкснциклогексан. 6) Эти л-2-ацети л-3-мети л бута но ат или
этйл-а-изопропилацетоацетат, в) N, N-Диметил -2-проп иодил изобутирамид,
г) Этил-3-о кси п решено ат или этил-а-формнл ацетат, д) Диэтилоксал ил ацетат,
е) Трнэтилоксалилсукцинат. ж) 2-Метил-2-карбметоксициклопентанон, з) Диал-
лилу key сная кислота, и) 4,7-Диметилоктанон-3, к) 2-н-Пропялпентен-4-оновая
кислота, л) Диэтилацётилмалонат.
16-51. ~
CH.ONa
а) С1СН2(СН2)3СНаС1Ц-СН2(СОаСН3)1 ——=--->
—.2 НС1
СН2 —СНа СОаСНд
->н2с/ - >с/
СН2—СНг W2CH3
:СдНвО1\н
б' CHsCOCH2COsC2Hs+(CH9)2CHBr —— СН3СОСНСОЙСЙН2
-НВг I
СНСНДа
ОТВЕТЫ К УПРАЖНЕНИЯМ
797
C,H,ONa ; 1. С,Н,ОНа
в) 2GH8CH2CO2CaH3------->СН8СН2СО—СН—СО2С3Н3 ------------*
Na | 2. СН,1
СН3
сн8
I HNiCH,), .
.... —» CHeCHsCO-C-COsCsH5-----------> GH3CHaCOC(CH3)2CON(CH3)2
ч <4н3
г) СН3СОаС2На ,c»H>9Wa, fcH2CO2CaH6 -fcO,C‘H^.
-С,Н,О®
О:
к
—> НССНаСОС2Н6 —HOCH =CHGOaCaH6
л) сн3соас2н6 _2^2^®снасоасана
-с2ндое
—> С2Н8ОСОСОСНаСОаСаН6
C,HsONa
е) (СН2)а(СО2СаН6)24-СаНаОгССР2С2Н5 ---—>•
—+ С2НйОСОСОСНСОаС2Н5
(fjHsCOiCjHj
ж) /СНЙСО2СН3 /СНаСО2СНа
НаС СН,О.\а 112С -СН,О®
Н2Ь . Hat
. \CH,CO2CHS '4CHCOaGH3
сн2
н2с/\
| с = о
СНСО2СНЭ
] ,, CH,ONa
2. СН„! ’
]. GjH.ONb
7 СН,=СЕСН,С|
з) CHa(CO2CaHs)a
1, C,H,ONa
2. CH„=CH-CH,CJ
—+ СНа = СНСНа—СН(СОаС2Н6)г
—•> (СНэ=СН-СН2)аС(СОаСаН6)а
—(СНг = СН-СНг1ЕСНС02Н
1. НаО, нФ
2. нагревание, -СО,
1. NaOH
и) CH3CHaCOCHaCO2CaHs ; /сйон сн^г1
2, (V.rl|)ibrlU<rljUn»pr
1. NaOH
—- CHaCHaCOCHCHaCHaCH(CHs)2 ^-37,7*
СОаСгНв
798
ОТВЕТЫ К УПРАЖНЕНИЯМ
, I. I. HSO, Н®
—► СНэСНаСОС-СН2СН2СН(СН3) ----------------*
। Й. нагревание, -COj
со2с2н6
—*• CH9CH3COCH(CHS)CH2CH2CH(CHS)S
- 0 -ЫаВг
к) СН3СН2СН2Вг + ®NaCH(COaCaHj)a-----”
NaOH
СНаСНаСНаСН(СОаСаН6)г -t
I. H,O, H®
—> QH3CHaCH2C(CO2C2Hll)i ----:-----
I D/a 2. нагревание
CH2CH = CHi
—* снаснйснаснсоан
CHsCft=CHa
_ A -NaCJ
л) CHaCOC14-®NaCH(CO2CaHfi)2----> CH3C0CH(CO3C2Ha)a
Глава 17. Оптическая изомерия
17-1. Цель этого упражнения — подчеркнуть, что оптическая активность или вра-
щение плоскополяризованного света является молекулярным явлением. Ясно,
что оптическая активность несимметричных предметов, иалример'перчаток, боти-
нок и т. д„ не может быть измерена, если только молекулы их компонентов не
являются асимметричными.
17-2.
Если бы цис-цикло гексан-1,2-ди карбо новая кислота существовала в жесткой фор-
ме кресла (например, 1а), она была бы несовместимой со своим зеркальным изобра-
жением (1 в) и, следовательно, оптически активной. (Она имеет два асимметриче-
ских атома углерода и не имеет плоскости симметрии.) Однако в действительности
циклогексановое кольцо является более гибким, и имеет место быстрое равнове-
сие lajt 16. Фактически конформация 16 представляет собой зеркальное изобра-
жение 1а, т. е. 1в. Так как простая инверсия цикла приводит к превращению од-
ОТВЕТЫ К УПРАЖНЕНИЯМ
799
кого энантиомера в другой, оптической активности не наблюдается.
i/wc -циклогексан-
!,Э-дакарбоновая кислота
(оптически неактивна)
m р анс -цикиог екс ан*
1,>дикарбоноЕая кислота
(нар а э наш и ом ср о в) ,
17-3.
Ни одна из трех приведенных выше заторможенных конформаций (4-)-ви1!ной
кислоты не идентична своему зеркальному изображению. Если вращение вокруг
2,3-связи было бы невозможно, существовало бы три пары энантиомеров винной
кислоты.
17-4.
сно
но- С— Н [О]
но-с-н
^Н2ОН
(+)-эритроза
СО2Н
но—(!:—н
I
но-с-н
СО2Н
мезовинная кислота
сно СО2Н
Н0-(!-Н [О] НО-(!-Н
Н—(L—ОН Н-С-ОН
снаон io2H
(-)-треоза (-)-винная кислота
17-5.
СО2Н со,н СО3Н СО2Н
н-с-он но-с-н н-с-он ho-Ji-h
Н-С-ОН НО-С-Н Н—(!—ОН НО-С-Н
н—(i-он но-с-н ho-(J-h H-ti-он
Illi
СН3 CHS CHj CH3
800
ОТВЕТЫ К УПРАЖНЕНИЯМ
СОаН СОЛ-i со5н СО2Н
Н-С-ОН НО-А— Н Н-А-ОН НО—С-Н
но-А-н II — С-ОН но—С-Н ' н—с—он
ш о 1 F-?” :Ж 1 1 1 ъ Н-С-ОН Н-С-ОН но-с-н Ан». Ана Ан,
Имеются три ас-имметрйчёских центра и, следовательно, 23 оптических изомеров.
17-6. Известны только два оптических изомера камфоры, поскольку два из четы-
рех теоретически возможных оптических изомеров были бы чрезвычайно напря-
женными.
известные оптические изомеры камфоры
черезвычайпо напряженная
форма камфоры (неизвестна)
/7-7.
ОН
а) с^-с-н
CjHj—С—н
CHj
здытро -1,2-диф енИДпропанол-Г
?Н
, CfHj-q-H
CHj
тр со -1,2-дифенил пропанол-1
ОН
б) H-G-CHj
Н-^-С.Н;
О6н5
рритро -З-фешипеитаноЛ-1
ОТВЕТЫ к УПРАЖНЕНИЯМ
80!
он
H-G-CH,
CZHS-C-H '
Gjflj .
m»ta •3-феиилпвнтапол>2
s) СОгН
H-C-Br
I W
H-C-Br
СНЭ
spumpo^,3 диброммасляная кислота
(fOsH
Н-С---ВГ
Br-C-H
I
CHj
rnp eo-2,3. дибром-
масляная кислота
17-8. Обе приведенные ниже структуры имеют плоскость симметрии и не могут
быть оптически активными.
Н
H(Br)
; i/fc или Wtfwe
802
ОТВЕТЫ к УПРАЖНЕНИЯМ
17-9.
пара энантиомеров
(второй энантиомер
не показан)
Пара энантиомеров
(второй энантиомер
нс показан)
17-10. а) Атомы брома в о,о'-дибромбифениле являются достаточно объемистыми
заместителями, чтобы помешать свободному вращению при обычной температуре;
следовательно, энантиомеры должны быть достаточно устойчивыми, чтобы было
возможно их разделение, б) При условии, что центральное кольцо является не-
плоским и строго сохраняет одну конфигурацию, разделение такого соединения
возможно. Однако в действительности веществ а‘этого типа не являются оптиче-
ски активными в отсутствие дополнительных о,о'-заместителей.
в) Хотя нитро- и треш-бутил иные группы, по-видимому, недостаточно велики,
чтобы перекрываться с орто-водородами другого кольца в такой степени, чтобы
соединение можно было разделить, рассмотрение моделей дает основание предпо-
ложить, что энантиомеры будут устойчивыми, г) Как и в пункте (а), но в этом слу-
чае наряду с оптической изомерией может существовать цис — транс-изомер ня.
транс
Число изомеров такое же, как и для 1-бром-2-хлорциклопропана.
ОТВЕТЫ К УПРАЖНЕНИЯМ
803
17-1L Замещение такими объемистыми группами, как трет-бутильная, на концах
двойной связи может предотвратить инверсию и сделать возможным разделение.
Атомы фтора в 1,1-дифтор-1,2-дибром-2-феинлпрриане магнитно не эквивалентны
при комнатной температуре, поскольку в каждой из трех заторможенных конфор-
маций они имеют различное пространственное и магнитное окружение. Поэтому
независимо от скорости взаимопревращения конформеров атомы фтора остаются
неэквивалентными. Можно ожидать, что при —84 °C взаимопревращение между
тремя конформерами будет медленным и спектр каждого будет индивидуальным.
Это приведет к трем квартетам, обусловленным тремя парами неэквивалентных
атомов фтора. Можно ожидать, что конформеры (!) и (2), в которых пары замести-
телей бром — фенил или бром — бром занимают транс-положение, будут преоб-
ладать над (3).
17-13. 17-14. а) Первая —L-, две другие—D-конфигурации.
СО,Н б) сн, в) СО,Н ।
H2N-C-H 1 1 НО-С-Н 1 H-C-NH, 1
СН, Н-С-ОН но-с-н
0 сно 1 Е А) 1 „ СНз я > ‘бутандиол- 2,3 s ахн 1 1 СН, D.-туеоння сн.
но-с-н 1 н-с-он 1 1 СН3О—с—н
н-с-он г но-d-H 1 но-с-н 1
но-с-н НО—с—н сн.сн L-тлюиоэа 1 сн, кислота СН, мовомети.-овый эфир Ъ„-:рктри-С>таи- Двола-2,3
,804 ОТВЕТЫ к УПРАЖНЕНИЯМ
/7-/5. . - ,
Вг, SO3H, SGHjCHs, SCH3. ОСНа, NOa> NHOH, NHGH3, CC13, COgH, CONHa,
COCHS, CH2OCHa, CH2OH, CeH5, CH3, H.
17-/6.
CH3
a) l, S; 6) l, S; в) H-C-OH d, S
; H—C—Br d, R
ch2chs
Г) СНО д)
HO-C-H v.S /=4'
H-C-OH DtR Z 3
H-C-OH D,R
CHjOH DtS
17-/7.
17-lS.
a) Cl’s CHS 6)- CaHs, CeHs
HO—C-CeH3 CaHB-C-OH H-C-OH HO-Z.-H
C2ITj-d-H GHj-d-H H-C-OH H-C-OH
GSH. : (ieHe i,H6 i3Hs
(главяьш образам) (главна образам) >'
ОТВЕТЫ К, УПРАЖНЕНИЯМ
805
в) сн8 сна
Н—(i —ОН НО —С—Н
Н—С-СН3 Н—С—сн3
! I
С6нь CcHs
(главным образом)
Г) СНр СН3
н—i-Он но-с-н
(сн2)2 («Ан*)
H-i-CHs н—с—сн3
I:. I
C6HS СрН6
-50% —50%
17-19.
со2н
!
СНа разделение
С(ОН)СОаН
С^Н^Вг
D, L
СО2Н :
।
сн2
I I.
—*• НО—С—СО3Н —
I
СНз
СО2Н
<Lh3
I
НО—С—СО2Н
I.
СН2Вг
L
н,о, ®он
——-—> НО-С—СО,Н
г. а® 1
сна
ИСО2Н
K"CN
с, Ht0 н
со2н
I
сн,
17-20.
D ,—< D
I CH.-Q-SO.Cl | „ ___
СН3—С—ОН —-------------” CH3-c4-O-SO,-<f >-сн8
t ’ -и^ |
н н
Н О 1 II - © н н.о, он I
> CHjCO.H CH8-C-O-tC-CH3 1 1 > СН3-С-0Н
D D
17-21,
снэ снэ 1 сн8 1
Н-С-ОН г но-с-н Н—С—ОН
H-C-NHa HjN-C—Н I HaN-G-H 1
сна сн3 СНа
ti> (2) (3)
сн3 " 1 CHS СНз 1
Н-С-ОН 1 1 НО-С-Н но—с—н
h2n-c-h 1 H-C-NHs 1 1 н-c-nh2 t
с*:на сн3 СНз
(4) (6)
806
ОТВЕТЫ к УПРАЖНЕНИЯМ
Очевидно, что структуры (3) и (4)
идентичны; структуры (5) и (6) также
идентичны.
27-22.
я) СН2С1 1 СН.С1 1 “ ся/з
Н-С—С1 С1 1 г н—с-а
Н-С-С1 н. 1 -С-С1 1 С1-С-Н
СН2С1 СНаС1 с*:нас1
б) СНз 1
13 только один изомер (плоская молекула)
С3Н7 С2Нд
в) СОаН 1 СО3Н
н-d—вг ) СНаВг Br—С—Н ч
j СНаВг
г) СН(СН8)# (нет асимметрических атомов углерода)
Н —С—СН(СН3)а (!н(СН3)а
Д) СНа ‘СНЭ сн3 сн3
н-<--он : НО-С-Н 1 1 но—c-Н Н-С-ОН
н—к—вг 1 Br —С—Н 1 1 н—с—Вг Вг —С—Н
1 сн. сн3 1 1 1 СН3 СНа । ।
н-с-он : но-с-н 1 н-с-он НО-С-Н
1 СН» <4 снз <*:н3
СНз L . СН3 сн3 сн_,
Н—С—ОН 1 но-с-н 1 1 1 Н-С-ОН но-с-н
1 Вг—С—Н 1 Н-С-Вг 1 f ! Н-С-Вг Вг—С—Н 1 1
СНа 1 бн, сна сн3
н—с—он НО-С-Н 1 1 1 но-с-н Н-С-ОН
(!hs сна 1 1 СНэ сНа
е) СН3О2С COjCHj
ОТВЕТЫ К УПРАЖНЕНИЯМ
Mff
ж) СО2Н СО2Н СО2Н cosH
он но- -С—Н НО-С-Н Н-^-ОН
Н-С-ОН но- -С—H Н-С-ОН НО-С-Н
CO2CHj СО2СН, СО2СНЭ СОгСН3
з) СН2СНа 1 СН2СНз СНаСНз । | снасн*
снэ-с—н н -С-СНа H-C-CHj 1 1 1 СН^-С-Н
0 i о 1 1 <!)
с=о t=o c=o с=о
Н-С-ОН но -С—н Н-С-ОН НО—(2—н
СНЭ сн, сн. СН,
/7-23.
а) СНз СН3
н-с-он -н,со?1° H-ii-ococHj
csH5 Сгн5
D D
с2нв С2Н, С2н(
б) снэ-с-он сн3-с!-а ч- C1-C—сн4
СН^СН (СНз)^ СН2СН (СН,). 3 СН.СН (СН,),
D о, *
СН3ОСОСН3 СН2°Н —Л н-с-он +снэа
в) Н—С—ОН -22
j СН2ОН СН2ОН
D D
СН3 ' i H,Cf -КВГ н.с/С0\ СН,
г) Н—С—Вг+ _ NK “ N -С-Н
кн. ''СО/ н,с\со/ (!зНз
D L
сн, сн3 сн,
д) 1 Н—с-СОС(СНэ)з - ^-2^ Вг—С—COC (СН,)3 + (СН3)3ССО - С - Вг
<^н. С2Н6 CaHs
D D. L
(образовавшийся через еаол}
80S
ОТВЕТЫ К УПРАЖНЕНИЯМ
снэ сн3 С2Н5 снасн8
е) Н-С-СОС,Н5 -СН.,.^.ВУ Н-С— (Z-OH-S-H-i-d-OH
in, iHscHs с'нйс2н5
D (эритро и трео с небольшим
преобладанием тргоу
17-24.
а) С8Н5 б) CHS в) СО2Н
Br-L-Н Н-С-ОН H-d-CH,
H-(Z-Ci H-C-D Н-2-СН3
СвНв • £н» Сб2Н
г) СО?
Н-С-ОН
СН2
СО?
СН3 © 1 нвн—с—н I. CeHj ф 1 нЛ-с-н
csHs сщ и н-с-он сн8 Свнг
© ! . НзМ-С-Н сн2 '] H3N-i-H
с,н» сн? ; t.H3
со^ сн8 А 1 СО? с8на © !
1 н-с-он нэ®—с-н 1 • V с-С-ОН HjN-C-H
1 снг 1 свщ » <*> сн»
со? c6Hs ф' 1 СО? сн3 ® 1 .
H3N-C-H 1 Н3М —С —н 1
СНЛ: с,н4
17-2$.
НгОг, HCOgHj,
Ijilt
транс
Если образуется трине-пИкло пент ап диол-1,2, его можно разделить на оптически
активные формы, Напротив, разделение ^нс-цнклопентандиола-1,2 невозможно,
так как ой имеет плоскость симметрии.
ОТВЕТЬ! К УПРАЖНЕНИЯМ
809
17-26.
CHS
н-Ь-он
СН2
I
СНз
H.tPt
СНз
Н-к-ОН
начало' реакции,
разделение н ис-
пользование
одного изомера
Н-С-ОН
I
сно
сно
Н—(i—он
кнгон
I RSH; N1, Н2
1 (См. разд. !4-6,Б)
СНз
-аВН,> и—с—он
СНцОН
Приведенная выше схема позволяет избежать разрыва связей Н—С или —ОН
у важного асимметрического центра. Ключевой является та часть схемы, которая
позволяет установить относительную конфигурацию бутен-З-ола-2 по изомеру
втор-бутилового спирта, а также ио D-глицериновому альдегиду. Если восстанов-
ление D-глицеринового альдегида дает пропакдйол-1,2 с таким же вращением, как
и в случае соединения, полученного из определенного изомера бутен-З-ола-2, тогда
этот, изомер является D-изомером, а продукт его гидрирова!!ия представляет собой
Р-етор-бутиловыЙ спррт.
17-27. \
а) СОЙНв СОаН
1 I разделение при
снон снон
D-молочная кислота с Н10Н н®
. -2_!—L—„ этил-о-лактатд-этил-ь-лактат
L-молочная кислота .
б) СО2С2Н5 раЯдеяеняе с по-
I мощью оптически
СНОН ---------------т--->
I активного ацетил-
!, хлорида *ROCl
COjCgHj
CHOR*
кна
D и L
I» ujv 'jn • .
. ,J----->. этил-0-лактат-j- этил-ь-лактат
17-26.
a) CHa
H-C-Br
H—С—Br
I
CH8
CHs CHa
H-fi-Br Br-C-H
Вг—С—H H — k — Br
CHa кнв
810
ОТВЕТЫ К УПРАЖНЕНИЯМ
б) Присоединение брома к алкенам происходит по механизму транс-присоедине-
ния. Таким же образом (транс)- должна протекать обратная реакция — деброми-
рование 1,2-дибромида. Следовательно, оптически активный 2,3-дибромбутап даст
фд;-бутен-2, как можно видеть из механизма, приведенного в пункте (в).
СН3
Н-С-Вг
в) Вг-С-Н
СН,
17-29. Реакции элиминирования с бутен дибромидам и могут рассматриваться как
ирдао!,2-элиминирование, как показано ниже:
СН,
H-i-Br
I =
Н-С-Вг
1
сн,
мезо-2,3-дибромбутан
-IB г,®
СН,х^Н
Н^СН,
трянс-бутен-2
СН,
Вг-ё-Н
Н-С-Вг
I
СН,
о-2,3-дибром бутан
»/вс-бутен-2
Аналогично L-изомер дает фтс-бутеи-2. Тот же механизм в случае 1,2-дибром-1,2-
дндейтероэтана дает изомер противоположной конфигурации.
Н
1
В—С-Вг
I
D-C-Br
I
Н
мезо-!,2-дибром-
1,2-ди дейтеро этан
ОТВЕТЫ К УПРАЖНЕНИЯМ
811
Чтобы согласовать подобное представление о механизме отщепления с наблюдае-
мым продуктом, мы должны допустить, что па какой-то стадии происходит инвер-
сия. Она может быть результатом S№-замещен и я 1® исходного дибромида с по-
следующим элиминированием 1Вг вместо Вга,
/7-ЗО. Наосновании следующего детального механизма катализируемой кислотой
дегидратации диастереомерных бу тан диолов-2,3 можно предсказать, что D- или
L-формы будут давать главным образом меги лэти л кетон, поскольку они приводят
к переходному состоянию, в котором метильные группы, находясь в транс-ыт-
формации, создают наименьшие препятствия переносу ;Н®,
ипо-еутаиджл-г,3
нгзо4
да-СН)-группы
!
снаснгсосн3
-W®
(Склонено
17-31, Если осуществлять превращение (+)-винной кислоты, восстановив одну из
карбоксильных групп до метильной, восстановив далее соседнюю с оставшимся
карбоксилом СНОН-группу до метиленовой, то образуется L-P-оксимасляная
кислота. Тогда следовало бы сказать, что (ЧО-винная кислота принадлежит к
ь-ряду, что противоречит заключению, основанному на восстановлении в D-яблоч-
иую кислоту, согласно которому она принадлежит к ь-ряду.
соан со2н СОгН
н-с-он И—с—он —> 1 сн3
но—с—н 1 НО-С-Н НО—L—н
со2н' СНз СНз
(+)-в пиная кислота 1 СО2Н 1 +Н—G—ОН г СНа СОаН D -яблочная кислота L - р-окси м асл иная кислота
17-32. Рацемизация А через енолизацию Затруднена, так как скорость рацеми-
зации в кислом растворителе не увеличивается, и в А совершенно не содержится
дейтерия в том случае, когда рацемизация проводится в CH3CO»D.
ОТВЕТЫ К УПРАЖНЕНИЯМ
813
Рацемизация путем обмена хлорида по механизму Sn2 также не играет существен-
ной роли. Наиболее разумно объяснить .механизм рацемизации как обратимую ре-
акцию раскрытия цикла, которая осуществляется при нагревании.
17-33, Удельное вращение соединения определяется уравнением
taJ^TT(CM‘ разд' |7‘2)
Чтобы проверить, является или нет измеренное вращение (—100°) равным в дейст-
вительности 4-260°, следует провести измерения при двух или более концентраци-
ях (с). Правильные данные будут удовлетворять приведенному выше уравнению,
связывающему [a] с а, I и с.
17-34, Масштабный рисунок иллюстрирует сильное «поддерживающее» влияние
3- и З'-иодэаместителей.
осевая связь-
Это мешает 2,2'-иодзаместителям «отогнуться» в переходном состоянии рацемиза-
ции и замедляет тем самым скорость рацемизации.
17-35. opmo-Метильные заместители должны перекрываться в такой степени, что
это заставляет их выйти из плоскости кольца фенантрена. Когда одна метильная
группа находится над, а другая под плоскостью кольца, соединение не имеет эле-
ментов симметрии и поэтому может быть разделено.
814
ОТВЕТЫ К УПРАЖНЕНИЯМ
/7-36. (Звездочка обозначает Ji,C.)
Отметим,.что метка иС'находится в том же положении в конечном Ц-транс-
продукте, как и до превращения в окись.
Предметный указатель
Абсорбционная спектроскопия атомов
см.< Линейчатые спектры
Адамантан 480, 481
Адипиновая кислота 594, 595
Декарбоксилирование 464
применение 594, 595
синтез в промышленности 594
циклвйция 595
Адипиновый альдегид 458
Акриловая кислота 588
Акролеин (пропен-2-аль) 471, 485
гибридная структура 263
резонансные формы 263
Аксиальные водороды 127
Аланин
отнесение конфигурации 627
синтез 564
АлкаДиенины 238
Алкадиены 287 — 305 (см. 1,2* и 1,3-
Диены)
номенклатура 173 и сл.
АлкаДиины, номенклатура 238
Алкйиы 79—115
анализ с помощью масс-спектров 91
атомно-орбитальные модели 161
бромирование 111, 112, 113
галогенирование 98—114
ИК-спектры 90 и сл,
иодирование 112
нитрование 114—115
номенклатура 80—85
сгорание 91 и сл.
синтез 195 и сл., 217—218, 227 и
сл., 376 и сл., 381, 390 и сл.,
444, 496, 498, 559, 561
УФ -поглощение 91
физические свойства 86—91, 409
фторирование 111, 364 н сл.
химические сдвиги 62
хлорирование 111—114
число изомеров 81
ЯМР-спектры 90, 91
Алкатриияы. номенклатура 238
Алке иди ины 238
Алкеннлгалогениды 352—360
АлДенины 238
Алкены 171—233
алкилирование 227—228
анализ с помощью реакции при-
соединения брома 207
атом во-on бита л иные модели 161—
164
гидратация 414
гидрирование 195—199
гидроборирование 217—219, 414
гидроксилирование 221 и сл., 467
цис—транс-изомер и я 183—188
И К-спектры 175—178
комплексы с переносом заряда 206
номенклатура 172—174
озонирование 219—220
окисление 219—220, 417, 457, 458,
462—463, 465, 540
определение положения двойной
связи 220
полимеризация 222—227
— анионная 223
— катионная 223—225
— координицнонпая 226—227
— свободнорадикальная 225—226
присоединение 194—205
— брома 194, 200, 201, 202 , 203
— бромистоводородной кислоты
'201, 202
— воды 200
— галогенов 200
— галогенов атйстых кислот 200
— галогеноводородой 200
— гидридов бора 217—219
— несимметричных реагентов про-
тив правила Марковникова 215—
217
— нитрилов 572
— серной кислоты 200
— спиртов 444
— хлорноватистой кислоты 200,
202
реакционная способность 194, 214
синтез 223—225, 231, 245, 336—
343, 349, 350, 377, 390, 397,
422, 430 и сл.
УФ-спектры 178
физические свойства 174—175
эпоксидирование 448
816
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
ЯМР -спектр ы 179—181
— химический сдвиг 62
Ал кил ацетоуксусные эфиры 463, 585
и сл.
А л кил га л о ген иды 351—352
гидролиз алкил бромидов 329
ИК-спектры 352
номенклатура 309, 312
окисление 461
реакции 328—336
— с алкоголятами 422
— с металлами 376 и сл,
— с реактивами Гриньяра 390
— с солями карбоновых кислот 569
синтез 98—114, 200, 215, 232 и
сл,, 316, 318, 351, 382, 426—429
скорости реакций нуклеофильного
замещения 329, 332
----отщепления 339—341
У ф. спектры 352
физические.свойства 352
ЯМР-спектры 352
Алкилирование по Халлеру—Бауэру
516
Алкилмалоиовые эфиры, гидролиз 585
Алкилсульфат кислый 430
Алкилхлорсульфиты 569
Алкины 236—249
гидратация 244, 461
гидроборирование 244—245
ИК-спектры 239, 240
кислотность 246—249
комплексы с металлами.244
номенклатура 237—238
проба на тройную связь 249
реакция присоединения 243—245
синтез 243, 304 и сл,, 316, 492
теплоты сгорания 239
УФ-спектры 240
физические свойства 288—239
ЯМР-спектры 240, 241
— химический сдвиг 62, 240
Аллен (пропадиен-1,2) 301, 303 , 304
1,2-присоединение 296
равновесие с метил а цетиле ном 303
синтез 492, 524
Аллены см. 1,2-Диены
Аллилгалогениды 353—359
перегруппировка 357
реакции нуклеофильного замеще-
ния 354, 356 н сл.
— с реактивами Гриньяра 390
— Sjv2'’ 359 и сл.-
- реакционная способность 354
синтез 265, 353, 354
Аллйл-катион 356 и сл,
атом но-Орбитальная модель 280
гибридная структура 265 и сл.
схема спаривания электронов 280
Аллилмагиийбромид, ЯМР-спектр 404
Аллиловый спирт 442
Алли л уксус пая кислота 542, 589
Аллилэтиловый эфир 444
АльдегВД-аммиаки 480
Альдегиды
альдольная конденсация 509—513
восстановление 417, 438—439,
493—498
галогенирование $04—506
гидраты 483
ИК-спектры 54 и сл., 471
конденсация с аминами 488—491
— с гидразином 488
— с гидроксил амин ом 488
— с замещенными гидразинами 488
•S- с семика рбазндом 488, 490
номенклатура 407
окисление 498—499, 540
полимеризация 486—487
Присоединение аммиака 480
г?- бисульфита натрия 479
— галогеноводородов 491
— спиртов 481^-486, 491
— цианистого водорода 476
реакционная способность 469 и
сл., 474—475
синтез 220, 243 и сл., 245, 435,
438, 457, 465-469, 577
— таблица 458—461
УФ-поглощение 546, 548
физические свойства 470, 471
ЯМР-спектры 471 и сл.
Альдокетены 522
Альдоли
дегидратация 509, 513
синтез 509—513
Альдольная конденсация: 509
смешанная 511 и сл,
Алюминийорганнческие соединения
396 и сл.
димеры 374
координация с растворителем 374
применение в промышленности 397
синтез 379
Амиды карбоновых кислот 566/ 573
восстановление 460, 577
гидролиз 538
синтез 523, 573
— таблица 57Г—672
н-Амилацетат, пиролиз 337
трет- Амилбр омид 113, 342
н-Амилмагнийбромид, реакция с этил-
ортоформиатом 460
Амиловый спирт 409
трет-Амиловый спирт 414
трет-Амил хлор ид 343
а-Ам и иокис лоты, отнесение конфигу-
рации 625—627
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
817
Линии, синтезы 466, 576 и, сл., 598
Ангидриды карбоновых кислот 566
восстановление 576
реакции с аминами,571
— с аммиаком 571, 573
— со спиртами 568 , 573
— с хлористым тионнлом 570
синтез 187 и с л,, 255, 523, 596
— таблица 571
Анилин, энергия стабилизация 270
Антиоксиданты каучуков 298
Антрацен, энергия стабилизации 270
Арндт — Э истерт, реакция хлоран-
тидрйдов кислот с диазометаном 539
Асимметрическая индукция 639
Асимметрический
атом углерода 608
синтез 635, 638—642
— стереоспецифичность 639
Асимметрия молекулы, условия 608 и
сл.
Атомно-орбитальные модели органи-
ческих молекул 161—166
Ацетали
положение равновесия при обра-
зовании 485
синтез 481, 483—485
Ацетальдегид 243 , 441, 471
альдольная конденсация 509 и сл.
диметил а цета ль 481
ИК-спектр 546, 547
конденсаций с формальдегидом 512
и сл,
образование енолят-иона 509
полимеризация 487
реакция с метанолом 481
синтез 435, 461
УФ-поглощение 546, 549
Ацетальдегнд-аммиак 480
Ацетамид, энергия стабилизации 271
Ацетат, натрия, декарбоксилирование
559
Ацетилацетон 471, 527—529
кето-енольная таутомерия 528 и сл.
хелаты 529
ЯМР-спёктр 527—528
— химический сдвиг протонов ОН-
группы 52 А
Ацетйлацетоиат
бериллия 529
меди 529
Анетилбромид
снолизация 562 и сл,
реакция с бромом 563
синтез 562
Ацетилен 20, 21, 24, 241 и сл.
атом но-орбита льна я модель 164—
165, 237
гидратация 461
27 № 1540
горение 242
димеризация 244
кислотность 246, 248
присоединение брома 244
—. HF 243
— серной кислоты 243
реакциц-с карбоновыми кислотами
442
— с маг нН Йорга и ичес кими сое-
динениями 379
— со спиртами 442
синтез 241 исл.
соли 246, 249
физические свойства 239, 240, 242
шарсстержлевая модель 237
Ацетиленид
калия 246
серебра 249
Ацетон 303, 462, 471
альдольная конденсация 510 исл.
галогенирование 503—505, 507
как дегидрирующий агент 438 и сл.
енблизация 505—507
ИК-спектр 44, 45, 47
конденсация с формальдегидом
511—512
масс-спектр 76, 77
превращение в кетен 522—523
присоединение бисульфита натрия
— цианистого водорода.476
синтез 436 и сл.
УФ-спектр 54, 55 и сл., 549
Ацетонйлацетон, реакция с аммиаком
530
Ацетонитрил 20, 21
гидролиз 565
Апетенцнангндрии 476, 477
Ацетоуксусная кислота, декарбокси-
лирование 560
Ацетоуксусный эфир
алкилирование .584—586
ацилирование 586
кето-енольная таутомерия 579—580
кислотность а-водородов. 577, 578
в конденсации Михаэля 590
реакция с этил бензоатом 583
синтез 580 и сл.
в синтезах 539
ЯМР-спектр i579, 580
Ацетофенон 471 :
диэтилкеталь 485
синтез 464 .
Ацил азиды 566
синтез 572
Ацил галогениды 566
гидролиз 573
номенклатура 408
синтез 466, 558
818
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
— таблица 570
Ацилгидразиды 566
синтез 573
Ацилхлориды
восстановление 459, 460, 466, 576
гидролиз 573
реакции с аминами 571
— с аммиаком 571, 573
— с магнийорганическими соеди-
нениями 383
— со спиртами 568, 573
синтез 558 и сл.
Байер, теория напряжения в циклах
132 и сл.
Байер—Виллигер, окисление кетонов
надкислотами 540
Бензальдегид 471, 499
Бензил 471, 525
перегруппировка 526
Бензиловая кислота 526
перегруппировка 437
Бензойная кислота 499, 545
Бензол 253—260
атомно-орбитальная модель 256 и
сл.
бромирование 255
кадрирование 254 , 255
метод резонанса 258 и сл.
нитрование 255
озонирование 254, 255
реакционная способность 254
реакция с малеиновый ангидридом
255
резонансные структуры 258
строение 253 и сл.
структуры Кекуле 254, 258 и сл.
теплота гидрирования 256
— сгорания 256
энергия резонанса 275
— стабилизации 269, 270
Бензохинон, энергия стабилизации 271
Биохимические реакции, стереоспе-
цифичность 640
Бифенил, энергия стабилизации 270
Бифенилея, энергия стабилизации 270
Бифенилы
оптическая активность 619—621
рацемизация 621
Бициклические углеводороды, номен-
клатура 140—141
Бицикло-11,1,01-бутан 141
Б и циклогекс адиен 259.
Бицикло-[2,2,1]-гептан 141
Бицикло-[3,1,1]-гептан 141
Бицикло-|3,2,1]-октан 141
а-Бромацетилбромид 563
Бромгидрнны 448
транс- ЬВром-1,2-диметилциклогексац
205, 202
Бромистый бензил 562
Бромистый кротил, реакция с магни-
ем 541
Бромистый метил
реакция с литием 376
в реакциях нуклеофильного заме-
щения 332
Бромистый этил, реакция
с ацетоуксусным эфиром 541
с магнием 376
с фенилмагнийбромидом 391
а-Б ром карбо новые кислоты 562
1-Бром-2-метилпря1анол-2 212
Бромониевый ион 205
Бромоформ 507
а-Бромпропионовая кислота<564
Р-Бромпропионовая кислота 588
а-Бромуксусная кислота 562
2-Бром-З-фёнилбутан, трео- nspumpo-
диастереомеры 616 и сл.
2-Бромциклогексан он 503
З-Бромциклогексен 354
2-Бромциклогексил ацет ат, цис и транс
Бруцин как оптически активное осно-
вание 635
Бутадиен-1,3
атомно-орбитальная модель 278,
279
бромирование 266
гидрохлорирование 266
1,2- и 1,4-присоединение 287—288
— тетрафторэтилсна 295, 296
— хлористого водорода 287 и сл.
— этилена 289
резонансные формы 261 и сл., 275
синтетические каучуки 298—300
схемы спаривания электронов 279
теплота гидрирования 304
УФ-поглощение 275, 277
хлорирование 265
энергия стабилизации 271
н-Бутан 28, 81, 86
Бутея-1 175, 184
ИК-епектр 175, 176
озонирование 220
теплота гидрирования 199
УФ-поглощение 277
Бутен-2 175
цис- и троне-изомеры 175, 183,
184
— теплоты гидрирования 199
озонирование 220
Бутен-З-овая кислота 558
Бутеп-З-ол-1 442, 558
я-Бутилакрилат 568
mpcm-Бути л ацетат 568
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
819
трда-Бутнлбромид 209
трегп-Бутилди(бутен-1-ил)бор 245
Бутир кар бито л 443
Бутйллитий 378, 379
mpem-Бутил мети л кетон, реакция с йо-
дистым метилом 514
Бутиловые спирты, газо-жидкостная
хроматография 31
ятеор-Бутиловый спирт, энантиомеры
608 и сл.
н-Бутиловый спирт, реакция с метила-
крилатом 568
тгрда-Бутиловый спирт 37, 337, 342
как растворитель 401
реакция с а цетил хлор и дом 568
— с серной кислотой 431
синтез 200, 419
н-Б у ти л 4,6-три мети л бензоат 569
утор-Бутилхлорид, оптические изо-
меры 324—325, 326
трда-Бутилхлорид 208
реакция с магнием 541
сольволиз 341—343
4-тр да - Б у тил ня к л ore кс и л хлор ид, сте-
реоизомерия 138 и сл.
1 -Бутилэтилен 338
Бутин-1 (этилацетилен) 239
гидроборирование 244
Бутин-2 239
у-Бутиролактон 589
Валериановая кислота 541, 545
у-Вале рол актов 589
Валеронитрил, гидролиз 541
Вальдеилнское обращение 326
Вильямсон, синтез простых эфиров
422, 444
Винилацетат 442
Винилгалогениды 352—353
изомеризация 357
перегруппировка в реакциях нук-
леофильного замещения 357
реакционная способность 352
синтез 303, 352, 492
Вицилмагнийгалогениды 377
Виниловый-спирт 441
Винилуксусная кислота, декарбокси-
лирование 560
Винилфторид 243
Вииильные водороды 173, 176
сиип-спииовое расщепление 179 и
сл.
химический сдвиг 179
Винная кислота 628
мезо 610, 614, 615, 616
(+) 610, 616, 628, 629, 631, 636
(-) 610
(^) 610, 636
Витамин А 37
Внутренний возврат 357, 358
Воль — Циглер, реакция бромирования
N-бромсукцинимидом 354
Вулканизация 298
ускорители 298
Вюрца конденсация 377
Габриэль, метод синтеза аминов 598
а-Галогенальдегиды
реакции нуклеофильного замеще-
ния 567
реакционная способность 508
синтез 503 и сл., 521
аТ алогенкетоцы
реакции нуклеофильного замеще-
ния 567
реакционная способность 508
синтез 503 и сл., 521
Галоформная реакция 507—508, 540
1,2,3,4,5,6-Гексагалогенциклогексаны
254
«-Гексальдегид 245
Гекса метилацетон 516
Гексаметилентетрамин (уротропин) 480,
481
Гексан 82, 86, 88
н-, синтез 82, 101
«-Гексаналь
дн эти л ацеталь 460
синтез 460
Гексатриен-1,3,5, реакции 254, 255
Гексафторацетон, гидрат 440
Гексен-1 101, 175
циклизация 102
Гексен-2, цис и транс 175
Гсксен-3, цис и транс 175, 186
Гекссн-4-ол-З 389
Гексин-1 239
Гексип-2 239
Гекс ин-3 239
гидроборирование 245
Гелль—Фольгард—Зелинский, реакция
получения а-r а л огензамещенных кар-
боновых кислот 562—563
Гептан 86, 88, 365
«Гептаналь 461
Гептилноднд, окисление 461
Гептин-1 239
Гетерогенный катализ 196
Гетеролит плеская (полярная) реакция
201
Гибридизация орбиталей 154, 158 И сл.
Гибридная структура 260
Гидроксамовые кислоты 566
синтез 572
Гидроперекиси алкилов
27
820
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
перегруппировка 464, 468 и сл.
синтез 382, 468
Гликолевая кислота 526
1,2- Гликоли
иинакоп-пипаколивовая перегруп-
пировка 463, 466—467
расщепление: 457, 458
синтез 417, 451
Глиоксаль 525
Глицерин (1,2,3-триоксипропан) 440
свойства 440 и сл.
синтез 353, 441
трямкграт 441
Глицериновый альдегид
диэтилацеталь 485
синтез 485
как стандарт при-Отнесении конфи-
гурации 625, 626
Глутаровая кислота 593
превращение в ангидрид 595, 596
применениеJ 593
синтез 542, 593
Глутаровый ангидрид 595, 596
Гомолитичес к и Йе вободнор ади каль н ы й
процесс 201
Гомология 88
Гомон олймеры 298
Гофман, расщепление тетраал килам-
мониевыл: солей 337
Гунда правило 153
Гуттаперча (транс-1,4 -по л и изопрен) 300
Двойной резонанс 60
Двойные связи
кумулированные 173
сопряжённые 173 и сл.
энергия связи 194
Двухатомная молекула, энергия связи
252 и сл.
Дейтеровииилацетижн, ЯМР-спектр
70, 71
а-Дейтероэтиловый спирт, окисление
эйаятмрмеров 642
Декалин (б и цикл о-[4,4,0]-дека гидро-
нафталин) 116
Инверсия цикла 143
конформация цис — транс 142 и
сл.
— кресло— ванна 143
а-Декалол, окисление 462
а-Декалон 462
Декан 82, 86, 88
Дбльрия 487
Дециловый спирт 409
Децин-1 239
Д палки ла люмнкийгидрнд 397
Диал кил оксонбя ионы 445
Диалкилсульфаты 430
Диастереомеры 615
нритро и трео 616 и сл.:
Диацетил 471, 525
Диацетоновый спирт
дегидратация 513
синтез 510, 511
ДМР-спектр 63
Диборан 205, 206, 217
мезо-2,З-Дибромбутан 614
транс-i ,2- Ди бромциклогексен 201
шра>щ-1,2-Дибромэтилей 243
Ди-щрет-бутилкётЬн 395
Ди-трет-бутшловый эфир 431, 432
Ди-к-бутилсульфат 430
Ди-л-бутилсульфдт 430
рпс-1,4-Ди-щрет-бутил циклогексан,
конформация 139
снлм-Ди-щокщ.бутилэтилен 185, 199
Диглим 443
Диенофилы 290
таблица 290
1,2-Диены 301—305
бромирование 303
гидратация 303 и сл.
гидрирование 303
гидрохлорирование 303
изомеризация в ацетилены 304 и сл.
ИК-спектры 302
окисление 303
оптическая активность 617—619
стереоизомерия 302
структура 301
УФ-поглощение 302
ДМР-спектры 302 и сл.
1,3- Диены 287—300
полимеризация 297—300
1,2-прнсоединение 295—297
1,4-п р исоеди не f ше 289—29 5
реакции с га Логе нов одор одам и 353
Диизобутилен 224
ДиИзопропнлкетон, реакции с метал-
лоорганическими соединениями 393,
394
1,2- Двкарбопнльные соединения 255
525—526, 583
1,3- Дикарбонильные соединения
527—529
кето-е но л ь ная та у томе ри я 527—528
синтез 518, 524 и Сл., 580—584, 599
хелаты 529
1,4- Дикарбоцильяые соединения 530
Ди карбо новые кислоты 592—599
кислотные свойства 595
поведение при нагревании 595—596
применение 593—594
производные 597—599
синтез 538, 564 , 585
— в промышленности 593—594
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
821
физические свойства (таблица)
593—594
Дикетен 523 и сл .
пиролиз 524
реакция с аминами 524
— со спиртами 524
Дикман, конденсация эфиров дикарбо-
новых кислот 599
Дильс — Альдер, реакция, диенового
синтеза 289—295
диенофилы 290
механизм 293—295
стереоспецифичность 290 и сл.
стереохимия 292 и сл.
Димегилалюмииий хлористый, димер
374.
Ди метилацеталь, ЯМР-спектр 67
N,N-Диметил ацетамид, реакции с маг-
1Й1йоргаяическимй соединениями 386
Диметилбериллий, полимер 374
2,3-Диметилбутацдиол-2,3 (пинакон),
перегруппировка 467
3,3-Дйметилбутанощ2 (пинаколин) 467
Ди-(3-метял-2-бути.т) боран 245
3,5-Димет И л гексен-4-о л-3 389
Диметил гидроксил амия 350
1,2-Д и мети ле нци к лоб у та и 296
1,3-Диметиленпиклобутан 274
Диметилкарбоват, энергия стабилиза-
ции 271
Диметил магний 375
Диметил малеат 568
Диметиловый эфир 28, 445
2,5-Диметилпиррол 530
Диметилртуть 375, 376 , 378
Диметилсульфат 430
Диметилсульфоксид 401
цис-1,2-Димети л циклогексан 198
.N,N - Д икетилцнклосекса я ка рбокса -
мид, восстановление 460
1,2 - Д имети лци клогексе н
восстановление 198
присоединение бромистого водо-
рода 201
1,2-Диметилпиклопропан, цис—транс-
изомерия 137
Димет^лциклопропилкарбинол 415
Днметилцинк 375
о,о'-Динитродифеновая кислота, оп-
тические изомеры 620
1,4-Диоксан 443, 446, 447
1,2-Диолы
ИК-спектр 412
расщепление 457, 458
синтез 136, 221—222, 353, 417,
440, 447, 451, 467, 485
гем г Диолы 440
Дипольные момепты, определение 188—
Дисперсия оптического вращения 632—
635
Дифенил пол иены, поглощение света 276
Дифенилтрйкетон 530
моногидрат 530
1,1- Дифеиилэтнлен, реакция е пере-
кисью водорода 464
Дифракция
рентгеновских лучей 41
электронов и нейтронов 41
о,о'-Дифтордифеновая кислота, оп-
тические изомеры 620
Дифтордихлорметан 364, 367
1,1-Дифтор-2,2-дихлорэтнлен 366
Дифторкарбеи 366
1,2- Дифтортетрахлорэтан, ЯМР-спектр
74
1,1 - Дифтор -1,2,2-трибром-2-фени лэтан
оптическая активность 623
ЯМР-спектр 624
1,2- Дихлорбутен-З 265
1,4-Дихлорбутев-2 265
Дихлоркарбен 362, 363
Дихлорметан (хлористый метилен) 112
361
реакционная способность 362
1,2-Дихлорпропан 353
Дихлоруксусная кислота 545
шмм-Дихлорэтилен, цис —- трснс-изо-
меры 186
Диэтил адипинат, реакция с этилатом
натрия 599
Ди этиленгликоль 446, 447
Днэтилмалонат 578
синтез 569
Диэгиловый эфир 443
синтез 431
Диэти.ч-а-оксалилбутират 583
Диэтил оке они йбромид 445
Диэтил эти лм ал онат 584
Длнпысвязей 273 и сл.
таблица 273
я-Додекан 86
Енамины (виниламины) 516—518
алкилирование 517
С-ацилирование 518
в конденсации Михаэля 591
реакция присоединения 517
Енолизация 391
Енолы 499
Енолят-анионы 509—516
Жирные кислоты 537
Заксе — Мора теория ненапряженных
больших циклов 133
822
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Изобутан 27, 28, 227, 228
Изобутилен
гидроксилирование 467
полимеризация 224, 299, 200
присоединение алюминия 379
— бромистого водорода 209 и сл.
— бромноватистой кислоты 211 и
сл.
— хлористого водорода 208
синтез 337, 342, 343, 431, 432
Изовалериановая кислота 558
Изовалернлхлорид 558
Изомасляная кислота 545
Изомасляный альдегид 415, 471
синтез 467
цис — Hipawc-Изомерия
алкенов 183 И сл.
циклоалкенов 137—140
цис- и иронс-Изомеры 185 и сл.
установление конфигурации 185—
188
эндо- и э«эо-Из омеры 392
Изопентан
фотохимическое монобромирование
хлорирование 112
Изопрен см. 2-Метилбутадиен-1,3
Изопроиилат алюминия 495
Изопропилбромид 215
Изопропилиодид, реакция с метидат-
ионом 422
Изопропиллитий, реакция с диизопро-
нилкетоном 394, 395
Изопропиловый спирт
окисление 436 и сл.
синтез 419
ИК-спектр
ацетальдегида 546, 547
ацетона 44, 45, 47
бутена-1 175, 176
метилциклогсксана 119, 120
меТилэтилкетона 44, 45, 47
н-октаиа 89, 91
тетрахлорэтилена. 52
2,2,4-тримета л пентана 89, 91
уксусной кислоты 546, 547
фенил ацетилена 239, 240
циклогексена 52, 53
циклооктана 119, 120
ИК-спектрометр 43, 44
ИК-спектроскопИя 41, 43—50
ИК-спектры
алкенов 175 и сл.
алкилгалогенидов 352
алкинов 239
алленов 302
гликолей 412
карбоновых кислот 546—548
а,р -ненасыщенных альдегидов 519
— кетонов 519
спиртов 410—412
сравнение с К.Р-спектрами 52, 53
характерные частоты поглощения
46, 47
Имиды 473
циклические 596—599
— кислотность 597, 598
— резонансные структуры 597, 598
— синтез 316, 597 '
— соли 598
Имины 488
Инверсия цикла 128
частота -128
Ингибиторы (ловушки радикалов) 109
Индуктивный эффект 551—554
влияние на К А 553
способы передачи 552
Инициирование цепи 108
Йодистый метил 352
реакция с амальгамой ртути 376
— с трет-бутил метил кетоном 514
— с изопроиилат-анионом 422
Йодистый этил 64 и сл.
«-Иодпропионовая кислота 564
Ионность связи металл — углерод 372,
таблица 373
Ионные пары внутренние 357, 358
Иоцича реагент 379
К адм И йор тонические соединения 385
Кал и йор тонические соединения 372
Канниццаро, реакция окисления —
восстановления альдегидов Й0, 526,
540
Карбанионы 223
реакции с их образованием 399—
402
-------— влияние растворителей 401
Карбен 363
синтез 363
Карбены 362, 363
Карбинол 312
Карбитолы 443
Карбовакс 447
Карбоксилат-анион
гибридная структура 264
резонансные структуры 264
резонансный гибрид 550 и сл.
энергия стабилизации 550
Карбоксилат-радикалы, генерирова-
ние 560 и сл.
Карбониевый иоц 203
перегруппировка 433
переходное состояние 433—435
Карбоновые кислоты 536—599
ассоциация 544
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
823
водородные связи 544, 546
восстановление 465 и с л., 558 и сл,
а-галогензамещенные 563—5G5
— кислотность 552
декарбоксилирование 464, 549,
559—562
диссоциация 550 и сл,
ИК-спектры 546, 547
индуктивный эффект 551—554
кислотность 536
а, Р-ненасыщенные 521
номенклатура 313
оптически активные для разделе-
ния рацемических оснований
635—637
реакции с аминами 571
— с аммиаком 571
— с а ди л галогенидам и 571
— с диазометаном 569
— X кетенами 571
— с оксалил хлор и дом 570
— с РС1Л, РОС13, и SOCls 558, 559
— с серной кислотой 563 и сл.
— со спиртами 555—557, 569
— с участием карбонильного уг-
лерода 554—559
----«-углерода 562—565
как резонансный гибрид 550 и сл.
синтез 375, 383. 384, 476, 498, 500,
508, 523, 560, 665, 574, 585, 586,
596
— примеры (таблица) 541—543
— таблица 539—540
соли 561 и сл., 571
~г- электролиз 561
УФ-поглощение 546, 548, 549
физические свойства 544—546
----- таблица 545
функциональные производные
565—567, 673, 575
химические свойства 549—566
ЯМР-спектры 548
2-Карбэтокс и циклогексанон 584
2-Карбэтоксициклонентанон 599
Каучуки синтетические 298—300
Квантовый выход реакции 109
Кетали 485 .
Кетен
как ацилирующий агент 523, 524
димер 523 и сл.
реакция с карбоновыми кислота-
ми 571
— с циклопента диеном 296
синтез 522—523
Кетены 522—525
реакции 522 и сл,
синтез 522, 523
Кетимины 389
а-Кетоглутаровая кислота 641
Кето-енольная таутомерия 527—529
Кстокетсны 522—525
димеризация 523 и сл.
Котомалонивая кислота 475
Кетоны
алкилирование 514—516
альдольная конденсация 509—513
восстановление 417, 493—498
галогенирование 503—508
енолизации 505—506
замещение С^=О иа два хлора 492
— — — фтора 492
ИК-спектры 470
конденсация с аминами 488
— с гидразидом 488
— с гидр о кси л а ми ном 488
— с замещенными гидразинами 488
— с семи карбазидом 488, 490
«,Р-ненасыщенные 519—521
Р.^-ненасыщенные 522, 587
номенклатура 406, 407
окисление 499, 540
окисление.— восстановление 500
присоединение бисульфита натрия
479
— галогеноводородов 491 н сл.
— спиртов 485 и сл.
— цианистого водорода 476
реакционная способность 469,
474—475
сшггез 220, 243, 245, 296, 38.6, 386,
435, 436, 437, 438, 457, 462, 464,
465, 466—469, 514, 516,/>18, 595
— таблица 462—464
УФ-поглощение 546, 548
физические свойства 470, 471
циклические, реакционная способ-
ность 475
ЯМР-спектр 471 и сл.
3 - Кетоци клоб ута 11 ка рб о 11 ов ая кислота
463
Р-Кетоэфиры, расщепление 463
Кижнер—Волъф, восстановление, мо-
дификация Хуанг—Мицлола 497
Кинетический
изотопный эффект 437
контроль реакции 209
Классификация органических соеди-
нений
как производных неорганических
соединений 309, 310—311
по функциональным группам 283—
286
Клемменсен, восстановление карбо-
нильной группы амальгамированным
цинком 496
Кляйзена конденсация 580—584
механизм 581 и СЛ-
смсшанпая 683
824
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Ковалентные связи направленные 154—
158
Кольбе, электролиз солей карбоновых
кислот 561
Комплексы с переносом заряда 206
Коцстанты
равновесий 95, 99—101
скоростей реакций 321
Конфигурации 184
абсолютные 624—631
относительные 624—631
— на основе кривых дисперсии
оптического вращения 633—635
система обозначений D.L 625,
626, 628 и сл.
----Кана — Ингольда — Пре-
лога 629
----R,S 630—631
трео и эритро 616 и сл.
Коиформадая 25, 137, 184
аксиальная и экваториальная 126,
127
заслоненная 25
заторможенная 25
способы изображения 24—26
форма ванны 123
----искаженной 125
— кресла 123
Конформер 437, 184, 528
Координата реакции НО
цис-Кор нч ная кислота, реакция с
нгранс-пентадиеном-1,4 294
Коричные кислоты, цис и транс 187
Коричный альдегид 459
Кротиловый спирт 357
реакция с тионилхлоридом 429
синтез 416, 417
Кротилхлорсульфит 429
Кротоновый альдегид 471
Восстановление 416,. 417
реакция с этилмагнийбромидрм 389
Синтез 509
Лактамы 567
.Лактиды 589
Лактоны 566
синтез 524 , 589
Лимонная кислота в асимметрическом
синтезе 641
Линейная комбинация атомных орби-
талей (Л КАО) 277 и сл.
Линейчатые спектры 42 и сл.
Линолевая кислота 537
Литийорганические соединения 395—
396
использование в синтезах 374, 375
карбонизация 541
присоединение: к карбонильной
группе 395, 396
реакционная способность 395
реакция с Н,И-дизамеш.енными
амидами 387
синтез 376, 377
Лукаса реактив 427
М а гнй й ор гав и чес кие сое дм не нй я (реак-
тивы Гриньяра) 380—394
восстановление, конкурирующее с
присоединением 391, 392
енолизация, конкурирующая с
присоединением 391, 392 .
карбонизация 383, 538, 541
Координация с растворителем 381
окисление 415
молярность связи С—Mg 381
реакции с алкилгалагенндами 390
и сл.
— с аллил галогенидами 390
— с ацетиленом 379
— с ацилхлоридами 383—385
— с галогенами 382
— с галогенидами металлов 378
— с двойными связями С—С 387—
389
— с М.М-дизамещенными амида-
ми 386
— замещения 390—391
— с кислородом 382
— присоединения к диметилфор-
мамиду 461
----к диэтилортоформнату 460
---- к карбонильной группе 383—
387
— — — побочные процессы
391—394
,— -------таблица 384
— с Ce=N -связями 389
— с серой 382
— со сложными эфирами 386
— с соединениями с подвижным
водородом 381 й сл.
— с циклическими эфирами 391,
415
— с формальдегидом 414
синтез 376, 380
структура 380 и сл.
Малеиновая кислота 188
восстановление 595
применение 594
синтез и промышленности 594
।физические свойства 594
циклизация 596
Малеиновый ангидрид 188
реакция е метанолом 568
синтез 596
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
825
Малонитрил
в конденсации Михаэля 591
этанолиз 569
Малоновая кислота 596
декарбоксилирование 560, 596
применение 593
синтез в промышленности 593
физические свойства 593
Малоновый эфир
алкилирование 584—586
ацилирование 586
конденсация с эти л дин на матом
590
в синтезах 538, 539
Марковников, правило присоединения
к ненасыщенным системам 208—211
H-Масляная кислота 545
УФ-снектр 549
М^ёляный альдегид 471
УФ-спектр М9
Масс-спектр
ацетона 76, 77
мети лэги л кетона 76, 77
пропионового альдегида 76, 77
Масс-спектрометр 75, 76
Масс-спектрометрия 41, 75—78
определение молекулярных масс 33
Мёервейн—Пандорф—Верлей, ,метод
восстановления альдегидов и кето-
нов 439, 495
Межатомное отталкивание 104
МежэлектронНое отталкивание 168
Мезитойная кислота, этерификация
556, 557
Металлоорганические соединения 372—
402
бериллия 374
димеры 374
ионный характер связи металл —
углерод 372 и сл.
использование в синтезах 375
карбонизация 538
координация с растворителем 374
оптически активные 398 и сл.
растворы 379
реакции с галогенидами металлов
378
-г- с карбонильными соединениями
414—415
— с органическими галогенидами
377 и сл.
— Присоединения к нитрилам 463
----к хлористым ацилам 464
— с растворителями 376
— с углеводородами с подаижным
водородом 379
— электрофильного замещения
397—402
реакционная способность 373
свинца 396
синтез 376—379
— растворители 376
физические свойства 372 и сл.
Метальдегид 487
Метан 17, 19, 22, 381
пространственные модели 27
сгорание 93
— теплота 93—94
физические свойства 86, 87
хлорирование 98, 102—109
— константа равновесия 99, 102
— механизм 102—109
— фотохимическое 106—109
энергия диссоциации связей 106
Метанол
реакция с ацетальдегидом 481
— с бромистой одер од ной кисло-
той 420
— с малеиновым ангидридом 568
— с серной кислотой 430:
— с уксусной кислотой 424
синтез 500
физические свойства 409
Метантиол 350
Метилакрилат, реакция с «-бутиловым
спиртом 568
а-МеТилакрилонятрил 476
Метил аллен
изомеризация 304—305
синтез 338
теплота гидрирования 304
Метилаллиловый спирт 357
а-Мётилаллилхлорнд 357, 429
Метил-анион 169
Метилацетат, реакция с этанолом 573,
574
Метилацетилен, Кд 379
п-Мсти л ацетофен он 396
2-Метил6утадиен-1,3 (изопрен)
димеризация 289
синтетические- каучуки 298—300
энергия стабилизации 271
2-Мети лбу тен-2 345
гидратация 414
2-Метилбутеи-2-овая кислота
синтез 541
2-Метилбутен-3-ол-2 (а, а-диметилалли-
ловый спирт) 37
Мети л-трет-б ути л карби но л, дегидра-
тация 433
Метил-трет-бутил кето и, окисление 543
Метил-н-бутйновый эфир 444
Метил ви пил кетоп 471
Метилвиниловый спирт 443
Метил вин иловый эфир 443
5-Метилгексен-4-аль 459
5-МетиЛгексен-4-ол 459
8-Мстилгидринданон-5 (цис и транс),
826
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
дисперсия оптического вращения
633, 634
10-Метилдекал011-2 (цис и транс), дис-
персия оптического вршцепия 632,
633
Меги лдиэти л ацетальдегид 438
Метиле и гликоль 439
Метилизопропилкарбинол 415
Мети л изопропиловый эфир 422
Мот и л кар бито л 447
Метил-катион 168
Метижетен, изомеры 525
Мет ил кетоны
качественная проба 567
окисление 540
Мстилликтат, удельное вращение 624,
625
Мет и л.литий 18
реакции 374, 375
реакционная способность 374
синтез 376
физические свойства 375
Метилмагцийгалогениды 380
Метилмагнийиодид, реакция с формаль-
дегидом 383
Метил малоновая кислота 564
Метилнатрий 375, 378
З-Метилоксония борфторид 445
МетилоксопИя-ион 424
2-Метил пентен-2-аль, окисление 542
2-Метидпентен-2-овая кислота 542
4-Метилпецтен-4-он-2, реакция с этил-
магиш[бромидом 388
N-Мети л прол ин 35
Метилфениловый эфир (анизол) 443
А1етил фтористый 18
Мети л целлозольв 443, 447
3-Мети л циообута нк ар бонов а я кисло-
та, окисление 463
Мсти л ци к догенеан
ИК-спектр 119, 120
конформации аксиальная и эква-
ториальная 127, 128
ЯМР-спектр 121, 122
1-Метилциклогексанол 386
тр йнс-2-Мсти л циклогекс ано л 414
ЬМетилциклогексеп, гидр обор про ва-
нне 414
Мсти «тци к логе кс и л Карби цол, окисле-
ние 462
Метилциклогексил кетон 462
щранс-2-метилцнклопентаиол-! 219
1-Метилвдклопситен, гидроборирова-
ние 218 и сл.
ААетилпнклопропан 184
Мети л циклопропил ацетат 569
Метнлцнклопропижстон, реакция :
метплмагнийиодидом 415
2-Метил-2-этилбутапол-1 438
Мети л эта л кетон 471
ИК-спектр 44, 45
масс-спектр 76, 77
S-Метц л-О-эти л кс а итоге наг 350
Метилэтиловый, эфир 422
Метилэтилуксусная кислота 541
Метод резонанса 257—268
правила использования 260—268
Метбксиуксусная кислота 545
Микроволновая спектроскопия 41, 42
и сл.
Михаэль, реакция присоединения к
сопряженным системам 509, 590 и сл.
Модели
Дрсйдннга 126, 127
Стюарта 27, 104
шаростержневые 23, 138
Молекулярное вращение 607
Молекулярные массы, методы опреде-
ления 32 и сл.
Молекуляных орбиталей метод 277—
281
Молочная кислота 624
связь с аланином 626, 627
синтез 564
удельное вращение 624
Vстановление конфигурации 626,
627
Мольозоннд 219
Моляррпя рефракция 189
Мочевина, энергия стабилизации 271
Муравьиная кислота 545
Мыла 537
Надбепзойная кислота 499
Натри Йорга ни чес кие соединения 394
и сл.
присоединение к карбонильной
группе 394, 395
реакционная способность 394
синтез 376, 377
Натуральный каучук 299, 300
Нафталин, энергия стабилизации 270
а-Нафтил уксусная кислота 542
Нафтойная кнелота 542
а ,Р-Не насыщенные альдегиды 519—521
ИК-спектр 519
миграция двойной связи 587
реакции с галогеноводородами 521
— с гидразином 521
— с цианистым водородом 520
синтез 519
УФ-спектры 519
ЯМР'Спектры 519, 520
Р, у-Ненасыщенные альдегиды 522
и,р-Ненасыщенные карбоновые кислоты
587—591
бромирование 587
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
827
гидрйтация 587, 588
гидробромирование 587, 588
гидроксилирование 587
конденсация Михаэля 590 н сл.
миграция двойной связи 587
образование двойной связи 589
1,4-присоединение металлоорга-
нических соединений 387—389,
590
синтез 589
сопряженные кислоты 588
Р,-у-Ненасыщенные карбоновые кисло-
ты, миграция двойной связи 587
а,р(р,-^-Ненасыщенные сложные эфи-
ры, миграция двойной связи 587
Неогексан 88
Неопентилбромнд 328
Не о п ецти л ди мети л ка рб и ни л х л ори д 34 4
Неопентилиодид 345, 382
Неопентилхлорид, реакция с магнием
382
Нэфть, продукты перегонки 91
Никель Ренея 198
Никотин 34, 35
Никотинамидадениннуклеотид 642
Нингидрин 531
Нитрилы
алкоголиз 569
восстановление 439, 466
гидролиз 538, 565, 571
реакция с алкенами 572
синтез 316, 466, 476 , 520
Нитроглицерин (трииитрат глицерина)
441
Нитрометан 115
Нитронарафцны 114 и сл.
Нитропропаны 115
Ннтроуксусная кислота, декарбокси-
лирование 560
Нитроэтан 115
Номенклатура 36—38
Нонан 81, 101, 102
Нонип-1 239
Норбор нилхлорид, эндо и экзо 392
Нуклеофильного замещения- реакции
315—336
алкилгалогенидов 316 и сл., 318
механизмы 320—323, 328—336
нуклеофильные агенты 316, 317,
332—333
растворители 316, 317, 322, 334—
336
стереохимия 323—327
термохимия 319—320
тип соединений, вступающих в ре-
акцию (таблица) 318
уходящая группа 331—332
Нуклеофильного отщепления реакции
336—350
влияние структурных факторов
340, 343—345
Е1 341—345
Е2 339—341
механизм 343—345
стереохимия 346—350
таблица 337—338
Обращение конфигурации 325
Обрыв цепи 108
Общий кислотный катализ 490
Озониды 219—220
Окись
транс-б уте на-2 448
Час-бутена-2 (2,3-диметилоксиран)
447
диметилэтиламина 350
мезитила (неитен-З-он-2) 471, 513
пропилена (метилоксиран) 447
— реакция с фенилмагнийброми-
дом 415
----- с этанолом 452
стирола (фенилоксиран) 447
— восстановление 416
триметилена 447
— реакция с магнийорганически-
ми соединениями 391
циклопентена, раскрытие цикла
451
этилена 440, 443, 446, 447
— реакции 391, 447
а-Оксикислоты 476, 526, 564, 589
Р-Оке и кислоты 520, 588, 589
у- и 6-Оке и кислоты, внутримолеку-
лярная этерификация 589
Р-Оксимасляная кислота, дегидрата-
ция 589
у-Оксимасляпая кислота, внутримоле-
кулярная этерификация 589
Р-Оисимасляный альдегид (ацеталь-
доль) 509
2-Окси-2-метилпропноновая кислота
476
а-Оксипронионовая кислота, бимоле-
кулярная этерификация 589
Оксираны (эпоксисоединения) 447—452
раскрытие кольца 451—452
синтез 448 и сл.
сольволиз 451
Оке они ев ые соли 420, 445
л-Октан 81, 86
ИК-спектр 89, 91
физические свойства 86
ЯМР-спектр 90
Ьктафтор циклобута и 366, 367
Октнн-1 239
Олеиновая кислота 537
Ониевые катионы 317
828
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Огшенауэр, окисление спиртов 439, 459'
Оптическая активность
замещенных этанов 623 и сл.
соединений с двумя асимметриче-
скими атомами углерода 612—617
— не содержащих асимметриче-
ских атомов 617—624
— с одним асимметрическим ато-
мом у глерода 608— 610
цйклоалкенов 622 и сл.
Оптические изомеры 302
Оптическое вращение 604—605
Орбитали
атомные 147, 151—166
— энергии 149
вырожденные 149
гибридные
— so 159
— sp2 159
— sp3 160
разрыхляющие 55, 56, 151
связывающие 56, 151
— т-тина 163
d 147, 155
f 147, 155
р 147, 148, 149, 154, 156
s 147, 148, 154, 155, 156
Основания оптически активные для
разделения энантиомеров 635—638
Пальмитиновая кислота 537, 545
Параформ альдегид (полно кснмети ле и)
487
Паули, принцип исключения 149
н-Пента декан 86
Пентадиен-1,2 286
Пентадиен-1,3 286
теплота гидрирования .304
транс, реакция с коричной кисло-
той 294
энергия стабилизации 271
Пента диен-1,4 286
теплота гидрирования 304
УФ-поглощение 274
Пентан 81, 86
Пентаэритрит 513
Пентен-1 175, 337
теплота гидрирования 196
Пснтен-2
цис- и трс«с-изомеры 175
теплота гидрирования 199
Пентсн-З-он-2, реакция с этилмагний-
бромидом 388
Пентин-1 (н-np опила цетиле и) 239
Пентин-2 239
Перекиси: 382 , 468
ди ацетилов, термическое разло-
жение 444.
Перекрывание орбиталей 154—158, 162
о 163
л 163
Переходные состояния 335, 336
Пёрфторгептан 365
Пе рфто р изобу ти л ен 3 67
Пимел ивовая кислота 594, 595
Пинакон-пи наколи но вал перегруп-
пировка 1,2-гликолен 466—467
Пиразолйны 52!
Пиридин, энергия стабилизации 270
Пиридин-3-карбоновая кислота 35
Пирослизевая кислота 543
Плоскополяризованный свет 604
Пол и глимы 443
Пол и изобутилен 224
Полимеризация
алкенов, анионная 223
— катионная 223—225
— координационная 226—227
— свободнорадикальная 225—226
катализатор Циглера 227
сопряженных диенов 297—300
Полипропилен 222
Полициклоалканы 140 и сл.
Полиэтилен 226
Полуацетали
‘равновесие при образовании 485
синтез 481—482
Поляризация
дипольная 189
молекулярная индуцированная 188
молярная 189
растворители 189 и сл.
Порядок реакции 32
Пропан 86, 115
Пропан дитио л-1,3 498
Пропанол-1, окисление 458
Пропен 175
теплота гидрирования 199
и-Пр опил бромид 215
Пропилен
гидроборирование 217 и сл,
гидробромирование 215 н сл.
гйдрохлорирование 208
полимеризация 222, 227
Пропил-катион 356, 357
Пропиловый спирт 409
к-Пропилхлорид, валентные схемы 356
Пропин-1 (метилацетилён) 239
Пропионовая кислота
реакция с этанолом 555
физические свойства 545
хлорирование 563
Пропионовый альдегид 458, 471
масс-спектр 76, 77
Простая связь 151
энергия связи 194
Пространственное ускорение 330
ПРЕДМЕТНЫЙ: УКАЗАТЕЛЬ
829
Пространственные затруднения 124
Простые эфиры
комплексы с кислотами Льюиса 445
номенклатура 312
основные свойства 445
реакции со свободными радикала-
ми 446
реакционная способность 443
синтезы 422
— таблица 444
циклические 446—452
раскрытие цикла 456—452
— синтез 316, 317, 318, 359, 422,
431, 442, 444 , 447—449, 514
ЯМР-спектр, химические сдвиги 62
Протониевый ион 20а, 210
Протбтропноё: превращение 528
Рацемизация оптически активных сое-
динений 609, 642—645
вторичных галогенидов 643
карбонильных соединений 642
спиртов 644
углеводородов 644 и сл.
Рацемическая смесь 609
Рацемическое соединение (рацемат) 609
Sn2'-Реакции 359—360
стереохимия 359 и сл.
Резонанс и спектры поглощения 274—
277
Резонаисньге структуры 258 и сл.
Резонансный эффект в карбоновых кис-
лотах 556—551
Реформатского реакция 395
Розенмунд, восстановление ацилхло-
ридов 459, 466
Ртутьор га ническ ие с оеди неи и я
применение в промышленности 396
реакционная способность 375
D-Ряд 626
L-Ряд 626
'Саймонса процесс 365
Связи, образование 19 и сл;
т-Связи 163, 166
Синтез органических соединений, пла-
нирование 229—233:
Скорости реакций 102—109
Сложные эфиры алифатических карбо-
новых кислот
алкилирование водородов 684—
586
восстановление 576 и сл.
гидролиз 538, 567, 573
кислотность а-водородов 577
конденсация Кляйзена 580—584
номенклатура 313
переэтерификация 568 , 573, 574
реакция с аммиаком 573
синтезы 423—425, 554—557, 573
— таблица 568—569
Сополимеры 227, 298
Сопряженная кислота 482
Сопряженное основание 482
Спектрометр комбинационного рассе-
яния 50, 51
Спектроскопия как метод идентифика-
ции 31
комбинационного рассеяния света
41, 56—54
Спектры комбинационного рассеяния
56—54
тетрахлорэтилена 52
циклогексена: 52, 53
Спин-с липовое расщепление 64—67,
70—72
второго порядка 65,:71
д ля неэквивалентных протонов 66
первого порядка 64
распределение интенсивностей ли-
ний 67, 70 и СЛ;
соотношение с химическими сдви-
гами 70—73
Спираны, оптическая активность 619
Сниро-|2,21-пентпИ, оптическая актив-
ность 619
Спирты 405—442
ассоциация за счет водородных
связей 409
вторичные, гидробромирование 426
и сл.
— гидрохлорирование 427 и сл.
— окисление 435, 436, 462
— синтез 4.15, 416
дегидратация 430 нс л,, 444
— с перегруппировкой 433—435
ИК-спектр: 410—412
кислотные и основные свойства
419—422
координация 423
метилирование дйазометаном 444
многоатомные 439—441
ненасыщенные 441—442
— окисление 437, 438
номенклатура 309, 312
окисление 406, 435—439
первичные, автоконденсацня 431
— тндробромпрование 426 и сл.
— гидрохлорнрование 427
— дегидратация 430
— окисление 435, 468 , 459, 540
— реакции с карбоновыми кисло-
тами 568
— синтез 335 и сл., 414 , 416, 576,
588 и сл.
реакции с алкенами 444
830
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
— с алкил галогенидами 422
— с альдегидами 481—486
— с ангидридами 568
— с ацил галогенидам и 423 и сл.
— с ацилхлорндами 568
— нуклеофильногозамещеиияЗЗО,
331
— переэтерификации 568
— с серной кислотой 430—435
— с тионилхлоридом 569
— с участием связи О—Н419—426
г. _ С—О 426—435
синтез 200, 238, 266, 353—358,
382—389, 413, 419, 493 и сл.
— таблица 414—417
третичные, гидробромированне 427
— гидрохлорирование 427 и сл.
— дегидратация 431
— окислен ие435
— реакция с серной кислотой 431
и сл.
— синтез 383, 408—410, 415
физические свойства 391 и сл., 415
ЯМР-спектр 62
Стеариновая кислота 537, 545
Степень даоесвязности 274
Стереоизомерия 184
Стирол 275
Стрихнин как оптически активное ос-
нование 635, 636
Структура, методы определения 31, 32
и сл.
Сукцинимид 596, 597
Схемы спаривания электронов (валент-
ные схемы) 257—260
Таутомер 528
Теплоты
активации 109—110
гидрирования 198—199
— таблица 199
реакций, расчет 92 и сл,
сгорания из энергий связи 92 и сл.
Термодинамический контроль реакции
209
1,1,2,2-Тетрабромэтан 243
Тетрагидрофуран 443, 447
Тетраметилен гликоль 440
Тетраметилене ил ан как стандарт в
ЯМР-спектр ос коп и и 61
Тетраметилэтилен, теплота гидриро-
вания 199
Тетр афен и лэта ндио л -1,2 (бензпинакон),
перегруппировка 463
Тетрафторметан 352
Тетрафторэтилен
полимеризация 366
получение 366
реакции 296
Тетрахлбрметан (четыреххлористый
углерод) 112, 361
Тетрахлорэтилен 52, 53
Тетраэтилсвинец 396
Тефлон (политетрафторэтилен) 366
Тиоацетали, восстановление 497 и сл.
Тиокетали, восстановление 498
Треоза, проекционные формулы 615,
616, 628
-Треонин 628
Триаконтан 81, 86
Триалкилборы 217
I р и-трет-б ути л ка рби но л 395
Триизобутил алюминий 379
Триизопропилкарбинол 395
Трикарбонильные сое ди не ни я 530—531
Триметил алюминий 374
димер 374
Три метилами и-трет -бу ти лбор а н 245
2,4,6-Триметилбензоат 569
Триметиленметил
атомно-орбитальная модель 278,279
схема спаривания электронов 278,
2,2,4-Три мети л пентан 225, 228
ИК-снектр 89
ЯМР-спектр 90
Триметилуксусная кислота 541, 543
Триметидэтилен, теплота гидрирова-
ния 199
2,4,6- Трвнитробензойная кислота, де-
карбоксилирование 560
1,3,о-Тринитробензол 560
2,3,4-Триоксибутаналь, диастереомеры
615
Триоксиметилен 487
Три-w-пропилбор 218
Т рифе инлка р би нол 415
Т р и фтор а цети лх л ор и Д 365
Трифторуксусная кислота 365
Трифгорхлорэтилен 366
Трнхлорацетальдсгид (хлораль) 475
Трихлорметан (хлороформ) 112, 361,
362
Трихлор уксусная кислота 545, 552
декарбоксилирование 560
Трихлорэтилен 361
Трицикло-13,3,1,13’7]-декан (адамантан)
141
Триэтилалюминий 396
Триэтилбор 217
Углеводороды, определение 80
Углерод
методы определения 32 и сл.
связи с другими элементами 16
и сл.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
831
четырехвалентность 19—21
Угловое напряжение 122
Углы между связями 23исл., 168—170
Удельное вращение 607
Уксусная кислота 20, 21, 22
дегидратация 523
ИК-спектр 546, 047
реакции с бромом и фосфором 562
— со спиртами 424, 426, 568
синтезы 560, 565
УФ-поглощение 546, 549
физические свойства 545
фторирование электролитическое
365
энергия стабилизации 271
этерификация 556
н-Ундекан 86
УФ-спектр
мети л винил кетона 276
мётилэтилкетона 276
УФ-сиектрокопия см. Электронные
спектры
Уф-спектры
алкенов 178
алкинов 240
алленов 302
а.р-иенасыщенных альдегидов 519
— кетонов 519
и резонанс 274 и сл.
Фенантрен, энергия стабилизации 271
Фен и л а деталь де гид 459
Фени л ацетил ей
ИК-спектр 239, 240
ЯМР-спектр 240, 241
ФенилацетилхлорнД, восстановление
459
Фенилацетоцитрил, гидролиз 541
З-Фенилбутанон-2 463
Фенил-трега-бутнлкетон 464
фекилгалстеивды 353
Фенилмагнийбромид, реакции 391, 415
Фенилмагпийгалогениды 380
З-Феннлпропандиол-1,2, окислитель-
ное расщепление 458
1-Фецилпропаяол-2 415
а-Фенилпропионитрил 400
2-Фенилпропионитрил 463
Фе ни лтр и фенил мети л кетон 464
Фенилуксусная кислота 545
серебряная соль, декарбокенли-
роваиие 562
синтез 541
ЯМР-спектр 548
а-Фе ни лота дол 428
а-Фе: [И л этиловый спирт 416
Фенол, энергия стабилизации 270
Ферменты 640
Формальдегид 20, 22, 471
гидратация 470
конденсация с ацетальдегидом 512
и сл.
— с ацетоном 511 и сл.
полимеризация 486—437
реакция с аммиаком 480
— Канниццаро 500
— с магни Йорга гщ вескими соеди-
нениями 383, 414
синтез 439
Формиат натрия, реакция со щелочью
593
Формил хлорид 558
Формулы
молекулярные 32 и сл.
структурные 21
— методы определения 32—35
— упрощенные 21
Фронтальная атака 324
Фталгидразид 599
Фталевая кислота 594, 596
Фталевый ангидрид
реакции 570, 597
синтез 596
Фталимид 597
Фталоил хлорид 570
Фтор ацетат натрия 367
Фторуглероды 364—367
2-Фторзтанол 367
Фумаровая кислота 188, 594
Функциональная группа 284
Фуриловый спирт 543
Хелаты 529
Хинин как оптически активное основа-
ние 635, 636
Хлоральгидрат 440
Хлор ангидриды алифатических карбо-
новых кислот, реакции 538, 570, 571
Хлорацетон 503
8-Хлорбицикло-[3,2,1]-октан 141
2-Хлорбутадиен-1,3 (хлоропрен) 298,
3-Хлор-«-валериановая кислота 545
Хлористый
аллил 353, 356, 442
винил 352
изопропил 208
Кротил 357, 420
метил (хлорметан) 112, 323
этил, реакция со щелочью 339
Хлормасляная кислота 545
1-Хлор-2-метилбутан 112
1 - X лор-3-мети лбу тан (изоамил хлорид)
2-Хлор-2-метилбутан (трет -амил х л о-
рнд) 112
832
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
З-Хлор-2-мётилбутан 112
З-Хлорпропии-1 (процаргнлхлорид) 356
а- й ji-Хлор пр они о новые кислоты 563
Хлоруксусная кислота 545,: 552
гс-Хлорфепил.титан 378
Хлор цйктагекса пол 2в1
Холестерилдибромиды, реакция от-
щепления 348, 349:
Хроматография 28
анализ 28 и сл,
гаэо-жидкостная 29~31
жидкость— твердое вещество 29,
30
Хунсдаккера реакция 351, 549, 561
Целлозольвы 443
Цепная реакция 108
Церееитинов, метод определения числа:
подвижных водородов 382
Циангидрины 476—478, 519 , 520
а-Циапкислоты 564
Цйавуксусная кислота 545
декарбоксилирование 560
Циануксусный эфир в синтезах539, 591
Циклоалканы 118—-144
ц ис~ транс-изомер и я 137—140
ЙК-спеетры 119, 120
инверсия цикла 128
конформации 121—131
напряжение в циклах 132—135
номенклатура 118 к сл.
реакционная способность 134—136
синтез 198, 255, 256, 363
теплоты сгорания 132, 133 и сл.
УФ-поглощепие 121
физические свойства 119, 121
ЯМР-спектры 121, 122
Циклоалкенил га логе ниды 492
Циклоалкены
гидроксилирование-221 и сл,
синтез 289—294 , 296
транс, оптически активные 622 и
сл.
химические сдвиги в ЯМР-спектрах
62.
Ци к лоа л кил галогениды 202, 296, 360—
361, 366
Циклоалкииы 492
Циклоаллены 492
Циклобутан 121, 132, 184
конформация 130—131
реакционная способность 134, 136
синтез 38i, 497
Циклобутанол 416, 494
Циклобутанон 471
восстановление 416, 493 и сл.
реакция с гидразином 497
Циклобутен, резонансные формы: 261
и сл.
Цйклобутилбромид, реакция с магни-
ем 381
Циклогексан 101, 102, 118, 121, 132
инверсия цикла 128
конформации 121—129
конформация ванны 123, 124, 125
---------искаженной 125
— заслоненная 122
—г заторможенная 124
— кресла 123, 124
напряжение в .цикле 132
реакционная способность 135, 136
синтезы 102, 256
цпс-Циклогексан-1,2-Дикарб6новая ки-
слота 614
цкс-Циклогександиол-1,2 417
Циклогекса нкарбоксальдёгид 460
Циклогексан! карбо новая Кислота, хло-
рапгидрид, восстановление 460
Циклогексанон 471, 503, 517, 595
«Цикл огексатриен-1,3,5» 254, 255, 268:
локализация электронов 254
теплота гидрипования 256
— сгорания 256
Циклогексен
ИК-спектр 52, 53
окисление 458
реакции 202, 354
синтез 337
спектр комбииаииониого рассея-
ния 52, 53
теплота гидрирования 256
N - (Ци и логекс е п -1 -и л) пи рр оли ди и 517,
591
Циклогексил кар би но л 414
Циклогексилмагнийхлорид, реакция с
формальдегидом 414
Циклогсксилмотилкарбииол 417
3- Цй к л оге кс и л мети л кето н, гидриро-
вание 416
Циклогексил хлорид 337, 348.
Циклогептан 121, 132
Цикло'гептёц 338
Ц-(Циклогептён-:1-ил)пирролидин 518
ЦиклоДСкан 132:
конформация 133, 134
напряжение в цикле 132
Циклонит (гексоген) 481
Циклононан 121, 132
Циклооктан 121, 132
ИК-спектр 119, 120
ЯМР-спектр 121, 122
Ци к л о окт атетр аен
атомно-орбитальная модель 272
конфигурация 272
энергия стабилизации 269, 271
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
833
мранс-Циклооктен, оптические изо-
меры 622
Циклопентадеиам 132
ЦЙклрпентадиен-1,3
кислотность 266
реакции 296, 379
Цн кл опента дие ни л-а ин он, резонанс-
ные структуры 266—267
Циклбпентан 121, 132
конформация 129—130
реакционная способность 135, 136
дьс-Цнкл one итак-1,3-дикарбоноеая; ки-
слота 543
Циклопентан диол - Г,2
транс 221
цис 222, 412
Циклопентанов
реакция с PCI5 492
окисление 593
синтез 464, 595
Циклоприсоединение
1,2 295—297
1,4 289—295
Циклопропан 23, 121, 132, 169
атомно-орбатальная модель 165—
166
конформация 131
напряжение в цикле 134
реакционная способность 134, 136
синтез 386
Цнклопропанкарбоксальдегид 466
Цнклопропанкарбоиитрвл, восстанов-
ление 385
Циклопроианкарбоновая кислота
восстановление 416
синтезы 598, 541, 543
Циклопропнлбромид, реакция с лити-
ем 541
Ци клоп р он и-т га логе виды 361
Циклопропилкарбинилхлорид 361
Циклопропилкарбинол 416
Ци клоп ропилмети л кетон 508, 543
Цин кор га ни чес кие соединения 395 и сл.
а л кил производные 396
синтез 376
Циркулярнополяризованный свет 605
и сл.
Четырех фтор истый углерод 17
Четырех хлор исты и углерод, фториро-
вание 361
Шкала электроотрицательности 212,
373
Щавелевая кислота 593, 596
декарбоксилирование 596
Эйкозан 81, 86
Экваториальные водороды 127
Экзотермическая реакция 93
Электронная конфигурация атома азота
167
Электронное строение органических мо-
лекул в терминах структур Льюиса
147
Электронные конфигурации основного
состояния ряда атомов 152
Электронные Переходы 54—58
ч-ул* 54, О 7
д-нт* 54, 57
л->-л* 56
о-чт* 57
Электронные спектры 41, 54—58
Электроотрицательность 212 и сл.
шкала Полинга 212
Электрофильного замещения реакции
397—402
механизм 397 н с л.
стереохимия 398 и сл.
Электрофильные реагенты 194, 203
Энантиомеры
разделение 609, 63&—638
проекционные формулы Фишера
610 и сл.
Эндотермическая реакция 93
Энергия
возбуждения атома 167
диссоциации связей 97, 106
разрыва связей 105 и"сл.
резонанса 256, 268—272, 275
связей 94
стабилизации 256, 268 и сл.
— таблица 270, 271
Энтропийные эффекты 101—102
Эритроза 615, 616
Этан 17, 19, 86, 92
вращательные конформации 24, 25,
26
пространственные модели 27
теплота сгорания 242
Этанол 409
автоконденсация: 431
атом но-орбитальная ,модель 161
дегидратация 430
дегидрирование 435
ИК-спектр 410; 411, 546, 547
константа кислотной диссоциации
419, 420
пространственные модели 27
реакции 422, 427, 452, 555, 568, 573
синтезы 200, 419
ЯМР-спектр 59, 61, 413, 421, 422
Этйлацетат 35&, 568, 573, 574
автокоцденсация 581
л-Этилбензилацетат 569
Н-Этилбевзилхлорид 569
834
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Этилбензоат
реакция с ацетоуксусным эфи-
ром 583
— с фенилматнийбромидом 415
Этилбензоилацетат 583
Этил-т/зецг-бутиловый эфир 444
Этилбутират 583
2-Этилгексановая кислота 542
2-Этил гекс а нол, окисление 542
Этиддиалкилалюмикий 397
Этилен 20, 21, 24, 175, 350
атом но-орбиталь на я модель 160—
163
бромирование 194, 203
гидратация 419, 470
гидрирование 195—196
гидроборирование 217
конформации 13]
полимеризация 223, 224 и сл.,
397
Цис- и транс-присоединение 201,
202
пространственные модели 27
реакции 289, 397
реакционная способность 135, 136
синтез 339
скрученная неплоская конфигура-
ция 163
строение 182
теплота сгорания 242
углы связей 182
УФ-поглощение 275
шдростержневая модель 182, 183
энергия напряжения 134
Этиленгликоль 440, 447, 451
ЭтиЛенхлоргидрин 447
Этилмагнийгалогениды 376, 380
Этилмеркурхлорид 396
Этилиитроацетат 578
Этилоксалат 583
Этил прониопат 555
Этил фенилацетат 583
Этилфор ми л фенил ацетат 583
Этн л ₽ -х лор нр они о наг, конденсация
с ацетоуксусным эфиром 542
Этилциананетат 578
Этилииннамат, конденсация с малоно-
вым эфиром 590
Этинилгалогениды 353
Эфиры алифатических ди кар боновых
кислот
в конденсации Кляйзена 599
— Дикмана 599 и сл.
синтез 316, 317, 38g, 424, 523,
555-557, 573, 574
— таблица 568—569
Эффект
диамагнитного экранирования 61
Коттона 633
(—)-Яблочная кислота 636
ЯМР-спектр
йллилмагннйбромнда 404
ацетилацетона 527
ацетоуксусного эфира 579, 580
бензилового спирта 548
дейтеровинилацетилена 70, 71
диацетолового спирта 63
диметил ацеталя 67
1,2-дифтортетрахлорэтана 74
1,1-дифтор-1,2,2-трибром-2-фенилэ-
тана 624
йодистого этила 64
1 -метил ‘1 -фениэтил ена 178
мет илци кл отеке анода 121, 122
«-октана 9’0
2,2,2-трпметнлпентана 90
фенилацетилеца 240, 241
фенилуксусной кислоты 548
циклооктаиа 121, 122
Этанола 59, 421 и сл.
ЯМР-спектрометр 58, 59
ЯМР-спектр ос копия 41, 58—75
для качественного анализа 6S—70
применение 59 и сл.
и процессы, протекающие во вре-
мени 73—75
спНн-спиновое расщепление 64—67
сравнение с Другими видами спект-
росконии 60—61
стандарты 61
химические сдвиги 61—63
ЯМР-спектры
алкенов 179—181
алкинов 240, 241
алленов 302 и сл.
альдегидов 471 и сл.
карбоновых кислот 548
кетонов 471 и сл., 519, 520
а ,Д-ненасыщенных альдегидов
519, 520
расшифровка 64 и сл.
спиртов 412 и сл., 419 и сл.
Янтарная кислота 593
превращение а ангидрид 595, 596
Янтарный ангидрид 595, 596
Содержание
От редакции.......................................................... 5
Предисловие редактора первого русского издания ...................... 6
Предисловие авторов к первому русскому изданию ...................... 8
Предисловий авторов к американскому изданию......................... 10
Глава 1
Структура, идентификация и номенклатура...... 15
1-1. Образование связей в соединениях углерода............... 16
1-2. Структурная органическая химия...................... . - 19
1-3. Углы между связями и шаростержневые модели.............. 23
1-4. Вращательные конформации................................ 24
1-5. Пространственные модели ................................ 27
1-6. Идентификация и установление структуры.................. 27
А. Физические свойства и хроматография................. 28
В. Идентификация....................................... 31
В. Определение структурной формулы..................... 32
1-7. Номенклатура органических соединений.................... 36
Глава 2
Спектроскопия органических молекул . ................. . 40
2-1. Линейчатые спектры ........................................ 42
2-2. Микроволновая спектроскопия................................ 42
2-3. Инфракрасная спектроскопия................................. 43
2-4. Спектры комбинационного рассеяния (рамановская спектроскопия) 50
2-5. Электронные спектры органических молекул................... 54
2-6. Спектроскопия ядерного магнитного резонанса................ 58
А. Сравнение ЯМР с другими видами спектроскопии........ . 60
Б. Химический сдвиг.............-........................ 61
В. Спнн-спиновое расщепление ............................ 64
Г. Использование спектроскопии ядерного магнитного резонанса
для качественного анализа . ............................. 68
Д, Усложненные случаи спин-спинового расщепления.......... 70
Е. Я дар иый магнитный резонанс и процессы, протекающие во вре-
мени .................................................... 73
2-7. Масс-спектрометрия.......................................... 75
Библиография.................................... , , . . 78
Глава 3
Алканы ........................................................... 70
3-1. Номенклатура.......................................... > • . Н(1
3-2. Физические свойства алканов, понятие ГОМОЛОЛп)............
3-3. Спектральные свойства алканов......................... t i
836
СОДЕРЖАНИЕ
Химические реакции алканов .......................... .
3-4. Горение алканов . ................................... 91
3-5. Определение теплот сгорания. Энергии связей ......... 92
3-6. Дальнейшие замечания относительно энергий связей ...... 96
3-7. Галогенирование алканов и общие проблемы органического синте-
за . . .................................... ................ 98
А. Константы равновесий ............................. 99
Б. Энтропийные эффекты............................... 101
В. Скорости реакций.................................. 102
Г. Теплота активации . ............................... 109
3-8. Практика проведения галогенирования.................... 111
3-9. Нитрование алканов...................................•; 114
Глава 4
Циклоалканы...........................................
4-1. Номенклатура .................................. .........
4-2. Физические свойства циклоалкапов........................ . .
4-3. Спектральные свойства циклоалканов.......................
4-4. Конформации циклралканов................................
А. Циклогексан . ............................... , . . .
Б. Циклопентан.........................................
В. Циклобутан....................................
Г. Циклопропан.................................... ...
Д. Этилен......; .
4-5. Напряжение в циклоалканах . .............................
А; Теория Байера .........................................
Б. Теплоты сгорания циклоалканов.......................
В. Напряжение в малых циклах ..........................
4-6. Химические свойства......................................
4-7. цис — трЦнс-Иаомерия замещенных циклоалкапов ..... . . . .
4-8. Полициклоалканы . .............................., . . ,
4-9. Конформацйи декалина.................................. . ,
117
118
119
119
121
121
129
130
131
.131
132
132
1.33
134
134
137
140
142
Глава 5
Образование связей в органических молекулах Атомно-
орбитальныё модели ................................ . 146
5-1. Водородоподобные атомные орбитали ........................ 147
5-2. Использование атомных орбиталей при образовании связей ... 15!
5-3. Направленные ковалентные связи ................... . ; . 154
5-4. Гибридные орбитали связей................................ 158
5-5. Атом но-орбитальные модели органических соединении ..... 161
А. Насыщенные соединения......................... . 161
Б. Соединения е двойными связями . . -.................. 161
В. Соединения с тройными связями . . .... .... .... . ., 164
Г. Циклопропан...................................... . 165
5-6. Орбитали связей для атомов, имеющих Цеподелепные пары элект-
ронов ..... . . , . . . . . . ................................. ,167
5-7. Межэлектронное отталкивание и углы связей. , . . .. . , , . , 168
Глава б
Алкены. Структура, спектры и стереоизомерия . . . 171
6-1. Номенклатура ......................................... . 172
6-2. Физические свойства алкенов . . 174^
6-3. Спектральные свойства алкенов . . . . ". ; . ............ , . . 175
А, Инфракрасные спектры ................................ 175
Б. Ультрафиолетовые спектры поглощения алкенов □ » . , . , 178
СОДЕРЖАНИЕ 837
В. Спектры ядерного магнитного резонанса алкенов....... 179
6-4. Строение этилена.......................................... 182
ё<5. цис — транс-Изомерия ................................... 183
6-6. Установление конфигурации цис- и транс- изомеров.............. 186
6-7. Определение дипольных моментов................................ 188
Глава 7
Алкены. Реакции двойных угле род-угле родных связей юз
7-1- Присоединение к алкенам. Электрофильные и нуклеофильные реа-
генты........................................................ 194
7-2. Гидрирование алкенов. Гетерогенный катализ.................... 195
7-3. Теплоты гидрирования ......................................... 198
7-4. Электрофильное присоединение к алкенам........................ 200
А. Стадийный полярный механизм.......................... 201
Б. Почему именно транс-присоедипёние?.................... 204
В. Комплексы электрофильных агентов с двойными связями . . 206
Г. Анализ алкенов с помощью реакции присоединения брома . . 207
7-5. Направление присоединения к алкенам . ...................... 208
Л. Правило Марковникова . ................................... 208
Б. Теоретическое обоснование правила Марковникова............ 208
В. Присоединение других реагентов к несимметричным алкенам.
Шкала электроотрицательности............................. 211
Г. Присоединение к замещенным алкенам........................ 213
7-6. Присоединение несимметрично построенных реагентов, происходя-
щее против правила Марковникова ............................. 215
7-7'. Присоединение гидридов бора к алкенам........................ 217
7-8. Окисление алкенов................................... . . . . 219
А. Озонирование.............................................. 219
Б. Гидроксилирование......................................... 221
7-9. Полимеризаций алкенов ....................................... эа2
А. Анионная полимеризация................................... 223
Б. Катионная полимеризация................................... 223
В. Свободнорадикальная полимеризация........................ 225
Г. Координационная полимеризация............................. 226
7-10. Алкилирование алкенов........................................ 227
7-И. Синтезы органических соединений............................... 229
Глава 8
Алкины.................................................. 236
8-1. Номенклатура............................................. 237
8-2:. Физические свойства алкинов............................ . 238
8-3. Спектральные свойства алкинов........................... 239
8-4. Ацетилен .............................:. . . . . -. . . .... . 241
8-5. Реакции присоединения к алкинам ; . 243
8-6. Кислые свойства алкинов-1............ . . . . . ......... 246
Глава 9
Метод резонанса и некоторые его применения. Метод
молекулярных орбиталей .. .' . . . . . . . . 251
9-1. Связи, образованные двумя электронами ............. 252
9-2. Проблема бензола................................ 253
9-3. Атомно-орбитальная модель бензола . ............ 256
9-4. Схемы спаривания электронов (валентные схемы). Метод резонанса 257
9-5.. Дальнейшие замечания о методе резонанса ...... '. ... . 260
9-6. Правила применения метода резонанса .............. 260
838
СОДЕРЖАНИЕ
А. Бутадиен-1,3 и циклобутан........, . .................... 261
Б. Акролеин . ..................... . .......................... 263
В. Карбоксилат-анион........................................... 264
Г. Аллил-катиои.......................................... 265
Д. Циклопентадиенил-анион....................................... 266
9-7. Стабилизация и энергия резонанса ...................... . 268
9-8. Длины связей и степень двоесвязности ........................... 273
9-9. Резонанс и спектры поглощения................................... 274
9-10. Теория молекулярных орбиталей................................... 277
Глава 10
Бифункциональные соединения. Алкадиены.......................... 283
10-1. Классификация органических соединений с помощью функциональ-
ных групп 283
10-2. Алкадиены................ . ............................ 286
10-3. 1,3-Диены или сопряженные диены................................. 287
10-4. 1,4-ЦнклоприсоеДинение к диенам. Реакция Дильса — Альдера . 289
10-5. 1,2-Циклоприсоединение к диенам................................ 295
10-6. Полимеризация сопряженных диенов.................... . 297
10-7. 1,2-Диены, аллены.............................................. 301
А. Структура и стереоизомерия.................................. 301
Б. Спектральные свойства алленов............................... 302
В. Химия алленов.............................................. 303
Глава И
Реакции нуклеофильного замещения и отщепления. Ал-
кил-, циклоалкил-, алкенил- и алкинилгалогениды. ... 308
111. Органические производные неорганических соединений .. . , . . 308
11-2. Номенклатура спиртов и алкилгалогеиидов................... 308
11-3. Номенклатура простых эфиров.............................. 312
11-4. Номенклатура карбоновых кислот ... ...................... 313
11-5. Использование бу кв гр еческо го а лфа в ита дл я у каз ан и я п оложе н и я
заместителей.................................................... 313
11-6. Названия, состоящие из одного или нескольких слов . . . , , , , 314.
Реакции нуклеофильного замещения................................ 315
11-7. Общие положения...................................... , . 315
11-8. Термохимия реакций замещения...........................' . 319
11-9. Механизмы реакций замещения типа Sn......................, . . . 320
11-10. Стереохимия 5к2-эамещения...................................... 323
11-11. Стереохимия S^l-реакций......................................... 326
11-12. Влияние структурных факторов и природы растворителя при Sn-
реакцнях . . .................................................. 328
А. Структура алкильной группы.................................. 328
Б. Уходящая группа........................................... 331
В. Нуклеофильный агент......................................... 332
Г. Природа растворителя....................................... 334
Реакции отщепления............................................ 336
11-13. Реакции Е2.................................................... 339
11-14. Реакции Е1...................................................... 341
11-15. Стереохимия реакций отщепления.................................. 346
Алкил-, алкенил- и циклоалкилгалогениды......................... 351
И-16. Алкилталогениды................................................. 351
11-17. Алкен и л га логе ниды.......................................... 352
А. Вннилталогеннды............................................. 352
Б. Алл ил галогениды. ................. .... 353
В. Реакции Sn2'................................................ 359
СОДЕРЖАНИЕ 839
11-18. Циклоалкил галогениды . . ............................... 360
11-19. Пол и гал ore «производные................................ 36!
11-20. Фторированные алканы...................................... 304
А. Фтор хлор метаны.................................... 364
Б- Фторуглероды........................................... 364
В. Свойства фторуглеродов............................ . . . 309
Глава 12
Металлоорганические соединения .......... <, 371
12-1. Общие свойства металлоорганических соединении............. 372
12-2. Получение металлоорганических соединений.................. 376
А. Взаимодействие металлов с органическими галогенидами . . . 376
Б. Обмен галогена на металл............................... 377
В. Замещение металла на металл........................... 378
Г. Взаимодействие металлоорганических соединений с галогенида-
ми металлов . . ...................................... 378
Д. Металлоорганические соединения и углеводороды с подвижным
водородом................................................ 379
Е. Присоединение металла и водорода к алкенам........ . 379
12-3. Магвийорганичеекие соединения............................. 380
12-4. Реакции грнньяровских реактивов........................... 381
Л. Соединения с подвижным водородом....................... 381
Б. Кислород, сера И галогены.............................. 382
В. Присоединение к карбонильной группе.................... 383
Г. Присоединение к двойным углерод-углеродным связям . . , . 387
Д. Присоединение к тройным связям углерод — азот.......... 389
Е. Реакции замещения...................' , .............. 390
Ж- Побочные процессы при присоединении реактивов Гриньяра к
карбонильным соединениям............................... 391
12Д. Натрий- и лнтийорганические соединения...................... 394
12-6. Алкильные производные цинка. Реакция Реформатского .... 395
12-7. Применение металлоорганических соединений в промышленности 396
12-8. Реакции электрофильного замещения при атоме углерода .... .397
А. Стереохимия замещения Se2.............................. 398
Б. Стереохимия реакций, протекающих с образованием карбанио-
нов ..................................................... 399
Глава 13
Спирты и простые эфиры.................................... 405
13-1. Номенклатура карбонильных соединений...................... 406
13-2. Физические свойства спиртов. Водородная связь ............ 408
13-3. Спектральные свойства спиртов. Водородная связь........... 410
13-4. Получение спиртов......................................... 413
Химические реакции спиртов................................ 419
13-5. Реакции с участием связи О—Н спиртов . ,................. 419
А. Кислотные и основные свойства......................... 419
Б. Образование простых эфиров............................ 422
В. Образование сложных эфиров.......................... 423
13-6. Реакции с участием связи С—О спиртов ............. 426
А. Образование галогенидов . . .......................... 426
Б. Эфиры серной кислоты. Дегидратация спиртов . ,......... 430
13-7. Окисление спиртов......................................... 435
13-8. Многоатомные спирты....................................... 439
13-9. Ненасыщенные спирты................. ..................... 441
Простые эфиры ,......................................... 443
13-10. Типы простых эфиров и их реакции.......................... 443
840
СОДЕРЖАНИЕ
13-11. Циклические простые эфиры:.. . ........................................... 446
13-12. Оксираны . ............................................................. 447
А. Получение. ......................................................... 447
Б. Раскрытие кольца оксиранов........... .............. 450
Глаза 14
Альдегиды и кетоны. Реакции карбонильной группы . 457
14-1. Получение альдегидов й кетонов ............................................. 457
А. Окисление 1,2-диолов и алкенов ....................................... 457
Б. Восстановление карбоновых кислот до альдегидов.......... 465
В. Перегруппировки 1,2-гликолей......................................... 4Й6
Г. Перегруппировки гидроперекисей........................................ 468
14-2. Карбонильные группы альдегидов и кетонов . . .:............................. 469
А. Сравнение с двойными связями углерод — углерод., .... 469
Б. Спектральные свойства . . . ........................................... 470
В. Дальнейшее рассмотрение реакционной способности ..... 474
14-3. Некоторые типичные реакции присоединения к карбонильной груп-
пе .. . ................................... - . ... . . . . 476
А. Образование циангидринов ..... . . . . . . . . . 476
Б. Присоединение бисульфита к карбонильным соединениям . . . 479
В. Присоединение аммиака к альдегидам А . . . . 480
Г. Образование полуацеталей и ацеталей . ................................ 481
Д. Полимеризация альдегидов.............................................. 486
14-4. Кон деяса дня ка р бо пильных сое дине ни й с соеди не ни ями th па R N Н г 488
14-5, Присоединение гало генов одр родов изамещение на галоген. ... 491
14-6. Восстановление карбонильных соединений .... . . . . . . . . 493
А. Образование спиртов .................................. 493
Б. Восстановление карбонильных соединений до углеводородов . 496
14-7. Окисление карбонильных соединений .......... .... 498
14-8. Реакции Канниццаро......................................................... 500
Глава 15
Альдегиды и кетоны. Реакции с участием замещающих
групп. Ненасыщенные и поликарбмильные соединения 503
15-1. Галогенирование альдегидов и: кетонов.............. 503
А, Енолизаипя, катализируемая основанием .......... 505
Б. Ёнолизация, катализируемая кислотой . . ....... 506
В . Галоформная реакция ........................... 507
15-2. Реакции енолят-анионов............................. 509
А. Альдольное присоединение ..... . , . . . . ....... 509
Б. Нуклеофильное замещение с участием енол я т-анио нов ... . . 514
15-3. Енамины .................... > ...... : 516
Ненасыщенные карбонильные соединения ...... . . .: . , . . 518
15-4. а, 0-Не насыщенные альдегиды и кетоны .. ; 519
15г5. Кетены ...... . > . . . . . .......... . . . . . ; 522
Поликарбонильные соединения . о ... . . :. ..... 525
15-6. 4,2-Дмкарбонильные соединения . . . ............ 525
15-7. 1,3-Дцкарбонильные соединения *.................... 527
15-8. 1,4-Дикарбоцйльные соединения . ... . . . . ... . •; ... . , 530
15-9. Трикарбонильнйе соединения . ................. 530
Глава 16
Карбоновые кислоты и их производные . . . .... . . 536
Физические свойства .карбоновых кислот .... . ....... . 544
16-1. Водородная связь ..... ... . . .... . . г . . ;. 544
16-2. Спектры карбоновых кислот. . . . , . . , . . . . , . 546
СОДЕРЖАНИЕ
841
Химические свойства карбоновых кислот........................... 549
16-3. Диссоциация карбоновых кислот.................................... 550
А. Резонансный эффект.......................................... 550
Б. Индуктивный эффект.......................................... 551
16-4. Реакции с участием карбонильного углерода карбоновых кислот 554
А. Образование сложных эфиров................................... 555
Б. Образование ацилхлорндов.................................... 558
В. Восстановление карбоновых кислот............................ 558
16-5. Декарбоксилирование карбоновых кисло!'.......................... 559
16-6. Реакции а-углеррднЫх атомов карбоновых кислот................... 562
А. Реакция Гелля Фольгарда — Зелинского......................... 562
Б. Реакции замещения а-галогевкислот............................ 563
Функциональные производные карбоновых кислот.................... 565
16-7. Реакции с участием углеродного атома карбонильной группы . . . 567
А. Реакции замещения производных кислот........................ 567
Б. Реакции с металлоорганическими соединениями.................. 576
В. Восстановление производных кислот .......................... 576
16-8. Реакции производных карбоновых кислот по а-углеродному
атому. ............................................ . . . . - . 577
А. Кислотные свойства сложных эфиров, содержащих «-водо-
родные атомы.......................................... 577
Б. Конденсаций Кляйзена........................................ 580
В. Алкилирование ацетоуксусного и малонового эфиров ..... 584
Г. Ацилирование ацетоуксусного и малонового эфиров ..... 586
Реакции, ненасыщенных карбоновых кислот и их производных . . . 587
16-9. Миграция двойной связи.......................................... 587
16-10. Реакции присоединения по двойной связи.......................... 587
А. Гидратация и присоединение бромистого водорода.............. 587
Б. Образование лактонов ....................................... 589
В. Присоединение нуклеофильных агентов к сопряженным систе-
мам. Конденсация Михаэля............................. 590
Иикарбонмые кислоты........................................... 592
16-11. Кислотные свойства дика рбонозых кислот........................ 595
16-12. Поведение дикарбоновых кислот при нагревании ...... i . . 595
16-13. Производные дакарбововых кислот................................ 596
А. Циклические имиды......................................... 596
Б. Конденсация Дикмана .................... 599
Глава 17
Оптическая изомерия............................................ боз
17-1. Плоскополяризовавный свет и причины оптического вращения . . 604
17-2. Удельное вращение............................................. 607
17-3. Оптически активные соединения с асимметрическими углеродными
атомами.............................................. 608
А. Соединения с одним асимметрическим атомом углерода . : . . 608
Б. Проекционные формулы....................... ...... . . 610
В. Соединения с двумя асимметрическими атомами углерода . ;• . 612
17-4. Оптически активные соединения, не содержащие асимметрических
атомов углерода .... . .................................. .... 617
А. Аллейн и спираны.......................................... 647
Б. Оптически активные бифенилы............................... 619
В. Оптически активные циклоалкены . ......................... 622
Г. Затрудненное вращение и молекулярная асимметрия в замещен-
ных этанах ......................................... . 623
17-5. Абсолютные и относительные конфигурации ........... 624
17-6. Дисперсия оптического вращения ................ G32
17-7. Разделение энантиомеров . . , ................................ 635
17-8. Асимметрический синтез й асимметрическая индукция ...... 636
842
СОДЕРЖАНИЕ
17-9. Рацемизация ...... . .................................... . , 642
Ответы к упражнениям .....................................648
Глава 1. Структура, идентификация и номенклатура........ 648
Глава 2. Спектроскопия органических молекул ............ 654
Глава 3. Алканы....................................... 656
Глава 4. Циклоалканы.................................... 660
Глава 5. Образование связей в органических молекулах. Атом-
но-орбитальные модели..................................... 666
Глава 6. Алкены. Структура, спектры и стереоизомерия ..... 672
Глава 7. Алкены. Реакции двойных углерод-углеродных связей 677
Глава 8. Алкины........................................... 686
Глава 9. Метод резонанса и некоторые его применения. Метод
молекулярных орбиталей................................ . 688
Глава 10. Бифункциональные соединения. Алкадиены ...... 695
Глава 11. Реакции нуклеофильного замещения и отщепления.
Алкил-, циклоалкил-, алкенил- и ал кинил галогениды 704
Глава 12. Металлоорганические соединения................. 722
Глава 13. Спирты и простые эфиры........"................ 733
Глава 14. Альдегиды и кетоны. Реакции карбонильной группы 747
Глава 15. Альдегиды и кетоны. Реакции с участием замещающих
групп. Ненасыщеннные и поликарбонильные соедине-
ния .... ............................................. . 761
Глава 16. Карбоновые кислоты и их производные ........ 778
Глава 17. Оптическая изомерия . .......................... 798
Предметный указатель............................................ 815
УВАЖАЕМЫЙ ЧИТАТЕЛЬ!
Ваши замечания о содержании книги, ее оформлении,
качестве перевода и другие просим присылать по
адресу; 129820, Москва, И-110, ГСП, 1-й Рижский
пер., д, 2,