Автор: Рагимов А.А.
Теги: лекарственные средства в соответствии с их происхождением биологические науки в целом общая терапия медицина
ISBN: 978-5-9704-2310-3
Год: 2012
Текст
НАЦИОНАЛЬНОЕ РУКОВОДСТВО
АССОЦИАЦИЯ
МЕДИЦИНСКИХ
ОБЩЕСТВ
ПО КАЧЕСТВУ
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТАР-Медиа»
АССОЦИАЦИЯ
МЕДИЦИНСКИ
«■■Г ОБЩЕСТВ
Ш ПО КАЧЕСТВУ
ТРАНСФУЗИОЛОГИЯ
НАЦИОНАЛЬНОЕ РУКОВОДСТВО
Главный редактор
проф. А.А. Рагимов
Подготовлено под эгидой
Ассоциации медицинских обществ по качеству
Москва
ИЗДАТЕЛЬСКАЯ ГРУППА
«ГЭОТ АР-Медиа»
2012
УДК 615.38(083) (470+571)
ББК 53.535.2я82(2Рос)
Т65
Национальное руководство рекомендовано Ассоциацией
медицинских обществ по качеству
Т65 Трансфузиология: национальное руководство / под ред. проф. А.А. Рагимова. — М.:
ГЭОТАР-Медиа, 2012. - 1184 с.
ISBN 978-5-9704-2310-3
Национальные руководства — первая в России серия практических руководств по
основным медицинским специальностям, включающих всю основную информацию,
необходимую врачу для непрерывного последипломного образования. В отличие от
большинства других руководств, в национальных руководствах равное внимание уделено
профилактике, диагностике, фармакотерапии и немедикаментозным методам лечения.
Национальное руководство «Трансфузиология» содержит современную и актуальную
информацию об особенностях деятельности Службы крови с учетом применяемых в
настоящее время современных методик заготовки, обследования и переработки донор¬
ской крови, а также методик переработки и производства препаратов донорской крови.
Отдельные разделы посвящены показаниям к клиническому применению трансфузиоло-
гического пособия при различных нозологиях, рассмотрены вопросы обеспечения имму¬
нологической безопасности гемотрансфузий.
Дополнение к руководству на компакт-диске включает приложения, медицинские
калькуляторы, нормативно-правовые документы, фармакологический справочник.
В подготовке настоящего издания в качестве авторов и рецензентов принимали уча¬
стие ведущие специалисты-трансфузиологи. Все рекомендации прошли этап независимо¬
го рецензирования.
Руководство предназначено специалистам Службы крови, клиническим трансфузио-
логам, врачам смежных специальностей, деятельность которых связана с применением
методов трансфузиологической гемокоррекции, студентам старших курсов медицинских
высших учебных заведений, интернам, ординаторам, аспирантам.
УДК 615.38(083) (470+571)
ББК 53,535.2я82(2Рос)
Авторы, редакторы и издатели руководства предприняли максимум усилий, чтобы
обеспечить точность представленной информации, в том числе дозировок лекарствен¬
ных средств. Учитывая постоянные изменения, происходящие в медицинской науке, мы
рекомендуем уточнять дозы лекарственных средств по соответствующим инструкциям.
Пациенты не могут использовать эту информацию для диагностики и самолечения.
Права на данное издание принадлежат ООО Издательская группа «ГЭОТАР-Медиа».
Воспроизведение и распространение в каком бы то ни было виде части или целого издания не
могут быть осуществлены без письменного разрешения ООО Издательская группа «ГЭОТАР-
Медиа».
© Коллектив авторов, 2012
© ООО Издательская группа «ГЭОТАР-Медиа»,
2012
© ООО Издательская группа «ГЭОТАР-Медиа»,
ISBN 978-5-9704-2310-3 оформление, 2012
ОГЛАВЛЕНИЕ
Предисловие 5
Участники издания 6
Методология создания и программа обеспечения качества 8
Список сокращений и условных обозначений 11
Введение 16
РАЗДЕЛ I. ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Глава 1. Основные периоды и этапы истории трансфузионной медицины.
А.А. Рагимов 23
Глава 2. Профессиональное образование врача-трансфузиолога.
АЛ. Рагимов 64
Глава 3. Основные направления трансфузиологии. АЛ. Рагимов 72
Глава 4. Сосудистые доступы для трансфузиологических процедур.
ИЗ. Вайрамалибейли, АЛ. Рагимов 79
Глава 5. Клеточные основы трансфузиологии. В.М. Погорелое,
Г.И. Козинец 114
РАЗДЕЛ II. СЛУЖБА КРОВИ
Глава 6. Служба крови - структура, деятельность и современное состояние.
ЭЛ. Салимов, ИЗ. Вайрамалибейли, Н.Г. Дашкова, Ю.С. Суханов,
Н.И. Афонин, В.В. Лаптев, АЛ. Рагимов 149
Глава 7. Организация работы учреждений Службы крови. ЭЛ. Салимов,
ИЗ. Вайрамалибейли, Н.Г. Дашкова, Ю.С. Суханов, А.В. Точёное,
Н.И. Афонин, В.В. Лаптев, А.А. Рагимов 166
Глава 8. Служба крови в очагах, эндемичных по наследственным аномалиям
крови. ИЗ. Вайрамалибейли, ЭЛ. Салимов, Н.Г. Дашкова, АЛ. Рагимов 269
Глава 9. Основные полимерные изделия для нужд Службы крови.
ЭЛ. Салимов, В.В. Лаптев, А.А. Рагимов 279
Глава 10. Методы карантинизации и инактивации патогенов в компонентах
крови. А.И. Костин, А.Ю. Буланов, ЭЛ. Салимов, А.Н. Хрусталев,
АЛ. Рагимов 286
Глава 11. Получение гемопоэтических стволовых клеток периферической
крови. ОА. Майорова, СЛ. Румянцев 307
Глава 12. Гемобезопасность (haemovigilance). В.В. Богданова 320
Глава 13. Организация выполнения процедур трансфузиологической
гемокоррекции. Отделение трансфузиологии и его задачи
в многопрофильной клинике. А.А. Рагимов, В.В. Хватов 333
РАЗДЕЛ III. КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Глава 14. Трансфузиологические методы гемокоррекции. АЛ. Рагимов,
ИМ. Соловьева 343
Гхша 15. Основные средства трансфузионно-инфузионного пособия.
АА Рагимов, ГМ. Щербакова, АЛ. Еременко, ИЗ. Вайрамалибейли, А.В. Точеное 405
4 ОГЛАВЛЕНИЕ
Глава 16. Инфузионно-трансфузионная терапия при критических
состояниях. АЛ. Еременко 539
Глава 17. Кислотно-основное равновесие и водно-электролитный баланс.
И.И. Дементьева 582
Глава 18. Кровопотеря и принципы ее компенсации в экстренной хирургии.
В.Б. Хватов, А.А. Рагимов, В.В. Валетова, А.В. Точёное 593
Глава 19. Аутодонорство и аутогемотрансфузии. АЛ. Рагимов,
И.Э. Вайрамалибейли, ЛЛ. Алексеева, И.Н. Соловьева, В.Б. Хватов,
Е.Н. Кобзева, ИЛ. Крапивкин, Н.Н. Калинин, ТЛ. Федорова, МЛ. Чарная,
О.В. Рогачевский, ЮЛ. Морозов 617
Глава 20. Гемотрансфузии при анемиях. И.Э. Вайрамалибейли,
АЛ. Рагимов 724
Глава 21. Диссеминированное внутрисосудистое свертывание крови.
JI.A. Алексеева, А.А. Рагимов, А.В. Точёное 759
Глава 22. Посттрансфузионные реакции. Н.Г. Дашкова, АЛ. Рагимов,
ЛЛ. Алексеева 825
Глава 23. Парентеральное питание. Т.Н. Щербакова, АЛ. Рагимов,
Н.Н.Нигода 873
РАЗДЕЛ IV. ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Глава 24. Основные понятия и определения трансфузионной иммунологии.
Н.Г. Дашкова, А.А. Рагимов . 916
Глава 25. Иммунологическая безопасность гемотрансфузий. Н.Г. Дашкова,
АЛ. Рагимов, ЛЛ. Головкина 953
Глава 26. Гемолитическая болезнь новорожденных, обусловленная
аллоиммунизацией к эритроцитным антигенам. Н.Г. Дашкова,
A.А. Рагимов 1120
РАЗДЕЛ V. ПРОИЗВОДСТВЕННАЯ ТРАНСФУЗИОЛОГИЯ
Глава 27. Заготовка плазмы и производство препаратов крови.
B.М. Русанов, АЛ, Рагимов 1145
Предметный указатель 1177
СОДЕРЖАНИЕ КОМПАКТ-ДИСКА
Приложения
Клинические примеры
Перечень основных нормативно-правовых документов по Службе крови
(iсоставитель И.К. Никитин)
Стандарты медицинской помощи
Медицинские калькуляторы
Фармакологический справочник
Международная классификация болезней 10-го пересмотра
ПРЕДИСЛОВИЕ
В данном руководстве впервые охвачены все основные разделы трансфузион-
ной медицины: Служба крови, клиническая трансфузиология, трансфузионная
иммунология и производственная трансфузиология. Подробно изложены осо¬
бенности деятельности Службы крови с учетом применяемых в настоящее время
современных методик заготовки, обследования и переработки донорской крови,
описаны методики производства препаратов донорской крови. Представлены
показания к клиническому применению трансфузиологического пособия при раз¬
личных нозологиях. В разделе трансфузионной иммунологии рассматриваются
актуальные вопросы обеспечения иммунологической безопасности гемотранс-
фузий. Отдельный раздел издания, посвященный клинической трансфузиологии,
содержит варианты применения трансфузиологической гемокоррекции в терапии
и хирургии.
Работа над данным изданием проводилась при участии ведущих научных
сотрудников образовательных и исследовательских учреждений Москвы.
В связи с бурным развитием трансфузиологии, накоплением знаний и опыта,
внедрением новых медицинских технологий планируется регулярно переиздавать
национальное руководство по трансфузиологии.
Мы надеемся, что информация, изложенная в руководстве, будет способство¬
вать улучшению качества трансфузиологической помощи. Любые замечания
и предложения по совершенствованию данного руководства будут с благодарно¬
стью приняты авторами и учтены при переиздании книги.
Главный редактор
д-р мед. наук,
проф. А.А. Рагимов
УЧАСТНИКИ ИЗДАНИЯ
ГЛАВНЫЙ РЕДАКТОР
Рагимов Алигейдар Алекперович — д-р мед. наук, проф., заведую¬
щий кафедрой клинической трансфузиологии ФППО врачей Первого МГМУ
им. И.М, Сеченова, заведующий отделом трансфузиологии и лабораторных тех¬
нологий Российского научного центра хирургии им. академика Б.В. Петровского
РАМН
АВТОРСКИЙ КОЛЛЕКТИВ
Рагимов Алигейдар Алекперович - д-р мед. наук, проф., заведую¬
щий кафедрой клинической трансфузиологии ФППО врачей Первого МГМУ
им. И.М. Сеченова, заведующий отделом трансфузиологии и лабораторных тех¬
нологий Российского научного центра хирургии им. академика Б.В. Петровского
РАМН
Алексеева Лариса Александровна — канд. мед. наук, доцент кафедры клини¬
ческой трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова
Афонин Николай Иванович - д-р мед. наук, проф., главный научный сотруд¬
ник ФУ «Федеральный научно-исследовательский центр детской гематологии,
онкологии и иммунологии»
Вайрамалибейли Имнара Энверовна - д-р мед. наук, проф. кафедры клини¬
ческой трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова
Богданова Вера Васильевна — начальник Управления организации службы
крови Федерального медико-биологического агентства
Буланов Андрей Юльевич — канд. мед. наук, старший научный сотрудник
Гематологического научного центра РАМН
Валетова Валерия Вячеславовна — канд. мед. наук, старший научный
сотрудник отделения анестезиологии УЗМ НИИСП им Н.В. Склифосовского
Головкина Лариса Леонидовна - д-р мед. наук, заведующая лабораторией
иммуногематологии Гематологического научного центра РАМН
Дашкова Наталья Георгиевна — д-р мед. наук, проф. кафедры клинической
трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова
Дементьева Инна Иосифовна — д-р мед. наук, проф., заведующая лаборато¬
рией экспресс-диагностики Российского научного центра хирургии им. академика
Б.В. Петровского РАМН
Еременко Александр Анатольевич — д-р мед. наук, проф., заведующий отде¬
лением реанимации и интенсивной терапии Российского научного центра хирур¬
гии им. академика Б.В. Петровского РАМН
Калинин Николай Николаевич — д-р мед. наук, проф. кафедры клинической
трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова, руководитель
отделения экстракорпорального очищения крови Гематологического научного
центра РАМН
Кобзева Елена Николаевна — канд. мед. наук, заведующая отделением кли¬
нической, производственной трансфузиологии и гравитационной хирургии крови
УЗМ НИИСП им. Н.В. Склифосовского
Козинец Геннадий Иванович — д-р мед. наук, проф. кафедры клинической
трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова
Костин Александр Игоревич — канд. мед. наук, старший научный сотрудник
ФУ «Федеральный научно-исследовательский центр детской гематологии, онко¬
логии и иммунологии»
Крапивкин Игорь Алексеевич — канд. мед. наук, доцент кафедры клиниче¬
ской трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова
УЧАСТНИКИ ИЗДАНИЯ 1
Лаптев Владимир Валерьевич — канд. мед. наук, Медицинский центр
Управления делами Президента Российской Федерации, ФУ «Учебно-научный
медицинский центр»
Майорова Ольга Андреевна — д-р мед. наук, проф., заведующая кафедрой
поликлинической педиатрии Российского национального исследовательского
медицинского университета им. Н.И. Пирогова, главный врач Станции перелива¬
ния крови Департамента здравоохранения г. Москвы
Морозов Юрий Алексеевич — канд. мед. наук, старший научный сотрудник
лаборатории экспресс-диагностики РНЦХ им. академика Б.В. Петровского РАМН
Никода Владимир Владимирович — д-р мед. наук, главный научный сотруд¬
ник отделения общей реанимации РНЦХ им. академика Б.В. Петровского РАМН
Погорелов Валерий Михайлович — д-р мед. наук, проф., заведующий лабо¬
раторией гемоцитологии Гематологического научного центра РАМН
Рогачевский Олег Владимирович — д-р мед. наук, ведущий научный сотруд¬
ник отделения гравитационной хирургии крови ФУ «Научный центр акушерства,
гинекологии и перинатологии им. В.И. Кулакова» Росмедтехнологий
Румянцев Сергей Александрович — д-р мед. наук, проф., заведующий отде¬
лом Федерального научно-исследовательского центра детской гематологии, онко¬
логии и иммунологии
Русанов Валентин Михайлович — д-р мед. наук, проф., лауреат Государст¬
венной премии СССР, заместитель главного врача Станции переливания крови
Департамента здравоохранения г. Москвы
Салимов Эммин Львович — канд. мед. наук, сотрудник кафедры клинической
трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова
Соловьева Ирина Николаевна — канд. мед. наук, доцент кафедры клиниче¬
ской трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова
Суханов Юрий Семенович - д-р мед. наук, проф., заведующий лабораторией
кровезаменителей Государственного института кровезаменителей и лекарствен¬
ных препаратов
Точёное Александр Владимирович — д-р мед. наук, проф. кафедры клиниче¬
ской трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова
Федорова Татьяна Анатольевна — д-р мед. наук, проф., руководитель отде¬
ления гравитационной хирургии крови ФУ «Научный центр акушерства, гинеко¬
логии и перинатологии им. В.И. Кулакова» Росмедтехнологий
Хватов Валерий Борисович — д-р мед. наук, проф., заслуженный дея¬
тель науки РФ, руководитель отдела трансфузиологии, консервирования тканей
и искусственного питания УЗМ НИИСП им Н.В. Склифосовского
Хрусталев Александр Новомирович - руководитель направления Службы
крови ООО «Медицинская компания»
Чарная Марина Александровна — д-р биол. наук, главный научный сотруд¬
ник лаборатории экспресс-диагностики РНЦХ им. академика Б.В. Петровского
РАМН
Щербакова Галина Николаевна — канд. биол. наук, доцент кафедры клини¬
ческой трансфузиологии ФППО врачей Первого МГМУ им. И.М. Сеченова
МЕТОДОЛОГИЯ СОЗДАНИЯ
И ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВА
Национальные руководства — первая в России серия практических руководств
по медицинским специальностям, включающих в себя основную информацию,
необходимую врачу для практической деятельности и непрерывного медицинско¬
го образования. В отличие от большинства других руководств, в национальных
руководствах равное внимание уделено профилактике, диагностике, фармакоте¬
рапии и немедикаментозным методам лечения заболеваний.
Почему необходимы национальные руководства? Динамичное развитие меди¬
цинской науки, быстрое внедрение в клиническую практику новых высоко¬
технологичных методов диагностики и лечения требует от врача непрерывного
повышения профессионализма и обновления знаний на протяжении всей его про¬
фессиональной жизни. Данная задача решается системой последипломного обра¬
зования и периодической сертификацией специалистов лишь частично. Быстро
возрастающий объем научной медицинской информации предъявляет особые
требования к качеству используемых учебных и справочных руководств, особенно
с учетом внедрения в широкую клиническую практику достижений медицины,
основанной на доказательствах. Имеющиеся на сегодняшний день руководства
для врачей и фармакологические справочники не в полной мере отвечают совре¬
менным потребностям врачебной аудитории.
Ниже приведено описание требований и мероприятий по их по обеспече¬
нию, которые были использованы при подготовке национального руководства
по трансфузиологии.
КОНЦЕПЦИЯ И УПРАВЛЕНИЕ ПРОЕКТОМ
Для работы над проектом была создана группа управления в составе руководи¬
теля и менеджеров проекта.
Для разработки концепции и системы управления проектом руководители
проекта провели множество консультаций с отечественными и зарубежными
специалистами — руководителями профессиональных обществ, ведущими разра¬
ботчиками клинических рекомендаций, организаторами здравоохранения, пред¬
ставителями страховых компаний, представителями компаний, производящих
лекарственные средства и медицинское оборудование.
В результате разработана концепция проекта, сформулированы этапы, их после¬
довательность и сроки исполнения, требования к этапам и исполнителям; утверж¬
дены инструкции и методы контроля.
ЦЕЛЬ
Обеспечить врача всей современной информацией, необходимой для непре¬
рывного медицинского образования, что позволит существенно повысить качество
специализированной медицинской помощи в Российской Федерации.
ЗАДАЧИ
• Проанализировать современные источники достоверной высококачествен¬
ной информации.
• На основе полученных данных составить обобщающие материалы с уче¬
том особенностей отечественного здравоохранения по следующим направ¬
лениям:
❖ клинические рекомендации,
3* диагностические методы,
немедикаментозные методы лечения,
Ф лекарственные средства.
МЕТОДОЛОГИЯ СОЗДАНИЯ И ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВА
9
• Подготовить издание, соответствующее всем современным требованиям
к национальному руководству по отдельной специальности.
АУДИТОРИЯ
Национальное руководство по трансфузиологии предназначено специалистам
Службы крови, клиническим трансфузиологам, врачам смежных специальностей,
студентам старших курсов медицинских высших учебных заведений, интернам,
ординаторам, аспирантам.
Составители и редакторы привели авторские материалы в соответствие с усло¬
виями специализированной клинической практики в России.
ЭТАПЫ РАЗРАБОТКИ
Создание команды управления и разработчиков, определение концепции,
выбор тем, поиск литературы, создание авторских материалов, экспертиза, редак¬
тирование, независимое рецензирование с получением обратной связи от рецен¬
зентов (специалисты, практикующие врачи, организаторы здравоохранения, про¬
изводители лекарственных средств, медицинского оборудования, представители
страховых компаний и др.), публикация, внедрение, получение обратной связи
и дальнейшее улучшение.
СОДЕРЖАНИЕ
Национальное руководство «Трансфузиология» содержит современную и акту¬
альную информацию об особенностях деятельности Службы крови с учетом приме¬
няемых в настоящее время современных методик заготовки, обследования и пере¬
работки донорской крови, а также методик переработки и производства препаратов
донорской крови. Отдельные разделы посвящены показаниям к клиническому при¬
менению трансфузионной медицины при различных нозологиях, рассматриваются
вопросы обеспечения иммунологической безопасности гемотрансфузий.
РАЗРАБОТЧИКИ
• Авторы-составители — практикующие врачи, сотрудники научно-исследо¬
вательских учреждений России, руководители кафедр;
• главные редакторы — практикующие врачи, руководители ведущих научно-
исследовательских институтов России;
• научные редакторы — ведущие специалисты-трансфузиологи;
• рецензенты — ведущие специалисты-трансфузиологи;
• редакторы издательства — практикующие врачи с опытом работы в изда¬
тельстве не менее 5 лет;
• руководители проекта — опыт руководства проектами с большим числом
участников при ограниченных сроках создания, владение методологией соз¬
дания специализированных медицинских руководств.
Всем специалистам были предоставлены описание проекта, формат статьи,
инструкция по составлению каждого элемента содержания, источники информа¬
ции и инструкции по их использованию, пример каждого элемента содержания.
В инструкциях для составителей указывалась необходимость подтверждения
эффективности (польза/вред) вмешательств в независимых источниках инфор¬
мации, недопустимость упоминания каких-либо коммерческих наименований.
Приведены международные (некоммерческие) названия лекарственных пре¬
паратов, которые проверялись редакторами издательства по Государственному
реестру лекарственных средств (по состоянию на 1 июня 2008 г.). В требованиях
к авторам-составителям было подчеркнуто, что материалы должны кратко и кон¬
кретно отвечать на клинические вопросы. После редактирования текст согласовы¬
вали с авторами.
1 о МЕТОДОЛОГИЯ СОЗДАНИЯ И ПРОГРАММА ОБЕСПЕЧЕНИЯ КАЧЕСТВА
Со всеми разработчиками руководитель проекта и ответственные редакторы
поддерживали непрерывную связь по телефону и электронной почте с целью
решения оперативных вопросов.
РЕКЛАМА
В инструкциях для авторов, научных редакторов и рецензентов подчеркива¬
лась необходимость использования при работе над национальным руководством
только достоверных источников информации, не зависящих от мнения произво¬
дителей лекарственных средств и медицинской техники, что в конечном счете обе¬
спечило отсутствие информации рекламного характера в авторских материалах
руководства.
Реклама производителей лекарственных средств и медицинской техники
в настоящем издании представлена в следующих видах:
1) цветные рекламные имиджи;
2) тематические врезы, публикуемые на цветном фоне;
3) подстраничные примечания.
КОМПАКТ-ДИСК - ЭЛЕКТРОННОЕ ПРИЛОЖЕНИЕ К НАЦИОНАЛЬНОМУ РУКОВОДСТВУ
Каждый экземпляр национального руководства снабжен бесплатным элек¬
тронным приложением на компакт-диске. Электронное приложение содержит
дополнительные главы, диагностические шкалы, медицинские калькуляторы,
фармакологический справочник и другие дополнительные материалы (см. с, 4 —
содержание компакт-диска).
КОМПАКТ-ДИСК «КОНСУЛЬТАНТ ВРАЧА. ТРАНСФУЗИОЛОГИЯ»
В рамках проекта «Трансфузиология. Национальное руководство» также под¬
готовлена электронная информационно-образовательная система «Консультант
врача. Трансфузиология» (на компакт-диске). Система содержит полный текст
национального руководства, фармакологический справочник, диагностические
шкалы, стандарты медицинской помощи, утвержденные Минздравсоцразвития
России, раздел «Обучение пациентов» и другие дополнительные материалы.
Программа снабжена уникальной системой поиска. Информацию об электронной
информационной системе «Консультант врача. Трансфузиология» можно полу¬
чить по тел.: (495) 228-09-74, 228-99-75; по электронной почте: bookpost@geotar.
ru, а также на интернет-сайте www.geotar.ru.
ОБРАТНАЯ СВЯЗЬ
Руководство в удобной и доступной форме содержит все необходимые для
практической деятельности и непрерывного медицинского образования сведения
по трансфузионной медицине.
Все приведенные материалы рекомендованы ведущими научно-исследователь¬
скими институтами.
Национальное руководство по трансфузиологии будет регулярно пересматри¬
ваться и обновляться не реже 1 раза в 3-4 года. Замечания и пожелания по подго¬
товке национального руководства «Трансфузиология» можно направлять по адре¬
су издательской группы «ГЭОТАР-Медиа»: 115035, Москва, ул. Садовническая,
д. 9, стр. 4; электронный адрес: info@asmok.ru.
Дополнительную информацию о проекте «Национальные руководства» можно
получить на интернет-сайте: http://nr.asmok.ni.
СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
*— обозначение торговых наименований лекарственных средств
обозначение не зарегистрированных в РФ лекарственных средств
АГС - антиглобулиновая сыворотка
АГТ — антиглобулиновый тест
АД — артериальное давление
АДГ — антидиуритический гормон
АДФ — аденозиндифосфат
АИГА — аутоиммунная гемолитическая анемия
АИК — аппарат искусственного кровообращения
АК — аминокислоты
АКШ — аортокоронарное шунтирование
AJIT — аланинаминотрансфераза
АПК — антигенпредставляющая клетка
АПТВ — активированное парциальное тромбопластиновое время
АСГП — антисинегнойная плазма
АСП — антистафилококковая плазма
ACT — аспартатаминотрансфераза
AT III — антитромбин III
АТФ — аденозинтрифосфорная кислота
АЧТВ — активированное частичное тромбопластиновое время
БАБШ — бифуркационное аортобедренное шунтирование
БАБ — биологически активные вещества
БАКШ — бифуркационное аортокоронарное шунтирование
БКЯ — болезнь Крейтцфельдта-Якоба
БТПХ — болезнь «трансплантат против хозяина»
ВГ — вирусные гепатиты
BE — basis-excess - избыток или недостаток буферных оснований
ВИГ — внутривенный иммуноглобулин
ВИЧ — вирус иммунодефицита человека
ВК - вспомогательное кровообращение
ВМК - высокомолекулярный кининогеном
ВНП — В-тип натрийуретического пептида
ВПП — вспомогательное парентеральное питание
ВЭБ - вирус Эпштейна-Барр
Г-6-ФД - глюкозо-6-фосфатдегидрогеназа
ГАГ — гликозоаминогликаны
ГБН — гемолитическая болезнь новорожденных
ГДФ — гемодиафильтрация
Г-КСФ — гранулоцитарный колониестимулирующий фактор
ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий фактор
ГМФП — гексозомонофосфатный путь
ГО — глобулярный объем
ГСК — гемопоэтические стволовые клетки
ГТИ - гемотрансмиссивные инфекции
ГТР — гемотрансфузионные реакции
ГФ — гемофильтрация
ГЭК — гидроксиэтилкрахмал
ДВС - диссеминированное внутрисосудистое свертывание
дГО — дефицит глобулярного объема (крови)
ДЗЛА — давление заклинивания легочной артерии
ДЗЛК — давление заклинивания в легочных капиллярах
12
СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
ДМТ — дефицит массы тела
ДНК — дезоксирибонуклеиновая кислота
ДОЦК — дефицит объема циркулирующей крови
ДПП — давление в правом предсердии
ДЦТ — длинноцепочечные триглицериды
ЖКТ — желудочно-кишечный тракт
ПАРК — интраоперационная аппаратная реинфузия аутокрови
ИБС — ишемическая болезнь сердца
ИВЛ — искусственная вентиляция легких
ИГ — иммуноглобулин
ИКР — креатинин/ростовой индекс
ИЛ — интерлейкины
ИЛП — искусственное лечебное питание
ИМТ — индекс массы тела
ИПТФ (TFPI) — ингибитор пути тканевого фактора
ИТП — индекс тяжести поражения
ИТТ — инфузионно-трансфузионная терапия
ИФА — иммуноферментный анализ
КД — кислородный долг
КДД — конечное диастолическое давление
КДО — кривая диссоциации оксигемоглобина
КЖСТ - толщина кожно-жировых складок
КНП — концентрат нативной плазмы
КНТ — коэффициент насыщения трансферрина
КОД — коллоидно-осмотическое давление
КОР — кислотно-основное равновесие
КППК — клетки-предшественники из периферической крови
КПФ — каскадная плазмофильтрация
КСФ — колониеспецифический фактор
КТ — компьютерная томография
КЩР — кислотно-щелочное равновесие
ЛГИ — лактат-глюкозный индекс
ЛК — лейкоцитный концентрат
ЛКА — левая коронарная артерия
ЛОК — лазерное облучение крови
ЛОНП — липопротеиды очень низкой плотности
ЛПНП — липопротеиды низкой плотности
ЛПУ — лечебно-профилактическое учреждение
ЛС - лекарственные средства
МЖЖ — модифицированные жидкие желатины
МИАРК — модифицированная интраоперационная аппаратная реинфузия ауто¬
крови
М-КСФ — макрофагальный колониестимулирующий фактор
МКШ — маммарокоранарное шунтирование
МОС — минутный объем сердца
МР — микрореакция преципитации
МС — метиленовый синий
МТГК — методы трансфузиологической гемокоррекции
Н/А — отношение незаменимых аминокислот к общему азоту
НАГТ — непрямой антиглобулиновый тест
НАТП - неонатальная аллоимунная тромбоцитопеническая пурпура
НМГ — низкомолекулярные гепарины
НП — неоптерин
СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
13
НПК — непрямое переливание крови
НСТ-тесг — тест с нитросиним тетразолем
НЭЖК - неэстерифицированные жирные кислоты
ОБ — общий белок
ОБПК - обменное переливание крови
ОДА — опорно-двигательный аппарат
ОЖСС — общая железосвязывающая способность сыворотки
ОКТ — омега-3-жирные кислоты
ОНГ — острая нормоволемическая гемодилюция
ОП — окружность плеча
ОПК — отделение переливания крови
ОПН — острая почечная недостаточность
ОРДС (ARDS) — острый респираторный дистресс-синдром
ОРИТ - отделение реанимации и интенсивной терапии
ОРЭ — осмотическая резистентность эритроцитов
ОТГР — отсроченные гемолитические реакции
ОЦК — объем циркулирующей крови
ОЦП — объем циркулирующей плазмы
ОЦЭ — объем циркулирующих эритроцитов
ОЭ — отмытые эритроциты
ПАГТ - прямой антиглобулиновый тест
ПАП — плазмин-антиплазминовый комплекс
ПАТ — прямой антиглобулиновый тест
ПВ — протромбиновое время
ПГТР — поздние гемолитические трансфузионные реакции
ПДФ — продукты деградации фибриногена
ПК — прекалликреин
ПККА — парциальная красноклеточная аплазия
ПНГ — пароксизмальная ночная гемоглобинурия
ПНК — плазма нативная концентрированная
П02 - потребление кислорода
ПОН — полиорганная недостаточность
ПП — парентеральное питание
ППК — прямое переливание крови
ППП - полное парентеральное питание
ПТГ — посттрансфузионные гепатиты
ПТГР — посттрансфузионные гемолитические реакции
ПТО — посттрансфузионные осложнения
ПТП — посттрансфузионная тромбоцитопеническая пурпура
ПФ — плазмаферез
ПФОС — перфторорганические соединения
ПЦР — полимеразная цепная реакция
РИА — радиоиммунный анализ
РИБТ — реакция иммобилизации бледных трепонем
РИФ — реакция иммунофлюоресценции
РКФМ — растворимые комплексы фибрин-мономеров
РНК — рибонуклеиновая кислота
РНЦХ РАМН — Российский научный центр хирургии им. акад. Б.В. Петровского
Российской академии медицинских наук
ПЭГ - полиэтиленгликоль
РСК — реакция связывания комплемента
РТПХ — реакция «трансплантат против хозяина»
РЭС — ретикулоэндотелиальная система
14
СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
СБС — спектроскопия биоэлектрического сопротивления
С/Д — солвент-детергентный метод инактивации плазмы
СВ — сердечный выброс
СДЭ — стандартные дозы эритроцитов
СЖ — сывороточное железо
СЗП — свежезамороженная плазма
СИ — сердечный индекс
СК — стволовые клетки
СКВ — серповидно-клеточная болезнь
СОППЛ — синдром острого посттрансфузионного поражения легких
СОЭ — скорость оседания эритроцитов
СПИД — синдром приобретенного иммунодефицита
СПК — станция переливания крови
СПТП — скорректированный постгрансфузионный прирост
СРВ — С-реактивный белок
ССВР — синдром системной воспалительной реакции
СФ — сывороточный ферритин
СЦТ — среднецепочечные триглицериды
ТАП — тканевый активатор плазминогена
ТАК — тромбин-антиплазминовый комплекс
ТГК — трансфузиологическая гемокоррекция
ТИАРК — традиционная интраоперационная аппаратная реинфузия крови
ТК — тромбоцитный концентрат
Т02 — транспорт кислорода
ТР-БТПХ — трансфузионно обусловленная болезнь «трансплантат против хозяина»
Т-Рол — Т-розеткообразующие лимфоциты
ТСЭ — трансмиссивные спонгиоформные энцефалопатии
ТФ — тканевый фактор
ТЭГ — тромбоэластограмма
УВ — ударный выброс
УЗИ — ультразвуковое исследование
УК — учтенная кровопотеря
У О — ударный объем
УФГК — ультрафильтрационная гемоконцентрация
УФИЗ — ультрафильтрация изолированная
УФОК (УФО) — ультрафиолетовое облучение крови
ФАТ — фактор активации тромбоцитов
ФНГПТР — фебрильная негемолитическая посттрансфузионная реакция
ФИО — фактор некроза опухоли
ХГ — хронический гепатит
ХГБ — хроническая гранулематозная болезнь
ХПН — хроническая почечная недостаточность
ЦВД — центральное венозное давление
ЦБК — центральный венозный катетер
ЦИК — циркулирующий иммунный комплекс
ЦМВ — цитомегаловирус
ЧМТ — черепно-мозговая травма
ЧПП — частичное парентеральное питание
ЧСС — частота сердечных сокращений
ЭВ — эритроцитная взвесь
ЭЗП — энтерально-зондовое питание
ЭКГ — электрокардиограмма
ЭКГК — экстракорпоральная гемокоррекция
СПИСОК СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
15
ЭКД — экстракорпоральная детоксикация
ЭКЛ — эндотелиальные клетки
ЭКМО — экстракорпоральная мембранная оксигенация
ЭМОЛТ — эритроцитная масса, обедненная лейкоцитами и тромбоцитами
ЭП — энтеральное питание
ЭПО — эритропоэтин
ЭСК — электрическое сопротивление крови
ЭСС — эритроцитсодержащие среды
2,3-ДФГ — 2,3-дифосфоглицерат
ВВ — basis base — буферные основания
BE — величина избытка оснований
ССО - continuous cardiac output — распределение сердечного выброса
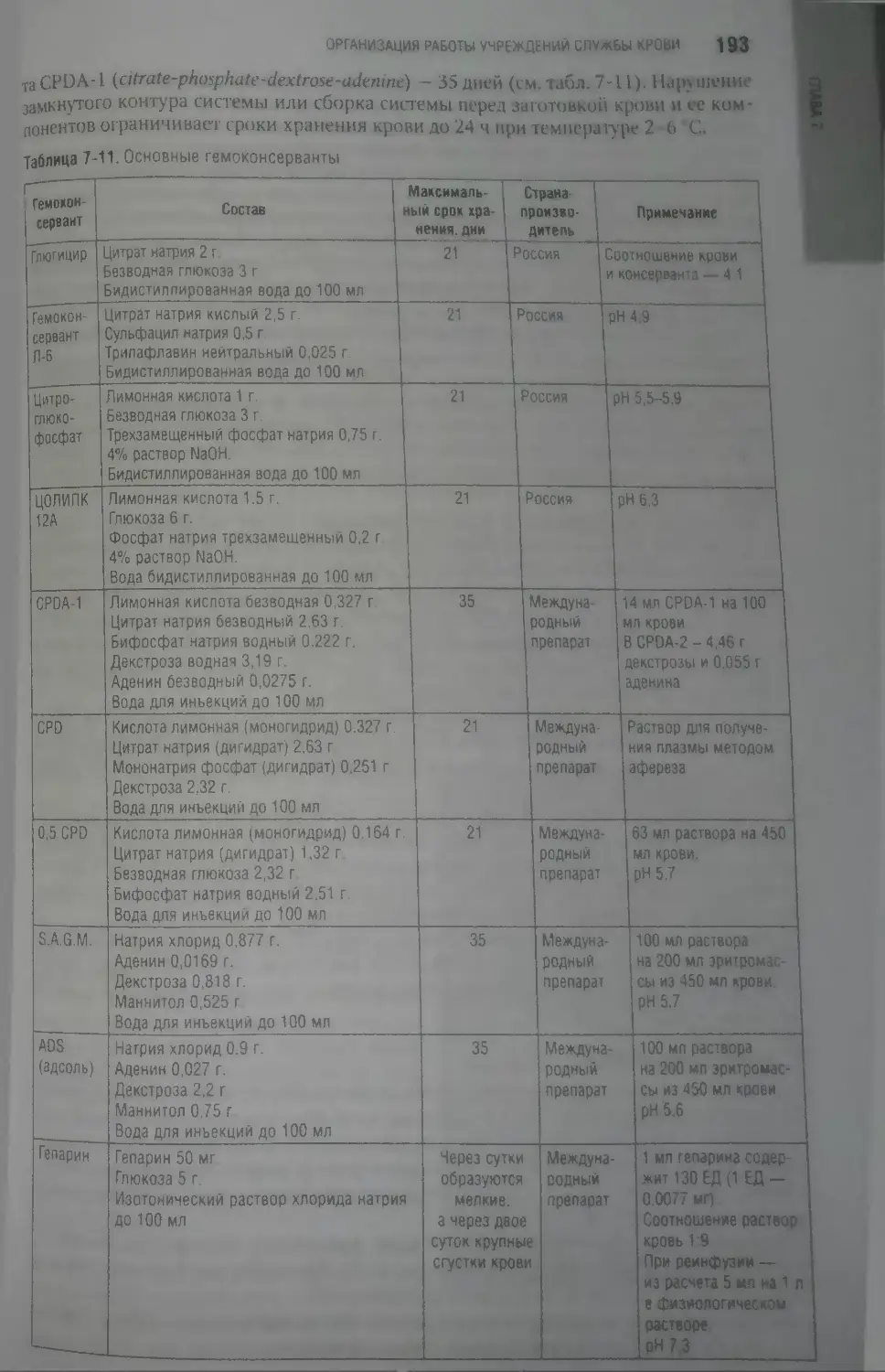
CPD — citrate-phosphate-dextrose — цитратный фосфат декстрозы
EAPI — European association of the plasma products industry — Европейская
ассоциация производителей продуктов плазмы
FDA (USA) — Food and Drug Administration - Управление США по надзору за
качеством пищевых продуктов и лекарственных средств
Hct — гематокрит
HLA — human leucocyte antigens — антигены тканевой совместимости
НРА — human platelet antigens — антиген тромбоцитов человека
МНС — major histocompatibility complex — главный комплекс гистосовместимости
N — общий азот мочи
PEEP — положительное давление в конце выдоха
РРТА — plasma protein therapeutics association
PRR — pattern recognition receptors — первичные рецепторы для патогенов
Sv02 — насыщение гемоглобина венозной крови кислородом
TNF — tissue necroses factor — тканевый фактор некроза (ТФН)
TRALI-синдром — transfusion related acute lung injury - острое трансфузионное
повреждение легких
ВВЕДЕНИЕ
Интерес человека к возможности применения крови для лечения заболева¬
ний прослеживается с самого рассвета человеческой истории. Только в начале
XX в, с открытием групповых свойств крови человека научная и практическая
медицина получила мощный толчок для изучения и, главное, успешного, впечат¬
ляющего клинического применения крови при лечении различных патологий.
Открытие возможности консервации крови с помощью лимоннокислого натрия,
изготовление пластиковых мешков для сбора крови расширило возможности
для применения крови при лечении врожденных и приобретенных заболеваний.
В последней четверти XX в. сформировалась самостоятельная и одновременно
тесно интегрированная с клиническими (хирургия, анестезиология, интенсивная
терапия, гематология, клиническая иммунология и др.), теоретическими и экспе¬
риментальными (биология, биохимия, иммуногенетика, коагулология, биофизика
и др.) разделами медицины новая медицинская научно-практическая дисципли¬
на — трансфузиология (трансфузионная медицина).
Положение о том, что трансфузиологию следует понимать как направление зна¬
чительно более широкое, чем вопросы, связанные с переливанием крови (с заго¬
товкой, переработкой, сертификацией и клиническим применением донорской
крови, ее компонентов и препаратов), сложилось не сразу. В первые десятилетия
после открытия групп крови К. Ландштейнером в 1901 г. основные усилия были
направлены на решение проблем по консервации, хранению, разделению на ком¬
поненты, эффективности применения сначала цельной консервированной крови,
а с середины века ее компонентов и препаратов. К середине 60-х годов XX в.
пришло понимание, что к области трансфузионной медицины следует относить
не только разделы, связанные со службой крови (заготовка, переработка, хранение
и распределение донорской крови) и процедурами внутрисосудистого введения
различных трансфузионных средств, но и все методы и способы работы с кровью
как с тканью, включая различные варианты афереза, интра- и экстракорпоральное
облучение крови, гемодиализ, искусственное кровообращение, гемофильтрацию,
иммуносорбцию и др.
В настоящее время в специальной литературе можно встретить ряд терминов
(«трансфузиология», «трансфузионная медицина», «переливание крови», «служба
крови»), которые применяются как для описания процессов, связанных с донор¬
ской кровью (заготовка, переработка, хранение и клиническое применение), так
и для определения комплекса лечебных мероприятий с использованием трансфу-
зиологического пособия для коррекции того или иного патологического состоя¬
ния. Несмотря на то что между процессами, объединенными под тем или иным
термином, имеется много общего и их часто используют как синонимы, необходи¬
мо различать особенности, характеризующие каждый из них.
Термин «трансфузионная медицина» (синоним — «трансфузиология»), при¬
меняемый в основном в западной литературе, — наиболее широкое понятие,
охватывающее все разделы трансфузиологии. Термин «переливание крови»
часто используют по инерции (показания к трансфузиям цельной консервиро¬
ванной крови крайне ограничены) или в силу традиции. Служба крови — систе¬
ма, связанная с агитацией и пропагандой безвозмездного донорства крови, заго¬
товкой, переработкой, хранением, обеспечением безопасности и распределением
компонентов крови, чем в основном и занимаются банки и станции переливания
крови. Несмотря на то что в Законе о донорстве крови (Федеральный закон
от 29 декабря 2006 г. №258-ФЗ) на сегодняшний день отсутствует определение
термина «Служба крови», врачи-трансфузиологи, медицинская общественность,
общественные организации, доноры крови и население в целом ясно понимают
и представляют себе эту систему, ее основные задачи. В дальнейшем мы будем
ВВЕДЕНИЕ 17
придерживаться термина «Служба крови», понимая под этим раздел трансфузи-
онной медицины, изучающий и реализующий на практике заготовку, сертифи¬
кацию, переработку, хранение, распределение, транспортировку компонентов,
отдельных препаратов, реагентов из донорской крови и обеспечение их безопас¬
ности, которое в целом корреспондируется с определением из Федерального
закона от 29 декабря 2006 г. №258-ФЗ: «организации, осуществляющие заго¬
товку, переработку, хранение и обеспечение безопасности донорской крови и ее
компонентов», но более точно отражает функции и цели одного из основных
направлений трансфузиологии и одновременно позволяет пользоваться устояв¬
шимся, общепринятым среди специалистов термином.
В проекте Федерального закона, планируемого к рассмотрению в 2012 г.
«Законопроект №632281-5 “О донорстве крови и ее компонентов”» определение
Службы крови представлено так.
«Службой крови являются объединенные в единую систему на функциональ¬
ной основе в целях обеспечения на территории Российской Федерации единства
организационных основ деятельности в сфере обращения донорской крови и ее
компонентов:
• уполномоченные на осуществление управления в сфере здравоохранения
федеральные органы исполнительной власти, органы исполнительной власти
субъектов Российской Федерации, органы местного самоуправления;
• осуществляющие деятельность в сфере обращения донорской крови и ее
компонентов государственные организации здравоохранения, а также госу¬
дарственные научные и образовательные организации, относящиеся к госу¬
дарственной системе здравоохранения, находящиеся в ведении федеральных
органов исполнительной власти, органов исполнительной власти субъектов
Российской Федерации и государственных академий наук;
• организации федеральных органов исполнительной власти, в которых пред¬
усмотрена военная и приравненная к ней служба;
• муниципальные организации здравоохранения, соответствующие структур¬
ные подразделения которых созданы не позднее 1 января 2006 г., осущест¬
вляющие заготовку, хранение, транспортировку донорской крови и (или) ее
компонентов» (подробнее о Службе крови см. в разделе II, главе 6 «Служба
крови — структура, деятельность и современное состояние»).
Термин «трансфузиология» («трансфузионная медицина») получил при¬
знание во всех странах и стал общепринятым названием отдельного раздела
медицинской науки и практики, новой медицинской специальности — транс¬
фузиологии.
Трансфузиология (от лат. transfusio — переливание, греч. logos — учение) —
раздел медицины, изучающий возможности управления гомеостазом организма
путем воздействия на системы крови средствами и методами трансфузиологиче-
ского пособия.
Трансфузиологическое пособие — комплекс лечебных, профилактических и диа¬
гностических мер, включающих:
• экстра- и интракорпоральные (васкулярные) методы (технологии) воздей¬
ствия на кровь (гемаферез, гемодиализ, ультрафильтрация, фотомодифика¬
ция, облучение и др.);
• трансфузионное пособие (трансфузионно-инфузионное) — парентерально
вводимые в сосудистое русло (внутривенно, внутриартериально, внутрилим-
фально) органические и неорганические лекарственные средства — донор¬
ская кровь, ее компоненты и препараты, кровезаменители, аутокровь и пр.;
• систему мониторинга безопасности ^эффективности используемых в про-
І I» I I I f ^ ‘Г ^ *
цессе лечения инфузиофош)ін(^^рі|н^і| ' и интракорпо-
ральных методов ВОЗДеигтпис
18 ВВЕДЕНИЕ
Трансфузиология — одно из самых динамично развивающихся направлений
медицинской науки, производства и лечебной практики включает:
• забор, переработку, хранение, распределение и транспортировку донорской
крови и ее компонентов;
• компонентную и препаратную гемотерапию;
• обеспечение инфекционной и изосерологической безопасности гемотранс¬
фузий;
• аутодонорство и аутогемотрансфузии (гемодилюцию, реинфузию);
• экстракорпоральную гемокоррекцию (аферез, гемодиализ, гемосорбцию,
экстракорпоральное облучение крови, иммуносорбцию и др.);
• использование кровезамещающнх растворов — гемо динамического и проти¬
вошокового действия, дезинтоксикационных растворов, препаратов паренте¬
рального питания и др.;
• применение инфузионных растворов с диагностической целью.
На практике трансфузиология решает две главные задачи:
• разработка и клиническое применение средств, методов и рекомендаций
для управления функциями организма путем направленного воздействия
на системы крови (гемостаза, клеточного и плазменного состава, кислотно¬
основного равновесия, агрегации, иммунитета, водно-электролитного соста¬
ва, белкового, липидного и углеводного обмена и др.), другие жидкие среды
организма (лимфа, спинномозговая и асцитическая жидкость и др.), а через
них на все органы и ткани;
• организация и оптимизация службы крови (заготовка, переработка, хране¬
ние и распределение компонентов донорской крови) и трансфузиологиче¬
ской помощи.
Исторически становление и развитие трансфузиологии было вызвано потреб¬
ностями клинической медицины, прежде всего акушерства, хирургии, гемато¬
логии и др. С момента возникновения у трансфузиологии была подчиненная
роль по отношению к другим клиническим дисциплинам. В то же время со всей
определенностью ясно, что без трансфузиологических методов гемокоррекции
сегодня немыслимы современные высокотехнологичные хирургия, гинекология,
акушерство, терапия, анестезиология, реаниматология и другие клинические
дисциплины. Трансфузиологические методы все чаще используются в качестве
основных для лечения различных патологических состояний: при наследственных
аномалиях крови — гемоглобинопатии, гиперхолестеринемии применяют аферез,
в том числе иммуноферез, при отсутствии или нарушении выделительной функции
почек - гемодиализ и др.
Трансфузиология, являясь комплексным научно-практическим направлением
медицины, при изучении своих проблем и задач использует известные методы
исследования из смежных, в ряде случаев тесно сопряженных и интегрированных,
научно-экспериментальных и клинических дисциплин. Вместе с тем трансфузио¬
логия, как всякое научно-практическое направление, располагает и специфически¬
ми методами — фракционирование крови и плазмы, методы афереза, гемодиализ,
выделение стволовых клеток периферической крови, общая, вспомогательная
и изолированная перфузия, инфекционное и иммуногематологическое тестирова¬
ние крови и др.
Трансфузиология родилась на стыке теоретических и клинических дисци¬
плин — иммунологии и физиологии, с одной стороны, и хирургии, акушерства,
гематологии и терапии — с другой. С открытием групп крови (начало научно¬
го периода трансфузионной медицины) трансфузиология, накапливая научно-
экспериментальные и клинические данные, постепенно выделилась, стала отдель¬
ной научно-практической дисциплиной и в середине прошлого века оформилась
в самостоятельный раздел медицины.
ВВЕДЕНИЕ 19
Трансфузиология — мультидисциплинарное направление медицины. Без зна¬
ний в области иммунологии, иммуногенетики, генетики, патофизиологии, био¬
химии, криобиологии, гематологии и других областях медицины и биологии
не представляется возможным освоить весь предмет и решать возникающие
на практике проблемы и задачи.
За последние десятилетия за счет новых медицинских технологий, позволяю¬
щих путем воздействия на кровь достигать лечебного эффекта, возможности кли¬
нической трансфузиологии значительно возросли. Это такие методы экстракорпо¬
рального воздействия на кровь и другие жидкие среды организма, как гемаферез,
гемосорбция, иммуносорбция, гемофильтрация, ультрафильтрация, экстракорпо¬
ральное облучение крови, гемодиализ, искусственное кровообращение и многие
другие.
Значимость экстра- и интракорпоральных (интраваскулярных) методов воз¬
действия на кровь, ее компоненты и другие жидкие среды организма в комплексе
лечебных мероприятий трудно переоценить. Достаточно отметить, что в настоя¬
щее время существует несколько десятков видов высокоэффективных экстра¬
корпоральных процедур на основе центрифужной, сорбционной, мембранной,
электрохимической, электромагнитной, преципитационной и перфузионной тех¬
нологий.
Как показывает опыт практической клинической работы при лечении раз¬
личных патологий, часто не удается адекватно, с достаточной эффективно¬
стью использовать весь огромный потенциал трансфузиологического пособия.
Разобщенность специалистов, выполняющих различные трансфузиологиче-
ские процедуры, отсутствие единой методологической базы и плана согласо¬
ванной лечебной работы, дефицит дорогостоящего оборудования и расходных
материалов, низкая квалификация специалистов, однобокость специального
образования (как правило, на практике один специалист — один метод транс¬
фузиологического лечения) не позволяют на сегодняшний день эффективно
использовать весь потенциал трансфузиологического пособия в клинике. Нет
единого мнения, какие диагностические и лечебные процедуры в компетенции
врача трансфузиолога, какие специалисты должны выполнять различные про¬
цедуры экстракорпоральной гемокоррекции — гемодиализ, гемофильтрацию,
искусственное кровообращение, как и кто должен согласовывать те или иные
методы лечения между различными специалистами. В настоящее время в одних
лечебных учреждениях это делают анестезиологи, в других — хирурги, в тре¬
тьих — урологи и т.д.
Для решения этих проблем важно определиться в следующих вопросах:
• кто (какой специалист) должен проводить экстракорпоральные процедуры;
• какое подразделение должно организовывать и нести ответственность за обе¬
спечение клиники всем комплексом трансфузиологического пособия.
Прежде всего необходимо изменить необоснованно сложившееся представление
о враче трансфузиологе как специалисте, занимающемся исключительно вопроса¬
ми заготовки, тестирования, переработки, хранения и распределения компонентов
донорской крови. Это положение верно для трансфузиолога, работающего в систе¬
ме Службы крови — на станциях переливания крови, центрах крови, отделениях
переливания крови, т.е. там, где ведется работа по агитации и пропаганде донор¬
ства, забору, переработке, тестированию, хранению и распределению компонентов
донорской крови. В рамках лечебного учреждения трансфузиолог — специалист,
владеющий всем арсеналом (или основными методами) трансфузиологического
пособия, от трансфузионно-инфузионных методов до нескольких экстракорпо¬
ральных методов.
Современное содержание специальности «Трансфузиология» охватывает все
многообразие видов деятельности, выполняемых врачом-специалистом, — диа-
20 ВВЕДЕНИЕ
гностических, профилактических, производственных и лечебных мероприятий,
связанных со всеми видами воздействия на кровь как больных, так и доноров. Это
определяется тем, что:
• по существу самой процедуры кровь (жидкая ткань) или другие жидкие
среды (лимфа, спинномозговая жидкость и т.д.) выводятся за пределы орга¬
низма, обрабатываются (разделяются на компоненты, очищаются от тех
или иных составляющих, шлаков, активируются и пр.), затем возвращаются
в сосудистое русло (в отдельных случаях воздействие может осуществляться
внутрисосудисто). Иначе говоря, выполняется управление функциями орга¬
низма путем целенаправленного воздействия на морфологический состав
и физиологические свойства крови или другой циркулирующей жидкости;
• очевидно, что нельзя бесконечно расширять номенклатуру («Номенклатура
врачебных и провизорских специальностей» 1998 г., М3 РФ) новыми узки¬
ми специальностями по виду процедуры: перфузиолог, специалист грави¬
тационной хирургии, специалист гемодиализа и пр. Названия «специалист
эфферентной гемокоррекции», «специалист экстракорпоральных процедур»,
«перфузиолог» или «специалист по гравитационной хирургии крови» ско¬
рее указывают на определенные методы или технологии, которыми владеет
врач и не полностью отражают содержание работы специалиста. Как извест¬
но, почти каждая из этих процедур сопровождается (включает в себя)
трансфузионно-инфузионными процедурами. Или нередко в процессе лече¬
ния необходимо сочетать эфферентные и неэфферентные процедуры, экстра-
и интракорпоральные технологии. Специальность — понятие устойчивое,
редко меняющееся, тогда как методы могут появляться и исчезать, быть свя¬
заны с определенной аппаратурой или технологией. При появлении новых
методов у специалиста открывается возможность обучения им. И в этом плане
в соответствии с существующей номенклатурой врачебных специальностей,
трансфузиолог — точное определение специальности для врачей, работающих
с кровью и другими жидкими средами больного и донора экстра- и интракор-
порально (васкулярно). При этом очевидно, что подразделения лечебного
учреждения могут называться по виду процедуры. (Подробнее см. главы
«Профессиональное образование врача-трансфузиолога» и «Организация
выполнения процедур трансфузиологической гемокоррекции. Отделение
трансфузиологии и его задачи в многопрофильной клинике».)
Примечание. От написания книги до ее выхода из типографии проходит немало
времени. За этот период в нашей стране вышли постановления, приказы, стандар¬
ты, инструкции и прочие документы, регламентирующие трансфузионную меди¬
цину. Одновременно трансфузиология и смежные медицинские и биологические
направления пополнились новыми научными данными, идет интенсивное вне¬
дрение полученных результатов в практическую трансфузиологию. Очевидно, нет
возможности привести в соответствие с нормативными документами все разделы
книги и включить все новые научные данные. Основной целью авторского кол¬
лектива было представить в книге базовые сведения об основных направлениях
трансфузионной медицины. Пользуясь современными средствами информации,
при желании можно быть в курсе новых научных данных и технологий трансфу¬
зиологии, получить информацию о последних нормативных документах (напри¬
мер, на сайте www.minzdravsoc.ru).
Профессор
А.А. Рагимов
РАЗДЕЛ I
ОБЩИЕ ВОПРОСЫ
ТРАНСФУЗИОЛОГИИ
Глава 1. Основные периоды и этапы истории
трансфузионной медицины
Глава 2. Профессиональное образование врача-
трансфузиолога
Глава 3. Основные направления
трансфузиологии
Глава 4. Сосудистые доступы для
трансфузиологических процедур
Глава 5. Клеточные основы трансфузиологии
Глава 1
Основные периоды и этапы
истории трансфузионной
медицины
С момента опубликования работ, обобщающих исторические
периоды и этапы развития трансфузиологии, прошло более четвер¬
ти века (Гаврилов O.K., Петровский Б.В., 1969-1979). Интенсивный
научно-технический прогресс, внедрение во все области деятель¬
ности человека информационных технологий, крупные научные
открытия в области биологических дисциплин, новые медицинские
технологии в лечении различных заболеваний оказали существен¬
ное влияние на трансфузиологию. Это потребовало нового осмыс¬
ления истории развития трансфузионной медицины, не столько
для уточнения ее отдельных периодов и этапов в прошлом, но, глав¬
ным образом, для того чтобы на основании имеющихся научных
достижений и современной медицинской практики прогнозировать
ближайшее и среднесрочное развитие трансфузиологии.
До недавнего времени в истории развития трансфузиологии выде¬
ляли два периода и несколько этапов, обусловленных уровнем раз¬
вития биологии и медицины и различными экономико-политичес¬
кими обстоятельствами жизни общества.
Основные исторические периоды и этапы трансфузиоло¬
гии (Руководство по общей и клинической трансфузиологии, 1979;
с изменениями и дополнениями).
• Первый период — до открытия К. Ландштейнером в 1901 г.
феномена изогемагглютинации.
❖ В первом периоде определены два хронологических этапа:
❖ I этап - от глубокой древности до открытия В. Гарвеем
в 1628 г. кругов кровообращения;
❖ II этап — с 1628 до 1901 г. — открытие первых групп крови
человека К. Ландштейнером.
• Второй период — после открытия и изучения групп крови.
•О Во втором периоде определены четыре хронологических
этапа:
❖ I этап — 1901-1925 гг. — научное обоснование переливания
крови и кровезаменителей, переливание крови с учетом
законов изогемагглютинации, открытие и внедрение гемо¬
консервантов для заготовки крови, разработка техники
переливания крови и кровезаменителей в условиях мирно¬
го и военного времени;
❖ II этап — 1925-1938 гг. — развитие метода перелива¬
ния крови между Первой и Второй мировыми войнами,
организация донорского движения, консервации крови, ее
24
ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
хранения и транспортировки, определение показаний к гемотрансфузиям
и их эффективность при различных заболеваниях;
-О- III этап - 1938-1945 гг. - развитие и совершенствование Службы крови,
массовое применение переливания консервированной крови в период Вто¬
рой мировой войны;
❖ IV этап — с 1945 по 1980 г. — развитие трансфузиологии в условиях научно-
технического прогресса второй половины XX в., разработка и внедрение
пластикового контейнера для сбора и хранения консервированной крови,
внедрение резус-фактора в трансфузиологическую практику, разработка
и применение метода фракционирования крови на компоненты, переход
к компонентной гемотерапии, производство новых эффективных кровеза¬
менителей и гемокорректоров, тестирование крови на гемотрансмиссивные
инфекции, типирование по антигенам гистосовместимости и др.
• Третий период — 1980-2005 гг. Моноклональные антитела и рекомбинант¬
ные реагенты, компонентная гемотерапия, аутодонорство, информационные
технологии.
❖ Определение основных разделов трансфузионной медицины со своими
проблемами и задачами: Служба крови, клиническая трансфузиология,
трансфузионная иммунология и промышленная трансфузиология.
<> Производство и применение моноклональных антител к эритроцитным
и лейкоцитным антигенам, рекомбинантных реагентов для лабораторной
практики.
-0- Типирование по антигенам гистосовместимости.
Внедрение метода ПЦР-диагностики в трансфузионную иммунологию.
❖ Господство компонентной гемотерапии.
❖ Аутодонорство и аутогемотрансфузии.
*0- Производство и применение новых препаратов крови из донорской кро¬
ви.
❖ Производство новых синтетических кровезаменителей и первых препара¬
тов крови и реагентов методами биотехнологии, генной инженерии.
❖ Информационные технологии — компьютеризация и штрих-кодирование
в службе крови и трансфузиологии.
• Четвертый период — с 2005 г. до настоящего времени ... «от компонентной
гемотерапии к препаратной трансфузиологии».
■О* В четвертом периоде определяются два хронологических этапа:
I этап — с середины 90-х годов XX в. до середины первой четверти XXI в. —
связанный с разработкой, производством и клиническим применением
препаратов из донорской крови (например, факторы свертывания крови,
интерферон, специфические иммуноглобулины и др.) - гемокомпонент-
ная терапия препаратами из донорской крови;
❖ II этап обусловлен развитием генной инженерии и биотехнологии —
трансфз^зионная терапия преимущественно препаратами и компонента¬
ми крови, полученными на основе достижений биотехнологии и генной
инженерии.
Первый период трансфузиологии длился несколько столетий и был насыщен
событиями с резкими сменами развития и застоя, признания и забвения.
В силу отсутствия знаний о научных основах переливания крови (прежде всего
о групповых свойствах крови, стерильности, механизмах свертывания, иммуно¬
логических характеристик и др.) до начала XX в. все попытки использовать кровь
для лечения носили эмпирический характер и, как правило, заканчивались траги¬
ческой неудачей.
Кровь во все времена символизировала жизненный поток. Очевидность связи
крови и жизни знали уже самые первые люди на заре цивилизации. Практически все
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ 25
древние народы отмечали в своих преданиях важность крови для жизни. В Древнем
Китае предполагали, что кровь содержит душу. Фараоны принимали ванны из крови
как средство от филяриоза. В период расцвета ацтекской империи, чтобы вселить
энергию в Солнце, когда утром оно возвращается из «загробного мира», проливали
кровь 20 ООО жертв в год. Норвежцы верили, что выпитая кровь тюленей и китов
лечит душевные расстройства и цингу. Греческая мифология изобилует историями
обмена кровью, дабы возвратить потерянную молодость. Еще Гиппократ упоми¬
нал о применении крови здоровых людей для лечения психических расстройств.
Казалось, что кровь и душа тесно взаимосвязаны — при истечении кровью душа
покидала тело. Отсюда и возникала мысль лечить душевные (психические) рас¬
стройства кровью. Некоторые римляне пили кровь павших гладиаторов как сред¬
ство от эпилепсии, в поисках духовного возрождения купались в крови жертвенных
тельцов (Плиний). Кровью смазывали лбы рожениц и новорожденных, тяжело¬
больных, чтобы придать им жизненных сил. Индейцы Америки применяли веното¬
мию как форму самонаказания. В дохристианских культурах считалось, что кровь
несет оплодотворяющую силу, содержит часть божественной энергии и, например,
пролитая в землю, делает ее плодороднее. Ветхий Завет содержит рекомендации
не употреблять кровь в пищу, так как она содержит плоть, а также «не проливать ее
(кровь) на землю, как вод}?». Католики и православные христиане для причащения
используют вино, символизирующее кровь Христа. На корриде в Мексике до сих
пор сохранилась традиция пить кровь заколотых быков.
Питье крови, ванны из крови, переливание крови долгое время рассматрива¬
лись как весьма эффективный способ омоложения. Кровь обезглавленных юно¬
шей (как и молоко молодых женщин) нередко использовалась для омоложения.
Так, в Средние века в целях омоложения венгерская графиня Батори принимала
ванны из крови молодых крепостных женщин. Есть мнение, что при сражении
при Ватерлоо больше офицеров британской армии погибло от «лечения» крово¬
пусканием, назначенного врачами, чем от французских пуль.
Переливание крови животных здоровым и больным людям сопровождалось
многочисленными осложнениями, не совместимыми, как правило, с жизнью реци¬
пиента. Из животных в качестве доноров крови использовали главным образом
овец, собак или телят. Основная цель переливаний — не столько возмещение утра¬
ченного объема крови при кровопотере, сколько желание омолодить организм,
повысить «жизненные силы» и облегчить любые тяжелые состояния, такие как
рак, чахотка, бешенство и пр.
Одно из самых первых письменных свидетельств о лечебном применении
крови человека относится к XV в. («Римский дневник» секретаря Римского
магистрата Стефано Инфессура). В 1492 г. умирающему от инсульта Римскому
Папе Иннокентию VIII [Джованни Батиста Чибо из Генуи, бывший кардинал
Мельфский (1484-1492)], по его требованию врачи влили в вену молодую кровь
от трех 10-летних мальчиков. Мальчики замерли, состояние Папы не изменилось,
судьба врача неизвестна (Лео Таксиль [10] и G. Undenboom [16]). [Некоторые
исследователи этого события полагают, что кровь пили как микстуру, а мальчики
умерли от воздушной эмболии (Gottleib).]
Одним из выдающихся открытий, без которого нельзя себе представить совре¬
менную клиническую медицину и ставшего предпосылкой к внедрению внутри¬
венного вливания жидкостей, в том числе и крови, послужило открытие в 1616 г.
(результаты исследования оп)'бликованы в 1628 г.) Уильямом Гарвеем (Harvey)
(1578-1657) системы кровообращения. Ученик Гарвея итальянец Франческо
Фолли в 1657 г. высказал мысль о возможности переливания крови с помощью
вставленных в кровеносные сосуды золотых или серебряных трубочек.
Первое (документированное) переливание крови от животного человеку выпол¬
нил французский врач Монпелье Жан-Батист Дени (М. J.-B. Denis). При помощи
26 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
хирурга К. Эммереза (К. Emmerez) он 15 июня 1667 г. провел успешную трансфузию
9 унций (около 300 мл) крови ягненка 15-летнему мальчику, страдающему лихорад¬
кой и геморрагическим синдромом, ослабленному после 20 «лечебных» кровопуска¬
ний. В последующем Ж.-Б. Дени выполнил еще два эксперимента по переливанию
крови ягненка здоровым людям, по данным историков, без клинических осложне¬
ний. Четвертым «пациентом» доктора Ж.-Б. Дени в декабре 1667 г. стал 34-летний
Антуан Моро (Mauroy). После повторной трансфузии крови ягненка у Антуана рука
стала горячей, пульс участился, появилась потливость, развились давящее ощущение
в груди, боль в пояснице и животе, носовое кровотечение, моча приобрела темно¬
кровавый («черный») цвет. Несмотря на серьезные, как сейчас мы понимаем, гемо-
трансфузионные осложнения, пациент выжил. Но цель, ради которой было проведено
переливание крови животного человеку (передать переливанием крови ягненка новые
добропорядочные свойства характера молодому повесе), не была достигнута. Через
пару месяцев Антуан возвратился к разгульному образу жизни, и в начале 1668 г.,
по настоянию молодой жены, пациенту была предпринята попытка третьего пере¬
ливания крови. При выполнении процедуры возникли технические трудности, врачу
лишь удалось извлечь немного крови и, как полагают, не удалось перелить кровь
ягненка. Пациент скончался той же ночью (как полагают, был отравлен мышьяком
супругой, не смирившейся с его образом жизни). Ж.-Б. Дени судили 27 апреля 1668 г.
Несмотря на то что переливание крови, как установил суд, скорее всего не имело отно¬
шения к смерти пациента, было вынесено решение запретить любые гемотрансфузии
без разрешения медицинского факультета Парижского университета (Jeanneney and
Ringenbach, 1940; Hall and Boas Hall, 1967; Keynes 1949,1967).
В ноябре 1667 г. доктор Р. Ловер (R. Lower) в Англии перелил кровь овцы
студенту богословия Артуру Кога (за что последний получил 20 шиллингов).
Очевидно, не было каких-либо серьезных осложнений, поскольку реципиент бла¬
годаря успеху эксперимента стал знаменит, но, как полагают, не вынеся «бремени
славы», спился.
Есть свидетельства того, что Д. Кардано (J. Cardano, 1501-1576), итальянский
врач, математик, механик и философ (изобрел, в частности, карданный вал),
использовал кровь баранов для омоложения.
Кристофер Рэн (С. Wren, 1632-1723), в середине XVII в. (в 1656 г.) выпол¬
нил первые эксперименты по внутривенному вливанию различных жидкостей,
используя в качестве инъекционной иглы птичье перо, а вместо шприца — пузы¬
ри рыб и животных (до изобретения полой инъекционной иглы и современного
шприца оставалось еще целых два столетия). В 1665 г. Рэн описал использование
полой иглы собственной конструкции как внутривенного катетера для сосудистого
доступа. С ее помощью он изучил действие на собаках внутривенной инъекции
вина, пива, настойки опия, растворов солей некоторых металлов. Именно К. Рэн
предложил медицину и физиологию как главные проблемы для изучения в первой
в мире академии наук — Лондонском Королевском обществе, основанном в 60-е
годы XVII в. под руководством Роберта Бойля (1627-1691), выдающегося физика
и химика, доктора медицины.
В 1667 г. был опубликован отчет врача из Лейпцига И.-Д. Майора, который
в октябре 1666 г. (на год раньше, чем Ж.-Б. Дени) перелил кровь своему парали¬
зованному учителю.
Р. Лоуэр (R. Lower, 1631-1691), член Лондонского Королевского общества,
в 1666 г., соединив сонную артерию одной собаки с яремной веной другой собаки,
показал, что обескровленное животное может быть воскрешено путем перелива¬
ния крови от другого, которое погибает от кровопотери. На следующий год он
перелил кровь овцы человеку без очевидных неблагоприятных эффектов.
В 1667 г. была опубликована первая книга немецкого врача И. Эльшольца
(J. S. Elscholz) «Ctysmatica Nova» (промывание «тела не через рот, а любым другим
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ 27
путем»), где описана схема гемотрансфузии от животных человеку и от человека
к человеку.
Многовековой опыт исследований показал, что, несмотря на отдельные слу¬
чайные удачи, практически все переливания крови от животных человеку закан¬
чивались трагически для человека, что, в конечном итоге, позволило прийти
к неутешительному заключению — при переливаниях крови возникает полная
несовместимость и как следствие смерть пациента. Очевидно, что нельзя было
полагаться на отдельные удачи при переливании крови от животных к человеку.
В Средние века сложилась шутка, что «для переливания крови нужно 3 барана:
у одного берут кровь, другому ее переливают, и третий — кто это выполняет»
(Zimmerman and Howell, 1932; Maluf N. R. S., 1954).
До конца XVII в. вышло не менее 7 книг, в которых упоминалось переливание
крови. В 1679 г. была опубликована книга К. Мерклина (С. Mercklin), посвящен¬
ная только проблеме переливания крови, с символическим названием — «Восход
и закат переливания крови» (De Ortu et Occasu Transfusions Sanguinis). Можно
сказать, что эта книга в целом подвела итог попыткам переливания крови, и закат
метода, как мы сегодня понимаем с высоты полученных позднее научных данных,
был предопределен.
Безуспешность попыток переливания крови животных человеку привела к
тому, что декретом палаты представителей Французского парламента, запретом
Лондонского Королевского общества и Римской Церковью (Папский эдикт 1678 г.)
переливание крови было запрещено и кануло в забвение почти на 150 лет.
Есть некоторые свидетельства, что, несмотря на запреты и очевидные неудачи,
отдельные исследователи испытывали различные методы переливания крови. Так,
например, в 1785 г. доктор Ф. Физик (Ph. Physic) из Филадельфии пытался лечить
рожениц после родового кровотечения переливанием человеческой крови. Ранее
доктор Э, Дарвин (Е. Darwin, 1731-1802, дед Чарльза Дарвина) проявлял большой
интерес к переливанию крови. В своей книге «Зоономии» (1794) он сообщает,
что попытки применить ежедневные гемотрансфузии больному с непроходимо¬
стью горла не удались, так как больной от процедур отказался.
В XVIII в. Роса (Rosa) в Италии и Гарвуд (Harwud) из Кембриджа без пред¬
варительного кровопускания внутрисосудисго переливали значительные объемы
лекарственных растворов человеку.
В России первые сведения о переливании крови относятся к 1787 г. (проф.
М. Пэкэне),
Концепция переливания крови от человека человеку возродилась только
в первой четверти XIX в„ благодаря исследованиям выдающегося английского
физиолога и акушера Джеймса Бланделла Qames Blundell, 1790-1877). Смерть
вследствие страшных кровотечений, особенно часто встречающихся после родов,
ужасала акушеров. Решение вопроса виделось в возвращении крови в систему кро¬
вообращения. Дж. Бланделл исследовал переливание крови «с целью сохранения
этого ценного выбора перед профессионалом и в надежде добавления чего-либо
к древу фактов». Дж. Бланделл был первым ученым, научно исследовавшим пере¬
ливание крови. Необходимо иметь в виду, что в то время значительные затрудне¬
ния вызывало практически полное отсутствие инструментов для инфузии, не было
антикоагулянтов, имелись лишь смутные представления о стерильности и др.,
что сегодня является очевидным даже для обывателя, далекого от медицинской
практики. Тем не менее вклад Дж. Бланделла в науку монументален. Прежде
чем Дж. Бланделл выполнил первое переливание крови человеку, он установил
два центральных принципа: первое — собака, у которой отбирали смертельный
объем периферической венозной крови, могла выжить, если ей перелить кровь
другой собаки, и второе — переливание собаке даже малого объема (114 мл)
крови другого вида (человека) может стать фатальным (Дж. Бланделл, 1824)
(рис. 1-1,1-2).
28 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Рис. 1-1. Переливание крови от животного человеку Рис. 1-2. Аппарат для переливания крови
(XVII в.) (из Руководства по применению крови и кро- Джеймса Бланделла: 1 — воронка для
везаменителей — под руководством А.И. Филатова, сбора крови; 2—шприц; 3 — фильтр; 4 —
1965) канюля для введения в вену больного
Убежденный, что только человеческая кровь подходит для переливания чело¬
веку, Дж. Бланделл начал осторожные эксперименты на людях, делая попытку
переливания, только когда пациент казался безнадежным (Blundell, 1818, 1824).
Дж. Бланделл в 1829 г. сообщил об успешной гемотрансфузии пациентке, которой
было перелито посредством специального шприца приблизительно 8 унций (227 мл)
крови. Со слов пациентки, она чувствовала «как будто жизнь вселена в ее тело».
Дж. Бланделл выступал против переливания человеку крови животных. Своими
исследованиями он предвосхитил многие основные положения безопасного пере¬
ливания крови, которые стали нормой только в начале XX столетия. Дж. Бланделл
показал, что кровь, забранная из любого сосуда, соответствует всем требованиям
переливания; использоваться должна только кровь той же самой разновидности;
кровь сохраняет свои свойства после контакта с инструментами; воздух должен
быть исключен из системы (при этом введение до 20 мл воздуха не является
фатальным); замещать количество крови, которое было потеряно, не только
лишне, но и опасно; медленное переливание крови крайне желательно. Он
утверждал, что для гемотрансфузии венозная кровь подходит лучше, чем артери¬
альная, и разработал приспособления для ее получения. Дж. Бланделл изобрел
несколько инструментов, в том числе в 1824 г. описал изобретенный им прибор
для прямого переливания крови под давлением (предшественник шприца).
22 декабря 1818 г. Дж. Бланделл доложил на заседании Лондонского медико-
хирургического общества о переливании крови от человека человеку, которое он
выполнил совместно с выдающимся хирургом своего времени Г. Кляйном (G. Klein).
Дж. Бланделл перелил кровь 10 пациентам, 5 из которых остались в живых.
В 1840 г. в Лондоне врач С.А. Лайн (S.A. Lane) под руководством доктора
Дж. Бланделла провел первую успешную трансфузию крови для лечения гемофилии.
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ 29
До 1849 г. было выполнено 48 переливаний крови, из них 30 пациентов выжили
(Routh). На основании своих исследований Дж. Бланделл вывел основные опас¬
ности и осложнения гемотрансфузии: свертывание крови, мешающее трансфу¬
зии, воздушная эмболия, несовместимость крови в некоторых случаях. Главным
показанием к гемотрансфузии он считал кровопотерю в родах. Дж. Бланделл
собирал кровь из влагалища и успешно реинфузировал ее в вену. Он вывел четы¬
ре вида контроля ответственности врача при выполнении гемотрансфузии —
за общим состоянием больного, объемом взятия крови, непрерывностью вливания
и за состоянием сердца.
Опыты Дж. Бланделла поражают смелостью и результативностью. До работ
о послеродовой лихорадке О.В. Холмса (O.W. Holmes) и И. Земмельвейса
(I. Semmelweis) оставалось два десятилетия, а до антисептики Дж. Листера
(J. Lister) — почти полвека.
Исследователи и врачи в конце девятнадцатого столетия основные усилия напра¬
вили на улучшение способов прямого и непрямого переливания крови и поиск
методов предотвращения коагуляции. В 1821 г. французские химики Жан-Луи
Прево (Prevo) и Жан-Батист-Андре Дюма (Duma) обнаружили, что после выпа¬
дения фибрина кровь хранится в жидком состоянии, а в эксперименте на живот¬
ных показали клиническую эффективность дефибринированной крови. Броун-
Секар (Brown-Sequard) механически дефибринировал кровь для переливания,
а Бракстон-Хикс (Braxton-Hicks) для предотвращения выпадения крови в сгусток
использовал фосфорнокислый натрий.
Эксперименты Дж. Бланделла освещались на страницах русских журналов
♦Врачебные записки», «Вестник естественных на}Ж медицины» (1827, 1828 гг.).
В1830 г. в «Военно-медицинском журнале» профессором С.Ф. Хотовицким была опу¬
бликована работа «Переливание крови», в которой указывалось на необходимость
использовать переливание крови при угрожающих жизни кровотечениях в родах.
Через четыре года (1834) в том же журнале была опубликована статья акушера про¬
фессора И.Т. Спасского, посвященная вопросам переливания крови.
В России первое успешное переливание крови при массивной кровопотере
у роженицы провел акушер А.М. Вольф 8 апреля 1832 г. в Санкт-Петербурге
(Обуховская больница), используя для переливания аппарат и методику, получен¬
ную им от Дж. Бланделла; донором крови был муж роженицы (первый в России
донор крови).
В 1846 г. профессор И.В. Буяльский (1789-1866) обратился с письменным
запросом на имя директора Медицинского департамента Военного министерства
о возможности переливания крови в России и получил положительный ответ.
В1847 г И.М. Соколов, прозектор Московского университета, перелил сыворот¬
ку крови человека больному холерой.
В 1848 г. профессором физиологии Императорского медицинского университе¬
та А.М. Филомафитским (1807-1849) была издана первая в России монография,
посвященная переливанию крови, — «Трактат о переливании крови (как единствен¬
ном средстве во многих случаях спасти угасавшую жизнь) в историческом, физио¬
логическом и хирургическом отношении» (рис, 1-3). А.М. Филомафитский описал
сконструированный оригинальный аппарат для трансфузии крови (рис. 1-4).
В 1865 г. В.В. Сугутин (1839-1900) защитил одну из первых диссертаций
на соискание степени доктора медицины «О переливании крови». В.В. Сугутин
высказал идею о возможности хранения дефибринированной крови в течение
недели при температуре О °С, указав на важную роль гемотрансфузий на войне,
необходимость сбора и использования крови, излившейся при кровотечении
{впервые в России высказана идея аутогемотрансфузии).
В. Раутенберг (V. Rautenberg) в 1867 г. показал, что добавление небольшого
количества углекислого натрия к крови задерживает свертываемость, не лишая ее
необходимых для переливания свойств.
30 ОБЩИЕ вопросы трансфузиологии
Ч*
. ..VI , Ї '.5
їХЖкм -'&кг.ч
V И . II f.
■
| •*•.. •. - v'.’.-V
ЙК5й:
.щтщ.
- ’ Зй*»-
ЕЕЕКЛИЕВДаЩ «*§»&
(Яльъ »:дчЯЄт«ГЕщи>іпі постіл ьл unor дета адуі* A v
сди<лгг 7Г1Си^Щ/Ю іАІсак)>і,
ith ЛОТОГОЧКГЛОМЪ, ^ШШОГИЧШІОІП,
и .іирурмічесвомт. бішітоші,
Яї»восог«5И> W.attKlfATOl«OiAVO Коставсйле
УазяБкигЕгд.
' imu* Г*1й Wtf.rfu», ..’
4**иц Ї* рдт, *****пмАймprt-
' .Me*.y :.«*»f f*ak..***?* +
.«іїегіЯЬ iltfslAtf r ,V>*t jw>5». .<рф*л « .w twbfb
і»*.*лЬі а ^ігЛ«і*н* Лк'цл, * en—
. «,t <с^л^іжг *u**^.'rd \iwjj£.’W' •^рі^їм'у '■* *v>'
. >»&iwcwr>o;<WT Tftaomw*-
ШЙ|
Б^ілкіг: «а
} T-<« . •
і ДЙДЙЙЙЙ StS&
Рис. 1-3. Трактат о переливании крови А.М. Филомафитского, 1848 г.
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ 31
Проблема инфицирования при переливании крови оставалась актуальной
еще несколько десятилетий, несмотря на то что английский хирург Д. Листер
в 1867 г. первым применил антисептик для борьбы с инфекцией при трансфузиях.
Впервые методика обратного переливания крови (аутогемотрансфузия) при
родах, сопровождающихся обильным кровотечением, — собирать кровь, вытек¬
шую из влагалища, дезинфицировать ее и после подогревания вводить в вену
роженицы — была опубликована Хигмором (W, Higmore) в журнале «Lancet»
в 1874 г. Широкому внедрению этого метода в практику мешала высокая опас¬
ность бактериального загрязнения крови.
Профессор С.П. Коломнин (1842-1886) первым в русской армии в 1876-1877 г.
переливал дефибринированную кровь раненым в условиях боевых действий.
Основатель первой в России научной школы патофизиологов профессор
В.В. Пашутин (1845-1901) описал основные симптомы посттрансфузионного
осложнения.
Выдающийся отечественный хирург профессор Н.И. Пирогов (1810-1881) ука¬
зывал, что гемотрансфузии должны сопровождать хирургические операции с кро-
вопотерей.
Об успешной реинфузии во время операции вычленения бедра сообщил
в 1885 г. А.Г. Миллер (A.G. Miller).
Обобщив успешный опыт своей работы по реинфузии аутокрови во время
ампутации в 1885-1886 гг. Г. Дункан (G. Duncan) ввел этот метод в свою практику
в качестве обычного и безопасного.
Как альтернативу гемотрансфузиям врачи США в 1873-1880 гг. и даже позже
использовали переливание человеку молока коров и коз. С середины 80-х годов
XIX столетия в качестве кровезаменителя все чаще начали использовать солевые
растворы, что сразу резко уменьшило отрицательные осложнения, связанные
с переливанием молока и растворов на его основе.
В конце XIX в. были определены научные факты, имеющие непосредственное
значение для будущего всей медицины и трансфузиологии в частности: установ¬
лено, что гемоглобинурия и гематурия сопровождают несовместимые перелива¬
ния, потеря крови сопровождается несоответствием между размером сосудистого
русла и объемом жидкости, содержащейся в нем, и объем вливаний может быть
шщыпим, если замещающая жидкость в достаточной степени содержит белки
■ли эритроциты (Bull). К этому времени пришло понимание, что применять
л качестве кровезаменителей коровье, овечье и человеческое молоко неэффектив¬
но и опасно — большинство попыток были безуспешны, трансфузии давали частые
■ серьезные осложнения. Для восполнения кровопотерь были введены кристалло¬
иды ые растворы.
К 1875 г. Л. Ландуа (L. Landois), проанализировав публикации за предыдущие
годы, обнаружил в литературе несколько сотен случаев переливания крови между
животными, от животных людям и между людьми. В XIX в. в мире было осущест-
клено около 600 переливаний крови, а в России — 145. Больше половины гемо¬
трансфузий заканчивались грозными, нередко несовместимыми с жизнью гемо-
трансфузионными осложнениями. Подсчитано, что при эмпирическом подходе,
случайном выборе донора для гемотрансфузии реципиенту, только 64,4% первых
переливаний крови прошло бы успешно (Greenwalt). В зависимости от частоты
распределения четырех групп крови системы АВ0 в популяции это соотношение
может колебаться в пределах 45-70%.
Несмотря на большой процент риска при гемотрансфузиях, переливание
крови рассматривалось как необходимая мера при кровопотерях. Однако невоз¬
можность предугадать результат гемотрансфузии, сложность процедуры и высо¬
кая смертность делали эту процедуру не менее опасной, чем в предыдущие сто¬
летия.
32 ОБЩИЕ вопросы трансфузиологии
Дальнейший прогресс в области переливания крови был объективно предо¬
пределен и ограничен знанием на тот период времени. Был необходим новый
«научный прорыв» в науке.
В конце XIX в. состоялись крупные открытия в области инфекционной иммуно¬
логии, вакцинации, стерильности, асептики и антисептики, в понимании механиз¬
мов иммунного ответа на инфекцию. Родилась новая медико-биологическая дис¬
циплина — иммунология, без достижений которой в конце XIX в. вряд ли могло
состояться основное открытие трансфузионной медицины в начале XX в. — груп¬
повые свойства крови. За исследования в области инфекционной иммунологии два
выдающихся ученых — П. Эрлих (P. Ehrlich) (Германия) и И.И. Мечников (Россия)
были удостоены в 1908 г. Нобелевской премии. В этот период был открыт феномен
бактериальной агглютинации в сыворотке предварительно иммунизированных
определенными бактериями животных, гемолиз и агглютинация эритроцитов кро¬
лика в кровяном русле гвинейской свиньи, предварительно сенсибилизированной
малыми дозами дефибринированной крови кролика. Примерно в это же время
несколько исследователей описали слипание эритроцитов в сыворотке, получен¬
ной от другого человека. Но большинство исследователей, находясь под впечат¬
лением достижений инфекционной иммунологии, полагали, что агглютинация
эритроцитов в сыворотке других людей - следствие инфекционного процесса, т.е.
вариант бактериальной агглютинации.
Кроме попыток гемотрансфузий, отдельные исследователи пытались найти спо¬
собы очистки крови от патологических субстратов. В начале XX в. (1902-1904 гг.)
греческий ученый Г. Яцидис (G. jacidis) опубликовал результаты своих опытов
по очистке крови путем пропускания ее через активированный уголь. Несмотря
на то что полученные результаты выглядели обнадеживающе, метод остался
невостребованным, поскольку в отсутствие антикоагулянтов и вследствие несо¬
вершенства подготовки адсорбента система быстро тромбировалась.
Начало современного, научно обоснованного периода истории трансфузиоло¬
гии связано с именем великого австрийского (с 1922 г. американского) ученого
патолога-биолога, в последующем лауреата Нобелевской премии (1930) - Карла
Ландштейнера (К. Landsteiner, 1868-1943). Открытия и последующие исследова¬
ния великого ученого XX столетия, его учеников и последователей имели огром¬
ное значение для биологии и медицины и дали начало важнейшим составляющим
трансфузионной медицины — новым научным направлениям - иммуногемато¬
логии и изосерологии, а в последующем иммуногенетике. Будучи сотрудником
Института патологической анатомии университета Вены, К. Ландштейнер в 1901 г.
опубликовал результаты исследования взаимодействия эритроцитов и сыворотки
крови 22 человек и сделал заключение о существовании трех групп крови 1(0),
И(А) и Ш(В). К. Ландштейнер объяснил причины агглютинации эритроцитов
одного здорового человека сывороткой другого здорового человека наличием
в сыворотке крови естественных (врожденных) антител, а на эритроцитах - соот¬
ветствующих антигенных детерминант (подробнее см. раздел «Трансфузионная
иммунология»). Он указал на важность определения совместимости крови, чтобы
переливание было успешным. Через год, в 1902 г., его сотрудники Альфред фон
Декастелло Речвер (A.D. Rechver) (1872-1960) и Адриано Стурли (A. Sturli)
(1872-1960) описали признаки IV (АВ) группы крови (присутствие на эритроци¬
тах индивида одновременно антигена А и В), но приняли ее за артефакт. В 1907 г.
Янский (Janski) и Масс (Mass) (1910) выделили IV группу крови. За 3 десятиле¬
тия усилиями лаборатории К, Ландштейнера и другими исследователями были
открыты и описаны несколько эритроцитных антигенных систем (см. раздел
«Трансфузионная иммунология»). К. Ландштейнер изучил и описал возможность
использования антикоагулянтов и консервантов, что в последующем позволило
отказаться от практики прямых переливаний «донор-реципиент». К сожалению,
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ зз
исследования К. Ландштейнера и его коллег о групповых свойствах крови не сразу
заинтересовали врачей, практикующих гемотрансфузии, и первые несколько лет
это открытие использовали в основном в судебной медицине.
Больший интерес у врачей вызвали исследования французского хирурга
А. Каррэла (A, Carrel) и его коллеги Д. Крайла (G. Crile), которые в 1907 г. неза¬
висимо друг от друга разработали и начали применять метод соединения артерии
донора с веной реципиента — так называемый «прямой» метод — хирургический
метод, позволявший предотвращать свертывание крови при трансфузии. Впервые
метод А. Каррэл применил при спасении жизни сына друга, используя отца
как донора крови. Однако сложность самой хирургической техники, метода (необ¬
ходимость присутствия донора у постели больного и хирургическая операция)
и его осложнения не позволяли применять метод в широкой практике. Способ,
малопригодный и не прижившийся в трансфузиологии, сыграл заметную роль
в сосудистой хирургии и трансплантации органов, и в 1912 г. А. Каррэл был удо¬
стоен Нобелевской премии.
Продолжался поиск метода, позволяющего с меньшей травматизацией боль¬
ного и донора переливать кровь. Альтернативой явилось открытие возможности
обработки игл, специальных трубок и приспособлений воском.
Спустя 7 лет после открытия групповых свойств крови в 1907 г. Хектоен
(Hektoen) предложил выделять пациентов, требующих гемотрансфузии,
по группам крови и до гемотрансфузии определять совместимость сыворотки
с эритроцитами путем смешивания их до переливания. В этом же году (1907)
Крайл впервые выполнил гемотрансфузии с учетом изоагглютинационных
(групповых) свойств крови и уже в 1909 г. сообщил о 61 успешном переливании
крови.
Оггенберг (Ottenberg) ввел эту концепцию в обычную практику, определяя
АВО-тип и совместимость до переливания. К 1913 г. Оттенберг и Калиски (Kaliski)
за 5 лет накопили и проанализировали опыт 128 успешных переливаний. И это
в условиях практического отсутствия противосвертывающих средств и удобного
метода переливания крови от донора к реципиенту.
Для широкого внедрения переливания крови необходимо было решить еще одну
крупную проблему — свертывания крови. Применяли различные решения — меха-
41 скую дефибринацию периферической крови, покрытие трубок и контейнеров
для крови парафином, использование различных антикоагулянтов: сульфата
■ оксалата аммония, фосфата, сульфата и йодида натрия, сульфарсенола, арсфе-
ідминя, гирудина.
Наконец, в 1914-1915 гг. А. Густином (A. Hustin), J1. Аготе (L. Agote) и Р. Леви-
совом (R. Lewisohn) был предложен простой и доступный консервант крови — цитрат
натрия (лимонно-кислый натрий), связывающий кальций и тем самым препят¬
ствующий свертыванию. Кровь стало возможным переливать с учетом групповых
свойств, поддерживать в жидком состоянии и транспортировать на необходимые
расстояния. Практически одновременно в этот же период (1914-1915 гг.) в России
RA. Юревич и Н.К. Розенберг предложили для стабилизации донорской крови
также использовать нетоксичный цитрат натрия. В.А. Юревич и Н. К. Розенберг
в 1914 г. применили метод аутогемотрансфузии в эксперименте,
В 1915 г. в Нью-Йоркском госпитале Mt. Sinai Р. Левисон (R. Levisohn), при¬
менив цитрат натрия для консервирования крови, впервые изменил процедуру
переливания крови — отпала необходимость присутствия донора у постели боль-
маго. Открылась возможность сохранять кровь относительно длительное время,
включалась необходимость контакта донора с пациентом. В середине 10-х годов
XX столетия исследователем Р. Вейлом (R. Weil) одним из первых было установ¬
кою. что консервированная кровь сохраняет свои свойства дольше, если хранит¬
ся при низких плюсовых температурах в рефрижераторе. Таким образом, было
34 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
положено начало хранению и накоплению необходимого объема донорской крови
в Банках крови.
В 1915-1916 гг. Ронз и Тернер (Rons, Turner) изготовили консервант, содер¬
жащий хлористый натрий, цитрат натрия и декстрозу, который использовался
в Первой мировой войне. Большинство переливаний крови проводили спустя
короткие сроки после забора крови. В то же время была установлена возмож¬
ность сохранения охлажденной крови с лимоннокислым натрием с минимальным
гемолизом до 3 нед. К 1918 г. цитратная кровь использовалась во время бое¬
вых действий британскими и американскими военными хирургами. Интересно,
что этот раствор (с незначительными изменениями, затрагивающими в основном
пропорции компонентов) использовали для заготовки и хранения все учреждения,
заготавливающие донорскую кровь до середины 1940-х годов.
Два упомянутых открытия — возможность определять группы крови и консер¬
вировать кровь — превратили гемотрансфузию в метод, доступный повседневной
клинической практике.
Заслуга применения реинфузии при кровоизлияниях в серозные полости, воз¬
никающие при повреждении паренхиматозных органов или крупных сосудов, при¬
надлежит хирургу К. Хенхсену (К. Henschen) (1916 г.).
Первую интраоперационную реинфузию аутокрови во время спленэктомии
при синдроме Банти в 1917 г. применил С. Локвуд (C.D. Lockwood).
Чаще всего реинфузию использовали в гинекологии при прервавшейся внема¬
точной беременности. Эффективность процедуры была так велика, что позволи¬
ла лейпцигским хирургам Д. Зису и Ф. Лихтенштейну 0. Thies, F. Liechtenstein)
в 1918 г. утверждать: «Отныне ни одна женщина не должна умирать от разрыва
трубы во время операции, если используется реинфузия крови».
В России первое переливание крови с учетом групп крови осуществили 23 июня
1919 г. В.Н. Шамов (1882-1962) при участии Н.Н. Еланского (1894-1964)
и И.Р. Петрова (1893-1970) в клинике факультетской хирургии Военно-меди¬
цинской академии. С этим методом В.Н. Шамов ознакомился, находясь в Америке
в клинике Д. Крайля.
То, что сегодня является привычным и рутинным, в начале века представля¬
ло большую проблему. Одна из них — сосудистый доступ для трансфузии крови
и инфузии кровезаменителей. Несмотря на изготовление многочисленных при¬
митивных устройств для переливания донорской крови реципиенту, сосудистый
доступ практически не отличался от описанного Рэном более чем за два столетия
до этого. Еще в начале XIX в. на практике применяли различные виды прямых
сосудистых анастомозов между донором и реципиентом. Все эти методы не только
наносили большой вред кровеносным сосудам, но и подвергали донора крайнему
риску. Поэтому их применение было весьма ограничено.
В 1913 г. Линдеман (Lindeman) (Нью-Йорк, США) описал метод с исполь¬
зованием шприца, который практически устранил потребность в анастомозе
(сосудистый анастомоз, в частности артериовенозная фистула между донором
и реципиентом, для прямого переливания крови) и риск посттрансфузионных
осложнений со стороны сосудов. Изобретенная Линдеманом тупоконечная широ¬
кая металлическая канюля оставалась популярной и продолжала использоваться
и усовершенствоваться до появления пластиковых катетеров, вводимых по игле.
До переливания крови с помощью прямого сосудистого анастомоза между доно¬
ром и реципиентом процедуру забора и переливания крови совершали с помощью
различных примитивных устройств, как открытых, так и закрытых, практически
не заботясь о предохранении от инфицирования. Проблема несколько упро¬
стилась с открытием в начале 1900-х годов возможности замедлять коагуляцию
на короткий срок покрытием стенок соединительных трубок парафином или вазе¬
лином. Отпала необходимость в физическом соединении кровеносных сосудов
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
35
донора и реципиента. Для забора крови использовали бутылки, флаконы и колбы
самых разных конструкций. Во время испанской гражданской войны кровь соби¬
рали в стерилизованные молочные бутыли, снабженные резиновой пробкой и сте¬
клянной трубкой. В Англии, во время Северо-Африканской кампании, когда спрос
на кровь резко возрос, для ее сбора использовались бутылки из-под пива.
Как это часто бывало в истории человечества, войны сильно стимулировали
исследования и их практическое воплощение в практику. Большое число раненых
в Первой мировой войне, необходимость восполнения кровопотери в непосред¬
ственной близости от военных действий потребовали детальной разработки про¬
блем переливания крови не только для условий мирного времени, но и в военно-
полевых условиях. Это обстоятельство имело особое значение для второго периода
развития трансфузиологии.
Создание растворов консервантов способствовало развитию программ сбора
■ распределения донорской крови. На первых этапах внедрение антикоагулянтных
растворов было сопряжено с определенными трудностями, так как большинство
госпиталей по устоявшейся традиции предпочитали использовать «свежую» кровь
■прямые переливания, где в качестве доноров крови выступали, как правило, члены
семьи и друзья. Реже больницы пользовались и услугами профессиональных доно¬
ров, которые в случае необходимости посылались в больницы службой Красного
Креста. Переливание запасенной цитратной крови было крайне редким. Но посте-
■шно преимущество заблаговременно заготовленной донорской крови при помощи
■писерванта стало очевидным, в особенности в период военных действий. В период
Первой мировой войны хирурги в армиях Антанты (Англия, Россия, Франция)
ипюолншш тысячи переливаний цитратной крови, что позволило вернуть в строй
большое количество раненых и в конечном итоге определило дополнительные
^имущества перед армией Германии и ее союзников. Так, например, в период
Первой мировой войны американский доброволец, воевавший в составе канадской
армии во Франции, О. Робертсон (О. Robertson) одним из первых организовал сбор
■ сохранение консервированной крови. Он собирал только кровь 0 группы и про¬
пел 22 переливания 20 реципиентам. Большинство доноров не участвовали непо¬
средственно в боевых действиях или являлись легко раненными и прошедшими
■ррс лечения в тылу. Большая часть крови переливалась в пределах 2-недельного
хранения, в отдельных случаях - 26-дневного хранения, без очевидных неблаго¬
приятных эффектов. Некоторые исследователи истории трансфузиологии считают
О. ІЧібертсона первым организатором банка крови. По крайней мере, его можно
сжтаггь первым организатором пункта забора, хранения и распределения донорской
фжи (банка крови) в условиях участвующей в боевых действиях армии.
Эффект от использования донорской крови в период Первой мировой войны
превзошел все ожидания. Было отмечено, что раненые, у которых выполнялась
гемотрансфузия, чаще и быстрее выздоравливали — выходили благополучно
■столько из геморрагического, но и из травматического шока.
После Первой мировой войны (вторая четверть XX столетия) переливание
прови становится доступным не только для хирургов, травматологов, акушеров,
■о ■ для врачей других специальностей и входит в арсенал лечебных процедур.
В этот период развиваются национальные службы крови, разрабатываются тео¬
ретические основы переливания крови. Вопрос о переливании крови становится
программным на послевоенном I Международном конгрессе хирургов в 1920 г.
Россия (СССР), многие годы отрезанная от научной и общественной жизни
Зіада (война, революция, эмиграция интеллигенции, ученых, врачей), отстала
■ реде отраслей, в том числе и в вопросах организации донорства и применения
метода переливания крови. Несмотря на то что отдельные энтузиасты в ведущих
■■имат нашей страны периодически использовали метод переливания крови, он
осппался неизвестным большинству врачей.
36 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
В России первое научно обоснованное переливание крови с учетом ее групповых
свойств было успешно выполнено в хирургической клинике Военно-медицинской
академии 20 июня 1919 г. В.Н. Шамовым. Поскольку в период после гражданской
войны, блокады, разрухи и голода Россия была отрезана от мира, В.Н. Шамову,
Н.Н. Еланскому и их коллегам пришлось самим создавать изогемагглютинирующие
сыворотки для определения групп крови, по существу повторить путь открытия
групп крови, правил подбора при переливании, основных правил гемотрансфузий.
За 5 лет (1919-1923) В.Н. Шамов выполнил всего 10 гемотрансфузий. Развитие
метода переливания крови шло с большими трудностями. Основная проблема —
подбор желающих сдать кровь. Нередко даже родственники больных отказыва¬
лись от донорства. Агитация донорства крови среди ближайших родственников
больного основывалась в те годы не только на большей вероятности согласия
дать свою кровь для переливания родному человеку, но и на распространенном
среди врачей мнении, что такая кровь более совместима с организмом больного,
чем кровь от «чужого» человека, и реакция организма больного на трансфузию
может быть выражена слабее. По мере накопления опыта стало выявляться все
больше данных о том, что решить вопрос об обеспечении гемотрансфузионных
потребностей за счет доноров родственников очень трудно — часто среди род¬
ственников нет человека с подходящей группой крови или они не могут быть при¬
влечены к даче крови по медицинским показателям.
В октябре 1921 г. П.Л. Оливер (P.L. Oliver) организовал в Камбервелле (Южный
Лондон) первый гражданский пункт для желающих стать безвозмездными донора¬
ми крови. При необходимости лондонские больницы обращались к П.Л. Оливеру,
и он направлял добровольцев из списка на операцию по переливанию крови.
Доноры-добровольцы заполняли анкету о состоянии здоровья, проходили неболь¬
шое медицинское обследование и проверялись на сифилис. В 1926 г. эта служба
была распространена на весь Лондон, и к 1938 г. количество донаций крови состав¬
ляло 6538.
Первое сообщение в РСФСР о реинфузии крови из брюшной полости принад¬
лежит Э.Р, Гессе (1925).
В 1925 г. К. Ландштейнер и Р. Левин (P. Levine) открыли и описали систему
антигенов М, N и Р.
Один из основоположников отечественной трансфузиологии А.Н. Филатов
доказал важность добавления в собираемую во время операции аутокровь стаби¬
лизирующего раствора и необходимость ее фильтрации перед гемотрансфузией
(1925).
В 1926 г., с целью ускорить внедрение в практику медицинских учреждений
нашей страны метода переливания крови, Наркомздравом РСФСР было принято
решение об организации специального учреждения, которое должно было ликви¬
дировать отсталость в вопросах переливания крови, заниматься исследованиями
в этой области, внедрять метод в практику здравоохранения.
Одним из знаменательных событий трансфузионной медицины стало откры¬
тие 26 февраля 1926 г. в Москве по инициативе А.А. Богданова (Малиновского)
(1873-1928) первого в мире Научно-исследовательского института переливания
крови. Известный до событий 1918 г. как революционер, философ и литератор,
имея диплом врача, А.А. Богданов стал его первым директором. Сотрудники
института с энтузиазмом взялись за новое дело, и уже к октябрю 1927 г. было
выполнено более 200 операций переливания крови, а к апрелю 1928 г. около 400.
Идея о возможности переливания крови интересовала А.А. Богданова давно.
Еще в своем романе, за двадцать лет до организации института («Красная звезда»,
1908), он высказал убеждение, что ускорить создание из человечества единого
братства, соединенного общей идеей (политический социализм), можно взаимным
обменом крови между членами этого общества.
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ 37
В институте А.А. Богданов проводил эксперименты взаимных переливаний
крови (500-1000 мл) между больными и здоровыми лицами и между больными.
Неоднократно сам участвовал в экспериментах в качестве и донора, и реципиента
крови. 24 марта 1928 г. сотрудники института провели операцию, в которой при¬
нял участие А.А. Богданов. Он по собственной инициативе обменялся кровью
с 21-летним студентом МГУ JI. И. Колдомасовым, у которого обнаружили скрытую
форму туберкулеза и последствия перенесенной ранее малярии. Планируя экспе¬
римент, А.А. Богданов полагал, что обмен кровью поможет студенту излечиться
от туберкулеза, так как сам он имеет сопротивляемость к туберкулезу. У обоих
была 0(1) группа крови. После обмена около одного литра крови у обоих через
3 ч развилась тяжелая гемолитическая реакция. 7 апреля 1928 г. А. А. Богданов,
несмотря на все усилия врачей, скончался от интоксикации вследствие почечной
недостаточности — результат гемолиза донорских эритроцитов после несовмести¬
мой гемотрансфузии. Л.И. Колдомасова неделю лечили в Институте переливания
крови, затем два месяца в туберкулезном санатории. Прожил он до середины
80-х годов XX столетия. Очевидно, у А.А. Богданова развилась трансфузионная
гемолитическая реакция, обусловленная иммунными анти-їОі-антителами (IgG),
поскольку он мог быть сенсибилизирован к одному из отсутствующих в его фено¬
типе эритроцитных антигенов (скорее всего, резус-антигену) предшествующими
двенадцатью экспериментами по переливанию крови от разных доноров (анти¬
гены системы Резус были открыты только в 39-м году XX столетия). Ученики
А-А. Богданова и его последователи продолжили исследования, связанные с про¬
блемами переливания, а НИИ переливания крови имени А.А. Богданова (в составе
Научного центра гематологии РАМН) многие десятилетия оставался ведущей
организацией по всем вопросам трансфузиологии в нашей стране.
В 1926 г. вопрос о кадрах доноров в нашей стране был поставлен на обсуждение
HJH. Еланским («Переливание крови»). Н.Н. Еланский и Э.Р. Гессе рекомендовали
привлекать в качестве доноров тех, кто из-за стремления помочь больному мог
Представить свою кровь — ближайших родственников больного, студентов, мед¬
персонал и добровольцев.
С целью активизировать донорство крови среди населения в 1927 г. в России
была введена денежная компенсация за дачу крови (с 1931 г. — выдача специаль¬
ного продуктового пайка).
14 августа 1928 г. народный комиссар здравоохранения РСФСР Н.А. Семашко
утвердил первое официальное издание «Инструкции по применению лечебного
метода переливания крови». В нем впервые излагались основные требования,
предъявляемые к донору, определялся максимальный объем крови для забора
{не должен превышать 1% массы тела донора (600 мл) и лишь для исключительно
здоровых лиц мог быть повышен до 1,25%]. В инструкции указывалось, что метод
переливания крови может быть широко применен в качестве незаменимого сред¬
ства при ряде заболеваний и допускается в практику лечебной помощи. Для пере¬
ливания крови использовали специальные устройства (рис. 1-5).
В 1928 г. В.Н. Шамов, тщательно изучив и обосновав возможность переливания
«адаверной фибринолизированной крови, предложил использовать этот метод
в клинической практике. Через два года профессор С.С. Юдин впервые в мировой
практике 23 марта 1930 г. провел успешное переливание трупной крови.
В 1928 г. в США впервые в мире врачи Ханкок (Hancock) и Рнотт (Rnott)
успешно выполнили реинфузию облученной ультрафиолетом собственной крови
(100-120 мл) двум пациенткам с угрожающим жизни послеродовым сепсисом
(идею о возможности УФО аутокрови как лечебной процедуры впервые выдвинул
Бехер в 1925 г.). В СССР УФО крови в 1937 г. впервые применили А.Н. Филатов
я Г. Касумов у больных с анемией, сепсисом, вяло гранулирующими ранами, тро¬
фическими язвами и фурункулезом.
38
ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Ч
1925-1930 гг. 1935-1948 гг.
а
?,
гл
Созданный в Ленинграде в
1932 г. постоянно функциониру¬
ющий гражданский банк донор¬
ской консервированной крови,
был первым в мире. Примерно
четырьмя годами позже С.С.
Юдин в Московском НИИ им.
Склифосовского основал банк
трупной крови. В течение несколь¬
ких лет банк снабдил кровью
для переливания 2500 пациентов
института, и несколько сотен доз
крови было перелито больным
в других клиниках. Сама кон¬
цепция заготовки трупной крови
коробила многих медиков и оспа¬
ривалась в течение многих лет.
В настоящее время заготовка када-
верной крови практически не про¬
водится, но ряд врачей в разных
странах еще несколько десятиле¬
тий продолжали экспериментиро¬
вать с данным методом.
Рис. 1-5. Устройства для прямого переливания в 1930 г. по инициативе про¬
крови (а) и стеклянная колба для консервированной фессора В.Н. Шамова был орга-
Н.Н. Еланский возглавлял комиссию по формированию в Ленинграде станции
переливания крови, реорганизованной в 1932 г. в институт (ныне — Российский
научно-исследовательский институт гематологии и трансфузиологии).
В 30-е годы выдающимся отечественным ученым С.С. Брюхоненко создан
и испытан первый прототип аппарата искусственного кровообращения — про¬
точный перфузионный аппарат (автожектор) (1934 г.), разработаны принципы
капельного переливания крови в артерии (вплоть до сонной) (Б. В. Петровский),
предложена техника введения крови в полости сердца, заложены основы аутоге¬
мотрансфузий.
В 1934 г. ДеБеки (DeBakey) описал переносной ротационный насос, который
облегчал прямое венозно-венозное переливание и стал предшественником насоса-
рулона (roller pump), на сегодняшний день стандартной части большинства при¬
боров экстракардиопульмонального (искусственного) кровообращения.
В СССР в начальный период внедрения аутодонорства (1934-1936 гг.) у больного
проводили эксфузию крови в объеме 200 мл за 8-10 дней до операции (С Л. Дошо-
янц, 1934 г.; Т.О. Жвания, 1935 г., и др.). В последующем, по мере накопления опыта,
объем однократно изъятой крови увеличили до 400 мл (Б.В. Петровский, 1965 г.;
М.И. Перельман, 1972 г.; Г.В. Головин и др., 1973 г., и др.).
В период гражданской войны в Испании (1936-1939 гг.) Д. Джорда (D. Jorda)
организовал банк крови в Барселоне, а Н. Бетун (N. Bethune), канадский хирург, —
такой же банк в Мадриде, по существу организовав службу переливания крови
для испанской республиканской армии. В этот период основная масса доноров
находилась на большом расстоянии от мест ведения боевых действий и заготавли¬
валась только кровь 1(0) и 11(A) групп. Одногруппная кровь нескольких доноров
смешивалась. Был реализован принцип — доставка крови к больному, а не больно¬
го к крови. Доноры получали дополнительное продовольствие во время донорства.
крови (б)
низован Институт переливания
крови в Харькове, а профессор
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
39
Пытаясь предотвратить рост анаэробной инфекции, в сосуды с кровью закачивали
под давлением воздух, что приводило к переходу практически всего гемоглобина
в оксигемоглобин. 9 тыс. л крови было собрано от 28 900 доноров в Барселоне
и 4 тыс. л в Мадриде. Проблема инфицирования заготовленной крови оставалась
очень актуальной. В 1933 г. в лаборатории фирмы Baxter (Baxter Transfuso-Vac)
была создана первая полностью замкнутая система для сбора, хранения и распре¬
деления крови. Сосуд (бутылка), содержащий раствор цитрата с физраствором,
был закрыт резиновой пробкой и снабжен эвакуатором, устранявшим потребность
шветнего забора во время взятия крови. В этот же период фирма Baxter создала
первый коммерчески доступный комплект для переливания крови из бутылки
больному, со специальным металлическим фильтром (рис. 1-6-1-8).
1942-1943 1949-1950
PBC.1-6L Специальные одноразовые бутылки для забора и переливания консервированной крови
В США организацию первого банка крови оспаривают госпиталь Кука (Cook
Gocmty Hospital, Chicago) в Чикаго [1937 г., основатель доктор Б. Фантус
(В. Fantus)] и группа анестезиологов из клиники Мейо (Mayo Clinic), организовав-
пе банк крови и службу переливания в 1933 г. До середины 40-х годов прошлого
столетия во многих странах сообщество анестезиологов отвечало за забор крови,
ее типирование, хранение и распределение. Так, американский анестезиолог,
контролировавший службу переливания крови с 1936 по 1955 г., Т.Н. Селдон
(ТЛ. Seldon, в 1950 г. избран президентом Американской ассоциации банков
крови) сообщает, что в течение 1935 г. 1289 доз крови было заготовлено от 711
профессиональных доноров и 578 добровольцев и перелито 754 реципиентам.
В России за сравнительно короткий срок с 1931 по 1936 г. под руководством
вдающегося организатора здравоохранения, директора Института переливания
крови (1931-1961) профессора А.А. Багдасарова развернули свою деятельность
более 50 филиалов института. Учитывая важность вопроса для страны в мирное
ж военное время, дополнительно к функционировавшим Харьковскому (1930)
ж Ленинградскому (1931) были организованы в 1932 г. Белорусский, в 1934 г.
Киевский и в 1935 г. Тбилисский институты переливания крови.
40 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Рис. 1-7. Стеклянные сосуды для забора и переливания консервированной крови (СССР, 1950-
1970 гг.). Собранный для взятия (а) и готовый для переливания (б) флакон с донорской кровью
<>б£4;«Д VPTllKtlHfl* К*
ДОСУв».-.- **ЯСт
Врш- «ДО.
*Я«Л MfXiM ираке^итк
15 Грулву ІІВДЬДОГСЦ
5J. гДОщу п*?вд»іадвмі)й Kjwm»
.5) IDHOfie' С I
A* «JKfcS*
Cfpfv
j}*JlMUl«4.T ЛДОлИВЛюиДОЇ
4t»33« njWWjWfb.'
I і rpytiuy доме Фяд!
*■' ?ЮЛМЙЬ«
U1.VC1 ^ Xi .
» 6*©A«r* «>*«*?*» *f«6y.
і ГГЯКЄГЛЯ Ж фЛЙКОП С кроль*)
і
і
Нїи>-±амь учрсодсг*», мкгогшиесго
Cre ~ aze*L„
ITfJJRU 61*»»
AB(IV)
AB(IV)
ИйИМДЧХС! Hp*l, ПДО*ИВ.ЯОМЛт ДО»*, OflSWiJ Пт»М*-
} t?M« *ЯАЧ» Ъ{*».*£Н»Ы ' ' - -,-'y \ч
■ ») »-pyafV ДО»* -/» V-',' Л%
{ Й ^рутшу яерелв9з«аеЯ к?дои ''V* Л
1 Зі ССИМбСТИвССГЬ Ь-ООІЇ ДОЛїра С СІ'-ІА'^ЦПлЩ Vfhvejj . .
] 4) 0|Чі*Лйь»-Н« Лоологи«Ч'С*у«4 cijjefly. ■'' •• і.VS*'; і;.'•■>'
Рис. 1-8. Этикетки на сосуды с кровью (СССР — Россия, 1960-2000 гг.)
К началу 30-х годов XX в. в разных странах накопился огромный научный
и клинический материал по групповым свойствам крови, заготовке, консервиро¬
ванию, хранению и распределению донорской крови, технике переливания, пока¬
заниям и противопоказаниям к гемотрансфузии, осложнениям гемотрансфузий
и другие данные, которыми необходимо было поделиться с коллегами, обсудить
результаты исследований, сделать необходимые выводы, согласовать дальнейшие
направления исследований. С этой целью был созван первый Международный
конгресс по переливанию крови, который состоялся в Риме 26-29 сентября 1935 г.
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ 41
Учитывая огромное значение проблем, связанных с переливанием крови, для
научной и клинической медицины уже через 2 года на 2-м Международном кон¬
грессе в Париже (20 сентября-2 октября 1937 г,) было основано Международное
общество переливания крови (International Society of Blood Transfusion, ISBT),
которое и по сей день является одним из самых авторитетных медицинских про¬
фессиональных сообществ, в значительной мере определяющим развитие основ¬
ных направлений трансфузионной медицины.
В СССР профессор А.Н. Филатов и Г.И. Касимов (1937) для лечения сепсиса
разработали метод переливания аутокрови, облученной ультрафиолетовыми
лучами (одно из первых упоминаний о клиническом применении УФО крови).
В 1938 г. Б. Фантус (В. Fantus) из Чикаго (США) впервые использовал филыра-
иию крови для удаления сгустков и клеточных агрегатов. Б. Фантусу приписывают
термин «банк крови и плазмы».
Во время военного конфликта на Халхин-Голе у озера Хасан были проведены
■ервые массовые переливания крови в военно-полевых условиях (для заготовки
консервированной крови было организованно ее взятие от значительного числа
•оноров во Владивостоке, Хабаровске, Чите и других городах Дальнего Востока),
•осле этого в нашей стране несколько лет обсуждался вопрос о необходимости
зиютовки для армии крови универсального донора — 0 группы. За широкое
использование в период военных действий крови универсальных доноров высту¬
пали В.Н. Шамов, А.А. Багдасаров, С.И. Спасокукоцкий и др. Однако уже к 1940 г.
от этого ошибочного мнения отошли. В Германии санитарной службой армии
(шло признано необходимым заготавливать кровь всех четырех основных групп
крови.
Широко применяли метод переливания крови в период Советско-финляндской
■ойны 1939-1940 гг, — за 100 дней войны было перелито 8 т крови. За эти же дни
• Ленинградском институте переливания крови была заготовлена кровь от 6000
•оноров-добровольцев.
В апреле 1939 г. для обеспечения Лондона кровью английским Отделом пере¬
живания крови Медицинского исследовательского центра (MRC) были созданы
четыре пункта (хранилища) для консервированной донорской крови (в последую¬
щем реорганизованные в региональные центры службы переливания крови).
В конце 30-х и начале 40-х годов был разработан метод получения безводной,
высушенной плазмы. Изготавливалась она методом лиофилизации (обезвожива¬
ет) и могла долго храниться, легко перевозилась и была проста в приготовлении.
После разведения плазма приобретала практически все свои нативные свойства
■ могла использоваться для переливания больным.
В 1940-1941 гг. К. Ландштейнер, А. Винер, Р. Левин и Р. Стетсон (A. Wiener,
P. Levine, R.E. Stetson) открыли систему резус. Вскоре была открыта причина
гемолитической болезни новорожденных и предложен метод лечения — обменное
■ереливание резус-отрицательной одногруппной донорской крови.
Начало 1940-х годов ознаменовало очередную важную веху в трансфузиологии.
Группа химиков из Гарварда во главе с Э. Кон (Е. Cohn) разработали метод фракци-
оифования плазмы, позволяющий получать на производстве необходимые для кли-
шпеского применения основные препараты плазмы человека — альбумин, имму-
шжтюбулины, факторы свертывания, которые можно было применять без учета
групповых свойств. И по сей день во всем мире этот метод носит имя автора (под¬
робнее в главе «Производственная трансфузиология»). Открылась возможность
собирать, хранить, распределять и применять не только консервированную кровь,
■о и использовать в качестве кровезаменителей лиофилизированную плазму
■ альбумин, заготовленные заблаговременно в тылу.
СССР к 1940 г. располагал мощной сетью учреждений Службы крови (несколь-
п> профильных НИИ, несколько десятков СПК), которые позволили увеличить
42 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
количество гемотрансфузий за пять лет с 1935 по 1940 г. в 10 раз — с 22 ООО
до 220 ООО переливаний крови.
Потребность в крови и ее компонентах во время Второй мировой войны создала
условия и значительно стимулировала организацию эффективной системы сбора
донорской крови и ее распределения (война в очередной раз ускорила развитие
трансфузиологии).
Во время Великой Отечественной войны Служба крови СССР прошла три основ¬
ных этапа развития.
Первый этап связан с ее развитием и формированием. В первые месяцы военных
действий стала очевидной необходимость создания в действующей армии специ¬
альной организации, руководящей переливанием крови в лечебных учреждениях.
В начале войны Главным военно-санитарным управлением СССР была разработана
и направлена в войска «Инструкция по переливанию крови в Красной Армии».
Первоначально планировалось централизованно снабжать полевые госпитали консер¬
вированной кровью, заготовленной в тылу станциями и институтами переливания
крови. Но реализовать этот проект не удалось в полной мере, поскольку пункты
забора крови (станции переливания крови и отделения), как правило, находились
в глубоком тылу, а кровь нужна была не только в тыловых госпиталях, но и непосред¬
ственно в районе боевых действий для лечения раненых с кровопотерей. В сложной
обстановке начального периода войны, когда нарушилась система управления,
были вынуждены отказаться от централизованного снабжения фронтов консер¬
вированной кровью. Необходимо было службу крови (заготовку донорской крови)
переместить ближе к воюющей армии. К осени 1941 г. в советской армии создают¬
ся первые внештатные «группы переливания крови» (Еланский Н.Н.). Через год
в составе санитарного управления Западного фронта было образовано отделение
переливания крови (ОПК), подчинявшееся главному хирургу фронта. Госпитали
каждого фронта снабжались кровью из нескольких станций переливания крови,
переданных в оперативное подчинение.
Только за первый год войны Центральный институт переливания крови загото¬
вил для фронта более 55 т консервированной крови. Объем работы СПК по всей
стране возрос в десятки раз.
Второй этап характеризуется накоплением и обобщением опыта, организацион¬
но-штатным формированием новых учреждений службы крови и широким вне¬
дрением переливания крови в практику лечения раненых и больных. В этот период
для снабжения донорской кровью госпиталей наступающей по всем фронтам
Советской армии (СПК, находящиеся в больших городах, оказались в глубо¬
ком тылу) Наркомздрав принимает решение об организации передвижных СПК
для каждого фронта. Во всех лечебных учреждениях фронта и эвакогоспиталях
были выделены врачи, ответственные за обучение медицинского персонала заготов¬
ке, хранению и распределению консервированной донорской крови и проведению
гемотрансфузий. На флотах и при госпиталях военно-морских баз были организо¬
ваны пункты переливания крови. Армейские и фронтовые станции переливания
крови на базе крупных госпиталей могли заготовить перед боевой операцией
до 200-300 л крови (Шамов В.Н., Еланский Н.Н., Ахутин М.Н.).
Третий этап военного периода — завершение организации стройной системы
службы крови в тылу и в районе военных действий, массовое применение пере¬
ливания крови во всех лечебных учреждениях Советской армии.
С началом Второй мировой войны по всей Великобритании были организованы
региональные банки донорской крови. В это же время Американский Красный
Крест организовал региональные центры сбора крови, которые позволили к концу
войны заготовить более 13 млн доз крови.
В середине войны (1943) Лоутит и Моллисон (Loutit, Mollison) из Лондонского
банка крови определили, что подкисленне цитрата декстрозы, входящего в широ-
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
43
во применявшийся к тому времени консервант (хлористый натрий, цитрат натрия
я декстроза) предотвращает карамелизацию декстрозы при стерилизации. Был
создан и внедрен в практику заготовки донорской крови новый консервант
крови — раствор acid-citrate-dextrose (ACD), и отношение крови и антикоагулянта
было снижено до 6:1. ACD стал стандартным антикоагулянтом и консервантом
■ оставался в использовании до появления раствора citrate-phosphate-dextrose
(CPD) в 1957 г. В последующем для увеличения сроков хранения в раствор был
добавлен аденин, а затем маннитол, что позволило увеличить срок годности сна¬
чала от 21 до 35, а затем и до 42 дней.
Большую роль в развитии и укреплении службы крови действующей Советской
армии сыграло «Руководство по переливанию крови» (1943 г., Шамов В.Н.).
За годы войны в военных лечебных учреждениях СССР было проведено около
7 млн гемотрансфузий. В 1945 г. в медсанбатах 10-12% раненых получали перели¬
вание крови, в госпиталях армии — 7-9%, в госпитальных базах фронта — 13-14%.
Развитая в достаточной степени служба крови Советской армии позволяла уже
■ концу Великой Отечественной войны применять на этапах специализированной
медицинской помощи вместо цельной консервированной крови отдельные ее ком¬
поненты (Карташевский Н. Г.).
Впервые в 1940 г. Д. Элиот (J. Elliott) продемонстрировал терапевтическую эф¬
фективность альбумина, а выдающийся хирург из Филадельфии И. Равдин (I. Rav-
4m) через год (1941 г.) получил опыт эффективного лечения альбумином раненых
солдат при атаке японской авиации на американскую базу Перл-Харбор (Pearl
Ssbor).
В период Второй мировой войны (1938-1945) массовое применение метода
■ереливания крови и кровезаменителей спасло миллионы жизней. Только в СССР
■о время войны в действующую армию было направлено более 1,7 млн л консерви¬
рованной крови, заготовленной от 5,5 млн доноров крови (Багдасаров А.А.).
В этот период продолжается развитие и совершенствование организации службы
■рою во всех странах, где в клинической практике используют переливание крови.
В нашей стране к концу сороковых годов прошлого столетия служба крови
(оформилась в виде многочисленных учреждений, объединенных общими идеоло-
пей, методами работы, инструкциями, рекомендациями, наставлениями, унифи¬
цированным оборудованием и административным контролем со стороны органов
эиравоохранения. Во многом основные принципы ее работы сохраняются в насто-
штее время. Впоследствии многие страны при организации или реорганизации
шииональных служб крови использовали богатый опыт организации и функцио-
врования системы службы крови СССР.
Донорство вышло за пределы узко медицинской проблемы, когда решался
только вопрос об обеспечении кровью лечебных учреждений, и стало проблемой
социальной, отражающей взаимоотношения людей и тем самым затрагивающей
интересы всего общества.
В конце Второй мировой войны (1945) английский ученый P.P. Кумбс
(ILR. Coombs) выдвинул идею использовать иммунные антитела животных
для выявления иммуноглобулинов человека, Кумбс, Моурант (Mourant) и Рейс
(Race) описали применение антиглобулина человека (Coombs Test — тест Кумбса)
■ля выявления «неполных» антител. Принцип реакции Кумбса оказался универ¬
сальным и используется по сей день (см. раздел «Трансфузионная иммунология»).
С помощью этого метода открыто более 500 эритроцитных факторов 36 антиген¬
ных систем.
В США в течение ноября 1947 г. была организована Национальная ассоциация
независимых банков крови, и тогда же сформировалось одно из самых больших
■ авторитетных объединений трансфузиологов — Американская ассоциация бан¬
ков крови. В декабре 1947 г. Красный Крест США сформулировал план возрожде¬
44 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
ния региональных центров крови и открыл первый в Рочестере (штат Нью-Йорк)
банк крови.
К 1950 г, сформировалась Федеральная система службы крови Соединенных
Штатов из приблизительно 1500 госпитальных банков крови, 46 общественных
центров крови и 31 центра крови Американского Красного Креста — Американская
ассоциация банков крови (ААВВ). Открылась возможность оперативно обмени¬
ваться кровью между банками крови Соединенных Штатов.
Е. Кон (Е. Cohn) в 1950 г. разработал метод выделения тромбоцитов из цельной
крови для лечения больных с депрессией костного мозга (в случае массового пораже¬
ния в ядерной войне). Это событие можно считать началом компонентной терапии.
В этом же году в качестве криопротектора был впервые применен глицерин,
что значительно облегчило проблемы замораживания и длительного хранения
эритроцитов. Возможность криоконсервации эритроцитов позволяла сохранять
клетки в течение многих лет и после размораживания применять в клинической
практике. К сожалению, сложность, большие затраты при заготовке и размора¬
живании клеток, относительно малый объем выхода готовой продукции после
размораживания препятствуют использованию метода в повседневной практике.
Как правило, криоконсервируют и хранят эритроциты редких групп крови.
МакКуллоуг (McCullough), изучив национальные программы крови в развитых
странах, пришел к выводу, что, хотя имеется много подобий и отличий, «каждая
сарана создает свою программу крови, соответствующую ее культуре, философии
и системе здравоохранения».
Новая историческая веха, сопоставимая с открытием групп крови и возмож¬
ностью длительной консервации донорской крови, в трансфузиологии наступила
с внедрением в середине прошлого века пластикового контейнера для сбора и хра¬
нения консервированной крови (производился под названием Fenwal), изобретен¬
ного в 1949-1950 гг. К. Уолтером (С. Walter, США). Исследования были выпол¬
нены по заказу военной медицины в преддверии войны в Корее. В дальнейшем
появились модификации из нескольких пластиковых контейнеров, позволяющие
разделять клеточные компоненты и плазму крови в закрытой системе.
Для стандартизации процедур получения компонентов крови и их качества
важное значение имели разработка и внедрение в производство в 1953 г. рефриже¬
раторной центрифуги для разделения крови на компоненты. Центрифуга с охлаж¬
дением позволила разработать метод получения криопреципитата для лечения
гемофилий. Криопреципитат был эффективным препаратом для лечения больных
в течение многих десятилетий и в отсутствие специфических факторов свертыва¬
ния остается востребованным и в наши дни.
В середине 1950-х годов французский ученый, впоследствии лауреат Нобелев¬
ской премии (1980 г.), Ж. Доссе открыл и начал изучать антигены лейкоцитов
человека {human leukocyte antigens, HLA), их роль при отторжении трансплантата
и гемотрансфузиях.
В 1955 г. В. Горовиц (В. Horowitz,) и А. Принц (A.M. Prince) разработали метод
инактивации вирусов обработкой белкового раствора растворителем и детергентом
(S/D метод). Этот принцип лег в основу одного из методов инактивации вирусов
плазмы, разработанных в конце XX в. и внедряемых в службу крови в ряде стран.
В середине пятидесятых годов (1954-1958) были разработаны технологические
приемы, позволившие из плазмы человека выделять иммуноглобулины направ¬
ленного действия для лечения таких заболеваний, как оспа и др.
Доступность получения плазмы методом афереза позволило А. Климану (A. Kli-
man) в 1961 г. предложить извлекать донорские тромбоциты из обогащенной
тромбоцитами плазмы, полученной путем плазмафереза.
В конце 50-х-начале 60-х годов XX в. были выполнены первые исследования
по использованию плазмафереза при лечении различных заболеваний. В 1959 г.
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
45
В, Скуг и В. Адамс (W.A. Skoog, W.S. Adams) опубликовали первую работу о лечебном
плазмаферезе у больного с макроглобулинемией Вальденстрема. [Термин «плазмафе-
рез» был предложен американским врачом Д. Абелом (J.J. Abel) в 1914 г.]
В начале 60-х годов XX в., когда в ряде европейских и других стран были начаты
поиски методов интенсивной детоксикации организма, в СССР эти исследования
возглавил профессор Ю.М. Лопухин.
В это же время, когда на смену стеклянной таре для сбора крови постепенно
внедряются пластиковые емкости (контейнеры с консервантом), впервые стало
возможно разделять кровь на компоненты в полностью закрытой стерильной
системе. С внедрением контейнеров и пластиковых магистралей были сведены
иа нет температурные реакции реципиентов, связанные с повторными стерилиза¬
циями резиновых компонентов системы и стеклянных бутылок.
1 октября 1960 г. приказом Министерства здравоохранения РСФСР в Кирове
был открыт филиал Ленинградского ордена Трудового Красного Знамени научно-
исследовательского института переливания крови. 1 ноября 1965 г. филиал был
реорганизован в Кировский научно-исследовательский институт переливания
■рови, а в мае 1982 г. — в Кировский научно-исследовательский институт гемато¬
логии и переливания крови, это был 3-й профильный институт в СССР.
Внедрение афереза крови (разделение на компоненты на специальных цен¬
трифугах, а впоследствии с помощью специальных приборов непосредственно
j кресла донора) расширило потенциал Службы крови, обеспечив возможность
■мучения нескольких компонентов от одного донора, что позволило значительно
сократить количество привлекаемых доноров.
Первый концентрат антигемофилического фактора VIII (AHF) получен путем
фракционирования плазмы в 1962 г.
Необходимость заготовки значительных объемов плазмы для фракционирова-
ш на препараты крови (альбумин, иммуноглобулины и др.) требовала разработ¬
ки технологий, позволяющих заготавливать большие объемы плазмы. В значи-
теяьной степени эта проблема была облегчена началом использования в 1964 г.
швзмафереза для массовой заготовки плазмы для фракционирования.
Параллельно совершенствованию производства компонентов и препаратов
крови проводились разработка и широкое внедрение плазмозамещающих раство-
Р»-
В 1962 г. был разработан первый фильтр для удаления лейкоцитов из крови
с целью профилактики аллоиммунизации лейкоцитными антигенами. В конце
XX в. лейкодепляция (удаление лейкоцитов) станет обязательной для компонен¬
тов крови в ряде стран, в том числе и России.
В 1963 г. Б.С. Блюмберг (В. S. Blumberg) определил причину трансфузионных
гепатитов, описав «австралийский» антиген, который впоследствии был иденти¬
фицирован как поверхностный антиген вируса гепатита В (HBsAg).
С развитием методов консервирования и фракционирования крови изменились
■мходы к назначению трансфузий цельной крови. При назначении гемотерапии
основное внимание уделяется заместительному действию. Уточняются тактика,
■оказания и противопоказания к трансфузионной терапии, исследуются состав
■ механизм действия различных трансфузионных сред, методы их использования
к лечебного действия, возможность комбинированного применения для повы¬
шения эффективности трансфузионной терапии, методы профилактики реак¬
ций и осложнений, вызванных переливанием крови и кровезаменителей. Резко
■оиысилась эффективность гемотерапии благодаря дифференцированному при¬
менению крови, препаратов крови и кровезаменителей. С середины 50-х годов
XX столетия в западных странах постепенно начинается повсеместный переход
от гемотрансфузий цельной крови к новой, более клинически и экономически
выгодной доктрине — компонентной гемотерапии. Способствовало этому внедре¬
46 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
ние в трансфузиологическую практику более совершенных технических средств
и аппаратов, в том числе из современных полимерных материалов, новых консер¬
вирующих растворов, обеспечивающих высокую безопасность трансфузионной
терапии и ее удобство в условиях любого лечебного учреждения.
Мировая медицинская практика к 50-60 гг. XX века накопила огромный опыт
по переливанию консервированной донорской крови. Анализ полученного опыта
показывал, что наряду с выраженным клиническим эффектом гемотрансфузии
имеют ряд отрицательных моментов, значительно влияющих на результаты лече¬
ния. К середине 60-х годов все более значимой становится проблема изосерологи-
ческой и инфекционной безопасности гемотрансфузий.
И в нашей стране с середины 60-х годов начинает внедряться новая транс¬
фузионная доктрина, предусматривающая не столько использование цельной
консервированной донорской крови, сколько применение гемодериватов: эритро-
цитной, тромбоцитной, лейкоцитной массы, плазмы или ее белковых фракций,
т.е. тех клеточных или белковых компонентов, которые оказались в дефиците
при том или ином заболевании. Происходит резкий рост потребности в средствах
трансфузионной терапии. Разрабатываются и применяются в клинике трансфу-
зиологические методы регулирования функций организма при шоке, кровопотере,
при наследственных аномалиях крови, у гематологических больных, при тяже¬
лых поражениях печени и свертывающей системы крови, у тяжелых послеопе¬
рационных больных с сердечно-сосудистой и дыхательной недостаточностью.
Изучаются и внедряются методы экстракорпоральной гемокоррекции (см. раздел
«Клиническая трансфузиология»). Как альтернатива аллогенной гемотрансфу¬
зии в ведущих центрах внедряются методы аутогемотрансфузий. В нашей стране
в пропаганде, разработке и внедрении метода аутокрови большое значение имели
работы Б.В. Петровского, И.С. Колесникова, М.И. Перельмана, В.А. Климанского
И др.
Пионерами в области лечебного цитафереза следует, очевидно, считать
Р. Колмана (R.W. Colman) и соавт., предложивших в 1966 г. использовать техно¬
логию, которую применяли при получении донорских тромбоцитов (при разделе¬
нии цельной крови на эритроцитную массу и плазму, обогащенную тромбоцитами,
путем «мягкого» центрифугирования с последующим «жестким» центрифугиро¬
ванием получали концентрат тромбоцитов, а обедненную тромбоцитами плазму
реинфузировали донору) для удаления тромбоцитов у больных с тромбоцитозом.
В СССР метод аутогемотрансфузий с 1965 г. начали выполнять при операциях
с искусственным кровообращением. После вводного наркоза перед операци¬
ей больному проводили обменное переливание крови в объеме 30-40% ОЦК.
Полученную аутокровь переливали в конце операции (Петровский Б.В,).
Для получения лечебных доз гранулоцитов от доноров компанией JBM
и Национальным раковым институтом (США) в 1965 г. был создан первый специ¬
альный аппарат (Freireich E.J., Judson G., Levin R.H., 1961), который мог разделять
кровь на компоненты в автоматическом режиме. Лечебный плазмаферез с помощью
этого аппарата был проведен в 1969 г. (Buckner C.D., Clift R., Thomas E.D., 1969).
В 1967 г. был внедрен в практику коммерческий антирезусный иммуноглобу¬
лин, что позволило не только лечить гемолитическую болезнь новорожденных,
но и проводить профилактику этой грозной патологии.
С 1968 г. стали применять плазмаферез для лечения беременных с резус-кон¬
фликтом.
В 1968 г. ВОЗ рекомендует аутогемотрансфузию как эффективный метод лече¬
ния хирургических кровотечений.
После того как в 1969 г. С. Мэрфи и Ф. Гарнер (S. Murphy, F. Garner) проде¬
монстрировали возможность хранения тромбоцитов при комнатной температуре,
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ 47
значительно облегчилась заготовка и соответственно расширилась возможность
снабжения клинических подразделений тромбоцитами.
В 1969 г. в Москве впервые прошел XII Международный конгресс по перелива¬
нию крови.
В 1971 г. начато регулярное тестирование крови на поверхностный антиген
вируса гепатита В (HB^Ag) [Бенсон (Beeson) еще в 1943 г. описал «серологическую
желтуху» как результат переливания крови].
Впервые в 1972 г. для выделения клеток периферической крови применен метод
афереза.
В 1975 г. в Кирове на Учредительной конференции было создано Всероссийское
общество гематологов и трансфузиологов.
Впервые в 1976 г. Д. Бергстром 0. Bergstrom) с целью устранения гипергидра¬
тации предложил метод изолированной ультрафильтрации, выполняемый путем
создания повышенного положительного гидростатического давления протекаю¬
щей через капиллярный гемодиализатор или гемофильтр крови частичным пере¬
жатием магистрали на выходе из диализатора.
Учитывая социальную значимость службы крови, в мае 1975 г. XXVIII Ассамблея
ВОЗ принимает специальную резолюцию, обращенную к членам ВОЗ:
• развивать национальные службы крови на основе безвозмездного донорства;
• формировать законодательное регулирование деятельности служб крови
и предпринимать другие действия для сохранения и укрепления здоровья
доноров и реципиентов крови и ее продуктов.
Впервые в 1975 г. JI. Хендерсон (L. Henderson) предложил метод гемофильтра¬
ции — конвекционное освобождение крови от воды и растворенных в ней веществ
с восполнением потерь воды и электролитов электролитным раствором.
Липен (Lupien) и соавт. в 1976 г. описали новый метод, позволяющий избира¬
тельно удалять из крови атерогенные липопротеиды (липопротеиды низкой плот¬
ности), применяя раствор стандартного гепарина в лечении пациентов с семейной
пшерхолестеринемией.
К середине 70-х годов XX в. открыты основные эритроцитные антигенные
системы, определена их клиническая значимость при гемотрансфузиях, разрабо¬
тки рекомендации по выполнению исследований по совместимости крови донора
ш реципиента по эритроцитным антигенным системам. Большое значение прида¬
ется профилактике изосенсибилизации антигенами лейкоцитов человека — HLA,
исследуется иммунологическая активность HLA-антигенов, реакция и осложне-
пя. вызываемые HLA-антителами, разрабатываются рекомендации по профилак¬
тике. Были открыты и изучены специфические антигены гранулоцитов системы
NA-NB (Lalezari Р., Зотиков Е.А.). Одним из первооткрывателей антигенов этой
системы и исследователей их клинической значимости был отечественный уче¬
ный. академик РАМН, проф. Е.А. Зотиков.
В 1979 г. под руководством И.С. Колесникова, М.И. Лыткина и В.Т. Плешакова
быка опубликована одна из первых обстоятельных монографий, освещающих про¬
биту аутодонорства и аутогемотрансфузий, — «Аутотрансфузия крови и ее компо-
идпов», которая не потеряла своей актуальности по многим вопросам и по сей день.
В 1979 г. внедрен новый консервант CPDA-1 (США), продлевающий срок хра-
кния цельной крови и эритроцитов до 35 дней.
В 1979-1980 гг. Т. Агисши (Т. Agischi) и соавт. впервые описали процедуру
штативного удаления из плазмы патологических компонентов с большой моле¬
кулярной массой — метод каскадной плазмофильтрации.
Решением Ученого медицинского совета М3 СССР от 21.09.1981 г. для кли-
вческого применения с целью повышения неспецифической резистентности
организма была разрешена квантовая гемотерапия (УФО, лазерное облучение
фояи др.).
48 ОБЩИЕ вопросы трансфузиологии
Введение в практику заготовки крови новых защитных растворов в 1983 г.
позволило увеличить срок хранения эритроцитов до 42 дней.
К концу 70-х годов XX в. большое внимание уделяется и обеспечению инфек¬
ционной безопасности. Идентификация в 1964-1965 гг. HBsAg и развитие более
чувствительных методов исследования позволило уточнить список трансмиссив¬
ных инфекций. Внедряются тесты на выявление гемотрансмиссивных инфекций
гепатита В и позже гепатита С, а с открытием вирусов иммунодефицита человека —
и на определения инфицированное™ доноров на эти вирусы. В конце 1970-х годов
в среде гомосексуалистов регистрируются первые случаи инфицирования вирусом
иммунодефицита человека (ВИЧ). Но лишь в 1982 г. появились первые данные
о наличии ВИЧ в донорской крови и ее компонентах.
С 1983 г. исследование крови на все основные трансмиссивные инфекции (гепа¬
титы В и С, ВИЧ, сифилис) стало обязательным.
Иммуногематологи с середины 90-х годов интенсивно исследуют тромбоцит-
ные антигены, их клиническую значимость при гемотрансфузиях и транспланта¬
ции костного мозга.
В настоящее время снабжение кровью (компонентами крови) в развитых стра¬
нах благодаря ее тестированию методом карантинизации и вирусной инактивации
в достаточной степени обеспечивает ее безопасность для реципиента. Первичный
метод предотвращения распространения гемотрансмиссивных инфекций включает
тщательный строго регламентированный отбор потенциальных доноров на основе
их медицинской и социальной истории. Большинство стран осуществляет лабора¬
торное тестирование на HBsAg, HCV, ВИЧ и сифилис. Некоторые страны, включая
США и Японию, с 1989 г. при скрининге крови доноров начали определять антитела
к Т - лимфотропному вирусу 1 (anti-HTLV-1).
Начало тестирования донорской крови на ВИЧ-1 и ВИЧ-2 (HIV-1 и HIV-2) анти¬
тела (анти-HIV-1 и анти-Н1Ч-2) относится к 1992 г. С 1996 г. внедрено тестирова¬
ние крови на ВИЧ-1 р24 (HIVp24) антиген.
Для всей крови и ее компонентов, ввозимых на территорию Европейского
экономического сообщества, необходимо иметь данные по уровню аланинами-
нотрансферазы (АЛТ). В России и большинстве стран СНГ АЛТ является одним
из тестов при исследовании донорской крови (после внедрения высокочувстви¬
тельных тестов, позволяющих выявлять гепатиты В и С, в некоторых странах
от определения уровня АЛТ у доноров крови отказались). Вопрос о целесообраз¬
ное™ этого теста в обеспечении безопасности и качества компонентов донорской
крови как маркера уже не столько гемотрансмиссивных инфекций (гепатитов),
сколько как суррогатного маркера состояния здоровья донора, обсуждается.
В эндемичных областях кровь может быть проверена на антитела на трипаносо-
мозах (Cruzi Т.) и бруцеллез.
В последние годы в целях повышения инфекционной безопасности внедряются
новые методы исследования - иммуноферментные тесты следующих поколений
с высокой разряжающей способностью выявлять как антитела, так и инфекцион¬
ные антигены. Очевидно, в ближайшие годы на станциях и в отделениях перели¬
вания крови всех развитых стран, в том числе и России, внедрят в практику метод
полимеразной цепной реакции нуклеиновых кислот (ПЦР), что позволит значи¬
тельно сократить серонегативный период для гепатита В, С и ВИЧ.
Необходимо оговорить, что всегда существует вероятность, что инфицированный
донор серонегативен и инфекция не может быть определена доступными лаборатор¬
ными методами или в крови имеются неизвестные науке инфекционные агенты.
Трансфузиолога должны быть всегда готовы к появлению новых гемотрансмис¬
сивных заболеваний и своевременно и адекватно реагировать на любые, реальные
или потенциальные, опасности. Наглядным примером последних лет может служить
болезнь Крейтцфельдта-Якоба — губчатая энцефалопатия с наличием прионов —
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ 49
патологических беков, могущих инфицировать реципиента крови или ее компо¬
ненты. Болезнь описана впервые в 1966 г., и уже через несколько лет встал вопрос
о ее гемотрансмиссивности в связи с продолжительным инкубационным периодом.
Очень продолжительный инкубационный период (иногда 10 лет и более) делает
эго инфекционное заболевание трудно диагностируемым. Насколько оно является
гемотрансмиссивно опасным, обсуждается, В экспериментах на животных показано,
что передача болезни Крейтцфельдта-Якоба возможна при трансфузиях как цель¬
ной крови, так и плазмы, и лейкотромбослоя (Houston F. et al., 2000; Hunter N. et. al.,
2002). В Англии зарегистрировано несколько случаев (первый в 2003 г.), когда диа¬
гноз заболевания был установлен у пациента, полущившего много лет назад гемо¬
трансфузию крови донора, болевшего болезнью Крейтцфельдта-Якоба (Pincock S.
et. al., 2004). В Великобритании принято решение не использовать плазму доноров
британцев для производства препаратов крови (для этого плазму завозят из США
в Германии) и рекомендовано использовать для лечения родившихся после 1 янва¬
ре 1996 г. СЗП из регионов с низкой эндемичностью коровьего бешенства и болез-
нн Крейтцфельдта-Якоба. В Канаде и США отсрочивают на время от кроводачи
доноров, если они находились какое-либо время на территории Великобритании.
Подсчитано, что данное действие уменьшит снабжение кровью США на 11%
(Заудер Г. Л., Стехлинг Л.). (Более подробно об инфекционной безопасности крови
см. главу «Трансфузионная иммунология».)
К началу 80-х годов на фоне бурного развития различных отраслей биологии
■ медицины, информационных технологий происходят качественные изменения
ш во всех разделах трансфузионной медицины, что позволяет говорить о начале
ціеіьего периода трансфузиологии, который охватывает время до конца XX СТО¬
ЛЕТНЯ.
80-е годы ознаменовались крупными научными открытиями в биологии и меди-
«яве, среди которых для трансфузионной медицины важнейшее значение имело
открытие генетически детерминированных структур поверхностей клеток, регули¬
рующих иммунные реакции (Нобелевская премия 1980 г., Б. Бенецерраф, Ж. Доссе,
Дм. Снелл), разработка техники получения гибридов и теория идиопатических
штител (Нобелевская премия 1984 г., Н. Ерне, Ц. Милыптейн, Г. Келлер).
В 1985 г. Носе и Малчески (Nose, Malchesky) из Кливлендской клиники США
4Qeveland Clinic Foundation) предложили метод термофильтрации (разновидность
вскадной плазмофильтрации), когда во время процедуры отделенная плазма
■□ступает в каскадный фильтр в охлажденном виде, и в результате образовавший¬
ся комплекс — криопротеин, состоящий из липопротеидов и фибриногена, удаля¬
ет.
В1985 г. метод инактивации вирусов «растворитель/детергент» (Solvent/Deter-
geni. SD) лицензирован для обработки концентратов факторов свертывания
я США. Суть метода заключается в инкубации пулов плазмы с органическим
растворителем три (n-бутил) фосфатом (TNBP) и детергентом Тритон Х-100.
При SD-обработке разрывается оболочка вирусов, содержащая липиды, и инфек-
доюнность вирусов иммунодефицита человека, гепатитов В, С и др. утрачивается.
Процедура сохраняет в пуле антитела, в том числе к безоболочечным вирусам
юитита А и парвовирусу В19.
В последней четверти XX в. научно-технический прогресс, бурное развитие
«формационных технологий, компьютерной техники позволили разработать
«дожную и доступную для медицинских учреждений высокопроизводительную,
эффективную и безопасную для пациента медицинскую технику для проведения
враисфузиологических экстракорпоральных процедур — плазмафереза, иммуно-
фереза, искусственного кровообращения, гемодиализа и др.
В середине восьмидесятых годов экспертами Комитета по переливанию крови
Совета Европы (Blood Transfusion Expert Committee of the Council of Eorope) сфор¬
50 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
мулировано положение о новой медицинской специальности — трансфузиологии
и специалисте по трансфузионной медицине:
«Специалист по трансфузионной медицине - квалифицированное медицинское
лицо, обладающее полными знаниями и определенным опытом в клинической и лабо¬
раторной медицине; прошедшее специальное обучение в области общей гематологии,
иммунологии и практики переливания крови, ее компонентов:
• который способен гарантировать максимальную эффективность и безопас¬
ность для донора и реципиента каждой процедуры переливания крови, ее ком¬
понентов;
• который ответствен за планирование и организацию заготовки, приготовле¬
ние, хранение, распределение и оптимальное использование крови и ее продук¬
тов, при установленных определенных методах качественного контроля;
• который помогает и советует при решении диагностических и терапевтиче¬
ских проблему больных, требующих трансфузий;
• который активно участвует в научных исследованиях и развитии трансфузи¬
онной медицины как науки;
• кто способен и желает обучать трансфузионной медицине врачей, студентов-
медиков и любых других сотрудников по данной профессии».
В США в 80-е годы XX в. врачи патологи, которые долгое время возглавляли
Банки крови и не особенно были заинтересованы в развитии клинических аспек¬
тов трансфузионной медицины (их задача ограничивалась поставкой в лечеб¬
ные учреждения в необходимом количестве тестированной донорской крови),
постепенно уступают место врачам нового поколения, специалистам, которые
были заинтересованы в развитии клинических аспектов трансфузиологии —
аутогемотрансфузий, экстракорпоральных методов детоксикации, применения
кровезамещающих растворов и др., что позволяло всей трансфузиологической
практике адекватно реагировать и адаптироваться к быстро меняющейся ситуа¬
ции в условиях научно-информационного прогресса. Риск гемотрансмиссивных
инфекций, иммуномодулирующих эффект аллогемотрансфузий, стимулировал
необходимость разработки и внедрения альтернативных методов гемотерапии.
На практике шире начали использовать аутодонорство и различные варианты
аутогемотрансфузий — реинфузии, нормоволемическую гемодилюцию и др. (см.
главу «Аутодонорство и аутогемотрансфузии»), когда внедрялись хирургические
и анестезиологические методы сбережения операционной кровопотери, чаще при¬
менять искусственные кровезаменители и препараты крови (альбумин, иммунол-
глобулины, факторы свертывания). В этот же период было признано, что нацио¬
нальные медицинские школы прилагали недостаточно усилий для поощрения
разработок соответствующих учебных планов по трансфузиологии. В надежде
привлечь студентов-медиков в эту развивающуюся дисциплину и подготовку
врачей трансфузиологов Национальный институт сердца, легких и крови США
в 1983 г. учредил премию Академии трансфузиологии, которой награждали вра¬
чей (анестезиологов, хирургов, акушеров, трансфузиологов и др.), использующих
в своей практике современные достижения трансфузионной медицины, направ¬
ленные на снижение объема использования переливания крови, повышение
безопасности гемотрансфузионной терапии, внедрение новых трансфузионных
технологий в практику и пр. Вскоре были созданы региональные и национальные
учебные планы по трансфузиологии.
В США врачи впервые с 19S0 г. стали проходить обязательное обучение и спе¬
циализацию по трансфузиологии. На международном уровне национальные орга¬
низации Европы, Канады и Соединенных Штатов на конференциях поддержали
исследования новых методов в трансфузиологии. В Европе начинает свою работу
и в течение многих лет успешно функционирует Интернациональная школа транс¬
фузиологов (ESTM), в которой повышают свою квалификацию специалисты
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ 51
из многих стран, в том числе и СНГ (The European School of Transfusion Medicine,
ESTM, Teaching of Transfusion Medicine, U. Rossi, J. D. Cash: editors, 1990).
В 1987 г. Клейн (Klein) в США и Бладжман (Blajchman) в Канаде, учитывая
изменения, произошедшие за последние десятилетия в службе крови и клиниче¬
ском применении компонентов и препаратов крови, предложили для новой дис¬
циплины название — «трансфузиология». В 1993 г., на основании запроса веду¬
щих трансфузиологов США в Американскую медицинскую ассоциацию (1992 г.),
устаревшее название специальности «Патология. Банки крови» было официально
заменено на «Банки крови. Трансфузиология». Так, одна из самых больших
и авторитетных медицинских организаций мира, врачебное сообщество США,
признало существование новой мультидисциплинарной специальности.
Термин «трансфузионная медицина» («трансфузиология») получил признание
ао всех странах и стал общепринятым названием отдельного раздела медицин¬
ской науки и практики, новой медицинской специальности — трансфузиологии.
Специалист-врач, работающий в этой медицинской дисциплине, — трансфузио-
лог. Разработаны специальные программы обучения по специальности «Транс¬
фузиология» (Франция, Германия, Австрия, Голландия, Россия, США, Канада,
страны СНГ и др.).
В 1989 г. (Hauktong) Хауктоном была создана первая тест-система для выяв¬
ления специфических антител к вирусу гепатита С (гепатит ни А, ни В), и было
начато тестирование на гепатит С в Службе крови стран Европы и США.
В 1998 г. Министерство здравоохранения Российской Федерации утвердило
наложение о враче-трансфузиологе (приказ М3 РФ «О введении в номенклатуру
■рачебных и провизорских специальностей «трансфузиология» №172 от 29 мая
1997 г.) и в «Номенклатуру врачебных и провизорских специальностей» была
шлючена специальность — «Трансфузиолог». Трансфузиология заняла свое место
среди медицинских дисциплин и в нашей стране.
В начале 90-х годов фирма Фрезениус (Германия) начала выпуск нового сор¬
бента, созданного на основе полиакрилата, позволяющего сорбировать селективно
апгерогенные липопротеиды (липопротеиды низкой плотности и липопротеид (а)
■ фибриноген непосредственно из крови пациента во время гемосорбции — систе-
ав ДАЛИ (Т. Bosch et al., 1993,1996).
С1990 г. в ряде ведущих западных стран на заводах по производству препаратов
внедрена противовирусная обработка пулов плазмы методом обработ¬
ки «растворитель/детергент» (Piet М. Р. et al., 1990) или методом пастеризации
(Bomouf-Radosevich М. et al., 1992).
На рубеже XX-XXI вв. в Банках крови приступили к внедрению теста ампли¬
фикации нуклеиновых кислот [Nucleic Amplification Testing (NAT)J донорской
крови. Новая технология позволяет проводить прямое определение генетического
материала вирусов:, HCV, ВИЧ и др. и сократить до нескольких дней недиагности-
руемое серонегативное окно. В России метод NAT (ПЦР) внедрен в нескольких
регионах с 2006-2007 гг. (например, в Москве — с 2007 г.).
Параллельно с внедрением новых методов и повышением качества реагентов
для выявления гемотрансмиссивных инфекций в 80-90 гг. XX столетия были
разработаны и предложены высокоэффективные методы инактивации или элими¬
нации вирусов плазмы от одного донора. В 1991 г. для инактивации вирусов пред¬
ложен метод облучения видимым светом плазмы, обработанной метиленовым
синим (Lambrecht В. et al., 1991). Показана максимальная, по сравнению с другими
методами, степень эффективности этого метода как в отношении безоболочечных
ичіусов (Muller-Breitkreutz К. et al., 1998), так и оболочечных (Knuever-Hopf J. et
aL, 2001). В начале XXI в. предложено несколько методов вирусной инактивации
одной дозы плазмы — облучение ультрафиолетом плазмы, обработанной псорале¬
ном (Hambleton J. et al., 2002), облучение ультрафиолетом плазмы, обработанной
52 ОБЩИЕ вопросы трансфузиологии
рибофлавином (Corbin F., 2002), прогревание плазмы (Goubran Н.А. et al., 2000),
нанофильтрации (Burnouf Т. et al., 2003).
К концу третьего периода (конец XX в.) четко определяются основные разделы
трансфузионной медицины (подробнее см. главу «Профессиональное образование
трансфузиолога») со своими проблемами и задачами:
• Служба крови (основная задача — заготовка и переработка донорской
крови на компоненты);
• клиническая трансфузиология (основная задача — использование транс¬
фузиологического пособия в профилактике и лечении больных, гемотранс-
фузионных реакций и осложнений);
• трансфузионная иммунология (основная задача — сертификация крови
доноров и больных с целью обеспечения иммунологической безопасности
и эффективности гемотрансфузий);
• производственная трансфузиология (основная задача — производство
препаратов крови и реагентов из компонентов донорской крови).
Все перечисленные направления существуют в тесной взаимосвязи между собой
и другими разделами медицины — хирургией, терапией, фармакологией и др.
(Рагимов А. А., 2002, 2003).
Служба крови оснащается высокопроизводительным автоматизированным
оборудованием (сепараторами крови) для получения компонентов крови, разра¬
батываются и внедряются стандарты, обеспечивающие гарантированно высокое
качество компонентов и препаратов крови, развивается донорское движение,
разрабатываются методы фракционирования белков плазмы с целью получения
препаратов направленного действия. В практику внедряется получение новых
компонентов крови (тромбоцитного концентрата, лейкоконцентрата, обедненных
лейкоцитами СЗП и эритроцитной массы). Развитие криобиологии обеспечивает
внедрение в практику методов длительного хранения компонентов крови при уль-
транизких температурах. В Службу крови внедряются методы автоматической
регистрации процесса забора, переработки, хранения и применения гемокомпо¬
нентов на основе информационных технологий. Поставлена и реализуется задача
компьютеризации и внедрения системы штрих-кодирования. В последние годы
для профилактики иммуносенсибилизации к лейкоцитным антигенам внедряются
методы лейкофильтрации.
В клинической трансфузиологии этот период характеризуется преимуще¬
ственным применением компонентов и препаратов донорской крови (форменные
элементы крови, СЗП, альбумин, иммуноглобулины, факторы свертывающей систе¬
мы и др.). Все шире вместо отдельных компонентов крови используются кровеза¬
менители. Разработаны и внедрены в клиническую практику схемы парентераль¬
ного питания при различных заболеваниях. Выполняются научно обоснованные
исследования, внедряются в практику лечебных учреждений кровесберегающие
технологии — аутодонорство, аутогемотрансфузии, реинфузии интра- и посто¬
перационной крови, процедуры гемоделюции при хирургических операциях
как альтернатива гемотрансфузиям компонентов донорской крови. При лечении
различных заболеваний широко применяется гравитационная хирургия крови —
различные варианты гемафереза, экстракорпоральной детоксикации, гемофиль¬
трации, гемодиализа, искусственного кровообращения и др. с использованием
современного, гарантирующего высокое качество процедуры и безопасность паци¬
ента специализированного оборудования.
Определены принципы профилактики и лечения посттрансфузионных реакций
и осложнений (в том числе и ДВС-синдрома), решены основные проблемы транс¬
фузионной тактики при острой кровопотере.
Клиническая трансфузиология занимается вопросами обоснования тактики
применения трансфузионных средств и методов экстра- и интракорпоральной
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
53
коррекции в лечении различных заболеваний, для профилактики и лечения транс¬
фузионных реакций и осложнений, используя при этом весь комплекс трансфузио-
вогического пособия.
В трансфузионной имлсунологии на первый план выдвигаются вопросы, свя¬
занные с обеспечением иммунологической безопасности гемотрансфузий.
Принципиально важная особенность третьего периода: получение и внедре¬
ние в трансфузиологическую практику гибридных моноклональных антител,
рекомбинантных диагностических систем нового поколения для инфекционной
сертификации крови. Активно исследуются тромбоцитные антигены и антитела
к ним, роль и значение их при гемотрансфузиях, аллотрансплантации костного
мозга. В эти годы становится очевидным, что дальнейший прогресс трансфузи-
оннон медицины, в особенности гемотерапии, в значительной степени зависит
оттого, насколько будет гарантирована безопасность реципиента от инфекционно-
■фусных заражений (гепатиты В, С, сифилис, ВИЧ и др.). И это связано не только
с возможностью лабораторного брака или некачественностью используемых реа-
ннтов, но главным образом с возможным пребыванием инфицированного донора
■серонегативном периоде.
Комплексное решение вопросов инфекционной и изосерологической безо¬
пасности гемотрансфузий, включающих иммуногематологические, изосероло-
шческие исследования, выявление гемотрансмиссивных инфекций, разработку
■ внедрение новых методов, обеспечивающих снижение риска (в идеале полную
Лгаопасность) трансфузий, профилактика, диагностика и лечение постгрансфу-
нинных осложнений формируют поле деятельности одного из центральных раз-
левов трансфузиологии — трансфузионной иммунологии, изучающей и реализующей
ш практике иммунологическую безопасность и эффективность трансфузионного
пособия (Рагимов А.А., Дашкова Н.Г., 2000).
Составляются картотеки типированных по эритроцитным и лейкоцитным анти¬
квам доноров крови. Осуществляется внедрение в практику стандартизированных
ишунологических исследований — новых лабораторных технологий (гелевый
метод определения эритроцитных антигенов, пробы Кумбса и др., экспресс-тесты,
цнгностические карты и т.д.), унифицируются тесты на гемотрансмиссивные
■вфекции. Активно исследуются тромбоцитные антигены и их значение при гемо-
фйсфузиях.
Поставлена задача адаптации методов ПЦР-диагностики для службы крови
■трансфузиологии. Среди большого числа проблем и задач трансфузионной науки
■практики вопросы, связанные с обеспечением безопасности трансфузий, остают-
С8 центральными.
Формализуются методы профилактики и диагностики посттрансфузионных
■свожнений. Актуальны исследования, направленные на выявление иммунологи¬
ческих аспектов гемотрансфузий — иммуносупрессивного, иммуномодулирующе-
юэффектов и иммунотолерантности. Результаты этих исследований способствуют
формулированию новых принципов, которые, в свою очередь, изменяют методы
традиционной гемотерапии.
Внедрение новых технологий лабораторной диагностики и клинических прие¬
мов, направленных на повышение безопасности трансфузиологических процедур,
■сажанных на доктринах, опирающихся на достижения современной биологии
■медицины, значительно расширяют поле деятельности трансфузионной медици¬
на и повышают эффективность лечения различных заболеваний.
Л промышленной трансфузиологии этот период характеризуется разработ¬
ан и производством широкого спектра кровозаменяющих растворов — синтези¬
рованы соединения, моделирующие отдельные компоненты плазмы и форменных
энментов крови. Задачи, связанные с переработкой донорской крови на компо-
■ и i и и получение из них основных препаратов крови (к. н. п, криопреципитат,
54 общие вопросы трансфузиологии
альбумин, иммуноглобулины, отдельные факторы системы гемостаза и др.), выде¬
ляют в раздел «Производственная трансфузиология», которая как составная
часть промышленной трансфузиологии и Службы крови изучает, разрабатывает,
совершенствует и внедряет методы переработки крови на компоненты и препара¬
ты крови, методы карантинизации и инактивации компонентов крови и т.д.
В ряде стран внедряется метод карантинизации СЗП — плазма донора допу¬
скается к клиническому использованию после повторного тестирования донора
на гемотрансмиссивные инвенции через 6 мес после кроводачи. Метод каранти¬
низации СЗП позволяет свести на нет серонегативное окно гемотрансмиссивных
инфекций. В России карантинизация плазмы — обязательная процедура.
Разрабатываются и внедряются методы вирусной инактивации инфекцион¬
ных агентов гемотрансфузионных заболеваний различными физико-химическими
и медикаментозными средствами в период заготовки и переработки донорской
крови на компоненты и препараты. Один из методов вирусной инактивации — обра¬
ботка одной дозы плазмы метиленовым синим — одобрен Всемирной организаци¬
ей здравоохранения (2001), и с 2003 г. процедура вирусной инактивации плазмы
предусмотрена рекомендациями Совета Европы («Руководство по приготовлению,
использованию и гарантии качества компонентов крови», 2007). К 2007 г. в Европе
и Азии успешно перелиты свыше 4 млн единиц плазмы, обработанной метиленовым
синим. С 2006 г. такая плазма разрешена к применению в России.
Основными плазмозаменяющими растворами, наряду с донорским альбумином,
выступают синтетические кровезаменители на основе гидроксиметил-крахмала
(НАЕС-стерил, Рефортан, Стабизол и др.), переработки желатина (полипептид
коллагена крупного рогатого скота) — Модежель, Гелофузин и др.
Промышленно производятся специальные высокоспецифические тесты и реа¬
генты для службы крови и трансфузиологии. Организуется промышленное про¬
изводство новых препаратов из донорской крови (VIII и IX факторы, интерферон
и др.). Арсенал кровезаменителей пополнился перфторуглеродной эмульсией —
отечественным кислородоносящим препаратом перфтораном (табл. 1-1),
Налажено производство широкого спектра различных препаратов парентераль¬
ного питания — аминокислотных смесей, жировых эмульсий, микроэлементных
и витаминных добавок, удовлетворяющих клинические потребности.
Совершенствуется техника Службы крови, расширяется спектр и повышается
надежность оборудования для трансфузиологических операций.
Начинается биотехнологическое производство первых препаратов, ранее полу¬
чаемых из донорской крови.
Очевидно, что в ближайшем будущем именно биотехнология, высокие медицин¬
ские технологии, молекулярная биология, генная инженерия и информационные
технологии будут определять основные точки роста и развития всей медицинской
науки и практики. Новые достижения в генетике, молек}чіярной биологии, имму¬
нологии, трансплантологии, фармакологии, клинических дисциплинах, внедрение
в медицину информационных технологий оказали существенное влияние на все
разделы трансфузиологии. Разрабатываются перспективные рекомбинантные,
синтетические и биотехнологические препараты и реагенты трансфузионной
медицины. Уже сегодня ряд зарубежных фирм предлагают коммерческие пре¬
параты и реагенты, полученные методами глубокой переработки плазмы крови,
генной инженерии и биотехнологии, новые синтетические кровезаменители (см.
табл. 1-1). Биотехнологическими методами получены первые коммерческие пре¬
параты, которые до недавнего времени производились исключительно из плазмы
донорской крови, например отдельные факторы гемостаза (рекомбинантные фак¬
торы свертывания VIII, IX и др.). С помощью рекомбинантного интерлейкина-2
предлагается стимулировать противоопухолевую активность культивированных
лимфоцитов, выделенных из периферической крови на сепараторах клеток. Можно
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
55
Таблица 1-1. Некоторые современные и перспективные рекомбинантные, синтетические и био¬
технологические лекарственные средства трансфузионной медицины
Рекомбинантные
Эритролоэтин человека — эритропоэтин (ЭПО) — стимуляция выработки эритроцитов.
Гранулоцитарный колониестимулирующий фактор человека негликозилированный,
r-Hu-G-CSF (Neupogen, Granocyte, Neutrogin, Leukine R и др.)-Г-КСФ, Filgrastim,
Lenograstim и др. — нейтропения и трансплантация стволовых клеток периферической
крови; стимуляция выработки гранулоцитов / нейтрофилов, моноцитов, макрофагов.
Фактор роста и дифференцировки мегакариоцитов человека, r-Hu-MGDF— стимуляция
выработки тромбоцитов.
Тромбоцитопоэтин человека, ТПО, r-Hu-TPO — стимуляция выработки тромбоцитов.
Интерлейкин-2 человека, г-Hu-IL-ll, Oprelvekin (Neumega) — стимуляция выработки
тромбоцитов.
Фактор роста стволовых клеток, r-Hu-SCF (Stemgen) — стимуляция выработки клегок-
предшественников кроветворения.
Фактор Vila (Niastase, NovoSeven) — фактор свертывания. Заместительная терапия.
Фактор VIII ( ReFacto, Код enate, Helixate и др.) — фактор свертывания. Заместительная
терапия.
Фактор IX (Benefix) — фактор свертывания. Заместительная терапия.
Вакцина против гепатита В {Engerix-B и др.) — вакцинопрофилактика гепатита В.
Интерферон альфа-2а, интерферон бета-1а, интерферон бета-1 в, интерферон гамма-
1в, интерлейкин-2 и др. — иммуномодуляторы.
Трансгенный альбумин человека*.
Гемоглобин {Opto или гНЬ1.1) — переносчик кислорода
Сштетические
фокзаменители
Перфторуглеродные эмульсии (PFC).
Перфторан (Россия).
Perfubron emusion (Oxygent).
Oxyfluor
Кровезаменители
Л основе гемо-
■шбина
Геленпол — Россия (утвержден и разрешен к производству в качестве кровезамените¬
ля).
РНР — пиридоксилированный полимер Нв человека,
PolyHeme -полимеризованный гемоглобин человека,
PNP — полинитроксил-гемоглобин человека,
HemoPure НВ0С-201 Oxyglobin — полимеризованный очищенный гемоглобин крупного
рогатого скота
Кит* крови
Эритроциты человека, выращенные из стволовых клеток in vitro**
Пвзма крови
Универсальная плазма человека — смесь плазмы различных групп крови, лишен¬
ных групповых свойств, вирусинактивированная, свободная от прионов (Uniplas®,
Октафарма)
■|нвечанне. Ряд лекарственных средств проходит различные этапы медицинской регистрации.
•Выращен трансгенный рис (Oryza sativa), содержащий от 1,4 до 10,6% клеток с генами альбуми-
вФловека [Дайчан Ян (Daichang Yang) и соавт., Китай, 2011J. Молекулярная масса альбумина
в семян, последовательность аминокислот, трехмерная структура и температура разложения
j «растительного» и человеческого альбумина совпадали. Альбумины вели себя абсолютно оди-
ввмо — они присоединили равное число молекул к одним и тем же точкам. Регулярное введе-
в небольших доз «растительного» альбумина в кровь крыс восстановило нормальный обмен
ввсі в. По предварительным оценкам можно ролучить 2,75 грамма альбумина на килограмм
сжаого риса, http://pharmcluster.ru/2011/ll/
*• Доказана возможность переливания эритроцитов, выращенных in vitro из стволовых CD34
(♦-) жлеток периферической крови человека-донора (Blood, 2011; Люка Дуэ и соавт.). В системе
МСЗ (Macopharma, Франция) получили миллиарды однородных эритроцитов. Оценили дефор-
вдеемость, содержание ферментов, способность гемоглобина связывать/отдавать кислород
■экспрессию антигенов группы крови. Тому же донору перелили 1010 генерированных в культуре
эритроцитов, меченных 51Сг. Количество этих клеток в сосудистом русле спустя 26 дней после
■и ищи сохраняется на уровне между 41 и 63% исходного, что соответствует полупериоду
г,ш" перелитых нативных эритроцитов — 28±2 дня.
отдать, что будут синтезированы трансфузионные среды, лишенные иммуно¬
гатой активности, но обладающие такими важными свойствами, как перенос
якяорода и С02. Выполняются многообещающие исследования по получению
■универсальных эритроцитов» — красных клеток крови, теряющих групповые
свойства после специальной обработки.
56 06ЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Перспективным видится использование выделенных из периферической крови
методами гемафереза лимфоцитов, которые могут быть клетками-переносчиками
генов, обладающими повышенной противоопухолевой активностью, что открыва¬
ет новые горизонты в лечении злокачественных новообразований.
Все вышесказанное позволяет говорить о том, что мы в преддверии четвертого
периода трансфузиологии, который сформулирован в рамках новой парадигмы —
от гемокомпонентной терапии к препаратной трансфузиологии (Рагимов А.А.,
1998, 2000, 2004) гемотерапии.
Нам представляется, что этот период будет состоять из двух этапов: I этап —
гемокомпонентная терапия препаратами из донорской крови, II этап — трансфу¬
зионная терапия преимущественно препаратами и компонентами крови, получен¬
ными на основе достижений биотехнологии.
С внедрением в клиническую практику препаратов и компонентов крови, полу¬
ченных методами биотехнологии, следует ожидать снижения объемов использо¬
вания компонентов донорской крови и постепенной замены их трансфузионными
средами биотехнологического и синтетического производства (рис. 1-9). Напри¬
мер, исследователям клиники Мейо в Рочестере в сотрудничестве с Университетом
Иллинойса (США) и компанией Advanced Cell Technologies (руководитель иссле¬
дования Роберт Ланза) удалось получить полноценно функционирующие эри¬
троциты из эмбриональных стволовых клеток {human embryonic stem cells, ESC).
Выращенные в лаборатории эритроциты способны переносить кислород не хуже,
чем клетки донорской крови. Новый метод позволяет заранее получать эритро¬
циты с заданными свойствами и произвести резус-положительные эритроциты
группы 0 в объеме 100 млрд клеток. Поскольку ни одна из линий ESC, одобренных
для использования в США, не позволяет получить резус-отрицательные эритро¬
циты группы 0, в этом направлении планируются исследования с использованием
клеток кожи доноров (NewScientist.com news service Andy Coghlan Blood, DOI:
10.1182/Blood-2008-05-157198 19 August 2008).
В сентябре 2011 г. (Blood) опубликована статья французского профессора Люка
Дуэ и его коллег. Французские ученые доказали возможность переливания эри¬
троцитов, выращенных из стволовых клеток in vitro. Использовали протокол эри-
троидной дифференциации из стволовых CD34 (+) клеток периферической крови
человека-донора. В системе МСЗ (Macopharma, Франция) получили миллиарды
однородных эритроцитов. Оценили деформируемость, содержание ферментов,
способность гемоглобина связывать/отдавать кислород и экспрессию антигенов
группы крови. Тому же донору перелили 101П генерированных в культуре эритро¬
цитов, меченных 51 Сг. Количество этих клеток в сосудистом русле спустя 26 дней
после инъекции сохраняется на уровне между 41 и 63% от исходного, что соответ¬
ствует полупериоду жизни перелитых нативных эритроцитов 28+2 дня.
Группа ученых под руководством Дайчан Ян (Daichang Yang, Китай) модифици¬
ровали геном посевного риса (Oryza sativa) и разработали технологию извлечения
альбумина из зерен риса. Ученые извлекли из бактерий рода Agrobacterium раковый
плазмид — кольцевой участок ДНК бактерии и заменили его «начинку» на несколько
человеческих генов, необходимых для синтеза человеческого альбумина. Высадили
культуры бактерий на корни взрослых растений и получили 9 штаммов трансген¬
ного риса. Трансгенный рис содержал от 1,4 до 10,6% клеток с генами альбумина,
подавляющая часть которых сконцентрирована в зернах риса. Молекулярная масса,
последовательность аминокислот, трехмерная структура и температура разложения
у «растительного» и человеческого альбумина совпадали. Человеческий и «рас¬
тительный» белки вели себя абсолютно одинаково - они присоединили равное
число молекул. Антикоагулянт варфарин и нестероидное противовоспалительное
средство напроксен одинаково эффективно связывались с белками. Регулярное вве¬
дение небольших доз альбумина в кровь больных крыс восстановило нормальный
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
57
обмен веществ. Разработана методика извлечения белка, достаточно дешевая для ее
массового применения. Производственный цикл занимает 48 ч и включает 3 ста¬
дам — измельчение семян, выделение белка и его очистку. По предварительным
оценкам, технология позволяет извлечь до 50% белка из зерен, что соответствует
2,75 г альбумина на килограмм спелого риса. Извлеченный белок по своей чистоте
ж уступает альбумину из сыворотки крови (Proceedings of the National Academy of
Sciences; http: /'/pharmcluster. ru/2011/11/).
100%
80%
60%
40%
20%
0%
...1950 1955- 1970- 1990- 2010 2025-... Годы
1965 1980 2000
® Биотехнологические препараты и компоненты крови
(. О Аутокровь
|.ч ^ Препараты крови
г 1 Щ Компоненты донорской крови
Г-: *;.. - ^
t . ■ Донорская кровь
§р
1 9ІВ.1-9. В плановой хирургии при необходимости компонентов крови будут использоваться раз-
Ёрмые варианты аутодонорства
I - В предстоящем столетии активными направлениями исследований в транс-
4^*юнной медицине станут диагностика, профилактика и терапия, основанные
■*шл методах гено- и биотехнологии. Наибольший интерес представляют методы
■ *ЛЕКя РНК-генодиагностики возбудителей гемотрансмиссионных болезней, кото-
I jee позволяют обнаруживать инфицированность и в серонегативном периоде.
I,*»- Лиизация концепции от гемокомпонентной терапии к препаратной транс-
гзфяшиогии в сочетании с использованием всех возможностей, которые открывает
I арииоеорсгво на современном этапе развития медицины (заготовка аутокомпо-
І с—нж применение эритропоэтина и др.), позволят практически полностью решить
(ірряйквш изосенсибилизации и передачи гемотрансмиссивных инфекций,
lis С учетом вышеизложенного и принимая во внимание то обстоятельство,
|ш ш трансфузионной медицине все больше будут использоваться препараты,
f замеченные синтетическим путем, методами генной инженерии, биотехнологии,
f Имвшжно, будет осуществляться постепенный (скорее всего, в течение ближайших
рД Ю лет) переход на препаратную трансфузиологию и аутодонорство. Можно
І временностью прогнозировать, что в ближайшие годы потребуется разработать
|«яииеярнть новую концепцию службы крови и трансфузиологии.
58 ОБЩИЕ вопросы трансфузиологии
В профильных научно-исследовательских учреждениях необходимо активи¬
зировать исследования по научным программам, связанным с биотехнологией,
генной инженерией, развитием аутодонорства, обоснованного и рационально¬
го клинического применения трансфузиологического пособия, профилактикой
и лечением трансфузионных осложнений.
Для станций переливания крови (только гражданских СПК на 2005 г. в России
было 182) необходимо определить новые задачи, связанные с получением, пере¬
работкой, хранением, распределением и обеспечением гарантированного качества
компонентов донорской крови, а также с переходом на новые технологии про¬
изводства компонентов и препаратов крови, основанные на современных дости¬
жениях генной инженерии и биотехнологии. Нужно своевременно позаботиться
о соответствующем технологическом переоснащении СПК, профессиональной
подготовке и переподготовке персонала. Это позволит рационально использовать
имеющиеся основные фонды, оборудование и кадры. СПК могут и должны стать
точками роста новой биотехнологической промышленности и полностью обе¬
спечить современными трансфузионными средствами, соответствующими всем
требованиям медицинской практики.
Одновременно следует ожидать и существенных изменений в работе отделе¬
ний трансфузиологии (отделений переливания крови) в лечебных учреждениях,
в частности повышения доли экстракорпоральных методов работы с кровью
больного, более широкого использования метода компонентного аутодонорства,
применения в лабораторной практике стандартизированных, унифицированных
методов исследования и др.
Можно надеяться, что сформулированное видение состояния проблем, задач
и перспектив развития трансфузиологии в начале нового тысячелетия позволит
расширить и дополнить представления о трансфузионной медицине и наметить
первоочередные задачи, решение которых позволит отечественной трансфузиоло¬
гии оставаться на передовых рубежах.
К началу четвертого периода, кроме проблем, стоящих перед каждым из четы¬
рех основных направлений, определились общие для всей трансфузионной меди¬
цины наиболее важные задачи.
• Согласование и координация усилий различных учреждений и ведомств —
НИИ, кафедр, клиник, СПК - по совершенствованию всей Службы крови
и трансфузиологии в стране с целью оптимизации и эффективности науч¬
ных исследований, производства и клинического применения трансфузио¬
логического пособия.
• Стандартизация и регламентация получения, сертификации, этикетирова¬
ния, хранения, транспортировки и клинического применения компонентов
и препаратов крови, кровезаменителей на основе протоколов лечения раз¬
личных патологических состояний.
• Разработка и внедрение в Службу крови методов инактивации инфекци¬
онных агентов гемотрансфузионных заболеваний различными физико¬
химическими и медикаментозными средствами в период заготовки и пере¬
работки донорской крови на компоненты и препараты.
• Разработка и внедрение методов ДНК и РНК-генодиагностики возбудителей
гемотрансмиссивных болезней, которые позволяют обнаруживать инфици-
рованность и в серонегативном периоде.
• Внедрение унифицированных для Службы крови, клинической трансфузио¬
логии и трансфузионной иммунологии информационных технологий.
• Обоснованное и адекватное использование всей палитры экстракорпораль¬
ных процедур в клинической практике.
• Внедрение информационных технологий в Службе крови, клинической
и трансфузионной иммунологии.
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
59
І • Оптимизация и адаптация вузовской и послевузовской профессиональной
I подготовки студентов медицинских вузов и специалистов Службы крови,
I клинической трансфузиологии, трансфузионной иммунологии и производ-
I ственной трансфузиологии к современным требованиям, предъявляемым
І к врачу-трансфузиологу.
І Несмотря на разработку и внедрение в медицинскую практику кровосберегаю-
! та технологий, аутодонорства и аутогемотрансфузий, применение искусствен-
|; тыл и генно-инженерных кровезаменителей и лекарственных средств, потреб-
I шкть в донорской крови остается очень высокой во всех странах мира. По данным
I 103 во всем мире постоянно существует дефицит донорской крови (около 20%) и,
I *3»KHM0CTii от страны, колеблется от 5 до 40% и более от уровня, необходимого
її дрі обеспечения клинических и производственных потребностей. Важнейшим
Ц шюи в получении компонентов и препаратов из донорской крови является сам
||;ЛЮр — человек, изъявивший желание добровольно сдать кровь. Все страны, где
Кі]рівствует система Службы крови, большое внимание уделяют агитации и про-
fc — шле безвозмездного донорства. Здоровье донора находится под постоянным
Кшшианием специалистов Службы крови и общественных организаций. На основа-
II предложений ВОЗ, Красного Креста и Красного Полумесяца, Международного
|«вщгспва переливания крови (ISBT) и Международной федерации организа-
I щт доноров крови в мае 2005 г. в ходе Всемирной ассамблеи здравоохранения
|шиввстры здравоохранения единодушно приняли заявление о приверженности
f Ливдяержке добровольного донорства крови и постановили ежегодно проводить
I Шпетрный день донора крови 14 июня (резолюции WHA58.13). День донора
I «икчается ежегодно и в нашей стране.
I Ж концу XX в, в трансфузиологии на первый план выдвигаются вопросы без-
^ёиигаости и эффективности применения всего трансфз^зиологического пособия.
| €кябое внимание уделяется проблеме гемобезопасности (haemovigilance) — внедре¬
нии» процедур наблюдения, охватывающих всю трансфузионную цепь (от донации
,Нрн и ее компонентов до мониторинга реципиентов гемотрансфузий), пред-
|ииипенных для сбора и оценки информации о неожиданных или нежелатель-
та явлениях, происшедших вследствие клинического применения лабильных
|*ри*?ктов крови, и для профилактики развития или повтора таких инцидентов
fRter J.C) (см. раздел «Служба крови»).
I -В ряде стран в учреждениях Службы крови вводятся новые, ранее не свойствен-
и: создание Банков замороженных стволовых клеток пуповинной крови
. et al.), инактивация компонентов крови, карантинизация плазмы.
І Іфоводятся работы по совершенствованию стратегии отбора доноров, техно-
Ь яшпш отбора и обработки стволовых клеток (Dhot P. S. et al.). В начале XXI в.
• ■ в России создаются отдельные Банки стволовых клеток пуповинной крови
fUnrrna, Казань и др.) (см. раздел «Служба крови»)
В їлинической трансфузиологии все шире используются различные варианты
: ^ряодонорства и аутогемотрансфузий, совершенствуется и становится доступнее
дав рядовых лечебных учреждений большая палитра экстракорпоральных методов.
В производственной трансфузиологии разрабатываются новые технологии
■мучения различных синтетических кровезаменителей (не проходит и года, чтобы
■г был заявлен новый кровезаменитель или его улучшенная форма), расширяются
■ Зпгочняются показания к их применению, разрабатываются новые компоненты
■ *ртараты. Так, в качестве альтернативы редким группам крови обсуждается
шмюжносгь технологии «стеле» (невидимок) для производства «универсальных»
зриірсщитов [клетки покрывают «зонтиком» молекул ПЭГ (полиэтиленгликолем)
■ воды, блокирующим специфические антитела] (Garratty G.).
Аяаишз исторического прошлого трансфузиологии, в особенности научно обо-
... шшитого периода за последний чуть более чем столетний промежуток времени,
60 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
интенсивное развитие всех четырех разделов трансфузиологии (Службы крови,
клинической и производственной трансфузиологии, трансфузионной иммуноло¬
гии) в последние десятилетия позволяет уверенно прогнозировать бурный рост
этого важнейшего направления медицины.
СПИСОК ЛИТЕРАТУРЫ
Воробьев А.И. Острая кровопотеря и переливание крови // Анест. и реан., прил.:
Альтернативы переливанию крови в хирургии. — 1999. — С. 14-26.
Выжшина М.А., Сизова Ж.М., Бунятян А,А., Протопопова Т.А., Заугольникова Т.В..
Жукова С.Г. Разработка системы зачетных единиц для непрерывного профессионального
образования: Сб. научн. работ. — М.: ММ А имени И.М. Сеченова, факультет послевузовско¬
го профессионального образования врачей, 2008. - С. 28-30.
Гаврилов O.K. Очерки истории развития и применения переливания крови. — Л.:
Медицина, 1968. — 128 с.
Донсков С.И., Ягодинский В.Н. Последние дни А.А. Богданова. Хроника трагических
событий. (К 80-летию Института переливания крови имени А.А. Богданова ГНЦ РАМН). -
М.: Гематологический научный центр РАМН, С. 8-12,
Жибурт Е.Б. Трансфузиология. — СПб.: Питер, 2002.— 733 с.
Зильбер А.П. Этика и закон в медицине критических состояний. Этюды критической
медицины, т. 4. — Петрозаводск: ПетрГУ, 1998. — 560 с.
Зильбер А.П. Кровопотеря и гемотрансфузия (Принципы и методы бескровной хирур¬
гии). — Петрозаводск: ПетрГУ, 1999. — 120 с.
Корякин А.В. Контроль и обеспечение вирусной безопасности при заготовке плазмы
для фракционирования и производства препаратов крови // Актуальные вопросы транс¬
фузиологии и клинической медицины. — Киров, 2005.— С. 109-112.
Петров В.А., Алюшин А.М., Жуков А.Н. и др. Клинико-эпидемиологическая характери¬
стика вспышки лихорадки Западного Нила в 1999 году в Волгоградской области // Клин.,
микробиол. и антимикроб, химиотер. — 2001. - Т. 3, N-1. — С. 17-21.
Петровский Б.В., Рагимов А.А. Учение о переливании крови: время, проблемы люди //
Вестник РАН. - 2001. - № 9. - С. 806-811,
Рагимов А.А., Дашкова Н.Г. Трансфузионная иммунология. - М.: ВУНМЦ, 2000. — 283 с.
Руководство по общей и клинической трансфузиологии / Под ред. Б. В. Петровского. —
М.: Медицина, 1979. — 352 с.
Румянцев А.Г., Аграненко В.А. Клиническая трансфузиология. — М.: Медицина, 1987. —
575 с.
Руководство по применению крови и кровезаменителей / Под рук, А.Н. Филатова. — М.:
Медицина, 1965. — 301 с.
Селиванов Е.А., Данилова Т.П., Дегтерева И.Н, и др. Служба крови на современном
этапе //Трансфузиология. — 2005. — Т. 6. — №3. — С. 4-22.
Abe Н., Wagner S J. Analysis of viral DNA, protein and envelope damage after methylene blue,
phthalocyanine derivative or merocyanine 540 photosensitization // Photochem. Photobiol. —
1995. -Vol. 61. - N 4. - P. 402-409.
Abel J.J., Rowntree L.G., Turner B.B. Plasma removal with return of corpuscles (plasmaphere¬
sis) //J. Pharmacol, Exp. Ther. — 1914, - Vol. 5. — P 625-627.
Agote L. Neuvo procedimiento para la transfusion de sangre. Annals of the Institute of Clinical
Medicine. — 1915; 1, — P. 12-14.
Armstrong Davison М. H. Evolution of Anaesthesia. - Altrincham: Jonh Sherratt a. Son,
1954. - 236 p.
Asnis D.S., Conetta R., Teixcira A.A. et al. The West Nile virus outbreak of 1999 in New York:
the Flushing Hospital experience // Clin. Infec. Dis. — 2000. — Vol. 30. —P. 413-418.
Atance R., Pereira A., Ramirez B. Transfusing methylene blue — photoinactivated plasma instead
of FFP is associated with an increased demand for plasma and cryoprecipitate // Transfusion. —
2001. - Vol. 41. -P. 1548-1552.
Barrett. N.A., Кат P.C. A. Transfusion-related acute lung injury: a literature review //
Anaesthesia. - 2006. - Vol. 61. - P. 777-785. BCSH (1988).
Bjerrum O.S., Jersild C. Class specific anti-IgA associated with severe ana-phylactic transfusion
reactions in a patient with pernicious anaemia j j Vox Sang. — 1971. — Vol. 21. — P. 411-424.
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
61
Blundell J. Experiments on the transfusion of blood by the syringe /7 Medicochir. Trans. —
ISIS. - Vol. 9. - P. 56-92.
Blundell J. Observations on transfusion of blood // Lancet. — 1829. — Vol. 2. — P. 321-324.
Bowman J.M., Peddle I.J.. Anderson C. Plasmapheresis in severe Rh iso-immunization // Vox
Sang. - 1968. - Vol. 15, - P. 272-277.
Buckner C.D., Clift R., Thomas E.D. Plasma exchange with NCI-IBM blood cell separator //
trv. Fr. Etud. Clin. Biol, - 1969. - Vol. 14. - P. 803-805.
Cardigan R,, Lawrie A.S., Mackie I.J., Williamson I..M. The quality of fresh-frozen plasma
jwoduced from whole blood stored at 4 °С overnight // Transfusion. -- 2005. — Vol. 45, — N 8. —
P. 1342-1348.
Carrel A. The surgery of blood vessels //Johns. Hopk. Hosp. Bull. — 1907. — Vol. 18. — P. 18-28.
Carson J.L., Poses R.M., Spence R.K., Bonavita G. Severity of anaemia and operative mortality
art morbidity // Lancet. - 1988. -Vol. 331. - P. 727-729."
Chapman J. Virus inactivation of plasma by methylene blue photoinacliva-tion: approaches and
ieoeology // Transfus. Today. — 1994. — N 20. - P. 2-4.
Chekrizova V., Murphy W.G. Solvent — detergent plasma: use in neonatal patients, in adult and
jmnfntrir patients with liver disease and in obstetric and gynaecological emergencies // Transfus.
Шві. - 2006. - Vol. 16. - P. 85-91.
Chevassu M. Emile Jeanbrau (1873-1950) // Bulletin de TAcademie de Medicine. — 1950. —
Ш.134. - P. 420-5.
Colman R.W. Hemostasis and thrombosis: Basic principles and clinical practice. 3rd ed. —
Ikftadelphia: Lippineott, 1993. - 958 p.
Colman R.W., Sievers C.A., Pugh R.P. Thrombocytapheresis; A rapid and effective approach to
^paptomatic thrombocytosis // J. Lab. Clin. Med. — 1966. — Vol. 68. - P. 389- 399.
Corbin F. Pathogen inactivation of blood components: current status and introduction of an
approach using riboflavin as a photosensitizer // Int. J, Hematol. — 2002. — Vol. 76 (Suppl. 2). -
F„ 253-257.
Council of Europe. Guide to the Preparation, Use and Quality Assurance of Blood Components,
UAed- — Strasbourg: Council of Europe Publishing, 2007. — P. 8 -13.
Grfle G. The technique of direct transfusion of blood // Ann. Surg. — 1907. — Vol. 46. — P. 329-
m
Depasse F„ Sensebe L., Seghatchian J. et al. The influence of methylene blue light treatment
arfaethvlene blue removal filter on fibrinogen activity states and fibrin polymerisation indices //
Unesfus Xpher. Sci. — 2005. — Vol. 33, — N 1. — P. 63-69.
Evans G., Llewelyn C., Luddington R. et al. Solvent/detergent fresh frozen plasma as primary
fainent of acute thrombotic thrombocytopenic purpura // Clin. Lab. Haemat. -- 1999. -
W. 21. - P. 119-123.
Boyd R.A., Schneider J.E., Dittmer D.P. Methylene blue photoinactivation of RNA viruses //
Jtatmral Res. - 2004. - Vol. 61. - N 3. - P. 141-151.
Franco A., Cortes J„ AlvarczJ., DizJ.C. The development of blood transfusion: the contributions
of Norman Bethune in the Spanish Civil War (1936-1939) //' Can. J. Anaesth. — P. 7-10.
Freireich E.J., Judson G., Levin R.H. Separation and collection of lesukocytes // Cancer Res. -
»Ь5. - Vol. 25. - P. 1516-1520.
Garwood М., Cardigan R.A., Drummond O. et al. The effect of methylene blue photoinactivation
aid methvlene blue removal on the quality of fresh-frozen plasma // Transfusion. — 2003. -
WtL 43. -N9. - P. 1238-1247.
Gunson HH, Dodsworth H. Fifty Years of Blood Transfusion // Transfus. Med. — 1996. —
ItaLd. (Suppl. 1) — P. 1-88.
Harke H„ Rahman S. Haemostatic disorders in massive transfusion // Bibliotheca
В—atologica. — 1980. -Vol. 46. -P. 179-188.
Harrington Т., Kuehnert M.J., Kamel H. et al. West Nile virus infection transmitted by blood
toasfosion // Transfusion. — 2003. — Vol. 43. -• P. 1018-1022.
iterison C.N., Lawrie A.S.. Iqbal A. et al. Plasma exchange with solvent/detergent plasma of resis-
lat thrombotic thrombocytopenic purpura j j Brit. J. Haemat. — 1996. — Vol. 94. — P. 756-758.
Шгоп D.A.. Ghani A.C., Conyers L. et al. Accumulation of prion protein in tonsil and appendix:
H»kw of tissue samples // Brit. Med. J. — 2002. — Vol. 325. —P. 633-634.
62 ОБЩИЕ вопросы трансфузиологии
Hindiyeh М., Shulman L.M., Mendelson Е. et ai. Isolation and characterization of West Nile
virus from the blood of viremic patients during the outbreak in Isreal. 2000 // Emerg. Infect. Dis. —
2001. - Vol. 7. - P. 74S-750.
Hogman CF, Akerblom 0, Hedlund K, et al. Red cell suspensions in SAG-M medium. // Vox
Sang. - 1983. - Vol. 45. - P. 217-223.
Holland P.V, Transfusion related acute lung injury // Brit. J. Haemat. — 1999. — Vol. 105. —
P. 322-329.
Homsey V.S., Young D.A., Docherty A. Cryopredpitate prepared from plasma treated with
methylene blue plus light: increasing the fibrinogen concentration // Transfus. Med. — 2004. -
Vol. 14. - N 5. - P. 369-374.
Huestis D.W. Russia's National Research Center for Hematology: its role in the development of
blood banking // Transfusion. - 2002. — Vol. 42. — N 4. - P. 490-494.
Hustin A. Principe d'une nouvelle methode de transfusion //Journal of Medidne (Brussels). —
1914. - Vol. 2. - P. 436.
Huston P,, ed. Building a blood system for the 21st century. - Health Canada, 1997. — 88 p.
Jansky J. Haematologicke, studie u. psychotiku // Sb. Klin. Praze. — 1907. - Vol. 8. -
P. 85-139,
Johansson P. L, Hansen M.B., Suirensen H. Transfusion practice in massively bleeding patients:
time for a change? j j Vox Sanguinis. — 2005. — Vol. 89. — P. 92-96.
Kimpton A.R., Brown ].H. A new and simple method of transfusion //JAMA. — 1913. —
Vol. 6. - P. 117-118.
Krijnen H.W., Kuivenhoven A.C. J„ de Wit JJFrM. The preservation of blood cells in the frozen
state. In: Modem problems of blood transfusion. Speilman W, Seidl S, Eds, // Gustav Fischer,
Stuttgart. — 1970. — P. 5-7.
Lakkis N.M., George S., Thomas E. et al. Use of ICHOR-platelet works to assess platelet function
in patients treated with GP Ilb/IIIa inhibitors // Catheteriz, Cardiovasc. Interventions. — 2001. —
Vol. 53, - P. 346-351.
Landsteiner K. Uber Agglutinationserscheinungen normalen menschlinchen Blutes // Weiner
Klinik Wochensctire. — 1901. — Vol. 1. — P. 5-8,
Laupacis A„ Fergusson D. Drugs to minimize perioperative blood loss in cardiac surgery: meta-
analyses using perioperative blood transfusion as the outcome j j Anaesth. Analgesia. — 1997. —
Vol. 85. - P. 1258-1267.
Lewisohn R., Rosenthal N. Prevention of chills following the transfusion of citrated blood //
J. Am. Med. Assoc. — 1933. — Vol. 100. — P. 466-9.
Lewisohn R. Blood transfusion by the citrate method // Surg. Gyn. Obs. — 1915. — Vol. 21. —
P. 37-47.
Lindenboom G.A. The story of a blood transfusion to a Pope //Jour. Hist. Med. — 1954. —
Vol. 9. - P. 455-459.
Lisman T„ Caldwell S.H., Porte R.J., Leebeek F.W. G. Hemostasis in chronic liver disease //
J. Thrombosis Haemostasis. — 2006. — Vol. 4. — P. 2062-2063.
Maluf N.R. S. History of blood transfusion //J. Hist. Med. — 1954. — Vol. 9. — P. 59-107.
Mansouri A., Lurie A. A. Consise review: methaemoglobinaemia j j Amer. J. Haemat. — 1993. —
Vol. 42. - P. 7-12.
Mine H., Emura H., Miyamoto M. et al. High throughput screening of 16 million serologically
negative blood donors for hepatitis В virus, hepatitis С virus and human immunodeficiency virus
type-1 by nucleic acid amplification testing with soecific and sensitive multiplex reagent in Japan j j
J. Virol. Methods. - 2003. - Vol. 112. - P. 145-151.
Mollison P.L. Blood Transfusion in Clinical Medicine. — 5th edn. — Oxford: Blackwell Scientific
Publications, 1972. -188 p.
Moss WL. Studies on isoagglutinins and isohemolysins //Johns Hopk. Hosp. Bull. — 1910. -
Vol. 21. - P. 63-70.
Pamphilon D. Viral inactivation of fresh frozen plasma // Br. J. Haematol. — 2006. — Vol.
109. - N 4. - P. 680-693.
Papin J.F., Floyd R.A., Dittmer D.P. Methylene blue photoinactivation abolishes West Nile virus
infectivity in vivo // Antiviral. Res. — 2005. — Vol. 68. — N 2. — P. 84-87.
Renwick W. Transfusion in a case of cholera // Dublin Medical Press. — 1854. — Vol. 31. —
P. 258-9.
Robertson L.B. Transfusion of whole blood // BMJ. — 1916. — July 8th. - P. 38.
ОСНОВНЫЕ ПЕРИОДЫ И ЭТАПЫ ИСТОРИИ ТРАНСФУЗИОННОЙ МЕДИЦИНЫ
63
Robertson О.Н. A method of ritrated blood transfusion // BMT. — 1918. — 27th Apr. -
IL 477-479.
Roche J.K, Stengle J.M. Open heart surgery and the demand for blood //J. Am. Med. Assoc. -
"1973. - Vol. 225 (12). - P. 1516-21.
Schwab P.J., Fahey J.L. Treatment of Waldenstrom’s macroglobulinemia by plasmapheresis //
ML Engl. J. Med. - 1960. - Vol. 263. - P. 574-579.
Smith AU. Prevention of haemolysis during freezing and thawing of red blood cells // Lancet. —
«ttfi:910. - P. 16-17.
Solomon A., Fahey F.L. Plasmapheresis therapy in macroglobulinemia j j Ann. Intern. Med. -
1K3- - Vol. 58. - P. 789-800.
Thomas M.J. G., Parry E.S., Nash S.G., Bell S.H. A method for the cryopreservation of red blood
using hydroxyethyl starch as a cryoprotectant // Transfusion Science. — 1996. — Vol. 17
C9. - P. 3S5-396.
Ї Thomas M.J. G. The Army Blood Supply Depot. In: Gunson H.H., Dodsworth H.Eds. //
, -jfcM t' - Med.' — 1996. - Vol. 6. (Suppl. 1) - P. 65-71.
I ;s, Wagner S.J. Virus inactivation in blood components by photoactive phenothiazine dyes //
Щтгік. Med. Rev. - 2002. - Vol. 16. - P. 61-66.
Глава 2
Профессиональное образование
врана-трансфузиолога
Трансфузиология — новая медицинская специальность, овладе¬
ние которой требует многосторонних знаний, получаемых врачом
путем специальной подготовки. Важнейшим звеном в подготов¬
ке квалифицированных специалистов-трансфузиологов, умеющих
эффективно и безопасно использовать весь арсенал трансфузиоло¬
гического пособия в лечебной практике, работать на современном
оборудовании, является система подготовки специалиста и посто¬
янное поддержание его профессионального уровня.
В нашей стране за последние два десятилетия сложилась опреде¬
ленная система последипломной подготовки врачей-трансфузио¬
логов.
Впервые в СССР и, очевидно, в мире систематическую подготов¬
ку врачей по специальности «Трансфузиология» в виде циклов усо¬
вершенствования продолжительностью 1-3 мес стали проводить на
кафедре трансфузиологии и гематологии, организованной в 1963 г.
учеником академика А.Н. Филатова профессором Г.В. Головиным
в составе хирургического факультета Ленинградского института
усовершенствования врачей (ныне Санкт-Петербургская медицин¬
ская академия последипломного образования — СПбМАПО). Усо¬
вершенствование проходили врачи Службы крови и лечебных
учреждений по всем разделам трансфузиологии, клинической гема¬
тологии и гематологической хирургии. С 1988 по 1998 г. кафедрой
заведовал проф. Н.Г. Дуткевич, а с 1998 г. — чл.-кор. РАМН, проф.
Е.А. Селиванов (директор Российского НИИ гематологии и транс¬
фузиологии) .
С 1971 г. в клинической ординатуре Военно-медицинской ака¬
демии проводится 2-3-летнее обучение по трансфузиологии. Курс
трансфузиологии организован в 1990 г. проф. Г.И. Козинцом на
факультете последипломной профессиональной подготовки врачей
Московской медицинской академии им. И.М. Сеченова (с 1999 г. —
кафедра клинической трансфузиологии, зав. кафедрой проф.
А.А. Рагимов). В настоящее время трансфузиологов готовят на кафе¬
дре гематологии и интенсивной терапии (зав. кафедрой академик
РАМН и РАН, проф. А.И. Воробьев) ГОУ ДПО Российской меди¬
цинской академии последипломного образования Росздрава; кафе¬
дре трансфузиологии и гематологии института СПбМАПО (зав.
кафедрой чл.-кор. РАМН, проф. Е.А. Селиванов); кафедре гемато¬
логии и трансфузиологии факультета усовершенствования врачей
Пермской государственной медицинской академии (с 1997 г.), зав.
ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ ВРАЧА-ТРАНСФУЗИОЛОГА
65
ифедрой проф. C.JL Шарыгин; на кафедре хирургических болезней с курсом гема¬
тологии и трансфузиологии Пермской государственной медицинской академии им.
акал Е.А. Вагнера, ФПК и ППС (зав. кафедрой проф. Заривчацкий М.Ф.); кафедре
гематологии и трансфузиологии Алтайского государственного медицинского уни¬
верситета (зав. кафедрой проф. В.А. Елыкомов); кафедре гематологии, трансфузио-
ммгии и трансплантологии Санкт-Петербургского государственного медицинского
|шиверситета им. акад. И.П. Павлова (зав. кафедрой проф. Б.В. Афанасьев); кафе-
щре гематологии и трансфузиологии с курсом клинической лабораторной диагно-
сшки Ростовского государственного медицинского университета (зав. кафедрой
ороф. Ю.В. Шатохин); кафедре гематологии и трансфузиологии Воронежской
шсударственной медицинской академии (зав. кафедрой проф. В.А. Белошевский);
с 2001 г. — на кафедре гематологии и трансфузиологии Новосибирского госу-
J4FTBeHHOro медицинского университета (зав. кафедрой проф. Т.Н. Поспелова);
оофедре анестезиологии и реаниматологии ФПК и ПП с курсом трансфузиологии
Вражьской медицинской академии (зав. кафедрой проф. В.М. Егоров); кафедре
цраасфузиологии с курсом геронтологии и гериатрии факультета усовершенство¬
ван врачей Российского государственного медицинского университета (зав.
оофедрой академик РАМН, проф. В.Н. Шабалин); кафедре трансфузиологии
■УВ Национального медико-хирургического центра им. Н.И. Пирогова (зав.
, щфедрой проф. Е.Б. Жибурт); кафедре анестезиологии и реаниматологии с транс-
фряюлогией ФУВ Волгоградского государтсвенного университета (зав. кафедрой
фіф. А.С. Попов); кафедре анестезиологии, реаниматологии и трансфузиологии
Щрбанского государственного медицинского университета (зав. кафедрой проф.
MR Заболотских); кафедре трансфузиологии ФГОУ ДПО Института повыше-
жвалификации ФМБА России (зав. кафедрой к. м. н. О.В. Гришина); кафе-
производственной и клинической трансфузиологии Московского медико¬
логического университета (зав. кафедрой проф. Б.М. Уртаев). Кафедры
■коедипломного образования, готовящие трансфузиологов, работают в Украине
рГшгп, Днепропетровск), Азербайджане (Баку), Белоруссии (Минск), Армении
Лиан). За последние годы в РФ были открыты несколько новых кафедр постди-
■ошого образования для подготовки врачей-трансфузиологов.
Подготовка специалистов-трансфузиологов в России происходит в соответ-
с образовательным стандартом послевузовской профессиональной подго-
специалистов [№040126.06. (040122.10 — трансфузиология), 2002 г.], стан-
разработан сотрудниками кафедры клинической трансфузиологии ФППО
1ША им. И.М. Сеченова, зав. кафедрой проф. А.А. Рагимов.
В соответствии с существующим порядком (приказ Минздравсоцразвития
ШФ «О номенклатуре специальностей специалистов с высшим медицинским
■ фармацевтическим образованием в учреждениях здравоохранения Российской
#цгрщии») трансфузиологом может стать специалист с высшим медицинским
образованием, окончивший лечебный или педиатрический факультеты и про-
I qojbiihI подготовку по основной специальности (хирургия, терапия, педиатрия,
jrnая хирургия, анестезиология и реаниматология) через обучение в интернату¬
ре о (или) ординатуре. Подготовка специалистов по специальностям, требующим
лриишительной подготовки, проводится через профессиональную переподготов-
щ мжи обучение в ординатуре при наличии послевузовского профессионального
образования и стажа работы не менее 3 лет по соответствующей основной специ-
В соответствии с образовательным стандартом послевузовская подготовка
ажщвалистов-трансфузиологов предусматривает два основных пути: двухго¬
ловая клиническая ординатура (продолжительностью 3356 ч) или общее усо-
Я|яшствс>вание (продолжительностью не менее 504 ч) для переподготовки
JCTOB терапевтического, хирургического и педиатрического профиля.
66 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
По окончании последипломной двухгодичной ординатуры или курса усовершен¬
ствования выдается диплом врача-трансфузиолога.
Профессиональная переподготовка - подготовка и прием экзамена на диплом
и сертификат по специальности «Трансфузиология» продолжительностью 63 учеб¬
ных дня (504 ч) для врачей-анестезиологов и реаниматологов, детских хирургов,
терапевтов, хирургов, педиатров со стажем работы по специальности не менее 3
лет.
Общее усовершенствование для подтверждения сертификата по специаль¬
ности «Трансфузиология» — 27 учебных дней (216 ч). Один раз в 5 лет врач-
трансфузиолог проходит переподготовку на курсах сертификации.
Врачи других специальностей, по роду своей работы использующие в процессе
лечения различные методы трансфузиологического пособия, проходят темати¬
ческие курсы. Тематическое усовершенствование по трансфузиологии занимает
18 учебных дней (144 ч).
Циклы посвящены вопросам организации службы крови и донорства, иммуно¬
гематологии и клинической гемостазиологии, организации и методике заготовки
крови и ее компонентов, вопросам клинической трансфузиологии, включая мето¬
ды трансфузиологической гемокоррекции.
Продолжительность обучения по специальности «Трансфузиология» в европей¬
ских странах занимает от 4 до 6 лет. В некоторых странах обучение специальности
требует предварительного дополнительного образования в смежных дисципли¬
нах после получения диплома врача: в Австрии -2 года в терапии или хирургии;
в Германии — 2 года в терапии, хирургии, анестезиологии, гинекологии, лабора¬
торном деле или педиатрии; во Франции - 2 года специального последипломного
образования; в Нидерландах — 4 года в терапии и дополнительно 2 года в транс¬
фузиологии; в Норвегии — полгода в гематологии; в Бельгии — 300 ч в течение
года последипломного образования по трансфузиологии. В Дании, Финляндии,
Греции и Швейцарии обучение трансфузиологии как отдельной специальности
включено в институтские программы, но не преподается в последипломный пери¬
од. В Ирландии, Люксембурге, Испании и Италии обучение трансфузиологии
в дипломный или последипломный периоды не проводят.
В последние годы происходят важные изменения в системе высшего образо¬
вания, направленные на адаптацию всего специального образования к мировым
стандартам, что позволит оптимизировать и интенсифицировать процесс пере¬
дачи и получения знаний. Россия, подписав в сентябре 2003 г. Болонскую декла¬
рацию (Совместная декларация министров образования стран Европы, Болонья,
19 июня 1999 г.), приняла на себя вполне определенные обязательства по рефор¬
мированию высшей школы. («Россия — член Совета Европы» /Федеральный
закон РФ от 23 февраля 1996 г. №19-ФЗ). Внедрение рекомендаций Болонского
соглашения преследует основную задачу — гармонизацию высшего образования
в Европе, Болонская декларация формирует модель европейского высшего обра¬
зования с учетом специфики и традиций национальных образовательных систем
и должна включать все лучшее, что есть на данный момент в мире. «Наша задача,
сохраняя исторические традиции системы высшего медицинского образования
и используя богатейший опыт подготовки медицинских кадров, свои принципы
и методологию обучения, прошедшие проверку временем, встроиться в систему
единого образовательного пространства в соответствии с общеевропейскими
требованиями и добиться путем преобразований признаваемое™ российских
дипломов европейскими странами-членами Болонского процесса» (академик,
проф. М.А. Пальцев).
Цель Болонского процесса — введение системы точно определенных и сопоста¬
вимых степеней, в том числе через введение выдачи диплома и последипломного
совершенствования с целью облегчения трудоустройства выпускников и увели-
ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ ВРАЧА-ТРАНСФУЗИОЛОГА
67
международной конкурентоспособности европейской системы высшего
^разования.
Медицинское образование и цели Болонского процесса
Введение системы двухэтапного высшего образования: базового — не менее
Злет (бакалавр) и последипломного — 1-2 года обучения (магистр и/или док¬
ерская степень). Степень, получаемую после первого этапа обучения, признают
шевропейском рынке труда как достаточный уровень квалификации. В медицин-
«шш образовании для лечебного факультета необходимы 6-7 лет непрерывного
4%квованкя — специалитет.
Т Принятие системы зачетных единиц-кредитов (ECTS - European Credit Tran fer
Щ/Шш) как средства, обеспечивающего широкую мобильность студентов. Кредиты
действовать на любом уровне системы образования, включая непрерывное
іние, при условии их признания всеми принимающими учебными заведе-
лирование мобильности и создание условий для свободного перемеще-
студентов и преподавателей.
ятие европейского сотрудничества в области контроля качества.
;итие европейских аспектов высшего образования: разработка учебных про-
межвузовское сотрудничество, планы мобильности, программы образова-
обучения и исследований.
е европейского сотрудничества в области обеспечения качества,
лирование мобильности путем преодоления препятствий на пути полной
и возможностей для свободного передвижения,
ние в течение всей жизни,
жка привлекательности общеевропейского пространства высшего обра-
іение связей между общеевропейским пространством высшего образова-
I общеевропейским пространством исследования.
іки Болонского процесса должны выйти на международную систему
ш как самих высших учебных заведений по совокупности многих
)в, так и программ, по которым проводится обучение. Во всем мире
1 медицинских вузов проходят систему аккредитации и осуществляют пре-
по общепринятым программам менее 50%,
)ящее время в высших учебных заведениях нашей страны традицион-
)т объем передаваемых знаний количеством часов, прослушанных
іенному учебному курсу. Мировое сообщество предлагает решать про-
' унификации путем перехода на систему образовательных кредитов,
из основных условий присоединения России к европейскому простран-
□пего образования, гарантирующее академическое признание обучения
)м (конвертация дипломов и уровней образования), — принятие и введе-
сех национальных школах высшего образования системы зачетных единиц
обеспечивающей как зачетную, так и накопительную функции.
іе системы зачетных единиц позволит студентам свободно передви-
! продолжать обучение на протяжении всей жизни, набирая кредиты и уве-
свой багаж знаний, а соответственно, и вес как специалиста (1 зачетная
составляет 36 академических часов, год «весит» 60 кредитных единиц,
первому диплому соответствует 180 кредитов, второму — еще 120).
і этапе эти процессы затронут высшую школу дипломного образования,
спинений, что в скором времени они коснутся и последипломного специ-
I образования.
оцессе адаптации российского профессионального образования врачей
зачетных единиц необходимо учесть, что основные положения Болон-
ідшзцрации разработаны главным образом для до дипломного образования
68 ОБЩИЕ вопросы трансфузиологии
и применительно к последипломному образованию имеют различные толкования
в разных странах. При этом существуют различия в сроках и программах подго¬
товки специалиста в России и странах, внедривших Болонскую декларацию. Так,
например, минимальные периоды обязательной последипломной профессиональ¬
ной подготовки в странах Евросоюза от 3 до 7 лет (срок зависит от специальности),
а в России срок последипломной подготовки составляет либо 1 год клинической
интернатуры, либо 2 года клинической ординатуры.
При адаптации российского медицинского последипломного образования к тре¬
бованиям Болонской декларации предложено: для последипломного профессио¬
нального образования (интернатура, клиническая ординатура и профессиональная
подготовка) ввести 1 кредит, равный 36 академическим часам; для непрерывного
профессионального развития (ресертификационные циклы вместо принятого на
сегодняшний день понятия «сертификационный цикл» j тематическое усовершен¬
ствование) 1 кредит приравнять к 1 академическому часу.
При переходе на систему накопительных кредитов специалисту следует нако¬
пить в течение пяти лет необходимую сумму кредитов, эквивалентную 144 акаде¬
мическим часам, для получения или подтверждения соответствующей квалифика¬
ции.
Накопление кредитов, например на цикле ресертификации, возможно несколь¬
кими взаимно дополняемыми путями: в соответствии с перечнем обучающих
действий, равномерно распределенных по годам; или накопление 144 кредитов
за 5 лет за счет двух циклов тематического усовершенствования по 72 кредита каж¬
дый; или накопление 36 кредитов за 5 лет в соответствии с перечнем обучающих
действий, равномерно распределенных по годам, плюс 108 кредитов одного цикла
тематического усовершенствования и др.
Полагают, что, как и в странах Европейского союза, банк накопительных креди¬
тов должен включать в себя все формы обновления знаний и умений по деятельно¬
сти врача-специалиста: освоение новых методов лечения, практических навыков,
учебный тренинг редко выполняемых практических процедур, участие в кли¬
нической апробации новых фармакологических средств, технических устройств
и аппаратуры, участие в работе конференций, съездов, конгрессов, симпозиумов
и прочих видов профессиональных медицинских сообществ, все виды учебной
деятельности врача.
В системе медицинского высшего и последипломного образования необходи¬
мо унифицировать и количество, и содержание медицинских специальностей.
В настоящее время из более чем 120 медицинских специальностей, входящих
в Номенклатуру (классификатор) специальностей специалистов с высшим меди¬
цинским и фармацевтическим образованием, в учреждениях здравоохранения
России в странах Европейского союза автоматически признают только 52 меди¬
цинские специальности. В число этих специальностей не вошли: онкология, эндо¬
скопия, гематология, эпидемиология, сексология, ультразвуковая диагностика,
функциональная диагностика, психиатрия-наркология, клиническая лаборатор¬
ная диагностика, генетика и др.
Со специальностью «Трансфузиология» ситуация следующая: по данным на
2005г., в7 европейских странах — Австрии, Германии, Франции, Нидерландах, Нор¬
вегии, Португалии и Швеции — трансфузиология официально признана отдель¬
ной медицинской специальностью. В Ирландии, Люксембурге, Испании и Италии
трансфузиология не выделена в отдельную специальность. На рис. 2.1 представлен
пример системы образования по специальности «Трансфузиология» во Франции.
В странах СНГ транофз^зиология выделена в отдельную специальность в России,
Белоруссии, Украине, Армении.
«С моей точки зрения, нужно опасаться буквального неразумного выполнения
требований Болонского процесса» (академик, проф. М.А. Пальцев). Очевидно,
в«ййі
Lv.'v
fl ■'•'<•' у*''' 'V .• *"Л
'•л' Ч*' V*\*Л vtV\'
ЩЩЛ'Лл^Л****;ЛД**‘‘ о Vэтиу\^’:^*V'V,.v •;jV'g®*
ft -fs-V* "‘v*L ^'" а\**v'■*:‘'Т*-*" ^,г‘.'"' Д*ТГ?Г Т'*' ‘ " т‘? .^к-/\:;^|“-,1;^ *&£"?*? ■,\,'^~
ф»пі£ »*>ii
5$ v -^ Vv^ ^ jgs ікис г'-;, <■/, нсжмма ю
ft -« V *• OjAV* ■ ч' '„ \
' лУ. ;'•■>•'
* » ' \-*'1*' +*■ - ч- ,И V
-fcb . ■v.b' ■■■ ;■>.,*,»■ ‘.І v' t\. 't
i-.V- .40'. - V’ - ~ -■' :
^ris'%v. V\*\\ ■•;>.
Техники, медсестры,
врачи, административные
, »■/ работники
4-дневные
курсы 4-. экза¬
мен .’
Экзамены, действительные для получения
кредитов СМЕ
INTSv^aiie
Курсы для средне¬
го медицинского
персонала
Univ. Mediterranee, .
Marseille Univ. Louis
Pasteur, Strasbourg, SHU
Bordeaux, Montpellier
Bioformation
?.‘Ж'
* Плюс 20 дней практических занятий в учреждениях Службы крови.
* Плюс 5 дней практических занятий в учреждениях Службы крови.
*** Плюс 3 нед практических занятий.
Рис. 2-1. Система образования по специальности «Трансфузиология» во Франции
ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ ВРАЧА-ТРАНСФУЗИОЛОГА
70 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
что количество узких специальностей не может расширяться бесконечно. Вместе
с тем также ясно, что с развитием возможностей медицины, медицинских и инфор¬
мационных технологий время от времени необходимо пересматривать этот
список. Надо полагать, что, учитывая роль и значение трансфузиологии в экс¬
периментальной и клинической медицине, признание трансфузиологии как само¬
стоятельной медицинской специальности в ряде стран Европейского сообщества
приняты положения о враче-трансфузиологе, США и Канаде — специальности
«Патология. Трансфузиология», России и некоторых странах СНГ — специаль¬
ность «Трансфузиология». Болонский процесс, находясь в постоянном развитии,
преследуя цель формирования модели европейского образования с учетом спец¬
ифики и традиций национальных образовательных систем, должен включать все
лучшее, что есть на данный момент в мире. Следует ожидать, что главное - быть
готовым к признанию трансфузиологии (специалиста-трансфузиолога) одной
из основных признанных специальностей в Европе и других странах.
В последние годы активно обсуждают вопрос о необходимости специального
преподавания трансфузиологии при подготовке врача в медицинских институтах.
Объем знаний, представляемых студентам медицинских институтов по вопро¬
сам трансфузиологии, нельзя считать достаточным. В настоящее время разделы,
относящиеся к трансфузионной медицине, преподают, как правило, хирурги,
анестезиологи и другие специалисты на соответствующих кафедрах «по остаточ¬
ному принципу», что, естественно, не позволяет в достаточной степени раскрыть
существо и содержание предмета современной трансфузиологии. Многие разделы
трансфузионной медицины — трансфузионная иммунология, экстракорпоральная
детоксикация, компонентная гемотерапия, парентеральное питание - остаются
неохваченными. Как уже было отмечено, в некоторых странах Европы (Дания,
Финляндия, Греция и Швейцария) обучение трансфузиологии как отдельной спе¬
циальности, включено в институтские программы, В нашей стране в медицинских
училищах, где идет подготовка среднего медицинского персонала, играющего
важную роль в реализации всех аспектов трансфузиологического пособия в кли¬
нической практике, не готовят медицинских сестер-трансфузиологов, разделы
трансфузионной медицины практически не преподаются (или представлены в уре¬
занном виде).
Наиболее целесообразна организация специального курса трансфузиологии
с целенаправленным обучением (лекциями, семинарами и практическими заня¬
тиями) для студентов старших курсов медицинских институтов или ординато¬
ров, а также отдельного курса при обучении среднего медицинского персонала.
Разработка и внедрение учебного плана по трансфузионной медицине для сту¬
дентов позволит осуществлять подготовку будущих врачей и медицинских сестер
в соответствии с современными требованиями клинической медицины.
С этой целью с 2003 по 2008 г. на кафедре госпитальной хирургии Российского
университета Дружбы народов (зав. кафедрой проф. Ю.В. Торичко) был обра¬
зован специальный курс в объеме 106 ч по основам трансфузиологии (проф.
А.А. Рагимов) для студентов V-VI курса лечебного факультета. Изданы два тома
избранных лекций для студентов медицинских вузов (2005, 2007).
СПИСОК ЛИТЕРАТУРЫ
Выжигина М.А., Сизова Ж.М., Бунятян А.А., Протопопова Т.А., Заугольникова Т.В.,
Жукова С.Г. Разработка системы зачетных единиц для непрерывного профессионального
образования: Сб. науч. работ. — ММА им. И.М. Сеченова, факультет послевузовского про¬
фессионального образования врачей, 2008. — С. 28-30.
Избранные лекции по трансфузиологии: Учебное пособие / Под ред. А.А. Рагимова. —
М.: Изд-во РУДН, 2005. - 160 с.
Пальцев М.А. Денисов И. Н., Чекнев Б. Высшая медицинская школа России и Болонский
процесс. — Вып. 4: Материалы Международного совещания по стратегии медицинского обра-
ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ ВРАЧА-ТРАНСФУЗИОЛОГА Т\
зопания в Европейском регионе в рамках программы сотрудничества между Министерством
здравоохранения и социального развития Российской Федерации и Европейского регио-
„Лвжьного бюро Всемирной организации здравоохранения при участии экспертов стратеги¬
ческого партнерства ВОЗ — ВФМО. Москва, 13-14 апр. 2005 г, — М., 2005. - 309 с.
Пальцев М.А. Высшая медицинская школа России и Болонский процесс. —
Вт пт 8: Интегрированный учебный план и кредитная система: материалы совещания
«Интегрированный учебный план подготовки врача», «Европейская система кредитов
fBCTS) и ее роль в медицинском образовании» с участием экспертов ВОЗ, ВФМО, КГМА.
Москва. 11-18 апр. 2006 г. - М.. 2006. - 129 с.
Рагимов А.А.,Точенов А.В.,ДашковаН.Г.,1ЦербаковаГ.Н.,СоловьеваИ.Н. Послевузовская
щяпгговка специалистов-трансфузиологов по основным направлениям трансфузиологии:
«& вауч. работ юбилейной конференции факультета послевузовского профессионального
f Мраэования врачей ММА им. И.М. Сеченова. — М., 2004. — С. 64-74.
74 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
• Служба крови:
• трансфузионная иммунология,
• клиническая трансфузиология:
• промышленная (производственная) трансфузиология.
Проблемы и задачи трансфузиологии формируются и решаются в рамках этих
четырех основных научно-практических направлений (рис. 3-1).
Служба крови — раздел трансфузионной медицины, изучающий и реализую¬
щий на практике заготовку, сертификацию, переработку, хранение, распределение,
транспортировку компонентов, отдельных препаратов, реагентов из донорской
крови и обеспечение их безопасности. Основные задачи Службы крови:
• агитация и пропаганда донорства (при участии и содействии общественных
организаций, в первую очередь, Общества Красного Креста);
• заготовка донорской крови и ее компонентов;
• совершенствование методов консервирования, переработки и хранения кро¬
ви, ее компонентов и костного мозга;
• разработка и внедрение методов и технологий, направленных на повышение
безопасности заготавливаемых компонентов крови доноров (карантиниза-
ция, инактивация и др.);
• решение вопросов организации Службы крови в системе здравоохранения;
• определение потребностей лечебных учреждений в трансфузионных средах
и оборудовании для обеспечения трансфузионного пособия;
• сбор, хранение и распределение стволовых клеток костного мозга, перифери¬
ческой и пуповинной крови.
Служба крови в нашей стране и в большинстве стран мира представлена
Центрами крови (или СПК), отделениями и кабинетами переливания крови (отде¬
лениями трансфузиологии) в лечебных учреждениях.
Клиническая трансфузиология — раздел трансфузионной медицины, изу¬
чающий возможности управления гомеостазом при патологических состояниях
методами трансфузиологической гемокоррекции.
Клиническая трансфузиология занимается:
• обоснованием применения трансфузионных сред (компонентов донорской
крови, кровезаменителей) и изучением их клинической эффективности;
• использованием методов экстракорпоральной гемокоррекции (гемафереза,
гемодиализа, искусственного кровообращения, иммунофереза и др.) в лече¬
нии различных заболеваний;
• клиническими аспектами применения технологий, альтернативных аллоген-
ным гемотрансфузиям - проблемами аутодонорства и аутогемотрансфузий;
• лечением трансфузионных реакций и осложнений.
Основные задачи клинической трансфузиологии:
• определение показаний и противопоказаний к применению трансфузионных
сред;
• обоснование тактики трансфузионной терапии в различных условиях,
при разных патологических состояниях;
• разработка и внедрение экстракорпоральных методов детоксикации;
• агитация, пропаганда аутодонорства, методов реинфузий крови, гемодилю-
ции в клинической практике;
• разработка, совершенствование и внедрение протоколов трансфузиологиче-
ских процедур:
• профилактика и лечение постгрансфузионных реакций и осложнений;
• обоснование требований к современным трансфузионным средам для клини¬
ческой медицины;
• изучение проблем эффективного применения гемотерапии;
• разработка требований к техническим средствам и аппаратуре для трансфу¬
зионной терапии.
ПРОМЫШЛЕННАЯ
ТРАНСФУЗИОЛОГИЯ
ОСНОВНЫЕ НАПРАВЛЕНИЯ ТРАНСФУЗИОЛОГИИ
75
ОБЩЕСТВЕННЫЕ ОРГАНИЗАЦИИ
(КРАСНЫЙ КРЕСТ И ДР.)
Служба крови
Раздел трансфузионной
медицины, изучающий
и реализующий на практике
заготовку, сертификацию,
переработку, хранение
и распределение компонентов,
отдельных препаратов
и реагентов из донорской
крови
Клиническая
Производственная трансфузиология
трансфузиология Раздел трансфузионной
Раздел трансфузионной гемо-;t медицины, издающий
медицины, изучающий В 6ез_ возможности управления
и реализующий на практике опас ■ • гомеостазом организма
получение промышленным ■ ность при патологических
способом компонентов, состояниях методами
препаратов и реагентов трансфузиологической
из донорской крови гемокоррекции
Трансфузионная
иммунология
Раздел трансфузионной
медицины, изучающий
и реализующий на практике
иммунологическую
безопасность и эффективность
трансфузиологического
пособия
ИММУНОЛОГИЯ
БИОЛОГИЯ
Рис. 3-1. Основные направления трансфузиологии
КЛИНИЧЕСКАЯ
МЕДИЦИНА
Ц 06ШИ6 ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
В соответствии с основными задачами в разделе клинической трансфузиологи
мояаюпцелить несколько ключевых научно-практических направлений:
• зксгра- и интракорпоральная гемокоррекция (аферез. гемодиализ, гемосопб
дня. гемофмльтрация. искусственное кровообращение и др.);
• применение кровезаменителей;
• применение компонентов донорской крови (гемотерапия);
• аутогемотрансфузия (аутодонорство, гемодилюция, реинфузия);
• парентеральное питание (искусственное лечебное питание);
• профилактика и лечение трансфузионных реакций и осложнений;
• квантатнвная (количественная) трансфузиология — расчет потребления пре-
паратов трансфузионно-инфузионного пособия в различных клинических
отделениях и лечебном учреждении в целом при лечении отдельных нозоло¬
гий или клинических состояний.
В клинической трансфузиологии, как и в большинстве клинических дисциплин
следует различать общую и частную трансфузиологию.
Общая трансфузиология изучает методы трансфузиологической гемокоррекции
(ТГК) и возможности их применения в клинических условиях (принцип: от метода
ТГК — к болезни), т.е. механизм действия того или иного метода ТГК на организм,
правила их применения.
Частная клиническая трансфузиология изучает последовательность использо¬
вания тех или иных методов ТГК при различных заболеваниях с учетом особен¬
ностей течения и возможных осложнений (принцип: от болезни — к совокупности
применяемых методов ТГК).
Предмет частной клинической трансфузиологии (по аналогии с другими клини¬
ческими дисциплинами) - изучение эффективности методов ТГК при определенном
заболевании с учетом стадии и тяжести течения, возможных осложнений. Таким
образом, частная клиническая трансфузиология решает проблемы, связанные с адек¬
ватностью и рациональностью использования методов ТГК с целью создания опти¬
мальных схем трансфузиологического лечения того или иного симптома, синдрома,
заболевания, состояния, осложнения. В настоящее время накоплен большой объем
данных по применению различных методов ТГК при различных патологических
состояниях во многих клинических дисциплинах: терапии, акушерстве, хирургии,
анестезиологии, реаниматологии и др. Вместе с тем не всегда методы ТГК используют
в адекватной клинической ситуации и соответственно с достаточным клиническим
эффектом. Основная задача частной трансфузиологии — разработка рациональных
схем применения методов ТГК при различных патологических состояниях (нозо¬
логических формах), например «ТГК при острой кровопотере», «ТГК при опухолях
легких, желудка, кишечника*, «ТГК при семейной гиперлипидемии» и т.д., и решать
ее необходимо, опираясь на преимущества, которыми обладает тот или иной метод.
Клиническая трансфузиология реализована в основном отделениями, отделами
трансфузиологии (переливания крови, гравитационной хирургии, гемодиализа,
искусственного кровообращения) в лечебно-профилактических учреждениях.
Трансфузионная иммунология - раздел трансфузионной медицины, изу¬
чающий и реализующий на практике иммунологическую безопасность и эффек¬
тивность трансфузиологического пособия. В ее задачи входят инфекционная
и иммунологическая сертификация крови доноров и больных; обеспечение имму¬
нологической безопасности и эффективности трансфузионного пособия; профи¬
лактика трансфузионных реакций и осложнений.
Основные задачи трансфузионной иммунологии:
• инфекционная сертификация крови доноров и больных на декретированные
гемотрансмиссивные инфекции;
• изосерологическан и иммуногематологическая сертификация крови — выяв¬
ление иммуногенетических маркеров клеток и плазмы периферической
крови и антител к ним;
ОСНОВНЫЕ НАПРАВЛЕНИЯ ТРАНСФУЗИОЛОГИИ 77
• подбор совместимых пар «донор-реципиент* по основным иммуногенетиче-
ским маркерам периферической крови;
• изучение и профилактика иммуномодулирующей активности трансфуэион-
ных средств;
• выяснение причин трансфузионных реакций и осложнений;
• разработка и внедрение новых методов и тестов лабораторной сертификации
крови доноров и больных;
• разработка методов контроля качества лабораторных исследований по имму¬
нологической сертификации крови больных и доноров;
• участие в программах внешнего контроля качества лабораторных исследо¬
ваний.
Лабораторное тестирование (сертификацию) крови доноров и больных выпол¬
няют в лабораториях Центров крови, отделениях трансфузиологии (переливания
крови) лечебных учреждений. В некоторых странах исследования по разделу
трансфузионной иммунологии выполняют централизованно в отдельных адми¬
нистративно самостоятельных лабораториях, которые сертифицируют донорскую
кровь для нескольких Центров крови.
Промышленная трансфузиология занимается разработкой и производством
препаратов крови из компонентов донорской крови; разработкой и производством
синтетических кровезаменителей; производством препаратов и компонентов крови,
реагентов с помощью методов биотехнологии и генной инженерии, разработкой
и производством оборудования и расходных материалов для всех разделов транс¬
фузионной медицины. Предприятия промышленной трансфузиологии - отдельные
производства, не имеющие прямого отношения к медицинской деятельности, прямо
не связанные с Центрами крови, лечебными учреждениями и лабораторной службой.
Составная часть промышленной трансфузиологии и Службы крови - производ¬
ственная трансфузиология, раздел трансфузионной медицины, изучающий и реа¬
лизующий на практике получение препаратов и реагентов из донорской крови
промышленным способом.
Основные задачи промышленной и производственной трансфузиологии:
• решение актуальных теоретических проблем производства препаратов
из компонентов донорской крови;
• разработка технологической документации на промышленное производство
препаратов крови;
• производство препаратов крови, кровезаменителей (в том числе препаратов
парентерального питания);
• разработка методов контроля состояния трансфузионных сред в процессе
их производства и хранения;
• разработка и внедрение в производство генно-инженерных и биотехнологи¬
ческих трансфузионных гемопрепаратов;
• разработка и производство расходных материалов для трансфузиологиче-
ских процедур, приборов, инструментов и другого оборудования, необходи¬
мого в трансфузиологии.
Производство основных препаратов крови из СЗП — альбумина, иммуногло¬
булинов, факторов свертывания и др. в нашей стране большей частью развернуто
в крупных Центрах крови (СПК). За рубежом это отдельные производства, пере¬
рабатывающие донорскую плазму на препараты от нескольких Центров крови.
Несмотря на важнейшее значение Службы крови, трансфузионной иммуноло¬
гии и производственной трансфузиологии, в ближайшие годы основной «точкой
роста* всей трансфузионной медицины станет клиническая трансфузий
Поле деятельности клинической трансфузиологии — использование I
плекса трансфузиологического пособия для диагностики, профилактики и лечения
различных патологических состояний, от переливания компонентов донорской
7t ОБЩИЕ вопросы ТРАНСФУЗИОЛОГИИ
ирове и кровезаменителей, парентерального питания до аутодонорства и аутогемо¬
трансфузий, реинфузии, гемодилюций, экстра- и интракорпоральных воздействий.
СПИСОК ЛИТЕРАТУРЫ
Константинов Б.А., Рагимов А.А., Дадвани СА. Трансфузиология в хирургии. — М.: Аир-
Арт, 2000. — 566 с.
Петровский Б.В.. Рагимов А.А. Учение о переливании крови: время, проблемы, люди //
Вестник РАН. - 2001. - № 9. - С. 806-811.
Руководство по общей и клинической трансфузиологии / Под ред. Б.В. Петровского. —
М.: Медицина, 1979. — 352 с.
Румянцев А.Г.. Аграненко В.А. Клиническая трансфузиология. — М.: Медицина, 1987. —
575 с
Глава 4
Сосудистые доступы
для трансфузиологических
процедур
Инвазивные процедуры, наиболее часто применяемые на прак¬
тике, — от простой венепункции до реанимационных мероприятий;
с диагностической целью (от забора крови до введения контраст¬
ных веществ в коронарные артерии) выполняют посредством того
или иного сосудистого доступа.
В зависимости от состояния больного трансфузия может быть
произведена в венозную или артериальную систему, костный
мозг. В повседневной клинической практике наиболее часто при¬
меняют венозный доступ. Трансфузию в артериальную систе¬
му обычно используют в реанимационной практике при крайне
тяжелом состоянии больного в порядке чрезвычайной срочности.
Интрамедуллярные переливания распространены в основном в
педиатрии, в силу физиологических особенностей детского орга¬
низма.
Венозный доступ
Периферический венозный доступ
Показания:
• длительная инфузионная терапия;
• частые внутривенные вливания;
• экстракорпоральная терапия;
• повышенный риск осложнений при катетеризации централь¬
ных вен;
• необходимость проведения наркоза.
Противопоказания: любое патологическое состояние перифе¬
рических вен — флебиты, тромбофлебиты, инфицирование места
пункции.
Центральный венозный доступ
Показания; длительная инфузионная терапия; измерение цен¬
трального венозного давления.
Основное достоинство центрального венозного доступа — быстрое
разведение раствора кровью и предотвращение раздражения стенки
вены благодаря быстрому кровотоку; возможность введения боль¬
ших объемов инфузионных растворов. Кроме того, необходимо
отметить малую вероятность выпадения катетера из вены (тщатель¬
ная фиксация катетера у места вкола препятствует ес^сл“чкр
кому продвижению, исключает опасность перфори loJa£ ‘wf i
правого предсердия и возникновения летального гемопірика
go ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Центральный венозный катетер вводят через подключичную, подмышечную
иди яремную вены. Для контроля положения катетера и исключения пневмото¬
ракса проводят рентгенографию.
Признаки правильного нахождения катетера в центральной вене: по катетеру
должна поступать кровь, при соединении катетера с манометром уровень давления
колеблется соответственно с дыхательными движениями, данные рентгенографии
(если кончик катетера перфорировал стенку сосуда и находится вне его, вокруг
него будет видно облачко контрастного вещества).
В зависимости от характера патологии и объема интенсивной терапии исполь¬
зуют различные способы пункции и катетеризации периферических и магистраль¬
ных сосудов:
• чрескожная пункция периферических вен (венепункция);
• чрескожная пункция и катетеризация периферических вен;
• чрескожная пункция и катетеризация магистральных вен;
• пункция и катетеризация вен открытым способом;
• венесекция.
ВЕНЕПУНКЦИЯ
Венепункция (от лат. vena — вена и punctio — прокол),— манипуляция, пред¬
ставляющая собой чрескожный прокол стенки вены с последующим введением
иглы в просвет сосуда.
Венепункцию применяют для взятия крови с диагностической и лечебной
целью, введения лекарственных веществ, при непродолжительной инфузионной
терапии.
Венепункцию осуществляют преимущественно на верхних конечностях. Обычно
местом пункции служат поверхностные вены локтевого сгиба. При их недостаточ¬
ной выраженности (особенности анатомического строения, спадение вен при шоке,
коллапсе) можно провести пункцию на тыле стопы или в области внутренней
лодыжки. При необходимости проведения инфузионной терапии в течение 2-3 сут
проводят венесекцию или чрескожную катетеризацию вен большего диаметра, так
как крупные вены менее подвержены воспалительным изменениям. Кроме того,
периферическая вена не всегда может обеспечить достаточную объемную скорость
введения трансфузионных сред. Обычно катетеризацию центральных вен прово¬
дят в отделении реанимации и интенсивной терапии (табл. 4-1, рис. 4-1).
При выборе методики катетеризации центральных вен необходимо учитывать
следующие факторы:
• время, в течение которого может потребоваться нахождение катетера в вене
(непродолжительное, средней продолжительности, длительное);
• опыт и квалификация врача, выполняющего катетеризацию;
• наличие инструментов;
• особенности методики катетеризации (частота осложнений, возможность
применения у больных разного возраста, частота успешного проведения
катетера в центральную вену).
Освоение артериального и венозного доступов необходимо врачам всех специаль¬
ностей. Навыки подобных манипуляций приобретают уже на рабочем месте. Однако
венозная система чрезвычайно вариабельна в силу конституционных особенностей
больного, различных анатомических вариантов, развития подкожной жировой
клетчатки. Кроме того, при пункции некоторых вен существует риск повреждения
жизненно важных структур. Это вызывает необходимость обеспечения безопас¬
ности инвазивных процедур не только для больного, но и для медицинского персо¬
нала. Именно поэтому практикующий врач нуждается в четких методических реко¬
мендациях при проведении подобных манипуляций, что позволит ему приобрести
нужные знания без риска и опасностей, связанных с их изучением.
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ ПРОЦЕДУР
Таблица 4-1. Выбор места для венепункции и катетеризации
81
Место пункции
Показания
Рука:
медиальная подкожная вена £
латеральная подкожная вена
вены предплечья j
вены тыльной поверхности руки 11
подмышечная вена
проксимальная часть медиальной подкожной вены
латеральная подкожная вена
дя непродолжительного использования
іля длительной катетеризации
Три невозможности использования дистальных вен
зуки
Грудная клетка:
подключичная вена:
над ключицей
под ключицей j
Длительное парентеральное питание
Длительная инфуэия лекарственных препаратов
Гемодиализ
Измерение и мониторинг ЦВД
Затруднение при пункции периферических вен
Шея:
наружная яремная вена
внутренняя яремная вена
При недоступности поверхностных вен для введения
центрального венозного катетера
Для длительного парентерального питания
При недоступности поверхностных вен
При искусственной вентиляции легких
Мониторинг ЦВД
Парентеральное питание
Длительная инфузия лекарственных средств
Гемодиализ
Введение инотропных агентов
Нога:
бедренная вена
поверхностные вены голени
поверхностные вены тыла стопы
При легочно-сердечной реанимации
При кратковременном доступе у больных в коматоз¬
ном состоянии
Гемодиализ
Невозможность катетеризации подключичной
или внутренней яремной вен для измерения ЦВД
или введения инотропных агентов
Общие осложнения венепункции
Ошибки при введении препарата. Поскольку препараты, введенные вну¬
тривенно, действуют очень быстро, при введении непредусмотренного или пере¬
дозировке назначенного препарата может наступить смертельный исход до вве¬
дения антидота. Именно поэтому необходимо внимательно проверять препараты
до внутривенного введения. Название и дозу препарата надо читать на ампуле,
а не на коробке. Иногда, когда вовремя замечена ошибка, больного спасает
быстрота применения антидота, но чаще необходимо поддержание жизненно
важных функций организма. Например, при угнетенном дыхании необходимо
искусственное дыхание методом «рот в рот» или «рот в нос», пока не будет начата
искусственная вентиляция легких более совершенным методом.
Глубокую артериальную гипотензию устраняют, приподняв ноги больного
или поместив его в положение Тренделенбурга. Кроме того, используют перелива¬
ние внутривенно и в быстром темпе любой имеющейся в наличии трансфузионной
среды.
Сердечная недостаточность выражается слабым пульсом, одышкой, набухани¬
ем шейных вен. В этом случае больного сажают, дают кислород и вводят морфин
или дигоксин. При остановке сердца показано проведение искусственного дыха¬
ния и закрытого массажа сердца. v пу—у
Случайная внутриартериальная пункция. При проїШі^іоідО]
достаточно прижатия места прокола в течение 5 мин. После этого дажеЧкш»~
82
ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Рис 4-1. Места катетеризации централь¬
ных вен: 1 — внутренняя яремная вена;
2 — латеральная подкожная вена руки;
3 — медиальная подкожная вена руки; 4 —
V. cephalica po/icis; 5—большая подкожная
вена ноги; 6— наружная яремная вена; 7—
ключица; 8 — I ребро; 9 — подключичная
вена; 10 — паховая складка; 11 — бедрен¬
ная артерия; 12 — бедренная вена
шие дефекты заживают, как правило,
без осложнений.
Случайное введение любого раство¬
ра в артерию. В этом случае возможно
развитие ишемии и некроза тканей. Пер¬
вый признак внутриартериального введе¬
ния раздражающего раствора — жгучие
боли, распространяющиеся вниз от места
введения. Иногда, при отсутствии болей,
вслед за инъекцией развивается выражен¬
ный артериальный спазм с побледнением
конечности и исчезновением перифериче¬
ского пульса. Возможно развитие вазомо¬
торного коллапса с замедлением действия
введенного препарата. При подобной
ошибке рекомендуют оставить иглу в про¬
свете артерии и ввести через нее папа¬
верин из расчета 40-80 мг на 10-20 мл
изотонического раствора натрия хлорида,
100-150 мл местного анестетика в 0,9%
растворе. Препараты можно вводить
в подключичную артерию и инфильтри¬
ровать вокруг спазмированного сегмента
артерии. Также начинают гепаринотера-
пию для предотвращения тромбирования
артерии и обеспечивают венозный и лим¬
фатический отток, приподняв конечность
до уровня сердца. Кроме того, рекомендуют
погрузить противоположную конечность
в теплую воду для активизации коллате¬
рального кровообращения на пораженной
конечности. Также пораженную конечность
можно завернуть в стерильные полотенца
и держать в тепле (не перегревая ее).
Воздушная эмболия — редко встре¬
чающееся, но тяжелое осложнение, свя¬
занное с проникновением в вену больного
некоторого количества воздуха. Одномоментное поступление в вену 2-3 мл воз¬
духа представляет опасность для жизни человека. Воздушная эмболия может быть
осложнением пункции как центральных, так и периферических вен.
Причины воздушной эмболии:
• неправильное заполнение кровью системы перед началом трансфузии, когда
оставшийся там воздух попадает в вену с первой порцией переливаемых рас¬
творов;
• несвоевременная остановка трансфузии ведет к попаданию воздуха в конце
манипуляции;
• негерметичность или неправильный монтаж используемой системы для
трансфузии.
Значительные воздушные эмболии, вызванные внутривенной терапией, всег¬
да наблюдались редко, а с применением современного инструментария частота
их уменьшилась, что обусловлено выпуском пластиковых пакетов для трансфузи¬
онных сред вместо флаконов. Пакеты при опорожнении не заполняются воздухом
или содержат его очень немного, тем самым исключая опасность воздушной эмбо¬
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОлогических ПРОЦЕДУР 83
лии. Она может развиться при негерметичности систем при проведении транс¬
фузионных процедур. Воздух, попавший в одну из вен. с током крови посту пает
в правые отделы сердца, а затем в легочную артерию. Здесь образуется воздушный
эмбол, механически препятствующий кровообращению.
Клинические проявления воздушной эмболии - внезапное и резкое ухудше¬
ние состояния больного во время процедуры, общее возбуждение, беспокойсгво.
Больной задыхается, хватается руками за грудь: В груди - ощущение давления
и боль. Развивается цианоз губ, лица, шеи, катастрофически падает АД, пульс -
нитевидный, частый. Как правило, при быстром введении воздуха в количестве
2-3 мл и более смерть наступает через несколько минут от асфиксии.
Для исключения возможности воздушной эмболии в процессе пункции цен¬
тральных вен больного укладывают на кровать с опущенным головным концом,
чтобы создать в пунктируемой вене положительное давление. Если пункция связа¬
на с последующей трансфузионной терапией, до начала манипуляции необходимо
тщательно проверять герметичность системы, заполнение кровью или другой
трансфузионной средой всех трубок системы или аппаратуры. При использовании
нагнетательных способов следует своевременно прекратить трансфузию, оставив
в контейнере или флаконе некоторое количество крови.
Исход воздушной эмболии чаще всего неблагоприятный. При ее возникнове¬
нии необходимо уложить больного в положение Тренделенбурга, чтобы воздух
не обтурировал выходной отдел правого желудочка. Если наступает остановка
сердца, проводят быструю торакотомию. аспирацию воздуха из правого желу¬
дочка через толстую иглу, открытый массаж сердца и другие реанимационные
мероприятия.
Тромбоэмболии. Возникают при попадании в вену сгустков различной вели¬
чины, которые могут образоваться в переливаемой крови, эритроцитной массе,
или разноситься током крови из тромбированных сосудов пациента. Клинически
тромбоэмболии характеризуются появлением симптомов легочного инфаркта.
Через некоторое время после трансфузии у больного возникают боли в груди,
кровохарканье, лихорадка. Если большой сгусток закупоривает легочную артерию
или ее ветвь, наблюдают картину воздушной эмболии. Чаще всего причиной тром¬
боэмболии служат неудачная пункция сосуда, неправильная техника заготовки
и хранения крови и ее компонентов. Последние две причины реже способствуют
возникновению тромбоэмболии, так как сгустки не могут пройти через иглу.
При закупорке иглы следует немедленно прекратить трансфузию и удалить иглу.
В качестве терапии применяют активаторы фибринолиза — стрептокиназу. уро-
киназу. Их вводят через катетер в легочную артерию для местного воздействия
на тромб. Также назначают гепарин* внутривенно, в дозе 24-35 тыс. ЕД в сутки,
сердечно-сосудистые и болеутоляющие препараты.
Тромбофлебит. Возникает при многократных пункциях, при длительных вли¬
ваниях (более 7-12 ч), при неудачной пункции вены с ее проколом и образовани¬
ем гематомы, при пункции тромбированного сосуда. Характеризуется уплотнени¬
ем по ходу вены. Главное правило профилактики этого осложнения - соблюдение
асептики при пункции вены.
Обработка места пункции
Оперирующий должен обработать руки (достаточно мытья с мылом), надеть
халат, маску, перчатки. Если волосы на теле больного не закрывают доступа
к вене, их можно не сбривать. Вначале кожу в месте пункции обрабатывают мылом
или детергентом, растворенным в воде, после чего — антисептическим препара¬
том, затем спиртовым раствором йода* (1-2%) с последующей обработкой 70%
раствором этанола. Кожу очищают, начиная от ме
по направлению от места венепункции круговыми
84 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
При пунктированим глубоких вен применяют местную анестезию (1% раствор
лндокаина вводят в кожу и подкожную клетчатку).
В экстремальных ситуациях оперирующий должен действовать по обстоятель¬
ствам в соответствии с реально существующими возможностями соблюдения
стерильности.
Существует несколько приемов, позволяющих облегчить ход венепункции.
Наложение жгута способствует лучшему контурированию вен. При этом необ¬
ходимо сохранять артериальную пульсацию. Метод применяют при венепункции
поверхностных вен руки, подмышечной ямки.
Положение Тренделенбурга — больной лежит на столе, руки вытянуты вдоль
туловища, головной конец стола опущен на 15-25°. Это увеличивает венозный
приток, облегчает попадание крови в шприц даже при минимальной аспирации
и уменьшает опасность воздушной эмболии. Прием используют при пункции
и последующей катетеризации подключичной вены, внутренней яремной вены.
Сдавливание вены пальцем выше места пункции для дополнительного контури-
рования вены применяют при доступах к наружной яремной вене.
Применение пробы Вальсальвы: больного просят выдохнуть при закрытой
голосовой щели, а если используется управляемое дыхание — проводят задержку
дыхания на вдохе. Это увеличивает наполнение вены, уменьшает опасность пнев¬
моторакса. Прием используют при пункции и катетеризации внутренней яремной
вены.
Венепункцию проводят иглой, отсоединенной от системы. Пункция включает
в себя прокол кожи над веной и прокол стенки вены с введением иглы в просвет
сосуда (приблизительно половина длины иглы). После поступления из просвета
иглы капель крови можно соединять канюлю с системой или проводить катете¬
ризацию. При получении проб крови достаточно, чтобы только часть среза иглы
находилась в вене и обеспечивала вытекание крови. При внутривенных инъек¬
циях это недопустимо, так как через оставшийся вне просвета сосуда срез иглы
вводимый раствор попадет в окружающие ткани. Именно поэтому при попадании
кончика иглы в вену шприц прижимают к коже, что при правильном нахождении
ее среза (повернут вверх) делает безопасным продвижение иглы внутрь сосуда,
не опасаясь его прокола. Если пункция вены проведена с целью вливания каких-
либо медикаментозных жидкостей, правильность попадания иглы в сосуд про¬
веряют подтягиванием поршня шприца к себе. При правильном попадании иглы
струя крови свободно потечет в шприц. Перед пункцией вены следует убедиться,
нет ли в шприце с набранным лекарством пузырьков воздуха. Для этого устанав¬
ливают шприц строго вертикально иглой вверх и выпускают через иглу воздух
и небольшую часть вводимого раствора. При введении лекарства шприц должен
быть постоянно прижат к коже, чтобы кончик иглы находился близко к ней.
В этом случае попадание раствора под кожу можно сразу заметить (табл. 4-2).
Таблица 4-2. Размеры игл для венепункции у взрослых
Место введения
Наружный диаметр иглы, №
Минимальная длина иглы или канюли, мм
Вены руки
14 или 16
Короткая — 40
Внутренняя яремная вена
14 или 16
Короткая — 40, иногда — 70
Подключичная вена
14 или 16
Среднеключичный доступ — 60, более лате¬
ральный — 70
Наружная яремная вена
14 или 16
Короткая — 40
Бедренная вена
14
Короткая — 40
ВЕНЫ РУКИ
Доступ через локтевую ямку
Наиболее часто венепункцию периферических вен осуществляют на венах
в локтевой ямке.
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ ПРОЦЕДУР 85
Преимущества. Вены локтевой ямки видимы, пальпируются, не наблюдается
осложнений при непродолжительной катетеризации, и, что самое главное, практи¬
чески любой клиницист имеет опыт венепункций этой области.
Недостатки. Поверхностные вены руки непригодны для длительной катете¬
ризации, так как быстро развиваются тромбофлебит и воспаление (через 24-48 ч
после введения катетера). Возможность подтекания раствора в подкожную клет¬
чатку, инфицирования и тромбирования вен исключает введение концентрирован¬
ных растворов, препаратов калия, раздражающих сосудистую стенку, и др. В связи
с этим целесообразно менять место пункции каждые 24 ч или при появлении при¬
знаков воспаления. Исключается возможность массивных инфузий.
Противопоказания. После наложения жгута вены не видны и не пальпируют¬
ся. Флебит или воспаление мягких тканей на руке.
Используемые вены. Медиальная подкожная вена руки, латеральная подкож¬
ная вена руки, вена на заднемедиальной поверхности предплечья.
Место пункции. Вблизи выбранной вены.
Положение больного. Сидя, рука отведена на 45°.
Инструменты. Игла №14, минимальная длина — 40 мм.
Анатомия локтевой ямки. Венозная кровь из руки оттекает по двум основ¬
ным сообщающимся венам — медиальной и латеральной подкожным венам руки
(рис. 4-2, 4-3).
Медиальная подкожная вена поднимается вдоль медиальной поверхности пред¬
плечья с тыльной поверхности кисти в виде двух ветвей, сливающихся между собой
перед локтевым сгибом. У локтя вена проходит спереди от медиального надмыщел-
ка, соединяясь с промежуточной веной локтя. Затем вена ложится в медиальную
борозду двуглавой мышцы плеча и на половине протяжения плеча прободает фас¬
цию. Остальные вены заднемедиальной поверхности предплечья впадают в меди¬
альную подкожную вену. Они хорошо контурируются, но, так как плотно не связаны
с подкожной жировой клетчаткой, при пункции легко уходят из-под иглы.
Рис. 4-2. Периферические вены руки: 1,2 — Рис. 4-3. Пункция периферических вен руки
латеральная подкожная вена руки; 3 — меди¬
альная подкожная вена руки; 4 — срединная
вена локтя • ' ' ■Ліщ.
00 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Латеральная подкожная вена следует с тыльной поверхности кисти на перед¬
нюю поверхность лучевого края предплечья, где принимает многочисленные кож¬
ные вены предплечья, укрупняется и идет к локтевой ямке. Здесь она анастомо-
зирует с медиальной подкожной веной и по боковой бороздке двуглавой МЫШЦЫ
плеча ложится в бороздку между дельтовидной и большой грудной мышцами, где
прободает фасцию и под ключицей впадает в подмышечную вену.
Промежуточная вена локтя. Представляет собой большую соединительную вену,
которая отделяется от латеральной подкожной вены ниже локтевого сгиба, прохо¬
дит наискосок и над локтевым сгибом впадает в медиальную подкожную вену руки.
Ход пункции. Для лучшего контурирования вены накладывают жгут на верх¬
нюю часть плеча, не сдавливая артерию (ее сдавление определяют по исчезно¬
вению или ослаблению пульса). Больной несколько раз сжимает и разжимает
пальцы для лучшего наполнения вен кровью. Место обрабатывают спиртовым
раствором йода*, затем этанолом. Пункция может быть проведена только иглой,
или иглой, соединенной со шприцем. Иглу вкалывают правой рукой, ею же
опираясь на руку больного. Левой слегка натягивают кожу и постепенно про¬
водят иглу через кожу и стенку вены. Как только покажется капля крови, иглу
опускают слегка книзу и продвигают по ходу сосуда. Если пункция осуществле¬
на для внутривенной инъекции, то после появления капель крови в игле жгут
удаляют. При взятии же крови из вены его оставляют до конца манипуляции.
Иглу вводят на половину длины. После пункции иглу быстро извлекают, место
укола придавливают стерильной марлевой салфеткой и смазывают спиртовым
раствором йода*. Больной сгибает руку в локте, сдавливая тем самым салфетку.
Отверстие в вене быстро затягивается.
Если в локтевой ямке пригодной для пункции вены нет, руку поворачивают
кнаружи и ищут удобный для венепункции сосуд на заднемедиальной поверхности
предплечья.
Пункция подмышечной вены
Показания к применению. Невозможность использования дистальных вен
руки.
Преимущества. Пункцию подмышечной или дистальной части подкожной
вены проводят вслепую, ориентируясь на подмышечную артерию, которую нахо¬
дят пальпаторно. Эту вену используют при коллапсе, когда спадаются перифери¬
ческие вены.
Анатомия. Поднявшись до подмышечной впадины, медиальная подкожная
вена руки переходит в подмышечную вену. Латеральная граница подмышечной
впадины образована латеральным краем большой грудной мышцы. В верхней
части подмышечной области, на уровне нижней границы I ребра, подмышечная
вена переходит в подключичную вену. Недалеко от этого места в нее впадает
латеральная подкожная вена руки. В месте пересечения подмышечной вены
и малой грудной мышцы вена делится на три части. Наиболее удобна для пунк¬
ции дистальная часть подмышечной вены (из-за ее поверхностного расположе¬
ния). Она отделена от кожи фасцией и подкожной жировой клетчаткой. К ней
прилегает медиальный подкожный нерв предплечья, а к нерву — подмышечная
артерия. Повреждение остальных образований плечевого сплетения во время
пункции маловероятно, так как они расположены ближе к плечевой артерии
(рис. 4-4).
Положение больного. Больной лежит на спине, голову держит прямо, под
головой - подушка. Рука для пункции отведена, ее ладонь подложена под заты¬
лок.
Положение врача. Стоя со стороны пункции.
Ориентиры. Пальпируют подмышечную артерию. Определяют место перехода
медиальной подкожной вены в подмышечную вену.
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИНЕСКИХ ПРОЦЕДУР 87
Инструменты. Игла №14, минимальная длина — 40 мм.
Место пункции. На 1 см медиальнее артерии, в месте перехода медиальной
подкожной вены руки в подмышечную вену.
Рис. 4-4. Анатомия подмышечной вены: 1 — подмышечная артерия; 2 — медиальный кожный
нерв плеча; 3 — плечевое сплетение; 4 — малая грудная мышца; 5 — большая грудная мышца;
6 — подмышечная вена; 7 — медиальная подкожная вена руки
Ход пункции. Асептические условия, при необходимости — применение
местной анестезии. Для контурирования вен на подмышечную область накла¬
дывают жгут, как можно выше. Если подмышечная область выражена сильно,
то для лучшего пережатия вен подкладывают под жгут марлевую салфетку либо
прижимают пальцами свободной руки вену медиальнее пульсации подмышечной
артерии (рис. 4-5). Или, если есть ассистирующий, с его помощью можно облег¬
чить венепункцию, нажимая на медиальную часть подмышечной области.
Конец иглы устанавливают в месте пункции, наклоняя ее под углом 30°
к поверхности тела и направляя к грудной стенке параллельно подмышечной
артерии. Для избежания повреждения и ограничения этой артерии желательно
во время пункции держать на ней палец.
Рис. 4-5. Венепункция подмышечной вены и проксимальной части медиальной подкожной вены
руки: 1 —подмышечная артерия; 2 — подмышечная вена
89 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Подключичная вена
Преимущества использования подключичной вены в трансфузиологии обу¬
словлены ее анатомо-физиологическими особенностями. Вена имеет большой диа¬
метр (у взрослого - 12-14 мм). Влагалище вены сращено с надкостницей ключицы
и I ребра, грудино-ключичной фасцией, поэтому она отличается постоянным рас¬
положением, неподвижностью, не изменяет своего положения при перемене позы.
Связанная с окружающими тканями вена не спадается даже при коллапсе, т.е. когда
другие сосуды становятся недоступными для венепункции. Расположение вены
обеспечивает минимальную опасность внешнего инфицирования. Значительная
скорость кровотока в вене препятствует тромбообразованию, делает возможным
вливание гипертонических растворов, а большой диаметр позволяет одномоментно
вводить значительные количества жидкости. Необходимо отметить сравнительную
простоту проведения пункции и комфортные условия для пациента (нет ограни¬
чений подвижности пациента в пределах постельного режима). Низкое давление
в вене и плотность окружающих ее тканей препятствуют образованию постинъек-
ционных гематом.
Показания:
• введение катетера в центральные вены;
• измерение и мониторинг ЦВД;
• необходимость длительного и многократного введения трансфузионных
средств, в случаях невозможности трансфузии через периферические вены
(при шоке, спазме периферических сосудов);
• введение растворов для парентерального питания;
• введение инотропных средств;
• проведение гемодиализа;
• необходимость быстрой инфузии жидкостей.
Противопоказания:
• венозный тромбоз;
• повышенная кровоточивость;
• нелеченый сепсис;
• травма ключицы;
• выраженная дыхательная недостаточность;
• синдром верхней полой вены.
Анатомия. Подключичная вена расположена в нижней части подключично¬
го треугольника, образованного задним краем грудино-ключично-сосцевидной
мышцы, средней частью ключицы и передним краем трапециевидной мышцы,
и представляет собой продолжение подмышечной вены. Начинаясь от нижней
границы I ребра и проходя за ключицу до соединения с внутренней яремной веной
позади грудино-ключичного сочленения, на всем протяжении подключичная вена
спереди отделена от кожи ключицей. На уровне верхней границы ключицы вена
достигает своей наивысшей точки. Вена лежит на передней лестничной мышце,
а под мышцей находится подключичная артерия. Верхушка легкого расположена
глубже артерии (рис. 4-6).
Осложнения при катетеризации подключичной вены: воздушная эмболия,
прободение миокарда с летальным исходом вследствие тампонады сердца, кро¬
вотечение в средостение вследствие перфорации плечеголовной вены, разрыв
грудного протока, временный паралич диафрагмального нерва в результате при¬
менения местного обезболивания, завязывание катетера в узел.
Все существующие методы пункции подключичной вены можно разделить
на две группы: с над- и подключичным доступом (рис. 4-7).
Надключичный доступ более удобен, так как расстояние от кожи до вены
короче (0,5-4 см), вена расположена прямо под кожей, и игла при пункции про¬
ходит только через кожу и фасцию. При необходимости введения катетера в цен-
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ ПРОЦЕДУР
Рис. 4-6. Наружные анатомические ориентиры при венепункции и катетеризации подключичной
и внутренней яремной вен: 1 — подключичный доступ при венепункции подключичной вены;
2 — надключичный доступ при венепункции подключичной вены; 3 — внутренняя яремная вена;
4 — грудино-ключично-сосцевидная мышца
Рис. 4-7. Доступы при венепункции и катетеризации подключичной вены: 1 — Aubaniac (1962);
2 — Mogil et al. (1967); 3 — Morgans, Harkins, (1972); 4 —Yoffa (1965); 5 —James, Myers (1973);
6 — Haapaniemi, Slatis (1974); 7 — Tofield (1969)
Рис. 4-8. Катетеризация подключичной вены:
I — подключичная артерия; 2 — латеральная
подкожная вена руки; 3 — подключичная
вена; 4 — ключица; 5 — I ребро; 6 —
II ребро
тральную вену надключичный доступ
имеет большую вероятность попада¬
ния. Игла проходит дальше от плевры,
поэтому меньше риск пневмоторакса.
Преимущество этого доступа перед под¬
ключичным состоит и в том, что пунк¬
ция более доступна анестезиологу в ходе
операции, когда он находится со сторо¬
ны головы больного: ход иглы при пунк¬
ции соответствует направлению вены.
При этом игла постепенно отклоняет¬
ся от подключичной артерии и плев¬
ры, что снижает риск их повреждения.
Однако необходимо отметить, что дли¬
тельная фиксация иглы или катетера
при этом доступе затруднена (рис. 4-8).
В случае подключичного доступа
необходима игла большей длины, так
Рис. 4-9. Подключичный доступ при катетеризации
подключичной вены
оыдие ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
как она проходит фасцию, кожу,
мышечный слой. Этот доступ более
предпочтителен при длительной
катетеризации (легче закрепить
катетер и меньше условий для раз¬
вития инфекции). При подключич¬
ном доступе лучше используются
выраженные анатомические ори¬
ентиры, что способствует большей
безопасности, поэтому данный
метод можно рекомендовать к при¬
менению у тучных больных.
К редким осложнениям пунк¬
ции подключичной вены относят
повреждение нервных стволов,
трахеи и щитовидной железы,
появление признаков тромбоза
и тромбофлебита подключичной
и плечеголовной вен.
Большинство специалистов предпочитают выполнять пункцию подключичной
вены на уровне середины ключицы по Aubaniac (рис. 4-9).
Подключичный доступ
Положение больного. Больной лежит на спине, головной конец стола опущен
на 25' (положение Тренделенбурга). Руки вытянуты вдоль туловища. Голову боль¬
ного поворачивают в сторону, противоположную месту пункции. Под грудную
клетку подкладывают валик или подушку.
Положение врача. Стоит со стороны пункции. Большинство врачей отдают
предпочтение правой стороне, так как при левостороннем подходе существует
опасность повреждения грудного лимфатического протока, впадающего в веноз¬
ный угол у места слияния внутренней яремной и левой подключичной вен.
Инструменты. Игла №14, минимальная длина — 60 мм. Острие заточено
под углом 35°, клиновидной формы. Такая форма позволяет легко проходить
кожу, связки, стенку вены и защищает кровеносный сосуд от попадания жировой
ткани.
Ориентиры. Середина ключицы, нижний край ее — треугольник, образован¬
ный грудинной и ключичной головками грудино-ключично-сосцевидной мышцы
и верхним краем ключицы.
Место пункции. На 1 см ниже середины нижнего края ключицы (у детей —
сразу у середины нижнего края ключицы).
Ход пункции. Антисептические условия, при необходимости — применение
местной анестезии. У больных с одышкой пункцию подключичной вены и ее
катетеризацию целесообразно выполнять после интубации трахеи в состоянии
искусственной вентиляции легких. Это предотвращает образование воздушного
эмбола.
Конец иглы устанавливают в место пункции. Шприц с иглой поворачивают
по направлению к голове. Затем его разворачивают кнаружи, чтобы острие иглы
указывало на треугольник, образованный грудинной и ключичной головками
Грудино-ключично-сосцевидной мышцы и верхним краем ключицы (из положе¬
ния А в положение Б), или в сторону яремной вырезки, поместив в нее в качестве
ориентира палец. Иглу продвигают позади ключицы (конец ее должен скользить
по задней поверхности ключицы), держа шприц строго параллельно фронталь¬
ной плоскости тела для предотвращения пневмоторакса. Срез иглы должен быть
повернут вниз.
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ ПРОЦЕДУР 91
Если в шприце не появляется венозная кровь после прохождения 5 см, иглу
слегка подтягивают, создавая разрежение в шприце (игла могла проколоть обе
стенки вены). Если кровь не аспирируется, полностью извлекают иглу и вводят ее
повторно, направляя на 1 см выше яремной вырезки.
Возможны и другие точки пункции подключичной вены при подключичном
доступе.
По Mogil и соавт. (1967): непосредственно у нижнего края ключицы, на уров¬
не границы между медиальной и средней третью ключицы. Такое расположение
точки пункции, по мнению ее сторонников, снижает возможность травмирования
подключичной артерии, плечевого сплетения и плевры.
По Tofield (1969): точка пункции расположена латеральнеє середины ключицы,
на 1 см книзу от нижнего края ключицы. По мнению ряда авторов, более лате¬
ральное расположение места пункции уменьшает риск пневмоторакса и попадания
в подключичную артерию.
Надключичный доступ
Существует много методик пункции подключичной вены с надключичным досту¬
пом, проводимых в одном и том же месте, но различающихся по направлению иглы.
Положение больного. Больной лежит на спине, головной конец стола опущен
на 25°. Руки вытянуты вдоль туловища. Голову больного поворачивают в сторону,
противоположную месту пункции. Под грудную клетку подкладывают подушку
или валик.
Положение врача. Стоит со стороны пункции.
Инструменты. Иглы №14-16, минимальная длина - 60 мм.
Ориентиры. Латеральный край ключичной головки грудино-ключично¬
сосцевидной мышцы сразу у верхнего края ключицы.
Если больной в сознании, для лучшего контурирования мышцы его просят при¬
поднять голову, при этом нажимая рукой на лоб больного.
Надключичный доступ по Yoffa (1965)
Место пункции. Угол между ключичной головкой грудино-ключично¬
сосцевидной мышцы и верхним краем ключицы.
Ход пункции. Асептические условия, при необходимости применение местной
анестезии. Острие иглы помещают в точку пункции так, чтобы оно располага¬
лось в каудальном направлении. Затем разворачивают шприц на 45° кнаружи
и под углом 15° ниже фронтальной плоскости. Обычно расстояние до вены состав¬
ляет 1-1,5 см.
Надключичный доступ по James и Myers (1973)
Место пункции. Вершина угла между задней границей грудино-ключично¬
сосцевидной мышцы и ключицей.
Ход пункции. Острие иглы помещают в точку пункции, держа шприц в кау¬
дальном направлении. Затем его разворачивают кнаружи, опуская ниже фрон¬
тальной плоскости на 10°. Иглу вводят в направлении области, расположенной
за рукояткой грудины на уровне угла грудины.
Надключичный доступ по Haapaniemi и Slatis (1974)
Место пункции. На 2-3 см выше ключицы, сразу у заднего края грудино¬
ключично-сосцевидной мышцы. Считают, что катетер продвигается легче, так
как игла входит в вену под менее тупым углом.
Ход пункции. Техника та же, но угол разворота шприца кнаружи из положения
А в положение В меньше — 35°.
Осложнения при использовании надключичного доступа.
• Прокол артерии:
•Ф- немедленно извлекают иглу и прижимают артерию пальцем на 5 мин;
❖ контролируют гемодинамику и дыхательные шумы для исключения пнев
моторакса.
92 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
• Воздушная эмболия:
❖ предпринимают попытку извлечь воздух аспирацией через катетер:
❖ при стабильной гемодинамике поворачивают больного на левый бок
в положении Тренделенбурга для того, чтобы «запереть» воздух в правом
желудочке; воздух постепенно исчезнет.
1 Пневмоторакс:
❖ при подозрении на напряженный пневмоторакс вводят иглу Ns16 во вто¬
рое межреберье по среднеключичной линии для декомпрессии;
❖ если пневмоторакс меньше 10% —ингаляция 100% кислорода и рентгено¬
логический контроль каждые 4 ч; если больше 10% — дренаж плевральной
полости.
При повреждении грудного лимфатического протока необходимо удалить кате¬
тер и асептически закрыть место вкола.
Внутренняя яремная вена
Показания к венепункции:
• мониторинг ЦВД;
• парентеральное питание;
• длительная инфузия лекарственных средств;
• введение инотропных агентов;
• гемодиализ;
• искусственная вентиляция легких;
• недоступность или непригодность периферических вен для пункции.
Противопоказания:
• нелеченый сепсис;
• венозный тромбоз;
• хирургическое вмешательство на шее в анамнезе (со стороны предполагае¬
мой пункции или катетеризации).
Преимущества. К положительным сторонам пункции внутренней яремной
вены относят минимальный риск пневмоторакса. Также необходимо отметить,
что венепункция указанной вены предъявляет меньше требований к опыту и тех¬
ническим навыкам врача, чем подобная манипуляция на подключичной вене,
в связи с этим отмечают больший процент успешных катетеризаций. Кроме того,
существует возможность контролировать кровотечение.
К отрицательным моментам следует отнести высокий риск повреждения сонной
артерии и грудного лимфатического протока (при левостороннем доступе), дис¬
комфорт для больного, особенно при проведении длительного парентерального
питания, плохую контурируемость вены у тучных больных, возможность спадения
при глубоком волемическом шоке.
Анатомия. Внутренняя яремная вена — крупная вена, которая, так же как и под¬
ключичная, может быть использована для введения короткого или центрального
катетеров. Ветви ее делятся на внутричерепные и внечерепные. Начавшись
в яремном отверстии черепа, где она имеет расширение, вена проходит вдоль шеи
под грудино-ключично-сосцевидной мышцей (рис. 4-10, 4-11). Яремная вена,
сонная артерия и блуждающий нерв проходят вместе в соединительнотканном
влагалище, в котором вена лежит латеральнеє блуждающего нерва и сонной
артерии. Начинаясь в области медиального края верхушки грудино-ключично¬
сосцевидной мышцы на шее, вена заканчивается в латеральных отделах мышцы
(место прикрепления латеральной головки мышцы к грудине) у основания шеи.
Позади вены расположены предпозвоночная пластинка шейной фасции, пред-
позвоночные мышцы, поперечные отростки шейных позвонков. Ниже к основа¬
нию шеи рядом с веной расположены подключичная артерия, диафрагмальный
и блуждающий нервы, купол плевры. Позади грудино-ключичного сочленения
внутренняя яремная вена сливается с подключичной веной, образуя плечеголов-
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ ПРОЦЕДУР
93
ную вену. Вена обладает способностью к значительному изменению своего внут¬
реннего объема в зависимости от притока крови. Обе плечеголовные вены обра¬
зуют верхнюю полую вену.
В место слияния внутренней яремной и подключичной вен слева впадает груд¬
ной проток, а справа — правый лимфатический проток.
Ориентиры. Как отмечено выше, внутренняя яремная вена проходит по шее
под грудино-ключично-сосцевидной мышцей. Когда голова повернута в противо¬
положную сторону, вена расположена прямо по линии, соединяющей ушную рако¬
вину с грудино-ключичным сочленением.
Положение больного. Больной лежит на столе, руки вытянуты вдоль тулови¬
ща. Головной конец стола опущен на 25° (положение Тренделенбурга). Под плечи
подкладывают небольшое полотенце. Голова повернута в противоположную
от пункции сторону. Обычно предпочтение отдают правой стороне, так как доступ
слева сопровождается большим риском повреждения грудного протока, образую¬
щего дугу на уровне VII шейного позвонка, вливающегося в левую яремную вену
и располагающегося прямо под ней.
Положение врача. Стоит у головы больного или с противоположной от пунк¬
ции стороны.
Инструменты. Игла №14.
Ход пункции. Условия асептические, при необходимости применяют местную
анестезию.
Ниже описан ход пункции, общий для всех вариантов доступа (см. рис. 4-9):
• определяют место введения иглы на коже;
• помещают в эту точку иглу, направляя шприц каудально (положение А);
• в зависимости от метода шприц разворачивают кнутри или кнаружи (из поло¬
жения А в положение Б);
• опускают или поднимают шприц относительно фронтальной плоскости
(из положения Б в положение С);
• прокалывают стенку вены.
Различают следующие виды доступа в зависимости от расположения точки
пункции относительно верхушки легкого: высокий (рис. 4-12), низкий (или цен¬
тральный), задний, передний.
Рис. 4-10. Анатомия внутренней яремной вены:
1 — наружная яремная вена; 2 — грудино-
ключично-сосцевидная мышца; 3 — внутрен¬
няя яремная вена; 4 — сонная артерия
Рис. 4-11. Катетеризация внутренней яремной
вены: 1 — грудино-ключично-сосцевидная
мышца; 2 — внутренняя яремная вена; 3 —
I ребро
94
ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Рис. 4-12. Высокий медиальный доступ при венепункции и катетеризации внутренней яремной вены:
X — щитовидный хрящ
Передний доступ. Позволяет пальпировать внутреннюю яремную вену и сон¬
ную артерию. Определяют треугольник, образованный головками грудино-
ключично-сосцевидной мышцы и ключицей. На вершине пальпируют сонную
артерию и сдвигают ее в медиальном направлении. Иглу вводят в средней точке
по переднему краю грудино-ключично-сосцевидной мышцы и направляют к пере¬
сечению IV ребра с парастернальной мышцей под углом 45° (срез иглы направ¬
лен кверху). Глубина введения иглы — 5 см. Если в игле не появляется кровь
после продвижения, медленно ее извлекают, постоянно поддерживая разрежение
в шприце. Если по-прежнему кровь не появляется, не меняя точки прокола, изме¬
няют направление иглы на 1-3 см латеральнеє.
При проколе сонной артерии возникает пульсирующее кровотечение алой кро¬
вью. В этом случае иглу удаляют и тампо¬
нируют область прокола на 10-15 мин.
Задний доступ. Хотя он менее удобен,
при этом доступе меньше риск попадания
в сонную артерию (рис. 4-13).
Точка пункции — иглу вводят под гру¬
дино-ключично-сосцевидную мышцу под
углом 15“ на границе средней и нижней
трети ее латеральной части и направля¬
ют к надгрудинной ямке, постоянно под¬
держивая разрежение в шприце. Если нет
обратного тока крови после продвижения
иглы на 3 см, ее медленно извлекают.
Вена находится на глубине 5-6 см
от поверхности кожи. Необходимо удер¬
живать иглу точно под брюшком мышцы.
Облегчают пункцию задержка дыхания
на вдохе и применение пробы Вальсальвы
(увеличивает наполнение вены и умень¬
шает опасность пневмоторакса).
Рис. 4-13. Задний доступ при венепункции
и катетеризации внутренней яремной вены:
1 — наружная яремная вена
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКЙХ ПРОЦЕДУР 95
Нижний или центральный доступ. Иглу вкалывают в точке на расстоянии
0,5-1 см от медиального края наружной ножки грудино-ключично-сосцевидной
мышцы и на 1 см выше ключицы, затем направляют каудально под углом 30 40*
к горизонтальной плоскости (рис. 4-14). При этом дважды возникает ощущение
препятствия и последующего «провяливания* иглы - при проколе фасций шеи
и вены.
Осложнения
Прокол сонной артерии: немедленно извлекают иглу и зажимают место прокола
пальцем.
Воздушная эмболия: в этом случае пытаются извлечь воздух аспирацией через кате¬
тер. При остановке сердца начинают реанимационные мероприятия. Если гемодина¬
мика стабильна, больного поворачивают на левый бок в положении Тренделенбурга
для «запирания* воздуха в правом желудочке. Воздух постепенно исчезнет.
Рис. 4-14. Центральный доступ при венепункции и катетеризации внутренней яремной вены
При напряженном пневмотораксе вводят иглу №16 во второе межреберье
по среднеключичной линии для декомпрессии. В других случаях при необходимо¬
сти дренируют плевральную полость.
Наружная яремная вена
Преимущества. Вена расположена поверхностно, вследствие этого нет опасно¬
сти травматических осложнений пункции, нет риска пневмоторакса. Вена хорошо
контурируема, даже у тучных больных. Возможно использование вены у больных
с различными нарушениями в свертывающей системе. Также необходимо отме¬
тить удобное для больного положение головы при катетеризации и пункции этой
вены и легкую контролируемость кровотечения из нее.
Показания:
• введение центрального венозного катетера;
• длительное парентеральное питание;
• недостаточность периферических вен руки и отсутствие достаточного опыта
пункции внутренней яремной и подключичной вен.
Недостатки. Технические трудности при катетеризации; затрудненный уход
при длительной катетеризации; процедура может повлечь нарушение подвижно¬
сти шеи.
Анатомия. Начавшись позади ушной раковины в области заднечелюстной
ямки, наружная яремная вена спускается, покрытая подкожной мышцей шеи.
по наружной поверхности грудино-ключично-сосцевидной мышцы, пересекая
ее наискосок книзу и кзади. Затем она проходит за этой мышцей и грудино¬
ключичным сочленением и под острым углом соединяется с подключичной
90 ОЫЦИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
веной. Именно это место служит основным препятствием для введения катетера
из наружной яремной вены.
Положение больного. Больной лежит на спине, руки вытянуты вдоль тулови¬
ща, головной конец стола опущен на 25°. Голова повернута в сторону, противопо¬
ложную месту пункции.
Положение врача. Стоит за головой больного.
Инструменты. Игла №14-16, длина - 40 мм.
Ориентиры. Грудино-ключично-сосцевидная мышца, наружная яремная вена.
Ход пункции. Условия — асептические, при необходимости применяют мест¬
ную анестезию.
Пункцию проводят в месте, где вена лучше всего видна (рис. 4-15). Она слабо
фиксирована соседними тканями и отодвигается от иглы. Во время введения иглы
вену можно фиксировать между большим и указательным пальцами. Вену сдав¬
ливают пальцем выше места пункции (на 1-2 см выше ключицы), в результате
чего происходит ее наполнение и лучшее контурирование. Срез иглы при пунк¬
ции направлен кверху, сама игла — по ходу сосуда. Вену перестают сдавливать
над ключицей лишь после поступления крови в просвет иглы и присоединения
системы для трансфузий. Это предохраняет от развития воздушной эмболии, так
как в венах шеи отрицательное давление.
А
Рис. 4-15. Венепункция и катетеризация наружной яремной вены
Бедренная вена
Показания к пункции и катетеризации:
• легочно-сердечная реанимация;
• кратковременный доступ к центральным венам у больных в коматозном
состоянии и у парализованных больных;
• невозможность катетеризации подключичной или внутренней яремной вены
для измерения ЦВД или введения инотропных агентов;
• гемодиализ.
Преимущества пункции бедренной вены — ее удобное анатомическое располо¬
жение и простота введения катетера.
Осложнения:
• высокий риск инфицирования;
• возможность тромбоза (в 10-12% случаев);
• пункция бедренной артерии (в 5% наблюдений).
Противопоказания. Относительным противопоказанием могут послужить
хирургические операции в паховой области в анамнезе. Также не следует приме¬
нять катетеризацию бедренной вены у больных с выраженной коагулопатией, так
как высок риск повреждения бедренной артерии.
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ ПРОЦЕДУР 97
Анатомия. Венозный отток от нижних конечностей осуществляется через
систему поверхностных и глубоких вен. Поверхностные вены расположены
под кожей, а глубокие сопровождают основные артерии.
Бедренная вена — основная глубокая вена нижней конечности сопровождает
бедренную артерию на бедре, лежит в бедренном влагалище медиальнее артерии.
В области паховой связки бедренное влагалище находится на глубине нескольких
сантиметров от поверхности кожи. В бедренном треугольнике в вену впадают
несколько крупных поверхностных вен. От кожи вена отделена глубокой и поверх¬
ностной фасциями бедра. Бедренная вена заканчивается на уровне паховой связки,
где переходит в наружную подвздошную вену (рис. 4-16).
Рис. 4-16. Венепункция и катетеризация бедренной вены: 1 — бедренная вена; 2— место пере¬
сечения вены и связки; 3 — место пункции — на 1 см дистальнеє связки
Ориентиры. Находят вену ниже паховой связки посредством пальпации в цен¬
тре воображаемого отрезка между верхней передней подвздошной остью и лон¬
ным сочленением. Вена расположена параллельно и медиальнее артерии.
Инструменты. Игла №14 длиной не менее 50 мм.
Положение больного. Лежит на спине. Под ягодицы подкладывают подушку,
чтобы паховая область выступала кверху. Бедро отводят и поворачивают немного
кнаружи. Врач стоит со стороны пункции лицом к голове больного.
Ход пункции. Процедуру проводят в асептических условиях под местной ане¬
стезией. Необходимо побрить кожу пациента. Вводят иглу в бедренный треуголь¬
ник ниже паховой складки. Вена расположена на 1-2 см медиальнее пальпируемой
артерии. Угол наклона иглы к поверхности бедра — 45-50°, параллельно пульси¬
рующей артерии. Риск неудачной венепункции выражен меньше при медиальном
подходе к сосуду, чем при латеральном. Обычно в вену попадают на глубине
2-4 см.
Осложнения
Если после попадания иглы в просвет сосуда вытекает пульсирующая красная
кровь, это свидетельствует о проколе бедренной артерии. Иглу удаляют, тампо¬
нируют паховую область в течение 20 мин. Затем накладывают давящую повязку
еще на 30 мин. Постельный режим не менее 4 ч.
Вены лодыжки и стопы
Вены тыла стопы. В поверхностных слоях тыла стопы находится венозное
сплетение, из медиального отдела которого возникает большая подкожная вена.
98 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
из латерального - малая подкожная вена. Дистально от венозной сети находится
тыльная венозная дуга стопы, куда впадают тыльные плюсневые вены.
Поверхностные вены голени проходят между поверхностной и собственной
фасцией.
Большая подкожная вена берет начало в области медиальной лодыжки.
Проходит по переднемедиальной поверхности ноги и впадает в бедренную вену
на уровне овальной ямки. Принимает многочисленные притоки — подкожные
вены передней поверхности голени и бедра, а также подкожные вены наружных
половых органов и передней стенки живота.
Малая подкожная вена начинается на уровне края стопы около латеральной
лодыжки и впадает в подколенную вену между головками икроножной мышцы,
прободая собственную фасцию (рис. 4-17).
Вены ног менее пригодны для пункций, так как в них легко возникают флебиты.
Рис. 4-17. Венозная сеть стопы. Места венепункции
Вены тыльной поверхности кисти
В последние годы стали чаще использовать этот венозный доступ, так как поя¬
вились специальные катетеры, приспособленные для катетеризации вен кисти.
Поверхностные вены развиты сильнее на тыле кисти, чем на ладонной поверх¬
ности. В поверхностных слоях находятся многочисленные вены, которые служат
истоками латеральной подкожной вены руки (на лучевой стороне) и медиальной
подкожной вены руки (на локтевой стороне) и образуют тыльную венозную сеть
кисти. Основу этой сети составляют тыльные пястные вены, из которых и форми¬
руются крупные подкожные вены верхних конечностей (рис. 4-18).
Надо помнить, что инфузия раздражающих растворов (например, диазепама)
в мелкие вены тыльной поверхности кисти очень болезненна, а введение такого
препарата, как тиопентал натрия, может вызвать развитие фиброза мелких мышц
кисти за счет ретроградного его поступления в артериальное русло кисти.
Венесекция (от лат. vena - вена и sectio — рассечение) — манипуляция, пред¬
ставляющая собой вскрытие просвета вены с последующим введением в ее просвет
иглы, канюли, катетера для проведения трансфузионной терапии. Венесекцию
применяют при недоступности подкожных периферических вен. Необходимость
в этой манипуляции возникает из-за анатомических особенностей организма
(сильное развитие подкожной клетчатки, слабая развитость венозных стволов -
так называемый рассыпной тип) или вследствие функциональных причин (шок,
гиповолемия). Кроме того, данную процедуру применяют при проведении дли¬
тельной инфузионной терапии.
Преимущества. Визуальный контроль введения катетера в вену и его надежная
фиксация.
Ход манипуляции. Производят разрез кожи и подкожной жировой клет¬
чатки длиной 2-3 см поперечно, косо или параллельно проекции сосуда. Тупым
ВЕНЕСЕКЦИЯ
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИМЕСКИХ ПРОЦЕДУР
99
концом пинцета осторожно выделяют вену на протяжении 1,5-2 см и подводят
под нее 2 шелковые лигатуры. Дистальную лигатуру завязывают и натягивают
для фиксации вены. Стенку вены между двумя лигатурами пунктируют толстой
иглой или надрезают ее на 1/2-У4 диаметра. В просвет сосуда вводят иглу, каню¬
лю или катетер. Над ним затягивают вторую лигатуру, присоединяют систему
для переливания. Края раны сближают шелковыми нитями. Одним из швов допол¬
нительно фиксируют катетер или иглу.
Из-за опасности развития флеботромбоза не рекомендуется оставлять катетер
в вене более 12-24 ч.
После окончания процедуры удаляют иглу или катетер из вены. Накладывают
асептическую давящую повязку на 6-12 ч.
Осложнения. Полное пересечение вены, тромбоз, флебит, тромбофлебит,
инфицирование раны, ранение артерии.
Наиболее часто венесекцию применяют на большой подкожной вене ноги.
Показания: невозможность чрескожного доступа к венозной системе.
Противопоказания: коагулопатия (протромбиновый индекс менее 1,3); веноз¬
ный тромбоз.
Процедуру проводят под местной анестезией 1% раствором лидокаина.
Необходимые инструменты: жгут, асептический раствор, стерильные повязки
и перчатки, скальпель, кровоостанавливающий зажим, ножницы, внутривенный
катетер, шелковые нити размером 3-0.
Положение больного. Лежит на спине, нога находится в удобном для венесек¬
ции положении.
Место венесекции. Большая подкожная вена ноги обычно расположена при¬
близительно на 1 см спереди и на 1 см выше внутренней лодыжки.
Ход манипуляции. Жгут, как правило, не накладывают. Обрабатывают кожу
над веной антисептиком и обкладывают стерильным материалом.
Кожу над веной инфильтрируют раствором лидокаина и производят разрез
кожи длиной 2,5 см (рис. 4-19). Осторожно выделяют вену, изолируя ее от нерва,
проходящего по передней стенке вены (повреждение нерва в дальнейшем вызо¬
вет боли). Поднимают вену, выделяя ее из ложа на протяжении 2 см, и проводят
под нее 2 лигатуры (дистально и проксимально). Перевязывают вену дистально,
оставляя концы нити для подтягивания. Осторожно делают поперечный разрез
на вене и расширяют его сомкнутым зажимом. Вводят внутривенный катетер
в вену. Завязывают проксимальную лигатуру для фиксации катетера, не пережи¬
мая его. Зашивают рану непрерывным нейлоновым швом и накладывают стериль¬
ную повязку с мазью, содержащей антибиотик.
IU лшдк вопросы ТРАНСФУЗИОЛОГИИ
Рік. 4-19. венесекция большой подкожной вены ноги: 1 — место разреза; 2 — медиальная
лодыжка; 3—большая подкожная вена ноги
К осложнениям венесекции относят кровотечение, инфицирование и флебит.
При кровотечении прижимают место кровотечения стерильной марлевой поду¬
шечкой; в случае инфицирования извлекают катетер и назначают антибиотики;
при флебите М накладывают теплый компресс (после удаления катетера).
КАТЕТЕРИЗАЦИЯ ВЕН
Катетеризация - введение катетера в просвет вены посредством чрескожной
венепункции или венесекции с лечебной или диагностической целью.
Различают катетеризацию центральных и периферических вен. Катетеризацию
центральных вен обычно проводят в отделениях интенсивной терапии и реани¬
мации. Для пункции видимых поверхностных вен пользуются обычно короткими
иглами и канюлями (длиной около 40 мм), для центральных вен необходима длина
60-70 мм. Максимальная длина катетера должна быть равна расстоянию от места
пункции до точки нахождения конца катетера в вене и длине наружной части
катетера, необходимой для надежной фиксации его к коже больного. Процедуру
проводят под местной анестезией (новокаином4 или лидокаином). Начало всех
манипуляций описано в разделе «Венепункции» (см. соответствующие вены),
поэтому далее ход процедуры будет изложен, начиная с момента попадания иглы
в сосуды. До настоящего времени нет четкого определения терминов «катетер»
и «канюля*. Обычно канюлями называют трубки меньшего диаметра, приме¬
няемые для инфузионной терапии через периферические вены. Катетеры имеют
большую длину и используются для введения в центральные вены (подключичную
или внутреннюю яремную).
Способы введения катетеров
Введение катетера на игле. Катетер плотно надет на иглу, которая находится
внутри катетера. Свободным кончиком иглы осуществляют пункцию вены. После
попадания в сосуд проводят катетер и извлекают иглу. Отрицательным моментом
является то. что конец катетера острый и твердый, так как он проходит через кожу,
поэтому возможно повреждение вены во время катетеризации или после установ¬
ки катетера. Кроме того, появление крови в шприце не является гарантией того,
что катетер находится в венозном сосуде, так как неизвестно — попал ли в вену
конец катетера, а не только иглы. Способ применяют для катетеризации подклю¬
чичной и внутренней яремной вен (рис. 4-20).
Введение катетера через иглу. Через широкий просвет иглы, которой
пунктировали вену, вводят катетер, затем иглу извлекают. Так как через кожу
и подлежащие ткани катетер проходит через иглу, он может быть изготовлен
из мягкого гибкого материала и его конец не заостряется. Однако необходимо
указать на некоторые отрицательные стороны этого способа введения катетера:
из-за roro, что диаметр катетера меньше диаметра места вкола иглы, существует
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСОУЗИОЛОПЯЧЕСКИХ ПРОЦЕДУР 181
возможность просачивания крови. Также
существует опасность повреждения кате-
тера срезом иглы при попытке его извле¬
чения при нахождении иглы в просвете ^S/0Y'
сосуда.
Введение катетера по проводнику —
метод Сельдингера. Процедуру начинают ?
с введения иглы в вену. Через просвет иглы 7
вводят гибкий проводник, а после удале-
ния иглы по проводнику продвигают кате-
тер. Основное преимущество этого способа
введения катетера в том, что прокол вены
осуществляют иглой меньшего диаметра,
чем при других вариантах. До минимума
уменьшается риск травмирования жизнен¬
но важных структур (в том числе артерий).
Однако введение по проводнику нередко т-п
затруднено из-за клапанов вен или их раз¬
ветвлений. Метод используют при катете¬
ризации подключичной, внутренней ярем¬
ной и бедренной вен (рис. 4-21).
Общее правило при введении катетера:
если катетер при продвижении (с помощью
вращательных движений вокруг оси) встре¬
чает сопротивление, необходимо его извлечь
и предпринять новую попытку с изменени¬
ем точки пункции. Прикладывание силы
при прохождении катетера по вене может
вызвать перфорацию сосуда, травмирова¬
ние окружающих тканей и повреждение
самого катетера (табл. 4-3).
Критерии подбора периферических вен для катетеризации обусловлены необ¬
ходимостью использования:
• дистальных вен;
• мягких и эластичных вен;
• крупных вен;
• прямых вен, соответствующих длине катетера;
• вен на рабочей руке.
Не рекомендуется катетеризировать:
• жесткие на ощупь и склерозированные вены;
• вены сгибательных поверхностей суставов;
• вены нижних конечностей;
• ранее катетеризированные вены;
• вены, близко расположенные к артериям или их проекциям;
• вены на конечностях с переломом;
• вены ладонной поверхности рук;
• вены на конечностях, подвергшихся хирургическим вмешательствам.
Фиксация катетера
После установки катетера производят его фиксацию следующими способами.
С помощью лейкопластыря, который проводят под катетером липкой сторо¬
ной вверх, перекрещивают его над ним и прикрепляют к коже. Метод применяют
для фиксации катетера на непродолжительное время, так как пластырь быстро
теряет свои свойства и может вызвать раздражение кожи.
182 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Рис. 4-21. Введение венозного катетера по методу Сельдингера (по проводнику): 1 — проволоч¬
ный проводник; 2—катетер-проводник; 3—катетер-расширитель; 4 — проволочный проводник
и катетер-расширитель; 5 — боковой катетер
Таблица 4-3. Параметры периферических венозных катетеров и их маркировка
Размер
Цвет
Наружный диаметр,
мм
Длина, мм
Скорость потока,
мл/мин
G14
Оранжевый
2,0
45
300
G16
Серый
1,7
45
150
G17
Белый
1.5
45
120
G18
Зеленый
1.3
45
75
G20
Розовый
1,1
32
54
G22
Синий
0,9
25
25
G24
Желтый
0,7
119
115
Для более длительной фиксации рекомендуют кожные швы. При этом проши¬
вают кожу и подкожную клетчатку шелковой нитью, оборачивают концы ее вокруг
катетера и туго завязывают. При таком способе фиксации риск эмболии катетером
при его случайном отсечении значительно меньше.
Фиксация катетера препятствует его движениям, тем самым снимая механиче¬
ское раздражение интимы сосуда, и уменьшает возможность появления местного
тромбофлебита. Кроме того, при случайной перерезке катетера он не будет потерян
в вене.
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИ0Л0ГИЧЕСКИХ ПРОЦЕДУР 103
Общие осложнения катетеризации
Перфорация вены. Это может произойти как при венепункции, так и при про¬
движении катетера. Результат перфорации — возникновение гематомы и попада¬
ние вливаемого раствора в окружающие ткани, что в ряде случаев (в зависимости
от препарата) может вызвать их некроз. Для профилактики подобных осложнений
необходима тщательная фиксация катетера.
Тромбирование катетера и вены. Для предупреждения данного осложнения
необходим тщательный уход за катетером. С этой целью его промывают раствором
гепарина* для удаления фибриновой пленки, тем самым снижая и риск инфекции.
При длительном парентеральном питании рекомендовано вводить гепарин* из рас¬
чета 1 ЕД на 1 мл инфузируемого раствора. Также следует использовать катетеры,
диаметр которых не мешает нормальному кровотоку в вене вокруг них. При тром-
бировании катетера его необходимо удалить во избежание тромбоэмболии.
Флебит. Катетер, являясь инородным предметом, может вызвать воспаление
стенок венозных сосудов, при этом с увеличением времени нахождения катетера
в вене возрастает риск возникновения флебита. Иногда воспаление стенок связано
с характером вводимого раствора (химическое раздражение). В данном случае
рекомендуют разведение растворов и введение с минимальной скоростью (исклю¬
чение — жировые эмульсии, концентрированные растворы глюкозы*, которые
не вводят в периферические вены).
Для профилактики этого осложнения необходима хорошая фиксация катетера.
При возникновении флебита катетер удаляют и назначают противовоспалитель¬
ную терапию.
Инфицирование. Необходимо тщательное соблюдение правил асептики,
важна правильная обработка рук персонала, места пункции, инструментов.
Инфицирование места пункции может вызвать тромбофлебиты, флебиты, тром¬
боэмболии и септицемию. При появлении этих осложнений катетер сразу удаля¬
ют. Периодически проводят посевы инфузируемых растворов, крови пациента,
с поверхности кожи в месте введения катетера. В случае наложения стерильной
повязки надо помнить, что она не должна быть полностью герметичной, так
как в таких условиях иногда обнаруживается быстрый рост бактерий и грибков
(исключение — место пункции вблизи открытой раны, ожога или трахеостомы).
Воздушная эмболия. См. в разделе «Общие осложнения венепункции».
Пневмоторакс. Чаще всего возникает при катетеризации подключичной вены.
В случае значительного спадения легкого и смещения органов средостения (пнев¬
моторакс >10%) необходимо хирургическое вмешательство с аспирацией воздуха
и дренированием плевральной полости. При пневмотораксе <10% рекомендована
ингаляция 100% кислорода и рентгенологический контроль каждые 4 ч. Если есть
подозрение на напряженный пневмоторакс, вводят иглу №16 во второе межребе-
рье по среднеключичной линии для декомпрессии.
Поломка катетера. Благодаря новым технологиям поломка катетера встре¬
чается редко и обычно в области наружных его отделов. В этих случаях показаны
немедленное извлечение катетера и замена на новый.
Циркуляторная перегрузка. Клинически характеризуется сердечно-сосу¬
дистой недостаточностью. При быстром введении большого количества раство¬
ров может произойти перегрузка правого отдела сердца с острым расширением
и остановкой сердца во время трансфузии. Это осложнение возникает редко и
обычно у пациентов с поражением сердечной мышцы (воспаление, пороки сердца,
склеротические или дистрофические изменения). Во время трансфузии появляют¬
ся затруднение дыхания, чувство стеснения в груди, цианоз губ. После этого резко
нарушается сердечная деятельность и наступает смерть. Профилактика данного
осложнения — введение растворов капельно, а при необходимости струйное вве¬
дение дробных доз. При появлении первых признаков циркуляторной перегрузки
104 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
немедленно прекращают трансфузию, для разгрузки правого отдела сердца делают
небольшое кровопускание. После этого рекомендовано назначение оксигенотера-
пии, гипертонических растворов глюкозы*, норэпинефрина, фенилэфрина, эфе¬
дрина, строфантина К (внутривенно), коргликона*. В случае клинической смерти
проводят комплекс реанимационных мероприятий.
К редким осложнениям катетеризации можно отнести гемоторакс, гемопери¬
кард, гидроторакс, гидроперикард. Для их устранения проводят целенаправленные
хирургические манипуляции. Также надо отметить возможность возникновения
нарушений сердечного ритма при механическом воздействии катетера на миокард.
Тампонада сердца может возникнуть, когда конец катетера располагается ниже
верхней границы перикарда и перфорирует стенку сосуда или сердца. Иногда воз¬
можно расслоение аорты — при многочисленных попытках катетеризации вну¬
тренней яремной вены катетером на игле.
Уход за катетером
Уход за катетером начинается с момента его введения в сосуд: соблюдение
асептики во время установки, при смене повязки и инфузионной системы, надеж¬
ная фиксация для исключения травмирования вены. Как было отмечено ранее,
необходима гепаринизация — для профилактики образования кровяного сгустка
и, следовательно, снижения вероятности септических осложнений.
Вопрос о частоте смены катетера является спорным. Многие специалисты
считают, что лучше его заменять только при появлении септицемии, лихорад¬
ки. Смену катетера можно проводить по методу Сельдингера без пункции вены,
в асептических условиях: в катетер вводят проводник, старый удаляют, а по прово¬
днику проводят новый катетер. После этого катетер фиксируют к коже.
Интрамедуллярный доступ. Переливания в костный мозг
Целесообразность этого метода заключена в тесной анатомической связи между
воронкообразными синусами костного мозга и региональными сосудами.
Для внутрикостного (интрамедуллярного) переливания крови используют
кости с достаточным количеством губчатого вещества (грудина, эпифизы трубча¬
тых костей, пяточные кости, крылья подвздошных костей).
Интрамедуллярно можно переливать кровь, кровезаменители и другие препараты.
Наиболее широко интрамедуллярный доступ используют в педиатрической
практике (что обусловлено мягкостью эпифизарных участков кости), когда другие
способы безуспешны, а время не позволяет провести венесекцию: при затруднении
применения обычных способов трансфузии. У детей до 3 лет не проводят транс¬
фузию в пяточную кость в связи с недостаточной ее васкуляризацией и слабым
оттоком крови из нее.
Преимущества. Прочная фиксация иглы в кости позволяет длительно вводить
необходимое количество жидкости, не опасаясь осложнений в виде флебитов
и тромбофлебитов, эмболий, особенно при необходимости транспортировки бес¬
покойных больных с системой для трансфузий.
Техника переливания достаточно проста, необходимы лишь специальные иглы
для внутрикостной пункции.
Существует два способа внутрикостного введения: струйный и капельный. При
капельном скорость введения составляет 5-20 капель в минуту. Для переливания
200-300 мл крови необходимо 12 ч, поэтому данный способ интрамедуллярного
вливания не получил широкого распространения. При струйном способе трансфу¬
зию проводят под давлением, скорость введения составляет 20-25 мл/мин, однако
при струйных внутрикостных трансфузиях отмечают болезненность, вызванную
давлением на губчатую субстанцию. Болевой синдром менее выражен при транс¬
фузии в плоские кости (крылья подвздошной кости и грудину).
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИНЕСКИХ ПРОЦЕДУР 105
Осложнения. Редко при пункции грудины возможно проникновение иглы
в загрудинное пространство с возможным повреждением внутренних органов.
Во избежание этого необходимо применять иглы с оградительной муфтой, уста¬
новленной на определенном уровне (у взрослых — 1-1,2 см, у детей — 0,4-0,6 см).
Безопаснее вливания в подвздошные и большеберцовые кости.
Ход пункции. При пункции костного мозга трубчатых костей предпочтение
отдают большеберцовой кости (место вкола — на 2-3 см ниже ее бугристости).
Также может быть использована нижняя треть данной кости. Под местной ане¬
стезией под углом 60-90° к кости вводят иглу срезом вверх и прокалывают мягкие
ткани. Затем иглу наклоняют к периферии и вращательным движением в сочета¬
нии с быстрым надавливанием вводят в компактный слой кости. Признак про¬
никновения иглы в губчатое вещество — уменьшение сопротивления. Вводят 2%
раствор новокаина*, затем начинают трансфузию.
Аспирация костного мозга подтверждает правильность положения иглы. Дру¬
гой признак правильного положения иглы — ее устойчивое вертикальное положе¬
ние в кости и свободная инфузия 5-10 мл жидкости. После проникновения иглы
в костный мозг проводят ее фиксацию.
Для доступа к костному мозгу грудины применяют стернальную иглу (иглу
Кассирского). Место прокола обезболивают 2% раствором новокаина* (послойно -
от кожи методом «лимонной корки» до надкостницы). После прокола кортикально¬
го слоя активным сверлящим движением игла должна неподвижно стоять в кости.
При этом можно производить несколько проколов в разных местах для ускорения
переливания (через 2-3 иглы). Извлекают мандрен, присоединяют шприц и вводят
5-10 мл 1% раствора новокаина* внутрикостно. После этого вместо шприца к игле
присоединяют приготовленную систему и приступают к гемотрансфузии.
Осложнения:
• инфильтрация мягких тканей — в этом случае иглу извлекают и вводят ее
в новом месте;
• воспаление мягких тканей — удаляют иглу и проводят лечение антибиоти¬
ками;
• остеомиелит — после удаления катетера проводят специфическое лечение;
• компартмент-синдром (введение жидкости в фасциальное влагалище) —
при этом осложнении проводят фасциотомию.
Артериальный доступ
Как и при венозном доступе, доступ через артериальное русло можно использо¬
вать для внутриартериального переливания крови, катетеризации артерий.
Для внутриартериальной инфузии используют сосуды, наиболее близко рас¬
положенные к сердцу. Внутриартериальное переливание крови технически слож¬
нее, чем внутривенное. Кроме того, возможны осложнения в виде повреждения
и тромбирования артериальных стволов. В связи с этим в настоящее время данный
метод практически не применяют, исключение составляют угрожающие жизни
состояния и проведение селективной или регионарной терапии.
Показания для срочных внутриартериальных инфузий:
• клиническая смерть вследствие массивной невосполненной кровопотери;
• терминальное состояние при шоках любой этиологии (систолическое АД
60 мм рт.ст. и ниже);
• внезапное массивное кровотечение во время операции;
• электротравма;
• асфиксия различной этиологии;
• нет доступа к венам.
Селективные, или регионарные, внутриартериальные инфузии применяют для
создания максимальной концентрации лекарственных препаратов в очагах пора¬
106 ОБЩИЕ ВОПРОСы ТРАНСФУЗИОЛОГИИ
жения, например органов брюшной полости (разлитой перитонит, деструктивный
панкреатит), конечностей (остеомиелит); для тромболизиса при тромбозах, тро«.
боэмболиях; при облитерирующих заболеваниях артерий.
Преимущества:
• возможность переливать достаточное количество трансфузионной среды в
сосудистое русло в максимально сжатые сроки;
• непосредственное снабжение кровью сосудов головного мозга и коронарных
сосудов;
• «обход* тканевых фильтров (легкие, почки, печень), в которых могут про¬
исходить задержка, разрушение и выведение фармакологически активных
веществ;
• рефлекторная стимуляция сердечной деятельности.
Кроме того, необходимо отметить, что диаметр игл при артериальном доступе
значительно меньше, чем при венозном.
Возможные осложнения:
• спазм артерий, который может вызвать ишемию и некроз тканей;
• тромбоз артерий:
I аррозивное кровотечение, ложная аневризма, гематома;
• неврит сопутствующего артерии нерва, вплоть до пареза и паралича.
ПУНКЦИЯ АРТЕРИЙ
Данная манипуляция необходима для получения проб артериальной крови,
прямой регистрации артериального давления, введения контрастных веществ
в случаях проведения определенных методов обследования.
Наиболее часто используют пункцию лучевой и бедренной артерий.
Пункция лучевой артерии
Пункцию лучевой артерии применяют чаще всего, так как при нарушении кро¬
вообращения в ней обычно не изменяется кровоснабжение кисти. Перед пункцией
надо убедиться в нормальном функционировании локтевой артерии и ее анасто¬
мозов с ладонной дугой — проводят тест Аллена на адекватность коллатерального
кровообращения: пережимают локтевую и лучевую артерии пальцами так, чтобы
кровь по венам оттекла из кисти, и она побледнела. Больного просят несколько раз
сжать и разжать ладонь. При этом ладонь приобретает мертвенно-бледный отте¬
нок. Освобождают локтевую артерию, и при достаточном коллатеральном кро¬
вообращении, несмотря на пережатую лучевую артерию, нормальный цвет кожи
восстанавливается через 5-10 с. Если же окраска руки не вернется к исходной
за это время, тест Аллена считают отрицательным, что указывает на окклюзию
лучевой артерии.
Анатомия. Лучевая и локтевая артерии являются ветвями плечевой арте¬
рии и снабжают кровью кисть через поверхностную и глубокую ладонную дуги
(рис. 4-22). Лучевая артерия расположена вдоль латерального края предплечья,
пальпируется на запястье у дистального конца лучевой кости. Здесь она покрыта
лишь фасцией и кожей.
Ход пункции. Кисть разгибают в лучезапястном суставе, укладывают на валик,
определяют пульсацию артерии. Кожу и подкожную клетчатку инфильтрируют
раствором анестетика, так как пункция артерий — болезненная для пациента про¬
цедура. Также анестезия устраняет артериальный спазм. Сосуд фиксируют между
указательным и средним пальцами, иглу вводят в проксимальном направлении
под углом 45° к горизонтальной плоскости. При медленном приближении к арте¬
рии возникает ощущение передаточной пульсации. Иглу продвигают до появления
крови. Более опытный врач может пунктировать артерию под прямым углом,
что снижает до минимума травму артерии. На нахождение иглы в артерии указы¬
вает поступление в шприц алой пульсирующей крови.
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ ПРОЦЕДУР
107
Рис. 4-22. Кровоснабжение кисти
Пункция бедренной артерии
Анатомия. Бедренная артерия — продолжение ствола наружной подвздошной
артерии. Артерия пересекает середину линии, проведенной от передней верхней
ости подвздошной кости к лонному сочленению. Медиальнее артерии лежит
бедренная вена, оба сосуда проходят вместе в скарповском треугольнике.
Ход пункции. Бедренную вену пунктируют у паховой связки. Используют
крупную иглу диаметром 1,2 мм. Для удобства манипуляции иглу насаживают
на шприц. Средним и указательным пальцами левой руки прощупывают пуль¬
сацию стенки сосуда. Иглу вводят между пальцами срезом вниз во избежание
прокола противоположной стенки и направляют под небольшим углом к коже.
Как только игла проникает в просвет артерии, кровь под сильным давлением
поступает в шприц. После этого шприц отсоединяют и приступают к дальнейшим
необходимым мероприятиям (трансфузия, катетеризация).
Осложнения пункции артерий
Гематома. Практически всегда возникает небольшая гематома, но ее про¬
явление можно уменьшить, прижав артерию во время извлечения иглы на срок
4-5 мин (не меньше). Если соблюдать это правило, то гематома, скорее всего,
не образуется.
Тромбоз. При однократной пункции полная закупорка просвета артерии встре¬
чается крайне редко. Однако при нахождении канюли в артерии в 10% случаев
на 1-2 сут исчезает пульсация артерии дистальнеє места пункции. При достаточ¬
ном развитии коллатерального кровообращения негативных последствий не отме¬
чено.
При проведении манипуляций на крупных артериях осложнения могут быть
более серьезными, поэтому, если есть возможность, желательно использование
лучевой артерии.
Воздушная эмболия артерий. Чаще всего возникает при мониторинге арте¬
риального давления прямым методом. Попавший в артериальную систему воз¬
дух быстро изгоняется из левого желудочка с закупоркой коронарных, мозговых
и других артерий, иногда с развитием тяжелых неврологических поражений
и внезапной смерти. Эти осложнения редко встречаются при проведении манипу¬
ляций на периферических артериях. Однако при промывании катетеров возможно
попадание пузырьков воздуха из шприца. При подозрении на воздушную эмболию
больного необходимо уложить головой вниз на левый бок. что уменьшает вероят¬
101 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
ность попадания воздуха в коронарные артерии. Проводят гипербарическую тера-
пво и ингаляцию кислорода, что способствует уменьшению размеров пузырьков
воздуха.
СЕКЦИЯ АРТЕРИЙ
Ход манипуляции:
я обнажение артерии оперативным путем;
• временная фиксация артерии на двух лигатурах;
• пережатие периферического отдела марлевым или резиновым жгутом;
• введение в артерию 10-15 мл 0,5% раствора новокаина* (для предотвраще¬
ния ее спазма);
• пункция артерии;
• фиксация иглы лигатурой.
Кровь для переливания подогревают до температуры тела. Скорость инфу¬
зии — 100-150 мл/мин под давлением 200-250 мм рт.ст. Инфузию прекращают
при быстром улучшении состояния больного и увеличении артериального систо¬
лического давления до 80-90 мм рт. ст., что позволяет перейти к внутривенному
доступу.
КАТЕТЕРИЗАЦИЯ АРТЕРИЙ
Катетеризация артерий позволяет осуществлять непрерывный мониторинг
частоты сердечных сокращений и артериального давления в отделениях реа¬
нимации; брать пробы крови для определения ее газового состава (рис. 4-23).
Внутриоперационный мониторинг проводят больным при высоком риске развития
осложнений со стороны сердечно-сосудистой системы. Некоторые авторы рас¬
полагают артериальные доступы в следующем порядке (по частоте использования):
лучевая артерия, бедренная артерия, артерии тыла стопы, подмышечная артерия.
Эти же авторы предпочитают использовать лучевую артерию и артерии тыла
стопы для катетеризации «быстрыми» катетерами или внутривенными ангио¬
катетерами, а бедренную и подмышечную артерии канюлировать по методике
Сельдингера.
Абсолютным противопоказанием к введению артериального катетера считают
наличие диализного шунта или артериовенозной фистулы в непосредственной
близости от предполагаемого места введения катетера.
Относительные противопоказания: расстройство гемостаза, очаг инфекции,
нарушение перфузии в области кровоснабжения выбранной для манипуляции
артерии.
Для катетеризации рекомендовано использование неконического тефлонового
катетера (№20). Маленький диаметр катетера способствует адекватной перфузии
дистальных по отношению к месту его введения участков. Введение конических
катетеров чаще вызывает нарушение перфузии дистальных отделов. При введении
катетеров большего диаметра повышен риск тромбообразования.
Следует регулярно проверять перфузию дистальных по отношению к месту вве¬
дения катетера отделов после катетеризации сосуда. Иногда единственным прояв¬
лением нарушенной перфузии является боль либо вокруг канюли, либо дистальнеє.
Побледнение участков кожи в этих местах и отсроченное заполнение капилляров —
показание к удалению катетера. В ряде случаев для улучшения перфузии использу¬
ют лекарственные препараты или прибегают к хирургическим методам.
Катетеризация лучевой артерии
Показания: проведение мониторинга гемодинамики; мониторинг газового
состава артериальной крови.
Противопоказания: отрицательная проба Аллена.
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИ0Л0ГИЧЕСКИХ ПРОЦЕДУР 109
| Катетеризация артерии показана j
Физикальное обследование
Оценка результатов физикального обследования
Резкая гипотензия
Я
Катетеризация
бедренной артерии
Резкой гипотензии нет I
В пробе Allen обнаружено
Jroy:
Плохое
коллатеральное
снабжение
Хорошее
коллатеральное
снабжение
Катетеризация артерий:
подмышечной, плечевой,
тыльной стопы, задней
большеберцовой, височной
Катетеризация артерий:
лучевой, локтевой
Вводится несуживающийся тефлоновый катетер
Кривая давления появляется
і
Кривая давления отсутствует
| Проверить поступление крови по катетеру |
^ Nk
Кровь поступает Кровь не поступает
L- ^ ^
Неисправность монитора.
Неисправность датчика.
Брак катетера
в положении «закрыто»
Устранить
неисправность
Качество кривой давления
удовлетворительное
Ежедневный осмотр
катетера
Не обнаружено
д
Эритема, инфекция, ухудшение
перфузии дистального отдела
Продолжать мониторинг
Перегиб
Катетер
катетера
не перегнут
Изменить
положение
катетера
Удалить
катетер
Обнаружено
Отсоединить катетер.
При плохой перфузии:
- исследование кровотока,
- ангиография,
- блокада симпатических
шейных ганглиев,
- внутриартериально —
резерпин,
- введение вазодилаторов
- тромбэктомия
Рис. 4-23. Алгоритм катетеризации артерий (схема)
Положение больного. Сидит или лежит. Кисть расположена ладонью вверх,
разогнута в запястном суставе (для лучшего разгибания под запястье помеща¬
ют свернутое валиком полотенце). Ладонь и предплечье фиксируют к подставке
для руки.
Ход манипуляции. Анестезия 1% раствором лидокаина. Кожу обрабатыва¬
ют антисептиком и обкладывают стерильными марлевыми салфетками. В месте
определения пульса у дистального конца лучевой кости осуществляют пункцию
ангиокатетером №20 под углом 45°. Катетер необходимо держать срезом вверх
и продвигать до появления крови из иглы. После этого проводят ангиокатетер
еще на 2 мм вглубь, удерживая иглу (для лучшего внутрисосудистого располо¬
жения). Затем отсоединяют иглу, пережимают пальцем проксимальный отдел
119 общие вопросы трансфузиологии
лучевой артерии, присоединяют систему для инфузии и фиксируют катетер к к01|.
с помощью шелковых швов.
Осложнения:
• кровь не появилась из иглы - извлекают ангиокатетер и повторяют пункции
под углом 60 .
• при извлечении иглы не появилась кровь — катетер находится не в просвете
артерии; в этом случае извлекают катетер, пережимают место пункции паль¬
цем 5 мин;
• ишемия пальцев руки - удаляют катетер.
Кашориэщия бедренной артерии
Показания: длительное наблюдение за гемодинамикой; артериографические
исследования; введение внутриаортального баллонного насоса.
Противопоказания: операции в паховой области в анамнезе.
Положение больного. Лежит на спине.
Ход манипуляции. После бритья область паха обрабатывают антисептическим
раствором и обкладывают стерильными салфетками. Вводят лидокаин в кожу
и подкожную клетчатку по ходу артерии (рис. 4-24). Дальнейший ход проце¬
дуры - как при пункции бедренной артерии (см. выше). После подтверждения
того, что игла (№18) находится в артерии, отсоединяют шприц, зажимая канюлю
иглы пальцем (для предупреждения сильного кровотечения), и вводят через иглу
J-образный проводник по методике Сельдингера по направлению к сердцу. После
прохождения проводника извлекают иглу, расширяют отверстие скальпелем и вво¬
дят центральный венозный катетер (№16) по проводнику в артерию. Затем удаляют
проводник и присоединяют необходимые системы или датчики. Катетер фиксируют
к коже шелковыми швами, сверху накладывают стерильные повязки. На все время
нахождения катетера в артерии необходимо соблюдать постельный режим.
Рве, 4-ti Катетеризация бедренной артерии А — место введения катетера
Осложнения:
• • шприце не появляется артериальная кровь - повторяют процедуру с уточ¬
нением ориентиров; при повторной неудаче рекомендовано прекращение
манипуляции,
я прокол бедренной вены извлекают иглу и зажимают место пункции рукой
• течение 10 мин;
К проводник встречает сопротивление при движении по игле — извлекают
проводник, уточняют положение иглы аспирацией крови и снова повторяют
атяп млннпуляиим: ■.. ц&аЙЙЙв
СОСУДИСТЫЕ доступы еля тиямсвузиопопмювих ПРОЦЫОО 111
• гематома — удаляют катетер, пережимают рукой место пункция на 15-20 мин.
накладывают тугую повязку на 30 мин: необходимо соблюдать постельный
режим 3-4 ч;
* тромбоз - удаляют катетер и наблюдают за пульсом на артериях для свое¬
временного распознавания дистальной эмболии.
Катетеризация подмышечной артерии
Показания: длительное наблюдение за гемодинамикой, артериографическме
исследования.
Противопоказания: практически нет. Не рекомендуется провидить кагетерн
зацию при плохом пульсе на дистальном конце лучевой артерии
Положение больного. Лежит на спине, рука отведена, плечо повернуто кна-
ружи.
Ход манипуляции. После бритья подмышечную область обрабатывают анти¬
септиком и обкладывают ее стерильными салфетками. Вводят лидокаин в кожу
и подкожную клетчатку по ходу артерии. Пунктируют кожу мглой (N>18) со шпри¬
цем и продвигают ее под углом 45° по направлению пульсации на подмышеч*
ной артерии, создавая разрежение в шприце. При поступлении артериальной
крови в шприц его отсоединяют, прижимают отверстие иглы идльцем и вводят
J-образный проводник по направлению к сердцу. При прохождении проводника
иглу извлекают, расширяют место пункции скальпелем и вводят центральный
венозный катетер (№16) по проводнику в артерию. Затем удаляют проводник,
присоединяют датчики и фиксируют катетер шелковыми швами к коже, сверху
накладывают стерильные повязки.
Осложнения:
• кровь не поступает в шприц на глубине 5 см извлекают иглу, поддерживая
разрежение в шприце; при повторной неудачной попытке пунктируют на 1 см
дистальнеє по ходу артерии;
• пункция вены — при появлении в шприце венозной крови извлекают иглу
и зажимают место пункции рукой на 10 мин;
• проводник встречает сопротивление извлекают его и уточняют положение
иглы аспирацией крови в шприц;
• тромбоз — удаляют катетер и наблюдают за пульсом по ходу сосуда;
• повреждение плечевого сплетения - удаляют катетер, проверяют чувстви¬
тельность и двигательную функцию, при необходимости назначают консуль¬
тацию нейрохирурга.
Катетеризация артерии тыла стопы
Показания; наблюдение за гемодинамикой.
Противопоказания: отсутствие пульса на артерии тыла стопы
Ход манипуляции. Обрабатывают тыльную поверхность стопы асептическим
раствором и обкладывают стерильными салфетками. Пальпируют пульс ма уровне
1 плюснево-клиновидного сустава латеральнеє длинного сгибателя пальца стопы.
Проводят анестезию кожи лидокаином и прокалывают ее ангиокатетером N>20
(рис. 4-25).
Осложнения:
• кровь не появилась в шприце — извлекают ангиокатгтер и пунктируют снова
под углом 60°;
• катетер не в просвете артерии (нет кровотечения после удаления иглы) -
удаляют катетер и прижимают место пункции пальцем на 15 мин;
• ишемия пальцев стопы — удаляют катетер и наблюдают за состоянием паль
цев.
112 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
■
Рис. 4-25. Катетеризация артерии тыла стопы
СПИСОК ЛИТЕРАТУРЫ
Анестезиология и реанимация / Под ред. О. А. Долиной. — М.: Медицина, 1998. — 544 с.
Бунятян А.А. и соав. Руководство по анестезиологии. — М.: Медицина, 1994. — 656 с.
Дон X. Принятие решений в интенсивной терапии. — М.: Медицина, 1995. — 224 с.
Интенсивная терапия: Пер. с анл. / Под ред. А.Н. Мартынова. — М.: ГЭОТАР Медицина,
1999. - 640 с.
Клиническая хирургия: Пер. с англ. / Под ред. Р. Кондена, Л. Найхуса. — М.: Практика,
1998. - 716 с.
Малышев В.Д. Интенсивная терапия. — М., 1997.
Мокеев И.Н. Инфузионно-трансфузионная терапия. — М., 1998.
Мухина С.А., Тарковская И.М. Атлас по манипуляции техники сестринского ухода. - М.:
АНМИ, 1995. - 256 с.
Основы неотложной хирургической помощи: руководство для врачей общей практики /
Под ред. Р.Н. Калашникова. — Архангельск, 1999, 291 с.
Островерхое Г.Е., Бомаш Ю.М., Лубоцкий Д.Н. Оперативная хирургия и топографическая
анатомия. — М.: Литера, 1998. — 320 с.
Роузен М., Латто Я.П., У Шэнг Нг. Чрескожная катетеризация центральных вен / Пер. с
англ. — М.: Медицина, 1986. — 160 с.
Практическая трансфузиология / Козинец Г.И. и др.. — М.: Триада X., 1997.
Чен Г., Сола Х.Е., Лиллемо К.Д. Руководство по технике врачебных манипуляций: Пер. с
англ. — Витебск, 1996. - 384 с.
Экстренная помощь в медицинской практике: Пер с англ. / Под ред. К. Ожильви. - М.:
Медицина, 1984. — 704 с.
Adar R., Mozes М. Fatal complications of central venous catheters // Brit. Med. J., 1971, 3,
Ayim E.N. Percutaneous catheterisation of the axillary vein and proximal basilc vein // Anaesth,
1997,32, 753.
Aubaniac R. L'injection intraveineuse sous-claviculaire; advantages et technique // Press
Medicale, 1952, 60.1456.
Blitt C.D., Wright W.A., Petty W.G., Webster T.A. Central venous catherisation via the external
jugular vein //J. of the Amer. Med. Assoc., 1974, 229, 817.
Bridges B.B., Carden E., Tacacs F.A. Introduction of central venous pressure catheters through
arm veins with a high success rate. - Can. Anaesth. Soc. J., 1970, 26,128.
Brikman A.J.. Costley D.O. Internal jugular venipuncture //J. of the Amer. Med. Ass., 1973,
223,182.
Boulanger М., Delva E.. Mailleet J.G., Paiment B. Une nouvelle voie d’abord de la veine jugulaire
interne//Can. Anaesth. Sov, J., 1976,23,609.
Civetta J.M., Gabel J.G., Gemer M. Internal-jugular-vein puneture with a margin of safety //
Anaesthesiology. 1972,36,622.
746.
СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ ПРОЦЕДУР 113
Daily P.O.. Griepp R.B., Shumway N.E. Percutaneous internal jugular vein cannulation / / Arch,
of Surgery. 1970,101,534.
Duffy B.J. The clinical use of polyethylene tubing for intravenous therapy // Annals of surgery.
1949,130.929.
English I.C.W.. Frew R.M., Pigott J.F., Zaki M. Percutaneous catheterization of the internal
jugular vein // Anaesthesia, 1969, 24, 521
James P.M., Myers R.T. Central venous pressure monitoring: complications and a new technic //
Amer. Surgeon, 1973, 39, 75.
Jemigan internal jugular vein for placement of central venous catheter // Surgery. Gynec. And
Obstetrics, 1970,130, 520. W.R., Gardner W.C., Mahr M.M.. Milbum J.L. et al.
Malatinsky J., Kadlic М., Majek М., Samel M. Misplacement and loop formation of central
venous catheters // Acta Anaesth. Scand., 1976. 20, 237.
Mogil R.A., Delaurentis D.A., Rosemoud G.P. The intraclavicular venepuncture // Arch, of
Surgery, 1967,95, 320.
Mostert J.W., Kenny G.M., Murphy G.P. Safe placement of central venous catheter into internal
jugular veins // Arch, of Surg., 1970,101.431.
Morgan W.W., Harkins G.A. Percutaneous introduction of long-term indwelling venous
catheters in infants //J. of Pediatr. Surgery, 1972,7, 538.
Ross S.М., Freedman P.S., Farmar J.V. Air embolism after accidental removal of intravenous
catheter // British Medical J., 1979, v. 987.
Sanders R.A., Sheldon G.F. Septic complications of total parenteral nutrition // Am. J. of
Surgery, 1976,132, 214.
Sprackien F.H.N., Niesche D„ Lord P.W., Beterman E.M.M. Percutaneous catheterisation of the
axillary vein // Cardiov. Res., 1967,1, 297.
Tofield J.J. A safer technique of percutanoesous catherisation of the cubclavian vein // Surgery.
Gynec. And Obstetrics. 1969,128.1069.
Vaughan R.W., Weygandt G.R. Rebiable percutaneous central venous pressure measurement //
Anesthesia and Analgesia: Current Researches, 1973, 52,709.
Wilson J.N., Grow J.B., Demong C.V., Prevedel A.E., Owens J.C. Central venous pressure in
optimal blood volume maintenance // Arch, of Sur., 1962,85,563.
Yoffa D. Supraclavicular subclavian venepuncture and catheterisation // Lancet, 1965.2,614.
Глава 5
Клеточные основы
трансфузиологии
ОБЩИЕ СВЕДЕНИЯ О КРОВЕТВОРЕНИИ
Краткая характеристика
Гемопоэтические клетки очень разнообразны. Такие функции
как транспорт кислорода, гемостаз, фагоцитоз и иммунная защита'
осуществляют клетки различных линий дифференцировки. В каж¬
дой из этих линий можно выделить несколько классов клеток.
К I классу относят морфологически нераспознаваемые клетки-
предшественники. II класс составляют морфологически распознавае¬
мые клетки-предшественники, способные к делению. В эритроидном
ряду это проэритробласты, базофильные и полихроматофильные
эритробласты, а в гранулоцитарном — миелобласты, промиело¬
циты и миелоциты. III класс составляют неспособные к делению
клетки-предшественники, которые созревают, подвергаясь мор¬
фологическим изменениям. В эритроидном ряду это ортохромные
эритробласты, нормобласты и ретикулоциты, а в гранулоцитарном
ряду — юные и палочкоядерные формы.
После созревания клетки покидают очаг кроветворения (у взрос¬
лого человека — костный мозг) и попадают в кровеносное русло,
где находятся, в зависимости от вида клеток, от нескольких часов
до нескольких месяцев. Основную свою функцию эритроциты
и тромбоциты осуществляют, находясь в кровеносном русле, а гра-
нулоциты и макрофаги — поступая в ткани.
Для клеток-предшественников, способных к делению, можно
определить временные параметры митотического цикла, т.е. период
времени между двумя последовательными митозами. Митотический
цикл включает в себя, кроме митоза, фазу Gr когда происходит под¬
готовка клетки к синтезу ДНК; S-фазу, во время которой клетка
удваивает количество ДНК (хромосом) с тем, чтобы обеспечить
равной долей наследственного материала две дочерние клетки;
фазу G2, включающую в себя период подготовки к митотическому
делению.
Функционирование костного мозга как органа зависит от мно¬
гих факторов, среди которых основная роль принадлежит:
• наличию и концентрации витамина В12 и фолиевой кислоты,
железа для синтеза гемоглобина (естественно, вместе с белка¬
ми, жирами и углеводами);
• состоянию микроокружения;
КЛЕТОЧНЫЕ основы трансфузиологии 115
• пролиферации родоначальных клеток;
• регуляции специфическими гормонами (эритропоэтин и другие Г10ЭТИНЫ,
колониестимулирующие факторы и др.);
• уровню контроля обратных связей (количество нейтрофилов, лимфоцитов,
тромбоцитов, концентрации кислорода и др.).
Очаги кроветворения расположены у взрослого человека в 206 костях ске¬
лета. При рождении только костные полости служат местами кроветворения.
К18 годам гемопоэтическую ткань обнаруживают в позвонках, ребрах, тазовых
и челюстных костях, проксимальных эпифизах бедренных и плечевых костей
и т.Д- Отношение числа клеток-предшественников в костном мозге к зрелым
клеткам периферической крови постоянно всю жизнь. В плане обеспечения
клетками крови костный мозг быстрее отвечает на запрос организма, чем вос¬
полняется объем циркулирующей крови, например после кровопотери. Прямые
измерения величины костных полостей показывают, что их объем увеличивает¬
ся от 1,4% массы тела при рождении до 4,8% у взрослых, в то время как объем
крови, определенный изотопным методом, уменьшается от 8% массы тела
при рождении до 7% у взрослого человека.
Масса красного костного мозга равна примерно 50% общей массы всей костно¬
мозговой субстанции и составляет 1400 г, что соответствует массе печени. Для под¬
держания клеточного состава крови на должном уровне в организме взрослого
человека с массой тела 70 кг ежесуточно должно вырабатываться 2x10і1 эритроцитов,
45x10’ нейтрофилов, 10’ моноцитов и 175x10’ тромбоцитов. За время дифференци-
ровки от стволовой клетки клетки эритроидного ростка проделывают 11-12 делений,
а клетки гранулоцитарного — 15-20. У здоровых людей эти показатели стабильны,
хотя в условиях повышенной потребности в клетках крови (острая кровопотеря,
инфекции) процессы созревания костномозговых предшественников ускоряются.
Гемопоэтические факторы роста — эритропоэтин, все типы колониеспецифиче¬
ских факторов (КСФ), интерлейкины (ИЛ-1, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6) обладают
рядом общих биологических свойств:
• являются гликопротеинами;
• имеют высокую биологическую активность и низкий уровень в крови и тка¬
нях в условиях нормы;
• быстро повышают концентрацию в ответ на кровопотерю, инфекцию, анти¬
генную стимуляцию и другие индукторы;
• могут действовать дистанционно и локально;
• отличаются от классических полипептидных гормонов, так как продуциру¬
ются многими типами клеток (фибробласты, эндотелиальные клетки, стро-
мальные клетки, макрофаги, лимфоциты).
Предполагают, что некоторые цитокины, включая ИЛ-3, ИЛ-4, ИЛ-6, ГМ-КСФ
и Г-КСФ, являются продуктами генов, образующихся посредством генной дупли¬
кации или дивергенции из одного общего гена.
Образующиеся в костном мозге клетки по мере созревания равномерно посту¬
пают в кровеносное русло, причем время циркуляции клеток различного типа
также постоянно: эритроциты находятся в кровотоке 120 сут, тромбоциты — 10
сут, а нейтрофилы — около 10 ч.
В обычных условиях костномозговое кроветворение не только покрывает
потребности организма, но и производит довольно большой запас клеток: зрелых
нейтрофилов, например, в костном мозге человека содержится в 10 раз больше,
чем в кровеносном русле. Что касается ретикулоцитов, то в костном мозге имеется
их трехдневный запас.
В среднем у человека за 70 лет жизни (при массе тела 70 кг) нарабатывается
460 кг эритроцитов, 5400 кг гранулоцитов, 40 кг тромбоцитов и 275 кг лимфоци¬
тов.
Ilf ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
Ростовые факторы в системе крови
При стабильном диапазоне характеристик кроветворение, конечно, нужно
рассматривать как своеобразную колебательную систему, изменения различных
типов физико-химических и морфологических параметров в которой протекают
в относительно узких границах; как систему, остро реагирующую практически
иа любые воздействия, которым подвергается организм, особенно разного рода
цитостатиков (при гематологических заболеваниях, новообразованиях), ионизи¬
рующего излучения и т.д.
Функционально костный мозг напоминает мозаику, которая проявляется
в видимой неоднородности морфологических характеристик клеток, темпов
пролиферации и процессов созревания в том или ином участке костного мозга.
Такие факторы, как фактор Стила, интерлейкины (ИЛ-3, ИЛ-6, ИЛ-11, ИЛ-1)
и ГМ-КСФ, можно рассматривать в качестве ростовых факторов. По мере того
как ранние клеточные предшественники дифференцируются в коммитирован-
ные клетки-предшественники одной из клеточных линий, в действие вступают
поздно действующие факторы. Так, например, эритропоэтин взаимодействует
с эритроидными предшественниками БОЕ-Э и КОЕ-Э, которые обладают рецеп¬
торами к этому специфическому для данной клеточной линии ростовому фактору
(эритрону), не обладая, по-видимому, рецепторами к другим специфическим
поздно действующим факторам. Неидентифицированный поздно действующий
фактор, названный тромбопоэтином, взаимодействует с предшественником мега-
кариоцитов и индуцирует его к образованию мегакариоцитов. Аналогично ИЛ-6,
как и ИЛ-11, может влиять на степень активности тромбопоэтина, а Г-КСФ,
М-КСФ и ИЛ-5 являются специфическими ростовыми факторами, воздействую¬
щими на определенных предшественников гранулоцитарного, моноцитарного
и эозинофильного клеточных рядов. Интересно, что у млекопитающих между
митотической активностью и количеством клеток того или иного типа в эритро-
бласто- или гранулоцитограмме существует прямая зависимость.
Рецепторы к ранним ростовым факторам широко представлены на кроветвор¬
ных клетках. Они были найдены на плюрипотентной стволовой клетке, миелоид-
ных стволовых клетках, частично и полностью коммитированных предшествен¬
никах, а именно: эритропоэтиновый рецептор может быть экспрессирован только
на предшественниках, которые коммитированы к эритроидной дифференцировке.
Эритропоэтиновые рецепторы продолжают экспрессироваться на ранних, но рас¬
познаваемых эритроидных клетках, таких как проэритробласты и базофильные
эритробласты. Макрофаги обладают рецепторами к ИЛ-3, ГМ-КСФ. Эозинофилы
имеют рецепторы к ИЛ-5, ГМ-КСФ и ИЛ-3. Такое распределение важно клиниче¬
ски, поскольку моноциты, гранулоциты и эозинофилы активируются теми гемо-
поэтическими ростовыми факторами, к которым они имеют рецепторы. Именно
по этой причине ростовые факторы, такие как ГМ-КСФ и ИЛ-3, очень токсичны
при использовании в качестве терапевтических препаратов, если тщательно
не контролировать их дозы.
Стабильность кроветворения
Свойственный современной эпохе динамизм социальных изменений, интен¬
сификация и планетарный размах хозяйственной деятельности приводят к гло¬
бальным измерениям в сфере обитания человека. В своей повседневной жизни
человек постоянно сталкивается с возрастающим воздействием самых различных
факторов: физических, химических, биологических и т.д. Система кроветворения
прямо или косвенно реагирует на действие этих факторов. При действии физиче¬
ских и химических факторов, с которыми сталкивается человек в современных
экологических условиях, а также в своей трудовой деятельности, большинство
изменений функций системы кровообращения имеет адаптационный характер.
КЛЕТОЧНЫЕ ОСНОВЫ ТРАНСФУЗИОЛОГИИ 117
Лишь в крайних случаях эти изменения — следствие каких-либо повреждений.
Выявить и правильно оценить адаптационные гематологические реакции на дей¬
ствие токсических факторов малой интенсивности трудно. Не всегда существует
четкая картина различных нарушений. Небольшие изменения количества клеток
крови легко «теряются» среди физиологических колебаний, свойственных этим
показателям, а сами изменения ограничены в своей направленности.
В связи с перечисленным особенно остро встает вопрос о том, что же следует
считать гематологической нормой, т.е. в каких пределах варьируют параметры
нормального кроветворения и где начинается патология? Для ответа на эти вопро¬
сы нами был проведен анализ доступной литературы за последние 100 лет и оце¬
нены результаты собственных многолетних исследований клеток крови и костного
мозга человека. Оказалось, что и миелограмма, по своей сути являясь отражением
характера пролиферации и дифференцировки костномозговых элементов гемопо-
эза, и гемограмма как оценка клеточного состава периферической крови за целый
век при всех упомянутых воздействиях на организм гематологически здорового
человека практически не претерпели каких-либо серьезных изменений.
Таким образом, диапазон количественных и морфологических параметров
клеток системы крови человека в норме характеризуется высокой стабильностью,
что, очевидно, связано с наличием консервативных регуляторных механизмов,
направленных на поддержание гомеостаза.
Особенности детского кроветворения
Все клетки крови — производные эмбриональной мезенхимы. Кровяные ост¬
ровки желточного мешка дифференцируются по двум направлениям: перифериче¬
ские клетки образуют первичные кровеносные сосуды, в то время как центрально
расположенные клетки превращаются в примитивные клетки крови, принадлежа¬
щие к эритроидному ряду.
Примерно к 35-м суткам гестации кровообразование начинается в печени, кото¬
рая становится основным кроветворным органом на 3-6-м месяце жизни плода.
На ранних этапах печеночного кроветворения (гемопоэза) преобладают недиффе¬
ренцированные мононуклеарные клетки (по-видимому, стволовые клетки), затем
возрастает доля эритроидных клеток.
Костномозговое кроветворение начинается на 4-5-м месяце и становится
значимым к 6 мес гестации. Последние 3 мес гестации, а также и в дальнейшем
костный мозг — основное место гемопоэза у человека. У ребенка грудного воз¬
раста костные полости заполнены активной гемопоэтической тканью (красный
костный мозг). По мере роста и развития ребенка в длинных трубчатых костях
гемопоэтическую ткань постепенно вытесняет жировая ткань (желтый костный
мозг). Процесс кроветворения у детей старшего возраста и взрослых протекает
в основном в ребрах, грудине, позвонках, тазовых костях, костях черепа, в ключи¬
цах и лопаточных костях.
Для кроветворения детей характерна лабильность кроветворного аппара¬
та, относительная легкость появления миелоидной и лимфоидной метаплазии
под влиянием самых незначительных факторов и причин. Вместе с тем гемопоэз
у детей имеет выраженную склонность к процессам регенерации.
Количество лейкоцитов у грудных детей колеблется в среднем от II ООО
до 16 ООО, можно считать, что в этом возрасте лейкоцитов больше, чем в после¬
дующие годы. Содержание базофилов не превышает 1% (в среднем 0,5%), плазма¬
тических клеток — от 0 до 0,1%.
Кроветворение у пожилых людей
Физиологическая адаптация кроветворных органов — одна из стабильных
функций человеческого организма. Костный мозг у лиц пожилого возраста (60-
70 лет) остается активно клеточным. Сохранена его функциональная способность
f|g ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
адекватно реагировать регенерацией соответствующих клеток крови на раз-
дражения, например эритроцитозом при сердечно-сосудистых заболеваниях
лейкоцитозом со сдвигом влево в лейкоцитной формуле при острых инфекциях
и интоксикации. О длительном отсутствии нарушений со стороны кроветворения
при физиологическом старении свидетельствует и динамическое постоянство
гематологических показателей периферической крови, наблюдаемое у лиц пожи¬
лого возраста. После 75 лет (чаще у женщин) имеется тенденция к некоторому
уменьшению количества эритроцитов и соответственно гемоглобина. Считают,
что падение концентрации гемоглобина с возрастом связано с уменьшением
секреции тестостерона и эстрогенов. Число пожилых людей, у которых содержа¬
ние гемоглобина опускается ниже границы нормы, широко варьирует в зависи¬
мости от принадлежности к различным этническим и социально-экономическим
группам. С другой стороны, в этом возрасте наблюдают более выраженную
гипоксию, и соответственно встречаются более высокие показатели количества
эритроцитов и концентрации гемоглобина. После 60-70 лет нарастает частота
диспротеинемии. с чем может быть связано некоторое повышение СОЭ. У лиц
пожилого возраста иногда возникает склонность к лейкопении с нейтропенией,
тенденция к постепенному снижению тромбоцитов без нарушения их функцио¬
нальной активности.
У лиц старше 75 лет в результате увеличения жировой части костного мозга,
прогрессирующего с возрастом, можно отметить состояние гипоплазии кровет¬
ворения. проявляющееся уменьшением содержания клеток эритро- и лейкопоэза,
мегакариоцитов с пониженной способностью образовывать тромбоциты, при этом
нарастает содержание лимфоидных элементов. Такое состояние анатомической
недостаточности гемопоэза у лиц пожилого возраста проявляется сначала сни¬
жением адаптационной реакции костного мозга на раздражение, а затем более
постоянной склонностью к панцитопении.
ЭРИТРОЦИТОПОЭЗ И ЕГО РЕГУЛЯЦИЯ
У взрослого человека с массой тела 70 кг циркулирует приблизительно 5 л
крови. Большая ее часть (2,75 л) на 93% состоит из воды с растворенными в ней
белками, преимущественно альбумином, и называется плазмой. Остальной
объем крови (2,25 л) занимают клетки, среди которых больше всего эритроцитов
(2,206 л).
Продукция эритроцитов
Эритрон
Система продукции эритроцитов, или эритропоэз, как и все кроветворение, про¬
исходящая из эмбриональной кроветворной стволовой клетки, в костном мозге
человека представлена эритроном — красным ростком гемопоэза.
На этапах дифференцировки клеток в эритроне можно выделить:
• ранние предшественники клеток эритроидного ряда, в их числе нечувстви¬
тельные и чувствительные к эритропоэтину (ЭПО) — гормону роста;
• морфологически узнаваемые пролиферирующие или непролиферирующие,
но при этом синтезирующие гемоглобин ядросодержащие элементы;
• ретикулоциты и эритроциты.
Ранние предшественники клеток эритроидного ряда идентифицируются только
экспериментально. Среди морфологически узнаваемых клеток эритрона к про¬
лиферирующим, т.е. делящимся, клеткам относят проэритробласт, базофильный
и полихроматофильный эритробласты (на этом этапе начинается синтез гемогло¬
бина). Оксифильные эритробласты и нормобласты не делятся, а лишь дозревают
до клеток следующей стадии дифференцировки. Не делятся также ретикулоциты
и эритроциты.
КЛЕТОЧНЫЕ ОСНОВЫ ТРАНСФУЗИОЛОГИИ 110
Эмбриональный эритропоэз
g эмбрионе человека первые стволовые кроветворные клетки появляются
на третьей неделе внутриутробной жизни из экстраэмбриональной мезенхи¬
мы стенки желточного мешка, соединительной хорды и хориона. Отдельные
очаги (гнезда) кроветворной (гемопоэтической) ткани располагаются в мезенхиме
ниже эндодермальных слоев. Некоторые из них полностью окружены эндоте¬
лиальными клетками, другие лежат свободно в мезенхиме. Сосуды желточного
мешка 3-4-недельного эмбриона часто пустые, хотя могут содержать скопле¬
ния недифференцированных, лимфоидных клеток. Примитивные эритробласты
редко обнаруживают в этих сосудах, а более дифференцированные примитивные
клетки заполняют широкие пупочные сосуды хориона и амниотические сосуды.
Первичные эритробласты (мегалобласты) представляют собой клетки с крупным
ядром из нежно-сетчатого хроматина с большими ядрышками и базофильной
цитоплазмой. После нескольких делений и дифференцировки хроматин ядер этих
клеток конденсируется, цитоплазма, накапливая гемоглобин, становится сначала
полихроматофильной, а затем и оксифильной. Как только первичные эритробла¬
сты теряют способность к делению, остатки ядра выталкиваются из них (карио-
рексис) и образуются крупные первичные эритроциты (мегалоциты).
С 8 нед гестации, помимо первичных эритробластов, в желточном мешке могут
образовываться и вторичные, которые, созревая, превращаются в нормоциты.
морфологически неотличимые от эритроцитов взрослого человека.
Примитивный эритропоэз в желточном мешке окончательно затухает после
8 нед внутриутробной жизни, но параллельно с ним уже к 4-5 нед гестации
в печени начинается дефинитивный эритропоэз (вторая генерация гемопоэза).
Интересно отметить, что стволовые клетки примитивного эритропоэза легче нахо¬
дят путь в циркулирующую кровь, чем ядерные клетки дефинитивного эритро¬
поэза. Кроветворение в печени (эмбриональная печень является преимущественно
эритропоэтическим органом) осуществляется вне сосудов. В начале кроветво¬
рения клетки — первичные эритробласты-мегалобласты, но с 6 нед и до конца
3 мес гестации появляются и начинают преобладать вторичные эритробласты
и эритроциты-нормоциты. Вторичные эритробласты отличаются от «желточных»
меньшей степенью диссоциации ядра и цитоплазмы. В их популяции сравни¬
тельно редко встречаются амитозы, ядерное почкование и двухъядерные клетки.
К 18-20 нед эритропоэз в печени резко сокращается, но все же продолжается
до конца внутриутробного развития плода.
Предполагают, что в конце 2-го месяца гестации, когда кроветворение только
начинает появляться в нескольких костях скелета, из печени идет «подсев* кле¬
ток в тимус и в селезенку. На 12-й неделе эритропоэз, наряду с другими ростками
кроветворения, возникает в селезенке, однако на 20-30-й неделе в этом органе он
полностью вытесняется лимфопоэзом — продукцией лимфоцитов.
Начиная с 13-14 нед, возникает костномозговое кроветворение — миелопоэз.
первые клеточные элементы всех трех ростков — эритроидного, гранулоцитарно-
го и тромбоцитного — обнаруживают в диафизах бедренных и плечевых костей.
Стромальный матрикс в костях развивается за две недели до миграции стволовых
клеток. Эти клетки колонизируют примитивную строму, образуя экстрасину-
соидальные очаги гемопоэза. Индивидуальная специфика начала костномозгового
гемопоэза определяется спецификой оссификации.
Клеточный состав эритрона
К моменту рождения человека продукцию эритроцитов осуществляет только
костный мозг. В норме на долю красного ростка кроветворения приходится от 20
До 30% ядросодержащих клеток костного мозга. Среди них, как уже было сказано,
можно выделить пролиферирующие, созревающие и зрелые клетки. Из морфоло¬
гически распознаваемых клеток-предшественников первые в эритроне — прозри-
f 20 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
тробласты. С каждым последующим их делением все четче проявляются черты
эритроиитной дифференцировки. Так. появляются два базофильных эритробла-
«*. которые соответственно дают по два полихроматофильных эритробласта
Процесс пролиферации клеток эритрона на этом заканчивается: после деления
половина дочерних полихроматофильных эритробластов созревает до оксифиль-
|thnr эритробластов. а остальные успевают перед этим разделиться еще один раз.
Исследования костномозговых предшественников, выполненные на уровне
световой и электронной микроскопии, показали, что их вызревание в костном
мозге здоровых людей сопровождается морфологическими изменениями нуклео-
лярного аппарата, свидетельствующими о постепенном подавлении транскрипции
рнбосомной РНК. В эритроидном ростке кроветворения нуклеолярный коэффи¬
циент (среднее число ядрышек на 100 клеток), достигая максимального значения
в базофильных эритробластах, в более зрелых клетках падает. Высокая частота
клеток с компактной нуклеолой, состоящей из нескольких фибриллярных цен¬
тров. окруженных тонким слоем перинуклеолярного гетерохроматина, постепен¬
но вытесняется клетками с микроядрышками, которые теряют свои очертания.
Их фибриллярные центры формируют области сегрегированных фибриллярных
и гранулярных компонентов, пронизанных глыбками конденсированного хро¬
матина (хромоцентры) и окруженных плотным перинуклеолярным хроматином.
Все эти изменения по мере вызревания клеток сопровождаются уменьшением
числа рибосом в их цитоплазме. При использовании цитохимической реакции
с серебром показано, что количество гранул импрегнировавшего нуклеолу серебра
в вызревающих клетках костного мозга прогрессивно снижается и процесс вызре¬
вания сопровождается уменьшением базофилии цитоплазмы: подавляется актив¬
ность рибосомного хроматина, а с ней и пролиферация клеток.
Проэритробласт - круглая клетка диаметром 15-25 мкм, ядро с 2-3 ядрышка¬
ми. крупное и круглое, занимает почти всю цитоплазму, расположено центрально,
хроматин мелкосетчатый с небольшими уплотнениями, поэтому выглядит зерни¬
стым. цитоплазма интенсивно базофильная, иногда с перинуклеарной зоной.
Базофильный эритробласт - клетка диаметром 10-18 мкм с большим кру¬
глым и центрально расположенным ядром, хроматин которого из-за чередования
светлых и темных полос напоминает характерную структуру колеса со спицами.
Цитоплазма окрашивается в темно-синий цвет.
Полихроматофильный эритробласт - по размеру меньше базофильного (диа¬
метр 10-14 мкм). Ядро все еще сохраняет четкую колесовидную структуру.
Цитоплазма клетки розово-голубая.
Оксифильный эритробласт — клетка округлой формы. Ядро бесструктурное,
темно-фиолетового цвета, по размеру еще меньше, чем у предыдущих клеток,
и расположено эксцентрично. Иногда выражен пикноз ядра. Цитоплазма насыще¬
на гемоглобином, и по своей окраске клетка почти не отличается от эритроцитов.
Кинетика пролиферации и регуляция зритропоэза
На морфологически распознаваемые клетки эритрона приходится всего
3-4 деления, причем продолжительность деления проэритробласта равна 13 ч,
базофильного эритробласта — 16 ч, а полихроматофильного — 35 ч. Затем на про¬
тяжении 25-29 ч клетки проходят дифференцировочные стадии оксифильного
эритробласта и нормобласта, заканчивающиеся выталкиванием ядра (кариорек-
сис) и образованием ретикулоцита. Ретикулоцит в течение 50 ч дозревает в кост¬
ном мозге и затем выходит в периферическую кровь.
Регуляция нормального гемопоэза осуществляется посредством гемопоэтиче-
ских факторов роста, которые контролируют пролиферацию, дифференцировку
и выживаемость кроветворных предшественников. В условиях редукции гемо-
яоэтических факторов роста активность пролиферации снижается включением
КЛЕТОЧНЫЕ ОСНОВЫ ТРАНСФУЗИОЛОГИИ 121
программы клеточного суицида — апоптоза. Эритропоэз у здорового взрослого
человека, наряду с образованием необходимого числа эритроидных предше¬
ственников, сопровождается разрушением части эритроидных предшественни¬
ков (неэффективный эритропоэз). В постнатальном периоде первым примером
супрессии апоптоза в эритроне является взаимодействие эритропозтина и зави¬
симых от него эритроидных предшественников. На стадии эритроидных колоние-
образующих единиц, например при малой концентрации ЭПО, возникают условия
для обширной гибели клеток, при высокой - большая часть их сохраняет жизне¬
способность.
Процессу деления и дифференцировки эритроидных клеток сопутствует конден¬
сация ядерного хроматина, а потеря способности эритробластов к делению сопря¬
жена с кариорексисом. Интересно, что репрессированный хроматин может быть
активирован in vitro переносом ядра в цитоплазму, не содержащую гемоглобин.
Неэффективный эритропоэз обусловлен тем, что часть эритробластов и нор-
мобластов (обычно не более 3-8%) в силу каких-либо условий не завершает
цикл дифференцировки и разрушается в костном мозге. В норме этот процесс -
один из физиологических механизмов регуляции равновесия в системе эритрона
при постоянно меняющейся потребности организма в эритроцитах. При анемиях
неэффективный эритропоэз может увеличиться до 50%. Считают, например,
что анемия Даймонда-Блекфена (истинная красноклеточная аплазия с выражен¬
ной анемией, макроцитозом и ретикулоцитопенией на фоне дефицита эритро¬
идных предшественников) связана с неспособностью эритрона к пролиферации
и дифференцировке из-за дефекта рецепторов к эритропоэтину, приводящего
клетки к апоптозу: in vitro в эритроидных клетках больных сразу же после удале¬
ния из среды гормона отмечены выраженная конденсация хроматина и регуляр¬
ная (180-360 пар оснований) фрагментация ДНК. Интересен тот факт, что интра-
нуклеосомные повреждения хроматина — в дифференцированных нормобластах.
Неэффективный эритропоэз при патологических состояниях может прояв¬
ляться на всех стадиях дифференцировки эритроидных клеток. Это полностью
справедливо и для гипопластической, и для сидеробластной анемии. При талас-
семии неэффективный эритропоэз наблюдают со стадии полихроматофильного
эритробласта. При эритремии неэффективный эритропоэз сокращен, число разру¬
шающихся клеток минимально, а их разрушение происходит на поздних стадиях
дифференцировки.
Эритропоэтин
В организме здорового человека находится примерно 2,3х101:' эритроцитов.
При условии, что каждый эритроцит живет примерно 120 сут, постоянное обнов¬
ление пула эритроцитов должно происходить со скоростью примерно 2.3 миллио¬
на клеток за 1 с.
Очевидно, что для поддержания постоянного уровня циркулирующих эритро¬
цитов при нормальных условиях дифференцировка и вызревание эритроидных
клеток должны строго регулироваться. В настоящее время получено множество
данных, свидетельствующих о том, что фактором, обеспечивающим контроль
дифференцировки клеток эритрона, служит эритропоэтин — циркулирующий
в крови гликопротеидный гормон, который вырабатывают почки.
Эритропоэтин человека представляет собой гликопротеид, в котором на долю
углеводного компонента приходится 40-50% молекулярной массы (молекулярная
масса гликопротеида 32 000-36 000 Да, а расчетная молекулярная масса белковой
части — 18 399 Да). Величина изоэлектрической точки ЭПО низкая (pH 3.5-4.0),
что обусловлено наличием сиаловых кислот в терминальных положениях углевод¬
ных цепочек эритропозтина. Изоэлектрическая фокусировка эритропозтина плаз¬
мы в полиакриламидном геле позволяет выявить несколько фракций, идентичных
122 06ЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
по молекулярной массе, но различающихся по величине их изоэлектрических
точек, что свидетельствует о гетерогенности в структуре углеводной части гормо¬
на. Отщепление сиаловых кислот при обработке нейраминидазой или при кислот¬
ном гидролизе приводит к потере стабильности гормона in vivo, но не влияет на его
активность in vitro.
В результате анализа аминокислотной последовательности эритропозтина
человека выявлено три потенциальных участка N-гликозилирования, которые
включают согласованную последовательность Asn-X-Ser. При обработке гормона
О-гликозидазой установлено, что эритропоэтин содержит также олигосахаридные
цепочки, связанные с белковой частью посредством О-гликозидных связей.
При исследовании свойств рекомбинантного эритропозтина, продуцируемого
клетками насекомых, было показано, что неполный углеводный компонент (моле¬
кулярная масса эритропозтина, синтезированного в этой системе, равна 23 кДа)
не влияет на активность гормона in vitro, но значительно снижает его активность
in vivo.
В то же время полное отщепление углеводной части с помощью гликозидаз
приводит к потере 80% биологической активности гормона in vitro. Эти данные
находятся в противоречии с существующими представлениями о том, что углевод¬
ный компонент эритропозтина не строго необходим для его активности in vitro.
Проведен детальный анализ структуры рекомбинантного эритропозтина, полу¬
ченного с помощью трансфекции клеток из яичника китайского хомячка линии
СНО в геном эритропозтина человека. Было установлено, что в клетках этой линии
синтезируются 2 типа эритропозтина (названных би- и тетра-формами), разли¬
чающихся по степени разветвления N-связанных углеводных цепочек. Би-форма,
содержащая менее разветвленный углеводный компонент, существенно отличается
по биологической активности от нативного эритропозтина, используемого в каче¬
стве стандарта: биологическая активность би-формы эритропозтина in vivo в 7 раз
ниже, a in vitro — в 3 раза выше. Биологическая активность тетра-формы очень близ¬
ка к активности нативного эритропозтина. Эти данные указывают на существенную
роль структуры углеводного компонента для биологической активности эритропоэ-
тина in vivo. По-видимому, более высокая активность in vitro тех форм эритропоэ-
тина. которые содержат неполный углеводный компонент, связана с облегчением
взаимодействий эритропозтина с рецепторами. В то же время, вероятно, именно
углеводный компонент обеспечивает стабильность гормона в организме и соответ¬
ственно высокий уровень биологической активности in vivo.
Среди клеточных моделей для изучения процесса эритропоэтин-зависимой
эритроидной дифференцировки на первом месте стоит культура костного мозга —
модель нормального эритропоэза. Однако, хотя в настоящее время разработаны
методы обогащения культуры костного мозга (а также периферической крови)
определенными типами клеток, в том числе и эритроидными, эта модель, в кото¬
рой клетки определенной стадии дифференцировки каждого ростка кроветворе¬
ния составляют лишь незначительную часть, очень сложна и гетерогенна.
Эффективное получение гомогенной популяции эритроидных клеток обеспечи¬
вает использование вирусов Френд. На клеточных линиях, полученных при пасси¬
ровании эритролейкоза мышей, зараженных комплексом вирусов Френд, показано,
что вирус блокирует процесс эритроидной дифференцировки на стадии бурст-
образующих единиц и колониеобразующих эритроидных клеток. Некоторые такие
линии, как и некоторые линии мышиного эритролейкоза, полученные с помощью
заражения in vitro культуры костного мозга комплексом вирусов Френд, сохраняют
чувствительность к эритропоэтину и способны в присутствии гормона претерпе¬
вать дифференцировку, вплоть до терминальных стадий. Другие теряют чувстви¬
тельность к эритропоэтину, однако их дифференцировку можно вызвать такими
неспецифическими агентами, как диметилсульфоксид.
КЛЕТОЧНЫЕ основы ТРАНСФУЗИОЛОГИИ 123
Описана также чувствительная к эритропоэтину мышиная линии лимфобластов
рА-1. однако ее клетки не дифференцируются, а только пролиферируют. Таким
образом, линия DA-1 — модель для исследования ЭПО как фактора роста.
Есть и другие клеточные линии, позволяющие изучать различные функцио¬
нальные аспекты дифференцировки под действием эритропозтина. Например,
линия МВ02 пригодна для изучения «переключения* экспрессии глобинового
локуса в ответ на добавление эритропозтина, морфологических изменений и изме¬
нений состава поверхностных антигенов в процессе эритропоэза.
С помощью трансфекции эмбриональных клеток печени ретровирусами, содер¬
жащими онкогены raj и туе, получена линия клеток, также способных претерпе¬
вать эритроидную дифференцировку in vitro в присутствии эритропозтина.
Действие эритропозтина исследуют и in vivo. В серии работ показана пря¬
мая зависимость пула зрелых бурст-образующих единиц от концентрации цир¬
кулирующего ЭПО; подтверждена большая чувствительность к ЭПО зрелых
бурст-образующих единиц, чем незрелых, при том, что для их индукции в целом
требуется концентрация гормона в 100 раз больше, чем для индукции колоние¬
образующих клеток эритроидного ряда. Степень же индукции колониеобразую¬
щих клеток строго зависит от концентрации эритропозтина. В результате деления
и дифференцировки колониеобразующих клеток образуются также чувствитель¬
ные к эритропоэтину эритробласты. В экспериментах по изозимному анализу
показано, что клон эритробластов происходит от одной клетки-предшественника.
Наибольшее число участков (сайтов) связывания ЭПО обнаружено на поверх¬
ностных мембранах проэритробластов и ранних полихроматофильных эритро¬
бластов. Оказалось, что по мере дальнейшей дифференцировки клеток эритрона
число таких сайтов постепенно уменьшается, однако в условиях экспериментально
индуцированной анемии оно может и увеличиться. Таким образом, не только кон¬
центрация гормона, но и количество рецепторов к нему, по-видимому, регулирует
интенсивность эритропоэза in vivo.
Компетентные к эритропоэтину клетки высокочувствительны к гормону.
Например, при изучении связывания меченного радиоактивной серой реком¬
бинантного эритропозтина с нормальными эритроидными предшественниками
установлено, что на нормальных клетках присутствует 100-200 сайтов связывания
гормона на клетку с константой связывания 750 пмоль/л. На клетках мышиного
эритролейкоза выявляют от двух (белки с молекулярной массой 85 и 100 кДа)
до трех (63,95 и 119 кДа) рецепторов к эритропоэтину. Интересно, что потерявшие
чувствительность к гормону клетки сохраняют только один рецептор (63 кДа).
При исследовании кинетики продукции эритропозтина в ответ на гипоксию
показано, что примерно через час после установления гипоксии количество РНК
эритропозтина в почке возрастает, и она продолжает накапливаться в течение
4 ч. При снятии гипоксии уровень мРНК эритропозтина быстро снижается.
Изменения количества плазменного и почечного эритропозтина. выявляемые
с помощью эритропоэтин-специфических антител, происходят строго параллель¬
но с изменением количества мРНК с соответствующим лаг-периодом. Полученные
результаты свидетельствуют о том, что при гипоксии продукция эритропозтина
стимулируется de novo.
Таким образом, данные по изучению рецепторов, специфичных к эритропоэти¬
ну, позволяют предположить, что главными клеточными мишенями для действия
эритропозтина служат колониеобразующие клетки эритрона и эритробласты.
По мере приближения клеток к терминальным стадиям эритроидной дифферен¬
цировки число сайтов связывания эритропозтина уменьшается и их чувствитель¬
ность к гормону ослабевает.
Основной фактор, стимулирующий биосинтез эритропозтина, - гипоксия.
В условиях гипоксии количество циркулирующего в плазме эритропозтина воз-
124 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
рзстагт примерно в 1000 раз и достигает 5-30 ед./мл. Предполагают, что гипоксия
приводит к снижению уровня кислорода в специфических сенсорных клетках
почек и усиливает продукцию простагландинов в клетках клубочков. Ингибиторы
синтеза простагландинов оказывают подавляющий эффект на продукцию эри-
тропоэтина при гипоксии. При гипоксии, как и при воздействии ионов кобальта
в почках высвобождаются нейтральные протеазы и лизосомные гидралазы, кото¬
рые. как было показано, также стимулируют продукцию эритропозтина.
Вероятно, важную роль в этих биохимических событиях играет кальциевая
система: ионы кальция стимулируют активность фосфолипазы А, и образование
простагландинов. Простагландини, в свою очередь, могут активировать аденнлат-
цнклазу и запускать каскад биохимических событий, приводящих к фосфорилиро-
ванию и активации гидралаз. Роль гидралаз и длина цепочки, приводящей в конце
концов к усилению синтеза эритропозтина, пока не ясны.
Активностью, стимулирующей биосинтез эритропозтина, обладают также неко¬
торые гормоны гипоталамо-гипофизарной системы, щитовидной железы и неко¬
торые стероидные гормоны. Специфический индуктор продукции эритропоэти-
на — ионы кобальта. Механизм действия ионов кобальта на систему биосинтеза
эритропозтина пока не ясен. Эта система — привлекательная экспериментальная
модель для изучения индукции биосинтеза эритропозтина.
Клетки, секретирующие эритропоэтин, расположены в корковой части почек.
Здесь же находится зона наиболее низкого давления кислорода. Данные гистоло¬
гического анализа свидетельствуют о том, что эритропоэтин синтезируют интер¬
стициальные клетки коркового слоя почки. Именно с увеличением числа этих
клеток связано усиление продукции эритропозтина. По мере восстановления нор¬
мального гематокрита количество эритропоэтин-синтезирующих клеток быстро
уменьшается, причем кинетика изменения коррелирует с кинетикой снижения
количества мРНК эритропозтина и циркулирующего гормона.
Долгое время основными кандидатами на роль эритропоэтин-продуцирующих
клеток считали клубочковые клетки и клетки проксимальной части канальцев.
Клонирование гена эритропозтина, а также разработка методов гибридизации
m situ, позволяющая идентифицировать непосредственно те клетки, в которых
происходит экспрессия тех или иных генов, изменили представления о приро¬
де клеток, синтезирующих эритропоэтин. Метод гибридизации in situ позволил
предположить, что основным местом синтеза эритропозтина в почках являются
интерстициальные или капиллярные эндотелиальные клетки. В то же время опи¬
саны случаи полицитемии у больных с карциномой тубулярного происхождения
и гиперпродукцией эритропозтина. Оказалось, что опухолевые клетки имеют
эпителиальную природу и конститутивно продуцируют значительные количества
эритропозтина.
Показано, что от 5 до 15% эритропозтина плазмы у взрослых животных имеет
внепочечное происхождение. Как уже отмечалось, у эмбрионов основное место
дефинитивного эритропоэза — печень. Во взрослом организме печень остается
органом, продуцирующим внепочечный эритропоэтин. Эритропоэтиновая мРНК
была обнаружена только в почках и печени, причем ее продукция стимулирова¬
лась при гипоксии. По-видимому, дополнительными клетками внепочечного син¬
теза эритропозтина могут быть макрофаги костного мозга и селезенки.
Вопрос о том, каким образом и почему происходит изменение места синтеза
основного количества эритропозтина в организме в течение онтогенеза, остается
невыясненным. Показано, что трансплантированная во взрослую овцу эмбрио¬
нальная печень продолжает секретировать эритропоэтин, несмотря на функцио¬
нально активные в этом отношении почки взрослого животного. Эти данные сви¬
детельствуют о том, что продукция гормона в печени не супрессируется почечным
эритропоэтином или какими-либо иными факторами, присутствующими во взрос-
КЛЕТОЧНЫЕ ОСНОВЫ ТРАНСФУЗИОЛОГИИ 125
яом организме. По-видимому, изменение основного места синтеза эритропозтина
g течение онтогенеза — генетически детерминированное событие.
Клонирование ДНК эритропозтина из клеток почечной карциномы человека,
продуцирующей эритропоэтин. впервые проведено в 1984 г. Затем появились
другие сообщения о клонировании гена эритропозтина. Сам ген эритропозтина
«человека локализован на длинном плече хромосомы 7: 7q21/EPO. Геном коди¬
руете белок, состоящий из 193 аминокислотных остатков. Кодирующая em часть
высококонсервативна: 80% гомологии на уровне аминокислотных последователь¬
ностей у человека и мыши.
С использованием двунитевых олигонуклеотидов, идентичных консерватив¬
ным участкам 5’-фланкирующей области гена эритропозтина мыши, проведена
работа по идентификации ядерных факторов, связывающихся с этими участками.
Было показано, что в ядерных экстрактах почек контрольных и эксперименталь¬
ных животных, получавших хлорид кобальта, присутствуют два типа факторов,
связывающихся с 5’-фланкирующей областью гена. Один из них с молекулярной
массой 47 кДа есть примерно в одинаковом количестве в обоих типах экстрактов.
Другой фактор (или факторы) имеет рибонуклеопротеидную природу.
Идентифицированы четыре вида РНК, участвующие во взаимодействии с геном
эритропозтина, причем два вида РНК представлены в экстрактах после введения
хлорида кобальта значительно меньшим числом копий, чем в нормальных экс¬
трактах. Эти данные указывают на присутствие негативных регуляторов (вероятно,
рибонуклеопротеидов), участвующих в контроле экспрессии гена эритропозтина.
Предположение о негативной регуляции экспрессии гена эритропозтина полу¬
чило подтверждение и на серии трансгенных мышей, несущих кодирующую часть
гена эритропозтина человека и различные фрагменты 5’-фланкирующей области.
Анализ экспрессии гена различных трансгенов позволил идентифицировать три
регуляторных элемента гена эритропозтина человека:
• позитивный регуляторный элемент, необходимый для индукции экспрессии
гена эритропозтина в печени; этот регуляторный элемент входит в состав
фрагмента длиной 4 тыс. пар нуклеотидов, включающего 0,4 тыс. пар нуклео¬
тидов 5'-фланкирующей области гена, кодирующую часть гена, и 0,7 тыс. пар
нуклеотидов 3’-фланкирующей области;
• негативный регуляторный элемент, расположенный между 0.4 тыс. и 6 тыс.
параминонуклеотидов 5’-фланкирующей области гена;
• регуляторный элемент, необходимый для индуцибельной экспрессии гена
в почках, расположенный далее 6 тыс. пар нуклеотидов 5'-фланкирующей
области гена или далее 700 пар нуклеотидов З’-фланкирующей области.
Здесь же показано, что существуют два участка инициации транскрипции гена
эритропозтина с множеством сайтов инициации. В норме инициация транскрип¬
ции происходит с ограниченного числа сайтов, расположенных на обоих участках.
При экспериментальной индукции анемии или при обработке хлоридом кобальта
количество функционирующих сайтов инициации транскрипции на обоих участ¬
ках возрастает.
Витамин В12, фолаты
Витамин В12 и фолаты — компоненты, необходимые для нормального метабо¬
лизма в организме (синтез ДНК, обмен жирных кислот и др.). Дефицит этих вита¬
минов нарушает функции быстро пролиферирующих клеток, вызывает мегало-
бластную анемию, неврологические и нейропсихические изменения. Витамин В,,
поступает с мясной пищей. За всасывание витамина ответствен внутренний фактор
пищеварительного тракта (фактор Касла) — термолабильный, щелочеустойчивый
гликопротеин. При его дефиците или отсутствии возникает пернициозная ане¬
мия.
Структурно витамин В12 относят к кобаламинам, в состав которых входит кор-
риновое кольцо — макроциклическое соединение, похожее на порфирин. в центре
126 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
его находится атом кобальта, верхний лиганд, ковалентно связанный с кобальтом
и нуклеотидная боковая цепь.
В организме человека содержится от 3 до 5 мг витамина В12, и этого количества
достаточно на 3-5 лет в случае прекращения обеспечения им.
Фолиевая кислота относится к птероглутаминовым кислотам и состоит из трех
компонентов: птероидинового кольца, парааминобензойной и глутаминовой кис¬
лот. Синтезируется фолиевая кислота различными растениями и бактериями
и поступает в организм человека, главным образом, с растительной пищей.
Как и витамин В12, фолаты имеют много дериватов. Среди известных витаминов
по структурной сложности и разнообразию кобаламины и фолаты занимают
первое место, а по концентрации в организме — одно из последних. Однако реак¬
ции с их участием крайне важны для нормального метаболизма: реакции переноса
метальных и формильных групп на гомоцистеин и другие соединения, синтез
метионинсинтетазы (звено каскада реакций, ответственных за проведение нерв¬
ных импульсов), реакция мутазного типа — по превращению метилмеланила-КоА
в сукцинил-КоА (ключевая стадия метаболитических и синтетических реакций).
Витамин В12 и фолаты участвуют в нормальном эритробластическом кроветво¬
рении путем образования из уридин-монофосфата тимидин-монофосфата, вклю¬
чаемого в ДНК. Крайне важно также участие витамина В12 в обмене жирных кис¬
лот, в результате чего из метилмалоновой кислоты образуется янтарная кислота.
При развитии сочетанного дефицита кобаламинов и фолатов нарушается созре¬
вание эритробластов, появляются мегалобласты, нарушается дифференцировка
клеток в гранулоцитопоэзе и тромбопоэзе, страдает формирование эпителия
желудочно-кишечного тракта.
Дефицит фолиевой кислоты приводит к накоплению гомоцистеина — токсич¬
ной промежуточной формы обмена метионина, вызывающего изменения сверты¬
вающей системы крови и окислительно-восстановительных реакций в организме,
что приводит к сердечно-сосудистым нарушениям. Запасы фолиевой кислоты
в организме составляют 12-15 мг, в случае отрицательного баланса фолатов этих
запасов хватает только на несколько месяцев. От 50 до 70% этих витаминов хра¬
нится в печени. Витамин В12 и фолаты содержатся также и в нервной ткани, цере¬
броспинальной жидкости (особенно много), тканях желудочно-кишечного тракта,
в сыворотке крови и эритроцитах.
Соотношение клеток в эритроне взрослого человека
Судя по парциальным эритробластограммам костного мозга человека, проэри-
тробласты составляют 5,6±0,75% всех ядросодержащих клеток; на долю базо¬
фильных эритробластов приходится 14,3±0,68%; полихроматофильных эритро¬
бластов — 76,7±5,3%; оксифильных эритробластов — 3,4±0,71%. Установлено,
что при переходе от проэритробластов к базофильным эритробластам число
клеток увеличивается почти в 3 раза, а от базофильных эритробластов к поли-
хроматофильным — в 5 раз. Очевидно, что каждая из перечисленных групп клеток,
отражая направление и уровень дифференцировки клеток красного ряда, не явля¬
ется единой клеточной генерацией. Клетки в течение одного цикла меняют мор¬
фологию и размеры в зависимости от метаболических процессов, протекающих
в разные его фазы. Структура хроматина клеточного ядра, количество, размеры
и базофилия ядрышек, базофилия, а затем и оксифилия цитоплазмы изменяются
в зависимости от интенсивности синтеза ДНК, РНК, белков и гемоглобина.
Фазоспецифичность синтеза гемоглобина
Интенсивное накопление гемоглобина начинается со стадии базофильного
эритробласта. Гемоглобин накапливается в основном в фазе Gj и в начале S-фазы
клеточного цикла. Далее (середина и конец S-фазы, фаза G2) количество гемо¬
глобина не изменяется или даже уменьшается, поскольку клетка начинает син¬
тезировать новые негемоглобиновые белки. Когда концентрация гемоглобина
КЛЕТОЧНЫЕ основы трансфузиологии 127
в цитоплазме клетки достигает 20%, синтез ДНК прекращается и клетка готова
делению. С утратой ядра в ретикулоцитах костного мозга синтез гемоглобина
пезко возрастает. Можно утверждать, что в ретикулоцитах на рибосомах, образо¬
вавшихся на ранних стадиях развития эритроидных клеток, продолжается синтез
глобинов.
ЭРИТРОЦИТЫ - УНИКАЛЬНАЯ СРЕДА ГЕМОГЛОБИНА
В обычных условиях у взрослого человека циркулирует приблизительно
25_з0х1012 эритроцитов. Костный мозг, в котором наряду с продукцией проис¬
ходит и разрушение части эритроцитов (неэффективный эритропоэз). за 70 лет
жизни в среднем нарабатывает 460 кг красных клеток. В кровотоке одна популя¬
ция эритроцитов живет 120 сут. При продукции до 1010 эритроцитов в час их коли¬
чество в периферической крови может увеличиваться или уменьшаться в зависи¬
мости от сложившейся ситуации и потребностей организма.
Мембрана эритроцитов
Может показаться, что морфологически эритроциты - самые простые клетки
в организме человека. Эти безъядерные, лишенные цитоплазматических органелл
и обладающие низкой ферментативной активностью элементы крови, на первый
взгляд, даже трудно назвать живыми — мешок с гемоглобином. Однако это далеко
не так. Эритроциты выполняют важнейшие функции поддержания жизнедеятель¬
ности организма: белковые комплексы их поверхностной мембраны, как мини¬
мум, обеспечивают группы крови, а сама клетка служит уникальной средой
для гемоглобина.
Поверхностная архитектоника эритроцитов
Абсолютное большинство (85,05%) эритроцитов здорового человека представ¬
ляет собой двояковогнутые диски диаметром от 6,5 до 8 мкм с гладкой поверхно¬
стью. На центральную впадину (пеллор) этих дисков обычно приходится 35-55%
поверхности, и на поперечном срезе эритроцит имеет форму бублика. Именно
такая форма клетки удовлетворяет требованиям как хранения гемоглобина —
белка, попеременно связывающего кислород и углекислый газ, так и эффективно¬
го газообмена, и позволяет эритроциту проходить через самые мелкие капилляры.
Для объяснения двояковогнутой конструкции красных кровяных телец предло¬
жено несколько теорий. Имеющиеся модели строения эритроцита соответствуют
представлению о специфических свойствах всей оболочки, неспособной противо¬
стоять деформирующему давлению, но, благодаря взаимодействию молекул
в мембране, противостоящей сгибу и возрастанию суммарной поверхности.
Цитоскелет эритроцита
Форму эритроцита поддерживает его цитоскелет, построение которого конт¬
ролируют мультигенные семейства мембраноассоциированных белков путем
организации специализированных мембранных доменов. Организацию и реорга¬
низацию мембранных рецепторов эритроцитов следует рассматривать как дина¬
мичные процессы. Вообще весь эритропоэз генетически зависим, и экспрес¬
сия соответствующих генов стимулируется снижением концентрации кислорода
в окружающем воздухе, кровотоке или в тканях. Некоторые аспекты этой пробле¬
мы становятся понятными благодаря исследованиям влияния эритропозтина, т.е.
гемопоэтического фактора роста, на продукцию эритроцитов при гипоксии.
Современные представления о структуре цитоскелета эритроцита обобщены в его
моделях. По одной из них существует мнение, что цитоскелет формируется спектри-
ном, двухцепочным (260 кДа a-цепь и 225 кДа (3-цепь) фиброзным полипептидом,
а- и (3-геликсы которого между собой связаны конец в конец. К образованному
таким образом тетрамеру присоединяются другие белки, включая иные молекулы
спектрина. Тетрамеры спектрина фиксируются на мембране эритроцита анкири-
ном (215 кДа), гликофорином (25 кДа) и другими белками, среди которых можно
128 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
назвать актин (43 кДа), палладии (72 кДа) и изоформы аддуцина (100-105 кДд)
своего рода стабилизаторами прикрепления спектрина к двуслойной мембране эри¬
троцита. Регуляторная функция описанных белков в отношении формы эритроцита
осуществляется путем их фосфорилирования и дефосфорилирования.
Двухслойная структура липидов мембраны критична для организации цито¬
скелета эритроцита — это условие стабильности трансмембранных белков
Из литературы известно, что размеры и деформируемость мембраны эритроци¬
тов - их наиважнейшие характеристики. С ними связано нормальное функцио¬
нирование этих клеток, в том числе прохождение через самые мелкие капилляры
участе в обменных процессах, в первую очередь в обмене кислорода.
Изменение микроэластометрических свойств эритроцитов и преобразование
дискоцита в другие морфологические формы вызывают различные агенты.
Появление выростов на поверхности клетки приводит к уменьшению эла¬
стичности мембраны, что. возможно, обусловлено противоположными силами
возникающими в процессе деформации эритроцита. Деформация усиливается
с уменьшенным содержанием АТФ в клетках. Если строение клеточной мембраны
нарушено, клетка приобретает сферичность и подвергается гемолизу. Становясь
сферичными, эритроциты покрываются отростками, истончаются и разрушаются.
Структура клеточной мембраны типичного дискоцита одинакова на всем ее
протяжении. Хотя впадины и выпуклости могут возникать в различных участках
мембраны, изменения внутри- или внеклеточного давления с разбросом в 15% не
вызывают сморщивания клетки, т.е. существует значительный запас деформируе¬
мости эритроцита. Мембрана эритроцита обладает достаточной эластичностью,
чтобы противостоять воздействию множества разнообразных факторов в процессе
микроциркуляции и при необходимости восстанавливать свою обычную форму.
В состав мембраны эритроцитов входят: фосфолипиды — 36,3%, сфингомие-
лины - 29,6%, холестерин — 22,2%, гликолипиды — 11,9%. Липидный бислой
мембраны пронизывают интегральные белки, внутри эритроцита связанные с его
цитоскелетом. Липиды в мембране находятся в жидком состоянии с относительно
небольшой вязкостью, всего в 10-100 раз больше вязкости воды. Липидный бислой
образуют сфингомиелин в водной фазе и амфифильные молекулы фосфолипидов,
различающиеся по растворимости в воде: обладающая высоким сродством к воде
(гидрофильная) полярная «головка* и «хвост» (жирный) из неполярных углево¬
дородных цепей жирных кислот (гидрофобный). Этот двойной липидный слой
в мембранах вообще выполняет три функции: барьерную для ионов и молекул,
структурной основы для функционирования рецепторов и ферментов (белки, гли¬
копротеины, гликолипиды), и механическую. В осуществлении специализирован¬
ных функций (перенос кислорода или двуокиси углерода для эритроцитов) основ¬
ную роль играют белки мембраны, «встроенные» в липидный бислой. Мембрана
эритроцита выглядит следующим образом: на внешней ее поверхности располо¬
жены липиды, сиаловая кислота, антигенные олигосахариды, адсорбированные
белки: внутренняя поверхность представлена гликолитическими ферментами,
натрием и кальцием, АТФазой, гликопротеинами и гемоглобином. Изменение
формы эритроцита прежде всего обусловлено взаимосвязью мембраны и гемогло¬
бина.
Определение содержания гемоглобина и площади эритроцита показало,
что по мере старения клетки ее площадь уменьшается, в то время как содержание
гемоглобина не меняется. Цитофотометрически распределение эритроцитов здоро¬
вых людей по гемоглобину имеет форму нормальной кривой Гаусса. По содержанию
сульфгидрильных групп, липопротеинового комплекса и гистидина, к изменению
которых весьма чувствительна структурно-функциональная полноценность эритро¬
цитов, эритроциты здоровых людей распределены асимметрично, отражая физио¬
логическую вариабельность клеток. Сульфгидрильные группы, находясь в составе
КЛЕТОЧНЫЕ ОСНОВЫ ТРАНСФУЗИОЛОГИИ 129
рдутатиона, а отчасти и в ферментах, активируют метаболические пути анаэробного
дыхания; липопротеиновые комплексы составляют основную часть мембраны,
определяя ее форму, деформируемость и физиологическую сохранность эритроци¬
та, а гистидин, инвариантная аминокислота в молекуле гемоглобина, поддерживает
буферные свойства, обеспечивает связь гема с глобином и способность двухвалент¬
ного железа к окислению. Эритроцитная популяция также неоднородна и по содер¬
жанию гемоглобина (исследование сухой массы эритроцитов). Предполагают,
что отмеченная вариабельность показателей говорит о том, что каждому возраст¬
ному периоду жизни эритроцита свойствен определенный количественный состав
химических веществ. Действительно, в «зрелом» возрасте эритроциты длительно
сохраняют постоянство химического состава, тогда как по мере старения клеток
содержание химических веществ постепенно снижается.
Принято считать, что отклонения от доминирующего варианта двояковогнуто¬
го диска, скорее всего, отражают промежуточные стадии старения клетки:
• при старении мембрана клеток постепенно становится ригидной и теряет
свои свойства (интересно, что форму двояковогнутого диска сохраняют
и микроциты, и макроциты, т.е. клетки, отличающиеся от обычного эритро¬
цита размерами);
• активность ферментов, прежде всего гексокиназы, глюкозо-6-фосфатде-
гидрогеназы, начинает снижаться примерно с 60-х суток после выхода
эритроцитов в кровяное русло, когда нарушается гликолиз и уменьшается
энергетический потенциал клеток.
Таким образом, эритроциты периферической крови человека могут быть раз¬
делены на дискоциты и недискоциты, и количественные изменения их соотно¬
шения служат отражением старения. Следует добавить, что причиной появления
и нарастания доли недискоцитов также могут быть патологические процессы
(анемия).
Следовательно, популяция эритроцитов состоит из совокупности клеток, неод¬
нородных в структурно-функциональном отношении, и между ними существует
динамическое равновесие. Форма и деформируемость эритроцита — компромисс
между способностью клетки проходить через самые мелкие капилляры, сохранять
в себе гемоглобин, особым образом взаимодействующий с мембраной клетки,
и обеспечивать эффективный газообмен в легких и тканях.
Электрофоретическая подвижность
Для выяснения механизма функционирования мембран необходимо иметь пред¬
ставление не только об их структуре, но также и о физико-химических свойствах.
Недостаток информации о свойствах мембран особенно ощутим в отношении
клеток гемопоэза с разнообразием их биологических свойств в норме и патологии.
Ценность информации, получаемой при помощи цитоэлектрофореза — простого
метода исследования поверхностных свойств клеточных мембран, бесспорна, так
как процесс непосредственно отражает состояние электрических зарядов на внеш¬
ней поверхности клетки, которые ответственны за такие процессы, как неспецифи¬
ческая агрегация, структурообразование в клеточной суспензии, взаимодействие
с тканями организма, микроциркуляция и т.д. Получаемые в ходе исследования
данные об электрофоретической подвижности (ЭФП) клеток, в частности эритро¬
цитов, позволяют судить об электрическом потенциале (^-потенциал) клеточной
поверхности, а также о поверхностной плотности заряда.
Электрический заряд эритроцитов. Полагают, что при средней площади
эритроцитов человека, равной примерно 1,63х10'6 см2, каждый электрический
заряд на поверхности эритроцита соответствует одной молекуле сиаловой кислоты
с молекулярной массой 309. Среди других клеток крови эритроциты, неся отри¬
цательный заряд, обладают наибольшей электрофоретической подвижностью:
1Д28±0,2 мкм/см в 1 с-1.
m 06W*ff 900POCW ТРАНСФУЗИОЛОГИИ
География, космос, биологические ритмы и нормативы красной кровй
Ср^имштельное интерферометрическое исследование содержания гемоглобин
в эритроцитах периферической крови жителей Москвы и Красноярска выявил
следующие значения: мужчины — 36,0+0,5 пг, женщины — 33,0±0.3 пг. Следуй
отлить, что Москва и Красноярск находятся примерно на одной широте
Различия не обнаружены.
Однако при сравнении северных и южных регионов Земли в направлении
от экватора к полюсам, по данным других авторов, отмечена недостоверная тен¬
денция к увеличению как числа эритроцитов, так и насыщения их гемоглобином
Более заметные отличия показателей красной крови выявлены у жителей
высокогорных районов: общее содержание гемоглобина на высоте 2 км от уровня
моря увеличивается в среднем на 10 г/л, на высоте 3 км — на 20 г/л. Интересно
что средняя концентрация гемоглобина в каждом эритроците при этом остается
такой же, как и у жителей равнины.
Суточные вариации содержания гемоглобина в эритроцитах периферической
крови составляют 15% с максимумом по утрам. В отношении сезонных колебаний
гематологических показателей данные литературы противоречивы.
Красная кровь человека в условиях невесомости
К настоящему времени у специалистов космической медицины сформировалось
целостное представление о сдвигах в организме космонавтов под влиянием косми¬
ческих полетов. Наименьшие сдвиги отмечены после кратковременных полетов
(от 2 до 8 сут). Однако красная кровь человека адаптирована к условиям невесомо¬
сти даже при полетах протяженностью более 3 мес, и лишь после более длительных
полетов количество эритроцитов в объеме крови начинает уменьшаться и снижа¬
ется концентрация гемоглобина. Интересно, что восстановление этих показателей
происходит примерно через 2-3 нед после возвращения на Землю. Количество
ретикулоцитов у космонавтов в полете уменьшается, а затем сразу по возвращении
возрастает в 4-5 раз по сравнению с дополетными значениями. Ретикулоцитоз
держится около месяца. На 7-10-е сутки после полета в моче определяют высокий
уровень эритропозтина. Дополетный уровень перечисленных параметров восста¬
навливается в течение 1,5-2 мес.
В настоящее время возникает вопрос о влиянии на организм человека такого
фактора внешней среды, как облучение. Однако проведенные исследования боль¬
ших контингентов людей показывают, что существенных изменений показателей
красной крови не происходит даже тогда, когда общая доза радиации превышает
естественный фон на 4%.
Метаболизм гемоглобина
Сравнительно крупная молекула гемоглобина (молекулярная масса — 64 ООО Да)
состоит из четырех субъединиц, вмещающих гем, т.е. четырех комплексов двух¬
валентного железа (Ее2+) с порфирином, и глобина — белка, состоящего из 574
аминокислотных остатков, в свою очередь, подразделенного на две а- и две
р-полипептидные цепи. Соединяясь в эритроцитах с гемом гемоглобина, свобод¬
ный кислород окисляет его до оксигемоглобина (НЬ02), что и определяет алый
цвет артериальной крови,
Гем - структурная единица гемоглобина. Гем входит в состав семейства
порфиринов. Представляя собой тетрапирролы, порфирины состоят из четырех
пиррольных колец, объединенных метильными мостиками. Пиррольные кольца
порфиринов нумеруют римскими цифрами от І до IV по часовой стрелке; металь¬
ные мостики обозначают греческими буквами от а до 8. Позиции, на которых
у пиррольных колец происходят замещения, отмечают арабскими цифрами.
Название порфирина, включая в себя слово и цифру, соответственно отражает
род и аранжировку замещений в его кольцах. В естественных условиях серии
КЛЕТОЧНЫЕ ОСНОВЫ ТРАНСФУЗИОЛОГИИ 131
порфиринов И и IV не встречаются. В сериях [, стартуя с кольца I. заместители
регулярно повторяются по типу АРАРАРАР. напоминая ритм сонет Шекспира
(ABAS CDCD EFEF GG). В сериях III порядок заместителей в IV кольце реверсиру¬
ет (АРАРАРРА), как у Петрарки: ABBA ABBA CDE CDE. В качестве заместителей
у уропорфиринов соответственно от первого и до четвертого пиррольных колец
чередуются уксусная (А) и пропионовая (Р) кислоты, у копропорфиринов метил
(М) и пропионовая кислота (Р), а у протопорфирина IX — метил (М). пропио¬
новая кислота (Р) и винил (V). причем пропионовая кислота может заменяться
винилом.
Гем происходит из порфиринов третьей серии, хотя его непосредственные пред¬
шественники обозначаются и как протопорфирин III, и как протопорфирин IX.
Менее стабильные, чем порфирины, протопорфирины в природе встречаются
часто. Их молекулы содержат четыре метальные группы (СН,). две винильные
группы (СН=СН2) и два остатка пропионовой кислоты (СН -СН .-СООН). Они
могут иметь три различных вида замещений и соответственно существовать
в 15 изомерных формах в зависимости от порядка расположения заместителей
в восьми возможных положениях боковой цепи. Образуют «четырехзубчатые*
комплексы с ионами таких металлов, как железо, магний, цинк, никель, серебро,
кобальт и медь. Именно хелатный комплекс протопорфирина IX с двухвалентным
железом Fe2+ называется протогемом или просто гемом. Клетки млекопитающих
содержат три различных вида гема: а, Ь и с. В геме а модифицирована вторая
винильная группа; в геме b никаких модификаций нет. в геме с цистииновые остат¬
ки белка ковалентно связаны с двумя винильными группами.
Глобин — белковый компонент гемоглобина. В качестве простетической
группы гем, причем только гем Ъ, входит в состав многих белков (гемопротеи¬
нов) клеток млекопитающих. Сейчас известно около 700 глобинов, возникших,
как предполагают, из семейства наследуемых гемопротеинов массой 17 кДа. К ним
относят цитохромы С и Р-450 митохондрий и эндоплазматического ретикулума
(участвуют в реакциях переноса электронов; полупериод их жизни равен 132 ч).
миоглобин (переносит кислород в мышцах), такие энзимы, как каталазы и перок-
сидазы (контролируют окисление перекисью водорода; полупериод жизни - 20 ч)
или триптофаноксигеназа (катализирует обмен триптофана, используя кислород
в качестве окислителя; полупериод жизни — приблизительно 2 ч). витамин В]2.
необходимый для продукции эритроцитов у млекопитающих, ну и, конечно, гемо¬
глобин, который, исходя из своей функции переносчика кислорода и двуокиси
углерода, занимает среди перечисленных белков особую позицию.
Являясь примером олигомерных белков, глобины состоят из двух идентичных
а- и двух идентичных (3-полипептидных цепей. Все четыре цепи белка плотно уло¬
жены вместе и образуют единую глобулярную структуру, обладающую высокой
стабильностью, даже при том условии, что между отдельными цепями нет кова¬
лентных связей. Все полипептидные цепи или субъединицы данного олигомерного
белка совершенно необходимы для выполнения свойственной ему функции.
Все эритроциты человека вмещают 750 г гемоглобина, который выполняет свою
функцию только при наличии в составе восстановленного гема, т.е. двухвалент¬
ного железа. Вместе с эритроцитами гемоглобин полностью обновляется каждые
120 сут: при ежедневном синтезе от 6 до 8 г гемоглобина 300 мг вновь синтезиро¬
ванного гема соединяется с глобинами, на создание которых организм расходует
около 14% всех аминокислот, доставляемых с пишей. Все, кроме железа, продукты
распада гемоглобина выделяются из организма.
Синтез гема. Синтез и концентрация гема происходят преимущественно
в митохондриях эритроидных клеток костного мозга (полихроматофилъные
эритробласты. нормобласты и ретикулоциты) или клеток печени. Эритроидные
клетки используют гем для построения гемоглобина, клетки печени — простетиче-
132 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
І ской группы цитохрома Р-450 (участвует в детоксикации). На ранних стадиях био
синтеза гема в митохондриях, глицин, взаимодействуя с сукцинил-КоА, образу^
связанную с ферментом а-амино-р-кетоадиминовую кислоту, а затем как резудь-
татдекарбоксилирования образуется б-аминолевулиновая кислота. Две молекулы
последней уже в цитоплазме конденсируются с образованием порфобилиногена
Из четырех его молекул в результате сложных реакций появляется протопор-
фирин IX. только после завершения структуры которого в молекулу включается
железо. Реакция протекает в присутствии фермента гемсинтетазы (феррохелата-
зы), локализованного в митохондриях.
Биосинтез гема в эритроне и печени регулируется по-разному. Эритроидные
клетки синтезируют гем на протяжении всей своей жизни, причем синтезирован¬
ный гем стимулирует образование энзимов, необходимых для нового синтеза,
Синтез гема в печени регулируется потребностью в нем.
Двух- и трехвалентное железо. У мужчины с массой тела 70 кг в организме
содержится приблизительно 3,7 г железа. Химически это железо очень активно.
Связываясь со многими белками, оно меняет их структуру; катализирует окисли¬
тельные реакции типа пероксидации ненасыщенных жиров в клеточных мембра¬
нах. Около 70% железа в организме используется гемоглобином, почти все осталь¬
ное сохраняется в виде ферритина и только немного расходуется на миоглобин,
цитохромы и другие гемопротеины.
В виде ферритина железо накапливается главным образом в печени. Ферритин
обладает способностью сохранять приблизительно 4500 ионов трехвалентного
железа. В случае превышения этого предела в печени и мышце сердца откладыва¬
ются фосфатные и гидрооксидные формы железа (гемосидерин).
Железо утрачивается при кровотечениях, беременности, менструациях
или при некрозе тканей. Его содержание восполняется путем его контролируемого
поглощения из пищи.
Отмечена зависимость усвоения алиментарного железа от формы его поступле¬
ния в желудочно-кишечный тракт; железо гема, поступающее с мясом, усваивается
наиболее легко, другие же формы, например связанные органическими компонен¬
тами, для лучшего усвоения требуют проведения специальной обработки пищи.
Некоторые продукты, например шпинат, из-за хелатирующих железо оксалатов,
хотя и содержат много железа, усваиваются плохо.
Попадающее в организм трехвалентное железо подвергается двунаправленным
изменениям:
• в желудке, под влиянием кислого pH, в присутствии аскорбиновой кислоты
трехвалентное железо восстанавливается до двухвалентного и в таком виде
легче освобождается от лиганд;
• в обогащенной бикарбонатом и щелочью среде двенадцатиперстной кишки
алиментарный гем напрямую абсорбируется клетками слизистой, внутри
которых происходит диссоциация железа; свободные же ионы двухвалент¬
ного железа из любой содержащей его пищи «захватываются» клетками сли¬
зистой и окисляются в них до трехвалентного железа.
Железо, сохраненное в клетках слизистой или печени, кровью переносится
в другие ткани. Для того чтобы пройти через плазматическую мембрану, трех¬
валентное железо при этом восстанавливается до двухвалентного, но в крови
под влиянием ферроксидазы II окисляется вновь, включаясь в сывороточный
белок трансферрин. Трансферрин только на насыщается железом (занятыми
оказываются шесть из 18 доступных для связи областей белка) — это и есть истин¬
ная железосвязывающая способность плазмы крови.
Железосвязывающую способность плазмы крови, представляющую клини¬
ческий интерес, целиком рассчитывают по трансферрину, и как показатель она
состоит из грех компонентов:
КЛЕТОЧНЫЕ ОСНОВЫ ТРАНСФУЗИОЛОГИИ 133
• сывороточное железо (СЖ) — истинная концентрация железа;
• общая железосвязывающая способность (ОЖСС) - максимум железа, кото¬
рое может быть связано;
• насыщение трансферрина железом, т.е. способность связывания ненасыщен¬
ного железа — разница между ОЖСС и количеством СЖ.
Синтез глобинов. По сведениям, включенным в так называемые базы данных
генов, синтез глобинов на разных стадиях онтогенеза позвоночных - сложный
многоступенчатый процесс генетического контроля дифференцировки. созревания
клеток эритрона и клеточного метаболизма. Контроль осуществляют гены глобинов,
совокупность транскрипционных факторов и энзимы метаболизма гема; в отсутствие
гема активируется независимая протеинкиназа сАМР, ингибирующая фактор эука¬
риотической инициации (eLF) и, таким образом, прерывающая синтез глобина.
Например, база данных Кел и соавт. (1997) содержит 42 гена, часть из которых,
по данным авторов, кодирует специфические белки эритрона (глобины), другие
на транскрипционном уровне регулируют биохимическую и морфологическую
специфичность эритроидных клеток, т.е. кодируют синтез энзимов (92 регулятор¬
ные единицы), факторов транскрипции (411 наименований) и антигенов клеточ¬
ной поверхности.
Высшим регуляторным уровнем всех членов одной группы глобиновых
генов считают так называемые локусы контрольных областей (LCR), которые
могут отвечать за тканевую и стадийную специфику регуляции транскрипции.
Такие локусы глобиновых генов позвоночных консервативны по составляющим
их последовательностям ДНК, не транслируются, состоят из участков, очень чув¬
ствительных к ДНКазе-1 (HS) и, таким образом, по-видимому, сохраняют функ¬
ции эритроидных клеток в ходе эволюции.
Синтез двух а- и двух р-полипептидных цепей кодируют несцепленные гены,
локализованные в разных хромосомах. Кластер а-глобиновых генов (приблизи¬
тельно 30 kb) у человека расположен на коротком плече хромосомы 16 (ІбрІЗ.З)
и, наряду с LCR, содержит еще пять локусов: 5’-£-псевдозета-псевдоальфа-1-
<х2-а1-3’. Гены а1 и а.2, достоверно отличаясь между собой только прилегающими
кЗ’-концу нетранслируемыми областями, но не областями 5'-конца или нитрона¬
ми, кодируют идентичные последовательности. Эти две a-цепи с двумя р-цепями
образуют НЬА, т.е. большую часть (97%) гемоглобина взрослого человека. Кроме
того, комбинируясь с 5-цепями, a-цепи дают НЬА2, который вместе с HbF (феталь¬
ный гемоглобин) составляет остальные 3% гемоглобина. Синтез p-цепей кодиру¬
ется кластером генов (приблизительно 60 kb), локализованных на коротком плече
хромосомы 11 (11р15.5) в следующем порядке: 5’-u-6-G-5-A-5-p-3\ Таким
образом, функциональные отличия групп а- и р-глобиновых генов, по-видимому,
зависят от структуры их хроматина. Вместе с тем отмечено, что экспрессия этих
генов, кодирующих синтез цепей гемоглобина у человека, зависит от возраста.
Деградация гемоглобина. Хотя печень и костный мозг человека способны
удалять из циркуляции стареющие эритроциты, основная масса этих клеток (около
9x10?) ежедневно разрушается в селезенке. Освобождающийся при этом гемогло¬
бин - основной источник деградирующего гема. Если деструкция эритроцитов
происходит непосредственно в кровотоке (при гемолитических анемиях, напри¬
мер, когда около 10% клеток разрушается в плазме), следующие белки способны
связать гемоглобин или свободный гем, чтобы предотвратить потерю железа через
почки: гаптоглобин связывает димеры метгемоглобина (гем с Fe! ). гемопексин
связывает свободный гем, трансферрин связывает свободное железо.
При ежедневном синтезе 6-8 г гемоглобина также ежедневно должно дегради¬
ровать не менее 6-8 г этого белка, т.е. приблизительно 300 мг гема.
В клетках селезенки гем деградирует до билирубина — желчного пигмента,
который появляется в результате распада протопорфирина IX. Деградация прохо-
fJ4 06iUH€ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
лиг і два этапа. На первом этапе кольцо гема разрезается микросомальной гемок-
сидазой. которая разрушает метильные мостики между пиррольными кольцами
несущими винильные фуппы. Углеродные мостики удаляются с выделением
смшси углерода (СО), и соответственно около 1% областей гемоглобина, связыва¬
ющих кислород, блокируются СО. На втором этапе биливердин восстанавливается
НАДФ до плохо растворимого оранжево-желтого билирубина. Билирубин легко
проникает через клеточную мембрану и диффундирует в кровяной поток (прямой
билирубин, в норме его содержание равно 0-3.4 мкмоль/л), где формирует рас¬
творимый комплекс с сывороточным альбумином (общий билирубин, В норме
его содержание равно 3,4-22.2 мкмоль/л) и переносится в печень. Растворимый
билирубин из печени попадает в тонкий кишечник, превращаясь в уробилииоген
или родственные ему продукты. Небольшие количества уробилиногена через
портальную систему могут попадать в плазму и тогда захватываются печенью,
или в виде малой фракции (1-4 мг/день) выделяются почками. Окисление бес¬
цветного уробилиногена переводит его в уробилин, придающий цвет моче и калу.
Массивные разрушения эритроцитов способствуют сверхпродукции билирубина,
печень не справляется с таким его поступлением, и тогда несвязанный билирубин
попадает в кровь.
Освобожденное железо рециркулирует и сохраняется, как уже было сказано
ранее, в форме ферритина или гемосидерина (форма деградации ферритина).
Наибольший резерв железа образуется в печени, костном мозге, скелетной муску¬
латуре и в селезенке. Как правило, эритроциты разрушаются в селезенке, хотя
при гемолизе (хрупкость эритроцитов, тепловой шок или фетальный эритробла-
стоз) гемоглобин (и железо) освобождается в плазму. В этом случае оксигемо-
глобин диссоциирует на а- и (3-димеры, и они через фильтрационную систему
почек попадают в мочу. В другом случае с этими димерами может соединиться
гаптоглобин плазмы. Тогда продукты реакции или поступят на переработку
в ретикуло-эндотелиальную систему, или само соединение приведет к активации
гема и к последующей его деградации. Попавший в плазму гемоглобин может
также связываться с гемопексином и в этом виде деградирует в печени.
Трансферрин — белок, специализирующийся на транспорте железа. Этот гли¬
копротеин синтезируется печенью, а затем попадает в плазму. Трансферрин и его
рецептор рециркулируют. Абсорбция железа рецептором в нейтральной среде
(pH 7) стимулирует эндоцитоз трансферрина, в кислой среде, наоборот, происхо¬
дит диссоциация железа из трансферрина, апотрансферрин возвращается в плазму
и ненадолго связывается с его рецептором.
В случае гемолиза оксигемоглобин в плазме крови диссоциируется на а-
и р-димеры, которые удаляются из организма через почки. Однако попавший
в плазму диссоциировавший на димеры гемоглобин может быть связан гаптогло-
бином (белком плазмы) и окончательно переработан в ретикуло-эндотелиальной
системе. Образовавшийся после деградации гемоглобина глобин гидролизуется
до свободных аминокислот.
Итак, биологическая сущность красной крови, другими словами — эритро¬
цитов. на всех этапах ее становления и функционирования состоит в том, чтобы
обеспечить синтез гемоглобина и полноценную среду существования этого высо¬
коспециализированного дыхательного белка.
ТКАНЕВОЕ ДЫХАНИЕ
Эритроциты осуществляют перенос кислорода от легких к тканям, а углекислого
газа - из тканей к легким. Необходимо отметить, что многие клетки млекопитаю¬
щих способны дышать анаэробно и лишь для клеток головного мозга даже короткие
перерывы снабжения кислородом губительны. Аэробное дыхание, комплекс хими¬
ческих реакций - посредник метаболизма, обеспечивает организм энергией.
клеточные основы ТРАНСФУЗИОЛОГИИ 135
Метаболизм
Известно, что обмен веществ (метаболизм) складывается из двух процессов -
катаболизма и анаболизма.
Катаболизм — ферментативное расщепление углеводов, жиров и белков (али¬
ментарных или депонированных в клетке), осуществляемое за счет реакций
окисления: в ходе этого процесса крупные молекулы («клеточное топливо*) рас¬
щепляются с образованием метаболитов (молочной кислоты, уксусной кислоты,
аммиака, мочевины и двуокиси углерода), что сопровождается выделением сво¬
бодной энергии и запасом ее в форме фосфатных связей АТФ.
Анаболизм — ферментативный синтез сравнительно крупных клеточных компо¬
нентов (полисахаридов, нуклеиновых кислот, белков и жиров) из простых предше¬
ственников. Анаболизм связан с потреблением энергии фосфатных связей АТФ.
Энергетические превращения на промежуточных стадиях метаболизма называ¬
ются сопряжением энергии. Если анаэробы получают энергию за счет гликолиза
(ферментативного расщепления глюкозы линейного порядка с пируватом в каче¬
стве акцептора электронов), то, сохраняя эту способность, все. за исключением
головного мозга, аэробные клетки млекопитающих большую часть энергии полу¬
чают за счет дыхания.
Энергетика брожения и дыхания
Тканевое дыхание — это перенос электронов от расщепляемых органиче¬
ских молекул на молекулярный кислород. Выход энергии при дыхании более
чем на порядок превышает выход ее при сбраживании глюкозы (гликолизе),
поэтому для получения энергии в анаэробных условиях клеткам приходится рас¬
ходовать гораздо больше глюкозы. Более того, двуокись углерода (СО,), продукт
дыхания, более простое соединение (единственный его атом углерода полно¬
стью окислен), чем молочная кислота — продукт гликолиза, столь же сложный,
как и сама глюкоза. При тканевом дыхании образовавшиеся в результате рас¬
щепления углеводов, жиров и аминокислот ацетильные группы вступают в цикл
трикарбоновых кислот (цикл Кребса), где на уровень катализа специфическими
ферментами накладывается каталитический эффект самих промежуточных про¬
дуктов цикла, и расщепляются дальше до С02 и атомов водорода. Последние
включаются в дыхательную цепь, состоящую из серии переносчиков к конечному
акцептору — молекулярному кислороду.
Кислород в крови присутствует в растворимой и связанной формах. Раствори¬
мого кислорода в крови явно недостаточно для удовлетворения запроса тканей
(около 6% от требуемого): при нормальной температуре тела (около 37 °С) и дав¬
лении 1 атм в каждом литре плазмы растворяется приблизительно 23 мл кисло¬
рода (кровь, циркулирующая в легких, содержит 3 мл/л растворимого кислорода,
т.е. значительно меньше). Парциальное давление кислорода крови обычно равно
100 мм рт.ст. (при pH 7,35-7,45 парциальное давление кислорода в артериальной
крови колеблется от 80 до 105 мм рт. ст.), или на 5-10 мм ниже парциального
давления кислорода во вдыхаемом воздухе (из-за примеси венозной крови). Это
значит, что каждый сердечный выброс в минуту доставляет тканям приблизитель¬
но 15 мл свободного кислорода. Каждый грамм гемоглобина способен связать 1,34
мл кислорода. Следовательно, при нормальной концентрации гемоглобина (150
г/л) каждый литр крови переносит 200 мл кислорода и каждый сердечный выброс
в покое доставляет тканям 1000 мл кислорода в минуту.
Сумма кислорода, растворенного в плазме, и кислорода, связанного с гемогло¬
бином эритроцитов, называется содержанием кислорода в крови (Oj/100 мл).
Гипоксия, или метаболический ацидоз
Используя кислород в качестве акцептора электронов, клетки млекопитаю-
ишх получают энергию, и, если обеспечение кислородом нарушено, нарушается
136 06ЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
и созидательная деятельность клеток. В отличие от низкого содержания кислорода
ВО вдыхаемом воздухе, Т.е. ГИПОКСИИ, клинические проявления НИЗКОГО содержа,
ния кислорода в крови обозначают терминами «гипоксия» и «метаболический
ацидоз».
Патогенез гипоксии, которая может возникнуть как при поражениях целого
органа или структуры (сердца, легких, кровеносных сосудов), так и при пораже¬
ниях на клеточном или тканевом уровнях, разнообразен. Среди многочисленных
ее проявлений внимания заслуживают, по крайней мере, четыре варианта: гипок-
сический, застойный, цитотоксический и анемический.
Гипоксическая гипоксия
Ситуация, когда парциальное давление кислорода в артериальной крови (рОЛ
падает настолько, что в заполняемых ею альвеолах легкого полного насыщения
гемоглобина кислородом не происходит. В качестве причины можно назвать
низкое парциальное давление кислорода во вдыхаемом воздухе (рА02), например,
при подъеме на большую высоту, хотя подобное состояние возникает и при прие¬
ме некоторых анестетиков или анальгетиков, действующих на дыхательный центр;
при фиброзе легочной ткани, когда эластические волокна замещаются коллаге¬
ном: при бронхитах или бронхиальной астме, т.е. при неэффективном дыхании.
Парциальное давление кислорода в крови может быть снижено и при нормальном
рА02, например при отеке легких, когда интерстициальная жидкость, накапливаясь
между эпителиальными и эндотелиальными клетками, препятствует насыще¬
нию гемоглобина кислородом, дефектах межжелудочковой перегородки (заброс
венозной крови), эмфиземе легких (уменьшение общей поверхности альвеол).
Перечисленные примеры по своей сути — отражение общего принципа станов¬
ления гипоксической гипоксии: отношение вентиляции к перфузии должно быть
корректным не только для легкого в целом, но и для каждой альвеолы.
Застойная гипоксия
Застойная, или статическая, гипоксия — уменьшение снабжения тканей кисло¬
родом из-за уменьшения потока крови. Подобное возникает как вследствие умень¬
шения сердечного выброса (шок, пороки сердца, гипотония), так и вследствие
нарушения кровообращения в каждом отдельном органе (спазмы сосудов, атеро¬
склероз сосудов, эмболия, инфаркты). Значения рА02 и р02, так же как насыщение
крови кислородом, в этом случае остаются нормальными.
Цитотоксическая (гистотоксическая) гипоксия
Возникает в результате отравления клеточными ядами. Так, цианиды, соеди¬
няясь с цитохромами, препятствуют включению кислорода в цепочку тканевого
дыхания. Дефицит некоторых витаминов группы В, участвующих в метаболизме,
приводит к тому, что клетки или ткани не могут использовать кислород. При цито-
токсической гипоксии парциальное давление кислорода в крови и насыщение
кислородом гемоглобина находятся в пределах нормы.
Анемическая гипоксия
В эту группу включены состояния, при которых концентрация гемоглобина
падает в результате нарушения его синтеза в клетках эритрона, или в результате
уменьшения количества эритроцитов, циркулирующих в периферической крови,
снижается кислородная емкость крови. Среди факторов, способствующих раз¬
витию анемической гипоксии, следует отметить дефицит железа, витамина В12
или фолиевой кислоты. Анемия возникает при нарушениях продукции эритро-
поэтина в случае заболеваний почек, а также при острых или хронических крово-
потерях. Довольно часто встречаются анемии наследственного генеза (например,
серповидно-клеточная анемия). Парциальное давление кислорода, определяемое
альвеолярной вентиляцией, как и расход кислорода при анемической гипок¬
сии, сохраняет нормальные значения, а гипоксия возникает из-за недостатка
или дефектов гемоглобина.
КЛЕТОЧНЫЕ основы ТРАНСФУЗИОЛОГИИ 137
КРОВОПОТЕРЯ
Кровопотерю считают ведущим компонентом в развитии гиповолемического
шока, в основе которого лежит снижение эффективности кровотока на протяже¬
нии значительного промежутка времени.
Кровопотери классифицируют по величине, тяжести и скорости развития изме¬
нений в организме пострадавшего. Американская коллегия хирургов установила
четыре класса кровотечений в зависимости от объема кровопотери и клинических
симптомов. Класс I соответствует потере 15% или менее объема циркулирующей
крови (ОЦК). При этом клинические симптомы отсутствуют или имеется тахи¬
кардия в покое, прежде всего в положении стоя (ортостатической тахикардию
считают тогда, когда ЧСС увеличивается не менее чем на 20 ударов при переходе
из горизонтального положения в вертикальное). Класс И соответствует потере
от 20 до 25% ОЦК. Основным клиническим признаком его служит ортостати¬
ческая гипотензия или снижение АД не менее чем на 15 мм рт.ст. при переходе
из горизонтального положения в вертикальное. В положении лежа АД нормаль¬
ное или немного снижено. Диурез сохранен. Класс III соответствует потере от 30
до 40% ОЦК. Проявляется гипотензией в положении лежа на спине, олигурией
(за сутки выделяется менее 400 мл мочи). Класс IV - потеря более 40% ОЦК. кол¬
лапс (крайне низкое АД) и нарушение сознания до комы.
Для диагностики кровопотери принципиально важно определение величины
дефицита ОЦК. Наиболее доступным в этом отношении показателем является
«шоковый индекс» — отношение частоты пульса к величине систолического арте¬
риального давления. В норме он равен 0,54. При кровопотере шоковый индекс
увеличивается.
Острая постгеморрагическая анемия (гемическая гипоксия)
Гемическая гипоксия — снижение кислородной емкости крови после быстрой
потери значительного объема циркулирующей крови вследствие наружного
или внутреннего кровотечения. Развивается как следствие травм, хирургических
вмешательств, кровотечений желудочных, кишечных, маточных, при разрыве
фаллопиевой трубы в случае внематочной беременности и др.
Острую кровопотерю в отечественной литературе классифицируют по величи¬
не, тяжести и скорости развития изменений в организме пострадавшего. Клини¬
ческая картина этих анемий определяется гиповолемией и гипоксией, потерей
значительного количества железа (500 мг и более при обильных кровотечениях)
и зависит от объема теряемой крови:
• до 10% — симптомы могут отсутствовать, только в отдельных случаях снижа¬
ется АД, появляется холодный пот, возникает полуобморочное состояние;
• до 30% — преобладают симптомы сердечно-сосудистой недостаточности -
тахикардия, одышка, головокружение:
• до 40-50% — развивается тяжелый шок — падение АД, исчезновение пульса,
ателектаз яремных и других вен.
Быстрая одномоментная потеря 30% ОЦК и более без срочных реанимацион¬
ных мероприятий смертельна.
Нормохромно-нормоцитарная анемия (цветовой показатель колеблется от 0.85
До 1,5, а средний диаметр эритроцитов равен 7,8 мкм) сразу же после кровопоте¬
ри, острая постгеморрагическая анемия быстро проявляются обманчивым повы¬
шением числа эритроцитов, концентрации гемоглобина и величины гематокрита
в единице объема периферической крови. Затем, в период от нескольких часов
До 1-2 сут, когда в кровяное русло, разбавляя циркулирующую кровь, начинает
поступать тканевая жидкость, указанные показатели снижаются соответственно
тяжести кровопотери. В препаратах периферической крови можно наблюдать
явления умеренного анизо- и пойкилоцитоза эритроцитов. Число тромбоци-
IU жде ВОПРОСЫ ГРАНСФУЗИОЖК ИИ
то* в единице объема крови также снижено из-за гемодилюции или вследсп^
мл потребления в процессе тромбообраэования. Общее количество лейкощл^
уменьшено как в связи с гемодилюцией. так и в связи с потерей во время кровом
чеяия. Возникающая при этом гипоксия, конечно, лишь при физической мягру*-
несоразмерной С величиной кровопотери. вызывает повышение уровня Эритр<).
поэтмна, к 4-5-м суткам начинается регенерация эритрона и возникает ретикуло-
цмтоз, увеличиваются полихромазня и аниэоцитоэ (микроцитоз). В случае массив-
мого кровотечения а периферической крови выявляют отдельные нормобласти
(регенераторная анемия). Цветовой показатель падает ниже 0.85 (гипохроми*
эритроцитов) в связи с тем. что скорость синтеза гемоглобина из-за дефицита
железа отстает от темпа пролиферации клеток эритрона. Развивается нейтрофиль
ный лейкоцитоз со сдвигом влево. В костном мозге в это время ВЫЯВЛЯЮТ При-
знаки интенсификации эритропоэза: увеличивается количество эритробластов
различных форм нормобластов, а также ретикулоцитов (костномозговая компен¬
сация кровопотери).
Исходя из этих данных, клинико-лабораторную картину острой постгеморраги-
ческой анемии подразделяют на III стадии.
Стадия рефлекторно-сосудистой компенсации. Концентрация гемоглобина
и количество эритроцитов в единице объема периферической крови не изменяет¬
ся из-за компенсаторного спазма сосудов. Отмечают лейкоцитоз (до 20,0х109/л)1
нередко с левым сдвигом, и тромбоцитоз в течение нескольких часов после кро¬
вопотери.
Стадия гмдремкческой компенсации. Концентрация гемоглобина, число эри¬
троцитов и гематокритная величина уменьшаются через 3 сут после кровопотери.
Стадия костномозговой компенсации. С 4-5-х суток после кровопотери
количество ретикулоцитов в периферической крови и величина ретикулоци-
тарного индекса увеличиваются (ретикулоцитарный криз), число тромбоцитов
и лейкоцитов уменьшается. В костном мозге отмечают гиперплазию эритроидного
ростка.
Терапия острой лостгеморрагической анемии
Показаний к переливанию цельной консервированной донорской крови
при гемической гипоксии нет. Кровь используют только лишь при массивных
кровопотерях. когда отсутствуют кровезаменители, свежезамороженная плазма,
эритроцнтная взвесь. Кроме того, ее применяют при проведении обменного пере¬
ливания в случае гемолитической болезни новорожденных.
В современной медицине утвердился принцип возмещения конкретных, недо¬
стающих организму больного компонентов крови. Кровопотеря уменьшает кисло¬
родную емкость крови, сердечный выброс и нарушает микроциркуляцию. Именно
поэтому терапия должна быть направлена на:
• восполнение объема циркулирующей крови;
• восстановление коагуляции и ликвидацию ДВС-синдрома;
• обеспечение тканей и клеток кислородом в количествах, адекватных нагрузке.
Схемы ликвидации последствий кровопотери, в различных сочетаниях в зави¬
симости от ее величины, включают плазмозамещающие растворы, плазму, ком¬
поненты крови. Необходимо переливать компоненты крови только той группы
системы АВО и той резус-принадлежности, которые имеются у реципиента.
Во всех без исключения случаях переливания эритроцитсодержащих компонентов
крови до начала переливания абсолютно обязательно проведение проб на инди¬
видуальную совместимость, и в начале трансфузии — биологические пробы.
Запрещается переливание компонентов крови, предварительно не исследованных
на ВИЧ, гепатиты В и С.
Восполняя гиповолемию, кристаллоидные (раствор Рингера*, ацесоль*) и кол¬
лоидные (декстран, желатиноль*) растворы или компоненты крови (альбумин.
ХЛООЧИЬЯ ОСНОВЫ ТМйСЯУЭМЯвПШ 119
cif*(»*)po*fHHa* плазма) еще более разбавляют уже уммымммк щмчт*»
эритроцитов и снижают кислородную емкость периферической крови Однако
при этом частота сердечных сокращений н сердечный аыброс. как правило,
увеличиваются, порой превышая нормальные значения а 1.5-1 рака. Сроягим»
гемоглобина к кислороду снижается, и ткани получают на кроаи отиосителыю
большее количество кислорода - увеличивается коэффициент экстракции кис¬
лорода При гем и чес кой гипоксии, например с падением концентрации гемо¬
глобина до 50 г л. восполнение дефицита ОЦК 104 альбумином иди плазмой
у больных а сознании, находящихся в покое перед операцией, или у добровольцев
предотвращает кислородное голодание тканей. С другой стороны, свежезаморо¬
женная плазма (второй компонент крови с коллоидно-осмотическим давлением
250 300 мм вод. ст. и pH около 7.0). переливаемая однократно (с учетом совме¬
стимости по системе А ВО и резус-фактору) в количестве 2 л, является незамени¬
мым средством борьбы с шоком и ДВС. В лечебной практике используют плазму
свежезамороженную, нативную, криопреципитвт и препараты плазмы: альбумин,
у-глобулины. факторы свертывания крови, физиологические антикоагулянти
(антитромбин ІІ1. белки С и S). Таким образом, даже при низкой кислородной
емкости крови есть возможность сохранить нормальное насыщение тканей кисло
родом, не прибегая к переливанию консервированной крови Кроме того, понят¬
но, что нестабильность гемодинамики при острой кровопотере в первую очередь
обусловлена гиповолемией. а не снижением кислородной емкости крови Именно
поэтому использовать препараты крови только для поддержания показателей
артериального давления вряд ли рационально. Более того, увеличение кислород¬
ной емкости крови переливанием консервированной крови имеет отрицательные
последствия. Во-первых, увеличение гематокрита увеличивает вязкость крови
т.е. ухудшает микроциркуляцию и создает дополнительную нагрузку на миокард.
Во-вторых, низкое содержание 2.3-дифосфоглицерата (2.3 ДФГ) в эритроцитах
донорской крови увеличивает сродство кислорода к гемоглобину Кривая дис¬
социации кислорода (см. ниже) смещается влево (эффект Бора), что сокращает
насыщение тканей кислородом. В-третьих, перелитые эритроциты начинают
полноценно участвовать в транспорте кислорода только лишь через 12-24 ч
после гемотрансфузии. К тому же при хранении консервированной крови уже
к 21-м суткам содержание АТФ в ее эритроцитах, а следовательно, и их приживае¬
мость в русле реципиента падает на 70%. Кислородтранспортная функция таких
эритроцитов из-за уменьшения в них 2,3-ДФГ также снижается. При переливании
цельной консервированной крови длительных (более 7 сут) сроков хранения
реципиент, наряду с необходимыми ему компонентами, получает функционально
неполноценные тромбоциты, продукты распада лейкоцитов, антитела и антигены,
которые могут стать причиной посгтрансфузионных осложнений. Существуют
и другие отрицательные последствия переливания крови. К ним относят, отторже
ние клеточных элементов донора, риск бактериального и вирусного инфицирова¬
ния. развитие гемосидероза, угнетение кроветворения, усиление тромбогеиности,
аллосенсибилизацию и иммунологические реакции. « *
Введение донорских переносчиков газов крови направлено на восполнение объ¬
ема циркулирующих эритроцитов и поддержание нормальной кис дородтращ порт
ной функции крови при анемии. Переливание одной единицы эритроцит ной массы
(количества эритроцитов из одной кроводачн объемом 450,0t4Si) мл) повышает
уровень гемоглобина примерно на 10 r/л и уровень гематокрита на 3% (при отсут¬
ствии продолжающегося активного кровотечения). Использование эритроцит »й
массы, обедненной лейкоцитами и тромбоцитами, снижает риск передачи аиру сов.
Наряду с эритроцитной массой переливают эритроциткую взвесь - деплазмиро-
ванный концентрат эритроцитов, уровень белка в котором не превышает I.S г/л
Обсуждая вопрос о показаниях к возмещению кровопотери донорскими комік»
140 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
центами крови, следует подчеркнуть, что лабораторными критериями его необхо¬
димости служат не концентрация гемоглобина и не гематокрит больного, а степень
насыщения гемоглобина кислородом и артериовенозная разница по кислороду
Ранее считали, что переливать кровь нужно, ориентируясь на концентрацию гемо¬
глобина, уровень гематокрита и нестабильность гемодинамики. Наиболее общим
показанием было снижение содержания гемоглобина до 100 г/ли уменьшение
гематокрита до 30%. Возможно, что этот уровень гемодилюции действительно
критичен для развития тканевой гипоксии. Однако данные о допустимых уровнях
гемоглобина и гематокрита противоречивы: от 110 до 40-50 г/л и от 33 до 13-15%
соответственно. Гипоксия не возникает и при более низких значениях этих пока¬
зателей. Таким образом, и концентрация гемоглобина, и величина гематокрита -
всего лишь относительные критерии необходимости переливания крови, в част¬
ности у хирургических больных. Вместе с тем в «Инструкции по применению
компонентов крови» (2002) записано: «Показанием к переливанию переносчиков
газов крови при острой анемии вследствие массивной кровопотери является поте¬
ря 25-30% объема циркулирующей крови, сопровождающаяся снижением уровня
гемоглобина ниже 70-80 r/л и гематокрита ниже 25% и возникновением цирку¬
ляторных нарушений».
Проблему трансфузий цельной крови при кровопотере следует рассматривать
с позиций адекватности доставки кислорода тканям. При этом важно иметь в виду
три следующих фактора: концентрацию гемоглобина, сердечный выброс и окси-
генацию.
Доставка кислорода тканям. При полном насыщении (сатурации) гемогло¬
бина кислородом в легких нормальные эритроциты в каждом литре крови способ¬
ны перенести 200 мл газа: 1 г гемоглобина переносит 1,3 мл кислорода. Количество
кислорода, доступного для организма за минуту, известное как доставка кислоро¬
да, равняется сердечному выбросу, умноженному на содержание кислорода в арте¬
риальной крови. Тогда, если систолический объем в покое равен 50-70 мл крови,
а концентрация кислорода в одном сердечном выбросе — приблизительно 12 мл,
доставка кислорода при ЧСС 60 ударов составит 720 мл в минуту. Следует учесть,
что в покое человек обычно потребляет только 25% этого количества.
При анемии, с одной стороны, доставка кислорода неадекватна: низкая концен¬
трация гемоглобина, малый объем сердечного выброса и низкая сатурация. С дру¬
гой стороны, поскольку потребление кислорода определяется не одной только
доставкой, но и способностью ткани забирать его из крови, низкая доставка кис¬
лорода тканям вынуждает их потреблять больше газа. Как следствие этого проис¬
ходит падение сатурации кислорода смешанной крови с 75% до критических 60%
(безопасный предел) и ниже в течение короткого интервала времени, что приво¬
дит к появлению признаков тканевой кислородной задолженности. Клетки пере¬
ходят на анаэробный метаболизм, возникает лактат-ацидоз.
Традиционный анализ газового состава крови основан на измерении pH, пар¬
циального давления углекислого газа (рС02) и парциального давления кислоро¬
да (р02). Однако это даже в сочетании отражает только поглощение кислорода
в легких и кислотно-основное состояние крови. Чтобы составить более полное
представление по вопросу адекватности доставки кислорода, традиционный
анализ газового состава крови целесообразно дополнить параметрами, информи¬
рующими о поглощении кислорода, его транспорте и об отдаче кислорода тканям.
В число таких параметров входят:
• ра02 (парциальное давление кислорода в артериальной крови), которое ука¬
зывает, насколько хорошо происходит поглощение кислорода в легких;
• tHb (общий гемоглобин) как мера транспорта, т.е. потенциальной кислород¬
ной емкости;
• S02 (насыщение гемоглобина кислородом) как мера использования транс¬
порта имеющейся кислородной емкости;
КЛЕТОЧНЫЕ ОСНОВЫ ТРАНСФУЗИОЛОГИИ 141
, FO НЬ (фракция оксигемоглобина) как мера использования транспорта
потенциальной кислородной емкости;
• ct02 (содержание кислорода в крови) как мера количества транспортируемо¬
го кислорода;
„ р50 (напряжение кислорода при 50% насыщении гемоглобина) как мера
сродства гемоглобина к кислороду; это сродство отражает способность арте¬
риальной крови освобождать кислород в тканях.
Кислородная емкость крови — максимальное количество кислорода, обратимо
связанное кровью; выражается в объемных процентах и зависит от концентрации
кислорода в крови. Кислородная емкость крови человека в покое равна примерно
18-20%. Максимальная величина кислородной емкости крови составляет 0,2 л
кислорода на 1 л крови.
Однако такое содержание кислорода в крови достигается только в том случае,
когда кровь контактирует с газовой смесью с высоким содержанием кислоро¬
да В естественных условиях гемоглобин полностью никогда не оксигенируется.
Процентное отношение оксигемоглобина к общему содержанию гемоглобина в крови
называется насыщением гемоглобина кислородом, которое зависит от напряжения
кислорода. Графически эту зависимость отражает так называемая кривая диссоциа¬
ции оксигемоглобина, которая имеет S-образную форму (см. ниже). Кислородная
емкость фетального и взрослого гемоглобина одинакова, но HbF, в 2-2,5 раза
быстрее насыщаясь кислородом, медленнее отдает его тканям.
Ключевым в общей оценке кислородного баланса организма является показа¬
тель объемного транспорта кислорода (ОТК), т.е. показатель количества кисло¬
рода, которое транспортируется к органам и тканям за определенный промежуток
времени. ОТК можно выразить через относительную величину — кислородный
поток (КП), или объем кислорода, поступающего в организм с кровью за единицу
времени. КП вычисляют по формуле;
КП (мл/мин) = 0,2 ст х (АДши - АДшіп) х Ps х 0,1,
где 0,2 ст — объемное абсолютное содержание кислорода в крови, мл/100 мл.
Кроме того, можно вычислить индекс кислородного потока (ИКП), т.е. кисло¬
родный поток, отнесенный к поверхности тела;
ИКП - КП/S (мл/мин/м),
где S — площадь поверхности тела, вычисляемая по формуле Дюбуа (S = 167,2 х рост
в см х масса в кг) и номограмме для определения поверхности тела по росту и массе.
Хотя до сих пор нет информативных критериев для оценки оптимальности тех
или иных способов компенсации транспорта и потребления кислорода, насыщение
гемоглобина кислородом в смешанной венозной крови все же может быть ориен¬
тиром при решении вопроса: переливать или не переливать кровь.
Следует отдельно остановиться на газообмене в контексте с параметрами
поглощения кислорода, его транспорта и доставки тканям. В легких обмен газа¬
ми осуществляется посредством диффузии кислорода из альвеолярного воздуха
в кровь (приблизительно 500 мл в сутки) и двуокиси углерода из крови в альвео¬
лярный воздух (около 430 мл в сутки). Кислород, растворившись в плазме крови
малого круга кровообращения, диффундирует в эритроциты и сразу же связывает¬
ся с гемоглобином, окисляя его. На насыщение и сродство гемоглобина к кислоро¬
ду влияет парциальное давление газа.
Известно, что по мере поступления кислорода из атмосферного воздуха в легоч¬
ные альвеолы и дальнейшего транспорта к митохондриям клеток его давление
падает со 159 мм рт.ст. во вдыхаемой смеси до 4-20 мм рт.ст. в клетках — так
называемый кислородный каскад, каждая ступень которого может быть затронута
патологией. О шунте речь идет, когда деоксигенированная венозная кровь, возвра-
142 ОЫЦИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
шаясь от тканей, проходит через невентилируемые альвеолы (ателектазы альве
лы. уплотнение легкого, отек легких или обструкция дыхательных путей малог
калибра) и поступает в легочные вены и большой круг кровообращения с неиз°
пененным р02 (40 мм рт.ст.). Полностью, т.е. на 95%. насыщенный кислородом
гемоглобин (НЬОг) обладает более сильными кислотными свойствами, чем вос¬
становленный гемоглобин (НЬ). В результате в растворе, имеющем pH 7,25, осво¬
бождение 1 мМ 02 из НЬ02 делает возможным усвоение 0,7 мМ Н* без изменения
pH; таким образом, выделение 02 оказывает буферное действие.
Насыщение тканей кислородом. Отношение между парциальным давлением
в артериальной крови (р,02) и сатурацией графически иллюстрируется кривой
диссоциации гемоглобина. Именно кривая насыщения кислородом отличает гемо¬
глобин от миоглобина. Сигмовидная форма кривой отражает разгрузку кислорода
в периферических тканях, где показатель ра02 низкий. Форма кривой сохраняет¬
ся вне зависимости от того, выражено ли содержание оксигемоглобина (НЬОЛ
во взятой пробе как доля соединенного с кислородом гемоглобина (% НЬО),
или как объем 02 на 100 мл крови (объемные проценты). Сама кривая при различ¬
ных состояниях может сдвигаться влево или вправо, например, при увеличении
концентрации двуокиси углерода сродство гемоглобина к кислороду снижается
и кривая диссоциации оксигемоглобина смещается вправо.
Кинетика оксигенирования гемоглобина. Гемоглобин связывает четыре
молекулы кислорода на тетрамер (по одной на гем в каждой субъединице).
Способность гемоглобина связывать кислород зависит от того, содержатся ли дру¬
гие молекулы кислорода в данном тетрамере. Если да, то последующие молекулы
кислорода присоединяются легче. Следовательно, для гемоглобина характерна
кинетика кооперативного связывания кислорода, благодаря которой он связывает
максимальное количество кислорода в легких и отдает максимальное количество
кислорода при тех парциальных давлениях кислорода, которые имеются в перифе¬
рических тканях.
Сродство гемоглобина к кислороду (СГК), задавая скорость диссоциации окси¬
гемоглобина, формирует капиллярно-тканевый градиент р02, условия диффузии
кислорода в ткани и определяет, в конечном итоге, величину тканевого р02.
В организме от СГК в значительной степени зависит диффузия кислорода из аль¬
веолярного воздуха в кровь, а затем, на уровне капилляров, и в ткань. Свойство
гемоглобина обратимо связывать кислород — частный случай общей закономер¬
ности взаимодействия протеинов с лигандами. Гемоглобин является «совершен¬
ным кислородным буфером», а кривая диссоциации оксигемоглобина (КДО) есть
«титрационная кривая кислорода».
СГК - важный фактор транспорта кислорода в ткани. Однако этим функции
СГК в организме не ограничены. Вопрос о различных аспектах физиологиче¬
ского значения изменения СГК, либо сдвига КДО еще недостаточно выяснен.
Традиционно, как уже сказано выше, полагают, что сдвиг КДО вправо повы¬
шает отдачу кровью кислорода тканям. Сродство гемоглобинов к кислороду
характеризуется величиной р50 — значением парциального давления кислорода
в периферической крови, при котором наблюдают полунасыщение гемоглобина
кислородом. Значение р50 превышает значение парциального давления кислорода
в тканях. Это хорошо иллюстрирует фетальный гемоглобин человека. Для НЬА
р50=26 мм рт.ст., а для HbF р50=20 мм рт.ст. Благодаря этой разнице гемоглобин
F отбирает кислород у материнского НЬА, находящегося в плацентарной крови.
После рождения ребенка HbF утрачивает свою функцию: обладая более высо¬
ким сродством к кислороду, он высвобождает меньшее его количество в тканях.
Связывание кислорода сопровождается разрывом солевых связей, образованных
концевыми карбоксильными группами субъединиц. Это облегчает связывание
следующих молекул кислорода, поскольку при этом требуется разрыв меньшего
числа солевых связей. Указанные изменения заметно влияют на вторичную, тре-
КЛЕТОЧНЫЕ основы ТРАНСФУЗИОЛОГИИ 143
_йчную и особенно четвертичную структуру гемоглобина. При этом одна а/р-иара
субъединиц поворачивается относительно другой а/{)-пары. что приводит к ком-
пактизации тетрамера и повышению сродства гемов к кислороду.
Конформационные изменения в окружении гемогруппы. Оксигенирова-
цие гемоглобина сопровождается структурными изменениями в окружении гемо-
группы. При оксигенировании атом железа, который в дезоксигемоглобине высту¬
пал на 0,06 нм из плоскости гемового кольца, втягивается в эту плоскость. Вслед
за атомом железа ближе к гему перемещается проксимальный гистидин (F8),
уаюке связанные с ним соседние остатки.
Транспорт двуокиси углерода и буферная емкость крови. Гемоглобин
не только переносит кислород от легких к периферическим тканям, но и ускоряет
транспорт углекислого газа от тканей к легким. Углекислый газ связывается сразу
после высвобождения кислорода; молекулы гемоглобина переносят примерно
15% углекислого газа, присутствующего в крови. Превращение поступающего
из тканей углекислого газа в угольную кислоту катализирует карбоангидраза
эритроцитов. Угольная кислота быстро диссоциирует на бикарбонат-ион и про¬
тон, причем равновесие сдвинуто в сторону диссоциации. Для предотвращения
опасного повышения кислотности крови должна существовать буферная систе¬
ма, способная поглощать избыток протонов. Гемоглобин связывает два протона
на каждые четыре освободившиеся молекулы кислорода, что и определяет буфер¬
ную емкость крови. В легких идет обратный процесс: присоединение кислорода
к дезоксигемоглобину сопровождается высвобождением протонов, которые свя¬
зываются с бикарбонат-ионами, переводя их в угольную кислоту. Далее эффек¬
тивно действующая карбоангидраза катализирует превращение угольной кислоты
в углекислый газ, выдыхаемый из легких.
Таким образом, связывание кислорода гемоглобином тесно сопряжено с выды¬
ханием углекислого газа. Это обратимое явление известно как эффект Бора -
свойство тетрамерного гемоглобина и зависит от гем-гемового взаимодействия.
Молекулярная основа эффекта Бора. Протоны, ответственные за эффект
Бора, высвобождаются в результате разрушения солевых мостиков, которым
сопровождается связывание кислорода с Т-структурой. Эти протоны сдвигают
равновесие в сторону образования угольной кислоты, которая расщепляется кар-
боангидразой с образованием углекислого газа. Наоборот, при высвобождении
кислорода вновь формируется Т-структура с присущими ей солевыми мостиками,
при образовании которых происходит присоединение протонов к остаткам гисти¬
дина в p-цепях. В периферических тканях протоны благоприятствуют образова¬
нию солевых мостиков путем протонирования (по атому азота) концевых остатков
гистидина в р-субъединицах. Образование солевых мостиков форсирует освобож¬
дение кислорода из оксигенированной R-формы гемоглобина. Таким образом,
повышение концентрации протонов способствует освобождению кислорода (сдвиг
кривой диссоциации вправо), а повышение концентрации кислорода стимулирует
высвобождение протонов.
Таким образом, основной критерий выбора заместительной терапии в случае
острой кровопотери — насыщение гемоглобина кислородом. Показанием к гемо¬
трансфузии может стать только снижение сатурации ниже 60%.
Для измерения насыщения артериального гемоглобина кислородом в настоя¬
щее время эффективно используют пульсоксиметр. Прибор измеряет средний про¬
цент насыщения популяции молекул гемоглобина в определенном объеме крови,
т.е. кислородную сатурацию крови. Очень небольшое количество кислорода, рас¬
творенное в плазме крови, пульсоксиметр не выявляет. Оксиметрия - полезный
вид мониторинга кардиореспираторной системы, повышающий безопасность
больного. Во-первых, пульсоксиметр определяет среднее количество кислорода,
связанное с каждой молекулой гемоглобина. Данные выдаются в виде процен¬
144 ОБЩИЕ ВОПРОСЫ ТРАНСФУЗИОЛОГИИ
та насыщения и звукового сигнала, высота которого изменяется в зависимости
от сатурации. Во-вторых, прибор измеряет частоту пульса в среднем за 5-20 с
Сатурация также вычисляется в среднем за 5-20 с. Частота пульса рассчитывается
по числу циклов светодиодов и уверенным пульсирующим сигналам за определен¬
ный промежуток времени. Прибор не дает информации о дыхательном объеме
частоте дыхания или о сердечном выбросе и артериальном давлении. О систоли¬
ческом артериальном давлении можно судить лишь по появлению волны на пле-
тизмограмме при сдувании манжетки для неинвазивного измерения давления.
В «полевых условиях» наилучшим является простой портативный монитор типа
«все в одном», отслеживающий сатурацию, частоту пульса и регулярность ритма.
У критических больных эффективность метода мала, так как перфузия тканей
у них плохая и пульсоксиметр не может определить пульсирующий сигнал. Если
нет видимой пульсовой волны на пульсоксиметре, любой процент сатурации мало-
значим. Возраст, пол, анемия и желтуха практически не влияют на работу пуль-
соксиметра. Альтернативой пульсоксиметрии служит СО-оксиметрия — «золотой
стандарт» и классический метод калибровки пульсоксиметра. СО-оксиметр вычис¬
ляет фактическую концентрацию гемоглобина, деоксигемоглобина, карбоксиге-
моглобина, метгемоглобина в пробе крови, а затем — фактическую кислородную
сатурацию. СО-оксиметры более точны, чем пульсоксиметры (в пределах 1%),
Однако они измеряют сатурацию в определенный момент («снимок»), громоздки,
дороги и требуют забора пробы артериальной крови. Им необходимо постоянное
обслуживание.
Объем кровопотери можно рассчитывать по величинам плотности крови
и гематокрита, или использовать для этого формулу Мооге:
ОКП = ОЦК х (Ht - Htp/Ht,
где ОКП — объем кровопотери; ОЦК — нормальный объем циркулирующей
крови; Ht - нормальный гематокрит, равный 45% для мужчин и 42% для женщин;
Ht. — фактический гематокрит больного.
В этой формуле вместо гематокрита можно использовать показатель концен¬
трации гемоглобина, принимая за его нормальный уровень значение 150 г/л.
Нормальную величину ОЦК рассчитывают, исходя из массы тела пострадавших.
Для женщин он равен 60 мл/кг, для мужчин — 70 мл/кг, для беременных -
75 мл/кг.
С целью восполнения дефицита ОЦК в настоящее время используют программы
компонентной инфузионно-трансфузионной терапии, позволяющие дифферен¬
цированно применять кристаллоидные и коллоидные растворы, кровезамени¬
тели, плазму и компоненты крови. Это снижает опасность посттрансфузионных
осложнений, увеличивает ресурсы трансфузионных сред. При этом выполняются
следующиее главные задачи: восполнение ОЦК, восстановление гемодинамики,
устранение нарушений микроциркуляции за счет вливания коллоидных и кри-
сталлоидных растворов: повышение или восстановление кислородтранспортной
функции крови за счет введения эритроцитной массы.
Купирование острой постгеморрагической анемии наступает через 6-8 нед
после остановки кровотечения, если интенсивная терапия проведена коррек¬
тно. Через 2-3 нед нормализуется значение ретикулоцитарного индекса, через
4-6 нед — число эритроцитов, а затем и концентрация гемоглобина вместе с мор¬
фометрическими параметрами эритроцитов.
Хроническая постгеморрагическая анемия
Такое малокровие возникает вследствие обильных однократных или незначи¬
тельных, но длительно повторяющихся кровотечений. Частный вариант железоде¬
фицитной анемии. Анемия связана с нарастающим дефицитом железа в организме
вследствие длительных кровотечений, причиной которых являются разрывы
КЛЕТОЧНЫЕ ОСНОВЫ ТРАНСФУЗИОЛОГИИ 145
сгенок сосудов (инфильтрация в них опухолевых клеток, венозный застой крови,
страмедуллярное кроветворение, язвенные процессы в стенке желудка, кишеч¬
ника, кожи, подкожной клетчатке), эндокринопатия (дисгормональная аменорея)
нрасстройства гемостаза (нарушение его сосудистого, тромбоцитного. коагуляци¬
онного механизмов при геморрагических диатезах). Приводит к истощению запа¬
сов железа в организме, снижению регенераторной способности костного мозга.
Больные жалуются на слабость, быструю утомляемость, звон или шум в ушах,
головокружение, одышку, сердцебиение даже при незначительной физической
нагрузке. При аускультации выслушиваются так называемые анемические шумы
над областью сердца и яремной веной. В картине крови — гипохромия, микро-
цятоз, низкий цветовой показатель (0,6-0,4), морфологические изменения эри¬
троцитов (анизоцитоз, пойкилоцитоз и полихромазия). Наиболее часто наблю¬
дают бледную окраску эритроцитов с более широкой центральной неокрашенной
частью - гипохромия эритроцитов, которая обусловлена низким насыщением
эритроцита гемоглобином, что обычно характерно для распространенных форм
малокровия, связанных с дефицитом железа (при анемии беременных, при опу¬
холях, сепсисе и других тяжелых инфекциях, заболеваниях желудочно-кишечного
тракта и др.). Эта гипохромия, как правило, сочетается с уменьшением размера
эритроцитов — микроцитозом. Следует иметь в виду, что гипохромию эритро¬
цитов можно наблюдать не только при снижении концентрации гемоглобина
и числа эритроцитов в крови, но и при нормальных количественных показателях.
Регенеративные изменения эритроцитов (нормоциты, нормобласты, ретикулоци¬
ты) при хронической постгеморрагической анемии выражены слабо.
Костный мозг плоских костей обычного вида. В костном мозге трубчатых
костей в той или иной степени наблюдают явления регенерации и превращения
жирового костного мозга в красный. Нередко отмечают множественные очаги
внекостномозгового кроветворения.
В связи с хронической кровопотерей возникает гипоксия тканей и органов,
которая обусловливает развитие жировой дистрофии миокарда («тигровое серд¬
це»), печени, почек, дистрофических изменений в клетках головного мозга.
Появляются множественные точечные кровоизлияния в серозных и слизистых
оболочках, во внутренних органах.
По тяжести течения анемия может быть легкой (содержание гемоглобина
от 110,0 до 90,0 г/л), средней тяжести (от 90,0 до 70,0 г/л) и тяжелой (ниже
70,0 г/л). Число лейкоцитов и тромбоцитов колеблется.
Лечение включает наиболее раннее выявление и устранение причины крово¬
потери, а также восполнение дефицита железа и содержания железа в сыворотке
крови. В тяжелых случаях показано переливание эритроцитной массы под контро¬
лем сатурации гемоглобина.
ЗАКЛЮЧЕНИЕ
Таким образом, морфология клеток крови была и остается «золотым стан¬
дартом» гематологии. В то же время исследования на клеточном уровне могут
выявить адаптационные и компенсаторные изменения обменных процессов в тех
случаях, когда клетки морфологически не меняются. В этом смысле одним из пер¬
спективных направлений трансфузиологии как науки должно стать планомерное
изучение гемопоэза, и в частности эритроцитопоэза, исследование морфологиче¬
ских особенностей клеток красного ряда, анализа ферментных систем в клетках
крови. Все это послужит основанием научно обоснованной заготовки компонентов
крови, а также проведения коррекции трасфузионных мероприятий.
СПИСОК ЛИТЕРАТУРЫ
Гольдберг Е.Д., Дыгай А.М., Зюзиков Г.Н. Гипоксия и система крови. — Томск: Изд-
во Томского университета. — 2006. — 142 с.
141 Общие ВОПРОСЫ ТМНСФУЭИОЛОГИИ
Дворецкий Л.И. Анемии: стратегия и тактика диагностического поиска. Справочник
поликлинического врача. - М., 2002. — №6. — С. 5-10.
Долгов В.В.. Луговская С.А., Морозова В.Т., Почтарь М.Е. Лабораторная диагностик
анемии - Тверь: Губернская медицина, 2001. - 84 с.
Клетки крови и костного мозга / Под ред. Г.И. Козинца. - М.: Медицинское информаци¬
онное агентство. 2004. - 202 с.
Козинец Г.И. Анализы крови и мочи (клиническое значение). — М.: Практическая меди¬
цина. 2008. - 160 с.
Козинец Г.И. Физиологические системы организма человека, основные показатели
(справочное пособие). - М.: Триада-Х, 2000. - 336 с.
Козинец Г.И.. Погорелов В.М., Шмаров Д.А. и др. Клетки крови — современные техноло¬
гии их анализа. - М.: Триада-Х, 2002. - 535 с.
Козинец Г.И., Попова О.В., Будник М.И. и др. Электрический заряд клеток крови. - м.:
Практическая медицина, 2007. - 208 с.
Козинец Г.И., Сарычева Т.Г., Луговская С.А. и др. Гематологический атлас. Настольная
книга врача-лаборанта. - М.: Практическая медицина, 2008. — 187 с.
Коленкин С.М. Клинико-диагностическое значение показателей автоматизированного
исследования ретикулоцитов: Автореф. дис.... канд. мед. наук. — 2004. — 23 с.
Кольцова Г.Н., Гладун В.В., Смирнов И.В. Колориметрический метод определения желе¬
за в сыворотке крови. Материалы научно-практической конференции «Актуальные вопросы
гематологии и трансфузиологии*. Санкт-Петербург, 6-8 июня 2000 г. — С. 169.
Левина А.А., Цветаева Н.В.. Колошейнова Т.Н. Клинические, биохимические и социальные
аспекты железодефицитной анемии. // Гематол. и трансфузиол. — 2001. — №3. —С. 51-55.
Лисовская И.Л. Популяционные характеристики эритроцитов в норме и патологии:
фильтрационно-осмотические методы исследования деформируемости: Автореф. дис. ...
д-ра мед. наук. — 2004. - 40 с.
Луговская С.А.. Почтарь М.Е. Гематологический атлас. — М.: Триада, 2004. — 227 с.
Малахов В.Н., Меньшиков В.В., Заикин Е.В. и др. Федеральная система внешней оценки
качества клинических лабораторных исследований (лекция) // Клин.-лаб. диагностика. -
2002. 8 N»7. - С. 21-36.
Метод определения витамина В]2 и фолиевой кислоты: методические рекомендации
(составители: Н.Д. Хорошко, А.А. Левина, Н.В. Цветаева и др.). — М., 2002. — 26 с.
Одинаева Н.Д. Объемный транспорт кислорода у новорожденных с гипотрофией
при неосложненном течении раннего неонатального периода // Мед. научно- и учебно¬
методический журнал. - 2001. — №3. - С. 65-70.
Погорелов В.М., Козинец Г.И. Анемия, гипоксия, гемотрансфузии. — СПб.: Абрис+,
2005. - 183 с.
Погорелов В.М., Козинец Г.И. Диагностическая значимость морфологических особен¬
ностей эритроцитов в мазках периферической крови. // Гематол. и трансфузиол. — 2005. —
N*5. - С. 13-17.
Погорелов В.М., Козинец Г.И. Эритропоэз. Синтез и структура гемоглобина. — В кн.:
«Очерки по производственной и клинической трансфузиологии» (Под редакцией акад.
А.И. Воробьева). - М.: Ньюдиамед, 2006. — С. 306-329.
Погорелов В.М., Козинец Г.И., Дягилева О.А., Проценко Д.Д. Цветной атлас клеток
системы крови. Один источник и четыре составные части миелопоэза. — М.: Практическая
медицина, 2007. - 176 с.
Практическая трансфузиология / Под ред. Г.И. Козинца. — М.: Практическая медици¬
на. I 2005. - 543 с.
Приказ N*363 от 25 ноября 2002 «Об утверждении инструкции по применению компо¬
нентов крови». - М.: 2002. - 77 с.
Сарычева Т.Г. Морфофункциональная характеристика эритрона при гематологических
заболеваниях и хронической почечной недостаточности: Автореф. дис.... д-ра мед. наук. —
2000. - 38 с.
Точенов А.В. Патофизиологическое обоснование и оптимизация трансфузионных про¬
грамм лечения острой кровопотери у хирургических больных: Автореф. дис. ... д-ра мед.
наук. — 2000. — 38 с.
Фаллух А. Показатели феррокинетики и некоторых гемопоэтических факторов при дефи¬
ците железа и инфекционных заболеваниях у детей раннего возраста: Автореф. дис.... канд.
мед. наук. I 2001. - 30 с.
РАЗДЕЛ II
СЛУЖБА КРОВИ
Глава 6. Служба крови - структура,
деятельность и современное состояние
Глава 7. Организация работы учреждений
Службы крови
Глава 8. Служба крови в очагах, эндемичных
по наследственным аномалиям крови
Глава 9. Основные полимерные изделия
для нужд Службы крови
Глава 10. Методы карантинизации
и инактивации патогенов в компонентах крови
Глава 11. Получение гемопоэтических
стволовых клеток периферической крови
Глава 12. Гемобезопасность (
Глава 13. Организация выполнения процедур
трансфузиологической гемокоррекции.
Отделение трансфузиологии и его задачи
в многопрофильной клинике
Глава 6
Служба крови - структура,
деятельность и современное
состояние
Служба крови — раздел трансфузионной медицины, изучающий
и реализующий на практике заготовку, сертификацию, перера¬
ботку, хранение, распределение и транспортировку компонентов,
отдельных препаратов и реагентов из донорской крови и обеспечи¬
вающий безопасность этих процессов.
Службу крови рассматривают как самостоятельную отрасль транс¬
фузионной медицины, имеющую важнейшее значение как для кли¬
нической медицины, так и для производственной трансфузиологии.
Законом Российской Федерации от 9 июня 1993 г. №5142-1
«О донорстве крови и ее компонентов» впервые введено следующее
определение Службы крови: «Служба крови система самостоя¬
тельных государственных организаций здравоохранения, а также
входящих в состав государственных и муниципальных организа¬
ций здравоохранения структур (отделений переливания крови),
деятельность которых в соответствии с положениями настоящего
Закона направлена на осуществление заготовки, переработки, хра¬
нения крови и ее компонентов».
Федеральным законом от 29 декабря 2006 г. №258 «О внесе¬
нии изменений в отдельные законодательные акты Российской
Федерации в связи с совершенствованием разграничения полно¬
мочий» понятие «Служба крови» было исключено и заменено
на «организации здравоохранения, осуществляющие заготовку,
переработку, хранение и обеспечение безопасности донорской
крови и ее компонентов». Отмечено, что эти виды работ осущест¬
вляют государственные организации здравоохранения. В учреди¬
тельных документах таких организаций заготовка, переработка,
хранение и обеспечение безопасности донорской крови и ее ком¬
понентов должны быть указаны в качестве основной деятельности.
Важно, что впервые в этом же законе функции Службы крови
дополнены необходимостью «обеспечения безопасности» заготов¬
ки крови и ее компонентов.
В проекте федерального закона «О донорстве крови и ее ком¬
понентах» (2009) планировалось новое определение: «Служба
крови как система «органов государственной власти Российской
Федерации и субъектов Российской Федерации», как организации
донорства крови и ее компонентов, осуществляющих свою деятель¬
ность в части проведения мероприятий, направленных на орга¬
низацию, развитие и пропаганду донорства крови, установление
и обеспечение мер социальной поддержки донорам крови и ее ком-
І ISO СЛУЖБА КРОВИ
понентов. формирование информационных систем, а также иные мероприятия
направленные на удовлетворение потребности населения в крови, ее компонента
с учетом современных медицинских, научных и технических знаний».
В проекте федерального закона, планируемого к рассмотрению в 2012 г
«О донорстве крови И ее компонентов» сформулировано определение Службу
крови (см. Введение).
В России к организациям донорства крови и ее компонентов относят государ,
ственные организации здравоохранения, а также их структурные подразделения
структурные подразделения государственных научных и образовательных органи¬
заций, структурные подразделения организаций федеральных органов исполни¬
тельной власти, где законодательно предусмотрена военная и (или) приравненная
к ней служба, структурные подразделения муниципальных организаций здраво¬
охранения, созданные не позднее 1 января 2006 г., осуществляющие заготовку,
хранение, транспортировку донорской крови и ее компонентов.
Несмотря на то что понятие «Служба крови» некоторое время было исключено
из федерального закона, трансфузиологи, терапевты, хирурги, гинекологи, трав¬
матологи и другие специалисты продолжают использовать этот традиционный
термин. Далее по тексту будет встречаться именно этот термин, а также определе¬
ние, данное в начале настоящего раздела.
Основные задачи Службы крови:
• агитация и пропаганда донорства (при участии и содействии общественных
организаций, в первую очередь, Красного Креста и Красного Полумесяца);
• заготовка донорской крови и ее компонентов;
• совершенствование методов консервирования, переработки и хранения
крови, ее компонентов и костного мозга;
• разработка и внедрение методов и технологий, направленных на повышение
безопасности заготавливаемых компонентов крови доноров (карантиниза-
ция, инактивация и другие):
• вопросы организации Службы крови в системе здравоохранения:
• определение потребностей лечебных учреждений в трансфузионных средах
и оборудовании для обеспечения трансфузионного пособия;
• сбор, хранение и распределение стволовых клеток костного мозга, перифери¬
ческой и пуповинной крови;
• обеспечение гарантированного качества донорской крови и ее компонен¬
тов — соответствие донорской крови и ее компонентов установленным тре¬
бованиям;
І обеспечение безопасности донорской крови и ее компонентов на всех этапах
от отбора доноров крови, заготовки, переработки, хранения и доставки;
• организация необходимых мероприятий с целью обеспечения контроля
донорской крови и ее компонентов — возможность идентификации доно¬
ра и реципиента донорской крови и ее компонентов, а также результатов
исследований на этапах заготовки, переработки, хранения, транспортировки,
клинического использования и утилизации при помощи регистрации органи¬
зациями донорства крови и ее компонентов и иными медицинскими органи¬
зациями соответствующих данных в учетных формах.
Для выполнения этих задач в учреждениях и подразделениях специалисты
Службы крови совместно с общественными организациями и медицинскими
работниками организуют отбор и освидетельствование доноров крови, заготовку,
переработку, сертификацию, хранение, транспортировку донорской крови и ее
компонентов, а также распределение компонентов крови в клинические подраз¬
деления или в переработку на препараты крови.
Формирование донорских кадров - первичная и главная задача в работе
учреждений Службы крови. Сегодня проблема донорства вышла за пределы меди-
СЛУЖБА КРОВИ — СТРУКТУРА, ДЕЯТЕЛЬНОСТЬ И СОВРЕМЕННОЕ СОСТОЯНИЕ 151
цинской и стала общесоциальной. Помимо практического значения, донорское
движение играет особую роль в жизни общества, воспитывая в человеке важные
моральные качества: альтруизм, отзывчивость, готовность к пожертвованию.
В тех случаях, когда серьезной альтернативы донорской крови и ее компо¬
нентам не найдено, появляется потребность в продуктах крови. В развиваю¬
щихся странах она удовлетворяется на 40-60%, тогда как в развитых странах —
на 80-90%. Из 80 стран с низкими показателями наличия донорской крови
(менее 10 случаев донорства на тысячу человек) 79 стран относятся к развиваю¬
щимся. В развивающихся странах большую часть крови получают от платных
доноров. В развитых регионах, таких как США и Европа, основное количество
крови сдают безвозмездные доноры. За год в развитых странах переливается
около 60-70 млн доз крови и ее компонентов. Только в США почти 2% населе¬
ния получают трансфузии крови ежегодно, а около 15% имели в анамнезе эпизо¬
ды применения гемотерапии.
В большинстве стран доноры сдают кровь по 400-500 мл в среднем 1,5 раза в год.
для удовлетворения потребности в эритроцитах и других клеточных компонентах
крови необходимо 40-60 кроводач в год на 1000 человек (донация, или кровода-
ча, - процесс взятия донорской крови либо ее компонентов, предназначенных
для переливания реципиенту или другого использования в медицинских, научно-
исследовательских либо образовательных целях). Этого уровня достаточно также
для обеспечения клинических потребностей в альбумине, иммуноглобулине и пре¬
паратах, содержащих факторы свертываемости.
Несмотря на все достижения современной медицины, развитие бескровной
хирургии и широкое применение комплексной инфузионной терапии, потреб¬
ность в компонентах и препаратах крови каждый год увеличивается.
Следует также отметить развитие биотехнологий по получению ряда препаратов
крови. Приоритетные разработки западных специалистов касаются освоения про¬
мышленного выпуска VIII и IX факторов свертывания и ряда других препаратов.
Служба крови и донорство крови в Российской Федерации
СССР — одна из первых стран в мире, где в середине прошлого века была
организована стройная система, названная позднее Службой крови, обеспечи¬
вающая потребности клинической медицины в донорской крови и ее компонентах
как в мирное, так и в военное время.
В России Служба крови представлена станциями переливания крови (СПК),
Центрами крови, отделениями и кабинетами переливания крови в лечебных
учреждениях и центрами плазмафереза. Основная задача учреждений Службы
крови — заготовка, переработка, хранение и распределение компонентов донор¬
ской крови для клинических нужд и заготовка компонентов (в основном плазмы)
для переработки на препараты и реагенты.
В России, по данным за 2007 г., заготовку крови, производство компонентов
и препаратов осуществляли 170 СПК, 584 отделения переливания крови и 114
кабинетов переливания крови. Количество СПК по сравнению с 2006 г. умень¬
шилось на 12 вследствие преобразования их в филиалы региональных СПК,
число отделений переливания крови — на 161, число больниц, заготавливающих
кровь, - на 49.
В Российской Федерации к 2010 г. функционировало только 135 СПК и Центров
крови, 446 ОПК и 88 больниц, заготавливающих кровь. Только в 2010 г. 11 СПК
было закрыто или трансформировано в филиалы региональных станций перели¬
вания крови.
С каждым годом снижается число доноров крови и ее компонентов. Общее
число доноров в 2010 г. по сравнению с 2009 г. снизилось на 8,1% (155 514 чело¬
152 СЛУЖБА КРОВИ
век), уменьшилось число платных доноров — на 11% (18 548 человек), безвоз
мездных — на 7.9% (136 966 человек), а также количество первичных доноров
на 10.5% (75 731 человек). При этом потребность учреждений здравоохранения
я компонентах и препаратах крови растет из года в год, что связано с увеличением
количества высокотехнологических оперативных вмешательств, лечебных мани¬
пуляций и осложненных родов.
Ниже представлен анализ состояния Службы крови в 5-й период с 2004 по 2007 г
Обшее число доноров крови в 2007 г. составляло 1 800 995, а общее число кро-
водач — 2 367 513, т.е. менее двух кроводач в год на одного донора. По сравнению
с 2006 г. количество доноров уменьшилось на 0,1% (на 19 624 человека), а общее
чисто кроводач уменьшилось на 1,9% (на 46 376 населения), из них количество
безвозмездных доноров уменьшилось на 0,4%. Количество доноров на 1000
населения составило всего 12,7 человека (в 2006 г. — 12,8 человека). Несмотря
на снижение количества доноров, объем заготовленной цельной крови в 2007 г.
превысил показатель 2006 г. на 5,4% и составил 173 293 515 л. Кроме того, сред¬
няя разовая доза, полученная от безвозмездных доноров (доза крови или ее ком¬
понентов — донорская кровь или ее компоненты, полученные от одного донора
в процессе одной донации), увеличилась на 2,1% (2006 г. — 421 мл, 2007 г. -
430 мл). В 2007 г. по сравнению с 2006 г. возросло число доноров плазмы и иммун¬
ных доноров (на 8.1 и 10,3% соответственно) — об этом свидетельствуют данные
Российского НИИ гематологии и трансфузиологии из аналитической справки
о деятельности Службы крови России в 2007 г. (табл. 6-1).
Таблица 6-1. Динамика показателей развития донорства и заготовки крови в России в 2004-2007 гг.
Показатель
Годы
2004
2005
2006
2007
2007/2006,7.
Общее число доноров
2 031 747
1 939 593
1 802 957
1 800 995
99,9
Число платных доноров
331 961
256 224
224 074
190166
84,7
Число безвозмездных донорое
1 699 786
1 684 309
1 578 883
1 611 529
102,06
Из этого числа:
первичных доноров
746 403
689 237
643 051
674 880
104,95
доноров плазмы
200 818
222 663
236 572
255 678
108,1
иммунных доноров
15 868
16 831
15 403
16 986
110,3
изоиммунных доноров
793
643
579
513
88,6
доноров клеток крови
8 413
7 063
10 067
17 025
169,1
Общее число кроводач (без учета
ллазмодач)
2 774 947
2 654 877
2 413 889
2 367 513
98,1
Из них безвозмездных
2 345 564
2 251 157
2 104 212
2 112 568
100,4
Общее число плазмодач
864 581
909 477
945 984
1 032 828
109,2
Из них безвозмездных
543 281
630 124
668 772
760 146
113,7
Заготовлено цельной донорской
крови, л
1 661 503
1 674 309
1 643 534,4
1 732 935,5
105,4
В том числе от безвозмездных доно¬
ров, л
1 237 676
1 278 713
1 282 178,7
1 370 884,5
106,9
Средняя разовая доза крови от без¬
возмездного донора, мл
398,2
408,0
421,0
430,0
102,1
Число доноров на 1000 населения
14,5
13,7
12,8
12,7
99,2
Как видно из табл. 6-1, общее число донаций плазмы увеличилось на 9,2%, в том
числе безвозмездных на 0,4%. В пластиковую тару было заготовлено 98,5% объема
крови (нужно отметить, что в 71 регионе из 80 используют только пластиковую
тару). На СПК было заготовлено 80,3% всей крови, в ОПК — 19,6%, в больницах -
0,1% (табл. 6-2). Абсолютный брак консервированной крови составил 4,1%.
СЛУЖБА КРОВИ — СТРУКТУРА. ДЕЯТЕЛЬНОСТЬ И СОВРЕМЕННОЕ СОСТОЯНИЕ 1 S3
аблица в-2* Производство консервированной крови и ее компонентов в Российской Федерации
2004-2007 гг.
Годы
2004
2005
200«
2007
2007/200«. % :
рт'йрвированная кровь, л
1 875 170
1 892 840
1 859 827
1 947 271
104,7
чритооцитная масса, л
296 997
286 483
261 471,6
261 001,9
99.8
■зямпооженная эритроцитная масса, дозы
51 937
57 985
66 547
66165
129
Эрйтроцитная масса, обедненная лейкоци¬
ти и тромбоцитами, дозы
120 423
116138
126 995
133 217,6
105
чрктиоцитная взвесь, л
21 086
38184
54 265,2
61 842.8
114
йшвнтрат тромбоцитов, дозы
223 010
254 670
265 250
392 164
148
пвйкоиитная масса, дозы
36 202
35148
23 257
46 746
201
нативная плазма (замороженная), л
58 294
44 504
27 275
15 089,3
55,3
сухая плазма, л
3 565
2 534
858
562,1
65.5
Нативная концентрированная плазма, дозы
60 348
50 292
27 275
2 9041
106,4
Свежезамороженная плазма, л
456 540
476 664
476 509,6
506 091,1
106
Гипериммунная антистафилококковая
плазма, л
9 333
8 845
7 817,7
7 522,4
96
Сравнительные данные о деятельности Службы крови России за 2006-2007 гг. при¬
ведены в табл. 6-3.
Таблица 6-3. Расчетные показатели деятельности Службы крови России в 2006-2007 гг.
№
Показатель
2006 г.
2007 г. |
1.
Обеспеченность кадрами, %
95,3
95.1 |
2.
Занятость сотрудников в заготовке крови, производстве препаратов, %
705,7
705,8
3.
Структура донорских кадров, %
щ
Платные доноры
12,4
10.5 J
Безвозмездные доноры
87,6
89,5 ]
Первичные
35,6
37,6 J
Доноры плазмы
13,1
14,2 j
Иммунные
0.8
0.8
Доноры клеток крови
0,5
0.9
4.
Количество доноров на 1000 населения, %
12,7
12.5
5.
Количество первичных доноров на 1000 населения, %
4,5
4,7
6.
Заготовлено цельной крови на 1 жителя, мл
11,6
11,9 |
7.
Заготовлено консервированной крови на 1 койку, мл
1350.0
1422,6
8.
Заготовлено крови от безвозмездных доноров, %
78,0
79.7
9.
Заготовлено крови от платных доноров, %
22.0
20,3
10.
Кратность безвозмездных кроводач от 1 донора в год, шт.
1.3
1,3
11.
Кратность плазмодач от 1 донора ПФ в год, шт.
3.9
4,0
12.
Объем одной безвозмездной кроводачи, мл
421,0
429
13.
Объем одной плазмодачи, мл
351.0
358 І
14.
Заготовлено плазмы методом плазмафереза, %
38.3
41.3
15.
Израсходовано консервированной крови на компоненты, препараты, стан¬
дартные сыворотки, %
95,0
94.9 I
16.
Абсолютный брак консервированной крови, %
4,0
4.1 |
17.
выдано в лечебно-профилактические учреждения (ЛПУ) на переливание кон¬
сервированной крови,%
0.2
0.14 j
154
СЛУЖБА КРОВИ
1 *
Показатель
2006 г.
20077
11ft.
Израсходовано форменных элементов на: компоненты, %, препараты (инфу-
замнн*), %
62,0
0,2
66,4
0,02
19.
Израсходовано плазмы на компоненты. %,
препараты. %
47.2
12.3
44Л
—Hi
20.
Выход альбумина из 1 л плазмы, мл
211,0
220,2
21.
Соотношение объемов консервированной крови и эритроцитсодержащих
сред, переданных в ЛПУ
1:80
1:126
Служба крови как в России, так и в большинстве стран мира, представлена
Центрами крови (или СПК), плазмоцентрами, отделениями и кабинетами пере¬
ливания крови в лечебных учреждениях.
К организациям Службы крови (донорства крови и ее компонентов) относят:
• государственные организации здравоохранения и их структурные подраз¬
деления;
• структурные подразделения государственных научных и образовательных
организаций;
• структурные подразделения организаций федеральных органов исполни¬
тельной власти, где законодательно предусмотрена военная и (или) прирав¬
ненная к ней служба;
І структурные подразделения муниципальных организаций здравоохране¬
ния, созданные не позднее 1 января 2006 г. (проект Федерального закона
«О донорстве крови и ее компонентах», 2009).
Одна из главных составляющих системы организации донорства крови - пер¬
манентная и разносторонняя агитация и пропаганда донорства крови и ее ком¬
понентов, распространение и разъяснение в обществе информации о социальной
значимости донорства с целью привлечения потенциальных доноров к сдаче
крови и ее компонентов.
Российское общество Красного Креста и Красного Полумесяца, другие орга¬
низации, учредительными документами которых предусмотрено оказание содей¬
ствия охране здоровья населения, участвуют совместно с органами государ¬
ственного управления здравоохранением в организации донорства крови и ее
компонентов, в пропаганде среди населения безвозмездной добровольной сдачи
крови и ее компонентов для лечебных целей, а также могут принимать участие
в их поддержке.
Служба крови и донорство крови за рубежом
Служба крови стран Европейского Союза имеет в своем активе около 12 млн
доноров. Ежегодно в связи с уходом доноров-ветеранов необходимо пополнение
в 1-2 млн человек. США и ряд европейских стран имеют дополнительные источ¬
ники получения компонентов крови, преимущественно плазмы, доставляя ее
из других стран.
Традиционно высока донорская активность в Швейцарии — 90 доноров на 1000
населения, Дании - 83, Франции — 70, Бельгии — 68. В Болгарии, Португалии,
Польше и других странах этот показатель существенно ниже.
В Западной Европе и Северной Америке Служба крови включает следующие
учреждения.
• Общественный Банк крови (Community Blood Bank) — некоммерческое учреж¬
дение, обеспечивает заготовку, обследование и хранение крови для исполь¬
зования в лечебных учреждениях конкретного населенного пункта или реги¬
она. Эти центры чаще всего используют специальный транспорт для взятия
крови у добровольных доноров в выездных условиях (мобильные бригады)-
Практикуется взаимообмен кровью с другими регионами.
СЛУЖБА КРОВИ — СТРУКТУРА, ДЕЯТЕЛЬНОСТЬ И СОВРЕМЕННОЕ СОСТОЯНИЕ 155
• Центр крови (Blood Center) — некоммерческая организация, заготавливаю¬
щая кровь и компоненты, обследующая доноров и кровь. Принимает кровь
на обследование и хранение из общественных Банков крови. Обеспечивает
кровью лечебные учреждения региона.
• Госпитальный Банк крови (Hospital Blood Bank) — аналог российского
Отделения переливания крови. Обеспечивает заготовку крови от доноров -
родственников, аутокрови, прямые переливания крови. В основном обеспе¬
чивается донорской кровью региональными банками и центрами крови.
• Армейский Банк крови (Military Blood Bank) - некоммерческий центр
заготовки крови от военнослужащих для пациентов военных госпиталей.
К донорству также привлекаются гражданский персонал, военные пенсионе¬
ры и члены семей больных.
• Коммерческий центр крови и плазмы (Profit Collection Center), заготавливаю¬
щий донорскую кровь и плазму для продажи лечебным учреждениям, науч¬
ным институтам и фармацевтическим предприятиям.
В 1989 г. Совет Европейского союза (ЕС) принял программу по самообес¬
печению продуктами крови. Целью программы было устранение имеющегося
дефицита плазмы и снижение ее импорта из США. Отмечалось, что в странах ЕС
потребность в клеточных продуктах крови практически удовлетворена, в то время
как дефицит плазмы составлял более 3,5 млн л. В начале 1994 г. для достижения
самообеспечения плазмой была принята программа развития плазмафереза.
Заготовку плазмы и препаратов крови в ЕС осуществляют учреждения, находя¬
щиеся под контролем государства или общественных организаций, а также при¬
надлежащие коммерческим организациям или частным лицам. Координационные
вопросы, связанные с обеспечением общего рыночного пространства для плазмы,
получаемых препаратов и взаимодействия центров плазмафереза в странах ЕС
курирует European Plasma Collection Committee.
Большое значение придается вопросам обеспечения безопасности и получения
плазмы требуемого качества. Технология заготовки плазмы регламентирована
официальными национальными и международными документами. Изданы реко¬
мендации Всемирной организации здравоохранения (ВОЗ), действуют законода¬
тельные акты ЕС и Фармакопейный стандарт ЕС.
Следует обратить внимание на требование Фармакопеи ЕС и Спецификации
качества ведущих производств к максимальному удалению из исходной плаз¬
мы клеток крови, что обеспечивается широким внедрением гравитационного
и фильтрационного плазмафереза. Для получения же плазмы из цельной крови
необходимо во время кроводачи применять специальные фильтры. Этот критерий
качества плазмы для фракционирования пока не принимается во внимание всеми
отечественными производителями препаратов крови.
Наряду с увеличением объемов заготовки плазмы методом плазмафереза
важнейшая задача в странах ЕС — обеспечение вирусной безопасности плазмы.
Внедряются новые высокочувствительные методы лабораторного тестирования,
карантинизация плазмы. Все большее распространение получают методы инакти¬
вации крови и ее компонентов, что минимизирует риск заражения реципиентов.
Приведем два примера эффективной работы учреждений Службы крови
Красного Креста Финляндии и Ассоциации крупнейших коммерческих произво¬
дителей препаратов крови — РРТА (Plasma Protein Therapeutics Association).
В Финляндии — стране с населением 5 млн жителей — 23 донорских центра.
В год осуществляется 315 ООО кроводач. Нужно отметить, что в Финляндии всего
1 центр обследования и переработки крови. Наиболее удаленный донорский пункт
находится в 1250 км от центра крови (Хельсинки). Ежедневно заготовленную
кровь в термоконтейнерах с помощью транспортных компаний отправляют в цен¬
тры переработки крови. Обследование и переработку начинают в 6.00 следующего
156 СЛУЖБА КРОВИ
дня. К 12.00 заканчивают производство гемокомпонентов и получение результат
иммуноферментного анализа. К 14.00 получают результаты NAT-тестирования
после чего компоненты крови могут быть выданы в клинику.
США (РРТА): в стране 400 центров плазмафереза, в год выполняется 12 ООО ООО
донаций. Всю донорскую кровь обследуют в 15 диагностических лабораториях
Деятельность центров сбора плазмы РРТА находится под жестким контролем
государства и фактически представляет собой образец клинически грамотной и эко¬
номически обоснованной системы донорских пунктов. Донорство в этих центрах
осуществляется на платной основе. Стоимость одной процедуры 9-20 долл. СЩд
Для выхода учреждений Службы крови России на показатели, соответствующие
международной практике и стандартам, необходимо довести общее количество доно¬
ров крови до 7 млн человек (5% населения). Из них доноры крови должны составлять
5 млн человек (при расчете числа доноров учитывают их возможный отвод, который
может составлять 30% общего числа), доноры аутокрови — 1 млн человек, доноры
плазмы — 0,6 млн человек; доноры тромбоцитов — 0,4 млн человек.
При наличии указанного числа доноров (табл. 6-4) возможно получение
необходимого количества качественных компонентов и препаратов крови: 7 млн
доз эритроцитной массы, освобожденной от лейкоцитов, 0,3 млн лечебных ДОЗ
тромбоцитной массы, получаемой аппаратными методами от одного донора,
360 т свежезаготовленной освобожденной от лейкоцитов карантинизированной
или вирус-инактивированной плазмы, 1200 т стандартной плазмы, освобожден¬
ной от лейкоцитов и тромбоцитов для переработки на препараты, что позволит
выпускать достаточное количество альбумина — 30 000 кг, 300 млн ME VIII и 37,5
млн ME IX факторов свертывания. 1 млн доноров аутокрови (больных людей)
позволит на 15% уменьшить потребность в донорской крови.
Таблица 6-4. Потребность здравоохранения в компонентах и препаратах крови
Компоненты крови
Международные нормы на 1000 населения
Потребность России
Эритроцитная масса, дозы
47,9
7,2 млн
Тромбоцитная масса, дозы
1,8
0,3 млн
Плазма для клинических целей, л
2,4
360 тыс.
Альбумин, кг
0,2
30 тыс.
VIII фактор, ME
2000
300 млн
IX фактор, ME
250
37,5 млн
Таким образом, Служба крови в России на 15-20 лет отстает в своем развитии
от ведущих западных стран. В настоящее время предложены следующие способы
совершенствования работы Службы крови в России:
• создание новой, прогрессивной законодательной нормативно-правовой базы
организации и работы учреждений Службы крови;
І структурная перестройка и повышение экономической эффективности работы
учреждений Службы крови;
• стандартизация процессов путем разработки и внедрения отраслевых стан¬
дартов Службы крови;
• становление отечественной индустрии Службы крови;
• расширение источников финансирования и привлечения новых хозяйствую¬
щих субъектов.
Доноры крови
Донор (от лат. donore — давать, дарить) — человек, добровольно дающий
кровь, костный мозг, ткани или органы для их применения с лечебной целью.
Наибольшее распространение имеет донорство крови и ее компонентов. Донор
СЛУЖБА КРОВИ — СТРУКТУРА, ДЕЯТЕЛЬНОСТЬ И СОВРЕМЕННОЕ СОСТОЯНИЕ 157 Щ
крови — лицо, прошедшее медицинское обследование и добровольно сдающее
кровь или ее компоненты. Донорство крови и ее компонентов — свободно выра¬
женный добровольный акт. В зависимости от того, что дают доноры, различают
донорство крови, плазмы, клеток крови, клеток костного мозга, органов и тканей,
донорство крови и ее компонентов — комплекс мероприятий, направленных
на организацию безопасной заготовки крови и ее компонентов. Кровь и ее компо¬
ненты, применяемые в лечебных целях, могут быть получены только от человека.
Взятие от донора крови и ее компонентов допустимо только при условии, что здо¬
ровью донора не будет причинен вред.
Донорство крови в России осуществляется на основании закона Российской
федерации №5142-1 от 9 июня 1993 г. «О донорстве крови и ее компонентов»,
устанавливающего комплекс социальных, правовых, медицинских и экономиче¬
ских мер по организации донорства и защите прав доноров.
Ниже перечислены основные принципы донорства крови и ее компонентов
(согласно проекту федерального закона «О донорстве крови и ее компонентах»,
2009):
• развитие добровольного безвозмездного донорства;
• добровольное информированное согласие донора и реципиента;
• использование донорской крови и ее компонентов по обоснованным пока¬
заниям;
• обследование каждой дозы крови на инфекции, риск передачи которых суще¬
ствует при переливании крови;
• прослеживаемость донорской крови и ее компонентов;
• рациональное клиническое использование донорской крови и ее компонен¬
тов.
Отбор и обследование доноров крови и ее компонентов осуществляется в соот¬
ветствии с приказом Министерства здравоохранения Российской Федерации от
14 сентября 2001 г. №364 «Об утверждении Порядка медицинского обсле¬
дования донора крови и ее компонентов» и дополнений к нему и приказом
Минздравсоцразвития от 6 июня 2008 г. №261. В соответствии с этими докумен¬
тами донором может быть каждый дееспособный гражданин России, достигший
совершеннолетия и прошедший медицинское обследование.
Заготовка донорской крови и ее компонентов — совокупность процедур меди¬
цинского обследования лица, добровольно сдающего кровь, взятия, исследования,
переработки и создания запасов донорской крови и ее компонентов (согласно
закону РФ №5142-1 от 9 июня 1993 г. «О донорстве крови и ее компонентов»).
Донорская кровь — кровь, взятая от донора и предназначенная для клиниче¬
ского использования, производства лекарственных средств или использования
в научно-исследовательских и образовательных целях.
В зависимости от периодичности сдачи крови и ее компонентов доноров под¬
разделяют на следующие категории;
• активные (кадровые) доноры, имеющие 3 и более крово-, плазмо- или цито¬
дач в год;
• доноры резерва, имеющие менее 3 крово-, плазмо- или цитодач в году.
В зависимости от мотивации к донорству крови различают три группы доноров:
• безвозмездные;
• платные;
• доноры родственники.
Безвозмездные доноры (доноры резерва) — сдающие кровь в соответствии
со своей гражданской позицией и чувством социальной ответственности и не полу¬
чающие при этом никаких материальных выгод.
По определению Совета Европы и Европейского союза, безвозмездный донор —
Эт° человек, который ничего не получает за сдачу крови: ни дней отдыха, ни денег,
158 СЛУЖБА КРОВИ
ни каких-либо ценных материальных благ. За сдачу крови безвозмездный донор
может получить только небольшой завтрак или сувениры.
В соответствии с принципами Всемирной организации здравоохранения. Между,
народного общества переливания крови и «Кодекса этики донорства и перелива¬
ния крови* основной мотивацией доноров крови должна быть помощь ближнему.
Международным сообществом приветствуется только безвозмездное донорство.
В России практика безвозмездного донорства появилась в 1919 г., когда впер¬
вые стали проводить научно обоснованное переливание крови.
В связи с широким внедрением метода переливания крови во многие отрасли
медицины потребность в донорской крови продолжала увеличиваться и в после¬
военные годы. Прежние формы заготовки крови от ограниченного числа кадровых
доноров не удовлетворяли потребности, предъявляемые Службе крови лечебными
учреждениями.
В 1957 г. в Москве и Ленинграде среди членов Общества Красного Креста поя¬
вились энтузиасты, которые предложили безвозмездно отдавать свою кровь для
лечения больных. Вскоре на заводах, фабриках, в учебных заведениях стали
появляться целые группы людей, выражавших желание давать кровь безвозмезд¬
но. В дальнейшем это движение распространилось в других городах и регионах.
В течение 2-3 лет безвозмездное донорство стало массовым и постоянным явле¬
нием, что позволило заготавливать кровь для лечебных целей в основном за счет
этой категории доноров. К безвозмездной даче крови привлекались организован¬
ные контингенты людей, взятие крови у которых проводилось по месту их работы
или учебы специальными выездными бригадами учреждений Службы крови.
В настоящее время Службы крови ориентированы на создание контингента
активных (кадровых) доноров, сдающих кровь на безвозмездной основе.
Следует отметить, что в последние годы основное число безвозмездных доноров
составляют лица, дающие кровь повторно не только на протяжении нескольких
лет, но и в течение одного года. Однако для значительного расширения этого
вида донорства необходимо привлечение всего здорового населения к даче крови
для полного обеспечения лечебных учреждений компонентами и препаратами
крови. Для того чтобы донорство стало гражданским долгом каждого здоро¬
вого члена нашего общества, необходима широкая его пропаганда, в которой
должны принимать активное участие все медицинские работники. Так же как в
1950-х годах, проблему обеспечения лечебных учреждений кровью помогло
решить развитие безвозмездного донорства, и в настоящее время для восполнения
дефицита в компонентах и препаратах крови требуется привлечение возможно
большего количества людей, сдающих кровь безвозмездно.
Показано, что для полного удовлетворения больниц в компонентах и препа¬
ратах крови необходимо участие в донорстве минимум 5% населения при усло¬
вии дачи крови в количестве не менее 450 мл. Такой уровень участия населения
в донорстве достигнут во всех экономически развитых странах. В нашей стране,
к сожалению, степень развития донорства не соответствует этим требованиям,
более того, с конца 1970-х годов отмечен заметный спад активности донорских
кадров. Очевидно, что постоянно увеличивающаяся потребность в компонентах
и препаратах крови не может быть удовлетворена только за счет платного донор¬
ства. Для увеличения количества желающих стать донорами необходимы агитация
и пропаганда безвозмездного донорства крови среди населения.
Платные доноры — сдающие кровь за материальное вознаграждение с установ¬
ленной оплатой за процедуру кроводачи.
Кадровое донорство в нашей стране сложилось в 1930-х годах, вначале на базе
медицинских учреждений, затем - на станциях переливания крови. Это было
вызвано тем, что к тому времени переливание крови в качестве лечебного средства
все больше входило в практику работы клинических учреждений, особенно хирур-
СЛУЖБА КРОВИ — СТРУКТУРА, ДЕЯТЕЛЬНОСТЬ И СОВРЕМЕННОЕ СОСТОЯНИЕ
158
гического и акушерского профиля. Вместе с тем родственники больных и отдель¬
ные добровольцы уже не могли обеспечить растущие потребности в донорской
крови. Необходимо было создать группу заинтересованных лиц. сдающих кровь
на регулярной основе. Для этого постановлениями правительства были предусмо¬
трены денежная компенсация и усиленное питание для лиц, систематически сдаю¬
щих кровь. Комплектование такой категории доноров позволило ликвидировать
имеющийся дефицит и обеспечить лечебные учреждения донорской кровью.
Доноры-родственники — лица (родственники больного), дающие кровь, как
правило, однократно, в отделениях переливания крови тех учреждений, в которых
находятся на излечении близкие им люди. Доноры-родственники дают кровь без¬
возмездно. К группе «донор-родственник» причисляют не только родственников
по крови, т.е. генетически близких больному, но и родственников по семейным
отношениям, а также друзей и знакомых больного, т.е. всех тех, кто пережива¬
ет за больного и заинтересован в его скорейшем выздоровлении. Всех доноров
этой группы необходимо информировать, что их кровь или ее компоненты будут
использованы при лечении близкого человека по мере необходимости и толь¬
ко в том случае, если они будут соответствовать по иммуногематологическим
и инфекционным показателям (подробнее см. раздел «Трансфузионная иммуноло¬
гия»). Оставшиеся компоненты крови применяют при лечении других больных.
Немаловажное значение в привлечении родственников и друзей больных к
донорству имеют действия врачей лечебных учреждений. В работе по комплек¬
тованию доноров-родственников особую роль должны играть медсестры ЛПУ,
т.е. лица, наиболее близко контактирующие с больными и их родственниками.
Отсутствие роста численности доноров-родственников свидетельствует о слабой
разъяснительной работе персонала ЛПУ.
Как известно, на первых этапах развития донорства донорами были именно
родственники и знакомые больных. С развитием донорского движения доля этой
группы от общего количества доноров постепенно стала уменьшаться, и на сегод¬
няшний день она крайне немногочисленна. Принимая во внимание тот факт,
что за последние десятилетия наметилась явно выраженная тенденция умень¬
шения числа безвозмездных доноров, можно констатировать, что недостаточно
используемым резервом формирования донорских кадров остается возможность
привлечения к донорству родственников и друзей больных. В последние годы
большое значение в развитии безвозмездного донорства придают привлечению
к даче крови родственников и близких больных.
Необходимо отметить, что распространенное мнение о том, что родственники
и друзья больных — это контингент людей, наиболее ответственных, не скры¬
вающих свои заболевания, на практике не всегда соответствует действительности.
Зачастую родственники больных не могут или не хотят сами сдавать кровь и вме¬
сто себя приводят случайных людей. Поэтому брак крови, полученный от этой
группы лиц, как правило, выше (14,3%), чем среди первичных (9,8%) и, тем более,
платных доноров (4,1%).
В связи со всем вышесказанным важнейшая задача в комплектовании донор¬
ских кадров — привлечение к донорству слоев населения, не заинтересованных
в денежной компенсации и принимающих участие в донорстве безвозмездно,
по моральным соображениям. Во многих развитых странах заготовка крови осу¬
ществляется только от безвозмездных доноров, при этом показатель донорства
достигает 60-80 человек на 1000 населения, т.е. 6-8% населения участвуют в без¬
возмездном донорстве. В России этот показатель существенно ниже: 1,5%-2% (в
Москве - 0,78%).
Анализ причин такого неблагополучного положения выявил следующие фак¬
торы.
• Экономические и социальные проблемы в России, отрицательно влияющие
на состояние здоровья всего населения.
IU СЛУЖБА КРОВИ
• Рост инфекционных заболеваний (СПИД, гепатиты, сифилис, туберку
и др.), приводящий к снижению количества донороспособного населения3
• Незаинтересованность работодателей в условиях рыночных отноще1п,й
в участии работников их предприятий в донорстве. Многие руководите»
г деояіусісают своих сотрудников для дачи крови на СПК или отказывают/*
от проведения ранее согласованного «Дня донора» и не предоставляют оплд
чиваемых дней отдыха, нарушая тем самым закон РФ «О донорстве кров«
и ее компонентов».
• Недостаточно четкая и профессиональная информация о путях распрострд.
нения ВИЧ-инфекции и потенциальной опасности донорства в средствах
массовой информации.
І Непродуманные и безответственные сообщения в средствах массовой инфор.
мации о реальных потребностях в использовании донорской крови.
• Разобщенность учреждений Службы крови ведомственными рамками.
• Отсутствие единой информационно-управляющей системы, координирую¬
щей донорские резервы и управляющей ресурсами Службы крови.
• Отсутствие национальных отраслевых стандартов трансфузионной медицина.
Вследствие сокращения количества доноров возникают серьезные трудности
в организации заготовки и обеспечении больниц необходимыми гемотрансфузи-
онными средами.
Как правило, из числа кадровых доноров крови формируются различные кате¬
гории: доноры компонентов крови, иммунные доноры, доноры костного мозга
и другие.
ДОНОРЫ КОМПОНЕНТОВ КРОВИ
Как было сказано выше, из цельной консервированной крови можно получить
несколько компонентов крови: плазму, эритроциты, тромбоциты, лейкоциты,
стволовые клетки периферической крови. В зависимости от вида компонента
крови различают доноров плазмы и доноров клеток крови — тромбоцитов, эри¬
троцитов и др. От одного донора можно получить от одного до трех-четырех видов
компонентов крови.
Компоненты крови (плазма, эритроциты, тромбоциты, лейкоциты), приго¬
товленные различными методами из крови донора, используют в клинических,
научно-исследовательских и образовательных целях и для производства лекар¬
ственных средств.
Компоненты крови можно получить методом центрифугирования или филь¬
трации из цельной консервированной крови, заготовленной в пластиковом
контейнере, или на автоматизированных сепараторах крови. При этом необ¬
ходимо помнить, что в любом случае — производится ли забор крови в пла¬
стиковые контейнеры с консервантом для крови (450 мл) (с последующим
центрифугированием - разделением на компоненты; оставшиеся возвращают
донору в процессе одной процедуры забора-возврата) или компоненты полу¬
чают на сепараторах крови — первоначально заготавливается консервирован¬
ная кровь. На сепараторах с дробным забором крови (по 50-100 мл) кровь
смешивают с консервантом, разделяют на определенные компоненты, помещая
их в специальные емкости, а донору дробно возвращают оставшиеся компо¬
ненты крови. Процесс повторяется непрерывно, по специальной программе,
до сбора необходимого объема того или иного компонента. С этой точки
зрения все доноры первоначально являются донорами крови и только потом
донорами определенных компонентов крови.
Доноры плазмы - сдающие кровь, которая в процессе переработки разделяется
СЛУЖБА КРОВИ — СТРУКТУРА. ДЕЯТЕЛЬНОСТЬ И СОВРЕМЕННОЕ СОСТОЯНИЕ 161
плазмафереза: дискретный (прерывистый) с использованием центрифуг и автома¬
тический аппаратный. При однократном дискретном плазмаферезе взятую у доно¬
ра кровь в объеме 450 мл центрифугируют для отделения плазмы от клеточных
элементов. Во время центрифугирования, отделения плазмы и ресуспензирования
эритроцитов донору в ту же иглу подключают систему с плазмозамещающим рас¬
твором для замещения объема взятой крови. Полученные эритроциты смешивают
с ресуспензирующим раствором и реинфузируют донору после перепроверки груп¬
повой принадлежности и проведения пробы на совместимость по системе АВО.
Данную операцию можно проводить дважды. В результате двойного дискретного
плазмафереза можно получить до 600 мл плазмы.
При получении плазмы методом дискретного плазмафереза существует риск
развития следующих осложнений:
• несовместимость эритроцитов по системе АВО вследствие ошибок персонала:
• гемодинамические осложнения;
• воздушная эмболия;
• инфицирование донора или медицинского персонала.
Автоматический метод получения плазмы позволяет практически полностью
исключить риск указанных осложнений. Получаемая на автоматизированных
сепараторах крови плазма не содержит примеси клеток и сохраняет высокое
содержание факторов свертывания.
Доноры клеток крови (лейко-тромбоцитафереза) — сдающие кровь, которая
в процессе переработки разделяется на плазму и клеточные компоненты с после¬
дующей реинфузией донору плазмы и незаготавливаемых клеток.
К этой группе относят доноров, у которых извлекают лейкоциты и/или тромбо¬
циты для изготовления лейко- и тромбоцитного концентрата.
Получение лейко- и тромбоцитного концентрата можно осуществлять при про¬
цедуре ручного (центрифужного) плазмафереза или на автоматических сепара¬
торах (цитоферез). При использовании автоматических методов получают наи¬
большее количество клеток, поскольку через сепаратор в течение 2-3-часовой
процедуры пропускают весь объем циркулирующей крови.
Интервалы между процедурами тромбоцитафереза должны составлять не
менее 14 дней, лейкоцитафереза — не менее 30 дней.
Иммунные доноры — доноры плазмы, предварительно сенсибилизированные
определенными антигенами с целью получения плазмы, содержащей определен¬
ный титр необходимых антител.
К иммунным донорам относятся лица, согласившиеся подвергнуться специ¬
альной вакцинации, вследствие которой у них вырабатываются специфические
антитела. В настоящее время проводят иммунизацию доноров стафилококковым
анатоксином и антигенами системы резус. К этой же группе доноров относятся
лица, в крови которых в результате перенесенного заболевания содержатся есте¬
ственные антитела, а также лица, в крови которых содержатся антитела к анти¬
генам эритроцитов (так называемые изоиммунные доноры). Появление таких
антител связано с предшествующей сенсибилизацией в результате многократных
гемотрансфузий или беременностей.
При активной иммунизации доноров другими антигенами с целью получения
иммунных препаратов направленного действия следует использовать только раз¬
решенные к применению в медицинской практике вакцины и антигены эритроци¬
тов и руководствоваться положениями соответствующих инструкций Минздрава
России.
Доноры костного мозга — доноры, у которых из губчатых костей проводят
забор костномозговой взвеси молодых, способных к дальнейшему созреванию
клеточных элементов. Эту категорию комплектуют из числа здоровых доброволь¬
цев, родственников больных и кадровых доноров.
160 СЛУЖБА КРОВИ
• Рост инфекционных заболеваний (СПИД, гепатиты, сифилис, туберкуЛез
и др.), приводящий к снижению количества донороспособного населения
• Незаинтересованность работодателей в условиях рыночных отношений
в участии работников их предприятий в донорстве. Многие руководители
не отпускают своих сотрудников для дачи крови на СПК или отказываются
от проведения ранее согласованного «Дня донора» и не предоставляют опла¬
чиваемых дней отдыха, нарушая тем самым закон РФ «О донорстве крови
и ее компонентов».
• Недостаточно четкая и профессиональная информация о путях распростра¬
нения ВИЧ-инфекции и потенциальной опасности донорства в средствах
массовой информации.
• Непродуманные и безответственные сообщения в средствах массовой инфор¬
мации о реальных потребностях в использовании донорской крови.
• Разобщенность учреждений Службы крови ведомственными рамками.
• Отсутствие единой информационно-управляющей системы, координирую¬
щей донорские резервы и управляющей ресурсами Службы крови.
• Отсутствие национальных отраслевых стандартов трансфузионной медицины.
Вследствие сокращения количества доноров возникают серьезные трудности
в организации заготовки и обеспечении больниц необходимыми гемотрансфузи-
онными средами.
Как правило, из числа кадровых доноров крови формируются различные кате¬
гории: доноры компонентов крови, иммунные доноры, доноры костного мозга
и другие.
ДОНОРЫ КОМПОНЕНТОВ КРОВИ
Как было сказано выше, из цельной консервированной крови можно получить
несколько компонентов крови: плазму, эритроциты, тромбоциты, лейкоциты,
стволовые клетки периферической крови. В зависимости от вида компонента
крови различают доноров плазмы и доноров клеток крови — тромбоцитов, эри¬
троцитов и др. От одного донора можно получить от одного до трех-четырех видов
компонентов крови.
Компоненты крови (плазма, эритроциты, тромбоциты, лейкоциты), приго¬
товленные различными методами из крови донора, используют в клинических,
научно-исследовательских и образовательных целях и для производства лекар¬
ственных средств.
Компоненты крови можно получить методом центрифугирования или филь¬
трации из цельной консервированной крови, заготовленной в пластиковом
контейнере, или на автоматизированных сепараторах крови. При этом необ¬
ходимо помнить, что в любом случае — производится ли забор крови в пла¬
стиковые контейнеры с консервантом для крови (450 мл) (с последующим
центрифугированием — разделением на компоненты; оставшиеся возвращают
донору в процессе одной процедуры забора-возврата) или компоненты полу¬
чают на сепараторах крови — первоначально заготавливается консервирован¬
ная кровь. На сепараторах с дробным забором крови (по 50-100 мл) кровь
смешивают с консервантом, разделяют на определенные компоненты, помещая
их в специальные емкости, а донору дробно возвращают оставшиеся компо¬
ненты крови. Процесс повторяется непрерывно, по специальной программе,
до сбора необходимого объема того или иного компонента. С этой точки
зрения все доноры первоначально являются донорами крови и только потом
донорами определенных компонентов крови.
Доноры плазмы — сдающие кровь, которая в процессе переработки разделяется
на плазму и эритроцитную массу, с последующей реинфузией донору эритроцитов.
Заготовка плазмы производится методом плазмафереза. Известны два способа
СЛУЖБА КРОВИ — СТРУКТУРА, ДЕЯТЕЛЬНОСТЬ И СОВРЕМЕННОЕ СОСТОЯНИЕ 161
плазмафереза: дискретный (прерывистый) с использованием центрифуг и автома¬
тический аппаратный. При однократном дискретном плазмаферезе взятую у доно¬
ра кровь в объеме 450 мл центрифугируют для отделения плазмы от клеточных
элементов. Во время центрифугирования, отделения плазмы и ресуспензирования
эритроцитов донору в ту же иглу подключают систему с плазмозамещающим рас¬
твором для замещения объема взятой крови. Полученные эритроциты смешивают
с ресуспензирующим раствором и реинфузируют донору после перепроверки груп¬
повой принадлежности и проведения пробы на совместимость по системе АВО.
Данную операцию можно проводить дважды. В результате двойного дискретного
плазмафереза можно получить до 600 мл плазмы.
При получении плазмы методом дискретного плазмафереза существует риск
развития следующих осложнений:
• несовместимость эритроцитов по системе АВО вследствие ошибок персонала;
• гемодинамические осложнения;
• воздушная эмболия;
• инфицирование донора или медицинского персонала.
Автоматический метод получения плазмы позволяет практически полностью
исключить риск указанных осложнений. Получаемая на автоматизированных
сепараторах крови плазма не содержит примеси клеток и сохраняет высокое
содержание факторов свертывания.
Доноры клеток крови (лейко-тромбоцитафереза) — сдающие кровь, которая
в процессе переработки разделяется на плазму и клеточные компоненты с после¬
дующей реинфузией донору плазмы и незаготавливаемых клеток.
К этой группе относят доноров, у которых извлекают лейкоциты и/или тромбо¬
циты для изготовления лейко- и тромбоцитного концентрата.
Получение лейко- и тромбоцитного концентрата можно осуществлять при про¬
цедуре ручного (центрифужного) плазмафереза или на автоматических сепара¬
торах (цитоферез). При использовании автоматических методов получают наи¬
большее количество клеток, поскольку через сепаратор в течение 2-3-часовой
процедуры пропускают весь объем циркулирующей крови.
Интервалы между процедурами тромбоцитафереза должны составлять не
менее 14 дней, лейкоцитафереза — не менее 30 дней.
Иммунные доноры — доноры плазмы, предварительно сенсибилизированные
определенными антигенами с целью получения плазмы, содержащей определен¬
ный титр необходимых антител.
К иммунным донорам относятся лица, согласившиеся подвергнуться специ¬
альной вакцинации, вследствие которой у них вырабатываются специфические
антитела. В настоящее время проводят иммунизацию доноров стафилококковым
анатоксином и антигенами системы резус. К этой же группе доноров относятся
лица, в крови которых в результате перенесенного заболевания содержатся есте¬
ственные антитела, а также лица, в крови которых содержатся антитела к анти¬
генам эритроцитов (так называемые изоиммунные доноры). Появление таких
антител связано с предшествующей сенсибилизацией в результате многократных
гемотрансфузий или беременностей.
При активной иммунизации доноров другими антигенами с целью получения
иммунных препаратов направленного действия следует использовать только раз¬
решенные к применению в медицинской практике вакцины и антигены эритроци¬
тов и руководствоваться положениями соответствующих инструкций Минздрава
России.
Доноры костного мозга — доноры, у которых из губчатых костей проводят
забор костномозговой взвеси молодых, способных к дальнейшему созреванию
клеточных элементов. Эту категорию комплектуют из числа здоровых доброволь¬
цев, родственников больных и кадровых доноров.
f§2 СЯУЖБЛ кяовм
В соответствии с инструкцией по заготовке костного мозга разрешено изъятие
до 400 мл костномозговой взвеси. На практике, однако, объем эксфузии мо*^
достигать 1100-1200 мл, что обусловлено необходимостью получения достаточ¬
ного количества миелокариоцитов (2-10x10® клеток на 1 кг массы тела реципи¬
ента) для трансплантации. Для ликвидации гиповолемии и анемии при эксфузии
костного мозга донору вводят 400-500 мл аутокрови, которую заготавливают
за 3-6 дней до процедуры.
Доноры стандартных эритроцитов и лейкоцитов — доноры, клетки крови кото¬
рых используют для приготовления панелей эритроцитных и лейкоцитных анти¬
генов и для стандартов, применяемых в качестве контроля при определении групп
крови и резус-принадлежности. Данная группа доноров комплектуется из числа
лиц, имеющих высокоактивные антигены эритроцитов.
Донорство крови — важнейший раздел трансфузионной медицины. Без его
динамического развития невозможно успешно осуществлять деятельность таких
видов специализированной медицинской помощи, как хирургия, реанимация,
гематология, родовспоможение, онкология, травматология и др. Особая ответ¬
ственность возлагается на производственную и клиническую трансфузиологию
в условиях чрезвычайных ситуаций, при массовом поступлении раненых и постра¬
давших. Помимо сугубо практического значения донорства, необходимо помнить,
что оно играет существенную роль и в решении созидательных проблем, воспи¬
тывая в человеке важные моральные качества: гуманизм, доброту, отзывчивость,
патриотизм, в которых так нуждается современное общество.
Наиболее емко основополагающие этические принципы донорства крови сфор¬
мулированы в «Кодексе норм поведения при донорстве крови и гемотрансфузи¬
ях», который был разработан при технической поддержке Всемирной организации
здравоохранения (WSO) и принят Генеральной Ассамблеей Международного
общества переливания крови (ISBT) 12 июля 2000 г. (дополнен Генеральной
Ассамблеей ISBT 5 сентября 2006 г.).
КОДЕКС НОРМ ПОВЕДЕНИЯ ПРИ ДОНОРСТВЕ КРОВИ И ГЕМОТРАНСФУЗИЯХ
Цель кодекса — определение этических принципов и правил заготовки и при¬
менения донорской крови.
• Донорство крови, включая донорство гемопоэтических клеток для транс¬
плантации, должно быть добровольным и безвозмездным. Принуждение
к донорству крови недопустимо. Донорство считают добровольным и безвоз¬
мездным, если человек дает кровь, плазменные или клеточные компоненты
по собственной доброй воле и не получает никакой оплаты за это как в форме
наличных денег, так и в любой иной форме, которую можно было бы счесть
заменой деньгам. Это относится и к компенсациям за период рабочего вре¬
мени, кроме обоснованных затрат времени на дорогу к донорскому пункту.
Небольшие подарки, завтрак и компенсации прямых затрат на дорогу совме¬
стимы с принципами добровольного и безвозмездного донорства.
• Давая согласие на дачу крови или ее компонентов, донор должен быть полно¬
стью ознакомлен с полной информацией о последующем использовании
крови Службой крови.
• Мотив получения прибыли не должен быть основанием для учреждения
и управления Службой крови.
• Донору необходимо сообщать о рисках, связанных с процедурой. Все про¬
цедуры введения донору каких-либо веществ с целью увеличения концен¬
трации определенных компонентов крови должны быть согласованы с при¬
нятыми стандартами.
• Необходимо обеспечение конфиденциальности сведений о доноре крови.
Между донором и реципиентом должна быть обеспечена анонимность,
за исключением особых ситуаций.
СЛУЖБА КРОВИ — СТРУКТУРА, ДЕЯТЕЛЬНОСТЬ И СОВРЕМЕННОЕ СОСТОЯНИЕ 1 $3
с Донор должен осознавать свою ответственность, связанную с риском пере*
дачи гемотрансмиссивных инфекций с кровью.
• Донорство крови должно осуществляться исключительно на основании стан¬
дартных медицинских критериев и не сопровождаться дискриминацией
по половому, расовому, религиозному или другому признаку. Ни донор
крови, ни потенциальный реципиент не имеют права требовать исключений
из этих правил.
• За заготовку крови донора должен быть ответствен врач, имеющий соответ¬
ствующую квалификацию (трансфузиолог).
, Все процедуры, связанные с донорством крови и процедурами гемафереза.
должны выполняться в соответствии с принятыми стандартами.
« Доноры и реципиенты должны быть полностью информированы о возмож¬
ных осложнениях.
• Кровь - общественный ресурс, и доступ к нему не должен быть ограничен.
• При заготовке и использовании донорской крови и ее компонентов необхо¬
димо, по возможности, сокращать убытки крови, соблюдая интересы потен¬
циальных реципиентов и доноров.
• Пациентов необходимо информировать о всех достоинствах и недостатках
переливания крови и/или альтернативных терапий. Любое осознанное жела¬
ние пациента должно приниматься во внимание.
• В том случае, когда пациент не способен дать полностью осознанное предва¬
рительное согласие на гемотрансфузию, решение о гемотрансфузии должно
осуществляться исходя из интересов пациента.
• За проведение гемотрансфузии должен быть ответствен врач, имеющий соот¬
ветствующую квалификацию (трансфузиолог).
• Обоснованная клиническая потребность должна быть единственным основа¬
нием для гемотрансфузии.
• Мотив получения прибыли не должен быть основанием для назначения
и проведения гемотрансфузии.
• Пациент должен получить только клинически адекватные, обеспечивающие
наибольшую безопасность компоненты крови.
• Практика гемотрансфузий, установленная национальными или международ¬
ными институтами здоровья и другими компетентными и уполномоченными
агентствами, должна находиться в соответствии и согласии с настоящим
кодексом норм поведения при донорстве крови и гемотрансфузиях.
В РФ обязанности донора формулируются следующим образом.
• Гражданин, изъявивший согласие стать донором крови и ее компонентов,
обязан предоставить документы, удостоверяющие личность, а также досто¬
верные сведения о состоянии своего здоровья, сообщить известные ему све¬
дения о перенесенных им и имеющихся у него заболеваниях, а также об упо¬
треблении им наркотических средств. Кроме того, гражданин, изъявивший
согласие стать донором крови и ее компонентов, должен пройти медицинское
обследование для выявления возможных противопоказаний к донорству
крови и ее компонентов.
• Гражданин, умышленно скрывший или исказивший сведения о состоянии
своего здоровья, в случае неблагоприятных последствий для реципиента
несет ответственность, установленную законодательством РФ (законы РФ
от 9 июня 1993 г. №5142-1 «О донорстве крови и ее компонентов» и от 29
декабря 2006 г. №258 ФЗ «О внесении изменений в отдельные законодатель¬
ные акты Российской Федерации в связи с совершенствованием разграниче¬
ния полномочий»),
• Сведения о персональных данных донора крови и ее компонентов не под¬
лежат разглашению реципиенту, равно как и персональные данные реципи-
164 СЛУЖБА крови
ента не подлежат разглашению донору, за исключением случаев переливам
крови между родственниками и в иных случаях, установленных законов?
телыггвом Российской Федерации. d"
Донор в РФ имеет право на:
• полное информирование о возможных последствиях взятия крови и ее ком
понентов для своего организма;
• меры социальной поддержки (см. ниже);
• обязательное страхование за счет средств организаций, осуществляющих
заготовку, переработку, хранение и обеспечение безопасности донорской
крови и ее компонентов, на случай заражения донора инфекционными забо¬
леваниями при выполнении им донорской функции (средства на страхование
должны входить в себестоимость крови);
• защиту государством его прав и охрану его здоровья.
В РФ донору гарантируется защита его прав и охрана здоровья и предоставление
социальной поддержки. Меры социальной поддержки, предоставляемые донору
крови, осуществляются в соответствии с установленными нормативно-правовыми
актами РФ, субъектов РФ, а также иными государственными гарантиями, установ¬
ленными законодательством РФ:
• в день сдачи крови и ее компонентов донор обеспечивается бесплатным пита¬
нием за счет средств бюджета, осуществляющего финансовое обеспечение
организации донорства крови и ее компонентов;
• рацион питания устанавливается субъектом РФ на уровне не ниже при¬
мерного рациона питания, устанавливаемого федеральным органом испол¬
нительной власти, осуществляющим выработку государственной политики
и нормативно-правовое регулирование в сфере здравоохранения и социаль¬
ного развития;
• органы государственной власти субъектов РФ, органы местного самоуправления
вправе в пределах своей компетенции и имеющихся средств принимать решения
о дополнительных мерах социальной поддержки, не предусмотренных настоя¬
щим федеральным законом, для указанных в законе категорий граждан;
• медицинское обследование донора перед сдачей крови и ее компонентов
и выдача справок о состоянии его здоровья проводятся бесплатно.
В соответствии с законами РФ от 9 июня 1993 г. №5142-1 «О донорстве крови
и ее компонентов» и от 29 декабря 2006 г. №258 ФЗ «О внесении изменений
в отдельные законодательные акты Российской Федерации в связи с совершен¬
ствованием разграничения полномочий» донору, сдавшему в течение года кровь
и (или) ее компоненты в суммарном количестве, равном двум максимально допу¬
стимым дозам, в течение года предоставляются следующие дополнительные меры
социальной поддержки:
• пособие по временной нетрудоспособности при всех видах заболеваний
в размере полного заработка независимо от трудового стажа;
• первоочередное выделение по месту работы или учебы льготных путевок
для санаторно-курортного лечения.
Кроме того, вышеуказанными законодательными актами определены меры
социальной поддержки для лиц, награжденных знаком «Почетный донор России».
В порядке, установленном законодательством РФ, донору возмещается ущерб,
причиненный ему повреждением здоровья в связи с выполнением им донорской
функции, включая расходы на лечение, проведение медико-социальной эксперти¬
зы, социально-трудовую и профессиональную реабилитацию. Инвалидность доно¬
ра, наступившая в связи с выполнением им донорских функций, приравнивается
к инвалидности, наступившей вследствие трудового увечья. Вред, причиненный
жизни или здоровью донора в связи с выполнением им донорской функции, возме¬
щается в соответствии с гражданским законодательством Российской Федерации.
СЛУЖБА КРОВИ — СТРУКТУРА. ДЕЯТЕЛЬНОСТЬ И СОВРЕМЕННОЕ СОСТОЯНИЕ 165
Гоаждане, сдавшие бесплатно кровь 40 раз и более или плазму 60 раз и более.
гпаждаются нагрудным знаком «Почетный донор России» федеральным орга¬
зм исполнительной властИі осуществляющим выработку государственной поли*
1,0 и нормативное правовое регулирование в сфере здравоохранения, в порядке,
^ановленном Правительством РФ, и имеют право на следующие льготы:
У # внеочередное лечение в государственных или муниципальных организациях
здравоохранения в рамках Программы государственных гарантий оказания
гражданам РФ бесплатной медицинской помощи;
• первоочередное приобретение по месту работы или учебы льготных путевок
ДЛЯ санаторно-курортного лечения;
• предоставление ежегодного оплачиваемого отпуска в удобное для них время
года;
• ежегодную денежную выплату в размере 8501 руб. (данные на 2009 г.),
выплачиваемую в порядке, устанавливаемом федеральным органом испол¬
нительной власти, осуществляющим выработку государственной политики
и нормативно-правовое регулирование в сфере здравоохранения;
• ежегодная денежная выплата для лиц, награжденных знаком «Почетный
донор России», индексируется с января текущего года один раз в год, исходя
из прогнозируемого уровня инфляции, установленного федеральным зако¬
ном о федеральном бюджете на соответствующий финансовый год и плано¬
вый период.
Финансовое обеспечение расходов, связанных с ежегодной денежной выплатой
для лиц, награжденных знаком «Почетный донор России», относится к расходным
обязательствам Российской Федерации.
Глава 7
Организация работы учреждений
Службы крови
Организация донорства и использования крови и ее комп
тов — сложная многоплановая задача, которая включает: Нен'
• подбор, учет и использование донорских кадров;
• технологические процессы заготовки, апробации, перераб
крови и ее компонентов; ТКи
• создание и хранение оптимальных запасов инфузипт,
трансфузионных сред;
• передачу в лечебную сеть и рациональное использовани
инфузионно-трансфузионных сред.
Практически все этапы работы учреждений крови, связанные
с заготовкой донорской крови и ее компонентов, тестированием
разделением и хранением, строго регламентированы соответствую¬
щими приказами, положениями и инструкциями, методически¬
ми рекомендациями и другими документами. Неукоснительное
их исполнение обеспечивает безопасность всего трансфузиологиче¬
ского пособия.
Информационные технологии - основа
современной системы управления в Службе крови
Для эффективного выполнения вышеуказанных требований
необходим ряд условий. Важнейшее из них — наличие соответст¬
вующих информационно-технологических составляющих. Цент¬
ральное звено информационной базы — единый информационный
донорский центр региона (например, Москвы, Екатеринбурга или
более крупных объединений — Москвы и Московской области).
В перспективе региональные информационные донорские центры
регионов будут объединены в единую информационную базу доно¬
ров крови всей страны.
Для обеспечения контроля обращения донорской крови и ее
компонентов и наблюдения за последствиями трансфузии крови
и ее компонентов предусматривается создание Единого государ"
ственного автоматизированного информационного банка крови
и ее компонентов (проект федерального закона «О донорстве кров
и ее компонентах», 2009).
Единый государственный автоматизированный информаций
ный банк крови и ее компонентов управляется федеральным ор
ном исполнительной власти, который контролирует донор
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 187
вИ и ее компонентов. Информационный банк крови и ее компонентов должен
^полагать следующими сведениями:
Р , сведения о количестве забранной, заготовленной и переработанной донор¬
ской крови и ее компонентов;
• сведения о запасах донорской крови и ее компонентов с указанием группы
крови и резус-фактора;
t сведения об обращении донорской крови и ее компонентов;
• сведения об обмене, безвозмездной передаче, обеспечении за плату донор¬
ской кровью и ее компонентами;
» сведения о ввозе на территорию РФ и вывозе за ее пределы донорской крови
и ее компонентов;
• сведения о проведенных трансфузиях;
• сведения о посттрансфузионных реакциях и осложнениях у доноров и реци¬
пиентов;
• сведения о донорах и донациях;
• сведения об организациях донорства крови и ее компонентов;
• сведения о лицах с противопоказаниями к донорству крови и ее компонентов.
В целях обеспечения безопасности донорской крови и ее компонентов в Банке
хранится федеральный регистр доноров. Регистр включает следующие сведения
о доноре крови: фамилия, имя, отчество; фамилия, которая была у лица при рожде¬
нии (если фамилия изменялась); дата рождения; пол; адрес места жительства; серия
и номер паспорта или данные иного документа, удостоверяющего личность; дата
выдачи указанных документов, на основании которых в регистр включены соответ¬
ствующие сведения, наименование выдавшего их органа; дата включения в регистр;
вид донорства (донорство крови, донорство клеток крови, донорство плазмы); све¬
дения о группе крови, резус-принадлежности, наличии минорных трансфузионно
опасных антигенов и иммунных антител, категория донора и сведения о награжде¬
нии нагрудным знаком «Почетный донор России», «Почетный донор СССР*.
Информационная база данных доноров и лиц, отведенных от донорства (единый
донорский центр), обеспечивает возможность:
• предотвращения донаций от лиц, отведенных от донорства, на основа¬
нии априорной информации уже на этапе обращения. Априорный отвод
от донорства в качестве дополнительной меры обеспечения безопасности
крови и ее компонентов может существенно сэкономить средства, исключив
выплаты за донацию и затраты на расходные материалы и реактивы:
• мониторинга донорских кадров независимо от места проживания. Возмож¬
ность осуществления донаций в момент обращения в любом месте без
предъявления дополнительных справок расширит права потенциального
донора и приведет к росту объемов заготовок. С другой стороны, станет невоз¬
можной ситуация, когда доноры, пренебрегая своим здоровьем, сдают кровь
в разных учреждениях, не соблюдая установленные периоды реабилитации.
Наличие обобщенных сведений о доноре позволит в перспективе существен¬
но упростить процедуры присвоения звания «Почетный донор России*, сведя
их к подготовке приказа на основании выборки из базы. Единая база доноров
даст возможность при необходимости проводить индивидуальный подбор
доноров. В условиях чрезвычайной ситуации единая база даст возможность
для экстренной мобилизации необходимого количества донорского контин¬
гента из нужных регионов;
• использования материалов для анализа и статистических исследований про¬
блем донорства, состояния здоровья населения, миграций и других.
Компьютерные программы информационного сопровождения технологических
процессов заготовки и переработки крови и ее компонентов призваны приближать
Деятельность учреждения Службы крови к некоторому изначально заложенному
ЦІ СЛУЖБА КРОВИ
стандарту и обеспечивать абсолютную достоверность первичных исходных дан.
ных. фиксируемых непосредственно на каждом этапе технологического цикла
Жесткая последовательность действий персонала, определяемая компьютерными
программами, сквозное использование штрихкодированной маркировки, много¬
кратный программный контроль наличия необходимых признаков признания
продукции годной, автоматическая печать этикетки годной продукции в момент
считывания штрихкодового идентификатора исключают ошибки персонала и обе¬
спечивают безопасность продукции. Использование электронной накладной
сопровождающей передачу продукции в лечебное учреждение, также снижает
вероятности ошибки персонала. Все сведения, вносимые персоналом в базы дан¬
ных, персонифицируются, имеют юридическую значимость и создают доказатель¬
ную базу действий персонала.
Единая база данных запасов годной продукции, а также находящихся на каран¬
тинизации компонентов крови позволит:
і контролировать использование инфузионно-трансфузионных сред с точно¬
стью до единицы продукции:
і контролировать номенклатуру и объемы запасов инфузионно-трансфузион¬
ных сред и на этой основе осуществлять управление запасами;
• организовывать в экстренных случаях индивидуальный подбор компонентов
крови из уже имеющихся.
Компьютерный учет использования инфузионно-трансфузионных сред позволит:
• в необходимых случаях в считанные часы провести всю цепь расследования
причин посттрансфузионных осложнений, изъять заготовленные от выяв¬
ленного потенциально опасного донора другие компоненты крови;
• иметь первичный материал, необходимый для анализа и статистических
исследований правильности назначения и использования компонентов
крови.
Наличие автоматизированной информационной системы трансфузиологии -
один из определяющих факторов соответствия учреждения Службы крови стан¬
дартам GMP. Информационное пространство Службы крови в процессе деятель¬
ности должно обмениваться информацией с:
• центрами СПИД;
• центрами санэпиднадзора;
• кожно-венерологическими диспансерами;
• туберкулезными диспансерами;
• наркологическими диспансерами;
• Красным Крестом.
Задачи, решаемые информационными системами на СПК и ОПК:
• автоматизация информационной составляющей технологического процесса
работы СПК (ОПК) на всех рабочих местах медперсонала;
• применение этикетки с уникальным штрихкодовым номером для иденти¬
фикации донора, эксфузии, пробирки и компонента. Структура штрихкода
технологической этикетки должна соответствовать международным реко¬
мендациям;
• автоматизация процесса контроля годности продукции в момент считывания
штрихкодового номера с контейнера с компонентом крови и печать этикетки
на годную продукцию. Структура этикетки годной продукции должна соот¬
ветствовать международным рекомендациям;
• повторный контроль годности компонента при выдаче в ЛПУ;
• автоматизация документооборота технологического процесса работы СПК
с формированием и выдачей отчетных документов;
• ведение баз данных (БД) доноров крови, почетных доноров, лиц, отведенных
от донорства, лиц из групп риска;
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 169
, прием и обработка данных о донорах и отводах от СПК (ОПК):
I ведение БД результатов исследования крови доноров в лабораториях:
• поддержка целостности и актуальности БД у удаленных пользователей
на СПК (ОПК);
« проведение статистических исследований;
• автоматизация документооборота работы Единого донорского центра (ЕДЦ)
с формированием и выдачей отчетных документов;
, формирование обобщенных сведений о запасах крови и ее компонентов;
• ведение базовых данных о суточных запасах компонентов и препаратов крови
города, области, в том числе в экспедиции, на карантинизации, в криобанке;
• автоматизация документооборота работы регионального центра с формиро¬
ванием и выдачей отчетных документов.
Структурная схема информационного взаимодействия ЕДЦ с ЛПУ г. Москвы
представлена на рис. 7-1.
Структурная схема информационного взаимодействия ЕДЦ с ЛПУ г. Москвы
(данные Болотова А. И.)
I' ЛРм“
[Красный
I Крест
|Модем|
АРМ
Регистратура
ОПК
АРМ Щ
(Регистратура
1 СПК 11
(Модем)
Государственная телефонная сеть
Единый донорский центр Ч
Модемная стойка
БД
Сервер ЕДЦ
Телекоммуни-
кационный
сервер
АРМ ЕДЦ
Рис. 7-1. Структурная схема информационного взаимодействия ЕДЦ с ЛПУ г. Москвы
Регистрация, учет и освидетельствование доноров крови,
клеточных компонентов и плазмы
ЕДИНЫЙ ДОНОРСКИЙ ЦЕНТР (ОПЫТ РАБОТЫ СТАНЦИЙ ПЕРЕЛИВАНИЯ КРОВИ
КОМИТЕТА ЗДРАВООХРАНЕНИЯ МОСКВЫ)
Основные задачи ЕДЦ:
• организация учетов доноров;
• регистрация выявленных у доноров противопоказаний к кроводаче;
• получение информации на лиц - носителей возбудителей гемотрансмиссив¬
ных инфекций от учреждений санитарно-эпидемиологического контроля
и кожно-венерологических диспансеров;
• обмен информацией с учреждениями Службы крови г. Москвы. Принципы
работы ЕДЦ, заложенные 45 лет назад, сохранили свою преемственность
)70 СЛУЖБА КРОВ*
до сегодняшних дней, а постоянно пополняющаяся за эти годы БД содержи,,
сведения о 3 млн человек (см. рис. 7-1).
Информация, содержащаяся в БД ЕДЦ. относится к интеллектуальной собствен,
пости Комитета здравоохранения (КЗ) г. Москвы (ст. 128 Гражданского кодекса
РФ, федеральный закон «Об информации, информатизации и защите инфорща.
цих*, приказ Минздравмедпрома N*105 от 26.03.1996 г. «О государственном учете
и регистрации баз и банков данных*).
БД ЕДЦ передан в оперативное управление СПК КЗ г. Москвы. Деятельность
ЕДЦ по сбору и обмену информацией регламентируется приказом Министерства
здравоохранения СССР N*155 от 12.04.1990 г.. приказами Департамента здраво¬
охранения Москвы N»436 от 26.07.1995 г. «Об улучшении организации работы
ЕДЦ Станции переливания крови Департамента здравоохранения Москвы», N*549
от 04.09.1996 г. «Об организации обмена данными между регистратурами ОПК
и ЕДЦ СПК*, Комитета здравоохранения N*14 от 10.01.1997 г. «О базе данных
Единый донорский центр*, N*78/301 от 30.05.1997 г. «Об обмене информацией
между СПК КЗ и КВД, МГЦ СПИД, ОРУИБ МГЦ дезинфекции о больных сифили¬
сом, вирусным гепатитом В, С, Д и ВИЧ-инфицированных». №336 от 19.07.1999 г.
«О порядке обмена информацией между МГЦ СПИД, городским КВД и Единым
донорским центром Станции переливания крови Комитета».
Работа ЕДЦ осуществляется в режиме автоматизированной информационно-
управляющей системы «АИСТ», разработанной и обеспечивающей ее комплексное
сопровождение медико-техническим объединением «МЕТЕО-П». Данной систе¬
мой предусмотрены меры, препятствующие несанкционированному доступу к БД
и разглашению сводных сведений о донорах и больных, содержащихся в ЕДЦ.
Сохранность БД гарантируется ежедневным копированием всей поступающей
информации.
Ежедневно БД ЕДЦ пополняется из различных источников. Сведения о донорах
поступают от 29 учреждений Службы крови, из которых 22 работают в автомати¬
ческом режиме по каналам Московской городской телефонной связи через модем,
В это число входят все учреждения Службы крови КЗ Москвы и 7 организаций,
относящихся к другим ведомствам. Последние осуществляют обмен данными
с ЕДЦ на основе договора.
Как правило, учреждения Службы крови работают в системе модемной связи
с ЕДЦ. Направление информации о донорах в ЕДЦ на бумажных носителях и осу¬
ществление оперативной связи с ЕДЦ по телефону не способствует получению
информации пользователями в реальном режиме времени.
В ЕДЦ регулярно поступают сведения из санитарно-эпидемиологической
и дермато-венерологической службы о выявленных гемотрансмиссивных инфек¬
циях. Ежедневно в электронных картах доноров регистрируются данные, поступив¬
шие из диагностико-серологической лаборатории СПК КЗ Москвы о положитель¬
ных реакциях на ВИЧ, гепатиты, сифилис.
Проверка доноров по реестру МГЦ СПИД осуществляется путем автоматическо¬
го направления формирующихся в реальном режиме времени списков зарегистри¬
рованных доноров. Результаты проверки поступают оперативно, что исключает
выдачу в лечебную сеть гемопродукции, заготовленной от непроверенных доноров;
протоколы публикуются.
Учет донорских кадров ведут по определенному алгоритму. Каждому донору при¬
сваивают номер ЕДЦ. в электронную карту вносят фамилию, имя, отчество, дату
рождения (день, месяц, год), номер паспорта, домашний адрес, учреждение Службы
крови, где числится донор, вид донорства, группу крови, резус-принадлежность,
дату первичной регистрации, общее количество крово- и плазмодач, дату послед¬
ней донации, при наличии отвода от донорства - указание на абсолютный или вре¬
менный отвод, причину отвода, примечание.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 171
Выявленные у донора абсолютные (постоянные) противопоказания к донорству
вносят в электронную карту донора, защищая эту информацию от изменений систе¬
мой блокировки.
Изменение диагноза или его отмена может быть проведена только заведующим
ЕДЦ при наличии соответственно оформленных учреждениями Службы крови
справок на восстановление в донорстве.
Единым донорским центром в соответствии с «Инструкцией по освидетельство¬
ванию доноров крови, плазмы и клеток» от 1998 г. разработан справочник отводов.
Все внесенные в него отводы закодированы.
Регистрация поступивших сведений о больных с гепатитами и вирусоносителях,
больных сифилисом, малярией, туберкулезом и ВИЧ-инфицированных лицах
проводится по следующей схеме: регистрационный номер ЕДЦ, фамилия, имя.
отчество, дата рождения, домашний адрес, диагноз, дата регистрации, источник
информации и дата поступления информации в ЕДЦ.
Такая система учета доноров позволяет в автоматическом режиме совмещать
совпадающие по паспортным данным карты с соответствующим внесением в них
информации о выявленных заболеваниях.
Наличие автоматической системы регистрации сведений и поиска лиц. числя¬
щихся в БД, не исключает личной причастности оператора к проведению корректи¬
ровки электронных карт, совмещению дубликатов и внесению в электронную базу
данных информации, полученной на бумажных носителях. Это требует от сотруд¬
ников не только соответствующих навыков, но и медицинского подхода, поэтому
данная работа должна выполняться медицинским персоналом.
Работа операторов не обезличена: каждому присваиваются индивидуальный
пароль и код, под которыми он входит в сеть. Действия оператора контролируются
фискальной базой.
Высокий профессионализм необходим не только в работе операторов ЕДЦ.
но и на этапе заполнения электронных карт, так как даже незначительная неточ¬
ность при введении паспортных данных не позволит идентифицировать донора
и может стать причиной серьезных ошибок.
Качественное выполнение операторами своих функций непосредственно зависит
от уровня их знаний и понимания степени ответственности за выполняемую работу.
На СПК КЗ действует специальная система обучения операторов ОПК (СПК),
разработанная специалистами ООО «МЕТЕО-П» и ЕДЦ, предусматривающая
их сертификацию по программе «АИСТ».
Наряду с этим СПК КЗ осуществляет контроль за работой периферийных поль¬
зователей ЕДЦ и направляет им информационные письма и рекомендации по орга¬
низации производственного процесса.
Регулярность мероприятий, проводимых ЕДЦ по обучению и тестированию опе¬
раторов, выявлению и выяснению причин возникновения дубликатов донорских
карт, контролю работы операторов на местах, обеспечивает полноту и достовер¬
ность поступающей из учреждений Службы крови информации.
Однако повседневная работа ЕДЦ. связанная с получением информации о доно¬
рах, обработкой сведений о больных, формированием БД ЕДЦ новых карт и коррек¬
тировкой ранее введенных, контролем за результатами проверки доноров в МГЦ
СПИД, идентификацией дубликатов электронных карт, публикацией протоколов,
учетной и отчетной документации, — это только часть функций ЕДЦ.
Содержащаяся в БД информация предоставляет возможность для проведения
разносторонних аналитических исследований по проблемам состояния донорства,
причинам постоянных и временных отводов от донорства, прогнозированию пер¬
спектив комплектования донорских кадров и другим вопросам.
В условиях значительного дефицита доноров и ведомственной разобщенности
организаций Службы крови ЕДЦ призван объединять интересы всех учреждений
172 СЛУЖБА КРОВИ
Службы крови региона, помогая создать оптимальные условия для подъема до
ского движения и повышения гарантий вирусной безопасности гемотрансфу3и°^'
РЕГИСТРАТУРА
Регистратура — первое подразделение, встречающее доноров крови.
Основная задача подразделения — регистрация и учет доноров крови, плазм
J (в том числе иммунной) и клеток крови и ведение картотеки. ’ Ьі
В соответствии со своей основной задачей регистратура:
і осуществляет подбор и учет доноров:
s регулирует соблюдение донорами интервалов между кроводачами;
I ведет медицинскую документацию И представляет отчетность ПО утвержден-
ным формам в установленные сроки.
При обращении первичных и кадровых доноров регистратура учреждений
Службы крови обязана запросить в установленном порядке информацию на доно¬
ра в БД ЕДЦ. При получении результатов запроса ОПК, в случае отсутствия у дан¬
ного донора противопоказаний, допускает донора к кроводаче.
Регистрация донора как при первичном, так и при повторном обращении осу¬
ществляется регистратурой (медицинским регистратором) отделения (кабинета)
учета и комплектования донорских кадров только по предъявлении документа
удостоверяющего личность (паспорта, а для военнослужащих и сотрудников
МВД — военного билета и удостоверения личности).
При обращении донора резерва оформляется «Карта донора резерва» (форма
407/у) и «Учетная карточка донора» (форма N 405/у) с внесением в них паспорт¬
ных данных в соответствии с предъявленным документом. При обращении донора
резерва четвертый раз в году и желании его в дальнейшем регулярно сдавать кровь
или ее компоненты он переводится в категорию активного донора с оформлением
«Медицинской карты активного донора» (форма N 406/у).
При обращении активного донора его документы сверяются с паспортными
данными «Медицинской карты активного донора» (форма N 406/у) и «Учетной
карточкой донора» (форма N 405/у) из картотеки регистратуры.
При регистрации каждому донору выдается «Анкета донора», заполняемая
им самостоятельно или с помощью медицинского регистратора. Регистратура
(медицинский регистратор) заводит «Учетную карточку донора», в которую зано¬
сят данные о количестве сданной крови или ее компонентов из «Направления
на кроводачу, плазмаферез и др.» (форма N 404/у). При наличии единого тер¬
риториального центра учета доноров «Учетная карточка донора» заполняется
в двух экземплярах, один из которых направляется в центр. Оформляется справка,
подтверждающая факт медицинского обследования или медицинского обследова¬
ния с последующей сдачей крови или ее компонентов (формы 401/у или 402/у),
для предъявления по месту работы (учебы). Заполняется «Журнал регистрации
мероприятий, проводимых при заболевании доноров сифилисом, гепатитом и др.»
(форма N 403/у).
Учетные формы хранятся в регистратуре отдела комплектования донорских
кадров в течение 3 лет, после чего сдаются в архив учреждения, где хранятся в тече¬
ние 5 лет (за исключением формы 405/у, которая подлежит хранению в течение
50 лет). При снятии донора с учета в «Медицинской карте активного донора»
и в «Учетной карточке донора» делается запись причины снятия донора с учета
и подводится общий итог количества изъятой крови или ее компонентов за весь
период донорства.
При заготовке крови выездной бригадой на предприятиях допускается заполне¬
ние учетной документации доноров на основании списков, составленных и утверЖ"
денных медицинским работником предприятия.
Наличие электронной картотеки с данными о донорах не отменяет дублирования
информации на бумажных носителях согласно установленным учетным формам.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 173
медицинское освидетельствование доноров
Вся процедура медицинского обследования потенциальных доноров крови
| конечном итоге направлена на достижение максимальной эффективности и без¬
опасности гемотрансфузий.
Контроль качества компонентов крови должен проводиться на всех этапах:
(уг заготовки, хранения и транспортировки донорской крови и ее компонентов
до их клинического применения с соблюдением установленных стандартов. С этой
целью в европейских странах внедрена специальная система процедур наблюдения
за серьезными неблагоприятными или неожиданными явлениями либо реакция¬
ми доноров и реципиентов, а также наблюдение за эпидемиологическим статусом
доноров - haemovigilance («гемобезопасность»). Одно из основных требований этой
системы - обязательная прослеживаемость донорской крови и ее компонентов, т.е.
возможность идентификации донора и реципиента донорской крови и ее компонен¬
тов, а также результатов исследований. Это достигается путем регистрации соот¬
ветствующих данных медицинскими организациями на всех этапах, от заготовки
донорской крови или ее компонентов до их клинического использования (подроб¬
ней см. главу 7 «Гемобезопасность (haemovigilance)» настоящего раздела).
Медицинское освидетельствование включает сбор анамнестических данных,
медицинский осмотр (кожные покровы, слизистые, пульс, давление и др.) и лабо¬
раторные исследования (см. ниже). Медицинское (клиническое) обследование
донора осуществляется в отделении (кабинете) учета и комплектования донорских
кадров СПК и ОПК.
Помимо общих для всех видов донорства и категорий доноров требований,
медицинское обследование доноров имеет индивидуальные особенности для каж¬
дого вида донорства и категории доноров.
Медицинское освидетельствование доноров крови
Медицинское освидетельствование доноров крови включает сбор анамнеза
потенциального донора и медицинский осмотр. Перед каждой кроводачей опреде¬
ляют уровень гемоглобина в крови донора (табл. 7-1).
Таблица 7-1. Возможное содержание эритроцитов и гемоглобина в дозе донорской крови
Значение
показателя
Гематокрит, %
Средняя концентрация
гемоглобина, г/л
Доза крови,
мл
Эритроциты,
мл
Гемоглобин,
г
Среднее
45
140
450
202
69
Минимум
38
120
405
154
49
Максимум
49
160
495
243
87
Общий осмотр включает сбор анамнеза, осмотр кожных покровов, слизистых
оболочек и склер, пальпацию лимфатических узлов, аускультацию органов груд¬
ной клетки и пальпацию органов брюшной полости. Кроме того, донору измеряют
температуру тела, которая должна быть не менее 36 °С и не более 37 °С. Также
определяют частоту и ритмичность пульса. В норме пульс ритмичный, от 60 до 80
УД. /мин. Допустимые показатели артериального давления: систолическое —
90-140 мм рт.ст., диастолическое — 60-90 мм рт.ст.
При определении показаний к донорству, вида донорства и объема взятия крови
или ее компонентов врач руководствуется «Перечнем противопоказаний к донор-
СТВУ крови и ее компонентов», «Интервалами между видами донорства», а также
следующими нормативами:
S максимально допустимое число кроводач в год составляет 5 для мужчин и 4
Для женщин;
і стандартный объем заготовки крови составляет 450 мл ± 10% без учета коли¬
чества крови, взятой для анализа (до 40 мл).
174 СЛУЖБА КРОВИ
В течение 5 дней после каждой донации крови в объеме 400 мл наблюдается
снижение уровня гемоглобина на 10% исходного. Полное восстановление исхо-
дного уровня гемоглобина происходит примерно за 1 мес. Количество эритро¬
цитов обычно восстанавливается до исходного уровня немного раньше - через
15-25 дней. Однако необходимо учитывать различную способность кроветворной
системы к восстановлению в зависимости от возраста донора. Так, у лиц моложе
20 и старше 55 лет показатели гемопоэза возвращаются к исходным значениям
медленнее, поэтому для них введены некоторые ограничения по дозе сдаваемой
крови (обычно до 350 мл).
Лица с массой тела менее 50 кг и ростом менее 150 см допускаются к донорству
в индивидуальном порядке по усмотрению врача трансфузиолога. Объем кровода-
чи у них не должен превышать 12% объема циркулирующей крови (ОЦК), кото¬
рый в норме составляет 6,5-7% массы тела.
Как указано выше, перед кроводачей у донора определяют содержание гемо¬
глобина, группу крови и резус-фактор. Дальнейший скрининг донорской крови
проводится в лабораторных условиях по следующим показателям:
• группа, крови и резус-принадлежность;
• серологические исследования на сифилис;
• активность сывороточной аланинаминотрансферазы (АЛТ);
І поверхностный антиген вируса гепатита В;
• антитела к вирусу гепатита С;
• антитела к вирусам ВИЧ-1/2.
При повышении активности АЛТ менее чем в 2 раза донор отстраняется от кро-
водачи на 3 мес с последующим контрольным исследованием. При повторном
увеличении активности АЛТ в 2 раза и более донор отстраняется от донорства
и направляется на обследование. При наличии в регионе неблагоприятной эпиде¬
миологической ситуации по гепатитам вопрос о допуске к донорству лиц с двукрат¬
ным повышением активности АЛТ должен решаться органами Госэпиднадзора.
Дополнительные исследования донорской крови проводятся с учетом эпиде¬
миологической ситуации в регионе при согласовании с местными органами здра¬
воохранения и Госэпиднадзора.
Лица, регулярно сдающие кровь, плазму и клетки крови (активные доноры),
1 раз в год должны проходить медицинское освидетельствование, включающее
клинический анализ крови (табл. 7-2), рентгеноскопию или флюорографию орга¬
нов грудной клетки.
Таблица 7-2. Нормы состава периферической крови и биохимических показателей у доноров
Показатель
Пределы колебаний
Метод исследования
Гемоглобин
Не менее 130 г/л для мужчин,
не менее 120 r/л для женщин
Колориметрический метод
Гематокрит
0,40-0,48 л/л для мужчин,
0,38-0,42 л/л для женщин
Центрифужный метод
Количество эритроцитов
4,0-5,0х10’г л для мужчин,
3,8-4,7х10,г л для женщин
Подсчет в автоматическом счетчике
или в камере Горяева
СОЭ
2-10 мм/ч для мужчин,
2-15 мм/ч для женщин
Микрометод Панченкова
Количество тромбоцитов
180-320x10* л
Подсчет в камере Горяева, подсчет
в окрашенном мазке крови, подсчет
в автоматическом счетчике В
Количество лейкоцитов
(4-9) хЮ/л
Подсчет в камере Горяева, подсчет
а автоматическом счетчике Ш
Лейкоцитиая формула
Подсчет в окрашенном мазке __
папочкоядерные нейтрофилы |
1-6%
Подсчет в окрашенном мазке J
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 175
Окончание табл. 7-2
Показатель
Пределы колебаний
Метод исследования
пйгмвнтоядерные нейтрофилы
47-72%
Подсчет в окрашенном мазке
"базофилы
0-1%
эозинофилы
0,5-5%
моноциты
2-10%
""лимфоциты
18-38%
Билирубин
5,1-20,5 мкмоль/л
Метод Йендрашика
Аланинаминотрансфераза
0,1-0,68 ммоль/ч/л
Метод Райтмана и Френкеля
Общий белок сыворотки крови
65-85 г/л
Биуретовый метод
Белковые фракции сыворотки крови
Электрофоретический метод
альбумин
56,5-66,8%
глобулины
33,2-43,5%
а1-глобулины
3,5-6%
о2-глобулины
6,9-10,5%
р-глобулины
7,3-12,5%
у-глобулины
12,8-19%
Время свертывания крови
5-10 мин
Метод Ли-Уайта
Ретикулоциты
0,2-1,0%
Подсчет в окрашенном мазке
Активные доноры представляют справку лечебно-профилактического учрежде¬
ния (поликлиники по месту жительства или медсанчасти по месту работы) с ука¬
занием перенесенных заболеваний (раз в полгода или чаще по усмотрению врача
трансфузиолога) и справку из центра по вирусным гепатитам (в течение 3 мес
для гепатита Айв течение 6 мес для гепатитов В и С), а также другими инфек¬
ционными заболеваниями на 1 мес. Данные справки могут представляться чаще
по усмотрению регионального отдела Госэпиднадзора в зависимости от конкрет¬
ной эпидемиологической обстановки. Срок действия справок составляет 7 дней.
Доноры-женщины, регулярно сдающие кровь, представляют ежегодно заключе¬
ние гинеколога с данными о перенесенных заболеваниях, родах и оперативных
вмешательствах.
Медицинское освидетельствование доноров плазмафереза
Медицинское освидетельствование, общий осмотр и лабораторные исследова¬
ния доноров при плазмаферезе аналогично таковому при обычной даче крови.
Кроме того, при первичном освидетельствовании доноров плазмы осуществля¬
ются следующие дополнительные исследования:
• клинический анализ крови с определением количества тромбоцитов и рети¬
кулоцитов;
• содержание общего белка в сыворотке крови;
• белковые фракции сыворотки крови.
При повторных процедурах донорского плазмафереза определяют;
I содержание гемоглобина или гематокрит;
• СОЭ;
• содержание общего белка в сыворотке крови;
і количество лейкоцитов;
І клинический анализ крови с подсчетом тромбоцитов и ретикулоцитов (1 раз
В год);
• белковые фракции сыворотки крови (после каждых 5 плазмаферезов).
Если интервал между процедурами плазмафереза превышает 2 мес, донор
обследуется как при первичном освидетельствовании. При диспротеинемии донор
отводится от донорства на 1 мес. Если донор старше 40 лет, то 1 раз в год необхо¬
димо проводить электрокардиографию.
J76 СЛУЖБА КРОВИ
Максимальный объем плазмы, полученный от донора, не должен превышать 12
в год вместе с консервантом. Максимальная разовая доза, получаемая от донова
не должна превышать 600 мл. Интервалы между процедурами указаны в табл. 7-з ’
Таблица 7-3. Интервалы между различными видами процедур
1 Исходная процедура
Последующие процедуры
кроводача
плазмаферез
тромбоцитаферез
леикоцитафевет
І Кроводача
60
30
30
30
(Плазмаферез:
1 доза 250-300 мл
7-14
7-14
7-14
7-14
І доза 500-600 мл
14
14
14
14
1 Тромбоцитаферез
14
14
14
14
j Лейкоцитаферез
30
14
14
30
Объем донорской плазмодачи и кратность донорского плазмафереза варьирует
в зависимости от национальных рекомендаций каждой страны. Так, например,
в США. согласно «Руководству для донорских центров» (1993), при проведе¬
нии автоматического донорского плазмафереза количество плазмы, изымаемой
за одну процедуру, зависит от массы тела донора, а частота проведения плазмодач
не должна превышать двух раз в течение недели, т.е. шести раз в месяц и 60 л плаз¬
мы в год (табл. 7-4). Интервал между донациями тромбоцитов у доноров в США
должен быть не менее 48 ч, при этом тромбоцитаферез у одного донора должен
выполняться не более 2 раз в неделю или 24 раз в год.
Таблица 7-4. Максимальное количество плазмы, забираемой у доноров плазмафереза в США
Масса тела донора, кг
Масса изымаемой плазмы, г
50-67,5
705
68-78,9
846
79 и более
903
В соответствии с рекомендациями Совета Европы (1998) при проведении
донорского автоматического плазмафереза от донора однократно разрешено полу¬
чать до 700 мл плазмы (без учета антикоагулянта). Частота проводимых процедур
не должна превышать 2 раз в неделю. В течение года от одного донора разрешено
получать не больше 15 л плазмы, так как нет научных данных о влиянии изъятия
больших доз плазмы на здоровье доноров. Однако, несмотря на рекомендации
ВОЗ и Совета Европы, объем плазмы, получаемой от одного донора в течение года,
может быть изменен региональными и национальными компетентными органи¬
зациями. В частности, при рекомендованном объеме плазмы 15 л в год от одного
донора в Германии этот показатель составляет 25 л, а в Италии — 6 л.
Медицинское освидетельствование иммунных доноров
Медицинское освидетельствование иммунных доноров и скрининг крови про¬
водят по общим правилам для доноров крови и плазмафереза.
К иммунизации антигенами системы резус привлекаются мужчины в возрасте
18-50 лет и женщины в период менопаузы. Процедура иммунизации осущест¬
вляется в соответствии с действующей «Инструкцией по иммунизации доноров
для получения сыворотки и иммуноглобулина системы антирезус» Минздрава
России, утвержденной 9 января 1998 г.
Иммунизации стафилококковым анатоксином подвергаются только мужчины
I возрасте 20-40 лет. Женщины к иммунизации стафилококковым анатоксином
не допускаются. Процедура иммунизации осуществляется в соответствии с дей¬
ствующей «Инструкцией по иммунизации доноров стафилококковым анатокси¬
ном и проведению плазмафереза для получения антистафилококковой плазмы»,
утвержденной Минздравом России в 1977 г.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 177
Медицинское освидетельствование доноров клеток крови
Медицинское освидетельствование доноров клеток крови и лабораторное
обследование аналогично таковому для доноров крови.
Дополнительно при первичном обследовании перед цитаферезом определяют
время свертывания крови или время кровотечения по Дюке. За 1-7 дней до пер¬
вичного цитафереза проводят электрокардиографическое обследование, которое
необходимо повторять каждый год.
Медицинское освидетельствование доноров костного мозга
Медицинское освидетельствование доноров костного мозга и лабораторное
обследование аналогично таковому для доноров крови.
Дополнительно при подборе доноров костного мозга проводят тесты на инди¬
видуальную совместимость крови донора и реципиента как по групповой и резус-
принадлежности, так и по антигенам HLA.
Осложнения при донорстве
Среди возможных осложнений при донорстве крови выделяют местные, общие
и отдаленные осложнения.
МЕСТНЫЕ ОСЛОЖНЕНИЯ
К местным осложнениям относят такие последствия венепункции, как травмы
вены с развитием гематом (до 10% всех случаев кроводач), внесение инфекции
с возможным развитием абсцесса, флегмоны и местного тромбофлебита. Возможно
также развитие временного паралича руки вследствие прижатия локтевого нерва
при неправильном бинтовании.
Редко возможны также такие осложнения, как парез или паралич руки при оши¬
бочном уколе в нерв и эпикондилит локтевого сустава.
ОБЩИЕ ОСЛОЖНЕНИЯ
Общие осложнения после сдачи крови наступают в результате раздражения
блуждающего нерва и инверсной абдоминальной вазодилатации или в результате
вазоконстрикции. Первый вид осложнений является более частым и характерен
для молодых людей, а второй — для пожилых старше 55 лет.
У некоторых доноров, обыкновенно при первой кроводаче, могут появляться
следующие симптомы: слабость, бледность, повышенное потоотделение, рвота
без нарушений сердечной деятельности, без понижения АД и без потери сознания.
Это состояние проходит быстро и без медицинского вмешательства.
У определенной части доноров возможно наступление патологического состоя¬
ния, называемого синкопе. В продромальном периоде наблюдаются ощущение
жара, головокружение. При развитии реакции появляются бледность и потливость
(в 2/3 случаев), понижение АД, расширение зрачков и рвота; после этого наступает
потеря сознания (в 95% случаев), часто с мышечными судорогами или генерали¬
зованными конвульсиями (до 28% случаев). Иногда наступает непроизвольное
мочеиспускание.
Синкопальные состояния проходят за несколько минут, после исчезновения
острой мозговой гипоксии. Донора укладывают горизонтально, с согнутыми
в коленях ногами и дают тонизирующие средства.
По мнению некоторых авторов, частота синкопальных состояний колеблется
от 2,9 до 6,8%.
Интересное явление — так называемое эпидемическое синкопе. Если у одно-
го Донора из группы наблюдается синкопальное состояние, то оно появляется
ГЛАВА
J78 СЛУЖБА КРОВИ
I У других доноров группы. Вероятно, Причина ЭТОГО осложнения — неустойки
вость нервной системы доноров. и"
Реакции общего характера, обусловленные раздражением блуждающего цс.
встречаются главным образом у людей, сдающих кровь впервые. С возрастом Щр
35 лет у женщин и 45 лет у мужчин) их частота уменьшается приблизительно на 50%
Некоторые авторы считают, что нейроциркуляторная дистония с повышенным то»!'
сом блуждающего нерва благоприятствует развитию этой реакции. Наиболее важ
ный фактор наступления подобных реакций — соответствующее психологическое
состояние донора (беспокойство и страх перед сдачей крови). Часто неоднократное
и болезненное пунктирование вены, сопровождающееся длительным взятием крови
вызывает у донора беспокойство и может способствовать возникновению реакции.
Синкопальные состояния наблюдаются чаще в тех случаях, когда температу.
ра в помещении, где проводится взятие крови, слишком высокая и в помещении
душно.
Дополнительные факторы развития общих реакций и осложнений - это работа
в ночную смену, бессонная ночь, продолжительная поездка, обильное питание
или продолжительное голодание перед сдачей крови. Для предотвращения раз¬
вития синкопе после окончания донации донору рекомендуют оставаться в полу¬
лежачем положении в течение не менее 5 мин.
Также, хотя и редко, в результате сдачи крови могут возникнуть тяжелые
сердечно-сосудистые и мозговые осложнения.
Процедура сдачи крови оказывает на донора стрессовое воздействие. Обычно
клинически это проявляется увеличением ЧСС и частоты дыхания. Значительное
возрастание частоты дыхания может привести к развитию гипервентиляционного
синдрома. Для лечения этого осложнения рекомендуют ингаляции смеси, обога¬
щенной углекислым газом, и внутривенное введение глюконата кальция.
При технических ошибках возможно развитие воздушной эмболии. Она про¬
является цианозом, одышкой, учащением дыхания, сильным кашлем и тахикар¬
дией. Серьезная опасность для жизни донора существует, когда объем введенного
воздуха превышает 30 мл. В этом случае донора укладывают на левый бок и дают
дышать кислородом. В случае необходимости применяют нейролептики и сред¬
ства, улучшающие сердечную деятельность и периферическое кровообращение.
В целях оказания неотложной медицинской помощи донорам при возникно¬
вении у них реакций и осложнений в отделениях заготовки крови, плазмафе¬
реза, выездных бригадах необходимо иметь набор медикаментов и оснащения.
При любых осложнениях наряду с оказанием неотложной медицинской помощи
следует вызвать бригаду станции скорой помощи.
ОТДАЛЕННЫЕ ОСЛОЖНЕНИЯ
К отдаленным осложнениям относят возможное развитие у доноров крови
нарушения обмена железа.
Показано, что у доноров регулярной кроводачи и плазмафереза существует про¬
блема нарушений в обмене железа (Суханов и соавт., 2008). На фоне нормальных
общепринятых в службе крови нормативных клинико-лабораторных показателей
дефицит железа сыворотки крови обнаружен в среднем у 25% обследованных доно¬
ров, а тканевые запасы железа были снижены у 9% обследованных доноров. Сходные
результаты получили и японские исследователи Центра Красного Креста г. Аичи,
отметившие существенное снижение тканевых запасов железа при повторных афере-
зах, особенно среди доноров-женщин, сдававших плазму более 21 раза (Furuta et al.,
1999). Эти факты указывают на необходимость включить в перечень обязательных
методов исследования доноров определение показателей, отражающих обмен железа
в организме (ферритина и др.). Это позволит своевременно выявлять лиц, требующих
углубленного клинического и лабораторного обследования, и определять способы
профилактики и при необходимости медикаментозной коррекции этих нарушении.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 178
ОКАЗАНИЕ НЕОТЛОЖНОЙ МЕДИЦИНСКОЙ ПОМОЩИ ДОНОРАМ КРОВИ
Мероприятия по оказанию медицинской помощи донорам, состав укладок
и последовательность проведения посиндромной неотложной терапии представ¬
лены ниже (табл. 7-5).
Противопоказания к донорству крови и ее компонентов
Противопоказания к донорству разделяют на абсолютные и временные.
При наличии абсолютных противопоказаний донора отводят от донаций неза¬
висимо от давности заболевания и результатов лечения. При наличии временных
противопоказаний донора отводят от донаций на определенный срок.
В соответствии с приложением к приказу Минздрава РФ №364 от 14.09.2001 г. I
к абсолютным противопоказаниям относят следующие заболевания.
• Гемотрансмиссивные заболевания:
Ф инфекционные:
I СПИД, носительство ВИЧ-инфекции (а также группа риска: гомосек¬
суалисты, наркоманы, проститутки); .... ч"^Г*^у • I . •
- сифилис (врожденный или приобретенный);
- вирусные гепатиты В и С;
- туберкулез (все формы);
- бруцеллез;
- сыпной тиф;
- туляремия;
- лепра;
паразитарные:
- эхинококкоз;
- трипаносомоз;
- филяриатоз;
- ришта;
- лейшманиоз.
І Соматические заболевания:
❖ злокачественные новообразования;
❖ болезни крови;
<>■ органические заболевания ЦНС;
•О полное отсутствие слуха и речи;
■О психические заболевания;
■О наркомания, алкоголизм;
•О сердечно-сосудистые заболевания:
- гипертоническая болезнь 11-111 стадий;
- ишемическая болезнь сердца;
- атеросклероз, атеросклеротический кардиосклероз;
- облитерирующий эндоартериит, неспецифический аортоартериит, реци¬
дивирующий тромбофлебит;
- эндокардит, миокардит;
- порок сердца;
Ь болезни органов дыхания:
- бронхиальная астма;
І бронхоэктатическая болезнь, эмфизема легких, обструктивний бронхит,
диффузный пневмосклероз в стадии декомпенсации;
Ъ болезни органов пищеварения:
~ ахилический гастрит;
~ язвенная болезнь желудка и двенадцатиперстной кишки (активная
форма);
ISO СЛУЖБА КРОвИ
Твблмца 7-5, Состав укладок и последовательность проведения посиндромной неотложной те
ним (согласно письму М3 РСФСР от 05.06.1989 №20/03-306) Pa'
Т
Состав укладок
{Обморок
(Нашатырный спирт.
(Кислород
Кофеин 2.0 мл
Мероприятия
Коллапс Кофеин 2.0 мл.
Меза тон 1,0 мл.
Изотонический раствор
хлорида натрия 200.0 мл
Преднизалон
Стенокардия (Анальгин 50%.
напряжения ІДролеридол 30,0 мл.
Димедрол 1%.
Платифиллин 2,5%.
Преднизолон 90 мг.
Реополигпюкин 400,0 мл
Нктросорбид
Анафилак- (Преднизолон для внутри-
тинеский венного введения 90 мг.
шок Мезатон1,0мл.
Димедрол 1,0%.
ІПолиглюкин 400,0 мл.
(Изотонический раствор
{хлорида натрия
Клиническая Адреналин 0,1%, 1,0 мл.
смерть (Атропин 0,1 %, 1,0 мл.
Изотонический раствор
хлорида натрия 200,0 мл
Перевод в положение Тренделенбурга
(голова донора ниже ног).
Нашатырный спирт поднести к носо¬
вым ходам донора на ватном тампоне
Ингаляции кислорода.
Кофеин 2,0 мл внутримышечно
Перевод в положение
Тренделенбурга (голова донора ниже
ног).
Ингаляции кислорода.
Преднизолон 90 мг внутримышечно.
Кофеин 1-2 мл внутривенно
Нитросорбид под язык.
Ингаляции кислорода
Дополнительно
При отсутствии эффекта —
0,5 мл мезатона в 10,0 мл
изотонического раствора хло¬
рида натрия внутривенно
Ингаляции кислорода.
Преднизолон 90 мг внутривенно.
Мезатон 0,5 мл внутривенно.
Димедрол 2,0 мл в 10% изотони¬
ческом растворе хлорида натрия
внутривенно
При постановке диагноза «остановка
сердца» больного уложить на ровную
твердую поверхность, зафиксировать
время, сделать попытку механической
дефибрилляции сердца (короткий
удар ребром ладони или кулаком
по грудине), при отсутствии эффекта
фиксировать язык языкодержателем,
ввести воздуховод в рот, приступить
к искусственному дыханию «рот
в рот». Одновременно проводить
закрытый массаж сердца, ввести вну¬
тривенно 1,0 мл адреналина, 1,0 мл
атропина в 5,0—10,0 мл изотоническо¬
го раствора хлорида натрия. На голо¬
ву донора положить лед или полотен¬
це, смоченное холодной ВОДОЙ ;
При отсутствии эффекта—
2,0 мл анальгина, 2,0 мл дро-
перидола, 1,0 мл димедрола
и 12,0 мл платифиллина.
При развитии кардиогенного
шока — 90 мг преднизолона
и 0,5 мл мезатона, инфузия
реополиглюкина
При отсутствии эффекта—
переливание полиглюкина
При любых осложнениях наряду с оказанием неотложной медицинской помощи следует вызвать специали-
зированную бригаду станции скорой помощи
Перечень оснащения, необходимого для оказания неотложной медицинской помощи (согласно письму М3
РСФСР от 05.06.89 г. №20-03/306):
ручной дыхательный аппарат типа АДР-1 или ДЛ-10 (2 шт.), или АМБУ;
языкодержатель, 2 шт.;
воздуховод, 2 шт.;
шприцы одноразового пользования на 10,0 мл, 6 шт.;
шприцы одноразового использования на 5,0 мл, 6 шт.;
иглы однократного пользования для внутривенных и внутримышечных инъекций, 2 шт.;
иглы для внутрисердечных инъекций, 2 шт.;
ватные тампоны, 10 шт.;
спирт этиловый 70%, 50,0 мл;
системы для внутривенного введения инфузионных растворов, 10 шт. —-—
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИИ СЛУЖБЫ КРОВИ 181
Ф- заболевания печени и желчевыводящих путей:
- хронические заболевания печени, в том числе токсической природы
и неясной этиологии; V’-щ
- калькулезный холецистит с повторяющимися приступами и явлениями
холангита;
- цирроз печени;
Ф заболевания почек и мочевыводящих путей в стадии декомпенсации:
- диффузные и очаговые поражения почек;
- мочекаменная болезнь;
Ф- диффузные заболевания соединительной ткани;
Ф лучевая болезнь;
§ болезни эндокринной системы в случае выраженного нарушения функций
и обмена веществ;
Ф- болезни ЛОР-органов:
- озена;
- прочие острые и хронические тяжелые гнойно-воспалительные заболе¬
вания;
-О- глазные болезни:
І остаточные явления увеита (ирит, иридоциклит, хориоретинит);
І высокая миопия (6 D и более);
- трахома;
- полная слепота;
Ф кожные болезни в стадии обострения;
- распространенные заболевания кожи воспалительного и инфекционного
характера;
- генерализованный псориаз, эритродермия, экземы, пиодермия, сикоз,
красная волчанка;
I пузырчатые дерматозы;
- грибковые поражения кожи (микроспория, трихофития, фавус, эпидер¬
мофития) и внутренних органов (глубокие микозы);
I гнойничковые заболевания кожи (пиодермия, фурункулез, сикоз);
щ остеомиелит острый и хронический;
❖ оперативные вмешательства по поводу резекции органа (желудок, почка,
желчный пузырь, селезенка, яичники, матка и пр.) и трансплантации орга¬
нов и тканей.
При наличии у доноров заболеваний, не вошедших в данный список, вопрос о донор¬
стве решается врачом терапевтом (при необходимости после консультаций со спе¬
циалистами).
К временным противопоказаниям относят следующие (табл. 7-6).
Таблица 7-6. Временные противопоказания к донорству крови
Перенесенные заболевания и состояния
Отвод от донорства
Инфекционные заболевания, не указанные в разделе
«Абсолютные противопоказания»: малярия в анамнезе
в отсутствие симптомов и отрицательных результатов имму¬
нологических тестов, брюшной тиф после выздоровления
и полного клинического обследования в отсутствие выра¬
женных функциональных расстройств, ангина, грипп, ОРВИ
после выздоровления
13 мес
Прочие инфекционные заболевания после выздоровления
6 мес
Экстракция зуба
10 дней
Острые или хронические воспалительные процессы в стадии
обострения, независимо от их локализации, температура тела
выше 37,0 °С
1 мес после купирования острого периода
182 СЛУЖБА КР08И
Перенесенные заболевания и состояния
— щршб
Отвод от донорства
! вегвтососудистая дистония
1 мес ' ~"'
| Аллергические заболевания в стадии обострения
2 мес после купирования острого пеїмур •
I Период беременности и лактации
Не менее 1 года после родов, не менеТзиГ"
после окончания лактации
[ Период менструации
Не менее 5 дней после окончания
струации
1 Прививки убитыми вакцинами (гепатит В, столбняк, дифте-
1 рия. коклюш, тиф и паратиф, холера, грипп), анатоксинами
10 дней ІШі
1 Прививки живыми вакцинами (бруцеллез, чума, туляремия,
вакцина БЦЖ (бацилла Кальмета-Герена), оспа, краснуха,
І полиомиелит (перорально), введение противостолбнячной
сыворотки (при отсутствии выраженных воспалительных
j явлений на месте инъекции)
1 мес 1
Введение иммуноглобулина против гепатита
1 год
Вакцина против бешенства
1 ГОД
Реакция Манту
2 нед
Прием лекарственных препаратов: антибиотики
2 нед после окончания курса
Анальгетики и салицилаты
3 дня
Употребление алкоголя
48 ч
Кроме вышеперечисленных противопоказаний к донорству крови, возможно
наличие у потенциального донора высокого риска вирусного заражения, например
после посещения стран, эндемичных по заболеваниям, возбудители которых пере¬
даются парентеральным путем. В таком случае донор также временно отводится
от донаций.
В табл. 7-7 перечислены факторы риска заражения гемотрансмиссивными инфек¬
циями (подробнее см. раздел «Трансфузионная иммунология»).
Таблица 7-7. Факторы риска заражения гемотрансмиссивными заболеваниями
Заболевания состояния
Отвод от донорства
Трансфузии крови, ее компонентов (исключение составляют ожоговые рекон-
валесценты и лица, иммунизированные к резус-фактору)
6 мес
Операции, в том числе аборты (необходимо предоставление справки о характе¬
ре и дате операции из того лечебного учреждения, где она была произведена)
Не менее чем на 6 мес
после операции
Нанесение татуировки или лечение иглоукалыванием
1 год с момента окончания
процедур
Пребывание в заграничных командировках длительностью более 2мес
6 мес
Пребывание в эндемичных по малярии странах тропического и субтропического
климата (Азия, Африка, Южная и Центральная Америка) в течение более 3 мес
Згода
Контакт с больными гепатитом (А, В или С)
3 мес-1 год
Планирование донорства
Для рационального использования донорских кадров в учреждениях Службы
крови при планировании донорства выделяют следующие группы доноров:
• доноры крови — для обеспечения потребности лечебно-профилактических
учреждений в эритроцитсодержащих компонентах;
і доноры плазмы и клеток крови — для заготовки плазмы и клеток крови мето¬
дами плазмоцитафереза;
• аутодоноры — для дооперационного резервирования аутологичных эри¬
троцитов и плазмы с последующим их использованием во время и после
плановых хирургических операций (подробнее см. главу «Аутодонорство
и аутогемотрансфузии»).
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 183
П0и составлении плана работ (годового, месячного и др.) требуемое число
норов крови определяют, основываясь на анализе итогов работы СПК за преды-
^шие 3 года, а также исходя из прогнозируемой потребности ЛПУ в компонентах
2юви, в том числе для замены и пополнения запасов гемотрансфузионных средств
|| ис’пользования в чрезвычайных условиях.
Общее число доноров крови, включенных в план, должно быть четко согласо¬
вано с потребностью в эритроцитсодержащих компонентах, чтобы максимально
Тратить их избыток и последующую утилизацию по истечению сроков хране¬
ния.
Годовой план комплектования доноров должен предусматривать случаи, когда
«сальная потребность в гемокомпонентах оказывается выше прогнозируемой, на¬
пример вследствие природных или техногенных катастроф.
В целях обеспечения равномерного потока доноров в операционную необхо¬
дима организация их поступления на пункт заготовки крови с учетом пропускной
способности операционной, условий работы предприятия, учебного заведения
и т.п.
При массовой заготовке крови количество лиц, включаемых в списки потен¬
циальных доноров, конкретизируется за 5-7 сут до проведения Дня донора
с учетом потребности СПК в эритроцитсодержащих компонентах и обстановки
в учреждении (предприятии, воинской части и т.п.). В этот же период целе¬
сообразно провести отбор лиц с требуемой групповой и резус-принадлежностью
крови (при необходимости), изучение медицинских карт (книжек, протоколов
предыдущих кроводач), собеседование, а в необходимых случаях - анкетиро¬
вание с целью недопущения к донорству лиц, имеющих прямые или косвенные
признаки возможного носительства гемотрансмиссивных инфекций, склонности
к алкогольному или наркотическому опьянению. Четкое выполнение этих задач
достигается путем налаживания взаимодействия СПК-учреждение и позволяет
снизить показатели брака крови, необоснованного расходования дорогостоящих
тест-систем и повысить безопасность заготавливаемых средств.
Заготовка крови и плазмы
Заготовка крови строго регламентирована и осуществляется в соответствии
со следующими инструктивными документами:
і инструкцией по заготовке и консервированию донорской крови от 29 мая
1995 г.;
s инструкцией по проведению донорского прерывистого плазмафереза
от 23 сентября 2002 г. согласно приказу М3 РФ №295;
і инструкцией по проведению автоматического донорского плазмафереза
на аппарате Haemonetics (Гемонетик) PCS-2 от 25 января 1999г.;
І инструкцией по заготовке тромбоцитов от одного донора методом прерыви¬
стого тромбоцитафереза с применением полимерных контейнеров;
I приказом М3 РФ от 3 июля 2001 г. №244/63 «О внедрении в работу учреж¬
дений Службы крови устройств для удаления лейкоцитов из донорской
крови»;
• приказом М3 РФ от 7 мая 2003 г. №193 «О внедрении в практику работы
Службы крови в Российской Федерации метода карантинизации свежезамо¬
роженной плазмы».
ТРЕБОВАНИЯ К ПОМЕЩЕНИЮ ДЛЯ ЗАГОТОВКИ КРОВИ
Организация заготовки крови должна обеспечивать условия для получения
хорошо стабилизированной, биологически полноценной, апирогенной и сте¬
рильной консервированной крови. В настоящее время хорошо отработаны
184 СЛУЖБА КРОВИ
организационно-методические вопросы заготовки крови как в стационарных, так
и в выездных условиях.
Заготавливают кровь в стационарных условиях в боксированных или небок-
сированных операционных, во время выезда — в операционных, развернутых
в приспособленных помещениях, а также в операционных, смонтированных
на автомашинах, в железнодорожных вагонах и других транспортных средствах.
Отличие боксированной операционной от обычной состоит в том, что в первой
медицинский персонал отделен от донора перегородкой с окном для руки донора.
Сам донор находится вне операционной на донорском столе. Такая организа¬
ция взятия крови позволяет добиваться большей стерильности непосредственно
в операционной. С внедрением в практику стерильных одноразовых пластиковых
систем для забора донорской крови необходимость в боксированных помещениях
отпала.
Планировка и размеры помещений для заготовки крови должны предусматри¬
вать комнаты для регистрации доноров, их медицинского освидетельствования
врачом, лабораторного исследования крови у доноров (группа крови, показатель
гемоглобина), операционную для взятия крови, помещение для отдыха и оказания
помощи донорам в случае обморочного состояния, помещение для выдачи доно¬
рам денег и справок.
При планировке рабочих мест необходимо обеспечивать последовательность
прохождения донорами всех этапов, связанных со взятием крови, исключить
встречный поток доноров и скопление больших групп на отдельных этапах работы.
Под операционную выделяют наиболее чистые и светлые комнаты, в которых
легко провести влажную санитарную обработку и разместить необходимое коли¬
чество донорских мест из расчета 5-8 м2 на каждое. Очень важно соблюдение
температурного режима.
В операционной должно находиться только необходимое для работы оборудо¬
вание с поверхностью, легко поддающейся влажной уборке:
• столы или стулья (кресла) с легко обрабатываемой поверхностью (донорские
места);
• стол операционной сестры, на котором размещают полимерные контейнеры
с консервирующим раствором, флаконы-спутники, биксы со стерильным
материалом, банки с антисептическими растворами;
к подставки для полимерных контейнеров;
• столы (тумбочки), на которых находится перевязочный материал (бинты,
салфетки) и предметы, необходимые для первичной паспортизации контей¬
неров с донорской кровью;
і стол (место) для термоконтейнеров для транспортировки контейнеров
с донорской кровью;
• эмалированные баки или ведра с крышкой для сбора использованных систем
с отработанным материалом.
Операционную тщательно проветривают и проводят влажную уборку с помо¬
щью горячего (50°С) мыльного раствора с последующим применением дезин¬
фицирующих средств (3% раствор перекиси водорода с 0,5% моющим средством
или 2% раствор хлорамина) для обработки поверхностей.
Инвентарь, предназначенный для обработки операционной (ведра, щетки,
ветошь) после проведения донаций.
Доноры входят в операционную в своей одежде и обуви. В случае сильного
загрязнения одежду и обувь снимают, надевают медицинский халат и тапочки
(бахилы).
Во время работы в операционной персонал и доноры должны соблюдать тиши¬
ну и порядок, не допускать излишних хождений, разговоров, не нарушать потока
доноров.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖД ЕНИЙ СЛУЖБЫ КРОВИ 185
ЗАГОТОВКА крови в выездных условиях
Выездная бригада учреждения Службы крови (совместно с представителями
местных организаций Общества Красного Креста) организует пункт заготовки
крови, обеспечивает медицинское освидетельствование доноров, их регистра¬
цию. взятие крови, выдачу донорам справок для получения дня отдыха или денег
на обед, а также значков и открыток с благодарностью.
Расстановка персонала и его обязанности
расстановка персонала во время работы в выездных условиях должна обеспечи¬
вать рациональное проведение регистрации, обследования и взятия крови у доно¬
ров при минимальных затратах времени. Продолжительность пребывания донора
на пункте заготовки крови должна быть максимально сокращена.
Состав выездной бригады следующий.
• руководитель выездной бригады:
❖ осматривает и контролирует подготовку помещений для работы бригады;
несет ответственность за организацию всех этапов заготовки крови от
доноров, за комплектование, оснащение и оборудование выездной брига¬
ды;
❖ проводит разъяснительные беседы по вопросам донорства с лицами, явив¬
шимися на сдачу крови.
І Медицинский регистратор (в выездных условиях может назначаться из числа
санитарного актива учреждения) заполняет карту или контролирует запол¬
нение донорами «Карты учета донора резерва, родственника» и «Учетной
карточки активного/резервного донора» (ф. №238) для единого донорского
центра.
• Лаборант:
g определяет у доноров показатель гемоглобина и групповую принадлеж¬
ность крови (АВО);
❖ вносит в «Карту учета донора резерва, родственника» показатель гемогло¬
бина;
❖ наклеивает комплект клеевых марок. Марки имеют единый номер.
Одну марку лаборант наклеивает в погрупповой лист, против которой
записывает фамилию, имя, отчество донора. Оставшиеся марки наклеива¬
ет на «Карту учета активного/резервного донора» (ф. 405/у, 407/у по при¬
казу М3 СССР №155 от 12 апреля 1990 г.).
І Врач терапевт, согласно действующему «Порядку медицинского обследования
донора крови и ее компонентов», проводит обследование донора. При наличии
противопоказаний к кроводаче отмечает в карточке причину отвода.
I Помощник эксфузиониста (жгутист):
$ сверяет фамилию, имя, отчество донора с данными учетной карточки
путем его опроса;
Ф накладывает жгут на нижнюю треть плеча донора;
Ъ наблюдает за состоянием донора в процессе взятия крови;
Ф после кроводачи снимает жгут;
Ф накладывает повязку на место венепункции;
маркирует контейнер с кровью и флаконы-спутники наклеиванием в при¬
сутствии донора марок, прикрепленных к его учетной карточке, т.е. осу¬
ществляет первичную паспортизацию заготовленной крови;
Ф при необходимости оказывает донору помощь (при недомоганиях, обмо¬
роках).
• Операционная медицинская сестра:
Ь подготавливает контейнеры с консервирующим раствором, а также при¬
крепляет к полимерному контейнеру флаконы-спутники для взятия крови,
предназначенной для анализов;
ШМ»7
186 СЛУЖБА КРОВИ
р дважды обрабатывает место венепункции антисептическим растворов
§р после наложения зажима на систему для взятия крови производит вёц
пункцию и снимает зажим с системы;
ф следит за поступлением крови в контейнеры и периодически перемещива
ет кровь с консервирующим раствором, если нет автоматической меша*»
(рис. 7-2); **
Рис. 7-2. Весы для компонентов крови с функцией автоматического перемешивания («покачивания»)
❖ после заполнения кровью емкости с гемоконсервантами накладывает
зажим на систему для взятия крови, заполняет из системы флаконы-
спутники, после снятия жгута с плеча извлекает иглу из вены донора;
р на место венепункции накладывает стерильный марлевый тампон и фик¬
сирующую его повязку;
❖ контролирует в присутствии донора правильность фамилии, имени и отче¬
ства, группы крови, маркировки контейнеров с кровью и флаконов-
спутников.
I Медицинский регистратор:
V на основании данных карточки регистрации выдает донору справку
об освобождении от работы и талон на обед (или деньги);
я? по окончании работы сдает учетные карточки доноров в Единый донор¬
ский центр дацной административной территории.
• Шофер выездной бригады осуществляет перевозку бригады, оборудования,
крови, материалов, выполняет работы по указанию руководителя бригады,
участвует в погрузке, расстановке и монтаже оборудования и других вспомо¬
гательных работах.
• Санитарка-буфетчица (назначается из числа санитарного актива предпри¬
ятия) обеспечивает доноров перед кроводачей чаем с белым хлебом (пече¬
ньем, сухарями).
• Передвижные транспортные средства для заготовки крови и ее компонентов.
Во многих странах значительный объем донорской крови заготавлива¬
ют в выездных условиях. Для этих целей применяют специализированные
передвижные транспортные средства — автомобили (автобусы или прицепы)
с соответствующим оснащением, позволяющим заготавливать донорскую кровь
на выезде (рис. 7-3). Так, в ряде штатов США около половины объема донор¬
ской крови заготавливается на выезде при помощи автомобильного транспор¬
та. В России также разработаны специальные передвижные пункты заготовки
крови. Так, например, подвижный комплекс заготовки крови ПКЗК-2 предназна-
ОРГАНИЗАЦИЙ РАБОТЫ УЧРЕЖДЕНИЙ СІТУЖЬЬі КРОвИ 117
чей для трансфузиологического обеспечения раненых, пораженных и больных,
пополнения первоначальных запасов консервированной крови и ее компонентов
„угем заготовки консервированной крови в полевых условиях от доноров экс¬
тренного резерва в мирное и военное время в составе военно-полевых госпи¬
талей и медицинских отрядов специального назначения (рис 7-4). ПКЗК 2
рассчитан на эксплуатацию в любое время года и суток в макроклнматическом
районе с умеренным климатом (по ГОСТ 15150-69). ПКЗК-2 оснащен прибо¬
рами для освещения, обогрева, охлаждения и вентиляции внутреннего объема
кузовов-фургонов к кузовов-контейнеров для создания оптимальных условий
работы личного состава.
Рис. 7-3. Ручной запаиватель магистралей полимерных гемоконтейнеров
Рио» 7-4. Заготовка донорской крови в выездных условиях в подвижном комплексе
Подвижные комплексы заготовки крови выполняют следующие задачи:
• перевозка выездной бригады к месту развертывания комплекса и обратно,
а также транспортирование оборудования с сохранением его технических
характеристик;
І прием кандидатов в доноры и проведение у них лабораторных исследований
группы крови с определением уровня гемоглобина:
• проведение одномоментной эксфузии и операций плазмафереза у донором:
• проведение первичного фракционирования крови;
РАЗДЕЛИ
188 СЛУЖБА КРОВИ
І обеспечение условий хранения и транспортирования заготовленной консе
вированной крови, ее компонентов и свежезамороженной плазмы с соблюд
нием необходимых температурных режимов;
• трансфузиологическое обеспечение лечебных мероприятий, проводи^
раненым, пораженным и больным.
Передвижной комплекс оснащается всем необходимым оборудованием (ход0.
дильными камерами, аппаратами для плазмафереза, центрифугами, комгтып.
терной техникой) для осуществления автономного сбора, хранения, фракцио¬
нирования И доставки Крови И ее компонентов. Передвижной комплекс Может
функционировать как от внешней сети трехфазного переменного тока с напряже-
нием 380/220 В и частотой 50 Гц, так и от переносных электроагрегатов, транспор.
тируемых в кузовах-фургонах и кузовах-контейнерах; от аккумуляторных батарей
и преобразователей энергии (24-220 В) в донорском отделении.
Пропускная способность передвижного комплекса при заготовке крови I
10доноров/ч (при одновременном обслуживании в операционном отделении двух
доноров). Средняя производительность составляет 25 л консервированной крови
за 5 ч работы. Очевидно, что в скором времени и в нашей стране метод сбора крови
и ее компонентов на выезде с использованием транспортных систем типа ПКЗК-2
будет возрастать.
Опыт проведения выездов для забора донорской крови в высшие учебные
заведения отделением трансфузиологии РНЦХ им. академика Б.В. Петровского
РАМН
Отделение трансфузиологии РНЦХ им. академика Б.В. Петровского РАМН
регулярно организует выездные бригады, забирающие донорскую кровь в различ¬
ных организациях г. Москвы, в том числе в двух вузах — Московском институте
радиотехники, электроники и автоматики (МИРЭА) и в Российском государствен¬
ном технологическом университете им. К.Э. Циолковского (МАТИ РГТУ).
250
200
150
100
50
0
Рис. 7-5. Число студентов-доноров крови в 2005-2007 гг.
Многолетний опыт работы показывает, что донорство крови среди студентов
в значительной степени зависит от двух составляющих: адекватной своевременной
информационной обеспеченности акции (пропаганда донорства крови, инфор¬
мирование потенциальных доноров о безопасности процедуры донации крови,
социально-общественной и медицинской важности донорства, месте, условиях
и времени проведения акции) и степени готовности администрации принимаю¬
щей стороны (ректората, студенческих союзов и/или организаций) к проведению
Дня донора. Согласования между отделением трансфузиологии и институтом,
где планируется День донора, проводят при участии Общества Красного Креста
и Полумесяца.
~~— ~
IV.2005 XI.2005 IV.2006 XI.2006 IV.2007 XI.2007
■ МИРЭА ш МАТИ
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 189
Два раза в год (в апреле и ноябре) в МИРЭА и МАТИ выезжает бригада отделе¬
ния трансфузиологии для забора крови. Так, например, за период с 2005 по 2007 г.
проведено по 6 выездов в год (рис. 7-5). В среднем за один выезд заготавлива¬
ли кровь от 45-200 студентов. Можно видеть, что с каждым годом количество
доноров снижалось (так, в МИРЭА число доноров снизилось в 2 раза за 3 года).
Как было сказано выше, это связано с рядом факторов, в том числе с отсутствием
государственных программ агитации и поддержки донорства в России, неудовлет¬
ворительной работой общественных организаций, в первую очередь Общества
Красного Креста. Данная ситуация отражает общие тенденции современного
состояния донорства крови в России.
Для изучения инфекционной безопасности донорской крови был проана¬
лизирован брак по инфекционным маркерам и уровню AJ1T за те же 3 года
(рис. 7-6).
16
14
12
10
8
6
4
2
0
Рис. 7-6. Количество доз крови, забракованных по причине превышения уровня АЛТ от доноров-
студентов
Частота обнаружения маркеров гемотрансмиссивных инфекций (табл. 7-8,
7-9) среди доноров-студентов, сдающих кровь на выезде, не превышает таковую
у доноров, сдающих кровь в стационарных условиях.
Таблица 7-8. Распределение ВИЧ и сифилиса
Год
Вуз
ВИЧ
Сифилис
2005
МИРЗА
-
1
МАТИ
-
■-
2006
МИРЭА
-
-
МАТИ
-
-
2007
МИРЭА
1 (в «серой» зоне)
-
МАТИ
-
-
Таблица 7-9. Распределение гепатитов В и С
Год
Вуз
Гепатит В
Гепатит С
2005
МИРЭА
1
-
МАТИ
-
-
2006
——I
МИРЭА
1
1
МАТИ
1
-
Несмотря на некоторое снижение общего количества доноров в последние
годы, можно говорить о безусловной эффективности проведения заготовки крови
IV.2005 ХІ.2005 IV.2006 ХІ.2006 IV.2007 ХІ.2007
■ МИРЭА ■ МАТИ
190 СЛУЖБА КРОВИ
в выездных условиях. Так, например, из общего ежегодного объема заготав
мой крови отделением трансфузиологии РНЦХ им. академика Б.В. Петпп И8а*'
РАМН 25-35% донорской крови заготавливается в выездных условиях в оп0*^
эациях. на предприятиях и в вузах.
Переработка крови на компоненты
ЗАГОТОВКА КОМПОНЕНТОВ КРОВИ ПУТЕМ ФРАКЦИОНИРОВАНИЯ ЦЕЛЬНОЙ
КОНСЕРВИРОВАННОЙ КРОВИ
С середины прошлого века в гемотрансфузионной медицине используют искл
чительно гемокомпонентную гемотерапию. В условиях нормально функционип*!
ющей системы Службы крови гемотрансфузию цельной консервированной кров
уже не применяют в клинической практике. Гемотерапию необходимо ВЫПОЛНЯТЬ
строго по показаниям и исключительно теми компонентами крови, в которых
испытывает недостаток организм больного.
Необходимость перехода от гемотрансфузий цельной консервированной крови
к компонентной гемотерапии была обусловлена следующими факторами.
• За почти полувековой период со дня открытия групп крови человека постепен¬
но накопились сведения, указывающие на то, что цельная консервированная
кровь приносит не только пользу, но и имеет отдельные недостатки, которые
выражаются в различных посттрансфузионных реакциях и осложнениях.
і С течением времени стало очевидным, что нет необходимости переливать
цельную кровь больному, которому для коррекции нарушений в отдельном
звене требуется только один из компонентов (например, для коррекции ане¬
мии необходимы только эритроциты, а для возмещения факторов свертыва¬
ния достаточно плазмы крови),
і Поскольку все компоненты крови различны по своим функционально¬
физиологическим свойствам, отдельные компоненты крови требуют различ¬
ных условий при хранении и применении.
• Применение отдельных компонентов позволяет получать компоненты крови
для нескольких больных из дозы крови одного донора (эритроциты, плаз¬
му, тромбоциты, лейкоциты и др.), что повышает не только медицинскую,
но и экономическую эффективность гемотрансфузий.
Практика компонентной терапии возможна благодаря многолетнему опыту
применения консервированной крови и внедрению современных технологий
в медицинскую промышленность. Основной принцип компонентной гемотера¬
пии — дифференцированное получение от донора крови необходимых компонен¬
тов клеточного состава или плазмы крови и замещение недостающих компонентов
крови у больного соответствующими компонентами крови донора. Такой подход
позволяет экономить ресурсы донорской крови (компоненты крови одного доно¬
ра могут быть перелиты сразу нескольким больным) и обеспечивает оптималь¬
ный метод гемотрансфузии пациентам, требующим большого количества того
или иного компонента.
Одна из основных причин перехода на производство гемокомпонентов - Раз"
личные условия их последующего хранения:
в эритроциты сохраняют функциональную полноценность в охлаждение
состоянии при 4-8 °С;
| качественный состав плазмы поддерживается в замороженном состоянии
при -30 *С;
• оптимальные условия хранения тромбоцитов — помешивание при комнат
ной температуре;
• клетки-предшественники гемопоэза для сохранения своих функций ну#Л
ются в криоконсервировании.
ОРГАНИЗАЦИЯ РАБОТЫ УПРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 191
Хаким образом, лишь эритроциты могут храниться в условиях, адекватных
-ля цельной крови, тогда как терапевтический потенциал других составляющих
постепенно утрачивается при хранении в охлажденном виде.
другая причина необходимости заготовки и применения компонентов крови
вместо цельной консервированной крови — сложные процессы, происходящие
в цельной консервированной крови при хранении (табл. 7-10). В течение 2-5 сут
в консервированной крови распадается большая часть лейкоцитов и тромбоци¬
тов, выделяя значительное количество биологически активных веществ, которые
при гемотрансфузии могут оказать отрицательное влияние на организм больного.
Таблица 7-10. Изменения в цельной крови при хранении
——
Время хранения, дни
0
7
14
21
35
Пистроза плазмы, mg/dt
432
374
357
324
282
ЇЇШШ плазмы, mEq/L
169
162
159
157
153
Калий плазмы, mEq/L
3,3
12,3
17,6
21,7
17,2
Хлорид плазмы, mEq/L
80,4
80,1
70,9
70,7
79
Бикарбонат плазмы, mEq/L
12,0
17,0
12,5
12,2
8
оН цельной крови
7,16
6.94
6,93
6,87
6,73
Лактат цельной крови, mg/dl
19
62
91
130
202
Лактатдвгидрогеназа плазмы, ед.
296
1002
1222
1457
1816
Аммиак цельной крови, mg/dl
82
280
423
521
703
Гемоглобин плазмы, mg/dl
05
13,1
24,7
24,7
45,6
Гематокрит крови, g/dl
35
36
35
38
36
Гемоглобин крови, g/dl
12
12
12
12
12
Эритроциты, 10‘/т1
4,0
4,0
4,0
3,9
3,9
Возможность разделения консервированной крови на компоненты позволяет
оптимизировать качество получаемого компонента, создавая оптимальные усло¬
вия его хранения и повышая гемотерапевтическую эффективность компонента.
Состав консервирующих растворов
Современные консерванты позволяют продлить срок хранения крови. Помимо
стабилизаторов, предупреждающих свертывание крови, в состав консервирующих
растворов входят вещества, проникающие в эритроциты и участвующие в их мета¬
болизме, поддерживающие энергетический потенциал клетки (глюкоза, неорга¬
нический фосфат и др.). В ряде консервирующих растворов используются также
вещества, не проникающие в клетки: дисахариды, лактоза и многоатомные спирты
(маннит, сорбит). Эти вещества не принимают участия в метаболизме клетки.
Их действие сводится к защите структуры эритроцита, поддержанию резистент¬
ности мембраны и сохранению осмотического давления, что уменьшает набухание
клетки и ее гемолиз.
Растворы антикоагулянтов, используемые при заготовке крови, препятствуют свер¬
тыванию крови и позволяют сохранить эритроциты в течение определенного периода
времени. Все растворы антикоагулянтов содержат натрия цитрат, кислоту лимонную
и глюкозу, в некоторых присутствуют также аденин, гуанозин и фосфаты.
Цитрат связывает кальций и предотвращает превращение фибриногена в фибрин.
Глюкоза потребляется эритроцитами при хранении, каждая молекула глюкозы обра¬
зует две молекулы аденозинтрифосфата (АТФ), которые формируются при фосфо-
рилировании аденозиндифосфата (АДФ). АТФ — богатая энергией молекула,
которая поддерживает энергетически зависимые функции эритроцитов (эластич¬
ность и проницаемость мембраны). При этом АТФ превращается в АДФ. Кислоту
лимонную добавляют для поддержания концентрации ионов Н\ что особенно важно
8 начальном периоде хранения при 4 °С, когда pH крови имеет щелочное значение.
•J92 СЛУЖБА КРОВИ
По мере хранения происходит возрастание кислотности, что подавляет гликол
Содержание адениновых нуклеотидов (АТФ, АДФ, АМФ) снижается во время хпя
нения. Добавление в консервант аденина — основного элемента адениновых нущ^
тидов — предотвращает или уменьшает истощение последних при хранении.
Когда готовят концентрат эритроцитов, значительная часть глюкозы и аденіт*
в удаляется с плазмой. Эти потери следует компенсировать путем увеличения концем,
Я трации глюкозы или аденина в исходном антикоагулянте или добавления суспенди.
рующего раствора. Достаточную жизнеспособность эритроцитов можно поддеру
лишь в том случае, когда суспензия не слишком концентрирована. Концентрат зри-
троцитов в среднем не должен иметь гематокрит выше 0,70.
Эритроциты цельной крови, стабилизированные любым антикоагулянтом
без глюкозы, через 48 ч хранения утрачивают жизнеспособность. В растворы
для хранения крови вводят вещества, поддерживающие функциональное состоя¬
ние клеток крови (глюкоза, фосфат, аденин и др.). Поддержание жизнеспособно¬
сти эритроцитов при хранении коррелирует с внутриклеточным содержанием аде-
нозинтрифосфата, потребление которого сокращается в 40 раз при уменьшении
температуры хранения до 4 °С. Добавление в консервирующий раствор аденина
повышает уровень АТФ и жизнеспособность эритроцитов.
Кислородтранспортная функция эритроцитов коррелирует с количеством про¬
межуточного компонента гликолиза — 2,3-дифосфоглицерата, однако целесо¬
образность его использования в качестве маркера сохранности эритроцитов спорна,
так как есть данные о восстановлении уровня 2,3-дифосфоглицерата в сосудистом
русле реципиента от критического уровня (<50%) до нормы в течение 8 ч.
При консервации и хранении изменяется морфология эритроцитов (от дис-
коцитов к сфероцитам). Вследствие этого происходит снижение способности
эритроцита к деформации. В мембране эритроцитов изменяется распределение
фосфолипидов, при увеличении времени хранения утрачивается комплемент-
регуляторная активность клеточной поверхности. На клетках накапливаются ком¬
поненты комплемента (в частности, СЗЬ), а устойчивость клетки к комплемент-
опосредованному лизису снижается.
Использование суспендирующего консервирующего раствора позволяет под¬
держивать жизнеспособность эритроцитов даже при удалении более 90% плаз¬
мы. Добавление аденина и глюкозы позволяет поддерживать жизнеспособность
клеток; фосфаты используют для активации гликолиза, маннитол и цитрат -
для предотвращения гемолиза. Натрия хлорид или 2-натрийфосфат добавляют
для поддержания оптимального осмотического давления.
Тромбоциты и лейкоциты быстро теряют жизнеспособность при 4 °С. Они
образуют микроагрегаты, которые накапливаются в ощутимых количествах через
3-4 дня хранения цельной крови и в еще большем количестве в концентратах эри¬
троцитов. Микроагрегаты способны проходить через фильтры стандартных транс¬
фузионных систем. Блокируя капилляры, они могут быть причиной нарушения
функции легких, что вызывает проблемы при массивных трансфузиях. Удаление
тромбоцитов и лейкоцитов в процессе приготовления компонентов или во время
переливания больному практически исключает образование микроагрегатов.
Функциональная активность гранулоцитов и моноцитов резко сокращается
в течение 8 ч хранения, независимо от температуры хранения, а через 24 ч наступа¬
ет дезинтеграция этих клеток. Протеазы и другие продукты разрушения лейкоци¬
тов активизируют гемолиз, лейкоциты и тромбоциты формируют микроагрегаты.
В России утверждены к применению как отечественные, так и зарубежные рас¬
творы для консервирования крови (гемоконсерванты) (табл. 7-11).
Сроки хранения определяются используемыми консервирующими растворами
и условиями заготовки. Кровь, заготовленная в пластиковые мешки с использова¬
нием стерильной замкнутой системы и консерванта CPD (citrate-phoshate-dextxose)■
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 193
xaCPDA-1 (citrate-phosphate-dextrose-adenine) — 35 дней (см,табл. 7-11). Нарушение
замкнутого контура системы или сборка системы перед заготовкой крови и ее ком¬
понентов ограничивает сроки хранения крови до 24 ч при температуре 2 - 6 С.
Таблица 7-11. Основные гемоконсерванты
Гемокон-
сервант
I
Состав и
Лаксимапь- I 1
ый срок хра-1 п
нения, дни
грана
ронзіо- I
іитель
Примечание
глюгицир
Цитрат натрия 2 г.
Безводная глюкоза 3 г.
бидистиллированная вода до 100 мл
21 Ро
ссия Со
и к
отношение крови
онсерванта — 4.1
Гемокон-
сервант
Л-6
Цитрат натрия кислый 2,5 г.
Зульфацил натрия 0,5 г.
Трипафлавин нейтральный 0,025 г.
Бидистиллированная вода до 100 мл
21 Р(
)ССИЯ pH
4.9
Цитро-
глюко-
фосфат
Лимонная кислота 1 г.
Безводная глюкоза 3 г.
Трехзамещенный фосфат натрия 0,75 г.
4% раствор NaOH.
Бидистиллированная вода до 100 мл
21 Р
оссия р!
15,5-5,9 I
ЦОЛИПК
12А
Лимонная кислота 1,5 г.
Глюкоза 6 г.
Фосфат натрия трехзамещенный 0,2 г.
4% раствор NaOH.
Вода бидистиллированная до 100 мл
21
’оссия Iр
Н6.3
CPDA-1
Лимонная кислота безводная 0,327 г.
Цитрат натрия безводный 2,63 г.
Бифосфат натрия водный 0,222 г.
Декстроза водная 3,19 г.
Аденин безводный 0,0275 г.
Вода для инъекций до 100 мл
35
Междуна¬
родный
препарат
14 мл CPDA-1 на 100
мл крови.
В CPDA-2 - 4,46 г
декстрозы и 0.055 г
аденина
CPD
Кислота лимонная (моногидрид) 0,327 г.
Цитрат натрия (дигидрат) 2,63 г.
Мононатрия фосфат (дигидрат) 0,251 г.
Декстроза 2,32 г.
Вода для инъекций до 100 мл
21
Междуна¬
родный
препарат
Раствор для получе¬
ния плазмы методом
афереза
0,5 CPD
Кислота лимонная (моногидрид) 0,164 г.
Цитрат натрия (дигидрат) 1,32 г.
Безводная глюкоза 2,32 г.
Бифосфат натрия водный 2,51 г.
Вода для инъекций до 100 мл
21
Междуна¬
родный
препарат
63 мл раствора на 450
мл крови.
pH 5,7
S.A.G.M.
Натрия хлорид 0,877 г.
Аденин 0,0169 г.
Декстроза 0,818 г.
Маннитол 0,525 г.
Вода для инъекций до 100 мл
35
Междуна¬
родный
препарат
100 мл раствора
на 200 мл эритромас¬
сы из 450 мл крови,
pH 5.7
ADS
(адсоль)
Натрия хлорид 0,9 г.
Аденин 0,027 г.
Декстроза 2,2 г.
Маннитол 0,75 г.
Вода для инъекций до 100 мл
35
Междуна¬
родный
препарат
100 мл раствора
на 200 мл эритромас
сы из 450 мл крови.
pH 5.6
Гепарин
Гепарин 50 мг.
Глюкоза 5 г.
Изотонический раствор хлорида натрия
до 100 мл
Через сутки
образуются
мелкие,
а через двое
суток крупны)
сгустки крове
Междуна¬
родный
препарат
і
■
1 мл гепарина содер
жит 130 ЕД (1 ЕД —
0.0077 мг).
Соотношение раствс
кровь 1:9.
При реинфузии —
из расчета 5 мл на 1
в физиологическом
растворе
pH 7,3
1
п
194 СЯУЖЬА КРОВИ
Нужно отметить, ЧТО НИ ОДИН ИЗ известных гемоконсервантов не ПОЗВОл
полноценно сохранять все свойства крови. Сразу после того, как кровь по**7
нула сосудистое русло донора и была стабилизирована и консервирована, ца!г
наются необратимые процессы ее «старения*. Постепенно происходит сни*!
НИЄ физиологической полноценности Эритроцитов. В первую очередь страда6
их кислородно-транспортная функция. В зависимости от используемого консервант»
кислородно-транспортная функция эритроцитов консервированной крови сохраня
ется в течение 5-20 сут. После переливания консервированной крови длительных
сроков хранения (10 сут и более) эта функция эритроцитов in vivo восстанавлива¬
ет^! через 16-18 ч. В консервированной крови к последнему дню хранения оста-
ются жизнеспособными 70-80% эритроцитов.
Вторые сутки знаменуются утратой физиологической полноценности лейкоцитов
и тромбоцитов, разрушением антигемофильного глобулина и утратой гранулоцита¬
ми способности к фагоцитозу (через 24-48 ч).
Активность факторов свертывания в донорской крови уменьшается по мере
увеличения сроков ее хранения. Так, через 6-7 ч хранения активность факторов
V и VII практически сводится к нулю. В связи с этим цельная консервированная
кровь должна быть переработана на компоненты в течение 6 ч с момента забора
крови.
В процессе стабилизации и хранения донорской крови накапливаются высво¬
бождающиеся при разрушении клеток свободный гемоглобин и калий; повышается
уровень аммиака и молочной кислоты; снижается pH крови; эритроциты изменяют
свою форму, частично теряют свой электрокинетический потенциал, что способ¬
ствует образованию микроагрегатов. В результате совокупных изменений до 25%
клеточных элементов консервированной крови после переливания депонируются
и секвестируются в микроциркуляторном русле, что делает ее использование
при острой кровопотере и анемии нецелесообразным.
Таким образом, наличие продуктов распада лейкоцитов и тромбоцитов, мик-
ро- и макроагрегатов в консервированной донорской крови в процессе хранения
и особенности ее заместительного действия делают переливание цельной крови
нецелесообразным.
Сохранность физиологической полноценности компонентов крови во многом
определяется не только консервирующим раствором, но и характером пластико¬
вого материала, из которого изготовлены контейнеры и системы для сбора крови.
Наиболее распространенный и удовлетворяющий требованиям биосовместимости
материал для гемоконтейнеров — поливинилхлорид.
Режим хранения тромбоцитов при температуре 22-24 °С требует применения
пластика с повышенной проницаемостью для кислорода. Не должно быть ника¬
кого риска от вымывания пластификатора в кровь. Это же относится и к клею
для этикеток.
Хранение компонентов крови
Условия хранения компонентов крови должны обеспечивать максимальную
сохранность жизнеспособности и функциональной полноценности клеток во время
всего периода хранения. Риск бактериального загрязнения существенно уменьша¬
ется, если для изготовления и хранения применяются только замкнутые системы.
Режим хранения, так же как и условия транспортирования, должны подвергаться
постоянному контролю.
Компоненты крови, в зависимости от вида, хранят при температуре 20-24 °С,
2-6 °С или различных температурах ниже 0 °С. Температурный режим должен
быть определен, исходя из следующих соображений:
• холодильники и морозильники должны иметь избыточный объем, чтобы
внутреннее пространство хорошо просматривалось;
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КР08И 195
• оборудование должно быть надежным, а распределение внутренней температу¬
ры однородным;
• необходимо наличие устройства, регистрирующего температуру и сигнализи¬
рующего о нарушении температурного режима:
0 внутренние поверхности должны быть доступными для санитарной и дезин¬
фицирующей обработки,
рее этапы заготовки компонентов рекомендуется проводить с использованием
закрытой системы. Однако возможны ситуации, когда система подлежит разгер-
,етизации. В таком случае необходимо обеспечить асептические условия манипу¬
ляции. Эритроциты необходимо использовать в течение 24 ч после изготовления,
а тромбоциты - В течение 6 ч хранения.
Более подробно условия хранения различных компонентов рассмотрены ниже.
Принципы получения компонентов крови
На практике применяют несколько методов разделения консервированной
крови на компоненты: зональное центрифугирование, центрифугирование с исполь¬
зованием разницы плотности, противоточное центрифугирование, фильтрацию, пере¬
крестную фильтрацию, глубинную и поверхностную фильтрацию и др.
При зональном центрифугировании седиментация клеток достигается в результате
воздействия центробежных сил на движущийся слой крови перпендикулярно потоку.
Эффективность разделения зависит от соотношения центробежной силы и скоро¬
сти потока. При высоком соотношении получается плазма, обедненная тромбоцита¬
ми, при более низком — плазма, обогащенная тромбоцитами.
Существует ряд сепараторов для изготовления бесклеточной плазмы и плаз¬
мы, обогащенной тромбоцитами. Приборы для автоматического гемафереза
производят фирмы Fenval, IBM, Haemonetics, Fresenius, Dideco, Gambro medical,
«Биофизаппаратура» (рис. 7-7). Дальнейшее применение зонального центрифу¬
гирования состоит в выделении плазмы из суспензии эритроцитов. В дозу клеток
крови в роторе центрифуги поступает поток отмывающего раствора до тех пор,
пока концентрация белка в вытекающей і
жидкости не уменьшится до необходи¬
мого уровня. Затем центрифугирова¬
ние прекращают и отделяют суспензию
«отмытых» клеток.
Этот же принцип используется для
добавления и удаления криопротектора
перед замораживанием и после размора¬
живания эритроцитов при криоконсер¬
вировании.
При центрифугировании с использо¬
ванием разницы плотности седиментаци-
онное разделение крови, костного мозга
и лейкотромбослоя на поверхности слоя
с плотностью 1,077 г/мл ведет к «всплы¬
ванию» мононуклеарных клеток и раз¬
делению эритроцитов и гранулоцитов
при их прохождении через среду с плот¬
ностью, эквивалентной плотности кле¬
точной фракции.
Этот же принцип разделения при¬
меним для освобождения эритроцитов
°т примесей других клеток.
При противоточном центрифугирова- Рис. 7-7. Центрифуга для разделения крови
пии клетки под одновременным воздей- на компоненты
І V9WU
196 СЛУЖБА КРОВИ
станем потока жидкости и противоположно направленных центробежных сил м
быть разделены по размерам. Это свойство используется в клеточных сепарат^
для вриготовления концентрата аферезных тромбоцитов с редуцированием
жания лейкоцитов до менее 106 в дозе.
Противоточное центрифугирование используют также для отделения субпот,
ляций мононуклеарных клеток, полученных из крови или костного мозга.
Принципы центрифугирования используют и в аппаратах плазмоцитафепе
В большинстве аппаратов для плазмоцитафереза центробежная сила разделяет кво
на компоненты на основании разницы в их плотности. Во время удаления из органу
ма донора или пациента цельной крови к ней добавляется определенное количество
антикоагулянта. Кровь закачивают во вращающийся ротор, в котором происходит
разделение слоев компонентов. Необходимая фракция отводится, а остающиеся эле¬
менты возвращаются донору прерывистым или постоянным потоком.
Также для разделения крови на компоненты используют метод фильтрации.
В настоящее время применяют два основных принципа фильтрации:
• движение потока крови в направлении, перпендикулярном фильтрующей
поверхности (перекрестная фильтрация);
1 удаление лейкоцитов из клеточной суспензии посредством глубинной
или поверхностной фильтрации.
При перекрестной фильтрации кровь движется вдоль мембраны с размерами
пор, позволяющими свободно проходить белкам плазмы, но не клеткам крови. Это
позволяет получать свободную от клеток плазму.
Разработано оборудование для плазмафереза, в котором система насосов заби¬
рает кровь из вены донора и смешивает ее в требуемом соотношении с раство¬
ром антикоагулянта. Затем кровь направляется вдоль проницаемой для плазмы
плоской или половолоконной мембраны. На кровь воздействует давление в двух
направлениях. Одно направление параллельно мембране и создает ток крови
вдоль нее, другое — перпендикулярно мембране, «продавливая» кровь через
поры. Таким образом, исключается накопление клеток на фильтрующей поверх¬
ности в процессе отделения плазмы, при этом гематокрит в системе может возрас¬
тать с 0,40 до 0,75. Для усиления этого эффекта в некоторых моделях приборов
для плазмафереза скорость потока крови усиливается дополнительным вихревым
движением или движением мембраны.
Когда достигается определенный экстракорпоральный объем клеток, клетки
возвращаются донору и начинается следующий цикл. Процедуру продолжают
до тех пор, пока не достигается требуемый объем бесклеточной плазмы.
При глубинной и поверхностной фильтрации используются специфические свой¬
ства тромбоцитов и гранулоцитов и низкая эластичность лимфоцитов, вследствие
чего эти клетки легче захватываются волоконными фильтрами, чем эритроциты.
Четыре механизма захвата лейкоцитов работают в фильтрах, используемых для полу¬
чения эритроцитной массы, обедненной лейкоцитами:
I активация тромбоцитов, приводящая к прикреплению клеток к волокнам
в верхней части фильтра, после чего зафиксированные тромбоциты взаимодей¬
ствуют с гранулоцитами;
І активация тромбоцитов другим типом волокон, ведущая к фиксации их в сред¬
ней части фильтра;
• задержка лимфоцитов в порах и узлах тонковолокнистого материала и ни*-
нем слое фильтра; в настоящее время фильтры для удаления лейкоцитов делают
на основе волокнистых нетканых материалов с различными размерами пор
и толщиной волокон;
• обработка поверхности материала фильтра может предотвращать активацию
тромбоцитов и удалять примесь лейкоцитов из концентрата тромбоцитов пут6**
«процеживания».
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 197
фильтры, применяемые для удаления лейкоцитов из эритроцитов или тромбоци¬
тов. имеют разную эффективность и производительность. Кроме свойств фильтра,
на конечный результат влияют и некоторые параметры процесса (скорость истече¬
ния, температура, подготовка и промывание) и свойства фильтруемых компонентов
(сроки и условия их хранения, содержание лейкоцитов и тромбоцитов). При прове¬
дении процедуры фильтрации необходимо устанавливать пределы значений параме¬
тров и соблюдать стандарт проведения процедуры.
Эритроцитную массу получают из цельной консервированной крови путем отде¬
ления плазмы. Чаще всего используют метод заготовки, основанный на центрифуги¬
ровании (980 g, 25 мин) в день взятия крови. Гематокритный объем эритроцитарной
массы составляет в среднем 0,7-0,8. При заготовке эритроцитной массы над эритро¬
цитами оставляют слой плазмы в пределах 10 мм. Эритроцитную массу заготавлива¬
ют путем использования сдвоенных полимерных контейнеров. При этом в контейне¬
ре емкостью 500 мл находится консервированная кровь. Другой контейнер (пустой)
емкостью 300 мл, соединенный с первым замкнутой пластиковой трубкой, представ¬
ляет собой приемник для плазмы, которая переводится в него в результате давления
на контейнер с кровью специального устройства - плазмоэкстрактора.
Эритроцитную массу, обедненную лейкоцитами и тромбоцитами (ЭМОЛТ),
получают несколькими способами:
• методом серийного центрифугирования консервированной крови с последу¬
ющим удалением плазмы вместе с лейкотромбоцитным слоем и повторным
отмыванием эритроцитов раствором хлорида натрия:
і методом ускоренной седиментации эритроцитов при разведении большими
объемами растворов сахаров с последующим удалением плазмы вместе с лей¬
коцитами и тромбоцитами;
• применением коллоидных осадителей для седиментации эритроцитов и уда¬
ления плазмы, обогащенной лейкоцитами и тромбоцитами;
З путем фильтрации эритроцитной массы через специальные фильтры;
І методом криоконсервирования эритроцитов с их последующим разморажи¬
ванием и отмыванием.
Для получения ЭМОЛТ, заготовленной в полимерные контейнеры, цельную
консервированную кровь центрифугируют при 2000 g в течение 20 мин с после¬
дующим удалением лейкотромбоцитного слоя и двукратным или троекратным
отмыванием 0,9% раствором хлорида натрия с режимом центрифугирования
2000 g в течение 5 мин. При этом удается удалить 90-96% лейкоцитов и полно¬
стью удалить тромбоциты.
Концентрат тромбоцитов получают несколькими способами:
• методом дифференцированного центрифугирования в полимерных контей¬
нерах консервированной крови, полученной от рандомизированных доно¬
ров;
• методом дифференцированного центрифугирования отдельных доз кон¬
сервированной крови, полученных повторно от одного и того же донора,
с выделением из нее концентратов тромбоцитов и возвратом донору плазмы
и эритроцитной массы;
• методом автоматического (непрерывного или прерывистого) сепарирования
крови — тромбоцитафереэа с выделением необходимой лечебной дозы кон¬
центрата тромбоцитов от одного донора.
Из консервированной крови концентрат тромбоцитов выделяют двумя спосо¬
бами:
• выделением из обогащенной тромбоцитами плазмы;
I выделением из лейкотромбоцитного слоя.
Метод выделения из обогащенной тромбоцитами плазмы включает два
этапа. Процедуру выполняют во встроенном контейнере для сбора крови.
/ими
198 СЛУЖБА КРОВИ
На первом этапе контейнер №1 с консервированной кровью (хранившейся
не более 4-6 ч после кроводачи при комнатной температуре) подвергают «мяг¬
кому» центрифугированию (680 g в течение 13 мин), в результате чего тромбо¬
циты концентрируются в плазме, а под ней располагается эритроцитная масса
Обогащенную тромбоцитами плазму с помощью плазмоэкстрактора переводят
в контейнер №2. Контейнер №1 отсоединяют. На втором этапе обогащенную
тромбоцитами плазму подвергают «жесткому» центрифугированию (2400 g
в течение 20 мин), в результате чего тромбоциты оседают на дно контейнера
Бесклеточную плазму сразу же с помощью плазмоэкстрактора переводят в кон¬
тейнер N*3, оставляя в контейнере №2 около 55 мл плазмы для дальнейшего
ресуспендирования осадка тромбоцитов. Контейнер с бесклеточной плазмой
герметизируют и отсоединяют, а контейнер №2 с тромбоцитами оставляют
при комнатной температуре (22 °С) на 1-1,5 ч, так как немедленное ресу¬
спендирование осажденных тромбоцитов приводит к образованию агрегатов,
что связано с высвобождением содержимого тромбоцитных гранул. Через
1-1,5 ч контейнер с тромбоцитами помещают в аппарат автоматического пере¬
мешивания для их полного ресуспендирования.
Выделение концентрата тромбоцитов проводят во встроенном контейнере
для сбора крови.
На первом этапе консервированную кровь (контейнер №1), хранившуюся
не более 4-6 ч после кроводачи при комнатной температуре, подвергают «жест¬
кому» центрифугированию (2150 g в течение 20 мин). При этом тромбоциты
максимально концентрируются над эритроцитами в лейкотромбоцитном слое,
над которым располагается бесклеточная плазма. Большую часть бесклеточной
плазмы переводят в контейнер №2, оставляя в контейнере №1 над эритроцитами
слой плазмы толщиной 4-5 см (65-75 мл). Контейнеры №1 и №2 отсоединяют.
Далее лейкотромбоцитный слой с плазмой и минимальным слоем подлежащих
эритроцитов общим объемом 115-125 мл тщательно перемешивают. На втором
этапе контейнер №3 с лейкотромбоцитным слоем подвергают «мягкому» центри¬
фугированию (190 g в течение 10 мин), в результате чего эритроциты и лейкоци¬
ты, отличающиеся по удельному весу от тромбоцитов, оседают на дно контейнера,
а тромбоциты остаются взвешенными в плазме, которую с помощью плазмоэк¬
страктора переводят в контейнер №4.
Лейкофильтрация
Лейкофильтрация — процесс удаления лейкоцитов из крови и ее компонентов
с помощью специальных устройств — лейкофильтров. В отечественной и зарубеж¬
ной литературе процесс удаления лейкоцитов обозначают и как лейкоредукцию
(уменьшение количества лейкоцитов), и как лейкодеплецию (удаление лейкоци¬
тов). Несмотря на то что каждый из используемых терминов не в полной мере
охватывает весь процесс уменьшения (в идеале — полного удаления) лейкоцитов
из крови и ее компонентов, эти термины используют как синонимы.
Лейкоциты, содержащиеся в эритроцитных гемотрансфузионных средах,
в плазме и тромбоцитном концентрате, при переливании реципиентам могут
вызывать различные патологические иммуноопосредованные реакции и повы¬
шать риск передачи клеточноассоциированных вирусов (Bordin et al., 1994;
Schonewille et al., 1999). Отрицательное влияние лейкоцитов на организм
реципиента при гемотрансфузиях связано с сенсибилизацией к антигенам лей¬
коцитов (системы HLA, NA-NB и др.) биологически активными продуктами
распада лейкоцитов (цитокины, интерферон и др.), а также вирусами, ассоции¬
рованными с клетками лейкоцитного ряда (например, ЦМВ). Показана роль
аллогенных лейкоцитов в развитии полиорганной недостаточности у больных,
получавших массивные гемотрансфузии (Botha et al., 1995; Silliman et al., 1998;
Vincent et al., 2002).
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 199
стоящее время в большинстве стран Европы применяют современные транс*
ологические лейкофильтры, которые позволяют проводить универсальную
ФЯИоредукиию компонентов крови, или деплецию лейкоцитов (Nielsen. 2006).
,іЄГушествУК)Іцие на медицинском рынке трансфузиологические фильтры можно
елить на три категории: просеивающие (с диаметром пор 170-260 мкм).
Ра^пПпосеивающие (с диаметром пор 20-40 мкм), адгезивные и адсорбционные
їезивно-адсорбционньїе) (табл. 7-12).
Способность лейкофильтров удалять биологически активные вещества во мно-
висит от состава материалов, из которых они произведены. Так, фильтры
^ полиэстера удаляют СЗа из хранящейся крови, но не влияют на провоспали-
%1е цитокины (ИЛ-1, ИЛ-6) (Heiden et al., 2002).
Показано, что качество лейкофильтрованных эритроцитных гемокомпонентов
зависит от этапа производства (до или после разделения крови на компонен¬
ту) состава гемоконсерванта и конструктивных особенностей лейкофильтров
(Чечеткин и соавт., 2008).
Табмта 7-12. Применение фильтров при переливании компонентов крови
——
Размер
Механизм фильтрации
Удаление при фильтрации, %
Марка фильтра
пор, мкм
лейкоциты
цитокины
микросгустки
ПКТГ05ПК, 22-02
170-260
Просеивающий фильтр
- ■
-
20
ПК 23-01 «Интероко»
20-40
Микропросеивающий
фильтр
-
95
Лейкосеп
«Интероко»
-
Адгезивный фильтр
99,9
60
99,9
Импортные фильтры
-
Адсорбционно-
адгезивный фильтр
99,9
65
99,9
Поскольку при хранении консервированной крови быстро наступает разруше¬
ние и фрагментация лейкоцитов, эффективность лейкофильтрации зависит
от рительности и температурных условий хранения среды. Лейкофильтрация
крови более эффективна в течение 8 ч хранения при температуре 4 °С,
чем при 22 °С (Beaujean et al., 1992; Heaton et al., 1994; Rapaille et al., 1997).
Оптимальна лейкофильтрация консервированной крови, хранившейся при ком¬
натной температуре не более 2 ч (Glaser et al., 1996).
Показано, что обедненные лейкоцитами трансфузионные среды имеют раз¬
личный гематокрит и концентрацию гемоглобина в зависимости от производ¬
ственного этапа лейкофильтрации. В частности, эритроцитная масса, обедненная
лейкоцитами с помощью фильтров Imugard III-RC и BPF4, имеет более высокий
гематокрит, чем эритроцитсодержащие гемокомпоненты, полученные из лейко¬
фильтрованной консервированной крови (Чечеткин и соавт., 2008).
Лейкоредукции можно подвергать как консервированную кровь, так и компо¬
ненты крови (табл. 7-13).
Различают лейкофильтры для крови и ее компонентов, которые преимуще-
шр используют при заготовке крови и ее компонентов, и фильтры, которые
применяют у постели больного, — госпитальные (прикроватные). В процессе
заготовки крови и разделения ее на компоненты применяют, как правило, лейко¬
фильтры, встроенные в систему для забора и разделения донорской крови на компо¬
зиты (закрытые, банковские системы) (см. рис. 7-12). При применении открытых
птлм для лейкофильтрации компонентов (когда кровь или компонент фильтруют
'*4*3 отдельное устройство) срок хранения гемопродукта после фильтрации состав-
ет не более 24 ч. Недостаток прикроватной лейкодипляции — в том. что к моменту
отрансфузии практически все лейкоциты в компоненте (более 2-3 дней хране-
в п эРИтР°Читной массы, тромбомассы или размороженной СЗП) разрушаются.
3Ультате чего ожидаемый эффект лейкоредукции практически сводится к нулю.
200 СЛУЖБА КРОВИ
Вотличие от прикроватных лейкофильтров, при гемотрансфузии очень эффективн
микроагрегатные фильтры.
Современные фильтры способны одновременно удалять не ТОЛЬКО лейкоцити
ншшроагрегаты (прямое назначение), но и снижать уровень биологически актив
ных реагинов (например, цитокинов) в гемокомпоненте (см. табл. 7-12).
Описание отечественных лейкофильтров и работы с ними см. в разделе «Основ¬
ные полимерные изделия для нужд Службы крови».
Лейкоцитный фильтр «Лейкосеп» ЗАО «НПП Интероко» (Россия):
• удаляет около 99,9% лейкоцитов;
1 механизм фильтрации — адгезия;
і рекомендуемый срок хранения компонентов перед фильтрацией — 48 ч;
і заполнения физиологическим раствором не требуется;
• гематокрит фильтруемой среды — 60-70%;
• до фильтрации компоненты должны храниться при комнатной температуре;
і скорость фильтрации — 2-7 мл/мин (40-60 капель), время фильтрации -
35 мин;
і фильтрация двух компонентов, полученных из дозы крови.
Импортные фильтры (фирм Pall, Terumo):
• удаляют около 99,9% лейкоцитов;
І механизм фильтрации — просеивание и непрямая адгезия;
• рекомендуемый срок хранения компонентов перед фильтрацией — 48 ч;
І заполнения физиологическим раствором не требуется;
І гематокрит фильтруемой среды — 60-70%;
і может быть использовано дополнительное давление;
і время фильтрации — 10-25 мин;
• фильтрация одного компонента.
Таблица 7-13. Модели фильтров фирмы Pall и ЗАО «НПП Интероко»
Процесс
Эритроцитная масса
Тромбоциты
Плазма
До разделения на компоненты
Leukotrap WB
Leukotrap WB
В процессе разделения на компоненты
Leukotrap RC.
Leukotrap RCPL.
Leukotrap RCP
AutoStop ВС.
Leukotrap RCPL
Leukotrap RCP.
Leukotrap RCPL
После разделения на компоненты
BPF4.
«Лейкосеп» Интероко
LRP6/10
LPS1.
«Лейкосеп»
или «Лейкосеп-Пл»
Прикроватная фильтрация
RCXL1/2KLE
PXL2/3KLE
LPS2.
«Лейкосеп-Пк»
Метод лейкоредукции не теряет своей актуальности и для плазмы, полученной
на современных автоматических сепараторах крови. На практике аппаратные
методы позволяют достигать глубины лейкофильтрации при процедуре плазма¬
фереза до 5-ИЫО6 л (Кононенко, 2007), что никак не соответствует минимально
допустимому количеству лейкоцитов 1х106, установленному международными
требованиями по безопасности для эритроцит- и тромбоцитсодержащих компо¬
нентов. Необходима дополнительная процедура лейкофильтрации, особенно если
плазма в дальнейшем предназначена не только для клинического применения,
но и для фракционирования на препараты.
В России методом афереза заготавливают не более 6% компонентов крови,
преимущественно плазмы. В будущем этот метод будет применяться не более
чем в 25-35%. Остальная кровь, преимущественно заготовленная на выездах,
будет перерабатываться ручными методами, включая и лейкофильтрацию. Наряду
с достоинствами (хорошая переносимость процедуры, включая скорость заготов-
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 201
до, достижение стандартных условий выполнения процедуры и качества полу¬
чаемых компонентов) методы афереза имеют также недостатки, которые нельзя
не учитывать.
Процедура афереза для доноров плазмы может выполняться повторно через
2 нед. Таким образом, за год возможно проведение 20-23 процедур. Один из побу¬
дительных мотивов необходимости реализации интенсивных программ плазмафе¬
реза — показатель рентабельности работы аппарата, для чего ежедневная нагрузка
на аппарат должна составлять не менее шести доноров, что требует усиления кон¬
троля состояния здоровья доноров и проведения дополнительных исследований.
Имеются данные (Козлов и соавт., 2008), что проведение многократных цита-
и плазмаферезов требует полного исследования системы гемостаза до процедуры
и динамического контроля в процессе их выполнения. Интенсивный аферез требует
введения контроля обмена железа у доноров (Суханов и соавт., 2008; Селезнева
и соавт., 2008; Furuta et al., 1999) и осуществления железопрофилактики кадровых
доноров.
При выборе технологий получения компонентов крови для учреждений Службы
крови следует учитывать также ценовые показатели. При сравнительном анализе
суммарных затрат на приобретение расходных материалов и количества получае¬
мых компонентов за одну процедуру было установлено, что общие затраты на полу¬
чение трех компонентов за одну процедуру методом простого центрифугирования
в 2-3 меньше, чем затраты при использовании автоматических сепараторов.
Очевидно, что объемы цельной крови, заготавливаемой для получения компо¬
нентов крови методами центрифугирования в России, в будущем вряд ли снизятся
и преодолеют 60% барьер. В связи с этим в ближайшем будущем лейкофильтраци¬
онные технологии останутся востребованными.
202 СЛУЖБА КРОвИ
Имеющиеся на отечественном рынке устройства для лейкофильтрации оглич»
ются по своим функциональным свойствам и биосовместимости с компонентам
крови. Так. в работах Т. В. Кузьминой и соавт. (2008) показано, что фильтрующеИ
устройство «Лейкосеп». выпускаемое в России, не оказывает влияния на гемоста-
тнческий потенциал плазмы, тогда как фильтрующее устройство Leukofrap щ
увеличивает активность основного физиологического антикоагулянта - анти-
тромбина III, а фильтрующее устройство Leukoflex вызывает умеренное снижение
гемостатического потенциала плазмы.
При анализе показателей, отражающих состояние гемостаза в образцах плазмы
подученной либо методами афереза на автоматических сепараторах крови (аппа¬
раты Haemonetics с протоколами работы «СЗП» и «Обедненная тромбоцитами
плазма»), или с применением технологии лейкоредукции (фильтрующие устройства
Leukotrap WB, Pall, Германия; «УЛЛ-01») и «Лейкосеп» ЗАО «НПП Интероко»,
Россия, либо с применением метода центрифугирования статистически значимых
различий выявлено не было (Кононенко, 2007; Лаптев и соавт., 2009).
По мнению С.Н. Кононенко (2007), В.В. Лаптева и соавт. (2009), в ближайшем
будущем технологии лейкофильтрации компонентов крови, полученных методом
центрифугирования цельной крови, будут сохраняться в арсенале производствен¬
ной трансфузиологии, поскольку обеспечивают высокое качество и клиническую
эффективность, а также максимально доступны по экономическим параметрам
и технологическим возможностям реализации.
Задача достижения лейкоредукции ниже уровня 4 log сегодня решается на базе
новой генерации лейкофильтров на основе материалов из полиэстеров (Hiromichi
et al., 2003). Ведутся разработки полифункциональных лейкофильтров, способ¬
ных удалять биоактивные вещества и патогены (Gregori et al., 2004). Показано,
что применение стандартных лейкофильтров позволяет удалять до 42% общего
количества патогенов в крови. В настоящее время разрабатываются лейкофильтры
(например, фирмы Pall), обладающие способностью связывать прионы. Проведены
предварительные испытания таких лейкофильтров на зараженных почесухой 120
хомяках; контроль присутствия вируса проводили методом вестерн-блоттинга.
Количество удаленных вирусов составило 3,7 log. При переливании профиль¬
трованной (ранее инфицированной) крови 35 интактным животным ни в одном
случае не произошло заражения.
Особо следует отметить, что в условиях внедрения технологий вирусной инак¬
тивации процедуру лейкофильтрации продолжат использовать для удаления био¬
активных веществ и снижения опасности иммунизации реципиентов антигенами
лейкоцитов.
ИНФОРМАЦИЯ О КОМПОНЕНТЕ КРОВИ И ПРИНЦИПЫ ЭТИКЕТИРОВАНИЯ
Письменная информация о составе и свойствах компонента крови должна быть
понятна как специалистам Службы крови, так и врачам, применяющим их в кли¬
нической практике, и содержать сведения о составе, показаниях, хранении и прак¬
тике трансфузии.
Этикетирование должно соответствовать действующим национальным стандар¬
там (НЦРФ «Кровь донорская и ее компоненты. Контейнеры с консервированной
кровью или ее компонентами. Маркировка» ГОСТ 52938-2008) и международ¬
ным соглашениям. Каждый индивидуальный контейнер должен иметь уникаль¬
ную идентификацию посредством идентификационного номера и описания ком¬
понента, кода, хорошо определяемого визуально и считывающим устройством.
Идентификационные данные должны позволять прослеживать донора, процедуру
заготовки, тестирование, изготовление, хранение, выдачу, распределение и транс¬
фузию компонента крови (рис. 7-9).
Этикетка компонента, подготовленного к выдаче, должна содержать легко читае¬
мую информацию для безопасности трансфузии: уникальный идентификационный
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КР08И 203
номер (определяющий ответственную за заготовку крови организацию, год донации
„серийный номер), информацию о группе крови и резус-принадлежности, наимено¬
вание компонента и краткую информацию о свойствах, срок годности.
Рис. 7-9. Этикетка на готовом компоненте крови
Основные требования (стандарты) должны соблюдаться учреждениями Службы
крови с целью заготовки консервированной крови и ее компонентов, гаранти¬
рующей их качество и безопасность при лечебном применении. Невыполнение
или снижение этих требований приводит к заготовке некачественной продукции
и серьезным осложнениям при трансфузионной терапии.
ВЫДАНА И ТРАНСПОРТИРОВКА КОМПОНЕНТОВ КРОВИ
Компоненты крови необходимо перевозить в условиях постоянной регламен¬
тируемой температуры. Контейнеры для перевозки компонентов крови должны
быть удобны для санитарной обработки и изготовлены из материалов, устой¬
чивых к моющим средствам и дезинфекции. При использовании транспортных
рефрижераторов необходимо учитывать их возможности контроля температуры.
Регулируемые охлаждающие элементы не должны соприкасаться с контейнерами.
Необходимо учитывать время транспортирования и температуру окружающей
среды. Рекомендуется применять регистрирующие устройства, фиксирующие
уровень температуры на протяжении всего транспортирования. Для многих стран
Европы и Америки это требование — обязательное условие для перемещения ком¬
понентов крови.
Эритроциты хранят при температуре 2-6 °С. Транспортная система должна
гарантировать, что в конце перевозки в течение 24 ч температура не превысит
10 °С. Тромбоциты должны находиться при температуре 20-24 °С. Замороженную
плазму необходимо перевозить в замороженном состоянии при температуре,
максимально приближенной к регламентной (-30 °С). Температуру проверяют
следующим образом. Между двух контейнеров с компонентами помещают тер¬
мометр. Контейнеры с термометром фиксируют резинкой и помещают в закры¬
тый транспортный контейнер. Через 5 мин температура должна быть не выше
10 и не ниже 1 °С. Целесообразно использование электронного чувствительного
устройства для мгновенного определения температуры на поверхности гемокон-
теинера. Возвращенные продукты крови не должны быть использованы для транс-
204 СЛУЖБА КРОВИ
фузии, если обнаружено нарушение герметичности контейнера, выявлены нару.
н|яяи температу рного режима при перевозке или признаки утечки содержимого
Необъяснимое изменение цвета или красное окрашивание содержимого также
считают противопоказанием для лечебного применения продукта.
Можно считать оправданным предложение специалистов-трансфузиологов
0 выделении «транспортировки гемокомпонентов» в отдельный вид деятельно¬
сти: осуществление реальных требований к нему — безусловно оправданная мера
для обеспечения сохранения качества гемопродукции. Опыт показывает, что в пла¬
новом порядке транспортировку гемокомпонентов в ЛПУ оптимально осуществлять
средствами самой СПК: специально выделенным транспортом с морозильным
оборудованием, мониторингом температурного режима и подготовленным персо¬
налом.
Обязанности по транспортировке гемокомпонентов в экстренных случаях,
исходя из складывающейся нагрузки, могут быть возложены на СПК, кареты ско¬
рой помощи или дежурный транспорт ЛПУ.
Обеспечение данного вида деятельности требует специального финансирования.
Все сведения по идентификации компонента крови, времени его выдачи, усло¬
виях транспортирования должны быть документально зафиксированы.
Цельная консервированная кровь и ее компоненты
ЦЕЛЬНАЯ КРОВЬ
Определение
Цельная кровь для переливания — кровь, взятая у донора с применением сте¬
рильного и апирогенного антикоагулянта и контейнера.
Свойства
Свежая цельная кровь сохраняет свои свойства в течение ограниченного
периода времени. Быстрый распад фактора свертывания VIII, лейкоцитов и тром¬
боцитов делает цельную кровь непригодной для лечения нарушений гемостаза
после хранения в течение более 24 ч. При более длительном хранении происходят
изменения, такие как увеличение сродства к кислороду и потеря жизнеспособно¬
сти эритроцитами, снижение активности V и VIII факторов свертывания, утрата
функциональной способности тромбоцитов, формирование микроагрегатов, осво¬
бождение внутриклеточных калия и протеаз лейкоцитов, активация калликреина.
Метод получения
Кровь должна заготавливаться только обученным персоналом, работающим
под руководством квалифицированного врача, имеющего лицензию. Взятие крови
должно проводиться с использованием стерильной закрытой системы.
Этикетирование
Этикетка должная соответствовать национальным стандартам и международ¬
ным соглашениям. Следующая информация должна быть показана на этикетке
или листовке-вкладыше:
• идентификация производителя;
• уникальный идентификационный номер;
• группа крови АВО и Rh-принадлежность;
1 датадонации;
• название антикоагулянта;
і дополнительная информация - облучение и др. (если проводилось);
В срок применения;
I объем или масса компонента крови;
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 205
I температура хранения:
І фенотип группы крови, помимо АВО и Rh (если необходимо);
І компонент не может быть применен при выявлении гемолиза или других
изменений:
І компонент может быть применен с использованием 170-200 мкм фильтра.
Хранение и стабильность
Хранение донорской крови и ее компонентов — процесс обеспечения целост¬
ности, доступности и защищенности донорской крови и ее компонентов с целью
сохранения их биологических свойств.
При хранении крови температура в холодильнике должна поддерживаться
в интервале от 2 до 6 °С. Время хранения зависит от примененного консервирую¬
щего раствора. При использовании CPDA-1 продолжительность хранения состав¬
ляет 35 дней.
Микроагрегаты
При хранении крови формируются микроагрегаты.
Прогрессирует снижение лабильных факторов коагуляции V и VIII, возрастают
содержание калия и кислотность, что ведет к быстрому снижению жизнеспособ¬
ности тромбоцитов.
Способность эритроцитов переносить кислород падает вследствие потери
2,3-дифосфоглицерата (ДФГ). Через 10 дней хранения в CPDA-1 весь ДФГ теряет¬
ся. Однако после трансфузии его содержание регенерируется в кровеносном русле
реципиента.
Контроль качества
Контроль качества для обеспечения безопасности и эффективности в основном
необходим на стадии заготовки цельной крови. В дополнение к контролю, проводи¬
мому при заготовке, требуется проверка по параметрам, указанным в табл. 7-14.
Таблица 7-14. Контроль качества цельной крови
Объекты контроля
Критерии качества
Частота контроля
Место контроля
АВО, RhO
Определение группы
Сплошной
Серологическая лаборатория
Анти-ВИЧ 1 и 2
Отрицательные результаты раз¬
решенного скрининг-теста
Сплошной
Скрининг-лаборатория
Нв^Ад
Отрицательные результаты раз¬
решенного скрининг-теста
Сплошной
Скрининг-лаборатория
Анти-НВС (когда
требуется)
Отрицательные результаты раз¬
решенного скрининг-теста
Сплошной
Скрининг-лаборатория
Анти- HCv
Отрицательные результаты раз¬
решенного скрининг-теста
Сплошной
Скрининг-лаборатория
Сифилис (когда тре¬
буется)
Отрицательные результаты раз¬
решенного скрининг-теста
Сплошной
Скрининг-лаборатория
Анти-CMV (когда
требуется)
Отрицательные результаты раз¬
решенного скрининг-теста
Как предписано
Скрининг-лаборатория
Ahth-HTLV1-2 (когда
требуется)
Отрицательные результаты раз¬
решенного скрининг-теста
Сплошной
Скрининг-лаборатория
Объем
450 мл±10% без консерванта,
нестандартная донация должна
быть обозначена на этикетке
1% от общего
числа, минимум 4
дозы в месяц
Отделение компонентов
.Гемоглобин
Минимум 45 г в дозе
4 дозы в месяц
Лаборатория контроля
Гемолиз в конце
хранения
<0,8% массы эритроцитов
4 дозы в месяц
Лаборатория контроля
Транспортирование
Транспортировка донорской крови и ее компонентов — процесс доставки крови
ее компонентов из организаций донорства крови и ее компонентов в медицин-
ГЛАВА 7
206 служм крови
оси*, научные и образовательные организации, а также в организации, осущ^.
аляюшие производство лекарственных средств.
После заготовки кровь перевозят при контролируемой температуре 2-6 т
При этом температура крови не должна превышать 10 °С в течение 24 ч транс-
Щ портировки. Это условие особенно важно, если предполагается выделять из крови
тромбоциты.
Показания к применению
лРИ Клинические показания к применению хранящейся цельной крови чрезвы¬
чайно ограничены. При отсутствии кровезаменителей и компонентов крови ее
использование допустимо, когда должны быть восстановлены одновременно
объем крови и эритроцитов, например, при острой кровопотере (более 30% ОЦК)
или при обменном переливании.
Меры предосторожности при использовании
При определенных клинических ситуациях (согласно рекомендациям ААВВ,
США, 1996 г.) врач может заказать цельную кровь, в том числе «свежезаготов-
ленную или теплую*. В подобных случаях затребовавший эту кровь врач должен
предоставить документальное обоснование необходимости ее использования и без¬
опасности исходов трансфузии (исключить риск возникновения трансфузионных
осложнений, которые могут перевесить ожидаемый лечебный эффект).
0 заготовке и применении аутокрови см. главу «Аутодонорство и аутогемотранс-
фуэии крови*.
Совместимость цельной крови с предполагаемым реципиентом должна быть про¬
верена специальным тестом перед трансфузией.
Противопоказания
Использование цельной крови противопоказано в следующих случаях:
1 анемия без кровопотери;
• различные виды непереносимости плазмы;
• непереносимость вследствие аллоиммунизации против лейкоцитных антиге¬
нов.
Побочные эффекты
Могут наблюдаться следующие побочные эффекты:
• циркуляторная перегрузка;
• гемолитические посттрансфузионные реакции;
І негемолитические посттрансфузионные реакции (озноб, лихорадка, крапив¬
ница);
• сепсис вследствие невыделенной бактериальной контаминации крови;
• возможен сифилис, если цельная кровь хранилась менее 96 ч при 4 °С:
• возможна трансмиссия вирусов (гепатиты, ВИЧ), несмотря на тщательный
контроль;
• в редких случаях возможно заражение малярией;
• аллоиммунизация против HLA и эритроцитных антигенов;
• нитратная интоксикация у новорожденных и больных с нарушениями функ¬
ции печени;
• биохимический дисбаланс после массивных трансфузий, например гиперка-
лиемия;
1 лосттрансфузионная пурпура;
І острая посттранефузионная легочная недостаточность;
І трансмиссия других патогенов, которые не могли быть выявлены ранее.
Из цельной консервированной крови готовят компоненты крови (эритррцй*
тарную массу, СЗП, тромбоцитный концентрат, лейкомассу и др.). Компоненты
донорской крови составляющие крови (эритроциты, лейкоциты, тромбоциты.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 207
периферические стволовые клетки), взятые от донора или приготовлен*
методами из крови донора и предназначенные для клинического
Пользования, производства лекарственных средств или использования в научно-
мдовательских и образовательных целях.
Выделяя доноров компонентов крови или говоря о донорстве плазмы или тром-
'ggjfTOB, необходимо иметь в виду, что для получения любого компонента
.лови необходимо сначала получить дозу консервированной цельной венозной
В автоматических сепараторах крови, позволяющих сразу получать один
П несколько компонентов крови, смешивание антикоагулянта и венозной крови
„^исходит в автоматическом режиме с последующим разделением на соответ¬
ствующие составные компоненты.
ЗРИТРОЦИТНАЯ МАССА
Эго основная гемотрансфузионная среда, которую получают из консервиро¬
ванной крови путем отделения плазмы. По сравнению с кровью эрнтроцитная
иасса в меньшем объеме содержит то же количество эритрощггов. но значительно
иеньше цитрата, продуктов распада клеток, клеточных и белковых антигенов
в антител. Гематокрит эритроцитной массы не выше 80%. По своим лечебным
свойствам эрнтроцитная масса равноценна эритроцитам консервированной крови.
Эритроцитную массу хранят при 4-6 °С. Эрнтроцитная масса, полученная из крови,
заготовленной на консерванте CPD, имеет срок хранения 21 день, а на консерванте
CPDA - 35 дней. После 8-10 дней хранения в эритроцитной массе может обна¬
руживаться незначительный гемолиз, который не относят к противопоказаниям
для ее клинического использования.
Хранение зритроцитсодержащих сред
В рефрижераторе следует хранить только цельную кровь, ее компоненты и образ¬
цы для тестирования. Реагенты и тестовые наборы следует помещать в изолиро¬
ванный отсек (рис. 7-10). Отдельные отсеки холодильника должны быть предна¬
значены для:
• готовой продукции;
• продукции, отобранной для конкретных больных, включая аутокровь:
I продукции, находящейся на карантине до завершения тестирования;
I просроченной и забракованной продукции.
20f СЛУЖБА КРОВИ
і Отсеки (или отдельные холодильники) для продукции перечисленных типов
[, мы быть четко обозначены. Температура внутри продуктов должна регистрипо^*’
• аостоянном режиме. Датчики термографов должны быть помещены в контей3^
заполненные 10% раствором глицерина в объеме, эквивалентном количеству
цы контролируемого продукта. Такой контролируемый контейнер следует разм?ИИи
в верхней части охлаждаемого пространства. В больших холодильных камерах*^
сообразно оборудовать два или более контрольных устройств.
Сигнализация тревоги должна быть акустической и оптической и регул*
подвергаться проверке. ')H(1
Холодильное оборудование следует обеспечивать резервным источником Эл
тропитания.
С лечебной целью может применяться эрнтроцитная масса нескольких вило
в зависимости от метода заготовки и показаний к назначению.
Кроме стандартной эритроцитной массы с гематокритом не выше 80%, исполь¬
зуемой чаще всего, применяется эрнтроцитная масса фенотипированная - транс¬
фузионная среда, в которой определены не менее пяти антигенов, помимо антиге¬
нов А, В и D. Назначается с целью предупреждения аллоиммунизации к антигенам
эритроцитов. Переливание фенотипированной эритроцитной массы показано
при многократных трансфузиях.
Другие типы эритроцитсодержащих сред.
• Эритроциты с удаленным лейкотромбослоем — полученные из ОДНОЙ ДОЗЫ
цельной крови после удаления большей части плазмы. Лейкотромбослой,
содержащий большую часть тромбоцитов и лейкоцитов, удаляется.
• Эритроциты, обедненные лейкоцитами, — полученные из одной дозы цель¬
ной крови после удаления большей части плазмы. Лейкоциты из этой дозы
удалены с помощью лейкофильтров.
• Эритроциты в добавочном растворе (эрнтроцитная взвесь) — полученные
из одной дозы цельной крови после удаления большей части плазмы, к кото¬
рым добавлен питательный/консервирующий раствор.
я Эритроциты с удаленным лейкотромбослоем в добавочном растворе (эри-
троцитарная взвесь с удаленным лейкотромбослоем) — полученные из одной
дозы цельной крови после удаления большей части плазмы. Лейкотромбослой,
содержащий большую часть тромбоцитов и лейкоцитов в заготовленной
дозе, удаляется. Добавлен питательный/консервирующий раствор.
• Эритроциты, полученные методом афереза.
ЗРИТРОЦИТНАЯ МАССА СТАНДАРТНАЯ
Определение
Компонент, полученный после отделения части плазмы из цельной крови
без дальнейшей обработки.
Свойства
Гематокрит компонента составляет 0,65-0,75. Каждая доза содержит минимум
45 г гемоглобина.
Контейнер с компонентом содержит все эритроциты, находящиеся В ИСХОДНОЙ
дозе крови, большую часть лейкоцитов (около 2,5-3,Ox 109 клеток) и различное
количество тромбоцитов, зависящее от способа центрифугирования.
Способ изготовления
Компонент получают удалением плазмы из дозы крови после центрифугиро83
ОРГАНИЗАЦИЯ РАБОТЫ УЧРІЖДЕНИЙ СЛУЖБЫ КР06И 209
в
дотирование
Этикетирование должно производиться в соответствии с национальными пра¬
вилами и международными соглашениями. Следующая информация должна быть
размещена на этикетке или сопровождающей листовке-вкладыше:
• идентификация производителя;
• инивидуальный идентификационный номер;
• группа крови АВО и Rh-принадлежность;
• дата кроводачи;
• название типа консерванта;
• наименование компонента крови;
• дополнительная информация - облучение и др. (если проводилось);
• срок хранения;
1 объем или масса компонента;
• температура хранения;
• фенотип группы крови, помимо АВО и Rh-принадлежности;
• компонент не может быть применен при выявлении ненормального гемолиза
или других изменений;
• компонент может быть применен с использованием 170 200 мкм фильтра.
Хранение и стабильность
Те же, что для цельной крови. При хранении образуются агрегаты.
Контроль качества
Тот же, что для цельной крови, за исключением показателей табл. 7-15.
Таблица 7-15. Особенности контроля качества эритроцитной массы
Объекты контроля
Критерии качества
Частота контроля
Место контроля
Объем
280+50 мл
1 % общего числа доз
Отделение компонентов I
Гемоглобин
Минимум 45 г в дозе
14 дозы в месяц
Лаборатория контроля
Гемолиз в конце хранения
<0,8% массы эритро¬
цитов
14 дозы в месяц
Лаборатория контроля
, -г , — I
Гематокрит
0,65-0,75
I 4 дозы в месяц
I Лаборатория контроля
Транспортирование
Для эритроцитов, помещенных в рефрижератор, транспортные системы долж¬
ны гарантировать, что после транспортирования в течение 24 ч температура крови
не будет превышать 10 °С. Транспортировку без рефрижераторов осуществляют
в охлаждаемых термоизолированных контейнерах.
Предосторожности при применении
Тест на совместимость с реципиентом должен выполняться непосредственно
перед переливанием.
Не рекомендуется применять эритроцитную стандартную массу в случаях;
• различных видов непереносимости плазмы;
• несовместимости вследствие аллоиммунизации против антигенов лейкоцитов;
• при обменном переливании у новорожденных, если не добавлено дополни¬
тельное количество плазмы.
Побочные эффекты
Могут наблюдаться следующие побочные эффекты:
• Циркуляторная перегрузка;
• гемолитические посттрансфузионные реакции;
• негемолитические посттрансфузионные реакции (озноб, лихорадка, крапив
ница);
210 СЛУЖБА КРОВИ
і сепсис вследствие невыявленной бактериальной контаминации крови-
• возможно заражение Treponema pallidum, если эритроциты храни
при 4 °С менее 96 ч; Ис1>
а возможна трансмиссия вирусов (гепатиты, ВИЧ и др.);
• в редких случаях возможно заражение малярией;
і аллоиммунизация против HLA и эритроцитных антигенов;
I биохимический дисбаланс после массивных трансфузий, например гипел
лиемия; РКа'
• посттрансфузионная пурпура;
• острая посттрансфузионная легочная недостаточность;
а трансмиссия других патогенов, которые не могли быть выявлены ранее
ЭРНТРОЦИТНАЯ МАССА С УДАЛЕННЫМ ЛЕЙК0ТР0МБ0ЦНТНЫМ СЛОЕМ
Определение
Компонент, получаемый из цельной крови после удаления плазмы и лейко¬
тромбоцитного слоя.
Свойства
Гематокрит компонента составляет 0,65-0,75.
Доза содержит все эритроциты цельной крови, за исключением 20-30 мл крас¬
ных клеток, удаленных вместе с лейкотромбослоем. Каждая доза содержит мини¬
мум 43 г гемоглобина.
Содержание лейкоцитов в дозе менее 1,2х109, тромбоцитов — менее ІОхІО9.
Способ приготовления
При получении компонента после центрифугирования удаляют плазму и
20-60 мл слоя, содержащего лейкоциты и тромбоциты. Плазму возвращают к эри¬
троцитам, чтобы сохранить гематокрит в интервале 0,65-0,75.
Этикетирование
Этикетирование должно проводиться в соответствии с национальными прави¬
лами и международными соглашениями. Следующая информация должна бьггь
размещена на этикетке или сопровождающей листовке-вкладыше:
• идентификация производителя;
I индивидуальный идентификационный номер;
• группа крови АВО и Rh-принадлежность;
• дата кроводачи;
і название типа консерванта;
• наименование компонента крови;
• дополнительная информация — лейкоцитов менее 1,2х109, облучение и др.
(если проводилось);
• срок хранения;
• объем или масса компонента;
• температура хранения;
І фенотип группы крови, помимо АВО и Rh-принадлежности (если необходи¬
мо);
• компонент не может быть применен при выявлении ненормального гемолиза
или других изменений;
І компонент может быть применен с использованием 170-200 мкм фильтра.
Хранение и стабильность
Те же, что для цельной крови. Удаление лейкотромбослоя снижает образование
агрегатов.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КР08И 211
Контроль качества
Тот же, что цельной крови, за исключением показателей табл. 7-16.
Таблица 7-16. Особенности контроля качества эритроцитной массы с удаленным лейкотромбо-
цитарным слоем
Объекты контроля
Критерии качества
Частота контроля
Место контроля
объем
250±50 мл
1% общего числа доз
Отделение компонентов
гемоглобин
Минимум 43 г в дозе
4 дозы в месяц
Гемолиз в конце хранения
<0,8% массы эритро¬
цитов
4 дозы в месяц
Лаборатория контроля
Гематокрит
0,65-0,75
4 дозы в месяц
Содержание лейкоцитов в дозе
<1,2x10е
4 дозы в месяц
Лаборатория контроля
Транспортирование
Для эритроцитов, помещенных в рефрижератор, валидированные транспорт¬
ные системы должны гарантировать, что после транспортирования в течение 24 ч
температура крови не будет превышать 10 °С. Транспортировку без рефрижерато¬
ров осуществляют в охлаждаемых термоизолированных контейнерах.
Предосторожности при применении
Тест на совместимость с реципиентом должен выполняться непосредственно
перед переливанием.
Не рекомендуется применять эритроциты в случае;
• различных видов непереносимости плазмы;
і при обменном переливании у новорожденных, если не добавлено дополни¬
тельное количество плазмы;
• новорожденным при преждевременных родах и реципиентам с риском пере¬
грузки железом.
Побочные эффекты
s Циркуляторная перегрузка;
• гемолитические посттрансфузионные реакции;
І негемолитические посттрансфузионные реакции (озноб, лихорадка, крапив¬
ница);
і сепсис вследствие невыявленной бактериальной контаминации крови;
і возможно заражение Treponema pallidum, если эритроциты хранились
при 4 °С менее 96 ч;
і возможна трансмиссия вирусов (гепатиты, ВИЧ и другие);
і в редких случаях возможно заражение малярией;
І аллоиммунизация против HLA и эритроцитных антигенов;
• биохимический дисбаланс после массивных трансфузий, например гиперка-
лиемия;
S посттрансфузионная пурпура;
І острая посттрансфузионная легочная недостаточность;
І трансмиссия других патогенов, которые не могли быть выявлены ранее.
ЭРНТРОЦИТНАЯ МАССА В РЕСУСПЕНДИРУЮЩЕМ РАСТВОРЕ
Определение
Компонент, полученный из цельной крови центрифугированием и удалением
плазмы с добавлением эквивалентного количества питательного раствора.
Наряду с эритроцитной массой используют эритроцитную взвесь в ресуспенди-
Рующем консервирующем растворе (соотношение эритроцитов и раствора опреде¬
ляют ее гематокрит, а состав раствора — длительность хранения).
212 СЛУЖБА КР08И
Эрнтроцитная взвесь представляет собой деплазмированный концентрат
троцитов, уровень белка в котором не превышает 1,5 г/л. Ресуспендируя эрц^
цнтную массу в специальном растворе, можно получить эритроцитную взвесь
При этом эрнтроцитная взвесь, приобретая более высокую текучесть и соог-
ВЄСТВЄННО более высокие реологические свойства, одновременно имеет более
низкое гематокритное число (40-50%). В качестве ресуспендирующего раствора
используют 0,9% раствор хлорида натрия, модежель. Как правило, соотношение
эритроцитной массы и раствора составляет 1:1.
Ряд растворов не рекомендуется использовать для приготовления эритроцит-
ной взвеси. В частности, разведение эритроцитной массы 5% раствором глюкозы
(и его аналогами) приводит к склеиванию и гемолизу эритроцитов, а использо¬
вание для ресуспендирования растворов, содержащих ионы Са2\ может привести
к образованию сгустков.
Свойства
Гематокрит компонента зависит от свойств добавляемого раствора, метода
центрифугирования и количества остающейся плазмы. Он не должен превышать
0,7%. Каждая доза содержит минимум 45 г гемоглобина.
Контейнер с компонентом содержит все эритроциты, находящиеся в исходной
дозе крови, большую часть лейкоцитов (около 2,5-3,0х109 клеток) и различное
количество тромбоцитов, зависящее от способа центрифугирования.
Способ попучения
Первичный консервирующий раствор — CPD. Большинство ресуспендирующих
растворов содержат натрия хлорид, глюкозу, аденин и маннитол, растворенные
в воде. Другие растворы содержат цитрат, маннитол, фосфат и гуанозин. Объем
может составлять 80-100 мл. Цельная кровь может находиться до 24 ч в условиях
поддерживаемой температуры 20-24 °С.
После центрифугирования цельной крови эритроциты и плазма разделяются.
После тщательного перемешивания с добавляемым раствором эритроциты хранят
при температуре 4-6 °С.
Хранение и стабильность
Те же, что для цельной крови и эритроцитов.
В зависимости от антикоагулянта и суспендирующего раствора хранить следует
в пределах разрешенного срока. При хранении образуются агрегаты.
Контроль качества
Тот же, что для цельной крови, с дополнением показателей табл. 7-17.
Таблица 7-17. Особенности контроля качества эритроцитной массы в ресуспендирующем раство¬
ре
Объекты
контроля
Критерии
качества
Частота
контроля
Место
контроля
Объем
Зависит от примененного
раствора
1% общего числа доз
Отделение компонентов
Гемоглобин
Минимум 45 г е дозе
4 дозы в месяц
Лаборатория контооля
Гемолиз в конце
хранения
<0.8% массы эритроцитов
4 дозы в месяц
Лаборатория контроля
Гематокрит
0,50-0,70
4 дозы в месяц
Лаборатория контроля
Этикетирование, транспортирование, предосторожности при применении,
побочные эффекты те же, что для эритроцитной массы.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 213
ЭРИТРОЦИТЫ В РЕСУСПЕНДИРУЮЩЕМ РАСТВОРЕ С УДАЛЕННЫМ
лейкотромбослоем
Определение
Компонент, выделяемый из крови методом центрифугировании, при котором
после удаления плазмы и лейкотромбослоя эритроциты ресуспендируют в пита¬
тельном растворе, содержащем субстраты метаболизма.
Свойства
Гематокрит не должен превышать 0,70 и зависит от свойств добавляемого рас¬
твора. метода центрифугирования и количества остающейся плазмы. Каждая доза
должна содержать минимум 43 г гемоглобина после окончания процедуры.
Доза содержит все эритроциты исходной крови, за исключением 20-30 мл,
теряемых в ходе процедуры.
Содержание лейкоцитов в дозе менее 1,2x10’ и среднее число тромбоцитов
менее 20x10’.
Способ получения
Первичный консервирующий раствор — CPD. Большинство ресуспендирующих
растворов содержат натрия хлорид, глюкозу, аденин и маннитол, растворенные
в воде. Другие растворы содержат цитрат, маннитол. фосфат и гуанозин. Объем
может составлять 80-110 мл.
При приготовлении компонента плазма и 20-60 мл лейкотромбослоя удаляют¬
ся после центрифугирования.
После тщательного перемешивания с добавляемым раствором эритроциты хра¬
нят при температуре 4-6 °С.
Контроль качества — тот же, что для цельной крови, с дополнением показателей
табл. 7-18.
Таблица 7-18. Особенности контроля качества эритроцитной массы в ресуспендирующем раство¬
ре с удаленным лейкотромбослоем
Объекты контроля
Критерии качества
Частота кон¬
троля
Место контроля
Объем
Зависит от использованной
системы
1% общего
числа доз
Отделение компонентов
Гемоглобин
Минимум 43 г в дозе
4 дозы в месяц
Лаборатория контроля
Гемолиз в конце хранения
<0,8% массы эритроцитов
4 дозы в месяц
Лаборатория контроля
Гематокрит
0,50-0.70
4 дозы в месяц
Лаборатория контроля
Содержание лейкоцитов в дозе
<1,2x10®
4 дозы в месяц
Лаборатория контроля
Этикетирование, транспортирование, предосторожности при применении,
побочные эффекты, хранение и стабильность — те же, что для эритроцитной
массы.
ОТМЫТЫЕ ЭРИТРОЦИТЫ
Определение
Компонент, получаемый при центрифугировании цельной крови и удалении
плазмы, с последующим отмыванием эритроцитов в изотоническом растворе.
Свойства
Компонент из суспензии эритроцитов, из которой удалены большая часть плаз¬
мы. лейкоциты и тромбоциты. Количество остающейся плазмы зависит от способа
Смывания. Гематокрит может варьировать в зависимости от клинических показаний.
Кпидая доза содержит минимум 40 г гемоглобина после окончания процедуры.
РАДЙЛИ
И ^
214 СЛУЖБА КРОВИ
Способ получения
После центрифугирования и удаления плазмы и лейкотромбослоя эритро
несколько раз отмывают добавлением холодного (4 °С) изотонического paciw!
и центрифугированием на рефрижераторной центрифуге. •
Эритроцитную массу отмывают в тех же пластиковых контейнерах, в кото
она хранится. Отмывание может быть осуществлено для эритроцитной ма
любых сроков годности. Для детей, кардиососудистых больных предпочтен*1
Я отдается эритроцитам малых сроков хранения — до 7 дней. Эритроцитную масг!
отмывают 3 раза стерильным физиологическим раствором. После каждого доба
ления физиологического раствора эритроцитную массу осаждают методом цен
трифугирования. В процессе отмывания удаляются белки плазмы, лейкоциту
тромбоциты, микроагрегаты клеток и стромы разрушенных при хранении клеточ¬
ных компонентов. Отмытые эритроциты готовятся в отделении трансфузиологии
по заявке лечащего врача из нескольких доз крови, подобранных для больного
Это ареактогенная трансфузионная среда, переливание которой показано боль¬
ным, имеющим в анамнезе посттрансфузионные реакции негемолитического типа
а также лицам, сенсибилизированным к антигенам лейкоцитов, тромбоцитов
и белкам плазмы.
При отмывании, даже при тщательном подходе ко всем этапам процедуры, про¬
исходит удаление с отмывающим раствором части эритроцитов. Это необходимо
иметь в виду и назначать больному объем отмытых эритроцитов на 10-20% боль¬
ше, чем при назначении нативной эритроцитной массы.
Необходимо помнить, что трансфузии отмытых эритроцитов, хотя и снижают
риск заражения больного гематогенными инфекциями, полностью не избавляют
эритроцитную массу от вирусов гепатита, ВИЧ и других инфекций. Кроме того,
поскольку отмыванием не удается полностью избавиться от клеток лейкоцитного
ряда, то у иммунокомпрометированных больных существует опасность спровоци¬
ровать реакцию «трансплантат против хозяина».
Показания для трансфузий отмытых эритроцитов следующие:
• синдром гомологичной крови (как элемент комплексной терапии);
• сенсибилизирование повторными гемотрансфузиями или предшествующими
беременностями;
І аллергические заболевания (бронхиальная астма и другие) — с целью про¬
филактики анафилактических реакций.
Этикетирование - то же, что для эритроцитной массы.
Хранение и стабильность
Во время хранения температура должна составлять 4-6 °С. Время хранения
должно быть как можно короче после процедуры отмывания и никогда не превы¬
шать 24 ч. если проводились открытые манипуляции
Контроль качества - тот же, что для цельной крови, с дополнением показателей
табл. 7-19.
Таблица 7-19. Особенности контроля качества отмытых эритроцитов
Объекты контроля
Критерии качества
Частота
контроля
Место контроля
Объем
Зависит от использованной системы
Все дозы
Отделение компонентов^
Гемоглобин
Минимум 40 г в дозе
Все дозы
Лаборатория контроля^
Гемолиз е конце хранения
<0,8% массы эритроцитов
Все дозы
Лаборатория контроля
Гематокрит
0,65-0,75
Все дозы
Лаборатория контроля^
Содержание белка
1 финальном супернатанте
<0,5 г в дозе
Все дозы
Лаборатория контроля
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 215
транспортирование
Транспортирование ограничено коротким сроком хранения. Условия хранения
вялены поддерживаться во время транспортирования. Должно быть повышенное
внимание к температуре и времени транспортирования.
Предосторожности при применении
Тест на совместимость с реципиентом должен выполняться непосредственно
перед переливанием.
Так как во время приготовления компонент может быть переведен в другой кон*
тейнер, необходимо контролировать идентификацию каждой дозы компонента.
Побочные эффекты те же, что для эритроцитной массы.
ЭРИТРОЦИТНАЯ МАССА С УДАЛЕННЫМИ ЛЕЙКОЦИТАМИ
Определение
Компонент, получаемый из эритроцитной массы путем удаления большей части
лейкоцитов.
Свойства
Содержание лейкоцитов должно быть менее ІХІ0* в дозе. Может быть достиг¬
нуто такое низкое содержание, как 0,05х106. Каждая доза содержит не менее 40 г
гемоглобина.
Метод получения
Применяют различные способы, в том числе удаление лейкотромбослоя и
фильтрацию. Лучшие результаты достигаются при использовании обоих методов.
Рекомендуется применять фильтрацию в течение 48 ч после донации.
Этикетирование, хранение и стабильность те же, что для эритроцитной массы.
Контроль качества — тот же, что для цельной крови, с включением показателей
табл. 7-20.
Таблица 7-20. Особенности контроля качества эритроцитной массы с удаленными лейкоцитами
Объекты контроля
Критерии качества
Частота контроля
Место контроля
Объем
Зависит от использованной
системы
1% общего числа доз
Отделение компо¬
нентов
Гемоглобин
Минимум 40 г в дозе
1% всех доз, минимум
4 дозы в месяц
Лаборатория контроля
Гемолиз в конце хранения
<0.8% массы эритроцитов
4 дозы в месяц
Лаборатория контроля
Гематокрит
0,50-0,70
4 дозы в месяц
Лаборатория контроля
Остаточное содержание
лейкоитов
<1x10® в дозе
1% всех доз, минимум
4 дозы в месяц
Лаборатория контроля
Транспортирование
Те же принципы, что для цельной крови и других компонентов крови. Особое
внимание должно быть к контролю температуры и времени ввиду использования
открытой системы при получении.
Показания к применению
Те же показания, что и для других эритроцитсодержащих компонентов,
применение показано для пациентов, у которых выявлено или возможно наличие
антилейкоцитных антител либо у которых трансфузии следует проводить с осто¬
рожностью к аллоиммунизации к лейкоцитным антигенам. Эритроцитная масса
сУдаленными лейкоцитами — приемлемая альтернатива крови для профилактики
трансмиссии цитомегаловируса.
gjg СЛУЖБА КРОВИ
^ tier км во время приготовления компонент может быть перемещен В
контейнер, необходимо проверять идентификацию каждой его дозы.
Предосторожности при применении, побочные эффекты те же, что для ч
цктарной массы.
КРИОКОНСЕРВИРОВАННЫЕ ЭРИТРОЦИТЫ
Определеике
Эритроциты (до 7 дней хранения после заготовки) с добавлением криок
сервирующего раствора и последующим хранением при низких (-60...-8Q
или ультранизких (-196 °С) температурах. '
Перед применением эритроциты размораживают, отмывают и ресуспендипу*»,
в изотоническом или другом взвешивающем растворе.
Свойства
Готовый для введения компонент обеднен белками, гранулоцитами и тромбоцита-
ми. Содержание гемоглобина не менее 36 г. Максимальный срок хранения - 24 ч.
Метод приготовления
Применяют два принципиально различных метода. В одном замораживание
клеток осуществляют в растворе с высокой концентрацией глицерина, в другом I
с низкой концентрацией. Оба метода требуют удаления глицерина отмыванием
эритроцитов.
Побочные эффекты, этикетирование те же, что для эритроцитной массы.
Хранение и стабильность
Замороженные эритроциты должны постоянно находиться:
• в электроморозильниках при -60...-80 °С; максимальный срок хранения
составляет до 5 лет;
I в камерах, бункерах в жидком азоте или его парах при температуре -140...-
196 °С, срок хранения составляет до 10 лет и более.
Размороженные и восстановленные эритроциты должны храниться при тем¬
пературе 4-6 °С. Время хранения не должно превышать 24 1 при использовании
открытой системы.
Контроль качества - тот же, что для цельной крови, с включением показателей
табл. 7-21.
Таблица 7-21. Особенности контроля качества криоконсервированных эритроцитов
Объекты контроля
Критерии качества
Частота контроля
Место контроля
Объем
>185 мл
Все дозы
Отделение компонентов
Гемоглобин
(супернатант)
<0,2 г в дозе
Все дозы
Лаборатория контроля
Гемоглобин
>36 Г 8 дозе
Все дозы
Лаборатория контроля
Гематокрит
0.65-0,75
4 дозы в месяц
Лаборатория контроля
Лейкоциты
<0,1х108 в дозе
1% всех доз, минимум 4 дозы
в месяц или каждую дозу
Лаборатория контроля
Осмолярность
<340 мосм/л
1% асах доз, минимум 4 дозы
в месяц или каждую дозу
Отделение компонентов
Стерильность
Стерильно
1% всех доз, минимум 4 дозы
в месяц или каждую дозу
Лаборатория контроля
Транспортирование
Транспортирования в замороженном состоянии следует избегать ввиду труД'
ногти поддержания требуемой температуры. Перевозка размороженных эритро-
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 217
!ffOB лимитируется коротким периодом хранения. Необходимо обеспечивать
регламентируемые условия хранения.
Показания к применению
Криоконсервированные эритроциты предназначены для восполнения или заме¬
щения клеток. Этот компонент применяют только в особых ситуациях:
, переливание пациентам с редкой группой крови или множественными алло¬
антителами;
. для иммунизации используют эритроциты, которые хранились более 6 мес;
1 в некоторых случаях аутологичных трансфузий.
Предосторожности при применении, побочные эффекты те же. что для эритро-
цитарной массы.
Поскольку замороженные эритроциты могут храниться длительное время,
такое же время должны храниться образцы плазмы/сыворотки цельной исходной
крови. Это необходимо для возможных исследований в будущем, в случае откры¬
тия новых маркеров или трансмиссивных заболеваний.
аферезные эритроциты
Определение
Компонент, получаемый аферезом эритроцитов от одного донора с использова¬
нием аппарата автоматического разделения клеток.
Свойства
Обычно аферезные эритроциты состоят из одной или двух доз красных клеток,
полученных от одного донора.
В зависимости от метода получения и используемого аппарата имеется возмож¬
ность приготовить дозы эритроцитов с предсказуемым, повторяющимся и стан¬
дартизованным содержанием клеток. Каждая доза должна содержать не менее 40 г
гемоглобина. Содержание тромбоцитов, лейкоцитов и плазмы может варьировать.
Метод получения
Цельную кровь получают от донора с добавлением содержащего цитрат анти¬
коагулянта, отделяют на сепараторе эритроциты. Остающиеся компоненты крови
возвращают донору. При одной процедуре могут быть получены одна или две дозы
эритроцитов. Во время или после процедуры добавляют консервирующий раствор.
Объем консервирующего раствора составляет 80-120 мл, в зависимости от коли¬
чества заготовленных красных клеток и необходимости поддержания требуемого
гематокрита. В процесс может быть включена дополнительная стадия фильтрации
для снижения контаминации лейкоцитами.
Этикетирование
Этикетирование должно проводиться в соответствии с национальными прави¬
лами и международными соглашениями. Следующая информация должна быть
размещена на этикетке или сопровождающей листовке-вкладыше:
I идентификация производителя;
І индивидуальный идентификационный номер. Если от донора одновременно
получено две или более доз, должна быть добавлена нумерация процедуры;
аферез-1, аферез-2 и т.д.;
І группа крови АВО и Rh-принадлежность;
• датадонации;
• название и объем криоконсервирующего раствора или название и объем
добавленного раствора (если проводилось);
• наименование компонента крови;
21$ СЛУЖБА КР08И
• дополнительная информация — удаление лейкоцитов, облучение и др.
проводилось); и
S срок хранения, дата применения (если необходимо);
• объем или масса компонента;
• температура хранения;
в фенотип группы крови, помимо АВО и Rh-принадлежности (если необходи.
мо);
я компонент не может быть применен при выявлении ненормального гемолиза
или других изменений;
і компонент должен быть применен с использованием 170-200 мкм фильтра
Хранение и стабильность
Условия хранения те же, что для эритроцитов. Удаление лейкотромбослоя сни¬
жает возможность формирования микроагрегатов и выхода цитокининов.
В зависимости от антикоагулянта и суспендирующего раствора хранить следует
в пределах разрешенного срока.
Если фильтрация или другие манипуляции проводились открытым способом,
то время хранения не должно превышать 24 ч при температуре 4-6 °С.
Транспортирование
Те же принципы, что для цельной крови и других компонентов эритроцитов.
Ввиду использования открытой системы при изготовлении особое внимание
нужно уделять контролю температуры и времени.
Показания к применению
Те же показания, что для цельной крови и других эритроцитсодержащих ком¬
понентов.
Для реципиента оптимально получение двух доз компонента от одного донора.
Если одновременно удалены лейкоциты, то компонент является приемлемой аль¬
тернативой крови для профилактики трансмиссии цитомегаловируса.
Предосторожности при применении, побочные эффекты те же, что для эритро-
цитарной массы.
Контроль качества — тот же, что для цельной крови, включая показатели
табл. 7-22.
Таблица 7-22. Требования контроля качества для эритроцитсодержащих компонентов
Компонент
Требуемые пока¬
затели качества
Приемлемые результаты качества
Эритроциты (эритроцитная
масса)
Объем
Действительный для характеристик хранения в целях
поддержания продукта в соответствии со специфика¬
циями гемоглобина и гемолиза
Гемоглобин
Не менее 45 г/доза
Гемолиз
Менее 0,8% массы эритроцитов к концу срока хра¬
нения
Эритроциты с удаленным лей¬
котромбослоем
Объем
Действительный для характеристик хранения в целях
поддержания продукта в соответствии со специфика¬
циями гемоглобина и гемолиза
Гемоглобин
Не менее 43 г/доза
Гемолиз
Менее 0,8% массы эритроцитов к концу срока хранения
Эритроциты, обедненные лей¬
коцитами
Объем
Действительный для характеристик хранения в целях
поддержания продукта в соответствии со специфика¬
циями гемоглобина и гемолиза
Гемоглобин
Не менее 40 г/доза
Гемолиз
Менее 0,8% массы эритроцитов к концу срока хранения
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 219
Окончание табл. 7-22 ™
Компонент
Требуемые пока¬
затели качества
Приемлемые результаты качества
jggl
Содержание лей¬
коцитов
Иенее 1x10е в дозе
^роцитьГв добавочном
распоре (эритроцитная
Объем
Действительный для характеристик хранения в целях
поддержания продукта в соответствии со специфика¬
циями гемоглобина и гемолиза
Гемоглобин
Не менее 45 г/доза
Гемолиз
Менее 0,8% массы эритроцитов к концу срока хра¬
нения
мроциты с удаленным лей-
котромбослоем в добавочном
растворе (эритроцитная взвесь
11 удаленным лейкотромбос¬
лоем)
Объем
Действительный для характеристик хранения в целях
поддержания продукта в соответствии со специфика¬
циями гемоглобина и гемолиза
Гемоглобин
Не менее 43 г/доза
Гемолиз
Менее 0,8% массы эритроцитов к концу срока хра¬
нения
Эритроциты, обедненные лей¬
коцитами, в добавочном рас¬
творе (эритроцитная взвесь,
обедненная лейкоцитами)
Объем
Действительный для характеристик хранения в целях
поддержания продукта в соответствии со специфика¬
циями гемоглобина и гемолиза
Гемоглобин
Не менее 40 г/доза
Гемолиз
Менее 0,8% массы эритроцитов к концу срока хра¬
нения
Содержание лей¬
коцитов
Менее 1x106 в дозе
.... - 1
Эритроциты, полученные
методом афереза
Объем
Действительный для характеристик хранения в целях 1
поддержания продукта в соответствии со специфика¬
циями гемоглобина и гемолиза
Гемоглобин
Не менее 40 г/доза
Гемолиз
Менее 0,8% массы эритроцитов к концу срока хранения
ПОКАЗАНИЯ К ПЕРЕЛИВАНИЮ ЭРИТРОЦИТСОДЕРЖАЩИХ СРЕД
Введение донорских эритроцитов направлено на восполнение объема цир¬
кулирующих эритроцитов и поддержание нормальной кислородотранспортной
функции крови при анемии. До середины прошлого века для этих целей пере¬
ливали цельную консервированную донорскую кровь. С внедрением идеологии
компонентной гемотерапии, основной постулат которой — переливать только тот
компонент, который необходим для восполения утраченной функции, переливают
эритроцитсодержащие растворы — эритроцитную массу, отмытые эритроциты,
эритроцитную взвесь, лейкодеплицированную эритроцитную массу и др.
Преимущества эритроцитной массы по сравнению с цельной консервированной
кровью:
* более высокая кислородотранспортная емкость в меньшем объеме продукта;
I минимальное содержание иммуногенных факторов — белков плазмы, лейко¬
цитов, тромбоцитов;
І низкое содержание продуктов распада клеток и белков плазмы;
І низкое содержание вазоактивных веществ — серотонина, гистамина, натрия,
калия;
І низкое содержание микроагрегатов;
* низкое содержание факторов гемокоагуляции;
* низкое содержание консервирующего раствора;
' возможность приготовления отмытых эритроцитов (принципиально важное
значение для больных, сенсибилизированных антигенами лейкоцитов, тром¬
боцитов, белков плазмы).
mm
220 СЛУЖБА КРОВИ
Эффективность переливания эритроцитной массы, о которой можно суди
по уменьшению одышки, тахикардии, повышению уровня гемоглобина, завип«
от исходного состояния пациента, уровня гемоглобина, а также от уровня гема
токрита трансфузионной среды и сроков ее хранения. Переливание одной дозы
эритроцитной массы (т.е. количества эритроцитов из одной кроводачи объемом
450+45 мл) повышает, как правило, уровень гемоглобина примерно на Ю гд
и уровень гематокрита на 3% (при отсутствии продолжающегося активного кро¬
вотечения).
Пациенты с кровопотерей в пределах 1000-1200 мл (до 20% ОЦК) очень
редко нуждаются в трансфузиях эритроцитов. Переливание солевых и коллоид¬
ных растворов вполне обеспечивает им восполнение и поддержание нормово-
лемии. тем более что неизбежное снижение мышечной активности сопровожда¬
ется уменьшением потребности организма в кислороде. Чрезмерное стремление
к «нормальному» уровню гемоглобина может привести, с одной стороны, к раз¬
витию сердечной недостаточности из-за гиперволемии, с другой стороны — может
способствовать повышению тромбогенности. Особенно опасно стремление к пол¬
ному замещению объема утраченных эритроцитов, если кровотечение сопрово¬
ждалось развитием геморрагического шока, с последующим возникновением ДВС-
синдрома, усиливающегося при переливании эритроцитной массы.
Показание к переливанию эритроцитной массы при острой анемии вследст¬
вие массивной кровопотери — потеря 25-30% ОЦК, сопровождающаяся снижени¬
ем уровня гемоглобина ниже 70-80 г/л, гематокрита ниже 25% и возникновением
циркуляторных нарушений. В первые часы острая кровопотеря обычно не сопро¬
вождается падением концентрации гемоглобина. Уменьшение ОЦК проявляется
бледностью кожи, слизистых (особенно конъюнктив), запустением вен, появлени¬
ем одышки и тахикардии. В этих случаях цель трансфузионной терапии — быстрое
восстановление внутрисосудистого объема для обеспечения нормальной перфузии
органов, что в данный момент более важно, чем увеличение числа циркулирующих
эритроцитов. Необходимо немедленное введение солевых растворов, коллоидных
плазмозаменителей или альбумина, СЗП с последующим подключением эритро-
цитарной массы.
Еще более строги показания к назначению переливания эритроцитной массы
при хронической анемии. Для подобных пациентов со сниженным количеством
циркулирующего гемоглобина необходима ликвидация причины, вызвавшей
анемию, а не восстановление уровня гемоглобина с помощью трансфузий эри¬
троцитсодержащих трансфузионных сред. У этих больных наблюдается развитие
компенсаторных механизмов: увеличение сердечного выброса, сдвиг вправо кри¬
вой диссоциации оксигемоглобина (что увеличивает отдачу кислорода в тканях),
увеличение частоты дыхания и т.п. В результате до некоторой степени нивели¬
руются клинические проявления уменьшенного количества эритроцитов и гемо¬
глобина в циркуляции. Трансфузии переносчиков газов крови назначают только
для коррекции важнейших симптомов, обусловленных анемией и не поддающихся
основной патогенетической терапии. Кроме того, постоянное введение донорских
эритроцитов может подавлять собственный эритропоэз реципиента.
При назначении переливания эритроцитной массы больным с хронической ане¬
мией необходимо руководствоваться следующими правилами:
і установить клинические симптомы, обусловленные анемией, которые могут
быть критерием эффективности трансфузии;
• не назначать переливание эритроцитной массы, ориентируясь только на уро¬
вень гемоглобина, так как он колеблется в зависимости от объема переливае¬
мых солевых растворов, диуреза, степени сердечной компенсации;
• при сочетании сердечной недостаточности и анемии трансфузии должны
быть осторожными (скорость переливания 1 -2 мл эритроцитной массы на кг
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 221
массы тела в час) с возможным назначением диуретиков перед трансфузией
(опасность гиперволемии из-за увеличенного объема ОЦК).
Хаким образом, трансфузии эритроцитной массы показаны в следующих слу-
ч1Й*'острые постгеморрагические анемии;
* анемии, сопровождающие хронические заболевания;
анемии при инфекционных заболеваниях, гнойно-септических осложнениях,
ожогах, заболеваниях кроветворной системы и злокачественных новообра¬
зованиях;
, травматический и операционный шок, осложненный кровопотерей;
' анемическая гипоксия при нормо-гиповолемических состояниях;
, период подготовки больных с критически низкими показателями гемограм¬
мы к обширным хирургическим вмешательствам.
В определении показаний к гемотрансфузиям у хирургических больных глав¬
ный критерий - кровопотеря во время операции и постоперационный период,
а также резервы компенсаторных возможностей организма.
ТРОМБОТИЧЕСКИЙ КОНЦЕНТРАТ (ТК)
Эго компонент крови, получаемый из цельной крови методом центрифугирования и
содержащий тромбоциты, суспендированные в плазме. Для получения ТК используют
методы центрифугирования цельной крови, заготовленной на консерванте (из одной
дозы крови - 450 мл), т.е. дифференцированное центрифугирование - выделение
ТК из цельной консервированной донорской крови. Также применяют плазмотром-
боцитаферез - выделение ТК из обогащенной плазмы, на специальных сепараторах,
производящих разделение крови на компоненты в автоматическом режиме.
Стандартный ТК, приготовленный из одной дозы консервированной крови объ¬
емом 450 мл, содержит не менее 55x109 тромбоцитов. Такое количество считается
одной единицей ТК, переливание которой должно увеличивать количество тром¬
боцитов в циркуляции реципиента с площадью поверхности тела 1,8 м2 примерно
на 5-10x10’ /л при отсутствии у него признаков кровотечения. Однако такая
трансфузия не будет терапевтически эффективной при глубокой тромбоцитопе-
нии у больных с миелодепрессией, осложненной кровотечением. Установлено,
что терапевтическая доза ТК составляет не менее 50-70x10’ тромбоцитов на каж¬
дые 10 кг массы тела или 200-250x10’ на 1 м2 поверхности тела.
В ТК, полученном любым способом, всегда присутствует примесь лейкоцитов
и эритроцитов, в связи с чем при появлении у реципиентов тяжелых трансфузион¬
ных реакций на введение ТК или рефрактерности необходимо удаление эритроци¬
тов и особенно лейкоцитов. С этой целью ТК монодонорский подвергают мягкому
Центрифугированию (178 g) в течение 3 мин. Такая методика позволяет «отмыть*
почти 96% имевшихся в ТК лейкоцитов, но, к сожалению, при этом теряется около
20% тромбоцитов. В настоящее время имеются специальные фильтры, удаляющие
лейкоциты из ТК непосредственно во время переливания реципиенту, что суще¬
ственно повышает эффективность заместительной терапии.
Температурные режимы и сроки хранения ТК определяют в зависимости от того,
как быстро необходимо получить гемостатический эффект и как долго его нужно
°°ддерживать. Для хранения ТК до применения можно использовать 2 температур-
7е режима: 4 и 22 °С. Показано, что ТК, сохраняемый при 4 °С, дает сравнительно
ьизрьщ гемостатичекий эффект, тогда как ТК, сохраняемый при комнатной темпе-
{*vPe. после трансфузии оказывает отсроченный гемостатический эффект, что свя-
^0т с удлинением сроков циркуляции донорских тромбоцитов.
настоящее время в большинстве клиник используют регламент, по которому
дц*Ранят в специальной пластиковой таре при температуре 22-24 °С при посто-
°и данном перемешивании.
222 с/покьд крови
Храмнм
Тромбоциты хранят при температуре 20-24 "С в закрытой камере с автомат
ческим поддержанием температурного режима. Если такое оснащение недоступно
следует выбрать место в помещении, где температура относительно постоянна
Тромбоциты необходимо постоянно перемешивать, для чего имеются специалъ.
ные платформы - агитаторы, которые обеспечивают постоянное перемешивание
и газообмен через стенки контейнера, позволяют избежать складок и перегибов
контейнеров, варьируют скорость перемешивания для избежания вспенивания.
Закрытая камера должна быть снабжена термографом и сигнальным устройством
При их отсутствии температуру хранения следует измерять вручную несколько раз
в день. Движение агитатора регулярно проверяют на соответствие характеристикам
изготовителя.
Тромбоциты особенно чувствительны к условиям хранения. Метаболизм тром¬
боците». их функциональность и жизнеспособность после переливания зависят
от адекватного снабжения кислородом, температуры и pH препарата.
При температуре хранения 22 ‘С 100x10’ клеток потребляют приблизительно
10 ммоль кислорода в час. На интенсивность потребления кислорода можно влиять,
применяя различные модели агитаторов, варьируя pH и температуру. Добавление
ацетата в консервант может увеличивать потребление кислорода. Примесные
лейкоциты также потребляют кислород, однако их количество в стандартной дозе
столь невелико, что этим можно пренебречь. Когда максимум содержания тромбо¬
цитов в хранимом контейнере превышает количество, для сохранности которого
достаточно кислорода, потребление глюкозы возрастает в 3-5 раз. В результате
активно образуется молочная кислота, снижается pH, падает концентрация АТФ
и теряется жизнеспособность тромбоцитов.
Таким образом, максимальное количество хранимых тромбоцитов ограни¬
чивается способностью диффузии кислорода через стенки контейнера. Когда
появляются новые контейнеры для хранения тромбоцитов, должно быть лими¬
тировано максимальное количество содержащихся клеток. Это определяет способ
приготовления, модель перемешивающего устройства, состав и pH поддерживаю¬
щей среды. Для получения оптимальных результатов при хранении тромбоцитов
нужно использовать специальные газопроницаемые контейнеры и обеспечивать
постоянное перемешивание и температуру 20-24 °С.
ТРОМБОЦИТЫ ИЗ ОТДЕЛЬНОЙ ДОЗЫ ЦЕЛЬНОЙ КРОВИ
Определение
Компонент, полученный из свежей цельной крови и содержащий большую
часть тромбоцитов в терапевтически эффективной форме.
Свойства
В зависимости от метода получения компонент в одной дозе содержит 45-85x10
(в среднем 70ХІ09) тромбоцитов в 50-60 мл суспендирующей среды. В одной дозе
компонента содержатся лейкоциты в количестве 0,05-1x10’ и эритроциты - 0,2-
1.0x10’, если не приняты меры к их уменьшению.
Количество тромбоцитов в «стандартной дозе* компонента для взрослых рецН'
пиентов эквивалентно количеству тромбоцитов, выделенных из 4-6 доз цельной
крови.
Метод получения
Используется доза свежей крови со сроком хранения до 24 ч при 20-24 “о.
Обогащенная тромбоцитами плазма отделяется от цельной крови при «мягком*
центрифугировании, а тромбоциты концентрируются при «жестком* центрифуг’*'
роаании (5000 g, 5 мин).
ОРГАНИЗАЦМЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОЮ* 223
дд„ обеспечения эффективности центрифугирования температура крови долж-
бьегь стандартизована. Следует избегать перемешивания слоев, образующихся
* ^итрифугировании. Удаление надосадочной плазмы должно осуществляться
кратно с остановкой на уровне 8-Ю мм над поверхностью слоя эритроцитов.
Тромбоциты из обогащенной тромбоцитами плазмы осаждают жестким цен-
фугированием, супернатантную обедненную тромбоцитами плазму удаляют.
у-являя 50-70 мл плазмы с тромбоцитами. Тромбоцитам дают время дезагреги-
д^ься. затем их ресуспендируют.
^ри выделении тромбоцитов из лейкотромбослоя центрифугируют свежезаго- ЯННЦ
явленную кровь так. чтобы тромбоциты сразу седиментировали вместе с лейко¬
цитами, образовав лейкотромбослой. кторый отделяют и разбавляют надосадоч-
н0и плазмой. После тщательного перемешивания контейнер с лейкотромбослоем
центрифугируют так, чтобы тромбоциты остались в верхнем надосадочном слое,
а эритроциты и лейкоциты преципитировали на дне контейнера.
Освобожденные от лейкоцитов тромбоциты могут быть получены фильтраци¬
ей Рекомендуется удалять лейкоциты перед хранением компонента, предпочти¬
тельно в течение 6 ч после выделения тромбоцитов.
Процедура должна быть регламентирована для установления оптимальных
условий удаления лейкоцитов.
По специальным показаниям может быть приготовлен компонент уменьшенно¬
го объема. Отмытые тромбоциты могут быть приготовлены для больных, у кото¬
рых наблюдались повторяющиеся реакции после введения тромбоцитов. Также
можно обработать компонент для больных с наличием анти-І§А-антитеіІ, когда
изготовить тромбоциты от доноров с дефицитом IgA маловероятно. Троекратное
отмывание изотоническим или буферным раствором уменьшает содержание белка
в супернатантном растворе более чем на 3 log. Однако при этом теряется 20 -30%
тромбоцитов.
Этикетирование
Этикетирование должно проводиться в соответствии с национальными прави¬
лами и международными соглашениями. Следующая информация должна быть
размещена на этикетке или сопровождающей листовке-вкладыше:
• идентификация производителя;
• индивидуальный идентификационный номер. Если от донора одновременно
получено две или более доз, должна быть добавлена нумерация процедуры
аферез-1, аферез-2 и т.д.;
• группа крови АВО и Rh-принадлежность;
I датадонации;
• название и объем криоконсервирующего раствора или название и объем
добавленного раствора (если производилось);
• наименование компонента крови;
• дополнительная информация — удаление лейкоцитов, облучение и др. (если
проводилось);
• срок хранения, дата применения (если необходимо);
? объем или масса компонента;
• температура хранения;
' фенотип группы крови, помимо АВО и Rh-принадлежности (если необходимо);
• компонент не может быть применен при выявлении ненормального гемолиза
“ЛИ других изменений;
• компонент должен быть применен с использованием 170-200 мкм фильтра.
Хранение и стабильность
Тромбоцитный концентрат должен храниться в условиях, гарантирующих
жизнеспособность и гемостатическую активность тромбоцитов. Клетки должны
224 служба крови
находиться в плазме или в комбинированной среде — плазме с питательным о
мальным раствором. Ти-
Полимерный контейнер должен обладать хорошей газопроницаемостью чтпк
обеспечить поступление кислорода тромбоцитам. Потребность в кислороде ow
деляется содержанием тромбоцитов в продукте. Обычно оптимум хранения соя
ется при концентрации тромбоцитов более 1,5х109/мл и постоянном pH в пред^
М-7,4 на протяжении периода хранения. Перемешивание тромбоцитов во ви
хранения должно быть эффективным для максимального доступа кислопп
и в то же время по возможности мягким. Температура хранения — 20-24 °С. **
При оптимальных условиях жизнеспособность тромбоцитов сохраняете
7 дней. Однако хранить тромбоциты более 3-5 дней не рекомендуется из-за 0%
ности инфекционного загрязнения.
Контроль качества
Контроль качества тот же, что для цельной крови, с добавлением показателей
табл. 7-23.
Таблица 7-23. Особенности контроля качества тромбоцитного концентрата из отдельной дозы
цельной крови
Объекты контроля
Критерии качества
Частота
контроля
I
Место контроля
Объем
>40 мл с содер¬
жанием 60x10®
тромбоцитов
Все дозы
Отделение компонентов ~~
HLA или антигены тромбоцитов
(если требуется)
Типирование
Как установлено
Лаборатория типирования
Тромбоциты
>60x108эквива¬
лентно одной дозе
1% всех доз,
минимум 10 доз
в месяц
Лаборатория контроля
Остаточные лейкоциты (до лей-
кодеплеции). Полученные из обо¬
гащенной тромбоцитами плазмы.
Полученные из лейкотромбослоя
<0,2х109эквива-
лентно одной дозе.
<0,05x10® эквива¬
лентно одной дозе
1% всех доз,
минимум 10 доз
в месяц
Лаборатория контроля
Остаточные лейкоциты (после лей¬
кодеплеции)
<0,2x10® в дозе
1% всех доз,
минимум 10 доз
в месяц
Лаборатория контроля
pH (22 °С) после рекомендованного
срока хранения
ІИИЯН
6,4-7,4
1% всех доз,
минимум 4 дозы
в месяц
Лаборатория контроля
Транспортирование
При транспортировании температура компонента должна поддерживаться мак¬
симально в пределах, рекомендованных для хранения. Даже при необходимости
быстрого применения тромбоциты должны быть выдержаны при перемешивании.
Показания к применению
Решение о трансфузии тромбоцитов не должно быть принято только на основа¬
нии низкого их содержания у больного. Абсолютным показанием является тромбоци-
топения с клинически выраженными геморрагиями. Все другие показания являются
более или менее относительными и зависят от клинического состояния больного.
После валидированной лейкодеплеции применение тромбоцитов - альтернатива
ЦМВ отрицательных тромбоцитов для предотвращения трансмиссии ЦМВ.
Предосторожности при применении
Если перед хранением клетки объединяют (в виде лейкотромбослоя или суспен¬
зии) с использованием валидированной системы, обеспечивающей стерильность.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КР06И 225
^ тромбоциты могут храниться до 5 дней после донации. Если же тромбоциты
уединяют после хранения, т.е. в открытой системе, то компонент должен быть
перелит как можно быстрее, не позже 6 ч после изготовления.
Так как во время приготовления компонент может быть перемещен в другой кон-
тейнер, необходимо проверять, не произошло ли смешение тромбоцитов, для чего
проводить идентификацию пула с каждой смешиваемой дозой компонента.
Резус-отрицательным женщинам в детородном возрасте или младше лучше
не переливать тромбоциты от резус-положительных доноров. Если все же есть такая
необходимость, то следует одновременно ввести RhO-иммуноглобулин.
Побочные эффекты
Побочные эффекты следующие:
« негемолитические посттрансфузионные реакции (озноб, лихорадка, крапив¬
ница);
• сепсис от невыделенной бактериальной контаминации крови;
І возможна передача Treponema pallidum4,
, возможна трансмиссия вирусов (гепатиты, ВИЧ и др.), несмотря на тщатель¬
ный контроль; риск ЦМВ трансмиссии может быть уменьшен посредством
удаления лейкоцитов;
I в редких случаях возможно заражение малярией;
• может наблюдаться аллоиммунизация, прежде всего против HLA и тромбо-
цитарных антигенов; при удалении лейкоцитов риск HLA иммунизации сни¬
жается при условии, что другие введенные компоненты также подвергались
лейкодеплеции;
і посттрансфузионная пурпура;
І острая посттрансфузионная легочная недостаточность;
s трансмиссия патогенов, которые не могли быть выявлены ранее;
і синдром «трансплантат против хозяина» у иммунокомпрометированных
пациентов.
ТРОМБОЦИТЫ АФЕРЕЗНЫЕ
Определение
Компонент крови, полученный тромбоцитаферезом от одного донора с приме¬
нением автоматического сепаратора клеток крови.
Свойства
В зависимости от метода и используемой аппаратуры выход тромбоцитов
в результате процедуры может колебаться в пределах 200-800x10’. От способа
получения и оборудования может также зависеть содержание лейкоцитов и эри¬
троцитов. Метод обеспечивает возможность заготавливать тромбоциты от подо¬
бранных доноров, уменьшать риск HLA-аллоиммунизации и эффективно лечить
уже аллоиммунизированных больных. Уменьшение числа привлеченных доноров
снижает риск трансмиссии вирусов.
Способ получения
У донора берут цельную кровь, из которой тромбоциты выделяют с помощью
специальных аферезных сепараторов. Остающиеся компоненты крови возвраща¬
ют донору. Для уменьшения числа лейкоцитов в процесс включают дополнитель¬
ное центрифугирование и фильтрацию.
При применении тромбоцитафереза количество клеток, выделяемых из крови
донора за одну процедуру, эквивалентно числу тромбоцитов, которые можно
получить из 3-13 доз цельной крови. Аферезный продукт можно также разделить
на несколько стандартных частей для трансфузий.
226 СЛУЖБА КРОВИ
Полученные аферезные тромбоциты могут храниться в плазме или в
ции плазмы и рекомендованного питательного раствора. Предварительн*01*^'
ляция доноров тромбопоэтином не может быть рекомендована с увепен СТИк|ї-
поскольку безопасность такого воздействия должна быть тщательно изучРН0СГЬ|°.
Отмытые тромбоциты могут быть приготовлены для больных, у которыхНаг
даются реакции после трансфузий тромбоцитов. Отмытые клетки также по ^
пациентам с анти-IgA-антителами, когда нет возможности заготовить тромбо3^
от IgA-дефицитных доноров. Троекратная отмывка тромбоцитов уменьшает4^
И центрацию белков в супернатанте, но при этом теряется до 10-20% тромбоцитов3
Этикетирование
Этикетирование должно проводиться в соответствии с национальными Ц
лами и международными соглашениями. Следующая информация должна
размещена на этикетке или сопровождающей листовке-вкладыше:
■ идентификация производителя;
І индивидуальный идентификационный номер. Если от донора одновременно
получено две или более доз, должна быть добавлена нумерация процедуры-.
аферез-1, аферез-2 и т.д.;
• группа крови АВО и Rh-принадлежность;
• датадонации;
• название и объем криоконсервирующего раствора или название и объем
добавленного раствора (если производилось);
• наименование компонента крови;
в дополнительная информация — удаление лейкоцитов, облучение и др. (если
проводилось);
І срок хранения, дата применения (если необходимо);
І количество тромбоцитов (в среднем или подсчитанном);
• температура хранения;
I результаты HLA типирования или наличие антитромбоцитных антител;
і компонент должен быть применен с использованием 170-200 мкм фильтра.
Хранение и стабильность
Компонент должен храниться в условиях, гарантирующих жизнеспособность
и гемостатическую активность тромбоцитов.
Компонент, хранящийся более 6 ч, должен быть получен в закрытой системе,
т.е. быть стерильным.
Полимерный контейнер должен обладать хорошей газопроницаемостью, чтобы
обеспечить поступление кислорода тромбоцитам. Потребность в кислороде опре¬
деляется содержанием тромбоцитов в продукте. Обычно оптимум хранения созда¬
ется при концентрации тромбоцитов более 1,5х109/мл и постоянном pH в преде¬
лах 6,4-7,4 на протяжении периода хранения.
Перемешивание тромбоцитов во время хранения должно быть эффективным
для максимального доступа кислорода и в то же время по возможности мягким.
Температура хранения - 20-24 °С.
При оптимальных условиях жизнеспособность тромбоцитов сохраняется 7 дней.
Однако хранить более 3-5 дней не рекомендуется из-за опасности бактериального
обсеменения.
Контроль качества
Контроль качества тот же, что для цельной крови, с добавлением показателей
табл. 7-24.
Транспортирование
При транспортировании температурный режим должен поддерживаться в пр
делах, рекомендованных для хранения. Даже при краткосрочном хранении содер
жнмое контейнера нужно постоянно перемешивать.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 227
Таблица 7-24. Особенности контроля качества аферезного тромбоцитного концентрата
Объекты контроля
Критерии качества I
Частота контроля | Место контроля
Объем
>40 мл с содержани¬
ем клеток 6010*
Все дозы
Отделение компонентов
HL/Гили антигены тром-
(кшитов (если требуется)
Типирование
Как установлено
Лаборатория типироеания
Тромбоциты
>200x10* эквивалент¬
но одной дозе
1% всех доз, минимум
10 доз в месяц
Лаборатория контроля
Остаточные лейкоциты
(после лейкодеплеции)
<1хЮ*в дозе
1% всех доз, минимум
10 доз в месяц
Лаборатория контроля
pH (22 °С) после реко¬
мендованного срока
хоаиения
6,8-7,4
1% всех доз, минимум
4 дозы в месяц
Лаборатория контроля
Показания к применению
решение о трансфузии тромбоцитов не должно быть принято только на осно¬
вании низкого их содержания у больного. Абсолютное показание — тромбоци-
топения с клинически выраженными геморрагиями, связанными с дефицитом
тромбоцитов. Все другие показания более или менее относительны и зависят
от клинического состояния больного.
Тромбоциты, совместимые по HLA и тромбоцитным антигенам, могут приме¬
няться для лечения сенсибилизированных пациентов.
После валидированной лейкодеплеции применение аферезных тромбоцитов -
приемлемая альтернатива ЦМВ отрицательных тромбоцитов для предотвращения
трансмиссии цитомегаловируса.
Предосторожности при применении
Девочкам и резус-отрицательным женщинам в детородном возрасте лучше
не переливать тромбоциты от резус-положительных доноров. Если все же есть
такая необходимость, то следует одновременно ввести RhO-иммуноглобулин.
Лечащий врач должен быть проинформирован, если доза аферезных тромбо¬
цитов не стандартизована по содержанию клеток.
При выборе компонента для трансфузии сенсибилизированному пациенту
необходимо проводить тест на совместимость тромбоцитов.
Поскольку во время приготовления компонент может быть переведен в другой
контейнер, необходимо идентифицировать каждую дозу компонента.
ТК переливают внутривенно капельно через одноразовую систему с капроновым
фильтром. Перед трансфузией определяют группу крови АВО и Rh-принадлежность
и проводят пробу на индивидуальную совместимость.
ТРОМБОЦИТЫ КРИОКОНСЕРВИРОВАННЫЕ АФЕРЕЗНЫЕ
Компонент, изготовленный путем замораживания тромбоцитов в течение 24 ч
после заготовки, с использованием криопротектора, и хранящийся при температу¬
ре -80 °С или ниже.
Свойства
Восстановленные криоконсервированные тромбоциты содержат незначитель¬
ное количество эритроцитов и лейкоцитов. Метод позволяет хранить клетки ауто¬
доноров и отобранных доноров.
Способ получения
Два способа применяют для получения криоконсервированных тромбоцитов,
отличающиеся выбором криопротектора. Один — с ДМСО (6% масса/объем}.
Другой - с низкой концентрацией глицерина (5% масса/объем).
I V8VUJ
228 служба крови
Этикетирование
Этикетирование должно проводиться в соответствии с национальными
лами и международными соглашениями. Следующая информация долзкн
размещена на этикетке или сопровождающей листовке-вкладыше: а
В идентификация производителя;
і индивидуальный идентификационный номер. Если от донора одновце
получено две или более доз. должна быть добавлена нумерация процедур1"10
аферез-1. аферез-2 и т.д.;
• группа крови АВО и Rh-принадлежность;
• дата донации;
I название и объем криоконсервирующего раствора или название и оби.
добавленного раствора (если производилось);
• наименование компонента крови:
• дополнительная информация - удаление лейкоцитов, облучение и др. (ец)
проводилось); 11
• срок хранения, дата применения (если необходимо);
• количество тромбоцитов (в среднем или подсчитанном);
• температура хранения:
• результаты HLA типирования;
• компонент должен быть применен с использованием 170-200 мкм фильтра
Хранение н стабильность
Тромбоциты в замороженном состоянии должны постоянно находиться при
температуре -80 °С при хранении в электроморозильнике или -150 °С при хране¬
нии в парах жидкого азота.
Если предполагается хранение более года, предпочтительна температура -150 °С
Размороженные тромбоциты должны быть использованы немедленно.
Если предусматривается краткосрочное хранение, продукт должен находиться
при температуре 20-24 °С с постоянным перемешиванием.
Контроль качества
Принципы контроля качества соответствуют указанным в табл. 7-23 со следую¬
щими добавлениями (табл. 7-25).
Таблица 7-25. Особенности контроля качества тромбоцитов криоконсервированных аферезных
Объекты
контроля
Критерии
Качества
Частота
контроля
Место
контроля
Объем
50-200 мл
Все дозы
Отделение компонентов
Число тромбоцитов
>40% содержания
до замораживания
Все дозы
Лаборатория контроля
качества
Остаточные лейкоциты
(до замораживания)
<1x10* в дозе
Все дозы
Лаборатория контроля
качества
Транспортирование
Если транспортирования в замороженном состоянии нельзя избежать, необхо¬
димо обеспечить температурные условия во время перевозки.
Транспортирование размороженных тромбоцитов лимитируется коротким сро¬
ком хранения. Необходимо обеспечивать поддержание температурного режима.
Показания к применению
Криоконсервированные тромбоциты целесообразно сохранять для формировз"
мин .запаса клеток, типированных по HLA и тромбоцитным антигенам, на случаи
возникновения острой потребности в совместимых тромбоцитах и отсутствия ПОД¬
ХОДЯЩИХ доноров.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИИ СЛУЖБЫ КРОВИ 229
предосторожности при применении
При наличии показаний должен быть выполнен тест на совместимость тромбо*
jutoB по HLA и/или НРА. Следует иметь в виду токсичность реагентов, используе*
ць1Х дЛЯ Криоконсервирования, например ДМСО.
Показания и противопоказания
Причинами тромбоцитопении и обусловленной ею кровоточивости могут быть:
• недостаточное образование тромбоцитов в костном мозге — амегакариоци*
тарная тромбоцитопения (лейкозы, гематосаркомы и иные онкологические
заболевания с поражением костного мозга, апластическая анемия, миело-
депрессия в результате лучевой и цитостатической терапии, острая лучевая
болезнь, трансплантация костного мозга);
I повышенное потребление тромбоцитов (острый ДВС-синдром, массивная
кровопотеря, дилюционная тромбоцитопения при синдроме массивных
трансфузий, массивные вмешательства с использованием искусственного
кровообращения). Нередко при этих обстоятельствах не только снижается
количество тромбоцитов, но и нарушается их функциональная способность,
что увеличивает тяжесть кровоточивости;
I повышенное разрушение тромбоцитов (иммунные и другие тромбоцитоли-
тические заболевания, при которых, как правило, количество мегакариоци-
тов в костном мозге может быть нормальным или даже повышенным):
І качественная неполноценность тромбоцитов, т.е. наследственные или приоб¬
ретенные тромбоцитопатии, при которых количество тромбоцитов, как пра¬
вило, в пределах нормы или умеренно снижено в результате укорочения
жизни дефектных клеток.
Уровень тромбоцитов до 50x10’ /л обычно является достаточным для гемостаза
при условии их нормальной функциональной способности. В этих случаях время
кровотечения находится в пределах нормы, необходимости в переливании ТК нет
даже при выполнении полостных операций. Исключение составляют оперативные
вмешательства с высоким риском большого кровотечения (более 500 мл), напри¬
мер сердечно-сосудистые операции с искусственным кровообращением, нейрохи¬
рургические и т.п.
При снижении уровня тромбоцитов до 20хЮ’/л в большинстве случаев наблю¬
даются клинические проявления спонтанного тромбоцитопенического геморраги¬
ческого синдрома — петехиальные высыпания на коже нижних конечностей, спон¬
танная кровоточивость на слизистой полости рта и носа. Переливание ТК в таких
состояниях необходимо, а при появлении мелкоточечных геморрагий на верхней
половине туловища, кровоизлияний в конъюнктиву и на глазном дне. локальных
кровотечений (ЖКТ, матка, почки, мочевой пузырь) переливание ТК - экстрен¬
ная, жизненно важная процедура. Больные с такой выраженной формой тромбо¬
цитопении (в основном пациенты с онкологической патологией) перед операцией
нуждаются в специальной медикаментозной предоперационной гематологической
коррекции гемостаза и трансфузиологической подготовке, включающей профи¬
лактическую и обычно, по мере необходимости, постоперативную трансфузию
больших количеств (более 8-10 доз) ТК. Кровопотеря в постоперационный пери¬
од более 5 мл/кг в час или более 100 мл/ч рассматривается как результат неадек¬
ватного хирургического гемостаза и только во вторую очередь - как следствие
Нхэмбоцитопении или/и тромбоцитопатии.
Переливание ТК при повышенном разрушении тромбоцитов иммунного генеза
не показано, так как циркулирующие у реципиента антитромбоцитные антитела
быстро (в течение нескольких минут) лизиругот донорские тромбоциты.
Значительно чаще в клинической практике встречаются приобретенные тром-
ооцитопатии. Среди медикаментов, нарушающих функции тромбоцитов, первое
230 СЛУЖБА КРОВИ
ыесто принадлежит аспирину*, который, в отличие от других НПВС (иб„
индометацин), угнетает способность тромбоцитов к активации необ^К
Также функцию тромбоцитов нарушают большое количество препаратов
ности метилксантины (теофиллин и т.п.), антибиотики (пенициллину'BV
этанол, фуросемид. гепарин*, цитостатики. У пациентов без серьезных л
гемостаза нарушение функции тромбоцитов, вызванное лекарственными *
ратами, обычно не ведет к значимому вторичному кровотечению или увели^
интраоперационной кровопотери. Тем не менее в период подготовки к one s
целесообразно отменить (заменить) эти медикаменты. При тромбоцитои*311^
переливание ТК показано лишь в ургентных состояниях — при массивных й?*’
течениях, операциях, в родах. Переливание ТК с профилактической целью»
категории больных не рекомендуется из*за возможного быстрого
аллоиммунизации и развития рефрактерности при необходимости передка
тромбоцитов в критической ситуации.
Перитонеальный диализ или гемодиализ способствует восстановлению фу»,
ции тромбоцитов у больных с уремией. Для коррекции гемостаза у таких пащ,
ентов предпочтительно использование І-дезамино-вБ-аргинин-вазопрессніи
или криопреципитата.
Тромбоцитопатия сопутствует многим злокачественным опухолям кроветворад
ткани и часто возникает вследствие аномального клона тромбоцитов. Так, при пер.
вичном тромбоцитозе, несмотря на очень высокое содержание тромбоцитов, иногда
развивается кровотечение, обусловленное тромбоцитопатией. Учитывая сложное^
лечения таких пациентов, длительные периоды ремиссии, возможность повтор¬
ных тромбоцитопений, следует стараться минимизировать количество трансфузий
тромбоцитов и использовать фильтрационную элиминацию лейкоцитов.
Конкретные показания к назначению ТК устанавливаются лечащим врачом
на основании анализа клинической картины и причин тромбоцитопении, степени
ее выраженности и локализации кровотечения, объема и тяжести предстоящей
операции.
Не рекомендуется переливать ТК:
І больным с аутоиммунной тромбоцитопенией (за исключением кровотече¬
ния, угрожающего жизни);
• профилактически после искусственного кровообращения;
• профилактически параллельно с массивной гемотрансфузией.
Переливание ТК может сопровождаться трансфузионными реакциями неге¬
молитического типа: повышением температуры тела, ознобом, аллергическим
реакциями. Крайне редко, при АВО несовместимости (из-за плазмы), трансфузия
может осложниться гемолизом.
Редко встречающееся осложнение при переливании ТК — «трансплантатпротия
хозяина» представляет серьезную опасность для больных с иммунодефицитам,
пациентов после трансплантации костного мозга или других органов и ткане*
и новорожденных. Развитие иммунологического конфликта можно предупре¬
дить гамма-облучением ТК в дозе 15 Гр (1500-2000 рад) перед гемотрансфу¬
зией. Облучение позволяет уничтожить иммуноактивные клетки, не разрушая
и не нарушая функциональной потенции тромбоцитов.
Показано, что ультрафиолетовое облучение ТК при длине волны 280-310 в* ,
подавляя реактивность лимфоцитов и снижая их иммуногенность. не алка¬
ет на функцию тромбоцитов и их посттрансфузионную выживаемость /л
Механизм действия ультрафиолетового облучения точно не установлен. Мор
полагать, что внедрение в практику специально разработанной тары для хранен**
тромбоцитов, проницаемой для ультрафиолетовых лучей и приборов, с яомовр
которых осуществляется облучение, позволит получать более безопасный
для иммунодефицитных больных.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КР08И 231
К сожалению, посттрансфузионные фебрильные реакции наблюдаются часто.
Озноб кожные высыпания, повышение температуры - характерные признаки
реакции негемолитического типа на трансфузию ТК. Такие реакции связаны
^основном с реакцией «антиген-антитело* и вовлекающимся в продолжение
^того процесса активации каскадом плазменно-клеточных факторов (высвобож¬
дением эндогенных пирогенов из лейкоцитов, повышением цитокинов в КТ в про¬
цессе хранения и др.). Полагают, что механизм запускается в основном антителами
против HLA-антигенов или специфическими антилейкоцитиыми. аитнтромбоцит-
ньіми антителами.
Наиболее эффективный способ предотвращения HLA-сенсибилизации при¬
менение ТК. отфильтрованного через специальные фильтры, задерживающие более
99- 99,9% лейкоцитов. Повторные трансфузии ТК могут сенсибилизировать паци-
ента в отношении HLA и тромбоцитных антигенов. Больные с высоким уровнем
антитромбоцитных и антилейкоцитных HLA-антител резистентны к переливаниям
ТК, и достичь желаемого результата у данной категории больных переливанием
тромбоцитов не удается. Для таких больных необходимо подбирать тромбоциты
от доноров, совместимых по HLA-системе и/или громбоцитным антигенам.
Число тромбоцитов у больных необходимо подсчитывать трижды: непосред¬
ственно перед переливанием, через 1 ч и 18-24 ч после трансфузии. Повысить
информационную содержательность исследований можно, выполнив параллельно
иммунологические тесты на HLA и тромбоцитные антитела. Аллоиммунизация
не всегда ведет к рефрактерности, а больные с антитромбоцитными антителами
могут давать адекватный посттрансфузионный прирост тромбоцитов с соответ¬
ствующим гемостатическим эффектом. Так, например, наличие в сыворотке крови
больных анти-РДА-антител не всегда вызывает рефрактерность к трансфузиям ТК.
Полагают, что наличие 7,5-10x10’/л тромбоцитов в образцах, взятых в течение
от 10 мин до 1 ч, и уровень тромбоцитов через 18-24 ч после трансфузии не менее
4,5x10’/л указывают на отсутствие рефрактерности, в частности, в связи с наличи¬
ем антител, направленных к антигенам, представленным на тромбоцитах
При необходимости подбора ТК по HLA-антигенам или по иным причинам,
когда необходимо получить дозу с высоким содержанием тромбоцитов, исполь¬
зуют гемаферез. Методом гемафереза можно получить от одного донора с соот¬
ветствующим для определенного пациента HLA-фенотипом в течение 2-3 ч
3-5х10’/л тромбоцитов в 200-400 мл плазмы, т.е. в 6-8 раз больше, чем от одного
донора при обычной кроводаче. Метод аппаратного гемафереза позволяет свести
к минимуму загрязнения ТК эритроцитами и лейкоцитами. В идеале желательно
получать тромбоцитную массу с большим содержанием тромбоцитов от одного
хорошо обследованного донора.
Один из эффективных методов, снижающий риск сенсибилизации бального,
a следовательно, и предупреждающий рефрактерность к тромбоцитам в отноше¬
нии лейкоцитных антигенов, — метод фильтрации ТК через специальные лейко-
цитные фильтры. Даже при использовании самых современных аппаратов гемафе¬
реза в тромбоцитной массе сохраняется около 0.5-1,0x10’/л лейкоцитов, которые
при повторных трансфузиях могут сенсибилизировать больного.
При использовании нового поколения фильтров из ТК удаляется более 99%
лейкоцитов и менее чем 10% тромбоцитов, что существенно превышает пока¬
затели, получаемые при использовании обычных методов центрифугирования
(80-90% лейкоцитов и 20-30% тромбоцитов).
КРИТЕРИИ ЭФФЕКТИВНОСТИ ПЕРЕЛИВАНИЙ ТР0МБ0К0НЦЕНТРАТА
Клинические критерии эффективности — прекращение спонтанной кровото¬
чивости и отсутствие свежих геморрагий на коже и видимых слизистых. Клмниче-
ски наблюдаемый гемостаз — важнейший критерий эффективности и адекватно-
232 СЛУЖБА КРОВИ
ЄЯ» ДОЗЫ перелитых донорских тромбоцитов, ХОТЯ при ЭТОМ часто не происх
(досчитанного и ожидаемого увеличения количества тромбоцитов в циркуля ^
Лабораторные признаки эффективности заместительной терапии перели*
1К заключаются в увеличении количества циркулирующих тромбоцитов в !г®
іез час после трансфузии (при эффективном перелив*
их число достигает 50-60x10’ /л). Через 24 ч при положительном резуль®
их количество должно превышать критический уровень 20x10’ /л или, во вся
случае, быть выше исходного предтрансфузионного количества. Нормализа °Ч
ИЛИ уменьшение времени кровотечения также может быть критерием эффект^*11
ности переливаний ТК. Ив‘
Другой критерий эффективности трансфузий ТК — время возвращения коли
чества тромбоцитов у реципиента к исходному уровню, что происходит обычн
через 1-2 дня. Этот показатель позволяет оценивать не только эффективность
терапии тромбоцитами, но и прогнозировать частоту переливаний и их иммуно¬
логическую совместимость.
Реально никогда не наблюдается 100% ожидаемого прироста числа тромбо¬
цитов. На снижение посттрансфузионного уровня влияют наличие у реципиентов
спленомегалии, инфекционных осложнений, сопровождающихся гипертермией
синдрома ДВС, массивного локального кровотечения (особенно ЖК или маточно¬
го), аллоиммунизация с иммунологически обусловленной деструкцией донорскщ
тромбоцитов, вызванной антителами к антигенам тромбоцитов и/или лейкоци¬
тов. В этих не столь редких клинических ситуациях потребность в переливании
терапевтически эффективного количества тромбоцитов возрастает. При сплено¬
мегалии количество переливаемых тромбоцитов должно быть увеличено по срав¬
нению с обычным на 40-60%, при инфекционных осложнениях —. в среднем
на 20%, при выраженном ДВС-синдроме, массивной кровопотере, явлениях алло¬
иммунизации - на 60-80%. При этом необходимая терапевтическая доза может
быть перелита в 2 приема (утром и вечером). Оптимальный режим переливания
ТК - такой, при котором время длительности кровотечения находится в преде¬
лах нормы, а количество тромбоцитов в периферической крови поддерживается
на уровне выше 40х10’/л.
При профилактическом назначении переливаний ТК, т.е. при наличии относи¬
тельно глубокой тромбоцитопении (20-30х10’/л) амегакариоцитарной природы
без признаков спонтанной кровоточивости, трансфузиолог всегда обязан соотнести
риск возможных геморрагических осложнений с риском ранней аллоиммунизации
больных, особенно при использовании полидонорского ТК. Профилактические
переливания ТК показаны при наличии сепсиса у больных на фоне агранулоци¬
тозе и ДВС-синдрома. Показано переливание ТК у больных с острыми лейкозами
для профилактики геморрагий. Подобным больным целесообразно проводить
предварительный подбор доноров типированием по HLA-системе, так как имен¬
но эти антигены, присутствующие на самих тромбоцитах, наиболее часто служат
причиной сенсибилизации и рефрактерности, развивающихся при многократных
трансфузиях ТК.
Профилактическое применение переливаний ТК требует более строгого отно¬
шения, чем терапевтическое назначение заместительной трансфузии донорских
тромбоцитов при минимальной кровоточивости.
Пара «донор-реципиент» при переливании ТК должна быть совместима
по антигенам АВО и Rh-прииадлежности. Несовместимость по АВО снижает
эффективность донорских тромбоцитов. Непосредственно перед переливанием
ТК врач тщательно проверяет маркировку контейнера, его герметичность, све¬
ряет идентичность групп донора и реципиента. При многократных переливаниях
ТК (иногда после 6-8 переливаний) у некоторых больных может наблюдаться
рефрактерность (отсутствие как прироста тромбоцитов в крови, так и гемоста-
гического эффекта), связанная с развитием у них состояния аллоиммунизаш®-
в РУсяе
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 233
дллоиммунизация вызывается сенсибилизацией реципиента аллоантигенами
тромбоцитов донора и характеризуется появлением у реципиента иммунных
антитромбоцитных и анти-НЬА-антител. В этих случаях трансфузии ТК сопро¬
вождаются температурной реакцией, ознобом, отсутствием прироста числа тром¬
боцитов в циркуляции и гемостатического эффекта. Поэтому у реципиентов,
которые заведомо будут нуждаться в длительных и повторных переливаниях ТК
(апластическая анемия, трансплантация костного мозга), лучше использовать ТК,
полученный автоматическим аферезом от доноров-родственников или донора
костного мозга. С целью удаления примеси лейкоцитов, помимо дополнительно¬
го «мягкого» центрифугирования, следует использовать специальные фильтры,
позволяющие уменьшить количество лейкоцитов в ТК.
В целом при использовании ТК в обычной (неосложненной) практике рекомен¬
дуется следующая тактика: больные, не имеющие отягощенного трансфузионного
анамнеза, получают переливания ТК-одноименных по эритроцитным антигенам
групп АВО и Rh-принадлежности. При появлении клинических и иммунологиче¬
ских данных о рефрактерности последующие трансфузии ТК требуют специаль¬
ного подбора пары «донор-реципиент* по тромбоцитным антигенам и антигенам
системы HLA, знания фенотипа тромбоцитов реципиента, проведения пробы
на совместимость плазмы больного с тромбоцитами донора, переливания тромбо¬
цитов через специальные лейкоцитные фильтры.
СВЕЖЕЗАМОРОЖЕННАЯ ПЛАЗМА (СЗП)
Среди компонентов крови по объему применения в клинике СЗП занимает
первое место. Плазма — внутренняя жидкая среда организма, содержащая компо¬
зицию различных по составу и свойствам биологически активных веществ (бел¬
ковых, липоидных, углеводных), что определяет ее важную роль в обеспечении
жизнедеятельности человека.
Плазма периферической крови состоит из воды и приблизительно 7% белка,
2% углеводов, липидов и многокомпонентных солей. Плазма крови - это 7-8%
коллоидный раствор смеси белков: альбумина, альфа-, бета- и гамма-глобулинов,
фибриногена и др., а также их комплексов, pH 7. Терапевтический эффект
при трансфузиях препаратов плазмы основан на дезинтоксикационном, статиче¬
ском действии, коррекции белковой недостаточности. Устраняя белковый дефи¬
цит и соответственно повышая онкотическое давление в крови, плазма способству¬
ет устранению отеков, усиливает диурез.
Получают плазму тремя способами. Первый, наиболее распространенный -
метод «жесткого» центрифугирования консервированной крови с последующим
перемещением надклеточной части (плазмы) в отдельный контейнер. Второй
метод - получение плазмы в автоматическом режиме, при помощи специальных
сепараторов. Третий (на практике его используют редко) — фильтрация через
специальные фильтры, задерживающие форменные элементы крови и свободно
пропускающие плазму.
Замораживание — критический фактор для сохранения фактора VIII плазмы.
Во время замораживания формируется лед, который концентрируется в остаю¬
щейся воде. Когда превышается предел растворимости, каждый компонент обра¬
зует кристаллы, на что влияет присутствие антикоагулянта. Этот процесс требует
дальнейшего изучения.
Формирование льда зависит от интенсивности отвода тепла, степень диффузии
компонентов плазмы определяется их перемещением в пространстве. При мед¬
ленном замораживании диффузия определяется скоростью образования льда.
Растворенные компоненты постепенно концентрируются в центре контейнера
с плазмой.
Так как перераспределение всех растворенных веществ происходит одновре¬
менно, молекулы фактора VIII подвергаются воздействию высокой концентрации
солей, и белок теряет активность.
Ш СЛУЖКА КРОВИ
фактора VIII с концентрированными солями. та
Для достижения максимального выхода фактора VIII плазму нужно заыо
живать при - 30 *С и ниже (рис. 7-11). Если затвердение плазмы продолжает?
более 1 ч. уровень фактора VIII снижается. Это можно проконтролировать ий»
рением общего белка в пробе из центральной части объема замороженной плазм
Концентрация белка должна совпадать с данными измерения до замораживания
Оптимальная скорость замораживания достигается при интенсивности теплоот-
вода 38 ккал/ч из каждой дозы плазмы, что контролируется с помощью термо¬
датчика.
При внедрении метода эффективного замораживания персонал должен пред.
ставлять сущность явления, знать ограничения и особенности процедуры.
Рис. 7-11. Быстрая заморозка плазмы в замораживателе Frigera при -80 °С
Методы замораживания
При замораживании плазмы скорость охлаждения должна быть максимальной.
В идеале достижение температуры -30 °С или ниже должно произойти в течение
60 мин. Опыт показывает, что при отсутствии специального замораживающего
оборудования требуется несколько часов для достижения требуемой температуры.
Время может быть сокращено следующим способом.
Плазма должна находиться в оптимальном положении — в горизонтальном
либо в специальных кюветах вертикально.
Описание условий хранения изложено в предыдущих главах.
Хранение замороженной плазмы
Точка замерзания плазмы (эвтектическая точка) -23 °С. Из-за колебания темпе¬
ратуры во время эксплуатации (открывание-закрывание дверей) хранение замо¬
роженного материала следует осуществлять в морозильных камерах при температуре
30 °С или ниже. Для хранения продуктов крови и плазмы нелечебного предна¬
значения должны быть выделены отдельные изолированные и четко обозначенные
участки.
Следует избегать морозильных устройств с автоматической системой оттаивания.
Должна быть безусловная гарантия, что во время оттаивания температура внутри
камеры не будет повышаться.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 235
Температура внутри морозильников должна регистрироваться в постоянном
«евло*- Сигнализация тревоги должна быть акустической и оптической и регулярно
проверяться.
Холодильное оборудование следует обеспечивать резервным источником элек-
,ровитания.
Методы оттаивания
С замороженной плазмой следует обращаться осторожно, так как контей¬
неры становятся хрупкими. До и после оттаивания необходимо проверить
целостность, протекающие контейнеры должны быть удалены. После изъятия
„з места хранения плазму немедленно размораживают в контролируемой среде
лрИ 37 °С. Оттаянная плазма должна быть визуально проверена на отсутствие
хлопьев криопреципитата, который мог образоваться в процессе разморажива¬
ния. Продукт не подлежит использованию, если обнаружены нерастворенные
частицы. Для сохранения лабильных факторов плазму используют немедленно
после оттаивания, по крайней мере не позже 6 ч. Повторное замораживание
плазмы не допускается.
По инструкции плазму отделяют от эритроцитов в течение 4-6 ч после эксфузии
крови. Затем ее помещают в низкотемпературный холодильник, обеспечивающий
полное замораживание до температуры -30 °С в течение 1 ч. Такой режим заготов¬
ки плазмы обеспечивает ее длительное хранение (до 1 года). В СЗП в оптималь¬
ном соотношении сохраняются лабильные (V и VIII) и стабильные (I, II, VII, IX)
факторы свертывания. Кроме того, СЗП содержит факторы системы комплемента
и пропердина, разномолекулярные белковые комплексы и иммунологическую
составляющую крови.
Если из плазмы в процессе фракционирования удалить криопреципитат, можно
получить супернатантную фракцию плазмы (криосупернатант), имеющую свои
показания к применению.
Различают 2 вида плазмы: нативную и свежезамороженную. Нативная консер¬
вированная плазма получается сразу после отделения клеточных компонентов
крови. В результате существенно возрастает концентрация общего белка и плаз¬
менных факторов свертывания, в частности фактора IX.
СЗП - это компонент для трансфузий, полученный из цельной крови или посред¬
ством афереза, замороженный в течение времени и при температуре, оптимальных
для сохранения факторов свертывания крови в полноценном функциональном
состоянии.
СЗП имеет нормальное содержание стабильных факторов свертывания крови,
альбумина и иммуноглобулина. Компонент содержит не менее 70 ME фактора VIII
в 100 мл, такое же количество других лабильных факторов свертывания и есте¬
ственных ингибиторов.
Если СЗП предназначается для изготовления препаратов плазмы, то качество ее
должно соответствовать требованиям Фармакопеи ЕС.
Свежезамороженная плазма не должна содержать иммунные антитела, имею¬
щие клиническое значение.
Методы получения свежезамороженной плазмы
При выделении СЗП из цельной крови используют цельную консервированную
кровь, заготовленную с использованием закрытой системы контейнеров путем
♦жесткого* центрифугирования. Операция выполняется в первые 6 ч и не позже
18 ч после донации, если кровь находилась в электроморозильнике. СЗП можно
также получить из обогащенной тромбоцитами плазмы.
Замораживание проводят в аппаратах, обеспечивающих быстрое, в течение 1 ч,
полное охлаждение плазмы до температуры -30 °С.
236 СЛУЖБА КРОВИ
Получение аферезом
Плазму можно заготавливать ручным или автоматическим а<Ье
Замораживание должно быть проведено в течение 6 ч после донации в ЩрШ
обеспечивающем температурный режим -30 °С в течение 1 ч. При наличи^'
рудования, гарантирующего быстрое охлаждение плазмы до 20-22 °С, замо
вание может быть проведено по истечении 24 ч после заготовки. ^а*01-
Карантинизация СЗП
Доза свежезамороженной плазмы может быть реализована после 6 мес Ц
ния, когда негативные первичные тесты на декретированные гемотрансмиссив
маркеры в крови донора будут повторно подтверждены.
Этикетирование
Этикетирование должно проводиться в соответствии с национальными прави
лами и международными соглашениями. Следующая информация должна быть
размещена на этикетке или сопровождающей листовке-вкладыше:
• идентификация производителя:
• индивидуальный идентификационный номер. Если от донора одновременно
получено две или более доз, должна быть добавлена нумерация процедуры |
аферез-1, аферез-2 и т.д.;
• группа крови АВО и Rh-принадлежность;
• дата донации:
• название и объем криоконсервирующего раствора или название и объем
добавленного раствора (если производилось):
• наименование компонента крови;
I дополнительная информация — удаление лейкоцитов, облучение и др. (если
проводилось):
і срок хранения, дата применения (если необходимо);
• температура хранения;
в компонент должен быть применен с использованием 170-200 мкм фильтра.
Хранение и стабильность
Стабильность при хранении зависит от температуры хранения, которая состав¬
ляет -25 °С или ниже. Допустимы следующие режимы и сроки хранения:
• 24 мес при температуре -30 °С и ниже;
в 12 мес при температуре от -25 до -30 °С.
Транспортирование
Регламентируемая температура хранения должна поддерживаться во время
транспортирования, вплоть до момента применения.
В табл. 7-26 представлены особенности контроля качества СЗП.
Таблица 7-26. Особенности контроля качества СЗП
Объекты контроля
Критерии качества
Частота контроля
Место контроля
АВО. Rh-фактор
Определение группы
Сплошной
Серологическая лаборатория
Анти-Hiv 1 и 2*
Отрицательные результаты
разрешенного скрининг-теста
Сплошной
Скрининг-лаборатория
Отрицательные результаты
разрешенного скрининг-теста
Сплошной
Скрининг-лаборатория
ALT
Отсутствие повышения
Сплошной
Скрининг-лабооатория
Анти-Н8с* (когда
требуется)
Отрицательные результаты
разрешенного скрининг-теста
Сплошной
Скрининг-лаборатория
Анти-HCV*
Отрицательные результаты
разрешенного скрининг-теста
Сплошной
Скрининг-лаборатория
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 237
["Чдеьекты контроля
Гойфилис* (когда тре¬
буется)
HTLV* (когда
Критерии качества
Отрицательные результаты
разрешенного скрининг-теста
Частота контроля
Сплошной
Отрицательные результаты
разрешенного скрининг-теста
Полученный объем+10%
После замораживания и оттай
вания в среднем >70% значе¬
ния в свежвзаготовлвнной
Не должно быть после дав¬
ления на плазмоэкстракторе,
перед замораживанием
и после оттаивания
Сплошной
Все дозы
Каждые 3 мес.
10 доз в первый
месяц хранения'
Окончание табп 7-26
Место контроле I
[ Скрининг-лабораторие
I Скрининг-лаборатория
Отделение компонентов
Лаборатория контроля каче-
Все дозы
Остаточные
[визуальные изме¬
нения
Лаборатория контроля каче¬
ства
Эритроциты; <6,0x10® в литре;
лейкоциты; <0,1x10® в литре;
тромбоциты: <50x10° в литре
Не должно быть видимых
сгустков и необычного цвета
1% всех доз,
минимум 4 дозы
в месяц
Все дозы
Лаборатория контроля каче¬
ства
Отделение компонентов
Отделение компонентов
, em11 не выполняется для цельной крови при получении из нее плазмы.
Свежезамороженная плазма широко применяется в клинике (см. соответствую¬
щие показания) и служит исходным сырьем для фракционирования при произ¬
водстве препаратов крови.
Предосторожности при применении
Свежезамороженную плазму не используют только для коррекции объема
при отсутствии недостаточности свертывания крови или как источник иммуно¬
глобулинов.
Не следует использовать СЗП, когда имеются альтернативные вирус-инак-
тивированные продукты плазмы.
|зр нельзя применять при выявлении у больного реактивности на белки плазмы.
Применяют только АВО-совместимую плазму.
Продукт должен быть использован немедленно после размораживания, повтор¬
ное замораживание не допускается. Оттаивание должно производиться при кон¬
тролируемых температурных условиях. Перед применением контейнер должен
быть проверен на герметичность. Не должны выявляться видимые хлопья нерас-
творенного криопреципитата.
Побочные эффекты
Побочные эффекты следующие:
і цитратная интоксикация может наблюдаться при быстром введении боль¬
ших объемов:
і негемолитические посттрансфузионные реакции (озноб, лихорадка, крапив¬
ница);
І сепсис от невыделенной бактериальной контаминации крови;
• возможна трансмиссия вирусов (гепатиты, ВИЧ и др.), несмотря на тщатель¬
ный контроль, риск ЦМВ трансмиссии может быть уменьшен посредством
удаления лейкоцитов;
і острая посттрансфузионная легочная недостаточность;
І трансмиссия патогенов, которые не могли быть выявлены ранее.
Показания к применению
Показания для назначений переливаний плазмы следующие.
239 СЛУЖБАКРОВИ
• Острый ДВС-синдром. осложняющий течение шоков различного генеза
(септического, геморрагического, гемолитического) ИЛИ вызванный другими
причинами (эмболия околоплодными водами, краш-синдром, тяжелые трав
мы с разможжением тканей, обширные хирургические операции, особенно
на легких, сосудах, головном мозге, простате и т.п.), синдром массивных
трансфузий.
І Острая массивная кровопотеря (более 30% ОЦК) с развитием геморрагии*,
ского шока и ДВС-синдрома.
• Болезни печени, сопровождающиеся снижением продукции плазменных
факторов свертывания и соответственно их дефицитом в циркуляции (ост¬
рый фульминантный гепатит, цирроз печени).
• Передозировка антикоагулянтов непрямого действия (дикумарине и др.),
і При выполнении терапевтического плазмафереза у больных с тромботи¬
ческой тромбоцитопенической пурпурой, тяжелых отравлениях, сепсисе
и ДВС-синдроме.
• Коагулопатии, обусловленные дефицитом плазменных физиологических
антикоагулянтов.
• Синдром массивных гемотрансфузий.
Массивное переливание крови — трансфузия 1 ОЦК в течение 24 ч. В такой
ситуации нарушения гемостаза связаны не только с коагулопатией разведения,
но и с основным заболеванием, длительной гипотензией, тромбоцитопенией,
НПВС, врожденной патологией. Коагулопатия разведения вследствие трансфузии
консервированной крови приобретает клиническое значение при переливании
объема около двух ОЦК. В отсутствие ДВС-синдрома увеличение протромбино-
вого времени (ПВ) и АЧТВ обусловлено главным образом гипофибриногенемией.
Значимое разведение тромбоцитов происходит ранее — при трансфузии одно¬
го ОЦК. Таким образом, осложнения массивной гемотрансфузии обусловлены
потреблением тромбоцитов, факторов свертывания и возможным развитием ДВС-
синдрома. Клинические проявления — кровоточивость повреждений, хирургиче¬
ских ран, мест инъекций.
Лечение следует начинать, не дожидаясь результатов лабораторных исследова¬
ний. Показаны трансфузии концентратов тромбоцитов (значимость мониторинга
количества тромбоцитов в крови пациента ограничена вследствие весьма вероят¬
ной тромбоцитопатии). СЗП вводят в дозе 10-15 мл/кг массы тела реципиента
для восполнения фибриногена и других факторов свертывания. Клинически зна¬
чительное снижение содержания фибриногена в плазме (менее 0,8 г/л) оптималь¬
но восполнить криопреципитатом. У взрослого 10 единиц криопреципитата увели¬
чивают уровень фибриногена на 1 r/л. Введение СЗП необходимо при увеличении
международного нормализованного отношения более 1,8.
Может потребоваться использование препаратов кальция, поскольку растворы,
содержащие цитрат и применяемые в качестве антикоагулянта для компонентов
крови, способны связывать кальций плазмы пациента и вызывать гипокальцие-
мию.
Суммируя вышеизложенное, можно заключить, что коррекцию синдрома мас¬
сивной трансфузии следует начинать эмпирически с переливания тромбоцитов
и СЗП в дозе 10—15 мл/кг. В дальнейшем ориентируются на клинические и лабо¬
раторные показатели.
Не рекомендуется переливать СЗП с целью восполнения ОЦК (есть более безо¬
пасные и экономичные средства) или для целей парентерального питания. С осто¬
рожностью следует назначать переливание СЗП у лиц с отягощенным трансфузио-
логическим анамнезом, при наличии застойной сердечной недостаточности.
Переливаемая СЗП должна быть одной группы с реципиентом по системе АВО.
Совместимость по системе Резус не носит обязательного характера, так как плаз-
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 239
обставляет собой бесклеточную среду, однако при объемных переливаниях
* иы (более 1 л) Rh-совместимостъ обязательна. Совместимость по минорным
^«оцитным антигенам не требуется,
желательно, чтобы плазма соответствовала следующим стандартным крите-
* качества'. количество белка не менее 60 г/л, количество гемоглобина менее
r/л, уровень калия менее 5 ммоль/л. Уровень трансаминаз должен быть
ппеделах нормы. Результаты анализов на маркеры ВИЧ, сифилиса, гепатитов
яи С должны быть отрицательными.
Переливание СЗП осуществляется через стандартную систему для перели-
крови с фильтром, в зависимости от клинических показаний — струйно
ва капельНо, при остром ДВС-синдроме с выраженным геморрагическим синдро-
J _ струйно. Запрещается переливание плазмы нескольким больным из одного
контейнера.
Пои переливании СЗП необходимо выполнение биологической пробы. Первые
«долько минут после начала инфузии плазмы, когда в циркуляцию реципиента
оступило еще небольшое количество переливаемого объема, являются решаю¬
щими при возникновении возможных анафилактических, аллергических и других
реакций.
Объем переливаемой плазмы зависит от клинических показании. При крово¬
течении, связанном с ДВС-синдромом, показано введение не менее 1000 мл СЗП
одномоментно под контролем гемодинамических показателей и ЦВД. Нередко
необходимо повторное введение таких же объемов плазмы под динамическим
контролем коагулограммы и клинической картины. В этом состоянии неэффек¬
тивно введение небольших количеств плазмы (300-400 мл).
При острой массивной кровопотере (более 30% ОЦК, для взрослых - более 1500
мл), сопровождающейся развитием острого ДВС-синдрома, количество перели¬
ваемой плазмы должно составлять не менее 25-30% всего объема трансфузионных
сред, назначаемых для восполнения кровопотери (т.е. не менее 800-1000 мл).
При хроническом ДВС-синдроме, как правило, сочетают переливание СЗП
с назначением прямых антикоагулянтов и антиагрегантов (необходим коагуло-
гический контроль, являющийся критерием адекватности проводимой терапии).
В этой клинической ситуации объем однократно переливаемой плазмы - не менее
600 мл.
При тяжелых заболеваниях печени, сопровождающихся резким снижением
уровня плазменных факторов свертывания и развившейся кровоточивостью
или угрозой кровотечения во время операции, показано переливание плазмы
из расчета 15 мл/кг массы тела с последующим, через 4-8 ч, повторным перелива¬
нием плазмы в меньшем объеме (5-10 мл/кг).
У пациентов с тяжелой патологией печени коагулопатия приводит к геморра¬
гическому синдрому в сочетании с другим патологическим процессом или хирур¬
гическим вмешательством (биопсия печени, разрыв варикозных вен пищевода).
Трансфузии СЗП у таких пациентов показаны при угрозе или развившемся крово¬
течении. Для остановки кровотечения или коррекции дефекта гемостаза необхо¬
дима трансфузия 6-8 доз СЗП. Сложность лечения таких пациентов - изначально
увеличенный ОДП.
При сильном кровотечении (во время или после хирургического вмешательства)
ДДя обеспечения гемостаза необходимо вводить СЗП каждые 6-12 ч. В некоторых
требуются дополнительные меры для достижения гемостаза, например
енные трансфузии, применение концентратов протромбинового комплекса
вированный фактор 10 может вызвать ДВС), введение концентратов АТШ.
^Рнпрсфилаюгических трансфузиях СЗП достаточно достичь МНО порядка
Чей их возникнуть необходимость трансфузии тромбоцитов для коррек-
Дисфункции и тромбоцитопении. Трансфузии ТК при подготовке к эндо-
240 служи xeoe*
сжоііии. парацентеэу и люмбальной пункции показаны пациентам с количеств
тромбоцитов менее 50 ООО клеток/мкл. ^
Больным с тяжелыми дефектами функции тромбоцитов можно вводить д.
прессин. Перед удалением зубов пациентам целесообразно назначить анчцфид °*
нолигнческие препараты, например эпсилонаминокапроновую кислоту (Эакк/
Подготовка к большой хирургической операции может включать:
• парентеральное введение витамина К и СЗП:
• трансфузии ТК для поддержания количества тромбоцитов на уровне окоп
100 ООО клеток/мкл.
В тех случаях, когда трансфузии СЗП сочетаются с трансфузиями тромбокои-
центрата. следует учитывать, что с каждыми 5-6 дозами ТК больной получает
объем плазмы, эквивалентный 1 дозе СЗП.
Данные рекомендации появились недавно, поэтому до этого момента показания
к переливанию СЗП неуклонно расширялись без достаточных для того оснований
Главной причиной была высокая стоимость и отсутствие в достаточном количе¬
стве и ассортименте специфических концентратов свертывающих факторов.
В последние годы, по рекомендациям обществ трансфузиологов, материалам
конгрессов и т.п.. можно определить случаи, при которых трансфузия СЗП не пока¬
зана:
• в качестве средства профилактики осложнений при массивной трансфузии;
• для нейтрализации гепарина при сердечно-легочной перфузии:
• для увеличения ОЦК;
• профилактически после сердечно-легочного шунтирования;
• профилактически вместе с массивной гемотрансфузией;
• для профилактических трансфузий больным без клинических проявлений
активного кровотечения, у которых имеется небольшое увеличение протром-
бинового времени (на 3 с выше верхней границы нормы);
• при хроническом ДВС в отсутствие геморрагий;
• при выявлении у больных явлений гиперкоагуляции и повышенной сенсиби¬
лизации к парентеральному введению белка.
При переливании СЗП высок риск передачи вирусных и бактериальных инфек¬
ций. Именно поэтому сегодня уделяют большое внимание методам вирусной
инактивации плазмы (карантинизация в течение 3-6 мес, обработка детергентом
и т.п.). Кроме того, потенциально возможны иммунологические реакции, свя¬
занные с наличием антител в плазме донора и реципиента. Наиболее тяжелая
из них - анафилактический шок. В этих случаях требуется прекращение перели¬
вания плазмы, введение адреналина и преднизолона.
Плазма, отделенная от эритроцитов и замороженная позднее чем через 8 ч,
называется замороженной. Как и криосупернатантная (оставшаяся после полу¬
чения криопреципитата), замороженная плазма содержит меньшее количество
факторов V и VIII, однако достаточное количество факторов II, VII, IX и X. В крио-
су перната нтной плазме также снижено содержание фибриногена. Эти виды плаз¬
мы могут с успехом применяться для лечения пациентов с дефицитом стабильных
факторов свертывания (например, коагулопатия из-за передозировки произво¬
дных кумарина).
СВЕЖЕЗАМОРОЖЕННАЯ ПЛАЗМА ПОСЛЕ УДАЛЕНИЯ КРИОПРЕЦИПИТАТА
Определение
Компонент, изготовленный из свежезамороженной плазмы после удаления
крнопреципитата.
Сеойства
Содержание альбумина, иммуноглобулинов и факторов свертывания то *е-
что и в свежезамороженной плазме, за исключением уменьшенной концентрации
«л Апотдецум КАЫЛЫ УЧРЕЖДЕНИИ СЛУЖБЫ КРОВИ 241
^НЛЬЙШ факторов V и VIII. фибриногена. Компонент не должен содержать зна*
_.мь* дд! клиники патологические антитела.
^со* іМгвто,яен,ІЯ
Компонент •— побочный продукт при изготовлении крнопреципитата из свеже*
за)|прпжеиной плазмы.
В некоторых странах рекомендуется вирусная инактивация компонента
„или караитинизация.
^котирование
пикетирование должно проводиться в соответствии с национальными прави¬
ли и международными соглашениями. Следующая информация должна быть
-умешена на этикетке или сопровождающей листовке-вкладыше:
• идентификация производителя;
• индивидуальный идентификационный номер. Если от донора одновременно
получено две или более доз, должна быть добавлена нумерация процедуры
аферез-1, аферез-2 и т.д.;
• группа крови АВО и Rh-принадлежность;
• дата донации;
• наименование компонента крови;
• дополнительная информация — удаление лейкоцитов, облучение и др. (если
проводилось);
і срок хранения, дата применения (если необходимо);
і температура хранения;
• компонент должен быть применен с использованием 170-200 мкм фильтра.
Хранение и стабильность
Стабильность при хранении зависит от температуры хранения, которая должна
составлять 25 °С или ниже. Допустимы следующие продолжительность и темпера¬
тура хранения:
• 24 мес при температуре -30 °С и ниже;
• 12 мес при температуре от -18 до -25 °С.
Транспортирование
Регламентируемая температура хранения должна поддерживаться во время
транспортирования, вплоть до момента применения.
При получении компонента лечебное учреждение должно убедиться, что во
время транзита контейнер находился в замороженном состоянии.
Показания к применению
Применение компонента показано только для лечения тромбоцитопенической
пурпуры.
Меры предосторожности
Рутинное применение не рекомендуется ввиду риска трансмиссии вирусов.
Желательно использовать альтернативные средства.
СЗП нельзя применять при выявлении у больного реактивности на белки плаз¬
мы. Применяют только АВО-совместимую плазму.
Продукт должен быть использован немедленно после размораживания, повтор-
** вмораживание не допускается. Оттаивание должно производиться при кон¬
воируемых температурных условиях. Перед применением контейнер должен
°мть проверен на герметичность. Не должны выявляться видимые хлопья нерас-
ТВо1*нного криопреципитата.
Побочные эффекты указаны выше.
242 СЛУЖБА КРОВИ
КРИОПРЕЦИПИТАТ
Определение
Компонент, содержащий криоглобулиновую фракцию плазмы, выдели,-
центрифугированием из свежезаготовленной. освобожденной от клеток гита
и сконцентрированный до объема 10-20 мл. ^
Свойства
Содержит большую часть содержащихся в исходной СЗП фактора VIII, фактов
фон Виллебранда. фибриногена, фактора XIII и фибринонектина.
Способ получения
Замороженный контейнер с плазмой, еще соединенный с общей системой кон¬
тейнеров, размораживают в течение ночи при температуре 2-6 °С или быстрым
сифонным способом оттаивания. После медленного размораживания при
2-6 °С систему контейнеров вновь центрифугируют при жестком режиме итакой
же температуре. Криосупернатант переводят в контейнер с эритроцитами или в
отдельный контейнер. Часть супернатантной плазмы оставляют с криопреципи¬
татом для сохранения объема 40 мл. Полученные компоненты отделяют друг от
друга. Отделенный контейнер с криопреципитатом вновь замораживается и хра¬
нится в требуемых условиях.
Таким же образом компонент получают из аферезной плазмы.
В некоторых странах рекомендованы вирусная инактивация и/или карантини-
зация компонента.
Этикетирование
Этикетирование должно проводиться в соответствии с национальными прави¬
лами и международными соглашениями. Следующая информация должна быть
размещена на этикетке или сопровождающей листовке-вкладыше:
• идентификация производителя;
• индивидуальный идентификационный номер. Если от донора одновременно
получено две или более доз, должна быть добавлена нумерация процедуры -
аферез-1, аферез-2 и т.д.;
• группа крови АВО и Rh-принадлежность;
• дата донации;
• наименование компонента крови;
• дополнительная информация — удаление лейкоцитов, облучение и др. (если
проводилось);
• срок хранения, дата применения (если необходимо);
• температура хранения;
• компонент должен быть применен с использованием 170-200 мкм фильтра.
Хранение и стабильность
Стабильность при хранении зависит от температуры хранения, которая должна
быть -25 °С или ниже. Допустимы следующие условия хранения:
• 24 мес при температуре -30 °С и ниже;
• 12 мес при температуре от -18 до -25 °С.
В табл. 7-27 отражен контроль качества криопреципитата.
Транспортирование
Регламентируемая температура хранения должна поддерживаться во время
транспортирования вплоть до момента применения.
При получении компонента лечебное учреждение должно убедиться, что ВО
время перевозки контейнер находился в замороженном состоянии.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КР06Й 243
Таблица 7-27. Контроль качества криопреципитата
Объекты контроля
——■ ■——
Критерии
качества
Частота контроля j Моею контроля
;Объем
30-40 мл
Все дозы
Отделение компо¬
нентов
[фактор Vlllc
>70 ME
в дозе
Каждые 2 мес:
а) пул из 6 доз. смешанных по группам, а течение
первого месяца хранения,
б) пул из 6 доз, смешанных по группам, а течение
последнего месяца хранения
Лаборатория кон¬
троля качества
[фибриноген
>140 мг
в дозе
1% всех доз. минимум 4 дозы в месяц
Лаборатория кон¬
троля качества
Фактор фон
Виллебранда
>100 ME
в дозе
I
Каждые 2 мес:
а) пуп из 6 доз. смешанных по группам, в течение
первого месяца хранения:
б) пуп из 6 доз, смешанных по группам, в течение
последнего месяца хранения
Лаборатория кон¬
троля качества
Показания к применению
Применяется в следующих случаях:
• дефицит фактора VIII;
• другие состояния дефицита факторов свертывания крови, такие как диссеми¬
нированное внутрисосудистое свертывание:
I недостаточность фибриногена (качественная и количественная).
Меры предосторожности
После изъятия из морозильника непосредственно перед применением компо¬
нент оттаивают при 37 “С. Во время этой процедуры компонент осторожно вруч¬
ную перемешивают для лучшего растворения криопреципитата.
При низкой температуре стенки полимерных контейнеров становятся хрупкими
и могут образовываться трещины. При оттаивании следует внимательно следить
за появлением протечек содержимого. В случае обнаружения дефектов контейнера
компонент не используют.
Повторному замораживанию компонент не подлежит.
Побочные эффекты указаны выше.
Приготовление небольших пулов
В некоторых случаях желательно объединить до 10 доз криопреципитата. Если
это делают в открытой системе, то пул должен быть использован в течение 1 ч;
компонент нельзя повторно замораживать для дальнейшего хранения. Пул дол¬
жен быть паспортизирован таким образом, чтобы можно было проследить каждый
индивидуальный криопреципитат.
Для гемостаза необходимо поддерживать уровень фактора VIII до 50% во время
операций и до 30% в послеоперационном периоде. Одна единица фактора VIII
соответствует 1 мл СЗП. Криопреципитат, полученный из одной дозы крови, дол¬
жен содержать, как минимум, 100 ед. фактора VIII.
Расчет потребности в переливании криопреципитата проводится следующим
образом:
• масса тела (кг) х 70 мл/кг = объем крови (мл);
• объем крови (мл) х (1,0 — гематокрит) = объем плазмы (мл);
• объем плазмы (мл) х (необходимый уровень фактора VIII - имеющийся уровень
фактора VIII) = необходимое количество фактора VIII для переливания (ед.):
• необходимое количество фактора VIII (ед.)/100 ед. = количество доз крио¬
преципитата. нужное для разовой трансфузии.
244 служба кроєм
Время полужизни перелитого фактора VIII в кровотоке реципиента сосга
Ц12 ч, поэтому, как правило, необходимы повторные переливания криопрец31^
тата для поддержания терапевтического уровня. Чипя-
Количество перелитого криопреципитата зависит от тяжести гемо*
А и выраженности кровотечения. Терапевтический эффект зависит or
распределения фактора между внутрисосудистым и внёсосудистым простран^?
ми. В среднем 1/4 перелитого фактора VIII, содержащегося в криопреіщщ^*
переходит во внесосудистое пространство в процессе терапии, ате*
Длительность терапии зависит от тяжести и локализации кровотечения и к»
нического ответа реципиента. Если в силу каких-либо обстоятельств нет возмо
ности определить уровень фактора, то опосредованно можно судить об адекватна
ста терапии по активированному частичному тромбопластиновому времени. Если
оно в пределах нормы (30-40 с), то уровень фактора обычно выше 10%.
Еще одно показание к назначению криопреципитата — это гипофибриног*.
немил, которая крайне редко наблюдается изолированно, чаще входя в состав
острого ДВС-синдрома. Одна доза криопреципитата содержит в среднем 250 щ
фибриногена. Однако большие дозы криопреципитата могут вызывать гиперфц.
бриногенемию, чреватую тромботическими осложнениями и повышенной седи¬
ментацией эритроцитов.
Криопреципитат должен быть совместим по системе АВО. Объем каждой дозы
небольшой, но переливание сразу многих доз может приводить к полемическим
нарушениям, что особенно важно учитывать при лечении детей, имеющих мень¬
ший объем крови, чем взрослые. Анафилаксия, аллергические реакции на плаз¬
менные белки, волемическая перегрузка могут наблюдаться при переливании
криопреципитата.
АФЕРЕЗНЫЕ ГРАНУЛОЦИТЫ
Определение
Компонент, состоящий в основном из гранулоцитов, полученных аферезом
от одного донора и суспендированных в плазме.
Свойства
Основная функция гранулоцитов — фагоцитоз бактерий.
Методы получения
Лейкоферез на сепараторе клеток крови с использованием методов прерывистого
или непрерывного центрифугирования в Потоке. Повышенных выходов клеток крови
можно достичь добавлением седиментирующих агентов, таких, как гидроксиэтил*
крахмал, низкомолекулярный декстран или модифицированный жидкий желатин.
Премедикация Доноров глюкортикоидами и 6-С5Р не рекомендуется до уста¬
новления подтверждения безопасности процедуры. Такая операция может быть
предпринята в дальнейшем.
Этикетирование
Этикетка должна соответствовать национальным стандартам и международ*
ным соглашениям. Следующая информация должна быть показана на этикетке
или листовке-вкладыше:
• идентификация производителя;
• индивидуальный идентификационный номер. Если от донора одновременно
получено две или более доз, должна быть добавлена нумерация процедуры -
аферез-1, аферез-2 и т.д.;
• группа крови АВО и Rh-пркнадлежность;
• дата донации;
uri япиолции гади і Ы УЧРЮКДЕНИИ СЛУЖБЫ лгОон £ЦЭ
наименование компонента крови;
• дополнительная информация — удаление лейкоцитов, облучение и др. (если
доводилось);
, срок применения, время применения (если необходимо);
, название антикоагулянта, добавляемых растворов и/или других агентов;
, число гранулоцитов;
• Hla-тип (если определялся);
• температура хранения;
, компонент должен быть применен с использованием 170-200 мкм фильтра,
хранение и стабильность
Компонент должен быть применен как можно быстрее после получения. Если
-io невозможно, то его можно хранить при температуре 20-24 °С не более 24 ч,
Контоль качества гранулоцитов предствлен в табл. 7-28.
Таблиця 7-28. Контроль качества гранулоцитов
ришты контроля
Критерии качества
Частота контроля
Место контроля
Кем
<500 мл
Все дозы
Отделение компонентов
число гранулоцитов
<1x1010 в дозе
Все дозы
Отдаление компонентов
шдТкогда требуется)
Типирование
Как рекомендовано
HLA-лаборатория
Транспортирование
В термоконтейнере при температуре 20-24 °С.
Показания к применению
Может быть показан пациентам с нейтропенией при установленном сепсисе
одновременно с адекватной терапией антибиотиками.
Предосторожности при применении
Поскольку имеется значительная примесь эритроцитов, следует проводить тест
на совместимость.
Гранулоциты перед трансфузией можно подвергнуть воздействию ионизирую¬
щей радиации в рекомендованной дозе.
Побочные эффекты
Возможны следующие побочные эффекты:
* аегемолитические посттрансфузионные реакции (озноб, лихорадка, крапив¬
ница);
• сепсис от невыделенной бактериальной контаминации крови;
І возможно заражение Treponema pallidum;
• возможна трансмиссия вирусов (гепатиты, ВИЧ и др.), несмотря на тщатель¬
ный контроль;
• имеется значительный риск трансмиссии латентных вирусов (CMV, HBV
и др.) иммуносупрессивным пациентам;
* в редких случаях возможно заражение малярией;
*: аллоиммунизация против HLA и эритроцитных антигенов;
* посттрансфузионная пурпура;
• аккумуляция гидрооксиэтилкрахмала;
* острая посттрансфузионная легочная недостаточность;
• трансмиссия других патогенов, которые не могли быть выявлены ранее;
* синдром «трансплантат против хозяина» у иммунокомпрометированных
пациентов.
Таким образом, в настоящее время единственным действием ге мотерапевтиче-
000 сред принято считать заместительное — устранение дефицита структурно-
246 СЛУЖБА КРОвИ
функционального компонента крови пациента (эритроцитов, тромбоцитов
плазмы). Из этой парадигмы современной трансфузионной медицины
несколько важных следствий:
• отсутствуют показания для переливания цельной крови:
• переливание гемокомпонентов с целью детоксикации, парентерально
ния, стимуляции защитных сил организма и т.д. недопустимо; ntfra
• основные требования к компонентам и препаратам крови - безопапвч_
биологическая полноценность и клиническая эффективность; асй0сгь,
• необходимо стремиться к использованию гемокомпонентов, максима
очищенных от «балластных* клеточных и гуморальных примесей, не на 'ЬНо
ленных на реализацию замещения дефицита функций крови;
• срок непосредственного действия гемотрансфузионного средства ЬШщйг
временем структурной полноценности и функционального эффекта пене ?Н
того компонента крови (например, для эритроцитов — не более 120 дней!
• учитывая потенциальную опасность аллогенных гемокомпонентов, необх
димо строго ограничить показания к их применению, максимально испод,,
зовать методы, альтернативные аллогенным гемотрансфузиям.
Подготовка к переливанию крови начинается с определения показаний и пись-
менного требования, необходимого для переливания компонента. Следует полу¬
чить полное информированное добровольное согласие пациента, т.е. врач обязан
разъяснить необходимость трансфузионной терапии, цели, возможный риск
и альтернативное лечение. Согласие пациента на гемотрансфузию должно быть
подтверждено документально.
Основы Законодательства Российской Федерации об охране здоровья граждан
от 22 июля 1993 г. №5487-1, приказы М3 РФ, методические рекомендации Фонда
обязательного медицинского страхования требуют предварительного информиро¬
ванного добровольного согласия пациента на любое медицинское вмешательство.
Переливание донорской крови и ее компонентов, аутогемотрансфузии и альтер¬
нативные им методы, сопряженные с возможным развитием реакций и осложне¬
ний, как любые медицинские вмешательства, требуют информированного добро¬
вольного согласия на их проведение.
Наиболее полно права пациентов отражены в статьях 30, 31, 32, 33 Основ
Законодательства РФ об охране здоровья граждан. Среди основных прав:
• право на информацию о состоянии здоровья;
• право на информированное добровольное согласие на медицинское вмеша¬
тельство;
• право на отказ от медицинского вмешательства;
• право на получение медицинских и иных услуг в рамках программ добро¬
вольного медицинского страхования;
• право на возмещение ущерба в случае причинения вреда здоровью при ока¬
зании медицинской помощи.
Добровольное согласие пациента на вмешательство означает отсутствие какого-либо
давления в момент принятия решения, а также возможность отказа в любое время.
Согласие на медицинское вмешательство в отношении лиц, не достигших 15
лет, и граждан, признанных в установленном порядке недееспособными, дают
их законные представители (ст. 32 Основ Законодательства). Нарушение права
пациента на информированное добровольное согласие может послужить основа¬
нием для медико-правовых конфликтов.
Мероприятия, проводимые при переливании компонентов крови
При необходимости длительной гемотрансфузионной терапии у больных с ми
лодепрессией или апластическим синдромом желательно определить фсн°
реципиента и переливать подобранные по фенотипу эритроциты.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЯУЖШ КРОМ 247
При наступлении больного в стационар и взяггии на учет ■ поликлинике груп-
крови по системам АВО и Rh определяет в плановом порядке врач-лаборант
врач кабинета переливания крови, имеющий специальную подготовку по изо*
серологии. Бланк с результатом определения вкладывается в историю болезни
переносится лечащим врачом на титульный лист истории болезни с обязатель¬
ной подписью врача.
Трансфузию крови или ее компонентов проводят лечащий врач, дежурный врач,
врач отделения или кабинета переливания крови, во время операции - дежурный
анестезиолог, непосредственно не участвующий в операции или наркозе, или спе¬
циальный врач трансфузиолог.
Перед тем как приступить к переливанию компонента крови или цельной крови,
необходимо убедиться в их пригодности для переливания и идентичности груп*
повой принадлежности донора и реципиента по системам АВО и Rh. Врач, пере¬
ливающий трансфузионную среду, визуально проверяет герметичность упаковки,
правильность паспортизации, макроскопически оценивает качество гемотранс¬
фузионной среды. Определять годность гемотрансфузионной среды необходимо
при достаточном освещении непосредственно на месте хранения, не допуская
взбалтывания, так как оно может привести к ошибочному заключению. Критерии
годности для переливания следующие: для цельной крови - прозрачность плазмы
при отсутствии в ней мути и хлопьев, красного окрашивания плазменного слоя
(гемолиз), равномерность верхнего слоя эритроцитов, наличие четкой границы
между эритроцитами и плазмой: для плазмы — прозрачность. При возможном
бактериальном загрязнении цельной крови или эритроцитной массы цвет плазмы
будет тусклым, с серо-бурым оттенком, она теряет прозрачность, в ней появляют¬
ся взвешенные частицы в виде хлопьев или пленок. Такие гемотрансфузионные
среды переливанию не подлежат.
При подозрении на развитие гемолиза неотстоявшуюся кровь (эритроцитную
взвесь) перемешивают в контейнере, после чего берут в пробирку 8-10 мл и цен¬
трифугируют. Яркое розовое окрашивание плазмы после центрифугирования сви¬
детельствует о недоброкачественности гемотрансфузионной среды. Для проверки
эритроцитного концентрата (массы) в пробирку в 2-3 мл 0,9% раствора хлорида
натрия вносят 5 капель эритроцитсодержащей среды, перемешивают и после
центрифугирования (для оседания эритроцитов) убеждаются в отсутствии яркого
розового окрашивания физиологического раствора. Наличие такого окрашивания
указывает на гемолиз проверяемой среды и, следовательно, на непригодность ее
для переливания.
Паспорт (этикетка) должен содержать все необходимые сведения:
• наименование среды;
• название учреждения-изготовителя;
• дату заготовки;
• срок годности:
• группу крови АВО и Rh-принадлежность;
• регистрационный номер;
' фамилию и инициалы донора;
• фамилию врача, заготовившего кровь;
• отметку «Стерильно»;
• указание, что среда проверена на ВИЧ-1/2, гепатиты В и С. сифилис.
Учреждение Службы крови, заготовившее гемотрансфузионную среду и выдав-
иеееев клинику, гарантирует качество этой среды и несет за нее полную юриди¬
ческую ответственность.
Запрещается использовать для переливания трансфузионные средства:
• если отсутствует или неправильно оформлена этикетка, если истек срок год¬
ности;
1
249 сйужьа***»»
0 при наличии гемолиза или других признаков недоброкачественности г*
1 при нарушении герметичности контейнера.
Врач, проводящий трансфузию эритроцитсодержащих сред, обязан, незавие
от проведенных ранее исследований и записей, лично провести следующие '
трольмые исследования непосредственно у постели реципиента.
• Убедиться, что перед ним именно тот пациент, и для трансфузии получл.
необходимое гемотрансфузионное средство.
• Определить группу крови реципиента по системе АВО И сверить полученный
результат с данными истории болезни.
• Определить группу крови из донорского контейнера по системе АВО и сопо¬
ставить результат с данными на этикетке контейнера.
• Провести пробу на индивидуальную совместимость эритроцитов доном
с сывороткой или плазмой реципиента по системам АВО и Rh.
• Провести биологическую пробу.
Примечание. Необходимо отметить одно важное обстоятельство
в Национальном стандарте Российской Федерации (ГОСТ Р 53470-2009), 2010 г
«Кровь донорская и ее компоненты. Руководство по применению компонентов
донорской крови» в пункте 6.11 «Предтрансфузионное тестирование (определение
совместимости)» указано, что «Прямое определение совместимости (кроссматч)
обычно осуществляется перед трансфузией крови. Это выявляет реакцию между
сывороткой пациента и эритроцитами донора». Иными словами, в отличие от при¬
каза №363 от 25 ноября 2002 г. «Об утверждении инструкции по применению
компонентов крови», нет прямого указания на необходимость перепроверки груп¬
пы крови АВО, резус-принадлежности пациента и эритросодержащей среды перед
гемотрансфузией. Отсутствует также требование проведения специальной пробы
на совместимость по резус-фактору.
Биологическая проба предшествует переливанию каждой отдельной дозы транс¬
фузионной среды для исключения ее индивидуальной несовместимости с кровью
реципиента или непереносимости. Первые 50 мл среды вводят струйно 3 порциями
по 10-15 мл с перерывами в 3 мин между введениями. Если не появляются субъ¬
ективные (озноб, боли в пояснице, чувство жара и стеснения в груди, головная
боль, тошнота, рвота), объективные (немотивированное усиление кровоточиво¬
сти в операционной ране, снижение артериального давления и учащение пульса,
изменение цвета мочи при катетеризации мочевого пузыря) и другие признаки
несовместимости, переливание продолжают до конца, контролируя самочувствие
реципиента. При проявлении признаков несовместимости (непереносимости)
переливание следует прекратить.
Переливание гемотрансфузионных сред проводится медицинским персоналом
при строжайшем соблюдении правил асептики и антисептики с использованием
одноразовых пластиковых систем для внутривенного введения, имеющих филь¬
трующее устройство, предпочтительно микрофильтр.
Запрещается переливание компонентов крови из одного контейнера последова¬
тельно нескольким больным.
Быстрое переливание больших объемов холодной крови может понизить
температуру синусно-предсердного узла до значений ниже 30 °С, что приводит
к развитию экстрасистолии. Перед переливанием контейнер с эритроцитсодер¬
жащей трансфузионной средой следует подогреть, выдерживая при температуре
18-25 °С в течение 30-60 мин.
В эритроцитный концентрат (массу) для улучшения их реологических свойств
непосредственно перед трансфузией добавляют 50-100 мл 0,9% раствора хлори¬
да натрия. Запрещено введение в контейнер с трансфузионной средой каких-ли¬
бо других медикаментов и растворов, кроме 0.9% раствора хлорида натрия.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЯУЖЫ»
241
нельзя не только добавлять к компонентам крови, но даже одновременно вво-
вену следующие растворы: лактат, раствор Риигера (Рингер-лактвт).
водный раствор глюкозы и гипотонический раствор хлорида натрия. Раствор
^козы может стать причиной агрегации эритроцитов в системе и, что более
г,!®| 0 вызвать их набухание и гемолиз при проникновении глюкозы и связанной
^•оды из межклеточного пространства в клетки. Раствор Рингера содержит
Даточное количество ионов кальция, чтобы подавить хелатирующие агенты
^консерванта, тем самым способствуя образованию мелких свертков крови.
Время трансфузии обычно не превышает 2 ч. Увеличивать продолжительность
„«(Ьузии свыше 4 ч не рекомендуется.
Оттаивание СЗП и криопреципитата осуществляют после проверки паспорта*
-««сетки И герметичности контейнера. Эту процедуру выполняют в специальном
мзмораживателе или на водяной бане при температуре 38-40 °С. Применение
размораживателя имеет следующие преимущества:
• отсутствие перегрева и нарушения состава крови;
• простота в обслуживании;
» размораживание без полного погружения контейнеров в воду за счет при¬
менения специального держателя (верхние части контейнеров и входные
трубки остаются сухими);
. возможность установки времени размораживания;
« таймер со световой и звуковой индикациями;
• встроенный электронный термометр.
Контейнер с плазмой перед размораживанием должен находиться в упаковоч¬
ном полимерном мешке. Переливанию плазмы предшествует выполнение биоло¬
гической пробы. При трансфузии тромбоцитов и плазмы пробы на совместимость
не проводят.
В ходе трансфузии врач и средний медицинский персонал контролируют само¬
чувствие реципиента и его реакцию на переливание.
После гемотрансфузии определяют ее непосредственный лечебный эффект,
а также наличие или отсутствие реакции (осложнения). Через сутки после перели¬
вания эритроцитсодержащих сред необходимо провести общеклинический анализ
мочи, а через 3 сут — общеклинический анализ крови. Если гемотрансфуэия про¬
водилась во время оперативного вмешательства под наркозом, макрооценку мочи
(а при необходимости — микроскопическое исследование осадка) проводят в ходе
операции и после ее окончания, для чего осуществляют катетеризацию мочевого
пузыря до начала трансфузии.
Каждый случай переливания крови и ее компонентов записывают в историю
болезни в виде протокола (см. ниже), в котором отражают показания к гемотрансфу-
зии. название перелитой среды и ее паспортные данные, пробы, проведенные перед
переливанием, метод переливания, время начала и окончания, реакцию больного
на переливания (пульс, АД. температура тела через 1; 2 и 3 ч после трансфузии).
Герметизированные контейнеры с остатками крови (донорской, аутокрови),
компонентов и растворов, добавленных к эритроцитной массе (концентрату),
>также пробирки с кровью (сывороткой) реципиента, использованной для прове¬
дения проб на совместимость, сохраняют в холодильнике в течение 2 сут для про¬
верки в случае возникновения посттрансфузионного осложнения. При развитии
иоатрансфузионной реакции (осложнения) принимают меры по ликвидации
осложнения, а также выяснению его причины (повторная проверка совместимости
крови донора и реципиента, исследование крови на внутрисосудистый гемолиз,
''аалиа Мочи и пр.). Оказание лечебных и организационных мероприятий прово-
^8 соответствии с приказом М3 РФ от 25 мая 1985 г. N*700 «О мерах по даль*
предупреждению осложнений при переливании крови, ее компонентов.
^Паратов и кровезаменителей».
250 СЛУЖБА КРОЄМ
Показания и опыт применения отечественных систем
для переливания крови с микрофильтром
Донорская кровь после заготовки претерпевает необратимые изменения в ш
с образованием устойчивых агрегатов, размеры и количество которых |Ыр
возрастают после хранения в течение более 3 дней, достигая через 3 нед кол»?0
ства 70 млн агрегатов из микро- и макросгустков размером 10-200 мкм в Яш
при этом основная масса представлена микросгустками размером более 40 мкм**’
Попадание в русло крови большого количества микроагрегатов инициипу
развитие эмболических осложнений, особенно в тех случаях, когда имеется щр
расположенность пациента к подобным осложнениям, если этому способствую
сопутствующие факторы (возраст, избыточная масса тела, оперативное вмеша¬
тельство, беременность, роды и послеродовый период).
Избежать осложнений можно при использовании для переливания эритроцит¬
содержащих сред отечественных систем ПК-23-01 с микрофильтром МФТ-оі
однократного применения (ЗАО НПП «Интероко», Россия) (рис. 7-12).
Микрофильтр обеспечивает удаление из эритромассы 95% микроагрегатов раз¬
мером более 30 мкм. Изделия выпускают в полиэтиленовых упаковках, они сте¬
рильны, апирогенны и нетоксичны.
Комплект системы состоит из двухканальной
иглы, микрофильтра, капельницы, роликового
зажима, инъекционного узла и двух полимерных
игл, которые одновременно позволяют подсоеди¬
ниться к контейнеру с эритроцитной массой или кро¬
вью и к флакону или контейнеру с инфузионным
раствором, что позволяет разбавить эритроцитную
массу до гематокрита 50-60% в замкнутой системе.
Система комплектуется инъекционной иглой диа¬
метром 1,5 мм. Больным переливают 400-800 мл
эритроцитной взвеси с гематокритом 50-60%.
Устройство предназначено для безопасного про¬
ведения трансфузии крови и эритроцитной массы
с показателем гематокрита не более 60% из поли¬
мерных контейнеров, а также кровезаменителей
и инфузионных растворов.
Особенность использования системы ПК-23-01
заключается в предварительном заполнении микро¬
фильтра физиологическим раствором с вытеснением
воздуха до венепункции (открыты клапаны 2 и 3, кла¬
пан 1 закрыт) и последующей венепункции и перели¬
вании инфузионной среды (клапаны 1 и 3 открыты,
клапан 2 закрыт).
Отмечено, что двухканальная полимерная игла
системы легко, без разрушения прокалывает отече¬
ственные пробки из разных марок резины, надежно
и герметично присоединяется к штуцерам отече¬
ственных и зарубежных полимерных контейнеров.
Заполнение систем с микрофильтром трансфузион-
ными средами не вызывает затруднений и проводит-И
ся в течение 1-2 мин в соответствии с инструкцией рис 7_12. Устройства для филь-
по применению. Зажим устройства позволяет регу- грации крови и ее компонен-
лировать режим трансфузии, а также обеспечивает тов — ПК-23-01 с микрофиль-
надежное перекрытие тока жидкости. Трансфузию тром (ЗАО «НПП Интероко»)
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 251
„троцитнои массы проводят в капельном режиме. Введение 500 мл эритроцитнои
происходит в среднем за 15-20 мин. Для струйного переливания дополни-
шШ используют выжимное устройство,
устройство предназначено для использования в хирургии различных направле-
|| педиатрии, гематологии, онкологии, акушерстве и гинекологии, при оказании
еотложной помощи, в проведении интенсивной терапии, в «медицине ката¬
строф»- Оно эффективно для предупреждения тромбоэмболических поражений
легких, печени, мозга, почек, гипертензии (после переливания) большого круга
кровообращения, а также уменьшения возможности возникновения «синдрома
^грой легочной недостаточности».
І основе острого респираторного дистресс-синдрома (ОРДС) лежит первичное
поражение зоны микроциркуляции в малом круге кровообращения, а не поражение
дыхательных путей или альвеол.
Нужно отметить, что смертность от ОРДС, составляющая 40-70%, фактически
с годами не меняется. Это связано с тем, что в стандартных системах для переливания
крови фильтр задерживает микросгустки размером от 170 мкм и более, находящиеся
в большом количестве в консервированной крови и эритроцитной массе, но про¬
пускает более мелкие микроагрегаты, состоящие из нежизнеспособных лейкоцитов,
тромбоцитов и нитей фибрина, которые блокируют прекапилляры малого круга кро¬
вообращения, тем самым вызывают ОРДС и дыхательную недостаточность.
Переливание эритроцитсодержащих сред с помощью устройства с микрофиль¬
тром показано в тех случаях, когда необходимы:
• многократные переливания компонентов крови;
• трансфузии донорской эритромассы при сроках хранения более 3 дней;
t трансфузии донорских эритровзвеси и отмытых эритроцитов в течение 24 ч
после их получения;
• трансфузии заготовленных до операции аутоэритроцитов при сроках хране¬
ния более 5 дней;
• трансфузии цельной аутологичной крови, заготовленной в ходе операции
методом гемодилюции;
• трансфузии аутоэритроцитов, заготовленных в ходе операции при реинфузии;
• трансфузии «дренажной» крови, используемой до 6 ч после окончания опе¬
рации;
• трансфузии более 3 доз донорских эритроцитов в экстренных ситуациях
при проведении массивной трансфузионной терапии;
I трансфузии свежезаготовленной цельной крови при обменных гемотрансфу¬
зиях у детей;
• переливания у беременных в родах и послеродовом периоде;
I переливания у больных с посттрансфузионными реакциями и осложнениями;
s переливания у больных с отягощенным аллергологическим и иммунологи¬
ческим анамнезом;
• переливания у трансплантационных больных;
• переливания у больных старше 60 лет;
• трансфузия более 3 доз донорских эритроцитов;
в трансфузия аутокрови и ее компонентов независимо от сроков хранения;
• переливание донорских эритроцитов в педиатрической практике;
• трансфузия донорских эритроцитов при реологических нарушениях.
Выбраковка и паспортизация готовых компонентов крови
Апробацию консервированной донорской крови проводят из флакона-спутника
(пробирки) в лабораториях сертификации донорской крови.
Паспортизацию крови осуществляют после полной ее выбраковки. Цель выбра-
ковки и паспортизации донорской крови — не допустить поступления в ЛПУ
252 внштж
ЯОШЮИЄКТОВ донорской крови, непригодных ДЛЯ переливания. Консеп
ДООрСКаЯ Кровь И ее компоненты, не прошедшие контрольных исс1,р0ВаНЯ311
к применению не допускаются. едов*нм
Донорская кровь до результатов апробации хранится в отдельном
мне ори температуре 2-6 *С который промаркирован «Кровь не обХ°Лог1Иль-
Выдаче не подлежит!*.
Флакон-спутник (пробирку) с сопроводительными документами Нап
• лаборатории сертификации для проведения анализов. PaBj>%
ПОРЯДОК ПРОВЕДЕНИЯ ВЫБРАКОВКИ КОМПОНЕНТОВ КРОВИ
Выбраковка включает следующие исследования:
• определение группы крови по системе АВО;
• определение Rh-принадлежности;
• серологические реакции на сифилис;
• определение антител к ВИЧ-1,2 и антигена ВИЧ-1 р24;
І определение поверхностного антигена вирусного гепатита В;
а определение антител к вирусу гепатита С;
• определение активности аланинаминотрансферазы, уровня билирубина.
Бактериологический контроль проводят в соответствии с действующей инструк¬
цией.
Результаты каждого лабораторного исследования записывает сотрудник, про¬
водивший исследование, в карточку донора, погрупповой лист и журнал лаборато¬
рии. Журнал должен быть пронумерован, прошнурован, заверен подписью главно¬
го врача и скреплен печатью. На карточки тех доноров, чья кровь или компонент
оставлен «в работе», прикрепляют бирку «В работе». Эти документы поступают
к сотруднику, ответственному за выбраковку и паспортизацию крови.
Получив документы, ответственный (назначенный) человек сверяет запись
в журналах лабораторий, проводивших анализы, с донорской карточкой и под-
групповыми листами. При полном соответствии этих записей консервированная
донорская кровь или ее компоненты, непригодные для переливания, изымаются.
Забракованную кровь или ее компоненты помещают в отдельный маркирован¬
ный холодильник, раздельно по причинам брака (абсолютный брак, относитель¬
ный брак, компоненты на переработку, «в работе») до списания или получения
окончательного результата. При этом забракованная кровь или ее компоненты
хранятся на разных полках холодильника, соответственно промаркированных.
Причину брака рекомендуется писать красным сигнальным цветом на первич¬
ной этикетке контейнера.
На каждой донорской карточке человек, ответственный за проведение паспор¬
тизации донорской крови и ее компонентов, делает отметку о пригодности
или непригодности данного компонента к переливанию, переработке на препа¬
раты. использованию как сырья длцадмунологического отдела (производство
иммунологических стандартов), абсолютный или относительный брак.
Продолжительность манипуляций с компонентами крови при выбраковке и«
должна превышать установленной нормы, чтобы не допустить риска ухудшения
качества продуктов.
Для сокращения ошибок и продолжительности манипуляций при проверке про¬
дуктов рекомендуется внедрить систему компьютерного учета и штрихового кодиро¬
вания, оборудованную устройствами считывания информации с этикетки продукт08,
ПРИЧИНЫ БРАКА КРОВИ И ЕЕ КОМПОНЕНТОВ
Абсвяютиый брак
Основания для списания консервированной донорской крови и ее компо
в абсолютный брак указаны в табл. 7-29-7-34.
ШВ Нв нн
{цщ 742. Результаты исследования индивидуальных донаций доноров в Пцр ^
аи* аамсямост от ИФА '
(Яяринымбергармге тести- 'Оценка результатов для отделения выбракощ ц-Г''
ШаяуЩдм я ее компонентов
1 ВВ-я г'*’-1 ■■ ■*■■■ "Г—
j ІЦР ( «якгь ; ПЦР. 2-я мт- j результат
яш ниша I исследования
категория
брака
компоненты крови,
не подлежащие
карантинизации
(эритрокомпонен¬
ты и КТ)
*°«яоиенщ
«ров», под*
зачи"1плазц$
(Яммипаяьмый 1 Положительный I Положительный
Абсолютный
Уничтожение
Уничтожимте
уПилоияіяьїцій Отрицательный j Отрицательный
Абсолютный 1
Уничтожение
Уничтож^ТГН
Табшца 7-33. Результаты иммунологического исследования доноров на маркеры сифилиса
j Результаты лабораторного тестя
рмашп крови
Оцени результатов для отделения выбраковки кровіТїГеіТмиГ^
нентов ™"
Г * J
*•***’ИФА/МР. 2-я
j №шВ постановка
И
результат
исследования
категория
брака
компоненты
крови, не под¬
лежащие
карантинизации
(эритрокомпо¬
ненты и КТ)
компоненты
кроен, подтека-
щие карантин»,
зации (плазма!
[Положительный [Положительный
Положительный
Абсолютный
Уничтожение
Уничтожение]
[Положительный [Сомнительный
Сомнительный
Абсолютный
Уничтожение
УничтожёншП
j Сомнительный Сомнительный
Сомнительный
Абсолютный
Уничтожение
Уничтожений]
Таблица 7-34. Результаты биохимического исследования доноров на содержание АЛТ
Результаты дабора
торного теетирока
Оценка результатов для отделения выбраковки
крови и ее компонентов
микром
результат
всследования
категория
брака
компоненты крови, не под¬
лежащие карантинизации
(эритрокомпоненты и КТ)
компоненты крови,
подлежащие каран¬
тинизации (плазма)
Пря кыилении
повышенного содер¬
жания уровня АЛТ
Больше нормы
Абсолютный
Уничтожение
Уничтожение
Кроме того, к основаниям для списания донорской крови и ее компонентов
в абсолютный брак относят:
• отсутствие полных сведений о доноре и невозможность их уточнения:
• отсутствие марочного номера на контейнере с кровью или компонентом:
• выявленный контакт по инфекционным гепатитам:
• гемолиз, хилез продуктов крови:
• признаки инфицирования продуктов крови (мутность, хлопья):
• нарушение герметичности контейнера.
Относительный брак
Основания для списания консервированной донорской крови и ее компонентов
в относительный брак указаны в табл. 7-35-7-39.
ПОРЯДОК ПРОВЕДЕНИЯ ПАСПОРТИЗАЦИИ
КОМПОНЕНТОВ КРОВИ
Система качества не должна допускать выпуска и поставки в ЛПУ продукди
непригодной для клинического использования. В организации в административ
ном порядке должны быть назначены ответственные лица, имеющие полномоч
на выпуск готовой продукции. Заключение о пригодности продукта для
зии может быть сделано только на основании подтверждения того, что все
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ
255
|Б
I *
11
^ й
2 сх
I*
п о
0) CJ
3 Ж
се «-
* 2
ж о
во а.
о fc
S х
О X
ж н-
т- о
- *о
^ 8
е 5-
8 Si
H
s »
« і
5 it
X о
м ж
о о
і *
S =г
ІІ
І Я
і І
g
І
і!
< Ж X
'S
то
I =1,1
5 * 'fi I
П л iUl
£І5с
Щ\ ii
-1 то
•
GL tt і
=j> 1 ТО і
Ш < 1
в о
3
X
3
м
X
«5
л
Ф
s
fit
то
X
X
о
X
е
S
О
1 <2
с
S
0ВМ**ШИ
Iftttaptnrw иммунологического исследования крови доноров
ОДОЮ результатов дня отделения вьібраіювхй «пп..
и ее компотитов риви
Лцрм—і иВвріИрЦгі
ширшим Ирин
ряэуяьтг
mtmm-
мим
категория
брака
компоненты кроен,
не подлежащие каранти¬
низации (зритрокомпо-
ненты и КТ)
крови. ПОДвЛ
"WeKapa^
зашм
[НвЛИЧЯб
I Относительный
Уничтожение
—
ИвРвраОоттіГ—'
Переливание
(П,ф. ЦТф)
1
rarMmSmrmi rrrrrr
і Наличие
Относительный
Уничтожение
— _
Переработкам
Гофотпмм» ряда
j UHWH ДРИДММПЯТ КІЙ
І0ртт
{наличие
Относительный
Уничтожение
пёрер5оли1
Парояогячееш формула
j * сшрятг дамисгвующий
ИДИ
Наличие
Относительный
Уничтожение
Переработка
[ПИМТШИМИаШ ГШІНШЧТПГГ
Наличие
Относительный
Уничтожение
Переработка
f/bmtnDV И DW (независимо
тМмйВмМмжНОСТЙІ
Наличие
Относительный
Уничтожение
Переливание~
Антигю. С л/шш антиген £
(ери вкутспии антнгкиа D)
Наличие
Относительный
Уничтожение (или
в СЩХКК — при каранти¬
низации эритросред)
Переливание
£?$-
п
(при отсутствии Квяьаигигана)
Наличие
Относительный
Уничтожение
(или в ОДХКК)
Переливание-"
Образцы хром л м комло*
пит яш бвктариального
ПОСШ им с истекшим сроком
прости
Относительный
Уничтожение
Переработка Н
. J
ходнмые производственные и контрольные операции завершены, и результаты
тестов удовлетворительные.
Перед окончательным этикетированием необходимо провести контроль каж¬
дой единицы продукции в соответствии с учетным документом (список кроводач
или другой документ по усмотрению организации):
• проверить регистрационные записи условий хранения продукции на каран¬
тине, которые должны удовлетворять установленным требованиям;
• проверить целостность упаковки, маркировку и внешний вид ;
• убедиться, что все необходимые тесты выполнены, результаты исследований
соответствуют требованиям .отсутствуют расхождения в предыдущих и теку*
щих записях о группе крови донора;
• проверить наличие всей необходимой информации в записях о доноре
и или кроводаче (плазмодаче).
Наличие зтикетки готовой продукции считают подтверждением статуса «при¬
годен для выдачи».
Выпуск продукта можно осуществлять только при условии соответствия про¬
дукта всем установленным требованиям. Продукты с любыми выявленными несо¬
ответствиями по мере выбраковки должны размещаться отдельно от остальной
продукции, Все несоответствующие продукты должны быть идентифицированы,
найдены, учтены и перемещены в специально предусмотренную и защищенную
огг несанкционированного доступа зону.
Готовые компоненты крови могут быть окончательно этикетированы как при
годные для использования в лечебных целях только после выбраковки и надежно
го отделения несоответствующей или забракованной продукции (рис. 7-13).
«nvwAUMW РАБОТЫ УЧРЕЖДЕНИИ СЛУЖБЫ КИИ»
«уаортизация (этикетирование) осуществля¬
ла только с использованием донорской карточ¬
ке включает:
, полное наименование учреждения, заго¬
товившего консервированную донорскую
кровь или ее компонент,
, объем цельной крови или ее компонентов;
, объем гемоконсерванта;
, индивидуальный номер донора;
, группу крови АВО и Rh-принадлежность;
( дату донации;
, срок годности, температуру хранения;
« фамилию, имя, отчество врача, ответствен¬
ного за заготовку крови;
• информацию об отсутствии маркеров ВИЧ-
1,2, сифилиса, гепатитов В и С.
После заполнения паспорта-этикетки крови
действенный проводит идентификацию этикет¬
ки с первичной (марочной) маркировкой кон¬
тейнера. При полном их соответствии этикетку
фиксируют на контейнере так, чтобы первичная
маркировка (марка) была хорошо видна. После
паспортизации консервированную донорскую
кровь или ее компоненты рекомендуется упако¬
вать в прозрачный полиэтиленовый пакет.
Следует соблюдать цветность контрольной
полосы на этикетках:
• I группа крови — контур контрольной поло¬
сы без цвета;
• II группа крови — контур контрольной поло¬
сы синего цвета;
• Щ группа крови — контур контрольной поло¬
сы красного или розового цвета;
• IV группа крови — контур контрольной поло¬
сы желтого цвета.
СИСТЕМА ШТРИХКОДИРОВАНИЯ КОМПОНЕНТОВ
157
Штриховое кодирование — один из элемен¬
тов, обеспечивающих надежность информации
при заготовке крови. Представление информации
штриховым кодом и замена ручного ввода счи¬
тыванием этого кода практически сводит на нет
ошибки вследствие так называемого человеческо¬
го фактора.
Технология штрихкодирования при заготовке
крови
Когда донор приходит в учреждение Службы
крови, ему выдают блок марок (рис. 7-14) с уни¬
кальным номером кроводачи. К этому номеру
в ^азе Данных привязывают все данные о кроводаче. На каждой штрихмарке при-
сугствует индивидуальный номер.
Рис. 7-13. Внешний вид контейнера
с гемокомпонентом (эритроцитная
масса), прошедшим выбраковку
и этикетировку
258 служба крови
Блоки подготавливают заранее для
бесперебойного функционирования
учреждения. Уникальность номера
кроводачи обеспечивается программой
печати блоков.
Одну из марок врач наклеивает
в карточку донора рядом с отметкой
о кроводаче (плазмодаче). Остальные
марки в блоке предназначены для иден¬
тификации продуктов первичной пере¬
работки (плазма, эритроцитная масса,
тромбомасса) и пробирок, отправ¬
ляемых в лаборатории сертификации
крови. После центрифугирования каж¬
дый контейнер помечают своей мар¬
кой. Кроме марок со штрихкодами,
на контейнере с кровью нет никакой
дополнительной информации. В лабо¬
раториях, куда отправляют пробирки,
делают анализы. Их результаты вводят
в компьютер в соответствии с номера¬
ми штрихкодов на пробирках. Данные
об анализах передают в основную базу,
где они соединяются с другой информа¬
цией о доноре и кроводаче.
На следующем этапе происходит
этикетировка продукции и передача ее
в другие подразделения. Участок этике-
тировки оснащен дополнительно тер¬
мотрансферным принтером для печа¬
ти этикеток на готовую продукцию.
При этикетировке медицинская сестра
берет контейнер с продукцией и счи¬
тывает его штрихкод. Компьютер ищет И
в базе данных информацию, соответствующую этому конкретному продукту,
и осуществляет несколько видов контроля:
• контроль наличия всей необходимой информации (из регистратуры, ЕДЦ,
лабораторий, врача, операционной забора крови, операционной переработки
крови на компоненты);
• контроль результатов анализов (ВИЧ, гепатит, сифилис, биохимические
анализы);
• контроль дополнительных условий, которые могут стать причиной брака
(нарушение герметичности и т.п.).
Если данный продукт не проходит хотя бы по одному параметру, выдается
соответствующее предупреждение, и этикетка не печатается. Если же все резуль¬
таты контроля удовлетворительны, печатается готовая этикетка, соответствующая
международному стандарту ISBT-128. После этикетировки печатают накладную
и партию заготовленных компонентов передают в экспедицию.
В экспедиции при приеме продукции считывается информация со штрихкода.
Проводится проверка того факта, что этот контейнер действительно передан в экс¬
педицию. Если все правильно, данные об этом мешке заносят в картотеку продую
ции в экспедиции. При выдаче продукции достаточно считать штрихкод с мешка,
после чего вся информация из картотеки переносится в накладную.
Эта цепочка может быть продолжена в лечебном учреждении для регистрации
трансфузии в больничной информационной системе.
Рис. 7-14. Блок штрихмарок
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИИ СЛУЖБЫ КРОВИ 259
иичсскиб средства, применяемые в штриховом кодировании
учрежден® Службы крови, переходящее на систему штрихкодирования ком¬
див крови, должно быть в полной степени обеспечено компьютерами с соот-
^-вуюшим программным обеспечением на каждом рабочем месте. Для взаимо-
^ между собой должна быть организована локальная сеть с достаточной
^ остью передачи данных и необходимым уровнем защиты от несанкциониро-
2ого доступа.
На базе нашего отделения (отделение трансфузиологии ГУ РНЦХ им. академи¬
ки Петровского РАМН) эта задача реализована следующим образом. Создана
® ранговая сеть с одним выделенным сервером, объединяющая с помощью
«портового хаба все компьютеры на рабочих местах. Эта локальная сеть изолиро-
на от Интернета и локальной сети базового учреждения (РНЦХ РАМН). Сервер,
Л^щпоченный через ИБП, необходим для хранения баз данных и администрирова-
мядоступа к ним с различных рабочих мест. Он работает круглосуточно, так как
юм же режиме работает экспедиция. К основному серверу подключен запасной,
^рый каждые 3 ч копируются базы данных с основного. Запасной сервер готов
дяряюен к немедленной замене в случае неполадок с основным (рис. 7-15).
Ркс. 7-15. Схема организации системы электронного штрихкодирования производства компонен¬
тов крови на базе отделения переливания крови
Для использования штрихового кодирования необходимо решить следующие
задачи:
• печать этикеток (марок) со штрихкодами (рис. 7-16);
• считывание штрихкодов в компьютер.
Первая задача может быть решена двумя принципиально различными спосо¬
бами:
• печать всех видов этикеток заранее, в типографии;
' печать на месте в режиме on-demand, т.е. когда эта этикетка нужна.
При заказе штрихмарок в типографии необходимо рассчитывать их прогнози¬
руемый
расход по группам крови и заказывать заранее в достаточных количествах
і1я бесперебойной работы Службы крови.
260 СЛУЖБА КРОВИ
Второй способ позволяет печатать
этикетки своими силами и в нужных
количествах. Производить штрихкод
можно на любом принтере* с достаточ¬
но высоким разрешением (от 150 точек
на дюйм). Можно использовать лазер¬
ный или струйный принтер. Но в этом
случае приходится решать проблему
программного обеспечения, способного
воспроизводить штриховые коды. Кроме
того, обычные принтеры ориентированы
на печать на обычной листовой бума¬
ге, в то время как оптимально приоб¬
ретение специализированного принте¬
ра для печати этикеток со штриховыми
кодами (например, термотрансферный
принтер фирмы Zebra) (см. рис. 7-16).
Принтер печатает штрихкоды
на рулоне, разделенном на этикетки
нужного размера. Он обладает встро¬
енной системой распознавания язы¬
ков, позволяющей легко производить
нужные этикетки. Расходные материа¬
лы для принтера включают красящую
ленту (Ribbon) и рулон самоклеящихся
этикеток. Расходные материалы фирмы
Zebra сертифицированы для использования в службе крови.
Вторая задача решается использованием специализированных считывателей
штрихкодов (сканеров). Различают несколько типов сканеров:
І контактные считыватели-карандаши;
• стационарные считыватели;
• лазерные считывающие пистолеты.
Как показал опыт работы, считывающие пистолеты (например, ручные
считыватели-пистолеты фирмы Symbol, комплектующиеся декодерами, способны¬
ми распознавать практически любую кодировку штрихкодов) удобны в использо¬
вании и достаточно хорошо считывают штрихкоды даже с неровных поверхностей
(например, с пробирок). Считыватели подключаются параллельно с клавиатурой.
После этого считываемые символы поступают в компьютер так же. как если бы
они вводились непосредственно с клавиатуры. Это позволяет не вносить никаких
изменений в программы в связи с внедрением штрихкодирования.
УТИЛИЗАЦИЯ ЗАБРАКОВАННЫХ КРОВИ И ГЕМОКОМПОНЕНТОВ
Утилизация абсолютного и относительного брака или передача непригодной
для переливания донорской плазмы как сырья для препаратов крови произво¬
дится только при получении всех результатов исследований (если какое-либо
исследование проводится не в одно время с остальными, необходимо дождаться
его результатов и только после этого передать образец по назначению или утили¬
зировать).
Все компоненты, изъятые по вышеперечисленным причинам, фиксируются
в учетной форме №418/у (приказ М3 РФ от 07.08.2007 г.) в день получения
результатов исследования.
Списание забракованной крови по причине абсолютного брака проводится посто-
■нш) лриггвуюшей комиссией, назначенной ішиказом пекоиплытепя умпр*-прния.
У
Рис. 7-16. Принтер для печати штрихмарок
и этикеток со штрихкодом
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖ
261
комиссия должна не позднее 3 дней после выявлении брака составить акт
списание (утилизацию) брака. Акт составляется в 3 экземплярах по каждому
Сдельному случаю, с указанием вида брака крови или ее компонента, и утвержда¬
ла руководителем учреждения.
*рервый экземпляр передается в бухгалтерию учреждения, второй остается
подразделении, где выявлен брак, в отделе, где произошла утилизация.
* Особое внимание необходимо уделять контролю списания и утилизации абсо-
0ХНОГО и относительного брака.
Вирусная безопасность плазмы и лечебных препаратов крови
При использовании плазмы крови для трансфузий и изготовления препаратов
существует опасность заражения больного, несмотря на тщательный отбор и обсле¬
дование доноров. Плазма, как и другие продукты крови, может быть источником
заражения такими «экзотическими* инфекциями, как малярия, токсоплазмоз, бабе-
зиоз, болезнь Шагаса, которые все чаще встречаются в медицинской практике в связи
с распространенностью миграционных процессов и международного туризма.
Серьезная медико-социальная проблема — туберкулез и сифилис. Уровень
заболеваемости сифилисом за 10 лет возрос примерно в 67 раз. причем «совре¬
менный» сифилис характеризуется преобладанием скрытых форм, атипичным
проявлением и устойчивостью к терапии.
Некоторые вирусы, передаваемые при трансфузии, в частности цитомегалом-
рус и HTLV-1, присутствуют исключительно в клетках и потому не предс I—яют
опасности при терапии белковыми препаратами плазмы.
Среди других потенциально опасных вирусов через концентраты факторов
и другие плазматические препараты, вероятно, способен передаваться вирус
гепатита G (HGV), однако его патогенность и тропизм к печеночным клеткам
сомнительны. HGV, вероятно, чувствителен к стандартной технологии вирус-
инактивации других липидоболочечных вирусов, хотя для уточнения этого необ¬
ходимы дополнительные исследования.
Вирусы животных также представляют опасность, хотя их патогенность
для человека сомнительна. Например, свиной фактор VIII был контаминирован
свиным парвовирусом, который высокоэндемичен у свиней. Однако случаев его
передачи человеку пока не наблюдалось, а клинические и лабораторные данные
пока не продемонстрировали его опасность для здоровья человека.
20-30% доноров — носителей вируса гепатита В не выявляются на ранних ста¬
диях заболевания с применением теста на австралийский антиген. Исследования,
проведенные Красным Крестом США. выявили более 9 млн кроводач. кото¬
рые были произведены в период сероконверсии инфицированных доноров.
Сопоставимые данные были получены исследователями других стран.
Недавние публикации подняли в сообществе больных гемофилией тревогу
по поводу возможного переноса с препаратами болезни Крейтцфельдта-Якоба
(CJD), трансмиссионной спонгиоформы энцефалопатии (TSE). Вызывающий ее
агент был идентифицирован как необычный агент, называемый «орион», кото¬
рый. вероятно, будет устойчив к применяемым методам инактивации вирусов.
Несколько успокаивает тот факт, что диагноз TSE ни разу не был поставлен боль¬
ному гемофилией, даже после примерно 30-летней истории применения концен¬
тратов фактора, полученных из больших пулов плазмы. Однако, учитывая очень
Долгий инкубационный период CJD, срок в 30 лет может оказаться недостаточным
ли полного исключения возможности передачи этого инфекционного агента,
истемы для тестирования прионов находятся в стадии разработки и станут важ¬
ным инструментом обеспечения безопасности препаратов крови после валидации,
редварительные данные позволяют предположить, что прионы циркулируют
*Р°*и в значительно меньших концентрациях, чем в нервной ткани, и их можно
"1
282 СЛУЖБА КРОВИ
эффективно отделить ОТ плазмы С ПОМОЩЬЮ обычно Применяемых стадий пращ
таиии. ионообменной хроматографии и гельфильтрации.
Использование рекомбинантных препаратов также не позволяет полностью а
лючить риск вирусной инфекции. Некоторые рекомбинантные препараты содеп»!
в своем составе человеческий альбумин. Даже рекомбинанты, не содержащие альЬ
мин, теоретически могут переносить вирусы млекопитающих, которые способі
проникнуть в препарат из материнской клеточной культуры или из жидких сред,
используемых для роста или замораживания этих клеток.
СОВЕРШЕНСТВОВАНИЕ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ГЕМОТРАНСМИССИВНЫХ
ИНФЕКЦИЙ
Тестирование на вирусный антиген обычно проводят для гепатита В и 1||
Скрининг поверхностного антигена гепатита В (HbsAg) достаточно эффективен
так как синтез вирусного протеина происходит уже на ранней стадии заболевания!
Тем не менее вирус гепатита В может быть инфекционен даже в невыявляемом
этим методом титре. Более того, чувствительность может быть снижена в при¬
сутствии антител. В случаях СПИДа и гепатита С, напротив, в ранней фазе инфекции
в крови циркулирует очень малое количество вирусных антигенов, что потенци¬
ально снижает значение скрининг-тестов. В течение первого года после введения
Американским Красным Крестом антигенного тестирования крови доноров на ВИЧ
в период «окна» и до сероконверсии было получено только 2 положительных
результата (и 44 ложноположительных) из проведенных 6,75 млн обследований.
Наиболее эффективный скрининг-тест — тест с использованием моноспецифи-
ческих антител или тесты на вирусный антиген для каждого отдельного вируса,
которые постоянно совершенствуются. Главное достоинство этих тестов - высокая
чувствительность, обеспечивающая низкое соотношение истинно положительных
и ложноположительных результатов в избранном донорском контингенте. Среди
195 тыс. добровольных доноров в США подтверждение положительного резуль¬
тата скрининга на антитела к ВИЧ было получено только у 0,17%, в то время
как для гепатита С 60% положительных результатов на антитела было под¬
тверждено с помощью рекомбинантного иммуноблоттингового исследования.
Для исключения ложноположительных результатов эти сыворотки должны кон¬
тролироваться повторно такой же тест-системой, а затем и подтверждающим
референс-тестом. Тем не менее клиническое значение обнаружения истинно
положительных антител может быть проблематичным, эти антитела в некоторых
случаях обладают защитным эффектом.
При отсутствии ошибки или недостаточном контроле качества тестинга ложно¬
отрицательные результаты возможны при подпороговом уровне вирусного зараже¬
ния. Это может происходить в ранней стадии вирусной инфекции, так называемом
асимптоматическом периоде «окна», или в позднем периоде хронического носи-
тельства, когда виремия или серологический ответ организма хозяина существен¬
но снижается. Один из подходов для закрытия этого раннего «окна» заключается
в карантинизации свежезамороженной плазмы на достаточное время (например,
3 мес) для повторного тестирования первоначально негативных доноров.
Ложнонегативные результаты достаточно редки. Так, в США риск передачи
инфекции от единичного негативного донора оценивается примерно в 1:500000
для ВИЧ, 1:100 ООО для гепатита С и 1:63000 для гепатита В. Однако одна порция
способна контаминировать весь пул. используемый для приготовления большой
партии препарата, прежде всего концентрата фактора свертывания крови. Размер
пула часто вызывает противоречивые суждения, так как диктуется соображениями
коммерческой экономичности. С одной стороны, вероятность вирусного зараже¬
ния, очевидно, тем выше, чем больше размер пула, с другой — разведение вируй
в большом пуле уменьшает инфекционность конечного продукта и может даже
увеличить эффективность процедур инактивации.
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 263
Совершенствование методов тестирования крови, несомненно, снижает опас¬
ность трансмиссии вирусов. Для лабораторного исследования крови все шире
применяется генотестирование с помощью ПЦР (полимеразная цепная реак¬
ции) как наиболее чувствительный и достоверный метод выявления инфекции,
достаточно дорогой ПЦР-метод находит практическое применение благодаря
дологической модификации обследования мини-пулов плазмы, что существен¬
но снижает его стоимость. Некоторые производители препаратов ввели в техно¬
логическую документацию методы обнаружения вирусного генома с помощью
[ЩР или сходных технологий генной амплификации. Основное достоинство ПЦР
заключается в ее высокой чувствительности к HBV, которая превышает чувстви¬
тельность антигенного тестинга на 6 порядков.
В отношении ВИЧ-инфекции данные ПЦР позволяют предполагать, что серо-
логически промежуточные и серонегативные доноры высокого риска с очень
«алой вероятностью могут быть источником инфицирования. ПЦР-тестирование
также значительно чувствительнее по сравнению с р24-тестированием. В иссле¬
довании Американского Красного Креста, которое уже упоминалось, ПЦР-
обследование показало, что 44 из 46 р24-положительных порций крови и все
из 1216 р24-промежуточных порций были в действительности РНК-негативными.
Поэтому, если ПЦР-тестирование отдельных порций станет обязательным. р24-
обследование можно исключить из употребления.
В табл. 7-40 приведена характеристика некоторых вирусов.
Таблица 7-40. Характеристика некоторых вирусов
Вирус
Размер, мм | Геном
Наличие оболочки
тл
90-100 |
РНК
Да
Гепатит В
40-45 ДНК
Да
Гепатит С
40-60
РНК
Да
Гепатит А
25-30
РНК
Нет
j Парвовирус 19
18-20
ДНК | Нет
Хранение и распределение компонентов и препаратов крови
Для обеспечения жизнеспособности, безопасности и клинической эффектив¬
ности крови и ее компонентов от источника получения до конечного использова¬
ния организация должна сохранять соответствие крови и ее компонентов в ходе
внутренней обработки и в процессе поставки в ЛПУ. Организация Службы крови
должна осуществлять методическое руководство и периодически контролировать
обеспечение сохранения компонентов крови в ЛПУ.
Меры защиты крови и компонентов от порчи и разрушения должны включать:
* обеспечение соответствующих условий переработки, хранения, транспорти¬
рования и использования крови и ее компонентов;
* идентификацию продукции;
* доведение соответствующей информации до потребителя.
ИМЕНИЕ
Шя крови и компонентов крови должны быть определены и обеспечены усло-
*1 хранения:
* температура;
* Длительность хранения;
* меры защиты от повреждения и загрязнения;
* специальные требования, например помешивание тромбоцитов;
* необходимое оборудование;
* максимально допустимое время хранения при несоответствующей температуре.
264 СЛУЖБА КРОВИ
Для хранения крови и ее компонентов
в зависимости от требуемой температуры
рекомендуется использовать специальное
(а не приспособленное бытовое) оборудо¬
вание (рис. 7-17):
• тромбомиксеры;
• холодильные установки;
• морозильные установки;
• механизмы контроля температурно¬
го режима;
і датчики контроля температуры;
• жидкостные стандартизованные
термометры.
Для хранения каждого вида продук¬
та (цельная кровь, компоненты крови,
образцы, реагенты) следует предусмо¬
треть отдельное оборудование.
Емкость холодильников должна быть
больше минимально необходимой.
Продукты должны храниться в защи¬
щенном от несанкционированного дос¬
тупа месте. Для хранения следует при¬
менять холодильное оборудование, снаб¬
женное замками, или устройства ограни- рис 7^7 хранение эритроцитной массы
чения доступа.
Необходимо обеспечить постоянное наблюдение за температурой при хране¬
нии. Рекомендуется применение централизованного компьютерного контроля.
ТРАНСПОРТИРОВАНИЕ
Доставка может осуществляться транспортом организации Службы крови,
заказчика (ЛПУ) или внешней организацией по контракту.
Персонал, осуществляющий доставку, должен быть обучен правилам обраще¬
ния с продуктами крови при погрузке, разгрузке и транспортировке.
Система доставки должна обеспечивать прибытие заказанного продукта в конеч¬
ный пункт в ожидаемое время и его сохранность при транспортировке.
Кровь и продукты крови следует транспортировать в условиях «холодовой
цепи*, которая включает:
• специально обученный персонал;
І холодильное оборудование, обеспечивающее соответствующие условия
доставки продуктов крови, — термоконтейнеры или авторефрижераторы;
і упаковку, способную сохранять надлежащую температуру, защитить продукт
от физического повреждения и минимизировать риск микробиологического
загрязнения;
і постоянное наблюдение за соблюдением температурного режима на всех
этапах.
Необходимо обеспечивать раздельное транспортирование клеточных продук¬
тов и любых других, транспортируемых в ледяной упаковке.
Также необходимо регистрировать в соответствующих учетно-регистрационных
формах параметры хранения и транспортирования:
• температуру;
І уровень запасов продуктов для клинического использования;
I отправленные и реально полученные продукты;
• время отправки и получения;
• подписи ответственных лиц.
"■ ■ ™ "'опцпл г«ои 101 УЧГЬЖДЬНИИ СЛУЖБЫ КРОВИ Z8S
Хранение крови и компонентов крови должно быть организовано таким спосо-
Чтобы исключить ошибку при выдаче;
Ш раздельное хранение продуктов разного статуса (разрешенных для выдачи;
на карантине, несоответствующих и др.);
# раздельное размещение продуктов по группе крови АВО;
* идентификация статуса местонахождения.
Организация Службы крови должна доводить до потребителей информацию
/ условиях хранения и обращения с компонентами крови такими средствами, как;
, соответствующая маркировка продуктов, содержащая информацию об уело- WH
виях хранения и транспортирования;
J обучение персонала ЛПУ правилам хранения и обращения с компонентами
крови;
i обучение персонала организаций, доставляющих кровь в ЛПУ, правилам
транспортирования компонентов крови.
распределение
Порядок заказа крови, включая стандартную форму заказа, должен быть согла¬
сован с ЛПУ, как предусмотрено в разделе соответствующих нормативных доку¬
ментов.
Продукты крови должны отпускаться на основе заявки, подписанной лицом,
ответственным за трансфузию.
Заказ может быть принят только от лица, уполномоченного ЛПУ на полу¬
чение компонентов крови. При приеме заявки следует идентифицировать лич¬
ность предъявителя и проверить правильность оформления заявки. Неправильно
оформленную заявку (отсутствие необходимых подписей, данных) следует воз¬
вращать в ЛПУ для переоформления.
Продукты, имеющие статус «разрешенные для выдачи», должны размещаться
в отдельной защищенной зоне (отдела выдачи, экспедиции).
При выдаче продукта необходимо идентифицировать контейнер с продуктом
крови, проверить статус «разрешен для выдачи» (рекомендуется, чтобы эта про¬
верка была автоматизирована устройствами считывания), целостность упаковки
и внешний вид продукта, этикетку и срок годности. Выданная продукция должна
быть учтена и не должна приниматься обратно для повторного использования.
Необходимо вести записи о приеме, возврате заявок, выдаче продуктов крови,
указывать дату выдачи и подписи уполномоченных лиц (организации Службы
крови, ЛПУ, транспортной организации).
Экспедиция
Экспедиция располагается в здании учреждения Службы крови, в составе ее
помещений должны быть; комната для хранения крови, ее компонентов и препа¬
ратов в холодильниках (холодильная камера), комната выдачи трансфузионных
сред ЛПУ.
Персонал экспедиции осуществляет;
• получение из подразделений заготовленной крови, ее компонентов, препара¬
тов и других трансфузионных сред;
• хранение трансфузионных сред в соответствии с действующими инструкциями;
* круглосуточную выдачу ЛПУ трансфузионных сред, пригодных для клиниче¬
ского использования;
' контроль условий и организацию транспортировки трансфузионных сред
І лечебные учреждения в соответствии с действующими инструкциями;
* поддержание связи с Центром управления запасами крови [организуется
в составе экспедиции городской, республиканской, областной (краевой)
станций переливания крови].
РАЗДЕЛИ
266 СЛУЖБА КРОВИ
Организация работы отделения долгосрочного хранения
компонентов крови (ОДХК)
РЕКОМЕНДАЦИИ ПО СОСТАВЛЕНИЮ МЕДИКО-ТЕХНИЧЕСКИХ ТРЕБОВАНИЙ
ОТДЕЛЕНИИ ДОЛГОСРОЧНОГО ХРАНЕНИЯ КОМПОНЕНТОВ КРОВИ
Долгосрочное хранение клеток крови может осуществляться в двух темпепа
турных режимах: технологией криоконсервирования при умеренно низких темпе¬
ратурах (-80 °С) и при ультранизких температурах (от -150 до -196 °С) в парах
или непосредственно в жидком азоте.
Опыт работы современных ОДХК свидетельствует о необходимости примене¬
ния обеих технологий. Целесообразно соблюсти пропорцию, при которой в моро¬
зильниках медицинского назначения хранилось бы до 60% эритроцитной массы
в дьюарах с жидким азотом — 40%.
Это должны быть фенотипированные эритроциты редких групп и тромбоциты
полученные от одного донора (лечебная доза) методом афереза и прошедшие лей-
кофильтрацию.
Криоконсервирование эритроцитов позволяет решить следующие задачи,
і Обеспечить иммунологическую безопасность трансфузий за счет:
щ соблюдения принципа «один донор-один больной»;
Ц создания запасов крови от одного донора;
реализации компонентов с учетом фенотипа эритроцитных антигенов
донора и реципиента (в первую очередь для детского контингента, женщин
детородного возраста и всех больных, которым трансфузии компонентов
крови предполагается применять многократно);
Щ получения ареактогенной среды (отмытых эритроцитов, освобожденных
от белков плазмы и лейкоцитов).
• Обеспечить инфекционную безопасность путем внедрения технологии каран¬
тинизации эритроцитов (аналогично методике карантинизации плазмы).
• Создать запасы лечебных доз тромбоцитов.
я Решить задачу хранения стволовых клеток (задача будущего).
Производственные задачи ОДХК состоят в следующем:
• обеспечивать круглосуточное хранение компонентов крови;
• выдавать запрашиваемые компоненты по первому требованию;
• при организации закладки преимущество отдавать донорам, регулярно сдающим
кровь, создавая максимальные запасы (до 1 л и более) компонентов крови;
• осуществлять процедуру карантинизации компонентов крови со сроком хра¬
нения 6-12 мес.
Единовременное хранение клеток крови целесообразно проводить в следующих
объемах:
• эритроцитная масса — 1500 доз, в том числе редких групп;
• при -80 °С — 900 доз;
• при -196 °С — 600 доз;
і тромбоцитный концентрат лейкофильтрованный — 60 и более лечебных доз
(хранение при -196 °С).
При двукратной закладке компонентов крови в течение года мощность Банка
крови составит 2250-3000 доз в год для эритроцитной массы и 120 и более лечеб¬
ных доз в год для тромбоцитного концентрата.
ОДХК должно быть самостоятельной структурой Центра крови. В штат ОДХК
входят: руководитель ОДХК (1 чел.), врач (1 чел.), медицинская сестра (2 чел.),
инженер (1 чел.), техник (1 чел.).
Функциональные обязанности выполняются в соответствии с «Инструкцией
по криоконсервированию клеток крови» (1995).
ОРГАНИЗАЦИЯ РАБОТЫ УЧРЕЖДЕНИЙ СЛУЖБЫ КРОВИ 267
Требования * оборудованию
Морозильники должны быть предназначены для медицинских целей. Пред*
почтительно использование морозильников вертикального типа. Они должны
иметь термозаписывающие устройства, звуковую сигнализацию (контроль темпе*
натуры) и возможность поддержания температуры в течение 24 ч в случае аварий¬
ной ситуации с помощью прилагаемых баллонов с углекислым газом.
Дьюары для хранения биоматериалов должны иметь электронные устройства
контроля уровня азота. Они должны размещаться таким образом (это касается
и транспортных, и подпиточных цистерн), чтобы соединяющие их шланги имели
шшимальную длину (экономия расходования жидкого азота).
С учетом предполагаемых объемов хранения компонентов крови и перспектив
развития необходимо иметь:
• цистерну транспортную ЦТК 5/0,25 (1 ед.);
• промежуточные емкости высокого давления: (4 ед.);
• модель 230 (для дьюара MVE 1536; 815 и программного замораживателя);
І морозильники медицинские вертикальные на -86 °С Sanyo (5 ед.); внешний
размер 804x772x182;
S дьюар для хранения биоматериалов MVE1536 (2 ед.);
• дьюар для хранения биоматериалов MVE 815 (1 ед.);
• программный замораживатель Planer, мод. KRYO 750 (1 ед.);
І размораживатель клеток крови Forma Scientific S/N 67434-142 (1 ед.);
• центрифугу рефрижераторную со стаканами на 1000 и 500 мл (1 ед.).
Требования к помещениям
ОДХК должно иметь 3 помещения; хранилище для размещения оборудования
(1 комната 50 м2 и более), комнату для хранения запасных частей (15-20 м2)
и комнату для персонала (15 м2, для инженера и техника).
В помещении хранилища пол должен быть наливным или выложен плиткой.
Стены обкладывают плиткой или красят масляной краской.
Вентиляция должна быть двукратной, приточно-вытяжной.
Приборный контроль кислорода осуществляется с помощью газоанализато¬
ра ГК-1, который закрепляется на стене. Концентрация кислорода должна быть
не менее 19%.
В помещении хранилища и в комнате персонала должен быть водопровод (рако¬
вины для мытья рук).
Указанные помещения располагают рядом. Посторонним лицам вход в поме¬
щения запрещен.
ОДХК также должно иметь стерильный бокс для работы по подготовке компо¬
нентов крови к замораживанию и размораживанию. В боксе обязательна стериль¬
ная комната с системой подачи стерильного воздуха, УФ-установка и предбокс
с раковиной и центрифугой с охлаждением и стаканами на 1000 и 500 мл. Бокс
должен располагаться в асептическом блоке отдела заготовки крови и предназна¬
чается исключительно для работы персонала ОДХК.
Требования по технике безопасности
Требования по технике безопасности выполняются с учетом требований
‘Инструкции по криоконсервированию клеток крови» (1995).
Особые требования:
I в помещении с оборудованием запрещается работать по одному человеку,
I во время работы с жидким азотом необходимо иметь и пользоваться в обя¬
зательном порядке средствами защиты (фартук, очки, спецперчатки) и спе¬
циальными инструментами для извлечения или размещения контейнеров
(щипцы, различные держатели, линейки для контроля уровня азота и т.п.).
РАЗДЕЛ»
268 СЛУЖБА КРОВИ
Требования по энергообеспечению
Потребляемая мощность — 35-40 кВт, наличие контура заземления
электроэнергии 220-380 В, наличие аварийного источника электрос П°*Ч
(параллельная линия энергоснабжения, дизель или газогенератор). Hafj*%
Требования к документации /
Все сведения о замороженном образце биопрепарата заносятся впа
медицинской сестрой в «Журнал регистрации замороженных компонентов04*
(форма 414/у), который заводят отдельно для каждого компонента.
График-сетка заполняется и ведется инженером ОДХК. В нем обозначены
ра контейнеров (мешков) и место расположения в биохранилище (морозилк"01^
номер корзины (поддона) и номер ячейки, в которой находится контейнео Pi
Параллельно учет и движение компонентов крови ведется с использова
специальных информационных программ «Банк крови» с определенными Л**
нями защиты доступа.
ФОРМИРОВАНИЕ ПЛАНА РАЗМЕЩЕНИЯ ОДХК
Рекомендации к плану размещения ОДХК составляют в соответствии с if
струкцией по криоконсервированию клеток крови», а также с учетом медико¬
технических требований по организации работы ОДХК.
Определяют порядок размещения ОДХК, который фиксируется на экспликации
обычно 1-го этажа здания. Уточненная планировка помещений ОДХК выделяется
на схеме цветными линиями. Это связано с тем, что после подготовки экспликации
1-го этажа часто появляется необходимость перепланировки помещений.
С учетом дополнительного изменения планировки функциональные структура
ОДХК закрепляются за определенными помещениями:
I хранилище ОДХК:
§ складирование запасных частей;
і комната для сотрудников:
я кладовая.
Определяют рабочую зону размещения оборудования для ультранизких темпе
ратур (обычно вдоль наружной стены). При этом с наружной стороны стены раз¬
мещается транспортная цистерна, с внутренней стороны — подпиточная цистерна
(1 шт.) и дьюары (3 шт.).
Транспортную цистерну размещают под навесом, исключающим прямое попа¬
дание солнечных лучей, и обносят металлической сеткой.
Зона низкотемпературного хранения эритроцитов в морозильниках чаще рас¬
полагается вдоль внутренних стен. По мере развития ОДХК может быть сформи¬
рован второй ряд морозильников — параллельно первому с сохранением прохода.
Морозильники должны быть расположены таким образом, чтобы к ним был
доступ со всех сторон.
При формировании дополнительных рядов морозильники должны размешать¬
ся тыльной стороной друг к другу.
Определяют зону программного замораживания и оттаивания компоненто»
крови.
Организуют зону складирования запасных частей. Вдоль стен оборудуют стел
лажи для хранения запасных частей и прочих материалов.
Оборудуют автоматизированное рабочее место Банка крови для работы ин*
нера и техника.
Рабочие места остальных сотрудников, как правило, организуют в дополните»
но предоставляемых помещениях.
План размещения ОДХК согласуют с руководителем учреждения.
Глава 8
Служба крови в очагах,
эндемичных по наследственным
аномалиям крови
В последние годы, несмотря на все усилия по агитации и про¬
паганде донорства, отмечается тенденция к снижению количества
доноров крови.
Показано, что для полного удовлетворения потребностей в ком¬
понентах и препаратах крови необходимо участие в донорстве
не менее 5% населения (Hollan et al., 1993). В ряде экономически
развитых стран показатель донорства (количество взрослого насе¬
ления, участвующего в донорстве крови) составляет 60-80 чел.
на 1000 населения, т.е. 6-8%. В России количество доноров на 1000
населения в 2000 г. составило всего 15 чел. (Селиванов и соавт..
2002). Резкое снижение доноров крови отмечается во всех стра¬
нах СНГ. В России общее число доноров уменьшилось за послед¬
ние 6 лет на 27,6%, а объем заготовленной крови соответственно
на 14,2% (Селиванов, 1999; Ажигирова и соавт., 1999; Селиванов
и соавт., 2002). В Азербайджане количество донаций за год соста¬
вило 13 206 для цельной крови и 152 для плазмы, в Грузии - 20 000
и 1700 соответственно (Асадов, 2003).
В отдельных регионах мира ситуация с заготовкой крови усу¬
губляется особенностями, связанными с краевыми патологиями
и наследственными аномалиями среди коренного населения. В этом
отношении особый интерес вызывают наследственные аномалии
крови. По данным ВОЗ, в мире более 240 млн человек являются
носителями аномальных генов гемоглобина, а 400 млн имеют
наследственный дефицит фермента Г-6-ФД.
Дефицит фермента глюкозо-6-фосфатдегидрогеназы (Г-6-ФД)
и гемоглобинопатии (количественные — р-талассемия и каче¬
ственные — СКА) — самые распространенные в мире наслед¬
ственные аномалии. Частота встречаемости лиц — носителей
аномальных генов в странах так называемого малярийного пояса
(Азербайджан, Грузия, Средняя Азия, Средиземноморье) может
достигать 20-25% (Ахундова, 1972; Рустамов, 1986), а СКА в неко¬
торых странах Африки отмечается у 40% населения (Троицкая О.В.
и др., 1996).
Кроме того, как правило, во многих регионах численная база
доноров крови снижается также в связи с высокой частотой ЖДА
среди населения (Рагимов, 1986; Гайдукова, Выдыборец, 2002).
В этих условиях вопрос о расширении платформы донорских кадров
за счет привлечения к донорству здоровых носителей наследствен¬
ных аномалий приобретает особую актуальность.
270 СЛУЖБА КРОВИ
В связи с этой проблемой Службе крови в очагах распространения наследств*,
ных аномалий крови необходимо разрабатывать пути решения следующих зада •
• отбор доноров с учетом возможного носительства наследственных аномалий
крови; "
І заготовка крови и получение полноценных компонентов крови от ДОНОио
с наследственными аномалиями крови;
І проведение гемокомпонентной терапии компонентами, полученными
от доноров с наследственными аномалиями крови;
• поиск альтернативных путей расширения донорской базы (аутодонорство
и родственное донорство при наследственных аномалиях крови - см. главы
«Аутодонорство и аутогемотрансфузии», «Гемотрансфузионная тактика
при анемиях»).
Отбор доноров
Носительство аномальных генов имеет целый спектр клинических проявле¬
ний — от бессимптомных до крайне тяжелых. Отвод от донорства крови лиц с кли¬
ническими признаками той или иной наследственной аномалии крови в целом
не представляет трудностей и может быть осуществлен в рамках существующих
инструкций и положений о донорстве. Однако вопросы обследования доноров,
забора крови, ее переработки на компоненты, хранения и применения от лиц
без клинических признаков дефицита Г-6-ФД, р-талассемии или СКА остаются
неисследованными. Обследование доноров (закон «О донорстве крови и ее компо¬
нентов» от 09.06.93 г. №5142-1 РФ, приказ М3 РФ №364 от 14.09.01 г. «Порядок
медицинского освидетельствования доноров крови и ее компонентов» І не позво¬
ляет выявить наследственные аномалии крови, такие как дефицит фермента
Г-6-ФД и р-талассемия. Наследственные аномалии крови не включены в список
противопоказаний для донорства (приложение 2 к «Порядку мед. обследования
доноров крови и ее компонентов»). В пункте 2.2 настоящего приложения указано
противопоказание — болезни крови. Однако при бессимптомном носительстве
аномалий крови пациент узнает о наличии того или иного заболевания случай¬
но при обращении к врачу в связи с другим заболеванием, при диспансеризации
или популяционных исследованиях населения. Поэтому существует опасность
привлечения к донорству лиц с талассемией, СКА или дефицитом Г-6-ФД.
Отсутствие алгоритма клинического и лабораторного обследования доноров
крови в очагах, эндемичных по наследственным аномалиям крови, не позволяет
осуществлять сбор, переработку, хранение и применение компонентов от лиц
с гетерозиготной талассемией и дефицитом Г-6-ФД. Поэтому необходимо выра¬
ботать определенный алгоритм обследования доноров крови и ее компонентов
в очагах, эндемичных по дефициту Г-6-ФД, р-талассемии и СКА, с целью возмож¬
ности расширения и оптимизации донорской базы в этих регионах.
Как было отмечено выше, гомозиготы р-талассемии и гемоглобина S (боль¬
шая талассемия и серповидно-клеточная анемия), как правило, не доживают
до «донорского» возраста или же при адекватной терапии находятся на гипер*
трансфузионном режиме. Носительство генов в гомозиготном состоянии про¬
текает крайне тяжело, с поражением многих систем организма, поэтому такие
лица не могут быть привлечены к донорству. В связи с выраженной клинической
картиной лица, имеющие сочетание нескольких аномальных генов, например гена
серповидно-клеточности и р-талассемии, также не могут быть донорами крови.
Предлагаемый алгоритм освидетельствования доноров крови касается выяв¬
ления лиц с наследственными аномалиями крови без клинических проявлений -
гетерозигот по генам р-талассемии, гемоглобина S и дефицита Г-6-ФД. В основу
положен принцип этапносги обследования (приказ №364 М3 РФ) с учетом
СЛУЖБА КРОВИ В ОЧАГАХ. ЭНДЕМИЧНЫХ ПО НАСЛЕДСТВЕННЫМ АНОМАЛИЯМ КРОВИ 271
_бенностей, обусловленных возможным наличием среди доноров носителей
^следственных аномалий крови.
на Метод включает следующие этапы.
1-й этап - регистрация донора. Проводится заполнение донорской карты
с направлением на первичное освидетельствование. На этом этапе необходи¬
мо дополнительно зафиксировать в карте донора место рождения, что может
способствовать установлению у обследуемого определенных краевых пато¬
логий.
, 2-й этап - первичное клинико-лабораторное исследование. Обследование
донора включает общепринятые методы исследования, предусмотренные
в соответствии с положениями (Инструкция по медицинскому освидетель¬
ствованию доноров крови, плазмы, клеток крови от 29.05.1995 г. М3 РФ;
«Порядок медицинского обследования донора крови и ее компонентов» -
приказ М3 РФ №364 от 14.09.2001 г.): определение количества гемоглобина
(при каждой донации), количества эритроцитов, лейкоцитов, тромбоцитов.
СОЭ (не реже 1 раза в год), показатель билирубина, общего белка (при каж¬
дом повторном плазмаферезе). Клиническое освидетельствование донора
включает измерение температуры тела, артериального давления и пульса.
Важнейшее значение в регионах с высокой частотой наследственных анома¬
лий крови имеет осмотр врача. Необходимо обратить внимание на кожные
покровы и видимые слизистые для выявления бледности или истерич¬
ности как симптомов анемии или гемолиза и провести пальпацию живота
для выявления гепато- и спленомегалии. Сбор личного анамнеза будущего
донора, помимо вопросов, предусмотренных приложением 1 приказа №364,
включает и уточнение некоторых пунктов, которые помогают предположить
наличие наследственных аномалий крови:
І симптомы анемии (утомляемость, слабость, тахикардия и др.);
І эпизоды гемолитических кризов с выделением темной мочи, гематурии;
I переносимость физических нагрузок, в том числе занятий спортом;
і реакция на проживание в высокогорных областях;
І переносимость авиационных перелетов;
І реакция на изменение погоды.
• На этом этапе необходим сбор и семейного анамнеза (приказом №364 М3
РФ не предусмотрено). Поскольку гемоглобин S и (З-талассемия наследуются
по законам Менделя, а дефицит Г-6-ФД сцеплен с Х-хромосомой, то уточне¬
ние следующих вопросов позволяет предположить вероятность наследствен¬
ных аномалий в семье:
❖ характер брака родителей донора — родственный или нет (при родствен¬
ном браке — степень родства);
ф анемия или гемолитические кризы в семье;
І состояние здоровья родителей или причины их смерти;
Ф случаи мертворождения и ранней детской смертности, причины смерти
и возраст умерших детей с указанием половой принадлежности;
Ф состояние здоровья братьев и сестер будущего донора или причины
их смерти.
* При обследовании доноров в очагах распространения наследственных ано¬
малий крови выделяют следующие группы методов исследований;
fj общепринятые (в соответствии с «Инструкцией» — показатели гемоглоби¬
на, эритроцитов и т.п.);
§ скрининговые — тесты на наличие наследственных аномалий крови
(дефицита Г-6-ФД, р-талассемии, гемоглобина S);
^ углубленные (специальные) методы исследования — электрофорез гемо¬
глобина, количественное определение Г-6-ФД.
272 СЛУЖБА КРОВИ
• Отвод от кроводачи доноров с наследственными аномалиями крови
знаками анемии проводят по установленным правилам. Снижение С П^"
гемоглобина (или гематокрита) или количества эритроцитов - ^
причина для отвода от кроводачи. При этом анемия может быть
этиологии: ЖДА. р-талассемия, дефицит фермента Г-6-фд, ВТо_ |°®°в
анемии, обусловленные каким-либо основным заболеванием, серпов4"11'
клеточная анемия (СКА) и др. Снижение уровня гемоглобина (или"4"0
токрита) либо количества эритроцитов может отмечаться также в ел™*
гетерозиготного носительства наследственных аномалий крови (на**
мер, при отягощении сопутствующими заболеваниями или беременногт"
Поэтому на этапе первичного клинико-лабораторного освидетельствова
доноров отстраняются от донации лица с анемией при Р-талассемии в гет*
розиготном состоянии и серповидно-клеточной аномалией (гетерозиготи
форма HbAS) (рис. 8-1).
Алгоритм освидетельствования доноров в очагах эндемичного
распространения наследственных аномалий крови
|1 этап
2 этап
3 этап
Регистрация доноров
Первичное клинико-лабораторное
освидетельствование доноров
Скрининг-тесты - ОРЭ, качественное
определение Г-6-ФД, проба на
серповидность _
Г1НЬ и/или число RBC-*Анемия -* ОТВОД
+ t билирубинов —►Гемолиз-»ОТВОД
* t ретикулоцитов—►Гемолиз-» отвод
Изменение двух и более
показателей
'''♦Все пробы в норме -
ОТВОД
ДОНОРЫ
t ОРЭ или положительная проба на
серповидность, уровень Г-6-ФД в
норме
Дополнительное обследование
донора
этап!
"ОРЭ в норме, отрицательная
проба на серповидность,
дефицит Г-6-ФД
Количественное определение Г-6-ФД
Форез Hb, tl-minor,
tl-minima, HbS
і
ДОНОРЫ
Менее 25%
ОТВОД
Более 25%
1
ДОНОРЫ
Рис. 8-1. Алгоритм освидетельствования доноров в очагах эндемичного распространения наслед¬
ственных аномалий крови
• Одна из причин увеличения уровня билирубина — хронически протекающий
гемолиз, что может быть следствием дефицита фермента Г-6-ФД в форме
хронической несфероцитарной гемолитической анемии, р-талассемии, гемо¬
литического криза при серповидно-клеточной болезни.
• При наследственных гемолитических анемиях: дефиците Г-6-ФД.
р-талассемии характерно увеличение количества ретикулоцитов (компенса¬
торная реакция организма на деструкцию эритроцитов).
• Таким образом, на втором этапе от донаций отстраняются носители аномаль¬
ных генов, имеющих анемию или хронический гемолиз эритроцитов.
I 3-й этап. Лиц, прошедших второй этап отбора, обследуют на наличие основ¬
ных краевых патологий, а именно р-талассемии, СКА и дефицита Г-6-ФД-
С этой целью применяют следующие скрининг-тесты:
Ц определение осмотической резистентности эритроцитов (ОРЭ):
СЛУЖБА КРОВИ В ОЧАГАХ, ЭНДЕМИЧНЫХ ПО НАСЛЕДСТВЕННЫМ АНОМАЛИЯМ КРОВИ 273
Ф проба на серповидность (наложение жгута на основание пальца или проба
с метабисульфитом);
ф, качественное определение фермента Г-6-ФД.
, В регионах с высокой частотой наследственных аномалий крови (5-10%)
скрининговые тесты целесообразно выполнять уже на втором этапе освиде¬
тельствования доноров, т.е. на этапе определения гемоглобина, групповой
и резус-принадлежности. В регионах с более низкой частотой распростране¬
ния (менее 5%) проведение этих тестов возможно на этапе инфекционной
сертификации крови, т.е. после донации.
, результаты и интерпретация лабораторных скрининг-тестов;
Ф показатели всех тестов в норме — обследованные могут быть допущены
к донорству;
Ф увеличение ОРЭ или положительная проба на серповидность, активность
Г-6-ФД в норме — требуется дальнейшее обследование;
Ф ОРЭ в норме, отрицательная проба на серповидность, дефицит активности
Г-6-ФД — необходимо продолжение обследования;
Ф увеличение ОРЭ, уменьшение активности Г-6-ФД и положительная проба
на серповидность (наличие сочетания двух и более аномалий) - обследо¬
ванные отводятся от донорства.
В зависимости от результатов скрининг-тестов доноров подразделяют на не¬
сколько групп (табл. 8-1).
Таблица 8-1. Распределение доноров по группам в зависимости от результатов скрининг-тестов
Группы доноров
Результаты скрининг-теста
ОРЗ
качественная проба
на активность Г-6-ФД
проба на серповидность 1
1
Норма
Норма
Отрицательная
2
Увеличена
Норма
Положительная
3
Норма
Уменьшена
Отрицательная
4
Увеличена
Уменьшена
Положительная
1 4-й этап. Дополнительное обследование лиц из 2-й и 3-й групп.
❖ 2-я группа; необходимо проведение электрофореза гемоглобина.
Проведение дополнительного обследования в этой группе необязательно,
однако оно позволяет подтвердить или опровергнуть наличие наслед¬
ственной аномалии и установить величину малых фракций гемоглобина,
тем самым и форму гетерозиготной р-талассемии:
- увеличение фракций НЬА, и HbF указывает на гетерозиготное носитель¬
ство р-талассемии (напоминаем, что гомозиготы не доходят до этого
этапа) — малая (Р-Thalassemia minor), при которой возможно отсутствие
клинико-лабораторной картины, и минимальная (р-Thalassemia min¬
ima) — бессимптомная формы р-талассемии. Поскольку все другие
показатели (гемоглобин, билирубин и т.д.) находятся в пределах нормы,
обследованные могут быть допущены к донорству;
- выявленное электрофорезом носительство гемоглобина S в гетерозигот¬
ной форме также не считают противопоказанием для донорства. Однако
в этих случаях рекомендуется специальная маркировка полученных
компонентов крови.
^ 3-я группа: необходимо проведение количественного определения фермен¬
та Г-6-ФД в цельной крови. При активности энзима менее 25% нормальной
величины проводят относительный отвод от донорства (возможно донор¬
ство плазмы методом плазмафереза при более щадящем режиме центрифу¬
гирования). При уровне более 25% проводят допуск к донорству с обяза¬
тельным маркированием заготовленных компонентов крови.
274 СЛУЖБА КРОВИ
Предложенный алгоритм был апробирован в регионах эндемичного
странения наследственных аномалий крови (дефицита Г-6-Фд и В- за»
в городах Ленкорань, А стара, Ахсу, Шеки, Сальяны (Азербайджан) В *
ствин с предложенным алгоритмом освидетельствования доноров от kdo00^'
были отведены 55 человек, или 8,53% от первоначально заоегигтпш,
оыли огведены ээ человек, или о.дзто от первоначально зарегистриоо 11
которые могли бы быть допущены, исходя из общепринятого «Порядка м101,
ского освидетельствования доноров крови и ее компонентов». Ан¬
іяким образом, бессимптомное носительство аномальных генов р-тала
гемоглобина S и дефицита Г-6-ФД (без клинических проявлений и из^’
ний лабораторных показателей) не считают противопоказанием для доно ЄНе
В регионах, эндемичных по наследственным аномалиям крови, при обследов '
доноров крови необходимо придерживаться следующих принципов: НИи
• при регистрации донора обязательно указание места рождения:
• при осмотре будущего донора врачом-трансфузиологом повышенное вним
ние следует обращать на внешний вид пациента (деформация лицевого ске"
лета, наличие легкой иктеричности склер и видимых слизистых, деформация
суставов);
I необходим сбор подробного анамнеза донора;
• необходимо включение в освидетельствование донора и изучение семейного
анамнеза для выявления наследственных аномалий крови;
• необходим отвод от донорства лиц, имеющих сочетание генов двух и более
наследственных аномалий, даже без клинической картины и при допустимы*
общепринятых в донорстве показателях периферической крови, поскольку
использование компонентов крови от таких доноров может вызвать непред¬
сказуемые реакции и осложнения;
• необходима специальная маркировка карт донора с наследственными анома¬
лиями крови;
• необходима специальная маркировка крови и ее компонентов, полученных
от таких доноров, с целью более безопасного и эффективного их применения.
СКРИНИНГ-ТЕСТЫ НА ВЫЯВЛЕНИЕ НАСЛЕДСТВЕННЫХ АНОМАЛИИ КРОВИ
Проба на серповидность
Серповидные эритроциты в мазках встречаются редко, в связи с чем для дна-
І
гностики серповидно-клеточной анемии используется проба на серповидность -
самый простой и доступный метод из существующих. На основание пальца
обследуемого накладывается жгут. Через 5 мин из пальца берут кровь и исследуют
без окраски под микроскопом. Под влиянием искусственно вызванной местной
гипоксии у больных с СКА аномальный гемоглобин восстанавливается и обра¬
зует кристаллы, серпообразно изменяющие форму клеток. Результат может быть
ложноотрицательным при нагревании пробы или удлиненном отмывании эри¬
троцитов, при бактериальной контаминации, у больных с СКА при переливании
нормальных эритроцитов, у новорожденных.
При проведении пробы с метабисульфитом каплю крови помещают на пред¬
метное стекло, добавляя к ней каплю свежеприготовленного 2% раствора мета-
бисульфита (или гипосульфита) натрия. После перемешивания делают мазок,
покрывают его покровным стеклом. Для создания герметичности на края стекла
помещают вазелин или парафин. Затем инкубируют при 37 °С и микроскопирую*
через 20 мин, 1 ч и сутки от начала инкубации. У гомозигот серповидность опреде*
ляется уже в течение часа от момента инкубации, у гетерозигот — через cynj£
Применение этого метода позволяет выявлять феномен серповидности у 95—1007»
эритроцитов как при СКА, так и при гетерозиготном носительстве.
Определение осмотической резистентности эритроцитов (ОРЭ). характери¬
зующей способность эритроцитов принимать воду без лизиса клетки, прово-
СЛУЖБА КРОВИ В ОЧАГАХ, ЭНДЕМИЧНЫХ ПО НАСЛЕДСТВЕННЫМ АНОМАЛИЯМ КРОВИ 275
- по общепринятому методу в нашей модификации (Рагимов и соавт., 1986).
Гдунки микрокамер под вазелиновое масло раскапывают по 0,005 мл раствора
«35% NaCl и вводят по 0,001 мл 2% взвеси эритроцитов в физиологическом рас-
2% взвесь эритроцитов готовят добавлением к 0.002 мл клеток 0.098 мл
физиологического раствора. Результаты оценивают через 30 мин.
кячествеииое определение активности фермента Г-б-ФД в цельной крови
по методу Бернштейна (1962)
Метод основан на обесцвечивании 2,6-дихлорфенилиндофенолата при окисле¬
нии Ґ-6-Ф. протекающем с высвобождением ионов водорода. В качестве скрининг*
теста при проведении популяционных исследований целесообразно использова¬
ние его модификации — микрометода Рагимова и соавт.
В центрифужную пробирку с 1,0 мл дистиллированной воды добавляют 0.2 мл
крови. После гемолиза прибавляют 0,5 мл реакционной смеси, которая включает
• 0.5 частей 20 мм раствора Г-6-Ф;
І о,5 частей 2,5мМ раствора НАДФ;
• 2 части раствора ФМС;
• 8 частей краски - 0,5 мм 2,6-ДХФИФ на 0,1 М трис-HCl буфере. рН-8,0.
результат оценивают через 30 мин:
І полное восстановление первоначальной окраски (от синего до ярко-
красного) — нормальная активность фермента;
1 отсутствие обесцвечивания окраски — выраженный дефицит фермента;
I частичное обесцвечивание окраски через 30 мин — недостаточность Г-б-ФД.
РЕКОМЕНДАЦИИ ДЛЯ ДОНОРОВ С НАСЛЕДСТВЕННЫМИ АНОМАЛИЯМИ КРОВИ
Донорам — носителям гетерозиготной р-талассемии вместо профилактиче¬
ских курсов ферротерапии необходим прием фолиевой кислоты (0,005 г 1-2 раза
в день). Такая же профилактика предусмотрена для них и при стрессовых ситуа¬
циях - болезнях, беременностях. Кроме того, рекомендуется перед донациями
избегать тяжелых физических нагрузок.
Лицам с HbS перед донациями рекомендуется избегать тяжелых физических
нагрузок, подъемов в горы, подводного плавания, т.е. всего, что может вызвать
состояние гипоксии и как следствие инициировать процесс серпления эритроцитов.
Донорам - носителям дефицита Г-б-ФД за 2 нед до предполагаемой донации
рекомендуется воздерживаться от приема лекарственных препаратов, которые
могут спровоцировать деструкцию эритроцитов с пониженным уровнем фермента.
Кроме того, для профилактики донорам с дефицитом Г-б-ФД рекомендуют
принимать перед донацией рибофлавин (0,015 г 2-3 раза в сутки) или флавинат*
(2 мг внутримышечно) и ксилит* (5-10 г 3-4 раза в сутки). Эти средства повыша¬
ют уровень восстановленного глутатиона.
Лекарственные препараты, вызывающие гемолиз при недостаточности Г -6-ФД:
• сульфаниламиды [сульфаниламид, сульфапиридин*. сульфацетамид, суль-
фапиридазин*. сульфаметоксазол (бактрим*), сульфамеразан*. сульфадиме¬
зин*, норсульфазол*, стрептоцид);
• нитрофураны (фурацилин*. фуразолидон, фурадонин*. фурагин*, фуразо-
лин*. нитрофурантоин®);
• противомалярийные препараты [хинин*, памахинр, примахин, хиноцил*,
Шрохин (делагил*), плазмохин*, резохин*. хинакрин*];
• дапсон;
• хлорамфеникол;
• Доксорубицин;
• жаропонижающие и обезболивающие (ацетанилид*. амидопирин*, ацетилса¬
лициловая кислота, фенацетин®, ТераФлю*);
276 СЛУЖБА КРОВИ
• антибиотики (новобиоцин®, левомицетин*. амфотерицин В);
• противотуберкулезные препараты (фтивазид, ПАСК*, тубазид*, изониазиду
• пробенецид*;
• витамины С и К;
• 5-НОК*;
• налидиксовая кислота (невиграмон*);
• сульфоны [дисулон*’, тиазолсульфон (промизол*), диаминодифенилсуль-
фон*, сульфоксон*];
• метиленовый синий;
I тринитротолуол;
• толуидиновый синий;
• L-дофа.
Перед донациями необходимо воздерживаться от употребления в пищу опреде¬
ленных продуктов (голубика, черника, конские бобы — Vicia fava) и контакта с вер¬
беной гибридной, папоротником мужским, нафталином и пыльцой конских бобов.
Заготовка компонентов крови от доноров с наследственными
аномалиями крови
ЗАГОТОВКА ЭРИТРОЦИТНОЙ МАССЫ ОТ ДОНОРОВ С НАСЛЕДСТВЕННЫМИ
АНОМАЛИЯМИ КРОВИ
По литературным данным, уровень фермента Г-б-ФД свыше 25% и гетерози¬
готную форму р-талассемии не считают противопоказанием для привлечения
к донорству эритроцитной массы (Вайрамалибейли, 2006). Эритроцитная масса,
полученная от доноров с наследственными аномалиями крови, в функциональ¬
ном отношении (по уровню АТФ, 2,3-ДФГ) сравнима с эритроцитной массой,
полученной от доноров без наследственных аномалий крови. Также показа¬
но, что консервирующий раствор (SAGM или CPDA) практически не влияет
на сроки хранения эритроцитной массы от доноров с наследственными анома¬
лиями крови.
Однако существуют особенности, которые должна учитывать Служба крови
в регионах, эндемичных по данным наследственным аномалиям. Так, заготовку
эритроцитной массы у лиц с недостаточной активностью фермента Г-б-ФД необ¬
ходимо осуществлять после определения уровня фермента в эритроцитах и лей¬
коцитах.
Существование независимо друг от друга эритроцитного и лейкоцитного дефи¬
цитов фермента Г-б-ФД и выделение в соответствии с этим четырех фенотипов -
Эр+Лейк+, Эр+Лейк-, Эр-Лейк-, Эр-Лейк+ — требуют подробного рассмотрения
возможности использования эритроцитной массы от доноров с наследственным
дефицитом фермента Г-б-ФД.
Фенотип Эр+Лейк+ — нормальная активность фермента в клетках эритроцит¬
ного и лейкоцитного рядов. Это фенотип доноров без наследственной аномалии.
Фенотип Эр+Лейк- — уровень лейкоцитного фермента, по литературным
данным (Рагимов, 1987), особенно не влияет на суммарную Г-6-ФД-активность
цельной крови, составляя всего до 15% ее. Поэтому доноры с таким фенотипом
также могут быть отнесены к донорам эритроцитной массы без наследственной
аномалии.
Фенотип Эр-Лейк- — фенотип доноров с наследственной аномалией крови.
При этом фенотипе трансфузии эритроцитной массы должны осуществляться
с учетом величины эритроцитной Г-б-ФД.
Фенотип Эр-Лейк+ представляет наибольший интерес для трансфузиологов-
Если при фенотипе Эр-Лейк- лейкоцитный дефицит не может быть причиной
СЛУЖБА КРОВИ В ОЧАГАХ, ЭНДЕМИЧНЫХ ПО НАСЛЕДСТВЕННЫМ АНОМАЛИЯМ КРОВИ 277
-либо осложнений при трансфузиях эритроцитной массы, то нормальная
^питная активность фермента при дефиците Г-б-ФД в эритроцитах спо-
tff0 прИ определенных условиях запустить механизм их гемолиза (например,
инфекции на фоне «фагоцитарного взрыва»). Считают, что свойство лейкоци-
фенотипом Эр-Лейк+ разрушать эритроциты могло оказывать дополни-
100 се защитное действие против малярии. Широкое распространение дефицита
в странах «малярийного пояса» связано с тем, что гемолиз эритроцитов,
паженных малярийным плазмодием, способствует устранению паразита из орга-
№&• лишая его внутриэритроцитного этапа развития. Очевидно, гемолиз зри- ЩЯЩ
!!шитов при фенотипе Эр-Лейк+ происходит на фоне провоцирующего актив-
§| фаГоцитоз эффекта «ножниц», который выражается в высокой активности
їоиента в лейкоцитах и минимальной активности фермента в эритроцитах,
дох лиц рекомендуется отстранять от донорства.
Сроки хранения эритроцитной массы зависят от степени выраженности эритро-
щпного и лейкоцитного дефицита Г-б-ФД. Так, при активности Г-б-ФД в цель¬
ной крови в пределах 25-50% срок пригодности эритроцитной массы составляет
1б41±ЗД сут, выше 50% — 25,20±4,2 сут (в контрольной группе — 31,4±5,1).
В связи с этим у доноров с дефицитом Г-б-ФД при заготовке цельной крови
и эритроцитной массы рекомендуют применение лейкоцитных фильтров в ран¬
ние сроки (через 25-35 мин после взятия). Это позволяет не определять уровень
фермента в клетках лейкоцитного ряда, привлекать к донорству лиц с фенотипом
Эр-Лейк+, избегать негативного влияния уровня лейкоцитного фермента на хра¬
нение крови и компонента, делает возможным заготовку и хранение эритроцитной
массы независимо от уровня фермента в лейкоцитах и способствует увеличению
сроков хранения компонентов крови. Так, после применения лейкоцитных филь¬
тров у доноров с уровнем фермента выше 50% срок хранения эритроцитной массы
возрос с 25,20+4,2 до 29,5±3,1 сут.
Для лиц с гетерозиготной формой р-талассемии характерно повышение содер¬
жания НЬА2 до 4-8% (норма — до 3,5%) и увеличение HbF до 2,5-5% (норма -
до 2,0%). В физиологических условиях сродство к кислороду у HbF больше,
чем у НЬА. Это обусловлено более слабыми связями HbF с 2,3-ДФГ по сравнению
с НЬА (основная фракция гемоглобина взрослых). Это свойство фетального гемо¬
глобина позволяет эффективно снабжать кислородом ткани плода (Страйер, 1984).
Малая фракция НЬА2 имеется только у взрослых и повышается при талассемии.
Сроки хранения ЭМ при гетерозиготной р-талассемии несколько снижены
по сравнению с контрольной группой (30,6±2,51 и 31,4+5,1 соответственно),
при этом уровень HbF и НЬА2 не оказывает влияния на длительность хранения
компонента.
Следующий момент, на который необходимо обратить внимание, — изменение
режима кроводач донорам-носителям наследственных аномалий крови (дефици¬
та Г-б-ФД и гетерозиготной р-талассемии) с рекомендованного «Инструкцией
по освидетельствованию доноров» на щадящий — не более 4 донаций в год у муж¬
нин и не более 3 донаций в год у женщин. Это позволяет поддерживать показатели
периферической крови на исходном уровне и способствует сохранению здоровья
Донорских кадров. Кроме того, щадящий режим у доноров с дефицитом фермента
Г-6-фд продлевает сроки хранения компонента крови (эритроцитной массы)
понижает величину гемолиза, выявляемую в контейнерах с эритроцитной массы
при хранении.
ЗАГОТОВКА СЗП ОТ ДОНОРОВ С НАСЛЕДСТВЕННЫМИ АНОМАЛИЯМИ КРОВИ
ГГица с гетерозиготной р-талассемией и дефицитом Г-б-ФД могут быть при-
Ш® к донорскому плазмаферезу. Плазма таких доноров имеет параметры.
^чающие требованиям Совета Европы (общий белок, содержание эритроцитов,
тадбрцитов, лейкоцитов, фактора VIII).
ПМвАв
271 СЛУЖБА КРОВИ
В литературе встречаются описания гемолитических реакций у доноров G д.,
цитом Г-б-ФД после донаций. которые в основном обусловлены не зависяіщГ
от проводимой процедуры внешними факторами (прием лекарственных п"
паратов. воздействие инфекции) (Байрамадибейли, 2006). В то же время выг*
кая частота возникновения деструкции эритроцитов при проведении процедур
характерна при уровне фермента менее 25%, что является относительным про^*
вопоказанием к донорскому плазмаферезу. Лиц, имеющих сочетание р-талассем'
и дефицита Г-б-ФД. необходимо отстранять от донорского плазмафереза. Частт!
и выраженность постпроцедурных реакций у этой категории обследованных высо*
кая и не зависит от уровня HbF и степени недостаточности активности Г-6-фд
Как и донорам кроводач. при регулярной сдаче плазмы донорам с гетеррзи
готной р-талассемией и дефицитом Г-б-ФД необходимы щадящие режимы дона-
ций - 1 раз в месяц или 2 раза в месяц с перерывом 1 мес (не более 12 донаций
в год).
Кроме того, донорам с наследственным дефицитом фермента Г-б-ФД реко.
мендуется профилактический прием лекарственных препаратов: рибофлавин -
0,015 г 2-3 раза в сутки (или флавин*’ 2 мг 3 раза в сутки внутримышечно), кси¬
лит*’ - 5-10 г 3-4 раза в сутки. Цель такого профилактического курса заключается
в том, чтобы избежать или минимизировать гемолитические реакции при необхо¬
димом приеме лекарств-«оксидантов». Исследование влияния профилактического
приема лекарственных препаратов, повышающих уровень восстановленного глу-
татиона. на частоту интра- и постпроцедурных гемолитических реакций показало
значительное уменьшение количества интра- и постпроцедурных осложнений
при проведении донорского плазмафереза.
Щадящий режим донорского плазмафереза у лиц с дефицитом Г-б-ФД способ¬
ствовал сохранению показателей периферической крови практически на исходном
уровне. При общепринятом режиме изменения показателей были более значимы¬
ми по сравнению с исходными значениями. В то же время на количество интра-
процедурных реакций - деструкцию эритроцитов при центрифугировании -
щадящий режим не оказывал почти никакого влияния.
Результаты профилактического приема лекарственных препаратов (ксилита*’,
флавина*') и изменения режима донаций показали, что для доноров с наслед¬
ственным дефицитом фермента Г-б-ФД оба направления оправданы: профилакти¬
ческий прием препаратов способствует значительному снижению интра- и пост¬
процедурных гемолитических реакций за счет повышения стойкости эритроцитов
к деструкции, а щадящий режим донаций сохраняет показатели периферической
крови на исходном уровне.
Анкета донора в очагах распространения наследственных аномалий крови пред¬
ставлена на диске J&L
Глава 9
Основные полимерные изделия
для нужд Службы крови
Общие требования
к системам полимерных контейнеров
Полимерный контейнер для сбора донорской крови, ее пере¬
работки и хранения компонентов должен иметь высокие эластич¬
ность, износостойкость и надежность швов. При центрифугировании
и замораживании в контейнере не должно возникать нарушений
целостности, потери крови или вымывания веществ в кровь. Качество
контейнеров для крови и содержащихся в них растворов должно
гарантироваться на срок не менее 2-2,5 года. В контейнере должен
быть выходной порт со съемной крышкой для подключения к систе¬
мам переливания крови или к другим системам. Многие фирмы
выпускают системы контейнеров для забора крови с защищенной
атравматичной иглой, имеющей на внутренней поверхности неболь¬
шое количество антикоагулянта. Такая игла обеспечивает макси¬
мальный уровень кровотока и минимизирует неприятные ощущения
у донора. Два вида антикоагулянта (CPD, CPDA-1) и дополнитель¬
ный ресуспендирующий раствор SAGM за счет улучшения условий
жизнедеятельности клеток позволяют увеличить сроки хранения
компонентов крови (для эритроцитов — до 42 дней). Оптимизация
количества и качества консервирующих растворов предполагает
получение компонентов крови высокого качества при использова¬
нии минимального объема антикоагулянта. Кроме того, вследствие
относительно низкого содержания глюкозы в антикоагулянте умень¬
шается метаболическая нагрузка на пациента. Для забора и перера¬
ботки донорской крови на компоненты разработаны различные виды
контейнеров: одинарные, сдвоенные, строенные и другие контейнеры
(рис. 9-1) отечественного [полимерные контейнеры «Гемакон-500»,
«Гемакон-500/300», «Гемакон-500/300/300» (ТУ-64-2-298-80,
ТУ-64-2-299-80)] или зарубежного производства. Такие контейнеры
позволяют, не нарушая стерильности, разделять цельную кровь сразу
на несколько компонентов.
ПОРЯДОК ЗАБОРА КРОВИ В ПОЛИМЕРНЫЕ КОНТЕЙНЕРЫ
(на примере полимерных контейнеров «Компопласт»)
Внедрение одноразовых пластиковых контейнеров в повседнев¬
ную практику работы Службы крови изменило всю систему органи¬
зации сбора крови.
СЛУЖБА КРОВИ
Одинарные контейнеры для сбора_к£2—
РазработаньГ ^
сбора и хрзне?
ильной
ВОЗМОЖНО их I, I
менение для j*|
ления цельной КроТ
на компоненты nJ
использовании леЛ
носных пластикові»
контейнеров
Разработаны ^
разделения цельной!
крови на две части I
Могут использо-!
ваться для отделе¬
ния эритроцитов!
от плазмы. Их при¬
меняют также для!
получения ОТМЫТЫХ]
эритроцитов
Рис. 9-1. Полимерные контейнеры для сбора и разделения крови на компоненты
Современные пластиковые контейнеры для крови — закрытые системы 0
сбора крови и последующего ее разделения на компоненты. Они также пригодны
для хранения цельной крови и компонентов, получаемых из нее. Характеристик}
полимерных контейнеров см. далее.
Порядок заготовки крови в полимерные контейнеры следующий.
Операционная медицинская сестра перед вскрытием пакетов индивидуальной
упаковки проверяет срок годности изделия, осуществляет визуальный контрол*
целостности первичной и вторичной упаковок путем сдавливания руками Яа'
ОСНОВНЫЕ ПОЛИМЕРНЫЕ ИЗДЕЛИЯ ДЛЯ НУЖД СЛУЖБЫ КРОВИ 281
«о#очных пакетов. При опадении пакетов, т.е. выходе из них воздуха, упаковку
считают негерметичной и не используют. После вскрытия упаковок необходимо
убедиться в отсутствии мутности консерванта, взвесей, плесени; нажатием на кон¬
тейнер с консервирующим раствором проверяют его герметичность, обращая осо¬
бое внимание на герметичность мембран штуцеров. При наличии консервирующе¬
го раствора над мембраной штуцера изделие бракуют.
При заготовке крови в сдвоенные контейнеры медицинская сестра переводит
весь консервант в контейнер 500 мл, накладывает зажим на соединительную труб¬
ку между контейнерами и подсоединяет флаконы-спутники.
Если не используют металлические клипсы и ручной зажим (или запаивание),
на донорской трубке на расстоянии около 15-20 см от контейнера делают петлю
и накладывают зажим вблизи иглы.
Медицинская сестра переносит контейнер на весы или в аппарат для дозирован¬
ного взятия и перемешивания крови с консервирующим раствором (рис. 9-2).
Помощник эксфузиониста накладывает жгут.
Нк9
■** '■ i1 '"*|Гшш
j&ygK' ’
■1 L.
ПГ ” i
■Я •
1 • Ци
■■■ • 9?
■Г’ • У
Рис. 9-2. Весы для компонентов крови с функцией автоматического перемешивания («покачивания»)
Эксфузионист выбирает хорошо видимые вены на локтевом сгибе, ватным
тампоном, смоченным антисептическим раствором, дважды с интервалом 1 мин
тщательно обрабатывает место венепункции. Избранную область после обработки
накрывают сухой стерильной салфеткой. После того как кожа подготовлена, к ней
нельзя прикасаться вновь; не следует повторно пальпировать вену в избранной
для венепункции области. Затем эксфузионист вращательным движением снимает
защитный колпачок с иглы и проводит венепункцию, снимает зажим с трубки.
При проколе кожи поверх кончика иглы пальцем в перчатке можно выполнять
пальпацию, не касаясь иглы.
Донор медленно сжимает и разжимает кулак каждые 10-12 с во время сбора
крови. Рекомендуется снабдить донора специальным кистевым эспандером.
Поступающую в контейнер кровь необходимо тщательно перемешивать с кон¬
сервирующим раствором вручную (приблизительно каждые 45 с) или автомати¬
чески с помощью специального аппарата. При повторной венепункции выбирают
для прокола другое место и используют другой полимерный контейнер. 1 мл
крови весит не менее 1,053 г, что определяется минимально допустимой удель¬
ной массой для доноров. Для удобства используют величину 1,06 г/мл; доза,
содержащая 405-495 мл крови, должна весить 429-525 г плюс масса контейнера
с антикоагулянтом.
212 СЛУЖБА КРОВИ
Дозировку ВЗЯТИЯ крови определяют либо С ПОМОЩЬЮ специальных устной,
со встроенными весами, автоматически прекращающих гемоэксфузию, либо**1
ально по времени гемоэксфузии (по наполнению контейнера). Все образцы ва
крови, вызывающие сомнение в отношении количества взятой крови, дол»^
быть проверены путем взвешивания. Если объем крови (без учета консервам!?
составляет 300-379 мл в контейнерах «Гемакон» отечественного произволе^
или 300-404 мл в контейнерах с растворами ACD, CPD, CPDA, то такие образі
помечают: «Неполная доза.... мл».
После взятия дозы крови (по массе или объему) эксфузионист пережимає
зажимом трубку (ближе к игле), накладывает металлическую клипсу или затя
гивает приготовленную петлю в тугой узел на донорской трубке и отсекает но*,
ницами трубку (вплотную к узлу). Снимает зажим с трубки, наполняет первый
флакон-спутник, после чего жгутист снимает жгут, а эксфузионист извлекает
иглу из вены и заполняет второй флакон-спутник кровью, оставшейся в системе
На место венепункции накладывает стерильный марлевый тампон, после чего
немедленно накладывает второй узел на трубке на расстоянии 7-10 см от кон¬
тейнера; оставшуюся в нижнем отрезке трубки кровь выжимает в контейнер
для предотвращения свертывания. Третий узел накладывает между двумя первы¬
ми. Альтернатива завязыванию узлом — металлические клипсы или запаивание.
Применение токов высокой частоты для запаивания пластиковых трубок обе¬
спечивает;
❖ отсутствие нагрева и нарушения состава крови;
❖ стерильность и герметичность шва;
❖ исключение контакта персонала с кровью.
Современные устройства для запаивания трубок полимерных гемоконтейне¬
ров могут комплектоваться как встроенным, так и выносным приспособлением
для запайки трубок и встроенным зарядным устройством. Желательно иметь воз¬
можность установки времени запаивания в зависимости от диаметра и материала
трубки. Желательно также наличие специальной насечки на шве для разделения
трубки после герметизации без разрезания (рис. 9-3).
Жгутист накладывает на локтевой сгиб донора фиксирующую повязку, в при¬
сутствии донора на полимерные контейнеры и флаконы-спутники наклеивает
цветные марки, соответствующие группе крови.
Оптимальное время эксфузии стандартной дозы крови составляет 4-10 мин,
однако допустимо увеличение времени до 15 мин (без потери качества заготавли¬
ваемых компонентов).
Предупреждение микробной контаминации взятой крови достигается на основе:
• тщательного отбора и проверки гемоконтейнеров на предмет отсутствия
признаков их повреждения истечением раствора, отсутствия примесей,
изменения цвета в нем или других признаков, которые могли бы указывать
на исходную инфицированность содержимого изделия;
• аккуратной, с соблюдением установленных правил, обработки кожи локте¬
вого сгиба, выполнения венепункции, гемоэксфузии и герметизации трубок
контейнера (оптимальное решение — запаивание токами высокой частоты);
I повторного осмотра контейнера, заполненного кровью, для проверки его
герметичности;
• применения современных систем полимерных контейнеров для сбора крови,
имеющих сателлитные мешочки для предонационных образцов крови объе¬
мом до 50 мл. Кровь используют для лабораторных целей.
Такая организация заготовки донорской крови позволяет персонифицировать
ответственность каждого члена выездной бригады (отделения), использовать
стандартные операции на каждом этапе работы, что обеспечивает высокое каче¬
ство консервированной крови.
скованные полимерные контейнеры с донорской кровью и прикрепленными
ОСНОВНЫЕ ПОЛИМЕРНЫЕ ИЗДЕЛИЯ ДЛЯ НУЖД СЛУЖЬЫ КРОВИ 283
■
винтов, хранят при температуре 22±2 °С. Тромбоциты должны быть выделены
ОТЕЧЕСТВЕННЫЕ ПОЛИМЕРНЫЕ УСТРОЙСТВА ДЛЯ УДАЛЕНИЯ ЛЕЙКОЦИТОВ
Устройство для удаления лейкоцитов — прикроватный «Лейкосеп-Пк* (ЗАО
«НПП Интероко») предназначено для удаления лейкоцитов, макро-и микро-
сгустков из эритроцитных сред (крови или эритроцитной массы) с показателем
гематокрита не более 60% и плазмы в процессе их переливания из полимерных
контейнеров непосредственно у кровати больного (рис. 9-4). Устройство пред¬
назначено для работы в условиях клиник и больниц. Используется аналогично
системе ПК-23-01 с предварительным заполнением фильтра (3) физиологиче¬
ским раствором (1) с вытеснением воздуха, заполнением воздушной ловушки (4)
и последующей венепункцией и инфузией эритроцитсодержащих сред (2).
Устройство «Лейкосеп» для удаления лейкоцитов из компонентов консервиро¬
ванной крови (ЗАО «НПП Интероко») предназначено для удаления лейкоцитов
из компонентов консервированной крови (эритроцитной массы с показателем
гематокрита не более 70% и плазмы) для профилактики иммунологических
реакций, осложнений и предупреждения инфекционных заболеваний (рис. 9-5).
Удаление лейкоцитов препятствует образованию микросгустков и улучшает усло¬
вия хранения эритроцитных сред. Устройство применяют на СПК и ОПК лечеб¬
ных учреждений. Срок хранения плазмы и эритроцитной массы до фильтрации
не должен превышать 48 ч. Фильтрацию эритроцитной массы необходимо прово¬
дить после фильтрации плазмы.
Лейкофильтрующая система «Лейкосеп» отличается от предыдущих систем тем.
что для заполнения лейкофильтра и вытеснения воздуха используется плазма.
Для лейкофильтрации используют разделенную на компоненты (обычно эритро-
читную массу и плазму) донорскую кровь. К специальному разъему (1). имеющему
ящитную мембрану (2), сохраняющую стерильность, подсоединяется контей-
йеР с плазмой. При закрытых остальных зажимах открываются клапаны (5 и 6)
н после заполнения лейкофильтра (4) плазму перемещают в контейнер (7). Затем
Рис. 9-3. Ручной запаиватель магистралей полимерных гемоконтейнеров
Рис. 9-4. Устройство прикро- Рис. 9-5. Устройство «Лейко- Рис. 9-6. Устройство для уда-
ватное «Лейкосел-Пк» для сеп» для удаления лейкоцитов ления лейкоцитов из плазмы
удаления лейкоцитов из компонентов консервиро- «Лейкосеп-Пл»
ванной крови
эритроцитарную массу перемещают в контейнер, освобожденный от плазмы (3)-
и. закрыв все клапаны, открывают зажимы (5 и 8). Эритроцитная масса при этом
перемещается в контейнер (9). Таким образом, на выходе получают два контейне¬
ра: с отфильтрованной плазмой (7) и эритроцитной массой (9). Используя соот¬
ветствующие клапаны, удаляют из контейнеров воздух.
ОСНОВНЫЕ ПОЛИМЕРНЫЕ ИЗДЕЛИЯ ДЛЯ НУЖД СЛУЖ&Ы КРОВИ 295
пойство для удаления лейкоцитов из плазмы «Лейкосеп-Пл* (ЗАО «НПП
tfJreooKO*) предназначено для удаления лейкоцитов, получения высококаче-
^^ной плазмы и производства препаратов крови (рис. 9-6). Обедненная ленко-
плазма обеспечивает предупреждение у реципиента иммуногематологиче-
^йХ реакций и осложнений, снижает опасность переноса вирусных инфекций
1 в отличие от устройства «Лейкосеп*, в данной системе фильтруется однокомпо¬
нентная среда - плазма. После подсоединения контейнера с плазмой (2) к разъему
(1) открывают клапаны (4 и 5), заполняют лейкофильтр (3) плазмой и фильтруют
плазму, перемещая ее в контейнер (6). Клапаны (7 и 8) используют для удаления
воздуха. ц
Устройство применяют на СПК и ОПК лечебных учреждений. Срок хранения
плазмы до фильтрации не должен превышать 48 ч.
Глава 10
Методы карантинизации
и инактивации патогенов
в компонентах крови
ПРОБЛЕМЫ ИНФЕКЦИОННОЙ БЕЗОПАСНОСТИ КОМПОНЕНТОВ
ДОНОРСКОЙ КРОВИ
От качества заготовляемых компонентов крови в значитель *
степени зависит успешность и эффективность гемотрансфуч °"И
Безопасность и качество компонентов аллогенной крови отел**
ляется в основном лабораторным тестированием крови на гемо
трансмиссивные инфекции. Начиная с середины прошлого века
перманентно идут научные исследования, направленные на обеспе¬
чение иммунологической безопасности гемотрансфузий, главным
образом — инфекционной безопасности.
Длительный период времени, с начала 80-х до конца 90-х годов
прошлого века, существенного прогресса в профилактике инфек¬
ционных осложнений трансфузий достигали совершенствованием
диагностических тестов. Однако работа в этом направлении стано¬
вится все менее эффективной и более затратной.
В настоящее время удалось достичь значительных успехов в
снижении остаточного риска инфицирования, в основном за счет
совершенствования детекции социально значимых инфекций
(рис. 10-1). Вместе с тем для иммунокомпрометированных боль-
Рис. 10-1. Остаточный риск инфицирования патогенами при трансфузиях ко
понентов крови (динамика за период с 1984 по 2000 г.)
МЕТОДЫ КАРАНТИНИЗАЦИИ И ИНАКТИВАЦИИ ПАТОГЕНОВ В КОМПОНЕНТАХ КРОВИ 287
\
менее значимы, например, вирусы группы герпеса, которые не подвергают-
j|ggjj| скринингу. Подсчитано, что внедрение нового теста стоит около
50 И*
da*®"'";.точек зрения)? Есть ли предел совершенствованию скрининга донорской
с,тШа долларов в год. Каково оптимальное количество тестов для обеспечения
50 Ильной безопасности донорской крови (как с практической, так и с эконо-
|іИ'іЄС? Насколько реальны перспективы преодоления периода «окна» для пере-
вирусов?
в экономически развитых странах, где трансфузионное пособие находится под
ггоянным контролем трансфузионных комитетов и хорошо поставлены аудит и
і „рация нежелательных реакций, ассоциированных с гемотрансфузиями, риск
figi на несколько порядков ниже, чем в странах, не имеющих столь развитой
эджбы крови (табл. 10-1). Как обстоят дела в России, к сожалению, доподлинно
неизвестно.
110-1. Частота трансмиссивных инфекций
Возбудители
Частота
трансмиссивных инфекций
вирус гепатита В
вирус гепатита С
бактерии
в странах с высоким развитием системы
здравоохранения
1 468 000-1:4 700 000
31 000-1:205 000
1 935 000-1:3100 000
2 000-1.8 000 (концентрат тромбоцитов)
28 000—1:143 000 (эритроциты)
в странах с низким развитием
системы здравоохранения
1:50-1:2 578
1:74-1:1 000
1:2 578
Нет данных
1:4 000 000
1:3
Паразиты: малярия
Несмотря на высокую чувствительность ИФА-диагностикумов (золотой стан¬
дарт при исследовании донорской крови на вирусы гепатита В, С и ВИЧ), ряд
вопросов, связанных с инфекционной контаминацией, остаются нерешенными.
Так, например, при условии, что маркер скрининговой диагностики HBV — HBSAg
выявляют у 0,86% доноров, в HBSAg-отрицательных пробах другие маркеры
HBV обнаруживают у 19,6% доноров, а ДНК HBV — у 3,1% доноров. Среди Не¬
отрицательных образцов плазмы при повторном тестировании выявлено 2,41%
HCV-положительных, а РНК HCV выявлена в 1,2% образцов.
Бактериальная контаминация компонентов крови — не менее важная проблема,
чем остаточный риск инфицирования вирусами, несмотря на то, что не каждый
случай детекции микроорганизма в образце компонента обязательно приводит к
сепсису. Наиболее вероятно это у иммунокомпрометированных (онкогематологи-
ческих) больных. Следует отдельно отметить, что идентифицировать эти случаи
кактрансфузионный сепсис очень трудно. Это связано не столько с недостаточным
клинико-лабораторным обеспечением, сколько со слабым развитием систем учета
и объективной отчетности в клиниках большинства стран мира. Большая часть
указанных осложнений протекает незамеченными либо списывается на инфекци¬
онные осложнения цитостатического агранулоцитоза.
За последние десятилетия серьезной медико-социальной проблемой стали
текулез и сифилис. Уровень заболеваемости сифилисом возрос за прошедшие
10 лет -
примерно в 67 раз, причем для «современного» сифилиса характерны пре-
ладание скрытых форм, атипичное течение и резистентность к проводимой
/*®ни. 20-30% доноров — носителей вируса гепатита В не выявляют на ранних
заболевания с применением теста на австралийский антиген,
бол ССаЛеД0Вания- пРоведанные Обществом Красного Креста в США, выявили
nnD, кроводач, которые были проведены в период сероконверсии инфици-
ЩШ|| доноров.
ГЛАВА 10
288 СЛУЖБА КРОВИ
Таким образом, дефицит донорского ресурса и, как следствие, недостаточна
селекция доноров в совокупности с высокой инфицированностью населения делаЯ
ют проблематичным адекватное обеспечение больных безопасными трансфузИон
ными средами. При массивной трансфузионной терапии происходит неизбежное
инфицирование реципиентов, нивелируются результаты высокотехнологичных
методов лечения, увеличивается и без того высокий показатель распространен¬
ности социально значимых вирусных инфекций в популяции.
Доступность компонентов аллогенной крови привела к росту трансфузион-
ной активности, что потребовало значительно усилить все службы, связанные
с обеспечением безопасности гемотрансфузий. Одновременно с доступностью
компонентов аллогенной крови и увеличением числа гемотрансфузий не
только повышаются риски гемотрансфузионных реакций, но и, как это было
показано в ряде исследований, чрезмерно большое количество трансфузий не
коррелирует с показателями выживаемости пациентов и даже ухудшает про¬
гноз и качество жизни из-за развития посттрансфузионных реакций. Многие
авторы сходятся во мнении, что дальнейший рост трансфузионной нагрузки
на отдельного реципиента уже нецелесообразен. Необходимо особо отметить,
что и применение отдельных компонентов крови в разных странах значитель¬
но различается. В большинстве экономически развитых стран соотношение
переливания свежезамороженной плазмы (СЗП) и эритроцитов составляет от
3,2 (США) до 7,4 (Франция), тогда как в России это соотношение равно 0,7
(данные ежегодного отчета трансфузиологической службы, Е.А. Селиванов -
публикуется в журнале «Трансфузиология»). (Поскольку ситуации по заготов¬
ке и гемотрансфузиям отдельных компонентов крови в разных странах могут
значительно разниться, то и транспонировать результаты анализа посттранс¬
фузионных реакций в одной стране на другую необходимо осторожно, с учетом
этих особенностей).
Использование СЗП практически во всех странах год от года увеличивается: так,
например, в Великобритании оно возросло на 20-25% за несколько последних лет.
При этом в ряде исследований особо отмечается необоснованность трансфузий
СЗП, которые достигают 15-35%. По мнению некоторых экспертов, оптимальной
величиной соотношения СЗП/эритроциты является 1,0.
Рост трансфузионной активности наглядно можно продемонстрировать и на
примере использования в клинической практике трансфузий тромбоцитов.
В США, Канаде и странах Западной Европы значительно больше, чем в нашей
стране, переливают тромбоцитный концентрат (ТК). Так, если в 1998 г. в России
заготовлялось всего 138 ООО единиц ТК в год, то в 2001 г, — 156 000, в 2002 г. -
182 000, а в 2007 г. было заготовлено уже 392 164 единиц ТК. Таким образом, за
последние 10 лет потребность в трансфузиях тромбоцитного концентрата в России
увеличилась минимум на 200%. В сравнении с другими странами трансфузионная
активность в России все еще является очень низкой. В США в 1997 г. было исполь¬
зовано 9 037 000 доз ТК, в 2006 г. было перелито около 11 000 000 доз ТК (что
ориентировочно соответствует 1 900 000 трансфузий терапевтических доз ТК).
По данным Трансфузионной службы Национального института биологических
стандартов и контроля Соединенного Королевства за 2001-2002 гг., в госпиталях
Англии выполнено 215 050 трансфузий терапевтических доз ТК, в 2004 г. количе¬
ство трансфузий увеличилось до 220 000 терапевтических доз (что ориентировоч¬
но составляет 1 300 000 доз ТК в год).
В настоящее время в европейских странах трансфузионная активность (количе¬
ство трансфузий тромбоцитного концентрата на 1000 человек в год) в 10-15 раз
выше, чем в России (рис. 10-2). В США этот показатель в 2006 г. составил 30 транс¬
фузий на 1000 жителей, что примерно в 70 раз выше, чем в России.
МЕТОДЫ КАРАНТИНИЗАЦИИ И ИНАКТИВАЦИИ ПАТОГЕНОВ В КОМПОНЕНТАХ КРОВИ 289
Рю.10-2. Заготовка тромбоцитного концентрата в Европе и России
На основании имеющихся данных нетрудно прогнозировать ежегодный 25-50%
прирост потребления трансфузионных сред в нашей стране и увеличивающийся
медом «снежный ком» проблем, связанных с обеспечением безопасности транс¬
фузий. Прежде всего это связано с тем, что любая гемотрансфузия несет риск пере¬
дачи трансмиссивных инфекций (табл. 10-2).
Шца10-2. Вирусные агенты, передаваемые человеку при трансфузии компонентов крови
Размер
Передается через
Вирусный патоген
Семейство
Геном
Оболочка
нм
клеточные
компоненты
плазму
Вирус иммунодефицита человека
Retroviridae
ss-RNA
+
80-100
Да
Да
Вирус Т-клеточной лейкемии
Retroviridae
ss-RNA
+
80-100
Да
Нет
«века
Вирус гепатита В
Hepadnaviridae
ds-DNA
+
40-48
Да
Да
Вирус гепатита С
Togaviridae
ss-RNA
+
40-50
Да
Да
Вирус лихорадки Западного Нила
Flavivirus
ss-RNA
+
40-60
Да
Да
Вирус гепатита А
Picornaviridae
ss-RNA
-
27-32
Да
Да
Парвовирус 819
Parvoviridae
SS-DNA
-
18-26
Да
Да
Вирус гепатита G
Flavivirus
SS-RNA
+
40-60
Да
Да
Вирус гепатита Е
Calci vivirus
ss-RNA
-
35-39
?
?
Вирус гепатита 0
Delta virus
ss-RNA
+
36
Да
Да
її
Circo virus
ss-DNA
+
30-50
Да
Да
Вирус Эпштейна-Барр
Herpesvirus
ds-DNA
+
120-220
Да
Да
Дитомегаловирус
Herpesvirus
ds-DNA
+
180-200
Да
Нет
Герпес-вирус 8
Herpesvirus
ds-DNA
+
120-200
Да
Нет
Анализ ситуации по заготовке аллогенной крови и ее компонентов и динамика
гемотрансфузий компонентов крови в нашей стране, мероприятия, осуществлен*
ньіе а последние годы по централизованному переоснащение СПК, Центров крови
"отделений современным оборудованием, новые законодательные положения о
чужбе крови и трансфузионной медицине позволяют уверенно говорить о
"Дательном развитии отечественной трансфузиологии и приближении в ско-
I вРемени к показателям западных стран. Уже сейчас проблемы, которые бес-
Ко"т "оллег-трансфузиологов в США и странах Западной Европы беспокоят и
ГЛАВА 10
290 СЛУЖБА КРОВИ
отечественных специалистов. Важнейшей из них является обеспечение инфе
онной безопасности гемотрансфузий. На сегодняшний день стало очевидне
исследование крови доноров на декретированные инфекции (сифилис, rena*!?
В и С. ВИЧ) даже самыми современными тест-системами ИФА-анализа им
дами ПЦР не обеспечивают полную безопасность. Это связано с двумя основи
ми причинами: невозможностью исключить серонегативное «окно* извести
(исследуемых) инфекций И ВОЗМОЖНОСТЬЮ присутствия у донора инфекционн
агентов, не входящих в число обязательных для исследования (или не извесг*
ных науке). Решение видится в разработке и внедрении способов, позволяют
полностью исключить эти риски, — методов карантинизации и инактиващп,
компонентов крови.
МЕТОД КАРАНТИНИЗАЦИИ КОМПОНЕНТОВ КРОВИ
Как уже было сказано, технические возможности лабораторного тестирования
крови не дают полной гарантии ее вирусобезопасности, особенно в серонегатив-
ном периоде (фазе «окна*) вирусоносительства. продолжительность которою
варьирует для различных вирусов (табл. 10-3).
Таблица 10-3. Продолжительность фазы «окна» у различных вирусов
Вирус
Фаза «окна», сутки
Диапазон колебаний, сутки
ВИЧ
22
8-38
Гепатит С
82
54-193
Гепатит В
59
37-81
Инфекционная безопасность гемотрансфузий — многогранная проблема, кото¬
рая может быть решена только при соблюдении нескольких условий:
• тщательный отбор доноров крови и ее компонентов;
• пропаганда донорства с обязательным акцентом на информированность
донора о гемотрансмиссивных инфекциях и его ответственности (программа
«Образование доноров крови»);
• внедрение более совершенных технологий тестирования крови;
• поиск и внедрение суррогатных маркеров, позволяющих оценить состояние
здоровья донора;
І разработка методов карантинизации компонентов крови;
• инактивация патогенов в крови и ее компонентах, продуктах крови.
В настоящее время нет единого мнения, какой из этих методов (или какая ком¬
бинация методов) позволит достичь максимальной инфекционной безопасности.
Дело осложняется тем, что при внедрении того или иного метода необходи¬
мо принимать во внимание конечную стоимость получаемого компонента или
продукта крови. Так, например, внедрение NAT-тестирования донорской крови
с одновременной инактивацией увеличивает стоимость СЗП в десятки раз. В
настоящее время экономическая составляющая (высокая стоимость конечного
продукта) — основное препятствие для широкого внедрения высокотехнологич¬
ных эффективных методов, обеспечивающих высокий уровень инфекционной
безопасности донорской крови.
Определенным прорывом в обеспечении безопасности трансфузионной под¬
держки явился метод карантинизации плазмы. Суть его в том, что компонент
донорской крови выдают в лечебные учреждения или на переработку на пре¬
параты крови только после повторного обследования донора крови, от которого
были получены эти компоненты. До этого компоненты крови хранятся на складе
(в специальных условиях) ровно столько, сколько необходимо (в России - ОТ
6 мес до 3 лет) для покрытия самого продолжительного серонегативного периода
инфекции. Как правило, карантинизации подвергают СЗП.
МЕТОДЫ КАРАНТИНИЗАЦИИ И ИНАКТИВАЦИИ ПАТОГЕНОВ В КОМПОНЕНТАХ КРОВИ 211
Метод карантинизации отчасти применим и к эритроцитной массе — кркокон-
сервирование позволяет сохранять эритроциты в течение времени, достаточного
дяя исключения гемотрансмиссивных инфекций при повторном обследовании
донора крови. Однако на практике метод карантинизации эритроцитов не нашел
широкого применения. В основном ограничиваются криоконсервированием
и карантинизацией донорских эритроцитов редких групп крови.
Тромбоцитный концентрат и лейкоцитная масса не могут быть карантинизнро-
ваны из-за коротких сроков хранения.
Помимо медицинских и морально-этических аспектов инфекционной безопас¬
ности компонентов крови, существенное значение приобретает экономическая
составляющая этой проблемы.
В России, как и в большинстве стран, функционируют относительно крупные
предприятия, на которых ежегодно перерабатывают несколько тысяч литров плаз¬
мы. Технологический процесс предусматривает объединение в стартовые загрузки
дх 200 до 800 л исходной плазмы, что означает ее смешивание в пулах от 500
до 1500 доноров. Несмотря на то что доноры проходят соответствующий отбор
и обследование, достаточно часто возникает ситуация, когда из медицинских
служб (кожно-венерологические диспансеры, санитарно-эпидемиологические
станции) поступает информация о заболевании лиц, сдавших ранее кровь на плаз¬
му. Плазма таких доноров как доброкачественная чаще всего уже была введена
в производственный процесс. Если даже одна порция плазмы от одного заболевше¬
го донора попадает в пул от 500-1500 доноров, то вся плазма или уже полученная
из нее продукция должна быть уничтожена.
Моральный ущерб и финансовые потери трудно оценить. Ситуация еще более
драматична, когда такая плазма направляется в лечебные учреждения и перелива¬
ется пациенту.
Один из возможных способов решения этой проблемы - карантинизация плазмы.
Карантинизация свежезамороженной плазмы
При карантинизации СЗП хранят в Банке крови при температуре -30 ’С и
ря клинического использования выдают только по истечении 3-6 мес, после
повторного клинико-лабораторного обследования донора на гемотрансмиссивные
инфекции. Продолжительность карантинизации СЗП определяют национальные
органы здравоохранения, она составляет от 4 (в Германии) до 6 мес в подавляю»
щем большинстве других стран, включая Россию. Этот срок перекрывает инкуба¬
ционный период возможной вирусной инфекции у донора или переход ее из серо¬
негативного в серопозитивный период.
Метод карантинизации плазмы внедрен в нашей стране в соответствии с при¬
казом М3 РФ от 7 мая 2003 г. «О внедрении в практику работы Службы крови
в Российской Федерации метода карантинизации свежезамороженной плазмы*.
Для карантинизации СЗП помещают в специальные холодильные установки
(специально сконструированные термоизолированные помещения), позволяющие
поддерживать температуру -30...-40 *С. При такой температуре СЗП можно хра¬
нить до двух лет (согласно дополнению к приказу М3 РФ от 19 марта 2010 г. N* 170
«0 внесении изменений в приказ Министерства здравоохранения Российской
Федерации от 7 мая 2003 г. N*193 «О внедрении в практику работы службы крови
в Российской Федерации метода карантинизации свежезамороженной плазмы»
срок хранения увеличен до 36 мес). В этих же целях вместо одной холодильной
установки можно использовать специальные холодильные камеры, расположен¬
ные в отдельно отведенном помещении (рис. 10-3).
Учреждения Службы крови, выполняющие карантннизацию. должны иметь
Документированную процедуру размещения на карантин:
• необследованной крови и компонентов крови до получения результатов
лабораторного тестирования;
292
СЛУЖБА КРОВИ
обследованной СЗП (помещенной на хранение в течение 180 сут) до noav»
ння результатов повторного обследования донора на маркеры гемотрансм
сивных инфекций: И(
закупленной продукции/материалов до получения результатов входи
контроля.
Рис. 10-3. Помещение для хранения карантинизированной плазмы
Продукты и материалы, помещаемые на карантин, должны быть соответствую¬
щим образом маркированы.
Кровь и компоненты крови, имеющие статус «на карантине», должны быть
взяты на учет и храниться отдельно от разрешенной к выдаче продукции.
Карантинизацию плазмы уже давно практикуют за рубежом, в ряде стран плаз¬
му, не прошедшую карантинизацию, запрещено использовать в лечебных целях.
Очевидно, что эффективность карантинизации будет достигнута при хорошо
отлаженных оперативных контактах с донорами. Практика успешного взаимодей¬
ствия между службами и учреждениями здравоохранения, совершенствующееся
информационное обеспечение дают основание полагать, что внедрение каранти¬
низации послужит действенным и существенным фактором борьбы с распростра¬
нением вирусных заболеваний, связанных с трансфузионным лечением.
Далеко не все страны применяют карантинизацию всей плазмы (табл. 10-4).
Только 4 страны — Чехия, Германия, Нидерланды, Румыния — сообщили о каран¬
тинизации 100% плазмы.
Таблица 10-4. Инактивация вирусов или карантинизация свежезамороженной плазмы
Страны
Карантинизация, %
Инактивация, %
Армения
0
0
Австрия
9
10 2
Бельгия
0
100
Болгария
0
0 -
Чехия
100
0 ______
Дания
7
?
Македония
0
0 -
Финляндия
1
0 -
Франция
57
43 Щ—
Германия
100
0 —
МЕТОДЫ КАРАНТИНИЗАЦИИ И ИНАКТИВАЦИИ ПАТОГЕНОВ В КОМПОНЕНТАХ КРОВИ 293
Страны
Патеия
Пміійи6УРг.
Г^дврланды,
і порт1
[Польша
&
Швеция
Швейцария
Украина
Карантинизация, %
20
Окончание табл. 10-4
Инактивация, %
65
О
100
69
100
42
80
100
100
20
Великобритания
Криоконсервирование эритроцитной массы как метод ее карантинизации
Один из методов карантинизации эритроцитной массы — хранение в условиях
низких температур.
Для этого могут быть в равной степени применены технологии криоконсерви¬
рования как при температуре -80 °С, так и при глубоком замораживании в жидком
азоте (-196 °С). Последний метод предпочтителен в тех случаях, когда наряду
с карантинизацией стоит цель накопления больших объемов фенотипированной
крови от одного донора, в том числе редких групп.
Хранить эритроциты необходимо на протяжении не менее 6 мес. как того тре¬
бует инструкция по карантинизации плазмы от 7 мая 2003 г. №193 «О внедрении
в практику работы службы крови в Российской Федерации метода карантинизации
свежезамороженной плазмы». Для принятия решения о размораживании эритро¬
цитов с целью их использования в клинике необходимо иметь результаты повтор¬
ного обследования донора на основные инфекции. При условии многократных
процедур сбора и криоконсервирования крови результаты последнего обследова¬
ния на патогены (при условии отрицательного ответа) позволяют применять все
ранее заготовленные дозы, срок хранения которых достиг 6 мес
Применение такой практики работы позволяет достигать гарантированного
уровня инфекционной безопасности используемых криоконсервированных и раз¬
мороженных эритроцитов.
Высокого уровня безопасности достигают еще и тем, что при разморозке в ходе
отмывания и при серийном центрифугировании удаляются белковые компоненты
плазмы, лейкоциты и тромбоциты.
В Великобритании, Бельгии, Дании, Норвегии. Италии и других странах не убеж¬
дены в степени эффективности карантинизации, для осуществления которой следует
ИДга на любые расходы. В этих странах идут по пути более эффективных, прием¬
лемых в соотношении «затраты-результат» способов борьбы с гемотрансмиссив¬
ными инфекциями — ведется поиск более информативных методов анализа (NAT-
Диагностика), удаление лейкоцитов, инактивация и удаление вирусов.
«ГОДЫ ИНАКТИВАЦИИ ПАТОГЕНОВ В КОМПОНЕНТАХ КРОВИ
Как и всякий метод, карантинизация компонентов крови имеет ряд недостатков.
К ним следует отнести невозможность повторного тестирования 100% доноров
по истечении 6-месячного срока хранения СЗП. достаточно высокую стоимость
логистики плазмы и высокий процент списания СЗП. не прошедшей карантин
294 СЛУЖБА КРОВИ
после 2-летнего срока хранения, отсутствие возможности карантинизивп
остальные компоненты крови (эритроцитную массу, тромбоцитный конце*1
лейкоконцентрат, стволовые клетки периферической крови). цедтРИ,
Наиболее перспективными методами обеспечения безопасности трансА
онной поддержки являются технологии инактивации патогенов в компоне
и препаратах крови. ентах
Инактивация патогенов в крови — группа методов, позволяющих уничтожив
(инактивировать) гемотрансмиссивные инфекционные агенты в донорской коо
ее компонентах и препаратах, что позволяет выполнять гемотрансфузии и прим
нять препараты крови без риска инфицирования больного.
Метод инактивации гемопатогенов предложено внедрить как завершающ*,
звено технологической цепочки производства компонентов крови. В настоящее
время в зарубежной литературе накопился немалый объем сведений о различных
методиках инактивации патогенов в компонентах крови, как лицензированных
так и находящихся на этапах внедрения.
Классификацию методов инактивации патогенов в компонентах крови можно
рассматривать применительно к виду трансфузионной среды.
Способы инактивации патогенов в плазме:
І физические — пастеризация, прогревание плазмы, нанофильтрация;
• химические — сольвент/детергент;
• фотохимические: видимый свет+метиленовый синий, УФО+амотосолен
(S-59), УФО+рибофлавин.
Способы инактивации патогенов в клеточных компонентах крови:
і тромбоциты — фотохимические (УФО І амотосолен, УФО 1 рибофлавин);
УФО без добавления фотоактивного вещества:
• эритроциты — физические (лейкодеплеция, отмывание): химические и фото¬
химические (dimethylmethylene blue, псорален S-303, PEN-110 или binary
ethyleneamine, рибофлавин, порфирин) в стадии разработки.
Некоторые химические агенты, используемые в методиках инактивации, пред¬
ставлены на рис. 10-4.
ОН
НО-у*— о
сн но^, м
щё.
и О NH-HBr
®*®® Рибофлавин Бинарный этиленамин
Рис. 10-4. Некоторые химические агенты, используемые в методиках инактивации
Инактивация патогенов в плазме
Существует два подхода к инактивации патогенов в плазме: в промышленных
условиях (из пула плазмы) и из одной дозы плазмы.
г
МЕТОДЫ КАРАНТИНИЗАЦИИ И ИНАКТИВАЦИИ ПАТОГЕНОВ В КОМПОНЕНТАХ КРОВИ 295
_дЫ инактивации патогенов в пулах плазмы в промышленных условиях:
пастеризация (исторический метод);
' обработка пула плазмы по методу сольвент/детергент с получением препара-
* т0в Octaplas и Uniplas (Octapharma, Австрия).
Методы для инактивации патогенов в одной дозе плазмы;
, облучение видимым светом плазмы, обработанной метиленовым синим, —
* theraflex mb plasma (MacoPharma, Франция);
, облучение ультрафиолетом плазмы, обработанной амотосоленом (псорале-
* ном S-59) -intercept (Cerus Europe BV, Leusden, Нидерланды);
, облучение ультрафиолетом плазмы, обработанной рибофлавином - Mirasol
з (Caridian ВСТ Biotechnologies LLC, Бельгия);
I прогревание плазмы;
* нанофильтрация.
ХАРАКТЕРИСТИКА отдельных методов инактивации патогенов
Метод сольвент/детергент
Метод инактивации вирусов при помощи растворителя-детергента (SD или РД)
был лицензирован FDA в 1985 г. для производства концентрата АТФ (антигемо-
фильный фактор) и применен для обработки СЗП. Плазма РД была лицензирова¬
на в Германии в 1991 г. и применяется там рутинно, как и во Франции, Австрии
и Нидерландах. Плазма РД полностью заменила СЗП в Норвегии и Бельгии. Более
2 млн доз плазмы РД и более 11 млн доз, обработанных РД, продуктов из крови
было перелито во всем мире без единого выявленного случая передачи вирусов.
Применение РД-метода для уменьшения вирусной инфекционности фракцио¬
нированных белковых продуктов из крови берет начало в использовании раство¬
рителя этилового эфира и детергента Твин-80 для разделения вирусов, покрытых
липидной оболочкой, от вирусов, покрытых белковой оболочкой. Исследования
показали, что различные составы РД, введенные в плазму и ее фракции, инакти¬
вируют различные вирусы в липидной оболочке, в то же время сохраняя состав
и биологические функции отдельных белков плазмы. Используемый метод сочета¬
ет органический растворитель три- (п-бутил) -фосфат (ТНБФ) с неионным детер¬
гентом, Тритоном Х-100, позволяя достичь высокого уровня уничтожения вирусов
при приемлемой совместимости с белками.
Метод включает инкубацию плазмы, подобранной по группам АВ(0), из пулов
по 2500 добровольных доноров (10-20% плазмы применяют для приготовления
пулов, идущих на коммерческое фракционирование плазмы) с 1% ТНБФ и 1%
Тритона Х-100 в течение 4 ч при температуре 30 °С. Реагенты удаляют экстрак¬
цией растительным маслом и последующей хроматографией в обращенной фазе
на смоле С18. Стерильную после фильтрации плазму замораживают в стандарт¬
ных контейнерах объемом 200 мл. Процесс изготовления предусматривает полу¬
чение компонента плазмы, стандартизированного по объему и уровню факторов
енертывания. Соответствие было показано в более чем 2000 партиях, произве¬
денных в Европе этим методом после его введения в 1991 г. РД-плазма содержит
минимум 0,7 ед./мл каждого из факторов свертывания: V, VII, VIII, IX, X, XI и XIII,
н минимум 1,8 мг/мл фибриногена. Маркеры активации свертывания, уровень
основных белков плазмы, стабильность при хранении находятся на ответствен-
Ности изготовителя.
Полная инактивация введенных вирусов обычно достигается в первые 15 мин
J°** процедуры. Была показана инактивация вирусов, больше или равная
средних инфекционных доз HBV для шимпанзе, >105 таких доз HCV и >107,2
МЫ РЛИНФЄКЦИ0ННЬ,Х Д03 для культуры ткани ВИЧ. Содержание белков плаз-
ЧФа -'ПЛаЗМе находится в пределах нормы. ТНБФ и Тритон Х-100 удаляются
mWthbho, остаток в конечном продукте составляет <3 мкг/мл. При этом уровне
296 СЛУЖБА КРОВИ
человек, весящий 70 кг, получающий 2 л РД-плазмы, может получить Оли
инактивирующих химикатов на 1 кг массы тела. Чі
Показания к применению РД-плазмы почти, но не совсем такие же, как для п
Клинические исследования выявили эффективность только в двух случаях- з 1
щение дефицитных факторов свертывания, для которых нет специальных ***'
паратов; лечение ТТП. При лечении побочных действий варфарина ин*^
РД-плазмы значительно уменьшали протромбиновое время во всех шести ис
дованных случаях. По данным, представленным изготовителем в FDA, РД-пла
вызвала желаемое лечебное действие во всех девяти случаях. РД-плазма не соя
жит самых крупных мультимеров фактора фон Виллебранда.
Методом сольвент/детергент пользуются В промышленных условиях. Прим
ром служит официнальный препарат Octaplas (Octapharma, Австрия). Представ
ляет собой свежезамороженную плазму, предварительно с целью инактивации воз-
можной вирусной инфекции обработанную сольвент/детергентом. Существенный
недостаток сольвент/детергентной плазмы — еще более высокая стоимость
чем у СЗП, и большая потребность по сравнению с последней. Это связано с тем
что активность факторов свертывания и других компонентов системы гемостаза
при обработке плазмы снижается на 15-25%.
Интересен другой препарат той же фирмы — Uniplas (универсальная соль¬
вент/детергентная плазма). Препарат аналогичен предыдущему. Отличается отсут¬
ствием групповой специфичности за счет удаления анти-А- и анти-В-антител.
Представляет по сути вирусинактивированную СЗП АВ (IV).
Обработка плазмы РД эффективно инактивирует вирусы с липидной капсулой,
В эту категорию попадает большинство клинически значимых вирусов, передаю¬
щихся при трансфузии, поэтому безопасность компонента значительно повыша¬
ется. С другой стороны, РД не инактивирует безоболочечные вирусы, а РД-плазму
готовят из пулов. Теоретически это повышает вероятность передачи безоболочеч-
ных вирусов, таких как HAV и В19.
Облучение видимым светом плазмы, обработанной метиленовым синим
В 2001 г. для практического использования лицензирован метод обработки
одной дозы плазмы метиленовой синью, затем — облучение видимым спектром
света: THERAFLEX MB PLASMA (MacoPharma, Франция).
Метиленовый синий (МС) — фенотиазиновый краситель. Красители этого
класса способны внедряться в структуру нуклеиновых кислот вирусов и тесно свя¬
зываться с остатками гуанозина ДНК/РНК. После фотоактивации с длиной волн
около 590 нм краситель окисляет кислород до синглентного кислорода, химически
повреждающего генетический материал вируса, тем самым останавливая реплика¬
цию вируса.
Процедура обработки включает следующие этапы:
• присоединение контейнера с плазмой к пластиковой системе для вирусинак-
тивации;
• фильтрационное удаление лейкоцитов из плазмы;
• добавление к плазме метиленового синего;
• облучение видимым светом в аппарате «Макотроник»;
• фильтрационное удаление из плазмы метиленового синего.
Эффективность инактивации патогенов методом облучения видимым светом
плазмы, обработанной метиленовым синим, достаточна высока по отношению
как к инкапсулированным, так и безоболочечным вирусам (табл. 10-5).
В настоящее время перелито более 4 млн доз плазмы, обработанной данным
веществом. Терапевтическая доза МС при лечении метгемоглобинемии и отравле¬
нии цианидами составляет 1 -5 мг/кг без данных о каких-либо побочных эффек¬
тах; Количество МС, используемой в системе Theraflex, — 85 нг на дозу плазмы
объемом 230 315 мл. При переливании 1000 мл СЗП, обработанной МС. пациенту
МЕТОДЫ КАРАНТИНИЗАЦИИ И ИНАКТИВАЦИИ ПАТОГЕНОВ В КОМПОНЕНТАХ КРОВИ 297
С массой тела 70 кг остаточное количество МС после ее удаления фильтром Blueflex
(оставит 0,00003 мг/кг. Метод обработки одной дозы плазмы метиленовым синим
Одобрен Всемирной организацией здравоохранения (2004 г.) и предусмотрен
руководством по заготовке, использованию и контролю качества компонентов
крови Совета Европы (2003 г.).
Таблица 10-5. Уровень редукции патогенов в THERAFLEX MB PLASMA
Патоген Тип
И
Вирус гепатита С
і вирус гепатита В
j гйпєс обыкновенный
ІПарвовирус В19
Степень редукции
Оболочечный
Оболочечный
Оболочечный
24.9
25.4
Оболочечный I >55
Безоболочечный I >5
В различных странах существуют три типа внедрения вирусинактивации одной
дозы плазмы, обработанной метиленовым синим:
• все дозы плазмы для переливания в стране (Бельгия);
• все дозы плазмы в стране, предназначенные для переливания детям до 16 лет
(Великобритания);
• в инициативном порядке в качестве дополнительного метода повышения
безопасности трансфузионной терапии (Франция. Испания, Италия, Греция.
Бразилия, Аргентина и др.).
Ультрафиолетовое облучение плазмы и тромбоцитного концентрата,
обработанных амотосоленом
Технология INTERCEPT зарегистрирована в Европе в 2001 г. для тромбоцит¬
ного концентрата и в 2007 г. для плазмы, основана на применении фотоактивного
вещества амотосолена (псорален S-59), мишенями которого являются нуклеиновые
кислоты (рис. 10-5). Амотосолен образует ковалентные связи с пиримидиновыми
основаниями нуклеиновых кислот. При добавлении амотосолена в трансфузионные
среды (СЗП или тромбоцитный концентрат) и последующем УФО происходит фото¬
химическая реакция амотосолена со всеми присутствующими в контейнере ДНК
и РНК, имеющимися в вирусах, бактериях, простейших, лейкоцитах. В результате
все патогены инактивируются, а лимфоциты теряют способность к пролиферации,
соответственно трансфузионная среда становится безопасной для реципиента.
10-5. Фотобиологический механизм действия технологии INTERCEPT
Технология включает в себя следующие этапы:
• Добавление амотосолена в контейнер с СЗП или тромбоцитным концентра-
/
298 СЛУЖБА КРОВИ
• УФО;
І удаление остатков фотоактивного вещества путем адсорбции.
Результаты по инактивации патогенов по технологии INTERCEPT (Уф-об
концентрата компонента крови, обработанного амотосоленом) на примере том!*
цитарного концентрата позволяют говорить о высокой эффективности ппої^
как в отношении вирусов, так и бактериальной контаминации (табл. 10-6,10^7)^
Таблица 10-6. Уровень редукции вирусов в концентратах тромбоцитов, обработанных пп
логии INTERCEPT
Патоген
Тип
Степень редухцш
ВИН
Оболочечный
>6,2 —-
Вирус гепатита С
Оболочечный
>4,5
Вирус гепатита В
Оболочечный
>5,5
Цитомегаловирус
Оболочечный
>5,9
Парвовирус В19
Безоболочечный
4,(И,9
Таблица 10-7. Уровень редукции бактерий в концентратах тромбоцитов, обработанных потехнп
логии INTERCEPT
Патоген
Тип
Степень редукции
Staphylococcus
Yersinia enterocolitica
Serratia marcescens
Pseudomonas
Salmonella choleraesuis
Bacillus cereus
Plasmodium falciparum
Грамположительный
Грамотрицательный
Грамотрицательный
Грамотрицательный
Грамотрицательный
Грамположительный
Protozoa
>6,6
>5,9
>6,7
4,5
>6,2
>6,0
>7,0
Основной приоритет данной технологии — безопасность пациента. Трансфузи-
онные среды становятся доступными через 4 ч после инактивации.
Дополнительный эффект фотохимической инактивации с амотосоленом В тормо¬
жение пролиферации лимфоцитов и угнетение выработки ими цитокинов. Это позво¬
ляет профилактировать реакцию «трансплантат против хозяина» без у-облучения
тромбоцитных концентратов и СЗП. Так, 150 цМ амотосолена й 3 J/cm2 УФО обра¬
зует 1 связь молекулы амотосолена на 83 пары оснований в ДНК лимфоцита, тогда
как 2500 cGy у-облучения (в настоящее время стандартная доза для компонентов
крови) индуцирует один разрыв цепи ДНК на 37 000 пар оснований.
Ультрафиолетовое облучение плазмы и тромбоцитного концентрата,
обработанных рибофлавином
Технология Mirasol для тромбоцитного концентрата зарегистрирована в Европе
в октябре 2007 г., для плазмы — в августе 2008 г. В системе Mirasol для видоизме¬
нения нуклеиновых кислот болезнетворных микроорганизмов в препаратах крови
и для уменьшения нагрузки возбудителями инфекционных заболеваний использо¬
ваны рибофлавин (витамин В2) и УФО (рис. 10-6).
На первой стадии в стерильных условиях мешок с тромбоцитной массой соеди¬
няют с мешком для иллюминации/хранения Mirasol и переводят в этот контейнер
тромбоциты.
На второй стадии мешок с раствором рибофлавина (содержит 35 мл раствора
рибофлавина и входит в состав каждого набора Mirasol для обработки тромбоци¬
тов — Mirasol Platelet Kit) в стерильных условиях соединяют с мешком для иллю¬
минации, и весь объем рибофлавина добавляют к препарату.
Затем препарат с рибофлавином помещают в облучатель Mirasol. где его под¬
вергают иллюминации (после перемешивания) в течение 6-10 мин. Точное время
иллюминации рассчитывают на основании объема препарата.
Процесс обработки плазмы очень сходен с процессом обработки тромбоцитов-
Как показали исследования, УФО плазмы и тромбоцитного концентрата, обрабо-
МЕТОДЫ КАРАНТИНИЗАЦИИ И ИНАКТИВАЦИИ ПАТОГЕНОВ В КОМПОНЕНТАХ КРОВИ 299
рибофлавином. — высокоэффективный метод инактивации компонента
вИрусного и бактериального загрязнения (табл. 10-8.10-9).
.Л#
Метод инактивации СЗП и ТК с рибофлавином
Прямое воздействие
уф-облучения
Перенос электронов
от рибофлавина-гуанина
Активные
формы кислорода
і продуктах крови
нуклеиновые кислоты
вирусов, бактерий
и паразитов абсорбируют
низкочастотные фотоны (hV),
что приводит к повреждению
зшх нуклеиновых кислот
Рибофлавин взаимодействует
с нуклеиновыми кислотами,
вызывая дополнительные
необратимые повреждения
нуклеиновых кислот
посредством химического
процесса переноса
электроном, прежде всего
между рибофлавином
и гуанином
Во всех препаратах
крови под действием
рибофлавина
и иллюминации образуются
«активные формы
кислорода», вызывающие
через различные
окислительные реакции
необратимые повреждения
нуклеиновых кислот
Рпс.10-6. Фотобиологический механизм действия технологии Mirasol
Шлица 10-8. Уровень редукции вирусов в концентратах тромбоцитов, обработанных по техно-
погии Mirasol
Патоген
Тип
Степень редукции
ВИЧ
Оболочечный
5.9
Вирус гепатита С
Оболочечный
3,2
Вирус гепатита В
Оболочечный
4,0
Цитамегаловирус
Оболочечный
3,4
Пареоеирус В19
Безоболочечный
>5,0
Таблица 10-9. Уровень редукции бактерий в концентратах тромбоцитов, обработанных по техно¬
логии Mirasol
Патоген
Тип
Степень редукции
ЩЩсост
Грамположительный
4,8
Smtia mmcens
Грамотрицательный
4,0
Ытопаз
Грамотрицательный
4.7
facilius cereus
Грамположительный
2.7
ШшШ falciparum
Protozoa
I >¥
Изучают дополнительный эффект фотохимической инактивации срибофлави-
юм - торможение пролиферации лимфоцитов и угнетение выработки ими цито-
кинов. Получены доказательства профилактики реакции «трансплантат против
хозяина» у животных.
Ультрафиолетовое облучение тромбоцитов без фотоактивного вещества
В октябре 2008 г. компания Масо Pharma (Франция) получила Европейский сер¬
тификат на аппаратную систему, расходный набор и методику инактивации пато-
тромбоцитных концентратах без использования фотоактивных веществ.
^т1ект инактивации достигается одноминутным облучением концентрата тром-
300 СЛУЖБА КРОВИ
боцитов УФ-спектром света определенной длины волны - 254 нм. Весь циц.
ти нации патогене» занимает около 5 мин. Ни*»-
Инактивация патогенов в эритроцитах
Активно разрабатываемые эффективные методы инактивации патогенов в
ме и тромбоцитных концентратах с помощью детергентов и УФО не могут я**3"
приемлемыми В ТОЙ же технологии ДЛЯ эритроцитов. Это связано с тем, ЧТО йрт!!!^
генты не всегда хорошо проникают через мембрану эритроцитов либо оказыва
на них повреждающее действие. По принципу действия все методы могут &
разделены на физические (лейкодеплеция. отмывание), химические и фотохин
ческие (Dimethylmethylene blue, псорален S-303, PEN-110 или binary ethyleneamin*
рибофлавин, порфирин). e'
Физические методы основаны на том, что некоторые из возбудителей, глав
ным образом вирусы типа ЦМВ и HTLV, находятся преимущественно внутпй
лейкоцитов и передаются при переливании с донорскими компонентами примеси
лейкоцитов. Снижения риска передачи указанных гемотрансмиссивных инфек¬
ций достигают в данном случае удалением лейкоцитной примеси с помощью
адгезивно-адсорбционных лейкофильтров, отмывания нативных эритроцитов
или в процессе деглицеринизации размороженных.
Лейкодеплеция на 4 log уменьшает примесь лейкоцитов <106 на 1 компоненти
соответственно снижает риск передачи указанных гемотрансмиссивных инфекций
Отмывание нативных эритроцитов или отмывание в процессе деглицеринизации
размороженных эритроцитов также сокращает, но в меньшей степени, контамина¬
цию этих компонентов лейкоцитами и тоже уменьшает риск передачи инфекций,
Однако все физические методы далеки от идеальных и не могут быть использова¬
ны как надежный метод профилактики гемотрансмиссивных инфекций.
РАЗРАБАТЫВАЕМЫЕ МЕТОДЫ
Нанофильтрация
Фильтрующие системы для удаления вирусов впервые были представлены
в начале 1990-х гг. Суть нанофильтрации заключена в технологии перехода бел¬
ковых субстанций через поры размером 15-40 нм, через которые не могут пройти
вирусные частицы, как правило, большего размера. Технология проста, надежна
и перспективна в отношении снижения риска инфицирования безоболочечны-
ми вирусами, прионами (коровье бешенство — губчатый энцефалит) и другими
неизвестными возбудителями. Методика применима только для плазмы. Может
применяться как дополнительный этап обработки к методу сольвент/детергент.
Находится в стадии доработки.
Химические и фотохимические технологии
Суть химических и фотохимических методов заключена в обработке компонен¬
тов крови активным химическим веществом, способным самостоятельно инакти¬
вировать патогены или сенсибилизировать их к последующему ультрафиолетово¬
му облучению.
Некоторые из вирусов типа ВИЧ могут быть переданы при трансфузии и с лей¬
коцитами, и с плазмой, они также прикрепляются к мембране эритроцитов и могут
находиться на тромбоцитах. Парвовирус В19 — плазменный агенти может при¬
крепляться к мембране эритроцитов. Таким образом, эффективный метод редук-
ции патогенов в эритроцитсодержащих компонентах должен инактивировать
вирусы в плазме, внутри клетки и на мембране.
S-303 (FRALE).Технология Helinx для обработки эритроцитсодержащих сред
основана на применении псоралена S-303 (FRALE). Данное вещество являет-
ся алкилирующим агентом, имеет высокое сродство к нуклеиновым кислота*
Технология включает добавление вещества S-303 в эритроцитсодержащую среД)
и последующую инкубацию в течение 2 ч при комнатной температуре. При370
МЕТОДЫ КАРАНТИНИЗАЦИИ И ИНАКТИВАЦИИ ПАТОГЕНОВ В КОМПОНЕНТАХ КРОВИ 301
ироисюдит независимая реакция изменения от кислого до нейтрального pH
Хды. Идет активация вещества S-303 и его гидролиз с образованием неактивного
вещества S-300. Результат этой реакции — образование ковалентных перекрещи¬
вающихся связей между участками нуклеиновых кислот и инактивация патогенов,
функция эритроцитов остается нормальной. Изучение радиоактивно меченных
й обработанных таким образом эритроцитов показало их высокую выживаемость
i сосудистом русле после трансфузии через 24 ч.
Dimethylmethylene blue. Вещество по своему химическому составу близко
к метиленовому синему (также способно убивать вирусы), однако в отличие от МС
более гидрофобно и легко проникает в эритроциты. При экспозиции происходит
редукция патогенов на фоне минимального повреждения эритроцитов.
inactine (двойной этиленамин). Вещество легко проникает внутрь клеток,
обладает очень низкой реактивностью в отношении биомолекул и очень высокой
селективностью в отношении нуклеиновых кислот. Метод не является фото¬
химическим. Экспозиция 0,1% Inactine в трансфузионной среде при комнатной
температуре в течение 6-24 ч приводит к тому, что полностью блокируется
функция ДНК и РНК полимераз, таким образом, не происходит транскрипции
и репликации. Метод высокоэффективен в отношении широкого спектра пато¬
генов и соответственно блокирует пролиферацию лимфоцитов. Токсичного
и мутагенного действия не обнаружено. Остатки вещества удаляют при отмыва¬
нии эритроцитов.
Рибофлавин (описан в технологии Mirasol) добавляют в эритроцитсодер¬
жащую среду, которую подвергают облучению видимым светом с длиной волны
450 нм в течение 60 мин. Достигают достаточного уровня редукции патогенов
без повреждающего воздействия на эритроциты.
ДОСТУПНОСТЬ МЕТОДОВ ИНАКТИВАЦИИ В МИРЕ
Из описанных методов инактивации в настоящее время в мире используют
только 4 метода: для плазмы - сольвент/детергент и THERAFLEX MB PLASMA,
для плазмы и тромбоцитов — INTERCEPT и Mirasol. Остальные методы не зареги¬
стрированы (табл. 10-10).
Таблица 10-10. Клиническая доступность методов инактивации патогенов
Компонент крови
Компания
Метод
] Состояние в США
1 Состояние в Европе і
Плазма
Octapharma
Сольвент/детергент
1 Зарегистрирован
I Зарегистрирован
Cerus
Амотосолен + УФО
Фаза III
1 Зарегистрирован 1
Macopharma
Метиленовый синий + облу¬
чение видимым светом
7
! Зарегистрирован
Caridian
Рибофлавин + УФО
?
[Зарегистрирован |
Тромбоциты
Cerus
Амотосолен + УФО
j Фаза III
І Зарегистрирован
Caridian
Рибофлавин + УФО
Фаза II
{Зарегистрирован
Macopharma
УФО
Предклйнмческие
1 Предклииическне
1 испытания
{испытания
Эритроциты
Vitex
Инактин
?
?
Cerus
S-303 (FRALE)
Фаза №
Фаза lb
Caridian
Рибофлавин + УФО
І Предшшческие
j Предшнические
І испытания пред-
{испытании
American
Тиолирилиум (порфирин) +
клиническме
Прадкпииичесхия |
■
Red Cross
облучение видимым светом
I испытания
{испытания
Примечание: фаза I — клинические испытания первой фазы (безопасность на добровольцах).
т838 II - клинические испытания второй фазы (безопасность у пациентов), фаза П1 - клини-
чеоо|е испытания третьей фазы (эффективность у пациентов). Фаза lb — доклиническая стадия
исследования на добровольцах.
Технологии инактивации патогенов постепенно внедряются в мире, однако
в настоящее время их распространенность представляет собой «мозаичную» кар¬
тину (табл. 10-11).
Таблица 10-11. Применение технологий редукции патогенов в компонентах крови в мире (состояние на начало 2009 г.’
Свежезамооожеиная плазма : 1
Тромбоциты
Страна
Растворитель/ I
детергент
Метиленовый синий + облучение
видимым светом
Амотосолен + УФО
Рибофлавин (вита¬
мин fej * УФО
Амотосолен + УФО
>и6офлаеии (витамин]
$MS...
Австралия
Нет
Нет
Нет
Нет
Нет
Начальный этап
изучения
Австрия
50 100 доз
В одном центре (Инсбрук)
Нет
Нет
Клинические испытания
в Инсбруке
Нет
Аогеншна
Один центр
Беларусь
Нет
Зарегистрирован
Нет
Нет
Нет
Заоегистоиооеан
Бельгия
Малая доля
Широкое использование (около
96% доз)
Используют в двух центрах,
изучают в одном центре
Разрешен к при¬
менению
Используют в четырех центрах,
изучают в двух центрах
Частичная компен- ]
сация
Болгария
Нет
Нет
Нет
Нет
Нет
Нет
Босния-
Герцеговина
Нет
Нет
Нет
Нет
Нет
Нет
Бразилия
Один центр
Великобри¬
тания
Всем пациентам
с ТТЛ
4% (импортная плазма для паци¬
ентов до 16 лет) 15 000 доз в год
Нет
Нет
Нет
Нет
Венгрия
Нет
Нет
Нет
Нет
Нет
Нет
Германия
Около 10%
Лицензированы две организации
Широкое использование в трех
региональных центрах
Нет
Широкое использование в трех
региональных центрах
Нет
Греция
20 000 доз.
Зарегистрирована методика
Грузия
Нет
Нет
Нет
Нет
Нет
Нет
Ирландия
Около 100%
Нет
Нет
Нет
Изучают в одном центре
Изучают в одном
центре
Исландия
Нет
Нет
Нет
Нет
Изучают в одном центов
Нет /
«Испания (Нет
(64% —110 000 доз в год
Нет
Завершены науч¬
ные исследования
Используют в трех центрах, идет Идет многоцентровое 1
валидация в четырех центрах исследование
(Италия (Около 20%
(Около 40% -120 000 доз в год
Используют в четырех центрах,
изучают в четырех центрах
Идет исследование
Используют в восьми центрах. Идет многоцентровое /
изучают в четырех центрах исследование 1
(Казахстан ( (Один центр
(Кувейт
Используют в одном центов j /
(Канада (Непостоянное (Один центр
\ Хмспопьзоеаиие (
Нет
Нет
іет J Обсуждав гея волаож- J
/мость амвмлвннщ /
yAanafcwfl \ (оамн иенто
\Hinw» \УЛв1 (Нет
Нет /Нет /Наг /Н&г
г
р= Щ
І Страна
Растворитель/
детергент
Свежезаморожен
Метиленовым синий +■ облучение
видимым светом
іная плазма
Рм
Амотосолен + УФО
\ Тромйзддоъх \
мин В,) §. УФО ( \ 0,1 * їВО \
Молдова
Нет Г
{ет Г
ет Не
5Т (Нет (Нет ... _ \
Нидерланды
Нет h
ІЄТ Ь
ет Н
ет (Идет исследование (Идет исследование \
Новая
Зеландия
ІЄТ h
Іет Г
Іет Н
ет (Нет (Нет A j
1 1 „- \
Норвегия
00% н
ЄТ I"
(ет
(ет 1И
спользуют в трех центрах (Нет \
Польша
іет I
[ва центра J
1ва центра
^ва центра (клини- 1VI
веские испытания) 1
спользуют в двух центрах \ Д
(с
ва центра (клиниче- \
кие испытания) \
Португалия 1
6
0% (около
5 ООО доз)
Іет
Чет
Идет исследование )
Чет (V
(дет исследование (
Россия
(ет
(спользуют в 50 центрах
Используют в четырех центрах
Нет
Используют в четырех центрах Ті
іет Д
Румыния Ь
\ет Ь
(ет
Нет
Нет
Нет
Нет
Сербия 1-
(ет С
Зарегистрирована методика
Нет
Идет исследование
Нет
Идет исследование
Сингапур
(
)дин центр
Словакия
Нет
Чет
Нет
Нет
Нет
Нет
Словения
Чет
Чет
Нет
Нет
Рутинное использование (70%
концентратов тромбоцитов
к апрелю 2008 г.)
Нет
США
Нет
Нет
Нет
Завершены науч¬
ные исследования
Завершена № фаза клинических
испытаний
Готовится протокол
исследования
Турция
Используют в одном центов
Украина
Нет
Заоегистоиоована методика
Нет
Нет
Нет
Нет
Финляндия
100% (около
60 ООО доз в год)
Нет
Нет
Нет
Нет
Нет
Франция
Рутинное исполь¬
зование
Карантин плазмы заменен вирус-
инактивацией метиленовым
синим в сентябре 2008 г.
5%. используют в одном
центре
Нет
100%, Используют в четырех
центрах; изучают в трех центрах
III фаза клинических
испытаний
Хорватия
Нет
Заоегистоиоована методика
Нет
Нет
Нет
Нет
Чешская
Республика
Нет
Нет
Нет
Нет
Клиническое исследование
Нет
Черногория
Нет
Нет
Нет
Нет
Нет
Нет
Швейцария
20%
Заоегистоиоована методика
Нет
Нет
Изучают в одном центов
Нет
Швеция
Небольшое коли¬
чество доз
Нет
Нет
Нет
Используют в двух центрах;
изучают в одном центре
Нет
і
Примечание пустая ячейка означает отсутствие данных.
304 служба крови
Несмотря на привлекательную «всесильность» в отношении гемотрац^.
сивных инфекций, методы инактивации имеют свои ограничения, связан
как с их отдельными недостатками (различная чувствительность патогенов к мНь'с
дам инактивации, различные платформы для разных компонентов, потенциалГ0-
токсичность, мутагенность, влияние на качество продукта), так и стоимосг*11
самого метода. Малый опыт применения этих методов также ограничивает их ц1*10
дрение в практику. Можно с уверенностью полагать, что с совершенствованы*
и оптимизацией методов инактивации и снижением стоимости процедуру ip
станут обязательной и неотъемлемой составной частью многоэтапной процедур
заготовки компонентов и препаратов донорской крови.
ЗАКЛЮЧЕНИЕ
По мере накопления информации и клинического опыта о различных техно¬
логиях вопросов появится еще больше. Прежде чем выбрать тот или иной метод
можно предложить следующий алгоритм оценки технологий инактивации паю-
генов:
• история создания метода;
• суть технологии;
І спектр и уровень редукции патогенов;
І дополнительные эффекты (например, подавление пролиферации лимфоци¬
тов);
і токсикологическая безопасность;
• влияние на качество компонента крови;
І клиническая эффективность;
І затраты на исследования, их уровень доказательности.
Стоимость можно охарактеризовать только ориентировочно. Увеличение
стоимости, минимизация стоимости, отношение «стоимость/эффективность» -
посчитать все это можно только при проведении сравнительных исследований
в условиях России.
Технологии редукции патогенов и решаемые проблемы
І Минимизация риска передачи инфекции через компоненты крови в период
«окна».
- Дополнительная защита против патогенных микроорганизмов, наличие
которых обычно не исследуют (ограниченный спектр перечисленных выше
тестируемых вирусов, фактически допускающий передачу вирусов группы
герпеса, Т-лимфотропного вируса человека, вируса лихорадки Западного
Нила, вирусов других гепатитов, включая вирусы, неизвестные современной
науке).
г Уменьшение риска загрязнения компонентов крови бактериями.
I Уменьшение частоты развития осложнений, связанных с остаточным пулом
лимфоцитов.
I Возможность пересмотра сроков временного запрета на донорство
и увеличение количества доноров.
I Уменьшение затрат на карантинизацию плазмы.
В этом плане на начальных этапах внедрения методов инактивации, очевид¬
но, следует придерживаться следующих рекомендаций. Методы инактивации
патогенов необходимы в следующих условиях; при высоких значениях инфици-
рованности определенных групп населения гемотрансмиссивными инфекциями,
при появлении новых гемотрансмиссивных инфекций (детекция которых не соот¬
ветствует требованиям безопасности), при обнаружении быстрой мутации извест¬
ных патогенов (которые не выявляются или плохо определяются в общепринятых
стандартизованных методах), для компонентов аутокрови пациентов с гемотраис-
миссивными маркерами.
юс IVMDI клгкп IинизАЦИИ И ИНАКТИВАЦИИ ПАТОГЕНОВ 8 КОМПОНЕНТАХ КРОВИ 305
Можно полагать, что тотальная инактивация станет возможна лишь при уело*
„ни, когда аргументы за тестирование крови станут слабее аргументов за инакти-
jaipuo всех компонентов (в том числе по экономической составляющей).
Таким образом, безопасность компонентов крови — основная и очень много*
гранная проблема трансфузионной медицины. Предложенные к настоящему вре¬
мени способы ее решения схематично можно представить следующим образом:
• селекция доноров, NAT-тестирование;
• лейкодеплеция;
• карантинизация плазмы;
• аутодонорство;
• криоконсервирование;
• аферезные технологии и многокомпонентное донорство;
• инактивация патогенов в компонентах крови;
і стратегия минимизации трансфузий;
• препараты крови и альтернативные корректоры (эритропоэтины, тромбо*
поэтины) и т.д.
Инактивация патогенов — всего лишь одно из звеньев длинной цепочки регла¬
ментированных действий, направленных на обеспечение безопасности гемоком*
понентной терапии, хотя и очень перспективное. В настоящее время невозможно
решить глобальную проблему безопасности применения компонентов и препара¬
тов из донорской крови, двигаясь только в одном направлении.
СПИСОК ЛИТЕРАТУРЫ
Жибурт Е.Б. Концентрат тромбоцитов в России и за рубежом // Медицинская газета. -
2007. - №46.
Жибурт Е.Б. Правила переливания плазмы. — М.: Медицина, 2008. - 240 с.
Левин И., Русанов В.М. Служба крови и препараты плазмы. (Международный аналитиче¬
ский обзор). — М.: Медпрактика-М, 2007. — 316 с.
Оприщенко С.А., Захаров В.В., Русанов В.М. Международные регулирующие документы
и стандарты Службы крови и производства препаратов плазмы. - М.: Медпрактика-М.
2008.
Селиванов Е.А., Данилова Т.Н., Дегтерева И.Н. Основные показатели деятельности
Службы крови России в 2002 г. // Трансфузиология. — 2003. - №4. - С. 7-28.
Селиванов Е.А., Данилова Т.Н., Дегтерева И.Н. Основные показатели деятельности
Службы крови России в 2001 г. // Трансфузиология. — 2002. - №1. - С. 7-29.
Селиванов Е.А., Данилова Т.Н., Дегтерева И.Н. и др. Характеристика деятельности
учреждений Службы крови в 2007 г. // Трансфузиология. — 2008. - №3. — С. 4-26.
Allain J.P., Bianco С.. Blajchman М.А. et al. Protecting the blood supply from emerging pato-
gens; the role of pathogen inactivation // Transfus. Med. Rev. — 2005. - N 19. - P. 110-126.
Angelini-Tibert M.F., Currie С., Slaedts M. et al. Safety of platelet components prepared with
photochemical treatment (INTERCEPT) transfused to pediatric oncology-hematology patients //
Transfusion — 2007 — N 43.
Awisati G., Tirindelli M.C., Annibali O. Thrombocytopenia and hemorrhagic risk in cancer
patients // Crit.Rev. Oncol. Hematol. — Oct 2003. — N 15. — P. 13-16.
Barin F. Controlled viral risks // Transfus. Clin. Biol. — 2000. — N 2. - P. 24-29.
Barin F. Viruses and unconventional transmissible agents: update on transmission via blood //
Transfus. Clin. Biol. - 2000. - Vol. 7. - P. 5-10.
Bjarte G. Solheim M.D. Universal Pathogen-Reduced Plasma in Elective Open-Heart Surgery
and Liver Resection // Clinical Medicine & Research. — 2003. — N 3. - P. 209-217.
Bumouf Т., Radosevich M. Nanofiltration of plasma-derived biopharmaceutical products //
Haemophilia. - 2003 - N 9. - P. 24-37.
Corash L. Helinx technology for inactivation of infectious pathogens and leukocytes in labile
blood components: from theory to clinical application // Transfus Apheresis Sri. — 2001. —
N 25. - p. 179-181.
Corash L. Inactivation of infectious pathogens in labile blood components: meeting die chal-
1е««е//Transfus. Clin. Biol. - 2001 - N 8. - P. 138-45.
306 СЛУЖБА КРОВИ
Corash L. Pathogen reduction technology: methods, status of clinical trials, and ft*.*
peets // Curr. Hematol. Rep. -2003. — N 2. — P. 495-502. Pros,
Engelfrieght C.P., Reesink H.W., Pietersz R.N. et. al. Universal leucocyte-depletion of u
components: cell concentrates and plasma // Vox Sang. — 2001. — N 1. — P. 56-77. Ц|
Goodrich R.P. The use of riboflavin for the inactivation of pathogens in blood product*
Sang S 2000. - N 78. - P. 211-215.
Hearst J.E., Reames A.. Grass J. S-59/UVA treated human T-cells with precisely jw
genomic addition frequencies retain immunological functions and yet are inhibited in огы» ^
tion // Blood. - 2001. - N 92. - P. 292b. 1
Klein H.G.. Bryant B.J. Pathogen-reduction methods: advantages and limits // ISBT с
Series. - 2009. - N 4. - P. 154-160. ^
Lazo A.. Tassello J., Jayarama V et al. Broad-spectrum virus reduction in red cell concern
using INACTINE PEN110 chemistry // Vox. Sang. - 2002. - N 83. - P. 313-323. fes
Mather Т.. Takeda Т.. Tassello J. et al. West Nile virus in blood: stability, distribution, and
ceptibility to PEN110 inactivation // Transfusion. — 2003. — N 43. — P. 1029-1037. Щ
Mazeron M.C. Leukocyte depletion and infection by cytomegalovirus // Transfus. Clin Biol
2000. - Vol. 7 - P. 31-35. '
McAteer M„ Tay-Goodrich B., Doane S. et al. Photoinactivation of virus in packed red cell unit
using riboflavin and visible light // Transfusion. — 2000. — N 40.
Murphy S. Platelets from pooled buffy coats // Transfusion. — 2005. — Vol. 45. - p m
639.
Ohagen A., Gibaja V., Horrigan J. et al. Induction of latent human cytomegalovirus by conven-
tional gamma irradiation and prevention by treatment with INACTINE PEN110 // Vox. Sang -
2004. - N 87. - P. 1-9.
Purmal A., Valeri C.R., Dzik W. et al. Process for the preparation of pathogen-inactivated RBC
concentrates by using PEN 110 chemistry: preclinical studies // Transfusion. — 2002. - N 42 -
P. 139-145.
Rennie I., Rawlinson P.S., Clark P. Universal leukodepletion of blood and febrile reactions //
Transf. Med. -2001. - N 2. - P. 115.
Soli М., Blanco L., Riggert J. et al. A multicentre evaluation of a new filtration protokol for leu¬
cocyte depletion of high -haematocrit red blood cells collected by an automated blood collection
system // Vox. Sang. - 2001. - N 2. - P. 108-112.
Sullivan M.T., McCullough J., Schreiber G.B. et al. Blood collection and transfusion in the
United States in 1997 // Transfusion. — 2002. — N 42. — P. 1253-1260.
Trannoy L.L., Lagerberg J.W., Dubbelman T.M. Positively charged porphyrins: a new series of
photosensitizers for sterilization of RBCs // Transfusion. — 2004. — N 44. — P. 1186-1196.
Wagner S.J. Virus inactivation in blood components by photoactive phenothiazine dyes //
Transfus. Med. Rev. -2002. - N 16.
Yarranton H.. Cohen H., Pavord S.R. Venous thromboembolism associated with the manage¬
ment of acute thrombotic thrombocytopenic purpura // Br.J. Haematol. — 2003. - N 121. -
P. 778-785.
Yokoyama Т., Murai K.. Murozuka T. et al. Removal of small non-enveloped viruses by nanofil¬
tration // Vox. Sang. — 2004. — N 86. — P. 225-229.
Zavizion B., Pereira М., de Melo J.M. et al. Inactivation of protozoan parasites in red blood cells
using INACTINE PEN110 chemistry // Transfusion. - 2004. - N 44. - P. 731-738.
Zavizion B., Purmal A., Chapman J. Inactivation of mycoplasma species in blood by INACTINE
PEN 110 process // Transfusion. — 2004. — N 44. — P. 286-293.
Zavizion B., Serebryanik D., Serebryanik I. Prevention of Yersinia enterocolitica, Pseudomonas
fluorescens, and Pseudomonas putida outgrowth in deliberately inoculated blood by a novel patho¬
gen-reduction process // Transfusion. — 2003. — N 43. — P. 135-142.
Получение гемопоэтических
стволовых клеток
периферической крови
Клетки-предшественники из периферической крови (КППК) -
один из предпочтительных источников гемопоэтических СТВОЛО¬
ВЫХ клеток (ГСК) для пациентов, которым необходима трансплан¬
тация костного мозга. По сравнению с трансплантатами костного
мозга от HLA-совместимого сибса, трансплантат КППК содержит
большее количество ГСК, происходит более быстрое восстановле¬
ние клеток миелоидного ряда и тромбоцитов, раньше восстанавли¬
вается клеточный иммунитет, а также ниже смертность, ассоции¬
рованная с трансплантацией. Препараты КППК содержат большее
количество Т-лимфоцитов, чем костный мозг, но частота острой
реакции «трансплантат против хозяина* II—IV степени не отли¬
чается между реципиентами КППК и костного мозга от HLA-
идентичного сибса, однако частота хронической реакции «транс¬
плантат против хозяина» выше у реципиентов КППК. У больных
с неблагоприятными формами лейкозов, такими как острый лей¬
коз во второй ремиссии, хронический миелолейкоз в фазе аксе¬
лерации, получивших КППК от совместимого сибса, смертность,
ассоциированная с трансплантацией, более низкая, чем у реци¬
пиентов костного мозга. Именно поэтому многие центры теперь
предпочитают использовать КППК, а не костный мозг, именно
для указанных групп пациентов.
Преимущества КППК ведут к разработке новых показаний
для их трансплантации. Переливания КППК, полученных от HLA-
совместимого сибса, назначают больным, получившим немиело-
аблативные режимы кондиционирования. Предварительные иссле¬
дования дают основания полагать, что иммуномодулирующий
эффект этих трансплантатов может быть с успехом использован
для лечения пациентов с метастазами почечно-клеточной карци¬
номы. У большинства больных, получивших немиелоаблативные
подготовительные протоколы и КППК, отмечают короткую цито¬
пению. В результате трансплантат-ассоциированная токсичность
достаточно невелика, и этот тип трансплантации используют
для лечения пациентов, которым ранее аллогенная трансплан¬
тация была противопоказана из-за возраста или сопутствующих
заболеваний.
По мере накопления опыта сбора и проведения трансплантации
КППК от HLA-совместимых сибсов многие аспекты мобилизации
и сбора клеток были унифицированы. Рекомбинантный человече¬
ский гранулоцитарный колониестимулирующий фактор (Г-КСФ)
1
308 СЛУЖБА КРОЄМ
стал стандартным препаратом для мобилизации КППК. Его назначают
10-20 мкг/кг в сутки однократно или разделяют на два подкожных вве й03*
«течение 4-6 сут. Через 4-6 сут проводят сбор КППК путем афереза, всег^1*
петляют от 1 до 3 процедур. Объем цельной крови, обработанной в ппо
афереза, больше, чем при стандартных процедурах получения концентр®
тромбоцитов или гранулоцитов. Поскольку трансплантация КППК стано °в
рутинной процедурой, есть необходимость обсуждения ВОЗМОЖНЫХ ОСЛОЖн ^
и проблем процесса мобилизации и сбора. н,|й
Требования к донору
Используют трансплантаты КППК, полученные как от родственных
и от неродственных доноров. Принципы отбора доноров костного мозга полнот
сохранены и для доноров КППК. Донор и реципиент должны иметь совместим *
HLA-фенотип, донор должен быть всесторонне обследован; чтобы подтвепл Ш
возможность проведения процедуры мобилизации и афереза по состоянию Ь
вья, донор не должен быть носителем возбудителей инфекционных заболеваний
или других гемотрансмиссивных болезней. У донора не должно быть онкологи-
ческих или аутоиммунных заболеваний, которые он может передать реципиенту
Показатели анализов крови и костного мозга донора должны находиться в преде¬
лах нормальных значений.
К донору аллогенных КППК применим перечень вопросов, задаваемых донору
цельной крови с целью выяснения состояния здоровья. Необходимо тестирование
на антитела к ВИЧ, вирусам гепатита В и С, человеческому Т-лимфотропному
вирусу (HTLV) І/ІІ, возбудителю сифилиса, антигену ВИЧ р24. Несмотря на то
что донации концентрата КППК здоровые лица переносят обычно хорошо, про¬
цедура может спровоцировать ухудшение течения воспалительного заболевания
и атеросклеротического процесса. Именно поэтому доноры должны пройти меди¬
цинское обследование, включающее общий осмотр, ЭКГ, рентгенограмму грудной
клетки, лабораторное обследование с обязательной оценкой функций печени
и почек. Поскольку биохимические показатели крови меняются по мере назначе¬
ния Г-КСФ, необходимо определить исходные параметры. Из-за необходимости
постановки центрального венозного катетера возникают условия для развития
осложнений, поэтому необходимо обследование вен донора для того, чтобы убе¬
диться, что процедура афереза технически выполнима.
Носителей ВИЧ, вирусов гепатита В или С исключают из списка доноров,
поскольку они могут нанести вред здоровью реципиента трансплантата. Доноры
с атеросклерозом в анамнезе должны быть тщательно обследованы из сообра¬
жений собственной безопасности. Донорство на фоне легкого или стабильного
атеросклероза обычно безопасно, но за донором необходимо тщательное наблю¬
дение. Людей с нестабильным или тяжелым течением заболевания к донации
не допускают.
Обязательно получение информированного согласия как от родственного, так
и от неродственного донора. Несмотря на то что обычно доноры хорошо перено¬
сят процедуру мобилизации и сбора, проведение ее требует времени, соблюдения
предписаний, а также процедура несет в себе потенциальный риск осложнений.
Именно поэтому необходимо все детально изложить потенциальному донору.
Определение количества клеток-предшественников из периферической крови
Для того чтобы удостовериться, что собрано достаточное количество ГСК,
их количество в концентрате КППК тестируют немедленно после окончания
процесса сбора. Если количества недостаточно, проводят повторный сбор КППК
или клеток костного мозга.
Для оценки количества ГСК предложено множество методов, включая культуры
не метилцеллюлозе, методы оценки долговременной способности клеток к колоние-
ПОЛУЧЕНИЕ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК ПЕРИФЕРИЧЕСКОЙ КРОВИ 309
л^зованию, проточную цитометрию. Поскольку культуральные методы требуют
"цени оценки результатов от 2 до 6 нед, проточная цитометрия стала методом
!frf)opa при оценке эффективности процесса клеточной мобилизации и сбора, так
позволяет точно оценить количество клеток CD34' в течение нескольких часов,
для успешной и быстрой трансплантации концентрата КППК необходимая доза
jtok CD34’ составляет 1-5х106 клеток на килограмм массы тела реципиента,
для аутологичной трансплантации минимальная необходимая доза находится
^пределах 1-2ХІ06 клеток, а для аллогенной - 2-5х106. Если проводят обработку
концентрата КППК с целью удаления Т-лимфоцитов для предотвращения раз¬
вития реакции «трансплантат против хозяина», то теряется некоторое количество
рСК, поэтому необходим сбор клеток с запасом. Кроме того, скорость приживле¬
ния миелоидных клеток зависит от дозы клеток трансплантата, поэтому при 1-3
процедур3* афереза стараются собрать максимально возможное количество ГСК.
Необходимость мобилизации клеток-предшественников из периферической крови
ГСК всегда циркулируют в крови, но их концентрация в крови здорового взрослого
человека очень низка. Обычно концентрация клеток CD34* в крови варьирует в пре¬
делах 2-5х106 клеток в 1 л, поэтому если не проводить дополнительных мероприятий
с целью увеличения количества клеток в периферической циркуляции, то потребуется
большое количество процедур афереза, чтобы собрать нужное количество клеток. Если
реципиент аллогенного трансплантата весит 70 кг, то ему необходимо 140-350ХІ06
клеток CD34\ и это количество можно получить из 28-175 л крови. Современные
сепараторы способны выделять 50-70% клеток CD34* из крови, при этом будет обра¬
ботано приблизительно от 40 до 350 л крови донора. Это потребует проведения от 3
до 20 и более процедур афереза, что непрактично, очень дорого и во многих случаях
просто невозможно. Именно поэтому разработаны методы для увеличения концен¬
трации ГСК в крови перед сбором концентрата КППК.
Препараты, используемые для мобилизации гемопоэтических стволовых клеток
Доноры получают два типа препаратов для увеличения количества циркули¬
рующих ГСК: гемопоэтические ростовые факторы и химиотерапевтические агенты.
Гемопоэтические ростовые факторы используют очень широко для мобилизации ГСК
как при аутологичном, так и при аллогенном донорстве. Поскольку химиотерапевти¬
ческие агенты очень токсичны, их не применяют в случае аллогенного донорства.
Ростовые факторы, используемые как монопрепарат (преимущественно гра-
нулоцитарный колониестимулирующий фактор), - стандарт ведения аллоген -
ных доноров. Фактор роста стволовых клеток применяют для мобилизации
ГСК у аутологичных доноров, но его токсичность не позволяет использовать
его у аллогенных доноров. Гранулоцитарно-макрофагальный колониестимули¬
рующий фактор (ГМ-КСФ) применяют для стимуляции у аллогенных доноров.
В целом ГМ-КСФ доноры переносят хорошо, но доноры КППК часто отмечают
боли в костях, миалгии, слабость. Сравнительные исследования эффективности
Г-КСФ и ГМ-КСФ выявили, что при введении Г-КСФ мобилизуется большее
количество клеток CD34\ но разные агенты стимулируют выход разных субпопу¬
ляций клеток-предшественников. Поскольку Г-КСФ стимулирует выход большего
числа клеток CD34\ его чаще используют у аллогенных доноров.
Мобилизация гемопоэтических клеток-предшественников с помощью
гранулоцитарного колониестимулирующего фактора
Г-КСФ - гликопротеин массой 24-25 кДа, выпускается как гликозилирован-
иый (ленограстим) и негликозилированный (филграстим) человеческий реком¬
бинантный протеин. Его можно вводить подкожно и внутривенно. Г-КСФ почти
всегда вводят подкожно один раз в сутки или делят на два введения. При подкож¬
ном введении пик концентрации препарата в плазме отмечают через 2-8 ч, период
S10 стжьАкроеи
полураспада составляет 3.5 ч. Суточная доза от 2 до 5 мкг/кг в сутки мобили
ГСК у здоровых доноров, но обычно доноры получают 10-20 мкг/кг в сутки 3?ет
Влияние гранулоцитарного колониестимулирующего фактора на *0
чесгво форменных элементов крови Лн
При введенні! препарата здоровому донору отмечают увеличение количеств
лейкоцитов в несколько раз уже через 12-18ч после первого введения. Повышен?3
количество лейкоцитов сохраняется СТОЛЬ ДОЛГО, СКОЛЬКО применяют Препап °е
При использовании препарата в дозе 10-16 мкг/кг в сутки количество лейкоцит
вырастает до 30-40х10ул, но может достичь и 80х109/л. В некоторых цент1)°в
дозу врепарата снижают, если достигнут столь высокий уровень лейкоцитов, ної
может привести и к снижению мобилизации клеток CD34\ Дозу Г-КСФ необходи
мо вводить ежедневно в течение всего периода мобилизации, в противном случае
количество клеток CD34- уменьшается. Короткий 5-7-дневный курс Г-КСФ, Кото_
рый получают доноры КППК, не влияет на уровень гемоглобина и гематокрита
при этом незначительно возрастает количество лимфоцитов и моноцитов. Г-КСф
также влияет на уровень тромбоцитов, через 5-6 сут после введения препарата
количество тромбоцитов снижается приблизительно на 10%. В редких случаях
отмечают тяжелую тромбоцитопению. Существует мнение, что это может бьггь
следствием утяжеления течения сопутствующей иммунной тромбоцитопении.
«Окно» мобилизации клеток CD34*
В то время как количество лейкоцитов нарастает уже через несколько часов
после введения первой дозы Г-КСФ. количество клеток CD34* не увеличивается
до 3- 4 сут применения препарата. Количество клеток CD34* достигает максимума
после введения 4-5 доз, а затем падает даже при продолжении введения препарата.
Поскольку повышение количества клеток CD34’ транзиторно, сбор КППК можно
эффективно осуществить только в «окне» 3-4 сут. В результате этого определение
времени проведения аферезов чрезвычайно важно. День максимальной мобили¬
зации у различных доноров отличается незначительно, поэтому у большинства
здоровых доноров степень мобилизации достаточно велика и время пика более
или менее предсказуемо. Рутинно процедуры афереза начинают в пределах от 12
ДО ?4ч после 3,4 или 5 сут назначения Г-КСФ.
Доза гранулоцитарного колониестимулирующего фактора
Степень увеличения количества клеток CD34’ у донора зависит от дозы Г-КСФ.
При дозе 2 МКГ/ КГ в сутки происходит небольшое увеличение количества клеток
CD34 в периферической крови, при повышении дозы до 5 мкг/кг в сутки растет
и число клеток, еще небольшой рост количества клеток отмечается при повышении
дозы до 10 мкг/кг в сутки. Дозы 20 и 24 мкг/кг в сутки приводят к еще большей
мобилизации. Однако наиболее часто применяемые дозы у аллогенных доноров
составляют 10-16 мкг/кг в сутки.
Г-КСФ обычно вводят один раз в сутки подкожно. Однако мобилизация прохо¬
дит более успешно, если Г-КСФ вводить дробно, по половине суточной дозы утром
и вечером. Показано, что применение двух доз по 6 мкг/кг утром и вечером при-
ВОДИТ к получению большего количества клеток CD34\ чем однократное введение
дозы 10 мкг кг. В некоторых центрах двукратное введение Г-КСФ обязательно, хотя
в раде случаев это может создавать неудобства как для донора, так и для персонала-
В целом Г-КСФ очень эффективно повышает количество циркулирующих ГСК.
Когда используют препарат в дозе 7,5-10 мкг/кг в течение 5 сут, количество кле¬
ток CD34" возрастает в 8-13 раз. Тем не менее отмечена широкая вариабельность
количества клеток CD34' среди доноров. Через 5-6 сут введения Г-КСФ концен¬
трация циркулирующих клеток CD34’ может составлять и 8х106/л. и 1100x10*/л-
Колебания количества мобилизованных клеток можно наблюдать и при более
высоких дозах Г-КСФ.
У здоровых доноров Г-КСФ также увеличивает концентрацию циркулирующие
ГСК. подтвержденную исследованием колониеобразования. Через 5 сут приме
r
ПОЛУЧЕНИЕ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК ПЕРИФЕРИЧЕСКОЙ КРОВИ 311
КСф в дозе 7,5-10 мкг/кг в сутки количество колониеобразующих еди-
стает в 12 раз, а число колоний в длительной культуре - в 60. Однако
jjttu ^ количество мобилизованных клеток CD34* являются более зрелыми
предшественниками, которые способны поддерживать гемопоэз к дли-
культуре в течение 5. но не 8 нед.
"переносимость гранулоцитарного колониестимулнрующего фактора
здоровые доноры хорошо переносят назначение Г-КСФ. тем не менее
0 «ос количество доноров, получающих Г-КСФ, сообщают о таких симптомах.
в костях, головные боли, слабость, миалгии, артралгии. нарушения сна
2ія 11*1)- Как минимум, один симптом встречается у 80-90% доноров. Наиболее
^ отмечают боли в костях и головные боли. Когда головные боли, миалгии
^бость встречаются в комплексе, некоторые доноры описывают это состояние
* гоиппоподобное. Обычно симптоматика легкая или умеренная. 38% доноров
5тпк ощущают, что их способность выполнять физические нагрузки ограничена
время применения Г-КСФ, но только единичные доноры не способны на практике
їдяться с ежедневной физической работой (табл. 11-2). Доноры часто применя-
пгПрспараты ибупрофена, которые могут облегчить, но не полностью нивелировать
болезненные симптомы. Несмотря на применение анальгетиков, 2-4% доноров стра¬
дают от тяжелых побочных эффектов. Тяжесть симптомов значительно уменьшается
через 48-72 ч после последней примененной дозы Г-КСФ, но некоторые доноры
не годностью восстанавливаются даже через неделю после отмены препарата.
Таблица 11-1. Симптомы, отмеченные у лиц, получавших гранулоцитарный колониестимулирую¬
щий фактор в течение 6 сут с последующим двукратным аферезом клеток-предшественников
из периферической крови
Симптом
Доноры с каждым симптомом, %
5 мкг/кг в сутки, 0=19
10 мкг/кг в сутки, 0=21
Воли в костях
52,6
76,2
Головная боль
73,7
66,7
Миалгия
31,6
66,7*
Слабость
36,8
42,9
Нарушения сна
15,8
23,8
Парестезии
15,8
38,1
Диарея
10,5
4.8
Тошнота
15,8
23,8
Артралгии
10,5
0
[Боли в спине
15,8
0
Насморк
15,8
23,8
jОзноб
5,3
14,3
[Кожная сыпь
10,5
4.8
Примечание: *р<0,05 по сравнению с донорами, получавшими Г-КСФ в дозе 5 мкг/кг в сутки.
Влияние гранулоцитарного колониестимулирующего фактора на био-
ииюческие показатели крови
В течение курса Г-КСФ у здоровых доноров могут быть транзиторные измене¬
ния биохимических показателей крови. Отмечают повышение значений уровня
натрия, лактатдегидрогеназы, щелочной фосфатазы, АЛТ и мочевой кислоты.
Ри этом снижается уровень калия, билирубина, азота мочевины крови, магния,
изменения весьма умеренны и возвращаются к исходным показателям в тече-
недели (табл. 11-3). Практически всегда они клинически не значимы для здо-
ьи доноров. Поскольку повышение уровня АЛТ транзиторно, его нельзя
в качестве суррогатного маркера гемотрансмиссивного заболевания
ІР^ стимулированного Г-КСФ.
gra «рй» крови
Таблица 11-2. Количество доноров клеток-предшественников из периферической кровм
минися на ограничение физической активности
Де*
Доза Г-КСФ
S мкг/кг а сутки, л=19
О
5,3
15,8
15,8
15,8
10,5
5,3
10 мкг/кг а сутйціьгТ
Примечание Г-КСФ назначали с 1-х по 5-е сутки, а концентрат КППК собран на 5-е и 6-ёсута*
Ограничение физической активности - неспособность выполнять тяжелую работу при сошн
нии способности делать легкую работу по дому или в офисе. е’
Шлица 11-3. Биохимические показатели у доноров, получивших гранулоцитарный коло-
нивстимулирующий фактор в течение 5 сут, с последующей донацией 1 концентрата клеток-
предшественников из периферической крови
Показатель
я
День 0
День 2
День 4
День 6
День 8
1 Ни
34
139+2
140+2
141±2*
142+2*
140+2
К, мМ/л
34
4,0+0,3
4,0+0,3
3,9±0,3
3,7±0,4*
4,1 ±0,4
Азот мочевины крови, мг/дл
34
11±3
10+2
9±2*
10+3
11+3
Щелочная фосфатаза, мг/дл
34
73±20
86±22*
133+33*
179+43*
136+31*
Лактатдегидрогеназа, вд7л
20
452+49
558+93*
954+298*
1.307+363*
862+257*
билирубин, мг/дл
34
0,7±0,3
0,5±0,3*
0,4±0,2*
0,4+0,2*
0,4+0,2*
АЛТ, ад/л
34
28±9
26±10
26+10
38±21
56+49*
Примечание: Г-КСФ был назначен с 1-х по 5-е сутки, а концентрат КППК собран на 6-е сутки.
*р<0,05 по сравнению с «днем О».
Метаболизм костной ткани послужил причиной ряда вышеперечисленных
изменений. У доноров, получающих Г-КСФ в течение 5 сут, повышается актив¬
ность костной щелочной фосфатазы и снижается содержание остеокальцина.
Костная щелочная фосфатаза и остеокальцин — маркеры образования кости,
и сходные изменения указанных параметров отмечают у пациентов с остеолити-
ческими костными метастазами.
Описаны и редкие осложнения применения Г-КСФ. Поскольку большинство сим¬
птомов, отмечаемых у доноров, - следствие применения Г-КСФ, тяжелые и атипич¬
ные проявления необходимо тщательно отслеживать. Следует четко разграничивать
результаты воздействия Г-КСФ и возникшие независимые новые проблемы со здо¬
ровьем донора. Редко у доноров КППК, получивших Г-КСФ, развиваются инфаркт
миокарда, разрыв селезенки, острый ревматоидный артрит, кожный васкулит, ирит,
усиление кожных высыпаний. Также были сообщения об артериальном тромбозе
и анафилактических реакциях после назначения Г-КСФ. Описаны инфаркт мио¬
карда у 64-летнего мужчины и смерть 54-летней женщины от инсульта через 2 сут
после донации концентрата КППК, в последнем случае патологоанатомическое
исследование не проведено. Эти реакции могут быть как идиосинкратическими,
так и представлять собой ухудшение течения сопутствующего заболевания. Г-КСФ
может также утяжелять течение атеросклеротического процесса.
Длительное назначение Г-КСФ приводит к остеопорозу и спленомегалии.
Спонтанный разрыв селезенки описан у двух доноров после сбора мобилизован¬
ных КППК. 22-летний мужчина получал Г-КСФ в дозе 10 мкг/кг в сутки в течение
ПОЛУЧЕНИЕ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК ПЕРИФЕРИЧЕСКОЙ КРОВИ 313
леоез был проведен на 6 и 7-е сутки. Разрыв селезенки зарегистрирован
после второй донации. Селезенка была сильно увеличена в размерах,
ip. отческое исследование выявило экстенсивный экстрамедуллярный гемо-
1 гиС1ятооой случай спонтанного разрыва селезенки описан у 33-летнего мужчи-
йоэз. в получал Г-КСФ в дозе 16 мкг/кг в сутки в течение 6 сут, а донации
к»к0 РйЛИ на 4,5 и 6-е сутки. На 5-е сутки он пожаловался на боль в левом под-
(11’0ИСХ Пальпация и УЗИ выявили увеличение селезенки (2 см из-под реберной
«енее чем через сутки после третьей донации произошел разрыв селезенки
бедовавшей экстренной спленэктомией. При гистологическом исследовании
массивный экстрамедуллярный гемопоэз.
^-большое увеличение селезенки часто наблюдают у большинства здоровых доно-
fi одном из исследований была проведена оценка размеров селезенки у 91 доно-
Р°КППК. Все они получали Г-КСФ в дозе 7,5 мг/кг в сутки, а аферез был проведен
№ аза. Средняя длина селезенки увеличивалась на 11 мм (или 10%), увеличение
шыболее 19 мм отмечено у 20% доноров. К сожалению, не удалось идентифици-
мть факторы прогноза, влияющие на степень увеличения селезенки у различных
яоноров. Возраст донора, количество лейкоцитов, тромбоцитов, нейтрофилов,
Цдеток CD34*, а также биохимические показатели крови на 5-е сутки стимуляции
небыли связаны со степенью увеличения селезенки. Несмотря на то что рутинное
Обследование размеров селезенки не является необходимым, тем не менее, если
будут выявлены демографические факторы или простейшие лабораторные пока¬
зали, ассоциирующиеся со значительной степенью увеличения селезенки, более
дательное обследование этой группы доноров будет оправдано.
Процедура сбора клеток-предшественников из периферической крови
Сепараторы клеток крови
Для сбора ГСК могут быть использованы различные типы сепараторов клеток
крови, при этом результаты будут достаточно близкими. Большинство машин
непрерывно забирают 40-70 мл крови донора в минуту, удаляют фракцию лим¬
фоцитов и моноцитов, обогащенную ГСК, и возвращают плазму и остающиеся
клетки донору. Такие аппараты, действие которых основано на непрерывном
потоке, требуют хорошего венозного доступа иглами с широким просветом в двух
независимых местах. В качестве альтернативы используют широкий двухпро-
светный катетер, способный справляться с таким потоком крови. Антикоагулянт
добавляют к крови для предотвращения тромбообразования, как только кровь
поступает в аппарат. Антикоагулянт выбора —цитрат, он не влияет на системную
способность донора к коагуляции, поскольку очень быстро подвергается метабо¬
лизму в печени. Некоторые аппараты используют прерывистый поток, поэтому
возможен только один венозный доступ. Однако в этом случае скорость обработки
крови значительно медленнее. Даже при работе с непрерывным потоком время
Фреза весьма значительно, именно поэтому аппараты с прерывистым потоком
используют для сбора ГСК очень редко.
Принцип действия сепараторов клеток крови основан на использовании раз-
Ши плотности клеток. ГСК в большинстве своем имеют такие же размеры
^плотность, как лимфоциты и моноциты. Именно поэтому установки аппара-
СпгиИЛ*1 Ре практически идентичны таковым при сборе лимфоцитов.
Двойственно параллельно ГСК аппараты выделяют большое количество лим-
®с°в и тромбоцитов (табл. 11-4).
ирови^ПЛЬносгь пР°ЦСДУры афереза зависит от общего объема обработанной
іфц ' Ри сборе концентрата тромбоцитов обычно обрабатывают 4-5 л цельной
*0%нтт!^И С^°^)е гРанУл°Цитов ~ около 7 л. Стандартная процедура получения
КППК в различных центрах сильно варьирует, но обычно обработке
т от 10 до 20 л крови за 3-5 ч.
ці owe* woo*
Мац ііч Состав «онційтрата клвтш-лрвдшвств«нников из периферической крови, nojw.
мета n 1S0 доноров, получавших грануяоцитарный каяояивстимулирующий фактор в дозе
МИ W ШШ I сутхи в течение 5 сут ’Л
Кета
Mtm
Медиана
Взриабвлыт^/-^.
ІМиоцить. xIO*
35Д*16,4
32,4
11.9-1633 '""'•I
[квпядамю
421*287
330
70-1668
иМЙМРВіЮР
480*110
470
250-290 '"H
'■■МММ
7,2*4,0
7,6
0-22,1
ЙиМврмь
65,6*13,7
67,5
27.0-ЙЛ "Ч
ІМмитЛ
22,5*8.8
22,3
3.0-49Д ~~Ч
|НМтроф*лы.%
3,6±5,2
2,0
047 ТТЛ
В целом процедура афереза безопасна, но возможны те же осложнен^.
ЧТО Н у доноров компонентов крови. Среди НИХ следует отметить цитратну^
реакция, потерю крови, если возникают проблемы с сепаратором, гематоци
или повреждение нервных стволов в месте пункции, воздушную эмболию и гнпер-
чувствителыюсть к этилендиоксиду.
Состав концентрата клеток-предшественников из периферической крови
Наибольшее количество клеток в концентрате КППК представлено моно-
иуклеарами. Около 90-95% лейкоцитов в концентрате КППК - лимфоциты
1 не более 10% - гранулоциты. Только 1-2% клеток экспрессируют антиген
CD34. Концентрат КППК содержит относительно небольшое количество эри¬
троцитов. Объем эритроцитов и тромбоцитов, присутствующих В концентрате,
зависит в меньшей степени от типа сепаратора и в большей — от объема обрабо¬
танной крови. Чем больше объем крови, тем выше число эритроцитов и тромбо¬
цитов. Один из типов сепараторов - CS3000+ (Baxter Healthcare Corporation,
Deerfield, 1L) - забирает около 1 m эритроцитов на литр обработанной крови,
таким образом, продукт, полученный путем обработки 10 л цельной кровні будет
содержать 7-Ювл зритромассы. После обработки 10 л цельной крови концентрат
КППК содержит около 4x10і1 тромбоцитов, количество, сравнимое с содержанием
их в тромбоцитном концентрате, полученном путем афереза. Объем плазмы зави¬
сит от типа сепаратора и варьирует от 50 до 300 мл. Если концентрат был собран
в объеме 50 мл и он предназначен для хранения или транспортировки, рациональ¬
но добавление дополнительной аутологичной плазмы.
Количество собираемых гемопоэтических клеток
Сепараторы клеток крови собирают фиксированную пропорцию мононуклеар-
ных и клеток CD34* из крови, поступающей в аппарат. Пропорция выделяемых
клеток или эффективность сбора в большинстве типов аппаратов сходна. Таким
образом, количество клеток CD34* в концентрате КППК зависит от объема
обработанной крови в процессе афереза и исходной концентрации клеток CD34*
І цельной крови.
Количество мобилизованных и, следовательно, собранных клеток CD34* зави¬
сит от дозы Г-КСФ. В случае назначения Г-КСФ в дозе 10 мкг/кг в сутки и одно¬
кратном проведении афереза среднее количество клеток CD34\ которое удается
получить при обработке 10 л цельной крови, составляет 452х106, достаточное
для трансплантации реципиенту массой тела 90 кг (табл. 11-5). Дробное назначе¬
ние Г-КСФ дважды в день увеличивает количество клеток CD34* в концентрате.
При назначении Г-КСФ в дозе 20 мкг/кг в сутки (в два приема по 10 мкг/кг) среднее
количество собранных клеток CD34* увеличивается на 34% (с 427 до 672ХІ06)-
К сожалению, содержание клеток CD34* в концентрате КППК сильно разли¬
чается между донорами, и практически невозможно предсказать, какая донавня
к сбору достаточного количества ГСК до ее окончания и определения
РШиІ клеток CD34' в конечном препарате. Измерение уровня клеток CD34'
крови донора до начала афереза позволяет лишь приблизительно
I & Г.ЛЧМПЖНОЄ количество клеток В кониентпат* Три lia МРМРЯ 110ГЫП-
їна зависимость количества клеток CD34' в периферической крови до сбора
указать возможное количество клеток в концентрате. Тем не менее, несмо-
# “ а И1 в конечном концентрате, исходный уровень клеток CD34* не является
"^ЮТНЫМ фактором прогноза получения необходимого количества ГСК в кон-
утрате.
а ^.5. влияние дозы гранулоцитарного колониестимулирующего фактора на количество
«...а і/ПОТПіг.ППРПМІРГТПеНІ-ШКПі^ІЛЧ.ПЙПМІ+ІАПМЦОГКПй кплаи
ЙЙрК
і концентрате клеток-предшественников из периферической крови
Клетки
mt* CD341,
<10*
Пыйсоиить!. ХКУ
[Мононуклеары,
<10*
Нейтрофилы,
«10»
Тромбоциты,
<10*
ЭРИТРОЦИТЫ.
Суточная доза Г-КСФ
5 мкг/кг, л=25
М±ш
276±189
26,5*9,0
25,9+8,4
0;6±1,1
430±80
5,4±4,7
Вариабель¬
ность
91-767
11,9-56,2
11,0-51,1
0-5,1
300-630
0-19,0
7,5 мкг/кг, л>58
10 мкг/кг, л*07
М±т
428±300
34,0±11,1
31,9±8,6
2,1+4,3
490±120
8,0±3,9
Вариабель¬
ность
М+ІЛ
70-1.658
16,4-74,4
14,9-58,5
0-27,6
300-920
0-22,1
4523294
39,8*19,4
38.1119,4
1,8*3,4
4901100
7,2*3,5
Вариабаль
ность
380
78-
39.6-163.3
15.6-139,6
0-23,7
250-740
0-15.5
Примечание: Г-КСФ был назначен с 1 по 5-е сутки, а концентрат КППК собран на 6-е сутки.
Другими факторами, определяющими количество клеток CD34*. мобилизо¬
ванных и выделенных в концентрат, являются возраст, масса тела и пол донора.
Большее количество клеток CD34+ собирают от мужчин, имеющих большую массу
тела и возраст моложе 65 лет. До сих пор не выяснено, являются ли масса тела
И под независимыми прогностическими факторами.
Достаточное количество клеток CD34+ может быть получено уже при однократ¬
ном аферезе для 62-68% аллогенных трансплантаций. Количество клеток CD34'
может быть увеличено за счет проведения повторного афереза в последующие дни
после первого. После второго сбора достаточным количеством клеток бывают обе¬
спечены 86-91% аллогенных трансплантаций. Однако, если проводят повторный
аферез при достаточно высокой дозе Г-КСФ (10-16 мкг/кг в сутки), выход клеток
при втором аферезе на 22-24% меньше, чем при первом. Это снижение является
отражением общего снижения содержания клеток CD344 в циркуляции. В одном
из исследований показано, что при дозе Г-КСФ 10 мкг/кг в сутки и повторном
сборе клеток количество клеток CD34+ во втором концентрате у 20 доноров было
на 22% меньше, чем в первом. При сравнении уровня ГСК в цельной крови до афе¬
реза и перед первой и второй процедурой выявлено снижение их количества перед
вторым аферезом. Поскольку в контрольной группе, не подвергшейся проведению
афереза, количество клеток CD34* оставалось стабильным, снижение числа ГСК
является результатом удаления клеток CD34' из циркуляции в процессе сбора.
Если Г-КСФ назначали в более низкой дозе (5 мкг/кг в сутки), снижения количе¬
ства клеток CD34* в циркуляции и в концентрате при второй процедуре не наблю-
®4и. Однако это сопровождается в целом более низкой степенью мобилизации
следовательно, их меньшим количеством в концентрате.
Приблизительно у 0,3-4% доноров концентрат содержит так мало клеток
что две и более процедур афереза не способны обеспечить количество
|(Летои для проведения успешной трансплантации. В большинстве случаев у этих
доноров отмечен и низкий уровень клеток CD34' (менее 20х106/л) в циркуляции
Г-кгл*33, ® этом слУцае происходит неэффективный сбор КППК даже при дозе
^. составляющей 16 мкг/кг в сутки.
ці окжмкгави
СІ* дмтатнмего количества гемопоэтических стволовых клеток
Я І центров переливают собранные КППК сразу после ц0
8ШЦ афереза. так же как проводят большинство процедур трансплантат*
костного мозга. Это в значительной степени влияет на ряд аспектов проведе»
сбора концентрата КППК. Процесс кондиционирования реципиента начинав
Я сборе донорских ГСК. поэтому минимально необходимая доза клеток дол*»!
быть получена I день трансплантации или накануне. Некоторые центры обо
додают «трансплантационную дозу* как 1 или 2 дозы концентрата КППК
I собранные стандартным способом после стандартного режима мобилизации
Однако в большинстве центров под «трансплантационной дозой* понимаю
ажщфический минимум клеток CD34*. определяемый массой тела реципиента
и в большинстве клиник подсчитывают содержание CD34' клеток в концентрате
КППК немедленно после процедуры афереза. В этих центрах продолжают еже-
дневное назначение Г-КСФ и сбор клеток CD34* до достижения необходимого
количества ГСК. Тем не менее длительность мобилизации ограничена во вре¬
мени. и в некоторых случаях даже повторные аферезы не способны обеспечить
нужного количество клеток в трансплантате. В этих случаях чаще всего проводят
эвбор костного мозга вместо продолжения неэффективных процедур афереза
Когда количество циркулирующих клеток CD34' менее 8х106/л, сбор КППК
скорее всего, окажется неэффективным.
Для уменьшения проблем, ассоциирующихся с получением малоклеточного
концентрата КППК. многие центры проводят мобилизацию, сбор и криосохра¬
нение ГСК до начала протокола кондиционирования реципиента. В этом случае
при недостаточном количестве собранных клеток начало подготовки к транс¬
плантации можно отложить, а донору назначить новый курс Г-КСФ для моби¬
лизации и добрать необходимое количество ГСК. В случае повторения курса
мобилизации с использованием Г-КСФ через год после первого, степень моби¬
лизации и количество клеток CD34\ полученных путем афереза, очень близки
к таковым, полученным во время первого курса. Если же повторный курс проводят
в пределах 60 сут после первого, количество мобилизованных и собранных клеток
С034*значительио меньше.
Сбор больших объемов
Были предприняты значительные усилия для увеличения количества клеток
CD34' в концентрате КППК, чтобы обеспечить достаточный трансплантат для всех
реципиентов, а также создать запас клеток в том случае, если концентрат подвер¬
гают обработке (с неизбежной потерей некоторого количества ГСК). Количество
собранных клеток может быть увеличено при интенсификации мобилизации,
повторных аферезах или при нарастании объема обработанной цельной крови
при каждом аферезе.
Увеличение дозы Г-КСФ с 20 до 24 мкг/кг в сутки приводит к небольшому
нарастанию количества мобилизованных ГСК. Совместное назначение Г-КСФ
и ГМ-КСФ может оказаться значительно более эффективным по сравнению
с монотерапией Г-КСФ, но эта тактика пока подробно не изучена.
Поскольку в настоящее время сложно оказать влияние на степень максималь¬
ной мобилизации ГСК. увеличение количества собранных КППК можно получить
i результате проведения повторных аферезов и/или увеличения объема обраба¬
тываемой крови при каждой процедуре. Поскольку интервал, в котором мобили-
зуются клетки CD34\ составляет 3-4 сут, за это время сложно осуществить более
2-3 аферезов. Обычно первые два концентрата КППК содержат значительное
пмюство клеток CD34'. Однако к третьему аферезу их количество значительно
рмыввекя, и соответственно сбор значительно менее эффективен. В большин-
спм случаев проведение четвертого афереза вообще бессмысленно.
T
ПОЛУЧЕНИЕ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК ПЕРИФЕРИЧЕСКОЙ КРОВИ 317
,учшим способом повышения выхода клеток CD34* в концентрат ока*
увеличение времени первых двух аферезов. В большинстве центров
к обработке 20 л цельной крови по сравнению с исходными 10 л.
ь процедуры и соответственно объем цельной крови зависят от вре-
в течение которого донор чувствует себя комфортно. Тем не менее про-
***, соПровождающиеся обработкой большого объема и занимающие 4-6 ч.
обычно переносят удовлетворительно,
я увеличения объемов обрабатываемой крови без увеличения времени про-
jL, можно повысить скорость потока цельной крови, поступающей в села-
Ш;. Максимальная скорость потока крови лимитирована конструктивными
Тленностями каждого сепаратора, диаметром вен донора, размером внутривен-
Тткатетера, используемого при аферезе, и толерантностью донора к цитрату.
добавляемого к крови цитрата и соответственно поступающего донору
дйяорционален скорости потока крови. Следовательно, увеличение потока при-
к повышению поступления цитрата донору, и увеличивается риск развития
дітратной гипокальциемии. Первыми симптомами гипокальциемии являются
парестезии, которые могут перерасти в мышечные судороги, тетанию и остановку
сердца-
Можно увеличить скорость потока и избежать цитратных реакции путем изоли¬
рованного применения гепарина* или в комбинации его с цитратом. При исполь¬
зовании гепарина* требуется значительно меньше цитрата, или его не применяют
совсем, а скорость потока крови увеличивается. Однако гепарин* может привести
к системным нарушениям коагуляции у донора, поэтому высок риск развития
обширных гематом или других серьезных кровотечений. Кроме того, может прои¬
зойти образование необратимых агрегатов клеток в случае длительного хранения
концентрата КППК, поскольку за это время гепарин* может метаболизироваться.
В связи с этим, если гепарин* был использован в качестве антикоагулянта при афе¬
резе, к конечному концентрату клеток необходимо дополнительно добавлять
цитрат для предотвращения образования сгустков.
Напротив, изолированное применение цитрата при увеличении потока при афе¬
резе возможно, если донору вводить дополнительное количество кальция внутри¬
венно через линию возврата крови. При этом следует соблюдать осторожность,
чтобы не допустить передозировки кальция.
Опыт проведения аферезов гранулоцитов и тромбоцитов свидетельствует,
что если исходную скорость потока крови донор переносил хорошо, то уровень
цитрата и кальция останется стабильным в течение всей процедуры, и признаки
цитратных реакций будут отсутствовать. Однако опыт аферезов с обработкой
больших объемов цельной крови для получения концентрата КППК показал,
что симптомы цитратных реакций появляются через 2-3 ч после начала сбора,
несмотря на стабильную скорость потока крови. Тщательный анализ фармако¬
кинетических параметров кальция и цитрата показал, что их уровень во время
процедуры не является стабильным, если используют схему введения, принятую
при обычном сборе гранулоцитов, тромбоцитов и концентрата КППК. В этих
ровнях цитрат накапливается, а уровень кальция падает. Именно поэтому, пока
донору КППК не будет дополнительно внутривенно назначен кальций, сохраня¬
ются симптомы гипокальциемии.
Во время процедур с обработкой больших объемов происходит некоторое
снижение количества циркулирующих клеток CD34\ но, несмотря на это, даже
8 конце афереза сбор эффективен. Следует помнить, что с увеличением времени
* донор теряет большое количество эритроцитов и тромбоцитов. Обработка
большого объема крови оказывается эффективным методом повышения выхода
четок CD34', но при этом следует помнить, что у донора есть риск развития кли¬
нически выраженной тромбоцитопении.
ЦІ СЛУЖБА КРОВИ
Сбор гиювохтвчвсхнх стволовых клеток с использованием центрального
венозного катетера
Не всегда возможно использовать периферические вены для сбора концеитп-
КППК. Ряд здоровых взрослых не обладают венами на обеих руках, достаточна*!
для обеспечения необходимой скорости потока. В некоторых случаях nenndJ
рические вены могут быть использованы ДЛЯ осуществления первой процедур
но пункционная травма, нанесенная вене, может препятствовать повторному &
использованию. В этих случаях концентрат КППК можно собирать с прими*,
нием широкого двухпросветного катетера, помещенного в центральную вещ
Этот катетер должен быть специально предназначен для проведения гемодиализ
или афереза.
Постановка центрального венозного катетера (ЦВК) сопровождается неболь¬
шим, но реальным риском таких осложнений, как кровотечение или инфициро¬
вание либо, в зависимости от места постановки, пневмотораксом. Риск указанных
осложнений составляет приблизительно 1%. Постановка ЦВК сама по себе более
опасная процедура, чем проведение мобилизации клеток и их сбор. Возможный
риск можно снизить только в случае осуществления всех манипуляций с ЦВК
высокопрофессиональным персоналом под контролем УЗИ или других методов
получения изображения. Постановка ЦВК в бедренную вену элиминирует риск
пневмоторакса, и эти катетеры доноры хорошо переносят.
Если доступны два HLA-совместимых донора для одного реципиента, и один
из них обладает двумя хорошими периферическими венами, способными выдер¬
жать процедуры афереза без использования ЦВК, а другой - нет, то предпочте¬
ние следует отдать человеку с лучшим венозным статусом. Поскольку проблемы
с венами не всегда можно предусмотреть, все доноры должны быть заранее про¬
информированы о потенциальной необходимости и возможном риске при поста¬
новке ЦВК.
Ведение донора после сбора концентрата клеток-предшественников
из периферической крови
Оценка количества тромбоцитов
После сбора КППК у донора может возникнуть клинически значимая тромбо¬
цитопения. При обработке 8-10 л цельной крови донор теряет около 4x10й тром¬
боцитов при каждом сборе ГСК, и уровень тромбоцитов снижается на 30%. После
сбора двух концентратов КППК с обработкой 10 л крови каждый раз у 20-23%
доноров количество тромбоцитов оказывается менее 100хЮч/л. Доноры с низким
уровнем тромбоцитов составляют группу риска развития кровотечений в течение
1 нед после анафереза.
В отличие от доноров тромбоцитов, чей уровень тромбоцитов начинает восста¬
навливаться немедленно после афереза, у доноров КППК восстановление тромбо¬
цитов отсрочено. Количество тромбоцитов остается на уровне, зарегистрирован¬
ном сразу после процедуры, в течение 2 сут и лишь затем начинает увеличиваться.
Уровень тромбоцитов восстанавливается до исходного к 7- 10-м суткам, затем пре¬
вышает его к 14-м суткам, после чего возвращается к исходным значениям к концу
3-й недели после афереза.
Причина снижения уровня тромбоцитов комплексная: часть тромбоцитов пере¬
ходит в концентрат КППК. но и назначение Г-КСФ сопровождается снижением
их количества. Группа исследователей назначала здоровым индивидуумам Г-КСФ
в лозе 10 мкг/кг в сутки в течение 5 сут. после чего определяли показатели обшего
анализа крови без последующего афереза КППК. Было установлено, что количе¬
ство тромбоцитов значительно снижалось в день после последнего введения пре¬
парата, и восстановление не начиналось еще, как минимум. 2 сут. Восстановление
показателей уровня тромбоцитов отмечено на 7-10-е сутки, затем он поднялся
ПОЛУЧЕНИЕ ГЕМОПОЭТИЧЕСКИХ СТ80Л08ЫХ КЛЕТОК ПЕРИФЕРИЧЕСКОЙ КРШ
31«
-f исходного, после чего опять вернулся на исходный уровень. Этот волноо*
мь1й процесс идентичен динамике показателя количества тромбоцитов у дона*
Подвергшихся стимуляции Г-КСФ в аналогичном режиме, а затем осуществив
■дії «чаймо КППК.
/шиї количества лейкоцитов
у доноров концентратов КГІПК также отмечают легкую транзиторную лейкопе-
i течение 2-3 нед после проведения двух аферезов. Абсолютное количество
||(ЗтрофИЛОВ снижается до 0,9-1,0x107 л у 10% доноров, подучавших Г-КСФ
«зе 10 мкг/кг в сутки перед сдачей двух концентратов КППК. Количество ней-
^рфйЛОВ может быть низким в течение 1-2 нед. Несмотря на снижение кодиче-
сбанейтрофилов, инфекции не являются клинической проблемой. После афере
й»также отмечается некоторое снижение количества лимфоцитов.
Снижение числа лейкоцитов может быть следствием перехода ГСК в концен-
*іт КППК. У доноров отмечено снижение количества циркулирующих клеток
0)34' в течение 2-3 нед после донации. Снижение количества нейтрофилов и юте
jo! CD34' не зарегистрировано у индивидуумов, получивших Г-КСФ. ко не осу
ществивших донацию клеток. Это подтверждает предположение перехода ГСК
й циркуляции в концентрат КППК.
Безопасность доноров и катамнез
В нескольких исследованиях прослежено состояние здоровья доноров в течение
да после афереза. Показатели анализа крови, включая лейкоциты, находились
на уровне, зарегистрированном до мобилизации, а у самих доноров не отмечено
проблем со здоровьем. Кроме того, количество Т-, В-лимфоцитов и естественных
киллеров также находилось в пределах нормальных значений через год после
афереза. но присутствовала легкая моноцитопения. Это свидетельствует о том.
что сбор ГСК, мобилизованных ГСК не оказывает негативного влияния на здоро-
вье донора. Тем не менее необходимо отслеживать здоровье всех доноров в тече¬
ние многих лет. чтобы выявить минимальные побочные эффекты назначения
Г-КСФ или афереза клеток.
СЛИСОК ЛИТЕРАТУРЫ
Amrolia P., Gapar Н. В.. Hassan A. et al. Nonmyeloablative stem cell transplantation for con-
genital immunodeficiences // Blood. - 2000. - N 96. - P. 1239-1246.
Anderlini P.. Giralt S.. Andersson B. et al. Allogeneic stem cell transplantation with tludarabine-
bas.ed less intensive conditioning regimens as adoptive immunotherapy in advanced Hodgkin's
£see//Bone Marrow Transplant. — 2000. — N 26. - P. 615-620.
Champlin R.E., Smitz N.. Horowitz M.M. et. al. Blood and stem sells compared with bone mar
row as a source of hematopoetic cells for allogeneic transplantation / і Blood. - 2000. - N 95. - P.
1792-3709.
Childs R., Chemoff A., Contentin N. et al. Regression of metastatic renal-cell carcinoma after
nonmyeloablative allogeneic peripheral-blood-stem-cell transplantation ; і N. Engl. J. Med. -
2000. - N 343. - P. 750-758.
Bolan C.D., Greer S.B., Cecco S. et al. Comprehensive analysis of citrate effects during platelet -
pheresis in normal donors // Transfusion. — 2001. — N 41, — P. 1165- 117L
Kowfey S.D., Donaldson G.. Lilleby K. et al. Experiences of donors carolled in a randomized
of allogeneic bone marrow or peripheral blood stem cell transplantation, / Blood. - 2001. -
NW. - P. 2541-2548.
Plazbecker U., Prange-Krex G.. Bornhauser M. et al. Spleen enlargement in healthy donors
^®4G-CSF mobilization of peripheral blood stem cells // Transfusion. — 2001. - N 41. -
*1*4-189.
kwtkj.. Dawson M.A., Maloney D. G. Normal T. B. NK cell counts in healthy donors at 1 year
blood stem cell harvesting (letter) // Blood. — 2000. — N 95. — P. 2993-2994.
Глава 12
емобезопасность
'haemovigilance}
ИСТОРИЯ «HAEMOVIGILANCE»
K началу 1990-х годов стало очевидно что высокие дости*
в технической области не избавили трансфузионнуїа^^^®
от ошибок и осложнений, связанных с переливанием крови Jtor
вопросы клинической безопасности были мало исследойайй и00*6
бовали изменений в профессиональном подходе к переливав^
крови.
Первые работы по организации системы мониторинга ошибок,
реакций и осложнений, связанных с переливанием компонентов
крови, были инициированы в связи с массовым заражением паци¬
ентов через переливание крови во Франции в 1991 г. Ответом на эти
события стали создание в 1992 г. Национального трансфузионной
комитета, а в 1993 г. — разработка и внедрение национальной
системы наблюдения и предупреждения, охватывающей все этапы
заготовки и переливания крови, включающей также анализ небла¬
гоприятных случаев, связанных с переливанием крови, и направ¬
ленной на предотвращение их повторения. Система получила
собственное название — «haemovigilance» (в отечественной литера¬
туре используется несколько вариантов написания этого термина -
гемобезопасность, гемовиджиленс).
На общеевропейском уровне «haemovigilance» получила разви¬
тие в июне 1995 г., когда Совет Европы опубликовал резолюцию
и постановление по «Безопасности крови и самообеспечению сооб¬
щества продуктами крови человека». Цель проекта н привлечение
общественного внимания к проблеме безопасности крови.
Впервые термин «haemovigilance» появился в документах
Европейского Сообщества, когда Еврокомиссия предложила соз¬
дать систему обмена информацией о реакциях и осложнениях
между странами-участницами Евросоюза. В рамках проекта было
запланировано внедрение системы мониторинга рисков и опасно
стей, связанных с заготовкой и переливанием компонентов кров
а также разработка руководства по осуществлению мониторив •
Были определены цели, методы и средства, необходимые дли
дания сети «haemovigilance».
В том же году на V Региональном (IV Европейском) к
грессе Международного общества переливания крови в &ен
(Италия) впервые был организован симпозиум «Процент
“haemovigilance” в трансфузионной медицине». Симпозиум
ГЕМОБЕЗОПАСНОСТЬ (HAEMOVIGILANCE) 321
что «haemovigilance» следует понимать как часть системы обеспечения каче¬
на в трансфузионной медицине и определил основную функцию системы - сбор
связанных с переливанием компонентов крови. В то же время было при-
^ что не все виды данных одинаково значимы, но те, которые действительно
необходимо собирать и анализировать.
84 Первьій европейский семинар по «haemovigilance» был организован фран¬
кским агентством Song в Бордо (Франция) в 1997 г. Эта встреча была очень
олезной и имела важные последствия: в феврале 1998 г. была предпринята
юпытка организовать европейскую сеть «haemovigilance». В том же году в Лионе
/франция) был проведен II Европейский семинар по «haemovigilance», а в 1999 г.
Европейская Комиссия выпустила отчет о результатах функционирования евро*
пейской сети «haemovigilance».
g 2000 и 2001 гг. прошли III и IV семинары «haemovigilance». на которых были
рассмотрены вопросы организации и работы системы; ее статус - должна ли
система быть добровольной или обязательной; виды и структура необходимых
данных по донорам и продуктам крови, их использование и прослеживаемость.
Горячо обсуждался вопрос разработай системы сообщений об осложнениях и соз-
дания веб-сайта как средства связи.
Вместе с формированием европейской сети началось создание национальных
программ «haemovigilance».
«Haemovogilance» в европейском законодательстве
Директива Европейского Союза 2002/98/ЕС от 27 января 2003 г., устанавли¬
вающая стандарты качества и безопасности заготовки, обследования, приготовле¬
ния, хранения и применения крови и компонентов крови человека, содержит ряд
определений, относящихся к «haemovigilance»:
• «серьезный неблагоприятный эпизод» - непредвиденное событие, связан¬
ное с заготовкой, обследованием, переработкой, хранением и выдачей крови
или ее компонентов, которое может привести к смерти, угрозе жизни, потере
Трудоспособности или инвалидности пациента, а также госпитализации,
продлению срока лечения или развитию заболевания;
• «серьезная неблагоприятная реакция» — непредвиденный (клинический)
ответ донора или реципиента, связанный с взятием или переливанием крови
или ее компонентов, который может привести к смерти или угрозе жизни,
инвалидности, госпитализации, увеличению срока лечения или развитию
заболевания;
• «haemovigilance» — система мер наблюдения за серьезными неблагоприят¬
ными или непредвиденными эпизодами или реакциями у доноров и реципи¬
ентов, а также наблюдение за эпидемиологическим статусом доноров.
«Дочерняя» Директива 2005/61/БС содержит положения, устанавливающие
требования к созданию системы прослеживаемости доз крови и компонентов,
атакже системы регистрации и анализа информации о побочных реакциях с целью
предупреждения их повторения.
Одна из основных целей, установленная Европейскими директивами, - созда¬
ние единой системы информирования о серьезных побочных эффектах и реакциях
при заготовке, переработке, обследовании, хранении и применении крови и ком¬
понентов крови человека.
В статьях 15 и 29 Директивы 2002/98/ЕС сформулированы требования к отчет-
Носги по неблагоприятным осложнениям, а также формы извещений:
* страны-участницы Европейского Союза обязаны передавать в компетент¬
ний орган управления информацию о любых серьезных побочных эффек¬
тна (осложнениях или ошибках), относящихся к заготовке, обследованию,
переработке, хранению и использованию крови и ее компонентов, а также
322 СЛУЖБА КРОВИ
о серьезных побочных реакциях, наблюдаемых в течение или после
фузии, которые могут быть связаны с качеством и безопасностью кпо*^-
компонентов;
1 страны-участницы должны внедрить единую форму уведомления о
ных побочных эффектах;
• учреждения службы должны внедрить процедуру эффективного и К
лируемого отзыва крови и ее компонентов в случае получения уведо^^'
об осложнениях, связанных с трансфузией крови. л?и*я
Статья 8 Директивы устанавливает требование к организации инспекций ■
гих контрольных мероприятий, осуществляемых уполномоченным органон Vn
ления при получении сообщения о серьезных побочных реакциях ИЛИ Прип*
зрении на них.
Кроме тех определений «haemovigilance*, которые установлены в Европейс» •
директиве, существует множество других. Самые простые — это «проспеллив
МОСТЬ», ИЛИ «способность проследить каждую индивидуальную единицу кро
компонентов крови ИЛИ продуктов крови ОТ донора ДО ее Применения ИЛИ Меси
нахождения*. Прослеживаемость — действительно основа «haemovigilance*, а щ
системы заключается в установлении и регистрации причин побочных эффектов
с целью их предупреждения. Прослеживаемость донорской крови и ее компонента
следует понимать как возможность идентификации донора и реципиента гемогранс-
фузии. а также результатов исследований на этапах заготовки, переработки, хра¬
нения, транспортировки, клинического (или другого) использования при помощи
регистрации организациями донорства крови и ее компонентов и иными медицин¬
скими организациями соответствующих данных в учетных формах.
Европейское «Руководство по приготовлению, использованию и обеспече¬
нию качества компонентов крови*, которое получило международное признание
как «золотой стандарт* Службы крови, определяет «haemovigilance» как «...органи¬
зованную систему процедур наблюдения за серьезными неблагоприятными реак¬
циями или эпизодами у доноров или реципиентов и эпидемиологическим статусом
доноров*. Этот документ, разработанный Комитетом по переливанию крови Совета
Европы, ответственным за его составление и актуализацию, используют как нацио¬
нальный стандарт не только европейские страны. Его также применяют в Новой
Зеландии, Китае, Молдове и других странах, которые взаимодействуют с Советом
Европы и имеют статус наблюдателей в Комитете по переливанию крови.
В настоящее время системы «haemovigilance» действуют более чем в двух десят¬
ках стран. Большинство из них входят в европейскую сеть «haemovigilance» -
EHN.
Рабочая группа «haemovigilance» Международного общества переливания крови
(ISBT) объединяет участников со всех континентов, ведет совместную работу
с EHN по разработке принципов наблюдения за функционированием трансфузи¬
онной цепи от донора до реципиента и стандартизации элементов системы мони¬
торинга побочных эффектов трансфузий.
На встрече рабочих групп EHN и ISBT в 2006 г. на Конгрессе ISBT, который про¬
ходил в Кейптауне (ЮАР), были утверждены и опубликованы стандартные опреле
ления «haemovigilance», а также классификатор реакций и осложнений, связанны
с переливанием крови. Элементы стандартизации данных, разработанные рабочими
группами, обеспечили возможность сравнения информации, получаемой в разных
системах, и создания условий для отчетности на международном уровне.
Основополагающий принцип системы «haemovigilance», принятый при обшей
согласии, ~ отчетность без указания виновника неблагоприятной реакции
или эпизода, и неприменение дисциплинарных действий по отчетным случая*
Данный принцип является важным условием, обеспечивающим выявление рисков
и опасностей в трансфузионной цепи с целью их устранения и предупреждения
ГЕМОБЕЗОПАСНОСТЬ (ИАЫЖМвМИСЕ) 323
довпвйсш сеть «haemovigilance» (European «Haemovigilance» Net - EHN)
gyiN была образована в 1998 г., в нее вошли Бельгия. Франция. Люксембург.
Нидерланды- Португалия.
Позднее к европейской сети в качестве действительных участников при¬
соединились Дания, Финляндия. Греция, Ирландия. Великобритания. Исландия,
Хорватия и ряд других стран.
Швейцария, Норвегия, Австралия, Канада. Новая Зеландия имеют статус
наблюдателей.
Своей главной задачей EHN считает повышение безопасности крови на евро¬
пейском уровне, раннее выявление неблагоприятных реакций н с этой целью
развивает и поддерживает общие подходы к обеспечению безопасности крови
и продуктов крови человека.
В рамках EHN разрешен обмен достоверной информацией между участниками
н поощряется их совместная деятельность по мониторингу побочных эффектов
переливания крови, ускоренное оповещение или своевременное предупреждение
о возможных рисках.
EHN оказывает помощь странам-участницам системы в организации нацио¬
нальных систем «haemovigilance», предоставлении источников информации,
в обмене данными по серьезным неблагоприятным реакциям и результатам
их изучения, а также организации обучения вопросам «haemovigilance*.
За годы функционирования системы проведено 10 ежегодных образовательных
семинаров, внедрена Интернет-система быстрого оповещения стран-участниц.
Благодаря вовлечению в систему многих мировых лидеров и специалистов
службы крови, EHN со временем стала в большей степени интернациональной,
чем европейской, системой.
Для того чтобы оценить реальный риск, сопровождающий переливание крови,
необходимо не только организовать сбор и анализ информации. С целью обе¬
спечения возможности сравнения данных и оценки различий в обеспечении без¬
опасности трансфузий в разных странах, а также выявления причин осложнений
информация должна быть стандартизована и гармонизирована.
В полномочия Комиссии EHN входит разработка средств стандартизации про¬
цессов и формы отчетности, а также составление общей «матрицы* для сбора
и анализа данных, полученных в национальных системах европейских стран.
ИСТОРИЯ «HAEMOVIGILANCE» В РОССИИ
Началом «haemovigilance* в России можно считать 1965 г., когда Министерством
здравоохранения СССР была утверждена «Инструкция по вскрытию трупов лид.
умерших от гемотрансфузионного осложнения*.
Следующим шагом, направленным на изучение побочных эффектов в перелива¬
нии крови, стала утвержденная в 1966 г. схема передачи сообщения о возникшем
осложнении (приказ М3 СССР №407). Приказ обязывал руководителей подраз¬
делений передавать информацию об осложнении в местные органы здравоохране¬
ния и главному врачу региональной станции переливания крови.
В 1971 г. М3 СССР утвердило методические рекомендации ♦Гемотрансфузиоя-
ные реакции и осложнения», а в 1974 г. — методические указания «Предупреж¬
дение несовместимости при переливании крови, клиника и лечение гемстрансфу-
зионных осложнений».
Благодаря этим документам, последовательно аккумулирующим опыт я знания
о побочных эффектах переливания крови, к 1985 г. в трансфузионной медицине
сложились системные представления о посттрансфузионных осложнениях и путях
их предупреждения, которые были реализованы в приказе М3 СССР №700
«О мерах по дальнейшему предупреждению осложнений при переливании крови,
ее компонентов, препаратов и кровезаменителей*.
t
324 СЛУЖБА КРОВИ
Этот документ, изданный задолго до официального упоминания «haem™
Ішсе» I Европе и создания европейской сети «haemovigilance», определил*110'1®'
ные принципы и механизм функционирования системы регистрации а 8"
и предупреждения посттрансфузионных осложнений. ’ ализ*
В этом документе впервые (в том числе в Европе) был предложен системный
ход к анализу и предупреждению побочных эффектов при переливании крови °°а
Важным элементом развивающейся системы стало назначение специалі.
учреждения, ответственного за оказание консультативной и практической пом
по посттрансфузионным осложнениям. Им стал Центральный НИИ гематол^
и переливания крови Минздрава СССР. В институте было создано специали
рованное отделение, которое обеспечивало систематическую консультативні
помощь и, при необходимости, прием больных с посттрансфузионными ОСЛОЖНИ
ниями для лечения в клинике.
Были также определены основные причины посттрансфузионных осложнений'
• переливание крови, несовместимой по системе АВ (0) и резус-фактору;
І использование консервированной крови, ее компонентов и препаратов
с истекшими сроками годности или инфицированных в процессе заготовки
хранения или непосредственно в процессе применения;
і развитие у реципиента посттрансфузионного гепатита в результате перели¬
вания крови, ее компонентов или препаратов, контаминированных вирусами
гепатита;
і использование крови и кровезаменителей без учета показаний и противопо¬
казаний к их применению или с нарушением методики их введения.
Для рассмотрения случаев посттрансфузионных осложнений была назначена
Центральная комиссия, в задачи которой входил анализ причин, вызывающи
осложнения, и разработка мероприятий по их предупреждению.
В этом приказе, который действует и в настоящее время, содержится подробная
инструкция по организации мероприятий при возникновении посттрансфузион¬
ных осложнений, предусмотрена ежегодная научная обработка и анализ материа¬
лов комиссии с целью выявления причин наиболее часто встречающихся осложне¬
ний, выработка конкретных рекомендации по их устранению.
В 2004 г. М3 Российской Федерации был издан приказ №82 «О совершенствова¬
нии работы по профилактике посттрансфузионных осложнений», который, кроме
положения «О Центральной комиссии», утвердил также Положение о территори¬
альной комиссии по профилактике посттрансфузионных осложнений и учетную
форму извещения о посттрансфузионном осложнении.
В отличие от предыдущего состава Центральной комиссии, в которую входили
в основном специалисты Центрального НИИ гематологии и переливания крови,
в нее вошли специалисты разных профилей: организаторы здравоохранения,
трансфузиологи, гематологи, анестезиологи-реаниматологи, хирурги, акушеры-
гинекологи, педиатры и др.
Задачи центральной комиссии были расширены, при их успешной реализации
планировалось создание единой системы учета посттрансфузионных осложне¬
ний, организационно-методическое обеспечение и координация деятельности
территориальных комиссий по профилактике посттрансфузионных осложнении.
С этой целью комиссия наделялась дополнительными функциями и полномочия¬
ми по разрешению спорных вопросов расследования посттрансфузионных ослож¬
нений, установления показаний и противопоказаний к трансфузионной терапии,
оценке эффективности проведенных мероприятий.
Планировались заседания комиссии на регулярной основе и ежегодная отчет¬
ность перед Министерством здравоохранения.
Более чем на два десятилетия опередив разработку основ «haemovogilance»
в Европе, суть которой составляет системный подход к анализу посттрансфузион-
ГЕМОБЕЗОПАСНОСТЬ (HAEMOVIGILANCE j 325
осложнений с целью их предупреждения, в дальнейшем российская система
^неэффективной.
„{ЗОР СТАТУСА СИСТЕМЫ «HAEMOVIGILANCE» В НЕКОТОРЫХ СТРАНАХ
Законодательство в области «haemovigilance* в разных странах различно,
везде существуют законы, регулирующие «haemovigilance*. В Австрии,
f омании, франции, Нидерландах, и Швейцарии отчетность по неблагоприят¬
ным реакциям обязательна. В Дании обязательно только сообщение по инфек-
то же время достоверно известно, что при наличии законодательных требова-
„Й к обязательной системе учреждения не всегда сообщают о неблагоприятных
^уведомление на добровольной основе внедрено в Бельгии, Греции. Ирландии.
Люксембурге, Швеции и Великобритании.
Во многих странах программы «haemovigilance» являются приоритетным
правлением в развитии службы крови. Существующие различия в определениях
«haemovigilance» в разных странах не так велики, в концепциях - более суще¬
ственны.
В одних странах системы уже внедрены и функционируют, в других только соз¬
даются или рассматривается возможность их создания.
Южно-Африканская Республика
Система «haemovigilance» внедрена в 2000 г. и организована на национальном
уровне.
В соответствии с законодательством больница на добровольной основе сооб¬
щает учреждению службы крови о побочных эффектах, связанных с трансфузия¬
ми. Учреждение службы крови совместно с больницей исследует данный случай
и сообщает Комитету по «haemovigilance», который, в свою очередь, направляет
отчет Министерству здравоохранения.
Отчет 2001 г. содержит 69 случаев побочных эффектов на 814 894 заготовлен¬
ных единиц эритроцитной массы (8,5 ошибки на 100 000 ед.).
6% случаев - серьезные; смертельные — отсутствуют. Корректирующие меры
не принимались.
Соединенные Штаты Америки
Система «haemovigilance» в национальной службе крови не организована.
FDA (Национальное управление контроля за качеством лекарственных средств)
требует отчетности только о смертельных случаях, связанных с переливанием
крови.
FDA проводит обучение больниц правилам составления отчета по осложнени¬
ям, связанным с компонентами крови.
Центры крови обязаны сохранять данные об исследовании осложнений.
Программа «haemovigilance» внедрена Американским Обществом Красного
Креста.
В 2001 г. зарегистрировано 47 случаев на 7 100 000 заготовленных единиц цель¬
ной крови:
І бактериальная контаминация — 23 случая, из них 13 подтвержденных (1 смер¬
тельный);
І трансфузионное легочное повреждение (TRALI) - 16 случаев: донорские
антитела, определенные по HLA, — 11 (2 смертельных); гранулоциты -2;
HLA и гранулоциты — 2; антитела пациентов — 1 (смертельный);
' Другие осложнения у пациентов — 8 случаев: анафилактическая реакция — 1;
фебрильная — 2; гемолитическая — 2; другие — 3.
326 СЯЮЮМКГОвИ
Кшда
Система «haemovigilance» внедрена в апреле 2001 г. — пилотный пло*
анищт; на национальном уровне — в 2002 г. 4 чро-
В соответствии с законодательством отчетность добровольная. Клиник,
кы сообщать Министерству здравоохранения провинций (администрати**** ^°ла-
ниц) о серьезных реакциях и смертельных случаях, связанных с трансбу ^ еД*-
На национальном уровне отчет обязателен только о серьезных случая31*8*01'
В отчетах 4 провинций за 2001 г. сообщено о 66 серьезных ин*
Корректирующие меры не принимались. Лентал
Гондурас
Система «haemovigilance» не организована.
Законодательством установлена обязательная отчетность о побочных э<и
В учреждениях Службы крови внедрена процедура реагирования на иіве'Щ
о серьезных побочных эффектах, связанных с трансфузиями. f||i
В 2001 г. об осложнениях официально не сообщалось, при этом известно о
смертельных случаях. Корректирующие меры не принимались. ^
Бразилия
Национальная программа была внедрена в 100 «пилотных» больница в июн
2006 г. | не
Больницы должны информировать Министерство здравоохранении о побоч¬
ных эффектах на добровольной основе.
Отчетных данных нет.
Китайская Народная Республика
Система повсеместно не внедрена.
Почти все учреждения Службы крови принимают и исследуют обращения
(жалобы) о побочных эффектах переливания крови.
Таиланд
Программа «haemovigilance» внедрена в 2001 г.
Отчетные данные: АВ(0)-совместимость — 3 случая на 100 000 переливаний,
смертельные случаи -1 на 200 000 переливаний. Совместимость по другим груп¬
пам - 1 случай на 500 000. Смертельных исходов не отмечено.
Вирусные инфекции: HIV -1 случай на 1 000 000; HBsAg - 1 случай на 200000;
HCV - 1 случай на 500 000; малярия - 1 случай на 1500 000.
Бактериальные инфекции - 0.
Другие: CMV -1 случай на 700 000.
Индия
Система «haemovigilance» на шщональном уровне не внедрена.
Сообщения о побочных эффектах в Орган по контролю за лекарствами (кото¬
рый также реіулирует деятельность центров крови) поступают нерегулярно.
Япония
Система «haemovigilance», организованная на национальном уровне, внедрена
в 1993 г.
Больницы должны на добровольной основе представлять отчет Министерству
здравоохранения о тяжелых или редких побочных эффектах. , _
В отчете 2001 г. сообщено о 1290 случаях; большинство из них (1115 случаев)
негемолитические реакции. Корректирующие меры не принимались.
Вьетнам
Программа «haemovigilance» не внедрена, планируется организовать на наДО
нальном уровне.
ГЕМОБЕЗОПАСНОСТЬ (HAEMOVtG&ANCE) 327
НСТРаЛИ* .
Систем «haemovigilance» внедрена на национальном уровне.
8 отчете 2010 г. сообщается о 294 случаях побочных эффектов.
Новая Зеландия
Система «haemovigilance» организована на национальном уровне.
Больницы должны на добровольной основе сообщать о побочных эффектах.
я отчете 2005 г. отмечен 271 случай (257 реципиентов), в отчете 2010 г. 635
случаев-
„HAEMOVIGILANCE» В ЕВРОПЕ
Франция
Система «haemovigilance» организована на национальном уровне в 1994 г.
Больницы должны в обязательном порядке извещать о побочных эффектах
переливания крови во Французское агентство по безопасности крови и продук¬
те крови — главный национальный орган контроля. Отчетность обязательна
как для учреждений службы крови, так и для клиник.
В отчете 2001 г. сообщалось о 7500 случаях реакций (на 2,5 млн трансфузий
зрйроцитсодержащих компонентов, или 300 на 100 000), в 2010 г. - 10 018, в том
числе 440 Серьезных на 538 506 перелитых доз компонентов.
Соединенное королевство
Национальный орган контроля — NBA (Национальное управление крови).
Система «haemovigilance» организована на национальном уровне в ноябре 1996 г.
Больницы должны на добровольной основе извещать SHOT (Комитет по серьез-
ным трансфузионным осложнениям) о побочных эффектах.
В отчете 2001 г. сообщалось о 283 случаях на 3,5 млн выпущенных эритроцитных
компонентов (8,1 на 100 000), а в 2009 г. 1279 реакций, классифицированных в соот¬
ветствии с тяжестью и уровнем причинной связи с переливанием крови.
Германия
В1998 г. был введен в действие Закон о переливании, регулирующий функцио¬
нирование системы «haemovigilance», организованной на национальном уровне.
Уполномоченным органом «haemovigilance» определен Институт Пауля
Эрлиха.
Больницы обязаны сообщать о реакциях и осложнениях, связанных с транс¬
фузиями, в учреждение Службы крови и в Институт Пауля Эрлиха. Кроме того,
учреждение Службы крови должно регулярно предоставлять в Институт Пауля
Эрлиха сведения о легких неблагоприятных реакциях.
В отчете 2001 г. сообщалось о 230 случаях (5,5 на 100 000 донаций):
* 6 перелитых компонентов, инфицированных гепатитом С (перелиты в 1988-
1990 гг.);
|рщ ВИЧ (год переливания — 2000);
• 5 бактериальных инфекций, возможная или вероятная связь которых с про¬
дуктами крови была установлена;
1218 иммунных реакций.
Корректирующие меры не принимались.
Отчетность по неблагоприятным реакциям в Европейской сети «haemovigilance» (EHN)
Одна из задач «haemovigilance* — сообщение о побочных эффектах или непред-
8"*нных эпизодах, связанных с клиническим применением компонентов донор-
1X011 Чюви. Организация отчетности — сложная задача, решение которой зависит
01 согласованного взаимодействия учреждений службы крови и клиник и требует
32$ свммягам
щфдого кругозора и знаний в области технологий получения ком
; кроем, і трансфузионной медицине, иммуногематологии, микробиологци°Не,+То8
миологии, а также I менеджменте качества. • эпнде.
Причиной неблагоприятной реакции или осложнения может стать отк
ОГЭЮМШфованного сценария в каждом отдельном звене трансфузионной 0ї1Єи**е
от донора до реципиента. Сообщение о неблагоприятном инциденте в п '
ЯМ кроен должно содержать доказанную причину, потенциальную (Bervf^488' I
ЯЯИСШКП ИЛИ обоснованную неопределенность. Р°вП|уі0) I
Количество и сроки годности продуктов крови, полученных ИЗ ОДНОЙ ДО
различны, поэтому время их действительного использования также мож°Нациі1,1
различным. В случае выявления вреда, причиненного реципиенту в ^ЬГгь I
переливания одного из компонентов, например зараженных бактериямиИЬТаїе I
боцитов. МОЖНО быстро известить учреждение Службы крови, трансфузи Tp°v* I
кабинет или клиническое отделение больницы. Это сообщение позволит п°„ННЫЙ I
вратить выдачу или переливание дозы эритроцитов или свежезамороженной ^ I
мы, приготовленных от той же донации, от которой были заготовлены тромбп 33 I
ты, на основании потенциального прогноза неблагоприятной реакции. I
Этот пример показывает, что система извещения должна состоять из лш™
й*»ул ЭЛр» I
ментов: I
« системы быстрого оповещения/своевременного предупреждения;
• системы отчетности по неблагоприятным реакциям на переливание комп I
нентов ІфОВИ. 0
Для своевременного принятия решений и мер, направленных на предупрежде- I
ние побочных эффектов терапевтического использования лабильных продуктов I
крови, процесс передачи информации должен быть стандартизован. С этой целью I
Комиссия Европейской сети «haemovigilance» (EHN) разработала формы сроч- I
ного оповещения и отчетности по неблагоприятным реакциям на переливание I
компонентов крови. Проект формы сообщения, разработанный на рабочей ветре- I
че и горячо обсуждавшийся на семинаре EHN, был одобрен всеми участниками I
на IV семинаре в Афинах в 2001 г. Для того чтобы внедрить этот документ в дей- I
ствующие системы «haemovigilance» и использовать единый формат отчетности I
по неблагоприятным эпизодам во всех европейских системах, дискуссии были I
организованы в каждой из стран-участниц.
Форма сообщения о реакциях и осложнениях сопровождается формой «руко- I
водства пользователя», которое предназначено для помощи в заполнении формы. I
В зависимости от типа и серьезности сообщаемого случая определены последую- I
щие анкетные опросы для получения более детальной информации.
Классификация неблагоприятных побочных эффектов, связанных I
с переливанием крови
Каждый отчетный инцидент классифицируют как серьезный или несерьезный.
Серьезный инцидент определен как неблагоприятный случай, если в результате
него:
• требуется госпитализация или длительное пребывание в клинике:
• наступила постоянная или существенная недееспособность;
• требуется медицинское или хирургическое вмешательство для предотвраще¬
ния ущерба или ухудшения функций органов тела;
• наступила смерть или серьезное временное либо постоянное заболевание
(заболевания).
Существует множество факторов, влияющих на физиологический статус пациен
Я, получающего трансфузию крови, например дополнительное медикаментозн
лечение, которое может вызывать реакцию или другие существенные изменен
в статусе пациента. Для классификации случая необходимо установить взаим°
вязь реакции с переливанием, но определить, связана ли реакция или осложне
с переливанием крови, можно только с большей или меньшей степенью веро
ности (табл. 12-1).
ГЕМОБЕЗОПАСНОСТЬ (HAEMOVIGILANCE) 329
1 взаимосвязь реакции с переливанием крови
Й 1* , — —
Саязь маловероятна
Сязь возможна, вероятна
Связь вероятна
Поясненне
Нет достаточных данных для установления причинной связи
Имеется очевидное основание (свидетельство), не вызывающее сомне¬
ний в том, что случай относится к причинам, не связанным с компонен¬
тами крови
Имеются очевидные свидетельства для отнесения случая к другим при¬
чинам, не связанным с компонентами крови
Имеющиеся данные не позволяют отчетливо установить причинную
связь случая с компонентами крови
Имеется очевидное свидетельство в пользу отнесения случая к компо¬
нентам крови
Имеется очевидное свидетельство, не вызывающее сомнений в причин¬
ной связи случая с компонентом крови
L-JЖ ■
Реакции, являющиеся результатом трансфузии крови и ее компонентов
Определения разработаны Рабочей группой EHN по определению неблагопри-
событий вследствие трансфузий (ЕСТ) (табл. 12-2-12-5).
Тип
Определение
Цн компонент/продукт
КООВЙ
Пациенту был перелит компонент крови, который не соответствовал 1
требованиям или был предназначен для другого пациента
Острая гемолитическая реакция
идругие серьезные острые реакции
«осложнения
Реакция, развившаяся в течение 24 ч после переливания компонента 1
крови, исключая случаи острых реакций из-за переливания непра- 1
вильного компонента крови; основная задача в их оценке — исклю- 1
чение бактериального загрязнения компонента крови или гемолиза 1
из-за несовместимости эритроцитов
Отсроченная реакция при перелива¬
нии компонентов крови
Реакция, развившаяся через 24 ч после переливания компонентов 1
или продуктов крови. Обычно происходит задержка развития гемоли- 1
тической реакции из-за развития антител к эритроцитам. Простое раз- I
витие аллоантител без положительного DAT или очевидного гемолиза
Негемолитическая
реакция (NHFTR)
умеренная
Повышение температуры не более 1,5 °С от основной и никаких дру-1
гих признаков гемолиза или инфекции
умеренная/
серьезная
Увеличение температуры более 1,5 °С от основной с выраженным j
ознобом без признаков гемолиза или инфекции,
TRALI
Выраженные диспноэ и гипоксия с двусторонним легочным пораже- I
нием, развившиеся в пределах 6 ч после переливания компонентов I
крови, без другой очевидной причины
Реакция «трансплантат против
хозяина» (TA-GvHD)
Классические признаки лихорадки, выраженной дисфункции печени, I
диареи и панцитопении, появившиеся через 1-6 нед после пере¬
ливания компонентов крови без другой очевидной причины; диагноз I
подтверждается биопсией кожи и присутствием циркулирующих
лимфоцитов донора
посттрансфузионная пурпура (РТР)
Тромбоцитопения, возникшая через 5-12 сут после переливания зри- I
троцитов, связанная с присутствием у пациента антител, направленных I
против НРА-системы (антигены тромбоцитов человека)
Аллергическая
Реакция
незначительная
аллергическая
реакция
Кожная реакция, характеризующаяся преходящей крапивницей
или другой кожной сыпью; отсутствие лихорадки или других при¬
знаков
анафилактическая
реакция
Анафилактические реакции охватывают диапазон разных симптомов,
таких как свистящее дыхание, бронхослазм. отек гортани и гипотензия
■нцягариая перегрузка (ТАСО)
Перегрузка объемом, ведущая к сердечному отказу с признаками
диспноэ, цианоза, тахикардии и гипертонии вследствие задержки
жидкости и отека, в течение 24 ч после переливания
Посттрансфузионная инфекция, развившаяся после переливания ком-
330 СЛУЖБДКР0ЄИ
Тип
Определение
Окончание
j Реакция, связанная с оборудова-
Неблагоприятный случай, возникший из-за неправильного
использования или сбоя оборудования, включая фильтры на
или устройства давления
I Реакция, связанная с расходным
{материалом
Неблагоприятный случай, связанный с расходным материалом
например антикоагулянтом, или использование дефективного
или контейнера, могут также включать использование несоотввтЄШка
ствующего резуспендирующего раствора
Любой неблагоприятный случай, который в настоящее в реши»—
вестен или признан связанным с переливанием компонентов км
(или продуктом), или тот, который не соответствует никакой BDVrnl
из представленных категорий v’ w
Таблица 12-3. Трансмиссивные заболевания
Инфекционный агент
Вирусная инфекция
Бактериальная
инфекция
Определение
Реципиент имеет очевидные признаки вирусной посттрансфузионной инфекций^
при очевидном отсутствии инфекции до переливания;
хотя бы один компонент, полученный инфицированным реципиентом, был заго¬
товлен от донора, у которого была обнаружена та же самая инфекция;
хотя бы один компонент, полученный зараженным реципиентом, был шщЩщ
рован инфекционным агентом
Инфекция, клинически подозреваемая
Если в течение 4 ч после переливания появились следующие признаки:
лихорадка >38,5 °С или повышение температуры на 1,5 °С от предтрансфузион-
ного состояния;
озноб;
тахикардия >120 в минуту или увеличение количества ударов на 40 в минуту
от предтрансфузионного состояния, или повышение или снижение систоличе¬
ского давления на 30 мм рт. ст.
Возможная инфекция
Клинически подозреваемая инфекция, обусловленная:
обнаружением роста бактерий в перелитом компоненте крови, отсутствием
роста бактерий в крови пациента, или обнаружением роста бактерий в крови
пациента, и отсутствием роста бактерий в перелитом компоненте крови, если
обнаружение культуры в крови пациента находится в связи с переливанием
и отсутствуют другие причины для роста бактерий в крови пациента
Подтвержденная инфекция
Обнаружение того же самого роста бактерий в крови пациента и в перелитом ком-
поненте крови
Обнаружение паразитарной инфекции в крови реципиента при отсутствии других
причин, кроме трансфузии
Паразитарная
инфекция
Таблица 12-4. Иммунные реакции при переливании
Реакция
Определение
Гемолитические транс-
фузионные реакции
HTR клинически подозревается, присутствует один или большее количество при¬
знаков:
лихорадка и разнообразие других признаков (включая диспноэ, гипотензию, тахи¬
кардию, боль в спине и т.д.);
неадекватное повышение уровня гемоглобина после переливания эритроцитов;
повышение уровня гемоглобина (>2 г/дл в течение 24 ч);
повышение LDH (>50% в течение 24 ч);
повышение билирубина, свободного гемоглобина (в плазме или моче), уменьше¬
ние гаптоглобина.
Реакции могут быть далее определены как острые или отсроченные.
HTR-подтверждение:
положительный прямой антиглобулиновый тест,
положительное перекрестное определение эритроцитов.
Два типа HTR, различимых клинически;
острая HTR — реакция происходит в течение 24 ч после трансфузии;
отсроченная HTR — реакция происходит в течение 28 сут после трансфузии
ГЕМОБЕЗОПАСНОСТЬ (HAEMOVIGILANCE) 331
Окончание табл. 12-4
ійІІІірШїїюї
Определение
ЙшВИВ
Донные реакции
быть легкой,
Щ, и тяжелой сте-
|щек)
Легкая степень:
температура тела <38,5 °С или увеличение не более 1,5 °С от првдтраисфуэи-
онного состояния в отсутствие других признаков (включая HTR и бактериаль¬
ную инфекцию).
Средняя степень тяжести:
температура тела > 38,5 °С или увеличение >1,5 °С от предтраисфузионного
состояния плюс один или несколько следующих признаков: лихорадка, озноб,
головная боль, тошнота/рвота.
При тяжелой степени клиническая картина схожа с течением средней степени,
но симптомы более выражены
|ЙрвХшЛ(Ши)
Острый респираторный дистресс-синдром:
гипоксемия (раС02/ Fi02 <300 или насыщенность кислорода <90%);
двустороннее повреждение легкого на рентгенограмме;
возникновение в течение 6 ч после переливания;
отсутствие признаков ТАСО;
отсутствие других факторов риска для возникновения острого повреждения
легкого (ALI): сепсиса, аспирации, множественной травмы, пневмонии, конту¬
зии легкого, острого панкреатита, передозировки наркотиков (лекарственных
препаратов) и др.
Возможный TRALI:
TRALI с одним или большим количеством факторов риска для AU: сепсис,
аспирация, множественная травма, пневмония, контузия легкого, острый пан¬
креатит, передозировка наркотиков (лекарственных препаратов) и др.
Подтипы TRALI:
иммунный (связанный с антителами) TRALI — подтверждено обнаружение
антител к лейкоцитам донора в крови;
неиммунный (нет связи с антителами) TRALI
Реакция «трансплантат
против хозяина»
Лихорадка, выраженная дисфункция печени, диарея и цитопения через 1-6 нед
после переливания, без другой очевидной причины;
TA-GvHD подтвержден GvHD-типичной биопсией и генетическим анализом, под¬
тверждена идентичность химеризмом лимфоцитов пациента и лимфоцитов донора
Тромбоцитопеническая
посттрансфузионная
пурпура
Пурпура и тромбоцитопения в течение 12 сут после переливания; подтвержда¬
ется обнаружением антител к тромбоцитам (обычно anti-HPA-1 а) в крови
Аллергическая реакция
Один или несколько признаков без гипотензии во время или в течение 24 ч
после переливания компонентов крови:
гиперемия;
аллергическое диспноэ (кашель, цианоз, одышка);
отек гортани;
генерализованная сыпь;
крапивница
Анафилактическая
реакция
Аллергическая реакция с гипотензией (снижение систолического давления
>30 мм рт. ст.) в течение 24 ч после трансфузии
Анафилактический шок
Шок, связанный с переливанием компонентов крови без любых признаков
шока другого происхождения
Аллоиммунизация
Формирование аллоантител к RBC, HLA, НРА и HNA-антигенам, которые
не были обнаружены до трансфузии
Аутоиммунная гемолити¬
ческая анемия
Гемолитические признаки (бледность кожи, тахикардия, гипервентиляция и т.д.)
во временной ассоциации с переливанием (передачей); подтверждается сниже¬
нием уровня гемоглобина, положительным прямым актиглобулиновым тестом
и обнаружением антител к эритроцитам, которые отсутствовали до трансфузии
Таблица 12-5. Сердечно-сосудистые и метаболические осложнения
Осложнение
Определение
ГАСО
Респираторный дистресс-синдром, тахикардия и повышение АД в течение 12 ч после
трансфузии; ТАСО обусловлен типичными признаками кардиогенного легочного отека
на рентгенограмме, обнаружением жидкости в плевральной полости и нарушением
сердечной деятельности
ЩйШ
332
СЛУЖБА КРОВИ
Осложнение
Трансфузионное
диспноэ
Гипотермия
Гиперкалиемия
Гипокальциемия
Гемосидероз
Определение
Окончанивт^, ^
Респираторный дистресс-синдром, связанный с трансфузией, и никакого свиапиГ
ства (очевидности) TRALI, аллергического диспноэ или ТАСО ^
Понижение температуры тела после переливания, заканчивающегося диспноэ щ
тензией и/или сердечной дисфункцией '
Повышение уровня калия после переливания крови, которое может закончиться а
мией
Снижение уровня кальция после переливания крови, которое может закончиться с
рогами и нарушением сердечной деятельности
Перегрузка железом, подтвержденная лабораторными результатами или биопсией
из-за хронического переливания, которое может закончиться повреждением серши
печени, легкого и/или эндокринных желез
Гипотензия
Снижение систолического давления >30 мм рт.ст. в течение 4 ч после трансфузии
и отсутствие свидетельств (очевидности) других реакций, описанных выше
Гипертензия
Повышение систолического давления крови >30 мм рт.ст. в в течение 4 ч после транс-
фузии и отсутствие свидетельств (очевидности) других реакций, описанных выше
Неизвестная реакция переливания
Неблагоприятный эпизод или реакция, связанные с переливанием крови, кото¬
рые не могут быть приписаны другим побочным эффектам или осложнениям
(определенным в табл. 12-2-12-5) и никакому другому фактору риска.
ЗАКЛЮЧЕНИЕ
Внедрение процедур «гемовиджеленс» направлено на обеспечение системати¬
ческого наблюдения за серьезными неблагоприятными или непредвиденными
эпизодами или реакциями у реципиентов компонентов крови.
Система «гемовиджеленс» предоставляет полезную информацию о заболе¬
ваемости, связанной с донорством и переливанием крови, а также служит основой
для корректирующих мер с целью предотвращения повторения неблагоприятны!
реакций.
Эффективность системы зависит от тесного сотрудничества между отделениями
клиник, где проводятся трансфузии, и учреждениями, заготовливающими компо¬
ненты крови. Больницы должны информировать учреждение службы крови обо
всех случаях серьезных неблагоприятных реакций у реципиента.
СПИСОК ЛИТЕРАТУРЫ
Руководство по приготовлению, использованию и обеспечению качества компоненто»
крови. Европейский комитет (частичное соглашение) по переливанию крови (CD-P-TS) /
Рекомендация R (95) 15-16 изд. — 2011. — 490 с.
Глава 13
выполнения процедур
трансфузиологической
гемокоррекции. Отделение
трансфузиологии и его задачи
в многопрофильной клинике
Трансфузиологическая гемокоррекция (ТГК) - важнейший
составной раздел клинической трансфузиологии. Количество мето¬
дов ТГК непрерывно увеличивается, с каждым годом растет вос¬
требованность в этих высокоэффективных методах. Не исключено,
что за время подготовки этого издания появились новые методи¬
ки или были усовершенствованы уже существующие. Несмотря
на большие потенциальные возможности методов ТГК, вопросы,
связанные с их эффективностью и применением, адекватным кли¬
нической ситуации, остаются наиболее актуальными и широко
обсуждаемыми врачами различных специальностей.
По-видимому, одна из основных причин медленного внедрения
и/или неэффективного использования имеющегося арсенала мето¬
дов ТГК в клиническую практику — отсутствие единого подразделе¬
ния, которое полностью обеспечивало бы потребности клинических
отделений в трансфузиологическом пособии - от инфузионно-
трансфузионных процедур до всего комплекса методов экстракор¬
поральной гемокоррекции (ЭКГК).
В плане организации лечебного процесса наиболее оптимален
такой подход, когда вопросы, связанные со службой крови и кли¬
нической трансфузиологией (трансфузиологической гемокоррек-
Цией), решаются комплексно. Для этого необходимо сосредоточить
высококвалифицированные кадры, дорогостоящее оборудование
и высокие трансфузиологические технологии в одном месте — отде¬
лении (отделе) трансфузиологии. Базой для формирования совре¬
менного отдела (отделения) трансфузиологии могут стать отделе¬
ния (кабинеты) переливания крови лечебно-профилактических
учреждений. Очевидно, настало время переименовать отделения
(кабинеты) переливания крови (собственно говоря, цельная кон¬
сервированная кровь практически не используется) в отделения
(кабинеты) трансфузиологии и на их базе формировать комплекс
клинической трансфузиологии - штат, оборудование, кабинеты
и пр. Это название будет действительно отражать всю полноту
334 СЛУЖБА крови
1
к многосторонность работы данного подразделения. (Необходимо особо
что впервые в законе РФ «О донорстве крови и ее компонентах» вместо °Т**ГИт1
(кабинетов) переливания крови указано: «В целях клинического испо°ТД*Лений
донорской крови и ее компонентов в организациях здравоохранения ЬЭоваНия
в качестве структурных подразделений трансфузионные кабинеты (отСОЗДа|°^л
обеспечивающие рациональное клиническое использование донорской К И|1).
компонентов, создание и хранение запасов донорской крови и ее компи **
ведение статистического учета, в том числе по посттрансфузионным п Нент°*.
и осложнениям».)
Врачи-трансфузиологи этого отделения должны решать все задачи по к
чению многопрофильного лечебного учреждения (или нескольких ОТНОСИ
небольших лечебных центров) трансфузиологическим пособием — от ком ЄЛЬ,ІІ)
тов крови и кровезаменителей до методов экстракорпоральной гемокорреки°Ней
Организация в лечебном учреждении подразделения, специалисты кото
занимаются всеми вопросами трансфузиологического пособия, позволит nef0r°
вопросы обеспечения лечебного процесса комплексно и оперативно, значител^
облегчить планирование и согласование по применению процедур ЭКГК паї»*0
терального питания, гемокомпонентной и препаратной терапии со специалистам'
других лечебных отделений — реаниматологами, анестезиологами, хирургами
лабораторной службой и др.
В зависимости от клинических задач отдел (отделение) трансфузиологии может
дополняться необходимыми видами методов ЭКГК и соответствующим потребно¬
стям лечебного учреждения объемом трансфузионного пособия.
Исходя из задач, стоящих перед трансфузиологической службой в многопро¬
фильных лечебно-профилактических учреждениях, отдел трансфузиологии целе¬
сообразно формировать из следующих служб:
• отделения Службы крови (вопросы заготовки, переработки и распределения
компонентов донорской крови);
• лаборатории трансфузионной иммунологии (сертификация крови доноров
и больных, тканевое типирование и др.);
• отделения клинической трансфузиологии (применение всего арсенала мето¬
дов трансфузиологической гемокоррекции при лечении различных патоло¬
гий, аутодонорство, реинфузии, гемодилюции и др.);
• отделения производственной трансфузиологии (карантинизация, лейкоде-
пляция, инактивация и др.);
• отделения клинической трансфузиологии (аутодонорство, реинфузия, гемо-
дилюция, экстракорпоральные методы гемокоррекции — цитаферез, плазма¬
ферез, гемодиализ, гемофильтрация, фотомодификация и др.).
Можно уверенно прогнозировать, что в ближайшие годы основной задачей
отделений трансфузиологии станет не заготовка и переработка донорской крови
(эта задача преимущественно должна решаться на станции переливания крови),
а методы клинической трансфузиологии — аутодонорство, эфферентные методы
лечения, назначение и контроль парентерального питания и др. Это главным обра¬
зом связано с новой парадигмой, определяющей развитие всей трансфузионной
медицины в целом, и клинической трансфузиологии в частности, в ближайшие
десятилетия - от компонентной гемотерапии к препаратной трансфузиологии.
Очевидно, что по мере реализации этой концепции будут уточнены клинические
задачи ТГК, разработаны новые, более совершенные и специфические методы
экстракорпоральной коррекции нарушений гомеостаза, что, несомненно, окажет
положительный эффект как на результаты, так и на сроки лечения больных.
Организация отделений клинической трансфузиологии, оснащенных соответ¬
ствующей аппаратурой и укомплектованных квалифицированными медицински
ми кадрами, позволит использовать имеющиеся в арсенале методы ТГК адекватно
ОРГАНИЗАЦИЯ ВЫПОЛНЕНИЯ ПРОЦЕДУР ТРАНСФУЗИОЛОГИЧЕСКОЙ ГЕМОКОРРЕКЦИИ 838
ческой ситуации. Только ооъединение всех методов И К в руках конкретных
^калистов, а именно трансфузиологов. облегчит решение целого ряда проблем.
с ших перед трансфузионной медициной.
^ настояшее время производственная деятельность подразделения службы
и многопрофильного стационара (кабинета или отделения трансфузиологии)
Цитирована на постоянное увеличение количества доноров с целью заготовки
Цгенной крови и получения различных ее компонентов. Наряду с совершен-
Цванием производственного направления в трансфузиологии. а также учитывая
^Анцит кадровых доноров и всевозрастающий риск переноса трансмиссивных
Лекций. особое значение приобретает развитие клинической трансфузиологии
U доедрение методов, альтернативных использованию компонентов аллогенной
крови. „ 1 _
Как было сказано выше, комплекс мероприятии, связанных с реализацией
тиансфузиологического пособия в лечебном учреждении, наиболее целесообразно
осуществлять через специализированное отделение. Эффективная организация
лечебной помощи в значительной степени зависит от работы отделении трансфу¬
зиологии. Отделение трансфузиологии должно стать центром реализации транс-
Аузиологического пособия в лечебно-профилактическом учреждении (ЛПУ).
В новых условиях, с расширением поля организационного, диагностического
и клинического действия, отделение трансфузиологии станет организационно-
методическим центром трансфузиологической службы всего лечебного учреж¬
дения. Современное отделение трансфузиологии — многопрофильное высоко¬
специализированное подразделение, позволяющее обеспечить в полном объеме
практически все потребности лечебного учреждения в трансфузиологическом посо¬
бии (рис. 13-1).
Основные задачи отделения трансфузиологии:
• агитация и пропаганда донорства (совместно с общественными организация¬
ми - Обществом Красного Креста и др.), аутодонорства, кровосберегающих
технологий;
• забор крови доноров в стационарных условиях и на выезде;
• переработка крови на компоненты (эритроцитную массу, тромбоцнтный
концентрат, свежезамороженную плазму и др.);
• карантинизация, лейкодепляция, инактивация и др.;
• хранение и распределение компонентов крови и кровезаменителей;
• обеспечение безопасности гемокомпонентой терапии;
• проведение экстракорпоральных методов гемокоррекции — гемафереза. уль¬
трафиолетового облучения крови, иммуносорбции и др.;
• проведение лабораторных исследований по изосерологической и инфекци¬
онной сертификации крови доноров и больных;
І организация и выполнение работ по аутодонорству, гемодилюция, проведе¬
ние периоперационной и постоперационной реинфузии крови;
• консультация и контроль трансфузионно-инфузионного лечения в стацио¬
наре.
Задачи отделения трансфузиологии определяют профиль работ и выполняют-
01 в рамках четырех основных направлений трансфузиологии - Службы крови
(организационные работы, заготовка крови и ее компонентов и др.); трансфуэион-
н°и иммунологии (лабораторные исследования); клинической и производствен -
вой трансфузиологии (переработка крови на компоненты, их хранение и др.):
• организационная работа —агитация и пропаганда донорства крови и плазмы,
комплектование доноров крови (ведение картотеки доноров);
• производственная деятельность — заготовка и переработка крови на компо¬
зиты, их хранение;
з»
Структура современного отделения трансфузиологии
(Единая служба крови и трансфузиологии ММА и РНЦХ)
Лаборатория
трансфузионной
иммунологии
Группа
забора крови
Доноры
Выездная бригада
Группа
донорского
плазмафереза
Группа медицинского
освидетельствования
доноров
Структура отделения трансфузиологии
Отделение
комплектования
доноров
С выездной бригадой
Отделение
клинической
трансфузиологии
Лечебное
искусственное питание
Лабораторное
отделение
Лаборатория
иэосерологической
сертификации
Лаборатория
инфекционной
сертификации
Отделение
заготовки
и переработки крови
Экспедиция
(хранение и распределение
компонентов крови
и кровезаменителей)
Вспомогательные
группы
Касса, буфет, склад
Put 13-1. Структура отделения трансфузиологии
• клиническая работа - процедуры экстракорпорального воздействия на кровь
(гемаферез), гемоквантовые методы (фотомодификация крови и др.), паренте¬
рально-энтеральное питание, определение тактики и обеспечение безопас¬
ности и эффективности инфузионно-трансфузионной терапии, аутодонорство
и аугогемотрансфузии др.;
• распределение компонентов и препаратов крови, кровезаменителей и других
препаратов для внутривенного введения, планирование и реализация транс
фузиологического и инфузионно-трансфузионного пособия и др.;
• лабораторные исследования: сертификация крови доноров и больных
определение групп крови [АВ (0), резус-фактор и др.), тканевое типирован
(шигены системы HLA и др.), определение гемотрансмиссивных инфекд0
(ВИЧ, сифилис, гепатиты В и С и др.);
ОРГАНИЗАЦИЯ ВЫПОЛНЕНИЯ ПРОЦЕДУР ТРАНСФУЗИОЛОГИЧЕСКОЙ ПЕМОКОРРЕКЦИИ 387
t обеспечение безопасности гемотрансфузий — постоянный контроль соблю¬
дения обоснованности назначения и применения компонентов и препаратов
крови;
, цаучно*педагогическая деятельность в НИИ и вузах отделения выпол¬
няют исследования по научным программам и темам, ведут подготовку
специалистов-трансфузиологов, проводят занятия по вопросам трансфузио¬
логии с врачами смежных клинических специальностей. Ь
g настоящее время производственная мощность отделения трансфуэиоло-
ми (переливания крови) зависит от двух основных условий — коечного фонда
Їд5ьема крови, используемой в лечебном процессе. Например, отделения транс-
ьузиологии организуют в клинических стационарах мощностью более 150 коек
!/цли потребностью в крови и ее компонентах не менее 120 л в год. Как показыва-
•Ї практика, такой подход безнадежно устарел и не позволяет адекватно отвечать
„а все трансфузионные потребности клиники. Отделения трансфузиологии необ¬
ходимо организовывать и укомплектовывать штатами и соответствующим обо¬
рудованием, исходя из современных возможностей трансфузиологии и тех задач,
которые стоят перед лечебным учреждением, - обеспечение всех клинических
подразделений полным комплексом трансфузиологического пособия; компоненты
донорской крови, аутодонорство, кровезаменители, экстракорпоральные проце¬
дуры, лабораторная диагностика гемотрансмиссивных инфекций, серологические
тесты, парентеральное питание и др.
Сотрудники отделения трансфузиологии повышают квалификацию и специали¬
зацию врачей по вопросам трансфузиологии, внедрения в практику новых транс¬
фузионных средств, техники переливания крови, ее компонентов и препаратов,
кровезаменителей, методов определения групповой принадлежности крови, про¬
ведения индивидуальной совместимости переливаемой крови, по методам и про¬
цедурам, обеспечивающим безопасность трансфузиологических процедур.
Отделение трансфузиологии многопрофильной клиники осуществляет свою
многостороннюю деятельность по заявкам клинических отделений, в тесном кон¬
такте с лабораторными подразделениями, ОПК (отделениями переливания крови,
кабинетами трансфузиологии) и станциями переливания крови (СПК), Центрами
крови сторонних организаций, Обществом Красного Креста (рис. 13-2).
крови доноров компонентов крови
и больных
ЩЩ Связи отделения трансфузиологии с лечебными, лабораторными и сторонними подо-
^пениями и учреждениями
Особое место в работе отделений трансфузиологии занимает консультативная
ч лечебная помощь при посттрансфузионных реакциях и осложнениях.
131 СЯУЖМ КРОЄМ
Отделение трансфузиологии постоянно контролирует качество за
крови, ее компонентов и обеспечивает условия хранения и распреде п°ТОВДяеМо-
фузионных сред по заявкам лечебных подразделений клиники. 6Ния транс
Внедрение в практику работы лечебного учреждения и активное
специальных методов гемотерапии - заготовка и применение аутокп ^ИМєнєнир
крови, экстра- и ингракорпоральное облучение, гемосорбция, паш> ВИ' а<^Рез
витание и другие вопросы, относящиеся к разделу клинической транссЬ P4lNoe
составляют важнейшую задачу отделений трансфузиологии. ^ЗИОлогиц
В стационарах экстренной хирургии (скорой помощи, экстренной м
медицины катастроф и др.), где больных принимают круглосуточно ЄДИЦИііь>,
бразна организация в составе отделения трансфузиологии специальной^46**000'
бригады с соответствующим оснащением, которая будет выполнять весь к ^Ноі*
трансфузиологических задач в вечернее, ночное время, в воскресные и §н МПлекс
ные дни (рис. 13-3). разднич-
Дежурная трансфузионная бригада
Отделение клинической трансфузиологии
Компенсация острой
кровопотери
и профилактика развития
коагупопатии
Получение аутокрови
и ее компонентов
Обеспечение безопасности
аутокомпонентов
7 Дежурная 'г*
{трансфузионная I
бригада і
Иэосеропогическая диагностика
и приготовление компонентов крови
по подбору
Организация и проведение
реинфузии
и аутогемотрансфузий
Профилактика и лечение
гнойно-септических
осложнений
Организация и проведение
операций
экстракорпоральной
гемокоррекции
Трансфузионный аудит
Рис. 13-3. Задачи дежурной трансфузионной бригады
В оказании экстренной помощи больным и пострадавшим, поступающим
в стационар, трансфузиология занимает важное место. В рамках идеологии мини¬
мизации применения компонентов донорской крови, в стремлении к внедрению
«бескровной хирургии» особое место в многопрофильных стационарах скорой
медицинской помощи занимает аппаратная реинфузия. Совершенствование меди¬
цинской технологии проведения интраоперационного трансфузионного пособия
требует применения аппаратов, позволяющих в автоматическом режиме отмывать
эритроциты (типа Cell Saver), обеспечивающих быстрый забор крови из серозных
полостей или операционной раны, ее разделения, отмывания и быстрый возврат
клеточных компонентов на фоне продолжающегося сбора и переработки ауто¬
крови. Это требует создания в штате ОПК круглосуточной трансфузионной бри¬
гады, состоящей из врача-трансфузиолога и операционной медицинской сестры.
Основные задачи бригады: круглосуточная инфузионно-трансфузионная терапия,
определение показаний и проведение реинфузии, предоперационная заготовка
аутокрови, процедуры плазмафереза, УФО крови и другие методы ТГК, изосеро-
логический контроль трансфузионной терапии.
Врач-трансфузиолог, находясь непосредственно в операционной, совмести
с хирургом и анестезиологом проводит экспертную оценку объема и степе
ни тяжести кровопотери, участвует в проведении интенсивной инфузионнои
ОРГАНИЗАЦИЯ ВЫПОЛНЕНИЯ ПРОЦЕДУР ТРАНСФУЗИОЛОГИЧЕСКОЙ ГЕМОКОРРЕКЦИИ
339
13-4. Организация обеспечения многопрофильного клинического центра трансфузиологиче-
м пособием: А — до реорганизации; Б — после реорганизации
терапии (ИТТ), направленной на компенсацию гиповолемии
пациента из шока. Трансфузиолог решает вопрос о необходимости
^Сообразности интраоперационного использования аутокрови и выборе наи-
340 стаж* крови
боме эффективного трвнсфузионного пособия. В распоряжении дежурной тп.
фішііпггї бригады находятся запасы компонентов, препаратов крови и кпп с'
миттелей. которые обоснованно применяют интраоперационно для восполї?1'
кровопотери я коррекции системы гемостаза (крахмалы, тромбоцитная м*
шшарепшттат). Клиническая деятельность врачей-трансфузиологов в „а<4
операционном периоде включает организацию и проведение операций экстг^ '
поральной гемокоррекции, ірансфузионньїй аудит. | р КоР'
Примером организации современных отделений, использующих весь а
нал трансфузиологического пособия, могут служить отделение трансфузії**'
РНЦХ им. академика Б.В. Петровского РАМН и отделения клинической и ПроГИи
водственной трансфузиологии с круглосуточной дежурной трансфузионной
Щ НИИСП им. Н.В. Склифосовского (рис. 13-4). ■ Т
Можно ожидать, что в многопрофильных лечебных учреждениях, благодап
разработке и внедрению в практику новых кровезаменителей, крЬвесберегаЮщ^
технологий, медикаментозных методов коррекции гемограммы и гемостаза, объем
работ отделений трансфузиологии, относящийся к разделу клинической трансф».
зиоаогии, будет увеличиваться. • _1
КЛИНИЧЕСКАЯ
трансфузиология
Глава 14. Трансфузиологические методы
гемокоррекции
Глава 15. Основные средства
трансфузионно-инфузионного пособия
Глава 16. Инфузионно-трансфузионная терапия
при критических состояниях
Глава 17. Кислотно-основное равновесие
и водно-электролитный баланс
Глава 18. Кровопотеря и принципы
ее компенсации в экстренной хирургии
Глава 19. Аутодонорство и аутогемотрансфузии
Глава 20. Гемотрансфузии при анемиях
Глава 21. Диссеминированное внутрисосудистое
свертывание крови
Глава 22. Посттрансфузионные реакции
Глава 23. Парентеральное питание
Глава 14
Твансфузиологические методы
гемокоррекции
Одним из наиболее интенсивно развивающихся разделов кли¬
нической трансфузиологии является направление, связанное
с использованием высокотехнологичных методов, позволяющих
воздействием на кровь или другие жидкие среды больного вне
организма (экстракорпорально) достигать прогнозируемого кли¬
нического эффекта.
Всю историю медицины можно рассматривать как поиск раз¬
личных способов поддержания обменного равновесия в организме.
При ряде патологических изменений важнейшее значение для под¬
держания гомеостаза организма приобретает своевременная коррек¬
ция метаболических нарушений, связанных с интоксикацией орга¬
низма эндо- и экзогенными токсинами. В настоящее время в целях
Детоксикации организма используют различные методы. Наиболее
простые способы выведения из организма ядов и токсинов известны
с глубокой древности — рвотные, желчегонные, слабительные, моче¬
гонные, потогонные средства. Для удаления из организма вредной
крови на протяжении многих столетий прибегали к кровопусканию.
. Широкому внедрению различных методов экстракорпорального
воздействия на жидкие среды организма способствовали техниче¬
ский прогресс и разработка современных приборов — аппаратов
искусственного кровообращения, диализаторов, сепараторов крови
и др. Значимость экстракорпоральных методов в комплексе совре¬
менных лечебных мероприятий трудно переоценить. Например,
разработка и широкое использование гемодиализа позволяют под¬
держивать удовлетворительное качество жизни у сотен тысяч
пациентов с терминальной стадией хронической почечной недо¬
статочности. В настоящее время применяют несколько десятков
видов высокоэффективных экстракорпоральных методов на основе
центрифужной, сорбционной, мембранной, электрохимической,
преципитационной, перфузионной и других технологий. Пик соз¬
дания новых высокотехнологичных экстракорпоральных методов
пришелся на последние 20-25 лет. В обычных условиях организм
функционирует как саморегулирующаяся система, и равновесие
в обмене веществ достигается путем сложного координированного
взаимодействия различных систем организма: нервной, эндокрин-
н°й, иммунной и др. При стрессе (а любое заболевание, травма
или хирургическая операция - стресс для организма) механизмы
саморегуляции нарушаются. Наряду с другими страдает функция
Детоксикации, включающая обезвреживание не только чуждых
344 клмничссшшнсжузиология
организм компонентов, но и избытка его собственных метаболитов. Накоп
в Организме чужеродных токсичных веществ ведет к экзотоксикозу. и>е
естественных метаболитов также приводит к эндотоксикозу, причиной к<5?*
может стать накопление субстратов любой биохимической структуры, разл^
по электрохимическим свойствам и молекулярной массе. Эндогенные токси!^
вещества образуются в результате нормального обмена веществ или ауто*
некроза и других процессов, в том числе патологических. В обычных ус*?*1,
функционирования организма они выводятся наружу или подвергаются йа'***
ным химическим превращениям путем окисления, гидролиза, метилиров ’
восстановления и образования парных соединений, протекающих с учао?*’
значительного количества ферментных систем. В условиях стресса и сбоя в ада
ционных механизмах детоксикациоиная функция организма нарушается, щш •!!!*'
состояние экзо- или эндотоксикоза прогрессирует и достаточно часто выхо
на первый план в клинических проявлениях заболевания.
Токсины любого происхождения принято классифицировать согласно их мо
кулярной массе, способности растворяться в воде или жирах и электрохимии!
скому заряду. Полная характеристика токсина (токсинов), вызвавшего состоят»
экзо- или зндотоксикоза, позволяет определить адекватный способ детоксикация
I каждом конкретном случае. В зависимости от размера молекул токсины делят
на низко-, средне-, крупномолекулярные вещества и сверхвысокомолекулярные
соединения. Низкомолекулярные токсины имеют молекулярную массу до 500 Да.
Это прежде всего вода, различные ионы, креатинин, мочевина, катехоламины,
гистамин, серотонин и многие другие вещества.
Среднемолекулярные токсины, которым приписывают основную роль в инток¬
сикации при большинстве заболеваний, имеют молекулярную массу от 500
до 5000 Да. Сюда относят большинство биологически активных веществ: гормоны,
витамин В12, брадикинин, лейкотриены, простагландини, продукты деградации
фибриногена и др.
Молекулярная масса крупномолекулярных токсинов — от 5000 до десятков
тысяч дальтон. Эта группа веществ представлена белками и липопротеидами.
Сверхвысокомолекулярные соединения характеризуются молекулярной массой
в миллионы дальтон: белковые соединения, иммунные комплексы, растворимые
комплексы фибринмономеров, криоглобулины, криофибриноген и др.
По физико-химическим свойствам токсины делят на водо- и жирораствори¬
мые, положительно и отрицательно заряженные. Основную массу токсичньп
и условно патологических субстратов относят к водорастворимым субстратам.
Жирорастворимыми являются, к примеру, большинство токсинов при печеночной
недостаточности.
Знание основных свойств веществ, так или иначе задействованных в патогенезе
того или иного заболевания, позволяет выбрать адекватный метод экстракорпо¬
ральной гемокоррекции.
Важным этапом в формировании трансфузионной медицины явились разра¬
ботка и внедрение методов, позволяющих активно воздействовать на извлечен¬
ные из организма жидкие среды (кровь, ее компоненты, лимфу, спинномозговую
или асцитическую жидкость и др.). Такие воздействия получили название экс¬
тракорпоральных, т.е. осуществляемых вне организма. Разработаны и успешно
используются методы воздействия на свойства крови интракорпорально, напри
мер внутрисосудистое лазерное облучение крови. Методов, позволяющих через
влияние на кровь или ее компоненты оказывать воздействие на отдельные
или организм в целом, в настоящее время более 50. Постоянно разрабатываю1
новые методы и совершенствуют прежние.
За последние 10 лет неоднократно предпринимались попытки систематики^
•атъ и упорядочить разрозненную информацию о методах воздействия на жид**
ТРАНСФУЭИОЛОГИЧЕСМИЕ МЕТОДЫ ГШЖОРИЕКЦМ 345
•и организма. Однако, несмотря на все усилия, до настоящего времени нет
яого общепризнанного термина, позволяющего обозначить совокупность всех
методов* отсутствует единый методологический подход к их систематизации.
JjLpa используют различные термины, подчас не совсем соответствующие той
^иной Процедуре: «эфферентные методы*, «методы Эфферентной терапии*,
экстракорпоральной детоксикации», «методы экстракорпоральной гемо-
рекиии*. «методы афереза», «гравитационная хирургия крови», «тералевтиче*
«ййаферез» и пр.
дд. Абдуллаев (1995) предложил классифицировать экстракорпоральные ™
иетодй следующим образом.
• Стимуляция функций органов и систем, выведение токсинов и их удаление
(аферез) через естественные интракорпоральные мембраны с помощью
медикаментозных средств (рвотные, слабительные, мочегонные, желчегон¬
ные, потогонные), немедикаментозных средств (электро-, терма», свето*.
магнито», лазеротерапия), перитонеальный и кишечный диализ.
, Удаление токсинов с экстракорпоральным воздействием на кровь и ее фракции.
• Разделение (сепарация) крови с удалением отдельных ее компонентов
и их адекватным замещением (интраферезом) разными способами:
- центрифужным (гравитационным) - изоволемическая гемодилюция.
плазмаферез, цитаферез (лейкоцит-, гранулоцит-, лимфоцит-,
эритроцит-, бластоцит-, тромбоцит-, мегакариоцитаферез);
- фильтрационным (мембранным) — гемо-, плазмо-, криофилырация;
каскадная плазмафильтрация, изолированная ультрафильтрация
с удалением избытка воды (акваферез);
- центрифужно-фильтрационным;
- диализным (гемодиализ);
- диализно-фильтрационным (гемодиафильтрация);
- отстаиванием во флаконах (ручной плазма- или эритроцитаферез).
• Удаление с поглощением (сорбцией) избытка патологических субстратов
на поверхности или в глубине различных сред - гемо-, плазмо-, лимфо-,
шшуносорбция.
• Моделирование детоксикационной функции печени, электрохимическое
окисление.
• Дренирование лимфатического протока с выведением лимфы (лимфаферез).
• Кровопускание (гемаферез).
Авторы монографии «Эфферентная терапия» (под ред. АЛ. Костюченхо.
2000) объединяют все существующие методы экстракорпорального воздей¬
ствия на жидкие среды организма под термином «экстракорпоральные методы
гемокоррекции». Под экстракорпоральной гемокоррекцией авторы понимают
направленное количественное и качественное изменение клеточного, белкового,
водно-электролитного, ферментного, газового состава крови путем обработки
ее вне организма. При этом эфферентные и неэфферентные экстракорпораль¬
ные воздействия объединены под одним термином - «эфферентная терапия*.
Классификация процедур экстракорпоральной гемокоррекции приведена по сте¬
пени их селективности (по К.Я. Гуревичу, с дополнениями).
• Неселективные методы:
Ф обменное переливание крови;
Ф плазмаферез;
• гемосорбция;
Ь неселективная плазмосорбция.
* Условно селективные методы:
^ гемодиализ; =:У
№ 346 (жш*сш1Ю€0гэютпя
|§ гемоднафильтрация;
+ каскадный алаэмафсреэ (каскадная плазмафильтрация); Н
р лршронитаферез:
♦ лейкоонтаферсз.
♦ іршбаккгаферез;
♦ ярмояреципитация (термофильтрация);
♦ Яриояреюглитация (криоаферез);
4- фюмаэмосорбция;
4 кислотная гепариновая преципитация;
4 военоперфузия.
« Селективные методы;
■ ♦ иммуносорбция:
4 аффинная сорбция:
4 биоспецифическая сорбция.
Авторы «Эфферентной терапии» выделяют шесть различных технологи* I
тываюших Вое экстракорпоральные методы гемокоррекции:
I мембранную - гемодиализ, ультрафильтрацию, гемофильтрацию, гемоли I
фильтрацию, олязмофильтрацию, гемоксигенацию;
• центрифужную - лейкоцит-, тромбоцит-, эритроцит-, плазмаферез;
• сорбционную - гемо-, плазмо-, лимфосорбцию, ксеноперфузню;
• преципитационную - кислотную гепариновую преципитацию, криопрещД
цитацию (криоаферез), криоплазмосорбцию, термопреципитацию (термої
фильтрацию, термогоиомосорбци ю); ■
• электромагнитную - фотомодификацию крови (ультрафиолетовое и лазер-'
ное облучение, облучение видимым светом, магнитную обработку крпмД
рентгеновское облучение крови); Н
• электрохимическую - непрямое'электрохимическое окисление, озонирова-Н
ниеяроам.
В зависимости от длительности и особенностей операций экстрвкорМфбМИйН
гемокоррекции выделяют процедуры прерывистые (продолжающиеся Ш 6 ч)Н
I продолженные (от 6 ч до нескольких суток). O.K. Гаврилов и А.О. Гаврилов I
(2001) - авторы термина «гравитационная хирургия крови» — делят экпрамрН
поральные методы на 4 класса;
1) экдоваскулярная реконструктивная хирургия крови — лазерные, аэроион-И
ные, электрохимические, мембранные методы, искусственное кровообра-И
щенке, управляемая гемодилюция, нанохирургия (генная, протонная, мог!
тронная);
2) экстракорпоральная реконструктивная хирургия крови - гравитационные.И
сорбционные, фильтрационные, фотонные методы, УФО, гемодиализ, ЩЩ
фузия через клеточные субстраты, иммуносорбция;
3) ампутационная (аферезная) хирургия крови - гема*. плазма-, цитафер&И
аферез липидов, липонротеидов, отдельных фракций белков плазмы, ум*‘1
ние токсинов яе ксенобиотиков.
4) восстановите лъно-заместительная хирургия крови - методы гемотрансфу*■
зим, трансфузии плазмы, плазмоэамешающих растворов, клеточных и яле-!
мемных компонентов крови, трасплантация костного мозга, стволовых I
вотворных клеток. I
ЮЛ. Шевченко и соавт. (2003) разделяют методы воздействия на жидкие сред?1
организма на экстра- и интракорпоральные. К последним относят перитонеадь
вый, кишечный диализ, энтеросорбцию и т.д.
AII Постникоа (2003) подверг анализу методы прямого очищения
(по приводимой здесь терминологии - эфферентные) и разделил ИХ по СП0С
«ыделеиив составляющих на следующие группы.
ГРАНСФУЗИОПОГИЧбШб МЕТОДЫ гщаамгекцц Ые
Крввоизвлеченне: ™
^ аоаонушит;
» кровопускание с восполнением ОЦК кровезаменителями;
$ обменное переливание крови.
, Кроворвзделение:
♦ гравитационное - эритроцит-, тромбоцит- лейкоцит-. лимфощтгаФеш
плазмаферез (плазмозамещение), криоплазмафереэ;
♦ фильтрационное - плазмаферез. гемо-, ультра-, каскадная фильтрация
, Диффузия; гемодиализ, гемодиафильтрация,
« Сорбция:
+ гемосорбция — ^специфическими и специфическими сорбентами;
+ олазмосорбция - неспецифическими и специфическими сорбентами
криошшмасорбция.
• Экстракция — гемо-, плазмоэкстракция.
. Ксеяоорганоперфузия - ксеносплено-. ксеиогепато-, ксеиогепатощггмм
перфузия.
• Сочетанное применение различных методов очищения крови.
Наряду с разделением методов прямого очищения крови по способам малече
нйя компонентов А.А. Постников различает их по составу удаляемой фракции:
» гемафереэ:
♦ гемофракциаферез — цитаферез. плазмаферез;
Ф плазмофракциаферез — удаление комплекса веществ:
- крупномолекулярных — каскадная фильтрация, криоплазмафгрез,
криоплазмосорбция, гемо- и плазмоэкстракция;
- средне- и мелкомолекулярных - гемофильтрация, гемодиііфнльтрация,
гемосорбция, плазмосорбция, гемо- и плазмоэкстракция;
- мелкомолекулярных — гемодиализ, ультрафильтрация:
• избирательное удаление отдельных соединений: аффинная сорбция, нмму-
носорбция:
« биологическая органная иммитация: ксеноцитогепато-, ксеноцнтоспяено-.
кееноцитогепатоспленоперфузия.
Приведенные классификации, отличаясь друг от друга в деталях, имеют много
общего. В частности, они не охватывают все существующие методы экстракорпо¬
ральных воздействий. Например, не рассмотрены некоторые методы искусствен¬
ного и вспомогательного кровообращения, отсутствует единая терминология
Часто используемый термин «экстракорпоральные методы лечения» не может
полностью отражать существо процедур, поскольку охватывает не только трмкфу-
зиологические, но и все другие экстракорпоральные лечебные методы, например
экстракорпоральное оплодотворение. Даже в вопросе, считать ли экстра- и митра*
корпоральные методы терапевтическими или хирургическими процедурами,
единого мнения не существует. Многообразие существующих экстра- и иятрвкпр*
моральных методов лечения и необходимость адекватного клинической ситуация
Дифференцированного подхода к их применению требуют упорядочения термино¬
логии и понятной классификации.
Разработка протоколов, унификация, стандартизация и оптимизация ракита*
•ва методов не представляются возможными без ясности а ряде обеих вопросов,
8 значительной степени определяющих терминологию я классификацию экстра*
и яятракорпоральных (васкулярных) методов клинической тремсфузиеяапв.
Новыми являются следующие вопросы. _ ■-
Что объединяет между собой все существующие методы воздействия иа жидкие
организма?
различаются эти методы/1
_ Каиой специалист должен выполнять процедуры экстре- ■ интрекориершаей
|g ЦЦТГГГЛГТ 111II111 'II "* *""**
артыгнжтъ тот или иной метод • клинической практик#.?
Уники* отите тине единого методологического подхода, нерешенные
иробл'мы. была предпринята попытка еистематизировэть 2^
ригйпмм на анниг среды организма
(Ьмц* всего. необходимо определиться с названием для всей группы ц.,
щ| from необходимо учесть несколько важных положений. Название ж **'
асе методы воздействия на кровь (и желательно другие жидкие Г**
ортите) I экстре* и иптракорпоральные, эфферентные и неэффере^3^
Щ ГОШ М противоречить ОСНОВНЫМ положениям трансфузиологии и ***-
аМІИМід расширения для новых методов. Название должно соответсгвг
«Ноакяметуре врачебных и провизорских специальностей» М3 Рф>
Ш специалист, работающий с кровью больного и донора как с '
бым видом жидкой ткани).
Поскольку все анализируемые методы являются сосудисто-инвазивными ГГПг,
I (экстра- или интраваскулярными) и оказывают направленное влияв
ка кровь, то их следует рассматривать исключительно как трансфузиологическТ
a m хирургические или терапевтические. Часто встречающиеся в литературе ело'
■OMWMfflli «экстракорпоральная терапия*, «эфферентная терапия*, «хирург
кроаи* «терапевтическая гемокоррекция* необходимо рассматривать только
дмвь как традиционно устоявшиеся понятия, аналогичные «переливанию крови*
цц иуишму несмотря на то, что цельная донорская кровь для гемотрансфузий
йрвкпгаскн недоступна и при необходимости проводят высокоэффективную ком¬
понентную или препаратную гемотерапию.
Экстра-1 интракорпоральные (васкулярные) воздействия приводят к определен¬
ным изменениям качественного и/или количественного состава крови, т.е. первона¬
чально происходит гемокоррекция с последующими опосредованными изменения¬
ми и тканевом обмене веществ, с чем и связаны лечебные эффекты процедур.
0 состоянии органов и систем организма, безопасности и эффективности при¬
меняемых методон гемокоррекции, как правило, судят на основании результатов
лабораторных исследований периферической крови.
1 настоящее время и в обозримом будущем управление гомеостазом организма
посредством изменения качественного и количественного состава жидких сред
организма в подавляющем большинстве случаев будет осуществляться целена¬
правленным непосредственным воздействием на кровь или ее компоненты.
И( ходя из вышеизложенного, всю группу методов, позволяющих посредством
воздействия на кровь изменять функциональные показатели организма, можно
обозначить под общим названием методы трансфузиологической гемокоррек-
нии (МТГК), а способ воздействии трансфузиологическая гемокоррекция (ТГК).
что достаточно полно и содержательно отражает существо всей этой группы
лечебно-диагностических медицинских процедур.
Трансфузиологическая гемокоррекция представляет собой группу целенаправ-
ленных экстра и интракорпоральных (васкулярных) воздействий (биологиче
ских, химических физических или фармакологических) на морфологический
состав и физические свойства крови или других жидких сред организма (отдель-
ных компонентов крови, лимфы, спинномозговой или асцитической жидкости,
раиеаот отделяемого и т.д.) в целях управления функциями тканей, органе*
I систем организма.
Трансфузиологическая гемокоррекция центральная задача клинической
траигфузиолоеии. Под термин «трансфузиологическая гемокоррекция* подій
дяюг и все процедуры, связанные с трансфузией компонентов крови (донорской
или аутологичной) и кровезаменителей, в том числе препаратов парентеральной
питания. І настоящей главе трамсфузионно-инфузионная гемокоррекция компо
ментами крови и кровезаменителями рассматриваться не будет. Этот вопрос дост»
тииггґтшіпг ггг л методы гщщргрі»* 341
__g о&етеи в одлгкі монографиях, учебных пособиях троттітки
указаниям
большинство трансфузнологических процедур включает иеоо-
воздействие на кровь, находящуюся вне или внутри сосудистого
jjjjio отметить, что некоторые экстра- и интракорпорадьные методы,
ак пер«тонеальны“ дихш3’ экстракорпоральное воздействия на лимфу
^ввдаомозговую жидкость, нельзя строго отнести к процедурам гемокор-
4* непосредственному воздействия на кровь. Тем не менее целесообразно
je**Sn)HMTb и систематизировать небольшую группу методов, направленных
на все жидкие среды организма в рамках МТГК. поскольку в кди-
*ой практике применение одного из вышеперечисленных методов часто
с одновременным или последовательным использованием других мето-
^’^ансфузионной гемокоррекдии. Идеология, принципы и методология про-
Р сТКаневыми жидкостями сходны с методами гемокоррекции: как правило,
“'їяолняют специалисты по экстра- и интракорпоральным процедурам.
Й2Гм«тоДы ТГК прямо или опосредованно оказывают влияние на гомеостаз,
^илены на коррекцию иммунитета, реологических и гемостатнческих пара-
детоксикацию, изменения количественного и качественного клеточного
*та!й и другие параметры периферической крови, а через нее - на все основные
ЇЇенно важные органы и системы организма.
Подавляющее большинство МТГК выполняют с кровью вне сосудистого русла
(экстракорпорально); по существу они являются методами экстракорпоральной
гемокоррекции (ЭКГК). В тех случаях, когда процедура ЭКГК направлена на уда¬
ление определенного токсичного продукта, допустим термин «экстракорпоральная
детоксикация» (ЭКД). Строго говоря, при любой процедуре ТГК прямо или кос¬
венно происходят удаление или нейтрализация эндо- или экзогенных токсинов.
те. осуществляется детоксикация.
Основные механизмы воздействия различных методов ТГК на патологический
процесс и организм в целом представлены следующим образом:
• элиминация из организма экзо-, эндотоксинов и избытка метаболитов
при моно- и политоксикозах;
• иммуномодуляция (иммунокоррекция);
• коррекция обменных нарушений при болезнях накопления:
• коррекция нарушений реологии и микроциркуляции;
• полное или частичное, постоянное или временное замещение некоторых
функций внутренних органов:
• нормализация клеточного и плазменного состава крови.
Все существующие методы ТГК можно разделить на три большие группы -
тр*нсфузионно-инфузионные, эфферентные и неэфферентные (табл. 14-1,14-2).
то составляет основной арсенал клинической трансфузиологии. Это деление
основано на том, что ТГК можно осуществлять тремя основными способами:
• обогащением крови, находящейся в экстракорпоральном контуре, необходимы¬
ми физиологическими или лекарственными субстратами (экстракорпоральная
фармакотерапия); воздействием на жидкие среды физическими или физико¬
химическими способами (УФО. лазерным излучением, магнитным полем и тд.),
что составляет группу неэфферентных экстракорпоральных методов;
• ^°ле* или менее избирательным удалением из организма избыточных коли¬
честв патологических или условно патологических субстратов — группа
методов эфферентного воздействия;
изменением количественного и/или качественного состава крови инфузион-
ио-трансфузионными средствами — гемотрансфузиями (компонентами
Донорской или аутокрови), инфузиями кровезаменителей, в том числе и пре-
вДратов парентерального питания.
114-1. Шн трвнсфуэеюяопиаской гемокоррекции
Методы
ІІдаисфузиаиіо-иифгзиоииме)
эфферентные
ИЯВИВІроам к ея иомпонентое
тіми І то ■оппонентов
і ШШшЩі
!®зффеп^>-
Экстракорпоральные
Йнгракорпорапьные
ИИШиииии щИМЫ методо» трансфуэиояопечеаюй гемокоррекции
Трвнсфузионные (трансфузионно-инфузионные) методы гемокорр^
коррекция гомеостаза организма посредством внутрисосудистого введения к Г
ментов крови І кровезаменителей. °1(п0'
Эфферентные методы гемокоррекции - извлечение И последующее удал ,
из крови и других жидких сред организма различных субстратов: молекул**1*
{искусственное кровообращение), воды, электролитов (ультрафильтрация 1М
ДИ*ДНЗ), биологически активных молекул и среднемолекулярных веществ (грМ°
сорбция, гемофильтрация И др.), крупномолекулярных соединений (иммуносо^
цкя.реоаферез). компонентов жидких сред (гемаферез).
Неэфферентные МТГК - экстра- или интракорпоральные методы физическо
(например, светового или радиационного облучения), химического или фармако°
логического воздействия на кровь и другие жидкие среды организма или их ком¬
поненты без непосредственного удаления из них каких-либо субстратов.
Сочетанные МТГК - одновременное или последовательное применение только
эфферентных (или только неэфферентных) методов в течение одной экстракорпо¬
ральной процедуры или курса лечения.
Комбинированные МТГК - одновременное или последовательное использова¬
ние в течение одной процедуры или курса лечения как эфферентных, так и неэф¬
ферентных методов гемокоррекции.
Таблица 14*1 Основные эфферентные и неэфферентные методы трансфузиологической гемо-
коррекции
Методы
эффараитше
неэфферентные
[экстракорпоральны'
і ийтракорпоральные
і экстракорпоральные
интракорпоральные
[Упьтрафильтрация
' —
Ультрафиолетовое облучение крови
[Гемофильграция
—
Лазерное облучение крови
Лазерное облучение крови
Ллазмофильтрация
Радиационное облучение крови
— :
Каскадная пяаэмо-
\ —
Лекарственная обработка отдель¬
—.
фильтрация
ных компонентов крови — лейко¬
цитов, лимфоцитов и др.
Гамосорбция
Энтеросорбция
Магнитотералия
' 'іШШІ
Лшмосорбция
'
Озонотерапия
Озонотерапия -
Лнмфосорбция
Низкопоточная окейгинация
— _
Ийобросорбцня
Непрямое электрохимическое
окисление гипохлоритом натрия
Непрямое электрохимиче¬
ское окисление гипохлори¬
том натрия _J
Иммунная сорбция
—
Вспомогательное кровообращение
Вспомогательное кровообра¬
щение (внугриаортальная
баллонная контопульсацияН
Аффинная сорбция
a»**—
— ,т, —4
Плазмаферез
т
м. чі^і *—I
: -рал
1 —л
{пмадиафильтрация
[Гемодиализ I
Ш , і
(^врттонвальный
1ИВЛНЗ
Sfirv*
д» ' 1
(йшачный диализ
— | . —-1
РЩІІІІІМІїфоГ
нШщ
*
ТРАНСФУЗУЮЛОПЛЧЕСЮАЕ МЕТОДЫ ГтОКОРРЙЩИИ 551 Я
а цЩГж1,я|0Шем большинстве случаев при лечении различных заболеваний
или комбинируют различные методы гемокоррекции - трансфузионно-
^^онные. эфферентные и неэфферентные.
^І^фрдояогнческую гемокоррекцию, как эфферентную, так и неэфферент*
Jno*HO осуществлять в двух вариантах: экстра- (вне организма) и интракор-
(иитраваскулярно). Преобладают методы экстракорпорального лечеб*
^воздействия на кровь и другие жидкие среды организма, т.е. осуществляемые
^ракорпоральном контуре.
1 сшую большую группу методов в трансфузиологической гемокоррекции ™
-являют Эфферентные, которые изначально направлены на удаление из крови
«м другой жидкой среды организма одного или нескольких патологических
условно патологических) субстратов.
1 зфферентные методы ТГК направлены на извлечение и последующее удаление
крови и других жидких сред организма различных субстратов: молекул газов,
^ды, биологически активных молекул и веществ, электролитов, химических
соеДіінений или целиком жидких сред либо их компонентов.
Удаляемые субстраты могут иметь как экзогенное (поступили в организм
„3 окружающей среды), так и эндогенное (естественные метаболиты, нахопив¬
шеся в условиях патологического процесса в избыточных количествах, продукты
нарушенного обмена веществ) происхождение.
Эфферентные методы в различной степени обладают элиминирующим, деплаз-
яирующим, дренирующим, детоксикационным действием. В ряде случаев эти
яегоды позволяют замещать естественные детоксикационные и обменные функции
жизненно важных органов. Все прочие лечебные эффекты эфферентных методов
достигаются на основании их элиминирующего действия в результате множествен¬
ных биохимических и биофизических превращений в организме. Относительно
эфферентных методов в ряде случаев допустим также термин «методы экстракор¬
поральной детоксикации». В эту группу необходимо отнести искусственное крово¬
обращение, которое позволяет обеспечить перфузию и оксигенацию крови пациента
вовремя операций на открытом сердце и аорте, т.е. метод, протезирующий насосную
функцию сердца и оксигенирующую функцию легких.
Ко второй группе методов ЭКГК относят все прочие способы внешнего воздей¬
ствия на кровь и другие жидкие среды — методы неэфферентной экстракорпораль¬
ной гемокоррекции: физические, химические, фармакологические (медикаментоз¬
ные, биологические, иммунные).
При применении неэфферентных методов ТГК взаимодействие (контакт)
крови, ее компонентов или другой жидкой среды организма и воздействующего
агента (ультрафиолетовых или лазерных лучей, магнитного поля или лекарствен¬
ного средства) происходит вне организма пациента, а обработанная активным
агентом часть жидкой среды организма возвращается в организм. Неэфферентные
методы экстракорпоральной гемокоррекции применяют для усиления соб¬
ственных защитных сил организма, иммуномодуляции, коррекции агрегатного
состояния крови, активации метаболизма и естественных детоксикационных
механизмов организма. При этом активному лечебному воздействию подвергают
не всю кровь или другую жидкую среду организма, а только ее расчетную часть.
Механизм терапевтического воздействия неэфферентных экстракорпоральных
методов связан с непрямой стимуляцией собственных защитных сил организма,
ег® детоксикационной, репаративной и иммунной функций. К неэфферентным
экстракорпоральным воздействиям относят и методы вспомогательного крово¬
обращения.
Оптимизацию методов ТГК необходимо проводить на основе алгоритмов и про¬
колов для разных заболеваний, клинических состояний и ситуаций. В соот-
Ветсгвующих схемах (протоколах) должна быть отражена последовательность
352 |М№| ТРАНСФУЗИОЛОГИЯ
использования всех необходимых методов ТГК при определенном заб0;
с учетом тяжести и стадии его течения, тяжести состояния пациента, сопуІЄЕанИи
цих заболеваний и возможных клинических осложнений.
Поскольку клиническую проблему можно решить различными метода»,
перед выбором и назначением процедуры или их сочетания (комбинации) / ^
дико определиться в следующих положениях (основные вопросы частной
фузиологин).
С какой целью назначен метод ТГК?
Когда он назначен (на каком этапе заболевания, при каких симптомах)?
Каким образом?
В какой последовательности?
В каком сочетании?
Какие конкретные методы ТГК необходимо использовать при данном заболе
нии с учетом особенностей его течения (стадии, тяжести, осложнений)? а
Основная задача трансфузиолога — поиск оптимального, рационального сп
соба достижения клинического эффекта с одновременной наибольшей гарантией
безопасности процедуры и экономически выгодного способа решения проблемы
в той или иной клинической ситуации. Соответствующее сочетание симптомов
и синдромов составляет клиническую картину заболевания, а сочетание наиболее
адекватных клинической ситуации трансфузиологических методов лечения -
таблицу ТГК (табл. 14-3),
Таблица 14-3. Клиническое применение трансфузиологической гемокоррекции
Трамефузяологическая
гемокоррекция
Методы
ОЦК (ОЦП, ОЦЭ)
Инфузии кровезаменителей (кристаллоиды, коллоиды), введение препаратов
крови (растворов альбумина, протеина), трансфузии компонентов крови
(СЗП, КНП, эритроцитсодержащих сред)
Клеточного и плазменного
состава крови
Инфузии эритроцитсодержащих сред, тромбоцитного концентрата, СЗП
или ее компонентов
Белковых фракций крови
Инфузии СЗП или ее компонентов (КНП, криопреципитата), препаратов крови
(растворов альбумина, протеина, иммуноглобулинов)
Водно-электролитного
баланса и онкотического
давления
Инфузии кристаллоидных кровезаменителей, СЗП, растворов альбумина
или протеина
Метаболических нару¬
шений
Методы экстракорпоральной эфферентной гемокоррекции
Коегулопатий
При гипокоагуляции; инфузии СЗП, криопреципитата, тромбоцитного концентра
та, обменный плазмаферез с адекватным замещением удаленного объема СЗП;
при гиперкоагуляции; инфузии кристаллоидов, реологически активных крове¬
заменителей, растворов гидроксиэтилкрахмала, плазмаферез малообъемный
(до 30% ОЦП), тромбоцитаферез или сочетание с плазмаферезом
Иммунологических нару¬
шений (иммунокоррекции)
Специфическая иммуномодуляция: применение СЗП, иммуноглобулинов
специфического антимикробного действия;
нвспецифическая иммуномодуляция: парентеральная нутритиеная поддерж¬
ка, иммуноглобулины (пентоглобин, габриглобин и т.д.), УФО крови, лазерное
облучение крови, озонотерапия, экстракорпоральная фармакотерапия, плаз-
маферез
Реологических свойств
кроем и микроциркуляции
Кровезаменители реологического действия, методы эфферентной рвокор-
рекции (гемоэксфузия, эритроцитаферез, тромбоцитаферез, малообъемный >
плазмаферез или их сочетание), методы неэфферентной реокоррекции
(лазерное облучение крови, УФО крови), комбинированная экстракорпораль¬
ная реокоррекция (плазмаферез + ТАФ + УФО крови) I
Нутритиеная поддержка
Полное или вспомогательное парентеральное питание в тех случаях, когда
естественное или искусственное энтеральное питание невозможно или неэф¬
фективно —
ТРАНСФУЗИ0Л0ГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 353
Окончание табл. 14-3
Методы
I функции
гай*
Инфузионно-трансфузионные мероприятия направлены на снижение кон
центрации токсического субстрата в организме и повышение транспортной
функции альбумина и эритроцитов и т.д.
Эфферентная детоксикация (диффузионная, фильтрационная, сорбционная,
преципитационная,гравитационная).
Неэфферентная детоксикация (непрямое электрохимическое окисление гипохло
ритом натрия, озонотерапия, экстракорпоральная фармакотерапия)
ПК и экстракорпоральные эфферентные методы гемокоррекции (диффузи¬
онные, фильтрационные, гравитационные)
Предоперационная заготовка компонентов аутокрови,
-острая управляемая нормоволемичвская гемодилюция,
- интраоперационная реинфузия отмытых аутоэритроцитов из крови опера¬
ционной раны,
- послеоперационная реинфузия отмытых аутоэритроцитов из дренажной крови
Оценив
или иного
все перечисленное многообразие способов ТГК для коррекции того
симптома или синдрома, трансфузиологу предстоит выбрать оптималь-
J меЮд или их комбинацию для лечения конкретного клинического состояния.
ЦЁ структуре каждого заболевания следует выделить проблемы, требующие
Ш-Аузиологической гемокоррекции, и составить алгоритм применения мето-
VnX направленный на повышение эффективности медикаментозной и других
вариантов терапии. Алгоритм применения методов ТГК можно представить сле¬
дующим образом.
• определить, какие клинические и патофизиологические проблемы преобла¬
дают при том или ином состоянии (заболевании, его стадии);
I ВЫяснить, какие из них не могут быть эффективно решены без методов ТГК;
• найти сочетание и последовательность способов ТГК для эффективного
решения имеющихся проблем.
Назначаемые методы ТГК должны повышать эффективность друг друга, пре-
шпствовать возможным побочным реакциям и осложнениям и в целом улучшать
результаты лечения данного заболевания.
Экстракорпоральные трансфузиологические методы
гемокоррекции
В клинической практике наиболее часто применяют эфферентные методы экс¬
тракорпорального воздействия на кровь или другие жидкие среды. Удалению
из организма может подлежать любой субстрат, попавший извне и вызвавший
нарушения метаболизма и функций жизненно важных органов (печени, почек,
легких, головного мозга и т.д.), а также метаболит, накопившийся в избыточных
количествах в силу патологического процесса и вызвавший дальнейшее про¬
грессирование метаболических сдвигов и нарушения функций органов и систем.
Основными показаниями к применению экстракорпоральных эфферентных мето¬
дов служат моно- или полиэтиологичные экзо- и эндотоксикозы, болезни нако¬
пления, иммунные расстройства.
® ряде случаев целью применения эфферентных методов является частичное
^ полное, постоянное или временное протезирование утраченных или нарушен-
Ны* функций некоторых внутренних органов (табл. 14-4).
Как правило, показания к эфферентным процедурам возникают тогда, когда
аментозная и инфузионно-трансфузионная терапия имеющихся метаболи-
gWj крушений неэффективна. В ряде случаев эфферентная процедура явля-
°сновным видом лечения (например, гемодиализ), в других применяется
»1 «виц
354 миийчгемя грлнсФУзиологич
Таблица 14-4 Возможности экстракорпоральных эфферентных методов гемокоррекции
газировании функций внутренних органов
1 Органы к мстеиы организма
Замещаемая функция 1
/Комплекс -сердце-легкие»
Удаление углекислоты, насыщение крови кислородом ~——~
1 Печи
Удаление воды, электролитов, водорастворимых почечных шлаш» '—
Печено
Удаление жирорастворимых печеночных токсинов и аммиака г ~
ии дополнительный метод (плазмаферез при терапии некоторых заболеваний
или в целях профилактики возможных осложнений (цитаферез при эритерми
или аффинная сорбция при семейной гиперхолестеринемии). Важен оптимальный
выбор эфферентного метода, т.е. адекватного обстоятельствам способа, позво¬
ляющего достичь максимального клинического эффекта в каждой конкретной
ситуации. Выбор в значительной степени зависит от возможностей того или иного
метода ТГК. Все известные экстракорпоральные эфферентные методы различают¬
ся по возможности эффективного удаления из организма определенного субстрата
и механизму действия.
В основе элиминационных механизмов эфферентных методов лежат следую¬
щие физико-химические процессы (Коновалов Г. А., с дополнениями):
• диффузия;
• фильтрация (конвекция):
I сорбция;
• гравитация:
і преципитация:
I перфузия.
В соответствии с механизмами элиминационного действия различают шесть
видов эфферентных методов: диффузионные (диализные), фильтрационные (кон¬
векционные), сорбционные, гравитационные (центрифужные), перфузионные
и смешанного механизма действия (табл. 14-5).
Выделяют несколько видов сорбции:
I угольную, с помощью угольных сорбентов — гемо-, плазмо-, лимфо-, ликво-
росорбцию;
• биосорбцию, с помощью биосорбентов — альбумина, донорских эритроцитов
(эритросорбцию), ксеногенных тканей, органов или клеток (ксеносорбцию);
• иммунную;
• аффинную.
Эфферентные методы смешанного механизма действия представляют собой
сочетание вышеперечисленных методов (элиминационных механизмов).
Например, гемодиафильтрация сочетает механизмы диффузии и фильтрации,
что позволяет расширить спектр удаляемых субстратов. Метод интраоперацион-
ной реинфузии связан с получением раневого отделяемого и дренажного содержи¬
мого с последующими гравитационными или фильтрационными воздействиями.
Фильтрационные, сорбционные и гравитационные воздействия могут быть
дополнены преципитацией - Холодовой, тепловой или химической, что повы¬
шает селективность элиминационного эффекта. Например, применение гепарина*
с последующим замораживанием обрабатываемой среды лежит в основе криоафе-
реза.
Эфферентные методы смешанного механизма действия направлены на увели¬
чение спектра удаляемых одновременно субстратов и на более селективное извле¬
чение из обрабатываемой среды определенных веществ. Так, например, метод
иммуиосорбции, или иммуноаферез, в действительности представляет собой
сочетание фильтрационного или гравитационного плазмафереза и последующего
•шмолействия полученной плазмы с иммуносорбентом.
ТРАНСФУЗИОЛаГИЧЕСКИЁ МЕТОДЫ ГЕМОКОРРЕКЦИИ 355
из экстракорпоральных эфферентных методов обладает пренмуще-
^эрлечения из организма веществ определенной природы, электрохимиче-
tjj: здрядд и молекулярной массы. Так, например, диффузионные эфферентные
позволяют эффективно удалять из организма больного избыток воды,
Эолитов и низкомолекулярные водорастворимые почечные шлаки. Методы
фильтрации и гемодиафильтрации эффективны для элиминации веществ низ*
Передней молекулярной массы и относятся к способам заместительной почеч-
^ терапии. Сорбция с помощью активированного угля эффективна для удаления
^растворимых веществ низкой (>50 Да) и средней молекулярной массы, а также
Отрицательной микрофлоры и продуктов ее жизнедеятельности. Биосорбцию
?**ощьк> молекул альбумина эффективно используют при накоплении жирора-
-оримых токсинов печеночной недостаточности. Для удаления крупномолеку-
оных субстратов применяют методы каскадной плазмофильтрации, иммунной
Енной сорбции, плазмофильтрации и плазмафереза. Для удаления формен-
^хэлементов крови используют различные варианты цитафереза.
ткяща 14-5. Экстракорпоральные эфферентные методы гемокоррекции
Методы
Вид процедуры
Рекомендуемые
сокращения
рКонйые или диализные
Гемодиализ
гд
Фильтрационные или конвек¬
Ультрафильтрация
УФ
ционные
Гемофильтрация
ГФ
Плазмофильтрация
ПФ
Каскадная плазмофильтрация
КПФ
Сорбционные
Угольная сорбция:
гемосорбция
ГС
плазмосорбция
ПС
лимфосорбция
ПС
ликворосорбция
лкс
Иммунная сорбция
ИС
Аффинная сорбция
АС
Биосорбция:
ксеносорбция
КС
эритросорбция
эс
альбуминосорбция
—
Гравитационные
Плазмаферез
ПАФ
Тромбоцитаферез
ТЦАФ
Гранулоцитаферез
ГЦАФ
Лимфоцитаферез
ЛЦАФ
Эритроцитаферез
ЗЦАФ
Аферез стволовых клеток
АСК
ІПврфузнонньїе
Искусственное кровообращение
ИК
! Сиешаиного механизма дей-
Гемодиафильтрация
ГДФ
[СТВИЯ
Аутодонорство компонентов крови:
аутоплазма
АСЗП
аутоэритроцитная масса
АЭМ
аутотромбоцитная масса
ATM
Реинфузия крови:
Интраоперационная реинфузия
ИОРК
—
Послеоперационная реинфузия
ПОРК |
роме того, из организма посредством соответствующего доступа (венепункции,
чЭДоцентеза, пункции грудного лимфатического протока, спинномозговой пунк-
Мо*ет быть извлечена любая цельная жидкая среда; кровь, лимфа, спин-
Г®083» или асцитическая жидкость, раневое или дренажное отделяемое. Обычно
Др» среды организма получают для их последующей обработки различ-
^фферентными или неэфферентными экстракорпоральными методами.
356 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
субстрат (субстраты), подлежащий элиминации из организма, Зав
от характера патологии. В этиологии и патогенезе большинства заболев*
задействовано значительное количество веществ различной природы и мо *
лярной массы. Известны заболевания, патогенез которых вполне определЛЄКу'
связан с избыточным накоплением в организме одного конкретного субстпНН°
например врожденных и приобретенных гиперлипидемий, эритремии ^’
личных паропротеинемий и т.д. Именно поэтому при различных патологи*3
ских состояниях удалению из организма подлежат самые разные субо-гГ6
или их группы.
Дея удаления одного и того же субстрата, например среднемолекуляпн
токсинов, могут быть применены различные эфферентные методы - Гф гпл*
ГС, ПС J1C, ПФ, ПАФ. КС (табл. 14-6). Необходимо иметь в виду, что эффе,^и
ность различных экстракорпоральных эфферентных методов для элиминации те
или иных патологических субстратов неодинакова. Решение о соответствующе *
экстракорпоральном методе принимает врач-трансфузиолог.
Таблица 14-6. Возможные экстракорпоральные эфферентные методы в зависимости от характе
ра удаляемого субстрата
Удаляемый субстрат
Методы
Молекулы газов (углекислота)
ИК 7
Молекулы воды
УФ, ГД, ГФ, ГДФ, ПД, ПФ, ПАФ 1
Ионы
УФ, ГД, ГФ. ГДФ, ПД, ПФ, ПАФ
Низкомолекулярные водорастворимые шлаки
ГД, ГФ, ГДФ, ПФ, ПАФ 77
Токсины среднемолекулярной массы
ГФ, ГДФ, ГС, ПС, ЛС, ПФ, ПАФ, КС
Субстраты крупномалекулярной массы
(>1000 ООО Да)
КПФ, ИС, АС, ПФ, ПАФ, реоаферез
Жирорастворимые токсины печеночной недо¬
статочности
Биосорбция (альбумин — MARS, ксеногепатоперфузия)
ПФ, ПАФ
каление одной из жидких сред организма
ПФ, ПАФ, кровопускание, лимфо-, асцит-, ликвороафе-
рез, периоперационная аспирация раневого и дренажно¬
го отделяемого
Таким образом, с помощью различных экстракорпоральных эфферентных
методов из организма более или менее избирательно могут быть элиминированы:
• отдельные молекулы (газы, вода, молекулы низкой, высокой и сверхвысокой
молекулярной массы);
І ионы (калия, натрия и т.д.);
8 пулы молекул (низкой и средней молекулярной массы, токсины печеночной
недостаточности, крупномолекулярные вещества);
I компоненты жидких сред организма;
І любая жидкая среда целиком.
Жидкие среды организма можно удалять с лечебной целью как частично, так
и в значительных объемах, что предполагает их последующую обработку и воз¬
врат больному.
Назначая больному тот или иной эфферентный метод, трансфузиологу следует
решить ряд вопросов.
Какой субстрат подлежит удалению?
Какой метод эфферентной терапии следует использовать для более быстрого
и эффективного достижения клинического результата?
Из какой жидкой среды организма целесообразнее удалять данное вещество
(вещества)?
Адекватное решение всех поставленных вопросов позволит достичь максималь¬
ного клинического результата в каждой конкретной ситуации, сделать лечение
клинически и экономически эффективным.
ТРАНСФУЗИОЛОГИНЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 357
н0€ переливание крови, которое в середине прошлого века применяли
V чении гемолитической болезни новорожденных и отдельных токсико-
лр* состояний, можно рассматривать как первый положительный опыт
^^орпоральной детоксикации организма. При этом самым первым методом
^ной детоксикации, очевидно, необходимо считать обычное кровопускание,
исПользовали в лечебных целях до начала применения современных
*^°дов ЭКД в течение многих столетий.
||Г^6солютными показаниями к обменному переливанию крови служили отрав-
Vj токсичными веществами: гемолитическими ядами ~ неорганическими
битами, сульфаниламидами, анилином, нитробензолом и его производными,
“!1ьяковистым водородом, дихлорэтаном, фосфорорганическими инсектици-
^(ФОИ). оказывающими непосредственное воздействие на кровь и вызы-
дощми тяжелую гемическую гипоксию. Такие отравления сопровождаются
!!*елой метгемоглобинемией, нарастающим массивным гемолизом, в ряде слу-
ф - изменениями ферментативной активности крови (при отравлениях ФОН),
обменные переливания крови с использованием цельной одногруппной донор¬
ской крови в количествах, в 2-3 раза превышающих объем циркулирующей крови
пациента, позволяли относительно быстро корригировать морфологический
биохимический состав крови. При этом организм справлялся с интоксикацией
и сроки, необходимые для физиологического восстановления утраченных функ¬
ций. Выполняли обменные переливания крови прерывистым или непрерывным
способом. Такой метод экстракорпоральной детоксикации имел высокий риск
серьезных гемотрансфузионных реакций и осложнений, связанных с массивны¬
ми гемотрансфузиями. Реально существовала угроза развития цитратного шока,
гипокальциемии, гемодинамических расстройств, нарушений в системе гемостаза,
заражения реципиента гемотрансмиссивными инфекциями. В настоящее время
обменное переливание крови иногда используют при лечении гемолитической
болезни новорожденных; его рекомендуют при отравлении ядовитыми грибами,
когда фалло- и аманитотоксины располагаются не только в плазме и других жид¬
ких средах, но и прочно связаны с оболочкой эритроцитов.
Все существующие современные эфферентные методы, или методы экстра¬
корпоральной детоксикации, условно можно разделить по степени их избира¬
тельности, т.е. по способности более или менее избирательно элиминировать
из организма тот или иной патологический или условно патологический субстрат.
Значительную часть существующих эфферентных методов можно характеризо¬
вать как неизбирательные, или общего действия.
При использовании эфферентных методов общего действия, как правило,
удаляют целиком среду (кровь, плазму, лимфу, ликвор, раневое или дренажное
отделяемое, асцитическую жидкость или плевральный экссудат) со всеми содер¬
жащимися в ней компонентами или все те субстраты, сродство к которым имеет
используемый неселективный сорбент. К таким методам относят кровопускание,
обменное переливание крови, реинфузию крови, излившуюся в полости организ¬
ма, плазмаферез, гемосорбцию, неселективную плазмосорбцию, лимфосорбцию.
ликворосорбцию, асцитаферез и т.д. Получаемые биологические жидкости могут
подвергаться дальнейшей экстракорпоральной обработке с помощью фильтров,
сорбентов и других методов; так, появились отдельные сообщения о каскадной
плазмофильтрации с асцитической жидкостью. Цель подобного мероприятия -
яозврат больному потерянных альбуминов. В клинической практике нередко
применяют процедуру наружного дренажа грудного лимфатического протока
при портальной гипертензии, некоторых эндотоксикозах, нарушениях лимфоцир-
«УЛЯЩЩ.
Избирательные (селективные) методы позволяют удалять несколько субстра-
TOBi близких по молекулярной массе (например, реоаферез), а также конкретные
«іммоаїжяишиопяі
ІшшвшбмртЛііім методы иммуииой » Цфківцц
: мм^мій ШіІІМ ТІіОІХї ШШИЙ*рГМ
В? І oaEWSywc* » последние десятилетия тенденцию «мрец^
«щирим л рмрябвяке я внедрению вмгодосдоеггиамых методов, Pppm»
Нікшггітп способов эфферентной терапии пгщ оіи^,
ДіЯвВРИ. ттвишсяюие шг много рболевамий. ■ патгитнезе когорт
і пиша шві ииясшгиипг качество. jrttwwtr которого мет принанят чнщ
шиитккий вффипст. V бвямивтм Случаев, ЮМГКМ ОДИН конкретный
мнмм вами* толькомоею ммю патогенеза. таи как большинство мбщ**,^
пшмтю*т* как. «примере все хирургические эядоггоисикозы.
lijMWTirnrfl практике мселекгмвиые афферентные методы применяв ttmi
ІфФа яли 1 ШЧРЙйвШ С другими метолами экстракорпоральной чеговп^
ков яяияиффиреятип* ПМОМфуеіЩНИ
Самый ярвггай метод эфферентной терапии кровопускание (гемвзксфу.
Ш применяют W итгеяюег врем*. Лечебное кровопускание использует
в I повышении І —имтета ВЯЗКОСТИ крови м счет одновременного иэбмц,
(щрнгянш итинтлв « высокого содержание белков плазмы. При ЭТОМ об**,
найм «ияоиюттом лечебного воздействия является замещение удаленное
объема крова ириствдлпиднымм или коллоидными кровезаменителями.
Крамкусаяие выполняют у дрвкпгмски здоровых людей - доноров крови
ич «лядом цельной ковсераироввиной крови или ее компонентов. Очевидно,
тте .ып пивку донорской крови нельзя отмести к методам эфферентной терапии,
до хм щм этом не преследуется цель лечения какой-либо патологии (к донор-
гдо крмк допускают лиц. прошедших специальные клини ко-лабораторные
net «довамма к признанных здоровыми). Однако н в этом случае, как показа-
w i ююгочиммшх исследованиях. регулярное донорство крови оказывает
мамкдоыюе влкяиве на жизненно важные системы организма, в частности
(ердечиочвсуанстую. яв реологию крови.
Эфферентные методы обоего действия (неселективные), такие как гемоэксфу
ms. сборкржи, излившейся в раму во время операции или собранной из дренажей
IeocjHoofpauwiHHuH период, служат основой всех известных трансфузиологиче-
Iкрояосберпвквдих технологий - предоперационной заготовки компонентов
ярншогичвюй крови больного, «фшоводемичеч кой гемодилюции и интраоперя-
шкжнов реинфузия собственных эритроюгтов, собранных с раневым или дреим-
ным 0ГДЄ1ЯЄМММ. При этом неселекткамые эфферентные методы, как правила
дополняют грявипщишмьши или фильтрационными воздействиями, что пшво-
ляп подучать отдельные компоненты аутокрови пациентов: аутоэритромассу,
•упвьшму, яркяроыбовмесь. собственные отмытые эритроциты. Гемоэксфушя
в шлях заготовки собственных аутогемокомпомеиток. как правило, сапровожда-
етса звмеспятяяыюй инфузионной терапией кристаллоидными или коллоидным»
ммипяишыя При управляемой кормоволемической гемодилюции (УМГЛ
“fewв ммируемоЙ заготовки аутокрови может достигать 800-1200 мл, его вые
•виосруюг введением адекватного количества кровезаменителей кристаллоид®**4
■ вмвпвиипео рдев, р результате дозированного разведения крови имя io*#*
•дожведо и 25-28%. что в условиях опера иконкой кровопотери сокрм**
«ярю ifWTpouim и других форменных элементов крови. Заготовленную
Щйшниркрішннуїо аутокроя* возвращают а сосу дистое русло больного вас*
1 знака, мервкиш к хирургическог о гамостаэа.
І реинфузии аупмфоаи (эритроцитов), излившейся в гру ли»*
я брнигпр яввость вследствие ранения, разрыва органа или оиерягия****
•мминеаытвв. повышается яосле отмывания ее физиологическим
■ Ц яемерифуге либо • орибвре гравитационного иди
I щЩ'ЩЛшш ам Сій-ймі При атом удается вернуть больному фв»11**
трянсфэзиепогич* ш МГОйМ гтиоиОИЧКідм 359
цтцццртгш с&ободнуто от примесей лекарственных веществ, тшшеаых
«вдвости, р*»|>ушенныX меток * рови, биологическиактивныхсубпра*
^1ГІіі(»штм№іх ршюго отделяемого.
ДреНИрОВаНИТ грудного лимфатического протока (ГЛП) пун-
* * яра риличиых патологических состояниях дм илпким ив оргамниав
веществ. лимфоцитов. а также дм коррекции чкмфоциркуяаиип
крутому дренированию ГЛ П могут возникнуть при цнррше вгкад
*„яи*авш аортальной гипертензией, напряженным асцитом, печеночной жкг
^^яинтью. і так же при острых хирургических «аболеаамиах органов брюшной
. остром перитоните, остром деструктивном панкреатите. При тапедом
■ітинкт абдоминальном процессе токсины и патологически мпгивиэиро*
*0# медиаторы, бактерии, продукты клеточного распада поступают с лимфой
^яктве русло. Лияотропность многих перечисленных сгрукгур затрудняет
ах ю организма с помощью других афферентных методов. Количество
т0>шЛ лимфы зависит от степени интоксикации. В среднем удаляют до 1 д
)«йфы в сутки, а общая продолжительность процедуры составляет I \ сут и боэее
Ірмруяком дренаже ГЛП необходимо предусмотреть обязательное адекватное
всролнение белковых и электролитных потерь из расчета, что содержание балка
s антральной якмфе в 2-3 раза ниже, чем в сыворотке крони, а содержание
дюррцу электролитов приближается к плазме крови. Поскольку через лимфа*
п!ческую систему • центральный кровоток поступает большад часть шпатгдьмех
веществ, особенно жиров, то наружное дренирование ГЛП приводит к яынеденма»
их из организма. Для поддержания энергетического и азотистого баланса бодьио-
шнеобходимо обеспечить адекватным парентеральным питанием, а если таковое
«кэиожмо ~ адекватной белковой заместительной терапией, акдючаюяей
щейие растворов альбумина и СЗП. Лимфу, получаемую при наружном дреии
роммш ГЯП. можно подвергнуть различным методам детоксикации — сорбции
ш непрямому электрохимическому окислению гипоілоритом натрия, после чего
•мутрпемно возвращают пациенту.
Селективность (избирательность) таких экстракорпоральных воздействий,
«кжифо-, асцитаферез, кровопускание, сбор раневого отделяемого, может быть
швышена путем сочетания их с другими эфферентными или иеэффереитнымм
«щеми.
Возможности детоксикационной терапии существенно расширились, когда
гг. XX в. в клиническую практику были внедрены физические, химические,
Цшввмеическис способы экстракорпоральной гемокоррекции.
ШЗШЫЕ ЭФФЕРЕНТНЫЕ МЕТОДЫ
Іижяк диффузионных эфферентных методов лежат механизмы молекуаир-
■й аффузмм через полупроницаемую мембрану, осуществляемой ав гриви игу
ад*»атр»ими м ультрафильтрации, состоящей в перемещении жидкости через
"Цй? ва градиенту гидростатического давления. К этой груаие ЭКГК относят
перитонеальный диализ (в роли полупроницаемой мембраны вмету»
Ф^ввв») и кишечный диализ (полупроницаемой мембраной слухом слизи*
’’й 5&WSJ кишечника ).
г«япшишз — первый эфферентный метод, для которого в 1941 г. была совлвиа
^^Шммя техника - аппарат «искусственная почка», который • хавчите ль
*- ^QMpwtKTaoBaMHoH форме успешно используют до мстоаимго времени
****** встрой и хронической почечной недостаточмостш Гемодмвлаа
ушить из организма азотистые шлаки, ионы кадил. Другие ишвво*
вещеггаа. в том числе воду. В основе гемодиализа лежат механизмы
Цурлй диффузии и уяьтрафмльтрации. Осиовмой адампгт диализатора -
^Иашиеиав мембрана, через которую продукты вбмеиа диффетиируаве
т жвжвжсшттожжймодаяв
НШ|Ммтв«ш«иируюшу)0 жидкость, омывающую мембрану с пш
I стороны. Промесс диффузии осуществляется по градиенту конц^/3’
цм*. оря этом дроисходнт самопроизвольный процесс выравнивания
дні молекул во обе стороны от диффузионной мембраны. Молекулы
tfMI—pffil удалению, аередвипыотся из среды с большей концентрацией в г**
І иекыжй. Скорость диффузии зависит от размеров молекул и градиента щТ?
jt Параллельно с проиессом диффузии при гемодиализе ocyiaecnJ?
І у.іьтрмфидьтрации - перемещение жидкости через мембрану ЦТ?
дрют пцропатического давления. Ультрафильтрация способствует удмел*
«з организма избытка жидкости
Эффективность гемодиализа зависит от качества полупроницаемой ыембг*
им, состава двалмзируюшей жидкости, времени проведения процедуры и дршГ
Офметров. Оптимальная продолжительность программного или хроническое
гпеаршша 112-15 ч в неделю.
К rjnпо» диффузионных методов относят также перитонеальный и кишечны*
ЛИШЬ Эти методы входят в группу интракорпоральных воздействий, но по ме».
ШМ? действия являются аналогами диффузионных экстракорпоральных мето¬
де*
Гемодиализ - метод выбора при острой и хронической почечной недостаточ-
иост Различают гемодиализ острый и хронический. Применение хронического
(цюграммного) гемодиализа — важный элемент пооперационной подготовки
-МОШОмрвционного ведения больных с хронической почечной недостаточно¬
стью. При невозможности трансплантации почки программный гемодиализ -
едянственнын способ, позволяющий в течение многих лет поддерживать жиз-
ИЖягельность пациентов. у которых собственные функции почек отсутствуют
І значительно снижены.
Выделяют методы низко- и высокопоточного гемодиализа. Один сеанс обыч¬
ного низкопоточного гемодиализа позволяет удалять из организма до 60-70%
мочевины. 40-60% креатинина, нормализовать электролитный состав крови
и кислотно-основное равновесие.
Гемодиализ был первым аппаратным эфферентным методом, используемым
в клиническом токсикологии, что позволило обеспечить очищение крови и ткане¬
вых депо от широкого спектра водорастворимых ядов (барбитуратов длительного
действия, салицклатов. метанола, хлорофоса и др.). Большой объем диализируе-
ШЙцюви (до 100 л за сеанс) обеспечивал достаточно высокий темп выведения
ядов (клиренс - 60-100 мл/мин).
При отравлении ядами, избирательно накапливающимися в жировой клет¬
чатке брюшной полости (хлорированными углеводородами, анилином), а также
при противопоказаниях к другим методам экстракорпоральной детоксикации
в качестве основного метода эфферентной терапии используют перитонеальный
диализ. Методика его проста и доступна, не требует сложной, дорогостоящей
аппаратуры. Стерильный диализирующий раствор через катетер вводят непосред-
сшнио в брюшную полость. Следует отметить, что метод перитонеального диали¬
за! последние годы асе чаще применяют и при хронической почечной недостаточ¬
ности. особенно в педиатрической практике. Сравнительный анализ результат»
многолетнего применения показал, что, имея свои преимущества и недостатки.
• целом м*юды гемодиализа и перитонеального диализа не имеют определенны!
четких медицинских и экономических преимуществ один над другим. Средняя
продолжительность жизни больных, находящихся на перитонеальном диализ*
сравнима*аналогичной при гемодиализе. У взрослых больных перитонеальный
I часто применяют в случаях, когда невозможно наложить артериовеноз-
либо приходится ликвидировать уже имеющуюся. К существенным
■;ШШт*пт перитонеального диализа относят риск развития перитонита. ІДО
'АНСФУЗЙОЛОГИЧЕСКЙЕ МШДЬІ ГШЖОВ*СКЦ|М
^00Хьного диализа в статистике большинства европейских стран (за исклю-
i и кобр и тан и и) и США составляет около 10%.
рояоооточмом гемодиализе эффективно удаляют из организма вещества
1*ой молекулярной массой и практически не удаляют средиемолекулярмые
ответственные за прогрессирование полнорганной недечтаточмектв
^гмх нею- и эндотоксикозов. Современная методика высокопогочного дна
* «а отличается более высокой скоростью перфузии и возможность «о частично
* дозревать вещества среднемолекулярной массы. Наиболее же эффективны
Среднемолекулярных ТОКСИНОВ фильтрамионные методы ЖСТрВКОр-
іл»лой детоксикации.
^ЬТРАЦИОИНЫЕ ЭФФЕРЕНТНЫЕ МЕТОДЫ
фильтрационные методы ЭКГК основаны на конвекции (фильтрации) крови
мембраны различной пороэности. Среди фильтрационных методов выделя¬
ет изолированную ультра-, гемо*, плазмофильтрации). Более сложным фильтра-
^лйым методом является каскадная плазмофильтрация.
фильтрационные, сорбционные и гравитационные воздействия могут быть
зополнены преципитацией — термической (ХОЛОДОВОЙ, тепловой) или химиче
кой. что повышает селективность элиминационного эффекта.
Необходимость выведения из организма токсинов средней и высокой молеку¬
лой массы стимулировала разработку других методов эфферентного воздей
пзия. Например, уже в 1943 г. были выполнены первые сеансы гравитационного
плазмафереза пациентам с парапротеинемиями. Значительно позже, в 80-е гг.
XXШ| появились методы экстракорпоральной детоксикации, основанные на фмль
грации (конвекции) крови через мембраны различной пороэности фильтраци¬
онные методы детоксикации. Это методы так называемого внепочечного очище*
ниякрови. Вместе с гемодиализом методы гемофильтрации и гемодиафилырации
составляют группу методов заместительной почечной терапии.
Эфферентные методы, основанные на использовании мембранных фильтров
разной пороэности, включают ультра-, гемо-, плазмо- и гемодиафиль грацию
(метод смешанного действия, в основе которого одновременно используют меха¬
низмы диффузии и фильтрации). Получил развитие также метод селективной
гемофильтрации — каскадная плазмофильтрация, направленная на выделение
и элиминацию крупномолекулярных субстратов путем последовательного ис поль¬
зования (каскада) нескольких мембранофильтров.
Изолированная ультрафильтрация (акваферез) (УФИЗ) метод, позво¬
ляющий выводить из крови воду и растворенные в ней ионы и низкомодекуляр-
ные вещества.
Согласно терминологии Шелдона (1977), ультрафильтрацией называют кон¬
векционное освобождение крови от воды и растворенных в ней веществ путем
©здания повышенного положительного гидростатического давления со сто¬
роны крови или разрежения с внешней стороны полупроницаемой мембра¬
ны. Ультрафильтрация, выполняемая без предшествующего или последующего
гемодиализа, называется изолированной и относится к методам, направленным
•устранение гипергидратации.
Для изолированной ультрафильтрации кровь больного пропускают через
•нвллярный или с низкопорозной полупроницаемой мембраной диализатор
*улм создания повышенного положительного гидростатического давления
Объем УФИЗ обычно составляет от 1 до 10 л за процедуру, скорость ультра-
^ьтрации - от 500 до 3000 мл/ч. Трансмембранное давление при этом состав-
•**от 100 до 400 мм рт. ст. ,;А- '
Яродицаемость диализатора, или гемофильтра, дія воды - одна из важнейших
®®*арактериггик. выражается коэффициентом ультрафильтрации (КУФ) данного
Фйьтра, который представляет собой объем жидкости, удаляемый из крови папи-
382 ктшємАятнсФгзшюгм
та я 1 чари приложенном трансмембранном давлении 1 мм рт.ст. у рзз
типов диализаторов КУФ колеблется в пределах 0,5-15,0 мл/мм рт.^,
широкое распространение получили фильтры производства фирм «Фрез^И
«Гамбро», «Оспаль*. «Амикон* и др. Большое значение при длительных^5'0»]
ррт придают бяосовместимости мембраны с кровью пациента. рсв1еДн
Метод УФИЗ применяют при удалении из организма избытка *н.
при сердечной недостаточности, нефротическом синдроме, почечной недоДКОсги|
ности, тяжелой артериальной гипертензии и других патологических созд —'I
УФИЗ позволяет немедленно начать удаление жидкости с заданной скопо^Ч
І нужном объеме и при необходимости прекратить ее, когда гапергйдм^10,
будет устранена. За одну процедуру можно удалить 4-5 л жидкости и более 1
Показания к применению УФИЗ:
• острая и хроническая почечная недостаточность с выраженной гапапші.„
тадиея (асцит, гидроторакс, щдроперикард, отек легких и т.д.), осо& * I
при нестабильной гемодинамике, гипертоническом кризе и плохой пеш>8Й° I
сямости удаления жидкости во время гемодиафильтрации; ^ I
• сердечная недостаточность с повышением центрального венозного давлен I
отеком легких, полисерозитом у пациентов с ишемической болезнью car I
ца, врожденными и приобретенными пороками сердца, кардиомиопатией I
резистентностью к диуретической терапии, нарушением сердечного; ритм I
на фоне гипокалиемии, гипертоническим кризом, зависимым от гипеогишй!
.^пйй.. сопутствующей почечной недостаточностью; I
І нефротический синдром;
S тяжелая гипергидратация, дисэлектролитемия в реанимационной практике. I
(Йрртивопоказания:
• необратимые изменения миокарда со значительным (критическим)! щ I
жением насосной функции сердца у больных с хронической ишемической I
болезнью сердца;
# «корригируемые нарушения гемодинамики с систолическим артериальным I
давлением ниже 60 мм рт. ст.;
* внутреннее кровотечение или внутричерепная гематома, геморрагическая
форма инсульта.
Гемофильтрация (ГФ) - метод внепочечного очищения крови посредством
фильтрационного и конвекционного транспорта веществ через высокопористую
мембрану за счет создания гидравлического градиента давления. Метод ГФ впервые
предложил в 1975 г. Л. Гендерсон (L. Henderson). Суть метода заключается в конвек- |
ционном освобождении крови от воды и растворенных в ней веществ с восполнени¬
ем потерь воды и электролитов стандартным электролитным раствором.11
Объем выведенной жидкости во время гемофильтрации обычно существенно
больше такового при изолированной ультрафильтрации (в 10-20 раз), он может
составлять 20-80 л, сравним с объемом общей воды тела, а иногда и превышает
его. Таким образом, замена значительной части воды Тела путем конвекции осво¬
бождает организм от большого количества растворенных в воде веществ (мочеви¬
ны, креатинина, веществ со средней молекулярной массой). Верхний предел эли-
мииациониых возможностей гемофильтрации — вещества с молекулярной массой
20 000-30000 Да. Клиренс мочевины и креатинина при гемофильтрации с заме¬
ной 40-50 л жидкости несколько меньше такового при гемодиализе, а клире®
средних молекул намного выше. Точное замещение потерь жидкости позволяет
избежать осложнений даже при высокой скорости обмена жидкости из-за сохрз
нения стабильной осмолярности внутренних сред организма. ц
Процедуру гемофильтрации выполняют путем перфузии гепаринизированй
крови пациента через высокопроницаемый фильтр или диализатор с полупро
цаемой мембраной большой поверхности (0,7-2,0 М2).
показана при экзогенных и эндогенных интоксикациях и тяжелых гиперги-
^ ggj различного генеза. когда возникает необходимость удаления веществ
Яр**** „ средней молекулярной массы. Посредством конвекции вещества пере*
с потоком жидкости через высокопористую мембрану до градиента
н0<2йя- ГФ представляет собой физиологическую процедуру, поскольку доста-
* яо точи® воспроизводит работу здоровой почки по клубочковой фильтрации
Мальцевой реабсорбции. При этом тубулярная функция частично замещается
^ватным введением полиэлектролитной смеси, близкой по составу к безбедно-
Задет плазмы.
Самый простои метод ГФ - спонтанный артериовенозный, осуществляемый
счет естественного артериовенозного градиента давления. Поскольку скорость
38 «txpnvobi невелика, то соответственно детоксикационная способность метода
также незначительна.
ддя аппаратной ГФ необходимы гемофильтр, гемопроцессор или высокопоточ-
нц} диализатор со специальной гемофильтрационной приставкой и стерильный
решающий раствор, близкий по составу к безбелковой части плазмы, в коли-
qecrBax, адекватных объему фильтрации. В зависимости от места его введения
гф можно проводить в двух основных режимах: пре- и постдилюции. В режиме
друдялюпии лучше удаляются низкомолекулярные субстанции, а также вещества,
дотированные и/или секвестрированные на поверхности белков и клеток
крови. Однако эта методика требует почти вдвое большее количество замещаю¬
щего раствора. Коммерческие полиионные замещающие растворы обычно имеют
следующий состав: натрия хлорида — 5,917 г/л, натрия лактата — 5,7835 г/л,
калия хлорида—0,149 г/л. Такое количество калия хлорида обеспечивает концен¬
трацию калия 2 ммоль/л.
ГФ относят к категории продолженных экстракорпоральных процедур.
Выполняют ее не менее 2-3 сут непрерывно. За сутки удаляют до 40-50 л жидко¬
сти, содержащей токсины низкой и средней молекулярной массы.
Применяют ГФ, как правило, при полиорганной недостаточности различного
генеза в стадии дыхательных расстройств, сердечно-сосудистой и почечной недо¬
статочности. При этом ГФ позволяет не только корригировать нарушенные функ¬
ции организма, но и воздействовать на причину их возникновения. Эффекты ГФ
связаны с удалением медиаторов, участвующих в развитии повышенной проница-
ежод микрососудов легких, уменьшением интерстициального отека и удалением
избытка жидкости из организма, а также уремических токсинов, фактора депрес¬
сии миокарда, вазоактивных веществ и других токсинов низко- и среднемолеку¬
лярной массы. Широкому внедрению ГФ в клиническую практику в настоящее
время препятствует высокая стоимость гемофильтров и замещающих растворов,
требующихся в больших количествах (от 10 до 60 л). При этом при заместитель¬
ной терапии следует также учитывать значительные потери с фильтратом амино¬
кислот (до 7,5 г) и белка, что делает процедуру еще дороже.
В целях повышения клиренса низкомолекулярных водорастворимых веществ
бьа разработан и внедрен в клиническую практику метод постоянной гемодиа¬
фильтрации (ГДФ), при котором диализ и фильтрация происходят одновремен¬
но. Этот метод включает взаимодействие крови больного не только с высокопори-
floi мембраной, но и с диализирующим раствором. Процедура длится несколько
(продолженная ГДФ), при этом за 3-5 ч обрабатывается до 15-30 л крови.
Преимущества продолженной гемодиафильтрации: минимальное воздействие
йа системы кровообращения и дыхания, широкий спектр и достаточно высокий
2*нс удаляемых патологических веществ, безопасность и высокая лечебная
^фиктивность. ГДФ позволяет эффективно регулировать водный баланс организ-
- корригировать электролитный баланс, активно элиминировать мелко- и сред-
®*°лекулярные токсины, протекает с устойчивой гемодинамикой и без мета-
Н панмчвяіміймиюиопопт
г||Маш нарушений. ГДФ эффективна в коррекции синдрома систем
ЩЕммышп) ответа, так как позволяет элиминировать из кровеносного г*
ицріітпрі воспаление цитокины. ИЛ-1. ИЛ-6. ИЛ-8, фактор активации троЇЇ?
ГФ и ГДФ В методы выбора у гемодинамически нестабильных паци6й
Гсмодинамическая толерантность ГФ и ГДФ обусловлена фильтрацией фа1стТ°а
|рфвпи миокарда (размер молекулы - 800-1000 нм). Кроме того, с уды?3
фшротом удаляется значительное количество вазоактивных веществ: кате*?3'
ІШОВ (160 нм), брадикинина (1206 нм), гистамина (127 нм), серотонина (210
І^КІ (600 нм), простагландинов (600 нм). ИЛ-1, что оказывает поло»
тельное влияние на центральную и регионарную гемодинамику.
Показания к применению продолженных методов внепочечного очищещ,
Крови: острая почечная недостаточность, респираторный дистресс-синдром
взрослых, деструктивный панкреатит, сепсис, грубые нарушения водно-электпп!
лнтного гомеостаза. Методы непрерывной ГФ и ГДФ позволяют обеспечивал
эффективную и безопасную экстракорпоральную детоксикацию у оперированньд
больных с синдромом полиорганной недостаточности в случае преобладания в ее
клинической картине шокового легкого или почечной недостаточности.
Плазмофильтрация - метод удаления плазмы после разделения крови
ка плазму и форменные элементы с последующим возвращением клеточных эле¬
ментов в кровяное русло пациента. В отличие от плазмафереза, плазмофильтрация
подразумевает конвекционное освобождение крови от плазмы и растворенных
в ней веществ через высокопроницаемые фильтры путем создания разрежения
І внешней стороны полупроницаемой мембраны или повышенного гидростатиче¬
ского давления со стороны крови.
Пороэность фильтров при неселективной плазмофильтрации позволяет задержи-
вать форменные элементы крови и допускает прохождение частиц с молекулярным
весом от 2 до 4 млн Дальтон. Основные материалы для изготовления капилляров
фильтров - диацетат целлюлозы, полипропилен и поливинилхлорид с размером
пор от 0,2 до 0,77 мкм. эффективной поверхностью от 0,005 до 0,65 м2 и внутрен¬
ним объемом заполнения от 7 до 35 мл. Первыми начали развивать оборудование
для плазмофильтрации фирмы Asahi в Японии, Enka и Fresenius в Европе. В отличие
от центрифужного плазмафереза, этот метод проще, имеет меньший экстракорпо¬
ральный объем, однако для его осуществления требуется большая скорость крово¬
тока. поскольку скорость фильтрации зависит от размера пор и трансмембранного
давления, превышение которого может привести к гемолизу. При плазмофильтра¬
ции существует проблема коэффициента просеивания из-за неравномерности пор,
«к. например, концентрация IgM в профильтрованной плазме может составить
70-90% по сравнению с плазмой пациента. Так же как и другие фильтрационные
методы, плазмофильтрация требует полиионных замещающих растворов. Скорость
отделения плазмы при плазмофильтрации составляет от 10 до 30 мл/мин. За одну
процедуру можно заменить от 300 мл до 5-6 л плазмы. Принципы плазмозамеще-
ния аналогичны таковым при плазмаферезе.
Специфическое осложнение плазмофильтрации — гемолиз, причиной которого
может стать превышение трансмембранного давления.
Показания к плазмофильтрации аналогичны таковым к плазмаферезу. Часто
этот метод является частью более селективных эфферентных методов - иммун¬
ной или аффинной сорбции, каскадной плазмофильтрации.
В литературе имеются единичные сообщения о возможности проведення
также ликворофильтрации через специальные ликворные фильтры (ЗАО
«Плазмофильтр*, Санкт-Петербург) у пациентов с травматическим субарахнои*
дальным кровоизлиянием. Порозность фильтров позволяет задерживать все фор*
менные элементы, при этом концентрация в ликворе электролитов, нейропептидо®'
T
ТРАНСФУЗИОЛОГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 305
я друшх физиологически значимых веществ неизменна. Фильтрации И
^20-140 мл ликвора (один объем циркулирующей спинномозго- Я
ж выполняли 1-2 процедуры. Содержание эритроцитов в ликворе Я
5*н35С ь в 20-30 раз, вплоть до полного исчезновения клеток. Клиническими Я
^^япроцедуры были восстановление сознания и ликвидация неврологиче-
Р^^оМатики в более быстрые, чем при обычной терапии, сроки.
^ яеяные прйборы зарубежного производства (ADM 08, Multyfihrate.
Сопре ГермаНия) позволяют проводить в автоматическом режиме все способы
Жш’нй0Й И фильтрационной детоксикации: острый гемодиализ, гемофиль-
^ «модиафильтРацию- неселективную и селективную плазмофильтрацию.
І^'антами фильтрационных эфферентных методов являются современные
^Аикаций селективной плазмофильтрации: каскадные плазмо- и криоплазмо-
тоация (термофильтрация). Их относят к методам реофереза, они направле-
^ДЬ элиминацию крупномолекулярных субстратов и позволяют принципиально
Й3, на реологические свойства крови и микроциркуляцию. Метод КПФ впер-
писалТ. Agischi как процедуру селективного удаления из плазмы патологиче-
компонентов с большой молекулярной массой. Каскадной плазмофильтраци-
процедуру назвали европейские исследователи Sieberth и Gurland. Японские
впервые описавшие этот процесс, придерживались термина «двойная
начали выпускать плазменные фильтры и аппаратуру для каскадной
плазмофильтрации три японские фирмы: Asahi, Тогау, Кигагау. В настоящее время
Наиболее' приемлемы для коррекции гиперхолестеринемии фильтры Evaflux-4A
и -5А японской фирмы Кигагау.
Принцип КПФ основан на последовательном применении двух плазменных
фильтров с различными размерами пор мембран. Первый фильтр с большими
размерами пор отделяет плазму от клеточных элементе®. Затем плазма поступа¬
ет во второй фильтр с меньшими порами, разделяясь при этом на две фракции
1 щисимости от типа применяемых мембран. Фракция плазмы с веществами
большой молекулярной массы концентрируется и удаляется, а с меньшей молеку¬
лярной массой, включая альбумин (69 ООО Да) и иммуноглобулины (150 000 Да),
возвращается пациенту. М. Valbonesi (2000) рекомендует выполнять повторную
обработку плазмы через фильтр с порозностью 300 000 Да, что позволяет изби¬
рательно задерживать крупные молекулы — концентраты высокомолекулярных
белков Илипопротеидов.
F.A. Коновалов рекомендует выполнять КПФ путем первичного отделения
плазмы на сепараторах клеток крови «Кобе-Спектра», «Кобе» (США), или «АС-
204», «Фрезениус» (Германия), или на первичном фильтре. Затем плазму про¬
пускают через вторичный плазменный фильтр (реофильтр), разделяя на концен¬
трат. содержащий макромолекулы, размер которых больше, чем у IgG (включая
липопротеиды низкой плотности, триглицериды, фибриноген), и плазмофиль-
тр», содержащий IgG, липопротеиды высокой плотности, компоненты плазмы
с меньшей молекулярной массой, который вместе с эритроцитами и замещающим
раствором возвращают пациентам. При этом за одну процедуру удаляют от 500
® 800 мл концентрата. Замещение удаляемого концентрата плазмы проводят
адекватным количеством электролитного раствора или 4% раствором альбумина.
.^°д применяют в лечении метаболического синдрома X, атеросклероза, при-
%еенных и наследственных гиперлипидемий.
в ^?°видностью каскадной плазмофильтрации, предложенной Nose, Malchesky
О r” является термофильтрация, или каскадная криоплазмофильтрация.
НИмП* пРш^едУРы заключается в том, что отделенная плазма поступает
и^^№ый фильтр в охлажденном виде и в результате образуется комплекс —
яротеин, состоящий из липопротеидов и фибриногена. Повторная фильтра-
ЛІ доашмімісизиологмя
щи каедаст отделить криоглобулиновый осадок от всех оставшихся б
которые воэацшоапт пациенту.
Пациенты переносят КПФ лучше, чем плазмаферез, что, по-видимому г»
с мгипі г**ц объемом удаляемой плазмы. Гемодинамика во время процеси й°
при этом КПФ могут применять как с использованием плазмоф СТа*
«ров («КЕМ-21». Япония; «Хайджия», «Кимал», Англия), так и на сепа?кТра‘
крови «Виваселл», «Дидеко». «Кобе-спектр», «Кобе», АС-104 и -204, «Фрез*^
в др., без специальной аппаратуры, с использованием периферических вед ^
ростыо кровотока. не превышающего 30-70 мл/мин. Небольшой по срав****0'
с ввазмофкльтрацией объем удаления концентрата плазмы (300-500 мл) ЧЄНиі°
яяет избежать применения белковых препаратов для замены удаленной n°ЗВ°'
что исключает риск возможных осложнений, связанных с применением33^’
твора альбумина или донорской плазмы, большим объемом плазмозамеше^
я оря этом существенно увеличить эффект процедуры. НИя>
Методы селективной и неселективной плазмофильтрации используют при а
иммунной патологии, криоглобулинемиях, гиперхолестеринемиях, заболеванГ°
сопровождающихся нарушениями реологических свойств крови, т.е. состояния*
ори которых традиционно применяют центрифужный или мембранный плазм
ферез. Основными показаниями для КПФ служат рефрактерная к лекарственно"
терапии пшерхолестеринемия, особенно с выраженным повышением уровня лило-
протеидов низкой плотности, значительная гиперкоагуляция, повышение уровня
фибриногена, циркулирующих антител, nmep-IgM-мия, нарушения микроцирку,
ляции І дистального кровотока при периферическом атеросклерозе, диабетиче¬
ская и старческая макулопатия, острая нейросенсорная тугоухость, церебральный
атеросклероз и т.д. Существуют данные о применении КПФ при деструктивном
панкреатите, сочетании асцитафереза с КПФ, однако широкого распространения
последний метод пока еще не получил.
Таким образом, каскадные варианты плазмофильтрации направлены на удале¬
ние патологических субстратов крупной массы, в том числе циркулирующих анти-
тел І иммунных комплексов, фибриногена, фибронектина, л ипопротеидов низкой
и очень низкой плотности, парапротеинов, криоглобулинов и др. Следовательно,
если в конкретной клинической ситуации неселективный плазмаферез неэффекти¬
вен, то и каскадную плазмофильтрацию использовать нецелесообразно. К сожале¬
нию, широкому внедрению селективных методов плазмофильтрации препятствует
высокая стоимость мембранофильтров.
СОРБЦИОННЫЕ ЭФФЕРЕНТНЫЕ МЕТОДЫ
Сорбционные эфферентные методы основаны на способности пористых веществ,
ионообменных смол и других органических и неорганических субстратов извле¬
кать (сорбировать) при контакте с биологическими жидкостями находящиеся
в них патологические вещества экзогенного или эндогенного происхождения.
В основе сорбционных методов лежат специфические и неспецифические меха¬
низмы 1 адсорбция, абсорбция, хемосорбция, ионообмен, кожшексообрааование.
Выделяют несколько видов сорбции:
• неселективная - с помощью угольных и других неорганических сорбенто»
(гемо-, плазмо-, лимфо- и ликворосорбция);
• условно селективная - с помощью биосорбентов (альбумина, донорских
эритроцитов — эритросорбция; ксеногенных тканей, органов или клеток -
яеемосорбция);
• селективная - иммунная и аффинная сорбция.
История применения сорбционных эфферентных методов в России начал
с внедрения в клиническую практику неселективной сорбции с помощью акт
mix угольных сорбентов. В конце 60-х гг. XX в. группа специалистов Московск
ТРАНСФУЗИОЛОГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 367
ского института им. Н.И. Пирогова под научным руководством академи-
Лопухина интенсивно разрабатывала проблему пересадки аллогенной
0 искусственной печени. В процессе этих работ особое внимание было
^ методам очистки крови от токсичных веществ с помощью сорбентов -
^І^бции. Испытание отечественных промышленных марок активных углей
й СКТ показало, что они обладают свойствами активно сорбировать
^ ибин. аммоний, желчные кислоты и другие вещества, задействованные
незе печеночной недостаточности. Впоследствии угольные сорбен-
1 Й?°ли’ существенно модифицированы. Разработаны технологии получения
^ й медицинских сорбентов на основе природного (фруктовой косточки.
кокосового ореха, щепы древесины) и синтетического (фенолфор-
^•егидных смол, фуриловых смол, ионообменников) сырья. Это открыло
|^Е2деые возможности регулирования физико-механических и физико-
1,0110 ческих свойств углеродных сорбентов, а также получения их разновидно-
1ИМ. заданными свойствами. В настоящее время отечественная медицинская
%1Шяенность выпускает значительное количество гранулированных (СУМС,
йМИТУ. ФАС, Симплекс Ф, СКН, ТЭТРА и их разновидности) и волокнистых
мгялен) угольных сорбентов. - I М
В основе метода неселективнои сорбции лежит способность пористых веществ
яявированного угля) или ионообменных смол (ионитов) извлекать (сорбиро-
L>) при контакте с биологическими жидкостями (кровью, плазмой, лимфой,
одщомозговой жидкостью) различные вещества, в том числе токсины зкзо-
„эндогенного происхождения. В основе всех сорбционных методов лежат специ¬
фические и®ешецифические механизмы — адсорбция, абсорбция, хемосорбция,
яонообмен, комплексообразование. Селективность сорбционных процедур зави¬
сит от характера используемого сорбента.
Первым в истории эфферентной медицины сорбционным методом явилась
неселективная гемосорбция, а наиболее доступным и поэтому распространенным
сорбентом по-прежнему остается активированный уголь. Неселективные уголь¬
ные гемосорбенты ориентированы на сорбцию широкого спектра веществ низкой
и средней молекулярной массы, грамотрицательной бактериальной флоры и ее
эндотоксинов из крови и других биологических жидкостей.
Углеродный сорбент представляет собой углеродный материал, подвергнутый
активации, деминерализации, депирогенизации, гидромеханической обработ¬
ке, ионной балансировке и стерилизации. В настоящее время разработан целый
ряд технологий, позволяющих создавать угольные сорбенты с максимальным
сохранением их сорбционной емкости и активной поверхности. Выпускаемые
углеродные сорбенты нетоксичны, стерильны, апирогенны, однократного при¬
менения. Ведутся многочисленные работы по регенерации и модификации гемо-
сорбентов. С этой целью предлагают их обработку различными окислителями:
кислородом, озоном, 40% раствором перекиси водорода4, йодидом калия, гипо-
иоритом натрия и др. Чаще всего с этой целью используют гипохлорит натрия,
3 видоизменению подвергают углеволокнистые сорбенты, обладающие большей
сорбционной поверхностью. Цель подобной модификации сорбента — увеличить
сорбционную активность по отношению к веществам низкой и средней молеку¬
лярной массы. В процессе взаимодействия сорбента и окислителя происходит
^Разование кислородсодержащих функциональных группировок на поверхности
сорбента, что способствует возрастанию ионообменных свойств и сорбционной
а*®вн°сти на границе фаз «адсорбент-биологическая жидкость».
Технологические приемы использования и клинические показания к приме-
ДДО неселективных сорбционных методов терапии за годы их существования
Терпели существенные изменения.
Ill кЛМІИчКХМГРМФФУЗМтОПМ
\{Мдоі современных сорбционных технологий с использованием неселектл
ртаиш сорбентов на первом месте по частоте применения по-прежнему ^1
крови (гемосорбция) и других биологических жидкостей - пла^
лиифск дмсворосорбция и т.д. Имеются сообщения об энтеросорбции С испМ°'
эомшием таблетированного порошкообразного активированного угля, confit
Iотделяемого (вульнеросорбции). Последний метод позволяет извле
токсичные метаболиты, микробные клетки и бактериальные токсины из отде^
мого гнойных ран при прямом контакте их с сорбентом. Ляеч
Сорбционным, как и другим экстракорпоральным эфферентным методам п
gap следующие эффекты воздействия на организм: ’ Ри‘
I детоксикация;
• иммунокоррекция;
• воздействие на микроциркуляцию и реологические свойства крови;
• коррекция эндокринного статуса;
• активация противовоспалительных реакций;
• коррекция функциональной активности рецепторов органов, клеточных
мембран и процессов метаболизма пищевых и лекарственных веществ.
Гемосорбция - один из самых эффективных методов детоксикации. Современ¬
ные сорбенты способны связывать широкий спектр веществ различной молекуляр¬
ной массы, форменные элементы крови (нейтрофилы, тромбоциты, моноциты}
и другие компоненты перфузата. В зависимости от своих физико-химических
свойств сорбенты обладают определенной сорбционной емкостью в отношении раз¬
личных классов веществ, которая зависит от количества того или иного вещества
поглощаемого сорбентом. Исходя из сорбционной емкости можно определить необ¬
ходимое количество используемого сорбента и объем перфузии для достижения
максимального детоксицирующего эффекта.
Гемогорбцня обладает выраженным воздействием на все звенья иммунитета.
Изменения иммунологических показателей после гемосорбции могут быть обу¬
словлены различными механизмами: непосредственной элиминацией иммунных
факторов: воздействием на рецепторный аппарат иммунокомпетентных клеток,
снижением иммуносупрессии, вызванной развитием интоксикации.
Большинство современных неспецифических сорбентов обладают малой сорб¬
ционной емкостью в отношении иммуноглобулинов и циркулирующих иммун¬
ных комплексов. В связи с этим динамика данных показателей в ходе процедуры
незначительна. Существенная элиминация циркулирующих иммунных комплек¬
сов (до 43% исходного уровня) непосредственно во время гемосорбции отмече¬
на только при использовании гемосорбентов ТЭТРА, однако к 10-14-м суткам
отмечена нормализация уровней IgA, M, Е, G в сыворотке крови, сохраняющихся
до 6 мес и более. Отмечена аналогичная динамика для уровня циркулирующих
иммунных комплексов. Это объясняют нормализующим воздействием на функ¬
цию В-лимфоцитов, синтез антител, комплементарную активность и образование
иммунных комплексов.
Гемосорбция оказывает нормализующее воздействие на уровень субпопуляций
Т-лимфоцитов и иммунорегуляторный индекс. В течение первых 60 мин перфу¬
зии на сорбенте оседает до 80% фагоцитов, что приводит к обновлению их цир¬
кулирующего пула. В связи с этим в течение первых 12-18 ч постсорбционного
периода отмечают снижение фагоцитарной активности нейтрофилов и моноцитов.
Начиная 11 7-х суток у 73-78% пациентов наблюдают активацию этого звена
иммунитета. У больных эндогенной бронхиальной астмой в результате сорбцион¬
ной терапии происходят снижение исходно повышенного спонтанного НСТ-теста
и нормализация активированного теста.
При изучении воздействия гемосорбции на систему сывороточных интерфер0*
нов при иммунодефицитных состояниях, обусловленных вирусами, выявлена
ТРАНСФУЗИОЛОГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 369
м При этом уровень сывороточного интерферона возрастает с 4.08±0.7
,^9*0.4 мЕ/мл (при норме 3,1±0,06), содержание интерферона а с 84,3±8,3
6±12.8 МЕ/мл (норма —148±9,3), концентрация интерферона у существен-
30 меняется (выявлено снижение с 18,86±2.1 до 16,6±6,8 МЕ/мл при норме
цИе j kiE/мл), но при этом увеличивается его выброс в ответ на раздражение
генами. Отмечено увеличение уровня ИЛ в сыворотке уже через 2 ч от начала
Сорбция. Это повышение сохраняется в течение 4,2±2,8 ч. К концу вторых
^ постсорбционного периода отмечено снижение уровня провоспалительных
ШЁнормальных значений. Выявление такой динамики цитокинов (в том числе
я.2 называемого эндогенным пирогеналом) позволило объяснить феномен
птермии, отмечаемой у 2/3 пациентов в первые часы после сорбции.
ыт выявлены иммуномодулирующие свойства гемосорбции в отношении
ц,парной активности нейтрофилов и моноцитов, уровня циркулирующих
тонных комплексов, иммуноглобулинов и ряда других показателей. Подобное
I ^ализующее воздействие было отмечено в отношении синтеза эндогенного
Лизола надпочечниками, окситоцина, гормонов гипофиза, щитовидной железы
‘ада других гуморальных факторов.
Воздействие гемосорбции на процессы воспаления и систему микроциркуляции
ализуется через различные механизмы, в первую очередь за счет улучшения
ПЄ0ЛОГИИ крови (и соответственно микроциркуляции) В зоне воспаления. ЧТО спо¬
собствует адекватной санации очага. Динамика снижения вязкости крови имеет
два периода. Первый длится 4-7 ч от начала гемоперфузии и обусловлен гепари-
низацией и гемодилюцией во время процедуры. К концу первых суток реологиче¬
ские показатели возвращаются к исходным значениям. Начиная с третьих суток
отмечают снижение показателей вязкости крови, нормализацию поверхностного
j зар}ща эритроцитов, улучшение эластических свойств мембраны эритроцитов.
Улучшение кровообращения в микроциркуляторном русле происходит за счет
повышения текучести крови, снижения выраженности сладж-синдрома, повы¬
шения эластичности сосудистой стенки и мембраны эритроцитов. Этому также
способствует снижение уровня атерогенных липидов.
Немалую роль в противовоспалительном действии играет снижение уровня
провоспалительных лейкотриенов и ИЛ за счет их прямой сорбции, а также
из-за нормализации их выработки клетками-продуцентами. Кроме того, сорб¬
ция токсичных продуктов воспаления, улучшение физиологических процессов
их дезактивации и естественной элиминации в постсорбционном периоде способ-
ствуют скорейшему разрешению воспалительного процесса.
В ряде исследований было доказано воздействие сорбционных методов на фар¬
макокинетику и фармакодинамику лекарственных препаратов.
Возможные осложнения гемосорбции:
I нарушения сердечно-сосудистой деятельности — гипотонические реакции,
нарушения ритма сердца;
• кровотечения из потенциальных очагов, активация существующих хирурги¬
ческих кровотечений;
• пирогенные реакции;
• гипогликемические состояния, в первую очередь у больных сахарным диа¬
бетом;
' эмболические осложнения.
Абсолютных противопоказаний к применению гемосорбции нет, из числа отно-
^вльных наиболее серьезным является возможный источник кровотечения.
Д° настоящего времени нет единого мнения по поводу целесообразности кли-
нического применения неселективной сорбции в том или ином случае. Внедрение
мосорбцИИ в клиническую практику начиналось с ургентной токсикологии.
Ранение сорбционных методов позволило значительно расширить возмож*
378 І(ЛН4И*«СХАЯТПШСФУЗИОЛОГИЯ
мости лечения при отравлениях гидрофобными веществами (небарбит^рТГ
I п.і/пі.пимиі^пийииищп^гщяищ^^^^*^**Кі|
|«ть|
период пребывания их в крови в 3-10 раз.
MgKjgH jlv іСПЛЛ uj/п w«—— — * ' * 'УмОВк!
психотропными средствами, алкалоидами, фибными токсинами и т.д.), Л0ВЫс м
интенсивность очищения крови от ядов (клиренс до 100-200 мл/мин) и СОКрати^-
Положительные результаты гемосорбции на неселективных угольных сорбеп
тах в терапии неотложных состояний позволили рекомендовать их и для лечен
дож заболеваний. Эти методы используют при лечении острой и хроническгг
печеночной недостаточности, синдромах длительного и позиционного сдавл"
ния, некоторых кожных заболеваниях, алкогольной и наркотической интокси
нации, медикаментозных отравлениях. Были попытки применять гемосорбцію
при лечении атеросклероза, аутоиммунных заболеваний, коллагенозов, гнойно¬
септической патологии, инфекционных заболеваний, ожоговой болезни в стадии
токсемии. В настоящее время интерес к неселективным вариантам гемосорбции
ограничился достаточно четко очерченными видами патологий.
Показания к применению неселективной гемосорбции:
• эндотоксикозы при сепсисе, гнойном перитоните, деструктивных панкреати¬
тах. ожоговой болезни, травмах;
• заболевания, сопровождающиеся накоплением токсинов средней молекуляр¬
ной массы, - острая и хроническая почечно-печеночная недостаточность
синдромы длительного и позиционного сдавления;
• экзотоксикозы - отравления фосфорорганическими соединениями, бар¬
битуратами. лекарственными препаратами, алкогольная и наркотическая
интоксикация, отравления небарбитуровыми психотропными средствами,
алкалоидами, грибными токсинами и т.д.
При токсикозах, обусловленных септическими осложнениями хирургических
операций (преимущественно среднемолекулярных токсикозах), наиболее эффек¬
тивны фильтрационные методы ЭКД (гемо- и гемодиафильтрация). Угольную
гемосорбцию используют гораздо реже. В то же время при отравлениях различной
этиологии метод угольной гемосорбции остается ведущим, так как клиренс выве¬
дения перечисленных экзотоксинов, несомненно, выше именно при этом способе
детоксикации.
Следует отметить, что гемосорбцию как самостоятельный метод ЭКД в настоя¬
щее время используют гораздо реже, чем 10-15 лет назад. Чаще всего этот метод
эфферентной терапии сочетают с непрямым электрохимическим окислением гипо¬
хлоритом натрия, магнитотерапией, гемоквантовыми методами, цитаферезом и т.д.
Методы плазмо- и лимфосорбции с угольными сорбентами всегда использовали
гораздо реже, чем сорбцию цельной крови, хотя они и имеют ряд преимуществ.
Так, отсутствие контакта форменных элементов крови с экстракорпоральным
контуром и сорбентом (полностью исключается возможность негативного воздей¬
ствия сорбента на клетки крови) делает эти методы более щадящими по сравнению
с сорбцией цельной крови. Применение сорбции цельной крови приводит к потере
и травматизации форменных элементов крови: при перфузии одного ОЦК через
сорбент теряется до 5% циркулирующего пула клеток. Помимо этого, при деток¬
сикации плазмы, лимфы или ликвора снижается расход сорбента (при гемосорб¬
ции цельной крови часть сорбента блокируется клетками крови). При сорбции
цельной крови возможны также цитокиновые реакции, вызванные контактом
лейкоцитов с поверхностью сорбента. Выброс цитокинов начинается с момента
контакта клеток крови с поверхностью сорбента. В ряде случаев выраженность
цитокиновой реакции может приводить к синдрому системного воспалительного
ответа различной степени тяжести. Повышение уровня ИЛ-1 может быть при¬
чиной гипертермических реакций в постсорбционном периоде. Сорбция цельной
крови гребует введения значительных доз гепарина* — 250-350 ЕД/кг массы тела,
или 17 500-25 ООО ЕД на процедуру пациенту с массой тела 70 кг, что чревато раз-
ТРАНСФУЗИОЛОГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 371
йвщений гемостаза в постперфузионном периоде. При плазмо- или лим-
<ЄІиД0п°лнительн0Г0 введения антикоагулянтов не требуется, так как сор-
среда уже стабилизирована на стандартном гемоконсерванте.
^уЄ*^осорбцию применяют в тех случаях, когда существует возможность
№ удаления тех или иных токсинов из плазмы с помощью сорбента,
сеі^оляет значительно повысить селективность и эффективность плазмафе-
Э*°1,03 зить потребность в донорских плазмозамещающих препаратах и вернуть
^’с ТУ большинство необходимых для жизнедеятельности собственных плаз-
компонентов. Плазмосорбции присущи все терапевтические механизмы,
^ктеоные для гемосорбции, кроме удаления клеточных элементов. Отсутствие
* чной адгезии, приводящей к уменьшению площади активной поверхности,
^ляег уменьшать объем используемого сорбента до 50%, регенерировать сор-
Я использовать его повторно.
Показания к плазмосорбции: эндотоксикозы с накоплением токсинов средне-
екулярной массы. Скорость плазмосорбции зависит от таковой (технического
Іпианта) плазмафереза.
Лямфосорбция - метод детоксикации, в основе которого лежат наружный
оенаж грудного лимфатического протока и сорбция отводимой лимфы через
гольный сорбент с последующим возвратом в центральную вену пациента. Суть
^йода состоит в удалении маркеров начальной токсемии и факторов вторичной
токсической агрессии, которые попадают в лимфу грудного протока из очагов,
дренирующихся его системой, до их попадания в кровь, что является преимуще¬
ством лимфосорбции перед сорбцией цельной крови. Однозначно, что концен-
ірация токсичных веществ в лимфе, оттекающей от пораженного участка, выше,
чеМ в магистральном кровотоке, соответственно эффективность такого метода
экстракорпоральной детоксикации также выше. Эффективной считают сорбци¬
онную обработку лимфы, равной 1 ОЦП. Известен положительный опыт при¬
менения продленной лимфосорбции в комплексном лечении больных с острым
деструктивным панкреатитом в фазе токсемии после выведения из панкреатиче¬
ского шока и при токсикозе, сопутствующем синдрому позиционного сдавления.
Данная методика состояла в наружном дренировании грудного лимфатического
протока, порционного сбора лимфы в контейнеры с антикоагулянтом, сорбции
лимфы в режиме рециркуляции на угольном сорбенте с последующим введени¬
ем прошедшего сорбированную обработку продукта в центральную вену. Объем
реинфузируемой лимфы в процессе лечения составлял от 2 до 30 л, продолжитель¬
ность процедуры — 3-10 сут. В результате продленной лимфосорбции отмечено
снижение молекул средней массы на 50-60%, у больных с панкреатитом норма¬
лизовалось содержание амилазы в плазме. Недостатком метода лимфосорбции
можно считать необходимость открытой катетеризации грудного лимфатического
протока, что опасно вероятностью формирования лимфатического свища и стой¬
ких нарушений лимфообращения.
Ликворосорбция — метод экстракорпоральной сорбционной санации лик-
юра. Для проведения операции катетеризируют один из желудочков головного
мозга. Забираемый через этот катетер ликвор перфузируют через сорбционную
колонку и вводят в спинномозговой канал. Метод применяют для выведения
форменных элементов крови и продуктов их распада при травмах и кровоизлия¬
ниях в мозг. Также метод позволяет очищать ликвор от токсинов, образующихся
8 результате воспалительных, инфекционных процессов в головном и спинном
РЦ и при отравлениях ядами, проникающими через гематоэнцефалический
“зрьер. Существуют данные об эффективности процедуры при лечении ряда
"*Рвно-психических расстройств (некоторых форм шизофрении и эпилепсии,
петского церебрального паралича, миастении и т.д.), инфекционных менингитов,
^икоманий.
■ КМИИССМЯ ТРАНСФУЗИОЛОГИЯ
Широкому применению метода препятствуют необходимость трепа наІІИГШ
головного мозга и длительность процедуры (до 24 ч и более)*
У нейрохирургических больных показания к применению метода неселве»
Жй дошоросорбции обосновывают тем. что в раннем послеоперационном п^*
Ц ■ спинномозговой жидкости накапливаются патологические субстанции, ъц
ноли элементы поврежденной мозговой ткани, крови, продукты распада клетп!
которые усугубляют циркуляторные изменения, нарастает отек мозга. Поскол°К'
естественная санация ликвора происходит в течение длительного времени
яед). метод ликворосорбции позволяет в кратчайшие сроки элиминировав
зговой жидкости патологические субстанции и, таким образом, ус*^
рить процесс послеоперационной реабилитации.
К категории наиболее древних методов активной детоксикации относят энте¬
росорбцию, которая известна со времен Гиппократа. В последние годы интеиег
к энтеросорбции опять возрос. Метод привлекает внимание своей простотой
к практически полным отсутствием побочных реакций. В его основе лежит при¬
менение энтеросорбентов — лечебных препаратов различной структуры, связы-
экзогенные и эндогенные вещества в желудочно-кишечном тракте путем
тех же механизмов, которые задействованы при экстракорпоральной сорбции
жидких сред организма (адсорбции, абсорбции, ионообмена и комплексообра-
эомния). В качестве энтеросорбентов используют активированный уголь, лиг¬
нин, кремнийорганические соединения, поливинилпирролидон, пищевые волокна
(мнкроцеллюлоза) и другие субстанции (порошкообразный активированный
уголь «ОУ-А*, карбактин* на основе микроцеллюлозы, лигносорб*, полифепан*),
Характер используемого сорбента определяется его моно-, би-, полифункциональ-
ной селективностью или неселективностью. Процесс энтеросорбции начинается
в желудке и завершается в толстой кишке. Метод апробирован для детоксикации
при острых эндогенных и экзогенных отравлениях, у онкологических больных
ну фоне лучевой и полихимиотерапии, при лечении пищевых токсикоинфекцнй,
дизентерии, сальмонеллеза, ожоговой болезни в стадии токсемии и септикотоксе-
мии. хронической почечной недостаточности, хронического гепатита, в том числе
холестатического, цирроза печени, атопического дерматита, псориаза, бронхиаль¬
ной астмы и др.
При знтеросорбции принятый внутрь сорбент осуществляет сорбционное воз¬
действие на кровь, омывающую стенку кишечника. Все известные энтеросорбенты
имеют естественное происхождение и созданы на основе растительного и мине¬
рального сырья. Самый первый и древний препарат этого класса — активирован¬
ный уголь. Высокими сорбирующими свойствами обладают растительные пекти¬
ны. кристаллическая целлюлоза, отруби, лигнин.
Энтеросорбции присущи все эффекты, характерные для других сорбцион¬
ных методов: детоксикация, противовоспалительное, противоаллергическое,
рео* І иммуномодулирующее воздействие, потенцирование эффективности фар¬
макотерапии и т.д. Механизмы терапевтического воздействия энтеросорбции
аналогичны таковым гемосорбции, за исключением сорбции форменных элемен¬
тов, В связи с этим показания к применению этих методов совпадают. Различна
тактика их применения, Если перфузионные сорбционные методы являются «ско-
ропомощными* и используются как методы интенсивной терапии, то энтеросоро-
кия метод, требующий длительного применения. Она лишена многих серьезных
осложнений, свойственных экстракорпоральным инвазивным воздействиям.
Вульнеросорбцмя - способ удаления продуктов раневого процесса непосреД'
стаєнно с поверхности раны с помощью сорбирующей повязки. При этом сорог
рукииими свойствами может обладать салфетка (ткань из волоконных сорбентов)
либо на рану наносят сорбент в виде присыпки, мази, геля и т.д. Подобная повязю
позволит существенно сократить выраженность токсикоза на системном УР°
ТРАНСФУЗИОПОПЛЧЕСКИЕ МЕТОДЫ гаЮКОРРЕКЦМ 373
roro, если сорбент предварительно насытить раствором антисептика
* Ллибиотика, то при попадании на рану будет происходить обмен антисептика
раневого процесса. Таким образом, помимо снижения интоксикации.
и»#05^ топическая доставка лекарственных препаратов.
^*іьзование уГ0ЛЬНЬ1Х сорбентов для сорбции раневого отделяемого из гной-
и - вопрос, несомненно, спорный. Поведение сорбента в гнойных ранах.
,Й* «моекоторых содержит большое количество фибрина, фибриногена, других
фрагментов клеточного детрита различной величины, до конца не выяс-
^°ПрИ электронной микроскопии отмечено, что в процессе взаимодействия
ЩУ|| отделяемым поверхность гранул сорбента теряет свой характерный
сгый вид из-за обволакивания их нитями фибрина. На покрытой фибрином
^гпйюсги расположены различные по величине белково-клеточные конгло-
jfjjf правило, это некротизированные ткани, бактерии, иммунокомпе-
^ые клетки, которые не сорбируются препаратом, а оседают на фибриновом
гранул сорбента. При удалении сорбционных препаратов на перевязках
акте с гранулами элиминируются большие фрагменты нежизнеспособных тка¬
ла! 8 белково-клеточные конгломераты.
для избирательных (селективных) вариантов сорбции применяют биологиче-
Щ аффинные и иммунные сорбенты. Применение определенных клеточных
«ли иеклеточных структур в качестве биосорбентов основано на их естественной
функции, выполняемой в организме в обычных условиях. Предприняты попытки
использовать в качестве биосорбентов донорские эритроциты и альбумин, ткани
печени и селезенки животных.
Способность эритроцитов сорбировать на своей поверхности и транспорти¬
ровать большинство ксенобиотиков позволила разработать метод плазмоэри-
тросорбции, основанный на адсорбции токсинов плазмы мембранами отмытых
донорских эритроцитов. Для получения детоксикационного эффекта срок хране¬
ния эритроцитов донора не должен превышать 5 сут. срок инкубации эритроцитов
с плазмой больного — не менее 15-30 мин, а соотношение эритроциты/плазма
должно составлять 1:1. За одну процедуру используют не менее двух доз отмытых
донорских эритроцитов.
Альбумин является одним из основных транспортных белков крови, перенося¬
щих массу низкомолекулярных гидрофобных метаболитов, в том числе токсичных.
Для связывания таких метаболитов молекула альбумина имеет специальные цен¬
тры. Детоксикационные возможности альбумина по отношению к альбуминсвя-
заннымтоксинам используются в приборе «МАРС». Название прибора расшифро¬
вывается как молекулярная адсорбирующая рециркулирующая система (Teraklin,
Германия). Метод сочетает специфическое удаление альбуминсвязанных токсинов
печеночной недостаточности с выведением водорастворимых токсинов путем
выбранного транспорта, как при гемодиализе. Таким образом, система «МАРС»
имеет смешанный механизм дезинтоксикационного действия и позволяет удалять
к организма билирубин, желчные кислоты, фенолы, меркаптаны, индолы, окись
^.эндогенные бензодиазепины, избыток триптофана и ароматических амино-
*ислот, ложные медиаторы (фенилэтиламин), аммиак.
Прически все перечисленные субстанции гидрофобны (за исключением
который относится к водорастворимым субстанциям) и удаляются путем
^«ания с альбумином. Связь большинства токсинов печеночной недостаточ-
с белками плазмы затрудняет их удаление из организма другими экстра-
2*£*®>ными способами. Важнейшее преимущество системы «МАРС» — воз-
ость детоксикации с сохранением всех жизненно важных веществ и белков,
использованию в аппарате специфической мембраны и сывороточного
-УМййа человека в качестве селективного адсорбента система «МАРС* -
Генное устройство, способное удалить с высокой степенью селективности
И МУШ
174 мшмихайтпмсфуэиология
1 связанные с альбумином токсины с низкой и средней молекул
массой. Система «МАРС* хорошо зарекомендовала себя в лечении острой 0*
«ческой печеночной недостаточности, желтухи, гепаторенального син!^
коррекции экскреторной и синтетической функции печени и печеночной
лопатам. Данный метод позволяет подготовить пациента к трансплантации
им, эффективен в посттрансплантационном периоде и после обширных peJ^
вечюи. Т.е выступает В роли искусственной печени. Широкому ИСПОЛЬЗДв^®®
этой методики препятствует высокая стоимость оборудования, расходных
риалов и донорского альбумина.
Вопрос создания искусственной печени существует не одно десятилетие, и Dpi
ли его по-разному. Отправным моментом в решении этой проблемы чалап!
то. что основная масса гепатотоксинов - жирорастворимые вещества, в ев»!
С чем гемодиализ и прочие методы заместительной почечной терапии в данн
случае неприемлемы. Более эффективными методами в терапии печеночной нед **
статочности стали плазмаферез и плазмофильтрация, позволяющие в течение
многократных плаэмообменов поддерживать относительно стабильный гомео¬
стаз в организме. Так, в процессе подготовки к трансплантации печени удалению
подлежали до 40 л плазмы и больше, что требовало соответствующего плазмо-
замещения. В 60-е гг. XX в. в целях борьбы с острой и хронической печеночной
недостаточностью были предприняты попытки использовать неселективную
гемосорбцию, эффективность которой также оказалась недостаточно высока, так
как угольный гемосорбент имеет гидрофильную поверхность, в связи с чем он
недостаточно активен по отношению к гидрофобным соединениям. Именно
поэтому практически параллельно с гемосорбцией разрабатывались методы ксе-
носорбции или ксеноперфузии. Метод ксеносорбции основан на использовании
естественных детоксикацинных возможностей живых ксеногенных тканей, орга¬
ни, отдельных популяций клеток при контакте с жидкими средами организма
(кровью, плазмой). Клинические эффекты ксеносорбции сложны и связаны с эли-
имшщией и биотрансформацией, характерными для определенного органа, ткани
или клеточной массы, а также со стимуляцией биологически активных веществ,
клеточных медиаторов, выделяющихся из донорской ткани, и со специфической
стимуляцией систем иммунитета и фагоцитоза больного при контакте с чуже¬
родной тканью. Первый зарубежный опыт ксеносорбции относится к 70-м гг.
прошлого века, когда были предприняты попытки экстракорпоральной перфузии
крови через свежую печень свиней и павианов. Исследования в этом направлении
достаточно быстро прекратились, и внимание было сосредоточено на разработке
и применении методов, использующих способность гепатоцитов культивиро¬
ваться in vitro для последующего введения внутривенно или в ткань печени. Были
предприняты попытки использования живых печеночных клеток человека (метод
ELAD), а также свиных гепатоцитов (прибор Circe). В связи с большим количе¬
ством осложнений эти методы не нашли широкого применения.
В России, в НИИ трансплантологии и искусственных органов, разработаны
методы ксеноспленосорбции (ксеноспленоперфузии) и ксеногепатосорбции (ксе-
ногепатоперфузии) с использованием биосорбента, содержащего фрагменты ксе-
носелезенки и ксеногепатоцитов.
При спленосорбции кровь пропускают через свежую изолированную селезенку
свиней или телят. Селезенка агглютинирует антигены, выделяет лизосомальные I
ферменты. Эффект взаимодействия жидкой среды организма с органом живот- I
ного выражается значительным детоксикационным эффектом и иммуномодули- I
рующим действием на Т-лимфоциты и их субпопуляции (CD3, CD4, CD8), сти- I
муляцией клеток NH/CD16, В-лимфоцитов и гуморального звена иммунитета
Спленоперфузия способствует снижению уровня токсинов средней молекулярной
магсы и индекса лейкоцитной интоксикации.
ТРАНСФУЗИ0Л0ГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 375
„яоксикации использовали не только свежие донорские органы, но и кри*
^йвйрованные ксеногепатоциты и ксеноспленоциты. Различные методы ксе-
применяли при острой печеночной недостаточности, сепсисе, хирур-
^ их эндотоксикозах, ожоговой токсемии в различных ее проявлениях (шок,
,1, гнойно-септических осложнениях. Через экстракорпоральный контур.
1*®жащйй ксеносорбент. за одну процедуру перфузировалось до 11.5 ОЦК.
1 «случаев ксеносорбцию сочетали с плаэмаферезом, и через биосорбент была
^шена эритроцитная масса.
ЙЧйешдУ с экстракорпоральным использованием ксеногенных клеток применя-
^хное их введение непосредственно в гнойный патологический очаг, хотя
Активность такой методики не доказана. Ткани и клетки, введенные в участок
'•Аения, подвергаются воздействию протеолитических ферментов из бактерий
Лейкоцитов и быстро разрушаются. Продукты их распада служат питательной
ЙУ ддя микроорганизмов и постепенно всасываются в организм. Кроме того,
юоклетки иммунологически чужеродны для человека и способны вызывать
Аичиые аллергические реакции, вплоть до анафилактического шока. В целом
Ардс к методам ксеносорбции в последние годы существенно снизился, при-
КЯ чего достаточно много: это и вероятность серьезных побочных осложнений.
й сложности, связанные с содержанием животных, технологические проблемы
получения ксеносорбентов и др. В настоящее время основное внимание уделя¬
ют развитию более безопасных и эффективных эфферентных методов, таких
как система «МАРС» и фильтрационные методы ЭКД.
Наиболее прогрессивным и развивающимся вариантом эфферентной тера¬
пии является селективная сорбция с помощью высокоспецифичных иммунных
ииеиммунных (аффинных) сорбентов.
Высокоселективная иммунная сорбция — связывание в экстракорпоральном
контуре патологического субстрата (антигена), находящегося в организме паци¬
ента в избыточных количествах, с антителами, закрепленными на специальном
носителе.
Основные принципы высокоспецифичных аффинных взаимодействий
можно представить следующим образом: «лиганд-рецептор»; «анион-катион»;
«фермент-субстрат»; «белок-белок»; «белок-пептид».
бедует отметить, что для процесса иммунной сорбции характерно образование
непрочных соединений типа «антиген-антитело», которые легко разрушаются
при обработке иммуносорбционной колонки буферным раствором. Этот принцип
обеспечивает повторное использование иммуносорбента. В основе аффинной
сорбции лежит образование прочных связей, при этом, в отличие от иммуносорб¬
ции, сорбционную колонку используют однократно.
Как правило, для селективных вариантов сорбции применяют плазму, полу¬
чаемую с помощью гравитационного или мембранного плазмафереза. Эти мето¬
ды носят название селективной плазмосорбции. Характер удаляемых структур
зависит от особенностей сорбента. Преимущество плазмосорбции перед иммуно¬
сорбцией из цельной крови — отсутствие контакта форменных элементов крови
с сорбентом и магистралями экстракорпорального контура. В то же время этап
получения плазмы существенно удлиняет процедуру и повышает ее стоимость.
В настоящее время существует порядка 20 селективных сорбентов для лече-
Ийя Чалого ряда обменных и аутоиммунных заболеваний. Наиболее популярны
Лунные и неиммунные сорбенты для удаления из плазмы холестерина и ате-
Рогенных липопротеидов. Это объясняется высокой частотой приобретенных
* ^следственных гиперлипидемий. Например, заболеваемость семейными фор-
^ гиперхолестеринемии такова: гомозиготные формы — 1:1 ООО ООО, гете-
ДОниготные - 1:500. Различные варианты ЛНП-афереза используют во многих
™нах мира. Иммуносорбционные колонки, выпускаемые российской научно-
371 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
I производственной фирмой «ПОКАРД» (Москва), по качеству не уступают л vo
і Ц образцам.
Иішуноаферез позволяет удалять специфические вещества, определя
основной механизм патологического процесса. При этом иммуносорбциН>1ЧИе
I колонка содержит специфические антитела, способные связываться с субст»?ЙНая
подлежащим удалению. При гиперхолестеринемиях это антитела к липопр^3^’
* низкой плотности и липопротеиду (а), при системной красной волчанке - к лн**
при атопической бронхиальной астме и поллинозах — поли- и моноклональ
антитела против IgE, при рассеянном склерозе и аутоиммунной дилатационр^
гардиомиопатии - антитела к IgG. Научно-производственная фирма «nOKAPrf
выпускает следующие виды иммуносорбционных колонок: Ш
1 «ЛНП ЛИПОПАК» - для удаления атерогенных липопротеидов низк !
плотности, ЛОНП, ЛП (а) у пациентов с наследственной гиперхолестеп°И
немией. после оперативной реваскуляризации миокарда или коронапн-
ангиопластики:
• «ЛП(а)ЛИПОПАК» - для удаления липопротеида (а) у пациентов с атеро-
склеротическими поражениями коронарных, мозговых и периферических
артерий, повышенным уровнем ЛП (а) и нормальным уровнем других липо¬
протеидов;
і Щ АДСОПАК» - для снижения концентрации IgG, А и М при аутоиммун¬
ных заболеваниях, рассеянном склерозе, дилатационной кардиомиопатии
для подготовки пациентов к трансплантации органов и предотвращения
реакции отторжения.
Процесс производства иммуносорбционной колонки длителен и технологиче¬
ски очень сложен. Схематически его можно представить в следующем виде:
• выделение антигена из плазмы пациента;
і иммунизация линейного животного (барана);
1 получение чистых моноспецифических поликлональных антител против
антигена из крови животного-донора;
i иммобилизация антител на биологически инертном носителе — агарозе;
к заполнение гелем сорбента стеклянного корпуса колонки в асептических
условиях;
я конечная проверка колонки на стерильность и пирогенность.
Колонки предназначены для многократного длительного использования -
1-2 года при еженедельных процедурах. Каждый пациент должен иметь две
индивидуальные колонки. Схему селективной иммуносорбции можно представить
следующим образом:
• подготовка колонки к процедуре (промывание физиологическим раствором
в объеме 5 л);
• подготовка пациента к процедуре иммуноафереза;
• проведение процедуры непрерывного аппаратного плазмафереза;
і прогон плазмы, получаемой при плазмаферезе, через первую сорбционную
колонку в течение 40-50 мин;
І иммуносорбция через вторую колонку в течение 60-70 мин;
І регенерация первой колонки; „
і иммуносорбция через регенерированную первую колонку в течение 70-
мин;
• контроль анализов пациента;
§ регенерация колонок и консервация их на хранение.
Удлинение процедуры каждого следующего цикла иммуносорбции связа
со снижением концентрации удаляемого субстрата в поступающей плазме. В ко
процедуры наблюдают снижение концентрации удаляемого субстрата от 50 до
исходного уровня.
ТРАНСФУЗИОЛОГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 377
Ц ^-летний опыт применения селективной иммуносорбции липопро-
Р 4 к0й плотности и ЛП (а) в клиниках России показал, что у пациентов
нИнНЬ1МИ и приобретенными нарушениями липидного обмена этот метод
с поддерживать хорошее качество жизни; в ряде случаев способствует
0озв°лЯ атер0склеротических поражений коронарных артерий; предупреждает
Шш инфаркты миокарда.
11 V своей высокой селективности метод имеет большое будущее не только
І сИЛррЛипидемиях, но и различных аутоиммунных патологиях. Получены
I ^Обнадеживающие результаты Ig-афереза при рассеянном склерозе и ауто-
<0Й дилатационной кардиомиопатии, единственным способом лечения
и до недавнего времени оставалась трансплантация сердца. К сожалению,
Hi внедрению этого метода в клиническую практику препятствует его
Ий стоимость.
Актуальность проблемы гиперхолестеринемии, раннего атеросклероза с поте-
іспособности, а также сложности создания иммуносорбционных колонок
Оттолкнули исследователей к активным разработкам неиммунных сорбентов
удаления из плазмы холестерина и атерогенных липопротеидов. Известны
ого р°Да сорбенты японской фирмы Kaneha. Группой санкт-петербургских
w нЫХ разрабатывается отечественный аффинный сорбент «Сфероцелл ЛП-М»
і удаЛения холестерина и липопротеидов низкой и очень низкой плотности,
всеоедине 90-х гг. XX в. разработан и внедрен в клиническую практику новый спо¬
соб экстракорпоральной селективной сорбции липопротеидов низкой плотности,
получивший название метода DALI (Direct Adsorbtion and Lipoprotein Iliminetion).
Адсорбирующим материалом в данном случае служит полиакриламид, несущий
на себе полиакриловую кислоту. Гранулы сорбента отрицательными зарядами
связывают положительно заряженные элементы липопротеида. Этот принцип
моделирует физиологические условия рецепторного связывания липопротеидов
низкой плотности в печени. Диаметр пор адсорбента составляет 100-200 мкм.
От всех предшествующих селективных методов, направленных на удаление липо¬
протеидов низкой плотности и липопротеида (а), этот отличается тем, что уда¬
ление субстрата происходит из цельной крови. Лишенный стадии плазмафереза
метод позволяет ускорить процедуру и снизить ее стоимость. Подобный метод
элиминации липопротеидов низкой и очень низкой плотности из цельной крови
несколько позже, в 2001 г., был разработан фирмой Kaneha в Японии. Для аффин¬
ной сорбции используют колонки Liposorber LA 75, которые содержат в качестве
лиганда декстран-сульфат.
В Германии в течение 20 лет успешно используют метод элиминации липопро¬
теидов низкой плотности, ЛОНП и фибриногена, в основе которого лежат принци¬
пы химической преципитации и сорбции, — гепарининдуцированный липоаферез
(HELP apheresis system). Суть метода состоит в том, что в плазму, полученную путем
плазмофильтрации, добавляют гепарин* и пропускают ее через колонку, где оседа¬
ют комплексы, образующиеся в результате взаимодействия гепарина* с липопро-
тсидами. Далее плазму пропускают через колонку, в которой происходит нейтра¬
лизация гепарина*, после чего ее возвращают пациенту. Метод позволяет снизить
концентрацию атерогенных фракций холестерина и фибриногена. Несмотря
к трудоемкость процедуры, метод HELP apheresis system хорошо зарекомендовал
Ія ПРИ ишемической болезни сердца, для профилактики рецидивов стенокардии
е аортокоронарного шунтирования и трансплантации сердца.
ГРАВИТАЦИОННЫЕ (ЦЕНТРИФУЖНЫЕ) ЭФФЕРЕНТНЫЕ МЕТОДЫ
Рационные эфферентные методы основаны на центробежной силе (цен¬
зурований) для разделения жидких сред организма (крови) на составляю-
Их Компоненты. Их объединяют под термином «аферез», или «гемаферез».
J7f ТИЙОФУЗМОПГУ *я
Процедуру I «рои* р компоненты с применением «ЯГпм^
снлы можно выполнять двумя способами *%й
• яри вращении грови і центрифуге с горизонтальным ротором. когда
I жидкостью располагается во время центрифугирования
ИЮ
І в особых приспособлениях в виде двухслойною колокола в сепароторак
I обоих случаях разделение крови на компоненты происходит силой
бежйого ускорения. При этом форменные элементы располагаются вою**'
вращение слоями Наиболее плотные клетки, эритроциты, оказываются на **
ферм*. ближе к центру располагаются форменные элементы, имеющие щ
влотиесть, лейкоциты, затем тромбоциты. В центре делительной камеру^
()СТа>
Для удалении ИЗ крови определенного компонента необходимо подоб
соответствующий режим центрифугирования, который бы обеспечил К0н|)ать
Грецию удаляемых клеток в одном слое. В конце 70-х гг. XX в. академик Рлші
O.K. Гаврилов и его коллеги предложили термины «гравитационная хирурги
и «хирургия крови» способы экстракорпорального воздействия на пери/*
ричегкую кровь, костный мозг, другие жидкие внутренние среды организм*"
предусматривающие разделения их на фракции с помощью сил гравитащ»
(центрифугирования). Цель такого воздействия - выделение и получение
определенных структур из жидких субстратов организма для лечебных целей
или удаление из них патологических элементов (опухолевых клеток, агрегатов
клеток, антител, комплексов «антиген-антитело», белков и др.) для стабилиза¬
ции гомеостаза.
Согласно извлекаемым компонентам крови различают следующие виды гема¬
фереза;
і плазмаферез;
і цитаферез - эритроцит-, тромбоцит-, лейкоцит- (гранулоцит-, лимфоцит-),
бластоцит , неоцит*, миелокариоцитаферез, аферез периферических стволо¬
вых клеток.
Плазмаферез (ПАФ) ведущий метод гемафереза по количеству выпол¬
няемых процедур. ПАФ предусматривает удаление плазмы больного целиком,
со всеми содержащимися в ней физиологическими и токсичными компонентами,
I замену ее донорской плазмой или кровезаменителями. ПАФ — универсальный
эфферентный метод, позволяющий воздействовать на токсичные субстраты любой
молекулярной массы и электрохимического заряда. Обладая детоксикационным.
деплазмирующим. иммуномодулирующим, дренирующим действием, плазмаферез
позволяет воздействовать на все жидкостные пространства организма - внутрикле¬
точное, внеклеточное, внутрисосудистое, а также на структуру клеточных мембран
эритроцитов, тромбоцитов и лейкоцитов. Отмечено, что у метода ПАФ, по сравне-
нию с другими эфферентными способами, суммарное детоксикационное действие,
влияние на реологические и иммунологические параметры выше. В настоящее
время ПАФ занял прочное место в лечении целого ряда заболеваний самой различ¬
ной природы В ряде клинических ситуаций ПАФ может быть частью сочетанной
или комбинированной эфферентной гемокоррекции, если полученную плазму под¬
вергают дальнейшей обработке - сорбции, фильтрации, преципитации и т.д.
Часто І качестве отдельного эфферентного метода выделяют обменный ПАФ.
NSX плазмообмен. Особенность этого варианта ПАФ — большой объем плазмоза-
мещеиия (>1 ОЦП) и характер заместительной терапии. Не менее 70-80% объема
удаленной плазмы при этом замещают свежезамороженной донорской плазмой
ют растворами альбумина. ПАФ в режиме плазмообмена применяют при лечении
хирургических энлотоксикоэов, полиорган ной недостаточности, синдрома Д» *
остром вмутрисосуднстом гемолизе, синдромах длительного и позиционного сдав
Q0Jt$&мв ишемии-реперфузии и т.п. Если поводом к обменному птазиафг
иммуиономпетентная патология, то не менее 60% объема удмемюй
^ ^обходимо восполнить растворами альбумина. _
t гравитационным (центрифужным) ПАФ существует также мти
jJJJigi цлаэмы с помощью специальных плазмофильтров — фильтрационный
^^дргорые фирмы предлагают для этих целей плазмофильтры не основе
^fi гыт волых волокон. В России более продуктивной оказалась идея сишшм
&2^1т.гол с использованием плоских пористых, тік называемых трековых.
Мембраны получают с помощью бомбардировки плоской лавсановой
*уГ«ярями аргона в ускорителе с последующим травлением в щелочном par-
тех местах, где прошло такое ядро, остаются следы а виде деструкции матв-
JjC я при травлении там формируются абсолютно круглые одинаковые поры
Jjjjmoll около 0.5 мкм. Диаметр пор позволяет свободно проходить всем жидким
***юйеКТам крови и задерживать форменные элементы. Первый такой плазмо-
•гТпМФ'в00- был допущен к клиническому применению в 1992 г. Последняя
отечественного плазмофильтра ПМФ-ТТ «Роса» позволяет получать до I л
i час. Протекание крови через плазмофильтр может происходить спонтанно
*L с помощью насоса, что предусмотрено в отечественных приборах для мембран¬
ні плазмафереза «Гемос* и «Гемофеникс*. Использование названных приборов
^щяег существенно повысить скорость плазмофильтрации.
С момента внедрения в клиническую практику ПАФ предприняты попытки
использования этого метода эфферентной терапии для профилактики и лечения
«опее чем 200 нозологий. В России первые процедуры ПАФ были выполнены в
1%4г. при макроглобулинемии Вальденстрема. Пик использования ПАФ в прак¬
тике пришелся на 80-е гг. прошлого века. Накопленный за многие годы опыт при¬
менения ПАФ при различных патологических состояниях позволил очертить круг
заболеваний, при которых оно клинически обоснованно и экономически оправ¬
данно. Сегодня отношение к этому методу экстракорпоральной терапии стало
более сдержанным. В последние годы ПАФ, как правило, используют при полива¬
лентных эндотоксикозах, токсикозах, вызванных крупномолекулярными токсина¬
ми, или сочетают с методами селективной и неселективной плазмосорбции.
Согласно положениям Всемирной ассоциации гемафереза (1993, 1997, 2000,
2005). ПАФ высокоэффективен при следующих заболеваниях:
• миастеническом кризе;
• тиреотоксическом кризе;
• полирадикулоневрите Гийена-Барре;
• тромботической тромбоцитопенической пурпуре;
• гемолитико-уремическом синдроме;
• ДВС-синдроме в фазе гипокоагуляции;
• краш-синдроме;
• синдроме позиционного сдавления.
ПАФ рекомендуют в комплексном лечении следующих заболеваний и состояний:
• системной красной волчанки;
• системных васкулитов;
• иузырчатки;
• АВ(0)-несовместимости при трансплантации костного мозга;
• при наличии ингибиторов к факторам свертывания;
• наследственных гиперхолестеринемий;
• отравлений белоксвязывающимися токсинами;
• ираяротеинемических полинейропатий;
• ииедомной болезни;
• болезни Вальденстрема;
• быстропрогрессирующего нефрита;
З80 КЯМГСЄКДЯІМНСФУЗИО/ЮГИЯ
криоглобул инем и й.
Объем удаляемой плазмы, кратность процедур, характер и объем замести
ной терапии, кратность курсов ПАФ определяют индивидуально в кажд^^ь-
крегном случае.
Эффективность ПАФ может быть повышена за счет использования Мр
криоафереэа (криогепариновой преципитации). Сочетание ПАФ с криоа<Ье*
позволяет также сократить количество необходимых плазмозамещающих сп^30"
Метод криоафереза основан на свойстве белка плазмы фибронектина
меризоваться в присутствии гепарина* на холоде и образовывать npenJ^'
в состав которого, помимо фибронектина, входят циркулирующие иммунные^1,
ялексы, IgM, А и G, криоглобулины, фибриноген, перекисно-модифицирова^'
липопротеиды. фактор фон Виллебранда. Метод позволяет удалять из цЛаЙЬ!е
от 30 до 50% перечисленных веществ, более 80% криоглобулинов, рколо^по1
фибронектина при сохранении до 85% альбумина. Таким образом, криоайе
позволяет повысить иммуно- и реокорригирующее действие ПАФ. Суть мет
состоит в том, что в плазму, полученную при ПАФ, добавляют гепарин* из пасч *
20 ЕД на 1 мл плазмы. Гепаринизированную плазму сохраняют в холодильну
затем повторно центрифугируют для осаждения образовавшегося криогепаои'
нового осадка. Супернатант возвращают пациенту. Частичный возврат больном"
собственной плазмы, содержащей до 85% альбумина, делает процедуру болееэко
иомичной и позволяет сократить количество реакций и осложнений, связанных
с замещением, в том числе и инфекционных. Факт, что большая часть полезных
компонентов плазмы возвращается больному, важен при терапии антибиотиками
иммуномодуляторами и другими лекарственными средствами.
Описано несколько вариантов криогепариновой преципитации. Классический
вариант предусматривает инкубирование гепаринизированной плазмы при тем¬
пературе +4 °С в течение 12 или 24 ч, затем плазму сепарируют при той же темпе¬
ратуре. При такой методике не всегда получается выраженный осадок, что делает
дальнейшее использование плазмы невозможным.
Возможно замораживание гепаринизированной аутоплазмы при -20 °С, а затем
ее центрифугирование при температуре +22-25'^С,, скорости вращения ротора
3000 об./мин в течение 50 мин. Осадок при таком режиме получаёВД в зна¬
чительно большем объеме, однако плазма не всегда успевает разморозиться
Увеличение температуры размораживания ‘ дб+30 "С приводит к выпадению
фибрина. Увеличение времени центрифугирования до 60-80 мин резко обедняет
над осадочный слой альбумином.
Предлагают замораживать гепаринизированную плазму, а за 12 ч до ее исполь¬
зования помещать в холодильник с температурой +4 °С. Центрифугирование
осуществляют при температуре +20-22 “С в течение 35-40 мин со' скоростью
2000 об./мин. В результате получается гомогенный криопреципитат с высоким
содержанием глобулинов, циркулирующих иммунных комплексов; холестерина
и липопротеидов. В яадосадочной части плазмы криоглобулины отсутствуют,
содержание глобулинов и холестерина снижается до 80% исходного уровня, уро¬
вень общего белка снижается на 30% за счет сохранения до 80-85% фракции аль¬
буминов. Такой супернатант можно считать полноценной замещающей средой.
Метод гепаринопреципитации применяют при аутоиммунной патологии,
Криоглобулинемиях, системных васкулитах. У больных атеросклерозом отмече¬
но умеренное снижение уровня общего холестерина и триглицеридов. Снижается
содержание в плазме высокоатерогенных перекисно-модифицированных липо¬
протеидов, возрастает устойчивость липопротеидов к окислению. Снижается
содержание высокоатерогенных холестеринсодержащих иммунных комплексов,
концентрация фибриногена, Улучшаются другие реологические показатели
крови. Клиническое подтверждение указанных положительных лабораторны*
данных наблюдают в 79% случаев.
ТРАНСФУ31Л0Л0ГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 381
мет0д термопреципитации, в основе которого лежит способность тер*
ных белков плазмы переходить в нерастворимую форму при нагревшим
При термопреципитации из плазмы полностью удаляются фибриноген.
^ ^пбулины, значительно уменьшается активность фактора фон Виллебранда,
рйР°гЛ° свертывания крови (V, VII, VIII, IX, XI и XII), ингибитора активатора
^°^°огена. Эти изменения приводят к значительному снижению кинематиче*
^^зкости, уменьшению агрегации тромбоцитов и эритроцитов, повышению
^Политической активности крови. Методы термопреципитации (термоплаз*
^ традия или термоплазмосорбция), теоретически обладающие высоким
Нитрующим действием, пока еще не нашли клинического применения.
Отличие от плазмафереза, получение клеток крови (цитаферез) возможно
їо с помощью сил гравитации. Развитию цитафереза во многом способствова-
^яание целого ряда современных сепараторов крови с высокой разрешающей
j ‘“костью оптических датчиков. Это позволило сделать процедуру цитафереза
^^селективным эфферентным методом. Получение клеток крови происходит
так и непрерывным аппаратными методами, а самым простым
і гемафереза по-прежнему является центрифугирование крови в центри-
j с автоматическим или воздушным охлаждением. Центрифужные процедуры
^іфереза можно отнесги к условно селективным методам эфферентной гемоте-
'’^функциональному назначению различают продуктивный (донорский
имйтодонорский) и лечебный гемаферез.
Донорский гемаферез позволяет обеспечивать лечебные учреждения компо¬
нентами крови - плазмой, тромбоцитным концентратом, эритроцитной мас¬
сой, стволовыми клетками. В службе крови ведущий метод гемафереза - ПАФ,
І цю обусловлено высокой потребностью стационаров в донорской плазме. Плазму,
получаемую посредством донорского ПАФ, используют для последующих транс-
! фузий, плазмообмена, производства плазменных белков и других компонентов
нпрепаратов.
Аутодонорский гемаферез применяют для заготовки компонентов собствен¬
ной крови больных. Этот способ широко используют в хирургии, акушерстве,
ортопедии, гематологической практике. Различные методы компонентного ауто¬
донорства позволяют в предоперационном периоде или до родов заготовить
необходимое количество плазмы, эритроцитной массы, тромбовзвеси, а также
подготовить пациента к интраоперационной нормоволемической гемодилюции.
В лечении ряда гематологических заболеваний в последние годы используют
аутодонорский аферез периферических стволовых клеток, выполняемый перед
лучевой или химиотерапией. Методы аутогемотрансфузии выступают как альтер¬
натива трансфузии компонентов донорской крови, способствуют поддержанию
иммунного статуса, обеспечивают более благоприятное послеоперационное тече-
Нй0, Одним из широко применяемых в хирургической практике вариантов ауто-
гаитрансфузии является реинфузия отмытых эритроцитов, полученных после
Чйтрифугирования и отмывания в физиологическом растворе крови, излившейся
в ФУДную или брюшную полость организма и собранной посредством активной
асп.ирации во время или после оперативного вмешательства.
Пмзи- и цитаферез у гематологических больных
(Д^фрез у этой категории больных, как правило, носит характер высоко-
|к?*3ания к плазмаферезу в гематологии
^Рзиротеинемические гемобластозы - множественная миелома и макрогло-
скоз емия Вальденстрема характеризуются гиперпарапротеинемией, гиперви-
111 синДромом. Показаниями к ПАФ служат гипервискозный (при уровне
ПИВА 14
I Ut пммем* пявдвтщявтив
обмито белка >1<Л г я млн atpmtprmtma >90 г/я) и геморрагически# ctw
Яффптнмюгтъ лечения оценивают по иормалиэвции уровня общего белей*
аииип уровня яарвлротеммов {<30 t/я). нормализации реологических --т**
МІ яровв (вямостм кроям, юммш. агрегаоии эритроцитов)
Аяшпттшв яття ~ заболевание, харгіктсфизуквдееся глубокой яя^*.
тншФ я игддгпгючиостмо костномозгового кроветворения, обусловлен вое ~
мозге, Денная нозология предусматривает частые и м иогочж VJ "
мвютрмсфуаия.рШ-1 приводит к сенсибилизации. В свою очередь, аялостгм^Г
ион* вызываю рефрактерность к переливаемым компонентам крови.
ПоямаюМИ I ПАФ служит неэффективность трансфузий компонентов п*
Процедуру Цроягддят 2 раза в неделю а объеме 0.5 ОЦП. курс •- 5-ю ткм*
При замещения объема удаляемой плазмы используют гвежеза мороженную дЛ|[?
му «тряснете 20 -25 мл/кг. При низком содержании альбумина замещение про*,
дат 5% раствором альбумина (40% объема удаленного белка).
Эффективность ПАФ оценивают по снижению уровня антилейкоцитных и антм
тромбоннтмш антител, увеличению пгрйроста тромбоцитов И Эритроцитов ПООІР
переливания компонентов крови через 1, 6,15,24 ч, уменьшению или отсутствшг
геморрагического синдроме.
Порфнрия я период обострения (острая перемежающаяся и кожная порфнрия)
показаниями к ПАФ служат периферическая полинейропатия и повышенный
уровень порфиринов. Курс лечения обычно состоит из 8-10 процедур с интерпа-
лом от 3 до 3 сут. При острой перемежающейся форме порфирии одномоментно
удалят ) ОЦП. при кожной форме — 0,25-0,5 ОЦП (в зависимости отстоим
повышения уровня порфиринов).
Эффективность лечения оценивают по улучшению клинических показателе#:
исчезновению периферической полинейропатии, нарушений функции централь¬
ной нервной системы, повышенной светочувствительности, нормализации лабо¬
раторных показателей порфяринового обмена.
Антифосфолипидный синдром в период обострения: показаниями к ПАФ ш-1
жат тромбофилия. наличие волчаночного антикоагулянта, антифосфолипидаш |
антител Кур»: ПАФ состоит из 8 10 процедур, выполняемых с интервалом 1-2 cvt.
.к одну процедуру удаляют 300 400 мл плазмы, восполнение которой осуществля¬
ют эквивалентным объемом изотонического раствора натрия хлорида.
Эффект лечения оценивают по улучшению клинических показателей основного
заболевания, нормализации лабораторных показателей фогфолипидзавигимых
тестов |яолчвкочнЫЙ антикоагулянт, антифосфолипидные антитела. ЦИК. имму¬
ноглобулинов (в основном G и М)|. нормализации измененных показателей ко»-
гулоцмммы.
Гемя пленные ттюмбофилии, которые проявляются гиперкоагуляционным out-
дромим Этот вариант наблюдают при аномалиях системы протеинов С и S, м\таит
иом V фд*сто)м? Лейленя, мутации гена метилентетрагидіюфолатредукгазьі и гиііерго-
моцмгггинемнн. мутантном протромбине СІ2022І0А, мутации интегринов. наличия
волчаночного антикпягулянта, аутоямтител к фосфолипидам, синдроме резко новы
ютной агрегации тромбоцитов (синдроме липких тромбоцитов), существенном
повышении уровня или ыультимерности фактора фон Виллебранда и активности
фактора VIII. амсоком уровне фактора ХП1 свертывающей системы крови.
Показания к ПАФ перечисленные нарушении гемокоагуляции с клинической
каргмной тромбозов. Курс лечения СОСТОИТ из 8 10 илазмаферезов, проводимы»
г интервалом 1 2 сут За одну процедуру удаляю г 300 4(H) мл плазмы.
Эффективность лечения оценивают по улучшению клинических показателе*
игиояноеп заболевания, нормализации измененных показателей коагулограммьь
Нгожместимостъ между донором и ренипирнтом по антигенам системы АщУі
ври нж яги ной трансплантации костного мозга. Согласно международной
т^якжтоіяг»«міаюа^ішнр««і4і* Ш
различают 2 мела несовместимое ги т мяпмм сигами AB(Q).
|ИГ* вместимостью понимают наличие у рвпиош кжямш
І^^цмциштипні антигенам допори ~ і ммоі опрн возникает раки
^gggga осложнений. ДЛЯ Предотвращения такого ром ОСИОИШтиД ИМИ'
^'■шиип эритроциты донора из триисялимвив и проводит обменным
у риряжита » цепа удаления антител. Малой несовместимостью
системы АВ{0) считают калган у донора монпндвммю»
* лшмгятиым антигенам реципиента - • таких случаях бывает достаточно »да-
т трансплантата.
мазание для ПАФ - несовместимость между донором к реципиентом т
системы АВ(О). В зависимости от уровня ■—i тпгпмпнпд • крови
^явтеита проводят в среднем от 1 до 3 процедур пввияпобмми медомкио -
мм»ере€»джы костного мозга. Обычно удаляют 1 ОЦП
1 Активность лечения оценивают по снижению уровня изоигглиотмишви
и/ш реоипитнта ниже разведения 1:16 (более благоприятно снижение до рва*
ІеиН-М).
Различные методы цитафереза (эритроцит-, тромбоцит-, лейкоцит-, грану*
^0f., лимфоцитаферез) используют при конини івеїіімі him качественных
g00ga соответствующего клеточного пула. Сочетанное применение мявз-
и цитафереза, например лимфоцитплазмаферез. применяют им уявлення
„з крови патологического фактора и снижения активности клеток, ответственных
я но продукцию.
Методы лечебного цитафереза с удалением из периферической крови воанм-
тятое лейкоцитов, тромбоцитов и эритроцитов применяют в целях:
, немедленного снижения концентрации клеточных компонентов в перифери¬
ческой крови для уменьшения риска сосудистых инфарктов:
• улучшения состояния больных, рефрактерных к химиотерапии май мнив¬
ших противопоказания к ней:
«изменения иммунного ответа:
4 получения большого количества клеток для исследований я иста
Методы лечебного цитафереза позволяют достичь следующих эффектов.
4 уменьшить массу опухолевых клеток при гемоблаетшах (эритрешш, хрони¬
ческом миелолейкозе, хроническом лимфолейкозе):
4 удалить патологический пул клеток с заменой их на нормальные донорские
клетки (например, замена эритроцитов при серповидно клеточной анемии
к других гемоглобинопатиях);
• ушить или снизить содержание нормальной клеточной линии, ответствен
мой за продукцию медиаторов болезни (лимфоцитаферез как метод иммуно-
депрессни).
Другие области применения цитафереза: обмен эритроцитов для уменьшения пара*
Вдрчой нагрузки при малярии, получение клеток патологических чиним с после¬
живай их обработкой in vitro и возвратом больному как мещд иммуиотеравии
Иоказаиня к лейкоцитаферезу: гиперлейкоцитоз у больных с острым имело -
Частным лейкозом, хроническим миелолеикозом и хроническим лнмфоаей-
йаом' Цель проводимых экстракорпоральных мероприятий - профилактика
*ОДмискулярных кровотечений у пациентов с хроническ ими л и мфолейышМИ
“фя {одержании лейкоцитов в крови более 300* 10“/л. Для эффективного сют-
уровня лейкоцитов в периферической крови рекомендуют обрабатывать
Шліфом.
Влечении других лейкозов ленкоцитаферез применяют при высоком яейкши-
(*00-200х10ч/л) для удаления больших масс опухолевых «леток с носледтю-
^^““ютерапией. Удалением 85% количества лейкоцитов в периферической
*«Ыо*но снизить их содержание на 50%.
ЦІ клиничесштмнссуэиология
При ОМ;1 показаниями к лейкоцитаферезу служат:
• лейкоцитоз более 100x1О’/л без признаков лейкостазов;
• клинические признаки лейкостазов;
• быстрое нарастание содержания лейкоцитов (удвоение их числа с 50*10’/
• неэффективность медикаментозной терапии в течение суток;
• невозможность применения гидроксимочевиньг.
Метод противопоказан при агональном состоянии больного, массивных кров
дкуииииі I головной мозг, профузных кровотечениях.
Mi І терапии гидроксимочевиной *' лейкоцитаферез проводят ежедневи
до снижения лейкоцитоза до уровня 50х10’/л. При выраженном цитолизе показан
ПАФ объемом 50% ОЦІЇ.
Показания к лейкоцитаферезу у больных с ХМЛ: выраженная интоксика¬
ция при лейкоцитозе более ІООхІОУл с гипертромбоцитозом более 350x10*/л
Ш |ызывает стазы а сосудах головного мозга и резистентность к полихимиоте-
рал ии.
Курс лейкоцитафереза состоит из 2-3 процедур, проводимых ежедневно до сни¬
жения количества лейкоцитов в 2 раза.
Больным с ХЛЛ лейкоцитаферез проводят при лейкоцитозе более 200хЮ9/л
сочетающемся с анемией, тромбоцитопенией, спленомегалией и неэффективностью
различных программ цитостатического лечения. Курс состоит из 2-3 процедур
с интервалом 7-10 сут. Эффект оценивают по снижению количества лейкоцитов,
признаков интоксикации, уменьшению размеров селезенки, увеличению показате¬
лей красной крови (эритроцитов, гемоглобина), количества тромбоцитов.
Лимфоцитаферез проводят больным с тяжелой формой апластической ане¬
мии при отсутствии эффекта от иммуносупрессивной терапии и лимфоцитозом
в периферической крови (80-90%). Курс лечения состоит из 5-7 процедур в тече¬
ние 3-4 нед. Лечебный эффект оценивают по отсутствию прогрессирования болез¬
ни, относительной стабилизации показателей периферической крови.
Показанием к тромбоцитаферезу служит гипертромбоцитоз — повышение
содержания тромбоцитов в крови более 500х109/л. Он сопровождается такими
миелопролиферативными заболеваниями, как полицитемия, хронический мие-
лолейкоз, миелофиброз. эссенциальная тромбоцитемия. Осложнениями тромбо¬
цитози являются тромбозы, сопровождающиеся в части случаев геморрагическим
синдромом. Риск тромбозов у пациентов с миелопролиферативными заболевания¬
ми выше, чем с вторичным, или реактивным, тромбоцитозом.
Как правило, удается снизить содержание тромбоцитов в крови на 35-50%
при их исходной концентрации 1-3,5х1012/л.
Терапевтический эритроцитаферез (ЭЦАФ) — один из наиболее часто при¬
менимых видов цитафереза. Он показан при истинных или вторичных эритремиях,
полицитемии, в случаях острого ишемического криза при серповидно-клеточной
анемии, осложненной окклюзией сосудов. В некоторых случаях ЭЦАФ использу¬
ют в лечении малярии, пароксизмальной ночной гемоглобинурии, аутоиммунной
іемолитической анемии и порфирии, симптоматических эритремий и прочих эри¬
тропатий. Следует отметить, что у значительного количества больных с истинном
полицитемией. исходно сопровождающейся тяжелыми клиническими проявлени¬
ями (головными болями, синдромом Рейно, артериальной гипертензией), в тече¬
ние многих лет удается поддерживать стабильный гомеостаз и работоспособность
без назначения химиотерапии на фоне регулярных курсов эритроцитафереза-
ЭЦАФ можно применять параллельно с цитостатической терапией.
ЭЦАФ проводят при увеличении одного или двух следующих показателей пери¬
ферической крови:
I количества эритроцитов более 6 ООО 000/л;
і гематокрита более 0,5:
i mriw»yдаш ил ические МЕТОДЫ ГЕМОКОРРЕКЦИИ ЗВЬ
_овНЯ гемоглобина более 160 г/л;
* ^ОСТИ крови более 5 ед.
* лечения состоит из 1-2 процедур интенсивного цитафереза. зависит
^гематологической картины, так и от пола, возраста, массы тела больного,
f** заболевания, наличия спленомегалии, эффекта от предыдущих процедур.
ние выполняют в условиях стационара. Оптимальное количество эритроци-
^. дадяемых во время одной процедуры, для женщин составляет 20% объема
2^лИруюших эритроцитов (ОЦЭ), или 800-1200 мл, для мужчин - 25% ОЦЭ
1400 мл). Если содержание эритроцитов увеличено, а показатели гемогло-
Їйнєпревышают 110 r/л, то удаляют 15% ОЦЭ. Плазму возвращают пациенту,
Ценные эритроциты замещают адекватным объемом кристаллоидов и реополи-
скйна* в сочетании 2:1. Лабораторными критериями терапевтического эффекта
!1*ат следующие показатели:
t количество эритроцитов менее 5 000 000/л;
! гематокрит менее 0,5 (^0,3);
I уровень гемоглобина менее 160 г/л (^110 г/л).
Кратность курсов ЭЦАФ зависит от клинических и гематологических показа¬
телей.
Для проведения процедуры в амбулаторных условиях предлагают вариант дис¬
кретного цитафереза с удалением не более 400 мл клеточной массы за одну про¬
цедуру І замещением удаленного объема кристаллоидами и реополиглюкином*
В соотношении 1:1 в режиме гиперволемии. Курс лечения состоит из 3-5 процедур
(суммарным удалением 30-50% исходного объема циркулирующих эритроцитов.
Явное преимущество такого метода цитафереза — удаление не только циркули¬
рующих, но и депонированных клеток.
ЭЦАФ противопоказан при острых воспалительных процессах любой локали¬
зации, декомпенсированной сердечно-сосудистой недостаточности, острых нару¬
шениях сердечного ритма и проводимости, остром тромбофлебите и флеботром¬
бозе, отеке легких и головного мозга, кровотечениях различного генеза. острых
психозах.
Лечебный эритроцитаферез проводят не только больным с эритремией
(истинной полицитемией), но и при вторичных эритроцитозах (хронических
обструктивных заболеваниях легких, врожденных пороках сердца, кардиомио-
патиях, первичной легочной гипертонии, пиквикском синдроме, стенозах почеч¬
ных артерий и др.). Исходные и результирующие гематологические показатели
і рекомендуемый протокол процедур соответствуют таковым при истинной
полицитемии.
Все способы лечебного цитафереза применяют в различных областях меди¬
цины - интенсивной терапии, нефрологии, трансплантологии, хирургии и др.
Эффективность процедур зависит также от количества полученных клеток.
При качественно проведенной процедуре должно быть удалено не менее 20%
пула циркулирующих клеток соответствующего вида. Тромбоцитаферез исполь¬
зуют при реактивных тромбоцитозах, лимфоцитаферез — при некоторых имму-
нокомпетентных заболеваниях, таких как ревматоидный артрит, генерализо¬
ванная миастения, полимиозит, криз отторжения трансплантата, псориаз и др.
Лимфоцитаферез можно выполнять как самостоятельную лечебную процедуру
"ли в сочетании с плазмаферезом, экстракорпоральной фотохимиотерапией.
Историческое значение имеет миелокариоцитаферез (метод разработан
1 *НЦ РАМН около 20 лет назад) — выделение фракции ядросодержащих клеток
вирированного костного мозга и возвращение донору непосредственно после
*®*лоэксфузии взвеси аутологичных эритроцитов с незначительным содержа-
‘•ивм других форменных элементов. Метод позволял восполнять кровопотерю
®НоРУ костного мозга за счет реинфузии взвеси его собственных форменных
' Тентов крови с незначительным содержанием миелокариоцитов. Реципиент
пиал и
lie КЛИНИЧЕСКАЯ ТМИОДОЗИОЛОГИЯ
ори этом получал только гемопоэтические клетки. Миелокариоцитаферез „
меняли также в тех случаях, когда извлеченный костный мозг предстояло за -
розить, так как режим іфиоконсервирования эритроцитов и миелокариощ^0'
различен. Кроме того, миелокариоцитаферез использовали у аутодоноров - ^ в
логических больных с сохранным кроветворением при заготовке фракций т'
содержащих элементов костного мозга перед интенсивной химио- или луче!!!»
терапией с целью последующей аутомиелотрансплантации для предупрежден/
ИЛИ лечения І НИХ вторичной миелодепрессии. В последние ГОДЫ ЭТОТ метод Пй!?
ряд свою актуальность, так как современные сепараторы крови позволяют пад!
чать І подобных случаях периферические стволовые клетки.
ЛЕРФУЗИОННЫЕ ЭФФЕРЕНТНЫЕ МЕТОДЫ
Перфузионные эфферентные методы направлены на удаление из венозной крови
избытка углекислоты при одновременном насыщении ее кислородом посред-
ством газообмена через мембрану, аналогичную по своим свойствам альвеоляр¬
ной мембране легких. Этот метод гемокоррекции лежит в основе искусственного
кровообращения. В предыдущих разделах неоднократно отмечалось, что многие
экстракорпоральные технологии были созданы в целях протезирования функций
(частично или полностью, временно или на длительный срок) жизненно важных
органов и систем, в частности печени и почек. Поскольку методы искусственною
и вспомогательного кровообращения позволяют временно протезировать функцию
целых систем (дыхательной и Сердечно-сосудистой), их следует отнести к методам
экстракорпорального воздействия на кровь, или экстракорпоральным технологиям
Например, искусственное кровообращение (ИК) — метод временной полной замены
насосной функции сердца и газообменной функции легких с помощью механиче¬
ского насоса и искусственного легкого. Метод ИК позволяет избирательно удалять
из экстракорпорально циркулирующей крови углекислоту, при этом насыщая ее
кислородом. Таким образом, методы ИК необходимо рассматривать в рамках экс
тракорпоральных эфферентных методов с учетом всех особенностей й условий
их применения в клинической практике. Методы искусственного и вспомогатель¬
ного кровообращения развивались и совершенствовались параллельно с задачами
сердечно-сосудистой хирургии и трансплантологии. Без искусственного и вспо¬
могательного кровообращения операции на открытом сердце, аорте, при пере¬
садке печени были бы невозможны. Теоретические основы ИК были заложены в
30—40-е гг. XX в., а начиная с 60-х гг. метод активно внедряли в клиническую прак¬
тику. В настоящее время во всем мире ежегодно выполняют более 650 тыс. операций
с ИК: коррекцию врожденных и приобретенных пороков сердца, хирургическое
лечение ишемической болезни сердца, операции на аорте, трансплантации сердца
и легких, а также комплекса этих органов, операции по поводу опухолей сердца,
сложных нарушений сердечного ритма и в ряде других случаев.
Основными составляющими аппарата искусственного кровообращения (АИК)
служат насосы и газообменное устройство — оксигенатор. Артериальный насос
играет роль искусственного сердца, обеспечивая возврат больному артериализи-
рованной в оксигенаторе крови во время основного этапа операции. Оксигенатор
выступает в роли искусственного легкого и предназначен для экстракорпорально¬
го насыщения крови кислородом и удаления из нее углекислоты. По сути дела, он
превращает венозную кровь в артериальную. Наиболее современный вариант |
оксигенаторы мембранного типа, в которых газ (смесь воздуха с кислородом)
отделен от крови мембраной, аналогичной по своему назначению альвеолярно»
мембране легких. Мембранный оксигенатор обеспечивает транспорт кислород8
со скоростью до 260 мл/мин, элиминацию углекислоты — до 280 мл/мин при кр0'
■отоке 4 л/мин. Составной частью современного оксигенатора является таю#
теплообменник, предназначенный для создания и поддержания необходимою
ТРАНСФУЗИОЛОГИЧЕСКИЕ МЕТОД Ы ГЕМОКОРРЕКЦИИ 387
аоайрного режима ИК. С подробным устройством и принципом работы АИК
^Знакомиться в специальной литературе.
^проводят в условиях управляемой нормоволемической или гиперволеми-
й й гемодилюции. В качестве гемодилютантов используют различные колло-
ч^0 й идасталлоидные кровезаменители. Обязательное условие работы АИК -
^книзация организма. Гепарин* вводят в дозе 8000-9000 ME. Заканчивается
^сгвенное кровообращение нейтрализацией гепарина* сульфатом протамина
^ношении 1:1 или 0,8:1 по отношению к введенному ранее гепарину*. В ряде
Сев наблюдают тяжелые анафилактические реакции на введение протами-
qjafon, которые в итоге могут определить конечный исход вмешательства
ИК.
С Искусственное кровообращение считают адекватным, если кровоснабжение кле-
„тканей организма соответствует их потребностям в кислороде. Операции с
S проводят как на сокращающемся сердце, так и на остановленном, применяя
І этом различные методы защиты миокарда.
ИК может быть дополнено ультрафильтрационной гемоконцентрацией (УФГК),
«угорая представляет собой метод удаления из крови излишков воды, электро-
LroB, других соединений с относительно малой молекулярной массой путем
Й конвективного транспорта через полупроницаемую мембрану за счет градиента
ддпостатического давления по обе стороны мембраны. Все соединения, молеку¬
лярная масса которых позволяет проникнуть через поры мембраны ультрафиль¬
тра, удаляются с ультрафильтратом. УФГК позволяет уменьшить объем плазмы
к внеклеточной жидкости. Перемещение интерстициальной жидкости В сосуди¬
стое руш происходит вследствие увеличения коллоидно-онкотического давления
плазмы за счет повышения в ней концентрации белков, не фильтрующихся через
мембрану ультрафильтра. Таким образом, УФГК предоставляет возможность уда¬
ления избытка электролитов плазмы, а также токсичных низко- и среднемолеку¬
лярных соединений независимо от их происхождения (эндогенная интоксикация,
передозировка препаратов и т.п.). УФГК улучшает реологические свойства крови
больного, снижает ее травму при ИК, а также расход донорской крови и уменьша¬
ет или исключает синдром гомологичной крови, позволяет регулировать процесс
гемодилюции. Для УФГК используют одноразовые диализаторы аппарата «искус¬
ственная почка» или специальные гемоконцентраторы. Ультрафильтрат, получае¬
мый при УФГК, по своему составу соответствует первичной моче, образующейся
в почках в результате клубочковой фильтрации. В ультрафильтрате обнаружи¬
вают также токсины с малой и средней молекулярной массой. При операциях
сИКпоказания к УФГК могут присутствовать изначально или возникать по ходу
вмешательства. К предоперационным показаниям относят: заведомо длитель¬
ное (более 1,5-2 ч) ИК, отеки любой этиологии, выраженную недостаточность
выделительной функции почек, выраженную анемию, септическое состояние.
Кнгараоперационным показаниям к УФГК относят: избыточную гемодилюцию,
некупируемую диуретиками, с падением гематокрита ниже 20% на фоне увеличен¬
ного объема циркулирующей крови.
Таким образом, ИІС — сложный экстракорпоральный метод, позволяющий
^Одерживать основные составляющие гомеостаза и протезировать функции ряда
жизненно важных органов при кардиохирургических вмешательствах в условиях
скрытого сердца. Выполняя свою основную функцию поддержания жизнедея-
^Носги организма во время операций на открытом сердце, ИК многосторонне
ОДняет на все без исключения органы и системы организма. Белки крови и фор-
‘‘ОДнью элементы, соприкасаясь с инородными поверхностями системы ИК,
^нмируются. Особенно страдают тромбоциты, которые претерпевают морфоло-
изменения и частично гибнут. ИК вызывает активизацию комплемента,
Нинов°й системы, способствует фибринолизу и нарушает систему свертывания.
S5S иЯИНИЧЕСКЛЯ ТРАНСФУЗИОЛОГИЯ
Ответом на ИК является системная воспалительная реакция всего опг»
ИК подавляет гуморальный и клеточный иммунитет, нарушает функщ Н,,3ма
ку.тоэндотелиальной системы, что способствует возникновению бактери*1 Рет1>-
I И вирусной инфекции В послеоперационном периоде. ОтрицааЛкИ°'<,
мивше ИК на деятельность центральной нервной системы связано не !!Лкн<*
с ишооерфузией мозга во время операции, сколько с эмболизацией кат °ЛЬк°
мезга микрогромбами и микроагрегатами клеток, частицами атероматоэны ^
жира, кальция и т.п. Поражения миокарда при операциях с ИК связаны прей Ma°c’
стаємо с его ишемией-реперфузией, а также с активацией комплемента, лей 140
тов и цитокинов, выделением свободных радикалов и других факторов. Во К°ЧИ
ИК нарушается как перфузия, так и вентиляция легких, особенно при продВ^Мя
тельностн ИК более 3 ч. Степень травмы легких может варьировать от м*И
скопических изменений до возникновения респираторного дистресс-синл^0
ИК может оказать и существенное влияние на функции почек — диурез об
снижается, а после операции нередко наблюдают снижение клиренса <й!ЙІг
воды I креатинина. Ситуация может быть осложнена гемолизом эритроцито
одним из редких осложнений ИК, которое приводит к блокированию почечв "
канальцев свободным гемоглобином. ИК сопровождается также более или ме
выраженными изменениями водно-электролитного баланса.
Все перечисленные проблемы, связанные с осложнениями при ИК, в ПОЛ
вляющем большинстве случаев решаются опытными квалифицированными спе
циалистами с применением современного высокотехнологичного оборудования
Основные исследования в области перфузиологии (раздел медицины, занимаю¬
щийся проблемами ИК) направлены на предупреждение возможных отрицатель¬
ных сторон этого метода, а также на создание новых оксигенаторов, артериальных
насосов и других составных частей АИК, оптимизацию состава инфузионно-
трансфузионных средств, используемых для заполнения АИК, режимов и времени
выполнения процедуры.
ИК В один из самых сложных эфферентных методов, позволяющих на опреде¬
ленное время протезировать функции сердечно-сосудистой системы и легких,
Наряду с ИК в ряде клинических ситуаций применяют различные методы вспомо¬
гательного кровообращения (ВК), к которым относят:
• веноартериальную перфузию с оксигенацией;
• веноартериальную перфузию без оксигенации;
а экстракорпоральную мембранную оксигенацию;
■ обход левого желудочка;
■ обход правого желудочка;
■ обход обоих желудочков;
• обходное веновенозное шунтирование;
я внутриаортальную баллонную контрпульсацию.
Придерживаясь логики основных положений вышеприведенной систематиза¬
ции МТГК, способы вспомогательного кровообращения, очевидно, условно могут
быть отнесены к группе неэфферентных методов экстракорпорального воздей¬
ствия на кровь. Не обладая прямым элиминационным эффектом, методы ВК через
механическое воздействие на кровь оказывают влияние на сердечно-сосудистую
систему, частично протезируя сократительную функцию сердечных мышц, допол¬
няют и стимулируют собственные функциональные резервы организма. Поскольку
они осуществляют свое воздействие непосредственно через кровь и их применение
тесно сопряжено с ИК, целесообразно представить в настоящей главе основные
сведения о методах вспомогательного кровообращения. Трансфузиологу неоо
ходимо иметь общие представления об этих высокотехнологичных методах экс
тциюряорального воздействия на кровь, являющихся частью операционно
или реанимационного пособия в кардиохирургии и трансплантологии.
'1 nrtwH^ownyi тсычпс wt »иды I tWUKUtWm pm HH|
^„огательное кровообращение — реанимационное пособие, обеспечи-
j^gjcoBMecTHO с сердцем минутный объем кровообращения, достаточный для
^яйЯ тканей в условиях острой сердечной недостаточности.
Свнсимосги от способа разгрузки сердца все виды вспомогательного крово-
^шения делят на три группы:
методы, основанные на снижении противодавления сердечному выбросу
* (контрпульсация)*,
методы- основанные на уменьшении перекачиваемого сердцем объема крови
* (шунтирование);
методы прямой помощи желудочкам (массаж сердца).
Методы шунтирования (перфузионные методы ВК) обладают большими воз-
Шрйями разгрузки сердца, вплоть до полной замены функции одного или двух
^ дочков. Помимо уменьшения потребности миокарда в кислороде, почти все
51ды ВК одновременно увеличивают его доставку в результате повышения
коронарного кровотока.
I шунтирующим методам ВК относят веноартериальную перфузию и обходы
„дного или двух желудочков. Основная задача перфузионных методов ВК - сум¬
марное с сердцем обеспечение перфузионного индекса для адекватного метаболиз¬
ма в организме пациента в целях восстановления утраченной функции жизненно
зажных органов (сердца, легких, мозга, почек, печени и т.д.) в случаях рефрактер¬
ности к медикаментозной терапии. Перспективы пациентов в случаях применения
методов ВК зависят от того, произошли необратимые изменения в жизненно важ¬
ных органах на момент начала экстракорпорального вмешательства или нет, т.е.
ет своевременности начала процедуры.
Показания к различным вариантам шунтирования определяются следующим
образом:
• изолированная слабость левого желудочка служит показанием к левожелу¬
дочковому обходу;
« изолированная недостаточность правого желудочка является показанием
к правожелудочковому обходу;
I при тотальной сердечной слабости требуется бивентрикулярный обход.
В случаях когда острая сердечная недостаточность сочетается с острой дыха¬
тельной, используют один из вариантов веноартериальной перфузии с оксигена-
цией. Суть этих методов — частичная замена функции сердца и легких, что дает
возможность удвоить или учетверить доставку оксигенированной крови к тканям
иорганам и разгрузить ослабленное сердце. Поскольку уменьшение объема каждой
камеры сердца приводит к снижению потребления кислорода миокардом, появля¬
ется возможность уменьшить введение катехоламинов и снизить вероятность
развития метаболических некрозов в миокарде. Согласно гемодинамическим кри¬
териям, веноартериальная перфузия с оксигенацией показана, если при венозном
давлении 10-14 мм рт.ст. среднее артериальное давление не поднимается более
бОммрт. ст., а на ЭКГ отмечают признаки ишемии миокарда.
Экстракорпоральная мембранная оксигенация (ЭКМО) показана главным
образом при резко выраженной гипоксемии, если, несмотря на вдыхание смеси,
содержащей более 50% кислорода, напряжение кислорода в артериальной крови
йе поднимается более 50 мм рт.ст. ЭКМО не является лечением самого патологи¬
ческого процесса, приведшего к острой дыхательной недостаточности. Этот метод
озволяет выиграть время, в течение которого газобменная функция легких может
^восстановлена.
"вутриаортальная баллонная контрпульсация — способ ВК, суть которого
’помается в повышении диастолического и снижении пресистолического дав-
® порте. При повышении диастолического давления увеличивается коро-
и кровоток и, следовательно, улучшается питание миокарда. При снижении
НО ХЯМНИЧКЖАЯ ТРАНСФУЗИОЛОГИЯ
иресистолического давления в аорте уменьшается преднагрузка на левый ж
чех I увеличивается его выброс. Считают, что эффективность внутриаорта^^0'
хоитрпульсации равна 10% сердечного выброса, т.е. составляет 500-800 мл/ЬН°І'
Этот метод непосредственно не усиливает кровоток, однако он остается Ёэий 1
распространенным для механического поддержания нарушенного кровообгь
ния у пациентов с левожелудочковой недостаточностью. ^e'
Внутриаортальный баллон вводят через бедренную артерию и располз
в нисходящей аорте тотчас от отхождения левой подключичной артерии в ^
позиции его гемодинамическая эффективность наибольшая. Баллон, введен
» аорту, попеременно раздувают и сдувают. Во время систолы баллон сдува
что ведет к уменьшению нагрузки на сердце при его сокращении. В диастолу ба
лон раздувают, что обеспечивает ускорение тока крови, выброшенной из сепл
в систолу. Раздувание баллона также ведет к повышению диастолического даад
ния в аорте, особенно в восходящей, и к увеличению кровотока по артериям голов
ного мозга, сердца и почек. Преимущества метода внутриаортальной баллонной
контрпульсации - относительная простота и невысокий процент осложнений
Показаниями к этому методу ВК являются периоперационная сердечная недоста¬
точность или сердечная недостаточность на фоне инфаркта миокарда, кардиоген-
ного шока, если сердечный индекс менее 2,5 л в мин/м2, среднее давление в аорте
менее 80 мм рт. ст., среднее давление в левом предсердии более 15 мм рт. ст., диу¬
рез менее 20 мл/ч; доза допамина более 5 мкг/кг в мин.
Противопоказания к внутриаортальной баллонной контрпульсации: острая сер¬
дечная недостаточность, требующая более эффективных методов ВК, выраженные
тахикардия и аритмия, атеросклеротические окклюзии бедренных или подвздош¬
ных артерий, препятствующие проведению баллона в аорту.
В настоящее время метод внутриаортальной баллонной контрпульсации оста¬
ется наиболее распространенным методом ВК у пациентов с левожелудочковой
недостаточностью, рефрактерной к медикаментозной терапии. Следует учитывать,
что все вышеперечисленные методы вспомогательного кровообращения имеют
строго ограниченное время применения. Способом, который позволил бы решить
проблему лечения длительной сердечной недостаточности, является создание
искусственного сердца.
Шунтирующие методы вспомогательного кровообращения нашли широкое при¬
менение в хирургии аорты и при трансплантации печени. В последнем случае для
профилактики нарушений гемодинамики во время беспеченочного периода опера¬
ции используют вспомогательное бедренно-яремное или портояремное венозное
шунтирование. Дело в том, что применение в беспеченочном периоде пассивного
веновенозного шунта не обеспечивает полноценного венозного возврата и сопро¬
вождается выраженными нарушениями гомеостаза вследствие венозного полно¬
кровия. Кроме того, венозное полнокровие органов в течение беспеченочного
периода резко повышает риск объемной кровопотери. Возврат застойной крови
в реперфузионном периоде ведет к грубым гемодинамическим и метаболическим
последствиям. Активное шунтирование с использованием перфузионного насоса
типа Biopump обеспечивает относительно стабильную гемодинамику в течение
беспеченочного периода, когда нижняя полая и воротная вены пережаты перед
гепатэктомисй. Вспомогательное кровообращение в подобном случае предотвра¬
щает застой крови в селезенке, снижение сердечного выброса и массивные кро¬
вотечения из-за высокого давления в коллатералях, нарушения функций поче
и возможные тромбоэмболические осложнения.
Постоянное совершенствование методов ВК направлено на снижение риска во
можных осложнений. Так, например, в течение последних 10-15 лет во всех пр
борах ВК роликовые насосы были заменены на менее травматичные центрифу*
ные, в связи с чем удалось снизить риск гемолитических осложнений и нарушен»
ТРАНСФУЗИОЛОГИЧЕСКЙЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 391
существующие потребности реконструктивной хирургии и трансплан-
будут неизменно способствовать дальнейшему развитию методов искус-
1010 ного и вспомогательного кровообращения.
битные методы смешанного механизма действия представляют собой
5|ние двух ИЛИ нескольких из вышеперечисленных элиминационных меха-
Їйов. Например, гемодиафильтрация (ГДФ) сочетает механизмы диффузии
"Сьтрации. что позволяет расширить спектр удаляемых субстратов.
11 фильтрационные, сорбционные и гравитационные воздействия могут быть
полнены преципитацией - термической (ХОЛОДОВОЙ, тепловой) или химиче-
Й что повышает селективность элиминационного эффекта.
^Перечень эфферентных методов постоянно дополняется и изменяется с ПОЯВ*
ннем новых и совершенствованием существующих. Разнообразие методов
^рентной терапии обусловлено тем, что каждый из них обладает своими осо-
Хшостями в плане удаления из организма различных токсинов, отличной от дру*
пй методов продуктивностью, стоимостью аппаратуры и расходного материала и
-оответственно возможностью их использования.
В каждой конкретной клинической ситуации выбор метода детоксикации
должен быть направлен на получение максимального эффекта с минималь¬
ным количеством возможных осложнений и материальных затрат. Очевидно,
ню при моноэтиологичных заболеваниях при наличии соответствующего обо¬
рудования и квалификации сотрудников более приемлемы современные высоко¬
избирательные экстракорпоральные технологии, такие как иммунная и аффинная
сорбция, каскадная плазмофильтрация и др. При полиэтиологичных заболевани¬
ях весьма эффективны неселективные методы эфферентной терапии, например
ПАФ, и соответственно они будут востребованы еще долгое время. В случаях поли-
зтиологичных эндотоксикозов наиболее рациональна комплексная эфферентная
терапия 1 применение нескольких методов детоксикации, которые чередуют
во времени или выполняют одновременно через разные венозные доступы. Такое
комплексное воздействие позволяет быстрее добиться положительного резуль¬
тата и снизить вероятность осложнений. Одновременное применение у пациента
нескольких эфферентных процедур носит название «сочетанная эфферентная
терапия».
Неэфферентная экстракорпоральная гемокоррекция
Возможности детоксикационной терапии существенно расширились, когда
в 70-е гг. XX в. в клиническую практику были внедрены физические, химические,
фармакологические способы экстракорпоральной гемокоррекции.
Идеи использования некоторых физических, химических, медикаментозных
веществ для воздействия на жидкие среды вне организма появились гораздо
раньше. Не оказывая прямого эфферентного действия, эти методы позволяют
симулировать собственные защитные силы организма, его дезинтоксикационную
и иммунную функции. При этом экстракорпоральному воздействию подвергают
иевсю кровь или другую жидкую среду, а лишь расчетную ее часть, что уменьшает
иероятность побочных реакций при выраженном клиническом результате. В ком¬
иксе с другими терапевтическими воздействиями эти методы позволяют добить-
ся эффективной коррекции нарушенных параметров гомеостаза и, таким обра-
•vf? существенно активизировать процессы естественной детоксикации, устранить
проявления эндотоксикоза. Неэфферентные методы экстракорпоральной
коррекции оказывают благоприятное воздействие на морфологический состав
^°Ви‘ Улучшают структуру клеточных мембран, повышают оксигенацию тканей.
ГИвиРУют окислительно-восстановительные процессы, препятствуют гиперкоагу-
и- Улучшают реологию и микроциркуляцию, стимулируют гуморальный и кле-
392 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
ТОЧНЫЙ иммунитет, В ТОМ числе Противомикробный И Противовирусный
«•эфферентной экстракорпорпальной гемокоррекции потенцируют дей
рентных методов, повышая клиренс выведения токсичных субстратоГВИвзф21
часто их применяют одновременно. Сочетание экстракорпоральных мет* Поа,Ч
название «комбинированная экстракорпоральная гемокоррекция» ® °в W
или комбинированная, экстракорпоральная гемокоррекция — одна из ЧЄТа,в,ая
тенденций современной трансфузионной медицины. Сочетание нескольки°СН°*н,<*
эфферентной и неэфферентной гемокоррекции способствует: х МетОДо*
• повышению клинической эффективности экстракорпоральных воз ой
К уменьшению объема экстракорпорально обрабатываемой среды-
• снижению осложнений, связанных с применением одного конкретною
Показания к самостоятельному применению неэфферентных методов^*8,
корпоральноЙ гемокоррекции можно сформулировать следующим образо
ферентные методы следует применять тогда, когда не сформулирован ^
кретные показания к эфферентной терапии, т.е. не решен главный вопрос К0||‘
субстрат (субстраты) подлежит удалению, но при этом возможности меди ^
тозной и инфузионно-трансфузионной терапии уже исчерпаны.
По механизму действия на биологический субстрат методы неэфферентн
тракорпоральной гемокоррекции можно разделить на следующие виды. Ш
І Физические:
❖ гемоквантовые (фотомодификация крови) — ультрафиолетовое, лазе
I облучение крови; ’ Щ
❖ воздействие магнитных полей;
❖ рентгеновские и радиационные воздействия;
I химические:
❖ непрямое электрохимическое окисление крови гипохлоритом натрия;
^ низкопоточная оксигенотерапия;
Ф озонирование крови;
• фармакологические:
ж медикаментозные (антибиотики и другие препараты);
биологические (гормоны, цитокины);
Ц экстракорпоральная иммунокоррекция (иммуномодуляторы);
І сочетанные;
• комбинированные.
В соответствии с характером используемого неэфферентного экстракорпораль¬
ного воздействия можно получить тот и или иной лечебный эффект. Например,
наибольшим иммуномодулирующим действием обладают ультрафиолетовое
облучение крови и экстракорпоральная фармакотерапия. Наиболее выраженный
реокорригирующий эффект получен при использовании гемоквантовых методов
и магнитотерапии. Наибольший детоксикационный эффект оказывает химический
метод иеэфферентной ЭКГК, в частности непрямое электрохимическое окисление
гипохлоритом натрия. Соответственно выбор метода неэфферентной гемокоррек¬
ции определяют отдельно в каждой конкретной клинической ситуации. В Росой
широкое распространение получили физические методы экстракорпорально*
гемокоррекции, и прежде всего гемоквантовые (фотомодификация крови).
Гемоквантовые методы основаны на воздействии на кровь фотонов - квав-
тов оптического излучения ультрафиолетового, видимого и инфракрасного диапа¬
зонов. Фитобиологическое действие гемоквантовых методов обусловлено погло¬
щением квантов света определенной длины волны биоструктурами, изменяющие
при этом свое энергетическое состояние. Клинические эффекты фотомодифява
ции крови связаны с воздействием излучения на отдельные структуры облуча
го объема крови - форменные элементы, аминокислоты, нуклеиновые кислот^
беден, липиды, полисахариды и многие другие. Это служит пусковым механизм0»
ТРАНСФУЗИОЛОГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 393
^биологических процессов, реализуемых на уровне клеток, тканей и всего
& i*a в целом после смешивания фотомодифицированного объема крови
^ й циркулирующей в организме пациента.
с^ ные эффекты фотомодификации крови крайне разнообразны и зависят
12 ВОЛНЫ, дозы излучения и количества процедур. В целом они обусловле-
^^Ьокоррекцией, улучшением реологических свойств и изменением гемо*
& Декого потенциала циркулирующей крови, улучшением микроциркуляции.
й(/ляцией эритропоэза, повышением кислородной емкости крови, нормализа-
ккелотно-основного состояния, стимуляцией регенераторных и обменных
йн
свесов.
Наиболее часто в клиническом практике применяют методы ультрафиолетово-
й лазерного облучения крови.
Первые попытки ультрафиолетового облучения крови (УФОК) при гнойно*
веских состояниях относят к началу XX в. Техническое несовершенство
а также внедРение в клиническую практику высокоэффективных лекар-
SflHbix средств (антибиотиков) в 1940-е гг. на определенный период времени
*|1вел0 к их забвению. Повторно интерес к фотомодификации крови, в частности
^^фиолетовыми лучами, вновь возродился в середине 70-х гг. двадцатого
столетия.
Ультрафиолетовый диапазон разделяют,
і на длинноволновый (UVA) — 320-400 нм;
»средневолновый (UVB) — 280-320 нм;
* коротковолновый (UVC) — 200-280 нм.
За рубежом длинноволновый ультрафиолет используют для экстракорпораль*
догофотофереза с фоточувствительным веществом пеораленом. Облучение ткане¬
вых жидкостей UVC-спектром не нашло широкого применения и проводят крайне
редко. Полагают, что большая клиническая перспектива имеется в использова¬
нии средневолнового спектра — UVB. Попытки применения UVB осуществлены
нё только в эксперименте, но и в клинической практике для экстракорпорального
облучения отдельных компонентов крови — аутологичных и донорских. Так,
например, есть сообщения, что облучение тромбовзвеси, приготовленной из пула
от двенадцати доноров для последующего использования после операции с ИК
в сочетании с фильтрацией вводимой эритроцитной массы через лейкофильтр,
позволило избежать реакции HLA-несовместимоєти и повысить гемостатическую
активность вводимых тромбоцитов. Полученный результат объясняют мутаген¬
ным действием облучения; фотоны средневолнового ультрафиолета (пик адсорби¬
рующегося света — 297 нм) абсорбируются молекулами ДНК благодаря специфике
строения тимидинового основания и вызывают хромосомные транслокации.
В России первый прибор УФОК «Изольда», характеризующийся низковолно-
вьм постоянным излучением с длиной волны 254 нм, был создан ленинградскими
специалистами в 70-е гг. XX в. В 1997 г. воронежскими специалистами был разра¬
ботан и внедрен в клиническую практику аппарат для УФОК «Юлия* с кварцевой
ятипой длинноволнового ультрафиолетового излучения.
Несмотря на тридцатилетний опыт применения УФОК, интерес к этому методу
®>сих пор не ослабевает. Ультрафиолетовому облучению как длинноволновым,
^ и коротковолновым ультрафиолетом можно подвергать как цельную кровь
Мипиента или донора, так и ее отдельные компоненты — эритро-, лейко-, тром-
§Ш и т.д. Как правило, УФОК осуществляют экстракорпорально, в потоке
Дотекающей крови. Имеются отдельные сведения о внутрисосудистом УФОК.
Ультрафиолетовое облучение крови преследует своей целью коррекцию имму-
п логических, реологических показателей и микроциркуляции, Метод оказывает
ложительное воздействие практически на все звенья тканевого и гуморального
унитета. Под воздействием ультрафиолетовых лучей снижается плотность
пмая w
394 ШМ4МЕСКАЯ ТРАНСФУЗИОЛОГИЯ
мембран эритроцитов, ЧТО объясняет повышение ИХ деформируемости
ти чес кой резистентности, усиление проницаемости для газов и ионов 11 'Хо¬
реологических свойств крови, капиллярного кровотока, увеличение снкВ,ейи*
тканей кислородом, активацию процессов метаболизма в тканях. , еНия
Метод ультрафиолетового облучения крови и ее компонентов широко
эуют при гнойно-септической патологии, синдроме системного воспалит
ответа, атеросклеротических окклюзионных поражениях коронарных и
рнческих артерий, болезни и синдроме Рейно, облитерирующих эндартт^'
н тромбаягиитах, диабетических ангиопатиях, хронической венозной НрЙВТа)[
точности и других нарушениях микроциркуляции. Описан опыт эффед^®1*’
использования УФОК у пациентов со стенокардией III—IV функционального Н°Г°
са. нестабильной стенокардией и острым рецидивирующим инфарктом миокГ30'
Бактерицидный и иммуностимулирующий эффекты УФОК используют при сеп^
се. гнойно-воспалительных осложнениях и других проявлениях системного воспал"
тельного ответа в хирургии, в случаях обострения многих хронических заболеваний
Клинический опыт свидетельствует о большой эффективности длинноволново
УФОК в борьбе с хирургической инфекцией. При использовании метода гемокван* I
товой терапии клинический и лабораторный эффекты наступают быстрее и бывают
более выраженными, чем при коротковолновом ультрафиолете.
Метод УФОК практически не имеет противопоказаний, за исключением повы¬
шенной фоточувствительности у пациента. Есть данные о его успешном примене¬
нии у больных с лейкозами при лечении инфекционных осложнений. Для дости¬
жения клинического эффекта бывает достаточно 5-7, иногда 10 процедур уфо^
Однократная доза облучения - не менее 2,5-3 мл/кг массы тела пациента. Часта
УФОК используют в сочетании с различными методами экстракорпоральной
детоксикации. Данных о применении в России средневолнового ультрафиолето¬
вого облучения в настоящее время нет.
Несколько позднее для фотомодификации крови стали использовать источники
видимого красного света - лазерное облучение крови (JIOK). В клинической прак¬
тике применяют аппараты, в которых используется гелий-неоновый (длина волны
632 нм), полупроводниковый (820-850 нм) и другие виды лазерного излучения
(азотный, аргоновый). Облучение крови пучком лазера просходит либо в экстракор¬
поральном контуре, либо через световод, введенный внутривенно. Облучению могут
подвергаться компоненты собственной крови больного или крови донора. В послед¬
ние годы все более популярно чрескожное применение лазерного облучения. Курс
лечения колеблется от 5 до 10 процедур продолжительностью 40-60 мин.
Действие лазерного облучения на организм, как и ультрафиолетового света, мно¬
гостороннее. В результате поглощения квантов излучения происходит ряд физико¬
химических процессов, в частности перестройка белковых полимеров, изменение
активности ферментов и структурно-функциональных свойств клеточных мем¬
бран. ЛОК нормализует некоторые показатели, измененные при патологическом
процессе: происходит повышение проницаемости, деформируемости и осморе¬
зистентности мембраны эритроцитов, снижение их агрегационной способности,
изменение сорбционных свойств, повышение уровня АТФ, 2,3-ДФГ, увеличение
кислородтранспортной функции. Выявлены: повышение активности мембранных
рецепторов лейкоцитов; активация синтеза в них ДНК вследствие активации соот¬
ветствующих ферментных систем; повышение фагоцитарной активности, секре¬
ции бактерицидных катионных белков, интерлейкинов, ростостимулируюшего
и реологического факторов, серотонина, гистамина и других биологически актив
ных веществ; изменение активности иммунокомпетентных клеток. В тромбоцита
отмечены изменения структуры мембраны, адгезивных и агрегационных свойств,
стимуляция секреции реологического фактора и других биологически ак?ив*
веществ. В плазме крови повышается активность комплемента, лизоцима, естг
і тгіцфузиолої ичьикиі методы ГЕМОКОРРЕКЦИИ 395
и иммунных антител, бактерицидная и антиоксидантная активность.
^ ткется протеолитическая активность, снижается содержание продуктов
окисления липидов, изменяются прокоагулянтные. антикоагулянт¬
ам фибринолитические свойства, повышаются сорбционные свойства альбу-
в Агрегация эритроцитов и тромбоцитов уменьшается на 17-34%. снижается
ЦИНосгь крови без уменьшения количества форменных элементов. Наблюдается
Газование новых капилляров и открытие старых. Восстанавливается равно-
М^между свертывающей и противосвертывающей системами крови. Отмечена
Муляция клеточного (увеличивается количество макрофагов, Т-хелперов.
fcvnpeccopoB, В-лимфоцитов) и гуморального (повышаются уровни иммуногло-
^ ‘ нов) звеньев иммунитета как при местном, так и при системном воздействии
Озерного излучения на организм. Терапия гелий-неоновым лазером повышает
Активность антибиотикотерапии. ускоряет заживление ран, длительно неза-
Аюших язв. ожоговых поверхностей.
Одним из источников видимого красного, а точнее оранжевого света стала ртут-
ф лампа ЛК 6. используемая в новой версии прибора «Юлия 4» наряду с
источником длинноволнового ультрафиолета. Излучаемая лампой длина волны
составляет 610-620 нм. что весьма близко к таковой гелий-неонового лазера,
проведенные клинические испытания свидетельствуют о высокой эффективности
нового источника гемоквантовой терапии при трофических дефектах различного
генеза. диабетических и аутоиммунных ангиопатиях и других нарушениях микро¬
циркуляции. Метод успешно потенцирует действие ПАФ, позволяя уменьшить
удаляемой плазмы.
Действие всех перечисленных методов гемоквантовой терапии на организм
многопланово, а клиническая эффективность определяется комплексным влия¬
нием на различные системы. При действии гемоквантовых методов наблюдают
следующие эффекты:
I коррекцию клеточного и гуморального иммунитета:
• повышение неспецифической резистентности организма;
• улучшение реологических свойств крови и микроциркуляции:
і регуляцию гемостатического потенциала крови:
• сосудорасширяющее действие;
і нормализацию кислотно-основного состояния крови;
• повышение кислородтранспортной функции крови;
• нормализацию протеолитической активности крови;
• повышение антиоксидантной активности крови;
• нормализацию процессов перекисного окисления липидов в мембранах клеток;
• стимуляцию эритропоэза;
• стимуляцию внутриклеточных систем репарации ДНК;
• нормализацию тканевого дыхания и, как следствие, обменных процессов
(белкового, липидного, углеводного, внутриклеточного энергетического
баланса);
• нормализацию и стимуляцию регенераторных процессов.
Кроме того, гемоквантовые методы обладают способностью активировать
выход патологических субстратов из межуточного пространства в кровоток
в гем самым ускоряют элиминацию их из организма. Именно поэтому их исполь-
3Уют в комплексном лечении острых экзогенных отравлений в сочетании с эффе¬
рентными методами.
Учитывая широкий спектр действия методов гемоквантовой терапии, показа-
ВДВ К их использованию также достаточно широки:
' острые и хронические воспалительные процессы различной локализации
(специфические и неспецифические);
' воспалительные (инфекционные) осложнения после операций и травм;
КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
I сепсис:
I энзотоксикозы и эндотоксикозы различной этиологии;
І тромбооблитерирующие заболевания артерий конечностей;
а острые и хронические тромбофлебиты, флеботромбозы, хроническая
мая недостаточность; е1)оз-
к ишемическая болезнь сердца и атеросклеротические окклюзии другой
дизации: Кі
I осложненный сахарный диабет;
• лммфостаз;
• вторичный иммунодефицит при различных заболеваниях, травмах
оперативных вмешательств; ’ 0СіІе
І острые воспалительные заболевания кожи и подкожной клетчатки па
ной локализации; Ич'
• острый и хронический панкреатит;
• язвенная болезнь желудка и двенадцатиперстной кишки;
є трофические язвы, замедление заживления ран и консолидации переломо
I термические поражения (ожоги, отморожения);
I инфекционные заболевания (герпетическая инфекция и др.);
а профилактика послеоперационных и посттравматических осложнений-
• профилактика обострений некоторых хронических заболеваний;
• период реконвалесценции после травм, операций и т.д.;
• повышение неспецифической резистентности организма.
При этом противопоказания к гемоквантовой терапии невелики. Это фотодер¬
матозы и повышенная фоточувствительность, все формы порфирии и пеллагра
гемобластозы в терминальной стадии, гипокоагуляционный синдром. Не следует
сочетать гемоквантовую терапию с приемом некоторых лекарственных веществ
являющихся фотосенсибилизаторами, — антибиотиков тетрациклинового ряда'
фенотиазинов. сульфаниламидов, а также антикоагулянтов.
Выбор источника фотогемотерапии определенной спектральной характеристи¬
ки осуществляют индивидуально в каждом конкретном клиническом случае.
Магнитная гемотерапия — дозированное воздействие на кровь, циркулирую¬
щую в экстракорпоральном контуре магнитных полей. Магнитную гемотерапию
можно проводить с помощью аппарата УМГТ-3 (Россия, НПФ «Микра»), кото¬
рый в зависимости от настройки генеририрует как постоянные, так и импульсные
магнитные поля.
Полагают, что экстракорпоральные дозированные воздействия магнитных полей
способствуют поддержанию определенного расстояния между клетками крови,
модифицируют структуру метаболитов белковой и небелковой природы, что пре¬
пятствует агрегации и улучшает деформируемость форменных элементов крови,
снижает ее вязкость и тем самым улучшает реологические свойства и состояние
параметров гемостаза. Собственный детоксикационный эффект магнитотерапии
невелик, однако метод повышает эффективность различных методов ЭКД, усиливая
выход экзо- или эндотоксинов из интерстициального пространства в магистраль¬
ный кровоток. Магнитотерапия показана при лечении острых экзо- и эндотоксико¬
зов в сочетании с эфферентными методами в целях повышения их эффективности
и дополнительной коррекции нарушений гомеостаза.
Значительно реже для воздействия на кровь пациента применяют рентгеновское
излучение. Существуют сведения о применении рентгеновского излучения в качестве
метода экстракорпоральной гемокоррекции при гнойно-септических заболеваниях
и послеоперационных гнойных осложнениях в хирургии и гинекологии. Облучению
рентгеновскими лучами можно подвергать как вводимую больному донорскую кровь
так и его собственную. Цель подобного вмешательства — изменение биологической
реактивности организма. Облучение крови проводят на обычном рентгенотерапев-
ТРАНСФУЗИОЛОГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 397
м аппарате (например. РУМ-17) за сутки до трансфузии или непосредственно
***. объем облучаемой крови — 250 мл. мощность поглощенной дозы -
млн. Доза облучения зависит от массы тела пациента. Отмечены положи-
Ф клинический и биохимический результаты, повышение эффективности
'^аперіильной терапии и иммунореактивности организма. Несмотря на обнаде-
^імцие данные, широкого распространения этот метод не получил,
омические методы гемокоррекции достаточно часто используют при лече-
^ойяо-септических осложнений при хирургических заболеваниях. Один
Наиболее популярных методов — применение 0.04-0.06% раствора гипохло-
& даТрия. Являясь донатором активного кислорода и. следовательно, сшіь-
Ш окислителем, гипохлорит натрия обеспечивает окисление биологически
соединений, ускоряет биотрансформацию токсинов. Метод моделирует
длительную функцию цитохрома Р450 печени и окислительную (фагоцитар-
^ у функцию нейтрофильных лейкоцитов. Недоокисленные на цитохроме Р450
Тнобиотики и метаболиты, соединяясь с белками крови и аминокислотами,
!йоазуют галтеновые группировки, обладающие антигенными свойствами, кото-
Je и активизируют иммунную систему элиминации. При этом в процесс детон¬
ации активно включаются неспецифические факторы иммунитета - микро-
иакрофаги. которые в процессе адгезии бактерий, вирусов, ксенобиотиков
СВОИХ мембранах выделяют сильные окислительные соединения (гипохлорит-,
гияобромид-, гипойодид-ион), поражающие мембраны бактерий. Происходит
доокисление токсичных гидрофобных агентов и перевод их в малотоксичные
ддрофильные, которые выводятся почками.
Поступая в кровь, гипохлорит натрия высвобождает активный кислород.
При этом происходит активное окисление таких токсичных и балластных веществ,
как билирубин, мочевина, аммиак, мочевая кислота, креатинин. холестерин, окись
углерода, ацетон, ацетоацетат, этанол, метанол, барбитураты, сердечные гликози-
ды и т.д. Посредством реакции гидролиза гипохлорит натрия может инактивиро¬
вать крупномолекулярные токсичные соединения, расположенные на поверхно¬
сти клеток крови или циркулирующие в плазме, в том числе экзо- и эндотоксины
микроорганизмов. В силу своей небольшой молекулярной массы гипохлорит
натрия может свободно проникать через мембраны клеток и окислять содержа¬
щиеся внутри них токсины.
Установлено положительное влияние гипохлорита натрия на газовый состав
крови и кислотно-основное состояние, что проявляется снижением парциального
давления углекислого газа и повышением такового кислорода, коррекцией мета¬
болического алкалоза и ацидоза. Гипохлорит натрия повышает утилизацию глю¬
козы, поэтому может быть использован у пациентов с сахарным диабетом.
Антимикробное действие препарата распространяется на грамположительные
играмотрицательные микроорганизмы, грибы и вирусы. Антимикробное действие
связано с окислением или хлорированием активных групп протоплазмы микроб¬
ных клеток, приводящим к блокированию ферментов и поражению клеточных
мембран. Чувствительность к антибиотикам ранее резистентной микробной фло¬
ры при этом возрастает.
Гипохлорит натрия оказывает положительное воздействие на реологию и мик-
роциркуляцию, проявляясь как высокоактивный антикоагулянт прямого дей-
й§и снижает агрегацию тромбоцитов.
Введение гипохлорита натрия внутривенно или в перфузионную систему
°ри сочетании нескольких методов экстракорпорального воздействия приво-
®r I снижению содержания средних молекул и биологических аминов. Метод
Усиливает действие других эфферентных и неэфферентных гемокорригирующих
^Действий. Электрохимическое окисление гипохлоритом натрия безопасно.
Рекомендуют в качестве детоксикационного средства при эндо- и экзоген-
гамм м!
1
IU Ш1ІІІГШПЯ rrrrrrr*^
•вй кктимиции. Ьсзомсиыс дозы гипохлорита натрия составляют в~|а
0.04 0,06% растворк и* килограмм массы тала. Кратность процедур ^ '.**
0Г состояния пациента Метод относительно противопоказан при полно»Л?*’
ясамтвточжхти и гипокоягуляции. когда существует риск кровотечения.
Есть сообщения о применении ги по хлорита натрия для непрямого элею^
мического окисления лимфы, полученной посредством наружного дренирова#11'
гру л мого лимфатического притока. Метод с высокой эффективностью примем?
при тяжелых абдоминальных деструктивных процессах. 200 мл 0,9% pacrw)
гипохлорита натрия смешивают с 200 мл лимфы н 500 ЕД гепарина*, эту cZr
реинфузируют после 4-часовой экспозиции.
Непрямое электрохимическое окисление крови гипохлоритом натрия ИСП0Л1
Н при следующих заболеваниях и состояниях:
I эндо* и экзотоксикоэах (исключая отравления ФОС) II Ш степени;
» повышенной резистентности микрофлоры к антибиотикам;
I гиперкоагудяционном сиидроме;
■ гипергликемнчесхом синдроме с высокой резистентностью к инсулину,
I гиперлипидемиях.
I ОТЛИЧИЄ от эфферентных методов ЭКГК. позволяющих снизить интокси¬
кацию преимущественно за счет удаления олигопептидов среднемолекулярной
массы (как правило, гидрофильных соединений), циркулирующих в плазме
мнфузированный гипохлорит натрия инактивирует крупные токсичные молеку¬
лярные соединения, фиксированные на мембранах форменных элементов крови
в также обеспечивает трансформацию гидрофобных метаболитов в гидрофиль¬
ные. активно выводимые экскреторными органами. При этом после однократ¬
ной инфузии 500 мл 0,06% раствора гипохлорита натрия на 30-56% возрастает
фнбринолитическая активность, на 16-20% уменьшается агрегация тромбоци¬
тов, на 12-21% снижается вязкость крови, что обеспечивает улучшение микро¬
циркуляции.
Показания к повторным введениям гипохлорита натрия определяются степе¬
нью возрастания компонентов интоксикации, уровнем компенсации метаболиче¬
ского ацидоза, контролем гликемии, гемостаза и протеинемии.
Первичная и наиболее безопасная инфузия 0,03% раствора гипохлорита натрия
я периферическую вену показана в объеме 1/10 ОЦК, главным образом в целях
активизации фагоцитарной активности лейкоцитов (на фоне предварительно про¬
веденной детоксикации до уровня I-1I степени).
Абсолютные противопоказания к использованию метода непрямого электро¬
химического окисления гипохлоритом натрия:
« гипогликемическам кома;
• кровотечения различной этиологии — афибриногенемические; вследствие
ненадежного хирургического гемостаза; паренхиматозные; в менструальной
и предменструальном периоде; капилляротоксикоэ; вследствие тромбоците-
пенической пурпуры, гемофилии;
• респираторный дистресс-синдром у взрослых;
• отравления ФОС.
Относ ительные противопоказания — гипогликемия, гипопротеинемия, анемия,
пгаоволемня.
Для непрямого электрохимического окисления гипохлоритом натрия необхо¬
димы определенные условия.
Достаточный венозный кровоток (нормоволемия). так как реакция окисления
начинается непосредственно у кончика внутривенного катетера. При обедненной
кривого к г возможно химическое поражение сосудистой стенки, что и наблюдают
при инфузии в периферические спазмироваиные вены. Кроме того, при слябов
виміном кровотоке возможно распространение гипохлорита натрия в систему
П>АНСФУЗИ0 ЛОГИЧЕСКИЕ МЕТОДЫ ГЕШЙРРЕ«в№ ш
<г,чи» малого «руга кровообращения, что может созвать аотешдольмую
ажени» сурфактанта
адекватной белковой защиты форменных элементов крови: перед
JL „№й гиЯОХЛОРИТВ метрик необходимо провести коррекцию гмюпретеимемим
jLhbmm, протеином, свежезамороженной плазмой крови хотя бы до уровня ■
границы физиологической нормы.
І^олкруя ОЦК (ОЦП), ЦВД, уровни гемоглобина, гематокрита, необходимо
^сичить нормо волемию При сгушеиии крови предварительно осущеепшют
Ч^існоиию до уровня гематокрита 36-40%. ЦВД — 4-Д см вод. ст. В противном
'«чаеиспользование гипохлорита натрия в концентрации 0,06% чревато пореже
^форменных элементов крови и стенки сосуда.
Обязательны: динамический контроль и коррекция уровня гликемии на этапах
и после инфузии и параметров гемостаза перед каждым введением препарата
fLiotnopwr натрия проявляет свое действие в течение 4-6 ч как мощный ангнкоа-
упрямого действия за счет воздействия ка ряд факторов свертывания, в част
LtH способствует деградации фибрина на 30 52%. снижает адгезию тромбоци
0 вязкость крови, при этом время свертывания крови увеличивается ив 40-60%.
учитывая относительно малую продолжительность аитихоагуляциоиного эффек¬
та пвіоїлорита натрия, целесообразно между сеансами НЭХО крови проводить
минимальную антикоагулянтную терапию гепарином* или фракционированным
гепарином * (во избежание эффекта рикошета).
Гемокситерапия — методы оксигенации крови в экстракорпоральном кон-
яре, не связанные напрямую с искусственным кровообращением. Практическое
значение имеет низкопоточная оксигенация крови. Изолированно ее практически
Кб применяют, а используют для потенцирования дптжеикациониого и реокор-
рнгирующего действия других экстракорпоральных методов в целях уменьшения
гдаксемии. Метод позволяет улучшить кислородтранспортаую функцию кроен,
ликвидировать нарушения кислотно-основного обмена, улучшить тггттттнвшш
ланей и тканевый метаболизм. Гипероксия крови способствует окислению не до
окисленных метаболитов, освобождению рецепторов клеток и белков крови, акти¬
вации, клеточного звена иммунитета.
Для низкопоточной оксигенации обычно используют диализатор, в который
шесто диализирующего раствора подают кислород.
В последние годы приобретает популярность метод внутривенном озовотера-
пии. Простота проведения и невысокая стоимость процедуры делают ее доступной
практически для любого лечебного учреждения. Суть метода состоит во внутри-
венном введении озонированных растворов (изотонического раствора натрия хло¬
рида. глюкозы4, реополиглкжина4). При аутогемооэонотервпнн озонированию
подвергают цельную кровь больного или аутоэритровзвесь. Концентрация озона
опыляет 3-4 мг/л. В сутки вводят 400 мл озонированного раствора. Как само-
етшгтельный метод ГК или в сочетании с другими экстракорпоральными воздей¬
ствиями озонирование оказывает комплексное метаболическое действие.
Озон - аллотропное соединение кислорода, газ светло-голубого цвета с харак-
герчым резким запахом, трехатомная молекула, которая имеет треугольную форму
^чйзуется i результате реакции расщепления молекулы кислорода на атомы при
действии электрического разряда. Отдельные атомы кислорода вступают в реяж-
ЗДсиодекулярным кислородом, и образуется озон.
Озон - одно из наиболее сильных окислительных средств. Окислительное дей-
fr*ee °w«a на органические соединения может протекать тремя путями:
* Посредственное окисление с потерей атома кислорода;
* присоединение молекулы озона к окисляемому веществу.
* язтзштическое воздействие, увеличивающее окислительную роль кислорода.
400 шюа»ссЩ тиовпипплгпп
Щ кис лородэависимая смесь, которую получают из
путем ею разложения в электрическом разряде или пос^*^-
облучения. При обработке озоном изотонического
ЩНрцОМра» образуется дополнительный радикал хлора. В результат**0*
«рдміою авелекия озонированного изотонического раствора натрия Па^‘
ВяВВрргужают сооы, кислород и свободные радикалы, вступающие^1
что обеспечивает эффекты озонотерапии. Поступ1
ЩШтт способствует нормализации газового состава крови, восстано****
рн Наличие я среде свободных радикалов кислорода с одновременным
ЩнрИЫрН активирует систему антиоксидаитных ферментов - супетуж^
|НрММ И каталазы. В подобных условиях происходит оптимизация r2u!!'
ииїтоаофкфапкио шунта. В ходе его работы образуются рибозы и, что особ 1
H Восстановленная форма НАДФ-Н\ Это соединение — донор поот^0
«да Восстановлен и я окисленного НАД и глутатиона, который сам является а Н°В
аящдаитом и, кроме того, активирует глутатионпероксидазу. Н АДФ-н и Налы
•дальнейшем принимают участие в восстановлении неферментативных антиок
дамтов Реагируя | ненасыщенными и полиненасыщенными жирными кислота*
свободные радикалы кислорода инициируют процессы перекисного окислени
Молекула озона может встраиваться по месту двойной связи с образоваЯ
нием короткоцепочечных пероксидов и озонидов.
В отличие от длинных аутогенных пероксидов, которые не могут проникать
ІІррВ вдохи, короткоцепочечные соединения минуют мембрану беспрепят¬
ственно. Поскольку они несут перекисные группировки, содержащие кислород, то
НрщрЯПШе в клетку усиливает кислородзависимые реакции. В первую очередь
І|І$фдашаі аэробных процессов, происходящих в эритроцитах. В результате
даНН|ІІ0ифЛііколнза происходит повышение концентрации АТФ, которая акти-
ШЙншшгвбиторы Na', К> АТФ азы. Благодаря взаимной диффузии ионов калия
НВррмю» а ионов натрия наружу, достигается потенциал покоя эритроцитов.
43осшямие мембраны эритроцитов ответственно за способность красных кровя-
ШрряЩш к агреіации, адгезии, т.е. за один из компонентов реологии крови.
Помимо активации метаболических реакций, при воздействии озона отмечают
«Мвюния І микровнзкости мембран эритроцитов, что приводит к увеличению
деформируемости эритроцитов, т.е. способности изменять свою форму и про¬
никать в кровеносные сосуды, диаметр которых меньше их собственного. В ряде
ЛМйМДОванин отмечено влияние озонированных перфузатов на стенки кровенос¬
ных сосудов н поддержание функционирующих капилляров.
Изменение метаболических процессов под действием озона происходит не толь-
*01 эритроцитах. но и в лейкоцитах. Отмечены коррекция энергетического обмена
$ «детках белой крови, накопление жировых включений, нормализация содер*
жания гликогена. Стабилизация биохимических процессов в лейкоцитах ведет
«активации их функции, конкретным примером которой может служить оптими¬
зации работы нейтрофилов.
Нрмввммм гепатоцитов также претерпевает изменения под влиянием озона.
Отмечено, что в клетках печени происходит накопление цитохрома Р450, катали,
гликогена, являющихся важнейшими антиоксидантами. В основе метаболической
Мрэстройкн лежат морфофункциональные изменения гепатоцитов: возрастание
IIWWCTM пероксисом и элементов гладкого эндоплазматического ретикулума,
«мырплазия и гимогенизация митохондрий. Благодаря взаимосвязанной дек*
ТВЛЫИКТИ этих механизмов происходит улучшение функций печени, в том числе
в «иптжснчесхой.
ШШрробряэом. качественно изменяя метаболизм кислорода и энергетически*
■МрШ в клеточных и субклеточных структурах, озон определяет ориентацию
Црнрдавроцестов на органном и системном уровнях. Совокупность этих измг
I • ТРАНСФУЗИОЛОЛШЖИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 401
„ гоСТавляет метаболическую адаптацию организма в целом, являясь основой
развивающихся лечебных эффектов: улучшения микроциркуляции,
г’^^вления иммунного гомеостаза за счет влияния как на неспецифические
защиты, так и на все звенья иммунитета, дезинтоксикации и десенсиби-
антистрессовой адаптации, аналгезии, седативного эффекта,
важнейших лечебных свойств озона - способность инактивировать
?2ии. вирусы, грибы. Достаточно легко объяснить механизм антимикробно-
озона при прямом контакте микроорганизма и высокой концен-
данного газа. Непосредственная причина гибели бактерий при действии
локальные поражения плазматической мембраны, приводящие к утрате
^способности бактериальной клетки и способности ее к размножению. Ввиду
реакционной способности озона и плотной упаковки липидов и белков
^£>мембранах именно плазматические мембраны выступают в роли основной
Їйїеии биологического действия озона на клетку. По мере нарастания дозы
в плазматической мембране (эритроциты, дрожжевые и бактериальные
^ки\ модифицируются силы межмолекулярного взаимодействия (изменения
Ьчивости к детергентам и направление криофрактографического скола), рас-
^гидрофильносгь и разнонаправлено изменяется микровязкость анулярного
бвслойного липида, а также зарядовое состояние поверхности.
" действие озона на кислородный метаболизм в случае нарушенного снабжения
ислородом можно объяснить прямым и косвенным вмешательством в реакцион¬
ный процесс. При действии озона наблюдают следующие эффекты.
Улучшение текучести крови — вследствие озонокислородной терапии прекра¬
щается образование «монетных столбиков» эритроцитов, типичное, например,
j «до артериальной тромбоэмболии в результате изменения заряда мембраны эри¬
троцитов, одновременно повышается упругость и изменчивость формы эритроци¬
тов, что улучшает транспорт кислорода и уменьшает вязкость крови.
Под воздействием глутатионовой системы происходит активация гликолиза,
следствием чего является увеличение концентрации 23-дифосфоглицерата, так
как он ослабляет связь «гемоглобин-кислород» и облегчает переход кислорода
вткани.
При терапевтической дозе необходимо учитывать активацию ферментов, кото¬
рые отвечают за окислительные реакции в организме и на которые в равной
степени возложена защитная функция от дегенеративных остаточных процессов
j в случае избыточной продукции перекиси или остаточного кислорода.
Окислительное декарбоксилирование пировиноградной кислоты в ходе обра¬
зования ацетил-коэнзима-А представляет собой дальнейший ход реакции, в
которой непосредственно участвует озон или его пероксид.
В качестве еще одного фактора рассматривают непосредственное влияние
озона на окислительно-восстановительную функцию митохондральной цепи про¬
цесса дыхания. Активация цепи происходит за счет окисления, например НАДФ,
нлн в результате окисления цитохромной С-системы при дефиците или отсутствии
Широмоксидазы.
Введение озона в организм в определенных концентрациях сопровождается
широким диапазоном действия на различные органы и системы: эндокринную.
Дыхательную, кроветворную, иммунную. В терапевтических концентрациях вво-
димый внутривенно озонированный раствор оказывает иммуномодулирующее,
противовоспалительное, бактерицидное, вирусолитическое, фунгицидное, цито-
^тическое, антистрессовое и аналгезирующее действие. Помимо внутривенного
св°яба введения озонированных растворов или аутокрови, возможны местные
Дппликации, ректальное введение, интраоперационное промывание брюшной
волости.
Описанные биомеханизмы действия озона служат предпосылкой для широкого
Пользования его в клинической практике при самых разнообразных патоло-
402 КЯИМИКМВТМИ6СУЭИОЛОГИЯ
IH процессах. Внутривенную озонотерапию применяют у хирурГич
шгаШ в акушерстве и гинекологии. при ряде кожных заболеваний, о ^
плодика внтраоперационного озонирования перфузата при коррекци^Писа,»а
км сердца У пациентов с инфекционно-септическим эндокардитом в уел**0**0'
искусственного Кровообращения. При этом улучшается оксигенирование
оныамтся содержание 2,3-ДФГ в эритроцитах венозной крови, уменьщ ***’
ШРЩр интоксикации. У пациентов с атеросклерозом отмечают уменьщ0^4
концентрации общего холестерина и липопротеидов низкой плотности, а тЄНИе
I коэффициента атерогенности. ^
При синдроме диабетической стопы (Fonten IV) внутривенное введение
нированного изотонического раствора натрия хлорида приводит к снижен*^
продуктов липоаероксидации и повышению антиоксидантной активности cyn*"0
оксиддисмутазы и каталазы. Метод не имеет побочных эффектов и, следователе
противопоказаний. Единственный недостаток — короткий срок хранения озов°
рованного раствора (20-30 мин), что ограничивает его применение.
Экстракорпоральная фармако- и иммунотерапия — методы, позволявши
экстракорпорально воздействовать на кровь или ее компоненты медикаментами
биологическими субстратами, иммуномодуляторами или иммуносупрессорами
Экстракорпоральному воздействию лекарственных и биологических субстратов
обычно подвергают форменные элементы крови, поэтому процедуре предше¬
ствует цитаферез. Затем клетки крови инкубируют с лекарственным веществом -
антибиотиками, глюкокортикоидами и т.п. Процедура позволяет значительно
уменьшить дозу лекарственного вещества, повысить эффективность его действия
при этом снизив вероятность негативного его воздействия на организм.
Экстракорпоральную антибиотикотерапию применяют при длительно ше¬
ствующих гнойных очагах и неэффективности антибактериальной терапии
при традиционных способах введения препаратов. При длительном существо¬
вании очага воспаления проникновение в него антибактериального препарата
затруднено из-за формирования естественного защитного барьера. Именно поэто¬
му концентрация антибиотиков в очаге и их активность в нем не соответствуют
данным показателям в кровотоке, и применение экстракорпорального взаимодей¬
ствия клеток-мишеней с антибактериальным препаратом весьма рационально и,
как показывает практика, эффективно.
При экстракорпоральной антибиотикотерапии установлено, что для анти¬
биотиков из группы аминогликозидов (гентамицина, нетилмицина) более эффек¬
тивным носителем является эритроцитная масса, а для фторхинолонов (пеф-
локсацина, ципрофлоксацина) — эритроциты с тромболейкоцитной взвесью.
При экстракорпоральном инкубировании цефтриаксонов (цефтазидима) с оди¬
наковой эффективностью может быть использована эритромасса как без примеси
других форменных элементов, так и с примесью тромбоцитов и лейкоцитов.
Экстракорпоральную антибиотикотерапию можно сочетать с дискретным плаз-
маферезом, когда плазму больного удаляют, а клеточную массу смешивают с необ¬
ходимым антибиотиком, инкубируют, а затем возвращают пациенту.
Для экстракорпоральной иммунотерапии используют иммуномодуляторы
ИЛ-1 и ИЛ-2, лейкинферон*. Метод применяют при лечении онкологических
заболеваний, первичных и вторичных иммунодефицитов.
Изучена возможность экстракорпорального иммуносупрессивного действия
предниэолона и циклоспорина в курсе терапии диссеминированных аутоиммуя-
ных заболеваний легочной ткани (саркоидоза легких, фиброзирующего альвео-
лита). Пул лейкоцитов, снятых с 3-4 доз цельной крови больного, инкубировали
с 30-60 мг (200 мкг/мл) преднизолона или циклоспорином (10 мкг/мл) в течение
%ч ври температуре +37 ’С. Выполняли 2 процедуры с интервалом 10 сут. В пр°
цессе исследования было отмечено, что экстракорпорально обработанные супр*^
ТРАНСФУЗИОЛОГИЧЕСКИЕ МЕТОДЫ ГЕМОКОРРЕКЦИИ 403
^детки (лимфоциты) при смешении с нормальными лимфоцитами переда*
СВОИ новые качества. Непосредственным результатом экстракорпоральной
^котерапии было более быстрое купирование обострения, чем при етан-
Ш медикаментозной терапии и ПАФ. В дальнейшем отмечали удлинение
** н и сокращение количества рецидивов заболевания. Результат лечения
зависел от количества обработанных клеток.
г йіямУЮ зависел
эдстракорпоральные методы медикаментозного, биологического, иммуно
пигирующег0 воздействия имеют ряд преимуществ перед введением этих же
■StJffW® непосредственно в организм больного. Поскольку экстракорпоральная
Ккотералия направлена на прямое взаимодействие лекарственного агента
веткой-мишенью, удается уменьшить дозы лекарственного вещества и повы-
* эффективность проводимой терапии. При меньших дозах появляется реаль-
^возможность избежать многих побочных эффектов, связанных с токсическим
їйсгвием препаратов.
Были проведены исследования по экстракорпоральной обработке лейкоцитов
^кинфероном*. который является комплексным препаратом цитокинов началь¬
ной (неспецифической) фазы иммунного ответа. Лейкинферон4 координирует
^щеточные взаимодействия на уровне «макрофаг-Т-хелпер-эффекторная
метка». Наряду с интерфероном а (10 ООО ME) препарат включает ИЛ-1 и ИЛ-6,
хактор некроза опухоли, факторы ингибиции миграции макрофагов и лейкоцитов
кдр. При внутримышечном введении лейкинферона4 ускоряются процессы про-
лиферации и дифференцировки иммунорегуляторных субпопуляций лимфоцитов,
повышается эффективность иммунного распознавания антигена, активируются
фагоцитарные р цитолитические эффекты.
Для Экстракорпоральной иммунокоррекции с лейкинфероном4 используют
рорские или аутолейковзвеси, полученные путем аппаратного или дискретно¬
го цитафереза. Получают 200-400 мл лейковзвеси с содержанием лейкоцитов
0-6,5х1(Я к которой добавляют 1-2 ампулы лейкинферона4 (10000-20 000 ME
интерферона а) и инкубируют 2-3 ч при температуре 37 °С. Обработанные лей¬
коциты вводят внутривенно капельно в течение 60 мин, предварительно доба¬
вив растворитель. Описанный метод эффективен у онкологических больных,
при гнойно-септических заболеваниях и осложнениях, раневой инфекции, атопи¬
ческом дерматите и других вторичных иммунодефицитах.
Для достижения наибольшего клинического эффекта в ряде случаев рекомен¬
дуют использовать сочетание или комбинацию различных экстракорпоральных
методов.
Можно уверенно прогнозировать, что сочетанные и комбинированные методы
трансфузиологической гемокоррекции в перспективе составят значительную долю
всех методов экстракорпоральной медицины.
Примером комбинированного воздействия является экстракорпоральная
фотохимиотерапия. Суть метода состоит в том, что в лейковзвесь, полученную
из крови пациента центрифугированием или аппаратным цитаферезом, добавляют
фотоактивное лекарственное вещество (8-метоксипсораленр), полученную смесь
инкубируют, а затем подвергают облучению ультрафиолетовыми лучами в диапа¬
зоне длинноволнового спектра (320-400 нм). Метод экстракорпоральной фотохи-
миотерапии разработали Эдельсон и соавт. (США) в 1985 г. В настоящее время его
используют более чем в 160 лечебных центрах Европы и Америки. Предприняты
^Дельные попытки внедрения экстракорпоральной фотохимиотерапии в России.
Согласно представленной схеме, за курс лечения обрабатывают 10-15% обще¬
го количества лимфоцитов организма. Метод оказывает иммунокорригирующее
Действие при Т-клеточной кожной лимфоме, синдроме Сезарн. аутоиммунных
клеваниях.
101 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
СПІШ ЛИТЕРАТУРЫ
Аталиые аспект экстракорпорального очищения крови в интенсивной теш
НЦССХ им. А.Н. Бакулева РАМН: Сборник материалов. - М., 2000. -141 с. ^ //
Актуальные аспект экгракорлорального очищения крови в интенсивной те
Актуальные вопросы острой почечной недостаточности // НЦССХ им. А.Н. g *)аШВ|-
РАМН: Сборник материалов. - М.. 2004. - 142 с.
Актуальные проблемы экстракорпорального очищения крови, нефрологии и гемаА
я и НЦССХ им. АЛ. Бакулева РАМН: Сборник материалов. - М.. 2002. - 242 с. ^е*
Ветчмнникова О.Н., Пиксин И.Н.. Калинин А.П. Экстракорпоральное ультрафиолет
облучение крови s медицине. - М.. 2002. -263 с. **oeoe
Воинов ВА. Мембранный плазмаферез. - СПб.: Эскулап, 2002. - 44 с.
Воинов ВА Эфферентная терапия. Мембранный плазмаферез. - СПб.: Эскулап 2005
272 с. ’ ~
Иммуносорбция липопротеидов низкой плотности (ЛНП аферез) в лечении боль
с нарушениями липидного обмена: Методические рекомендации для врачей. — м 2Щ?Х
28с. " '
Коновалов ГА Терапевтический гемаферез в современной медицине // Эффепентя
терапия. - 2003. -N*1.- С 39-42. я
Лурье Г.О, Искусственное кровообращение. - М.: Медицинское информационное аген-
ство. 2001 - 32 с
Москвин СВ., Азизов Г.А. Внутривенное лазерное облучение крови. - М.: Ньюдиамед
АО, 2003. -32 с.
Петров ММ. Актуальные проблемы клинической трансфузиологии // Новые технологии
в акушерстве, гинекологии и неонатологии (эфферентные и квантовые методы терапии) -
М., 2002.-С 89-106.
Плазмаферез в интенсивной терапии тяжелых форм гестоза: Пособие для врачей. - м
2000. -5 с. ’• '
Покровский С.Н. Сорбционные технологии - итоги и перспективы // Эфферентная тера¬
пия. - 2003. - N4 - С. 42-46.
Постников А.А. Прямое очищение крови (лабораторный контроль). — М.: Практическая
медицина, 2003. -182 с.
Проблемы физиологии и патологии системы гемостаза. — Барнаул: Азбука, 2000. - 346 с
Рагимов А.А. Основные направления современной трансфузиологии // Анналы РНЦХ
РАМН. - 2002. - N»12. - С. 137-143.
Рагимов АЛ. Клиническая трансфузиология — задачи и проблемы // Вестник службы
крови России. - 2003. - №3 - С. 9-12.
Сердечно-сосудистые заболевания // Бюлл. НЦССХ им. А.Н. Бакулева. — 2002. - Т. 3. -
№4.-94 с.
Труды VIII конференции Московского общества гемафереза. — М., 2000. - 161 с.
Труды IX конференции Московского общества гемафереза. — М., 2001. — 152 с.
Труды ХП конференции Московского общества гемафереза. — М., 2004. — 100 с.
Федосеев А.В., Тарасенко С.В., Зайцев О .В. Электрохимическая детоксикация лимфы
в лечении больных с гнойно-резорбтивным эндотоксикозом // Анестезиология и реанима¬
тология. - 2001. - №2. - С. 48-51.
Эфферентные и квантовые методы лечения в медицине // Материалы Всероссийской
конференции хирургов. - Саранск: Изд-во Мордов. ун-та, 2002. — 172 с.
Эфферентная терапия. - СПб.: ИКФ «Фолиант». 2000. — 432 с.
Яковлева И.И., Тимохов В.С., Ляликова Г.В. и др. Высокообъемная гемодиафильтра¬
ция в лечении сепсиса и полиорганной недостаточности: два способа элиминации TNF //
Анестезиология и реаниматология. - 2001. — №2. — С. 46-48.
Goodnough LT., Shander A., Spence R. Bloodless medicine: clinical care without allogenec
Wood transfusion // Transfusion 2003. - N 43 (5). - P. 668-676. __
Knobler R. Extracorporeal Photochemotherapy — Present and Future // Vox. Sang. - 2000.
Vol. 78.- P. 197-201.
Valbonesi М., Bruni R„ De Luigy M.C. Terapeutic Hemapheresis as of 2000 // Vox. Sang.
2000.-Vol. 78.-P. 051-056.
Глава із
Основные средства
трансфузионно-инфузионного
пособия
Основные ПОНЯТИЯ
Инфузионно-трансфузионная терапия (ИТТ) — парентеральная,
внутрисосудистая, чаще всего внутривенная жидкостная терапия.
ИТТ является первой ступенью в лечении острой гиповолемии,
шока, тяжелой травмы, кровотечений, компенсации периопераци-
о иных потерь жидкости и дегидратации. В настоящее время задачи
инфузионно-трансфузионной терапии значительно расширились:
теперь это не только возмещение кровопотери и коррекция дефи¬
цита жидкости, но и создание нового гемодинамического фона, обе¬
спечивающего адекватную гемодинамику и аэробный метаболизм
в органах и тканях.
Все средства инфузионно-трансфузионного (трансфузионного)
пособия — коррекция гомеостаза организма посредством внутри-
сосудистого введения компонентов крови и кровезаменителей —
можно условно разделить на три основные составляющие: трансфу¬
зии донорской крови и ее компонентов, инфузии кровезаменителей
и трансфузии аутокрови и ее компонентов.
Йнфузия — это парентеральное (внутривенное, внутриартери-
альное, внутрилимфатическое) введение в организм различных
жидкостей с лечебной или диагностической целью (рентгенокон-
трастов, соноконтрастов, красителей и др.).
, Гемотрансфузия (haemotransfusion), или трансфузия, - введение
в кровяное русло реципиенту (переливание) предварительно заго¬
товленной крови или ее компонентов.
По способу введения различают:
• внутривенные — в крупную вену или венозный синус;
• внутриартериальные — в одну из крупных артерий;
• внутрикостные — в губчатое вещество кости;
• внутриматочные — плоду (пункция брюшной полости плода
после амниоцентеза);
• внутрисердечные - в левый желудочек сердца (в обнаженное
сердце или чрескожная пункция).
Все гемотрансфузии можно разделить на две группы: аллогенные
и аутогемотрансфузии.
Аллогенные трансфузии — переливание крови или компонентов
||зйіСК0Й крови- Различают следующие виды аллогенных транс-
• простые — переливание реципиенту одной или нескольких доз
Донорской крови или ее компонентов;
406 КЛИНЯЧЄСКЛЯ ТРЛИСФУЗИОЛОГНЯ
• обменные І замещение определенного объема крови реципиента таки
объемом крови донора. Основная цель обменных переливаний - удаГ **
из организма реципиента различных ядов, продуктов распада, гемо*1"*
или антител. [При отравлениях, эндогенных интоксикациях, гемолитичес*3*
болезни новорожденных (ГБН). гемотрансфузионном шоке, острой почечи*
недостаточности, тяжелых токсикозах и т.д.]. Обменное переливание кп
можно заменить интенсивным лечебным плазмаферезом с удалением за о
процедуру до одного объема циркулирующей плазмы (ОЦП) и адекватні
замещением кровезаменителями и свежезамороженной плазмой (сзт
При обменном переливании важную роль играет сохранение равновесия
между количеством вводимой и выводимой крови (при анемизации пациент
количество вводимой крови может быть больше);
І заменные - практически полное замещение крови реципиента донорской
кровью за 24 ч. Средняя скорость трансфузий должна составлять не более
1000 мл за 15 мин. Пример обменных или заменных трансфузий - тращ.
фузии при СКА и ГБН:
• массивные - количество перелитой крови составляет более 30% объема цир¬
кулирующей крови (ОЦК).
По методу переливания применяют непрямые гемотрансфузии, т.е. заготовлен¬
ные в ближайшие часы либо в течение 6 ч после экспресс-метода на инфекции.
По времени применения;
• неотложные;
I постоянные.
По способу введения:
• струйные;
• капельные;
І струйно-капельные.
Основные режимы гемотрансфузий:
І обычный (консервативный);
1 гипертрансфузионный (или агрессивный);
• супертрансфузионный.
Аутогемотрансфузия — переливание больному (реципиенту) собственной (ауто¬
логичной) крови или ее компонентов, предварительно взятых у него и возвращен¬
ных в целях возмещения кровопотери (аутогемотрансфузия), или излившейся
при операциях в полости тела крови (реинфузия). Один из видов аутогемотранс¬
фузии называется реинфузией, или обратным переливанием крови (возвращение
реципиенту его крови, излившейся в раневые или серозные полости и находив¬
шейся в них не более 12 ч).
Цели современной инфузионной терапии:
і восстановление и поддержание объема и качественного состава во всех водных
разделах организма - сосудистом, интерстициальном, клеточном (соблюде¬
ние принципа дозированного объемного и секторального возмещения);
• оптимизация параметров центральной и периферической гемодинамики;
• коррекция параметров гомеостаза: поддержание ионного и кислотно¬
основного равновесия, осмолярности и онкотического давления;
к обеспечение адекватного транспорта кислорода к органам и тканям (главное
условие адекватной ИТТ);
ж профилактика реперфузионных осложнений;
• поддержание гемодинамики;
• парентеральное питание.
Согласно опыту РНЦХ им. академика Б.В. Петровского РАМН, 95% пациен¬
тов многопрофильного хирургического стационара в процессе лечения получают
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЙ 407
76% ив них инфузируют кровезамещающие растворы, включая парентераль-
^цтание-
цо* оКОмпонентная терапия донорских компонентов крови связана с рядом осо-
I* объясняющих большой риск ее использования:
еобходимость П°Дбора по изоиммунологической совместимости:
' сенСИбилизация организма в результате неоднократных переливаний:
" оиск переноса инфекционных заболеваний (несмотря на плановое обследо-
' вание донора крови);
индивидуальная непереносимость компонентов крови:
* высокий риск трансфузионных осложнений, связанных с заготовкой и пере-
' оаботкой донорской крови (человеческий фактор);
высокая стоимость заготовки, переработки и хранения крови, ее компонен¬
тов и препаратов.
Специализированные кровезамещающие растворы предназначены восполнять,
в ряде случаев и эффективно восстанавливать отдельные функции крови. Они
позволяют:
, заполнять кровеносное русло и поддерживать на необходимом уровне арте¬
риальное давление, нарушенное в результате кровопотери или шока;
I восстанавливать осмотическое или электролитное равновесие;
• освобождать организм от токсинов, образующихся под влиянием патогенных
факторов и инфекционных агентов или поступающих в организм при отрав¬
лениях;
i обеспечивать ткани необходимыми питательными веществами и источника¬
ми энергии (растворами аминокислот, сахаров, жиров, витаминов, минераль¬
ных веществ).
По сравнению с компонентами и препаратами крови кровезаменители
обладают рядом достоинств, которые помогают избегать основных трансфу¬
зионных осложнений, сопутствующих переливаниям компонентов крови. Это
связано с низкой сенсибилизирующей активностью, исключением передачи
инфекционных осложнений, а также с тем, что пациенту не нужно проводить
иммунологический подбор. Низкая стоимость препаратов, простота хранения
и транспортировки делают их необходимыми компонентами трансфузионной
медицины.
КЛИНИКО-ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ РАЦИОНАЛЬНОЙ
ИНФУЗИОННОЙ ТЕРАПИИ
Передвижение воды в жидкостных пространствах подчиняется некоторым
физиологическим принципам.
Осмотическое давление — это связывающая способность водных растворов,
которая зависит от количества растворенных частиц, но не от природы раство¬
ренного вещества или растворителя. Осмотическое давление плазмы равно сумме
осмотических давлений содержащихся в ней ингредиентов (в норме - 296-
3W мосмоль/л). Осмотическую концентрацию обозначают как осмолярностъ -
количество ммоль, растворенных в 1 л жидкости.
Осмотическое давление, создаваемое высокомолекулярными коллоидными
иществами, называется коллоидно-осмотическим давлением (КОД). В норме оно
составляет 25 мм рт.ст. и зависит от молекулярной массы растворенного вещества
к его концентрации.
Водные области организма
Внеклеточное водное пространство — это жидкость, окружающая клетки.
объем
и состав которой поддерживаются с помощью сложных регулирующих
ggg даИИШЖАЯ ТРАНСФУЗИОЛОГИЯ
1
механизмов. Основной катион — натрий, основной анион — Хло_ и
лежит главная роль в поддержании осмотического давления и объём Прннад
этого пространства. Через него обеспечиваются транспорт кислород 3 ЖИдк°сти
ных веществ и вывод шлаков. Внеклеточное пространство состоит- ПИТатМь.
• из внутрисосудистого сектора — плазма с постоянным анионно-
составом (4-5% массы тела); Каг,,0'|цым
интерстициального сектора - среда, которая считается своего no I
между внутрисосудистым и клеточным секторами. Объем ■
МсЖДУ внутриеисудлL1ЫМ *1 ЛЛСТиЧПЫМ LCI4 lUpdMH. иоъем ИНТеВСТ СР0\|
го сектора составляет ‘/4 всей жидкости организма (15% массытр Иальн°-
интерстициальный сектор осуществляются транспорт ионов к
питательных веществ в клетку и обратное движение шлаков в С0ИО10Р°Да,
объем значительно увеличивается и уменьшается при гипер- и деги
соответственно. Именно за счет жидкости интерстициального сектпЗТа1<Ии
исходит компенсация объема плазмы при острой кровопотере. Пепе Т Про'
большого количества кристаллоидных растворов не сопровождаетсяИВаНИе
тельным увеличением ОЦК вследствие их проникновения через сосуЗНаЧИ'
мембраны в межтканевую жидкость; УДистые
І трансцеллюлярного сектора — жидкость, расположенная в полостях od
ма. Ее объем составляет около 2,3% массы тела. Низ‘
2. Внутриклеточное водное пространство. Вода в клетках окружает внутпен
структуры, обеспечивает их жизнедеятельность и считается составной частью п
топлазмы. Внутриклеточное пространство содержит более высокие количеств
калия и белка, основной анион — фосфат. Калий составляет около 2/3 активны
клеточных катионов, около */, приходится на долю магния. Изменения концен¬
трации калия и магния в сыворотке крови не полностью соответствуют измене¬
ниям концентрации этих ионов в клеточной жидкости. Снижение концентрации
калия в сыворотке крови при ацидемии свидетельствует о дефиците калия не толь¬
ко в плазме, но и в клетках. Однако нормальный уровень калия в сыворотке крови
не всегда соответствует его нормальному содержанию в клетках.
В физиологических условиях движение жидкости между капилляром и интер-
стицием определяют уравнением Старлинга:
J =Kfs х f(P - P. ) - ad х (я -п.,)],
IV cap ini' v cap int'J’
где Kfc - коэффициент фильтрации в капилляре (результат взаимодействия пло¬
щади поверхности капилляра и гидравлической проводимости); Р — гидростати¬
ческое давление; л — онкотическое давление; ad — коэффициент отражения (от О
до 1; 0 - капилляр свободно проницаем для белка, 1 — капилляр непроницаем
для белка).
При целом ряде патологических состояний, на фоне повышенной проницаемо¬
сти капилляров распределение жидкости и коллоидной части плазмы, и в частно¬
сти альбумина, между секторами перестает быть уравновешенным. Развивающееся
под действием цитокинов нарушение микроциркуляции и так называемый эндо-
телит (поражение эндотелия, активация эндотелиоцитов с набуханием и экс¬
прессией адгезивных молекул) становятся причиной вазодилатации, увеличения
проницаемости, капиллярной утечки и потери жидкости.
Дифферецированное распределение воды, солей и плазменных белков обяза¬
тельно следует учитывать при планировании инфузионной терапии.
Объем инфузионной терапии определяется индивидуально на основании ком
плексной динамической оценки показателей гемодинамики (ЦВД, АД, ЧСС, О )•
диуреза и кислородтранспортной функции.
При соблюдении этого протокола необходимо стремиться к следующим по
зателям:
• ЦВД - 4-7 мм рт.ст. (6-10 см вод.ст.);
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 409
чСС 60-90 в минуту;
• - более 70 мм рт.ст.;
’ «явление заклинивания легочных капилляров (ДЗЛК) - 10-15 мм рт.ст.;
' аппечный индекс (СИ) - 2,5-4,5 л/мин на м2;
’ го%<\о,>80%,
НВД правильно оценивать в сочетании с инфузионной нагрузкой (так пазы-
^ правило 5-2 см вод.ст.). Больному в течение 10 мин вводят внутривенно
*Т-0зу жидкости: 200 мл при исходном ЦВД 6 см вод.ст., 100 мл при ЦВД
^елах 6-8 см вод.ст., 50 мл - при ЦВД 10 см вод.ст. Если ЦВД увеличилось
іціеечем на ■*см В°Д,СТ,>то инфузию прекращают и решают вопрос об инотропной
вдержке, так как такое повышение свидетельствует о нарушении сократимости.
йяИ ЦВД увеличилось не более чем на 2 см вод.ст,, то продолжают инфузионную
йЯИЮ без инотропной поддержки, поскольку причиной низкого ЦВД считают
І^оволемию. Нередко нормальные или повышенные значения ЦВД наблюдаются
[^ гиповолемии и вазоспазме, и в ответ на инфузионную нагрузку происходит
йижение этого показателя. Другой способ заключается в постуральной пробе.
согда ЦВД измеряют в положении лежа на спине, а потом в положении сидя. Если
ЦВД уменьшается более чем на 5 см вод.ст., это свидетельствует о гиповолемии.
Перед измерением ЦВД необходимо правильно установить нулевой уровень.
Кроме того, оно может оказаться неточным вследствие инфузии в ту же венозную
магистраль растворов и введения вазоактивных лекарственных препаратов.
До определенного уровня повышение ЧСС влечет параллельное увеличение
сердечного выброса. Однако по достижении величины более 120-160 в минуту
диастола становится настолько короткой, что сердце не успевает наполняться кро¬
вью и сердечный выброс падает.
Надежным критерием эффективности инфузионной терапии считают почасо¬
вой диурез, объем которого должен составлять не менее 0,5-1,0 мл/кг в час.
Несмотря на определенные разногласия о целесообразности катетеризации
легочной артерии при инфузионной терапии, следует признать, что определение
давления в легочной артерии и ДЗЛК, а также СВ с помощью катетера Свана-
Ганса значительно расширяют возможности мониторного контроля и оценки
эффективности терапии.
При построении адекватной схемы инфузионной терапии следует учитывать
следующие моменты:
• тип и состав инфузионной среды (коллоиды, кристаллоиды, компоненты
крови);
І объем и темп инфузии (зависит от волемического статуса);
І конечную цель инфузии (ЧСС — менее 110 в минуту; АД^ - не менее 70 мм
рт.ст.; диурез — 0,5-1,0 мл/кг в час);
• потенциальные побочные эффекты препаратов.
ОБЩИЕ ПРИНЦИПЫ КОМПОНЕНТНОЙ ГЕМОТЕРАПИИ
Многолетние фундаментальные исследования гематологов, иммунологов, изо-
ирологов, морфологов, биохимиков состава и функции клеток и плазмы крови,
накопившийся клинический опыт применения донорской крови и ее компонентов
позволили пересмотреть устоявшиеся положения о переливании цельной консер¬
вированной крови как методе гемотерапии многостороннего действия. С течением
времени пришло понимание, что необоснованное переливание крови крайне опас¬
но. Опыт многих десятилетий по применению консервированной крови позволил
сначала выдвинуть, а затем шаг за шагом реализовать концепцию компонентной
^отерапии: ее необходимо выполнять строго по показаниям и теми компонента*
чи крови, в которых испытывает недостаток организм больного.
Mb
HI і/ттшомШ€тшопогт
Ц§ пособие трансфузиологической гемокоррекции можно разделить m
ьмкшооііолняющир части:
І краа» и ее компоненты: донорская и/или ауто;
• лекарстаениые (кровезаменители и препараты парентерального питания»
І препараты крови. 'f:Fl
■л крови - ЭТО клетки крови (Эритроциты, лейкоциты, тромбої
ты. стволовые клетки периферической крови), плазма крови и ее производит
I И индивидуальными особенностями донора (АВО, Rho(D), нц
НРА, Kell. Iи др.). При применении компонентов донорской крови нельзя по,.'
яоетью исключить риск заражения гемотрансмиссивными инфекциями (напри-
щи яря кроводаче в серонегативный период после заражения).
Препараты крови - трансфузионные среды, приготовленные из компоненто*
крови донора путем более сложной и многоэтапной переработки, в результат?
«стгольэуемых технологий лишенные индивидуальных особенностей донора
В препаратах крови полностью исключена возможность наличия возбудителей
гемотрансмиссивных инфекций.
Основу принципа компонентной гемотерапии составляет дифференцированное
получение от донора крови необходимого/необходимых компонентов клеточного
состава или плазмы крови и замещение ими недостающих компонентов крови
у больного. Такой подход позволяет экономить ресурсы донорской крови (кровь
одного донора может приносить пользу сразу нескольким больным) и обеспечи¬
вает оптимальное проведение гемотрансфузии пациентам, требующим большого
количества того или иного специфического компонента крови. Внедрение идеоло¬
гии компонентной гемотерапии, кроме очевидной клинической пользы, позволяет
увеличить ресурсы Банка крови в препаратах крови, так как из одной дозы цель¬
ной консервированной крови получают несколько ее компонентов.
К переливанию компонентов крови необходимо относиться как к серьезной
медицинской инвазивной процедуре, операции, которая может стать причиной
как ранних, так и отдаленных осложнений. Консервированная донорская кровь
І ее компоненты -- это не лекарственные препараты, как их понимают в обычном
смысле, а ткань организма, и соответственно отношение к их применению должно
быть таким же, как и к трансплантации других органов и тканей. В каждом кон¬
кретном случае врач назначает и применяет тот компонент крови, который наи¬
более необходим данному пациенту. Переливание отдельных компонентов крови,
выполняемое на основании клинических и лабораторных показателей, значитель¬
но повышает лечебную эффективность гемотерапии, снижает риск и опасность
реакций и осложнений.
Современная трансфузионная гемотерапия базируется преимущественно на
принципе заместительного и/или гемостатического лечебного эффекта соответ¬
ствующего компонента крови. Так, в условиях анемизации при острой кровопотере
о заместительном действии гемотрансфузии эритроцитной массы свидетельствует
улучшение клинического состояния пациента, сопровождающееся повышением
уровня гемоглобина, гематокрита и количества эритроцитов, насыщением крови
кислородом и нормализацией артериовенозной разницы.
Одна из основных составляющих идеологии компонентной гемотерапии заклю¬
чается в том, что купирование дефицита компонента крови больного не прово¬
дится по принципу «капля за каплю*, т.е. нет необходимости в полном замещении
имеющегося дефицита того или иного клеточного или белкового компонента.
Лечебные мероприятия, проводимые с помощью препаратов и компонентов
крови, следует осуществлять на основании анализа всей совокупности клиниче¬
ских и лабораторных данных, которое дает врачу четкое представление о степени
дефицита отдельных факторов дефицита крови и особенностях состояния больно-
ОСНОВНЫЕ СРЕДСТВА ТРАИСОУЗИОННО-ИНФУЗШННОІС
OHM
411
анализ позволяет достичь необходимого лечебного эффект» с ммни-
трансфузионных средств.
#^ягность больных к тому или иному уровню дефицита компонентов крови -
^МТЙИНйЙ патологии может быть разной, что определяется МНОГИМИ При-
«С"10* Стоянием сердечно-сосудистой системы, компенсаторными возможно-
^^'танизма характером и длительностью заболевания, травмой, величиной
^ттгеря. наличием или отсутствием осложняющих факторов и др. Именно
gp®0*1 ijj, назначении компонентной гемотерапии важно прежде всего выяс-
объясняются клиническая симптоматика и тяжесть состояния больного ■
множества факторов. Данные лабораторных исследований дополняют
; ую оценку и указывают на вид дефицитного компонента крови, уровень
и позволяют определить необходимую дозу трансфузии
в лечебную практику компонентной гемотерапии позволило дифе-
^шанйо вводить больному недостающий клеточный или белковый ком-
^Р°не перегружая кровяное русло. Переливание больших объемов цельной
“ ■ ял я получения аналогичного лечебного эффекта привело бы к гиперво-
Ж перегрузке сердечно-сосудистой системы, изосенсибилизации, а также
Ложным изменениям в иммунной системе. Так, для восстановления окси-
к ^^щей функции крови отпала необходимость переливания цельной крови,
«необходимых клеток (эритроцитов), содержащей другие клетки и плазму.
^ _уХ больной не нуждался. Другой пример: для купирования тромбоцитопе-
Леской геморрагии и восстановления уровня тромбоцитов вводят 100-200 мл
^ мббцйїиогр концентрата вместо эквивалентного переливания 4-6 л свежезаго-
^енной цитратной крови. При гипо- и афибриногенемиях эффективной дозой
Лтают 4-8 г фибриногена, что эквивалентно 10 л цельной крови, а для лече¬
ния гемофилии используют криопреципитат в дозе 50-100 мл (1000-1500 ЕД)
или концентрат фактора VIII вместо нескольких литров цельной крови.
Приведенные в книге компоненты крови соответствуют требованиям отрас¬
левого классификатора 91500.18.0001-2001 «Консервированная кровь человека
и ее компоненты» (ОК ККЧиК). ОК ККиЧ от 30.10.01 г. рассмотрен и принят
Экспертным советом по стандартизации в здравоохранении М3 России.
ОК ККЧиК — систематизированный свод лечебных средств, применяемых
pi оказания трансфузионной помощи, разрешенных к медицинскому примене¬
нию, предназначен для лицензированных и аттестованных учреждений здравоох¬
ранения вне зависимости от ведомственной подчиненности, которым разрешены
заготовка, переработка, хранение донорской крови и ее компонентов (разделы
III и IV Закона Российской Федерации о донорстве крови и ее компонентов -
№5142-1 от 09.06.1993 г.).
В 0К ККЧиК-стандарте используются термины в интерпретации, делающей
их однозначными для восприятия всеми участниками лечебно-диагностического
процесса (табл. 15-1,15-2).
Таблица. 15-1. Основные термины 0К ККЧиК-стандарта
I Аферез
Процесс, при котором один или более компонентов донорской крови иэбира- ]
тельно изымают из нее. возвращая донору остальные составляющие компо¬
ненты донорской крови
Асоь консервированная
Цельная кровь, взятая у донора, помещенная в контейнер с консервантом
и сохраненная официально разрешенным способом, предназначаю для фрак- і
ционирования или для трансфузий (при отсутствии донорских эритроцитов)
j WTOOHWTW крови
Клетки (эритроциты, лейкоциты, тромбоциты) и плазма крови с сохранен¬
ными индивидуальными особенностями донора [АВО. Rho(D). HLA, НРА Kell.
MNS и др.]
^Фвципитат
Компонент плазмы крови, обладающий высокой знтигемофипьной активно- і
стью благодаря содержанию в нем фактора свертывания крови VHI фактора
фон Виллебранда и фибриногена
412
МРЧКЖАЯ ТТЦНСОУЗИОЛОГИЯ
Окончание табл
mm иапаиая noment- I Производное супернатантной фракции плазмы с повышенным голргГ— Ч
ромеи» (фактора IX
[ Часть крови после отделения форменных элементов крови
[ Смтэаиоромеииая
(плазма
'Замороженная плазма
1Ауголлазма свежезаморо
метая
і Препараты крови
Ппазма, заготовленная в сроки менее 6 ч от момента взятия крови
Плазма, заготовленная в сроки от 6 до 24 ч с момента взятия крови
Плазма заготовленная от пациента в сроки менее 6 ч
Эритроцитная масса
Эритроцитная взвесь
I Тромбоцитные концентрат
Трансфуэионные среды, изготавливаемые из консервированной кровйт—
ра, лишенные индивидуальных особенностей донора и предназначенные '^
для инфуэий пациенту
Компонент, получаемый после удаления из крови части плазмы
Эритроцитная масса с удаленным лейкотромбослоем в ресуспендирующем
растворе, предназначенная для трансфузий пациенту
Концентрат форменных элементов крови, ответственных за первичный гемостаз
Таблица 15-2. Отраслевой классификатор «Консервированная кровь человека и ее компоненты]
Переносчики газов крови
D1.01 Компоненты консервированной донорской крови
01.01.001 Эритроцитная масса
Эритроцитная масса фильтрованная
01.01.003
Эритроцитная масса гамма-облученная
lot .01.004
Эритроцитная масса, обедненная лейкоцитами и тромбоцитами
j 01.01005
Эритроцитная масса с удаленным лейкотромбослоем
01.01.006
Эритроцитная масса с удаленным лейкотромбослоем фильтрованная
0101.007
Эритроцитная масса с удаленным лейкотромбослоем гамма-облученная
0101.008
Эритроцитная взвесь с физиологическим раствором
01.01009
Эритроцитная взвесь с ресуспендирующим раствором
01.01.010
Эритроцитная взвесь с ресуспендирующим раствором фильтрованная ^—
101.01.011
Эритроцитная взвесь с ресуспендирующим раствором гамма-облученная ІййІ
101.01012 I Эритроцитная взвесь размороженная и отмытая ! —
101.02 ІК
омпоненты аутологичной (аутогенной) консервированной крови —
0102.001 (Аутоэригроцитная масса
01.02002 I Аутозритроцитная масса фильтрованная
101.02 003 I Аутоэригроцитная масса гамма-облученная
01.02.004 Аутоэригроцитная масса, обедненная лейкоцитами и тромбоцитами
101 02 005 | Аутозритроцитная масса с удаленным лейкотромбослоем фильтрованная
[ 0102006 Аутозритроцитная масса с удаленным лейкотромбослоем гамма-облученная
101 02 007 j Аутоэригроцитная взвесь с физиологическим растворомВ
01
02.008 i Аутозритроцитная взвесь с ресуспендирующим раствором
01 02009 j Аутозритроцитная взвесь с ресуспендирующим раствором фильтрованная
0102010 I Аутозритроцитная взвесь с рвсуспендирующим раствором гамма-облученная
0102.011I Аутозритроцитная взвесь размороженная и отмытая
10103 і Цельная консервированная донорская кровь
0103001 j Кровь консервированная
0103 002 I Кровь консервированная фильтрованная
01.04 I Цельная консервированная аутокровь
0104.001 тАутоировь консервированная
1002 I Аутокровь консервированная фильтрованная
т
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСХ
413
Окончание табл.
■Г^^Гполостная, консервированная, фильтрованная для реинфузии
^^юры гемостаза и фибринояиза
вкгсры сосудисто-тромбоцитного гемостаза
' концентрат нз дозы крови
трпгійоцитньїй концентрат из дозы крови гамма-облученный
іпмбоцитньій концентрат пулированный, монодонорский
ТппгаП1)итмый концентрат пулированный. монодонорский, фильтрованный
I концентрат пулированный. монодонорский, гамма-облу
Іррийтіитиьій концентрат пулированный. монодонорский, гамма-облученный, фильтрованный
обогащенная тромбоцитами, гамма-облученная
їгрпмбсіцйтньїй концентрат пулированный. полидонорский
ТрлиЛпиитный концентрат пулированный, полидонорский, гамма-обяуаенный
трпмбоиитный концентрат пулированный, полидонорский, фильтрованный
ТпомбОЦИтный концентрат пулированный, полидонорский. гамма-облуненный, фильтрованный
трпмбоиитный концентрат пулированный, полидонорский, полуавтоматический
трпмбоиитный концентрат пулированный, полидонорский, полуавтоматический, гамма-облуненный
Тоомбоцитный концентрат пулированный, полидонорский, полуавтоматический, фильтрованный
Тромбоцитный концентрат пулированный, полидонорский, полуавтоматический, гамма
облученный, фильтрованный
Тоомбоцитный концентрат, полученный дискретным аферезом
Тоомбоцитный концентрат, полученный дискретным аферезом, гамма-облученный
Тромбоцитный концентрат, полученный дискретным аферезом. фильтрованный
Тромбоцитный концентрат, полученный дискретным аферезом, гамма-облученный, фильтро¬
ванный " -
Тромбоцитный концентрат, полученный автоматическим аферезом
Тромбоцитный концентрат, полученный автоматическим аферезом. гамма-облученный
Тромбоцитный концентрат, полученный автоматическим аферезом, фильтрованный
Тромбоцитный концентрат, полученный автоматическим аферезом, гамма-облученный, фильтро¬
ванный
Тромбоцитный концентрат размороженный
Корректоры плазменно-коагуляционного гемостаза донорские
Плазма свежезамороженная из дозы крови
Плазма свежезамороженная, полученная дискретным аферезом
Плазма свежезамороженная, полученная автоматическим аферезом
Плазма свежезамороженная фильтрованная
Плазма замороженная
Плазма замороженная фильтрованная
Криопреципитат
Плазма нативная концентрированная
Корректоры плазменно-коагуляционного гемостаза аутологичные (аутогенные)
Аутоплазма свежезамороженная из дозы крови
Аутоплазма свежезамороженная, полученная дискретным аферезом
Аутоплазма свежезамороженная, полученная автоматическим аферезом
.Аутоплазма свежезамороженная фильтрованная
Средства коррекции иммунитета
Компоненты крови для иммунозаместительной терапии
Плазма противопротейная человеческая
Плазма антисинегнойная человеческая
Плазма антисинегнойная антитоксическая человека
Плазма антистаФилококковая человеческая
Дойкоцитный концентрат гамма-облученный
КМИИЧЕСКАЯ ТЙАИОФУЗИОЛОГИЯ
В ОК ККЧиК обозначения ряда компонентов крови отличаются от тех
потреблялись до недавнего времени (табл. 15-3). • ho'fopMe
15*3. Новы* названия некоторых компонентов крови
I Нюнят явтяошт jptiiii де ОК ККЧиК
fltomewpBT непмиоа плммы
ІЗритромжцвнгрзт
|0иутст»уг
(Омыты* эритроциты
/Отсутствует
[Отсутствует
І Рюморожвнны* отмытые эритроциты
Название компонента по ОК ККЧиК
Плазма нативная концентрированная
Отсутствует
Аутозритроцитная масса с удаленным лейкотрош^Г'
гамма-облученная 0ем
Эритроцитная взвесь с физиологическим раствором—
и/или эритроцитная взвесь С ресуспвндируюшим ГПг[ I
ДиТПЯПИТППИИТМЯА МЯГГЯ "" ^
Аутозритроцитная масса
Аутоплазма свежезамороженная из дозы крови
Эритроцитная взвесь, размороженная и отмытая
ОК ККЧиК разработан для решения следующих задач:
• нормативного обеспечения разработки и использования отраслевого ст
дарта «Компоненты крови. Общие требования»;
• нормативного обеспечения разработки и использования отраслевого ста
дарта «Порядок маркировки компонентов крови»;
• создания единого информационного пространства с регламентированным
комплексом нормативных и методических документов в составе Единой
системы классификации и кодирования технико-экономической и социаль¬
ной информации;
• соответствия национальных требований гарантированной безопасности
гемотрансфузий международным стандартам.
Специалисты-трансфузиологи обсуждают вопрос о необходимости принятия
в нашей стране правил, определяющих название продуктов крови исходя из назва¬
ния самого компонента (например, эритроциты, плазма, тромбоциты, лейкоциты)
н только затем уточнения его вида (например, эритроциты, отмытые в физиологи¬
ческом растворе, или плазма карантинизированная свежезамороженная, или плаз¬
ма инактивированная свежезамороженная и т.д). Подобная практика принята
в ряде стран g имеет свои преимущества.
В ОК ККЧиК обозначения ряда компоненты крови отличаются от тех, которые
употреблялись до недавнего времени (до принятия отраслевого стандарта), неко¬
торые компоненты исключены, многие введены впервые. Так, ОК ККЧиК остается
открытой системой, элементы которой могут быть корректированы и дополне¬
ны. Например, в ближайшее время в ОК ККЧиК по результатам апробации будет
включен ряд проходящих клинические испытания препаратов крови. Очевидно,
что с течением времени список лекарственных препаратов трансфузиологического
пособия будет изменяться, пополняться новыми препаратами. В процессе широкого
клинического использования компонентов крови, кровезаменителей, препаратов
парентерального питания в лечебных учереждениях часть средств трансфузиологи¬
ческого пособия может потерять свою актуальность по разным причинам, что соот¬
ветственно должно привести к исключению неэффективного продукта из списка.
В настоящем разделе сведения о трансфузионно-инфузионных средствах пред¬
ставлены в виде лекарственного формуляра, который определяется как список
лекарственных средств, обязательных для применения в данном учреждении,
регионе и т.д. При составлении формуляра авторы ориентировались на много¬
профильную клинику, где есть все основные лечебные отделения: хирургические,
гинекологические, терапевтические и др. Очевидно, что в зависимости от задач
лечебного учреждения, коечного фонда и клинических отделений состав лекар
стаєнного формуляра трансфузиологического пособия может быть изменен.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 415
«^ионно-инфузионного П0С0бия многопрофиль-
и ее компоненты.
'цельная консервированная донорская кровь.
• “ кровь консервированная.
V Кровь консервированная фильтрованная.
Компоненты консервированной донорской крови.
• £ Эритроцитная масса.
Ф Эритроцитная взвесь с физиологическим раствором.
4 Эритроцитная масса, обедненная лейкоцитами и тромбоцитами
£ эритроцитная взвесь размороженная и отмытая.
а Плазма свежезамороженная.
$ Плазма антистафилококковая человеческая и плазма антисинегнойная
человеческая.
а Криопреципитат.
і Плазма нативная концентрированная.
У тромбоцитный концентрат.
Ф Лейкоцитный концентрат, гамма-облученный.
, Цельная консервированная аутокровь.
І дутокровь консервированная.
І дутокровь консервированная фильтрованная.
ф Аутокровь полостная, консервированная, фильтрованная для реинфузии.
« Компоненты аутологичной (аутогенной) консервированной крови.
I Аутозритроцитная масса.
і Аутозритроцитная масса, обедненная лейкоцитами и тромбоцитами.
І Аутозритроцитная взвесь.
І Аутозритроцитная взвесь размороженная и отмытая.
І Аутоплазма свежезамороженная из дозы крови.
І Аутоплазма свежезамороженная, полученная дискретным аферезом.
ф Аутоплазма свежезамороженная, полученная автоматическим аферезом.
І Аутоплазма свежезамороженная, фильтрованная.
2. Препараты крови.
і Альбумин человека.
I Протеин.
« Иммуноглобулин человека нормальный для внутримышечного введения,
t Иммуноглобулин человека нормальный для внутривенного введения.
• Иммуноглобулин человека антистафилококковый жидкий.
• Иммуноглобулин человека антирезус.
3. Кровезаменители.
• Кровезаменители гемодинамического действия.
I Волюлайт*.
Ф Желатин (желатиноль4).
Ф Гелоплазма баланс4.
Ф Гелофузин4.
I Модежель4.
Ь Полиглюкин4 (аналоги: реополиглюкин4, реомакродекс4. реоглюман4).
Ф Полифер4.
Ф Полиоксидин4.
^ Полиоксифумарин4.
^ Волекам4.
* Инфукол4 6%.
♦ Инфукол410%.
f ХАЕС-стерил4 6%.
* ХАЕС-стерил410%.
♦ Гемохес4 6,10%.
«а КЛИНИЧЕСКАЯ ТШНСФУЗИОЛОГИЯ
Ц Рефортан*6%.
Ш Рефортан* 10%.
❖ Стабизол*.
Ц Волювен*.
❖ Венофундин*.
Щ Тетраспан*.
• Кровезаменители дезинтоксикационного действия.
'О Глюконеодез*.
Ц Полидез*,
в Синтетические переносчики кислорода.
Ц Перфторан*.
І Реіулятори водно-солевого обмена.
Раствор натрия хлорида 0,9%.
/ ❖ Дисоль*.
Ц Трометамол (трисамин*).
Ц Трисоль*.
❖ Ацесоль*.
|| Хлосоль*.
❖ Квинтасоль*.
I Препараты для парентерального питания.
Ц Растворы аминокислот.
- Хаймикс (полиамин) *.
а Вамины.
- Аминостерил КЕ* 10%.
Аминоплазмаль Е* 10%.
‘ І Аминоплазмаль Е* 5%.
- Инфезол-40*.
- Фреамин III* 8,5%.
- Аминосолы.
- Аминоплазмаль Гепа* 10%.
і - Аминостерил Н Гепа* 5,8%.
- Аминостерил КЕ Нефро*.
1 Нефрамин*.
- Нефротект*.
- Ваминолакт*.
- Аминовен Инфант* 10%.
I - Дипептивен*.
❖ I Углеводы.
- Глюкозы* раствор для инфузий 5,10,20,40%.
- Глюкозы* 40% и аскорбиновой кислоты 1% раствор.
- Глюкозы* 40% с аскорбинатом магния 5% раствор.
- Глюкозы раствор * 10%.
- Глюкостерил* 20%.
Ф І Жировые эмульсии.
і Интралипид* 10,20%,
- Липовеноз* 10,20%.
і Липофундин МСТ/ЛСТ* 10,20%.
і Инфузолипол для инъекций* 10%.
0 Микродобавки к препаратам парентерального питания.
- АддамельН*.
1 Виталипид Н взрослый/детский*.
- СолувитН*.
і Церневит*.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 417
новой формуляра трансфузионно-инфузионного пособия многопрофильной
является список средств для инфузионно-трансфузионных процедур,
(^'>в^едетавленньій список и не считается официальным, он позволяет транс*
Пологам и Другим специалистам ориентироваться в достаточно большом
Фатиме нте как отечественных, так и зарубежных препаратов крови человека,
‘‘заменителей, препаратов для парентерального питания и др.
<Р^декарственные средства разделены на восемь групп, каждая из них состоит
^„одгрупн-
^'' Искусственные переносчики газов крови.
І! Корректоры гемостаза и фибринолиза.
г 21 Корректоры сосудисто-тромбоцитного гемостаза.
2.2. Корректоры плазменно-коагуляционного гемостаза.
Л* Препараты фибринолитического действия.
г Средства коррекции иммунитета.
31 Компоненты крови для иммунозаместительной терапии.
$.2. Препараты крови для иммунозаместительной терапии.
1 С^ъемзамещающие плазмозаменители.
4.1. Препараты плазмы человека.
4.2 Объемзамещающие искусственные коллоиды,
р дезинтоксикационные кровезаменители.
5.1. Препараты низкомолекулярного поливинилпирролидона.
52. Препараты плазмы крови человека.
6 Препараты для парентерального питания.
6.Ї; Белковые гидролизаты.
6.2. Аминокислотные растворы.
6.3. Углеводные растворы.
6.4. Жировые эмульсии.
6.5. Растворы витаминов.
64 Микроэлементы.
7. Корректоры водно-солевого и кислотно-основного равновесия.
7.1,. Солевые растворы.
7.2. Корректоры электролитного и кислотно-основного состояния.
8? Гемоконсерванты.
Очевидно, что в объеме одной книги не представляется возможным отразить
особенности всех инфузионно-трансфузионных растворов и компонентові крови.
Ниже описаны те из них, что наиболее часто используются в клинической практи¬
ке и/или должны составлять основу лекарственного формуляра трансфузионно-
инфузионного пособия многопрофильной клиники.
Не каждая клиника может позволить себе иметь в своем арсенале весь набор
Трансфузиологического пособия. Как правило, это маловероятно, да и особой
необходимости нет. Содержание трансфузиологического пособия клиники фор¬
мируется в зависимости от конкретных клинических задач, коечного фонда, аппа¬
ратного оснащения, квалификации персонала, профильных отделений, хирурги¬
ческой активности и др.
КРОВЬ, ЕЕ КОМПОНЕНТЫ И ПРЕПАРАТЫ
Под клиническим использованием компонентов донорской крови (или цельной
консервированной крови) понимают трансфузии (переливания) заготовленных
аллогенных компонентов крови реципиенту в лечебных целях. Реципиент — это
пациент, которому требуется или проведена гемотрансфузия (переливание донор-
р0$ крови или ее компонентов).
«Клиническое использование донорской крови и ее компонентов осуществля-
8 организациях здравоохранения, научных и образовательных организаци-
ГЛАВА р
HI КЛИ*«СМ«1МММ¥Э№Л0ГИЯ
В структурных подразделениях федеральных органов исполнительной Вл
іяе законодательно предусмотрена военная и/или приравненная к ней qZ?'
В муниципальных организациях здравоохранения, имеющих лицензию наї*
фосхую деятельность, включая работы/услуги по хранению донорской крови
компонентов І трансфузиологии (далее - организации здравоохранения), Tq Ие*
а лечебных целях. ’ ЬКо
В целях клинического использования донорской крови и ее компонент
в организациях здравоохранения создаются в качестве структурных подпаТ°В
||Р трансфузионные кабинеты (отделения), обеспечивающие рациональ
клиническое использование донорской крови и ее компонентов, создание йхъГ
нение запасов донорской крови и ее компонентов, ведение статистического уЛ!!
в гои числе по постгрансфузионным реакциям и осложнениям» (из закона м
<0 донорстве крови и ее компонентах»).
Планируя гемотрансфузию, необходимо в обязательном порядке в письме
НОЙ форме В истории болезни оформить информированное согласие реципиента
на процедуру. Переливание крови или ее компонентов реципиенту без его согла
сия либо без согласия его законного представителя проводят в исключительных
случаях по решению консилиума врачей [при невозможности собрать консили¬
ум - непосредственно лечащего (дежурного) врача с последующим уведомлением
должностных лиц медицинской организации], когда промедление в переливании
крови угрожает жизни реципиента.
Следует особо подчеркнуть, что реципиент имеет право на:
• сформированное добровольное согласие на переливание крови и/или ее і
компонентов;
• отказ от переливания крови и/или ее компонентов;
I полное информирование о возможных осложнениях для его здоровья в связи
с предстоящим переливанием крови и/или ее компонентов.
Цельная консервированная донорская кровь
Цельная консервированная донорская кровь (по классификатору ОК ККЧиК) -
венозная кровь, заготовленная на утвержденных консервирующих растворах
от доноров крови. Единица консервированной крови (510-515 мл), как правило,
содержит 63 мл консерванта и около 450 мл донорской крови. Плотность крови
составляет 1,056-1,064 у мужчин и 1,051-1,060 у женщин. Гематокрит консерви¬
рованной крови должен быть равен 0,36-0,44 (36-44%).
В масштабе реального времени консервированная кровь для клинического при¬
менения в течение 24 ч с момента ее забора практически недоступна. Это время
необходимо для соответствующей сертификации и маркирования, что включает
комплекс лабораторных методов исследования, направленных на обеспечение
максимальной трансфузиологической безопасности пациента от гематрансмис-
сивных инфекций и изоиммунологических осложнений.
Контейнеры с консервированной донорской кровью должны отвечать следую*
щим требованиям;
І иметь сохранность целостности и герметичности упаковки;
1 оформленную этикетку с указаниями срока годности, групповой и резус*
принадлежности;
• при отстаивании иметь четко выраженную границу разделения на плазму j I
И и клеточную массу;
• плазма должна быть прозрачной, без мути, хлопьев, нитей фибрина, вырз
женного гемолиза;
• глобулярный (клеточный) слой крови должен быть равномерным, без неро
ностей на поверхности и видимых сгустков.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ЙНФУЗИОННОГО ПОСОБИЯ 419
ь трансфузии консервированной крови определяется клиническими
при отсутствии острой массивной кровопотери трансфузия 450-
#8*коови должна быть осуществлена в пределах 4 ч.
больных один объем (450-500 мл) цельной крови увеличивает кон-
^ лйо гемоглобина примерно до 10 г/л или гематокрит примерно на 3-4%,
хранения цельной консервированной донорской крови определяются
Пирующими растворами и условиями заготовки. Кровь, заготовленная
^пользовании стерильной замкнутой системы и консерванта CPD (Citrate-
^fte-Bextrose) и помещенная в пластиковые мешки, хранится при температуре
- 60 "С в течение 21 дня, при использовании консерванта CPDA-1 (Сйпйе-
Ше-Vextrose-Adenine) - 35 дней (табл. 15-4). Нарушение замкнутого конту-
**^емы или сборка системы перед заготовкой крови и ее компонентов ограни-
срою* хранения крови до 24 ч при температуре +2-6 *С.
_«154, Основные гемоконсерванты
Гемоконсервант
Ті
Состав
Максималь-1
ный срок
хранения
крови, дни
Страна-
произво¬
дитель
Примечания
угроза+натрия
JJpar (гпюгицир*)
Цитрат натрия 2 г.
Безводная глюкоза 3 г.
Бидистиллированная вода до 100 мл
21
Россия С
к
1
{
^отношение
рови и консвр-
іанта 4:1.
»Н5,0
(5о«онсервант Л-8*
Цитрат натрия кислый 2,5 г.
Сульфацил натрия ОД г.
Трилафлавин нейтральный 0,025 г.
Бидистиллированная вода до 100 мл
21
Россия 1
)Н 4,9
Декстроза І лимонная
«ота+натрия
фосфат (цитроглюко-
фосфат4)
Лимонная кислота 1 г.
Безводная глюкоза 3 г.
Трехзамещенный фосфат натрия 0,75 г.
4% раствор NaOH.
Бидистиллированная вода до 100 мл
21
Россия
pH 5,5-5.9
ЦОЛИПК12А*
Лимонная кислота 1,5 г.
Глюкоза 6 г.
Фосфат натрия трехзамещенный 0,2 г.
4% раствор NaOH.
Вода бидистиллированная до 100 мл
21
Россия
pH 6,3
CPDA-1*
Лимонная кислота безводная 0,327 г.
Цитрат натрия безводный 2,63 г.
Бифосфат натрия водный 0,222 г.
Декстроза водная 3,19 г. ,
Аденин безводный 0,0275 г.
Вода для инъекций до 100 мл
35
Междуна¬
родный
препарат
14 мл СРОА-1
на 100 мл крови.
В CPDA-2 дек¬
строзы 4,46 г
и аденина
0,055г
CPD*"
Кислота лимонная (моногидрид) 0,327 г.
Цитрат натрия (дипчдрат) 2,63 г.
Мононатрия фосфат (дигидрат) 0,251 г.
Декстроза 2,32 г.
Вода для инъекций до 100 мл
21
Междуна¬
родный
препарат
Раствор
для получения
плазмы мето¬
дом афереза
wD* —
ferr-
Кислота лимонная (моногидрид) 0,164 г.
Цитрат натрия (дигидрат) 1,32 г.
Безводная глюкоза 2,32 г.
Бифосфат натрия водный 2,51 г.
Вода для инъекций до 100 мл
21
Междуна¬
родный
препарат
- 63 мл раство¬
ра на 450 мл
крови.
pH 5,7
4 я!,*
Натрия хлорид 0,877 г.
Аденин 0,0169 г.
Декстроза 0,816 г.
Маннитол 0,525 г.
Вода для инъекций до 100 мл
35
Междуна
родный
препара;
г
- 100 мл растворе
на 200 мл эрм-
г тромассы из 450
мп крови.
pH 5.7
лт mww ecwwwHOeyjHonoftei
В I используемого консерванта кислородно-транспортно л.
щм эритроцитов консервированной крови сохраняется в течение 5-20 сут п*
$ консервированной крови и длительных сроков Хранения ila*
и более) эта функция эритроцитов in vivo восстанавливается через 16- Ц ч »
сервированной крови к последнему дню хранения остаются жизнеепособ К°Н
70"80% эритроцитов
Вторые сутки знаменуются утратой физиологической полноценности м.
цнтов и тромбоцитов, разрушением антигемофильного глобулина, гранулощ^
неспособны к фагоцитозу через 24-48 ч. ТЬ|
Активность факторов свертывания уменьшается по мере увеличения cm
хранения, и через 6-7 ч хранения активность факторов V и VII практически 8
деиа к нулю. Б связи с этим цельная консервированная кровь должна быт. „ *
- -» * в,,в nfna,
работана на компоненты в течение 6 ч с момента забора крови.
В процессе стабилизации и хранения донорской крови накапливаются высвг
бождающиеся при разрушении клеток свободный гемоглобин и калий; мараста>
уровень аммиака и молочной кислоты; снижается pH крови; эритроциты изменяют
свою форму, частично теряют свой электрокинетический потенциал, что способ¬
ствует образованию микроагрегатов. В результате совокупных изменений до 25%
КЛСГОЧНЫХ элементов консервированной крови после переливания депонируются
и секвестрируются в микроциркуляторном русле, что делает ее использование
при острой кровопотере и анемии неэффективным.
Тзким образом, наличие продуктов распада лейкоцитов и тромбоцитов, микро-
I макроагрегатов в консервированной донорской крови в процессе хранения
и особенности ее заместительного действия делают переливание цельной крови
неэффективным, а переработку ее на компоненты крайне актуальной.
КРОВЬ КОНСЕРВИРОВАННАЯ ФИЛЬТРОВАННАЯ
Удаление лейкоцитов из цельной консервированной крови или ее компонентов-
это профилактика изосенсибилизации к лейкоцитным антигенам, гемотрансмиссив¬
ных вирусных инфекций (цитомегаловирусов), анафилактических, аллергических
реакций, обусловленных лейкореагинами. Лейкофильтры, встроенные в замкнутую
систему контейнеров, не изменяют установленных сроков хранения донорской
крови и ее компонентов. При применении лейкофильтров, не встроенных В систем)'
с контейнерами, срок хранения такой среды сокращается до 24 ч.
Гемотрансфузию рекомендуют лишь тогда, когда она жизненно необходима,
а ожидаемый лечебный эффект исключает или превалирует над возможными !
осложнениями.
Продолжительность заместительного эффекта гемотрансфузий во многом зави¬
сит от исходного состояния организма. При лихорадочных состояниях, высоком I
уровне катаболизма при ожогах, обширных хирургических вмешательствах,
сепсисе, гемолизе и нарушениях коагуляции крови она сокращается. В процессе ]
трансфузии и ближайшие 2-3 сут после нее донорская кровь обеспечивает волеми-
ческий эффект в случае, если объем перелитой крови не превышает 20-30% ОЦК
Н отсутствии микроциркуляторных сдвигов. Переливание крови в количестве,
превышающем 30-50% ОЦК, при нарушениях периферического кровообращения
приводит к ухудшению кровообращения, нарушению стабильности гемодинами¬
ки. патологическому депонированию крови.
К переливанию крови следует относиться как к трансплантации со всеми выте¬
кающими из этого последствиями: возможным отторжением клеточных и плазмен
пых элементов крови донора. У пациентов с иммуносупрессией переливание цель-
I крови чревато развитием опасной реакции «трансплантат против хозяина».
К недостаткам гемотрансфузий следует отнести в первую очередь реальную
опасность вирусного, бактериального и паразитарного инфицирования, воз-
ОСНОВНЫЕ СРЕДСТВ* ТГЯІІПВГМПІІІІП ИШПГМПИЦП) ПОСОПШІ 121
заражения сывороточным гепатитом, сифилисом, СПИДом и другими
Ф^^смнссианымм инфекциями. При длительном хранении коекервнрован-
'jaiopcM* кровь утрачивает целый рад ценных свойств и приобретает новые.
«тельные для пациента качества. Это и гииеркалиемии. и нарастание тдадо-
**^ркеиие pH. образование и увеличение количества микросгустко».
В3 тяжелых и опасных осложнений массивных переливаний донорской
считается комплекс патологических расстройств, получивших назван**
гомологичной кровна.
АЙСЛО*неНИЯ' свяэанные с трансфузией донорской крови, могут возникнуть
яос,«операционном периоде. К ним относятся отсроченные анафилактические
** иИИ легочный дистресс-синдром, почечно-печеночная недостаточность и др.
^смотря на обоснованную пропаганду компонентной гемотерапии, примене
. ильной крови имеет свои, хотя и ограниченные, показания:
*1 массивные кровопотери с выраженными явлениями гипояолемического шока
и анемической гипоксии, снижением объема ОЦК (эритроцитов и плазмы),
• массивные обменные трансфузии (гемолитическая болезнь новорожденных,
острый гемолиз, токсикоз, хроническая почечная недостаточность), осо¬
бенно в военно-полевых условиях, при катастрофах, когда нет возможности
немедленно получить достаточное количество компонентов крови.
Однако во всех перечисленных случаях при правильной организации трансфу-
^^логического пособия в стационарных условиях более целесообразно и оправ¬
дано с медицинской и экономической точек зрения применение гемокомпонентов
крови. Переливания цельной консервированной крови в условиях многопро¬
фильного стационара, в особенности больным в плановой хирургии, необходимо
рассматривать как результат неудовлетворительной работы отделения трансфу¬
зиологии и службы крови.
При определении противопоказаний к переливанию консервированной крови
необходимо исходить из того, что больной не должен погибать от невозмешен-
ной кровопотери независимо от существующей у него патологии. Другими слова¬
ми. переливание крови не должно дополнительно вредить организму нацией га
Несмотря на относительность любого противопоказания к трансфузии крови,
можно уверенно определить, что основным противопоказанием остается наличие
у больного декомпенсированной патологии основных органов и систем организма
Еще раз необходимо подчеркнуть основной постулат современной гемотерапии;
исключительно компонентная гемотерапия, позволяющая эффективно, с мини¬
мальными рисками для пациента протезировать недостающие составляйвдие
крови при конкретной патологии у определенного больного в конкретной клини
ческой ситуации.
Компоненты консервированной донорской крови
Переработка донорской крови и ее компонентов — это совокупность произ¬
водственно-технологических операций с донорской кровью и/или ее компонен¬
тами в целях получения готового продукта крови (соответствующего компонента
•ии препарата).
Методами фракционирования из цельной консервированной крови можно
мяучить плазму, эритроциты, лейкоциты, тромбоциты и стволовые клетки пери¬
ферической крови (на автоматических сепараторах крови).
ЭРИТРОЦИТНАЯ МАССА
в ОК ККЧиК выделяют шесть видов эритроцитной массы (ЭМ): эритрошгг-
аая масса фильтрованная, эритроцитная масса гамма-облученная. эритроцитная
изсса, обедненная лейкоцитами и тромбоцитами, эритроцитная масса с удаленным
м КЛИНИЧЕСКАЯ ТМНСФУЭИОЛОГИЯ
змйдоромбослоем, эритроцитная масса с удаленным лейкотромбослоем фИльт
««иная, эрнтроцитная масса с удаленным лейкотромбослоем гамма-облучсцІГ'
I также несколько видов аутоЭМ: аутоэритроцитная масса. аутоэритр0цИТ} Я’
МИСІ фильтрованная, аутоэритроцитная масса гамма-облученная и др.
ЭМ - WO ОДИН ИЗ ОСНОВНЫХ компонентов крови, ее получают ИЗ цельной Кон.
сервированной крови методом центрифугирования и последующего уДалениН‘
I лейкоцитов и тромбоцитов.
Эрнтроцитная масса состоит из эритроцитов (70-80%) и плазмы (20-зо%.
I І$ лейкоцитов и тромбоцитов. По содержанию эритроцитов одна
доев эритроцитной массы (270±20 мл) эквивалентна таковой (510 мл) крови
Гематокрит ЭМ составляет 65-80% в зависимости от первоначальных гемато¬
логических параметров донора, консервирующего раствора и метода получения
эритрошггной массы.
Для улучшения реологических СВОЙСТВ ЭМ непосредственно перед трансфузией
допускается добавление в контейнер 50-100 мл 0,9% раствора натрия хлорида.
компонентная гемотерапия анемических состояний базируется на преимуще¬
ственном применении эритроцитной массы. ЭМ в сравнении с цельной кровью
в меньшем объеме содержит то же количество эритроцитов, гемоглобина и значи¬
тельно (в 3-4 раза) меньше цитрата, тромбоцитов, лейкоцитов, продуктов распада,
антигенов белков плазмы и антител. По своим лечебным свойствам ЭМ равноцен-
№ эритроцитам консервированной крови.
Преимущества ЭМ по сравнению с цельной консервированной кровью следую¬
щие.
• Более высокая кислородтранспортная емкость в меньшем объеме продукта.
• Минимальное содержание иммуногенных факторов: белков плазмы, лейко¬
цитов, тромбоцитов.
• Низкое содержание продуктов распада клеток и белков плазмы.
• Низкое содержание вазоактивных веществ: серотонина, гистамина, натрия,
калия, аммония и др.
і Низкое содержание микроагрегатов.
• Низкое содержание факторов гемокоагуляции.
I Низкое содержание консервирующего раствора.
а Возможность приготовления отмытых эритроцитов (имеет принципиально
важное значение для больных, сенсибилизированных антигенами лейкоци¬
тов. тромбоцитов и белков плазмы).
I Возможность разведения ЭМ необходимыми трансфузионными средами
(желатинолем, модежелем, гелофузином и др.).
ЭМ хранится при температуре +4-6 °С. ЭМ из крови, заготовленной на консер¬
ванте CPD. имеет срок хранения 21 день, а на консерванте CPDA-I — 35 дней. В ЭМ
могут быть примеси тромбоцитов и лейкоцитов.
В ЭМ 8-10 дней хранения может обнаружиться незначительный гемолиз,
который не считается противопоказанием для ее клинического использования.
Установить какие-либо абсолютные лабораторные критерии для назначения
ЭМ не представляется возможным и вряд ли целесообразно. Прежде всего необ-
ходнмо учитывать клиническое состояние пациента, сопутствующую патологию,
степень и место травмы, причину анемизации, время кровотечения и многие дру-
мкфвкторы. ЭМ назначают в целях купирования анемии для усиления оксигени¬
рующей функции крови. Гемотрансфузия ЭМ должна осуществляться не только
из (чиовании показателей гематокрита, гемоглобина и количества эритроцитов,
но и с учетом клинического состояния пациента.
- Твв, известно, что больные с хронической анемией более адаптированы к низ¬
кому уровню гемоглобина. В то же время больные с артериальной гипотензией,
выраженной i ердечно-легочиой недостаточностью, инфекционными заболева
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 423
грС5уют переливания ЭМ и при более высоких значениях показателей
І крови.
•^зщонических кровопотерях или недостаточности кроветворения основа*
Щ 1(? вливания эритроцитов в большинстве случаев остается падение уровня
*** юбина крови ниже 80 г/л и гематокрита менее 25%.
^пациентов с нормальными исходными показателями гемоглобина, гемато-
^ и белков плазмы при кровопотере в пределах 10-15% ОЦК нет необходимо*
^оименеиия ЭМ. Для поддержания стабильной гемодинамики и возмещения
'^Иямкугери достаточно кровезаменителей.
‘СГкровопотере более 15-20% ОЦК. как правило, наблюдаются первые при-
J крушения кислородотранспортной функции крови, что требует адекватно*
'‘Исполнения дефицита эритроцитов, т.е. применения ЭМ.
Оделяя показания к гемотрансфузии у хирургических больных, главным
ерйеМ следует считать кровопотерю во время операции и постоперацион-
Si период. а также резервы компенсаторных возможностей организма. Однако
^ейТИроваться на средние показатели операционной кровопотери рискованно.
Трійно особенностей патологии, общего состояния пациента, тщательности пре-
-ооерационной подготовки, вида операции, кровопотеря зависит от принципов
ккетодов операционного гемостаза и квалификации хирурга. Трудно переоценить
значение тщательности и аккуратности работы хирурга в обеспечении гемостаза.
Требования к методике подготовки и проведения трансфузии эритросодержа¬
щих сред следующие.
1. Перед трансфузией контейнер с ЭМ (консервированной кровью) выдерживают
при комнатной температуре в течение 30-40 мин или во время трансфузии исполь¬
зуют специальные устройства для подогрева вводимой трансфузионной среды.
2. Врач должен лично провести следующие контрольные исследования:
i определить групповую принадлежность крови реципиента по системе АВО
и сверить результат с данными истории болезни;
• определить групповую принадлежность эритроцитов донора и сопоставить
результат с данными на этикетке контейнера;
• провести пробы на совместимость в отношении групп крови донора и реци¬
пиента по системе АВО и резус-фактору;
• провести биологическую пробу.
3. Запрещается переливать кровь или ее компоненты из одного контейнера
нескольким больным.
4. В течение 2 ч после гемотрансфузии реципиент должен соблюдать постель¬
ный режим и находиться под врачебным наблюдением.
5. На следующий день после трансфузии необходимо провести клинический
анализ крови и мочи.
6. После переливания контейнер с остатками трансфузионной среды хранят
в холодильнике в течение 2 сут.
7 Все действия врача, переливавшего кровь либо ее компоненты, так же
Оки показания к гемотрансфузии, должны быть зафиксированы в истории болеэ-
® пациента.
Дм улучшения реологических свойств ЭМ непосредственно перед трансфузией
ппзможнр добавление в контейнер 50-100 мл 0,9% раствора натрия хлорида.
^суспензируя ЭМ в специальном растворе (0,9% растворе натрия хлорида.
Декеля* и др.), можно получить эритроцитную взвесь (ЭВ). При этом ЭВ, при-
более высокую текучесть и соответственно более высокие реологические
свойства, одновременно становится менее вязкой (гематокрит - 40-50%).
^правило, соотношение ЭМ и раствора составляет 1:1.
**е рекомендуют использовать для приготовления ЭВ растворы глюкозы* и рас-
^°РЫ. содержащие ионы кальция. Использование 5% раствора глюкозы* или его
424 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
jp вызывает склеивание и гемолиз эритроцитов. Растворы, содеп*
Щу кальция, вызывают свертывание и образование сгустков. ’ р^ац1Ие
Показания к применению ЭВ те же, что и для ЭМ. На практике часто ЭМ
р 30-50 мл изотонического раствора натрия хлорида непосредСтв Раз'
перед введением в целях повышения текучести раствора для ускорения ckoS?1
введения. Трансфузию ЭВ проводят капельно или струйно.
Несомненна целесообразность применения эритроцитсодержащих сред в«
їда» с кровезаменителями. Применение раствора ЭМ в реополиглюкине4 в г°Че
ношении 1:1 или 1:0.5 надежно сохраняет ОЦК, уменьшает агрегацию и секвестр
цию форменных элементов в период операции и на следующие сутки. '
Применение ЭМ в растворе модежеля*, что представляет собой оригинальн "
компонент крови - эритроцитный трансфузат, не только восполняет кровопотегГ
и воссганавливает кислородтранспортную функцию крови, но и оказывает гемол
намическое дезафегирующее действие с достаточно выраженным волемическим
эффектом.
Срок хранения ЭВ ограничен 24-72 ч (в зависимости от консервирующего рас¬
твора) при температуре +4 °С.
Показания к переливанию ЭВ аналогичны таковым ЭМ. Трансфузии ЭМ и ЭВ
проводят капельно или струйно.
Противопоказания к применению ЭМ и ЭВ:
і гипокоагуляционные состояния;
І тромбоэмболии различного генеза;
і приобретенная негемолитическая анемия.
Чрезмерное введение ЭМ или ЭВ может привести к гемоконцентрации, сни¬
жающей сердечный выброс и тем самым ухудшающий гемодинамику в целом.
Эритроцитная масса, обедненная лейкоцитами и тромбоцитами (отмытые эри¬
троциты В ОЭ), представляет собой ЭМ, лишенную плазмы, а также лейкоцитов
и тромбоцитов путем 1-5-кратного повторного добавления 0,9% раствора натрия
хлорида и удаления надосадочной жидкости после центрифугирования.
В процессе отмывания удаляются белки плазмы, лейкоциты, тромбоциты,
микроагрегаты клеток и стромы, разрушенные при хранении клеточных компо¬
нентов.
ОЭ. как правило, готовят из ЭМ небольших (до 10 дней) сроков хранения,
в связи с чем они обладают достаточной кислородтранспортной функцией.
ЭМ отмывают в тех же пластиковых контейнерах, в которых она хранится.
Для детей, сердечно-сосудистых больных предпочтение отдают эритроцитам
малых сроков хранения - до 7 дней. ЭМ отмывают 1-5 раз стерильным физиоло¬
гическим раствором. Отмытые эритроциты сохраняют до использования во взвеси
100-150 мл 0,9% раствора натрия хлорида с гематокритом 70-80%.
При отмывании ЭМ в открытой системе срок хранения до использования
из-за риска бактериального загрязнения может быть не более 24 ч при +1-6 °С.
Кроме того, в отмытой солевым раствором ЭМ через 24 ч увеличивается уровень
свободного гемоглобина, т.е. происходит гемолиз эритроцитов, который нарастает
с течением времени, и к 3-му дню более 35-40% эритроцитов разрушаются. Срок
жизни отмытой ЭМ можно увеличить до 3-4 суток и более, если в пакет после
отмывания сразу добавить (при условии выполнения всех процедур в условиях,
обеспечивающих стерильность) 50-100 мл раствора модежеля*.
Отмытую ЭМ применяют у пациентов, сенсибилизированных предыдуши**и
гемотрансфузиями к плазменным факторам или антигенам лейкоцитов и тромоо
цитов. Отмытую ЭМ готовят в отделении трансфузиологии по заявке на пациен
из 5-10 доз крови, подобранных для больного в пробе Кумбса.
При отмывании, даже при тщательном подходе ко всем этапам процедуры. пр°
всходит удаление с отмывающим раствором части эритроцитов. Это обстоятель
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 425
яло иметь в виду и назначать больному на 10-20% больший объем отмытой
при нативной эм.
храНят при температуре +4-6 °С. ОЭ, взвешенные в 0.9% растворе натрия
^да, подлежат переливанию в течение 24 ч с момента приготовления. Ис-
*ование в качестве консерванта модежеля4 позволяет продлить срок хранения
%72ч.
Сказания к применению:
анемии различной этиологии, сопровождающиеся сенсибилизацией реци-
* пиента к антигенам белков плазмы, лейкоцитов и тромбоцитов в результате
повторных переливаний крови или беременности;
синдром гомологичной крови (как элемент комплексной терапии):
возмещение кровопотери у больных-аллергиков (бронхиальная астма и др.)
' в целях профилактики анафилактических реакций.
удаление лейкоцитов в целях профилактики сенсибилизации пациентов, полу-
щих компоненты крови, можно обеспечить использованием специальных лей-
цитарных фильтров, которые позволяют удалять более 99% лейкоцитов.
%йкоцитные фильтры применяют для подготовки ЭМ:
, больным, имеющим антилейкоцитные антитела вследствие сенсибилизации
предыдущими гемотрансфузиями;
і женщинам с многократной беременностью в анамнезе:
« в целях профилактики больным, которым планируются многократные транс¬
фузии компонентов крови.
Лейкоцитные фильтры позволяют значительно уменьшить количество пост¬
трансфузионных реакций негемолитического типа и тем самым повысить эффект
лечебных процедур.
Метод замораживания и хранения эритроцитов при низких температурах позво¬
ляя получить после размораживания и отмывания функционально полноценные
Эритроциты - эритроцитную взвесь, размороженную и отмытую. Для предотвраще¬
ния гибели или поражения клеток при замораживании к ним в определенных соот¬
ношениях добавляют специальные химические агенты (криопротекторы, например
глицерин), которые при оттаивании эритроцитов должны быть удалены. Как пра¬
вило, к замораживанию подготавливают ЭМ малых сроков хранения - не более
5-6 сут. Замораживание ЭМ в растворе глицерина выполняют в специальных
металлических сосудах при низких температурах (-65 или -200 °С). Температурный
режим и программа замораживания зависят от концентрации криопротектора.
В замороженном состоянии эритроциты могут находиться до 10 лет.
После оттаивания ЭМ отмывают специальными растворами от глицерина
и ресуспензируют в физиологическом растворе. Гематокрит готовой к употре¬
блению ЭМ должен колебаться в пределах 70-80%. Поскольку часть процедур
при приготовлении отмытых размороженных эритроцитов происходит в условиях
разгерметизации стерильных систем, срок хранения готовой продукции составля-
ет не более 24 ч при +1-6 °С.
Метод замораживания ЭМ позволяет накопить и хранить продолжительное
время эритроциты доноров с редкими группами крови и достаточно оперативно
^Доставлять их после размораживания и отмывания тем пациентам, которые
8 них нуждаются.
возможность сохранять функционально полноценные эритроциты более дли¬
нно, чем при обычных условиях, открыло возможность дробно заготавливать,
^ораживать и хранить достаточные объемы аутологичной крови, которую
^пользуют в период операции для самого больного. Существуют сведения
целесообразности применения метода замораживания, хранения ЭМ доноров.
®*еющих антитела к цитомегаловирусам (ЦМВ), для трансфузии больным.
Рым переливание компонентов крови, содержащих ЦМВ, противопоказано
ГЛАВА t$
42S КЛИНИЧЕСКАЯ ТЙШСФУЭМОЛОГИЯ
(шмуяокопрометированные больные, пациенты, готовящиеся к трансплаи
органов І тканей). НтаЧиц
Возможность замораживать и хранить достаточно большие объемы av-rw
троцнтов позволяет использовать этот метод для хранения СКОЛЬ угодно
время эритроцитов людей, чья профессия связана с риском механической 06
ческой или радиационной травмы. 'ХИМи
В размороженных отмытых эритроцитах уровень свободного гемоглой
перед трансфузией не должен превышать 2 г/л при гематокрите не менее V|Ha
сохранность должна составлять не менее 80% клеток, суточная посттрансфуз
ная приживаемость не менее 70%. °н'
Условия хранения. Размороженные отмытые эритроциты, как и другие э
троцитные среды, должны храниться до трансфузии при температуре +2-6 °с
Предельные сроки хранения размороженных отмытых эритроцитов составля
24 в после их оттаивания. т
Показания к переливанию размороженных отмытых эритроцитов аналогами
таковым ЭВ или нативных ОЭ. Однако взвесь размороженных эритроцитов обла
дает целым рядом преимуществ.
1. В процессе криоконсервирования и отмывания из взвеси эритроцитов уда-
ляются все другие клеточные элементы крови, вазоактивные вещества, калий
и антикоагулянты, входящие в состав гемоконсерванта, старые и нестойкие эри¬
троциты.
2. В процессе отмывания из взвеси эритроцитов практически полностью удаля¬
ются вирусы гепатита В и С.
3. Размороженные эритроциты практически лишены аллергизирующих свойств
так как основные иммунизирующие факторы удаляются в процессе отмывания.
Трансфузии ЭМ или ЭВ. Одной из трудностей, с которой сталкиваются
при гемотрансфузии ЭМ, остается скорость переливания. Особое значение ско¬
рость введения компонентов крови, в особенности ЭМ, приобретает в критических
ситуациях при массивной кровопотере. Основную роль в уменьшении скорости
инфузии цельной крови и ЭМ за счет увеличения вязкости играют эритроциты.
В целом стратегия гемотрансфузии консервированной крови, ЭМ и других ком¬
понентов крови аналогична таковой при внутривенных вливаниях жидкостей -
солевых или плазмозаменяющих растворов. В соответствии с известным уравне¬
нием Гагена-Пуазейля скорость трансфузии увеличивается:
• с повышением градиента давления в системе;
• при использовании катетеров большего диаметра;
і при применении коротких катетеров;
• при снижении вязкости переливаемых препаратов крови.
Увеличения скорости трансфузии ЭМ или цельной консервированной крови
можно добиться, используя достаточно простые, но эффективные приемы.
Поскольку определяющее сопротивление в трансфузии оказывают эритроциты,
увеличить текучесть можно добавлением к ЭМ 0,9% раствора натрия хлорида.
Для этой цели обычно применяют Y-образные соединительные трубки, позволяю¬
щие смешивать форменные элементы и 0,9% раствор натрия хлорида в равных
объемах. Такой простой прием позволяет увеличить скорость инфузии в 3 раза.
Разведение ЭМ следует проводить 0,9% раствором натрия хлорида. При необ¬
ходимости применения в этих целях других солевых растворов надо принять
во внимание возможность возникновения побочных эффектов. Так, раствор
Рингера* с лактатом может усилить свертывание крови, что связано с ионами
кальция.
Другим способом, позволяющим увеличить скорость гемотрансфузии, является
инфузия под давлением. Обычно для увеличения давления применяют надувные
манжеты для измерения артериального давления. Манжету накладывают вокруг
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИ0НН0-ИНФУЗИ0НН0Г0 ПОСОБИЯ 427
ф контейнера с ЭМ и нагнетают воздух до давления 200-220 мм рт.ст.
/^ процедура обычно увеличивает скорость инфузии в 2-3 раза по отноше-
^^алогичной процедуре, проводимой при атмосферном давлении. При стуг¬
ін* «кеты аналогичного результата можно добиться, сжимая пакет руками.
^ ^авных условиях наибольшую скорость инфузии компонентов крови мож-
при Р чИТЬ< используя катетер с большим внутренним диаметром. Например.
1,0 жидкости, протекающей через катетер №14, на 75% больше, чем через кате-
^16 такой же длины, а скорость протекания жидкости через короткий (5 см)
на 50% больше, чем через длинный (20 см) такого же диаметра,
‘олнительное сопротивление во время гемотрансфузии могут создать также
°ты на системах для переливания крови или дополнительно вмонтированные
^гтему для удаления лейкоцитов, тромбоцитов и микроагрегатов. Фильтры
9 СЙ м для переливания крови (вместе со всей системой) рекомендуют менять
2 переливания 3-4 стандартных упаковок крови или ЭМ, так как они доста-
о быстро забиваются и препятствуют прохождению гемотрансфузионного
10 яства, что сказывается на скорости инфузии. При необходимости быстрой
лузии компоненты крови следует пропустить через специальные антилейкоцит-
Зантитромбоцитные и антиагрегатные фильтры.
Подогревание крови также способствует ускорению гемотрансфузии. Согре¬
ве снижает вязкость охлажденной крови в 2,5 раза. Обычно подогревание
„иоводят, погружая пакет с ЭМ в воду с температурой +37 °С на 20-30 мин.
Нередко - при отсутствии контроля за температурой нагревания — такая процеду-
„априводит к перегреванию крови и гемолизу части эритроцитов. Для подогрева¬
ния компонентов крови рекомендуют использовать специальные приспособления,
позволяющие осуществлять контроль за процессом согревания. Как правило, эти
приборы имеют свернутую спиралью трубку, накрученную вокруг нагревательно¬
го элемента, температура в которой поддерживается на уровне 35-37 °С с помо¬
щью электрических нагревательных элементов. Трубки, через которые протекают
компоненты крови, одноразового использования и монтируются перед фильтром
системы для гемотрансфузии. Подогревание крови с помощью специальных
устройств позволяет увеличить скорость инфузии до 150 мл/мин.
Согревание компонентов крови снижает риск гипотермии при массивных пере¬
ливаниях охлажденных компонентов крови. При гемотрансфузии неподогретой
крови иногда можно наблюдать желудочковые аритмии (обычно не развиваются
до снижения температуры тела менее +28 °С). Минимальная рекомендуемая тем¬
пература переливаемой крови и ее компонентов равна +35 °С.
ПЛАЗМА СВЕЖЕЗАМОРОЖЕННАЯ
Среди компонентов крови по объему применения в клинической практике
плазма занимает первое место. Так, только в США ежегодно используют 1,8-2,0
млн доз плазмы.
В соответствии с ОК ККЧиК в зависимости от способа получения, сроков
вмораживания, лейкофильтрации выделяют различные виды СЗП (плазму све¬
жезамороженную из дозы крови, плазму свежезамороженную, полученную дис-
Чктным аферезом, плазму свежезамороженную, полученную автоматическим
аферезом, плазму свежезамороженную, фильтрованную) и аутоСЗП (аутоплазму
^замороженную из дозы аутокрови и др.).
Плазма - бесклеточная жидкая часть крови человека. По объему она занимает
чти половину всей массы крови. Это внутренняя жидкая среда организма, содер¬
жи композицию различных по составу и свойствам биологически активных
J||| (белковых, углеводных, липидных и других соединений), что определяет
^•Ую роль плазмы в обеспечении жизнедеятельности человека.
428 кттвЖАЯ трансфузиология
Соотношение форменных элементов и плазмы в крови человека определ
показателем гематокрита. У здорового человека гематокрит равен 45% І|§'Щ
всего объема (50% по массе) составляют форменные элементы, остальная
приходится на долю плазмы. Чзсть
Плазма крови - это 7-8% коллоидный раствор смеси белков: 90% воды 7
белка - альбумина, альфа-, бета- и гамма-глобулинов, фибриногена, атГ
га комплексов с липидами и углеводами (липо- и гликопротеидов) и 0,9% неп е
їх соединений (электролитов и микроэлементов). pH плазмы равен 7 ^
Практически всю плазму получают из консервированной крови в пределах ь
после забора крови и сразу подвергают глубокому замораживанию при темпе™ '*
ре^та *С Приготовленную таким образом плазму называют свежезамороженн "
она содержит весь комплекс стабильных и лабильных факторов гемостаза, фибп
нолиза. системы комплемента и пропердина, разномолекулярные белковые ком
плексы, обеспечивающие онкотическое давление, антитела, иммунные комплексы
В другие факторы.
При -30 °С СЗП может храниться до года. Такие условия позволяют сохранить
с минимальными потерями факторы V и VIII, а также другие неустойчивые факто¬
ры свертывающей системы крови.
Нативная плазма и СЗП содержат: жиры; углеводы; минеральные вещества; весь
комплекс стабильных и лабильных факторов гемостаза, фибринолиза, системы
комплемента и пропердина; разномолекулярные белковые комплексы, обеспечи¬
вающие онкотическое давление; антитела и вещества, модулирующие иммунитет.
Белки плазмы обладают высокой иммуногенностью, что может стать причиной
сенсибилизации больных, особенно в результате многократных трансфузий.
В период или непосредственно после трансфузии СЗП у больных, сенсибилизиро¬
ванных к белковым комплексам плазмы, могут возникнуть осложнения в виде ана¬
филактических трансфузионных реакций. Пациенты с дефицитом IgA в этом отно¬
шении должны находиться под особым наблюдением, поскольку входят в группу
повышенного риска предрасположенности к анафилактическим реакциям,
В рамках анализа лабораторных показателей в трансфузии СЗП нет необходи¬
мости при условии, что:
• протромбиновое время превышает не более чем в 1,5 раза (>18 с) средний
нормальный показатель;
• активированное парциальное тромбопластиновое время (АПТВ) превышает
не более чем в 1,5 раза верхнюю границу нормы (>50-60 с);
• выявляется менее 25% активности фактора свертывания;
• не проводились лабораторные исследования.
При назначении СЗП необходимо помнить следующие правила.
• СЗП у пациентов с тяжелым заболеванием печени при активном кровотече¬
нии, в послеоперационном периоде малоэффективна, так как не может кор¬
ригировать коагуляционные нарушения. Для достижения коагуляционного
эффекта требуются большие дозы (5 и более) СЗП.
• СЗП малоэффективна при лечении иммунодефицитных состояний.
1 Одна доза СЗП для лечения взрослого больного во многих случаях малоэф¬
фективна.
§ СЗП поддерживает коагуляционные тесты в пределах физиологической
нормы у пациентов с дефицитом факторов XI, VII, V, протеина С, протеина S,
антитромбина III (ATIII).
• При лечении тромботической тромбоцитопенической пурпуры рекомендуют
плазмообмен с замещением СЗП.
і Гиповолемия не требует трансфузий СЗП. Безопаснее, дешевле и доступнее
в этих случаях инфузии коллоидных кровезаменителей в сочетании с кри
сталлоидами и/или растворами альбумина.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 429
отсутствии активного кровотечения не следует назначать СЗП, если про-
• ЛРЙ Лиловое время не более чем на 3 с выше верхней границы нормы.
еетво патологических состояний, при которых установлена эффектив-
Кол"4 ф й сзп, весьма велико. СЗП обладает большой лечебной эффек-
ф сР8 кровотечениях и кровоточивости, вызванных дефицитом комплек-
• ^мъшаюших факторов, коагулопатиями.
j ^^Чдвиях недостаточного количества специфических концентрированных
I ^нент0в плазмы, соответствующих фармакологических препаратов трудно
fcj значение трансфузий СЗП как эффективного лечебного средства
заболеваний. Особо следует отметить следующее обстоятельство: основ-
I pP*j^j данных об эффективности СЗП была получена в тот период, когда
I И нке отсутствовали факторы гемостаза в виде лекарственных препаратов.
I fexjjj^ee время в большинстве из перечисленных случаев при наличии препа-
Щj плазмы (белковых и специфических концентратов факторов свертывания)
заменителей использование СЗП можно ограничить, а в ряде случаев пред-
лительно обойтись без трансфузий плазмы.
II gjg может храниться при температуре -30 °С в течение 12 мес при условии
сохранения герметичности упаковки.
Способ применения и дозы: СЗП используют прежде всего в целях восполнения
фаКТ0рОв коагуляции. С заместительной целью СЗП вводят струйно в больших
объемах.
Дозы СЗП зависят от клинической ситуации и течения заболевания и могут
составлять от 250-300 до 1000 мл в сутки. Введение капельное или струйное
в зависимости от показаний к применению. Для лечения большинства заболева¬
ний рекомендуют стандартную дозу СЗП — 15 мл/кг массы тела. В тех случаях,
кода трансфузии СЗП сочетаются с трансфузиями тромбоцитным концентратом,
следует принимать в расчет, что с каждыми 5-6 дозами тромбоцитного концентра-
табольной получает объем плазмы, эквивалентный 1 дозе СЗП таковы.
Дія достижения гемодинамического эффекта суммарная доза инфузируемой
QIT должна обеспечивать устойчивое повышение АД >90 мм рт.ст. (критический
уровень). В целях дегидратации у пациентов с признаками отека головного мозга,
отека легких при отсутствии альбумина показано введение концентрата нативной
I плазмы.
Требования к методике подготовки и проведения трансфузии СЗП таковы.
• Подбор пары «донор-реципиент» проводят по системе АВО. При необходи¬
мости трансфузий больших объемов СЗП рекомендуют выполнять перели¬
вание с учетом резус-фактора. Плазму группы АВ (IV) в экстренных случаях
можно переливать больному с любой группой крови.
j Непосредственно перед переливанием СЗП размораживают при температуре
+37-38 °С. Если нет специального оборудования, можно использовать водя¬
ные бани (при строгом контроле за температурой воды — перегрев не допу¬
скается!) После размораживания до начала трансфузии допускается хранение
плазмы в течение короткого времени (<1 ч) при +1-6 °С. Содержание в раз¬
мороженной плазме хлопьев фибрина не препятствует переливанию через
стандартные пластиковые системы, имеющие фильтры. Повторное замора¬
живание и использование повторно размороженной плазмы не допускается.
' Если консервированная кровь до разделения на компоненты не делейкоци-
таровалась, то рекомендуют переливать СЗП через специальные фильтры,
задерживающие лейкоциты.
замороженную СЗП вводят, как правило, внутривенно. По отдельным показа-
й' при массивных хирургических кровотечениях возможно внутриартериаль-
ведение. Плазму можно также вводить в костный мозг и подкожно.
М к переливанию СЗП неуклонно расширяются без достаточных к
“У оснований. Можно выделить две основные причины, способствующие это-
ГЛАВА »5
1 430 «лтнесмя тмнсфузиология
му. высокая стойкость и отсутствие в достаточном количестве и ассорти
(по крайней мере для отечественных клиник) специфических концентратов*1*1**
гывающнх факторов, которые могли бы заменить СЗП, и. что очень важно СВе^
сівие на сегодняшний день унифицированных рекомендаций и четких покя^'
I трансфузиям СЗП. Зании
Применение СЗП показано при следующих клинических состояниях:
• отсутствии специфического препарата для терапии изолированного деА
та факторов свертывания крови (II, V, VII, IX, X, XI и XIII) или ингибииГ*1
(антитромбина III. протеинов С и S, Cl-эстеразы);
• остром ДВС-синдроме;
• тромботической тромбоцитопенической пурпуре:
• сепсисе (включая сепсис новорожденных);
• операциях на открытом сердце в анамнезе;
• экстракорпоральном кровообращении;
• необходимости срочной нейтрализации орального антикоагулянта в случат
их передозировки (при отсутствии соответствующих антидотов или их неэГ
фективности):
• дефиците витамина К (у новорожденных);
• гемофилиях А и В, сопровождающихся кровотечениями;
• коррекции ОЦК при массивной кровопотере, наружных и внутренних кро¬
вотечениях;
• ожоговой болезни - возмещение объема плазмы;
• гнойно-септических процессах различной этиологии — возмещение плазмен¬
ного объема и как дезинтоксикационное средство;
• отеке головного мозга — в целях дегидратации.
Использовать плазму для возмещения плазменного объема, как дезинтоксика¬
ционное средство и в целях дегидратации следует только при отсутствии соответ¬
ствующих кровезаменителей.
До- и постгрансфузионная оценка состояния коагуляции у пациента на основа¬
нии комплекса клинических и лабораторных данных — важнейшая составляющая
трансфузиологической тактики при использовании СЗП.
Абсолютные противопоказания к трансфузиям СЗП:
• гнперкоагуляция;
• сенсибилизация к парентеральному введению белка.
СЗП не показана:
• в качестве средства профилактики осложнений при массивной трансфузии;
• для нейтрализации гепарина при сердечно-легочной перфузии;
• для увеличения ОЦК;
• профилактически после сердечно-легочного шунтирования;
• профилактически вместе с массивной гемотрансфузией;
• в целях парентерального питания;
• для профилактических трансфузий больным без клинических проявлений
активного кровотечения, у которых регистрируется небольшое увеличение
протромбинового времени (на 3 с выше верхней границы нормы);
• при замещении, удалении грудных дренажей и других открытых хирургиче¬
ских процедурах;
I перед биопсией печени;
• при хроническом ДВС-синдроме при отсутствии геморрагий;
• при выявлении гиперкоагуляции и повышенной сенсибилизации к паренте¬
ральному введению белка.
Необходимо помнить, что плазма является основным носителем маркеров
инфекционных заболеваний.
■r/w«ivi и iu nut-ijnunnyiu ГДДАЛЭТГО 40 I
„-4 дНТИСТАФИЛОКОККОВАЯ ЧЕЛОВЕЧЕСКАЯ И ПЛАЗМА АНТИСИНЕГНОЙНАЯ
Ир*
ымунн°й считается плазма, содержащая антитела против стафилококка в титре
gVболее или синегнойной палочки 300 ЕД ИФА и более.
ffiJlHi плазмы антистафилококковой человеческой (АСП) или плазмы
^м^інегнойной человеческой (АСГП) показаны в целях лечения или профилак-
н гнойно-септических осложнений, вызываемых соответствующим бактери-
Hbig агентом (сепсиса, раневой инфекции, ожоговой болезни, абсцедирующей
ямонии, гемобластозов и т.д.).
^Плазму вводят внутривенно капельно ежедневно или через день в зависимости
тяжести заболевания по 200-300 мл или 3-5 мл/кг массы тела (>18 ME). Курс
Ц ведений и более в соответствии с тяжестью заболевания и терапевтическим
Ліектом.
Новорожденным, в том числе недоношенным, переливание антистафилококко-
вой плазмы проводят из расчета 10 мл/кг массы тела (>60 ME).
препараты ПЛАЗМЫ
Из плазмы донорской крови можно получить ряд эффективных препаратов.
Из препаратов плазмы — корректоров системы гемостаза — широкое применение
нашли криопреципитат (протромбиновый комплекс, или PPSB), плазма нативная
концентрированная, фибриноген, тромбин.
Криопреципитат
Криопреципитат — это концентрированная смесь плазменных факторов свер¬
тывания, полученная из СЗП методом криопреципитации. В небольшом объеме
содержит фибриноген и фактор VIII в высокой концентрации. Одна доза содержит
фибриноген - 250 мг, фактор VIII — активность не менее 90 ME, фибронектин.
антитромбин III.
Показаниями к применению криопреципитата являются лечение и профилак¬
тика кровотечений у пациентов с гемофилией А и болезнью фон Виллебранда
(ангиогемофилией), кровотечения другой этиологии, при которых резко умень¬
шается концентрация фактора VIII в крови больного.
Как правило, для остановки кровотечения при дефиците соответствующих
факторов свертывающей системы крови требуется от 6 до 10 ЕД криопреципитата
на одну гемотрансфузию. Основными потребителями криопреципитата остают¬
ся больные гемофилией. С разработкой и внедрением в клиническую практику
лекарственных препаратов, полученных генно-инженерными методами, можно
прогнозировать снижение использования этого компонента крови. Следует иметь
в виду, что степень риска заражения инфекциями, передающимися через кровь
при переливании криопреципитата, такая же, как при переливании СЗП или дру¬
гих компонентов крови.
Кроме больных гемофилией, имеющих генетически обусловленный дефицит
плазменных факторов свертывания крови, показанием к применению крио¬
преципитата является не купируемое иными медикаментозными средствами
'фовотечение при уремии, экстракорпоральном кровообращении. Полагают,
■по присутствующий в криопреципитате фактор фон Виллебранда (фактор VIII)
Останавливает функциональную способность тромбоцитов. По-видимому, поло-
Отельное влияние оказывает и антитромбин III, снижение которого отмечается
“Р* Уремии и экстракорпоральном кровообращении.
Криопреципитат в высоких концентрациях содержит фибронектин. обладаю-
■ опсонизирующей активностью по отношению к инкапсулированным грам-
^ложительным бактериям (например, стафилококкам). Это, в свою очередь,
иккобетвует- их дальнейшему поглощению нейтрофилами. Отмечено, что у пацк-
432 ИЯШЧСМ» №ЛНС*УЗ»ЮЛОГИЯ
еитов а тяже лом состоянии уровень циркулирующего фибронектина чаете
егся. Бисаоднить дефицит фибринектина можно переливанием криолреиипЧй*’'
Срок годности замороженного криопреципитата - 3 мес при темп*/***
-ЗО'С. ^Тфе
Яшма катимая концентрированная
П.шма нативная концентрированная (ПНК) содержит все основные сосм
части еяежезаготовленной плазмы (кроме сниженного содержания фактора vf**
і 2,5 -4 раза меньшем объеме (80+20 мл). Концентрация общего белка i
чем в нативной плазме, и должна быть не менее 10% (100 г/л). Обладает пт»
шемяыми гемостатнческими и онкотичеткими свойствами вследствие увелнче
-шрММтя белков плазмы и факторов свертывания (кроме фактора VIII). **
ПНК предназначена для лечения бальных с выраженным дефицитом различи
прокоаіулянтиа. гипо- и афибриногенемией, как дегидратирующее и дезинтоксик
ционное средство, для лечения заболеваний, сопровождающихся белковой недоста
фшостью, развитием отечно-асцитического и геморрагического синдромов.
При кровотечениях, обусловленных врожденным или приобретенным дефц-
цитом орокоагулянтов. ПНК вводят по 5-10 мл/кг массы тела в сутки до полной
остановки кровотечения.
При белковой недостаточности с асцитическим синдромом возможно примем-
Н препарата в дозе 125 -150 мл в сутки с интервалами 2-3 дня, в среднем на курс
5-6 переливаний.
ПНК не следует применять при тяжелых нарушениях функций почек с анурией
Шсде введения препарата возможны аллергические реакции, которые купиру-
шеа введением антигистаминных средств. Срок годности ПНК составляет 3 мес
при температуре -30 °С.
Тромбоцитный концентрат
Тромбоцитный концентрат (ТК) - это суспензия жизнеспособных и гемо-
статически активных тромбоцитов в плазме, приготовленная методом серийно-
Щ дешрифугировлния консервированной крови или тромбоцитафереза крови
ИЩвко донора. ТК - высокоэффективный корректор сосудисто-тромбоцитного
гемостаза,
В ОК ККЧиК в зависимости от метода получения и количества доноров,
от которых были получены тромбоциты, пулирования (смешивания различных
доЦ облучения, условий хранения, фильтрации выделяют 24 вида компонента
крою, содержащих тромбоциты: тромбоцитный концентрат из дозы крови, тром-
боцитный концентрат из дозы крови гамма-облученный, тромбоцитный концен¬
трат аудированный монодонорский и др.
Содержание тромбоцитов в одной дозе ТК зависит от метода его получения:
• ТК, приготовленный из обогащенной тромбоцитами плазмы (ОТП), содер¬
жит в среднем 0,7x10“ тромбоцитов в 50 -60 мл плазмы и примесь эритроци¬
тов до 1 х 10’ и лейкоцитов до 0,2x10*;
• ТК. приготовленный из лейкотромбослоя (JITC), содержите среднем0,65x10м
тромбоцитов в 50 -75 мл плазмы и примесь лейкоцитов до 0,05x10’;
Я ТК. полученный тромбоцитафереэом, содержит не менее 2x10й тромбоцитов
І 200-300 ид плазмы и содержит примесь эритроцитов менее 1x10і0 и лей¬
коцитов до 0.6х 10’.
Когда необходимо получить дозу с высоким содержанием тромбоцитов,
используют метод тромбафереза на автоматических сепараторах крови. Методов
гемафереэл чп* ко получить от одного донора с соответствующим для опрел*'
денного пациента HLA-фенотипом в течение 2-3 ч 3*5х10и тромбоцитов
І 200-400 мл плазмы, т.е. в 6 -8 раз больше, чем от одного донора при обычно»
кроаодаче
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 433
аппаратного гемафереза позволяет свести к минимуму загрязнения ТК
**^тами и лейкоцитами. Желательно получать ТК с большим содержанием
от одного хорошо обследованного донора.
тКДОЛ*®11 отвечать следующим требованиям (выборочный контроль).
Не содержать макроскопических агрегатов, видимых сгустков, нитей фибрина.
* § конце разрешенного срока хранения pH должен быть не ниже 6.
до конца срока хранения содержание тромбоцитов в ТК, выделенных нз
' отдельных доз консервированной крови, должно оставаться не менее0.5* 10";
подученных аферезным методом — не менее 2x10". ЩЩЩ
дбъем плазмы в ТК должен быть в зависимости от метода его получения
* 45 60.45 -75. 200-300 мл.
, Примесь лейкоцитов не должна превышать 0,2*10" в дозе ТК, выделенного
* изОТП; 0,05*10’ - в дозе ТК. выделенного из ЛТС; 1*10", полученного мето¬
дом афереза.
, Примесь эритроцитов не должна превышать 1*10" в одной дозе ТК.
, упаковка ТК должна быть герметичной и содержать правильную маркировку.
При применении больших доз тромбоцитов допускается их аудирование, т.е.
объединение в одном объеме нескольких доз тромбоцитов от различных доноров
крови. Такие тромбоциты должны быть перелиты в пределах 6 ч с момента их при¬
готовления.
В целях предотвращения реакции «трансплантат против хозяина» тромбокон-
центрат, который готовят для пациентов со сниженным иммунитетом, подвергают
радиационному облучению в специальных установках.
Для хранения ТК можно использовать два температурных режима; +4 и +24 “С.
. Тромбоциты, хранящиеся при +4 °С, менее жизнеспособны и через 48 ч
такого температурного режима хранения функционально неполноценны.
Однако in vivo они дают немедленный гемостатический эффект. Именно
поэтому такие тромбоциты предпочтительнее при тяжелом геморрагическом
синдроме.
I Хранение тромбоцитов в специальных пластиковых контейнерах при тем¬
пературе +22-24 °С при постоянном перемешивании способствует сохране¬
нию их жизнеспособности, поддержанию стабильного pH на уровне 7 и обе¬
спечению клеток кислородом. При таком режиме хранения в течение 5 дней
отсутствует бактериальный рост. Тромбоциты, хранящиеся при комнатной
температуре, теряют способность к агрегации и гемостатическую функцию,
что восстанавливается при введении их в сосудистое русло. Следует учиты¬
вать, что хранящиеся в таком режиме тромбоциты не оказывают клиниче¬
ского гемостатического эффекта во время первых часов после их перелива¬
ния, поэтому при тяжелом геморрагическом синдроме, как сказано выше,
предпочтительнее использовать тромбоциты, хранящиеся при +4 °С.
• Возможно хранение тромбоцитов в замороженном состоянии при температу¬
ре -80 °С. В течение 6 ч размороженные тромбоциты должны быть перелиты.
Начальное посттрансфузионное восстановление размороженных тромбо¬
цитов у реципиента такое же, как при переливании свежих тромбоцитов.
Тем не менее хранение тромбоцитов в замороженном состоянии не нашло
широкого распространения из-за большой потери клеток и грубого нару¬
шения функциональных свойств (клинически полноценными сохраняются
около 30% клеток).
Несмотря на многолетний опыт применения, до сих пор окончательно не уста-
пелены точные показания к переливанию тромбоцитов. Не существует единого
Ч*®ииеского порога или количества тромбоцитов для назначения трансфузии.
‘Учебное действие трансфузий ТК зависит не только от общего состояния боль-
наличия осложнений, но и от функциональной полноценности и дозы пере-
434 КЛИНИЧЕСКАЯ ТРАНСФУЗШГЮГИЯ
ютммыж тромбоцитов, а также иммунологической совместимости Крови л
и реципиента. fl0lloPa
Основные показания к назначению ТК такие.
• Недостаточное образование тромбоцитов в костном мозге - амегакао
тарная тромбоцитопения (лейкозы, гематосаркомы и другие онкологиче01№
процессы с поражением костного мозга, апластическая анемия, депп СКИе
костномозгового кроветворения в результате лучевой и/или Цито(татш,Ия
ской терапии, острая лучевая болезнь, трансплантация костного мозга)
1 Повышенное потребление тромбоцитов (ДВС-синдром в фазе гипокоагу
ции. при оперативных вмешательствах с использованием аппарата ис
ственного кровообращения, где наблюдается не только снижение количеств
тромбоцитов менее критического уровня, НО и изменение их функционал 3
ной активности). '
• Геморрагический синдром, обусловленный недостаточным количество
тромбоцитов или нарушением их функциональной способности.
Заболевания, при которых показаны трансфузии ТК:
• геморрагический диатез, возникающий в связи с глубокой тромбоцитопени-
ей (<20-30х109/л), как элемент комплексной терапии;
і ДВС-синдром (III стадия);
• депрессия костномозгового кроветворения в связи с лучевой или цитостати-
ческой терапией.
При легкой тромбоцитопении (60-100х109/л) больные, как правило, не нужда¬
ются в трансфузиях тромбоцитов. Это бывает при небольших операциях или трав¬
ме, за исключением хирургических вмешательств с высоким риском большого
кровотечения (>500 мл крови), например сердечно-сосудистых операций с искус¬
ственным кровообращением, нейрохирургических операций и др.
При умеренной тромбоцитопении (<20-60х109/л) оперативные вмешательства
рекомендуют проводить с применением профилактических трансфузий тромбо¬
цитов. Больные, получившие массивные трансфузии крови или эритроцитной
массы (7-10 доз и более за несколько часов), могут страдать умеренной степенью
тромбоцитопении.
Больные с выраженной формой тромбоцитопении (<20х109/л; в основном
пациенты с онкологической патологией) перед операцией нуждаются в спе¬
циальной медикаментозной предоперационной гематологической коррекции
гемостаза и трансфузиологической подготовке, включающей профилактическую
и обычно (по мере необходимости) постоперационную трансфузию больших доз
(>8-10) ТК.
Кровопотеря в постоперационный период более 5 мл/кг массы тела в час,
или более 100 мл/ч, должна рассматриваться как результат неадекватного хирур¬
гического гемостаза и только во вторую очередь — как следствие тромбоцитопе¬
нии и/или тромбоцитопатии.
В настоящее время общепринятым является представление о том, что коли¬
чество тромбоцитов 100х109/л или время кровотечения, не превышающее менее
чем в 2 раза нормальные величины, позволяет проводить большинство хирурги¬
ческих операций (абдоминальных, торакальных, ортопедических, гинекологиче¬
ских и др.) без риска возникновения геморрагий, связанных с тромбоцитопенией.
Полагают, что у больных с гипоплазией кроветворения, не имеющих дополни¬
тельных осложнений, при содержании тромбоцитов в периферической крови
5—10х109/л более интенсивный тромбоцитопоэз обеспечивает суточную потреб¬
ность в тромбоцитах, составляющую в среднем 4,7х109 клеток в день, что вполне
может предупредить развитие спонтанной кровоточивости.
Лабораторные данные помогают оценить функцию свертывающей системы
крови. На практике, до получения лабораторных данных, удобнее ориентиро-
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 435
йц,ея на клинически значимые признаки нарушений гемоття™ „„
^рня'. И1ем°стаза. включающие три И
® повторное кровотечение из раны после его остановки-
4 усиление кровотечения без повышения ИЩЙШ,
ния или изменений в области операционной раны: венозного давле- Я
, пониженную степень свертывания крови, скапливаю.,.**™ <
Тромбоциты теряются ИЗ кровотока посредством лииу ^ В области Раны-
, 17%, ИЛИ 7.ІХІ09 из 41,2±4,9х109 (т.е. <3% UHDKvnu М0В:
вых людей теряются ежедневно и удаляются изптХЮЩеГ0 Пула)> у ЗД°Р°'
для поддержания функции эндотелия); циркуляции (используются
I оставшиеся 83% удаляются механизмом старения
Стандартная терапевтическая доза ТК содержит 4 0-5 ШШ
i Однако для каждого^ конкретного больной
НМ может быть подобрано индивидуально.
Основанием для расчета лечебной дозы переливаемых тромбоцитов счита
куг необходимость получения определенного посттрзнсфузионного их прироста,
достаточного для купирования геморрагического синдрома. Полагают что уве*
явление количества тромбоцитов на 50-70х109/л (50 000-70 000/мкл)’сопрово¬
ждается длительным гемостазом, так как после переливания 1 дозы ТК (в среднем
О е_о,7ж109/л тромбоцитов) прирост через 1 ч после трансфузии составляет,
по разным данным, от 6 до 10х109/л (6000-10 000/мкл) клеток. Одна доза ТК
обычно увеличивает количество тромбоцитов у взрослого больного массой 70 кг
на Лечебный эффект при переливании тромбоцитов наступает не всегда и требует
особого внимания. Трансфузии ТК могут и не сопровождаться увеличением коли¬
чества циркулирующих тромбоцитов и/или нередко отсутствует их гемостатиче¬
ский эффект.
Как правило, снижение количества тромбоцитов до 20хЮ9/л клеток при отсут¬
ствии угрозы возникновения геморрагических осложнений не является показа¬
нием для трансфузии тромбоцитов. В том случае, когда в отношении больных
не предполагается оперативных вмешательств, сам по себе низкий уровень
тромбоцитов не является показанием к назначению переливаний ТК. Уровень
тромбоцитов 85-50х109/л считают достаточным и не требуется переливания ТК
даже при полостных операциях при нормальной функциональной способности
0еток. Исключением остаются операции на головном мозге, где опасность крово¬
течения очень высока. В этом случае количество тромбоцитов должно превышать
ІООхЮ’/л.
На фоне глубокой тромбоцитопении абсолютным показанием к трансфузии ТК
остаются геморрагии (снижение количества тромбоцитов до 20х109/л) на коже
нижних конечностей, спонтанная кровоточивость слизистых рта и носа. В этих
случаях переливание тромбоцитов показано не только при оперативных вмеша¬
тельствах, но и при катетеризации магистральных сосудов, люмбальной пункции,
лапароскопии и пункционной биопсии органов, экстракции зубов, вскрытии флег¬
мон и абсцессов.
Показанием к экстренному переливанию ТК служит появление геморрагий
на верхней половине туловища, на коже лица, кровоизлияний в конъюнктиву
11 на глазном дне, локальных кровотечений (в желудочно-кишечном тракте, матке,
®чках, мочевом пузыре).
I период острых кровотечений, кроме снижения количества тромбоцитов,
показанием для трансфузии ТК может служить время кровотечения, которое
удваиваться по отношению к исходному.
ТК неэффективен при идиопатической аутоиммунной тромбоцитопенической
пурпуре и диссеминированной внутрисосудистой коагулопатии, малоэффективен
"пациентов с септицемией и гиперспленизмом.
■ КЛММЧЕСМЯТтНСФУЗИОПОГМЯ
Рад вопроса, связанных с клиническим применением тромбоцитной и
осдекя до конца не выясненным. Так. нет убедительных доказательств ^
что переливание тромбоцитов уменьшает кровопотерю у кардиохирург Тог°'
больных
При острой массивной кровопотере опасность представляет снижение к0л
стад тромбоцитов менее 50*107л. что бывает крайне редко. В подобных елуГ*
» первую очередь необходимо остановить кровотечение, т.е. обеспечить хитГ
Н гемостаз, восстановить адекватный уровень показателей, отражало
состояние красной крови (гемоглобина, эритроцитов, гемотокрита) и лишь
при необходимости проводить трансфузию ТК. Переливания ТК желательно птю
водить после операции при тщательном лабораторном контроле.
Противопоказание: профилактические трансфузии ТК при отсутствии после¬
операционной кровоточивости.
Не рекомендуют переливать тромбоцитную массу:
• при иммунных (тромбоцитолитических) тромбоцитопениях и тромботиче¬
ской тромбоцитопенической пурпуре (за исключением кровотечения, утро,
жающего жизни);
• профилактических, после искусственного кровообращения;
• профилактических, параллельно с массивной гемотрансфузией.
Трансфузию ТК необходимо осуществлять с учетом групповой совместимости
донора и реципиента, как минимум, по системам АВО и резус.
При необходимости частых гемотрансфузий ТК сенсибилизированным к анти¬
генам лейкоцитов и тромбоцитов больным необходимо выполнять подбор доно¬
ров и реципиента по антигенам системы HLA и тромбоцитным антигенам.
ТК переливают внутривенно капельно через одноразовую систему с капроно¬
вым фильтром. Успех заместительной терапии зависит от количества перелитых
тромбоцитов и их функциональной полноценности. Стандартной лечебной дозой
считают 4 5x10і1 донорских тромбоцитов, однако для каждого конкретного боль¬
ного необходимое количество тромбоцитов может быть подобрано индивидуаль¬
но, Рекомендуют несколько простых, доступных в повседневной работе методов
расчета. Количество переливаемых тромбоцитов должно составлять 0,7—1,0x10і1
тромбоцитов на каждый литр циркулирующей крови реципиента, или 0,5-0,7x10“
тромбоцитов на каждые 10 кг массы тела, или 2,0-2,5x10“ тромбоцитов на 1 м2
площади поверхности тела реципиента.
При спленомегалии, инфекционных осложнениях с гипертермией и сепси¬
сом, ДВС-синдроме. массивных кровотечениях из желудочно-кишечного тракта
потребность больного в количестве донорских тромбоцитов возрастает на 40-80%
расчетной дозы.
В зависимости от характера заболевания и тяжести тромбоцитзависимого
геморрагического синдрома концентраты тромбоцитов вводят ежедневно или 2-3
раза в неделю.
Общепринята практика переливания одной дозы ТК на 10 кг массы тела боль¬
ного или четырех доз ТК на 1 м2 площади поверхности его тела. Естественно,
что дозу корригируют индивидуально с учетом многих факторов. В частности,
при наличии у больного осложняющих факторов (инфекции, сепсиса, спленомега¬
лии и др.) или аллоиммунизации объем трансфузий увеличивают даже до двух доз
ТК на 10 кг массы тела.
Основными критериями оценки лечебной эффективности трансфузий тромбо¬
цитов являются клинические признаки прекращения или уменьшения кровоточи¬
вости. увеличение количества циркулирующих тромбоцитов, адекватный скоррек*
тированный прирост тромбоцитов через 1 и 18-24 ч после трансфузии ТК.
В каждом конкретном случае в целях остановки кровотечения или для профи*
штики дозу ТК определяют индивидуально для каждого больного на основании
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 437
клинических и лабораторных показателей, прежде всего коагулограм-
Ф явовыми признаками эффективности переливаемых тромбоцитов явля-
,1*6°Р* ч^ние количества тромбоцитов у реципиента через час после трансфу-
60л07л) и их повышенное содержание через 24 ч, коррекция длитель-
вотечения у больного через 1 и 24 ч после трансфузии.
^’С неудовлетворительных лабораторных показателях необходимо пом-
дазке п"система гемостаза обладает огромными резервными возможностями
girrh обеспечить адекватный гемостаз во многих ситуациях.
*^*°мальньім режимом трансфузий тромбоцитов считается такой, при кото-
О,ГГ0«лвносгь кровотечения нормализуется, что обычно соответствует КОН-
^ тромбоцитов в периферической крови реципиента 40x10s/л и выше,
^мтво тромбоцитов у пациента с тромбоцитопенической кровоточивостью
I К°ЛИЧ й час после трансфузии ТК должно быть увеличено до 50-бОх10*/л.
*1Г вливание ТК может сопровождаться трансфузионными реакциями неге-
итмческого типа — повышением температуры тела, ознобом, аллергическими
і ^ ^ми крайне редко при АВО-несовместимосги (из-за плазмы) трансфузия
І Сет осложниться гемолизом.
Реакции и осложнения тромбоцитотерапии:
, трансфузионные фебрильные реакции;
, гемолитические реакции и осложнения;
, циркуляторная перегрузка (особенно у детей);
, токсемия (при бактериальном загрязнении ТК);
I гематогенные инфекции (ВИЧ, гепатиты В и С, сифилис, ЦМВ и др.);
« «трансплантат против хозяина» (у иммунокомпрометированных больных);
. сенсибилизация к антигенам эритроцитов;
i сенсибилизация к HLA-антигенам;
. сенсибилизация к антигенам тромбоцитов;
, сенсибилизация к антигенам белков крови;
• гранулоцитопения и угнетение костномозгового кроветворения (при много¬
кратных, объемных трансфузиях ТК у онкологических больных).
Редко встречающееся осложнение при переливании ТК — «трансплантат против
хозяина» - представляет серьезную опасность для больных с иммунодефицитами,
после трансплантации костного мозга или других органов и тканей, для новорож¬
денных. Иммунологический конфликт можно предупредить посредством гамма-
облучения ТК в дозе 15 Гр (1500-2000 рад) перед гемотрансфузией. Облучение
позволяет уничтожить иммуноактивные клетки, не разрушая и не нарушая функ¬
циональной потенции тромбоцитов.
К сожалению, посттрансфузионные фебрильные реакции наблюдаются часто.
Озноб, кожные высыпания, повышение температуры — характерные признаки
рвкции негемолитического типа на трансфузию ТК. Такие реакции связаны
в основном с реакцией «антиген-антитело» и вовлекаемой в продолжение этого
процесса активацией каскада плазменно-клеточных факторов (высвобождением
эндогенных пирогенов из лейкоцитов, повышением цитокинов в ТК в процессе
•'ранения и др.). Полагают, что механизм запускается в основном антителами про-
1118 НЦ-антигенов или специфическими антилейкоцитными, антитромбоцитны-
‘«аитгелами.
Наиболее эффективным способом избежать HLA-сенсибилизации является
^®*нение ТК, отфильтрованного через специальные устройства (фильтры),
^кивающие более 95-99% лейкоцитов.
_аьные с высоким уровнем антитромбоцитных и антилейкоцитных HLA-
^©йстентны к переливаниям ТК, и достичь желаемого результата у кате-
больных переливанием тромбоцитов не удается. Для таких больных
43S КЛИНИЧЕСКАЯ ГРАНСФУЗИОПОГИЯ
необходимо подбирать тромбоциты от доноров, совместимых по HLA
и/или тромбоцитным антигенам. СИст?Че
Количество тромбоцитов у больных необходимо подсчитывать трижды-
средственно перед переливанием, через 1 и 18-24 ч после трансфузии. По И*П°‘
информационную содержательность исследований можно, выполнив паралВЬ1СИть
иммунологические тесты на HLA и тромбоцитные антитела. Аллоиммун Є)ІЬй0
не всегда ведет к рефрактерности, а пациенты с антитромбоцитными
могут давать адекватный посттрансфузионный прирост тромбоцитов с соот!Ми
ствуюшим гемостатическим эффектом. Так, обнаружение в сыворотке крови&Г*
ных анти-ША-антител не всегда вызывает рефрактерность к трансфузиям ТК
Необходимо отдельно оговорить и возможность более высокого риска б
риального загрязнения ТК. так как он, в отличие от других компонентов kdo*
хранится при комнатной температуре или в специальном инкубаторе при +22°с’
Лейкоцмтный концентрат гамма-облученный
Лейкоцитный концентрат гамма-облученный (ЛК) — трансфузионная сое
с большим содержанием лейкоцитов (10-20х109).
Лейкоциты - это ядросодержащие клетки, склонные к адгезии и необратимой
агрегации. Гибель лейкоцитов в процессе хранения происходит в течение несколь¬
ких дней. Это и определяет тот факт, что для трансфузий применяют ЛК либо
свежезаготовленный, либо со сроком хранения не более суток.
Доза, полученная от одного донора, содержит более 1х1010 гранулоцитов, доста¬
точно большое количество лимфоцитов, тромбоцитов и эритроцитов, взвешенных
В 200-300 мл плазмы.
Увеличить выход лейкоцитов можно, вводя донору до забора крови растворы
гидроксикрахмала и глюкокортикоиды.
Одну терапевтическую дозу ЛК, которая будет содержать в среднем 12 млрд
лейкоцитов, можно получить из 5 л крови одного здорового донора на специаль¬
ных сепараторах клеток.
ЛК хранят (пока донорская кровь проходит лабораторную сертификацию)
при температуре +20-24 °С и переливают не позже 24 ч с момента заготовки.
При обычных условиях хранения консервированной цельной крови гранулоциты
утрачивают фагоцитарную активность через 48 ч.
Как примеси в состав ЛК могут входить эритроциты, тромбоциты и плазма.
Лейкоцитный концентрат подвергают гамма-облученнию для инактивации
лимфоцитов, обладающих высокой иммунологической активностью, профилак¬
тики грозного осложнения «трансплантат против хозяина», в особенности у имму-
нокомпромитированных больных, а также возбудителей гемотрансмиссивных
инфекций.
Основные показания к назначению ЛК следующие.
І Длительная и тяжелая нейтропения (<0,5х109/л).
• Инфекционная бактериальная лихорадка в течение 24-48 ч при неэффектив¬
ной терапии антибиотиками.
К Диагностированный или предполагаемый сепсис, нечувствительный к анти¬
биотикам либо другим способам терапии.
• Гематологические заболевания с гипоплазией костного мозга.
I Серьезная дисфункция гранулоцитов.
1 Грамотрицательная бактериемия.
• Инфекция, локализованная в жизненно важных областях и паренхиматоз
ных органах.
I Грибковые инфекции.
Трансфузии ЛК рекомендуют при:
• иммунодефицитных состояниях при гнойно-септических осложнениях
хирургии:
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 439
-«офилактике иммунодефицита при цитостатической болезни;
* коррекции дефицита лейкоцитов при миелотоксической депрессии крове-
* творения.
терапевтическая ценность JIK как профилактического средства весьма сомни-
Ккаждым годом во всем мире отмечается выраженная тенденция к снижению
§|ы применения ЛК. Это связано с двумя обстоятельствами.
первых, адекватное лечение различных инфекционных заболеваний анти-
' ^ктериальными препаратами оказалось более эффективным, чем перелива¬
ние гранулоцитов. У больных с аплазией или гипоплазией костного мозга
(если восстановление функции костного мозга сомнительно) трансфузии
гранулоцитов практически не влияют на клиническую картину заболевания.
Не получено убедительных, однозначных данных о том, что трансфузии ЛК
существенно влияют на септический процесс в организме больного. Сферу
применения ЛК резко ограничивают и современные препараты иммуногло¬
булинов направленного действия против определенных инфекций внутри¬
мышечного и внутривенного применения.
, Во-вторых, риск передачи цитомегаловируса от донора реципиенту при
переливании ЛК очень велик. При рутинной работе в условиях, когда необ¬
ходимо обеспечить большие и частые трансфузии этого компонента, риск
заражения гемотрансмиссивными инфекциями возрастает многократно.
Серьезные сомнения вызывают и трансфузии ЛК пациентам с высокими
титрами цитотоксичных антилимфоцитарных антител. Даже для отделений
трансфузиологии с хорошо оснащенной лабораторной техникой и большой
картотекой типированных по HLA-антигенам доноров обеспечить необхо¬
димыми объемами ЛК-сенсибилизированных к лейкоцитным антигенам
больных представляет непростую задачу.
В связи с тем что убедительных доказательств эффективности трансфузий ЛК
I показаний к его применению до сих пор нет, принято считать, что при исполь¬
зовании этого компонента крови для получения клинического эффекта необходи¬
мо переливать не менее 2-4 доз ЛК в течение 4-5 дней ежедневно. Ежедневные
трансфузии необходимы из-за короткого периода жизни донорских лейкоцитов
в кровяном русле (6-8 ч).
Все большее количество врачей справедливо считают, что лечение инфекцион-
яо-септических осложнений более целесообразно и эффективно проводить анти¬
бактериальными препаратами комплексного действия и специфическими имму¬
ноглобулинами. В любом случае лечение больных с различными инфекциями
следует начинать с антибактериальных препаратов и только в случае отсутствия
лечебного эффекта можно обсуждать вопрос о трансфузиях ЛК.
Довольно часто во время или сразу после трансфузии ЛК наблюдаются реакции
S міде озноба с последующим повышением температуры. Они купируются назна¬
чением дифенгидрамина (димедрола*), хлоропирамина (супрастина*), метамизо-
натрия (анальгина*).
Необходимо помнить об опасности развития у иммунокомпрометированных
вольных реакции «трансплантат против хозяина».
Основные показатели эффективности трансфузий ЛК:
' снижение гипертермии;
* уменьшение частоты возникновения инфекций;
' купирование или положительная динамика инфекционных осложнений:
* изменение количества лейкоцитов в периферической крови после трансфу¬
зии;
1 Уличение уровня комплемента в сыворотке;
повышение гемотоксической активности;
П1ММ19
Щ «:ЪМ»ЧЕСКАЯ ТМНСФУЗИОЛОГИЯ
• купирование лнхорадхи:
• стерильность крови при бактериальных посевах;
І положительная динамика гнойно-септических осложнений.
Гюный показатель эффективности трансфузии ЛК — изменение
характеризующих клиническое состояние больного. 3Ha4%jj
Осложнения при трансфузии ЛК;
• трансфузионные фебрильные реакции;
• гематогенные инфекции (ЦМВ. ВИЧ, гепатиты В и С, сифилис и дп v
I реакция «трансплантат против хозяина» (у иммунокомпрометипов
больных); Ванных
• сенсибилизация к антигенам эритроцитов;
• сенсибилизация к HLA-антигенам;
• сенсибилизация к антигенам тромбоцитов;
і сенсибилизация к антигенам белков крови;
• гранулоцитопения и угнетение костномозгового кроветворения (при м
кратных объемных трансфузиях у онкологических больных); Ног°'
• непрогнозируемое воздействие на иммунную систему;
• TRALI-синдром (Transfusion Related Acute Lung Injury) — острая легочн
недостаточность, связанная с трансфузиями. ая
ЛК рекомендуют вводить в первые 6 ч с момента заготовки. Как исключени
допускается хранение ЛК при температуре от +4 до +24 °С.
Необходим подбор совместимых пар «донор-реципиент», основанный на ти-
пировании крови по системам АВО, резус, HLA. У лиц, получавших многократные
гемотрансфузии, исследуют индивидуальную совместимость в реакции лейкоаг-
глютинации и/или лимфоцитотоксического теста (при переливании гранулоци-
тов, лимфоцитов, тромбоцитов). При многократных гемотрансфузиях лейкоцит-
ной массы необходим подбор донора и реципиента по системе гранулоцитарных
антигенов.
Трансфузии Л К проводят ежедневно или через день внутривенно капельно сразу
после заготовки. Скорость трансфузии - 30-40 капель в минуту. Для переливания
ЛК используют стандартные одноразовые системы с капроновым фильтром.
Терапевтическая доза составляет 1-4х1010 клеток. Для проявления эффекта
терапевтическую дозу ЛК переливают ежедневно не менее 3-4 дней подряд.
Решение о трансфузиях ЛК рекомендуют согласовывать с врачом-трансфузио-
логом.
Вопросы терапевтического эффекта ЛК во многом все еще остаются нерешен¬
ными и вызывают споры. В целом трансфузии ЛК, в отличие от других компонен¬
тов крови, не нашли широкого применения в клинической практике.
ПЛАНИРОВАНИЕ ОБЪЕМОВ ДОНОРСКОЙ КРОВИ И ЕЕ КОМПОНЕНТОВ
НА ХИРУРГИЧЕСКИЕ ОПЕРАЦИИ
На хирургические операции с планируемой кровопотерей донорскую кровь
и ее компоненты заготавливают заранее, на основании предполагаемых объемов
крови, которая может быть востребована у больного с определенным диагнозом
(табл. 15-5. 15-6). Как правило, необходимые объемы крови или ее компонен¬
тов определяются в каждой клинике эмпирически на основе многолетнего опьгга
и во многом зависят от мастерства хирурга, анестезиологического пособия, fffla-
тельности гемостаза, адекватности гемостатической терапии и др. В отделении
трансфузиологии РНЦХ им. академика Б.В. Петровского РАМН каждому больно
му, которому планируется гемокомпонентная терапия, проводят индивидуальный
подбор эритроцитсодержащих сред в непрямом АГТ (см. раздел «Трансфузионн
иммунология»).
Такой подход позволяет минимизировать риск гемотрансфузионных рва
ций. связанных с минорными антигенами или предшествующими антитела
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 441
ддимо помнить, что при индивидуальном подборе следует заранее плани*
количество доноров крови, которое, как правило, должно быть несколько
|На 20-25%). чем необходимо крови или ее компонентов на определенный
“пера«ии> поскольку часть заготовленной крови может не подойти по имму-
^логическим параметрам для определенного больного.
.15-5. Средняя потребность в обеспечении ЭСС плановых операций по MB0S
Оперативное вмешательство
''^аневризмы брюшной аорты
^JlbHoe зндопротезирование тазобедренного сустава
ишктомия
I на голове и шее
Гистерэктомия
идясничная ламинэктомия
1 ТиреОИДЭКТОМИЯ
упПйЦИСТЭКТОМИЯ
ЭСС перекрестным определением соаме-
стимости по MBOS, дозы
4.5
2.9
2.2
2.0
1.3
1.4
0,7
0,7
ТяблИІ 15-6. Средняя потребность в обеспечении кровью плановых операций для ГУ РНЦХ
і академика Б.В. Петровского РАМН
Компоненты крови с перекрестным определением совместимости в пробе ]
Кумбса
Операция
ЭМ, л
СЗП, л
ТК, дозы
криопреципи¬
тат, дозы
КНП,
дозы
другие ком¬
поненты, л
Аортокоронарное шунти-
рование
1,0
1,0
4
—
—
—
Протезирование аорты
3,5
3,0
10
5
' —
1,0 (отмытых
эритроцитов)
Операция Крауфорда
Операция Бенталла де
Боно
3,5
3,0
10
5
5
1,0 (отмытых
эритроцитов)
Трансплантация печени
5,0-6,0
8,0-9,0
По показаниям
По показа¬
ниям
По пока¬
заниям
По показа¬
ниям
Резекция печени
1,5-2,0
1,0-2,0
По показаниям
—
—
По показа¬
ниям
Бифуркационное аорто¬
бедренное шунтирование
0,5-1,0
0,5
—
—
—
—
Пластика аорты
0,25
0,3
—
—
—
Эхинококкэктомия
0,5-3,0
1,0-2,0
—
—
—
—
Операции на желчных
путах
2,0
2,0
—
—
—
—
Операции на легких
0,5-2,0
1,0-2,0
—
—
—
—
Гастрэктомия
0,25-0,5
0,3-0,6
—
—
—
—
Нмстика пищевода
0,5-0,75
1,0
—
—
-
I. -
Примечание. КНП — концентрат нативной плазмы.
МЕТОДЫ ПЕРЕЛИВАНИЯ КРОВИ И ЕЕ КОМПОНЕНТОВ
Непрямое переливание крови (НПК) или ее компонентов — это внутрисосуди-
ЙЙ трансфузии (донорской или собственной) или ее компонентов из пластико-
1ого мешка (флакона).
° зависимости от пути введения различают виды НПК:
* внутривенное;
* виутриартериальное;
442 кгммчесхаяшнсфузіюлогия
І внугриаортальное;
і внутрикостное.
Переливание крови или ее компонентов в периферическую вену:
а для переливания крови в вену используют два способа: венепункцию
секцию; и в*не-
• чаще всего ДЛЯ пункции используют одну ИЗ поверхностных вен пп
сгиба. локтевого
Переливание крови или ее компонентов в подключичную или яремную
эти доступы в сосудистую систему используют при длительном либо многоВеНу:
Щ введении трансфузионных сред, а также при невозможности по каким-^Т
причинам провести трансфузию в периферические вены.
Венесекцию применяют при недоступности для пунктирования не только П
ферических, но и центральных вен. Места для венесекции І те же вены локтевРИ
сгиба, предплечья, плеча, внутренней лодыжки или тыла стопы. Операцию й?йР
дят под местным обезболиванием.
Переливание крови или ее компонентов в артерию и аорту:
І в настоящее время практически не используют;
• метод внутриартериального переливания крови применяют исключительно
при операциях с высоким риском кровопотери. Для внутриартериальной
инфузии используют, как правило, сосуды, наиболее близкие к сердцу;
• данная методика позволяет максимально ускорить поступление достаточного
количества трансфузионной среды в сосудистое русло, чего нельзя достичь
используя внутривенный путь введения.
Показания к внутриартериальным трансфузиям:
• терминальные состояния при шоках любой этиологии;
• невозможность доступа к венам.
Следует помнить, что внутриартериальное переливание может стать причиной
серьезных осложнений, связанных с поражением и тромбированием артериаль¬
ных стволов.
Для внутриартериальных инфузий применяют специальные системы с вмон¬
тированным прибором для измерения давления. Перед началом трансфузии кровь
или ее ЭСС необходимо подогреть до температуры тела. Нагнетание крови в арте¬
рию проводят под давлением 200-250 мм рт.ст. со скоростью 100-150 мл/мин.
Внутриартериальную инфузию рекомендуют завершить после достижения
стабильного повышения систолического АД до 80-90 мм рт.ст. В дальнейшем
трансфузионно-инфузионную терапию выполняют внутривенным доступом.
Переливание крови в костный мозг:
• метод применяют обычно в педиатрической практике. Полагают, что мето¬
дика оправдана тесной анатомической связью между воронкообразными
синусами костного мозга и регионарными внекостными сосудами;
• для внутрикостного переливания крови часто используют грудину, а также
эпифизы длинных трубчатых костей, пяточные кости, крылья подвздошных
костей;
• внутрикостно можно переливать кровезаменители и другие препараты.
Прямое переливание крови (ППК) - метод переливания крови (только крови,
а не ее компонентов, препаратов, кровезаменителей) непосредственно от донора
реципиенту. При ППК не требуется стабилизации крови консервантом, кровь
из вены донора забирают в специальное устройство и сразу вводят в сосудистое
русло больного.
Главное достоинство ППК в том, что переливаемая кровь сохраняет все свои
полезные свойства в максимальной степени.
В условиях стабильной и полноценной работы отделений трансфузиологи
и Службы крови в этом методе нет необходимости. Более того, ППК свойстве
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 443
остатков, которые нередко сводят на нет ожидаемый эффект. К ним отно-
^ „исутсгвие При ППК донора;
* ожное аппаратное обеспечение метода;
' яефипит времени (ППК требует максимально быстрого переливания крови
' из вены донора в сосуд реципиента из-за возможности тромбообразования);
ысокий риск эмболических осложнений;
' ®сокий риск заражения пациента гематогенными инфекциями (СПИДом,
' отитами, сифилисом и др.);
невозможность обеспечить нужный объем крови (количество доноров онре-
I -еденной группы крови) при массивных кровотечениях.
Метод необходимо рассматривать исключительно как вынужденное лечебное
приятие и использовать лишь в экстремальных ситуациях: при внезапном
явном кровотечении, отсутствии необходимого объема компонентов крови,
овую очередь большого количества эритроцитов.
8 Обменное переливание^ крови (ОБПК) - метод, при котором одновременно
с переливанием донорской крови проводят эксфузию собственной крови реципи-
РйТЗ. о
Ари ОБПК объем переливаемой донорской крови должен быть либо адекват-
щли либо превышающим объем эксфузируемой крови.
ОБПК выполняют через две вены (обычно на локтевом сгибе) больного: через
одну вену кровь реципиента эксфузируют, а через другую одновременно вливают
донорскую кровь со скоростью 50-100 мл/мин. Количество кровопусканий и темп
эксфузии устанавливают индивидуально для каждого конкретного больного
в зависимости от его исходного состояния и уровня АД во время операции.
Процедуру ОБПК нельзя рассматривать только как простое замещение «пло-
юй» крови некоторым объемом «хорошей». При ОБПК сочетаются, как мини¬
мум, два эффекта — заместительный и дезинтоксикационный. ОБПК уменьшает
степень интоксикации, способствует нормализации гемостаза, улучшению микро¬
циркуляции, повышению иммунологического статуса реципиента.
Показания к ОБПК:
і прогрессирующие септические процессы;
* септический шок;
* тяжелые экзогенные отравления различными ядами;
I гипербилирубинемия при гемолитической болезни у новорожденных.
При ОБПК из кровотока удаляются крупномолекулярные соединения, такие
как гемоглобин и миоглобин. Для достижения дезинтоксикационного эффекта,
как правило, достаточно переливания 2-3 л донорской крови, т.е. замещения
до уз ОЦК. В ряде случаев вместо обменного переливания в последние годы
используют адекватные методы селективного гемафереза.
ГЕМОКОМПОНЕНТНАЯ ТЕРАПИЯ В ОЧАГАХ РАСПРОСТРАНЕНИЯ
НАСЛЕДСТВЕННЫХ АНОМАЛИЙ КРОВИ
При гемокомпонентной терапии с применением компонентов крови от доно-
Р°в і носителей наследственных аномалий необходимо рассматривать две воз¬
можные ситуации;
* переливание компонента крови от доноров с наследственной аномалией
крови реципиенту без таковой;
* трансфузии компонента крови от донора с наследственной аномалией крови
Реципиенту — носителю того же аномального гена.
некоторых случаях трансфузии от доноров с наследственными аномалиями
и ЩЩ быть не только бесполезными и неэффективными, т.е. не оказывать
444 клиническая тишсдазиология
никакого терапевтического действия, но и небезопасными для реципиенто
почему необходимы разработка четких показаний к использованию тех или* ^
компонентов крови у пациентов с наследственными аномалиями крови и ВьИНьа
ние целесообразности гемокомпонентной терапии. Не¬
применение эритроцитной массы от доноров - носителей
наследственных аномалий крови
Основные трудности при гемокомпонентной терапии с использованием ком
нентов крови от доноров с наследственными аномалиями крови могут возникн!!,"
при трансфузиях эритроцитсодержащих сред, что обусловлено особенностями r?Tk
розиготной р-талассемии и дефицита глюкозо-6-фосфатдегидрогеназы (Г-6-фД)
ПРИМЕНЕНИЕ ЭРИТРОЦИТНОЙ МАССЫ ОТ ДОНОРОВ С ГЕТЕРОЗИГОТНОЙ
р-ТШССЕМИЕЙ
При применении эритроцитсодержащих сред от доноров С гетерозиготной
р-талассемией посттрансфузионные реакции или осложнения не отмечаются
Кровь таких доноров обладает кислородтранспортной способностью, сравнимой
с нормальной кровью, и может быть использована без риска посттрансфузионных
осложнений при соблюдении положений, определяющих в конечном итоге целе¬
сообразность и эффективность ее применения.
При трансфузии одной-двух доз эритроцитсодержащих сред от доноров с гетеро¬
зиготной р-талассемией, характеризующихся повышенным сродством к кислороду
и соответственно сниженной кислородтранспортной функцией переливаемых эри¬
троцитов, пациентам без наследственной аномалии крови происходит разведение
донорских клеток в объеме эритроцитов с нормальной кислородтранспортной
функцией. Эритроциты с утраченной кислородтранспортной функцией при попа¬
дании в кровеносное русло реципиента с физиологическим значением pH в течение
12-24 ч восстанавливают содержание 2,3-дифосфоглицерата и свою кислородтран-
слортную функцию. В связи с этим подобные гемотрансфузии эффективны для вос¬
становления объема циркулирующих эритроцитов при умеренной кровопотере
и хронической анемии, но для коррекции гипоксии вследствие острой кровопотери
и шока менее эффективны по сравнению с нормальной донорской ЭМ.
Трансфузии эритроцитсодержащих сред от доноров с гетерозиготной
шталассемией реципиенту с fi-талассемией. Поскольку собственные эритроциты
пациента уже имеют сниженную кислородтранспортную функцию, добавление
к ним неполноценных в этом отношении эритроцитов донора не только не устра¬
няет гипоксию, но, по-видимому, может ее усугубить.
Во всех случаях вопрос о целесообразности и правомочности таких трансфузий
должен решаться на основании степени гипоксии у пациента, количества пере¬
ливаемых доз эритроцитной массы, а также запаса эритроцитсодержащих сред,
заготовленных от доноров без наследственной аномалии крови.
ТРАНСФУЗИИ ЭРИТРОЦИТНОЙ МАССЫ ОТ ДОНОРОВ С ДЕФИЦИТОМ ГЛЮКОЗО-6-
ФОСФАТДЕГИДРОГЕНАЗЫ
При применении ЭМ от доноров с дефицитом Г-6-ФД могут отмечаться реакции I
и осложнения, которые ошибочно относят к отсроченным постгрансфузионным I
реакциям: падение гемоглобина, увеличение свободного гемоглобина плазмы, появ¬
ление желтушности склер и видимых слизистых оболочек, гематурия. Как правил ■ I
такие посттрансфузионные осложнения в большинстве случаев (до 80%) наблюла
ются у реципиентов І носителей этой наследственной аномалии.
Согласно опубликованным данным, в 75% случаев посттрансфузионные pea I
ции и осложнения отмечались, когда реципиентам переливала ЭМ от доноре i
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО П0С06ИЯ 445
„остью Г-6-ФД менее 25% и при фенотипе донора Эр Лейк*. Осложнения
й ПРИ трансФУзиях эм от доноров с уровнем Г-6-ФД более 25% в цель-
^пови, по-видимому, вследствие отягощающего фенотипа Эр Лейк*,
^«илизе посттрансфузионных гемолитических реакций после переливания
or доноров с дефицитом Г-6-ФД реципиентам как с нормальным уровнем
Р так и с дефицитом Г-6-ФД было установлено, что они обусловлены двумя
'„чинами-
Г немом реципиентами определенных лекарственных препаратов, противо-
I „оказанных при дефиците Г-6-ФД. В этих случаях при определении активно¬
сти фермента в клетках крови донора выявлено полное отсутствие фермента
как в эритроцитах, так и в лейкоцитах (фенотип Эр Лейк );
присоединением инфекции. Активность фермента в эритроцитах доно-
' „з отсутствует, в то время как в лейкоцитах величина Г-6-ФД составля¬
ет 75-100% нормального значения (фенотип Эр Лейк*). «Фагоцитарный
взрыв» (высвобождение большого количества перекиси водорода в процессе
фагоцитоза) провоцирует гемолиз Г-6-ФД-дефицитных эритроцитов, чув¬
ствительных к перекисному окислению.
Признаки острых гемолитических реакций, обусловленных переливанием несо-
естимой крови, дефицитом Г-6-ФД и переливанием донорской крови с дефици¬
том Г-6-ФД. представлены в табл. 15-7.
Провоцирующие факторы:
І лекарственные препараты (см. приложение);
» пищевые продукты (конские бобы, бобовые, черника, голубика и т.д.);
3 инфекции (острые респираторные вирусные, вирусный гепатит, инфекцион¬
ный мононуклеоз, сепсис, бактериальная пневмония);
• диабетический кетоацидоз;
I уремия.
Как известно, клиническая картина острого гемолитического криза при среди¬
земноморском варианте Г-6-ФД В\ распространенном в Азербайджане, характе¬
ризуется тяжелым состоянием больного, сильной головной болью, лихорадкой,
увеличением печени и селезенки, иктеричностью склер и кожных покровов.
Типичный симптом острого внутрисосудистого гемолиза — появление мочи чер¬
ного цвета. При средиземноморском варианте активность Г-6-ФД эритроцитов
может составлять менее 1% нормальной величины.
Наблюдаемые случаи гемолитических кризов у реципиентов после перели¬
вания эритроцитной массы от доноров с наследственным дефицитом Г-6-ФД
характеризуются более легким течением, чем классический гемолитический криз,
обусловленный дефицитом Г-6-ФД и спровоцированный приемом лекарственных
препаратов. Так, состояние больного средней степени тяжести, печень и селезенка
не увеличены, иктеричность склер и кожных покровов выражена слабо, увеличе¬
ние показателя билирубина крови не достигает величин, свойственных классиче¬
скому гемолитическому кризу.
Таким образом, донорская кровь от лиц с наследственным дефицитом Г-6-ФД
представляет определенный риск для реципиента в связи с возможным наступле¬
нием острого гемолитического криза под влиянием провоцирующих факторов.
Однако с учетом непродолжительности жизни Г-6-ФД-дефицитных эритроцитов
(80-100 дней) этот риск может быть сведен до минимума. Реципиент, получивший
Чювь или ее компоненты от донора — носителя гена дефицита Г-6-ФД, должен
соблюдать определенные правила до прекращения циркуляции в крови донорских
■«•ФД-дефицитных эритроцитов: исключить прием лекарственных препаратов,
Р°*оцирующих их деструкцию, предохраняться от инфекции, воздерживаться
^приема бобовых культур. При таком режиме малое количество перелитой эри-
Дитной массы в общем объеме циркулирующей крови при достаточном уровне
Теблмца 15-7. Клинические и лабораторные признаки ряда острых гемолитических реакций
Признаки
.
Острый гемолитический криз при дефиците
Г-б-ФД
Остра* гемолитическая реакция яосяе переяиеа-1
иия донорских эритроцитов с дефкцятом Г *-ФД І
и обусловленная приемом пеырстаеииых яра- 1
паратое
Острее тамояятячасвае рвавши, i
обусловленная переливанием aeca- |
«мести май крааа
я
1
I время появления
2-3 сут после действия провоцирующего
фактора, при фавизме — при первом кон¬
такте до нескольких часов
2-3 сут после действия провоцирующего фак- 1
тора !
Непосредственно to время транс 1
фузии 1
!
Б
1
Повышение температуры
++
і
~
Озноб
+
1
і
Кратковременное возбуждение
-
- ■ ' !
+.* 1
Покраснение лица
-
і Щ
++
Иктеричностъ кожи и слизистых
++
Лимонно-желтый цвет
.4
Общая слабость
+
4
44
Артериальная гипотензия
++
-
44
Тахикардия
+
- ;
4
Одышка
+
4
Боли в пояснице
-
-
44
Боль в месте трансфузии
-
-
4
Головная боль
++
+
44
Боль за грудиной
4
Боли в конечностях
+
•
Тошнота
+
і
4
Рвота
++ С примесью желчи
. Диспептические явления
-г (при фавизме)
і
7
\ Светобоязнь
11
/
4 /
\ Шок
+»
- /
++' /
\ Увеличение печени
Иногда
і /
7
\ Увеличение селезенки
Иногда(безболезненное)
і
/
\ Гамюроагичвский синдром
' ... Ші . : К . 1
_ ... - /
~ /
А
Оюи'шмие лаем». ЛЬ-7
/ Признаки
Острый гемолитический криз при дефиците
Г-б-ФД
Острая г*«опят»чес«»я рсвяця» oocnc nw»»v\ іШ§2ятвмопгачмжая«Миш». \
ння донорских арнтроцитов с дефтипом Г-В-Ф R \ 0^0япеИММ пврввявв^м ввсс \
и обусловленная приемом лекарственных пре- \ 1 \
паратое \ \
І Активность Г-6-ФД цельной крови
Снижена
Норма \
Норма \
І Свободный гемоглобин в плазме
++
(нередко до 2-3 г/л)
4
* I
1 Непрямой билирубин"
++
4
1 Количество лейкоцитов
Увеличено со сдвигом влево
Норма
Норма
1 Количество тромбоцитов
Норма
Норма
Тромбоцитопения
Количество ретикулоцитов
Увеличено ++
4
Норма
Тельца Гейнца
++
-
-
Анемия — количество эритроцитов
Снижено*
Снижено*
Снижено’
Гемоглобин
Падение на 20-30 г/л и более
Не более 30 г/л
Падение на 20-30 г/л и более
Железо сыворотки
Повышено
Повышено
Повышено
Галтоглобин крови
Понижен
Понижен
Понижен
Прямая реакция Кумбса
_
нм
+
Темная моча
++
4
4
Гемоглобинурия
++
4
4
Гемосидеринурия
(через 2 сут от начала криза)
+
Встречаемость
Чаще у мужчин
Не зависит от пола реципиента
Не зависит от пола реципиента
Наследственный характер
+*
и
Сроки прекращения гемолиза*
3-4-й день после отмены лекарственного
препарата
Через 1-2 дня после отмены лекарственного
препарата
1—2-й день после трансфузии, но ино¬
гда на 5-8-й день •
• Зависит от степени выраженности дефицита Г-б-ФД, дозы принятого лекарства и количества перелитой крови.
'* Уровень билирубина может быть нормальным при компенсированном гемолизе, интенсивном диурезе.
t
Щ
SI V0VUJ
I КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
фермента в донорских эритроцитах (>25%) делает подобные трансфу3ии п
чески безопасными для реципиента. Ра,%
Применение свежезамороженной плазмы, заготовленной
от доноров - носителей наследственных аномалий крови
Трансфузии СЗП от доноров с гетерозиготной р-талассемией и наследсгвеин
дефицитом Г-6-ФД считаются эффективными и безопасными для реципи^®*
не вызывают каких-либо осложнений у реципиентов как с наследственными^8,
мадиями крови, так и без них. Показаний и противопоказаний к трансфузиям п°
от доноров с наследственными аномалиями крови, отличных от общепринятых нет
Применение лейкоцитного концентрата от доноров -
носителей наследственных аномалий крови
Как правило, несмотря на широкий спектр показаний, к трансфузиям ЛК при¬
бегают достаточно редко. При инфекционных осложнениях большинство КЛИНИЦИ¬
СТОВ предпочитают применение антибактериальных препаратов широкого спектра
действия. Из отрицательных сторон трансфузий ЛК следует отметить сложность
получения больших доз гранулоцитов и аллоиммунизацию реципиентов. В то же
время, поскольку ЛК входит в отраслевой классификатор (91500.18.0001-2001
«Консервированная кровь человека и ее компоненты», приказы М3 РФ pg
от 29.02.2000 г., №302 от 31.07.2000 г., №301 от 31.07.2000 г.) и его приготовление
и применение предусмотрены рекомендациями Совета Европы, логично рассмотреть
возможность применения ЛК от доноров с наследственными аномалиями крови.
ПРИМЕНЕНИЕ ЛЕЙКОЦИТНОГО КОНЦЕНТРАТА, ЗАГОТОВЛЕННОГО ОТ ДОНОРОВ
С ДЕФИЦИТОМ ГЛЮК030-6-Ф0СФАТДЕГИДР0ГЕНАЗЫ
Приготовление ЛК считается нецелесообразным при лейкоцитном дефиците,
т.е. Лейк", так как Г-6-ФД-дефицитные лейкоциты характеризуются снижением
функциональных свойств, что влечет ослабление отдельных звеньев иммунной
системы: уменьшение всех этапов фагоцитарной активности, суммарной поглоти¬
тельной способности нейтрофилов, снижение спонтанной миграционной актив¬
ности, бласттрансформирующей способности лимфоцитов и т.д. Такие нарушения
позволили отнести лейкоцитный дефицит Г-6-ФД к первичному иммунодефициту,
связанному с дефектом неспецифического иммунитета, а именно с дефектом уни¬
чтожения бактерий. Отсюда можно сделать вывод, что у доноров с уменьшением
активности Г-6-ФД рассматривается возможность приготовления и трансфузии
ЛК только при нормальном уровне лейкоцитного фермента, т.е. при Лейк’.
В то же время в регионах эндемичного распространения наследственного
дефицита фермента Г-6-ФД при ретроспективном анализе были выявлены слу¬
чаи, когда у донора крови наблюдали снижение активности энзима, в том числе
и лейкоцитарного, т.е. лейкоцитный концентрат, приготовленный из крови такого
донора, не оказывал никакого лечебного действия. Кроме того, в этих случаях
возможно и отягощение состояния реципиента при наличии у него каталазопози-
тивной инфекции. Многие исследователи отмечают сходство нарушений функции
лейкоцитов при хронической гранулематозной болезни (ХГБ) и при дефиците
гранулоцитарной Г-6-ФД. Хотя при этих двух состояниях молекулярная осно
различна, функциональный метаболический эффект один и тот же - уменьш
ние оборота ГМФП (гексозомонофосфатный путь) и отсутствие «окислительно
взрыва», следствием чего становится нарушение бактерицидной функции. В нор
мальных фагоцитах метаболиты кислорода, в том числе и перекись
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 449
вэются в фагосоме, содержащей патогенные микроорганизмы. Такого
на*3" „а перекиси водорода достаточно, чтобы блокировать действие катала*
фермента, разрушающего пероксид (вырабатывается многими микроорга-
зь1 ми)- ^Ри дефиците лейкоцитной Г-6-ФД, как уже отмечалось, происходит
<„ие образования перекиси водорода. Подобно лейкоцитам при ХГБ Г-6-
^яефицитные лейкоциты неспособны убивать каталазопозитивные микро-
низмы. Такие бактерии фагоцитируются нормально, но не погибают, а даже
If®ножаются внутри нейтрофила. Фагоциты при этом выполняют роль своео-
§МЙЬ| капсул, защищающих бактерии от воздействия специфических факторов
ыунного ответа, в частности от антител и антибактериальных препаратов.
§|i инфекциях, вызванных каталазонегативными микроорганизмами (стрел¬
ком), У ЛИД І выраженным дефицитом Г-6-ФД в лейкоцитах отмечается
Учительное снижение фагоцитарного показателя и фагоцитарного индекса (т.е.
Ужение поглотительной способности нейтрофилов) независимо от количествен*
cHQro уровня фермента. В этом случае не наблюдают нарушения переваривающей
іособности клетки: индекс завершенности фагоцитоза не отличается от нормаль-
ного значения.
Показания к трансфузии JIK реципиентам без наследственной аномалии не
отличаются от общепринятых.
При трансфузиях у реципиентов с наследственной аномалией необходимо
принимать во внимание активность Г-6-ФД: эритроцитный дефицит (или дефи¬
цит цельной крови) у реципиента считается относительным противопоказанием
к переливанию ЛК, так как существует опасность гемолиза Г-6-ФД-дефицитных
эритроцитов вследствие высвобождения большого количества перекиси водорода
в процессе фагоцитоза при присоединении инфекции. Активность эритроцитного
энзима у реципиента более 25% снижает риск подобных осложнений.
Таким образом, при заготовке и применении ЛК от доноров с наследственным
дефицитом Г-6-ФД необходимо учитывать:
• уровень Г-6-ФД в лейкоцитах донора;
• активность эритроцитного фермента реципиента;
I наличие у реципиента каталазопозитивной или каталазонегативной инфек¬
ции. Этот фактор имеет значение только в случае, когда трансфузии ЛК осу¬
ществляют от доноров с дефицитом Г-6-ФД без определения уровня лейко¬
цитного фермента. Как отмечалось выше, при каталозопозитивной инфекции
у реципиента переливание Г-6-ФД-дефицитного лейкоконцентрата может
способствовать если не генерализации процесса, то более длительному тече¬
нию инфекции. При невозможности определения по тем или иным причинам
уровня лейкоцитного фермента у донора следует воздерживаться от приго¬
товления и применения J1K.
Клинический пример
При ретроспективном анализе трансфузий было установлен случай, когда
пациенту с каталазопозитивной инфекцией (Brucella) был перелит ЛК от донора
СВыраженным дефицитом лейкоцитного фермента Г-6-ФД.
Больной Г-ев В., 15 лет, находился в стационаре с диагнозом «бруцеллез, острая
Ш (длительность заболевания предположительно меньше месяца)*. Отмечались
•Чае недомогание, потеря аппетита, боли в суставах, пояснице, мышцах, увеличе-
2?,РЗДа лимфатических желез, печени и селезенки. На фоне высокой температуры
L С) выявлена лейкопения — количество лейкоцитов составляло 4,7х109/л, СОЭ —
дЫ/ч. Несмотря на проводимую терапию (тетрациклин внутрь 4-5 раз в день
Іг). состояние пациента было без положительной динамики. Вакцинотерапию
вводили из-за повышенной реакции организма на ее введение.
н ЧИТЫвая малую эффективность проводимой антибиотикотерапии и лейкопе-
’ ^Ществлены трансфузии JIK от трех доноров. Несмотря на это, состояние
4gf И|СКАЯ ТРАНСвУЭИОЛОГЙЙ
вмилгга оставалось тяжелым. Кроме того, стали выявляться признаки ген-
«цим инфекции (бактериемия). ’^и-
« «морских карт показал, что два донора из трех имели дефицит щ.
мойого фермента. Активность Г-б-ФД в эритроцитах у первого донора 7?°'
в лейкоцитах I 0-5%. фенотип Эр Лейк . У второго соответственно 20 и (К
фенотип Эр Лейк . Трансфузии Л К. приготовленного из Г-6-ФД-дефицит>)Ьц °0*.
1ЯР*М> способствовали генерализации процесса, поскольку Brucella относи
I итадаэопозитивным микроорганизмам. . Тсч
При полноценности лейкоцитов переливание ЛК оказывает положитель»
>ффгкт который выражается снижением гипертермии, положительной дина
Мій течения инфекционных или гнойно-септических осложнений, повышенГ
количества лейкоцитов в периферической крови.
ПРИМЕНЕНИЕ ЛЕЙКОЦИТНОГО КОНЦЕНТРАТА, ЗАГОТОВЛЕННОГО ОТ ДОНОРОВ
С ГЕТЕРОЗИГОТНОЙ Д-ТАЛАССЕМИЕЙ
По данным литературы, лейкоциты при гетерозиготной р-талассемии характе¬
ризуются изменением морфофункциональных свойств в виде снижения фагоци-
тарной активности, уменьшения поглотительной и переваривающей способности
изменения свойств Т-лимфоцитов и т.д. При минимальной и малой форме анома¬
лии эти нарушения выражены незначительно, но приготовление ЛК, по-видимому
нецелесообразно. В связи с этим можно сделать вывод, что трансфузии ЛК, заго¬
товленного от доноров с гетерозиготной р-талассемией, неэффективны.
Более того, не оказывая терапевтического действия, такие трансфузии могут спо¬
собствовать аллоиммунизации реципиентов. В связи с этим возникает необходимость
быстрого определения функциональной полноценности лейкоцитов донора, а следо¬
вательно. и целесообразности приготовления ЛК на стадии забора крови у донора.
ПРИМЕНЕНИЕ ТЕСТА ВОССТАНОВЛЕНИЯ НИТР0СИНЕГ0 ТЕТРАЗОЛИЯ
ДЛЯ ОПРЕДЕЛЕНИЯ ЦЕЛЕСООБРАЗНОСТИ ПРИГОТОВЛЕНИЯ ЛЕЙКОЦИТНОГО
КОНЦЕНТРАТА ОТ ДОНОРОВ С НАСЛЕДСТВЕННЫМИ АНОМАЛИЯМИ КРОВИ
В 1967 г. R.L. Baehner, D.J. Nathan и в 1968 г. N.H. Park и соавт. предложили тест
восстановления нитросинего тетразолия (НСТ-тест), позволяющий выявить спо¬
собность нейтрофилов к «метаболическому взрыву», состояние поглотительной
функции лейкоцитов, бактерицидную активность их ферментных систем. У здо¬
ровых людей лишь небольшая часть нейтрофилов (4-14%) способна спонтанно
восстанавливать соли тетразолия. В целом НСТ-тест отражает степень кислород-
зависнмого метаболизма, прежде всего функцию ГМФП (гексозомонофосфатного
пути) І связанного с ним образования свободных радикалов.
У носителей аномальных генов р-талассемии отмечается достоверное повыше¬
ние значений НСТ-теста. При малой и минимальной форме показатель спонтанно¬
го теста достоверно выше по сравнению с контрольной группой. При проведении
«Ямулированиого НСТ-теста при малой форме аномалии меньшее количество
нейтрофилов периферической крови отвечает на стимуляцию по сравнению 1
как с контрольной группой, так и с минимальной формой р-талассемии.
Восстановление НСТ связано с кислородными ионами, накапливающимися
ЩК стимуляции окислительно-восстановительных процессов в клетке. Высокая
аюиавостъ таких процессов у больных при отсутствии инфекции показывает,
ЧТО а крови носителей генов р-талассемии есть большое количество нейтрофилов,
томятся I стадии «метаболического взрыва». Такие клетки неспособны при-
ЯН* участие в реакции фагоцитоза, так как, вероятно, уже израсходовали свои
энергетические I ферментные ресурсы. Вышесказанное согласуется с данными
литературы о результатах реакции фагоцитоза с микроорганизмами, полученны¬
ми V лиц с р-талассемией. Сниженные уровни фагоцитарного показателя, фагоци
00екса, индекса завершенности фагоцитоза и суммарной поглотительной
иейтрофилов свидетельствуют о том, что они имеют низкую поглоти-
переваривающую активность, это может быть следствием перегрузки
различными продуктами, которые необходимо постоянно удалять
Множественные гемотрансфузии, постоянный гемолиз, частые
«^даонные осложнения приводят к накоплению в плазме и тканях иммунных
Фагоцитоз и элиминация продуктов гемолиза, иммунных комплек-
'^ZiTKOB разрушенных клеток осуществляются нейтрофнлами.
;°йяозм0*ность повышения значения НСТ-теста в присутствии микробного
«ывлятора до уровня, регистрируемого у здоровых лиц, указывает на ограни*
потенциальные возможности нейтрофилов в выполнении своей функции
Жителей гена 0-талассемии.
) '«96-98% случаев дефицита фермента Г-6-ФД отмечается совпадение показате-
j спонтанно-стимулированного НСТ-теста с соответствующим уровнем актив¬
ні г-6-ФД в лейкоцитах при его количественном определении: с повышением
Юности фермента увеличивается и способность клеток восстанавливать НСТ:
Спонтанном варианте коэффициент корреляции составляет 0,9789, при стиму-
Іванном- 0.9381.
ш фенотипах Эр Лейк и Эр'Лейк' значения как спонтанного, так и стимули*
оованного НСТ-теста достоверно ниже, чем в контрольной группе и при фенотипе
Сдейк*. Как и следовало ожидать, фактором, определяющим способность лей¬
коцитов восстанавливать НСТ, является уровень активности в них гексозомоно-
фосфатного шунта, а следовательно, активность лейкоцитной, а не эритроцитной
Г-6-ФД-
Сравнение результатов НСТ-теста с уровнем лейкоцитного фермента и данны¬
ми, полученными в качественной пробе Бернштейна, позволило сделать вывод,
что по величине НСТ-теста можно ориентировочно определять уровень актив¬
ности Г-6-ФД в клетках лейкоцитного ряда. Нулевые значения, полученные
в регионах, эндемичных по гену недостаточной активности Г-6-ФД. могут быть
использованы как дополнительный скринирующий тест для выявления выражен¬
ного лейкоцитного дефицита фермента.
Получение популяции лейкоцитов — сложная процедура, требующая опреде¬
ленных навыков и оборудования, в то время как применение НСТ-теста позволяет
без выделения клеточных популяций судить об уровне лейкоцитного фермента
Г-6-ФД донорской крови.
Таким образом, НСТ-тест предлагают как скринирующий метод определения
функциональной полноценности лейкоцитов периферической крови доноров
«целях выяснения целесообразности приготовления компонента крови - лейко-
иитного концентрата.
Преимущества метода:
* НСТ-тест можно применять непосредственно при заборе крови как скрини¬
рующий метод:
* требуется минимальное количество крови, необходимое для проведения
реакции:
' требуется минимальное количество времени — 30 мин:
* не требуется выделения клеточных популяций для определения активности
Г-6-ФД в лейкоцитах;
' не применяются микроорганизмы для постановки реакции фагоцитоза
* целях определения функциональных свойств клеток;
* отличается простотой выполнения и высокой корреляцией между величиной
показателя и функциональными свойствами лейкоцитов, а также со степе-
ныо активности фермента Г-6-ФД.
^*им образом, гемотрансфузионная терапия с применением компонентов
заготовленных от доноров с гетерозиготной 0-талассемией и наследствен-
452 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
ным дефицитом Г-б-ФД имеет своя особенности в зависимости от того, К(Й№
ЮД ГГ трансфузии - реципиентам с аналогичной наследственной аномалией Пр0-
илм без нее. Показания к применению компонентов крови от здоровых До^°«и
У реципиентов с наследственными аномалиями крови соответствуют общ ^
мятым (рис. 15-1). ^
ПРИМЕНЕНИЕ КОМПОНЕНТОВ КРОВИ ОТ ДОНОРОВ
С НАСЛЕДСТВЕННЫМ АНОМАЛИЯМКРОВ^^^^^^^^І
Г-б-ФД
Реципиент
безнаследственной
аномалии
По показаниям Ч
Соблюдение режима
По показаниям ч—
По показаниям
Реципиент
с дефицитом
фермента Г-б-ФД /
По показаниям ^
Соблюдение режима
По показаниям
По показаниям
при активности
свыше 25%
Противопоказания:
Эритроцитный
дефицит < 25%
Фенотип реципиента
Эр-Лейк+.
1 **]
Реципиент
без наследствен
аномалии
По показаниям
«ой
—► По показаниям
Не переливается
Реципиент
t с гетерозиготной
V р-талассемией
^ По показаниям
* По показаниям
Не переливается
Рис. 15-1. Применение компонентов крови от доноров с наследственными аномалиями крови
Трансфузии СЗП от доноров с аномалиями крови (гетерозиготной р-талассемией
и дефицитом Г-б-ФД) безопасны и эффективны для всех реципиентов, в том числе
и для носителей р-талассемии и наследственного дефицита фермента Г-б-ФД.
Трансфузии ЭМ в очагах эндемичного распространения наследственных анома¬
лий крови необходимо осуществлять с лейкоцитными фильтрами (если они не были І
применены при заготовлении ЭМ), что Делает такие переливания полностью I
безопасными для всех реципиентов, позволяет устранить риск посттрансфузионных I
реакций. Трансфузии ЭМ с активностью Г-б-ФД менее 25% нормального уровня I
для всех реципиентов считаются небезопасными: при определенных условиях
(приеме лекарственных препаратов, присоединении инфекции и т.д.) эритроциты I
донора могут спровоцировать гемолиз собственных эритроцитов реципиента. I
Трансфузии ЛК, приготовленного от доноров с гетерозиготной форм° I
Р-талассемии и от доноров с лейкоцитным дефицитом Г-б-ФД, не оказыва^ ,
терапевтического эффекта, так как такие лейкоциты характеризуются снижение .
иммунофункциональных свойств, в то время как применение ЛК от доноров с нор
ОСНОВНЫЕ СРЕДСТВА ГРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 453
л активностью Г-6-ФД в лейкоцитах эффективно для всех реципиентов.
М0жно использовать в качестве скринирующего метода определения
^^лиальной полноценности ЛК.
ПРОТИВОПОКАЗАНИЯ К ПЕРЕЛИВАНИЮ КРОВИ
И ЕЕ КОМПОНЕНТОВ
ровным противопоказанием к переливанию донорской крови и ее компо-
в (за исключением особых ситуаций, например по жизненным показаниям)
Сакггдек^пенсированную патологию основных органов и систем организма.
^Острый И подострый инфекционный эндокардит с декомпенсацией крово-
' обращения.
Пороки сердца, миокардиты в стадии декомпенсации.
, Отек легких.
V рищкгоническая болезнь III стадии с выраженным атеросклерозом сосудов
головного мозга.
. Миллиарный и дессиминированный туберкулез.
I тромбоэмболия легочной артерии.
I Тяжелое нарушение функции печени.
, Ґепатаргия.
* Прогрессирующий диффузный гломерулонефрит.
У Амилоидоз почек.
.Нефросклероз,
i Кровоизлияние в мозг.
I Тяжелые расстройства мозгового кровообращения.
ПРЕПАРАТЫ ДОНОРСКОЙ КРОВИ
Из донорской крови можно получить более двух десятков препаратов.
Препараты крови — это трансфузионные среды, приготовленные из компо¬
нентов крови Донора (клеток, плазмы крови и ее производных с сохраненными
индивидуальными особенностями донора) путем более сложной и многоэтапной
переработки, в результате чего они лишаются индивидуальных особенностей
донора; 1 препаратах крови полностью исключено наличие возбудителей гемо-
трансмиссивных инфекций.
Одним из наиболее часто используемых препаратов плазмы остается альбумин
человека, который может быть отнесен к природным коллоидам.
Альбумин человека
Физиологическая роль альбумина представлена двумя основными механизмами;
' обеспечением необходимого объема циркулирующей жидкости посредством
шодержания внутрисосудистого КОД;
* обеспечением доставки с плазмой питательных веществ, биологически актив¬
ных субстанций, лекарств, ферментов, продуктов метаболизма, микроэле¬
ментов.
Период полувыведения альбумина человека из внутрисосудистого сектора со-
^ЙЛяет около 16 ч. В среднем 10% альбумина человека покидают сосудистое
в течение 2 ч, а 70% — в течение 2 сут. Из плазмы альбумин человека посту¬
пи основные внесосудиетые депо; интерстициальное пространство кожи, мышц
® Этих областях содержится 60% запасов альбумина.
^**“УМИН - это белок сыворотки крови. В норме в 100 мл сыворотки содер-
ся ® г белка, из которых 4,1 г составляет альбумин. Молекулярная масса
OMMI9
ЦІ КЯМНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
иьбуюша колеблется в пределах 66 000-69 ООО Да. содержит ряд необходи
дм организма аминокислот: глутаминовую и аспарагиновую, аргинин, Ц^Г4Ь|Х
JMHL вейпин. валин. фенилаланин. В нем мало изолейцина, метионина и ИН’
яфона. Вязкость концентрированного раствора альбумина человека (2 о??П
несколько меньше таковой крови (3,8-5,3). Осмотическое давление плаз
на 80% обусловлено альбуминами и составляет 28 мм рт.ст. В крови взрос*Mbl
человека содержится приблизительно 125 г альбумина. Период полураспад0Г°
15-М дней. Физиологическое действие альбумина человека зависит от его вли~
ння Ц осмотическое давление, объем циркулирующей крови и диурез. Альбтв
может обратимо связываться с катионами и анионами, а также с различными тоИН
сичными веществами, на чем основаны его транспортная и дезинтоксикационная
функции.
Введение концентрированных растворов альбумина человека значительно уве¬
личивает объем циркулирующей крови за счет притока жидкости в кровеносное
русло. Так, 25 г альбумина человека увеличивают объем циркулирующей крови
на 500 мл.
Отсутствие риска заражения реципиента вирусным гепатитом, так как в процес¬
се заготовки альбумин подвергается пастеризации, возможность применения пре¬
парата без предварительной подготовки и определения группы крови реципиента
считаются существенными преимуществами альбумина человека. Переливание
альбумина человека (в особенности 10-20%) позволяет ввести значительное
количество белка в небольшом объеме раствора, который способен длительное
время (8-10 дней) удерживаться в кровеносном русле, поддерживая осмотическое
давление и оказывая дегидратационное действие.
Альбумин человека содержит небольшие количества натрия и калия, не обла¬
дает способностью накапливаться в органах и тканях, не оказывает выраженного
действия на свертывающую систему крови (даже в больших дозах), при его при¬
менении крайне редко происходит изосенсибилизация.
Растворы альбумина человека низкой концентрации практически не имеют
преимуществ перед искусственными коллоидами. Растворы альбумина человека
высокой концентрации часто используют при выраженном снижении концентрации
общего белка или альбумина в плазме, а также при низких показателях КОД. У боль¬
ных с повышенной проницаемостью капилляров (например, с септическим шоком
и др.) использованию природных и синтетических коллоидов должно предшество¬
вать применение кристаллоидных растворов, так как в такой ситуации коллоиды
(особенно альбумины) проникают в интерстициальное пространство и создают
там повышенное онкотическое давление, удерживают воду в межклеточном депо.
Результаты многочисленных исследований свидетельствуют о том, что пока
концентрация общего белка крови не падает ниже 3 г/л, необходимости вводить
альбумин человека нет.
Синтез альбумина в организме не регулируется его плазматической концентра¬
цией.
При некоторых патологических состояниях (сепсисе, термических и радиоло- ■
гических поражениях, ожогах и др.) плазматические белки, введенные в организм
в большой пропорции, покидают кровоток и попадают в интерстициальное про¬
странство, что неблагоприятно влияет на функции легких.
Показания к применению:
• тяжелая гипотония, если повышенная проницаемость капилляров не выра¬
жена, а лимит дозы синтетического коллоида уже достигнут:
I выраженная гипоальбуминемия - альбумин сыворотки менее 2,5 г/дл.
Альбумин человека чаще всего используют при следующих клинических ситуа
циях:
• острой почечной недостаточности, нефротическом синдроме:
^модиализе;
І ^мзамещающей терапии у беременных и новорожденных;
# АЛселых ожогах (но не в первые 24 ч из-за повышенной проницаемости
' капилляров);
циррозе печени с асцитом;
# повышенном внутричерепном давлении при отсутствии других лекарствен-
1 ных средств;
лечебном плазмаферезе.
АльбУмин человека не рекомендуют применять:
t „ри тромбозах;
' сраженной гипертонии;
# продолжающемся внутреннем кровотечении.
дльбумин человека не является средством внутривенного парентерального
ктания (нет необходимости вводить альбумин человека, пока концентрация
общего белка крови не станет менее 3 г/л),
дльбумин человека выпускают в стеклянных флаконах - 20% раствор по 50
100 мл (например, плазбумин 20*), 5 и 10% растворы по 100,200 мл. Срок хра¬
нения - до 5 лет при температуре +2-8 °С.
дльбумин человека вводят внутривенно капельно, в отдельных случаях струй¬
но. Разовая доза зависит от концентрации препарата и состояния больного. Менее
концентрированные растворы (10%) назначают в объеме 200-300 мл, а более
концентрированные (20%) — в меньшем (до 100 мл). При лечении заболева¬
ний, сопровождающихся анемией, препарат применяют в виде курса трансфузий
по 100-200 мл. Длительность курса зависит от динамики уровня альбумина
в плазме и картины красной крови.
Протеин
Протеин представляет собой 4,3-4,8% раствор стабилизированных каприлатом
натрия пастеризованных белков донорской плазмы. Раствор состоит из альбумина
(80%) и стабильных а- и (3-глобулинов (20%), a также эритропоэтических актив¬
ных веществ. Содержит трехвалентное железо в виде альбумината.
КОД препарата соответствует плазме. Обладает всеми свойствами нативной
плазмы по участию в обмене веществ и длительности пребывания в кровеносном
русле.
Показания к применению аналогичны таковым альбумина человека с некото¬
рым ограничением в связи с более высокой аллергенностью. Может быть исполь¬
зован для коррекции анемий.
Противопоказания; все состояния, когда противопоказано вливание белков
и жидкости (кровоизлияние в мозг, тромбоэмболия, сердечная декомпенсация,
гипертоническая болезнь II-III степени).
Протеин выпускают во флаконах по 250, 400 и 500 мл. Хранят при комнатной
температуре. Срок годности — 3 года.
В зависимости от показаний вводят внутривенно капельно или струйно. Разовая
Доза - 250-500 мл. При хронических гипопротеинемиях и анемиях препарат
вводят ежедневно или через день, длительность курса определяется динамикой
показателей крови.
В настоящее время протеин производят в ограниченном количестве.
Иммуноглобулины
Из выделяемой фракции глобулинов донорской крови получают иммунологи-
Чески активные препараты — гамма- и полиглобулины. Препараты иммуноглобу-
ЛИНов представляют собой концентраты антител — продуктов иммунного обмена.
456 КЛИНИЧЕСКАЯ ТШНСФУЗИОЛОГИЯ
опсонизьфующая. нейтрализующая и комплементсвязывающая аюги
рых считается основным фактором их клинической эффективности Носгь Шг
Для получения иммуноглобулина направленного действия пров
иммунизацию доноров соответствующим антигеном. Когда в крови^ активНуіо
иают выявляться антитела с высоким титром, у него забирают иммун^9
к выделяют из нее иммуноглобулиновую фракцию. ™ную njjag
Производят лекарственные формы иммуноглобулинов для внутри**
І внутривенного введения. МЫЩеЧНоГо
ИММУНОГЛОБУЛИН ЧЕЛОВЕКА НОРМАЛЬНЫЙ
Препарат представляет собой иммунологически активную белковую А
выделенную из человеческой сыворотки или плазмы, очищенную и ко КЧИ|0,
рованнуто методом фракционирования этиловым спиртом при температурі!'
О вС. Прозрачная или слегка опалесцирующая жидкость, бесцветная или со ^
желтой окраской. Действующим началом препарата являются иммуноглобГ
обладающие активностью антител различной специфичности. 1
Показания к применению следующие.
• Профилактика гепатита А, кори, коклюша, менингококковой инфекции, пол
миелита. ЛИо
і Лечение гипо- и агаммаглобулинемии у детей.
і Повышение резистентности организма в период реконвалесценций инфекщ.
онных заболеваний.
Противопоказания: тяжелые аллергические реакции на введение препаратов
крови человека в анамнезе.
Препарат вводят внутримышечно в верхний наружный квадрат ягодичной
мышцы:
• для профилактики гепатита А — детям дошкольного возраста 0,75 мл, осталь¬
ным возрастным группам — 1,5 мл;
• профилактики кори — детям с 3 мес 1,5-3,0 мл однократно в течение 6 сут
после контакта с больным, взрослым при контакте со смешанными инфек¬
циями - 3 мл;
I профилактики коклюша — детям, не болевшим коклюшем, 3 мл двукратно
с интервалом 24 я;
і профилактики менингококковой инфекции — однократно в течение 7 сут
после контакта детям до 3 лет -г 1,5 мл* старше 3 лет — З мл;
• профилактики полиомиелита - однократно 3-6 мл в как можно более ран¬
ние сроки после контакта;
І повышения резистентности организма — 0,15-0,2 мл/кг; кратность инъек¬
ций - до 4 с интервалами между инъекциями 2-3 сут. .
Выпускают в ампулах по 1,5 и 3,0 мл. Хранят в темном месте при 6±4 I
Транспортировка всеми видами крытого транспорта при такой же температуре-
Срок годности - 2 года, продлению не подлежит.
ИММУНОГЛОБУЛИН ЧЕЛОВЕКА НОРМАЛЬНЫЙ
ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ
Препарат представляет собой иммунологически активную белковую ’
выделенную из человеческой плазмы доноров, очищенную и концентрую
ную методом фракционирования этиловым спиртом при температуре ни
Активным компонентом препарата являются иммуноглобулины, облад _
активностью антител различной специфичности. Препарат обладает такж : и3.
цифической активностью, проявляющейся в повьшіении резистентности ор
ма; 25 мл препарата содержат 1,25 г белка.
Показания к применению следующие.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 457
Лечение тяжелых токсических форм различных бактериальных и вирусных
' фекций, послеоперационных осложнений, сопровождающихся септицеми-
g у детей и взрослых.
Первичный гуморальный иммунодефицит.
* Пдяопатическая тромбоцитопения.
ШШдетей.
* Профилактика инфекции при трансплантации костного мозга.
Ндоявопоказания:
анафилактические или тяжелые системные реакции на введение иммуногло-
' булина человека;
селективный дефицит IgA при наличии антител к IgA.
Lg взрослых разовая доза составляет 25-50 мл. Без дополнительного разве-
іиммуноглобулин вводят внутривенно капельно со скоростью 30-40 капель
«ИНГУ' Курс лечения состоит из 3-10 трансфузий, проводимых через 24-72 ч
/ зависимости от тяжести заболевания). Перед введением флаконы выдерживают
L комнатной температуре не менее 2 ч.
Для детей разовая доза составляет 3-4 мл/кг массы тела, но не более 25 мл, если
Пользуется специально разработанный курс лечения. Непосредственно перед
введением иммуноглобулин разводят 0,9% раствором натрия хлорида или 5% рас¬
твором глюкозы* из расчета 1 часть препарата на 4 части разводящего раствора.
Полученный разведенный иммуноглобулин вводят внутривенно капельно со ско-
росгью 8-10 капель в минуту.
^упускают во флаконах по 10,25 и 50 мл.
Препарат хранят в темном сухом месте при температуре 6±4 °С. Срок годно¬
сти 11 ^.продлению не поддежит.
ИММУНОГЛОБУЛИН ЧЕЛОВЕКА АНТИСТАФИЛ0К0КК0ВЫЙ
Препарат представляет собой белковый раствор иммунологически активной
фрадиидабвеческой гипериммунной плазмы крови доноров, содержащий анти-
етрйІфилококковому экзотоксину. Прдзрачная или слегка опалесцирующая
жидкость, бесцветная или бледно-желтого цвета. Действующим началом препара¬
та являются иммуноглобулины, обладающие активностью антител к стафилокок¬
ковому экзотоксину.
Показание к применению: лечение различных заболеваний стафилококковой
этиологии у детей и взрослых.
Иммуноглобулин человека антистафилококковый предназначен для внутри¬
мышечного введения. При генерализованной инфекции минимальная разовая
доза препарата, составляет 5 ME антиальфастафилолизина на 1 кг массы тела
(для детей менее 5 лет разовая доза препарата должна быть не менее 100 ME).
При более легких локализованных заболеваниях минимальная доза препарата
составляет не менее 100 ME. Курс лечения состоит из 3-5 инъекций, проводимых
ежедневно или через день в зависимости от тяжести заболевания и терапевтиче¬
ского эффекта.
Противопоказания: тяжелые аллергические реакции в анамнезе на введение
Маратов крови человека.
Лицам, страдающим иммунологическими системными заболеваниями (болез-
крови, соединительной ткани, нефритом и т.д.), препарат следует вводить
Ше соответствующей терапии.
^Иммуноглобулин человека антистафилококковый выпускают в жидком виде
~5 мл в ампуле. Одна доза препарата содержит не менее 100 ME активной
станции.
Agat хранят в сухом и темном месте при температуре от 2 до 10 °С. Срок
^препарата - 2 года, продлению не подлежит.
ПМВА№
458 КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
ИММУНОГЛОБУЛИН ЧЕЛОВЕКА АНТИРЕЗУС
Препарат содержит антирезусные антитела с высоким титром.
Иммуноглобулин человека антирезус назначают:
• Юі(0)-отрицательньш женщинам, несенсибилизированным
антигену и родившим ЛЬ(В)-положительного ребенка: §|Щ
• при искусственном прерывании беременности женщинам, не сенсиби
ванным Rh(D)-aHrareHOM, в случае ІПі(В)-положительной принадле*3^0'
крови мужа. юности
Иммуноглобулин человека антирезус вводят по одной дозе внутримь
однократно родильнице В течение первых 48 Ч после родов, при ИСКусстврЄЧН°
прерывании беременности - непосредственно по окончании операции. НН°М
Противопоказания:
• Ш)(0)-положительные родильницы:
Я гиперчувствительность к препарату;
• Rh(D)-отрицательные родильницы, сенсибилизированные к антигену Rhfny
• новорожденные.
Препарат вводят по одной дозе внутримышечно однократно:
• родильнице - в течение первых 72 ч после родов;
• при искусственном прерывании беременности — непосредственно после
окончания операции;
• для профилактики в предродовой период — 1 дозу приблизительно на 28-й
неделе.
Выпускают в ампулах по 1 и 2 мл, содержащих 1 дозу иммуноглобулина
антирезус-Rh0 (D) человека.
Иммуноглобулин человека антирезус хранят при температуре от +2
до +10 °С в сухом, защищенном от света месте. Замораживание категорически
запрещается, так как в этом случае происходит разрушение препарата. Срок год¬
ности - не более 1 года. Применяют только в стационаре.
Фактор свертывания крови VIII
Препарат представляет собой стерильный, стабильный, очищенный сухой кон¬
центрат человеческого антигемофильного фактора, полученный путем очищения
охлажденной нерастворимой фракции пула свежезамороженной плазмы доноров,
тестированных на отсутствие антител к вирусам ВИЧ-1, ВИЧ-2, гепатита С и поверх¬
ностного антигена гепатита В. Препарат производят с использованием двух независи¬
мых стадий инактивации вирусов: процесса сольвент-детергентной и тепловой обра¬
ботки, что позволяет добиваться уменьшения инфицирующей способности вирусов
в ІОМО*2 раз. Содержит фактор фон Виллебранда естественного происхождения.
Показания к применению: лечение и профилактика кровотечений у больных гемо¬
филией А, в том числе при экстренном и плановом хирургическом вмешательстве.
Протвопоказания:
я повышенная индивидуальная чувствительность к препарату; .
• синдром диссеминированного внутрисосудистого свертывания (ДВС-
синдром) и/или гиперфибринолиз.
Препарат вводят только внутривенно. Дозу, необходимую для восстановления
гемостаза, подбирают индивидуально в зависимости от тяжести кровотечения,
наличия ингибиторов и требуемого уровня фактора VIII.
Расчет необходимой дозы основан на том, что введение 1 ME препарата на
массы тела повышает содержание фактора VIII на 2%.
Необходимая доза (ME) =
масса тела (кг) х желаемый уровень (5) фактора VIII / 2.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 459
л. дозы зависит от локализации и степени кровотечения.
Легко* кровотечение — 10 МЕ/кг, что приводит к увеличению уровня фак¬
тора на 2%.
Умеренное кровотечение — уровень фактора следует поднимать на 30-50%;
' иачаЛьная доза - 15-25 МЕ/кг, при необходимости вводят 10-15 МЕ/кг
повторно каждые 8-12 ч.
Тяжелые кровотечения — уровень фактора следует увеличивать на 80-100%;
* начальная доза - 40-50 МЕ/кг; поддерживающая - 20-25 МЕ/кг, вводят
каждые 8-12 ч.
t ХирУРгические вмешательства — уровень фактора следует увеличивать
«о 100%; предоперационная доза — 50 МЕ/кг, парентеральные введения
повторяют каждые 6-12 ч в течение 10-14 дней.
Профилактика — поддерживающая доза у больных с тяжелой формой гемо-
' филии - 20-23 МЕ/кг 2 раза в неделю.
Препарат выпускают в виде порошка для внутривенных инъекций в комплекте
творителем, иглами и системой для введения. Фактическое содержание факто-
fflVIIIуказывается на упаковке для каждой серии препарата и может варьировать:
^ 200 до 300 ME - 5 мл, от 400 до 600 ME - 5 мл, от 800 до 1200 ME - 10 мл.
На упаковке имеется цветовой код дозировки.
Хранить следует при температуре от +2 до +8 °С. В случае лечения на дому
лиофилизированный порошок можно хранить в течение 6 мес при комнатной
температуре.
Октоког-альфа
Препарат представляет собой стерильный, стабильный, очищенный апиро-
генный лиофилизат, полученный рекомбинантным способом с помощью клеток
почек детенышей хомячков, в которые был введен ген фактора свертывания крови
VIII человека. Препарат производят с использованием сольвент-детергентного
метода инактивации вирусов, что позволяет добиваться уменьшения инфицирую¬
щей способности вирусов в 109-1022 раз.
Каждый флакон октоког-альфа (когенэйта ФС *) содержит 250, 500,1000 ME
фактора свертывания VIII. Вспомогательные вещества: каждый флакон содержит
сахарозу - 0,9-1,3% (28 мг), глицин — 21-25 мг/мл, гистидин - 18-23 ммоль.
Внутривенное введение сахарозы, входящей в состав препарата, не изменяет кон¬
центрацию глюкозы крови.
Показания к применению: лечение и профилактика кровотечений у больных гемо¬
филией А, в том числе при экстренном и плановом хирургическом вмешательстве.
Противопоказание: повышенная индивидуальная чувствительность к препара¬
ту и его компонентам.
Приготовленный препарат вводят только внутривенно. Дозу, необходимую
мя восстановления гемостаза, подбирают индивидуально в зависимости от тяже¬
сти кровотечения, наличия ингибиторов и требуемого уровня фактора VIII.
Пациентов с низким титром ингибитора (10 ЕД Бетезда) можно успешно лечить
чогенэйтом ФС \
Расчет необходимой дозы основан на том, что введение 1 ME препарата на 1 кг
иассы тела повышает содержание фактора VIII на 2%.
Необходимая доза (ME) =
= масса тела (кг) х желаемый уровень (%) фактора VIII / 2.
Выбор дозы зависит от локализации и степени кровотечения.
* Легкое кровотечение — 10 МЕ/кг массы тела, что приводит к увеличению
Уровня фактора VIII на 2%.
Е ІМИН'ШИІММ' Illi' WWW
• ущреижж ip—et ene ime - уровень фактора VIII следует щ>дав(
jpjjMWe «вчады» дсаа - 15-25 МЕ/кг массы тедз, при нейбаовГ^'*
мр 10-15 ME/ir массы тем повторно каждые 8-12 ч. ^
І Твжслме кровотечения уровень фактора VIII следует увеящ^^.
т ШУЮ0*Ы начальная доза 40 50 МЕ/кг массы тела; поддержиз*юа&*
JP-2S МЕ/кг массы тела, вводят каждые 8 12 %
• Хируптксш вмшовтелкты *» уровень фактора VFII следует увеличти*
де ИЙ>Н; прадпнертнонная доза - 50 МЕ/кг массы тела, паревт^адь,^
Мэйн повторяют каждые 6-12 ч в течение 10-14 дней.
• Профилактика азддерживающая доза у больных с тяжелой формой г**
фидям - 20 -50 МЕ/кг массы тела 2 раза в неделю.
Выпускают в акте порошка для внутривенных инъекций во флаконах, еодап*,
«а 250. 500 я 1000 М£ активности VU1 фактора свертывания крови в кома***
с растворителем (2J мл стерильной воды для инъекций), стерильными двупв-
ровней иглой, мглой с фильтром и системой для введения. На упаковке имеется
цветовой вод дозировки
Хранят І оригинальной упаковке в прохладном (от +2 до +8 °С), защищенном
от шта месте. Срок годности - 23 мес. После приготовления раствор вводят I
втечемне Зч.
КРОВЕЗАМЕНИТЕЛИ
Кровезаменители это лекарственные препараты, которые при внутривенном
введении могут заменять лечебное действие донорской крови или ее отдельных
компонентов. Само определение указывает ма способность кровезаменителей вос¬
полнять. з в ряде случаев и эффективно восстанавливать функции крови.
• Заполнять кровеносное русло и обеспечивать поддержание на необходимом
уровне артериального давления, нарушенного в результате кровопотери
или шока.
■ Восстанавливать осмотическое или электролитное равновесие.
В I к вобождать организм от токсинов, образующихся при действии патогенных
факторов и инфекционных агентов или поступающих в организм при отрав-
деммях
» Обеспечивать ткани необходимыми питательными веществами и источни¬
ками энергии (растворами аминокислот, сахаров, жиров, витаминов, минг-
рвльных веществ).
На основе функциональных свойств кровезамещающих препаратов и особен¬
ностей их действия была разработана классификация кровезаменителей, которая
положена в основу современного списка препаратов трансфузиологического посо¬
вай,
і Регуляторы водно-солевого и кислотно-основного состояний.
I Препараты гемо динамического противошокового действия.
• Препараты дезинтохгикационного действия (препараты этого ряда; гемо-
дез*, кеогемодез*. повидон, поливндон, глюконеодез, полидез и др. С 1
сентября 2005 г. эти препараты исключены из Государственного реестра
лекарственных средств в соответствии с приказом Росздравнадзора РФ
Nf 1100-пр 05 от 24.05.2005, а также анулирована регистрация лекарствен-
ных средств, содержащих поливинилпирролидон низкомолекулярный меди¬
цинский с молекулярной массой 12 600+2700 Да).
I Переносчики кислорода.
• Препараты для парентерального питания.
• Инфузионные антиоксиданты.
• Крове йме ми гели комплексного действия.
тш тжш тлгтітпшъттшштшышшт 461
ТОРЫ ВОдаО-СОЛЕВОГО И КИСЛОТНО-ОСНОВНОГО
состояний
j внутривенная терапия направлена «вбо т внгтрмсостдигты*.
да«*-тет°4!ИЫЙ аоъем ЖИЛ*ПСТИ’ w6o m объем как іінінтт.й 1«
**лкости- 8ыб°Р «иджхтиш растворов нипт о? шив
№7«тсг* лефмиита жидкости и электролитов. осшлялыкмги пммп
^ЧУ1ИО-«»ОВЙОГО состояния. Изотонический (0,9%) рйСТВцр метри* ІШН
только *° внеклеточном гарисгрвжпе. т> применяют «яя уве*
объема янутрисосу диетой жидкости или для коррекции увеличенных
ifiS*** Глюкоза и воя. распределяются М «ЕГПГ
^ікої пространстве, и п исполмтют ям течения общего згріціпі вми
^#*зме электролитные растворы обеспечивают дополнительное ПОСТУПЯТ-
! ^і^ктролятов (калия, кальция, магния) и буферов (.лактата, юти, малага)
РаствоРы квзнічкгт. как правило, для поддержания жнлкистиого
g цз0тонические — в качестве замещающих.
л|аке содержание воды в организме составляет около 60%, при атом ома рас-
^цнся I различных жидкостных пространствах. Согласно нянино исвйе*
Отелей. V, воды находится во внутриклеточном и */, - во внеклеточном вро-
Zg0Xwe. Последнее подразделяется:
.иа внутрисосудистое пространство (жидкость, находящаяся внутри крове
косных сосудов);
* интерстициальное пространство (жидкость, находящаяся между клггками).
, транс клеточное пространство (желудочно-кишечные соки, желчь, спинно¬
мозговая жидкость, моча, внутриглазная жидкость, перитонеальная, паю
радьиая, перикардиальная и синовиальная жидкости).
Минимальный суточный расход воды у взрослых составляет ориблм «ительио
1700 нл, из которых 840 мл выделяется через кожу и при дыхании. 100 мя -
апулом и 760 мл - с мочой.
Внеклеточное пространство состоит из интерстициального и виутрисосудистого
акторов. Обычно 75% внеклеточной жидкости находится а иитерспинш и 25% -
i сосудистом русле. Плазма, интерстициальная и внутриклеточная жидкости сидер¬
ит положительно и отрицательно заряженные ионы - электролиты, соотношение
которых крайне важно для поддержания физиологического состояния организма
Существуют значительные различия в электролитном составе внутри- и внекле¬
точного жидкостных пространств. В клетках преобладает содержание ионов калия,
m внеклеточном пространстве — ионов натрия и хлора. Для поддержания мемро*
итого градиента необходима функция натрий - калиевого насоса.
В норме мембрана клетки обладает относительной проницаемостью для мек
фюпоа, но она свободно проницаема для воды. Например, снижение концгм-
фиим натрия и осмолярноети во внеклеточном пространстве аосле инфу ым
^ раствора глюкозы4 сопровождается перемещением воды а клетку, что может
■фивесга к уравниванию осмотического давления а этих жидкостных сектор*»
И наоборот, увеличение концентрации натрия и осмол яркости во внеклеточном
**трмсты, например в результате инфузии гипертонического раствора натрия
сопровождаете я перемещением воды из внутриклеточного во аиа влетая
пространство. Инфузия изотонических растворов электролитов не изменяет
*вмврцость внеклеточного пространства и тем самым не приводит в асремеще*
®*®поды.
^мещ^ние воды между двумя компонентами внесосу дистого простран-
°°Р*деля€тсн прежде всего разностью концентрации белка. К^шомаи-
^йнеское давление считается основным фактором, благодаря которому
яелнй непроницаем для белков плазмы. При нарушениях белкового обмена
Им тмекияиятмшмтммк
і рррьтаї* ватпяшшяхг джбанки са ти» переходит т ттшп^.
Р • ярішиосио* русло. Молекулы кристаллоидов щ
ІІНМІНМНИк ЦСІШІМу ОИЯ ГКАяИО Ірвйвигг Через игмбміп г • *Н
і мрае Фв% КОД оваемчювггся м «чет различных белка» (ж*
pS^-fjatfWWtwe Эй СЧГТ глобулинов и фмбриногрна) м.^ *
амифвммегся t» «чгг —ншггрицин катионов, На основаним aoeawi^J*^*
ue*rtp4u»* абмвго белка плазмы (ОБ) для расчета КОД испольэугя
КОД - 2.1 М. ОБ 10.16 * ОБ * 2 ♦ 0.09 * ОБ * 3.
Исследователи обмару «или низкую корглляаию между вычисленными п —
репными течениями КОД имамы у здоровых субъектов. • у пациентов мю>.
ip • ijMMaruM состоянии. эта корелляиия еще ниже
Дл* измерения КОД с одной стороны полупроницаемой мембраны аомемм
ряглюр Щ с другой ** растаор. не содержащий белок. Жидкость ивою»,
через мембрану до достижения давления которое препятствует дальнейшим
I осмосу. У нормальных индивидуумов КОД составляет 25 мм рт.гг.. в положений
дока ' 22. У пациентов отделения интенсивной терапии ■ от 18 до 20 мм т. ст
рт иэооикотических растворов, например 5% раствора альбумина <**.
•ма. приводит I увеличению внутрисосудистого пространства без перемещения
жидкости между другими пространствами. Введение гиперонкотичегкого рестю-
ре.» частности 25% раствора альбумина человека, увеличивает ОЦК нтропом*
опально количеству введенного раствора за счет перемещения воды и электрод,
та и.1 ингтртиция. Одиако если осмоляльиость внеклеточного сектора при поя
не изменяется, то аода не покидает внутри клеточное пространство.
Феномен перемещения воды между внутрисосудистым и интерстициальным
открыл Starting в 1896 г. Математическое выражение этого про-
цесса вывели І |948 г Papprrnheimer и Soto-Rtvera. и оно получило на;шм»
«уравнение транекяпиллярмого обмена Старлинга*:
Q,-к,* I (Р - р,) О * (я - /г,)|,
где Q, суммарный поток жидкости через капиллярную мембрану; К, - коэффи-
цнент фильтрации жидкости; Р - капиллярное гидростатическое давление: Р -
интерстициальное гидростатическое давление; а ~ осмотический коэффициент
к капиллярное оикотическое давление; я, - интерстициальное онкотичесюх
давлен иг.
Процесс фильтрации оп^іеделяется градиентом давления между Р и Р Гил
рн гагичеекчяг давление в капилляре считается основным фактором, способствую*
ажм перемещению жидкости в интерстициальное пространство, и обычно оно
уравновешивается гидростатическим давлением интерстициального пространств
Разница между давлениями в этих секторах становится положительной при к*
никноаения отеков. Таким образом. КОД плазмы это основной фактор, ужу
жиминцмй жидкость во внутрнеосудистом пространстве. КОД иитерстицмалы**1
пространства направлено в противоіюложную сторону, что описывается разницей
между t и I И коэффициент фильтрации, определяется двумя факторами Lp'
гидравлической проводимостью, которая отражает скорость прохождения жидкостя
через михросжудистый обменный барьер (капиллярную мембрану, интерстнню»
тай таль и терминальную лимфатику), и S площадью капилляров, через копр*
осуществляет* я фильтрация. Если один из компонентов К, повышается. наор&мЗ'
|Н нш пел калькой мембраны или ваэодмлатации в ответ на усилив»
ЩИШйяъ выброс*. воличгство фильтруемой жидкости увеличивается
і ко •ффициеит фильтрации (су) определяется свойствами ме*Н«
Ш ЩЩйинтвовять переходу бе іка Ес ли «г»І, мембрана полностью иеяроияи***
ЯВМИМІ МвММГ
^^даИМ»а.€яИМ Я»Ш|ИІИПІ І—І
^f^einnMinipBMfarMgiQpMHMiai _
r w^j00№» гяггиг-т около Ч Q tirn жптпмьи —тттпрц 1—1 П.-
•*■* №ГКШ *ШИИ * •«« ТЖЫЯВЯИ шшшж ЧИМ «мс •
^<»1«*—«ИМ*ИИМЙ «ММ «МММ Ж «MfMMM жре-
anpWM и беями • ммпм «руте кровмбрамямм. Г ни іииіп
*^ЯШГ wrnmtnre аатятртат штятш яят «мазями* ПД «мамы
приведут i наяву лепахк. ти «ш а ип мйгмумв ияяяимяим.
^,щ—и мамияеимя» жидкости • вямргхииивмами яраггуожтче
*д^жгмгког давление в иитерстиаивяаиои ЯрВУТ»ИИ,ІВі ЦП— t мри»
»Tir—««ічямю Вследствие мшмро шия мини ара яямимнаи* жшть-
’Іщдал*рсгй«*аяь»«» пространстве я быстро чврмщі, чи» вреяяагтвт
'лЯ00щпп переходу жидкости. поскольку гаарпалаявіия оииипі грв-
между Рг и Р,- Если давление в иіеїчгргтнммяммм врагтрааггяе легкая
|^дет выше атмосферного, жю способствует переводу в вваа —п—
сопровождается незначительным повышением я, величия* яаяврят
^в*еяе легких составляет от 1 до 5 та ргст.
ртоІ компенсаторный механизм заключаете* • смяаями я. • рмраюие
якзплешя в интерстициальном прострамгтм жидкости с «ими саиримшм
до. I норме онкотическое давление в иігтірпмиаяіяии ярмтрантг четких
являет 75% КОД плазмы крови. Онкотяческии гримни «в «швіириші
вбране легких (между я и я) составляет всего 4-6 мм рт гг Прм смяяммм
КОД плазмы крови таковое интерстициального прострмпм пнмгпі ярожр-
вйоиальйо по мере поступления в него жидкости, что яреиаи'яиет яычим.миим
изменению сижотического градиента.
Снижение *( происходит не только за счет раааеяпма Сами, но а жтаетш
дамам его лимфатической системой легких Последний фактор нерап эчеиь
важную роль, «скольку в экспериментальных исследованиях впваыип мак жм-
Мяриский дренаж может возрасти • 10 раз в ответ аа веарветжи» объема
ш давления в интерстициальном пространстве легких.
Инфузионная терапия у пациентов с циркуляторной недостаточностью, обрела*
«мой низкой преднагузкой сердца, ведет к увеличению объема «риуаирукямй
крови, венозного возврата к сердцу и сердечного выброса. Для двстмжмм пой
кеш используют препараты крови, крнсталлоидные или коллоидные растворы.
Кристаллоиды
Нарушения водного баланса приводят к различным видам легидраяамм
* гипергидратации (пню-, изо- и гипертонической). при которых изменяется
4вмшемме не только воды в различных секторах организма человека.« в мм-
фиата*.
Дм коррекции нарушений водно-электролитного балыка яеввамрмт сйычин
бемчаые солевые растворы Натрий является основный компонентом таких
Ф^таро*, поскольку он представляет собой главный электролит, содфяшамйсв
1 Наостк внеклеточного пространства, причем 80% его раокмоиепю же с осуди
^ РУИ4 Следовательно внутривенно введенный в составе го мм и растворов
•ИИ» вскоре окажется за пределами сосу дистой системы.
‘ Мммий гру ппе относятся кнфузномные растворы электролитов в спірна.
авмо|%«) этих растворов обеспечиваются базисная (физиологическая) потреб
%% • воду и электролитах и коррекция нарушений водного, шчаролигтмоте
Мцотно-осноаіняхі равновесия. В отличие от коллоидных бодымм часть кри
растворов быстро покидает сосудистое русло и переходит в «трети
щ m2**' кктммпмые плазме, равномерно рк’удгмюгм ««тли imi
i^Qr|pawTay. что подтверждено распределением сбаямиироааммеге соленого
Ill кпин* tcm» ТУКИСаУЗДОПОПЦ
рвстаора Риніера лактата* между водными пространствами организма g
30 мин после введения 2 д препарата достигается полное равновесие
дистым и интерстициальным секторами пропорционально их начальным
(13). Таким образом. 500 мл введенного раствора остается в сосудистом
11500 мл переходит в интерстициальное пространство. Поскольку данный
считается ИЗООСМОТИЧНЫМ плазме и внутриклеточной ЖИДКОСТИ, то не ВОам*^
осмотического градиента и объем внутриклеточной жидкости не изменяете ЙКа?ї
Кристаллоидные (натрийсодержащие) растворы были разработаны яд.
дмчения именно объема интерстициального пространства, а отнюдь не оби!*
циркулирующей крови (в сосудистом русле остается всего V, 0,9% раствора нат^*
хлорида после его внутривенной инфузии). Внутривенное введение 1 л Рин
лактата* в среднем приводит к увеличению объема циркулирующей крохи пп?
мерно на 200 мл. что будет сопровождаться соответствующим распределений
ионов натрия в различных водных секторах. еі|
Гипотонические растворы (т.е. с меньшим содержанием натрия, чем в пя
ме). I также растворы, осмотическая активность которых обеспечена глюкозой
содержат так называемую свободную воду, которая способна проникать во щ
ірмслеточное пространство. Количество свободной воды в растворе определяется
содержанием I нем натрия по отношению к его содержанию в 0.9% растворе
Кристаллоидные растворы применяют для увеличения объема интерстициаль¬
ного пространства и в меньшей степени — объема циркулирующей крови и сердеч-
ного выброса. Они свободно проникают через эндотелий капилляров и не изме¬
няют онкотическое давление плазмы крови. Их распределение после инфузии
определяется концентрацией натрия. Этот ион считается основным компонентом
тхкнх растворов, поскольку представляет собой электролит, содержащийся в жид¬
кости внеклеточного пространства (80% Na* находится вне сосудистого русла).
Одно из существенных преимуществ кристаллоидных препаратов — их невысокая
стоимость. При применении в достаточных количествах солевые растворы оказы-
вают деэинтоксикационное действие. Для достижения нужных эффектов требу¬
ется чрезмерно большой объем инфузии кристаллоидных препаратов, что сопро-
вождается повышением выхода жидкости из сосудов и формированием отека
тканей. Генерализованный отек, в свою очередь, ухудшает транспорт кислорода и
соответственно поддерживает органную дисфункцию.
Солевые растворы с гиперосмолярным эффектом оказывают небольшое диуре¬
тическое действие и способны повышать эффект осмотических диуретиков.
Показания к их применению следующие.
• Восполнение объема внеклеточной жидкости.
• Поддержание объема внеклеточной жидкости во время операции и в после¬
операционном периоде.
• Лечение умеренной гиповолемии (препараты для первичного восполнения
ОЦК).
В исследованиях показано, что острая кровопотеря или гиповолемия приводит
к дефициту интерстициальной жидкости, который должен быть быстро устранен.
В эксперименте было установлено, что сочетанное применение гемотрансфузий
и инфузии солевых растворов значительно увеличивало выживаемость животных
при геморрагическом шоке по сравнению со случаями, когда их лечение включало
только гемокомпоиентную терапию.
Существует три возможных механизма, объясняющих уменьшение объема
интерстициальной жидкости:
• после кровопотери средней степени тяжести жидкость из интерстициального
пространства поступает в сосудистое русло со скоростью 90-120 мл/ч (про¬
исходит восполнение объема плазмы). Это обусловлено снижением гидре
статического давления в капиллярах, а также увеличением соотношения
основные СРЕДСТВА ГРАНСФУЗИОНК0-ИНФУЗНОЙНОГО ПОСОБИЯ 46 Э
^.дид дяпного/посткапилллрного сопротивления. Изменение тонуса нре-
^^пйяиллярных сфинктеров обусловлено сишттоадренаяовой активацией;
JLpoксия приводит к повышению внутриклеточной осмолярмости. В резуль-
* лит жидкость перемещается из внеклеточного пространства в клетки;
й поражении жидкость перемещается в участки иитерстиция. выключен-
* ^ ИЗ обмена (третье пространство).
А знологические потребности в жидкости зависят от массы тела, и на рве*
бывают следующим образом (табл. 15-8); масса тела до 10 кг - 4 мл/кг в час;
.20 кг
2 мл/кг в час; более 21 кг — 1 мл/кг в час.
_. расчет инфузии, обеспечивающей физиологические потребности в вода (Парк Г
nuua» тяпапиа^— М : Бином, 2006)
< Масса тала, кг
Скорость инфузии. мл/ч
Овммиифузш. мя/аут
Pgft 50
90
21G9
И—“ М
100
2400
t/v 70
110
2640
\— 80
120
2880
90
130
3120
г" 100
140
ззво
Хирургическая травма приводит к потерям жидкости в ткани и ее секвестра¬
ции. Этот дефицит проявляется уменьшением объема жидкости в интерстици¬
альном и внутрисосудистом пространствах. Ниже приведен расчет дополнитель¬
ного объема жидкости для компенсации потерь, обусловленных хирургической
травмой:
« минимальная (в частности, грыжесечение) — 3-4 мл/кг в час;
« среднетяжелая (например, холецистэктомия) - 5-6 мл /кг в час:
• тяжелая (такая как резекция кишечника) — 7-8 мл кг в час.
При отсутствии сопутствующих заболеваний почек и сердца цель инфузии
состоит в обеспечении безопасной жидкостной нагрузки, позволяющей гомеоста¬
тическим механизмам самостоятельно распределять жидкость и удалять ее избы¬
ток. Необходимый объем инфузии рассчитывают исходя из физиологической
потребности в жидкости с учетом дополнительно имеющихся и текущих потерь.
Физиологическая потребность в жидкости зависит от диуреза.
Потребность в жидкости рассчитывают следующим образом:
• физиологическая потребность в жидкости;
• неощутимые потери — 20 мл/ч (500 мл/сут);
• при лихорадке добавляют 10 мл/ч (250 мл/сут) на каждый градус свыше 37 *С;
• при предполагаемом парезе кишечника добавляют 20 мл/ч в первые 24 ч
после операции;
• при потерях в третье пространство после лапаротомии или торакотомии
добавляют 40 мл/ч (1000 мл/сут) в первые 24 ч после операции;
• возмещают любые другие измеряемые потери (через назогастральный зонд,
дренажи, с мочой и стулом).
Многокомпонентные электролитные растворы содержат катионы и анионы.
Катионы;
' натрий — оказывает наиболее значительное влияние на внеклеточный объем
жидкости и соответственно на циркулирующий объем крови и внутрисосуди-
стый объем;
• калий — считается преобладающим катионом во внутриклеточном про¬
странстве и играет центральную электрофизиологмческую роль, особенно
при сердечных аритмиях;
• кальций - отвечает за нейронную возбудимость и электромеханическое
взаимодействие мышечных клеток, участвует в свертывании крови;
ЦІ КЛИНГСІЖАЯТТМИСФКЖШОГИЯ
• магний - необходим для нейромышечной стимуляции.
Ашкжы:
а хлорид І аналогично натрию считается самым важным анионом во
точном пространстве, несет ответственность за ‘/3 всех внеклеточн BHei0lt-
' Вином активных частиц, отвечает за направление мембранного пот * °См°'
его используют для предотвращения дилюционного ацидоза; енииала.
І электролитные растворы — могут содержать метаболизируемые
(ацетат, лактат, малат, цитрат). ани°Ны
Эюстролитные растворы применяют для коррекции нарушений:
І водного обмена;
• электролитного обмена;
і водно-электролитного обмена;
і кислотно-основного состояния (метаболического ацидоза);
І водно-электролитного обмена и кислотно-основного состояния.
Таким образом, кристаллоидные растворы должны восполнить потери во
и электролитов. Потеря воды затрагивает все жидкостные пространства органит^
(внутриклеточное, интерстициальное и плазму). В различных клинических chtv 3
циях эти пространства могут обезвоживаться в разной степени. Внутриклеточная
дегидратация почти всегда обусловлена дефицитом воды, что возмещают 5% fag
твором глюкозы*. Для лечения гиповолемии 5% раствор глюкозы* использовать
нельзя, так как при инфузии 1000 мл такого раствора в сосудистом русле остается
только 100 мл, что соответствует удельной дозе плазмы в структуре жидкостных
пространств организма. Основная цель инфузионной терапии при гиповолемии -
максимально быстрая нормализация ОЦК, что осуществляется введением колло¬
идных и кристаллоидных растворов, причем при гиповолемии кристаллоидных
растворов требуется в три раза больше, чем коллоидных, что обусловлено разни¬
цей в распределении.
Рецептурный состав кристаллоидных электролитных растворов определяет
их свойства і осмолярность, изотоничность, ионность, резервную щелочность
(табл. 15-9).
Таблица 15-9. Сбалансированные электролитные растворы
Электролитный раствор
Na. ммоль/л
К, ммоль/л
Са, ммоль/л
Mg, ммоль/л
CI, ммоль/л
Бикарбонат, г
Ацетат, г
Лактат, г
|_
<0
X
о
ж
S
с
Малат, г
Сухая глюко¬
за, г
Расчетная
осмоляль-
ность,
мОсм/л
0,9% раствор натрия хлорида
154
—
—
—
154
—
—
—
—
—
—
308
Дисоль*
127
—
_
—
103
—
24
—
—
—
—
254
Трисоль*
133
13
—
—
98
48
—
—
—
292
Ацвсоль*
110
13
—
—
99
—
24
—
—
—
—
246
Хлосоль*
120
3.0
_
—
104
—
—
—
—
—
—
286
Квинтасоль*
140
5,0
2,5
1.5
103
—
50
—
—
—
272-332
Лахтосол*
140
4,0
1.5
1.0
115
3,5
30
—
—
294
Йоиостерил *
137
4.0
1,65
1.25
110
—
37
—
—
—
—
291
Плазма-Лит *
140
5,0
—
1.5
98
—
27
—
23
—
—
295
Староф ундин изотонический*
140
4.0
2,5
1.0
127
—
24
—
—
5
—
304
Стврофундин Г-5*
140
4.0
2.5
1,0
141
—
—
—
10
50
ятМ
Нормофундин Г-5*
100
18
2.0
3,0
90
—
38
—
—
—
50
mTJ
Вода, химически связанная с ионами, распределяется между внутрисосудисты»
І шсосудистым пространствами как 25 к 75%. Волемический эффект составляет
100% при струйном введении и 25% — через 30 мин после окончания введения.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗЙОННО-ИНФУЭИОННОГО ПОСОБИЯ 487
поденные анионы: ацетат, малат и лактат - через 1,5-2 ч полностью метабо*
тются тканями организма в бикарбонат, увеличивая резервную щелочность
*2?ратов. которые их содержат (1 моль ацетата равен 1 моль гидрокарбоната,
^«пьмалата равен 2 молям гидрокарбоната).
' раСГворы кристаллоидов больше всего подходят для возмещения внеклеточ-
* потери жидкости (внеклеточной дегидратации), но наряду с этим могут быть
Пользованы и для восполнения кровопотери. Острая кровопотеря (или гипо-
аілемия) непременно ведет к дефициту интерстициальной жидкости, который
^ен быть немедленно устранен. В эксперименте было установлено, что ком-
йинированное применение гемотрансфузии и внутривенных вливаний солевых
^створов, способствующих восполнению дефицита жидкости в интерстициаль-
U пространстве, значительно увеличивало выживаемость животных при гемор¬
рагическом шоке по сравнению со случаями, когда их лечение ограничивалось
(олько переливанием крови. Растворы кристаллоидов убедительно доказали свою
эффективность при реанимации больных с острой кровопотерей, а также нашли
Апфокое применение при травмах различного генеза.
Важное положительное свойство электролитных растворов - это способность
улучшать реологические свойства крови и микроциркуляцию, профилактика ДВС-
синдрома и образования микросгустков.
Наиболее часто применяемые солевые растворы — регуляторы водно-солевого
обмена: раствор Рингера*, ацесоль \ трисоль \ лактосол*, хлосоль *, дисоль *.
йоностерил*.
РАСТВОР НАТРИЯ ХЛОРИДА 0,9%
Содержит ионы натрия (154 ммоль/л) и ионы хлора (154 ммоль/л). Тео¬
ретическая осмоляльность — 308 мОсм/л. Несколько гипертоничен по отношению
к плазме крови. Имеет слабокислую реакцию. Ионы натрия и хлора считаются
важнейшими неорганическими компонентами внеклеточной жидкости, поддер¬
живающими соответствующее осмотическое давление плазмы и внеклеточной
жидкости. Раствор восполняет дефицит жидкости в организме при дегидратации.
Препарат применяют при дегидратациях различного происхождения, во время
и после операций для поддержания объема циркулирующей плазмы на физиоло¬
гическом уровне, в качестве универсального растворителя для различных лекар¬
ственных препаратов.
Противопоказаниями к применению препарата считаются состояния гиперги¬
дратации, гипернатриемии, угроза отека легких или мозга.
Препарат следует с осторожностью применять у пациентов с нарушением выде¬
лительной функции почек, при гипокалиемии. Введение больших доз раствора
может привести к хлоридному ацидозу, гипергидратации, увеличению выведения
калия из организма.
Препарат вводят внутривенно, чаще капельно. Дозу и скорость введения
выбирают индивидуально в зависимости от клинической ситуации (до 3000 мл
за сутки).
При длительном применении препарата необходим контроль концентрации
электролитов в плазме и суточного диуреза.
Выпускают во флаконах по 50,100, 200 и 400 мл.
ДИСОЛЬ4
Дисоль4 — это полиионный солевой раствор следующего состава: натрия хло¬
рида - 600 мг, натрия ацетата — 200 мг (ионы натрия — 127 ммоль/л. ионы хло-
Р® ~ ЮЗ ммоль/л, ионы ацетата — 24 ммоль/л). Теоретическая осмолярностъ —
254 м0см/л. Слабощелочная реакция.
Препарат восстанавливает водно-электролитное и кислотно-щелочное равно-
весие в организме при обезвоживании различного генеза. препятствует развитию
'^’’иболического ацидоза, усиливает диурез.
Ж KAW>r«OWITWWC#y3HOnSnW
Показания к применению: регидратация и коррекция гиперкалиемии
НШасмдствне обезвоживания (упорной диареи, рвоты при холере, острой ***
терми і нишевых токсикоикфекций).
Противопоказание: повышенная чувствительность к компонентам прела
Введение внутривенное капельное со скоростью 40-120 в минуту до но^*
вдн| показателей электролитного баланса.
Препарат применяют под контролем концентрации электролитов в п
І определения баланса введенной и потерянной жидкости (каждые 6 ч). Лаз“*
Выпускают во флаконах по 400 и 200 мл. Хранят при комнатной температи
Раствор Рингера
Предложен І 1882 г. английским физиологом S. Ringer. Содержит хп
ивгрия - 8,6 r/л, хлорид кальция - 330 мг/л, хлорид калия - 300 мг/л, чтосоот^
ствует 147 ммоль ионов натрия, 2,25 - ионов кальция и 155,6 ммоль ионов кал!Г
Раствор Рингера показан к применению в следующих случаях,
і 6 качестве плазмозамещающего средства при шоке, коллапсе, ожогах, обм
рожениях, длительной рвоте, диарее при отсутствии необходимости В Воз
мещеним эритроцитов,
і Для коррекции водно-электролитного баланса при остром разлитом перито
ните и кишечной непроходимости, кишечных свищах,
в При дегидратации различной этиологии.
в При метаболическом алкалозе, сопровождающемся потерей жидкости.
Противопоказания:
і гипернатриемия;
і гаперхлоремия;
I ацидоз:
• хроническая сердечная недостаточность:
• отек легких;
I отек мозга:
в хроническая почечная недостаточность;
і гиперволемия;
і сопутствующая терапия глюкокортикоидами;
І гиперчувствительность к компонентам препарата.
Режим дозирования - внутривенно капельно со скоростью 60-80 капель/мин
или струйно. Суточная доза для взрослых — 5-20 мл/кг массы тела, при необходи¬
мости может быть увеличена до 30-50 мл/кг. Суточная доза для детей 5-10 мл/кг
массы тела, скорость введения 30-60 капель/мин. Курс лечения 3-5 дней.
Раствор Рингера-Локка
Содержит натрия хлорида 9 г/л, натрия гидрокарбоната, кальция хлорида
І калия хлорида по 0,2 г/л, глюкозы 1 г. Имеет более физиологический состав,
чем изотонический раствор натрия хлорида.
Показания к применению:
і обезвоживание и интоксикация организма при различных заболеваниях
(острая дизентерия, пищевая токсикоинфекция, холера Эль-Тор и др.):
і острые циркуляторные нарушения, сопровождающиеся дегидратацией;
І ожоги;
• геморрагический, операционный, послеоперационный шок;
• перитонит;
• диарея различного происхождения.
Раствор готовят перед употреблением с соблюдением всех условий, необходи¬
мых для приготовления инъекционных растворов.
Раствор Рингер лактата
Раствор содержит натрия хлорида 6 г/л, калия хлорида 400 мг/л, кальция
гексагидрата 270 мг/л, натрия лактата 3,2 г/л, оказывает подщелачивай#8
действие.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ
ци ври выраженной гиповолемии и дегидратации при нормальном КЩР
^абом ацидозе, для поддержания объема эстрацеллюлярной жидкости
и после хирургического вмешательства, для начального лечения при эиа-
кровопотере. шоке, травмах.
показания: тяжелые нарушения функции печени, острая почечная недр-
отек легких, алкалоз, лактат-ацидоз, гипертоническая дегидратация.
,1*Нв следуй применять при тяжелом дефиците ионов натрия, калия, кальция,
режим дозирования: вводят внутривенно в дозе до 2500 мл/сут, средняя схо-
введения 2,5 мл/кг или 60 капель/мин, при неотложных состояниях до
Цапель/мин. Количество применяемого раствора зависит от состояния пациента,
раствор Рингер лактата по Хартману (натрия лактат раствор сложный)
раствор содержит калия хлорид, кальция хлорид, натрия хлорид, натрия
легат. Оказывает регидратирующее и дезинтоксикациоиное действие, нор*
' лизует КОС. восполняет дефицит ОЦК, стабилизирует водный и электро-
а^ный состав крови. Ускоряет выведение Li' и салицилатов. Осмолярность
іствора 290 мОсм/кг.
Показания к применению: гиповолемия, изотоническая дегидратация, метабо-
іический ацидоз.
Противопоказания: гиперчувствительность, гиперволемия, гипертоническая
дегидратация, гиперкалиемия, гипернатриемия, артериальная гипертензия, сер¬
дечная или почечная недостаточность, гиперхлоремия, алкалоз, печеночная недо¬
статочность, гиперлактатацидемия. С острожностью при дыхательной недостаточ¬
ности. острой дегидратации, лечении ГКС.
Способ применения и дозы: внутривенно капельно, взрослым средняя суточная
доза I л, детям - 20-30 мл/кг, максимальная суточная доза - 2.5 л.
і ЛАКТОСОЛ*
Полиионный раствор со сбалансированным содержанием электролитов сле¬
дующего состава:
• натрия хлорида — 620 мг;
• калия хлорида — 30 мг;
• кальция хлорида — 16 мг;
• магния хлорида — 10 мг;
• натрия лактата — 336 мг;
• натрия гидрокарбоната — количество, необходимое для доведения pH раст¬
вора до 6,0-8,2.
Теоретическая осмолярность — 294 мОсм/л. Количество ионов натрия -
140 ммоль/л, калия — 4 ммоль/л, кальция - 1,5 ммоль/л, магния - 1 ммоль/л,
хлора -115 ммоль/л, лактата — 30 ммоль/л, бикарбоната - 3,5 ммоль/л.
Лактосол * компенсирует нарушение водно-электролитного баланса с одновре¬
менной коррекцией метаболического ацидоза путем увеличения буферной емкости
крови при превращении в организме лактата натрия в бикарбонат. В результате
полученной гемодилюции и снижения вязкости крови улучшаются реологические
свойства крови и периферическая перфузия тканей.
При применении в достаточных количествах раствор оказывает дезинтокси-
юционное и гемодинамическое действие, повышает диурез и усиливает действие
осмотических диуретиков.
Препарат применяют при острых циркуляторных нарушениях, сопровождаю¬
тся дефицитом экстрацеллюлярной жидкости или дегидратацией в сочетании
с метаболическим ацидозом.
Раствор противопоказан при алкалозе (особенно декомпенсированном); во всех
Щрт, когда не показано введение в организм больших количеств жидкости
(закрытая травма черепа, декомпенсация сердечной деятельности, отек легких,
0стРая дегидратация и др.); при терапии глюкокортикоидами.
47В ШЧССКАЯ ТРАНСФУЗИОЛОГИЯ
Рекомендуют ограничивать объем инфузий препарата при почечной не
точности, ожогах дыхательных путей, у лиц пожилого и старческого возраст0^'
Раствор вводят внутривенно струйно или капельно в зависимости от клинич
го состояния больного. Средняя скорость введения — 70-80 мл в минуту Cnecit0-
дон для взрослого 1100-500 мл/сут. Максимальная суточная доза І зооо йЙР
При травматическом шоке раствор вводят в дозе от 1 до 3 л в зависим
от стадии шока вначале струйно, при улучшении гемодинамических показа ІЙ
переходят на капельный режим введения. Телей
Лактосол J используют при ожоговой болезни в дозе от 400 мл до 3 л в зав
мости от ее периода. си~
При острых циркуляторных нарушениях в результате тяжелых гнойно-хип
гичесхих осложнений (панкреатита, перитонита, сепсиса) препарат примен
в течение 3-4 дней до 2-4 л в сутки. ЯЮт
В предоперационном, операционном или послеоперационном периоде ввол
от 0,5 до 3 л раствора в зависимости от степени локальной травмы и кровопотери
При компенсации метаболического ацидоза доза препарата зависит от степени
ацид отеческого сдвига. При умеренно выраженном сдвиге достаточно 400 мл рас¬
твора, при глубоком ацидозе вводят препарат в объеме 1600 мл и более. Инфузия
400 мл раствора приводит к увеличению буферной емкости крови на 1-1,5 мЭкв/л
Возможные осложнения:
І содержащиеся в растворе ионы калия могут оказать негативное влияние
на пациентов с заболеваниями почек и недостаточностью надпочечников-
я с раствором Рингера* несовместимы компоненты крови и ряд лекарственных
веществ вследствие способности взаимодействовать с ионами кальция в рас¬
творе (табл. 15-10).
Таблица 15-10. Лекарственные средства, несовместимые с раствором Рингера*
Несовместимость
полная
относительная
Компоненты крови
Амикацин
Тиопвнтал-натрий
Азлоциллин
Этиловый спирт
Орнидазол
Кислота аминокапроновая
Клиндамицин
Цефамандол
Норадреналин
Амфотерицин В
Маннитол
Метилпреднизолон
Нитроглицерин
Натрия нитропруссид
Анаприлин
Циклоспорин
Ванкомицин
Вазопрессин*
Урокиназа
Прокаин
Выпускают во флаконах по 400 мл. Хранят при комнатной температуре.
При транспортировке допускается замораживание.
ТРОМЕТАМОЛ (ТРИСАМИН*)
Парентеральное средство для коррекции ацидоза. Представляет собой белое
кристаллическое вещество, легкорастворимое в воде. Водный раствор трометамо
ла (в концентрации 3,66%) изоосмотичен плазме крови, pH 10,2-10,7.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 471
метамол — буферное вещество, связывающее ионы водорода органических
ТР° аНИоны которых затем либо трансформируются, либо пополняют щелоч-
кН^'раы. Введенный внутривенно трометамол снижает концентрацию ионов
рР® JI крови (т.е. повышает ее pH, устраняет ацидоз). Препарат способен
кать через клеточные мембраны и устранять внутриклеточный ацидоз
APUOTUUOrwnP TIMUnPTUUPrvnP ПРМГТПЫО Uannauun DtionniiTTC
также осмотическое диуретическое действие. Медленно выводится
°ка3ганизма* в основном почками.
п «меняют для коррекции метаболического ацидоза любого происхождения
Ша „una гиппкгии. шока, мяггивных пепеливаний КППТШ ПГТППРП пан-
(звоживания, гипоксии, шока, массивных переливании крови, острого пан
II
с^узии трометамола показаны во время реанимации и в послереанимационном
^ п/члл tJOmnoTTOlITin ОШІПЛОО ТПЛИЛ П лппл ТТОГУП ІТОІГЛІІМІІЛ
1 атнта и др.). лечения острых отравлений слабыми кислотами (барбитуратами,
"лиоилатами и
v для быстрого устранения ацидоза. Трометамол обладает гипогликемиче-
^ствием, поэтому его назначают при лечении диабетического ацидоза.
f противопоказания:
почечная недостаточность (выраженные нарушения вьщелительной функции);
, дыхательная недостаточность, сопровождаемая хроническим респиратор¬
ным ацидозом;
, возраст до 1 года.
трометамол может приводить к снижению содержания электролитов, острому
уменьшению ионизированного кальция, потерям натрия и калия.
Препарат в виде 3,66% раствора используют для внутривенного капельного
„да струйного введения. Средняя доза для больного с массой тела 60 кг - 500
мл/ч (около 120 мл в минуту). Максимальная доза — 1,5 г/кг массы тела в сутки.
Необходимое количество трисамина может быть определено по формуле;
количество раствора (мл) = BE (мЭкв/л) х масса тела (кг).
Максимальная доза препарата не должна превышать 1,5 г/кг массы тела
в сутки.
Повторные введения допустимы лишь через 2-3 сут. Если необходимо более
частое использование препарата, то следует уменьшать его дозу.
При использовании больших доз перед употреблением к трометамолу следует
добавить (в расчете на 1 л) 1,75 г хлорида натрия, 0,372 г хлорида калия и 5-10%
раствор глюкозы* с инсулином (1 ЕД инсулина на 4 г сухой глюкозы*) в дозе
10-15 мл/кг массы тела.
При передозировке трометамола может развиться алкалоз, приводящий к угне¬
тению дыхания и даже к его остановке. Могут возникать гипогликемия, гипото¬
ния, тошнота, рвота, местные реакции в виде флебитов.
Выпускают в полиэтиленовых емкостях по 250 мл. Хранить следует в прохлад¬
ном, защищенном от света месте.
ТРОМЕТАМОЛ Н*
Цель терапии трометамолом Н* заключается в снижении концентрации ионов
водорода путем введения соединений, действующих в качестве акцепторов Н\
каковым и является трометамол.
Использование принципа терапевтического действия трометамола показано
8 тех случаях, когда введение ионов Na+, связанное с отдачей гидрокарбоната,
нежелательно для электролитного баланса, а также при дыхательном ацидозе,
11 котором введение гидрокарбоната увеличивает парциальное давление угле-
Р°Дн диоксида. 1 моль трометамола нейтрализует 1 моль Н2С03 и предосгавля-
°рганизму 1 моль гидрокарбоната. Благодаря этому парциальное давление
°ксида углерода и концентрация ионов водорода снижаются без привлечения
HiMenf ЛЄГКИХ' Таким образом, трометамол можно применять при дыхательном
472 ШШёсш трансфузиология
Тромета.мол и трометамол Н* выводятся почками в неизмененном виде-
из организма выводится 75%. Трометамол подвергается клубочковой <Ьи 4^>ез®1
и не подвергается канальцевой реабсорбции, в связи с чем он, как и
диуретики, увеличивает диурез и быстро выводится из организма. Это де^тп ^
мггамола на функции почек полезно при метаболическом ацидозе и олигу^6^
Показания к применению - тяжелые формы метаболического и дым™
ацидозов в следующих клинических ситуациях: Лького
I послеродовые ацидозы;
• трансфузионный ацидоз в результате длительной гемотрансфузии-
1 клеточный ацидоз при гипергликемической коме;
I тяжелые ожоги;
I шок:
І использование экстракорпорального кровообращения в сердечной хитт
• отек головного мозга; ^Ии;
• тяжелые формы токсического отека легких;
I функциональная послеоперационная почечная недостаточность:
I отравление барбитуратами, салицилатами и метиловым спиртом.
Противопоказания:
І повышенная чувствительность к компонентам препарата;
I алкалозы;
• тяжелая почечная недостаточность;
• хроническая компенсированная дыхательная недостаточность (эмфизема
легких):
I шок в терминальной стадии;
• гипергидратация;
• гипокалиемия;
1 гипонатриемия;
І дети до 1 года.
С осторожностью применяют при умеренной почечной или печеночной недо¬
статочности, Назначение препарата во время беременности и в период лактации
возможно только в том случае, если предполагаемая польза для матери превышает
возможный риск для плода или ребенка.
Препарат предназначен только для внутривенного введения путем длительной
капельной инфузии в течение не менее 1 ч. При необходимости введения во вто¬
рые и последующие сутки дозу следует уменьшить.
Первоначальную дозу устанавливают в зависимости от степени тяжести имею¬
щегося ацидоза. Необходимое количество трометамола Н* рассчитывают из вели¬
чины избытка основания (BE) и массы тела:
1 мл трометамола Н‘ = BE (мМ/л) х масса тела (кг) х 2.
Коэффициент 2 получен в результате уменьшения буферной емкости после
добавления 100 мМ ацетата в литрах.
Если нет технических условий для определения кислотно-щелочного состоя¬
ния. то при клинических показаниях можно провести слепое буферирование тро-
метамолом Н*. В этом случае средняя доза для взрослых составляет 5-Ю ДО
трометамола Н4 на 1 кг массы тела в час, что соответствует 500 мл/ч. Суточная
доза і 1000-2000 мл. Суточная доза для детей от 1 года составляет 10-20 мл/кг
массы тела. Максимальная доза - 1,5 г/кг в сутки.
При использовании высоких доз рекомендуют во избежание уменьшения кон
центрации электролитов в крови добавить натрия хлорид и калия хлорид из рас
чета 1,75 и 0,372 г на I л 3,66% раствора соответственно.
Если есть опасность развития гипогликемии, рекомендуют одновременно вв
лить 5-10% раствор декстрозы с инсулином из расчета 1 ЕД инсулина на 4 г сухо
глюкозы4.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЙ 473
дпи слишком высокой скорости инфузии могут наблюдаться раздражение сте-
вен и гемолиз, снижение артериального давления, гипокалиемия. веноспазм,
*°!иожен тромбофлебит. При дыхательном ацидозе вливание трометамола Н*
омендуют при условии проведения искусственной вентиляции легких.
1*«рИ передозировке возможны общая слабость, артериальная гипотензия,
_етение дыхания, гипогликемия, нарушение водно-электролитного баланса
^слотно-щелочного равновесия.
* при смешивании в одном контейнере с другими лекарственными препаратами
возможно образование осадка в смеси, может наблюдаться помутнение или опа-
ВсСценция, что делает невозможным парентеральное введение комбинированных
njCTBOpOB.
Усиливает эффект наркотических анальгетиков и ослабляет эффект непрямых
антикоагулянтов, барбитуратов и салицилатов.
Большинство электролитных растворов могут вводиться как в центральные.
К и периферические вены. Скорость введения и объемы диктуются чаще всего
клинической ситуацией. Более подробно указано в инструкциях по применению
препаратов.
ТРИСОЛЬ*
Трисоль* — это комбинированный полиионный препарат, состоящий из сле¬
дующих солей:
• натрия хлорида - 5 г;
I калия хлорида — 1 г;
І натрия гидрокарбоната — 4 г (на 1 л раствора).
Раствор содержит: ионы натрия — 133 ммоль/л, калия - 13 ммоль/л,
хлора - 98 ммоль/л, бикарбоната - 48 ммоль/л. Теоретическая осмолярность -
292 мОсм/л. Раствор имеет слабощелочную реакцию.
Уменьшает гиповолемию, сгущение крови и метаболический ацидоз, улучшает
капиллярное кровообращение, функциональную способность сердца и почек, ока¬
зывает дезинтоксикационное действие.
Показания к применению:
І лечение больных холерой, острой дизентерией и пищевой токсикоинфекци¬
ей для устранения или уменьшения явлений обезвоживания и интоксикации
организма;
І потери воды и электролитов при патологии желудочно-кишечного тракта
(свищах, дренажах, перитоните, панкреатите и т.п.) и форсированном диу¬
резе;
і изотоническая дегидратация в сочетании с гипокалиемией и метаболическим
ацидозом.
Противопоказания;
• гипергидратация;
• алкалоз;
• гиперкалиемия.
Трисоль* применяют внутривенно струйно или капельно. Общее количе¬
ство вводимого раствора должно соответствовать объему жидкости, потерянной
с испражнениями, рвотными массами, мочой и потом. Баланс потерянной и вве¬
денной жидкости определяют каждые 6 ч.
При тяжелых формах заболевания препарат вводят струйно с последующим
Переходом на капельное введение. Предназначенный для введения раствор дол-
*е» быть подогрет до 38-40 °С. Препарат вводят под контролем лабораторных
исследований.
Выпускают во флаконах по 500 мл. Хранят при комнатной температуре.
474 клмгссмтдоэиология
мдеоль*
Адесоль* 1 полиионный препарат, состоящий из следующих солей-
і натрия ацетат - 2 г,
• натрия хлорид - 5 г,
і калия хлорид - 1 г (на 1 л раствора).
Раствор содержит ионы натрия - 110 ммоль/л, калия - із ммоль/
99 ммоль/л. ацетата - 24 ммоль/л. Теоретическая осмолярность - 246 ХЛОрз >
Раствор имеет слабощелочную реакцию. м0см/д
Уменьшает гивюволемию. сгущение крови и метаболический ацидоз v
капиллярное кровообращение, функциональную способность сердца и по Л^П1,а*г
зывает дезивтоксикационное действие. чек’ °*а-
Ацесоль* применяют в качестве средства, устраняющего или уменш';
явления обезвоживания и интоксикации организма. аЮщего
Противопоказания.
I гипотоническая ^гидратация;
г гиперкалиемия;
І гиоергидратация.
Ацесоль* применяют внутривенно струйно или капельно. Общее КОЛИ
ство вводимого раствора должно соответствовать объему жидкости, потертий
с испражнениями, рвотными массами, мочой и потом. Баланс потерянной в вве
денной жидкости определяют каждые 6 ч.
При тяжелых формах заболевания препарат вводят струйно с последующим
переходом на капельное введение. Предназначенный для введения раствор дол¬
жен быть подогрет до 38-40 *С. Препарат вводят под контролем лабораторных
исследований.
Выпускают во флаконах по 500 мл. Хранят при комнатной температуре.
хлосоль*
Хлосоль* - солевой раствор, в 1 л которого Содержится;
І натрия ацетата - 3,6 г;
• натрия хлорида - 4,75 г;
і калия хлорида - 1,5 г.
Препарат содержит: ионы натрия - 120 ммоль/л, калия - 23 ммоль/л, хлора -
104 ммоль/л, Теоретическая осмолярность - 286 мОсм/л. Раствор имеет слабо¬
щелочную реакцию.
Хлосоль* оказывает дезинтоксикационное и гемодинамическое действие, повы¬
шает диурез, улучшает реологические свойства крови.
Хлосоль* применяют при дегидратации и интоксикации организма, возникаю¬
щих при различных заболеваниях (острой дизентерии, пищевой токсикоинфек-
ции, холере и др.).
Противопоказания:
І ншергидратация;
• алкалоз;
І гиперкалием ия.
Хлосоль* вводят внутривенно струйно или капельно. Перед употреблением
раствор подогревают до 36-38 *С. Общее количество вводимого раствора дол*’
но соответствовать объему жидкости, потерянной с испражнениями, рвотными
массами, мочой и потом. Баланс потерянной и введенной жидкости определяют
каждые 6 ч.
При тяжелых формах заболевания препарат вводят струйно с последую®*®
переходом на капельное введение. Препарат вводят под контролем лабораторн
исследований.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 475
__оДЬ. выпускают во флаконах по 100,200 и 400 мл. Хранят при комнатной
л#т»соЛЬ‘
* итасояь* - инфузионныи электролитный раствор, который содержит ноны:
^Ешия - МО ммоль/л;
*їїв:~5*в»опъ/л;
* йльЦИЯ-2'5ммолУл:
' „аОИЯ-1.5 ммоль/л;
* хлорид3 -103,0 ммоль/л;
' ^дата-^Мммоль/л.
катионный состав раствора и содержание ионов хлора соответствуют электро¬
ду составу плазмы, pH раствора - 6,0-7,5.
иитасоль* купирует метаболический ацидоз, нормализует кислотно-щелоч-
состОяиие, стабилизирует водный обмен и электролитный состав крови.
Состав препарата включен ион ацетата, который быстро метаболизируется
^образованием бикарбоната,
йиягасоль* применяют у взрослых и детей как компонент инфузионной терапии:
, при комплексном лечении шока, термической травмы и острой кровопотере;
*, гипотонической и изотонической формах гипогидратации и метаболическом
ацидозе у тяжелобольных;
• для коррекции водного и солевого баланса при остром разлитом перитоните
и кишечной непроходимости;
• для лечения пациентов с кишечными свищами при декомпенсации электро¬
литных нарушений;
» у больных с острыми кишечными инфекциями при обезвоживании и мета¬
болическом ацидозе;
» при лечебном плазмаферезе;
, диализно-фильтрационных методах.
Квинтасоль4 обладает небольшим непродолжительным волемическим действием.
Применение квинтасоля4 противопоказано:
• при алкалозе;
• гипертонической дегидратации, в случаях, когда противопоказано введение
больших объемов жидкости.
Квинтасоль4 применяют внутривенно капельно со скоростью 60-80 капель/мин
для взрослых и 30-60 капель/мин для детей. У взрослых допускается струйное
введение. Суточная доза для взрослых - 5-20, для детей - 5-10 мл/кг массы тела.
Курс лечения обычно составляет 3-5 дней.
При лечебном плазмаферезе квинтасоль4 вводят в двукратном объеме по срав¬
нению с удаленной плазмой (1200-2400 мл) в сочетании с коллоидными раство¬
рами в случае выраженной гиповолемии.
Квинтасоль4 выпукают во флаконах по 50,100, 200 и 400 мл. Хранят в сухом
месте при температуре от +10 до + 25 °С. Допускается кратковременное заморажи¬
вание во время транспортировки.
Препарат применяют только в условиях стационара.
ИАФУСОЛ4
Мафусол — солевой инфузионный раствор, основным фармакологически актив-
ным компонентом которого является фумарат натрия. В состав препарата входят
1а*е Шриды натрия, калия и магния. Осмолярность мафусола - 400-410 мОсм/л.
Обладает выраженным антигипоксическим действием, которое обеспечивается
тератом натрия. Фумарат натрия — природное вещество, содержащееся во всех
^леткал организма с аэробным типом дыхания. Это соединение, подобно лактату
а1йТатУ натрия, способствует ликвидации ацидемии путем химической нейтра-
ИВ
479 10*НГ€СШТРЛИСФУЭИ0Л0ГИЯ
аттш кислых продуктов метаболизма. Однако преимущество фумарэта
яппш и ацетатом заключается в том, что он метаболизируется и
япоксии, его утилизация сопровождается образованием АТФ. За счет своей^0**
ярюсти мафусол* быстро восполняет объем циркулирующей ЖИДКОСТИ пп °СЦо"
аашопеских состояниях, предотвращает дегидратацию тканей. Препарат 1ЙП°“
МИГ вязкость крови и улучшает ее реологические свойства. Инфузии ма&г^'
ВИЖИТГ-щпн количестве оказывают гемодинамический эффект, повыша^0^*
рд, способствуют активации дезинтоксикационных процессов, снижают ко ДИу*
трацию продуктов переписного окисления липидов в крови, ЧТО свидетельств
об антиоксидантних свойствах препарата.
Безвреден, нетоксичен, не накапливается в организме, а полностью метабол
руется. Не вызывает аллергических реакций. Изи
Показания к применению:
• гиповолемические И ГИПОКСИЧЄСКИЄ СОСТОЯНИЯ различной ЭТИОЛОГИИ у др Г
и взрослых (кровопотеря, шок, травмы, ожоги, интоксикации); Те"
• острые нарушения мозгового кровообращения, протекающие по ишемии
скому и геморрагическому типу (у взрослых);
• в качестве компонента перфузионной смеси для заполнения контура аппа¬
рата искусственного кровообращения при кардиохирургических операциях
у взрослых и детей.
Противопоказание: во всех случаях, где противопоказано внутривенное введе¬
ние больших объемов жидкости. Побочные действия не отмечены.
Способ применения и дозы: у детей - 20-25 мл/кг массы тела, при тяжелых
интоксикациях - 30-35 мл/кг массы тела.
У взрослых до 2-3 л при шоке, вначале струйно, при нормализации показателей
гемодинамики капельно (внутривенно или внутриартериально).
Выпускают в бутылках по 400-450 мл или в полимерной упаковке по 100,200,
250,500 мл. Хранят при температуре от 0 до +25 °С. Допускается замораживание!
Срок годности - 2 года.
КРОВЕЗАМЕНИТЕЛИ ГЕМ0ДИНАМИЧЕСК0Г0
(ПРОТИВОШОКОВОГО) ДЕЙСТВИЯ
Из всех существующих средств для быстрого восстановления внутрисосудисто¬
го объема наиболее эффективными считаются гетерогенные коллоидные раство¬
ры, обладающие выраженным гемодинамическим (противошоковым) действием.
Препараты этого ряда называют еще плазмозамещающими раствораш. Ос¬
новная задача препаратов гемодинамического действия — заполнять кровеносное
русло и обеспечивать поддержание на необходимом уровне артериального давле¬
ния, нарушенного в результате кровотечения или по другим причинам.
Коллоидные инфузионные растворы — водные растворы крупных молекул,
масса которых превышает 10 000 Да. Эти молекулы плохо проникают через
эндотелий капилляров, поэтому коллоидные растворы повышают онкотическое
давление плазмы. Весь объем введенного коллоида остается в кровеносном русле,
что приводит к большему увеличению ОЦК, чем при использовании кристаллои¬
дов. Эффект увеличения ОЦК временный, его выраженность и продолжительность
зависят от типа коллоидного раствора.
Препараты гемодинамического действия в зависимости от компонента, состав¬
ляющего их основу, разделены на несколько групп (табл. 15-11):
• альбумин человека различной концентрации (естественный коллоид);
• растворы на основе желатина;
І растворы на основе декстранов;
• растворы на основе гидроксиэтилированнбго крахмала.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ Щ Щ
Препараты гемодинамического действия
iS'W" ——
Коллоиды
искусствеині и
Декстран I Гидроксиэтилкрахмал 1 Полизтилонпииояь
Полиглюкин* Вдлекам'
Полиоксидин*
Макродекс*
По лиоксифу марли*
Полифер» ХАЕС-стерил* 3,6.10%
Инфукол ГЭК* 6,10%
Гелоплазма
баланс
Реоглюман*. Стабизол ГЭК*
Реомакродекс* [рефортан ГЭК* 6.10%
Лонгастерил* 40 Гемохес* 6,10%
Волювен*.
Венофундин.
Волюлайт.
Тетраспан 6,10%.
IГиперхаес
(^гётические коллоиды (растворы модифицированного желатина, декстраны
ппоксиэтилированные крахмалы) представляют собой смеси молекул с разной
"Пекулярной массой (полидисперсные коллоиды).
К современным коллоидным препаратам предъявляют следующие требования:
оптимальная плазмозамещающая способность, т.е. коррекция и поддержа-
I „ие код и внутрисосудистая персистенция макромолекул;
• модулирующее действие на каскадные системы свертывания и синдром
системной воспалительной реакции (ССВР);
• влияние на лейкоцитно-эндотелиальные взаимодействия, т.е. на микроцир-
, хуляцию; о ‘
• максимальная безопасность, минимальный риск неблагоприятных, прежде
всего анафилактоидных, реакций.
Коллоидные растворы отличаются следующими особенностями:
• 'концентрация натрия в пределах 130-155 ммоль/л;
• КОД, обусловленное субстанциями большой молекулярной массы;
• способность удерживать жидкость в сосудистом русле;
• способность поддерживать или увеличивать ОЦК;
• более медленное, чем у кристаллоидов, выведение через почки;
» значительно более продолжительный, чем у кристаллоидов, волемический
эффект.
Способность поддерживать гемодинамическое состояние обусловлена в основ¬
ном плазменной частью крови, которая представляет собой 7-8% коллоидный
раствор смеси белков: альбумина, альфа-, бета- и гамма-глобулинов, фибриноге¬
на, а также их комплексов с липидами и углеводами. Кровезаменители гемодина-
мического действия используют для замещения данной функции плазмы, поэтому
еще их называют плазмозамещающими растворами, или плазмозаменителями.
Они обладают физико-химическими и биологическими характеристиками, близ¬
или к свойствам плазмы крови.
Основная задача препаратов гемодинамического действия — заполнять крове¬
носное русло и поддерживать на необходимом уровне АД, нарушенное в резуль-
тате кровотечения или по другим причинам. Основными характеристиками этих
препаратов являются объемный эффект и его продолжительность:
• максимальное объемное действие (объемный эффект) — первоначальное
максимальное возмещение объема циркулирующей жидкости в процентах
объема введенного препарата без учета вторичных эффектов;
• продолжительность объемного действия — промежуток времени, в течение
которого сохраняется по меньшей мере 100% возмещение объема циркули¬
рующей жидкости в процентах объема введенного препарата;
м
47t иш*чиж»імнс«¥зиалогия
i продолжительность половинного объемного действия — промежуток
НИ. В течение которого сохраняется ПО меньшей мере 50% возмещение8***6'
Ц циркулирующей жидкости в процентах объема введенного препаиа
Природный коллоидный раствор альбумина человека считается «золотым*
даром» дм искусственных коллоидов. <*н-
Рекомендации В. Landauer (1980):
I коллоидные растворы следует Применять ТОЛЬКО в концентрации, При кот
их осмотическое действие будет равно осмотическому давлению плазмы киТ*
і должны составлять не более 50% всего вводимого объема кровезамещаюш11’
средств; 1>
І не должны существенно влиять на реакцию агглютинации при определен»
группы крови; нии
• вязкость кровезаменителя должна быть Достаточно низкой, чтобы не созла
вать для сердца дополнительной нагрузки;
« трансфузиям всех коллоидных растворов обязательно должна предшество*
вать биологическая проба.
Показания к введению коллоидных растворов:
• лечение выраженной гиповолемии и шока (первичное восполнение ОЦК
при кровотечении, травме и сепсисе);
• использование кровосберегающих «технологий — намеренная нормоволемн-
ческая гемодилюция или компонентное кровевосполнение;
• профилактика относительной гиповолемии во время спинальной и эпиду-
ральной анестезии;
• первичное заполнение аппарата исскуственного кровообращений (ИК). ,
Искусственные коллоиды
Идеальный препарат для замещения плазмы и восстановления объема циркули¬
рующей жидкости должен отвечать следующим требованиям:
• быстро возмещать потерю объема циркулирующей крови;
• восстанавливать гемодинамическое равновесие;
• нормализовывать микроциркуляцию;
« достаточно долго находиться в кровеносных сосудах;
• улучшать реологию циркулирующей крови;
• улучшать доставку кислорода и других компонентов, а также тканевый обмен
и функционирование органов;
• легко метаболизироваться, не накапливаться в тканях, легко выводиться
І хорошо переноситься;
• оказывать минимальное воздействие на иммунную систему.
Использование искусственных коллоидов практически полностью исключа¬
ет инфицирование реципиента. Они сравнительно дешевы и весьма стабильны
при хранении, а при клиническом применении обладают достаточно низким уров¬
ням нежелательных побочных реакций. Помимо основного объемзамещающего
действия, синтетические коллоидные растворы улучшают реологические свойства
крови и микроциркуляцию, что улучшает обеспечение тканей кислородом.
Для количественной оценки объемного действия коллоидных растворов
используют различные методы, в большинстве своем основанные на определении
степени разведения маркеров: гемоглобина, гематокритного числа, эритроцитов,
маркированных флюоресцеином или радиоактивным хромом, красителя, альоу
мина, а также измерения показателей вязкости и плотности плазмы.
Молекулы синтетического коллоида т vivo подвергаются расщеплению и элими
нации. Скоростью этих процессов и определяется длительность объемзамещаюше
действия препарата. Более мелкие молекулы в определенных пределах создают бол
ЙИСОУОС коллоидное осмотическое давление; чем крупнее молекулы, тем они быстр
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 479
дпуются почками. Более крупные молекулы при расщеплении на более мел*
создают вторичный объемный эффект, обеспечивающий длительное
ф T^npffliiinmee действие. У больных с геморрагическим шоком выраженный объ-
•^аіюіощий эффект после вливания коллоидного раствора вызывает увеличение
й^^кровотока и ускоренное выведение действующего вещества.
надежность действия синтетических коллоидов сочетается с относитель-
локим уровнем побочных реакций. Им всем свойственны следующие качества:
f Оіособность задерживаться на длительный срок в клетках ретикулоэндоте-
* яйльной системы;
выраженное в той или инои степени влияние на систему свертывания крови;
У действие на функции почек;
способность вызывать реакции непереносимости (в исключительно редких
случаях).
цели молекулы альбумина имеют одинаковую молекулярную массу (моноди*
мереный коллоид), то синтетические коллоиды (желатины, декстраны, крахма-
^представляют собой смеси молекул с разной молекулярной массой (полиди-
аерсные коллоиды). Средней молекулярной массой таких коллоидов считается
їщиая масса всех молекул, деленная на их количество (MWJ. Она имеет тенден¬
цию к искажению из-за присутствия очень крупных молекул, молекулярная масса
которых может, достигать 10 млн Да и вклад их в онкотический эффект очень неве¬
лик. MW представляет собой медиану средней массы большинства онкотически
активных частиц раствора, к которым относятся более мелкие.
Коллоиды увеличивают ОЦК в большей степени при гиповолемии, чем при нор-
моволемии, у больных в критическом состоянии длительность волемического дей¬
ствия КОЛЛОИДОВ уменьшена (табл. 15-12).
Таблица 15-12. Основные характеристики синтетических коллоидных растворов
Производные
Наименование
ММ, тыс.
Да/степень
замещения
ВЭ,%
Продолжи¬
тельность
В3,ч
КОД, мм
рт.ст.
Макс. суточ¬
ная доза,
мл/кг
Желатины
')Келатйноль4
20±5
60
1-2
16,2-21,4
40
Гелофузин*
30
100
3-4
33
200
Гелоплазма баланс4
45
100%
3-4
34
200
Декстран
Шлиглюкин4
60±10
120
4-6
58,8
20
Реополиглюкин4
30±10
140
3-4
90
12
Гидроксиэтил-
ХАЁС-стерил410%
200/0,5
145
3-4
68
20
крахмал
Инфукол ГЭК4 6%
200/0,5
85-100
4-6
33
Инфукол ГЭК410%
‘200/0,5
130-140
4-6
20
Гемохес4 6%
200/0,5
85-100
4-6
25-36
33
Гемохес410%
200/0.5
130-140
4-6
60-80
20
Рефортан4 6%
200/0,5
85-100
4-6
28
33
Рефортан410%
200/0,5
130-140
4-6
65
20
Стабизол ГЭК4 6%
450/0,7
85-100
6-8
18
20
Волювен4 6%
130/0,4
100
4-6
36
50
Венофундин4 6%
130/0,42
100
4-8
36
50
Волюлайт4 6%
130/0,4
100
4-6
36
50
Тетраспан4 6%
130/0,4
100
6
-
50
ГипврХАЕС4 6%
200/0,5
400-450
-
4
Ржание. ММ — молекулярная масса.
Ватины
С** производят из коллагеновой ткани (хрящей) крупного рогатого скота
термической деградации, гидролиза и сукцинирования. С помощью раз-
В9К КЛИИИЧСХАЯ ТЛНСЖУЗИОЛОГМЯ
личных методов получают короткие пептидные цепи, которые С ИСПОЛЬЗОВЗН
той ИЛИ ИНОЙ технологии объединяют В более Крупные модифицированные Уг
куляриые структуры. Основная часть желатина удаляется почками, неболы^
да» расщепляется пептидазами или удаляется через кишечник. Однако техно**
гмческие факторы ограничивают базовые свойства желатинов, поэтому дли^
щхп их объемного действия невелика. За это время не происходит существенно
воздействия ни на клетки ретикулоэндотелиальной системы, ни на общий урове^
иммунитета, ио на 2-3-й день после введения растворов желатина регистрируем
снижение концентрации фибронектина в плазме.
В российской клинической практике применяют два вида препарата желати-
на: желатиноль* и представитель модифицированных желатинов гелофузин* и
гелоплазма баланс*. Желатиноль* имеет нестабильную молекулярную массу -
25 000±5000 Да. волюмический эффект 60% и очень короткий период его под.
держания 1-2 ч.
У модифицированных желатинов (гелофузина) аминогруппы заменены карбо-
сильными, что изменяет конфигурацию молекул (гелоплазма баланс* тоже моди¬
фицированный желатин), увеличивая их линейные размеры. Эти изменения влияют
на стабильность молекулярной массы (30-45 кДа), увеличивают объемный эффект
до 100% и повышают длительность действия препарата до 3-4 ч. Модифицированные
жидкие желатины (МЖЖ) характеризуются более низким содержанием кальция,
что упрощает процедуру переливания крови после инфузий МЖЖ (профилакти¬
ка свертывания крови). Желатины растворены в 0,9% растворе натрия хлорида,
что при массивной инфузии может быть причиной большой натриевой нагрузки.
Гелоплазма баланс* - модифицированный желатин в сбалансированном растворе
электролитов, что позволяет избежать избыточной негрузки натрием и хлором.
Желатины в основной своей части выводятся с мочой, небольшая часть рас¬
щепляется пептидазами и удаляется через кишечник. Быстрое выведение почками
делает эти препараты осмотическими диуретиками. При почечной недостаточности
препараты группы желатина оказывают более продолжительное действие. В течение
первых 2 сут после переливания в моче пациентов могут обнаружить белок. Однако
даже повторные вливания не нарушают функции почек. У диализных больных
с нарушенной деятельностью почек также не обнаруживают признаков кумуляции
желатина. Более того, вызывая осмотический диурез, растворы МЖЖ обеспечивают
поддержание функций почек при шоке, способствуют снижению вязкости крови,
улучшению микроциркуляции. Препараты МЖЖ благодаря своим коллоидно¬
осмотическим свойствам предотвращают и снижают вероятность развития интер¬
стициального отека легких. Все плазмозамещающие средства на основе желатина
оказывают негативное влияние на систему гемостаза, замедляют тромбообразова-
кие и подавляют агрегацию эритроцитов, взаимодействуя с плазменным фактором
свертывания фон Виллебранда. Аллергия развивается очень редко. Невысокий
объемный эффект и непродолжительное объемное действие ограничивают область
применения растворов желатина. Основные показания для использования - гипо-
волемия при критических состояниях, увеличение ОЦК при вазодилатации. обу¬
словленной спинальной анестезией или общими анестетиками.
Суммарная доза, продолжительность и скорость инфузии зависят от объема
потери крови или плазмы крови, а также от состояния пациента. Низкая средняя
молекулярная масса находится ниже почечного порога фильтрации, так что рас-
поры МЖЖ относительно недолго циркулируют в сосудистом русле. Перкой
полувыведения сравним с таковым у декстрана*40, но короче, чем у декстрана-70
или гидроксиэтилкрахмала. В связи с этим применение больших объемов счи*
татя безопасным. Необходимо контролировать водно-электролитный баланс
организма; при необходимости проводят возмещение электролитов. Введение яр*'
парата может илнять на ряд лабораторных показателей; СОЭ, удельную плотность
основные СРЄДСТВА ТРАНС«УЭИОНН04М*УЗИОНИОГ С ПОСОБИЯ 491
результаты неспецифического определения белка (например, с помощью
f^fjotofO метода). Молекулярная масса растворов на основе модмфмциро
^^*елатнна близка к идеальной, а показатель полидисперсности более
к белку плазмы крови, чем у других искусственных коллоидов. Растворы
не оказывают неблагоприятных воздействий на коагуляцию, даже
^ «объемы инфузии превышают 4 л в сутки, и относятся к препаратам выбора
массивных кровотечениях. Дозирование препаратов 3-4% МЖЖ указано
Ш 15-13.
пи снижении гематокрита до уровня ниже 25% (для пациентов с сердечно-
лсудисгой или легочной недостаточностью — 30%) требуется вводить зритроци
ліпную массу.
раствор 3-4% МЖЖ можно применять одновременно с компонентами
и скорость и объем инфузии зависят от клинического состояния пациента.
Максимальная суточная доза определяется объемом потерянной крови или плаз
' крови, а также состоянием пациента.
При введении раствора 3-4% МЖЖ, как и других коллоидных плазмозамеща
юших препаратов, могут возникать аллергические (анафилактические анафилапс
иидиыс) реакции различной степени тяжести: крапивница, гиперемия кожи шеи
к лица, в редких случаях — снижение АД, бронхоспаэм, анафилактический шок,
остановка сердца и дыхания. Их частота от 1:6000 до 1:13 ООО случаев. Длявыяв-
1ения возможных анафилактических/анафилактоидных реакций первые 20-30 мл
препарата вводят медленно под врачебным наблюдением.
Таблица 15-13. Дозирование 3-4% или просто модифицированного желатина
Показания
Реешмендувим средня доза
Профилактика гиповолемии и артериальной гипо¬
тензии, лечение при легкой гиповолемии (например,
при умеренной кровопотере)
500-1000 мл на протяжении 1-3 ч
г-****"
Печение при тяжелой гиповолемии
1000-2000 мл
Критическая ситуация, угроза для жизни
Быстров введение 500 мл (под давлением), затем,
после улучшения параметров гемодинамики, проев-
дят инфузию раствора модифицированного жела¬
тина в количестве, эквивалентном дефициту объема I
плазмы крови
Гемодилюция (изоволемическая)
Объем вводимого 4% МЖЖ должен быть экви¬
валентен дефициту плазмы крови, но не более
чем 200 мл/кг в сутки
Экстракорпоральное кровообращение
?1РОф*ілактика и коррекция гиповолемии при спи-
Мр и эпидуральной анестезии
Доза зависит от используемой системы циркуляции,
но обычно составляет около 500-1500 мл
500-1000 мл внутривенно капельно
С особой осторожностью следует применять раствор 4% МЖЖ при:
* гипернатриемии — вместе с раствором вводят дополнительный натрий;
* состояниях дегидратации — в этих случаях в первую очередь требуется кор¬
рекция водного баланса;
* нарушении свертывания крови (введение препарата влияет на факторы свер¬
тывания);
* почечной недостаточности (может быть нарушена элиминация препарата);
* иронических заболеваниях печени (препарат может влиять на синтез альбу-
.*ина и факторов свертывания).
^ Раствор 4% МЖЖ содержит мало кальция (<0,4 ммоль/я), поэтому не вызыы-
'^Ртывания крови; можно применять как растворитель для инсулина.
Щ КЛИНИЧЕСКАЯ ТМНСФУЗИОЖХИЯ
ЖЕЛАТИНОЛЬ *
Жемтиколь 11 8% раствор полипептида, получаемого из коллагена
рогатого скота, в 0,9% растворе натрия хлорида. Средняя молекулярная ^jg|
оті
атр
Величина объемного действия - 60%, продолжительность - 1- 2 ч. Через | М )1ь
20 000t5000 Да, теоретическая осмолярность — 371 мОсм/л, pH 6,8-7 4 ml** '
тельная вязкость - 2,4-3.5, Содержит ряд аминокислот и электролиты: йа-т*'
162 ммольН калий - 0.4 ммоль/л. кальций — 9,38 ммоль/л, хлор 162 мм^-
окончания инфузии препарата АД снижается по сравнению с исходным на 20
Нетоксичен, апирогенен, не вызывает антигенных реакций.
Основная часть желатиноля * удаляется почками, частично в неизмене
виде, в результате чего в моче в течение 1 -2 дней обнаруживают белок.
Ийо*
~ ~ —
Желатиноль* применяют:
• в качестве плазмозамещающего средства при геморрагиях, операциош
и травматическом шоке I и II степени;
• для заполнения аппарата ИК при операциях на открытом сердце.
Кратковременность объемного действия и его небольшая величина огранич
вают область применения желатиноля *.
Кроме того, инфузия раствора желатиноля * вызывает высвобождение гиста¬
мина, что может способствовать тахикардии, брадикардии, появлению крапинни-
цы и бронхоспазма.
Желатиноль* нарушает агрегацию тромбоцитов и гемостаз за счет торможения
адгезии тромбоцитов. Нарушение функции тромбоцитов при введении раствора жела¬
тина может вызывать увеличение времени кровотечения у больных с травмами.
Введение желатиноля * может вызвать аллергические и анафилактические реак¬
ции. Противопоказан при острых и хронических нефритах.
Перед инфузией желатиноля * обязательно проводят биологическую пробу.
При острой кровопотере и шоке желатиноль * вводят сначала внутривенно
или внугриартериально струйно, затем переходят на капельное введение до нор¬
мализации артериального давления. Одновременно может быть введено не более
2000 мл. После переливания максимального объема необходимы трансфузии
компонентов крови.
Выпускают в стеклянных флаконах по 450 мл.
Условия хранения: при температуре от +4 до +20 °С. При появлении осадка пре¬
парат к употреблению непригоден.
Особая ситуация в последнее время сложилась в связи с угрозой распростра¬
нения возбудителя трансмиссивной спонгиоформной энцефалопатии крупного
рогатого скота (бешенство коров — BSE). В рекомендациях Консультативного
совещания экспертов ВОЗ от 24-26 марта 1997 г. подчеркивается необходимость
принятия адекватных мер по снижению риска заражения населения при исполь¬
зовании медицинских препаратов и изделий, получаемых из органов и тканей
крупного рогатого скота (обычно используемые режимы стерилизации не инакти¬
вируют возбудителя BSE).
ГЕЛОФУЗИН*
Гелофузин* представляет собой 4% раствор МЖЖ. Средняя молекулярная масса -
30 тыс. Да. Теоретическая осмолярность — 274 мОсм/л, вязкость - 1,9. pH 7,1-7,7,
объемный эффект - 100%, длительность объемного действия — 3-4 ч. Содержит
ионы натрия - 154 ммоль/л, кальция - менее 0,04 ммоль/л. хлора - 120 ммоль/л.
Период полувыведения гелофузина* — 9 ч. Около 90 -95% препарата выделя¬
ются почками, 5-10% - кишечником.
Результатом лечебных действий гелофузина* являются следующие эффекты.
• гемодилюционный - его введение понижает вязкость крови, что приводит
к улучшению периферической микроциркуляции и значительному увеличе
нию объема циркулирующей крови и сердечного выброса:
uuiutHiMt ЬКЬДСТВА ТРАНСФУЗИОННО-ИНФУЗЙШОГО ПОСОБИЯ ДО
дофузии гелофузина* вызывают снижение уровня гематокрита ш. следом-
* цельно, уменьшают насыщение крови кислородом. Однако уменьшение вяз-
пости и улучшение микроциркуляции понижают нагрузку на сердце. Таким
образом, сердечный выброс увеличивается без повышения потребности
сердца в кислороде;
t удушается кислородтранспортная функция крови (при условии, что гемато-
* кріїт не снизится менее 25% или менее 30% у пожилых);
, коллоидно-осмотическое давление гелофузина* (333 мм рт. ст.) снижает раз¬
витие интестициального отека.
Показания к применению:
# профилактика и лечение абсолютной и относительной гиповолемии. сопро¬
вождающейся гемоконцентрацией (в целях гемодилюции);
i профилактика и лечение шока;
, экстракорпоральное кровообращение (заполнение аппарата искусственного
кровообращения);
• профилактика артериальной гипотензии (например, при перидурадьной
анестезии);
, увеличение воспроизводства лейкоцитов при лейкоферезе.
При восполнении кровопотери, не превышающей 20% общего объема, допол¬
нительных введений трансфузионных сред не требуется. Однако при инфузии
2Q00-3OOO мл раствора требуется контроль концентрации белков сыворотки
крови и при снижении их менее 52 г/л - введение растворов альбумина, белков
плазмы, эритроцитной массы. При массивных инфузиях возможно нарушение
свертывания крови.
Противопоказания к применению гелофузина*:
І гипергидратация;
* гиперволемия;
• тяжелая сердечная недостаточность;
і серьезные нарушения свертывания крови;
« наличие в анамнезе аллергических и анафилактических реакций, обуслов¬
ленных применением гелофузина *.
Гелофузин * имеет ограниченное применение:
I • при гипонатриемии, гипокальциемии;
I дегидратации;
• почечной недостаточности, так как обычный путь выведения препарата
может быть нарушен;
I хронических заболеваниях печени.
Нет данных о проникновении гелофузина * в материнское молоко и примене¬
нии его у детей. Поскольку опасность аллергических и анафилактических реакций
не исключается, использовать гелофузин * у беременных следует только в крайних
случаях.
Гелофузин* может изменять показатели диагностических тестов на глюкозу, фрук¬
тозу, холестерин, жирные кислоты, скорость оседания эритроцитов, плотность мочи.
При введении гелофузина * возможность анафилактических реакций составляет
I 0.0077%.
Способ применения и дозы следующие.
* Перед началом инфузии гелофузина* обязательно проведение биологиче¬
ской пробы.
* Режим дозирования гелофузина* устанавливают индивидуально с учетом
выраженности дефицита объема плазмы, динамики ЧСС, АД, диуреза, состо¬
яния тканевой перфузии.
* При кровопотере средней степени тяжести препарат вводят в дозе 500-
1000 мл за 1-3 ч, аналогично во время операций.
I ЩВ ТРАНСФУЗИОЛОГІ4Я
II Теорегически при ликвидации ШОКОВЫХ СОСТОЯНИЙ объем перелива
препарата может соаавлять 10-15 л. Однако такая гемодилюцияЗЄМоі1й
вызывать нарушения гемостаза, падение гематокрита ниже 25% (у пац **0^
с сердечно-сосудистой и легочной недостаточностью это составляет чпо°8
что требует переливания эритроцитной массы и альбумина. 4)>
• При изоволемической гемодилюции объем ВВОДИМОГО гелофузина* до
быть эквивалентен количеству удаленной плазмы (^20 мл/кг в сутки)
• Для увеличения количества лейкоцитов при лейкаферезе дозы ввёл
могут составлять 500-1000 мл на процедуру.
• Гелофузин* не рекомендуют смешивать с жировыми эмульсиями и другм
лекарственными препаратами. и
Выпускают в полиэтиленовых контейнерах по 500 мл.
Условия хранения: при температуре не выше +25 °С.
Европейский опыт подтверждает, что раствор МЖЖ имеет преимуществ
по сравнению с другими искусственными коллоидами, применяемыми в настоя¬
щее время. Его молекулярная масса близка к идеальной, и показатель полиди¬
сперсности более близок к белку плазмы крови, чем у других искусственных
коллоидов. Гелофузин* не оказывал неблагоприятных воздействий на коагуляцию
крови, даже когда объемы инфузии превышали 4 л в сутки.
Существуют ограниченные противопоказания для применения гелофузина4
по гемодинамическому эффекту (в варианте гипергидратации и высокой предна-
грузки), но нет данных об отрицательном влиянии этого раствора на кислород*
транспортную функцию крови.
Гелофузин* можно использовать для восполнения кровопотери, проведения
намеренной нормоволемической гемодилюции, афферентных процедур и запол¬
нения аппарата искусственного кровообращения.
Поскольку по сравнению с другими растворами синтетических коллоидов
препарат не вызывает перемещения в циркуляторное русло значительных объ¬
емов жидкости из интерстициального и внутриклеточного пространств, гелофу¬
зин* предпочтительно использовать у пациентов с сердечной недостаточностью
и при выраженном обезвоживании.
К числу положительных качеств препарата можно также отнести отсутствие
отрицательного влияния на свертывающую систему крови даже при больших
объемах инфузии.
С учетом относительно небольшого периода полувыведения и отсутствия отри¬
цательного влияния на функции почек гелофузину* отдают предпочтение у паци¬
ентов с клиническими признаками почечной недостаточности.
При восполнении кровопотери у больных с различными видами хирургических
вмешательств гелофузин* используют в объеме инфузии 500-3000 мл.
Поскольку раствор гидроксиэтилкрахмала может оказывать отрицательное
влияние на свертывающую систему крови, его максимальную дозу рекомендуют
ограничивать до 20 мг/кг массы тела. Раствор МЖЖ не влияет на свертывающую
систему крови, даже если объем инфузии превышает 4 л за 24 ч. Есть указания
на его особые преимущества при исходной гипокоагуляции и/или тромбоцитопе¬
нии, а также в ситуациях с высоким риском развития ДВС-синдрома. Считается,
что гелофузин* при инфузионной терапии гиповолемических состояний различ¬
ного генеза у больных хирургического профиля оказывает стойкие волемиче-
ский и гемодинамический эффекты, устраняет микроциркуляторные нарушения
Iулучшает газотранспортную функцию крови.
Гелофузин* применяют в качестве основного препарата при противоотечнон
терапии для профилактики реперфузионного синдрома у больных нейрохирург"
ческого профиля, перенесших черепно-мозговую травму.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ
485
применение гелофузина* в практике скорой помощи при кровопотере различ-
происхождения (травма, желудочно-кишечное кровотечение) на догоспи-
этапе может решить одновременно две задачи: стабилизировать гемоди-
пациентов с шоком и создать преемственность в работе бриг-ад скорой
J?oo»h и стационаров.
ЭксфУ30Я КР0ВИ в объеме 15-17 мл/кг в целях ее сбережения при одновремен-
і заместительной терапии гелофузином* не оказывает отрицательного влияния
гемодинамику, а кислородтранспортная функция не страдает за счет компенса-
^вного увеличения сердечного выброса.
Гелофузин* используют в качестве одного из компонентов для заполнения
арата ЦК как адекватную и безопасную альтернативу альбумину человека.
* имущества перед другими искусственными коллоидами заключаются в том,
Jo гелофузин* не влияет на свертывающую систему крови, возможно его при¬
менение в больших дозах при относительно небольшой стоимости. Кроме того,
поепарат не накапливается в ретикулоэндотелиальной системе и не влияет на кон-
центрацию фибронектина.
Применение гелофузина* в качестве компенсирующего раствора при эфферент¬
ных процедурах (плазмаферезе, плазмозамещении) предпочтительнее, чем рас¬
творов декстрана и гидроксиэтилкрахмала, поскольку, в отличие от последних,
он не оказывает отрицательного воздействия на свертывающую систему крови,
углеводный обмен, а также функции поджелудочной железы и почек.
Особого внимания заслуживает преимущество препаратов желатина по сравне¬
нию с другими синтетическими коллоидами у больных с почечной недостаточно¬
стью.
Показано, что введение 500 мл коллоидных растворов пациентам, находя¬
щимся на гемодиализе, сопровождается различным эффектом, который опре¬
деляется видом коллоида. В частности, наблюдается накопление в организме
пациентов декстрана-40 и гидроксиэтилкрахмала. в то время как для препара¬
тов желатина это не характерно. Этот факт объясняется тем, что при гемодиа¬
лизе удаляются макромолекулы коллоидов с молекулярной массой менее 10
тыс. Да. Более того, существуют указания, что у больных с анурией усиление
элиминации гидроксиэтилкрахмала в печени может приводить к портальной
гипертензии и асциту. С другой стороны, поскольку концентрация натрия
в растворе гелофузина* составляет 154 ммоль/л, нельзя забывать о возмож¬
ности избыточного накопления этого электролита в организме пациентов
с почечной недостаточностью.
Возможные побочные эффекты гелофузина*: частота возникновения анафи¬
лактических реакций III и IV типа на препараты модифицированного жидкого
желатина сравнима с реакциями на другие синтетические коллоиды. В частности,
Аля гелофузина* она составляет от 1:6000 до 1:13 ООО случаев. Такие реакции
считаются результатом выброса большого количества вазоактивных субстанций
и чаще наблюдаются у лиц, предрасположенных к аллергии.
Существуют публикации о возможном негативном влиянии растворов на осно¬
ве желатина на систему иммунитета: эти препараты могут приводить к увеличению
выработки факторов воспаления, например интерлейкина-1-р. а также стимуля¬
ции системы комплемента и снижению иммунореактивной концентрации фибро¬
нектина плазмы.
Анализ литературных данных показывает, что коллоидный плазмозаменитель
^офузин* нашел широкое применение в анестезиологической практике, интен¬
сивной терапии и реаниматологии. Препарат обладает положительным влиянием
1,3 состояние гемодинамики и кислородтранспортную функцию крови при сравни-
небольшой частоте побочных эффектов.
485 КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
ГЕЛОПЛАЗМА БАЛАНС*
Гелоплазма баланс* - 3% раствор сукцинированного желатина и
фицированного жидкого желатина со средней молекулярной массой 45пл!і°®<-
сбалансированном растворе электролитов. 000 Да,
Состав 1000 мл раствора содержит:
Действующие вещества: Желатин модифицированный жидкий (
тдролиэованный и сукцинированный) в пересчете на безводный желатютяп*4110
Ионный состав: натрий —150 ммоль/л, калий — 5 ммоль/л, магний -15 и ІЩ|г.
хлорид 1 100 ммоль/л, лактат - 30 ммоль/л. Теоретическая ocMoiiJiifflp?
320 мОсм/л, pH 5,8-7,0. РНосЪ -
Отрицательные заряды, возникающие в молекуле желатины в результа
цитирования приводят к увеличению молекулы в размерах и таким образо**!*'
мируются более объемные белковые цепи при сохранении молекулярнойм
В результате Гелоплазма баланс* оказывает достаточный волемический зЛ*!*1,
в течение 3-4 ч. Волемический эффект Гелоплазмы баланс* эквивалентен кол
ству введенного раствора. УМ
Препарат увеличивает объем циркулирующей крови, что приводит к
личению венозного возврата и минутного объема кровообращения, пов^
нию артериального давления и улучшению перфузии периферических тсан!”
Вызывая осмотический диурез, обеспечивает поддержание функции поче
при шоке. Снижает вязкость крови, улучшает микроциркуляцию. Благодаря своим
коллоидно-осмотическим свойствам предотвращает или снижает вероятносиГок
вития й^герсйщиаяьного отека.
Гелоплазма баланс* быстро покидает кровяное русло, что объясняется наличи¬
ем большого количества низкомолекулярных фракций (через 2 ч в крови остается
около 20% введенного препарата). Т1/2 — 9 ч. Выводится почками - 75.%-, через
кишечник -15% (10% расщепляется в тканях посредством протеолизаи включа¬
ется в белковый обмен). Не кумулирует.
Показания к применению
Гиповолемия (профилактика и лечение): геморрагический, травматический,
ожоговый и токсический шок.
Профилактика и лечение артериальной гипотензии при спинальной или эпиду
ральной анестезии.
Экстракорпоральное кровообращение.
Гемодилюции.
Противопоказания
Гиперчувствительность, гиперволемия, тяжелая сердечная недостаточность,
серьезное нарушение свертываемости крови, гипергидратация.
Способ применения и дозы
Внутривенно капельно, длительность инфузии и объем вводимого раствора
корригируют с учетом динамики ЧСС, АД, диуреза, состояния перфузии перифе¬
рических тканей. При среднетяжелой кровопотере и с профилактической целью
в предоперационном периоде или во время операции вводят в дозе 0,5-1 л в тече¬
ние 1-3 ч. При лечении тяжелой гиповолемии — 1-2 л. В экстренных, угрожаю¬
щих жизни ситуациях вводят 500 мл в виде быстрой инфузии (под давлением),
затем после улучшения показателей кровообращения инфузия проводится в коли
честве, эквивалентном объемному дефициту. Для поддержания ОЦК при шоке
до 10-15 11 течение 24 ч. Экстракорпоральное кровообращение: 0,5-1.5 л (в зав
симости от используемой системы).
Побочные эффекты £’
В результате инфузии Гелоплазмы баланс* возможны аллергические(
филактоидные или анафилактические) реакции, как при введении любых ДР;
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО пособия 487
дляайозамещающйх растворов, при массивном введении - гипокоагуляция
^.званная эффектом разведения).
^взаимодействие с другими лекарственными средствами
фармацевтически несовместим с жировыми эмульсиями, барбитуратами, мио-
-лксантами, антибиотиками, глюкокортикостероидами. Совместим с раствора-
^члектролитов, углеводов, цельной кровью.
^применение при беременности, лактации и в детском возрасте
Никакой информации о применении Гелоплазмы баланс* у детей в возрасте
«одного года не имеется.
^Не было отмечено случаев эмбриотоксического действия Гелоплазмы баланс.
йак0 возможность возникновения аллергических реакций нельзя исключить
олностью- При беременности препарат следует назначать тогда, когда возможная
Польза для матери превышает потенциальный риск для плода.
Отсутствуют данные по проникновению Гелоплазмы баланс* в материнское
волоко,
форма выпуска
раствор для инфузий 3%.
По 500 мл в двухслойном пластиковом полихлорвиниловом мешке, снабжен¬
ном двумя портами.
Срок годности - 2 года.
МОДЕЖЕЛЬ*
Модежель* — это отечественный 8% раствор декальцинированного пищево¬
го желатина в 0,9% растворе натрия хлорида. Средняя молекулярная масса -
16 тыс. Да, теоретическая осмолярность - 282 мОсм/д, pH 6,5-7,4, содержание
ионов натрия - 145 ммоль/л, кальция - 0,31 ммоль/л, хлора - 59,8 ммоль/л.
Показания к применению:
* Профилактика и лечение гиповолемии;
• приготовление взвеси эритроцитов. У взвеси 00 срок хранения может быть
продлен до 72 ч вместо 24 ч при консервировании их 0,9% раствором натрия
хлорида;
« заполнение аппарата ИК.
Традиционно ресуспендирующей средой для ОЭ считается 0,9% раствор натрия
хлорида, в котором ОЭ в соответствии с регламентом хранят при температуре
+4 °С в течение 24 ч с момента заготовки, что достаточно неудобно и приводит
к неполноценному использованию заготовленной трансфузионной среды.
0Э представляют собой ареактогенную трансфузионную среду и показа¬
ны бальным, у которых в анамнезе отмечались посттрансфузионные реакции
негемолитического типа, а также больным, сенсибилизированным к антигенам
белков плазмы, тканевым антигенам и антигенам лейкоцитов и тромбоцитов.
В связи с отсутствием в ОЭ стабилизаторов крови и продуктов метаболизма
клеточных компонентов, оказывающих токсическое действие, их трансфузии
показаны в терапии глубоких анемий у больных с почечной и печеночной недо¬
статочностью и при синдроме массивных трансфузий. В проведенных в РНЦХ
ии* академика Б.В. Петровского РАМН и РНИИ гематологии и трансфузиоло-
сии М3 РФ исследованиях показана возможность использования модежеля*
Мя получения взвеси эритроцитов. Эритроциты, ресуспендированные в моде-
желе* (1:1), сохраняют свои морфофункциональные свойства до 21 сут не хуже,
чем I собственной плазме. Взвесь ОЭ 1:1 позволяет продлить срок их жизни
№ 72 ч без Существенного изменения содержания свободного гемоглобина
и Уровня гемолиза. Изменение соотношения модежель*-эритроциты позволяет
Радировать уровень гематокрита, при соотношении 0,3:1 гематокрит находит-
в пределах 69-73%. Применение трансфузионных сред на основе модежеля*
1
at обмдаюг іаореаеленньїмл преимуществами при заполнении аппарата и-
->• гемоглобина в пределах 8 г/дл. АД 80/65 мм рт.ст. и рО. в предел»
I да артериальной и 45 -46 мм рт.ст. для венозной крови отвечают необходим.***
гИвмшош.
0 результате проведенных лабораторных и клинических исследований г>ь,
гвгпкм следующие ВЫВОДЫ.
1 Ямвсь ОЭ в модежеле* может быть использована для заполнения аппарата ЙК
2. Концентрация взвеси не имеет существенного значения для поддержания АД
рО. и гематокрита.
ДО» поддержание уровня гемоглобина 8-9 г/дл наиболее оптимальна ко*,
огитрацня 1:0.5 (50%).
4 Срок хранения отмытых эритроцитов может быть продлен с 24 до 72 ч.
5. Перед переливанием необходимо проведение биологической пробы.
6. Возможны температурные реакции легкой и средней тяжести.
ИОДШЛЬ АФ
Модежель АФ* представляет собой препарат модежель* с добавлением аденина
В натрия фосфата двузамещенного. Предназначен для заготовки из эритроцитного
концентрата ЭВ и последующего ее хранения. Модежель АФ" добавляют к эри-
троцитному концентрату в соотношении 1:1.
Препзраг обеспечивает сохранность морфофункциональных свойств эритро-
адггов при температуре +4 °С в течение 42 сут хранения, придает ЭВ выраженные
коллоидно-осмотические свойства, обеспечивая при ее переливании гемодина-
мичесхое. реологическое, детоксическое действие и нормализацию КОС. Взвесь
эритроцитов в модежеле АФ" обладает сниженной по сравнению с цельной кон¬
сервированной кровью иммунологической реактогенностью.
Взвесь эритроцитов в модежеле АФ"' используют вместо консервированной
Ян І других эритроцитных сред для восполнения острой кровопотери, коррек¬
ции анемии различного генеза.
Противопоказаниями к введению больших объемов взвеси эритроцитов в моде-
желе АФ" считают отеки легкого, мозга, почечную недостаточность. При трансфу¬
зиях взвеси эритроцитов в модежеле АФ"1 могут наблюдаться посттрансфузионные
температурные реакции, обусловленные наличием в среде остаточных лейкоцитов
ишшиы.
Взвесь эритроцитов в модежеле АФ"' применяют внутривенно до 3 л в сутки.
Выпускают модежель АФ*’ в стеклянных бутылках по 200 и 450 мл. Хранят
при температуре от +4 до +25 °С, Срок хранения — 3 года.
В настоящий момент данный препарат регистрации не имеет.
МОДЕЖЕЛЬ-ГЛЮКОФОСФАТ
Ш||М||М1№'ГЛюкофосфат|> представляет собой препарат модежель* с добавкой
глюкозы и натрия фосфата двузамещенного. Предназначен для ресуспендирова-
ЮМ и хранения 0Э. Добавляют к отмытым 0,9% раствором натрия хлорида эри¬
троцитам в соотношении 1:1.
Мадежель-глюкофосфат*’ обеспечивает морфофункциональную сохранность
взвешенных в нем отмытых эритроцитов в течение 21 сут хранения при +4 “С.
і придает взвеси отмытых эритроцитов выраженные
кодлондио-псмотические свойства, которые предопределяют гемодинамичеекое.
ЦММЛпеское, детоксическое действие и коррекцию кислотно-основного состоя¬
ния «роям
основные СРЕДСТВА ТРМСв^ЭИОИИОнАШЭЙОНИиг и ПОСШй 4ff
овмытых Эритроцитов в модежеле- гл юкофосфате4 Ыааадает сниженной
^логической реактогенностыо вследствие низкого содержания в ней деико-
и плазменных белков (<0,25 г/д).
^Показания к применению:
циипиентам с комплементзависимыми гемолитическими анемиями,
пациентам с анемиями различного генеза. иэосенснбилизнровамным к аитм-
тнам лейкоцитов и белков плазмы;
# йрйшоке;
, кровопотере;
# пересадке органов;
# тлттии у пациентов в анамнезе посттрансфузионных реакций и осложне
ВЙ&
, выявлении в крови реципиентов анти-HLA-антител в случаях невозмож
пости использования лейкоцитных фильтров или криоконсервированных
эритроцитов.
Противопоказаниями к введению больших объемов взвеси отмытых лритро-
доов в модежеле-глюкофосфатеv считают отек легкого, мозга, почечную
^уосгаточность. При трансфузиях взвеси отмытых эритроцитов в модежеле-
-иокофосфате*' могут наблюдаться посттрансфузионные температурные реакции,
обусловленные наличием в среде остаточных лейкоцитов.
Взвесь отмытых эритроцитов в модежеле-глюкофосфатеw вводят внутривенно
капельно или струйно;
t пациентам с анемиями по 1-2 дозе однократно до получения клинического
эффекта;
» при кровопотере — не более 2 л в сутки.
Выпускают модежель-глюкофосфат* в стеклянных бутылках по 200 и 450 мл.
Хранят при температуре от +4 до 25 °С. Срок годности - 3 года.
В настоящий момент данный препарат регистрации не имеет.
РАСТВОРЫ ДЕКСТРАНА
Декстран — водорастворимый одноцепочечный высокомолекулярный поли¬
сахарид, построенный из остатков глюкозы, имеющих различную молекулярную
массу. Получают декстраны из культур бактерий-продуцентов, выращиваемых
на среде, содержащей сахарозу. Нативный декстран непригоден для использо¬
вания в качестве плазмозамещающего средства, так как имеет очень большую
молекулярную массу, значительную вязкость, обладает токсическим действием
и изменяет иммунореактивные свойства организма. В целях снижения молеку¬
лярной массы декстран подвергают частичному гидролизу. Из полученной смеси
выделяют среднемолекулярную фракцию, очищают и на ее основе изготавлива¬
ют лекарственную форму с заданным молекулярно-массовым распределением.
По этому критерию плазмозамещающие средства на основе декстраиа делят
і на 2 группы:
* низкомолекулярные декстраны — молекулярная масса 30-40 тыс. Да (реопо-
лиглюкин*. реомакродекс*, реоглюман*, лонгастерил-40*);
* среднемолекулярные декстраны — молекулярная масса 50-70 тыс. Да (полн-
глюкин*. полифер*).
Существует прямая зависимость между молекулярной массой декстрина, его
ОДиянием на реологические свойства крови и временем циркуляции в сосуд и-
^ русле. После ферментативного расщепления в кровеносном русле декстран
со средней молекулярной массой удаляется в основном почками. 6% раствор дек-
с молекулярной массой 60-75 тыс. Да вызывает объемный эффект до 130%
с вроаолжительностью объемного действия 4-6 ч. Максимальная суточная доза
г
Ш клмагссхм ТРАНСФУЗИОЛОГИЯ
отпишет 1.2 г декстрана (или 20 ил раствора) на 1 кг в сутки. 10% рас
страна с молекулярной массой 40 тыс. Да вызывает объемный эффект **'
с продолжительностью объемного действия 3-4 ч. Максимальная суточна ^
состаляет 1Ц гдекстрана (или 15 мл раствора) на 1 кг массы в сутки. Я Доэз
На практике было показано, что препараты на основе декстрана оказы
мнительное отрицательное воздействие на систему гемостаза, причем о?83107
этого їия прямо пропорциональна молекулярной массе и получ П*Нк
дозе декстрана. Объясняется это тем. что. обладая обволакивающим дейспи^
дштран блокирует адгезивные свойства тромбоцитов и снижает функциональ***’
аклшюстъ свертывающих факторов. Особенно значительно уменьшается акт*0
ностъ факторов И. V, VIII. В связи со значительным нарушением свертывания кпп*
тогда декстраны используют для профилактики и лечения послеоперацион -
тромбоэмболии.
Раствор декстрана-40 имеет концентрацию 10%, является гиперонкотически
и в силу этого вызывает перемещение жидкости из интерстициального ПпМ
странства в сосудистое русло, что приводит к кратковременному увеличению
ОЦК. Уменьшение объема интерстициальной жидкости нежелательно при дегн.
дратации и может спровоцировать почечную недостаточность. Ограниченный
диурез и быстрое выделение почками фракции декстрана с молекулярной массой
40 тыс. Да вызывает значительное повышение вязкости мочи, в результате чего
происходит резкое снижение гломерулярной фильтрации вплоть до анурии.
Несмотря на то что современные плазмозамещающие средства на основе дек¬
страна лучше очищены от иммуногенных ингредиентов микробного продуцен¬
та, актуальной остается проблема побочных реакций на их введение (0,032%).
Примерно у 60-70% пациентов при введении декстрана сохраняется вероятность
образования иммунных комплексов как следствие реакции «антиген-антитело».
Декстранреактивные антитела относятся к классу IgG и образуются в резуль¬
тате сенсибилизации повторными трансфузиями декстрановых препаратов.
Образующиеся антитела фиксируются на клетках-мишенях аллергии, к которым
относятся тучные клетки, базофильные лейкоциты и мастоциты. На поверхности
этих клеток находятся рецепторы, имеющие высокое сродство к Fc-фрагменту
иммуноглобулинов IgG и IgE. Этот этап характеризует начало иммунологической
фазы - фазы сенсибилизации. При повторном попадании декстрана происходит
его соединение с антителами, фиксированными на клетках-мишенях, что приво¬
дит к образованию медиаторов типа гистамина, лейкотриенов, которые и вызыва¬
ют анафилактическую реакцию. С учетом данного обстоятельства для целенаправ¬
ленной профилактики анафилактоидных/анафилактических реакций при инфузии
препаратов на основе декстрана вливанию основной дозы должно предшествовать
введение гаптен-декстрана (декстрана с молекулярной массой 1000 Да).
Декстраны образуют молекулярный слой на поверхности форменных элемен¬
тов, что может послужить препятствием для определения группы крови. В этих
случаях используют отмытые эритроциты. Внутривенное вливание растворов дек¬
страна может стать причиной острой почечной недостаточности, что связывают
с возникновением гиперосмолярности плазмы крови и снижением эффективного
фильтрационного давления, определяющего скорость клубочковой фильтрации.
Наиболее часто используют растворы низкомолекулярного декстрана - 40
(молекулярная масса 40 тыс. Да, 10% раствор) и среднемолекулярного декстра-
на-70 (молекулярная масса 70 тыс. Да, 6% раствор).
При внутривенном введении период полувыведения декстрана-70 составляет 6 ч.
дектрана-4011-2 ч. Декстран-40 используют в виде 10% раствора с КОД, равным
приблизительно 40 мм рт.ст. Прирост ОЦК вследствие внутривенного введения рас-
твора декстрана-40 практически в 2 раза превышает объем инфузии. Увеличение
объема плазмы при применении декстрана-40 более выражено в первые 90 мин
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОИН04ІНФУЗИОННОГО ПОСОБИЯ 491
ения Через 6 ч после инфузии содержание раствора в крови уменьшается
*«0 в 2 раза* В первые сутки с мочой выводится до 80% препарата,
к применению:
А°**^ходимость быстрого восполнения ОЦК;
• "яктран-40 используют в целях улучшения реологических свойств крови
• дС^ дарушениях периферического кровообращения.
*г№ЗН'40 может спровоцировать повышенную кровоточивость в резуль-
^«яьшсния агрегации тромбоцитов, а также способствовать фибринолизу.
# ^антикоагулянтный эффект проявляется при введении дозы, превышающей
Pg массы тела, из-за чего декстран-40 имеет достаточно узкое терапевтиче-
04Г 0 _ максимальная суточная доза составляет не более 15-16 мл/кг массы
^ Анафилактические реакции наблюдаются у 1% больных.
^створы декстрана занимают первое место среди синтетических коллоидов
питательному воздействию на систему свертывания крови, причем это дей-
1,0 иг прямо пропорционально молекулярной массе и дозе декстрана.
декстран снижает способность тромбоцитов к адгезии на сосудистой стенке
нленцию тромбоцитов к агрегации и разрушению. Уменьшается активность
^оров II, V, VIII. ,
Ыи ограниченном диурезе быстрое выделение почками фракции декстрана-40
изывает значительное повышение вязкости мочи, в результате чего гломеруляр-
фильтрация резко падает, вплоть до анурии.
Высока вероятность возникновения анафилактоидных реакций (0,032%). свя¬
занных с конфликтом «антиген-антитело». Для профилактики анафилактоидных
Реакций у декстранов вливанию основной дозы препарата должно предшествовать
введение гаптена-декстрана с молекулярной массой 1000 Да.
Полиглюкин*
Полиглюкин* - 6% раствор декстрана со средней молекулярной массой
60 тыс. Да в изотоническом растворе натрия хлорида. Теоретическая осмоляр¬
ность - 308 мОсм/л, pH 4,0-6,5. Объемный эффект - 120%, длительность объ¬
емного действия - 4-6 ч. Основной путь выведения - с мочой, в течение суток
из организма выводится 50% препарата.
Применяют для профилактики и лечения шока (травматического, геморрагиче¬
ского, ожогового).
Противопоказания:
j черепно-мозговая травма с повышением внутричерепного давления;
• гиперволемия;
• сердечная недостаточность;
• заболевания почек с анурией;
• отек легких;
I геморрагические диатезы;
• продолжающееся кровотечение.
Значительное повышение АД может спровоцировать усиление кровотечения,
J обволакивающее действие декстрана на тромбоциты провоцирует кровотечение
пРи суточной дозе полиглюкина* 1,5-2,0 л.
Перед инфузией полиглюкина* обязательно проведение биологической пробы.
Дозы и скорость введения препарата устанавливаются в зависимости от состоя-
I® больного.
• При развивающемся шоке доза вводимого препарата может составлять 400-
1200 мл для взрослого и 10-25 мл/кг массы тела для ребенка. Первые 400 мл
вводят струйно, после подъема АД и улучшения состояния больного переходят
на капельное введение. При кровопотере 500-750 мл крови у взрослого инфузии
полиглюкина* целесообразно сочетать с переливаниями компонентов крови.
452 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
• При операциях в целях профилактики операционного шока вливан
глюкнна4 следует проводить капельно с переходом на струйное при**6
артериального давления. Возможен внутриартериальный метод здЯЕВ
I Ппи лечении ожогового шока количество препаоатщтщпд^^2[я^
Полиглюкин* выпускают в стандартных стеклянных флаконах по 100,200
мл. Препарат следует хранить в сухом месте при температуре от +10 д0 +?о 11МІ
Ш 1
Показания к применению те же, что и у полиглюкина4. Наиболее целесооб
разно назначение полифера* при оперативных вмешательствах у больных с исхо¬
дной анемией, обусловленной опухолевыми и длительно текущими гнойно-
деструктивными процессами и ожогами.
Противопоказания такие же, как и у полиглюкина4.
Дозы и способы введения такие же, как и у полиглюкина4. Обязательно про¬
ведение биологической пробы.
Полифер4 выпускают во флаконах по 100, 200 и 400 мл. Хранят в сухом месте
при температуре от +10 до +25 °С.
Существует несколько препаратов — аналогов полиглюкина4.
Макродекс4 - декаран-60 (молекулярная масса 60 тыс. Да) в 0,9% растворе
натрия хлорида.
Показания и противопоказания, дозы и способы введения в основном такие же,
как и у полиглюкина4.
Реополиглюкин4 - 10% раавор декстрана с молекулярной массой от 30 до
40 тыс. Да в 0,9% рааворе натрия хлорида. Производится форма с 5% раствором
глюкозы*. Теоретическая осмолярность — 308 мОсм/л, pH 4,0-6,5. Волемический
эффект - 140%, длительность волемического действия — 3-4 ч. Содержит ионы
натрия - 154 ммоль/л и хлора — 154 ммоль/л. Довольно быстро выводится
из организма, в основном почками, в первые сутки — около 80% препарата.
Препарат обладает антиагрегантным, гемодинамическим, дезинтоксикаци-
онным дейавием. Основной особенностью фармакологического эффекта пре¬
парата считается его выраженная способность улучшать реологические свойства
крови и восстанавливать микроциркуляцию. Препарат уменьшает вязкость крови
и повышает ее суспензионную устойчивость, предотвращает или снижает агрега¬
цию форменных элементов крови, что способствует восстановлению кровотока
в мелких капиллярах.
Показания к применению:
• профилактика и лечение микроциркуляторных нарушений при травматическом,
операционном и ожоговом шоках, при сосудистых и пластических операциях,
трансплантации органов и тканей, при заболеваниях сетчатки и зрительного
нерва, воспалительных процессах роговицы и сосудистой оболочки глаза:
• добавление к перфузионной жидкости в аппаратах искусственного крово¬
обращения при операциях на сердце. Кровезаменитель уменьшает разру
шение эритроцитов и тромбоцитов, в результате чего уменьшается гемоли.
годности - 5 лет со дня изготовления.
Полифер4
жа
отличается ит полиглюкина-.
Реополиглюкин4
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 493
ппотивопоказания:
почечная недостаточность;
I тяжелая застойная сердечная недостаточность;
* заболевания легких (бронхиальная астма, хроническая пневмония);
* непереносимость лекарственных средств (сывороток, вакцин), внутривенных
* вливаний белковых препаратов и препаратов декстрана;
гипергидратация;
I тяжелая дегидратация.
у пациентов с перечисленными клиническими состояниями весьма велика воз-
Locrb возникновения анафилактического шока (группа риска).
%ія выявления пациентов группы риска перед переливанием реополиглюкина*
комендуют кожную пробу. Обязательно проведение биологической пробы,
реополиглюкин* вводят внутривенно струйно, струйно-капельно, капельно.
позы І скорость введения препарата следует выбирать индивидуально в соответ-
ии 1 показаниями и состоянием больного.
i При нарушениях капиллярного кровотока (различные формы шока) рео¬
полиглюкин* вводят внутривенно капельно или струйно-капельно в дозе от 400
1200 мл до стабилизации гемодинамических показателей. При необходимости
количество препарата может быть увеличено до 1600 мл. У детей при различных
формах шока реополиглюкин* вводят из расчета 5-10 мл/кг массы тела, при необ¬
ходимости доза может быть увеличена до 15 мл/кг.
2. При сердечно-сосудистых и пластических операциях реополиглюкин* вводят
внутривенно капельно:
» перед операцией в течение 30-60 мин взрослым и детям в дозе 10 мл/кг;
I вовремя операции - взрослым в дозе 400 мл, детям — 15 мл/кг;
[ после операции в течение 5-6 дней взрослым в дозе 10 мл/кг на однократ¬
ное введение, детям в зависимости от возраста от 10 до 5-7 мл/кг в течение
60 мин один, реже 2 раза в сутки.
3. При операциях с ИК добавляют к крови из расчета 10-20 мл/кг массы тела
для заполнения насоса оксигенатора. Концентрация реополиглюкина* в перфузи-
онном растворе не должна превышать 3%.
Для восполнения и поддержания водно-электролитного баланса одновременно
среополиглюкином* целесообразно вводить кристаллоидные растворы.
В офтальмологической практике реополиглюкин* применяют путем электрофо¬
реза. Расход препарата на одну процедуру составляет 10 мл. Процедуру проводят
общепринятым способом 1 раз в день. Курс лечения состоит из 5-10 процедур.
Реоплиглюкин* выпускают в стеклянных бутылках по 100, 200 и 400 мл
или по 250 и 500 мл в емкостях из полиэтилена. Хранят в сухом месте при темпе¬
ратуре от+10 до +25 °С.
Реомакродекс*
Реомакродекс* — 0,9% раствор натрия хлорида с 10% содержанием декстрана
с молекулярной массой 40 тыс. Да, аналог реополиглюкина* по своему составу
и гемодинамическому действию.
Показания к применению аналогичны реополиглюкину*.
Противопоказания аналогичны таковым у реополиглюкина*, а также при выра¬
женной тромбоцитопении.
При использовании препарата всегда следует помнить о возможности перегруз-
рсосудистой системы. Для поддержания нормального водного и электролитного
оаланса с реомакродексом* следует применять кристаллоидные водные растворы.
Ильных с обезвоживанием количество вводимого реомакродекса* не должно
превышать 500 мл в течение 60 мин.
ГЛАВА И
494 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
При переливании реомакродекса* обязательно проведение биологичес
I Реомакродекс* применяют: к°й
і при состояниях, сопровождающихся выраженной интраваскулярной am
гацией. доза для первоначальной внутривенной инфузии составляет 50гГ
1000 мл (500 мл в течение 30 мин). В последующие 2 сут доза обычно соста
ляет 1000-2000 мл в сутки. В последующие 3 сут следует использовать лиш
половину указанных доз;
• В сосудистой хирургии непосредственно перед операцией следует внутривен
но ввести 500 мл препарата, во время операции еще 500 мл, в послеопераци^
окном периоде доза составляет 500 мл в сутки в течение 3 сут:
• при операциях с использованием аппарата ИК к перфузионному расгвог»
реомакродекс* добавляют из расчета около 20 мл/кг массы тела; ^
І перед аортографией реомакродекс* вводят внутривенно из расчета
10-15 мл/кг массы тела в течение 30 мин.
Реомакродес* выпускают во флаконах по 500 мл. Хранят при постоянной тем¬
пературе, не превышающей 25 °С. При транспортировке оберегают от холода
При появлении хлопьев реомакродекс* следует нагреть в течение короткого време¬
ни при температуре 100 °С или в автоклаве при 110 °С.
Реоглюман*
Реоглюман* - 10% раствор реополиглюкина* с добавлением 5% маннитола
и 0.9% натрия хлорида. Обладает гемодинамическим, реологическим и диуретиче¬
ским действием. Выводится в основном почками, в первые сутки - до 70%.
Реоглюман* применяют для улучшения капиллярного кровотока, мобилиза¬
ции жидкости из интерстициального и клеточного пространств, выведения через
почки метаболических продуктов. Его использование показано:
• при нарушении капиллярного кровотока при травматическом, операцион¬
ном, кардиогенном, ожоговом шоках;
I при нарушениях венозного и артериального кровообращения (тромбозах,
тромбофлебитах, эндартериитах, болезни Рейно);
I в сосудистой и пластической хирургии для улучшения местной циркуляции
и уменьшения тенденции к тромбозам в трансплантате;
I у больных с почечной и почечно-печеночной недостаточностью с сохранен¬
ной фильтрационной функцией;
• при посттрансфузионных осложнениях;
• при ожогах, перитонитах, панкреатите, посттрансфузионных осложнениях,
вызванных вливанием несовместимой крови, для дезинтоксикации.
Применение реоглюмана* противопоказано:
• при чрезмерной гемодилюции (гематокрит ниже 25%);
• геморрагических диатезах (тромбоцитопении);
• недостаточности кровообращения с резко выраженной анасаркой;
• недостаточности почек, сопровождающейся анурией;
• значительной дегидратации;
• тяжелых аллергических состояниях неясной этиологии.
Не исключены появление аллергических реакций (уртикарных высыпании,
кожного зуда, отека Квинке и др.), учащение пульса и снижение артериально¬
го давления. В этих случаях вливание реоглюмана* должно быть прекращено.
Больному срочно должны быть введены антигистаминные средства, сердечные,
сосудистые препараты, глюкокортикоиды.
Реоглюман* вводят внутривенно капельно со скоростью 40 капель в минуту
после биологической пробы. Струйное введение может привести к гиперволемии
за счет осмотического действия препарата. Дозы и скорость введения следует выби¬
рать І соответствии с показаниями, оценкой состояния больного и его почасового
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 495
ого диуреза. Для поддержания жидкостного и электролитного баланса вме-
,,(^°еоглюманоМ* целесообразно вводить растворы, содержащие калий и натрий.
введения:
^ при шоке - 0.4-0.8 л;
* осле операций на магистральных сосудах — по 0,4-0,7 л в течение 5-6 сут;
• п и острой почечной недостаточности с сохраненной фильтрацией - 0,4-
' о 8 л однократно.
пускают в бутылках по 100, 200 и 400 мл. Хранят при температуре от +10
срок годности указан на этикетке препарата.
ДО ’
РАСТВОРЫ П0ЛИЭТИЛЕНГЛИК0ЛЯ
Полиоксидин*
Полиоксидин* -1.5% раствор полиэтиленгликоля (молекулярная масса 20 тыс. Да)
09% растворе натрия хлорида. Теоретаческая осмолярность - 315 мОсм/л, pH
7Ч5-7 45. Обладает противошоковым действием. При массивной кровопотере и про¬
лонгированной гипотензии введение полиоксидина* в объеме потерянной крови
,10 ровождается стойким восстановлением гемодинамики, нормализацией реологиче-
свойств и кислотно-основного состояния крови, капиллярного кровотока.
Основной путь выведения — через почки. Период полувыведения из сосудисто¬
го русла равен 8 ч. Около 90% препарата выводится в течение 7 сут.
Препарат показан для лечения и профилактики гиповолемии и шока различно¬
го генеза.
Применение препарата противопоказано при лечении больных с черепно¬
мозговой травмой, протекающей с повышением внутричерепного давления.
Взаимодействие с другими лекарственными препаратами неизвестно.
При использовании полиоксидина* проведение биологической пробы обя¬
зательно. Препарат вводят внутривенно струйно или капельно. Дозу и скорость
введения выбирают в зависимости от показаний и состояния больного.
1. Лечение шока. Препарат вводят струйно до восстановления АД до нормально¬
го уровня, после чего переходят на капельное введение со скоростью 60-80 капель
в минуту. Суточная доза — до 20 мл/кг. Максимальная доза - 1200 мл на одно
введение.
2. Профилактика операционного шока. Препарат в начале операции вводят
капельно со скоростью 60-80 капель в минуту, а при падении АД ниже физиоло¬
гического уровня переходят на струйное введение.
Полиоксидин* выпускают во флаконах по 200 и 400 мл. Хранят при обычных
условиях. Допускается замораживание препарата при условии сохранения его гер¬
метичности. Срок годности - 2 года.
Полиоксифумарин*
Полиоксифумарин* — коллоидный кровезаменитель гемодинамического дей-
гоия с выраженным антигипоксическим действием. В состав препарата входят
полэтиленгликоль-20 000, фумарат натрия, а также хлориды натрия и магния,
иодид калия.
Полиоксифумарин* обладает полифункциональными свойствами:
* коллоидная основа обеспечивает стойкую коррекцию гемодинамики;
* антигипоксант фумарат натрия нормализует кислотно-основное состояние
организма и энергетический обмен на клеточном уровне;
* солевой компонент поддерживает стабильность водно-электролитного баланса;
* при введении полиоксифумарина* возникает постинфузионная гемодилю-
Ния, в результате которой уменьшается вязкость крови и улучшаются ее
Реологические свойства;
ПМвА Ц
РАЗДЕЛ Ш
496 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
• инфузии препарата повышают диурез и способствуют активации
кационных процессов.
Многократные введения полиоксифумарина* не приводят к накоп
парата в органах и тканях организма. Антигипоксант фумарат натрия ЄНй!о У
метаболизируется. П°Лч°%
Показания к применению:
• гиповолемические и гипоксические состояния различной этиологи I
потеря, шок, травмы, ожоги, интоксикации); и (кРог
• в качестве компонента перфузионной смеси для заполнения кон-пт
таИК. Раапг|з
Противопоказания: черепно-мозговая травма и все прочие случаи, где
показано введение больших объемов жидкости. Аллергических и других
ных реакций не вызывает.
Препарат вводят внутривенно по 400-800 мл капельно или струйно, ппи и},
ходимости до 2 л.
Выпускают препарат в бутылках по 200 и 400 мл, с 2002 г. - в полимеайЕ
упаковке. Хранят при температуре 0-25 °С в течение 2 лет, допускается
живание.
РАСТВОРЫ ГИДРОКСИЭТИЛКРАХМАЛА
Гидроксиэтилкрахмал (ГЭК) — природный полисахарид, получаемый из ащ.]
лопектинового крахмала и состоящий из остатков глюкозы. Исходным сырье» ]
служат натуральные растительные продукты: картофель, тапиока, зерна различный
сортов кукурузы, пшеницы или риса. Схема получения ГЭК включает частичный
кислотный или ферментативный гидролиз нативного крахмала с молекулярной мас¬
сой от 10 до 700 млн Да до заданных параметров размера молекул, составляющий
40 тыс. Да (низкая молекулярная масса), 200 тыс. Да (средняя молекулярная масса)j
450 тыс. Да (высокая молекулярная масса). Далее следует гидроксиэтилирование,'
т.е. включение гидроксиэтиловых групп в молекулу вещества, с тем чтобы получил.]
молекулярное замещение, например 0,5; 0,6 или 0,7. Используемая технологи’
позволяет получить готовые лекарственные формы 3,6 и 10%.
Профиль гидроксиэтилированного крахмала характеризуется несколькими крите¬
риями.
1. Концентрация - во многом определяет волемический эффект препарата
На территории России используют препараты в концентрации 6 и 10%. 6% рас¬
твор ГЭК считается изоонкотическим, вследствие чего при его введении объем
внутрисосудистой жидкости увеличивается пропорционально введенному объему.;
10% растворы ГЭК считаются гиперонкотическими.
2. ММ, или молекулярная масса, находящихся в растворе молекул. В зависим!
сти от молекулярной массы все ГЭК разделяют на 3 группы:
І высокомолекулярные ГЭК (ММ >250 кДа) были представлены первыми]
из всех ГЭК, обеспечивают хороший терапевтический эффект, но с их приї
менением может быть связано большое количество побочных действии, .-j
• низкомолекулярные ГЭК (ММ <100 кДа) были разработаны для того, чШ
уменьшить побочные действия, связанные с применением высок0^°^
лярных ГЭК. Однако отсутствие стойкого волемического эффекта и быйИ
выведение из организма не способствовали широкому применению преп Р |
тов в Европе, в России препараты не использовались никогда;И
• среднемолекулярные ГЭК (ММ 100-250 кДа) в настоящее время пред *1
лены наиболее широко, и большинство известных на территории " Ш
крахмалов относится именно к этой группе.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 497
Молярное замещение (Ms) — число глюкозных остатков из 10. которые
^ шены одной или более гидроксиэтилированных групп. Например, молярное
Рйейие 0,5 означает, что из 10 глюкозных остатков 5 являются замещенными
^этилированными группами.
’’’^Степень замещения (D) - число замещенных гидроксиэтилированных групп
10 глюкозных остатков. У современных крахмалов молярное замещение и сте-
1 заМещения могут быть взаимозаменяемыми понятиями, так как их значение
до совпадает. Высокое молярное замещение и степень замещения увеличивают
і ^нтность к воздействию а-амилазы, но в то же время способствуют разви-
й неблагоприятных эффектов, увеличивают риск развития нарушений коагуля-
ш и неблагоприятных влияний на систему гемостаза. Таким образом, чем выше
нцентрация, молекулярная масса и степень замещения, тем больше и продолжи -
Цельнее увеличение ОЦК, но чем больше степень замещения, тем более выражены
побочные эффекты.
5 Характер замещения (соотношение С2:С6) имеет важное значение для скорости
«гоадации молекулы ГЭК. Гидроксильные группы, как правило, могут замещать
«ом углерода в двух основных положениях С2 или С6 молекулы глюкозы. ГЭК
питается более устойчивым к воздействию а-амилазы, когда большее количество
[(идроксиэтилированных групп находится в положении С2. Например, характер
замещения С2:С6, равный 9:1, означает, что 9 гидроксиэтилированных групп нахо¬
дися в положении С2 и 1 — в положении С6. Таким образом, по отношению к воз¬
действию а-амилазы эта связь более устойчива, чем, к примеру, характер замещения
5:1 или 6:1.
6. В настоящее время имеется два крахмала третьего поколения, получен¬
ные из картофеля и кукурузы. Эти крахмалы входят в состав ряда препаратов.
Согласно данным одного исследования, растворы ГЭК, созданные на основе
картофеля и кукурузы восковой зрелости, не являются биоэквивалентными.
(Lehmann G, Marx G, Forster H: Bioequivalence comparison between hydroxyethyl
starch 130/0.42/6:1 and hydroxyethyl starch 130/0.4/9:1. Drugs RD 2007; 8:229-40.)
Крахмал кукурузы восковой зрелости (ГЭК 130/0,4) главным образом состо¬
ит (приблизительно 98%) из амилопектина, разветвленного в высокой степени,
а крахмал картофеля (ГЭК 130/0,42) представляет собой гетерогенную смесь
амилопектина (приблизительно 75%) и линейных цепей амилозы. То есть степень
разветвления в картофельном крахмале ниже. (Singh N, Singh J, Kaur L, Sodhi NS,
Gill BS: Morphological, thermal and rheological properties of starches from different
botanical sources. Food Chem 2003; 81:219-31.)
Картофельный крахмал содержит эстерифицированные фосфатные группы,
количество которых составляет несколько тысяч на миллион, в то время как в крах¬
мале восковой кукурузы они не определяются. (Blennow A, Bay-Smidt AM, Olsen
СЕ, Mailer BL. The distribution of covalently bound phosphate in the starch granule in
relation to starch crystallinity. Int J Biol Macromol 2000; 27:211-8.)
Эти различия относятся и к очищенному препарату. Оба вида крахмала имеют
сравнимую СМЗ (0,4 у крахмала восковой кукурузы и 0,42 у крахмала картофеля),
ютя Sommermeyer с сотр. высказали предположение, что СМЗ в препарате, полу¬
ченном из картофельного крахмала, на самом деле достигает 0,45. (Sommermeyer
Н Cech F, Schossow R: Differences in chemical structures between waxy maize- and
Potato-starch-based hydroxyethyl starch volume therapeutics. Transfiis Altern Transfus
Med 2007; 9:127-33.)
I связи с этим может быть неправомерным переносить данные, полученные
исследовании, в котором был использован один тип крахмала, на другой его
498 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Названия типов ГЭК. как правило, связаны с молярным замещением данной ft
• ГЭК. имеющие молярное замещение 0,7, называются гетакрахмал
(Hetastarch); ац«
• ГЭК, имеющие молярное замещение 0,6, называются гексакрахмала
(Hexastarch); 'dMl1
• ГЭК. имеющие молярное замещение 0,5, называются пентакрахмала
IPentastarchy Ми
і ГЭК. имеющие молярное замещение 0,4, называются тетракрахмалаи
(Tetrastarch). И
Растворы ГЭК разделены на две фармакологические группы. Препараты щ
со средней молекулярной массой 200 тыс. Да и степенью замещения 0,5 отнесены
к группе Pentastarch, а препараты с высокой молекулярной массой 450 тыс. Да
и степенью замещения 0.6-0.8 - к фармакологической группе Hetastarch.
Фармакологические свойства указанных групп препаратов существенно раз¬
личаются. Препараты с высокой молекулярной массой и степенью замещения 0 7
обладают способностью более длительно удерживать воду в кровеносном русле
но негативно влияют на системы свертывания крови и длительно сохраняются
в тканях и органах в виде баласта. В связи с этим более широкое распростра¬
нение в клинической практике получили растворы ГЭК с молекулярной массой
200 тыс. Да и степенью замещения 0,5, которые при меньшем времени цирку¬
ляции в сосудистом русле обладают менее выраженным влиянием на систему
гемостаза. К ним относятся препараты ХАЕС-стерил* 6 и 10%, рефортан ГЭК*
6 и 10%, гемохес* 6 и 10% и ГЭК последнего поколения инфукол ГЭК 6 и 10%,
Препарат стабизол ГЭК*, относящийся к группе Hetastarch, рекомендуют при¬
менять избирательно. Препараты со средней молекулярной массой 130 тыс. Да
и степенью замещения 0,4 относят к группе Tetrastarch. К ним относят волювен
и венофундин в концентрации 6%.
Препараты Волюлайт* и Тетраспан* являются ГЭКами со средней моле¬
кулярной массой (130 кДа), растворенные в сбалансированных растворах
электролитов.
Предполагается, что применение сбалансированных растворов может быть
более благоприятным в отношении профилактики развития гиперхлоремического
ацидоза, нарушений свертывания крови и функции тромбоцитов.
Ряд авторов делают вывод, что если требуется проведение инфузионной тера¬
пии в умеренном объеме, то, по-видимому, нет необходимости в использовании
сбалансированных растворов; сбалансированные растворы могут быть использо¬
ваны с целью снижения хлоридной нагрузки, если требуется проведение инфузи¬
онной терапии в большом объеме.
Растворы ГЭК обладают низкой частотой побочных реакций. Вероятность ана¬
филактоидных реакций при использовании растворов ГЭК 200/0,5 в 3 раза ниже,
чем при введении желатина, в 2,4 раза ниже, чем при введении растворов декстра¬
на, и в 1,1 раза ниже, чем при введении растворов альбумина человека.
ГЭК значительно реже, чем другие группы коллоидов, вызывают аллергические
реакции. При их применении не зарегистрировано повышения уровня гистамина,
что возникает при введении растворов желатина, и отсутствует появление реакции
«антиген-антитело*, что характерно для декстранов. Не оказывают отрицатель¬
ного воздействия на иммунную систему человека и животных.
Применяемые в клинической практике по оптимальной схеме растворы ГЭК
(200/0,5) восстанавливают нарушенную гемодинамику, повышают эффективность
работы сердца, улучшают доставку и потребление кислорода тканями. Их исполь-
зование для профилактики и лечения шока позволяет предупредить возникнове¬
ние полиорганной недостаточности и в значительной мере улучшить результаты
лечения при хирургических вмешательствах, травмах, ожогах и сепсисе.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 499
_льзование раств0ров ГЭК (200/0,5) для острой и терапевтической нормо-
гемодилюции обеспечивает значительное улучшение реологии крови
^ывает высокую эффективность при лечении ишемических поражений мозга,
,о0* ренопатии, окклюзионных заболеваниях периферических артерий.
4*5 внутривенного введения отдельные молекулы с ММ ниже почечного
^(доя ГЭК 70 тыс. Да) экстретируются почками. Если ММ выше, то моле-
1,0 вначале гидролизируются а-амилазой (со скоростью, прямо пропорцио*
0jj степени замещения), а через почки выводятся уже низкомолекулярные
ЇІІКТЬІ этого гидролиза.
Wr коЛЛоидные плазмозаменители в значимых дозах влияют на свертываю-
снстему. Воздействие их складывается из следующих моментов:
^ воздействия на сосудисто-тромбоцитный гемостаз (все плазмозаменители);
' взаимодействия с плазменными факторами свертывания и компонентами
' 4ибринолитической системы (препаратами желатина с фактором фон Вилле¬
бранда, декстранами с факторами И, V, VIII, крахмалами с фактором VIII);
, интеграции в структуру тромба;
в степени влияния, которое, как правило, зависит от свойств препарата, дозы
и сроков применения, особенностей пациента,
пои введении всех коллоидных кровезаменителей могут возникать анафи-
акгоидные реакции — легкие (I—II степени) и тяжелые, угрожающие жизни
,цт IV степени). Их частота и тяжесть обычно указываются в инструкции по при¬
менению1 альбумин человека — 0,099%, желатиноль4 - 0,155%, гелофузин4 -
00077%, декстраны - до 7%, ГЭК 200/0,5 - до 0,047%, ГЭК 450/0,7 - до 0,085%.
для профилактики анафилактоидных реакций в обязательном порядке проводят
биологическую пробу.
На фоне введения ГЭК и декстранов (особенно полиглюкина4) при определе¬
нии группы крови возможна псевдоагглютинация эритроцитов, которая исчезает
при добавлении одной капли 0,9% раствора натрия хлорида.
После введения декстраны с молекулярной массой 40 и 70 тыс. Да и ГЭК 200/0,5
персистируют в клетках системы мононуклеарных фагоцитов недели, а ГЭК
430/0,7 - месяцы.
Накопление препаратов ГЭК, имеющих меньшую ММ, было менее выражен¬
ным, чем накопление гетакрахмала. Waitzinger с сотр. показали, что у здоровых
добровольцев при введении 6% или 10% раствора ГЭК 130/0,4 не происходило
клинически значимого кумулирования в плазме после однократного или повтор¬
ных введений на протяжении 10 сут.
(Waitzinger J, Bepperling F, Pabst G, Opitz J, Muller M, Baron J: Pharmacokinetics
and tolerability of a new hydroxyethyl starch (HES) specification [HES (130/0.4)] after
single-dose infusion of 6% or 10% solutions in healthy volunteers. Clin Drug Investig
1998;16:151-60.
Waitzinger J, Bepperling F, Pabst G, Opitz J: Hydroxyethyl starch (HES) [130/0.4].
Jnew HES specification. Pharmacokinetics and safety after multiple infusions of 10%
solution in healthy volunteers. Drugs RD 2003; 4:149-57).
Длительное ежедневное применение ГЭК в средних и высоких дозах (суммар¬
на курсовая доза гидроксиэтилкрахмала — >300 г) может вызывать зуд кожи
^ниталий различной интенсивности и продолжительности.
Все содержащиеся в плазме молекулы вносят вклад в создание онкотического
актЦЄНИЯ ^0ТЯ ®олее крупные молекулы обладают весьма малой онкотической
і в своем исходном состоянии, продукты их гидролиза образуют мно-
молекул с промежуточной молекулярной массой. Это происходит к тому
коі«)ЄНИ? Когда исходные молекулы под действием а-амилазы распадаются до низ-
I циркулярных частиц и начинают выводиться с мочой. Этот эффект также спо-
Ш полемическому действию гидроксиэтилкрахмалов.
500 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Кроме того, такие эффекты, как улучшение реологических свойств
уменьшение капиллярной утечки за счет ингибирования активации эндо ^
цитов и «запечатывающего эффекта*, снижение выброса ксантиноксидазы Ио'
ишемни-реперфузии, ослабление системной воспалительной реакции, веп П0С|,е
вследствие улучшения микроциркуляции СО снижением активации эндотел ЛТН°’
то8 и поражения эндотелия, позволяют использовать их в качестве плела °^Н
выбора при гиповолемии и шоке, особенно на фоне ССВР. Рат°8
Показания к применению:
я лечение и профилактика гиповолемических состояний, шока при хилулш
ских вмешательствах, ранениях, инфекционных заболеваниях, ожогах m Є
матических повреждениях, интоксикациях и других состояниях, требуюп
возмещения ОЦК; *
и терапевтическое разведение крови (гемодилюция);
В для уменьшения объемов препаратов крови при кровезамещении.
Противопоказания: препараты ГЭК нельзя применять при гиперволемии, сост
яниях гипергидратации, в случаях тяжелой застойной сердечной недостаточности
почечной недостаточности, а также при содержании креатинина в сыворотк
2 мг/дл, тяжелых геморрагических диатезах и известной повышенной чувстви¬
тельности пациента к гидроксиэтилкрахмалу.
Первые 10-20 мл следует вводить медленно для своевременного выявления
анафилактоидных реакций. Лишь в исключительных случаях допускается превы¬
шение дозы 20 мл/кг массы тела в сутки (для ГЭК 130 — 50 мл/кг). При отсутствии
острой экстренной ситуации рекомендуемая продолжительность вливания -
не менее 30 мин на 500 мл.
При применении препаратов ГЭК в целях гемодилюции в течение несколыац
дней подряд суточная доза обычно составляет 500 мл. Общая доза в объеме 5 л
может быть распределена на срок лечения продолжительностью до 4 нед.
Возможные осложнения следующие. Во время инфузии раствора уровень ами¬
лазы в сыворотке крови возрастает в 2-3 раза, что может наблюдаться в течение
5 сут. Для препаратов 450/0,7 анафилактоидные реакции встречаются с частотой
0,085%. Такие реакции проявляются в большинстве случаев в виде рвоты, лег¬
кого повышения температуры, чувства холода, зуда. Наблюдались увеличение
верхней подчелюстной и околоушной слюнных желез, легкие симптомы обще¬
го недомогания, такие как головная боль, ломота в мышцах и периферические
отеки нижних конечностей. Реакции непереносимости, сопровождающиеся
шоком и угрожающими жизни симптомами (иногда вплоть до прекращения кро¬
вообращения и остановки дыхания) исключительно редки (распространенность
в пересчете на введенное количество единиц инфузионного раствора составляет
около 0,006%).
Растворы ГЭК принято классифицировать в зависимости от молекулярной
массы, степени замещения, а также концентрации раствора. Приставка «гета*
означает степень замещения 0,7, «гекса-» — 0,6, а «пента-» — 0,5, «тетра-» - ОД
Волекам*
Волекам* — 6% раствор оксиэтилированного крахмала с молекулярной массой
170 тыс. Да и степенью замещения 0,6 (170/0,6). Теоретическая осмолярность -
308 мОсм/л, pH - 5-7. Волемический эффект 100%, длительность волемического
действия - 3-4 ч. Содержит ионы натрия — 154 ммоль/л и хлора — 154 ммоль/л
Расщепляется амилазой и выводится с мочой.
Показания к применению:
• профилактика и лечение гиповолемии и шока;
• предоперационная изоволемическая гемодилюция;
• венозный тромбоз.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 501
Ппотивопоказания:
тяжелая застойная сердечная недостаточность;
' почечная недостаточность;
, склонность к кровоточивости вследствие гипофибриногенемии или тромбо¬
цитопении;
гипергидратация;
I дегидратация;
• травма черепа, сопровождающаяся повышением внутричерепного давления;
| аллергия к крахмалу.
препарат может вызывать аллергические реакции.
До переливания необходимо проведение биологической пробы. Для лечения
профилактики гиповолемии и шока максимальная суточная доза - до 1500 мл.
Максимальная скорость инфузии — первые 500 мл внутривенно струйно, далее
капельно.
I настоящее время препарат не производят, и его включение в список препара¬
тов можно рассматривать только как исторический аспект.
Инфукол ГЭК* 6%
йнфукол ГЭК* 6% — 6% раствор гидроксиэтилкрахмала с молекулярной мас¬
сой 200 тыс. Да и степенью замещения 0,5 (200/0,5). Относится к фармаколо¬
гической группе Pentastarch. Технология его получения позволяет производить
оригинальную субстанцию с максимально узким молекулярно-массовым рас¬
пределением и точно заданными молекулярными параметрами, что обеспечивает
его высокую терапевтическую и экономическую эффективность. Теоретическая
осмолярность - 309 мОсм/л, pH 5,0-7,0. Содержит ионы натрия - 154 ммоль/л
и хлора - 154 ммоль/л. Волемическое действие - 85-100% введенного объема.
Длительность объемного действия — 4-6 ч.
Улучшает реологические свойства крови за счет снижения показателя гемато¬
крита; уменьшает вязкость плазмы, снижает агрегацию тромбоцитов и препят¬
ствует таковой эритроцитов.
Инфукол ГЭК* депонируется в клетках ретикулоэндотелиальной системы без про¬
явлений токсического действия на печень, легкие, селезенку и лимфатические узлы.
Под действием амилазы инфукол ГЭК* расщепляется до низкомолекулярных
фрагментов (<70 тыс. Да), которые удаляются почками.
Сходство структуры инфукола ГЭК* с гликогеном объясняется высоким уров¬
нем переносимости и практическим отсутствием побочных реакций.
Период полувыведения — 12ч.Показательклиренса — 7,33 мл/мин. Максимальная
концентрация препарата в сыворотке составляет 11,1±2,7 мг/л; на третий день после
введения в сыворотке определяются следовые количества гидроксиэтилкрахма¬
ла. В течение первых 12 ч после начала введения препарата в моче присутствует
24,48+3,93 г гидроксиэтилкрахмала (49% введенного количества).
Показания к применению:
• профилактика и лечение гиповолемии и шока в связи с операциями, острыми
кровопотерями, травмами, ожогами и инфекциями;
• нарушения микроциркуляции;
' гемодилюция.
Препарат разрешен для клинического применения у детей, включая новорож-
I Денных.
При инфузионной терапии у больных сахарным диабетом введение препарата
не сопровождается повышением уровня глюкозы в крови.
Противопоказания:
I ЙВЙЕІІГИіта<гаі»ілд*
302 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
I гиперволемия;
• декомпенсиро ванная сердечная недостаточность;
• почечная недостаточность с олигурией или анурией;
I аллергия на крахмал;
• кардногенный отек легких;
• внутричерепные кровотечения;
І выраженные нарушения свертываемости крови;
■ первые три месяца беременности.
Стишком быстрое внутривенное введение, так же как применение больших до
может приводить к нарушениям гемодинамики. Изредка может возникать обрати
мый кожный зуд.
Введение препарата оказывает влияние на результаты определения активности
амилазы сыворотки крови, что не связано с клиническими проявлениями панкреа¬
тита.
При лечении препаратом следует контролировать ионограмму сыворотки
и баланс жидкости, обеспечивать достаточное введение жидкости и контролиро¬
вать функции почек; состояние дегидратации требует предварительной коррекции'
необходимо проявлять осторожность при геморрагических диатезах.
До введения препарата обязательна биологическая проба. Инфукол ГЭК* 6%
вводят внутривенно капельно в соответствии с потребностью замещения объема
циркулирующей жидкости в определенных возрастных дозах (табл. 15-14).
Таблица 15-14. Возрастные дозы инфукола ГЭК* 6%
Возрастная группа
Среднесуточная доза, мл/кг
массы тела
Максимальная суточная доза,
мл/кг массы тела
Взрослые и дети старше 12 лет
33
33
Дети от 6 до 12 лет
15-20
33
Дети от 3 до 6 лет
15-20
33
Новорожденные и дети до 3 лет
10-15
33
Суточную дозу и скорость внутривенного введения рассчитывают в зависимо¬
сти от кровопотери и концентрации гемоглобина. У молодых пациентов без риска
поражения сердечно-сосудистой системы и легких контрольным уровнем приме¬
нения коллоидного плазмозамещающего препарата считается гематокрит, равный
30% и менее. Максимальная суточная доза — до 33 мл раствора на 1 кг массы тела
в сутки. Максимальная скорость инфузии зависит от исходных показателей гемо¬
динамики и составляет примерно 20 мл/кг массы тела в час. Учитывая возможные
анафилактические реакции, первые 10-20 мл препарата следует вводить медлен¬
но, при тщательном наблюдении за состоянием больного.
У новорожденных и детей до 3 лет рекомендуют придерживаться среднесуточ¬
ной дозы препарата при тщательном наблюдении за уровнем гидратации и содер¬
жанием электролитов.
Следует учитывать риск перегрузки системы кровообращения при слишком
быстром введении или слишком высокой дозе препарата.
Инфукол ГЭК* не рекомендуют смешивать с другими лекарственными средства
МИ В ОДНОЙ емкости и В ОДНОЙ системе. -до
Формы выпуска: флаконы по 100,250 и 500 мл или полимерные мешки по 250 и
мл. Хранят при температуре не выше +25 °С. Срок годности указан на упаковке.
Инфукол ГЭК* 10%
Яз
Инфукол ГЭК* 10% - раствор гидроксиэтилкрахмала с ММ 200 ТМ*.
и степенью замещения 0,5, относится к фармакологической группе ?еп
Теоретическая осмолярность — 309 мОсм/л, pH 5,0-7,0. Содержит ионы натр
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 503
оль/л и хлора — 154 ммоль/л. Волемическое действие — 130-140% введен-
объема. Длительность волемического действия 4-6 ч.
Инфукол ГЭК* 10% предназначен для внутривенных инфузий. Перед началом
алии обязательна биологическая проба. Инфукол ГЭК* 10% вводят капельно
ответствии с потребностью замещения объема циркулирующей жидкости
’определенных возрастных дозах (табл. 15-15).
115-15. Возрастные дозы инфукола ГЭК* 10%
Возрастная группа
и дети старше 12 лет
от 6 до 12 лет
L ОТ з ДО 6 лет
црмупжденные и дети до 3 лет
Среднесуточная доза, мл/кг
массы тела
20
10-15
10-15
8-10
Максимальная суточная доза,
мл/кг массы тела
20
20
20
20
Суточную дозу и скорость внутривенного введения рассчитывают в зависимо¬
сти от кровопотери и концентрации гемоглобина. У молодых пациентов без риска
поражения сердечно-сосудистой системы и легких пределом применения колло¬
идного объемзамещающего препарата считается гематокрит, равный 30% и менее.
Максимальная суточная доза — 20 мл/кг массы тела в сутки.
Вся остальная информация идентична инфуколу ГЭК* 6%.
Для препаратов инфукол ГЭК* 6 и 10% разработана базовая схема инфузионно-
трансфузионной терапии операционной кровопотери у детей, взрослых, беремен¬
ных и рожениц.
При операционной кровопотере до 20% ОЦК не показано использование пре¬
паратов донорской крови. В течение операции кровопотеря возмещается инфузией
или 6% раствора инфукола ГЭК*, или растворов кристаллоидов. В раннем после¬
операционном периоде используются только глюкозо-солевые растворы.
При операционной кровопотере до 30% во время операции проводят инфузию
6% раствора инфукола ГЭК* в дозе 20-25 мл/кг массы тела, при значительном сни¬
жении гематокрита (<27) — трансфузию эритроцитной массы в дозах 6-8 мл/кг.
При операциях с кровопотерей до 50% ОЦК 6% раствор инфукола ГЭК* вводят
вдозе 25-33,10% —15-20 мл/кг в зависимости от показателей центральной гемо¬
динамики. Донорские эритроциты в дозе 6-8 мл/кг назначают в случае перегрузки
сердечно-сосудистой системы или снижения уровня гематокрита (<27).
При операционной кровопотере 75% ОЦК и более дозы 6 и 10% растворов
инфукола ГЭК* могут достигать соответственно 45 и 30 мл/кг. Обязательным
компонентом терапии считаются в этом случае трансфузии эритроцитной массы
(115 мл/кг и более). В раннем послеоперационном периоде проводят инфузии
коллоидов и эритроцитной массы по показаниям. Трансфузии свежезаморожен¬
ной плазмы и концентрата тромбоцитов необходимо проводить только в случае
значимых нарушений гемокоагуляции, а раствора альбумина человека - только
8 случае гипоальбуминемии.
Инфукол ГЭК* 10% выпускают во флаконах по 100,250 и 500 мл или полимер-
ных мешках по 250 и 500 мл. Хранят при температуре не выше +25 °С. Срок год¬
ности указан на упаковке.
ХАЕС-стерил* 6%
ХАЕС-стерил* 6% — это 6% раствор полигидроксиэтилкрахмала 200/0,5 в изо-
«fcKOM растворе натрия хлорида. Теоретическая осмолярность — 308 мОсм/л,
L *>5-6,0. Содержит ионы натрия — 154 ммоль/л и хлора — 154 ммоль/л.
^омический эффект - 100%, длительность волемического действия - 3-4 ч.
^оказания к применению:
Профилактика и лечение гиповолемии и шока;
ГПАВА15
504 «ТОНИЧЕСКАЯ ТВАНСФУЗИОЛОГИЯ
• терапевтическая гемодилюция.
Противопоказания:
І тяжелая застойная сердечная недостаточность;
1 точечная недостаточность (креатинин >177 мкмоль/л);
• тяжелые нарушения коагуляции крови;
• гипергидратация;
1 тяжелая дегидратация;
• внутричерепное кровотечение;
■ отек легких;
• тяжелые хронические заболевания печени;
• аллергия на крахмал.
Инфузию ХАЕС-стерила* следует обеспечивать достаточным количеством к
сталлоидных растворов. №'
Данных о применении у детей, беременных и матерей в период лактации нет
Применение препарата длительное время и в больших дозах может вызыва
увеличение времени кровотечения.
В редких случаях может вызывать анафилактоидные реакции. Длительное еже¬
дневное применение часто вызывает кожный зуд.
При применении ХАЕС-стерила* повышается концентрация сывороточной
амилазы, что может затруднять диагностику панкреатита.
При определении группы крови возможна псевдоагглютинация эритроцитов
которая исчезает при добавлении одной капли 0,95% раствора натрия хлорида.
Перед инфузией обязательна биологическая проба. При лечении и профилак¬
тике гиповолемии и шока максимальная суточная доза ХАЕС-стерила* составляет
33 мл/кг массы тела, максимальная скорость внутривенной инфузии - 20 мл/кг
массы тела в час. Степенью и длительностью гиповолемии определяется продол¬
жительность вливания ХАЕС-стерила 6%.
При септическом и ожоговом шоке скорость переливания должна бьггь меньше.
При хирургических операциях при отсутствии других указаний для непо¬
средственного предоперационного замещения собственной крови рекомендуют
одновременное введение ХАЕС-стерила 6% в соотношении 1:1 (до показателя
гематокрита не ниже 30%).
При терапевтической гемодилюции и отсутствии других указаний используют
следующие суточные дозы:
• 250 мл (низкая доза) за 0,5-2 ч;
I 500 мл (средняя доза) за 4-6 ч;
• 2 раза по 500 мл в сутки (высокая доза) за 8-24 ч.
Критерием выбора программы служит снижение показателя гематокрита,
определяемое для каждого больного. Использовать препарат в этом случае реко¬
мендуют до 10 дней.
Взаимодействие с другими лекарственными препаратами не установлено.
Формы выпуска: флаконы 250 мл из пластика и по 500 мл из стекла и пластика.
Хранят при температуре не выше +25 °С. Не замораживать! Срок годности - 5 лет.
ХАЕС-стерил 10%
ХАЕС-стерил* 10% — это 10% раствор полигидроксиэтилкрахмала 200/0,5 в
0,9% растворе натрия хлорида. Теоретическая осмолярность - 308 мОсм/л, pH 3,5-
6,0. Волемический эффект - 145% в течение 1 ч и 100% с длительностью 2-3 ч.
До применения обязательна биологическая проба. При лечении и профилак¬
тике гиповолемии и шока максимальная суточная доза до 20 мл/кг массы тела
(1500 мл - с массой тела 75 кг), максимальная скорость внутривенной инфузии -
до 20 мл/кг. Степенью и длительностью гиповолемии определяется продолжи
тельиость инфузий ХАЕС-стерила* 10%.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 505
ш остальная информация о препарате идентична ХАЕС-стерилу* 6%
дозирование препарата указано в табл. 15-16.
15-16. Рекомендуемые дозы гидроксиэтилкрахмала (ХАЕС-стерила*)
ХАЕС-стерил* 6%
33 мл/кг массы тела или 2 г/кг массы
тела (2500 мл — с массой тела 75 кг)
ХАЕС-стерил* 10%
20 мл/кг массы тела или 2 г/кг массы тела
(1500 мл — с массой тела 75 к г)
инфузии
0,33 мл/ (кгхмин) или 25 мл/мин с мас¬
сой тела 75 кг
0,33 мл/ (кгхмии) или 25 мл/мин с массой
тела 75 кг
Об Эффективности использования препарата судят по следующим показателям:
деднее АД, ЦВД, давление заклинивания, Hct - более 30%, НЬ - 10 г/л, факторы
Іертьівзния. количество тромбоцитов, уровень белков сыворотки.
в исследовании гемодинамических и кардиореспираторных параметров на фоне
^рволемической гемодилюции 10% ХАЕС-стерилом* и 5% альбумином челове¬
ка показано, что:
, оба коллоидных раствора вызывают значимое повышение среднего АД, удар¬
ного объема и утилизации кислорода;
і степень снижения гемоглобина при гемодилюции обоими растворами сопо¬
ставима;
І Ю% ХАЕС-стерил* не вызывал увеличения ЧСС, но в большей степени, чем 5%
альбумин человека, повышал ударный объем и утилизацию кислорода.
Своевременное и обоснованное использование современных плазмозаменящих
препаратов для профилактики и лечения шока позволяет предупредить возник¬
новение полиорганной недостаточности и в значительной мере улучшить прогноз
и исход при хирургических вмешательствах, травмах, ожогах и сепсисе.
Использование 6% и 10% растворов ГЭК (200/0,5) для острой и терапевтиче¬
ской нормоволемической гемодилюции обеспечивает значительное улучшение
реологии крови и показывает высокую эффективность при лечении ишемических
поражений мозга, тугоухости, ретинопатии, окклюзионных заболеваниях перифе¬
рических артерий.
Гемохес*
Гемохес* - раствор гидроксиэтилкрахмала 200/0,5 в 0,9% растворе натрия
ыорида, выпускают в концентрации 6 и 10%. Волемический эффект 6% раство¬
ра - 85-100% и 130-140% для 10% раствора с длительностью волемического
действия 4-6 ч.
Показания к применению:
I профилактика и лечение гиповолемии и шока;
I профилактика артериальной гипотензии;
І гемодилюция;
І экстракорпоральное кровообращение.
Противопоказания;
• аллергия к крахмалу;
I гипергидратация;
• гиперволемия;
I тяжелая сердечная недостаточность;
* почечная недостаточность (креатинин >180 ммоль/л);
* тяжелые нарушения свертывающей системы;
' хронические заболевания печени;
I геморрагические диатезы;
506 КЛИНИЧЕСКАЯ ТРАНСФУЗИ0Л0ГИЯ
• церебральная геморрагия;
I дегидратация (без введения сбалансированного количества электролит
• гематокрит менее 25%, а у пациентов с кардиологическими или пульм °^:
гическими расстройствами — менее 30%. °н°Л(ь
Безопасность и эффективность введения гемохеса* детям до 12 лет недостать.
изучены. Использование препарата при беременности - только в крайних сигтаГ^
Отсутствуют какие-либо данные по использованию гемохеса* в период лактахт^
В редких случаях препарат может вызывать анафилактоидные Щр
как в сознании, так и под наркозом. Профилактическое назначение глюкок
коидов неэффективно.
Повторные назначения препарата как в высоких, так и в средних дозах І
приводить к упорному зуду, не поддающемуся терапии.
Использование пентакрахмала гемохеса* требует постоянного контроля эл
тролитов, параметров коагуляции и сывороточного альбумина.
Применение препарата на 3-5-е сутки вызывает повышение сывороточной ам
лазы, что может затруднять диагностику панкреатита.
Перед переливанием обязательна биологическая проба. Гемохес* вводят внутпи
венно капельно. При лечении и профилактике гиповолемии и шока максимальная
суточная доза для 6% раствора - 33 мл/кг массы тела (около 2500 мл/сут при массе
тела 75 кг) с максимальной скоростью 33 мл/кг в час. При предоперационной гемо¬
дилюции суточная доза для 10% раствора 1 не более 20 мл/кг. При терапевтической
гемодилюции суточная доза препарата - 500 мл в течение 4-6 ч.
Взаимодействие с другими лекарственными компонентами не установлено.
Гемохес* 6% и 10% выпускают в полиэтиленовых контейнерах по 500 мл
Хранят при комнатной температуре. Нельзя использовать после срока годности
указанного на упаковке.
Рефортан* 6%
Рефортан* 6% - 6% раствор гидроксиэтилкрахмала с молекулярной мас¬
сой 200 тыс. Да и степенью замещения 0,5 (200/0,5). Теоретическая осмоляр¬
ность - 308 мОсм/л, значение pH 4,0-7,0. Содержит ионы натрия - 154 ммоль/л
и хлора - 154 ммоль/л. Волемический эффект — 85-100%, длительность волеми-
ческого эффекта - 4-6 ч.
Показания к применению;
• восполнение недостающего объема крови в сосудах при состояниях с недо¬
статочным ОЦК;
• профилактика и лечение гиповолемического шока в связи с ожогами, трав¬
мами, операциями;
I гемодилюция.
Противопоказания:
• гиперволемия;
і гипергидратация;
• тяжелая застойная сердечная недостаточность;
• почечная недостаточность в сочетании с олигурией или анурией (креатинин
>2 мг/дл);
і геморрагические диатезы;
І внутричерепное кровотечение;
• аллергия на крахмал;
і отек легких;
I хронические заболевания печени.
При дегидратации рекомендуют вначале провести замещение жидкости с пом
щью кристаллоидных растворов. .. j
Применяется у детей с 0 лет. О применении у беременных и кормящих дан I
отсутствуют.
РвФОРТАН* — плазмозамещающее средство, «золотой стандарт» в инфузионной терапии пп.,
любых видах кровотечений. Занимает ведущее место по качеству и эффективности в групп
коллоидных препаратов. Рефортан* — препарат выбора в терапии гиповолемии за счет того
что наиболее полно отвечает требованиям, предъявляемым к «идеальному» плазмозамени
тало: восстанавливает гемодинамическое равновесие, улучшает микроциркуляцию, быстро I
восстанавливает ОЦК, обеспечивая высокий прирост объема циркулирующей крови, имеет
оптимальный период выведения из сосудистого русла.
Рефортан* 6% — препарат выбора при необходимости возмещения ОЦК.
Рефортан* 10% — препарат выбора для экстренного лечения тяжелой кровопотери, пре¬
парат «скорой помощи». Ре<{юртан* 6% увеличивает ОЦК почти эквивалентно введенному
объему препарата, а Рефортан* 10% — на 130% от введенного объема и повышает АД,
крайне важно у пациентов с критической гемодинамикой и признаками системной воспали¬
тельной реакции, предполагающей капиллярную утечку.
По сравнению с ГЭК 130/0,4 — у Рефортана® 200/0,5 более высокий объемный эффект,
большая продолжительность действия, он оказывает минимальное влияние на систему гемо-
коагуляции и в рекомендуемых дозировках — так же безопасен, как и ГЭК 130/0,4.
Препарат Рефортан*, в отличие от многих других ГЭК-ов, производится на основе куку¬
рузного крахмала, что обеспечивает оптимальное замещение гидроксиэтиловых групп в по¬
ложениях С2-С6 в соотношении 8:1 — 9:1. Подобное замещение обеспечивает длительный
и эффективный волемический эффект в течение 6 часов.
У Рефортана®, как у производного кукурузного крахмала, в отличие от производных карто¬
фельного крахмала, эстерификации фосфорной кислотой не происходит. Применение Рефор¬
тана* не приводит к гипербилирубинемии и не усиливает лизис сгустка, т.е. нет негативного
влияния на систему гемостаза и метаболизм в печени, в отличие от производных картофель¬
ного крахмала.
КОД у Рефортана* 6%—28 мм.рт.ст., что более приближено к КОР плазмы (в норме 25-30
мм.рт.ст.) и является более физиологичным, в отличие от МНОГИХ друг Я препартов ГЭК.
Показания: гиповолемия; профилактика и лечение гиповолеми'ИЯго шока при ожогах,
травмах, операциях; гемодилюция (включая изоволемическую).
Дозирование:
Рефортан* ГЭК 6%
ГЭК 10%
|| Средняя суточная
доза (мп/кг)
Максимальная
суточная доза (мл/кг)
Средняя суто- зр І
доза (мл/кг)
Максимальная
суточная доза (мл/кг)
Новорожденные
I и дети до 3 лет
33
33
20
20
Дети 3-12 лет
15-20
33
10-15
20
j Взрослые и дети
[старше 12 лет
10-15
33
8-10
20
Суточная доза и скорость внутривенного введения: низкая доза — однократно 250 мл/сутки
в течение 0,5—2ч; средняя доза — однократно 500мл/сутки в течение 4-6 ч; высокая доза—
дважды по 500 мл/сутки в течение 8-24 ч. Продолжительность курса лечения зависит от облас¬
ти показания и ОЦК.
Jamnicki М. et at, Switzerland, Anesth Analg 1998;87:989-93
J von Rolen, Switzerland, Br. J Anesth 2006
O. Sander at all, Germany, Anaesth. Scand., 2003
№І^:Сіириі!Ов, «Дегидратация и методы контроля за проводимой терапией» «Consilium
medicum» N«1,2008
Бугров А.В, "Использование препаратов ГЭК в интенсивной терапии панкреатитов» РМЖ
т. 15, No 29,2007
Т А, Федорова, «Инфузионно-трансфузионное обесмпечение при абдоминальной гистерэкто¬
мии у женщин с миомами матки больших размеров», «Consilium medicum» Хир. №2 2008
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИ0НН0-ИНФУЗИ0НН0Г0 ПОСОБИЯ 507
В отдельных случаях возможны анафилактоидные реакции. При продолжи-
вньиой высокодозированной терапии возможно появление кожного зуда.
При введении высоких доз препарата не исключена вероятность повышенной
кровоточивости, обусловленной гемодилюционной коагулопатией и специфиче-
дйм действием препарата на первичный и вторичный гемостаз.
уровень амилазы в сыворотке после вливания рефортана* 6% заметно возрас¬
тает, однако через 3-5 дней приходит в норму. Диагностические или терапевтиче¬
ские мероприятия не требуются.
Перед переливанием обязательно проведение биологической пробы.
Суточная доза и скорость внутривенного вливания зависят от размеров потери
крови и значения гематокрита; продолжительность и объем лечения - от дли¬
тельности и уровня гиповолемии.
При замещении объема крови среднесуточная доза составляет, как правило,
250-1000 мл. Лишь в исключительных случаях допускается превышение значения
20 мл/кг массы тела.
При использовании рефортана* 6% в целях гемодилюции суточная доза обычно
составляет 500 мл. Курсовая доза — не более 5000 л в течение 4 нед.
Скорость инфузии - не менее 30 мин на 500 мл препарата. Первые 10-20 мл
следует вливать медленно при тщательном наблюдении за больным, так как ана¬
филактоидные реакции исключены не полностью.
Снижение гемоглобина менее 10 мг%, гематокрита менее 27%, общего белка
менее 5 г% считается при использовании рефортана* 6% критическим. В этих
случаях показано введение альбумина человека и эритроцитов. При потерях крови
свыше 20-25% циркулирующего объема обязательно введение эритроцитов.
Следует иметь в виду, что рефортан* 6% может оказывать влияние на клинико¬
химические показатели: глюкозу, белок, СОЭ, жирные кислоты, холестерин, сор-
битдегидрогеназу, удельный вес мочи, данные электрофореза мочи.
При смешивании с другими лекарственными средствами следует проявлять
осторожность. При одновременном применении с аминогликозидными антибио¬
тиками рефортан* 6% может инициировать их нефротоксичность.
Выпускают во флаконах по 250 и 500 мл. Хранят при температуре не выше +25
'С. Срок годности — 60 мес.
Рефортан410%
Рефортан* 10% — это 10% раствор гидроксиэтилкрахмала 200/0,5 в 0,9% рас¬
творе натрия хлорида. Теоретическая осмолярность - 308 мОсм/л, pH 4,0-7,0.
Содержит ионы натрия — 154 ммоль/л и хлора - 154 ммоль/л. Волемический
эффект и длительность его действия в инструкции не представлены. Теоретически
могут бьггь такими же, как и у других ГЭК 200/0,5 в такой же концентрации: воле-
мическое действие — 130-140% введенного объема, длительность волемического
действия - 4-6 ч.
Показания к применению:
• восполнение недостающего объема крови в сосудах при состояниях с недо¬
статочным ОЦК;
• профилактика и лечение гиповолемического шока в связи с ожогами, трав¬
мами, операциями;
І гемодилюция.
Противопоказания:
І гиперволемия;
І гипергидратация;
• тяжелая застойная сердечная недостаточность; ^
• почечная недостаточность в сочетании с олигуриеи или анури (кре
>2 мг/дл);
• геморрагические диатезы;
508 КЛИНИЧЕСКАЯ ТРАНСФУЗИ0Л0ГИЯ
• внутричерепное кровотечение;
• аллергия к крахмалу;
• отек легких;
• хронические заболевания печени.
При дегидратации рекомендуют вначале провести замещение жидкости с пом
щью кристаллоидных растворов. °* 1
Применяется у детей С 0 лет. О применении у беременных и кормящих данны* I
отсутствуют. е I
В отдельных случаях возможны анафилактоидные реакции. При продолжи-
тельной высокодозированной терапии возможно появление кожного зуда. Ц
При введении высоких доз препарата не исключена вероятность повышенной і
кровоточивости, обусловленной гемодилюционной коагулопатией и специфиче¬
ским действием препарата на первичный и вторичный гемостаз.
Уровень амилазы в сыворотке после вливания рефортана* 10% заметно возрас- I
тает, однако через 3-5 дней приходит в норму. Диагностические или терапевтиче-
ские мероприятия не требуются.
Перед инфузией обязательно проведение биологической пробы.
Суточная доза и скорость внутривенного вливания рефортана* 10% зависят |
от размеров потери крови и значения гематокрита; длительность и объем тера¬
пии — от продолжительности и величины гиповолемии.
При замещении объема крови среднесуточная доза составляет, как правило, I
250-1000 мл. Лишь в исключительных случаях допускается превышение значения I
20 мл/кг массы тела.
При использовании препарата в целях гемодилюции суточная доза обычно 1
составляет 250-500 мл. Курсовая доза — не более 5000 мл в течение 4 нед.
Скорость инфузии — не менее 30 мин на 500 мл препарата. Первые 10-20 мл I
следует вводить медленно, внимательно наблюдая за состоянием пациента, так Е
как нельзя полностью исключить возможность анафилактоидных реакций.
Снижение гемоглобина менее 10 мг%, гематокрита менее 27%, общего белка В
менее 5 г% считается при применении рефортана* 10% критическим. В этих слу- I
чаях показано введение альбумина человека и эритроцитов. При потерях крови я
свыше 20-25% циркулирующего объема обязательно введение эритроцитов.
Рефортан* 10% может оказывать влияние на клинико-химические показатели: |
глюкозу, белок, СОЭ, жирные кислоты, холестерин, сорбитдегидрогеназу, удель-
ный вес мочи, данные электрофореза мочи.
При смешивании с другими лекарственными средствами следует проявлять I
осторожность. При одновременном применении с аминогликозидными антибио¬
тиками рефортан* 10% может инициировать их нефротоксичность.
Формы выпуска: флаконы по 500 мл. Хранят при температуре не выше +25 °С.
Срок годности - 60 мес.
Стабизол*
Стабизол* — 6% раствор гидроксиэтилкрахмала с молекулярной массой
450 тыс. Да и степенью замещения 0,7 (450/0,7) в 0,9% растворе натрия хлорида. \
Теоретическая осмолярность — примерно 300 мОсм/л, pH — 4,0-7,0. Содержит
ионы натрия - 154 ммоль/л и хлора - 154 ммоль/л. Волемический эффект и его
длительность в инструкции не указаны, однако ГЭК этой фармакологической
группы более длительно удерживаются в кровеносном русле, чем пентакрахмалы,
по некоторым данным, 6-8 ч.
Показания к применению:
• восполнение недостающего объема крови в сосудах при состояниях с недо¬
статочностью ОЦК;
• профилактика и лечение гиповолемии и шока;
• изоволемическая гемодилюция.
СТАБИЗОЛ® — единственный в России препарат из группы Hetastarch, препа
выбора для восполнения ОЦК при любых состояниях, связанных с повышенной
ницаемостью эндотелия (при тяжелых гестозах, сепсисе, ожогах etc), а также п
проведении длительных операций. Стабизол® нормализует микроциркуляцию вос¬
станавливает стенки порозных капилляров. Стабизол® способен «запечатывать»
поры в эндотелии, появляющиеся при разных формах его повреждения.
Большая величина молекулы (450 кД) позволяет эффективно компенсировать
ОЦК при поврежденном эндотелии, в отличие от плазмозаменителей с меньшей ве¬
личиной молекулы, которые при поврежденном эндотелии могут «уходить» в интер-
стиций.
Высокая молекулярная масса Стабизола® и высокая степень замещения (0.7)
обуславливает большую продолжительность действия препарата (около 8 часов)
позволяет эффективно и безопасно проводить минимальную трансфузию во время
длительных операций. Например, в ходе нейрохирургических операций возможно ис¬
пользование всего одного флакона Стабизола® (при этом инфузия не повышает риск
развития отека мозга).
Стабизол® безопасен при использовании в рекомендуемых дозировках.
Клинические наблюдения позволяют предположить, что, в дополнение к свойс¬
твам идеального восполнения ОЦК, Стабизол® в условиях ишемически реперфузион-
ного повреждения снижает степень повреждения легких и дру внутренних органов,
а также выброс ксантиноксидазы.
fv-j'-.
При гиповолемическом шоке инфузионная терапия с п^^Ягением Стабизола*
снижает частоту развития отека легких по сравнению с г^^Ннением альбумина
и физиологического раствора хлорида натрия.
Стабизол® снижает концентрацию циркулирующего фактої ^Qil и ингибирует вы¬
брос фактора Виллебрандта из эндотелиальных клеток. Это по,.^Яяет предположить,
что Стабизол® способен ингибировать экспрессию Р-селектин; активацию клеток
эндотелия. Поскольку взаимодействие лейкоцитов и эндотелия Определяет транс-эн-
дотелиальный выход и тканевую инфильтрацию лейкоцитами, влияние на этот па¬
тогенетический механизм может уменьшить выраженность повреждения тканей при
многих критических состояниях.
В США в качестве гидроксиэтилкрахмалов отдается предпочтение Хетакрахма-
лам (ГЭК 450/0,7 или ГЭК 670/0,75). Эффективность и безопасность Стабизола® ГЭК
450/07 доказаны и проверены временем и не подвергаются сомнению.
Показания. Гиповолемия; профилактика и терапия гиповолемического шока при
ожогах, травмах, операциях; гемодилюция.
Дозирование. Внутривенно, капельно, первые 10-20 мл вводят медленно. При ги-
поволемии — по 500-1000 мл в сутки (до 20 мл/кг в сутки). В отсутствии экстренной
ситуации рекомендуемая продолжительность вливания — не менее 30 мин на 500 мл.
При применении препарата в целях гемодилюции в течение нескольких дней подряд
суточная доза обычно составляет 500 мл.
Молчанов И.В., Буланов А.Ю., Шулутко Е.М. Некоторые аспекты безопасности ин¬
фузионной терапии // Клиническая анестезиология и реаниматология. 2004.
Руденко М. И. Замещение операционной кровопотери рефортаном и стабизолом //
Новости анестезиологии и реаниматологии (медицина критических состояний). 2005.
Ne 4.
Серов В.Н., Баранов И.И. Растворы гидроксиэтилированного крахмала в акушерско-
гинекологической практике // РМЖ. 2006. Т. 14. Ne 1
Бутров А.В., Борисов А.Ю., Галенко С.В. «Рациональная инфузионная терапия
у больных в критических состояниях»
Jamnicki М. et al., Switzerland, Anesth Analg 1998;87:989-93
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО пособия grig
противопоказания:
, пшергидратация;
, гиперволемия;
тяжелая застойная сердечная недостаточность;
, почечная недостаточность с олигурией или анурией (креатинин
>180 ммоль/л);
I хронические заболевания печени;
, отек легких;
І геморрагические диатезы;
• дегидратация (без введения сбалансированного количества электролитов);
. аллергия к крахмалу.
Применяется у детей с 10 лет. О применении у беременных и кормящих данных
нет.
В редких случаях препарат может вызывать анафилактоидные реакции.
Длительное ежедневное применение препарата может вызывать трудноподдаю-
ЩЙЙСЯ лечению кожный зуд.
При введении высоких доз препарата не исключена возможность повышения
кровоточивости, что может быть связано с эффектом гемодилюции или специфи¬
ческим действием препарата.
Применение препарата на 3-5-е сутки вызывает повышение сывороточной ами¬
лазы, что затрудняет диагностику панкреатита.
Перед переливанием обязательно проведение биологической пробы. Стабизол*
вводят внутривенно капельно. Суточная доза и скорость введения раствора зави¬
сят от уровня кровопотери или показателя гематокрита. Длительность и объем
лечения зависят от продолжительности и уровня гиповолемии. Максимальная
суточная доза — до 20 мл/кг массы тела с максимальной скоростью 20 мл/кг массы
тела в час. Если ситуация не экстренная, рекомендуемая продолжительность вли¬
вания составляет 500 мл за 30 мин.
Взаимодействие с другими лекарственными компонентами неизвестно.
Препарат рекомендуют использовать в единичных случаях.
Выпускают во флаконах по 500 мл. Срок годности — 60 мес. Хранят при темпе¬
ратуре не выше 25 °С.
Волювен4
Волювен* — 6% ГЭК 130/0,4 в 0,9% растворе хлорида натрия. Молекулярная
масса — 130 000 Да, степень замещения — 0,4, теоретическая осмолярность -
308 мОсм/л, pH 4,0-5,5. Объемный эффект — 100%, длительность объемного
эффекта приблизительно — 4-6 ч. Содержание ионов натрия — 154 ммоль/л, хло¬
ридов - также 154 ммоль/л. Исходное сырье — кукуруза восковой спелости.
Более низкая степень замещения у препаратов ГЭК 130/0,4 по сравнению с ГЭК
200/0,5 способствует более быстрому расщеплению их амилазой и выведению
из организма, меньшему накоплению в тканях и плазме крови, снижению влияния
на коагуляцию. Характер замещения 9:1 обеспечивает препарату более стабильный
волемический эффект. Период полувыведения волювена* составляет в первой фазе
1.4 ч, во второй — 12,1 ч. При однократном введении 500 мл волювена* молекулы
гидрокси этилированного крахмала полностью выводятся из организма через 24 ч.
Показания к применению:
і лечение и профилактика гиповолемии любогого генеза и шока:
• острая нормоволемическая гемодилюция;
• терапевтическая гемодилюция:
І заполнение аппарата экстракорпорального кровообращения.
Противопоказания:
і повышенная индивидуальная чувствительность к препарату;
• гипергидратация;
£1 V0VUJ
510 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
• гнперволемия;
• застойная сердечная надосгаточность, кардиогенный отек легких
к тяжелые нарушения свертывающей системы крови;
I внутричерепное кровотечение;
• дегидратация;
• почечная недостаточность тяжелой степени с олигурией или анурией-
я у пациентов, находящихся на гемодиализе; ’
я гиперхлоремия. гипернатриемия.
Побочными эффектами использования препарата могут быть;кожньй
повышение активности амилазы в Сыворотке крови, дилюция, проявляю S
снижением гематокрита, протеинов плазмы и факторов коагуляции (в частоаЯСя
фактор VIH фон Виллебранда). Ности
Способ применения: внутривенная инфузия с проведением биологичео? *
пробы. При восполнении объема циркулирующей крови максимальная суточн°И
доза составляет: ая
для взрослых - 50 мл/кг массы тела;
детей 10-18 лет — 33 мл/кг массы тела;
детей 2-10 лет - 25 мл/кг массы тела;
новорожденных - 25 мл/кг массы тела.
Длительность применения зависит от продолжительности и тяжести гиповоле-
мни, гемодинамической эффективности терапии и гемодилюции.
Выпускают в полиолефиновом контейнере «Фрифлекс» до 250 и 500 мл, срок
годности - 3 года. По 500 мл в пластиковых флаконах, срок годностй -’5 лег.
Хранят в защищенном от света месте при температуре не выше 25 °С f
Венофундин4
К группе крахмалов Tetrastarch относится также препарат венофундин^анало-
гичными волювену* свойствами.
Венофундин* - 6% раствор іидроксизтил крахмал а с молекулярной массой
130 000Да и степенью замещения0,42,Теоретическая осмоляльноеть гг 309м0см/л,
pH 4,0-6,5. Содержание ионов натрия и хлоридов — &о 154 ммоль/л.
Более низкая степень замещения у препаратов ГЭК 130/0,4 по сравнению с ГЭК
200/0,5 способствует более быстрому расщеплению их амилазой и выведению
из организма, меньшему накоплению в тканях й плазме крови. Период иолувы-
ведения из сыворотки крови составляет 12 ч. Объемный эффект — 100%, продол¬
жительность объемного действия — 4-6 ч.
Показания к применению:
• профилактика и лечение гиповолемии и шбка'любой этиологий;
• острай ЙОрмоволемическая гемодилюция;
• терапевтическая гемодилюция;
• заполнение аппарата экстракорпорального кровообращения.
Противопоказания:
• гипергидратация, включая отёк легких;
• хроническая сердечная недостаточность;
• почечная недостаточность с олигурией или анурией;
• выявленная сенсибилизация к ГЭК;
• внутричерепные кровотечения;
• выраженные гипернатриемия и гиперхлоремия;
• выраженная печеночная недостаточность. аКТцв-
Побочными эффектами препарата могут быть кожный зуд, повышени ^
ности амилазы в сыворотке крови, дилюция, проявляющаяся снижением
крита, протеинов плазмы и факторов коагуляции (в частности, фактора
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 511
I препарат следует с осторожностью применять у больных гемофи-
• янда)- препарат следу сі с
9"^ при подозрении на болезнь Виллебранда-И
'gjj йЯИ _^пСть и эффективность применения венофундина у детей, беременных
Ртйод лактации изучены недостаточно. Редко наблюдают анафилактические
‘ ,яй различной тяжести.
®rt)6 применения: внутривенное введение с обязательным проведением био-
^«ясой пробы. Суточная доза и скорость введения зависят от объема крово-
„п, ппа глггптгяя паяя HP ЛПЛЖНЯ ШІРВкШаті; 40 un/un wgm.1 nano
^ я максимальная суточная доза не должна превышать 50 мл/кг массы тела,
НВНрврт 3 г ГЭК на килограмм массы тела в сутки.
^ямпускают ^ полиэтиленовых бутылках по 25Q, 500 и 1000 мл, срок годности -
и по 250,500 и 1000 мл в пластиковых контейнерах, срок годности - 5 лет.
дошл ip Температуре не выше 25 вС. Ц
Тетраспан4
зІІйистрированньїе в последние годы препараты тетраспан* и Волюлайт*.
гипеоХаес* можно считать кровезаменителями комплексного действия, так
[Гони представляют растворы крахмалов в кристаллоидах. ‘
Тетраспан* - 6% Изотонический раствор гидроксиэтилированного крахмала
вАадеированном электролитном растворе. Средняя молекулярная масса -
130 ООО Да, степень молярного замещения — 0,42. Волемический эффект - 100%,
сохранность объемного действия — до 6 ч. В 1 л раствора содержится ионов
натрия -140 ммоль, калия — 4,0 ммоль, кальция - 2,5 ммоль, магния -1,0 ммоль,
зуюридов -118,0 ммоль, ацетатов — 24,0 ммоль, манатов — 5,0 ммоль. Указанные
анионы{ позволяют минимизировать риск гиперхлоремии и ацидоза, особенно
молочнокислого ^Теоретическая осмолярность — 296 мОсм/л, pH 5,6-6,4.
Йердбд цолувыведения из сыворотки — 12 ч. Примерно 50% введенной дозы
выводится с мочой в течение 24 ч.
^оказания в применению:
профилактика и лечение относительной и абсолютной гиповолемии и шока;
• острая нбрмоволемическая и терапевтическая гемодилюция;
і заполнение аппарата экстракорпорального кровообращения.
Йрсщвопоказания:
,4/в^ергидратация, включая отек легких;
* почечная недостаточность с олигурией или анурией;
§;Ііфтричерепное кровоизлияние;
* гиперкалиемия;
• тяжелые гииёрнатриемия и гиперхлоремия;
• выраженная печеночная недостаточность;
* застойная сердечная недостаточность;
Щрерчувствительность к гидроксиэтилкрахмалу или вспомогательным веще¬
ствам.
Применение тетраспана* требует особой осторожности при нарушениях свер¬
тываемости крови, особенно при выявленной или подозреваемой болезни фон
Ииллебранда. Назначение беременным и кормящим не рекомендуют.
^точная доза и скорость введения зависят от величины кровопотери и пара¬
дов гемодинамики. Максимальная доза — 50 мл/кг массы тела в сутки
w>0 г гидроксиэтилкрахмала/кг). Пациентам в острой фазе шока можно вводить
ки ^МЛ/КГ в час’ ПРИ состояниях, угрожающих жизни, возможно быстрое введе-
е 500 мл раствора под давлением. Опыт применения у детей ограничен: 41 ребе-
н/Мда в целях гемодинамической стабилизации — доза 16 мл/кг, без побоч-
в 4 эффектов, и 21 ребенок от 6 мес до 6 лет после кардиохирургических операций
™ мл/кг массы тела - также без побочных
9^2 клиивчюш тлмсвтэиологмя
Высоки? юзы препарата могут приводить к нарушению гемокоагулвииі.
лячивается время кровотечения и индекс АПТВ (активированное паті”* **
Minor время), уменьшается активносп^фактора фон Виляет
уромбооластимоаое время).
Следует избегать сочетания тетраспана с препаратами, вызывающими
И»рма или калия Существует риск аллергических и анафилактических
филактондных реакций 1
Форма выпуска' 6% раствор для инфузий в бутылках из полиэтилена по ю»
Хранят при температуре не мыше 25 “С в течение 2 лет.
Волюлайт* (ГЭК 130/0,4/9:1) в сбалансированном растворе
электролитов
Исходное сырье: крахмал кукурузы восковой спелости. Концентрация -
Молекулярная масса - 130 (±20) кДа. Степень замещения - 0.4. Харакгт
имещения (С2/С6) - 9:1. Волемический эффект - 100% на протяжении 4?
Терапевтический эффект до 6 ч. Состав: 1000 мл Волюлайта* содержат поли(0-
2-гндроксиэтил)крахмал 60.0 г. Концентрация электролитов: Na' 137.0 ммоль/л
К 4.0 ммоль/ л, Mg- 1.5 ммоль/л. С1 110.0 ммоль/л, СН,СОО 34,0 ммоль/л
Теоретическая осмолярность 286,5 мОсм/л. pH 5.7-6,5.
Активной основой препарата является ГЭК 130/0.4 9:1. Электролитный состм
максимально приближен к составу плазмы крови (минимизирован риск развития
гиперхлоремии и ацидоза). Средняя молекулярная масса Волюлайта* в ппялцР
крови in vivo в первые минуты после инфузий составляет 70 000-80 000 Да. Препарат
характеризуется отсутствием накопления в тканях и ретикулоэндотелиальной
системе дюке после многократного применения, полностью выводится почками
(нарушение функции почек не влияет на время элиминации). Эффективно влияет
ив макро- н микроциркуляцию. улучшает оксигенацию тканей. Не имеет противо¬
показаний к применению у больных с нарушенной функцией печени. Разрешен»
применению в педиатрии в странах ЕС и России (включая период новорожденно-
сти). При прямом сравнении ГЭК 130/0,4 6% в сбалансированном электролитном
растворе (Волюлайт*) и ГЭК 130/0,4 6% в физиологическом растворе (Волювен)
были установлены сходные эффективность и общий профиль безопасности. При
метаболическом алкалозе, а также в тех случаях, когда необходимо избежал»
алкалоза, предпочтительно применение препарата, содержащего 6%ГЭК 130/0,4в
0.9% растворе натрия хлорида - Волювена. Если необходимо избежать гиперхло-
ремического ацидоза, то применение Волюлайта* (6%ГЭК 130/0,4 в сбалансиро¬
ванном расі норе электролитов) имеет преимущества перед другими растворами.
Показания
I Лечение и профилактика гиповолемии любого генеза и шока (вследствие
травм, в том числе травмы позвоночника с повреждением спинного мозга,
кровопотери, ожога, сепсиса, полиорганной недостаточности, в послеопера¬
ционном периоде, острой надпочечниковой недостаточности, анафилаксии*
других состояний, сопровождающихся развитием коллапса).
• Острая нормоволемическая и терапевтическая гемодилюция.
К Заполнение аппарата экстракорпорального кровообращения.
Противопоказания
• Повышенная индивидуальная чувствительность к препарату (в т.н. к кр**
малям)
• Гиперволемня
• Хроническая сердечная недостаточность.
• Кардмогеиный отек легких.
• Тяжелые нарушения свертывающей системы крови.
« Внутричерепное кровотечение
ОСНОВНЫЕ СРЕДСТВА ТтСФШОННО І 171— - ЮЛ0 ТЩГ* $13
гпстояиие дегидратации, требующее коррекции водію-электролитного
* баланса.
двнгчиМ недостаточность тяжелой степени с олигурией ш анурией.
* доцпггам. находящимся на гемодиализе.
гиде/Об применения и дозы
* Максимальная суточная доза для взрослых 50 мл/кг массы тела а сутки,
дети ■ возрасте от 10 до 18 лет 33 мл/кг. новорожденные и дети до 10 лет
25 «й/кг-
, форма выпуска: по 250 мл или 500 мл в полимерной упаковке типа
«фрифлекс*.
, Срок годности: 3 года.
ГиперХАЕС*
ГиперХАЕС* представляет собой гипертонический иэоонкотический раствор,
содержащий на 1000 мл раствора 60 г гидроксиэтилкрахмала 200 0.5 и натрия
хлорйда - 72 г, или 1232 ммоль/л. содержание хлоридов - 1232 ммоль/я.
Теоретическая осмолярность 2464 мОсмоль/л, pH 3.5 6.0.
Благодаря высокой осмолярности жидкость в основном из межклеточного про¬
странства быстро перемещается в кровеносные сосуды, в результате чего давление
крови и объем сердечного выброса быстро увеличиваются а зависимости от дозы
і скорости инфузии препарата. После введения препарата увеличение объема
циркулирующей крови происходит за короткое время и должно быть ствби пни
ровано немедленным введением достаточного объема жидкости (солевых и код*
лоидных растворов).
Период полувыведения ГЭК из кровяного русла - около 4 ч. экскретирутя
«основном почками, за 24 ч выводится 50% введенной дозы. Введенный хлоре*
стый натрий через 30 мин равномерно распределяется по всему внеклеточном)
пространству, выводится преимущественно через почки
Показание к применению: первоначальное лечение на догоспитальном этапе
острой гиповолемии и шока путем однократного введения одной дозы препарата
(малообъемная реанимация).
Раствор предназначен для замещения объема крови, его нельзя использовать
как заменитель крови или плазмы крови.
Противопоказания:
• подтвержденная гиперчувствительность к гидроксиэтилкрахмала*,
• тяжелая почечная недостаточность с анурией;
• беременность;
• обезвоживание;
• гиперволемия;
• некомпенсированная хроническая сердечная недостаточность.
ГкперХАЕС* вводят путем однократной внутривенной болюсной икъекими
Ii течение 4-5 мин) в дозе примерно 4 мл кг (250 мл для пациентов с массой тела
^"70 кг). Предпочтительнее препарат вводить в центральную вену, но возможно
и 1 периферическую.
ГиперХАЕС* предназначен только для однократного введения. Сразу после его
"ведения следует провести стандартную плазмозамещающую терапию солевыми
в коллоидными растворами в дозах, соответствующих состоянию пациент*.
При передозировке проявляются симптомы гмпернатриемии.
с осторожностью применяют.
' ври компенсированной застойной сердечной недостаточности;
* подтвержденных нарушениях свертывания крови.
§14 КЛВНИЧККАЯ ТРАНСФУЗИОЛОГИЯ
■ гияеросмолярности крови;
• выраженной гипер- и гипонатриемии;
• выраженной гипер- и гипохлоремии:
• тяжелой печеночной недостаточности.
Не следует применять во время родов для Профилактики ГИПОТОНИИ
Н эяидуральной анестезией, так как существует риск анафил ИИ'
или анафилактоидной реакции. ак™ч*г»ов
Частота побочных эффектов суммирована в табл. 15-7.
Таблица 15-7 Развитие побочных реакций при применении ГиперХАЕС4
Сметам, орган, масс ( Побочные реакции
Частоті ~ ~ '
! Нарушения кровообращения
и функция сердца
Снижение артериального давления, лево-
желудочковая недостаточность, аритмия,
легочная гипертензия у больных, не имею¬
щих выраженного гиповолемического шока
Часто " "''"'''“’'Ч
Лабораторные показатели
Повышение уровня амилазы плазмы крови
Часто -j
Нарушение функций иммун¬
ной системы
Анафилактические реакции
Очень редко
Нарушения метаболизма
и питания
Гипернатриемия и гиперхлоремия.
Обезвоживание
Очень часто
Нарушения функций крови
и лимфатической системы
Нарушения свертываемости крови
Еще не наблюдались,
но считаются возможными
Поражение нервной системы
Мивлинолиз ствола мозга
Еще не наблюдался,
но считается возможным
Нарушения дыхания
Расстройства дыхания
Еще не наблюдались,
но считаются возможными
Местные реакции
Местные реакции непереносимости
Еще не наблюдались,
но считаются возможными
Выпускают в полиолефиновом контейнере «Фрифлекс» по 250 мл. После
вскрытия мешка препарат следует использовать немедленно, остатки раствора
необходимо уничтожать. Хранят при температуре +25 °С в защищенном отсвета
месте. Срок годности — 3 года.
КРОВЕЗАМЕНИТЕЛИ ДЕЗИНТ0КСИКАЦИ0НН0Г0 ДЕЙСТВИЯ
Этот класс кровезаменителей на сегодняшний день представляет лишь исто¬
рический интерес. На основе поливинипирролидона были созданы препараты
дезинтоксикационного действия, показанием для которых была пищевая инток¬
сикация. К ним относились гемодез® — 6% раствор низкомолекулярного поливи-
ннлпирролидона (ПВП) со средней молекулярной массой 12 600±2700 Да и неоге¬
модез4 - 6% раствор иизкомолекулярного ПВП со средней молекулярной массой
8 тыс. Да.
Препараты поливинипирролидона связывают токсины, находящиеся в кро¬
веносном русле, и выводят их из организма главным образом через почки
Делинтоксикационный эффект гемодеза® начинает проявляться вскоре после
начала инфузии. Основной путь выведения - с мочой. Скорость выведения
12 24 ч для гемодеза4 и 13 ч для неогемодеза4.
В связи с новыми данными сравнительного изучения специфической фарм**
логической активности и общетоксического действия гемодеза Федеральной слу*
бой по надзору в сфере здравоохранения и социального развития издан прика^
N* 1 ІОО-Пр/05 от 24 мая 2005 г. «Об аннулировании государственной регистраии
иядрствеиных средств, содержащих поливинилпирролидон низкомолекулярн
ОСНОВНЫЕ СРЕДСТВА ТРШСОДЗМЙШ^ШїІШОИНОІ а посеем 51$
-«яский 12 600±2700 (повидон) в качестве действующего вещества, и исклю-
из Государственного реестра лекарственных средств*
^соответствии с этим приказом с 1 сентября 2005 г. лекарственные веше-
содерхашие поливинилпирролидон низкомолекудярныи меДИШАНСКММ
twjjj0t2700 (повидон). исключены из Государственного реестра, действующего
—пркторни Российской Федерации. Указанные лекарственные средства не под-
*\aT ортифнкации. реализации и медицинскому применению. Запрещается
1!ипяа разрешений на ввоз на территорию РФ фармацевтических субстан •
лекарственных средств, содержащих поливинил пирролидон (щвидон)
1б00±2700. Сохраняется производство поливинидпирролидона с молекулярной
ївссой 8ТЫС. Да под названием «Гемодез Н**
ИНФУЗИОННЫЕ АНТИОКСИДАНТЫ
Иифузионные антиоксиданты — растворы, предназначенные для повышения
энергетического потенциала клеток организма. Эти свойства растворы приобретший
щд і»«»» « ■■■; * » ■
spter введения в их состав фумарата или сукцината вещества, которь
тм клетки
навливают клеточный метаболизм (активируя адаптационны
к недостатку кислорода путем участия в реакции обратимого окисления и вос¬
становления в цикле Кребса), способствуют утилизации клетками жирных кислот
и глюкозы, нормализуют кислотно-основной баланс и газовый сос тш крою.
растворы фумарата: мафусол* и полиоксифумарин*
Мафусол4
Состав: содержит ионы натрия, калия, магния, хлора и фумарат.
Механизмы действия и фармакологические эффекты: обладает волемическим
игемодилюционным эффектами.
Фармакокинетика: выводится с мочой.
Показания:
• лечение и профилактика гиповолемии: кровопотери. шока, иктошпдарш;
• гипоксические состояния;
• интоксикации;
• острое нарушение мозгового кровообращения;
• при искусственном кровообращении - 50-70% аппарата ИК
Переносимость, побочные эффекты не отмечены.
Противопоказания: гипергидратация, черепно-мозговая травма с повышенным
внутричерепным давлением.
Взаимодействия: совместим со всеми солевыми растворами, компонентами крови.
Полиоксифумарин4
Состав: 1,5% раствор полиэтиленгликоля с электролитами и фу Маратом.
Механизмы действия и фармакологические эффект обладает аолемичесхим
в г*модилюционным эффектами. Не обладает прямым гемостатическим эффектом
* влияет на сосудисто-тромбоцитный и вторичный (коагулогический) гемостаз.
®врмакокинетика: выводится с мочой.
Место в терапии: при хирургических пост- и интраоиерациоаиых кровопотеря*
'^Дельно или в сочетании с другими кровезаменителями. Сюзроси» инфутмм *•
отруйно 400-800 мл или капельно 60-80 капель в минуту.
"оказания:
* лечение и профилактика гиповолемии — кровопотери. шока, иитоипшмаак
4ля заполнения аппарата ИК.
Крс
Противопоказания: гипергидратация, гиперволемия, черепно-мозговая
с повышенным внутричерепным давлением.
ИИ йДШШва тиянсфузиология
Переносимость. побочные эффекты: гемодилюция. Максимальна:
доя -1.2 я.
1Я ^на,
эвая травм.
Состав: содержит ионы натрия, калия, магния, хлора и сукцината.
Механизмы действия и фармакологические эффекты: обладает дезинтоксик
ционным і гемодилюционным эффектами. а'
Фармакокинетика: выводится с мочой.
Место в терапии: в зависимости от степени выраженности симптомов интокси
кации и тяжести заболевания реамберин* применяют от 2 до 12 дней, вводят bhv-
тривенно капельно. Взрослым — до 800 мл/сут со скоростью не более 90 капель
в минуту. Детям 1 из расчета 10 мл/мг массы тела один раз в сутки со скоростью
не более 60 капель в минуту.
Показания: гипоксические состояния различного генеза, острые интоксикации
комплексная терапия гепатитов.
Переносимость, побочный эффект: индивидуальная непереносимость препара¬
та. При быстром введении пациенты отмечают сосудистые реакции в виде жара.
Противопоказание: индивидуальная непереносимость препарата.
Взаимодействия: совместим со всеми солевыми растворами, компонентами
крови. Вследствие активации реамберином* аэробных процессов возможны заще-
лачивание мочи и крови, снижение уровня глюкозы в крови.
ЛИПОФЕРОЛ»1
Липоферол’’ - липосомальный препарат с DL-а-токоферолом для внутривен¬
ного введения. В состав препарата входят фосфолипиды сои, DL-а-токоферол,
D-сорбитфосфатный буфер. Обладает антиоксидантным и мембраностабилизи¬
рующим действием. Антиоксидантное действие обусловлено наличием в составе
а-токоферола и проявляется в предупреждении перекисного окисления липидов,
инактивации свободнорадикального окисления, увеличения доставки кислорода
к органам и тканям. Мембраностабилизирующее действие липоферола*’ обуслов¬
лено наличием в его составе фосфолипидов, которые способствуют предупре¬
ждению нарушения и ускорению восстановления нарушенных структур и функ¬
ции клеточных мембран и органелл, обеспечивая гепатопротекторное действие.
Способствует также стабилизации мембран эритроцитов и уменьшению агрегаци-
онных свойств тромбоцитов, тем самым улучшая реологию крови.
Липоферол»’ безвреден, нетоксичен, не вызывает аллергических реакций,
не накапливается в организме вследствие полного метаболизма.
Показания к применению: самостоятельно и в схемах комплексной терапии
при ожоговом шоке, шокогенной травме, токсемиях различного происхождения,
токсических и инфекционных гепатитах.
Противопоказания и побочные действия не выявлены.
Вводят внутривенно капельно со скоростью 40-60 капель в минуту (120-180
мл/ч). Рекомендуемая суточная доза - 6-10мл/кг массы тела. Курс лечения липо*
феролом*' определяется состоянием больного.
Выпускают в бутылках по 200 и 400 мл. Хранят при температуре +4-8 С.
Замораживание не допускается. Срок годности — 2 года. Препарат находится на
стадии клинического изучения.
Препараты комплексного действия
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 517
СИНТЕТИЧЕСКИЕ ПЕРЕНОСЧИКИ КИСЛОРОДА
из основных, важнейших функций крови — транспорт кислорода и обе-
0®13 им всех жизненно важных систем организма, включая его доставку
***** и тканям с одновременным выведением двуокиси углерода. Нарушения
,оР* його дыхания и кровообращения приводят к гипоксии и, как следствие,
портному поражению тканей. Переливание гомологичной крови помогает
i об®1*? поддерживать транспорт кислорода. Однако такие побочные эффекты,
<*, и осложнения гемотрансфузий, иммуносупрессия и гемотрансмис-
'0* Ре инфекции, свидетельствуют о необходимости поиска искусственных
с*^ятелей транспорта кислорода, модифицированных растворов гемоглобина
^Іоруглеродньїх эмульсий. Современные препараты модифицированного
"Ляила гемоглобина и перфторуглеродные эмульсии не обладают выраженной
^чностью и антигенностью, поддерживают достаточный уровень доставки
1г 00ІІ1к тканям, вязкость, онкотические, осмотические и реологические свой-
^адоогичныетаковым крови. Оба вида растворов характеризуются коротким
полураспада в организме и обладают свойством на определенное время
пеРилНЯть функцию эритроцитов - обеспечивать ткани кислородом.
Модифицированные гемоглобины (табл. 15-18) производят из высокоочищен-
го гемоглобина человека или крупного рогатого скота, химически видоизменен-
я° пли методами генной инженерии — рекомбинантный модифицированный
ft„гпобин. Молекулы гемоглобина могут быть инкапсулированы в липосомы
Повременно с другими молекулами.
Перфторуглероды — биохимически инертные, густые жидкости, обладающие
высокой способностью растворять газы (пропорционально парциальному давле¬
нию) и выполняющие функцию переноса и доставки кислорода без его химиче¬
ского связывания. Эти растворы применяют в форме эмульсий. Перфторуглероды
I поколения (флуозол*) оказались нестабильными, неудобными в применении
и вызывающими реакции, связанные с активацией комплемента составом эмуль¬
гатора. Эмульсии II поколения (перфторан*) более концентрированы, стабильны
и при соблюдении правил применения не оказывают отрицательного влияния
на организм. Их изготавливают с помощью линейных перфторуглеродов и специ¬
альных эмульгаторов (см. табл. 15-18).
Таблица 15-18. Переносчики кислорода
Перфторуглероды
Модифицированные гемоглобины
Перфторан* (Россия)
Разрабатываются из высокоочищенного гемоглобина человека
или крупного рогатого скота
Флуазол” (Япония)
Фторосан*’ (Россия)
Эмульсия №2Р (Китай)
Оксифлуорр
Разрабатываются из рекомбинантного модифицированного
гемоглобина
Оксигент*3
Модифицированные гемоглобины и перфторуглероды применяют в клинической
практике при геморрагическом шоке, периоперационной гемодилюции, инсульте,
їронической анемии, инфаркте миокарда, пластических операциях на коронарных
с°судах, а также при заготовке и хранении органов перед трансплантацией.
Несмотря на ряд преимуществ, которыми обладают искусственные переносчики
01слоР°Да по сравнению с донорскими эритроцитами, определять показания к при-
I |*енению данных растворов следует с определенной осторожностью. Катаболизм
модифицированных растворов гемоглобина все еще остается малоизученным,
этом нельзя исключать возможность усиления окислительных реакций
I ^рзясениём тканей. В отличие от гемоглобинов, перфторуглероды не метабо-
^Фуются и лишены токсичности, но могут аккумулироваться в паренхиматоз-
ГПАВА Ц
Jig *Г*'н»*Ч£СКАЯ трАмСФУЗИОЛОГИЯ
па органах. Высок риск насыщения и блокады моноцитарно-макрофагал
системы І случае неоднократного использования. Для обоих видов переносчЬН°й
mrtnffW характерно короткое время циркуляции в кровяносном русле, в п*0*
с чем наиболее оптимальным считается использование модифицированных
глобинов н перфторуглеродов в экстремальных ситуациях.
Геленпол*7
рЯИМММ* - первый отечественный кислородпереносящий кровезамените
m основе модифицированного полимеризованного гемоглобина, полученной
из эритроцитов донорской крови. 0
Представляет собой лиофильновысушенное полимерное производное гемогло¬
бин дня внутривенного введения с молекулярной массой 150-200 кДа, содержа-
щее поликонденсированный гемоглобин — 4 г, глюкозу — 3 г, натрия хлорид -
0,8 І аскорбиновую кислоту — 0,1 г.
Обладает полифункциональным действием:
• корригирует газотранспортную функцию крови;
• восстанавливает гемодинамику;
І стимулирует гемопоэз.
Шрвшвания геленпола*' не требуют предварительного определения группы
крови и постановки реакций на совместимость с кровью реципиента. Способ
получения геленпола*' практически устраняет опасность заражения реципиентов
вирусными инфекциями при введении препарата.
Показания к применению:
І геморрагический и травматический шок;
• интраоперационная кровопотеря;
к анемии различной этиологии.
Противопоказаний к применению нет: геленполр отличается хорошей пере¬
носимостью больными. Нарушения экскреторной функции почек в период вве¬
дения и действия препарата не наблюдались. Побочных действий (в том числе
при струйных введениях) не выявлено.
Перед применением содержимое флакона растворяют в 400 мл 0,9% раствора
натрия хлорида или 5% глюкозы*. Вводят внутривенно капельно или струйно
в количестве от 400 до 2400 мл в зависимости от клинических показаний.
Длительность хранения без потери функциональной активности - 2 года.
Перфторан*
Перфторан* - субмикронная эмульсия с газотранспортными функциями,
содержащая 10 об.% перфторорганических соединений (ПФОС).
Состав: перфтордекалин - 13 г; перфторметилциклогексилпиперидин - 6,5 г;
проксанол 1 4 г; натрия хлорид - 0,6 г; магния хлорид — 0,019 г; калия хлорид -
0,039 г; натрия гидрокарбонат - 0,065 г; глюкоза — 0,2 г; натрия гидрофосфат -
0,02 І вода для инъекций - до 100 мл.
Теоретическая осмолярность - 280-310 мОсм/л, pH 7,2-7,8, относительная
вязкость - 2,5 сП, средний размер частиц эмульсии — 0,07 мкм.
Перфторан* считается полифункциональным кровезаменителем, обладающим
газотранспортной функцией за счет высокой способности ПФОС растворять кис¬
лород. Препарат обладает большой поверхностью газообмена, что обеспечивает
высокую скорость диффузии кислорода. За счет субмикронных частиц эмульсии
происходит более полное снабжение кислородом участков ткани с обедненной
сосудистой сетью и зон значительной гипертрофии.
Соотношение между диаметром частиц эмульсии перфторана* и сечением
■ самых узких капилляров обеспечивает ламинарность потока и низкое сопротив
не сосуд08- Проксанол, входящий в состав препарата, улучшает реологические
йства крови и положительно влияет на микроциркуляцию в тканях.
Поепар3'1' обладает реологическими, гемодинамическими. диуретическими, мем-
иосгабилизирующими, кардиопротекторными и сорбционными свойствами.
^влияние перфторана* на газотранспорт обеспечивается увеличением кислород*
- емкости и динамики газообмена. Кислородная емкость перфторана* почти
^ паза выше, чем у всех традиционных негазотранспортных кровезаменителей
9 плазмы, но приблизительно во столько же раз она ниже кислородной емкости
Цельной крови.
Период полувыведения перфторана* из кровотока составляет 24 ч. Прокса-
268 выводится с мочой в течение 1-2 сут. ПФОС выводятся через легкие
11 жу, в меньшей степени — с желчью. Перфторуглероды химически инертны
** я организме не метаболизируются. Частицы эмульсии ПФОС временно акку*
* руются в макрофагах печени, селезенки, костного мозга. Период полувыве-
ния ПФОС из макрофагов составляет для перфтордекалина - 14 дней (полное
ведение - 1 мес), для перфторметилциклогексипиперидина - 90 дней (полное
’,а,«ение- 18-24 мес).
Показания к применению следующие.
, внутривенно:
|1 при острой и хронической гиповолемии (травматическом, геморрагиче¬
ском, ожоговом и инфекционно-токсическом шоке);
при нарушениях микроциркуляции и периферического кровообращения
(изменениях тканевого метаболизма и газообмена, черепно-мозговой
травме, ишемическом отеке головного мозга, нарушениях мозгового
кровообращения, шоковой почке, жировой эмболии при множественной
травме, облитерирующих заболеваниях сосудов конечностей):
ф для противоишемической защиты донорских органов;
I при операциях на остановленном сердце для заполнения аппарата И К:
І глубокой изоволемической гемодилюции;
і анемической гипоксии, угрожающей жизни больного, при отсутствии
донорской крови и эритроцитных сред.
• Местно:
I для лаважа легких, промывания гнойных ран, брюшной и других поло¬
стей, орошения раневой поверхности слизистых и кожи.
Противопоказания;
• анафилактоидная реакция при биологической пробе;
• гемофилия;
• беременность;
• неостановленное хирургическими методами маточное кровотечение в родах.
При применении перфторана* возможны аллергические реакции, учащение
пульса, снижение артериального давления, повышение температуры, головная
боль, боль за грудиной и в поясничной области, затруднение дыхания, анафилак-
тоидные реакции.
Введение перфторана* можно сочетать с трансфузиями альбумина человека.
Донорской крови, изотонических солевых растворов, глюкозы*, введением анти-
^риальных препаратов.
Перфторан* несовместим с коллоидными кровезаменителями, которые спо¬
собствуют резкому укрупнению частиц эмульсии и изменяют ее биологические
"физико-химические свойства.
При применении перфторана* обязательно проведение биологической пробы.
Ри лечении острой или хронической гиповолемии перфторан* вводят внутривен-
I ^струйно или капельно в дозе 5-30 мл/кг (взрослым). Разовая и су ммарная дозы
!'Р*®зрзта зависят от тяжести исходного состояния и возраста больного. Эффект
ЯН КЛИНИЧЕСКАЯ ТтнСФУЗИОЛОГИЯ
1
лерфторэна* максимален, если во время и после его инфузии в течен
НОЙ ДЫШИТ СМеСЬЮ. обогащенной КИСЛОРОДОМ (40-60%). ИЄШМбп
Для яротивоишемической защиты донорских органов перфтопян* Ь'
• аппарате ИК в составе перфузата из расчета 10-40 мл/кг массы тел Исп°льзуч>г
V При наущении микроциркуляции и периферического кровообгГ
фгоран* вводят внутривенно капельно в дозе 4-10 мл/кг. Препара Ия %
дать в той же дозе 2-3 раза с интервалом в 1-4 дня. т Мо*Но Вв£
Перед забором органов для трансплантации перфторан* вводят до
но или струйно в дозе 20-30 мл/кг при постоянной оксигенации препа°^ Kanej|1>-
геиом. Реципиенту перфторан* вводят за 2 ч до операции в дозе ПО-гп^3 Ка^°‘
Перфторан* выпускают во флаконах из стекла по 50,100, 200 и 400
Перфторан* следует хранить в замороженном состоянии при температоп
Размораживают препарат при комнатной температуре, но не выше +зо°г ^ ^
размораживания при комнатной температуре флаконов с перфтораном* ^емя
составляет 1,5-2 ч. После разморозки препарат необходимо осторожно в°б^Мл
до полной однородности состава, а перед инфузией — согреть до +213 т?Гь
Допускается 5-кратное размораживание/замораживание. В размороженн
препарат можно хранить в холодильнике при температуре +4 °С не более 2**ВИДе
Срок годности препарата при -18 °С — до 3 лет. ^
Запрещается хранить перфторан* при температуре ниже -18 °С и размета
вать при температуре выше +30 °С. р Жи'
Препарат непригоден к использованию в случае:
• расслоения эмульсии;
• помутнения эмульсии до молочного цвета;
I появления белого осадка на дне флакона.
ПРЕПАРАТЫ ДЛЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
Согласно мировой статистике, госпитальное голодание пациентов составляет
от 30 до 50%. Причины недостаточности питания могут быть весьма разно¬
образными. Это и неадекватное потребление питательных веществ, и нарушения
приема, ассимиляции или метаболизма питательных компонентов вследствие
болезни, ранения или травмы. Недостаточность питания вызывает потерю массы
тела, энергетических запасов и тканевых белков, что может приводить к удли¬
нению сроков выздоровления. В связи с этим необходимость дополнительной
питательной поддержки не вызывает сомнения. Альтернативными вариантами
питательной поддержки считаются энтерально-зондовое (ЭЗП) и парентеральное
питание (ПП). В многопрофильном стационаре не менее 25% пациентов нуждают¬
ся именно в ПП. Подобно естественному, ПП должно включать те же питательные
ингредиенты, что и естественное питание (белки, жиры, углеводы, витамины,
минеральные вещества).
Белковый компонент ПП обеспечивается растворами аминокислот, энергетиче¬
ский і жировыми эмульсиями, глюкозой, фруктозой, многоатомными спиртами.
Минеральные вещества и витамины включают в программу ПП в виде известны
соединений калия, натрия, кальция, фосфора, магния и специализированных
добавок.
КОМПОНЕНТЫ АМИНОКИСЛОТНОГО ОБЕСПЕЧЕНИЯ
Компоненты, обеспечивающие пациента пластическим материалом, -
творы аминокислот. Различают несколько специфических групп аминокисл
растворов:
I общего типа;
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 521
используемые при заболеваниях почек;
* используемые при заболеваниях печени;
\ для детского парентерального питания;
* аминокислот с высоким содержанием глутамина.
я табл. 15'19 представлены наиболее часто встречающие в настоящее время
растворы аминокислот.
jjpj. 15-19. Аминокислотные растворы общего и специального назначения
растворы аминокислот
Cm
дциальные или метаболически направленные
растворы аминокислот
общего типа
для нефрологии
для гепатологии
для педиатрии
с высоким содер¬
жанием глютамина
^^иамин*)
Аминостерил КЕ
Нефро*
Аминостерил Гепа*
8%
Аминовен
инфант* 6.10%
Дипептиван*
дминоплазмаль*
s BDavH Є5 и ЕЮ
Нефротект*
Дминоплазмаль
Гепа* 10%
Ваминолакт*
-
Камин* 18
Нефрамин*
Гепасол НЕО* 8%
-
-
дминовен* 5,10,15%
-
-
-
Инфезол* 100,40
-
-
-
Аминосол НЕ0* 5,10,15%
-
-
-
-
Фоеамин* III 8,5%
-
-
-
аминокислотные растворы общего типа
Аминокислотные растворы общего типа содержат, как правило. 18 L-амино-
кислот (незаменимых и заменимых) с добавками основных электролитов
или без них. В некоторые растворы добавляют компоненты энергетического обе¬
спечения (сорбитол или ксилитол). Содержание общего азота в этих растворах
колеблется от 6,3 до 16 г/л. Концентрированные растворы аминокислот гипе-
росмолярны, поэтому их можно вводить только в центральные вены. Высокая
концентрация общего азота позволяет в меньшем количестве жидкости ввести
больше пластического материала. Применяют аминокислотные растворы обще¬
го типа для коррекции белковой недостаточности в пред- и послеоперационном
периоде, при кахексии любой этиологии, нарушении акта глотания, кишечных
фистулах, патологических изменениях слизистой оболочки тонкой кишки и т.д.
При отсутствии противопоказаний в отделениях реанимации предпочтительнее
высококонцентрированные растворы аминокислот.
Особенно важно выделить растворы аминоплазмаля Е* 5 и 10%, содержащие 20
аминокислот, в том числе орнитин. Орнитин стимулирует глюкозоиндуцирован¬
ную выработку инсулина и активность карбамоилфосфатсинтетазы. что способ¬
ствует увеличению утилизации глюкозы периферическими тканями, синтезу моче¬
вины, в сочетании с аспарагином уменьшению уровня аммиака. Содержащийся
в растворах фосфор активизирует глюкофосфатный цикл.
ХАЙМИКС (ПОЛИАМИН4)
Единственным отечественным представителем аминокислотных растворов явля¬
ется полиамин4, который представляет собой 8% раствор смеси 13 кристалли¬
ческих L-аминокислот и D-сорбита. Общий азот - 11,3 г/л. осмолярность -
SI мОсм/л.
Применяют для коррекции белковой недостаточности в программе паренте-
РЭДьного питания.
Противопоказания: острая почечная и печеночная недостаточность.
При вспомогательном парентеральном питании (ВПП) или частичном парен-
^рэльном питании (ЧПП) суточная доза составляет 400-600 мл, при полном
St У8УШ
522 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
парентеральном питании (ППП) — 800-1200 мл. Скорость введения -
в минуту. Предназначен для введения только в центральные вены. Каг|ель
Выпускают во флаконах по 400 мл.
Вами* 18*
Препараты серии «Вамин» выпускают в нескольких модификациях отл
ся друг от друга концентрацией заменимых и незаменимых аминокислот
общего азота (9.14 и 18 г) и наличием или отсутствием в их составе электпл^°ВНем
Вамин 18 без электролитов* — белковый компонент ПП, содержащий 18 ЛИТ°В'
кислот. Электролиты в состав препарата не входят. Общий азот — 18 г/л п аМИн°'
ность-1130 мОсм/л. ’ОСМОЛяр.
Применяют как азотистый компонент в программе ПП у пациентов с по
ной потребностью в белке. 1Щен-
Противопоказания: острая печеночная и почечная недостаточность.
Максимальная суточная доза для взрослых — до 1000 мл. Максимальная
рость - 1000 мл за 8 ч. Предназначен для введения в центральные вены.
Выпускают во флаконах по 500 и 1000 мл.
Остальные препараты этой серии в настоящее время менее распростране
или не зарегистрированы в РФ. ы
Аминостерил КЕ* 10%
Аминостерил КЕ* 10% - раствор смеси кристаллических аминокислот, обеспе¬
чивающий азотистое питание в программе ПП. Содержание общего азота і 16 г/л
осмолярность - 1048 мОсм/л. Содержит электролиты: калий - 20 ммоль/л
натрий - 3 ммоль/л, магний — 5 ммоль/л.
Применяют как азотистый компонент в программе полного или вспомогатель¬
ного ПП.
Противопоказания: выраженные нарушения функций печени и почек, гиперка-
лиемия, хроническая сердечная недостаточность в фазе декомпенсации.
Максимальная суточная доза для взрослых — 1000 мл. Скорость введения -
20-30 капель в минуту. Предназначен для введения в центральные вены.
Выпускают во флаконах по 500 мл.
С 2009 г. выпуск препарата прекращен, выпускается новый аминокислотный
раствор общего типа аминовен*, содержащий таурин*, который улучшает метабо¬
лизм при стрессе, критических состояниях и тяжелых физических нагрузках.
АМИНОВЕН*
Аминокислотный раствор аминовен* выпускают в концентрациях 5,10 и 15%.
Содержит 16 аминокислот, в том числе таурин*, в нем нет углеводов, электролитов
и консервантов, что определяет высокую безопасность применения. Доля неза¬
менимых аминокислот составляет 43%, разветвленных — 19%. Состав 10% и 15%
растворов представлен в табл. 15-20. Растворы предназначены для парентерально¬
го питания больных с различной патологией и низкой, нормальной и повышенной
потребностью в белке.
Показания к применению: полное или частичное парентеральное питание, про¬
филактика и терапия потерь белков.
Противопоказания:
• шок любой этиологии;
• гипоксия;
• нарушение метаболизма аминокислот;
I метаболический ацидоз;
I почечная недостаточность при отсутствии гемодиализа или гемофияьтр
ции;
I тяжелая печеночная недостаточность;
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-МНФУЗИОКНОГО ПОСОБИЯ 523
Группы населения
Аминовен* 10%
Аминовен* 15%
ВЗРОСЛЫЕ
Средняя суточная доза
Максимальная суточная доза
Максимальная скорость инфузии
10-20 мл/кг
20 мл/кг
1,0 мл/ (КГхЧ)
6,7-13,3 мл/кг
13.3 мл/кг
0,67 мл/ (кгхч)
ДЕТИ
Максимальная суточная доза
Максимальная скорость инфузии
10-20 мл/кг
1,0 мл/ (кгхч)
Использовать не рекомен¬
дуют
Необходимо контролировать уровень электролитов, баланс жидкости и функ¬
ций почек. В случае гипокалиемии или гипонатриемии следует одновременно
вводить достаточное количество калия или натрия.
форма выпуска: стеклянные флаконы по 500 или 1000 мл. Хранят при темпера¬
туре не выше 25 °С. Срок годности — 2 года.
Дминоплазмаль Е* 10%
Дминоплазмаль Е* 10% — раствор для ПП, содержащий 20 аминокислот и электро¬
литы, в том числе фосфор, которого нет в других аминокислотных растворах: калий -
25 ммоль/л, натрий — 43 ммоль/л, магний — 2,6 ммоль/л, дигидроген фосфат —
9 ммоль/л. Содержание общего азота — 16 г/л, осмолярность — 1030 мОсм/л.
Применяется как азотистый компонент в программе полного и вспомогатель¬
ного ПП.
Противопоказания: тяжелые нарушения кровообращения, ацидоз, выраженные
нарушения функции печени, почечная недостаточность с повышенными показате¬
лями остаточного азота, гипергидратация, гиперкалиемия, хроническая сердечная
недостаточность.
Не рекомендуют назначать детям до 2 лет, беременным и в период лактации.
Максимальная суточная доза — 1000 мл. Скорость введения — не более
20 капель/мин. Предназначен для введения в центральные вены.
Выпускают во флаконах по 500 и 1000 мл.
Аииноплазмаль Е* 5%
Дминоплазмаль Е* 5% — раствор для ПП, содержащий 20 аминокислот и элек¬
тролиты: натрий - 43,0 ммоль/л, калий — 25 ммоль/л, магний - 2,6 ммоль/л, аце-
Тат - 59 ммоль/л, хлорид — 29 ммоль/л, дигидрофосфат — 9 ммоль/л, L-малат -
2.5 ммоль/л. Содержание общего азота — 8 г/л, осмолярность - 590 мОсм/л.
Применяют как азотистый компонент в программе частичного и вспомогатель-
ного парентерального питания.
Противопоказания: тяжелые нарушения кровообращения, ацидоз, выраженные
нарушения функции печени, почечная недостаточность с повышенными показате¬
лями остаточного азота, гипергидратация, гиперкалиемия, хроническая сердечная
^Достаточность.
Не рекомендуют назначать детям до 2 лет, беременным и в период лактации.
, тпергидратация;
* декомпенсированная сердечная недостаточность;
I ноВорожденные. грудные и дети до 2 лет.
Следствие отсутствия достаточного опыта клинического применения не реко-
^дуют назначать аминовен* 15% детям до 18 лет. Специальные исследования
МЄІ безопасности применения аминовена* в период беременности и лактации
проводились.
Для аминовена* 5% и 10% выбор центральной или периферической вены зави¬
єш конечной осмолярности при одновременном введении с другими раствора¬
ми Аминовен* 15% следует вводить только в центральные вены.
Таблица 15-20. Состав 10% и 15% растворов аминовена*
$24 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
||Р взрослых максимальная суточная доза — до 40 мл/кг массы теля
от индивидуальных потребностей (до 2 г/кг в сутки). СкопоЛ ДеНь
ленкя - до 45 капель в минуту. ^ вве-
Для детей 3-5 лет рекомендуемая суточная доза — 15 мл/кг в сутки лл
6-14 лет - 10 мл/кг в сутки. Скорость введения препарата — до 1 мл/кг в * Дете®
Предназначен для введения в периферические и центральные вены.
Выпускают во флаконах по 500 и 1000 мл. Хранят при температуре не
+25 I в защищенном от света месте. Вьіціе
Инфезол 40*
Инфезол 40* - раствор L-аминокислот для ПП. Содержит углеводы (ксилит
и электролиты: калий — 25 ммоль/л, натрий — 40 ммоль/л, магний - 2,5 ммо/
Содержание общего азота — 6,3 г/л, осмолярность — 801 мОсм/л. ’ Щ
Препарат используют для профилактики и восполнения потерь белка в on
низме с одномоментной коррекцией нарушений водного баланса. Возможно S
менение при ограниченных функциях почек. ^и'
Противопоказания: острая почечная недостаточность, тяжелые поражен»
печени, нарушения обмена фруктозы и сорбитола, отравления метиловым спить
том. бронхиальная астма. ^
Максимальные дозы для взрослых — до 25 мл/кг массы тела в сутки, для детей І
до 50 мл ./кг массы тела в сутки. Предназначен для введения в периферические
вены.
Выпускают во флаконах по 500 мл.
Инфезол 100*
Инфезол 100* содержит 19 аминокислот, в том числе орнитин, и электролиты:
натрий - 69 ммоль/л, калий — 45 ммоль/л, кальций — 5 ммоль/л, магний І
5 ммоль/л. Содержание общего азота — 15,6 г/л, теоретическая осмолярность -
1145 мОсм/л.
Показания к применению:
I парентеральное питание;
• профилактика и терапия состояния белкового дефицита различного генеза.
Абсолютные противопоказания:
[ шок любой этиологии;
• недостаточное обеспечение клеток кислородом.
Относительные противопоказания:
• нарушения аминокислотного обмена;
g гипергидратация;
8 гиперкалиемия;
• гипонатриемия.
При печеночной и почечной недостаточности требуются индивидуальные дозы.
Максимальная суточная доза — 2 г аминокислот на килограмм массы тела.
Вводят внутривенно капельно, максимальная скорость инфузии — 0,1 г аминокис¬
лот или 1 мл раствора на килограмм массы тела в час. Для взрослых максимальная
подача жидкости - 40 мл/кг массы тела в сутки.
Выпускают в стеклянных флаконах по 250,500,1000 мл. Хранят в защищенном
от света месте при температуре не выше 25 °С, срок годности — 2 года.
Фреамии III* 8,5%
Фреамин III* 8,5% содержит 8 незаменимых и 7 заменимых аминокислот,
электролиты (натрий и фосфор). Содержание общего азота — 13 г/л.
Применяют для поддержания уровня белка у больных с неярко выражении
катаболизмом.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИ0НН0-ИНФУЗИ0НН0Г0 ПОСОБИЯ 525
ппптивопоказания: препарат не следует назначать при анурии, печеночной
гиперчувствительности к компонентам препарата.
<0пбшая дневная доза может достигать 3 л раствора. Возможно введение в пери-
ипические вены.
^пускают во флаконах по 500 мл.
■ццНОСОЛ
г-ппрекцию белковой недостаточности можно проводить препаратами ами-
Ijgf I настоящее время зарегистрирована последняя серия препаратов этой
^'-аминосолНЕО*.
дминосол НЕО* представлен растворами 10% и 15% концентрации, содержит
а аминокислот, в том числе таурин (таурин*), в соответствии с современными
«давлениями крайне важен при сепсисе и гиперкатаболических состояниях.
гаеР*ание общего азота для 15% раствора составляет 25,7 г/л, теоретическая
полярность — 1505 мОсм/л, раствор представлен без электролитов. Содержание
бшего азота для 10% раствора составляет 16,4 г/л, теоретическая осмолярность -
1137 мОсм/л, раствор может быть с электролитами (натрий — 60 ммоль/л,
-дий - 30 ммоль/л, кальций — 5 ммоль/л, магний — 5 ммоль/л) или без них.
раствор содержит также малат — 69,2 ммоль/л и глицерофосфат. Соотношение
незаменимых аминокислот и азота, характеризующее питательную ценность рас¬
твора, составляет 2,0-2,5.
Показания к применению: парентеральное питание при тяжелых заболеваниях
желудочно-кишечного тракта, при гиперкатаболических состояниях, в предопе¬
рационном и послеоперационном периодах, 10% раствор можно использовать
при почечной недостаточности, 15% раствор — при сердечной недостаточности
(более высокая концентрация сокращает объем вводимой жидкости).
Противопоказания:
• беременность и лактация;
• шок любой этиологии;
1 декомпенсированная сердечная недостаточность;
• декомпенсированная почечная недостаточность;
І декомпенсированная печеночная недостаточность;
• метаболический ацидоз;
і гиперкалиемия, гипернатриемия для 10% раствора, содержащего электро¬
литы.
Средняя доза для взрослых — 10-20 мл/кг в сутки для 10% раствора и 6.7-
13,3 мл/кг в сутки для 15% раствора. Максимально допустимая скорость введе¬
ния-1 мл/кг в час для 10% раствора и 0,67 мл/кг в час — для 15% раствора.
Максимальная суточная доза для человека с массой тела 70 кг — 1400 мл 10% рас¬
твора и 930 мл — 15% раствора. Инфузии только в центральные вены.
Выпускают в стеклянных флаконах по 500 мл. Срок годности — 2 года.
Состав аминокислотных растворов для больных с патологией печени представ¬
лен в табл. 15-21.
Неонутрин*
Неонутрин* — комплексный раствор L-аминокислот, содержащий все незаме-
®мые и заменимые аминокислоты в сбалансированном соотношении, 20% всех
аминокислот составляют аминокислоты с разветвленной структурой. Объем тиро-
Зина увеличен за счет добавления дипептида глицилтирозина, что обеспечивает
Достаточное его поступление даже при катаболических состояниях, когда может
II блокировано преобразование фенилаланина в тирозин. Повышен объем
^отеина/цистина, важных для поддержания клеточной антиоксидантной защи-
JВо всех концентрациях аминокислоты присутствуют в равных соотношениях.
е содержит электролиты. V
T
526 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Таблица 15-21. Состав аминокислотных растворов для больных с заболеваниями печени
Сост. г/я
Гепасол НЕО* 5%
Аминостерил Гепа* 8%
Ам"ноплазм^Г?^
Аланин
4,64
4,64
I Аргинин
10.72
10,72
<мГ'"—о
1 Аспарагиновая к-та
—
—
w О
Валин
10,08
10,08
iw -О
I Глицин
5,82
—
Гистидин
2,8
2,8
47"—-Ч
Глутаминовая к-та
—
—
5,7
Изолейцин
10,4
10,4
8,8 —J
Лейцин
13,09
13,09
13,6 -ч
Лизин
6,88
9,71
7,51 '-'Ч
Метионин
1,1
1,1
1,2 Ч
Пролин
5,73
5,73
7,4 Щ
Серии
2,24
2,24
3,7
Тирозин
—
. —
0,7 Ч
Треонин
4,4
4,4
4,6 j
Триптофан
0,7
0,7
1.5 |
Фенилаланин
0,88
0,88
1,6 Б
Цистин/цистеин
/0,52
0,52
0,52 ~~
Ледяная уксусная к-та
4,42
4,42
Аминоуксусная к-та
—
5,82
— ■ "~r~'
Орнитин
—
—
1,3 Щ
Общий азот
12,9
12,9
15,3
Осмолярность. мОсм/л
770
770
875
Применяют при состояниях, требующих дополнительного или полного парен¬
терального питания, когда достаточное питание больного нельзя обеспечить I
пероральным или энтеральным путем. Предназначен для больных с базисной |
или средней степенью метаболической нагрузки. Сбалансированный спектр ами-
нокислот в комбинациях со специальными аминокислотными соединениями
делает препарат эффективным при гиперкатаболических состояниях, расстройстве
функций органов и в детской практике. Нет противопоказаний для использования
у беременных и в период лактации.
Противопоказания: состояние шока, олигурическая почечная недостаточность
при отсутствии диализа, врожденное расстройство аминокислотного обмена.
Препарат не предназначен для использования у недоношенных и детей младше
2 лет.
Возможны одиночные случаи проявления непереносимости в виде тошноты
и рвоты, что обычно проходит после понижения скорости введения.
Способы введения и дозы представлены в табл. 15-22.
Таблица 15-22. Способы введения и дозы неонутрина*
Степень метаболи¬
ческой нагрузки
Аминокислоты, г/кг
массы тела
5% раствор, мл/сут
для взрослого
10% раствор,
мл/сут
для взрослого
15% раствор,
мл/сут
ря взрослого^
Базовая
0,7-1,0
500-700
330-470
Средняя
1,0-1,5
1000-1400
700-1100
470-700
Высокая
1,5-2,0
1400-2100
1100-1400
700-1000 _
Предельная скорость вливания — 0,1 г аминокислот на килограмм массы тела
в час. т.е. не более 150 мл 5% раствора, 75 мл 10% раствора и 50 мл 15% раствора
в час для взрослого пациента. Более точным будет расчет на массу тела.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 527
Неонутрин4 5% предназначен только для введения в периферические вены,
оджительность вливания одной упаковки (500 мл) составляет 4-6 ч.
ИВИ ■'■^°//° предназначен прежде всего для введения по центральному
н н0му катетеру и для приготовления состава «все в одном*.
*ЄІНеоНугРин4 ШЙ предназначен только для центрального венозного катетера
виготовлення состава «все в одном*.
"необходимо добавлять основные электролиты по табличным данным
-и по наблюдению за балансом.
Выпускают в упаковке по 500 мл. Хранят в сухом, защищенном от света и моро-
месте при температуре +10-25 °С. После срока годности, указанного на упаков-
I препарат не применяют.
В настоящее время на территорию РФ не ввозится.
РАСТВОРЫ АМИНОКИСЛОТ ДЛЯ ПАЦИЕНТОВ С ПАТОЛОГИЕЙ ПОЧЕК
для пациентов с патологией почек предназначены растворы, состоящие из неза¬
менимых аминокислот и не содержащие электролитов. Введенные аминокислоты
и мочевина используются организмом для построения заменимых аминокислот,
ЧТО приводит к росту уровня общего белка и снижению мочевины в крови и моче.
Аминостерил КЕ Нефро*
Аминостерил КЕ Нефро* — 6,7% раствор 8 классических незаменимых ами¬
нокислот. Содержит также незаменимую (при уремии) аминокислоту гистидин,
а также углеводы сорбит и ксилит. Не содержит заменимых аминокислот и элек¬
тролитов. Содержание общего азота — 8,8 г/л. Теоретическая осмолярность -
835 мОсмоль/л. Выпускаются варианты без углеводов.
Препарат используют для ПП при развитии у больного послеоперационной азо¬
темии, при явлениях острой и хронической почечной недостаточности, для заме¬
стительной терапии при потере аминокислот в результате диализа или гемо¬
фильтрации. Согласно теории, из незаменимых аминокислот и повышенного
количества сывороточной мочевины у больных с хронической почечной недо¬
статочностью происходит построение собственного белка. Одновременно вводят
достаточное количество калорий (>35 ккал/кг массы тела).
Противопоказания:
• нарушения метаболизма аминокислот;
і хроническая сердечная недостаточность в фазе декомпенсации;
I повышенная чувствительность к компонентам препарата;
• анурия;
• непереносимость фруктозы и сорбита;
1 отравление метанолом;
• дефицит фруктозо-1,6-дифосфатазы.
Препарат вводят внутривенно капельно по 250-500 мл ежедневно по окончании
Диализа. Максимальная скорость вливания при массе пациента 70 кг должна состав¬
лять около 20 капель в минуту. Возможно введение в периферические вены.
Выпускают во флаконах по 250 мл.
С 2009 г. ввоз препарата на территорию РФ прекращен. Вместо него зареги-
^рирован аминокислотный раствор нефротект*, подробное описание которого
представлено в главе «Парентеральное питание».
Нефротект*
Весьма перспективным для ПП больных с почечной недостаточностью счита-
ся пРепарат нефротект*, который представляет собой сбалансированный 10%
Раствор незаменимых и заменимых аминокислот и дипептида глицилтирозина.
Чее содержание азота — 16,3 г/л.
Спускают во флаконах по 250 и 500 мл.
1
521 КЯМНМЧЙЖЙЯ ТРАНСФУЗИОЛОГИЯ
Шн
лов - 3 мЭкв/л. иР«-
Применяют у взрослых и детей, больных уремией, в комплексной тепап
дм парентерального питания. Обеспечивает синтез белков организма без увел
чення концентрации мочевины в крови, нормализует азотистый баланс. Вводите
с достаточным обеспечением энергетическими калориями.
Противопоказан пациентам с некорригируемым электролитным и кислотно¬
щелочным дисбалансом, гипераммониемией, пониженным объемом циркулирующей
крови, врожденными нарушениями аминокислотного метаболизма или повышенной
чувствительностью к одной или более аминокислотам, присутствующим в растворе
Максимальная суточная доза для взрослых — 500 мл в сочетании с концентри¬
рованным раствором глюкозы*. Скорость введения — не более 20 капель в минуту
в центральные и периферические вены.
Выпускают во флаконах по 500 мл.
РАСТВОРЫ АМИНОКИСЛОТ ДЛЯ ПАЦИЕНТОВ С ЗАБОЛЕВАНИЯМИ ПЕЧЕНИ
Растворы аминокислот, которые используют при патологии печени, характе¬
ризуются снижением доли ароматических аминокислот и обогащением растворов
аминокислотами с разветвленными боковыми цепями. Исключение ароматиче¬
ских аминокислот из смесей обусловлено тем, что при печеночной недостаточно¬
сти в плазме повышается концентрация ароматических аминокислот и метионина.
Одновременно концентрация разветвленных аминокислот снижается. Увеличение
транспорта ароматических аминокислот в головной мозг усиливает синтез пато¬
логических медиаторов, вызывающих симптомы печеночной энцефалопатии.
Введение препаратов с повышенным содержанием разветвленных незаменимых
аминокислот уменьшает эти проявления.
Аммиоплаэмаль Гепа* 10%
Дминоплазмаль Гепа* 10% представляет собой раствор для парентерального
питания, который применяют при лечении больных с печеночной недостаточно¬
стью. Он содержит 20 левовращающих изомеров аминокислот, адаптированных
для больных с печеночной энцефалопатией. Содержание общего азота -15,3 г/л,
осмолярность - 875 мОсм/л.
Дминоплазмаль Гепа* применяют для парентерального питания у пациентов
с печеночной недостаточностью, в том числе с явлениями энцефалопатии, а также
у больных, находящихся в состоянии печеночной комы.
Противопоказания:
■ нарушения аминокислотного метаболизма внепеченочной этиологии;
2 гипергидратация;
• ацидоз;
2 гипокалиемия.
Суточная доза - 7-15 мл/кг массы тела. Вводят преимущественно в централь¬
ные вены.
Рекомендуемая скорость введения при лечении печеночной комы указана
в табл. 15-23.
Таблица 15-23. Скорость введения аминоплазмаля Гепа* для парентерального питания больных
печеночной комой
I Скорость введения 150 Мл/ч (50 кап, в минуту) 75 мл/ч (25 кап, в минуту)
М|рвм* иедент Первый и второй час Третий и четвертый час
Выпускают во флаконах по 500 мл.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 529
„е^игепа- 5, 8%
^діностерил Н Гепа* 5, 8% — аминокислотный препарат для ПП пациентов
• „очной недостаточностью. В профиле незаменимых и заменимых аминокис-
с 42% разветвленных и только 2% ароматических аминокислот. Не содержит
Блитов и углеводов. Содержание общего азота в 5% растворе — 8,1 г/’л.
’^растворе - 12,9 г/л. Теоретическая осмолярность -480 и 770 мОсм/л соот¬
ветственно.
ПрепаРат ИСП0ЛЬЗУЮТ лля парентерального питания в случаях выраженного
-колита белка на фоне нарушений функции печени, в том числе сопровождаю¬
тся энцефалопатией и комой.
Противопоказания:
# нарушения метаболизма аминокислот;
, состояние гипергидратации;
, гипокалиемия;
, гипонатриемия;
, хроническая сердечная недостаточность в фазе декомпенсации;
I беременность;
, детский возраст.
Побочные эффекты: внутривенное введение препарата может приводить
[(повышению образования соляной кислоты и обострению эрозивно-язвенных
поражений желудочно-кишечного тракта.
Препараты вводят внутривенно капельно в центральные и периферические
вены. Режим дозирования и введения указан в табл. 15-24.
Таблица 15-24. Режим дозирования и введения препарата аминостерил Н Гепа*
Режим дозирования
Модификация препарата
Аминостерил Н Гепа* 5%
Аминостерил Н Гепа* 8%
Скорость введения
40-50 капель/мин
30-35 капель/мин
Средняя доза (для больного массой
70 кг)
1,7-2,1 мл/кг
1,3-1,5 мл/кг
Максимальная суточная доза
1,5 г аминокислот на кг массы
тела
1,5 г аминокислот на кг массы
тела
Выпускают во флаконах по 500 мл.
В настоящее время зарегистрирован еще один препарат для пациентов с пече¬
ночной недостаточностью — гепасол НЕО* 8%.
Гепасол НЕО*
Гепасол НЕО* 8% содержит 33,57 г/л аминокислот (АК) с разветвленной боковой
цепью и всего лишь 1,58 г/л ароматических АК. Соотношение АК с разветвленной
цепью/общее количество АК составляет 42%, доля незаменимых АК — 59,4%, всего
аминокислот — 80 г/л, соотношение незаменимые АК/общий азот — 3,68. Общий
азот составляет 12,9 г/л, теоретическая осмолярность — 770 мОсм/л.
Показания к применению:
І полное или частичное парентеральное питание при нарушении функции
печени с нарушением функции мозга или без него;
• терапия печеночной комы и прекоматозных состояний.
Противопоказания:
• повышенная чувствительность к компонентам препарата;
' беременность и период лактации.
*ерапию инфузионным раствором гепасол НЕО* проводят в зависи¬
мости от концентрации аммиака в крови и степени тяжести заболевания.
Р°4олжительность терапии устанавливают индивидуально до полного исчез-
01ения неврологической симптоматики. Вводят внутривенно капельно. реко-
530 (OWHHSEOWtrPWiUWJIIUIWW
ыендуемая скорость инфузии - 1,0-1,25 мл/кг в час (30-35 капель/W,
что соответствует 0,8-0,1 г АК на кг/ч. Максимальная суточная доза составла
18,75 мл/кг (1.5 г АК на кг/сут), т.е. 1300 мл для больного с массой тела 70 кг^
Выпускают в стеклянных флаконах по 500 мл. Срок годности — 2 года.
РАСТВОРЫ АМИНОКИСЛОТ, ПРИМЕНЯЕМЫЕ В ПЕДИАТРИИ
В педиатрической практике предпочтительнее использовать специализирован-
ные аминокислотные растворы, которые, кроме 18 аминокислот, необходимых
дія синтеза белка, содержат сульфоаминокислоту таурин, необходимую для нор¬
мальной работы сетчатки глаза и других тканей. Аминокислоты подобраны в про¬
порции, соответствующей соотношению аминокислот в материнском молоке.
Ваиинолакт*
Ваминолакт* - раствор для осуществления программ парентерального питания
в педиатрии.
Препарат используют для парентерального питания новорожденных, грудных
и детей более старшего возраста.
Препарат противопоказан пациентам с выраженными нарушениями функции
печени, тяжелой уремией (при отсутствии возможности диализа).
Побочные эффекты: возможен тромбофлебит в месте инъекции препарата,
со стороны желудочно-кишечного тракта возможна реакция в виде тошноты.
Препарат вводят внутривенно капельно из расчета 30-35 мл/кг в сутки ново¬
рожденным и грудным детям.
Детям старше 1 года препарат назначают в дозе, рассчитанной на килограмм
массы тела, ориентируясь на данные в табл. 15-25.
Таблица 15-25. Расчет дозы ваминолакта* исходя из массы тела ребенка
Масса тала, кг
Доза препарата, мл/кг в сутки
10-20
24,0-18,5
20-30
18,5-16,0
30-40
16,0-14,5
В целях обеспечения оптимальной утилизации вводимых аминокислот необ¬
ходимо повысить энергетическую ценность раствора. Этого можно добиться,
осуществляя одновременное введение ваминолакта* и раствора глюкозы* или изо¬
тонической жировой эмульсии.
Выпускают во флаконах по 100,250 и 500 мл.
Аминовен Инфант* 10%
Аминовен Инфант* 10% - аминокислотный раствор для парентерального пита¬
ния в педиатрической практике. Содержит 52% незаменимых и 30% разветвлен¬
ных аминокислот, кроме того, таурин — аминокислоту, незаменимую для ново¬
рожденных. Содержание общего азота — 14,9 г/л, осмолярность — 885 мОсм/л.
Не содержит электролиты и углеводы.
Показания: парентеральное питание детей разных периодов жизни (недоно¬
шенных, новорожденных, грудных и детей более старшего возраста). Применяют
одновременно с расчетным количеством углеводов, жиров, витаминов, электро¬
литов и микроэлементов.
Противопоказания: аналогичны подобным препаратам.
Максимальные суточные дозы следующие: 1 год — 15-25 мл/кг массы тела:
2-5 лет - 15 мл/кг: 6-14 лет — 10 мл/кг массы тела.
Выпускают во флаконах по 100 и 250 мл.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 531
лрЕПАРАТЫ о ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ГЛУТАМИНА
ящіептивен
дипептивен * — 20% раствор дипептида глутамина: 100 мл препарата содержат
1 активиого компонента (соответственно L-аланина - 8,2 г, L-глутамина -
ч4б г)- Теоретическая осмолярность — 921 мОсм/л, pH 5,4-6,0.
пипептивен* используют как часть внутривенного питания в качестве добавки
ййнокислотным и инфузионным растворам, в состав которых входят аминокис-
Возмещает дефицит глутамина при повышенном его потреблении в рамках ЯН
’энтерального питания.
Противопоказания:
, тяжелая почечная недостаточность (клиренс креатинина <25 мл/мин);
, тяжелая печеночная недостаточность;
* тяжелый метаболический ацидоз;
, повышенная чувствительность к одному из ингредиентов препарата.
Отсутствуют данные о применении дипептивена у беременных, в период лакта¬
ции и детей, поэтому введение препарата больным этих групп не рекомендуют.
Пипептивен* предназначен для инфузии в центральные вены после добавления
совместимому раствору-носителю. В зависимости от тяжести катаболического
состояния суточная доза составляет 1,5-2,0 мл/кг массы тела. Максимальная
суточная доза - 2,0 мл/кг, что соответствует 0,4 г N (2) -Ь-аланил-Ь-глутамина
на килограмм массы тела.
Добавление дипептивена * к аминокислотному раствору-носителю рекоменду¬
ют проводить следующим образом:
I если суточная потребность в аминокислотах 1,5 г/кг, то необходимо ввести
1,2 г аминокислот и 0,3 г дипептивена*;
j если суточная потребность аминокислот составляет 2 г, то вводят 1,6 г ами¬
нокислот и 0,4 г дипептивена* на килограмм массы тела.
В среднем 100 мл дипептивена* добавляют к 500 мл раствора аминокислот.
Скорость инфузии зависит от таковой введения раствора-носителя и не должна
превышать 0,1 г аминокислот на килограмм массы тела в час. Длительность при¬
менения не должна превышать 3 нед.
Препарат выпускают в стеклянных флаконах по 50 и 100 мл. Хранят при темпе¬
ратуре не выше +25 °С. Нельзя использовать дипептивен* после окончания срока
хранения, указанного на упаковке. Смешивать дипептивен* с раствором-носителем
следует сразу же после вскрытия флакона; данная смесь хранению не подлежит.
Присутствие в программе ПП добавок глутамина или аминокислотных раство¬
ров с высоким содержанием глутамина способствует профилактике атонии кишеч¬
ника, сопровождающей длительное ПП.
КОМПОНЕНТЫ ЭНЕРГООБЕСПЕЧЕНИЯ
Для того чтобы белок полностью использовался в пластических процессах,
необходимо каждый грамм вводимого азота обеспечивать 150 ккал энергии.
Считают, что энергетические потребности организма должны удовлетворяться
Глориями, полученными от усвоения углеводов и жиров, в соотношении 70:30
ИЛИ 60:40%.
Углеводы
' Глюкоза.
* Фруктоза.
* Многоатомные спирты; сорбитол, ксилитол.
Особенности их применения см. в главе «Парентеральное питание».
ГЛАВА 15
532 КЛИНИКЕ СКАЙ ТРАНСФУЗИОЛОГИЯ
Жировые эмульсии
Жировые эмульсии считаются не только энергетическим компоненти
но и источником незаменимых жирных кислот и фосфора. Вследствие нэп!^-
лярных свойств их вводят периферические вены. Не терпят смешиванияс*10'
ми растворами и лекарственными препаратами. %гн-
ИНТРАЛИПИД*
Классический представитель жировых эмульсий — препарат интралипид4
Интралипид* содержит фракционированное соевое масло, эмульгирова
с фосфолипидами яичного желтка. Соевое масло состоит из смеси тригли#^!
преимущественно полиненасыщенных жирных кислот. Размер липидны* гл?8
и биологические свойства интралипида* идентичны таковым у хиломикпо
Интралипид* удаляется из кровотока путем таких же метаболических превпап?’
ний, как и хижшикроны, ^утилизируется как источник энергии. Интралипид
тмпптаттшт и£>ППГ-гаТПШ1ПГТК ЯГГРНИИЯЛЬНЬПГ ЖИПНЫУ ИИ1Ч1Л-г и 'W
предотвращает недостаточность эссенциальных жирных кислот и позволяет JH
ригировать клинические проявления этого синдрома. Препарат выпускают в' ко»
центрации 10,20 и 30%. Иэоосмолярен. ,; ш н'
Интралипид* используют как источник энергии и эссенциальных жирных кис¬
лот у больных, нуждающихся в парентеральном питании.
Интралипид* следует применять с Осторожностью при заболеваниях, протекаю¬
щих с нарушением обмена жиров, таких как почечная недостаточность, сахарный
диабет, панкреатит, нарушение функции печени, гипотиреоз (если наблюдается
гипертришщеридемия) и сепсис. При его назначении необходим тщательный
контроль уровня триглицеридов в сыворотке.
У пациентов с аллергией на соевый белок интралипид* применяют с осторож¬
ностью и только после аллергических проб.
Повышенное внимание Необходимо при назначении препарата для новорож¬
денных и недоношенных детей с ^гипербилирубинемией, а также при подозрении
на легочную гипертензию. !У йаворожденных^!6РОбенно недоношенных, при дли¬
тельном ППП необходим контроль Количества тромбоцитов, печеночнь® проб
и концентрации триглицеридов в ^сыворотке крови.
Интралипид* может оказывать влияние на результаты определенных лабора¬
торных исследований (билирубина, лактатдегидрогеназы, насыщения кислоро¬
дом, гемоглобина и др.) в тех случаях, когда забор крови проводят до полного
удаления жира из сосудистого русла. Вследствие этого указанные исследования
желательно проводить спустя 5-6 ч после инфузии препарата.
Выпускаютво флаконах по 100,250 и 500 мл.
ЛИП0ВЕН03*
Липовеноз* - жировая эмульсия для парентерального питания, полученная
на основе соевого масла* Считается источником энергии и незаменимых жирных
кислот. Выпускается в концентрации 10% и 20%. Изоосмолярна.
Препарат используют для программ ЧП или ППП (в комбинации с растворами
аминокислот и углеводов) в пред- и послеоперационном периодах, при опера¬
тивных вмешательствах и заболеваниях желудочно-кишечного тракта, тяжелых
ожогах, нарушениях функций почек, кахексии.
Противопоказания: общие для ПП, а также выраженные нарушения липидного
обмена (тяжелые поражения печени, шок, декомпенсированный сахарный диабет,
тяжелая форма почечной недостаточности), геморрагические диатезы, I триместр
беременности.
Побочные эффекты: при применении препарата возможны незначительное
повышение температуры тела, озноб, тошнота, рвота, одышка, головная боль,
боль в спине, костях, грудине и пояснице.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО пособия 533
гїоепараТ вводят внутривенно капельно. Суточную дозу определяют из рас-
*2 г жиров на килограмм массы тела или 20 мл 10% (10 мл 20%) раствора
грамм массы тела. Начальная скорость введения составляет 50 мг/кг в час.
я» сИМальнаяскорость введения - 100 мг/кг в час.
Препарат необходимо сочетать с введением углеводов и аминокислотных рас-
^йыпускают в0 флаконах по 100, 250 и 500 мл.
Внаст°я1цее вРемя на территорию РФ не поступает.
„ПОФУНЛИН мст/пст-
Липофундин МСТ/ЛСТ* — жировая эмульсия для парентерального питания
основе соевого масла. Источник энергии и незаменимых (полиненасыщенных)
Мирных кислот. Считается жировой эмульсией II поколения, содержащей по 50%
алиня°1 и среднецепочечных триглицеридов. Среднецепочечные триглицериды
покидают кровеносное русло и окисляются в организме значительно быстрее
ддинноцепочечных, так как их метаболизм не зависит от активности фермента
карнитинпальмитоилтрансферазы. В связи с этим липофундин МСТ/ЛСТ* быстрее
других жировых эмульсий усваивается организмом из кровяного русла и защища¬
ет печень от ожирения и дисфункции, положительно воздействует на иммунную
систему. Существует в концентрации 10 и 20%. Изоосмолярен.
Применяют как источник энергии у больных, нуждающихся в полном паренте¬
ральном питании. При ППП в течение пяти и более суток считается источником
незаменимых жирных кислот в целях предупреждения их дефицита.
Противопоказания: нестабильность основных жизненно важных систем орга¬
низма, а также нарушения жирового обмена в виде патологической гиперлипиде-
мии, жирового нефроза или острого панкреатита, сопровождаемого гиперлипиде-
мией. d і ,>'■:
У взрослых липофундин МСТ/ЛСТ обеспечивает до 60% суточных небелковых
калорий с дозой 1-2 г/кг в сутки.
Липофундин МСТ/ЛСТ 10%. Первые 15 мин скорость инфузии - 0,5-1,0, затем
до 2 мл/кг в час.
Липофундин МСТ/ЛСТ 20%. Первые 15 мин скорость инфузии - 0,25-0,5,
затем до 1 мл/кг в час.
Инфузию препарата следует сопровождать одновременным переливанием угле¬
водных растворов, калорийность которых должна составлять не менее 40% общей
калорийности переливаемых растворов ПП.
Выпускают во флаконах по 100,250 и 500 мл.
ИНФУЗОЛИПОЛ*
Инфузолипол* — отечественная жировая эмульсия, основной компонент кото¬
рой - соевое масло. Эмульгатором служит соевый лецитин. Изотоничность
препарата обеспечивается 5% раствором сорбита. Тонкая очистка компонентов
и высокая степень дисперсности (размер глобул - 0,2-0,6 мкм) способствуют луч¬
шему усвоению и снижению реактогенности препарата. Калорийность -1200 ккал
81000 мл. Снабжает организм триглицеридами, фосфором, незаменимыми жир¬
ными кислотами. Поддерживет нормальный липидный состав и способствует вос¬
становлению пораженной липидной структуры клеточных мембран. Проявляет
азотсберегающее действие. Не вызывает нарушений в системе свертывания крови.
Выводится из сосудистого русла в течение 24 ч. Идентичен интралипиду*.
Показания:
• в пред- и послеоперационном периодах (при операциях на желудочно-
кишечном тракте, у онкологических больных);
• при длительных бессознательных состояниях и анорексии нервного проис¬
хождения;
134 Й1ЙЙ0ШАЯ ШЮФУЗИОЛОГИЯ
І при лучевой терапии с применением цитостатических средств
Противопоказания: общие для ПП в целом, а также нарушения
обмена. Лип,%оіь
Препарат вводят внутривенно со скоростью 20 капель в минуту
доза І 1-2 г жира на килограмм массы тела. сУточная
Выпускают инфузолипол* в стеклянных бутылках по 200 и 400
в защищенном от света месте при температуре +4-8 °С. Замораживанию *****
лежит. Срок годности - 2 года. Не под.
Представители жировых эмульсий III поколения с высоким соле
3-омега-жирных кислот представлены в главе «Парентеральное питание»>*аНИ<1<
ДОБАВКИ К ПРЕПАРАТАМ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
ПП (особенно ППП) не может ограничиваться только введением осно
продуктов питания (белков, жиров, углеводов). Большинство микроэлемент!*
и витаминов являются кофакторами или катализаторами активности фермент*
что делает их незаменимыми в регуляции биосинтетических процессов. Введе
микроэлементов и витаминов в программу ПП по праву считается необходимы!!
условием оптимальной утилизации основных продуктов и сохранения нормаль*
ной функции тканей. ь
Потребности в витаминах и микроэлементах могут варьировать в зависимости
от возникшей ситуации: характера заболевания, необходимости их восполнения,
сопутствующей патологии или профилактики интоксикации. В большинстве слу.
чаев при адекватной калорийности ПП стандартные растворы электролитов, вита¬
минов і микроэлементов обеспечивают суточные потребности организма:
Аддамель Н*
Аддамель Н* - комбинированный препарат для добавления микроэлементов
к инфузируемым питательным растворам. Действие аддамеля Н* определяется
эффектами микроэлементов, входящих в его состав (табл. 15-26).Ш
Таблица 15-26. Состав аддамеля Н (мкмоль/1 мл)
Компонент
мкмоль/ил
Хром (в форме хлорида гидрата)
0,02
Медь (в форме хлорида гидрата)
rfl S
Железо (в форме хлорида гидрата)
2,0
Марганец (в форме хлорида гидрата)
0.5
Йод (е форме иодида калия)
0,1
Фтор (в форме натрия фторида)
5,0
Молибден (в форма молибдата натрия гидрата)
0,02
Сален (в форме селенита натрия гидрата)
0,04
Цинк (е форме хлорида)
10,0 J
Прочие ингредиенты: сорбитол, соляная кислота, вода для инъекций.
Препарат используют для парентерального питания (в качестве добавки к рас
творам аминокислот). Его назначают как взрослым, так и детям (с учетом суто4
ной потребности в микроэлементах у пациентов разного возраста).
Противопоказание: повышенная чувствительность к компонентам препарату
Режим дозирования: после растворения препарат добавляют к растворам а
нокислот. Не рекомендуют добавлять к препарату другие инфузионные раствор
Выпускают в ампулах по 10 мл. Хранят при комнатной температуре- Срок
ности — 2 года.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 535
Виталилид Н*
йПИд н* - добавка жирорастворимых витаминов к жировой эмульсии.
Н* выпускают в двух формах: для взрослых и детей (табл. 15-27).
1547. Состав виталипида Н* на 1 мл препарата
щи»
Ингредиенты
ьтштДерол
Модификация препарата
Виталилид Н* взрослый, мкг
194,1
0,5
910
Виталилид Н* датский, мкГ
135,а
640
_20 j
ЙІІ
Прочие ингредиенты: очищенное соевое масло, очищенные фосфолипиды кури-
Jяйца, глицерин, натрия гидроокись.
Социальная витаминсодержащая добавка к интралипиду* для парентерально-
иягания взрослых и детей старше 11 лет для удовлетворения суточной потреб¬
ив уирорастворимых витаминах. Осмолярность — около 300 мОсм/д.
Показание: добавка к растворам для парентерального питания.
' противопоказание: повышенная чувствительность к компонентам препарата.
Побочные эффекты: возможны аллергические реакции на компоненты препарата.
Рекомендуемая суточная доза для взрослых составляет 10 мл эмульсии, для детей
в возрасте до 11 лет дозу рассчитывают исходя из 1 мл/кг массы тела ребенка.
Эмульшю виталипида Н* добавляют к основной жировой эмульсии не ранее
чем за час до начала инфузии. Во избежание микробного загрязнения инфузию
следует завершить в течение 24 ч.
Выпускают в ампулах по 10 мл. Хранят в темном месте при температуре от +2
до+8’С. Срок годности - 2 года.
Солувит Н*
Солувит Н* поливитаминная добавка к инфузионным растворам, комплекс
водорастворимых витаминов (табл. 15-28).
Таблица 15-28. Состав препарата солувит Н*
Ингредиенты
Состав, кг
Тиамина моногидрат
3,1
Рибофлавина натрия фосфат
4,9
Никотинамид
40,0
ІПиридоксина гидрохлорид
4,9
[Лакготенат натрия
16,5
Аскорбат натция
113,0
Фолиевая кислота
0,4
Цианокобаламин
5,0
Показания к применению: комплекс водорастворимых витаминов, добавляе¬
мых в питательные смеси при осуществлении программ ППП.
Противопоказание; повышенная чувствительность к компонентам препарата.
Побочные эффекты: аллергические реакции на компоненты препарата.
Режим дозирования: после растворения препарат добавляют к растворам глю¬
козы*.
Препарат можно назначать как взрослым, так и детям с учетом возрастных
Потребностей.
Вытекают во флаконе сухое вещество 1 мл. Хранят при температуре от +6
+*5*С в защищенном от света месте.
CtVWUi
538 КЛИНИЧЕСКАЯ ТРАНСФУЗИОлогия
Церневит* р комплекс водо- и жирорастворимых витаминов (подпой
саниепредставлено в главе «Парентеральное питание*). Ное огщ.
СПИСОК ЛИТЕРАТУРЫ
Асадов 4J3- Морфофункциональная характеристика сегментоядерных нейто
J у больных с гетерозні отной р-талассемией: Дис... канд. мед. наук. — М.. 198 с ^°Фидов
Афонии Н.И., Гольдина ОА, Горбачевский Ю.В. Современные аспекты
крови с использованием плазмозамещающих растворов на основе^81*111
аотнлированного крахмала для последующей гемотрансфузии // Вестник cnvwfi ^Р0*-
России. I 1998. В N*4. - С. 37-41. у оъ> кРови
Байрамалибейли ИЭ. Функциональная характеристика Г-6-ФД-дефицитных
тов: Дне.... канд. мед. наук. — М., 1986. — 107 с. 0 °Чи-
Байрамалибейли И.Э. Фагоцитарная активность сегментоядерных нейтрофилов
С дефіцитом фермента Г-6-ФД // Материалы республиканской научной копфепйпІІ ^
Баку. 1984. - 124 с. ции' "
Байрамалибейли И.Э., Рагимов А.А. Лейкоцитарный и эритроцитарный дефицит А
мента Г-6-ФДГ в популяциях с высокой частотой этой аномалии // Гематология и то»
фузиология. - 1988. — №1. — С. 15-18. Нс'
Байрамалибейли И.Э. Донорство и аутодонорство при наследственных аномалии
крови - дефиците фермента Г-6-ФД и гетерозиготной р-талассемии: Дис. д-ра kf
наук. - М.. 2006. 1
Барышев Б.А. Применение препарата гелофузин* в клиниках СПбГМУ им. акад
И.П. Павлова // Тезисы докладов. Новое в трансфузиологии: опыт клинического применения
шшмозамещающего препарата гемодинамического действия гелофузина*. - 1997. - С. 3-7
Барышев Б.А. Кровезаменители: Справочник для врачей. — СПб.: Человек, 2001. - 95 с
Вретлинд А., Суджян А. Клиническое питание. — Стокгольм; М., 1990. — 354 с.
Гольдина О.А., Горбачевский Ю.В. Гемодилюционная терапия с использованием плазмо¬
замещающих растворов гидроксиэтилированного крахмала при нарушениях микроциркуля¬
ции 7 Вестник интенсивной терапии. — 1998. — Ns3. — С. 25-32.
Дуткевич И.Г. Перспективы использования препаратов модифицированного желатина
в медицине катастроф щ Тезисы докладов. Новое в трансфузиологии: опыт клинического
применения плазмозамещающего препарата гемодинамического действия гелофузина*. -
1997.-С. 11-12.
Жибурт Е.Б., Чечеткин А.В., Баранова О.В. Плазмозаменители на основе гидроксиэтили¬
рованного крахмала в клинической практике // Terra Medica. — 1999. — №1. — С. 16-18.
Исаков Ю.С., Михельсон В.А., Штатное М.К. Инфузионная терапия и парентеральное
питание в детской хирургам. — М.: Медицина, 1985. — 288 с.
Карпун Н.А.. Мороз В.В., Руденко М.И. и др. Операционная нормоволемическая гемоди¬
люция при хирургическом лечении ишемической болезни сердца // Вестник интенсивной
терапии. 1 1999. - N*4. - С. 11-18.
Костюченко А.Л. Современная инфузионная терапия: достижения и возможности // Мир
медицины. - 2000. - N*1-2.
Кротовский А.Г. Аутогемотрансфузия при операциях с искусственным кровообращени¬
ем: Автореф. дис.... канд. мед. наук. - М., 1990.
Константинов Б.А., Рагимов А.А., Дадвани С.А. Трансфузиология в хирургии. - М.: Аир-
арт, 2000.
Кровезаменители, консерванты крови и костного мозга / Под общ. ред. Г.Н. Хлябича. -
М.: Медицина, 1997. - 192 с.
Мариино П. Интенсивная терапия. - М.: ГЭОТАР-Медиа, 1998. — 640 с.
Марютнн П.В., Левченко Л.Б., Учваткин В.Г. и др. Кровопотеря — гиповолемия, подходы
к инфузионно-трансфузионной терапии // Анестезиология и реаниматология. - 1998. -
N*1- С. 35-41.
Марютин П.В., Левченко Л.Б., Учваткин В.Г. Применение гелофузина* в интенсивной
терапии пациентов хирургического профиля // Тезисы докладов. Новое в трансфузиологии-
опыт клинического применения плазмозамещающего препарата гемодинамического Д*
В гелофузина*. - 1997. - С. 8-10.
Мокеев Й.Н. Инфузионно-трансфузионная терапия: Справочник. — М., 1998. - 232с-
Молчанов И.В., Гольдина О.А., Горбачевский Ю.В. Растворы гидроксиэтилированя
крахмала і современные и эффективные плазмозамещающие средства инфузионнои Р
пии. М.: НЦССХ, 1998. - 137 с.
ОСНОВНЫЕ СРЕДСТВА ТРАНСФУЗИОННО-ИНФУЗИОННОГО ПОСОБИЯ 537
■яцпв И.В.. Афонин Н.И., Горбачевским Ю.В. и др. Плазмозамещающие растворы
М°Г^)Елатина - все в прошлом? // Вестник интенсивной терапии. - 1999. - N*3. -
С. І! В.В., Дергунов В.А. Трансфузионные средства с высокой кислородной емкостью
*) в клинической медицине // В кн.: Методы сбережения крови в хирургии. -
(1*-!л997.
ймушин А.В., Курапеев И.С., Гордеев M.JI. Опыт проведения аутогемотрансфузии
питованием гелофузина* при операциях аортокоронарного шунтирования // Вопросы
£ логии и трансфузиологии. - 2000. - №2. - С. 34-40.
І^пвЙКИЙ А.Г., Карашуров Е.С. Переливание крови, препаратов крови и кровезамени-
°Г?пстразаводск: ПетрГУ. 2000. - 136 с.
^гкипов В.П.. Шабалкин Б.В., Кротовский А.Г. Первый опыт работы по программе пол-
гтгаанения крови пациента в кардиохирургии // Анестезиология и реаниматология. -
пя|
п»п(Ьторорганические соединения в биологии и медицине / Под общ. ред. Г.Р. Иваниц-
BJB Мороза. - Пущино. 2001. - 228 с.
*0Гп'«пАтоРОрганические соединения в биологии и медицине: Сборник материалов конфе-
^2 -Пушино. 2004. - С. 18-32.
Полов В.В.. Молчанов И.В., Карпуничев О.Б. и др. Базовая интенсивная терапия ишеми-
церебрального инсульта. Метод терапевтической гемодилюции // Анестезиология
^тлогия. - 2000. - №4.1 С. 44-49.
Рагимов А.А., Вайрамалибейли И.Э. Основы диагностики, профилактики и лечения ане-
1 Й Ц ГОУ ВУНМЦ М3 РФ, 2002. - 288 с.
Рагимов А.А. Иммунологическая структура популяции и иммунитет при наследственных
аномалиях крови (гемоглобинопатиях и дефиците фермента Г-б-ФД): Дис. ... д-ра мед.
йук.-М., 1987.
Рагимов А.А., Дашкова Н.Г., Вайрамалибейли И.Э. Микрометод определения ОСЭ
и активности Г-б-ФД // Лаб. дело. - 1984. - №9. - С. 520-522.
Рагимов А.А., Крапивкин И.А. Кровосберегающие технологии в сердечно-сосудистой
хирургии. - М.: ГОУ ВУНМЦ М3 РФ. 1999. - 73 С.
Рагимов А.А., Щербакова Г.Н., Соловьева И.Н. Парентеральное питание в хирургии. -
М.: ГОУ ВУНМЦ М3 РФ, 1999. - 144 с.
Руководство по военной трансфузиологии / Под общ. ред. Нечаева Э.А. - М., 1991. - 280 с.
Руководство по парентеральному и энтеральному питанию / Под общ. ред.
Й.Е. Хорошилова. — СПб.: Нордмед-Издат, 2000. - 376 с.
Рябов Г.А., Емцов Ю.Г., Титова И.А. Об оценке степени тяжести состояния реанимацион¬
ных больных по параметрам системы транспорта кислорода // Анестезиология и реанима¬
тология. - 1988. — №5. — С. 7-9.
Справочник по переливанию крови и кровезаменителей / Под общ. ред. O.K. Гаврилова. -
М.: Медицина, 1982. — 304 с.
Франке Р. Восполнение объема циркулирующей крови с использованием коллоидных
растворов// Анестезиология и реаниматология. — 1999. — №3. — С. 70-76.
Суханов Ю.С., Аграненко В.А. Аутогемотрансфузии. — М.: Медиа-Сфера, 1999. — 204 с.
Хартиг В. Современная инфузионная терапия. Парентеральное питание. - М.: Медицина,
1982. - 494 с.
Ханин А.З. Гелофузин* в практике скорой медицинской помощи // Тезисы докладов.
Новое в трансфузиологии: опыт клинического применения плазмозамещающего препарата
биодинамического действия гелофузина*. — 1997. — С. 13.
Чеботкевич Е.Н., Селиванов Е.А. Прионы — новая проблема трансфузиологии // Вестник
' иужбы крови России. - 1999. - №2. - С. 51-57.
Шестопалов А.Е., Пасько В.Г. Объемзамещающая терапия волемических нарушений
“Апаратом гелофузином4 у хирургических больных // Вестник службы крови России. —
1999, - №4 _ _ с 31_34
Шевченко Ю.Л., Жибурт Е.Б. Плазмозаменители на основе гидроксиэтилированно-
10 Чйхмала в клинической практике: Руководство для врачей: Безопасное переливание
*№1. - СПб.: Питер, 2000. - С. 268-272.
Baehner R.L., Nathan P.G. Leukocyte oxydase: Defective activety in chronic granulomatous
“^//Science. - 1967. - Vol. 155. - P. 835-837.
Baehner R.L., Johnstone R.B. Jr., Nathan P. G Reduced pyricine nucleotide (RPN) content in
■o-PD deficient granulocytes (PMN). An explanation for their defective bactericidal function //
1'Cl®. Invest. - 1970. — 50 p.
131 кшичкэиятмюсузиология
BNtecr R.L Johnstone R.B. Jr.. Nathan P. G Comporative study of the metabolic and batten
ehanctenaics of severely G-6-PD. Deficient Poiymorpholonucleans Leukocytes and Leukocyt*b
children with Chronic Granulomatous Disease // R.E. S. — 1972. — Vol. 12. — P. 150-169 1
Beards S.CU Edwards J.D.. Nightingale P.. Farragher E.B. Comparison of the hemodynami,
oxygen transport responses to modified fluid gelatin and hetastarch in critically Щ patients- *C ^
spective. randomized trial // Critical Care Medicine. — 1994. — Vol. 22. — N*4. P10'
Beyer R.. Harmening U., Rittmeyer 0.. Zielmann S. et al. Use of modified fluid gelatin
I starch for colloidal volume replacement in major orthopaedic surgery // n
Journal of Anesthesia. - 1997. - Vol. 78. - P. 44-50. n,lsh
Brodin B. et al. Decrease of plasma fibronectin concentration following infusion of gelatin-h
plasma substitute in man // Scan.J. Clin. Lab. Invest. — 1984. — Vol. 44. - P. 529-533. aS0(l
Costa E.. VasconcekB J.. Santos E. et al. Neutrophil dysfunction in a case of glucose-6'phosnh і
dehydrogenase deficiency // Journal of Pediatric Haematology/Oncology. - 2002. - Vol 24
P. 164-165.
Edwards J.D., Nightingale P.. Wilkins R.G., Faragher E.B. Hemodynamic and oxygen transport
response to modified fluid gelatin in critically ill patients // Critical Care Medicine. - 1989
В17.1 P. 996-998.
Edwards J.D.. Wilkins R.G. Atrial fibrillation precipitated by acute hypovolemia // Br Med I
1987. -Vbl.294. -P.283-284.
Gddblatt D.. Thrasher A.J. Cronic granulomatous disease // Clinical and Experimental
Immunology. - 2000. - Vol. 122. - P. 1-9.
Heufr H.G., Goudeva I., Pulver N. Granulocyte for successful treatment of critically ill neutro-
penic patients with septic complications // Vox. Sang. - 2005. — Vol. 89. — №1. - p. 49,
Heynkes R. Gelatin without BSE infectivity can only be produced from healthy animals //
Therapiewoche. — 19%. — Vol, 46. — P. 1618-1620.
Himpe D.. Van Cauwelaert P.. Neels H., Stinkens D.. van den Fonteyne F. et al. Priming
Solutions for Cardiopulmonary Bypass: Comparison of Three Colloids //Journal of Cardiothoracic
and Vascular Anesthesia. — 1991. — Vol. 5. — №5. — P. 457-466.
Jansan P.G. М., Velthuis H., Wildevuur W.R.. Huybregts M.A. J. M. et al. Cardiopulmonary
bypass with modified fluid gelatin and heparin-coated circuits // British Journal of Anesthesia. -
1996.-Vol. 76.-P. 13-19.
Lundsgaard-Hansen P.. Tschirren B. Modified Fluid Gelatin As a Plasma Substitute // Blood
Substitutes and Plasma Expanders. - P. 227-257.
Maeda М.. Constantoulakis P., Chen C-S. et al. Molecular abnormalities of glucose-6-phosphate
dehydrogenase variantassociated with undetectable enzyme activity and immunologically cross¬
reacting material //American Journal of Human Genetics. — 1992. — Vol. 51. — P. 386-395.
Mishler I Synthetic plasma volume expanders — Their pharmacology, safety and clinical effi¬
cacy // Clin. Haematol. - 1984. - Vol. 13. - P. 75.
Moore F.D. The Metabolic Care of the Surgical Patient. — Philadelphia: Saunders, 1959. - 220 p,
Park B.H., Firking S.M., Smithwick E.M. Infection and nitrobluetetrasolium reduction by neu¬
trophils//Lancet. - 1968. - Vol. 11. - P. 532-534.
RingJ., Messmer K. Incidence and severity of anaphylactoid reactions to colloid volume substi¬
tutes // Lancet. -1977. - 466 p.
Sabine J.C., Jung E.D., Fish M.B. et al. Observation on the inheritance of G-6-PD deficiency in
erythrocyte ana in leucocytes //Br.J. Haematol. - 1963. — Vol. 9. — P. 164-171.
Salewsky et al. Der Einflib von kolloidalen Plasmaersatzmitteln auf die Freisetzung von L-lalfa
und IL-beta in humanen Vollblut in vitro // Anaesthesist. — 1995. — Vol. 44. — 311 p.
Shatney CH.. Deepika K., Militello P.R. et al. Efficacy of hetastarch in the resuscitation of
patients with multisystem trauma and shok // Arch. Surg. - 1983. — Vol. 118. - P. 804-809.
Stanworth S.J., Massey E., Lucas G. et al. A systematic review of therapeutic granulocyte transfu¬
sion and possible routes forward//Vox. Sanguinis. - 2004. - Vol. 87. - №3. - P. 15.
Tourtelotfe D„ Williams H.E. Acyiated Gelatins and Their Preparations // US Patent. -
1958. I N»2.1 P. 827,419.
Videm V„ Moilnes T.E. Human complement activation by polygeline and dextran-70 // Scand.
J. Immunol. - 1994, - Vol. 39. - P. 314-320.
Watkins J. et al. Complement activation by polystarch and gelatin volume expanders //
Lancet. 11990. | Vol. 335. - 233 p.
Wnkins J., Hardy G. Immunological implications of complement activation by plasma volume
expanders: comparison of polystarch and a gelatin expander // Fluid replacement by eloHaes. -
1990. і P. 31-32.
Г глава 16
Инфузионно-трансфузионная
терапия при критических
; СОСТОЯНИЯХ
МОНИТОРИНГ СОСТОЯНИЯ ПАЦИЕНТА
В основе лечебных мероприятий, связанных с переливанием
продуктов крови и плазмозаменителей, лежит оценка клинических
данных, показателей кислородного статуса и состояния гемодина¬
мики пациентов.
Кислородный статус организма
Основные функции системы кровообращения заключаются в рас¬
пределении кислорода между метаболически активными тканями
и выведении продуктов обмена и двуокиси углерода. Потребность
в кислороде является наиболее важным регулятором кровотока
в большинстве тканей. По некоторым данным, достаточное снаб¬
жение клеток глюкозой может сохраняться при тридцатикрат¬
ном уменьшении кровотока, в то время как для кислорода этот
резерв значительно меньше. Следовательно, главным результатом
острой недостаточности кровообращения становится циркулятор¬
ная гипоксия, возникающая в результате несоответствия между
доставкой кислорода к тканям и потребностью в нем.
Для оценки кислородного статуса организма необходимы дан¬
ные, отражающие пять основных этапов кислородного снабжения;
• поступление кислорода;
і содержание кислорода в крови;
І транспорт кислорода;
і высвобождение кислорода;
• эффективность утилизации кислорода.
ПОСТУПЛЕНИЕ КИСЛОРОДА
Поступление кислорода в легкие определяется:
• парциальным напряжением кислорода в альвеолярном воз¬
духе, зависящим от атмосферного давления или фракции кис¬
лорода на вдохе (Fi02), минутной вентиляции легких и альвео¬
лярного рС02;
І степенью внутрилегочного шунтирования крови;
• Диффузионной способностью легочной ткани.
Ключевой параметр, используемый для оценки адекватности
поступления кислорода, — парциальное напряжение кислорода
в артериальной крови (ра02). Для расчета нормальных или долж-
540 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
ных индивидуальных значении ра02 (при условии, что Fi02=0,2l) поль.
следующей формулой: 3У°тся
р‘0| (должное) = 100 § половина возраста пациента.
Термин «внутрилегочное шунтирование крови» отражает соответ
между вентиляцией и кровоснабжением в различных участках легочной СГВНе
Оксигенация притекающей к легким венозной крови происходит в капиТ^11'
прилежащем к вентилируемой альвеоле. Если вентилируемая альвеола прій*'
к легочному капилляру без кровотока, или, наоборот, открытый капиллял ^
лежит к невентилируемой альвеоле, оксигенации венозной крови не происх Ш
Чем больше таких несоответствий, тем выше фракция внутрилегочного шунти*!'
вания. Р°"
Фракцию внутрилегочного шунтирования можно рассчитать по формуле1
0/0,= [0,03х(А I а) рО2]/0,03х(А | а) р02+ [1.36xHbx(Sa02-Sv02)}
0/0,= [(рАОг P02)xO,003)/[l,36(Sa02-Sv02) I (рА02- РО2)х0,003]
где 0/0, — фракция внутрилегочного шунтирования; (А - а) рО, - альвеолярно¬
артериальная разница по р02; 1,36 -константа Хюффнера; Sa02 - насыщение кис¬
лородом артериальной крови; Sv02 — насыщение кислородом венозной крови.
При нормальных показателях фракции внутрилегочного шунтирования, состав¬
ляющих 2-6%, адекватные значения ра02 будут определяться на фоне дыхания
атмосферным воздухом. По мере возрастания фракции внутрилегочного шун¬
тирования для поддержания достаточного ра02 необходимы повышенные FiO
При высокой степени внутрилегочного шунтирования, достигающей 30% и выше,
даже использование 100% кислорода не позволяет достичь нормального ра02.
В клинических ситуациях, связанных с инфузионно-трансфузионной терапией,
к увеличению фракции внутрилегочного шунтирования могут привести факторы,
обусловливающие нарушения как вентиляции, так и кровоснабжения легких.
Среди них закупорка альвеол кровью или бронхиальным секретом (количество
секрета может увеличиваться при гипергидратации), образование гемо- или гидро¬
торакса, травма легкого, пневмоторакс, формирование ателектазов, бронхоспазм,
анафилактические реакции на переливание продуктов крови или кровезамените¬
лей и др.
Нарушения кровоснабжения легких могут быть обусловлены значительным
сокращением количества открытых капилляров при выраженной гиповолемии,
сладжем форменных элементов и образованием микросгустков при ДВС-синдроме,
тромбоэмболическим синдромом, воздушной эмболией (например, при исполь¬
зовании центральных венозных катетеров), сдавлением легочных капилляров
при установке неоправданно высоких значений дыхательного объема или PEEP
во время ИВЛ у пациентов с гиповолемией.
Несмотря на то что во многих классических учебниках нарушению диффузион¬
ной способности легочной ткани придается второстепенное значение, у пациентов
отделений реанимации и интенсивной терапии этот фактор может играть ведущую
роль в развитии артериальной гипоксемии. Известно, что избыточное введение
кристаллоидных растворов приводит к увеличению интерстициального простран¬
ства легких. В интерстиции при нарушении капиллярной проницаемости могут
накапливаться вводимые в вену альбумин и коллоидные растворы с относительно
небольшой молекулярной массой.
СОДЕРЖАНИЕ КИСЛОРОДА В АРТЕРИАЛЬНОЙ КРОВИ
Концентрация кислорода в артериальной крови (сЮ2а) отражает общее содер
жание кислорода в единице объема крови, зависящее от следующих факторов.
• концентрации гемоглобина крови;
ИНФУЗИ0НН0-ТРАНСФУЗИ0ННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях 541
концентрации дисгемоглобинов;
* парциального давления кислорода в артериальной крови;
' насыщения кислородом артериальной крови, в свою очередь, зависящего
' отр 0 и сродства гемоглобина к кислороду.
р осматривая роль концентрации гемоглобина в крови, необходимо отметить,
по сих пор в большинстве клиник оценивают общую концентрацию гемогло-
(ctHb). Этот показатель включает все виды гемоглобина; деоксигемогло-
щ 0КСИгемоглобин, карбоксигемоглобин, метгемоглобин и сульфгемоглобин.
оксиметры, позволяющие определять все вышеперечисленные фракции гемо*
Ё|ина, пока еще не получили широкого распространения. В этой связи необхо¬
димо учитывать, что в определенных клинических ситуациях, при повышенной
^центрации дисгемоглобинов, ориентироваться на ctHb необходимо с большой
осторожностью.
Известно, что наиболее частыми причинами высокого ctHb являются истин¬
ная полицитемия, дегидратация, хронические заболевания легких, проживание
в условиях высокогорья, занятия спортом. Высокие значения ctHb приводят к уве¬
личению вязкости крови и нарушению микроциркуляции. Вместе с тем при пере¬
ливании крови и определении оптимального уровня гематокрита иногда прихо¬
дится ориентироваться на исходные (до кровопотери) значения ctHb, поскольку
полицитемия может носить компенсаторный характер.
Причинами низкой ctHb являются кровотечение, гипергидратация, намерен¬
ная гемодилюция, гемолиз, нарушение продукции эритроцитов, множественные
заборы крови для анализов (особенно у новорожденных). Снижение этого пара¬
метра сигнализирует о риске тканевой гипоксии. Поскольку основным фактором
компенсации кислородного дефицита при анемии служит возрастание сердечного
выброса, этот риск повышен у пациентов с ишемической болезнью сердца, нару¬
шениями сократительной способности миокарда, а также при пороках сердца,
приводящих к препятствию изгнанию крови из него.
Нормальные значения ctHb — это еще не гарантия адекватного кислородного
снабжения тканей, поэтому в условиях отделений реанимации и интенсивной
терапии очень важно определять все фракции гемоглобина.
Фракция оксигемоглобина артериальной крови (F02Hb) — соотношение
между концентрациями оксигемоглобина и общего гемоглобина, которое опреде¬
ляется как
F02Hb = c02Hb/(c02Hb + cHHb i cCOHb 1 cMetHb).
Нормальные значения этого параметра составляют 94-99%.
На практике чаще пользуются показателем насыщения гемоглобина крови кис¬
лородом (sOj) — это отношение оксигемоглобина к общей фракции гемоглобина,
переносящего кислород:
s02= с02НЬ/ (с02НЬ + сННЬ).
Вместе с тем между s02 и F02Hb существует следующая зависимость:
F02Hb I s02(l I cCOHb + cMetHb + cSHb).
lf| означает, что при отсутствии в крови дисгемоглобинов фракция оксиге-
оглобина соответствует насыщению гемоглобина крови кислородом. В случае
овыщения концентрации в крови какой-либо из аномальных форм гемоглобина
ВДУ этими показателями могут быть существенные различия.
['лоб°СЛЄ^НЄе «утрируется примером с повышением фракции карбоксигемо-
ctHb=10;
ГЛАВА >6
I клиническая ттктэнопогня
cHHb-0.2;
cC0Hb=3;
c02Hb=6,S;
F02Hb=6,8/ (6.8+0,2+3) xlOO-68%;
s02=6,8/ (6,8+0,2) x100-97%.
Таким образом, присутствие повышенной фракции карбоксигемоглобина в ля
ном случае дает разницу между сравниваемыми параметрами в 31%. Посколі,Н
карбоксигемоглобинемия встречается при лечении пациентов с травмой и ш
вопотерей. поступающих из районов стихийных бедствий, пожаров или взрыво
определение F02Hb имеет у них большое значение.
Сказанное выше верно и при использовании пульсоксиметрии, поскольку
насыщение крови кислородом, определяемое с помощью пульсоксиметра, соот¬
ветствует sOj. Строго говоря, данные пульсоксиметра могут быть ниже F0 НЬ
при спазме периферических сосудов и нарушениях микроциркуляции и выше
этого показателя при высоких фракциях аномальных форм гемоглобина. Это
также означает, что мониторинг функции дыхания на основе одной пульсокси¬
метрии может давать ложные результаты, и в этих случаях необходимо делать
поправку на ctHb.
Фракция карбоксигемоглобина определяется как соотношение концентра¬
ций карбоксигемоглобина и общего гемоглобина:
FCOHb = cCOHb/ctHb.
Нормальные значения этого показателя у взрослых составляют от 0 до 2%.
У злостных курильщиков FCOHb может достигать 10-12%.
Окись углерода обратимо связывается с ионами железа гема, сродство гемогло¬
бина к СО в 200-250 раз выше, чем к кислороду. Кроме того, карбоксигемоглобин
приводит к смещению кривой диссоциации оксигемоглобина влево. Это означа¬
ет, что при отравлениях СО наряду с уменьшением кислородной емкости крови
затруднена отдача кислорода в тканях.
При острых отравлениях окисью углерода, когда FCOHb превышает 30%, отме¬
чаются сильные головные боли, общая слабость, рвота, одышка и тахикардия,
а при уровне более 50% - судороги, кома, летальный исход.
Лечение заключается в вентиляции 100% кислородом, гипербарической окси-
генации, заменном переливании крови или синтетических кислородпереносящих
кровезаменителей (перфторуглеродов).
Фракция метгемоглобина определяется как соотношение концентраций мет-
гемоглобина и общего гемоглобина:
FMetHb = cMetHb/ctHb.
Нормальные значения этого показателя у взрослых составляют от 0,2 до 0,6%.
Метгемоглобин образуется в результате окисления в геме двухвалентного желе¬
за в трехвалентное. Метгемоглобин не способен переносить кислород, кроме
того, он затрудняет освобождение кислорода вследствие смещения КДО влево.
Большинство случаев метгемоглобинемии обусловлены отравлением веществами,
содержащими ннтро- и аминогруппы. При уровне FMetHb выше 10-15% развива¬
ется псевдоцианоз, при значениях, превышающих 30%, появляются головная боль
и одышка, а метгемоглобинемии более 70% может привести к летальному исходу-
Лечение метгемоглобинемии заключается во внутривенном введении метиленово¬
го синего и переливании эритроцитной массы.
Концентрация кислорода в артериальной крови (сЮ2) — это сумма концен¬
траций кислорода, связанного с гемоглобином и растворенного в плазме крови:
ИНФУЗИ0НН0-ТРАНСФУЗИ0ННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ $43
ct02*s0, (1 - FCOHb- FMetHb - FSHb) фсрОг
видно из представленного уравнения, при расчете данного параметра
все фракции гемоглобина и концентрацию кислорода, растворенного
крови. Поскольку в условиях нормального атмосферного давления коэф-
растворимости кислорода в плазме мал (к=0,031), вклад растворенной
К*ИИ невелик. Вместе с тем в условиях гипербарической оксигенации удается
<“ьувеличения ct02 за счет растворенной фракции до 6 об.%.
^мальные значения ct02 для мужчин составляют 8,4-9,9 ммоль/л (18.8-
Ш%)*а для женщин ~ 7Д_8,9 ммоль/л (15,8-19,9 об.%).
**'нонимом термина «концентрация кислорода» является понятие «содержание
.рода*, поскольку ct02 служит интегральным показателем, отражающим кис-
jSrpaHcnopTHbie свойства крови.
IfAHCnOPT КИСЛОРОДА
Артериальный транспорт кислорода — общее количество кислорода, поступаю-
М СИстему большого круга кровообращения в единицу времени:
D02=ct02xCB.
Менее точно артериальный транспорт кислорода можно определить по формуле:
D02=CBx (Hbxl,36xHb02+0,0031xpa02) хЮ,
где DO - артериальный транспорт кислорода, мл/мин; СВ — сердечный выброс.
і/мин;2НЬ - концентрация эффективного гемоглобина, г%; 1,36 - константа
Хюффнера; НЬ02 - насыщение гемоглобина артериальной крови кислородом, %;
00031 1 коэффициент растворимости кислорода в плазме крови; ра02 - парци¬
альное давление кислорода в артериальной крови, мм рт.ст.
Поскольку антропометрические характеристики пациентов могут существенно
различаться, принято пользоваться индексированными параметрами сердечного
выброса и Т02, соотнося их с величиной поверхности тела.
Следует обратить внимание на некоторые методические особенности, способные
повлиять на величину Т02. Прежде всего точность определения СВ зависит от мето¬
дики его измерения. В этой связи ниже приведен краткий обзор методов измерения
этого параметра, используемых в отделениях реанимации и интенсивной терапии.
Поскольку в ряде клинических ситуаций в крови может возрастать содержа¬
ние патологических форм гемоглобина (карбоксигемоглобина, метгемоглобина,
сульфгемоглобина, а в педиатрической практике — фетального гемоглобина),
целесообразно пользоваться приборами, позволяющими определять содержание
в крови эффективного (переносящего кислород) гемоглобина.
Константа Хюффнера характеризует способность гемоглобина крови связывать
кислород, может варьировать в пределах от 1,32 до 1,39, но, поскольку аппарату¬
рой для ее измерения располагает ограниченное количество отделений, а отличие
к несколько сотых единиц вряд ли окажет большое влияние на результат вычисле¬
ния, рекомендуют наиболее часто встречаемую величину — 1,36.
Особое значение имеет прямое определение величины НЬ02, поскольку в ряде
иучаев, когда в газоанализаторе отсутствует гемоксиметрический блок, данный
параметр рассчитывают исходя из значений ра02. При отклонениях положения
кривой диссоциации оксигемоглобина различия между измеренными и расчетны¬
ми значениями НЬ02 могут быть значительными.
Таким образом, можно заключить, что для более точного определения D02
“Шкодимо пользоваться приборами, позволяющими непосредственно изме¬
рить сЮг
DQj - кислородный выброс (доставка кислорода). Это интегральный пока-
ль, учитывающий следующие процессы: поступление кислорода в легкие,
544 КЛИНИЧЕСКАЯ ТРАНСФУЗИ0Л0ГИЯ
концентрацию гемоглобина и его фракций, сродство гемоглобина к к
растворенную в плазме крови фракцию кислорода, а также производит'
сердца. Последнюю считают основной детерминантой артериального
кислорода, поскольку при одном и том же ct02 чем больше минутный обПоР*а
вообрашения, т.е. СВ, тем больше кислорода доставляется к органам и**1 Кр0'
Кроме того, СВ служит основным фактором компенсации анемии и артеп ТКан’,М.
гипоксемии, особенно в острых случаях. ^Hojj
ВЫСВОБОЖДЕНИЕ КИСЛОРОДА
Высвобождение кислорода, т.е. разрыв его связи с гемоглобином, зависит
факторов. Способность гемоглобина отдавать кислород оценивают по поло»
кривой диссоциации оксигемоглобина, отражающей зависимость между sO
При сдвиге КДО вправо способность гемоглобина отдавать кислород понижа^'
а при сдвиге влево — увеличивается. ется.
Факторы, проводящие к сдвигу КДО влево:
я снижение концентрации 2,3-ДФГ в эритроцитах:
• снижение температуры тела;
• гипокапния:
В метаболический алкалоз:
• высокая концентрация фетального гемоглобина;
а повышение концентрации карбоксигемоглобина;
• повышение концентрации метгемоглобина;
і переливание крови со сроком хранения более недели.
Факторы, приводящие к смещению КДО вправо:
я повышение концентрации 2,3-ДФГ в эритроцитах;
• гипертермия;
• гиперкапния;
і метаболический ацидоз;
• повышение концентрации сульфгемоглобина.
Поскольку для построения КДО необходимы специальная аппаратура или мате¬
матические модели, в рутинной практике пользуются расчетным параметром
р50, он представляет собой парциальное напряжение кислорода при сатурации
гемоглобина, равной 50%. Данный показатель отражает сродство гемоглобина
к кислороду, и его уменьшение ассоциируется со смещением КДО влево, а увели¬
чение — вправо.
Некоторые авторы указывают, что при расчете р50 на основании пробы только
артериальной крови достоверным этот параметр можно считать лишь в случаях,
когда s02a не превышает 97%.
ЭФФЕКТИВНОСТЬ УТИЛИЗАЦИИ КИСЛОРОДА
Если проследить изменения парциального давления кислорода по мере движе¬
ния его по артериальной системе от легких до капилляров, где происходит диффу¬
зия II в клетки, уже на уровне мелких артерий наблюдается заметное снижение
ра02. Значительное его падение происходит по мере прохождения капиллярного
русла, что, собственно, и отражает высвобождение или потребление кислорода.
Очевидно, что в различных органах и тканях потребление кислорода неодинаково,
это определяется их различной метаболической активностью.
В рутинной клинической практике об эффективности высвобождения кис¬
лорода судят по интегральным показателям, отражающим этот процесс во всем
организме, однако существуют способы оценки освобождения и потребления кис¬
лорода в отдельных органах.
К числу интегральных показателей, отражающих эффективность утилизации
кислорода, относят:
потребление кислорода - VOz;
\ артериовенозную разницу по кислороду - Ca02-Cv02;
* коэффициент тканевой экстракции кислорода - (C,02-Cv02)/C,02 или
* V0j/DOr
уменьшение потребления кислорода, характерное для синдрома шока, сопро-
«дается снижением артериовенозной разницы по кислороду и его тканевой
*!дяякдии. При восстановлении циркуляторных нарушений на фоне возрастания
So происходит увеличение V02, при этом обычно в течение некоторого времени
^«ебление I может значительно превышать нормальные значения. Данный
^объясняется восполнением кислородной задолженности, возникшей за пери-
д дефицита доставки кислорода.
Высокие значения коэффициента тканевой экстракции кислорода и артериове-
одной разницы указывают на абсолютный или относительный дефицит доставки
і подобные изменения можно рассматривать как проявление компенсаторных
-^яний, направленных на устранение этого дефицита.
Адекватность тканевой оксигенации. Оценка адекватности тканевой окси¬
генации - одна из наиболее сложных задач клинической практики. В этих целях
используют следующие параметры:
* насыщение и парциальное напряжение кислорода в смешанной венозной
крови I Sv02 и Pv02;
» концентрацию лактата в артериальной крови — cLac.
Отдельно взятые Sv02 и Pv02 обладают ограниченной диагностической ценно¬
стью. Низкие их значения свидетельствуют о неадекватной тканевой оксигена¬
ции. Однако относительно нормальные или повышенные значения встречаются
при дефиците тканевой оксигенации и переходе к анаэробному метаболизму,
при смещении КДО влево и затруднении отдачи кислорода в тканях, а также
при существенном преобладании доставки 02 над потребностью в нем. Это воз¬
можно при следующих ситуациях:
• синдроме периферического артериовенозного шунтирования;
1 гипотермии и/или глубокой анестезии;
• смещении КДО влево;
• гипердинамическом состоянии кровообращения.
Лактат крови. Тяжелая степень клеточной гипоксии смещает аэробный мета¬
болизм в сторону анаэробного, что сопровождается усиленной продукцией молоч¬
ной кислоты. В большинстве случаев повышение концентрации лактата в крови
становится следствием сниженного кровоснабжения, нарушений артериальной
доставки кислорода или комбинации этих факторов.
Нормальные значения лактата плазмы артериальной крови (cLac) у взрослых
составляют 0,5-1,4 ммоль/л, или 4,5-14,4 мг%. Высокие значения cLac обычно
свидетельствуют о плохом прогнозе. На рис. 16-1 показана зависимость между
концентрацией лактата и вероятностью циркуляторной гипоксии, полученная
У кардиохирургических больных.
После значений cLac, составляющих 4 ммоль/л, вероятность циркуляторной
гипоксии достигает 100%. Данный клинический синдром сопровождается высокой
летальностью, что свидетельствует о неблагоприятном прогнозе.
Зависимость между вероятностью летального исхода исследована в нескольких
работах. Авторы показали, что при значениях cLac более 8 ммоль/л летальность
превышает 80%.
Опыт показывает, что в ряде клинических ситуаций благоприятный исход
может наблюдаться даже при очень высоких значениях cLac, если они под влия¬
нием лечения быстро снижаются. С другой стороны, длительно регистрируемое
Умеренное повышение значений лактата свидетельствует о неадекватности тера-
°ии и может предвещать неблагоприятный исход. Невысокие концентрации cLac
ГЛАВА 16
КЛИНИЧЕСКАЯ ТПИЮЖЯИОЛОГИЙ
Рж. 16-1. Зависимость между концентрацией лактата в артериальной крови и вероятностью
циркуляторной гипоксии (Р)
возможны при выраженных нарушениях микроциркуляции ввиду низкой скоро¬
сти его вымывания из тканей. В этой связи рекомендуют оценивать не абсолютные
значения данного показателя, а его динамику. Высокие концентрации cLac могут
наблюдаться при гипергликемии, после эпилептического припадка или физиче¬
ских упражнений, поэтому рассматривать его необходимо в комплексе с другими
показателями, учитывая конкретную клиническую ситуацию.
Таким образом, оценку состояния системы кровообращения при инфузионно-
трансфузионной терапии целесообразно проводить с учетом вышеперечисленных
детерминант артериального транспорта кислорода. Наиболее значимой и опера¬
тивно управляемой из них служит сердечный выброс, т.е. количество крови, посту¬
пающей в аорту или в легочную артерию в единицу времени. Именно поэтому
методы его измерения, применяемые у пациентов отделений реанимации и интен¬
сивной терапии, представлены в следующем разделе.
Оценка гемодинамики
СЕРДЕЧНЫЙ ВЫБРОС
Известно большое количество методов измерения сердечного выброса, однако
немногие из них нашли применение у пациентов отделений реанимации и интенсив¬
ной терапии. Специфика этой категории пациентов требует использования методов,
позволяющих определять СВ в режиме мониторного наблюдения. Прежде всего
это подразумевает возможность многократного его измерения в течение коротких
промежутков времени. До сих пор не предложен метод, сочетающий достаточную
достоверность получаемых результатов с минимальной инвазивностью.
Несмотря на обилие методов определения СВ, каждый из них обладает рядом
отрицательных характеристик, в некоторых случаях ограничивающих возможно¬
сти его использования у реанимационных больных.
Термодилюциониые методы
Метод термодилюции с использованием катетера Свана-Ганса. Принцип
определения СВ с помощью изотонического индикатора, температура которого отли¬
чается от таковой крови, разработали W. Lochner (1953) и G. Fegler (1954). Широкої
распространение метод получил после изобретения W. Swan и R. Ganz многопросвгт
ных катетеров с баллоном на конце и встроенным термистором (1972).
ЙНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ |П
3
«,16-2- Катетер Свана-Ганса: 1 — канал дистального входа; 2 — канал проксимального входа:
y^gХОд канала, предназначенный для раздувания баллона; 4 — разъем термистора
В настоящее время существует множество модификаций катетера Свана-Ганса.
Классическая конструкция катетера представлена на рис. 16-2. Катетер имеет три
входа. Канал дистального входа заканчивается на конце катетера и предназна¬
чен для регистрации легочного капиллярного давления и определения давления
крови во время проведения катетера в легочную артерию. Канал проксимального
входа при установке катетера в позицию измерения СВ заканчивается на уровне
правого предсердия. Он служит для введения индикатора, а в перерывах между
измерениями СВ — для регистрации давления в правом предсердии или инфузий.
Вход канала, предназначенный для раздувания баллона, расположен на конце
катетера и снабжен краником, его закрытие препятствует обратному току воздуха.
Благодаря воздушному баллону облегчается продвижение катетера по камерам
сердца (катетер называют плавающим), а также снижается риск перфорации сте¬
нок сердца. Кроме того, при раздувании баллона после проведения катетера в одну
из ветвей легочной артерии происходит ее заклинивание, что позволяет измерить
легочное капиллярное давление. Данный параметр называют давлением заклини¬
вания легочной артерии (ДЗЛА). Катетер имеет встроенный термистор, его конец
находится в нескольких миллиметрах дистальнеє баллона. Разъем термистора
предназначен для соединения его с термодилюционным блоком прикроватного
монитора или регистратора (термодилютора).
Катетер проводят в легочную артерию через специальную канюлю (интро-
дьюсер), введенную в одну из центральных вен (внутреннюю яремную, подклю¬
чичную или бедренную). В исключительных случаях используют плечевую вену
или выполняют венесекцию одной из подкожных вен верхних конечностей.
Перед введением дистальный и проксимальный просветы катетера заполняют
промывочным раствором (5000 ЕД гепарина на 500 мл 0,9% раствора натрия хло¬
рида) и присоединяют к тензометрическим датчикам. Затем проверяют герметич¬
ность воздушного баллона. Для этого баллон помещают в стерильный сосуд с 0,9%
раствором натрия хлорида и в воздушный канал катетера вводят 1-2 мл воздуха.
Поступление пузырьков воздуха из баллона свидетельствует о его негерметично-
яи и требует замены катетера.
После введения положение дистального конца катетера в вене определяют
00 форме кривой давления, отображаемой на экране прикроватного монитора
Или регистратора. Для облегчения прохождения катетера по сосудам в воздушный
мллон вводят 1-2 мл воздуха. По мере прохождения катетера по камерам сердца
(правому предсердию и правому желудочку) и легочной артерии форма кривой
Явления и его значения меняются (рис. 16-3).
После попадания катетера в ствол легочной артерии баллон сдувают. В дан¬
ії позиции проводят измерение сердечного выброса. Для этого в проксималь-
Ньм просвет катетера вводят тест-раствор, а кривая терморазведения отображается
И'или обрабатывается с помощью термодилюционного блока или термодилютора
Ut «яинмярии ттктжпспт
(рмс 16-4). йля ЖМЬШГКИЯ ТОЧНОСТИ определения сердечного выброса Целег
ЯИМамткя специальными системами с предусмотренным измерением т^^Рлзнг,
жт-распора » емкости, гае он находится, или в месте соединения шприївс^Ь
имьмым входом катетера. Для этого используют дополнительный термодат^*0^1»
RA RV РА PAW
Риє. 1И Динамика давления по мере прохождения катетера Свана-Ганса. RA — правое предсер-
до В правый желудочек; РА — легочная артерия; PAW давление заклинивания в легочной
фпрм
ЩЯрЩЗакрытая система для измерения сердечного выброса при комнатной температур
рктпра. ^игыеая вариабельность антропометрических характеристик больных, получ
величину сердечного выброса целесообразно соотносить с поверхностью тепа обследу
ориентируясь на значения сердечного индекса (СИ)
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях $49
регисгрвхши ДЗЛА в воздушный просвет катетера вводят 1*2 мл воздуха
-ко продвигают вперед до появления характерной кривой. После измерения
«С^ушный баллон сдувают, а катетер подтягивают до уровня ствола легоч-
'мотер*1*- , _
gicTOdiaec время выпускаются модификации катетера Свана-Ганса с дополни-
® ^ функцией непрерывного определения насыщения кислородом смешанной
крови (Sv02), а также системы для вычисления фракции изгнания правого
%дочка сердца и непрерывного определения сердечного выброса (ССО). Катетер
000 снабжен дополнительной спиралью, расположенной между термистором
'^душным баллоном. Принцип определения СВ основан на измерении энергии,
•родимой для поддержания температуры спирали на 1 "С выше температуры
измеряемой термистором катетера. Величина этой энергии пропорциональна
Зоиной скорости кровотока, т.е. сердечному выбросу. Первоначально определяют
доое значение СВ с помощью инъекции индикатора, а в дальнейшем его величи-
окисляют на основе вышеуказанного принципа.
^осложнения, связанные с использованием катетера Свана-Ганса В лите-
-гіум описан ряд серьезных осложнений, полученных при катетеризации легоч-
чой артерии с помощью катетера Свана-Ганса. Среди них:
• поражение сонных и подключичных артерий;
« пневмоторакс;
• нарушения ритма сердца — желудочковая экстрасистолия, фибрилляция
желудочков;
• перфорация стенки предсердия или желудочка сердца;
• тампонада сердца;
» разрыв баллона и воздушная эмболия;
t поражение трехстворчатого клапана или клапанов легочной артерии;
• разрыв легочной артерии;
• завязывание катетера, находящегося в полости сердца, в узел;
• отрыв части катетера и катетерная эмболия;
• тромбирование просвета катетера и тромбоэмболия легочной артерии;
1 эндокардит и катетерный сепсис.
В исследовании А.Ф. Коннорс и соавт. (1996) при анализе результатов лечения
2184 пациентов отделения интенсивной терапии было обнаружено, что при срав¬
нимой тяжести состояния в группе больных, которым устанавливали катетер
Свана-Ганса, летальность была выше на 24%.
Вышеперечисленные факты настраивают некоторых авторов на весьма скепти¬
ческий лад в отношении данной процедуры. Существует мнение о необходимости
поставить вопрос перед FDA о запрете на использование катетеров Свана-Ганса
до контролируемых рандомизированных клинических исследований.
Более высокую летальность среди пациентов, у которых использовали катетер
Свана-Ганса, видимо, можно объяснить тем, что обычно его устанавливают наи¬
более тяжелым больным.
Многолетний опыт использования катетера Свана-Ганса в отделении реани¬
мации РНЦХ РАМН показал, что при соблюдении правил постановки и ухода
й катетером вышеперечисленные осложнения встречаются не так часто. Не оста¬
навливаясь на осложнениях, присущих любой процедуре катетеризации цен¬
тральных вен, хотелось бы сказать о том, что за двадцатипятилетний период
использования данных катетеров более чем у 2000 больных наблюдали лишь три
случая завязывания катетера в узел и ни одного случая перфорации стенок серд-
М. эмболии воздухом или тромбоэмболии. Появление нарушений ритма сердца
“■редко представляет серьезную проблему, особенно у пациентов с ишемической
болезнью сердца. В этой связи во время катетеризации необходимо иметь шприц
с раствором лидокаина. при необходимости препарат вводят непосредственно
550 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
tono* «о просветов катетера. У пациентов с чувствительным миокардом от
ркзацни правых отделов сердца лучше отказаться и использовать альтеон КаТеть
методы оценки производительности сердца. Многие осложнения могут быГИВИЬ|*
заны с повторным использованием катетеров, что недопустимо. 1Ть Свя-
Несмотря на справедливость критического отношения к определению гп
модилюционным методом при катетеризации правых отделов сердца л ^
метод наиболее информативный и достоверный. Именно поэтому в иасте
время он относится к наиболее распространенным в практике отделений реан^
ции и интенсивной терапии. 1Ма’
Помимо определения величины сердечного выброса, с помощью катет
Свана-Ганса можно получить большой объем важной информации. Измеряв*^
с его помощью среднее давление в правом предсердии соответствует конечн*
диастолическому давлению (КДД) в правом желудочке и отражает его предка
грузку. Давление в легочной артерии отражает состояние малого круга кровообоа
щения. Среднее давление заклинивания в легочной артерии соответствует КДЛ
левого желудочка и отражает преднагрузку левого желудочка сердца. Насыщен^
(БД) и парциальное напряжение (Pv02) кислорода в смешанной венозной крови
взятой из ствола легочной артерии, отражают эффективность кислородтранспорт-
ной функции кровообращения.
Вместе с тем предложены альтернативные способы определения СВ. Продол¬
жаются работы по созданию менее инвазивных методик, удобных для применения
у пациентов, находящихся в критическом состоянии.
Метод артериальной термодилюции. Работы, посвященные методу артери¬
альной термодилюции, основываются на недостатках метода терморазведения,
выполняемого посредством катетеризации легочной артерии. Помимо осложне¬
ний, связанных с этой процедурой, их авторы указывают на возможность полу¬
чения недостоверных результатов измерения СВ. В частности, Т. Jullien и соавт.
(1995), используя контрастную эхокардиографию и допплерографию, показали,
что ИВЛ может приводить к выраженной недостаточности трехстворчатого кла¬
пана и возникающий при этом обратный ток крови существенно искажает резуль¬
таты измерения СВ.
При аппаратном дыхании положительное давление в грудной клетке во время
вдоха также может сказываться на результатах измерения СВ, его величина зави¬
сит от того, в какую фазу дыхательного цикла проводят инъекцию индикатора.
Метод артериальной термодилюции основан на анализе изменений температуры
артериальной крови. Индикатор (охлажденный 0,9% раствор натрия хлорида) вводят
в центральный венозный катетер, а кривую терморазведения регистрируют с помо¬
щью термодилюционного катетера, введенного в бедренную или плечевую артерию.
Метод артериальной термодилюции можно применять в режиме непрерывного
измерения СВ. При этом, в отличие от доступа через легочную артерию, нет необ¬
ходимости в использовании специального дорогостоящего катетера. После изме¬
рения СВ методом артериальной термодилюции полученные значения ударного
выброса принимают за базовый уровень. В дальнейшем значения СВ вычисляют
исходя из результатов математической обработки кривой артериального давле¬
ния и базового значения У В. В исследовании A. Perel (1998) при сопоставлении
результатов, полученных на основе непрерывного измерения СВ, с термодилюци-
онным методом коэффициент линейной корреляции составил 0,95.
Несмотря на справедливость замечаний авторов метода артериальной термоди*
люции, вряд ли его можно признать менее инвазивным, чем термодилюциониыи
метод, осуществляемый с помощью установки катетера Свана-Ганса. В этой связи
оба метода применимы у наиболее тяжелой категории пациентов, требующи >
помимо инфузионно-трансфузионной терапии, применения вазоактивных и кар
диатонических препаратов.
ИНФУЗИиМПи-1 ГАПЬФУОИиппди I Crftl ІИИ ІІгИ КгИIИЧЬиКИХ СОСТОЯНИЯХ ЭЭ1
,йГОд фмка і
1 д разработал и описал А. Фик в 1870 г., в качестве индикатора он пред-
использовать кислород. Для определения величины СВ измеряют коли-
1°*^ кислорода, поглощаемого из воздуха за определенный отрезок времени,
^временно берут пробы артериальной и смешанной венозной крови, взятой
0ДНсгья легочной артерии, и определяют в них содержание кислорода. При этом
Сходимо вычислить разницу в содержании кислорода в артериальной и веноз*
а крови, т.е. измерить количество кислорода, связываемое каждым кубическим
ТИМСТрО” КР0ВИ 80 вРемя ее прохождения через легкие. Сердечный выброс
I ^исляют по формуле:
СВ = П02/(С.02-С,02),
QB - сердечный выброс, л/мин (фактически количество крови, проходящей
щУ малый круг кровообращения); П02 — потребление кислорода, мл/мин,
гО - содержание кислорода в артериальной, a Cv02 - в венозной крови, мл/л.
Потребление кислорода определяют с помощью спирометра, а артериовеноз-
0) разницу по кислороду оценивают, анализируя содержание кислорода в одной
из магистральных артерий и легочной артерии.
Поскольку принцип Фика, как и любой из методов, основанных на разведе¬
нии индикатора, подразумевает его равномерное смешивание с кровью, на время
исследования необходимо соблюдение следующих условий:
| стабильное состояние дыхания и кровообращения в момент исследования;
І анализ содержания кислорода, который проводят только в смешанной веноз¬
ной крови, взятой из ствола легочной артерии, где сходятся все венозные
сосудистые пути;
I с помощью прямого принципа Фика нельзя определять СВ при внутрисер-
дечных сбросах крови, поскольку в данном случае часть крови минует малый
круг кровообращения.
Несмотря на то что прямой метод определения сердечного выброса по Фику —
одан из самых точных, в отделениях интенсивной терапии и реанимации его
применяют сравнительно редко. Это обусловлено необходимостью относительно
сложного и дорогостоящего оборудования для оценки потребления кислорода.
Вместе с тем в условиях искусственной вентиляции легких эта задача облегчает¬
ся при использовании современных метаболических мониторов, позволяющих
определять содержание кислорода и углекислого газа в контуре вдоха и выдоха.
Величину V02 вычисляют, умножив разницу содержания кислорода на вдохе
и выдохе на величину минутного объема дыхания. В настоящее время существуют
аппараты ИВЛ со встроенным метаболическим монитором, помимо других пара¬
метров, в них осуществляется постоянное измерение V02.
Для получения смешанной венозной крови необходима катетеризация легочной
артерии. Связанные с этим проблемы описаны в разделе, посвященном методу тер¬
моразведения. Для этих целей можно использовать плавающий катетер с баллоном
на конце типа Pulmobal, но в клинической практике чаще используют термодилюци-
онные катетеры Свана-Ганса, которые отличаются от предыдущих наличием встро-
енного термистора. Поскольку при установке катетера в легочной артерии СВ проще
0Г1рсделить с помощью метода терморазведения, метод Фика может быть оставлен
и* случаев, когда отсутствует или неисправен регистратор (термодилютор).
**етод разведения электроимпедансных индикаторов
разведения электроимпедансных индикаторов разработали в РНЦХ
АМН Н.И. Кривицкий и В.В. Кислухин. Суть метода заключается в оценке гемо-
Намических показателей по кривым изменения электрического сопротивления
P08». получаемых в результате введения растворов, отличных от крови по своему
Вя ктттштшсатвтм
сопротивлению Введение индикаторов пс«ще
тто Фышхю или » ним капельной инфузии). регистреw
І помощью тонного биполярного игольчатого датчик Ич**е>>*ЧіцЧ
дгоеоаленного в просвет любой периферической артерии п«т**°
щтт м чРескЛ
Д*Я определения СВ последовательно болюсно ВВОДЯТ два ^
Ш электролит (0,9% раствор натрия хлорида) и Дизлектп°°ІМОТі4<іЄ(
глюкозы* > Объем вводимых растворов составляет 10-20 мл П/^Ик ^ Рас****
двго тест*агента проводят регистрацию кривой изменения ЭСК на н** ^
юаі самопис». Количественное значение СВ находят по формуле Двухк°ордин-3*
и» рю 16*1 •представ^-
Nc. 1I-S. Изменение электрического сопротивления артериальной крови в результате внутри-
В {югоосного введения изоосмотических растворов натрия хлорида и глюкозы: а—кривая
Мрвого прохождения 0.9% раствора натрия хлорида: б — кривая первого прохождения изоосмо-
щческото раствора глюкозы I — электрическое сопротивление крови, Ом; S и S — площади
Щр кривыми первого прохождения индикаторов, Ом/мин; Zf — электрическое сопротивление
изоосмотического раствора натрия хлорида. Ом; Va — объем раствора при болюсной инъекции
индикатора, мл. Стрелкой указан момент инъекции индикатора
Для оценки достоверности результатов исследования СВ данным методов
яылоднена серия одновременных определений этого показателя с применением
мггода Фика и термодилюцин. При сравнении с методом Фика получен коэффи¬
циент линейной корреляции: г = +0,96 (р <0.01).
При сопоставлении СВ. измеренного с применением метода разведения элех-
трокмпедансных индикаторов и термодилюцин, также обнаружена тесная корре¬
ляционная связь: r I +0.92 {р <0,01).
При изучении воспроизводимости метода разведения электронмпеданенш
■шмеатороа показано, что различия в измерениях в среднем не превышают 2.5%.
коэффициент корреляции составляет: г = +0.99 (р <0,001).
Таким образом, в проведенных исследованиях показано, что полученн
вивчення СВ сопоставимы с наиболее корректными методами (Фика и териодг
JBMDM). Определение СВ данным методом в рамках мониторно-компьютер
чиги^тдиннаи IHW ПР> КРИГМЧШШ СОСїШ 1Ш ЦЖ
_^00фв* за состоянием центральной гемодинамики и кислородмо-
П* функцией кровообращения позволяет бистро и своевременно
сяють нарушения производительности сердца и проводить ш меди-
^доаиую коррекцию
экспериментах по применению метода пошано, что он воаво-
измерить величину объема циркулирующей крови, определить наличие
авнность патологического шунтирования крови на уровне камер сердца
* —-тральных сосу до».
* іілШ «рост в исполнении, отличается малой инвазивноегыо, реализуется
^уррогой и доступной аппаратуре и позволяет проводить многократные
^драанйя в течение коротких промежутков времени. При вспомогательном
^обращении метод дает возможность раздельно оценить производительность
^веяного сердца пациента и аппарата,
дедеяемае сердечного выброса методой разведения индикатора с поиощыо
^дозвукового флоуметра
а л994 г. Н.М. Кривицкий предложил способ измерения СВ методом разведения
0)Р«дтора при измерении ультразвуковой плотности крови во время экггракор-
тральной детоксикации. Определение СВ основано на регистрации изменения
ддмути ультразвуковой волны в крови в ответ на болюсную инъекцию опреде-
;]й)Ного объема жидкости (0,9% раствора натрия хлорида). При измерении СВ
ю время использования аппарата для экстракорпоральной детоксикации ультра'
луковой флоуметрический датчик помешают на проксимальный по отношению
/артериальному конец гемодиализной магистрали. При отсутствии аппарата
ря экстракорпоральной циркуляции канюли, предварительно установленные
i лучевую артерию и подкожную вену той же конечности, соединяют катетером
длиной 20-40 см. На проксимальный по отношению к артериальной канюле уча¬
сток помещают накидной датчик ультразвукового флоуметра.
Схема измерения СВ показана на рис. 16-6. Измеряют скорость кровотока,
что в реальном времени отражается в линейном виде на мониторе компьютера.
Перед началом исследования проводят калибровочную инъекцию 1 мл 0.9%
раствора натрия хлорида с температурой, близкой к температуре тела, в прокат-
мольный участок системы (перед датчиком). Проходя через область датчика, эта
порция индикатора дает кривую разведения площадью Su(. Затем в центральную
вену вводят индикатор (0,9% раствора натрия хлорида - 20 мл), при прохожде¬
ния через область датчика он дает кривую изменения УЗ-плотности крови. Ее пдо-
щь фиксируется как S^. Поскольку скорость кровотока, площадь под кривыми
вобьем калибровочной кривой известны, СВ рассчитывают по формуле:
CB^Qx^/VJx^/SJ.
wQ- величина потока, измеренного УЗ-датчиком: Viw — объем инъекции. \’ыл -
объем калибровочной инъекции: S — площадь под калибровочной кривой: Sw —
к®вщь под кривой первого прохождения индикатора. При расчете площадей
кривыми используют методы линейной экстраполяции.
В экспериментальных исследованиях на животных величина СВ колебалась
*0,7 до 3,5 л/мин. При сравнении с методом термодилюции коэффициент лнней-
корреляции составил 0.98.
Ирм измерении СВ у пациентов во время сеансов экстракорпоральной детокси-
его значения колебались в пределах от 2 до 8 л мин. Коэффициент л иней-
корреляции в сравнении с термодил юционным методом составил 0,97.
клиническом испытании у пациентов с использованием временного арте-
^®*енозного шунта разброс величин СВ колебался от 3.0 до 9.1 л/мин. При этом
*азНиииент корреляции с термодил юционным методом составил 0.97.
ц4 НН£§и| гркысфузиология
Рис. 18-Л Схема определения сердечного выброса методом индикаторной ультразвуковой флоу.
метрии
Таким образом, были проведены три серии исследований по сопоставлению
результатов измерения СВ методом ультразвуковой индикаторной флоуметрии
с методом терморазведения.
Наиболее просто определять СВ вышеописанным методом при сеансах экс¬
тракорпоральной детоксикации с подключением аппарата через артериовеноз-
ный шунт. Оценка производительности сердца у пациентов отделений реанима¬
ции и интенсивной терапии во время таких процедур имеет большое значение,
поскольку проводить их нередко приходится на фоне нестабильной гемодинами¬
ки, инфузии кардиотоников и вазопрессоров.
В эксперименте на животных и в клинической практике была доказана воз¬
можность использования индикаторного метода разведения УЗ-плотности крови
для определения СВ без применения аппарата для экстракорпоральной цирку¬
ляции крови. Предложенный способ не требует дополнительных инвазивных
вмешательств у пациентов отделения интенсивной терапии кардиохирургиче¬
ского профиля, поскольку установка артериальной и венозной канюль у них -
обязательная процедура. Ультразвуковой флоуметрический датчик устанавли¬
вают на пластиковую трубку, соединяющую артериальную и венозную канюли.
Поскольку кровоток по ней пускают только на момент исследования СВ, осталь¬
ное время она может быть выключена из кровотока и заполнена физиологиче¬
ским раствором. При этом артериальную канюлю используют для мониторинга
АД, а венозную - для инъекций и инфузий. Потенциальная возможность тром-
бирования шунта может быть снижена при использовании трубок с внутренним
антикоагулянтным покрытием.
Немаловажное значение имеет доступность аппаратуры и индикаторов. Метод
ультразвуковой флоуметрии в настоящее время широко используют в хирургии
сосудов, он позволяет с высокой точностью определять величину кровотока
по сосудам, особенно малого диаметра. Его также можно применять для опреде¬
ляли производительности аппарата искусственного кровообращения, аппара¬
тов для экстракорпоральной детоксикации, вспомогательного кровообращения,
а при введении индикатора (0,9% раствора натрия хлорида) — для оценки Сс
как во время данных процедур, так и при отсутствии системы для активной экс
тракорпоральной циркуляции.
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ критических состояниях 555
в|Р!3*еденія красителя
W ^йоллииа КПЯГИТРЛ
я разведения красителя основан на внутривенном введении красителя и ре-
ции в артериальной крови изменения его концентрации во времени. Для опре-
сердечного выброса чаще применяют такие красители, как Т-1824 (эванс
*■**) метиленовый синий или кардиогрин.
< иту ряда причин в настоящее время красители не находят широкого при*
кия в практике отделений реанимации и интенсивной терапии. Прежде всего
^непригодны для частых и многократных измерений. Кроме того, общепри-
°нИ меТодика регистрации кривой первого прохождения индикатора с помощью
**L>ro датчика неприменима в условиях спазма периферических сосудов, часто
^щегося у пациентов в критическом состоянии. Повторные исследования
^пользованием Т-1824 влияют на показатель насыщения гемоглобина крови
С слородом. В редких случаях встречаются публикации, в которых описано
^пользование кардиогрина, с оценкой его количества в магистральной артерии
j с помощью пульсового фотометрического метода.
1 О заключение следует отметить, что выбор метода определения сердечного
броса зависит от возможностей отделения реанимации и интенсивной терапии.
Особенностей патологического процесса и тяжести гемодинамических нарушений,
наблюдаемых у пациента. В большинстве случаев при возникновении синдрома
шока, требующего прецизионной оценки центральной гемодинамики и кислород-
тоанспортной функции, при сложном выборе лечебных воздействий и трудностях
оценке их эффективности предпочтение отдают методу термодилюцин с исполь¬
зованием катетера Свана-Ганса.
Измерение артериального давления
Неинвазивное измерение артериального давления приемлемо у большинства
пациентов, поскольку у многих из них нет необходимости в постоянной оценке
гемодинамики. Непрямое измерение АД можно осуществлять на основе аускуль¬
тативного, осциллометрического и допплеровского методов. Кроме того, в настоя¬
щее время неинвазивное измерение АД проводят на основе фотоплетизмографи-
ческого метода.
МЕТОД КОРОТКОВА
Метод Короткова, основанный на аускультации. — наиболее часто исполь¬
зуемый способ неинвазивного измерения АД. При правильном применении он
позволяет довольно точно определять АД у больных со стабильной гемодинами¬
кой. Известно, что аускультативный метод дает неточные результаты у пациентов
с высоким общим периферическим сосудистым сопротивлением, отмечаемым
при синдроме шока или же при использовании сосудосуживающих препаратов.
Несмотря на то что отмечена корреляция между данными, получаемыми с помо¬
щью аускультативного метода и прямого измерения АД при сниженном тонусе
периферических сосудов и гиповолемии, аускультативный метод считается непри¬
годным для измерения АД в связи с необходимостью постоянно контролировать
его у нестабильного больного.
автоматическое неинвазивное измерение артериального давления
Устройства для автоматического неинвазивного измерения АД приобрели
большую популярность благодаря относительно небольшой стоимости, точности
Прения АД и возможности многократного и частого использования.
Осциллометрия — метод непрямого определения АД, базирующийся на изме-
ір манометрических осцилляций, вызванных пульсацией артерий во время
Звания манжеты. Манжету надувают и сдувают с помощью специального насоса,
$51 КЯМЖХМТМНДОЭИОЛОГИЯ
помешенного в блок монитора или автоматический тонометр. Манжета т.
с манометром, после создания в ней давления, превышающего сие-m
ее постепенно сдувают. При первом появлении пульсирующих волн^^Ч
жпй на манометре появляются осцилляторные колебания, соответст*!
ОЕТодаческому АД. По мере сдувания манжеты амплитуда осцилляций^1
Н до максимальной, что соответствует прямому измерению среди,!****'
Диастолическое АД определяют при исчезновении осцилляций. его Ад_
Для измерения системного АД используют также допплеровский метод
Цмншровский датчик помещают над артерией. Датчик излучает зв
Мши и воспринимает их после того, как они отражаются от стенки сосудз^0ВЬ1е
проводят частотный анализ отраженной волны, на основании чего можно ^
0 движении стенки сосуда или кровотоке В нем. І
При использовании манжеты можно с приемлемой точностью определ
систолическое и диастолическое АД. Недостатки метода связаны с различн"*^
помехами, которые могут быть вызваны движениями пациента или перемещен**"1
датчика.
Метод фотоплетизмографии позволяет осуществлять непрямое измерение АП
благодаря пальцевой манжете, содержащей источник инфракрасного излучен
1 фотометрический датчик. <н
Объем кровотока мониторируют путем анализа отраженных инфракрасных
лучей. Давление в манжете повышают до тех пор, пока наружное давление, окру¬
жающее палец, позволяет поддерживать постоянный кровоток. Это наружное
давление эквивалентно среднему АД. Поскольку устройство позволяет измерять
давление при каждом сердечном цикле, существует возможность постоянного
измерения систолического и диастолического АД. Вместе с тем следует учитывать
что при периферической вазоконстрикции могут быть получены неточные резуль¬
таты.
В сравнительных исследованиях аускультативного и осциллометрического
методов с инвазивным продемонстрированы различные результаты.
У взрослых пациентов со стабильной гемодинамикой неинвазивные методики
могут завышать систолическое и занижать диастолическое АД до 15% в сравнении
с одновременным прямым измерением.
Среди всех неинвазивных способов наиболее точно можно измерить систоли¬
ческое АД с помощью осциллометрического метода. При непрямом измерении
систолического АД возможны погрешности, зависящие от величины манжеты,
а также используемого при этом мониторного оборудования. Кроме того, к допол¬
нительным факторам, приводящим к ошибкам измерения, относят скорость сдува¬
ния манжеты, ее размер и позицию на руке, объем конечности, смещение датчика
и анатомические вариации артерий.
Частое надувание манжеты может привести к трофическим нарушениям на коже
и поражению локтевого нерва. При неинвазивном измерении АД возможны ошиб¬
ки, связанные с нарушением ритма сердца. Кроме того, понижение эластичности
артериальной стенки, наблюдаемое при выраженном атеросклерозе, может приво¬
дить к нарушению окклюзии артерии при надувании манжеты, в результате чего
измеренное неинвазивно АД оказывается выше измеренного с помощью артери¬
ального катетера. Несмотря на вышеизложенное, автоматическое неинвазивное
измерение АД является эффективным методом мониторирования у относительно
стабильного пациента, не требующего частого измерения АД в течение коротких
промежутков времени.
При неустойчивой гемодинамике непрямые методы определения давления
являются менее точными, поскольку требуют определенных затрат времени
на измерение, кроме того, с их помощью нельзя проводить частые измерения.
Аускультативный метод существенно завышает систолическое АД. а осцидлом
ИНФУЗМОНИО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ 557
_кий и допплеровский методы несостоятельны у нестабильных пациентов,
^^ированных пациентов ошибки непрямого измерения могут превышать
У больных, которым осуществляют введение вазоактивных препарз-
Ф ^^соответствия могут достигать еще больших величин.
Показаниями к прямому измерению АД являются нестабильная гемодинамика.
.Жженная вазоконстрикция периферических сосудов, введение вазоактивных
’Паратов. Кроме того, эту методику применяют у больных, чье состояние тре-
постоянного измерения АД. Установка артериального катетера или канюли
азана также при необходимости частого забора проб для анализов артериаль¬
ной кр°ви.
ИНВАЗИВНОЕ (ПРЯМОЕ) ИЗМЕРЕНИЕ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
при ведении тяжелых больных, а также пациентов с нестабильной гемоди-
микой для оценки состояния сердечно-сосудистой системы и эффективности
„Хйпевтических воздействий возникает необходимость в постоянной регистрации
Нединамических параметров.
Прямое измерение артериального давления осуществляют через катетер или
анюлю, введенную в просвет артерии. Прямой доступ используют как для
непрерывной регистрации АД, так и для забора крови на анализ газового состава
н кислотно-основного состояния. Показаниями к катетеризации артерии служат
нестабильное АД и инфузия вазоактивных препаратов.
Наиболее распространенными доступами для введения артериального катетера
являются лучевая и бедренная артерии. Значительно реже используют плечевую,
подмышечную или артерии стопы. При выборе доступа учитывают следующие
факторы:
I соответствие диаметра артерии таковому канюли;
I место катетеризации, которое должно быть доступным и свободным от попа¬
дания на него секретов организма;
• конечность дистальнеє места введения катетера должна иметь достаточный
коллатеральный кровоток, поскольку всегда существует вероятность окклю¬
зии артерии.
Чаще всего используют лучевую артерию, поскольку она имеет поверхностное
расположение и легко пальпируется. Кроме того, ее канюляция связана с наимень¬
шим ограничением подвижности пациента.
Во избежание осложнений предпочтительно пользоваться не артериальными
катетерами, а артериальными канюлями.
Перед канюляцией лучевой артерии проводят пробу Аллена (рис. 16-7). Для
этого пережимают лучевую и локтевую артерии. Затем пациента просят несколько
раз сжать и разжать кулак до побледнения кисти. Локтевую артерию освобождают
и наблюдают за восстановлением цвета кисти. Если происходит восстановление в
течение 5-7 с, кровоток по локтевой артерии считают адекватным. Время, состав¬
ляющее от 7 до 15 с, свидетельствует о нарушении кровообращения по локтевой
артерии. Если цвет конечности восстанавливается более чем через 15 с, от канюля-
шш лучевой артерии отказываются.
Канюляцию артерии выполняют в стерильных условиях. Предварительно
заполняют раствором систему для измерения АД и калибруют тензометрический
Датчик. Для заполнения и промывки системы пользуются 0,9% раствором натрия
хлорида с добавлением 5000 ЕД гепарина.
Мониторинг инвазивного АД обеспечивает непрерывное измерение этого
параметра в режиме реального времени, но при интерпретации получаемой
^формации возможны ограничения и погрешности. Прежде всего форма кривой
начального давления, полученная в периферической артерии, не всегда точно
сражает таковую в аорте и других магистральных сосудах. На форму кривой АД
до КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
У
1 б
Рис. 18-7. Проба Аллена: а — пережатие лучевой и локтевой артерий; б — пережатие лучевой
артерии; 1 — место пережатия на предплечье, 2 — локтевая артерия, 3 — лучевая артерия, 4-
ладонная дуга
влияют инотропная функция левого желудочка, сопротивление | аорте й пери¬
ферических сосудах и характеристики системы для мониторирования Сама
монлторная система может вызывать различные артефакты, в результате чего
меняется форма кривой артериального давления. Правильная интерпретация
информаций, получаемой с помощью инвазивного мониторинга, требует опреде¬
ленного опыта, и прежде всего следует указать на необходимость распознавания
недостоверных данных. Это имеет большое значение, поскольку неверный анализ
и ошибочная интерпретация получаемых данных могут приводить к неправиль¬
ным врачебным решениям.
Оборудование для прямого измерения артериального давления
Система для инвазивного мониторинга артериального давления обычно состо¬
ит из гидравлической системы, заполняемой жидкостью, жидкостно-мёханиче-
ского интерфейса, трансдьюсера и электронного оборудования, включающего
усилитель, монитор, осциллоскоп и записывающее устройство (рис. 16-8).
Гидравлическая часть мониторной системы состоит из катетера (или канюля),
соединительной трубки, краников, устройства для промывки катетер! и головки
трансдьюсера. Обычно применяют тефлоновые или полиуретановые внутриар*
термальные катетеры или канюли. Несмотря на то что короткие широкопросвет-
ные катетеры обеспечивают максимально точное' отображение физиологических
характеристик, в настоящее время предпочитают использовать короткие катетеры
небольшого диаметра, поскольку это значительно снижает вероятность тромбоза
сосуда. Коннектор, соединяющий катетер и трансдьюсер, не должен быть длиннее
1 м. Краник присоединяют непосредственно к катетеру и используют для забора j
проб крови. Еще один краник устанавливают на головку трансдьюсера для того, j
чтобы выставлять нулевой уровень давления. Система для промывки, в которой
создается давление до 300 мм рт.ст., обеспечивает постоянную инфузию гепарини* і
зирован ного изотонического раствора натрия хлорида со скоростью от 1 до 3 мл/4
Щ обеспечения проходимости системы и снижения риска тромбоза.
Изменения внутрисосудистого давления передаются через заполненную *яд
костью соединительную трубку на мембрану трансдьюсера, где механически*-
колебания преобразуются в электрический сигнал, пропорциональный измени
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЮ $§0
Рис. 18-8. Система для прямого измерения артериального давления: 1 — прикроватный монитор;
£-'тензометриче'ский датчик с системой для соединения с артериальной канюлей
нию давления. Сигнал усиливается и фильтруется для удаления высокочастотных
помех. Кривая давления отображается на дисплее монитора, где представлена
графическая и цифровая информация. Калиброванная бумага, используемая в пи¬
шущем устройстве, позволяет проверять данные, отображающиеся на экране при¬
кроватного монитора. Точность измерения АД зависит от характеристик всей
системы, прежде всего от ее способности к передаче физиологического сигнала.
Поскольку гидравлическая составляющая системы может быть источником оши¬
бок (ввиду инерции при колебаниях столба жидкости), она становится одним из
слабых компонентов в мониторной системе.
Большое значение имеют частотные характеристики мониторной системы,
а именно ее электронной части, поскольку частота работы нормальной сердечно¬
сосудистой системы колеблется от 60 до 180 циклов в минуту или составляет
Н Гц. Следовательно, мониторная система для измерения артериального дав¬
ления должна иметь флотирующую частоту, составляющую по меньшей мере
я 5 до 20 Гц, что позволяет обеспечить точное отображение сигнала. Любая
система, заполненная жидкостью, имеет тенденцию к вибрации (или осцилля¬
ции) и, кроме того, каждая из них имеет так называемую резонансную частоту.
Физиологические частоты сосудистой системы могут достигать 10-15 Гц. следо-
мтельно, мониторная система должна иметь резонансную частоту, превышаю-
■ЧУЮ15, а лучше 25 Гц. К сожалению, резонансная частота трубок, заполненных
иидкостью, колеблется от 5 до 20 Гц, следовательно, кривая частотного ответа
не всегДИ может соответствовать частотным характеристикам физиологического
ЯИИала, исходящего из сосудистой системы. В связи с этим возможно появление
артефактов при усилении сигнала, соответствующего систолическому давлению,
лебания столба жидкости в системе гасятся за счет сил трения, благодаря
Действию система приходит к нулевой отметке. Этот эффект также зависит
ш КЛИНИЧЕСКАЯ ТРАНС ФУЗИО/ЮГИЯ
1
or мзкогти и комплаенса системы и называется демпингом. Характеристи
пинга описываются демпинговым коэффициентом. Кй Де»,.
При нулевом значении коэффициента наблюдаются избыточные осцилл
колебания, в то время как при коэффициенте, достигающем единицы, подавТ°РНь,е
любые осцилляции, даже обусловленные резонансом. Теоретически оптима
демпинговый коэффициент находится в пределах от 0,6 до 0,7. Ньій
Ос новными характеристиками мониторной системы служат резонансна
оде и демпинговые показатели. Обычные мониторные системы, примени 430
в клинической практике, имеют резонансную частоту между ДО и 20 Гц
их нормальной работы требуется демпинговый коэффициент в пределаДЛя
0.5 до 0,7. В системах, имеющих резонансную частоту, составляющую 25*
возможен демпинговый коэффициент, достигающий 0,2-0,3. Для увеличе
частоты и оптимизации демпингового эффекта применяют короткие удли ИЯ
тельные трубки и небольшие тензометрические датчики, проводят тщательн**
удаление пузырьков воздуха и используют минимальное количество краник^
И мест для инъекций. Для точного измерения давления необходима калибров^
системы, и прежде всего нулевой точки. С этой целью краник на головке датчика
давления открывают в атмосферу, а сам тензометрический датчик помещают
Ц уровне правого предсердия (четвертое межреберье на уровне средней под¬
мышечной линии), после чего на мониторе нажимают кнопку калибровки нуля
Следует помнить, что после калибровки изменение уровня положения тензоме-
грического датчика влияет на получаемую величину давления. Если датчик нахо¬
дится ниже указанного уровня, получаемые величины давления будут завышен¬
ными, и наоборот. Положение самого катетера или канюли относительно сердца
не влияет на точность измерения давления. Калибровку нуля следует проводить
при любом изменении положения тела больного или значительных изменениях
артериального давления.
Тензометрический датчик необходимо периодически калибровать. Для этого
к нему присоединяют систему, заполненную водой, давление в которой известно.
Если получаемые на мониторе значения соответствуют данному давлению, значит,
тензометрический датчик показывает верные результаты.
Кривая артериального давления
Нормальная кривая артериального давления характеризуется быстрым
подъемом, выраженным дикротическим зубцом и четко выраженной конечно¬
диастолической частью (рис. 16-9). Первый острый зубец отражает быстрое изгна¬
ние крови из левого желудочка в аорту. Дикротический зубец отражает обратный
ток крови в аорте при закрытии аортального клапана. В этот момент давление
крови в аорте превышает таковое в левом желудочке.
Пик кривой соответствует систолическому давлению, которое в норме колеблет¬
ся от 90 до 140 мм рт.ст. Дикротический зубец отражает конец систолы и начало
диастолы левого желудочка. Нижняя точка кривой соответствует диастолическому
давлению, в норме оно составляет от 60 до 90 мм рт.ст. Среднее артериальное дав¬
ление используют для оценки кровоснабжения жизненно важных органов. В боль¬
шинстве прикроватных мониторов его величина определяется автоматически.
Нормальные значения среднего АД составляют от 70 до 105 мм рт.ст. Сглажива¬
ние или отсутствие характерных зубцов на кривой АД наблюдается при образова¬
нии тромба в просвете канюли, попадании воздуха в систему или при использова¬
нии удлинительных систем избыточной длины. На форму артериальной кривой
оказывают большое влияние место канюляции и канюлируемая артерия. Считают,
что канюляции лучевой, плечевой, бедренной артерий и тыльной артерии стопы
адекватно отражает величину центрального артериального давления, т.е. давления
• (Юрте. Однако эти предположения не всегда верны.
r
рис 16-9. Кривая артериального давления при прямом измерении: А — первый острый зубец; Б —
некротический зубец; С — конечно-дистальная часть кривой
При использовании плечевой артерии получают сигнал, достаточно точно отра¬
жающий кривую давления в аорте, но при канюляции лучевой артерии могут быть
получены результаты, на 10-15% превышающие получаемые в плечевой артерии.
И эти показатели могут быть выше, чем получаемые при катетеризации бедренной
артерии. Данные, получаемые при катетеризации тыльной артерии стопы, могут
быть на 20 мм выше, чем при использовании лучевой артерии. Данные, получае¬
мые в периферических артериях, могут быть выше, чем в центральных, что обу¬
словлено более высоким сопротивлением в них, поскольку калибр их меньше.
Таким образом, чем меньше диаметр канюлируемой артерии, тем более высокие
величины систолического и диастолического давления получают. Величина сред¬
него артериального давления подвержена меньшей зависимости от места каню¬
ляции, поскольку для его измерения проводят интегрирование области, находя¬
щейся под кривой давления, в результате периферическое среднее артериальное
давление соответствует полученному в центральных артериях и может служить
в качестве достаточно информативного показателя при определении терапевтиче¬
ской тактики.
Один из наиболее частых артефактов при записи кривой АД, наблюдаю¬
щийся в клинической практике, — систолический скачок. При измерении АД
в периферической артерии нередко может наблюдаться систолический пик, на
10-15 мм рт.ст. превышающий значение систолического АД в центральном сосу¬
де. Вместе с тем завышение АД на 20-40 мм рт.ст. часто наблюдается у больных
в течение первых 48 ч после операции на сердце и магистральных сосудах. Этот
феномен подобен наблюдаемому у больных с генерализованным или мультифо¬
кальным атеросклерозом. Кроме того, систолический спайк может наблюдаться
У пациентов с гипердинамическим состоянием кровообращения и при ЧСС более
120 в минуту. Наблюдаемые изменения могут являться суммой высокочастотного
компонента сигнала АД, резонансной частоты мониторной системы и/или особен¬
ностями сосудистого дерева пациента.
При гиповолемии и вазоконстрикции, когда контрактильность миокарда
Л нарушена, на кривой АД может наблюдаться значительное уширение ино-
тропного пика и части, характеризующей изгнание крови из левого желудочка
Как правило, такие изменения наблюдаются при регистрации АД в пери¬
ферических сосудах. Иногда высокие значения систолического пика на кривой,
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях 581
А
\
пнем І
512 КЛИНИЧЕСКАЯ ТИИНСФУЗЙОЛОГИЯ
получаемой в периферических сосудах, могут давать завышенные
Ж в этих случаях можно ошибочно поставить диагноз артериальной гип/ЛЬТЗтЧ
Ври одновременном измерении значения давления в аорте могут бьггьГЄНЗИи
іельно ниже. Неправильная интерпретация результатов в этих случаях ЗНа<1н‘
приводит к неправильной терапевтической тактике. Повышение инот ИН0Гі!а
пика может также наблюдаться при различных фармакологических воздейНого
Вазопрессоры могут приводить к увеличению систолического пика со знач Иях
иым снижением части кривой, отражающей перераспределение кровотока рТель'
В тивоположность этому вазодилататоры снижают систолический пик и vbp П^°
вают часть кривой, отражающей перераспределение кровотока. Важно оті!»!!
что подобные изменения, как правило, наблюдаются при регистрации дав!] ’
в периферических артериях. На кривых, полученных из центральных артепці"ЄНИя
встречаются крайне редко. ,0Ни
Важно отметить, что систолический пик и его увеличение не оказывают в
ния на величину среднего АД. Следовательно, в подобных ситуациях необхоли
ориентироваться на величину среднего артериального давления и меньше об М°
щать внимание на значения систолического АД.
Возможны обратные взаимоотношения периферического и центрального Ал
что наблюдалось непосредственно после операций, выполненных в условиях
искусственного кровообращения. В частности, наблюдали систолическое АЛ
которое было ниже центрального давления в аорте на 10-30 мм рт.ст. Авторы
объясняют данный феномен изменением сопротивления периферических сосудов
и рекомендуют ориентироваться на величину центрального давления, регистри¬
руемого в аорте.
На величину и форму АД при прямом его измерении могут также оказывать
влияние изменения внутриплеврального давления. В норме АД немного снижает¬
ся во время вдоха и увеличивается в фазу выдоха, что обусловлено изменениями
преднагрузки левого желудочка и синергизма работ левого и правого желудочков
сердца. Увеличение работы дыхания может влиять на данный механизм, и в этих
случаях иногда наблюдается парадоксальный пульс, как, например, при тампонаде
сердца или тяжелом приступе бронхиальной астмы. Вентиляция с положитель¬
ным давлением может увеличивать пульсовое давление, прежде всего у пациентов
с нарушением функции левого желудочка в связи с уменьшением его преднагруз¬
ки. В то же время у тех больных с гиповолемией, кому начинают искусственную
вентиляцию легких с положительным давлением, нередко наблюдается падение
систолического и диастолического АД. Следовательно, при искусственной венти¬
ляции легких существенное значение имеет оценка ее влияния на данные, получае¬
мые при мониторинге АД.
Осложнения катетеризации артерии
К непосредственным осложнениям катетеризации артерии относят инфекцион¬
ные осложнения, кровопотерю и нарушение кровообращения в конечности.
Инфекционные осложнения. Риск инфицирования снижается при соблюдении
стерильности при катетеризации и заборе проб крови, а также правил эксплуа¬
тации системы для измерения АД. Необходимо периодически осматривать место
введения катетера на наличие признаков инфекции. При перевязках, замене про¬
мывочного раствора и удлинителей, при заборе крови на анализы пользуются сте¬
рильными перчатками. Пробы крови берут через трехходовой краник, после чего
его промывают, а открытые порты закрывают стерильной заглушкой. Необходимо
избегать попадания воздуха и крови в систему.
Кровопотеря. При разъединении системы для прямого измерения АД возможна
значительная кровопотеря. Во избежание этого конечность с введенным катете¬
ром необходимо иммобилизовать. Части системы для измерения АД должны быть
надежно соединены между собой, и доступ к ним нужно оставлять свободным.
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ критических состояниях 583
отменив кровообращения в конечности. Во избежание этого осложнения сразу
^канюляции и не реже чем 1 раз в 8 ч исследуют цвет, чувствительность
1^иЖность конечности, в которую введен катетер. В случае появления симпто-
нарУшенИЯ кРовообРащения в конечности катетер или канюлю немедленно
ддДЯЮ1-
Центральное венозное давление
КГГОДИКА УСТАНОВКИ ЦЕНТРАЛЬНОГО ВЕНОЗНОГО КАТЕТЕРА
Катетер в центральную вену вводят в стерильных условиях, предварительно
/работав место инъекции. Врач пользуется стерильными халатом и перчатка-
2и маской и шапочкой. Так же одеваются ассистент и любой персонал, находя¬
тся в непосредственной близости от места введения катетера. Центральный
йнозный катетер вводят через вены предплечья, плечевую вену, внутреннюю
'наружную яремные вены, бедренную или подключичную. Дистальный конец
атетера устанавливают в верхней или нижней полой вене вблизи от правого
Предсердия. В некоторых случаях дистальный конец катетера может попасть
е правое предсердие. В этих случаях при использовании водного манометра
дія измерения ЦВД появляются ритмические колебания столба жидкости, соот-
5егствующие частоте сердечных сокращений пациента. Если используют мем¬
бранный тензометрический датчик, гемодинамическая форма кривой, отобра¬
жающейся на экране прикроватного монитора, меняется. В этих случаях катетер
извлекают на несколько сантиметров до достижения его нормальной позиции.
Необходимо пользоваться рентгеноконтрастными катетерами. После установки
положение дистального конца катетера проверяют с помощью рентгенограммы
органов грудной клетки.
ИЗМЕРЕНИЕ ЦЕНТРАЛЬНОГО ВЕНОЗНОГО ДАВЛЕНИЯ
Ислользование водного манометра
На рис. 16-10 показана система для измерения ЦВД. Манометр, имеющий трех¬
ходовой краник, устанавливают между промывочным раствором и центральным
венозным катетером. Перед измерением ЦВД манометр частично заполняют
раствором, при этом краник поворачивают таким образом, чтобы он соединял
линию обычного катетера с трубкой манометра, а линию, идущую к центральному
венозному катетеру, отключают. Для промывания катетера краник переключают
в позицию, соединяющую промывочную жидкость с внутривенным катетером,
отключая при этом манометр. Для измерения ЦВД краник устанавливают в пози¬
цию, при которой ЦВК сообщается с манометром.
При измерении ЦВД с помощью прикроватного монитора и тензометрическо-
го датчика пользуются тем же оборудованием, что и при измерении АД. В этом
случае за позицией катетера наблюдают по кривой давления, отображающейся
на экране прикроватного монитора. Там же получают и величины ЦВД.
Осложнения катетеризации описаны в параграфе «Сосудистые доступы для
срансфузиологических процедур».
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЯ ЦЕНТРАЛЬНОГО ВЕНОЗНОГО
ДАВЛЕНИЯ
ЦВД измеряют в сантиметрах водного столба или в миллиметрах ртутного
столба. Нормальными считают значения ЦВД, составляющие от 5 до 8 см водного
столба или от 0 до 6 мм рт.ст. Большое значение имеет мониторинг динамики ЦВД,
дольку он позволяет оценить не только функции сердечно-сосудистой системы,
І41 Реакцию на различные медикаментозные и лечебные воздействия.
Ш КЛИНИЧЕСКАЯ ГРАНСФУЗИО ЛОГ ИЯ
Система
для заполнения
смывочной жидкостью
СТО
у К больному
Рис. 16-10. Измерение центрального венозного давления с помощью тензометричещщ дат¬
чика
ЦВД отражает внутрисосудистый объем крови, объем крови в конце диастолы
правого желудочка и насосную функцию правого Желудочка. С большими ограни¬
чениями можно считать, что ЦВД отражает состояние функции левого желудочка
однако это верно только при отсутствии нарушений кровообращений малом
яруге.
Низкие значения ЦВД обычно свидетельствуют о гиповолемии и, как прі'іЩ
являются показанием для инфузии жидкости. При адекватном врспотнении^уь
обычно наблюдают повышение ЦВД.
При диуретической терапии, снижающей объем «нутрисосудистой жидкости,
также может наблюдаться понижение ЦВД. Низкие или пониженнщ раче¬
ния ЦВД могут быть связаны с вазодилатацией, наблюдающейся при сепсисе
или использовании вазодилататоров. В этих случаях говорят об отноштельной
гиповолемии, поскольку абсолютного дефицита ОЦК может и не быть. у
Высокие значения ЦВД бывают следствием многих причин.
Наиболее частые причины высокого ЦВД —, недостаточность правого желудоч¬
ка і ИВЛ, особенно с использованием положительного давления в конце выдоха
ИВЛ приводит к повышению внутригрудного давления, которое передается через
сосуды малого круга, правые отделы сердца на полые, вены. В ряде случаев увели¬
чение внутригрудного давления, обусловленное ИВЛ, приводит к. самостоятель¬
ным нарушениям функции правого желудочка.
Причинами повышения ЦВД могут быть увеличение центрального объема
крови и гиперволемия.
Высокие значения ЦВД могут наблюдаться при поражении правого желу-
дочка, вызванного инфарктом миокарда или при левожелудочковой сердечной
недостаточности. Повышение давления в легочной артерии (легочная гипер¬
тензия) может быть связано как с левожелудочковой недостаточностью.'***
и с органическим поражением сосудов малого крута, оно также проявляется
повышением ЦВД.
Необходимо понимать, что ЦВД не может служить самостоятельным диагно
стическим показателем, и обычно его рассматривают в комплексе с клиническим
данными, полученными при аускультации легких и сердца, измерении АД и " 1
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях 585
ЭКГ в 12 стандартных отведениях, рентгенографии органов грудной клет-
завй^кже при исследовании мочеотделения, показателей газового состава и КЩР
гчались случаи, когда пациенты с высокими или нормальными значениями
'ШмеЬи абсолютную гиповолемию. Внутривенная инфузия плазмозаменителей
нождалэсь снижением ЦВД, нормализацией частоты сердечных сокращений
Медального давления. Поскольку причиной повышения ЦВД может быть
н а'о0судов малого круга кровообращения, в сомнительных случаях проводят
ся^м с встрой инфузией плазмозаменители.
'убольных, оперированных на сердце и органах средостения, причиной высоко-
Ln М0Гут стать кровотечение и тампонада сердца. В этих ситуациях в качестве
- олнительных диагностических процедур используют рентгенографию органов
^ной клетки и трансторакальную эхокардиографию:
ІТРОЛЬ ЗА ГЕМОДИНАМИЧЕСКИМИ ПОКАЗАТЕЛЯМИ В ПРОЦЕССЕ
ИИФУЗИОННО-ТРАНСФУЗИОННОЙ ТЕРАПИИ
Вопросы контроля гемодинамических параметров при инфузионной терапии
„ляются весьма проблематичными. Измерение отдельных параметров, например
гтдилй ДЗЛА, Не коррелирует с прямым определением ОЦК. Нередко на фоне
гиповолемии отмечаться венозная и артериолярная вазоконстрикция, при этом
могут отмечаться высокие значения ЦВД. Кроме того, на этот параметр влия¬
ют другие |акторы: давление в грудной клетке, состояние сосудов малого круга
кровообращения, функция трехстворчатого клапана, насосная функция левых
«правых отделов сердца. Высокое ЦВД на фоне гиповолемии может наблюдаться
при'неоправданно больших дыхательных объемах и PEEP во время ИВЛ, у паци¬
ентов с легочной гипертензией, а также при сердечной недостаточности. Кроме
^Достоверные результаты могут быть получены при неправильной позиции
центрального венозйого катетера, к примеру, попадании его дистального конца
в правый желудочек сердца.
Величина ДЗЛА также не всегда отражает состояние ОЦК и преднагрузки лево¬
го'Желудочка. На этот показатель нельзя ориентировать^ у больных со II—ГО
степенью легочной гипертензии. Во избежание диагностических Ошибок при зна-
чительньіХ;Еемодинамических нарушениях во время восполнения ОЦК, помимо
вышеперечисленных параметров, необходим комплексный мониторинг с измере¬
нием сердечного выброса, Т02, П02, концентрации лактата и показателей оксиге¬
нации смешанной венозной крови.
Дяя йпределения оптимального давления наполнения желудочков сердца целе¬
сообразна проба с нагрузкой объемом жидкости. Для этого в центральную вену
в быстром темпе вводят раствор плазмозаменителя, регистрируя изменение СВ
ПРИ Увеличении ДЗЛК и ДПП на 1-2 мм рт.ст. Если во время пробы наблюда-
I 8108 снижение СВ, инфузию жидкости прекращают. На рис. 16-11 представлены
варианты кривых функции левого желудочка сердца. При нормальном ответе
83 пробу значения СИ достигают 2,5-3,5 л/ (минхм2) после возрастания ДЗЛК
До 10-12 мм рт.ст. (кривая 1). У некоторых больных нормальная работа сердца
, юдается при высоком давлении наполнения, достигающем 18-20 мм рт.ст.
давая 2), Встречаются случаи, когда нормальная производительность сердца
/ Людается при относительно невысоких значениях показателей преднагрузки
сищ* Рд некот°рых пациентов при низком давлении наполнения желудочков
РЦ инфузия небольших объемов приводит к резкому падению СИ, что свиде-
недостаточных функциональных резервах миокарда и необходимости
цепной поддержки (кривая 4). В этих случаях возможно медленное введение
яод прикрытием симпатомиметиков.
•tvenu
И КЛИНИЧЮШ) ТЖИСФЮИОЯОГИЯ
СИ (А/мин/игО
Рис. 18-11. Кривые зависимости между сердечным выбросом и давлением заклинивания в лего
ных капиллярах, полученные при пробе с инфузией жидкости (объяснения см. в тексте)
ИНФУЗН0НН0-ТРАНСФУЗИ0ННАЯ ТЕРАПИЯ КРИТИЧЕСКИХ
СОСТОЯНИЙ
Циркуляторный шок
Циркуляторный шок - клинический синдром общей недостаточности крово¬
обращения с неадекватной тканевой оксигенацией (Т02), приводящей к снижению
потребления кислорода (П02), анаэробному метаболизму и лактат-ацидозу. Шок
подразделяют на четыре категории: гиповолемический, кардиогенный, дистрибу¬
тивный (обусловленный относительной гиповолемией) и обструктивний (обу¬
словленный обструкцией магистральных сосудов).
Гиповолемический шок обусловлен снижением ОЦК. Его основными причи¬
нами являются кровотечение (травматический или геморрагический шок) и деги¬
дратация (ожоговый шок или шок, обусловленный потерей жидкости и электро¬
литов при диарее, рвоте либо через фистулу).
Дистрибутивный шок (увеличение емкости сосудистой системы):
I анафилактический;
I септический:
• неврогенный (нарушение центральной регуляции сосудистого тонуса после
церебральной или спинальной травмы).
Обструктивний шок (обструкция магистральных сосудов):
• тромбоэмболия легочной артерии;
• синдром верхней полой вены.
ГИПОВОЛЕМИЧЕСКИЙ ШОК
Снижение объема плазмы является основной причиной гиповолемическогошо
Ц І некоторых случаях нарушения тканевой оксигенации могут быть обусл°
лены сочетанием абсолютной и относительной гиповолемии. Снижение о6ъе
плазмы приводит к уменьшению конечно-диастолического объема левого *еЛ-
дочка. что сопровождается падением ударного выброса. До определенного мом
t* я счет активации симпатической нервной системы, приводящей к тахикард
в виюконстрикции. артериальное давление и СВ поддерживаются на удовлетвори
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях 597
b})0W уровне, однако при истощении компенсаторных механизмов происходит
падение гемодинамики.
Цинические проявления гиповолемического шока зависят от степени дефи-
0UK. Согласно данным, представленным в табл. 16-1, при I степени, когда
йвОООТСрЯ не превышает 15%, обычно наблюдаются беспокойство, тахикардия
«значительное Повышение шокового индекса.
деці Клинические признаки при различных степенях дефицита ОЦК
Г или <0,75 л
Конечности
□
Цвет лица 1
Состояние сознание
Тревожное
Обычный цвет
Обычный
б TTwov
Бледные
Бледный
Беспокойство или агрессивность
ИДИ 0,75-1.5 л
[Г I3M0V
[или 1,5-2,0 п
Бледные
Бледный
Беспокойство, агрессивность
или сонливость
>40%. или >2,0 л
Бледные и холодные
Бледно-серый
Сонливость, спутанность
или отсутствие сознания
Потеря 15-30% ОЦК (II степень) может сопровождаться двигательным бес¬
покойством и агрессивностью, бледностью кожных покровов, нарастанием тахи¬
кардии, снижением диастолического АД и возрастанием шокового индекса до двух
кори. Появляются признаки нарушения периферической микроциркуляции: при
дотии пальцев рук цвет восстанавливается более чем через 2 с. При этом темп
мочеотделения снижается до 20-30 мл/ч.
При потере 30-40% ОЦК (III степень) нарастают проявления нарушения созна¬
ния, беспокойство и агрессивность сменяются заторможенностью и сонливостью.
Снижается как систолическое, так и диастолическое АД. Нарастает тахикардия,
появляется одышка, темп мочеотделения прогрессивно падает.
Потеря более чем 40% ОЦК (IV степень) приводит к выраженной артериальной
гипотензии, заторможенности, спутанности или отсутствию сознания. Кожные
покровы приобретают бледно-серый цвет, конечности становятся холодными,
иногда мраморной окраски. Нарастают тахикардия, одышка, значения шокового
индекса достигают трех норм, появляется олигурия или анурия.
СЕПТИЧЕСКИЙ ШОК
В экспериментальных моделях эндотоксинового шока доказано, что причина
данного синдрома - депонирование крови в сосудистом русле, преимуществен¬
но в венозной системе. У пациентов с септическим шоком обычно наблюдается
понижение ЦВД на фоне нормального ОЦК, что может служить подтверждением
экспериментальных данных.
У больных с тяжелым сепсисом очень часто возникает относительная гипово-
лемия с возможностью артериальной гипотензии и клинической картины септи¬
ческого шока. Этому способствуют следующие факторы: недостаточное введение
жидкости, ее большие потери в результате гипертермии, рвоты, диареи, выпота
• брюшную полость у пациентов с перитонитом, а также генерализованное повы¬
шение проницаемости капилляров, приводящее к накоплению жидкости в интер¬
стициальном пространстве.
Абсолютный или относительный дефицит внутрисосудистого объема крови
^оровождается неадекватной работой сердца и сниженным кровоснабжением
Дйдей;
большинство исследований гемодинамики при септическом шоке, представ¬
ших в литературе, проводили после инфузионной терапии. В то же время есть
демонстрирующие, что до начала введения растворов среднее давление
ЭДвдцшания в легочной артерии и СВ обычно находятся в районе нижней гра-
Ш нормы. Гипердинамическое состояние, характеризующееся высоким СВ.
наблюдается после мероприятий по восполнению ОЦК.
ИЗ <ЛИНИЧЄС*АЯ ТРАНСФУЗИОЛОСИЯ
Возмещение дефицита жидкости - первостепенная задача в лечении бо
< септическим шоком. Это приводит к увеличению венозного возврата, Св*^
рекцни артериальной гипотензии и олигурии. ’ ’ Кор-
Основная цель терапевтических мероприятий заключается в увеличении дг
км кислорода. Как правило, у больных с септическим шоком наблюдается п
пенная потребность в кислороде. В связи с этим оптимальный сердечный
у них превышает общепринятые нормальные значения. Некоторые авторы сч ***
ют, что у пациентов с септическим шоком необходимо достигать гипердинам
схого состояния кровообращения, что удается приблизительно в 68% случаев ?
При инфузионной терапии следует избегать избыточного введения жидкости
поскольку это может привести к нарушению оксигенирующей функции легки
В этой связи тщательный мониторинг гемодинамики и кислородтранспортной
функции, о котором говорилось в предыдущем разделе, также актуален и для дан.
ной категории больных.
До сих пор окончательно не решен вопрос о выборе инфузионных препаратов
для лечения септического шока. Коллоидные растворы позволяют поддерживать
адекватное КОД плазмы крови, что способствует оптимизации ОЦК. Однако
при увеличении проницаемости микрососудов не всегда удается удерживать гра¬
диент онкотического давления между внутри- и внесосудистым пространствами
Сторонники кристаллоидных растворов указывают, что в этом случае коллоид¬
ные растворы могут попадать в интерстициальное пространство легких, повышая
там онкотическое давление и увеличивая накопление жидкости во внесосудистом
секторе.
Важную роль в контроле инфузионной терапии играет мониторирование
онкотически- гидростатического градиента по давлению. Разница между КОД
плазмы крови и ДЗЛК менее 8 мм рт.ст. обычно сопровождается выходом жидко¬
сти из внутрисосудистого пространства в интерстициальный сектор.
Большинство авторов настаивают на необходимости мониторирования ДЗЛК
и СВ при инфузионной терапии у больных с септическим шоком. Это связано
с отсутствием корреляции между ЦВД и ДЗЛК.
Для определения оптимальных значений ДЗЛК используют объемную нагруз¬
ку. При этом оценивают, при каком среднем давлении в легочных капиллярах
наблюдаются значения СВ. достаточные для достижения адекватного транспорта
кислорода. Обычно оптимальный сердечный выброс у этой категории больных
наблюдается при значениях ДЗЛК, составляющих около 12 мм рт. ст.
У больных с септическим шоком нередко отмечаются нарушения функции
правого желудочка сердца, связанные с поражением легких (пневмонией, ОРДС).
В этой связи мониторинг функционального состояния правого желудочка сердца
у данной категории пациентов также актуален.
При низких СВ и АД можно использовать симпатомиметики, однако их введе- I
чиє необходимо сочетать с адекватным восполнением ОЦК.
В ряде случаев у пациентов с септическим шоком наблюдается клиническая
картина сосудистой недостаточности, проявляющейся относительно нормальны- I
ми или повышенными значениями СВ на фоне снижения среднего АД (в основном I
за счет диастолического). В такой ситуации оптимизации гемодинамики удается I
достичь инфузией вазопрессоров - норадреналина*, мезатона*, адреналина*. I
У пациентов с низкими функциональными резервами миокарда оправдано ■
назначение добутамина или допамина.
АНАФИЛАКТИЧЕСКИЙ ШОК
Основными патогенетическими признаками анафилактического шока являю
ся вазодилатация, депонирование крови в периферических сосудах и системи
увеличение проницаемости микроциркуляторного русла. В некоторых случая*
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях 569
льтате увеличения проницаемости сосудов малого круга кровообращения
»Дается отек легких. При этом за счет перемещения жидкости в интерстици-
Pa|JJ^npocTpaHCTBO легких потеря объема циркулирующей плазмы может дости-
Игь50%-
Лечение анафилактического шока заключается в сочетанном введении симиато-
^иков (адреналина* и/или норадреналина*), глюкокортикоидных гормонов
-о в случаях тяжелого анафилактического шока более эффективным способом вос-
^полнении объема циркулирующей плазмы. Клинический опыт показывает.
лнения объема циркулирующем плазмы служит введение коллоидных растворов.
110при клинических проявлениях интерстициального отека легких, что является
У„ признаком нарушения капиллярной проницаемости, целесообразно введе¬
те растворов гидроксиэтилкрахмала с высокой молекулярной массой, поскольку
до может способствовать возвращению жидкости в сосудистое русло.
КАРДИОГЕННЫЙ ШОК
В классической работе J.S. Forrester и соавт., посвященной изучению гемоди¬
намики у больных с инфарктом миокарда, осложненным кардиогенным шоком,
показано, что около 15% пациентов имеют низкие значения СВ на фоне невы¬
соких величин ДЗЛК. У большинства из них отмечаются низкий ударный объем
и компенсаторная тахикардия. Авторы считают, что комплексная терапия таких
пациентов обязательно должна включать инфузию плазмозаменителей.
Есть указания, что при инфаркте правого желудочка, когда КДЦ в нем превы¬
шает таковое в левом, у значительного количества больных можно достичь улуч¬
шения гемодинамики только за счет инфузионной терапии.
Некоторые авторы придерживаются мнения, что у больных с кардиогенным
шоком вследствие инфаркта миокарда показаниями к введению плазмозамени¬
телей являются значения СИ менее 2,2 л/ (минхм2) и ДЗЛК менее 18 мм рт.ст.
К данной рекомендации следует относиться с большой осторожностью. Во всех
случаях при восполнении ОЦК у больных с кардиогенным шоком целесообразны
пробы с нагрузкой жидкостью. Инфузионная терапия у них оправдана, если в ответ
на введение плазмозамещающего раствора наблюдается возрастание произво¬
дительности сердца. Однако у этой категории пациентов безопаснее восполнение
ОЦК при одновременной инфузии симпатомиметиков. Это связано с тем, что, как
правило, быстрая инфузия плазмозаменителя может усугублять сердечную недо¬
статочность, а при медленном темпе инфузии для адекватного повышения СВ
может потребоваться длительное время, в течение которого будет наблюдаться
неадекватная тканевая оксигенация.
У пациентов с кардиогенным шоком гиповолемия может носить ятрогенный
характер. К примеру, подобные ситуации могут возникать при избыточном вве¬
дении диуретиков и морфина при лечении отека легких. В этих случаях суще¬
ственную помощь также оказывает исследование центральной внутрисердечной
гемодинамики. Несмотря на клинические признаки застоя в легких (влажные
хрипы, изменения на рентгенограмме), при низких значениях ДЗЛК и СВ у данной
категории пациентов некоторые авторы считают целесообразной инфузионную
терапию. Опыт свидетельствует о необходимости тщательного контроля произ-
аодительности сердца при инфузии плазмозаменителей у данной категории боль-
ных. Если в ответ на повышение ЦВД и ДЗЛК сердечный выброс не возрастает,
инфузию прекращают.
ожоговый шок
Инфузионная терапия при ожоговом шоке имеет свои особенности. При обшир¬
ных ожогах на ранних стадиях наблюдается типичная клиническая картина гипо¬
тетического шока, обусловленного нарушением капиллярной проницаемости.
ГЛАВА «6
570 кяииичесмя тжнсфузиолотя
приводящей I перемещению белков И ЖИДКОСТИ ИЗ внутрисосудистого
суджтое пространство. Эти процессы связаны с непосредственным разп*0 вН€со-
клеток и освобождением вазоактивных субстанций. Потеря внутрисо^ ени?м
объема плазмы прямо пропорциональна степени ожога и величине о ДИст°|')
поверхности Величину ожоговой поверхности принято оценивать пг» *°Г08°Й
«девяток»: "Равилу
І область головы и шеи — 9%;
і верхняя конечность — 9%;
I нижняя конечность — 18%;
• передняя поверхность грудной стенки и живота — 18%;
и задняя поверхность грудной стенки и спины — 18%.
В Первые 24 ч рекомендуют проводить инфузию растворов натрия, пит
существуют три схемы, предусматривающие использование гипо-, изо- и гипетт!*
нических концентраций. '
При гипотонической схеме используют рекомендацию Parkland, согласи
которой переливают растворы, имеющие концентрацию натрия в пределах
130-140 мЭкв/л из расчета 4 мл/кг массы тела на процент ожоговой поверхности
Таким образом, пациент с массой тела 60 кг с величиной ожоговой поверхности
составляющей 70%, получает в первые сутки около 17 л раствора, причем полови¬
ну объема вводят в течение первых 8 ч. При данной схеме возможны избыточное
введение жидкости и развитие отеков, в том числе легких и мозга, однако наблю¬
дается меньшая частота почечной недостаточности.
При изотонической схеме используют растворы, содержащие 150-160 мЭкв/л
натрия. Пациент с вышеуказанными параметрами в первые сутки получает
12-13 б раствора, и половину объема вводят в первые 8 ч. По сравнению с преды¬
дущей при данной схеме наблюдается менее выраженное прибавление массы тела,
что объясняется более интенсивным натрийурезом. Вместе с тем частота отечньи
осложнений ниже.
Гипертоническая схема подразумевает введение растворов, содержащих
225-250 мЭкв/л натрия в количестве 2,0-2,5 мл/кг массы тела на процент ожого¬
вой поверхности. При данном подходе повышается риск гипернатриемии и почеч¬
ной недостаточности.
Согласно современным концепциям, коллоидные растворы вводят через 24 ч,
поскольку к этому времени обычно нормализуется капиллярная проницаемость.
В этот период особое значение имеет поддержание концентрации белка плазмы
крови, что обеспечивается за счет инфузии плазмы и альбумина.
Спустя 48 ч после ожога обычно применяют растворы, не содержащие натрий,
поскольку в этот период наблюдается его накопление в организме пациента.
На всех этапах лечения ожогового шока чрезвычайное значение имеют тща¬
тельный мониторинг состояния гемодинамики, функций легких, почек, централь¬
ной нервной системы и контроль водно-электролитного баланса.
Выбор плазмозамещающего раствора
Основной задачей в лечении гиповолемического шока становятся быстрое вос¬
полнение ОЦК и улучшение тканевой оксигенации. При использовании в этих
целях растворов коллоидов и кристаллоидов капиллярный кровоток улучшается
в большей степени, чем при гемотрансфузии. Считают, что умеренная гемодилю¬
ция (снижение гематокрита до 30%) хорошо переносится большинством пациен¬
тов и при восполненном ОЦК не приводит к снижению Т02.
Вопрос выбора раствора для восполнения ОЦК до сих пор остается спорным.
Сторонники кристаллоидов считают, что первичную роль в патофизиологи
гиповолемического шока играет дефицит внеклеточной жидкости и для улучше
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ 571
ыЖИВаемости больных необходимо срочное его восполнение. При дефи-
^клеточной жидкости особое значение придают нарушению функции
^й-калиевого насоса. В этой связи на основании данных экспериментальных
Типических исследований многие авторы считают обязательным введение
“конического раствора натрия хлорида при лечении пациентов с гиповолеми-
современных рекомендациях Американского колледжа хирургов указано,
01 учение больных с травматическим геморрагическим шоком необходимо
^ать с быстрой инфузии раствора Рингера лактата* в объеме до 2 л.
Если при этом не удается достичь стабилизации гемодинамики, дальнейшее
олнение дефицита ОЦК осуществляют с помощью эритроцитной массы.
Сторонники коллоидов делают акцент на снижение ОЦК и транспорта кисло-
а в качестве основного патофизиологического фактора гиповолемического
^ока В этой связи они считают первостепенным восполнение внутрисосудистого
объема крови. u
Гемодинамическии эффект инфузионнои терапии зависит от выбора плазмо*
закенителя, сосудистого тонуса и функционального состояния сердца. Сравнение
^одинамических эффектов кристаллоидов и коллоидов проводили в целом ряде
исследований. В исследовании W.C. Shoemaker проведено сопоставление эффекта
инфузии 500 мл цельной крови, 500 мл 5% альбумина, 500 мл декстрана-70, 500
ил 10%-го декстрана-40 и 1000 мл раствора Рингера лактата* у пациентов, нахо¬
дящихся в критическом состоянии. Все растворы вводили в течение 1 ч. Цельная
кровь и коллоиды значительно увеличивали ОЦК, СВ, ударный индекс, индекс
ударной работы левого желудочка, ЦВД и давление заклинивания в легочной
артерии. Однако, несмотря на то что объем введенного кристаллоидного раство¬
ра был в 2 раза больше, достоверных изменений вышеперечисленных параметров
получено не было.
Таким образом, при возникновении артериальной гипотензии, обусловлен¬
ной выраженной гиповолемией, для более быстрой стабилизации гемодинамики
большинство авторов отдают предпочтение не кристаллоидным, а коллоидным
растворам.
Очевидно, что необходим индивидуальный подход к назначению кристалло¬
идных и коллоидных растворов с учетом степени дефицита ОЦК, причины, его
вызвавшей, общего состояния пациента и сопутствующих заболеваний и ослож¬
нений.
Необходимо учитывать следующие основные особенности кристаллоидных
растворов:
! кристаллоиды не имеют коллоидно-осмотического давления, что приводит
к переходу жидкости во внеклеточное пространство;
І быстро выводятся почками;
І имеют ограниченный волемический эффект и его продолжительность;
I сложно восполнить гиповолемию, превышающую 30%;
• возможен риск переполнения интерстициального пространства с развитием
отека легких и гипоксии, отека внутренних органов;
• у пациентов с заболеваниями сердца и почек объем вводимых кристаллоидных
растворов должен быть ограничен.
Коллоидные растворы отличаются следующими особенностями:
I концентрацией натрия в пределах 130-155 ммоль/л;
• КОД, обусловленным субстанциями большой молекулярной массы;
I способностью удерживать жидкость в сосудистом русле;
I способностью поддерживать или увеличивать ОЦК;
' более медленным, чем у кристаллоидов, выведением через почки;
I значительно более продолжительным, чем у кристаллоидов, волемическим
зффектом.
572 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Исходя из вышеизложенного, основными показаниями к введению кпи
лоидных растворов являются: СТал'
• восполнение объема внеклеточной жидкости;
• поддержание объема внеклеточной жидкости во время операции и в пос
операционном периоде; СЛе"
• лечение умеренной гиповолемии (препараты для первичного восполнен
ОЦК). ния
Показания к введению коллоидных растворов:
• лечение выраженной гиповолемии и шока (первичное восполнение ОИК
при кровотечении, травме и сепсисе);
• использование кровосберегающих технологий — намеренная нормоволеми-
ческая гемодилюция или компонентное кровевосполнение;
• профилактика относительной гиповолемии во время спинальной и эпиду-
ральной анестезии;
• первичное заполнение аппарата ИК.
Коллоидным плазмозаменителям отдается предпочтение при гиповолемиче-
ском шоке. Объемы переливаемых коллоидных плазмозаменителей необходи¬
мо рассчитывать, основываясь на значениях шокового индекса в соответствии
с классификацией степени кровопотери (см. табл. 14-1). В случаях когда уровень
водного баланса организма невозможно оценить, следует стремиться к восполне¬
нию ОЦК, избегая при этом накопления коллоидных растворов в интерстициаль¬
ном пространстве. Они должны приводить к стабилизации состояния пациента
в течение нескольких часов, но не иметь большой продолжительности действия,
чтобы не усложнять лечебный процесс в условиях стационара. Коллоидные плаз¬
мозаменители не должны влиять на свертывающую систему крови, определение
группы крови и кросс-матч реакции. При введении коллоидных плазмозаме¬
нителей необходимо учитывать количество содержащихся в них электролитов.
При сбалансированном восполнении дефицита ОЦК коллоидные растворы вводят
в сочетании с кристаллоидными во избежание обезвоживания интерстициального
пространства организма.
Компонентная терапия при острой кровопотере
Известно, что при различном объеме острой кровопотери на первый план
выступает дефицит определенных компонентов крови. Говоря иначе, на каждой
стадии гиповолемии недостаток этих компонентов приобретает критическое зна¬
чение. В этой связи показания к назначению плазмозаменителей и компонентов
крови необходимо определять в соответствии с классификацией выраженности
гиповолемии (рис. 16-12).
У исходно здоровых субъектов потеря менее 15% ОЦК может быть полностью
скомпенсирована за счет внутренних резервов — активации симпатоадреналовой
системы, перехода жидкости из внесосудистого во внутрисосудистое пространство,
поступления альбумина и эритроцитов из естественных депо организма.
Кровопотеря, достигающая 30%, обычно сопровождается снижением сердечно¬
го выброса и артериального давления. В этих случаях восполнение дефицита ОЦК
осуществляют синтетическими коллоидными, а дефицит жидкости в интерстици¬
альном пространстве - кристаллоидными растворами.
При кровопотере от 30 до 40% наблюдается критическое снижение гемоглоби¬
на и гематокрита крови, поэтому наряду с вышеперечисленными мероприятиями
необходимо назначение эритроцитной массы или цельной крови.
Потеря от 40 до 60% циркулирующей крови приводит к гипоальбуминемии
и снижению КОД плазмы. При концентрации сывороточного альбумина менее
2,5 г/л показана инфузия растворов человеческого альбумина.
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях 573
[Кровопотеря (%)
Последствия
Терапия
до
30%.
ДО
40%
-
До
60%
-
ДО
80%
1
ОЦК - 100% от N
Растворы кристаллоидов
(дефицит интерсти¬
циального пространства)
Растворы коллоидов
(дефицит ОЦК)
II
Гематокрит <25%
(Hb <7,5 g/dl)
I + эритромасса
III
Сывороточный
альбумин <25 г/л
II + повышение КОД
растворами коллоидов
(раствор альбумина)
IV
Факторы
свертывания
<35% от N
II + факторы свертывания
(свежезамороженная
плазма)
>
80%
V
Тромбоциты
<50 000/мм3
II + факторы свертывания
(свежезамороженная
плазма) + тромбоциты
или свежая кровь (0—48 ч)
Рис. 16-12, Принципы многокомпонентной терапии
При значительной кровопотере, превышающей 60%, возникают дефицит фак¬
торов свертывания и падение содержания тромбоцитов крови до критического
уровня. Помимо указанных выше мероприятий, пациентам показано переливание
свежезамороженной плазмы, криопреципитата, антитромбина III, фибриногена и
тромбоцитной массы. У пациентов данной категории оправдана трансфузия све-
жезаготовленной (сроком до 12 ч) цельной крови. При значительной кровопотере
назначают апротинин (трасилол*), который, помимо активации функциональ¬
ного состояния тромбоцитов, оказывает стабилизирующее влияние на альвео-
ло-капиллярную мембрану легких, что снижает риск острого респираторного
дистресс-синдрома.
Оптимальный гематокрит
Большинство исследователей считают, что при условии адекватного воспол¬
нения объема циркулирующей плазмы допустимыми являются значения гемато¬
крита крови в пределах 30-35%. Наблюдаемое при этом снижение содержания
кислорода в артериальной крови должно компенсироваться за счет адекватного
возрастания сердечного выброса и улучшения микроциркуляции.
На практике более корректно ориентироваться на показатель эффективного
(переносящего кислород) гемоглобина, поскольку показатель гематокрита —
сумма всех фракций гемоглобина (в том числе и дисгемоглобинов).
Критерием адекватной компенсации снижения гемоглобина являются нормаль¬
ные значения артериального транспорта кислорода. Совершенно очевидно, что
Данная компенсация может быть обеспечена при условии сохранных функцио¬
нальных резервов миокарда. При ограниченном кардиореспираторном резерве
(например, у пациентов с атеросклеротическим и постинфарктным кардиосклеро-
3°м, у кардиохирургических больных) необходима индивидуальная оценка реак¬
ции кровообращения и его кислородтранспортной функции на низкое содержание
гемоглобина в крови.
I исследованиях, проведенных у больных, оперированных на открытом сердце,
^нззано, что возможны различные варианты изменения кислородтранспортной
тУнкции крови в ответ на одинаковую степень снижения гемоглобина. Были выде-
ГЛАВА 16
00 вММЧЮСМТПМДОЗИШЮГИЯ
I пациентов е одинаковой степенью снижения гемоглобина крови
(»срШР*м 100 г/л) ПРИ нормоволемической гемодилюции (рис. 16-13).
1 б в
Рис 16-13 Варианты изменения кислородтранспортной функции при гемодилюции
Пациенты исследуемых групп не различались по основным показателям гемо¬
динамики: артериальному и центральному венозному давлению. ЧСС и давлению
наполнения желудочков сердца, что свидетельствовало об адекватном воспол¬
нении ОЦК. Не было также различий в показателях оксигенации артериальной
крови (Pp., Hb02 и концентрации кислорода). Средние значения полученных
показателей сравнивали с таковыми у пациентов, имевших неосложненное тече¬
ние послеоперационного периода, которые были приняты за 100%. Данные,
полученные у пациентов с адекватным компенсаторным ответом, представлены на
рис. 16-13, а. Снижение НЬ привело к возрастанию сердечного индекса в среднем
на 35%, при этом показатели артериального транспорта кислорода и адекватности
тканевой оксигенации существенно не отличались от таковых в контрольной груп¬
пе. Полученные данные свидетельствуют об адекватном кардиореспираторном
резерве и допустимости намеренной нормоволемической гемодилюции в данной
группе пациентов.
По сравнению с контрольной во второй группе (рис. 16-13, б) обнаружена тен¬
денция к увеличению СИ в среднем на 12% и уменьшению Т02 на 13%, однако раз¬
личия этих показателей были статистически недостоверны. Экстракция кислорода
была увеличена в среднем на 26% (р <0,05), а показатель лактата артериальной
крови существенно не отличался от нормы. Следовательно, у больных данной груп¬
пы компенсация низкой кислородной емкости крови обеспечивалась в основном
за счет возрастания тканевой экстракции кислорода. Можно считать, что при таком
варианте нормоволемическая гемодилюция допустима, однако данные пациенты
требуют более тщательного мониторинга кислородного статуса организма.
Интересные данные были получены у пациентов третьей группы (рис. 16-13, в).
При отсутствии достоверных различий в значениях СВ и Т02 по сравнению с кон¬
трольной группой наблюдались крайне высокие показатели коэффициента тка¬
невой экстракции кислорода (183%) и содержания лактата в артериальной крови
(180% нормы). Объяснить столь выраженную недостаточность тканевой оксиге¬
нации у пациентов третьей группы можно повышенной потребностью в кислоро¬
де. У кардиохирургических больных чаще всего это может быть связано с длитель¬
ным или неадекватным искусственным кровообращением или предшествующими
нарушениями гемодинамики. Подобные ситуации нередки и в общеклинической
практике. Например, при травматическом или геморрагическом шоке восполнение
кровопотери до относительно нормальных значений гемодинамических показа¬
телей и рекомендуемого уровня гематокрита крови в пределах 30-35% не веет-
да свидетельствует о полном благополучии в кислородном статусе организма.
больше Кровопотеря И продолжительнее состояние шока, тем больше «КИС'
В подобных случаях необходимо делать выбор между
ИНФУЗИ0НН0-ТРАНСФУЗИ0ННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях 575
мнением инотропных препаратов в целях повышения сердечного выброса
‘^трансфузией. Поскольку у пациентов со сниженным кардиореспираторным
* *овом возможность трансфузии крови в быстром темпе ограничена, начинают
*2ию с инфузии симпатомиметиков (добутамина или допамина), а затем про-
переливание эритроцитной массы. В подобных случаях большое значение
ИВмониторинг показателей гемодинамики, транспорта кислорода и его эффек¬
тивности.
jl3 вышеизложенного можно сделать несколько важных заключении.
, При восполнении дефицита ОЦК или намеренной нормоволемической гемо¬
дилюции целесообразно ориентироваться в большей степени не на показатель
гематокрита, а на концентрацию эффективного гемоглобина крови. Значения
утих параметров определяют индивидуально для каждого пациента.
, Основным компенсаторным механизмом при снижении гемоглобина крови
служит увеличение сердечного выброса, а при отсутствии резервов увеличе¬
ния производительности сердца - повышение тканевой экстракции кислоро¬
да (либо их комбинация).
I Гемодилюция применима прежде всего у пациентов с сохранными компен¬
саторными возможностями. В случаях значительного увеличения потреб¬
ности в кислороде, а также при несостоятельности компенсаторных влияний
или угрозе их срыва в зависимости от клинической ситуации необходимо
решать вопрос о гемотрансфузии либо использовании кардиотонических пре¬
паратов.
Послеоперационная кровопотеря
Клиническая оценка послеоперационной кровопотери осложняется влиянием
предшествующей общей анестезии, а также лечебными мероприятиями в отде¬
лении интенсивной терапии, связанными с особенностями основной патологии
и проведенным оперативным вмешательством.
Оценка кровопотери по дренажам не всегда позволяет полностью контролиро¬
вать ее объем. Часть крови может задерживаться в полостях организма, возмож¬
но нарушение проходимости дренажей в результате образования в них сгустков
крови, сдавления или перегиба. В этой связи у больных, оперированных на орга¬
нах грудной клетки, в первые часы послеоперационного периода контролируют
показатели гематокрита и свертывающей системы крови, параметры гемодинами¬
ки и газового состава артериальной крови. Обязательно выполняют рентгеногра¬
фию органов грудной клетки, а при подозрении на скопление жидкости в области
средостения и перикарда — трансторакальную эхокардиографию.
Значимой считается потеря по дренажам более 70 мл/м2 геморрагической
жидкости с гематокритом, близким по значению к таковому крови, в течение
2-4 ч при отсутствии выраженных нарушений свертывающей системы крови
ми при признаках гиперкоагуляции. Это служит показанием к повторному опера¬
тивному вмешательству в целях гемостаза. При подозрении на внутреннее крово¬
течение объем потери эритроцитной составляющей ОЦК можно приблизительно
огфеделить по степени падения гематокрита крови:
ДШ х ОЦК,
Где Ц выражен в процентах, а ОЦК вычисляют из расчета 70 мл/м2 поверхности
тела пациента.
Данная формула дает приблизительный результат, поскольку не учитывается
^ем эритроцитов, поступающих из внутренних депо организма, а также переме¬
щение жидкости из внесосудистых пространств организма. Кроме того, необходи-
*° Учитывать объем введенных инфузионно-трансфузионных препаратов.
Sag КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
jgfg подозрении на кровотечение в брюшную полость или забрюшинное п
странсгво выполняют ультразвуковое исследование. Р°'
У больных, имеющих в анамнезе язвенную болезнь желудка и Двенадцатипепг,
УйХ ишаки а также пациентов с высоким риском стрессорных язв при исключен
других источников кровотечения устанавливают назогастральный зонд и оцен
вают цвет стула.
Восполнение послеоперационной кровопотери проводят в соответствии С ПОИ
цмлами, изложенными в параграфе «Острое кровотечение и принципы лечени
кровопотери*. '
Поскольку хирургическое кровотечение обычно сопровождается вторичными
нарушениями гемостаза, в первые часы при признаках кровотечения проводят
консервативную гемостатическую терапию:
• апротинин 2000-4000 млн ЕД;
і переливание криопреципитата и свежезамороженной плазмы;
• переливание тромбоконцентрата в объеме 6-8 доз.
За исключением случаев профузного кровотечения, дифференциальная диа¬
гностика между хирургической причиной кровотечения и нарушениями гемостаза
нередко представляет очень сложную задачу. В этих случаях важно не допустить
потери больших объемов крови.
Следствием массивной кровопотери и гемотрансфузии являются ДВС-синдром,
синдромы системной воспалительной реакции и полиорганной недостаточности.
Если кровотечение продолжается после консервативных мероприятий, вопрос
решается в пользу повторного оперативного вмешательства.
Инфузионная терапия при увеличенной проницаемости
микрососудистого русла
Наиболее часто увеличение проницаемости микрососудов как для жидкости,
так и для макромолекул наблюдается при септическом синдроме, ОРДС, ожогах,
анафилактических реакциях и некоторых отравлениях. Длительность нарушения
проницаемости может быть небольшой, как, например при анафилаксии, или про¬
должаться в течение нескольких дней, например при ОРДС. Поскольку пере¬
распределение воды из внутрисосудистого в интерстициальный сектор нередко
сочетается с вазодилатацией, может возникать абсолютная или относительная
гиповолемия, вплоть до гиповолемического шока.
Показания и выбор инфузионных препаратов у больных с ОРДС остаются спор¬
ными. В условиях повышенной проницаемости микрососудов для воды и белков
плазмы основным фактором, определяющим перемещение жидкости из внутрисо-
судистого в интерстициальное пространство, является гидростатическое давление
в легочных капиллярах. Влияние КОД на перемещение жидкости между этими
пространствами уменьшается по мере возрастания проницаемости микрососудов.
При этом на фоне отека легких переход жидкости в интерстициальное простран¬
ство может происходить при нормальном осмотически-гидростатическом гради¬
енте давления.
При низких значениях ДЗЛК вероятность отека легких снижается, что под¬
тверждается уменьшением объема внесосудистой жидкости в них.
Лечение больных с ОРДС осложняется тем, что терапия, направленная на умень¬
шение ДЗЛК и внесосудистой жидкости в легких (ограничение введения жидко¬
сти, применение диуретиков), может привести к снижению венозного возврата
X уменьшению СВ и доставки кислорода. В этих случаях необходимо рациональ-
Н яН сочетание инфузионной терапии и кардиотонической поддержки.
Инфузионная терапия у больных с ОРДС на фоне гемодиафильтрации более без- I
Н опасна. поскольку предоставляет большие возможности в коррекции жидкостного
баланса организма.
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях 577
пои вьфаженных нарушениях проницаемости микрососудов, когда наблюдает-
ободнос перемещение белков плазмы и других макромолекул, нет большой
с* ицы в выборе между вливанием кристаллоидных или коллоидных растворов.
с тем. по-видимому, лучше отдавать предпочтение последним, поскольку
^позволяют удерживать КОД на более высоком уровне. Терапия коллоидными
'’"форами более эффективна на ранних стадиях ОРДС. У больных, находящихся
Ординальной фазе ОРДС, выбор плазмозаменителя не имеет значения.
Осложнения инфузионной терапии
ОСТРАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Избыточное введение плазмозаменителей может приводить к перегрузке сердца
клиническим признакам декомпенсации кровообращения: увеличению печени,
интерстициальному или альвеолярному отеку легких. Риск этих осложнений наи¬
более велик у пожилых пациентов и кардиологических больных. В этой связи
нфузию плазмозаменителей у таких пациентов проводят при тщательном клини¬
ческом и гемодинамическом мониторинге.
НЕКАРДИОГЕННЫЙ ОТЕК ЛЕГКИХ
Отек легких во время или после лечения циркуляторного шока или реанимаци¬
онных мероприятий увеличивает вероятность летального исхода.
Многие специалисты связывают данное осложнение с выбором между колло¬
идными и кристаллоидными растворами. Вопрос о том, влияет ли вид раствора
I на частоту некардиогенного отека легких, до сих пор обсуждается. С этой целью
было проведено большое количество экспериментальных и клинических иссле¬
дований, но окончательного ответа на поставленный вопрос эти исследования
не дали.
Многие диагностические методы, предлагаемые в качестве критериев оценки
нарушения функции легких в результате инфузионной терапии, нельзя признать
строго специфичными. К их числу относятся: фракция внутрилегочного шунтиро¬
вания, альвеолярно-артериальный градиент по кислороду, статический комплаенс
легких, парциального напряжения кислорода в артериальной крови, объем внесо-
судистой жидкости в легких, а также серийные рентгенологические исследования
легких. Каждый из них имеет свои ограничения.
Величина объема внесосудистой жидкости в легких не всегда коррелирует со
I значениями фракции внутрилегочного шунтирования и альвеоло-артериального
градиента по кислороду у больных с отеком легких и ОРДС. Объем внесосудистой
жидкости в легких может значительно повышаться при отсутствии нарушений
газообмена.
Оценка степени поражения легких на серийных рентгеновских снимках также
имеет свои ограничения. Во-первых, это связано с невозможностью их многократ¬
ного выполнения в течение коротких промежутков времени. Во-вторых, известно,
что даже после купирования клинических признаков отека легких рентгенологи¬
ческая картина может сохраняться в течение нескольких дней.
По мнению некоторых авторов, градиент между коллоидно-осмотическим дав¬
анием и давлением заклинивания в легочной артерии служит достоверным про¬
гностическим критерием, указывающим на возможность отека легких.
Известно, что по сравнению с коллоидными кристаллоидные растворы чаще
приводят к системному отеку и нарушениям оксигенирующей функции легких
бедствие снижения КОД плазмы крови. С другой стороны, существует мне-
что изолированное снижение коллоидно-осмотического давления в плазме
фи отсутствии сопутствующих факторов, повреждающих легкие, может не при-
571 ШВІГССХАЯ танСФУЭМОЛОГИЯ
вошь к их отеку даже при существенном снижении градиента между коллоид
осмотическим и давлением заклинивания в легочной артерии. ""ЧНо-
Неоютря на неоднозначность суждений по данному вопросу, на основа
результатов клинических исследований можно указать на ряд доказанных па**
НИ
• при повышении ДЗЛК и одновременном снижении КОД плазмы крови вен
ятность отека легких возрастает; Р°'
і у ранее здорового пациента, имеющего значительные запасы альбумин
в организме, при нормальном ДЗЛК вероятность отека легких невелика да*3
при значительном снижении КОД;
І отек легких может развиваться при нормальных значениях ДЗЛК и сни¬
женном КОД у пациентов с хроническими заболеваниями и, следовательно
с ограниченными запасами белка в организме;
• у больных, перенесших синдром шока, а также у пациентов с хроническими
заболеваниями могут наблюдаться нарушения капиллярной проницаемости
поэтому отек легких и других органов у них может развиваться вне зависимо¬
сти от вида раствора, применяемого для восполнения ОЦК.
СИСТЕМНЫЙ ОТЕК
Относится к довольно частым осложнениям, встречающимся у пациентов отде¬
лений реанимации и интенсивной терапии. Нередко фактором, предрасполагаю¬
щим к возникновению этого осложнения, становится инфузия различных раство¬
ров. Наиболее часто отек развивается в кишечнике, сердце, мозге, коже, мышцах
і жировой ткани. К примеру, в исследованиях Е. Pappova и соавт. (1977) было
показано, что при использовании больших объемов кристаллоидов для воспол¬
нения дефицита объема плазмы 25% жидкости накапливается в жировой ткани,
25% - в мышечной ткани и около 37% — в коже. Даже при нормальных функциях
почек у больных, длительно находящихся в отделениях реанимации и интенсив¬
ной терапии после различных хирургических вмешательств и травм, может наблю¬
даться положительный жидкостный баланс.
Результатом отека мягких тканей становится увеличение диффузионного пути
кислорода от капилляра к клетке. Это приводит к следующим клиническим
последствиям;
• ухудшению заживления ран, поскольку низкая оксигенация тканей наруша¬
ет образование коллагена и эпителизацию ран;
• снижению фиксирующей силы швов с возможностью их прорезывания;
• уменьшению бактерицидной активности лейкоцитов, приводящей к увеличе¬
нию риска раневой инфекции;
І анаэробному метаболизму даже после восстановления адекватного транс¬
порта кислорода.
Как правило, системные отеки развиваются в результате гипопротеинемии
и снижения КОД плазмы крови. Известно также, что гипопротеинемия может
приводить к выраженным нарушениям функции желудочно-кишечного тракта.
Нередко при системных отеках наблюдаются стрессорные язвы. Имеются также
данные, указывающие на существование корреляции между гипоальбуминеми-
ей и отеком стенки кишечника, что приводит к неэффективности энтерального
зондового питания. Даже умеренные гипоонкотические состояния могут сопро¬
вождаться увеличением интерстициального давления в кишечнике и нарушением
всасывания, что сопровождается диареей. Скопление жидкости в толстой кишке
приводит к рефлекторному снижению ее перистальтики и нарушению функции
тонкого кишечника. Для улучшения перистальтики кишечника и уменьшения его
отека рекомендуют использовать инфузию альбумина. Следствием отека кишеч¬
ника І нарушения всасывания становится поступление бактерий через слизистую
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ состояниях
579
йка в мезентериальные лимфатические узлы, что повышает риск септи¬
ка*4 осложнений. Считают, что нарушение функций кишечника также служит
из определяющих факторов, приводящих к синдрому системной и нолиор-
<1 недостаточности.
ЗАКЛЮЧЕНИЕ I
Первостепенной задачей восполнения дефицита ОЦК становится восстановле-
адекватного сердечного выброса и транспорта кислорода. В ряде клинических
rflvauHH выбор жидкости для восполнения дефицита ОЦК не является опреде-
ющим. Большое значение имеет быстрота восстановления адекватного артери-
Гного транспорта кислорода.
Особое значение имеет обоснованный инвазивный гемодинамический монито-
г. Это позволяет не только оптимизировать сам процесс восполнения дефицита
flllK, НО и снизить риск перегрузки жидкостью.
Выбор раствора для восполнения дефицита ОЦК должен зависеть от конкрет¬
ной клинической ситуации. В этом отношении не бывает всеобъемлющих реко¬
мендаций. Например, молодой пациент, получивший травму, может быть успешно
пролечен как коллоидными, так и кристаллоидными растворами, но в его случае
адекватное восполнение кристаллоидами является лучшим вариантом, поскольку
это связано с меньшими финансовыми затратами. Однако стоит отдавать пред¬
почтение сбалансированной инфузионной терапии, суть которой заключается
в рациональном сочетании коллоидных и кристаллоидных растворов.
СПИСОК ЛИТЕРАТУРЫ
Власов В.В. Эффективность диагностических исследований. — М.: Медицина, 1988. - 253 с.
Кислухин В.В., Кривицкий Н.М Определение параметров гемодинамики по электри¬
ческому сопротивлению крови методом разведения // Медицинская техника. - 1987. -
№1. - С. 3-6.
Кривицкий Н.М., Кислухин В.В., Абакумов В.В. и др. Определение сердечного выброса
методом разведения электроимпедансных индикаторов // Анестезиология и реаниматоло¬
гия. -1988. - №3. - С. 51-52.
Кривицкий Н.М., Кислухин В.В., Максименко В.А. и др. Применение 0,9% раствора
хлорида натрия в качестве индикатора для определения объема циркулирующей крови //
Кровоснабжение, метаболизм и функции органов при реконструктивных операциях. Тезисы
докладов IV Всесоюзной научной конференции. — Ереван. - 1989. — 106 с.
Лебедева Р.Н., Абакумов В.В., Борисова И.В. и др. Современные методы оценки
гемодинамики в условиях отделения интенсивной терапии (сравнительный аспект) //
Анестезиология и реаниматология. — 1989. — №4. — С. 3-8.
Лебедева Р.Н., Абакумов В.В.. Свирщевский Е.Б. Недостаточность кровообращения
У оперированных больных. — Ташкент: Медицина, 1989. — 190 с.
Маршалл Р.Д., Шеферд Дж. Т. Функция сердца у здоровых и больных. — М.: Медицина.
1972. - 391 с.
Рашнер Р.ф. Динамика сердечно-сосудистой системы. — М.: Медицина, 1981. - 600 с.
Bernstein D.P. Noninvasive Cardiac Output Doppler Flowmetry and Gold-Plated assuinp-
tions // Crit. Care Med. - 1987. - Vol. 15. - N 9. - P. 886-888.
Boutros A., Albert S. Effect of dynamic response of transducer-tubing system on accuracy of
|§ blood pressure measurement in patients // Crit. Care Med. — 1983. - Vol. 11. — P. 124.
Brigham K.L., Kariman K., Harris T.R. et al. Correlation of oxygenation with vascular
№neability-surface area but not with lung water in humans with acute respiratory failure and
care unit //
methods of
jjfg J' nicuu L.J., rwUUbUIcUl J.IVI. Cl dl. VjUlUJjai louu Ul шші aiiu muunt methods of
^■nng arterial blood pressure. Part III // Med. Instrum. — 1981. — Vol. 14. — P. 182.
і-щадіагу edema //J. Clin. Invest. - 1983. - Vol. 72. - P. 339.
nnson R., Guild R., Kolts B. Diarrhea and hypoalbuminemia in a medical intensive
^oenterology. - 1985. - Vol. 88. - P. 1336.
^funer Ji M.R., Krenis L.J., Kunsman J.M. et al. Comparison of direct and indirect
^uring arterial blood pressure // Med. Instrum. — 1981. — Vol. 15. — P. 11.
ЭДВДГ I. M R If rente I T Vimcmnn T at ol Глтпогіслп nf HirPTt ЯПГІ ІпИігЛІ
500 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
1
^^ШіМИкпмп GW., Kwun K.B.. Lumb P.D., et al. The axillary artery catheter / / u
1983. I VoL 12. В 1491 630 L«ng. „
Сагтко GJ.. Cantzaro P.G, Shires G.T. Fluid resuscitation following injury: Ratin i
*e of balanced salt solutions // Grit. Care Med. - 1976. — Vol. 4. — P. 46. *°r the
Carrol G.C. Blood pressure monitoring // Grit. Care Clin. — 1998. — Vol. 4. - p 4ц
Deris ILF. Clinical comparison of automated auscultatory and oscillometric and
ЩіШІШШ measurements of arterial pressure //]. Clin. Monit. — 1985. — Vol. 1. - p
Deitcb EA. Winterton J.. Berg R. The gut as a portal of entry for bacteremia // Am, I'
Ш.-VoL 205. - P. 681. " *4 -
Edwards Щ Whittaker S., Prior A Cardiogenic shock without a critically raised left vent •
end diastolic pressure: Management and outcome in eighteen patients // Br. Heart T - 1 oICU*ar
Vol 55, - P. 549. : Щб- -
Eliis Did. Interpretation of beat-to-beat blood pressure values in the presence of ventu
changes //J. CKn. Monit. -1985. - Vol. 1. - P. 65. l3t0r*
Rgueras J.. Weil M.H. Hypovolemia and hypotension complicating management of
cardiogenic pulmonary edema // Am.J. Cardiol. — 1979. — Vol. 44. — P. 1349.
Finch J.S., Reid C.. Bandy K. et al. Compared effects of selected colloids on extravaseular hi
water in dogs after oleic add - induced lung injury and severe hemorrhage // Grit Care Ми) ^
1983. - Vol 11. - P. 267. ~
Fisher M. Anaphylaxis // Dis. Mon. — 1987. — Vol 33. — P. 433.
Forrester J^., Diamond G., Chatteijee K. et al. Medical therapy of acute myocardial infarction
by application of hemodynamic subsets // N. Engl. J. Med. — 1976. — Vol. 295, — P. X356
Gallagher J.D., Moore R A, MCNicholas K. W. et al. Comparison of radial and femoral arterial blood
pressures in children after cardiopulmonary bypass //J. Clin. Monit. — 1985. — Vol. 1. - P. raF
Gardner R.M.. Chapman R.H. trouble-shooting pressure monitoring systems: When do the
numbers lie? if in: Fallat R. G.. Luce J. M. (eds): Clinics in Critical Care Medidne, Cardiopulmonary
Critical Care Management. — NY, Churchill Livingstone, 1988. — P. 145.
Gardner R.M., Hollingsworth K.W. Optimizing the electrocardiogram and pressure monitoring//
Crit, Care Med. - 1986. - Vol. 14. - P. 651.
Gardner R.M. Direct blood pressure measurement — Dynamic response requirements //
Anesthesiology. - 1981. - Vol. 54. — P. 227.
Gravenstein J.S., Paulus D.A. Clinical Monitoring Practice. — 2nd ed. - Philadelphia: JB
Dppincott. 1987.
Guyton A.C., Lindsey A.W. Effect of elevated left atrial pressure and decreased plasma protein
concentration on the development of pulmonary edema // Qrc. Res. — 1959, — Vol. 7. - P. 649.
Harrington D.P. Disparities between direct and indirect arterial systolic blood pressure
measurements // Cardiovasc. Pulmonary Technol. — 1978. — Vol. 6. — P. 4.
Hillis LD.. Firth B.C., Winniford M.D, Analysis of Factors Affecting the variability of Pick
Versus Indicator Dilution Measurements of Cardiac Output // Am.I. Cardiol, - 1985. -
Vol. 56.1 P. 764-768.
Hohn D.C., Makay R.D., Halliday B. et al. The effect of a tension on microbidjdal function of
leukocytes in wounds and in vitro // Surg. Forum — 1976. — V®1.27. — P. 18.
Hutton P., Dye J., Prys-Roberts C. An assessment of the Dinamap 845 // Anaesthesia. -
1984.1 Vol. 39. - P. 261.
Johnson C.J. H., Kerr J.H. Automatic blood pressure monitors. A clinical evaluation of five
models in adults //Anaesthesia —1985. — Vol. 40. — P. 471.
Kaufman B.S., Rockow E.C., Falk J.L. Response to fluid challenge in patients with acute
myocardial infarction and hypovolemia // Clin. Res. — 1988.;— Vol. 31. — P. 824A
MacLean L. D„ Weil M.H. Hypotension in dogs produced by Escherichifl coli endotoxin//Circ.
Res. -1956. - Vol. 4. - P. 546.
McGregor M. Pulsus paradoxus // N. Engl.J. Med. — 1979. — Vol. 301. — P. 480.
Messmer K, Hemodilution // Surg. Clin. North Am. — 1975. — Vol. 55. - P. 659.
Modig J, Effectiveness of dextran 70 versus Ringer’s acetate in traumatic shock and adult
respiratory distress syndrome // Crit. Care Med. — 1986. — Vol. 14. — P. 454. , ,
Moore F.A.. Moore Е.Б.. Jones T.N. et al. TEN versus TPN following major abdominal
treona - Reducing septic mortality //J. Trauma. — 1989. — Vol. 29. — P. 916.
Moore F.A.. Moore E.E.. Jones T.N. et al. The crystalloid versus colloid controversy: Bias, logs
and toss-up //Theor, Surg. - 1989. - Vol. 4. - P. 205.
ИНФУЗИОННО-ТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ 581
Jjg м F-, Yaginuma Т. Wave reflections and the arterial pulse // Arch. Intern- Med- -
144. - P. 366.
^va e., Bachmeier W., Crevoisier J.L. et al. Acute hypoproteinemic fluid overload: Its
P«Pr.nt$ distribution and treatment with concentrated albumin and diuretics // Vox. Sang. -
- P. 307.
da Nonmvasive blood pressure measurement // Med. Instrum. - 1981. - Vol 15. -
,jh о м., McCarthy J.. Wood L.D. H. Treatment of acute low pressure pulmonary edema in
*"7Clin. Invest. - 1981. - Vol. 67. - P. 409.
у V Weil M.H., Michaels S. et al. Pulmonary edema associated with reduction in plasma
pressure //Surg. Gynecol. Obstet. - 1980. - Vol. 151. - P. 344.
MtheCJF., Kim K.C. Measuring systolic arterial blood pressure. Possible errors from extension
of disposable transducer domes // Crit. Care Med. - 1980. - Vol. 8. - P. 683.
i* G.G.. Krovetz L.J. Damped and undamped frequency responses of underdamped
. Zr manometer systems // Am. Heart J. - 1970. - Vol. 80. - P. 226.
shinozaki Т., Deane R.S., Mazuzan J.E. The dynamic responses erf liquid-filled catheter systems
direct measurements of blood pressure // Anesthesiology. -1980. - Vol. 53. - P. 498.
shires G.T.. Cunningham J.N., Baker C.R. F. et al. Alterations in cellular membrane function
rtiiring hemorrhagic shock in primates // Ann. Surg. - 1972. - Vol. 176. - P. 288.
Shies G.T., Williams J., Brown F. Simultaneous measurement of plasma volume, extracellular
я «Л volume and red blood cell mass in man utilizing I131, S5,0, Cr51 //J.Lab. Clin. Med. -1960. -
Vd55.-P.776.
cKjres G T. The role of sodium containing solution in the treatment of oligemic shock // Surg.
din. North Am. -1965. - Vol. 45. - P. 365.
Shires T* Coin D., Carrico J. et al. Fluid therapy in hemorrhagic shock // Arch. Surg. - 1964. -
VoL88.-P.688.
Shoemaker W.C., Appel P.L., Kram H.P. et al. Multicomponent noninvasive physiologic monitoring
of the circulatory function // Crit. Care Med. — 1988. — Vol. 1-6. - N. 5. - P. 482-490.
Shoemaker W.C., Appel P.L., Kram H.B. Prospective trial of supranorma values of survivors as
therapeutic goals in high-risk surgical patients // Chest. - 1988. - Vol. 94. - P. 1176.
Shoemaker W.C., Hauser C.J. Critique of crystalloid versus colloid therapy in shock and shock
teg// Crit. Care Med. - 1979. - Vol. 7. - P. 117.
Shoemaker W.C., Schluchter М., Hopkins J.A. et al. Comparison of the relative effectiveness of
colloids and crystalloids in emergency resusci-tation // Am.J. Surg. — 1981. - Vol. 142. - P. 73.
Shoemaker W.C. Comparison of the relative effectiveness of whole blood transfusions and
various types of fluid therapy in resuscitation // Crit. Care Med. — 1976. — Vol. 4. - P. 71.
Sibbald W.J., Warshawski F.J., Short A.K. et al. Clinical studies of measuring extravascular lung
water by the thermal dye technique in critically ill patients // Chest. — 1983. — Vol. 5. - P. 725.
Stem D.H., Gerson J.I., Allen F.C., et al. Can we trust the direct radial artery pressure immediately
following cardiopulmonary bypass? // Anesthesiology. — 1985. — Vol. 62. — P. 557.
ShmnJA, Carpenter M A, Lewis F.R. et al. Water and protein movemen in the sheep lung after septic
shock: Effect of colloid versus crystalloil resuscitation //J. Surg. Res. —1979. — Vol. 6. — P. 233.
Veremakis C., Hafloran Т.Н. The technique of monitoring arterial blood pressure // J. Crit.
illness. -1989. - Vol. 4 (10). - P. 82.
Weil М.И., Henning R.J. New concepts in the diagnosis and fluid treatment of circulatory
^//Anesth. Analg. - 1979. - Vol. 58. - P. 124.
Wise R. Effect of alterations of pleural pressure on cardiac output // South MedJ. - 1985. -
Vol78.-P.423.
Youngberg J.A., Miller E.D. Evaluation of percutaneous cannulations of the dorsalis pedis
ЩЦ Anesthesiology. - 1976. - Vol. 44. - P. 80.
&rins C.K., Rice C.L., Peters R.M. et al. Lymph and pulmonary response to isobaric reduction
111 plasma oncotic pressure in baboons // Circ. Res. — 1978. — Vol. 43. — P. 925.
Глава 17
КИСЛОТНО-ОСНОВНОе paSNQRPnu
и водно-электролитный бал?
ОБЩИЕ ПОЛОЖЕНИЯ
Среди физико-химических показателей организм
шее место принадлежит кислотно-основному равновег Ва>КНей-
крови. От соотношения концентраций ионов Н+ и ОН' к
сят активность ферментов, интенсивность окислительРн0ВИЗави-
новительных реакций, процессы расщепления и синтеза R°CCTa'
окисления углеводов и липидов, чувствительность кл °В’
рецепторов к медиаторам и гормонам, проницаемость щ^НЬ1х
мембран, физико-химические свойства коллоидных системк*Щ
и межклеточных структур И Т.Д. :лет°й
Водород - наиболее распространенный атом во всех клетк
главным образом в составе воды. Ион водорода (Н+) играет од*’
ную роль в образовании кислот и оснований, его концентрация
должна находиться в строгих пределах, иначе клетки погибнут
Это связано в основном с действием Н+ на форму и функции белков
и активных ферментов. Основание является донором ионов водо¬
рода, а кислота — акцептором.
Большая часть ионов водорода образуется в результате метабо¬
лизма углеводов (С6Н1206+602-^6С02+6Н20), жиров и белков.
Другим важным продуктом обмена веществ является углекислый
газ (С02), оказывающий влияние на концентрацию Н+. Углекислый
газ называется кислотой, хотя к нему и не присоединен Н+, посколь¬
ку С02 вступает в реакцию с водой с образованием углекисло¬
ты (Н,С03); углекислота диссоциирует с образованием протонов
и является, таким образом, ведущим фактором закислення среды:
С02+Н20оН2С03<=>Н++НС03-.
При постоянной температуре давление газа над поверхно
стью жидкости определяется количеством нерастворенного газа.
Поскольку воздух представляет собой смесь газов, давление
го газа пропорционально его молекулярной концентрации и на
вается парциальным давлением. ^
При растворении углекислого газа в воде происходят Д®а ^
ных события. Небольшое количество углекислого газа пРев^аовоту
в углекислоту, количество которой прямо пропорционально т’ н1до
углекислого газа в растворе и, следовательно, парциальному д‘ Ha4lt-
С02 (рССд. Углекислота является слабой кислотой и лии!^В та-
тельной степени диссоциирует на ионы водорода и бикар
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ И ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНС 583
___ приводит к тому, что повышение давления С02 в альвеолах увеличивает
С02 в легочных капиллярах, а также количество углекислоты во внекле-
* 1 жидкости, и наоборот.
фактором образования водородных ионов является соотношение оки-
иного И восстановленного гемоглобина (превращение двухвалентного железа
^"валентное, и наоборот):
2Fe+* + 1/202 + 2W о 2Fe+++ + Н20.
РОЛЬ ВОДОРОДНОГО ИОНА В КИСЛОТНО-ОСНОВНОМ
РАВНОВЕСИИ
Проблема КОР — это, прежде всего, проблема иона водорода, поэтому основ¬
ами вопросами являются: где образуется, какую реакцию вызывает и как выво¬
дится этот ион. Нормальная концентрация водородных ионов настолько важна
-до организма, что самые незначительные изменения в скорости его образо-
ания или выведения приводят к серьезным нарушениям общего гомеостаза
оргзнизмз.
Баланс ионов водорода в организме
Накопление
• СО - 13 ООО ммоль/сут.
• Лактат - 1500 ммоль/сут.
І Белок, S04-, Р04 - 45 ммоль/сут.
I фосфолипиды — 13 ммоль/сут.
І Другие причины — 12 ммоль/сут.
Удаление
I Легкие — 13 ООО ммоль/сут.
§ Печень/почки — 1500 ммоль/сут.
§ Титрационные кислоты — 30 ммоль/сут.
I NH/ - 40 ммоль/сут.
Можно видеть, что основным источником ионов водорода в клетке являет¬
ся углекислый газ, накапливающийся в результате распада жиров и углеводов.
В свою очередь, их накопление происходит при диссоциации органических кислот,
метаболизации белков, преобразования неорганических кислот, фосфолипидов
или вследствие других причин. При условии адекватной работы механизмов ком¬
пенсации соотношение между накопленными и удаленными Н* находится в равно¬
весии. Так, С02 выделяется легкими, лактат метаболизируется печенью и частично
выделяется почками. Почками также удаляются (в виде титрационных кислот
и аммония) ионы водорода, накопленные при метаболизации белков, диссоциа¬
ции неорганических кислот, фосфолипидов и т.п.
Основные причины накопления водородных ионов следующие:
І дефицит выведения С02;
І неадекватное снабжение клеток кислородом (накопление молочной кислоты
и увеличение продукции С02 в клетках);
• аномальное образование кислот;
І неадекватное выведение кислот почками.
Первая причина обусловлена неадекватной функцией легких. Так, если легкие
не я состоянии полностью вывести накопленное количество С02, то соединенный
с водой углекислый газ образует угольную кислоту, которая вследствие диссоциа¬
ции образует ионы водорода и бикарбоната, т.е. реакция будет сдвинута вправо —
количество водородных ионов увеличится;
С02+Н20оН2С03->Н*+НС03-
Вторая причина главным образом обусловлена неадекватным снабж
«к кислородом, результатом чего становится интенсивное накоплениеЄНИЄМ Кле'
кислоты. В результате диссоциации кислоты образуются ионы водород Мол<?чЧой
та. Кроме того, вследствие накопления углекислого газа в клетках сскггГ Лакта-
между продукцией СО, и потреблением О, в организме увеличиваетг^°ШеЙ
іением и2 в организме увеличивает™ сНие
0.8 (продукция С02=200 мл/мин- потгїЛее
' ,10ТРебленв.
тогда как в норме оно составляет
О 250 мл мин). —нтиленщ.
Третья причина обусловлена накоплением органических и неорга
I быстрее, чем возможна их нейтрализация. Нических
Четвертая причина обычно наблюдается у больных с хронической п
недостаточностью, вместе с тем острая почечная недостаточность такого ЧН0І*
не оказывает, поскольку общее выделение почками водородных ионов ЦВЛИЯНИ|>
шает 100-200 ммоль/сут. Не пРе»ы-
Концентрацию водородных ионов измеряют в нмоль/л, для клинических цел "
Віет pH
ийе диссоциации наиболее мощной буферной системы (угольной кислоты/б”0*
боната). отражающее контроль за КОР крови. Итак: икаР'
используют отрицательный логарифм ионов водорода - величину pH. Расч
проводят по уравнению Гендерсона-Хассельбаха, в его основу положено состоя1
рН рК + lgHC03
оС02 х рС02
где рК і 6,10: аСО, - константа растворимости углекислого газа =0,03 ммоль/л
на мм рт.ст. /л
Данное уравнение можно записать следующим образом:
pH =6,1 + lg
рС02 х 0,03
Нормальная концентрация актуального бикарбоната (НСО ) составляет
27 ммоль/л. нормальная величина рС02 = 40 мм рт.ст. - (40 х 0,03 = 1,35).
pH =6,1 + lg = 6,1 + lg(20 = 1,3)-
В конечном итоге получается: pH т 6,1 + 1,3 = 7,40.
Именно изменение величины pH 7,40 характеризует нарушения КОР крови: его
уменьшение свидетельствует о накоплении Н+ и называется ацидозом, увеличение
указывает на уменьшение Н* и называется алкалозом.
Соотношение между концентрацией водородных ионов и pH следующее:
при pH 7,40 концентрация водородных ионов составляет 40 нмоль/л; каждое
увеличение pH на 0,01 ед. снижает, а снижение увеличивает концентрацию водо¬
родных ионов на 1 нмоль/л.
ЗАКОН ПОДДЕРЖАНИЯ ПОСТОЯНСТВА pH
Организм всегда стремится к удержанию pH в строгих пределах, что создается
и поддерживается тремя основными механизмами: вне- и внутриклеточным буфе¬
рированием. респираторной регуляцией С02 путем изменения частоты и глубины
дыхания, почечной регуляцией концентрации ионов бикарбоната (НС03) и выде¬
ления Н*.
Основные компенсаторные механизмы, нормализующие pH
ПЛАЗМА
Наиболее мощной в плазме является система «угольная кислота-бикарбонат»'
Только Щ чистого СО, переносятся плазмой в растворенном виде, 20% — транслор
тируются в эритроцитах, остальные 75% СО , переносятся кровью как бикарбонат.
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ И ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНС 585
*»» кислота/бикарбонат
(Н"+НС03 -<=>Н2С03оС02+Н20),
буферная мощность =65%.
избытке ионов водорода указанная реакция сдвигается вправо и образую*
Ji вследствие диссоциации угольной кислоты углекислый газ удаляется лег-
#1СЯ ' избытке ионов НСОз - реакция сдвигается влево, при этом усиливается
кИ1*И еиие почками бикарбоната, а концентрация Н’ увеличивается.
5 е»<и
(Н*+белок-»НБ),
буферная мощность =5%.
поскольку концентрация белков в плазме невелика, их буферная мощность
чительна. Однако в клетках они играют существенную роль при переносе
щУ межДу вне- и внутриклеточным пространством.
(Н*+НР04->Н2Р04),
буферная мощность =1%.
Небольшая концентрация фосфатов в плазме определяет их низкую буферную
мощность, вместе с тем основная их роль как буферных механизмов проявляется
в клетках и почках.
ЭРИТРОЦИТЫ
Н++НЬ-->ННВ,
буферная мощность =29%.
Особой по силе является гемоглобиновая буферная система. В эритроцитах
с помощью фермента карбоангидразы С02 соединяется с водой, образуя угле¬
кислоту, которая сразу диссоциирует на Н+ и НС03_. Ион водорода, как было
указано выше, соединяется с восстановленным гемоглобином. Ион бикарбоната
соединяется с калием, образуя бикарбонатную соль КНССк. Ионы бикарбоната
накапливаются в эритроцитах и при снижении их концентрации в плазме пере¬
ходят в КНС03 '> К* + НС03~ -> в плазму. При этом в эритроциты входят ионы
хлора, соединяясь с калием, таким образом, клетка остается нейтральной (плазма:
й‘->эритроциты->КСЬ). Кроме того, буферная емкость гемоглобина увеличива¬
ется содержащимся в нем белком.
Необходимо отметить буферную роль окисленного и восстановленного гемо¬
глобина. Буферирование осуществляется частью гемоглобиновой молекулы, назы¬
ваемой имидазольной группой, присоединение же кислорода происходит с помо¬
щью железосодержащей группы. Каждая из имидазольных групп может отдавать
ми присоединять ионы водорода в зависимости от того, присоединяет или отдает
Другая часть молекулы кислорода.
Окисленный гемоглобин ведет себя как кислота, увеличивая концентрацию Н\
а восстановленный — как основание, нейтрализуя Н*. Чем ниже насыщение веноз-
н°и крови кислородом, тем выше в ней величина восстановленного гемоглобина,
а следовательно, концентрация бикарбоната и величина BE также будут более
высокими, чем в артериальной крови.
Время действия механизмов компенсации нарушений КОР крови:
* инеклеточного буферирования - 10-15 мин;
Cfg КЛИНИЧЕСКАЯ ТМНСФУЗИОЛОГИЯ
• внутриклеточного буферирования - 2-4 ч;
І респираторной компенсации - 3-5 ч (максимально — 12-24 ч);
• почечной (метаболической) компенсации - 6-18 ч (максимально - 5-7
Механизм внеклеточной компенсации нарушений pH вступает в действие^^
тнчески мгновенно, если же его сила недостаточна для возвращения pH к ,Прак"
тоиачинают работу три следующих механизма, причем внутриклеточное буфе°РМе’
цине проходит на фоне респираторной и почечной компенсации. Легкие дост^0'
быстро проявляют свое действие, усиливая или снижая выведение СО . Почеч ^
механизм компенсации более медленный, он как бы делится на три стадии. НЫЙ
1 Первая І буферирование: при преобразовании монофосфата в дифопь*.
с последующим его соединением с ионами натрия или хлора и выделен
в мочу (Н +НР04 -*Н2Р041) экскретируется 20-30 ммоль ионов водорГ"
в сутки.
• Вторая I при соединении аммиака с ионами Н* формируется амм
ний. он соединяется с ионами натрия или хлора и выделяется с мочо"
(H'+NH,’->NH44), в сутки экскретируется 30-50 ммоль водородных ионов*
В условиях выраженного метаболического ацидоза таким способом может
выводиться до 700 ммоль Н* в сутки.
• Третья і реабсорбция бикарбоната. В почках с помощью фермен¬
та карбоангидразы углекислый газ соединяется с водой, образую¬
щаяся угольная кислота диссоциирует на ионы водорода и бикарбоната
^рН20->НгС03->Н+1+НС03-->).
Ионы водорода нейтрализуются путями, указанными в первой и второй стадии
а ионы бикарбоната остаются в организме. Почками реабсорбируется и возвра¬
щается в кровь 85-90% фильтруемого бикарбоната. Недостаток ионов водорода
в организме компенсируется почками, в основном именно на третьей стадии,
таким образом, бикарбонат не возвращается в кровь, а экскретируется с мочой,
кроме того, снижается экскрекция аммония и хлора.
ОБОЗНАЧЕНИЕ ОСНОВНЫХ ПОКАЗАТЕЛЕЙ КИСЛОТНО-ОСНОВНОГО РАВНОВЕСИЯ
pH І кислотность капиллярной или смешанной венозной крови, определяемая
без доступа воздуха при температуре 37 °С, измеряется в единицах (ед.).
рСО, - парциальное давление С02 артериальной, капиллярной или смешанной
венозной крови, определенное без доступа воздуха при температуре 37 °С, изме¬
ряется в мм рт.ст.
АВ I актуальное (истинное) содержание бикарбоната в плазме, рассчитанное
при истинных рС02 и насыщении крови кислородом, измеряется в ммоль/л.
SB - стандартный бикарбонат, рассчитанное содержание бикарбоната в плазме
при насыщении крови кислородом составляет 100%, рСО2=40 мм рт. ст., и темпе¬
ратуре 37 °С, измеряется в ммоль/л.
(ВЕ-В) - рассчитанный истинный избыток (дефицит) оснований крови,
а именно количество сильного основания или кислоты, необходимой для того,
чтобы вернуть pH к норме при рСО2=40 мм рт.ст. и температуре 37 °С, измеряется
в ммоль/л.
(BE-ECF) 1 рассчитанный стандартный избыток оснований во всей внеклеточ¬
ной жидкости, измеряется в ммоль/л.
ТС021 рассчитанная общая концентрация углекислого газа, представляющая
собой все формы, в виде которых он находится в организме (газообразную, НС0}.
H_C0V физически растворенную и связанную с белками), измеряется в ммоль/л.
ВВ сумма буферных оснований. Показатель, определяющий связь между КОР
и электролитами, непосредственно участвует в поддержании закона электронеи
тральиости. Величина ВВ складывается из суммы бикарбоната и белка, измеряется
I ммоль/л.
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ И ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНС 587
* 17-1 представлены нормальные величины показателей КОР крови
втв®"
«7-1. Нормы показателей кислотно-основного равновесия крови
rjflpr- .
Показатель
Величина
он
7,35-7,45*
^рСО,
35-45 мм рт.ст.
^ ~ АВ
22-28 ммоль/л
'Ф*7"' SB
21-25 ммоль/л
ВЕ-В
±2,5 ммоль/л
BE-ECF
±2.9 ммоль/л
ТС02
24-33 ммоль/л
вв
45-50 ммоль/л
ГрХпентные величины pH: для недоношенных новорожденных в течение 48 ч - 7.35-7,50;
' пшенных детей при рождении - 7,11-7.36; через 5—10 мин - 7,09-7,30; через 30 мин -
721-738; ЧЄрЄз 60 мин - 7,26-7,49; 1 сут - 7.29-7,45. Для взрослых старше 60 лет - 7,31-7,42;
сяфше90 лет - 7,26-7,43.
Пределы значения pH крови в организме обычно составляют 7,35-7,45 ед„ они
являются наиболее жесткими из всех известных гомеостатических показателей.
Даже небольшие их отклонения влекут нарушение жизненно важных физиологи¬
ческих процессов. Так, сдвиг pH на 0,1 ед. сопряжен с нарушениями дыхательной
и сердечно-сосудистой систем, снижение pH на 0,3 ед. вызывает ацидотическую
кому, а на 0,4 ед. — как правило, состояние, несовместимое с жизнью.
В зависимости от величины pH нарушения КОР крови существуют в двух видах:
ацидоз I при снижении pH менее 7,35 и алкалоз — при увеличении pH более 7,45.
Причины нарушения КОР крови следующие.
І Метаболические (ацидоз или алкалоз), когда изменяется концентрация осно¬
ваний при сохранной скорости образования и выведения С02.
[ Респираторные (ацидоз или алкалоз), характеризующиеся нарушением соот¬
ношения между количеством образованного и выведенного С02 при неизме¬
ненной метаболической концентрации ионов бикарбоната.
Определив все четыре основных нарушения КОР крови, необходимо отметить
следующее. В чистом виде как метаболические, так и респираторные нарушения диа¬
гностируются достаточно непродолжительное время, поскольку, как было указано
выше, быстро вступают в действие механизмы компенсации. Обычно метаболический
ацидоз компенсируется респираторным алкалозом, а метаболический алкалоз —
респираторным ацидозом, и наоборот. Первичные метаболические и респираторные
нарушения крови могут протекать одновременно, при этом они оказывают противо¬
положное влияние на величину pH крови, так что (не видя больного) по этому пока¬
зателю бывает трудно определить, какое из нарушений первично.
Вместе с тем необходимо помнить, что любая компенсация направлена лишь
на нормализацию pH, поэтому при величине pH выше или ниже 7,40 нарушения
КОР будут смешанными, и именно с такими нарушениями чаще всего приходится
ктречаться в клинической практике.
Отсутствие или наличие респираторных нарушений на фоне метаболических
Достаточно легко диагностируется по разнице между актуальным и стандартным
оикарбонатом, поскольку основная часть ионов НС03 переносится в виде уголь¬
ной кислоты;
• актуальный бикарбонат равен стандартному — респираторных нарушений нет,
* актуальный бикарбонат выше стандартного — имеется респираторный ацидоз;
■ бальный бикарбонат ниже стандартного — имеется респираторный алкалоз.
ВВ КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Ям опенки нормальной компенсации нарушении КОР крови проводят^
а основании разницы между измеренными и нормальными величинами рс£
чкяттшжо бикарбоната, который представлен в табл. 17-2. При мета©
Шшнюоэе или алкалозе величина реального изменения рС02 указывав
Тяпт нарушений. Если эта величина равна расчетной (ДрСО;), наруШе^
полностью компенсировано. Если же изменение рС02 ниже или выше расчетной
аачнны. это свидетельствует о наличии наряду с метаболическими и респи-
миашмт нарушений. При остром либо хроническом респираторном ацидоз»
■ли алкалозе аналогично оценивают величину дельты актуального бикарбоната
если она выше или ниже расчетной величины, то наряду с респираторными прИ-
§ г и метаболические нарушения КОРкрош^^^^^^^^^І
Таблица 17-2. Нормальная компенсация нарушений кислотно-основного равновесия крови
Вид
нарушения
Степень
компенсации
Время
ПОЛНОЙ компенсации
[ Метаболический ацидоз
ДрС02=ДНС03х1,2
12-24ч і
| Метаболический алкалоз
ДрС02=ДНС03хО,9
12-24 ч~~" ~~
[Острый респираторный ацидоз
ДНС03=ДрС02х0.07
Минуты
I Хронический респираторный ацидоз
ДНС03=ДрС02хО,4
3-5 сут
Острый респираторный алкалоз
ДНСО3=ДрСО2х0,2
Минуты
Хронический респираторный алкалоз
ДНСО3=ДрСО2х0,5
2-3 сут
ВЗАИМОСВЯЗЬ КИСЛОТНО-ОСНОВНОГО РАВНОВЕСИЯ КРОВИ
И ВОДНО-ЭЛЕКТРОЛИТНОГО БАЛАНСА
Кислотно-основное равновесие нельзя рассматривать отдельно от водно-
электролитного баланса, поскольку они тесно связаны тремя основными законами.
Первый, физиологический закон (организм всегда стремится к поддержанию посто¬
янной величины pH), был разобран выше. Два следующих закона физико-хими¬
ческие:
І закон электронейтральности - сумма положительных зарядов катионов
всегда должна быть равна сумме отрицательных зарядов анионов;
1 закон изоосмоляльности — осмоляльность во всех жидкостных средах долж¬
на быть одинаковой.
ЗАКОН ЭЛЕКТРОНЕЙТРАЛЬНОСТИ
Этот закон определяет соотношение анионов и катионов в растворе, а пото¬
му очень важен для интерпретации параметров КОР и электролитного баланса
крови. Диаграмма Gamble иллюстрирует закон электронейтральности для плазмы
(табл. 17-3).
Таблица 17-3. Диаграмма соотношения катионов и анионов в плазме
Катионы -151 мЭкв/л (+)
Анионы -151 мЭкв/л (-)
Na=l40
К-4,5
Са=5,0
Мд=1,5
L..
CL=100
НС03=24
>ВВ = 39
белок =15
остаточные анионы *12
Как можно видеть, суммы катионов и анионов равны. Основным катионом
является натрий, основным анионом — хлор. Сумма бикарбоната и белка состав'
ЛЯЄТ буферные ОСНОВаНИЯ (ВВ), ЯВЛЯЮЩИеСЯ СВЯЗуЮЩИМ ЗВеНОМ МеЖДУ КИСЛОТНО'
основным равновесием и электролитным балансом. Конечно, связующим звеном
можно считать и просто ион бикарбоната, однако эта величина сильно зависит
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ И ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНС 589
внЯ рС02 и поэтому не может точно отражать метаболические нарушения
о* ^фови. Указанную диаграмму можно выразить уравнением:
BBsNa’-Cl'.
Величина ВВ в левой части уравнения отражает метаболическое состояние КОР,
правой - концентрацию двух наиболее важных для плазмы электролитов.
а 1 ли можно более наглядно продемонстрировать связь между КОР и электро¬
дным балансом.
В клинической практике вместо буферных основании для оценки метаболиче-
ого компонента КОР принято использовать величину избытка (дефицита) осно¬
вний, обозначаемую символом BE. Этот показатель тоже можно рассчитать, зная
концентрацию наТрИЯ> хлора и нормальную величину ВВ:
BE=BB-NBB или BEsNa‘-Cl -NBB.
Таким образом, если у постели больного необходимо быстро оценить, име¬
ются ли метаболические нарушения КОР, но при этом нет возможности сделать
полный анализ, достаточно провести указанный расчет. Вместе с тем необходимо
помнить, что такой расчет величины BE можно проводить при условии неизменен¬
ной концентрации остаточных анионов.
На величину остаточных (ОА) или резидуальных (R) анионов хотелось бы
обратить особое внимание, поскольку этот показатель весьма информативен
для оценки метаболических нарушений КОР крови, обусловленных накоплением
в организме недоокисленных продуктов обмена. Общая сумма остаточных анио¬
нов в норме равна 8-16 мЭкв/л.
Величину остаточных анионов можно рассчитать из разницы между концентраци¬
ей натрия и суммой концентраций хлора и актуального (истинного) бикарбоната:
OA=Na*- (Cl+НСО3 ).
Вместе с тем следует обратить внимание, что, несмотря на небольшую концен¬
трацию в плазме, ион калия играет весьма существенную роль в изменении КОР
крови (см. ниже), поэтому более правильно проводить расчет остаточных анионов
с учетом этого катиона:
ОА= (Na++K+) - (Cl + НСО3 ) = мэкв/л.
Необходимо отметить также, что изменения концентрации наиболее важных
электролитов плазмы (калия, натрия, кальция, магния и хлора) или обусловлены,
или же сами являются непосредственной причиной развития либо увеличения
степени нарушений КОР крови.
ЗАКОН изоосмоляльности
Данный закон гласит, что осмоляльность во всех жидких секторах орга¬
низма должна быть одинаковой. Осмоляльность плазмы в норме составляет
286+2 мосмоль/кг и является весьма стабильной величиной. Увеличение или сни¬
жение этого показателя даже на 2 мосмоль/кг вызывает резкое изменение вне-
и внутриклеточных перемещений воды. В свою очередь, стремление уравновесить
ее изменения в водных секторах сопровождается увеличением активности АДГ
и альдостерона, что может приводить к нарушениям важных параметров гемоди¬
намики и гомеостаза.
Основной вклад в осмоляльность плазмы вносят натрий и хлор (табл. 17-4), вто¬
рые по значимости — кислоты и белок, меньшее влияние оказывают глюкоза, моче¬
вина и электролиты. Диагностическая значимость осмоляльности плазмы весьма
велика при решении вопроса о введении различных кровозамещающих растворов.
590 КЛИМГССКАЯ ТРАНСФУЗИОЛОГИЯ
Таблица 17-4. Компоненты, определяющие величину осмоляльности плазмы, мосмоль/кг
[нгряй
140 рЬЩ
НИ
98
бикарбонат
18
Калий, кальций, магний
6
Глюкоза
5 _ ~ ШІ
Мочевина
3
Белок, кислоты
16 " ■
Итого, мосмоль/кг
286
Компоненты, определяющие величину осмоляльности мочи:
мочевина — 555
натрий + хлор — 200
калий + хлор — 140
895 мосмоль/кг.
В противоположность плазме осмоляльность мочи колеблется в довольно широ¬
ких пределах - 550-950 мосмоль/кг. Эта величина в основном обусловлена содер¬
жанием мочевины и в меньшей степени — электролитов. В связи с этим для диагно¬
стики нарушений функционального состояния почек главным образом используют
не величину осмоляльности мочи, а ее соотношение с осмоляльностью плазмы.
Причины увеличения осмоляльности:
• гипернатриемия;
• увеличение концентрации глюкозы и мочевины;
• гипоксия;
• дегидратация.
Причины снижения осмоляльности:
• избыточное количество воды (гипергидратация);
• гипонатриемия;
• сочетание гипергидратации с гипонатриемией.
Таким образом, только оценка всех трех законов, связывающих КОР крови и вод¬
но-электролитный баланс, позволяет правильно дифференцировать их нарушения.
Ключевым фактором, определяющим последовательное нарушение КОР крови
и водно-электролитного баланса, является кислородный дисбаланс, наблюдаемый
в различной степени у всех больных в критическом состоянии. Именно поэтому
в современных газоанализаторах обязательно имеются электроды, определяю¬
щие лактат и глюкозу - два важнейших метаболита, непосредственно влияющих
на нарушение гомеостаза. В связи с этим адекватная коррекция смешанных нару¬
шений КОР крови возможна только при правильной оценке причин, их вызвав¬
ших, особенно если эти нарушения обусловлены дефицитом кислорода в орга¬
низме, что часто наблюдается во время крупных хирургических вмешательств
и в отделениях интенсивной терапии.
ВЛИЯНИЕ ГЕМОТРАНСФУЗИИ НА НАРУШЕНИЯ
КИСЛОТНО-ОСНОВНОГО РАВНОВЕСИЯ
И ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНС КРОВИ
Трансфузии более 1000 мл кристаллоидных растворов вследствие разведения
приводят;
I к снижению кислородной емкости крови, т.е. дисбалансу кислорода в Ш
низме, развитию гипоксии и накоплению токсичного лактата;
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ И ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНС 501
, уменьшению концентрации НС03~, что способствует развитию метаболиче¬
ского ацидоза,
, снижению концентрации важнейших электролитов (натрия, калия, кальция,
хлора и др.);
g нарушения гемостаза и, как следствие этого, усиленной интраоперационной
кровопотере, требующей значительных переливаний компонентов донор¬
ской крови.
Последствия избыточной гемотрансфузии проявляются:
I I гипоксии вследствие сдвига кривой диссоциации оксигемоглобина влево
(укрепления связи НЬ с кислородом) и затрудненной отдачи 02 тканям;
« снижении НС03_, что способствует развитию метаболического ацидоза,
сопровождающегося увеличением концентрации калия в крови;
, увеличении концентрации свободного гемоглобина (гемолиза) в плазме;
, нарушении вязкости крови и функциональных свойств эритроцитов,
что определяется развитием тромбов на уровне микроциркуляции и может
способствовать ДВС-синдрому.
Избыточные гемотрансфузии, сопровождающиеся указанными нарушениями
гомеостаза, оказывают непосредственное влияние на частоту и степень развития
органной и полиорганной недостаточности в раннем послеоперационном периоде.
Существуют следующие данные.
І Переливание более 1500 мл эритроцитной массы может сопровождаться
в 55% случаев нарушением оксигенирующей функции легких; в 35% - выхо¬
дом свободного гемоглобина в плазму (гемолизом); в 45% — почечной недо¬
статочностью.
І Переливание более 2000 мл донорской плазмы может способствовать в 69%
случаев нарушению оксигенирующей функции легких; в 45% — печеночно-
почечной недостаточности; в 35% — нарушениям функций поджелудочной
железы.
• Гемотрансфузии, включающие переливание более 3500 мл различных ком¬
понентов донорской крови, всегда сопровождаются полиорганной недоста¬
точностью двух и более органов. Так, в 88% случаев отмечают нарушение
оксигенирующей функции легких; в 68% — почечную недостаточность;
в 55% - печеночную недостаточность; в 45% — нарушение функции подже¬
лудочной железы; в 35% — сердечно-сосудистую недостаточность.
Степень органной и полиорганной недостаточности вследствие массивных
гемотрансфузий бывает различной, однако, даже быстропроходящая, она значи¬
тельно утяжеляет клиническое состояние больного.
ПРИБОРЫ ДЛЯ ОПРЕДЕЛЕНИЯ КИСЛОТНО-ОСНОВНОГО
РАВНОВЕСИЯ КРОВИ И ВОДНО-ЭЛЕКТРОЛИТНОГО БАЛАНСА
Современная концепция лабораторной экспресс-диагностики неотложных
состояний основана на понятии РОСТ (Point-of-Care-Testing), т.е. на анализе
«непосредственно у постели больного». В интенсивной практике концепция РОСТ
подразумевает работу анализаторов КОР, газов крови, электролитов, метаболитов
(лактата и глюкозы), ко-оксиметров непосредственно в операционной, отделении
интенсивной терапии, отделении гемодиализа и т.п.
Для этого анализаторы должны отвечать следующим требованиям: быть пор¬
тативными, простыми в обслуживании, давать простор для работы, брать малый
°пьем пробы крови, получать анализ в течение 2-3 мин после введения крови.
Измерение трех параметров - pH, р02, рС02 в артериальной крови необходимо
любом стационаре при хирургической активности и наличии отделений реани-
Мачии. В большинстве развитых стран необходимость измерения этих параметров
ГЛАВА Ш
592 клиническая іщптигаишгаї и*
I в качестве стандарта доказательной медицины, а подчас и закреплена
эиюнодательно как неотложный минимум. В частности, измерение уровня рсо
необходимо для констатации диагноза «смерть мозга» при проведении теста
апноэтической оксигенации.
Потребность стационаров в измерении параметров золотого стандарта реша¬
ется инсталляцией базовых классических моделей газоонализаторов (например
ABL фирмы Radiometer Medical, Дания; Compact фирмы Roche, Швейцария; Bayer
248 фирмы Bayer. Германия). Кроме того, в этих приборах наряду с измерением
шов крови и параметров КОР измеряют уровень основных электролитов (сК\
cNa* сСа*\ сС1), а также ургентные метаболиты (лактат, глюкозу). По данным
производителей, стоимость одной пробы в данных анализаторах составляет от 0,5
до 1,0 доллара США.
Друше классы анализаторов отличаются портативностью и мобильностью,
а также в ряде случаев возможностью работать автономно от электрической сети:
паковые модели, где жидкие реагенты в смеси с летучими газами упакованы
в контейнеры (газоанализатор Easy Blood Gas фирмы Medica или рНОх/рНОх Plus
фирмы Nova Biomedical, США);
картриджные модели с применением вместо долгоживущих электродов однора¬
зовых картриджей или сенсорных кассет, рассчитанных на определенное количе¬
ство измерений (газоанализатор Rapid Point фирмы Вауег, Германия; Gem Premier
3000 фирмы Instrumentation Laboratories, США; NPT7 фирмы Radiometer Medical,
Дания).
Однако стоимость измерения одной пробы на этих портативных анализаторах
составляет не менее 3 долларов США, а при применении одноразовых кассет
или картриджей - свыше 7-10 долларов США (например, портативный анализа¬
тор i-STAT фирмы Abbott, США; MiniGastat фирмы TechnoMedica, Япония).
СПИСОК ЛИТЕРАТУРЫ
Дементьева И.И. Исследование кислотно-основного равновесия // Клиническая лабора¬
торная аналитика / Под ред. В. В. Меньшикова. — М.: Москва, 2000. — Т. 3. — С. 349-361.
Дементьева И.И. Лабораторная диагностика и клиническая оценка нарушений гомеостаза
у больных в критическом состоянии. — М.: УПК МИПК «POLIGRAFueHTp», 2007. — 162 с.
Коровкин Ф. Биохимические показатели в клинике внутренних болезней. - М.:
МЕДпресс-информ, 2002. - 208 с.
Bakker I., Vincent J.-L. The oxygen dependency phenomenon is associated with increased blood
lactate levels //J. Crit. Care. - 1991. - Vol. 1. - N 6. - P. 152-159.
Goldberger E.A Primer of water, electrolyte and acid-base syndromes. — Philadelphia, 1985. -
704 p.
Глава 18
Кровопотеря и принципы
ее компенсации в экстренной
хирургии
Во все времена существования человечества лечение кровопотери
оставалось и остается важнейшей проблемой. Некомпенсированная
кровопотеря занимает второе место в структуре смертности людей
в возрасте от 5 до 44 лет, уступая только черепно-мозговой травме,
в общей структуре смертности на долю острой кровопотери при¬
ходится 10%. Вот почему эффективное лечение острой кровопотери
остается одним из важнейших направлений медицины.
С проблемой компенсации острой кровопотери могут столкнуть¬
ся врачи практически любой специальности, поэтому крайне важно
иметь четкое представление о патогенезе кровопотери, основных
принципах ее диагностики и лечения.
Величина кровопотери зависит от многих факторов: характе¬
ра и объема оперативного вмешательства, особенностей системы
коагуляции пациента, локализации и тяжести повреждений, про¬
должительности кровотечения (табл. 18-1). В экстренной хирургии
кровопотеря чаще всего сопровождается травмой, но она может
возникать и при ряде заболеваний, таких как, например, язвенная
болезнь или аневризма брюшной аорты.
Таблица 18-1. Объем кровопотери при плановых хирургических вмешательствах
и травме различной локализации
Локализация
Объем
кровопотери, мл
Плановые хирургические вмешательства
Легкие, пищевод
400-1000
Сердце
200-1500
Желудок
400-1300
Кишечник
300-600
Печень (без повреждения магистральных сосудов)
1000-4000
Печень (с повреждением магистральных сосудов)
5000 и более
Щитовидная железа
200-1000
Вентральные грыжи (большие и гигантские)
300-1500
Крупные трубчатые кости и тазобедренный сустав
800-2500
Позвоночник
1500-2500
Травма
Гемоторакс
1500-2000
Перелом одного ребра
200-500
$14 КЛИНИЧЕСКАЯ ГНАНСФУЗИОЛОГИЯ
Окончание тщ 1я
Локализация
Объем '
кровопотери Чп
Травма живота без повреждения печени и магистральных сосудов
До 200?)
Трем печени
До 5000
Перелом костей таза
3000-5000 ~~
Перелом бедра
1000-2500
1 Перелом плеча или голени
500-1500
Перелом костей предплечья
200-500
Перелом позвоночника
500-1500
Скальпированная рана размером с ладонь
500
Не всегда кровотечение сопровождается четкими клиническими признаками.
На клиническую картину влияют алкогольная или наркотическая интоксикация
переохлаждение, прием ряда лекарств (бета-адреноблокаторов, седативных пре¬
паратов), что неоспоримо затрудняет диагностику. Принято считать, что класси¬
ческая развернутая картина шока развивается при кровопотере более 40% объема
циркулирующей крови (ОЦК):
і нарушения сознания (от возбуждения до комы);
і бледные и влажные кожные покровы;
• артериальная гипотензия и низкое пульсовое давление;
і тахикардия;
I одышка;
і холодные конечности, слабый пульс, отсутствие сигнала при пульсоксиме-
трии;
• снижение темпа диуреза;
• увеличение времени наполнения капилляров;
• снижение тургора кожи;
• прогрессирующая анемия;
• повышение осмолярности плазмы;
і ацидоз, выраженный дефицит оснований, гиперлактатемия;
• снижение венозной сатурации и другие признаки гипоперфузии тканей.
Следует помнить, что на момент поступления в стационар нарушения системной
гемодинамики (артериальная гипотензия и тахикардия) могут быть обусловлены
не только кровопотерей, но и высокими адаптивными возможностями, позво¬
ляющими поддержать нормальные или субнормальные АД и частоту сердечного
ритма в течение некоторого времени даже при больших объемах кровопотери.
Традиционный признак кровотечения — острая анемия со снижением гематокри¬
та И развивается при аутокомпенсации гиповолемии, когда в сосудистое русло
в ответ на потерю крови перемещается интерстициальная жидкость. При высоком
темпе кровотечения механизм аутодилюции запаздывает. Показатели красной
крови могут соответствовать нормальным или субнормальным значениям. Также
на уровень гематокрита влияют инфузия и гемотрансфузия. При оценке объема
и тяжести кровопотери однократное или повторное исследование гематокрита
не рекомендуют использовать в качестве базового критерия из-за низкой чув¬
ствительности метода. Необходимо помнить, что продолжающееся кровотечение
представляет непосредственную угрозу жизни больного, поэтому предпочтитель¬
нее считать шок геморрагическим, если другая его причина не установлена.
Не вызывает сомнений, что успешное лечение кровопотери невозможно без
остановки кровотечения, для чего необходимо найти его источник. Проще всего
обнаружить источник наружного кровотечения, сложнее разобраться с источ¬
ником внутреннего кровотечения. Известно пять локализаций потенциально
опасных для жизни кровотечений, которые требуют специфических методов диа-
r
КРОВОПОТЕРЯ И ПРИНЦИПЫ ЕЕ КОМПЕНСАЦИИ В ЭКСТРЕННОЙ ХИРУРГИИ 598
и хирургического лечения (табл. 18-2). В экстренной хирургии чаще
г^пооблемы вызывает диагностика внутрибрюшного кровотечения. Ведущие
^^«ческие синдромы экстренной медицины — шок и боль — значительно
^ чивают возможности локализовать источник кровотечения из-за тяжести
M пациента и дефицита времени, когда действия персонала фактически
С°СТ°оДЯТ в режиме реанимационных мероприятий.
Таблица
18-2. Локализация источника кровотечения
пмализация
Грудная клетка
брюшная
полость
чабоюшинное пространство
^ - костей таза)
^(перелом бедренной
КОСТИ)
Наружное кровотечение
Диагностические тесты
Осмотр.
Рентгенография.
Компьютерная томография
Ультразвуковое исследование
органов брюшной полости.
Компьютерная томография
Основные методы лечения
Дренирование плевральной полости.
Торакотомия и хирургическая остановка
кровотечения
Компьютерная томография
Осмотр.
Рентгенография
Осмотр.
Медицинская документация
Ангиографическая эмболизация
Лапаротомия и хирургическая остановка
кровотечения
Ангиографическая эмболизация.
Фиксация костей таза
Фиксация
Давящая повязка.
Лигирование артерий.
Другие методы хирургической остановки
кровотечения
Несмотря на трудности диагностики, тяжесть состояния и дефицит времени, все
пациенты нуждаются в минимальном обследовании, необходимом для адекватной
компенсации острой кровопотери. Оно включает:
» определение группы крови, резус-фактора, Келл-антигена;
• развернутый клинический анализ крови;
• биохимический анализ крови (электролиты, мочевина, креатинин, глюкоза);
• коагулограмму (протромбин, активированное частичное тромбопластиновое
время);
• параметры гомеостаза (уровень лактата в артериальной или венозной крови,
кислотно-основное состояние и газы артериальной и венозной крови);
• общий анализ мочи.
ОПРЕДЕЛЕНИЕ
Понятие кровопотери значительно шире, чем обозначение утраченного объема
крови. Под кровопотерей понимают универсальные адаптационные и патологиче¬
ские реакции, возникающие в ответ на кровотечение.
КЛАССИФИКАЦИЯ
Тяжесть состояния пациента определяется не только объемом кровопотери, но и
w скоростью, а также индивидуальными компенсаторными возможностями организ¬
ма- В связи с этим современные классификации кровопотери базируются на определе¬
нии утраченного объема крови и патофизиологических изменениях организма.
В мировой практике используют классификацию Американской коллегии хи-
РУРгов, опирающуюся на клинические проявления кровопотери и степень гипово¬
лемии (табл. 18-3).
базируясь на клинической картине и объеме кровопотери, выделяют четыре
асса кровотечений. Данная классификация весьма приблизительна, но позво-
^ет хирургу предположить объем кровопотери при поступлении пациента. Одна
I МоДЙфикацйй, основанная на степени тяжести гиповолемии, предполагает
^Деленную клиническую картину (табл. 18-4).
яр КАЖхмфмкаиия вроволотери Американской коллегии хирургов
К—гите а—темы I Объем «ровопствр»
Ti—npniin
Рвтостапнвская гипотензия
20-25
' Артериальная гипотензия в положении лежа на спине, оли-
ІПіриі
йтнн сознание, коллапс
30-40
194. Клинические проявления в зависимости от степени гиповолемии
«готель
f V
В
m
ІЧСС
<100
>100
>120
>140
Н1
Норма
Норма
і
Пуяьсоаое давление
Норма или t
4-
і
Почасовой диурез мл
>30
20-30
5-15
Анурия]
УрОввНЬ С0ЭИГОЯ
Легкое возбуждение
Возбуждение
Спутанное
сознание
ПрвкомаГкомаї
ЧДД в квмуту
Норма
20-30
30-40
>45
І Тест заполнения капилляров
■
Норма
Замедленный
Очень
замедленный
Заполнения
отсутствует
IJJ 11 1 г г ' 1
Объем кровопотери мл
<750
750-1500
1500-2000
>2000
^Дефицит ОЦК. %
<15
15-30
30-40
>40
В России в экстренной хирургии широко распространена классификация
кровопотери. предложенная П.Г. Брюсовым (табл. 18-5). В ней учитываются
количественные и качественные характеристики кровопотери, что позволяет
оценить тяжесть кровопотери, опираясь на утраченный глобулярный объем
(ГО) крови.
118-5. Классификация кровопотери по П.Г. Брюсову (1998)
Признак
Виды
(степени) кровопотери
Описание
По виду
Травматическая
Раневая, операционная
Патологическая
Заболевания
Искусственная
Эксфузия
По быстроте развития
Острая
>7% ОЦК за час
Подострая
5-7% ОЦК за час _
Хроническая
<5% ОЦК за час —
По объему
Малая
Дефицит ОЦК 0,5-10% (около 0,5 л)
Средняя
Дефицит ОЦК 10-20% (0,5-1 л)
Большая
Дефицит ОЦК 21-40% (1-2 л)
Массивная
Дефицит ОЦК 41-70% (2-3,5 л)
Смертельная
Дефицит ОЦК >70% (>3,5 л)
По степени гиповоле-
иии и возможности
развития шока
Легкая
Дефицит ОЦК 10-20%, дефицит ГО 30%, при¬
знаков шока нет —.•"
Умеренная
Дефицит ОЦК 21-30%, дефицит ГО 30-45%, ДО*
развивается при длительной гиповолемии ^
Тяжелая
Дефицит ОЦК 31-40%, дефицит ГО 46-60%, Р*3'
витие шока неизбежно
Крайне тяжелая
Дефицит ОЦК >40%, дефицит ГО >60%. шок
необратим
ПАТОГЕНЕЗ
.дочееой фактор любой критической ситуации - ишемия и перестройка кле-
дмпго метаболизма. При острой кровопотере пусковыми факторами становятся
g острая гиповолемии, но серьезным нарушениям клеточного обмена пред-
^LgyeT цепь компенсаторных реакций. Нейрогуморальная реакция на кровоте-
аіЄ^€ включает симпатическую активацию и выброс антидиуретического гормона,
мехоламины увеличивают силу и частоту сердечных сокращений (положитель¬
на даотропный и дромотропный эффекты), вызывают генерализованный спазм
_уд0р и уменьшают объем сосудистого русла. Антидиуретическии гормон обе
ечйВает задержку жидкости и ее перераспределение между интерстициальным
ujjocfpaHCTBOM и сосудистым сектором, тем самым увеличивая ОЦК и уменьшая
5адеНЬ гиповолемии. Все это в совокупности приводит к временной компенса¬
ції щповолемии и стабилизации состояния у части пациентов. В ответ на стресс
активизируется высвобождение энергообразующих субстратов в печени. На этом
ЗАЛе спонтанный гемостаз или временная остановка кровотечения (действия
медицинского персонала) и быстрая коррекция ОЦК могут прервать каскад,
и гемодинамика больного останется стабильной, несмотря на утраченный объем
крови (рис. 18-1, кривая А).
Доставка
кислорода
Норма
Рис. 18-1. Вероятные исходы при острой кровопотере (по руководству Perioperative Transfusion
Medicine, 2006): кривая А — аутокомпенсация кровопотери; точка 1 — истощение механизмов
ауторегуляции при продолжающемся кровотечении; кривая В — благоприятное течение (крат¬
ковременный период шока с последующим гиперметаболизмом для компенсации кислородной
задолженности); кривая С — шоковый каскад развивается, несмотря на контроль повреждений
и остановку кровотечения, грубые изменения кислородного баланса приводят к необратимому
повреждению внутренних органов, полиорганной недостаточности и летальному исходу; кривая
D—развитие необратимого шока
При истощении компенсаторных резервов резко снижается доставка кисло¬
рода к тканям. Клеточный обмен перестраивается на анаэробный тип метабо¬
лизма, что резко снижает выработку энергии, приводит к гибернации, некрозу
и/или апоптозу. В этот период, несмотря на вовлечение в кровоток жидкости из
интерстициального и внеклеточного сектора, усугубляется гиповолемия и затруд¬
няется капиллярный кровоток. При ишемии клеток высвобождаются медиаторы
воспаления и недоокисленные продукты обмена, которые вследствие прямого ток¬
сического действия на миокард снижают сердечный выброс, усугубляют ваэокон-
осрикцию. Шок становится необратимым, когда истощаются резервы сосудистого
ИЙ*® (рис. 18-1, кривая D). Ситуацию завершает летальная триада - ацидоз, коа-
лопати я, гипотермия. При вазодилатации неинтенсивная терапия, как правило.
до кяммкхм ттнсФУЗиология
неэффективна (инфузкя в высоком темпе, введение больших доз катехоламин
ввдагосяжталыюм этапе при продолжающемся кровотечении больные умиш^
•следствие критического снижения сердечного выброса и острой сердечной н
I иишггтп Основная причина смерти в стационаре — изменения клегочн °
йбмеЯ I сосудистого тонуса даже при восполненном ОЦК. 0г°
Геморрагический шок можно описать как соотношение гипоперфузии тка
в дотеки кислорода во времени (см. рис. 18-1). Очевидно, что существует поГ
! нежуток времени, когда происходит перестройка метаболизма и развиваютТ
необратимые изменения. Именно на этом этапе приобретают огромное значит!
хирургические и нехирургические методы интенсивной терапии. Выздоровление
бального невозможно, если не остановить кровотечение. Нехирургические мет.
ды интенсивной терапии (ИТТ, симпатомиметическая поддержка и др.) на боя
временной остановки кровотечения позволяют стабилизировать состояние и под¬
готовить пациента к операции (см. рис. 18-1, кривая В). Эти заключения легли
в основу концепции «золотого часа» при травме. При благоприятном течении
процесса (см. рис. 18-1, кривая В) патофизиологические изменения обратимы.
При истощении собственных резервов (см. рис. 18-1, кривая С) в послеопераци¬
онном периоде развивается полиорганная дисфункция и больной умирает спустя
несколько дней или недель после кровотечения.
Головной мозг и сердце считаются наименее защищенными от ишемии орга¬
нами. Достаточно редко встречается первичное ишемическое поражение легких
потому что клетки легочной ткани имеют непосредственный доступ к кислороду;
вторичное поражение легких вызывают медиаторы воспаления. Более чувстви¬
тельны к первичной ишемии клетки кишечника и печени, которые под действием
вышеупомянутых факторов отекают, вследствие чего капиллярный кровоток
затрудняется, вплоть до полного его прекращения. Этот синдром может раз¬
виваться даже при восстановленном ОЦК и нормальной гемодинамике, если
в кровотоке находится большое количество медиаторов воспаления. Дисфункция
печени нарушает обмен метаболических субстратов, в первую очередь глюкозы,
и синтез факторов свертывания. Ишемия тонкой кишки приводит к транслокации
бактерий из просвета в кровоток с последующей генерализацией процесса, вплоть
до развернутой клинической картины сепсиса. При ишемии почек сначала сни¬
жается их фильтрационная способность, а затем развивается острый тубулярный
некроз с характерной клинической картиной острой почечной недостаточности.
Кожа, мышцы и кости могут выдерживать достаточно длительные периоды гипо¬
перфузии до появления клинических признаков необратимого ишемического
поражения. Мышечная ткань обеспечивает основное количество лактата и других
продуктов анаэробного метаболизма в крови при гипоперфузии.
С одной стороны, системный воспалительный ответ необходим для восстанов¬
ления органов и тканей после шока. С другой стороны, существует определен¬
ная зависимость между концентрацией медиаторов воспаления, особенностями
иммунного ответа и течением послеоперационного периода у пациентов с острой
кроволотерей.
Особые изменения реакции системы микроциркуляции в ответ на интенсивную
терапию и связанные с ней последствия объединяются в два синдрома - репер-
фузионный и синдром невосстановленного кровотока (так называемый no-reflow
syndrome).
Реперфуэионный синдром формируется при свободнорадикальном поражении
органов и тканей недоокисленными продуктами метаболизма при восстановле¬
нии кровотока. Он проявляется резистентной к проводимой терапии гипотензией
и низким сосудистым тонусом, а также рядом органоспецифических наруше¬
ний, например аритмиями и возобновлением болевого синдрома при инфаркте
карда, Развитию реперфузии всегда предшествует период ишемии тканей
КРОВОПОТЕРЯ И ПРИНЦИПЫ ЕЕ КОМПЕНСАЦИИ В ЭКСТРЕННОЙ ХИРУРГИИ 599
ГЯДОКСИИ клеток, когда формируется кислородный долг (см. ниже) - суммар-
* разница между потребленным и доставленным кислородом, если транспорт
на\еднего превышает критический уровень. В течение первых 5 мин аноксии
* ко снижается уровень АТФ в митохондриях, несмотря на активацию гликолиза.
С гипоксии этот период несколько увеличивается. Следующий этап поражения
jLtkm при аноксии продолжается около 10 мин. Снижение концентрации АТФ
отекает поражающий каскад: повышается концентрация ионов кальция в цито-
38 'jjgl что, в свою очередь, вызывает активацию кальцийзависимых протеаз
Аосфорилаз. разрушение мембраны, набухание митохондрий, разрыв лизосом
в Освобождение протеолитических ферментов. Если в этот момент возобновля¬
йся поступление кислорода к клетке, то процесс становится более выраженным,
в последующие 15 мин аноксии происходит гидролиз фосфолипидов митохондрий
„нарушается митохондриальная мембрана, разобщается окислительное фосфори-
«ирование, что еще более угнетает нарушенное клеточное дыхание. Затем прибли¬
зительно на 30 мин функции митохондрий частично восстанавливаются за счет
пока неизвестных клеточных механизмов. Через 90-120 мин от начала аноксии
митохондрии необратимо поражаются и происходит гибель клетки. Эффекты
ишемического поражения тканей не ограничиваются внутриклеточным простран¬
ством. При ишемии активизируется процесс хемотаксиса нейтрофилов. которые
блокируют капиллярную сеть в зоне поражения. Нейтрофилы вносят свой вклад
в реперфузионное поражение, выбрасывая в кровоток свободные радикалы и ряд
активных субстанций, поражающих эндотелий. При восстановлении кровотока
и реоксигенации тканей также наблюдают повышение концентрации ионов каль¬
ция в цитоплазме клетки, выброс простогландинов, тромбоксанов, лейкотриенов
с образованием свободных радикалов кислорода и ряда цитотоксических агентов.
Таким образом, ишемия, реперфузия и свободнорадикальное поражение внутрен¬
них органов — взаимосвязанные процессы, и трудно сказать, какой процесс вносит
наибольший вклад в смерть клетки.
Синдром невосстановленного кровотока — это устойчивая гипоперфузия тка¬
ней после восстановления кровотока по приводящим сосудам. Патогенез синдрома
невосстановленного кровотока изучен недостаточно, но не вызывает сомнений,
что он сопряжен с ишемией тканей и клеточной гипоксией. Принято считать,
что он обусловлен накоплением ионов кальция в гладких мышцах, что проявляется
высоким тонусом артериол и приводит к эндотериальной дисфункции, отеку пери-
капиллярных тканей, микроэмболиям и воспалительному ответу. Как и реперфу¬
зия, синдром невосстановленного кровотока неспецифичен, но больше всего он
исследован при поражении или манипуляциях на коронарных сосудах. Оба син¬
дрома - реперфузионный и невосстановленного кровотока - приводят к полиор-
ганной дисфункции.
Таким образом, ишемия — важнейший, решающий аспект патофизиологии
кровопотери. Вот почему интенсивная терапия кровопотери должна опираться
на показатели кислородного баланса. В экстренной хирургии кислородный баланс
и тканевый обмен чаще всего оценивают косвенными методами — по изменениям
кислотно-основного состояния смешанной венозной крови и уровню метаболитов
(лактата, пирувата). Этой информации недостаточно, так как она не позволяет
оценить базовые показатели кислородного баланса — транспорт и потребление,
коэффициент использования кислорода.
Определение показателей кислородного баланса предполагает мониторинг цен-
Тальной гемодинамики, в первую очередь сердечного выброса. Однако этот вид
иониторинга предоставляет другие возможности, необходимые для выбора тактики
интенсивной терапии, например определение общего периферического сосудистого
Противления, содержание свободной жидкости в легких и др. В настоящее время
в экстренной хирургии наряду с эталонным термодилюционным методом исполь-
100 КЛИНИЧЕСКАЯ ТРАНСФУЭИОЛОГИЯ
ЩШ НОВЫС. МИНИ-инвазивные методы определения сердечного выбпо
PULSION Medical Systems AG; Vigileo FloTrac, Edwards LifeStience Laboratories)
пищеводную эхокардиографию. Каждый из этих методов обеспечивает л ^
точное определение показателей центральной гемодинамики: по сравнен 7041,0
шцмюционным методом, точность измерений составляет 0,8-0,92. с ТеР*
В процессе дыхания кислород проникает через альвеолярную мембрану
быстро образует обратимую связь с гемоглобином в эритроците. ЗатемзВ КР°ВЬ'
Цш кислород эритроцит перемещается по току крови к органам и ткашГ3™8
&|дение «гемоглобин-кислород* разрушается до исходных продуктов ** 1
лород по фадиенту концентрации направляется внутрь клетки к митохонл Ч
где потребляется около 90% молекулярного кислорода. Диффузию газов и 1
веолярного воздуха в кровь и из крови в ткани описывает закон Фика: «ДжЬЛ^Ч
кислорода прямо пропорциональна проницаемости мембран, площади диАА Л
І градиенту давления и обратно пропорциональна толщине мембраны», в лег
таош барьером становится альвеоло-артериальная мембрана. Парциальное даю
Iкислорода в альвеолярном газе составляет около 100 мм рт.ст., а в легочны
капиллярах - около 90 мм рт.ст. В периферических тканях барьером служит
стенка капилляра, и диффузионный фадиент значительно увеличивается так
как ра02 на входе в капилляр приблизительно равно 90 мм рт.ст., а у митохондрий
оно составляет менее 1 мм рт.ст. Попадая в легочный капилляр, кислород быстро
связывается с гемоглобином. Способность гемоглобина удерживать кислород уве¬
личивается вместе с его насыщением (рис. 18-2).
Р02, мм рт.ст.
Рис. 18-2. Кривая диссоциации оксигемоглобина
Транспорт (доставка) кислорода (Т02) — это скорость поступления кислорода
к тканям, которая зависит от сердечного выброса (СВ) и содержания кислорода
в артериальной крови:
ТО,=СВхС 0„
2 арт 2*
где С Ог І содержание кислорода в крови. Его можно определить по хорош
известному уравнению:
CmO=1.34xHbxSO.J+0.003xp О,.
арт i а 2 * а і
В уравнении учитываются связанная с гемоглобином фракция кислорода и ра|
творенный в плазме кислород. В норме при исследовании кислородтранспортн
КРОВОПОТЕРЯ И ПРИНЦИПЫ ЕЕ КОМПЕНСАЦИИ В ЭКСТРЕННОЙ ХИРУРГИИ
ции крови на уровне моря транспорт составляет приблизительно 1 л/мин
^ величине СВ 5 л/мин и уровне гемоглобина 150 г/л. Соотношение связанного
"Р* глобина к растворенному составляет около 21 мл/100 мл к 0.3 мл/100 мл.
отсутствии гемоглобина обеспечить нормальное потребление кислорода
f^io 250 мл/мин) можно, только повысив СВ до 80 л/мин и более. При уровне
АО более 90% дальнейшее повышение концентрации в дыхательной смеси и аль¬
веолярном газе не увеличивает транспорт кислорода, избыток кислорода раство¬
ряется В плазме.
Потребление кислорода (П02) определяют как произведение СВ и артериове-
„озной разницы по кислороду (C02-Cv02):
П02=СВх (Ca02-CvOz).
В норме потребление кислорода составляет около 250 мл/мин при СВ 5 л/мин.
учитывая различия в росте и массе тела пациентов, унифицировать показатели
позволяют индекс — частное от абсолютной величины показателей (транспорта
иди потребления кислорода) и площадь поверхности тела. В норме Т02 составляет
500-800 мл/мин на м2, П02 - 110-160 мл/мин на м2.
Также важно соотношение потребления и транспорта кислорода, которое назы¬
вают коэффициентом экстракции кислорода (КЭ02):
КЭ02= (П0/Г02) хЮО (%).
Это соотношение показывает напряжение компенсаторных механизмов
и в норме составляет около 22-32%. При индексе транспорта кислорода (ИТ02)
более 320 мл/мин на м2 этот коэффициент может увеличиваться в несколько раз
вследствие повышенной экстракции кислорода тканями. Ишемию и высокую
экстракцию кислорода отражают сниженное парциальное давление и насыще¬
ние кислородом гемоглобина венозной крови. КЭ02 значительно различается
между органами. Для сердца оно составляет 23,9%, для головного мозга — 47,9%,
для почек - 15,9%, для печени — 20,9%. Чем более чувствителен к гипоксии
орган, тем выше регионарный КЭ02.
При ИТ02 более 300-320 мл/мин на м2 величина индекса потребления кисло¬
рода (ИП02) не имеет прямой зависимости от него и регулируется за счет коэффи¬
циента использования кислорода (рис. 18-3).
200 -
г 150 -
* 100 -
ф
ц
V
®
а
50 -
Критический
уровень Ь02
Независимое
от кровотока V02
Состояние шока
1 1 1 1
200 400 600
Доставка кислорода, мл/(минхм2)
И^ависимость потребления кислорода от его доставки
ГЛАВА 18
502 КЯИНИЧИЮ» ТРАНСФУЗИОЛОГИЯ
При снижении ИТО, менее этой величины проявляется прямая зависим
■отребления кислорода"от его транспорта, что отражает резкое ухудшение
И# перфузии и перестройку клеточного обмена на анаэробный тип. Как ппа^
до. смешение показателей на опасный участок кривой зависимости происхо
Щэтиологии и массивной некомпенсированной кровопотере, пои?
му тактика компенсации кровопотери зависит от состояния кислородного бали
І в первую очередь направлена на поддержание и повышение доставки кислом*
I периферическим органам и тканям. ‘а
Кислородный долг (КД) — один из важнейших физиологических параметоо
непосредственно влияющих на выживаемость больных, развитие осложнений
Несмотря на многочисленные публикации, по-прежнему трудно вычислить его
непосредственно у кровати больного. КД определяют как количество накапли¬
вающейся разницы потребления кислорода между требуемым и реальным потре-
бдением при снижении доставки кислорода ниже критического уровня. Таким
обрізом, накапливающийся КД — это показатель, напрямую связанный с выжи¬
ванием больных в любом критическом состоянии, в том числе обусловленном
кровопотерей. Исследования в экстренной хирургии показали, что при КД менее
4100 мл/м3 вероятность летального исхода невысока. Летальность увеличива¬
ется с 50 до 95%, когда КД увеличивается до 4900 и 5800 мл/м2 соответственно.
Таким образом, считается наиболее целесообразным исследовать именно КД
а не абсолютные величины транспорта и потребления, потому что он непо¬
средственно связан с риском полиорганной дисфункции и летального исхода.
Существуют данные о связи между КД, степенью реперфузионного повреждения
и иммунных расстройств.
Таким образом, восполнение кровопотери подразумевает повышение транспор¬
та кислорода соответственно имеющемуся потреблению. Это означает, что необ¬
ходимо воздействовать на все составляющие, которые определяют газотранспорт¬
ную функцию, включая преднагрузку и уровень гемоглобина.
При ишемии клеток активируется анаэробный механизм образования энергии,
при котором в избытке образуются пируват и лактат, а продукция энергоемких
субстратов (АТФ) значительно падает. Чтобы компенсировать расход субстратов
для выработки энергии, повышается образование глюкозы из гликогена. Так фор¬
мируется биохимическая триада клеточной энергетической недостаточности -
гипергликемия, гиперпируватемия и гиперлактатемия. Пируват крови (норма 1
0,03-0,1 ммоль/л) - наиболее чувствительный индикатор клеточной гипоксии.
В клинической практике уровень пирувата определяется нечасто из-за техниче¬
ских трудностей, поэтому чаще ориентируются на уровень лактата - более ста¬
бильного и проще определяемого метаболита.
Концентрация лактата в крови (в норме <2 ммоль/л) может повышаться вслед¬
ствие ряда причин. Выделяют два типа гиперлактатемии в зависимости от соот¬
ношения лактат/пируват (норма — 17-30 ммоль/л). При I типе гиперлактате-
мни нет выраженных нарушений кислотно-основного состояния, соотношение
лактат/пируват в норме. Этот тип гиперлактатемии развивается при активной
утилизации глюкозы, например, при физической нагрузке, гипервентиляции,
ори тяжелой анемии, введении инсулина. При ІІА типе гиперлактатемии наблю¬
даются выраженный ацидоз и высокое соотношение лактат/пируват. Этот тип
гиперлактатемии развивается при любых состояниях с неадекватной доставкой
кислорода к тканям - при кровотечении, сердечной недостаточности, острой
пшохсии. При 11Б типе гиперлактатемии ацидоз может быть умеренным, но соот¬
ношение лактат/пируват повышено. Этот тип гиперлактатемии выявляют при урс
мни, инфекционных заболеваниях, поражении печени, сахарном диабете.
Определить причину гиперлактатемии позволяет также лактат-глюкозныи
индекс (ЛГИ):
КРОВОПОItrn И 11РИНЦИПЫ ЕЕ КОМПЕНСАЦИИ В ЭКСТРЕННОЙ ХИРУРГИЙ 60S
ЛГИ (%) = (Lacven -Lacan) + [2 х (Glucose>n -GlucoseTO1)j.
В норме ЛГИ характеризуется образованием лактата из глюкозы и варьирует
j до 10%. Высокие значения ЛГИ свидетельствуют об избыточном образо¬
чки лактата, что возможно только в условиях ишемии клетки. Мониторинг
концентрации лактата обязателен у пациентов в состоянии шока (уровень дока*
^ьности 1В).
Помимо лактата, неблагоприятное воздействие на многие параметры гомео-
стаза< включая процессы оксигенации, оказывают изменения кислотно-основного
состояния крови. Метаболический ацидоз как следствие сниженной перфузии
тканей отмечают у многих поступающих в операционную больных с абдоминаль¬
ной травмой и продолжающимся кровотечением. Увеличенное содержание ионов
водорода угнетает метаболические реакции и нормальный трансмембранный
перенос ионов. Ацидоз приводит к изменению физико-химических свойств кле¬
точных мембран и повышению проницаемости эндотелия сосудов, способствуя
накоплению жидкости в интерстициальном пространстве и дополнительной бло¬
каде микроциркуляторного русла. Хорошо известно, что метаболический ацидоз
сопровождается угнетением сократимости миокарда, несмотря на гиперкатехо-
ламинемию как универсальный регулятор стресса и усиливающий сократимость
фактор. В условиях метаболического ацидоза возникает также дилатация арте-
риол, повышается тонус вен и снижается их податливость, что в совокупности
с повышением эндотелиальной проницаемости увеличивает риск отека тканей
даже при незначительной перегрузке объемом. При лечении пострадавших с кро-
вопотерей рекомендуют мониторировать показатели кислотно-основного состоя¬
ния, наиболее чувствительным из которых считают дефицит оснований (уровень
доказательности 1C). Установлено, что исходный дефицит оснований может
служить независимым прогностическим признаком летального исхода и развития
осложнений при травме и массивной кровопотере. Для коррекции метаболическо¬
го ацидоза у пациентов с острой кровопотерей часто используют буферные (още-
лачивающие) средства (натрия гидрокарбонат, трометамол).
В настоящее время пересмотрены показания к использованию буферных раство¬
ров при острой кровопотере, что обусловлено выявленными негативными послед¬
ствиями бесконтрольного или либерального назначения ощелачивающих сред.
Гидрокарбонат натрия действует быстро, но сначала повышает pH только во вне¬
клеточном пространстве, тогда как во внутриклеточном его действие значительно
ограничено или не выражено. Было установлено, что после введения бикарбоната
натрия большая его часть превращается в С02 и создает дополнительную нагрузку
на легкие, что требует больших объемов вентиляции. Часть СО, поступает внутрь
клетки и усугубляет внутриклеточный ацидоз. Бесконтрольное или необоснованное
введение бикарбоната натрия также сопровождается гипернатриемией и повышает
осмолярность внеклеточной жидкости, что, в свою очередь, провоцирует клеточную
дегидратацию и угнетает функции клеток. Также известно, что бикарбонат натрия
снижает сократительную способность миокарда, ухудшает микроциркуляцию тка¬
ней и органов, включая головной мозг, затрудняет высвобождение кислорода
в микроциркуляторном русле. Вот почему показания для гидрокарбоната натрия
в настоящее время сужены — его назначают при тяжелом метаболическом ацидо-
36 (pH артериальной крови <7,2 и дефицит BE <10 ммоль/л), когда ИВЛ и ИТТ
не компенсируют кислотно-основные изменения. Первоначальная доза бикарбо¬
ната натрия составляет не более 100-200 мл 4,2% раствора (50-100 мЭкв НСО3).
Повторные введения гидрокарбоната натрия допускаются только после исследова¬
ния кислотно-основного состояния крови (pH, НСО3-, BE).
Трометамол (трометамол Н\ трисамин*) — органическое основание, неиони-
3ированная часть которого проникает через клеточную мембрану и ошелачивает
янутриклеточную среду. Трометамол изменяет трансмембранное соотношение
ЦІ іглв вгссяи ТГШіГІТЧІППГГГГ*
шитргтптш її повышает концентрацию калия во внеклеточном rrpormw
Дишшниг препарата через почки ограничивает его использование Г»?****
I нарушенными ргиальными функциями, олиго- или анурией. К побочним**1
I относят нарушения обмена калия, гипогликемию, гипотензию и
ори быстром введении препарата. Скорость введения препарата - до 250*
у варосшх. максимальная доза - до 1.5 r/кг в сутки. **/4
Гипотермия - чрезвычайно опасное состояние, отягощающее течение
операционного периода и негативно влияющее на результаты лечения пост №*>ї"
tua с острой кровопотерей. Она может развиться при переохлаждении надо!^3*
тадьном этапе и во время хирургического вмешательства. Гипотермию вызы*
среасгм анестезии, непосредственно влияющие на центральную регуляцию ^
пературы. Хорошо известно, что в течение первых 40 мин общей анестезии
тральная температура тела снижается приблизительно на 10 ‘С и стабилизирует*
через 12ч после начала хирургического вмешательства, если потери тепла бы
минимальными. Интраоперационное охлаждение также обусловлено наружным
потерями тепла. До 60% интраоперационных потерь тепла связаны с согревании!
воздуха и предметов в операционной. Около 25% потерь тепла вызывает испа¬
рение с поверхности кожи, раневой поверхности и дыхательных путей. Особое
значение имеют потери тепла с обширных операционных ран, например, при да¬
тельных операциях на органах брюшной и грудной полости. До 15% потерь тепла
во время операции связано с согреванием непосредственно прилегающих к телу
плодных поверхностей (операционного стола, например), введением холодил
растворов и трансфузионных сред, орошением раны холодными растворами, а
также обдувом холодным воздухом.
Гипотермия резко снижает перфузию тканей, способствует прогрессированию
ацндиза и нарушениям коагуляции, снижает метаболизм лекарственных препа¬
ратов. в том числе средств анестезии, способствует увеличению объема крово¬
потери и повышает потребность в компонентах крови, увеличивает летальность.
Важно помнить, что при снижении температуры на 1 °С активность факторов
свертывания, как любой другой ферментативной системы, уменьшается на 10%,
а том числе инактивируются фибринолиэ и вся система коагуляции. Учитывав
вышеизложенное, согревание, предотвращение интраоперационных потерь
тепла и поддержание нормотермии имеют большое значение при травмах живо¬
та. Во время операции настоятельно рекомендуют контролировать центральную
и периферическую температуру тела. Градиент между центральной и перифери¬
ческой температурой указывает на состояние периферической тканевой перфу¬
зии. В норме он составляет не более 0,5-1 °С. при шоке и массивной кровопотере
может увеличиться до 2 °С и более. Элементарные меры по предотвращению
гипотермии и согреванию пострадавших с травмами живота включают изоляцию
кожи, повышение температуры воздуха в помещении, форсированное согрева¬
ние тела, инфузию теплых растворов и компонентов крови, а в тяжелых случа¬
ях I экстракорпоральное согревание крови. Хорошо известно, что инфузия 1 л
кристаллоидных растворов или 500 мл охлажденной донорской крови снижает
температуру тела приблизительно на 0,25 °С. Цель всех мероприятий - добиться
нормотермии и предотвратить интраоперационное охлаждение пациента (УР0'
аеиь доказательности 1C).
Большое значение при кровопотере имеют расстройства коагуляции.
Компенсаторные механизмы (вазоконстрикция, ухудшение микроциркуляции
способствуют сладжированню и развитию микротромбозов, что, в свою очередь,
редуцирует периферический кровоток. Вследствие инфузионно-трансфузионно
терапин. проводимой при кровопотере, у пациентов могут развиться дилюшювн»
ямгуяопятия и синдром массивной гемотрансфузии.
КРОВОПОТЕРЯ М ПРИНЦИПЫ ct компенсации • ЭКСТРЕННОЙ шикт |К
«ряиромная коагулопатия — наиболее настое проявление нарушений сперты- ™
системы, характерный признак - кровоточивость слизистых ободочек,
^,,4^« поверхностей и мест пункций, что не всегда позволяет отличить ее от яоа*
^чййяй® потребления. Она манифестирует после введення больших объемов
(ионных сред и обусловлена резким снижением концентрации факторов
компонентов системы гемостаза. • первую очередь фибриногена и тромбоцитов,
установлено, что при обменном переливании крови, когда эвакуируется
в объеме собственного ОЦК. в кровотоке остается около 37% исходно имев¬
шихся факторов свертывающей и протнвосвертывающей систем. Этого количества
достаточно, чтобы обеспечить гемостаз. При обменном переливаним двух и трех
ОЦК количество факторов свертывания снижается до 15 и 5% соответственно,
уровень тромбоцитов редко снижается менее 100 ООО» 10“ при замещении крови
i объеме полутора ОЦК. При снижении активности факторов свертывания
іфОЗИ до 30% отмечают удлинение протромбинового времени и активированно¬
го частичного тромбопластинового времени. Разведение факторов свертывания
д0 30% исходной концентрации может сопровождаться увеличением протром-
бинового и активированного частичного тромбопластинового времени. Было
установлено, что тромбоциты и факторы свертывания не снижаются ли криги
четкого уровня, пока объем инфузионной терапии не составит более двух ОЦК
Исключение составляет фибриноген, запасы которого истощаются при меньшие
объемах инфузии.
Еще одно опасное состояние в экстренной хирургии - синдром массивной
трансфузии, когда в течение 24 ч больному переливают компоненты донорской
крови в объеме 0,7-1,2 ОЦК. При травмах этот объем может быть использован
за более короткое время. Чаще всего массивная гемотрансфузня встречается
при повреждениях сосудов шеи, грудной клетки, аорты, живота, а также при пол*
ном или частичном отрыве конечностей. Вследствие массивной гемотрансфузии
значительно увеличивается риск гемолиза, острого повреждения легких, чаще
развиваются инфекционные осложнения. Массивные гемотрансфузии сильно
нарушают гомеостаз, вызывая ацидоз, цитратную интоксикацию и гиперкалие-
мию, нарушается высвобождение кислорода в тканях вследствие сдвига кривой
диссоциации оксигемоглобина, поэтому не рекомендуется использование компо¬
нентов крови в профилактических целях. Уменьшить риск посттрансфузионных
осложнений при массивной гемотрансфузии позволяют тщательное совмещение
крови; своевременное связывание цитрата препаратами кальция; тщательный
мониторинг и коррекция уровня калия.
Гипоперфузия тканей, утрата факторов системы гемостаза с вытекающей кро¬
вью и их активное потребление приводят к синдрому ДВС - наиболее опасному
нарушению коагуляции в экстренной и плановой хирургии Частота развития
ДВС в экстренной хирургии не гак высока, как принято считать, и составляет
10—11%, что значительно ниже, чем при онкологических или гематологических
заболеваниях. Развитие ДВС зависит от локализации и объема травмы, тяжести
<вока, особенностей интенсивной терапии, в том числе приводящих к активации
плазменных компонентов системы гемостаза. При ДВС гемокоагуляинонный
аххад запускают клеточные активаторы гемостаза, попадающие в кровоток
в поврежденных тканей и клеток эндотелия. Нарушения коагуляции усугубляют¬
ся гипоперфузией тканей, тяжелыми расстройствами микроциркуляции и гомео-
СТ1эа- Несоответствие между коагуляцией и фибринолизом определится дефек-
в системе антитромбина, тканевого ингибитора свертывания и протеина С
при продолжающемся потреблении факторов свертывания, утрате фибриногена
* тромбошт>в ДВС манифестирует клинически как коагудопатня потребления.
Не*°статок компонентов фибринолитической системы приводит к неконтроли¬
руемому свертыванию, формированию неполноценного сгустка, депонированию
•а «виц
Mf О* f« СХЛ* ичижямсюп»
МЦнш в мшроциркулигорном русле, его блокаде и развитию синдром»
органной дисфункции. При гипотермии, помимо указанных факторов fin ***'
жчешк имеет дисфункция тромбоцитов: снижается продукция тромбоїк ^
чю нарушает агрегацию тромбоцитов. Клинические и лабораторные проя»** В -
ДВС при гипотермии, как правило, развиваются после согревания пациент***
Диагностика системного ДВС-синдрома базируется на клинических пп
Ц (продолжающемся кровотечении и неконтролируемом свертывании
и лабораторных тестах. Лабораторные признаки ДВС включают тромбоцит?
кию. птофибриногенемию. снижение протромбина, факторов свертывани ***
I повышение содержания продуктов деградации фибрина, определ* V'
шш-мономера и уровня D-димера. Оценить эффективность терапии и п***
люешровстъ дальнейшее развитие событий позволяет повторное .пабопатоп^°
обследование системы плазменного и клеточного гемостаза - уровня антитоп^
бимов, D-днмера, растворимых фибрин-мономерных комплексов, количеств
t активности тромбоцитов. Продукты деградации фибрина или D-димер чал*
оовмвемы при остром ДВС, но не считаются специфичными диагностическими
цтзнакамн. D-лимер - конечный продукт действия плазмина на фибрин и может
выявляться при других клинических ситуациях, связанных с активацией сверты¬
вания. Также неспецифичны тромбоцитный фактор 4 и р-тромбоглобулин, кото¬
рые повышаются при внутрисосудистом свертывании различного генеза. Большее
значение при остром ДВС имеет активность антитромбина III и антигена тканевого
активатора плазминогена. Так. активный тромбин образует нестойкие комплексы
с антитромбнном III и снижает его функциональную активность при ДВС. Таким
образом, лабораторная диагностика ДВС в экстренной хирургии — сложный про¬
цесс. требующий нескольких повторных исследований.
Современная тактика лечения ДВС при продолжающемся кровотечении включает
Яисточника и быструю остановку кровотечения, поддержание и восстановление
гомеостаза и нормальной деятельности органов и их систем, направленное действие
Sfeсистему гемостаза. Быстрое распознавание расстройств коагуляции и раннее
нпвяо терапии увеличивают шансы пациента выжить. Продолжающийся ДВС-
синдром В первую очередь характеризуется потреблением тромбоцитов, а при мас¬
сивной кровопотере к этому присоединяется и острая анемия, поэтому возможна
трансфузия тромбоцит- и эритроцитсодержащих трансфузионных сред. Лечение
ффааяено прежде всего на стабилизацию состояния больного, а не на нормализа¬
цию показателей коагулограммы и анализа крови, поэтому гемотрансфузию следует
щрврвгь с осторожностью, так как она усиливает образование фибрина.
Более 30 лет гепарин натрия использовали в качестве основного средства при
лечении ДВС., несмотря на недоказанную эффективность. По сравнению с нефрак-
ционированными. низкомолекулярные гепарины уменьшают кровотечение,
но не увеличивают выживаемость. В последние годы при продолжающемся крово¬
течении чаще используют естественные антикоагулянты — антитромбин, протеки
С или тканевый ингибитор свертывания, которые более безопасны и не усиливают
кровотечение по сравнению с гепарином натрия, а также повышают выживае¬
мость.
В случае развития ДВС и дилюционной коагулопатии трансфузионную компо¬
нентную терапию, как правило, начинают при первых признаках кровоточивости.
допоявления неконтролируемого кровотечения. Показания к началу интенсивной
компонентной терапии при продолжающемся остром кровотечении:
• снижение тромбоцитов плазмы менее 80-100x10’ (тромбоцитная масса):
• снижение до 50% нормы протромбинового или активированного частичного
Тромбопластинового времени (свежезамороженная плазма); __
• снижение фибриногена менее 1 г/л на фоне продолжающегося кровотечения
(криопреципитат).
КРОВОПОТЕРЯ И ПРИНЦИПЫ ЕЕ КОМПЕНСАЦИИ I {ОТИЕИМОИ ЯЩШ 187
юя .К^нии необходимо учитывать тяжесть и объем поражения, прододжи-
шокового состояния, ответ на проводимую терапию и риск осложнений
*'* ^«черепного кровоизлияния). Контролировать свертывание крови позвюля-
(•^^ременная интенсивная терапия, хирургическая остановка кровотечения
SujoflVCTHMO вводить тромбоцитную массу для профилактики кровотечения.
необходимо ограничить трансфузию донорских эритроцитов, гак как их
^цнональная активность снижена, они вызывают выброс цитокинов и могут
nvcWTb коатулопатию. Дополнительные возможности предоставляет использо*
jfL рекомбинантного фактора Vila, хотя он не предназначен непосредственно
лечения ДВС-синдрома.
в последние годы вновь появились данные об эффективности использования
нтйфмбринолитических средств у пациентов с травмой, осложнившейся мас-
И0НОЙ кровопотерей. Была доказана эффективность транексамовой, амином
пооиовой кислот и апротинина. Транексамовая кислота - синтетический аналог
естественного ингибитора плазмина и плазминогена, значительно превышает
по эффективности и силе воздействия аминокапроновую кислоту. Ее рекомендуют
вводить в дозе 10-15 мг/кг болюсно с последующей инфузией 15 мг/кг в час
после того, как удается контролировать кровотечение. Аминокапроновую кислоту
рекомендуют использовать в дозе 150 мг/кг болюсно с последующей инфузией
15 мг/кг в час. Апротинин как мощный антиплазминовый агент назначают в дозе
500 ООО ЕД/ч внутривенно, доза может быть увеличена до 2 ООО ООО ЕД при лече¬
нии гиперфибринолизиса. Риск тромбообраэования при использовании антифи-
бринолитических агентов не подтвердился при многотысячных исследованиях
Таким образом, ключевыми моментами патогенеза кровопотери следует счи¬
тать:
• снижение доставки кислорода к органам и тканям (гиповолемии. дефицит
эритроцитов, нестабильная гемодинамика, вазоконстрикция или вазопле-
гия);
• прогрессирующую гипоксию тканей и снижение их перфузии;
• грубые расстройства гомеостаза;
• нарушения в системе коагуляции крови.
КОНЦЕПЦИЯ ИНТЕНСИВНОЙ ТЕРАПИИ КРОВОПОТЕРИ.
КРИТЕРИИ ЭФФЕКТИВНОСТИ
Важнейшая цель современной интенсивной терапии - поддержать аэробный
метаболизм тканей, обеспечив соответствующий потреблению транспорт кисло¬
рода. Эта концепция основана на понятии кислородного баланса, включающего
транспорт и потребление кислорода. Такой подход требует пересмотра задач,
стоящих перед врачом, методов их решения, дополнительных критериев эффек¬
тивности терапии. Современную концепцию компенсации кровопотери можно
представить в виде схемы (рис. 18-4). Безусловно, компенсировать острую крово¬
потерю невозможно, если продолжается кровотечение, поэтому наиболее ранняя
остановка кровотечения — обязательное условие успешного лечения пациентов
с острой кровопотерей. Из представленных на схеме решаются по меньшей мере
три направления компенсации с помощью ИТТ: обеспечение транспорта, компен¬
сация нарушений гомеостаза и коррекция коагуляционных нарушений.
Чтобы обеспечить и поддержать доставку кислорода на должном уровне, необхо¬
димы адекватный сердечный выброс, достаточный объем жидкости в кровеносном
№сле (нормоволемия), адекватное количество переносчиков кислорода (эритро-
МТо*) и поступление кислорода через легкие (состав дыхательной смеси, инди¬
видуальный подбор параметров вентиляции), восстановление микроииркуляими
Нормализация сосудистого тонуса). Снизить потребление кислорода и улучшить
КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Рис. 18-4. Принципы компенсации острой кровопотери в экстренной хирургии
соотношение между его транспортом и потреблением позволяет перевод больного
на искусственную вентиляцию легких до появления признаков декомпенсирован-
ной дыхательной недостаточности. Необходимо также воздействовать на обрати¬
мые изменения гомеостаза, которые развиваются при острой кровопотере, - мета¬
болический ацидоз, электролитные нарушения, гипергликемию, гиперлактатемию
и другие маркеры ишемии клетки. Компенсация коагуляционных нарушений пред¬
усматривает восполнение утраченных плазменных факторов гемостаза и клеточных
элементов (тромбоцитов). Следовательно, ранние критерии эффективности лечения
должны включать по меньшей мере три группы факторов:
І гемодинамические критерии: центральное венозное давление (ЦВД) ~
4-7 мм рт.ст., ЧСС - 60-90 в минуту, сердечный индекс — 2,5-4,5 л/мин
нам3;
• критерии адекватной доставки кислорода — гемоглобин, гематокрит, объем
циркулирующих эритроцитов или дефицит глобулярного объема крови,
показатели кислотно-основного состояния артериальной крови (pH, р.Ц*
StOv Щщ BE), индекс транспорта кислорода — не менее 500 мл/мин на м і
• критерии адекватной перфузии и характера клеточного метаболизма — Щр|
нее артериальное давление более 70 мм рт.ст., насыщение гемоглобина веноз¬
КРОВОПОТЕРЯ И ПРИНЦИПЫ ЕЕ КОМПЕНСАЦИИ В ЭКСТРЕННОЙ ХИРУРГИИ 609
ной крови кислородом (S,02) — 70-80%, показатели кислотно-основного
состояния венозной крови (pH, BE), индекс потребления и коэффициент
использования кислорода, нормальный уровень лактата, пирувата крови,
нормальные значения ЛГИ и соотношения лактат/пируват.
Дефицит объема циркулирующей крови и дефицит
глобулярного объема крови
Приступая к интенсивной терапии острой кровопотери, необходимо определить
предполагаемый объем кровопотери — дефицит объема циркулирующей крови
(дОЦК) и дефицит глобулярного объема крови (дГО). Первое предположение
о дОЦК, как правило, базируется на клинических признаках — шоковом индексе
дльговера-Брубера, ЦВД (табл. 18-6), локализации и предполагаемом объеме
поражений (табл. 18-7).
Таблица 18-6. Клинические методы определения дефицита объема циркулирующей крови
Показатель
Предполагаемый дефицит ОЦК, % должного
Шоковый индекс
0,54
0
S 0,78
10-20
0,99
20-30
1,11
30-40
1,38
40-50
Центральное венозное давление (см вод. ст.)
+4
<10
+2
10-20
0
20-25
-2
25-30
-4
>30
Более точно определить дОЦК позволяют лабораторные методы:
1 расчетные (математические, включающие номограммы и расчет дОЦК
у постели больного);
• аппаратные (основаны на импедансе, обследуют конкретного больного
или образцы крови);
і лабораторные (определяют разницу гематокрита, количества эритроцитов
после введения определенных индикаторов: красителей, электролитов, глю¬
козы, радиоизотопов).
Способ 1 (по Мооге):
объем кровопотери (л) = ОЦКдолжныйх (Шдолжный-
^^факгичкий^ ' ^^дмяпшй'
Вместо гематокрита можно использовать гемоглобин или глобулярный объем.
При этом Ht составляет 42%, ОЦКдолжный — 70 мл/кг для мужчин и 60 мл/кг
Для женщин, НІГ . - 130 г/л, ГО . - 24 мл/кг.
Р с ДОЛЖНЫЙ I * ДОЛЖНЫЙ ’
U10C0D 2 (метод Филлипса):
« - V х Ht!+ (Ht,- Ht,) х ОЦК^ (л)=ОЦК^- оцк^_.
PII - исходный гематокрит; Ht2 — гематокрит после струйного введения 300 мл
^страна V (полиглюкина*).
Способ 3 (по объему эритроцитов):
Объем потерянных эритроцитов (мл) = ОЦК^х (Ht^-
ГЛАВА It
В КІННЖСШ ТРАНСФУЗИОЛОГИЯ
Можно предположить объем кровопотери, опираясь на относительную
« м»«им1лн#т /ni то/^п 152-74 Tairwp nn иоиопп и*т«^ У® ;
ноль крови и гематокрит (см. табл. 18-7). Также до начала ИТТ для оЯ?Ч1
объема кровопотери можно использовать номограмму Genkins. Невосп!) е\1
объем крови определяют, опуская перпендикуляр из точки пересечения линЛ"%
го крита (график) и массы тела больного (ордината) к оси абсцисс (рис І8-5?
Таблица 18-7. Объем кровопотери и относительная плотность крови
і Опмоггаяыме плотность i
Я
1057-1054
1053-1060
1049-1044
<044
Гемоглобин, г/л
05-62
61-50
49-43
<43
Гематокрит. %
44-40
38-32
30-23
<23
Показатель гематокрита, %
Объем кровопотери, мл
Рис. 18-5. Номограмма Genkins (пояснения см. в тексте)
Компенсация объема циркулирующей крови
В настоящее время при компенсации утраченного ОЦК и восстановлении нор-
моволемии используют две группы инфузионных сред — кристаллоидные (соле¬
вые) и коллоидные растворы.
Первое документированное использование солевых растворов для лечения холе¬
ры относится к 1834 г., когда в журнале Lancet Т. Latta опубликовал работу о лечении
холеры внутривенным вливанием растворов соды. Позже, в 1869 г., были опублико¬
ваны результаты первых экспериментальных исследований И.Р. Тарханова (Россия)
и A. Conheim (Германия) по внутривенному использованию растворов поваренной
КРОВОПОТЕРЯ И ПРИНЦИПЫ ЕЕ КОМПЕНСАЦИИ В ЭКСТРЕННОЙ ХИРУРГИИ 611
й » обескровленных лягушек. 10 июля 1881 г. считают началом инфузионной
^піпии:в атот ^ень Landerer успешно провел вливание больному физиологически-
поваренной соли. Большую роль в инфузионной терапии и появлении
^оидных растворов сыграли военные конфликты XX в. Так. во время Великой
"Ічеегвенной войны фронтовые медики использовали, помимо физиологического.
Только эквилибрированных (уравновешенных) солевых растворов: растворы
рнигера*. Рингера -Локка*. АМ-4 Бабинского, смесь Тирода. нормозаль и тутофу-
н кровезамещающий раствор ЦОЛИПК №3 и инфузин ЦОЛИПК. В настоящее
спектр кристаллоидных инфузионных сред значительно шире. Невысокая ШШ
^имость препаратов и более простая технология изготовления, чем у коллои-
на длительное время сделала коллоидные растворы препаратами выбора.
3 том числе при лечении кровопотери. Кристаллоидные растворы подразделяют
8 две группы: нормотонические (0,9% раствор натрия хлорида, раствор Рингера*
И рингер лактат*, трисоль*, ацесоль*, дисоль*, мафусол* и др.) и гипертонические
/7,2% или 7,5% раствор натрия хлорида). Преимущества кристаллоидных раство¬
ри хорошо известны. Они непосредственно после введения повышают сердечный
выброс, хорошо восполняют внесосудистый объем жидкости. Недостатки инфузи¬
онной терапии кристаллоидами также хорошо изучены:
« дозы кристаллоидов в 2-4 раза превышают эквивалентные дозы коллоидов
(волемический коэффициент около 30%);
* обладают коротким действием (время пребывания в кровотоке до 40 мин
с последующим перемещением до 70-80% введенного объема в интерстици¬
альное пространство);
1 не поддерживают сердечный выброс;
і снижают онкотическое давление плазмы;
І не восстанавливают микроциркуляцию и способствуют отеку тканей в зонах
с нарушенной сосудистой проницаемостью;
I вызывают гиперхлоремический ацидоз при больших объемах инфузии;
• отмечается гипо- или гиперосмолярность большинства растворов.
При больших объемах инфузионной терапии большое значение приобретают
состав и стабилизаторы кристаллоидных растворов, что отразилось в современной
концепции сбалансированной инфузии. Сбалансированные кристаллоидные рас¬
творы содержат оптимальный (наиболее приближенный к составу плазмы) набор
и концентрацию электролитов, что исключает нежелательные изменения электро¬
литов плазмы и развитие гиперхлоремического ацидоза. Современные стабилиза¬
торы - малат и ацетат — утилизируются в любой мышечной ткани, а потребление
кислорода при инфузии ниже в 1,5-2 раза по сравнению с использованием лактата.
Основное назначение гипертонического раствора хлорида натрия - быстро
увеличить ОЦК за счет интерстициальной жидкости и тем самым обеспечить
быструю стабилизацию гемодинамики. К дополнительным положительным фак¬
торам применения гипертонического раствора следует отнести блокаду активации
лейкоцитов и угнетение системного воспалительного ответа, что значительно
снижает частоту гнойно-септических осложнений. Отрицательные последствия
использования гипертонического солевого раствора — гипернатриемия и гиперос-
молярный синдром — ограничивают его использование.
Низкий волемический коэффициент и отрицательные последствия инфузий
солевых растворов при острой кровопотере и травматическом шоке стимулирова¬
ли поиск и разработку более эффективных растворов — коллоидов. К преимуще¬
ствам коллоидов относят:
• эффективное восполнение внутрисосудистых объема и персистенции молекул;
• коррекцию и поддержание коллоидно-онкотического давления плазмы:
• восстановление и поддержание микроциркуляции;
і увеличение внутригрудного объема крови без повышения содержания воды
в легочном интерстиции и ухудшения оксигенации;
• редкие побочные эффекты.
1 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
В настоящее время группу коллоидов объединяют коллоиды естественн
и искусственного происхождения. Чг°
Первым из коллоидов, использованных для компенсации смертельной кровоп
терн, был желатин (Hogan J., 1915). Эффективность препарата оценили как нев°
сокуто, в связи с чем в последующие годы активно разрабатывали коллоидны
среды на основе других белков животного происхождения: коллоидный инфузин*
ЦОЛИЛК (на основе казеина), лечебную сыворотку по рецепту Н.Г. Беленького
раствор БК-8, раствор КС-120 (на основе белков крови крупного рогатого
скота), которые часто провоцировали побочные реакции и осложнения, из-за чего
в последующем использование препаратов было прекращено. В настоящее время
из синтетических коллоидов на основе белков животного происхождения исполь¬
зуют только препараты желатина.
Желатин - это денатурированный белок, получаемый из коллагенсодержащих
тканей крупного рогатого скота посредством ступенчатой тепловой и химической
обработки. Выделяют три группы современных препаратов на основе желатина -
оксиполижелатины, сукцинилированный модифицированный желатин и препара¬
ты на основе желатина, приготовленного из мочевины. Технология не исключает
возможности вирусного и прионного инфицирования, за исключением модифици¬
рованных желатинов. Продолжительность действия сукцинилированного желатина
составляет 3-4 ч, объем замещения - 50-70%. В отличие от других производных
желатина, сукцинилированный желатин не влияет на коагуляцию, не нарушает
функции почек, изоонкотичен и изоосмотичен, не накапливается в ретикулоэндоте-
лиальной системе, не повышает уровень провоспалительных веществ, крайне редко
вызывает анафилактические реакции. Учитывая особенности фармакодинамики,
взрослому за сутки можно ввести до 200 мл/кг модифицированного желатина.
В 1940-х гг. появилась новая группа коллоидов — синтетические препараты.
Первым из них был синтезирован перистон® — производное поливинилпирро-
лидона (1940, Германия). Несмотря на высокий волемический коэффициент
(до 190%), к концу 1950-х гг. использование препарата было практически прекра¬
щено из-за выраженного побочного действия на коагуляцию. В 1944 г. был син¬
тезирован первый декстран (Gronwall A., Ingelman В., Швеция), позже известный
под названием макродекс*\ а в 1954 г. появился отечественный препарат поли-
глюкин* (ЦОЛИПК), которые несколько десятилетий были препаратами выбора
при лечении шока и острой кровопотери.
Декстран - полимер глюкозы, который продуцируется бактериями Leuconostoc
mesenteroides на содержащих сахарозу средах. Препарат для инфузий представляет
собой гидролизат нативного декстрана с определенной средней молекулярной мас¬
сой. Большее распространение получили среднемолекулярные декстраны (средняя
молекулярная масса около 70 кДа). Популярность декстранов в 1950—1970-х гг.
во всем мире объясняется самым высоким волемическим коэффициентом -
до 145-170%. Продолжительность действия наиболее популярного декстрана
в нашей стране - полиглюкина* — сопоставима с другими коллоидами (4-6 ч).
Недостатки декстранов хорошо изучены:
І гиперосмолярность;
• гиперонкотичность;
І значительные нарушения коагуляции;
g повышение осмолярности мочи и поражение почек (декстрановая почка);
• частые анафилактические реакции.
Максимальная суточная доза полиглюкина* для взрослых составляет 20 мл/кг.
Параллельно с коллоидами на основе белков и синтетических материалов раз¬
рабатывали коллоиды растительного происхождения. Первым из них была создана
кровезамещающая жидкость на основе 6,5% раствора гуммиарабика (Bayliss W»
1914-1915), который оказался токсичным и дальнейшего распространения не полу-
КРОВОПОТЕРЯ И ПРИНЦИПЫ ЕЕ КОМПЕНСАЦИИ В ЭКСТРЕННОЙ ХИРУРГИИ $13
В 1941 г. F.W. Hartman, V. Schelling и Н. Harkins предложили использовать
ійСівоРь11 пектина. Препараты показали высокую эффективность и высокий риск
^очного действия вследствие кумуляции. В конце 1940-х гг. Л.Г. Богомолова.
В.И- Шарков, З.А. Чаплыгина и И.И. Корольков предложили гидропектин из яблок,
кщорый также не получил широкого клинического применения. М.Н. Лившиц
02-1933) предложил оригинальный углеводно-коллоидный раствор на основе
винограда, который в связи с токсичностью, побочными эффектами также не полу-
широкого распространения. С 1940-х гг. предпринимались попытки исполь¬
зовать амилопектин. Похожие разработки проводились и в СССР (раствор АП, Ш
разработанный из картофельного крахмала А.Н. Лепорским и А.В. Макаревичем).
Несмотря на высокую эффективность и хорошие результаты экспериментальных
исследований, препарат не использовали в клинической практике. Затем в течение
нескольких десятилетий растворы амилопектина не использовали в практической
медицине. Появление нового, высокоэффективного препарата амилопектина в сере¬
дине 1960-х гг. значительно потеснило декстраны, с 1990-х гг. гидроксиэтилкрахма-
лы практически вытеснили их из клинической практики.
Источник для производства гидроксиэтилкрахмала - зерна кукурузы восковой
спелости и картофель. Гидроксиэтилкрахмал получают частичным кислотным
гидролизом природного крахмала до молекул заданных размеров. Именно гидрок-
сиэтилирование препятствует быстрому расщеплению крахмала, повышает спо¬
собность удерживать воду и повышать коллоидно-осмотическое давление плазмы,
на чем основан плазмозамещающий эффект препаратов. На обмен и свойства
гидроксиэтилкрахмалов влияют молекулярная масса, степень замещения и лока¬
лизация гидроксиэтиловых групп. Обычно в препарате гидроксиэтилкрахмала
200/0,5 около 30% глюкозных ядер содержат монозамещения, 6% - двойные
замещения и 1% — полизамещенные. Чаще всего в препаратах гидроксиэтиловые
группы занимают положение С2:С3:С6 в соотношении 5:1:1. Высокомолекулярные
фракции гидроксиэтилкрахмала в крови расщепляются сывороточной амилазой
до низкомолекулярных, когда общая молекулярная масса постепенно снижается
до 70 кДа. У крахмала 200/0,5 этот процесс занимает около 4 ч.
Преимущества современных гидроксиэтилкрахмалов известны:
• эффективно восполняют объем;
і в рекомендованных дозах не нарушают гемостаз;
і не влияют на функции почек;
S снижают капиллярную утечку при нарушенной проницаемости сосудов;
• ослабляют системную воспалительную реакцию.
Хорошая контролируемость и предсказуемость действия сделала их препарата¬
ми выбора при лечении острой кровопотери. В современной клинической практи¬
ке чаще всего используют гидрокиэтилкрахмалы 200/0,5 и 130/0,4 или 130/0,42
(пента- и тетракрахмалы соответственно).
6% раствор гидроксиэтилкрахмала 200/0,5 оказывает приблизительно 100%
объемзамещающий эффект, продолжительность которого составляет около 4 ч
и постепенно снижается и полностью исчезает через 8 ч. Препараты используют
при всех видах гиповолемии, для гемодилюции. Максимальная рекомендованная
доза составляет 33 мл/кг в сутки.
10% раствор гидроксиэтилкрахмала 200/0,5 гиперонкотичен, волемический
коэффициент его достаточно высок — около 150%. Эффективное действие про¬
должается около 4 ч, а общая продолжительность может достигать 10 ч. Показание
Для применения препарата — выраженная гиповолемия, в том числе обусловлен¬
ная кровопотерей. Вследствие гиперонкотичности препарат можно использовать
при гипоальбуминемии и интерстициальном отеке. Максимальная рекомендуемая
Доза невелика — всего 20 мл/кг.
6% раствор гидроксиэтилкрахмала 130/0,4 (0,42); волемический коэффициент
около 100%, продолжительность эффективного объема замещения не более 4 ч.
IU КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
а общая продолжительность пребывания в кровотоке после однократной инфуЗИй
составляет 6-8 ч. По сравнению с пентакрахмалами тетракрахмалы:
І не кумулируются даже после многократного введения, ЧТО ПОЗВОЛИЛО увели-
нить максимальную суточную дозу для взрослых до 50 мл/кг;
1 при одинаковом плазмозамещающем действии тетракрахмалы слабее дей.
ствуют на гемостаз.
В настоящее время появилась новая группа инфузионных сред — комбиниро-
итшле препараты на основе коллоида (гидроксиэтилкрахмала или декстрана-70)
и 7.2% раствора хлорида натрия. По результатам исследований, волемический
коэффициент препаратов может составлять 450-700%, что позволяет использовать
нх в небольшом объеме (так называемая малообъемная реанимация). Препараты
предназначены для первоначальной терапии острой гиповолемии. Они быстро уве¬
личивают внутрисосудистый объем за счет интерстициальной жидкости (основное
действие гипертонического солевого раствора) и стабилизируют гемодинамику,
но вызывают гипернатриемию. Продолжительность волемического эффекта зави¬
сит от коллоида, входящего в состав инфузионной среды. В последующем пациенты
нуждаются в адекватной инфузионной терапии, контроле и коррекции электро¬
литных расстройств, в противном случае значительно повышается риск полиор¬
ганной недостаточности и летального исхода. Несмотря на возлагаемые надежды,
при рандомизированном исследовании этих препаратов при геморрагическом шоке
не удалось повысить выживаемость больных. Соотнеся риск осложнений и пользу
от препаратов, исследование было досрочно прекращено.
Существуют различные рекомендации по восполнению кровопотери, базирую¬
щиеся на ее объеме (табл. 18-8). Соотношение сред и их выбор в большей степени
зависят от этапа операции, на котором проводят инфузию. Так, до остановки крово¬
течения нерационально использовать эритроцитсодержащие среды и свежезаморо¬
женную плазму, если нет прямых показаний к их назначению: острой анемии (<70
г/л), признаков коагулопатии потребления. Поддерживать гемодинамику и перифе¬
рический кровоток на этом этапе лучше с помощью коллоидных препаратов, вводя
их в соотношении 1:1 или 2:1 с кристаллоидами. С увеличением объема кровопотери
?то соотношение должно увеличиваться в пользу коллоидов. После гемостаза необ¬
ходимо компенсировать утраченный глобулярный объем (эритроцитсодержащими
средами) и факторы свертывания (свежезамороженной плазмой). При кровопотере
менее 1 л пациенты не нуждаются в трансфузии, исключая случаи исходных анемий
(<70 г/л), гипоальбуминемии и гипокоагуляции.
Таблица 18-8. Схема восполнения кровопотери
Уровень
кровеэа-
мещенм
Величина
кровопоте¬
ри, % ОЦК
Объем инфузионно-
трансфузионной терапии,
% объема кровопотери
Компоненты терапии
и их соотношение
I
>10
200-300
Кристаллоиды или кристаллоиды и коллоиды
в соотношении 7:3
II
11-20
200
Коллоиды и кристаллоиды в соотношении 1:1
III
21-40
180
Эритроцитная масса, альбумин, коллоиды и кри¬
сталлоиды в соотношении 3:1:3:3 __
IV
41-70
170
Эритроцитная масса, свежезамороженная плаз¬
ма, коллоиды и кристаллоиды в соотношении
4:1:2,5:2,5 —
V
71-100
150
Эритроцитная масса, альбумин или плазма, кол¬
лоиды, кристаллоиды в соотношении 5:1:2:2 1
Вопрос использования эритроцитсодержащих сред при острой кровопотере
только кажется простым. Так, зачастую происходит подмена целей, когда гемо-
трансфузия направлена не на восстановление оксигенации тканей, а на повышение
уровня гемоглобина. Само по себе снижение гемоглобина не считается абсолют¬
ным показанием к началу гемотрансфузии, оно должно сочетаться с признаками
КРОВОПОТЕРЯ И ПРИНЦИПЫ ЕЕ КОМПЕНСАЦИИ В ЭКСТРЕННОЙ ХИРУРГИИ 615
екватной оксигенации тканей, резистентной к проводимому восполнению
If ннфузионными средами,^ — метаболическим ацидозом, низким выбросом
ными признаками тканевой ишемии. Современный подход к трансфузии эри-
йЯВиитов предполагает, что эритроцитсодержащие среды показаны:
^ при клинических признаках гипоксии, прогрессировании лактат-ацидоза,
І п0вышении дефицита оснований и кислородного долга;
после коррекции ОЦК кристаллоидами и коллоидами;
| при обязательной вентиляции 100% кислородом;
* посЛе оптимизации сердечной деятельности и тканевой перфузии;
Г; „„и очевидном дефиците гемоглобина (обычно триггером считают снижение
гемоглобина до 70 г/л и менее);
і „ри продолжающемся активном кровотечении, когда не удается быстро его
остановить и инфузионная терапия не может обеспечить достаточный транс¬
порт кислорода.
Во всех случаях оксигенация дыхательной смеси и объемная инфузионная тера-
Л с высокой скоростью обязательно должны предшествовать гемотрансфузии.
Большое значение имеет выбор способа компенсации утраченных эритроци-
т0В Было установлено, что при кровопотере более 40% ОЦК аутогемотрансфу¬
зия обладает преимуществами — снижается частота воспалительных и гнойно¬
септических осложнений, полиорганной дисфункции, быстрее стабилизируются
регионарная гемодинамика и тканевый метаболизм в послеоперационном перио¬
де. Интраоперационная аппаратная реинфузия крови (см. соответствующий раз¬
дел) не исключает трансфузию донорской крови, особенно у пациентов с исходно
большим дефицитом глобулярного объема.
СПИСОК ЛИТЕРАТУРЫ
Абакумов М.М., Булава Г.В. Повреждения груди, живота и иммунная система. - М.:
Фирма СТРОМ, 2006. — 176 с.
Воробьев А.И., Городецкий В.М., Шулутко Е.М., Васильев С.А. Острая массивная крово¬
потеря. 1 М.: ГЭОТАР-Медиа, 2001. — 175 с.
Корячкин В.А., Страшнов В.И., Чуфаров В.Н. Клинические функциональные и лабора¬
торные тесты в анестезиологии и интенсивной терапии. — СПб.: Санкт-Петербургское мед.
изд-во, 2004. — 304 с.
Мариино П. Интенсивная терапия. — М.: ГЭОТАР-Медиа, 1998. - 640 с.
Румянцева А.Г., Аграненко В.А., Брюсов П.Г. Клиническая трансфузиология. - М.:
ГЭОТАР-Медиа, 1997. - 576 с.
Рябов Г.А. Гипоксия критических состояний. — М.: Медицина, 1988. — 288 с.
Рябов Г.А. Синдром критических состояний. — М.: Медицина, 1994. — 368 с.
American College of Surgeons, Committee on Trauma. Early care of the injured patient. —
Philadelphia: W.B. Saunders, 1982. H P. 24-26.
Bakker J. Lactate: May I have your votes please? /j Intensive Care Med. - 2001. - Vol. 27. -
N1.-P. 6-11.
Basic and Advanced Prehospital Trauma Life Support. 6th ed. — MOSBY/JEMS, 2007. — 420 p.
Biffl W.L., Harrington D.T., Majercik S.D. et al. The evolution of trauma care at a level I trauma
“nter //J. Am. Coll. Surg. - 2005.1 Vol. 200. - N 6. - P. 922-929.
Bishop M.H., Shoemaker W.C., Appel P.L. et al. Prospective, randomized trial of survivor values
of cardiac index, oxygen delivery, and oxygen consumption as resuscitation endpoints in severe
trauma//J. Trauma. - 1995. - Vol. 38. - N 5. - P. 780-787.
Brod V.I., Krausz M.M., Hirsh M. et al. Hemodynamic effects of combined treatment with oxygen
and hypertonic saline in hemorrhagic shock // Crit. Care Med. — Vol. 34. — N 11. — P. 2784-2791.
Committee on Trauma. American college of surgeons: advanced trauma life support program for
doctors. - Chicago. 1997.
Davis J.W., Kaups K.L. Base deficit in the elderly: a marker of severe injury and death //
J- Trauma. - 1998. - Vol. 45. - P. 873-877.
j7avisJ.VV., Kaups K.L., Parks S.N. Base deficit is superior to pH in evaluating clearance of aci-
after traumatic shock //J. Trauma. — 1998. — Vol. 44. — P. 114-118.
ГЛАВА >8
Щ «-птичим» трансфизиология
МЙШШ§Я>.. ЛИ» S-М.. Kaups K.L. rt al. Admission base deficit predicts transfusion ret
■МЯО aod nsk of complications // J. Trauma. - 1996. — Vol. 41. — P. 769-774.
D. Lactic acidosis // Intensive Care Med. — 2003. — VoL 29. — N S. — P 699-7(ft
Demetrtades D.. Murray j., Charalambides K. et al. Trauma fatalities: time and location trf к
pM deaths// J. Am. Coll. Surg. - 2004. Vol. 198. - N 1. - P. 20-26. **"
Dunham C M . Fahian М.. Siegel J.H. et al. Relationship of plasma amino acids to oxyeen й ь
Щhemorrhagic shock // Circ. Shock. - 1991. - Vol. 35. - P. 87-95. Wht
Cberhardt MX Reactive oxygen metabolites: chemistry and medical consequences. - ex¬
press Bo< a Raton. London; New York; Washington, 2001. — 591 p.
Hcyfand O.K.. Cook D.J.. King D. et al. Maximizing oxygen delivery in critically ill patient*
mcthodoiogic appraisal of the evidence // Crit Care Med. — 1996. — Vol. 24. — N 3. — P. 517-524*
hin K.JL Fischer B. Oxygen in physiology and medicine. - Springfield, 1989. - p. 25-53
Krug E.G.. Sharma G.K., Lozano R. The global burden of injuries // Am. J. Public. Health
2000, - Vol. 90. - P. 523-526.
Kuhne C. Zettl R.P.. Fischbacher M. et al. Emergency Transfusion Score (ETS): a use.
ful instrument for prediction of blood transfusion requirement in severely injured patients n
World J. Surg. 2008. - Vol. 32. - N 6. - P. 1183-1188.
Majno G.. Joris I. Cells. Tissues, and Disease: Principles of General Pathology. - 2nd ed. -
Oxford Llniversity Press. 2004. — 968 p.
Moore iff] Staged laparotomy for the hypothermia, acidosis, coagulopathy syndrome //
Arn.J. Surg. - 19%. - Vol. 72. - P. 405.
Murray C.J., Lopez A.D. Mortality by cause for eight regions of the world: Global Burden of
Disease Study // Lancet. - 1997. - Vol. 349. - P. 1269-1276.
Ong CL. Pung D.J., Chan S.T, Abdominal trauma — a review // Singapore Med. J. - 1994. -
Vol. 35. - N 3. - P. 269 -270.
Paradis N.A.. Balter S.. Davison C.M. et ai. Hematocrit as a predictor of significant injury after
penetrating trauma // Am. J. Emerg. Med. - 1997. — Vol. 15. — P. 224-228.
Faturas J.L., Wertz E.M. et al. Basic and Advanced Prehospital Trauma Life Support. - 4thed. -
Mosbv: Year Book. 1999.
Perioperative Transfusion Medicine. - 2nd ed. — Lippincott: Williams & Wilkins, 2006. - 672 p.
Risen D.. Raum М., Holzgraefe B. et al. A pig hemorrhagic shock model: oxygen and metabolic
acidemia as indicators of severity // Shock. — 2001. — Vol. 16. — P. 239-244.
Rixen D.. Siegel J.H. Metabolic correlates of oxygen predict posttrauma early acute respiratory dis¬
tress syndrome and the related cytokine response //J. Trauma. — 2000. — Vol. 49. - P. 392-403.
Rossaint R., Cerny V., Coats T.J. Key issues in advanced bleeding care in trauma // Shock. -
2006. 1 Vol. 26. - N 4. - P. 322-331.
Rutherford E.J., Morris J.A. Jr.. Reed G.W., Hall K.S. Base deficit stratifies mortality and deter¬
mines therapy //J, Trauma. - 1992. - Vol. 33. — P. 417-423.
Salomone J.P., Ustin J.S., McSwain N. E., Feliciano D.V. Opinions of trauma practitioners
regarding prehospital interventions for critically injured patients // J. Trauma. - 200S. -
Vol. 58. - N 3. - P. 509-515.
Sell S.L.. Avilla M.A., Yu G. et al. Hypertonic resuscitation improves neuronal and behavioral
outcomes after traumatic brain injury plus hemorrhage // Anesthesiology. — 2008. - Vol. 108. -
N5. - P. 873 881.
Shack ford S.R.. Mackersie R.C., Holbrook T.L. et al. The epidemiology of traumatic death: a
population-based analysis // Arch. Surg. — 1993. — Vol. 128. — P. 571-575.
Siegel J.H. Immediate versus delayed fluid resuscitation in patients with trauma // N. Engl.
I Med. 1995. - Vol. 332. - P. 681.
Snyder M.S. Significance of the initial spun hematocrit in trauma patients // Am. J. Emerg
Med. 1998. - Vol, 16. - P. 150-153.
Spahn D.R., Cerny V., Coats T.J. et al. Management of Bleeding Following Major Trauma: a
European Guideline j j Crit. Care. -- 2007. — Vol. 11.
Velmahos G.C., Demetriades D., Shoemaker W.C. et al. Endpoints of resuscitation of critical!)
injured patients: normal or supranormal? A prospective randomized trial // Ann. Surg. - 2000. -
Vol, 232. - N3. - P. 409 - 418.
Yuh-Cliin T.H. Monitoring Oxygen Delivery in the Critically III // Chest. — 2005, - Vol. 128-
P, 554-560.
Zehtabchi S., Sinert R„ Goldman M. et al. Diagnostic performance of serial haematocrit measunr
merits in identifying major injury in adult trauma patients // Injury. - 2006. — Vol. 37. - P. 46->i
Глава 19
Аутодонорство
и аутогемотрансфузии
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИЯ -
АЛЬТЕРНАТИВА АЛЛОГЕННОЙ
ГЕМОКОМПОНЕНТНОЙ ТЕРАПИИ
Внедрение высоких хирургических технологий при операциях
на сердце и сосудах, трансплантации органов и тканей, рекон¬
структивных операциях и лечении гематологических больных тре¬
буют адекватного обеспечения компонентами донорской крови.
Для удовлетворения требований клинической медицины в компо¬
нентах и препаратах донорской крови Службы крови многих стран
интенсивно развивали и совершенствовали организацию массового
донорства, заготовку консервированной крови. Трансфузии алло¬
генной крови, ее компонентов и препаратов заняли важное место
в лечебной практике. Необходимость в значительных объемах
компонентов и препаратов донорской крови требует значительного
числа доноров крови. Общепринято, что для обеспечения страны
компонентами и препаратами донорской крови необходимо, чтобы
на 1000 населения приходилось 40-45 доноров крови. В ряде ана¬
литических работ, посвященных проблеме снабжения клинических
подразделений компонентами крови, указано, что дефицит донор¬
ской крови в различных регионах мира может достигать по разным
причинам от 10-15 до 70% и более. В России снижение объемов
заготовки донорской крови связано с рядом экономических, органи¬
зационных и технологических проблем. На протяжении последних
15-20 лет сложилась крайне неблагоприятная эпидемиологическая
ситуация в отношении гемотрансмиссивных инфекций. Существуют
большие трудности в комплектации донорских кадров, отсутствуют
должные перманентные агитации и пропаганда безвозмездного
донорства, устарело и требует кардинальной реконструкции специ¬
альное оборудование учреждений Службы крови. За 15 лет общее
количество доноров уменьшилось более чем в 2 раза, в том числе
за последние 10 лет на 40%. Объемы заготовки донорской крови
упали на 30-40% по сравнению с 1970-1980 гт. Так, например,
в Научном центре акушерства, гинекологии и перинатологии им.
В И. Кулакова Росмедтехнологий за последние 12 лет объемы
заготовки донорской эритроцитной массы сократились в 5 раз, что
прежде всего связано с катастрофическим снижением количества
Доноров крови. В настоящее время в России на 1000 населения при-
І КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
холится всего 15-18 доноров крови, а в некоторых регионах (например, в Мос*
всего 8-12.
Несмотря на многолетний опыт заготовки, переработки, хранения и клини
- , miannauuo urtDLiv ^ *6'
СКОГО применения крови И ее компонентов, внедрение НОВЫХ, более ВЫСОКОМ
стшельных методов тестирования крови доноров^июгёшш^емотрансф^*
птяппгапт пкиишт. пппРЛРленные ОПасеНИЯ За ЗДОРОВЬе И ЖИЗНЬ пепин,. **
продолжают вызывать определенные опасения за здоровье и жизнь реципиент
При каждом переливании донорской (аллогенной) крови и ее компонент
ов.
действуют шесть ОСНОВНЫХ факторов риска, которые В конечном итоге определяю
посттрансфузионные реакции:
• иммунологические (аллоиммунизация к антигенам клеток и белкам плазмы
периферической крови, иммуномодулирующий эффект гемотрансфузий)
которые клинически проявляются рефрактерностью к проводимой компо¬
нентной гемотерапии, постгрансфузионной тромбоцитопенической пурпу.
рой, фебрильной негемолитической постгрансфузионной реакцией:
I инфекционные (вирусы гепатитов В и С, вирус ВИЧ, цитомегаловирусы
вирусы Т-клеточного лейкоза, Эбштейна-Барр, простого герпеса, возбудите¬
ли бабезиоза, малярии, сифилиса и т.д.). Кроме этого, аллогенные трансфу¬
зии могут привести к посттрансфузионному сепсису вследствие бактериаль¬
ной контаминации в гемокомпоненте;
• метаболические (ацидоз, цитратная, калиевая интоксикации и др.);
• попадание в циркулирующую кровь микросгустков, что приводит к ухудше¬
нию перфузии легких и паренхиматозных органов (воздушная эмболия);
• возможные ошибки в определении группы крови и резус-принадлежности
донора и пациента с последующей трансфузией компонентов донорской
крови, несовместимой по системе АВО или резус-фактору, приводящей
к острому или отсроченному гемолитическому осложнению. По литера¬
турным данным, риск неправильного переливания крови составляет 1:400
(Бельгия), 1:19 ООО (США), 1:27 ООО (Шотландия), 1:36 ООО (Германия);
• погрешности в технике переливания крови [эмболии (воздушная или мате¬
риальная) сгустками крови, которые могут образовываться в процессе заго¬
товки или хранения крови].
Возрастающая потребность в донорской крови нередко превосходит объем ее
заготовки, что в ряде случаев приводит к отсрочке запланированных хирургиче¬
ских операций.
Одновременно со снижением количества доноров крови, несмотря на все усилия
по повышению качества исследования донорской крови, возрастает потенциаль¬
ная опасность передачи вирусных инфекций. По современным представлени¬
ям, это в первую очередь связано с увеличением количества доноров, сдающих
кровь за материальное вознаграждение («кадровые» доноры) при резком паде¬
нии безвозмездного донорства. Не все учреждения Службы крови располагают
технологиями вирусной инактивации, скрининг донорской крови на маркеры
вирусной инфекции осуществляют далеко не лучшими по международным стан¬
дартам тест-системами, нормативными документами, ПЦР-диагностика не введе¬
на в рутинную практику Службы крови. По данным военно-медицинской акаде¬
мии Санкт-Петербурга, за 2004 г. выявлено; ВИЧ — у 0,01% первичных доноров,
HB^Ag - у 0,65%. антитела к вирусу гепатита С — у 1,58%, антитела к бледной
трепонеме І у 0.17%. По статистическим данным, за 2006 г. среди доноров г.
Москвы и Московской области частота выявления маркеров ВИЧ составила
0,03%, гепатитов В и С -1,6 и 2,3% соответственно, сифилиса — 1,9%. У
обследованных выявлено сочетание маркеров двух и более гемотрансмиссивных
инфекций. При определении структуры инфицированности установлено, что чаще
других регистрировали маркеры гепатита С (38,08% случаев), реже - сифилиса
(33,61%), еще реже І гепатита В (27.88%! и ВИЧ го дяо/л
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 619
У вольных (например, гематологические больные), получающих неоднократ-
гемотрансфузии не только от одного донора, риск заражения гемотрансмис-
ными инфекциями очень высок. Сокращение количества безопасных доноров,
J трансфузионных осложнений при аллогенных гемотрансфузиях и высокая
Ш донорской крови кардинально изменили отношение к переливанию донор-
$ « кр0Ви как к дорогому и небезопасному методу лечения.
СК°Помимо риска передачи трансмиссивных инфекций при гемотрансфузиях
_кИцита донорской крови, врачи все чаще сталкиваются с религиозными, эти-
^ еішмй и правовыми аспектами аллотрансфузий. Для определенной категории
'’ ных согласие на оперативное вмешательство в значительной степени связано
\ем какая кровь будет использована — собственная или донорская.
с обеспечения потребностей клинической медицины в кровезамещающих
средствах необходимы:
« агитация и пропаганда донорства крови в целях привлечения к донорству
крови большего количества населения (оптимальное соотношение - 40-50
доноров крови на 1000 населения);
« широкое применение хирургических, медикаментозных, анестезиологиче¬
ских кровесберегающих технологий (современный хирургический инстру¬
ментарий — лазерные ножи, кровоостанавливающие клеи, адекватное ане¬
стезиологическое пособие);
І кровезаменители (препараты гемодинамического противошокового дей¬
ствия, регуляторы водно-солевого и кислотно-основного состояния, искус¬
ственные переносчики кислорода, препараты для парентерального питания,
инфузионные антиоксиданты, кровезаменители комплексного действия);
§ переход от компонентной аллогенной гемотерапии к новой идеологии —
препаратной трансфузиологии (переход от компонентов донорской крови
к препаратам, полученным методами биотехнологии, генной инженерии
и химии);
• аутодонорство и аутогемотрансфузии (заготовка и использование собствен¬
ной крови или ее компонентов).
Как было сказано выше, именно дефицит донорской крови существенно влияет
на реализацию клинических задач. Кроме того, как показывает мировой опыт,
основным ограничивающим фактором к использованию донорской крови в послед¬
ние десятилетия стали гемотрансмиссивные инфекции. Открытие прионов и воз¬
можность инфицирования ими при гемотрансфузиях значительно осложнили про¬
блему инфекционной безопасности гемотрансфузий. Решение видится во внедрении
в практику методов инфекционной инактивации донорской крови, что, в свою оче¬
редь, резко повышает цену конечного продукта и соответственно делает его мало¬
доступным для широкого применения. Оптимальным считается переход от компо¬
нентной гемотерапии к препаратной трансфузиологии. В настоящее время в ряде
клиник широко используют генно-инженерные факторы гемостаза — факторы VII,
VIII и IX, антитромбин III, в качестве кислородоносителей применяют кровезаме¬
нители на основе перфторуглеродных соединений — перфторан* и гемоглобина —
геленпол*’. Вместе с тем, несмотря на бурное развитие медицинской биотехнологии
и очевидные преимущества идеологии препаратной трансфузиологии, пока не уда¬
лось синтезировать все (или все основные) составляющие плазмы и получить синте¬
тический препарат, который полностью заменил бы функцию эритроцитов. Кроме
т°то, синтетические препараты остаются достаточно дорогими, и большинство кли¬
ник не могут себе позволить их покупку по экономическим соображениям.
Современные кровезаменители — это лекарственные препараты, которые
пРи внутривенном введении могут заменять лечебное действие донорской крови
отдельных компонентов. Кровезаменители восполняют, а в ряде случаев
^вктивно восстанавливают функции крови:
etWPftU
820 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
І заполняют кровеносное русло и обеспечивают поддержание на необходимо
уровне артериального давления, нарушенного в результате кровопотепи
или шока;
і восстанавливают осмотическое и электролитное равновесие;
I освобождают организм от токсинов, образующихся при действии патогенных
факторов и инфекционных агентов или поступающих в организм при отрав-
лениях;
• обеспечивают ткани необходимыми питательными веществами и источника¬
ми энергии (растворами аминокислот, сахаров, жиров, витаминов, минераль¬
ными веществами).
Хотя кровезаменители в полной мере не могут заменить свойства компонентов
крови, они считаются альтернативой аллогенной гемотрансфузии, в основном
как объемзаменяющие растворы.
Анализ существующих ресурсов позволяет уже сегодня успешно применять
комплекс методов, позволяющих сократить объемы использования компонентов
донорской крови в клинической практике. Бескровная хирургия - комплекс¬
ный периоперационный подход, концепция, заключающаяся в применении всех
доступных методик для избегания переливания аллогенной крови без ухудшения
результатов лечения пациента.
Каждый из методов кровесбережения вносит свой вклад в уменьшение количе¬
ства аллогенных гемотрансфузий. На первый взгляд, все стратегии кровесбереже¬
ния доступны и могут быть легко реализованы, но, как показывает опыт, все они
редко используются комплексно. Как правило, каждая клиника разрабатывает
и применяет определенный набор методов, которые позволяют решать задачи
по оптимизации снижения объемов аллогенных гемотрансфузий.
Приблизительный вклад отдельных методик сбережения крови у хирургиче-
ских больных приведен в табл. 19-1.
Таблица 19-1. Методики сбережения крови в хирургии
Методы
Количество единиц
крови
Предоперационные
Толерантность к анемии (сокращение количества показаний к переливанию крови)
Увеличение предоперационной массы эритроцитов (применение эритропоэтина)
Программа предоперационного донорства аутологичной крови
1-2
Интраоперационные
Тщательный гемостаз и современная хирургическая техника
Острая нормоволемическая гемодилюция
Методики реинфузии
1 и более
1-2
1 и более
Послеоперационные
Методики реинфузии I 1
В настоящее время предложены и в клинической практике апробированы
анестезиологические и хирургические приемы, которые, отличаясь между собой
по безопасности и эффективности, позволяют снизить объемы использования
в хирургии донорской крови и ее компонентов.
Для реализации концепции бескровной хирургии существенную роль играет
фармакологическая гемокоррекция. Противосвертывающие средства, десмопрес-
син для усиления гемокоагуляционного потенциала крови в сердечно-сосудистой
хирургии, ингибиторы протеаз, аминокапроновая кислота при гиперфибринолизе,
препараты для усиления функции тромбоцитов (апротинин) могут существенным
образом повлиять на интра- и постоперационые потери крови. Фармакологические
средства применяют и для усиления гемопоэза (эпоэтин-б(эритропоэтин*)|. чтобы
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ
821
личить продукцию эритроцитов у пациента в ожидании потери крови во время
Соации или для увеличения доз аутокомпонентов, лечения нейтропении коло-
°2тимулирующий фактор гранулоцита или макрофагальный колониестимули-
І^юший фактор, при тромбоцитопении - тромбопоэтин.
'для снижения объемов используемой аллогенной крови необходимо по воз-
ожности применение принципа «один донор - один реципиент», когда транс-
Гдаологическая служба стремится обеспечить определенного пациента компо-
ентами крови от минимально возможного количества доноров, в идеале - одного
орз. Так, например, этого можно достичь, применяя тромбоциты, полученные
іетодом афереза от одного донора, а не пула от нескольких, заготовкой больших
объемов (двух доз и более) СЗП от определенного донора в одном контейнере.
Одним из доступных методов, позволяющих сэкономить компоненты донор¬
ской крови и избежать проблем, связанных с гемотрансфузией донорских компо¬
нентов крови, является аутогемотрансфузия.
Трансфузия аутологичной крови становится наиболее обоснованным вариан¬
том обеспечения безопасности пациента, дающим возможность избежать реакций,
связанных с трансфузиями донорских компонентов, таких как аллоиммунизация,
заражение гемотрансмиссивными инфекциями, аллергические проявления, реак¬
ция «трансплантат против хозяина», иммуносупрессия.
Аутокровь — полноценная трансфузионная среда, при возмещении которой
не происходит ее депонирования и секвестрации. Одна доза собственной крови
может заменить 2-4 дозы аллокрови. Выживаемость аутоэритроцитов составляет
95-100%, а время их полураспада равно 24-31 сут. При переливании донорской
крови эти параметры составляют 89% и 14-23 сут соответственно.
После трансфузии аутокрови восстановление показателей красной крови про¬
исходит значительно быстрее, чем после аллотрансфузии, при этом кислородтран-
спортная функция крови выше в 2 раза, чем при переливании донорской крови.
К числу аргументов в пользу аутодонорства следует отнести и положительное
влияние предоперационного кровопускания, после которого отмечается стимуля¬
ция гемопоэза: значительно возрастает количество ретикулоцитов (через 6-10 ч
после кровопускания; достигает максимума через 7-9 дней), увеличивается про¬
должительность циркуляции эритроцитов в крови реципиента.
Аутологичную кровь и/или ее компоненты успешно используют в сердечно¬
сосудистой хирургии, акушерстве и гинекологии, травматологии, неотложной
хирургии, трансплантологии, медицине катастроф, гематологии, детской нейро¬
хирургии и др. Аутогемотрансфузии вносят большой вклад в снижение риска,
связанного с переливанием компонентов донорской крови (гемотрансмиссивными
инфекциями), аллоиммуносенсибилизацией реципиента, что важно в лечении
больных, которым требуются множественные гемотрансфузии различных компо¬
нентов донорской крови (больным после трансплантации органов, гематологиче¬
ским больным, пациентам с наследственными аномалиями крови и др.).
Комплекс мероприятий в рамках адаптированных к потребностям клиники
программ аутодонорства и аутогемотрансфузий позволяет полностью заменить
или значительно ограничить применение компонентов гомологичной крови.
В публикациях встречаются различные определения процедур, связанных
с забором и переливанием собственной крови. Часто понятия «аутодонорство*
и «аутогемотрансфузия» путают, принимая их за синонимы.
Аутодонорство — заготовка собственной крови или ее компонентов в предо-
яерационный или операционный периоды (сюда относят и различные варианты
ГСМОДИЛЮЦИИ).
Аутогемотрансфузия — переливание больному компонентов его собственной
крови. Не всякое аутодонорство завершается аутогемотрансфузией. Кроме того,
необходимо различать запланированную дооперационную заготовку аутокрови
622 оівяикювтлнсяммиюп*»
«щ ее комяоиеитов (здесь и далее по тексту — аутодонорство) от реинфуд,
гбора и переливания излившейся в операционную рану крови или дренаж*
крови. В отдельных схемах преоперационной заготовки аутокрови или ее ко*!?
центов аутодонорство может сочетаться с реинфузиями. Таким образом, еле
различать следующие виды процедур, объединенных понятием «аутодонорст*!^
• аутодонорство — дооперационная плановая заготовка собственной kdoL
иди ее компонентов в целях возврата в операционный или послеоперац^*
ный периоды тому же пациенту;
• реинфузия - сбор и возвращение больному операционной раневой или пост-
пера ционной дренажной крови;
I гемодилюция - заготовка консервированной крови пациента после вводного
наркоза (или непосредственно до начала операции) в целях возврата в one-
рационный период;
• аутогемотрансфузия - переливание больному компонентов его собственной
крови.
В публикациях Американской ассоциации банков крови указано, что за период
с 1982 по 1987 г. общее количество доз заготовленной аутологичной крови увели¬
чилось почти в 15 раз - с 18 787 до 282 857. В 115 трансфузиологических центрах
Массачусетского департамента здоровья за период с января по сентябрь 1989 г.
было выполнено 10 289 аутотрансфузий крови, а количество гомологичных транс¬
фузий за этот период снизилось.
Очень показателен 5-летний опыт внедрения программ аутодонорства и ауто¬
гемотрансфузий в США: заготовка аутологичной крови увеличилась на 70,5%,
(с 655 ООО в 1989 г. до 1117 ООО единиц в 1992 г.), в то время как общий объем
заготовки (аллогенной и аутогенной) крови уменьшился на 3,1%. В американском
госпитале общехирургического профиля около 50% ортопедических операций
и 40% вмешательств в отделении торакальной хирургии проводили с использова¬
нием аутогемотранс-фузий. Показано, что в многопрофильной клинике 18% боль¬
ных, которым были проведены трансфузии, могли быть включены в программу
аутогемотрансфузий.
По данным немецких авторов, в большинстве университетских госпиталей
Германии в 1985-1987 гг. 5-10% всех трансфузий были обеспечены аутологичной
кровью.
В префектуре Фукуока (Япония) с 1984 г. применяют программу заготовки
аутокрови -1119 больных (564 сердечно-сосудистых и 555 ортопедических) были
прооперированы с использованием аутологичной крови.
В 1993 г. в Научном центре акушерства, гинекологии и перинатологии им.
В.И. Кулакова Росмедтехнологий альтернативные переливанию донорских ком¬
понентов технологии кровесбережения применяли только в 2% случаев, к 2008 г.
они составили 65% трансфузионного обеспечения, что позволило снизить объемы
гемотрансфузий аллогенной эритроцитной массы в 13 раз. Различные методы
аутогемодонорства в акушерстве и гинекологии способствуют снижению частоты
гемотрансфузионных реакций и в конечном итоге улучшению показателей здоро¬
вья женщины и ребенка.
В Научном центре хирургии им. академика Б.В. Петровского РАМН с 2000 г.
60-80% операций аортокоронарного шунтирования выполнены с использованием
аутокомпонентов и/или методов интраоперационной гемодилюции.
В НИИСП им. Н.В. Склифосовского с 1997 по 2007 г. заготовлено и перерабо¬
тано более 10 000 л аутокрови и ее компонентов, что позволило в 4 раза сократить
применение эритроцитсодержащих компонентов аллокрови. С 2005 г. объем
получаемой аутокрови (70-75% за счет аппаратной реинфузии) для потребностей
неотложной хирургии составляет 2500 л в год.
С 1989 по 1992 г, в США общий объем применения аллогенной крови умень
шился на 6,2%, а использование аутологичных компонентов увеличилось на 59%
АУТОДОНОРСТВО И AVTOTEMOТРАНСФУЗИИ
тоа см
623
гм 7TOM отмечено, что 49,1% заготовленных аутогемокошонен
ребованными (табл. 19-2).
ПрМЗ»Т8ЛЬ
тыс доз
19-2. Заготовка и переливание аутологичной крови в США
1W2”1
ЩВГО
к^ЯПННЫХ
Muiero
&тоГтыс. доз
[Іісвго___
іуітПОГИ^ЬІХ
isofeyro
1980
11 174
28
0.25
1986
13 807
206
1.5
1989
13 554
13169
655
Ізг
4-^-і
1117
i.. »Л
1994
12 908
1013
1
4—1
_1987
2 560
<11
4.9
9934
Н/Д
12 159
Н/Д
12 059
369
3.1
ГзоГГ
566
5.0
11 107 І 11 476
482 І 421
"ТІ ІТ~
>2 389
307
ТІ
Примечание. Н/д - нет данных.
Метод предоперационного аутодонорства имеет свои особенности, которые
в известной степени ограничивают его применение.
К ним относятся:
t необходимость планирования оперативного вмешательства в зависимости
от сроков заготовки и хранения аутокомпонентов крови:
« возможность возникновения ятрогенной анемии при нарушении сроков
и объемов заготовки аутоэритроцитов;
• опасность инфицирования при заборе:
• высокая стоимость программы предоперационной заготовки, учитывая,
что полученные компоненты крови по тем или иным причинам в ряде случа¬
ев не используются.
Несмотря на популярность аутодонорства как метода, позволяющего снизить
риск гемотрансмиссивных инфекций, вопросы, связанные с заготовкой (у какой
категории больных и в каких объемах), остаются нерешенными, а их рентабель¬
ность - плохо регламентированной.
В связи с этим при планировании аутодонорства важно правильно оценить все
риски, как медицинские, так и экономические. В противном случае эффективность
аутогемотрансфузий будет скомпрометирована высокой стоимостью и нерента¬
бельностью процедуры. В первую очередь аутодонорство необходимо планиро¬
вать только в том случае, когда есть уверенность, что заготовленные аутокомпо¬
ненты будут востребованы с высокой долей вероятности. Не стоит заготавливать
аутогемокомпоненты для больных, не требующих гемотрансфузионной терапии
(при холецистэктомии, грыжесечениях, нормальной беременности и др.).
Благодаря определенной стабильности безвозмездного донорства в странах
с высоким уровнем его агитации и пропаганды (Западной Европы, США. Канады
и др.), введению новых технологий тестирования донорской крови на маркеры
гемотрансмиссивных инфекций (высокочувствительных ИФА-методов послед¬
него поколения, NAT-технологий), применению вирусной инактивации компо¬
нентов крови (плазмы, тромбоцитов), использованию лейкофильтров, методов
карантинизации плазмы риск заражения гемотрансмиссивными инфекциями
при переливании донорской крови стал минимальным. Вот почему среди преиму¬
ществ использования аутокрови некоторые зарубежные авторы на первое место
ставят предотвращение аллоиммунизации и иммуносупрессии, и только затем
снижение риска передачи гемотрансмиссивных инфекций.
Можно с уверенностью прогнозировать, что с каждым годом будет увеличи-
Мться количество хирургов и соответственно клиник, применяющих методы
угогемотрансфузий. Вряд ли в ближайшем будущем (5-10 лег) доля аллогенных
трансфузий будет сведена к нулю. Однако со временем, с внедрением новых лекар-
стаенных средств, по мере совершенствования хирургической техники применение
IS24 КЛИНИЧЕСКАЯ ГРАНСФУЗИ0Л0ГИЯ
специальных кровесберегающих технологий, новых кровезаменителей в п
хирургии может быть вытеснено аутотрансфузиями. ан°Воц
Акту альность проблемы предоперационного аутодонорства, в том числе
шшмодонорства, с течением времени нарастает. и аУто-
Этому способствует ряд факторов.
1. Рост количества медицинских центров, в которых проводят операции н
це. аорте и магистральных сосудах, сложные ортопедические вмешательства
гие хирургические пособия, связанные с высокой кровопотерей и необходимо^
кровезамещения. Опыт специалистов во вновь открываемых стационарах
невелик, поэтому выше количество интраоперационных кровопотерь. аСГ°
2. Отмечается закономерный рост информированности населения о негативи
последствиях переливания донорской крови и ее компонентов, в результате раст4
количество пациентов, которые отказываются от аллогенных гемотрансфузий
3. Не только находящиеся в стационарах больные, но и лица, считающие себя
здоровыми, настаивают на заготовке компонентов аутокрови на случай возмож-
ной необходимости в их переливании.
4. Хирурги и анестезиологии, однажды испытавшие на практике программы
аутодонорства и аутогемотрансфузий, в последующей своей работе пользуются
этими методами постоянно.
Большое значение в реализации программ аутодонорства, эффективности и рен¬
табельности использования аутокрови имеют агитация и пропаганда аутодонор¬
ства в клинике. Как показали опросы больных, главное побуждение для аутоло¬
гичной заготовки собственной крови — это рекомендация врача, а не страх паци¬
ента перед переданной переливанием инфекцией. Лечащий врач и трансфузиолог
должны дать пациенту обстоятельные разъяснения обо всех этапах аутогемо¬
трансфузии, получить информированное согласие пациента на процедуру.
Не без основания полагают, что в современных условиях более 40-70% потреб¬
ностей в крови у хирургических больных могут быть удовлетворены различными
вариантами аутодонорства. Из них 10-20% — за счет предоперационной заготов¬
ки крови. 5-10% - различных вариантов гемодилюции и 40-50% - реинфузии
собранной операционной и постоперационной крови. Применение аутотрансфу¬
зий в травматологии и ортопедии, трансплантации печени позволяет сократить
потребности в донорской крови на 80-89%.
ИСТОРИЯ ВОПРОСА (См. «Приложения» на диске @)
КОЛИЧЕСТВЕННАЯ ОЦЕНКА ОБЪЕМА И СТЕПЕНИ ТЯЖЕСТИ
ИНТРА0ПЕРАЦИ0НН0Й КРОВОПОТЕРИ
Большинство специалистов считают показанием для переливания аллогенной
эритроцитной массы кровопотерю более 20% ОЦК, снижение гематокрита менее
25-27%, концентрации гемоглобина ниже 70-80 г/л на фоне циркуляторных
нарушений. Прежде чем планировать любую программу аутодонорства/аутогемо¬
трансфузий, необходимо ответить на следующие вопросы.
• Сколько доз крови может потребоваться (исходя из тяжести планируемой
операции)?
• Какой объем аллогенных компонентов крови необходимо заготовить перед
операцией?
• Можно ли провести операцию, используя только технологии аутодонор
ства/аутогемотрансфузий (или какой объем аллогенных компонентов кров
можно заменить аутокомпонентами) ?
• Как определить объем кровопотери у больных при плановых операциях.
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 825
, Как определить объем кровопотери при ургентных состояниях (у пациентов
при различных травмах, сопровождающихся повреждением сосудов и крово¬
течениями)?
Важнейшая задача трансфузиолога — учет величины кровопотери. Несмотря
з то что существует множество методов определения кровопотери, большинство
** лих так и остались невостребованными в клинической практике. Относительно
!очные методы не получили широкого распространения из-за сложности их выпол¬
нения. а доступные и простые обладают большой погрешностью и/или рядом
серьезных недостатков.
Все известные в настоящее время методы определения объема кровопотери
можно условно разделить на две группы.
І прямое или косвенное определение объема крови, теряемой при травме,
наружном кровотечении, хирургической операции, в послеоперационном
периоде — объем наружной кровопотери.
§ Определение внутренней кровопотери, основанное на оценке отдельных
компенсаторных механизмов, общей устойчивости организма к гиповоле¬
мии, дефицита ОЦК.
ОПРЕДЕЛЕНИЕ НАРУЖНОЙ КРОВОПОТЕРИ
Метод визуальной оценки — субъективный, основанный на опьгге хирурга
и знании основных средних величин кровопотери при операциях; кровопотерю
определяют по степени окрашивания кровью операционного материала, белья,
скорости истечения крови в рану.
Метод определения размеров скальпированной раны путем наложения
на нее кисти руки (правило ладони). Этот метод применяют для определения
площади пораженных участков кожи ожоговых больных. Ориентировочная оцен¬
ка величины кровопотери на месте происшествия. Позволяет на догоспитальном
этапе определить программу оказания первой помощи и последующего лечения
при поступлении пострадавшего в стационар. Площадь, занимаемая одной кистью,
соответствует объему кровопотери около 10% ОЦК (500 мл), 2-3 — 20%, 3-5 -
40%, 5 - 50% и более.
Метод взвешивания больного до и после операции. Необходим специаль¬
ный стол-весы. Метод позволяет определить объем кровопотери, потери жидкости
при испарении с поверхности тела, раны и при дыхании.
Взвешивание операционного материала и белья. Наиболее простой метод.
Его можно использовать в любой операционной.
Все разновидности весового (гравиметрического) метода дают допустимую
для практической работы погрешность 3-15%.
Калориметрический метод основан на определении общего количества
гемоглобина, теряемого пациентом с кровью. По сравнению с гравиметрическими
методами, калориметрический менее зависим от неучтенного объема жидкости,
введенной больному.
ОПРЕДЕЛЕНИЕ КРОВОПОТЕРИ
Метод визуальной оценки состояния больного. Хотя его автоматически
выполняет врач на месте происшествия, нельзя считать этот метод достаточно
Достоверным, поскольку он основан на таких показателях, как окраска кожи и сли¬
зистых оболочек, наполнение поверхностных вен, интенсивность дыхания, пове¬
дение больного, которые могут изменяться под воздействием различных причин.
Метод определения кровопотери с помощью индекса шока Альговера —
Устное от деления количества сердечных сокращений в минуту на величину систо¬
лического АД (мм рт.ст.). Метод позволяет оценить степень устойчивости больного
к кровопотере (степень компенсации) и коррелирует с величиной кровопотери.
ю
ммгсемя ШШШШШ
&5~0,75; при кровопотере 10-15% ОЦК (500-700 мл для взрослого)
11 0Д5 1.1; 3(1-40% - 1.2-1.4; при потере 50% ОЦК и более ,
ІяиНЯВ
во 0А 20-25%
ЩсШШотм эффективна в тех случаях, когда нельзя использоа^
фдог метояы. ~ на догоспитальном этапе при травмах, внутренних кровотечениях
Метая определения ЦВД*' один из самых точных и чувствительных методов
ДОЗВОЛЯЮЩИЙ определить степень гиповолемии. Динамический контроль ЦВД
I обнаружить раннюю, доклиническую стадию гиповолемии при кроно-
mnam a скорректировать инфузионно-трансфузионную терапию. При экспира-
ЩрМке или ИВЛ информативность ЦВД значительно снижается.
Метод определения величины кровопотери путем плотности (удельной
массы) крови (метод Филипса); суть метода заключается в том, что капля крови
при погружении в раствор CuS04-5H20 в зависимости от своей плотности свободно
плавает, всплывает или тонет.
Гемятокритный метод: основан на определении степени постгеморрагической
гемодилюции. зависящей от дефицита эритроцитов. Поскольку объем циркулиру¬
ющих эритроцитов и гематокрит связаны прямо пропорционально, кровопотерю
можно вычислить по специальной формуле.
Метод определения осмолярности крови. Основан на изучении изменения
осмотического давления плазмы после кровопотери.
Примерные объемы кровопотери в зависимости от характера и локализации
травмы представлены в табл. 19-3.
Таблица 10-3. Ориентировочная величина кровопотери в зависимости от характера и локализации
травмы (по Жизиевскому Я А.. 1994)
Характер и локализация травмы
Величина кровопотери, мл
[Паркломы метай
яинн
300-600
Плачі
600-650
Гомни
800-1000
ИВ
1000-1800
Таза
1250-2500
Черала открытые
500
Чарала закрытые
1200
Траамы груди
500-1800
Травмы живота с повреждением внутренних органов
1700
Опиетрельиые рамы
Чарала
1200-1500
рш
1800-2000
Живота
1700-2000
Там
2000-2500
В£Ш
1500-1800
Голени И (ТОЛЫ
1000-1200
Плача, предплечья, кисти
1000-1600 J
Как уже было сказано выше, в настоящее время не существует полностью досто¬
верных методов определения кровопотери. Это связано как с несовершенством
I неудобством некоторых методов на практике, так и с индивидуальными реак¬
циями пациентов на одинаковый дефицит ОЦК.
Потребность І переливании крови или ее компонентов при хирургических вме¬
шательствах прогнозировать довольно трудно. Она зависит от ряда причин: мето¬
да операции и хирургической техники, уровня подготовки оперирующего хирург*-
показателя снижения гематокрита, предельно допустимого в данной больнице
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 827
,_jггический показатель гематокрита), состояния пациента, а также от конкрет-
мероприятий по экономии гомологичной крови, проводимых в конкретном
лзциойаре. Показатель объема кровопотерь при одних и тех же вмешательствах
сожст колебаться в широких пределах у разных пациентов в различных клини-
ф, Тем не менее попытки определить зависимость объема кровопотери от вида
овераДОН время от времени предпринимаются (табл. 19-4). Они носят рекоменда¬
тельный характер и год от года изменяются (как правило, в сторону уменьшения)
по мере усовершенствования хирургической техники, инструментов и тактики
хирургического вмешательства, оптимизации медикаментозного сопровождения
и анестезиологического пособия.
Таблице 19-4. Операции с предполагаемой потребностью в переливании более 1 л компонентов
крови
Ортопедия
Операции на тазобедренном суставе, по поводу сколиоза
Кардиохирургия
Аортокоронарное шунтирование, резекция аневризм грудной аорты, нмп
тация искусственных клапанов
їлан-
Пластическая хирургия
Уменьшение молочной железы, яилэктомия
Гинекология
Гистерэктомия
Акушерство и гинекология
Внематочная беременность, кесарево сечение
1
Сосудистая хирургия
Резекция аневризмы аорты
[нейрохирургия
Ламинэктомия, иссечение гемангиомы
Другие области хирургии
Челюстная хирургия, оториноларингологические операции, оперативная уро- j
логия, торакальная хирургия
Факторы, влияющие на потребность в крови или ее компонентах при хирурги¬
ческих вмешательствах:
S индивидуальное состояние пациента:
• хирургическая техника/методика;
І уровень профессиональной подготовки оперирующего хирурга;
1 проводимые меры по экономии гомологичной крови:
• предельно низкий показатель гематокрита, допустимый в клинике.
Большинство исследователей сходятся во мнении, что прогнозировать потреб¬
ность в переливании крови при определенных операциях можно только на осно¬
вании внутренней статистики больницы.
В каждой клинике отрабатывают и принимают для практического использова¬
ния один или два метода определения кровопотери при плановой или экстренной
операции.
У плановых хирургических больных объем кровопотери и соответственно пред¬
полагаемое количество необходимых компонентов крови (как аллогенных. так
и аутологичных) в каждой клинике рассчитывают на основании статистических
данных. При этом исходят из эмпирического опыта, вида операции, клинико-
лабораторных показателей пациента, оперирующей бригады хирургов и особен¬
ностей анестезиологического пособия. В процессе усовершенствования хирурги¬
ческой техники, инструментов, адекватного медикаментозного сопровождения,
анестезиологического и трансфузионного пособия множество операций, при кото¬
рых ранее требовалось переливание донорской крови или ее компонентов, выпол¬
няют без гемотрансфузий. Некоторые операции при адекватном планировании
и проведении можно выполнить с использованием исключительно аутокрови
или ее компонентов. При применении любой из программ аутодонорства/ауто-
гемотрансфузий необходимо страховать хирургическую операцию необходимым
количеством компонентов донорской крови.
Всю кровь, потерянную больным в период травмы и/или при хирургической
операции, можно условно разделить на жидкую (излившуюся из организма).
g2$ ТРАНСФУЗИОЛОГИЯ
jqpOH» • операционном материале, кровь в сгустках, удаленном органе, болы
ЩВМПК (ащшыер. в забрюшинном пространстве). Чаще всего точно измео
^ЩИЩрЙОТотттргп не удается. Как правило, о ней судят по прямым (как пра
ло. оценивая объем кровопотери визуально) и клинико-лабораторным показа**
лям. От того, насколько точно определен объем кровопотери, зависит не толь*
пособие (ауто- и аллокомпонентами, кровезаменителями!1
Щ(рирцультат всей операции, сроки выздоровления пациента, а также стоимость
лечения.
В предоперационном периоде объем кровопотери, особенно у пациенте
с травмой, оценивают по ее локализации и характеру повреждения. В частности.
||р гемотораксе кровопотеря составляет примерно 1,5-2,0 л, переломе одного
ребра - 0.2-0.5 л. травме живота - до 2 л. печени — 2-5 л, переломе костей таза
(забрюшинная гематома) - 3-5 л, бедра — 1,0-2,5 л, плеча/голени - 0,5-1,5 л
костей предплечья - 0.2-0.5 л, позвоночника — 0,5-1,5 л, а при скальпированной
ране размером с ладонь — 0,5 л.
В интраоперационном периоде используют прямые методы (калориметри¬
ческий. весовой, объемный) оценки величины кровопотери. При этом сложно
определить скрытые потери крови в рану и на хирургическое белье. Наиболее
распространены измерение объема крови в резервуаре вакуум-аспиратора и визу¬
альная оценка степени пропитывания кровью хирургических тампонов и салфе¬
ток. Более точный способ — взвешивание перевязочного материала до и после
использования, но орошение операционной раны существенно затрудняет оценку
кровопотери. Измерение концентрации гемоглобина и гематокрита не всегда
позволяет оценить кровопотерю, на эти показатели существенно влияют инфузия,
быстрые жидкостные сдвиги, зависящие от размера операционной раны, дли¬
тельность и травматичность хирургических манипуляций. Кроме того, величина
кровопотери, выраженная только в объеме, не отражает патологические процес¬
сы, происходящие в организме. Следовательно, степень тяжести кровопотери
более адекватно оценивать через дефицит ОЦК. Однако в неотложной хирургии
(при травматическом, геморрагическом шоке) определение ОЦК затруднено,
а его дефицит неравнозначен объему кровопотери. В этом случае степень тяжести
острой кровопотери более целесообразно оценивать через дефицит ГО крови, учи¬
тывая, что он уменьшается строго на величину кровопотери.
В основе предлагаемого метода оценки объема и степени тяжести кровопоте¬
ри лежат два принципа: максимальный учет излившейся крови (полостной,
раневой, дренажной, в больших гематомах, в резервуаре АИК, на операционном
материале, в удаленном органе и сгустках) и количество утраченных эритро¬
цитов - дефицит ГО крови. Существуют следующие способы анализа количе¬
ства утраченных эритроцитов или утерянного ГО крови,
а В жидкой крови: полостную, раневую и дренажную кровь собирают с помощью
черпака, хирургического вакуум-аспиратора, или Cell-Saver, в мерную емкость,
содержащую антикоагулянт (50 мл 4% раствора натрия цитрата на 500 мл
крови). В каждом из собранных образцов крови измеряют гематокрит, рассчи¬
тывают среднюю концентрацию гемоглобина для всего пула собранной жидкои
крови. Произведение среднего гематокрита на ее объем указывает на величину
утерянного ГО (в мл) (см. «Клинический пример №1» на диске @).
• В крови, находящейся на операционном материале. Пропитанные кро¬
вью операционные салфетки извлекают из операционной раны и помещают
в стерильную емкость (5 л), содержащую 4% раствор натрия цитрата в 0,9%
растворе натрия хлорида (в соотношении 1:10). В 3 л такого раствора перено¬
сят 35 60 салфеток среднего размера (30x40 см). Происходит перемещение
эритроцитов из операционного материала в раствор. Для лучшего выхода
(элюции) эритроцитов в консервирующий раствор помешивают салфетки
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 629
арильным корнцангом (при этом все салфетки должны быть погружены
в консервирующий раствор). Салфетки выдерживают в растворе в течение
15-30 мин, после чего их отжимают и извлекают. Затем измеряют объем
полученного элюата и определяют его гематокрит. Произведение объема
элюата на его гематокрит указывает на количество утерянного ГО. находя¬
щегося на операционном материале.
с Отметим, что количество крови на операционных салфетках зависит
ОТИХ размера (большие - 60x40 см, средние - 30x40 см и малые - 20x25 см),
а также от вида операционного вмешательства, операционной техники
и опыта операционных сестер.
с Установлено, что при травматологических операциях (остеосинтез бедрен¬
ной кости и эндопротезирование тазобедренного сустава) в одной средней
салфетке находится от 2,7 до 4,8 мл утерянного ГО, что соответствует 6,4
и 11,6 мл крови (в среднем 8 мл) на салфетку среднего размера. При сочетан¬
ной травме, внематочной беременности, а также при трансплантации печени
на средней операционной салфетке обнаружено большее количество крови -
от 8,3 до 14,1 мл утраченного ГО, что соответствует от 20,7 до 35,1 мл крови
или примерно 27,7 мл крови на салфетке среднего размера.
I Аналогичным способом определяют утерянный ГО, находящийся на опера¬
ционных пеленках. Одну пропитанную кровью пеленку помещают в 3 л кон¬
сервирующего раствора, выдерживают 15-30 мин, извлекают и отжимают.
Далее измеряют объем элюата и его гематокрит. Произведение объема элюа¬
та на его гематокрит указывает на величину утерянного ГО, находящегося
на пеленке (см. «Клинический пример №2» на диске @)
• Кровь в сгустках. Сгустки крови извлекают из операционной раны и взве¬
шивают. 1 г сгустков крови соответствует 1 мл крови. Величину утеряннно-
го ГО оценивают как произведение объема сгустков на гематокрит крови
больного до оперативного вмешательства (см. «Клинический пример №3»
на диске @).
• Кровь в больших гематомах и забрюшинном пространстве. Объем
крови, находящийся в забрюшинном пространстве и больших гематомах,
определяют с помощью КТ. Утерянный ГО равен произведению объема
гематомы (мл) на гематокрит больного до оперативного вмешательства (см.
«Клинический пример №4» на диске @).
І Кровь в удаленном органе — см. на диске «Реинфузия крови из удаленных
органов».
Для объективной количественной оценки интраоперационной кровопотери
и адекватности ее восполнения введен новый трансфузионный параметр — учтен¬
ная кровопотеря (УК). УК — количество крови, собранной во время операции
из серозных полостей, операционной раны, дренажей, операционного материала,
сгустков крови, остаточный объем в АЙК и кровь, находящаяся в гематомах и уда¬
ленных органах. Таким образом, сумма составляющих утраченного ГО — в жидкой
крови, крови на операционном материале, в сгустках, больших гематомах, крови
из удаленного органа — соответствует понятию УК.
Необходимо отметить значение каждой составляющей УК при различных опера¬
тивных вмешательствах. Доля жидкой крови при расслаивающей аневризме брюш¬
ного отдела аорты и тупой травме груди составляет от 63 до 92% всей УК. При неко¬
торых операциях доля крови, находящейся на операционных салфетках, более
значима. Например, при пангистерэктомии у пациенток с миомой матки она дости¬
гает 82% УК. Большое значение имеет количество крови в сгустках — при ножевом
Рвении передней брюшной стенки, лапаротомии и ушивании ранения печени
®тгустках может находиться до 40% УК. При некоторых операциях ббльшая часть
Р приходится на кровь из удаленного органа. В частности, при экстирпации матки
По поводу миомы она составляет 14-33%, а при трансплантации печени - до 26%
ГЛАВА I*
И КЛИНМЧССХЛЯ ТИШСФУЗИОЛОГИЯ
tffwwM УК, наконец, кровь а забрюшинной гематоме достигает 35% ук
всей УК ори резекции аневризмы брюшного отдела аорты. Следовательно юГ. \
вв выбранных составляющих кровопотери — жидкая кровь, кровь в операци^
материале. сгустках, удаленном органе, больших гематомах (в забрюшинномННОі|
сіраистве) I имеет значение при определении степени кровопотери и интп» П^°'
ционном инфузионно-трансфузионном пособии (ИТТ). Для адекватности
сияной терапии при острой кровопотере УК выражают в различных единица* ^
В эквиваленте крови больного (мл) — для этого утраченный ГО
на значение гематокрита до операции. По П.Г. Брюсову (1997), выделяют неск*
ко видов УК: к< Ль
• малая - менее 0,5 л;
I средняя - 0,5-1,0 л;
• большая - 1,1-2,0 л;
I массивная — 2.1-3.5 л;
• летальная - более 3,5 л (>1 ОЦК).
Например, утраченный ГО равен 1000 мл, гематокрит больного до операци
составляет 40%. Объем УК = 1000: 0,4 = 2500 мл (массивная кровопотеря). И
Кровь в дефиците ГО, % должного у больного - необходимо оценить
должный ГО. Для этого путем расчетов определяют должный ОЦК, который
у женщин составляет 65, а у мужчин 75 мл/кг. После этого рассчитывают должный
ГО, который равен произведению должного ОЦК на значение гематокрита (жен¬
щины - 0,40. мужчины - 0,42). Частное от деления утраченного ГО на должное
равно его дефициту (%). Это позволяет оценить степень тяжести кровопотери
По П.Г. Брюсову (1997), выделяют следующие степени гиповолемии:
І легкая I менее 30%:
в умеренная - 31-45%;
I тяжелая 146-60%;
• крайне тяжелая - более 61% должного ГО (см. «Клинический пример №5»
на диске @).
Кровь в стандартных дозах эритроцитов (СДЭ). Утраченный ГО делят на 200.
1 СДЭ=200±10 мл эритроцитсодержащей среды с гематокритом, равным 1, что соот¬
ветствует 450+25 мл цельной или 513±50 мл консервированной донорской крови.
Оценка величины кровопотери и рекомендации
Кровопотеря, выраженная в объеме крови больного (мл), - ориентирует
на количественное восполнение ОЦК; объем кровезаменителей должен в 1,5-
2,5 раза превышать УК.
Выраженная в дефиците ГО (%) - показывает степень тяжести кровопотери
и обосновывает тактику адекватной компенсации утраченного ГО крови больного
и восстановление функции транспорта кислорода.
Выраженная в СДЭ - позволяет оценить необходимое для трансфузии коли¬
чество эритроцитсодержащей среды. За рубежом количество эритроцитной массы,
эритроцитной взвеси, неразделенной крови обозначают в дозах. Нормативы
потребности в эритроцитсодержащих средах при различных оперативных вмеша¬
тельствах в Российской Федерации, Европе и США также выражают в дозах.
АУТ0Д0Н0РСТВ0
Аутодонорство - процедура заготовки собственной (аутологичной) крови
И/ или ее компонентов в целях возмещения кровопотери у данного индивида
(аутогемотрансфузии).
Программы аутодонорства (и аутогемотрансфузий) необходимо рассчитывать
с учетом характера заболевания и предстоящей операции, объема возможной кро*
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 631
.потери, общего состояния больного, его компенсаторных возможностей и необ-
одимости в крови и ее компонентах (в первую очередь аутологичных) в процессе
* ургического вмешательства и/или после него.
* Основные методы заготовки аутокрови
в предварительная заготовка аутокомпонентов крови у лиц с высоким риском
кровопотери.
• предоперационная заготовка аутокрови и/или ее компонентов у больных.
• предоперационная гемодилюция.
« Интраоперационная гемодилюция.
• Интраоперационный сбор раневой операционной крови в целях реинфузии.
I послеоперационный сбор дренажной крови в целях реинфузии.
Донору аутокрови необходимо провести клиническое и лабораторное иссле¬
дования в соответствии с теми же требованиями, которые предъявляют к ДОНО¬
РУ гомологичной крови (определение группы крови и резус-фактора, анализы
на сифилис, гепатиты, ВИЧ), а также с учетом основного и сопутствующих забо¬
леваний. Методика заготовки аутокрови соответствует правилам и требованиям
заготовки крови от доноров. Таким образом, необходимо соблюдение всех мер,
определенных инструкциями и положениями для заготовки, исследования, пере¬
работки и хранения донорской крови.
Основные лабораторные показатели у донора аутокрови:
I концентрация гемоглобина в крови более 110 г/л;
• гематокрит более 35%;
• концентрация общего белка более 60 г/л;
і проба Квика и АЧТВ в пределах нормы;
I количество лейкоцитов 4,0-9,0хЮ9/л;
• количество тромбоцитов более 180,0 хЮ9/л.
Сдача одной дозы крови может снизить концентрацию гемоглобина у донора
до 100 г/л и гематокрит до 33-35%. При этом установлено, что еженедельные
кровосдачи одной дозы крови в 1,5 раза ускоряют эритропоэз (при условии под¬
держания нормальной концентрации железа в сыворотке крови).
Трансфузиолог совместно с лечащим врачом больного и после консультации
с анестезиологом (если кровосдача происходит непосредственно перед операцией
после вводного наркоза) определяют программы аутодонорства - назначают дозу
и интервал между кровосдачами.
Стандартный объем эксфузии — 400-450 мл (5-7 мл/кг). В зависимости от за
болевания, тяжести патологического процесса, сроков до операции, программ
аутодонорства однократная доза эксфузии может быть изменена — уменьшена
или увеличена.
Кратность, объем и промежутки между предоперационными эксфузиями ауто¬
крови определяют лечащий врач и трансфузиолог индивидуально для каждого
больного с учетом его общего состояния и предполагаемой операционной крово¬
потери.
При отборе больных для аутодонорства учитывают:
І необходимость переливания крови при операции на основании степени ане¬
мии, гематокрита, ОЦК у пациента, объема предполагаемой кровопотери
во время операции и после нее (не следует прибегать к аутотрансфузии, если
не предполагается существенная кровопотеря);
• наличие инфекции — как противопоказание к аутодонорству;
• адекватный уровень гемоглобина и гематокрита;
• способность больного перенести временную острую кровопотерю — паци¬
енты с массой тела более 60 кг могут сдать до 450 мл крови при каждой
эксфузии; при меньшей массе тела следует эксфузировать половину дозы
или не более 10% ОЦК;
1
532 КЛИММЕСКАЯ ГРАНСФУЗИОЛОГИЯ
• возможность вазовагальных реакций (по данным многих исслелл
и на основании нашего опыта и литературных данных, у 2-5% аутп
отмечались подобные реакции на эксфузию крови). ДОн°Ров
Виды и программы аутодонорства
В зависимости от цели процедуры, задач, стоящих перед трансфузи
и состояния здоровья пациента необходимо различать донорство а Олог<4
и/кли ее компонентов: 0кРови
• у лиц, прошедших соответствующие клинико-лабораторные обследо
1 освидетельствованных как доноры аллогенной крови; Ия
• у пациентов при плановых операциях с последующей аутогемотрансфуч *
І І лиц (или пациентов) с наследственными аномалиями крови - гемог гл*’
нопатиями (СКА. талассемии), энзимопатиями (дефицит фермента Г-6-Фт
наследственными или приобретенными нарушениями в системе гемостаз
Существуют различные варианты заблаговременной заготовки аутокрови
В условиях дооперационного дефицита времени большинство исследователе"
рекомендуют проводить заготовку аутокрови за 4-5 сут до операции. Этот подход
наиболее часто используют и в настоящее время.
При оперативных вмешательствах с кровопотерей до 500 мл и предполагаемым
снижением концентрации гемоглобина до 80-100 г/л и гематокрита до 30-31%
целесообразно заготавливать 450-500 мл цельной консервированной аутокрови
за 3-5 сут до операции. При операциях с планируемой кровопотерей 500-600 мл
и более рекомендуют использовать ступенчато-поэтапный метод заготовки аута-
крови в различных модификациях (см. ниже). При этом кровь заготавливают и кон¬
сервируют в несколько этапов: на первом этапе у пациента за 7-10 сут до операции
забирают и консервируют 400 мл крови, на втором (через 7-10 сут) - забирают
и консервируют 600-650 мл с одновременным переливанием крови, заготовленной
на первом этапе, на третьем — 800-850 мл крови через 10-13 сут после второго
этапа (за 3 сут до операции) с одновременной трансфузией крови, заготовленной
на втором этапе. Количество этапов, как и объем эксфузированной аутокрови, зави¬
сит от состояния пациента и предполагаемой кровопотери (табл. 19-5).
Таблица 19-5. Показания к аутодонорству — плановое хирургическое вмешательство с предпо¬
лагаемой кровопотерей более 550 мл (указаны рекомендуемые сроки последней аутодонации)
j Выбор протокола
Дооперационное резервирование
Интраоперационная гемодилюция
Аппаратная реинфузия
Послеопераї іипнная реинфузия —
Вид необходимого компонента
АутоСЗП и/или аутоэритроцитная масса
-
Аутотромбоконцентрат
Оптимальные сроки аутодонации
АутоСЗП — за 2-7 сут до операции
Аутоэритроцитная масса — за 2-3 сут до операции
т ..
Аутотромбоконцентрат — за 2-4 сут до операции
£
Как правило, заготовка крови заканчивается за 3-7 сут до операции, а начина
» несколько недель до нее. что зависит от запланированного объема аутокров •
Оригинальный подход к заготовке аутокрови предложили М.И. Перед
и соавт. (1972). Метод получил название поэтапной заготовки крови.
На первом этапе у больного забирают 300-400 мл крови.
На втором этапе через 4 сут забирают 200 мл. аК)Т
На третьем этапе через 4 -5 сут (за 3-5 сут до операции) больному пере т
«•готовленную на первых двух этапах аутокровь (500-600 мл) и эксфу3 Р
800 мл аутокрови.
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИЙ 633
Существует видоизмененный вариант метода поэтапной заготовки крови.
На первом этапе у больного забирают 300-400 мл крови. На каждом последую-
u этапе эритроцитную массу, заготовленную на предыдущем этапе, возвращают
ллііьному и вновь забирают — на 250 мл больше. За 10 сут можно получить 750 мл,
j5 - 1000 мл, а за 25 — 1500 мл аутокрови.
38 Хорошо зарекомендовал себя ступенчато-поэтапный метод («прыгающей
лгушки») заготовки консервированной аутокрови, когда большие объемы крови
Лоіо заготавливать и консервировать в несколько этапов.
* первый этап — эксфузия крови в объеме 400-450 мл.
, Второй этап — через 5-7 сут повторная эксфузия 800-900 мл с возвращением
больному аутокрови, заготовленной на первом этапе.
! Третий этап — через 10-14 сут после первого этапа (но не менее чем за 72 ч
до операции) еще одна, третья эксфузия 1200-1400 мл с одновременным воз¬
вратом 800-900 мл крови, заготовленной на втором этапе.
Метод «прыгающей лягушки» позволяет до операции с предполагаемой кро¬
вопотерей примерно 1200-1500 мл заготовить 1200-1400 мл аутокрови малого
срока хранения (<3-4 сут). В зависимости от предполагаемой кровопотери коли¬
чество этапов может быть увеличено (или уменьшено).
Для подбора дозы эксфузии при ступенчато-поэтапном методе необходим кон¬
троль показателей гемодинамики и общего анализа крови (концентрация гемогло¬
бина >110-120 г/л; гематокрит — 32-34%), а также контроль за состоянием боль¬
ного. В зависимости от этого следует определять количество и объем забираемых
компонентов крови. Во всех случаях эксфузии сопровождаются трансфузиями
кровезаменителей.
В последние годы заготовку необходимых компонентов крови в объемах, доста¬
точных для определенного вида операции, выполняют на специальных автомати¬
ческих аппаратах, позволяющих в зависимости от вида устройства или выбранной
программы выполнять соответствующую процедуру гемафереза. Критерии отбора
пациентов для гемафереза аналогичны критериям отбора пациентов для экс¬
фузии консервированной крови для аутогемотрансфузии. После каждого этапа
донорства заготавливают аутоСЗП, аутоэритроцитную массу, аутотромбокон-
центрат. Метод гемафереза позволяет оптимизировать гемостаз, стабилизирует
ОЦК путем притока аутологичных факторов свертывания, снижает концентрацию
липидов - оказывает дополнительное положительное воздействие на организм
больного перед предстоящей операцией. Из методов гемафереза наиболее часто
применяют плазмаферез для заготовки аутоСЗП. За каждый сеанс можно получить
от 600 до 900 мл аутоСЗП. Свежую плазму быстро замораживают и хранят до года
при температуре -40 °С. Возможность длительного хранения аутоСЗП при низких
температурах позволяет заготавливать ее задолго до операции.
Заготовка аутокомпонентов крови методом гемафереза с использованием сложной
техники предъявляет повышенные требования к уровню подготовки персонала.
Все вышеперечисленные методы заблаговременной дооперационной заготовки
тутокрови или ее компонентов следует рассматривать как схему, которая может
выть изменена в зависимости от состояния больного, планируемой кровопотери,
3 также сроков операции. Главное при планировании аутодонорства — не переоце-
нть сумму факторов, когда преимущества того или иного вида предоперационной
заготовки крови или ее компонентов может превысить риск для больного, особен¬
ной, интра- и послеоперационном периоде.
Ответственность за эффективную организацию и проведение программы ауто-
норства в клиниках несет врач-трансфузиолог. Она регламентирована долж¬
ными обязанностями специалиста. Медицинский персонал, осуществляющий
Готовку аутокрови или ее компонентов, должен пройти специальную подготовку,
Сонары оснащены необходимым для заготовки и хранения аутокомпонентов
<и WUJ
134 КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
оборудованием. Необходимо помнить, что заготовка аутокрови может с
вцаться осложнениями, требующими принятия экстренных мер. пР°во-
Донорство аутокрови и/или ее компонентов у лиц
освидетельствованных как доноры аллогенной крови
Заготовка и хранение аутокомпонентов крови показано для лиц с потені
ным риском травматической кровопотери, ожогов, связанных с их прскЬе ^
иальмой деятельностью (работников МВД, МЧС, пожарных), а также лице °
кнми группами крови (табл. 19-6). В эту же группу с определенными оговопк^'
можно отнести женщин с анормально протекающей беременностью. 1411
Заготовку и хранение аутокомпонентов проводят в соответствии с требованн
ми и правилами, установленными для доноров аллогенной крови. У беременнГ
кроме строгого соблюдения всех мер, определенных инструкциями и положен/
ми для заготовки, исследования, переработки и хранения донорской крови, нужен
постоянный контроль за клинико-лабораторными показателями, отражающими
состояние пациентки и определяющимися диагнозом.
Помимо обычных параметров (даты заготовки, группы крови, резус-фактора
объема препарата), на этикетке полученных компонентов должны быть указаны
фамилия, имя, отчество, места работы или домашнего адреса аутодонора, а также
данные имеющейся медицинской документации (номер медицинской, амбулаторной
или стационарной карты).
Хранить эти препараты следует в Банках крови, а при их отсутствии - в местах
их заготовки в специальных, отдельных от компонентов донорской крови холо¬
дильниках с маркировкой: «Аутокомпоненты» или «Зарезервированные аутоком¬
поненты».
Аутодоноры не могут быть включены в общий список доноров крови и ее ком¬
понентов. Необходимо выделение их в отдельную группу — доноры зарезервиро¬
ванной аутокрови, поскольку эти компоненты заготавливаются индивидуально
и их нельзя переливать другим лицам; при этом аутогемотрансфузия не носит
обязательный характер.
По истечении срока годности неиспользованные аутокомпоненты этой катего¬
рии лиц могут быть переданы на переработку для изготовления препаратов крови
(с информированного согласия аутодонора) или утилизированы.
Сроки, объемы и режимы восполнения Банка аутокомпонентов устанавлива¬
ют исходя из теоретической вероятности травматической кровопотери у лиц той
или иной группы риска (в ряде случаев индивидуально) после истечения срока
годности аутокомпонента. Неиспользованные компоненты крови могут быть
переданы на переработку для получения препаратов крови.
Таблица 19-6. Количество компонентов аутокрови у различных групп населения и больных
Группы
Аутокровь, л
Аутоэритро¬
цитная масса, л
АутоСЗП, л
Аутотром-
бомасса,
дозы*
Аутогемопоз-
тичесиие
клеш, ДОЗИ.
(Лица Я редким фенотипом
0,5-1,0
1-1.5
1-2 и более
? _
і Работающие на вредных
производствах
1,5-4,0
2-5
3-4
и
Больные, готовящиеся
к плановым операциям
-
1,0-1,5
1-5
3-5 и более
Гематологические пациенты
1-3
?
1-2“
?**
1-j^-
/Беременные (роженицы)
: - 1
0,5-1
0,5-1,5
-
* Заготовку проводят в исключительных случаях.
** Вогцюс мало изучен
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 635
Несмотря на всю очевидность пользы применения аутокомпонентов, целе-
побразность резервирования аутокрови у здоровых граждан, профессиональная
зеятельность которых связана с высоким потенциальным риском травматизации,
также у лиц с редкими группами крови до конца не определена. Вопрос не столь¬
ко в том, как организовать сбор и хранение, а в основном как использовать
и компоненты. Если сотрудники с риском профессиональной травматизации
/например, пожарные, милиционеры) работают в регионе, где можно обеспечить
информационную преемственность в отношении собственных компонентов крови
н при необходимости их применения обеспечить доставку, очевидно, процедура
перманентного аудонорства при таких условиях целесообразна и рекомендуема.
Если сотрудники (в частности, МЧС) работают в регионах, значительно удален¬
ных от места хранения компонентов, целесообразность такого аутодонорства
необходимо оценивать в каждом конкретном случае. Относительно лиц с редкими
группами крови, проживающих в регионе, где они будут проходить хирургическое
лечение, аутодонорство эритроцитной массы имеет смысл (заготовка и хранение
замороженных эритроцитов, СЗП).
Аутодонорство при плановых операциях
Этот вид аутодонорства необходим пациентам, готовящимся к хирургическим
операциям, и женщинам с различными отклонениями в течение беременности,
с вероятным риском кровопотери более 500-1000 мл. Заготовка и хранение ауто¬
компонентов у пациентов отличаются от тех, что установлены для донорских
компонентов крови, и требуют соблюдения некоторых организационных особен¬
ностей.
Во-первых, предоперационные эксфузии необходимо выполнять в отдельных
помещениях отделений трансфузиологии, переливания крови, в центрах крови
или в соответствующих клинических подразделениях с соблюдением тех же пра¬
вил и контроля, что и в учреждениях Службы крови.
Обязательно должны быть в учреждениях, выполняющих заготовку аутокрови
или ее компонентов, отделения (палаты) реанимации или интенсивной терапии
с соответствующим оснащением и квалификацией персонала либо возможность
транспортировки пациента в соответствующие отделения.
Во-вторых, предоперационную заготовку аутокомпонентов крови должен
выполнять врач или опытная медицинская сестра под непосредственным наблю¬
дением врача-трансфузиолога. Заготовку можно проводить как в условиях стацио¬
нара (на этапе подготовки больного к операции), так и амбулаторно.
Помимо строгого соблюдения всех мер, определенных инструкциями и поло¬
жениями для заготовки, исследования, переработки и хранения аутодонорской
крови, необходим постоянный контроль за клинико-лабораторными показателя¬
ми пациента, отражающими состояние и определяющиеся диагнозом.
Технически заготовку аутокрови проводят в соответствии с теми же правила¬
ми и требованиями, по которым заготавливают кровь от донора. В зависимости
от клинико-лабораторных показателей у отдельных категорий больных однократ¬
ная доза забираемой крови может быть снижена. Необходимо соблюдение всех
мор, определенных инструкциями и положениями для заготовки, исследования,
переработки и хранения донорской крови.
На этикетке, кроме необходимых сведений для донорской крови (группы крови,
резус-фактора и даты заготовки), обязательно указывают, что данная аутокровь
предназначена только для определенного больного — Ф.И.О., номер истории
°°лезни, диагноз (см. «Приложения» на диске @).
Трансфузиолог совместно с лечащим врачом больного и анестезиологом (если
Ут°донорство осуществляют непосредственно перед операцией после вводного
Н КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
наркоза) определяют программу действий — назначают дозу и интервал
эксфузиями. Ме*Ду
Заключительное решение относительно возможности аутодонации кров
нимает трансфузиолог после консультации с лечащим врачом, что помогает 'Ш-
оптимальное решение в каждом клиническом случае. На"тч
Хранить компоненты крови, заготовленные для аутогемотрансфузии непп
димо в отдельном холодильнике, на котором должно быть указано, что да *
холодильная камера предназначена только для хранения аутогемокомпоне ^
Аутодонорство эритроцитов особенно важно для больных с редкой группой КПП
и/или отягощенных трансфузионным анамнезом. Р°Ви
Аутодонорство у лиц с наследственными аномалиями крови
(см. «Приложения» на диске @)
Методы, сроки и объемы заготовки аутокрови
Планирование вариантов, определение необходимости заготовки аутокомпо¬
нентов крови больных в предоперационном периоде зависят от объема предстоя¬
щего хирургического вмешательства, предполагаемого объема интраоперацион-
ной кровопотери и наличия или отсутствия противопоказаний к этой процедуре.
Выбор вен, обработка участка для венепункции, использование контейнеров
и другого оборудования для взятия крови, фракционирование, хранение и про¬
чие процедуры при заготовке аутокомпонентов аналогичны донорской крови.
При необходимости заготовки меньшего объема аутокрови (у детей, больных
с низкой массой тела, по медицинским показаниям) часть консерванта можно уда¬
лить из контейнера в спутниковый мешок.
Как было сказано выше, при аутодонорстве у пациентов и беременных, кроме
строгого соблюдения всех мер, определенных инструкциями и положениями
для заготовки, исследования, переработки и хранения донорской крови, необ¬
ходим постоянный контроль за клинико-лабораторными показателями, отра¬
жающими состояние аутодоноров. У лиц с наследственными аномалиями, нару¬
шениями в системе гемостаза заготовку аутокрови и ее компонентов необходимо
выполнять с учетом ряда особенностей, присущих этим категориям пациентов (см.
соответствующие разделы).
В большинстве случаев заготовку аутокомпонентов крови при соответствую¬
щей организации можно выполнять в отделении трансфузиологии амбулаторно
(или в стационаре одного дня), сочетая эксфузии с предоперационной медикамен¬
тозной подготовкой пациента на протяжении 2-3 нед.
Аутокомпоненты крови, так же как и компоненты донорской крови, можно
получить двумя основными способами:
і разделением (фракционированием) на компоненты цельной консервирован¬
ной крови путем центрифугирования:
• аппаратным способом на специализированном, работающем в автоматиче
ском режиме оборудовании — сепараторе крови. .
Как подтверждают многочисленные опубликованные данные и собственн
опыт авторов, аутодонорство достаточно безопасно для подавляющего больш
ства пациентов. Несмотря на относительную безопасность аутодонорства, нео
ходимо учитывать тот факт, что заготовка аутокрови — инвазивная процеДЗТ •
связанная с кровопотерей и возможным риском последующих изменений гемо
намики и гомеостаза. ..
Объемы и сроки заготовки аутокомпонентов зависят от характера 0X[t^
ного вмешательства и планируемой кровопотери. Потребность в компон
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 637
при хирургических вмешательствах прогнозировать довольно трудно,
Эмпирическим методом установлены среднестатистические объемы кровопоте-
н°Характерные для различных операций (табл. 19-7).
j 19-7. Среднестатистическая величина интраоперационной кровопотери во время раз-
Т«ЧНЬ1Х хирургических вмешательств
Показатель объема кровопотери при одних и тех же вмешательствах может коле¬
баться в широких пределах у разных пациентов в различных клиниках. Потребность
в трансфузии крови при операциях зависит от ряда причин: методики операции
и хирургической техники, степени подготовки оперирующего хирурга, показателя
снижения гематокрита, принятого в данной клинике как предельно допустимый
(критического показателя гематокрита), состояния пациента, а также конкретных
мероприятий по экономии гомологичной крови, проводимых в клинике. Все это
осложняет планирование работы по программам аутогемотрансфузий.
Большинство исследователей этого вопроса сходятся во мнении, что прогно¬
зировать потребность в гемотрансфузиях (как аллогенных, так и аутологичных)
при определенном виде хирургического вмешательства можно только на осно¬
вании внутренней статистики больницы, квалификации оперирующего хирурга
и анестезиологической бригады.
Для большинства плановых хирургических операций возможна заготовка ауто¬
логичных компонентов крови в количестве, близком к требуемому: эритроцитной
массы 11-3 дозы; СЗП — 4-6 доз, концентрата тромбоцитов — 2 дозы и более.
Такой объем аутокомпонентов позволяет обеспечить гемотрансфузию во время
неосложненной плановой операции.
При необходимости трансфузии аутокрови или аутоэритроцитной массы
в сроки, превышающие 2-3 сут после заготовки, рекомендуют профильтровать
кровь через лейкофильтры (по ОК ККЧиК: аутокровь консервированная, филь¬
трованная; аутозритроцитная взвесь с ресуспендирующим раствором, фильтрован¬
ная), Удаление лейкоцитов позволяет снизить риск бактериальной контаминации
аутоэритроцитной массы и увеличить длительность хранения аутокомпонентов.
Таким образом, выбор метода и объема заготовки аутокрови и ее компонентов
необходимо планировать заблаговременно, в зависимости от характера плановой опе¬
рации, ее длительности, травматичности и главное — предполагаемой кровопотери.
Несмотря на существующие протоколы резервирования аутокомпонентов, каж¬
дую процедуру аутодонорства необходимо проводить с учетом индивидуальных
ос°бенностей пациента и согласовывать с хирургом и анестезиологом.
Организация процедур заготовки, переработки и хранения
аутокрови и ее компонентов
Решение организационных вопросов аутодонорства определено возможностя-
^иник и связано с формированием подразделения, состоящего из опытного,
ки аЛЬН0 бученного медицинского персонала, который будет заниматься всем
ексом вопросов по аутодонорству в лечебном учреждении.
ГЛАВА 19
§38 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИИ
Заготовку аутокрови больных можно проводить в перевязочной, процедур
кабинете хирургического отделения, поликлинике При хирургическом стациоїй
операционной отделения трансфузиологии. За эффективную организацию и
ведение программ аутодонорства в клиниках отвечают врачи-трансфузиодог^
что регламентировано их должностными обязанностями. Медицинский персона
осуществляющий заготовку аутокрови или ее компонентов, должен пройти спе
цналъную подготовку, а стационары должны быть оснащены всем необходимым
дм заготовки и хранения аутокомпонентов оборудованием (см. «Приложения»
на диске @).
Необходимо помнить, что заготовка аутокрови может сопровождаться ослож¬
нениями. требующими принятия экстренных мер и интенсивной терапии.
Аутокомпоненты крови хранят в соответствующих условиях — в отделении
трансфузиологии или кабинетах переливания крови, оснащенных соответствую-
щим оборудованием (центрифугами, холодильными и морозильными камерами
аппаратами для автоматической сепарации крови). Заготовку аутокрови (компо¬
нентов) и ее хранение также проводят на станции переливания крови с последую¬
щей передачей в хирургическую клинику накануне или в день операции.
Заготовка аутокомпонентов в отделении трансфузиологии, кабинете пере¬
ливания крови и на станции переливания, где аутокровь надлежащим образом
регистрируют, хранят и выдают, требует четкой координации деятельности всех
служб, принимающих участие в программе аутогемотрансфузии. Это позволяет
избежать потери аутокомпонентов, несвоевременной их выдачи, перекрестного
переливания и ухудшения качества при неправильном и/или длительном хра¬
нении.
Перед плановыми операциями, во время которых предполагается переливание
компонентов крови, лечащий врач совместно с трансфузиологом определяет воз¬
можность предоперационной заготовки аутокрови и ее компонентов. Составляется
индивидуальный протокол аутодонорства с указанием диагноза, вида хирургиче¬
ского вмешательства, объема требуемых компонентов крови, кратности процедур.
При необходимости пациенту предварительно проводят медикаментозное лечение
(препаратами железа, эритропоэтином, витаминными средствами). При этом
медикаментозная подготовка к аутодонорству возможна еще на догоспитальном,
поликлиническом этапе.
Пациент должен быть информирован о процедуре заготовки аутокрови и соот¬
ветствующих рисках и ограничениях, связанных с аутологичными и аллоген-
ными переливаниями, о необходимых лабораторных исследованиях, о том,
что при необходимости ему может быть перелита аллогенная кровь или ее ком¬
поненты, что неиспользованные дозы аутокрови уничтожают. Согласие пациента
на процедуру оформляют в виде письменной подписи и информированного согла¬
сия на проведение процедуры (см. «Приложения» на диске @).
В педиатрии информацию необходимо представлять родителям, которые на ее
основе должны дать письменное информированное согласие на аутогемотрансфу¬
зию. Не рекомендуют включать в программу предоперационного аутодонорства
детей с массой тела до 10 кг.
Таким образом, трансфузиолог совместно с лечащим врачом и анестезиоло¬
гом (если проводят интраоперационное резервирование аутокрови) определяют
программы резервирования аутокрови: назначают дозу и интервал между эксфу¬
зиями, при противопоказаниях к аутодонорству информируют об этом пациента.
Трансфузиолог проводит заготовку аутокрови и определяет возможность предо¬
перационного применения в каждой конкретной ситуации. Кроме того, транс¬
фузиолог отвечает за клиническое состояние пациента и несет окончательную
ответственность за безопасность больного, сохранность в надлежащих условиях
зарезервированных аутокомпонентов и их своевременную выдачу.
r
АУТОДОНОРСТВО И АУГОГЕМОТРАНСФУЗИИ 639
Критерии отбора пациентов для аутодонорства
Аутодонорство возможно только после детального клинико-лабораторного
, -рдования пациента, в том числе сертификации крови больного в соответствии
требованиями, которые предъявляют к донору гомологичной крови (определе-
§Лгруппы крови и резус-фактора, реакции на сифилис, гепатит и ВИЧ). В зави-
ШЖ от заболевания, тяжести патологического процесса, сроков до операции,
РШШщ аутодонорства однократная доза эксфузии может быть изменена -
Уменьшена или увеличена.
Кратность, объем и промежутки между предоперационной эксфузией крови
поеделяют индивидуально в зависимости от состояния больного и предполагае-
°ой операционной кровопотери; эти вопросы решают совместно лечащий врач,
«инсфузиолог и анестезиолог.
В соответствии с рекомендациями Американского Красного Креста и Амери¬
канской ассоциации Банков крови эксфузию проводят с интервалом 72 ч и не
позже чем за 72 ч до плановой операции. При этом гематокрит после эксфузии
должен составлять не менее 34%, а концентрация гемоглобина — более 110 г/л.
Рекомендовать больного к аутодонорству можно при соблюдении двух основ¬
ных условий:
• отсутствии декомпенсации функции органов (сердечно-сосудистой, легочной
недостаточности, выраженных нарушений кроветворения, нарушений нутри-
тивного статуса);
I исключении острой генерализованной инфекции, в частности бактерие¬
мии/сепсиса.
Основные противопоказания для заготовки аутокомпонентов
• Стойкая гипотония — снижение АД менее 100/60 мм рт.ст.
• Анемия — концентрация гемоглобина менее 100 г/л.
І Тромбоцитопения — количество тромбоцитов менее 150-180 тыс. мкл.
• Лейкопения — количество лейкоцитов менее 3500 мкл.
І Гемолиз любого генеза — увеличение концентрации свободного гемоглобина
в плазме крови.
• Гипопротеинемия — концентрация общего белка менее 60 г/л.
I Тяжелое соматическое, острое воспалительное либо инфекционное заболе¬
вание (почечная недостаточность, выраженные нарушения функции печени,
сердечная и дыхательная недостаточность).
і Злокачественные новообразования с метастазами.
і Выраженное истощение, кахексия.
Установлено, что при изъятии 1 дозы крови (450 мл) концентрация гемоглоби¬
на снижается на 10-15 г/л, общего белка — на 10—20 г/л, гематокрит — на 3-5%,
количество эритроцитов — на 0,2-0,4х1012/л. Еженедельные эксфузии 1 дозы
крови в 1,5 раза ускоряют эритропоэз (при условии поддержания нормальной
концентрации железа).
Эксфузия крови у пациентов может сопровождаться легкой головной болью,
кратковременным снижением АД, не требующим лечения; у 0,3% доноров могут
возникать обмороки, у 0,03% — судороги, брадикардия, вплоть до остановки серд-
Р (типа синкопэ).
Особая тема — возможность аутодонорства при гепатитах, ВИЧ-инфекции,
онкологических заболеваниях. Существующие на сегодняшний день норматив-
ные документы и рекомендации исключают заготовку аутокомпонентов от этой
категории лиц. Однако решение необходимо принимать на основании наличия
Щ отсутствия достаточного количества аллокомпонентов крови, особенностей,
вязанных с фенотипом больного либо желаниями пациента (отказ от гемо-
ИйИсфузии аллогенных компонентов по религиозным или иным причинам).
540 КЛИНИЧЕСКАЯ ТРАНСФУЗИ0Л0П1Я
Использование аутокрови — иногда единственная возможность обеспечить
вью и ее компонентами больных с редкими группами, у которых затруднен ^°"
серологический подбор совместимой крови по эритроцитным антигенам.
Вопрос, в какой степени аутокровь или ее компоненты от лиц с трансмиссив
мя инфекциями представляют опасность для самого пациента (в плане активи It
ции вирусной инфекции), неизвестен. Можно полагать, что на фоне хирургической
я операции (хирургического стресса) заготовленная и перелитая во время 6перац°И
аутокровь вряд ли окажет существенное отрицательное влияние на активаци»!
I вирусной инфекции. ю
С середины прошлого века активно обсуждается вопрос о допустимости заго
Т08КИ крови у больных со злокачественными опухолями. Существует мнение
что эксфузия может удлинить срок предоперационного пребывания больного
в стационаре, что в целом увеличивает стоимость лечения. Также полагают, что
учитывая стимулирующее влияние кровопускания, может ускориться метастази-
рованне или метастатические клетки могут активизироваться при консервирова¬
нии аутокрови и, попав в организм, вызвать возникновение новых очагов опухоли
И.К. Деденко и И.А. Ковальчук (1976), не выявив разницы в отдаленных резуль¬
татах хирургического лечения больных раком желудка и молочной железы в груп¬
пах с применением аутогемотрансфузии и донорской крови (результаты оказались
даже лучше у пациентов с аутогемотрансфузией), доказали, что эти опасения бес¬
почвенны, по крайней мере в отношении данных групп больных.
Кроме того, еще в 1970-х гг. после анализа 100 операций у онкологических
больных с аутогемотрансфузией и опубликованных данных был сделан вывод
об онкобезопасности аутогемотрансфузии. Авторы пришли к заключению, что
«...рак различной локализации не считается противопоказанием к заготовке крови,
во-первых, потому что никогда не проводят эксфузию, если она грозит задержкой
оперативного вмешательства, во-вторых, потому что отдаленные результаты опе¬
ративного лечения рака легкого с применением аутогемотрансфузии при более
чем 5-летнем наблюдении... оказались не хуже, а лучше, чем без нее».
Опубликованные данные содержат отдельные сведения о заготовке и успешном
применении аутокомпонентов от пациентов с солидными опухолями при приме¬
нении лейкофильтров.
Большой интерес вызывает вопрос о возможности заготовки аутокрови у пар-
ентов, инфицированных или с гепатитами В и С. По данным Н. Г. Дашковой (2006),
в Москве отмечена достаточно высокая частота гепатитов В и С у хирургических
больных, имевших в анамнезе пять и более гемотрансфузий: инфицированность
гепатитом В у них составила 2,34, гепатитом С — 5,15%.
Авторам данного руководства не удалось обнаружить информации об активи¬
зации трансмиссивной инфекции у больных с искусственным кровообращени¬
ем. Об этом свидетельствует и многолетний опыт работы РНЦХ им. академика
Б.В. Петровского РАМН. Анализ заготовки и гемотрансфузии аутоСЗП от лиц
с маркерами гепатитов В и С при операциях на сердце с искусственным кровоо¬
бращением (аортокоронарном шунтировании, протезировании аорты) показал,
что больные как в раннем послеоперационном периоде, так и в ближайшие 6-8 мес
после операции (сроки наблюдения) не имели каких-либо клинико-лабораторных
признаков активации вирусного гепатита. В ГУ ГНЦ РАМН у больных с гепа¬
титами В и С (в период отсутствия признаков активности процесса) проводили
предоперационную заготовку аутокомпонентов и интраоперационную реинфУ'
зию аутокрови, и при этом не было отмечено обострения хронических гепатитов
или реактивации вирусной инфекции.
Важнейшая проблема, требующая организационного решения, связана с пере
работкой, маркировкой, хранением и применением крови или ее компонентов
от лип с маркерами трансмиссивных инфекций или онкологических больных
АУТОДОНОРСТВО И АУТ0ГЕМ0ТРАНСФУЗИИ 641
солидными опухолями. Все этапы процедуры — от заготовки до трансфузии
^^компонентов — требуют особых условий и повышенного внимания.
в итоге отражается на стоимости дозы препарата. Для разделения и хранения
^компонентов крови от пациентов с гепатитами, ВИЧ, цитомегаловирусной
Инфекцией и другими трансмиссивными инфекциями необходимо выделить
отдельные холодильные камеры (желательно под каждую инфекцию), отдельные
центрифуги (автоматические сепараторы крови), особую маркировку готовой про¬
дукции. а также соблюдать повышенные санитарно-эпидемиологические и техно¬
логические требования к медицинскому персоналу при гемотрансфузии. Как пра¬
вило, в обычной практике эти требования выполнять крайне сложно и дорого.
Вследствие этого заготовку аутокрови от лиц с трансмиссивными инфекциями
0ез крайней необходимости (редкая группа крови пациента, отказ от аллогенной
гемотрансфузии по религиозным причинам) обычно не проводят.
Выполнив детальный анализ экономической и медицинской эффективности,
этических требований, рисков, связанных с заготовкой и гемотрансфузиями
аутокрови от лиц с трансмиссивными инфекциями, было доказано, что все эти
факторы сбалансированы только у пациентов с гепатитом С (Vanston V.. Smith D.,
Eisenstaedt R., 1994). Любые иные инфекции несут больше вреда другим (медицин¬
скому персоналу, больным), чем пользы пациенту. При отсутствии общепринятых
положений относительно нормативов по заготовке и применению аутогемоком¬
понентов у носителей маркеров трансмиссивных заболеваний каждое учреждение
должно установить свои собственные требования по этой проблеме, зависящие,
с одной стороны, от медицинской полезности такой крови и, с другой, - от рисков
случайного инфицирования персонала или других пациентов.
Таким образом, проблема заключается не в противопоказании к заготовке
и трансфузии аутокомпонентов у онкологических больных и пациентов с марке¬
рами трансмиссивных инфекций, а в высоком риске инфицирования персонала
во время заготовки, хранения или использования аутокомпонентов. Кроме этого,
необходимо полностью исключить риск перекрестной гемотрансфузии даже имму¬
нологически совместимой одногруппной крови от инфицированных больных.
Вопрос о рентабельности программ аутодонорства и аутогемотрансфузий
обсуждается много лет. Очевидно, что стоимость аутологичной крови выше,
чем аллогенной. Для принятия решения по каждому больному требуется больше
времени (участвуют 2-3 специалиста — трансфузиолог, лечащий врач и анестезио¬
лог): дополнительные лабораторные исследования, особенности и условия хра¬
нения, маркировки и транспортировки (если аутокровь заготовлена не в той же
клинике) готовых аутокомпонентов и другие факторы увеличивают стоимость
каждой дозы аутокрови. При этом следует учитывать, что в соответствии с опу¬
бликованными данными около 25-50% аутологичной крови, заготовленной перед
операцией, не используют, что также увеличивает затраты. Таким образом, ауто¬
кровь значительно дороже аллогенной. Обоснованное с медицинской точки зрения
широкое распространение трансфузий аутокрови — пример того, как в медицине
определяющим фактором становится не столько стоимость, сколько безопасность
пациентов. Рентабельность аутодонорства можно повысить при адекватном пла¬
нировании заготовки (например, минимизировать объемы неиспользованных
аутогемокомпонентов) и соблюдении разработанных правил ее использования
в клинической практике.
Кроме того, при рассмотрении вопроса о рентабельности восполнения крово¬
потери аутокровью следует учесть, что состояние больного после операции Зави¬
ся1 не только от массивности операционной кровопотери и адекватности ее вос-
п°лнения, но и определяется комплексом факторов (возрастом, полом больного,
Принесенными ранее и сопутствующими заболеваниями, особенностями течения
14 Тя*естью основного заболевания, травматичностыо операции) и возможным
142 юИиЯНаВІ ттиооуэиояопю
авшвнем тех или кны* лечебных мероприятий, предпринимаемых ао воем.
(■ВИИ или после нее. ремя°п«-
экономической целееообразиости аутогемсггранефузий
ё 7X57 Факт> что лечение одного пациента с гемотрансфуъЛГ^
или гепатитами В и С (заражение аллогенной кровью от до ^
»I серонегативном периоде инфекции), обходится в несколькоН0р°1
ИйЦцсич долларов в год и продолжается в течение всей жизни.
Предоперационная заготовка аутокрови и ее компонентов
у больных
Аутодонорство проводят в соответствии с принципом информирование
«глхеня Пациент должен быть осведомлен о предстоящей процедуре, преимуш
ггмх аутодгжорсгва и его возможных осложнениях: ему необходимо объяснил
каким методом будут проводить забор крови, как ее будут перерабатывать на ком¬
поненты. какой объем крови необходим для операции, рассказать об условиях
хранения и применении аутокрови и/или ее компонентов. При согласии на проце¬
дуру пациент подписывает бланк информированного согласия (см. образец бланка
в «Приложении» на диске @).
Метод заготовки крови или ее компонентов до операции рекомендуется боль¬
ным. которым не планируется экстренное хирургическое вмешательство. Проце¬
дуру заготовки можно начать уже на этапе амбулаторного наблюдения за боль¬
ным, до его поступления в стационар. Предоперационную заготовку аутокрови
или ее компонентов проводят с учетом состояния больного, в дозе, необходимой
для восполнения предстоящей операционной кровопотери.
Таким образом, метод, вид и объемы предоперационной заготовки аутокрови
или ее компонентов определяются объемом кровопотери при планируемом опера-
тивном вмешательстве и лимитируются состоянием пациента, а также временем,
которым врачи располагают до операции.
Необходимые условия для предоперационной заготовки аутокрови или ее ком¬
понентов приведены ниже.
• Сзгласис пациента на проведение данной операции.
• Согласие пациента на сдачу крови.
• Достаточные сроки до операции.
• Предполагаемая интраоперационная кровопотеря более 500 мл.
• Согласование аутоэксфузии с лечащим врачом.
Противопоказания к предоперационной заготовке аутокрови следующие.
• Анемия (концентрация гемоглобина в крови <110 г/л; гематокрит <30%).
• Тромбоцитопения (количество тромбоцитов <150х109/л).
• Гипопротеинемия (концентрация общего белка <60 г/л; альбумина <35 г/л).
• Артериальная гипотензия (АД ниже 100/60 мм рт. ст.).
• Сердечно-сосудистая или дыхательная недостаточность.
• Нестабильная стенокардия, недавно перенесенный инфаркт миокарда, тяже
лые формы нарушений ритма и проводимости сердца.
• Сепсис, бактериемия, вирусные заболевания, острые воспалительные забо¬
левания.
• Кахексия, дефицит нугритивного статуса, адинамия.
• Гемолиз любого генеза.
• Менструация (за пять дней до) и первые 5 сут после нее.
• Нарушение азотовыводящей функции почек. ниеи
• Поражения печени, сопровождаемые гипербилирубинемией. нару
синтеза белка I печени.
АУТОДОНОРСТВО И АУТйГШОТМСФУЗМ* 643
иультифокальное поражение коронарных артерий, критическим стеноз
* ствола левой коронарной артерии, тяжелое поражение сосудов головного
ыозга.
пациенты младше 8 и старше 75 лет.
t ремофи^®'
Эпилепсия, психические нарушения, недееспособность пациента.
Наследственные заболевания крови (гемоглобинопатии и ферментопатии).
* Метастазирующий рак.
# Тромбофилии: тромбоэмболические эпизоды в анамнезе, тромбозы, тромбо¬
флебит.
( Прием антикоагулянтных препаратов в предоперационном периоде (решает¬
ся индивидуально на основании показателей гемостазиограммы).
Тяжелая форма бронхиальной астмы.
• ухудшение состояния пациента в день эксфузин.
Пациентов с положительными анализами на маркеры гепатитов В и С. ВИЧ.
эх правило, не включают в программу предоперационного аутодонорства (под¬
робнее см. выше).
Придерживаясь правил, связанных с условиями заготовки аутокрови и ее компо¬
нентов, а также учитывая противопоказания к предоперационному аутодонорству,
трансфузиолог обязан заготовить достаточный объем аутокомпонентов крови
без ущерба для состояния пациента. Кроме того, необходимо учесть рекомендации
ВОЗ, в которых указано, что «...некоторые критерии отбора аутологичных доноров
моїутбыть более либеральными, чем установленные для гомологичных доноров*.
Окончательное заключение о возможности резервирования аутокрови принимают
на основании оценки целесообразности применения аутокрови и риска ухудшения
состояния больного или осложнения основного заболевания из-за аутодонорства.
Как показывает опыт многолетней работы по заготовке аутокрови у различных
категорий хирургических больных в ГУ РНЦХ им. академика Б.В. Петровского
РАМН, учет всех клинических особенностей пациента и высокая квалификация
трансфузиолога, выполняющего процедуру, чаще всего позволяют обойти некото¬
рые противопоказания к аутодонорству и заготовить достаточный объем компо¬
нентов крови у большинства пациентов.
В предоперационном периоде применяют следующие методы резервиро¬
вания аутокомпонентов крови, заготовку которых можно проводить на этапе
амбулаторно-поликлинического или стационарного лечения.
• Однократная эксфузия в дозе 450 мл. У пациентов с массой тела менее 50 кг
объем эксфузии крови не должен превышать 8 мл/кг (объем консерванта
рассчитывают пропорционально предполагаемому объему эксфузии ауто¬
крови). Резервированную аутокровь фракционируют. Этот вариант имеет
временной лимит: заготовку крови необходимо проводить в максимально
приближенные к плановой операции сроки. Оптимальный срок для заготов¬
ки аутоэритроцитной массы составляет 3-8 сут до операции. Условия и сроки
хранения аутокрови не отличаются от таковых аллогенной крови.
• Многократная эксфузия. При таком режиме проводят две и более аутодо-
наций на протяжении 2-3 нед до операции. Этот вариант заготовки ауто-
крови предполагает медикаментозную коррекцию возможной ятрогенний
анемии с использованием препаратов железа, витаминов, реже - эпоэтина
(назначают перед началом аутодонации). Возможно применение двух вари¬
антов многократной эксфузии крови. При стандартном режиме у пациентов
заготавливают по 450±45 мл аутокрови в неделю, в ряде случаев возможно
Увеличение объема эксфузии до 10,5 мл/кг в неделю, но при этом суммарное
количество доз аутокрови должно быть не более трех. Интенсивный режим
заготовки аутокрови предполагает проведение двух процедур аутодонорства
144 юшгвсм* тивювузиология
за неделю с суммарным количеством доз резервированной крови более rtw
Также используют ступенчато-поэтапный метод заготовки аутокрови
гающей лягушки»). ^
Щ На первом этапе забирают 450 мл крови; на втором (через 5-7
реинфузируют аутоэритроцитную массу и повторно забирают уже бо^
ший объем - до 600-650 мл крови с возмещением ОЦК коллоидный
І кристаллоидными растворами в количестве, не меньшем, чем ofoj!!'
резервированной крови. На следующих этапах процедуру повторяют, тТ*
чем после каждой эксфузии кровь фракционируют, что позволяет загощ!
вить значительное количество аутоСЗП. Данный вариант резервировали
крови требует длительного времени и рекомендуется для соматически
сохранных пациентов (например, перед реконструктивными операциям»
в микрохирургии, пластической хирургии, плановой травматологии, орт0-
педии). Количество этапов зависит от состояния больного и предполагае¬
мой потребности в аутокомпонентах крови.
I Заготовка аутеэритроцитной массы. Используют метод дискретного центри¬
фужного эритроцитафереза (1-2 процедуры) или сепараторы крови, имею¬
щие режим заготовки эритроцитной массы (например, MCS+ Haemonetics
TRIMA. GAMBRO). Резервированную аутоэритроцитную массу хранят
при температуре +4-6 “С, также возможно криоконсервирование в ультра-
низких (от -150 до -196 вС) или умеренно низких температурах (от -зо
до-80*С).
і Заготовка аутоСЗП методами аппаратного, дискретного или фильтрацион¬
ного плазмафереза с резервированием от 1 до 5 доз аутоСЗП. Заготовленную
аутоСЗП хранят не более года при температуре -30...-32 °С.
в Заготовка аутотромбоконцентрата аппаратным или дискретным методом,
ш Заготовку аутотромбоцитов применяют реже вышеперечисленных мето¬
дов, так как срок хранения аутотромбоконцентрата составляет 3-5 сут,
из-за этого отмена операции или ее перенос может привести к потере
аугокомпонента. Кроме того, процедура Заготовки аутотромбоконцеи-
трата аппаратным или дискретным методом может потребовать более
длительного времени по сравнению е другими видами аутодонорства.
Аутотромбоконцентрат необходимо хранить в тромбомиксере с посто¬
янным помешиванием при температуре +22-24 °С. Противопоказания
для заготовки аутотромбоконцентрата — тромбоцитопении, тромбоцито-
патия, нарушения гемостаза, прием антикоагулянтов.
І Комбинированные методы.
❖ Сочетание заготовки аутоСЗП на раннем предоперационном этапе с заго¬
товкой цельной крови (и ее последующим фракционированием) непосред¬
ственно перед операцией.
❖ Заготовка аутоэритроцитной массы и ее криоконсервирование в отдален¬
ные сроки перед операцией с последующим резервированием аутоСЗП
непосредственно перед операцией.
❖ Заготовка аутоСЗП и аутотромбоконцентрата аппаратным или дискрет¬
ным методом.
Кроме того, предоперационное резервирование необходимого набора аутоком¬
понентов может сочетаться с острой нормоволемической гемодилюцией, прово¬
димой во время операции, и ннтраоперационной реинфузией излившейся в рану
крови.
Возможна заготовка аутокрови у детей с 8 лет. Эту процедуру дети переносят
хорошо, количество осложнений, реакций во время аутодонорства не превыше*
ет таковое у взрослых. Резервирование аутокомпонентов в педиатрии показано
при операциях с предполагаемой кровопотерей более 10-15% ОЦК. Процедур*
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 048
д-дпаопоказана детям с анемией, замедлением психофизического развития, тяже*
0Й соматической патологией: сердечно-сосудистой недостаточностью, бронхи-
лдьцой астмой в стадии обострения, эпилепсией, инфекционными процессами,
^рушениями гемостаза при технических сложностях (невозможности венепунх*
или). У детей с массой тела менее 50 кг количество забираемой крови не должно
превышать 8 мл/кг (обычно 6-7 мл/кг), при этом объем консерванта пропорции-
таковому заготовленной крови.
Отмечено увеличение частоты вазовагальных реакций у детей, особенно
jo время первой аутодонации, из-за лабильности нервно-психического статуса.
Необходимо отметить, что всю аутокровь (независимо от способов и сроков ее
заготовки) обязательно фракционируют. Разделение аутокрови на компоненты
позволяет улучшить сохранность форменных элементов крови, сохранить гемо-
статический потенциал аутоСЗП и проводить во время операции компонентную
гемотрансфузию.
В ряде случаев из аутоэритроцитной массы получают аутозритроцитную взвесь
с изотоническим раствором натрия хлорида или (при дополнительной филь¬
трации) с ресуспендирующим раствором, фильтрованную. Для иммуноскомпро-
дотированных больных рекомендуют заготавливать аутозритроцитную массу
тамма-облученную или аутозритроцитную взвесь с ресуспендирующим раствором
гамма-облученную.
Поскольку методики консервирования и хранения аутокрови и донорской крови
идентичны, то продолжительное хранение цельной консервированной аутокрови
ухудшает ее свойства и она приобретает многие недостатки, присущие донорской
крови. Одним из методов, позволяющих избежать длительного хранения аутокро¬
ви, считают повторные аутотрансфузии/эксфузии с небольшим, до 5-7 сут, сроком
хранения крови.
Аутодонорство в сердечно-сосудистой хирургии
В отделении трансфузиологии ГУ РНЦХ им. академика Б.В. Петровского РАМН
и ММА им. И.М. Сеченова широко применяют кровесберегающие технологии,
программа которых зависит от вида предстоящего планового хирургического вме¬
шательства.
АУТОДОНОРСТВО В ХИРУРГИИ АОРТЫ
Хирургические вмешательства на торакоабдоминальных отделах аорты отно¬
сят к наиболее травматичным и технически сложным операциям в сосудистой
хирургии. Разработка новых видов операций, совершенствование хирургиче¬
ской техники, анестезиологического пособия, применение совершенных методов
иитраоперационной защиты пациента (искусственного кровообращения, гипо¬
термии, би- или моногемосфеморальной антеградной перфузии головного мозга,
левопредсердно-бедренного сосудистого обхода) позволяют спасти жизнь боль¬
ным, прогноз у которых еще несколько лет назад был крайне неблагоприятным.
Несмотря на усовершенствование техники операций, медикаментозные методы
кровеебережения операции на аорте, особенно на восходящем отделе и дуге аорты,
сопровождаются массивной кровопотерей и соответственно большими объемами
№мотрансфузии.
8 многочисленных исследованиях подтвердили влияние объема периопераци-
°нной кровопотери и гемотрансфузии на течение и результаты хирургического
Лечения заболеваний аорты. В частности, установлено, что массивная кровопотеря
* трансфузия крови могут вызывать осложнения со стороны кардиоваскулярной
системы. Также выявлено, что гемотрансфузия оказывает выраженное иммуно-
сУ°Рассивное действие и может обусловливать системный воспалительный ответ
Ilf КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГ ИЯ
концентрация провоспалительных цитокинов (нейтрофильной эласгазы и факт
ра невроза опухоли-а) достоверно выше у пациентов, которым была проведен
пассивная гемотрансфузия. Таким образом, уменьшение объема кровопотеп3
и I аллогенной крови - важное условие оптимизации хирургического
лечения заболеваний аорты.
На объем интраоперационной кровопотери существенно влияют исходное
состояние пациента и характер предоперационного медикаментозного лечения
У больного с анемией требуется лечение с применением препаратов железа
витаминов, дополнительного лечебного питания, в ряде случаев - эпоэтина-п
Необходимы лабораторный контроль показателей свертывающей системы (МНО
АЧТВ. количества тромбоцитов и их функциональной активности, ТЭГ), тща¬
тельный сбор анамнестических данных для выявления предшествующих гемо¬
трансфузий и патологии гемостаза (кровоточивости, тромбозов, тромбоэмболий)
У пациентов также необходимо узнать о приеме лекарственных препаратов, кото¬
рые могут значительно увеличить кровопотерю во время операции: непрямых
антикоагулянтов, нестероидных противовоспалительных препаратов, ацетилса¬
лициловой кислоты и препаратов, снижающих агрегационные свойства тромбо¬
цитов. Для профилактики медикаментозно опосредованных интраоперационных
кровотечений прием данных препаратов прекращают за 14-10 сут до планового
хирургического вмешательства.
Кроме того, на объем кровопотери влияют такие факторы, как экстренность
хирургического вмешательства, локализация и распространенность поражения
аорты, возраст пациента, вид и длительность операции, квалификация хирурга,
техническое и медикаментозное оснащение, альтернативные аллогенным транс¬
фузиям методики, позволяющие уменьшить кровопотерю. Не меньшее значение
при определении объема кровопотери имеют размер аневризмы аорты (рис. 19-1)
и предыдущие операции.
Ряс. 19-1. Влияние размера аневризмы аорты на объем интраоперационной кровопотери (по:
Lord R.S., Hardman О.Т., Margovsky А., 1997).
Резервирование аутокрови перед плановой операцией позволяет существенно
(на 30-50%) сократить потребность в аллогенной крови при различных видах
хирургических вмешательств. Однако данный вариант аутодонорства в хирургии
торакоабдоминальных отделов аорты имеет довольно ограниченное применение.
Как показывает опыт операций на торакоабдоминальных отделах аорты в ГУ
РНЦХ им. академика Б.В. Петровского, предоперационная заготовка аутокомпо*
нентов крови у пациентов, которым предстоит операция на восходящем, грудном
отделе аорты, имеет ограничения по ряду причин. Во-первых, резервирование
даже значительного объема аутокомпонентов (2-3 доз аутоэритроцитной массы.
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 847
-5 доз аутоСЗП), которое при других видах хирургических вмешательств поро¬
дит почти полностью восполнить интраоперационную кровопотерю аутокровью,
хирургии аорты позволит обеспечить не более 20% необходимого объема
хрови, переливаемого во время неосложненной операции (табл. 19-8). Во-вторых,
что более существенно, для пациентов с патологией аорты, особенно при распро¬
страненном поражении с явлениями расслоения, характерны существенные сдвиги
в системе гемостаза, которые можно охарактеризовать как явления хроническо¬
го или подострого ДВС-синдрома, что проявляется активацией фибринолиза:
укорочением времени XII, — калликреинзависимого фибринолиза, увеличением
концентрации D-димеров, растворимых фибринмономерных комплексов. Таким
образом, предоперационная заготовка аутокрови, которая неизбежно сопрово¬
ждается потерей плазменных факторов свертывания и гемоглобина, может в пред¬
операционном периоде дестабилизировать систему гемостаза, вызвать анемию,
что способно привести к еще большему объему интраоперационной гемотранс¬
фузии. В-третьих, осуществить резервирование аутокрови не всегда позволяют
тяжесть состояния больного и отсутствие достаточного времени: для заготовки
2-3 доз аутоэритроцитной массы и 3-5 доз аутоСЗП необходимо около 2 нед.
Кроме того, многие авторы считают, что предоперационное резервирование ауто¬
крови не совсем безопасно для пациентов с распространенной патологией торако-
абдоминального отдела аорты и приводит к существенному удорожанию хирурги¬
ческого лечения. Предпочтение отдают интраоперационной заготовке аутокрови
в сочетании с реинфузией крови, излившейся в рану.
Таблица 19-8. Протокол трансфузиологического обеспечения компонентами донорской крови
операций на аорте в ГУ РНЦХ им. академика Б.В. Петровского РАМН
Вид гемокомпонента
Протезирование торакоабдоминального
отдела аорты
Протезирование дуги аорты
Эритроцитная масса, л
3,5 (в том числе 1 — отмытых эритроци¬
тов)
3,5 (в том числе 1 — отмытых
эритроцитов)
СЗП, л
3
3
Тромбоконцентрат, доз
10-14
10
Криопреципитат СЗП, доз
5-8
5
КНП, доз
5
—
Перед операциями на абдоминальном отделе аорты проводят предопераци¬
онное резервирование аутокрови в объеме 450-900 мл, что позволяет сократить
потребность в аллогенных компонентах крови на 40-50%.
Таким образом, предоперационная заготовка аутокомпонентов у пациентов
с патологией аорты целесообразна и имеет более выраженный экономический
эффект при хирургическом лечении абдоминальных отделов аорты.
АУТОДОНОРСТВО В КАРДИОХИРУРГИИ
Хирургические вмешательства по поводу ИБС составляют большую часть всех опе¬
раций на сердце, выполняемых в ГУ РНЦХ им. академика Б.В. Петровского РАМН.
Как показывает опыт многолетней работы (1998-2007), аутоСЗП — компонент
кРови, который можно заготовить у подавляющего большинства кардиохирурги¬
ческих больных, поскольку:
• процедура аутодонорского плазмафереза (ПФ) не оказывает отрицательно¬
го влияния на течение заболевания и не препятствует подготовке больных
к операции:
• аутодонорский ПФ технически несложен;
• аутоСЗП имеет относительно длительный срок хранения (до года), что важно
Для больных, у которых операция откладывается по тем или иным причинам;
І 648 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
II с учетом состояния и срока нахождения пациента в клинике до опепа
(чаще 5-7 сут) эритроцитную массу из-за риска анемизации пацие^
как правило, не заготавливают. ^
Определяя показания к аутоплазмодонорству и необходимые объемы загоц,
ливаемой аутоСЗП. в ГУ РНЦХ руководствовались принципом замещения утп!
■ ченных функций крови - необходимо восстановить нарушенные ИК-показатЛ.
плазменного гемостаза и восполнить объем кровопотери (ОЦК). По данны"
предварительных исследований и анализа опубликованных данных, у больны**
I которым операцию проводят с использованием ИК, основные проблемы связаны
с нарушениями гемостаза.
В группу пациентов, у которых заготавливали аутоСЗП, были включены лица
которым предстояли операции с риском возникновения жизненно важных наруШе.
ний в системе гемостаза (на основании предварительных клинико-лабораторных
показателей). В это число вошли все больные, оперируемые в условиях ИК
и пациенты с предполагаемой кровопотерей примерно 20-30% ОЦК.
Заготовку аутоСЗП у пациентов кардиохирургического профиля выполняли в ста-
ционарных условиях, реже - амбулаторно (в отделении трансфузиологии) за 2-7 сут
до предполагаемой операции. Заготавливали две дозы аутоСЗП методом двойно¬
го дискретного плазмафереза. удаленный объем плазмы замещали 6% раствором
гидроксиэтилкрахмала. желатина, декстранов и растворами кристаллоидов (0,9%
раствором натрия хлорида или трисолем*) в соотношении 2:1. 0,9% раствор натрия
хлорида применяли для разведения реинфузируемой аутоэритроцитной массы.
Программу резервирования аутоСЗП у больных с ИБС применяют в ГУ РНЦХ
им. академика Б.В. Петровского РАМН с 1997 г. Из 1790 пациентов, у которых
была заготовлена аутоСЗП, 96,4% аутодоноров составляли пациенты кардио¬
хирургического профиля и 70,6% — пациенты с ИБС (табл. 19-9).
Таблица 19-9. Заготовка аутоСЗП у хирургических больных с сердечно-сосудистой патологией
(1997-2007)
Заболевания
Пациенты
абсолютное количество
%
Ишемическая болезнь сердца
1264
70,6
Приобретенные пороки сердца
323
18,0
Врожденные пороки сердца
61
3,4
Дмлатационная кардиомиопатия
56
3,1
Опухоли сердца
5
0,3
Аневризмы аорты
16
0,9
Прочие заболевания
65
3,6
Всего
1790
100
По результатам более чем 10-летнего опыта аутогемотрансфузий в РНЦХ.
у больных с ИБС наиболее оптимальным вариантом можно считать резервирова¬
ние двух доз (реже 3 и более) аутоСЗП за одну (83,3%), реже две (15,2%) процеду¬
ры плазмафереза (рис. 19-2).
Как известно, операции аортокоронарного (АКШ) и маммарокоронарного
(МКШ) шунтирования выполняют в условиях искусственного кровообращения
(ИК), что требует системной гепаринизации крови больного. После окончания
основного этапа операции и отключения ИК проводят медикаментозную ней¬
трализацию гепарина натрия и трансфузию аутологичной СЗП в объеме 600 мл.
что позволяет восстановить активность свертывающей системы крови.
У большинства пациентов с ИБС заготовка аутоСЗП до операции (по данным ГУ
РНЦХ им. академика Б.В. Петровского за 2007 г.; табл. 19-10) сочеталась с острой
нормоволемической интраоперационной гемодилюцией — заготовкой цельной
аутокрови.
АУТОДОНОРСТВО И ДУТОГЕМОТМИСФУЗИИ (49
Режим заготовки аутоСЗП у больных с ИБС
Протокол — резервирование 2-3 доз аутоСЗП
Цель — интраоперационная коррекция гемостаза
и проведения — в процессе госпитального обследования и подготовки к операции
реваскуляризации миокарда
2 процедуры
1S%
Количество процедур
3 процедуры
2%
1 процедура
■ 83%
Количество доз аутоСЗП
3-4 дозы 1 ДОМ
2% ^ 10%
2 дозы
88%
Рис. 19-2. Режим заготовки аутоСЗП у больных с ИБС
Таблица 19-10. Заготовка аутоСЗП у больных с ИБС перед операциями с использованием ИК в ГУ
РНЦХ им. акад. Б.В. Петровского РАМН в 2007 г.
Заболевание
Возраст, годы
Всего
40-49
50-59
50-69
70-79
80
Стенокардия І АГ + множественные стенозы
4
19
14
3
40
Стенокардия + ПИКС
11
32
39
6
1
89
Поражение ствола ЯКА ± постинфарктный кар¬
диосклероз
4
13
10
4
3
34
Ре-АКШ
1
—
1
— ■
2
ИБС 1 поражения клапанов сердца
1
4
9
1
15
Итого
21
68
73
14
4
180
22.2
49.4
18.9
1,1
"аз"
100
Преимущества заготовки аутоСЗП у больных с ИБС следующие.
І Позволяет полностью обеспечить потребность в аутоСЗП во время неослож¬
ненных операций АКШ.
І Сохраняется кислородная емкость крови, что позволяет резервировать
аутоСЗП у наиболее тяжелых пациентов — после повторных инфарктов мио¬
карда, с нестабильной стенокардией, поражением основного ствола левой
коронарной артерии (JIKA), у пациентов, готовящихся к повторному АКШ.
• Позволяет снизить количество осложнений аутодонации у больных с ИБС
(не превышает 7%).
• Не влияет на решение вопроса об интраоперационной нормоволемической
гемодилюции.
1 Дополняет интраоперационную реинфузию отмытых эритроцитов плазмен¬
ными компонентами.
За период 1997-2006 гг. в РНЦХ наблюдали 1264 больных, которым предстоя¬
ли оперативные вмешательства по поводу ИБС (1137 мужчин от 31 года до 83 лет
и 127 женщин от 30 до 80 лет). В этой группе пациентов преобладали мужчины
работоспособного возраста, 35% больных — старше 60 лет, 4,7% — старше 70 лет.
> последних категорий больных, как правило, отмечали более выраженное тече¬
ние основного заболевания и больше сопутствующей патологии.
150 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
В клинической предоперационной оценке больных с ИБС учитывали*
І функциональный класс заболевания согласно принятой в Центре клят
кации; КЛаесифц.
S характер поражения коронарных артерий;
І наличие в анамнезе крупноочаговых инфарктов миокарда;
І степень недостаточности кровообращения;
• сопутствующие заболевания сердечно-сосудистой системы (гипепт
скую болезнь, атеросклероз аорты, ее ветвей, артерий головного мози°Ч^Є'
дов нижних конечностей, висцеральных ветвей); ’ СОсУ*
І сопутствующие заболевания других внутренних органов;
І состояние нутритивного статуса пациента (ожирение, дефицит питания!
АутоСЗП заготавливали независимо от характера и объема поражений ком
нш артерий, возраста больного, длительности анамнеза, давности перенесені
инфарктов миокарда, выраженности клинических проявлений и сопутствуют^
заболеваний. АутоСЗП заготавливали за 2-14 сут до предстоящей операции чат
за 2-4 сут. е
В качестве плазмозамещения при ПФ использовали средне- (реополиглюкин*!
н высокомолекулярные (полиглюкин*) декстраны, 6% растворы гидроксиэтил¬
крахмала (инфукол ГЭК*, волювен*. стабизол ГЭК 6%*, ХАЕС-стерил*), кристал¬
лоиды (0.9% раствор натрия хлорида или трисоль*) (табл. 19-11). 6% растворы
гидроксиэтилкрахмала были использованы в 1172 случаях, декстраны - в 282
только кристаллоиды — в 36.
Таблица 19-11. Характер плазмозамещения при аутодонорском плазмаферезе
Характер плазмозамещения
Количество процедур
абсолютное число
%
Инфукол ГЭК*+кристаллоиды
1115
74,8
Другие 6% растворы гидроксиэтилкрахмала (волювен*, стабизол ГЭК 6%*,
ХАЕС-стерил*) «кристаллоиды
57
3,8
Рвололиглюкиннфнсталлоиды
264
17,7
Полиглюкиннфисталлоиды
18
1,2
Кристаллоиды
36
2,4
Без замещения
2
0,1
Всего
1492
100
Замещение удаленной плазмы только кристаллоидными растворами выполняли:
• при поливалентной аллергии;
• заболеваниях почек с исходом в ХПН;
• повышении АД в течение всей процедуры (систолическое АД >150 мм рт.ст.,
диастолическое - £100 мм рт.ст.);
• аллергических и анафилактических реакциях на лекарственные препара¬
ты в анамнезе, в том числе на препараты для внутривенного введения (см.
♦Клинический пример №6 и 7* на диске @).
Предоперационное резервирование цельной аутокрови при ИБС возможно
у сохранных пациентов со стабильной стенокардией II—III ФК, без предшествую¬
щих инфарктов миокарда и тяжелой сопутствующей патологии и наиболее целе¬
сообразно у больных с высокими показателями гематокрита (>50%) и концентра¬
цией гемоглобина (<150 г/л).
Процедуру проводят исключительно в стационарных условиях после прохож*
дения пациентом полного комплекса клинико-лабораторных и инструментальных
исследований (коронароангиографии, эхокардиографии, гастроскопии), в про
цессе которых оценивают степень поражения коронарного русла, сохранност
сократительной функции миокарда, выявляют сопутствующую патологию. В про
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 651
подготовки к операции назначают комплексное медикаментозное лечение,
визирующее клинические проявления ИБС, нормализующее АД, компенси*
—*1 НК.
(^®сзп заготавливают заблаговременно, последнюю процедуру необходимо
«ретине позднее чем за 3-2 сут до операции. При низком исходном АД (менее
Л мм рт. ст.) процедуру начинают с инфузии коллоидных растворов - 6%
вора гидроксиэтилкрахмала (инфукола ГЭК*, ХАЕС-стерила*, рефортана* 6%,
Р* вена*, волекама*. стабизола ГЭК 6%*), желатина (гелофузина*), декстранов
8® прппппигпіпкиня*! в объеме 200—300 мл ппгпе ueiSn чючЬхгеитппт
иглюкина*. реополиглюкина*) в объеме 200-300 мл. после чего эксфузируют
(п° 0рИ стабильном состоянии больного резервирование всего необходимого
Сма аутоСЗП проводят в одну процедуру.
АутоСЗП можно заготавливать дискретным центрифужным методом или с помо-
m Jфракционаторов крови.
В настоящее время 85% пациентов, готовящихся к АКШ, МКШ в ГУ РНЦХ им.
елика Б.В. Петровского РАМН, проводят заготовку аутоСЗП, что позволяет
8 месгВенно сократить потребность в аллогенных компонентах крови (рис. 19-3)
сочетании с другими кровесберегающими методами (острой нормоволемической
гемодилюцией и интраоперационной реинфузией).
Годы
Рис. 19-3. Использование компонентов донорской крови во время операций с искусственным
кровообращением
Накопленный в РНЦХ опыт по заготовке аутоСЗП у больных с ИБС позволил
существенно расширить показания к аутодонорству и эффективно заготавливать
аутоСЗП даже у пациентов после перенесенных инфарктов миокарда, с поражени¬
ем ствола Л КА, перед ре-АКШ.
Аутодонорство в хирургии приобретенных и врожденных пороков сердца,
пРи дилатационной кардиомиопатии
Основные принципы заготовки аутокомпонентов у хирургических больных
с приобретенными и врожденными пороками сердца (операции по протезирова-
Нию митрального, аортального, трехстворчатого клапана, коррекции врожден-
аномалий сердца) и дилатационной кардиомиопатией аналогична таковым
Щ заготовке аутоСЗП у больных с ИБС (рис. 19-4, табл. 19-12). Среди характер-
* особенностей данной категории больных выделяют следующие.
152 іСЛІМ№ССМЯГМНС«УЗіЮЛ0ГИЯ
► Тенденция к артериальной гипотензии на фоне недостаточности кро
ценил I снижения ОЦК (при длительном приеме диуретиков). В°°®Рч-
Ондром увеличения вязкости крови (при длительном приеме л
вов или вторичной эритремии, которая наиболее характерна для бл*11'
с врожденными пороками сердца). ЛЬн*ях
Рвмнм заготовки аутоСЗП у больных с врожденными, приобретении
пороками сердца, дилатационной, ишемической кардиомиолатией^
Протокол — резервирование 2-3 доз аутоСЗП
Цель — интраоперационная коррекция гемостаза
проведения—в процессе госпитального обследования и подготовки к oneDa
протезирования клапанов, имплантации экстракардиального каркаса I
Рис. 19-4. Режим заготовки аутоСЗП у больных с врожденными и приобретенными пороками
сердца, дилатационной, ишемической кардиомиопатией
Таблица 19-12. Заготовка аутоСЗП перед операциями с использованием искусственного крово¬
обращения в ГУ РНЦХ им. академика Б.В. Петровского РАМН в 2007 г. (у больных с приобретен¬
ными. врожденными пороками сердца, ДКМП)
Диагноз
Возраст, годы
18-29
30-39
40-49
50-59
60-69
£70
Всего
Недостаточность митрального клапана, сте¬
ноз митрального клапана
1
4
11
15
9
2
42
Недостаточность астрального клапана, стеноз
аотрального клапана
—
3
5
10
4
1
23
Миксома, опухоли
—
—
1
1
—
—
2
Комбинированные, сочетанные пороки
1
—
8
9
4
—
21
Дилатационная кардиомиопатия. ишемиче¬
ская кардиомиопатия
1
3
3
—
—
—
7
Врожденные пороки сердца
6
9
5
6
4
—
30
Ш|111.1ТП.- —
1 Репротезирование
—
1
—
1
1
—
3
Итого
9
20
33
42
22
3
128
• Большинству пациентов с артериальной гипотензией перед взятием крови
проводят инфузию плазмозаменителей по описанной выше методике. В ряде
случаев, когда аутоСЗП заготавливают у пациентов с массой тела менее 60 кг.
объем эксфузии крови необходимо рассчитывать по соотношению 8 мл/иг
что позволяет избежать осложнений аутодонации (см. «Клинический пример
№8» на диске ф).
По мнению авторов данной книги, аутодонация абсолютно противопоказана.
I Эти недостаточности кровообращения более ИВ степени (по классификаии
NYHA):
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 653
рецидивирующих тромбоэмболиях:
* выраженной артериальной гипотензии (среднее АД <65 мм рт.ст.)
* /рагимов А.А., Соловьева И.Н., Алексеева Л.А. и др., 2002).
Гораздо реже, чем заготовку аутоСЗП. резервируют цельную аутокровь.
* показаниями к аутодонации цельной крови в предоперационном периоде
можно считать эритремию, синдром гипервязкости крови у больных с врож¬
денными пороками сердца, ДКМП (см. «Клинический пример N*9* на диске
0)’
Состояние свертывающей системы крови
при аутоплазмодонорстве и в процессе кардиохирургического
вмешательства
Для определения качества заготавливаемой аутоСЗП были изучены показатели
плазменного и тромбоцитного звеньев свертывающей системы крови перед проце¬
дурой аутодонорского ПФ, перед началом операции, после окончания ИК и после
переливания аутоСЗП. Кроме того, показатели плазменного звена гемостаза были
изучены в аутоСЗП перед ее введением пациенту (в среднем после 4,68+1,78 сут
хранения). Первую группу составили образцы аутоСЗП со сроком хранения менее
5 сут (группа 1, п=19); вторую группу — образцы аутоСЗП со сроком хранения
более 5 сут (группа 2, я=16) (табл. 19-13).
Таблица 19-13. Концентрация факторов свертывания в аутоСЗП
Показатель
Исходно
Группа 1
(срок хранения <5 сут)
Группа 2
(срок хранения <5 сут)
НИ
85,1 ±2,6
87,2±3,7
91,5±3,1
Протеин С, НО
1,04±0,09
1.01+0,12
0,72±0,04 (р=0,04)
ХИа КЗФ, с
663,2+139,4
459,7±50,2
486,2+94,5
РФМК, мг/%
4,3+0,2
11,4+0.8
12,8±1,0
Фактор V, %
89,6±2,1
87,1+3,9
95,9+4,4
Фактор VIII, %
86,6±2,0
88,7+3,0
91,8±3,4
Фактор IX, %
88.1+2,0
90,8+2,2
89,7x3,3
Фактор XIII, %
91,9±3,5
78,9+6,8
80,5±7,8
Фактор фон Виллебранда, %
117,5±0,6
138,8+30,9
133,6+28,7
Тромбиновое время, с
11,5±0,6
14,0+0,7
13,1 ±1,3
МНО
1,18+0,04
1,09±0,04
1,27±0,17
Фибриноген, г/л
3,97+0,17
4.94+0,26
4,92+0,39
АЧТВ,с
34,6±1,3
33,6+1,4
34,1 ±2,6
Плазминоген, %
71,5±3,1
81,7+4,3
92,5±2,5
Как следует из табл. 19-13, активность основных факторов свертывания, кон¬
центрация фибриногена и растворимых фибринмономерных комплексов не зави¬
сят от сроков хранения аутоСЗП. Обращает на себя внимание только достоверно
меньшая активность протеина С в группе 2.
Исходная активность протеина С была значительно выше, чем в аутоСЗП, хра¬
нившейся более 5 сут. Достоверное увеличение концентрации РКФМ в аутоСЗП
00 сравнению с данными, полученными до плазмафереза. свидетельствовало
0 повышении фибринолитической активности в аутоСЗП, которое не зависело
01 сроков ее хранения. Это подтверждается и динамическим ростом активности
пнзминогена, которая в плазме со сроком хранения более 5 сут была значимо
исходных значений. Указанное снижение активности протеина С проис-
154 КЛННИЧбСХАЯ ТРАНСФУЗИОЛОГИЯ
щнло в ответ на усиление фнбрі
> хранения.
Hi основании полученных данных предпочтение отдают заготовке
МИКДОв ответ на усиление фибринолитической активности в аутоСЗП в пп
ее хранения. Р0Чёссе
за 2-5 сут до предстоящей операции. ут°СзП
Была выполнена сравнительная оценка гемостатического действия ауто-
иорасой СЗП. Обследованы 40 больных, оперированных на сердце и аорте в ** *°*
внях ИК. После окончания ИК и нейтрализации гепарина натрия внутривен^
введением протамина сульфата 20 больным переливали две дозы аутоСЗП а д**
b
|ня
гам 20 І аналогичное количество донорской свежезамороженной карантинизи!
ванной плазмы со сроком хранения не менее 6 мес (СЗП). До и после переливу
плазмы оценивали состояние системы гемостаза по следующим показателям
тромбоэластограмма - R (мин), к (мин), угол а, МА (мм), плотность сгусткаг
(дин/с), коагуляционный индекс Cl, ЬуЗО (%). Рассчитывали коагуляционн
логический индекс (КЛИ) по следующей формуле:
(R + k + MA)/Ly30.
Определяли концентрацию фибриногена (г/л), активность фактора XIII (%\
(табл. 19-14), оценивали величину послеоперационной кровопотери в мл/кг за 12 л
Таблица 19-14. Концентрация фибриногена и активность фактора XIII в аутоСЗП и карантинизи-
рованной донорской СЗП
Показатель
АутоСЗП
Донорская СЗП
Фибриноген, г/л
4,94±0,26
2,84±0,59*
Фактор XIII, %
91,9±3,50
74,1+5,0“ '
І Достоверность различий: р <0,05.
Группы больных не отличались по условиям проведения операции, длитель¬
ности ИК, объемам перелитой аутологичной или донорской СЗП. Показатель R
в группах 1 и 2 не изменялся. После трансфузии аутоСЗП значение к укорачи¬
валось, а в ответ на введение донорской СЗП оно практически не изменялось.
После введения аутоСЗП отмечалось большее увеличение угла а по сравнению
с введением аллогенной. Разнонаправленные изменения наблюдали в величи¬
нах МА, CI и G: после введения аутоСЗП эти показатели увеличивались, после
введения донорской - уменьшались. Подъем ЬуЗО отмечен в обеих группах,
но в большей степени после введения донорской СЗП. Значение КЛИ после
переливания аутоСЗП не изменялось, а после введения донорской - снижа¬
лось.
Изменения показателей тромбоэластограммы (к, угла а, МА, CI) свидетель¬
ствуют о том, что при использовании аутоСЗП увеличивается общая коагуляци¬
онная активность крови пациента, не сопровождающаяся вторичной активацией
фибринолиза. Повышение прочности сгустка (нарастание величины G) препят¬
ствует энзиматическому лизису последнего. Это подтверждают данные о более
высокой концентрации фибриногена и активности фактора XIII в аутоСЗП
по сравнению с донорской. На фоне введения аутоСЗП КЛИ не изменялся,
в то время как после применения донорской СЗП этот показатель сокращался
на 15,5%, что отражало нарастание фибринолитической активности. Эти дискор^
дантные изменения КЛИ в итоге сопровождались более высокой кровопотерен
I раннем послеоперационном периоде: 3,8±0,3 мл/кг — после введения аутоСЗП
І 5,8±0,7 мл/кг - на протяжении 12 ч после трансфузии донорской карантини"
зироваиной СЗП (р <0,05).
В проведенных исследованиях показатели гемостаза свидетельствуют о том,
чю предоперационная заготовка и интраоперационное переливание заготовлен*
ной аутоСЗП:
ШПРНВОЛИТ 1 ИИИйИп' ПСИСТеме грмпгтяяя ня игру этапах ИССЛеДОВаНИЯ,
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 855
оказывают более выраженный гемостатический эффект, что подтверждается
* достоверно меньшей кровопотерей в раннем послеоперационном периоде.
ной активации системы фибринолиза. Таким образом, использование аутоСЗП
операций с ИК не только безопасно в плане гемотрансфузионных осложне-
к" е операции с Шч не только оезопасно в плане гемотрансфузионных осложне-
1,0 i,. jjQ и оказывает более выраженный гемостатический эффект по сравнению
антинизированной донорской СЗП. Трансфузия 2 доз аутоСЗП обеспечивает
- . I - . у,. . ".TV.
омалнзацию основных параметров гемостаза и предотвращает послеоперацион-
^кровопотерю.
Следует отметить, что использование во время аутодонорского ПФ 6% растворов
-троксиэтилкрахмала (в качестве заместительной терапии) также не оказывало
ЯмМ^ного воздействия на основные параметры плазменного и тромбоцитного
ЇЇюсгаза. Достоверной разницы между аналогичными показателями, изученными
^дплазмодачей и непосредственно перед операцией, не получено.
После введения аутоСЗП отмечалась тенденция к нормализации параметров
кодограммы, нарушенных в ходе вмешательства с ИК, при удовлетворитель¬
ных показателях фибринолиза. Этот факт имеет большое клиническое значение,
Ц; как снижение некоторых показателей свертывающей системы крови после
ПК может приводить к неблагоприятным последствиям, в частности повы¬
шенной послеоперационной кровоточивости. Так, установлено, что снижение
концентрации фактора XIII после вмешательства с ИК приводит к образованию
более рыхлого фибринового сгустка даже при нормальном уровне тромбоцитов
и может сопровождаться повышенной кровоточивостью (Чарная М.А. и др.,
2007). Выявлена отрицательная корреляция между активностью фактора фон
Виллебранда и объемом послеоперационной кровопотери при операциях с ИК
(Морозов Ю.А. и др., 2007).
Согласно опубликованным данным, заготовленная аутоСЗП может сохранять
свои свойства до года без существенных изменений гемостатического потенциала
(Вияьон, 1999).
Протокол аутоплазмодонорства у пациентов
кардиохирургического профиля (см. «Приложения» на диске @)
Аутодонорство у больных общехирургического профиля
Резервирование аутокомпонентов у пациентов общехирургического профиля
до планового вмешательства целесообразно при предполагаемой интраоперацион¬
ной кровопотере больше 500 мл. В частности, установлено, что средняя кровопоте¬
ря во время неосложненной резекции желудка составляет 600 мл, соответственно
для обеспечения интраоперационной потребности в компонентах крови у пациен¬
та, которому предстоит эта операция, необходимо заготовить, как минимум, 1 дозу
дельной крови в максимально приближенные к операции сроки. Оптимальное
время резервирования первой дозы цельной аутокрови — 7-3 сут до операции.
Заготовка аутокрови в эти сроки позволит избежать потери качества аутоэритро-
Дитной массы при более длительном хранении и возможных гемодинамических
нарушений во время вводного наркоза. Основной компонент, заготавливаемый
в преоперационный период, — по 1 дозе аутоСЗП и аутоэритроцигной массы (рис.
5)- Из общего объема заготовленной в 2007 г, крови на цельную консервиро-
кровь, которую перелили без сепарации на компоненты, пришлось около
Щт Объем заготавливаемых компонентов крови в разных отделениях определя-
видом предстоящего хирургического вмешательства и состоянием пациента
(табл. 19-15).
1
пвоеливание донорской карантинизированной СЗП однозначно ведет к вто-
Ї* * . .Mtrvilf ЛМ/vrflWLI /Кыппыипттоо Tet/11%* лХяйпах - лЛОП
КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
2000 г.
■ Аугокро*
И АутоСЗП
2007 г.
Put 19-5. Количество процедур аутодонаций компонентов крови у больных в ГУ РНЦХ им. акаде¬
мика Б.В. Петровского РАМН в 2007 г.
Таблица 19-15. Заготовка аутокрови с разделением на аутозритроцитную массу и аутоСЗП
в 2007 г. (ГУ РНЦХ им. академика Б.В. Петровского РАМН)
Отделение
Количество больных
Заготовлено СЗП,
дозы
Заготовлено эритроцит¬
ной массы, дозы
Хирургии позвоночника
20
30
29
Нейрохирургии
6
7
7
Хирургии легких и средостения
8
10
9
Хирургии печени, желчных путей,
поджелудочной железы
2
2
2 І
Микрохирургии
13
18
18
Урологии
330
337
336
Всего
379
404
401
Вопрос о целесообразности, организации и технической возможности аутодонор¬
ства (с учетом противопоказаний) в каждом случае индивидуально решают лечащий
врач і трансфузиолог. Большое значение в заготовке аутокрови и ее компонентов
имеет готовность сотрудников клинического отделения к восприятию и реализации
на практике идеи и идеологии аутодонорства/аутогемотрансфузий. Так, если в уро¬
логическом отделении аутокровь заготавливали у примерно 70% больных, то в дру¬
гих отделениях этот показатель не превышал в среднем 22% (от 7 до 30%). При этом
в данных хирургических отделениях аутокомпоненты перелили 89% больных
(из них СЗП І эритроцитную массу - 60%, только СЗП — 23% и только эритроцит¬
ную массу S 17%). Это свидетельствует о том, что минимум 40% больных, которым
в послеоперационном периоде потребовалось переливание 1-2 доз СЗП или одной
дозы эритроцитной массы, соответствуют программе аутокрови. Проблема орга¬
низации предоперационного аутодонорства и ее осуществление непосредственно
в хирургических отделениях - одна из самых сложных в реализации концепции
кровесберегающих технологий в клинической практике. Успешность решения этой
проблемы в значительной степени зависит не столько от квалификации сотрудников
отделения трансфузиологии или его оснащения (обязательные условия для выпол¬
нения программы аутодонорства), сколько от отсутствия интереса и/или желания
лечащих врачей хирургического отделения и осведомленности больных, которые
должны дать информированное согласие на гемотрансфузии, имея полную инфор¬
мацию о пользе и рисках аллогенных и аутогенных гемотрансфузий.
Каждая операция с предполагаемой кровопотерей более 500 мл, независимо
от того, заготовлены аутокомпоненты крови или нет, должна быть обеспечена
определенным объемом аллогенных компонентов. При этом эритроцитсодер"
жащие компоненты крови должны бьггь индивидуально подобраны для каждого
больного.
аутодонорство и аутогемотрансфузии 857
дллогенные компоненты крови можно хранить в отделении трансфузиологии
сразу выдать в операционную. При хорошо налаженной организации процесса
^ операционной и отделения трансфузиологии) предпочтительно хранение
йогенных компонентов в отделении трансфузиологии, тогда как аутологичные
^ходимо доставить в операционную до начала (или вскоре после начала) оле¬
ний. В условиях неопределенности в отношении востребованности аллогенных
^понентов (как правило, они требуются к концу операции или при нехватке
* литых аутокомпонентов) предпочтительно (и экономически выгодно) хране-
отделении трансфузиологии, поскольку они будут находиться в необходи-
jLjj для каждого компонента температурных режимах. В операционной не всегда
сгь условия для хранения компонентов крови.
Протокол процедур аутодонорства у общехирургических больных принципи¬
ально не отличается от такового у пациентов кардиохирургического профиля.
• Определяют потребность в необходимом объеме и типе аутокомпонентов.
• Определяют сроки и кратность аутодонаций.
» Определяют необходимость интраоперационной реинфузии.
І обсуждают с анестезиологом и при необходимости проводят интраопераци-
онную гемодилюцию.
і Проводят послеоперационную реинфузию дренажной крови.
Для профилактики возможных осложнений необходим учет клинико-лаборатор¬
ных показателей, данных анамнеза, в том числе трансфузиологического и аллерго¬
логического. Кроме того, любая аутодонация должна быть восполнена тем или иным
кровезаменителем, выбор которого определяют индивидуально в каждом конкретном
случае. Препаратами выбора для этого считают коллоидные или кристаллоидные рас¬
творы в объеме 400-1000 мл, возможно сочетание этих препаратов.
Организация программы аутодонорства у больных общехирургического про¬
филя предусматривает два варианта резервирования аутокрови.
З Заготовку аутокрови на госпитальном периоде, которая целесообразна
у пациентов в более тяжелом состоянии, пожилых, подростков.
§ Заготовку аутокрови у соматически сохранных пациентов на догоспитальном
этапе после клинико-лабораторного исследования и при отсутствии противо¬
показаний к аутодонации, в частности анемии, гипопротеинемии. При этом
в течение 7-10 сут можно заготовить 1-2 дозы цельной крови (с последую¬
щим обязательным фракционированием), а после госпитализации больного
(при необходимости) — еще одну дозу аутокрови. При отмене или переносе
операции заготовленную аутоэритроцитную массу реинфузируют. аутоСЗП
хранят в Банке крови на протяжении установленного срока годности.
На основании многолетнего опыта работы установлено, что практически всем
больным, за исключением отдельных пациентов (урологических), не потребова¬
лись (не планировались) гемодилюции и реинфузии при операции или в послеопе¬
рационном периоде. Из заготовленного объема аутокрови и/или ее компонентов
невостребованными оказались 12% аутоСЗП и 6% аутоэритроцитной массы.
У 16% урологических пациентов в интра- и/или послеоперационом периоде
проводили дополнительные гемотрансфузии аллогенных компонентов, из них
эритроцитной массы — 1-4 дозы, в среднем 2,3 дозы на одного больного, и СЗП -
2-4 дозы, в среднем 3,3 дозы на одного больного. Все гемотрансфузии, как ауто¬
логичные, так и аллогенные, прошли без осложнений (см. «Клинический пример
N*10-12» на диске @).
Аутодонорство в акушерстве и гинекологии
Показаниями к заготовке аутокомпонентов крови считают принадлежность
«аяцины к группе риска кровотечения (рубец на матке, многоплодную беремен-
миому, аномалии матки, аутоиммунные нарушения), редкую группу крови.
планируемые кесарево сечение, гинекологическую операцию С большим
вмешательства (выраженный спаечный процесс в малом тазу, гистерэктомию Сп
датками и лнмфаденэетомией, консервативную миомэктомию, аднексэктомию] '
В отделении гравитационной хирургии крови ФГУ НЦ АГиП им. В.И. Кулак
разработана методика заготовки аутоСЗП с использованием ПФ, предназначен»8*
для женщин, госпитализируемых для оперативного лечения или родоразрещ^*
У беременных заготовку аутоСЗП путем прерывистого ПФ проводят на 32-з**й
неделе, обычно на 36-й неделе. Средний интервал между забором плазмы и род!
разрешением составляет 2.5 нед. Осложнений при ПФ ни у одной паїшадГ
не отмечалось. Объем заготовленной аутоСЗП. как правило, составляет 418±з§ Г?
Пшмовозмещение проводят кристалоидными и коллоидными растворами (6~i(W
растворами гидроксиэтилкрахмала) в соотношении к эксфузируемой плазме 2:1
У гинекологических больных плазмаферез в целях заготовки аутоСЗП проводят
за неделю до планируемого оперативного вмешательства с использованием метод
прерывистого или аппаратного плазмафереза (аппарат PCS-2). Объем эксфузИр.,еа
мой плазмы за один сеанс обычно составляет 450 мл. Плазмовозмещение проводят
кристаллоидными и коллоидными растворами в соотношении к эксфузируемой
плазме 1,2:1. Осложнений во время ПФ ни в одном случае не отмечалось.
Противопоказания для заготовки аутоСЗП: анемия (концентрация гемогло¬
бина ниже 80 г/л), гипопротеинемия (концентрация общего белка менее 60 г/л)
заболевания крови (гемофилия, тромбоцитопения), тяжелая экстрагенитальная
патология (заболевания сердечно-сосудистой системы, эпилепсия, злокачествен¬
ные опухоли).
Данные биохимического исследования, а также параметры системы гемостаза
и показатели периферической крови после ПФ у обследованных беременных прак¬
тически не изменялись. По данным допплерометрии, отрицательного влияния
аутоплазмодонорства на маточно- и фетоплацентарное кровообращение также
не отмечено.
Аутодонорство у гематологических больных
и при гемофилиях
У гематологических больных обычно множество противопоказаний к аутодо¬
норству: цитопения, коагулопатия, нарушения в системе гемостаза и т.д. Учитывая
особенности течения заболевания, у онкогематологических больных заготовку
аутокомпонентов крови, как правило, не проводят. В исключительных случаях,
при необходимости оперативного вмешательства с риском кровотечения, необ¬
ходимо применить все возможные методы: анестезиологические, хирургические
и трансфузиологические технологии, позволяющие минимизировать аллогенные
трансфузии. По литературным данным, для операций у таких больных необ¬
ходимо подготовить достаточно большое количество компонентов аллогенной
крови, подбор которых затруднен выраженной сенсибилизацией предыдущими
гемотрансфузиями. В ГНЦ РАМН активно изучают переносимость заготовок ауто¬
компонентов крови у пациентов с более низкими показателями анализов крови
(концентрация гемоглобина - <110 г/л, гематокрит — <30%, количество лейко¬
цитов - <4,0х10ч/л, тромбоцитов — <170*109г/л, концентрация общего белка -
<60 г/л), с использованием в качестве замещающих растворов не только 0,9% рас-
твора натрия хлорида, но и коллоидных растворов. Большое значение имеет реше¬
ние вопроса о заготовке аутокомпонентов при невозможности подбора донорских-
Каждый случай заготовки аутокрови или ее компонентов у гематологических
больных необходимо рассматривать отдельно и выполнять процедуру с большой
осторожностью только при крайней необходимости.
АУТОДОНОРСТВО И АУТОГШОТРАНСФУЗйй в59
у больных гемофилией (с учетом опасности интраоперационного кровотече-
, использование аутогемотрансфузиологических методик особенно актуально,
появления концентрированных препаратов факторов свертывания VIII и IX
филию считали противопоказанием к любому большому хирургическому
'^І^тельству. Наибольшую опасность представляли реконструктивные операции
гостях и суставах из-за особенно высокого риска неуправляемого кровотечения,
бальной угрозы для жизни больного. Препараты факторов свертывания позволи-
„ред°твратить или Уменьшить вероятность развития массивного кровотечения.
а иногда этого бывает недостаточно из-за объема и сложности оперативного
даДОіьства, а также наличия у больных гемофилией ингибиторов факторов
!!Гптывания. Как результат множественных гемотрансфузий в анамнезе у пациен-
gc гемофилией частота определения маркеров к гепатитам В и С весьма высока.
вГНЦ РАМН она составляет для гепатита В 2,25-2,86%, гепатита С - 52-56%
амбулаторных больных и 69-72% — у пациентов хирургического отделения
конструктивно-восстановительной ортопедии. Из 15 больных гемофилией
Редким эритроцитным фенотипом, которым была осуществлена предоперацион¬
ная заготовка аутокомпонентов, у 14 обнаружены антитела к вирусу гепатита С.
у 9 пациентов одномоментно заготовлена двойная доза аутоэритроцитной массы
объемом 400-560 мл (в среднем 450 мл); у 5 - 400-560 мл (в среднем 450 мл)
аутоэритроцитной массы и 600-1200 мл (в среднем 900 мл) аутоСЗП; у 1 больно¬
го с низкими показателями удалось заготовить только 230 мл аутоэритроцитной
массы.
Из табл. 19-16, отражающей динамику изменения лабораторных показателей
У больных гемофилией при заготовке аутокомпонентов крови и после опера¬
ции, следует, что основные показатели гемограммы находятся ниже принятых
для доноров крови норм, но вполне достаточны для послеоперационного периода,
и больные вполне компенсированы по этим параметрам. Изменения в показателях
обмена железа естественны, не представляют непосредственной угрозы жизни
в послеоперационном периоде и легко могут быть скорректированы назначением
лекарственных препаратов.
Таблица 19-16. Изменения лабораторных показателей у больных гемофилией при заготовке ауто¬
компонентов крови и после операции
Динамика гематологических параметров у больных гемофилией
показатель
до заготовки
после заготовки
(перед операцией)
после операции
Средняя концентра¬
ция гемоглобина, г/л
146 (123-146) г/л
124 (108-123)
103 (73-143)
Гематокрит, %
42 (38-44)
36(33-37)
32(20-37)
Количество эритро¬
цитов
5,3х10'7л (4,9-5,8х10!г/л)
4,6х10'7л (4>0-5і2хІ0«/л)
4,0х10,г/п (2,6—4,6х10'*/п)
1 -—
Фвррокинетика основных средних показателей биохимического анализа крови у больных гемофилией
показатель
І
до заготовки
после заготовки
(перед операцией)
Концентрация ферритина в сыворотке
крови, мкг/л
61,3
54,6
I
Концентрация железа, мкмоль/л
20,0
9,7
Общая железосвязывающая способность,
мкмоль/л
53,5
76,3
"ЗСыщание трансферрина железом, %
24,9
14,7
концентрация трансферрина, г/л
2.6
Те I
Интраоперационно переливание донорских компонентов потребовалось одно¬
му больному, которому удалось заготовить только одну дозу аутоэритроцитной
ggg КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
массы (230 мл). Таким образом, предоперационная заготовка аутоко
л» крови у больных гемофилией в большинстве случаев оказалась ал°МП0Нен"
да коррекции интраоперационной кровопотери. Дополнительного ислКВатн°й
я» донорских компонентов не потребовалось. Ользова-
МЕДИКАМЕНТ03Н0Е СОПРОВОЖДЕНИЕ ЗАБЛАГОВРЕМЕННО
ЗАГОТОВКИ АУТОКРОВИ И ЕЕ КОМПОНЕНТОВ
При заблаговременной заготовке аутокомпонентов особое внимание неой
но уделять назначению лекарственных препаратов, повышающих эффектив*0**
згой процедуры и ее безопасность. Период предоперационного аутодоноН0СТЬ
ограничен во времени и составляет в зависимости от используемого гем^
серванта от 3 до 5 нед. Способность пациентов к аутодонорству зависит
факторов. Основной причиной прерывания программы аутодонорства при
кратном взятии крови чаще всего бывает снижение гематокрита до предел
допустимого значения - 32-34%. Способность пациентов к сдаче крови зави Н°
прежде всего от исходного гематокрита.
Одна из основных задач, которую необходимо решить при аутодонорстве -
сохранение показателей красной крови на должном уровне (концентрации гемогло¬
бина >110-120 r/л; гематокрита >32-34%) даже после неоднократных эксфузий
Восстановление красной крови зависит от ее исходных показателей, объема и крат¬
ности эксфузии. Для профилактики железодефицитной анемии пациентам, в отно¬
шении которых применяют поэтапно-ступенчатый метод аутодонорства, за 3-7
сут до первой эксфузии назначают не менее 200-300 мг препаратов железа внутрь
Прием препаратов железа необходимо продолжать и после операции на протяже¬
нии 3-4 нед, а женщинам старше 30 лет — 6-8 нед, до нормализации показателей
красной крови. В отдельных случаях, например, когда организм пациента не усваи¬
вает препараты железа при приеме внутрь или для более быстрого достижения
желаемого эффекта, препараты железа назначают парентерально.
В последние годы хорошие результаты в поддержании концентрации гемо¬
глобина, количества эритроцитов получены при использовании стимуляторов
эритропоэза - эпоэтина-р (отечественный аналог — эритростим*, высокоочи-
щенный рекомбинантный эритропоэтин человека, полученный методом генной
инженерии). По своим биологическим свойствам и активности эритростим* соот¬
ветствует природному эритропоэтину. Эритростим* содержит 500 или 2000 ME
рекомбинантного эритропозтина человека в сывороточном альбумине человека,
разведенном в физиологическом натрийцитратном буфере.
Эритропоэтин (ЭПО) — гликопротеид с молекулярной массой около 34 ООО Да,
который на 60% состоит из белка (165 аминокислот). Белки-регуляторы, такие
как эритропоэтин, содержатся в организме человека только в малых концентр
циях. В отношении углеводного содержания эритропоэтин не представляет собой
строго единую молекулу. Четыре углеводные цепи соединены с белком тремя
М-гликозидными и одной О-гликозидной связями.
На протяжении всего внутриутробного развития и в неонатальном периоде
синтез ЭПО происходит в печени. После рождения ребенка ЭПО начинает сии
тезироваться и почками. Печень сохраняет свою способность вырабатывать а
и у взрослых, но доля ее участия составляет не более 10%.
ЭПО обеспечивает дифференцировку эритроидных клеток и стимулирует о рт
зование эритроцитов на этапе ранних клеток-предшественников в костном м
Действие ЭПО начинается на уровне популяции ранних колониеобразующих
троидных предшественников, образующих «взрывообразные» колонии. | g
В норме существует отрицательная корреляция между концентрацие
в крови и гематокритом как показателем количества эритроцитов. Гипокси .
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ (61
ющая при потере крови, — основной физиологический стимул, приводящий
"быстрому увеличению выработки эритропозтина в почках путем экспоненци¬
ального увеличения эритропоэтинпродуцирующих клеток. Кровопотеря может,
частности, привести к снижению концентрации гемоглобина, что влечет за собой
яижение кислородтранспортной функции крови. Недостаток кислорода реги-
лОЙруется в почке кислородными сенсорами, что вызывает усиленную выработку
ЗЛО. Результат этого круга регуляции — повышение концентрации ЭПО в крови.
которым следует (с задержкой во времени) образование эритроцитов из эритро-
кдкьй предшественников в костном мозге. Регулирующее действие этой системы
проявляется через обратную связь между концентрацией гемоглобина и ЭПО.
Концентрация ЭПО в плазме здоровых взрослых людей составляет от 10
,030 МЕ/л, но возможны и резкие колебания. При недостаточном снабжении тка¬
ней кислородом или увеличении потребности в нем концентрация эритропозтина
повышается. Анемия — самый сильный стимул для увеличения образования ЭПО
в почках. Снижение гематокрита непосредственно приводит к резкому повыше¬
нию концентрации ЭПО в крови.
ЭПО проявляет биологическую активность только в присутствии других факто¬
ров роста, таких как интерлейкин-3, а также кофакторов - железа, фолиевой кис¬
лоты и витамина В12. Клеточные рецепторы эритропозтина относятся к семейству
рецепторов для гормонов роста.
В обычных дозах ЭПО не оказывает влияния на мегакарио- и лейкоцити ые
клеточные линии. Есть сведения, что в очень высокой концентрации ЭПО стиму¬
лирует мегакариопоэз (созревание тромбоцитов) (Stockenhuber et al., 1990),
Применение ЭПО в предоперационном периоде считают одним из методов
кровесберегающей хирургии. Существует четкая зависимость увеличения продук¬
ции эритроцитов от введенной дозы ЭПО. Эритропоэз, стимулированный ЭПО.
не зависит от пола и возраста. Отличие реакции на лечение у различных пациентов
обусловлено резервными запасами железа в организме.
Увеличение количества ретикулоцитов на 3-й сутки лечения эпоэтином-р у паци¬
ентов без анемии и с достаточными запасами железа считают прогностическим
показателем увеличения количества эритроцитов. К 7-м суткам организм выраба¬
тывает эквивалент 1 единицы крови, к 28-м — 5 единиц крови. Если переливание
аллогенной крови нежелательно, то перед крупным оперативным вмешательством
(например, заменой суставов в ортопедии) для стимуляции эритропоэза достаточно
будет предоперационного курса эпоэтина-р продолжительностью 3-4 нед.
Существуют значительные отличия между внутривенным и подкожным введе¬
нием; подкожное введение меньших доз эпоэтина-р ближе к физиологическому
типу продукции ЭПО в организме и благодаря этому более эффективно.
Применение эпоэтина-р способствует стимуляции гемопоэза для аутодонорства
перед плановым хирургическим вмешательством, коррекции анемии перед опера¬
цией, усилению гемопоэза после операции.
Показания к применению эритропозтина следующие.
І Анемия при хронической почечной недостаточности.
• Стимуляция эритропоэза в рамках программы аутодонорства.
• Анемия при злокачественных заболеваниях.
I Анемия, вызванная химио- и лучевой терапией.
• Анемия при ревматоидном артрите, болезни Крона, неспецифическом язвен¬
ном колите.
' ВИЧ-инфекция.
• Гемоглобинопатии.
• Анемия после пересадки костного мозга.
' Апластическая анемия.
' Миелодиспластический синдром.
Mg OMtMECKM ТМНСФУЭЙОЛОГИЯ
Ц ‘<Щ/тшаш зпоэтша-р позволяет заготавливать аутокровь у пациент
щрЩздаже 90). а также при анемиях различного генеза. 1 °тар^
Кжшпесхое применение эдоэтина-р для профилактики анемии пред
«кт несхольхо программ в зависимости от категории пациентов. йа%
• Программа заготовки аутокрови перед хирургической операцией у Па,
§ с анемией (концентрация гемоглобина — <135 г/л, гематокрит
* ОЦК менее 5 л и предполагаемой интраоперационной кровопотет*й^:
IДОВ крови, б°Л«е
В аллоиммунизацией;
♦ отказывающихся от переливания крови по религиозным убежден»
1 доноров костного мозга. м
• Предоперационное введение — пациенты хирургического профиля ко
■сключили из программ аутодонорства из-за короткого периода вое ^
оставшегося до операции (<3 нед). или по организационным причинам ЄНИ'
/..* Профілактика анемии и уменьшение потребности в переливании к
у пациентов, находящихся на химиотерапевтическом лечении препарата
платины. - пациенты с пограничной или низкой концентрацией гемоглобГ
ка. получающие препараты платины.
Применение препаратов ЭПО в хирургии [примеры использования зло-
этина-а (эпрекса*) при подготовке операционных больных].
Внутривенное введение: период полувыведения препарата составляет 5-6 ч вне
зависимости от тяжести заболевания.
Продолжительность введения — 1-5 мин. Запрещено вводить эпрекс* в виде
внутривенной инфузии или смешивать его с другими препаратами.
Подкожное введение: концентрация препарата в сыворотке более низкая
чем при внутривенном введении. Она медленно повышается, достигая максимума
через 12-18 ч после введения. Период полувыведения — 24 ч. При этом способе
введения чаще, чем при внутривенном, отмечают кожные реакции: покраснение,
чувство жжения, слабую или умеренную боль в месте инъекции. Максимальный
объем одной инъекции не должен превышать 1 мл. При больших объемах пре¬
парата следует использовать несколько точек введения. Места введения - конеч¬
ности и живот.
До начала и на протяжении всего курса лечения необходимо периодически
определять концентрацию ферритина в плазме. Пациентам, у которых этот пока¬
затель составляет менее 100 нг/мл, рекомендуют заместительное назначение пре¬
паратов железа внутрь по 200-300 мг/сут (детям — 100-200 мг/сут).
Эпозтин-а не показан пациентам с анемией, желающим сдать аутокровь непо¬
средственно перед операцией.
Схемы применения эритропоэтина при аутодонорстве
Перед назначением препаратов ЭПО следует учесть все противопоказания
к сбору аутологичной крови. Если диагностирован дефицит железа, необходимо
принять меры по восстановлению его концентрации в крови до начала программы
по сбору крови. Все пациенты, находящиеся в пред- и постоперационном перио¬
де и сдающие аутокровь, в качестве профилактики должны получать препараты
железа внутрь из расчета 200 мг/сут. Назначение препаратов ЭПО не рекомендуют
больным с исходной концентрацией гемоглобина более 150 г/л. Необходимо при
нять во внимание, что предоперационное повышение концентрации гемоглобина
может быть предрасполагающим фактором для тромботических осложнении.
Если до операции осталось более 3 нед, целесообразно назначение препа
ратов ЭПО для стимуляции эритропоэза у пациентов, принимающих У430™
в программе аутодонорства (рис. 19-6). Препараты ЭПО вводят в количеств
АУТОДОНОРСТВО И АУТОГЕМОТРЛНСФУЗИЙ 863
йО до 300 МЕ/кг на протяжении 3 нед (по 2 раза в неделю) перед операци-
** препараты железа для внутривенной инъекции, например венофер (200 мг).
go время каждого визита пациента (6 раз), если он сдает 1 дозу аутокрови
’’^гематокрит выше 34%. При назначении препаратов железа внутрь доза соот-
200 мг элементарного железа (900 мг железа сульфата), поэтому необхо-
^ увеличить дозу препаратов ЭПО в 2 раза.
—Г"* і Ъъшшшш
3 2 1 0 1
Неделя Операция
Каждая стрелка обозначает визит для сдачи крови +
введение ЭПО подкожно и железа внутривенно,
сдача крови при гематокрите не ниже 34%
put 19-6- Сдача аутокрови с применением эритропозтина (Cazzola V. et al., 1996)
Объем заготовленной крови зависит от дозы введенного препарата ЭПО.
Наиболее распространенный протокол лечения — внутривенное введение 2 раза
в неделю на протяжении 3 нед одновременно с назначением препаратов желе¬
за. Общая эффективная доза для достаточной стимуляции эритропоэза в целях
увеличения объема предварительно заготовленной крови составляет не менее
600 МЕ/кг. Большие дозы препаратов ЭПО приводили к соответствующему уве¬
личению продукции новых эритроцитов с диапазоном от 250 мл при обшей дозе
600 МЕ/кг до более 900 мл при дозе 3600 МЕ/кг. Внутривенное ведение препа¬
ратов железа позволяет, возможно, более адекватно восполнять запасы железа
для эритропоэза с соответствующим увеличением концентрации гемоглобина
в ответ на введение аналогичных или сниженных доз эпоэтина. При внутривенном
введении венофера регенерация эритроцитов и объем заготовленной аутокрови
были идентичны таковым при общей дозе препаратов ЭПО 1800 и 3600 МЕ/кг.
Предоперационная заготовка аутокрови на фоне введения препаратов ЭПО —
600 МЕ/кг 2 раза в неделю внутривенно в течение 3 нед. При каждом посещении
врача у больного эксфузируют дозу крови (если гематокрит >33% и/или концен¬
трация гемоглобина £110 г/л) и сохраняют ее для аутотрансфузии.
У пациентов, которым требуется меньшая степень стимуляции эритропоэза,
доза препаратов ЭПО составляет 150-300 ЕД/кг 2 раза в неделю.
Перед ортопедическими и операциями на сосудах доза эпоэтина 250 ЕД/кг
подкожно 2 раза в неделю в течение 3 нед обеспечивает заготовку 2 доз и позволя¬
ет избежать аллогенных трансфузий у 95% пациентов.
Протезирование суставов при ревматоидном артрите — доза 400-800
ЕД/кг 1 раз в неделю обеспечивает заготовку 1-3 доз аутокрови.
Торакальная хирургия (пневмонэктомия, лобэктомия, сегментэкто-
мия) - одновременная заготовка 1200-1600 мл аутокрови с введением эпоэтина
в Дозе 3000 ЕД/кг внутривенно. При этой программе аллогенная трансфузия
н* нужна 85% пациентов.
У пациентов перед АКШ при анемии (концентрация гемоглобина менее
ТОО г/д) возможно применение нескольких схем назначения препаратов ЭПО.
• 600-700 ЕД/кг в неделю на протяжении 2-12 нед.
• 200 ЕД/кг внутривенно 3 раза в неделю с назначением железа сульфата в дозе
200 мг/сут.
ГЛАВА It
ЦІ КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
• 400-800 ЕД/icr внутривенно 2 раза в неделю на протяжении 4 нед с п
препаратов железа внутрь. При использовании этой схемы 81% Па [S
аллогенные трансфузии не проводят.
Концентрацию гемоглобина доводят до 110-145 г/л. Этот способ дает во
НОСА заготовить 400-1200 мл крови и ликвидировать потребность в аллог^0*'
трансфузиях у 90% пациентов. нЧіц
Предоперационное применение эпоэтина
Если до операции осталось от 2 до 3 нед или сдача аутокрови невозц
назначают 6 доз эпоэтина подкожно (от 250 до 300 ЕД/кг) в сочетании с пве і***’
таыи железа. Эти 6 доз распределяют на период от 10 до 21 сут (рис. 19-7)
ш Щ
3 2 1 0 1
Неделя Операция
Каждая стрелка обозначает введение ЭПО подкожно и железа внутривенно.
Если до операции осталось от 2 до 3 нед или забор
аутокрови невозможен — подкожно 6 доз ЭПО (от 250 до 300 ЕД/кг)
в сочетании с препаратами железа, как по 1-й схеме.
Эти 6 доз распределяются на период времени от 10 до 21 дня
Рис. 19-7. Предоперационное применение эпоэтина
Интраоперационное применение эпоэтина
Подкожно вводят 4 дозы эпоэтина по 600 мг/кг каждые 7 суток, начиная с
21-х суток до операции, с ежедневным приемом препаратов железа (рис. 19-8).
2
Неделя
0
Операция
Каждая стрелка обозначает введение ЭПО подкожно.
Подкожное введение 4 доз ЭПО по 600 мг/кг каждые
7 дней, начиная с 21-го предоперационного дня
с ежедневным приемом препаратов железа
Рис. 19-8. Периоперационное применение эпоэтина
Кратковременное интраоперационное применение эпоэтина
Подкожное введение эпоэтина 100 МЕ/кг в день начиная с 4-х суток перед опе¬
рацией и заканчивая 2-ми сутками после операции. В первые сутки доза эпоэтин
составляет 200 МЕ/кг внутривенно (рис. 19-9). Одновременно назначают сахарат
железа" для внутривенного введения в общей дозе от 600 до 1000 мг, в зависимо
сти от исходного резервного запаса железа. По данным F. Mercuriari и соавт. (1’° ’
1993), такое лечение приводит к увеличению гематокрита на 2-7%, а массы цирку
лируюших эритроцитов на 100 мл. Кроме того, эта схема применения препар*
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 665
О дает возможность стимулировать эритропоэз и уменьшить потребность
ТО» ^ иваниях крови у пациентов с ограниченным периодом времени до опера-
»^ торые не могут сдать аутокровь.
„йИ.к0Т
пп ш
і
Неделя
О
Операция
Каждая стрелка обозначает введение ЭПО подкожно и железа внутривенно
19-9 Кратковременное интраоперационное применение эпоэтина
Применение препаратов ЭПО во время операции в сочетании с острой нормо-
лемической гемодилюцией и/или сбор крови позволяют еще больше снизить
Потребность в заготовке аутокрови.
ХРИОКОНСЕРВИРОВАНИЕ КОМПОНЕНТОВ АУТОКРОВИ И ЕГО КЛИНИЧЕСКОЕ
ПРИМЕНЕНИЕ
Криоконсервирование компонентов аутокрови (в ОК ККЧиК - аутозритро¬
цитная взвесь, размороженная и отмытая) открывает новые перспективы для
аутогемотрансфузий, так как позволяет задолго до операции накапливать и дли¬
тельно хранить необходимое количество клеточных компонентов и плазму
для оперативного вмешательства или лечения больного.
В целом условия замораживания, хранения, размораживания аутоСЗП и ауто¬
эритроцитной массы не отличаются от используемых для криоконсервирования
аллогенных компонентов крови.
ИНТРАОПЕРАЦИОННАЯ ГЕМОДИЛЮЦИЯ
Одним из эффективных методов, позволяющих снизить операционную кро¬
вопотерю, уменьшить объемы использования компонентов донорской крови,
сохранить и возвратить больному значительные объемы аутокрови, является
гемодилюция — искусственное разведение крови. В литературе она именуется
контролируемой гемодилюцией, гемодилюцией и аутотрансфузией, интраопе-
рационным резервированием крови, острой нормоволемической гемодилюцией,
интраоперационной гемодилюцией, управляемой гемодилюцией, предоперацион¬
ной изоволемической гемодилюцией.
Гемодилюция (в различных вариантах своего выполнения) направлена на адап¬
тацию организма к кровопотере при резервировании аутокрови и во время опера¬
ции.
В клинической практике не всегда есть время и возможность для предопераци¬
онной заготовки крови или ее компонентов, в то время как различные варианты
Гемодилюции в условиях операционного блока обеспечивают создание срочного
Ро^Рва свежезаготовленной цельной крови,
омодилюция, снижая концентрацию крови, улучшает ее реологические свой-
и условия общей гемодинамики, способствует интенсификации коронарно-
< мозгового и капиллярного кровотока. В экспериментальных исследованиях
получены данные, свидетельствующие о том, что гемодилюция обладает
тР°мбо°М Наи^олее эффективно воздействовать на различные звенья патогенеза
566 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
В это же время гемодилюция стимулирует водный обмен, вызывая Пол
І и форсируя тем самым очищение организма от шлаков и токсичных ве-
Разведение крови при гемодилюции снижает операционную кровопотерю ^
сокращения потери эритроцитов и других компонентов крови. Совершенно й
видно, что чем больше снижается гематокрит, тем большее количество эрит^6
тов сберегается при операционной кровопотере. р°1(и-
Благодаря вымытым из депо эритроцитам восполняется кислородная емк
крови. Ускорение кровотока и увеличение оборачиваемости собственных ЩІК
цитов путем уменьшения вязкости крови снижает опасность возникновения а
мии при адекватном восполнении дефицита ОЦК. Даже при уменьшении объе *
циркулирующего гемоглобина на фоне гемодилюции в 3 раза интенсивная рабо
всех четырех гемов молекулы гемоглобина, а не одного, как в норме, обеспечива
нормальный газообмен в тканях.
В отличие от обычных способов применения кровезамещающих жидкостей
при управляемой гемодилюции заданная степень разведения крови достигается
не в процессе возмещения кровопотери, а ранее, еще до начала оперативного вме¬
шательства. максимально быстро и в пределах должного объема ОЦК. Состояние
такого разбавления крови поддерживают на протяжении того периода, когда орга¬
низм больного испытывает наибольшую степень напряжения компенсаторных
механизмов при адаптации к поражающим факторам. Затем, когда необходимость
в ней отпадает, гемодилюцию устраняют путем включения естественных реак¬
ций организма, направленных на нормализацию системы гомеостаза, или путем
медикаментозной стимуляции физиологических процессов выведения избытка
жидкости.
Для гемодилюции отбирают больных с предполагаемой операционной кро¬
вопотерей не менее 15-20% ОЦК. Кровопотеря во время операции 5-10% ОЦК,
как правило, не требует возмещения кровью, и в таких случаях целесообразно
ограничиться инфузией солевых или коллоидных растворов.
Доза эксфузии зависит от состояния больного, предполагаемой кровопотери,
показателей красной крови, компенсаторных (адаптационных) реакций на крово¬
потерю. Хирург, трансфузиолог и анестезиолог совместно решают вопрос об объеме
и виде кровезаменителей, необходимых для возмещения кровопотери и/или про¬
ведения предоперационной нормоволемической гемодилюции. Наиболее целесо¬
образна интраоперационная гемодилюция крови после интубации больного и инга¬
ляции дыхательной смеси с высокой концентрацией кислорода, что позволяет
увеличить кислородную емкость эксфузируемой венозной крови.
Методы управляемой гемодилюции
• Предоперационная.
• Интраоперационная:
❖ гиперволемическая;
❖ нормоволемическая (ОНГ).
При предоперационной гемодилюции, которую проводят за 6-12 ч перед
операцией, часть ОЦК больного замещают кровезаменителями до достижения
показателя гематокрита 32-35%, считающегося зоной оптимальной гемодилю¬
ции. Собранную кровь используют для компенсации интраоперационного кро¬
вотечения. Предоперационная гемодилюция снижает потребность в переливании
крови на 18-100%. Метод применяют редко.
Интраоперационная гемодилюция — эксфузию крови проводят на операци¬
онном столе непосредственно перед наркозом или после него.
Гиперволемическая гемодилюция — метод быстрого внутривенного введен
больших объемов (4-5 л) сбалансированных солевых растворов для создания
резерва внеклеточной жидкости и усиления процессов естественной гемодилюц •
Его чаще используют в зарубежных клиниках. При острой гиперволемическ
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 667
одилюции увеличение ОЦК выше нормы путем избыточного переливания
азмозаменителей под контролем показателей гемодинамики и ЦВД еще больше
^ижает потерю эритроцитов во время операции. Последний метод применяют
гораздо реже, чем ОНГ, поскольку он требует более тщательного отбора пациентов
мониторинга центральной гемодинамики пациента и параметров сердечной про-
Цзводительносги, в том числе с использованием инвазивной методики — катетери-
ИИИ легочной артерии по методу Свана-Ганса.
Щ ГиПерволемическую гемодилюцию проводят по тем же принципам, что и нор-
оволемическую, но при этом поддерживают гематокрит в пределах 23-25%,
используя для замещения эксфузируемой аутокрови сначала растворы гидрокси¬
этилкрахмала или 5-10% раствор альбумина человека и другие коллоиды, а затем
растворы кристаллоидов.
Гиперволемическая гемодилюция противопоказана больным с выраженной
коронарной недостаточностью, тяжелыми нарушениями ритма, артериальной
гипертензией (систолическое АД >180 мм рт.ст.), тяжелыми поражениями лег¬
ких с дыхательной недостаточностью, патологией почек, печени, нарушениями
I системе свертывания, при очагах инфекции.
Во время гемодилюции реализуются несколько компенсационных механизмов
для поддержания доставки кислорода к тканям организма: снижение вязкости
крови уменьшает периферическое сосудистое сопротивление, что увеличивает
сократительную функцию сердца и соответственно доставку кислорода в ткани
(улучшение микроциркуляции). Установлено, что максимально допустимое сни¬
жение периферического сосудистого сопротивления происходит при значении
гематокрита примерно 30%, и максимальная способность транспорта кислорода
эритроцитами возможна при гематокрите 30%. Таким образом, у пациента может
улучшаться гемодинамика при более низком гематокрите.
Нормоволемическая гемодилюция — метод, при котором непосредственно перед
операцией после вводного наркоза в отношении больного осуществляют эксфузию
крови с одномоментным замещением ее гемодилюционным раствором, состоящим
из средне- или низкомолекулярных плазмозаменителей. Большие дозы солевых
растворов требуют соблюдения мер по профилактике отека легких и мозга - при¬
менение диуретических препаратов, в том числе салуретиков.
ОНГ - процедура аутодонорства, когда в операционной после эксфузии крови
больного часть ОЦК замещают кровезаменителями до достижения гематокрита
не ниже 30% (в исключительных случаях — до 21-22%). Под контролем состоя¬
ния сердечно-сосудистой системы больного и показателей АД эксфузируют
кровь в дозе 750-1000 мл или более, одновременно замещая эту потерю равным
объемом кровезаменителя. Обычно это инфузия больших объемов кристаллоидов
(отношение к объему удаленной крови — 3:1) или коллоидов (ГД),
Острую нормоволемическую гемодилюцию (в зависимости от целевого значе¬
ния гематокрита) подразделяют:
і на умеренную ОНГ — допускают снижение гематокрита до 30-25%;
• экстремальную — до 20-15%.
Экстремальную ОНГ хорошо переносят молодые пациенты общехирургическо¬
го профиля.
Существенное преимущество острой нормоволемической гемодилюции — ис¬
пользование всей заготовленной крови, тогда как значительную часть крови, заго¬
товленной перед операцией, в итоге не переливают.
Критерии отбора пациентов для ОНГ таковы.
• Предполагаемая операционная кровопотеря более 20% ОЦК.
I Концентрация гемоглобина в крови — 100-120 г/л.
І Второй этап заготовки аутокомпонентов после предоперационного резерви¬
рования, а также невозможность заготовки аутокрови перед операцией.
gig КЛИНИЧЕСКАЯ ТЙЯНСФУЗИОЛОГИЯ
і Посттрансфузионные осложнения в анамнезе.
§ Редкая группа крови больного, отсутствие необходимого объема компонен
тов донорской крови.
і Предполагаемая кровопотеря более 20% у пациентов, отказывающие
от гемотрансфузий по религиозным или каким-либо другим мотивам. 1
I Нормальные функции сердца - нет клинических и ЭКГ-признаков ишемйи
миокарда.
• Отсутствие признаков рестриктивной или обструктивной легочной недоста-
точности.
ОНГ применяют в сердечно-сосудистой хирургии, ортопедии, гинекологии
урологии - во время всех операций с предполагаемой кровопотерей более 20%
ОЦК. Возможно применение этого метода резервирования крови и в педиатрии.
Внедрение ОНГ в клиническую практику основано на исследованиях, проведен¬
ных в 1950-е гг., свидетельствующих о хорошей переносимости острой кровопоте¬
ри до 50% ОЦК на фоне ее возмещения декстранами. Последующие исследования
патофизиологических аспектов геморрагического шока, связанных с изменением
реологических свойств крови, гемодинамическими и сердечно-сосудистыми ком¬
пенсаторными реакциями организма на шок, доказали возможность применения
гемодилюции для кровесбережения следующие.
Преимущества ОНГ по сравнению с предоперационным резервированием ауто¬
компонентов крови следующие.
I Эксфузия крови с одномоментным восполнением ОЦК плазмозаменителями
улучшает ее реологические свойства, уменьшает вязкость, снижает агрегаци-
онные свойства тромбоцитов, эритроцитов, увеличивает сердечный выброс.
Все это приводит к улучшению микроциркуляции и перфузии тканей, повы¬
шает транспорт и экскрецию кислорода. Если производительность сердца
после эксфузии крови эффективно восстановлена, то доставка кислорода тка¬
ням при гематокрите 25-30% остается на том же уровне, что и при 35-40%.
Возрастает отдача кислорода тканям.
• Хранение аутокрови в течение ограниченного времени при комнатной тем¬
пературе способствует сохранности лабильных факторов свертывания крови,
тромбоцитов - гемостатического потенциала крови.
і Это единственный метод резервирования аутокрови при отсутствии возмож¬
ности ее предоперационной заготовки.
• ОНГ проводят после вводного наркоза и начала ИВЛ воздушно-кислородной
смесью, что увеличивает кислородную емкость крови.
• ОНГ в операционной обеспечивает большую безопасность для пациента,
поскольку есть возможность мониторинга АД, ЧСС, Sp02, ЭКГ, контроля
показателей гемограммы, кислотно-основного равновесия (КОР), водно¬
электролитного состава крови.
• Экономические преимущества: не нужно фракционировать и хранить ауто¬
кровь, не требуется присутствие врача-трансфузилога (ОНГ, как правило,
проводит анестезиолог).
Противопоказания к ОНГ те же, что и к предоперационной заготовке ауто¬
компонентов крови:
• анемия с концентрацией гемоглобина менее 100 г/л;
і сердечная недостаточность более ИВ степени по NYHA, острая ишемия мио¬
карда, нестабильная стенокардия, выраженный стеноз аорты, поражение
ствола левой коронарной артерии, тяжелые нарушения ритма и проводимо¬
сти сердца:
і легочная гипертензия более ИВ степени, ХПН, дыхательная недостаточность,
рестриктивные или обструктивные заболевания легких:
I олигурия, требующая лечения диуретиками, заболевания почек;
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 669
заболевания печени с явлениями печеночной недостаточности;
j продолжающееся кровотечение, нарушения свертывания крови, коагулопа-
тии на фоне тромбоцитопении менее 150хЮ9/л;
• инфекция, сепсис, гнойно-воспалительные процессы, кахексия;
, гепатиты В, С, ВИЧ.
Методика острой нормоволемической гемодилюции
Объем эксфузии крови во время ОНГ зависит от целевой концентрации гемо¬
глобина, минимальный уровень которого после эксфузии должен составлять более
^Расчет предполагаемого объема эксфузии проводят по формуле, предложенной
D- Vignon (1999):
V3BC* = 04K(Hti,c]o-HtKoH)/Http,
где v»c4 1 °бъем эксфузии (мл); ОЦК — объем циркулирующей крови, рас¬
считанный как процент массы тела (у мужчин - 7%, у женщин - 6,5%); ШйС1 —
исходный гематокрит, г/л; Шкоя — конечный гематокрит, г/л; Htcp - средний
гематокрит, 0,38хг/л.
При ОНГ в педиатрии применяют следующую формулу:
V = Ht1-Ht2/04KxHtcp,
где V - объем эксфузии аутокрови; ОЦК — объем циркулирующей крови ребенка,
рассчитанный по номограмме; — исходный гематокрит, г/л; Ht2 - целевое
значение гематокрита, г/л; Htcp — среднее значение гематокрита, г/л.
Эксфузированный объем крови восполняют солевыми растворами 3-4 мл на
каждый миллилитр изъятой крови (раствором Рингера*, трисолем*, 0,9% раствором
натрия хлорида), коллоидами — 1-2 мл на каждый мл изъятой крови (растворами
желатинов, декстранов или 6,10% растворами гидроксиэтилкрахмалов) или 5, 10
или 20% растворами альбумина человека. Объем резервируемой аутокрови зависит
от предполагаемой кровопотери и тяжести состояния пациента, но постгемодилюци-
онная концентрация гемоглобина не должна быть ниже 90-100 г/л, а гематокрит —
не менее 28%. Обязательно заполняют протокол ОНГ, где отмечают АД, ЧСС,
объем эксфузии, заместительной инфузионной терапии, перечисляют препараты
для восполнения ОЦК. Кроме того, в протоколе фиксируют лабораторные показа¬
тели (концентрацию гемоглобина, гематокрит), ЦВД, Sp02 до эксфузии и после нее.
Объем эксфузии крови составляет в среднем 450-1200 мл крови. Скорость инфузии
кровезаменителей зависит от показателей гемодинамики, а объем кровезамените¬
лей коллоидного и кристаллоидного типа определяют целевым значением гемато¬
крита. В кардиохирургии допустимо снижение гематокрита до 30% (установлено,
что при этом уровне гемодилюции эффективный транспорт кислорода кровью,
несмотря на уменьшение количества эритроцитов, существенно не изменяется).
Достаточная для жизнедеятельности органов и тканей оксигенация при гемоди¬
люции обеспечивается компенсаторными механизмами: увеличением сердечного
выброса, снижением вязкости крови, увеличением экскреции кислорода в ткани,
сдвигом кривой диссоциации кислорода. Кровопотеря у больных, оперированных
методом гемодилюции, характеризуется меньшей потерей эритроцитов за счет
потери введенных солевых растворов. Заготовленную методом ОНГ аутокровь воз¬
вращают больному свежецитратной со сроком консервации обычно не более 1-6 ч.
Управляемая гемодилюция показана пациентам:
• при оперативных вмешательствах, сопровождающихся кровопотерей более
• с нормальными показателями гемограммы;
• с Достаточными резервами функциональных возможностей сердечно¬
сосудистой системы;
І І Условиях, когда нет времени на заготовку аутокрови до операции.
ГЛАВА 19
171 чЛИНИЧССКАЯ ТРАНСФУЗИОЛОГИЯ
Управляемая интраоперационная гемодилюция не показана при on
їЩЛітлю» кровопотерей, когда известно, что для ее компенсации мо-ж
тись переливанием только кровезаменителей. °6oj.
Таким образом, ОНГ не следует применять у больных с выраженным ате
розом. декомпенсированными заболеваниями паренхиматозных органов г***''
печени, почек), а также при некоторых онкологических заболеваниях. епЧ
При аллергических заболеваниях для профилактики тяжелых реакций и
нений важно своевременно выявлять повышенную чувствительность к гемо*
ntny, которая может ограничить возможность ОНГ.
При определении возможности ОНГ следует обращать внимание не сто
на показатели красной крови больного, сколько на клиническое состояние и **
пенсаторные возможности организма пациента. Ком'
Техника управляемой гемодилюции
В клинической практике чаще всего используют метод острой заменной нопм
волемической гемодилюции. Эксфузию аутокрови осуществляют в пластиковые
контейнеры с гемоконсервантом после вводного наркоза из центральной (рЄНІ,.
периферической) вены обязательно под прикрытием инфузией кровезаменителей
Скорость инфузии определяют по показателям гемодинамики. При управляемой
гемодилюции предпочтительно использовать сложные комплексные кровеза¬
менители. которые не только обеспечивают дозированную степень разведения
крови, но и максимальное реологическое воздействие, полную коррекцию воз¬
можных электролитных сдвигов и компенсацию возникающего дефицита основа¬
ний. Идеальными гемодилютантами считают препараты гидроксиэтилкрахмала,
декстрана. желатина (гелофузин*. желатиноль*), растворы альбумина человека,
большинство противошоковых коллоидных кровезаменителей.
Трансфузионные среды должны быть согреты до 36 °С, и вводить их необходи¬
мо последовательно.
Строгое соблюдение последовательности имеет решающее значение в эффек¬
тивности метода. Вначале вводят препараты с высоким онкотическим давлени¬
ем - растворы альбумина человека или желатина. Затем переливают раствор
Рингера*. Благодаря созданному резерву онкотического давления солевой раствор
дольше удерживается в кровеносном русле и более эффективно обеспечивает раз-
ведение крови. Заканчивают инфузию введением раствора декстранов, ГЭК.
Для гемодилюции нельзя использовать 0,9% раствор натрия хлорида из-за его
свойства быстро перемещаться во внесосудистые водные секторы организма паци¬
ентов.
Суммарная доза гемодилюционного раствора зависит от массы тела и роста
больного, исходного гематокрита, операционной кровопотери, предполагаемого
разведения крови. Для определения необходимой суммарной дозы гемодилютанта
используют следующую формулу (Унжаков В. В., 1990):
Д = [Н х ОЦК х Ht (пл.) х 2XJ/100,
гдеД 1 доза гемодилютанта, мл; Н — масса тела больного, кг; ОЦК — объем цир-
кулирующей крови, мл/кг, истинный (определенный методом разведения инди¬
катора) или должный (соответствующий полу и массе тела больного); Ht (пл.)'
гематокрит по плазме, л/л; X - заданное разведение крови, %.
В норме ОЦК взрослого мужчины составляет 80, женщины - 75 мл/кг. Д-
более точного определения должной массы тела применяют формулу Лоренца.
Р = Т-100 [(Т- 150)/41,
где Р должная масса тела, кг; Т - рост, см.
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ ®71
q учетом того что в процессе операции часть жидкости покидает сосудистое
село. для обеспечения заданного разведения крови приходится увеличивать рас-
^иуіо дозу гемодилютанта (Д) на 10-15%.
Количество эксфузированной крови зависит от исходных показателей ОЦК
гематокрита. До настоящего времени нет единого мнения об объеме заготовки
"угокрови при острой предоперационной гемодилюции. который можно было бы
^зервировать у больного и использовать в дальнейшем по мере необходимости.
Возможно, нарушения циркулярного гомеостаза, несмотря на параллельно прово¬
кую гемодилюцию, а также снижение кислородной емкости крови и ее коагули¬
рующих свойств становятся тем препятствием, которое не позволяет достаточно
Гласно отнестись к большим по объему эксфузиям крови непосредственно
перед операцией. ^
При управляемой гемодилюции количество эритроцитов уменьшается в лога¬
рифмической зависимости. Это означает, что по мере разбавления абсолютное
(но не относительное) количество эритроцитов, теряющихся при кровотечении,
прогрессивно снижается (табл. 19-17).
Таблице 19-17. Соотношение объема кровопотери и гематокрита
Кровопотеря, мл
Гемтокрит, %
ШВД о
4S
' 791
35
ЛшШ 1561
30
В 2472
25
При практическом применении гемодилюции необходимо заранее знать, сколь¬
ко крови должно быть эксфузировано методом острой гемодилюции для получе¬
ния того или иного значения гематокрита. Для этого можно использовать форму¬
лу, предложенную A. Y. Coburg и соавт.:
Htn = Ht„c*. * [10(500 мл х п/ОЦК)),
где Ht - искомая величина гематокрита; Шю — исходное значение гематокрита;
п - количество доз консервированной крови; 500 мл - объем одной дозы консер¬
вированной крови; ОЦК — объем циркулирующей крови, мл.
Безопасный объем извлекаемой аутокрови может быть рассчитан по формуле
D. Malcolm:
где V - объем заготавливаемой крови, мл; Р — масса тела больного (кг) х70 (сред¬
ний объем крови взрослого человека — 70 мл/кг); Ht^ — гематокрит исходный,
л/л; HtK - гематокрит конечный, г/л (после эксфузии).
Безопасный объем извлекаемой аутокрови можно рассчитать и по формуле Z.
Stehling и соавт.:
v-BV[(Ht„-Hy/Hg,
где V - объем эксфузии, мл; BV — рассчитанный по массе тела объем крови, мл
(у взрослого в среднем 70 мл/кг); Ht^ — гематокрит исходный, л/л; Hte - гема¬
токрит желаемый, л/л; Htc — гематокрит средний, л/л (разность между исходным
и желаемым).
Нормоволемическая гемодилюция мобилизует адаптационные механизмы
сердца, регионарного кровообращения и микроциркуляторного русла. Она умень-
шает вязкость крови, что приводит к снижению общего периферического сопро¬
тивления току крови, предупреждает агрегацию клеток крови, секвестрацию
эритроцитов, устраняет явление сладжирования, облегчает работу сердца, улуч-
172 КЛИНИЧЕСКАЯ ТМНСФУЗИОЛОГИЯ
вист процессы микроциркуляции. увеличивает венозный возврат крови к
и интенсификацию регионарного тканевого кровотока. Увеличение сеп
выброса при этом происходит путем мобилизации функционального й°^
сердца и не сопровождается повышением интенсивности сердечной деятель*36^
Установлено. что снижение вязкости крови на 25% увеличивает производи!*111'
ность сердца на 50%. ДИт«ль.
Стандартный мониторинг при острой нормоволемической гемодилюцн
дующий. СЛе-
I Непрерывный: ЭКГ-мониторинг, АД, ЦВД, пульсоксигемометрия, измели
темпа и объема диуреза. ^ени(
• Периодический: анализ газового состава артериальной крови, гем
крит/концентрация гемоглобина, свертывание крови, концентрация ал»
тролитов в сыворотке крови. ЭЛек‘
Если при интраоперационной гемодилюции кровопотерю восполняют посп»
сгеом введения раствора альбумина человека, то количество эритроцитов снижав
на 37% исходного уровня. При предоперационной гемодилюции такое же развел *
ние проводят перед операцией. Затем, во время операции, кровопотерю восполняю
собранной кровью больного, что увеличивает количество эритроцитов и дает іти
рост В 16,7% по сравнению с интраоперационной гемодилюцией (рис. 19-10).
% количества замещенной крови
Рис. 19-10. Изменение количества эритроцитов при гемодилюции
Эксфузия крови с синхронно проводимой гемодилюцией коллоидными раство¬
рами и кристаллоидами в объеме 15-25% ОЦК приводит к изменениям крово¬
обращения, выражающимся в снижении общего периферического сопротивления
Я среднего АД (ЧСС и систолическое АД после гемодилюции не изменены, но отме¬
чается снижение диастолического АД до нормальных показателей), а также в уве¬
личении минутной производительности сердца преимущественно за счет ударного
объема. В этом отличие ОНГ от эксфузии крови у доноров, у которых повышается
общее периферическое сопротивление,
ОНГ безопасна у больных, не имеющих грубых нарушений кровообращения
и свертывания крови. Эритроциты аутокрови, заготовленной путем предоперацн
онной ОНГ. обладают большей резистентностью по сравнению с таковыми донор
ской крови 3-5 сут хранения.
При операционной кровопотере
ОНГ аутогемотрансфузия позволяет РНЦ! ЩИРИЯИИЯИЩЯЩРИ
и не вызывает при этом изменений, характерных для гомологичных гемотр
фузий. Однако установлено, что гемодилюция коллоидных и кристаллоид
Ю% ОЦК на фоне предоперационной
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 673
g до достижения значения гематокрита 30% уменьшает коагуляционный
'ftaaJiкрови и повышаетфибринолитическуюактивность.
^"линической практике имеется множество примеров переносимости пациен-
Р значительно более низкой гемодилюции. что достигается крайним напря-
****!! м компенсаторных механизмов организма, в первую очередь увеличением
АеИЙ ного выброса. При гематокрите менее 20% в эритроцитах снижается содер-
^ 2 з-ДФГ, из-за чего кислород легче отщепляется от гемоглобина и возрас-
*їГе*> поглощение тканями.
Таким образом, гемодилюция - один из основных методов профилактики
«явной кровопотери. Она обеспечивает снижение клеточных потерь при опе-
М ионной потере крови с низким содержанием эритроцитов после временного
изъятия из циркуляции. Кроме того, гемодилюция способствует профилактике
яї боэмболических осложнений после операции путем улучшения текучести
^ви и увеличения скорости кровотока как по артериальным, так и по венозным
Зігудам, что дает возможность улучшить физико-химические свойства крови
я интенсификации кровообращения, особенно на уровне капилляров.
В ГУ РНЦХ им. академика Б.В. Петровского РАМН широко применяют ОНГ
go время кардиохирургических операций. Модификация методики заключается
однократном заборе крови у пациента в операционной после вводного наркоза
из центральной (подключичной или внутренней яремной) вены, реже - из пери¬
ферической. Объем эксфузии крови составляет в среднем 500±40 мл и зависит
от предполагаемой кровопотери и тяжести состояния пациента. Во время наркоза
и операции необходим контроль гемодинамических показателей, почасового диуре¬
за газового состава крови для поддержания нормальной оксигенации тканей и нор-
моволемии, обеспечивающей адекватную перфузию органов. Во время операций
с ИК возможна заготовка аутокрови как до, так и после введения гепарина натрия.
Одним из эффективных методов заготовки аутокрови в акушерско-гинеко¬
логической практике считают ОНГ у женщин группы высокого риска кровотече¬
ния при кесаревом сечении и других гинекологических операциях.
ОНГ с использованием 10% раствора гидроксиэтилкрахмала у беременных при
кесаревом сечении позволяет улучшить объемные показатели кровотока: МОС уве¬
личивается на 37%, СИ - на 30%, а УО - на 33% на фоне стабильной ЧСС. ОПСС
снижается на 29% по сравнению с исходными показателями. ОНГ с аутогемотранс¬
фузией позволяет обеспечить полноценную кислородтранспортную функцию крови
с сохранением цитохимических структур эритроцитов. Этот метод дает возможность
восстановить популяцию эритроцитов в сосудистом русле. Не выявлено неблаго¬
приятного влияния ОНГ на плод, анемию у новорожденного не обнаруживают.
Проведение ОНГ более рентабельно и экономически выгодно, чем доопераци-
онная заготовка аутокрови. Подсчитано, что 3 дозы аутокрови обходятся в
300 долларов США, в то время как ОНГ с изъятием 4 доз крови стоит всего 100
долларов США. Кроме того, как показывает опыт авторов данной книги и других
исследователей, не всегда есть уверенность, что заготовленная до операции кровь
или ее компоненты будут использованы в полном объеме. В частности, имеются
сообщения, что 38-40% заготовленной в предоперационный период аутокрови
никогда не переливают больному по тем или иным причинам, тогда как кровь,
сготовленную методом гемодилюции, используют всегда.
Гемодилюция позволяет снизить на 18-90% использование аллогенной крови.
Применение методов гемодилюции у кардиохирургических больных привело
к снижению количества трансфузий тромбоцитной массы, при этом отмечено уве¬
рение концентрации гемоглобина после операции. При операциях на позвоноч-
ОНГ позволила снизить потребность в аллогенной крови на 75-85%.
Методика проведения управляемой — как пред-, так и острой интраопераци-
0нн°й гемодилюции требует специальной подготовки медицинского персонала
*74 КЛИП*СОСАН ГРАНСФУЗИОЛОГИЯ
I лабораторных методик контроля гомеостаза. При интп
ішонной гемодилюции необходимо присутствие врача и медицинойі°ПеРа-
■■ррмнй «млеющих этой методикой. Главное условие эффект
I безопасности интраоперационной гемодилюции - детальное знаниеeel**1
костей, учет противопоказании, тщательный контроль за состоянием бп™
Н^^НИНІ іпііНмм їй i» « паічмпмл плгии м na
глубокое знание анестезиологии и патофизиологии операционной травмы
Метод гемодилюции с эксфузией крови из ушка
правого предсердия
Эго модифицированный метод ОНГ, разработанный в ГУ РНЦХ им акал
Б.В. Петровского РАМН. . демик«
Основным преимуществом данного варианта ОНГ является возможность
свмально безопасного резервирования аутокрови у больного, поскольку Пп—т
дуру проводят на этапе канюляции аорты, что позволяет сразу подключить Аик
І стабилизировать гемодинамику искусственным кровообращением. К момент!
эксфузии аутокрови пациенту проводят гемодилюцию, переливая коллоидны
и кристаллоидные растворы, при этом гематокрит снижается до минимально дот-
стимого для данной категории пациентов значения (38-35%).
Противопоказания к проведению данного метода:
• концентрация гемоглобина менее 110 г/л;
• нестабильная гемодинамика после вводного наркоза, осложненное течение
начального этапа операции (аллергические, анафилактоидные реакции);
• исходное низкое ЦВД (<5 мм вод. ст.);
і поражение ствола левой коронарной артерии (у больных с ИБС);
• септический эндокардит.
Методика заготовки аутокрови из ушка правого предсердия сводится к следующе¬
му (рис. 19*11): после наложения кисетного шва на ушко правого предсердия, которое
I дальнейшем будет служить местом введения канюли магистрали АИК в верхнюю
швдюаену, в него вводят иглу от системы для взятия крови в гемоконтейнер.
Эту процедуру проводят под контролем центральной гемодинамики (к моменту
эксфузии крови осуществляют постановку катетера Свана-Ганса), АД-инвазивным
(ацутрнартериальным) методом, а также КОР и гематокрита, минимально допу¬
стимое значение которого после эксфузии крови должно составлять не менее
30%. При этом объем эксфузии аутокрови у больных с ИБС составляет в среднем
500-550 мл. У больных, страдающих поражением клапанного аппарата сердца
или дилатационной кардиомиопатией, объем эксфузии может быть увеличен
в зависимости от показателей гемодинамики и гематокрита до 600-660 мл.
ИНТРАОПЕРАЦИОННАЯ ГЕМОДИЛЮЦИЯ С ПЕРФТ0РАН0М* (см. «Приложения»
В диске Щ
ОСЛОЖНЕНИЯ АУТ0Д0Н0РСТВА КРОВИ И ИХ ПРОФИЛАКТИКА
Аутодонорство — инвазивная трансфузиологическая процедура, которая может
сопровождаться реакциями и осложнениями, обусловленными как самой гіроце
дурой, так и состоянием пациента. Аутодонорство может сопровождаться легко
головкой болью, кратковременным снижением АД, не требующими лечени
У 0,3% доноров наблюдаются обмороки с кратковременной потерей сознан ■
•у 0Щи І судороги, брадикардия, вплоть до остановки сердца (типа синкоп^
При аугодонорстве необходимо каждый раз оценивать риск кроводачи. Д
f тяжелобольных, по сравнению с риском возможных осложнений при алло
мой трансфузии
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 675
Заготовки аутокрови методом эксфузии
из ушка правого предсердия
(Трекова Н.А., Яворовский А.Г. и др.)
Противопоказания:
- Ht ниже 38-37%;
- нестабильная
гемодинамика;
і исходно низкое
венозное давление
(ниже 5 мм вод.ст.);
- поражение ствола
коронарных артерий
(у больных с ишемией)
Объем эксфузии
аутокрови у больных,
в среднем 500-550 мл
Показания:
1. Возможность
резервирования
определенного объема
аутокрови.
2. Опосредованное
снижение операционной
кровопотери за смет
\ разведения
| циркулирующей крови
| введением
I гемодилютанта.
13. Снижение травмы
і форменных элементов
і крови при ее заготовке.
\ 4. Сохранение всех
{свертывающих
факторов,
/ содержащихся в
собственной крови
больного
Забор крови
проводится после
канюляции аорты,
чтобы избежать
гемодинамических
нарушений и иметь
возможность
моментального
включения АИК
Введение иглы
контейнера для
заготовки крови
вплоть до полости
правого предсердия
Рис. 19-11. Заготовка аутокрови методом эксфузии из ушка правого предсердия
Вопрос относительно частоты осложнений при заготовке аутокрови по сравне¬
нию с аллогенным донорством некорректен. Это сравнение осложнено тем. что
аутогенные доноры — пациенты с различным диагнозом, и их средний возраст,
как правило, выше, чем у доноров аллогенной крови.
Очень тяжелые реакции, заканчивающиеся госпитализацией, у аутогенных доно¬
ров возникают в 12 раз чаще, чем у доноров аллогенной крови. Их частота составляет
1 случай на 17 ООО кроводач. Поскольку эксфузия крови у пациентов может сопрово-
*Даться осложнениями, аутодонорство необходимо назначать только после тщатедь-
ного анализа всех особенностей течения заболевания и показаний к гемотрансфузии.
Существует ошибочное мнение, приравнивающее процедуру забора крови
• ^доноров (в том числе риски и осложнения) к таковой у доноров аллоген-
пои крови, прошедших соответствующее медицинское освидетельствование.
родимо постоянно помнить, что аутодонорство у лиц, имеющих определен-
1401 диагноз (пациентов), само по себе увеличивает риск возможных осложнений.
1171 клиничтосаятияновузмология
связанных как с самой процедурой забора крови, так и с ее влиянием на течей
заболевания, а также операционный и послеоперационный период.
При ЭТОМ следует иметь В виду, ЧТО аутокровь ИЛИ ее компоненты имеют Вт
особенности (маркеры), присущие крови при определенном заболевании, и могу!
отличаться по ряду лабораторных показателей от донорских компонентов, в чагГ
ности, имеются сведения, что на 6-е сутки хранения в крови больных раком ле
кого и больных с ХОБЛ содержание сгустков, превышающих в диаметре 100 мю,
в 1 мл препарата, примерно в 2 раза больше, чем у доноров аллогенной крови
Несмотря на все преимущества и соблюдение необходимых условий, у
донорства имеются относительные недостатки, обусловленные специфическим
особенностями этого метода (табл. 19-18 и 19-19).
• Необходимость специального отбора больных с учетом общего состояния
противопоказаний к эксфузии крови, показателей анализов крови, возмож¬
ной сердечно-сосудистой и общей реакции на кровопотерю.
І Ограничение дозы эксфузии и тщательный контроль за состоянием больного
во время трансфузии.
I Опасность технических погрешностей, потенциально вызывающих воздущ.
ную, жировую эмболию или бактериальное загрязнение крови.
• Опасность ошибок при заполнении документации.
• Переливание аутокрови одного больного другому.
• Непереносимость препаратов железа, необходимых при повторных эксфузиях.
Таблица 19-18. Возможные осложнения аутодонорства (по данным различных источников, часто¬
та составляет от 9:10 ООО до 12:28 ООО)
Бвктвриаяьная контаминация аутокомпонентов крови
Скрытая бактериемия у аутодоноров
Дпнттныв сроки хранения аутокомпонентов
Фебряльиея негемолитичесш посттрансфузионнэя реакция
Продукция аутояейкоцитзми лроеоспалительных цитокинов в процессе хранения аутоэритроцитной част
Ятрогаиим анемия
Технические вогрешиости
Перекрестная трансфузия аутокрови, несовместимой по системе АВО и резус-фактору
|Потеря аупжомпонента при отмене операции, нарушении целостности гемоконтейнера, техническом браке
І ряда сяучаеа аутодонорство приводит я увеличению стоимости лечения и сопряжено с задержкой пла¬
номга хирургического вмешательства.
Таблица 11-18. Возможные осложнения при аутодонорстве и их причины (по опубликованным
данным)
Осложнения
Частота воз¬
никновения. %
Причины
Ні утім заготовки, маркировки и хранении
/Технические
20-25
Разгерметизация гемоконтейнеров, образование сгусти»
/Производственные
—
Трудности с доставкой (плохая связь, поздняя доставка) .
I Медицинские 1 —
Головокружение, снижение АД, тахикардия J
j Осложнения, связанные с мар-1
І кироехой компонентов крови 1
15-50
Невнимание персонала при регистрации пациента
І Разрушение заготовленных j
клеток кроаи при хранении j
1-2
1
Нарушения условий или истечение сроков хранения 1
I И» агвив иииического применения
5-10
{Использование аллогенной Т
І крови вместо аутокрови
I или совместно с аплокомпо-
1 нашив j
I Трансфузии аутаивмгюнвнта I оде
[другому пациенту |
I Клиническая необходимость (профузное кровотечение,
І резкая анемизация), техническая ошибка медицинского
І персонала
I Организационные ошибки, недостаточный профессмо-
[наяизм _______
АУТОДОНОРСТВО и аутогемотрансфузии 877
Одни из наиболее частых и опасных осложнений у доноров аутокрови, так же
„у доноров аллогенной крови, — реакции на эксфузию сердечно-сосудистой
"иегемы- В публикациях описаны смертельные случаи после сдачи крови у лиц,
с1доЫе соответствовали всем критериям для донорства (критерии FDA, США).
Таким образом, при аутодонорстве необходимо повышенное внимание врача,
особенно к больным с сердечно-сосудистой патологией. Заболевания сердечно-
\1дйСтой системы — противопоказания к аутодонорству:
, идиопатическая обструктивная кардиомиопатия;
, аортальный стеноз;
, нестабильная стенокардия;
• порок сердца;
• недавний инфаркт миокарда;
« желудочковая аритмия;
, атриовентрикулярная блокада;
, проявление симптомов заболевания в день сдачи крови,
для снижения частоты осложнений во время процедур аутодонации крови
показано соблюдение определенных мер профилактики.
• Необходим мониторинг АД. ЧСС, желательна пульсоксиметрия до. во время
и после эксфузии крови (особенно при заготовке аутокрови у больных с
ИБС, приобретенными, врожденными пороками сердца, а также у пациентов,
имеющих сопутствующую терапевтическую патологию).
• При низком исходном АД (среднее АД <70 мм рт.ст.) процедуру следует начи¬
нать с инфузии кристаллоидов или коллоидов в объеме не менее 250 мл.
Перед началом инфузии растворов следует уточнить аллергологический и транс-
фузионный анамнез. Необходимо учитывать характер медикаментозного лечения
в предоперационном периоде: например, заготовка аутокрови у пациентов кар¬
диохирургического профиля несколько затруднена из-за назначения им гипотен¬
зивных, диуретических препаратов, что может привести к увеличению частоты
коллаптоидных состояний после эксфузии крови (медикаментозной вазодила-
тации периферического сосудистого русла или уменьшению ОЦК как результата
длительного приема диуретиков).
Эксфузию аутокрови проводят в положении пациента лежа на спине, под посто¬
янным наблюдением врача-трансфузиолога в операционной отделения трансфузи-
логии или в процедурном кабинете хирургического, поликлинического отделения.
Трансфузиолог, проводящий заготовку аутокрови, должен разъяснить пациен¬
ту преимущества аутодонорства, по возможности наладить контакт с больным
для создания оптимальных психологических условий. Не рекомендуют проводить
процедуру аутодонорства натощак, после тяжелых инвазивных диагностических
процедур (гастроскопии, колоноскопии, тредмил-теста). Целесообразно оценить
состояние пациента после эксфузии крови, при необходимости организовать
транспортировку пациента в хирургическое отделение в сопровождении меди¬
цинского персонала. После заготовки аутокрови на догоспитальном, поликли¬
ническом этапе необходимо наблюдение за состоянием пациента на протяжении
30 мин, после чего при отсутствии осложнений (снижения АД) его можно отпу¬
стить домой.
Во всех случаях обязательна инфузия плазмозаменителей коллоидного
и/или кристаллоидного ряда. С этой целью применяют растворы гидроксиэтил-
крахмала (инфукол ГЭК*, ХАЕС-стерил*. рефортан* 6%, волювен*, волекам*.
стабизол ГЭК 6%*), желатина (гелофузин*), декстранов (полиглюкин*. реополи-
слкжин*), а также различные солевые растворы (для ресуспендирования аутоэ¬
ритроцитной массы применяют 0,9% раствор натрия хлорида). Объем инфузии
^исит не только от объема резервированной крови, но и от вида аутокомпонента,
‘фитности процедуры, состояния пациента и составляет не менее 400 мл.
ем КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
1
Необходим набор медикаментозных препаратов для оказани
помощи больным при возможных осложнениях - вазовагальных * НЄ(УГЛо*Нг
или других: ’ аллеРгичес^
• 0,1% раствор атропина — 1 мл (ампула);
• преднизолон - 30 мг (ампула);
• 10% раствор кальция хлорида — 10 мл (ампула);
І 2.4% раствор эуфиллина — 5 мл (ампула);
• 1% раствор димедрола - 1 мл (ампула);
• нитроглицерин, седативные препараты в таблетках.
При тяжелых вазовагальных реакциях на эксфузию крови в виде бпа
с ЧСС менее 40 в минуту, сопровождаемой коллапсом, тошнотой, рвотой**Раии
ным потоотделением, потерей сознания, показано внутривенное ВйшШР
раствора атропина в дозе 1 мл (разведенного 0.9% раствором натрия хл* I
под контролем ЧСС и преднизолона в дозе 60-180 мг. Гиповолемию ко^
В струйной инфузией кристаллоидных растворов в объеме 250-400ПЄЯ
«затем - коллоидных плазмозаменителей до нормализации АД и ЧСС. Паци ***’
с патологией сердечно-сосудистой системы при осложнениях аутодонации каТ*
показан контроль ЭКГ. При отсутствии терапевтического эффекта от проводим
лечебных мероприятий процедуру прекращают, аутокровь реинфузируют, паци
ента переводят в отделение реанимации для необходимого лечения и дальнейшего
наблюдения.
На основании наблюдений установлено, что осложнения возникают в 68%
всех аутодонаций у больных с ИБС, врожденными и приобретенными пороками
сердца. Наиболее часто отмечались коллаптоидные состояния после эксфузии
крови в объеме 450 мл. Реакции и осложнения при аутодонорском ПФ у больных
с ИБС наблюдались в 106 случаях (7,1%). Это были гиповолемические нарушения
различной степени тяжести, приступы стенокардии, нарушения ритма сердца,
а также аллергические реакции с кожными проявлениями и пирогенные реакции
(табл. 19-20).
Частота осложнений аутодонаций перед операциями с ИК в РНЦХ несколько
выше, чем в других клиниках, где резервирование аутокрови у больных с тяже¬
лыми сердечно-сосудистыми заболеваниями не проводят. В этих учреждениях
осложнения аутодонаций отмечены в 4,5% процедур: резервирование аутокрови
проводили у 60-70% хирургических больных, за исключением пациентов с неста¬
бильной стенокардией, критическими стенозами коронарных артерий, аортально¬
го клапана и окклюзирующими цереброваскулярными заболеваниями.
Таблица 19-20. Осложнения аутодонорского ПФ у пациентов с ИБС (1997-2007)
"!
Частота осложнений (я=1790)
характер осложнения
абсолютное количество
%|
Гиповолемические реакции
без потери сознания
61
І
с потерей сознания
6
Приступы стенокардии
32
■Ч
Нарушения ритма
1
щ.
Сочетанные (снижение АД + приступ стенокардии + нарушения ритма)
2
0,13
Пирогенные
2
0,13
[Аллергические
2 __
0,13
[Всего
106
JJJ
Таким образом, по данным опыта проведения в РНХЦ аутодонорского
мафереза у 1790 пациентов на протяжении 10 лет, наиболее часто регистриря
ли реакции гиповолемического характера, которые наблюдались у 67 боль
АУТОДОНОРСТВО и аутогемотрансфузии 679
ii*)- Гиповолемическими считали состояния, когда систолическое и диасто*
aqfiOtpe АД снижалось на 25-30% и более исходного уровня без субъективных
1 «уїдений или величина снижения АД была меньше, но имелись субъективные
мщения — слабость, тахикардия, холодный пот, тошнота, головокружение, дис*
омфррт в эпигастрии. Подобную клиническую картину расценивают как гипо-
^емическую реакцию, для купирования которой было достаточно актив-
инфузии и прекращения процедуры. Подобные реакции со снижением АД
0 90/60-60/40 мм рт.ст. были отмечены в 61 случае. При 6 процедурах наблю-
д^ись снижение АД до 60/0-40/0 мм рт.ст. с потерей сознания. Подобные сим-
^мы расценивали как гиповолемическое осложнение, для купирования которого
йспользовали интенсивную инфузию и глюкокортикоиды - преднизолон внутри-
нн0 болюсно в дозе 90-150 мг (табл. 19-21).
Таблица. 19-21. Сравнительная оценка частоты возникновения неблагоприятных реакций во время
аутодонаций плазмы у больных с ИБС, врожденными и приобретенными пороками сердца (ГУ
РНЦХ им. академика Б.В. Петровского РАМН, 2007)
Клинические проявления реакции
■
ИБС (№180)
Врожденные, приобретенные
пороки сердца, ДКМЛ (№128)
"Ішііоллапс) после эксфузии крови
6
i ' "
Тдд (коллапс) после эксфузии крови с потерей сознания
1
АНГИНОЗНЫЙ приступ
2
.
■ - J
Технические осложнения: хилез плазмы, отсутствие
венозного доступа
1
2
. —
Аллергическая реакция на реополиглюкин*
1
Всего
13 (7,2%)
7 (5,5%)
Во всех случаях осложненных аутодонаций плазмы показаны введение глюко-
кортикоидов (от 60 до 180 мг преднизолона внутривенно) и струйное введение
плазмозаменителей в объеме 250-400 мл. У этих пациентов заготавливали только
1 дозу аутоСЗП, затем, во время операции, у них заготавливали цельную аутокровь
на фоне ОНГ и реинфузировали кровь, излившуюся в рану (рис. 19-12).
Причины коллаптоидных реакций во время процедур заготовки
аутоСЗП у больных кардиохирургического профиля
Причины коллаптоидных реакций во время процедур заготовки аутоСЗП у больных
‘ардиохирургического профиля
В постэксфузионном периоде, как правило, достаточно ограничения физических
и психологических нагрузок, назначения полноценного питания, в некоторых
gjjg КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
случаях - постельного режима. Восстановление ОЦК происходит путем увел
ния объема плазмы и активации кроветворения. Белковый состав крови в тече
3-4 сут полностью восстанавливается. и*
Осложнения, развитие которых возможно в процессе ОНГ, обычно обусловл
ны большим объемом инфузии плазмозаменителей и артериальной гипогензи*-
при гиповолемии. Наиболее характерные осложнения инфузионной терапи
при ОНГ - периферические отеки, отек легких, нарушение оксигенируют!*
функции легких в послеоперационном периоде у пациентов с нарушениями сокп
тимости миокарда левого желудочка. Гемодинамические реакции на эксфуз^
500-700 мл аутокрови минимальны, при резервировании более 1000 мл кров»
развиваются артериальная гипотензия и тахикардия, увеличивающие потребность
миокарда в кислороде.
Для безопасности ОНГ необходимо выполнять следующие условия:
• обеспечить адекватный венозный доступ (2 вены);
• обеспечить мониторинг SpOjJ
• катетеризировать мочевой пузырь для постоянного контроля диуреза (жела¬
тельно);
I в кардиохирургии мониторировать центральную гемодинамику с помощью
инвазивных методик.
Интервал между эксфузией и реинфузией не должен составлять более 6 і
в противном случае контейнеры с кровью необходимо поместить в холодильник
для хранения при температуре +4 °С. Из операционной аутокровь не выносят,
контейнеры маркируют в соответствии с групповой и резус-принадлежностью.
На этикетке делают пометку «Аутокровь», записывают Ф.И.О. больного, номер
истории болезни, отмечают время и дату эксфузии.
АУТОГЕМОТРАНСФУЗИИ
Аутогемотрансфузия (АГТ) — процедура возмещения кровопотери собственной
(аутологичной) кровью или ее компонентами.
Аутогемотрансфузии осуществляют компонентами крови, заготовленными
заблаговременно из крови больных или полученными в пери- и операционный
периоды методами реинфузии и гемодилюции.
Метод АГТ целесообразно применять во всех случаях, когда показана транс¬
фузия компонентов крови для возмещения кровопотери и отсутствуют противо¬
показания к эксфузии крови у данного больного.
Показания к компонентной аутогемотрансфузии
Показания к аутокомпонентной гемотерапии в целом схожи с теми, которые
применяют при использовании компонентов донорской крови:
• аллоиммунизированные пациенты с антителами к лейкоцитам, тромбоци¬
там, комплексу HLA-антигенов;
• пациенты с атипичными антителами, делающими неэффективными транс¬
фузии гомологичных компонентов или вызывающие посттрансфузионные
реакции;
• пациенты, рефрактерные к переливанию клеточных компонентов крови;
• пациенты с отягощенным анамнезом, не воспринимающие плазменные белки;
• пациенты, подверженные опасности иммуносупрессивного действия гомоло¬
гичных компонентов крови.
Комплексный подход к проблеме аутодонорства привел к тому, что в большин¬
стве стран с развитой медициной, как уже отмечалось выше, каждое четвертое
переливание крови или ее компонентов является аутологичным.
Предтрансфузионный контроль аутологичных компонентов крови, пробы
на совместимость и биологическую пробу выполняет врач, так же как и в случае
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 681
енения компонентов аллогенной крови. Сочетанное использование донор*
Ш а>тодонорских компонентов крови требует от врача максимально четкого
пянения инструктивных требований к трансфузиям.
^Алокровь возвращают больному во время или после операции. Время начала ауто-
Тдинсфузии зависит от состояния больного и периода операции. Как правило,
^^сггрансфузию проводят к концу основного момента операции, когда заканчи-
а ^вмешательство, которое может привести к дополнительной кровопотере.
8*Тоайсфузия цельной консервированной аутологичной крови, заготовленной
лом ОНГ несколькими часами ранее, после окончания этапа основной хирур-
еской кровопотери позволяет быстро повысить концентрацию гемоглобина,
^РЕЛЯЦИОННЫХ факторов, уровень тромбоцитов и восполнить объем циркули-
шей крови. При определении показаний к гемотрансфузии больным, которым
«Зла заготовлена аутокровь, рекомендуют придерживаться основных правил:
» при удовлетворительных показателях гемоглобина, гематокрита и гемоди¬
намики у больного нет необходимости проводить аутогемотрансфузию к кон¬
цу операции или в ближайшем послеоперационном периоде:
1 прИ необходимости гемотрансфузий больших доз компонентов крови в пер¬
вую очередь необходимо перелить аутологичную кровь.
Преимущества аутогемотрансфузий в отличие от переливаний гомологичной
крови и ее компонентов:
• отсутствие риска передачи трансмиссивных инфекций (гепатитов В и С, ВИЧ-
инфекции, сифилиса, малярии, цитомегаловирусной инфекции и др.):
I отсутствие риска посттрансфузионных осложнений, обусловленных иммуно¬
логической несовместимостью крови донора и реципиента;
I исключение синдрома гомологичной крови и реакции «трансплантант про¬
тив хозяина»;
I отсутствие опасности аллоиммунизации к клеточным элементам крови
и белкам плазмы;
I обеспечение больного иммунологически совместимой кровью, особенно
при наличии у него редкой группы и аллоиммунизации к антигенам редких
групп;
• сбережение донорской крови и ее компонентов.
При различных методах аутогемотрансфузий отмечается более выраженный
эффект, чем от использования гомологичной крови, который можно свести к сле¬
дующим моментам;
• выраженный лечебный (антианемический) заместительный эффект транс¬
фузии аутокрови;
• быстрое послеоперационное восстановление объема крови вследствие сти¬
муляции гемопоэза повторной предоперационной кроводачей;
І отсутствие иммунодепрессивного эффекта трансфузии;
І лучшее восстановление сосудистого объема:
І улучшение сердечно-сосудистой деятельности, микроциркуляции и снабже¬
ния тканей кислородом;
• меньшая выраженность постоперационной анемии;
• сохранение запасов донорской гомологичной крови и сокращение сроков
госпитализации больных (экономический эффект).
Аутогемотрансфузия является единственным вариантом гемотрансфузиологи-
ческого обеспечения операции в случаях:
• отсутствия крови, эритроцитной массы необходимой групповой принадлеж¬
ности или редкой группы крови у больного;
' невозможности подбора совместимой гемотрансфузионной среды;
• наличия в анамнезе больного посттрансфузионных реакций и осложнений
на аллогенные гемокомпоненты.
(ОМНМЧвЖАЯ ТРАНСФУЗИОЛОГИЯ
Аутогемотрансфузии в акушерстве и гинекологии
В современных акушерстве И гинекологии проблемы профилактики и терад
иреютечений остаются одними из наиболее актуальных. Несмотря на все усиди^
«^прежнему имеют существенное значение в структуре материн
сков заболеваемости и смертности, составляя в среднем около 20%, в настоящ^
|рр внедрение В практику современных медицинских технологий ПОЗВОЛИЛ,
достичь значительных положительных сдвигов в лечении массивных кровотеч
нмй в акушерско-гинекологической практике. Своевременная регуляция еокр^
тигельной деятельности матки, адекватное обезболивание способствуют сни¬
жению частоты аномалий родовой деятельности и кровотечений с 8.4 до 13*
Появившиеся В последние ГОДЫ современные гемостатические средства и новые
пдкяюзамешающие растворы позволили значительно повысить эффективность
инфуэионно-трансфузионной терапии при акушерских и гинекологических
кровотечениях. Однако до настоящего времени основной проблемой лечения
акушерско-гинекологических кровотечений является адекватное возмещение фак¬
торов свертывания и белков крови, потерянных во время кровотечения, Многие
годы эта проблема решалась за счет трансфузии донорской крови и ее компонен¬
тов, недостатки которой общеизвестны: опасность заражения вирусными инфек¬
циями, возможность тяжелых гемотрансфузионных осложнений, значительные
сдвиги в клеточном и гуморальном звеньях иммунитета у женщин, которым была
проведена трансфузия донорских компонентов крови. В проведенных исследова¬
ниях выявлены многочисленные отрицательные стороны возмещения кровопо¬
тери компонентами донорской крови у акушерских и гинекологических больных
(Федорова Т.А., Рогачевский О.В.. 2002-2007). Так, после трансфузии донорской
эритроцитной массы и плазмы при кесаревом сечении у родильниц в послеопера¬
ционном периоде в периферической крови достоверно снизилось относительное
содержание Т-лимфоцитов, наметилась тенденция к снижению общего абсолют¬
ного количества лимфоцитов и Т-лимфоцитов. Наблюдается снижение абсолют¬
ного и относительного содержания CD4"-клеток, отмечено уменьшение иммуно-
регуляторного индекса (соотношения CD4/CD8). Оценка уровней сывороточных
иммуноглобулинов показала достоверное повышение концентрации IgM, IgG
и IgA. После переливания донорских компонентов крови у родильниц наблюдает¬
ся угнетение Т-клеточного иммунитета, что связано со снижением субпопуляции
CD4 -клеток на фоне напряжения гуморального иммунитета за счет иммуноглобу¬
линов классов G. М и А. Все это заставило усомниться в безопасности донорской
крови, потребовало переоценки показаний к ее использованию.
В проведенном обследовании родильниц, которым выполнена трансфузия
аутоплазмы во время кесарева сечения или после родов, показано, что у всех жен¬
щин в первые сутки отмечено достоверное снижение гемоглобина, гематокрита,
эритроцитов. К 7-м суткам после инфузии аутоплазмы указанные показатели воз¬
вращались к исходным (гемоглобин - 108,9±2,6 r/л, гематокрит — 33,7±0,5%, эри¬
троциты - 3.69±0.13х10,2/л). Данный факт можно объяснить стимуляцией гемо¬
поэза у беременных после плазмафереза, что проявилось быстрым возвращением
популяции эритроцитов к норме после оперативных родов. До родоразрешения
у беременных отмечалась гиперактивность прокоагулянтного звена системы гемо¬
стаза, что является физиологической особенностью гемостаза беременных накану¬
не родов. После инфузии аутоплазмы у женщин отмечено достоверное снижение
ИТП (16,9+0,8 и 17,7±0,9усл. ед.) в 1-е и 7-е сутки послеоперационного периода,
что крайне важно в плане профилактики тромбоэмболических осложнений.
При анализе течения послеоперационного или послеродового периода обсле¬
дованных женщин выявлено, что в группе женщин, которым проводили инфузию
аутоплазмы, инфекционно-воспалительных осложнений не было ни в одном слу
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ М3
_ которым была перелита донорская свежезамороженная
f- йХ частота составила 7,5%. Послеоперационный койко-лень составил
*1*03 и 9.3tO,3 (р <0.05) соответственно (см. «Клинический пример N43 14*
дКске 0)-
, грутніе женшин.
йх частота состави)1
дутогемотрансфузии при наследственных аномалиях крови
ДУТ0ГЕНІОТРАНСФУЗИИ ПРИ Э-ТАЛАССЕМИИ
при аутогемотрансфузиях у пациентов с р-талассемией в интра- или постоле-
ииййном периоде не выявлены гемолитические реакции как непосредственно
5 „ереливании аутокомпонента, так и отсроченные. Постоперационный период
^таких пациентов протекал более благоприятно по сравнению с контрольной
Ljinoft: не было случаев нагноения послеоперационных швов, субфебрильную
температуру отмечали только в 3,27% случаев (в контрольной группе - у 65%),
ппкечали полное отсутствие трансфузионных реакций (в контрольной группе
25% реципиентов — озноб), гемодинамические нарушения выявляли значи¬
тельно реже, выписку осуществляли в более ранние сроки (табл. 19-22). При
jtom к моменту выписки отмечали полную нормализацию показателей перифери¬
ческой крови (Байрамалибейли И.Э., 2006).
Таблица 19-22. Посттрансфузионные реакции и осложнения у пациентов с гетерозиготной
р-талассемией
Реакции и осложнения
Группы обследованных
трансфузии аутокомпонентов
(л-61)
трансфузии адлокомпонеитов |
(п=20)
абсолютное
количество
%
абсолютное
количество
Ч
Пирогенныв реакции
2
3,27
13
65
Озноб
0
0
5
25
Гемодинамические нарушения
3
4,91
8
40
Показатели
Сроки госпитализации, дни
15,3±4,5
23,7x6,4
Количество перелитых аллогенных
компонентов:
СЗП,дозы
ЭМ, дозы
0,6±0,1 (р <0,001)
0,4+0,2 (р <0,001)
3,110,4
2,410,2
Примечание: р — статистическое различие между группами обследованных.
АУТОЛОГИЧНЫЕ ТРАНСФУЗИИ У ПАЦИЕНТОВ С ГЕМОГЛОБИНОМ S
Целью гемотрансфузий у пациентов с гемоглобином S является уменьшение
серповидных эритроцитов для предупреждения постоперационных осложнений.
Возвращение во время операции заготовленных аутоэритроцитов увеличивает
количество циркулирующих серповидных клеток, тем самым сводит на нет защит¬
ный эффект предоперационных трансфузий изологичных (НЬАА) эритроцитов.
Исходя из этого, больным с гемоглобином S не следует переливать аутоэри-
Цюциты. Есть сведения об увеличении смертности, вызванной обширной секве¬
страцией серповидных клеток и ДВС-синдромом после трансфузий аутологичных
HbSC-эритроцитов во время операции (De Christopher P.J., Orlina A.R., 1990),
Переливания собранных во время операции эритроцитов возможны, но толь-
тем пациентам с серповидно-клеточной анемией, которым были проведены
предоперационные изологические обменные трансфузии. В этих случаях собран-
ые эритроциты фактически являются изологичными (НЬАА), и только малое
количество (<50%) будут аутологичными (HbSS). Больным, не получавшим
gg4 ИЛМНЕСШ ТРАНСФУЗИОЛОГИЯ
трансфузии донорской крови до операции, переливания собранных во вреМя
Эритроцитов не рекомендуют. Кроме ТОГО, кровесберегающие Процедуру со Не*
вождаются различными техническими трудностями. При отсутствии разбавлл/
серповидных эритроцитов ИЭОЛОГИЧНЫе клетки имеют тенденцию к СЛИЛан
а центрифужном баллоне и в колоколе автоматического аппарата для реинфу3И|°
Некоторые авторы рекомендуют проводить аутотрансфузию эритроцитов, собпа?
ных во Время операции, только при уровне серповидных клеток ниже 50%, достц.
нутом благодаря дооперационным изологичным (HbAA) трансфузиям.
Для хирургических больных с HbAS существуют хорошие альтернативы изо-
логическим трансфузиям, аналогичные таковым у пациентов без гемоглобина s
Аутетрансфузии, проведенные лицам с серповидными эритроцитами, не имел
отрицательных последствий. Кровь с признаками серповидности (HbAS) обладай
кислородтранспортной способностью и в функциональном отношении сравнима
с нормальной кровью в наиболее важных трансфузионных свойствах, вследствие
чего может быть использована без риска посттрансфузионных осложнений. Кроме
того, она пригодна для аутологичных трансфузий, если реципиент не имел другщ
факторов риска в период инфузии. Однако в тех случаях, когда у пациента отмеча¬
ется высокий риск гипоксемии или ацидоза, следует избегать переливания крови
с серповидностью. так как при этих обстоятельствах такая кровь может подвер¬
гнуться серплению. Это можно наблюдать, например, в неонатальной практике
(особенно у недоношенных новорожденных на искусственной вентиляции легких)
и у пациентов с выраженной патологией сердечно-легочной системы и шоком.
Кровь с серповидностью не может быть заморожена, так как HbAS-эритроциты
могут подвергаться сильной деструкции в процессе деглицеролизации.
Отмытые HbAS-эритроциты не влияют на внутрисосудистую выживаемость
у аутологичных или гомологичных пациентов, в то время как замороженные
HbAS-эритроциты требуют определенных процедур для деглицеролизации, кото¬
рые могут спровоцировать гемолиз дефектных эритроцитов.
Определенные трудности возникают при приготовлении дозы серповидных
эритроцитов с использованием лейкоцитных фильтров, поскольку в период филь¬
трации происходит блокирование фильтра серповидными клетками, что во мно¬
гом определяется тромботической и коагулогической активностью крови. Вопрос
о применении аппарата Cell-Saver для внутриоперационных аутотрансфузий
при HbAS дискутируется, так как существует опасность проявления серповидности
эритроцитов после собирания крови в аппарат во время операции.
АУТОГЕМОТРАНСФУЗИИ ПРИ ДЕФИЦИТЕ ГЛЮКОЗО-6-ФОСФАТДЕГИДРОГЕНАЗЫ
У хирургических больных с наследственным дефицитом глкжозо-6-фосфатдеІ
гидрогеназы (Г-б-ФД) после гемотрансфузий предварительно заготовленных ayrol
компонентов в интра- и постоперационном периоде не зарегистрировано ни одного]
случая гемолитических осложнений (Вайрамалибейли И.Э., 2005). При трансфузи!
ях же аллогенной эритроцитной массы у реципиентов с наследственным дефицитом]
глюкозо-6-фосфатдегидрогеназы в 26,7% случаях по тем или иным причинам раз!
вивался гемолитический криз (табл. 19-23). В исследованиях показано, что в боль
шинстве случаев доноры крови также имели выраженный дефицит фермента.
Как и в случаях аллогенных компонентов, применение аутокрови у лиц с наслед!
ственным дефицитом глюкозо-6-фосфатдегидрогеназы представляет определенный
риск, обусловленный носительством аномалии, а именно возможен острый гемо
литический криз под влиянием провоцирующих факторов. Аутореципиент должен
исключить прием лекарственных препаратов, провоцирующих их деструкцию, прел
дохраняться от инфекции, воздерживаться от приема в пищу бобовых культур, т.е
придерживаться тех же правил, которые рекомендуют для носителей наследствен
ного дефицита глюкозо-6-фосфатдегидрогеназы в повседневной жизни. При соблю
дении такого режима аутотрансфузии полностью безопасны для реципиента.
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ
685
11-23- Посттрансфузионные реакции и осложнения у пациентов с наследственным двфи
?|глюкозо-6-фосфатдегидрогеназы
реакции и осложнения
Группы обспвдрванных
трансфузии аутокомпоиеитое
(л=36) __
т%
трансфузии ышокомпоиентое
(ff*1S)
абсолютное количество
ТІ
температуры тела
{мой
графические нарушения
гмтический криз
I абсолютное коиичестао [ %
8,331 7 [46.6
2,78 I 5 1 33.331
33.33
5,56
26.67
госпитализации, дни
[допество перелитых аллогенных
компонентов:
СЗП,дозы
ЭМ, ДОЗЫ ...
14,6±5.5
0,45i0,2 (р <0,001)
0,3±0,3 [р <0,001)
24.9t6,0
2,8±0,5
3,1+0,4’
ЛрЯМечавие: р - статистическое различие между группами обследованных.
Аутогемотрансфузии у гематологических больных
и при гемофилиях (см. «Приложения» на диске ®)
Аутогемотрансфузии крови, заготовленной методом острой
нормоволемической гемодилюции
Переливание цельной консервированной аутокрови, заготовленной методом
ОНГ, начинают, как правило, после окончания этапа, связанного с наибольшей
кровопотерей, или сразу после завершения операции. Дозу аутокрови, заготов¬
ленную последней, переливают в первую очередь: в первой резервированной дозе
крови наибольшие гематокрит, концентрация факторов свертывания и тромбоци¬
тов. Трансфузию аутокрови проводят через стандартные системы для переливания
крови с фильтром. Как правило, аутокровь реинфузируют после окончательного
хирургического гемостаза или сразу после отключения АИК, перед медикаментоз¬
ной нейтрализацией гепарина натрия введением протамина сульфата, апротинина
и трансфузией СЗП (ауто- или донорской).
Типичные ошибки при переливании аутологичных компонентов крови
Практически все ошибки при заготовке и трансфузии аутокрови или ее компо¬
нентов отмечаются и при применении компонентов донорской крови.
• Бактериальное инфицирование аутокомпонента (наибольшая опасность
для аутотромбоконцентрата или аутоСЗП. обогащенной тромбоцитами).
І Нарушение последовательности применения — при наличии аутокрови
выдают и/или переливают аллогенные компоненты.
І Отсутствие информации о наличии аутогемокомпонента крови.
• Гемотрансфузия инфицированного аутогемокомпонента другому пациенту'.
I Выдача и гемотрансфузия аутогемокомпонента с истекшим сроком хранения.
• Гемотрансфузия одногруппного аутогемокомпонента другому пациенту.
• Гемолиз аутокрови из-за нарушений правил заготовки, переработки и хра¬
нения.
• Гемолиз или свертывание при гемотрансфузии аутогемокомпонентов (напри¬
мер, неправильное подогревание).
Самая серьезная проблема — трансфузия аутогемокомпонента другому пациен-
* 8 одном из первых исследований итогов заготовки и применения 251 228 доз
586 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
аутокрови было установлено, что ошибки переливания встречались с част
1 случай на 15 600 гемотрансфузий или 1 случай на 14 800 пациентов. Пода 8
анализа случаев в клинической практике, вероятность ошибочной гемртоащж!!!^
аллогенной крови была оценена как 1 на 30 000-50 000. По данным Америка .
ассоциации Банков крови (ААВВ), 1,2% всех аутогемотрансфузий выпол^
не тому больному, для которого аутогемокомпонент предназначен. Риск оший^
ной гемотрансфузии аллогенного гемокомпонента другому пациенту оцени
как 1 на 15 000-50 ООО аутогемотрансфузий. ^
РЕИНФУЗИЯ КРОВИ
Под термином «интра- и послеоперационная реинфузия крови» следует по
мать возврат больному собственной крови, излившейся или изливающейся в сеа?
ные полости или операционную рану.
Варианты интраоперационного кровесбережения (процедуры регламе
тированы «Инструкцией по применению компонентов крови», 2003). §ш|
І Реинфузия крови, излившейся в рану, с помощью специального оборудп.
вания во время операции из операционной раны и полостей и возвращени
реципиенту после специальной обработки - фильтрации и/или отмывания
(по ОК ККЧиК аутокровь полостная, консервированная, фильтрованная
для реинфузии).
І Реинфузия стерильной дренажной крови в ближайшие 6 ч после операции І
сбор дренажной крови, получаемой в стерильных условиях при послеопера¬
ционном дренировании полостей тела и возврат ее реципиенту.
Каждый из этих методов можно применять отдельно или в различных сочета
ниях. Возможно также одновременное или последовательное применение пере
ливаний аутологичных и аллогенных компонентов крови.
Существует три типа одноразовых устройств для реинфузии крови: твердостей
ные пластиковые емкости (с консервантом или без него), устройства для аппарат
ной реинфузии отмытых эритроцитов и резервуары (например, кардиотомные)
Пластиковые емкости (системы для реинфузии крови) рекомендуют использовать
при операциях с планируемой кровопотерей не более 1 л. Собранную кровь можно
переливать фазу или после отмывания. Аппаратная реинфузия — для случаев
с большой планируемой (>1 л) кровопотерей, когда необходимо вернуть пациенту
отмытые эритроциты.
Различают два способа реинфузии аутокрови.
Первый способ - фильтрационный. При этом способе используют аспиратор
для сбора дренажной крови (при давлении <100 мм рт.ст.), смешиваемой с анти¬
коагулянтом. Затем кровь очищают через фильтры (от 180 до 10 мкм) и переливают
больному. Типичный пример — система аутотрансфузии Hemovac фирмы Zimmer,
которую чаще всего используют после операций в ортопедической практике. В этой
случае реципиенту переливают неразделенную аутокровь. В таком исполнении этот
способ нельзя применять в экстренной хирургии, так как существует высокая вероят¬
ность бактериальной контаминации дренажной крови без ее отмывания.
Существует традиционный фильтрационный способ реинфузии полостной
крови, включающий ее сбор вручную — стерильной ложкой-черпаком в стерильную
кружку емкостью 500-1000 мл, заполненную (100-150 мл) антикоагулянтом -4™
раствором натрия цитрата. Затем консервированную аутокровь фильтруют через о
слоев стерильной марли, смоченной антикоагулянтом. Аутокровь переливают в сте¬
рильные флаконы или гемоконы. Трансфузию осуществляют внутривенно через
систему для переливания крови, имеющую соответствующий фильтр. Этот способ
фильтрационной реинфузии аутокрови отражен в методических рекомендация*
«Реинфузия крови при внутрибрюшном кровотечении у гинекологических ПОЛЬ
ных» М3 РСФСР. 1979. Однако в настоящее время в соответствии с приказом М3
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 687
лЭбЗ от 25.11.2002 г. (приложение №1) «фильтрование излившейся крови через
^сколько слоев марли недопустимо», так как марля способна задерживать только
крупные сгустки крови и частицы тканей. Переливать такую трансфузионную среду
-комендуют через лейкоцитные или другие микрофильтры с порами размером
цеболее 40 мкм. Это приводит к резкому замедлению трансфузии, но не препят-
доунгг поступлению в кровоток больного растворимых биологически активных
gffflecTB, способных вызвать осложнения. Таким образом, традиционный способ
фильтрационной реинфузии аутокрови можно использовать только при утро?
^аюЩИХ жизни острых массивных полостных кровотечениях при отсутствии других
йетодбв в качестве реанимационного пособия.
Второй способ — аппаратный. Представляет собой аферез полостной или ране*
до# аутокрови: удаление ее жидкой части (плазмы), отмывание клеток крови, их кон*
центрирование (гематокрит - 65-75%) и возврат больному. В этом случае реципиенту
переливают только клеточный компонент аутокрови (в основном отмытые эритро-
циты) " интра- или послеоперационная реинфузия клеточного компонента
аутокрови, или аппаратная реинфузия аутоэритроцитов, которую используют
для компенсации дефицита глобулярного объема (ГО) крови больного.
Кровь, покинувшая сосудистое русло в результате травмы или оперативного
вмешательства, изменяет свои свойства, в том числе в зависимости от времени ее
истечения в рану. Это обусловливает изменение режимов ее переработки. Таким
образом, собираемую для реинфузии аутокровь можно разделить:
I на излившуюся, или полостную; — кровь, находившуюся до операции в сероз¬
ных полостях:
І изливающуюся — кровь, истекающую из раны во время (раневую) или после
(дренажную) оперативного вмешательства:
і смешанную — излившуюся и изливающуюся.
Необходимо проводить лабораторную оценку собираемой для реинфузии
крови. При исследованиях отмечена определенная встречаемость различных
примесей (табл. 19-24). При сочетанной травме, сопровождающейся закрытой
травмой живота, 75% образцов перитонеальной крови содержат большое количе¬
ство (2,5-4,5 г/л) свободного гемоглобина плазмы, причем чем продолжительнее
кровь находится в брюшной полости, тем выше гемолиз. Кроме того, в 70% образ¬
цов перитонеальной крови имеются макросгустки. Кроме того, в перитонеальной
крови при открытых повреждениях брюшной полости выявлены примеси желчи
(15%), мочи (10%), желудочного или кишечного содержимого (20% случаев).
Таблица 19-24. Макроскопическая оценка крови, покинувшей сосудистое русло
Включения или примеси
Излившаяся кровь (полостная)
Изливающаяся кровь (ранеаая)
перитонеальная плевральная
сердечно-сосудистая хирургия | траама
Распространенность анализируемых признаков (средние величины), %
Гемолиз
75
3
10
21
Макросгустки
70
26
35
4
Моча
10
0
0
0
Желчь
15
0
0
0
Костный детрит
5
1
0
30 1
Жировые включения
10
1*
0
15
Частицы тканей
10
1*
35
20
Желудочное или кишечное
Одержимое
20
1*
0
0
Признаки гнойного процесса
5”
3“
0
Г*
' /казанные примеси наблюдали при торакоабдоминальных ранениях.
Аппаратную реинфузню не проводили.
figg КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
В плевральной крови меньше примесей: макросгустки выявлены в 2 о
лнз. жировые включения и желчь — в 1-3% случаев1^^^^^^^^^^°\
ч
В 3-5% случаев в излившейся крови обнаруживали гнойное содержим
больных реинфузию не проводили, так как гнойный процесс в серозных Так%.
можно считать абсолютным противопоказанием ко всем видам реинфузи П°Лост«х
Раневая кровь также имеет некоторые особенности. При оперативнь
тельствах у больных с патологией крупных сосудов в изливающейся кло ВМец,а'
случаев были обнаружены макросгустки и частицы биологических ткане“*В Щ
примеси связаны с эвакуацией содержимого аневризмы и забрюшинной ге е
во время операции. Особенность раневой крови при травме — значительно
чество костного детрита (30%) и жировых включений (20% случаев). K0JIK‘
Особое место среди изливающейся крови занимает дренажная. Чаще вс
сбор проводят при травматологических и ортопедических операциях. ШЬР і
кровь имеет высокую концентрацию свободного гемоглобина плазмы (3-5 л?
а также часто содержит жировые включения (85%). щ
Проведено клинико-биохимическое исследование полостной аутокрови, испо
зованной для реинфузии (табл. 19-25). Перитонеальная кровь характеризуете
отсутствием фибриногена, повышенной (в среднем в 50 раз) концентрацией свобо
ного гемоглобина, высокой (в среднем в 27 раз) фибринолитической активностью
повышенной на 80% концентрацией общих липидов. По клеточному составу пери¬
тонеальная кровь отличается от донорской выраженным уменьшением количества
тромбоцитов (в среднем на 69%), умеренным снижением количества эритроцитов
(на 35%) и значительным увеличением количества лейкоцитов (на 61%).
Таблица 19-25. Характеристика клинико-биохимических свойств различных видов аутокрови,
заготовленной для аппаратной реинфузии
Концентрация ппазмина
Антилротеиназная актив¬
ность
a-2-макроглобулин
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 689
Окончание табл. 19-25
Показатели
^нтитрипсин,
фрагмент
фибриногена
^гмент фибриногена
Единицы
измере¬
ния
г/л
г/л
г/л
г/л
Донорская
консерви¬
рованная
кровь
М*
2,5
Излившаяся кровь
перитонеальная
М*
1,7
1,3
0,4
1,7
кратность
изменений,
%
-32
плевральная
М*
1,6
0,2
1,0
кратность
изменений,
О/
70
-36
Изливающаяся
кровь
раневая
М*
2,7
кратность
изменений,
%
+8
pnm суммарные)
•и - ошибка средней арифметической не превышает 7%.
Плевральная кровь в отличие от перитонеальной имеет менее выраженное увели¬
чение концентрации свободного гемоглобина, активации фибринолитической систе¬
мы, а общая концентрация липидов не отличается от таковой донорской крови.
В раневой крови выявлено наиболее выраженное повышение концентрации
свободного гемоглобина (в среднем в 100 раз) и соответственно повышенная кон¬
центрация ионов калия. Эти изменения связаны с большой травматизацией клеток
при сборе крови для реинфузии, когда наконечник аспиратора следует по ране
за инструментом хирурга. По клеточному составу в раневой крови отмечено уме¬
ренное снижение количества тромбоцитов (в среднем на 30%) и повышение коли¬
чества лейкоцитов (в среднем на 22%). В свойствах этой крови отмечено подавле¬
ние фибринолитической активности (0,007±0,002 при норме 0,015+0,003 ФЕ/мл,
р <0,05). Кроме того, в раневой крови выявлена высокая общая концентрация
липидов (10,2+0,5 г/л), что на 92% выше нормы. Это обусловлено особенностями
плановых и отсроченных оперативных вмешательств в травматологии, ортопедии,
сосудистой хирургии и размозжением жировой ткани.
Визуальная макроскопическая оценка и анализ клинико-биохимических
свойств аутокрови, собираемой для реинфузии, свидетельствуют о том, что при ее
использовании в неразделенном виде нежелательные реакции и осложнения раз¬
виваются чаще. Для предотвращения проявления этих последствий необходима
переработка (отмывание) аутокрови, собранной для реинфузии.
При этом используют различные режимы переработки аутокрови.
• Высококачественный (High Quality Wash) — тщательная обработка загряз¬
ненной крови, 7 циклов отмывания клеток.
• Качественный (Quality Wash) — стандартная программа интра- и послеопера¬
ционной обработки раневой и дренажной крови, 5 циклов отмывания клеток.
• Ускоренный (High Flow Wash) — для обработки чистой крови при массивной
одновременной кровопотере, 3 цикла отмывания клеток, поток эритроцит¬
ной массы — 30-70 мл/мин.
• Быстрый (Ultra Flow Wash) — для обработки чистой крови при массивной
одновременной кровопотере, 1 цикл отмывания клеток, поток эритроцитной
массы — 50-100 мл/мин.
• Срочный (Emergency Wash) — максимальная скорость обработки, 1 цикл
отмывания клеток, поток эритромассы — 50-100 мл/мин.
• Экстренный 350 (Blood Transfer 350) — работает как система сбора и филь¬
трации в ургентных ситуациях. Кровь только фильтруют и перегоняют
из кардиотомного резервуара в мешок для реинфузии со скоростью 200-
350 мл/мин. В результате получается неотмытая эритроцитная взвесь,
э клетки в ней не концентрированы.
Таким образом, с помощью аппаратов для реинфузии получают аутотрансфу-
зионную среду для компенсации дефицита глобулярного объема и, следова-
Тельно, восстановления кислородтранпортной функции крови у пострадавшего
или пациента с острой кровопотерей. Следует подчеркнуть, что при этом вое-
jggjj КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
I объема утраченной крови осуществляют с помощью кристаллоид^,,
и коллоидных растворов.
Свойства аутотрансфузионной среды — клеточного компонента
Клеточный компонент аутокрови представляет собой бесплазменную (к0й
ценграция общего белка не превышает 1,3 г/л) трансфузионную среду в ВИд
концентрата клеток в изотоническом солевом растворе. Эта среда содержит вс!
клетки крови больного, что обусловливает ее название — «клеточный компонент!
аутокрови. Проведены многочисленные исследования состава клеток в этой транс!
фузионной среде: количество эритроцитов в среднем составляет 7,8 млн/мод
или 7,8 Т/л, лейкоцитов - в среднем 7,5 тыс./мкл, или 7,5 г/л, и тромбоцитов L
в среднем 57 тыс. /мкл, или 57 г/л (см. табл. 19-25).
Сравнительный анализ свойств клеточного компонента и полостной крови сви¬
детельствует, что последним этапом аппаратной переработки собранной для реин¬
фузии аутокрови является концентрирование. Например, гематокрит клеточного
компонента в среднем составляет 69±3.%, что на 77% выше такового в консерви¬
рованной донорской крови (39±2%) и в 3 раза (на 200%) больше, чем в полостной
аутокрови. Концентрация гемоглобина в среднем на 66% выше, чем в консервиро¬
ванной донорской (122±15 г/л) и на 171%, чем в полостной (75±4 г/л) крови.
При удалении 97-98% плазменных белков из полостной крови элиминируются
нежелательные примеси и биологически активные факторы, в том числе фермен¬
ты протеолиза, фибринолиза и протромбинового комплекса, отрицательно вли¬
яющие на состояние системы гемостаза в случае переливания пациенту нефрак-
ционированной (фильтрованной) полостной крови. Таким образом, аппаратная
переработка аутокрови обеспечивает полное удаление активаторов плазминогена,
плазмина, продуктов деградации фибрина, что проявляется отсутствием фибрино-
литической активности в клеточном компоненте. С другой стороны, надосадочная
жидкость такой трансфузионной среды не проявляет коагуляционной активности,
что указывает на отсутствие в ней белков протромбинового комплекса, тромбина
и других активированных факторов плазменного гемостаза.
При сравнительном анализе гемореологических свойств клеточного компо¬
нента и полостной крови (табл. 19-26) установлено, что индекс деформируемости
эритроцитов аналогичен таковому в донорской консервированной крови ранних
сроков хранения, кроме того, в полостной крови отмечается высокий уровень
метаболизма нейтрофилов (хемилюминесцентный анализ). После фракциони¬
рования аутокрови в полученном клеточном компоненте кислородзависимый
метаболизм нейтрофилов либо соответствует нормальным параметрам, либо
существенно снижается.
Таким образом, аппаратная переработка полостной крови приводит к удале¬
нию нежелательных компонентов и биологически активных веществ, которые
при переливании больному могли бы изменить систему гомеостаза в неблагопри¬
ятную сторону и вызвать ятрогенные осложнения.
Все вышеперечисленное прежде всего свидетельствует о преимуществах аппа¬
ратной реинфузии перед фильтрационной или реинфузией вручную. Следует
отметить, что раньше процедуру реинфузии у пострадавших с закрытой и откры¬
той травмой груди и живота, сопровождавшейся внутриполостным кровотечени¬
ем, рассматривали как реанимационное пособие по выведению пациента из гемор¬
рагического шока. Однако углубленные исследования свойств излившейся крови
и динамическое наблюдение за больными свидетельствуют, что при массивной
реинфузии (>2 л) неотмытой крови течение раннего послеоперационного перио
да осложняется кровоточивостью тканей, что свидетельствует о развитии ДВС'
синдрома. Кроме того, при реинфузии вручную не гарантированы необходимы1*
уровень фильтрации от микросгустков и безопасность от бактериальной контзми
МДМ НИНЄ И изнутри. особенно при ранениях полых органов.
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 691
долина 19-27. Сравнительный анализ свойств полостной крови и ее клеточного компонента
ши
Полостная кровь
Клеточный компонент
—1
Кратность изменений |
дйаяязирувмьл параметры
Mtm
Mim
%
Гематокрит. %
23±3
69±3
«200
^«чество эритроцитов. х101?/Л
2,8+0.9
7,8±0,7
+179
р^ИИТВО лейкоцитов, г/л
8,5+0,3
7,5±0,4
-11,8
рійеШ Тромбоцитов, г/л
83+15
57±7
-31,3
■^йёнтрация гемоглобина, г/л
75+4
203±9
♦171
свободного гемо¬
глобина. г/л
5,0+0,5
0,20t0,09
-96
Тпнйентрация калия, ммоль/л
7,6±0,7
0,61+0.08
-91
ййшёнтрация общего белка, г/л
53±5
1,3+0,1
-97,5
Фибринолитическая активность,
фЕ/мл
0,30±0,03
0
-100
Концентрация активатора плаз-
миногена, АЕ/мл
13,5±2,1
0
-100
Концентрация плазмина, мКЕ/мл
167+15
0
-100
ПДФ суммарно, г/л
2,3±0,3
0
-100
Реинфузия крови, теряемой во время операции, предполагает ее извлечение
с помощью аспиратора из операционной раны или полостей тела в асептиче¬
ских условиях в герметичную стерильную емкость с последующим отмыва¬
нием. Отмытые аутоэритроциты (по ОК ККЧиК - аутозритроцитная взвесь
с ресуспендирующим раствором фильтрованная) возвращают реципиенту во время
операции или не позже 6 ч после начала сбора. Интраоперационную реинфузию
крови проводят при плановых операциях с предполагаемой кровопотерей, пре¬
вышающей 20% ОЦК. В экстренной хирургии этот метод используют у пациентов
с политравмой, ранениями и кровотечениями в плевральную и брюшную полости.
Применение данной методики регламентировано «Инструкцией по применению
компонентов крови» (2003). В настоящее время реинфузия операционной ауто¬
крови, профильтрованной через многослойную марлю, недопустима.
Показания к интраоперационной реинфузии в плановой хирургии
І Трансплантация органов: печени, сердца, легкого, почки, поджелудочной
железы.
І Полостная хирургия: операции на желудке, поджелудочной железе, пече¬
ни, пищеводе, спленэктомия, плеврэктомия, портокавальное шунтирование
у пациентов с циррозом печени.
І Кардиохирургия с искусственным кровообращением и без него: протези¬
рование клапанов, АКШ, операции на восходящем, грудном отделе аорты
по Крауфорду, Бенталлу де Боно.
І Сосудистая хирургия: БАБШ, линейное аортобедренное шунтирование, проте¬
зирование брюшного отдела аорты с реимплантацией висцеральных артерий.
і Урология, нефрология: расширенная простатэктомия. удаление мочевого
пузыря, нефрэктомия.
* Ортопедия: протезирование бедренного, коленного сустава, артродез.
| Нейрохирургия: операции на позвоночнике, спинном мозге, спондилолистез.
* Гинекология, акушерство: расширенная миомэктомия, гистерэктомия, кеса¬
рево сечение.
Показания к интраоперационной реинфузии в экстренной хирургии
' кровотечения при нарушенной трубной беременности.
* Закрытая и открытая травма живота с повреждением селезенки и печени.
* Закрытая и открытая травма груди с повреждением органов грудной полости.
gyi клиническая трансфузиояогия
I
Данную методику кровесбережения можно применять также в педиатп
ях травматичных операций с предполагаемой кровопотерей более15-20^Ив%а.
До недавнего времени активно обсуждалась возможность применен! ^
ной реинфузии во время онкологических операций. Противники испо anDaPaT'
этого метода в онкологии считают возможным диссеминированное Ь308айия
рование после интраоперационной реинфузии крови, содержащей on^W
клетки. При этом кратность и тщательность отмывания аутоэритроцитн ”°Ле8||({
не влияют на количество реинфузируемых клеток опухоли. Однако пе*
аутоэритроцитной массы через лейкоцитные фильтры, волокнистаяс™ЇВ
которых способна задерживать все форменные элементы, кроме зритооі
эффективный метод очистки реинфузата от опухолевых клеток. Таким ofi ’'
онкологические заболевания можно исключить из перечня абсолютных п 1111
показаний к интраоперационной реинфузии аутокрови. "РиіИв.
Не меньший интерес представлял вопрос о возможности применения
операционной реинфузии во время кесарева сечения, поскольку очень
опасность попадания в реинфузат околоплодных вод, содержащих ткан ■
тромбопластин в высоких концентрациях (медиатор тромбинемии, приводи
ДВС-синдрому в фазе гипокоагуляции). Режимы качественной отмывки ау-к»
троцитов позволяют полностью исключить попадание тканевого тромбоїшастГ
в реинфузат. Дополнительная профилактика контаминации крови амниотичесвд*
жидкостью значительно улучшает качество реинфузата: амниотомия; применен»
второго аспиратора после извлечения плода для удаления околоплодных вод,
сыровидной смазки, мекония; режим высококачественного отмывания в большом
объеме раствора.
Интраоперационная реинфузия крови — наиболее эффективный метод крове¬
сбережения в хирургии магистральных сосудов, где прогнозируемая кровопотеря
может составлять более одного ОЦК. Клиническое применение интраоперационной
аппаратной реинфузии крови особенно оправданно во время операций на восходя¬
щем отделе, дуге аорты, поскольку этот метод реинфузии экономически целесообра¬
зен во время операций, сопровождающихся кровопотерей более 1000 мл.
Необходимость интраоперационной аппаратной реинфузии определяется осо¬
бенностями и характером травмы экстренно оперированных больных, объемом
оперативного вмешательства, при котором не менее 750 мл (дефицит ГО >15%)
аутокрови находится в серозных полостях или ране. Основной контингент боль¬
ных (53%), которым при экстренном оперативном вмешательстве проводят
аппаратную реинфузию, — пострадавшие с сочетанной травмой груди, живота
и опорно-двигательного аппарата (ОДА), закрытыми повреждениями органов
грудной и брюшной полости (22%), огнестрельными или ножевыми ранениями
грудной и брюшной полости (31%).
ПРИНЦИПЫ ИНТРАОПЕРАЦИОННОЙ РЕИНФУЗИИ АУТОКРОВИ
Реинфузия без отмывания аутокрови
Метод основан на сборе раневой крови в стерильных условиях, стабилизации
ее антикоагулянтом (раствором гепарина натрия, 4% раствором натрия цитрата)
и последующей фильтрации. Устройства, работающие с использованием только
стабилизации и фильтрации, — Berdey, Davol, Solcotrans. Принцип работы эда
аппаратов основан на аспирации крови в резервуар, куда предварительно введе
антикоагулянт. После фильтрации (устройства снабжены фильтрами с диаметр
пор 260-300 мкм) аутокровь реинфузируют больному. Устройства данного ти
предназначенные для реинфузии стабилизированной и профильтрованной кро
просты в эксплуатации.
АУТ0Д0Н0РСТ80 И АУТОГЕМОТРАНСФУЗИИ 693
g России разработано устройство для безаппаратной технологии реинфузии
««крови (Рис- 19*13). Прибор предназначен для сбора, очистки и реинфузии
^бсгвенной крови пациента во время хирургических операций, сопровождаемых
^овопбтерей, в подразделениях экстремальной медицины (медицины катастроф),
якже в условиях полевых медицинских частей и учреждений.
3 реинфузия больших объемов (>500 мл) раневой крови, собранной в эти аппа-
__У без предварительного отмывания 0.9% раствором натрия хлорида может
ызывать осложнения из-за присутствия в ней клеточных микроагрегатов, про¬
ектов тканевой и клеточной деструкции, свободного гемоглобина, микрочастиц
тканей, жидкостей, применяемых для обработки хирургического поля, антикоагу¬
лянта. Кроме того, в этой крови в большой концентрации содержатся активиро¬
ванные факторы свертывания крови, продукты деградации фибриногена (ПДФ).
р-димеры фибриногена, биологические медиаторы (в том числе тканевый тром-
бопластин - основной триггер тромбинемии), которые активизируют гемостаз
И Приводят к синдрому ДВС.
Контакт клеток крови с чужеродной поверхностью аппарата, его магистралями
активизирует аутолейкоциты, что приводит к накоплению провоспалительных
цитокинов (IL-1, -6, -8, TNF-a), которые вырабатывают активизированные лей¬
коциты. Дальнейшее увеличение концентрации цитокинов приводит к синдрому
генерализованного воспалительного ответа и посттрансфузионному повреждению
легких. Кроме этого, повышается активность системы комплемента, увеличивает¬
ся содержание СЗа- и С5а-компонентов комплемента, индуцирующих выработку
провоспалительных цитокинов, лизосомальных ферментов, простагландинов.
Проблему улучшения качества реинфузата можно частично решить применением
лейкоцитных фильтров.
Таким образом, реинфузия значительных объемов аутокрови без предвари¬
тельного отмывания может провоцировать синдром ДВС (синдром манифестирует
в фазе гипокоагуляции), острое посттрансфузионное повреждение легких, почеч¬
ную дисфункцию или недостаточность.
Следовательно, применение данных приборов для реинфузии крови во время
операций на магистральных сосудах, сопровождающихся массивной кровопоте¬
рей, возможно лишь при невозможности аппаратной реинфузии.
Большое количество осложнений интраоперационной реинфузии аутокрови
без отмывания побудило к поиску дополнительных мер, улучшающих качество
реинфузата. Следующее поколение устройств для реинфузии было снабжено при¬
способлениями для отмывания аутокрови.
Реинфузия с отмыванием аутозритроцитов
Метод основан на сборе раневой крови, стабилизации ее антикоагулянтом
и фильтрации с последующим отмыванием. Способы фракционирования
крови: гравитационный — например, аппарат Cell-Saver 5+ (Haemonetics), CATS
(Fresenius), или фильтрационный — Haemocell-350.
Гравитационный метод реинфузии. Раневую кровь собирают с помощью
аспиратора, в котором она смешивается с антикоагулянтом и подается после
фильтрации через фильтр (размер пор - 260 мкм) в кардиотомный резервуар.
Центрифугирование крови и отделение эритроцитов от плазмы, частиц тканей
осуществляется в центрифуге, встроенной в аппарат для реинфузии крови.
Центробежную силу (F) определяют по формуле:
F = m(v2/r),
где m - масса частицы: v — скорость вращения центрифуги: г — радиус центри¬
фуги.
694
КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Рис. 19-13. Устройство для безаппаратной технологии реинфузии аутокров
ИНТЕРОКОМ
(ЗАО
Д антикоагулянт
]вакуум/=
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 895
разделение крови в центрифуге основано на разнице в скорости оседания раз¬
личных клеточных элементов, зависящей от их плотности: наибольшей относи-
Г,ной плотностью обладают эритроциты, ретикулоциты, следовательно, они
ведают на дне центрифуги. Надосадочную жидкость, помимо плазмы, состав-
лот разрушенные клетки, свободный гемоглобин и растворы для промывания
'Грационного поля. Кроме этого, надосадочная жидкость содержит антикоагу-
„нт, активированные факторы свертывания, активизированные тромбоциты.
После центрифугирования и сепарации крови надосадочная жидкость удаляется,
в колокол центрифуги поступает отмывающий раствор - 0,9% раствор натрия
Дорида, вытесняющий загрязненную плазму. Процесс может повторяться неод¬
нократно в зависимости от целевых установок и необходимой степени очистки
аутоэритроцитной массы, которая после завершения отмывки подается в отдель-
Jjl контейнер и реинфузируется. Длительность отмывания в основном определя¬
лся конкретной клинической ситуацией и экстренностью реинфузии.
фильтрационный метод реинфузии. При использовании этого метода
аутокровь разделяют на плазменную и клеточную части при прохождении через
мембранный фильтр при малом давлении. Кроме того, кровь, перемешиваясь
во время фильтрации, в определенном направлении подается через микропори¬
стую пластиковую мембрану, снижая адгезию клеток к поверхности мембраны,
что уменьшает силу трения, испытываемую клеточными компонентами, и практи¬
чески устраняет любые поражения клеток. Кровь, собранная и фракционирован¬
ная с помощью системы Haemocell-350 во время или после операции, позволяет
компенсировать кровопотерю аутоэритроконцентратом, что предотвращает раз¬
витие осложнений, связанных с переливанием донорской крови или неотмытой
аутокрови.
Аппарат Haemocell АВТ System-350 осуществляет два режима обработки:
• только концентрацию (8 мин) — кровь проходит через фильтр лишь 1 раз,
в результате чего обеспечивается быстрое получение отфильтрованной взве¬
си эритроцитов;
і полное отмывание (14 мин) — при этом режиме кровь проходит через
фильтр мембраны, и концентрированные эритроциты, взвешенные в физио¬
логическом растворе (0,9% растворе натрия хлорида), промываются до пол¬
ного удаления плазмы, фрагментов эритроцитов, лейкоцитов, тромбоцитов
и фрагментов тканей при повторном прохождении через мембрану фильтра.
Реинфузат имеет гематокрит 35-65%, при этом удаляется 80% свободного
гемоглобина, присутствующего в собранной крови. В процессе фильтрации
удаляются также раствор антикоагулянта, 85-90% активированного компле¬
мента и факторов свертывания крови, а также липиды плазмы. Для уменьше¬
ния травматизации клеток во время сбора крови поддерживают постоянное
давление аспирации не выше 75 мм рт.ст. (средняя величина давления в аспи-
рационном насосе составляет 50-70 мм рт. ст.).
Аппараты для реинфузии крови
Аппараты для реинфузии крови разделяют на две группы:
• прерывисто-поточного метода работы (например, Cell-Saver, STAT, BRAT);
• непрерывного действия (например, CATS).
Во всех аппаратах для реинфузии крови используется центрифужный, или филь-
фзционный, метод.
Отличие методов реинфузии крови заключается в использовании центрифуг.
в которых разделение эритроцитов и плазмы происходит с использованием цен-
I фобежных сил или фильтров, позволяющих высокоэффективно разделить кровь
На плазму и клеточную часть при малом давлении. При центрифужном методе
ГПА8АЩ
ggg КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
собранная кровь поступает в ротор-центрифугу, где происходит ее раз
на плазму, точнее, на жидкость, содержащую плазму и попавшие в операи*ЄЛЄі1|,е
рану растворы, и форменные элементы (при 5600 об. /мин на эритроцит
снла. равная g). Плазму, содержащийся в ней свободный гемоглобин и
ную строму эритроцитов после отмывания удаляют в специальный коим*'
и утилизируют, а форменные элементы (эритроциты) отмывают 0,9% растаИй{'1
натрия хлорида. Отмытые аутоэритроциты с гематокритом 65±5% пепе 11
в специальный стерильный контейнер для дальнейшей трансфузии.
Аппараты, где используется фильтрационный метод, представляют собой
номную систему для сбора крови во время операции с последующем отмывав*10
эритроцитов, удаления белковых, плазменных компонентов и контаминаци*
К сожалению, в данной модификации аппаратов значительное количество свобп
ного гемоглобина аутокрови остается в отмытых аутоэритроцитах.
Аппарат Haemocell-350 представляет собой автономную систему для сбоп
крови с последующим отмыванием эритроцитов, удалением белковых, плазме
ных компонентов и контаминантов (рис. 19-14). Аппарат предназначен для обш
ботки крови путем отделения пораженных клеток крови от плазмы с помощью
мембранной фильтрации. Для сбора крови, ее сепарации и реинфузии исполь¬
зуют фильтры, позволяющие выборочно удалять компоненты загрязнения, такие
как осколки клеток, антикоагулянтный раствор, активированные сгустки крови
и ирригационные жидкости.
Сепарация крови достигается путем использования слабого гидродинамическо¬
го эффекта, называемого вихревым смешением. Вихревое смешение происходит
когда в потоке крови создается заданное волнение, что снижает тенденцию при¬
липания клеток крови к поверхности мембраны.
Кровь закачивается и проходит через микропористую мембрану, что позволяя
пропускать плазму, но при этом задерживать эритроциты.
Система позволяет компенсировать кровопотерю объемом от 200 мл. В резуль¬
тате использования системы Haemocell-350 в процессе отмывания крови удаляется
примерно 80% загрязненной плазмы. Учитывая, что вихревое смешение позволяя
обрабатывать кровь при низком давлении, эритроциты остаются неповрежден¬
ными. Средняя величина давления в аспирационном насосе составляет 50-70 мм
рт.ст. Таким образом, не происходит увеличения концентрации гемоглобина
в плазме. Концентрация клеточных компонентов крови повышается в процессе ее
переработки. Степень концентрации зависит от метода сбора крови.
Гематокрит крови, переработанной с помощью системы Haemocell-350 и воз¬
вращенной пациенту, колеблется от 30 до 60%, а полное отмывание продолжается
примерно 14 мин. Система не связана с пациентом, и отмывание можно проводин
в любом помещении, не связанном с операционной.
Аппараты прерывисто-поточного действия выполняют весь процесс реинфузии
последовательно: собираемая раневая кровь после стабилизации и фильтрации
подается в колокол, центрифугируется. Затем в колокол центрифуги поступает 0,9%
раствор натрия хлорида и происходит отмывание аутоэритроцитов, цикл отмыва¬
ния повторяется, аутоэритроцитная масса реинфузируется, после чего начинается
новый цикл сбора раневой крови. Стабилизация крови происходит непосредственно
в ране в момент сбора с помощью наконечника оригинальной конструкции, подсое¬
диненного к магистрали аспиратора. Гемоконсервант подается в рану со скоростью
40-60 капель в минуту (рис. 19-15, 19-16). Колокол-ротор аппарата Cell-Saver 5+
(Haemonetics) имеет различные объемы в зависимости от прогнозируемой кровопо
терн и необходимого объема трансфузии отмытых эритроцитов:
• 225 мл - для больших кровопотерь;
• 125 мл - для операций с небольшой кровопотерей;
• 70 мл для педиатрических операций.
АУТОДОНОРСТВО И АУТ0ГЕМ0ТРАНСФУЗИИ 897
б
Рис. 19-14. Аппарат Haemocell-350 (Autologous Blood Transfusion Intraoperative): a — схематиче¬
ское изображение аппарата; б — резервуар для сбора крови аппарата реинфузии; в — резервуар
ДОя сбора крови оснащен фильтрами (40—120 мкм)
Рис. 19-15. Схема работы аппаратов для реинфузии крови Cell-Saver прерывисто-поточнор дей¬
ствия
Существенный недостаток аппаратов данного типа — достаточно медленная
обработка аутокрови, что при нрофузном кровотечении приводит к быстрому
наполнению колокола центрифуги (аппарат не успевает обрабатывать аутоэри¬
троцитную массу и опорожнять резервуар). Кроме того, аппарат снабжен только
одним роликовым насосом, который производит подачу собранной крови в цен¬
трифугу и возврат отмытых аутоэритроцитов пациенту через одну н ту же маги¬
страль, что может снизить качество реинфузата. Аппараты данного типа снабжены
штатными центрифугами,, рассчитанными на различные объемы крови, при этом
выбор комплектации в экстренных ситуациях может быть значительно затруднен.
В стандартных ситуациях применяют малообъемный режим, при котором исполь¬
зуют центрифугу минимального объема; подобный режим также применяют
в педиатрии.
К преимуществам работы аппаратов прерывисто-роточного действия относят
возможность контроля качества реинфузата, при этом применяют режим ручного
и/или повторного отмывания.
Модификация аппарата Cell-Saver 5 — аппарат Cell-Saver 5+ (Haemonetics),
имеющий более высокую скорость работы. Время одного цикла с использованием
типовых скоростей насоса при 1200 мл собранной крови с гематокритом 10-20%
составляет 3 мин. Скорость насоса можно регулировать в широких диапазонах
от 0 до 1000 мл/мин. Аппарат снабжен дисплеем, на котором отображаются этапы
и параметры процесса отмывания аутокрови.
Благодаря конструкции аппарата оператор может визуально оценивать ход
отмывки, осуществлять контроль качества получаемого продукта и при необхо¬
димости перейти на ручной режим управления. Качество реинфузата обеспечено
наличием:
• шюголучевого оптического датчика контроля гематокрита аутоэритромассы;
• оптического датчика наличия эритроцитов в промывочном растворе;
• детектора свободного гемоглобина в реинфузате.
Аппарат Cell-Saver 5+ позволяет осуществлять аутотрансфузию у взрослых
пациентов (с применением высокоскоростной магистрали, оснащенной колоколом
объемом 225 мл), у детей (с объемом 125 или 70 мл), а также проводить предопе¬
рационное или интраоперационное резервирование аутокрови пациента с разде¬
лением ее на аутоэритроцитную массу и аутоСЗП, обогащенную тромбоцитами.
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 689
Рис. 19-1 і Аппарат для реинфузии прерывисто-паточного действия Cell Saver 5+ (Haemonetics):
і—центрифуга; б —• колокол-ротор
Тавновидность приборов прерывисто-поточного действия - аппарат для ауто-
гемотрансфузии крови OrthoPAT (Haemonetics), работающий по центрифужно¬
му методу получения реинфузата. Основная особенность аппарата — уникаль¬
ный динамический диск (разделительная камера, имеющая переменный объем
и позволяющая работать с объемом кровопотери от 50 до 2000 мл/ч). Небольшой
объем д инамического диска (100 мл) позволяет успешно применять данный аппа¬
рат а педиатрии и неонаталогии. Время отмывания аутоэритроцитов составляет
в среднем 5 мин; дисплей прибора отображает объем кровопотери и полученного
реинфузата, гематокрит которого составляет не менее 70-80% независимо от его
первоначального значения.
Аппараты для реинфузии непрерывного действия [CATS (Fresenius)] работа-
101 в непрерывном режиме сбора и отмывания эритроцитов вне зависимости от объ-
700 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
еш и скорости интраоперационной кровопотери, обеспечивая при
качество реинфузата. Разделение крови на плазму, содержащую нежелател* ВЫс°Чое
меси, аугоэритроциты и их отмывание происходят в разделительной спиш НЫе пРн-
камере. Особое устройство камеры позволяет получить минимально тпав 1Ви^Й
ванные, более жизнеспособные эритроциты. Аппарат имеет большое рВМатизиро.
режимов непрерывного отмывания реинфузата. Кроме этого, прибор позв НОо®РазИе
товитъ аутокровь больного и фракционировать ее на этапе вводного напкогГ^ Зар°'
отмывать криоконсервированную донорскую и аутологичную эритроцитни^Taic,te
Процесс сбора, обработки и реинфузии аутокрови обеспечивается тремя пол*0 Масс^
насосами, осуществляющими непрерывный цикл, что ускоряет процедуру 1ИК0вь#«1
Таким образом, преимуществами аппаратов непрерывного действия я
высокая скорость обработки реинфузата, более высокое качество решпГИС|
(риск бактериальной контаминации минимален) благодаря раздельным^
стралям для сбора и реинфузии крови, а также полная автоматизация ппо^'
Относительный недостаток — невозможность изменить режим процедуры ^
ную из-за полной автоматизации процесса.
В ГУ РНЦХ им. академика Б.В. Петровского РАМН все операции на восходят
отделе и дуге аорты, грудной и брюшной аорте проводят с использованием а®
ратной реинфузии, в большинстве случаев применяют аппараты непрерывного дей
ствия, обеспечивающие высокую скорость отмывания аутокрови, достаточный щ
вень безопасности пациентов и существенно сокращающие объем гемотрансфуздо
Результаты сравнительной оценки эффективности различных аппаратов
для интраоперационной реинфузии крови свидетельствуют, что в условиях нео¬
сложненных плановых хирургических вмешательств с ожидаемой кровопотерей
более 15-20% ОЦК можно применять аппараты с невысокой производитель¬
ностью - Cell-Saver 5 (Haemonetics), STAT (Dideco/Shilay/Sorin), BRAT (Cobe).
При плановых операциях на магистральных сосудах, аорте, сопровождающихся
массивной кровопотерей, целесообразно использовать аппарат CATS (Fresenius)
(рис. 19-17). В сепараторной камере аппарата излившаяся в операционную рану
и собранная стабилизированная аутокровь, подвергнутая промывке физиологиче¬
ским раствором, освобождается от всех плазменных и неэритроцитных клеточных
компонентов, активированных факторов коагуляции, продуктов фибринолиза
и травмированных клеток, а также от самого антикоагулянта.
При отсутствии соответствующего оснащения, при операциях на магистральных
сосудах и аорте можно использовать следующий вариант реинфузии: собирать
излившуюся кровь в кардиотомный резервуар (Autotrans, Haemonetics) (рис. 19-18),
в котором кровь стабилизируется (с помощью консервантов: 4% раствора натрия
цитрата, глюгицира*) и фильтруется. Затем собранную кровь в стерильных усло¬
виях переливают в пластиковые гемоконтейнеры, сепарируют и отмывают 0,9%
раствором натрия хлорида ручным способом в центрифугах (ЦЛП З, ЦЛП 3,5, НПО
«Биофизаппаратура» или аналогичных) 2-3 раза в зависимости от желаемого каче¬
ства реинфузата и экстренности процедуры. Стоимость данного метода интраопера¬
ционной реинфузии существенно ниже аппаратного способа.
Данный метод реинфузии крови не лишен недостатков, к которым относят сле¬
дующие.
• Возможность перекрестного переливания аутокрови при одновременной
работе в нескольких операционных. ,
• Вероятность бактериальной контаминации в процессе отмывания (реинфу
зию проводят в незамкнутой системе: сбор крови — в операционной, от
вание - в помещении, где установлены центрифуги). ^
• Процесс ручного отмывания достаточно длителен (на каждый цикл °™ы
ния аутоэритроцитов требуется 10 мин и более). Качество реинфузата, та
как и при аппаратной реинфузии, улучшают путем увеличения кратн
отмывания.
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ
701
б
Рис. 19-17. Аппарат для реинфузии CATS (Fresenius): а — сепараторная камера; б — дисплей
аппарата
ОСОБЕННОСТИ АППАРАТНОЙ РЕИНФУЗИИ АУТОКРОВИ
В НЕОТЛОЖНОЙ ХИРУРГИИ
Показание для вызова трансфузиолога на экстренную операцию — обнару¬
жение в полостях крови в объеме 500-750 мл по данным УЗИ или рентгеновского
исследования, а также интенсивное продолжающееся наружное кровотечение
(табл. 19-27). Дежурного трансфузиолога вызывают в операционную одновре-
енно_с хирургом и ожидают раскрытия полости или начала кровоточивости
тканей. Команду к открытию системы для реинфузии дает оперирующий хирург.
702
КЛИК
W» ТРАНСФУЗИОЛОГИЯ
і Резервуар
І крови
І Потерянная
пациентом
I кровь
Детектор крови
Насос крови
Г
Промыв.
I раствор
(солевой)
Мешок для
отходов
Плазма +
промывочный
раствор
Мешок для
обратного
вливания
Промытые
упакованные
■ красные
кровяные
клетки
Насос
упакованных
красных кровяных
клеток (PRC)
1-я стадия
Стадия
2-я стадия
сепарации
промывки
W
сепарации
Промывочная камера
в
Рис. 19-17 (продолжение). Аппарат для реинфузии CATS (Fresenius): в — схема работы аппарата
Рис. 19-18. Сбор раневой крови в резервуар (кардиотомный) для последующего отмывания
и реинфузии (Autotrans, Haemonetics)
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 703
: , 19-27. Основные экстренные оперативные вмешательства, требующие компенсации
йрицит3 ^крови П0СРеДст80М аппаратной реинфузии
Заболевания
Количество боль-
Оперативные вмешательства і ных с дефицитом
1 ГО более 15%, % 1
' Отделение гинекологии
Экстирпация матки без и с придатками
75
дщрцпние матки
Экстирпация матки без придатков
35
Ї^Жйая беременность
Тубэктомия
75
•— Отделение сосудистой хирургии
^пияма брюшного отдела аорты
Аортобедренное протезирование
100
^іозйи и тромбозы магистральных
Реконструктивные операции на крупных маги¬
стральных сосудах
65
Отделение травмы опорно-двигательного аппарата
ріарелом костей таза
Остеосинтез костей таза
100
ппрШм позвоночника
Остеосинтез позвоночника
60
перелом бедренной кости
Остеосинтез бедренной кости
55
Эндопротезирование тазобедренного сустава
75
П&ПАЛОМ костей голени
Остеосинтез костей
5
Отделение нейрохирургии
Ппухоли головного мозга, позвоночника
Удаление опухоли
60
чмт. гематома
Удаление гематомы
35
Аневоизмы головного мозга
Клипирование
45
Отделение торакоабдоминальной хирургии
Травма груди
Торакотомия, ушивание поврежденного органа
65
Сочетанная травма груди, живота, ОДА
Торакотомия, лапаротомия, ушивание повреж¬
денного органа
80
Травма живота
Торакотомия, ушивание поврежденного орган
65
Отделение трансплантации печени
Цирроз печени
Трансплантация печени
100
Опухоли печени
Резекция доли печени 1 75
Такая строгость в определении тактики принятия решения обусловлена тем,
что от начала сбора аутокрови зависят эффективность процедуры интраопераци¬
онной реинфузии и адекватность компенсации кровопотери. При таком подходе
возможны ситуации, когда сбор крови был осуществлен, но объем ее недостаточен
для полноценной реинфузии (<500 мл, низкий гематокрит, выраженный гемолиз,
загрязнение). В этом случае решают вопрос о показаниях к малообъемной реин¬
фузии или вообще не проводят эту процедуру.
При отсроченных оперативных вмешательствах программу трансфузионного
обеспечения определяют заранее. Хирург подает заявку в ОПК на аппаратную
реинфузию, если ожидаемая интраоперационная кровопотеря превышает 1000 мл.
При этом трансфузиолог находится в операционной, пока оперирующий хирург
не решает начать сбор раневой крови.
Основное показание к аппаратной реинфузии — интраоперационная крово¬
потеря более 750 мл.
Абсолютное противопоказание для реинфузии — выраженный гнойный
инфекционный процесс в ране.
Регламент интраоперационной реинфузии:
I организационно-тактические мероприятия;
• медицинская технология процедуры в зависимости от характера травмы,
объема и степени тяжести кровопотери, времени начала оперативного вме¬
шательства от момента поступления пострадавшего в стационар;
7§4 вЛИНИ*€СКЛЯ ТРАНСФИЗИОЛОГИЯ
• адекватность компенсации острой кровопотери посредством л.
трамсфуэионных сред. ииФузло^г
Алгоритм действия для компенсации острой кровопотери
• Определение должного ОЦК.
• Восполнение дефицита ОЦК - создание нормоволемии.
• Определение дефицита ГО крови.
• Восполнение дефицита ГО крови до 65-75% учтенной кровопотепи
• Компенсация метаболических расстройств, включая параметры кис
го бюджета организма и системы гемостаза. °Родно-
При этом программа соотношения компонентов ИТТ может быть гш.
(Ложкин А.В., 2005):
эритроцитная масса (мл) = 0,19 х объем УК х 10;
свежезамороженная плазма (мл) = 283 + 0,23 х объем УК;
коллоиды (мл) = 1701 + 0,21 х объем УК;
кристаллоиды (мл) = 733 + 0.11 х объем УК.
Особенности аппаратной реинфузии
Аппаратную реинфузию аутокрови в НИИСП им. Н.В. Склифосовского исполь¬
зуют с 1997 г. За много лет использования реинфузии выявлено несколько особен¬
ностей ее проведения. Традиционная интраоперационная аппаратная реинфузия
аутокрови (ТИАРК) может быть оптимальной и осложненной. В частности
при оперативном лечении аневризмы брюшного отдела аорты с использованием
оптимального варианта ТИАРК собирают от 66,4 до 74,2% объема УК, а возврат
клеточного компонента составляет 50-62%. При осложненной ТИАРК сбор ране¬
вой крови составляет 35-39% объема УК. Затруднения при сборе раневой крови
у этой категории больных связаны с гиперкоагуляционным синдромом, что вызы¬
вает быстрое свертывание крови, а следовательно, нарушение работы вакуумного
аспиратора, быструю закупорку фильтра в емкости для сбора крови. Этим определя¬
ются малый объем получаемого клеточного компонента (23-27%) и недостаточная
компенсация дефицита ГО (только аутоэритроцитсодержащими средами).
При травматологических операциях анализ аппаратной интраоперационной
реинфузии выявил следующие недостатки: сбор раневой крови ограничен из-за того,
что значительная часть крови изливается из раны, остается на операционном мате¬
риале (операционных салфетках и простынях). Общепринятым способом удается
заготовить до 55% объема УК. Следовательно, при массивной интраоперационной
кровопотере этот метод аппаратной реинфузии не позволяет адекватно компен¬
сировать кислородную задолженность у больного. В гинекологической практике
при оперативном лечении миом матки выявлено минимальное количество жидкой
раневой крови и большое ее количество на операционном материале. Это определи¬
ло необходимость усовершенствования метода аппаратной реинфузии путем увели¬
чения сбора раневой крови при различных оперативных вмешательствах.
ОСОБЕННОСТИ АППАРАТНОЙ РЕИНФУЗИИ
В ТРАВМАТОЛОГИЧЕСКОЙ ПРАКТИКЕ
При травматологических операциях значительная часть раневой крови теря
ется, оставаясь на операционном белье и материале. Таким образом, невозможно
одномоментно собрать большое количество крови, как в торакоабдоминально11
хирургии. Кровь собирают медленно на протяжении всей операции. Важнейши.
этапом в увеличении сбора раневой крови при операциях травматологическо
профиля считают использование операционного материала: пропитанные кров
аутодонорство и АУТогшотрАнсФУЗйи 705
„дционные салфетки извлекают из раны и помешают в стерильную ємкості
содержащую 4% раствор натрия цитрата и 0.9% раствор натрия хлорида
раствор предназначен для элюации эритроцитов из операционного материк-
емкость вносят не более 120 салфеток среднего размера (30-40 см) (рис
*1,19). Для лучшего выхода эритроцитов в консервирующий раствор опера
1 ый материал перемешивают корнцангом, полностью погружая его в р-—
ллфетки выдерживают в течение 15-30 мин, затем их извлекают, а элюат,
аутоэритроциты, подвергают переработке (отмывке и кон центри рої
Помощью аппарата Cell-Saver.
Рис. 19-19. Сбор клеточного компонента аутокрови из элюата операционных салфеток
Установлено, что из элюата операционного материала можно получить в сред¬
нем 584 мл (1,2 СДЭ) аутокрови, что составляет 44% УК.
Величина утраченного ГО крови, находящейся на салфетках, зависит от вида
и техники операционного вмешательства. Экспериментально установлено,
что при остеосинтезе бедренной кости и эндопротезировании тазобедренного
сустава на одной средней салфетке (30x40 см) находится от 2.7 до 4.8 мл ГОу .
что в среднем соответствует 8,0±1 мл крови.
Другой метод дополнительного сбора крови из операционной раны основан
на специфике оперативного вмешательства при эндопротезировании тазобе¬
дренного сустава. На операционном столе больной находится в положении лежа
на спине. Сбор крови для реинфузии происходит путем самотека под действием
гравитации в специальный пакет с антикоагулянтом. Перед операцией по нижне¬
му краю предполагаемой операционной раны с помощью стерильной адгезивной
пленки фиксируют стерильный пакет, в который помешают 100 мл 4% раствора
натрия цитрата. Пакет представляет собой стерильную апирогенную упаков¬
ку магистралей сменной системы для аппаратной реинфузии аутокрови (Set
CATS), который применяют в Службе крови. Этот вариант позволяет увеличить
сбор раневой крови при эндопротезировании тазобедренного сустава в среднем
на 15%.
Таким образом, модифицированная интраоперационная аппаратная реинфузия
аутокрови (МИАРК) при остеосинтезе бедренной кости и эндопротезировании
тазобедренного сустава позволяет увеличить сбор аутокрови в среднем на 59%
00 сравнению с ТИАРК. Это увеличивает объем эритроцитсодержащей трансфузи-
0Нн°й среды с 0,8 до 1,5 СДЭ при средней кровопотере, с 0.9 до 2,7 - при большой
с 1.7 до 4,5 — при массивной.
708 ХЛИНИЧбСКАЯ ТРАНСФУЗИОЛОГИЯ
Вышеприведенная модификация аппаратной реинфузии (МИАРк
весьма эффективной и в гинекологической практике при оператв 01саз*%
внематочной беременности и экстирпации матки. Доля собраний0**
при экстирпации матки распределяется следующим образом: жид* йауТ°кР°С
а среднем 10,2%, в удаленном органе — 11,4%, в сгустках - 10,4% кР°»и „
I салфетках соответственно от 48,9 до 83,8% (67.8%) ук. ’ На °ПеРацц.
ОСОБЕННОСТИ АППАРАТНОЙ РЕИНФУЗИИ
В НЕЙРОХИРУРГИЧЕСКОЙ ПРАКТИКЕ
В нейрохирургическом отделении НИИСП им. Н.В. Склифосовско
применяют с 2000 г. Отличительная черта этого метода - продолжи*
(в процессе всей операции) сбор большого количества раневой крови сТельный
гематокритом. Традиционно при аппаратной реинфузии кровь собиралиНИЗКИМ
из операционной раны, в то же время существует выраженная потеря ауто™11'0
истекающей на операционное белье. Аналогичные исследования по внелпГВИ’
МИАРК с использованием на операциях пакета и операционных салфетокб10
проведены в нейрохирургических клиниках. ьии
Для сбора крови самотеком в пакет операционное поле (область головы) пои
обработки покрывают стерильной адгезивной пленкой, по нижнему краю котооой
закрепляют пакет. В него помещают 50 мл антикоагулянта. Доля утраченного ГО
аутокрови при нейрохирургических операциях следующая: 42,5% составляет жид¬
кая кровь и 57,5% находится на операционном белье, причем 39,7% аутокрови
собирают в пакет и 17,8% находится на салфетках. Применение МИАРК позволи¬
ло при большой кровопотере получать 3,9 СДЭ, тогда как при ТИАРК - только 1,6
СДЭ эритроцитсодержащей среды.
Проведено исследование функциональной полноценности отмытых эритроци¬
тов. получаемых при модифицированной аппаратной реинфузии (табл. 19-28).
Состав эритроцитов раневой крови при МИАРК после переработки на аппарате
CATS существенно не отличается от такового донорской крови со сроком хранения
1-3 сут и соответствует требованиям, предъявляемым Службой крови для эри¬
троцитов, предназначенных для клинического использования. Активность АТФ
и 2,3-ДФГ в эритроцитах раневой крови свидетельствует об их функциональной
полноценности. Переработка эритроцитов раневой крови с последующим отмыва¬
нием обеспечивает элиминацию слабых форм эритроцитов, сохраняя популяции
клеток, обладающих функциональной активностью, что оказывает положитель¬
ный эффект при гемотрансфузии. Предлагаемый модифицированный способ
интраоперационной аппаратной реинфузии аутокрови можно широко использо¬
вать в клинической практике.
Таблица 19-28. Сравнение функциональной полноценности эритроцитов донорской и раневой
крови, полученной при аппаратной реинфузии модифицированным способом
Исследуемые параметры
Эритроциты крови
_
донорской (1-3 сут хранения)
раневой
разница, %
2,3-ДФГ, мкмольЛ г гемоглобина
12,3+1,1
11,7±1,3
-4,9 ,
АТФ, мкмоль/1 г гемоглобина
5,1+0,4
4,9±0,5
і®
Концентрация калия в эритроците, ммоль/л
74,6*2,5
76,1±1,6
+2,oJ
Концентрация натрия а эритроците, ммоль/л
22,0+2,7
19,9±4,0
Внеклеточная концентрация калия, ммоль/л
4,2+0,1
4,0*0,1
—4,8 J
Объем эритроцитов, мкм’
92±2
87*3
-gj
+8;6J
{Толщина эритроцитоа, мкм
2,27*0,04
2,39*0,12
1 Коэффициент деформации эритроцитов
0,075*0,02
0,080*0,03_
(Агрегация эритроцитов, у.в.
17,7+1,2
15,6* ГО
АУТОДОНОРСТВО И АУТOf EMO ТРАНСФУЗИИ
707
внедрение МИАРК и получение дополнительного количества аутокрови (эри-
[мтсодержащей среды) позволило расширить показания к аппаратной реин*
^ С 2003 г. в НИИСП увеличилось количество реинфузий; в травматоло-
,-иа 46%. в гинекологии — на 83% и в нейрохирургии - на 74%. Необходимо
^метить, что эффективность 1 СДЭ аутоэритроцитов соответствует 3 СДЭ алло-
° иных эритроцитов. Это обусловлено более высокой кислородтранспортной
^дщией аутоэритроцитов (Константинов Б.А. и др., 2000).
Таким образом, аппаратная реинфузия компонентов аутокрови - безвредный,
активный метод компенсации дефицита ГО крови при острой кровопотере.
Денно в экстренной хирургии.
Осложнения интраоперационной аппаратной реинфузии крови
Бактериальная контаминация реинфузируемой крови возможна не только
поя попадании в реинфузат кишечного содержимого, но и инфицированного ране-
10го отделяемого, а также при реинфузии крови во время операций у септических
больных. При этом режим максимально тщательного отмывания не гарантирует
стерильность реинфузата. Эту проблему можно частично решить с помощью лей-
кодеплеции и массивной антибиотикотерапии.
В настоящее время разрабатывают методики, обеспечивающие бактериальную
безопасность реинфузируемой аутокрови (Lenzen С., 2006). Предложена многоэтап¬
ная обработка аутокрови in vitro, включающая шесть последовательных стадий.
I сбор, фильтрацию, стабилизацию аутокрови и первое отмывание в аппарате
CATS.
І Лейкодеплецию.
I Добавление антимикробных и противогрибковых препаратов (тазобакта-
мар — 4,5 г/л, гентамицина -240 мг/л, флуконазола - 1600 мг/л) с после¬
дующей инкубацией в течение 2 ч. Указанное сочетание антибактери¬
альных препаратов обеспечивает стерильность реинфузируемой крови,
инфицированной микробной флорой полости рта пациентов во время опера¬
ций в челюстно-лицевой хирургии.
• Повторную лейкодеплецию.
[ Гемоперфузию через колонку MATISSE (Fresenius AG), которая обеспечивает
удаление бактериальных эндотоксинов.
I Повторное отмывание в аппарате CATS.
Очевидно, что подобные методики абсолютно неприменимы в экстренной хи¬
рургии.
Воздушная эмболия. Возникает при реинфузии неотмытой крови под давле¬
нием в экстренных ситуациях. Это осложнение возможно также при неисправно¬
сти воздушных сенсоров на линии возврата крови.
Осложнения, вызванные реинфузией неотмытой или некачественно
отмытой аутокрови
Реинфузия гемолизированной крови приводит к гемоглобинурии. почечной
дисфункции, а в тяжелых случаях — острой почечной недостаточности.
Причины гемолиза:
* разрежение вакуума отсоса более 150 мм рт.ст.;
I применение травматичных металлических наконечников аспиратора с не¬
большими отверстиями;
Ї попадание в реинфузат большого количества воздуха (во многом это зависит
от внимательности и квалификации оператора); кроме этого качество реин¬
фузата значительно снижается при некачественном отмывании и использо¬
вании укороченного цикла аппаратного отмывания эритроцитов.
Синдром возвращенной крови, коагулопатия
Установлено, что массивная реинфузия, особенно некачественно отмьггой ауто-
ирови, обычно сопровождается гипотензией, лихорадкой, острой дыхательной
іияпртимл inw^omjvMivi
ееякшочностью. Попадание в кровеносное русло при реинфузии аутокрови би
логически активных веществ ИЛ-1р. ИЛ-6, TNF-a, сериновых протеаз, в том чцг»,
полиморфнонуклеарной эластазы, приводит к синдрому возвращенной крдГ*
который проявляется симптомокомплексом. включающим ОРДС, ДВС, сердец’
сосудистую недостаточность, синдром системного воспалительного ответа.
большое значение в этом патологическом процессе имеет PMN-эластаз»
сериновая протеаза, вырабатываемая нейтрофильными гранулоцитами: увеличь
Iконцентрации PMN-эластазы свидетельствует о повреждении или разруШении
гранулоцитов в процессе реинфузии. Эластаза оказывает повреждающее воздей¬
ствие на ткани организма путем деградации фибриногена, эластина, протеоглик».
нов. Кроме этого, существуют данные, что PMN-эластаза инактивирует ингибит0о
активатора плазминогена I типа, вызывая активацию фибринолиза. Эти измене¬
ния еще больше активизируют систему фибринолиза во время операции: повыша¬
ется уровень фибринолитической активности, уменьшается активность факторов
свертывания крови, что может существенно увеличивать интраоперационную
кровопотерю.
Попадание в кровеносное русло активированных факторов свертывания крови
тканевого тромбопластина (из раневой поверхности, стромы разрушенных эри¬
троцитов), продуктов деградации фибриногена, D-димеров фибриногена приво¬
дит к коагулопатии. Нарушения свертывания крови усугубляются потерей тром¬
боцитов с излившейся кровью, нарушением их функций, а также применением
для стабилизации реинфузируемой крови гепарина натрия (качественно отмытая
аутоэритроцитная масса его практически не содержит).
На нарушения гемостаза во время или после операций на аорте влияют
интраоперационные осложнения: геморрагический шок, массивная кровопотеря
и гемотрансфузия, сопровождаемые дилюционной коагулопатией. Необходимо
отметить, что аппаратная реинфузия отмытых эритроцитов приводит к неизбеж¬
ной потере плазмы больного и требует коррекции гипокоагуляции трансфузией
донорской СЗП и тромбоцитной массы.
Попадание в реинфузируемую кровь инородных веществ и биологиче¬
ских материалов
Неотмытая кровь может содержать костные фрагменты, жир, некротизирован-
ные ткани, местные гемостатические, цементирующие материалы, лекарственные
препараты, жидкости, применяемые для обработки операционного поля, микро¬
частицы операционного белья, тальк. Примесь этих веществ в реинфузате требует
тщательного отмывания и очищения с использованием лейкоцитных фильтров.
РЕИНФУЗИЯ КРОВИ В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Одним из возможных путей решения проблемы профилактики и лечения крово¬
течений в акушерстве и гинекологии считают метод интраоперационной реинфу¬
зии аутоэритроцитов. Во время кесарева сечения интраоперационная реинфузия
эритроцитов в РФ впервые проведена в НЦ АГиП РАМН в 1993 г. Для интраопе¬
рационной реинфузии используют аппараты фирм Fresenius (Германия), Dideco
(Италия), Haemonetic (США), которые соответствуют всем требованиям, необхо¬
димым для безопасной реинфузии аутоэритроцитов, полученных из операцион¬
ной раны.
Важной считают проблему безопасности реинфузии эритроцитов в акушерской
практике. Это связано с тромбопластическими субстанциями в околоплодны*
водах и возможностью их переноса в сосудистое русло пациентки. Существует
методика, согласно которой перед операцией беременной проводят амниотомию.
непосредственно после извлечения плода для удаления околоплодных вод. сыр0'
ИСПОЛЬЗУЮТ /1ПУГПЙ ;irnnn:iтпи Ппгпг» ■атпгп СрбирЗ101
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 709
ь кроме того, рекомендуют режим высококачественной отмывки большим
ячеством раствора, делающего процедуру безопасной.
доказательства безопасности реинфузии в акушерстве было проведено
кронно-микроскопическое исследование проб получаемой суспензии эритро-
При изучении ультраструктуры и ультрацитохимии проб было отмечено.
*L.Bce эритросуспензии практически не отличаются между собой, что доказывает
лаИдартизированность технологии получения перфузионных суспензий эритро-
,00В. Каждая проба представляет собой практически на 100% чистую суспензию
^роцитов. Отсутствуют другие форменные элементы крови, а также макро-
олекулярные компоненты плазмы между клетками. Популяция эритроцитов
Дородна по форме клеток, состоянию клеточной мембраны и ультраструктуре
уятрикса цитоплазмы. Практически не наблюдаются клетки, образующие между
ttfoii плотные контакты, и агрегаты эритроцитов. Форма эритроцитов типична
и представляет собой двояковогнутые диски, ограниченные целостной внеш¬
ней цитоплазматической мембраной на всем протяжении клетки. Эритроциты
неправильной формы, с выростами и шиповидными образованиями не обнару¬
жены. Матрикс цитоплазмы эритроцитов состоит из равномерно распределенных
по объему клетки ультрамикрофибрилл гемоглобина, что характерно для нор¬
мальных эритроцитов.
Результаты ультрацитохимического определения активности АМФазы и АТФазы
в суспензиях эритроцитов подтверждают полученные данные ультраструктурного
анализа. Эритроциты обладают хорошо выраженной нуклеозидфосфатной активно¬
стью, что свидетельствует о нормальном функциональном состоянии клеток и пре¬
жде всего об активном состоянии внешней цитоплазматической мембраны, которая
определяет метаболическую и транспортную функцию клеток. Хорошо выражена
активность ферментов АМФазы и АТФазы, которые контролируют потоки метабо¬
литов через мембрану эритроцитов преимущественно с внешней стороны мембраны.
Активность АТФазы, кроме того, выявлена в матриксе цитоплазмы, что свидетель¬
ствует о нормальной скорости метаболических процессов, связанных с дыхательной
функцией эритроцитов. Таким образом, после реинфузии эритроциты обладают
свойствами, достаточными для полноценного функционирования.
Также выявлено, что реинфузируемая эритроцитная взвесь не обладает антикоа-
гулянтной активностью и не может оказывать неблагоприятное влияние на систему
свертывания крови. Это подтверждено снижением концентрации антитромбина III
с одновременным резким снижением его активности, а также повышением концен¬
трации ТАТ. Фрагменты ПДФ свидетельствуют об отсутствии внутрисосудистого
тромбообразования, а комплекс ТАТ — об активации тромбиногенеза.
Проведенные исследования позволяют сделать заключение, что аспирирован-
ная из операционной раны кровь при ее возврате без предварительной обработки
может стать причиной нарушения свертывания крови, в то время как реинфузия
отмытых эритроцитов, полученных с использованием аппаратов для реинфузии,
такой опасности не представляет.
На основании проведенных исследований у 170 беременных, родоразрешенных
путем кесарева сечения, и у 72 женщин, оперированных по поводу гинекологи¬
ческих заболеваний, выделены следующие показания к реинфузии эритроцитов
* акушерстве и гинекологии:
• предлежание и преждевременная отслойка нормально расположенной пла¬
центы;
• наследственные и приобретенные дефекты системы гемостаза;
* многоплодная беременность;
• спаечный процесс в малом тазу;
* Рубец на матке;
' варикозное расширение вен матки;
* гемангиомы органов малого таза, миома;
710 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГ ИЯ
• аномалии развития матки, разрыв матки;
• расширение объема оперативного вмешательства;
• редкая группа крови;
• ранения крупных сосудов при лапароскопических операциях.
Противопоказание для реинфузии: гнойное или кишечное содержимое в 6d
ной полости.
О высокой клинической эффективности реинфузии аутоэритроцитов сви
тельствуют следующие данные. После реинфузии аутоэритроцитов показатвГ
красной крови у родильниц практически не меняются, в то время как после тпав
фузии донорских эритроцитов показатели достоверно снижаются как на пегівь|С
так и на пятые сутки (рис. 19-20). Это можно объяснить недостаточной транс¬
фузией донорских эритроцитов и значительным их депонированием, гемоли¬
зом. Реинфузия аутоэритроцитов позволяет практически полностью сохранить
их популяцию в сосудистом русле пациенток.
До операции 1-е сутки 5-е сутки
■ Реинфузия ■ Донорские эритроциты
Рис. 19-20. Динамика содержания эритроцитов у женщин после реинфузии аутоэритроцитов
и трансфузии донорских эритроцитов (х1012/л)
После переливания донорских эритроцитов выявлен токсический эффект, что
подтверждалось увеличением концентрации мочевины и креатинина на 38 и 25%
соответственно, а билирубина - в 2 раза. Повышение концентрации мочевины
и креатинина связано с задержкой азотистых шлаков из-за микроциркуляторных
нарушений в почечной паренхиме после трансфузии донорских эритроцитов.
Увеличение концентрации билирубина можно объяснить гемолизом части пере¬
литых донорских эритроцитов. При реинфузии аутоэритроцитов этих нежелатель¬
ных явлений не бывает.
После реинфузии аутоэритроцитов у женщин отмечено достоверное повыше¬
ние показателя r+k и достоверное снижение ИТП тромбоэластограммы в первые
и пятые сутки послеоперационного периода, что можно считать положительным
фактором в плане профилактики тромбоэмболических осложнений. После транс¬
фузии донорских эритроцитов у женщин в послеоперационном периоде сохраня¬
лась гиперактивность прокоагулянтного звена.
Об улучшении кислородтранспортной функции крови у пациенток после
операции с реинфузией аутоэритоцитов свидетельствовали данные увеличения
и индекса кислородного потока (с 938,6±78,0 до 1159182,5 мл/мин и с 517,4±38.8
до 627,6±44,7 мл/минхм2 соответственно), а также р02 и SpO , (рО , достоверно воз¬
росло с 76,412.22 до 82,912,3 мм рт. ст.; Sp02 - с 14,1010,43 до 15,5410.11 об./*
соответственно).
При анализе течения послеоперационного периода обследованных женщин
шяыино, что после реинфузии аутоэритроцитов инфекционно-воспалительных
r
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 711
«нений не было, в то время как после переливания чужеродных эритроцитов
00,10 стота составила 12,5%. Послеоперационный койко-день составил 8,1±0,4
їй ^ с соответственно (см. 4Клинический пример №15-17* на диске *•*!).
ціЬ4іи'
абсолютные противопоказания к интраоперационной
№ РЕИНФУЗИИ КРОВИ
я соответствии с решением, принятым на XXV съезде Международного обще-
атрансфузиологов (Осло, 27 июня — 2 июля, 1998), абсолютными противопо-
адниями к аутогемотрансфузии можно считать:
1(33 бактериальную контаминацию (гнойное содержимое в реинфузате):
, примесь кишечного содержимого;
• наличие веществ, недопустимых для внутривенного введения (дистиллиро¬
ванная вода*, водорода пероксид*, другие лекарственные препараты).
В методических рекомендациях «Аутогемотрансфузии в клинической практи¬
ке» (2001) абсолютные противопоказания следующие:
, массивный гемолиз аутокрови (>2,5 г/л);
! бактериальное загрязнение;
• инфекции, сепсис;
• повреждения полых органов;
[ выраженная почечная и печеночная недостаточность;
. ДВС-синдром.
Относительным противопоказанием считают реинфузию неотмытой раневой
крови.
Таким образом, существуют различия в определении абсолютных противопо¬
казаний к процедуре. Как показывает опыт, ни ДВС-синдром, ни инфекции (транс¬
миссивные) или печеночно-почечная недостаточность не могут быть абсолютны¬
ми противопоказаниями к этой процедуре.
Относительными противопоказаниями считают:
3 длительное (>24 ч) нахождение крови в брюшной полости (такая гемолизи-
рованная кровь требует больших затрат для ее переработки, что значительно
снижает медико-экономическую эффективность применения ее компонен¬
тов);
• онкологическое заболевание у пациента;
і сбор крови, загрязненной каловыми массами.
Однако эти противопоказания относительны, так как при массивной кровопо¬
тере (>2,5 л), отсутствии или недостаточном количестве аллогенной крови, когда
возникают жизненные показания для быстрого восполнения кровопотери, ими
можно пренебречь, изменив программу переработки аутокрови, и использовать
специальные фильтры для переливания эритроцитсодержащего компонента.
ПОСТОПЕРАЦИОННАЯ РЕИНФУЗИЯ
После завершения операции и перевода пациента в отделение реанимации воз¬
можно продолжение кровотечения по дренажам, иногда достигающего значитель¬
ных объемов. Кровопотеря более 8 мл/кг и темп кровотечения более 150 мл/ч
оздают угрозу для жизни пациента и значительно увеличивают риск повторной
нсрзции. Наибольшую ценность реинфузия дренажной крови имеет у пациентов,
не получавших трансфузии во время операции. Чаще всего в клинической практи-
"Р^операционную реинфузию используют у больных кардиохирургического
Р°филя и пациентов после ортопедических операций (например, протезирова-
и П(,Тазо^еДРенного сустава). Существует несколько вариантов систем для сбора
Реинфузии дренажной крови. Несмотря на различия в конструкции, все они
ГЛАВА 19
712 КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
ммгют накопительный резервуар, соединенный с системой дренажны
а некоторые - встроенный специальный фильтр для реинфузии. При Ы*
аппарата Celi-Saver у кардиохирургических больных реинфузию дренаж^Т^и
можно проводить путем сбора в стерильный кардиотомный резервуар с п Кр0еи
щим ее отмыванием ручным методом (см. выше). Как правило, послеоп°СЛЄ'!'^)-
ная дренажная кровь не свертывается. Поскольку резервуар для сбора д РтЩІ
крови находится у постели больного при комнатной температуре, время а*й°Й
фузии не должно превышать 4 ч. Таким образом, реинфузия дренажно“° ^Иіі'
собранной в стерильных условиях, в течение 4-5 ч после операции - НеобИ К^°ВИ’
условие поддержания ОЦК, нормальной концентрации гемоглобина І гем'
та. Наиболее оптимальным решением считают сбор дренажной крови в ійаТокРи
апварата для реинфузии, что позволяет реинфузировать после отмывани^
дренажную кровь. я ВС|о
Несмотря на очевидную выгоду (стоимость процедуры значительно
ще. чем предоперационная заготовка аутокомпонентов), простоту и полез^
послеоперационной реинфузии, существует несколько обстоятельств, котОСТЬ
необходимо учитывать: ^Ь1е
• отделяемое из дренажей — обычно низкий гематокрит;
• эритроциты в дренажной крови частично гемолизируются;
• дренажная кровь содержит активированные белки коагуляции, цитокины
продукты распада клеток и фибринолиза.
Если реинфузию выполняют без отмывания эритроцитов, такое переливание
может быть опасным для пациента. Решение о реинфузии послеоперацион¬
ной дренажной крови в каждом конкретном случае принимают на основании
клинико-лабораторных показателей, объема дренажного содержимого, коли¬
чества эритроцитов [как правило, оценивают по внешнему виду отделяемого -
от светло-розового (незначительное количество эритроцитов) до красно-алого
(при кровотечении по дренажам)] и опыта применения дренажной крови в кон¬
кретном отделении. Если нет показаний к экстренной реинфузии (крайне редко
в плановой хирургии), рекомендуют отмыть эритроциты перед гемотрансфузией.
Осуществление реинфузии в послеоперационном периоде дает время на выяс¬
нение причин повышенной кровоточивости из операционной раны, позволяет
провести клинико-лабораторные исследования, предпринять необходимые лечеб¬
ные мероприятия и дифференцировать хирургическое кровотечение от коагуло-
патического.
УТИЛИЗАЦИЯ НЕВОСТРЕБОВАННОЙ АУТОКРОВИ И ЕЕ КОМПОНЕНТОВ
Невостребованные аутокомпоненты больных необходимо утилизировать,
Существует мнение, что неиспользованные компоненты крови без маркеров
трансмиссивных инфекций можно передать на переработку для изготовления
препаратов крови. Это спорный вопрос. Во-первых, при правильной организации
невостребованным остается минимальный объем аутокомпонентов, во-вторых,
нет полной гарантии, что кровь больного не имеет дополнительных, патологи¬
ческих факторов, свойственных данному заболеванию, которые могут оказать
отрицательное влияние на качество препарата крови. Следовательно, утилизация
неиспользованных аутокомпонентов — единственно правильное решение.
Таким образом, переливать аутокомпоненты крови одного больного
другому категорически запрещено.
ОСЛОЖНЕНИЯ ПРИ АУТОГЕМОТРАНСФУЗИЯХ
Поскольку аутокомпонеиты иммуноидентичны крови пациентов, Реак^
и осложнения, ассоциированные с переливанием компонентов донорской кр
r
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 713
соблюдении всех правил гемотрансфузий отсутствуют. В то же время сле-
учитывать, что в условиях хирургического стресса любые дополнительные
Дивные процедуры могут оказать определенное, не всегда прогнозируемое
"ч-гвие на организм больного, что, в свою очередь, может проявиться измене-
и состояния больного и клинико-лабораторных показателей. Как правило,
|г соблюдении всех правил выполнения аутогемотрансфузии эти отклонения
^значительны и не выходят за рамки нормы, а при клинически значимых про¬
длениях могут быть быстро купированы и не имеют долгосрочных последствий,
істота возможных ошибок и осложнений при аутодонорстве и их причины пред¬
ставлены в табл. 19-29 (на примере ГУ РНЦХ им. академика Б.В. Петровского
РАМН)-
Аспіда 19-29. Возможные ошибки и осложнения при аутодонорстве
—
Данные, %
Ошибки и осложнения
РНЦХ им. акад.
Б.В. Петровского
РАМН
опубликованные
Причины осложнений
и ошибок
"медицинские осложнения
1,25-1,75
3,9-6,8
Головокружение, снижение
АД, тахикардия
веские ошибки при приго¬
товлении компонентов крови
2-3,75
2,0-4,5
Разгерметизация (разрыв)
контейнеров, образование
сгустков
Неправильная маркировка компо¬
нентов крови
0,1
0,7-1,2
Невнимание персонала
при регистрации пациента
Разрушение клеток крови при хра¬
нении
Нет
0-0,5
Нарушение условий хранения I
Трансфузия аутокомпонента дру¬
гому пациенту
Нет
0-0,6
Организационные ошибки,
недостаточный профессио¬
нализм
Использование аллогенной крови
вместо аутокрови
10
5-10
Клиническая необходимость
(профузное кровотечение)
Несмотря на обоснованную пропаганду предоперационного аутодонорства
с последующей аутогемотрансфузией, существует ряд положений, ограничи¬
вающих этот эффективный метод трансфузиологической гемокоррекции, которые
необходимо учитывать при его использовании.
• Метод не устраняет риск бактериальной контаминации, что чревато развити¬
ем посттрансфузионного сепсиса. Среди причин, приводящих к бактериаль¬
ной контаминации аутокрови, выделяют следующие:
Ф ошибки при отборе аутодоноров;
Ф скрытую бактериемию у пациента;
Ф длительные сроки хранения аутокомпонентов,
і Для увеличения длительности хранения аутоэритроцитной массы можно
использовать лейкодеплецию. Необходимо отметить, что заготовка аутокро¬
ви из катетера, установленного в центральной вене, нежелательна; в исклю¬
чительных случаях она возможна после отрицательного результата бакте¬
риологического посева крови, взятой из центральной вены.
І Трансфузия аутокомпонентов может привести к редкому осложнению ауто¬
трансфузии — фебрильной негемолитической посттрансфузионной реакции.
Среди причин ее развития — аутолейкоцитная контаминация, накопление
в процессе хранения эндогенных провоспалительных цитокинов (ИЛ-1(3,
ИЛ-6, ФНО-а), которые обладают выраженными пирогенными свойствами.
При этом длительная консервация аутокомпонентов, особенно в случаях хра¬
нения цельной аутокрови, значительно увеличивает риск ФНГТР. Для про¬
филактики этого осложнения с успехом применяют лейкоредукцию, после
ГЛАВА 19
;j4 UVMNMKM WWCWSHOnOnw
которой лугоэрйтроцитиую массу можно хранить те же сроки, что
иые компоненты И 3;}%^
І И» угтраняет риск технических погрешностей, которые мот
не только к осложнениям во время заготовки аутокрови, но и к пеп
трансфузии крови, несовместимой по системе АВО. резус-фактору
потеря аутокомпонетов из-за истечения срока хранения, отказа ггг*1*
фузия иди отмены операции. Кроме того, не исключен технический
некачественная венепункция, из-за чего значительно увеличиваетс»
эксфузии Крови и ухудшается качество аутокомпонентов, разом» ^
• • *“ WfJKr*L
тейнера во время центрифугирования. *
• Предоперационная заготовка, во многих случаях неоднократная, мноп ■
ная. а также назначение препаратов для лечения анемии приводят к vi»**
« J ™ЛЦЧа.
нню стоимости лечения; при этом стоимость 1 дозы аутокрови, заготовл
мой в стандартный гемоконтейнер, на 30% превышает таковую аналогичной
объема донорской крови. Цена аутокомнонентов, заготовленных метод0°
аппаратного афереза, еще выше. Снижению стоимости способствуетищ»
визуализированная программа заготовки аутокомпонентов в соответствии
с их реальными потребностями.
• Приводит к развитию ятрогенной анемии, которая может увеличить потреб-
НОШ в трансфузии аллогенной крови во время операции. При этом степень
предоперационной анемии во многом зависит от интенсивности донации
срока заготовки аутокомнонентов, а также наличия и адекватности лечения
анемии препаратами железа, витаминами, эпоэтином.
• Аутокровь при хранении претерпевает те же изменения, что и аллогенная
кровь: накапливаются продукты жизнедеятельности эритроцитов (аммиак,
мочевина, лактат), провоспалительпые цитокины (ФНО-а, ИЛ-IJ), ИЛ-6),
внеклеточный калий, снижается pH, нарастает концентрация свободного
гемоглобина, продуктов деградации фибриногена. Кроме того, формируют
клеточные микросгустки и микроагрегаты, количество которых увеличивает¬
ся при длительном хранении компонента аутокрови.
• Сопряжено с задержкой планового хирургического вмешательства из-за
необходимого для заготовки аутокрови времени.
• Методы интраоперационной гемодилюции рассмотрены в разделе «Аутоге-
ыотрансфузин».
Все вышеперечисленные методы дооперационной заготовки аутокрови или ее
компонентов следует рассматривать как рекомендуемую программу, которая
должна быть индивидуализирована в зависимости от состояния больного, плани¬
руемой кровопотери, сроков до операции и других факторов.
КОМПЛЕКСНАЯ ПРОГРАММА АУТОДОНОРСТВА
И АУТОГЕМОТРАНСФУЗИЙ
Кровопотеря в хирургии неизбежна, но объем кровопотери и аллогенной гемо-
грансфмии во многом определяется наличием современных инструментальных
и медикаментозных средств кровесбережения, анестезиологического пособия.
Как показывает опыт, несмотря на определенные трудности (в основном организа-
цнонногт) характера), кровопотеря практически при любой операции может быт»
компенсирована собственной кровью.
Особенно эффективно сочетание комбинированных методик аутогемотрансф)
»ий, включающих предо перац ион кую, интраоперационную заготовку аутокроя*'
ннтраоперапионную и послеоперационную реинфузию.
Хирургические клиники, разработавшие собственные программы аутодонор
ства аутогемотрансфузнй, полностью отказались от переливания компоненто»
АУТОДОНОРСТЮ И АУГОГШОТРАКСФУЗИЙ 715
s„ при плановых операциях, если кровопотеря не превышает 1 л. Однако
многих оперативных вмешательствах в ортопедии, хирургии крупных сосу-
(аневризмы аорты), трансплантации органов (печени, сердца) невозможно
большой кровопотери. В этих случаях, несмотря на риск осложнений
35 рроговизну крови, ее приходится переливать. По данным исследований,
* „ЙМере гем отра не фу зио логического обеспечения операций при аневриз-
юрты с прогнозируемой кровопотерей 2 л и более не всегда целесообраз-
■ ставить перед собой задачу восполнения кровопотери только аутокровыо.
' необходимости можно использовать аллогенную кровь а дополнение к заго-
,,пленным аутокомпонентам (эритроцитной массы, СЗП. тромбоконцентрата).
. )Гим случае обеспечение уровня безопасности отвечает требованию «один
яор - один реципиент».
g ГУ РНЦХ им. академика Б.В. Петровского РАМН разработана комплексная
зксфузионно-трансфузиоиная программа сохранения собственной крови боль¬
шие находящихся на лечении в хирургических стационарах. Она предусматривает
применение различных методов аутогемотрансфузий, позволяет практически
полностью сохранить кровь пациентов, максимально снизить объемы грансфу-
«ій компонентов крови доноров и связанный с ними риск гемотрансфузионных
осложнений, что дает возможность хирургам выполнять более объемные рекон¬
структивные операции (рис. 19-21).
Объем предполагаемой
Кровопотери
менее 20% ОЦК
Предоперационное
резервирование 1-2 доз крови
с последующим
фракционированием
Объем предполагаемой
кровопотери
более 30% ОЦК
Аппаратная реинфузия крови.
Интраоперационная гемоделюция.
Реинфузия дренажной крови
Коррекция гемостаза во
время операции с
использованием ИК
Предоперационное резервирование
аутоСЗП.
Интраоперационная гемоделюция.
Аппаратная реинфузия крови
Рис. 19-21. Выбор протоколов аутодонорства и аутогемотрансфузий
Комплексная программа предусматривает.
• наиболее полное, целенаправленное обследование пациента, позволяющее
определить варианты аутогемотрансфузии или их сочетание:
• показания и противопоказания к предоперационной эксфузии аутокрови,
сроки и порядок ее проведения, а также максимально допустимую дозу.
• проведение интраоперационной управляемой нормоволемической гемодилю¬
ции в зависимости от состояния больного и данных общего анализа крови;
• сбор аутокрови. излившейся в операционную рану, с помощью аппаратов
и устройств, позволяющих полностью возвратить ее больному",
• сбор дренажной крови в первые часы после операции (не позднее 5 ч).
Комплексная программа снижения объемов гемотрансфузий аллогенной крови
яол®на включать ряд процедур, которые требуют определенных организацией-
4» «ММ
rn
Mnmicwvw ігяльч<гогили>пл
ных усилий и согласований со специалистами, принимающими участие I
гическом лечении больного. Трансфузиолог должен внимательно ознако*^'
с историей болезни до операции, идентифицировать факторы, которые* я
иредрасполагать к чрезмерной потере крови, изучить принимаемые бо Sp
препараты, которые могли бы увеличить потерю крови, определиться СЛЬНЬ11(
ходимостью фармакокоррекции (использование эпоэтина, препаратов жеНЄ°^
Необходимо обсудить процедуру С пациентом И получить его информиров!*3^
согласие на применение кровесберегающих технологий, обратить особое ^
мание на клинико-лабораторные показатели гемостаза и гемограммы, o6cv НИ
с анестезиологом необходимость заготовки аутокомпонентов, возможность ив*
операционной ОНГ. использования гипотермии, интраоперационной гепарин
ции. применения антифибринолитических средств в послеоперационном перио
а также решить вопросы организации и проведения интраоперационной и
операционной реинфузии крови.
Комплексная программа должна быть составлена и согласована со смежным
специалистами - анестезиологической и хирургической бригадой, лечащим впа!
чом. Программа должна включать не только трансфузиологические аспекты сбере¬
жения крови, но и медикаментозные, анестезиологические и хирургические 111
ды как интра-. до- и послеоперационные периоды лечения пациента (табл. 19-30)
Только последовательная преемственность запланированных и согласованных
действий может дать ожидаемый результат — сведение к минимуму использование
аллогенной крови в клинике.
Очевидно, что в плановой хирургии можно использовать схему аутодонорства
используемую при многих видах хирургических вмешательств:
і первый этап - предоперационная заготовка аутокрови и/или аутоСЗП
под контролем лабораторных показателей;
• второй этап - интраоперационная аутогемотрансфузия: резервирование
аутокрови на фоне ОНГ в сочетании с аппаратной реинфузией крови;
• третий этап - послеоперационная реинфузия крови.
Программа аутогемотрансфузии требует индивидуализации, особенно на этапе
предоперационной подготовки (рис. 19-22, табл. 19-31).
Кроме того, в интра- и послеоперационном периоде назначают лекарственные
препараты, оказывающие выраженное гемостатическое действие: апротинин,
транексамовую кислоту, фактор свертывания крови VII, десмопрессин, амино¬
капроновую кислоту. Не меньшее значение в снижении объема кровопотери
имеет применение местных гемостатических препаратов, таких как фибриновый
клей*.
Возможность увеличить объемы заготавливаемой в дооперационном периоде
аутокрови может быть реализована путем применения эпоэтина. Можно сформу¬
лировать следующие принципы его назначения.
• Подкожное введение эпоэтина в дозе 600 ЕД/кг на фоне приема препаратов
железа позволяет заготовить не менее 3 доз аутокрови за 3 нед.
• Назначение эпоэтина показано больным с концентрацией гемоглобина ниже
100 г/л. По данным рандомизированных исследований, введение эпоэтина
позволяло увеличить концентрацию гемоглобина с 90,4 до 127 г/л.
Эти оптимистичные данные нельзя переоценивать, так как применение эпоэ¬
тина у аутодоноров требует подбора оптимальной дозы и увеличивает экономи¬
ческие затраты.
Дальнейшие разработка и внедрение современных хирургических техноло¬
гий, планомерное применение мер по кровесбережению позволит «оптимально
использовать донорскую кровь в соответствии с принципами ее сбережения
как редкого и ценного вещества, с которым нельзя обращаться расточительно»
(материалы Европейской конвенции по правам человека и биомедицине, 1997).
АУТОДОНОРСТВО И АУТОГЕМОТРАНСФУЗИИ 717
19-30 Комплексная программа управления гемотрансфузиями при кардиохирургиче-
Р^лпмацияхИCooley Р А- с изменениями) , ■ '? ■■
—
Процедура
Примечания
мтикоагулянтная терапия | Отменять за несколько дней до операции
ЩЩ0 -
Іазначение эпоэтина I Для пациентов с высоким риском объемных кро- I
I вопотерь I
Назначение препаратов железа I Для пациентов с низкой концентрацией гемоглобина I
или клинико-лабораторными признаками анемии |
Заготовка аутокрови I Для пациентов с высоким риском объемных кроео-1
потерь. Ограничения: стоимость процедуры, слота I
ности организации и время до операции
Гемодилюция Ч
la!
С(
зезмерная гемодилюция (ОЦК <20%) может ока- I
ггь отрицательное влияние на функцию сердечно-1
зсудистой системы I
Гепаринизация IА
н
декватная антикоагуляция достигается при введе-1
ии дозы 3 мг/кг |
Введение апротинина IJE
в
р
дя пациентов с высоким риском объемных кро- I
опотерь. Снижает объемы кровопотери и гемо- I
рансфузий
Введение аминокапроновой I
Хнтифибринолизный эффект
кислоты
Введение десмопрессина
Тля пациентов с коагулопатиями: например,
уремической тромбопатией, болезнью фон
Виллебранда, дефектом тромбоцитов |
Гипотермия
Необходимо придерживаться умеренной гипотер- I
мии (22-28 °С); быстрое подогревание полностью
устраняет неблагоприятные эффекты
Гемостатические препараты
Создают более сухую операционную область
для местного применения
и снижают кровопотерю
Сбор и реинфузия аутокрови
В условиях сбора без антикоагулянта и отмывания
эритроцитов могут оказать отрицательное влияние
из-за присутствия активизированных продуктов
системы гемостаза и продуктов распада клеток
крови , 1 Ц §
Послеоперационный
Сбор и реинфузия дренажной
(в том числе медиастинальной)
крови
Могут снизить объем трансфузии аллогенных эри¬
троцитов на 50%. Неэффективно при реинфузии
менее 400 мл или позже чем через 4 ч
Аллогенные гемотрансфузии
Используют при крайней необходимости
Трансфузии эритроцитов
Могут потребоваться при концентрации гемогло¬
бина <80 г/л
Трансфузия тромбоцитов
При количестве тромбоцитов <50,0хШл
СЗП
При протромбиновом времени >15 с, АЧТ8 >45
скорость поступления крови по дренажам >300
мл/ч за 1 ч или 900 мл/ч за 3 ч
Гипертензия
Потенциально опасно для кровотечения.
Плазмозаменители могут повысить АД
Вопрос об экономических преимуществах аутодонорства по сравнению с транс¬
фузией донорской крови остается до конца не выясненным. Выявить существен¬
ные различия стоимости аутокрови по сравнению с донорской не удалось. Но если
принять во внимание стоимость лечебных процедур, направленных на ликви¬
дацию гемотрансфузионных осложнений, которые может вызвать переливание
Донорской крови или ее компонентов, то экономическая выгода от использования
Дутодонорства очевидна. При этом следует учесть, что чем больше объем исполь¬
зования аутокрови, тем больше экономия донорской крови.
71f
ЧМЧ6СКАЯ ТРАНСФУЗИОЯОГИЯ
операции
Аут-огемотрансфуэии-
КЦК, ТК, СЗП, ЭМ
Инфузия
поликлинических условиях или
в д невном стационаре клиники
Интраоперационная
реинфузия
Постоперациоиная
реинфузия
дренажной крови
Рис. 19-22. Комплексная схема заготовки аутогемокомпонентов и аутогемотрансфузий. КЦК —
консервированная цельная кровь; СЗП — свежезамороженная плазма; ЭМ — эритроцитная
масса; ТК — тромбоцитный концентрат
Таблица 19-31. Заготовка и применение аутокомпонентов крови при различных хирургических
операциях
Способ заготовки аутокрови
Операция
поопера¬
ционная
интраопе¬
рационная
послеопера¬
ционная
острая нормо-
волемическая
гемодилюция
АКШ с ИК
+
+
+
+
Операции на крупных сосудах
+
+
+
Первичное протезирование бедренного сустава
+
+
+
+
Ревизия бедренного сустава
+
+
+
+
Протезирование коленного сустава
+
+
+
Большие операции на позвоночнике
+
+
+ I
Нейрохирургические операции (например,
резекция артериовенозных образований)
+
+
- ,
+
Резекция печени
+
+
-
і
Простатэктомия
+
+
-
+ -
Гистерэктомия
Мастэктомия
' -
Трансуретральная простатэктомия
-
-
—'
Кесарево сечение
■-
-
Тонзиллэктомия
-
-
Холецистэктомия
І Маммопластика
! Грыжесечение
-
I грыжесечение - - Л
Примечание: по данным National Heart, Lung, and Blood Institute Expert Panel on t e
Afltotogous Blood. Transfusion alert, use of autologous blood Transfusion, 1995.
АУТОДОНОРСТВО и аутогемотрансфузии 719
свидетельствует опыт работы клиник, активно использующих метод заго-
и и переливания аутокрови, 30-50% взятой перед операцией аутокрови
** или иным причинам остаются неиспользованными (см. выше). При пра-
°° ном отборе больных для аутотрансфузии, использования комплексных
0,1,1 гоамм при различных патологиях, учете особенностей конкретного больного
11 пользованный объем аутокрови можно свести к минимуму. В ГУ РНЦХ им.
Б В. Петровского РАМН за 5 лет (2002-2007) было заготовлено и использо-
о100% крови, заготовленной методом преоперационной гемодилюции, и 94%
fin заготовленной от больных с сердечно-сосудистой патологией.
Необходимо отметить, что, несмотря на множество сведений о явных преиму-
гтвах различных вариантов аутогемотранзфузий, вопрос о нецелесообразности
ще овки аутокрови перед хирургическими операциями пока не решен.
32 Дальнейшее совершенствование и более широкое использование аутогемотранс-
. ни необходимо проводить в рамках отделений трансфузиологии, организовав
Отдельную группу (или другое подразделение в зависимости от количества обслужи-
аемых коек), состоящую из опытного, специально обученного медицинского пер¬
сонала, занимающегося всеми вопросами аутодонорства в лечебном учреждении.
Можно с уверенностью прогнозировать, что с каждым годом будет увеличи¬
ваться количество хирургов и соответственно клиник, применяющих методы
аутогемотрансфузий. Вряд ли в ближайшем будущем (5-10 лет) доля гомоло¬
гичных трансфузий будет сведена к нулю. Но со временем, с внедрением новых
лекарственных препаратов, по мере совершенствования хирургической техники,
применения специальных кровесберегающих технологий, новых кровезамените¬
лей в плановой хирургии они могут быть вытеснены аутотрансфузиями.
ОТДЕЛЕНИЕ ТРАНСФУЗИОЛОГИИ И ЕГО ЗАДАЧИ
В МНОГОПРОФИЛЬНОМ СТАЦИОНАРЕ
В настоящее время производственная деятельность Службы крови многопро¬
фильного стационара ориентирована на постоянное увеличение количества доно¬
ров аллогенной крови и получение различных ее компонентов. Наряду с совер¬
шенствованием производственного направления в трансфузиологии, а также
учитывая дефицит кадровых доноров и возрастающий риск переноса трансмис¬
сивных инфекций, большое значение приобретают развитие клинической транс¬
фузиологии и внедрение альтернативных методов.
Комплекс мероприятий, связанных с реализацией трансфузиологического посо¬
бия в лечебном учреждении, наиболее целесообразно осуществлять через спе¬
циализированное отделение. Наиболее оптимально использование для этих целей
потенциальных возможностей отделения переливания крови (или кабинеты пере¬
ливания крови) лечебных учреждений, которые могут стать прототипом современ¬
ного отделения трансфузиологии. Отделение трансфузиологии может выполнять
функцию базы для организации всего комплекса мер по реализации трансфузиоло¬
гического пособия в ЛПУ. Необходимо уточнить, что реорганизация этих подраз¬
делений в отделениях трансфузиологии должна затронуть не только название, уже
не отражающее их суть (более 20-30 лет цельную консервированную кровь прак¬
тически не применяют, а используют ее компоненты), а главным образом функцио¬
нальные обязанности. В новых условиях, с расширением поля организационного,
Диагностического и клинического действия, отделение трансфузиологии должно
стать организационно-методическим центром трансфузиологической службы всего
лечебного учреждения. Эффективная организация лечебной помощи в значитель¬
ной степени определяется работой отделения трансфузиологии.
Современное отделение трансфузиологии — многопрофильное высокоспециа-
низированное подразделение, позволяющее обеспечить все потребности в транс-
ФУзиологическом пособии лечебного учреждения (рис. 19-23).
72*
ммгсскм імждоаишюгмя
L.0
S Сторонние !
i Клинические подразделения НЦХ |
Отделение
комплектования
доноров
: С выездной бригадой
Лабораторное
отделение
Отделение
Лаборатория
изосерологической
сертификации
заготовки
и переработки крови
Лаборатория
инфекционной сертификации
Экспедиция
Вспомогательные
Отделение
(хранение
группы:
клинической
и распределение
касса,
трансфузиологии |
компонентов крови
и кровезаменителей)
буфет, склад и др.
Лечебное
искусственное питание
Рис. 19-23. Структура современного отделения трансфузиологии
Основные задачи отделения трансфузиологии
• Агитация и пропаганда донорства (совместно с общественными организация¬
ми І Красным Крестом и др.), аутодонорства, кровесберегающих технологии.
• Сбор крови доноров в стационарных и выездных условиях.
• Переработка крови на компоненты (эритроцитную массу, тромбоконцентрат,
СЗП).
і Хранение и распределение компонентов крови и кровезаменителей.
• Проведение экстракорпоральных методов гемокоррекции — гемафереза,
ультрафиолетового облучения крови, иммуносорбции и др.
• Проведение лабораторных исследований по изосерологической и инфекцй'
онной сертификации крови доноров и больных.
• Организация и выполнение работ по аутодонорству, гемодилюции. проведе*
ние периоиерационной и послеоперационной реинфузии крови.
» Консультация и контроль за трансфузионно-инфузионным лечением в ста-
циоиаре.
АЭТйДОНОРСТВО И АУГОГЙИ0ТРАНСШИИ 721
Задачи отделения трансфузиологии выполняют в рамках четырех основных
^правлений трансфузиологии - Службы крови (организационной работы, заго-
крови и ее компонентов), трансфузионной иммунологии (лабораторных
следований), клинической и производственной трансфузиологии (переработки
коови на компоненты, их хранения):
« организационная работа (комплектование доноров крови, агитация и про¬
паганда донорства крови и плазмы);
t производственная деятельность (заготовка и переработка крови на компо¬
ненты, их хранение);
• клиническая работа (экстракорпоральное воздействие на кровь гемаферез;
гемоквантовые методы — фотомодификация крови, парентеральное и энте¬
ральное питание; определение тактики и обеспечение безопасности и эффек¬
тивности инфузионно-трансфузионной терапии, аутодонорство и аутогемо-
трансфузии);
• распределение компонентов и препаратов крови, кровезаменителей и других
препаратов для внутривенного введения, планирование и реализация транс¬
фузиологического и инфузионно-трансфузионного пособия;
t лабораторные исследования - сертификация крови доноров и больных
(определение групп крови — АВО, резус-фактор; тканевое типирование
антигены системы HLA: определение трансмиссивных инфекций ВИЧ,
сифилиса, гепатитов В и С и др.);
• научно-педагогическая деятельность (в НИИ и вузах отделении выполняют
исследования по научным программам и темам).
В настоящее время производственная мощность отделении трансфузиологии
(переливания крови) определяется двумя основными условиями коечным фон¬
дом и объемом крови, используемой в лечебном процессе. Например, отделения
трансфузиологии организуют в клинических стационарах с мощностью более 150
коек и/или потребностью в крови и ее компонентах не менее 120 л в год, По дан¬
ным исследований, такой подход безнадежно устарел и не позволяет адекватно
обеспечить все трансфузионные потребности клиники. Отделения трансфузиологии
необходимо организовывать и укомплектовывать персоналом и соответствующим
оборудованием исходя из современных возможностей трансфузиологии и тех задач,
которые стоят перед лечебным учреждением: обеспечения всех клинических под¬
разделений полным комплексом трансфузиологического пособия (компоненты
донорской крови, аутодонорство, кровезаменители, экстракорпоральные проце¬
дуры, лабораторная диагностика гемотрансмиссивных инфекций, серологические
тесты, парентеральное питание).
Сотрудники отделения трансфузиологии обеспечивают повышение квалифи¬
кации врачей по вопросам трансфузиологии. внедрения в практику новых транс¬
фузионных средств, техники переливания крови, ее компонентов и препаратов,
кровезаменителей, методов определения групповой принадлежности крови, про¬
ведения индивидуальной совместимости переливаемой крови, методов, обеспечи¬
вающих безопасность трансфузиологических процедур.
Отделение трансфузиологии многопрофильной клиники осуществляет свою
деятельность по заявкам клинических отделений в тесном контакте с лабора¬
торными подразделениями, ОПК (отделениями, кабинетами трансфузиологии)
и СПК (Центрами крови) сторонних организаций, а также обществом Красного
Креста (рис. 19-24).
Особое место в работе отделений трансфузиологии занимает консультативная
я лечебная помощь при посттрансфузионных реакциях и осложнениях.
На отделение трансфузиологии возлагают ответственность за постоянный кон*
фОль качества заготовляемой крови, ее компонентов и обеспечение условий хра-
"ения и распределения трансфузионных сред по заявкам лечебных подразделений
клиники.
Общество^,
Красного Крас»
и Полумасс^
Анализы крови
доноров и больных
Покупка и продажа
компонентов крови
под.
Ряс. 10-24. Связи отделения трансфузиологии с лечебными, лабораторными и сторонними
разделениями и учреждениями
Внедрение в практику работы лечебного учреждения и активное применен»
специальных методов гемотерапии — заготовки и применения аутокрови, афереза
крови, экстра- и интракорпорального облучения крови, гемосорбции, паренте¬
рального питания и других вопросов, относящихся к разделу клинической транс-
фузиологии, составляют важнейшую задачу отделений трансфузиологии.
В стационарах экстренной хирургии (скорой помощи, экстренной медицины
медицины катастроф), где прием больных ведут круглосуточно, целесообразна орга¬
низация в составе отделения трансфузиологии специальной дежурной бригады с сод-
ветствующим оснащением, которая будет выполнять весь комплекс трансфузиологи-
ческих задач в вечернее, ночное время, выходные и праздничные дни (рис. 19-25).
Дежурная трансфузионная бригада
Отделение клинической трансфузиологии
Компенсация острой кровопотери
и профилактика развития
коагулопатии
Организация и проведение
реинфузии и аутогемотрансфузий
Получение аутокрови
и ее компонентов
Обеспечение безопасности
аутокомпоненгов
i Дежурная
(трансфузионная I
.\ бригада /
Ч -А
Профилактика и лечение
гнойно-септических
осложнений
Иэосералогическая диагностика и
приготовление компонентов крови
по подбору
Организация и проведение
операций экстракорпоральной
гемокоррекции
€
Трансфузионный аудит
Put 10-21 Дежурная трансфузионная бригада отделения клинической трансфузиологии
В оказании экстренной помощи больным трансфузиология занимает важное
место. Заготовка и использование аутокрови и ее компонентов — важнейший компо¬
нент реализации аутогемотрансфузионной терапии, клинической трансфузиологии-
В рамках реализации идеологии минимизации применения компонентов донорской
крови, в стремлении к внедрению бескровной хирургии особое место в многопро¬
фильных стационарах скорой медицинской помощи занимает аппаратная реинф)"
чия. Совершенствование медицинской технологии проведения интраоперационною
АУТОДОНОРСТВО и аутогемотрансфузии 723
диффузионного пособия требует применения аппаратов типа Cell-Saver, обеспе*
^іоших быстрый сбор крови из серозных полостей или операционной раны.
g разделение, отмывание и быстрый возврат клеточных компонентов на фоне
-одолжающегося сбора и переработки. Это требует создания в штате ОПК кру¬
глосуточной трансфузионной бригады, состоящей из врача-трансфузиолога и опе¬
рационной медицинской сестры, основные задачи которых включают круглосуточ¬
но инфузионно-трансфузионную терапию, определение показаний и реинфузию,
предоперационную заготовку аутокрови, иэосерологический контроль трансфузий.
Врач-трансфузиолor, находясь непосредственно в операционной, совместное хи¬
рургом и анестезиологом проводит экспертную оценку объема и степени тяжести
кровопотери, участвует в интенсивной ИТТ, направленной на компенсацию гипо¬
волемии и выведение пациента из шока. Клинический опыт, навыки производ¬
ственной трансфузиологии и гравитационной хирургии крови позволяюттрансфу*
зиологу решать вопрос о необходимости и целесообразности интраоперационного
использования аутокрови и выбрать наиболее эффективный метод трансфузион*
ного пособия. Кроме того, в распоряжении дежурной трансфузионной бригады
находятся запасы компонентов, препаратов крови и кровезаменителей, которые
применяют интраоперационно для восполнения кровопотери и коррекции систе¬
мы гемостаза (крахмалы, тромбоцитная масса, криопреципитат). Клиническая
деятельность врачей-трансфузиологов в послеоперационном периоде включает
организацию и операции экстракорпоральной гемокоррекции. профилактику
и лечение гнойно-септических осложнений, трансфузионный аудит.
Примером организации современных отделений, располагающих и исполь¬
зующих весь арсенал трансфузиологического пособия, можно считать отделение
трансфузиологии ГУ РНЦХ им. академика Б.В. Петровского РАМН и отделение
клинической и производственной трансфузиологии с круглосуточной дежурной
трансфузионной бригадой НИИСП им. Н.В. Склифосовского.
Можно ожидать, что в многопрофильных лечебных учреждениях благодаря
разработке и внедрению в практику новых кровезаменителей, кровесберегающих
технологий, медикаментозных методов коррекции гемограммы и гемостаза объем
работ отделений трансфузиологии, относящийся к разделу клинической трансфу¬
зиологии, будет увеличиваться и достигнет более 50%.
ПРИЛОЖЕНИЯ (см. на диске <*)
СПИСОК ЛИТЕРАТУРЫ (см. «Приложения» на диске ©)
Глава 20
Гемотрансфузии при анемиях
Долгое время считалось, что снижение уровня
и/или количества эритроцитов при анемиях являетсяМ°ГЛоби11а
показанием для гемотрансфузий - переливания $|1ЯВ
массы. Как показал опыт клинической работы многих лес°ЧИТНоі*
такой подход 1 назначение и осуществление гемотрансфуГ^1611®'
том только уровня гемоглобина - не всегда давал положит^ ^
эффект, а в ряде случаев, например при сидероахрестическихЬНЫЙ
миях. является недопустимым. Ориентация только на показа ^
гемоглобина, гематокрита и содержание эритроцитов (так назы™*
мые показатели красной крови) приводит к увеличению количества
трансфузий и, как следствие, к повышению случаев неоправдан™!
гемотрансфузий.
В 1988 г. на конференции Национального института здравоох¬
ранения (США) было отмечено, что показания к гемотрансфузии
определяются тяжестью анемии и последствий гипоксии, таких
как ухудшение функций легких, неадекватность сердечного выбро¬
са, ишемия миокарда, мозговые или периферические нарушения
кровообращения. Указывалось также, что некоторые пациенты
с хронической анемией хорошо адаптированы к концентрации
гемоглобина менее 70 г/л.
В 1992 г. Американский колледж врачей опубликовал клини¬
ческие рекомендации с критериями назначения гемотрансфузий.
В них подчеркивалась необходимость оценки терапевтической
ценности гемотрансфузии и ожидаемой выживаемости пациента.
При признаках анемии вопрос о необходимости гемотрансфузии
рассматривается индивидуально. Если симптомы анемии (обморок,
одышка, тахикардия, ортостатическая гипотензия, стенокарди
и транзиторная ишемия) отсутствуют, то необходимость гемотран
фузии определяется концентрацией гемоглобина. В рекомендаци
также отмечается, что пациенты хорошо переносят Н°РМ0® и
мическую анемию без клинических признаков при концен^ацИй
гемоглобина 70-100 г/л. Критики же разработанных рекоме
акцентировали внимание на гемотрансфузиях в целях пр
ждения этих симптомов, а не их коррекции. АмерИ'
В практических рекомендациях, сформулированных ^
канским союзом анестезиологов (1996), было указано, ^ ^
жение тканей кислородом в большинстве случаев адек ^сЛ0Та
концентрации гемоглобина менее 70 г/л. ^олочн анарУ1^
не образуется, пока гематокрит не снизится до 15-2 °>
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 725
ечной деятельности не проявляются до падения гематокрита ниже 10%.
нйЯгих рекомендациях подтверждалось, что хроническая анемия переносится
^ е по сравнению с острой. При хронической анемии трансфузии эритроцитов
М редко назначают при концентрации гемоглобина выше 100 г/л и всегда
Оіодимьі при снижении этого показателя менее 60 г/л.
Канадская экспертная рабочая группа в 1997 г. опубликовала рекомендации
проведению гемотрансфузий, где подтверждалось, что у клинически здоровых
1,0 !ей выявляются клинические признаки анемии: при концентрации гемоглоби-
выше 70-80 г/л - одышка при нагрузке, при 60 г/л - слабость, 30 г/л - одыш-
І покое, 20-25 г/л - застойные сердечные нарушения. Как указывается в этих
ка омендациях, гемотрансфузии для лечения хронической анемии необходимы
1L предотвращения неадекватной оксигенации тканей и нарушений сердечной
ятельносги. При этом необходимо учитывать выраженность симптомов, обу¬
гленных или отягощенных анемией, и тщательно взвесить все за и против,
ключая образ жизни пациента, сопутствующие заболевания, тяжесть анемии
и прогноз для пациента.
і практических рекомендациях, разработанных Колледжем американских
патологов (1998), указывается, что гемотрансфузии следует назначать пациентам
с хронической анемией для уменьшения клинических проявлений и рисков данно¬
го состояния, появляющихся при концентрации гемоглобина 50-80 г/л.
11997 г. в исследованиях, проведенных в США, установлено, что 59% вра¬
чей входящих в Ассоциацию университетов здоровья, назначали трансфузии
эритроцитной массы при хронической анемии при концентрации гемоглобина
80 г/л и гематокрите 24%, 25% врачей — при концентрации гемоглобина 70 г/л
и гематокрите 21%, 16% — при концентрации гемоглобина 90 г/л и гематокрите
27%. Помимо показателей гемоглобина и гематокрита, некоторые другие факторы
(пол, возраст, скорость развития анемии, физиологическая адаптация, легочно¬
сердечные функции, ишемические явления, симптомы анемии) также являются
важнейшими критериями при решении вопроса о необходимости гемотрансфу¬
зий. Только 10% врачей — членов ассоциации использовали уровни гемоглобина
и гематокрита как определяющие факторы для трансфузий эритроцитов.
У больных с хронической анемией включаются физиологические компенсатор¬
ные механизмы, способствующие увеличению отдачи кислорода тканям и тем
самым в значительной степени нивелирующие клинические проявления снижения
количества эритроцитов и гемоглобина.
• Увеличение сердечного выброса.
❖ Увеличение сердечных сокращений.
Ф Увеличение ударного объема.
• Увеличение кровотока в коронарных артериях (нарушен у пациентов со сте-
нотическими проявлениями).
І Перераспределение кровотока — изменение кровотока от областей с быстрым
и низкоэкстрактивным кровотоком к тканям с высокой кислородной потреб¬
ностью.
• Увеличение извлечения кислорода.
Ф Извлечение кислорода увеличивается от 0,25 до 0,75%.
• Увеличение содержания 2,3-дифосфоглицерата эритроцитов.
Щ Сдвиг право кривой диссоциации оксигемоглобина способствует снятию
кислородной нагрузки в тканях.
Среди компенсаторных механизмов при анемии, кроме усиления функций
^рдечно-сосудистой и дыхательной систем (увеличения ударного и минутного
объема сердца, глубины и частоты дыхания), наиболее важным является повы¬
шение в 2-4 раза содержания 2,3-ДФГ в эритроцитах, который поддерживает
Должный уровень оксигенации, способствуя переходу кислорода в ткани.
72С кяшчсшя гРАнсФУЗиология
V
За исключением сердца, доставка кислорода к тканям превышает
ноет приблизительно вчетверо. При нормальном сердечном выброс» *°тРеб
5 л/мин, у пациентов с концентрацией гемоглобина 150 г/л доставка f
составляет окало 1000 мл/мин, a его потребление - 200-300 мл/мин
При концентрации гемоглобина 100 г/л доставка кислорода
ет 680 мл/мин. Если сердечный выброс остается неизменным, при СОсга8%
уровня гемоглобина на 50 г/л доставка кислорода падает приблиНИ*е#ІІ>і
до 340 мл/шш. Зительц0
Потребление кислорода (до порогового уровня) при отсутствий
гипоксии не зависит от его доставки. Критический уровень доставки,кислКаНЄВоіі
4-10 мл/мин на килограмм, но при некоторых состояниях (сепсисе и SSI
дисфункции) он может быть выше. егоч«0й
В проявлении анемического синдрома значение имеет не только кониен*' Я
гемоглобина, но и темпы ее снижения, адаптационная способность ормТ4*1*
к анемии, возраст, под больного, общее состояние организма и другие заболе ^
Так. при хронических кровопотерях, в отличие от острых, происходит адапт101*
к анемии, в результате чего ее выраженность не всегда коррелирует-с жалс^
пациентов. Как правило, мужчины при одинаковых концентрациях гемоглоб**01
переносят анемию тяжелее, чем женщины. йЦ
Таким образом, многочисленные физиологические механизмы, компенсиш
щие снижение транспорта кислорода при анемии, нивелируют проявления болез¬
ни, и концентрацию гемоглобина 80 г/л (70-90 г/л) хорошо переносят пациенты
без нарушений функций сердечно-легочной системы, заболеваний коронарные
цереброваскулярных и периферических сосудов.
В1987 г. были сформулированы основополагающие принципы гемотрансфш-
онной терапии у пациентов с хронической анемией:
• не следует назначать гемотрансфузии пациентам, исходя только из показате¬
лей НЬиНСГ;
* необходимо установить симптомы й. признаки, обусловленные хронической
■ следует выявить, какие из этих симптомов или признаков купировались
или уменьшались после трансфузий;
» необходимо выявить положительные и отрицательные эффекты гемотранс-
• гемотрансфузионная терапия должна соответствовать реальным потребно¬
стям больного, а не представлениям врача об этом;
• цель гемотрансфузий — в стремлении не нормализовать показатели красної
крови у пациента, а насытить органы и ткани кислородом,
Трансфузии эритроцитной массы при анемиях необходимы для восполнения
количества циркулирующих эритроцитов и поддержания транспортной функции
крови. Переливание одной дозы эритроцитной массы повышает концентрацию
гемоглобина примерно на 10 г/л, а гематокрита — на 3%. У пациентов с заболе¬
ваниями, сопровождающимися критическими поражениями органе® и тканей,
необходимо поддерживать более высокую концентрацию гемоглобина. ,
В целом можно оказать, что при хронических формах анемии основным кри¬
терием для гемотрансфузионной терапии является общее состояние пациента,
а не концентрация гемоглобина и/или содержание эритроцитов. К признак
ухудшения состояния пациента относятся:
І выраженное прогрессирование анемии;
І признаки сердечно-легочной недостаточности;
• симптомы кислородного голодания;
І резистентность к общепринятым методам лечения;
• недостаточность вышеперечисленных компенсаторных механизмов,
анемией;
фузий;
ГЕМОТРАНСФУЗИИ ори АНЕМИЯХ 727
i нарушения деятельности центральной нервной системы:
, осложняющие факторы (сепсис, лихорадка и др.).
Необходимо также иметь в виду, что эффективность гемотрансфузионной тера¬
кт определяется не только исходным состоянием пациента, но и качеством и
условиями применения эритроцитсодержащих трансфузионных сред: сроками хра¬
нения. уровнем гематокрита, степенью делейкотизации и др.
Показания к трансфузиям эритроцитной массы следующие.
• Предупреждение и купирование гипоксии (тканевой, органной), возникшей
вследствие уменьшения количества эритроцитов.
• Подавление эритропоэза.
Цель гемотрансфузии эритроцитсодержащих сред — предупреждение осложне¬
ний анемии, при этом необходимо учитывать риск самой гемотрансфузии. Исходя
из этого врач-трансфузиолог должен принимать во внимание многие факторы:
• анамнез;
• ожидаемую выживаемость — прогноз;
• скорость развития анемии;
, • физиологическую адаптацию;
• функцию сердечно-легочной системы;
V сопутствующие ишемические нарушения в анамнезе;
• симптомы анемии;
• концентрацию НЬ и величину НСТ.
Необходимо учитывать как положительные эффекты гемотрансфузий, так
и вероятный риск гемотрансфузионных реакций и осложнений.
Ожидаемый результат гемотрансфузий — предупреждение выраженных сим¬
птомов анемии.
Окончательное решение о гемотрансфузии необходимо принимать;
• в каждом конкретном случае;
• доза за дозой (после трансфузии каждой дозы необходимо снова решать
вопрос о Продолжении переливания).
Значения НЬ и НСТ, являющиеся основаниями (но не решающими факторами)
доя назначения гемотрансфузий, — 80 г/л и 24% (колебания 70-90 г/л и 21-27%
соответственно).
Не следует переливать эритроцитную массу для восстановления ОЦК,
ускорения заживления ран или улучшения общего состояния пациента,
если эти симптомы не обусловлены анемией.
При умеренной кровопотере и хронической анемии одинаково эффективно при¬
менение эритроцитов как малых, так и длительных сроков хранения, в то время
как при остром гипоксическом состоянии из-за острой кровопотери и шока транс¬
фузии эритроцитов длительных сроков хранения малоэффективны. Эритроциты
с утраченной кислородтранспортной функцией при попадании в кровеносное
русло реципиента с физиологическим значением pH восстанавливают содержание
2,3-ДФГ в течение 12-24 ч. В течение этого периода восстанавливается утраченная
Функция введенных эритроцитов. При длительном хранении консервированной
крови или эритроцитсодержащих сред увеличивается сродство гемоглобина к кис¬
лороду, снижается отдача кислорода тканям и тем самым уменьшается способность
устранения гипоксии — основного составляющего симптома острой кровопотери.
Гемотрансфузии при железодефицитных анемиях
Вопрос о трансфузиях крови и ее компонентов при лечении ЖДА в настоящее
время решен однозначно: учитывая риск заражения гемотрансмиссивными инфек¬
ционными заболеваниями (гепатитами В и С, сифилисом, ВИЧ и др.), поступление
в кровеносное русло отсутствующих у пациента клеточных антигенов и групповых
728 КЛвЖВЖАв ТРЛНСФУЗИОЛОГИЯ
факторов сывороточных белков, неадекватное тяжести СОСТОЯНИЯ вот
железа (неводная нормализация обмена), назначение гемотрансфузИй П°ЛНеИйе
считаются целесообразными только по жизненным показаниям. При это
дяощмми факторами, как указывалось выше, являются не концентоаі °п^'
глобина и/или содержание эритроцитов, а общее состояние больного
гемодинамики, переносимость препаратов железа и необходимость xhdvti СТ°!п,йе
вмешательств. 1 1
Показания к переливанию эритроцитной массы при ЖДА:
• длительные микрокровотечения;
I выраженная анемия (НЬ <70 г/л);
І отсутствие эффекта медикаментозной терапии;
• сопутствующие заболевания, ослабляющие защитные силы организма и
ише к белковой и витаминной недостаточности; ВеАУ"
I необходимость быстрого купирования анемического синдрома.
Эритроцитную массу переливают по 150-200 мл с интервалом 1-4 дня, за ол
курс осуществляют 3-5 трансфузий. При этом эффективность использовав
эритроцитной массы малых (1-7 дней) и длительных сроков хранения одинакова
Трансфузии эритроцитной массы способствуют не только купированию анемиче
ского синдрома, но и улучшению функции печени, сократительной способное™
миокарда, показателей иммунологической реактивности организма. Применение
размороженных или отмытых эритроцитов при ЖДА имеет ряд преимущеод
по сравнению с эритроцитной массой: отсутствие сенсибилизирующих факторов
(белков плазмы, лейкоцитов и тромбоцитов), продуктов распада и вазоактивнщ
веществ, снижение риска заражения инфекциями. В последние годы рекомендуют
при применении эритроцитной массы использовать лейкофильтры для удаление
лейкоцитов.
Следует с осторожностью назначать гемотрансфузии лицам пожилого возраста
с длительной анемией, так как у таких пациентов повышен объем плазмы крови
и дальнейшее увеличение объема циркулирующей крови при гемотрансфузиях
может вызвать сердечную недостаточность.
Гемотрансфузии оказывают положительный, одномоментный, кратковремен¬
ный эффект, обусловленный сроком циркуляции перелитых эритроцитов, и в то
же время отрицательное воздействие на красный костный мозг, угнетая эритропо-
зз и подавляя синтез гемоглобина в эритроцитах.
При анемиях, протекающих со снижением эритронормобластической функции
костного мозга, резистентности к терапии железосодержащими препаратами и транс¬
фузиями эритроцитной массы хороший эффект оказывают препараты, обладаю¬
щие высокой эритропоэтической активностью, — протеин, плазма крови человека.
Рекомендуемая доза - 150-250 мл внутривенно капельно, курс — 4-7 трансфузии,
Гемотрансфузии при мегалобластной анемии,
сидеробластных анемиях, анемии Фанкони, анемии
Блекфена-Даймонда
Гемотрансфузионную терапию при В12-дефицитной (мегалобластной) анеми .
так же как и при ЖДА, проводят по жизненным показаниям:
і выраженные клинические проявления гипоксии;
I нарушение гемодинамики;
• коматозное состояние (анемическая кома или прекома);
• резко выраженная анемия без признаков комы или прекомы.
Во всех этих случаях показано переливание 200-400 мл эритроцитной м
с одиовременным назначением витамина В|2 (внутримышечно по 1000
до улучшения состояния больного.
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 729
При сидеробластных анемиях, связанных с дефектом ферментных систем кле¬
ток эритроидного ряда и характеризующихся гипохромией, высоким содержанием
#елеза в организме, гемосидерозом органов, показания к гемотрансфузиям те же.
00 и при всех других хронических анемиях:
• выраженная анемия;
, развивающаяся гипоксия.
Используют размороженные или отмытые эритроциты, эритроцитную массу,
учитывая сидероахрестический (от лат. сидеро — «железо*, ахрезия - «неисполь¬
зование») характер данных аномалий крови, необходимо назначение деферок-
саМина для выведения из организма избыточного количества железа (месячные
курсы по Ю мг/кг в сутки 3-6 раз в год).
‘ Апластическая анемия Фанкони - наследственная конституционная апласти-
ческая анемия, сопровождающаяся нарушениями гемопоэза, затрагивающими
все три кроветворных ростка костного мозга (эритроидный, миелоидный и
мегакариоцитарный) и проявляющаяся панцитопенией периферической крови.
Имеет аутосомно-рецессивный тип наследования. Резкая депрессия кроветворе¬
ния сопровождается замещением кроветворных участков костного мозга жировой
тканью.
Показания к заместительной гемотрансфузионной терапии:
I концентрация гемоглобина менее 80 г/л;
У содержание нейтрофилов менее 1,0x10’ /л;
• содержание тромбоцитов менее 20x10’ /л.
Показания к трансфузии эритроцитов:
1 выраженная анемия;
1 признаки гипоксии мозга;
і гемодинамические нарушения.
Частые гемотрансфузии повышают риск гемосидероза, оказывают депрессив¬
ное влияние на собственный эритроцитопоэз, способствуют изосенсибилизации.
В целях профилактики гемотрансфузионных осложнений необходимо использо¬
вать лейкоцитные фильтры или переливать только дву- или троекратно отмытые
эритроциты. Поддерживающая терапия включает переливание эритроцитной,
тромбоцитной массы и концентрата гранулоцитов (два последних компонента
крови требуют подбора по системе HLA). Если при трансфузии 250-400 мл эри¬
троцитов в неделю концентрация гемоглобина остается на уровне 90-100 г/л, нет
необходимости в более частых трансфузиях. У этой категории больных с самого
начала необходимо придерживаться следующего правила: все трансфузии осу¬
ществлять от доноров крови (желательно от ограниченного количества), подо¬
бранных не только по эритроцитным антигенам, но и по лейкоцитным и тромбо-
цитным антигенам.
Депрессия гемопоэза при апластической анемии приводит к снижению утилиза¬
ции железа и накоплению его в гемопоэтических клетках, что ведет к нарушению
их функции и в конечном итоге гибели.
Профилактику гемосидероза проводят на основе концентрации ферритина в
сыворотке крови 1 раз в 6 мес с назначением при необходимости дефероксамина.
Препарат вводят 2 раза в день внутримышечно или внутривенно в течение 2-3 нед.
затем следует перерыв 3-4 нед, после чего проводят еще 2-4 цикла терапии дан-
ным препаратом. Как показано в исследованиях, у 50% больных отмечается улуч¬
шение показателей гемопоэза. Противопоказание к назначению дефероксамина -
геморрагический синдром.
Выраженный геморрагический синдром является показанием к переливанию
тромбоцитов. Рекомендуют переливать тромбоциты, полученные от одного
(или ограниченного количества) доноров, придерживаясь принципа «один донор -
ОДИН больной».
тшщ
ВВ КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
В последние годы для лечения апластических анемий рекомендую
иммуноглобулин внутривенно (400 мкг/кг массы тела 5 дней подряд Йа?н%1
руюшИМ эритро- И тромбоцитопоэз. ’*
Алдастическая анемия Блекфена-Даймонда (парциальная красно
«шпстическая анемия) сопровождается избирательным поражением д^^чная
го ростка красного костного мозга. Предполагают, что в основе лежит avwf0^
ньхй механизм - аутоагрессия к эритроидному ростку кроветворения Г°Им^-
чего развивается выраженный анемический синдром. В периферичес|СЛ”ЄДСТВі1-
отмечается нормохромная анемия при нормальном содержании лр"И
и тромбоцитов. КоЧитов
При наследственной парциальной красноклеточной апластической
заместительные гемотрансфузии назначают в случае резистентности к
глюкокортикоидами И при ВЫСОКОЙ чувствительности К лечению Предни30Є*)аі1ИИ
Переливание эритроцитной массы (используют только отмытые эритроциту?011
водят каждые 3-4 нед. что оказывает симптоматический терапевтический
Для снижения концентрации железа в сыворотке крови назначают дефероксамив
Гемотрансфузионная терапия при наследственных
гемолитических анемиях
Большинство наследственных анемий (как правило, гетерозиготные состояния
по аномальному гену) не требуют гемотрансфузионной терапии. При выраженной
анемии (чаще всего это встречается у гомозигот по аномальным генам) применяют
трансфузии эритроцитной массы, размороженных и отмытых эритроцитов.
При наследственных гемолитических анемиях эритроциты донора (от доноров
без наследственных аномалий эритроцитов) циркулируют в кровотоке, полно¬
ценно выполняя свои функции при отсутствии у больных синдрома гиперспле-
низма. У больных с тяжелыми формами гемоглобино- и энзимопатий (имевших
многократные гемотрансфузии в анамнезе) продолжительность жизни перелитых
эритроцитов укорочена.
ГЕМОТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ ЛЕЧЕНИИ БОЛЬШОЙ р-ТАЛАССЕМИИ
Талассемии - гетерогенная группа заболеваний крови, которые обусловлены
нарушением синтеза отдельных цепей гемоглобина и являются количественными
гемоглобинопатиями.
р-Талассемия развивается при мутации гена, кодирующего р-глобин в локусе
хромосомы 11, что приводит к нарушению синтеза р-глобиновой цепи.
Патогенез р-талассемии связан не только с неспособностью синтезировать адек¬
ватное количество нормального глобина, но и с накоплением относительно нерас¬
творимого тетрамера a-цепей, образующегося из-за нехватки p-цепей. а-Цепи
нестабильны, если они не входят в состав HbF и НЬА2, то агрегируют и выпадают
в осадок. Появление таких внутриклеточных преципитатов a-цепей глобина
активирует ретикулоэндотелиальную систему. При этом происходит повреждени
эритроцитов, сокращается срок их жизни и наблюдается гемолиз.
При р-талассемии часть цепей глобина остается неизмененной. Нарушение
баланса синтеза цепей глобина приводит к неэффективному эритропоэзу, гемо®
зу и гипохромной анемии различной степени тяжести.
Гомозиготная форма р-талассемии (большая талассемия. анемия Кули) -
лое заболевание, возникающее при передаче мутантных генов от обоих родит*
Выделяют:
• тяжелую форму гомозиготной р-талассемии, заканчивающуюся смер*
больного еще в период новорожденности; у
• среднетяжелую - больные доживают до школьного возраста (6-8 лет/.
ГЕМОТРАНСФУЗИИ ПРИ анемиях 731
, мягкую, промежуточную, форму (thalassemia intermedia) — больные дожива*
ют до зрелого возраста. Некоторые авторы считают, что эта форма болезни
не всегда является гомозиготным состоянием р-талассемии, а больные насле¬
дуют две мутации, одну слабую и одну тяжелую, т.е. имеют двойное гетерози¬
готное носительство по генам р-талассемии и рб-талассемии.
Основа терапии пациентов с большой р-талассемией — периодические транс¬
фузии эритроцитов. Такие гемотрансфузии корректируют анемию и подавляют
^эффективный эритропоэз, что приводит к снижению его негативных послед¬
ствий. Как известно, количество клеток эритроидного ряда, созревающих до ста¬
дии эритроцита, характеризует величину эффективного эритропоэза. Анемия
при отсутствии ретикулоцитоза в периферической крови и расширении эритро-
идного ростка кроветворения в костном мозге свидетельствует о выраженном
неэффективном эритропоэзе: определенная часть эритробластов не созревает
-о эритроцита, разрушается в красном костном мозге.
До середины XX в. гемотрансфузии таким пациентам назначали для поддержа¬
ния концентрации гемоглобина 60-80 г/л, что нивелировало последствия анемии.
Однако при такой тактике не происходит эффективной супрессии эритропоэза
и гиперплазии костного мозга (увеличения желудочно-кишечной абсорбции желе¬
за). В1964 г. был предложен новый подход к лечению таких пациентов. Было уста¬
новлено, что эффективность лечения больных, которым проводили трансфузии
для поддержания концентрации гемоглобина 85-105 г/л, была выше, чем полу¬
чавших менее интенсивную трансфузионную терапию. У пациентов с более
выраженным повышением концентрации гемоглобина и соответственно большей
супрессией эритропоэза отмечалось и более успешное предупреждение послед¬
ствий неэффективного эритропоэза. Более того, ускорялось физическое развитие
(рост) и отмечалось улучшение сердечной деятельности. Следующий курс гемо¬
трансфузионной терапии увеличивал концентрацию гемоглобина до 95-100 г/л,
в результате чего несколько улучшалась клиническая картина заболевания. Эта
схема лечения получила название гипертрансфузионной терапии.
Основу современного лечения пациентов с большой р-талассемией составляет
гипертрансфузионный режим с применением размороженных и отмытых эритро¬
цитов. В начале терапии (ударный курс) проводят 8-10 трансфузий за 2-3 нед,
что приводит к повышению концентрации гемоглобина до 100-120 г/л. Затем
частоту трансфузий снижают: переливания проводят каждые 3-4 нед из расчета
20 мл/кг (3 мл/кг эритроцитной массы способствует увеличению концентрации
гемоглобина на 10 г/л). Такая тактика массивных трансфузий улучшает состояние
больного, позволяет длительное время поддерживать концентрацию гемоглобина
не менее 100 г/л, уменьшает изменения костного скелета, приводит к уменьшению
селезенки, улучшает развитие детей. Если программа гипертрансфузий начата
в раннем возрасте, то рост и развитие ребенка приближаются к нормальным пока¬
зателям. Регулярные трансфузии назначают при выраженной анемии после уста¬
новки диагноза. Обычно анемия проявляется уже на первом году жизни. Анемия
У детей прогрессирует и сопровождается замедлением роста.
Своевременно назначенные переливания компонентов крови больным с р-та¬
лассемией способны значительно увеличить продолжительность жизни, позволя¬
ют отсрочить гиперплазию костного мозга и ее последствия.
Полагают, что при раннем начале гипертрансфузий у реципиента может раз¬
литься относительная толерантность к наиболее иммуногенным эритроцитным
литигенам.
Некоторые исследователи на основании экспериментальных данных рекоменду¬
ют более интенсивный режим трансфузий — супертрансфузионный. который позво¬
ляет повысить гематокрит до 35% и концентрацию гемоглобина до 120-140 г/л.
Однако этот метод лечения больных с большой р-талассемией не получил широкого
732
ОСЛЯ ТРАНСФУЗИОЛОГИЯ
•Йения. Режим трансфузий должен быть индивидуален и определ
соотношения пользы подобного агрессивного лечения И рисков, KOTODb
гемосндероз. І также иммунологические и инфекционные осложнения
Применение лейкоцитных фильтров для получения эритроцитной И
дненной лейкоцитами, должно стать рутинной процедурой у таких болЫ,,*ь
поваляет минимизировать риск посттрансфузионных фебрильных пеЛ1>НЫх' Ч
I часто возникающих у данных пациентов. ос0.
Поливание больших объемов крови способствует накоплению я
3-4 г железа в год. что приводит к гемосидерозу внутренних органов.
фузионную терапию необходимо обязательно сочетать с введением
(дефероксамина). Гипертрансфузионную и хелатную терапию проводят^9^
постоянного контроля концентрации железа, что позволяет избежать „ На ^
осложнений (табл. 20-1). Назначение доз дефероксамина в соответствии^1*111
нем ферритина в сыворотке крови снижает концентрацию последнего, уме° ^
выраженность клинических проявлений заболевания. ’ btBa*i
Таблица 20-1. Влияние гемотрансфузий на показатели обмена железа у носителей
лассемии а
I Группа обследованных
Количество
Количество
Показатели обменажёпмГ
трансфузий
обследованых
СЖ,
мкмоль/л
ОЖСС.
мкмоль/л
кнт,%
СФ, нг/м
Больные с большой
0
19
32,2±3,1*
62,3±2,9
50,2+4,5*
ЙЙрг;
103,1+238*
(Иалассвмией
1-5
10
34,2+5,3
58,3+2,9
57,9±7,8‘
6-10
8
32,6±7,3
56,3±7,6
57,3+8,8*
190,6+301*
11-20
8
40±10
61,4+9,3
61,3+8,9*
453,9+50,3*
20
10
32,2±4,9
56,9+4,1
55,2+5,5
596,5+34.8*1
Больные с промежу¬
11-20
8
31,9+5,8
60,8±7,2
49,8+5,6°
401.4+94Т’
точной 0-талассвмией
20
11
43,6±6,9
58,3+9,4
54,3+6.7“
561,6±66ЛМ
Пациенты с малой
І минимальной
р-тапассемией
0
14
17,2±2,3
55,4 + 8,9
25.4 + 7,1
43.8+ЗЗІ8
Здоровые дети
0
13
20,8±3,0
63,8+3,9
33,1+4,9
30,0±14,8
Здоровые взрослые
0
40
19,3+1,7
61,8±1,7
26,3±2,8
55,0+28,8
1ВI <0,05 при сравнении соответствующих показателей с аналогичными для здоровых детей.
ь - р <0,05 при сравнении соответствующих показателей с аналогичными для здоровых взрослых
• - р <0,05 при сравнении внутри группы с больными, не получавшими трансфузий.
Для того чтобы изучить влияние гемотрансфузий на обмен железа, было про¬
ведено обследование 36 больных с большой р-талассемией (в возрасте от 1 года
до 14 лет), 14 - с промежуточной формой заболевания (в основном гомозиготы),
3 - с гетерозиготной формой (в возрасте 15-25 лет) и 14 — с малой и минималь¬
ной р-талассемией (в основном родители детей с гомозиготной формой), не имев¬
ших в анамнезе гемотрансфузий.
Как видно из табл. 20-1, у больных с р-талассемией по мере увеличения коли¬
чества гемотрансфузий прогрессирует перегрузка организма железом. Изменения
происходили на фоне введения дефероксамина (20-40 мг/кг).
Гемотрансфузии оказывают влияние и на иммунную систему больных - кон¬
центрацию циркулирующих иммунных комплексов (ЦИК), иммуноглобулинов,
фагоцитарную и бласттрансформирующую активность лейкоцитов (табл. 20-2)
Вследствие гемотрансфузий происходит повышение концентрации ЦИК,
приводит к появлению у больных с р-талассемией, имевших 6 и более пере®
ваний. статистически достоверных различий с группой здоровых лиц (Р < *
По мере увеличения количества гемотрансфузий повышается и показатель
тайного НСТ-теста, в то время как уровень стимулированного варианта теста
HI контрольной группе, и не зависит от проводимой трансфузионной терзпя
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 733
20-2. Влияние гемотрансфузий на уровень сывороточного ферритина (СФ). Т-РОЛ, цир-
Пирующих
иммунных комплексов, антилейкоцитных антител и НСТ-
!ті
(идаобследо-
„ЗННЫХ
КоЛЬНЫвС
большой
кялассвмивй
[больный с про-
межуточной
н-талассемией
Пациенты с малой
„минимальной
р-талассемией
Здоровые дети
взрос-
О
1-10
11-20
20
20
Т-РОЛ,
— Г
13 37,0±3,5 I
10 28.6*11.4
8 | 24.4+3,3
22.0*2,9
32,3*4,5
14
27
45,8±3,3
; ЦИК, ед.
j оптической
j платности,
*10*
80,2*11,9
90.4±14.9
143,9*15,8
184.9*24,6
198,6±22,8
77,1 ±9,1
Антитела
НСТ-тест
СФ. иг/мл
ЛА ЛЦ
споитаи
мый
61,6*3,7
60,4+2,0
57,6+11.4
51,8*4,63
. ,
94,8*19,5 0/20
136,7131,1 2/12
453.9150,3 I 4/12
596,5134,8
509,8+57.4
0/20 І 14,8*2.03
3/12 18.6t2.13
5/13 I 23,412,37
22.7И.87
21,2*2.01
15.811,94
1 12,311,52
0/16 10.1i1.46
! стимули
рованный
121,2*1.'
20,9*1,69
24.1*1 56
120.3*1,44
23.4И.16
27.3*1.27
34.5l2.36
32,6+1,10
Примечание:
ЛА - лейкоагглютинины; ЛЦ — лимфоцитотоксины. В числителе - количество обследованных,
„сыворотке которых выявлены соответствующие антитела: в знаменателе - количество доноров,
слейкоцитами (лимфоцитами) которых исследованы сыворотки больных.
Частые повторные гемотрансфузии оказывают выраженное иммуносупрес-
сивное воздействие: уменьшаются количество Т-лимфоцитов и соотношение
Т-хелперыД-супрессоры за счет снижения количества Т-хелперов. Степень всех
иммунных нарушений определяется количеством переливаний и обусловлен,
по-видимому, хронической антигенной стимуляцией иммунной системы аллогеи-
ными белками крови.
В связи с большим количеством гемотрансфузий важное значение для боль¬
ных с р-талассемией имеет сенсибилизация по отношению к форменным элемен¬
там крови. Данные по частоте антиэритроцитных и антилейкоцитных антител
у больных с большой р-талассемией в зависимости от частоты гемотрансфузий
представлены в табл. 20-3.
С увеличением количества гемотрансфузий повышается процент больных,
в сыворотке крови которых обнаруживают антиэритроцитные и антилейкоцитные
антитела. У больных, получивших более 14 гемотрансфузий, в сыворотке крови
с частотой 6,7-10,0% выявляют холодовые иррегулярные антиэритроцитные
антитела. По некоторым данным, у пациентов с большой р-талассемией, которым
часто проводят гемотрансфузии, в 12,71% случаев выявляется антиэритроцитная
аллоиммунизация.
Изучение специфичности аллоантител у больных с р-талассемией (табл. 20-4)
показало, что с наибольшей частотой встречаются антитела к антигенам системы
резус. В сыворотках трех больных с D (-) -фенотипом выявлены полные анти-ДС.
неполные ДС+ и анти-ДСЕ-антитела.
У 10 пациентов выявлены анти-1-антитела, у 2 - анти-і-антитела. В 30.1%
проб (44 сыворотки из 146 обследованных) выявлена полиспецифическая анти-
лимфоцитарная активность, а в 6 образцах обнаружены моно- и диспецифические
ЭДти-НЬА-антитела.
Существует предположение, что умеренные переливания крови при большой
Р'Талассемии, в отличие от гипертрансфузионного режима, более эффективны
Для предотвращения перегрузки организма железом и чрезмерного неэффек-
Таблица 20-3. Антиэритроцитные и антилейкоцитные антитела у больных с большой р-талассемией в зависимости от частоты
734
•ЛИНИЧЕСХАЯ ГРАНСФУЗИОЛОГИЯ
Щ Я 00 £|§ I
іяф®1
55 см см <
io°S 8°
1 1 +
sP >Р s»
^ о4 б4
В 9
і 1
^ «п
«о Щ
Ї ” s
" шш
CM to
р • - 5К
ь> з о
со о
■ 3 с£
о с о
а о О
ВІ ф з
& 11
III
Іеі
§ 2
0 £ й
■Є 5 о
1 о ч
* 5 °
с С 5
о о о
et о-
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 735
телица 20-4. Специфичность антиэритроцитных и антилимфоцитных антител у больных с
рТалассемией, имевших в анамнезе множественные (>25) гемотрансфузии
уровня определения или свой¬
ства антител
Количество активных сывороток
Специфичность
выпалено
обследовано
абсолютные
значении
%
В солевой пробе
полные эритроагглютинины:
холодовые (+4-8 “С)
Анти-1
Анти-1
Анти-Р (+)
Анти-Р +1
не идентифицированы
124
8
2
4
2
12
6.45
1.61
3.22
1,61
9,68
халловыв (+22-37 °С)
Анти-ДС
Анти-СЕ
Анти-N
Анти-М
не идентифицированы
136
1
2
2
2
15
0,74
1.47
1.47
1.47
11,03
В непрямой пробе Кумбса:
Анти-ДС
132
2
1,52
неполные эритроагглютинины
Анти-ДСЕ
1
0,76
Анти-СЕ
2
1,52
Анти-К Анти-Fy (а+) +?
2
1,52
Анти-С+Fy (а+) +?
1
0,76
Не идентифицированы
7
10,61
8 лимфоцитотоксическом тесте:
Ah™-HLA-A2
146
1
0,68
анпшимфоцитарные цитотоксины
Анти-Н1А-В5
2
1,37
Ah™-HLA-A2+B35
1
0.68
Ahth-HLA-B8
1
0,68
Анти-Н1_А-А3+В5
1
0,68
Полиспецифические:
5/10
3
2,05
6/10
8
5,48
7/10
7
4.79
8/10
10
6,85
9-10/10
16
10,96
тивного эритропоэза, а также в большей степени ускоряют физическое развитие
пациента. У таких больных эритроидная активность костного мозга не превышала
нормальную в 2-3 раза.
У нелеченых больных с большой р-талассемией обычно наблюдается выражен¬
ная спленомегалия. Регулярные трансфузии позволяют уменьшить экстрамедул¬
лярный гемопоэз, но не предотвратить его. Именно поэтому, даже при соответ¬
ствующей терапии больных, при большой р-талассемии по мере прогрессирования
заболевания развивается гиперспленизм. У таких пациентов режим гемотранс¬
фузий увеличивают постепенно и поступательно. Когда трансфузии превышают
200 мг/кг в год, рекомендуют спленэктомию, так как это реально уменьшает
трансфузионный режим на 25-75%.
Трансфузии изолированных популяций молодых клеток (неоцитов) имеют ряд
преимуществ: повышается приживаемость перелитой крови, уменьшается нагрузка
железом. Данные трансфузии могут быть осуществлены с помощью определенных
систем (Neocell и др.). Однако их потенциальная польза нивелируется серьезными
осложнениями, которые проявляются с увеличением количества доноров, а также
высокой стоимостью процедуры.
СЕМЕЙНОЕ ДОНОРСТВО И ПРИНЦИП «ОДИН ДОНОР - ОДИН РЕЦИПИЕНТ» В ОЧАГАХ
распространения р-талассемии
Одним из решений проблемы расширения донорской базы является привле-
ение к сдаче крови ближайших родственников — так называемое родственное
ГЛАВА 20
£ ОаММЕСХАЯ ГРАНСФУЗИОЛОГИЯ
донорство. К родственным донорам в ряде стран причисляются не юлыса
тнческн близкие к больному лица, но и друзья, знакомые. Однако при ^
темных аномалиях крови интерес представляет изучение возможного до^*'
именно генетически близких родственников, так как в этих случаях мо**0^
иякнуть различные проблемы, обусловленные как характером самой ано!! ^
Ш І механизмом наследования. Именно поэтому далее применяетс/11а^
«семейное донорство*, означающий привлечение в качестве доноров кров^"*1
компонентов членов семьи носителей наследственных аномалии.
Как известно, гомозиготная форма р-талассемии, или большая Р-таласе
(анемия Кули), представляет собой тяжелое заболевание с выраженной ют*
ческой картиной. Ее обычно выявляют в первые месяцы жизни, и в дальней*11
она прогрессирует. Без адекватной терапии пациенты, как правило, не додв*^
до 7-10 лет. Больные становятся трансфузионнозависимыми уже на первом*
жизни. Лечение предусматривает гипертрансфузионную терапию на протяже
всей жизни пациента. Однако потенциальная польза такой терапии нивелируеТ
серьезными осложнениями, которые проявляются с увеличением количества тм
фузий, а следовательно, и доноров, чьи компоненты крови были применены
Поскольку общепринятая тактика лечения большой р-талассемии - постоян
ные гемотрансфузии, начинающиеся в раннем возрасте, первостепенное значение
приобретает иммунологическая и инфекционная безопасность таких трансфузий
Для решения этой проблемы была предложена программа постоянного повторно-
го донорства. Эта программа позволяет снижать риск передачи гемотрансмиссив-
ных инфекций, которые значительно чаще встречаются у больных, многократно
получающих гемотрансфузии, осуществлять совмещение эритроцитной массы
по системам Rh, Kell, Kidd. Duffy и другим эритроцитным системам, т.е. применя¬
ется принцип «один донор - один реципиент». Однако в условиях снижения коли¬
чества доноров применение этого принципа не всегда возможно. Альтернативным
или дополнительным источником донорской крови может быть семейное донор¬
ство. Решение проблемы с помощью семейного донорства при р-талассемии имеет
два аспекта:
S с одной стороны, исключает или уменьшает количество необходимых посто¬
ронних доноров;
• с другой стороны, возникают вопросы, обусловленные наследственным
характером р-талассемии: возможно ли использовать в качестве доноров
носителей данного заболевания? Как исключить опасность отягощения носи-
тельства у доноров и реципиентов? И т.д.
Отсутствие сведений о возможном донорстве при гетерозиготной форме
р-талассемии до настоящего времени не способствовало решению этой проблемы.
Проведенные исследования позволили сделать вывод о возможности привлечения
к донорству гетерозиготных носителей, поскольку по основным параметрам (насы¬
щению кислородом, содержанию АТФ и 2,3-ДФГ, срокам хранения) эритроцитная
масса от таких доноров сопоставима с донорской ЭМ без наследственной патоло¬
гии. Исходя из этого в регионах эндемичного распространения р-талассемии были
обследованы 10 семей, в которых оба родителя страдали гетерозиготной формой
данного заболевания, а часть детей, в соответствии с законами наследования,
имели большую р-талассемию.
Для программы семейного донорства привлекали ближайших родственников
(мать, отца, бабушку, дедушку, братьев, сестер, дядей, тетей). Требования к дояо
рам: возраст - от 18 до 55 лет. без каких-либо хронических заболеваний, в ото
ствии инфекции при нормальных показателях периферической крови (табл. 2(Н
Однако, как видно из табл. 20-5, большое количество потенциальных донор
отсеивали в связи с имеющейся у них анемией, обусловленной наличием наел®
спи»иной аномалии в той или иной форме.
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 737
20-5. Характеристика доноров — родственников пациентов с большой (5-талзсс
Г Доноры
Показатели
родители (№20) (%) Нижайшие родшеиши
——— 1 (%)
да^йййа по группе крови Т 14(70) 15 (42.85)
тГ^внный диагноз гетерозиготной 20 (100) | 10(28.57) 1
„дласммии
I (40)
к^вующив заболевания 4 (20)
Ьд^щёйная частота инфекционных заболеваний 1 4(20)
hg^e к донорству I 8(40)
5 (14,20)
6 (17,14)
3 (8,57)
10(28.57)
По результатам исследования, исходя из совпадения по группе крови среди
родителей могли быть допущены к донорству 14 человек, но после их обследо¬
вания осталось только 8 человек — 40%. Среди ближайших родственников из 15
человек, имевших одну группу крови с реципиентом, осталось 10 человек
28.57%. Повышенная частота различных инфекций у родителей объясняется
нарушением иммунофункциональных свойств лейкоцитов периферической крови
и изменением иммунного гомеостаза, обусловленных носительством наследствен¬
ной аномалии крови.
Описание 3 семей представлено ниже.
Клинический пример 1
Семья А. Члены семьи были обследованы в связи с наличием у одного из детей
гомозиготной р-талассемии.
Мать и отец являются дальними родственниками. Ребенку 2 года на момент нача¬
ла исследования. Мальчик с характерными объективными и клиническими призна¬
ками: «башенный» череп, отставание в физическом развитии, анемия, увеличение
печени и селезенки, эпизодическое появление желтухи и темной мочи. Заболевание
было установлено в возрасте 1 года. Концентрация гемоглобина - 48 г/л. количе¬
ство эритроцитов — 1,65хЮ12/л, лейкоцитов — 10x10’/л. ретикулоцитов - 6%.
В мазках периферической крови — гипохромия, выраженный анизоцитоз. пойкило-
цитоз, мишеневидные эритроциты. Содержание HbF - 62, НЬА. - 6%.
Мать - 32 года. Количество беременностей — 4, мертворожденных - 2, двое
детей. Анемия отсутствует, концентрация гемоглобина — 132 г/л, количество эри¬
троцитов - 4x10і2/л, содержание HbF — 4, HbA^ — 3,5%. Диагноз - минимальная
форма |3-талассемии.
Отец — 35 лет. Отмечаются увеличение малых фракций гемоглобина (HbF
и НЬА2) и легкая анемия — снижение концентрации гемоглобина до 120 г/л.
повышение осмотической резистентности эритроцитов. Диагноз — малая форма
р-талассемии.
Второй ребенок (сестра пробанда) здоров.
Исходя из того что мать и пробанд имели одинаковую группу крови [0 (1).
Rh+] было решено использовать мать в качестве донора при гемотрансфузионной
терапии.
Вторым донором стал дядя пробанда, брат матери, с малой формой р-талассе-
мии без признаков анемии: концентрация гемоглобина - 145 г/л, количество
эритроцитов - 4,5х1012/л, HbF- 4 и НЬА, - 4%.
Трансфузионный режим: объем разовой дозы переливания эритроцитной мас¬
сы определяли из расчета 20 мл/кг массы тела и, учитывая массу тела ребенка
(15 кг), он составлял 300 мл. Трансфузии проводили каждые 3-5 нед. Компоненты
крови от донора-1 (матери) и донора-2 (дяди) чередовали с таковыми от двух
п°стоянных доноров, что позволяло придерживаться у них режима донаций
Не (*0JKe 3-4 в год с постоянным контролем показателей периферической крови.
731 клишмескля трансфуэмология
Такой режим в течение 2 лет позволял поддерживать концентрацию гем
на 110 г л. Поддержание концентрации гемоглобина на этом уровне ко¬
лено необходимостью подавления неэффективного эритропоэза, что у**
физическое развитие и состояние костной системы, снижает вcacывaниe®^e,
• желудочно-кишечном тракте и задерживает развитие спленомегалии
лению, летальный исход в возрасте 4 лет явился результатом присоедини ^
инфекции и развития двусторонней пневмонии. ви**с»
Клинический пример 2
Семья В. Больная - девочка 3 лет. Заболевание проявилось на первом
жизни гемолитическим кризом, тогда и был поставлен диагноз гомозит^
р-талассемии. Концентрация гемоглобина — 65 г/л, количество эритроцит*
1,8>10*3/л, лейкоцитов - 9хЮ9/л, ретикулоцитов — 8%. Характерный внеп°8'
вид ребенка: монголоидные черты лица, «башенный» череп, увеличение печ
и селезенки. Содержание HbF — 74, HbA2 — 4%. В мазках крови - гипохгюм
анизоцитоз и пойкилоцитоз, мишеневидные эритроциты. ^
При обследовании членов семьи пробанда установлена легкая анемия у мат»
ри: концентрация гемоглобина — 100 г/л, количество эритроцитов - 2,8x10“/»
ретикулоцитов - 2%, HbF — 3,5 и НЬА2 — 5%. Диагноз — гетерозиготная (малая)
Р -талассемия.
Отец практически здоров, но повышение малых фракций гемоглобина (ньр
-5,2, НЬА21 4%) и осмотическая резистентность эритроцитов позволили под¬
вить диагноз - минимальная форма р-талассемии.
Брат пробанда - гетерозиготная (малая) форма заболевания.
Сестра пробанда здорова.
Нормальные показатели крови отца пробанда и ее совместимость позволили
ему стать постоянным донором крови. Гипертрансфузионный режим аналогичен
предыдущему: 20 мл/кг массы тела каждые 4-5 нед, но и в этом случае притон-
лось дополнительно переливать кровь внешних доноров (3 постоянных донора),
Состояние ребенка стабильное на протяжении 4 лет, проводится соответствующая
терапия дефероксамином.
Клинический пример 3
Семья С. Больная - девочка 4 лет. Диагноз большой р-талассемии был
поставлен в возрасте 10 мес при появлении гемолитического криза. Отмечаются
отставание в физическом развитии, «башенный» череп, гепато- и спленомега-
лия. Концентрация гемоглобина — 47 г/л, количество эритроцитов - 2,5x10*71
HbF - 62, НЬА, - 4%.
Мать и отец - троюродные сестра и брат. При исследовании крови показатели
гемоглобина, эритроцитов и лейкоцитов находились в пределах нормальных вели¬
чин. У обоих отмечалось повышение малых фракций гемоглобина HbF и НЬА,
(5 и 4% у матери, 6,2 и 7% у отца соответственно).
По данным семейного анамнеза, по-видимому, в семьях отца и матери про¬
банда оба родителя страдали гетерозиготной формой р-талассемии (обследование
не представлялось возможным из-за их смерти). В обеих семьях отмечены случаи
ранней детской смертности — до 2-3 лет (рис. 20-1).
Однако группа крови матери не совпадала с таковой ребенка, поэтому доноре*
стал только отец. Режим трансфузий тот же. При массе тела ребенка 25 кг разовая
доза эритроцитной массы составляла 500 мл. Помимо компонентов крови, полу
ченных от отца, переливали донорскую ЭМ. Гемоглобин поддерживали на $>РвИ
100— 110 г/л. Всего, включая отца, использовали кровь только от 3 доноров,
несомненно, способствовало снижению риска передачи трансмиссивных инч*
цнй і позволило тщательно подбирать доноров по эритроцитным антигени,
системам. Смерть пробанда наступила в возрасте 7 лет от сердечной недоста
ности, обусловленной гемосидерозом.
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 739
t
^ — гетерозиготное носительство
■ — гомозиготное носительство
Рис. 20-1. Схема наследования р-талассемии в семье С.
Таким образом, семейное донорство и принцип «один донор - один реци¬
пиент» были применены в лечении детей с большой р-талассемией в 10 семьях.
При лечении большой р-талассемии принцип «один донор — один реципи¬
ент» следует рассматривать как способ максимального уменьшения количества
доноров, а вместо данного следует применять термины «постоянное повторное
донорство», «минимум постоянных доноров — один реципиент* и т.п. Доноров
крови подбирали по основным эритроцитным антигенным системам, исследовали
на гемотрансмиссивные инфекции (гепатиты В и С, ВИЧ-инфекцию, сифилис),
т.е. обеспечивали инфекционную и иммунологическую безопасность трансфузий.
Во всех наблюдаемых случаях гипертрансфузионный режим проводили по обще¬
принятой схеме. Трансфузии эритроцитной массы осуществляли с использовани¬
ем лейкоцитных фильтров.
Пациентов наблюдали на протяжении 4-5 лет. Ни в одном случае не было
отмечено передачи трансмиссивной инфекции, в то время как, согласно опублико¬
ванным данным, зараженность, в частности, гепатитами С и В у таких пациентов
достигает 57,1—62,3%. Другие авторы отмечают более высокую зараженность
гепатитом С у пациентов, которым постоянно проводят гемотрансфузии. Было
установлено, что у детей, находящихся на постоянном трансфузионном режиме
в течение 5,6±2,8 года, инфицированность HCV составила 74,7%.
Повторные трансфузии от разных доноров повышают риск воздействия на реци¬
пиента многих антигенов, в частности системы HLA, что приводит к появлению
антител к HLA разных классов. Гемотрансфузионная терапия индуцирует реакции,
аналогичные наблюдаемым при трансплантации органов, - развитие сенсибили¬
зации по отношению к форменным элементам крови. У больных с р-талассемией
повышается частота выявления сывороток с антиэритроцитными и антилейкоцит -
ными антителами.
В исследуемых семьях уровень антилейкоцитных антител сыворотки крови
До начала трансфузий и при исследовании, проводимом после одного года гипер-
граисфузионного режима, был практически одинаков. Этому способствовали
как тщательный подбор доноров и уменьшение их количества, так и использова-
ние эритроцитной массы, обедненной лейкоцитами (табл. 20-6). При сравнении
^Держания лейкоагглютининов (ЛА) и лимфоцитотоксинов (ЛЦ) при различном
подборе доноров выявляется статистически достоверная разница в этих показа те-
740 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Таблица I Эритроцитныв и лейкоцитные антитела у больных с большой Р-талассвм
снмости от принципа подбора доноров
щ,
Ч
Антитела
Показатели
Количество активных^ыворп^
ЛЛИйп,- 1
58
случайный подбор
доноров
принцип «од
ОДИН Ми
количество
трансфузий
<25
количество
трансфузий
>25
количество
трансфузий
<25
Эритроагтютинииы в солевой пробе:
N
44
34
10
-^25
галловые
%+
3,0
18
10
холодовые
%+
2,5
16
0
Щ ....
в непрямой пробе Кумбсе
%+
8,8
24
0
0
Лвйкоаптаотинины
N
42
32
0
%+
46
72
—
W
Лимфоцитотошшы:
N
41
30
10
галловые
%+
42
82
0
холодовые
%+
38
66
0
о
Аутоэритроагппотмнины:
N
42
30
10
8 *
тепловые
%+
0
0
0
о
холодоаые
%+
0
10
0
0
Аутолинфоцитотохсины:
N
44
34
10
8
тепловые
%+
0
0
0
1
холодовые
%+
0
10
0
0
Примечание:
возраст обследованных больных - 0,8 мес-14 лет.
%+ В процент активных сывороток.
N - средняя частота реагирования исследованных сывороток, %. Каждую сыворотку исследовал
не менее чем с 10-12% образцов клеток.
Тепловые антитела выявляли при температуре +22-37 °С, холодовые — при +4-8 °С
Так, лейкоагглютинины при случайном подборе доноров выявляли у Ц
реципиентов, в то время как соблюдение принципа «один донор - один реци¬
пиент* позволял снизить этот показатель до 8%. Аналогичная тенденция отме¬
чается и в лимфоцитотоксическом тесте, что согласуется с данными литературы.
Тщательный подбор доноров способствовал снижению частоты выявления лим-
фоцитотоксинов с 82 до 28%.
Повышение уровня ЦИК у пациентов, которым переливали кровь одного
донора, менее выражено, чем у пациентов, в лечении которых данный принцип
не соблюдали (табл. 20-7). Однако надо иметь в виду, что при р-талассемии изме¬
нения в иммунной системе связаны не только с гемотрансфузиями, но и с самой
аномалией крови. Кроме того, имеется статистически достоверное различие в
уровне ЦИК при разных принципах подбора доноров: при случайном подборе -
143,9+15,8 ед. опт. пл. хЮ3, при соблюдении принципа «один донор - один реци¬
пиент* 1 125,2±3,45; р <0,001. При этом среднее количество гемотрансфузий
практически одинаково - 32,6±2,01 и 31,3±2,35 соответственно (р >0,1).
Клинически аллоиммунизация может проявляться по-разному. Наиболее
часто развиваются острые фебрильные негемолитические реакции. У наблю¬
даемых реципиентов, получавших гемотрансфузии от родственников и подо¬
бранных доноров, ни в одном случае не отмечались какие-либо посттрансфузи'
онные реакции (табл. 20-8), в то время как в группе больных с |-талассемией.
находящихся на гипертрансфузионном режиме без применения принципа «одн*
донор I один реципиент*, фебрильные реакции были отмечены в 42% случаев-
Таким образом, при семейном донорстве в регионах с высокой распростр*
ненностью р-талассемии из-за необходимости гипертрансфузионного
возникают трудности в обеспечении пациентов адекватным количеством д
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 741
іш того, донорам с гетерозиготной р-талассемией рекомендуют щадящий
*им донаций (S3 раз в год у женщин и <4 раз в год у мужчин). В связи с этим
Р\\дечение к донорству ближайших родственников и проведение родственных
"^трансфузий необходимо сочетать с использованием ЭМ внешних доноров,
f добранных по принципу «один донор — один реципиент*. Это позволяет
П°еиьшить количество доноров, эритроцитную массу которых переливают одному
^ципиенту, снизить риск передачи гемотрансмиссивных инфекций, уменьшить
' ибилизацию реципиентов к форменным элементам крови и решить вопрос
профилактики посттрансфузионных фебрильных негемолитических реакций.
таММ* 20-7. Циркулирующие иммунные комплексы, лейкоагглютинины и лимфоцитотоксины
-больных с большой р-талассемией, находящихся на гипертрансфузионном режиме, при раз-
дичных принципах
подбора доноров
Группы обследованных
кпипюльная фуппа (доноры крови)
Гемотрансфузии от случайных
Гемотрансфузии по принципу
«один донор — один реципиент»
Количество
обследован¬
ных
50
25
10
Среднее
количество
гемотрансфузий
0
32,6+2,01 (10-45)
31,3±2,35
р >0,1 (10-45)
ЦИК, ед. опт. пл.
хЮ3
51.8+4,63
143,9+15,8
р <0,001
ПА*, % ПЦ*, %
125,2 ±3,45
р, <0,001
р <0,001
49
82
"гГ
, g ммфоиитотоксическом и лейкоагглютининовом тестах сыворотки исследуемых испытывали
с 20-25 образцами лейкоцитов и лимфоцитов от разных доноров крови.
Примечание:
ЛА1 лейкоагглютинины: ЛЦ — лимфоцитотоксины.
я I статистическое различие с контрольной группой.
р- статистическое различие при различном принципе подбора доноров.
Таблица 20-8. Фебрильные негемолитические посттрансфузионные реакции у больных с боль¬
шой с р-талассемией
Группы обследованных
Количество обследованных
(%)
ЭМ от случайных доноров
25 (42)
ЗМ от родственников и подобранных доноров
10(0)
ДРУГИЕ ФОРМЫ ТАЛАССЕМИИ
а-Талассемия — наследственная форма гемолитической анемии. Делеция одно¬
го или нескольких генов из четырех, контролирующих синтез a-цепей глобина,
приводит к нарушению синтеза глобина. Гомозиготная форма а-талассемии —
водянка плода - несовместимое с жизнью заболевание.
При гетерозиготной форме а-талассемии пациенты с НЬН обычно не нужда¬
ются в гемотрансфузиях, но во время периодов оксидативного стресса могут быть
рекомендованы трансфузии эритроцитов. а-Талассемия-1 и а-талассемия-2 про¬
текают практически бессимптомно, и нет необходимости в гемотрансфузиях.
Как отмечалось выше, гемотрансфузии применяются в основном у пациентов
с гомозиготной формой р-талассемии.
Промежуточная форма р-талассемии является гетерогенным заболеванием. Обыч¬
но этим термином обозначают гомозиготную р-талассемию с менее выраженными
клиническими проявлениями, отличающуюся доброкачественным и благоприятным
•^вшем и не требующую постоянных гемотрансфузий. Частота гемотрансфузий
*®®блется от одного раза в 2-3 нед до одного раза в 2-3 мес Потребность в транс-
г№ях появляется в основном в стрессовых ситуациях (сопутствующие заболевания.
"Нфвкции, беременность) и при возникновении гиперспленизма.
742 SmjSpgl ГРАНСФУЗИОЛОГИЯ
Гіиірішттіїог носительство р-талассемии также не требует гемт-рд^^
1 - ait «ервюм. во У беременных с гетерозиготной р-талассемией при npojz?**
няня анемии рекомендуют назначение гемотрансфузий.
ГИЮТМНСФУЗИОННАЯ ТЕРАПИЯ ПРИ СЕРПОВИДНО-КЛЕТОЧНОЙ АНЕМИИ
Серповидно-клеточная анемия (СКА) — гемоглобинопатия, наиболее
ЩСТростраиенная у народов Америки, Африки, Индии, жителей СредиземноИроіі<І
И Средней Азии.
ДрМСТМЛяет собой группу генетических нарушений, характеризую
ев присутствием HbS в эритроцитах. При гомозиготном носительстве№ И*
4 «Црвовмдно-клеточной анемии (заболеваемость СКА составляет у новг*
денных 1:625). при гетерозиготном - о серповидно-клеточной болезни (ГКс
или серповидно-клеточной аномалии.
Серповидно-клеточная анемия - наследственная патология крови. HbS 66
дуется в результате точечной мутации в гене p-цепи хромосомы 11, приводят**
І замещению в шестом положении глутаминовой кислоты на валин. Результато?
этого являются изменение отрицательного заряда НЬА на нейтральный, характеп.
мый для HbS, усиление связи между молекулами гемоглобина, развитие струпі
ной неустойчивости и уменьшение растворимости восстановленной формы Hbs
которая уменьшается в 100 раз, и гемоглобин приобретает способность к поли¬
меризации. Аномальный гемоглобин откладывается в виде мононитей с после¬
дующим превращением последних в кристаллы — тактоиды. Кристаллы имеют
Веретенообразную остроконечную форму, изменяют мембрану клеток. Образуется
серповидность эритроцитов, увеличивается вязкость крови, замедляется кровоток
и возникает стаз крови в капиллярах. Нарушение процессов гликолиза, снижение
уровня АТФ и другие изменения в жизненном цикле эритроцитов ведут к увели¬
чению частоты аутогемолиза. Таким образом, патофизиологические последствия
ригидности и серповидности эритроцитов — это хроническая гемолитическая ане¬
мия и эпизодические поражения тканей, называемые кризами.
Описаны случаи абдоминальных кризов, обусловленных тромбозом капил¬
ляров брыжейки, - состояние по типу синдрома острого живота. Они являются
вариантами болевого (вазоокклюзивного) криза, возникающего при нару¬
шении микроциркуляции при взаимодействии деформированных серповидньл
эритроцитов с тромбоцитами, эндотелием, коагуляционными белками и другими
циркулирующими факторами. Вследствие этого развиваются тканевая гипоксия,
инфаркты внутренних органов и болевые приступы. Чаще всего такие острые
вазоокклюзивные кризы провоцируются инфекцией, холодом, физической и эмо¬
циональной нагрузкой.
Острый грудной синдром характеризуется болью в груди, одышкой, гипок-
семией и лихорадкой. Он обусловлен появлением серповидных эритроцитов
І микрососудах легких. В этих случаях часто неверно диагностируют пневмонию
Такое состояние угрожает жизни больных и является показанием к гемотранф
зкям и постоянному мониторированию пациента.
Нередко на фоне инфекций (пневмонии, кори и др.) возникают тяжелые
гемолитические кризы. Отмечаются озноб, повышение температуры, гемогл
бинурня, прогрессирующая анемия. Появляется иктеричность склер, видиму*
слизистых и кожных покровов, повышается концентрация непрямого билирубин
Iсыворотке крови, выявляется уробилин в моче и повышается концентрацияскг
кобилина і кале.
Вследствие укорочения жизни эритроцитов больные очень чувствите
І транзиторной супрессии гемопоэза, вызванной инфекцией (парвовирусом
пневмококком, сальмонеллой, вирусом Эпштейна- Барр и др.). Описаны .
возникновения так называемых апластических кризов, когда во время
ГШОТРАНСФУЗИИ ПРИ АНЕМИЯХ 743
.„ого процесса или сразу после него происходит разрушение эрнтрокариоци-
, красном костном мозге, исчезают ретикулоциты, отмечаются иентропения
тонбоцитопения. Возможно появление признаков сердечной недостаточности,
вшивается апластический криз спонтанно через 10-14 дней с повышением
количества ретикулоцитов и концентрации гемоглобина. Подобная клиническая
•»гияа была описана при инфицировании парвовирусом.
Таким образом, в клинической картине серповидно-клеточной анемии доми-
нцруют гемолитические и сосудисто-тромботические (вазоокклюзивные) кризы,
реже встречаются апластические и секвестрационкые кризы (у детей в воз-
Dajjj от 5 мес до 2 лет), которые связаны с внезапным удалением из кровотока
«kg разрушения) и депонированием значительного количества эритроцитов
в печени и селезенке, что вызывает резкую слабость, снижение количества эри¬
троцитов и концентрации гемоглобина без признаков гемолиза. Может развить¬
ся коллапс.
Повторяющиеся эпизоды окклюзии сосудов и хронический гемолиз ведут
к прогрессирующей дисфункции практически всех органов (табл. 20-9).
Таблица 20-9. Клинические проявления серповидно-клеточной анемии
Г Птг
Органы
Проявления
острые
хронические
1 Легкие
Острый грудной синдром
Хроническая гилоксемня
Мочеполовая система
Гематурия.
Папиллярный некроз.
Приапизм
Гипостенурия.
Тубулярные дефекты.
Хроническая почечная недостаточность
І нервная система
Ишемический инсульт.
Геморрагический инсульт.
Припадки.
Транзиторные ишемические атаки
Заболевания спинного мозга.
Неоваскуляризация с образованием анев¬
ризмы
Гелатобилиарный тракт
Синдром правого верхнего ква¬
дранта.
Вирусный гепатит
Холелитиаз.
Гепатопатия
Опорно-двигательный
аппарат
Остеомиелит (особенно вызванный
сальмонеллой).
Костный инфаркт
Аваскулярный некроз.
Рентгенологическая патология
(деформация по типу рыбьего рта)
Глаза
Ишемия и геморрагии сетчатки
Пролиферативная ретинопатия
1 i it 1
Кожа
Отслоение сетчатки
Кожные язвы
Гемотрансфузионная терапия СКА имеет несколько режимов: неотложные,
замените (обменные) и постоянные переливания крови.
Неотложные трансфузии. Осуществляются при секвестрационном и апла-
стическом кризах, тяжелой анемии и кровопотере и имеют целью увеличение
транспортной функции крови без выраженного снижения уровня HbS.
Постоянные трансфузии. Могут быть как простыми, так и обменными.
В первом случае достигается уменьшение содержания HbS ниже 35%, во втором -
нормализация содержания HbS и гематокрита.
Простые и обменные трансфузии. Показаниями для обменных трансфузий
яри СКА ЯВЛЯЮТСЯ острый грудной синдром С гипоксемией. некроз Красного KOCT-
ного мозга, приапиэм, непереносимая боль у определенных больных перед плано¬
выми или неотложными операциями.
цель обменных трансфузий — снижение содержания HbS менее 35%. Этого
можно добиться двумя путями — простыми или обменными гемотрансфузиями,
фи выраженной анемии переливают донорскую эритроцитную массу до достиже-
Нйя нормальной концентрации гемоглобина.
ЛМ0Я&
744
■ШЦ IIUWI tPW1tWOflUIM»W
Простые трансфузии легковыполнимы, способствуют уменьшению по
серповидных клеток у реципиента. Эффект гемотрансфузий становится ^
выражен со временем, так как перелитые эритроциты имеют большую ^
должительность жизни, чем собственные клетки. Простые переливания Л
ЧП4ЮТ гематокрит И подавляют собственный эритропоэз больного, пп^И
количество серповидных эритроцитов некоторое время не будет превышать •!(»?
общего содержания эритроцитов. Простые трансфузии — наиболее оптиіш
процедура для пациентов с резко выраженной анемией (например, при
болезни). Однако простые трансфузии повышают концентрацию гемоглоб -
приблизительно на 10 г/л на одну дозу эритроцитной массы (у взрослых),
их не назначают пациентам с более высоким гематокритом (к примеру, больны^
HbSC- и HbS-fi'-талассемией. У таких больных повышение гематокрита при ml!
Н гемотрансфузиях приводит к увеличению вязкости крови. В этих случа
обменные переливания предпочтительнее: они быстро уменьшают процент сен
невидных клеток, не влияя на гематокрит. Если у пациента развивается тяжел!
криз на фоне относительно высокой концентрации гемоглобина (80 г/л и более)
проводят частичное обменное переливание путем забора одной дозы крови с одно¬
временным замещением ее ОДНОЙ ДОЗОЙ донорской крови. Эту процедуру повто¬
ряют до тех пор, пока количество серповидных эритроцитов не снизится до 30%
Данный показатель можно достаточно долго поддерживать на этом уровне - каж¬
дые 3-4 нед проводить переливания донорской крови для подавления собствен¬
ного эритропоэза. Все манипуляции следует сочетать с регулярным контролен
состава эритроцитов в крови пациента. Необходимо отметить, что большинству
больных с СКА при концентрации гемоглобина 80-100 г/л не следует проводить
гемотрансфузии, так как они могут способствовать повышению гематокрита и уве¬
личению вязкости крови I тем самым спровоцировать криз.
Обменные трансфузии по сравнению с обычными гемотрансфузиями имеют
следующие преимущества:
• более физиологичный (более низкий) посттрансфузионный гематокрит;
• быстрое и выраженное снижение процентного содержания серповидных кле¬
ток;
• значительно меньшая нагрузка железом.
Для обменных трансфузий требуется эритроцитная масса от одного или
нескольких доноров в зависимости от массы тела пациента. Чем больше исполь¬
зуется доноров крови для гемотерапии одного больного, тем больше проявляются
недостатки обменных трансфузий.
Обменные трансфузии выполняют различными неаппаратными способами
или с помощью автоматических сепараторов крови (эритроцитафереза). Ниже
приведен простой метод неаппаратного обменного переливания пациенту с СКА
при концентрации гемоглобина не менее 70 г/л и гематокрите не ниже 20%.
1. Удаление одной дозы крови (450 мл) у взрослых или 7,5 мл/кг массы тела-
у детей из периферической вены руки.
2. Восстановление объема крови быстрой инфузией солевого раствора: 500 w
взрослым и 8 мл/кг массы тела — детям.
3. Повторение первого пункта.
4. Переливание двух доз эритроцитной массы взрослым и 10 мл/кг массы
тела 1 детям.
5. У пациентов с СКА пункты 1-4 повторяют неоднократно, а у больных с более
высоким уровнем гематокрита (например, при HbSC) — дважды.
При более низких показателях гемоглобина и гематокрита перед обменный
переливанием назначают одну дозу (450 мл) эритроцитной массы взрослы*
и 5 мл/кг массы тела - детям. Если переливание такого количества эритроцит^
массы не привело к повышению концентрации гемоглобина до 70 г/л, то для
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 745
гдеки больного к операции применяют несколько простых переливаний вместо
оЭ®ньк.
Зхим методом удаляют 4 единицы (дозы) крови у взрослых с восполнением
i дозами эритроцитной массы и 1000 мл солевого раствора. У взрослых с более
цісоким уровнем гематокрита (при HbSC) удаляют 6 единиц крови и возвращают
6 ДОЗ эритроцитной массы и 1500 мл солевого раствора. После таких обменов коли¬
во НЬА превышает 50%, а уровень HbS (при СКА) или HbS+HbC (при HbSC-
болезни) становится ниже 50%. Основная цель инфузионно-трансфузионной
терапии - достижение нормоволемии и уровня гемоглобина до 100 г/л, снижение
содержания HbS.
При использовании автоматических сепараторов крови возможны как эри-
троцитаферез. т.е. удаление некоторого количества собственных эритроцитов.
лк и обмен эритроцитов — удаление эритроцитов пациента с последующим
переливанием донорских клеток. Как и при ручном способе, обменивают 4 дозы
эритроцитов у взрослых с СКА и 6 доз у пациентов с HbSC. Автоматический обмен
эритроцитов пациенты переносят легче, так как его выполняют с поддержанием
экстракорпорального объема около 250 мл у взрослых, в то время как при ручном
обмене (центрифуговом дискретном способе) экстракорпоральный объем больше
500 мл.
Поскольку хирургическое вмешательство и анестезия сами по себе являются
факторами риска для больных с серповидно-клеточной анемией, во время опера¬
ций и в постоперационном периоде часто наблюдаются различные вазоокклюзив-
ные нарушения и осложнения, вплоть до летальных исходов. У пациентов с СКА
наиболее частыми осложнениями хирургических вмешательств являются посто¬
перационные грудной синдром и вазоокклюзивный криз, в основе которых лежат
процессы гипоперфузии, стаза, ацидоза, гипоксии, дегидратация и гипотермия
во время операции. Существует предположение, что предоперационные трансфу¬
зии эритроцитов от доноров без наследственных аномалий крови снижают частоту
послеоперационных осложнений при СКА, так как уменьшают процент циркули¬
рующих эритроцитов, имеющих склонность к серповидности. Экспериментальные
и клинические наблюдения подтверждают выдвинутую гипотезу о том, что гемо¬
трансфузии улучшают тканевую перфузию и предупреждают вазоокклюзию сер¬
повидными клетками.
• Добавление даже малого количества HbA-эритроцитов к HbSS-эритроцитам
in vitro улучшает реологическую характеристику смеси.
1 Гипостенурия и функциональная аспления, характерные для детей с СКА.
могут быть временно скорректированы гемотрансфузиями.
і Обменные трансфузии повышают работоспособность пациентов с СКА
без увеличения по существу уровня гематокрита, т.е. добавление НЬА-
эритроцитов улучшает реологические свойства крови и тканевую перфузию
in vivo.
• Вазоокклюзивные осложнения, такие как болевые кризы, грудной синдром
и приапизм, редко отмечаются у детей с СКА, находящихся на длительных
(продолжительных) трансфузионных программах.
І Профилактические трансфузии уменьшают частоту вазоокклюзивных кри¬
зов у беременных, страдающих серповидно-клеточной анемией.
В связи этим большинство гематологов рекомендуют предоперационные транс¬
фузии пациентам с наиболее тяжелыми формами серповидно-клеточной болезни,
а именно СКА и при сочетании с р-талассемией. Трансфузии в действительности
не являются необходимыми для увеличения насыщения крови кислородом, так
Ик большинство пациентов с СКА в стадии ремиссии адаптарованы к низкой
концентрации гемоглобина и, как правило, не нуждаются в коррекции анемии.
Предоперационные трансфузии рекомендуют главным образом для улучшения
0ZV8VUJ
ТИ пШ ТРАНСФУЗИОЛОГИЯ
ланевом і I течение операции и анестезии, так как снижают кпТ1Тч.
эршроцитов. склонных к серповидности. ^
Агрессины* i юисернтквиый режимы трансфузий
В1995 г. были опубликованы результаты исследования, где сравнили ди
хода І предоперационным трансфузиям при СКА. У 551 пациента с HbSS (взраї*
•дет. которым были проведены плановые или экстренные хирургические вме**
«яшм) проводили трансфузии в агрессивном и консервативном режимах
Цель агрессивного режима - повышение концентрации предоперациовд
гемоглобина до 100 г/л и снижение фракции HbS до 30% и менее. ЭтоГр^
обычно требует обменных трансфузий.
Цель консервативного режима - повышение концентрации гемоглобин*
10100-110 r/л без учета процентного содержания HbS. Большинство пациент
на этом режиме получают простые трансфузии.
Самыми частыми хирургическими вмешательствами у описанных пациент
были холецистэктомия, ЛОР- И ортопедические процедуры, ИЗ которых 80% осу.
ществлялись при комбинации ингаляционной и внутривенной анестезии (среднад
длительность операции - 2,5 ч). В табл. 20-10 представлены результаты сравне¬
ния агрессивного и консервативного режимов.
Таблица 20-10. Клинические испытания консервативного и агрессивного режимов предопераци¬
онных трансфузий у больных с СКА
Показатели
Режим
консервативный
агрессивный
1 Количество пациентов/операций
273/301
278/303
І НЬ парад операцией, г/дл
7,9
8
І Клятст лереянтих доз зрнтроцнтной массы.
уаарослых;
3,3
3,8
j у детей (до 9 лет)
1,5
6,1
нь посла трансфузий, г/дл
10,6
11
HbS посла трансфузий, %
59
31
1 Послеоперационные осложнения, %:
1 трудной синдром
10
10
лихорадка или инфекция
5
7
[болеаойкриэ
7
4
Трзнсф/зионные осложнения, %:
гаиолитичаскиа реакции
1
6
новые эритроцитныа аллоантитела
5
10
Примечание: при «консервативном* режиме 77% составляли простые трансфузии. При агрес¬
сивном режиме 57% составляли обменные переливания.
Как видно из табл. 20-10, агрессивный режим не превосходит консервативный
в предупреждении послоперационных осложнений, наиболее частым из кото¬
рых является грудной синдром. Частота лихорадки, инфекционных осложнений
и болевых кризов не зависит от выбранного режима. В то же время при агрессив¬
ном режиме отмечается повышенное количество трансфузионных осложнений,
обусловленных, по-видимому, большим количеством доз перелитой эритро-
щггиой массы (6 против 1 при консервативном режиме). Возраст старше 10 Дй
я более 5 госпитализаций являлись отягощающими факторами для послеопераци-
оииого болевого криза. Как показано в приведенных выше исследованиях, обмен¬
ные переливания или другие интенсивные трансфузионные режимы, снижающие
содержание HbS менее 50%, не имеют преимуществ по сравнению с простыми
трансфузиями для предотвращения вазоокклюзивных осложнений. Простые
трансфузии предпочтительнее при предоперационной подготовке больных с СКА.
—• ипя finnum.iv r HbSS г бод&е высокой
гшотнсфузии пм диавш 747
_дС)ГГраішей гемоглобина. При вазоокклюэивных осложнениях во время оое*
показаны обменные трансфузии. Также было установлено, что у больных
ие получавших трансфузий до операций, уровень послеоперационной зябо*
^.цосгн и смертности значительно выше.
тктн* предоперационной трансфузионной терапии при других генотипах HbS
Клиническая картина при HbSC разнообразна, но в основном характеризуется
■йее выраженными гемолизом и анемией и меньшей склонностью к вазооккдю-
осложнениям. У больных, получавших предоперационные трансфузии,
^цввхся низкая частота возникновения послеоперационных кризов и грудного
смИДрома.
При HbSC, а также при сочетании генов серповидно-клеточнои анемии и р -та-
яассемии предоперационные обменные трансфузии показаны при следующих
состояниях;
• офтальмологические процедуры, обычно при удалении хрусталика, риске
ишемии переднего сегмента и/или вторичной глаукомы;
« кардиопульмонологические операции, имеющие высокий риск осложнений;
» операции, в ходе которых возможна существенная кровопотеря;
• гематологические заболевания с выраженными клиническими проявлениями
(3 и более госпитализаций в связи с вазоокклюзивными кризами И/ или груд¬
ным синдромом в течение года);
• факторы риска, которые могут спровоцировать послеоперационный грудной
синдром при HbSS.
К предоперационным трансфузиям следует подходить строго индивидуаль¬
но с обязательным предварительным проведением специальных лабораторных
исследований (электрофореза гемоглобина пациента). Трансфузии показаны
для всех пациентов перед хирургическими вмешательствами, требующими обшей
анестезии, и даже при лапароскопических процедурах и пересадке кожи при язвах
нижних конечностей (табл. 20-11).
Таблица 20-11. Тактика трансфузионной терапии в предоперационной подготовке пациентов
с различными генотипами серповидно-клеточной анемии
Генотипы серповидно-клеточной
анемии
Гематокрит, %
Количество доз
для взрослых
Дозы для детей, I
мл/кг
СКА, HbSS, HbS-Р °th, HbS-Sp THAI
Простые трансфузии
20-30
3
15
Обменные трансфузии
>30
4-6
15
HbSC, HbS-р THAI
Простые трансфузии
<25
3
15
Обменные трансфузии (при необходи¬
>25
4-6
15
мости)
Примечание: во всех случаях переливают эритроцитную массу.
В 20% случаев серповидно-клеточной болезни происходит аллоиммунизация
эритроцитами, поэтому такие пациенты имеют высокий риск трансфузионных
реакций. Если у пациента в анамнезе отмечалось образование эритроцитных
аллоантител, ему назначают дозы эритроцитной массы, являющиеся негативными
по соответствующим антигенам, даже если скрининговое исследование в течение
Долгого времени не выявляло эти антитела. Половина аллоантител, формирую¬
щихся у больных с СКА, не определяются серологическими методами в течение
года. Когда таким пациентам переливают эритроциты, содержащие антигены,
ответственные за первичную иммунизацию, может развиться выраженная гемо¬
литическая трансфузионная реакция. Если трансфузии осуществляли во время
°пераций, гемотрансфузионные осложнения и реакции могут проявиться в после-
°перационном периоде.
748 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГ ИЙ
При переливании необходимо использовать дозы эритроцитной ма
знаков серповидных эритроцитов, так как при трансфузиях комлонецСЫ6е3|»й|
ров с СКА возникают трудности в определении послеоперационного^9 01W
Пациентам следует переливать эритроцитную массу без лейкоцить4* %
последние могут спровоцировать посттрансфузионные фебрильные пеа ’ 4
I связи с высоким риском аллоиммунизации всем пациентам с с КЧИи
клеточностью рекомендуют подбор эритроцитов по основным ЭРИ^
антигенам. Однако у 25% больных с СКА такой подбор может быть недо
для предупреждения аллоиммунизации. Кроме того, подбор предопеп°<,Ні111
трансфузий может привести к неоправданной задержке хирургических
Некоторые авторы считают, что назначение эритроцитов, подобранных01^441'
генным системам для предоперационных трансфузий пациентам без а а,ГТй'
ниэации, оправдано только в тех случаях, когда это не влечет за собой °И^
операции и/или трансфузии. ТсР°ч*у
Гетерозиготы по гену HbS (HbAS) не имеют проявлений серповидно-кл
болезни (гемолиза или анемии), так как величина фракции HbS-эритроцито ^
низкая и не может быть причиной полимеризации in vivo. У этих пациентов н
чается повышения риска при хирургических операциях, и предоперационные
фузии при отсутствии анемии, обусловленной каким-либо другим заболевав
им не назначают. Некоторые исследователи рекомендуют обменные трансл
до оперативных вмешательств, связанных с возникновением гипоксии и гипо
фузии (например, операции на сердце и в грудной полости), но другие специалист
не применяли предоперационные трансфузии при HbAS даже в этих случаях
У больных с СКА многочисленные гемотрансфузии вызывают перегрузку оига
низма железом, поэтому при уровне ферритина 2500-3000 нг/л рекомендуют пои.
менение дефероксамина.
Трансфузионная тактика у беременных с серповидно-клеточной анемией
У беременных с СКА повышается риск возникновения осложнений как для жен¬
щины, так и для плода: отягощение заболевания и даже увеличение смертности
вследствие повышения частоты вазоокклюэивных осложнений (болевого криза,
острого грудного синдрома, острой селезеночной секвестрации), инфекционни
осложнений, преимущественно инфекций мочевыводящих путей. Возможны
прогрессирование анемии, отслойка плаценты и токсемия, увеличивается риск
самопроизвольных выкидышей, мертворождения, преждевременных родов
и задержки развития плода. Материнская смертность составляет 2%, перина¬
тальная - 10-25%, если в течение беременности не проводят профилактиче¬
ские трансфузии. Нет единого мнения относительно применения гемотрансфу¬
зий при беременности на фоне СКА. Некоторые исследователи рекомендуют
профилактическую трансфузионную терапию при наступлении беременности
или в начале II триместра, другие пропагандируют воздержание от превентивны!
трансфузий эритроцитов.
Было проведено исследование, в котором сравнивали результаты гемотрансфу-
зионной терапии у двух групп беременных, не имевших выраженных системны!
нарушений:
і одна группа получала превентивные трансфузии, причем каждой пациент*®
было перелито в среднем 12 единиц эритроцитной массы. У них
несколько болевых кризов и другие вазоокклюзивные осложнения. Кро.
того, у '/4 из них развилась аллоиммунизация; ...
І вторая группа получала гемотрансфузии только при необходимости (?Л
нем I единицы эритроцитной массы). В этой группе были и женщины с
типами HbSC (27%). и HbS-р-талассемией (52%), получавшие в сред»
по 6,5 единицы.
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 749
Существенных статистических различий в перинатальном исходе между обеими
-nvnnaMH установлено не было. Авторы пришли к выводу, что профилактиче-
гемотрансфузии не следует назначать беременным с серповидно-клеточной
IV
ские
боя®
гзнью при отсутствии факторов риска. С патофизиологической точки зрения,
сражается отсутствием улучшения маточно-плацентарного кровотока после
геяотрансфузий матери, страдающей СКБ. Вазоокклюзивные осложнения, связан-
е с патологией плаценты (отслойкой и предлежанием плаценты), рано появля¬
йся при беременности. Именно поэтому ранние и интенсивные гемотрансфузии
озволяют добиться тех же результатов, что и превентивные.
Профилактические трансфузии рекомендуют беременным, имеющим такие
Факторы риска, как многократные беременности, отягощенный акушерский анам¬
нез (выкидыши). Дополнительные (но необязательные) показания для назна¬
чения трансфузий - токсемия, септицемия, острая почечная недостаточность,
выраженная анемия (концентрация гемоглобина <60 r/л или ее снижение более
чем на 30% первоначального уровня). Надо отметить, что даже при отсутствии
факторов риска 25-50% беременных с СКА и другими, менее тяжелыми гемо¬
глобинопатиями нуждаются в экстренных гемотрансфузиях в связи с серьезными
осложнениями. В этих случаях трансфузии необходимы.
Таким образом, и у беременной с серповидно-клеточной болезнью, и у плода
высокий риск серьезных осложнений. После выявления этого риска рекомендуют
профилактические трансфузии в начале беременности или во II триместре. При этом
необходимо учитывать как достоинства, так и недостатки данного метода (особенно
риск аллоиммунизации). В случаях когда превентивные трансфузии не назначают,
необходимо тщательное наблюдение за пациентом для быстрого распознавания
возникшего осложнения болезни и своевременной гемотрансфузии.
Отсроченные гемолитические трансфузионные реакции
Отсроченные гемолитические реакции наблюдаются у 5-20% пациентов
с серповидно-клеточной болезнью, регулярно получающих гемотрансфузии. Этот
показатель значительно выше, чем в других группах больных, получающих дан¬
ную терапию. Они имеют некоторые особенности у пациентов с СКА. и их объеди¬
няют в отдельный синдром, важнейшими характеристиками которого являются:
і сильная боль, имеющая сходство с болевым синдромом при СКА;
І выраженная ретикулоцитопения;
І уменьшение посттрансфузионного гематокрита ниже уровня до трансфузии.
Возможные механизмы этих состояний — супрессия эритропоэза. что проявляет¬
ся ретикулоцитопенией, и гемолиз донорских эритроцитов, иногда обусловленный
аллоиммунизацией реципиента. Деструкция аутологичных эритроцитов возникает
из-за обычного аллоиммуностимулированного гемолиза или гемолиза, назы¬
ваемого «невинный свидетель», — образования тройного иммунного комплекса.
В последнем процессе может быть взаимодействие антиген-антитело с перелиты¬
ми клетками, но главное следствие — активация и осаждение их на аутологичных
клетках, которые становятся предметом чрезмерного гемолиза. Отсроченные
гемолитические реакции являются особенно угрожающими из-за их потенциаль¬
ных летальных осложнений и невозможностью предупреждения, несмотря на при¬
менение фенотипически подобранной крови.
гемотрансфузионная ТЕРАПИЯ ПРИ НАСЛЕДСТВЕННОМ ДЕФИЦИТЕ ФЕРМЕНТА
Г-6-ФД
Дефицит фермента Г-6-ФД является самой распространенной энзимопатией.
Около 300 млн человек на земном шаре — носители мутантного гена фермента
Г'6-фД. Эта патология, впервые описанная Карсоном и соавт. в 1956 г.. и по сей
®нь привлекает внимание исследователей различных специальностей: генети-
751 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
ков. биохимиков, гематологов. С 1970 г. по настоящее время выявлено бг
мутантных форм Г-б-ФД. Лее Й|
Структурный ген и ген-регулятор, обусловливающие синтез Г-6-Фд, распо
в Х-хромосоме. следовательно, наследование этой аномалии всегда связано с ^
Именно поэтому гемолитическая анемия при дефиците Г-6-ФД проявляется П0Л(Й1
• у гемизиготных мужчин, унаследовавших патологию вместе с Х-хромо
от матери; Vf
• ГОМОЗИГОТНЫХ женщин, получивших по Х-хромосоме ОТ обоих родителе"-
і гетерозиготных женщин, унаследовавших одну Х-хромосому с патоло
ным геном. У женщин-гетерозигот наблюдается мозаицизм - существовав
двух популяций эритроцитов с нормальной (контролируется нормали ■
Х-хромосомой) и пониженной (влияние Х-хромосомы с аномальным геном!
активностью Г-б-ФД.
Снижение активности ферментов в эритроцитах ведет к уменьшению выработ¬
ки АТФ, изменению ионного состава клетки, что в конечном итоге укорачивая
жизнь эритроцитов и делает их чувствительными к различного рода окислителям.
Происходят образование перекисных соединений и гемолиз эритроцитов.
Гемотрансфузионная тактика при наследственном дефиците Г-б-ФД имеет
некоторые особенности, обусловленные склонностью аномальных эритроцитов
к гемолизу.
Среди факторов, провоцирующих гемолитический криз при наследственном
дефиците Г-б-ФД, — употребление определенных лекарственных препаратов
или пищевых продуктов, инфекции.
Гемолитический криз — синдром, характеризующийся резким обострением
клинических и лабораторных признаков гемолиза эритроцитов.
Гемолитический криз (острый внутрисосудистый гемолиз) при наследственном
дефиците Г-б-ФД развивается спустя несколько часов или дней после воздействия
провоцирующего фактора. При этом надо отметить, что чем раньше развивается
гемолиз, тем более вероятно его тяжелое течение.
Выраженность гемолиза варьирует в зависимости от варианта фермента, уровня
активности Г-б-ФД и дозы принятого препарата. Распространенный на террито¬
рии Азербайджана средиземноморский вариант Г-б-ФД Med- характеризуется
чувствительностью к более низкой дозе оксиданта, чем другие варианты фермента.
Кроме того, для него характерна уменьшенная активность Г-б-ФД и в молодш
клетках - ретикулоцитах. Таким образом, наблюдаемое при африканском вариан¬
те самоограничение гемолиза при Г-б-ФД Med- многими авторами оспаривается.
Необходимо отметить, что ретикулоцитоз, ограничивающий гемолиз за счет более
высокого уровня Г-б-ФД в молодых клетках и которому отводится основная роль
в самоограничении, развивается лишь на 4-6-е сутки от начала гемолитического
криза.
Фавизм представляет собой одно из проявлений носительства мутантного гена
и возникает при употреблении в пищу конских бобов (а также черники, голуби-
ки, фасоли, гороха), вдыхании пыльцы этого растения или нафталиновой пыли
Развитию криза могут предшествовать продромальный период, слабость, озноб,
сонливость, боли в пояснице и животе, тошнота, рвота.
Гемолитический криз при фавизме носит стремительный и тяжелый характер-
чаще других эта форма недостаточности активности Г-6-ФД осложняется острой
почечной недостаточностью.
Лечение в период гемолитического криза при дефиците Г-б-ФД всегда провод
в стационаре и оно направлено на купирование анемического синдрома, билир)
биновой интоксикации и профилактику осложнений.
Существующую тактику лечения гемолитического криза при дефиците Г-6
проводят по принципу терапии ДВС-синдрома. Для предупреждения или устр8
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 751
нения острой почечной недостаточности показана инфузионная терапия на фоне
зеПщратат<и.
Тактика лечения гемолитического криза при наследственном дефиците
фермента Г-б-ФД
, По возможности исключают фактор, провоцирующий гемолиз.
• Для купирования анемического синдрома при снижении концентрации
гемоглобина до 40 r/л и менее проводят переливание эритроцитной массы
от донора без дефицита Г-б-ФД (способствует увеличению процентного
содержания эритроцитов с нормальной активностью фермента).
• Для предупреждения метаболического ацидоза внутривенно капельно вво¬
дят 500-800 мл 4-5% раствора натрия гидрокарбоната. Действуя как слабое
диуретическое средство, он способствует быстрейшему выведению продуктов
гемолиза и предупреждает образование солянокислого гематина в почечных
канальцах.
• Для улучшения почечного кровотока внутривенно струйно назначают
10-20 мл аминофиллина 2,4% в 10 мл раствора натрия хлорида, что усили¬
вает мочегонный эффект фуросемида (при отсутствии артериальной гипо¬
тензии).
• Для поддержания форсированного диуреза внутривенно капельно назначают
10% раствор маннитола из расчета 1 г/кг.
• Для борьбы с гиперкалиемией внутривенно капельно вводят раствор глюко¬
зы* с инсулином растворимым.
• Для профилактики почечной недостаточности назначают фуросемид внутри¬
венно струйно в дозе 40-60 мг, через 1,5—2,5 ч вызывающий форсированный
натрийурез.
1 Для профилактики ДВС целесообразно назначение малых доз гепарина
натрия под кожу живота,
і При развитии анурии введение маннитола не показано, а при нарастании
почечной недостаточности проводят перитонеальный диализ или гемодиализ.
• Эффективно введение витамина Е, эревита*. ксилита*’ в дозе 5-10 г 3 раза
в день в сочетании с рибофлавином в дозе 0,02-0,05 г 3 раза в день, что спо¬
собствует увеличению содержания восстановленного глутатиона в эритро¬
цитах.
В исследованиях по применению экстракорпоральных методов гемокоррекции
при острых гемолитических кризах, обусловленных недостаточностью активности
Г-б-ФД, доказана их высокая эффективность. Плазмаферез был проведен в раннем
периоде гемолитического криза при фавизме (5 человек) и при лекарственно инду¬
цированном гемолизе (6 человек), обусловленном дефицитом фермента Г-б-ФД.
Во всех описанных случаях активность Г-б-ФД колебалась в пределах 0-3%
нормальной величины. Среди пациентов 8 мужчин (от 8 до 32 лет) и 3 женщины
(от 18 до 27 лет).
Процедуру проводили при первых признаках гемолитического криза через
2.6 ч, через сутки после употребления в пищу бобовых. Плазмаферез осуществляли
Дискретным центрифугированием с удалением в среднем одного объема циркули¬
рующей плазмы (в зависимости от массы тела больного ОЦП различен). Удаленный
объем плазмы замещали донорской плазмой, растворами кристаллоидов.
Критерием для определения объема удаляемой плазмы служила величина сво¬
бодного гемоглобина плазмы.
Надо отметить, что уже в процессе детоксикации отмечались значительное
улучшение общего состояния пациентов, уменьшение выраженности симптомов
билирубиновой интоксикации (снижение уровня билирубина до величин, корри-
горуемых консервативными способами в течение следующих суток, осветление
м°чи). Период реконвалесценции существенно укоротился по сравнению с паци-
Л2 ияркекпя трмсфузиопили
еяггамя. которым плазмафереэ не выполняли. Ни у одного из пациентов посд.
доенного плазмафереза не развились симптомы острой почечной недоста-,, ^
ЗМІНИШ от fimi in пг которым не выполняли плазмаферез. Анализ арх^"
ЇЙ- болезни 20 больных с гемолитическим кризом на фоне фавизма вы Hbu
что у 9 человек (45%), лечение которых проводили традиционным способом (
доено выше), возникли симптомы острой почечной недостаточности разлив*
степени тяжести.
В одном случае гемолитического криза на фоне фавизма был проведен повт
ный сеанс плазмафереза через сутки с удалением одного объема Циркулирую^
плазмы. Эффективность плазмафереза при гемолитических кризах, обусловлен^
недостаточностью Г-6-ФД. была подтверждена исследованиями Д.Б. Гаджие^
я соавт. в 2005 г.
Полученные результаты позволяют включить плазмаферез на ранних стадию
гемолитического криза при дефиците Г-6-ФД (особенно при фавизме) в стан-
дартный протокол комплексной интенсивной терапии. Плазмаферез позволяет
удалить свободный гемоглобин плазмы, продукты клеточного распада, строму
разрушенных дефектных эритроцитов из плазмы крови, значительно уменьшить
количество эритроцитов с дефектами мембран и старых, функционально мало¬
активных форм. Кроме того, плазмаферез способствует увеличению поступления
тканевой жидкости из собственных тканей организма в кровяное русло, улучше¬
нию микроциркуляции в периферических сосудах, сосудах печени и почек, малом
круге кровообращения, оказывая положительное влияние на реологические свой¬
ства крови, свертывающую и иммунную системы. Помимо детоксикационного,
необходимо отметить антиоксидантный эффект экстракорпоральных процедур.
Элиминация продуктов свободнорадикального окисления приводит к увеличению
активное™ факторов оксидантной защиты, что имеет особое значение при дефи¬
ците фермента Г-6-ФД.
ПРИМЕНЕНИЕ ХЕЛАТОРОВ ПРИ ТРАНСФУЗИОННОЙ ТЕРАПИИ НАСЛЕДСТВЕННЫХ
АНЕМИЙ
Избыток железа в организме приводит к повышению концентрации железо¬
связывающих белков: ферритина и гемосидерина. Железо является катализатором
окислительных процессов в биохимических реакциях. Кроме того, избыток ткане¬
вого железа способствует необратимому поражению молекул и тканей.
Основные причины, приводящие к перегрузке организма железом:
І повышенная абсорбция пищевого железа (сидероз Банту);
• первичный гемосидероз;
j повышенная абсорбция железа вследствие повышенной эритропоэтической
активности костного мозга (большая (3-талассемия, сидеробластная ане¬
мия);
• трансфузионная перегрузка железом (большая и промежуточная формы
р-талассемии, гемоглобинопатия Н, конституциональные гипо- и апластиче-
ские анемии, хронический гемодиализ и др.).
Стандартная тактика лечения р-талассемии — постоянные гемотрансфузии,
начатые еще в раннем возрасте. Гипертрансфузионный режим обеспечивает таким
пациентам нормальное качество жизни, снижает гиперактивность красного кост¬
ного мозга, предотвращает деформацию плоских костей, снижает проявления
гиперспленизма, Длительная гемотрансфузионная терапия способствует накопле-
нию железа в организме и развитию гемосидероза внутренних органов. В среднем
такие пациенты получают до 165 мг/кг эритроцитной массы в год (больные поел*
сплеиэктомии - 140 мг/кг в год). Это количество соответствует 180 мг железа
из 1 кг массы тела (для больных после спленэктомии — 160 мг железа на
массы тела). Избыток железа накапливается в клетках ретикулоэндотелиально11
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 753
емкость которой составляет 10-15 г железа, откладывается в паренхима-
органах, коже, приводит к кардиомиопатиям, сахарному диабету, гипопа-
^иоеозу. циррозу печени и т.д. В связи с этим единственным способом предот-
^«хьпоследствия накопления железа в организме является длительная терапия
^торами, что способствует выведению железа и профилактике гемосидероза,
^астояшее время назначают десфероксамин и деферипрон*\
десфероксамин связывает свободное сывороточное железо, вытесняет его
комплекса с трансферрином и ферритином, а также выводит внутриклеточное
лезо из гепатоцитов. Показаниями к хелаторной терапии являются повышение
Іовяя сывороточного ферритина (>1000 нг/мл) и положительная десфероксами-
вая проба. При СКА десфероксамин рекомендуют назначать при концентрации
Еррйтдна более 2500-3000 нг/мл.
Данный препарат назначают при каждой гемотрансфузии (500 мг десферокса-
мина внутривенно) одновременно с переливаемым компонентом крови, а также
„о2 инъекции в сутки внутримышечно в дозе 25-50 мг/кг в сутки.
Аскорбиновая кислота, назначаемая через месяц после начала терапии, потен-
пирует действие десфероксамина и усиливает эффективность хелаторов.
При высокой концентрации ферритина в сыворотке крови (>5000 мкг/л). т.е.
пои большей перегрузке железом, рекомендуют применение 6-8 мг десфероксами¬
на в сутки в течение 24 ч внутривенно капельно. Курс длится 2-3 нед с последую¬
щим назначением десфероксамина в дозе 40-50 мг/кг в сутки подкожно в течение
6-8 ч (используют портативный перфузатор) или деферипрона* (ежедневно
в дозе 50-75 мг/кг в сутки).
Некоторые исследователи отмечают хороший эффект комбинированной тера¬
пии хелаторами: десфероксамином (40-50 мг/кг в сутки 2-3 раза в неделю
или 50-75 мг/сут внутривенно параллельно гемотрансфузии 1 раз в месяц) и дефе-
рипроном*’ (50-75 мг/кг в сутки ежедневно). Комбинированная терапия позволя¬
ет усилить хелатный эффект при отсутствии риска токсических проявлений.
Среди осложнений хелаторной терапии необходимо отметить местные реакции
в виде отека, токсические и анафилактические реакции, возникающие при длитель¬
ном применении десфероксамина или высоких доз препарата (100 мг/кг в сутки) -
так называемый дозозависимый эффект. Может развиться катаракта, отмечаются
снижение слуха, ночная слепота, дисплазия метафизов костей, отставание в росте.
Кроме того, хелаторы образуют комплексы и с другими металлами (медью, цин¬
ком, алюминием, технецием), что приводит к выведению их из организма. Однако
подобные нежелательные реакции возникают лишь при недостатке железа в орга¬
низме, так как сродство десфероксамина к этим металлам намного меньше.
ТАКТИКА ТРАНСФУЗИОННОЙ ТЕРАПИИ ПРИ АУТОИММУННОЙ ГЕМОЛИТИЧЕСКОЙ
АНЕМИИ
При аутоиммунных гемолитических анемиях трансфузии назначают больным
с сильно выраженной анемией, которая может вызвать нарушение сердечной
деятельности, легочную недостаточность, головокружение, слабость, тахикардию,
боли в груди. Таким образом, определяющим фактором тактики гемотранс¬
фузионной терапии при ЛИГА является ее проведение только но жизнен-
иьїм показаниям.
Существуют некоторые трудности лечения пациентов с АИГА: у таких больных
в плазме крови могут циркулировать аллоантитела, несовместимые или малосо¬
вместимые с компонентами переливаемой крови вследствие сенсибилизации орга¬
низма предыдущими трансфузиями конфликта -«мать-плод» при беременности.
Гакие аллоантитела трудно выявить при лабораторной диагностике.
Переливание эритроцитной массы проводят только после теста на индиви¬
дуальную совместимость в непрямой пробе Кумбса. Необходимо помнить, что
754 иіннескля трінсфузвюяогмя
трансфузионная терапия не является методом лечения ЛИГА, и после v
состояния больного ее прекращают. лу^*Иц|
I принципы трансфузионной терапии у больных с ЛИГА
• При тяжелом СОСТОЯНИИ больного И ВЫСОКОМ риске нарушения Се
деятельности или функции головного мозга трансфузии назначают^1**
ленно, даже до проведения всех серологических тестов. Не%
• Всем пациентам, даже тем. кому никогда не проводили гемотп
зин и у кого отсутствовали беременности в анамнезе, переливаю С^’
и ^-совместимые эритроциты. АВО.
• Всем пациентам, имеющим в анамнезе гемотрансфузии или беремен
обязательно проводят серологическое исследование в целях выявления1001’1,
антител. Переливаемые эритроциты должны быть негативными по ан^
нам. против которых направлены аллоантитела.
1 Переливают относительно малое количество эритроцитов (0,5-1,о in IN
лым и 2-5 мл/кг детям). Такого объема обычно бывает достаточно
устранения признаков и симптомов анемии. Дополнительные трансЛуз
могут вызывать нарушения сердечно-сосудистой системы.
• Пациентам с Холодовой агглютининовой болезнью и пароксизмальной Холо¬
довой гемоглобинурией необходимо переливать предварительно согреты'
и предпочтительно отмытые эритроциты.
• Трансфузии осуществляют медленно и С Применением лейкоцитных филь-
тров для предотвращения трансфузионных реакций, которые моїуг был,
спутаны с гемолитическими.
• После трансфузий рекомендуют назначение фуросемида и наблюдение
за больным в течение 6-12 ч для предотвращения перегрузки организма
жидкостью.
і Необходимо постоянное наблюдение за больным в связи с возможными
гемолитическими посттрансфузионными реакциями, так как острый внутри-
сосудистый гемолиз может возникнуть и при отсутствии любой серологиче¬
ской несовместимости.
• В ходе предоперационной подготовки трансфузии назначают для увеличения
концентрации гемоглобина до 80 г/л.
ПАРОКСИЗМАЛЬНАЯ НОЧНАЯ ГЕМОГЛОБИНУРИЯ
(БОЛЕЗНЬ МАРКИАФАВЫ-МИКЕЛИ)
Пароксизмальная ночная гемоглобинурия — приобретенная гемолитическая
анемия, обусловленная дефектом мембран эритроцитов и повышением их чув¬
ствительности к компонентам комплемента сыворотки.
Показаниями к гемотрансфузиям являются низкая концентрация гемоглоби¬
на и тяжелое общее состояние больного, при этом назначают размороженные
и отмытые (>5 раз) эритроциты, желательно после теста на индивидуальную
совместимость в непрямой пробе Кумбса. Это обусловлено тем, что многие боль¬
ные нуждаются в постоянных трансфузиях, и с течением времени у них возникают
трансфузионные реакции даже на отмытые эритроциты. Количество трансфузии
определяется концентрацией гемоглобина. Многим больным необходимы транс¬
фузии с интервалом от 5 дней до нескольких месяцев. В связи с повышенной чув¬
ствительностью эритроцитов к компонентам комплемента трансфузии эритроцит¬
ной массы небольших сроков хранения (свежезаготовленной или до 1 нед) строго
противопоказаны. Они провоцируют гемолитические кризы из-за присутствия
пропердина и лейкоцитов, что приводит к образованию антилейкоцитных антител
и активации комплемента.
Частые гемотрансфузиии могут стать причиной сенсибилизации больного
к антигенам компонентов донорской крови, и, как следствие, синтезированные
ГЕМОТРАНСФУЗИИ ПРИ АНЕМИЯХ 7S5
низмом антиэритроцитные и антилейкоцитные антитела могут провоциро-
^ усилсйие гемолиза. Избежать этого осложнения можно, строго придержива*
^следующих правил:
^ осуществлять гемотрансфузии делейкоцитированных компонентов крови:
* все трансфузии эритроцитов выполнять при их индивидуальной совместимо-
* сти В Пробе Кумбса:
, гемотрансфузию осуществлять отмытыми эритроцитами сроком хранения
* не более 7 дней:
минимизировать для конкретного больного количество доноров, от которых
осуществляется забор крови.
Заместительная гемотрансфузионная терапия показана для подавления проли¬
ферации аномального клона.
Парциальная красноклеточная аплазия - аутоиммунное заболевание, в основе
которого лежит аутоагрессия к эритроидному ростку кроветворения, вследствие
чег0 развивается выраженный анемический синдром. В периферической крови
отмечается нормохромная анемия при нормальном уровне лейкоцитов и тромбо-
ЦЛТОВ.
Заместительную гемотрансфузионную терапию применяют у больных, рези¬
стентных к терапии глюкокортикоидами, и при высоком пороге ответа на терапию
преднизолоном.
Переливание эритроцитной массы (только отмытые эритроциты) назначают
каждые 3-4 нед, и оно оказывает симптоматический терапевтический эффект.
Больным, у которых в сыворотке крови были обнаружены циркулирующие
иммунные комплексы или ингибитор эритропозтина, показаны плазмаферез
или плазмосорбции.
СПИСОК ЛИТЕРАТУРЫ
Аграненко В.А. Проблема лейкофильтрации и безопасность гемотрансфузий // Вестник
службы крови России. — 2002. — №1. — С. 7-9.
Асадов Ч.Д. Морфофункциональная характеристика сегментоядерных нейтрофилов
убольных с гетерозиготной р-талассемией: Дис.... канд. мед наук. — М.. 1984. - 198 с.
Вайрамалибейли И.Э. Донорство и аутодонорство при наследственных аномалиях
крови - дефиците фермента Г-б-ФД и гетерозиготной талассемии: Дис.... д-ра мед. наук. —
М., 2006.- 238 с.
Вайрамалибейли И.Э., Рагимов А.А., Гаджиев Д.Б. Применение плазмафереза при гемо¬
литическом кризе, обусловленном дефицитом фермента Г-б-ФД // Труды XI Конференции
Московского общества гемафереза. 20-21 мая. — М.. 2003. — С. 11.
Гаджиев Д.Б., Вайрамалибейли И.Э., Рагимов А.А. Режимы проведения плазмафере¬
за при гемолитических кризах, обусловленных наследственным дефицитом фермента
Г-6-Фд//Труды XIII Конференции Московского общества гемафереза, 30 мая-1 июня. -
М..2005.-С. 130-131.
Гайдукова С.Н., Выдыборец С.В. Современные комплексные подходы к терапии ЖДА //
Актуальные вопросы гематологии и трансфузиологии (материалы научно-практической
конференции). - СПб., 2000. - С. 165-166.
Дашкова Н.Г. Аллоиммунизация эритроцитарными и лейкоцитарными антигенами боль¬
ных гомозиготной талассемией, получающих множественные гемотрансфузии // Вестник
службы крови России. - 2005. - №2. - С. 52-56.
Кузнецова Ю.В. Обзор научной литературы по проблеме удаления лейкоцитов из донор¬
ской плазмы // Трансфузиология. — 2005. — №2. — С. 108-114.
Окороков А.Н. Диагностика болезней внутренних органов: Т. 4. Диагностика болезней
системы крови. - М.: Мед. лит., 2001. - 512 с.
Окороков А.Н. Лечение болезней внутренних органов: Т. 3, кн. 2. Лечение болезней серд-
и сосудов. Лечение болезней системы крови. — М.: Мед. лит., 2001. — 480 с.
Покровский В.И., Селиванов Е.А., Суханов Ю. С и др. Экономическая оценка использо-
^иия в России современных технологий для получения качественных компонентов крови
и* безопасного применения // Вестник службы крови России. — 2005. — N*4. — С. 7-11.
ці tmwH&fM тисФптонхю
Н^ВНММІгЯЬИ^тмігачесміїі структуре популяции и иммунитет при наст
шВВ&вдмав (пшоглобииопатиях и дефиците фермента J -6-ФДу ть*.
аца. - ИШ7. - 297с. ..
Гішмпа Л А . ЫАрамалибейли И.Э. Основы диагностики, профилактики и «—■
мм М ГОУ НУНМЦ М3 РФ, 2002. - 288 с. ***
А.А . Дашкова Н Г . Наэарли А.Г и др. Влияние гемотрансфузий на п
МІМбщрм мавши* железа у больных с различными формами талассемии // Г»м
й цжисфую-яопм - 1986. N*11. - С. 14-18. >,МйлЦ»
||Вш§Н|9АХ. Агрдмеико В.А. Клиническая трансфузиологии. М.: ГЭОТАР-и,
- Ш*.
Седмммш Е.А Разработки и первый опыт применения отечественного уС7В( •
ддя удалений лейкоцитов из донорской крови и других эритродитных сред // Пв</*
тавтология. 1999. - N*1. — С. 54 -59. і*0***!
Смгганнна Н.С.. Токарев Ю.Н. Хелаторная терапия при вторичной (постгрансАу
железом /' Гематология и трансфузиологии. - 1999. №5. -
Таги-иле Р. К.. Азимова А.А.. Керимов А.А. и др. Вирусный гепатит С у ди^й г
ЯШ гомгаитеггной талассеммей. в Азербайджане // Материалы XI национального конпжъ
Азербайджана по аллергологии, иммунологии и иммукореабилитадии. — Баку. - 20М
С. >43-345.
Токарев ЮН. Гемоглобинопатии: географическое распространение, этиопатогено, диапю-
егикн. принципы лечении и профилактика // Терапевтический архив. - 1988. - №5. - с. 61
Токарев Ю.Н, и др. Влияние различных схем трансфузионной терапии на метаболии
«ту больных Р'талассемией // Актуальные вопросы службы крови и трансфузиологии1
Тезисы доклада. - СПб.. 1995. - С. 369-370.
Токарев Ю.Н.. Скачилова Н.Н., Алехина З.М. и др. Применение размороженныхотмьгші
^ЩЙИЙЙ1 больных с р-талассемией // Гемолитические анемии (1-я Республикански
научная конференция). - Душанбе, 1976 — С. 101-102.
Троицка» О В., Юшкова Н.М.. Волкова Н.В. Гемоглобинопатии: Учебное пособие.-М.:
Идаво РУДН. 1996. ~ 145 с.
Шиффман Ф.Дж. Патофизиология крови: Пер. с англ. — СПб.: БИНОМ: Невский диалект,
2000. I 448 І
'ШшК9Ф 0Л.. GHhens J.H.. Alcorn К. et al. Experience with donors matched for minor blood
group antigens in patiens with sickle cell anemia who are receiving chronic transfusion therapy//
Trtnifwkm. 1987. - Vol. 27. - P. 94 98.
АшеНежп Society of Anaesthesiogists. Task Force on Blood Component Therapy. Practice
guidelines for blood component therapy // Anaesthesiology. — 1996. — Vol. 84. — P. 732-747.
Amlet A.M.. Goodnough L.T. Practice strategies for elective red blood cell transfusion //Ann.
Intern. Med, 1992. Vol, 116. P. 403-406.
Bayramalibeilv I.E.. Raginiov A.A. Blood component therapy in the areas with high prevalence
of congenital glucose-ь-phosphate dehydrogenase (G-6PD) deficiency // VIII European congress
ISBT. I 2003. - P. 155.
Bunn H.K Sickle hemoglobin and other hemoglobin mutants // In: Stamatoyoannopolous G.,
Nienhuisi A.W., Majerut P,W, Vannus H. (eds). The molecular Basis of Blood Diseases.
Philadelphia. 1994. P. 207 256Bunn H. F„ Forget B.G. Hemoglobin: Molecular. Genetic and
Clinical Aspects. Philadelphia: W.B. Saunders. 1986. — 207 p.
Castro О j Finke-Castro H.. Coats D. Improved method for automated red cell exchange in sickle
cell disease 1 /J. Clin. Apheresis. 1986. —Vol. 3. — P. 93-99.
Сапами I)., O/saucak A Temimhan N. Transfusion reactions in patients with thalassemia '
International Conference on Thalassemia and the Hemoglobinopathies, Malta. - 1997. - N 55. -
I 108 111.
(jtiut>m D., Oguz N.. Balt,i N.. Cosan R. et al. Red cell antibodies in patients with (i-thalassenn*
И I BBTM. 2003. Vol. 1. N 1. - P. 31 34.
Canatan D. Iranshision coinplications in patients with thalassemia // ISBT. - 2003. “ «.
Cgppeillni M f)., Gratiadei G., Ciceri L., Cotnino A. et al. Butyrate trials // Ann. N. J- Ac*®-
Art 1998 VOl. 850, P. 110 119.
Y Sitrkar ІI Marwahu K.K . Dilawari J.B. Multitranstused children with thalassen
•Mjor I not have g.iihiiifit-s Prop, Gastroenterol. — 1997, - Vol. 18(3). - P. 107-108. ^
" Chench» S Treatment **l sickling disorders /7 Curs. Opin. Hematol. - 1996. Vol. 3 («•
І Ш-И4.
гвмпмнсдазйи да» диаю® 757
(jsetropadhya D.. Aggawal 8.. Kumari S.S. et al. Lack of evidence of HTV-2 infection amet»
souBSransfHsed thalassemic children in the city of New Delhi 1 letter 1 H I IVon Pediatr - 19%
Apr.-V(d.42(2).-P. 116-117.
Саара M„ Clemente M.G., Don C. et al. HLA class II genes in chronic hepatitis С «іщ>
jfljtttion and associated immunological disorders // Hepatoiogv - 1996. Dec. - Vol. 24 (6) •
P. 1338-1341. ^
Dzic W Use of leucodepletion Filters for the removal of bacteria / Immunol Invest - 1995
Vd 24, N 1. - P. 95-115.
Embury S.H.. Hebbel R.P.. Mohandas N, et al. Sickle Cell Disease: Basic Principles and Clinical
practice- - New York: Raven Press; 1994. - P. 113-120.
Expert Working Group. Guidelines for red blood and plasma transfusion for adults and chib
jjtn j/ Can Med. Assos. — 1997. — Vol. 156. - P. 1-24.
Galanello R.. Cao A. Relationship between genotype and phenotype. Thalassemia intermedia .
Ann.N.J. Acad. Sci. - 1998. - Vol. 850. - P. 325-333.
Gandini G., Franchini М.. Bertuzzo D. Preoperative autologous blood donation by 1073
elderly patients undergoing elective surgery: a safe and effective practice Transfusion: 1999. -
yd 39,2.-P. 174-178.
Garratty G. Severe reactions associated with transfusion of patients with sickle cell disease (edi¬
torial) //Transfusion. - 1997. - Vol. 37. - P. 357 361.
elGohary A., Hassan A., Nooman Z. et al. High prevalence of hepatitis С virus among шЬая and
rural population groups in Egypt // Acta. Trop. - 1995. May - Vol, 59 (2). - P. 155 161
al Fawaz I., al-Rasheed-S.. al-Mugeiren-M. et al. Hepatitis E virus infection in patients from
Saudi Arabia with sickle cell anaemia and beta-thalassemia major possible transmission by blood
transfusion //J. Viral. Hepat. — 1996, Jul. - Vol. 3 (4). - P. 203-205.
Hebert P.C., Schweitzer I., Calder L et al. Review of the clinical practice literature os allogenic
red blood cell transfusion //Can. Med. Assos. J. — 1997. - Vol. 156. - P. 9-26.
Herbert V. Everyone should be tested for iron disorders J. Am. Diet. Assos. - 1992. - VoL 92
(12) - P. 1502-1509.
Hoffbrand A.V., A.L. Refaire F., Davis et al. Long term trial of defers prone hi 51 transfusion-
dependent iron overloaded patients // Blood. - 1998. - Vol. 91 (1). - P. 295-300.
Но H.K., Ha S.Y., Lam C.K. Alloimmunisation in Hong Kong southern Chinese transfusion -
dependent thalassemia pathients // Blood. - 2001. - Vol. 97 - P. 3999-4000.
Jefferies I.C. Transfusion therapy in autoimmune hemolytic anemia Hemard. Oncol. Clin.
North Am. - 1994. - Vol. 8. - P. 1087-1104.
Kaygusuz 1„ Sonmezoglu М., Ones T„ Dede F. Factors affecting the red cell survival in patients
receiving multiple blood transfusions // BBTM. — 2003. — Vol. 1. N 1. - P. 24 30.
Kim H.C., Dugan N.P., Silber J.H. et al. Erythrocytapheresis therapy to reduce iron overload in
chronically thransfused patients with sickle cell disease Blood. - 1994. - Vol. 83. - P. 1136—
1142.
King K.E., Shrey R.S.. Lankiewicz M.W. et al. Delayed hemolytic transfusion reaction in sickle
cell disease: Simultaneous destruction of recipients red cell Transfosion. 1997. Vol. 7.
P. 376-381.
Kocovska V.. Timova Т., Kostovska S. Compared overview for presence of transfusion trans¬
mitted infections to the voluntary and family donators within the last five years in the region of
Tetovo// ISBT Vox. Sang. - 2005. Vol. 89 (Suppl, 1) P. 97.
Mujeeb S.A.. Shiekh M. A. Prevalence of hepatitis В infection in beta thalassaemia major patients
Petter] // JPMA J.Pak. Med. Assoc. - 1996. Apr. - Vol. 46 (4), P. 93.
Muyile L Cytokines in haemolytic and non-haesnolytic transfusion reactions Y1 Regional European
congress of the international society of blood transfusion. -- Israel, Jerusalem. 1999. P. 19.
Nathan D.G. Pioneers and modern ideas. Prospective on thalassemia // Pediatrics. 1998.
Vol. 102. - P. 281-283.
Oliviery N.F. The (і-thalassemia/ Acta, haemat. (Basel.). -1996. Vol. 95. ~ P. 37-48.
OUviery N.F.. Koren G.. Harris J. et al. Thalassemia, clinical management/ Amer. J. Pediat
Hemat. Oncol. - 1992. - Vol. 14. - P. 48 -56.
Olivieri N.F. Thalassaemia: Clinical management 7 Clinical Haematology. - 1998. Vol. 11. -
P. 147-162.
Petz L. D. Tomasula P.A. Red cell transfusion / J. Kolins. LJ. Carthy (eds) / Contemporary
transfusion practice — Arlington, VA. AABB. — 1987. - P. 1-25.
ТИ КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
ha LD.. Calhoun L., Shuhnan LA. et al. The sickle cell hemolytic transfusion <•„.
Transfusion. 1 1997. — Vol. 37. — P. 382-392. .
И J.. Transmitted viral infections in France between 1992 and 2000 // jra
2002.1 Vol. 42 (8). - P. 980-988. s
JtHMfflS, Corash L. Davenport D. In vivo liability of G-6-PD in GdA and Gd Merit»
I ain. Invest. - 1968. - Vol. 47. - P. 940-948.
Piomeih S.. Karpatkin M.H. et al. Hypertransfusion regimen in patients with Cooley*
Atm N. І Acad. Sci. 1 1974. - Vol. 232. - P. 186-192. y an%,.
Propper 8. Current concepts in the overall management of thalassemia // Am. J. у Acad
1980.1 Vol. 344.1 P. 375-383. -
Rebuild F. Transfusion reactions in thalassemia. A survey from the Cooleycare proirra
- 1990. - Vol. 75 (Suppl. 5). - P. 122-127. 6 //
Kebuila P.. Modell B. Transfusion requirements and effects in patients with thalassemia ma
lancet. § 1991.1 Vol. 337. - P. 227-280. a,or//
Rebulla P. Blood transfusion in p-thalassemia major // Transfus. Med. - 1995. - Vol 5 r4\
P. 247-258. '
Rebulla P., Modell B. Transfusion requirements and effects in patients with thalassemia main»/
Lancet. I 1991. - Vol. 337. - P. 277-280. №//
Rosse W.F., Gallagher D.. Kinney T.R. et al. Transfusion and alloimmunisation in sickle rai
disease I Blood. - 1990. - Vol. 76. - P. 1431-1437.
Scott-Conner C.E. H.. Brunson S.D. Surgery and anesthesia / S.H. Embury. R.p.
N. Mohandas. M.H. Steinberg (eds.) Sickle cell disease. Basic principles and clinical practice-!
New York: Raven Press, 1994. — P. 809-827.
Sharon B.I. Transfusion therapy in congenital hemolytic anemias // Hematol. OncoL Clin
North. Am. 11994. - Vol. 8. - P. 1053-1086.
Singer S.T., Wu V.. Mignacca R. et al. Alloimmunisation and erythrocyte autoimmunisation и
transfusion-dependent thalassemia patients of predominantly Asian descent // Blood. - 2000 -
Vol. 96.1 P. 3369-3373.
Sokol R.J.. Hewitt S., Booker D .J., Morris B.M. Patients with red cell autoantibodies: selection of
blood for transfusion // Clin. Lab. Haemat. — 1988. — Vol. 10. — P. 257-264.
Spiess B.D.. Counts R.B., Gould S.A. Perioperative transfusion medicine // Blood. -1997. - P. 607.
Tagi-zadeh R. K., Karimov A.A., Hasanov A.R., Novruzova L.Y., Donskov S.I. Distribution of
RH and Kell antigens and phenotypes of RBC among patients with homozygous betta-thalassemia
in Azerbaijan. // ISBT Vox. Sang. — 2005. — Vol. 89 (Suppl. 1). — P. 152.
Tahhan H.R.. Holbrook C.T., Braddy L.R. et al. Antigen-matched donor blood in the transfusion
management of patients with sickle cell disease // Transfusion. — 1994. — Vol. 34. — P. 562-569.
Yund G.L., Channick R.N., Fedulio P.K. et al. Succesful pulmonary thromboendarerectomyin
two patients with sickle cell disease //Am. J. Respir. Crit. Care Med. — 1998. — Vol. 157 (5 pt 1). -
P. 1690-1693.
Vichinsky E.P. The morbidity of bone disease in thalassemia // Ann. N. Y. Acad. Sci. - 1998. -
Vol. 30.850.1 P. 344-348.
Vichinsky E.P., Haberkem C.M., Neumayr L. et al. A comprasion of servative and aggressive
transfusion in the preoperative managment of sickle cell disease // N. Endl. J. Med. - 1995. -
Vol. 333.1 P. 206-213.
Vichinsky E.P., Earles A., Johnson R.A. et al. Alloimmunisation in sickle cell anemia and trans¬
fusion of racially unmatched blood // N. Engl. J. Med. — 1990. — Vol. 322. — P. 1617-1621.
Vladareanu F., Constantinescu I.. Voicu D., Nitu I. Death causes in patients suffering from beta
thalassaemia major in Romania // ISBT Vox. Sang. — 2005. — Vol. 89 (Suppl. 1). - P-182.
Yoshida A. Subunit structure of human glucose-6-phosphate dehydrogenase and its Genetics
Implication-biochem // Genet. — 1968. — Vol. 2. — P. 237-243.
Wayne A.D.. Kevy S.V., Nathan D.G. Transfusion managment of sickle cell anemia //Blood -
1993.1 Vol. 81. і P. 1109-1123.
Welch H.G., Meehan K.R., Goodnough L.T. Prudent strategies for elective red blood cell trans¬
fusion // Ann. Intern. Med. - 1992. — Vol. 116. — P. 393-402.
Wood W.J. Haemoglobin synthesis during human fetal development // Brit. Med. Bull -
1976.1 Vol. 32. N 3. І P. 282.
Zinkhain W.H., Seidier A.J., Kickler T.S. Variable degrees of suppression of hemoglobin S syn
teHs in subjects with hemoglobin SS disease on a long-term transfusion regimen // J- Pediatr.
1994. І Vol. 124. - P. 215.
Глава 21
Диссеминированное
внутрисосудистое свертывание
крови
ОСНОВНЫЕ СВЕДЕНИЯ
О ДИССЕМИНИРОВАННОМ ВНУТРИСОСУДИСТОМ
СВЕРТЫВАНИИ КРОВИ
Диссеминированное внутрисосудистое свертывание крови (ДВС) -
сложный многокомплексный патологический процесс системы
гемостаза, ведущий к блокаде микроциркуляторного русла жизнен¬
но важных органов с последующим развитием их дисфункции.
ДВС — сложный процесс как с диагностической, так и с тера¬
певтической позиции. Клинические проявления ДВС различны,
диагностические критерии разнообразны. Несмотря на длительные
исследования ДВС в научных центрах многих стран, еще не разра¬
ботаны единые принципы терапии этого синдрома.
ДВС — одна из наиболее часто встречающихся в интенсивной
терапии патологий гемостаза. Увеличение количества диагно¬
стируемых случаев ДВС-синдрома при различных заболеваниях
связано как с выявлением новых данных об этиопатогенезе этого
заболевания, так и с возросшими диагностическими возможно¬
стями.
Синдром ДВС всегда является следствием или осложнением
основного заболевания. Пусковым фактором ДВС могут быть сеп¬
сис, шок любой этиологии, ВИЧ-инфекция, тяжелые хирургические
заболевания (панкреатит, травматичные хирургические вмешатель¬
ства), акушерская патология (подробнее этиология ДВС-синдрома
рассмотрена ниже). Смертность зависит от тяжести заболевания,
вызвавшего ДВС: чем тяжелее течение основного заболевания,
тем выраженнее проявления ДВС-синдрома.
Для ДВС характерны следующие изменения в органах:
• микрососудистый тромбоз:
• признаки системного воспаления;
• кровоточивость;
• тканевая дисфункция.
Поражение органов является результатом неконтролируемой
активации систем гемокоагуляции и воспаления.
Терминология, употребляемая для обозначения данного патоло¬
гического процесса, довольно разнообразна:
7(0 кЛИНКНССХЛЯ ГРАНСФУЗИОЛОГИЯ
I синдром диссеминированного внутрисосудистого свертывай
синдром: я’ пли д^.
• синдром РВС. или СРВС, - синдром рассеянного внутрисосуди
вания; СТОг° св^
• гнперкоагуляционный синдром;
• ТГС - тромбогеморрагический синдром;
• ВСФ - внутрисосудистое свертывание и фибринолиз;
• коагулопатия потребления.
В последние годы наиболее часто используют термин «диссеминипов
трисосудистое свертывание крови», или ДВС-синдром. анн°евну.
В настоящее время ДВС рассматривают как общебиологический
направленный на остановку кровотечения при травме сосудов и ottd Ці^і
пораженного участка (тканей, органа) от всего организма. НИче,,чв
ДВС-синдром неспецифичен и универсален, характеризуется рассеянным
тыванием крови с тромбообразованием, протекающим на фоне массивного
бления факторов свертывания крови, тромбинемии и в ряде случаев
сверхактивацией фибринолиза. что является причиной кровотечений различн°“
локализации. 11011
ДВС-синдром полиморфен, т.е. клинические и лабораторные показатели о
пень тяжести и распространенность синдрома, скорость его развития колеблются
в широких пределах.
Краткая справка о физиологии системы гемостаза
Система гемостаза является одной из защитных систем организма, препятству¬
ющая потере крови при поражении кровеносных сосудов, поддерживающая жид¬
кое состояние крови, сохраняющая нормальный объем циркулирующей крови,
способствующая удержанию клеточных элементов крови в сосудистом русле, вос¬
станавливающая целостность пораженного сосуда.
Гемостаз представлен процессами, происходящими в ответ на поражение сосу¬
дистой стенки, и может быть условно разделен на стадии:
• локальную вазоконстрикцию;
• адгезию и активацию тромбоцитов;
• формирование и стабилизацию тромбоцитным тромбофибрином;
• растворение тромба,
Система гемостаза включает три компонента: сосудистый, тромбоцитный,
плазменный. Сосудисто-тромбоцитный гемостаз осуществляется тромбоцитами,
эндотелиальными клетками и гладкой мускулатурой сосудов. Плазменный ком¬
понент подразделяется на свертывающую систему крови, противосвертывающую.
фибринолитическую (плазминовую), кинин-калликреиновую системы, систему
комплемента.
Эндотелий обладает низкой контактной активностью благодаря наличию
на нем нейтрального полисахаридного комплекса. При механическом, химич
ском. токсическом поражении сосудистой стенки происходит контактная акти
визация гемостаза, а в дальнейшем гемостатический потенциал эндотелия мож
истощаться. При этом патологический процесс усугубляется гипоксией, HaKonjj
ниєм продуктов измененного метаболизма, применением вазопрессорных пр®
ратов, что приводит к синдрому склеивания эритроцитов (сладж-синдрому)-
Антитромботический эффект эндотелия обусловлен синтезом ряда биоло
ски активных субстанций, среди которых:
• гликсшаминогликаны, имеющие отрицательный заряд; _а.
• циклический простациклин (простагландин I2, PgU ~ производив ^|(
хидоновой кислоты, а также эндотелиальный фактор релаксации.
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 761
вещества являются мощными вазоднлататорами и ингибиторами агрегации
тромбоцитов, они действуют синергично;
тканевый активатор плазминогена, активизирующий процессы фибринолиза;
* ингибитор пути тканевого фактора (ингибитор внешнего пути свертывания
крови) (ИПТФ, TFPI), который, образуя комплекс с фактором Ха, инактивирует
тканевый фактор (ТФ) благодаря взаимодействию с комплексом"«VIII + ТФ*;
тканевый фактор (ТФ) благодаря взаимодействию с комплексом
, тромбомодулин — мембранный рецепторный гликопротеин, который связы¬
вает и инактивирует тромбин, превращая его в активатор системы протеинов
С и S (одной из главных составляющих противосвертывающей системы).
При этом происходят инактивация факторов свертывания крови V, VIII,
и стимуляция фибринолиза. При взаимодействии тромбомодулина и тром¬
бина образуется комплекс, который подвергается эндоцитозу и деградации
в клетках эндотелия;
« оксид азота (N0) - активный вазодилататор и антиагрегант (рис. 21-1).
[д]
ФХІІ—XII
ВМКЇ
Гкк
Стенка сосуда
С.,-ингибитор I Тромбомодулин
і ШВШ
Простациклин
TFPI
ТФ+VII.
А А
XI—IX,
Активация
фибринолиза
Тромбин
ІХ-ЧХ,
Х-Х,
Фибрин Ч- Фибриноген
Агрегация
тромбоцитов
■БГГ
Фибринолиз
Рис. 21-1. Взаимодействие сосудистого эндотелия с системой гемостаза
О поражении эндотелия можно судить по повышению содержания в плазме
фактора фон Виллебранда, тромбомодулина и ингибитора ТАП. Противо-
тромботический потенциал сосудистой стенки резко снижается при многих пато¬
логиях, среди которых распространенный атеросклероз, экзо- и эндотоксикозы,
сепсис, хронические воспалительные процессы, сахарный диабет 1-го и 2-го
типа с диабетической микроангиопатией, тяжелые аутоиммунные патологии,
антифосфолипидный синдром, гипергомоцистеинемия. При этих состояни¬
ях эндотелий поражается лейкоцитными протеазами (трипсином, эластазой),
медиаторами воспаления (интерлейкинами, лейкотриенами, провоспалитель-
ными простагландинами, фактором некроза опухоли и другими цитокинами),
бактериальными эндотоксинами, иммунными комплексами, антифосфолипид-
ными антителами, липопротеидами низкой плотности (ЛПНП), холестерином,
триглицеридами, гомоцистеином.
Прокоагулянтная активность эндотелия повышается посредством продукции
эндотелиоцитами:
' цитокинов (TNF, интерлейкина-1);
* фактора фон Виллебранда, тромбоксана А2, способствующих усилению адге¬
зии и агрегации тромбоцитов;
ДО ШЛИ ГГГШ ГПГГ"**™™1”
« тканевого фактора (тканевого тромбопластина). запускающего
свертывая на крови посредством активизации факторов IX и X и
тромбиназы; Лро.
І еериновых протеаз (факторов V. X, XI. XII), а также фибриногена;
І ингибиторов активации аяазминогена 1-го и 2-го типа (ИАГН и
замедляющих фибринолиз: ’
• эндотелина I, вызывающего спазм гладкомышечных клеток сосудистй
■ кн и усиление агрегации тромбоцитов. Синтез эндотелина I активю^?**'
в присутствии ЛПНП, ангиотензина II. вазопрессина и замедляетсяп^
ствием NO. Pg£r 0дН
8 ответ на аовреждение тканей в месте травмы возникает спазм гладкой
амуры сосуда (вазоконстрикция) под действием рада биологически
веществ I эндотелина Ь ангиотензина II, гастамина, серотонина, брадии^^
что приводит к кратковременному, менее 60 с, запустеванию капилляровй ^
поэтому кровотечения в первые 15-20 с после поражения сосуда не возникав
Основную роль в первичном гемостазе играют тромбоциты, которые:
• способствуют восстановлению нормальной структуры энтотелия - ОСУШИ»,
вляют амгиотрофическую функцию; eci'
• образуют тромбоцитный тромб - агрегационная функция. Процесс агвем
ции двухфазный: обратимая и необратимая стадии, когда между тромбов*
тами лизируются мембраны и образуется единый конгломерат, ~1Щ)^
І способны ирилипать к пораженному эндотелию или к чужеродной повет-
носги - адгезивная функция;
І участвуют в плазменном гемостазе — в регуляции фибринолизаи процесса
.агрегации;
• осуществляют процессы репарации в месте поражения сосудов посредством
синтеза и выделения ростовых факторов, которые стимулируют пролифера-
цию эндотелиоцитов и гладкомышечных клеток сосудистой стенки, усиление
продукции этими клетками коллагена и фиброзной ткани.
Обнажение субэндотелиальных структур в результате поражения сосудисто!
стенки приводит к изменению формы тромбоцитов и их адгезии. Тромбоциты!!
тактируют с субзндотелием и адгезируют к Пораженным участкам, формируя зН
боцитные, или белые, тромбы, которые локализуются преимущественно в артерия
тогда как красные, обусловленные свертыванием крови, — в венах. Кроме того,И
можно формирование смешанных (тромбоцитно-коагуляционных) тромбов, голов]
ка которых образуется тромбоцитами, а хвост — фибрином и клетками крови.
Адгезия тромбоцитов опосредована действием кофакторов - ионизированного
І фактора фон Виллебранда, формирующих мостик между гликопротевиаш
мембраны тромбоцитов и обнаженными коллагеновыми структурами на месте
травмы. Контакт тромбоцитов с коллагеном субэндотелия и локально образую¬
щимся тромбином приводит к выделению тромбоцитных факторов,
• В настоящее время хорошо изучены тромбоцитные факторы, такие
как фибрмнодлаетический фактор, фибронектин, тромбоспондин, факторы
V, XI, протеин S. тромбоцитный тромбопластин (отличается от тканевого
тромбопластина отсутствием апопротеина III), антигепариновые факторы I
(пластиночный фактор 4, р-тромбоглобулин), АДФ (фактор агрегации тром¬
боцитов). Oj-плаэмюювый ингибитор, ингибитор-1 активатора плазминогп
на н др. Все вышеперечисленные медиаторы вырабатываются а-гранулами'
органеллами тромбоцитов.
I В результате адгезии тромбоциты активизируются, при этом содержим*
а-гранул выходит в плазму, что приводит к необратимой агрегации тромо^
питов. Наибольшее значение в процессе агрегации играют АДФ. тРоМ
и тромбоксан А, (рис. 21-2).
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 713
ПОВРЕЖДЕНИЕ СОСУДА
х" т ~Ч
Коллаген
АДФ-в—
I
Лабилизация -
мембраны
тромбоцитов
■ Гемолиз
Фактор
фон Виллебранда
Реакция
высвобождения
(АДФ, адреналин и др.)
АДГЕЗИЯ
/
V
Высвобождение Са**
)
Изменение формы,
образование отростков,
активация фосфолипвзы А»
д I
Арахидоновая кислота
I
Са2+, Mg,
белковые
плазменные
кофакторы
1 АГРЕГАЦИЯ I Jr. Тромбоксан Aj
'Ж
АГРЕГАЦИЯ II
СГУСТОК, ТРОМБ
акция
высвобождения
(фактор 4,
Р-тромбоглобулии,
ростовой фактор,
тромбослондии)
Тромбин
Фибриноген
■ Фибрин
РЕТРАКЦИЯ
Рис. 21-2. Схема тромбоцитного гемостаза
Одновременно с адгезией происходит агрегация тромбоцитов, которая стиму¬
лируется катехоламинами, серотонином, АДФ, тромбоксаном А2 - производным
арахидоновой кислоты. Коллаген и тромбин стимулируют синтез фосфолипазы
тромбоцитной мембраны, освобождая из фосфолипидного слоя арахидоновую
кислоту, превращающуюся под действием фермента циклооксигеназы в проста¬
гландини Н2 и G2 (PGH2, PGG2). Последние посредством тромбоксансинтетазы
превращаются в тромбоксан А2, который одновременно с выделяемой тромбоци¬
тами АДФ способствует агрегации тромбоцитов и закрытию участка пораженного
сосуда тромбоцитной пробкой (рис. 21-3).
Простациклин Е (PGI^ является антагонистом тромбоксана \ - при дефиците
простациклина Е повышается агрегациоиная способность тромбоцитов, а наруше¬
ние синтеза тромбоксана А2 приводит к снижению функциональной способности
тромбоцитов и кровоточивости. Простациклин сосудистой стенки и тромбоксан
\ синтезируются из одного предшественника — эндоперекисей простагланди¬
нов. На периферии тромбоцитной пробки происходит дезагрегация тромбоцитов
вследствие выделения интактными эндотелиальными клетками PGH2. оксида
азота, аденозинфосфатазы (АДФазы) и других ферментов, обладающих антиагре-
гаитным действием. В норме их синтез уравновешен, но в условиях патологии син¬
то тромбоксана А2 превалирует над таковым простациклина и АДФазы, что при¬
водит к активизации агрегации тромбоцитов.
7*4
КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Тромбоциты
Стенка сосуда
F
Р6£г
PGOj
PGHj
Фосфолипиды
PGCj, PGHj
і
Арахидомовая
кислота
Фосфолипаза А2
Циклооксигеназа 1
Фосфолипиды
► *
pgg2, pgh2
► і
Арахидоновая
І
Тромбоксан-
синтетаза
Простациклин.
І синтетаза
Тромбоксан А2
І
pgi2
(простациклин)
I
Тромбоксан Вг Агрегация тромбоцитов 6-KeTO-PGF2a
Рис. 21-і Участие простагландинов в регуляции функций тромбоцитов
При состояниях, сопровождающихся тромбоцитопенией, тромбоцитопатией
или дефицитом фактора фш Виллебранда, тромбоциты неспособны к агрегации
под воздействием АДФ, тромбина, коллагена, адреналина или метаболитов ара¬
хидоновой кислоты — происходит замедление агрегации тромбоцитов, тромбо*
образования, что клинически проявляется массивными кожными геморрагиями,
петехиями.
При адгезии и агрегации тромбоциты вырабатывают тромбоцитный фактор
III, который еще больше усиливает агрегацию клеток. Результатом взаимодей¬
ствия тромбоцитных и плазменных факторов свертывания является образование
тромбина, инициирующего дальнейшее свертывание крови, образование фибрина
и стабильной гемостатической пробки.
Плазменный (коагуляционный) гемостаз осуществляется последовательными
взаимодействиями тринадцати факторов свертывания крови с участием субстрат¬
ных белков и ионизированного кальция. В результате формируется фибриновый
сгусток, который уплотняет тромб, закрепляет его в месте поражения сосуда
и способствует процессу репарации тканей. Регуляцию плазменного гемостаза
осуществляют физиологические антикоагулянты и ингибиторы фибринолиза
(ингибиторы плазминовой системы).
Активация плазменного гемостаза может происходить по внешнему интенсив¬
ному пути, при этом система свертывания крови активизируется тканевым факто¬
ром в комплексе с факторами VIIt, Ха и Са2+. В плазминовой системе основными
внешними активаторами являются тканевый (эндотелиальный) активатор плаз-
миногена (ТАП) и урокиназа.
По внутреннему медленному пути активация свертывания крови обусловлена
фактором XIIt в комплексе с калликреином и высокомолекулярным кининогенои
(ВМК), а фибринолиз — активированными антикоагулянтами протеинами СиS.
Взаимодействие факторов свертывания между собой и с физиологическими
антикоагулянтами почти на всем протяжении процесса свертывания крови проис¬
ходит на плазматических фосфолипидных мембранах. Наибольшей коагуляцион¬
ной активностью обладают отрицательно заряженные фосфатидилхолин, фосфа-
тидилсерин или фосфатидилэтаноламин. Для активизации гемостаза необходим
выход фосфолипидов из клеток, что возможно при поражении клеточных мембран
м/или активации тромбоцитов. Функция фосфолипидов состоит в образовании
Д ИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ
765
* поверхностях (в присутствии ионов Са2') активизированных факторов X
н* тромбина, причем скорость этого процесса в присутствии специфических
а °|одашщшах рецепторов возрастает в тысячи раз.
*°2еферменты системы гемостаза (кроме фактора XII) - специализированные
новые протеазы. Основным механизмом активации факторов свертывания
с? ется ограниченный протеолиз.
каждой стадии каскада свертывания крови профермент превращается в соот-
^^ующую сериновую протеазу, которая катализирует превращение следующе-
|е1*оофермента в активизированный фактор свертывания.
^ Факторы свертывания подразделяют на группы:
* ферментные — активные факторы, непосредственно участвующие в процессе
" свертывания крови (XII, XI, IX, X, II, VII и прекалликренн);
неферментные — мощные кофакторы свертывания (факторы V, VIII и кини-
* иогеи с высокой молекулярной массой);
, тканевый фактор - кофактор/рецептор;
, фактор XIII - трансглутаминаза;
I фибриноген (фактор I) — субстрат для образования фибрина - конечного
продукта каскада свертывания крови (табл. 21-1).
Таблица 21-1. Факторы свертывания крови
Название
Синтез
Функции
I
Фибриноген
Гепатоциты
4-6 сут (
іубстрат
II
Протромбин
Гепатоциты/витамин К
3 сут i
Фермент
й
Тканевый фактор
ЭКЛ, многие другие клетки
.
Рецептор/кофактор
щ
Проакцелерин (лабильный
Фактор)
Гепатоциты, ЭКЛ, тромбо¬
циты
12-154
Кофактор
Пвоконвертин
Гепатоциты/витамин К
4-7 ч
Фермент
<»
;Антигемофильный фактор
Синусиоды печени
8-10 ч
Кофактор
iff
Кристмае-фактор (троМбо-
пластин плазмы)
Гепатоциты/витамин К
24 ч
Фермент
i
Фактор Стюарта
Гепатоциты/витамин К
г сут
Фермент
»
Предшественник плазменно¬
го тромбопластина
Гепатоциты
2-3 сут
Фермент
XII
Фактор Хагемана
Гепатоциты
1 сут
Фермент
XIII
Фибринстабилизирующий
фактор
Гепатоциты/тромбоциты
8 сут
Фермент
-
Прекалликренн (ПК)
(фактор Флетчера)
Гепатоциты
йтй ■■■
Фермент
Высокомолекулярный кини-
ноген (ВМК)
1 (фактор Вильямса)
Гепатоциты
Кофактор
Факторы VII, IX, X, II, протеины С и S синтезируются гепатоцитами и являются
витамин К-зависимыми факторами. Для конечного превращения в функциональ¬
но активную форму они должны подвергнуться у-карбоксилированию витамин
К-зависимой карбоксилазой. Соответственно при дефиците витамина К нару¬
шается синтез витамин К-зависимых факторов свертывающей системы крови,
Что приводит к нарушениям системы гемостаза. Механическая желтуха, тяжелые
поражения печени, нарушение всасываемости в тонком кишечнике, а также анти-
биотикотерапия (подавляет кишечную флору, продуцирующую витамин К) при-
®°Дят к дефициту витамина К.
Рид медикаментов, в частности непрямые антикоагулянты (кумарины, варфарин
“ ДР>). конкурентно нарушают карбоксилирование, в кровь поступают функцио-
Нально инертные некарбоксилированные предшественники факторов VII, IX, X, И.
I КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
(Схематически процесс свертывания крови условно можно разделить
• протромбинообразование, или контактная кинин-калликреинк ^
активация. Результатом этого процесса, проходящего на фосфол^3^
матрицах, является образование протромбиназы (комплекса фактц^^^
ВI фосфолипид + Са2') по внешнему и внутреннему механизмам а * ■
трансформирует протромбин в тромбин; ’ Кот°рая
• общий путь образования тромбина — тромбинообразование под возп 1
№ ем протромбиназы (эта фаза длится 2-5 с); Деис%
I фибринообразование и фибринолиз.
Основным этапом плазменного гемостаза является образование Щ
из фибриногена (фактора I) под воздействием тромбина (фактора И). Фибрино
плазменный глобулин, состоящий из трех пар полипептидных цепей, относящий?
к белкам острой фазы. Повышение концентрации фибриногена возможно пои1
папительных заболеваниях, атеросклерозе, гиперлипидемии, сахарном диа&^
приеме оральных контрацептивов, травме, стрессе, опухолевом процессе.
Ведущим механизмом стимуляции синтеза фибриногена является секве
макрофагами и моноцитами интерлейкина-6 в ответ на фагоцитоз йщР
деградации фибриногена. От фибриногена под воздействием тромбина отделяются
фрагменты - фибринопептиды, в результате образуются моно- и димеры фибпи-
на (при обязательном участии Са2+), а затем — полимерное волокно фибрина
которое стабилизируется фактором XIII. Прочные фибриновые нити удерживают
тромбоцитную массу на месте травмы сосуда. Активация фактора XIII иницииру¬
ется тромбином и происходит в присутствии ионов Са2+.
Стабильный фибрин устойчив к фибринолизу. При его лизисе под воздействи¬
ем плазмина образуются продукты деградации фибрина (D-D-димеры, D-E-D-
тримеры), тогда как при лизисе растворимого фибрин-полимера или фибриногена
образуются растворимые фибрин-мономерные комплексы (РКФМ, D-фрагменты),
Избыток содержания РКФМ (D-фрагментов) свидетельствует об активации
фибриногенолиза, а по уровню нарастания содержания ПДФ оценивают степень
тромбинемии, наличие ДВС-синдрома.
Переход неактивного фактора II (протромбина) в активный фактор II (тром¬
бин), который активирует синтез фибрина, происходит под воздействием про¬
тромбиназы (фактора Хв). Протромбиназа активизируется тромбоцитным факто¬
ром III, фактором V на фосфолипидах, при участии ионов Са2+.
Протромбин - наиболее распространенный из витамин К-зависимых факторов
свертывания крови. Протромбин синтезируется гепатоцитами. Протромбиназа
расщепляет его с образованием а-тромбина и протромбинового фрагмента.
Тромбин вызывает гидролиз фибриногена до фибрина, кроме этого, он активизи¬
рует тромбоциты, факторы и кофакторы про коагуляции. Тромбин активизирует
фибринолитическую систему, стимулирует ЭКЛ и лейкоциты, вызывает мигра¬
цию лейкоцитов, регулирует тонус сосудов, стимулирует рост клеток и репарацию
сосудов.
Протромбиназа активизируется посредством двух механизмов: внешнего и вну¬
треннего. Такое деление искусственное, поскольку оба пути свертывания крови
протекают одновременно; оно принято для облегчения интерпретации лаборатор¬
ных тестов. При внешнем механизме процесс запускается тканевым тромбопла-
стином (фактором III, ТФ), который поступает в кровоток в результате:
• травматизации, повреждения тканей, сосудов;
І поступления в кровеносное русло значительных объемов интерстициальном,
межтканевой жидкости вследствие дегидратации, кровопотери;
I гипоксии, ацидоза, сладж-синдрома, поражения эндотелия протеазами-
эндо- и экзотоксинами, вследствие чего в клетках эндотелия активизиру
ся синтез ТФ;
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 787
поступления в кровеносное русло гетерогенного тканевого тромбопластина
* /например, при эмболии околоплодными водами).
1§| I внутренний
ых остатков, по своей третичной структуре может быть отнесен к семейству
J0; „дейкинов и интерферонов а и р. В норме ТФ отсутствует, он поступает в кро-
Й к лишь при поражении клеток. Наибольшее количество фактора III содер-
В0Т°субэндотелиальные, эпителиальные и глиальные клетки (ТФ-содержащие
якн) Повреждение тканей приводит к разрушению эндотелиальных клеток,
,е в норме являются барьером, отделяющим ТФ-содержащие клетки от цир-
КОТиоующей крови. Попадающий в кровь ТФ является кофактором/рецептором.
К^тооьій в присутствии ионов Са2* активирует фактор VII. Фактор VII, не обладает
Неолитической активностью и реализует свой ферментативный потенциал
лько в комплексе с ТФ. Комплекс «ТФ + фактор VII + Са2*» активизирует факто-
^ IX и X, вследствие чего образуется тромбин. На этот процесс необходимо менее
20 с (рис. 21-4).
Тканевый фактор
+ Са2+
t
Фактор VII
*
Рис. 21-4. Внешний путь активации свертывания крови
Фактор VII облегчает активацию фактора IX в системе внутреннего пути и фак¬
тора X - в общем пути. Присутствие фактора VIII8 и Са2* необходимо для активи¬
зации фактора X.
Внутренний механизм образования протромбиназы более сложный. Компо¬
ненты внутренней системы - факторы XII, XI, IX, VIII, кофакторы - высокомоле¬
кулярный кининоген (ВМК), прекалликреин (ПК) и их ингибиторы. При контакте
с пораженным эндотелием, в частности с отрицательно зараженным коллагеном,
активизируется фактор XII (фактор Хагемана), который инициирует каскад слож¬
ных реакций, в которых последовательно активизируются факторы свертывания:
ХП, - XI, XI, — IX, IX, — VIII. Весь этот сложный процесс происходит на фосфоли-
иидных матрицах, вырабатывающих активизированные тромбоциты. Конечным
Результатом каскада реакций является образование фактора II, (под воздействием
Ротромбиназы). Этот механизм более длителен, занимает 10-20 мин. В норме
^ертывание крови происходит как по внешнему, так и по внутреннему механиз¬
мы (рис. 21-5).
Tff ВКрвсіДОтрлнсФУЗиология
Дефицит или качественный дефект факторов свертывания соппо
замедлением скорости образования фибрина и тромбов. Клинически это
ею» повышенной кровоточивостью и образованием гематом. Р°я%
Свертывание крови контролируется антитромботическими механизма
I ставленными системой физиологических антикоагулянтов, которые опґїШ%1‘
ют реакцию свертывания крови местом тканевого повреждения и пред^Н№,|,в9-
I возникновение массивного внутрисосудистого тромбоза. К регулирующи
Н рам также относят скорость кровотока, гемодилюцию, активность ретику ltI°'
I телиальной системы (РЭС), протеолитическое действие тромбина (по в*110'
обратной связи), фибринолиз. РИнИИпу
внутренний
Внешний
механизм
механизм
Фактор XII
Фактор Vlla
ВМК
+
Прекалликреин
тканевый фактор
+
Фибрин перекрестно-связанный
Щ 21-5, Свертывание крови (схема)
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ
769
Быстрый кровоток усиливает транспорт сериновых протеаз в печень и РЭС
«дя их утилизации и уменьшает размер гемостатической пробки за счет отрыва
тромбоцитов от тромбоцитных агрегатов. Тромбин вызывает протеолиз и дегра¬
дацию факторов XI, V, VIII, что облегчает их инактивацию и выведение. Тромбин
также инициирует активацию системы фибринолиза посредством протеина С.
цто приводит к лизису сгустка и стимуляции клеточного (лейкоцитного) фибри¬
нолиза.
Естественные антикоагулянты представлены плазменными белками - ингиби¬
торами сериновых протеаз, относящимися к семейству серпинов (за исключением
ИІГГФ и а2-макроглобулина). Термин «серпин* («serpin*) образован из сокра¬
щенного английского названия *serine protease inhibitor*, что в переводе означает
«ингибитор сывороточной протеазы». ИПТФ относится к белкам группы кунинов.
гомологичным апротинину - ингибитору панкреатического трипсина (табл. 21-2).
Таблица 21-2. Важнейшие ингибиторы свертывания крови
Название
Концентрация,
мкг/мл
г
ММ. кДа
Инактиаирует
Антйтромбин III (серпин)
150
58
Тромбин, факторы X,, IX,, XI,, XII,
Кофактор гепарина II (серпин)
70
65
Тромбин
а -Антитрипсин (серпин)
—
40-50
Трипсин, фактор XI,, плазмин
Oj-Антиплазмин
—
70
Плазмин
Ингибиторы активатора плазми-
ногена:
ТИПІ
тип II
50-70
Тканевый активатор плазминоге-
на (ТАЛ)
Урокиназу
(^-инактиватор (серпин)
200
104
Систему комплемента, капли-
креин
а,-Макроглобулин
—
730
Плазмин. калликреин, тромбин
Ингибитор пути тканевого фактора
(кунин)
0,1
30-45
Комплекс «фактор X, + ТФ»
Протеин С (витамин К-зависимый
гликопротеин)
4
62
Факторы V,, VIII,
Протеин S (витамин К-зависимый
гликопротеин)
25
71
Факторы Va, VIII' (является
кофактором протеина С)
Эндогенный гепарин
—
4-9
Тромбин, факторы X,, IX,, XI,, XII,
Артериальные или венозные тромбозы возникают вследствие локальной недо¬
статочности антитромботических механизмов, в отличие от синдрома диссеми¬
нированного внутрисосудистого свертывания, при котором имеется системный
дефицит физиологических антикоагулянтов. По мере прогрессирования ДВС-
синдрома система гемостаза становится крайне нестабильной из-за выраженного
истощения гемостатических и антитромботических механизмов.
Физиологические антикоагулянты контролируют процессы свертывания крови
и препятствуют тромбообразованию. Важнейшими медиаторами антитромботи-
ческой системы являются антитромбин III (AT III), протеины С и S, эндогенный
гепарин. На долю AT III приходится до 80% всей антикоагуляционной активности,
при дефиците AT III резко возрастает риск тромбообразования. Первые публи¬
кации, посвященные роли антитромбина III в генезе ДВС-синдрома, тромбозов,
тромбоэмболий, появились в конце 1970-х гг.
АТИ1 (ММ 58 кДа), который называют также гепариновым кофактором I, явля¬
йся а2-глобулином. Синтезируется в основном васкулярной и периваскулярной
тканью печени и в меньшей степени периваскулярной тканью почек и легких. АТ
HI инактивирует тромбин, факторы Xs, XIIa, Х1а, 1Ха, т.е. блокирует оба механизма
плазменного гемостаза. Сериновые протеазы блокируются антитромбином III лишь
f
Таблиц 21-3. Роль антитромбина III
Пшют ель
Свертывающая система
Фибринолитическая
система
Кинин-
калликреиновая
система
Система компле¬
мента
Нормальное
содержание
ATI»
Ингибирует факторы
XII, И X, тромбин (II,),
каскад коагуляции
Ингибирует плазмнн,
активаторы плазминоге-
на, фибринолиз
Ингибирует
синтез кинина,
калликреина
ШШШ
му комплемента
посредством
снижения синтеза
плазмина
Дефицит
ATI»
Удержание факторов
XII, XI, X, И, приводит
к неконтролируемой
коагуляции
ТСодержание плазмина,
активатора плазминогена,
вызывает неконтролируе¬
мый фибринолиз
ТСодержание
кининов, бради-
кинина, прони¬
цаемость сосудов
и вазодилатацию
Т Содержание
плазмина,
что приводит
к чрезмерной
активации систе¬
мы комплемента
77f климичесш ТРАНСФУЗИОЛОГИЯ
• присутствии гепарина. Скорость взаимодействия AT III с сериновыми
ми (факторами свертывания крови) зависит от концентрации гепарин Пр°%
Активность AT III в физиологических условиях варьирует в пределах «s KN
в сосудистом русле составляет около 65 ч. Значитель %
чисяо штггромбина III (до 50% общего содержания в организме) flenmTN-
•эвстраваскулярном пространстве, что позволяет поддерживать стабиль ■ ^
впнь его в плазме: 40% циркулирует в плазме, 10% - содержит сосудист"^^
гелий. Депонированием AT III во внесосудистом пространстве объясняете ^
леююе восстановление его уровня при заместительной терапии препава 3^-
III и СЗП. Минимальный антитромботический уровень содержания АТШ ^
Доказано, что спонтанные тромбозы и тромбоэмболии наблюдаются пси "
мим содержания AT III менее 60%, которое может развиться вследствие впг>НИ*е
ного или приобретенного дефицита этого фактора (табл. 21-3).
Врожденный дефицит AT III — гетерозиготная форма заболевания, приводящая
к тяжелым тромбозам глубоких вен и частым тромбоэмболиям легочной артерии.
Приобретенный дефицит AT III обусловлен:
• сниженным синтезом вследствие нарушения белково-синтетической функ¬
ции печени, назначения ряда медикаментозных препаратов (L-аспарги-
назы, эстрогенов, синтетических препаратов, обладающих эстрогенным
действием):
• повышенным потреблением или потерей АТ III при ДВС-синдроме, дли¬
тельной гепаринотерапии, нефротическом синдроме, желудочно-кишечньл
заболеваниях, когда потеря белка преобладает над его синтезом:
• экстракорпоральной циркуляцией крови в аппаратах для гемодиализа, плаз¬
мафереза, искусственного и вспомогательного кровообращения.
Клиническими проявлениями дефицита AT III являются диссеминированное
тромбирование сосудов микроциркуляторного русла (в редких случаях тромбо¬
эмболии), повышенная кровоточивость, шок, нарушение механизмов иммуноло¬
гической защиты и системы мононуклеарных фагоцитов. Все вышеперечисленны
симптомы соответствуют клинической картине ДВС-синдрома.
Необходимо отметить, что кофактором гепарина является AT III. При ним
чителыюм дефиците AT III гепарин будет оказывать антикоагулянтное дейлм*-
Однако при снижении AT III до 75% для достаточного терапевтического ЭФФ*
дозу гепарина увеличивают в 2 раза, а при снижении до 50% - в 5 раз по ср
нению с дозой при нормальных показателях содержания AT III- В то же i8Р®
интенсивная гепаринизация приводит к еще большему усугублению двфі*
AT III. Таким образом, для эффективного ингибирования АТ ПІ сериновыхпро^
аз необходимо присутствие кофактора гепарина, который продуцируется туч^
клетками, но в норме отсутствует. Однако на поверхности эндотелия и
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСФИСТОЕ СВЕРТЫВАНИЕ КРОВИ
771
„ййоводобные структуры (гликозоаминогликаны — ГАГ и гликопротеиды),
участвуют в активации AT III и нейтрализации тромбина (рис. 21-6).
Противовоспалительный эффект антитромбина
Рис. 21-в. Противовоспалительный эффект антитромбина
Некоторые факторы влияют на взаимодействие тромбина с гликопротеинами
эндотелия, в том числе фактор тромбоцитов IV, витронектин. Эти факторы препят¬
ствуют инактивации тромбина и фактора Ха. Активизированные нейтрофилы пода¬
вляют антикоагулянтные свойства поверхностных гликопротеидов, что приводит
к ДВС-синдрому при сепсисе, SIRS, онкологических заболеваниях, змеиных укусах
и т.д. Таким образом, массивное или интенсивное поражение эндотелия приводит
к активизации протромботического потенциала эндотелиальных клеток, диссеми¬
нированному внутрисосудистому свертыванию с последующим снижением концен¬
трации факторов свертывания крови, тромбоцитов, а также протеинов С и S.
Физиологические антикоагулянты подразделяют на 2 группы: первичные и вто¬
ричные.
Первичные антикоагулянты, к которым относятся AT III, протеины С и S.
антитромбопластин, фосфатидилсерин, ингибитор С,-компонента комплемента,
синтезируются в печени, в сосудистом эндотелии и постоянно циркулируют в сосу¬
дистом русле.
Протеины С и S — витамин К-зависимые антикоагулянты, синтезируются гепа-
тоцитами, ингибируют факторы VIII, и V,. Протеин С циркулирует в плазме в Иван¬
овной форме; его активация происходит на поверхности эндотелиальных клеток
772 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
поа воздействием тромбина в присутствии Са2~. протеина S (является кы,.
прО’^Н С) и тромбомодулина. Тромбомодулин обнаружен в клетках тЧ
артерий, вен. капилляров, сосудов лимфатической системы большинст^01**'*
Тромбомодулин не только ускоряет активацию протеина С, но и мен °Рган°»
КОСТЬ тромбина. Тромбин, связанный с тромбомодулином, теряет сп Mct|"1-
активизировать тромбоциты и фактор V. препятствует модификации
• фибрин. т.е. теряет прокоагулянтные свойства и приобретает антикоагу^41101^
Синтез тромбомодулина снижается при увеличении содержания интерГ"ЯКтНк1е
і ГИПОКСИИ. ЭНДО- И ЭКЗОТОКСИКОЗе. герпесной инфекции. Кроме ТОГО ИКИНа']'
речисленные факторы стимулируют синтез тканевого фактора. ' Вышепе-
Рад препаратов - ретиноевая кислота, пентоксифиллин. интерлейкин-4
лируют синтез тромбомодулина, подавляют активность TNF. СТи%-
Необходимо отметить, что антитромботические механизмы быстро исто
ся вследствие массивного потребления AT III. Дефицит протеинов С и S паз
ется медленнее. ■'
Вторичные антикоагулянты образуются в процессе свертывания кровиифий
нолиза. К ним относятся:
• антитромбин I, который активно связывает на своей поверхности свободи
молекулы тромбина, инактивируя их:
1 продукты деградации фибрина, фибриногена, растворимые комплек¬
сы фибрин-мономеров. В норме содержание ПДФ, РКФМ минимально
При патологии содержание этих продуктов резко возрастает, происходи
ингибирование активации фактора 1Ха, образования фибрина и агрегация
тромбоцитов, что может привести к гипокоагуляции;
• дериваты факторов V, VIIIa, которые также инактивируют тромбин.
Внедрение в клиническую практику новых лекарственных средств, влияющи
на систему гемостаза, в частности препарата эптаког-альфа (НовоСэвена*) -
рекомбинантного активированного фактора VIIa (rVIIJ, несколько изменило
представление о механизме свертывания крови. В современной модели отсутству¬
ет деление гемостаза на внешний и внутренний пути коагуляции. Весь процесс
свертывания крови представлен общим механизмом, который условно подразде¬
ляется на 3 фазы (рис. 21-7):
• инициации;
• начальной активации;
• воспроизводства (усиления) гемостаза.
В соответствии с новой моделью гемостаза контактные факторы свертывания,
такие как фактор XII, высокомолекулярный кининоген и прекалликреин, суще¬
ственную роль в процессе гемостаза не играют. Их дефицит не приводит к усиле¬
нию кровоточивости.
Важнейшим антитромботическим механизмом является фибринолиз, который
направлен на расщепление фибрина, удаление его из сосудистого русла, восста¬
новление целостности сосудистой стенки и поддержание крови в жидком состоя¬
нии. Фибринолиз - основной эндогенный противотромботический механизм
Фибринолитическая система состоит из двух компонентов: плазменного и клеточ¬
ного фибринолиза (табл. 21-4).
Фибрин расщепляется под действием протеолитического фермента плазми®'
который образуется из плазминогена (связанного с фибрином) под действием акти
ватора плазминогена тканевого типа (ТАП), активизированных протеинов С и •
фактора XII, а также стрептокиназы (продуцируемой гемолитическим стреіДО
кокком), урокиназы (фермента мочевыделительной системы) и некоторых ЗРР:
факторов. Фибринолитическая система крови является основной протеолитич®
системой в организме человека, следовательно, для подавления избыточной а
ности фибринолиза показано применение поливалентных ингибиторов протеаз.
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 773
А. Сосудистое повреждение приводит к высвобождению
тканевого фактора (ТФ), при этом происходит образование комплекса ТФ/фУИ,
I
Б. Комплекс ТФ/ф\/11а активизирует ф1Х и фХ.
Незначительное количество фХа связывается с фУа
В. Комплекс фХа/ф\/ав воздействуя на небольшое количество протромбина,
превращает последний в тромбин
I
Г. Тромбин в незначительной концентрации
активизирует фУ, фУШ и тромбоциты (в месте повреждения сосуда)
Д. фУа, фУШа и ф1Ха, связываясь с поверхностью активизированных
тромбоцитов, проводят к инициации образования значительного количества фХа
и образованию комплекса фХа/фУа
'Г
Рис. 21-7. Современная модель гемостаза (схема)
Таблица 21-4. Основные компоненты системы фибринолиза
Название
ММ, кДа
Функции
Плазииноген
90
Профермент
Тканевый активатор плазминогена
70
Активатор плазминогена
Урокиназа
30-55
Активатор плазминогена
Првкалликреин
90
Профермент
Фактор XII
80
Профермент
о,-Антиплазмин
70
Основной ингибитор плазмина
сц-Махрогпобулин
760
Ингибитор плазмина. калликрвина, ТАЛ
Ингибитор активатора плазминогена типа 1 (ИАП-1)
50
Ингибитор урокиназы, ТАП
^Ингибитор активатора плазминогена типа 2 (ИАП-2)
70
Ингибитор урокиназы
С,-ингибитор
105
Ингибитор системы комплемента.
плазмина
ь?атый гистидином гликопротеид
75
Конкурентный ингибитор плазминогена
1
774 (Лмкпчеомя шисФУЗиалогия
Циркулирующие в крови а2-антиплазмин и ингибитор активатора п
гена (ИАП-1. ИАП-2) ограничивают фибринолиз и препятствуют де
фибриногена Снижение активности фибринолиза возможно вследстви ад,,і
кш синтеза активаторов плазминогена, повышения содержания ИАП и *
цмна снижения концентрации плазминогена, что имеет место при хрон^1^3
рецидивирующем течении ДВС-синдрома. tI4e^
Фибринолитическая система состоит из профермента плазминоге
меита плазмина и нескольких ингибиторов фибринолиза (а -антипл ^
ctj-макроглобулина, С,-ингибитора, ИАП-1) (см. табл. 20-7). Плазмино*МИНз
глнкопротеин (ММ 90 кДа). синтезируемый печенью, эозинофилами, ШІ
обладает сильным сродством к лизиновым остаткам фибрина, а,-антипл ЧКйЯ|
тромбоспондина, иммуноглобулинов. Плазмин является мощным протеолит!!?9
ским ферментом, расщепляющим фибрин (с образованием продуктов дегря
фибрина, фибриногена), что позволяет сохранять проходимость кровено*
сосудов. Кроме того, плазмин вызывает протеолиз факторов коагуляции (XIY
XIII, V, VIII. фактор фон Виллебранда), а также деградацию тромбоцитных гли*
протеинов.
Превращение плазминогена катализируется его активаторами, которые щ».
дуцируются сосудистой стенкой (внутренняя активация) или тканями, клеткам'
крови (внешняя активация). Внутренний путь активации плазминогена осущеп?
вляется посредством факторов ХПа, Х1а, прекалликреина, высокомолекулярного
кининогена. Однако основным путем активации является внешний, происходящий
за счет экспрессии тканевого активатора плазминогена (ТАП), который содержит¬
ся в эндотелии сосудов, моноцитах, мегакариоцитах, мезотелиальных клетках
ТАП - сериновая протеаза, имеющая высокое сродство к фибрину. В присутствии
фибрина ТАП стимулирует синтез плазмина и расщепление фибрина. Действие
ТАП потенциируется урокиназой, которая также является сериновой протеазой.
Урокиназа продуцируется эндотелиальными клетками, моноцитами, макрофага¬
ми, фибробластами, в значительной концентрации содержится в моче.
Среди других факторов внешнего пути активации плазминогена выделяют
группу нефизиологических активаторов: стрептокиназу (продуцируется гемоли¬
тическим стрептококком), антистреплазу (комплекс человеческого плазминогена
и бактериальной стрептокиназы) и стафиллокиназу (продукт метаболизма золо¬
тистого стафиллококка).
Активность системы фибринолиза строго контролируется ингибиторами фиб¬
ринолиза, которые способны инактивировать как плазмин, так и активаторы
плазминогена. а,-Антиплазмин — серпин, являющийся основным ингибитором
плазмина в крови. Способен быстро ингибировать плазмин, затрудняет при¬
соединение плазминогена к фибрину, образует перекрестные связи с молекулами
фибрина во время фибринообразования. При избыточном образовании нейтра¬
лизация плазмина происходит в следующей последовательности: а2-антиплазмин,
а2-макроглобулин, AT III, С,-ингибитор.
Ингибитор активатора плазминогена типа 1 (ИАП-1) — гликопротеин, основ¬
ной ингибитор ТАП и урокиназы, продуцируется эндотелием, гладкомышечными
клетками, мегакариоцитами. Является серпином, способен депонироваться в тром
боцитах; содержание ИАП-1 возрастает при эндотоксикозе, тромбинемии, приеме
глюкокортикоидов, а также стимулируется интерлейкином-1, TNF. ИАП-2
ОСНОВНОЙ ингибитор двухцепочечной урокиназы. jj
Установлено, что концентрация активизирванного ТАП находится в пря
зависимости от синтеза его эндотелиальными клетками, концентрации и клИР®
ИАП-1 в гепатоцитах. Синтез ТАП эндотелиоцитами может быть значите
активизирован в течение нескольких минут, что приводит к сверхактира^
1 и кровотечению. Моделью сверхактивации фибринолиза
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 775
■пшситъ искусственное кровообращение. С первых минут ИК происходит вы*
в°сЛтдП в огромных концентрациях, что приводит к синтезу плазмина и активи-
бй «роцесса деградации фибриногена, результатом чего является кровотечение
послеоперационном периодах.
*г-ингибитор инактивирует трансформацию урокиназы и тем самым блокирует
2ктйук> фазу фибринолиза.
Гликопротеин, богатый гистидином, — конкурентный ингибитор плазмина.
* чная фибринолитическая система представлена лейкоцитами, макрофагами,
Утками эндотелия, тромбоцитами. Клетки крови, выделяя протеолитические
J менты, разрушают фибрин; лейкоциты и макрофаги фагоцитируют остатки
|2рина (рис-21-8).
Риа 21-8. Основные этапы фибринолиза
Этиология и патогенез синдрома диссеминированного
внутрисосудистого свертывания
Синдром диссеминированного внутрисосудистого свертывания - неспецифи¬
ческий синдром, развивающийся как осложнение основного заболевания —
индуктора, при котором в силу каких-либо обстоятельств активируется система
коагуляции. Для ДВС-синдрома характерны следующие патогенетические меха¬
низмы.
•Активация свертывающей системы крови эндогенными факторами (ткане¬
вым тромбопластином, протеазами лейцкоцитов, опухолевыми прокоагу¬
лянтами). На всех стадиях ДВС, даже в фазу выраженной кровоточивости.
І циркуляции имеется значительное количество активированных факторов
свертывания крови, что вызывает необходимость введения антикоагулянтов.
Характерны тромбинемия и появление ее маркеров — растворимых фибрин-
мономерных комплексов, D-D-димеров фибриногена.
•Активация тромбоцитного звена гемостаза за счет поступления в кровенос-
ное русло тканевого тромбопластина, тромбоксана приводящая к сладж-
синдрому. В целях восстановления микроциркуляции показано применение
препаратов реологического и антиагрегантного действия.
ГЛАВА 71
Ill КЛИНИЧЕСКАЯ ТРАМСФУЗИОЛОГИЯ
і Истощение противосвертывающих механизмов — дефицит естет^
антихоагулянтов - AT III. протеинов С и S. плазминогена, фибрин?8*1"1*'1*
ской и кинин-калликреиновой систем - и повышение содержания
модулина (свидетельствует о поражении сосудистой стенки),
дефицит AT III возможно за счет трансфузии донорской плазмы в 0ЛНИТі
препаратов AT ПІ. Ведеіі*и
І Истощение ретикулоэндотелиальной системы, системы мононукле
фагоцитов, что приводит к накоплению в кровотоке активизировании*'
торов свертывания, пораженных тромбоцитов, эритроцитов, микросгу*
Применение методов экстракорпоральной гемокоррекции позволяет юш
сировать недостаточность системы естественной детоксикации организм"*11
I Снижение противосвертывающего потенциала эндотелия за счет его Р
ственного дефекта, поэтому оправданно введение препаратов, обладают!
вазопротекторным эффектом.
Ниже приводится список патологий, потенциально опасных в плане развит»
ДВС-синдрома.
в Инфекции - сепсис, септический шок, молниеносная форма пневмококко
ВОГО сепсиса, постспленэктомический синдром, тяжелые вирусные инфекции
(лихорадка Денге, Эбола, генерализованный герпес, СПИД), протозойные
инфекции (малярия), лихорадка Скалистых гор, кандидоз, аспергиллез, кло-
стридиоз, диссеминированные формы туберкулеза.
S Шоки различной этиологии — анафилактический, септический, травматиче¬
ский, кардиогенный, ожоговый и др.
к Острый внутрисосудистый гемолиз, вызванный трансфузиями несовмести¬
мой крови, отравлениями гемолитическими ядами.
к Онкологические заболевания — особенно диссеминированные формы рака,
солидные опухоли, острые лейкозы, бластные кризы хронических лейкозов,
синдром повышенной вязкости крови (полиглобулии, парапротеинемии).
к Хирургические травмы — травматичные хирургические вмешательства,
трансплантация органов, тканей, протезирование сосудов, клапанов сердца,
использование аппаратов искусственного кровообращения и гемодиализа,
вспомогательного кровообращения (внутриаортальная контрпульсация),
Риск развития ДВС возрастает с ростом травматичности хирургическою
вмешательства и при наличии сопутствующих заболеваний, предраспола¬
гающих к ДВС, - онкологии, хронической сердечно-сосудистой недоста¬
точности.
1 Патологии сердечно-сосудистой системы — острый инфаркт миокарда,
врожденные и приобретенные пороки сердца, бивентрикулярная сердечная
недостаточность, тромбозы глубоких вен, тромбоэмболия легочной артерии,
аневризмы аорты, опухоли сердца, злокачественная гипертония, гигантские
гемангиомы, телеангиэктазии.
• Острые и хронические воспалительные, деструктивные заболевания легки,
поджелудочной железы, печени, почек.
• Травмы І переломы трубчатых костей, жировая эмболия, травматически*
шок, ожоги, отморожения, электротравма, краш-синдром и др.
І Акушерские патологии — эмболия околоплодными водами, преждевремен
ная отслойка плаценты, атонические маточные кровотечения, антенатальна
гибель плода, плодоразрушающие операции, септический аборт, тяжелы
поздний токсикоз беременных, эклампсия. Гинекологические патологии
гигантские миомы, дегенеративные фибромиомы матки.
S Массивные гемотрансфузии и реинфузии крови.
• Иммунные патологии — СКВ, ревматоидный полиартрит, болезнь Шенлеин*
Геноха. диффузный гломерулонефрит, криоглобулинемия, васкулитыик
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 777
лагенозы, анафилаксия, тяжелые аллергические реакции, гепарининду-
цированная тромбоцитопения, болезнь Кавасаки, саркоидоз, амилоидоз,
гемолитико-уремический синдром.
( Отравление гемокоагулирующими ядами.
• Трансплантация органов и тканей.
• ДВС-синдром новорожденных - инфекции, родовая асфиксия, болезнь гиа¬
линовых мембран, аспирационный синдром, ателектазы, полицитемия, пере¬
охлаждение, тромбоз крупных сосудов, фульминантная пурпура (врожден¬
ный дефицит протеинов С и S). некротизирующий энтероколит, гигантские
гемангиомы, поражения головного мозга ишемического и геморрагического
характера, врожденная патология печени, почек.
I Терминальное состояние, остановка сердца, асфиксия, гипоксия, реанимаци¬
онные мероприятия (в 100% случаев).
Таким образом, можно утверждать, что ДВС-синдром сопутствует или ослож¬
няет большинство тяжелых заболеваний и терминальных состояний. Необходимо
особо отметить, что в подавляющем большинстве случаев диагностика многих
из приведенных заболеваний означает, что ДВС-синдром либо уже спровоцирован,
либо может развиться, если не будут начаты профилактические мероприятия.
Перечень заболеваний и состояний, часто осложняющихся ДВС-синдромом
• Аборт.
• Амилоидоз.
• Ангиоматоз Казабаха-Мерритта (множественные и гигантские ангиомы).
• Аневризмы.
• Аортит Такаясу.
• Ацидоз, гипоксия.
• Вирусные инфекции (герпес, краснуха, натуральная оспа, цитомегаловирус).
• Внематочная беременность.
I Внутрисосудистый гемолиз.
I Внутриутробная гибель плода,
і Врожденные пороки сердца.
І Гемоуремический синдром.
• Гемоперфузия (на угольных фильтрах).
I Геморрагическая лихорадка.
I Гиперлипидемия.
І Гистиоцитоз.
• Глистная инвазия (кара-азар).
I Дефицит фермента Г-б-ФД (спровоцированный гемолиз).
• Жировая эмболия.
• Злокачественные солидные новообразования различных локализаций,
і Иммунокомплексные заболевания (васкулиты).
• Инфаркт миокарда.
I Карциноид, нейробластома.
• Кесарево сечение.
• Коарктация аорты.
І Конфликт матери и плода по системам АВО и Rh.
I Малярия.
• Массивные поражения тканей (краш-синдром).
І Острые и хронические заболевания печени.
• Острый панкреатит.
• Осложнения родов.
' Острый промиелоцитарный лейкоз.
• Отравления и интоксикации (змеиным ядом, лекарственными средствами).
• Отслойка плаценты.
ГЛАВАМ
К 778 КЛИНИЧЕСКАЯ ГРАНСФУЗИШЮГИЯ
• Переливание несовместимой крови.
• Рабдомиолиз.
I Рабдомиосаркома.
• Рестерногомия.
• Сепсис.
I Септический аборт.
• Серповидно-клеточная анемия (криз).
• Синдром гомологичной крови.
• Травматичные хирургические операции.
• Трансплантация органов и тканей.
• Трансплантация костного мозга.
• Тромбоэмболии легочной артерии.
• Тяжелая эклампсия.
• Хирургические кровотечения (отсутствие тщательного гемостаза).
• Хирургическая ангиопластика.
• Хронический мегакариоцитарный лейкоз.
• Шок (травматический, геморрагический, ожоговый, анафилактический »
тический).
I Эксикоз.
і Эмболия околоплодными водами.
• Эритремия.
Локализация, объем, степень тяжести травматизации тканей, а также шок.
осложняющий течение заболевания, являются наиболее важными факторами
предрасполагающими к ДВС-синдрому. Распространенность ДВС, осложняющего
течение политравмы, достигает 30%, при этом смертность составляет около 70%
всех случаев диагностированного ДВС-синдрома.
Частота диагностики клинически значимого ДВС-синдрома существенно варьи¬
рует и составляет:
• в онкологии - до 33,8% (в случаях солидных опухолей): 12,7% - при гемо-
бдастозах;
• при патологиях аорты, магистральных сосудов, соединительнотканной дис¬
плазии, приводящей к расслоению аорты, — 10,8%;
і инфекциях - до 6,4%;
• заболеваниях печени — 2,9%;
• акушерской патологии — 2,5%.
Установлено, что инфекции и септицемия являются основными причинами
ДВС-синдрома, на их долю приходится более 50% всех диагностированных слу¬
чаев.
Превалирующими клиническими симптомами ДВС-синдрома при различных
патологиях являются:
• полиорганная недостаточность — наиболее характерна для ДВС при инфек¬
циях. сепсисе (диагностируют у 77% больных), в онкологии (у 33%);
І кровоточивость, которая сопровождает ДВС-синдром при акушерской пато¬
логии в 100% случаев и в 30-50% случаев диагностированного ДВС-
синдрома, осложняющего течение заболеваний печени, онкологически!
заболеваний (гемобластозов, солидных опухолей).
В развитии ДВС-синдрома ведущая роль принадлежит:
• первичному поражению эндотелия сосудов;
• тромбопластическим веществам, попадающим в кровь;
• первичному поражению тромбоцитов.
В результате этих механизмов (как каждого в отдельности, так и в разли*"^
комбинациях) развиваются процесс множественного микросвертывания стро
зами и коагулопатия потребления с последующей активацией фибринолиза.
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 779
ДВС-синдром классифицируется по патогенетическому, этиологическому и кли-
ичгскому признакам. Ниже представлена детализированная классификация тром-
fLopparKHecKHX синдромов.
В патогенетической классификации различают 4 стадии развития ДВС-сиид-
^*1 - гиперкоагуляция и тромбообразование (характеризуется поступлением
в кровоток тромбопластина).
, II - нарастающая коагулопатия потребления с компенсаторным усилением
фибринолитической активности.
І ці - дефибринационно-фибринолитическая (характеризуется глубокой
гипокоагуляцией, вплоть до полной несвертываемости крови и выраженной
тромбоцитопении).
, IV - восстановительная, или стадия остаточных тромбозов и нарушения
циркуляции в органах-мишенях (характеризуется восстановлением фибри¬
ногена и других факторов свертывания крови).
В этиологической классификации выделяют следующие типы развития ДВС-
синдрома.
I. ДВС-синдром с преобладанием активации внешней системы гемостаза,
вызванной появлением тканевого тромбопластина в кровотоке.
I Введение извне тканевого тромбопластина.
❖ Введение извне тромбина.
1 Хирургические травмы: операции на сердце, легких, предстательной железе,
поджелудочной железе, матке.
I Генерализованный тромбоз,
ф Акушерская патология.
❖ Ожоги.
❖ Кровопотеря.
I Геморрагический и травматический шоки.
І Метастатический рак: поджелудочной, предстательной железы.
Щ Отравление ядами некоторых видов змей.
I Внезапная смерть.
I Тромбоз мезентериальных сосудов с геморрагическими проявлениями.
І Геморрагические инфаркты.
І Тромбоз легочной артерии.
Ф Гипоксия.
II. ДВС-синдром с преобладанием активации внутренней системы гемостаза,
вызванной появлением клеточно-тромбоцитного, эритроцитного и лейкоцитного
тромбопластина в кровотоке.
Ф Хронические лейкозы.
❖ Эритремия.
$ Тромбоцитемии, сопровождающие другие заболевания, а также состояния
после спленэктомии.
Ф Гемолитическая анемия.
Ф Переливание несовместимой крови.
^ Пароксизмальная ночная гемоглобинурия.
Ф Гемолитический шок.
$ Гемолитическая уремия.
Ф Отравление ядами некоторых видов змей.
III. ДВС-синдром с преобладанием активации системы гемостаза, связанной
с острым и хроническим васкулитами.
❖ Патологические состояния, при которых создаются условия для поступле¬
ния в кровоток бактерий.
~ Феномен Санарелли-Здродовского.
І: W
І НрЙИЧЕШАЯ ТРАНСФУЗИОЛОГИЯ r
- феномен Швартцмана
- Септический аборт.
I В Дифтерия.
I Дизентерия.
I Тонзиллит.
I Менянгококковый сепсис.
I Гастроэнтериты.
І Кумариновый некроз.
I Аллергические реакции.
- феномен Артюса.
I Болезнь Мошкович — тромботическая тромбоцитопеническая nvn
І Болезнь Шенлейна-Геноха. ^
- Анафилактические состояния.
- Заболевания, приводящие к геморрагическому нефриту с Цилиндпуп -
ДВС возникает при мощной активации системы гемостаза, при этом акщм»
гемокоагуляции значительно превышает возможности антитромботических
низмов контроля за свертываемостью.
Основные механизмы активации системы гемостаза при ДВС-синдроме п»
ставлены следующим образом. ре“
I Интенсивное высвобождение тканевого субстрата. Тканевый фактор нам
дится на поверхности большинства клеток, максимальное его количество
на поверхности эпителиальных и глиальных клеток. Клетки эндоте®.
сосудов, моноциты в норме не содержат тканевый фактор, но в ответ на пато¬
логическую стимуляцию эндотоксинами, фактором некроза опухоли, шпор.
лейкином-1 происходят массивный выброс тканевого фактора из субэндоте¬
лия в сосудистое русло и активация гемостаза. Примерами этого механизма
активации гемокоагуляции могут служить:
Ц классический акушерский тромбогеморрагический синдром, когда из мани
в кровоток интенсивно поступают тромбопластические вещества;
« травматичные хирургические вмешательства, особенно на паренхиматоз¬
ных органах;
1 сепсис, септический шок, сопровождающийся выходом протеаз;
1 реинфузия аутокрови, излившейся в рану во время операции (в ней содер¬
жатся не только микроагрегаты клеток, но и тканевый фактор, концентра¬
ция которого пропорциональна степени травматичности операции).
К Контактная активация гемостаза. Внутренний механизм и тромбоцитное
звено гемостаза активизируются при контакте с чужеродными поверхностя¬
ми, например при циркуляции крови в аппаратах искусственного, вспомога¬
тельного кровообращения, во время гемодиализа, гемодиаультрафильтра¬
ции, при контакте с искусственным клапаном сердца, сосудистым протезом,
атеросклеротической бляшкой. Вероятность развития ДВС зависит от сле¬
дующих факторов: количества крови, проходящей через аппарат, временя
контакта крови с чужеродной поверхностью и качества (степени тромбоген-
ности) материала, из которого изготовлен сосудистый протез, магистрали
аппарата.
І Чрезмерная активация гемокоагуляции. Наблюдается при большинстве онк
логических заболеваний (вырабатываются неопластические прокоагулянтные
факторы), панкреатите (в кровеносное русло попадает большое количеств"
лротеолитических ферментов), при укусах ядовитых змей, приводящих к
тезу гемокоагулирующих протеаз.
І Дефицит антикоагуляционных механизмов вследствие врожденного или рт
обретенного дефицита естественных антикоагулянтов. Врожденный да?
цит АТ Ш (<70% нормы) приводит к тромбозам глубоких вен,
ДИССЕМИНИРОВАННОЕ ВНУТРМСОСУДИШЕ СВЕРТЫВАНИЕ КРОВИ
781
Приобретенный дефицит АТ Ш появляется вследствие повышенно*
-j его потребления: при длительном применении больших доз гепарина
(>20 тыс. ЕД/сут), постоянной активации свертывающей системы (напри*
мер. беременность, хронические заболевания).
Рак
Сепсис
Г
1
г
Раковые
клетки
Лейкоциты
Рис. 21-9. Патогенез ДВС-синдрома
Всю схему развития ДВС-синдрома можно представить в виде последователь¬
ности патофизиологических процессов (рис. 21-9, 21-10).
Большое значение в формировании ДВС имеют скорость кровотока и агрегация
клеток крови (сладж-синдром), особенно в зоне микроциркуляции. Длительное
сладжирование приводит к освобождению клеточных тромбопластических
веществ, нарушению микроциркуляции, ацидозу, поражению энтотелия и субэн¬
дотелия, выходу тканевого фактора и микротромбированию. Это наблюдается
при шоке, сопровождающемся уменьшением фракции сердечного выброса, поли-
глобулиях, тромбоцитозах.
Клиническая классификация ДВС-синдрома:
• острый (вплоть до молниеносного);
• подострый;
• хронический;
• рецидивирующий;
• латентный.
Молниеносная форма ДВС с тяжелейшими геморрагиями характерна для аку¬
шерской патологии, гемолитического посттрансфузионного осложнения. Особен¬
ностью молниеносного ДВС-синдрома является минимальный срок его развития.
Кровоточивость при молниеносном ДВС носит неуправляемый, опасный для жизни
характер, проявляется профузными маточными кровотечениями, кровотечениями
из желудочно-кишечного тракта, операционной раны. Для острой формы ДВС
характерны диффузная кровоточивость из операционной раны, носовые, десне¬
вые, постинъекционые кровотечения, позже появляются кровотечения из органов
*мудочно-кишечного тракта, возможны обширные внутренние гематомы.
7 82
КЛИНИЧЕСКАЯ ТМНСФУЗИОЛОГИЯ
Рис. 21-10. Схема развития ДВС-синдрома
Острый ДВС развивается при интенсивной длительной активации свертывающей
системы крови, при этом острота и выраженность синдрома зависят от степени
тяжести заболевания-триггера. При остром ДВС быстро развивается мультифак-
торный дефицит гемостаза, таким образом, ДВС проявляется преимущественно
коагулопатией потребления, поэтому появление признаков кровоточивости часто
является наиболее ранним симптомом начинающегося ДВС. Однако основные кли¬
нические проявления ДВС-синдрома определяются выраженными микротромбоэм-
болическими нарушениями органов и тканей, которые являются причиной развития
полиорганной дисфункции или недостаточности. ДВС острого течения характерен
для сепсиса, травматичных хирургических вмешательств, краш-синдрома, массив¬
ных гемотрансфузий, распада опухоли, при применении бактерицидных антибиоти*
ков. Продолжительность развития острого ДВС-синдрома составляет от нескольких
часов до нескольких суток. „
Подострое течение ДВС наблюдается при аутоиммунных заболеваниях (
аутоиммунном геморрагическом васкулите), хронических инфекциях.
ность ДВС при подостром течении - от нескольких недель до месяцев, характер
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 783
ГЯ менее выраженными, чем при остром течении, клиническими проявления-
^ преобладанием микроциркуляторных нарушений органов.
^Хроническая форма ДВС сопровождается тяжелой терапевтической патологией
чение нескольких лет — хронической сердечно-сосудистой недостаточностью,
«ВС легочным сердцем, гипертонической болезнью, сахарным диабетом, диабети-
сКой ангиопатией, хроническим пиело- и гломерулонефритом. Кроме этих пато-
гий, причинами хронического, затяжного течения ДВС-синдрома являются сле¬
дующие аномалии: хрониосепсис, в том числе септический эндокардит, хронические
доусные заболевания (гепатиты, ВИЧ), иммунная и иммунокомплексная терапия,
п начальных стадиях заболевания, как правило, хронический ДВС-синдром бессим¬
птомен, в ряде случаев диагностируется преимущественно на основе лабораторных
показателей. Нарастание выраженности клинической симптоматики происходит
пои прогрессировании заболевания, спровоцировавшего этот процесс.
Необходимо отметить однотипность микроциркуляторных изменений при раз¬
личных формах ДВС: блокада микроциркуляции определяется тяжестью состоя¬
ния больных, характером осложнений, исходом болезни. Тяжелее всего поража¬
ются органы с развитой капиллярной сетью: легкие, почки, печень, головной мозг,
надпочечники. При аутопсии в органах находят ишемические и геморрагические
инфаркты, множественные кровоизлияния. При гистологическом исследовании
выявляют стаз и микроагрегаты форменных элементов крови, экстравазаты, мно¬
жественные отложения фибрина внутри сосудов и под эндотелием.
При хроническом ДВС тромбоцитное звено гемостаза находится в состоянии
активности: в органах-мишенях постоянно образуются тромбоцитные агрега¬
ты, разрастается соединительная ткань, развиваются склеротические изменения
в органах, что приводит к потере их функциональной способности.
На основании лабораторных и клинических признаков диссеминированное вну-
трисосудистое свертывание крови условно подразделяют на 3 стадии (рис. 21-11).
і 11 гиперкоагуляция. Эта стадия кратковременна при молниеносном и остром
течении ДВС и быстро переходит в стадию гипокоагуляции вследствие
истощения гемостатических механизмов и максимальной компенсаторной
активации фибринолиза.
• II - нормокоагуляция. Период нормокоагуляции очень кратковременный,
характеризуется субкомпенсацией гемостаза и отсутствием признаков кро¬
воточивости.
І ІП - гипокоагуляция, причиной которой является мультифакторная недо¬
статочность гемостаза, развивающаяся вследствие повышенного потребле¬
ния факторов при диссеминированном свертывании крови.
^Ремиссия ►^^ыздоровлени^^
I© Стадии ДВС-синдрома
II стадия
III стадия
I КЛИНИЧЕСКАЯ ТИШСФУЗВЮПОГИЯ Щ
I стадия ДВС (гипсркоагуляционная фаза) характеризуется гиперкоа
я повышенной агрегацией тромбоцитов. Ее продолжительность зависит
ш и степени тяжести основного заболевания. Характерное проявления 'Ч',
I - мгновенное свертывание крови В игле ИЛИ пробирке. ^ Ctj_
На этой стадии вследствие микротромбирования возникает блокада м
кудяцим. В ответ на микротромбообразование резко активизируется
лю. что можно зарегистрировать посредством следующих лаборатсющ^1^
(тябл. 21-5). ^
Таблица 21-5. Лабораторные тесты, подтверждающие наличие I стадии синдрома дИСс
ванного внутрмсосудистого свертывания
Показатели
Норма
При 1 ставйіГлт^^
1 Время свертывания по Ли-Уайту
8-12 мин
Укорочение ~
Гдймирвааниое частичное (парциальное) тромбо-
лпастинсеое время (АЧТВ)
Ц чувствительный метод из ориентировочных
тестов свертывания)
40-50 с
Укорочение —
Фибриноген (по Рутбергу)
2,0-4,0 г/л
Увеличивается s
Количество тромбоцитов
180-320х10»/л
Уменьшается или
Агрегация тромбоцитов (определяется гемолизат-
згрегационным методом)
20-40 с
Укорочение
При интенсивной активации коагуляции тромбоциты находятся в активиоо-
ванном состоянии, контактируют друг с другом, сладжируются, выделяют в кроа
тромбоцитные факторы. Постепенно количество тромбоцитов уменьшается, иста-
щается система физиологических антикоагулянтов.
II стадия ДВС (фаза нормокоагуляции) характеризуется нарастающей коагуло-
патией потребления и тромбоцитопенией. Лабораторные тесты могут подтвердил
нормокоагуляцию, которая возможна вследствие сочетания повышения коагуля¬
ции и начинающейся коагулопатии потребления (в первую очередь истощакщ
плазменные факторы свертывания — фибриноген, протромбин). Снижается содер¬
жание AT III, что связано с потреблением его на инактивацию тромбина и активи¬
рованных факторов свертывания. Снижение AT III менее 70-75% является фак¬
тором тромбогенности и отражает степень тяжести ДВС. Во II стадии возможно
появление повышенной кровоточивости, кровоизлияний на коже, слизистых.
При острой форме ДВС I и II стадии очень кратковременны и быстро перехода
в III стадию.
III стадия (гипокоагуляционная фаза) характеризуется выраженной гаю-
коагуляцией и коагулопатией потребления. В первые две стадии ДВС происходит
выработка значительного количества тромбина, вследствие чего резко возрастая
содержание фибрин-мономеров. Максимально активизируется фибринолиз,»
плазмина расщепляет фибриноген и другие нестабилизированные продукты пре¬
вращения фибрина (в том числе фибрин-мономеры и их комплексы с фибриноге¬
ном). Это приводит к накоплению продуктов деградации фибриногена. Часть ПДФ
поглощается макрофагами, однако большая часть остается в сосудистом русл*,
формируя растворимые фибрин-мономерные комплексы (РКФМ). На Р$Р
тромбин не оказывает свертывающего действия — развивается гипокоагуляция-
Таким образом, в крови больного находится еще достаточное количество активи¬
зированных факторов свертывания крови, в том числе тромбина, но коагуляции
не происходит из-за блокирования перехода фибриногена в фибрин продуктами
паракоагуляции. Это состояние иногда ошибочно называют афибриногенемиеи
Повышение содержания ПДФ и D-D-димеров фибриногена — наиболее надежн
диагностический признак ДВС-синдрома.
На этом этапе происходит истощение системы фибринолиза, образуюЩ^
микросгустки не подвергаются лизированию. Клинически это проявляется н.
ДИССЕМИНИРОВАННОЕ 8НУТРИСОСУДЙСІОЕ С8ЕРТЫ8АИИЕ КРОВИ 7®5
«ямой кровоточивостью и развитием вследствие блокады микроциркуляции
рзнной недостаточности. Развивается тромбоцитопения потребления -
я°^.дя часть тромбоцитов уходит в микросгустки. Отмечается также тромбо-
^''ііатия (нарушение функции тромбоцитов), развивающаяся вследствие Ингм¬
ар"* агрегации тромбоцитов продуктами паракоагуляции.
WJJ ^адня является критической в течении ДВС даже при успешной медика-
озной и хирургической терапии основного заболевания. Благоприятный
я возможен лишь в 30-40% случаев. Длительность реконвалесценции зависит
^ лепени тяжести поражения органов-мишеней.
o'* „С иногда сопровождается внутрисосудистым гемолизом, который усугубляет
опагическую анемию. Гемолиз обусловлен тем, что эритроциты, потерявшие
^обность к деформации, при прохождении по микроциркуляторному руслу
їгментируются нитями фибрина.
Пои хроническом ДВС активация свертывания носит менее выраженный харак-
что подтверждается умеренными изменениями лабораторных показателей:
• ПДФ " незначительное повышение;
• количество тромбоцитов — в норме или повышено;
І агрегация тромбоцитов — снижение (вследствие тромбоцитопатии);
• АТ Ш - умеренное снижение;
, фибриноген - повышен.
Микроциркуляторные нарушения при хронических формах ДВС играют зна¬
чительную роль в прогрессировании основного заболевания, при этом наруша¬
ются репаративные процессы, развиваются склеротические изменения органов-
мишеней.
Таблица 21-6. Лабораторная диагностика синдрома диссеминированного внутрисосудистого
свертывания
Лабораторные показатели
1 стадия
II стадия
Ill стадия
Количество тромбоцитов
Не меняется
4-
ш
АЧТВ
і
¥
*фф
D-0-димвр
Не меняется
Повышается
Фибриноген
t
Снижается
до нормы
****
AT III
Не меняется
+
Ш
Время кровотечения
1
Т
тт
Время свертывания
1
f
ффф
ПДФ
ф
тт
пт
Растворимый фибрин-мономерный
комплекс
Не меняется
ф
п
Начальная диагностика основывается на анализе клинико-лабораторных при¬
знаков, позволяющих предположить ДВС-синдром:
• заболевание-триггер;
• удлинение АЧТВ;
І тромбоцитопения;
• клинические проявления кровоточивости.
Лабораторная диагностика ДВС подразделяется на 2 этапа.
I | ~ минимальная диагностика, ориентировочные лабораторные тесты (к ним
относятся вышеуказанные методики, доступные всем лечебным учреждени¬
ям). Кратность проведения мониторинга — не реже 1 раза в 4 ч, при необхо¬
димости — чаще (табл. 21-6).
• И ~ максимальная диагностика, подтверждающие лабораторные тесты.
Для которых требуются значительное время и соответствующее оснащение
7Ц КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
клинических специализированных лабораторий. Диагностику
на соответствующих методиках, нередко проводят с большим
что существенно сказывается на качестве и своевременности пп
терапии. К этим методам относят исследования агрегационных свой^’Ч*
боцигов, определение толерантности плазмы к гепарину, времени
нового лизиса сгустка, ХІЬзависимого фибринолиза, содержания^0^
антитромбинового комплекса (ТАТ), плазмин-антиплазминового
(ПАП), D-D-димеров. к°Мп^
D-D-димеры являются продуктом расщепления фибрина, увеличени
жания которых свидетельствует об активации свертывания и компенст2Ч
го фибринолиза. Тест имеет значительную достоверность в диагностик'10'
синдрома. е %
Тромбин-антитромбиновый комплекс (ТАТ) — комплекс тромбина и
тромбина III, избыточное количество которого образуется в результате акти^11
свертывания крови, характерного для диссеминированного внутрисосудиВачИ11
свертывания крови. а°г
Плазмин-антиплазминовый комплекс (ПАП) — динамика показателя Ш
жает образование плазмина и соответственно активность фибринолитичео^
процессов при ДВС-синдроме.
Растворимые фибрин-мономерные комплексы (РФМК) — продукты раош
фибриногена, в норме отсутствуют, существенно повышаются при ДВС-синдром
Тромбомодулин - белок клеточной мембраны эндотелиоцитов, является мал
кером поражения эндотелия, субэндотелия; повышение его содержания свиде¬
тельствует о степени эндотелиального, тканевого поражения.
Зачастую клинические симптомы синдрома появляются значительно раньше
лабораторных маркеров активации системы гемостаза, соответственно в диагно¬
стике ДВС важнейшую роль отводят наличию заболевания-триггера, ассоцииро¬
ванного с этим серьезным осложнением.
Основными лабораторными маркерами синдрома являются персистируюпщ
тромбинемия, нарастание содержания в плазме растворимого фибрина и РФМК,
прогрессирование клеточных маркеров ДВС — фрагментированных эритроцитов,
спонтанной агрегации тромбоцитов и тромбоцитопения, а также снижение уровня
физиологиеских антикоагулянтов — АТ, протеина С и плазминогена.
Лабораторный мониторинг позволяет не только установить диагноз ДВС,
но и его стадию, форму, а также осуществить контроль эффективности терапии
заболевания-триггера и ДВС.
Клинические проявления синдрома диссеминированного
внутрисосудистого свертывания
Наряду с характерными для ДВС изменениями лабораторных показателей важное
место в диагностике этого синдрома занимают его клинические проявления. В тяже¬
лых случаях, когда у пациента развивается циркуляторная и дыхательная недостаточ¬
ность, снижается диурез, появляются кожные петехии, экхимозы, носовые, десневые
кровотечения, установление диагноза не представляет затруднений. Однако нередко
при подостром и хроническом течении синдрома клиническая манифестация до,'
нетипична, а лабораторные исследования малоинформативны. Тем не менее риск раз-
вития ДВС имеется у большинства тяжелобольных пациентов.
Диагностика ДВС-синдрома основывается на анализе клинических данных-
показателей системы гемостаза, позволяющих определить формы, стадии синдр0*
ма и реакции системы гемостаза на проводимую терапию. ^
Ранняя диагностика основана на выявлении заболеваний и патологичс
состояний, при которых ДВС-синдром закономерен. При отсутствии подтвер*
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 787
^дпjx ДВС тестов методом идентификации может служить биопсия пораженных
^^ов. при которой выявляются множественные микрососудистые тромбозы.
с поражением органов-мишеней при ДВС происходят изменения и в коже,
жа ■" эт0 °Рган’ наиболее активно (после почек и легких) вовлекающийся
патологический процесс. Максимальная выраженность поражения кожи имеет
\f~Q при молниеносной форме ДВС. В прижизненных биоптатах кожи определя¬
ли признаки ангиита, гиалиновые тромбы в просветах мелких сосудов (преиму¬
щественно венул). расположенных в сосочковом и сетчатом слоях дермы, в под¬
ложной клетчатке.
Основные типичные клинические проявления ДВС обусловлены распространен¬
ии, геморрагиями и/или тромбозами и полиорганной недостаточностью (ПОН).
ПОН развивается вследствие тромбогеморрагических поражений органов, имею¬
щих хорошо развитую микроциркуляторную сеть, в первую очередь легких, почек,
головного мозга, кожи, надпочечников, печени. Необходимо отметить, что в боль¬
шинстве случаев превалирующей клинической симптоматикой ДВС является ПОН.
тогда как геморрагическая симптоматика встречается лишь в 24% случаев.
ДЫХАТЕЛЬНАЯ СИСТЕМА
Первыми симптомами поражения легких являются одышка и падение арте¬
риальной оксигенации. Острая дыхательная недостаточность (в разной степени
выраженности) развивается вследствие:
• сосудистого микротромбирования;
І высвобождения из тромбоцитов вазоактивных субстанций и других продук¬
тов клеточной секреции.
Капилляры и бронхиолы под воздействием вазоактивных субстанций сужа¬
ются, падает артериальная оксигенация, нарастает рС02, увеличивается частота
дыхательных движений, возникает острая легочная гипертензия. В случае сво¬
евременного устранения патологического триггерного механизма прогноз благо¬
приятен, так как эндотелий сосудов легких обладает очень высокой фибриноли-
тической активностью, что позволяет лизировать образовавшиеся микротромбы
в легочных капиллярах в течение нескольких часов, т.е. патологический процесс
в легких в начальных стадиях носит обратимый характер.
При неадекватной терапии либо при развитии инфекционных или других
осложнений имеет место отсроченный микроэмболический синдром. Этот син¬
дром характеризуется интенсивным длительным процессом микротромбирования
в системе легочного кровообращения. Фибринолитическая активность эндотелия
легочных сосудов истощается, что является важным патогенетическим факто¬
ром. Система фибринолиза не в состоянии разрушить микротромбы, происходит
замедление выведения продуктов деградации фибрина и медиаторов воспаления.
Накопление ПДФ вызывает длительную вазоконстрикцию, в результате которой
повышается сосудистая проницаемость для жидкости и белков плазмы, возникает
интерстициальный, затем альвеолярный отек легких. Продукты распада лейко¬
цитов осложняют патологический процесс дополнительной вазоконстрикцией,
усугубляя поражение альвеоло-капиллярных мембран.
Таким образом, ДВС-синдром является одной из причин развития острого
респираторного дистресс-синдрома — ARDS (Acute Respiratory Ddistress Syndrome).
Вследствие поражения альвеоло-капиллярных мембран применение диуретиков
мало- или неэффективно.
МОЧЕВЫДЕЛИТЕЛЬНАЯ СИСТЕМА
Отложение фибрина в сосудах почечных клубочков может привести к почечной
недостаточности. Периоду олигурии иногда предшествует полиурия. В кортикаль¬
ном слое почек появляются множественные билатеральные некрозы, что прояв-
jfg КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
даете* ммкро~ и макрогематурией. Осмолярность мочи, как правило не
Диуретическая терапия оказывает слабовыраженный эффект. Гемодйяп МЄНя%
при высоких показателях мочевины, креатинина крови, при выраженной П0|<4
щциппи серьезных нарушениях электролитного состава крови. ГНп%(.
ЦЕНТРАЛЬНАЯ НЕРВНАЯ СИСТЕМА
Выраженность энцефалопатии определяется тяжестью состояния r
фульмннантного ДВС возможно менингеальное кровотечение, котоп
является явлениями менингизма, очаговой неврологической СИМПТОМ6 ^
при паренхиматозных кровоизлияниях в головной или спинной мозг. атнк<>й
КОЖА, СЛИЗИСТЫЕ ОБОЛОЧКИ
Мнкротромбирование сосудов кожи приводит к локальным геморрагии
инфарктам, локализующимся на лице, конечностях. Для ДВС характерны пи**11
альный, гематомный типы кровоточивости, носовые, десневые кровотечения*
вотечения из мест инъекций. Такая кровоточивость обусловлена формирован**0
неплотных, легко лизирующихся сгустков.
ПИЩЕВАРИТЕЛЬНАЯ СИСТЕМА
Для ДВС-синдрома характерны образование шоковых, гипоксических эрозий
и язв, нередко кровоточащих, диффузной кровоточивости слизистой оболочка
ЖКТ и нарушение барьерной функции слизистой оболочки, приводящей к бак¬
териемии. Выделяется особая закономерность — трансформация асептического
ДВС-синдрома в септический. Чаще всего этот процесс связан либо с инфицирова¬
нием раневой поверхности, либо с нарушением барьерной функции кишечника.
Профилактика и терапия синдрома диссеминированного
внутрисосудистого свертывания
В настоящее время в силу выраженной гетерогенности причин, приводящих
к ДВС-синдрому, не представляется возможным выработать единые рекоменда¬
ции, которые можно было бы использовать при лечении различных патологиче¬
ских состояний, вызвавших ДВС-синдром. Но, учитывая тот факт, что независимо
от заболевания-триггера, провоцирующего ДВС-синдром, течение процесса имеет
характерные особенности, можно определить общие принципы профилактики
и терапии этого грозного осложнения. Очевидно, что усилия должны быть направ¬
лены в первую очередь на ликвидацию или активную терапию основного заболе¬
вания. Активная этиотропная терапия, ранний перевод пациентов с клиническими
проявлениями развившегося ДВС-синдрома в реанимационное отделение позво¬
ляют оптимизировать течение заболевания. Пациенты, у которых диагностирован
ДВС-синдром, а особенно его острая или молниеносная формы, - это пациенты
реанимационного профиля, нуждающиеся в лечении в условиях отделения интен¬
сивной терапии с обязательным привлечением к лечебному процессу трансфузио-
логов и специалистов по патологии системы гемостаза.
Основные принципы, которых следует придерживаться при лечении Д®
синдрома:
В комплексность;
I патогенетичность;
• дифференцированность в зависимости от стадии процесса.
Своевременная терапия синдрома направлена: в.
• на устранение клинических проявлений основного заболевания, осло
шегося ДВС;
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 789
прерывание внутрисосудистого свертывания;
* осйновкУ коагулопатического кровотечения.
у пациентов группы риска ДВС обязателен мониторинг лабораторных пока-
-елей и функций жизненно важных органов; почасового диуреза, показателей
Р°2- содержания лактата, лактатдегидрогеназы, клинического анализа
^ -ii с определением количества тромбоцитов, содержания мочевины, креати¬
ні» коови. электролитов, а также АЧТВ, протромбинового времени, AT III. D-D-
Серов фибриногена, ПДФ. РКФМ.
в паНные лабораторных показателей в первые часы заболевания могут не выхо¬
дя! за пределы нормы, поскольку часто клинические симптомы значительно
^рпежают лабораторные изменения. Однако регулярный контроль их в течение
^скольких часов способствует ранней диагностике ДВС. определению стадии
Н активности патологического процесса, а также осуществлению контроля эффек¬
тности выбранной терапии.
Основополагающий принцип терапии ДВС-синдрома — максимально раннее
устранение триггерного фактора, поскольку диссеминированное внутрисосудистое
свертывание крови является неспецифической патологией гемостаза, в основе
патогенеза которой лежат рассеянное свертывание крови и блокада микроцирку-
ляторного русла, приводящие к полиорганной недостаточности с последующими
гипокоагуляцией, тромбоцитопенией и кровотечениями вследствие коагулопатии
потребления. Антибиотикотерапия гнойно-септических состояний и осложнений,
хирургическая санация, дренирование очагов инфекции, адекватная инфузионная
терапия гиповолемии, коррекция анемии, кардиопрессорная терапия при различ¬
ных вариантах шока, своевременное хирургическое лечение и другие мероприятия
являются этиотропной терапией ДВС-синдрома, которое прерывает патологиче¬
ские процессы системной активации свертывания крови, микротромбирования
и потребления факторов свертывающей системы.
І Таким образом, основой профилактики ДВС является ранняя терапия пато¬
логии, обусловившей тяжесть состояния больного. Особое значение в профи¬
лактике ДВС отводится быстрому восстановлению кровоснабжения тканей,
улучшению реологических свойств крови и ее кислородтранспортной функ¬
ции (рис. 21-12).
Дифференцированный подход к выбору вариантов лечения основан на опре¬
делении превалирующих клинико-лабораторных признаков ДВС-синдрома,
поскольку наличие или отсутствие геморрагий существенно видоизменяют тера¬
пию (рис. 21-13).
АНТИКОАГУЛЯНТНАЯ ТЕРАПИЯ
Гепарин натрия (гепарин*) — наиболее часто применяемый препарат для про¬
филактики и лечения тромбоэмболических состояний. Использование гепарина
оправданно на любой стадии лечения ДВС-синдрома. Гепарин* препятствует вну-
трисосудистому тромбообразованию, оказывает антитромбопластиновое и анти-
тромбиновое действие, тормозит переход фибриногена в фибрин, снижает агрега¬
цию эритроцитов и в меньшей степени тромбоцитов.
Назначением антикоагулянтов при терапии ДВС преследуют следующие цели:
• восстановление нормального гемостаза;
I профилактику дальнейшего тромбообразования;
' удаление образовавшихся тромбов и восстановление функций пораженных
органов.
Гепарин натрия — сульфатизированный полисахарид, относящийся к семейству
гаюкозоаминогликанов с молекулярной массой 4-30 кДа, средняя молекулярная
■Щ і 13 кДа. Гепарин* — антикоагулянт прямого действия, блокирует биосин-
3 тромбина, снижает агрегационную способность тромбоцитов, незначительно
В КЛИНИЧЕСКАЯ ТРАНСФУЗЙОЛОГИЯ
Ці 21-12. Терапия пациентов с острым ДВС-синдромом (схема)
Я-1Э. Дифференцированная терапия ДВС
ДИССЕМИНИРОВАННОЕ ВНУТРМСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 791
^визирует фибринолиз. Кофактором гепарина* является AT III. При дефиците
Loro естественного антикоагулянта гепарин* не оказывает антикоагуляционного
3 йствия. Следует иметь в виду, что гепарин* обладает рядом побочных эффектов.
?е более опасными из которых являются:
® , тенденция к повышенной кровоточивости, что особенно опасно в послеопе¬
рационном периоде:
• гепарининдуцированная тромбоцитопения. Через 2-10 сут гепаринотерапии
возникает незначительная тромбоцитопения. Как правило, уровень содержа¬
ния тромбоцитов при этом остается выше 100 ООО в 1 мкл и лечение гепари¬
ном* может быть продолжено. Однако в ряде случаев через 6-12 сут внутри¬
венного или подкожного введения гепарина* возникает тяжелая отсроченная
тромбоцитопения, очевидно, иммунного происхождения. На поверхности
тромбоцитов экспрессируется гепаринсвязывающий протеин PF4. к которо¬
му у некоторых пациентов вырабатываются антитела. Титр антител к протеи¬
ну PF4 максимально возрастает к 7-10-му дню назначения антикоагулянтной
терапии. При продолжении гепаринотерапии в течение нескольких часов
или суток может развиться тяжелая тромбоцитопения, которая сопровожда¬
ется артериальными и/или венозными тромбозами. У всех больных, получа¬
ющих гепарин*, необходимо периодически определять количество тромбо¬
цитов. При возникновении тяжелой тромбоцитопении препарат необходимо
отменить. Кроме того, трансфузии тромбоконцентрата противопоказаны из-за
высокого риска рикошетных артериальных тромбозов. В подобных случаях
назначают антитромботические препараты нового класса - прямые инги¬
биторы тромбина, к которым относятся рекомбинантный гирудин, аргатро-
банр, бивалирудин*’;
І усугубление дефицита AT III. Комплекс «АТ III + гепарин*» быстро выво¬
дится из циркуляторного русла. При использовании больших доз гепарина*
запасы AT III быстро истощаются и наступает рикошетная гиперкоагуляция:
І резистентность к гепарину. В ряде случаев, несмотря на максимальное уве¬
личение дозы гепарина*, отсутствует терапевтический эффект проводимой
гепаринотерапии. Установлено, что причиной резистентности к гепарину*
являются протеолитическое разрушение препарата либо инактивация его
гепариннейтрализирующими белками, в том числе тромбоцитным фактором
4. Выявление гепаринорезистентости является показанием для отмены пре¬
парата и назначения прямых ингибиторов тромбина [гирудина*, лепируди-
на*3 (Refludan), десирудина* (Revasc)]. Кроме того, гепаринорезистентность
во многом обусловлена дефицитом AT III. В подобных ситуациях, для вос¬
становления антикоагулянтного действия гепарина необходимо восполнить
дефицит AT III, а не увеличивать дозу антикоагулянта.
Назначение гепарина* при ДВС-синдроме необходимо начинать с малых доз -
50-100 МЕ/ч в виде постоянной инфузии, затем дозу вводимого препарата
при необходимости можно постепенно увеличить. Основной способ введения
гепарина* при терапии ДВС-синдрома — внутривенный капельный (в изотони¬
ческом растворе хлорида натрия, с плазмой), в некоторых случаях внутривенное
введение можно дополнять подкожными инъекциями.
Тактика гепаринотерапии, доза и частота введения препарата зависят от тече¬
ния и фазы ДВС-синдрома. Большое значение при назначении гепарина* и выбо¬
ре дозы антикоагулянта отводится анализу данных лабораторных исследований,
клинической ситуации, в частности таким факторам, как наличие или отсутствие
У больного раневой поверхности, продолжающегося кровотечения (из после¬
операционной раны, желудочно-кишечного тракта, из распадающейся опухоли,
маточного кровотечения и т.д.). В послеоперационном периоде гепарин* следует
применять с большой осторожностью с обязательным контролем показателей
712 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
исртивания крови. Если ДВС-синдром сопровождается кровоточив
і^радяю вообще необходимо отменить; при высоком риске КровоІ
Ill рвя
суточная доза гепарина* должна быть снижена в 2-3 раза. иив°т°чи^
Доза гепарина* также может изменяться в достаточно широких прел
вмости от формы и фазы ДВС-синдрома. В стадии гиперкоагуляции пЛЗХВзЧ
гепарина* имеет профилактическое значение и его суточная доза (при РИМе,%
геморрагий) может составить 35 000-50 ООО ЕД/сут (500-800 ЕДД^^Ч,
Первую дозу - 5000-10 000 ЕД вводят внутривенно болюсно. а затем ! ^1)
жеаательно с помощью инфузомата. Далее необходимую дозу гепари^?1^
бнрают в соответствии с лабораторными показателями и обязательной ^
при геморрагиях. Дозу гепарина* подбирают индивидуально на основант?*^
роторных показателей с учетом различной чувствительности к препарату Ла^
Оценить эффективность гепаринотерапии после внутривенного введения
лоданамике следующих лабораторных показателей: Ио*Но
• времени свертывания крови — удлинение в 1,2-1,8 раза по сравнению
мальными значениями; СноР-
• АСТ-тесту - удлинение до 160-170 с (норма — 110-120 с);
• АЧТВ - удлинение в 1,5-2,5 раза по сравнению с нормальными показа™
ми (норма — 35-45 с). еля'
Изменение показателя АЧТВ в указанных параметрах свидетельствует о до
жении терапевтической антикоагуляции. Контроль показателей гемостазиопм
мы проводят не реже чем через каждые 4 ч. Необходимо учитывать, что для проби
лактики тромбозов гепарин* назначают в низких дозах (такое лечение называется
терапией низких доз), при этом АЧТВ может удлиняться незначительно.
Наибольшие дозы гепарина* необходимы при наличии в крови больного белков
острой фазы (при острых инфекционно-септических процессах, краш-синдроме
ожогах і др.), которые инактивируют гепарин*, препятствуя его антикоагулянті
ной активности. Как было сказано выше, неэффективность гепарина* также свя¬
зана с блокадой и/или снижением содержания в плазме больного плазменного
кофактора гепарина* — антитромбина III.
В III стадии ДВС-синдрома (в фазе гипокоагуляции) гепарин* используют
под прикрытием трансфузий плазмы в гораздо меньших дозах, например, в нача¬
ле каждой трансфузии вводят 2500-5000 ЕД гепарина* внутривенно болюсно
или капельно. В целях снижения дозы гепарина* успешно применяют следующую
схему: непосредственно перед трансфузией СЗП в дозу плазмы (объем стандарт¬
ный дозы плазмы, полученной способом дискретного донорского плазмафереза,
составляет в среднем от 250 до 300 мл) добавляют 100-500 ЕД гепарина*. Данная
схема позволяет значительно снизить не только объем трансфузии плазмы,
но и дозу гепарина*. Кровотечение является противопоказанием к антикоагулянт-
ной терапии гепарином*.
В результате применения гепарина* улучшается состояние больного,■
ются явления ПОН, возрастают концентрация фибриногена и количество п
цитов и снижается содержание ПДФ. Обязателен контроль времени свер^
крови, терапевтический эффект возможен при удлинении времени свертывания
в 1,5 раза.
Путем фракционирования и деполимеризации синтезированы препараты гепа¬
рина* с низкой молекулярной массой - от 1 до 10 кДа (НМГ); средняя молекуляр¬
ная масса і 4,5 кДа, НМГ имеют отличные от стандартного гепарина механизм
действия, фармакокинетику, побочные эффекты. Препараты низкомолекулярн<ДО
гепарина - фраксипарин (надропарин кальция*), эноксапарин натрия (клекса >
далтепарин натрия (фрагмин*) и др. — оказывают более выраженное по сра
нию со стандартным гепарином, антитромботическое действие за счет выражен
активности против фактора Ха. высокой биодоступности и значительно более Р
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ С8ЕРТЫВАНИЕ КРОИЛ 793
jQ терапевтического эффекта. Биоусвояемость составляет 80-90%. вслед*
те^чего колебания концентрации препаратов НМГ незначительны. Значительно
сравнению со стандартным гепарином* отмечаются гепарининдуцирован-
Р^'мбоцитопения н гепаринорезистентносгь. Наиболее частым осложнением
*** гщи НМГ является кровоточивость; нейтрализация препаратов НМГ введенн-
^потамина сульфата или протамина хлорида- менее эффективна по сравнению
^ггандартным гепарином*. При опасных кровотечениях, возникших у пациентов
С° Лоне применения НМГ. проводят терапевтический плазмаферез в режиме плаз-
бмена с замещением удаленной плазмы донорской СЗП. возможно применение
^вированных препаратов факторов свертывания крови.
НМГ ММ >5400 Да
Рис. 21-14. Механизм действия НМГ на факторы свертывания
Молекулы НМГ с молекулярной массой менее 5,4 кДа взаимодействуют с АТ 111
плазмы, активизируя последний. К комплексу AT III + гепарин* присоединяется
фактор X, происходит его инактивация. Молекулы НМГ с молекулярной мас¬
сой более 5,4 кДа также активизируют AT III, но при этом образуется комплекс
с тромбином. Анти-На-активность НМГ замедляет процесс синтезирования тром¬
бина, тогда как анти-Ха-активность препарата уменьшает количество уже образо¬
вавшегося тромбина (рис. 21-14). В исследованиях фармакокинетики препарата
показано, что НМГ с молекулярной массой более 5,4 кДа элиминируется быстрее,
чем молекулы с молекулярной массой менее 5,4 кДа. Именно эта особенность обу¬
словливает пролонгированный анти-Ха-эффект низкомолекулярных гепаринов.
Помимо активизации AT III, НМГ имеют дополнительные воздействия на систе¬
му гемостаза (антитромбин Ш-независимые эффекты НМГ):
s в меньшей степени взаимодействуют с эндотелием сосудов, за счет чего ока¬
зывают более длительный по сравнению с гепарином* терапевтический
эффект;
І инициируют выработку ингибитора тканевого фактора (ингибитора тканево¬
го тромбопластина), концентрация которого после введения НМГ возрастает
в 3 раза;
• активизируют фибринолиз вследствие увеличения содержания активатора
плазминогена;
• улучшают реологические свойства крови.
Помимо противосвертывающего эффекта, AT III оказывает выраженное проти¬
вовоспалительное действие на сосудистый эндотелий, которое AT III осуществляет
33 счет стимуляции синтеза противовоспалительных простациклинов клетками
jag ЮМКИЧЄЄКАЯ тмнммиология
еосудактого эвдотелия. что приводит к снижению агрегации тромбони^
становлению микроциркуляции. в.
Препараты низкомолекулярного гепарина назначают подкожно р
парам препаратов низкомолекулярного гепарина отсутствует. поси^'Чі
дай препарат имеет различные эффективность, биодоступность, дозуу’*5' ***
уев с почечной недостаточностью необходим тщательный мониторив tliN-
вей свертывания крови в связи с угрозой кумуляции НМГ. г
Критерии эффективности терапии препаратами низкомолекулярного
І удлинение времени свертывания крови в 1.5-1,8 раза по сравнен ^
uanmuuu плікімтрлдии'
Рин»
И 1 1 ~раДПЄНИ1пГ
ррньшн показателями:
удлинение АСТ-теста до 140-160 с;
удлинение АЧТВ в 1.5-2,5 раза по сравнению с нормой (в случаях
назначения НМГ); '
В увеличение анти-Х^активности до 0,5-1,0 ЕД анти-Хумл. Этот теп
лает наиболее эффективно оценить действия НМГ; максимум действия"03^
подкожного введения наступает через 3-4 ч. Пос®
НМГ в терапии ДВС-синдрома показали достаточный эффект при мені,
по сравнению со стандартным гепарином* риске возникновения кровотечі
и меньшем потреблении АТ III.
В последние годы в литературе появились сообщения о применении с ХОПОШи
терапевтическим эффектом рекомбинантного гирудина [лепирудин (рефлу^!*
десирудин*' (реваск* )] - синтетических ингибиторов тромбина. Механизм лей
ствия препаратов основан на нейтрализации тромбина за счет блокады гируди¬
ном'' ферментативной активности тромбина.
Эффективность препаратов оценивают по АЧТВ, продолжительность которого
должна увеличиться в 1.5-2.5 раза по сравнению с исходным уровнем. Начальну»
дозу вводят в виде болюса до 0,1 мг/кг, затем переходят на постоянную инфузй»
в поддерживающей дозе 0,15 мг/кг в час под конторолем АЧТВ каждые 4 ч.
Основным побочным эффектом этих препаратов является резко возрастающий
риск неконтролируемых кровотечений, так как специфических антидотов к этим
препаратам нет. При передозировке, угрожающем жизни кровотечении прово¬
дят сеансы экстракорпоральной детоксикации — гемофильтрации, гемодиализа,
плазмообмена. Довольно часто возникает необходимость повторных сеансов
детоксикации, поскольку снижение концентрации гирудина в крови приводит
к перемещению накопленного во внесосудистом пространстве препарата в плазму
по градиенту концентрации.
ЗАМЕСТИТЕЛЬНАЯ ТЕРАПИЯ
Заместительная терапия направлена на восстановление гемостаза и в первую
очередь дефицита AT III и сериновых протеаз. Свежезамороженная донорски
плазма (СЗП), содержащая в естественном виде достаточные концентрации вен
необходимых компонентов системы гемостаза, является оптимальным препара¬
том для восполнения их дефицита и позволяет корригировать мультифакторную
коагулопатию, характерную для ДВС-синдрома.
Эффективность терапии достигается как можно более ранним струйным пере¬
ливанием СЗП до 800-1600 мл/сут. Первоначальная доза — 600-800 мл, затем
по 300-500 мл через каждые 3-6 ч. Таким образом, объем вливаемой плазмы
составляет 10-15 мл/кг, при необходимости его увеличивают. Трансфузию плаз
мы осуществляют с высокой объемной скоростью, по возможности в течение
При этом скорость инфузии ограничивается состоянием пациента, в
редь сердечно-сосудистой, почечной недостаточностью, гиперволемией.
СЗП в объеме 15 - 20 мл/кг позволяет увеличить активность факторов свертыва
в среднем на 30% исходного уровня. Кратность повтопных ин<Ьузий СЗП onpw
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КР08И 795
-ai клинической ситуацией и периодом полувыведения факторов свертывании
Р<«бл .21-7)
тзбпиЧ3 21 "7' Период полужизни факторов свертывания в свежезамороженной донорской плазме
г— фактор свертывания
Ти is vitra
Т,д послетранефузии, ч
Фибриноген
Стабильный
96
Стабильный
во
І-— V
3-5 дней
24
VII
Стабильный
4-6
Г" vi»
1-2 нед
11-12
f- IX
Стабильный
22
Г" X
Стабильный
35
Г" XI
Стабильный
во
XIII
Стабильный
144
фон Виллебранда
Стабильный
8-12
Трансфузии СЗП показаны при ДВС-синдроме, ассоциированном с кровоточи¬
востью, они позволяют:
• возместить недостаток практически всех компонентов гемостаза, в том числе
AT III и протеинов С и S (снижение содержания которых при ДВС-синдроме
происходит особенно интенсивно — в несколько раз быстрее, чем всех про¬
коагулянтов);
• ввести полный набор естественных антипротеаз и факторов, восстанав¬
ливающих антиагрегационную активность крови и тромборезистентность
эндотелия.
Трансфузии СЗП не применяют в целях профилактики ДВС-синдрома. при
отсутствии признаков кровоточивости и мультифакторного дефицита, так как
установлено, что профилактическое использование донорской плазмы не влияет
на частоту возникновения ДВС и не уменьшает потребность в дальнейшей транс¬
фузии.
Размораживание плазмы необходимо выполнять в специальных устройствах
для размораживания при температуре 37-40 °С. Размороженные препараты плаз¬
мы должны быть перелиты в течение 2 ч. Трансфузию плазмы осуществляют с уче¬
том групповой и биологической совместимости крови донора и реципиента.
Добавление небольших доз гепарина (около 500 ЕД) непосредственно перед
трансфузией в размороженную плазму позволяет существенно уменьшить объем
переливаемой плазмы и усилить лечебный эффект трансфузии. Гепарин* акти¬
визирует антитромбин III, вводимый с плазмой, превращая его в антикоагулянт
немедленного действия. Выраженный терапевтический эффект связан с быстрым
прекращением внутрисосудистого свертывания комплексом «АТ III + гепарин**.
Трансфузии плазмы со сниженным содержанием фибриногена и ряда других
факторов свертывания крови оказывают выраженный терапевтический эффект
при лечении ряда вариантов ДВС-синдрома. характеризующихся повышением
прокоагулянтной активности крови больных. Так, с этой целью успешно приме¬
няют концентрат нативной плазмы (КНП) — супернатантную фракцию плазмы
(получаемую после удаления криопреципитата), в которой в достаточном количе¬
стве содержатся плазменные белки, факторы свертывания крови, но существенно
снижено содержание фибриногена. КНП показан в гиперкоагуляционную фазу
или при ДВС хронического, рецидивирующего течения.
Криопреципитат, содержащий в большей концентрации, по сравнению с нефрак-
Чионированной СЗП, факторы VIII, фибриноген, фактор фон Виллебранда. фактор
КІН. фибронектин, показан для восполнения дефицита этих факторов в случаях
WG-синдрома острого, молниеносного течения (табл. 21-8). Применение целе-
jjg КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
сообразно также для профилактики объемной перегрузки, возможной
I трансфузии на фоне сердечно-сосудистой недостаточности и Ч-
дисфункции. После размораживания компонент должен быть введен в П0Чг<%
■ соответствии с групповой совместимостью через стандартные систему64*1*1*21
ливания крови, снабженные 160-микрометровыми фильтрами. вЛЯп*)к.
Таблица 21-8. Содержание факторов свертывания в одной дозе криопреципитата info.
j иента 10-15 мл)
Фактор свертывания
Концентрация (а одной дозе)
Фибриноген
150-250 мг
фон Виллебранда
100-150 ЕД
111
80-150 ЕД
т'Г ~-ч
XIII
50-75 ЕД
150-ЗЛО Э
Критическим уровнем содержания фибриногена при ДВС-синдромесчй»
0,7-1,0 г/л; целевой показатель компонентной гемотерапии — содержание УР
ногена более 1,0 г/л. Для восполнения выраженного дефицита фибриногена кпГ
преципитат вводят в терапевтической дозе: взрослым (массой тела 70 кг) - до а
детям - 1 доза/10 кг; новорожденным — 1 доза.
Для восполнения ОЦК применяют кристаллоидные препараты, растворы аль¬
бумина и плазмозаменители (декстраны, препараты гидроксиэтилированного
крахмала, желатина). В фазе гиперкоагуляции рекомендуют применение 400-
600 мл/сут декстранов, препаратов ГЭК, что позволяет снизить спонтанную
агрегацию тромбоцитов и способствует улучшению микроциркуляции в органаї
На других стадиях ДВС-синдрома применение коллоидных плазмозаменителей
не рекомендуют или возможно в объеме не более 400 мл/сут, поскольку введение
плазмозаменителей усугубляет явления коагулопатии потребления и предпочте¬
ние отдается препаратам желатина (гелофузин*) и растворам альбумина.
Если свежезамороженная плазма является обязательным компонентом терапии
ДВС, то трансфузию эритроцитной массы и тромбоконцентрата проводят по стро¬
гим показаниям: минимально допустимое содержание гемоглобина - 70-80 г/л,
гематокрит - 25%, количество эритроцитов — 2,5-Зх1012/л; тромбоцитопения
без клинических проявлений повышенной кровоточивости не требует замести¬
тельной терапии. При значительной анемизации, которая нередко сопровождает
течение ДВС-синдрома, показана трансфузия эритроцитной массы минимальнш
(до 3 дней) сроков хранения.
Для большей эффективности заместительной гемотерапии эритроцитсодержа-
шими препаратами крови необходимо придерживаться следующих правил:
і осуществлять трансфузии эритроцитной массы, а не цельной консервирован¬
ной крови;
S гемотрансфузии осуществлять на основе индивидуального подбора пробои
Кумбса;
I все гемотрансфузии осуществлять через лейкоцитные фильтры или перели¬
вать отмытые эритроциты (ЭМОЛТ);
• переливаемые компоненты крови необходимо подогревать до 35-37 "С;
с избегать циркуляторных перегрузок, строго учитывать объем трансфузии-
кровопотери и диуреза.
Фаза гипокоагуляции ДВС характеризуется нарастающей тромбоцитопеній •
которая требует адекватной заместительной терапии. Показания к трансфуз
донорских тромбоцитов:
I тромбоцитопения ~ менее 50-100х109/л;
• тромбоцитопатия - снижение агрегационных свойств тромбоцитов;
• клиническая картина повышенной кровоточивости при содержании тр
боцитов более 50-100x109/л — появление петехиальной, спонтан
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 797
кровоточивости слизистых оболочек, кровотечение из операционной раны
(источник хирургического кровотечения при ревизии раны выявить не уда¬
ется).
Концентрат тромбоцитов (ТК) переливают в терапевтической дозе, равной
10 ЕД КТ. Расчет необходимого количества доз ТК проводят исходя из массы
1»а пациента — 1 доза ТК на 10 кг массы тела. ТК противопоказан в случаях гепа-
^ниндуцированной тромбоцитопении, поскольку трансфузия тромбоконцентра-
в этих случаях приведет к артериальным и венозным тромбозам.
14 Критериями эффективности заместительной терапии являются:
, количество тромбоцитов больше предтрансфузионного;
І нормализация/укорочение времени свертывания крови;
, прекращение/уменьшение кровоточивости.
В табл. 21-9 представлены показания к назначению инфузионной заместитель¬
ной терапии.
Таблица 21-9. Показания к назначению инфузионной заместительной терапии
Компонент
Показания
сзп
ПВ и/или АЧТВ >1,5 нормы
Тромбоконцентрат
Количество
тромбоцитов <50-100x10’/л
Криопреципитат
Фибриноген <1,0 г/л
Если показано дальнейшее введение СЗП с высоким ЦВД (>12-14 см вод.ст.),
необходим обменный плазмаферез, который позволит осуществить трансфузию
СЗП в нужном объеме, не увеличивая ОЦК и не повышая центральное венозное
давление.
Концентраты антитромбина III
Препараты получают из вирусинактивированной донорской плазмы.
Как сказано выше, СЗП является основным источником сериновых протеаз,
фибриногена, AT III. Для эффективной гепаринотерапии содержание AT III
необходимо поддерживать на уровне более 80%. Известно, что в 1 мл плазмы
содержится 1 ME AT III. Таким образом, для одномоментного восполнения
дефицита этого естественного антикоагулянта необходима трансфузия значи¬
тельных объемов СЗП. Помимо инфекционных, аллергических осложнений,
трансфузия больших объемов СЗП чревата развитием гиперволемии и деком¬
пенсации сердечной недостаточности, именно поэтому трансфузию СЗП жела¬
тельно сочетать с препаратами AT III. Необходимо учитывать, что при остром
ДВС период полувыведения AT III укорачивается до 4 ч, что обусловливает
длительное или частое введение препаратов под контролем его активности.
Показанием к назначению концентратов антитромбина III является снижение
содержания AT III менее 50%; целевое значение терапии препаратами AT III —
уровень содержания более 80%.
Дозу препарата рассчитывают на основании определения активности антитром¬
бина в плазме больного до начала и в процессе лечения каждые 4-6 ч.
Раствор лиофилизированного AT III в начальной дозе 1000-1500 МЕ/сут вво¬
дится внутривенно со скоростью 50 МЕ/мин (около 60 капель в минуту); после
ведения 1 МЕ/кг массы тела активность антитромбина повышается на 1%
исходного значения. Поддерживающая доза вдвое меньше начальной и вводится
с интервалом от 8 до 24 ч.
При быстром введении возможны коллаптоидные состояния. Снижение содер-
*ания маркеров гиперкоагуляции (комплексов «тромбин-антитромбин», фибри-
иопептида А, РКФМ) и регрессия клинических симптомов свидетельствуют
эффективности выбранного режима терапии. Кроме этого, необходимо учиты-
ЦІ лТИЧИЧККАЯ ТРАНСФУЗИОЛОГИЯ
atm. факт, что применение АТ одновременно с гепарином усиливает антикг
доюшйэффект последнего, что должно учитываться при расчете дозы геп*1^*
I не должна превышать 500 ЕД. ари«э*1
Препараты AT III могут применяться для профилактики ДВС-синдроМа
акт с тяжелой полиорганной недостаточностью, особенно эффектней ^
ЯШ профилактики острого дистресс-синдрома. Установлено, что заместите!.
урмпм препаратами AT III значительно сокращает длительность забад^ *
и снижает смертность больных от ДВС. ^
Активированный протеин С*" [дротрекогин-альфа (активированн I
(зигрис*) | І рекомбинантный препарат, обладающий антикоагулянтным ^
ДбК'
станем.
Механизм действия препарата основан на блокировании синтеза тромбина за
яюгтвации факторов V и VIII; кроме этого зигрис* оказывает мощное тщ?
вовоспалительное действие. Доказана эффективность препарата для профиля»
теки и лечения ДВС-синдрома, осложняющего течение тяжелого сепсиса: па>
применения рекомбинантного активированного протеина С смертность снизилась
до 24% в сравнении со смертностью 30% в контрольной группе больных. На осно¬
вании этих данных зигрис* является препаратом выбора в лечении ДВС-сишнюш
при сепсисе.
Рекомбинантный активированный протеин Йр [зигрис*, дротрекогин-альфа (ах-
тивированный)] назначают внутривенно капельно в дозе 24 мкг/кг в час в течение
96 ч. Однако необходимо учитывать, что после применения препарата существен¬
но возрастает количество серьезных кровотечений, так как адекватный лабора¬
торный контроль показателей гемостазиограммы на фоне терапии зигрисом*
в настоящее время отсутствует.
Эптаког-альфа (НовоСэвен*) — рекомбинантный концентрат активизирован¬
ного фактора VIIa. Препарат НовоСэвен* был разработан для лечения спонтанны!
и связанных с операциями кровотечениями у пациентов с врожденной и при¬
обретенной (ингибиторной) гемофилией с действующими антителами против
факторов свертывания VIII или IX. В процессе клинических испытаний препарата
показана его высокая эффективность в случаях неконтролируемых посттравмати-
ческих, хирургических кровотечений у пациентов, не имеющих патологии гемо¬
стаза в анамнезе. Выраженный гемостатический эффект обусловлен механизмом
действия препарата НовоСэвен*, поскольку препарат инициирует гемостаз в месте
травматического, хирургического повреждения за счет формирования комплексов
с ТФ, выделенным пораженным субэндотелием. Несомненным преимуществом
является то, что на активность препарата НовоСэвен* не влияет мультифактор-
ная недостаточность гемостаза, характерная для массивной кровопотери, ДВС-
синдрома. Кроме того, в клинических испытаниях препарата не подтвердил*
существенную системную активацию гемостаза; повторные введения препарата
не оказывают влияние на содержание фибриногена и антитромбина. Тем не менее
применение препарата НовоСэвен* у больных с ДВС-синдромом в случаях опас¬
ных для жизни кровотечений требует тщательного лабораторного и клиническо
мониторинга для исключения активации процессов свертывания крови, особенно
при соответствующих факторах риска, к которым относят инфекции, септицени-
краш-синдром. Таким образом, НовоСэвен* в лечении ДВС-синдрома применя
только по жизненным показаниям и в тех случаях неконтролируемых кровоте^
ний, при которых другие виды консервативной гемостатической терапии не о
зывают эффекта,
Препарат назначают в дозе 90-120 мкг/кг с интервалом 2-8 ч; кратность в
дения определяется сохранением клинических проявлений профузной КР°® f
чивости. НовоСэвен* противопоказан пациентам, имеющим тромбоэмболия
эпизоды I анамнезе.
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 799
Препараты протромбинового комплекса (PPSB - Beriplex”. PPSB Konzentrat
' ТІМ'')- изготавливаемые из донорской плазмы, содержат в концентрированном
-иде витамин К-зависимые факторы свертывания крови: протромбин (Р), прокон-
!!п!гин (Р). фактор Стюарта (S), антигемофильный глобулин В (В) - PPSB.
Крайне нежелательным побочным эффектом препаратов PPSB является тром*
богенность, поэтому применение PPSB в лечении ДВС-синдрома возможно лишь
по жизненным показаниям и оправданно для купирования профузных кровоте¬
чений при отсутствии эффекта от антифибринолитиков и проводимой замести¬
тельной терапии СЗП, фибриногеном, тромбоконцентратом. В целях компенсации
системной активации свертывания крови необходимо назначение препаратов
концентратов антитромбина III: пограничным является уровень содержания AT III
менее 40%.
Расчет дозы препарата зависит от величины протромбинового времени (ПВ,
времени Квика), АЧТВ (активированного частичного тромбопластинового вре¬
мени): при удлинении ПВ, АЧТВ более чем в 2 раза по сравнению с нормой доза
препарата составляет 25 ЕД/кг.
В заключение необходимо отметить, что современный подход к антикоагулянт-
ной, заместительной гемотрансфузионной терапии ДВС-синдрома постепенно
видоизменяется, чему в немалой степени способствует появление концентратов
натуральных антикоагулянтов (антитромбина, протеина С, ингибитора тканевого
фактора), а также медикаментозных средств, обладающих выраженным гемоста-
тическим потенциалом (НовоСэвен*, PPSB). Вышеуказанные препараты в терапии
экспериментальной модели ДВС-синдрома у животных (клинические испытания
находятся в разных стадиях исследования) показали большую эффективность
в сравнении с гепаринотерапией и меньшее количество геморрагических осложне¬
ний после их назначения.
АНТИФИБРИНОЛИЗНЫЕ ПРЕПАРАТЫ
Антифибринолизные препараты в лечении ДВС-синдрома имеют ограничен¬
ное применение, их назначают в случаях фатальных кровотечений, развившихся
вследствие системного фибринолиза в сочетании с признаками диссеминирован¬
ного внутрисосудистого свертывания крови при хирургических вмешательствах
на органах, травма (в том числе хирургическая) которых приводит к активации
фибринолиза (головном, спинном мозге, сердце, сосудах, поджелудочной железе);
акушерских патологиях, трансплантации печени, синдроме массивной гемотранс¬
фузии.
Известно, что системный фибринолиз ассоциирован с чрезмерной концентра¬
цией в крови фибринолитических ферментов, в первую очередь плазмина и тка¬
невого активатора плазминогена (t-PA). Системный фибринолиз может быть
первичным (классической моделью первичного фибринолиза является активация
фибринолиза в ответ на тромболитическую терапию) и вторичным, который носит
компенсаторный характер (фибринолиз при ДВС-синдроме).
К препаратам, обладающим антифибринолизным действием, относятся:
• поливалентные ингибиторы протеаз, полученные из природного сырья, —
апротинин (трасилол 500 ООО*, гордокс*, контрикал*), полипептиды, выде¬
ленные из легких крупного рогатого скота;
І синтетические ингибиторы протеаз — є-аминокапроновая и транексамовая
кислоты.
Аминокапроновая (є-АК, ММ 131 Да) и транексамовая (ММ 157 Да) кислоты
являются синтетическими аналогами лизина и имеют сходный механизм действия
33 счет блокирования тканевого активатора плазминогена (t-PA) и плазмина.
Кроме того, аналоги лизина обладают антипротеазной. антикининовой активно-
Ш блокируя тканевые киназы, урокиназу, стрептокиназу, трипсин, калликреин.
1
gQO КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГ ИЯ
тем самым препятствуя растворению фибрина. Возможно примен
препаратов в дополнение к антикоагулянтной терапии, проводимой** Nib
»лагт'гілпотии пптгшйпдииа уапаїггопилм п па ШШґ* ** Лло
низкой молекулярной массе имеют короткий период полувыведения
«Ирюгематоэнцефалический барьер; высокая концентрация препарате
ется во всех тканях организма. в0tIPe^»
Аминокапроновую кислоту назначают внутривенно капельно по 100
творе в течение первого часа - в дозе 4-5 г, далее до полной остановки kdo ^ to¬
no 1 r/ч в течение не более 8 ч. Необходимы контроль лабораторныхп°В0Т?,,ен,,а
фибриюлитической активности, определение концентрации фибриноген*3*1*^
50% явствующего вещества выводится в неизмененном виде в течение 3 * ^Кол°
Транексамовую кислоту применяют для лечения и профилактики кпп
кий. вызванных гиперактивацией фибринолиза. Ампула препарата содеп» 0^'
транексамовой кислоты. Разовая доза препарата - 10-15 мг/кг внутривенн.
концентрации при внутривенном введении наступает через 10-15 мин; ловто ^
введения - при необходимости через 8-12 ч. Максимальная суточная доза Ш
При нарушении выделительной функции почек применяют в меньших л
В сочетании с гепарином* и другими антикоагулянтами, а также при тромба*1
или угрозе их развития применяют с осторожностью; при сочетании с гемоси***
ками возможна активация тромбообразования. Отличием транексамовой киакті
от Е-аминокапроновой является более низкий почечный клиренс (от 6 до І ■
е-АК <3 ч), вследствие чего транексамовую кислоту назначают в меньших дозц
и с меньшей периодичностью.
Аминометилбензойная кислота относится к группе производных аминока¬
проновой кислоты. Вводят внутривенно в дозе 1,5 мг/кг (в среднем 50-100 мг)
в дальнейшем необходимость повторного введения определяется клинической
ситуацией и лабораторными показателями.
Поливалентные ингибиторы протеаз — апротинин (трасилол 500 000‘, гор-
доке*, контрикал*, антагозан®) — изготавливаются из природного сырья, применя¬
ются в гипокоагуляционную фазу ДВС-синдрома в сочетании с трансфузией СЗП.
Лекарственные препараты обладают поливалентным действием (рис. 21-15,
І подавляют процессы протеолиза;
в инактивируют лизосомальные ферменты;
• стабилизируют мембрану клеток (встраиваясь в клеточную мембрану), явля¬
ются универсальными протекторами шока.
Определенные трудности вызывает расчет необходимой дозы препаратов
данной группы, поскольку контрикал* дозируется в антитрипсиновых единицах
(АтрЕ), а остальные препараты — в калликреининактивирующих единицах (КИЕ):
1 АтрЕ соответствует 1,33 КИЕ.
Апротинин (ММ 6512 Да): 10 мл раствора содержит 100 000 КИЕ препара¬
та. Апротинин ингибирует калликреин и другие протеиназы плазмы (плазмин,
кининогеназы, трипсин, химотрипсин), снижает фибринолитическую активность
крови. Применяют в качестве элемента комплексной терапии различных видов
шока: эндотоксического, ожогового, травматического, геморрагического.
Для терапии первичных гиперфибринолитических кровотечений и коагу
патий, характеризующихся вторичным гиперфибринолизом, применяют в на
ной дозе 500 000 КИЕ болюсно, поддерживающая доза в виде постоянной ииф№|
200 000 КИЕ в час. Для профилактических целей вводят до операции 200 0 _ ^
далее в течение 2 сут после операции по 100 ООО каждые 6 ч внутривенно кап
Контрикал*: препарат вводят внутривенно болюсно или капельно в нач
дозе 350 ООО АтрЕ, поддерживающая доза — 140 000 АтрЕ каждые 4 ч до нор
зации показателей гемостаза.
21-16);
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 801
21-15. Ингибирующее действие апротинина в кининовой системе (схема)
Рис. 21-16. Ингибирование фибринолиза и фибриногенолиза апротинином
В остром периоде ДВС-синдрома целесообразно сочетать ингибиторы протеаз
с небольшими дозами гепарина*, возможно введение гепарина* в СЗП.
Основным показанием к антифибринолизным препаратам больным с синдро¬
мом ДВС является угрожающее жизни кровотечение, развившееся вследствие
гиперфибринолиза. Несмотря на отсутствие однозначных лабораторных показа¬
ний к их назначению, заболевание-триггер, предрасполагающее к гиперфибрино-
лизу, кровотечению, снижению содержания фибриногена, повышенный уровень
D-D-димера, патологические изменения в тромбоэластограмме становятся объ¬
ективными показаниями к применению поливалентных ингибиторов протеаз.
Антифибринолизное действие препаратов снижает активность эндогенного
фибринолиза, что, несомненно, приведет к еще большим нарушениям микроцир¬
куляции органов-мишеней, пострадавших вследствие диссеминированного вну-
трисосудистого свертывания, и может усугубить полиорганную недостаточность.
Таким образом, перед назначением антифибринолизных препаратов необходимо
оценить целесообразность их применения — определить возможный терапевтиче¬
ский эффект, степень риска тромбообразования и соответственно влияние на про¬
грессирование полиорганной недостаточности.
ДЕЗАГРЕГАНТЫ и препараты реологического действия
Важным компонентом в комплексной терапии ДВС-синдрома является приме¬
нение дезагрегантов и препаратов, улучшающих микроциркуляцию в органах
gQ2 клиническая ТРАНСФУЗИОЛОГИЯ
Наибольшее распространение получили пентоксифиллин (трентад*
пидин (тиклид*), дефибротид®, дипиридамол (курантил*), ацетилсал ^
кислота, клопидогрел (плавике*) и др.
Антиагрегационное действие ацетилсалициловой кислоты (аспиви
заяо с активацией высвобождения простагландинов из сосудистого ч И%
втом числе простациклина, снижающего агрегацию тромбоцитов. Аспип
уменьшает образование тромбоксана А2, который является активным п ?***
ляционным фактором. Однако в больших дозах аспирин* тормозит б ^
простациклина и некоторых других антиагрегационных простагландин001^
Е,). При этом нарушается нормальное соотношение простациклин/тромй*
что чревато тромбоэмболическими осложнениями. В связи с этим ппиГ*8,
малые дозы ацетилсалициловой кислоты — в среднем 100-150 мг/сут. ^
Многие исследователи патологии гемостаза не рекомендуют назначать if
ты ацетилсалициловой кислоты при подостром, остром и тем более молниенг!^'
вариантах ДВС-синдрома из-за резко возрастающего риска желудочно-кишечН01*
кровотечений. В случае необходимости применения препаратов данной rovn
предпочтение отдают препаратам для внутривенного введения - япйп-пГг
аспизолу. в состав которых входят водорастворимые производные ацетилсалт
ловой кислоты, глицин и DL-салицилат лизина. Эти препараты лишены мнот
побочных эффектов таблетированного аспирина*: не вызывают изъязвление
слизистых желудочно-кишечного тракта, тошноту, рвоту. Однократное введение
250 мг ацелизина оказывает мягкое воздействие на свертывающую систему крови
которое приводит к достаточно длительному (до 3 сут) состоянию умеренной
гипокоагуляции.
Тиклид*, плавике* в дозе 500 мг/сут ингибируют агрегацию и адгезивность тром¬
боцитов и эритроцитов, стимулируют синтез простагландинов Ej и D,, обладающих
антиагрегационным действием, улучшают микроциркуляцию. В отличие от аспи¬
рина* подавляют агрегационную функцию тромбоцитов через 5-6 дней от начала
приема препарата. В процессе лечения необходимо систематически контролировать
гематологические показатели, так как возможно развитие тромбоцитопении, лей¬
копении, агранулоцитоза. Плавике* (клопидогрел) назначают в меньшей по срав¬
нению с тиклидом дозе — 75-100 мг/сут, он реже вызывает лейко- и нейтропению,
что позволяет применять его в течение длительного времени.
Таблетированные препараты аспирина*, тиенопиридинов (тиклид*, плавике*)
назначают в гиперкоагуляционную фазу, при хроническом, подостром течении
ДВС-синдрома.
Пентоксифиллин (трентал*) улучшает микроциркуляцию и реологические
свойства крови, оказывает сосудорасширяющее действие, улучшает снабжение
тканей кислородом, уменьшает агрегацию тромбоцитов, приводит к их дезагрега¬
ции, повышает деформируемость эритроцитов, снижает вязкость крови. Для тера¬
пии ДВС используют большие дозы трентала — 800-1200 мг/сут, внутривенно
капельно медленно.
Выраженным дезагрегационным действием обладают реологические раство¬
ры: реополиглюкин*, растворы гидроксиэтилированного крахмала (6% и 10%
растворы HAES*\ ONKOHASp). Они улучшают кислородтранспортную функцию
крови за счет увеличения ОЦК, сердечного выброса и скорости циркуляции
эритроцитов, нормализуют также реологические свойства крови и микроцирку
ляцию. Препараты при отсутствии противопоказаний вводят в дозе 5-7 Ц
в сутки. Необходимо отметить существенное снижение содержания в крови ф
тора VIII при инфузии значительных объемов растворов ГЭК, что принципиаль
при геморрагических проявлениях ДВС-синдрома, в таких случаях отдают прт
почтение препаратам желатина (гелофузину*). Применение плазмозаменителе
препаратов ГЭК последнего поколения, в частности волювена*. характер113.
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 803
выраженным угнетением коагуляции крови по сравнению с другими плаз-
Ценителями.
ИбРИНОЛИТИКИ (АКТИВАТОРЫ ПЛАЗМИНОГЕНА)
Пои преобладании у больных массивных тромбоэмболических осложнений
желых нарушений функций органов-мишеней ишемического характера оправ-
иТ о применение тромболитической терапии. В этих целях используют стрепто-
^назу. урокиназу и др. Однако установлено, что уже к концу первых суток лече-
101 наступает угнетение (истощение) системы «плазминоген-плазмин». В связи
|Ь| ддя достижения тромболитического эффекта и профилактики осложнений
СОбходимы трансфузия СЗП и прерывистое введение небольших доз тромбо-
"итических препаратов под контролем уровня плазминогена. Это позволяет
бахать дефицита плазминогена и усилить тромболитический эффект. Обычно
"водят 400-600 мл СЗП с гепарином* (5000-10 000 ЕД), после чего внутривенно
капельно вводят стрептокиназу (или другие препараты) в дозе 500 000 ЕД. Далее
каждому введению тромболитиков обязательно предшествуют лабораторный кон¬
троль и трансфузия СЗП.
Целесообразность фибринолитических препаратов еще не получила окончатель¬
ного подтверждения. Некоторые клиницисты считают, что тромболитики не следу¬
ет применять для лечения ДВС, так как при острых формах синдрома они усиливают
геморрагический синдром, а в случаях хронического течения синдрома активаторы
фибринолиза оказывают чрезмерное действие. Фибринолитики показаны при мас¬
сивных тромбозах, повторяющихся тромбоэмболических эпизодах, которые воз¬
можны при редко встречающемся тромбоэмболическом варианте ДВС.
ЭКСТРАКОРПОРАЛЬНАЯ ДЕТОКСИКАЦИЯ
Одним из важных компонентов комплексной терапии ДВС и полиорганной недо¬
статочности являются методы экстракорпоральной детоксикации. Плазмаферез, про¬
водимый на фоне медикаментозной терапии, позволяет удалить активаторы гемоста¬
за, продукты паракоагуляции, активизированные факторы свертывания и тем самым
осуществить коррекцию гипокоагуляции. За счет элиминации микротромбов, микро¬
агрегатов клеток крови, циркулирующих иммунных комплексов, крупномолекуляр¬
ных соединений нормализуется микроциркуляция, снижается активность процессов
гиперкоагуляции. Выраженный дезинтоксикационный эффект плазмафереза связан
с удалением из крови эндотоксинов, олигопептидов средней молекулярной массы,
билирубина, азотистых метаболитов, лизосомальных протеаз. При плазмаферезе
восстанавливается белково-синтетическая функция печени. Обменный плазмаферез
при краш-синдроме в первые сутки после декомпрессии позволяет элиминировать
из крови миоглобин и тем самым предотвратить развитие ОПН.
Известно, что условием эффективности плазмообмена являются следующие
принципы:
І плазмаферез необходимо проводить в максимально ранние сроки ДВС;
S Достаточная интенсивность плазмообмена — эксфузия не менее 50% ОЦП
за одну процедуру;
• обязательная трансфузия СЗП в объеме, адекватном удаленной плазме.
Трансфузия донорской плазмы, как сказано выше, позволяет восполнить дефи¬
цит компонентов системы гемостаза, а также предотвратить развитие гипопротеи-
немии и частично — иммунодефицита.
Плазмаферез со струйным плазмозамещением при выраженном протеолизе
тканях рекомендуют сочетать с повторным внутривенным введением больших
Доз контрикала* (до 300 000-500 000 АтрЕ и более) или других антипротеаз.
Цитаферез (удаление эритроцитов, тромбоцитов и их агрегатов) необходим
пациентам с рецидивирующими и хроническими формами ДВС, сопровождаю-
ш <«MNS*W ТР*НС4УЗИ0П0ШЯ
ДОМСЯ яожглобулинемией. эритремией, [-ипертромбоцитозом и СИНлпс
мщрмшости
Сформировавшаяся ОПН является показанием к гемофильтрации и гемо
зу. Детоксикация крови при веновенозной или артериовенозной гемофИль?^
осуществляется р счет конвективного транспорта токсичных веществ черв8®
«морозную мембрану, обладающую выраженной гидравлической пронц.,!^
сшо При этом нормализуются pH крови, осмоляльность плазмы, элиминиву
ишо- И среднемолекулярные токсины, фактор некроза опухоли (TNF),
кин-1. Смешение удаленной жидкости осуществляют специальным сбаланит!'
венным электролитным раствором.
Гемофильтрацию успешно применяют при остром дистресс-синдроме. За й
удаления медиаторов, вызывающих повышение проницаемости капилляров*?
км, уменьшается объем жидкости в интерстиции, улучшается кислородтранслог*
яая функция крови. Длительная, в течение 2-3 сут. гемофильтрация оказывав
выраженное терапевтическое действие. Ее необходимо выполнять в как моци
более ранние сроки ДВС-синдрома.
Методы экстракорпоральной детоксикации и плазмообмен повышают эффе*.
тивность как самого лечения ДВС-синдрома, так и заболеваний-триггерої
что позволяет резко снизить летальность.
Особенности синдрома диссеминированного
внутрисосудистого свертывания при различных патологиях
СЕПСИС
Инфекция является триггером ДВС в более чем половине случаев, таким обра¬
зом, сепсис - основная причина острого ДВС, а ДВС — наиболее частое ослож¬
нение сепсиса. Грамотрицательная септицемия часто сопровождается тяжелым
тромбогеморрагическими осложнениями, такими как генерализованная реак¬
ция Швартцмана (симметричная гангрена конечностей), синдром Уотерхауса-
Фридериксена (геморрагический некроз надпочечников).
Активация при сепсисе системы гемостаза обусловлена эндотоксемией, да¬
рованными компонентами бактериальных клеток и бактериальными лишиш-
сахаридами. Центральным медиатором сепсиса является фактор некроза опухоли
(TNF 1 Tumor Nnecrosis Factor), вырабатывающийся в ответ на поступление эндо¬
токсина. Вторичный медиатор — интерлейкин-1, концентрация которого резко
возрастает после максимального поступления в сосудистое русло TNF. Вслед
за выработкой этих провоспалительных медиаторов происходит повышение уров¬
ня интерлейкина-6, который активизирует синтез в печени белков острой фазы
(рис. 21-17).
Существует корреляция между исходом заболевания и уровнем содержание
интерлейкина-6: чем выше его содержание, тем хуже прогноз заболевания.
Цитокиновый механизм реализации ДВС при сепсисе подробно изучен в послед¬
ние годы (рис. 21-18). Липополисахариды, покрывающие бактерии, соединяются
с липополисахаридсвязывающим протеином, этот комплекс взаимодействует
с рецепторами макрофагов. При этом происходят высвобождение макрофагаль-
ных цитокинов и инициация активности каскада медиаторных систем: увеличи¬
вается содержание брадикинина, гистамина, эйкозаноидов (простагландин^
лейкотриенов, тромбоксана, простациклина), фракций комплемента, радикалов
перекисного окисления, активизируются факторы свертывания крови. В резуль
тате этих сложных реакций развивается генерализованное эндотелиальное вода
леиие синдром системного воспалительного ответа (SIRS). Провоспалительны?
цитпкины увеличивают проницаемость эндотелиальных клеток для жидкая
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 805
факторы, активизирующие тромбоциты, также повышают сосудистую
^дацаемосгь, действуя синергично с цитокинамн.
Рм. 21-17. Влияние токсемии на гемостаз при ДВС
Рис. 21-1 В. Активация цитокинового механизма при сепсисе
Одними из первых клинических проявлений повышенной капиллярной про¬
ницаемости являются ухудшение вентиляционных респираторных параметров
и периферические отеки.
Интерлейкин-1 снижает выработку эндотелием тканевого активатора плазми¬
ногена, в то время как продукция ингибитора активатора плазминогена повыша-
ется. Интерлейкин-1 ответствен также за активность комплекса «тромбомодулин
1 протеин С», который оказывает ингибирующий эффект на факторы V, VIII
н на ингибитор активатора плазминогена.
Полисахариды грамположительных бактерий также могут посредством цитоки-
Нов активизировать систему гемостаза, что резко увеличивает риск ДВС.
tCMVUJ
МІ ЩИИГОШІ ffWHDwawOHOnm
юаЗщируегся фульминантной вирусной инфекцией т
дарьвдеинфекции сопровождаются обычно лейкоцитозом. Нейтрг#ь'****'•
лейкоциты вырабатывают ряд субстанций (в том числе ней трофильную э,-цЧ1<-
ЯМШМнои дефицит AT III. который усугубляется гепаринотерапией.
Следует кит» в виду, что бактерицидные антибиотики увеличивают ш
ЯВИМШ септического шока вследствие массивного поступления в кроап^'
I эндотоксинов из разрушенных бактерий. Молниеносные формы!*0*
аошшсаюг на фоне иммуносупрессивной терапии. Смертность при септик4
шоке достигает 404. Септический шок, рефрактерный к терапии, быстро
(Єнескольких часов) приводит к полиорганной недостаточности.
В ряде случаев не удается установить возбудителя инфекции в гемокульп
больных сепсисом. Концепция системного воспалительного ответа Предио*
Г*ет сепсис при отсутствии (невозможности определения) возбудителя В KD0
при выраженных характерных клинических проявлениях - фебрильной У?
Нфлуре (>38 ’С) ИЛИ гипотермии (<35,5 °С — встречается у 10% больных),тад»!
мрдии. тахипноэ, гипервентиляции с респираторным алкалозом.
Дм лабораторных показателей характерны следующие изменения:
• лейкоцитоз более 15 000/мл или лейкопения менее 3500/мл;
• сдвиг лейкоцитной формулы влево, токсическая зернистость;
• изменения коагуляции — уменьшение количества тромбоцитов более
чем на 30% за 24 ч, снижение AT III;
I метаболические сдвиги - гиперлактатемия, гипергликемия, гипофосфате-
мия.
Для сепсиса характерен дефицит системы естественных антикоагулянтов,
причем снижение АТ III происходит раньше основных клинических проявлений
сепсиса. При снижении содержания AT III менее 60% смертность существенно
возрастает.
Количество тромбоцитов при сепсисе уменьшается вследствие тромбоцитом-
нии потребления: тромбоциты связываются с фибрином, адгезируют к поражен¬
ному эндотелию, секвестрируются в легких и печени. Тромбоцитопатия - сни¬
жение агрегирующих свойств тромбоцитов — может быть вызвана длительным
применением антибиотиков.
В комплексную терапию сепсиса, септического шока включают следующие
лечебные мероприятия.
• Хирургическое лечение очага инфекции (санацию и дренирование).
• Антибиотикотерапию, основанную на идентификации возбудителя и опреде¬
лении его чувствительности к соответствующей группе антибиотиков.
• Адекватную оксигенацию — при необходимости раннюю ИВЛ в различных
режимах.
• Инфузионно-трансфузионную терапию, которую проводят с учетом значи¬
тельной опасности гипергидратации, особенно в условиях тканевой гипок¬
сии и повышенной капиллярной проницаемости. Трансфузия эритроцитов
не только повышает кислородтранспортную функцию крови, но и обеспе¬
чивает эффективность трансфузионной терапии. Критическим для сеп¬
тических больных считается содержание гемоглобина менее 70-80 г/л
Предпочтительна трансфузия свежезаготовленной эритроцитной массы.
• Применение катехоламинов. Содержание фактора некроза опухоли (TNF)
при сепсисе значительно возрастает (TNF — медиатор, обладающий вырв
женным кардиодепрессивным действием).
I Препараты AT III. Некоторые исследователи рекомендуют поддер*и0?ть
содержание AT III на уровне 140%, это возможно при введении препарвт1
і суммарной дозе 18 000 ЕД. Содержание AT III не должно снижаться меи<*
80%.
ДИССЕМИНИРОВАННОЕ ВНУ7РИС0СУЙИСТ0Е СВЕРШНАКИЇ ЙЧ58И 887
фибримолитичеасие препараты. Установлено, что у погибших от сепсиса
больных отмечались выраженная активация коагуляции и еще более выра¬
женное угнетение фибринолиза. Это позволило предположить, что фибрм-
яолкгические препараты приведут к коррекции гемостаза. Применение
препаратов в экспериментах на животных с эндотоксемией повышает выжи¬
ваемость и препятствует развитию вентиляционных нарушений.
, Адекватное энтеральное и парентеральное питание. Рекомендуют ранний
переход на энтеральное питание, которое препятствует развитию паре¬
за желудочно-кишечного тракта и уменьшает интестинальную атрофию.
В питательные смеси для энтерального питания вводят специальные добав¬
ки: ш-3 жирные кислоты, аргинин, глутамин, рыбий жир. Раннее энтеральное
питание с вышеуказанными пищевыми добавками оказывает благоприятное
влияние на иммунный статус больных и называется иммунным питанием,
, Поливалентные иммуноглобулины — используют препараты, нейтрализую¬
щие эндотоксикоз.
« Методы экстракорпоральной детоксикации: гемофильтрация, плазмаферез.
Все чаще в последние годы применяют гемофильтрацию в качестве экстра¬
корпоральной методики, позволяющей элиминировать низко- и среднемо¬
лекулярные соединения. Установлено, что при длительной гемофильтрации
активно удаляются TNP и интерлейкин-1, при этом содержание эндотоксина
и интерлейкина-6 практически не меняется. Гемофильтрация в ранние сроки
сепсиса и ДВС позволяет получить более выраженный клинический эффект.
Плазмаферез способствует удалению эндотоксинов, активаторов свертыва¬
ния, продуктов паракоагуляции. При сепсисе плазмаферез в сочетании с дру¬
гими методами терапии позволяет стабилизировать гемодинамику, является
методом профилактики и лечения полиорганной недостаточности.
Разрабатываются новые виды медикаментозного воздействия. Имеются сооб¬
щения об эффективном применении препаратов антноксидантной зашиты, акти¬
вированного протеина Ср (зиргиса*) и др. Однако основными принципами, кото¬
рых следует придерживаться в терапии сопутствующего сепсису ДВС-синдрома.
являются следующие:
• интенсивная симптоматическая терапия:
• препараты AT III (поддерживающие содержание в крови не менее 80%);
1 гепаринотерапия (под контролем лабораторных показателей);
1 заместительная инфузионная терапия - СЗП (обязательно), эритроцитная
масса и тромбоконцентрат (по показаниям);
I экстракорпоральная детоксикация.
Включение в процесс лечения ДВС-синдрома методов экстракорпоральной
детоксикации — плазмафереза. гемофильтрации, гемодиафильтрации - позволяет
оптимизировать течение патологического процесса. Эти методы являются жела¬
тельными в программе терапии как самого ДВС-синдрома, так и обусловленной
нм полиорганной недостаточности.
СИНДРОМ МАССИВНОЙ ГЕМОТРАНСФУЗИИ
Массивная гемотрансфузия является несомненным следствием массивной кро¬
вопотери, которая сопровождает политравму, тяжелые хирургические вмешатель¬
ств (операции на магистральных сосудах, трансплантацию печени), осложненные
роды. Вышеуказанные состояния сами по себе могут служить триггером ДВС-
синдрома. поскольку геморрагический шок. политравма, акушерская патология
являются одними из наиболее распространенных причин диссеминированного
внутрисосудистого свертывания крови, приводящего в итоге к полиорганной недо¬
статочности. Совокупные патогенетические механизмы, сопровождающие мас¬
сивную кровопотерю, гемотрансфузию, реинфузию излившейся в рану аутокрови.
ІДО Ю*МГ€СКАЯ ТМНСФУЗИОЛОГИЯ
действуя синергично, усугубляют течение послеоперационного периода к.
количеством осложнений. d
Синдром массивной гемотрансфузии — это симптомокомплекс, вози
I кровопотере более 1 ОЦК и последующей гемотрансфузии цельн
или эритроцитной массы в объеме более 10-12 ЕД в течение 24 ч. См ^
от синдрома массивной гемотрансфузии достигает у взрослых 40% и ko^
ет с объемом гемотрансфузий. Однако оказание своевременной хируп^11^'
помощи увеличивает выживаемость пациентов до 70% даже при трансфузий01'
25 ЕД цельной крови или эритроцитной массы донорской крови. *”***
Помимо известных нежелательных эффектов переливания крови, при ц
нш гемотрансфузиях возникают специфические нарушения гемостаза-
• дилюционная коагулопатия:
• тромбоцитопатия;
• микроэмболия.
Изменения в системе гемостаза приводят в послеоперационном периоде к №
рагическому диатезу и диффузной микрососудистой кровоточивости, имею0**-
место в 20-30% случаев. Ие?
Основными причинами развития синдрома массивной гемотрансфузии яшщ
ются:
• кровопотеря и дефицит факторов свертывания, тромбоцитопения;
• обширная травма тканей и поступление в русло тканевого тромбопластина
вызывающего активацию гемостаза и дальнейшее усугубление дефицита
факторов свертывания крови;
• повышенное потребление факторов коагуляции;
• высокообъемная инфузионная терапия, усугубляющая гемодилюционную
коагулопатию;
• применение адреномиметиков, также активизирующих гемостаз и повышаю¬
щих концентрацию факторов свертывания крови (в частности, факторов V1IL
фон Виллебранда), тканевого активатора плазминогена, способствущц
еще более быстрому истощению противосвертывающей и свертывающей
систем;
• сама гемотрансфузия.
Эти патологические процессы завершаются развитием ДВС и полиорганной
недостаточности.
Наиболее типичными осложнениями и особенностями синдрома массивной
гемотрансфузии, которые необходимо учитывать при лечении ДВС-синдрома,
являются:
• дилюционная тромбоцитопения, развивающаяся при переливании крови
в объеме, превышающем 1,5 ОЦК;
• избыточное введение натрия цитрата, который используют для консервации
донорской крови. Оно может привести к связыванию ионов Са2' и, следо¬
вательно, к гипокальциемии. В норме цитрат быстро метаболизируется
в печени и частично экскретируется почками. Известно, что в эритроцит-
ной массе, заготовленной на консерванте CPDA-1, содержится 5 мг цитрата
натрия на каждый миллилитр компонента, тогда как в СЗП - 30 мг/мл-
Соответственно массивная трансфузия СЗП, криопреципитата приводи*
к цитратной интоксикации и снижению содержания ионизированного калв
ция в плазме у пациентов со сниженным метаболизмом цитрата в усл°в
гипотермии, гипотензии, печеночной недостаточности. Гипокальцие
является причиной мышечного тремора, нарушений сердечного ритма, с
жения производительности сердца, желудочковой фибрилляции;
• гиперкалиемия вследствие переливания эритроцитсодержащих пРеП
тов крови больших сроков хранения (содержание внеклеточного к
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 80S
в 42-дневной эритроцитной массе составляет 60-70 ммоль/л). В клиниче¬
ской практике гиперкалиемия возможна при высокой скорости гемотрансфу-
зии пациентам с тяжелым шоком и/или почечной недостаточностью, а также
при рабдомиолизе;
гипотермия, усугубляющая нарушения кислотно-основного состояния крови
больных.
При трансфузии больших объемов крови необходимо использовать лейкоцн-
оные фильтры и обязательно согревать трансфузионные среды до 35-37 “С.
Терапия синдрома направлена на коррекцию дилюционной коагулопатии
предусматривает трансфузию свежезамороженной плазмы, криопреципитата,
Іомбоконцентрата, эритроцитной массы. В целях коррекции дефицита факторов
йертывания применяют препараты AT III, фибриногена. Активную гемотранс-
Іузионную тактику при ДВС-синдроме необходимо выполнять с учетом того.
!гго при равных условиях цельная кровь менее предпочтительна, чем эритроцит¬
ная масса, так как по сравнению с компонентами крови имеет ряд недостатков:
• она менее стабильна при хранении;
І лейкоциты и тромбоциты уже в ранние сроки хранения формируют микро¬
агрегаты, которые являются причиной микроэмболии и дистресс-синдрома;
, содержание термолабильных факторов гемостаза (V, VIII. фактор фон
Виллебранда) снижается до 25% исходного уровня уже в первые часы кон¬
сервации при температуре +4 °С. При замораживании плазменные факторы
сохраняют свою активность в течение 6-12 мес.
Неблагоприятными прогностическими признаками при ДВС-синдроме, раз¬
вившемся на фоне массивной гемотрансфузии, являются усугубление тромбоци-
топении (содержание тромбоцитов <50х109/л) и глубокая гипофибриногенемия
(фибриноген <0,5 г/л).
В последние годы при угрожающих жизни кровотечениях широкое примене¬
ние нашла аппаратная реинфузия излившейся в операционную рану аутокрови.
Несмотря на очевидные преимущества этого метода кровесбережения, аппаратная
реинфузия может иметь побочные эффекты вследствие реинфузии неотмытой
или некачественно отмытой аутокрови, результатом чего является ДВС-синдром.
Реинфузия гемолизированной крови
Приводит к появлению гемоглобинурии, развитию почечной дисфункции,
а в тяжелых случаях — острой почечной недостаточности.
Среди причин гемолиза реинфузируемой излившейся в операционную рану
крови:
і разрежение вакуума отсоса более 150 мм рт. ст.:
і применение травматичных металлических наконечников отсоса с небольши¬
ми отверстиями;
• попадание в реинфузат большого количества воздуха (во многом это зависит
от внимательности и квалификации оператора). Кроме того, качество реин¬
фузата значительно снижается при плохом отмывании и при использовании
укороченного цикла аппаратного отмывания эритроцитов.
Синдром возвращенной крови, коагулопатия
Установлено, что массивная реинфузия, в том числе некачественно отмытой ауто-
■фови, в ряде случаев сопровождается гипотензией, фебрилитетом, острой дыхатель¬
ной недостаточностью. Попадание в циркуляцию в результате реинфузии аутокрови
биологически активных веществ — IL-1(1, IL-6, TNF-a. сериновых протеаз, в том
числе полиморфнонуклеарной эластазы (polymorfnonuclear PMN elastase) — приводит
к синдрому возвращенной крови, который клинически проявляется симптомоком-
плексом, включающим острый дистресс-синдром взрослых, ДВС-синдром, сердечно¬
сосудистую недостаточность, синдром системного воспалительного ответа.
f|0 КЛИНИЧЕСКАЯ ТМНСФУЗИОЛОГИЯ
Значительную роль в этом патологическом процессе отводят Рим
сериновой протеаэе. вырабатываемой нейтрофильными гранулощГ ЭЛасЧъ
иие концентрации PMN-эластазы свидетельствует о поражении щГаМИ: >'веди'
гранулоцитов в процессе реинфузии. Эластаза оказывает поража Г РЗз^ч!
на ткани организма за счет деградации фибриногена, эластина пп v?*6
Кроме того, показано, что PMN-эластаза инактивирует интбит Є0ГЛи*аС
плазминогена 1-го типа, следствием чего является активация фибии ^ ЗКТИї,тоь
Данные изменения свидетельствуют о еще большей активизаН0/1ИЗа'
фибринолиза во время операций: повышается уровень фибринолитич ИИ
ности, уменьшается активность факторов свертывания крови, что ЄСК0**аї%
увеличивает интраоперационную кровопотерю. ^УЩествен^
Кроме того, попадание в циркуляцию активизированных факторов!
невого тромбопластина (из раневой поверхности, стромы разрушение
крови,
Ш
цитов). продуктов деградации фибриногена, D-D-димеров фибриногена * —
к коагулопатии. Нарушения свертывания крови усугубляются потерей 1,1
тов, нарушением функции тромбоцитов, а также применением для стабв°Мб0Ци'
реинфузируемой крови гепарина4 (качественно отмытая аутоэромасса п ^
ски не содержит гепарина4). ^ктичс'
Во многом на нарушения гемостаза, являющиеся причиной ДВС-овимь.
во время или после операций, сопровождающихся реинфузией крови 1Я
интраоперационные осложнения: геморрагический шок, массивная кровопт
I гемотрансфузия, сопровождаемые дилюционной коагулопатией. Необходим
отметить, что аппаратная реинфузия отмытых эритроцитов приводит к norm!
плазмы и требует коррекции гипокоагуляции трансфузией донорской СЗПитшж
боцитарной массы.
Попадание инородных веществ и биологических материалов
Неотмытая кровь может содержать также костные фрагменты, жир, некроти-
зированные ткани, местные гемостатические, цементирующие материалы, лекар¬
ственные препараты, жидкости, применяемые для обработки операционного поля
(перекись водорода и т.п.), микрочастицы операционного белья, тальк. Примесь
этих веществ в реинфузате требует тщательного отмывания и фильтрации через
лейкоцитные фильтры.
Таким образом, улучшение качества реинфузата за счет режимов аппаратной
реинфузии, обеспечивающих как экстренность процедуры, так и ее безопасность,
становится основным методом профилактики синдрома возвращенной крови,
основным клиническим проявлением которого является ДВС-синдром.
ДВС-СИНДРОМ В ТРАНСПЛАНТАЦИОННОЙ ХИРУРГИИ
Геморрагические осложнения в трансплантационной хирургии обусловлены
как характером хирургического вмешательства, так и специфическими изменения¬
ми гемостаза вследствие исходного поражения органов.
Трансплантация сердца
Дефект гемостаза, развивающийся вследствие декомпенсации сердечной иеДО
статочности и сопутствующей полиорганной дисфункции, усугубляется экстрах
поральным искусственным кровообращением. ят.
В настоящее время в силу совершенствования оперативной техники вер
ность геморрагических осложнений и связанных с ними коагулопатии, ^
числе ДВС-синдрома, после трансплантации сердца крайне мала и практ
не превышает таковую при аортокоронарном шунтировании (АКШ) и J
операциях с ИК. Тем не менее риск геморрагии при трансплантации
выше, чем при АКШ.
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ
811
швсялантация печени
Трансплантация печени, несомненно, является более травматичным хирурги-
-ким вмешательством, и исключить развитие ДВС-синдрома в посттрансплан-
щонном периоде гораздо сложнее. Предпосылки к этому имеются уже на фоне
аыого исходного заболевания, ведущего к необходимости подобной операции.
Lflfoльку печень играет центральную роль в нормальном функционировании
системы гемостаза: гепатоцитами синтезируются факторы коагуляции, фибрино-
«за, естественные антикоагулянты, а также важнейшие ингибиторы протеаз.
Трансплантация печени усугубляет исходные нарушения гемостаза, которые
о*но расценивать как хронический ДВС-синдром. Это проявляется главным
образом диффузной интра- и послеоперационной кровоточивостью. Исходная
патология, которая привела к трансплантации, ведет к угнетению всех звеньев
гемостаза. Кровотечения при ортотопической трансплантации печени занимают
первое место в причинах смертности больных во время операции или в ближай¬
шем постгрансплантационом периоде.
Для больных, страдающих хроническими заболеваниями печени, характерен
усиленный распад эритроцитов, о чем свидетельствуют полихромаэия эритроци¬
тов и ретикулоцитоз. Основные причины распада эритроцитов — гиперспленизм
и дефект мембраны эритроцитов.
Тромбоцитопения развивается вследствие секвестрации тромбоцитов в селезен¬
ке. Для этих больных характерна и тромбоцитопатия. Нередко выявляются анти-
тромбоцитные антитела (при гепатите С в 88% и при гепатите В - в 47% случаев).
Снижаются агрегационные свойства и синтез тромбоцитов вследствие дефицита
фолиевой кислоты и как результат злоупотребления алкоголем.
Гепатоцит — клетка, в которой синтезируются все (за исключением фактора
фон Виллебранда) сериновые протеазы, ингибиторы свертывания, антитромбин
III, протеины С и S, кофактор II гепарина. Для заболеваний печени характерна дис-
фибриногенемия — может выявляться фибриноген низкой молекулярной массы.
Аномалии фибриногена приводят к удлинению протромбинового времени.
Геморрагическим осложнениям в посстрансплантационном периоде способ¬
ствуют следующие факторы:
• большая хирургическая травма и массивное поступление в кровоток ткане¬
вого тромбопластина;
І выброс в кровеносное русло активизированных медиаторов гемостаза
как из печени больного, так и во время реперфузии донорского органа;
I контакт крови с чужеродной поверхностью экстракорпорального портоси¬
стемного обхода;
і ряд медикаментозных препаратов в предоперационный период;
* предшествующие многочисленные гемотрансфузии.
Для беспеченочного периода характерны выраженная активация фибри¬
нолиза и повышение активности активатора плазминогена и плазмина. Отмечено,
что во время реперфузии печени донора значительно активизируется система гемо¬
стаза: значительно повышается содержание комплексов «тромбин-антитромбин»,
фибрин-мономеров на фоне снижения фибриногена, AT III, протеина С. Это соот¬
ветствует картине ДВС-синдрома, развивается коагулопатия потребления. После
неосложненной трансплантации постепенно, в течение 12 ч, нарастает содержа¬
ние фибриногена, AT III, протеина С, что указывает на нормализацию белково¬
синтетической функции трансплантата.
Изменения тромбоэластограммы и времени лизиса эуглобулинового сгустка
80 время реперфузии печени и в ближайший посттрансплантационный период
подтверждают резкую активацию фибринолиза. Возросшая активность фибри¬
нолитической системы обусловлена снижением клиренса активатора плаз¬
миногена и уменьшением содержания ингибитора активатора плазминогена
§U КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
V
Рстикулоэндотелиальная система печени ответственна за клиренс
ных факторов гемостаза и их комплексов с ингибиторами. Щр
В последите годы установлено, что важным фактором, усугубляюшЯ]
ства гемостаза во время трансплантации печени, является повыщещ^ра%^
лейкоцитной системы. При активации лейкоциты вырабатывают лиз аКТйвС'
протеазы (гранулоциты - эластазу, макрофаги - катепсин В), котопы°^2
в циркуляцию. Увеличивается также уровень фактора некроза опухол*”0*^
рина. Содержание комплекса оластаза + ингибитор протеиназы» и И Не<%
В резко возрастает во время реперфузии органа и постепенно, в течени
жается до исходного уровня. 012 I %
В ближайшие часы постгрансплантационного периода развивается %
топения. Снижению количества тромбоцитов способствуют следующие^Чь
ческие процессы:
I секвестрация тромбоцитов в печени;
1 поражение сосудистой системы донорского органа вследствие ишемии
сервации; Ико«-
і коагулопатия потребления, которой способствует мощная активация
ценного гемостаза; |§f
і синдром массивной кровопотери и гемотрансфузии — дилюционнаяк
яопатия. аГ)1‘
Терапия нарушений гемостаза в посттрансплатационном периоде основа
на заместительной инфузионной программе, включающей трансфузщр ОДэм!
троцитной массы, тромбоконцентрата в сочетании с другими препаратами - я
центратом АТ ПІ и фибриногеном. В большинстве случаев хороший гемостатиче¬
ский эффект оказывают синтетические антифибринолизные препараты - аналога
лизина (трансамча®) и поливалентные ингибиторы протеаз. Комплекс этих преш-
ратов существенно улучшает лабораторные показатели (купируется 'фибринолиз]
и не увеличивает частоту тромбоэмболических осложнений, при этом не требует
назначение антикоагулянтов во время операции в целях профилактики Щ
Антифибринолизные препараты особенно эффективны в случаях выраженной
диффузной кровоточивости.
В зарубежной литературе появились сообщения об успешном использоваш
малых доз простагландина Е для профилактики тромбоцитопения и тромбоцито¬
патии во время и после трансплантации печени.
ДВС-СИНДРОМ ПОСЛЕ ОПЕРАЦИЙ НА СЕРДЦЕ И МАГИСТРАЛЬНЫХ СОСУДАХ
С ПРИМЕНЕНИЕМ АППАРАТА ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ
Несмотря на усовершенствование технологий операций, аппаратуры для искус¬
ственного кровообращения, трансфузионной и медикаментозной терапии, про»
ма профилактики и лечения ДВС-синдрома, являющегося осложнением операции
на сердце и магистральных, сосудах с применением аппарата искусственно^!0-
вообращения, стоит очень остро, поскольку в большинстве случаев ДВС-синдро
возникающий как осложнение этих операций, протекает на фоне выражен»0
полиорганной недостаточности
Во время операций с использованием аппарата искусственного кровооора
ния (АИК) имеется высокий риск реализации всех основных патогенетичр^..
механизмов ДВС, так как: маС.
I операции на открытом сердце отличаются большой травматичностыо »
сивным поступлением в кровеносное русло тканевого тромбопластина*
механическая травматизации форменных элементов крови при ЦИРК^ ^
в АИК приводит к активации агрегационных свойств тромбоцитов, р .
ются тромбоцитопения и тромбоцитопатии. Стимулированные леи*
вырабатывают биологически активные субстанции, усугубляющие^
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 813
ния гемостаза. Снижается поверхностный отрицательный заряд эритроци¬
тов, что приводит к их склеиванию и, как следствие, к микротромбированию
капилляров органов-мишеней, результатом чего является полиорганная
недостаточность. Нарушение транспорта кислорода, развитие гипоксии сме¬
шанного генеза способствуют возникновению выраженной системной воспа¬
лительной реакции и выбросу в циркуляцию провоспалительных цитокинов,
большинство из которых обладает прямым прокоагулянтным и антифибри-
нолизным действием;
I' после окончания ИК и нейтрализации гепарина протамин-сульфатом воз¬
можно появление эффекта рикошетного действия гепарина и последующего
развития послеоперационного кровотечения;
• атеросклеротическое поражение эндотелия сосудов, приводящее к снижению
антитромботического потенциала сосудистой стенки, и синдром гипервязко¬
сти, характерный для распространенного атеросклероза, являются причиной
исходного нарушения системы гемостаза.
В условиях искусственного кровообращения проводят операции на аорте,
магистральных сосудах, радикальную коррекцию врожденных и приобретенных
пороков сердца, хирургическое лечение терминальных стадий ИБС. Септический
эндокардит, декомпенсированная сердечная недостаточность, синдром гипер¬
вязкости, характерный для ИБС, резко увеличивают риск развития ДВС и ПОН
у кардйохирургических больных. Для этой категории больных характерны острые
и молниеносные формы с быстрым развитием ПОН.
факторы риска, провоцирующие развитие ДВС во время операций с использо¬
ванием АИК:
І шок Любой этиологии (анафилактический, кардиогенный, геморрагиче-
ский);
^метаболические нарушения (ацидоз, гипокалиемия);
••••*• сердечно-сосудистая недостаточность;
* массивная гемотрансфузия и реинфузия крови.
Большое значение в развитии этих осложнений играет длительность ИК:
при увеличении времени ИК возрастают объем крови, проходящей через аппарат
искусственного кровообращения, время контакта крови с мембраной оксиге¬
натора и соответственно степень травматизации форменных элементов крови.
Определенный вклад в риск возникновения ДВС вносит и гипотермия, приме¬
няемая при ИК, которая позволяет улучшить защиту мозга и миокарда во время
операции, но в то же время существенно повышает вязкость крови, что оказывает
отрицательное влияние на реологические свойства крови.
Следует иметь в виду, что у большинства пациентов, оперированных в условиях
ИК, стадия гиперкоагуляции (I стадия ДВС) очень кратковременна, и поэтому ДВС
нередко манифестирует тяжелыми геморрагическими осложнениями в виде диф¬
фузной кровоточивости ив операционной раны, мест инъекций, кровотечениями
из острых стрессорных язв, эрозий желудочно-кишечного тракта и ранним раз¬
витием ПОН. При этом клинические проявления синдрома, как правило, опере-
жают ранние лабораторные признаки ДВС, к которым относят тромбоцитопению.
Удлинение АЧТВ, снижение концентрации фибриногена, появление РКФМ, ПДФ,
^■D-димеров фибриногена.
Основные принципы терапии ДВС после искусственного кровообращения
Не имеют выраженных отличий от лечения ДВС при других патологических
«стояниях и включают:
* Устранение действия триггерного фактора — терапию шока, кровопотери
и др.;
• антикоагулянтную терапию малыми дозами прямых антикоагулянтов (гепа¬
рина* или фраксипарина) по показаниям. В основном применяют в I стадию.
і КЛИНИЧЕСКАЯ ТРАНСЗУЗИОЛОГИЯ
при подостром или рецидивирующем течении ДВС-синдрома п
заниєм является продолжающееся кровотечение; ’
• заместительную инфузионную терапию большими объемами СЗп
ляет нормализовать состояние гемостаза. Восполнение дефишЧТ°П°%
возможно применением концентратов AT III; проводят коррекад ^ Ні
и тромбоцитопении; ю
І препараты антифибринолитического действия (аминокапроновая
показаны при кровотечениях, связанных с активацией фибринолиз
I препараты дезагрегационного и реологического действия для воеп*
ния реологических свойств крови и нормализации микроциркуля ^
препараты являются обязательным компонентом терапии. Наибсльт ^
пространение получил трентал*. который вводят внутривенно в дозЛгтк'
1200 мг/сут в течение длительного времени. С этой же целью проводят
дилюцию, снижающую вязкость крови и улучшающую перфузию тканей
• поливалентные ингибиторы протеаз для профилактики и лечения ііиг
позволяют значительно сократить частоту геморрагических осложнений
І экстракорпоральную детоксикацию — гемофильтрацию, плазма<Ье
Обменный плазмаферез позволяет нормализовать микроциркуляцию за
элиминации продуктов паракоагуляции, микротромбов и микроагрегат»
В результате адекватного плазмообмена улучшаются показатели сверл*'
вающей системы крови, реологические свойства крови и микроциркуляша
в органах-мишенях.
ТРАВМА
Травма - вторая по частоте (после сепсиса) причина ДВС-синдрома.
Циркуляторный коллапс, развивающийся вследствие травматического шока, резко
повышенное содержание катехоламинов и нарушения микроциркуляции, кислотно¬
основного состояния значительно увеличивают риск развития ДВС. Травматически
повреждения способствуют поступлению в циркуляцию огромного количеспа
тканевого фактора — это, как сказано выше, является основным механизмом реа¬
лизации ДВС. Гнойно-септические осложнения, часто усугубляющие течение пост-
травматического периода, увеличивают частоту развития ДВС. Основной причиной
снижения резистентности организма к инфекциям является вторичный иммуноде¬
фицит вследствие длительной гипоксии, характерной для шока.
Травма, травматический шок вызывают ряд изменений в гемостазе, способ¬
ствующих ДВС вследствие:
I резкого замедления кровотока, вплоть до полного стаза, выраженного нару¬
шения кровоснабжения органов-мишеней;
І поступления в кровеносное русло тканевого тромбопластина, освобождае¬
мого из поврежденных тканей, разрушенных эритроцитов и тромбоцитов,
простагландинов, эндотоксинов, НЭЖК, фракций комплемента, эндогеннш
активаторов свертывания крови и агрегации тромбоцитов, ацидоза, увеличе¬
ния концентрации кетоновых тел, тканевых протеаз. Необходимо отметить,
что травмы головного, спинного мозга наиболее часто осложняются ДО
синдромом, поскольку ткань мозга очень богата тканевым тромбопласгиноя
который при травматическом повреждении поступает в циркуляцию
того, травма головного мозга зачастую сопровождается политравмои, туда
магическим шоком, потерей крови, массивной гемотрансфузией и дил
онной коагулопатией;
І бактериальной эндотоксинемии, активизирующей коагуляцию кР°вИ- _
• образования агрегатов форменных элементов крови (лейкоцитов, эритр^
тов. тромбоцитов), образования пристеночных и обтурирующих микрг'
бов в местах поражения эндотелия сосудов;
ДИССЕМИНИРОВАННОЕ ВНУТРМСОСУдИСТОС СВЕРТЫВАНИЕ КРОВИ •18
• поражения эндотелия сосудов вследствие воздействия гуморальных факто¬
ров. сопровождающих гипоксию;
, блокады РЭС на фоне изменений иммунного статуса.
\'же через 10-20 мин после травмы выявляют активацию фибринолиза (опре-
йпот эуглобулиновым методом), гипофибриногенемию, тромбоцитопению.
Однако клинически выраженная активация фибринолиза в виде коагулолатиче-
дця кровотечений у пациентов с травмой встречается довольно редко. При бла¬
гоприятном течении посттравматического периода показатели гемостаза норма-
«яэуются. а затем формируется тенденция к гиперкоагуляции. В среднем через
jj-16 ч после травмы (в зависимости от тяжести травматического повреждения)
Фибринолитическая активность приходит в норму, концентрация фибриногена
повышается. К концу первых суток лечения у большинства больных активность
фибринолиза снижается, концентрация фибриногена достигает верхней границы
нормы, а у 30% - в 1,5 раза превышает норму. Время свободного гепарина* увели¬
чено, снижается тромбиновое время. Тенденция к гиперкоагуляции достигает мак¬
симума к 4-5-м суткам посттравматического периода. Концентрация фибриногена
резко возрастает, фибринолиз замедляется, свободный гепарин* отсутствует.
Фаза гиперкоагуляции и угнетения ферментативного фибринолиза являет¬
ся самой продолжительной. При адекватной терапии происходит постепенная
нормализация гемостаза. Однако при продолжающемся поступлении тканевого
тромбопластина в кровоток (в случаях тяжелого травматического повреждения)
на фоне гиперкоагуляции и замедления фибринолиза создаются благоприятные
условия для активного микротромбирования, поражаются органы-мишени, раз¬
вивается ПОН. На этом фоне иногда вновь возникают кровоточивость из после¬
операционных ран, желудочно-кишечные кровотечения.
Тенденция к гипокоагуляции связана не только с дефицитом факторов сверты¬
вания крови, но и с повышением концентрации продуктов деградации фибрина,
которые обладают выраженным антикоагуляционным эффектом.
Наряду с этим при травме имеют место следующие изменения гемостаза:
• замедление и нарушение трансформации фибриногена в фибрин, увеличива¬
ется содержание патологических форм фибриногена, затрудняется образова¬
ние сгустков;
• снижение активности фибринстабилизирующего фактора — фибриназы;
• тромбоцитопения и значительное нарушение тромбоцитного звена гемоста¬
за;
• усиление активности выработки тромбина;
І быстрое истощение активности системы естественных антикоагулянтов, осо¬
бенно AT III, который расходуется на нейтрализацию тромбина. Снижение
содержания AT III приводит к рефрактерности к гепаринотерапии (AT III —
кофактор гепарина*).
Традиционная комплексная терапия ДВС-синдрома при политравме (травма¬
тическом шоке) включает следующие лечебные мероприятия; купирование боле¬
вого синдрома, окончательную остановку кровотечения, коррекцию гиповолемии,
анемии, нарушений периферического кровообращения, реологических свойств
крови посредством адекватной инфузионно-трансфузионной терапии, коррекцию
гипоксии, сердечно-сосудистой недостаточности под контролем клинических,
лабораторных показателей с учетом характера патологий гемостаза, а также про¬
филактику и лечение гнойно-септических осложнений (как отмечалось выше, эти
осложнения являются основной причиной смерти больных, перенесших тяжелую
травму).
В целях восстановления нормального гемостаза применяют заместитель¬
ную инфузионную терапию свежезамороженной плазмой, криопреципитатом.
Ри лабораторно подтвержденных фибринолитических кровотечениях целе-
І К/ЧШЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
сообразны антифибринолизные препараты (аминокапроновая кислой
вин). Кроме того, при политравме доказана высокая эффективность п 3llN-
рекомбинантного фактора VIIIa (НовоСэвен*). Однако применение П Ц
НовоСэвен* при посправматическом ДВС-синдроме крайне бграничев^8^
назначают по жизненным показаниям в случаях профузных, неконтрод8
кровотечений При отсутствии эффекта ОТ хирургической И других видов
кровотечения. "н =
ГЕМОЛИТИЧЕСКИЕ П0СТТРАНСФУЗИ0ННЫЕ ОСЛОЖНЕНИЯ
Гемолитические посттрансфузионные осложнения обусловлены ИММ
конфликтом, в основе которого взаимодействие антител реципиента с
ствующими антигенами донорской крови. Гораздо реже гемолиз наступает в
тате разрушения эритроцитов реципиента антителами донора. Устанем
тго существуют два механизма цитолиза — в кровеносном русле (внуш*"0
судистый) и в тканях (внесосудистый, в основном в клетках ретикулоэщ
лиальной системы, в селезенке и печени). Антигенам донорских эритрощ!^
противодействуют специфические антитела, которые способны фиксировав
комплемент на поверхности эритроцитов донора. Образовавшийся кощцГ1
«антиген-антитело» активизирует систему комплемента, что приводит к §м§
мембран эритроцитов донора. Клинические признаки гемолиза могут прояви^
ся после трансфузии незначительного объема несовместимой крови или щ
во время биологической пробы. Эти наиболее тяжелые гемолитические посттранс¬
фузионные осложнения, как правило, связаны с несовместимостью крови донора
и реципиента по системе АВО. Антитела способны фиксировать комплемент за счет
наличия зон на тяжелых цепях, взаимодействующих с С1-компонентом системы
комплемента. Резус-антитела неспособны фиксировать комплемент и позаду
не вызывают внутрисосудистый гемолиз эритроцитов. При переливании крови,
несовместимой по антигенной системе резус, происходит внесосудистый гемолиз,
Антитела адсорбируются на несовместимые эритроциты. Fc-рецепторы макро¬
фагов, моноцитов печени и селезенки фиксируют комплекс «антиген-антюш»,
после чего следуют фагоцитоз и внутритканевый гемолиз.
Пораженный эндотелий и тромбоциты вырабатывают серотонин, гистамин,
цитокины, тромбоксан, эндотелии, лейкотриены, а разрушение стромы эритро¬
цитов приводит к выделению эритроцитина. Накопление данных медиаторов
приводит к активации внутреннего и внешнего механизмов свертывания крови.
Этому же способствует массивный выброс в кровеносное русло тканевого тромбо¬
пластина. У пациента развиваются коагулопатия потребления (дефицит факторов
свертывания), тромбоцитопения, тромбоцитопатия. В дальнейшем происходит
лизис фибрина, фибрин-мономеров, фибриногена, развивается гипо- или афи-
бриногенемия, что характерно для фибринолиза. Резко возрастает содержа¬
ние ПДФ, которые обладают ингибирующим действием на свертывание крови
На фоне фибринолиза формируются рыхлые тромбы, неспособные закрыть про¬
свет поврежденного сосуда, резко возрастает риск тяжелых геморрагий.
Специфические иммуноглобулины, связываясь с клеточными рецепторам*
эритроцитов донора, вызывают сладжирование и агглютинацию клеток кров*
Это является причиной ДВС-синдрома, сопровождающегося диссеминирован¬
ной микроэмболизацией, блокадой капиллярного русла, поражением органов
мишеней и формированием полиорганной недостаточности. Однако в случая
постгрансфузионного гемолитического осложнения в наибольшей степени нар
шаютея функции почек, при несвоевременном лечении возникает ОПН, котор.
при гемолитических посттрансфузионных осложнениях развивается вследсгви •
• гипоксического поражения канальцевого эпителия почек;
I блокады микроциркуляции;
І накопления в просвете канальцев почек дериватов свободного гемоглобин»
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 817
андотоксемия. которая развивается вследствие резкого увеличения содержания
„ови билирубина, желчных кислот, продуктов метаболизма белков (мочевины,
'пеатинина. мочевой кислоты и др.), довершает клинические проявления гемо*
Итяческого шока. Смертность в случаях тяжелых гемолитических осложнении
остигает 40-60%. Исход зависит от своевременности диагностики и лечения.
Lu этом ранняя диагностика основана на наиболее доступных лабораторных
стэх - выявлении гемоглобинемии и гемоглобинурии. Содержание непрямого
билирубин8 в крови резко повышается и сопровождается выделением уробилина
иочой и сгеркобилина с калом.
После появления первых клинических симптомов гемолитического ослож¬
нения гемотрансфузию прекращают и немедленно начинают терапию. Первый
угап предусматривает ряд симптоматических мероприятий: терапию сердечно¬
сосудистой недостаточности, применение глюкокортикоидов в больших дозах
(по 300 мг болюсно до 2000 мг). коррекцию гиповолемии. искусственную венти¬
ляцию легких, коррекцию водно-электролитных и метаболических расстройств,
восстановление нормального кровоснабжения почек, применение форсированно¬
го диуреза. При сохранении скорости мочеотделения 1 мл/кг в час внутривенно
капельно вводят 250 мг лазикса в 400-600 мл 40% раствора глюкозы. В случае
эффективности диуретической терапии инфузию продолжают до прекращения
гемоглобинурии.
Для успешного лечения гемолитического осложнения необходима экстракор¬
поральная детоксикация, целью которой является купирование ДВС-синдрома
и эндотоксемии. Обменный плазмаферез в ранние сроки клинических проявлений
позволяет предупредить полиорганные нарушения, поскольку оказывает поло¬
жительный эффект на всех этапах патологического процесса: во время плазма¬
фереза из циркуляции удаляются продукты гемолиза, свободный гемоглобин,
строма разрушенных клеток, ПДФ, медиаторы воспаления, иммунные комплексы,
микроагрегаты клеток крови. Кроме этого, при плазмаферезе плазма из тканей
организма поступает в циркуляцию, что способствует детоксикации, улучшению
микроцикруляции и реологических свойств крови пациента.
Одним из условий эффективности обменного плазмафереза является хорошее
плазмозамещение, которое позволяет быстро восполнить дефицит факторов свер¬
тывания и естественных антикоагулянтов. Кроме того, при выраженном дефиците
AT III в целях коррекции его содержания применяют препараты концентрата
AT III в дозе 1500-2000 ЕД в первые сутки лечения.
Выраженность положительного эффекта плазмафереза напрямую зависит
от объема эксфузии плазмы, который определяется исходным уровнем свободно¬
го гемоглобина в плазме: детоксикация достигается при больших и сверхбольших
объемах (>1,5-2 ОЦП за процедуру) плазмообмена. Установлено, что при исхо¬
дном уровне свободного гемоглобина менее 1000 мг% в большинстве случаев
достаточно удаления одного объема циркулирующей плазмы (ОЦП). Содержание
свободного гемоглобина в плазме, превышающее 2000 мг% является показанием
к удалению 2 ОЦП и более.
В случаях нарастания почечной недостаточности показан гемодиализ.
Гемофильтрация и гемодиаультрафильтрация позволяют не только провести кор¬
рекцию нарушений водно-электролитного баланса, но и элиминировать из цирку¬
ляции низко- и среднемолекулярные олигопептиды, энзимы, билирубин.
Трансфузии эритроцитной массы необходимы для коррекции гемолитической
анемии. В целях повышения эффективности и безопасности гемотрансфузий
в период развившегося осложнения необходимо фенотипирование эритроцитов
Реципиента и донора. При тромбоцитопении, геморрагическом синдроме пока¬
заны трансфузии концентрата тромбоцитов в терапевтической дозе (6-8 ЕД ТК),
а также криопреципитата.
ЦІ UWH/МКЖАЯ ТЯИНСФУЭИОЛОГИЯ
ЗАБОЛЕВАНИЯ
Отологические заболевания повышают риск тромбоэмболических
щ ДВС Многие виды опухолей активируют коагуляцию и фибринолиз С°Сг°,Ч
т процессы облегчают диссеминацию и имплантацию метастатических о
исток. Особенно высокому риску ДВС подвергаются пациенты, страдакн ^0;,еЧ
минированными формами рака, острыми лейкозами (в первую очередь
щеяофггарным лейкозом), хроническими лейкозами (при властных крад^01 Ч
Развитию тромбоэмболических осложнений при онкологических за0
ях способствуют высокий уровень клеточного поражения, распада и выгы^1-
клетками злокачественной опухоли прокоагулянтных субстанций, в тоы1|>
интерлейкина-1 и фактора некроза опухоли, которые стимулируют Вьт ^
прокоагулянтов макрофагами и эндотелиальными клетками. *)або%
ДВС у данных пациентов протекает в стертой (субклинической), хроник
форме. Однако хирургические вмешательства или инфекционные owo»w
часто приводят к обострению ДВС. ненН)|
Хронический ДВС характеризуется полной или частичной компенсацией гене*,
стаза, но у большинства больных имеются специфические изменения показі
лей свертывающей системы: увеличивается количество тромбоцитов. возрапГ
содержание факторов свертывания, фибриногена, а также продуктов деградац^
фибриногена, фибрина (табл. 21-10). Несмотря на это, активация гемокоагулящ
имеет менее выраженный характер, что подтверждается нормальными показате¬
лями свертывания крови. Уровень AT III снижается незначительно, активнощ
фибринолитической системы несколько падает.
Таблица 21-10. Лабораторные изменения гемостаза у онкологических больных
Показатель
Хронический ДВС
Острый ДВС
Норна
Протромбиновое время
Норма или укорочено
Удлинено
11-13,5 с
АЧТВ
Укорочено
Значительно удлинено
25-35 с
Фибриноген, г/л
5-6
<1
2-4
Тромбоциты
>500 ООО
<100 000
170-325x10^
D-D-димеры
Увеличены
Значительно увеличены
<0,5 мг/мл
Установлено, что при метастазировании опухолей хронический ДВС диа¬
гностируют у 75% больных. Нарушения гемостаза нередко проявляются тен¬
денцией к кровоточивости, однако склонность к тромбозам, тромбоэмболиче¬
ским осложнениям у этих больных представляет гораздо большую проблем)'
для терапии.
Поджелудочная железа богата тканевым фактором и содержит трипсин - про-
теолитический фермент, который активирует свертывающую систему крови
Новообразования поджелудочной железы, тяжелый панкреатит, а также хирур¬
гические вмешательства на этом органе резко увеличивают риск развития ДВС
или тромбоэмболических осложнений.
Химиотерапия провоцирует обострение хронического ДВС и развитие микро-
ангиопатической гемолитической анемии. При злокачественных опухолях моче
выводящей системы, меланоме и промиелоцитарном лейкозе возможен гемор¬
рагический диатез (капилляротоксикоз). Причиной этого осложнения являете*
резкое увеличение продукции ферментов фибринолиза клетками опухоли данной
локализации.
ХРОНИЧЕСКАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ, ПРОГРАММНЫЙ ГЕМОДИАЛИЗ
Роль почек в поддержании физиологического состояния гемостаза крайне веля®
І вырабатывают и выделяют в кровь и мочу факторы VIII, VII, IX, X,
пластин:
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДЙСТОЕ СВЕРТЫВАНИЕ КР08И |19
синтезируют проти вое ве рты вающие факторы — гепарин*, урокмназу, ткане*
• активатор плазминогена. соединения, ингибирующие фибринолиз;
поглощают и катаболизируют фактор XII и часть фибриногена. Фактор ХП
необходим для участия в синтезе коллагена базальными мембранами калил*
дярных стенок в клубочке.
Пои патологии почек снижается функциональный вклад этого органа в гемостаз
шикает процесс локальной активации системы свертывания крови. Этот про¬
чее При определенных условиях может перерасти в диссеминированное внутри-
'дистое свертывание. По мере прогрессирования почечной недостаточности
^5*сть нарушений гемостаза прогрессирует, возрастает частота геморрагических
ІІяожнений. Геморрагический синдром встречается более чем у 50% больных
ХПН. Кровоточивость носит гематомно-петехиальный характер, типичны носо-
сые десневые кровотечения и из желудочно-кишечного тракта.
Поскольку для больных с ХПН характерны разнонаправленные изменения
гемостаза (возможна гипер- и гипокоагуляция), то нередко наблюдается склон¬
ность к тромбозам: возникают тромбозы мезентериальных сосудов, вен сетчат¬
ки артериовенозных фистул. Во время диализа у этих больных тромбируются
(Ьистульные иглы, мембраны диализатора. Превентивное введение гепарина*
не препятствует развитию тромбозов.
В лабораторных тестах наблюдаются характерные для больных с ХПН изменения:
• снижаются агрегационные и адгезивные свойства тромбоцитов (тромбоцито-
патия). Количество тромбоцитов нормальное либо имеется незначительная
тромбоцитопения;
• повышается содержание фибриногена, ПДФ. появляются аномальные формы
фибриногена, тесты паракоагуляции положительны. Образовавшийся сгу¬
сток неполноценен, так как снижена фибриназная активность, замедлены
процессы ретракции сгустка;
• наблюдается фибринолитическая активность в сторону как активации, так
и угнетения фибринолиза;
• развивается анемия, но повышается агрегационная способность эритроци¬
тов, чему способствует увеличение содержания крупномолекулярных соеди¬
нений, в первую очередь фибриногена, (3-липопротеидов.
Все вышеуказанные клинические и лабораторные изменения свидетельствуют
о хроническом ДВС-синдроме. Декомпенсация нарушений гемостаза возможна
в терминальных стадиях заболевания, при наличии гнойно-септических осложне¬
ниях и в посттрансплантационный период.
Активация свертывания крови и развитие ДВС при программном гемодиализе
связаны со следующими факторами:
• контактом с чужеродной поверхностью мембран аппарата для гемодиализа;
• активацией свертывающей системы крови (посредством воздействия на фак¬
тор XII) иммунными комплексами, экзотоксинами и бактериальными эндо¬
токсинами, тканевым тромбопластином (вырабатывается при гемолизе,
цитолизе);
• гепаринизацией, приводящей к снижению (дефициту) AT III, которое являет¬
ся причиной рикошетных тромбозов.
Все материалы, применяемые для гемодиализа, в той или иной степени обла¬
дают тромбогенностью. Решение этой проблемы состоит в создании мембран,
обладающих наибольшей биосовместимостью, а также в применении антикоа-
ГУлянтов. Гепарин*, используемый во время гемодиализа, гетерогенен по отно¬
шению к эндогенному гепарину как по структуре, так и по молекулярной массе.
Именно поэтому нередки тяжелые побочные эффекты, связанные с применением
Апарина*: тромбоцитопения, повышение содержания трансаминаз, аллергические
риищии, кожный зуд, повышенная кровоточивость.
Щ КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
1
В воследние годы установлено, что активация коагуляции связа
вдолвдией и контактом крови с диализной мембраной. Показатели3 С
(Япемы у больных, находящихся на программном гемодиализе
характерных изменений. Состояние свертывания крови после сеанса
снует резко выраженной гиперкоагуляции: еще больше нарастает сол С0(%?
даю (средний его уровень у больных с ХПН значительно превьіща№ниеЙ
ЩргЯВ повышается содержание протромбина, факторов VIII, X ХП Н°РМал>%
нарушений гемостаза зависит от характера патологии
системы крови. Наиболее общие принципы терапии ДВС-синдрома
ном гемодиализе можно представить следующим образом. "и пР°гРаіц1.
і При гиперкоагуляции показан гепарин* в дозе 5000-10 ООО ЕЛ
раза в день подкожно. Применение малых доз гепарина* не требу8 СуТКи Зі
ного контроля за свертываемостью крови. *** ПостоЯ|).
• СЗП для восполнения дефицита AT III. При профузных кровотечен
ливание больших объемов СЗП проводит к быстрой их остановке П Пе^‘
латорном программном гемодиализе применяют небольшие л
в сочетании с малыми дозами гепарина*. дозы СЗП
• Эффективная терапия инфекционных осложнений.
Трансфузии СЗП в сочетании с малыми дозами гепарина* дают выпа
клинический эффект с положительной динамикой лабораторных (ЩрЯ
восстанавливаются функции тромбоцитов, нормализуется ТЭГ, паракоагуІ^
ные тесты отрицательны. он‘
ОСЛОЖНЕНИЯ БЕРЕМЕННОСТИ И РОДОВ
Начиная со II триместра нормально протекающей беременности, система гемо¬
стаза претерпевает ряд изменений:
і повышается активность тромбоцитов;
і снижается антикоагулянтный потенциал крови, і ПВ и АЧТВ;
• повышается содержание факторов свертывания крови (II, V, VIII IX X XL
и XII);
5 снижается активность фибринолитической системы, увеличивается содержа¬
ние фибриногена, PAI-1.
Таким образом, во время беременности имеет место активация свертывающей
системы крови. В процессе родов отмечается еще большее повышение количества
фибриногена, проконвертина, тромбоцитов, но при этом активность фибриноли¬
тической системы практически не меняется. В послеродовом периоде в течение
4-6 нед постепенно снижается гемокоагуляционная активность, удлиняется время
свертывания крови и ретракции кровяного сгустка, нормализуется АЧТВ.
Срыв адаптационно-компенсаторных механизмов гемостаза имеет место
при следующих патологиях беременности и родов: преждевременной отслойке
нормально расположенной плаценты, предлежании и разрывах плаценты, эмбо¬
лии околоплодными водами, атонических маточных кровотечениях, гипотонии
матки, разрыве матки, антенатальной гибели плода, плодоразрушающих операци¬
ях, кесаревом сечении (всегда сопровождается акушерской патологией), пузырном
заносе, гестозах беременных, преэклампсии, эклампсии, септическом аборте.
Акушерские кровотечения являются классической моделью молниеносного
ДВС-синдрома. Констатируется двухфазность изменений гемостаза: краткое
ременная стадия гиперкоагуляции сменяется фазой гипокоагуляции вследствие
острого фибринолиза, развивается коагулопатия потребления. Чрезмерная акти
вация фибринолиза приводит к лизису не только сгустков фибрина, но и ДОфч
лирующих факторов свертывания, имеет место усиление выработки
Развивающаяся на фоне кровопотери и ДВС полиорганная недостаточн
является непосредственной причиной летальности. О ДВС свидетельствует та
накопление ПДФ, РКФМ (в норме отсутствуют).
r
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ 821
терапия включает
коррекцию гиповолемии — восполнение дефицита ОЦК посредством аде-
* датной инфузионно-трансфузионной терапии. На этом этапе хорошо заре¬
комендовали себя инфузионные растворы гидроксиэтилированного крах¬
мала (6% и 10%), желатина (гелофузина*, желатиноля*). которые, помимо
коррекции гиповолемии, оказывают положительный эффект на реологиче¬
ские свойства крови и микроциркуляцию. В целях коррекции коагулопатии
осуществляют трансфузию СЗП в дозе 15 мл/кг;
медикаментозное воздействие на гемокоагуляцию — поливалентные инги-
*' 5ИТоры протеаз нормализуют процессы фибринолиза, кининогенеза: анти¬
фибринолизные препараты оказывают блокирующее действие на плазмин.
конкурентно ингибируют рецепторы плазмина и плазминогена, препятству¬
ют деградации фибриногена;
» коррекцию реологических свойств крови — введение дезагрегантов (трента-
ла*, агапурина*); гепарин* имеет ограниченные показания;
, симптоматическую терапию - направлена на поддержание функций жизнен¬
но важных органов, профилактику и лечение полиорганной недостаточности
и гнойно-септических осложнений;
1 экстракорпоральную детоксикацию — терапевтический эффект достига¬
ется механическим удалением патогенных субстанций (БАВ. активизи¬
рованных факторов свертывания крови, ПДФ и др.). Гемофильтрацию
применяют для терапии острого дистресс-синдрома и ОПН. Плазмаферез
показан при начальных стадиях острой печеночной и почечной недоста¬
точности.
ДВС-СИНДРОМ ПРИ ПАТОЛОГИИ НОВОРОЖДЕННЫХ
ДВС - достаточно часто встречаемая патология гемостаза у новорожденных
и особенно у недоношенных. Среди причин, приводящих к этому осложнению,
выделяют следующие, наиболее распространенные:
s осложнения беременности и родов — заболевания матери во время беремен¬
ности, внутриутробное инфицирование плода, многоплодная беременность,
недостаточность плацентарного кровоснабжения, отслойка плаценты;
I заболевания новорожденного — гемолитическая болезнь новорожденного,
инфекции, врожденные аномалии, онкология, пороки развития, гипоксия,
асфиксия плода, гипотермия, аспирация околоплодных вод, мекония.
Кроме вышеперечисленных патологий, осложняющихся ДВС-синдромом, высо¬
кая частота синдрома у новорожденных определяется особенностями гемостаза,
характерными для детей первых 6 мес жизни. У здоровых новорожденных по срав¬
нению со взрослыми отмечается снижение содержания факторов свертывания II,
VII, IX, X (витамин К-зависимых сериновых протеаз), протеинов С и S плазмино¬
гена, умеренное — количества тромбоцитов. Еще более выраженные изменения
гемостаза характерны для недоношенных новорожденных (табл. 21-11). В течение
первого полугодия жизни происходит постепенное формирование нормального
состояния свертывания крови.
Таблица 21-11. Показатели свертывающей системы крови у здоровых и недоношенных новорож¬
денных в сравнении со взрослыми
Показатель
Сутки жизни здорового новорож¬
денного
Сутки жизни недоношенного
новорожденного
Фибриноген, г/л
В пределах нормы взрослого
В пределах нормы взрослого
Антитромбин III
4
14-
Протеин С
4
ESiir
t
522 ИЯМИМЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Клинически ДВС может проявляться как подострым, так и молн
И'ииияи синдрома, для которого характерны кровоизлияния в мозг
полные, легочные кровотечения на фоне нарушений микроцир^^Ч
русла. Т°Р
Терапия синдрома включает общепризнанные методики, напгія
кш на ликвидацию или купирование основного заболевания, так и наЧ
магическое лечение расстройств гемостаза. С этой целью назначают то СИ*Ч
Ш в дозе 10-15 мл/кг, криопреципитата при гипофибриногенемии менеГ^"
(а дозе 1 ЕД компонента), тромбоконцентрата для поддержания уровня
догов более 50x107л. Для снижения количества посттрансфузионных от
Щ і новорожденных, в том числе острой волемической перегрузки,
трансфузии гемокомпонентов осуществляют с помощью перфузора с llpPf
ным подогреванием препаратов крови. ^
СПИСОК ЛИТЕРАТУРЫ
Аграненко В.А.. Скачилова Н.Н. Гемотрансфузионные реакции и осложнения
Медицина. 1986.1 247 с. “ Iі
Андрианова М.Ю., Белоус А.Е., Броун Н.К. и др. Диагностика и коррекция нарушам
гемостаза в беспеченочном и реперфузионном периодах при ОТТП // Итоги, результ^
научных исследований НЦХ РАМН по программной тематике. — М., 1997. - С. 45-56
Андрианова М.Ю.. Броун Н.К., Готье С.В. и др. Сравнительная оценка методов венове-
нозного шунтирования во время беспеченочного периода при ортотопической трансплан¬
тации печени // Итоги, результаты научных исследований НЦХ РАМН по программное
тематике. - М., 1996. - С. 76-83.
Баркаган З.С. Геморрагические заболевания и синдромы. — М.: Медицина, 1988. - 528с
Баркаган З.С., Момот А.П. Современнные аспекты патогенеза, диагностики и терапии
ДВС-синдрома // Вестник гематологии. — 2005. — Т. 1. — №2. — С. 5-14.
Баркаган З.С., Момот А.П. Основы диагностики нарушений гемостаза. — М.: Ньюниаму-
АО. 1999. - 224 с.
Беляевский А.Д., Беляевский С.А. Диссеминированное внутрисосудистое свертывание
крови (методические подходы к пониманию сущности процесса, его профилактике, диагно¬
стике и лечению). - 1996. — 36 с.
Буянов В.В. Экспериментальное изучение нарушений гемостаза при ортотопической
трансплантации печени: Автореф. дис.... канд. мед. наук. — 1994. — 31 с.
Бокарев И.Н. ДВС-синдром, современные представления и проблемы // Клинически
медицина. 1 1992. - №2. - С. 109-113.
Белобородов В.Б., Джексенбаев О.Ш. Эндотоксины грамотрицательных бактерий, цито-
кины и концепция септического шока: современное состояние проблемы // Анестезиология
и реаниматология. - 1991. - №4. — С. 68-75.
Введение в клиническую трансплантологию I Под общ. ред. Б.А. Константинова,
СЛ. Дземешкевича. - М., 1993. — 298 с.
Воробьев П.А., Дворецкий Л.И. Методы экстракорпорального воздействия на кровь:
Учебно-методическое пособие. - М., 1992. — 123 с.
Воробьев А.И., Городецкий В.М., Шулутко Е.М. и др. Острая массивная кровопотеря. -
М.: ГЭОТАР-Медиа. 2001. - 176 с.
Воробьев П.А. Диссеминированное внутрисосудистое свертывание крови. - М., 1994. -
137 с.
Ватазин А.В. Гемофильтрация и ее модификации при синдроме полиорганной недоев
точности//Анестезиология и реанимация. — 1995. — №3. — С. 35-44.
Городецкий В.М. Синдром массивных гемотрансфузий // Гематология и трансфузиол
гия. 1 1996.1 N»1. - С. 36-38. ш
Глазунов И.И., Григорьев А.В, Влияние гепарина на поражение эритроцитов при рааичнъ»
токсикогениых ДВС-синдромах // Гематология и трансфузиология. — 1990. - №7. -55 с.
Гусейнов Ч.С. Тромбоз и фибринолиз в хирургии. — М.: Менеджер, 1998. - 296с.
Дементьева И.И., Ройтман Е.В. Агрегатное состояние крови больных в ранние ср«
после операции 8 условиях искусственного кровообращения // Анестезиология и реа
толстя. - 1994. В N»6. - С. 39-51.
ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ
823
Дементьева И.И., Еременко А.А.. Леонова СФ. и др. Разработка компьютерного алгорит-
-дЯ диагностики тромбогеморрагических осложнений у кардиохирургических больных
^оаннем послеоперационном периоде // Итоги, результаты научных исследований РНЦХ
*аМН по программной тематике. — М., 1998. — С. 212-218.
Дементьева И.И., Еременко А.А., Парная М.А. и др. Использование рекомбинантного
оюироваиного фактора VII, в хирургической практике. - М., 2006. - 34 с.
Дементьева И.И., Марная М.А., Дземешкевич С.Л. и др. Превентивная роль больших доз
япотинина в снижении степени нарушений метаболизма при операциях аортокоронарного
„датирования // Анестезиология и реаниматология. — 1996. — №1. — С. 55-58.
Современные принципы лечения и профилактики синдрома полиорганной недостаточ¬
ней при массивной акушерской кровопотере. Методы гравитационной хирургии крови
^интенсивной терапии в акушерстве и гинекологии / Под общ. ред. акад. В.И. Кулакова.
* ,к0р. В.Н. Серова. - М., 1997. - С. 45.
Дюгеев А.Н., Фомин М.Ф. и др. Плазмаферез в комплексной терапии акушерского сепси¬
са и септического шока // Вестник акушера-гинеколога. - 1996. - N*3. - С. 87-92.
Зербино Д.Д., Лукасевич Л.Л. Синдром ДВС крови: морфологические критерии // Архив
патологии. - 1982. - Т. 44. - Вып. 7. - С. 36-41.
Зербино Д.Д., Лукасевич Л.Л. Диссеминированное внутрисосудистое свертывание
крови. - М.: Медицина, 1989. — 256 с.
Золотокрылина Е.С. Диссеминированное внутрисосудистое свертывание крови у боль¬
ных с массивной кровопотерей и тяжелой сочетанной травмой // Русский мед. журнал. -
1998. - Т. 6. - №24. - С. 58-66.
Лычев В.Г. Диагностика и лечение ДВС крови. - 2-е изд., перераб. и доп. - Н. Новгород,
1998І —191 с.
Лопаткин Н.Л., Козлов В.А. Плазмаферез в комплексной терапии острой реакции оттор¬
жения и гнойно-септических осложнений посттрансплантационного периода // Урология
и нефрология. — 1989. —№4. — С. 32-41.
Кузин М.И., Шимкевич Л.Л., Титова М.И. и др. Послеоперационные нарушения в системе
гемостаза: диагностика и лечение. Актуальные вопросы исследования системы гемостаза
в клинической практике.— М., 1995. - 62 с.
Матвеев С.А. Плазмаферез в лечении септического шока // Вестник хирургии. — 1991. -
Т. 146. - №4.1 С. 13-19.
Макаров В.А. Актуальные проблемы гемостазиологии // Клиническая медицина. -
1990. i Т. 68. - №6. - 24 с.
Мокеев И.Н. Инфузионно-трансфузионная терапия: Справочник. — М.: Изд-во Мокеева,
1998.1 С. 102-130.
Мелкумян А.Л., Морозов К.М., Самсонова Н.Н. и др. Факторы риска системы гемостаза
при заболеваниях аорты, магистральных и периферических сосудов: Метод, пособие. — М.,
2001. - 42 с.
Мухин Н.А., Полянцев Л.Р., Козловская Л.В. Клиническое значение исследования гемо¬
стаза в нефрологии // Тер. архив. — 1988. — Т. 60. — №6. — С 7-13.
Милас Б.Ю, Джоутс Д., Горман Р. Терапия кровотечений и коагулопатий после операций
на сердце. Сердечно-сосудустые заболевания // Бюллетень НЦССХ им. А.Н. Бакулева. —
2002. - Т. 3. - №4. - С. 58-63.
Морозов Б.Н. Применение плазмафереза при лечении больных с ДВС-синдромом и син¬
дромом полиорганной дисфункции в ранние сроки после операции в условиях искусствен¬
ного кровообращения: Дис.... канд. мед. наук / РАМН. — М., 1997. — 22 с.
Морозов Ю.А., Чарная М.А., Гладышева В.Г. и др. Изменение некоторых показателей
системы гемостаза при операциях на аорте // Ангиология и сосудистая хирургия. — 2006. —
Т.11-№2.-С 101-104.
Неговский В.А., Гурвич А.М., Золотокрылина Е.С. Постреанимационная болезнь. — М.:
Медицина, 1987. - 479 с.
Панченко Е.П., Добровольский А.Б. Тромбозы в кардиологии. — М.: Спорт и культура,
1999. - 462 с.
Палаян Л.П., Барышев Б.А. Синдром диссеминированного внутрисосудистого свертывания
крови - трагический срыв системы гемостаза // Трансфузиология. — 2001. — №2. — С 52-71.
Потапова И.В., Жаворонкова Е.К. Геморрагические осложнения у больных с ХПН //
Циническая медицина. - 1978. - Т. 58. - №7 - С. 67-70.
924 КЛИНИЧЕСКАЯ ТРАНСФУЗИ0Л0ГИЯ
Петч Б.. Мадленер К.. Сушко £. Гемостазиология. Рациональная
данное*,
пия. - Киев: Здоровье, 2006. — С. 198-211.
Рикмов А.А.. Соловьева И.Н. Гемаферез в хирургии. — М.: ФГОУ Rvu ^
1999.-93 с. НМ|Д Мз
Рагимов А.А.. Порешина С.А.. Салимов Э.Л. Плазмаферез при системном
ном ответе. - М.: Практическая медицина, 2008 — С. 123. Boci59%i{
Сидоркина А.Н.. Сидоркин В.Г.. Преснякова М.В. Биохимические оси
гемостаза и диссеминированного внутрисосудистого свертывания крови н ^
ННИИТО. 2001. - 92 с. Н
Стицюк Е.А.. Лопаткин Н.А., Михеева Л.А. Влияние гемодиализа на
систему крови // Урология и нефрология. — 1988. — №4. — С. 58-64.
Трансфузиологическая помощь при лечении острой массивной кровопогепи
ниц: Методические рекомендации. — М., 2000. — 20 с.
Чарная М.А. Патофизиологические аспекты применения больших доз апротинин
рациях с искусственным кровообращением: Дис.... канд. биол. наук. - М., 1993 h jfSl
Bellomo R.. Tippinq P., Boyce N. Continuous veno-venous hemofiltration with dialvsi C'
citokines from the circulatin ofseptic patients // Crit. Care Med. — 1993. - N 21. - p
Beliomo R„ Farmer M. Treatment of sepsis-assodated severe acute renal failure with сомі
hemofiltration // Blood purif. — 1995. — N 3. — P. 121-134.
Bick R., Arun B., Frenkel E. Disseminated intravascular coagulation. Clin, and path,
and manifistation // Haemostasis. — 1999. — P. 29.
Boldt G.. Kling D., Zickmann B. Acute plasmapheresis during cardiac surgery: volume replacemew
by crystalloids versus colloids //J. Cardiothoraric anest. — 1990. — Vol. 4. - N 5. - P. 87-95
Boue A.E. Multiple organ failure, multiple organ dysfunction syndrome and the systemicinL.
matory response syndrome // Shock. — 1994. — Vol. 1. — N 4. — P. 93-99.
Bone R.C.. Balk R. Adult respiratory distress syndrome. Sequence and importance of develop¬
ment of multiple organ failure // Chest. — 1992. — Vol. 101. — N 2. — P. 87-99.
Bohrer N.. Nawroth P.P. Pathophysiology, presentation and treatment of conditions associated
DIC // In: Life - Threatening coagulation disorders in critical care medicine. 1 1997.
Emergency Care Reserch Institute. Automated intraoperative processing autotransfusi«i
machines // Health. Devices. — 1998. — N 17. — P. 219-242.
Глава 22
Посттрансфузионные реакции
До недавнего времени термином ^посттрансфузионные реакции
и осложнения» обозначали все неблагоприятные последствия, воз¬
никающие у реципиента после гемотрансфузий. При этом пост-
трансфузионными реакциями называли побочные эффекты гемо¬
трансфузий, не сопровождающиеся серьезными и длительными
нарушениями функций органов и систем реципиента, а посттранс-
фузионными осложнениями — неблагоприятные последствия гемо¬
трансфузий, характеризующиеся тяжелыми клиническими про¬
явлениями, опасными для больного. Любые побочные явления,
связанные с взятием и применением донорской крови или ее ком¬
понентов и представляющие угрозу жизни и здоровью донора
или реципиента, определяются как посттрансфузионные реакции
и осложнения.
В мировой литературе используется термин ^transfusion reaction*
(«трансфузионная реакция»). В последние годы и в РФ для обозна¬
чения нежелательных последствий трансфузий используют термин
«посттрансфузионная реакция». Очевидно, следует согласиться
с таким подходом, поскольку на любую гемотрансфузию первична
реакция организма (имеют значение ее клинические проявления),
а осложнения являются лишь следствием декомпенсации адапта¬
ционных резервов организма. Необходимо помнить, что любая
инвазивная процедура, а тем более гемотрансфузия аллогенных
компонентов, будет сопровождаться реакцией организма. Когда
речь идет о посттрансфузионных реакциях, имеются в виду только
нежелательные, неблагоприятные последствия гемотрансфузий.
Практически все посттрансфузионные реакции в своей основе
имеют иммунные механизмы и/или сопровождаются изменениями
в иммунной системе.
Неблагоприятные последствия гемотрансфузий могут начаться
как слабовыраженная реакция, а затем очень быстро перерасти
в тяжелую клиническую форму. Нередко у одного больного отмеча¬
ется комплекс признаков реакции (например, фебрильные реакции
могут сопровождаться гемолизом). Острые трансфузионные реак¬
ции при отсутствии терапии или ее неадекватном проведении могут
перейти в отсроченные.
Крайняя степень клинических проявлений постгрансфузионной
реакции — гемотрансфузионный шок, тяжесть которого обуслов¬
лена иммунологическим конфликтом, острым внутрисосудистым
гемолизом, нередко нарушением функции жизненно важных орга-
$26 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
I
нов. токсикозом, геморрагическим диатезом, почечно-печеночной и
органной недостаточностью. в ^
КЛАССИФИКАЦИЯ ПОСТТРАНСФУЗИОННЫХ РЕАКЦИЙ
Посттрансфузионные реакции наблюдаются при нарушении или
от установленных правил техники и методики заготовки, хранения и
крови, ее компонентов, если не учитываются показания и противопоказ^1®51"!*
дению гемокомпонентов и неадекватно оценивается состояние реципиаНИЯ|(8В(-
трансфузией. ента Перед
Гемотрансфузионные реакции бывают:
• немедленные и отсроченные;
• клинически значимые и малозначимые;
• иммунные и неиммунные;
• гемолитические и негемолитические;
• пирогенные;
• аллергические:
• анафилактические;
а связанные с техническими погрешностями гемотрансфузий;
і связанные с физико-химическими факторами (перегреванием, нарушит
условий хранения и др.); ’ ем
і связанные с инфицированностью компонентов крови;
• посттрансфузионная иммуномодуляция.
Посттрансфузионные реакции с учетом вовлечения в процесс специфического
иммунного ответа делят на иммунные и неиммунные.
Иммунные реакции обусловлены иммунологическим конфликтом между
компонентами крови донора и реципиента, в основе которого лежит реакция
«антиген-антитело».
Неиммунные реакции возникают в тех случаях, когда иммунологический ком¬
понент может играть опосредованную роль, они связаны с трансфузиями инфи¬
цированных гемокомпонентов, гемолизом эритроцитов, вызванным химическими
или физическими факторами, метаболическими сдвигами, нарушениями техники
гемотрансфузий.
Частота трансфузионно-ассоциированных рисков возникновения посттранс¬
фузионных реакций зависит от различных причин и главным образом от степени
развития системы обеспечения безопасности трансфузионного пособия (в службе
крови она объединена понятием «Haemovigilance»). Европейское «ІЩ
по заготовке, использованию и обеспечению качества компонентов крови»И
которое получило международное признание как «золотой стандарт» службы
крови, определяет «Haemovigilance| как «...организованные процедуры монито¬
ринга реакций или осложнений у доноров или реципиентов и эпидемиологиче¬
ского статуса доноров...». В настоящее время системы «Haemovigilance» действуют
более чем в двух десятках стран. Большинство из них входит в Европейскую сеть
(European Haemovigilanse Net). В РФ эта система в данный момент находится
на стадии активного внедрения. Главной ее задачей является сбор и анализ инфор¬
мации о любых неблагоприятных последствиях гемотрансфузий в целях оценки
реального риска, сопровождающего переливание крови.
В странах, где на должном уровне действует система «Haemovigilance», т.е. в те
странах, в которых трансфузионное пособие находится под постоянным контро
лем трансфузионных комитетов, хорошо поставлены аудит и регистрация не*
лательных посттрансфузионных реакций, а ассоциированный с трансфузії
риск осложнений на несколько порядков ниже, чем в странах, не имеющих сто
развитую службу крови (табл. 22-1). н0
В рамках трансфузионной иммунологии основное внимание будет уд
посттрансфузионным реакциям иммунного генеза.
Классификация посттрансфузионных реакций приведена в табл. 22-2.
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 827
пбяМ* 22т1- Трансфузионно-ассоциированиые риски’
['''''''рйсйпередачи/развития IВ странах с развитой Службой крови ~ffl развивающихся странах 1
ОаМГСЫ — .. ' И 1 .-Л. . II
А1<ч
1:450 000-1:700 000
1:50-1:250
йГЯ
1:31 000-1:205 000
1:74-1:1000
-в
1:1 935 000-1:3 100 000
1:2570
Бактерии
илнтамииация)
1.2000-1 8000 (ТК)
1:28 000-1.143 000 (ЭМ)
—
пмазиты
шляоия
1:400 000
1.3
гоиппитические реакции
лстоый гемолиз
1:13 000
отсроченный гемолиз
1:5000
_
Аллоиммунизация
1:1600
—
Иммуносупрессия
1:1
—
Острая легочная недостаточность,
связанная с трансфузиями
1:70 000
—
•По Д.С. Маркучи (Marcuchi D. С.) и соавт., 2008.
Таблица 22-2. Классификация посттрансфузионных реакций
Немедленные
(возникают во время трансфузии или сразу после нее)
Отсроченные
(возникают через несколько дней, меся¬
цев или лет после трансфузии)
Иммунные
Неиммунные
Иммунные
Неиммунные
Гемолитические
Воздушная эмболия и тромбоэмболия
Гемолитические
Инфекции
Фебрильная негемоли¬
тическая реакция
Посттрансфузионный сепсис (бактери¬
альная контаминация)
Аллоиммунные
Гемосидероз
Аллергические
Циркуляторная перегрузка
Тромбоцитно-
рефрактерные
Анафилактические
Гемолиз вследствие физико¬
химического воздействия на компо¬
ненты донорской крови
(реакции, обусловленные нарушения¬
ми температурных режимов и/или сро¬
ков хранения, ошибками в выборе
ресуспендирующего раствора)
Болезнь «трансплантат
против хозяина*
Синдром острого пост-
трансфузион но го пора¬
жения легких
Иммуномодуляция/
иммуносупрессия
Классификация не может претендовать на полноту и содержит сведения
об основных, наиболее часто встречающихся на практике гемотрансфузионных
реакциях.
На рис. 22-1 и 22-2 приведено распределение распространенности реакций
гемолитического и негемолитического типа, а также симптомов негемолитических
реакций среди выявленных случаев посттрансфузионных осложнений (по данным
зарубежных авторов).
При определенных заболеваниях и состояниях переливание крови и ее компо¬
нентов может нанести больному больше вреда, чем пользы. Очевидно, что в ряде
случаев гемотрансфузии приходится выполнять по прямым неотложным пока¬
заниям, к которым относят острую массивную кровопотерю и геморрагический
шок при обширных хирургических вмешательствах с кровопотерей, осложненные
роды, коагулопатии различного генеза и др. Необходимо иметь в виду, что проти-
■^показания к гемотрансфузии носят относительный характер и при критических
состояниях для спасения жизни больного приходится их игнорировать, а сами
■^отрансфузии выполнять с большой осторожностью с использованием всех мер.
обеспечивающих положительный эффект процедуры.
128 хлиничнжая трансфузиология
pfnx Острый легочный
Рис. 22-1. Трансфузионные реакции (схема)
Гипотензия
Анафилаксия
28%
Рис. 22-2. Частота клинических симптомов негемолитических реакций (схема)
Следует еще раз напомнить, что трансфузии аллогенных гемокомпонентов
фактически являются биологической операцией трансплантации ткани, наибо¬
лее насыщенной антигенами и сопровождающейся существенными изменениями
в иммунном статусе реципиента, и, кроме того, несут определенный риск постгранс-
фузионных инфекционных осложнений. Современный подход к компонентной
гемотерапии ограничивает их применение только случаями, требующими восполне¬
ния недостающих компонентов крови больного - клеточных или плазменных. Т£
в качестве замещающих средств. Введение донорских компонентов крови практи-
чески представляет собой трансплантацию аллогенной ткани, и врач, прибегающий
к гемотрансфузиям, должен оценить потенциальный риск их применения и ожи¬
даемый лечебный эффект. Использование компонентов крови следует проводить
по строгим показаниям и ограничивать определенными клиническими ситуациями
(табл. 22*3),
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 829
дояа 22-3. Основные показания к гемокомпонентной терапии
Компоненты крови
цитрочитиая
масса
свежезаморо¬
женная плазма
тромбоциты
пейцкоцяты
лимфоциты
[дабыв виды крово-
потерь (операции,
доовсломожение,
[военные и граждан¬
кам ранения)
Нарушения коа¬
гуляции
Тромбоцитопении
различной этиоло¬
гии (кроме аутоим¬
мунной)
Угроза генерализации
инфекций (сепсис,
вторичный иммуноде¬
фицит. резистентность
к антибиотикам)
После транс¬
плантации кост¬
ного мозга
в случаях реци¬
дива лейкоза
веский син-
Медицина ката¬
Тромбоцитопени-
Перитонит
I дрОМ
строф
ческая пурпура
Ожоговый синдром
i медицина катастроф
ГЕМОЛИТИЧЕСКИЕ ПОСТТРАНСФУЗИОННЫЕ НЕМЕДЛЕННЫЕ И ОТСРОЧЕННЫЕ
РЕАКЦИИ
Причиной посттрансфузионных немедленных и отсроченных гемолитических
реакций является иммунологический конфликт между компонентами крови доно¬
ра и кровью реципиента, в основе которого лежит реакция «антиген-антитело*.
Чаще всего эти реакции обусловлены разрушением эритроцитов донора анти¬
телами реципиента; значительно реже возникают в результате разрушения эри¬
троцитов реципиента антителами, содержащимися в плазме донора. Частота всех
посггрансфузионных гемолитических реакций составляет, по данным различных
авторов, 0,02-0,20%.
В подавляющем большинстве случаев посттрансфузионные гемолитические
реакции (ПТГР) развиваются:
• вследствие нарушения технологии определения групп крови;
і несоблюдения правил проведения проб на индивидуальную совместимость;
• нарушения техники переливания крови.
Клиническая картина, прогноз и летальность пациентов от ПТГР, вызванных
переливанием донорских эритроцитов, несовместимых по антигенам ABO, Rh,
Kell, Lewis, определяются характером и структурой антител реципиента, которые
обусловливают механизм гемолиза (внутри- или внесосудистого).
Внутрисосудистый гемолиз
Самой частой причиной внутрисосудистого разрушения эритроцитов являют¬
ся трансфузии групп крови, несовместимых по антигенам системы АВО. Среди
основных причин трансфузий иногруппной донорской крови выделяют наруше¬
ние методик определения групп крови, несоблюдение правил проведения пробы
на групповую, Rh, индивидуальную совместимость крови донора и пациента,
а также нарушение техники переливания крови.
В табл. 22-4 представлены сочетания антигенов с типом гемолитической реак¬
ции (вне- или внутрисосудистый). Другие антиэритроцитные антитела могут
быть причиной внесосудистого гемолиза и, как правило, не представляют угрозу
ДЛЯ жизни.
В патогенезе посттрансфузионных реакций, вызванных несовместимостью
крови донора и реципиента по системе АВО, ведущую роль играет разрушение
(гемолиз) эритроцитов донора антителами реципиента, которые адсорбируют-
ся на несовместимых перелитых эритроцитах донора. Образовавшийся ком*
нлекс «антиген-антитело* фиксирует комплемент и активирует его компоненты,
^приводит к лизису мембраны и внутрисосудистому разрушению эритроцитов,
gf механизм гемолиза приводит к наиболее опасным и тяжелым клиническим
’Появлениям. В результате внутрисосудистого гемолиза несовместимых донор-
J3C *ш#икмв т«*нс*уз»юяогия
TMmis 224 Классы зрюроцитных антигенов, ассоциированных с
шввмзоы ^ ******
аттт
Кексы
Виутрисосудястый
гемолиз
А, В
1
ІРеЯу
іикмгал
Le4, Le4, Le3
Vei
i hM
Do*, Do"
сШ эритроцитов в крови реципиента появляются свободный гемоглобин R
генные амины, тромбопластин и другие биологически активные вещества о
обусловливают гемотрансфузионный шок, геморрагии и острую почечную
статочность в момент трансфузии или после ее окончания.
Скорость, интенсивность и степень внутрисосудистого гемолиза определяют'
• уровнем содержания антител;
• функциональной активностью (авидностью), специфичностью и классом
иммуноглобулинов антител;
І уровнем компонентов комплемента в крови реципиента;
] объемом перелитых гемокомпонентов (в меньшей степени).
Под влиянием стрессового воздействия и высоких концентраций биологически
аюквяых веществ, выделяемых клетками при разрушении эритроцитов, проис¬
ходит раздражение интерорецепторов, а затем, если воздействие не прекраща¬
ется, развивается запредельное торможение. Наибольшей нефротоксичносгъю
обладает свободный гемоглобин, который в почечных канальцах превращается
в солянокислый гематин. На фоне стрессового спазма почечных сосудов в просвете
почечных канальцев наряду с остатками разрушенных эритроцитов накапливается
гематин. Клубочковая фильтрация также снижает скорость почечного кровотока,
что вместе с некробиотическими изменениями эпителия канальцев является при¬
чиной олигоанурии, которая клинически проявляется нарушением гемодинамики
и поражением почек по типу острой циркуляторной нефропатии.
Тяжелая острая гемотрансфузионная реакция (ГТР), развивающаяся в течение
24 ч после трансфузии, сопровождается внутрисосудистым гемолизом, обуслов¬
ленным связыванием IgM-антител комплементом. Однако менее тяжелые ПР
могут сопровождаться внесосудистым гемолизом при наличии у реципиента
иммуноглобулинов класса G (анти-D, анти-К), у пациентов, сенсибилизирован¬
ных предыдущими гемотрансфузиями, или беременных. Частота появлении -
І среднем 1:25 ООО трансфузий. Отсроченная ГТР возникает через 3-5 сут после
трансфузии и является следствием анамнестических неточностей или возникает
как нторичный иммунный ответ у ранее сенсибилизированных пациентов. В даю
иом случае в претрансфузионных анализах антитела отсутствуют и реакция дав
ного типа происходит по механизму внесосудистого гемолиза. Частота ГТР такого
типа составляет приблизительно 1:2500 трансфузий.
Наиболее характерными симптомами острой и отсроченной ГТР являю
лихорадка и озноб. Гипотензия, рвота и диарея более свойственны острой р*
ции, а боли в груди и пояснице — отсроченной. При любом типе трансфузионн
реакции может возникать лейкоцитоз. Внутрисосудистый гемолиз при остро
г
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 831
-ддяетси симптомами гемоглобннемии и гемоглобинурии, которые при дан-
^°Т^тоятельствах являются патогномоничными (они могут появиться при ГТР.
^текакядей с внесосудистым гемолизом, если очень мощные антитела вызовут
путем активации цитотоксических реакций). Данные симптомы не шля-
^специфичными для отсроченной ГТР, при которой гемолиз в основном вне-
®даястый и характерным проявлением его является желтуха. ДВС и почечная
^«достаточность чаще наблюдаются при острой ГТР, но также могут встречаться
я* отсроченной, что иногда является причиной смертельного исхода. Такой
ынал наиболее вероятен для острой ГТР, сопровождающейся внутрисосудистым
гемолизом. Первыми симптомами ГТР могут быть гемоглобинурии и чрезмер-
де кровотечение при ДВС-синдроме. Биохимические тесты позволяют выявить
г<моглобинемию, повышение лактатдегидрогеназы, признаки почечной недо-
длочности и гипербилирубинемию. Понижение уровня гаптоглобина возможно
„мі обоих типах реакций, но более выражено при внутрисосудистом гемолизе.
Пораженный эндотелий и тромбоциты вырабатывают серотонин, гистамин,
цитокины, тромбоксан, эндотелии, лейкотриены, а разрушение стромы эритро¬
цитов приводит к выделению эритроцитина. Накопление данных медиаторов
приводит к активации внутреннего и внешнего механизмов свертывания крови.
Этому же способствует массивный выброс в кровеносное русло тканевого тромбо-
пластина. У пациента развиваются коагулопатия потребления (дефицит факторов
свертывания), тромбоцитопения, тромбоцитопатия. В дальнейшем происходит
лизис фибрина, фибрин-мономеров, фибриногена, развивается гипо- или афибри-
ногенемия, что характерно для фибринолиза. Резко возрастает содержание про¬
дуктов деградации фибрина (ПДФ), которые обладают ингибирующим действием
на свертывание крови. На фоне фибринолиза формируются рыхлые тромбы,
неспособные закрыть просвет пораженного сосуда, резко возрастает риск тяже¬
лых геморрагий.
Специфические иммуноглобулины, связываясь с клеточными рецепторами эри¬
троцитов донора, вызывают сладжирование и агглютинацию клеток крови. Это
является причиной развития ДВС-синдрома, сопровождающегося диссеминиро-
ваной микроэмболизацией, блокадой капиллярного русла, поражением органов-
мишеней и формированием полиорганной недостаточности. Однако в случаях
постгрансфузионного гемолитического осложнения в наибольшей степени наруша¬
ются функции почек и при несвоевременном лечении развивается острая почечная
недостаточность. Острая почечная недостаточность (ОПН) при гемолитических
посттрансфузионных осложнениях развивается вследствие:
• гипоксического поражения почек, канальцевого эпителия;
І блокады микроциркуляции:
• накопления в просвете канальцев почек дериватов свободного гемоглобина.
Иногда ГТР может быть результатом трансфузии не эритроцитов, а свежеза¬
мороженной плазмы или тромбоцитов. Трансфузия плазмы, при которой обыч¬
но 0 группу переливают реципиентам, имеющим А-, В- и АВ-антигены, может
вызвать гемолиз, если она содержит мощные антитела против А- и В-антигенов
эритроцитов реципиента. Гораздо реже может возникнуть несовместимость между
эритроцитами одного донора и плазмой другого, когда оба препарата переливают
одному реципиенту (внутридонорская несовместимость).
Характеристика аллоантител и их специфических детерминант крайне важна
при ГТР. Аллоантитела эритроцитов представлены в основном иммуноглобулина¬
ми класса G и в меньшей степени М. Антитела, относящиеся к иммуноглобулину
М, являются классической причиной острой ГТР, сопровождающейся вну-
фисосудистым гемолизом. Антитела, являющиеся иммуноглобулинами класса
’ ВЫзывают внесосудистый гемолиз, который может быть острым (если титр
Шр достаточен к моменту трансфузии) или отсроченным (в случае отсутствия
832
КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
антител при постановке предтрансфузионного теста их появление стим
трансфузией и определение возможно только через 5-8 сут после 1
эритроцитов). азРУЩецИя
Внутрнсосудистые гемолитические реакции, обусловленные анти-А
нами. анти-В-антигенами. анти-АВ-антигенами, анти-Ье-антигенами РРр Т[,Ге'
ютгя ГТР. опосредованными активацией системы комплемента по клаг л,‘
му пути. При этом образующиеся при иногруппном переливании
«антиген-антитело» приводят к гиперпродукции С1-С9-компонентов ком*^011
та и иммуноглобулина М, что клинически проявляется гемолизом.
Активация С1-С9 вызывает высвобождение анафилотоксинов СЗа и С5а
ственных за Проявление СИМПТОМОВ иммунного внутрисосудистого гемоли' °ТВЄТ'
и С5а активируют мононуклеарные фагоциты (моноциты, нейтрофилы) и 1Й
вождение из макрофагов и базофилов медиаторов, уже накопленных в их ilpS!
или вновь синтезируемых (гистамина, фактора активации тромбоцитов фім
ИЛ-1, -3, -4, -5, -6) (табл. 22-5). Кроме того, высвобождение тромбопласта
в результате гемолиза эритроцитов и активация комплемента запускают поо
свертывания по внешнему пути с последующим развитием ДВС-синдрома
Таблица 22-5. Участие цитокинов в гемолитических посттрансфузионных реакциях
Провоспалмтельные цитокины
Реакции і—I
Интерлейкин-1 (ИЛ-1)
Лихорадка, гипотензия, шок —
Фактор некроза опухоли-а (TNF-a)
Мобилизация лейкоцитов из костного мозга, активация І
Т- и В-лимфоцитов, индукция ИЛ-1, ИЛ-8, МСР и прокоагу¬
лянтов
Интерлейкин-6 (ИЛ-6)
Лихорадка, белки острой фазы, активация Т-
и В-лимфоцитов
Хемохины
Интерлейкин-8 (ИЛ-8)
Хемотаксис нейтрофилов, лимфоцитов, выброс гистамина
из базофилов
Monocyte Chemoattractant Protein-1 (МСР-1)
Хемотаксис моноцитов, отек легких, индукция ИЛ-1
Противовоспалительные цитокины
Антагонист ИЛИ-рецепторов
Ингибиция ИЛ-1 (типы 1 и 2)
Клиническая картина ГТР осложняется поражением других паренхиматознш
органов - легких, печени, эндокринных желез, что приводит к полиорганной дис¬
функции, а в дальнейшем и к недостаточности. Первостепенная роль в нарушении
функции этих органов принадлежит ДВС-синдрому, в пусковом моменте развития
которого ведущее место занимает процесс массивного поступления в кровоток
тканевого тромбопластина из разрушенных эритроцитов. Если не предпринять
экстренных реанимационных мер, гемотрансфузионный шок может привели
Я летальному исходу.
Четкой связи между степенью тяжести гемотрансфузионного шока, дозой
перелитой крови, скоростью ее введения и вероятностью летального исхода
не установлено. Полагают, что решающим фактором является состояние больного
в момент предшествующей гемотрансфузии. Следует отметить, что переливание
внутривенно струйно 50-75 мл крови, эритроцитной массы или плазмы во время
биологической пробы не может привести к летальному исходу.
По данным мировой статистики, большинство гемотрансфузий, несовместимых
по системе АВО I Rh. регистрируется в акушерско-гинекологических, хирургии
ских и реанимационных отделениях лечебных учреждений. В большинстве случ
ев эти осложнения наблюдаются при необходимости гемотрансфузий по экСТР
ным показаниям - шок, острая кровопотеря, обширные травмы, хирургичй
вмешательства и др.
Реактивные проявления и симптомы шока чаще всего отступают или |Ш‘
тельно выражены при несовместимой гемотрансфузии больным. находйЦ
ЛОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 833
наркозом или получающим гормональную, лучевую терапию, При гемотранс-
21 ии У такой категории больных необходимо ориентироваться на показатели
триального давления (гипотензию), ЧСС (тахикардию) и окраску кожного
!окрова лица и шеи.
Первые признаки гемотрансфузионного шока, вызванного переливанием боль-
оМУ крови, несовместимой по системе АВО, возникают в момент вливания
!л,40 мл крови. Реже развернутая реакция регистрируется в конце переливания,
отдельных случаях — через несколько дней.
2 При гемотрансфузиях очень внимательно следует относиться к субъективным
ощущениям и жалобам пациента: гипертермии, ухудшению самочувствия, стес-
нешво в груди, сердцебиению, ознобу, появлению ощущения жара во всем теле,
головной и абдоминальной боли, а также к сильно выраженной поясничной боли
/этот симптом считается патогномоничным для данного вида осложнения). Кроме
того, отмечают беспокойство больного, нарушение сознания, вплоть до его потери,
изменение окраски лица (покраснение, которое сменяется побледнением), в тяже¬
лых случаях — рвоту, непроизвольное мочеиспускание, дефекацию.
Из объективных ранних признаков наибольшее значение имеют повышение
температуры тела более чем на 1 °С исходного уровня, снижение артериального
давления (АД) и тахикардия.
В большинстве случаев при своевременном выявлении и прекращении про¬
цедуры гемотрансфузии через 1-2 ч все вышеописанные симптомы постепенно
стихают: АД нормализуется, боли уменьшаются, но еще некоторое время они
сохраняются в пояснице. Субъективно больной начинает чувствовать себя лучше.
Врач не должен обманываться этой положительной динамикой, так как обычно
через 3-4 ч состояние больного ухудшается: усиливается головная боль, повы¬
шается температура тела, возникает адинамия, появляется нарастающая желтуш-
ность склер, слизистых оболочек и кожного покрова. На первый план выступают
расстройства функций почек: резко снижается диурез, в анализе мочи - гематурия,
протеинурия и лейкоцитурия, вплоть до вида мясных помоев, или моча становит¬
ся бурой - гемоглобинурия. При отсутствии своевременной адекватной терапии
через 24-36 ч может развиться острая почечная недостаточность — олигоанурия
или полная анурия. Лечение пациента следует продолжать с использованием мето¬
да гемофильтрации в отделении гемодиализа.
При благоприятном течении, своевременном и адекватном лечении диурез вос¬
станавливается. Однако нередки случаи, когда, несмотря на все лечебные меро¬
приятия, острая почечная недостаточность на 2-3-й неделе может закончиться
легальным исходом.
Способность антител фиксировать комплемент определяется присутствием
на тяжелых цепях иммуноглобулина участка, взамодействующего с С1-молекулой
комплемента. Такой участок присутствует в антителах, относящихся к классу
иммуноглобулинов М и субклассам G1 и G3.
Несовместимость чаще всего проявляется гемолизом перелитых эритроцитов,
что является результатом сложных иммунобиохимических процессов с участием
антигенов, специфических к ним антител реципиента, компонентов комплемента,
пропердина и других плазменных факторов крови. Однако причиной внутрисосу¬
дистого гемолиза могут быть и антитела донора, содержащиеся в переливаемой
плазме (или цельной крови), которые разрушают эритроциты реципиента.
В ряде случаев гемолиз при переливании несовместимой крови не определяется
Фазу и носит отсроченный характер (например, при низком уровне антител и ком¬
понентов комплемента). Несовместимые эритроциты полностью поглощают анти¬
ка, но гемолиз отсутствует. Однако через несколько дней у таких больных может
проявиться развернутая картина гемолиза. Со временем у реципиента за счет
синтеза повышается уровень антител, затем они связываются с циркулирующими
Мф КГ^-ИіЕСМЯ ТРАНСФУЗИОЛОГИЯ
донорскими эритроцитами и разрушают их. Развивается поздний от™
гемолиз. сроче«Ц
гемолиз.
Способностью фиксировать комплемент обладают не только антите
иммуноглобулинов G. системы АВО, но и некоторые образцы анти-К^ ^
и ангк-Fv4. которые также могут вызывать внутрисосудистый гемолиз зд!!? ^
TOR РИТР0ЧЦ.
Несмотря на очевидную временную И причинно-следственную СВЯЗЬ гем
фузии и клинико-лабораторных проявлений ГТР, на ранних этапах диаго^'
необходимо дифференцировать реакции от патологий, имеющих сходную m”1181
ческую и лабораторную картину. ЛНііи
Дифференциальную диагностику при подозрении на острый внутрисосуди
гемолиз проводят со следующими заболеваниями: ’ ' ^
• аутоиммунными гемолитическими анемиями:
І криоглобулинемией;
• гемоглобинопатиями, серповидно-клеточной анемией:
• пароксизмальной ночной гемоглобинурией;
І дисфункцией искусственного клапана сердца:
ж микроангиопатическими гемолитическими анемиями;
І тромботической тромбоцитопенической пурпурой, HELLP-синдромом (гемо¬
лизом. повышением содержания печеночных ферментов, тромбоцитопенией)
• химическим или физическим гемолизом (лекарственным, вследствие пере
гревания. переохлаждения клеточных компонентов крови, нарушений усло¬
вий хранения или транспортировки компонентов крови, в связи с несо¬
вместимостью с растворами, трансфузией через тонкие иглы, применением
кровяных насосов):
І инфекционными заболеваниями — малярией, бабезиозом, болезнями, вызы¬
ваемыми Clostridium welchii.
Внесосудистый гемолиз
В результате несовместимой гемотрансфузии, при наличии у реципиента анти¬
тел, относящихся к иммуноглобулинам класса G, которые не обладают способно¬
стью фиксировать комплемент, может развиться внесосудистый гемолиз. При этом
в кровеносном русле происходит процесс адсорбции антител на несовместимы!
эритроцитах. Комплекс «антиген-антитело» распознается Fc-рецепторами клеток
ретикулоэндотелиальной системы (моноцитов/макрофагов), которые фагоцитиру¬
ют эритроциты, что приводит к внутритканевому гемолизу в селезенке и печени.
Типичным примером не связывающих комплемент антител являются иммуно¬
глобулины системы Rh (анти-Б-антитела, анти-Е-антитела, анти-е-антитела, аити-
С-антитела и анти-с-антитела). вовлекаемые в механизм внесосудистого гемолиза.
Внесосудистое разрушение несовместимых донорских эритроцитов могут
вызывать также некоторые IgG-антитела, не фиксирующие комплементы анти-S-
антитела, анти-К-антитела, анти-Еу*-антитела, а также анти-М-антитела, относя¬
щиеся к иммуноглобулинам класса М, неспособным фиксировать комплемент.
Интенсивность внесосудистого гемолиза зависит от объема перелитых несовме¬
стимых донорских эритроцитов, количества антигенных детерминант на эритро¬
цитах, концентрации антител у реципиента, активности макрофагов в связывании
комплекса «антиген-антитело».
Клинические проявления при внесосудистом гемолизе возникают через чае
или несколько часов после трансфузии и проявляются в виде анемии, иктеричн
сти склер и кожного покрова, увеличением размеров печени, селезенки, гиперо
лирубинемии. иногда гемоглобинурии.
Сравнительный анализ внутри- и внесосудистого разрушения эритроцитов яр*
веден в табл. 22-6.
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИЙ 835
рбдицй 22-4 Сравнительный анализ внутри- и в не сосудистого гемолиза
показатель
Внесосудистый гемолиз
Внутрисосудисшй гекояиз і
'^миой класс иммуноглобулинов
IgG
IflM
Иі^ігвньї эритроцитов
Rh. MNSs. К. Jk, Fy
АВО. P, 1
(давмзм поражения эритроцитов
Фагоцитоз
Гемолиз, опосредованный 1
комплементом
ьмп разрушения эритроцитов
Селезенка
Кровеносное русло
цягиостика
прямой АГТ
IgG И
С3(+)
НвпрЯМОЙ АГТ
IgG (+)
IgG (-)
гемолитические кризы при охлаждении
♦
Печение
Глнжокортикоиды, фолиевая кислота
иимунодепрессанты
+
иммуноглобулин в/в
+
Плазмаферез
+
- ♦
Профилактика несовместимых гемотрансфузий основана на соблюдении пра¬
вил определения групповой и Rh-принадлежности крови, проведения проб
на индивидуальную совместимость, техники переливания крови.
Отсроченные трансфузионные гемолитические реакции
Клинические проявления отсроченных трансфузионных гемолитических реак¬
ций (ОТГР) отмечаются на 5-8-е сутки после трансфузии, хотя описаны единичные
случаи начала разрушения эритроцитов через 30 сут. ОТГР возникают у рециииен
тов, сенсибилизированных предшествующими трансфузиями или беременностью.
Сенсибилизация к антигенам эритроцитов приводит к длительному существова¬
нию лимфоцитов памяти. Титр антител после антигенной стимуляции со временем
может снижаться до недетектируемого уровня, но после последующей трансфу¬
зии антигены эритроцитов стимулируют быстрый вторичный иммунный ответ
и выработку антител.
Через несколько дней, реже недель, концентрация антител в крови реципиента
повышается, молекулы антител связываются с соответствующими антигенами
циркулирующих эритроцитов донора, вызывая внутри- или внесосудистый гемо¬
лиз. Интенсивность разрушения эритроцитов пропорциональна нарастающей кон¬
центрации антител и зависит от количества перелитых донорских эритроцитов,
ОТГР могут быть вызваны антителами различной специфичности (анти-Е, -С,
•с,-e. -К, -M, -S,- Fy®, -Jka, -Jkb), чаще встречаются у женщин из-за их большей
предрасположенности к аллоиммунизации.
ОТГР встречаются редко и плохо распознаются из-за значительного временно¬
го разрыва причинно-следственной связи.
Клиническая картина обусловлена механизмом разрушения эритроцитов
внутри- или внесосудистым (табл. 22-7).
В редких случаях ОТГР могут быть обусловлены наличием у реципиента
эритроцитсодержащих сред антител к HLA-антигенам. Е.А. Зотиков и А.А. Раги-
нов (1979) наблюдали больную, у которой после переливания крови, подо¬
бранной в непрямой реакции Кумбса, возникла реакция гемолитического типа.
Сыворотка больной обладала значительной лимфоцитотоксической активно¬
стью и агглютинировала донорские эритроциты, обработанные 0,1% раствором
бромелина. Авторы пришли к заключению, что гемолитическая реакция была
вызвана лимфоциттоксическими антителами при их взаимодействии с перели¬
вам эритроцитами.
от КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Мшщв22-1. Клинические проявления внутри- (1) и внесосудистого (2) гемолиза
Г
Клинические СИМПТОМЫ
ftanpun (иной
Тошнота, рига
іояь 1 грудной клетке, поясничной области
Диспноэ
| Гипотензия, тахикардия
I Гипербилирубинемия
I Осложнения: острая почечная недостаточность
ДВС-синдром
ЛЛ. Головкина и соавт. (1998) также описали случаи возникновения
внутрисосудистого гемолиза после переливания эритромассы у гинекологически
ОСГРОР0
больных (осложненная миома, экстирпация матки). Поскольку при исследован^
сывороток в непрямой пробе Кумбса и реакции солевой агглютинации антиэв
троцитарные антитела к системе Rh, Kell, Duffy, MNSs не выявлялись и прям!
проба Кумбса также была отрицательной, был сделан вывод, что причиной осло»
нений гемолитического типа явились лимфоцитотоксические антитела, которые
были обнаружены в титре 1:32-1:64.
Лабораторная диагностика посттрансфузионных гемолитических реакций
При ПГТР для диагностики в лабораторию одновременно с актом о наступив¬
шей реакции должны быть направлены остатки гемокомпонента, при трансфузии
которого была отмечена реакция, и образец крови реципиента. В акте, подпи¬
санном врачом, проводившим трансфузию, указывают фамилию, имя и отчество
реципиента, номер истории болезни, группу крови и Rh-принадлежность, отме¬
ченные в истории болезни, и прилагают подробное описание признаков развита
ПГТР.
Лабораторный анализ ПГТР может быть затруднен из-за отсутствия достаточ¬
ного количества материала для исследования образца крови, взятого у реципи¬
ента до трансфузии. Таким образом, необходимо сохранять от каждого больного
образцы крови в количестве, достаточном для определения фенотипа эритроцитов
и специфичности антител, в случаях возникновения ПГТР. Исследование образцов
крови, взятой после трансфузии, не является информативным в связи с одно-
временным присутствием в нем донорских эритроцитов, но оно необходимо
для сравнения некоторых параметров, в частности уровня аллоантител до и после
трансфузии.
При выяснении причин ПГТР в лаборатории следует придерживаться опреде¬
ленного алгоритма.
1. Перепроверить группу крови и Rh-принадлежность реципиента в образив
крови, взятом до трансфузии.
2. Перепроверить группу крови и Rh-принадлежность крови донора в контеи
нере.
3. Провести пробу на индивидуальную совместимость эритроцитов донор*
и сыворотки реципиента, взятой до трансфузии, используя наиболее чУвствИ^ы
ный АГТ и для сравнения тот метод, который применялся для постановки пр
на совместимость до трансфузии. й(!!
4. Провести исследование антител по отношению к антигенам
эритроцитов в сыворотке реципиента, взятой до и после трансфузии, g
с тем что при ПГТР аллоантитела адсорбируются на несовместимых эритро
возможно снижение уровня антител в сыворотке образца крови, взятой
трансфузии.
П0СТТРАНСФУЗИ0ННЫЕ РЕАКЦИИ 837
с установить активность антител путем титрования сыворотки реципиента
.^роцитами донора теми же методами, которыми эти антитела были выявлены.
ПОЙ отсутствии эритроцитов данного донора титр устанавливают с помощью стан¬
иной 3-клеточной панели эритроцитов.
Кровь реципиента, взятую до и после трансфузии, следует исследовать
„аличие адсорбированных антител на эритроцитах в прямом антиглобулино-
1* тесте (ПАТ). Отрицательная реакция с образцом крови, взятой до трансфузии,
положительный ПАТ с образцом крови, взятой после трансфузии, свидетель-
jLyflT об адсорбции антител на несовместимых эритроцитах донора и иммуноло¬
гическом конфликте.
7. Для выяснения специфичности аллоантигена, вызвавшего несовместимость,
необходимо провести типирование крови донора и реципиента. Выявление несо¬
ответствия антигенного профиля эритроцитов донора и реципиента позволит
целенаправленно вести поиск аллоантител в крови реципиента, явившихся при¬
чиной ПГГР.
8. Определить специфичность аллоантител при исследовании с помощью пане¬
ли типированных эритроцитов.
При диагностике ПГТР, связанных с несовместимостью по эритроцитным
антигенам, необходимо исследовать титр антител в динамике. В первые дни после
трансфузии титр обычно невысок, к концу первой недели активность антител воз¬
растает и достигает максимума на 10-20-е сутки. В дальнейшем титр довольно
быстро снижается. Такая динамика активности аллоиммунных антител в крови
реципиента является точными признаком их участия в данных ПГТР.
В некоторых случаях посттрансфузионных реакций при значительном объеме
перелитой крови аллоантитела, обусловившие конфликт, могут не обнаруживать¬
ся, что связано с их абсорбцией донорскими эритроцитами. Через 2-4 сут после
трансфузии антитела начинают выявляться с типичным достижением максималь¬
ного титра на 10-20-е сутки и последующим постепенным его снижением.
Присутствие каких-либо антител в крови реципиента с ПГТР без изменения
их активности свидетельствует, как правило, об их непричастности к данной
реакции.
В ряде случаев антитела в сыворотке реципиента не удается детектировать
вследствие феномена зоны, который наблюдается при высокой сенсибилизации.
Для выявления антител необходимо исследовать сыворотку реципиента в разведе¬
нии. При феномене зоны специфические антитела оказывают гемоагглютинирую¬
щее действие в разведениях 1:2-1:32.
Исследования, проведенные в данном алгоритме, позволяют не только устано¬
вить причину ПГТР, но и в случае необходимости дальнейшей гемотерапии подо¬
брать совместимую с антителами реципиента эритроцитсодержащую среду.
В диагностике ПГТР, помимо изосерологических методов исследований, необ¬
ходимо проводить мониторинг клинических лабораторных исследований. Наибо¬
лее ранним, достоверным и доступным методом исследования являются выявление
и определение степени гемоглобинемии и гемоглобинурии. Исследование содер¬
жания свободного гемоглобина в крови пациента в динамике позволяет оценивать
течение ПГТР и контролировать адекватность, эффективность проводимой тера¬
пии- В диагностике постгеморрагической гемолитической реакции важную роль
играют изменения биохимических показателей крови больных: характерно уве¬
личение содержания лактатдегидрогеназы, общего билирубина (преимуществен-
110 33 счет прямого билирубина), снижение уровня гаптоглобина. Для тяжелого
течения ПГТР, особенно сопровождающихся осложнениями (острой почечной
недостаточностью, полиорганной недостаточностью), характерны гиперфермек-
темия, увеличение содержания аспартиламинотрансферазы (ACT), аланиламино-
трансферазы (AJ1T), гамма-глутамилтрансферазы (ГГТ), креатинфосфокиназы.
ГЛАВА 72
ИИ сТИНМЧЕСХАЯ ТРЖ/СФУЗИОЛОГИЯ
—nnnrmT- продуктов белкового метаболизма (мочевины, креатини»
ЭТИХ изменений, выявляется постгемолитическая анемия, характерный
тромбоцитопения. нарушение функциональной сохранности тромбоцито 03
боцитолатия Если инофуппное переливание проведено во время опеп ' Тр°н'
водимой на фоне общей анестезии, когда субъективные симптомы wwnw?®'
■«пмп ii in nauuuuH плтияхями
основными ранними признаками ПГТР становятся гипотензия, тахикап pH.
можно появление признаков диффузного кровотечения из операционн “Я’ ®°3'
слизистых оболочек, мест установки катетеров, меняется цвет мочи (Вы°И Ра.йЦ
гемоглобинурия). Вышеуказанные симптомы соответствуют картине'геи1^^
фгаюнного шока и ДВС-синдрома в стадии гипокоагуляции, часто nrnnw, °Tpai,c'
фузионного шока и ДВС-синдрома в стадии гипокоагуляции, часто ослоящ Ш
ПГТР. Ранней диагностике ДВС-синдрома способствуют исследования свет^0
mHI гкггрмм: хаоактеоны снижение солеожания (Ьибоинпгрня
щей системы: характерны снижение содержания фибриногена, антитромб
тромбоцитопения. удлинение активированного частичного тромбопластнИНЭ ^
времени (АЧТВ), увеличение содержания D-димеров фибриногена п!і!І!?80Го
' г°дуктоц
деградации фибриногена.
Терапия гемолитических посттрансфузионных реакций
В случаях достоверного выявления ПГТР пациенты нуждаются в тщательн
клинико-лабораторном мониторинге. При минимальной клинической сиадгт!
матике лечение пациентов и контроль лабораторных показателей, объема т
реза осуществляют в условиях отделения, в котором проведена гемотрансфиГ
приведшая к постгрансфузионной реакции. Однако выраженная клиническая
картина, сопровождающаяся гемодинамическими нарушениями, серьезными
изменениями лабораторных показателей и тем более развитием полиорганной
дисфункции/недостаточности, является показанием для перевода пациентов
в отделение реанимации. При этом основными направлениями лечебной тактики
являются поддержание ОЦК; профилактика и лечение острой почечной недоста¬
точности, при необходимости заместительно-почечная терапия и другие методы
экстракорпоральной детоксикации; терапия ДВС-синдрома, достаточно часто
осложняющего течение острых гемолитических посттрансфузионных реакций.
В целях восполнения ОЦК применяют различные варианты инфузионной
терапии с использованием кристаллоидных, коллоидных препаратов, растворов
альбумина (5%. 10%, 20%). В условиях олигурии необходимо четко учитывать
объемы инфузируемой жидкости, диуреза, контролировать ЦВД во избежание
циркуляторной перегрузки и гипергидратации пациентов. На ранних этапах лече¬
ния ГПТР до выявления причин гемолиза целесообразно применение растворов
газодинамического действия, позволяющих поддерживать ОЦК, артериальное
давление в физиологических параметрах. В дальнейшем потребуется трансфузия
компонентов донорской крови, поскольку ГПТР обязательно сопровождаются
гемолитической анемией в той или иной степени выраженности. Инфузионную
заместительную терапию препаратами донорской крови проводят только после
обязательного повторного определения групповой и Rh-принадлежности крови
пациента специалистами лаборатории изосерологических исследовании, |Р-
тельно после индивидуального подбора свежезаготовленной (до 5 сут хране¬
ния) донорской делейкотизированной эритроцитной массы (ЭМ фильтровали
ЭМОЛТ, отмытые эритроциты).
Гемодинамические последствия посттрансфузионного шока требуют ра
интенсивного лечения гипотензии. Препараты вазопрессорного действия по
вюжности применяют в низких, так называемых почечных, дозировках I
препарата в расчете на допамин составляет 1-3 мкг/кг в минуту). п0СК ^
рефлекторный длительный спазм почечных артериол, РазвиваюшиисяВЬІс0Кія
м гемолитическую реакцию, усугубляется воздействием кардиотоников в
Яшж $ настоящее время установлено, что основной причиной острой
T
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 839
-^точности, развивающейся в 33% инофуппных переливаний крови, служит
Ильная вазоконстрикция почечных артерий, результатом которой являются
і'!гкение кровоснабжаемости органа, ишемия и в итоге некроз корковых и пол¬
ных слоев почек.
Для успешного лечения гемолитического осложнения необходима экстракор-
J^bHa» детоксикация, целью которой является купирование ДВС-синдрома
^ндотоксемии. Эндотоксемия, которая развивается вследствие значительного
1 имения содержания в крови билирубина, желчных кислот, продуктов мета-
Ишізма белков (мочевины, креатинина, мочевой кислоты и др.). довершает кли-
^скую картину гемолитического шока. Смертность в случаях тяжелых гемоли¬
тических осложнений достигает 40-60%. Обменный плазмаферез в ранние сроки
клинических проявлений позволяет предупредить полиорганные нарушения,
оскольку он оказывает положительное влияние на все звенья патологического
цесса: во время процедуры из циркуляции удаляются продукты гемолиза, сво¬
бодный гемоглобин, строма разрушенных клеток, ПДФ, медиаторы воспаления,
иммунные комплексы, микроагрегаты клеток крови. Кроме того, плазмаферез
улучшает микроциркуляцию и реологию крови пациента.
Одним из условий эффективности обменного плазмафереза является адекват¬
ное плазмозамещение, которое позволяет быстро восполнить дефицит факторов
свертывания и естественных антикоагулянтов. Кроме того, при выраженном дефи¬
ците антитромбина III в целях коррекции его содержания применяют препараты
концентрата антитромбина III в дозе 1500-2000 ЕД в первые сутки лечения.
Выраженность терапевтического эффекта плазмафереза напрямую зависит от
объема эксфузии плазмы, который определяется исходным уровнем свободного
гемоглобина в плазме: детоксикация достигается при больших и сверхбольших
объемах [>1,5-2 объемов циркулирующей плазмы (ОЦП) за процедуру) плазмо¬
обмена. Установлено, что при исходном уровне свободного гемоглобина менее
1000 мг% в большинстве случаев достаточно удаления одного ОЦП. Содержание
свободного гемоглобина в плазме свыше 2000 мг% является показанием для уда¬
ления 2 ОЦП и более (Рагимов А.А., Порешина С.А., Салимов Э.Л.. 2008).
В случаях прогрессирования почечной недостаточности показано раннее при¬
менение почечно-заместительной терапии - гемодиализа, гемофильтрации и гемо¬
диаультрафильтрации. Методы почечно-заместительной терапии позволяют не
только провести коррекцию нарушений водно-электролитного баланса, но и эли¬
минировать из циркуляции низко- и среднемолекулярные олигопептиды, фермен¬
ты, билирубин.
Трансфузии эритроцитной массы необходимы для коррекции постгемолитиче-
ской анемии. В целях повышения эффективности и безопасности гемотрансфузий
в период осложнения необходимо фенотипирование эритроцитов реципиента
и донора. При тромбоцитопении, геморрагическом синдроме показаны трансфу¬
зии тромбоконцентрата в терапевтической дозе (6-8 ЕД ТК), а также криопреци¬
питата.
Поскольку ГПТР являются реакциями иммунного генеза, патогенетически
оправданно применение глюкокортикоидов в высоких дозах: в расчете на раствор
чреднизолона одномоментно внутривенно болюсно вводят 3-5 мг/кг массы тела;
Точная доза преднизолона может составлять 2000-2500 мг, т.е., по сути, прово¬
дится пульс-терапия глюкокортикоидами по схеме, применяемой для медикамен¬
тозной иммуносупрессии.
Важным элементом комплексной терапии ГПТР является форсированный
мУРез препаратами солевых диуретиков [внутривенное введение 20% раствора
ианнитола (маннита*) в дозе 0,5 мг/кг массы тела], а также салуретиков [внутри-
В®ВД болюсно фуросемид (лазикс*) в дозе 4-6 мг/кг массы тела]. При сохране-
щ Диуреза с темпом мочевыделения более 1 мл/кг в час внутривенно капельно
гг мим
де клиническая ТРЛНСФУЗИОЛОГИЯ
Вводят 250 мг фуросемида с разведением в 400-600 мл 40% раствора
Яра положительной реакции на форсирование диуреза, увеличении тем^0^
отделения до 100 мл/ч проводят дальнейшую стимуляцию диуреза до раз!!?0*'
проявлений гемоглобинурии и гемоглобинемии. При ЭТОМ НЄ0бХ0ДИмЄШйіі,«
троль жидкостного баланса и электролитного состава крови, восполнен!? *°н'
инфузионнычи полиионными препаратами в целях профилактики гипово ^
я электролитных нарушений. Кроме того, необходимо осуществлять коЛЄІ<І11І
I коррекцию КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ внутривенным введением Раст?°Лк
натрия гндрокарбоната (натрия бикарбоната*), трометамола (TpHcaMHHa*)T*0!)0'1
ходимо также определять кислотность мочи; pH мочи рекомендуют поддеп*^
на уровне более 7,5. 8911
Отсроченные гемолитические реакции имеют менее выраженные клиничн*.
в лабораторные проявления, прогноз более благоприятный по сравнению с ост
ми реакциями. Однако встречаются выраженные отсроченные реакции, развивЫ
щиеся в основном у пациентов с тяжелой сопутствующей патологией. Прово *
еиюггоматическуй терапию: стимуляцию диуреза на фоне Дезинтоксикационю-
инфузионной терапии, при необходимости назначают трансфузии донорской эк* і
троцитной массы, подобранной индивидуально. Тяжелое течение реакции пред! I
лагает комплексную терапию, применяемую для лечения острой ГПТР.
НЕГЕМОЛИТИЧЕСКИЕ П0СТТРАНСФУЗИ0ННЫЕ РЕАКЦИИ
Реакции, обусловленные антилейхоцитными антителами
Они вызваны наличием в плазме реципиента цитотоксических или агглюти¬
нирующих антител, реагирующих с антигенами, фиксированными на мембрана
переливаемых лимфоцитов, гранулоцитов, тромбоцитов. К ним относят:
• фебрильную негемолитическую посттрансфузионную реакцию (ФНГПТР); I
і синдром острого посттрансфузионного поражения легких (СОППЛ).
Фебрильные негемолитические посттрансфузионные реакции являются I
частыми осложнениями при переливаниях компонентов крови, относятся к реак |
циям острого посттрансфузионного периода иммунного генеза.
Сенсибилизация пациента возможна во время предшествующих гемотрансфу- |
зий или беременностей. В 70% случаев они обусловлены присутствием у боль- I
ных предшествующих антилейкоцитных (анти-HLA, анти-NA-NB) и анти-НРА-
антител (в 30% - инфекционными агентами). У пациентов с антилейкоцитньми
антителами частота возникновения фебрильных реакций после переливаний тром¬
боцитов может достигать 93%, причем температурные реакции тяжелой степени
чаще наблюдают у пациентов с антигранулоцитотоксическими антителами, чему
больных с анти-HLA антителами.
Иммунологическая диагностика заключается в выявлении иммунных анти¬
тел, направленных к антигенам лейкоцитов, тромбоцитов или белков плазмы
Для профилактики негемолитических реакций в целях планирования тактики
трансфузий важное значение имеет тщательный сбор анамнестических данньи
наличие и количество предыдущих гемотрансфузий, у женщин - присутствие
в анамнезе родов, беременностей, абортов. Лабораторная диагностика - выяви
ние иммунных антител - не всегда бывает успешной. /
Механизм развития фебрильных реакций следующий: при взаимодеисл
антител с соответствующими антигенами происходят активация комплеме^, |
разрушение клеток-мишеней и высвобождение таких эндогенных пирок
как интерлейкин-1, интерферон, фактор некроза опухоли-а, a в последнее вр
стали накапливаться сведения о значительной роли интерлейкина-6 и интер ,
юта-8. Более того, разрушение донорских клеток способствует выделению
тивных белков фагоцитирующими клетками. Пирогены стимулируют вырз
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИЙ 841
тагландинов в гипоталамусе, в результате чего повышается температура тела
"WbHoro-
* Основными клиническими проявлениями ФНГПТР являются повышение тем
jypbi тела более чем на 1 °С исходного уровня, озноб, миалгии. боль в груд¬
ей клетке. поясничной области, тошнота, рвота, возможно изменение состояния
иания. При появлении вышеуказанных симптомов, связанных с гемотранс*
чией. необходима лабораторная диагностика, направленная на исключение
Политической реакции, поскольку начальная, субъективная симптоматика этих
[Іакций сходна.
* Частоте возникновения ФНГПТР зависит от ряда факторов.
, Тип вводимого гемокомпонента. При переливании эритроцитной массы
частота ФНГПТР составляет 0,5-1,0% всех трансфузий эритроцитной массы,
при этом число реакции существенно возрастает (до 6%) при трансфузиях
у онкологических больных и еще более существенно (до 12%) в педиатрии.
ФНГПТР развивается во время 11,4-37,5% всех трансфузий тромбокон-
центрата (из них тяжелые реакции составляют до 8.6% общего количества
ФНГПТР).
§ установлено, что частота возникновения ФНГПТР значительно выше
при трансфузиях ТК, чем при переливании ЭМ, несмотря на тот факт,
что абсолютное количество лейкоцитов одинаково в переливаемых компо¬
нентах. При трансфузиях тромбоцитов среди 20% реципиентов, перенесших
ФНГПТР, у 55% первая реакция развилась во время первых трех процедур.
При изучении этих случаев стало ясно, что срок хранения компонентов крови
является важным фактором в возникновении ФНГПТР, обусловленной нако¬
плением биологически активных веществ в компонентах во время хранения.
І Срок хранения, количество лейкоцитов в гемокомпоненте. Выявлена
очевидная корреляционная зависимость между уровнем цитокинов. содер¬
жанием лейкоцитов и сроком хранения препарата. Цитокины накапливаются
при температуре хранения +22...-4 °С. Предварительное удаление лейкоцитов
из препарата предупреждает накопление цитокинов при хранении и сопрово¬
ждается значительным снижением частоты возникновения ФНГТР.
j Предтрансфузионное состояние больного (в меньшей степени). Возни¬
кновение ФНГПТР возможно при первых трансфузиях тромбоконцентрата,
что означает отсутствие предварительной сенсибилизации реципиента к лей¬
коцитам. Увеличение концентрации цитокинов, как эндогенных, так и экзо¬
генных, является опасным для реципиента, вызывая активацию эндогенных
пирогенов. Такие цитокины, как ИЛ-1р, ИЛ-8 и ФНО-а, активно синтезиру¬
ются и высвобождаются при хранении тромбоцитов и эритроцитов. Эффекты
ИЛ-1 обусловлены собственной пирогенной активностью и/или опосредо¬
ванной ИЛ-6- или простагландин E-2-стимуляцией гемопоэза и активаци¬
ей нейтрофилов и тромбоцитов. ФНО-а также является мощным пироге¬
ном, усиливающим пролиферацию В-клеток и активирующим коагуляцию
по внешнему пути через тканевый фактор. ИЛ-6 усиливает реакцию антител
и стимулирует пролиферацию и дифференцировку В-клеток. ИЛ-8 является
хемотаксическим фактором для нейтрофилов и Т-клеток, стимулирую¬
щим выделение окислительных ферментов нейтрофилами и высвобождение
гистамина базофилами (табл. 22-8).
Кроме того, установлено, что при соприкосновении плазмы донорской крови
с пластиковой поверхностью гемоконтейнера возможна активация комплемента
чо альтернативному пути. Активированный СЗ-компонент комплемента обладает
божественными патофизиологическими эффектами: поддерживает высвобож-
гистамина макрофагами, является вазодилататором, повышающим микро-
СосУдиетую проницаемость, также увеличивает in vitro агрегацию тромбоцитов
IU КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИИ
Tift—Ч» 22-8. Роль цитокинов* в реализации фебрильных негемолитических
ных реакций
nocTTpath%%
[йнщичйкин-тр
I Интврпеймж-б
Фшоо некооза опухоли-а
Цитокины
Пироген, вызывает rt
Пироген
Активирует нейтрофі
Пироген, вызывает п
цитаыи реципиента во время гемотрансфузии.
и высвобождение серотонина и брадикинина, что вызывает венозную вазодила
тацию, снижение давления, увеличение сосудистой проницаемости, спазм гладкой
мускулатуры, активацию фосфолипазы-А2 и усиление метаболизма арахидоновой
кислоты. Таким образом, активация комплемента может стимулировать моноцищ
в концентрате тромбоцитов к продуцированию цитокинов, что усугубляет харак¬
терные симптомы ФНГПТР. Некоторые из современных лейкоцитных фильтров
способны поглощать СЗа из концентрата тромбоцитов и могут быть использованы
для профилактики возникновения ФНГПТР.
Из вышесказанного становится очевидным, что основными методами про¬
филактики этой реакции являются редукция лейкоцитов в гемокомпоненга
(применение лейкофильтров, отмытых эритроцитов, ЭМОЛТ) и применение
компонентов незначительных сроков хранения для пациентов, входящих в группу
риска. В онкологии, гематологии, педиатрии применение делейкотизированнщ
препаратов крови обязательно. Лейкоредукция обязательна при лечении:
І талассемии major,
• апластической анемии:
І серповидно-клеточной анемии:
• лейкемии;
і рефрактерности к переливаемым донорским тромбоцитам:
І пациентов, которые были инфицированы предшествующими гемотрансфу¬
зиями;
• больных, ожидающих трансплантацию органов или тканей.
Также лейкоредукция показана при массивной и хронической гемотрансфузии.
В ряде случаев, особенно при плановой гемотрансфузии, действенным мето¬
дом профилактики ФНГПТР может стать премедикация. Назначение пациентам
с отягощенным аллергологическим, трансфузионным анамнезом, а также лицам,
попадающим в группу риска, антигистаминных препаратов, глюкокортиконР
накануне или во время плановой гемотрансфузии позволяет существенно снизить
частоту этой реакции.
Синдром острого посттрансфузионного поражения легких - острая
легочная недостаточность, связанная с трансфузией (синдром TRALI - TransfuM>n'
Related Acute Lung Injury), - наиболее частая причина посттрансфузионной леталь¬
ности в развитых странах. TRALI-синдром характеризуется как острая респира¬
торная недостаточность, гипоксемия, гипотензия и отек легких, развивающий*
в течение 6 ч (как правило, 1-2 ч) после трансфузий любых компонентов донор¬
ской крови. У 80% пациентов состояние улучшается и стабилизируется в течени
96 ч. Летальный исход наступает в 6-23% случаев.
TRALI-синдром может развиться после трансфузий всех компонентов и пре
паратов крови (за исключением альбумина), но чаще всего после переливай
эритроцитов, тромбоцитов и СЗП. Факторы, обусловливающие TRALI-CHHflpc*’
ЛО недавнего ВПРМРНИ ПГТЯВЯПИГІ. IIPRUOrupiMii iMU огпдпгтимр ТОГО. ЧТО 04
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 843
Й легочной недостаточности, а также из-за отсутствия специфических диа-
0<^йческих маркеров TRALI-синдрома. В настоящее время с большой степе-
* вероятности установлено, что причиной, обусловливающей возникновение
Сі-синдрома, являются анти-HLA и HNA-антитела у доноров и реципиентов,
того, существенную роль в патогенезе СОППЛ отводят цитокинам провос-
KaV№Horo пула" ил'1, ил'6, ил'8, ФН0'а-
Рис. 22-3. Патогенез синдрома острого посттрансфузионного поражения легких
СОППЛ относится к реакциям острого посттрансфузионного периода и прояв¬
ляется острой дыхательной недостаточностью, отеком легких во время гемотранс¬
фузии или в ближайшие 6 ч после нее. В работах недавнего времени для обозначе¬
ния подобных посттрансфузионных реакций применяли термин «некардиогенный
отек легких», который характеризовал причину интерстициального, альвеоляр¬
ного отека легких как причину, не связанную с патологией сердца (рис. 22-3).
Клинические проявления сходны с таковыми острого респираторного дистресс-
синдрома (ARDS). К ранним признакам СОППЛ относятся диспноэ, цианоз, тяже¬
лая гипоксемия (ра02: Fi02 <300 мм рт.ст.), тахикардия, лихорадка (повышение
температуры тела на 1-2 °С исходного уровня), возможна гипотензия. Иногда
выявляется транзиторная лейкопения, длящаяся менее 24 ч. Характерны измене-
ния на рентгенограмме легких в виде двусторонней симметричной инфильтрации
легких по типу интерстициального или альвеолярного отека.
Одним из ключевых диагностических критериев кардиогенного и некардиоген-
иого отека легких является изменение показателя давления заклинивания легоч-
н°и артерии: ДЗЛА менее 18 мм рт.ст. свидетельствует о некардиогенной причине
^екз легких.
Основными отличительными признаками острого посттрансфузионного пора-
*ения легких от ARDS являются:
Ці омигсодо ТРАНСФУЗИОЛОГИЯ
• ЦВД яри постгрансфузионной реакции, которое остается в пределах
ммышх показателей;
• характерно быстрое разрешение клинических проявлений СОППЛ ~ ■
мне 48-% ч полный регресс симптоматики отмечается у 80% больны*
ность составляет 20%, тогда как при ARDS прогноз существенно cepto*
я смертность составляет 40-50%;
• разрешение клинических проявлений отека легких на фоне респиратоим
поддержки (ингаляции 02, ИВЛ).
Вследствие СХОДНОЙ С другими СОСТОЯНИЯМИ клинической симптоматики нео(
ходима дифференциальная диагностика СОППЛ со следующими патологиями-
• аллергическими, анафилактоидными реакциями, для которых «е
характерны отек легких, лихорадка. Дыхательная недостаточность m*
аллергических, анафилактоидных реакциях, как правило, сопровождается
ларинго- или бронхоспазмом, характерны кожные аллергические проявле*
имя (эритема, крапивница), возможна гипотензия, вплоть до шока;
І бактериальной контаминацией. Трансфузия бактериально контаминиро-
ванных компонентов донорской или аутологичной крови быстро, в течение
нескольких часов, может привести к полиорганной недостаточности, ДВС
синдрому на фоне выраженных клинических проявлений септического шока,
для которого характерны гипотензия, сосудистая недостаточность, фебрили-
тет, выраженная интоксикация;
• циркуляторной перегрузкой, ассоциированной с гемотрансфузией.
Для данного вида посттрансфузионной реакции характерны появление
тахипноэ. цианоза на фоне тахикардии, систолической гипертензии и повы¬
шение ЦВД.
Аллергические реакции
Аллергические реакции различной степени выраженности отмечаются в 3-5%
случаев гемотрансфузий. Как правило, их регистрируют у больных, сенсибилизи¬
рованных предшествующими гемотрансфузиями или у женщин, имевших в анам¬
незе повторные беременности с антителами к антигенам плазменных белков,
лейкоцитов, тромбоцитов и даже иммуноглобулинам.
Иммунологические проявления сенсибилизации к белкам плазмы при гемо¬
трансфузиях часто протекают в виде аллергических реакций, проявляющихся
в основном уртикарными высыпаниями. Риск подобных реакций довольно высок
(1:1000 трансфузий), особенно при переливании свежезамороженной плазмы*
других трансфузионных сред с высоким содержанием плазмы и плазменных бы¬
ков (криопреципитата, тромбо- и лейковзвеси).
Аллергическими реакциями сопровождается 3-5% гемотрансфузий у пациен¬
тов, сенсибилизированных предшествующими гемотрансфузиями, у многорожи-
юих женщин, а также у пациентов с дефицитом иммуноглобулина А.
Среди основных причин аллергических посттрансфузионных реакций выделяет.
• наличие спонтанных антител к антигенам плазменных белков (альбумин)
гаптоглобину, трансферрину, а-1*антитрипсину);
і повышенное содержание анафилотоксинов СЗа, С5а в аллогенной крови,
• трансфузию аллергенов, которыми пациент был ранее сенсибилизирован
(к лекарственным препаратам, а также к средствам, которые используют^
для стерилизации гемоконтейнеров — формальдегиду, оксиду этилена),
• пассивную трансфузию антител донора класса иммуноглобулинов Е, синтез»*
рованных после приема донором лекарственных, пищевых продуктов
• криогяобулинемию у реципиента.
У части больных аллергические реакции наблюдаются уже при первом 0*г
дивании гем*(компонентов и не связаны с предшествующей изосенсибидизаДО
посттрансфузионные рсакции М5
пазагают. что в таких случаях эти реакции обусловлены спонтанными антителами Я
^„ужи'лобулинам и ответом иммуноглобулинов класса Е тучных клеток реци-
йЯЯ3 на перелитый специфический антиген донора, который часто ассоциирован
^^боцитами или плазменными белками.
Аллергические реакции могут возникать как во время переливания крови или ее
.депонентов, так и отсроченно, спустя 1 -2 ч после окончания процедуры.
Характерные признаки аллергической посттрансфузионной реакции адлер-
гичеекая сыпь, крапивница, эритема, ангноневротический отек, сопровождаемые
*аом боли в суставах. При более тяжелом течении реакции озноб, головные
^ли. лихорадка, миалгии, боль в грудной клетке, диарея. Следует иметь в виду.
«о аллергическая реакция может протекать с симптомами анафилактическою
характера - диспноэ, тахипноэ, цианозом, респираторными нарушениями - стрн-
лорозным дыханием, ларингеальным отеком, бронхоспазмом, снижением оксиге¬
нации крови и выраженной гипотензией, вплоть до шока.
При возникновении вышеуказанных жалоб в раннем посттрансфузионном пе¬
риоде необходима дифференциальная диагностика с патологиями, имеющими
сходную клиническую симптоматику:
• лекарственной аллергией;
t обострением бронхиальной астмы;
• тромбоэмболией легочной артерии;
• циркуляторной перегрузкой после гемотрансфузии.
Профилактика и лечение в случаях плановой гемотрансфузии заключаются 1
назначении премедикации (антигистаминными, десенсибилизирующими пре¬
паратами и/или глюкокортикоидами). При выраженной клинической картине -
глюкокортикоиды внутривенно болюсно в расчете на метшшредншолон в дозе
100-150 мг, эпинефрин (адреналин*) в дозе 0,3-0,5 мг подкожно, аминофшуаш
(эуфиллин*) 2,4% внутривенно болюсно. При необходимости пациента перево¬
дят в отделение реанимации, где продолжают симптоматическую терапию. Кроме
этого, необходимым в профилактике данной реакции является тщательный сбор
аллергологического и трансфузионного анамнеза, у женщин анамнестических
данных о количестве беременностей, родов.
Анафилактические реакции
Одними из самых опасных осложнений гемотрансфузий являются иаяфипцг
тнческая реакция и иногда молниеносно развивающаяся клиническая картина
анафилактического шока.
Частота возникновения осложнения варьирует от 1:20 ООО до 1:100 ООО транс¬
фузий. Среди причин — осложненный аллергологический и трансфузионмый
анамнез, дефицит у реципиентов иммуноглобулинов класса А (распространен¬
ность данного вида нарушений иммунитета составляет 1 на 1000 человек и попу¬
ляции), наличие класс-специфических антигенов к иммуноглобулину А.
Антигены сывороточных белков обладают достаточно высокой иммунологи
чккой активностью. При частых гемотрансфузиях аллосенсибилизация к анти-
ге®м белков плазмы развивается у большинства пациентов и зависит от объема
н частоты гемотрансфузий, вида компонента крови, возраста пациента и многих
других факторов.
При некоторых заболеваниях, например при коллагенезах, образуются анти
к Детерминантам тяжелых цепей IgG, которые могут стать причиной транс-
Фузиощщх реакций.
•Ьіболее частой причиной анафилактических реакций на гемотрансфузию
дефицит у реципиента иммуноглобулинов класса А. При гемотраисфу-
Адазмы донора с высоким (или даже в пределах нормы) содержанием LgA
наблюдать проявления аллергических реакций. Установлено, что пример
де КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
но 120-25% пациентов с дефицитом IgA в крови выявляются анти-lgA-a
относящиеся к классу IgG. Появление анти-А-антител при гемотрансфуз^Ч
можно и у пациентов с нормальным содержанием IgA как результат алло** ^
несовместимости типов IgA у донора и реципиента. Анафилактические пм"11*
описаны и у пациентов, в крови которых не содержатся иммунные
к иммуноглобулинам, т.е. не сенсибилизированные к lg. Поскольку реакци**
го типа имеют более вариабельный механизм развития, чем простое выл ^
гистамина при дегрануляции базофилов и тучных клеток, подобные реакции^
значают как анафклактоидные. °°°'
В клинической практике в большинстве случаев перед гемотрансфузией не
полняют исследования по определению уровня содержания или типа иммунп^
булина А у больного. В регламентах по обследованию доноров также отсутств^
положения о необходимости исследования уровня содержания и типа IgA у ао
ров. Выявление иммунодефицита IgA крайне затруднительно, и, как прави*
трансфузионные осложнения, обусловленные IgA, практически всегда неожидан'
ны. Чаще реакции, связанные с IgA, можно ожидать у пациентов, страдающихКОд
лагенозами (ревматоидным артритом, системной красной волчанкой) и другими
аутоиммунными заболеваниями. Очевидно, что разработка простых и доступиш
методов выявления иммунодефицитных СОСТОЯНИЙ, связанных с IgA, И внедрение
их в клиническую практику позволят исключить аллергические реакции при гемо-
трансфузиях, связанных с этим фактором. Анафилактические реакции могут раз-
виться даже после введения всего нескольких миллилитров крови, ее компонен¬
тов, кровезаменителей (полиглюкина, гемодеза, желатиноля и др.).
При анализе причин посттрансфузионной анафилактической реакции необхо¬
димо учитывать возможность пассивного переноса атопической аллергии от доно¬
ра пациенту посредством иммуноглобулинов класса IgE и антител к лекарственным
препаратам, например к антибиотикам пенициллинового ряда. Они могут прояв¬
ляться мгновенно или некоторое время спустя после трансфузии и характеризу¬
ются ознобом, повышением температуры тела, тахикардией, одышкой, тошнотой,
рвотой и т.п. Возможны отсроченные реакции, которые регистрируются порой
через 2-4 нед после трансфузии.
Различают две группы пациентов, у которых наблюдаются подобные осложнения:
• со сниженным количеством IgA и строго специфичными анти-^-антителаэд
• с нормальным содержанием IgA и менее специфичными анти-^А-антителамн
Анафилактический ответ организма на антигенную стимуляцию включает два
типа реакций: I и II (по Coombs et al.).
Тип I - IgE-опосредованная реакция протекает в 3 фазы.
S Специфическая (реакция «антиген-антитело»),
і Неспецифическая (биохимическая, обусловленная выделением медиаторов
и образованием биологически активных субстанций).
• Функциональная (морфофункциональные изменения, лежащие в основе
клинических проявлений иммунного ответа).
В 50% случаев анафилаксия манифестирует немедленно (в первые 5 мни),
в 30% - в течение 10 мин и около 20% — в течение 20 мин.
Тяжесть реакции пропорциональна скорости ее возникновения - от незначи¬
тельного снижения АД до асистолии.
Базофилы и тучные клетки характеризуются накоплением большого количе
ства гистамина. Выброс гистамина играет ведущую роль в начальных стадии
анафилактического шока.
Гистамин і имидазолиэтиламин, вещество с молекулярной массой 120 Да.000
средует физиологическое действие через два различных типа рецепторов.
• Н1 -стимуляция ведет к сужению бронхов и коронарных сосудов, повыше _
проницаемости капилляров, выработке простагландинов и усилению миф
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 847
JJU полиморфно-ядерных лейкоцитов. Активация Н 1-рецепторов сопрово¬
ждается повышением слизеобразования в верхних дыхательных путях,
•^-стимуляция сопровождается положительным хроно- и инотропным Воз*
* действием на гладкомышечные элементы, повышением секреции соляной
кислоты в желудке. Стимуляция Н2-рецепторов на тучных клетках препят¬
ствует их активации и подавляет функцию Т-лимфоцитов.
гіди воздействии малых концентраций гистамина на первый план выступают
■жекты, опосредованные через Н1-рецепторы, при высоких концентрациях
^іизукітся эффекты обратной связи, опосредующиеся через Н2-рецепторы.
Довременная активация рецепторов обоих типов приводит к вазодилатации
снижению порога возбудимости миокарда.
Сердечно-сосудистый эффект от действия гистамина исчезает в течение 5 мин
после прекращения введения вещества. Продолжительные гипотензии и иные
клинические симптомы обусловлены выработкой других ваэоактивных субстан¬
ций - кислых гидролаз, пероксидаз, нейтральных протеаз (триптазы, легочного
активатора Хагемана, активатор брадикинина), высвобождающихся в большом
количестве дегранулирующими тучными клетками и базофилами. Эти ферменты
обеспечивают подавление процессов свертывания около тучных клеток, а в усло¬
виях экстремальной дегрануляции способствуют усилению эффектов медиаторов
воспаления. Одновременно высвобождаются протеогликаны, в частности гепарин,
который модулирует активность протеаз, ингибирует как активацию системы
комплемента, так и систему свертывания крови. Миграция и скопление клеточ¬
ного субстрата воспалительной реакции сопровождаются выбросом медиаторов,
вызывающих хемотаксис эозинофилов, нейтрофилов, воспалительного фактора
анафилаксии и др.
Вслед за дегрануляцией начинается окисление арахидоновой кислоты с про¬
изводством биологически активных соединений: простагландинов, лейкотриенов
(медленно реагирующая субстанция анафилаксии — МРС-А) и фактора активации
тромбоцитов (ФАТ).
В МРС-А выделяют три лейкотриена: С4, D4, Е4, из которых С4 и D4 оказывают
мощное бронхоконстрикторное действие, превышающее эффект гистамина в 6000
раз. Эффект развивается медленно, спустя 10 мин, достигает максимума к 15-й минуте
и угасает в течение примерно получаса. Следует иметь в виду, что ни атропин, ни про-
тивогистаминные препараты не устраняют вызванную МРС-А обструкцию.
Тип II - реакции иммунных комплексов — перманентно протекающая физио¬
логическая реакция, в которой участвуют 2 механизма:
• образование комплексов «антиген-антитело*;
• неспецифическое взаимодействие Fc-структур, ускоряющее образование
комплексов.
В процесс вовлекаются компоненты комплемента. Их активация ведет к вто¬
ричным изменениям в стереохимической структуре комплекса, предупреждая
тем самым развитие патологических процессов. Циркулирующие иммунные ком¬
плексы (ЦИК), образующиеся в кровотоке, связываются с рецепторами СЗ-клеток
крови, транспортирующими их к клеткам ретикулоэндотелиальной системы.
В норме ЦИК быстро фагоцитируются и разрушаются. Система комплемента
текже способствует диссоциации ЦИК (в присутствии СЗ) на так называемые тер¬
минальные комплексы, неспособные к дальнейшему агрегированию.
Патологические реакции на ЦИК возможны в случаях, когда:
* скорость образования превышает таковую элиминации:
* ЦИК не могут быть элиминированы через механизмы, опосредованные СЗ
(например, IgA-содержащие иммунные комплексы активируют комплемент
но альтернативному пути);
щ» wmигиі тгмгапяплппг
I пмюі лефишп одного или нескольких компонентов КОМЩ,
I ^>90% патологических состояний, связанных с ЦИК. выявляете
err первых компонентов системы комплемента >:
І имеются внушения в функциональной активности фагоцитарной
(генетические дефекты, функциональная недостаточность, neperpy^*®*
вЩр.).
ДИК ври патофизиологических состояниях играют существенную роль
(Кавмыюй реакции и модулирующем влиянии на характер иммунной — -
активацию клеток крови (нейтрофилов. эоэинофилов, б азофилов, тучных»**
тромбоцитов, макрофагов) с выделением биологически активных субсвым
комплемента и системы свертывания крови (фактор Хагемана активируем?**1*
ко опосредованно через СЗ-систему комплемента). В зависимости от
и распространенности процесса наблюдается та или иная клиническая
поражения (узелковый периартериит. крапивница, узелковая эритема, гломе^
нефрит, иридоциклнт и т.д.).
На локализацию процесса существенное влияние оказывает состояние оь
икцае мости сосудов для ЦИК, как физиологически (почки, сосудистая сисам
глаза), так и патологически повышенное, например, вследствие сопутствуют?’
атопической реакции, опосредованной через IgE-антитела.
Несомненна роль ЦИК при заболеваниях, сопровождающихся цитопеннй
нагруженные иммунными комплексами клетки (положительно заряженные ко*,
плексы активно накапливаются на отрицательно заряженных клеточных меибм-
нах) быстрее элиминируются из кровотока.
В течении анафилактической реакции выделяют раннюю и позднюю фазы
В ранней фазе (первые 10- 20 мин) преобладают эффекты первичных меди-
торов - характерные вздутия, пузыри на коже или бронхоконстрикция. Спустя
6-12 ч, в поздней фазе, на первый план выдвигаются эффекты вторичньа мен-
иилмов и ютеточных реакций. На коже образуются эритематозные инфильтрат
В легких затяжная обструкция бронхов сопровождается соответствующими изые-
иениями слизистой. При анафилактическом шоке IgE-опосредованная реакция
«антиген антитело», сопровождающаяся выбросом большого количества вазо-
дилятаторов активированными тучными клеткам и базофилами, ведет к острой
сердечно-сосудистой недостаточности (синдрому малого выброса). Данный син¬
дром возникает в связи с увеличением емкости сосудистого русла (эффект сосу¬
дорасширяющих субстанций, например гистамина). Система малого давленні
(венозная) содержит 75% циркулирующей крови, а при анафилактическом шоке
увеличивается на 30% первоначального объема, в связи с чем возникает острое
несоответствие емкости кровеносного русла циркулирующему в ней объему
Сокращение на 20% исходной величины объема внеклеточного пространства -
неотъемлемого компонента защитной стресс-реакции при шоке - существенно
усугубляет клиническую картину синдрома. Иногда организм реагирует на вне-
денне антигенов очень бурно. В результате этого развивается тяжелейшее осноя
нение анафилактический шок, требующий немедленной комплексной терапии,
а нередко и реанимационных мероприятий. Исход анафилактического шоп
во многом определяется быстротой и полнотой проводимых лечебных и реанима
ционных мероприятий.
Симптоматика, характерная для анафилаксии с вовлечением в патогенез ий»
ннзмов аллергической реакции I и И типа, осложняет клиническое течение шока
О степени опасности анафилактического шока свидетельствует тот факт,
несмотря на все усилия, смертность при этом осложнении остается достаю411
Высокой - 3-4%.
ІіДПУ
Клиническая картина анафилактического шока характеризуется острым-
молниеносным началом и проявляется к 5-30-й минуте трансфузии. Больны .
покойны, жа луются на затрудненное дыхание, боли в груди, эпигастрии. К
ГТОСТТЯЦСФУЗИОННЬЖ пип»» м
жціивірош, видимые слизистые ободочки циавотнчны нередко
Отдаются акроцианоз и холодный пот. выраженная одышка со прдицкнннм
"^вигитом: дыхание шумное, свистящее, слышно на расстоянии. Вскоре гипер*-
* кожи сменяется бледностью, внезапно снижается АД. отпиши выровненной
1вииардия. пульс нитевидный, иногда определяющийся только нв сонный арте*
^ При аускультации сердца выслушиваются глухие тоны с акцентом It томя
ні «точкой артерией. В легких перкуторный коробочный звук, при аускульта-
_ гуіие. свистящие хрипы по всем полям: при развитии отека легких клокочу
0g дыхание, сопровождаемое кашлем с выделением пенистой розовой мокроты,
паи встрой нарушении центрального кровообращения возможна разнообразная
урологическая симптоматика, вплоть до потери сознания в судорог.
Нарушение внешнего дыхания вследствие бронхоконстрнкцин и увеличенной
снфеции (эффект гистамина и МРС-А) дополняет циркуляторную гипоксию
пикжсйческой.
В случае анафилактического шока при выборе терапевтической тактики следует
считывать патогенетические особенности гиповолемического шока и снецифику
патогенеза как ранней, так и поздней фазы анафилактической реакции.
Схема лечения включает первичные и вторичные терапевтические меры
Однако деление это условно, поскольку при лечении шока практически невозмож¬
но определить приоритет терапевтических мероприятий.
Первичные терапевтические меры следующие.
« Прекращение введения антигена.
І Ингаляция кислорода, восстановление проходимости щиті шимі путей
и при необходимости ИВЛ.
• Восполнение объема циркулирующей крови (коллоидными, кристаллондны-
ми растворами).
Вторичные терапевтические меры таковы.
I Симптоматическая терапия, включающая респираторную поддержку (инга¬
ляцию кислорода, масочную или искусственную вентиляцию легких).
• Коррекция гиповолемии методами инфузионной терапии.
• Введение:
❖ антигистаминных препаратов:
❖ катехоламинов (внутривенно капельно 2-4 мкг мин до получения желае¬
мого эффекта);
❖ аминофиллина (эуфиллина*) 2,4% (внутривенно медленно болюсно
или капельно при стойком бронхоспазме):
О глюкокортикоидов (0,25-1,0 г гидрокортизона или 1-2 г метилйредннзо-
лона).
• Коррекция нарушений кислотно-основного состояния внутривенным введе¬
нием гидрокарбоната натрия (бикарбоната натрия*), трометамола (трисамн-
на*) под контролем показателей кислотно-основного состояния (КОС).
Патогенетически обоснованная симптоматическая терапия включает ограниче¬
ние по возможности лекарственных средств, которые могут запустить гаптеновые
механизмы сенсибилизации.
Анафилактические реакции в клинической практике инфузионно-трансфу-
зиониой терапии чаще всего связаны с применением коллоидных кровезамените¬
ле и препаратов крови. Так, в среднем около 0.33% всех трансфузий коллоидных
растворов заканчивается анафилактической реакцией, препаратов желатина
“*Н5%, гидроксиэтилкрахмала - 0.085%, препаратов декстрана 0,032%, сыво¬
роточного альбумина человека - 0.011%.
Частоту реакций гиперчувствительности оценить трудно, особенно в условиях
®роза, операции, реанимации и интенсивной терапии. Следует иметь в виду,
^ *мтибиотики и препараты анестезиологического пособия имеют достаточно
высокий риск анафилаксигенности (пропанидид —1:600 и альтеэин - 1:900).
gjgg ОЛчНЕСХАЯ 7РАНСФУЗИ0Л0ГИЯ
1
Клинические признаки анафилактических реакций обычно вости*»,
как результат прямого токсического действия препаратов, в то времяНИ1<а|&>ь
шй фармакологический эффект и последствия анестезии чаще всего до ВоЦ.
но не фиксируются.
При появлении клинических признаков анафилаксии необходима пиАА
альная диагностика со следующими постгрансфузионными реакциями *^Є^ІІ1ІІ!'
• гемолитическими осложнениями:
• циркуляторной перегрузкой;
• бактериальной контаминацией;
• синдромом острого посттрансфузионного поражения легких.
Циркуляторная перегрузка, ассоциированная с гемотрансфузией
Клинические проявления циркуляторной перегрузки вследствие гемотоанаки*
были описаны еще на ранних этапах применения донорских компонентов кп 1111
Данная посттрансфузионная реакция, как правило, возникает спустя Г
после окончания гемотрансфузии. Основной причиной реакции является зн 1
тельное и быстрое увеличение ОЦК вследствие трансфузии любых гемокошо
тов. Как правило, возникновение циркуляторной перегрузки, ассоциирован1^1*
с трансфузией крови, зависит от исходного состояния больных и возможно-0*
I у пациентов с исходной сердечной недостаточностью;
І у пациентов старческого возраста;
• вследствие высокой скорости трансфузии;
І вследствие трансфузий новорожденным, недоношенным детям, а такжедепш
раннего возраста даже небольших объемов компонентов донорской крови
но с высокой скоростью.
Клиническая картина посттрансфузионного увеличения ОЦК включает появле¬
ние систолической гипертензии, тахикардии, цианоза, тахипноэ, диспноэ, ортоя-
ноэ, застойной сердечной недостаточности; в наиболее тяжелых случаях возможна
остановка сердца вследствие перегрузки правых отделов сердца. Аускультативно
выявляются признаки интерстициального, альвеолярного отека легких. При рент¬
генологических исследованиях подтверждается отек легких, кроме этого, возмож¬
но появление признаков острой кардиомегалии.
Диагностика данной реакции затруднительна, особенно у пациентов в слу¬
чаях осложненного течения операции или послеоперационного периода.
Дифференциальную диагностику проводят с СОППЛ (табл. 22-9), анафилакти¬
ческими, гемолитическимим постгрансфузионными реакциями, бактериальной
контаминацией. Однако наибольшие затруднения вызывает дифференциальная
диагностика циркуляторной перегрузки с синдромом острого посттрансфузион¬
ного поражения легких, поскольку терапия больных, у которых выявляются эти
посттрансфузионные реакции, принципиально различна.
Таблица 22-9. Дифференциальная диагностика СОППЛ и циркуляторной перегрузки
Показатели
Артериальное давление
ЦВД‘
ДЗЛА’*
Жидкостный баланс
Рентгенография
СОППЛ
Не меняется или умеренная гипотензия
Норма
<18 мм рт.ст.
Нормальный, + или •
Билатеральная инфильтрация
Может повышаться
Возможна транзиторная лейкопения (<24 ч)
<200
Температура тала
Клинический анализ крови
В-тил натрийуратичаского
[гормона, г/мл
•ЦВД - центральное венозное давление.
••ДІЛА давление заклинивания легочной артерии.
Циркуляторная перегрузи]
Повышается систолическоеjjU
Повышено
Повышено
Положительный —•
Билатеральная инфильтрм??^
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 851
0 ряде работ последних лет, посвященных проблеме посттрансфузионных
^клий, имеются данные исследований содержания В-типа натрийуретического
в плазме больных, у которых выявлены ГТТО, сопровождающиеся острым
.«точным поражением — СОППЛ и циркуляторной перегрузкой, ассоциирован¬
ий с гемотрансфузией. В-тип натрийуретического пептида (ВНП) - кардиаль-
jj цейрогормон, продуцируемый кардиомиоцитами желудочков сердца в ответ
инфузию И увеличение ЦВД.
Определение содержания В-типа натрийуретического пептида имеет опреде-
ннную диагностическую значимость: содержание ВНП более 1200 pg/rol ассо¬
циировано с циркуляторной перегрузкой, менее 200 pg/ml - сСОППЛ.
Основной профилактической мерой данной реакции является уменьшение
скорости трансфузии гемокомпонентов — рекомендуемая скорость составляет
1 мл/кг массы тела в час, что целесообразно в случаях плановых гемотрансфузий.
Пациентам группы риска данной постгрансфузионной реакции необходимо огра¬
ничить объем гемотрансфузии до 1 дозы компонента донорской крови. При кли¬
нической необходимости допустимо струйное введение небольших объемов гемо¬
компонента с последующим ограничением скорости введения до рекомендуемых
параметров. Пациентам с сердечной недостаточностью при плановых гемотранс¬
фузиях целесообразно назначение диуретиков накануне процедуры. Этим боль¬
ным предпочтительнее проводить компонентную терапию, при этом в первую оче¬
редь переливают компонент крови, компенсирующий превалирующий дефицит:
например, в первый день осуществляют коррекцию анемии, тромбоцитопении.
наследующий день — коррекцию дефицита системы свертывания.
Детям трансфузии проводят малыми объемами, предпочтительно применение
перфузоров.
Лечение включает немедленное прекращение гемотрансфузии при появлении
первых признаков гиперволемии. Необходим перевод больного в положение сидя,
применяют респираторную поддержку — ингаляцию кислорода, масочную венти¬
ляцию. Внутривенно вводят диуретики — фуросемид в дозе 40-80 мг. При неэф¬
фективности вышеуказанных мероприятий проводят экстренный плазмаферез.
который позволит снизить ОЦК за счет элиминации плазмы.
Синдром массивных гемотрансфузий
Трансфузии больших и сверхбольших объемов любых компонентов донорской
крови - более 3,5-5 л для взрослых, т. е. более одного ОЦК в течение 4-5 ч, явля¬
ются причиной развития симптомокомплекса, который носит название синдрома
массивных гемотрансфузий. Поскольку массивную гемотрансфузию всегда пред¬
варяет массивное кровотечение хирургического, травматического характера, при¬
водящее к выраженным изменениям гомеостаза, переливание кровезаменителей,
компонентов донорской крови дополняет клиническую картину постгеморрагиче-
ского состояния или шока рядом симптомов, характерных для массивной транс¬
фузии.
Этот симптомокомплекс включает следующие проявления:
• нитратную интоксикацию (снижение содержания в плазме ионизированного
кальция, гипомагниемию):
• гиперкалиемию — аритмию, брадикардию, острый зубец Г, расширение ком¬
плекса QRS\
• нарушения кислотно-основного равновесия:
• гипотермию;
• нарушения гемостаза — дилюционную коагулопатию, ДВС-синдром.
Цитратная интоксикация
При массивных гемотрансфузиях уровень лимонной кислоты в плазме может
Достичь более 100 мг% и вызывать тяжелую токсическую реакцию, обусловлен-
•52 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
^рамюшем уровня ионизированного кальция. Так. при обмени
вам» 500-600 мл крови новорожденный в течение часа гемотранс<Ь°М П%и
получить до 600 мг цитрата, что клинически проявится тремором
нениями на ЭКГ. **11 изц.
Наиболее выраженным электрокардиографическим признаком гип
мин является удлинение интервала Q.-T. Кроме этого, возможны °Ka'1t>lfl,t-
сократимости миокарда левого желудочка, гипотензия. Довольно часто
интоксикация приводит к гипомагниемии, которая усугубляет депрессию*^1
дольной сократимости и является причиной серьезных нарушений ритма^01^
до желудочковой тахикардии. ’ В[иЧ
^Ддоальциемия развивается при трансфузиях больших доз и/или б
обрати
переливании плазмы или крови, содержащих цитрат натрия. Имеется 2.
зависимость между скоростью внутривенного введения с кровью консерви™
го раствора и кумулятивным количеством цитрата, которое вызывает ослож ^
сердечной деятельности. Признаки цитратной интоксикации у взрослых паццНЄНИе
развиваются при трансфузиях 1 л консервированной крови за 10-12 мин Шт!!
натрия связывает в кровеносном русле свободный кальций, вызывая гипокаль
мию. Если трансфузию эритроцитной массы или плазмы проводят со скоросл
50 мл/мин. содержание свободного кальция реципиента меняется незначительн**
тогда как при увеличении скорости трансфузии в 3 раза (150 мл/мин) содержав»
свободного кальция снижается максимально до 0,6 ммоль и возвращается к ноли
сразу после прекращения переливания. Это обусловлено быстрой мобилизацией
кальция из эндогенных депо и метаболизмом цитрата в печени. В связи с большой
ролью паренхиматозных органов в утилизации цитрата особое внимание следу¬
ет обращать на больных с циррозом печени, активным гепатитом, хронической
почечной недостаточностью, D-авитаминозом, панкреатитом, токсикоинфекци-
онным шоком. С осторожностью в плане риска цитратной интоксикации следуя
использовать кровь и плазму при постреанимационном состоянии, длительной
терапии глюкокортикоидами и цитостатиками.
При приготовлении компонентов крови (эритроцитной массы и плазмы) в плаз¬
ме остается 80% цитрата. В плазме консервированной крови содержится примерно
1 мг% цитрата.
Цитратная интоксикация может быть спровоцирована не только отсутствием
в кровотоке ионизированного кальция, но и другими факторами — снижением pH
и повышением концентрации калия.
У больных с высоким риском предрасположенности к цитратной интоксикации,
в частности у пациентов с заболеваниями печени, целесообразно использовать
отмытые эритроциты.
В пользу применения при гемотрансфузиях компонентов крови свидетельству¬
ет и тот факт, что при переливании консервированной крови может наблюдаться
комбинированный эффект цитрата, калия и аммиака.
Цитратную интоксикацию достаточно легко предупредить или значительно
ослабить ее проявления превентивным назначением 10% раствора кальция глюко-
ната (10 мл на каждый литр гемокомпонента). При трансфузии больших объемов
с высокой скоростью (500 мл/мин) целесообразно вводить 10 мл 10% раствора
кальция глюконата до и после каждых 500 мл крови. Кроме того, снижение содер
жания ионизированного кальция до 50% нормального уровня является показали
ем к обязательному применению препаратов кальция.
Калиевая интоксикация
В норме содержание ионов калия в плазме доходит до 5,5 ммоль/л, а УР°
более 6,0 ммоль/л считается опасным для человека. В длительно хранивів^^
донорской крови увеличивается содержание внеклеточного калия всле11 ^
повышения проницаемости мембран клеток крови для калия. В основе этих
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 853
лежат нарушения функций мембранного К*. Na'-насоса. Опасность гиперка-
лієМИй возникает при массивных переливаниях, вызывающих резкое повышение
епжаиия калия в крови реципиента.
^ г«перкалиемию Достаточно просто диагностируют при исследовании крови,
(ядически гиперкалиемия проявляется апатией (после кратковременного периода
Суждения), сонливостью, вялостью, судорожным подергиванием мышц, вплоть
0 вялых параличей, падением АД, брадикардией, аритмией, нарушением дыха*
йия вплоть до остановки, атонией кишечника. При концентрации в плазме калия
g ммоль/л появляются типичные ЭКГ-признаки гиперкалиемии — нарушение
-утрисердечной проводимости (расширение зубца Р), возможна синоаурикулярная
блокада (снижение зубца R, углубление и уширение зубца S). При гиперкалиемии
ьппе 8 ммоль/л нарушается внутрижелудочковая проводимость (расширение
комплекса QRS), развивается желудочковая тахикардия, переходящая в асистолию.
На ЭКГ появляются высокие остроконечные зубцы Т с узким основанием.
Профилактика гиперкалиемии заключается прежде всего в своевременном
выявлении пациентов с потенциальной гипокальциемией и в переливании свежей
крови или эритроцитной массы. Скорость гемотрансфузии должна быть не более
50-70 мл/мин. Необходимо профилактическое введение растворов кальция (глю-
коната, хлорида кальция — 10 мл на каждые 0,5 л плазмы или крови).
Лечение гиперкалиемии сводится к отмене всех препаратов, содержащих калий,
в том числе калийсберегающих мочегонных. Необходимы внутривенные влива¬
ния хлорида или глюконата кальция и хлорида натрия после трансфузии каждых
500 мл цитратной крови, раствора глюкозы (100-200 мл) с инсулином (1 ЕД на 5 г
глюкозы). Больному назначают диету с низким содержанием белка.
Нарушения кислотно-основного состояния
Необходимо учитывать, что превалирующей причиной электролитного дис¬
баланса при массивной гемотрансфузии является нарушение кислотно-основ¬
ного состояния (КОС), сопровождающее геморрагический шок. Несмотря
на то что донорская кровь имеет кислую реакцию из-за присутствия в ней цитрата
и дальнейшего снижения pH в результате накопления лактата в процессе хране¬
ния, массивная трансфузия редко является причиной ацидоза. Более характерен
метаболический алкалоз вследствие метаболизма большого количества цитрата,
вводимого одновременно с гемокомпонентами. Выраженный алкалоз приводит
к снижению миокардиальной сократимости и ухудшению доставки кислорода
тканям. Таким образом, транзиторная гиперкалиемия вследствие массивной гемо¬
трансфузии возможна у пациентов с серьезными нарушениями КОС, гипокальцие¬
мией. Уменьшение скорости инфузии компонентов донорской крови, нормализа¬
ция КОС приведут к снижению содержания калия в плазме больного.
Массивная гемотрансфузия может привести к гипокалиемии, чему способству¬
ют назначение катехоламинов, потеря калия с мочой, метаболический алкалоз,
развивающийся в результате метаболизма цитрата.
Гипотермия
Гипотермия возможна в результате травматического повреждения или дли¬
тельной операции, поэтому массивная трансфузия несогретых или плохо согретых
гемокомпонентов усугубляет эту проблему.
Клинические и лабораторные проявления гипотермии:
• усугубление нарушений КОС, выраженный лактат-ацидоз:
• замедление метаболизма цитрата, лактата:
• увеличение сродства кислорода к гемоглобину, уменьшение доставки кисло¬
рода тканям:
• потеря внутриклеточного калия эритроцитами.
Кроме того, гипотермия усугубляет расстройства гемостаза, что лабораторно
подтверждается удлинением протромбинового времени (ПВ). активированного
в V8VUJ
Ц4 КЛИНИЧЕСКАЯ ТМНС*УЗ*ЮЛОГИЯ
4 частичного тромбопластинового времени (АЧТВ). нарушениями фуНк
щггов I снижением агрегационных свойств тромбоцитов. *>0«
Согревание переливаемых компонентов крови является обязател
I профилактики гипотермии и связанных с ней нарушений гомеосщНЫц цо
сждует учитывать временной фактор гемотрансфуэии: несомненно
тяжесть состояние пациента и экстренность ситуации определяют во ° и“%'
согревания до оптимальной температуры всех переливаемых компоне 3M°*Htl6i
и кровезаменителей. т°в кр0В))
Согревание крови проводят с применением устройств для подогревая
знойных растворов со встроенным термодатчиком (во избежание воЯИЯИ%
перегревания крови и гемолиза эритроцитов) и обязательно при трансА3*0*11^
в взрослым пациентам со скоростью более 50 мл/кг в час; Ч»узиях;
і детям со скоростью более 15 мл/кг в час;
і пациентам с клиническими проявлениями криоглобулинемии-
і больших объемов крови в центральные вены (холодная кровь мож
вать различные виды аритмий). Вь°и-
Применение для ресуспендирования эритроцитсодержащих компоненто
ви предварительно подогретого раствора натрия хлорида недопустимо из-В ^
можности гемолиза эритроцитов вследствие контакта клеток с раствором чм В°3"
но высокой температуры. ЗМеР
Необходимы также подогревание любых инфузируемых препаратов, подле
ние оптимальной температуры в операционной, согревание больного.'
Нарушения гемостаза
Массивная гемотрансфузия часто сопровождается нарушениями гемоси
в виде дилюционной коагулопатии или синдрома диссеминированного внутрисо¬
судистого свертывания крови (ДВС-синдрома).
Степень выраженности расстройств гемостаза определяется следующими фах-
торами:
к объемом трансфузии, при этом важен объем как перелитых кровезамените¬
лей, так и компонентов донорской крови;
я нарушениями гемодинамики - длительностью гипотензии, дозами приме¬
няемых катехоламинов, степенью и длительностью нарушений перфузии;
а тяжестью исходного состояний пациента, заболеваниями печени, почек, сер¬
дечной недостаточностью и т.д.
Одной из причин дилюционной коагулопатии является потеря вместе с кровью
факторов свертывания, тромбоцитов. Кроме того, применяемая для восполнения
ОЦК инфузионная терапия с использованием плазмозаменителей коллоидного
и кристаллоидного ряда, а также трансфузия эритромассы (которую переливают,
как правило, в первую очередь, поскольку эритроцитсодержащие препараты крови
наиболее доступны в экстренных ситуациях) приводят к усугублению гемодилю¬
ции и мультифакторному дефициту системы гемостаза. Лабораторные данные под¬
тверждают наличие гипокоагуляции: характерны удлинение времени свертывания
крови, АЧТВ, ПВ, МНО, гипофибриногенемия, тромбоцитопения. Клиническим
проявлением дилюционной коагулопатии является диффузная кровоточивості
в области хирургической раны.
Признаки кровоточивости мест катетеризации вен, инъекций, слизистых о
лочек (носовые, десневые, маточные, желудочно-кишечные кровотечения) СВИ
детельствуют о диссеминированном внутрисосудистом свертывании крови. ДО
синдром в фазе гипокоагуляции, осложняющий течение посттравматическ^
послеоперационного периода, не является прямым следствием массивно
трансфузии. Являясь неспецифическим, полиэтиологичным синдромом, Д
циируется высвобождением прокоагулянтов, в первую очередь тромооші ,
в результате травмы, травматичного хирургического вмешательства, аку г
посттрансфузионные реакция 856
логии. Как правило, вышеуказанные состояния сопровождаются массивной
опотерей и объемной гемотрансфузией.
Необходимость профилактического введения препаратов донорской крови гемо-
^-йческого действия, таких как СЗП, тромбоконцентрат. криопреципитат, при вос-
лйеНии массивной кровопотери определяется клинической ситуацией, объемом
'vgMHOM кровопотери и факторами, предрасполагающими к повышенной крово-
" кости в послеоперационном периоде, — печеночной недостаточностью, прие-
Н антикоагулянтов прямого и непрямого действия, врожденными аномалиями
^иостаза и т.д. Заместительная инфузионная терапия СЗП, тромбоконцентратом.
коиопреиипитатом обязательна при клинической картине повышенной диффуз¬
ной кровоточивости и лабораторных признаках мультифакторной недостаточ-
ости системы гемостаза. Трансфузия тромбоконцентрата в терапевтической дозе
"бсолютно показана при содержании тромбоцитов менее 50х10ул.
Воздушная эмболия
Воздушная эмболия возникает в начале или конце переливания при введении
с трансфузионной средой 2 см3 воздуха или более. Он попадает в правое сердце,
через него в легочную артерию и мелкие сосуды легких, создавая препятствие
для кровообращения. При этом у больного появляются затрудненное дыхание,
боль и чувство давления за грудиной, цианоз, тахикардия. Если воздуха немного,
через некоторое время дыхание и кровообращение восстанавливаются. Попадание
более 2 см3 воздуха в сосудистое русло сопровождается кратковременным бес¬
покойством больного, за которым следует клиническая смерть. Для лечения воз¬
душной эмболии требуются немедленные реанимационные мероприятия.
Профилактикой эмболии является строгое соблюдение правил трансфузии,
особенно в условиях экстренной трансфузии.
Бактериальная контаминация гемокомпонентов. Посттрансфузионный сепсис
Данное осложнение относится к острым посттрансфузионным реакциям. Ран¬
ние клинические проявления бактериальной контаминации возникают в первые
минуты трансфузии гемокомпонента, развернутая клиническая картина пост-
ірансфузионного сепсиса — в течение нескольких часов. Тяжесть клинической
картины и прогноз во многом зависят от вида перелитого гемокомпонента.
Причина — попадание микробного агента и бактериального эндотоксина в кро¬
воток рецепиента вместе с гемокомпонентом вследствие инфицирования крови
во время заготовки или при скрытой бактериемии у донора. Проявления анало¬
гичны септическому шоку с гипертермией, гипотонией и очень быстрым развити¬
ем полиорганной недостаточности и ДВС-синдрома.
Прогноз неблагоприятен и зависит от типа введенного гемокомпонента (чаще
данное осложнение развивается после трансфузий эритроцитной массы, тромбо¬
цитного, лейкоцитного концентрата), возбудителя и исходного состояния паци¬
ента. Смертность от посттрансфузионного сепсиса после переливания эритроцит¬
содержащих препаратов крови достигает 58%, после трансфузии тромбоцитного
концентрата — 26%.
Виды возбудителя:
I Yersinia enterocolitica, Pseudomonas putida, P. fluorescens, Serratia marcescens -
в эритроцитсодержащих средах (температура хранения +4-6 °С);
I Staphylococcus epidermidis, St. aureus, Streptococcus, Salmonella, Escherichia -
в тромбоконцентрате, лейкоцитной массе (температура хранения - +24 *С).
Дифференциальная диагностика затруднена и ее проводят с гемолитическими
постгрансфузионными осложнениями, негемолитическими фебрильными реак¬
циями, трансфузионной реакцией «трансплантат против хозяина», сепсисом иного
генеза.
Терапия симптоматическая, включающая антибиотикотерапию с применением
препаратов широкого спектра действия, противошоковые мероприятия.
ярмш
155 КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
Профилактика: тщательный скрининг доноров и аутодоноров, тщат»
ботка локтевых сгибов у доноров перед взятием крови, применение киЬваЯ %.
хром минимальных сроков хранения. Необходимы визуальный коитпо1П°н*,Ч
яеагтов перед трансфузией, соблюдение температурного режима хранений Коч”
Нрежимов заготовки крови (редукция лейкоцитов, дезинфекция ГЄМОКО И‘^-
во время размораживания на водяной бане, сокращение времени храненц
крови перед ее фракционированием). Помимо этого, в обязательном поп
водят предтрансфузионное исследование компонентов донорской крови ^
химический И культуральный контроль (выявление ЭНДОТОКСИНОВ, бакге ' ^
го возбудителя с помощью бактериологического исследования, рибосо аЛЬН°‘
и полимеразных проб). МальНід
Иммунологическая рефрактерность (невосприимчивость) к трансфузиям
Отсутствие посттрансфузионного прироста тромбоцитов (при исключении
мунных факторов рефрактерности) и повторяющиеся посттрансфузионные пр
должны навести врача на мысль о возможной аллоиммунизации больного К,№|
Появление иммунологической рефрактерности при АВО-несовместимойтпя
фузии является результатом взаимодействия или иммунных антител с
ствующими антигенами, представленными в достаточном количестве на tdoJI'
ците, или иммунных комплексов с Fc-рецептором тромбоцитов. Тромбоцит
с фиксированными антителами и иммунными комплексами разрушаются май■
фагами в ретикулоэндотелиальной системе.
Присутствие в трансфузионной среде эритроцитов может приводить к обра¬
зованию иммунных групповых антител. Более того, А-антиген на самих трои-
боцитарных гликопротеидах является самой важной детерминантой, спщу-
лирующей антителообразование. Об этом свидетельствует выявление антиген
анти-А-специфичности у 100% и анти-В-специфичности только у 17% больньп
с 0(1) группой крови при переливании им АВО-несовместимых тромбоцитов.
Циркулирующие иммунные комплексы после трансфузий тромбоцитсодержа-
щих сред, несовместимых с группой крови реципиента, состоят из изогемагглюти-
нинов плазмы донора и растворимых антигенов системы АВО реципиента. У 41%
больных с состоянием иммунологической рефрактерности доказано присутствие
циркулирующих иммунных комплексов (ЦИК) с высокой (200-900 кДа) и низкой
(150-180 кДа) молекулярной массой. Действующими инструкциями разреше¬
но использовать для трансфузий тромбоциты доноров 0(1) группы, что связано
с преобладанием людей с данной группой крови в популяции. Однако следует
учитывать, что 20-40% доноров с 0(1) группой имеют высокий титр естественны!
анти-А-антител, что может приводить к гемолитическим реакциям, хотя частота
их невелика и составляет 1:9000 иногруппных трансфузий.
В многочисленных клинических исследованиях показано, что трансфузии АВО-
несовместимых тромбоцитов могут быть ассоциированы со сниженным пост-
трансфузионным приростом тромбоцитов, укороченным периодом их циркуляции
в кровеносном русле реципиента. Скорректированный посттрансфузионный при¬
рост при переливании тромбоцитов от АВО-идентичных доноров почти в 2 раза
выше, чем при использовании тромбоцитов АВО-несовместимых доноров, осо¬
бенно когда имеет место большая несовместимость между реципиентом и доно¬
ром тромбоцитов (реципиент имеет изогемагглютинины к антигенам систем ■
АВО донора). Кроме того, переливание тромбоцитов АВО-несовместимых Д°н0
ров чаще приводит к иммунологической рефрактерности, причем стимуляи**
иммунной системы чужеродными антигенами системы АВО провоцирует ДоП®
нительную аллоиммунизацию к антигенам системы HLA. Таким образом, прей
чтительнее переливать тромбоциты, идентичные по группе крови с реципие
Однако могут быть и исключения. Тромбоциты доноров с группой крови А,
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 857
_тьсЯ совместимыми с реципиентами 0(1) группы, что повысит количество
1 местимых потенциальных доноров на 12-15%. Особенно ценными будут
^ мбоциты от доноров с группой крови А, для трансфузий больным после АВО-
Совместимой трансплантации гемопоэтических стволовых клеток, так как такие
Смбоцяты будут совместимы с реципиентом и по антителам, находящимся
Сизме, и по антигенам на поверхности тромбоцитов. Кроме того, 10-20% доно-
* с группой крови А, имеют слабую выраженность антигена А, а 80% доноров
группой крови В(Ш) имеют слабую экспрессию антигена В на тромбоцитах.
Сго можно выявить методом проточной цитофлюорометрии. Тромбоциты этих
Соров также могут быть перелиты реципиентам с 0(1) группой крови. Однако
!п0мбоциты от пациентов с высокой экспрессией антигенов системы АВО должны
Сгь перелиты больным, идентичным с донором по системе АВО.
Переливание тромбоцитов целесообразно проводить с учетом Rh-принадлеж-
ности реципиента и донора. Это связано с риском иммунизации больных к антиге¬
нам системы Rh за счет примеси эритроцитов в тромбоцитсодержащих трансфузн-
онных средах. Частота выявления анти-Б-антител у Rh-отрицательных больных
с гемобластозами, которым были перелиты тромбоциты от 0+-доноров. состав¬
ляет 10%.
раньше было принято считать, что основной причиной иммунологической
рефрактерности являются анти-НЬА-антитела, которые чаще вырабатываются
у пациентов с инфекционными осложнениями. Возможно, инфекционный агент
выступает в роли адъюванта, усиливающего иммунный ответ за счет депонирова¬
ния антигена и неспецифической стимуляции клеток иммунокомпетентной систе¬
мы. Однако в последние годы накапливается все больше фактов, свидетельствую¬
щих о менее значимой роли антигенов системы HLA в аллоиммунизации больных.
В частности, доказано, что первичная аллоиммунизация к антигенам системы HLA
развивается всего у 2,7% больных с апластической анемией, которым переливали
обедненные лейкоцитами эритроциты и тромбоциты. Более того, при перели¬
вании тромбоцитов, очищенных от примеси лейкоцитов, частота иммунизации
kHLA снижается с 30-40 до 0,15%.
Значение тромбоцитспецифических антигенов в трансфузиологии. их антиген-
ность и иммуногенность интенсивно изучаются последние 15 лет. В настоящее
время накопилось много фактов, свидетельствующих о том, что посттрансфузион¬
ные реакции негемолитического типа, обусловленные исключительно анти-НРА-
антителами, являются не такой уж редкой патологией. Частота выявления клини¬
чески значимых анти-НРА-антител у больных с множественными трансфузиями
компонентов крови, особенно тромбоцитов, составляет 25-30%.
Для раннего распознавания иммунологической рефрактерности необходимо
исследовать сыворотку пациента на наличие анти-HLA- и анти-НРА-антител каж¬
дую неделю.
У иммунизированных пациентов после переливания HLA- и/или НРА-
несовместимых тромбоцитов возможны аллергические реакции и осложнения
в виде аллергического шока, основой развития которых является взаимодействие
предсуществующих антител не с плазменными белками, а с антигенными детерми¬
нантами самих тромбоцитов.
Тромбоцитопения после трансплантации гемопоэтических стволовых клеток
Она нередко является причиной госпитализации и летальности больных,
выделяют две основные иммунологические причины недостаточного количества
тромбоцитов в периферической крови реципиента, связанные с различиями реци¬
пиента и донора по НРА:
• взаимодействие антител, продуцируемых остаточными В-лимфоцитами
реципиента, с антигенами тромбоцитов донора;
ВН КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
І реактивацию вторичного иммунного ответа вследствие распозяава
пяаитированными лимфоцитами антигенов малого комплекса
стимости реципиента и синтез В-лимфоцитами антитромбоцитныГ0^-
к антигенам реципиента. Именно поэтому при трансплантации ге
ческих стволовых клеток (ГСК) необходимо с осторожностью исп^.
I качестве доноров женщин, так как в их организме могут coxpaHflTbclh3°*,tl
иммунологической памяти относительно выработки аллоимлунньц*1^
после НРА-несовместимой беременности. О возможности длительц3^
дукции аллоиммунных антител после беременности свидетельствуют!11*10’
их обнаружения в течение длительного времени — ДО 30 лет. 'jNtil
Перед трансплантацией ГСК проводят интенсивную полихимиогерапию*
иррадикации лейкозного клона и собственного кроветворения пациента гГ0
режимов кондиционирования происходит снижение показателей тромбо»0^
в периферической крови реципиента, и одним из генетических факторов, вм ''
щих на длительность тромбоцитопении после алломиелотрансплантации
ется НРА-генотип больного и трансплантированных стволовых клеток доно
Если больной и донор являются НРА-идентичными или НРА-совместимыми f
на донорских ГСК не присутствуют НРА, отсутствующие у больного, то восстанов I
ление количества тромбоцитов до значения 50х109/л происходит в более короткие
сроки (в среднем на 16-й и 18-й день соответственно), чем у больных, имеющщ
НРА-несовместимого донора (гомозиготные по НРА реципиенты, которым транс¬
плантировали ГСК от гетерозиготных доноров, и реципиенты, отличающиеся
от доноров по аллелям целого локуса) — в среднем на 24-й день.
В период тромбоцитопении (при количестве тромбоцитов <20х10’/л) после
алломиелотрансплантации обычно проводят трансфузии тромбоцитсодержащю i
сред. Для профилактики геморрагических проявлений пациентам, имевшим НРА- |
идентичного/совместимого донора ГСК, требуется в среднем 14 доз и 3,4 трансфузии і
тромбоцитов, в то время как у пациентов, имевших НРА-несовместимого донора, I
потребности в тромбоцитах достоверно больше - в среднем 29,4 и 6 трансфузий.
Различия в длительности тромбоцитопении в зависимости от НРА- !
совместимости больного и его донора ГСК можно объяснить следующим образок. ;
Приживление ГСК, рассматриваемое как кульминационный эффект комплекса ;
событий, при которых циркулирующие клетки приобретают статус оседлых тка¬
невых клеток костного мозга, представляет собой сложный, динамичный, много¬
ступенчатый процесс, который регулируется совокупностью взаимодействия
адгезивных молекул различных клеток с лигандами, ростовыми факторами, бел- ;
ками внеклеточного матрикса. Нарушение в любом звене этой кооперации может
привести к изменению последующих событий, вплоть до их полной блокировки,
Несовместимость по НРА может привести к изменению адгезивного профиля
трансплантированных клеток-предшественников гемопоэза, снижению их проли¬
феративной активности и удлинению времени приживления, что в совокупности
с другими факторами отражается на длительности восстановления тромбоцитов.
Неонатальная аллоиммунная тромбоцитопеническая пурпура
Она обусловлена несовместимостью матери и плода по представленным на їр°-
боцитах антигенам систем НРА, HLA и АВО, отсутствующих у матери и наследуй11
ребенком от отца. Частота возникновения неонатальной аллоиммунной Tpow®"
цитопенической пурпуры (НАТП) составляет один случай на 1000-2000 новорож
денных, хотя антигенные различия между матерью и ребенком встречаются ча
один случай на 100-200 родов. Это связано с тем, что способность к выра
антител у матери зависит от HLA и связанных с ними генов иммунного ответа.
В патогенезе НАТП принято выделять три стадии. ^
• Аллоиммунизация матери отсутствующими у нее антигенами плода,
дованными от отца.
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 859
, Трансплацентарный переход материнских IgG-антител в кровеносное русло
ребенка.
# связь антител с антигенами-мишенями и деструкция тромбоцитов ребенка
клетками ретикулоэндотелиальной системы, приводящая к тромбоцитопе-
{Соличесгво тромбоцитов в периферической крови ребенка с НАТП может ксшег
от 150*109/л до нулевых значений. Типичным клиническим проявлением
яюибоцитопении является появление на поверхности кожи геморрагических
дцрлпаний спустя минуты или часы после рождения. Грозным осложнением
-вомбоцитопении являются кровотечения, кровоизлияния в мозг, развивающиеся
j20% случаев и приводящие к перинатальной или антенатальной гибели ребенка
(в 10% случаев) либо появлению неврологической симптоматики (в 20% случаев).
Обычно период тромбоцитопении длится от одной до трех недель. После выведе¬
ния материнских антител у ребенка происходит нормализация количества тромбо¬
цитов периферической крови.
Основной причиной развития НАТП (в 95% случаев) являются анти-НРА-антитела,
так как у представителей различных рас существует свойственный им полиморфизм
антигенов системы HP А; таким образом, вовлечение тех или иных НРА в процесс
аллоиммунизации зависит от этнической принадлежности супругов. У европеоидов
НАТП в 80% случаев обусловлена несовместимостью матери и ребенка по антиге¬
нам локуса НРА-1. Наиболее часто происходит иммунизация матери, гомозиготной
по редкому аллоантигену НРА-lb, аллоантигеном НРА-1а (в 80% случаев), присут¬
ствующим на тромбоцитах плода. Оказалось, что риск аллоиммунизации по такому
механизму повышается при наличии у матери HLA-DRw52a (DRB3*0101). На втором
месте по частоте вовлечения в процесс сенсибилизации при НАТП находится антиген
НРА-5Ь (в 18% случаев), ассоциированный с HLA-DR6, на третьем - HPA-За. У евро¬
пеоидов описаны редкие случаи НАТП вследствие аллоиммунизации матери анти¬
генами НРА-ЗЬ, -2а, -5а и др. Основной причиной НАТП для монголоидов являются
различия матери и ребенка по антигену НРА-4Ь (в 80% случаев).
Описаны случаи рождения детей с НАТП, обусловленной анти-HLA-антителами
матери. Существует мнение о малой значимости анти-НЬА-антител в патогенезе
НАТП вследствие как выраженной адсорбции материнских штги -HLA-антител
на плодной поверхности плаценты и других клетках организма плода, так и незна¬
чительной выраженности антигенов HLA на тромбоцитах ребенка. Доказательных
случаев НАТП, ассоциированной с анти-^А-аллоиммунизацией, описано мало,
в основном они касаются иммунизации матери высокоиммуногенным антигеном
HLA-A2. В лаборатории иммуногематологии ГНЦ РАМН диагностировано раз¬
витие НАТП у двух детей вследствие иммунизации матери высокоиммуногенным
антигеном HLA-B7.
Сочетание НАТП с гемолитической болезнью новорожденных встречается
очень редко. Неонатальная тромбоцитопения может быть следствием транспла¬
центарного перехода в организм ребенка аутоиммунных антитромбоцитных IgG-
антител матери с иммунной тромбоцитопенией.
Для лечения НАТП обычно применяют внутривенное введение иммуногло¬
булина и трансфузии донорских тромбоцитов с известным гено-/фенотипом
“РА и HLA. При отсутствии регистра типированных доноров для переливания
ребенку можно рекомендовать тромбоциты матери, обязательно освобожденные
°т плазмы с иммунными антителами. Трансфузии тромбоцитов противопоказаны
при наличии в кровеносном русле ребенка аутоиммунных материнских антител,
так как субстраты для взаимодействия с ними — аутоантигены представлены на
всех донорских тромбоцитах.
Тромбоцитспецифические антигены являются высокоиммуногенными. Об этом
свидетельствуют как сведения зарубежных исследователей о высокой частоте
H0 «WHtKCXA» ГРАНСФУЗИОЛОГИЯ
выявления акти-НРА-антител у 50% женщин уже после первой бережин
и наши данные о превалировании частоты аллоиммунизации к антигенами' ^
ЯРА В частотой аллоиммунизации к антигенам системы HLA и об оперев*''
аити-НРА-знтителообраэовании у пациентов с множественными тран^^
тромбоцитов. Если продолжить рассуждения об иммуногенности антигено *Н|1
мы НРА. интегрированных в гликопротеиды мембраны тромбоцитов т» ^
юшуноггнным комплексом должен быть GPIIb/IIIa. Именно этот комплект03*11"
ется самым многочисленным на тромбоците (80 ООО на один тромбоцит) и ° ****
на нем локализовано больше всего антигенов разных систем, в том числе ИУц1*0
0 высокой иммуногенности GPIIb/IIIa свидетельствуют и следующие набшол
• антитела к НРА-1а, интегрированному в a-цепь GPIIIa, значительно*
выявляют при неонатальной и посттрансфузионной тромбоцитопенич
пурпуре по сравнению с частотой обнаружения антител к локализован^
на иных гликопротеидах антигенным детерминантам;
І антитела к антигенным структурам GPIIb/IIIa первыми появляются
иммунизации животных комплексом тромбоцитных белков.
Аллоиимунные реакции
Аллоиммунизация к антигенам эритроцитов, лейкоцитов, тромбоцитов явля¬
ется следствием трансфузий гемокомпонентов, содержащих антигены, отсут¬
ствующие у реципиента. Первичная аллоиммунизация к эритроцитным антигену
становится очевидной спустя недели или месяцы после трансфузий. Именно
поэтому клетки, обусловившие выработку антител, обычно исчезают до того
как циркулирующие антитела достигают значительного уровня. Повторные транс¬
фузии гемокомпонентов, содержащих антигены, к которым реципиенты были
сенсибилизированы, приводят к посттрансфузионным реакциям гемолитического :
или негемолитического типа.
Аллоиммунизация к антигенам эритроцитов возникает, как правило, I
у реципиентов, имеющих в анамнезе множественные трансфузии эритроцитсодер- I
жащих сред. В большинстве случаев реакция бывает отсроченной, но у 30-35% !
реципиентов гемолиз является результатом сочетания высоких уровней антител
и большого количества перелитых эритроцитов.
Наиболее типичными проявлениями отсроченной реакции являются лихорад-
Й; снижение гемоглобина и незначительная желтушность и/или гемоглобинурия. |
Некоторые реакции проявляются как отсутствие ожидаемого увеличения гемоглоби¬
на. Возникновение острой почечной недостаточности маловероятно. Если заподозре-
на. отсроченная посттрансфузионная гемолитическая реакция, необходимо исследо- j
вать сыворотку реципиента на содержание антител и сравнить результаты с данными J
предыдущих тестов. Обнаружение ранее неопределяемых антител пациента с прояв¬
лениями гемолиза указывает на отсроченную гемолитическую реакцию.
Аллоиммунизация к антигенам лейкоцитов встречается чаще, чем к зри-
троцитарным антигенам. Частота аллоиммунизации у реципиентов, получавши
повторные трансфузии тромбоцитов, не обедненных лейкоцитами, составляй j
20-70%. Большинство женщин, имевших 4 беременности и более, имеют анти-
HLA-антитела.
Последующие трансфузии сенсибилизированным реципиентам требуются после
переливаний очень малых доз лейкоцитов, поэтому использование обеднений j
лейкоцитами компонентов может не предотвратить появление антител, если боль
ной был ранее иммунизирован в результате трансфузий или беременностей.
Тромбоцитрефрактерные реакции
Рефрактерность при трансфузии донорских тромбоцитов заключается eofljp
ствии прироста количества тромбоцитов у реципиента. Лизис перелитых тро
готов может быть обусловлен их взаимодействием со специфическими анти-
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦІЙ
861
-делами или связан с антителами, направленными против антигенов эритроцитов
АВО и HLA-антигенов класса 1, присутствующих на тромбоцитах.
к HLA-антигенам могут образовываться в результате множественных.
(гторных трансфузий компонентов крови (тромбоцитов, лейкоцитов и эритро-
цито») (табл- 22-10).
ІМЛГ 22-10- Появление антилейкоцитных антител у больных, сенсибилизированных повторны-
SfjffltMHHflMM крови
(щммстхо трансфузий
[21-25
Количество обследованных больных 1 Сенсибилизированные бальные, I
180
140
30
26
48
из них с антителами
5.0
33,0
57.7
70,4
87,5
В большинстве случаев образующиеся антитела являются лимфоциттоксиче-
скями. Риск сенсибилизации и образования антител зависит от иммуногенности
аггигенов и количества трансфузий (табл. 22-11).
Таблица 22-11. Характеристика иммуногенности основных HLA-антигенов
Антигены HLA
Частота встречаемости антигена, %
Коэффициент иммуиогеииости
А2
48,7
53,6
АЗ
30,3
17.8
А9
27,7
24,1
А1
23,8
28,7
А25
19,4
18,2
А28
6,8
23
і
23,4
62,9
835
22,3
38.9
В12
18,3
32,9
В5
17,6
68,7
815
16,2
16.6
88
15,8
34,4
В40
15,1
51
813
9,4
43,9
В17
8,6
19,2
827
7,0
56,1
К наиболее иммуногенным относятся аллоантигены HLA-A2, HLA-B5, -В7.
-В40, -В35.
С учетом характеристик иммуногенности HLA можно предположить, что у реци¬
пиентов, которые не содержат в своем фенотипе часто встречающиеся и иммуно-
гснные антигены, наиболее высок риск развития сенсибилизации при гемотранс-
Фузиях и образования анти-НЬА-антител.
Предупреждением развития тромбоцитно-рефрактерных реакций являет-
ся использование лейкоцитарных фильтров при трансфузии гемокомпонентов
зля снижения сенсибилизации к антигенам HLA.
■рансфузионно обусловленная болезнь «трансплантат против хозяина»
Одним из наиболее серьезных проявлений иммуномоделирующего действия
е“отрансфузий является болезнь «трансплантат против хозяина* (БТПХ).
ЦІ КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
При БТПХ лонорские Т-лимфоциты пролиферируют и приживаются
нокомпрометированного хозяина, который неспособен отторгать Чу. ^
метки (Hoak i. Koepeke L, 1976). Полагают, что минимальная доза лиыЙЛ1Ч
способная вызывать БТПХ. составляет 107 жизнеспособных клеток (Bruh ^
1988). В среднем одна доза концентратов эритроцитов, тромбоцитов или с
ют» содержит это количество лимфоцитов (Leitman A., Holland Р., 1985\^аи^1о‘
БТПХ. возникающую после гемотрансфузий, назвали трансфузионно L
ленной болезнью «трансплантат против хозяина* (ТР-БТПХ).
Несмотря на огромное количество гемотрансфузий, которые выполняют
мире, І различных клиниках ТР-БТПХ — достаточно редко встречаемая
ГИЯ.
ТР-БТПХ - тяжелейшее осложнение, чаще всего заканчивающееся лета
Анализ 131 случая развития ТР-БТПХ (Greenbaum, 1991) показал, что смеии11*0'
от нее составила 90%. 001
Минимальная доза лимфоцитов, способная спровоцировать ТР-БТПХ, соси
ляет чуть более 100 функционально активных клеток. Врач, готовящий пациент
к гемотрансфузии, должен иметь в виду, что одна доза эритроцитной масс
а тем более тромбоконцентрата или гранулоцитов, способна вызвать заболевание
«трансплантат против хозяина».
Наиболее высок риск развития ТР-БТПХ при гемотрансфузиях у пациентов
с иммунодепрессией при врожденном или приобретенном (химио- и лучевая тера¬
пия) иммунодефиците.
Парадоксально, но в литературе пока не описано ни одного случая ТР-БТЩ
у пациентов с синдромом приобретенного иммунодефицита (СПИДом). Недавние
эксперименты с выборочным снижением CD4+, CD8+ и NK-клеток у реципиен¬
та позволяют предположить, что CD4+ участвуют в патогенезе ТР-БТПХ, тогда
как CD8+ и NK-клетки относятся к механизмам защиты. Этим можно объяснить
отсутствие возникновения ТР-БТПХ у больных СПИДом.
К группе повышенного риска ТР-БТПХ относятся:
S недоношенные новорожденные;
• новорожденные с гемолитической болезнью, получающие внутриматочные
или обменные трансфузии:
• больные с гемобластозами с супрессией костного мозга в результате химио-
или лучевой терапии или с иммунной дисфункцией (как при болезни
Ходжкина);
І иммунокомпрометированные больные, получающие кровь от родителей
и родственников первого поколения или HLA-совместимых доноров;
• реципиенты аллогенного или аутологичного костного мозга;
і больные с выраженным наследственным иммунодефицитным синдромом;
к пара «реципиент-донор» в генетически гомологичных популяциях.
К группе среднего риска ТР-БТПХ относятся пациенты с неходжкинскими
В-клеточными лимфомами и солидными опухолями.
Низкий уровень риска ТР-БТПХ - у доношенных новорожденных, пациентов
со СПИДом и у получающих иммуносупрессивную терапию.
Кроме групп реципиентов, перечисленных выше, ТР-БТПХ описана и у ней» I
мунокомпрометированных больных (беременных, пациентов, перенесших опе¬
рацию на сердце и сосудах или брюшной полости, а также пациентов с активи
ревматоидным артритом и травмами).
у больных лейкозами. Это объясняется тем, что в отличие от БТПХ, возникаю
Клинические симптомы ТР-БТПХ обычно появляются на 8-Ю-и день да
трансфузии. Симптомокомплекс включает лихорадку, диарею, повышение >Р0В
показателей функциональных проб печени, а также возникновение характер
8ЙШ§ ncafouun ЙМПйИГРиипй ucі no nnuav м пазили na lit iLfTTi Г7Р W И И. ООЛ€€ ГЛУ
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 863
трансплвнтацмн костного мозга, гемопоэз при ТР-БТПХ осуществляется клет-
® й реципиента, которые «атакуются» донорскими Т-лимфоцитами,
^диагностика данного осложнения крайне затруднена. Достоверным критери-
является только обнаружение донорских лимфоцитов в кровотоке и тканях
ципиента. Характерные гистологические изменения могут быть обнаружены
до биопсии кожи, в которой обнаруживают дегенерацию в базально-клеточном
яое с его вакуолизацией, разделение дермы и эпидермиса, формирование булл,
ппи биопсии печени возможно обнаружение повышенного количества эозинофи-
^ а при анализе костного мозга выявляют его аплазию с лимфоидной инфиль*
нацией. Использование нескольких методов диагностики позволяет с большей
Лроятностью поставить правильный диагноз.
Лечение ТР-БТПХ малоэффективно. В терапию включают глюкокорти-
коиды, антитимоцитарный глобулин, циклоспорин и циклофосфамид, а также
т-клеточные моноклональные антитела. Данные препараты иногда используют
при БТПХ. возникающей после трансплантации стволовых клеток, но большая
эффективность наблюдается при ТР-БТПХ. Следовательно, основное внима¬
ние необходимо уделять профилактике, которая заключается в предтрансфу-
зионном гамма-облучении клеточных компонентов крови донора. По данным
Национального института здоровья США, среди 8300 больных со злокачествен¬
ными заболеваниями крови, получавших трансплантацию костного мозга
и трансфузии клеточных компонентов крови, не было случаев ТР-БТПХ.
До трансфузии компоненты крови облучали гамма-лучами, т.е. лишали донор¬
ские клетки иммунологической активности.
Посттрансфузионная иммуномодуляция/иммуносупрессия
Гемокомпонентная терапия обладает мощным иммуномодулирующим дей¬
ствием. Вопросы, связанные с влиянием гемотрансфузий на состояние иммунной
системы, остаются до конца не изученными. Отдельного рассмотрения заслужива¬
ют вопросы постгрансфузионной иммуносупрессии. Не затрагивая возможность
передачи с гемокомпонентами микроорганизмов и их способность оказывать вли¬
яние на иммунную систему, следует подчеркнуть, что такие изменения в иммун¬
ной системе реципиентов после гемотрансфузий, как анергия, иммунологическая
толерантность, сниженный иммунный ответ, встречаются с большей частотой,
чем клинически значимая аллосенсибилизация. Внутривенные гемотрансфузии
значительно выраженнее предрасполагают реципиента к анергии, чем к аллоим¬
мунизации.
Одни из первых доказательств об иммуносупрессивном действии гемотрансфузий
были получены при анализе результатов трансплантации почек у больных, имев¬
ших в анамнезе различное количество переливаний компонентов крови (Opelz G.
et al., 1973). У реципиентов аллогенной почки, получавших гемотрансфузии в тече¬
ние длительного времени, снижаются пролиферативная активность лимфоцитов
на митогены и антигены, антигенпрезентирующая функция макрофагов, актив¬
ность естественных киллеров, Т-клеточная пролиферация и секреция лимфокинов
(Fisher Е. et al., 1980), уменьшается количество естественных киллеров и отмечается
инверсия соотношения хелперы/супрессоры за счет снижения CD4*-лимфоцитов,
увеличивается количество С08+-клеток, В-лимфоцитов (Gafter U. et al.. 1992).
Аллогенные гемотрансфузии и предшествующие трансплантации органов и тка-
ней (в частности, при пересадке почек) улучшают результаты приживления транс¬
плантата. Полагают, что активация специфических и неспецифических иммуносу-
прессорных клеток, возникающая в ответ на трансфузию, подавляет специфические
посггрансплантационные реакции при пересадке почки. Определенную роль могут
играть формирующиеся после трансфузии антитела (антилимфоцитарные тепло-
*ые и/или холодовые, идиопатические и др.), которые подавляют клеточную
иммунологическую реактивность организма реципиента.
|g| ШШЧЕЙСАЯ ТРАНСФУЗИОЛОГИЯ
Механизмы иммуносупрессивного воздействия на организм пеци
трансфузий нуждаются в дальнейшем изучении. Иеита ц.
В настоящее время не вызывает сомнений, что гемотрансфузИи cvm^
образом влияют на иммунную систему организма и в конечном итогегт^Ч
жпот течение различных заболеваний - инфекций, онкологических
приживление трансплантата и др.
В этом плане большой интерес представляют данные об инфекционн
нениях у больных хирургического профиля. Так, если послеоперационнь& 0СЛ°*
ции у хирургических больных наблюдаются примерно в 5% случаев то
пиентов, получивших 2 дозы и более аллогенной крови, их частота в ^
до 20-30% (Blumberg N. et al, 1988). При этом реципиенты аутологичнсГ^
имеют такую же частоту инфекций, как и больные, не получившие гемотИ ^
зий (Mezrow С.К. et al., 1993). При гемотрансфузиях компонентов крови щ
рых удалены лейкоциты (лейкоцитарные фильтры), частота І^^Шева’цио^'
инфекционных осложнений снижается до 2 против 20% у больных, получав ■
нефильтрованные компоненты крови.
При гемотрансфузиях надо иметь в виду и возможность реактивации и генеп
лизации латентных вирусных инфекций у реципиентов гемокомпонентов, что вм
к угнетению противоинфекционной резистентности (Sloand E. et al., 1975).
О выраженном влиянии гемотрансфузий на иммунную систему свидетель¬
ствуют и результаты анализов лечения онкологических больных. Так, напримео
при ретроспективном анализе больных колоректальным раком (Blumberg | jj
al., 1988), опухолями легких (Piantadosi S., 1992), у пациентов с аденокарциномой
ободочной и прямой кишки обнаружено увеличение летальности в группе лиц,
получавших гемотрансфузии в периоперационном периоде. Смертность больньп
зависела не только от стадии опухолевого роста, размеров опухоли, но и от транс-
фузионного режима. Аутологичные гемокомпоненты оказывают более благопри¬
ятный эффект в послеоперационный период (Ablin R., Conder М., 1984) и даже
способствует снижению частоты рецидивов колоректальных опухолей (Blaj-
man М.А. et al., 1993).
Следует отметить, что в клинических и экспериментальных исследованиях
при аллогенных гемотрансфузиях выявлена значительная вариабельность опухо¬
левого роста (от усиления до ингибиции) (Blajman М.А. et al., 1993).
В проведенных в последние годы клинических исследованиях показано,
что трансфузионный эффект не может быть объяснен ни стадией опухолевого
роста, ни другими клиническими параметрами. Иммуносупрессия выявлена даже
при единичных трансфузиях отмытых эритроцитов или аллогенной плазмы,
при этом установлены ее дозозависимость и связь с типом применяемого гемоком¬
понента (Wobbes Т. et al., 1989).
Проникновение в периферическую кровь большого количества антигенного
материала, одновременно обладающего аллогенными и идентичными организму
реципиента детерминантами, вызывает многообразные изменения в иммунно
системе. Значительное повышение количества даже аутологичных антигени»
детерминант приводит к снижению активности многих иммунных резки
как это происходит при аутоиммунных процессах. «ей
В процессах гемотрансфузионной иммуномодуляции сУЩественна^,щ(\
принадлежит образующимся циркулирующим иммунным комплексам
Связываясь с различными субпопуляциями лимфоцитов, макрофагов, неитроч»
лов, ЦИК ингибируют активность клеток. ьй0Л
Иммуносупрессия индуцируется и некоторыми факторами норм
плазмы: растворимые HLA-антигены, фермент трансглутаминаза 'так нй0е
ваемый фибринстабилизирующий фактор, или фактор XIII) имеют выра
иммуносупрессивное действие на Т-лимфоциты и способствуют прол“
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 865
лимфоцитов- Введение препаратов плазмы и концентратов факторов сверты-
„ия, содержащих значительное количество фибриногена, приводит к повы¬
шению УРОвня альфа-2-макроглобулина, являющегося иммуносупрессорным
^„том, ингибитором ИЛ-1, способным подавлять пролиферацию лимфоци-
* естественную цитотоксичность и антителозависимый киллинг.
Интерлейкин-1, интерлейкин-6 и ФНО-а являются основной причиной пост-
^„сфузионных фебрильных реакций (Ed. Dunon D., Mackay C.R., 1993). Физио¬
логические эффекты цитокинов, накапливающихся в процессе хранения в контей¬
нера* с гемокомпонентами и попадающих в организм реципиента, не учитываются
доопределении показаний и не всегда сочетаются с задачами гемотрансфузии.
Постгрансфузионную иммуносупрессию следует рассматривать как результи-
пуюшую всех четырех основных иммунопатологических синдромов (Петров Р.В.
„др., 1984):
• инфекционного,
• аллергического,
I аутоиммунного,
• лимфопролиферативного.
Оптимизация функционального потенциала иммунной системы, обеспечи¬
вающей постоянство внутренней среды организма, — одна из важнейших задач
при лечении больных.
Профилактику иммуномоделирующего действия гемотрансфузий осуществляют
на основе диагностического мониторинга функционального состояния иммуни¬
тета и неспецифической резистентности. Такие процедуры, как удаление лейко¬
цитов из эритроцитной массы и плазмы, подбор гистосовместимых пар «донор-
реципиент», максимальная реализация правила «один донор — один реципиент»,
использование аутологичных гемокомпонентов и др. позволяют минимизировать
отрицательные иммунологические последствия гемотрансфузий.
Возможные реакции после трансфузий аутологичной крови
Несмотря на очевидные преимущества метода аутологичной гемотрансфузии,
в литературе имеются ссылки на посттрансфузионные реакции, возникающие
после реинфузии аутокрови.
Аутогемотрансфузия не устраняет риск бактериальной контамина¬
ции, которая чревата развитием посттрансфузионного сепсиса. Среди причин,
приводящих к бактериальной контаминации аутокрови, выделяют следующие:
скрытую бактериемию у пациента и менее тщательный отбор аутодоноров,
а также в некоторых случаях — более длительные сроки хранения аутоком¬
понентов (преимущественно аутоэритроцитной массы и цельной аутокрови).
Наиболее часто выявляемая микрофлора — Yersinia entrocolitica. Для увеличения
длительности хранения аутоэритромассы возможно применение лейкодеплеции.
Необходимо отметить, что заготовка аутокрови из катетера, установленного
I Центральной вене, нежелательна, в исключительных случаях возможна после
отрицательного результата бактериологического посева крови, взятой из цен¬
тральной вены.
Трансфузия аутокомпонентов может привести к фебрильной негемолити¬
ческой посттрансфузионной реакции (ФНГПТР). Среди причин ее разви¬
тия - аутолейкоцитарная контаминация, накопление в процессе хранения эндо-
тенных провоспалительных цитокинов (IL-ip, IL-6, TNF-a). которые обладают
Сраженными пирогенными свойствами. При этом длительная консервация
^компонентов, особенно в случаях хранения цельной аутокрови, значительно
Увеличивает риск развития ФНГПТР. Целесообразно заготавливать аутокровь
Фоки, приближенные к дню плановой операции. В целях профилактики этого
^ожнения с успехом применяют лейкоцитную редукцию, после которой ауто-
Ритромасса может храниться те же сроки, что и аллогенные компоненты.
ggg КЛШШЧЄСМЯ ТРАНСФУЗИОЛОГИЯ
Аутогемотрансфузня не устраняет риск технических пощ
которые могут привести не ТОЛЬКО К осложнениям ВО время процет В°С!м
км аутокрови, но и к перекрестной трансфузии несовместимой по си Ы Ззг°%
Й-фактору крови пациентов. Возможна потеря аутокомпонентов вел*л1,е %)
чения срока хранения, отказа от трансфузии или отмены операции к Ие,%
ве исключен технический брак — некачественная венепункция, ВслелР°Ме тцц,
значительно увеличивается время эксфузии крови и ухудшается качеств Ие ЧеП)
понентов, возможен разрыв гемоконтейнера во время Центрифугирован
Аутокровь при хранении претерпевает те же изменения, что и а
кровь: накапливаются продукты жизнедеятельности эритроцитов (aммЛЛ0ГeI,,la,|
вина, лактат), провоспалительные цитокины (TNF-a, IL-1J3, IL-6), внекЗК M04e'
калий, снижается pH, нарастает концентрация свободного гемоглобина ЄТ0ЧііЬ|й
деградации фибриногена. Кроме того, формируются клеточные микп*0^8
и микроагрегаты, количество которых пропорционально длительности х
Кроме того, предоперационная заготовка, во многих случаях неодим*01’1'
многоэтапная, а также медикаментозная терапия анемии приводят к
стоимости лечения, при этом стоимость 1 ед. аутокрови, заготовленной в Ш
ный гемоконтейнер, на 30% превышает таковую аналогичного объема |Р|Й
крови. Стоимость аутокомпонентов, заготовленных методом аппаратного йЩ*
возрастает еще существенней. Снижению стоимости способствует индивш
зированная программа заготовки аутокомпонентов в соответствии с реальш
потребностями в аутокомпонентах.
Несомненно, что чрезмерная аутодонация приводит к ятрогенной анемии
которая может увеличить потребность в трансфузии аллогенной крови во время
операции. При этом степень предоперационной анемии во многом определяется
интенсивностью донации, сроком заготовки аутокомпонентов, а также наличием
и адекватностью терапии анемии препаратами железа, витаминами, рекомби¬
нантным эритропоэтином. В ряде случаев резервирование аутокрови сопряжено
с задержкой планового хирургического вмешательства вследствие необходимого
для заготовки аутокрови времени.
Одной из распространенных кровесберегающих технологий является интраопе¬
рационная аппаратная реинфузия аутокрови, позволяющая сократить потребность
в компонентах аллогенной крови и тем самым снизить частоту посттрансфузион¬
ных реакций. Однако несоблюдение необходимых требований к качеству отмыва¬
ния аутоэритроцитов приводит к осложнениям, присущим данной методике.
Далее представлены осложнения интраоперационной аппаратной реинфузии
аутокрови.
I Бактериальная контаминация реинфузируемой крови, которая воз¬
можна не только при попадании в реинфузат кишечного содержимого,
но и при проникновении инфицированного раневого содержимого в реин-
фузируемую кровь. При этом режим максимально тщательного отмывания
не гарантирует стерильность реинфузата, лишь отчасти эту проблему решает
лейкодеплеция.
а Воздушная эмболия — встречается в экстренных ситуациях при реинфу¬
зии неотмытой крови под давлением. Данное осложнение возможно также
при неисправности воздушных сенсоров на линии возврата крови.
• Осложнения, вызванные реинфузией неотмытой или некачественно
отмытой аутокрови:
❖ реинфузия гемолизированной крови приводит к гемоглобинури.
почечной дисфункции, а в тяжелых случаях - к острой почечной нед
статочности. Среди причин гемолиза — разрежение вакуума отсоса
150 мм рт.ст., применение травматичных металлических наконечн
отсоса с небольшими отверстиями, попадание в реинфузат большого
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 867
чесгва воздуха. Кроме того, качество аутокрови значительно снижается
при некачественном отмывании и использовании укороченного цикла
отмывания эритроцитов;
л попадание в циркуляцию биологически активных веществ — IL-ip,
IL-6. TNF-a, сериновых протеаз, в том числе полиморфнонуклеарной
эластазы {polymorfhonuclear elastase — PMN) — приводит к синдрому воз¬
вращенной крови. Клинический симптомокомплекс включает острый
дистресс-синдром взрослых, ДВС, неуправляемую гипотензию, синдром
системного воспалительного ответа. Значительную роль в этом процессе
отводят PMN-эластазе: увеличение концентрации этой сериновой протеа¬
зи свидетельствует о поражении или разрушении гранулоцитов в процессе
реинфузии. Эластаза оказывает поражающее воздействие на ткани орга¬
низма за счет деградации фибриногена, эластина, протеогликанов. Кроме
этого, показано, что PMN-эластаза инактивирует ингибитор активатора
плазминогена I типа, следствием чего является активация фибринолиза;
Ф коагулопатия (гипокоагуляция) — попадание в циркуляцию активизи¬
рованных факторов крови, тканевого тромбопластина (из раневой поверх¬
ности, стромы разрушенных эритроцитов), продуктов деградации фибри¬
ногена, D-D-димеров фибриногена приводит к коагулопатии. Нарушения
свертывания крови усугубляются потерей тромбоцитов, а также примене¬
нием для стабилизации реинфузируемой крови гепарина4 (качественно
отмытая аутоэритроцитная масса практически не содержит гепарина4).
Диагностика коагулопатий основывается на удлинении АЧТВ, МНО;
0 попадание инородных веществ и биологических материалов -
неотмытая кровь может содержать костные фрагменты, жир, некротизи-
рованные ткани, местные гемостатические, цементирующие материалы,
лекарства, жидкости, применяемые для обработки операционного поля
(перекись водорода и т.п.), микрочастицы операционного белья, тальк.
Примесь этих веществ в реинфузате требует тщательного отмывания
и фильтрации через лейкоцитные фильтры.
В заключение следует добавить, что патологические воздействия или нежела¬
тельные реакции гемотрансфузий на организм реципиента проявляются очень
многообразно и подразделяются на следующие группы:
• иммунологическую несовместимость крови, которая проявляется в виде
иммунизации и отторжения (аллоиммунизации, гемолиза внутри- и внесо-
судистого);
І инфицированность донорских компонентов, в том числе такими редки¬
ми заболеваниями, как бабезиоз, болезнь Шага, болезнь Лайма, болезнь
Крейцтфельдта-Якоба (БКЯ — человеческая форма губчатого энцефали¬
та, дегенеративного фатального поражения нервной системы), болезнь
Сен-В (заболевание связывают с гепатитами у пациентов, оперированных
на сердце и получавших гемотрансфузию), вирусный гепатит G (обнаружен
у 2% доноров в США), вирус Западного Нила (передается через эритроциты
игранулоциты донорской крови);
• метаболическое несовершенство донорской крови в результате:
Ф накопления лейкоцитных провоспалительных цитокинов (IL-1, IL-8, IL-6,
TNF);
1 повышения содержания плазменного калия и продуктов белкового мета¬
болизма (аммиака, мочевины), которые накапливаются в процессе хране¬
ния, жизнедеятельности клеток крови;
Ф свободного гемоглобина, мембран лизированных эритроцитов — увеличе¬
ние длительности хранения компонентов крови приводит к существенно
му снижению осморезистентности мембран эритроцитов и их лизису;
fgjg КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
і изменения pH крови — существенное снижение В проце—
гемокомпоненты содержат цитрат натрия, который в
гемотрансфузии снижает содержание ионизированного
реципиента);
а потерю функциональных свойств в процессе консервации
генных гемокомпонентов вследствие:
1 уменьшения сродства гемоглобина к кислороду;
1
❖ снижения содержания 2,3-ДФГ;
❖ нарушений свертывающих свойств вследствие недостатка тпп
факторов свертывания крови (V, VIII и др.) в гемокомпонент^МбоЦитЧ
❖ ухудшения реологических свойств гемокомпонентов;
1 негомогенность переливаемых препаратов крови — наличие агрегат
і сгустков фибрина (в 1 мл двухнедельной крови содержится окГ10^
микросгустков), при этом количество микроагрегатов зависит как° ^ ^
тельности хранения гемокомпонента, так и от качества консерванта ^ ^
контейнера. Ге*о-
Исходя из вышесказанного можно утверждать, что зачастую постгрансА
ные реакции носят ятрогенный характер. Ятрогенные осложнения - это наг!!!!
ленное ИЛИ неизбежное ухудшение СОСТОЯНИЯ пациентов, вызванное медицин"011
ми вмешательствами. СКи
Классификация возможных ятрогенных осложнений гемотрансфузий предел
лена следующим образом:
I неизбежное действие гемотрансфузии, например риск инфицирования боль¬
ных, метаболических расстройств;
І неправильный выбор препарата, дозы или режима гемотрансфузии, превы¬
шение показаний к гемотрансфузиям;
я погрешности, связанные с несоблюдением или нарушением существующц
инструкций, например, иммунные реакции на кровь — от аллергической
реакции до острого гемолиза и гибели реципиента, а также технические
погрешности - флебит, воздушная эмболия.
Таким образом, трансфузии компонентов аллогенной крови требуют выпол¬
нения всех инструктивных требований безопасности переливания крови. Кроме
того, внедрение в практику новых методов профилактики посттрансфузионньп
реакций, безусловно, приведет к снижению их частоты.
К перспективным методам профилактики ПТ-реакций относятся:
і внедрение современных тестов, позволяющих выявить гемотрансмиссив-
ные инфекции на ранних этапах инфицирования — метод ПЦР ТНК - теп
на нуклеиновые кислоты (ТНК), определяются незначительные количества
вирусных нуклеиновых кислот до появления в крови специфических антиге¬
нов, выявляемых принятыми методами скрининга. При этом период «окна»
гепатита С сокращается с 82 до 25, а ВИЧ-1 - с 22 до 11 дней;
• лейкоцитная редукция с помощью лейкофильтров на этапе заготовки
до или после хранения в Банке крови, во время трансфузии (прикроватные),
фильтры in-line (используют при аппаратном аферезе). Альтернативой л
кофильтрам являются следующие компоненты крови: ЭМОЛТ, отмыл*
эритроциты; .
І методы удаления патогенов — инактивация инфекционных агентов с
щью детергентов-растворителей и методами ФХО, для эритроцитсод Р
щих сред детергенты эффективны против оболочечных и безоболоч
вирусов, грамположительных и грамотрицательных бактерий, параз '
Для инактивации плазмы применяют растворители-детергенты, к ^
эффективны против вирусов с липидной оболочкой (применяют в объеди ^
пулах около 1500 доз плазмы) и фотохимическую обработку с испол
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 869
-Jena HCl (S59) (подавляет репликацию вирусов, оказывает минимальное
«ающее действие на плазменные белки),
дяя инактивации тромбоцитов возможно применение фотохимического облу¬
чив с использованием псоралена HCl (S59) в сочетании с длинноволновым
?ф-о6лучением (320-400 нм). Основным недостатком методов инактивации ком-
иентов крови является их высокая стоимость.
РЕАКЦИИ ПРИ ТРАНСФУЗИЯХ КРОВЕЗАМЕНИТЕЛЕЙ
При применении современных кровезаменителей посттрансфузиологические
ции и осложнения в клинической практике наблюдаются редко.
1д0 данным различных авторов, при трансфузии декстранов частота анафи-
ктических реакций и осложнений колеблется от 0,5 до 10% и более. Реакции,
возникающие после применения кровезаменителей, составляют 14,6% всех пост-
гоансфузионных реакций.
Частота посттрансфузионных реакций при переливании кровезаменителей
(поданным Watkins и Ring, 1999) представлена в табл. 22-12.
Таблица 22-12. Частота посттрансфузионных реакций при переливании кровезаменителей
Кровезаменители
По Watkins
По Ring
мовые препараты
1:10000
1:10 000
Желатин
1:1000
1:1000
Декстраны
3:10 000
3:10 000
Высокомолекулярные кровезаменители оказывают сложное действие на кровь
больного: с одной стороны, повышают агглютинабельность эритроцитов реципи¬
ента, а с другой — изменяют свертывающую способность (гипокоагуляция).
У больных, которым намечают инфузии растворов декстрана или повидона
(поливинилпирролидона*), необходимо определить группу крови и Rh-принад¬
лежность до начала трансфузии. Это связано с тем, что высокомолекулярные
кровезаменители могут изменить агглютинабельность эритроцитов и реакция
определения групп крови будет прочитана неверно.
Выделяют следующие реакции после трансфузии кровезаменителей:
І технологического генеза — воздушная эмболия, эмболия инородными вклю¬
чениями, взвешенными в растворах;
I волемическая перегрузка, в частности сердца, при быстром введении боль¬
ших количеств растворов;
І вливания инфицированных кровезамещающих жидкостей;
• пирогенные;
• анафилактические;
І зависящие от первичной токсичности раствора;
• обусловленные токсичностью, приобретенной растворами в процессе хранения;
• связанные с влиянием кровезамещающих растворов на кровь реципиента
(ложной агглютинацией, кровоточивостью).
Пирогенные, токсические и анафилактические реакции, по мнению В.Н. Шаба¬
лина и соавт. (1982), необходимо выделить в специфические реакции, которые зави¬
сят от особенностей состава, структуры кровезаменителей и степени их очистки.
Пирогенные реакции обусловлены недостаточной очисткой препаратов
w бактериальных и клеточно-тканевых пирогенов, а также образованием био¬
логически активных продуктов в результате контакта бактериальной флоры
с белками плазмы.
По клиническому течению и последствиям это наиболее легкие и непродол¬
жительные реакции, которые ограничиваются, как правило, учащением пульса
11815-20 в минуту, появлением озноба, повышением температуры тела на 1,5-2 'С.
070 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
1
Токсические реакции в зависимости от времени проявления
на ранние и поздние. 'і і ;> .
Ранние токсические реакции могут быть вызваны вредным вги
химических веществ, находящихся в растворах, вследствие плохой ЗДе^Ст*Не
Я производстве или в результате образования сразу же после ВвИХ
творов в кровеносное русло. Клинически характеризуются тошнотп'ЄНИя РЧ-
судорожным синдромом, нарушением сердечной деятельности. При РВотОІІ
каких-либо признаков токсичности вливание необходимо немедленн1°ЯВі1Єн,"і
Я тить. Интенсивная терапия должна быть направлена на поддержание
жизненно важных органов, профилактику печеночно-почечной недоста ^
и нарушений системы PACK. аточнос?и
Необходимо напомнить, что сходные с токсическими реакциями осл
могут наблюдаться при быстром введении гидролизатов и аминокислотн*Н{Н1111
творов. Но. как правило, признаки токсичности полностью устраняются п '* ^
ленном внутривенном капельном вливании этих растворов. МеД-
Поздние токсические реакции. При несоблюдении температурных и
режимов хранения и введения в растворах может происходить спонтанная ^
меризация с образованием высокомолекулярных фракций, образующих °*Н'
или выпадающих в осадок. Чаще всего поздние токсические реакции возник
при введении КОЛЛОИДНЫХ растворов, которые имеют высокую М0ЛЄКУЛЯПН№
массу. Эти реакции развиваются через 2-3 нед после инфузии и характеризуй^
ся нарушением функций многих органов и систем: повышением проницаем^
капилляров, развитием геморрагического синдрома с явлениями диффузного гло¬
мерулонефрите, токсического гепатита и др.
Аллергическая реакция может возникнуть и на первое введение декстранов
Полагают, что реакция может быть связана с сенсибилизацией реципиента к дек-
страну в результате наличия примесей этого полимера в пищевых углеводах либо
в связи с образованием антител к антигенам микроорганизмов у пациентов, пере¬
несших инфекционно-воспалительные заболевания. Это подтверждается и тем,
что у больных с гнойными процессами реакции на вливание полиглюкина воз¬
никали чаще.
Анафилактические реакции и анафилактический шок могут возникнуть
при введении растворов, полученных путем бактериального синтеза или включаю¬
щих белковые вещества. Известно, что полярные концевые группы синтетически
полимеров способны вступать в комплексные соединения с белками, метаболи¬
тами и другими химическими веществами и образовывать высокоиммуногенные
соединения. Декстран при повторном введении способен стать причиной типич¬
ной анафилактогенной реакции, которая может протекать с различной степенью
тяжести клинических проявлений.
Рекомендация не переливать кровь, эритроцитную массу или плазму крови
одновременно с препаратами декстрана основана на том, что адсорбированные
на эритроцитах молекулы декстрана, а также соединенные с белками плазмы
крови являются более выраженными антигенами, чем собственно декстран.
Клиническая картина сходна с наблюдаемой при лекарственном анафилак¬
тическом шоке: острая боль за грудиной, удушье, головная боль, боли в животе,
пояснице, тошнота, рвота, непроизвольные мочеиспускание и дефекация после
введения нескольких миллилитров (10-20, иногда 50) полиглюкина.
Важное, а иногда решающее значение в генезе смерти от анафилактическо
шока имеет гипоксия. Клинически она проявляется цианозом кожи, лица, ДО1
кистей рук, верхней половины туловища, частым и шумным дыханием, поДО
жением артериального давления до критического уровня, тахикардией до
ударов в минуту, аритмией. Резкий цианоз развивается до появления ПРИЗН*
нарушения кровообращения и остановки сердечной деятельности. Грудная кл
ПОСТТРАНСФУЗИОННЫЕ РЕАКЦИИ 871
-,вает в положении глубокого вдоха, больной синеет на глазах. Потере созна-
ШШШ предшествуют психомоторное возбуждение, чувство страха, судороги,
быстро наступают остановка дыхания и клиническая смерть.
При первых же признаках анафилактической реакции необходимо немедленно
кратить трансфузию и начать реанимационные мероприятия, направленные
Поддержание функции жизненно важных органов и систем организма.
* следует помнить, что тщательный учет показаний и противопоказаний к гемо*
-нсфузии. соблюдение установленных правил по технике и методике выполне¬
нии всех серологических реакций позволяют провести процедуры переливания
крови, ее компонентов и кровезаменителей в подавляющем большинстве случаев
^отрицательных последствий для пациента.
СПИСОК ЛИТЕРАТУРЫ
Аграненко В.А., Скачилова Н.Н. Гемотрансфузионные реакции и осложнения. - М.:
Медицина, 1986.- 238 с.
Воробьев А.И. Острая кровопотеря и переливание крови // Анестезиология и реанимато¬
логия (приложение). - 1999. - С. 18-26.
Гаврилов O.K. Биологические закономерности регулирования агрегатного состояния крови
н задачи ее исследования // Пробл. гематол. и перелив, крови. - 1979. - N»7. - С. 16-24.
Голосова Т.В. и др. Ретроспективное исследование очага гепатита у доноров плазмы //
Гематология и трансфузиология. — 1993. — С. 42-44.
Доменик Виньон. Риск, связанный с переливанием крови // Анестезиология и реанима¬
тология (приложение). — 1999. - С. 27-42.
Изоиммунология и вопросы клиники и лечения гемотрансфузионных осложнений:
Сборник инструкций. - М., 1979. — 264 с.
Константинов Б.А., Рагимов А.А., Дадвани С.А. Трансфузиология в медицине. - М.: Аир-
Арт, 2000.-528 с.
Минеева Н.В., Кирина О.Н. Гемолитические трансфузионные реакции: причины возник¬
новения, механизмы развития, вопросы профилактики // Трансфузиол. медицина. - СПб.,
1995.-№5.-С. 73-75.
Петровский Б.В. Переливание крови в хирургии. — М.: Медицина, 1954.
Петровский Б.В., Аграненко В.А. Методы переливания крови: Руководство по общей
и клинической трансфузиологии. — М.: Медицина, 1979.
Петровский Б.В., Гусейнов Ч.С. Трансфузионная терапия в хирургии. - М., 1971.
Рагимов А.А., Дашкова Н.Г. Трансфузионная иммунология. - М.: ВУНМЦ, 2000. - 284 с.
Румянцев А.Г., Аграненко В.А. Клиническая трансфузиология. - М.: Макс Пресс, 2002. -
643 с.
Филатов А.Н. Опасность и осложнения при переливании крови и кровезаменителей.
Руководство по переливанию крови и кровезаменителей. — Л.: Медицина, 1973. - С. 453-498.
Шабалин В.Н., Серова Л.Д., Бушмарина Т.А. Изоиммунные посттрансфузионные реакции
негемолитического типа: Методика и техника переливания крови. - Л., 1975. - С. 92-94.
Anderson К.С., Weinstein H.J. Current concept: Transfusion associated graft-versus-host dis¬
ease // N. Engl. J. Med. - 1990. - Vol. 323. - P. 315-321.
Brigham K.L., Kariman K., Harris T.R. et al. Correlation of oxygenation with vascular permea-
bility-surface area but not with lung water in humans with acute respiratory failure and pulmonary
edema//J. Clin. Invest. - 1983. - Vol. 72. - P. 339.
Brinson R„ Guild R., Kolts B. Diarrhea and hypoalbuminemia in a medical intensive care unit //
Gastroenterology. - 1985. - Vol. 88. - P. 1336.
Brubaker D., Romnie C. The in vitro evaluation of twofilteis for white cell-poor peatelet rancen¬
tes//Transfusion. - 1988. - Vol. 18. - P. 383.
Conlreras M. Immunomodulatory effect of blood transfusion: an overestimated problem //
European School of Transfusion Medicine. — St. Petersburg. 1993. - P. 35-41.
Deitch E.A., Winterton J., Berg R. The gut as a portal of entry for bacteremia /,' Ann. Surg. -
N87. - Vol. 205. - P. 681.
Greenwalt T. Pathogenesis and management of haemolytic transfusion reaction // Sem.
Hematol. - 1981. - Vol. 18. - P. 84-94.
Guyton A.C., Lindsey A.W. Effect of elevated left atrial pressure and decreased plasma protein
concentration on the development of pulmonary edema // Circ. Res, - 1959. — Vol 7. - P. 649.
072 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
HoikJ.C.. Коереке J.A. Platelet transfusion //Clin. Heraatol. — 1976. ~ Vol.5 _p
Hahn D.C. Макау R.D., Halliday B. et al. The effect of Oa tension on microbicidal
leukocytes in wounds and in vitro // Surg. Forum. — 1976. — Vol. 27. - P. p|
Huetis D.W.. Bove J.K.. Buseh Sh. (eds). Practical blood transfusion. - Boston- Litti
Co. 1981. - P. 489. ' • Ьгіц
Kanter M.H. Transfusion-associated graft-versus-host disease: do transfusions from
degree relatives pose a greater risk than those from first-degree relatives // Transfus Й
Vol. 32.-N 4.-P. 323-327. ' ~ 1992-
Lenner P.. Holland P. Diagnosis and Management of Transfusion Reactions / L Pen
(eds) // Clinical Practice of Transfusion Medicine. — NV: Churchi U Zivingstone, 1995 _ ,).et 4
Merphy W.G. Adverse effects and complications of transfusion // Quality
Transfusion Medicine. - CRC Press, 1993. — P. 443-469.
Moliison P. et al. (eds): Blood Transfusion in clinical Medicine // Blackwey publ - ion,
P. 1112.
Moore F.A., Moore E.E., Jones T.N. et al. TEN versus TPN following major abdominal tranm.
Reducing septic mortality. J Trauma 29:916, The crystalloid versus colloid controversy; Bias u!
and toss-up//Theor. Surg. 4. — 1989. — Vol. 205. §Ц|
Pappova E.. Bachmeier W., Crevoisier J. L. et al. Acute hypoproteinemic fluid overload: ii
determinants, distribution and treatment with concentrated albumin and diuretics //Vox. Sana
1977.1 Vol. 33.1 P. 307.
Parkins H. Safety of the blood supply: making decisions in transfusion medicine / S. Nam*
(ed) // Blood Safety: curent Challenges. — Bethesida: AABB, 1992. — P. 125.
Petz L. et al. Transfusion-associated graft-veisng-host desiase in immunocompetent patients//
Ibid. - 1993.1 Vol. 33. - P. 742.
Popovsky M. et al. Transvusion related acute lung injnry: neglected, serious complication of
tnerapy // Ibid. - 1992. - Vol. 32. - P. 589.
Popovsky M.A., Moore S.B. Diagnostic and pathogenic considerations in transfusion-related
acute lung injury // Transfus. - 1985. — Vol. 25. — P. 573.
Puri V.K.. Weil M.H., Michaels S. et al. Pulmonary edema associated with reduction in plasma
oncotic pressure // Surg. Gynecol. Obstet. — 1980. — Vol. 151. — P. 344.
Rock G., Segafchian M.G. (eds) // Quality assurance in Transfusion medicine. Vol. III. Meth¬
odological advances and clinical aspects. — CRC Press, Boca Raton, Ann Arbor - London, Tokyo,
1990. - P. 450.
Shoemaker W.C., Hauser C.J. Critique of crystallloid versus colloid therapy in shock and shod
lung // Crit. Care Med. - 1979. - Vol. 7. - P. 117.
Sibbald W.J., Warshawski F.J., Short A.K. et al. Clinical studies of measuring extravascular lung
water by the thermal dye technique in critically ill patients // Chest. — 1983. - Vol. 5. - P. 725.
Wexler L.B. et al. The fate of citrate in erythoblastic infants with exchange transfusion //J. dia
Invest. - 1949. - Vol. 29 - P. 474.
Zarins C.K.. Rice C.L., Peters R.M. et al. Lymph and pulmonary response to isobaric reduction
in plasma oncotic pressure in baboons // Circ. Res. — 1978. — Vol. 43 — P. 925.
Глава 23
Парентеральное питание
Введение
Парентеральный путь доставки питательных компонентов свя¬
зан с внутрисосудистым (как правило, внутривенным) доступом.
Их использование в виде биологически активных веществ, непо¬
средственно включенных в метаболический путь, требует про¬
фессиональных знаний биохимии и метаболических процессов,
протекающих в организме человека. Оценка жизненно важных
систем организма связана с постоянным контролем клинического
состояния пациента. Мониторинг состояния питания и последую¬
щей эффективности проводимого лечения связан с тщательным
лабораторным контролем, требующим знания клинической лабо¬
раторной диагностики. Специальной подготовки требует и выбор
средств питания, которые по современной классификации относят¬
ся к группе кровезаменителей.
Использование парентерального питания (ПП) в качестве средства
инфузионной питательной терапии связано с объемом знаний, сопо¬
ставимым с требованиями, предъявляемыми врачу-трансфузиологу.
Поскольку ПП связано с существенной водной нагрузкой, способ¬
ной привести к нарушениям гемодинамики и кислотно-основного
состояния, трансфузиолог должен учитывать не только особенности
ПП, необходимого в определенной клинической ситуации, но и взве¬
сить все риски и возможные осложнения, связанные с применением
вводимых препаратов, соотнести и оптимизировать использование
других кровезаменителей, компонентов и препаратов крови.
Недостаточность питания — несоответствие поступления и рас¬
хода питательных веществ и энергии, приводящее к снижению массы
тела и изменению гомеостаза организма, распространенное среди
больных, находящихся на амбулаторном или стационарном лечении.
Если недостаточность питания отмечают у 10% амбулаторных боль¬
ных, то при поступлении в стационар ее регистрируют уже у 30-60%
пациентов, при этом тяжелую степень — в 10-25% случаев.
Среди получающих амбулаторное лечение чаще всего недостаток
питательного (нутритивного) статуса отмечают у пациентов, стра¬
дающих онкологическими и хроническими заболеваниями дыха¬
тельной и сердечно-сосудистой систем.
По некоторым данным, распределение недостаточности нутри¬
тивного статуса среди госпитализированных пациентов следующее:
1
го
(74 КЛИНИЧЕСКАЯ ТМНС4УЭИОЛОГИЯ
а пожилые - 50%;
• І респираторными заболеваниями — 45%;
• воспалительными заболеваниями кишечника — 80%;
• злокачественными опухолями — 85%.
Недостаточность питания широко распространена у пациентов невроло
ПрофиЛЯ Причины невозможности полноценного естественного
нарушение акта глотания (из-за отсутствия сознания или обструкцийЛ,П1111
дарительного тракта);
• нарушение пищеварения (мальдигестия) при заболеваниях, сопрово-
шихсн ферментной и билиарной недостаточностью; ^
а нарушение всасывания (мальабсорбция) при различных заболевании
ника; "«юте,.
I невозможность утилизации ассимилируемых нутриентов при разлита
врожденных или вызванных стрессовыми ситуациями патологических^1
нениях метаболизма, в том числе при ожогах, травме, сепсисе, хиттг
ском вмешательстве. ^ГНч-'
Недостаточность питания может привести:
• к инфекционным осложнениям;
І вторичной полиорганной недостаточности;
I увеличению продолжительности пребывания в стационаре;
I повышению стоимости лечения;
і замедлению выздоровления и повышению летальности.
Необходимость питательной поддержки для пациентов различных отделений
многопрофильного стационара не вызывает сомнений. Множество дискуссий
посвящено способу доставки питательных компонентов — парентеральному (вну¬
тривенному) или энтеральному. В зависимости от этого выделяют два вида искус¬
ственного лечебного питания (ИЛП); ПП и энтеральное (ЭП) или энтерально-
зондовое (ЭЗП) питание.
Каждый из этих способов доставки питательных веществ обладает определен¬
ными достоинствами и недостатками. ЭЗП — более физиологичное и относитель¬
но дешевое. Нефизиологичность же парентерального пути введения питательны
компонентов компенсируется биологической активностью последних, что позво¬
ляет оказывать целенаправленное влияние на метаболические процессы и быстрее
достигать необходимых результатов.
Многолетний опыт использования ИЛП в Российском научном центре хирургии
им. академика Б.В. Петровского РАМН показал, что 60% пациентов многопрофиль¬
ного хирургического стационара нуждаются в нутритивной поддержке. В послеопера¬
ционном периоде ИЛП получают 25% прооперированных пациентов, из них более №
больных требуют полного ПП, около 7% — сочетания парентерального и энтерально¬
го питания, а остальные могут получать нутритивную поддержку энтеральным путем.
По данным РНЦХ РАМН, ИЛП получают около 25% прооперированных больных
10,6% ЭП; 7,3% - ПП; 7,1% — ЭП + ПП. Они согласуются с результатами, получи»'
нымл в ходе проведения Nutrition Day в европейских госпиталях.
Основная цель ИЛП - обеспечение энергетической ценности рациона и предол-
вращение белковой недостаточности.
ОСНОВНЫЕ ПРИНЦИПЫ ИСКУССТВЕННОГО ЛЕЧЕБНОГО ПИТАНИЯ
• Своевременность начала ИЛП: кахексию легче предупредить, чем лечить.
S Оптимальность сроков ИЛП: назначать ИЛП следует до момента ставили
ции основных параметров трофического статуса — метаболических,
метрических, иммунологических (10-14 сут — срок обновления структур
го Epii в гепатоцитах). йТ).
• Полноценность ИЛГІ: сбалансированное обеспечение пациента всеми
тельными компонентами — белками, жирами, углеводами, визами
и минеральными веществами.
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 875
ДИАГНОСТИКА НЕДОСТАТОЧНОСТИ ПИТАНИЯ И ЕГО ОЦЕНКА
^^достаточность питания часто диагностируют и корректируют несвоевремен¬
но связано с отсутствием у персонала надлежащей подготовки в области
ЯргоД°в нутритивной терапии, нехваткой протоколов для исследования и оценки
«■яостаточностя питания, необходимого лабораторного оборудования и неадек-
*^ocn>(o предпринимаемых в связи с этим действий.
Первичное обследование должно быть простым, быстрым и доступным для про¬
дления средним медицинским персоналом. Оно основано на Ноттингемском
іюде скрининга и включает оценку:
, степени непроизвольной потери массы тела:
• полноценности питания в последнее время;
« индекса массы тела в настоящий момент;
. тяжести заболевания.
показатели оценивают по четырехбалльной системе. Если пациент набрал
более четырех баллов, то его направляют к члену бригады нутритивной поддерж¬
ки, проводящему детальную оценку нутритнвного статуса.
Принципы оценки недостаточности питания следующие.
• Анамнез и осмотр пациента (анализ потери массы тела, аппетита, симптомов
желудочно-кишечных нарушений и проводимого ранее медикаментозного
лечения, а также измерение температуры тела). Рацион питания пациента
следует проанализировать с точки зрения качества и количества иутриентов.
I Стандартное обследование клинического состояния больного: измерение
температуры тела, частоты сердечных сокращений (ЧСС), артериального
давления (АД), ЭКГ, рентгеноскопия и дополнительные исследования (УЗИ
органов брюшной полости, эндоскопические исследования. КТ. фистулогра-
фия, МРТ и др.).
• Функциональная оценка — обнаружение психических и физических наруше¬
ний, связанных с недостаточностью питания. Оценивают качество мышеч¬
ных сокращений, физическую выносливость, функцию внешнего дыхания
(пиковую скорость выдоха, объем форсированного выдоха за 1си др.).
t Лабораторные тесты — исследование периферической крови, определение
концентрации альбумина и С-реактивного белка в крови. Важным считают
измерение содержания калия, кальция, магния, фосфора, цинка, железа,
витаминов и микроэлементов, поскольку возможно развитие их недостаточ¬
ности. Кроме того, определяют активность ферментов печени, концентрацию
мочевины и креатинина, что позволяет оценить состояние печени и почек.
Немаловажен регулярный контроль содержания глюкозы в крови (особенно
при назначении ПП) и триглицеридов для оценки липидного обмена.
Водный баланс — важная составляющая нутритнвного статуса. Пациента осма¬
тривают в целях определения возможных отеков или признаков дегидратации.
Необходимо ежедневно следить за массой тела и записывать изменения водно¬
го баланса, вести его график и измерять концентрацию креатинина. мочевины
и электролитов в крови (по клиническим показаниям).
Методы оценки нутритнвного статуса таковы.
• Антропометрические — отражают изменения измеряемых анатомических
параметров. К антропометрическим методам относят взвешивание, сравне¬
ние массы тела с идеальной, характерной для индивидуума такого же пола
и возраста, а также ее потерю за определенный период. Индекс массы тела
(ИМТ) - отношение массы тела к росту (кг м2) - позволяет сравнивать оба
пола и возрастные группы, а также измерения конкретного пациента в дина¬
мике с разделением на степени уровня питания.
ИМТ более 30 — питание повышенное.
МТ 20-25 — питание нормальное.
га КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
ИМТ18-20 - возможное истощение.
ИМТ менее 18 - выраженное истощение.
Окружность плеча (ОП) косвенно характеризует совокупность состояния
ней, мышц, кости, жира и жидкости, а соотношение его с толщиной ко ^
жировой складки над трицепсом (КЖСТ) характеризует состояние
и мышечной массы в отдельности. ОП измеряют обычной сантиметровой
1 срединной точке между акромиальным и локтевым отростками. Водный
в организме влияет на измерение параметров КЖСТ и ОП. Именно поэтому истГ
кое значение показателя окружности мышц плеча можно получить из ушвимм
модифицированных Heymsfield:
ОМП для мужчин = [(ОП - тс х КЖСТ)2 - 10)]/4 ж л;
ОМП для женщин = [(ОП - я х КЖСТ)2 - 6,5)]/4 х я,
где ОМП - окружность мышц плеча (см); ОП — окружность плеча (см); КЖСТ-
кожно-жировая складка над трицепсом (см).
1 функциональные.
❖ Ручная динамометрия: измеряют произвольную силу сжатия кисти. Метод
отражает ранние функциональные нарушения мышц при голодании, воз¬
обновленном кормлении и в изменениях, возникших после восстановле¬
ния мышечной массы.
❖ Дыхательная функция: пиковая скорость выдоха и объем форсированного
выдоха изменяются при недостаточности питания, отражая силу дыхатель¬
ных мышц. Показана корреляция между этими показателями и концентраци¬
ей общего белка в крови, которая быстро снижается при потере 20% белка.
І Иммунная функция: установлена взаимосвязь тестов, отражающих состоя¬
ние клеточного иммунитета, со степенью недостаточности питания. В иссле¬
дованиях показано, что 1/4 тканевой массы тонкой кишки - лимфоидная
ткань. Эпителий тонкой кишки включает около 20% лимфоцитов. На МО
энтероцитов приходится 21 внутриэпителиальный лимфоцит, поэтомутон-
кую кишку рассматривают как центральный орган В-иммунитета. В1 юг
мембраны слизистой оболочки тонкой кишки содержится около 430 тыс
плазматических клеток, поэтому тонкая кишка служит источником иш-
ноглобулинов. В кишке находятся Т-лимфоциты и макрофаги, взаимо¬
действующие с лимфоцитами и вырабатывающие лизоцим, интерферон
Содержание в периферической крови лимфоцитов в количестве 900-1500
в 1 мм2 указывает на умеренную недостаточность питания, а количество
клеток менее 900 на 1 мм2 свидетельствует о ее тяжелой степени. Количество
Т-лимфоцитов в периферической крови при недостаточности питами
также снижено, но оно восстанавливается до нормального при возобнови
нии кормления. Функции лейкоцитов, секреция антител и содержание кои-
племента могут быть нарушены. Использование кожных реакций на виу
трикожные антигены - исследовательский, а не клинический метод.
I Лабораторные параметры: показатели концентрации сывороточных белю*
(альбумина, преальбумина и трансферрина). Сывороточный альбумин
прогностический параметр риска хирургического вмешательства, его конце»
трация отражает степень недостаточности питания и тяжесть заболевай)»
Замедленное возвращение показателя сывороточного альбумина к ДОР
мальным значениям после острой фазы заболевания — следствие неаде*
ватного потребления белка и энергии с пищей. На его показатели влияв»
два фактора: динамическое перераспределение между сосудистым РУ0
и интерстициальным пространством и его разведение в крови при измене
объема циркулирующей плазмы. Период полураспада альбумина длДО**
иый (18 сут), поэтому влияющие на его концентрацию процессы замедж
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 877
дльбумин и белки с более коротким периодом полураспада - преальбумин
(2 сут) и трансферрин (7 сут) — подвержены влиянию перераспределения
и разведения.
Рутинными должны быть исследования функций почек, печени — измерение
содержания креатинина, мочевины, электролитов, кальция, фосфора и магния.
Концентрация креатинина свидетельствует о нарушениях функций почек
л состоянии мышечной массы: при физических нагрузках она выше, у истощен¬
ных пациентов — ниже. Количество креатинина, выделенное за 24 ч, использу¬
ют для расчета креатинин/ростового индекса (ИКР) и характеристики степени
ксгошения мышечной массы:
ИКР (%) = (В х 100)/И;
где В - концентрация выделенного за 24 ч креатинина с мочой; И - идеальная
концентрация креатинина в моче для пациента соответствующего роста (за 24 ч).
Дефицит ИКР 5-15% соответствует легкому, 15-30% - среднему, более 30% -
тяжелому истощению.
При расчетах азотистого баланса для получения значения общего азота исполь¬
зуют метод Кьельдаля, однако при невозможности его проведения возможны рас¬
четы из показателя мочевины мочи:
общий азот мочи = М х 0,466 х 1,25,
гдеМ — концентрация мочевины в моче (г).
Значительный клиренс мочевины свидетельствует о преобладании в организме
процессов катаболизма. Голодание при ослаблении белкового обмена сопрово¬
ждается снижением концентрации мочевины в крови.
Очень важно определение содержания магния, цинка, селена, железа в крови
при желудочно-кишечных заболеваниях. Кроме того, необходимо измерение кон¬
центрации фолатов, витамина В12 и С-реактивного белка (маркер ответа организма
на воспаление).
Для определения объема вне-, внутриклеточного и общего содержания воды
в организме используют спектроскопию биоэлектрического сопротивления (СБС).
Этим методом с помощью соответствующих расчетов получают косвенные показа¬
тели массы свободного жира и тощей массы тела.
На основании наиболее доступных методов пациентов подразделяют по степени
нутритивной недостаточности на 4 группы (табл. 23-1). При определении рациона
питания стационарного пациента необходимо помнить, что признаки простого
и стрессового голодания клинически и лабораторно различаются, поэтому и сред¬
ства нутритивной коррекции имеют свои особенности (табл. 23-2).
Стрессовое голодание (квашиоркор) — реакция на сочетание голодания с вос¬
палением, характеризуется выраженной гипоальбуминемией. Характерные сим-
птомы - низкая концентрация альбумина и отек. Катаболическое состояние
при стрессовом голодании не может быть полностью скорректировано только
питанием. Однако для приведения к минимуму недостаточности питания важна
сбалансированная нутритиеная поддержка.
Простое голодание — результат частичного или полного прекращения посту¬
пления энергетических субстратов. Обычно люди хорошо адаптируются к крат¬
ковременному или длительному голоданию, используя свои резервные запасы
*ира и белка с помощью физиологических механизмов, позволяющих снижать
затраты энергии и запасенного белка. Простое голодание или маразм вызывает
снижение массы тела за счет потери жира и тощей массы тела, приводя к истоще-
н*ио организма в целом. В процессе простого голодания концентрация альбумина.
- правило, не изменяется, а показатель плазменных белков с более коротким
триодом полураспада может быть несколько снижен.
gjg КЛИНИЧЕСКАЯ 7РАНСФУЗИОЛОГИЯ
Таблица 23-1. Степени питательной недостаточности
ВиВюдці и показатели
Степень питательной недостаточности
норма
легкая
средняя
1 Альбумин. г/л
35-50
34-30
29-25 "
(фааяьбуммп. г/я
0,15-0,24
0,16-0.18
0,14—0,16
[Траисфвррин, г/л
2.0-2,5
1,7-2,0
1,4—1.7
ІКрмпмнь'роспмой индекс. %
<5
5-15
15-30
(Лимфоциты, юг1
1600-1400
1200-1400
900-1200
■инк
<10
10-15
16-25
(Индекс массы тала
20-25
20-18
18-16
[Окружность плеча, %
100-90
90-80
80-70
1 Кожно-жироеая складка над три¬
цепсом. В
100-90
90-80
80-70
Таблица 23-2. Лабораторные и клинические различия простого и стрессового голодания
Показатель
Простое голодание
Стрессовое голодани7(остёи^
Альбумин
Норма
Низкий
Параметры воспаления
Норма
Повышены ■—-
Трансферрин
Среднее снижение
Сильно понижен f—
Преальбумин
Среднее снижение
Сильно понижен
Масса тела
Понижена
Норма или повышена (зависйтотсодГ
яния отека) . /„^WS
Общий жир тала
Понижен
Понижен с
Балок тала
Понижен
Понижен
Внеклеточная вода
Слегка повышена
Сильно повышена
' Энергетические затраты
Понижены
Повышены
У истощенных пациентов нарушены многие физиологические функции. Такие
больные подвержены высокому риску осложнений и неблагоприятного исхода
заболеваний, особенно когда сама болезнь предрасполагает к развитию недо¬
статочности питания. С помощью минимального набора параметров определяют
степень недостаточности питания, при ее выявлении для назначения адекватного
лечения проводят тщательную оценку нутритнвного статуса и расчет индивиду¬
альных энергетических и белковых потребностей пациента.
РАСЧЕТ ИНДИВИДУАЛЬНЫХ ПОТРЕБНОСТЕЙ ПАЦИЕНТА
Определение потребности в энергии осуществляют двумя методами,
і С помощью уравнения Гарриса-Бенедикта, учитывающего пол, возраст, роя
и массу тела больного и указывающего на затраты энергии в состоянии покоя
(00):
00 мужчин = 66,47 + 13,75 х М + 5 х Н - 6,8 х А;
00 женщин і 655,1 І 9,56 хМ + 1,85 х Н - 4,68 х А,
где М - масса тела (кг); Н - рост (м); А — возраст, лет. Ш|
Для учета двигательной активности и стрессового фактора болезни получении
результат умножают на коэффициент метаболической активности (табл.
или используют расчетное уравнение:
ИРЭ = 00 х ФА х ФП х ТФ,
где ИРЭ І истинный расход энергии; ФА — фактор активности; ФП '
поражения; ТФ - температурный фактор.
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ
а 23-3. Коэффициенты метаболической активности
I ЦТ** кости
[п^оствпьный_
к*
1.1
1.2
1,3
Температурный фактор, °С
38
39
40
1.1
1.2
1.3
Фактор пораження
Пациент без осложнений
Перелом
Перитонит
После операции
Сепсис
Политравма, реабилитация
879
т~
1.0
1,2
1,4
1.1
1.3
1.5
и^ффициент метаболической активности.
, В отделении интенсивной терапии у тяжелых больных для определения
расхода энергии используют метод непрямой калориметрии. Он основан
на прямом измерении потребления кислорода и выделения углекислого газа.
Данным методом оценка суточного расхода энергии может быть выполнена
в течение 15-20 мин с погрешностью не более 10%. Метод основан на био¬
логическом окислении основных питательных веществ в организме с обра¬
зованием тепловой энергии, которую при выделении через кожу измеряют
в килокалориях (табл. 23-4). Суммарный метаболизм трех основных групп
питательных веществ (белков, жиров, углеводов) определяют общим потре¬
блением кислорода, продукцией углекислого газа и выделением общего азота
(табл. 23-5).
Таблица 23-4. Энергетическая ценность питательных компонентов, ккап/г
Бши
4.2
Углеводы
4,1
Жиры
9.3
Алкоголь
7.1
Таблица 23-5. Дыхательный коэффициент (RQ)
>1,0
Преобладает липогенез (при нестабильных состояниях, гипервентиляции, переедании)
1,0
Преимущественное окисление углеводов
0,85
Смешанное окисление углеводов и жиров
0,71
Окисление липидов
0,67
Метаболизм спирта и кетоновых тел
Расчет 00 проводят по формуле:
00 (ккал/сут) = 3,94 х V02 + 1,1 х VC02 - 2,17 х азот суточной мочи,
где V02 - объем потребленного кислорода; VC02 — объем выделенного углекис¬
лого газа.
При определении необходимых энергетических потребностей учитывают
затраты и способность организма пациента метаболизировать вводимые суб¬
страты. Большинство госпитализированных пациентов страдают от сочетания
стресса с недостаточностью питания. Часто их энергетические затраты оказы¬
ваются меньше значений, полученных из таблиц и с помощью классических
Уравнений. Значительное количество пациентов (включая находящихся в отде¬
лении интенсивной терапии) имеют энергетические затраты, не превышающие
2000 ккал/сут.
Современная концепция нутритивной поддержки — сохранение функций орга¬
низма и предотвращение потери тощей массы тела с помощью начальной нутри-
’лвной поддержки на ранней стадии с ограниченным объемом энергетических
компонентов.
ДО КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Частичное недокармливание (коррекция нутритивного статуса
учета коэффициента метаболической активности) допускается в *
ческой фазе, а повышенное обеспечение энергией полезно в период4**1^*?
ши или в анаболической фазе заболевания, когда возможна регенеп^^йг
По некоторым данным, ЭП обладает явными преимуществами
как вносит естественное ограничение калорийности по переносимости ^ Ч
оожное и сбалансированное обеспечение питательными веществами ^ И
Потребность в белке определяют тремя методами.
• По средней потребности в белке исходя из фактической массы тел а
го. Рассчитывается на основе фактической массы тела и составляет i °“
в сутки. Показатель может быть индивидуально уточнен умножени
І сутки на показатель метаболической активности данного больного* ^
• По определению содержания азота в суточной моче. Наиболее точный
основан на исследовании азотистого баланса: Ыи метод
азотистый баланс = N йоступления - N потери.
Азот потерь состоит из общего азота, выделяемого с мочой, калом, через
и волосы. Общий азот мочи рассчитывают определением мочевины в ШШ
моче, где азот мочевины составляет 80% общего азота мочи. Азот мочевины от?
деляют умножением суточной мочевины (г) на коэффициент 0,466, а общее кша
чество азота в моче — умножением полученной величины на коэффициент 1,25'
общий азот мочи = М (мочевина мочи, г) х 0,466 х 1,25.
К полученной величине прибавляют 6 г азота (4 г — на добавочные потери бели
через кожу, волосы и кал и 2 г — для достижения положительного азотистого балан¬
са). Мочу собирают в стабильных условиях при неизмененных функциях почек,.
Цель определения азотистого баланса — обеспечить поступление в организм боль¬
шего количества белка, чем его распад, и соответственно обеспечить пластически
материалом процессы репарации после хирургического вмешательства,
к По соотношению небелковых калорий и азота. В соответствии с данными
Шелдона используют соотношение небелковых калорий и вводимого азота
(оптимальным считают соотношение 150:1). Потребность в белке может
быть вычислена делением общего количества калорий на 150, что определяет
количество граммов необходимого азота. Умножение полученного значения
на 6,25 дает требуемое количество белка в граммах.
Суточная потребность в белке — 0,6-0,8 г/кг у здорового человека, у больного
на стационарном лечении - 0,8-1,0 г/кг, для купирования белкового дефици¬
та 11,1-1,5 г/кг. Количество белка более 1,5 г/кг в сутки требуется при тяжелых
ожогах и энтеропатиях с потерей белка; больным с почечной или печеночной
недостаточностью (без диализа) - не менее 0,55 г/кг, При гемодиализе добавляют
белок в количестве 6-9 г (1,0-1,2т/кг).
Рекомендуемые соотношения между белками, углеводами и жирами для аде
ватного усвоения белков приведены в табл, 23-6.
Таблица 23-8. Соотношение питательных веществ
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К НУТРИТИВНОЙ ПОДДЕРЖКЕ
Йутритивную поддержку назначают: ниЯ.
• всем пациентам с исходными признаками недостаточности пит
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 881
Ф ИМТ менее 19 кг/м2;
* ОП менее 90% нормы;
4 гемоглобином менее 110 г/л;
Ф пвюлротеинемией менее 60 г/л;
Ф гипоальбуминемией менее 30 г/л;
Ф лимфопенией менее 1200/мм3;
, при прогрессирующей потере массы тела более 2% за неделю или более 5%
за месяц;
# подготовке к хирургическому лечению и в восстановительный период после
а явных признаках гиперметаболического гиперкатаболизма.
Обычно это происходит через 12-24 ч после хирургического вмешательства
дои травмы, в течение которых стабилизируются жизненные функции (первая
фаза).
Искусственное питание противопоказано:
• в острой стадии болезни, непосредственно после хирургического вмешатель¬
ства или травмы (первая фаза);
• при любом шоковом состоянии;
• концентрации сывороточного лактата более 3-4 ммоль/л;
. гипоксии (р02 <50 мм рт.ст.);
• ацидозе (pH <7,2; рС02 >80 мм рт.ст.);
• по этическим соображениям.
Накопленный мировой опыт позволяет дифференцировать назначения различ¬
ной нутритивной поддержки — полного ПП, смешанного или ЭП.
Оценивая рацион питания пациента, разрабатывают специальный алгоритм ПП
или ЭП. Обычным лечебным питанием довольствуются, если у пациента сохраняется
естественное питание в полном объеме. При пониженном питании или нормальном,
но с высоким риском развития его недостаточности, показана нутритивная поддерж¬
ка. В этом случае при сохранении возможности естественно питаться к обычному
лечебному рациону добавляют питание специальными сбалансированными по всем
компонентам смесями. При невозможности естественного питания способ доставки
питательных компонентов определяется степенью функционирования ЖКТ: в слу¬
чае нарушения его функций рекомендуют полное ПП, при сохранности функций
применяют ЭЗП или ЭП полимерными либо полуэлементными смесями (зависит
от степени функционирования ЖКТ или места его поражения).
Полное парентеральное питание (ППП) применяют, если естественное питание
через рот невозможно или должно быть ограничено. Назначение ППП при сохра¬
ненных функциях ЖКТ считают неправильным.
Дополнительное ПП проводят при недостаточном ЭП.
Современные инфузионные растворы для ПП обладают широким спектром
фармакологического действия на системном, органном, клеточном и субклеточ-
ном уровнях, что позволяет использовать их для регуляции метаболических про¬
цессов.
Показания к ППП — все заболевания и патологические состояния с органи¬
ческой или функциональной несостоятельностью ЖКТ пациентов, находящихся
в критическом состоянии:
• ишемия кишечника после операций на ЖКТ;
• осложнения после операций на ЖКТ (несостоятельность анастомозов,
гнойно-септические осложнения, кишечные фистулы);
• после обширных резекций кишечника (синдром короткой петли);
• заболевания пищевода и желудка с нарушением доставки пищи;
него;
ПОКАЗАНИЯ К ПАРЕНТЕРАЛЬНОМУ ПИТАНИЮ
g£2 КЛИНИЧЕСКАЯ ГРАНСФУЗИОЛОГИЯ
• болезнь Крона и другие формы колитов;
І синдром мальабсорбции;
і непроходимость кишечника различной этиологии;
і коматозные состояния с нарушением акта глотания;
• острые кишечные инфекции;
к выраженный гиперметаболизм со значительной потерей бел
у больных с травмами и ожогами даже в случаях, когда возмож ВВ
питание); Но °бьіЦ
• сепсис.
Вспомогательное или частичное ПП используют при необходимости
ческой коррекции или невозможном полноценном питании натграчь ІЙАм
дуктами в следующих случаях: НЫМи Ш
• при онкологических заболеваниях (период лучевой и химиотерапи
готовки к операции); Щ %
• в раннем периоде после объемных внебрюшинных операций;
• при гнойно-септических осложнениях;
я язвенной болезни желудка и двенадцатиперстной кишки;
і различных форм колита;
І дистрофии и кахексии любого генеза;
і патологии органов гепатобилиарной системы с функциональной недостато
ностью печени;
і хронической почечной недостаточности;
• острых кишечных инфекциях;
• хронических воспалительных процессах;
• выраженном эндо- и экзотоксикозе;
• психической анорексии.
Противопоказания к ПП:
• нестабильная гемодинамика (гиповолемия, кардиогенный или септический
шок);
і анурия (без диализа);
• дегидратация и гипергидратация;
• гипоксия;
і нарушения электролитного обмена, осмолярности, кислотно-основного
состояния;
• выраженные метаболические расстройства.
Абсолютных противопоказаний к ПП нет из-за возможности медикаментозной
коррекции перечисленных состояний. Предварительная коррекция жизненно важ¬
ных систем организма (гемодинамики, водно-электролитного баланса, дыхательной
функции) позволяет осуществлять ПП практически при всех нозологических состоя¬
ниях с ограничениями по тем или иным компонентам в зависимости от показании.
Используемые термины:
І полное парентеральное питание (ППП) — введение всех питательных ком¬
понентов в количествах, полностью покрывающих потребности организм
(используют при абсолютной невозможности потреблять или усваивать есте
ственные продукты, осуществляют только через центральные вены);
і вспомогательное парентеральное питание (ВПП) — введение всех питатель
компонентов В количествах, ДОПОЛНЯЮЩИХ получение ИХ естественным пу!*"'
• частичное парентеральное питание (ЧПП) — включает отдельные питат
ные компоненты, применяют для краткосрочной поддержки организм .
• адекватное ПП - обеспечение организма всеми необходимыми рШуУ
ными компонентами в сбалансированной пропорции (ингредиенты щ.
должны покрывать основные потребности и компенсировать повыше^
потери и имеющийся дефицит), применяют для оценки всех вариантов
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 883
В зависимости от пути доставки питательных компонентов различают:
• центральное ПП — через магистральные сосуды;
I периферическое ПП — через периферические вены.
рПП используют при абсолютной невозможности потреблять энтерально
усваивать естественные продукты, осуществляют круглосуточно только через
центральный венозный катетер. ППП в периферические вены (по сравнению с цен¬
тральным) требует существенно большего объема жидкости, ухудшает венозный
кровоток и повышает риск возникновения тромбоза вен конечностей, при этом
|| осуществляет адекватного белкового и калорийного обеспечения.
Некоторые авторы рекомендуют для профилактики тромбофлебитов добавлять
да каждый литр жидкости 10 мл гидрокортизона и 1000 ЕД гепарина натрия.
К этим рекомендациям следует относиться с осторожностью у больных хирургиче¬
ского профиля и получающих специфическую лекарственную терапию.
Вливание питательных компонентов в периферические вены безопаснее,
чем в центральные, так как в этом случае снижается вероятность воздушной эмбо-
дии, сепсиса или тромбоза, но вливаемые жидкости должны быть изотоническими
или'слабогипертоническими.
Введение препаратов в периферические вены возможно только при ВПП
или ЧПП в короткий отрезок времени (7-10 сут).
Причинами назначения ВПП и ЧПП могут стать неполноценное усвоение пищи,
низкокалорийная диета, значительный рост энергозатрат и др.
СУБСТРАТЫ ИСКУССТВЕННОГО ЛЕЧЕБНОГО ПИТАНИЯ
Основные субстраты ИЛП, как и естественного, — белки, жиры, углеводы,
минеральные вещества и витамины.
Белковая часть питания представлена цельным белком или отдельными амино¬
кислотами, которые служат строительным материалом для построения собствен¬
ных белков пациентов и предшественниками биосинтеза важных биологических
і физиологических соединений.
Глюкоза — основной циркулирующий энергетический субстрат, который
используется большинством клеток организма. Однако в специализированных
смесях для ЭП ее заменяют другими углеводными компонентами, так как большая
нагрузка глюкозы может вызвать угрозу гипергликемии.
Жировые компоненты обеспечивают энергетические потребности, участву¬
ют в построении клеточных мембран и снабжают организм пациента важны¬
ми жирорастворимыми витаминами. В клинической практике потребление
жира составляет 30-50% небелковых калорий в зависимости от энергетической
потребности.
Незаменимые компоненты организма — основные электролиты. При нутри¬
тивной поддержке их потребности должны быть приведены в соответствие с фак¬
тическим клиническим состоянием. Микроэлементы и витамины - кофакторы
или активаторы различных ферментов — играют важную роль в метаболизме
основных продуктов питания: белков, жиров и углеводов. ЭП особенно ценно тем,
что компоненты питания сбалансированы в едином продукте.
ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
ПП включает те же питательные ингредиенты, что и естественное питание
(белки, жиры, углеводы, витамины, минеральные вещества), а также жидкость,
°бъем которой определяется:
• 1500 мл + 20 мл на каждый последующий килограмм свыше 20 кг, если нет
противопоказаний;
* 50-35 мл/кг (18-65 лет), 25 мл/кг (>65 лет);
' 1 мл/ккал.
VRVU
£34 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Потребность в жидкости возрастает при диарее, рвоте, дренаже фисто
шенном потоотделении, обезвоживании, повышении температуры тел ?’%•
ори повышении температуры тела на каждый градус более 37 °С), Ц а
ственно снижаться при циррозе печени, сердечной и почечной недостач^
ОТЄКЄ легких, респираторном дистресс-синдроме взрослых. Ol*H0CJn
АМИНОКИСЛОТНЫЕ РАСТВОРЫ
Аминокислотные растворы, используемые для обеспечения белкового
ния, подразделяют на две основные группы: общего типа и направленног
стары. Для полноценного использования аминокислот на пластические* ^
необходимо сочетание вводимых аминокислотных растворов с энергетичег^
компонентами (жирами и углеводами) в соотношении 1 г вводимого азота к
150 энергетическим калориям.
Наиболее часто встречаемые в России растворы аминокислот представл
в табл. 23-7. ltHl;
Таблица 23-7. Аминокислотные растворы, применяемые в России
Стандартные
Направленного
действия
в нефрологии
в гепатологии
в педиатрии
с высоким
содержанием
глутамина
Аминовен 5,10 или 15%*
Нефротект*
Аминостерил Гепа 8%®
Инфант* ами¬
новен 6,10%
Дипептивен*
Аминоллазмаль Е5*
Аминоплазмаль Гепа 10%*
Аминосол-Нео 10,15%*
Вамин 18* без электролитов
Инфезол 40*. инфезол 100*
Хаймикс*
Гепасол-Нео 8%*
Стандартные растворы аминокислот (общего типа)
Изначально примером для создания аминокислотных растворов общего типа
служил состав яичного белка (вамин 18 без электролитов®, аминостерил КЕ*),
Со временем рецептура растворов претерпела некоторые изменения: несколько
увеличилось содержание отдельных аминокислот (например, аргинина), были
введены метаболиты обмена аминокислот, например орнитин (аминоплазмаль*,
инфезол 100*), который стимулирует глюкозоиндуцированную выработку инсу¬
лина и активность карбамоилфосфатсинтетазы, что способствует усилению ути¬
лизации глюкозы периферическими тканями, синтезу мочевины, в сочетании
с аспарагином - уменьшению концентрации аммиака. Последние серии ами¬
нокислотных растворов (аминовен* и аминосол-Нео*) имеют в своем составе
таурин, улучшающий метаболизм при стрессе, гиперкатаболических состояний
и тяжелых физических нагрузках. Стандартные растворы аминокислот могут быть
в концентрации 5-15%, что позволяет использовать их при полном и частичном
ПП и вводить в центральные (10%, 15%) и периферические вены (5%). Более
высокая концентрация позволяет в меньшем объеме вводить большее количество
аминокислот и соответственно использовать у пациентов с ограничением потре¬
бления жидкости, но заставляет помнить о высокой осмолярности концентрирс
ванных растворов. Стандартные растворы аминокислот могут содержать основнім
электролиты (натрий, калий, кальций и магний) — аминоплазмаль Е*, ннфезол ■
аминосол* (с электролитами и без них). Отсутствие электролитов в более позд
сериях (аминовене*. хаймиксе*) позволяет применять их при дисбалансе электг
литов. Некоторые стандартные аминокислотные растворы содержат энерг^.
ские компоненты 1 ксилит и сорбит, что позволяет снизить количество г
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 885
юкозы. Тем не менее отсутствие этих компонентов в большей степени обеспечи¬
вает безопасность применения аминокислотных растворов.
Показанием к стандартным растворам аминокислот служат полное или частим*
ое ПП, профилактика и терапия потерь белков.
Состав некоторых стандартных аминокислотных растворов приведен
в табл. 23-8.
Таблица 23-8. Состав стандартных растворов аминокислот
Состав, г/л
Яичный
белок
Хаймикс*
15% амино¬
вен*
10% амино¬
вен*
Аминоплаз¬
маль ЕЮ*
§"*■
1
к
о § J»
3.0 |“
f? ii
**
Аланин
7,4
6,4
25,0
14,0
13,7
4,0
15,5 6,85
Аргинин
6,1
6,4
20,0
12,0
9,2
4,55
9,66 4,60
Аспарагиновая кислота
9,0
—
—
—
1,3
2,0
1,91 0,65
Аспарагин
—
—
—
—
3,28
—
— 1,86
Валин
7,3
4,9
5,5
6,2
4,8
2,25
5,0 2,40
Гистидин
2,4
3,2
7,3
3,0
5,2
1,35
3,3 2.60
Глицин
3,6
8,0
18,5
11,0
—
— 5
7,55 -
Глутаминовая кислота
16,0
—
—
—
4,6
5,0
5.0 2,30
Изолейцин
6,6
4,4
5,2
5,0
5,1
2,1
5,85 2,55
Лейцин
8,8
9,8
8,9
7,4
8,9
2,75
6.24 4,45
Лизин
6,4
11,5
11,1
6,6
5,6
2.0
7,1 2,8
Метионин
3,1
5,7
3,8
4,3
3,8
1,75
4,68 1.9
Пролин
8,1
6,4
17,0
11,2
8,9
—
7,5 4,45
Серии
8,5
9,6
6,5
2,4
—
4.3 1,2
Тирозин
4,2
—
0,4
0,4
0,7
—
1,62 0,65
Треонин
5,1
4,3
8,6
4,4
4,1
1,6
5,0 2,05
Триптофан
1,6
1,44
1,6
2,0
1,8
—
2,0 0.9
Фенилаланин
5,8
7,0
5,5
5,1
5,1
3.15
5,4 2,55
Цистин/цистеин
2,4
—
—
—
0,5
—
_ _
Таурин
—
—
2,0
1,0
—
—
_ _
Яблонная кислота
—
—
4,9-6,1
—
1.01
—
3,0 1,01
Аминоуксусная кислота
—
—
—
—
—
—
— —
Кислота уксусная ледяная
—
4,45
4,7-5,7
—
—
1,25
Здетиновая кислота
—
—
—
—
0,05
—
- 0,05
Орнитин
—
—
—
—
2,51
—
2,42-1,9 1.25
Сорбит(-ОЛ)
—
50
—
—
—
—
_ _
Ксилитол
50
_ _
Натрий, ммоль/л
—
—
—
—
43
40
69 43
Калий, ммоль/л
—
—
—
—
25
25
45 25
Кальций, ммоль/л
5,0 -
Магний, ммоль/л
—
—
—
—
2,6
2,5
5,0 2,6
Дигидрогенфосфат, ммоль/л
—
—
—
—
9.0
—
- 9,0
Общий азот
—
11,3
25,7
16,2
16,0
6.3
15,6 8,0
осмолярность, мОсм/л
—
1159
1505
990
103С
801.{
1145 590
общение незаменимых ами-
нокислот к общему азоту
3,2
—
—
—
2,6
—
— —
Аминокислотные растворы для пациентов с патологией печени
Особенность этих растворов аминокислот - высокое содержание разветвлен-
Ых (до 43%) и низкая концентрация ароматических (2%) аминокислот, кото-
РЫе конкурируют между собой за проникновение через энцефалопатический
М* КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
1
барьер. В этих растворах повышенное содержание аргинина и нет элеш»
Дрм печеночной недостаточности особенность их состава способству
кону введению аминокислот, нормализации уровня разветвленных и
чесхих аминокислот, улучшению детоксикации аммиака и выработке ЭДв
Показанием к их применению служит парентеральное введение амМ°Че®Ч
при тяжелых нарушениях функций печени с нарушениями (или без щШІЩ
мозга, лечение нарушений функций печени, вплоть до печеночной ко и
используемых в России в настоящее время растворов аминокислот для п
Нр с патологией печени представлен в табл. 23-9. 81о,%,
Таблица 23-9. Состав растворов аминокислот для пациентов с заболеваниями печени
Состав, г/л
Гепасол-Нео* 5%
Аминостерил N-Гепа* 8%
ЛминошіазімапГг^—^
Аланин
4,64
4,64
—-—‘losl
Ір 45
Арпмин
10.72
10,72
Аспарагиновая кислота
■ —
—
25
Валин
10,08
10,08
1
Глицин
5,82
—
13 'йЦ
Гистидин
2.8
2,8
іІ 11
Глутаминовая кислота
—
—
51
Изолвйцин
10,4
10,4
ад
Лейцин
13,09
13,09
13,6 іін
Лизин
6,88
9,71
В gg
Метионин
1,1
1,1
Ш 1
Пролин
5,73
5,73
7,1 ’’Ч
Сврин
2,24
2,24
3,7 ^
Тирозин
—
—
0,7 ■
Треонин
4,4
4,4
4,6
Триптофан
0,7
0,7
1.5
Фенилаланин
0,88
0,88
1.6
Цистин/цисгеин
0,52
0,52
0,52
Ледяная уксусная кислота
4,42
4,42
—
Аминоуксусная кислота
—
5,82
—
Орнитин
—
—
1,3
Общий азот
12,9
12,9
15,3
Осмолярность, мОсм/л
770
770
875
Аминокислотные растворы для пациентов с патологией почек
Растворы аминокислот для пациентов с почечной недостаточностью содержат
незаменимые аминокислоты и гистидин (аминостерил КЕ Нефро*, нефрамин*)-
Введенные аминокислоты и мочевина организма используются для построения
заменимых аминокислот, что приводит к повышению концентрации общего белка
и снижению содержания мочевины в крови и моче. Отсутствие электролитов
в составе данных препаратов не усиливает дисбаланс электролитов. Препараты
используют для ПП при развитии у пациента послеоперационной азотемии,
при острой и хронической почечной недостаточности, для заместительной тера¬
пии при потере аминокислот в результате диализа или гемофильтрации и ввод*1
с достаточным обеспечением энергетическими калориями.
Состав некоторых растворов аминокислот, применяемых у пациентов с И
ной недостаточностью, представлен в табл. 23-10. u ^
В настоящее время предложен новый для России аминокислотный препаР
Нефротект4, который имеет более высокую концентрацию аминокислот и сп
ально сбалансированный спектр незаменимых и заменимых аминокислот.
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 887
Таблица 23-10 Состав растворов аминокислот для пациентов с заболеваниями почек
гостав. г/я
Аминостерил КЕ Нефро*
Нефраиим
Валив
9.53
0.64
ГИСТИДИН
4.9
0.25
~— "7"
ИЗОЛВЙЦИН
7,52
0.56
Лейцин
11,32
0.88
і Лизин
9.63
0.64
Метионин
6.59
0.86
I Треонин
6,78
0.4
Триптофан
Г и„
2,91
0.2
j фенилаланин
7,76
0.88
циствин/цистин
-
0,02
Яблочная кислота
6,53
Сорбит
25
Ксилит
25
Натрий, ммоль/л
- ■
5
Общий азот
8,8
М I
Осмолярность, мОсмоль/л
835
435
Нефротект* - весьма перспективный для ПП пациентов с почечной недостаточ¬
ностью препарат, который состоит из сбалансированного профиля незаменимых
и заменимых аминокислот и дипептида глицил-тирозина. По сравнению с ами-
ностерилом КЕ Нефро* имеет более высокую концентрацию аминокислот и более
широкий спектр заменимых и незаменимых аминокислот. Концентрация раство¬
ра -10%. Содержание общего азота - 16,3 г/л, аминокислот - 100 г/л, теорети¬
ческая осмолярность — 935 мОсм/л, pH 5,5-6,5, без электролитов.
Показания к применению. Препарат применяют в комплексной терапии
доя ПП взрослым и детям, больным уремией. Обеспечивает синтез белков орга¬
низма без увеличения мочевины в крови, нормализует азотистый баланс. Вводят
с достаточным обеспечением энергетическими калориями.
Противопоказан пациентам:
І с некорригируемым электролитным и кислотно-основным дисбалансом;
• гипераммониемией;
• пониженным ОЦК;
I врожденными нарушениями аминокислотного метаболизма;
і повышенной чувствительностью к одной или нескольким аминокислотам,
присутствующим в растворе.
С осторожностью применяют у пациентов с гипонатриемией, повышенной
осмолярностью крови.
Методы введения и дозы. Нефротект* в сочетании с другими препаратами
Для ПП вводят в центральные или периферические вены (зависит от конечной
осмолярности).
Дозу препарата подбирают в зависимости от индивидуальной потребности
пациента. Среднесуточная доза у пациентов с острой и хронической почечной
недостаточностью, не получающих гемо- или перитонеальный диализ, - 0.6-0.8 г
лминокислот/кг, или 6-8 мл/кг; у пациентов с острой и хронической почечной
недостаточностью на гемо- или перитонеальном диализе - 0,8-1,2 г аминокис-
лот/кг, что соответствует 8-12 мл/кг; восполнение потерь аминокислот при гемо-
нли перитонеальном диализе в дозе 0.5-0.8 г аминокислот/кг. или 5-8 мл/кг.
Рекомендуемая максимальная суточная доза - 0.8-1,2 г аминокислот или
8-12 мл/кг.
ggg КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ 1
Максимальная рекомендуемая скорость введения:
І при ПП - 0,1 г аминокислот/кг в час, или 1 мл/кг в час;
І при восполнении потерь аминокислот при гемо- или перитонеа
лизе І 0.2 г аминокислот/кг в час, или 2,0 мл/кг в час, ^
Аияиокислотные растворы, применяемые в педиатрии
В педиатрической практике применяют аминокислотный раствоп
Инфант*, выпускаемый в концентрации 6% и 10%. Он содержит 52% aMKHo*fn
мых. 30% разветвленных аминокислот и таурин — аминокислоту, нeзГЗЩl,e’,,,■
для новорожденных. Соотношение аминокислот в растворе модулируете*10^
плоением в женском молоке. Содержание общего азота - 14.9 г/л, осмоля ^
885 мОсм/л для 10% раствора. Для 6% раствора содержание общего азота - о*1*'
теоретическая осмолярность - 531 мОсм/л. Не содержит электролиты и утл
Препараты с повышенным содержанием глютамина
Дипептивен*- 20% концентрат аланил-глютамина. 1000 мл раствора сол
82 г 1-аланина, 134,6 г L-глутамина, теоретическая осмолярность - 921
Дипептивен* служит источником стабильного глутамина для внутривенно
введения, восполняет дефицит глутамина, улучшает барьерную и иммунную ГГ
ции кишки, усиливает иммунную защиту и корригирует гиперкатаболизм, сни®
риск инфекций в хирургии. Препарат не аккумулируется в тканях.
Показания к применению. Препарат применяют у взрослых и детей Ц
дефиците глутамина или его повышенном потреблении, при гиперметаболиче-
ском или гиперкатаболическом типе обмена веществ в рамках полного или сме¬
шанного ПП.
Противопоказания. Тяжелая почечная (клиренс креатинина <25 мл/мин)
и печеночная недостаточность, выраженный метаболический ацидоз, повышении
чувствительность к одному из ингредиентов препарата. Данных по применению
препарата у беременных и в период лактации нет.
Способ применения и дозы. Дипептивен* — концентрированный раствор,
не предназначенный для изолированного введения. Перед применением дипеп¬
тивен* смешивают с совместимым раствором аминокислот или содержащим ами¬
нокислоты инфузионным препаратом в соотношении не менее 1:5. При конечной
концентрации не менее 800 мОсм/л смесь вводят в центральные вены. После
добавления к другим растворам дипептивен* не подлежит хранению.
Суточная доза препарата — 1,5-2,0 мл на 1 кг массы тела, что эквивалентно
введению 0,3-0,4 г/кг. Максимальная суточная доза — 2 мл/кг. Скорость введения
дипептивена* не должна превышать ОД г аминокислот/кг в час и определяется
скоростью вливания раствора-носителя. При превышении скорости введения
могут возникнуть озноб, тошнота, рвота, аллергические реакции. При возникнове¬
нии побочных реакций применение препарата следует немедленно прекратить.
УГЛЕВОДЫ
Углеводы - важнейшие источники энергии при ПП, вводимые в форме моноса¬
харидов. Для ПП применяют препараты, содержащие глюкозу, фруктозу, сорбитол
Іксилитол.
При выборе углеводов для внутривенного питания предпочитают глюкозу'
незаменимый субстрат для центральной нервной системы. Она активно исполь
зуется для построения клеточных субстанций (в том числе клеток крови) и раоо
ты надпочечников, а также обеспечивает восполнение энергетических затра
Во избежание неэкономного глюконеогенеза человеческому мозгу необходим
глюкоза в дозе 100-150 r/сут, а для облигатных потребностей нервной систс
мы - ице 100 г. Таким образом, минимальная суточная доза вводимой парей1*
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 889
глюкозы составляет 250 г сухого вещества, стандартная доза - 350-400 г.
Правильная суточная доза глюкозы не должна превышать 5-6 г/кг массы тела.
дня ПП используют водные растворы глюкозы с концентрацией 5%, 10.20,40,
с0_ 70%- При этом необходимо учитывать, что 5% раствором глюкозы в полной
мере энергетические затраты организма компенсировать невозможно, а ее кои-
центрированные растворы обладают высокой осмолярностью и их можно вводить
только в центральные вены (табл. 23-11). В клинической практике ПП чаще всего
используют 20%, 30% растворы декстрозы.
ТаИлица 23-11. Осмолярность используемых растворов глюкозы
"^Концентрация раствора
Осмолярность. мОсм/л
Энергетическая ценность, пи/я |
декстроза: 5%
290
205
Глмстроза 10%
523
*10 |
Дйкстооза 15%
800
615
декстроза 20%
1250
820
декстроза 30%
2100
1230
рекстооза 50%
3800
2050 1
Плазма
290
При пониженной толерантности к глюкозе используют инсулин. Коррекцию
уровня гликемии (концентрация глюкозы в крови должна быть 4-10 ммоль/'л)
необходимо проводить до начала ПП. Инсулин применяют из расчета I ЕД на 10 г
глюкозы (10 ЕД на 1 л 10% раствора глюкозы или 25 ЕД на 1 л 25% раствора дек¬
строзы). Максимальная доза - 1 ЕД на 5 г глюкозы. Коррекцию гликемии осущест¬
вляют подкожным введением болюсных доз инсулина. В настоящее время в спе¬
циализированной медицинской литературе активно обсуждают эффективность
и безопасность внутривенной интенсивной инсулинотерапии. Принципиальным
считают обеспечение адекватного мониторинга глюкозы. При внутривенном
введении инсулина возрастает риск возникновения гипогликемии по сравнению
со стандартным применением инсулина (рис. 23-1).
Нормогликемия
Сахарный
диабет
Гипергликемия
впервые выявленная
** й*1. Гипергликемия как независимый фактор госпитальной летальности
При сохраняющейся гипергликемии во время ПП выясняют ее причину, одно¬
именно снижая концентрацию вводимой глюкозы.
ипергликемия, возникшая в результате стресса (например, хирургического
8“ешательства), вызывает адаптационную реакцию в виде мобилизации источ-
ННЙ рнщещкіоі (ГЯПЬФУОПилиі гтп
ников энергии, направленную на поддержание функционирования жизнен»
важных систем организма (ЦНС, кровообращения). По данным различных иссл
дований. возможными причинами острого нарушения углеводного обмена мог£
быть хир^-ргические вмешательства, сепсис, тяжелая травма, шок и полиорганщГ
нарушения. Многие авторы приводят широкий спектр доказательств этого (W*
полученных при обследовании пациентов терапевтических, хирургических и огДе.’
лений интенсивной терапии и реанимации (ОИТР), в том числе и страдающе
сахарным диабетом. Интенсивная терапия, реанимационные мероприятия пред.
полагают применение лекарственных средств, способных вызвать гипергликемию
К ним относят ИЛП, введение катехоламинов, глюкокортикоидов, препаратов
крови, иммуносупрессивных лекарственных средств.
Гипергликемия - частое осложнение, связанное с введением концентрирован-
ного раствора глюкозы (компонента ПП). Ее высокое содержание в крови у боль¬
ных. находящихся в ОИТР, сопровождается нарушениями функционирования
жизненно важных систем организма, возникновением гнойных осложнений и
повышением летальности.
В одном из системных обзоров (2006) продемонстрировано, что снижение
летальности достигается постоянным контролем концентрации глюкозы в крови.
Введение инсулина со скоростью 0,5-1 ЕД/ч проводят для поддержания концен¬
трации глюкозы в крови 4,4-бД ммоль/л. Лечение, приводящее к нормогликемии,
уменьшает частоту осложнений и госпитальную летальность, особенно в группе
больных, находящихся в ОИТР более 3 сут, хотя не все исследователи разделяют
такую точку зрения. Инсулинотерапию начинают при концентрации глюкозы
в крови, превышающей 8 ммоль/л. Тем не менее некоторые авторы (2007) в пилот¬
ном рандомизированном исследовании не получили различий в результатах лече¬
ния больных, находящихся в ОИТР более 72 ч, и оценке тяжести APACHE II (32
балла), у которых обеспечивали два уровня целевой концентрации глюкозы - 5-7
и 8-10 ммоль/л. Недавно были опубликованы результаты мультицентрового
международного исследования NICE-SUGAR (2009), авторы которого исполь¬
зовали протокол уровней гликемии менее 4,4-6,1 ммоль/л и менее 10 ммоль/л.
Исследователи продемонстрировали, что летальность в группах с указанной гли¬
кемией составила 27,5 и 24,9% соответственно. В 2007 г. был представлен обзор
12 протоколов, применяемых в ОИТР инсулинотерапии. Все они не универсальны
и различаются по рекомендуемой целевой концентрации глюкозы, началу интен¬
сивной инсулинотерапии, необходимости титрования или введения болюсных доз,
расчету скорости введения инсулина и времени достижения целевых концентра¬
ций глюкозы. Одновременно 40% исследователей придерживаются протоколов
с сохранением максимальных значений глюкозы, не превышающих 10 ммоль/л.
Поддержание глюкозы в крови по целевой концентрации — трудная и нерешен¬
ная задача. Протоколы, алгоритмы и методы мониторинга глюкозы постоянно
изучаются в ОИТР, внедряются высокие технологии своевременной диагностики
и коррекции нарушений углеводного баланса. Оценку уровня гликемии как пока¬
зателя тяжести клинического состояния больного рассматривают в качестве
важного диагностического критерия, который часто сопровождается серьезными
осложнениями.
Весьма актуально сопоставление уровня гликемии и адекватного ИЛП у боль¬
ных ОРИТ. Протоколы для ПП с требуемым для больного определенным количе¬
ством калорий (20-35 ккал/кг в сутки) обусловливают необходимость инфузии.
например раствора «три в одном», со скоростью введения 60-105 мл/ч.
У больных, находящихся в ОРИТ, количество и скорость введения углево¬
дов могут значительно варьировать в зависимости от выбранной тактики ИЛП-
Именно поэтому важен выбор растворов для ПП. Их состав может отличаться
по концентрации глюкозы и жиров. Преимущества и недостатки ПП с высоким
r
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 891
^ношением углеводы/липиды регулярно обсуждают на страницах специализи¬
рованных медицинских журналов. Физиологическое значение углеводов (олиго-
полисахаридов) трудно переоценить. Введение концентрированных растворов
яокозы (>15-20%) на фоне стрессовой гипергликемии, обусловленной хирурги-
гесКйм вмешательством, сопровождается усилением гипергликемии, эскалацией
йНсулинотерапии. Еще более актуальна коррекция гипергликемии у пациентов
сахарным диабетом или нарушением толерантности к глюкозе и снижением
дыхательного коэффициента у пациентов с дыхательной недостаточностью.
Гнекоторых работах есть указания на угрозу развития гипергликемии при ПП.
Считают, что соотношение глюкоза/липиды определяется азотистым балансом
I организме при ПП. Тем не менее введение растворов с высокими значениями
индекса (глюкоза/жиры — 80/20) затрудняет коррекцию концентрации глюкозы
в крови, поэтому рекомендуют поддерживать соотношение 55/45.
Скорость введения глюкозы и обеспечение энергетического баланса в среднем
составляют 3-5 г/кг в сутки или 20-30 ккал/кг в сутки соответственно, и осущест¬
вляют их согласно рекомендациям ESPEN (2000), АКЕ (2002).
Мониторинг концентрации глюкозы в крови позволяет проводить ППП с помо¬
щью системы «три в одном», содержащей 20% раствор глюкозы, со скоростью
60-65 мл/ч без инсулинотерапии.
Увеличение поступления углеводов (скорость инфузии, концентрированные
растворы) или введение отдельных нутриентов могут обусловливать усиление
гликемии, необходимость введения инсулина и проведения более тщательного
контроля концентрации глюкозы для своевременной диагностики гипогликемии.
Растворы глюкозы легко смешиваются с другими субстратами (минералами,
микроэлементами, витаминами).
Зависимость метаболизма глюкозы от инсулина постоянно стимулировала пои¬
ски других источников энергии. Предпринимались попытки использовать фрукто¬
зу и многоатомные спирты — сорбитол и ксилитол. Некоторые авторы предпочи¬
тают в качестве источника углеводных калорий фруктозу, которая на начальных
этапах метаболизируется без участия инсулина. Однако фруктоза, так же как сор¬
битол и ксилитол, не может быть использована клетками мозга. Кроме того, 70%
этих углеводов в процессе метаболических превращений переходят в глюкозу,
и снова возникает зависимость от инсулина. Быстрый метаболизм фруктозы
вызывает увеличение уровня молочной кислоты и, как следствие, молочнокислый
ацидоз (табл. 23-12).
Таблица 23-12. Побочные реакции после введения фруктозы, сорбитола и ксилитола
Осложнения
Фруктоза
Сорбитол
Ксилитол
Метаболический ацидоз
+
+
+
Гиперурикемия
+
+
+
Снижение концентрации фосфата в крови и адениннуклео-
тида в печени
+
+
+
Осмотический диурез с потерей электролитов
- 1
+
+
Отложение кристаллов в почках и мозговой ткани
-
+
Фруктозу, сорбитол и ксилитол в качестве энергетических компонентов само¬
стоятельно не применяют. Они могут быть использованы в виде добавок к ами¬
нокислотным растворам или в специальных углеводных растворах, состоящих
І нескольких компонентов (например, глюкозы, фруктозы, ксилита в соотноше¬
нии 1:1:1).
ЖИРОВЫЕ ЭМУЛЬСИИ
Жировые эмульсии — источник незаменимых жирных кислот и фосфора,
Ш энергетический компонент ПП. Состав некоторых жировых эмульсий
ГЛАВА 23
192 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
представлен в табл. 23-13. Их можно вводить в периферические вены (
осмолярных свойств), но нельзя смешивать с другими растворами и л а?йо- і
ными препаратами. екаРствен. ;
В настоящее время различают три поколения жировых эмульсий (JK3V
I содержащие длинноцепочечные триглицериды (интралипил* uuJ’ і /
10 и 20%*); ^ j f
♦ содержащие средне- и длинноцепочечные триглицериды В СООТм
50:50 (липофундин МСТ/ЛСТ 10%, 20%*); °ШеВИц
• структурированные липиды (сгруктолипид) и эмульсии с преоблала J
омега-3-жирных кислот (омегавен*, липоплюс 20*. СМОФлипид*)^аИ
Таблица 23-13. Состав жировых эмульсий I и ІІ поколения
Составляющие компоненты, г
Интралипид*
Липофундин МГ/гшЯ
І Соевое масло
100-200
100-200
1 Яичные фосфолипиды
12
I i н
[Среднецепочечные триглицериды
50-100 л|
Глицерол
22,5
' Л
Дистиллированная вода, мл
1000
юоо 1^Н:
Энергетическая ценность, ккал/л
1100-2000
1058-1908 ^
1 Осмолярность, м0смоль/кг Н,0
310-360
345-380 ІЗ
Концентрация ЖЭ - 10-20%. Эмульсии первых двух поколений, как правило, 1
на основе соевого масла. Для производства ЖЭ III поколения используют также 1
оливковое масло и рыбий жир, что увеличивает содержание омега-3-жирнщї
кислот в их составе и существенно расширяет метаболические возможности и при-1
менение эмульсий в клинической практике.
Включение омега-3-жирных кислот позволяет:
і обеспечить баланс воспалительных процессов [равновесие между синдромоЯ
системной воспалительной реакции (SIRS) и синдромом компенсаторного 1
Ц антивоспалительного ответа (CARS)]»
І усилить образование полиренасыщенных жирных кислот (арахидоновои^
эйкозопентаеновой, шсозогексаеновой);
і продуцировать лейкотриены (Bj);
• снизить агрегацию тромбоцитов;
і снизить концентрацию холестерина и триглицеридов в крови;
і уменьшить выраженность атеросклеротического поражений;
• улучшить реологические способности крови (уменьшить вязкость крови,
склонность эритроцитов к адгезии);
І обеспечить антиоксидантную защиту (из-за присутствия а-токоферола
І аскорбилпальмитата).
В настоящее время в российском здравоохранении применяют ЖЭ ІП поко¬
ления; липоплюс 20*. СМОФлипид* и фармаконутриентную добавку омега-3-
жирных кислот омегавен*.
Оливковое масло и рыбий жир обеспечивают организм пациента омега-
3-жирными кислотами, которые оказывают фармакологическое воздействие
на систему про- и аштаоспалительных медиаторов, обладают иммуномодулирую¬
щим эффектом за счет продуцирования лейкотриенов, способствуют понижеш® |
концентрации холестеринов и триглицеридов, сокращению атеросклеротическй
поражений, снижению способности тромбоцитов к агрегации и склонности зри |
троцитов к адгезии.
Липоплюс 20*
Липоплюс 20*—ЖЭ, в которой соотношение среднецепочечных (СЦТ), длинно®- ,
почечных (ДЦТ) триглицеридов и ОКТ составляет 5:4:1. Незаменимые омега-жирнъ»
(jtCWJTbi представлены линолевой кислотой (омега-6), а-линоленовой. эйксшпеике-
яовой и декозогексаеновой кислотами (омега-3) в соотношении 3:1. Эмульсия лило*
даваае 20* содержит жирорастворимые антиоксиданты а-токоферол и нскорбил ішль-
иктат. защищающие ее от переписного окисления, а также лецитин яичный и натрия
олеат. Концентрация эмульсии - 200 мг/мл (20%), калорийность - 1910 ккал/л
/7990 кДж,/л). теоретическая осмолярность - 410 мОсм/л, pH 63 8.5.
Показания к применению. Введение липидов в качестве источника анергии
и незаменимых жирных кислот, включая омега-6 и омега-3-жирные кислоты,
как часть режима ПП взрослых.
Противопоказания:
• гиперлипидемия;
• нарушения гемокоагуляции;
• виутрипеченочный холестаз;
• печеночная недостаточность;
• почечная недостаточность при невозможности проведения гемофильтрации
или диализа;
• острая фаза инфаркта миокарда или инсульта;
• острая тромбоэмболия, жировая эмболия;
• аллергическая реакция на белок яйца, рыбы или сои, непереносимость дру¬
гих ингредиентов эмульсии;
• нестабильный гемодинамический статус с нарушением жизненных функций
(коллапс, шок);
• нестабилизированный метаболизм (декомпенсированный сахарный диабет,
ацидоз);
• отек легких;
І гипергидратация;
• декомпенсированная сердечная недостаточность, гипотоническая дегидра¬
тация;
І гипокалиемия.
С осторожностью применяют у пациентов, состояние которых сопровождается
нарушением жирового метаболизма (почечной недостаточностью, сахарным диа¬
бетом, панкреатитом, гипертриглицеридемией. заболеваниями легких).
Безопасность применения препарата при беременности, лактации и у детей
не изучена.
Способ применения и дозы. Дозу подбирают в соответствии с индивидуаль¬
ными потребностями пациента.
Рекомендуемая доза жира — 1-2 г/кг в сутки, что составляет 5-10 мл/кг в сутки
препарата липоплюс 20*. Введение осуществляют с максимально низкой скоро¬
стью, причем в первые 15 мин она должна составлять 50% максимальной скорости
инфузии. Максимальная скорость вливания липидов - до 0,15 г/кг в час, что соот¬
ветствует введению препарата со скоростью 0,75 мл/кг в час. Скорость вливания
должна быть снижена у истощенных пациентов. Для профилактики побочных
реакций при передозировке необходимо тщательно контролировать скорость вве¬
дения препарата и концентрацию триглицеридов в крови.
Выпускают в стеклянных бутылках по 100,250,500 мл. Хранят при температуре
не выше 25 °С в защищенном от света месте. Срок годности - 2 года,
СМОФлипид*
СМОФлипид* — гомогенная эмульсия белого цвета, содержащая 60 г соевого
иасла, 60 г среднецепочечных триглицеридов. 50 г оливкового масла и 30 г рыбье¬
го жира, а также фосфолипиды яичного желтка, а-токоферол и натрия олеат.
Энергетическая ценность — 2000 ккал/л (8,4 МДж/л), теоретическая осмоляр-
- 380 мОсмоль/л, pH 7,0-9,0, концентрация — 20%. Служит источником
энергии и незаменимых жирных кислот, в том числе омега-3-жирных кислот.
894 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
1
Показания к применению:
І при полном или частичном ПП - в качестве источника энергии і
мых жирных кислот, в том числе омега-3-жирных кислот:
• профилактика и лечение дефицита незаменимых жирных кислот в
омега-3-жирных кислот. '
Противопоказания:
I повышенная чувствительность к рыбьему, яичному или соевом
или к компонентам препарата: У 6%
• гипердипидемия;
• печеночная недостаточность;
• шок:
• некорректируемые нарушения свертывания крови;
• почечная недостаточность при невозможности выполнения гемофильди
или гемодиализа; ^4,111
• острый отек легких;
і гипергидратация;
І декомпенсированная сердечная недостаточность;
• нестабильные состояния (острый инфаркт миокарда, инсульт, эмболия
тяжелый метаболический ацидоз, гипертоническая дегидратация).
Специальных исследований по применению препарата при беременности, лак¬
тации и в детском возрасте не проводили.
Способ применения и дозы. Дозу и скорость вливания определяют способно¬
стью пациента элиминировать введенные внутривенно липиды. Стандартная доза
жира составляет 102 r/кг в сутки, что соответствует дозе препарата 5-10 мл/кг
в сутки. Максимальная суточная доза - 2 г/кг в сутки, что соответствует 10 мл/кг
в сутки.
Рекомендуемая скорость инфузии жира составляет 0,125 г/кг в час, что соот¬
ветствует скорости вливания СМОФлипида* 0,63 мл/кг в час. Максимальная
скорость введения жира не должна превышать 0,15 г/кг в час, что соответствует
скорости инфузии препарата 0,75мл/кг в час. Для профилактики синдрома пере¬
грузки жирами необходимо тщательно контролировать концентрацию тригли¬
церидов в крови, и при превышении их уровня более 4 ммоль/л инфузию любой
жировой эмульсии следует прекратить.
Выпускают в стеклянных флаконах по 100, 250, 500 мл.
Омегавен*
Омегавен* — 10% эмульсия для быстрого восполнения дефицита омега-3-
жирных кислот на основе рыбьего жира глубоководных северных рыб. Препарат
в объеме 1000 мл содержит 100 г рыбьего жира, в том числе 12,5-28,2 г эйко-
зопентаеновой кислоты, 14,4-30,9 г декозагексаеновой кислоты, 0,150-0,2% г
а-токоферола. Осмоляльность — 342±10% мОсмоль/кг Н20.
Показания к применению. Профилактика и лечение недостаточности омега-
3-жирных кислот в комплексной терапии воспалительных заболеваний кишечни¬
ка, сепсиса, ожогов, кахексии; в комплексном ПП взрослых.
Противопоказания;
• геморрагические нарушения;
• острые жизнеугрожающие состояния (шок, коллапс, острый инфаркт *
карда, инсульт, эмболия, кома);
• аллергия на рыбий или яичный белок;
• детский возраст;
І общие противопоказания для ПП. ^
Внутривенное введение омегавена* может привести к увеличению длительн
кровотечения и угнетению агрегации тромбоцитов.
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 895
Способы применения и дозы. Возможно введение в периферические и цен*
тральные вены. Суточная доза омегавена* — 1-2 мл/кг в сутки. Максимальная
^точная доза — 2 мл/кг в сутки. Максимальная скорость вливания 0.5 мл/кг
в час. Длительность применения — 5-7 сут и более. Препарат можно назначать
одновременно с другими ЖЭ. жиро- и водорастворимыми витаминами.
Омегавен* несовместим с поливалентными катионами, особенно в сочетании
с гепарином натрия.
Выпускают в стеклянных флаконах по 50, 100 мл. Хранят при температуре
не более 25 °С. Срок годности - 1,6 г.
СИСТЕМА «ДВА В ОДНОМ»
Кроме пофлаконной системы ПП, в лечебную практику широко внедряют
системы «два в одном» и «три в одном» в виде пластиковых контейнеров, вклю¬
чающих все основные продукты питания («три в одном») либо аминокислотные
и углеводные компоненты («два в одном»).
Применение этих систем позволяет:
І сократить трудозатраты на 30%:
! обеспечить гарантированную совместимость вводимых компонентов пита¬
ния;
• повысить степень асептики и антисептики при ПП:
і упростить процедуру ПП и создать предпосылки для его осуществления
в амбулаторных и домашних условиях.
Система «два в одном» представлена серией препаратов нутрифлекс*. в которых
в верхней камере находится аминокислотный раствор (аминоплазмаль*) с элек¬
тролитами, в нижней — раствор глюкозы с электролитами. Возможны варианты
нескольких концентраций (табл. 23-14).
Таблица 23-14. Состав системы нутрифлекс*
Состав
40/80
48/150
70/240
Аминокислоты, г/л
40
48
70
Глюкоза, г/л
80
150
240
Общий азот, г/л
5,7
6.8
10
Энергетическая ценность, ккал/л
320
600
960
Осмолярность, мОсмоль/л
900
1400
2100
Объем, мл
1000, 2000
1000,2000
1000,1500
В зависимости от концентрации препарата изменяется уровень содержащихся
электролитов (табл. 23-15).
Таблица 23-15. Содержание основных электролитов в системе нутрифлекс*
Электролиты, моль/л
40/80
48/150
78/240
Натрий
27
37,2
40.5
Калий
15
25,0
25.7
Кальций
2,5
3,6
4.1
Магний
4,0
5.7
5.0
Хлорид
31.6
35,5
49,5
Дигидрофосфат
5,7
20,0
14.7
Ацетат
19,5
22,9
22,0
Показания к применению. ПП в стационарных, амбулаторных и домашних
условиях для восполнения суточной потребности энергии, аминокислот и элек¬
тролитов у пациентов с нарушением катаболизма от умеренной до выраженной
степени.
895 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
Противопоказания :
• общие для ПП (шок, гипоксия, гипергидратация, нарушен»
электролитного баланса, отек легких, декомпенсированная ВМИ -До¬
статочность); ндечная цедо_
• нарушения аминокислотного метаболизма;
• гиперкалиемия;
І гнпонатриемия;
• нарушения метаболизма (сахарный диабет);
• кома неясной этиологии;
• пшергликемия, некорректируемая введением инсулина в дозе не к
бЕД/ч; ‘ Щ Мщ
• ацидоз;
• тяжелая степень печеночной или почечной недостаточности; -и,
• индивидуальная непереносимость одного из компонентов смеси;
• дети в возрасте до 2 лет.
Нутрифлекс* 70/240 следует с осторожностью применять у пациентов с увели-
ценной осмолярностью плазмы крови, сердечной, печеночной И почечной недо
статочностью.
Способ применения и дозы. Нутрифлекс* 40/80 предназначен :дяя вве
дения в периферические вены, нутрифлекс* 48/150 и 70/240 - только в цен
тральные. Дозы подбирают в соответствии с индивидуальными потребностями
Максимальные суточные дозы и скорость введения представлены § табл. 23-16,
Таблица 23-16. Максимальные суточные дозыи скорость введения смеси нутрифлекс*'
Нутрифлекс*
Максимальная суточная
доза
Скорость введения
Длительность при¬
менения
мл/кг
а сутки
амино¬
кислот (г)
на 1 кг/сут
глюкозы (г)
на 1 кг/сут
мл/кг
в час
амино¬
кислот (г)
на 1 кг/ч
глюкозы (г)
на 1 кг/ч
40/80
40
1,6
v_ 3.2
: 2
Нш
Не более 7 дней
48/150
40
1,92
6
ЕЁ
І 0.096
0,3
Ограничений нет
70/240
25
I 1,75
, 6
І 1,4
- 0.098
0,336 7
Ограничений нет
После смешивания содержимого двух камер возможно добавление жировой
эмульсии, электролитов, витаминов, микроэлементов.
Выпускают в сдвоенных пластиковых контейнерах объемом 1000 и 2000 мл
для нутрифлекса 40/80 и 48/150 мл; объемом 1000 и 1500 мл - для нутрифлек-
са 70/240 мл.
СИСТЕМА «ТРИ В ОДНОМ»
Система «три в одному на территории РФ в настоящее время представлена
лекарственными формами: нутрифлекс 48/150 липид*, кабйвен* центральный
и периферический, оликлиномель N7-1000 Е*.
Нутрифлекс 48/150 липид*
Верхняя левая камера содержит глюкозу, соли натрия и цинка; верхняя прз
вая камера содержит масло соевых бобов и триглицериды средней цепи; ни»
няя камера - аминокислоты по типу аминоплазмаля* и основные электролиты
(натрий, калий, кальций и магний). После смешивания содержимого камер ко
тейнера получают эмульсию объемом 1250, 1875, 2500 мл. На территории
в настоящее время зарегистрирована эмульсия 1250 мл, которая содержит 48
аминокислот, 6,8 г общего азота, 150 г глюкозы. Ее небелковая энергетическая
ценность - 1075 ккал (4500 кДж), осмоляльность - 1540 мОсмоль/кг, pH ~
5,0-6,0. Содержание электролитов: натрий — 50 ммоль, калий — 35 ммоль,маг*
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 897
л - 4,0 ммоль, кальций 4,0 ммоль, цинк — 0,03 ммоль, хлориды - 45 ммоль,
ь1 _ 45 ммоль, фосфаты — 15 ммоль.
'“показания к применению. Восполнение суточной потребности в энергии,
ценимых жирных кислотах, аминокислотах, электролитах и воды при ПП
ЙпаШ*еНТ0В с УмеРенным и выраженным катаболизмом.
У Противопоказания:
• нарушения аминокислотного метаболизма;
І нарушения жирового метаболизма;
гиперкалиемия, гипернатриемия;
« нарушения метаболизма при выраженном постагрессивном синдроме;
i некомпенсированная гипергликемия при сахарном диабете;
• кома неизвестной этиологии;
, выраженная гипергликемия, некорригируемая дозами инсулина до 6 ЕД/ч;
І ацидоз;
• внутрипеченочный холестаз;
І тяжелая печеночная недостаточность;
• тяжелая почечная недостаточность;
• выраженная сердечная недостаточность;
• геморрагический диатез;
• острая фаза Инфаркта миокарда;
• острые случаи тромбоэмболии, жировой эмболии;
% гиперчувствительность к яичному или соевому белку, ореховому маслу
или любому из вспомогательных веществ;
• общие противопоказания для ПП.
Состав нутрифлекс 48/150 липида* исключает возможность его применения
у новорожденных, младенцев и детей в возрасте до 2 лет.
Применение смеси при беременности и лактации нежелательно (недостаточно
изучено).
Способ применения и дозы. Нутрифлекс 48/150 липид* предназначен для
внутривенного введения только в центральные вены. Добавление к получившей¬
ся эмульсии других растворов не рекомендуют. Дозы подбирают в соответствии
с индивидуальными потребностями. Максимальная суточная доза для взрослых
и детей от 2 до 5 лет составляет 40 мл/кг массы тела, что соответствует дозе ами¬
нокислот 1,54 г/кг, глюкозы — 4,8 г/кг и жира - 1,6 г/кг.
Для детей от 6 до 14 лет суточная доза составляет 25 мл/кг, что соответствует
дозе аминокислот 0,98 г/кг, глюкозы — 3,0 г/кг, жира -1,0 г/кг.
Рекомендуют продолжительное применение данной питательной смеси. Сту¬
пенчатое увеличение скорости введения в течение первых 30 мин снижает риск
возможных осложнений.
Максимальная скорость введения — 2,0 мл/кг в час, что соответствует скорости
инфузии аминокислот 0,08 г/кг в час, глюкозы - 0,24 г/кг в час и жира - 0,08 г/кг
вчас. Длительность применения не лимитирована.
Слишком быстрая скорость вливания препарата может привести к синдрому
перегрузки и нарушениям концентраций электролитов, гипергидратации и отеку
легких. Передозировка и синдром перегрузки, сопровождаемые рядом клиниче-
ских симптомов, могут быть предотвращены тщательным соблюдением скорости
введения эмульсии и мониторингом состояния пациента (контролем содержания
г®окозы, триглицеридов, электролитов в крови).
После смешивания эмульсия должна быть сразу использована, при температуре
С может храниться в течение 4 сут.
Выпускают в строенных пластиковых контейнерах на 1250, 1875, 2500 мл.
Рвнят при температуре не выше 25 °С в защищенном от света месте.
НЦ КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
т
Кабивен*
Кабивен центральный* или периферический* - средство для Пп
ровано на территории РФ в формах для центрального и
ния. параметры которых представлены в табл. 23-17. т р еског0щ"
Таблица 23-17. Состав системы кабивен
Состм
Кабивен центральный4
Кабивен
I Глюкоза. %
§§
19
I Раствор аминокислот
Вамин 18® -н/А 2,8
Вамин 18*^м/Г7^—
І Жировая эмульсия. %
Интралипид 20*
Интралипид pS d
Объем, ил
ЬЛТДТТ- .
1026,1540,2053
1440.19202ЙГ—-J
I Энергетическая ценность, ккал
900,1400,1900
ЮОО, 1400Гш!—I!
Осмолярность эмульсии, получаемой в результате смешивания, у кабйваа
трального* составляет около 1060 мОсмоль/л, pH 5,4-5,8. В кабивене центральні
общий азот составляет при объеме 1026 мл — 5,4 г, 1540 мл - 8,1 г и при ІШ
2053 мл і 10,8 г. Эмульсия содержит электролиты, представленные в табл. щр
Таблица 23-18. Электролитный состав системы кабивен
Состав электролитов, ммоль
Объем контейнера кабивена центрального4, мл "]
1026
1540
2053
Натрий
32
48
64 '
Калий
24
36
48
Магний
4
6
8
Кальций
2
3
4
Фосфаты
10
15
20
Сульфаты
4
6
8
Хлориды
46
70
93
Ацетаты
39
58
78
Показания к применению. ПП взрослых и детей старше 2 лет с нормальной,
умеренно повышенной или сниженной потребностью в питательных веществах
Противопоказания:
• гиперчувствительность к яичным или соевым белкам или к любому вспомо¬
гательному компоненту;
• выраженная гиперлипидемия;
а выраженная печеночная недостаточность;
• выраженные нарушения свертывания крови;
а выраженные нарушения метаболизма аминокислот;
пп її ПЫ ГЙиГ
І тяжелая почечная недостаточность при отсутствии гемодиализа или
фильтрации;
• острая фаза шока;
I гипергликемия, требующая введения инсулина более 6 ЕД/ч;
• патологически повышенная концентрация в плазме крови любого из
щих в состав препарата электролитов;
І общие противопоказания к инфузионной терапии; -ц
I нестабильные состояния (некомпенсированный сахарный диабет, дек
сированиый метаболический ацидоз, сепсис и др.). Шщ
С осторожностью следует применять при нарушении метаболизма
(требуется тщательный контроль концентрации триглицеридов в крови)- ^
Специальные исследования безопасности кабивена* центрального в
беременности и кормления грудью не проводились.
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 899
Способ применения и дозы. Кабивен центральный* вводят только в цен¬
тральные вены, кабивен периферический* можно вводить в периферические вены,
дозу и скорость вливания определяют способностью пациента выводить липиды
ацетаболизировать глюкозу.
у пациентов с умеренным или тяжелым катаболическим стрессом потребность
i аминокислотах составляет 1,0-2,0 г/кг в сутки, что соответствует 0,15 -030 г/кг
в сутки азота (27-40 мл/кг в сутки кабивена центрального*).
у пациентов без тяжелого катаболического стресса потребность в аминокисло¬
та составляет 0.7-1.3 г/кг в сутки, что соответствует 0,1-0,2 г/кг в сутки азота
/19-38 мл кабивена центрального*). Максимальная суточная доза - 40 мл/кг.
что соответствует контейнеру наибольшего объема (2566 мл).
Инфузию детям от 2 до 10 лет начинают с низких доз (14-28 мл/кг в сутки)
и постепенно увеличивают до 40 мл/кг в сутки. Детям старше 10 лез вводят
такие же дозы, как и у взрослых.
Скорость инфузии кабивена центрального не должна превышать 2.6 мл/кг
в час. Рекомендуемая длительность вливания кабивена центрального* должна
быть 12-24 ч. После смешивания компонентов трех камер в контейнермогут быть
введены совместимые добавки. Для микробиологической безопасности смесь
необходимо использовать сразу после введения добавок.
Выпускают в трехкамерных пластиковых контейнерах объемом 1026, 1540,
2053,2566 мл. Хранят при температуре не выше 25 °С.
Оликлиномель N7-1000 Е4
В оликлиномеле N7-1000 Е4 три камеры. В одной из них - 10% раствор ами¬
нокислот с электролитами (натрием, калием и магнием), в другой - 40% раствор
декстрозы (глюкоза с кальция хлоридом), а в третьей - 20% липидная эмульсия,
содержащая рафинированное соевое и оливковое масла и вспомогательные ингре¬
диенты (табл. 23-19).
Аминокислотный профиль в данном препарате:
• незаменимые аминокислоты по отношению ко всем аминокислотам 40.5%;
І незаменимые аминокислоты к общему азоту - 2,5;
I аминокислоты с разветвленной цепью ко всем аминокислотам - 19%;
І общий азот — 6,6 г/л.
Липидная эмульсия содержит рафинированные оливковое и соевое масла
в соотношении 80:20. Содержание жирных кислот 15% насыщенных жирных кис¬
лот, 65% мононенасыщенных жирных кислот, 20% полиненасыщенных жирных
кислот, в оливковом масле — значительное количество а-токоферола, который
в сочетании с небольшим количеством ПНЖК повышает содержание витамина Е
в организме и снижает перекисное окисление липидов.
Таблица 23-19. Состав раствора оликлиномель N7-1000 Е*
Состав
Глюкоза, г/л
160
Раствор аминокислот
Синтамин н/А-2,5
Жировая эмульсия
КлинОлеик 20% (80% оливкового масла)
Объем, мл
1000,1500,2000
Энергетическая ценность, ккал
1200,1800, 2400
Показания к применению. ПП у взрослых и детей старше 2 лет.
Противопоказания:
• дети до 2 лег,
• повышенная чувствительность к компонентам препарата;
• тяжелая почечная недостаточность при невозможности гемофильтрации
или диализа;
900 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
• тяжелая печеночная недостаточность:
• врожденные нарушения метаболизма аминокислот;
• тяжелые нарушения свертывания крови;
• выраженная гилерлилидемия;
• гипергликемия:
• нарушение электролитного обмена, повышенная концентраті
крови одного из электролитов, входящего в состав смеси; в
« лактат-ацидоз:
і отек легких;
• декомпенсированная сердечная недостаточность;
• гипергидратация, гипотоническая дегидратация;
• нестабильные состояния (декомпенсированный сахарный диабет
фаза гиповолемического шока, сепсис и др.). ’ 0стРу
С осторожностью применяют у пациентов с повышенной осмолярностью
мы, надпочечниковой и сердечной недостаточностью, патологией легких III
Достоверные данные о применении препарата у беременных и кормящих отп*.
сгвуют. ^
Способ применения и дозы. Препарат вводят внутривенно только через ш
тральную вену. Дозу препарата и длительность назначения определяют потребно
стью каждого конкретного пациента.
В настоящее время у пациентов, находящихся на ПП, среднесуточная потреб¬
ность в органическом азоте — 0,16-0,35 г/кг. Энергетические потребности варьи¬
руют в зависимости от состояния пациента и интенсивности катаболическю
процессов и в среднем составляют 2-40 ккал/кг в сутки. В соответствии с этан
максимальная суточная доза оликлиномеля N7-1000 Е* составляет 36 мл/й,
что соответствует 1,44 г аминокислот, 5,26 г глюкозы и 1,44 г липидов.
При использовании у детей старше 2 лет необходимо помнить, что у них выше
потребность і органическом азоте (0,35-0,45 г/кг в сутки) и энергии (60-110
ккал/кг в сутки), важен водный обмен. Максимальная суточная доза - 75 мл/кг,
что эквивалентно 3 г аминокислот, 12 г глюкозы и 3 г липидов.
Максимальная скорость вливания — не более 1,5 мл/кг в час. Препарат чрез¬
вычайно чувствителен й выполнению требований скоростного режима инфузии,
При нарушении ее скорости возможна передозировка глюкозой и липидами, при¬
водящая к гипергликемии, глюкозурии, гиперосмолярному синдрому, синдрому
жировой перегрузки.
В готовую смесь могут быть введены другие йутриенты:
• витамины и микроэлементы (стабильность эмульсии сохраняется при добав¬
лении доз, не превышающих суточные);
І электролиты (стабильность эмульсии сохраняется при добавлении не более
150 ммоль натрия, 150 ммоль калия, 5,6 ммоль магния и 5 ммоль кальциа
на 1л готовой смеси); , т
• органические фосфаты (стабильность эмульсии сохраняется при дооавле
до 15 ммоль на 1 пакет). 2и2.5л-
Выпускают Iтрехкамерных пластиковых контейнерах объемом 1,1,5»»*
Хранят при температуре 2-25 °С.
ДОБАВКИ К ПРЕПАРАТАМ ДЛЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
ПП (особенно ППП) не может ограничиваться только введением основные
дуктов питания (белков, жиров, углеводов). ппэлеиен‘
ППП включает также полноценное обеспечение электролитами,
тики и витаминами. Целенаправленное введение солевых растворов ооеш
СТ основными электролитами (табл. 23*20).
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 901
^ЛИ,)Я 23-20: Потребность в электролитах при парентеральном питании
1^- наименование
Взрослые
Дети
М
80-130 мЭкв/сут
3-4 мЭке/кг в сутки
70-150 мЭкв/сут
2-3 мЭкв/кг в сутки
& ~
1,8-2,7 г/сут
80-90 мг/кг в сутки
Ы)рМЙ
0,25-0,35 мЭкв/сут
0,25-0,5 мЭкв/кг в сутки
[фосфор
930-1390 мг/сут
47-70 мг/кг в сутки
Приведенные дозы электролитов можно изменять в зависимости ОТ СОСТОЯ¬
НИЯ и потребностей пациента. Магний и фосфор необходимо восполнять всегда
(за исключением тяжелой почечной недостаточности). При очевидных признаках
истощения следует помнить о скрытом внутриклеточном истощении калия, фос¬
фатов и магния, которое не всегда сопровождается понижением их концентрации
в плазме крови.
Общее количество микроэлементов в организме человека - 10 г, но они очень
существенны в метаболических процессах. Большинство микроэлементов - кофак¬
торы или катализаторы активности ферментов, что определяет их необходимость
мл оптимальной утилизации основных продуктов и обеспечения нормальной
функции тканей. В программу ПП микроэлементы вводят в виде специализиро¬
ванных добавок к растворам аминокислот или углеводов (одна доза в первый литр
вводимых растворов). Одна из таких добавок - аддамель Н\
Аддамель Н*
Аддамель Н* — добавка микроэлементов к вводимым питательным растворам.
Комбинированный препарат, действие которого определяется микроэлемента¬
ми, родящими в его состав (табл. 23-21).
Таблица 23-21. Состав аддамеля Н* (мкмоль/мл)
Хром (в форме хлорида гидрата)
0,02
Медь (в форме хлорида гидрата)
2,0
Железо (в форме хлорида гидрата)
2.0
Марганец (в форме хлорида гидрата)
03
Йод (в форме йодида калия)
0,1
Фтор (в форме натрия фторида)
5,0
Молибден (в форме молибдата натрия гидрата)
OJ02
Селен (в форме селенита натрия гидрата)
0,04
Цинк (в форме хлорида)
10,0
Прочие ингредиенты: сорбитол, соляная кислота, вода для инъекций.
Показание к применению. ПП (в качестве добавки к растворам аминокис¬
лот), Препарат можно назначать как взрослым, так и детям (с учетом суточной
потребности в микроэлементах у пациентов разного возраста).
Противопоказание к применению. Повышенная чувствительность к компо¬
нентам препарата.
После растворения препарат добавляют к растворам аминокислот. Другие
иифузионные растворы добавлять к препарату не рекомендуют.
Выпускают в ампулах по 10 мл. Хранят при комнатной температуре. Срок грд-
В0сти ~ 2 года.
Дефицит микроэлементов развивается через 3 нед после начала ППП, не содер-
^его микроэлементы. Именно поэтому их введение в процессе кратковремен-
Ного ПП послеоперационных больных необязательно, но крайне необходимо
^ больных, находящихся на длительном ППП (особенно с фистулами и обшир*
^ Резекциями тонкой кишки, печеночной недостаточностью).
902 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
к
Важные компоненты ПП — витамины. Активно участвуя в обмене fi*
водов и жиров, они стимулируют метаболические процессы в органи 0|'
с микроэлементами способствуют оптимальной утилизации основи* -г
тов ПП. Используют их в виде специализированных добавок водора** "Ц*
(например, солувит Н*) и жирорастворимых (например, виталипид №°р%
или детский) витаминов. Водорастворимые витамины, как правило ВЗр°с'Ч
в растворы глюкозы, жирорастворимые витамины — в ЖЭ (одна дозд8*^
литр вводимых растворов). в Q(pi^
Виталипид N*
Виталипид N* взрослый или детский — добавка жирорастворимых
к ЖЭ. Препарат выпускают в двух формах: взрослый и детский (табл. щі
'Щ
Таблица 23-22. Состав виталипида N (на 1 мл препарата)
Ингредиенты, мхг
Виталипид* N взрослый
Ретинола пальмитат
194,1
135^3
Эргокальциферол
0,5
1 '
а-Токоферол
910
640 "
Фитоменадион
15
20 ~~
Прочие ингредиенты: очищенные соевое масло и фосфолипиды куриногояйца
глицерин, натрия гидроокись.
Специальная витаминсодержащая добавка к интралипиду*, для ПП взрос¬
лых и детей в возрасте старше 11 лет для удовлетворения суточной потребности
в жирорастворимых витаминах. Осмолярность — около 300 мОсмоль/л.
Показание к применению. Добавка к растворам для ПП.
Противопоказание к применению. Повышенная чувствительность к компо¬
нентам препарата.
Побочные эффекты. Возможны аллергические реакции на компоненты пре¬
парата.
Методы введения и дозы. Рекомендуемая суточная доза эмульсии для взрос¬
лых - 10 мл, для детей до 11 лет дозу рассчитывают исходя из 1 мл/кг массытела.
Препарат добавляют к основной ЖЭ не ранее чем за час до начала введения.
Во избежание микробного загрязнения процедуру следует завершить в течение 241
Выпускают в ампулах по 10 мл. Хранят в темном месте при температуре 2-8’С.
Срок годности - 2 года.
Жирорастворимые витамины вводят через 14 сут после начала комплексного
ПП неистощенным больным.
Солувит Н*
Солувит Н*- поливитаминная добавка к инфузионным растворам. Состоит
из комплекса водорастворимых витаминов (табл. 23-23).
Таблица 23-23. Состав одного флакона витаминного комплекса солувит H® I
Рибофлавина натрия фосфат, мг
Нихотинамид, мг
Пиридохсина гидрохлорид, мг
Паитопнат натрии, мг
Асхорбат натрии, мг
Фояина* хислота. мг
[Мшнохобаламин, мхг
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 903
Показание к применению. Добавка в питательные смеси при ППП.
Противопоказание. Повышенная чувствительность к компонентам препарата.
Побочные эффекты. Аллергические реакции на компоненты препарата,
режим дозирования. После растворения препарат добавляют к растворам
ГЛЮКОЗЫ.
Препарат назначают взрослым и детям с учетом возрастных потребностей,
форма выпуска — во флаконе сухое вещество 1 мл. Хранят при температуре
6-15 'C в защищенном от света месте.
церимит*
Церневит* — сбалансированная смесь водо- и жирорастворимых витаминов,
обеспечивающая полноценное снабжение организма витаминами при ПП.
Каждый флакон (5 мл) содержит:
• ретинол (витамин А) — 3500 ME;
§ колекальциферол (витамин D3) — 220 ME;
I а-токоферол (витамин Е) — 11,2 ME;
[ аскорбиновую кислоту (витамин С) — 125 мг;
• тиамин (витамин Bj) — 3,51 мг;
• рибофлавин (витамин В2) — 4,14 мг,
• пиридоксин (витамин В6) — 4,53 мг;
• цианокобаламин (витамин В12) — 6 мкг;
• фолиевую кислоту (витамин В9) — 414 мкг,
• пантотеновую кислоту (витамин В5) — 17,25 мг;
• биотин (витамин В3) — 0,069 мг;
• никотинамид (витамин РР) — 40 мг.
Показание к применению. Дополнение к ПП для взрослых и детей старше
И лет.
Противопоказания;
• повышенная чувствительность к компонентам препарата, особенно витами¬
ну В,;
І детский возраст до 11 лет;
і одновременный прием леводопы.
Способ применения и дозы. Препарат предназначен только для внутривен¬
ного введения. Рекомендуемая доза — 5 мл (один флакон) в сутки. Содержимое
флакона растворяют в воде для инъекций, глюкозе (декстрозе) либо физиологи¬
ческом растворе.
Применение препарата может продолжаться весь период ПП. При введении
церневита* в многокомпонентные смеси необходимо контролировать их совме¬
стимость. У больных с активной формой энтероколита иногда возможно повы¬
шение активности АЛТ.
Препарат можно применять в период беременности при соблюдении режима
дозирования. Применение в период лактации не рекомендуют.
Выпускают во флаконах из темного стекла, содержащих 0,747 г лиофилизнро-
ванного порошка. Хранят при температуре не выше 25 °С в защищенном от света
месте. Срок годности — 3 года.
ПРОТОКОЛ ДЕЙСТВИЙ ЛЕЧАЩЕГО ВРАЧА ПРИ НАЗНАЧЕНИИ ПАРЕНТЕРАЛЬНОГО
ПИТАНИЯ
' Оценка питательного и трофического статуса больного с определением его
суточных потребностей в энергетических и пластических компонентах.
• Определение противопоказаний для ПП в целом или его отдельных компо¬
нентов.
* Выбор вида ПП (полное, вспомогательное или частичное) с последующим
определением способа введения (центральное или периферическое).
904 КЛИНИЧ6СКАЯ ТРАНСФУЗИОЛОГИЯ
Расчет схемы ПП на сутки и определение приблизительной ллм*.
проведения.
Постановка катетера в центральные вены при ППП или длительна
питательных компонентов. м
Назначение обязательной схемы биохимического и гематология
троля за состоянием пациента. ес*0го ^
Коррекция функционирования жизненно важных систем организм
электролитного обмена и кислотно-основного равновесия, вое^
внутрисосудистого пространства по глобулярному и плазменному0^8
ликвидация гипоксии. *
Проведение ПП.
ПРАВИЛА ПРОВЕДЕНИЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
Растворы аминокислот и углеводов вводят одновременно, желательно
Y-образный переходник. ч*3
ЖЭ при пофлаконной системе нельзя сочетать с растворами электролитов
нокислот, лекарственных препаратов. Вводят по отдельной системе.
Период инфузии должен быть в среднем 10-12 ч. Медленнее и длительнее L
водят инфузию больным, плохо переносящим нагрузку жидкостью.
Скорость введения:
і аминокислот — до 0,1 г/кг в час (20-30 капель/мин);
• глюкозы - до 0,5 г/кг в час, 20% раствор — 40 капель/мин (более концентри¬
рованные растворы, а также детям как можно медленнее):
I жиров - до 0,15 г/кг в час (10% ЖЭ — до 100 мл/ч, 20% - $50 мл/ч).
Гиперосмолярные растворы вводят только в центральную вену. В перифе¬
рическую вену можно вводить растворы, осмолярность которых не превышает
830 мОсмоль/л.
Инфузию концентрированных растворов следует прекращать постепенно
(в целях профилактики гипогликемии). Скорость введения уменьшают в 2 рал
в течение 15 мин. В последующие 15 мин инфузию постепенно прекращают. Этот
период может быть увеличен до 45-60 мин, если при обычном режиме внутри¬
венного обеспечения у больного развивается гипогликемия. Период постепенного
прекращения инфузии не входит в общее время ПП.
При необходимости дополнительного введения инсулина следует помнить,
что его не добавляют в раствор ПП в период инфузии.
Окончательно готовить инфузионные смеси (добавлять в основные растворы
электролиты, витамины, микроэлементы и др.) следует в асептических условия.
Если раствор смешивают в отделении, то его необходимо использовать немедлен¬
но после приготовления.
Вводимые растворы подогревают до температуры тела (36-37 °С).
Введение питательных растворов и переливание крови проводят через разные
системы.
Нельзя использовать место введения питательных растворов для друг® ЭД
тривенных манипуляций, в том числе для забора крови.
МОНИТОРИНГ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
Показатели, которые необходимо контролировать и учитывать при ПП,
ставлены в табл. 23-24.
ОЦЕНКА ЭФФЕКТИВНОСТИ НУТРИТИВНОЙ ПОДДЕРЖКИ
І Изменение параметров нутритивного статуса: концентрации 8J
трансферрина, лимфоцитов.
1 Динамика изменения МЯГГМ ТРПЯ
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 90S
до*!* 23-М. Мониторинг парентерального питания
Показатель
Мониторинг
нестабильные пациенты 1
стабильные пациенты
гммоагура тала
Ежедневно
Ежедневно
ПКЛЬС
Ежедневно
Ежедневно
[дртвриальнов давление
Ежедневно
Ежедневно
wna дыханий
Ежедневно
Ежедневно
КРОВЬ
—
Глюкоза’
Ежедневно
+-
Ежедневно
(Гемоглобин
Ежедневно
г
2разів неділю
[гематокрит
Ежедневно
2 резв и неделю
ПШоциты
Ежедневно
2 раза в неделю
[Тромбоциты
Ежедневно
2 раз а в неделю
Протромбиновое время
Ежедневно
2 раза в неделю
Кислотно-основное состояние
Ежедневно
2 раза в неделю
Калий, натрий, хлор, кальций, магний
Ежедневно
Ежедневно
Креатинин, мочевина
Ежедневно
Ежедневно
Альбумин
Ежедневно
2 раза в неделю
Триглицериды”
3 раза в неделю
2 разав неделю
ACT, АЛТ, билирубин
Ежедневно
З раза в неделю
.. . . ...
Осмолярность
3 раза в неделю
2 раза в неделю
МОЧА
І , , . ~ —
Глюкоза
Ежедневно
Ежедневно
Мочевина
Ежедневно
2 раза в неделю
Осмолярность
Ежедневно
3 разі i неделю
' При нестабильном состоянии определяют каждые 6 ч при постоянной скрости инфучми и через
2 ч после каждого повышения скорости инфузии. Концентрацию глюкозы в крови определяют
через 30 и 60 мин после отключения ПП.
** Смотрят не ранее чем через 6 ч после окончания введения ЖЭ.
• Динамика индекса масса/рост2.
• Азотистый баланс.
• Состояние хирургической раны.
• Изменение клинического состояния пациента, выраженность и динамика
нарушений функционирования органов.
ОСОБЕННОСТИ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ ПРИ РАЗЛИЧНЫХ ПАТОЛОГИЧЕСКИХ
СОСТОЯНИЯХ
При расчете программ ПП нужно учитывать не только общие потребности
организма в белке и калориях, но также и особенности метаболизма, присущие
различным заболеваниям и их стадиям. ПП чаще всего показано при патологии
ЖКТ. Именно для его заболеваний разработаны стандартные программы ПП,
представленные в табл. 23-25.
Обязательно введение электролитов и витаминов в соответствии с суточными
потребностями.
ВПП или ЧПП можно применять при подготовке больных к хирургическо¬
му вмешательству при дисфагии. В послеоперационном периоде при операциях
щ ЖКТ методом выбора нутритивной поддержки остается ПП.
ППП назначают в случаях длительного его использования: при осложнениях
послеоперационного периода (в том числе кишечных фистулах, несостоятельио-
п® анастомозов, гнойно-септических осложнениях), обширных резекциях тонкой
шн клмиичіская гйшсФУЗйОлогия
ШШ ШШ Основные характеристики полного и вспомогательного паренім»**»
—— ■ few
Основные характеристик*
■ - ■
йвреитепки,,,,.
полнее ; irrui»
[Кояичвстео условного белка на килограмм массы тела, r/кг в сутки
— ■<
1.0-2,0
——
fflBWHlCTPO общей анергии на килограмм массы тела, ккал/кг в сутки
30-40
І Количество небелковой энергии на 1 г азота, ккал/г
150-200
ЙиаГ44
I Количество жидкости на килограмм массы тела, мл/кг в сутки
30-35
{(Продолжительность курса, сут
10-14
_ МьЦ
кишки, отсутствии акта глотания любой этиологии, дисфагии и т.д. Пр» йпп
предъявляют повышенные требования к обеспечению минеральными коле,,,!
тами и витаминами. Следует помнить, что антибиотики резко сокращают обео»
ченность организма витаминами. При кишечных инфекциях, кишечных фигт*
резекции тонкой кишки организм страдает от повышенной потери электроду»
и микроэлементов. Чем дольше пациент находится на ППП, тем острее сказы*,
ется недостаточность минеральных компонентов и витаминов при неадекватном
обеспечении ими. При стандартном послеоперационном периоде в первые 3 ст:
проводят коррекцию водно-электролитного баланса и ЧПП.
При заболеваниях печени, сопровождающихся печеночной недостаточностью,
происходит нарушение метаболизма аминокислот с накоплением в плазме крот
продуктов белкового метаболизма (ароматических аминокислот, метюшернв-
танов. серотонина, аммония и др.), что способствует печеночной энцефалопатии
(циррозу печени, гепатитам, холестазу, множественным травмам, алкогольнім
поражениям, воздействию токсичных продуктов и др.). Риск развития процес¬
са может быть уменьшен специальными растворами аминокислот с высокими
их концентрациями с разветвленными цепями и низким содержанием ароматиче¬
ских аминокислот.
После снятия болевого синдрома и стабилизации функции печени и подану-
дочной железы можно вернуться к стандартной программе.
С большой потерей белковых компонентов связано течение панкреатита,
особенно в острой стадии. Острый панкреатит нередко сопровождает печенок
ную недостаточность, поэтому в острый период рекомендуют малобелкшюе
и низкокалорийное ПП с применением аминокислотных растворов специального
назначения при полном исключении приема пищи через рот. Продолжительной
лечебного голодания с внутривенным обеспечением питательными компонентами
зависит от степени тяжести острого панкреатита: при легком течении и рецидиви
воспаления - до 7 сут, при средней тяжести — до 8-12 сут, при тяжелом течении
заболевания - до 18-22 сут. Только при нормализации активности фермент
поджелудочной железы можно изменить схему ПП - увеличить квоту основных
питательных компонентов с подключением специализированного ЭП.
Снижена переносимость белка и у пациентов с заболеваниями почек. Кай
болмческие состояния часто осложнены повышением концентрации калик, г
фора и магния в сыворотке крови, увеличением уровня аминокислот при И*
женной гипоальбуминемии. ПП проводят с учетом этих нарушений. Рекоменду*-
снижать количество вводимого белка (0.7-0.8 г/кг в сутки) с одноврй»^
повышением отношения небелковых калорий к азоту (до 300:1). чтосяосо&Ф
усилению анаболических процессов и возвращению белка в клетку. Дли ^
и среднего по времени ПП у пациентов с почечной недостаточностью прим**’1'
растворы, содержащие только незаменимые аминокислоты.
У ПП пациентов с заболеваниями легких есть особенности.
белвово-энергетический дефицит, не всегда корректируемый средствами *
ральиого или дополнительного ЭП, сопутствует большинству хронически*
ПАР£ЦЇ$>ЛЯЬИОЄ ЧИТАН* fgj
легких. Такие пациенты негативно реагируют на вариюбытов ь пжъпт*
«* рационе жидкости, белка и особенно углем*». В результат* метаболии»
•гмсвод<>й (а также избыточного количества белка, не обеспеченного иебешоаыш
дофиями) образуется большое количество углекислого газа, Пум іртіяга
anw обструктивних поражениях легких выведение углекислого газа нарушено.
друТОМу ПОСЛеДСТВИЯ МОГут быТЬ Весьма серьезными. ВПЛОТЬ Ж pet ПИрІНЦИИІІІі
дактресс-сивдрома. Профилактикой может быть поступление белка а доэе I г/ж
с адекватным его энергетическим обеспечением, при котором соотяовіение кало¬
рий углеводного и жирового происхождения должно составлять 5050 или ФЫ)
Возможности современного ЭП позволяют отдать ему предпочтение у пациентов
с заболеваниями легких.
При сердечной недостаточности. ПИККВИКСКОМ синдроме больше «ьчмчиц при¬
носят гипокалорийная диета и потеря массы тела. При невыраженной сердечной
недостаточности обычно нет противопоказании к ПП. Больные с сердечной пато¬
логией в условиях аэробного гликолиза хорошо переносят все основные компо¬
ненты ПП. Сложности возникают с объемом жидкости, электролитным составом
и осмолярностью вводимых растворов, что делает исжмьзмвмие ЭЙ метилом
выбора нутритивной поддержки.
Особенно тщательный подход необходим при длительном проведении ГО1 (Ч)
сут и более), как. например, при синдроме короткой кишки. ППП в ближайшем
послеоперационном периоде требует тщательной сбалансированности до всем
питательным компонентам в оптимальных количествах Переход к питанию дет-
коусвояемыми смесями и натуральными продуктами должен быть постепенным
Сроки перехода зависят от объема выполненной резекции Длительно сохраняют¬
ся ограничения для введения жировых компонентов энтеральным путем. Раннее
начало ЭП специализированными смесями у пациентов с синдромом короткой
кишки позволяет более эффективно адаптировать их к естественному питамяо.
ОСЛОЖНЕНИЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
• Технические:
❖ пневмоторакс;
Ф гидроторакс;
❖ перфорация вены;
❖ пункция артерии;
Ф воздушная или катетернан эмболия;
❖ венозный тромбоз;
❖ синдром верхней или нижней полой вены;
Ф повреждение плечевого сплетения;
Ф перфорация миокарда, тампонада сердца;
Ф аритмии;
Ф повреждение грудного лимфатического протока:
Ф повреждение, окклюзия, тромбоз катетера.
Факторы, указывающие на окклюзию катетера:
• катетер непроходим для ЖЭ, даже если он пропускает растворы глюкозы
и аминокислот. '
• затруднения при промывании центрального венозного катетера (ЦВКУ.
• невозможность получения крови из ЦВК;
• заброс крови в инфузионную систему.
«рй тромбозе катетера для устранения блока ЦВК (ври оттеши протвмп*
Оказаний) возможно введение небольшого количества урокиназы, «оторва
'страняет блок внутреннего просвета ЦВК и не влияет ив обже время сверит
***•*- При возникновении отека лица, шеи или коме мюлей проксимальнеє
или болезненности по ходу катетере во время инфузии желвак жюлитыиу-
908 КЛИНИЧЕСКАЯ ТРАНСФУЗИОЛОГИЯ
тривенно урокиназу до ангиографического или ультразвукового
для исключения тромбоза сосудов. ИсследоваКи
Непроходимость катетера после применения урокиназы указыва
ботмческую окклюзию, которая бывает вызвана плохой растворимость ^ НетР°»<-
кальция, других двухвалентных катионов. Для растворения минерал*
применяют 0,1 Н соляную кислоту. ЬНого осадц,
І Септические осложнения - катетерный сепсис (5-6% случаев) §
признаки которого: аРактернце
I повышение температуры тела более 38,5 °С на фоне применения If
0 источник инфекции - катетер или питательный раствор, если тем
тела снижается после прекращения ПП и вновь повышается nn»
обновлении; риегов°з-
❖ клиническая картина сепсиса при отсутствии других причин для во
новения инфекции; Ник'
❖ рост идентичной флоры в пробе крови, взятой из катетера и другой Щ.
р внезапное нарушение толерантности к глюкозе;
Ц воспаление кожи в месте выхода катетера из вены;
❖ артериальная гипотензия, олигурия.
Соблюдение асептики и протокола по уходу за ЦВК сводят инфекционные
осложнения к минимуму.
• Метаболические осложнения (3-25% случаев):
❖ гипо- и гипергликемия;
❖ нарушения электролитного баланса;
❖ повышение концентрации мочевины в крови;
g повышение активности аминотрансфераз в крови;
❖ холецистит (у пациентов, находящихся на ПП длительное время);
Ц нарушение баланса липопротеинов (недопустимая концентрация тригли¬
церидов >10 г/л);
1 обменные заболевания костей (у пациентов, длительно получающих ПП);
❖ почечная недостаточность;
1 замедленное опорожнение желудка, синдром быстрого насыщения, пере¬
насыщение.
Профилактика гипо- и гипергликемии — постоянный контроль концентрации
глюкозы в крови и моче, соблюдение правил техники введения растворов глюко¬
зы, учет клинических особенностей пациента.
Наиболее часто нарушается баланс калия, фосфора и магния, поэтому, как пра¬
вило, эти электролиты вводят постоянно. Исключение — пациенты с острой
почечной недостаточностью. Нарушения баланса кальция встречаются значитель¬
но реже. При лечении гиперхлоремического метаболического ацидоза хлориды
натрия и калия заменяют ацетатными солями. При свищах и диарее дефицит
электролитов замещают электролитными растворами отдельно от ПП.
Причина повышения концентрации азота мочевины в крови — катаболически
процессы из-за недостаточного или избыточного поступления белков и/или мал
калорийности. ,пТ
Через 2-14 сут после начала ПП может повыситься активность ACT,
и/или щелочной фосфатазы (ЩФ). Обычно ACT и АЛТ нормализуются безлрЭД^
щения ПП. Незначительное повышение ЩФ может сохраняться из-за холестатич
ского эффекта ПП и застоя желчи у пациентов, находящихся на ПП более 4 нед
Повышение уровня триглицеридов может быть связано с введением
Снижение клиренса триглицеридов наблюдают при почечной недостаточн
и применении циклоспорина. Для цирроза печени это нехарактерно. При
центрации триглицеридов более 10 г/л может развиться острый панкре^
Для определения поглотительной способности липидов пациентам проводят
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ 909
3 12 ч после введения ЖЭ берут 1-2 мл сыворотки крови больного. Если сыво-
прозрачная, то ЖЭ включают в программу ПП. При определении в сыворот-
^илеза от переливания жиров воздерживаются.
*Єглюкозоаминокислотньіе РаствоРы и ЖЭ вызывают замедленное опорожнение
аяудка и быстрое насыщение, что приводит к нарушению сердечной деятель-
* й и нейромышечным нарушениям, в связи с чем калорийность питательных
" сей необходимо повышать постепенно, в течение недели. Эффект быстрого
С сыщения может сохраняться спустя некоторое время после отмены ППП.
mm профилактики перегрузки жидкостью и последующего развития застойной
речной недостаточности начало ПП должно быть постепенным.
При длительном ПП отмечено снижение скорости клубочковой фильтрации.
ВОЗМОЖНО, это связано с системными инфекциями и избыточным поступлением
хрома.
Полный покои кишечника в течение длительного времени приводит к деге¬
неративным изменениям в слизистой оболочке тонкой кишки и соответственно
поражению ее защитного барьера. Профилактика этого - применение глутамина
раннее подключение ЭП специализированными смесями.
Профилактика метаболических осложнений - оптимальное обеспечение паци¬
ента всеми компонентами ПП, соблюдение правил введения питательных раство¬
ров и мониторирование гомеостаза.
СПИСОК ЛИТЕРАТУРЫ
Бахман A.JI. Искусственное питание: Справочное руководство по энтеральному и парен¬
теральному питанию. — СПб., 2001. — 190 с.
Вретлинд А., Суджян А. Клиническое питание. - М., 1990. - 402 с.
Костюченко А.П., Костин Э.Д., Курыгин А.А. Энтеральное искусственное питание
в интенсивной медицине. - СПб., 1996. - 330 с.
Козлов И.А. Интенсивное энтеральное и парентеральное питание как компонент анесте¬
зиологического обеспечения кардиохирургических вмешательств: Дис.... канд. мед. наук. -
М., 1985. - 190 с.
Корчак А.М., Щербакова Г.Н. и др. Внутривенное питание больных после резекции тон¬
кой кишки // Вопросы питания. — 1987. — №4. — С. 28-31.
Лукомский Г.И., Алексеева М.Е. и др. Парентеральное питание больных с гнойными
заболеваниями легких и плевры // Грудная хирургия. - 1976. - №2. - С. 57-61.
Лыскин Г.И., Щербакова Г.Н. и др. Искусственное лечебное питание в хирургии пищево¬
да//Вестник АМН. — 1990. — №10. — С. 54-59.
Малышев В.Д. Парентеральное питание: современные концепции и методические прие¬
мы//Анестезиология и реаниматология. — 1998. — №1. — С. 55-64.
Мокеев И.Н. Инфузионно-трансфузионная терапия: Справочник. — М., 1998. - 232 С.
Никода В.В., Рагозин А.К., Бондаренко А.В. и др. Полное парентеральное питание
и мониторинг глюкозы у больных в ранний послеоперационный период // Вестник интен¬
сивной терапии. - 2008. - №3. - С. 43-46.
Попова Т.С, Тамазошвили Т.Ш., Шестопалов А.Е. Парентеральное и энтеральное пита¬
ние в хирургии. - М., 1996. - 221 С.
Пугаев А.В. Тактика лечения острого панкреатита: Дис.... д-ра мед. наук. - М.. 1988. -
460 с.
Рагимов А.А., Щербакова Г.Н., Соловьева И.Н. Парентеральное питание в хирургии. —
М., 1999. - 138 с.
Руководство по парентеральному и энтеральному питанию / Под ред. И. Е. Хорошилова. -
СПб., 2000. -357 с.
Салтанов А.И., Обухова О.А., Кадырова Э.Г. Оценка питательного статуса в анестезиоло-
^ и интенсивной терапии // Вестник интенсивной терапии. - 1996. -N*4. — С. 42-49.
И 198^МЄННаЯ инФУзионная теРапия- Парентеральное питание / Под ред. В. Хартига. -
Цаданиди К.Н.. Манукян Г.В. Метаболическая основа белково-энергетической недо-
iMfW0CTH и роль питательной поддержки у больных циррозом печени // Хирургия. -
Ш § №4. - с. 137-145.
I КЛИНИЧЕСКАЯ ТВАНОТУЗИОЛОГИЯ 1
Щербаком Г.Н.. Горяйнов В.А. Аминостерил К.Е. Нефро в корпев,....
І больных с хронической почечной недостаточностью // Нове*» ИИ 4ln<*4w
1997 -N*18. - С. 30-32. в тРансфу^нЧк
Me Clave 11 Short A.F. et al. Total parenteral nutrition. Conoid 0r4
Postgraduate. Med - 1990. - Vol. 88. - N 1. -P. 235-248. 4 ЄПпЄ ‘he C0ln,,
Capes. Hunt Ц Malmberg K.. Gerstem H. StTess hyperglycaemia and In *** Ь
after myocardial infarction in patients with and without diabetes: a ased risk ы,
їшГ- 2000.1 Vol. 355. - N 9206. - P. 773-778. SySternahc ove^°%
Umpierrez G.E.. Isaacs S.D.. Bazargan N. et al. Hyperglycemia: an indent ^
hospital mortality in patients with undiagnosed diabetes //J. Clin. Endocrine w ®*ker *
VbL87.1N 3.1 P. 978-982. n0L M«ab. - A
Krinsley J.5. Association between hyperglycemia and increased hospital mow iu.
geneous population of critically ill patients // Mayo Clin. Proc. - 2003 - v!j 'ty ® a heter
P. 1471-1478. ' 78- ~ Піц/
Malmberg K., Norhammar A.. Wedel H. et al. Glycometabolic state at admission- •
marker of mortality in conventionally treated patients with diabetes mellitus and a Imp0rtam risk
infarction: long-term results from the Diabetes and Insulin-Glucouse Infusion in рШм
Infarction (DIGAMI) study // Circulation. - 1999. - Vol. 25. - N 99. - p. 2626
Krinsley J. S. Effect of an intensive glucose management protocol on the mortalitvIf ■
adult patients // Mayo Clin. Proc. -2004. - Vol. 79. - N 8. - P. 992-1000. ‘.9ПНсаЦущ
Nadzialdewicz P.. Knapik P., Urbanska E. et al. Postoperative hyperglycaemia -
increased risk of complication or death in non-diabetic patients following согопагЛ!^”01
рЦ // European. J. of Anaesthesiology. - 2007. — Vol. 24. - N 39. - p. 47. ^ f®
Van den Berghe G.. Wouters P.J., Weekers F. et al. Intensive insulin therapv in гнн іг
patients // N. Engl. J Med. - 2001. - Vol. 345. - N 19. - N. 8. - P. 1359-1367. У
Langley J.. Adams G. Insulin-based regimens decrease mortality rates in critically ill patient ■
systematic review // Diabetes Metab. Res. Rev. — 2006. — Vol. 6. — N. 23. — P. 184-192 '
Friere A.X., Bridges L„ Umpierrez G.E. et al. Admission Hyperglycemia and Other Risk Factors
as predictors of hospital mortality in a medical ICU population // Chest. - 2005. - Vol 128 і
P. 3109-3116.
Oddo М.. Chioldro R. Tight glucose control in the ICU: how aggressive should we be? // Rev
Med. Suisse. - 2006. - Vol. 13. - N 2. -P. 2840-2844.
McMullin J., Brozek J., McDonald E. et al. Lowering of glucose in critical care: a randomized
pilot trial //J. Critical Care. - 2007. - Vol. 22. - N 2. - P. 112-118.
NICE-SUGAR Study Investigators // N. Engl. J. Med. - 2009. - Vol. 26. - N 360. - P. 1283-
1297.
Wilson M„ Weinreb M. et al. Intensive insulin Therapy in Critical Care // Diabetes Care. -
2007. і Vol 30. - N 4. - P. 1005-1011.
Chase J.G., Shaw G.M., Le Compte A.J. et al. Implementation and evaluation of the SPRINT
protocol for tight glycaemic control in critically ill patients: a clinical practice change //Critical
Care. - 2008. - Vol. 16. - N 12. -49 p.
McMahon M.M. Management of parenteral nutrition in acutely ill patients with hypei$№
mia // Nutrition in Clinical Practice. - 2004. - Vol. 19. - N 2. - P. 120-128.
Boutetreau P., Chassard D., Allaouchiche B. et al. Glucose-lipid ratio is a determinant 0 ni
gen balance during total parenteral nutrition in critically ill patients: a prospective,ran _
multicenter blind ptrial with an intention-to-treat analysis // Intensive Care Med. —
Vol. 31. - N10. - P. 1394-1400. . nuBi.
Gramlich L„ Kichian K.. Pinilla J. et al. Does enteral nutrition compared to P®*®?.jfflte//
tion result in better outcomes in critically ill adult patients? A systematic review of the me
Nutrition. - 2004. - Vol. 20. - N 10. - P. 843-848. nutrition sup-
Jimenez L.L, Ramage J.E. Jr. Benefits of postpyloric enteral access placement by
port dietitian//Nutr. Clin. Pract. - 2004. - Vol. 19. - N 5. - P. 518-522. . .jon onth«
Saito H., Trocki O., Alexander J. W. et al. The effect of route of nutrient administra * «jjN
nutritional state, catabolic hormone secretion, and gut mucosal integrity after burn
J. Parenter. Enteral. Nutr. - 1987. - Vol. 11. - P 1-7.
pIVHONTO
. ... 24 Основные понятия и определения
трансфузионной иммунологии
яШ 95 иммунологическая безопасность
гемотрансфузий
Глава 26. Гемолитическая болезнь
новорожденных, обусловленная
аллоиммунизацией к эритроцитным антигенам
Введение
Научно-практические основы трансфузиологии были заложены
более 100 лет назад, когда К. Ландштейнер обнаружил и описал
группы крови системы АВО, что позволило использовать перелива¬
ния донорской крови, а в последующем ее компоненты и препараты
для лечения различных категорий больных.
Компоненты и препараты крови — это эффективная, зачастую
единственная альтернатива в лечении различных патологических
состояний. Однако уже в первые годы применения донорской крови
было обнаружено, что наряду с выраженным клиническим эффектом
в ряде случаев наблюдаются реакции и осложнения, которые резко
ухудшают состояние больного и могут стать причиной летального
исхода. С течением времени пришло понимание, что каждую транс¬
фузию необходимо осуществлять исходя из принципа «опасная
необходимость», и основная задача трансфузиологов — последова¬
тельное уменьшение всего, что составляет «опасность», и уточнение
того, что составляет «необходимость*.
В первые десятилетия научно обоснованного применения гемо¬
трансфузий основные усилия исследователей были направлены
на профилактику посттрансфузионных осложнений гемолитиче¬
ского типа, т.е. на решение вопросов иммуногематологии и изо¬
серологии.
Несмотря на все усилия современных лабораторных технологий
и клинических протоколов, направленных на иммунологическое
совмещение при аллогенных гемотрансфузиях, риск постгрансфу-
зионных реакций и осложнений остается достаточно высоким -
от 1:6000 до 1:12 000 гемотрансфузий.
С середины 60-х гг. прошлого столетия к этому вопросу присое¬
динились проблемы профилактики посттрансфузионных инфекци¬
онных осложнений в результате передачи с донорской кровью воз¬
будителей гемотрансмиссивных инфекций. Инфекционно-вирусная
безопасность гемотрансфузий — одна из важнейших проблем. Даже
тщательный лабораторный контроль донорской крови не исключа¬
ет риск инфицирования реципиента. Это связано не только с воз¬
можностью лабораторного брака или недостаточной чувствитель¬
ностью используемых реагентов, но главным образом с возможным
пребыванием инфицированного донора в серонегативном периоде.
Парентеральный механизм введения с компонентами крови бакте¬
рий, микробов и вирусов даже в минимальных количествах неми¬
нуемо приводит к инфицированию реципиента и заболеваниям
различной этиологии. Высокая вероятность инфицирования в пер¬
вую очередь связана с тем, что инфицирующую дозу вводят непо¬
средственно в кровеносное русло, во-вторых, гемотрансфузионную
терапию проводят, как правило, при объемных оперативных вме-
914 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
шательствах. ослабленным больным на фоне сниженного иммунитета
ствует развитию тяжелых форм посттрансфузионных инфекций. ’ ^ fnocM
Трансфузии аллогенных гемокомпонентов — это фактически тім
ткани, насыщенной антигенами, что приводит к значительным иммуноаИіаі,*і
сдвигам в организме реципиента. Как показал многолетний опыт
даже при максимальном совмещении крови донора и больного поа '
составу и тщательном исследовании крови на гемотрансмиссивные Г*^|>
переливание крови или ее компонентов оказывает определенное воинФч
на иммунную систему, приводя к иммуносупрессии или иммуности^'7®11'
что было определено как иммуномодулирующее действие гемотрансфузий ^
И по сей день, несмотря на все усилия, полностью безопасная гемопи
зия недостижима. Максимальное снижение риска посттрансфузионных
и осложнений должно обеспечиваться определенным алгоритмом исслел
на каждом этапе - от обследования доноров и больных до подбора и транс*'^
гемокомпонентов. *31111
На всех этапах развития трансфузиологии одной из первостепенных за
оставалась проблема обеспечения максимальной безопасности взятия Я
для доноров и гемотрансфузий для реципиентов. Сейчас выделяют три общ
риска при трансфузиях, которые требуют внимания и общих усилий специали
стов Службы крови и трансфузиологов: осложнения, связанные с несоответ¬
ствием групп крови донора и реципиента, бактериальные и вирусные заражения
и иммуномодуляции после аллогенных гемотрансфузий. По данным FDA (USA)
тремя главными причинами смерти от посттрансфузионных осложнений с 1999
по 2004 г. были бактериальное загрязнение (15,4%), острые гемолитические реак¬
ции (14,3%) и острые легочные осложнения (12,7%).
В связи с этим актуальным остается совершенствование системы комплексной
лабораторного обеспечения безопасности всех этапов подготовки и проведения
гемотрансфузионной терапии.
Качество и эффективность исследований по обеспечению безопасности гемо¬
компонентной терапии, анализа и научного обобщения результатов обследова¬
ния доноров и больных с оценкой степени риска посттрансфузионных реакция
и/или осложнений иммуногематологического и инфекционного генеза, прове¬
дения регламентированных и дополнительных профилактических мероприятий
обеспечиваются комплексным подходом в рамках идеологии нового научно-
практического направления трансфузиологии — трансфузионной иммунологии.
Трансфузионная иммунология — одно из четырех основных направлений
трансфузиологии наряду со Службой крови, клинической трансфузиологией
и производственной трансфузиологией — это раздел трансфузионной медици¬
ны, изучающий и реализующий на практике иммунологическую безопасность
и эффективность трансфузиологического пособия.
Трансфузионная иммунология — это научно-практическое направление транс¬
фузионной медицины, охватывающее изучение, разработку новых технологии
по практической сертификации крови доноров и больных в целях обеспечении
максимальной иммунологической безопасности и эффективности, в первую оче
редь гемотрансфузий.
Необходимость выделения трансфузионной иммунологии как научно
практического направления объясняется тремя основными причинами.
Подавляющее количество лабораторных исследований, используемых Д/uw
тификации крови доноров и больных, выявления изменений в организме ре®1
ента после гемотрансфуэий, основаны на реакции «антиген-антитело» вРаЗЛИЧ|\
модификациях, т.е. остаются иммунологическими (это комплекс иммуного®^
логических, иммуносерологических, иммуногенетических, иммуноферме
и других тестов).
ВВЕДЕНИЕ 918
ГеМ°ТРаНСФУЗИИ льшинство тРансФузиологичесю« процедур необходимо
иполнятъ с учетом иммунного статуса пациента, на основе специальных лабо-
!?л)рных исследовании крови донора и реципиента: определенна групповых
Сіггв крови, выявления гемотрансмиссивных инфекций, подбора пар «донор-
.ципиент* по основным и дополнительным иммуногенетическим маркерам кле¬
пан периферической крови, показателей клеточного и гуморального иммунитета.
Практически все реакции и осложнения при гемотрансфузиях имеют сущест-
«енный, з в большинстве случаев ведущий иммунологический компонент — реак¬
цию специфических антител с соответствующими или перекрестно-реагирующими
антигенами с вовлечением в иммунный процесс факторов неспецифического
иммунитета.
Глава 24
Основные поняш и определи/
трансфузионной иммунощ*
Трансфузионная иммунология как интегративное
ние включает знания и практические умения различны HanpaBJIe'
биологии, медицины, иммунологии, иммуногематологиРаЗДЄЛ0В
НОГЄНЄТИКИ, изосерологии, иммунобиотехнологии, КЛИНИИММУ
иммунологии, трансплантологии, гематологии и др’. Она пЧеско®
ется, опираясь на результаты исследований в смежных ctf113'
и одновременно в рамках трансфузиологии, пополняет их ншГ™*
научными результатами, полученными из лабораторной и клин"
ческой практики. Вот почему мы посчитали необходимым, правд
чем приступить к обсуждению вопросов, касающихся поля дея¬
тельности трансфузионной иммунологии, рассмотреть основные
понятия и определения тех разделов медицины и биологии, кото¬
рые составляют основу и тесно соприкасаются, а в ряде случаев
интегрированы в трансфузионную иммунологию, — иммунологии,
иммуногематологии, трансфузиологии.
ОСНОВЫ ИММУНОЛОГИИ
Иммунология — это наука об органах, клетках и молекулах,
составляющих иммунную систему, ответственную за распознавание
и удаление чужеродных веществ.
Иммунная система — это совокупность лимфоидных органов,
тканей и клеток, обеспечивающих биохимическую, структурную
и функциональную индивидуальность организма путем удаления
из него носителей чужеродной генетической информации.
Иммунитет — ЭТО особое биологическое СВОЙСТВО °РГаНИдоВ'
предназначенное для защиты от генетически чужеродных
способных при попадании во внутреннюю среду организма встр
в прочные связи с клетками и/или межклеточным веществом^^
Чужеродность — это термин, означающий генетическое РмИ чаще
между веществами. Чужеродными для организма материал ^ ^
всего становятся патогенные микроорганизмы и ткани ДРУШН
бей. Однако при определенных условиях даже пищевы ^
и лекарственные препараты способны вызвать иммуниь £следу-
Условно иммунологию подразделяют на инФек^^РН^!/па) и неин-
ется иммунный ответ на внедрение инфекционного фа ^тигены)-
фекционную (исследуется иммунный ответ на тканевые пеи1ньв
До открытия групп крови основным ограничением дл д0нора
аллогенных гемотрансфузий оставалась несовмести
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИЙ 917
реципиента по иммуногенетическим факторам. Открытие групповых свойств
* К. Ландштейнером в 1900 г. дало начало одному из важнейших и старейших
Уделов иммунологии — иммуногематологии.
*Иимуногематология — это наука о групповых свойствах клеток и плазмы пери¬
ферической КРОВИ. ; , «
Групповая специфичность (группы крови) определяется различиями между
особями одного вида по изоантигенам клеток и плазмы периферической крови.
Поскольку изоантигенная дифференцировка не ограничивается групповыми раз¬
личиями крови, то изоантигены (и соответственно изоантитела) - понятие значи¬
тельно более обширное, чем групповые свойства крови, так как распространяется
на все клетки и тканевые жидкости организма.
Изосерология — это наука о свойствах естественных и иммунных изоантител.
Иммуногенетика — это наука, исследующая иммунологическими методами
наследование, частоту распределения антигенов и генов в популяции.
Иммунологические методы — это исследования, направленные на изучение
количественных и качественных показателей иммунной системы. Иммуно¬
логические методы включают иммуногематологические. иэосерологические.
иммуногенетические, иммунофункциональные и др. В основе большинства имму¬
нологических методов лежит принцип реакции «антиген-антитело*.
Органы иммунной системы делят на центральные (первичные) и перифериче¬
ские (вторичные).
К центральным органам иммунной системы относятся вилочковая железа
(тимус) и костный мозг. В этих органах начинается лимфопоэз - дифференциров¬
ка лимфоцитов от стволовой клетки (СК) до зрелого неиммунного лимфоцита.
Тимус - это орган, в котором происходит дифференцировка СК костного мозга
в зрелые Т-лимфоциты. Тимус состоит их множества мелких долек, в каждой
из которых различают корковый и мозговой слои. В корковом слое в основном
протекают пролиферация и отбор Т-лимфоцитов. Эпителиальные клетки, находя¬
щиеся в корковом слое тимуса, поддерживают дифференцировку Т-лимфоцитов.
продуцируя гормоны и цитокины. Лимфоциты коркового слоя характеризуются
выраженным анизоцитозом. Во внутренней зоне коры находится большое количе¬
ство малых лейкоцитов, несущих Т-клеточные антигены. В мозговом слое содер¬
жатся зрелые Т-лимфоциты, покидающие тимус и включающиеся в общий кро¬
воток. Возрастная инволюция тимуса происходит в период полового созревания.
Атрофия начинается с коркового слоя с последующим зарастанием паренхимы
жировой тканью, активность в мозговом слое сохраняется до старости.
Костный мозг поставляет клетки-предшественники для всей кроветворной сис¬
темы, в том числе для различных популяций лимфоцитов и макрофагов. Лим¬
фоциты составляют около 20% всех клеток костного мозга. В то же время в кост¬
ном мозге протекают специфические иммунные реакции, связанные, например,
с синтезом антител. После начала вторичного иммунного ответа наблюдается
миграция активированных В-клеток памяти в костный мозг, где они дифференци¬
руются в плазматические клетки. Костный мозг служит также основным источни¬
ком сывороточных иммуноглобулинов.
К периферическим органам иммунной системы относят селезенку, лимфатиче-
скиеузлы, неинкапсулированную лимфоидную ткань. В периферических органах
зрелые неиммунные лимфоциты вступают в контакт с антигенпрезентирующими
клетками (АПК).
Селезенка — непарный орган массой около 150 г. Лимфоидная ткань селезен-
*8 ~ белая пульпа, в ней выделяют тимусзависимые и тимуснезависимые зоны,
которые заселяются соответственно Т- и В-лимфоцитами. Антигены с током
*Р°ви достигают селезенки, фиксируются в дендритных клетках и маргинальной
3°Не* откуда транспортируются в центры размножения белой пульпы. Эти акти-
§18 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
гены индуцируют пролиферацию лимфоцитов и образование
клеток в тимуснезависимой и лимфобластов в тимусзависимой ПЛазМатИчесь
Лимфоциты селезенки накапливаются вокруг артериол в виде п*”6
ных муфт. Тимусзависимая зона муфты непосредственно окруЖаСРИа^С
В-клеточные фолликулы расположены ближе к краю муфты. Adt*
зенки впадают в синусоиды - это уже красная пульпа. Синусоиды за?И°ЛЬ1 %
венулами, которые собираются в селезеночную вену, впадающую н пп анчив^іотгв
печени. Р0тнУИїєі^
Печень выполняет важные иммунные функции: синтезирует белки Ofm,
(С-реактивный белок и связывающий маннозу лектин), а іаі® will
комплемента. В печени содержатся различные субпопуляции лимфоцищ 11
числе сочетающих признаки Т- и NK-клеток. в’6 тоц
Лимфатические узлы — множественные инкапсулированные першЬеп
лимфоидные органы, состоят из заключенной в капсулу паренхимы, вюпоГЄСКі(е
Т- и В-клеточную зоны и мозговой СЛОЙ. ’ SI
Т-клеточная зона расположена в паракортикальной (Т-зависимой) зоне
жит Т-лимфоциты и ДК, которые представляют антиген для Т-лимфоцитов^
В-клеточная зона расположена в лимфоидных фолликулах, строма кою
содержит большое количество делящихся лимфоидных клеток, больших и с»
них лимфоцитов и плазматических клеток. Лимфоидные фолликулы проходять
стадии развития. Первичный фолликул состоит из неиммунных В-лимфоцитов
Во время активной иммунизации начинается процесс иммуногенеза, при кото¬
ром примерно через неделю формируется зародышевый (герминативный) центр
содержащий активно пролиферирующие В-лимфоциты. После завершения про^
цесса иммуногенеза лимфоидный фолликул значительно уменьшается в разме¬
рах — это вторичный фолликул.
Мозговые тяжи, расположенные под паракортикальной зоной, содержат макро¬
фаги. При активном иммунном ответе в тяжах находят большое количество зре¬
лых В-лимфоцитов.
Некапсулированная лимфоидная ткань представлена глоточными миндали¬
нами, лимфоидной тканью дыхательных путей и кишечника, включая пейеровы
бляшки и аппендикс. Во всех этих органах наблюдается тесная связь между лим¬
фоидными клетками и эндотелиальным эпителием.
Пейеровы бляшки — это групповые лимфатические фолликулы тонкой кишки,
Антиген, попадая в кишечник, проникает в пейеровы бляшки через спедо-
ализированные эпителиальные клетки и стимулирует антигенреактивные Т-
и В-лимфоциты. В-лимфоциты составляют 50-70%, Т-лимфоциты -10-30%всех
клеток пейеровой бляшки.
В пейеровых бляшках поддерживаются иммуногенез В-лимфоцитов и их диф
ференцировка в плазматические клетки, продуцирующие антитела - секреторные
иммуноглобулины классов А и Е. На долю IgA приходится около 70% общей еже¬
дневной продукции иммуноглобулинов в организме.
Кроме организованной лимфоидной ткани, в слизистых оболочках встречаются
одиночные внутриэпителиальные Т-лимфоциты, рассеянные среди эпитеШ»
ных клеток. На их поверхности представлена молекула, обеспечивающая ЭДШ
этих лимфоцитов к энтероцитам.
Клетки иммунной системы
Клетки иммунной системы имеют костномозговое происхождение. Из
тентной стволовой клетки происходят клетки крови и некоторые иммунные КЛ
которые в основном находятся в тканях. Вырабатываемые клетками костного
цитокины влияют на дифференцировку стволовых клеток в две клеточные
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ Ц 9
каждой из них способны к самовоспроизведению и дифференцировке с обра-
^взнием нескольких различных линий. Лимфоидные стволовые клетки при соот-
^-гвующем стимуле дают начало Т* и В-лимфоцитам и NK-клеткам - естествен-
(нормальным) киллерам. Миелоидные стволовые клетки дифференцируются
^нулоциты. макрофаги, мегакариоциты и эритроциты. В состав некоторых лим-
АоидньР1 органов (тимуса и некоторых неинкапсулированных лимфоидных тканей)
ходят эпителиальные клетки экто- и эндодермального происхождения.
Помимо клеток, большую роль в иммунных реакциях играют гуморальные фак-
юпы, представленные растворимыми молекулами. Это продукты В-лимфоцитов •-
внтитела (иммуноглобулины) и растворимые медиаторы межклеточных взаимо¬
действий, цитокины.
Т- и в-лимфоциты характеризуются следующими уникальными свойствами:
• наличием узкоспециализированных рецепторов, которые позволяют каждой
клетке распознавать индивидуальный антиген, что определяет специфич¬
ность иммунного ответа;
I клональной пролиферацией и длительной продолжительностью жизни.
что считается основой иммунной памяти;
і рециркуляцией из тканей в кровоток.
Созревание Т-лимфоцитов происходит в тимусе, контакт со стромальными
клетками которых приводит к образованию нескольких популяций Т-лимфоцитов.
В тимусе осуществляется не только дифференцировка Т-клеток, но также отбор
и подавление клеток, потенциально способных взаимодействовать с антигенами
собственного организма, т.е. происходит защита организма от аутоиммунных
реакций.
Для процесса созревания и дифференцировки пре-В-клетки в иммуннокомпе¬
тентную, но нестимулированную циркулирующую В-клетку. необходим контакт
со стромальными клетками костного мозга. Зрелая нестимулированная В-клетка
выходит из костного мозга и циркулирует до тех пор, пока не встретит антиген,
соответствующий ее рецепторам. Последующие процессы активации, пролифе¬
рации и формирования антителообразующей плазматической клетки или перси-
стирующей клетки памяти требуют иммуномоделирующего действия цитокинов.
которые продуцируются активированными Т-клетками и макрофагами.
Клетки каждой популяции несут на своей мембране молекулы. Молекулы, при¬
сутствующие только на одном определенном типе клеток или на клетках, нахо¬
дящихся на определенном этапе развития, считаются маркерами, позволяющими
идентифицировать данную популяцию клеток.
Если мембранная молекула постоянно присутствует на клетках определенного
типа независимо от ее функционального состояния, такой маркер называют кон¬
ститутивным. Если молекула появляется только после стимуляции клетки, такой
маркер называют индуцибельным.
Мембранные молекулы, детерминируемые главным комплексом гистосовме¬
стимости (МНС), образуют классы антигенов системы HLA (МНС-маркеры).
HLA-антигены А-, В-, С-серий называют молекулами I класса, а антигены D-, DQ-,
HR-серий — молекулами II класса. Молекулы I класса постоянно несут на своей
Поверхности все ядросодержащие клетки, молекулы II класса постоянно присут¬
ствуют только на зрелых В-лимфоцитах, клетках моноцитарно-макрофагального
РПДВ и на дендритных клетках. Экспрессию антигенов II класса можно индуциро-
вать У многих других клеток в частности иммунным стимулом у Т-лимфоцитов.
Многие характерные для клеток, лейкоцитно-лимфоцитарного ряда маркерные
"Ояекулы были идентифицированы с помощью моноклональных антител и назва-
пы антигенами кластеров дифференцировки (CD-антигенами).
** и В-лимфоциты несут множество различных CD-антигенов, позволяющих
** идентифицировать (табл. 24-1).
§20 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Таблица 24-1. Некоторые из основных СО-антигенов клеток иммунной системы
1 СО-аятягены
Популяция клеток
ДругиїГ клеткиТнегуйїіТп^—
СО!
Кортикальные лимфоциты
Некоторые АПК и
С02
Ранние тимоциты
NK-лимфоциты ~fcjs
t CD3
Зрелые тимоциты и периферические
Т-лимфоциты
С04
Развивающиеся и зрелые тимоциты, 2/3
периферических Т-лимфоцитов
Некоторые макрофаги "—
COS
Ранние тимоциты
В-лимфоциты при )Щ7иутппм^^
В-лимфоциты
CD8
Развивающиеся и зрелые тимоциты, '/3
периферических Т-лимфоцитов
C011a/CD18
Зрелые Т- и В-лимфоциты
Все лейкоциты ~~ ^
С021
Зрелые В-лимфоциты
Макрофаги '—-—
С025
Активированные Т- и В-лимфоциты
Макрофаги,
CD28
Зрелые и активированные Т-лимфоциты,
плазматические клетки
С032
Зрелые В-лимфоциты
Макрофаги, гранулоциты,
С034
Незрелые В-лимфоциты
ГСК, эндотелиальные клетки ~~—
CD3S
Зрелые и активированные В-лимфоциты
Эритроциты, макрофаги, гранулоцитьТмЦГ '
дритные клетки
С045
Незрелые и зрелые В- и Т-лимфоциты
Все клетки гемопоэза, за исключением зек.
троцитов
С054
Активированные Т- и В-лимфоциты
Эндотелиальные клетки, различные сомалйёГ
ские клетки после стимуляции цитокинами
CD71
Ранние тимоциты, активированные
г- и В-лимфоциты
Активированные гемопоэтические клеш ~
Т-лимфоциты предназначены прежде всего для распознавания поверхностны?
структур собственных клеток организма, участвуют в клеточных иммунных реак¬
циях.
Т-лимфоцит несет на поверхности специфический рецептор для распознавания
антигена - T-cell receptor (TCR). Он представляет собой гетеродимер, т.е. состоит
из двух разных полипептидных цепей. Известны два варианта TCR, различающие¬
ся составом полипептидных цепей, — TCR-сф и TCR-yS. Т-лимфоциты не секрети-
руют молекулы, обладающие иммунной специфичностью, продукты активирован¬
ных Т-лимфоцитов представлены различными цитокинами.
Лимфоциты, несущие TCR-aP (T-ap-лимфоциты), составляют 99% всех лимфо¬
цитов - тимусзависимые, т.е. проходящие лимфопоэз в тимусе; около 1%, несущи
TCR-уб (Т-уб-лимфоциты), являются тимуснезависимыми. Каждая из полипеп¬
тидных TCR-цепей имеет константную и вариабельную области. Вариабельный
участок связывается с антигеном и молекулами МНС (главным комплексом
гистосовместимосги). У иммунокомпетентных Т-лимфоцитов TCR связан в ко
плекс с молекулой CD3, которая участвует в передаче сигнала от гетеродя*^
узнающего антиген внутри клетки, т.е. рецептор Т-лимфоцита представляет
комплекс, образованный гетеродимером и CD3. одаї
Кроме TCR, каждый лимфоцит при созревании в тимусе приобретает,
из двух мембранных молекул — CD4 и CD8, которые выполняют разл
функции селективных молекул адгезии. Эти молекулы определяют ТИП(,носПі
с которым данная Т-клетка будет взаимодействовать, повышают спос ,
лимфоцита к формированию тесного мембранного контакта с соответству^
АПК. а также играют определенную роль при передаче внешнего сигнала
гаетки. Молекула CD4 представляет собой мономерный трансмембранний^
а СМ димер, состоящий из двух различных цепей, каждая из который
эывает мембрану.
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГ ИИ 921
CD8' Т-лимфоциты выполняют функции цитотоксических Т-лимфоцитов и
посредственно «убивают* клетки, на мембране которых они распознали анти-
^CD*' Т-лимфоциты выполняют более разнообразные функции. Из них
могут развиться цитотоксические Т-лимфоциты CD4'. но основная часть CD4
Т-лимфоцитов дифференцируется в Т-хелперы (Th-клетки), которые секре-
^ируют цитокины, осуществляющие регуляцию иммунных ответов как В-, так
„Т-клетками. При этом выработка антител может подавляться или активировать¬
ся в зависимости от типа СБ4*-клеток.
Т-хелперы индуцируют размножение и/или дифференцировку клеток других
типов. Так, они индуцируют В-клетки к секреции антител, стимулируют моноци¬
ты, тучные клетки и предшественники Т-киллеров к участию в клеточных иммун¬
ных реакциях. Ранее различали несколько субпопуляций Т-хелперов в зависимо¬
сти от того, какой набор цитокинов они продуцируют:
* ThO — Т4-лимфоциты на ранних стадиях развития иммунного ответа про¬
дуцируют митоген для всех лимфоцитов (ИЛ-2);
i Thl - дифференцированная субпопуляция иммунных Т4-лимфоцитов
продуцирует интерферон у (ИФН у), активирует макрофаги, участвующие
в развитии воспаления в виде гиперчувствительности замедленного типа
(ГЗТ);
I Th2 — дифференцированная субпопуляция иммунных Т4-лимфоцитов
продуцирует интерлейкины ИЛ-4 и ИЛ-13:
■ Th3 - иммунные Т4-лимфоциты на более поздних стадиях развития иммун¬
ного ответа — продуцируют ингибитор пролиферации лимфоцитов - транс¬
формирующий фактор роста (ТФР-р);
• Тг - Т4-регуляторы — продуцируют иммуносупрессорные цитокины ИЛ-10
(ингибитор активности макрофагов и Thl) и ТФР-р.
В настоящее время считается, что каждый зрелый иммунный Т4-лимфоцит
в каждый момент времени продуцирует только один цитокин (в редких случа¬
ях - два), поэтому предлагают говорить не о разных субпопуляциях иммунных
Т4-лимфоцитов, а о различных типах иммунного ответа.
Тимуснезависимые лимфоциты (Т-уб-лимфоциты) в основном дифференцируют¬
ся в слизистых оболочках желудочно-кишечного тракта, продуцируют цитокины.
Т-уб-лимфоциты не экпрессируют CD4, но часть из них экспрессирует CD8,
который на этих клетках представлен не в виде ap-димера, а в виде гомодимера,
состоящего из двух а-цепей.
В-лимфоциты участвуют в гуморальных иммунных реакциях. В дифференци¬
ровке В-клеток выделяют две фазы: антигензависимую и антигеннезависимую.
Предшественники В-лимфоцитов — большие пре-В-клетки - делятся, образуя
пре-В-клетки, синтезирующие сначала тяжелые, а затем и легкие цепи иммуно¬
глобулинов класса М. Эти клетки еще не имеют поверхностных lg - антигеннеза-
висимая стадия дифференцировки В-клеток. во время которой возникает большое
разнообразие преклеточных клонов, не имеющих иммуноглобулиновых рецеп¬
торов, способных реагировать с антигеном. Позднее пре-В-клетки превращаются
впалые незрелые В-клетки, на мембране которых уже появляются поверхностные
IgM. На стадии незрелых В-лимфоцитов начинает развиваться толерантность
в собственным тканям организма, которая обеспечивается следующими механиз-
Мами: делецией аутореактивных клонов, а реактиви остью при связывании незре¬
лого В-лимфоцита с растворимым антигеном и повышенной чувствительностью
незрелых В-клеток к сшиванию их поверхностных молекул IgM, что сразу же
инактивирует эти незрелые В-лимфоциты.
Из костного мозга незрелые В-клетки попадают в кровоток и мигрируют в селе
3*нку. лимфатические узлы и другие лимфоидные органы. По мере созревания
122 ТРАМС4УЗИ0ННАЯ ИММУНОЛОГИЯ
m их поверхности появляются иммуноглобулины класса D, ргцсщ
то* комплемента, рецепторы Fc-фрагмента секретируемых IgG-a °РЬ1
каждого клона часть В-клеток переключается с экспрессии 1еМ « S'
ООО IgG. IgA и IgE. ё И на Л
Одними из важнейших поверхностных мембранных маркеров в
считаются молекулы МНС II класса - HLA-DR. Они играют вЛИц^),впг
при взаимодействии В-лимфоцитов с активированным антигеном Т-лй*^10 N,
что приводит к активации В-лимфоцитов. Молекулы HLA-DR эксщк^**^
как на пре-В-клетках. так и на В-клетках. Экспрессия этих молекул nn«fHp^
при дифференцировке В-лимфоцитов в плазматические клетки.
Плазмоциты (плазматические клетки) появляются на завершающем
ференцировки В-клеток. которые постепенно теряют поверхностные Имапед4
булины и превращаются в зрелые плазматические клетки, синтезирующие^^
заданной специфичности. Зрелые плазматические клетки синтезируют и
ют несколько тысяч короткоживущих (в среднем 2-3 дня) антител в секунда^'
Поверхностные рецепторы В-лимфоцитов:
• антигенспецифические рецепторы:
І рецепторы для факторов роста и дифференцировки:
I Fc-рецепторы;
• рецепторы для комплемента.
Антигенспецифические рецепторы представлены иммуноглобулинами клеточ¬
ной поверхности (slg), в основном IgM и IgD в форме мономеров. На поверхно¬
сти одной В-клетки находится от 5 до 15 тыс. молекул slg. Связывание антигена
с поверхностным IgM или IgD запускает целый ряд последовательных процессов,
что в конечном итоге приводит к образованию антител, продуцирующих клеток
и В-лимфоцитов памяти.
Рецепторы для факторов роста и дифференцировки предназначены для веществ
(митогенов). вызывающих деление В-клеток и секрецию ими иммуноглобулинов.
Одни митогены стимулируют как В-, так и Т-лимфоциты, другие специфичны
только для В-лимфоцитов - это поликлональные В-клеточные активаторы.
Факторами роста и дифференцировки В-клеток могут служить также цитокины,
продуцируемые ThO-клетками, в частности ИЛ-2, который стимулирует деление
В-лимфоцитов.
Fc-рецепторы — это ассоциированные с мембраной рецепторы, специфиче¬
ски связывающие Fc-фрагменты иммуноглобулинов. Fc-рецепторы присутствуют
как на лимфоцитах, так и на лейкоцитах. Клетка-носитель Fc-рецептора связывает
антиген с помощью антител и запускает иммунную реакцию. По изотопу связы¬
ваемых тяжелых цепей выделяют четыре разновидности Fc-рецепторов: | е, а р,
a по аффинности связи с лигандом — три типа Fc-рецептора: I, II и III. Рецепторы
I типа способны связывать свободные молекулы антител, а II и III типа - только
комплексы АГ- АТ.
Рецепторы для комплемента (CR) представлены двумя типами - CR1 и CR2.
CR1 обнаруживают как на В-лимфоцитах, так и эритроцитах, a CR2 - только
на В-лимфоцитах. Рецепторы для комплемента типа CR1 и CR2 - это само¬
стоятельные молекулы, которые связываются с разными участками различию
компонентов системы комплемента. Они участвуют в концентрировании антиген
на поверхности В-клеток. усилении клеточной кооперации, процессах активаи*
В-лимфоцитов и межклеточного взаимодействия. _
Механизм иммунной защиты — одна из самых сложных и до конца не иссл
ванных систем, обеспечивающих гомеостаз организма в норме и при патологи
Первым барьером на пути проникновения в организм любого чужеродн®^
материала считаются факторы внешней защиты. Неповрежденные слизистые
дочки и кожный покров представляют серьезное препятствие на пути про
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ 923
патогенных микроорганизмов, кроме того, они вырабатывают различные
^ .дисробные секреты. Более специализированная защита включает высокую
*^0гностъ желудочного сока, слизь и подвижные реснички бронхиального дере-
Благодаря факторам внешней защиты большая часть микробов не попадает
**■ таНизм. Проникшие в организм чужеродные вещества прежде всего подвер-
* !угся воздействию факторов естественной резистентности и быстро, в течение
лсольких минут или часов, уничтожаются факторами естественного иммуните-
Бсди этого не происходит, включаются механизмы иммунного ответа.
^Поскольку резистентность к заболеванию может быть естественной (врожден-
илй приобретенной, то определяющие ее механизмы подразделяюгся на есте-
^нные и приобретенные (адаптивные), каждый из которых имеет как гумораль-
йЫе,так и клеточные элементы.
Естественная резистентность
Естественная (доиммунная) резистентность основана на действии неспецифи¬
ческих механизмов, в большинстве своем реагирующих на поражение тканей вос¬
палительными реакциями. В случаях когда факторы естественной резистентности
не могут обеспечить защиту организма в полном объеме, включаются механизмы
приобретенного иммунитета. Приобретенный иммунитет основан на свойствах
X- и В-лимфоцитов избирательно отвечать на внедрение чужеродных веществ
(антигенов) образованием специфической памяти и реагирования, индивидуаль¬
ного для каждого конкретного антигена. Против некоторых антигенов адаптивные
механизмы действуют автономно, но в большинстве случаев происходит взаимо¬
действие с элементами естественного иммунитета: Т-лимфоцитов - с макрофага¬
ми, антител — с комплементом и фагоцитарными клетками. Адаптивный иммун¬
ный ответ, активируя факторы естественного иммунитета, может проявляться
острым или хроническим воспалением (иногда гиперчувствительностью).
В механизмах естественной резистентности организма важную роль играют:
• первичные рецепторы для патогенов;
• система комплемента;
1 система фагоцитов;
• бактерицидные гуморальные факторы;
■ интерфероны;
І нормальные (естественные) киллеры;
• эндогенные пептиды-антибиотики.
ПЕРВИЧНЫЕ РЕЦЕПТОРЫ ДЛЯ ПАТОГЕНОВ
Первичные рецепторы для патогенов (PRR) служат для распознавания клетка¬
ми естественного иммунитета микробных клеток. Известны два типа PRR - рас¬
творимые и мембранные.
Растворимые рецепторы — липополисахаридсвязывающие белки сыворотки
крови, синтезируемые печенью, компонент системы комплемента Clg, белки
острой фазы — С-реактивный белок (СРБ) и связывающий маннозу лектин
(CMJI). Эти белки считаются опсонинами, поскольку связывают микробные про¬
дукты в жидких средах организма и обеспечивают возможность их поглощения
фагоцитами.
Мембранные рецепторы — это рецепторы на мембранах дендритных клеток
и макрофагов.
СИСТЕМА КОМПЛЕМЕНТА
Система комплемента включает 25-30 сывороточных и мембранных белков,
которые действуют в каскадной реакции. Последовательно активируясь, они
924 ТММС4УЭИ0ННАЯ ИММУНОЛОГИЯ
способны вызывать воспалительные процессы, лизис клеток и ос
точных мембранах, стимулировать фагоциты. Все это важные комп ДаЯСьы.
IВ юггогенных микроорганизмов, и любые дефекты В систем °НеНТк' Щ
швчнтельно снижают сопротивляемость организма инфекциям Аю1°МПл%т-
племента может осуществляться тремя путями: классическим ал ™0341,11 w
- терн<:
и лектиновым.
вита
Компоненты комплемента (табл. 24-2) обозначают буквами латинг
га С, В. D с добавлением цифр (номера компонента). Компоненты к„СКОго
г с а I 'ассИЧ|
пути обозначают буквой С с добавлением номера (С1, СЗ, С5 и т
Ш °бозі
В, D применяют при описании альтернативного пути. Для субкомпоне eifll*
племента к соответствующему обозначению добавляют строчные латинг^8 K0li-
(СЗЬ, С5а и т.д.). КИеЧ
Таблица 24-2. Компоненты системы комплемента
j Комюиеит
Биологическая активность компонента комплемента ~~—*
1 Классический путь ~—J
С1
| Саг,-зависимоа соединение трех субкомпонентов: С1 q, С1 г и С1 s j —-Л
C1q
Взаимодействует и распознает связывание антигена с Fc-фрагментом антител ІдІЇГй/йм—і
классами IgG (lgG3,1 и 2), взаимодействие активируют проферменты С1т и Cis *4
СІ г
Расщепляется с образованием лротеазы C1s, гидролизирующей С2 и С4 "
С2
Взаимодействует с С4Ь и расщепляется субкомпонентом C1s на С2а- и С2Ь-фрагментьГйГ
протеазный компонент СЗ/С5-конвертазы
СЗ
Основной компонент всех реакций комплемента, расщепляется С2Ь на анафилотоксинсзГ'
и опсонин СЗЬ, является компонентом СЗ/С5-конвертазы
С4
Расщепляется на С4Ь- и С4а-фрагменты. Фрагменты С4Ь и С2а соединяются и прикрепгоь]
ются к комплексу «антиген-антитело» или к мембране клетки, с которой связан антиген,
образуя конвертазу СЗ
Альтернативный путь
В
Аналог С2 классического пути активации, образует комплекс с СЗЬ
D
Сывороточная протеаза, активирующая фактор В путем его расщепления
Рг
Пропердин — первый выделенный компонент альтернативного пути активации, стабилизи¬
рует комплекс СЗЬ/В, расщепляющий СЗ на два фрагмента — СЗа и СЗЬ. Полученный СЗЬ,
в свою очередь, взаимодействует с факторами В и 0, в результате чего возрастает количе¬
ство СЗЬ (положительная обратная связь)
Пектиновый путь
СМЛ
Сходен с C1q, распознает некоторые микробные компоненты и активирует фрагменты С1г и Cis
СМЛ-
протеаза
Активизирует расщепление С4 на С4а и C4b, С2 на С2а и С2Ь
Мвмйп*ні>пплпяжляіпі(|ий (комплекс . .ііяШІ
С5
Расщепляется конвертазой СЗ/С5 на С5а-фрагменты НИ
С5а
Воздействует на тучные клетки, гранулоциты и гладкие мышцы, стимулируя воспалительны
процессы —
С5Ь
Начинает формирование С6, С7, С8 и С9 в мембраноатакующий или литический комплв|_
се
Взаимодействует с С5Ь и образует фиксирующий комплекс для С7 —■
С7
Взаимодействует с С5Ь и С6, затем весь комплекс встраивается в клеточную стенку и фи*-
сирует С8 ..—-ч
С8
Взаимодействует с комплексом C5b, С6 и С7, образует стабильный комплекс и фиксДіЕ
С8
После взаимодействия с комплексом С5-С8 полимеризуется, что приводит к лизисуклв^
клетках организма:
I CR1 экспрессирован на макрофагах, нейтрофилах и эритроцитах. Связью ^
СЗЬ и С4Ь, На эритроцитах CR1 через СЗЬ, С4Ь и растворимые иммуи
комплексы доставляет их к макрофагам селезенки и печени;
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ 925
, CR2 в-лимфоцитов связывает продукты деградации C3b-C3dg и СЗЬі, что уве¬
нчивает сродство В-лимфоцитов к «своему» антигену. CR2, возможно, уча¬
ствует также в индукции иммунной памяти. Через этот рецептор в организм
проникает вирус Эпштейна-Барр;
( CR3 связывает СЗЬі, экспрессиован на тучных клетках, фагоцитах и части
В-лимфоцитов;
, CR4 также связывает СЗЬі, находится на тучных клетках, фагоцитах и клет¬
ках гладкой мускулатуры;
, CR5 состоит из семи доменов, пенетрирующих мембрану клетки, связан
с G-белками, способными связывать гуаниновые нуклеотиды.
Классический путь активации комплемента называется так, поскольку длитель¬
ное время был единственно известным. В нем выделяют следующие этапы;
• распознавание иммунных комплексов и активация компонента С1 - осущест¬
вляется вследствие взаимодействия С1 с Fc-фрагментом антител, в основном
IgM и IgG;
і образование СЗ-конвертазы (комплекса C4b/C2b) путем расщепления С4
на субкомпоненты С4а и С4Ь. К фрагментам С4Ь присоединяются С2Ь-
фрагменты, образуя комплекс С4Ь/С2Ь, в котором протеазной активностью
обладает C2b, а С4Ь ковалентно связывается с поверхностью микробных
клеток.
Практически все основные биологические эффекты комплемента - это резуль¬
тат расщепления СЗ, т.е. классический и альтернативный пути активации компле¬
мента взаимно влияют друг на друга через компонент СЗ.
Альтернативный путь активации комплемента начинается с расщепления СЗ
на СЗа и СЗЬ. В активации комплемента по альтернативному пути не участвуют
компоненты С1, С2, С4 и ионы кальция. Не требуется взаимодействия антигена
и антитела. Дальнейшее течение процесса по классическому и альтернатив¬
ному пути протекает идентично. СЗ-конвертаза расщепляет СЗ на СЗа- и СЗЬ-
фрагменты. СЗа обладает свойствами анафилатоксина и хемотоксина. СЗЬ спо¬
собен фиксироваться на мембране клеток патогенов. В связанной с мембраной
клетки форме СЗЬ обладает аффинностью к поверхности макрофагов, нейтрофи¬
лов. Т- и В-лимфоцитов и может связываться с компонентом С5, подготавливая
образовавшийся комплекс к действию С5-конвертазы.
СЗа вместе с факторами В, D и Рг (активаторами альтернативного пути) сти¬
мулирует дальнейшее расщепление СЗ и приобретает активность С5-конвертазы.
С5-конвертаза расщепляет С5 на С5а и С5Ь. который чрезвычайно лабилен и ста¬
билизируется при связывании с С6 и С7. Комплекс С5Ь/С6/С7 может существо¬
вать как в растворенной форме, так и связываясь с мембраной клетки-мишени.
При этом он присоединяет к себе молекулу С8 и СЗ, молекулы С9, образуя ком¬
плекс С5Ь-С9, который повреждает мембрану, что приводит к лизису бактерий
или осмотическому гемолизу эритроцитов.
Лектиновый путь гомологичен классическому пути активации системы ком¬
племента, отличается от альтернативного способом активации СЗ. Главной
СЗ-конвертазой лектинового пути, как и классического, считается комплекс
С4Ь/С2Ь. При активации по лектиновому пути СМЛ взамодействует с манноэой
на поверхности микробных клеток. CMJI-ассоциированная сериновая протеаза
катализирует активационное расщепление С4 на С4а и C4b, а С2 на С2а и C2b. С4Ь
8Ц| объединяясь на поверхности микроорганизма, формируют СЗ-конвертазу,
лі? И Действуют как хемоаттрактанты.
«шовные биологические эффекты системы комплемента
»■ Опсонизация увеличивает эффективность защитных процессов благода¬
ря пРИсУтствию на клетках или частицах молекул комплемента или антител.
Ные с поверхностью клеток или микроорганизмов белки изменяют реак-
926 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
У
цню организма на эти клетки или частицы. Нейтрофилы и макш^к
руют любые частицы, которые контактируют с их мембраной э™ Г" Чи.
текают быстрее, если частицы плотно примыкают к мембране A
клетки. Для достижения такого эффекта фагоцитирующие клеткиГ0ЦитиРУЮщ^
ные молекулы, которые связывают Fc-фрагменты иммуноглобули”^
распада СЗ. особенно СЗЬ. Образование СЗЬ в альтернативном nvrL°B И
эффект опсонизации при отсутствии специфических антител.
2. Образование анафилотоксинов — СЗа- и С5а-фрагменты (в мё
Щ С4а) связываются с рецепторами тучных клеток, базофилов КровиНЬШей
собствуя высвобождению гистамина и других медиаторов, вызываюТканей> 0®.
фагоцитов и секрецию лизосомальных ферментов, воздействуют на м
ляцию. Внутрисосудистое образование СЗа и С5а может привести к а*тШн!
через эффекты гистамина и кининов. аФилак(ии
3. Цитолиз и бактерицидность - индуцируются несколькими путями-
а прямой активацией пропердина через альтернативный путь актива
племента; ЦИИ1ИН|'
• участием активированных фагоцитов;
і цитолитическим действием иммунных комплексов, содержащих 1еМ
имеющих рецептор к комплементу. Т‘
4. Конглютинация - агглютинация частиц, нагруженных СЗ в пристав
сывороточного белка конглютинина. Конглютинины агглютинируют нагружу
ные СЗ эритроциты, бактерии, частицы и тем самым участвуют в повышав®
резистентности организма.
5. Противовирусное воздействие — обусловлено;
І лизисом вируса за счет фрагментов комплемента С1-С9;
• агрегацией вируса за счет иммунных конглютининов;
• опсонизацией и фагоцитозом;
• блокадой вирусных лиганд для соответствующих рецепторов клеточной
мембраны;
І блокадой пенетрации вируса в клетку.
6. Разрушение иммунных комплексов — происходит в результате связывания
активированных компонентов комплемента с IgG и IgM, входящими в иммунные
комплексы, что препятствует образованию крупных агрегатов, а также способству¬
ет разрыхлению и расщеплению активированными протеазами образовавшим
агрегатов. Удаление продуктов распада из кровотока осуществляется вследствие
опсонизации и фагоцитоза этих фрагментов. Из тканей отложившиеся иммунные
комплексы удаляются также путем фагоцитоза.
7. Повышение цитолитической активности лимфоцитов осуществляется путем
регуляторного действия системы комплемента через компонент СЗ и фактор В
на Т- и В-лимфоциты.
8. Взаимодействие с системой свертывания крови и системой кининов - просле¬
живается при состояниях, обусловленных иммунными комплексами. Калликриннн.
плазмин і тромбин активируют С1 и расщепляют СЗ, С5 и фактор В. Активация
тромбоцитов осуществляется через взаимодействие СЗ, фактора В, проперди •
фибриногена и тромбина. Активированные макрофаги и фагоциты - это и
ники тканевых протеаз из тромбопластина при всех видах воспаления. Акпда**
всех трех систем происходит через активацию фактора XII.
СИСТЕМА ФАГОЦИТОВ
Фагоцитоз -- процесс поглощения клеткой крупных молекулярных КО^
или корпускулярных структур. К фагоцитарным клеткам относят в основно ?
типа дифференцированных клеток: нейтрофилы и макрофаги, которые созре
из (,К и имеют общую промежуточную клетку-предшёственника.
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ Q27
фагоцитарным клеткам присущи следующие функции:
, миграция и хемотаксис;
) адгезия и фагоцитоз;
, цитотоксичность;
, секреция биологически активных веществ.
Нейтрофилы — короткоживущие клетки, способные к хемотаксису и фагоци-
У составляют 60-70% лейкоцитов крови. В норме нейтрофилы циркулируют
сосудистом русле, но выходят в очаг воспаления за счет быстрой экспрессии
молекул адгезии. При поверхностной стимуляции в нейтрофилах начинаются ™
окислительные реакции и накапливается значительное количество метаболитов
и гидролитических ферментов, уничтожающих микроорганизмы как в клетках,
^ и вне их. Фагоцитоз усиливается в присутствии ионов кальция и магния.
К поверхности бактерий, особенно инкапсулированных, прикрепление затруд¬
нено, поэтому такие микроорганизмы устойчивы к фагоцитозу. В этих случаях
компоненты комплемента и специфические антитела покрывают поверхность
микроорганизмов, что облегчает их прикрепление к фагоцитирующим клет¬
кам и поглощение. Опсонизирующая активность свойственна в основном IgG,
которые взаимодействуют с бактериями с помощью специфических участков
в jab-областях, одновременно прикрепляясь к поверхности нейтрофилов через
Fc-фрагменты. В опсонизации большую роль играют также и компоненты компле¬
мента, особенно СЗЬ. Прикрепление СЗЬ к микроорганизму ускоряет его связыва¬
ние и поглощение нейтрофилом. Кроме рецепторов IgG и СЗЬ, нейтрофилы несут
также рецепторы для хемотаксического пептида ФМЛФ (формил-Ь-метионин-Ь-
лейцин-Ь-фениланин), С5а, СЗа, JITB4. Активированные микробными клетками
нейтрофилы продуцируют и выделяют литические ферменты - коллагеназу,
катепсин С, желатиназу, эластазу, фосфолипазу А2 и цитокины - ФИО, ИЛ-12,
ИЛ-8 и ФАТ.
Макрофаги обладают высокой фагоцитарной активностью, значительной под¬
вижностью и способностью образовывать токсические метаболиты кислорода
и наборы гидролитических ферментов. В отличие от нейтрофилов. у макрофагов
более медленная, но более продолжительная реакция на внешние раздражители.
Макрофаги происходят из моноцитов, которые считаются промежуточной формой,
в крови содержание моноцитов составляет 5-10% общего количества лейкоцитов.
Моноциты из крови переходят в ткани, дифференцируясь в макрофаги, которые
оседают в тканях печени (купферовы клетки), мозга (микроглия), легких, почек.
Макрофаги несут на своей поверхности разнообразные рецепторы:
I CD64 - считаются мембранными маркерами моноцитов/макрофа¬
гов, поскольку эспрессируются только на этих клетках, связываются
с Fc-фрагментами IgG, обеспечивая поглощение иммунных комплексов;
І CD14 - рецептор для бактериальных липосахаридов;
• CD3 и CD4 — рецепторы для компонентов комплемента и ряда бактериаль¬
ных продуктов: липосахаридов, гемагглютинина, поверхностных структур
некоторых дрожжевых клеток;
• рецепторы для связывания фосфолипидных мембран и других компонентов
собственных поврежденных клеток, например CD163 - для «старых» эри¬
троцитов;
• рецептор, связывающий маннозу, — присутствует только на мембране ткане¬
вых макрофагов;
• CDU5 — рецептор для колониестимулирующего фактора моноцитов.
Присутствует также на мембране полипотентной клетки-предшественницы
транулоцитов и моноцитов;
• Рецепторы для цитокинов, вырабатываемых иммунными лимфоцитами.
Связывание с лигандами рецепторов для ФНО и ИФН у ведет к активации
928 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
макрофагов. Связывание с рецептором для ИЛ-10 приво
макрофагов; Дит к ина^
I CD40. В7. MHC-I/II - мембранные молекулы для контакт
тарными мембранными молекулами лимфоцитов, т.е не
межклеточных взаимодействий. П0^д<л*е%)
Макрофагами осуществляются также процессинг и представл
т.е. образование внутри клеток комплексов из продуктов parae”*16 aitrHteia
цитированного материала с собственными молекулами МНС-Ц ПЛеввя Фаги!
этого комплекса на поверхность клетки для дальнейшего ern 3KcnP(4h
Т-лимфоцитами. расп031<,,
Активированные микробными продуктами макрофаги начинают
вать цитокины и другие биологически активные вещества, создающие
дрения чужеродных субстанций воспаление, которое подготавливает лим^^
ный иммунный ответ, — ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, ФИО, ФАТ, простат**8'1'
лейкотриен В4. ланДИНы
БАКТЕРИЦИДНЫЕ ГУМОРАЛЬНЫЕ ФАКТОРЫ
Бактерицидной активностью обладает ряд растворимых соединений, вымб»
тываемых клетками организма и ограничивающих распространение шН
К ним относятся:
• лизоцим - секретируется гранулоцитами, моноцитами и макрофагами;
S мукомидаза - расщепляет муромоновую кислоту, входящую в состав обл.
лочки грамположительных бактерий, что ведет к их лизису. В этом процессе
лизоцим действует одновременно с комплементом;
§ фибронектин — синтезируется макрофагами, играет важную роль в процессе
фиксации клеток на нерастворимых субстратах, несет участки связывай
коллагена, частиц фибрина, Clq и различных бактерий. Связывание эти
лигандов ведет к конформационным изменениям молекул, которые рас¬
познаются и уничтожаются фагоцитами;
В С-реактивный белок — синтезируется в печени под влиянием интерлейки¬
на-1, выработка которого стимулируется эндотокисинами микробов. СРВ
считается связующим звеном в прямой активации системы комплемен¬
та поверхностными структурами оболочки микроорганизмов и клеточной
мембраной. СРБ при участии ионов кальция связывается с клеточкой мем¬
браной микроорганизма, и затем комплекс «СРБ-бактерия» активирует
систему комплемента по классическому пути. Это приводит к связыванию
СЗЬ с поверхностью микроорганизма, в результате чего он опсонизируега
и фагоцитируется.
ИНТЕРФЕРОНЫ
Интерфероны играют важную роль в механизмах неспецифической защитыорга
низма. Система интерферонов включает более 20 разновидностей белков, обьеДО
ненных в пять типов. Интерфероны обладают широким спектром биологии
эффектов, но наиболее важная их функция — защита от вирусов (в основном
фероны I типа: ИНФ а и ИНФ (3). ИНФ I типа синтезируются лимфонднь^^
дритными клетками. Синтез ИФН индуцируется внедрением вирусов. ИндукВДР
синтеза могут быть геномная РНК вирусов или промежуточный продукт транс 1^
ции ДНК-содержащих вирусов. Интерфероны способствуют выработке в
ряда ферментов, которые блокируют репликацию вируса.
НОРМАЛЬНЫЕ (ЕСТЕСТВЕННЫЕ) КИЛЛЕРЫ ^
Нормальные киллеры (NK-клетки) — большие гранулярные лимфоциты^
ются низкодифференцированными потомками стволовой кроветворной кл
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ 929
■ібіїьі спонтанно, без предварительной иммунизации убивать инфицированные
С** и клетки и некоторые опухолевые клетки. В крови NK-клетки составляют
^яо 15% всех мононуклеарных клеток, в тканях они находятся в печени, сли-
оКОЛ х оболочках, красной пульпе селезенки. NK-клетки - эффекторные клег-
іобладающие клеточной цитотоксичностью и экспрессирующие Fc-рецепторы
j_Q Цитотоксическое действие NK-клеток не ограничивается белками МНС.
^у Т-киллеров. NK не формируют клетки иммунологической памяти.
ЭНДОГЕННЫЕ ПЕПТИДЫ-АНТИБИОТИКИ
Эндогенные пептиды, обладающие активностью антибиотиков, - одно из
ых новых исследований последнего десятилетия. Эндогенные пептиды-
С(ГГибиотики содержат 13-80 аминокислотных остатков, образуются путем
ооцессинга более крупных белков-предшественников. Обнаружены в клет¬
ка* многих эукариот — от растений до человека. Выделяют несколько групп
пептидов-антибиотиков, из них для человека важны дефензины (а и [1) - пепти¬
ды содержащие несколько цистеинов, связанных тремя дисульфидными связя¬
ми'а-Дефензины содержатся в гранулах нейтрофилов, р-дефензины синтезиру¬
ются в клетках эпителия дыхательных путей и желудочно-кишечного тракта.
Иммунный ответ
развитие иммунного ответа начинается в случаях, когда механизмы естествен¬
ной резистентности оказываются недостаточными для защиты организма.
Первичный контакт антигена с Т- и В-лимфоцитами формирует в конечном
итоге антителозависимые механизмы защиты (гуморальный иммунитет) и Т-лим-
фоцитзависимые (антителонезависимые) механизмы защиты (клеточный имму¬
нитет).
Ниже в этом разделе изложены преимущественно основы гуморального имму¬
нитета (антителозависимых механизмов защиты). Многие представления при¬
менимы непосредственно или в несколько измененном виде и к Т-лимфоцитзависи-
мым механизмам защиты, но в соответствии с существующими представлениями
клеточный иммунитет не имеет прямого отношения к трансфузионной медицине.
АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ
Для иммунного ответа на внедрение антигена необходимо представление (пре¬
зентация) его иммунным клеткам. Антигены, проникающие в организм, претер¬
певают определенные изменения, перед тем как инициировать иммунный ответ.
С молекулами рецептора антигена способны связываться только малые эпитопы
крупных молекул. Т-лимфоциты способны распознавать антиген только тогда,
когда он связан с пептидсвязывающим участком молекул МНС. В-лимфоциты
могут связывать антиген в нативной форме, однако в большинстве случаев
И* адекватного ответа В-лимфоцитов необходимо присутствие активированных
антигеном Т-лимфоцитов.
Обязательными характеристиками АПК считаются экспрессия МНС II класса,
способность инкорпорировать (и, как правило, разрушать) экзогенные антигены,
формировать комплекс «МНС-эпитоп* на своей мембране. Этим требованиям
отвечают макрофаги, дендритные клетки, М-клетки лимфатических фолликулов
пищеварительного тракта и других слизистых оболочек, эпителиальные ден-
Дритные клетки тимуса. Эти клетки захватывают, обрабатывают (процессируют)
представляют антиген на своей поверхности Т-хелперам. Кроме модификации
презентации антигена, АПК секретируют цитокины. которые увеличивают
^ тивноеть Т- и В-лимфоцитов, уже опознавших представленный антиген. АПК
обладают специфичностью в отношении антигена, специфичность приоб-
930 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
ретенного иммунитета обеспечивается антигенными рецепторами реат
лимфоцитов. ^РУЮЦц
Антиген - чужеродное для данного организма вещество, стимулирую^
тие иммунного ответа. Основное условие антигенности — поверхностные спЛ!^'
отличные от тканей организма хозяина. В роли антигена чаще всего оказ^1
генетически чужеродные частицы (клетки, вирусы, бактерии и т.п.) или ю^101
молекулы (белки, полисахариды), но в ряде случаев антигенными свойствами*
обладать мелкие молекулы или измененные клетки собственного организма,
рые способны индуцировать иммунологические реакции в организме - обоив!^
ние антител и активацию субпопуляций лимфоцитов и макрофагов.
Антигены характеризуются двумя основными свойствами.
• Иммуногенностью — способностью антигена вызывать образование анти
тел.
і Специфичностью — способностью антигена вступать в реакцию с соот¬
ветствующим антителом. Специфичность антигена определяется наличием
в химической структуре антигенной молекулы детерминантной группы
(эпитопа). Реакция «антиген-антитело» высокоспецифична, но не абсолют¬
на. Иногда определенный антиген реагирует с антителами, выработанными
к другому антигену. Так, например, хорошо известна перекрестная антиген¬
ная специфичность полисахаридов пневмококков и сальмонелл. В системе
антигенов гистосовместимости обнаружено перекрестное реагирование вну¬
три межлокусных антигенов HLA.
Большинство антигенов состоят из протеиновых молекул, определяющи
иммуногенность, т.е. способность вызывать синтез антител, и непротеиновш
молекул (гаптенов), определяющих специфичность.
Гаптены - это относительно низкомолекулярные вещества, сами по себе
не обладающие иммуногенной активностью, но приобретающие ее, соединяясь
с белками, которые придают им или всему комплексу «гаптен-белок» свойства
антигена. Гаптены реагируют со специфичными антителами, но сами лишены спо¬
собности индуцировать синтез антител.
Как правило, антиген (одна молекула иммунологически активного вещества)
обладает несколькими антигенными детерминантами, и при иммунизации образу¬
ются соответственно антитела с различной специфичностью, что определяет гете¬
рогенность синтезируемых антител. Гетерогенность — одна из основных причив
перекрестных реакций, которые наблюдаются, если:
I различные антигены имеют идентичные эпитопы, и образующиеся к кии
антитела будут перекрестно соединяться с соответствующими антигенами;
• антигенные детерминанты близки по своей структуре; -
І из двух антигенов образуется третий, общий антиген, и антитела, образовав:
шиеся к нему, будут реагировать и с «родоначальными» антигенами.
В зависимости от видового происхождения различают:
І гетероантигены (ксеноантигены, или видовые антигены) — антигены от др)
гого вида животных;
і изоантигены (внутривидовые, или аллоантигены) — антигены одного №
но генетически различных животных. Изоантигенами считаются антигени
групп крови (А, В, 0, Rh, M, N, S, К и др.); ГЙ
І аутоантигены - собственные нормальные антигены, а также образукшДО'
под воздействием различных биологических и физико-химических
и тогда идентифицирующиеся иммунной системой как чужеродные, п
на них вырабатываются аутоантитела и/или появляются специфически р**
гирующие С НИМИ клетки иммунной системы. $ЁЁ
і одних слУчаях антигены вызывают иммунный ответ - это так назыв#
••ыуногены, в других контакт с антигеном приводит к состоянию сни*
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ 931
^активности организма к этому антигену (толерантности) — такие антигены
взывают толерагенами.
На иммуногенность антигена влияют многие факторы:
, молекулярная масса — низкомолекулярные вещества (липиды, аминокис¬
лоты, моносахариды) не обладают иммуногенностыо. Вещества с молеку¬
лярной массой 5-10 кДа обладают слабовыраженными иммунногенными
свойствами. Сильными иммуногенами считаются вещества с молекулярной
массой в несколько сотен килодальтон;
, химическая неоднородность;
( доза антигена — с увеличением дозы вводимого антигена выраженность иммун¬
ного ответа повышается, однако сверхвысокие дозы антигена могут вызвать
состояние специфической ареактивности (иммунологической толерантности);
і способ введения антигена — иммунный ответ сильнее при введении антигена
подкожно или внутривенно;
• применение адъювантов — веществ, усиливающих иммуногенность антигена.
Суперантигены — это биомолекулы, синтезируемые вирусами, бактериями,
простейшими, гельминтами, микоплазмами. Важнейшим их отличием считается
способность одновременно активировать как Т-лимфоциты. так и АПК благодаря
прямому взаимодействию с Т-клеточным рецептором и участком молекулы МНС
П класса. В результате активируется сразу несколько типов Т-лимфоцитов разной
специфичности, каждый из которых формирует свой клон. Сила стимулирующего
воздействия суперантигенов значительно варьирует в зависимости от их природы
и доли участия Т-клеточного рецептора. Суперантигены приводят, как правило,
к массивной стимуляции Т-клеток, они способны также индуцировать иммуноло¬
гическую толерантность, апоптоз, обладают иммуносупрессорным эффектом.
Активация лимфоцитов
Активация лимфоцитов происходит под влиянием антигена, проникшего в
организм, что приводит к специфическому иммунному ответу. При активации
лимфоцитов запускается ряд процессов, приводящих к клеточному делению
и дифференцировке, в процессе которой развиваются антителообразовательная
функция В-лимфоцитов и цитотоксическая активность у части Т-лимфоцитов.
Под активацией лимфоцитов подразумевают достаточно сложный и многосту¬
пенчатый процесс перехода клетки из фазы покоя (G,,) в фазу деления и дифферен¬
циации (G,). Лимфоциты в фазе G. не делятся, характеризуются низкой метаболи¬
ческой активностью. При взаимодействии с антигеном лимфоциты переходят в фазу
С,, при этом наряду с метаболическими изменениями, характерными для делящихся
клеток, происходят процессы созревания, различные в разных субпопуляциях лим¬
фоцитов. В результате каждая субпопуляция лимфоцитов приобретает набор при¬
сущих только ей поверхностных маркеров и специфических функций.
Факторы, влияющие на активацию лимфоцитов:
• антигены, для которых существуют специальные рецепторы на лимфоцитах,
популяцию которых называют антигенсвязывающими клетками;
і антитела против иммуноглобулинов - сшивка поверхностных иммуноглобу¬
линов В-лимфоцитов бивалентными антителами к этим иммуноглобулинам;
• ИЛ-1, ИЛ-2;
1 инсулин, который, действуя на аденилатциклазу, опосредованно активирует
лимфоциты.
Механизмы активации лимфоцитов различных популяций характеризуются
^Деленной общностью, однако существуют отличительные особенности аюги-
мЧии Т- и В-лимфоцитов с различными поверхностными маркерами, с помощью
которых эти клетки взаимодействуют с внешними факторами.
Активация В-лимфоцитов происходит в ответ на внедрение трех классов анти¬
генов.
932 ТМНСФУЗИОННАЯ ИММУНОЛОГИЯ
1. Тимуснезависимого антигена первого класса (ТН-1), напоим
його липоволисахарида. КтеРиа&
Индуцирует поликлональную активацию В-лимфоцитов и пр0тл<
клональных иммуноглобулинов без участия т-лимфоцитов.
при этом развивается уже в первые двое суток после проникновени
І защищает организм в ранние сроки, однако при нем синтезируются т " аитигв|»
тела класса IgM и не формируются клетки памяти. ЛЬКо»»тк.
2. Тимуснезависимого антигена второго класса (ТН-2) - некоторых
антигенов, содержащих много повторяющихся структур, например !1ИНейНк|*
D-аминокислот, полисахарид пневмококков. ТН-2, в отличие от ТН-1 сЛНМе^
активировать только зрелые В-лимфоциты. В незрелых В-лимфоцитах пот«
щиеся эпитопы вызывают анергию или апоптоз. 1в*™рпо-
I Тимусзависимого антигена. При отсутствии Т-лимфоцитов эти анти
лишены иммуногенности. При связывании с В-клеточным рецептором ОНИ, П0Л(^
гаптенам. неспособны активировать В-лимфоциты. Для активации В-лимфотп!!1
необходимо, чтобы одна детерминанта тимусзависимого антигена связалась
с В-клеткой, а остальные - с Т-хел пером, активируя его. Т-хелпер распознает фраг¬
менты пептидного антигена в комплексе с молекулами МНС-II. Т-лимфоцит, рас-
познавший антиген, начинает делиться и дифференцироваться, в результате образу-
ется клон антигенспецифических дифференцированных Т-лимфоцитов (иммунньв
лимфоцитов или эффекторов), которые экспрессируют в необходимом количестве
мембранные молекулы и секретируют цитокины, необходимые для взаимодействия
с В-лимфоцитами. Взаимодействие Т-лимфоцитов, активированных антигеном,
с активированным антигеном В-лимфоцитом происходит в Т-зависимых зона
периферических лимфоидных органов. В-лимфоцит после взаимодействия с анти¬
геном и Т-лимфоцитом мигрирует в зону фолликула, где пролиферирует и диффе¬
ренцируется в плазматическую клетку, продуцирующую антитела.
Первые плазматические клетки остаются в лимфатическом узле и секретиру¬
ют антитела, которые в значительном количестве фиксируются на рецептора
для Fc-фрагментов антител фолликулярных дендритных клеток. Остальные плаз¬
матические клетки выходят из фолликулов лимфоидных органов и мигрируют
в костный мозг или слизистые оболочки, где и продуцируют в массовом количе¬
стве антитела, секретируя их в кровь или во внешнюю среду.
Активация Т-лимфоцитов происходит в результате действия двух сигналов:
антигена (первый сигнал), связанного с молекулой МНС II класса на поверхности
АПК. Взаимодействие антигена, гликопротеина МНС с рецептором Т-лимфоцита
генерирует сигнал, передаваемый Т-клетке, и одновременно обеспечивает воздей¬
ствие на клегку ИЛ-1 (второй сигнал), который продуцируется антигенпрезенти-
рукицей клеткой.
Активированные Т-лимфоциты секретируют:
І цитокин ИЛ-2, стимулирующий деление клеток с рецепторами к ИЛ-2:
• лимфокин BSF-I, активирующий В-лимфоциты:
І лимфокин BCGF-II, стимулирующий клонирование активированных В-лим
фоцитов;
I лимфокины BCDF - факторы дифференцировки В-клетки, стимулирую^
созревание клеток с высокой скоростью секреции IgM и вызывающие пере
ключение синтеза IgM на IgG.
АНТИТЕЛОЗАВИСИМЫЙ ИММУННЫЙ ОТВЕТ (ИММУННЫЙ ОТВЕТ ГУМОРАЛЬНОГО
ТИПА)
Иммунный ответ на Т-независимый антиген начинается с распознавания
кгем лимфоцитами. На первом этапе антиген связывается рецепторами
щгга, представляющими собой иммуноглобулины класса М. встроенные»*
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЙ ТРАНСФУЗИОННОЙ ИММУНОЛОГ*!
333
■ gjfl В-лимфоцитов. Важную роль играют также другие рецепторы, например
^еятор к Fc-фрагменту иммуноглобулина. Это служит сигналом к дальнейшим
£йяиферации и дифференцировке. Поскольку не все антигены после связывания
*^цепторами В-лимфоцитов могут стимулировать его пролиферацию и диффе-
1йШИровкУ> 8 большинстве случаев для индукции иммунного ответа необходим*
йпкклегочная кооперация.
На этапе межклеточной кооперации к индукции иммунного ответа подключа¬
йся антигенпрезентирующие клетки и Т-лимфоциты. АПК с помощью лиэпсо-
улльных ферментов расщепляет антиген, выводит на свою поверхность продукты
.^щеплення антигена и соединяет их с белками МНС класса II. Затем АПК пред¬
ъявляет этот комплекс Т-лимфоцитам. Субпопуляции Т-лимфоцитов (Т-хедперы
й х-индукторы) имеют специфические рецепторы для антигенов МНС класса И.
Таким образом, межклеточная кооперация осуществляется через двойное рас
познавание: АПК несут антигены и белок МНС класса II, а Т-лимфоциты имеют
вецепторы для обеих структур, вследствие чего АПК и Т-лимфоцит связываются
через эти два типа рецепторов. В межклеточной кооперации принимают также
участие медиаторы ИЛ-1, вырабатываемые макрофагами, и интерферон (выраба¬
тывается Т-лимфоцитами и активирует макрофаги).
Иммунный ответ на Т-зависимый антиген начинается с активации Г-индукто¬
ров. АПК взаимодействуют с антигенспецифическими лимфоцитами и стиму¬
лируют Т-индукторы, которые начинают вырабатывать и секретнровать ИЛ-2,
который, в свою очередь, активирует эффекторные Т-лимфоциты - Т-хедперы
ицитотоксические Т-клетки.
Оптимальный иммунный ответ реализуется только при эффективном взаимо¬
действии Т- и В-клеток.
На третьем этапе благодаря межклеточной кооперации начинается синтез анти¬
тел 1 активируются структурные гены, кодирующие синтез константных и вариа¬
бельных участков иммуноглобулинов. Образовавшиеся тяжелые (Н) и легкие (L)
цепи иммуноглобулинов выделяются в эндоплазматическнй ретикулум. где они
объединяются в комплексные молекулы - иммуноглобулины, которые затем
транспортируются к мембране клеток и встраиваются в нее.
Первичный иммунный ответ возникает при первом контакте организма с анти¬
геном.
Латентный период длится около недели, характеризуется циркуляцией в крови
свободного антигена и образованием циркулирующих иммунных комплексов
(ЦИК), которые элиминируются организмом.
Лаг-период (длительностью от нескольких дней до недель н месяцев) характе¬
ризуется синтезом и нарастанием количества специфических антител. Антитела,
которые появляются в циркуляторном русле после первого контакта с антигеном,
представляют собой иммуноглобулины класса IgM. Тимуснезависимые антигены
стимулируют синтез только IgM. Тимусзависимые антигены сначала индуцируют
преимущественно синтез высокомолекулярных антител, а затем, через несколько
Дней после появления IgM, как правило, синтезируют низкомолекулярные IgG-
и IgA-антитела. Если дальнейшего контакта с антигеном не происходит, уровень
ч>М достигает максимума и затем снижается, а IgG-антитела той же соецифич-
НОеги Циркулируют значительно дольше, иногда пожизненно. После достижения
максимального уровня синтез антител может прекратиться, и вследствие катабо¬
лизма иммуноглобулинов их концентрация снижается.
врсмя первичного иммунного ответа небольшая часть Т- и В-лимфоцитов
®игенспецифического клона персистирует в организме в течение неопредеден-
времени (для различных антигенов оно разное, составляет от нескольких
До пожизненного), образуя Т- и В-клетки памяти, играющие большую роль
вторичном иммунном ответе.
534 ттнсФУЗионнАЯ иммунология
Вторичный иммунный ответ возникает при повторном попадании а
■мам. При повторном контакте с антигеном клетки памяти реагипук^Генав%
быстрее, чем нестимулированные клетки, поэтому вторичный ИММунньгі|ЗНаЧИТЄ,С
теризуется коротким лаг-периодом, интенсивным антителообразован
высоким максимальным уровнем антител, сохраняющимся длительное И
При вторичном иммунном ответе, стимулированном тимусзавиащЄМЯ'
ном. синтез IgM- и IgG-антител начинается практически одновременно М аНТМг*‘
IgG-антитела синтезируются более активно. ’ ПР'< Лщ,
Антитела - это сывороточные иммуноглобулины с широким спекти
фичностн к различным антигенам. Антитела обладают свойством CIIMcn*lui-
оси связываться с антигеном и образовывать комплексы «антиген-aim!
Специфичность активного центра антитела определяется химической ст^10*
антигена. Антитела способны активировать комплемент, усиливать фагоц^^
активность макрофагов и нейтрализовывать бактериальные клетки. Подав^
выработки антител происходит с участием регуляторных Т-клеток. е
Все антитела - это белки, имеющие глобулярную вторичную структуру
му и названы иммуноглобулинами.
Иммуноглобулины - это класс структурно связанных белков, содержащих »
легкие (L) полипептидные цепи С НИЗКОЙ молекулярной массой И две тяжелы
(Н) с высокой молекулярной массой. Все цепи сшиты через цистеиновые остатки
дисульфидными связями.
Под действием протеолитических ферментов молекулы иммуноглобулинов
расщепляются на три фрагмента: два Fab-фрагмента, антигенсвязывающие фраг¬
менты и непарный Fc-фрагмент, который обеспечивает взаимодействие комплек¬
сов АГ АТ с системой комплемента.
Каждая из четырех цепей иммуноглобулина содержит константные (С) и вариа¬
бельные (V) участки, характеризующиеся специализацией и специфичностью
молекулы иммуноглобулина. Различия в константных участках тяжелых цепей
лежат в основе деления молекул иммуноглобулинов на классы и подклассы с раз¬
личными биологическими функциями.
На основании структурных и антигенных признаков тяжелых цепей иммуногло¬
булины подразделяют на пять классов антител: IgG, IgA, IgM, IgD и IgE. Молекулы
IgG, IgD I IgE представлены мономерами, молекулы IgM — пентамерами, молеку¬
лы IgA в сыворотке крови представлены мономерами, а в эксретируемых жидко¬
стях (слезах, слюне, секретах слизистых оболочек) — димерами.
Иммуноглобулины классов G и А имеют несколько подклассов: IgG,, IgG2, IgG,.
IgG4 и IgA,, IgA2.
Тяжелые цепи определяются различиями между классами иммуноглобулинов,
и разные типы тяжелых цепей обозначают греческими буквами: для IgG -1
IgA - a, IgM - (it, IgD - І и IgE - є. Каждая из Н-цепей IgG, IgA и IgD conwr
из четырех доменов (вторичная структура полипептидных цепей) - вариабель¬
ного (VH) и константных (СН,, СН2,СН3). Н-цепи молекул IgM и IgE содержат
дополнительно домен СН4.
Легкие цепи примыкают к N-концу тяжелых цепей. Каждая Е-цепь сосго
из двух доменов - VL и CL.
Вариабельные участки молекулы определяются специфичностью антиген
бывающего центра антител. Участки вариабельных областей тяжелой и лепс
цепей (по 3 -4 на каждой цепи) образуют гипервариабельные области, к
рые образуют антигенсвязывающий центр. Разнообразие антигенсвязываю
участков обеспечивается огромным разнообразием кодирующих участков Д
и высокой подверженностью генов гипервариабельных областей соматич
мутациям.
Гипервариабельные участки антител непосредственно и комплементарно сея
wot антиген. Антигенные детерминанты (эпитопы) вступают в ионные, водор
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ иммунологии 935
гидрофобные ван-дер-ваальсовы связи с активным центром Fab-фрагмента
Сродство антигена с антителом характеризуется аффинностью и авидно-
ґЛіЮ- м.
• афФинность ~ это сила химической связи одного эпитопа с одним из актив¬
ных центров иммуноглобулина. Аффинность количественно оценивают
по константе диссоциации одного антигенного эпитопа с одним активным
центром;
• авидность — это сила связи цельной молекулы антитела со всеми антигенны¬
ми эпитопами.
Константный участок тяжелых цепей может быть представлен пятью типа-
и|( аминокислотных последовательностей (а, у, 5, є и ц), каждая из которых,
как сказано выше, соответствует определенному классу иммуноглобулинов. Когда
нестимулированной В-клетке происходит активация одного из сегментов кон¬
стантного участка тяжелых цепей, это не препятствует синтезу тяжелых цепей
с другим типом константного участка у клональных потомков данного лимфоцита
в дальнейшем.
Способность В-лимфоцитов синтезировать иммуноглобулины с тяжелыми це¬
пями различных типов определяется возможностью этих клеток вырабатывать
антитела одной и той же специфичности, но отличающиеся тяжелыми цепями
и поэтому обладающие различными функциональными возможностями в ответ
на различные условия стимуляции.
Структурные различия белков иммуноглобулинов, относящихся к одной функ¬
циональной группе, называют изотипами, они одинаковы у всех особей данного
типа. Индивидуальные аллельные варианты иммуноглобулинов в пределах одного
идиотипа называют аллотипами. По антигенной специфичности антитела относят
к различным идиотипам (табл. 24-3). Когда потомки клетки, изначально продуци¬
рующей IgM данного изотипа, начинают вырабатывать IgG, этот процесс называ¬
ют переключением изотипа.
Таблица 24-3. Классификация антител
Тип
Классификация
Примеры
Изотип
Классы и подклассы иммуноглобулинов, присутствующие у всех пред¬
ставителей данного вида
IgG, IgA, IgM,
IgG,, IgG,
Аллотип
Различия в аминокислотной последовательности Н- и L-цепей,
не связанных со специфичностью антител. Присутствует у некоторых,
но не у всех представителей вида
Gm- и Кш-аллотипы
Идиотип
Антигенсвязывающие участки молекулы антитела. Присутствуют
на некоторых, но не на всех молекулах антител у данного представите¬
ля вида
Fab-участки молекулы
антитела
Аллотипы — это варианты молекул антител (иммуноглобулина) у отдельных
представителей данного вида. Они относятся к константным областям цепей
иммуноглобулинов и генетически детерминированы. Аллотипические детерми¬
нанты присущи В-клеткам. По закону аллельного исключения при антигенном
стимулировании возможна экспрессия только одного аллотипа иммуноглобулина.
Это значит, что для синтеза В-антител используется только один из двух наборов
хромосом клетки, скорее всего, тот, в котором раньше произошла перестройка
генов.
Идиотипы — это антитела, антигенсвязывающий участок которых распоз-
нан и связан другими антителами. В этих случаях одну молекулу называют
ндиотипом (It), а другую — антиидиотипом (анти-It). Можно предположить.
,т° они могут быть не только антителами, но и молекулами Т-клеточных
Рецепторов. Из этого предположения был сделан ряд важных выводов. Прежде
J|g опровергается привычное деление молекул на антигены и рецепторы,
дольку молекула иммуноглобулина-рецептора к определенному антигену
dgjjg ТР*НСФУЭИ0ИКАЯ ИММУНОЛОГИЯ
сама оказывается антигеном для нескольких других молекул иммуног
■О*. ДЛЯ которых. В СВОЮ очередь, существуют рецепторы, И Т.д. Ещ/Т^
английский иммунолог Н. Ерне на основании подобных предположений
мудировал теорию идиотип-антиидиотипической сети, которую подтвеп ^
следующие факты: Р*1»
• введение в организм моноклональных антител, т.е. антител одного
вызывает появление в сыворотке антиидиотипических антител, оггоед^
мых по их связыванию только индуцирующими моноклональными Г*
телами:
• нормальный, характерный для иммунного ответа прирост количества am*
тел для любого идиотипа в большинстве случаев ингибируется введени
соответствующего антиидиотипа;
І некоторые антиидиотипы подавляют связывание между идиотипическиц
антителами и антигеном, их индуцирующим, в связи с тем что направлены
против антигенсвязывающих участков антигена;
• на поздней стадии иммунного ответа антиидиотипические антитела появ¬
ляются спонтанно как раз в то время, когда снижается количество соответ¬
ствующих им идиотипов.
Дальнейшие исследования в этом направлении имеют большое значение прак¬
тически для всех разделов иммунологии, в частности, если подавление продукция
идиотипов будет надежно воспроизведено введением антиидиотипических анти¬
тел, то произойдет мощный прорыв в лечении аллергии, аутоиммунных заболе¬
ваний и т.д. Кроме того, в будущем, возможно, будут созданы вакцины на основе
антиидиотипических антител.
Антитела в зависимости от своего происхождения подразделяются на две боль¬
шие группы:
• естественные антитела, образование которых не вызвано антигенным сти¬
мулом;
• иммунные антитела, образующиеся в результате воздействия антигенного
стимула.
Иммунные антитела первоначально не содержатся в организме человека, а
синтезируются в результате антигенной стимуляции, например, после инфици¬
рования микроорганизмами, несовместимой гемотрансфузии или беременности.
Как правило, иммунные антитела в начале первичного иммунного ответа появ¬
ляются в виде иммуноглобулинов класса М, позднее заменяются антителами
IgG-класса. В ряде случаев антитела IgG-класса образуются на первом этапе.
Некоторые антитела всегда IgM-класса, например анти-М, анти-N, анти-Р,анти-
Le*. aHTH-Leb.
В зависимости от видового происхождения различают:
• гетероантитела - антитела одного вида животных, которые реагируют
с антигенами другого вида животных. Например, человеческая сыворотка
содержит естественные агглютинины или гемолизины против антигенов эри¬
троцитов собаки, кошки и многих других животных;
а изоантитела антитела особи данного вида животных, которые реагируют
с антигенами клеток другого представителя того же вида, например есте¬
ственные антитела групп крови человека или иммунные гемотрансфузиоа-
ные антитела;
• аутоантитела антитела против собственных антигенов клеток, ткане11
или жидких субстанций организма.
І зависимости от оптимума температуры реагирования различают антитела
• холодовые - оптимум реагирования от 0 до 18 “С;
I тепловые активны при 37 “С;
• комнатные реагируют преимущественно при 20-22 °С.
ОСНОШЫС ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ Л'ШШШЙ ишмвиаим вд
й реакциям in vivo антитела разделяют.
§ „а агглютинины - агглютинируют (склеивают) клетки (шшрішев.
цкгм или лейкоциты) с соответствующим антигенным фенотипом; Ж
гемолизины - осуществляют гемолиз с участием комплемента;
оосонины — антитела, которые, реагируя с антигенами клеток, облегчав*
процесс их поглощения фагоцитирующими клетками репщуладщщтелиа^
пой системы (в печени и селезенке). Например, виесостдистое г-іггліи
эритроцитов с К-фенотипом анти-К-антитеяамм Антитела нейтойизт
антифагоцитарные вещества или. связываясь с поверхностью миквооща-
низмов, облегчают поглощение (механизм опсонизации) их коламоцфцп.
ядерными лейкоцитами или макрофагами;
, ингибирующие антитела — обладают способностью тормозить и нейтрали-.
зовывать определенную тестовую иммунологическую пробу;
, преиипитирующие антитела - обнаруживаются в реакции преципитации
с растворимым антигеном.
Антитела принято подразделять на регулярные и иррегулярные.
• регулярные антитела постоянно присутствуют в плазме людей в соответ¬
ствии с группой крови, к ним относятся, например, естественные анти-А-
и анти-В-антитела.
• Иррегулярные антитела выявляются у отдельных лиц и мот быть есте¬
ственными и иммунными:
ф естественные иррегулярные антитела - анти-М, аяти-N. анти-Ье*. -Le*.
анти-Н; эритроцитные. холодовые. неспецифические агглютинины и холо¬
довые лимфоцитотоксины. естественные тепловые антнлейксщитарные
антитела;
❖ иммунные иррегулярные антитела - это большая группа вяиы, которая
включает все антитела к известным аллоантигенам и антитела неустанов¬
ленной специфичности, образующиеся в результате сенсибилизация орга¬
низма генетически чужеродными веществами - при гемотрансфузнях,
беременности, пересадке органов и тканей или под воздействием некото¬
рых микроорганизмов.
В зависимости от среды реагирования in vitro, в которой они агглютинируют
клетки, антитела разделяют на две группы:
• полные, или агглютинирующие, которые действуют в 0.9% растворе натрия
хлорида (отсюда их другое название - солевые);
• неполные, или конглютинирующие, действующие в высокомолекулярной
среде (человеческая сыворотка, альбумин, декстран и др.).
Неполные антитела не агглютинируют эритроциты в 0.9% растворе натрия
хлорида, но фиксируются на эритроцитах при наличии на них соответствующего
антигена. После предварительной обработки эритроцитов протеолитическимм
ферментами неполные антитела могут агглютинировать эритроциты в солевой
или высокомолекулярной среде.
Среди неполных различают антитела, агглютинирующие эритроциты в колло¬
идных средах, и так называемые блокирующие антитела, которые не агглютини¬
руют эритроциты даже в коллоидной среде, а выявляются только > аитиг.юбулн-
новом тесте после специальной обработки эритроцитов.
Классы иммуноглобулинов
1 Иммуноглобулины класса M - IgM (ММ 900 тыс. Да) - появились
первыми в процессе эволюции. Они также первыми синтезируются в ответ
1,3 антигенную стимуляцию. IgM составляют 5-10% иммуноглобулинов в мор¬
альной сыворотке, имеют пентамерную структуру с 10 активными центрами.
•W при невысокой аффинности обладают высокой авидностью из-за повто¬
ряющихся детерминант (связывающих активных центров). В серологических
938 н*нс*узионная иммунология
тестах с эритроцитами и другими клетками IgM характеризую
способностью к связыванию, выраженной активностью в агп^1*цЧ* J
НИИ клеток. Вследствие крупных размеров молекулы не проход*!0^?
центу. Связываясь с клеткой-мишенью, содержащей антиген сп Ч***4
поглощению ее макрофагами или лизису вследствие активации ко***1**»
На В-лимфоцитах IgM может быть представлен в виде мономет^6*’51’1».
роль иммуноглобулина. ’ вЫ1>олк,,
2. Иммуноглобулины класса G — IgG (ММ 160 тыс. Да). - существую
как мономеры, на их долю приходится около 80% иммуноглобул^?^0
ротки, он присутствует также в экстраваскулярной жидкости. Имеют a^LCl180'
Fc-участок. с помощью которого активно связываются с рецепторами <ьГИїВьіі'
и Clq-компонентом комплемента. Могут проникать через плаценту и во01
судистые пространства. Существует четыре подкласса молекул IgG: IgG*7^
IgGj, IgG4, которые различаются вариациями константных областей mojkk»
Варианты константных областей легких цепей иногда обозначают как подгиб
Биологические свойства подклассов имеют существенные отличия. IgG ofoJ?
ет наиболее выраженной способностью активировать комплемент, в меньше”
степени это свойственно IgGj и в еще меньшей — IgGr IgGj, IgG3 и IgG4 свободно '
проникают через плаценту в отличие от IgG2. Разные антигены вызывают синтез :
IgG различных подклассов. Например, вирусы стимулируют синтез IgGt и IgG
полисахариды - IgGr
3. Иммуноглобулины класса А — IgA (ММ 400 тыс. Да). Основная их фу®. I
ция - препятствовать проникновению Чужеродных веществ через внешние j
покровы тела, содержатся в секретах организма (слюне, поте, слезной жидкосщ, |
молоке и др.), моче, легких, кишечнике. В сыворотке на долю IgA приходити j
10-15% всех иммуноглобулинов. Имеют секреторный компонент^'поли- I
пептид, который включается в структуру IgA в эпителиальных клетках и обе- і
спечивает транспорт через эпителий, предохраняя молекулу антитела от рас- [
щеплення. Формируя защитный барьер против биологической агрессии, IgA
определяются преимущественно в местах наиболее вероятного проникновенна
микроорганизмов и чужеродных белковых структур. Плазматические клеш,
секретирующие IgA, чаще наблюдаются в лимфоидных органах, дренирующих
желудочно-кишечный тракт. IgA обнаружены также в слезной жидкости, слюне,
плазме иммунизированных лиц. Некоторые эпителиальные клетки продуциру¬
ют полипептид, так называемый секреторный компонент, с высоким сродством
к Fc-фрагменту IgA, что способствует организации иммунного барьера на эпите¬
лиальной поверхности.
4. Иммуноглобулины класса Е — IgE (ММ 190 тыс. Да) — через Fc-фрагмені
связываются с участками тучных клеток, тем самым стимулируя их дегрануля¬
цию. IgE - термолабильные иммуноглобулины (реагины), обладающие высо¬
кой аффинностью (специфическим сродством) фрагмента Fc к тучным клеткам
и базофилам. Включение IgE в реакцию «антиген-антитело» считается пусковым
моментом всех анафилактических реакций. Дегрануляция базофилов и тучньи
клеток вследствие воздействия комплекса «IgE-антиген» с высвобождена*
в большом количестве гистамина и гепарина формирует начальную фазу инафи
лактического шока, Концентрация IgE в сыворотке — менее 1% всех иммуногло¬
булинов.
5. Иммуноглобулины класса D - IgD (ММ 180 тыс. Да) - присутствую^
■ крови в следовых концентрациях, действуют на поверхности В-клеток, выпов
няя роль рецептора, и обеспечивают регулирующие функции, взаимодейстну
с антигенами, стимулируют пролиферацию клеток и преобразование их в ею**”
ные клетки.
ййямцшцшикд иммуноглобулинов (антител) представленадтабл.?4
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ 939
24-4. Признаки иммуноглобулинов
'■'^перистим
ЮМ 1
Ч»в 1 loA WE 1
№ ~1
масса. Да S
ЮОООО 1
60 000 Ut
Ю 000 \ 190 000 Т
180 000
тй«тура
Тентамер
Лономер 1в
г
||
плазмемоног ІМ
ир. в секретах \
[ИМВр
Мономер
^ы. цепи
. р ,
7
... * t
« '1
п^рсИв ивпи
к*\
к + X
ж+V.,
І
^личветво антиген-
раїмяающих мест
5(10) 1
2
2 Щ і
1
г
(^риод полувыведения
„1Г.ЫВОООТКИ, дни
1
18-23
6
І
І ... .
^мяиия комплемента
+
■ + -
І ...til
Прохождение через
nnaiMHTV
■йнайв
♦
ІЙМУІІРІ
1 ~ I
Основная функция
Первичный
иммун¬
ный ответ
на инфекцию
Защита
от микро¬
организмов
и токсинов
1 Защита слизи-
1 стых оболочек
1 от микроорга¬
низмов
{Стимуляция (Неизвестна 1
(выброса 1
t гистамина
1 при аллергии 1
Присутствие в биологи-
ческих жидкостях
В сыворот¬
ке, немного
вмежклеточ-
1 ной жидкости
Плазма крови
и межкпеточ-
I ная жидкость
Сыворотка,
слюна, секреты
ЖКТ и бронхов,
молоко, сперма
4 ^
—1
(Поверхность і
I лимфоцитов t
1 . .1
Многие варианты иммунного ответа опосредуются Т-лимфоцитами и осущест¬
вляются без участия В-лимфоцитов — это так называемые Т-лимфоцитзависимые
(вдаиелонезависимые) механизмы защиты (клеточный иммунитет).
Іг'Лимфоірггзавиеимьіе (антителонезависимще) механизмы иммунитета реализуют
I щпотоксические Т-лимфоциты, к которым относят CD8*. Т-сф-лимфоциты и CD4'.
1-лимфоциты участвуют в процессе отторжения трансплантата, противови¬
русном и противоопухолевом иммунитете, хроническом воспалении и т.д. Этот
вариант иммунного ответа проявляется в двух направлениях:
* генерации специфических цитотоксическвд Т-лимфоцитов против внутри-
клеточных вирусов;
♦ стимуляции Т-лимфоцитами активности неспецифических клеток, например
макрофагов к внутриклеточным бактериям и/или паразитам. В качестве при¬
мера можно рассмотреть ги перчу вствительностъ замедленного типа, опреде¬
ляемую в кожном тесте. Впервые этот тип реагирования описал Р. Кох в 1891 г.
При подкожном введении туберкулина больным туберкулезом через 24-48 ч
на месте инъекции наблюдались покраснение и отек - пшерчувсгвительность
замедленного типа. При наличии у больных антител подобная реакция разви¬
вается через несколько часов — гиперчувствитедыюсть немедленного типа.
При клеточном иммунном ответе, как и при гуморальном, наблюдаются взаи¬
модействие клеток с участием Т-хелперов и представление антигена в ассоциации
с молекулами МНС. Как и антительный ответ, клеточный иммунитет регулиру-
^ различными клетками и факторами, которые ограничивают повреждающие
побочные эффекты. Нежелательными последствиями реакций клеточного пшу-
Нитета могут быть отторжение трансплантата и повреждение тканей.
Цитокины и цитокиновая сеть
Цитокины — это продуцируемые клетками различных типе» белковые ыолеку-
‘Учаогоующие в межклеточных взаимодействиях и неспецифичные к антигену.
0КИНы оказывают как местное, так и системное влияние на клетки, действуя
940 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
в очень низких концентрациях и выполняя ряд различных, явно не г
антагонистических или синергических функций, реализация которых ІЯ
как к благоприятным, так и негативным последствиям при различных забг, ^
ях. Разные типы клеток могут продуцировать одинаковые по действию циЛЄВаки'
и экспрессировать рецепторы для них. В то же время, с одной стороны*00111
цитокины могут вызывать одинаковые реакции клеток, а с другой - кажды“ '^
кин индуцирует в разных клетках различные биологические реакции. На п ^
ноли клеток есть специфические рецепторы к цитокинам, связавшись с
они индуцируют реакции клетки-мишени или клетки-медиатора. В ответкл^01
мишень может продуцировать другие цитокины, таким образом запуская ка^
цитокинов. объединенных названием «цитокиновая сеть». В зависимости тш*
приложения выделяют аутокринные (на саму клетку, секретировавшую цитоюп
паракринные (на соседние клетки) и эндокринные (дистантные, или системный
эффекты цитокинов.
Условно цитокины можно разделить на интерлейкины, интерфероны, хемоки-
ны, факторы некроза опухоли и колониестимулирующие факторы.
По функциональному предназначению цитокины подразделяют на пять основ¬
ных групп:
• гемопоэтические цитокины — регулируют пролиферацию И дифференци¬
ровку всех клеток кроветворных органов. К ним относят колониестимули¬
рующие факторы для грануло-/моноцитарной клетки-предшественника,
предшественников гранулоцитов, моноцитов, эритропоэтин, тромбопоэ-
тин, ИЛ-5 для эозинофилов, ИЛ-7 для лимфоцитов. ИЛ-1 (гемопоэтин-1)
также относят к гемопоэтинам, поскольку он поддерживает рост самых
ранних клеток-предшественников кроветворения. Негативные регуляторы
гемопоэза - фактор некроза опухоли (TNF-a), трансформирующий фак¬
тор роста (ТФР-р), хемокин MIP-a, который ингибирует ранние клетки-
предшественники гемопоэза;
І цитокины доиммунного воспаления — ИЛ-1, ИЛ-6 и TNF-a — продуцируют;
ся главным образом макрофагами и лимфоидными дендритными клетками
в очаге внедрения патогенов;
• цитокины, участвующие в лимфоцитарном иммунном ответе, — ИЛ-2, ИЛ-4,
ИЛ-12, ИЛ-15.
1 ИФН у (активаторы макрофагов и NK) — регулируют пролиферацию и диф¬
ференцировку Т-, В-лимфоцитов и NK в периферических лимфоидных
органах и тканях, секретируются макрофагами, дендритными клетками
и лимфоцитами;
і цитокины - медиаторы иммунного воспаления — ИФН у, ИЛ-5, лимфоци-
тотоксины 1 вызывают активацию лейкоцитов общевоспалительного д®*
ствия, секретируются иммунными Т-лимфоцитами;
І противовоспалительные (иммуносупрессорные) цитокины — ИЛ-10 (про-
дуцируется макрофагами и ингибирует макрофаги), TNF-p (продуциру^*
иммунными CD4 Т-лимфоцитами и ингибирует пролиферацию лимфоци
тов), ИЛ-4 и ИЛ-13 (ингибируют макрофаги).
К наиболее изученным цитокинам относятся:
1. Интерлейкины:
І ИЛ-1 (ММ - 17 500 Да) — существует в двух формах, известен так
как фактор, активирующий лимфоциты;
В ИЛ-2 (ММ - 15 500 Да) — стимулирует рост и развитие Т-лимфоЦ
первоначально был назван фактором роста Т-лимфоцитов;
• ИЛ-3 (ММ - 15 000 Да) - колониестимулирующий фактор, мульти
стимулирует рост клеток-предшественников спинномозгового ПрОИСХО
имя;
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИМІ
941
, ИЛ'4 (ММ — 20 ООО Да) — фактор роста В-лимфоцитов, выделяется Т-хелпе-
рами;
( ИЛ*5 (ММ — 45 ООО Да) — также выделяется Т-хелперами, стимулирует рост
В-лимфоцитов и эозинофилов;
, ИЛ-6 (ММ — 26 ООО Да) — способствует дифференцировке В-лимфоцитов
и секреции антител, участвует в качестве медиатора острой фазы воспаления;
• ИЛ-7 (ММ — 25 ООО Да) — продуцируется стромальными клетками костного
мозга и стимулирует рост ранних Т-и В-лимфоцитов;
• ИЛ-8 (ММ - 8500 Да) - секретируется макрофагами, участвует в процессах *
хемотаксиса нейтрофилов;
• ИЛ-9 (ММ — 40 ООО Да) — фактор роста Т-лимфоцитов;
• ИЛ-Ю (ММ — 40 000 Да) — выделяется Т-хелперами, ингибирует клеточный
иммунный ответ;
I ИЛ-11 (ММ — 23 000 Да) — продуцируется в костном мозге, участвует в вос¬
палительных процессах, способствует выработке тромбоцитов;
• ИЛ-12 (ММ - 70 000 Да) — секретируется макрофагами и В-клетками, сти¬
мулирует функции NK и Th,-лимфоцитов;
і ил-13 (ММ - 12 000 Да) — продуцируется Т-хелперами (Th,), индуцирует
синтез иммуноглобулинов, участвует в ингибировании макрофагов;
• ИЛ-14 (ММ — 60 000 Да) - продуцируется Т- и В-лимфоцитами, фактор
роста В-клеток;
• ИЛ-15 (ММ — 11 000 Да) — стимулирует рост и развитие Т-лимфоцитов;
• ИЛ-16 (ММ 13 000 Да) — хемоаттрактант для Т-лимфоцитов, моноцитов
и эозинофилов;
§ ИЛ-17 (ММ 20 000 Да) — индуцирует продукцию ряда цитокинов фибробла-
стами, клетками эндотелия и эпителия;
І ИЛ-18 (ММ — 23 000 Да) — стимулирует продукцию ИФН у и активирует
функции Thj-лимфоцитов.
2. Интерфероны:
• ИФН типа I — продуцируется плазмоцитоидными дендритными клетками
и регулирует активность ТЬ,-лимфоцитов при иммунных реакциях, объеди¬
няет ИФН а (ММ 20 000 Да), или лейкоцитный ИФН, включающий около
20 подтипов, индуцирующих синтез противовирусных антител, и ИФН-{)
(ММ 20 000 Да) или фибробластный ИФН;
• ИФН типа II, или ИФН у (ММ — 45 000 Да. обычно в виде димера), секрети¬
руется Т-хелперами (Th,), NK-клетками, участвует в активации макрофагов,
более видоспецифичен, чем другие ИФН, многофункционален.
3. Колониестимулирующие факторы (КСФ):
• ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирующий фак¬
тор (ММ - 18 000-24 000 Да), стимулирует пролиферацию и активность
гранулоцитарно-макрофагальных предшественников;
• Г-КСФ — гранулоцитарный КСФ (ММ - 19 000-22 000 Да), стимулирует
созревание гранулоцитов;
• М-КСФ — макрофагальный КСФ (ММ — 40 000-90 000 Да), существу¬
ет в форме полимера, стимулирует созревание и активность моноцитов
и макрофагов.
• эритропоэтин (ММ - 36 000 Да), вырабатывается в почках, стимулирует
выработку эритроцитов.
4- Факторы некроза опухолей:
• TNF-a (ММ — 17 000 Да, обычно в виде тримера) - способен ограничивать
Р°ст некоторых опухолей, воздействуя на их кровоснабжение, участвует
также в процессах воспаления и регенерации;
• TNF-p - продуцируется лимфоцитами, аналогичен TNF-a.
942 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ 1
5. Хемокины ~ секреторные белки, регулирующие перемещения
поддерживают ангиогенез и продукцию коллагенов клетками Coed'S,
ткани. В настоящее время идентифицировано около 50 хемокинов flMHttTeV
факторы хемотаксиса моноцитов и нейтрофилов (ИЛ-80), участвуют8 ^ N
хемотаксиса нейтрофилов, моноцитов, Т-лимфоцитов к очагам восп8
хемокины имеют структурное сходство, в том числе в расположении*81*11 ^
цистеина, образующих дисульфидные мостики. В зависимости от раси 0ЄГїЧ
первых двух цистеиновых остатков хемокины подразделяют на чет*^
ства - СС, СХС, С и СХЗС. Ы{*
Помимо вышеуказанных, к цитокинам относятся ТФР (ММ 25 ООО ДаУ—
формирующий фактор роста, ингибирует действие некоторых цитокинов в ^
ет рост фибробластов, а также многочисленные общие ростовые и супресг^65
факторы, в частности эпидермальный ростовой фактор, тромбоцитный мл
фактор, фактор роста нервов и т.д. «*Чй|
Цитокины считаются одним из звеньев, связывающих иммунную и неов
системы. ИЛ-2 и ИЛ-6 обнаружены в мозге. Большие дозы цитоктинов мГ°
вызывать сонливость и общее недомогание. С другой стороны, иммунная йсг
ма тесно связана также с эндокринной. Некоторые продукты лимфоцитов давно
уже определены как гормоны или нейропептиды. Кроме того, использование
клетками иммунной системы молекул-посредников сходно с основанной на гор¬
монах организацией эндокринной системы, которая, в свою очередь, через сни¬
му «гипоталамус-гипофиз-надпочечники» связана с ЦНС. Это дает основание
рассматривать эти три системы (нервную, эндокринную и иммунную) как звенья
одной интегральной сети, объединенные в единую нейроэндокринно-иммунную
систему.
Торможение иммунной системы
Эволюция механизмов, распознающих и элиминирующих чужеродный антиген,
шла параллельно с развитием механизмов, защищающих от поражения собствен¬
ные ткани организма.
Механизмы адаптивного иммунитета, т.е. действие Т- и В-лимфоцитов, должно
ограничиваться в отношении тех рецепторов, которые распознают свои клеш
Механизмы этого ограничения не могут обеспечиваться генетически, посколь¬
ку свои молекулы и рецепторы, которые способны их распознать, наследуют
отдельно. К примеру, ребенок с группой крови AB(IV) от родителей с группами
крови А(И) и В(Ш) наследует от каждого из родителей способность продуциро¬
вать анти-А- и анти-В-антитела, но для нормальной жизнедеятельности он не дол¬
жен их вырабатывать, т.е. быть толерантным к А- и В-антигенам эритроцитов.
В организме аутореактивность, т.е. реактивность по отношению к своим анти¬
генам, ограничивается на нескольких уровнях. Одновременно сдерживающие
механизмы могут срабатывать по отношению к чужеродным молекулам, т.е
иммунная система воспринимает чужеродные клетки как свои - организм нахо¬
дится в состоянии толерантности.
Толерантность отмечается только в отношении того антигена, который ее инду
цировал. Явление толерантности используют при пересадке органов, но развит
толерантности к инфекционному агенту может вызвать тяжелые последствия*
В табл. 24-5 перечислены факторы, индуцирующие толерантность и их влияю
на механизмы, сдерживающие аутореактивность. ,
Представление антигена происходит АПК, несущими молекулы МНС клз<#
АПК обычно неспособны представлять растворимые антигены, поэтому они
толерантны.
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГ ИИ 94)
Ізблгіцз 24-5. Механизмы, сдерживающие реактивность в ответ на индукцию толерантности
Факторы, индуцирующие толерантность
Механизмы защиты претив ауторштишстн
д^двіїйе антигена в эмбриональный период
Растворимый антиген
Подавление функции АПК
Антигены, вводимые энтерально
Антиген ие представлен
Высокие дозы антигена
введение антигена в эмбриональный период
.Антигенное самоубийство»
Клональная элиминация
Т-лимфоцитов
В-лимфоцитов
растворимый антиген
Иммунные комплексы
миммуногенные носители
Блокировка рецепторов
Т-лимфоцитов
В-лимфоцитое
высокие дозы антигена
дмтиген не представляется
Т-супрессоры
Амтиидиотипические антитела
Антиидиотилические сети
Клональная элиминация лимфоцитов, по-видимому, лежит в основе толе¬
рантности к антигенам, вводимым в организм в эмбриональном или неонаталь¬
ном периодах. Клонально-селекционная теория, которую выдвинул в 1959 г.
ф. Вернет, предполагает, что лимфоциты ограничены в распознавании антигена,
а те из них, которые распознают свои антигены, уничтожаются на ранних этапах
развития в центральных органах иммунной системы - Т-лимфоциты в тимусе,
а в-лимфоциты — в костном мозге.
Антигенное «самоубийство» происходит путем конъюгации антигена с ток¬
синами или радиоизотопами. Оно обеспечивает разрушение специфических
Т- и В-лимфоцитов без последствий для окружающих клеток. Данный принцип
используют для элиминации опухолевых клеток при применении конъюгатов
специфических антител с токсинами.
Индукция толерантности может быть вызвана введением высоких доз антигена
или при их внутривенном введении. В последнем случае антигены подвергаются
действию макрофагов печени, которые уничтожают иммуногенные молекулы,
оставляя лишь растворимые толерогены. Присутствие в организме так называе¬
мых неиммуногенных носителей, таких как недеградируемые молекулы, например
D-аминокислоты, может вызвать толерантность к гаптенам. которые на нормаль¬
ных носителях становятся антигенами. Это явление используется для подавления
секреции IgE при аллергии. Наведение толерантности может быть обеспечено
при введении антиидиотипических антител, направленных против определенного
идиотипа, что может оказаться полезным при трансплантации.
Теорию идиотип-антиидиотипической сети впервые сформулировал в 1974 г
английский иммунолог Н. Ерне.
Основные положения теории сводятся к следующему: антигенрас познающие
участки антител Т-клеточных рецепторов кодируются в чрезвычайно большом
разнообразии для распознавания практически любых молекул, и, следовательно,
некоторые из них могут распознавать друг друга. В таких случаях одну молеку¬
лу называют идитипом (Id), а другую антиидиотипом (анти-Id). Теоретически
антиидиотипы могут быть не только антителами, но и молекулами Т-клсточных
рецепторов. Из этих предпосылок следует несколько выводов.
1. Таким образом можно объяснить явление аутоиммунитета иди аутореактив¬
ности.
2. Неизвестно, как антиидиотип влияет на клетку, синтезирующую идмолшы.
н наоборот, а также какие последствия эти влияния имеют на иммунный ответ
в Целом.
3. Нарушается привычное деление молекул на антигены и антитела,
Действительно, молекула рецептора иммуноглобулина (антитела) к определен-
144 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
ному антигену сама оказывается антигеном для других Ig-молекул ддя
в свою очередь, существуют рецепторы, причем эта цепь распространяем*0^*
ти чески бесконечно, и в этой цепи для каждого чужеродного антигена во ^
тжь молекула рецептора, точно соответствующая по конфигурации это*838**'
гену. Иначе говоря, все антигены окружающей среды представлены в пп -^
на лимфоцитах. В этом случае в организм с попаданием «чужеродных»^
не ВНОСИТСЯ ничего действительно чужеродного, и сеть ИЗ взаимодействуй
между собой рецепторов должна существовать в организме и без их проник *
ния. Однако антигены из окружающей среды стимулируют синтез дополни^!**
антител, нарушающих равновесие сети, и приводят к образованию мио**^
иднотнпов и антиидиотипов, некоторые из них частично или полностью сода*
ствуют исходному антигену.
Теория Н. Ерне находит свое подтверждение в целом ряде явлений.
• Введение моноклональных антител может вызвать появление atm
идиотипических антител (анти-Id), определяемых в сыворотке по их связы¬
ванию только с индуцирующим моноклоном.
• Нормальный прирост антител при иммунном ответе, как правило, ингмби*
ется для любого идиотипа введением соответствующих анти-Id, однако в до
случаев наблюдается стимуляция соответствующего идиотипа. Объяснения
этим фактам пока не найдено, но могут иметь значение класс или подклад
иммуноглобулинов и способ введения.
І Некоторые антиидиотипические антитела подавляют связывание между и
и антигеном, его индуцирующим, поскольку направлены против антиген®
зываюшего участка.
I На поздней стадии иммунного ответа антиидиотипические антитела появля¬
ются спонтанно в то время, когда уменьшается количество соответствующих
идиотипов.
Наибольшее распространение антиидиотипы смогут найти при производстве
ld-вакцин. Такие вакцины, во-первых, можно воспроизводить в необходимой
количестве, а во-вторых, будучи белками и тимусзависимыми антигенами, от
способны индуцировать иммунную память и сохранять невосприимчивость к воз¬
будителю длительное время.
Нежелательные проявления иммунитета
Эффективность иммунной системы в борьбе с возбудителями инфекционных
заболеваний и развитии противоопухолевого иммунитета в ряде случаев мояи
быть направлена против собственного организма в виде аллергии, анафилаксш
аутоиммунных заболеваний, отторжения трансплантата. Патологические иммув-
ные реакции возникают в процессе специфического распознавания и действия
эффекторных механизмов, ведущих к повреждению ткани.
І В-лимфоциты — предшественники антителобразующих клеток - в норы*
распознают свои антигены. Однако если Т-хелперы на том же антигене рк
познают не свои детерминанты, например вирусы, В-лимфоциты могутся-
мутировать антителообразование против собственных антигенов, ИДУ®*
к аутоиммунным заболеваниям.
І Тучные клетки содержат ваэоактивные амины и другие медиаторы, которые
освобождаются после того, как IgE, фиксированные на поверхности кзе**
связывают аллерген. Это приводит к локальному воспалению и алжУ*
ww общему воспалению и возникновению анафилаксии или анафилао**
свого шока
* Иммунные комплексы образуются в результате связывания антителсв^
• ІШіЙ 1 врыыие нормального гуморального ответа. Если раствор**^
ОСНОВНЫЕ ПОНЯТИЙ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГ Ий $45
иммунные комплексы не фагоцитируются, а циркулируют » крови, активируя
комплемент, тромбоциты и полиморфмо-ядгриыг лейкоциты, 14» ОМИ МОГУТ
вызывать повреждение тканей.
, СЗа* и С5а - компоненты комплемента действуют м тучные клетки, <ян.оййи
СЗЬ и литический комплекс С5 С9, участвуют в разрушении t ранен дантирм
ванных клеток. ЦИК связывают и вірегирушт тромбоциты, что ведет к вмиг
лению вазоактивных аминов и закупорке сосудов. Агрегации тромбоцитов
считается одним из признаков отторжения грат платига почки,
• Опосредуемый комплементом хемотаксис полиморфно* ядерных лейкоци¬
тов приводит к их накоплению в очаг» воспаления, где они фагоцитиру¬
ют иммунные комплексы. Лиэосомальиые ферменты гранулоцитом мот
вызвать деструкцию тканей.
Таким образом, патологические иммунные реакции могут быть класі ифини
рованы по типу задействованных эффекторных механизмов, Но класс ификлцим
Джелла и Кумбса выделяют следующие типы гиперчувствительносги.
I. Острая реакция, немедленная, анафилактическая - связанная с IgE или IgCi
антителами и тучными клетками. К ним относятся патологические расстройства
различной тяжести - от распространенных аллергических состояний (крвпивии
цы. экземы) до тяжелых состояний анафилаксии или знафилахтическсно шока.
В основе этих состояний лежат дегрануляция тучных клеток под действием специ¬
фических IgE-антител и освобождение медиаторов воспалительных процессов.
Таким образом, это случаи острого воспаления, индуцированного не инфекцией
или повреждением тканей, а антигеном.
II. Реакции с участием цитотоксических антител класса IgM или IgG вместе
с комплементом, NK-клеткамии или фагоцитами. К ним опмоогеся трансфу-
зионные реакции, многие аутоиммунные заболевания. Однако, возможно, но
не гиперчувствительность, а проявление аутоиммунитета и реакции отторжения
трансплантата.
III. Реакции, опосредуемые иммунными комплексами, приводят к восямммо
с участием комплемента, полиморфно-ядерных и других лейкоцитов (например,
сывороточная болезнь, феномен Артюса. хронический гломерулонефрит).
IV. Реакции, опосредуемые клетками при Т-зависимой активации макрофагов,
эозинофилов и др. (например, туберкулоидная лепра, отторжение трансплантата,
кожная сыпь вирусной природы).
V. Стимулирующая реакция — сравнительно недавно выделенная подгруппа
реагирования, протекающая по типу I. К ней относят случаи стимуляции антите¬
лами функции клеток, например стимуляции тиреоидегамуяирующего рецепторе
щитовидной железы при тиреотоксикозе.
ОТТОРЖЕНИЕ ТРАНСПЛАНТАТА
Успех трансплантации тканей и органов в настоящее время смэаи с подбором
донора и реципиента по антигенам МНС и подавлением иммунного own.
Типирование и подбор донора и реципиента необходимы во всех случаях пере¬
садки тканей и/или органов. Переливание компонентов крови также считаете я
процедурой трансплантации тканей, при проведении которой важно соблю іагь
принцип соответствия (и совместимости) группы крови доноре м реципиента
во системам АВО и резус. Совместимость по минорным антигенам имеет значение
Мя сенсибилизированных пациентов при повторных гемотрвясфузиях. К воэмож
ныи неблагоприятным осложнениям переливания крови относится также сенси¬
билизация реципиента к HLA-антигенам на В-лимфоцитах донора, Прн пересадке
«остносо мозга у пациентов с иммунодефииитами возможно развитие ывавмш
**Рзнсплантат против хозяина» (БТПХ). при которой Т-лимфоциты юмора рва
г*РУ*гт против антигенов реципиента. (Более подробные сведения вриаедемы
п соответствующих разделах.)
І ТМММУЗИОННАЯ ИММУНОЛОГИЯ
Неспецифическая супрессия — подавление иммунного ответа - достиг
применением цитотоксических препаратов и циклоспорина А, подавляющих
аегс
ч
нйе лимфоцитов, одновременно с противовоспалительными средствами
дами). Мощное иммуносупрессивное действие оказывает тотальное рентгеновой
облучение. При остром кризисе отторжения ДЛЯ удаления лимфоцитов примени
местное облучение или экстракорпоральное облучение крови. Для удаления
нот
лим¬
фоцитов иногда прибегают к дренажу грудного протока и тимэктомии.
Специфическая иммуносупрессия — наведение специфической толерантности
к антигенам МНС. Она направлена на антигены, вызывающие ответ, или на ревдп!
торы клеток, которые этот ответ опосредуют. Воздействие с антителами может
вызвать эффект усиления. Антитела к клеткам-мишеням, вероятно, способ¬
ны блокировать детерминанты молекул класса I, препятствуя, таким образом
отторжению. Переливание компонентов крови, предшествующее трансплантации
ПОЧКИ, содействует ее приживлению И уменьшает риск отторжения. Антирезусные
антитела предотвращают сенсибилизацию резус-отрицательной матери, устраняя
резус-положительные клетки.
Клональная элиминация (классическая толерантность) создается и yiim
при использовании антигена, конъюгированного с изотопами или оксическими
препаратами. Антитела, специфически связавшие конъюгированные антигены,
погибают. Этот способ получил название ретиарной терапии. В настоящее время
достигнуты определенные успехи и в ее использовании при лечении больных
По-видимому, супрессия, вызываемая антипролиферативными препаратами, в при¬
сутствии антигена содержит элементы специфической клональной элиминации.
Аутоиммунитет считается зеркальным отражением толерантности. При этом
состоянии утрачивается способность иммунной системы сдерживать аутореак¬
тивность лимфоцитов с помощью регуляторных механизмом и различать свои
антигены, в результате развиваются аутоиммунные заболевания. Аутоиммунные
болезни 1 это состояния, при которых аутоантитела играют основную роль
в патологическом процессе. К аутоиммунным болезням, в частности, относятся:
• гемолитическая анемия и тромбоцитопения — преимущественно идиопати-
ческой природы, однако деструкция клеток не всегда соответствует титру
антител, что может быть обусловлено другими пусковыми факторами раз¬
вития патологического процесса (более подробное описание см. в соответ¬
ствующих разделах);
I пернициозная анемия - развивается в результате дефицита так называемого
фактора Кастла, или внутреннего фактора желудка, переносчика витамина Вц.
Дефицит может быть обусловлен антителами к внутреннему фактору или ауто¬
иммунным разрушением обкладочных клеток при атрофическом гастрите;
я ревматоидный артрит - характеризуется присутствием аутоантител к имму¬
ноглобулинам класса G (ревматоидный фактор), с которыми связано забо¬
левание;
I тиреоидит - при нем различают тиреотоксикоз, развивающийся в результате
стимуляции антителами к рецепторам гипофизарного тиреоидина, и мик-
седему - заболевание, обусловленное подавлением клеток аутоантителами
и К-клетками. При этих заболеваниях во многих случаях наблюдается экс¬
прессия HLA-антигенов на клетках щитовидной железы;
• системная красная волчанка (СКВ) — при ней аутоантитела направлены
против ДНК и РНК, а образовавшиеся растворимые иммунные комплексы
поражают различные органы;
• злокачественная миастения - возникает в результате разрушения аутоаи
телами посгсинаптических рецепторов к ацетилхолину, вследствие чего
наблюдается нарушение нервно-мышечной проводимости. Заболевание
часто сопровождается аномалиями тимуса. Тимусэктомия может дать поло
жительный эффект, хотя причина этого неясна.
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ 947
„УНОДЕФИЦИТЫ
(^дефициты (ИД) — это качественные и/или количественные изменения
иди нескольких звеньев иммунной системы. ИД подразделяются на вер*
PjjjLjg (врожденные) — генетически обусловленные и вторичные, возникающие
81^удьтате каких-либо патологических процессов: инфекции, онкологической
' лезйй, облучения, нарушения питания и т.п. Большинство первичных ИД обу-
- влеяо дефектом иммунологически важных генов Х-хромосомы.
ПеРвиЧНЫе иммунодефициты, как правило, характеризуются множеством
гтичных разрозненных дефектов на клеточном уровне. Дефекты с преимуще¬
ственный поражением Т-клеток возникают в следующих случаях:
• при заражении вирусом иммунодефицита человека (ВИЧ), который пора¬
жает CD4 Т-клеток, ослабляет всю иммунную систему человека. Дефицит
Т-лимфоцитов снижает эффективность клеточного иммунитета, а также
часто угнетает синтез антител;
• дефиците фермента пуриннуклеозидфосфорилазы в Т-лимфоцитах нукле-
озиды, в первую очередь дезоксигуанозина, накапливаются и поражают
Т-супрессоры;
• врожденной аплазии тимуса и паращитовидных желез (синдроме Ди
Джорджи) тимусовый эпителий не может обеспечить нормальное развитие
Т-клеток. Положительный эффект достигается при пересадке тимуса;
• синдроме Незелофа — возникает в результате аплазии тимуса, паращитовид-
ные железы нормальные, но возможны дефекты В-лимфоцитов.
Дефекты с преимущественным поражением В-клеток возникают в следующих
случаях:
| агаммаглобулинемия характеризуется или отсутствием В-лимфоцитов,
или неспособностью В-клеток к дифференцировке в плазматические клетки.
Возможна также избирательная неспособность к продукции какого-либо
класса иммуноглобулинов, чаще IgA;
| аутоиммунные болезни, в частности аллергии и полиартриты, часто возника¬
ют у пациентов с дефицитом антителообразования.
Дефекты с поражением клеток нескольких типов приводят к следующим состо¬
яниям;
• тяжелому комбинированному иммунодефициту, при котором наблюдается
дефект и В-, и Т-лимфоцитов. В некоторых случаях патология обусловле¬
на Х-хромосомой, сцепленной с полом, в других — вызвана отсутствием
фермента аденозиндезаминазы. При дефиците фермента дает некоторый
лечебный эффект переливание компонентов крови или пересадка костного
мозга;
• ретикулярному дисгенезу — полному отсутствию стволовых клеток, состоя¬
нию, несовместимому с жизнью. Дети умирают через несколько дней после
рождения.
• ИД с атаксией-телеангиэктазией — возможно, вызывается нарушением
репликации ДНК, определяется сочетанием дефектов Т-лифицитов, иммуно¬
глобулинов, мозга и кожи;
• синдрому Вискота-Олдрича — тромбоцитопении, экземе и отсутствию анти-
тельного ответа на введение полисахаридов, очевидно, вследствие дефекта
субпопуляции В-лимфоцитов.
Дефекты системы комплемента могут выражаться в полном отсутствии ком-
“ВДента или снижении его количества в различной степени. Самые серьезные,
приводящие к летальному исходу, — дефекты компонента СЗ. Дефекты Cl. СА, С2
ределявдт предрасположенность к болезням, связанным с иммунными комплек-
Гр (чаще всего с системной красной волчанкой). С дефектами С5-С9 связана
^Расположенность к инфекциям.
948 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Дефекты миелоидных клеток характеризуются следующими патол
состояниями: 0гическнкц,
і склонностью к инфекциям, вызванным бактериями и грибами к
никают вследствие дефекта некоторых ферментов нейтрофилов ІРШі
6-фосфатдегидрогеназы и пируваткиназы; ~ ІШІІ
і хронической гранулематозной болезнью, которая в подавляют
шинстве случаев обусловлена Х-сцепленным дефектом генерации Г рР І
форм кислорода. Ведет к хроническим инфекциям, вызванным бакте ^
не вырабатывающими перекись водорода (каталазоположительньїмиї И’
Вторичные иммунодефициты могут быть обусловлены следующими фактом
§ приемом лекарственных препаратов — специально или непреднамеи*1’
вызванный иммунодефицит: ^ННо
1 инфекциями - многие микроорганизмы в качестве защитного механн
вызывают подавление иммунной системы у хозяина;
I нарушением питания — приводит к сбою антителообразования, а в тяжелы
случаях - к дефициту Т-лимфоцитов и в итоге к более тяжелому течению
болезней;
§ возрастом - у новорожденных и детей первых месяцев жизни, а также
в пожилом возрасте иммунитет ослаблен. У детей это состояние частично !
компенсируется пассивно переносимыми антителами от матери;
• новообразованиями — часто приводят к иммунодефициту, но могут также
возникать вследствие его развития, т.е. зачастую трудно установить причину
и следствие этих состояний.
Иммуностимуляция и вакцинация
Антигенспецифическая иммуностимуляция достигается применением следую- I
щих средств:
• адъювантов — это вещества, усиливающие иммунный ответ на антиген
при их одновременном введении. В качестве адъювантов вводят эмульсии
минеральных масел, соли некоторых металлов, а также липидные молекулы
(липосомы);
• некоторых микобактерий (например, БЦЖ) или продуктов бактериального
обмена (эндотоксинов), введение которых вызывает активацию макрофа¬
гов. Способностью активировать макрофаги обладают многие адъюванты,
а также цитокины;
I цитокинов, которые используются для стимуляции клеток-мишеней.
Показано, в частности, что NK-клетки особенно чувствительны к действию
ИЛ-12 и ИФН;
• экстракта нормальных лейкоцитов (фактора переноса), который используют
при инфекциях, связанных с дефицитом Т-клеток.
Пассивная иммунизация обеспечивается введением больным антисывороток
против соответствующих возбудителей. В ряде случаев введение антисывороток
на начальных стадиях заболевания сохраняет больному жизнь (при столбняке,
бешенстве, укусах змей). Ранее антисыворотки получали путем иммунизация
лошадей, но опасность сывороточной болезни заставила перейти к использованию
сывороток (или препаратов, полученных из них) лиц, перенесших аналогичное
заболевание. Так, переливание специфического иммуноглобулина против гепатита
В от лиц, его перенесших, дает хороший эффект на начальных стадиях заражения.
Введение нормального человеческого гамма-глобулина больным с дефицитом
В-лимфоцитов обеспечивает хорошую защиту от многих инфекций. В перспектив
пассивная иммунизация будет обеспечиваться введением моноклональных ант*
тел к микробным антигенам или токсинам.
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ 949
Щщо иммунизацию (вакцинацию) проводят в необходимых случаях вве-
вакцин. Термин «вакцина» ввел JI. Пастер, и его применяют ко всем анти-
gfe используемым для выработки специфического иммунитета и ослабления Нв
Щ едствий возможного инфицирования. На практике используют следующие
В вакцин'- Ш ШШ
живые гетеровакцины вызывают легкие формы заболевания, перекрестно
* защищающие от более тяжелых форм течения болезни, например, вакцина
против коровьей оспы;
живые ослабленные (аттенуированные) возбудители (вирусы или бакге-
* рии) в обеспечивают субклиническое заболевание и защиту. Таким образом
вакцинируют против кори, эпидемического паротита, полиомиелита, красну¬
хи, туберкулеза;
, убитые вакцины — применяют в случаях, когда невозможно аттенуировать
возбудителя. Убитые вакцины безопаснее, но менее эффективны, чем осла¬
бленные. Они включают убитые формалином вирусы (например, гриппа
или бешенства) или бактерии (коклюш, холера и др.);
Е фрагментные вакцины из вирусных субъединиц, например из поверхностно¬
го антигена вирусов гепатита В;
« ДНК-векторы. В качестве живой вакцины может быть использована гене¬
тическая конструкция, когда гены одного микроба встраиваются другому,
менее вирулентному. В последнее время было также обнаружено, что опреде¬
ленным образом модифицированная ДНК, кодирующая нужный антиген
возбудителя, может быть введена пациенту, что обеспечивает необходимую
защиту от данного воздействия.
• синтетические вакцины. Предпринимаются попытки синтеза чистых мик¬
робных антигенов для получения на их основе химическими методами или
дНК-рекомбинантной технологией синтетических вакцин. В случае успеш¬
ной реализации этих программ синтетические вакцины будут играть веду¬
щую роль при вакцинации населения.
Подводя итоги, следует отметить, что состояние иммунной системы организма
определяется способностью поддерживать постоянство внутренней среды, проти¬
востоять биологической агрессии.
Гемотрансфузии оказывают мощное воздействие на иммунную систему, что опре¬
деляет необходимость учитывать возможность иммуномодулирующего действия
препаратов и компонентов крови, в особенности у пациентов с нарушениями
в иммунной системе. Особую значимость оценка состояния иммунной системы при¬
обретает при заболеваниях иммунного характера, к которым относятся:
• болезни с первичной или вторичной иммунной недостаточностью, когда
определяется дефект в том или ином звене иммунной системы;
І болезни с извращенной функцией иммунной системы — аутоиммунная пато¬
логия, болезни иммунных комплексов;
j злокачественные заболевания иммунной системы (лимфолейкозы, лимфо¬
гранулематоз, миеломы);
• инфекции иммунной системы (инфицирование вирусом иммунодефицита,
герпеса, цитомегаловирусом).
ВЗАИМОДЕЙСТВИЯ ЗРИТРОЦИТНЫХ АНТИГЕНОВ
САНТИТЕЛАМИ И ОСНОВНЫЕ МЕТОДЫ ИХ ВЫЯВЛЕНИЯ
Взаимодействия эритроцитных антигенов с антителами представлены тремя
овными реакциями «антиген-антитело», основные методы их выявления сле¬
дующие.
• Агглютинация — процесс образования видимых клеточных агрегатов вслед-
Л °бъединения молекулами антител антигенных детерминант эритроцитов.
( 950 ТМНСФУЗИОННАЯ ИММУНОЛОГИЯ
Агглютинаты считаются итогом большинства реакций между э
и антителами групп крови. В некоторых тестах антитела непосредс^Тр°ЦИта‘ііі
няют соседние клетки, в других присоединяются к несущим антигенНИ0 COej>H-
Агглютинация эритроцитов в иммуносерологических реакциях может fi301'4311-
лена при обработке исследуемого материала протеолитическими
Эритроциты, обработанные трипсином, папаином. бромелином и другим ЙТ,Ми-
зами. реагируют в реакции агглютинации с неполными антителами дажеИ П^0ТЄї'
среде. Вс°левой
Реакция агглютинации протекает в два этапа:
• присоединение антитела к эритроцитной мембране — сенсибилизация'
і связывание сенсибилизированных клеток между собой — образование І
тинатов. Лю'
Каждый из этапов зависит от ряда факторов.
I этап. Взаимодействие антитела с антигеном зависит от их концентваї
т.е. от соотношения количества молекул антител и антигенных детермина"
на эритроците, а также от ряда физических параметров, таких как температум
pH. ионная сила раствора и время инкубации. В лабораторных тестах изменение
физических параметров системы может приводить к уменьшению или увеличению
чувствительности метода.
II этап. На формирование агглютинатов оказывают влияние размеры и физи¬
ческие свойства молекул антител, количество антигенных детерминант на каждом
эритроците и расстояние между клетками.
Преципитация — образование нерастворимых комплексов в результате взаимо¬
действия присутствующих в растворе антигенов и антител. При проведении теста
в пробирках комплексы имеют вид осадка или кольца, при использовании ага¬
рового геля - белой линии. Преципитация считается конечным этапом иммуно¬
диффузии или иммуноэлектрофореза. Для образования преципитата необходимо
оптимальное соотношение антител и антигена. Если антител в избытке, то анти¬
генных детерминант недостаточно для образования необходимого количества
связей с молекулами антител и формирования преципитата. Это явление получило
название «феномен прозоны».
2. Гемолиз - разрыв эритроцитов с высвобождением гемоглобина.
Опосредованный антителами гемолиз in vitro зависит от активности разрушающе¬
го мембрану комплемента. Если в сыворотке нет комплемента, гемолиз не проис- I
ходит. В тестах на антитела к эритроцитным антигенам гемолиз выявляет анти¬
тела, обладающие литическим действием in vitro. Выявление таких антител имеет I
большое значение, поскольку их присутствие с большой степенью вероятности I
может вызвать внутрисосудистый гемолиз у пациента при гемотрансфузии. I
Антиглобулиновый тест (проба Кумбса) — наиболее эффективный способ, I
позволивший выявить большинство неполных антител. Он стал в свое время peso- ■
люционным в иммуногематологии и по сей день в различных модификациях оста- ■
ется одним из основных методов обнаружения антигенов и антител клеток крови.
Основной реагент пробы Кумбса — специальная сыворотка, полученная
из крови животных, иммунизированных иммуноглобулинами (IgG, IgM, IgA) I
или их смесью, компонентами комплемента либо другими белками крови челове¬
ка. При фиксации антител на эритроцитах (in vivo или in vitro) иммунная сыворотй ■
позволяет выявлять неполные (или полные) противоэритроцитные антитела,Щ
вызывает агглютинацию эритроцитов, на которых абсорбирован человечески
белок (любое антитело).
Прямой антиглобулиновый тест (прямая проба Кумбса) — диагностический
тест для выявления сенсибилизированных in vivo эритроцитов, представляет
собой одноэтапный процесс. Положительная проба указывает на наличие анти
тел на эритроцитах. Титр прямой пробы Кумбса служит косвенным показателе
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТРАНСФУЗИОННОЙ ИММУНОЛОГИИ 951
й сенсибилизации. Прямой антиглобулиновый тест (ПАГТ) используют
диагностике аутоиммунной гемолитической анемии, гемолиза, вызванного
при Ценными препаратами, ГБН и аллоиммунных реакций на недавно введен-
^fSrrpouHThi.
нейрямоЙ антиглобулиновый тест (непрямая проба Кумбса, спин-метод)
личие от прямой пробы позволяет выявить антитела, не фиксированные
* °ТоИТРОЦитах ,л v,v0’а св°бодно находящиеся в сыворотке крови. Для выявления
1,4 необходимо предварительно фиксировать на стандартных эритроцитах с анти-
*** ми аналогичными тем, которые стали причиной появления этих антител.
ГЄ*Поо6у проводят в два этапа:
инкубация исследуемой сыворотки со стандартными эритроцитами (сенси¬
билизация in vitro)-,
реакция агглютинации с антиглобулиновой антисывороткой.
Непрямой антиглобулиновый тест используют:
, для выявления аллоантител в сыворотке и определения их специфичности;
• типирования антигенов эритроцитов, определения резус-принадлежности;
• проведения пробы на совместимость крови донора и реципиента перед гемо¬
трансфузией эритроцитсодержащих сред.
Реагенты для антиглобулинового тестирования
Полиспецифические античеловеческие реагенты используют для ПАТ. Эти
реагенты содержат антитела к человеческому IgG и СЗб-компоненту комплемента.
Используют и другие антитела к компонентам комплемента, в том числе анти-СЗЬ,
■C4b, -C4d. Полиспецифический античеловеческий реагент способен взаимодей¬
ствовать с молекулами IgA и IgM, поскольку реагирует с легкими цепями, которые
входят в состав иммуноглобулинов всех классов каппа (к) и лямбда (X). Наиболее
значимой функцией полиспецифического античеловеческого реагента считается
выявление IgG. К классу IgG-антител относится наибольшее количество клини¬
чески значимых антител. Полиспецифические античеловеческие реагенты также
проявляют антикомплементарную активность в отношении фактора C3d.
Моноспецифические античеловеческие реагенты, полученные против IgG, СЗЬ-
иСЗсІ-компонентов комплемента, используются наиболее часто:
• анти-IgG — основным компонентом являются антитела, направленные
к у-цепям иммуноглобулинов человека, используются в тестах на совме¬
стимость и при детекции антител не реагируют с комплементом, связанным
с эритроцитными Холодовыми антителами;
і анти-СЗЬ, -C3d — не проявляют активности по отношению к иммуногло¬
булинам человека и применяются одновременно с aHTH-IgG-сывороткой
в НАГТ для детекции комплементсвязывающих и комплементнесвязываю-
щих антител.
3. Иммунофлюоресценция позволяет идентифицировать и определять лока¬
лизацию антигенов на поверхности или внутри клеток. Присоединение флюорес¬
центно меченных антител к клеточным антигенам вызывает видимое свечение
покрытых антигеном клеток желто-зеленым или красным цветом (в зависимости
и используемого флюорохрома).
Иммунофлюоресцентные антитела можно использовать в прямом и непрямом
теста*. Метод иммунофлюоресценции применяют для определения антигенов
Ц лимфоцитах или тканевых срезах. Иммунофлюоресцентные антитела исполь-
также в проточной цитометрии, для идентификации перелитых клеток и сде-
ения за их выживанием у реципиента, дифференцировки экспрессии антигенов
тУип крови у гемо- и гетерозиготных лиц.
• Радиоиммунный анализ (РИА), при котором в качестве маркера антигенов
р^аатител в прямом или непрямом тестировании применяют радионуклиды.
Активная метка позволяет точно определить количество антител, связав-
T
552 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
шкхся с антигеном. Для регистрации результатов реакции используют
Радиоактивную метку используют также в методах конкурентного ЄГЧИ|Й'
когда с антигеном взаимодействуют меченые и немеченые антитела пп
фичности.
5. Иммуноферментный анализ (ИФА) применяют для определения ко /
антигенов и/или антител. В основе метода лежит реакция антигена (или
с соответствующим антителом (антигеном) с конъюгированным специй'3'
ферментом. Ферментную метку используют в качестве маркера антигена ил ^
тела для применения в прямом или непрямом тестировании. Положите*91"
реакция - обнаружение в исследуемом образце соответствующих анти»891
(или антител) после добавления субстрата, изменяющего окраску под действН°*
фермента. Большинство методов для определения маркеров гемотрансмиссив"61*
инфекций основано на различных модификациях иммуноферментного тест* 1
При исследовании эритроцитов данный метод часто называют иммунофермещ
ным антиглобулиновым тестом.
6. Гелевый тест применяют для определения поверхностных антигенов клеток
й сывороточных антител, он представляет собой комбинацию методов агглю- !
тинации и гель-фильтрации. При этом тестировании применяют пластиковые !
диагностические «гелевые» карты, которые содержат по шесть микропробирок
заполненных полиакриламидным гелем, нейтральным либо смешанным со специ¬
фическими реагентами. Частицы геля выполняют роль фильтра, задерживающею
агглютинаты эритроцитов, которые остаются на поверхности геля или в его толще
в зависимости от размеров агглютината. Неагглютинированные эритроциты про¬
ходят через гель и оседают на дне микропробирки. Сила реакции агглютинации
оценивается от 4+ до 1+ балла в зависимости от расположения агглютинатов
в геле. Гелевая технология позволяет проводить весь спектр изосерологичесщ
исследований, определять практически все антигенные детерминанты эритро¬
цитов и выявлять антиэритроцитные антитела, а также проводить кроссматч-
тестирование.
Глава 25
Иммунологическая
безопасность гемотрансфузий
В трансфузиологической практике подавляющее количество ре¬
гистрируемых реакций и осложнений — следствие аллогенных
гемотрансфузий. Однако следует иметь в виду, что кровезаменители
также могут быть причиной трансфузионных реакций и реже -
осложнений.
Практически все гемотрансфузионные реакции и осложнения
носят иммунный характер или содержат существенный иммуноло¬
гический компонент.
Неблагоприятные иммунологические последствия гемотрансфу¬
зий можно разделить на три категории, связанные:
• с групповой несовместимостью крови донора и реципиента
по клеточным и плазменным антигенам и антителам к ним;
• парентеральным заражением реципиента возбудителями
инфекционных заболеваний;
• иммуномодулирующим действием аллогенных гемотрансфу¬
зий.
Таким образом, в проблеме обеспечения безопасности гемо¬
трансфузий определяются три основные взаимозависимые состав¬
ляющие:
І максимальное совмещение по антигенам клеток и плазменных
белков крови донора и реципиента - иммуногематологиче-
ская (изосерологическая) безопасность;
• профилактика передачи возбудителей гемотрансмиссивных
болезней — инфекционная безопасность;
• предотвращение иммуномодулирующего эффекта гемотранс¬
фузий.
В литературе есть ряд определений, описывающих группу мето¬
дов, используемых для обеспечения иммуногематологической
(изосерологической) безопасности гемотрансфузий, - иммуно-
гематологические, изосерологические, иммуногенетические И Гф.
В большинстве случаев речь идет об одном и том же процессе -
подборе пар «донор-реципиент» для гемотрансфузии.
Как правило, в процессе работы по обеспечению иммуногемато¬
логической (изосерологической) совместимости гемотрансфуэим
исследуют как антигенный профиль (групповые свойства клеток
и плазмы крови) реципиента и донора (иммуногематологическме
исследования), так и свойства антител к антигенам клеток перифе¬
рической крови (изосерологические исследования).
954 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Исследования, направленные на изучение частоты распределения тех или инщ
антигенов (генов) в популяции или их наследования иммунологическими метода*
ми, принято обозначать как юшуногенетические.
Задача по обеспечению максимального совпадения антигенного профиля крови
донора и реципиента при гемотрансфузии решается в рамках иммуногематологи-
ческой (изосерологической) безопасности.
Последствиями несовместимой трансфузии могут быть либо иммунизация
реципиента против антигенов донора, отсутствующих у реципиента, либо пост-
трансфузионная реакция, если реципиент уже имеет антитела против антигенов
донора.
Значение групповых систем крови при обеспечении гемотрансфузионной безо¬
пасности неравнозначно. Особое место занимают эритроцитные антигены, однако
клиническая роль многочисленных аллоантигенов эритроцитов неоднозначна.
Клиническое значение антигенов определяется способностью аллоантител взаимо¬
действовать с данными антигенами и вызывать разрушение эритроцитов в организ¬
ме реципиента. В этом аспекте важнейшее значение имеют антигены систем АВО
и резус. Прежде всего обеспечивается совместимость по группам крови системы
АВО. В крови человека находятся естественные анти-А- и анти-В-антитела, и пото¬
му первая же несовместимая трансфузия заканчивается не только иммунизацией,
как в случае прочих антигенов, но и рнутрисосудистым гемолизом. Практическое
значение при гемотрансфузиях имеют также факторы системы Келл, Даффи, Кидд
и MNSs. Антитела к этим антигенам могут образовываться при повторных гемо¬
трансфузиях и беременностях и становиться причиной трансфузионных ослож¬
нений. В предупреждении несовместимости по этим факторам большое значение
имеет тщательный сбор акушерского и трансфузионного анамнеза.
Однако обеспечение безопасности гемокомпонентной терапии не ограничива¬
ется подбором пар «донор-реципиент» по антигенным факторам клеток перифе¬
рической крови и антителам к ним. Другая Важнейшая задача' - инфекционная
безопасность, т.е. недопущение гемотрансфузий инфицированных компонентов
донорской крови. Эта задача решается комплексом строго регламентированных
клинико-лабораторных методов обследования донора и реципиента на гемотранс-
миссивные инфекции. В последние десятилетия именно риск инфицирования
реципиента вирусными, бактериальными илй паразитарными инфекциями резко
ограничивает использование гемотрансфузионного пособия. Несмотря на все
усилия по профилактике вирусных й бактериальных заболеваний, во всем мире
растет количество лиц, инфицированных гепатитами В и С, ВИЧ, сифилисом и др.
В ряде стран это приняло характер эпидемии. Высокая инфицированность населе¬
ния, с одной стороны, резко сужает базу донорских кадров, а с другой — предъяв¬
ляет повышенные требования к тестированию донорской крови, предназначенной
для компонентной гемотерапии или получения препаратов крови.
Третья составляющая иммунологической безопасности трансфузионного
пособия - профилактика и управление иммуномодулирующей активностью
трансфузионных средств. Любая трансфузия в той или иной мере - вмеша¬
тельство во внутреннюю среду организма, его гомеостаз, иммунную систему.
Гемотрансфузия — мощный иммуномодулирующий фактор даже при соблюдении
всех строго регламентированных правил по обеспечению иммуногематологиче-
ской и инфекционной безопасности. Поскольку любой компонент крови — много¬
компонентная белковая среда, которая изначально обладает определенными
свойствами, небезразличными для иммунной системы реципиента, задача транс-
фузиолога сводится к принятию всех необходимых мер по снижению отрица¬
тельных влияний процедуры на иммунную систему, а в идеале — к оперативному
управлению процессом. Эти вопросы решаются в рамках обеспечения иммуномо¬
дулирующей безопасности. Особо важное значение обеспечение иммуномодули-
иммунолог»®*** кэолювсть ішж»аім до
, опасности трансфузий имеет для онкологически больны* оря таис-
^"нов и тканей, иммунодефицитом состояния, сепсисе я др.
^““"Хзом, иммунологическая безопасность - коиллек лабораториьа
uva. мероприятий,^направленных на снижение риска, диагностику, про-
печение реакции и осложнений, связанных с трансфузиями
^^бораторных тестов, направленных на обеспечение инщволоиЙЙ
“о#8? * трансфузий, составляют следующие исследование
^гематологические (изосерологические);
• ^^трансмиссивные инфекции;
, |a|JgaTejieH клеточного и гуморального звеньев иммунной системы.
иММУНОГЕМАТОЛОГИЧЕСКАЯ (И30СЕР0Л0ГИЧЕСКАЯ)
" безопасность гемотрансфузий
1 на многовековую историю попыток человека использовать кровь
■ Щу°т различных заболеваний, в том числе и внутрисосудистым введени-
’ Шо обоснованное начало трансфузиологии дало открытие групп крови
0,1 тимся ученым, впоследствии лауреатом Нобелевской премии Карлой
^йгейнером. в опубликованной им в 1901 г. статье «Об агглютинативных
ЖдЩ нормальной человеческой крови* суммированы первые результаты
Упований агглютинативных свойств эритроцитов и сывороток крови, взятой
*2удников его лаборатории. К. Ландштейнер установил, что разнообразие
реакции агглютинации обусловлено двумя антигенами (агглктшоге-
щр д. и^-эритроцитов и двумя соответствующим* естественными антитела-
Хтлютининами) - анти-А (а) и анти-В (р) сыворотки. Так были открыты
пеовые три группы крови системы АВО: А, В и С. К группе А Ландштейнер отнес
водей, эритроциты которых имеют антиген А, к группе В - людей с антигеном
Вик группе С — людей, эритроциты которых не имеют ни А, ни В агглютинина.
К. Ландштейнер среди обследованных лиц не обнаружил четвертую группу крови
ABflV). Это было связано с тем, что количество обследованных было незначителъ-
го{12 человек), и среди них, конечно, могло и не быть лиц со столь редкой груп-
mi Четвертую группу позже открыли его ученики - А. Декастелло и А. Стюрди.
Эритроциты этой группы склеивались сывороткой всех испытуемых лиц. Однако
AB(IV)-rpynna была ими исключена из исследований и общей классификации
групп крови как сомнительная, нетипичная. Только в 1906 г. было подтверждено
существование четвертой группы крови, которую, по сути, вновь открыл пражский
пейхиатр Ян Янский. Он искал причину психических заболеваний в свойствах
Ч»ви. Этиологию психических болезней Я. Янский не нашел, но установил,
человека имеется не три, а четыре группы крови. Четвертая группа встреча-
^значительно реже и объединяет людей, эритроциты которых содержат и А-,
1 В-агглютиногены. Я. Янский пришел к своему открытию, обобщив большой
*®*риментальный материал, объединивший около 3000 опытов. Столь большой
j ем.®аіедований позволил ему доказать наличие четвертой группы, а также
ответь существование в группе А (II) двух вариантов эритроцитов, отличаю-
сопенью экспрессии антигена А, впоследствии получивших обозначение
СЬТаты своих исследований Я. Янский изложил в статье «Некоторые гема-
изыскания У душевных больных*. Статью советовали направить
®енский журнал (Чехословакия в те годы входила с состав Австро-
Янский был патриотом и опубликовал свою работу в небольшом
Чрчти нез»нале. издававшемся на чешском языке. Публикация статьи прошла
і^^змеченной, и после того как в 1909 г. Мосс вторично открыл четвертую
0В11, Янскому пришлось доказывать свой приоритет. Он же предложил
191 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
значать группы крови римскими цифрами: I. II, III, IV. Буквенную ном
Ц групп крови предложили в 1910 г. Э. Дунгерн и Л. Гиршвельд. eiflw»Ty.
1 После исследований Ландштейнера стала ясна причина неудачных пепел
кроив, которые зачастую заканчивались смертью больного. Определение ИВЗНи^
крови перед каждым переливанием обеспечивало безопасность этого методаПЬ1
ЯШ. Вся значимость открытия групп крови предстала в период Первой МІ ЛЄЧе.'
войны (1914-1918). Использование сывороток К. Ландштейнера дало во*°Й
ность подбирать совместимую кровь и сделать гемотрансфузии обычной леч
процедурой, спасшей миллионы жизней. °Й
В первой половине XX столетия на основе сформулированных К. Ландштей
ром принципов было открыто более 200 антигенов эритроцитов, лейкой'
тромбоцитов и белков плазмы. На сегодняшний день открыта и изучена имми/
генная активность более 450 антигенных детерминант — групп крови, определя
щих иммуногенетический профиль индивидуума и популяции в целом.
Свой вклад в изучение антигенного полиморфизма внесли и отечествен
ные исследователи П.Н. Косяков, А.К. Туманов, В.В. Томилин, Н.В. Попов
Т.Г. Соловьева, М. А. Умнова, Е.А. Зотиков, С.И. Донсков, А.И. Башлай и др.
Антигенные системы периферической крови
Изучение антигенных систем периферической крови стало возможным после
открытия групповых свойств крови, давшего начало одному из важнейших и ста¬
рейших разделов иммунологии — иммуногематологии.
Открытие групп крови позволило выполнять гемотрансфузии от одного чело¬
века другому с прогнозируемым клиническим результатом и стало толчком к раз¬
витию различных научных направлений — трансфузиологии, неинфекционной
иммунологии, иммуногенетики, популяционной иммунологии и др.
Основные иммуногематологические задачи трансфузионной иммунологии:
• определение нормальных или измененных антигенов индивидуума - изо-,
алло-, ауто- и лекарственно-индуцированных антигенов;
• исследование иммунологической несовместимости при переливании компо¬
нентов крови, трансплантации органов, применении лекарственных препара¬
тов, а также при конфликтной беременности.
Трансфузии гемокомпонентов возможны только после оценки биосовместимо¬
сти крови донора и реципиента, которая предполагает общность их антигенного
профиля.
«Группы крови* - термин, охватывающий все генетически наследуемые фак¬
торы, выявляемые в крови человека. Групповые антигены передаются по наслед¬
ству и не меняются в течение жизни, их набор индивидуален у каждого человека.
Полное совпадение комбинаций групп крови у двух человек встречается крайне
редко (с учетом всех известных иммунологических маркеров - невозможно)
и наблюдается только у однояйцовых близнецов.
Различают групповые антигенные системы эритроцитов, лейкоцитов, тромбо¬
цитов и плазменных белков.
АНТИГЕНЫ ЭРИТРОЦИТОВ
Любая структура на поверхности эритроцита, способная вызвать иммунный
ответ, может рассматриваться как антиген группы крови. По своей химической
природе антигены эритроцитов считаются протеинами (системы Rh, Diego.
Kidd), гликолипидами (системы АВО, H, Р, Lewis, Ii) и гликопротеинами (систе¬
мы MNSs, Luterari). Гены полисахаридных антигенов (АВО, Н) кодируют^
специфическими гликозилтрансферазами - ферментами, присоединяющим"
различные сахара к полисахаридным цепям-предшественникам и формиру*0
ИММУНОЛОГИЧЕСКАЯ ЫЭОПАСНОСГЬ Г£М0ГРАНС*¥ЗИВ Ц7
такИМ образом антигенную структуру. Гены белковых антигенов група
кодируют полипептиды, которые сами встраиваются в мембрану эри-
и формируют антигенные детерминанты. Одна белковая молекула
^ вести несколько антигенных детерминант, к которым вырабатываются
<нЫе антитела. Ряд антигенов групп крови представлен только на зрм*
I***" - /Rh, Kell), другие экспрессируются также в некроветворных тканях
& Иіап)- • ■
І ««юсерологическая классификация групп крови основана на наличии или отсут-
п в разменных и клеточных элементах крови соответствующих групповых
Йнтдаенов и изоантител.
Аятигены эритроцитов — это структурные компоненты мембраны эритроцитов.
<! мюшие иммуногенной активностью, т.е. они вызывают выработку антител
«подействуют с антителами, образуя комплекс «антиген--антитело*,
к ^ гены групп крови выполняют следующие функции:
участвуют в переносе веществ в клетку, будучи каналами для их транспорта;
' участвуют в адгезии различных молекул;
I служат рецепторами экзогенных лигандов - бактерий, вирусов, паразитов.
I поддерживают структуру мембраны эритроцитов.
фенотип и генотип эритроцитов
фенотип обозначает антигены, присутствующие или отсутствующие на эритро¬
цитах данного индивидуума, что определяется по взаимодействию исследуемых
эритроцитов с соответствующими антисыворотками. При описании фенотипа
в зависимости от положительного или отрицательного результата реагирования
сантисыворотками антигены обозначают знаком «*» или ♦-». Например. А+. В-.
Ш»-).
Генотип групп крови до семейного исследования интерпретируется из фежтвя
эритроцитов индивидуума и квалифицируется как вероятный генотип.
Эритроциты невозможно генотипировать в связи с тем, что циркулирующие
клеш не имеют ядра и не экспрессируют гены, и с помощью серологических
тестов выявляют присутствие антигенов, но не генов.
Международным обществом переливания крови (ISBT) в ШО г. была сошна
Рабочая группа по терминологии антигенов эритроцитов, которая разработала
н предложила на основе генетического картирования новую классификацию
антигенов эритроцитов, по которой их в соответствии с генетическими характе¬
ристиками относят к одной из следующих классификаций:
і системы групп крови;
і коллекции групп крови;
• серии групп крови.
Системы групп крови состоят из антигенов (одного или более), контроли¬
руемых одним генетическим локусом или двумя и более гомологичными генами,
тесно связанными между собой, т.е. основным признаком, по которому антигены
Уединены в системы, считается общность контролирующих их генов.
Системам антигенов эритроцитов присвоены трехзначные номера в порядке
10открытия (табл. 25-1).
Коллекции групп крови содержат антигены, которые биохимически и серо-
Догически связаны на уровне фенотипа, но не могут входить в систему, так
не имеют общих генов, их кодирующих. Коллекции обозначают номерами
^205 до 210 (табл. 25-2).
ерии включают антигены, для которых не изучены кодирующие их гены. Они
рок дйненьі в Две группы: антигены с высокой частотой встречаемости под номе-
(jgg ^ (табл- 25-3) и антигены с низкой встречаемостью под номером 701
Ml туаНофузионная иммунология
Таблица 25-1. Системы групп крови
" ■■
Название системы
Символ ISBT Номер
Количество антигенов
Локализация ..
АЛО
ABO
001
4
9q34.1-^f^
MNSMN
MNS
002
43
4ц28чйГ\|
1
P1
003
1
22q11.2^SJ
Щ
RH
004
51
1p362iS^|
Lutheran
LU
005
20
i9qi2^T^J
кт
KEL
006
24
7<j33'~'''^>J
lewis
LE
007
6
1§p33~>sJ
Оияу
FY
008
6
1q22-q23 —J
KkM
JK
009
3
18q11-qi2^J
Diego
Ql
010
21
17q12-Q2iT-J
Yt Cartwright
YT
011
2
7«J22~~^—-j
I
XG
012
1
Xp22 ІГ''''Ч
Scianna
SC
013
4
1p36.2-tfT"4
Dombrock
DO
014
5
_?cH
Colton
CO
015
3
7p14 Ч
landstainer-Wiener
LW
016
3
19р13.2-свгГ~'~'>
Gbido/Rodqars
CH/RG
017
7
6р213 "
I
H
018
1
19ql3 "
Кх
XK
019
1
Хр21.1
Gerbich
GE
020
7
2q14-q21
Cromer
GROM
021
10
-Q
СО
Knops
KN
022
5
1q32
Min
IN
023
2
11р13
Ok
OK
024
1
_
Raph
RAPH
025
1
—
JMH
JMH
026
1
— .
I
027
1
—
etoboside
CLOB
028
1
—
GIL
GIL
029
1
Ц' !
Таблица 25-2. Коллекции групп крови
Таблица 25-3. Антигены с высокой частотой встречаемости
Название системы
Символ ISBT
Номер
, , , ,
Количество антигени
Cost
COST
205
2
І
1
207
2
Er
ER
206
2
Gtoboside
GLOB
209
3
Ll p и Le (d)
—
210
2
Название системы
Символ ISBT
Номер
Vel
901001
Langinia
Lari
901002
August
At*
901003
9І
Jr*
901005
OK*
901006
Щ -—
JMN
901007
ИММУНОЛОГИЧЕСКАЯ бЕЗСНШМййтк Щ
Окичаим габа IM
Кезеемие системы
симмя вот
Иим*е
Emm
МКМ
—
Anwj
»100»
MER2
»1011
Sd*
»1012
В . -
»1013
^ I wou
гдолиці* 2М- Антигены с низкой частотой встречаемости (<1%)
960 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Антигены, ранее входившие в серию антигенов с низкой частотой вст
СТИ. после уточняющих исследований были включены В системы или
групп крови (табл. 25-5).
ili
Таблица 25-5. Антигены (ранее входящие в серию антигенов с низкой частотой встречам*,
включенные 8 настоящее время В системы И коллекции групп Крови М°СТЦ).
Прежний номер
Символ ISBT
Новое обозначей*Р~''''--1
[700001
Wr*
WR1 (211 ООП
700007
Lsa
GE6 (020006І "Ч
700009
Wb
GES (020005V "~~"Ч
700011
Or
MNS31 (оогозіГ^ч
700012
Gf
—
700016
Heibel
—
700020
ii
GE7 (020007)
700024
Rla
Ls* GE6
700025
In*
IN1 (023001) Ш
700031
Dh*
GE8 (020008) і
700032
POLL
—
700033
Os*
MNS38 (002038)
700035
Tcb
GR0M3 (021003)
700036
Tcc
GR0M4 (021004)
700038
Hov
Wu (700013)
700042
WES
GR0M8 (021008) |
700048
FPTT
RH50 (004050)
В соответствии с классификацией ISBT каждому антигену присваивается шестиз¬
начный идентификационный номер. Первые три цифры соответствуют системе
(001-023), коллекции (205-215) или серии (901 и 701). Следующие три цифры -
порядковый номер антигена. Например, антиген А обозначается как 001001,
а антиген S - 002003.
ISBT установило также определенные правила для обозначения фенотипа
антигенов. Фенотип обозначает антигены, присутствующие или отсутствующие
на эритроцитах, что определяется при взаимодействии исследуемых эритроцитов
с соответствующими специфическими антисыворотками. При этом перечислякга
только те антигены, по которым проводили тестирование. При описании фенотипа
антигены обозначают знаком «+» или «-», который ставят после символа антиге¬
на, например К+, С- (антиген К 9 присутствует, антиген С - отсутствует).
Для антигенов, которые обозначаются буквой со степенью, букву степени поме¬
щают в скобки на одном уровне с обозначением антигена: Fy (a-), Fy (b+). Когда
фенотип обозначают буквой и номером, при наличии антигена знак «+»не ставит¬
ся. а знак «-* пишется перед номером Lu-4.
По отрицательным результатам тестирования нельзя делать заключение о фено¬
типе эритроцитов. Например, при отрицательном результате тестирования сыво¬
роткой анти-Келл нельзя сделать вывод о том, что эритроциты имеют фенотип кк.
Из известных на сегодняшний день 29 антигенных систем эритроцитов наи¬
большее значение для клинической практики имеют АВО (001) и резус (0(H)-
Совместимость по этим двум системам в обязательном порядке учитывают
при каждой трансфузии.
Наследование антигенов групп крови
Антигены групп крови передаются по наследству в соответствии с хром<$^
ной теорией и по законам наследственности Менделя. Наименьшим сегмент^
хромосомы, который контролирует появление и развитие любых наследствен*^
ДД признаков, в том числе групп крови, остается ген. Гены, расположенные ряД
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАИСФУ ЗИЙ 381
хромосоме, занимают определенное место, называемое локусом. Гены.
%олируюшие функционально одинаковые наследственные признаки, но с раз*
*^даіми проявлениями, называются аллельными. Аллели, расположенные сим-
^ячно в двух противоположных локусах соседних хромосом, образуют парные
)<eTL(}< Если на аллелях двух соседних хромосом расположены одинаковые гены.
,*^«у1ощие один и тот же наследственный признак (например, антиген ВВ).
индивид становится гомозиготным по этому признаку, а при расположении
10 йЧных генов, кодирующих один и тот же признак (например, В и 0). индивид
Р^-ится гетерозиготным по данному признаку.
Совокупность генов данного индивидуума называется генотипом. Совокупность
-появлений признаков, кодируемых генами, называют фенотипом. Фенотип обо¬
жает антигены, присутствующие или отсутствующие на эритроцитах, которые
Оделяются по взаимодействию исследуемых эритроцитов с антисыворотками:
!Й.с<-).ке>. • ~
g соответствии с одним из основных законов наследования, находящих при¬
гниє в генетике групп крови, наследование групповых факторов крови проис-
юдит независимо друг от друга. В ряде случаев, когда наследственные признаки
^даруются сцепленными генами, разными на одной и той же хромосоме, они
передаются вместе. Примером сцепленных генов групп крови мот служить груп¬
пы Luteran и Se.
Если в начале мейоза гомологичные хромосомы, приближаясь друг к другу,
переплетаются, может произойти обмен гомологичных частей. Это явление назы¬
вают кроссинговер («crossingover»), В ряде случаев в результате транслокаций
в хромосомных сегментах, обмена внутри одной хромосомы или обмена сегмента¬
ми гомологичных хромосом происходят такие изменения в области локусов групп
крови, при которых исчезают целые части хромосом, т.е. наблюдается делеция
генов, которая определяет, в частности, фенотипы Rhnull и «Бомбей*.
Система АВО (001)
Система АВО, как было сказано выше, — первая эритроцитная система антиге¬
нов, открытая венским ученым К. Ландштейнером в 1900 г. Она по праву считается
наиболее важной для трансфузиологической практики. К. Ландштейнер также
сформулировал правило, согласно которому особенностью системы АВО считается
постоянное и предсказуемое присутствие в сыворотке здоровых людей, не имев¬
ших трансфузий донорских эритроцитов, антител к отсутствующим на поверхно¬
сти их эритроцитов антигенам А или В (правило Ландштейнера).
Присутствие этих естественных (неиммунных) антител объясняется тяжелым
внутрисосудистым гемолизом при первой же трансфузии АВО-несовместимой
крови. Именно поэтому тестирование на АВО-совместимостъ донора и реципиента
остается основной предтрансфузионной процедурой.
По современной классификации система АВО содержит 4 антигена:
• 001001 — антиген А;
І 001002 — антиген В;
I 001003 — антигены А, В;
• 001004 — антиген А,.
Определение групп крови по системе АВО основывается на обнаружении антигенов
и В на эритроцитах и анти-А- и анти-В-антител в сыворотке крови (табл. 25-6).
В настоящее время по международным правилам принято обозначать антитела
III АВО как анти-А- и анти-В-антитела (взамен принятого ранее обозна¬
чил а- и р-агглютинины) и для обозначения групп крови используют только
“Уквы: А, В, АВ и 0.
в России принято смешанное буквенно-цифровое обозначение групп крови:
Чі>-А(И),В(ІП)иАВ(ІУ).
Н ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Talmts 25-в. Основные антигены и антитела, определяющие групповую поиналпв*
■патш АВО "«"««HOcn
Группа крови
Антигены
Антитела
0
Нет
Аити-А,анти-В
А
А
Анти-В
в
В
Анти-А
АВ
А+В
Нет
Генетические и биохимические особенности антигенов системы АВО
Наличие и локализацию антигенов А и В контролируют гены трех отдел
локусов: АВО. Hh, Sese. кНЫх
Аллели А. В и 0 находятся в локусе АВО на хромосоме 9. Гены А и В
К0Дируют
не антигены, а ферменты — гликозилтрансферазы, которые катализируют облаял
ванне антигенов А и В. Ген О считается нефункциональным, поскольку его белко"
вый продукт не участвует в образовании антигенов групп крови. На эритроциту
группы О (I) присутствует антиген Н — предшественник антигенов А и В.
Гены локусов Hh, Sese тесно сцеплены и локализуются на хромосоме 19
Оба локуса состоят из 2 аллелей, одна из которых аморфная. Активная аллель
Н-локуса кодирует фукозилтрансферазу, катализирующую образование антигена
Н, на основе которого формируются антигены А и В. За экспрессию антигена Н
на гликопротеинах в эпителиальных секретах (например, в слюне) отвечает ген
Se. Ген Se наследуют 80% населения, и гликопротеины их секретов несут антиген
Н. который модифицируется в антигены А и/или В при наличии экспрессирующих
их генов. Индивиды, имеющие гены SeSe или Sese, считаются выделителями, а sese-
гены В невыделителями. Секреторные гены Sese разрушают гликолипидные связи
в А- и В-тканевых антигенах, вследствие чего полисахаридная часть высвобожда¬
ется в тканевые жидкости.
Ферменты глюкозилтрансферазы, кодируемые генами А и В, достраивают
остатки сахаров на углеводные цепочки, преобразованные в Н-форму фукозил-
трансферазой, которую кодирует ген Я. Антигены Н собираются на цепочках оли¬
госахаридов, которые оканчиваются связями 1-го или 2-го типа, различающихся
только характером связи между остатками галактозы (Gal) и N-ацетилглюказамина
(GalNAc). В цепочках 1-го типа 1-й углеродный атом галактозы связан с 3-м угле¬
родным атомом NAc, а в цепях 2-го типа 4-й углеродный атом NAc связывает
галактозу. Олигосахариды 1-го типа, несущие антигены Н, А и В, присутствуют
в жидких средах и секретах организма, в плазме, молоке или моче и в тканях эпи¬
дермального происхождения, таких как эпителий кишечника.
Антигены А, В и Н на поверхности эритроцитов формируются на олигосахарид-
ных цепях 2-го типа, входящих в состав сильно разветвленных гликолипидов, свя¬
занных с белками мембраны эритроцитов. Ген Я кодирует фукозилтрансферазу,
которая присоединяет остаток фукозы ко второму углеродному атому терминаль¬
ного остатка галактозы цепей. В-антиген образуется при присоединении остатка
галактозы к предыдущему остатку галактозы, связанному с фукозой; если к нему
присоединяется GalNAc, то образуется А-антиген.
Наследование антигенов системы АВО
Один из трех аллельных генов А, В и 0, кодирующих образование А-
и В-антигенов, передается от матери, другой — от отца. Гены А и В считаются
доминантными по отношению к гену 0 и кодоминантными по отношению ДРГ
к другу. Ген 0 рецессивен по отношению к генам А и В. Доминантный признак про
является даже при наследовании от одного из родителей, рецессивный -
при наследовании от обоих родителей. Кодоминантные признаки проявляю^
яри наследовании одного признака от отца, а другого от матери. При наслМ0®3
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕИОТРМСтЭИК N3
одинаковых признаков от обоих родителей клетки гомозиготны, при иаследо-
разных - гетерозиготны.
Генетически возможны шесть комбинаций аллельных антигенов - 0. АО. АА,
рВ. АВ. Фенотипически различают четыре группы крови, так как гетеро-
оозиготные варианты причисляются к одной группе крови, поскольку не обла¬
ет различными свойствами,
улиц первой группы крови эритроциты всегда гомозиготны, содержат антиген Н.
Эритроциты четвертой группы, содержащие антигены АВ, всегда гетерозиготны.
Клетки второй и третьей группы могут быть как гомозиготными - АА и ВВ. так
^розиготными - АО и ВО (табл. 25-7).
"Ч№!1
Мать
Дата
1
00
00
—
-
т—
' “ і
Г ОА
АА
—
0А
АА
-
I г
Ш і
r»Z
0А
00
0А
АА
-
— і —
[М
АА
—
0А
—
_
-
1 1
ОА
00
00
.
0А
—
—
1.
-
АА
АА
-
АА
— :
1
* і
ОА
ОВ
00
0А
—
ОВ
АВ
ОВ
ВВ
—
— ...
-
ОВ
вв
ОВ
0В
00
-
-
ОВ
вв
00
ВВ
■ —
—
—
ОВ
-
ОВ
00
00
—
-
0В
- !
"З
ВВ
ВВ
—
—
—
... .
вв
_
АВ
00
—
0А
—
0В
L
. .
АВ
АО
—
0А
АА
ОВ
-
-
АВ
АА
—
—
АА
-
АВ
АВ
0В
—
0А
-
ОВ
вв
АВ
4———н
І АВ
ВВ
—
—
-
-
вв
АВ
Г АВ
АВ
-
—
АА
-
со
со
[■ "
АВ
Для определения А- и В-антигенов на поверхности эритроцитов используют
реакцию агглютинации. У подавляющего большинства людей антигены А и В выра¬
жены на эритроцитах достаточно хорошо, что позволяет при наличии антисыворо¬
ток соответствующего качества и направленности уверенно их идентифицировать.
В ряде случаев при определении групп крови могут возникнуть некоторые
^УДности, связанные со слабовыраженной агглютинабельностью эритроцитов
с соответствующими антисыворотками. Антисыворотки часто слабо реагиру-
Ют с эритроцитами новорожденных, что объясняется тем. что А- и В-антигены
"Ри рождении еще полностью не сформированы, хотя могут быть обнаружены
•v*e на эритроцитах 5-6-недельных эмбрионов. Экспрессия А- и В-антигенов
®°лностью развивается к 2-3 годам и остается практически постоянной в течение
^«изни. ’ Ї З*
Частота распределения основных групп крови системы АВО. по результатам
урваний различных авторов, приведена в табл. 25-8.
964 ТЙМСФУЗИОИНАЯ ИММУНОЛОГИЯ
ТаМаМ 26-1. Распределение групп крови
I Мима МЛ (1979)
Ивскаа. п»31896
I Рапиии АА (1988м
і Азербайджан д»2225|
i Меркулова Н.Н. (1999)]
1 Сургут. Я»9633
і Скудицкий А.Е (2001)|
I Первоуральск. я=17918
Михайлова Н.М. и соавт. (2002)
I Смоленска! область. л=9997
Фатьянов СА, Мороков ВА (2004).
Сыктывкар, »»18 090
Минее ва Н.В. (2004)
Санкт-Петербург
Топочко Г.В., Микупич А.И. (1972.1981)
Беларусь, (т=18 726
Дашкова Н.Г., Рагимов А.А. (2004, 2006)
Москва, л=51160
У жителей азиатских стран группа крови 0(1) встречается реже, а у народов
Севера, аборигенов Полинезии, Австралии и индейцев Южной Америки значи¬
тельно чаще, чем у жителей Европы.
По мере продвижения с запада на восток уменьшается встречаемость антигена
А І возрастает частота антигена В. Неравномерность распределения групповых
антигенов некоторые авторы объясняют влиянием различных пандемий - чумы,
холеры, оспы и др.
Подгруппы крови системы АВО
Антигены А и В, содержащиеся в эритроцитах лиц групп А, В и АВ, неодно¬
родны и могут быть представлены в виде нескольких подгрупп (табл. 25-9),
Подгруппы антигена А встречаются чаще и количество их разновидностей боль¬
ше, чем у антигена В. Подгруппы представляют собой АВО-фенотипы, разли¬
чающиеся количеством антигенных детерминант на поверхности эритроцит
Для клинической практики преимущественное значение имеют варианты (под¬
группы) А, и А2.
Таблица 25-9. Частота встречаемости подгрупп антигенов А и В (среднеевропейская популяр)
Основные варианты антигенов
Частота встречаемости, %
Редко встречающиеся варианты антигени
А,
45
Aint, Ах, Am. Ael. Av, Aend
А,
7
_
1
А,
0,1
В
14
Bx. Bm, Bel, J
В,
<0,1
щ—j
и зависит
Частота встречаемости групп крови различна у разных народов VI
от таковой распространения соответствующего гено- и фенотипа (табл. 25-1 ;•
Частота встречаемости антигена А2 у доноров крови групп А и АВ г.
при ведена в табл. 25-11. 8ij.
Данные о выявлении слабого варианта антигена А впервые опуолик ^
ли в 1911 г. Дунгерн (Dungern) и Хиршзельд (Hirszeld). Но только в ,
Даидштейнер (Landsteiner) и Левин (Levine) дали название этим двум лоДГрУ
антигена - А, и А..
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГВДОТРАНСФУЗИЙ ggg
различия между эритроцитами, относящимися к группам А, и А,, можно оха-
^ризовать как качественные и количественные одновременно.
о.ацз 25-10. Генотипы А,, А2, ВО, серологически определяемые фенотипы и процент ЯИЦ
Т(попупяции (среднеевропейской)
Генотип
А,/А,
А/А,
А./0
Фенотип
% пиц в популяции
VA
А^О
в/в
в/о
А,/В
АВ
I
■
АВ
—! 0/0
0
I «
Таблица 25-11. Частота антигенов А,, А? у доноров
—
Группа крови
А (л=3564)
АВ (№1288)
А,
А,
А, I А . J
82
18
M I 26
Качественные различия определяются тем, что ДНК гена А, отличается от тако¬
вой гена А2 одной — 156-й позицией, в которой аминокислота пролин заменена
на лейцин, что обеспечивает кодирование ими разных трансфераз. А,-трансфераза
трансформирует в антиген А большее количество антигена Н. чем А -трансфераза.
Количественные различия обусловлены в 3 раза большим количеством анти¬
генных детерминант на А,-клетках по сравнению с клетками А, и различным соот¬
ношением антигенов Н и А на эритроцитах индивида.
Эритроциты группы А, отличаются от таковых А, более выраженными агглю-
тинационными свойствами по отношению к анти-А-антителам.
Эти различия и определяют агглютинирующую способность эритроцитов лиц
с группой крови А2 и А2В и их иммуногенность при гемотрансфузиях.
По данным различных авторов, распространенность антигена А, составляет от I
до 9% у лиц с группой крови А (II) и от 0.64 до 25% — с АВ (IV), Данные о частоте
носительства вариантов антигена А во многом зависят от метода исследования.
Проведено сравнительное изучение различных диагностических реагентов (табл.
25-12). Для выявления слабого варианта антигена А были использованы:
І ID-карты, основанные на гелевой технологии, для определения антигенов А,
и Н. Их применение позволяет дать не только качественную, но и количествен¬
ную (от «-*• до «++++») оценку содержания соответствующих антигенов:
• зритротест анти-А,, (анти-А,-лектин — Dolichos biflorus). При смешивании
эритротеста с эритроцитами А, наблюдается крупная четкая агглютина¬
ция в первые секунды. С эритроцитами А, агглютинации не наблюдается
или отмечается мелкая агглютинация на 5-й минуте:
І стандартные изогемагглютинирующие сыворотки;
І Цоликлоны анти-А, анти-АВ;
• Цоликлон анти-А слабый.
Как видно из табл. 25-12, в исследованиях с эритроцитами доноров крови и боль¬
ше показано, что если при использовании эритротеста анти-А, и моноклональных
j сывороток выявляемость составляла 14.5-14,7% в группе А (II) и 23.2-235%
H2A^e ^ (IV)' то при применении ID-карт эти значения были выше - 17.8
**% соответственно. Очевидно, что наиболее точно групповую принадлежность
ЇМ ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
1
крови определяют ID'картами. Однако, поскольку гелевая технология
не всем лабораториям, определение подгрупп МОЖНО осуществлять ппи"0*3
тест антн-А,. ’ 1 Меи*
*
Таблица 2S-12. Определение групп крови А, (II) и A,B О^)сиспользоеа^ем оазпии
* Агглютинация носит невыраженный характер ЯНЯИЮТЯвНИИИи рраооом фоне.
При исследовании крови новорожденных и детей первого года жизни для ил
тификации вариантов антигена А необходимо использовать высокочувсгвте?
ный гелевый тест или эритротест анти-Aj, поскольку эритроциты таких
в силу их физиологической незрелости часто показывают мелкую агглютина
цию со стандартными сыворотками, даже если ребенок имеет группу крови А
или AtB.
В 1930 г. Ландштейнер и Левин опубликовали данные о еще одном субвари¬
анте антигена А, который был назван Aint, поскольку занимал промежуточную
позицию между А, и А2. Уровень антигена Н у Aint был выше, чем у Щ Антиген
Aint более характерен для негроидов, среди которых у лиц со второй группой он
достигает 8,5%, тогда как среди европеоидов - только у 1%.
Существующие еще несколько подгрупп антигена А (Ах, Am, Ael, Ay, Aend)
встречаются очень редко. Выявляются они только с помощью очень активной
иммунной анти-А-сыворотки или методом адсорбции/элюации антител с эритро¬
цитами А.
Антигенная структура различных подгрупп характеризуется уменьшением
количества антигенных детерминант, а также содержанием Н-антигена и увели¬
чением А-антигена. Встречаются индивиды, имеющие на эритроцитах антиген А,
полностью лишенные Н-антигена, — так называемые Acompl. У таких лиц можно
ожидать выявления в сыворотке анти-Н-антител.
Подгруппы антигена В также существуют (Вх, Вт, Bel), но крайне редко выяв¬
ляются среди европеоидов. Относительно часто варианты В-антигена встречают¬
ся среди монголоидов. Поскольку антиген В также формируется под действием
трансфераз на основе Н-антигена, эритроциты, имеющие слабые варианты ашя-
гена В, могут содержать на поверхности мембраны эритроцитов антиген Н.
В очень редких случаях эритроциты могут не содержать ни один из антю*-
нов АВО. Фенотип таких эритроцитов — «Бомбей» — обусловлен генотипом №
Отсутствие Н-антигена обусловливает репрессирование генов, ответственных
за выработку антигенов системы АВО, одновременно у этих лиц выявляю®
анти-А-, анти-В- и анти-Н-антитела.
Антитела против антигенов системы АВО
Особенность системы АВО состоит в том, что в плазме у неиммунных лиц су®
ствуют естественные, нормальные антитела к отсутствующему на эритрош^
антигену: у лиц группы 0 — антитела к антигенам А и В, группы А — к анти
В и группы В - анти-А-антитела. но8.
Естественные антитела - полные холодовые изогемагглютинины.
тт относящиеся к иммуноглобулинам класса IgM и частично IgG. Спосоон
{Стандартные изогемагглютинирующие сыворотки
j Цоликдсж анти-А слабый
Эрнтротесг анти-А,
Цоднклоиы: анти-А. антн-АВ
Ю-карты
Диагностическая система
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГШОТМНСФУЗИИ 987
„х выработке передается по наследству. Уровень этих антител подвержен «ме¬
рцям на протяжении жизни. Иногда антитела присутствуют уже при рождении.
большинство антител новорожденных передаются от матери. Выработка
<~доенных антител начинается с 4-6-месячного возраста и увеличивается, аости-
в своего максимального титра к 5-10 годам. С возрастом уровень естественных
Цяпел снижается.
днти-А-антитела у лиц группы В и анти-В-антитела у лиц группы А в основном
оедставлены иммуноглобулинами класса IgM и небольшой частью IgG. а у лиц
йлдпы 0 анти-А- и анти-В-антитела представлены в основном иммуноглобулина¬
ми класса IgG. Поскольку IgG, в отличие от IgM, могут проникать через плаценту,
Lji матерей групп крови 0 с гораздо большей вероятностью подвержены АВО-
ремолитической болезни новорожденных по сравнению с детьми матерей с груп¬
пами крови А и В.
днти-А- и анти-В-антитела в сыворотках некоторых лиц могут быть представ¬
лены также иммуноглобулинами класса IgA. Причем, по мнению R. Rieben и соавт.
/1991), У неиммунизированных лиц антитела этого класса встречаются крайне
»едко и обычно выявляются у иммунизированных индивидуумов.
Индивидуумы группы 0 считаются опасными универсальными донорами, по¬
скольку их плазма содержит иммуноглобулины класса IgG, и переливание эритро¬
цитов, содержащих даже небольшое количество плазмы реципиентам групп А, В и
АВ, может приводить к посттрансфузионным осложнениям.
Различия между иммуноглобулинами классов IgG и IgM приведены
в табл. 25-13.
Таблица 25-13. Особенности анти-А- и анти-В-антител классов IgG, IgM, IgA
Особенности
ж і
IB* Ґ\
Присутствие в сыворотке:
неиммунизированных доноров
Да
Иногда
Редко
иммунизированных доноров
Обычно
Обычно
Агглютинация усиливается:
при обработке эритроцитов ферментами
Да
Да
Да
при снижении температуры
Да
Нет
Hr
Ингибируются растворимыми А- и/или В-антигенами
Да
Нет
Вызывают гемолиз
Да
Да
Связывают комплемент
Да
Да
Hr
Повышают титр в АГТ
Нет
Да
А» .
Оптимум температуры
4°С
4-37 *С
Инактивируются при 56 °С
Да
Нет.
иг
Инактивируются при действии 2-МЕ или DTT
Да
Hr
Частично
Преобладают у неиммунизированных доноров групп А и В
Да
Hr
Hr
Сыворотка лиц группы 0 содержит антитела, названные анти-А, -В. поскольку
они взаимодействуют как с А-, так и В-эритроцитами и их специфичность по отно¬
шению к какому-либо типу клеток не устраняется методами дифференциальной
адсорбции.
Антитела анти-А у индивидов групп В можно разделить на анти-А,- и анти-Аг-
компоненты. Нативная сыворотка группы В агглютинирует А,- и А2-эритроциты,
но после адсорбции на А-клетках реагирует только с эритроцитами А,.
Кроме естественных антител, существуют иммунные антитела против антиге¬
нов системы АВО, образующиеся при трансфузиях АВО-несовместимых эритроци-
тов* что практически всегда приводит к возникновению гемолитических реакций
н/или осложнений, нередко сопровождающихся ДВС-синдромом, почечной недо-
^точностью и, возможно, смертью.
Иммунные антитела относятся преимущественно к иммуноглобулинам класса
№. реже - IgM, могут быть как в полной, так и неполной форме. Их выявляют
9^3 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
непрямой пробой Кумбса и, как правило, в более высоком титре п
в коллоидной среде по сравнению с солевой. Р*1
Обнаружены вещества растительного и животного происхождения
щие специфичностью антител системы АВО групп крови человека.
Лектины — вещества из семян некоторых видов растений, проявляюи
телоподобные свойства в серологических реакциях с эритроцитами опрел
антигенного фенотипа. Лектины получают, настаивая семена в водно-аш№НИОг°
творах. В отличие от истинных антител, открытые в 1948 г. Ренконеном и Бп
лектины не считаются глобулинами, но обладают способностью агглютини
эритроциты с определенным фенотипом. Например, лектины из семян iPfl
japonic а реагируют преимущественно с антигеном В, в меньшей степени с О
Экстракты из бобовых растений Vicia cracca и Dolichos biflorus реагируют с " ^
геном А и значительно слабее с В и 0. Экстракт из Dolichos biflorus в связи Г"
свойством намного сильнее реагировать с антигеном At может служить для nJ°
познавания подгрупп Щ и А2. Попытки использовать лектины в качестве стандапг
ных или тестовых реагентов для определения групп крови не увенчались успехом
и после появления моноклональных антител интерес к ним как к дешевому источ¬
нику для серологических реакций окончательно угас.
Необходимо упомянуть и о других веществах животного происхождения I
протектинах. В частности, протектины — антителоподобные вещества, содержа¬
щиеся в икринках рыб, обладают способностью агглютинировать эритроциты
Обработанные папаином или трипсином эритроциты В-группы агглютинируют
в присутствии экстракта икринок лосося. Протектин анти-А встречается у неко¬
торых пород свиней. Анти-Н-, анти-0- и анти-В-антитела обнаружены у цыплят
породы леггорн и угря. Анти-Н-сыворотка цыплят обладает более выраженными
свойствами и более специфична, чем экстракт, полученный из семян Ulex europeus.
Интересно, что эти антитела не выявлены у цыплят, выращенных в инкубаторе,
а только у тех, которые выросли в природных условиях. Это факт часто исполь¬
зуют как еще одно доказательство в пользу теории о значении внешней среды
в образовании естественных антител.
Протектины в целом по сей день остаются малоизученными и не получили
заметного применения в медицине.
Система MNS (002)
Система MNS — полиморфная система, объединяющая 43 известных к настояще¬
му времени антигенов. Эту вторую из систем эритроцитов открыли К. Ландштейнер
и П. Левин в 1927 г. Перечень антигенов системы MNS по международной класси¬
фикации представлен в табл. 25-14.
Таблица 25-14. Антигены системы MNS
№ антигена
Символ
антигена
N:антигена
Символ
антигена
N9 антигена
Символ
антигена
N9 антигена
Символ
антигена
MNS1
М
MNS12
Vr
MNS23
SD
MNS34
I My
MNS2
N
MNS13
М*
MNS24
Mit
MNS35
мит
——;—1
MNS3
S
MNS14
МР
MNS25
Oantu
MNS36
SAT__J
MNS4
S
MNS15
St'
MWS26
Hop
MNS37
Щ
MNS5
и
MNS16
Ri'
MNS27
Nob
MNS38
0£l
MNS6
Не
MNS17
СІ*
MNS28
En*
MNS39
Ю
MNS7
Mi.
MNS18
Ny*
MNS29
ENKT
MNS40
(0
HAfil
MNS8
м*
MNS19
Hut
MNS30
‘N'
MNS41
MNS9
VW
MNS20
Yil
MNS31
Or
MNS42
ENAVj
MNS10
Миг
MNS21
Mv
MNS32
DANE
MNS43
fpjwj
MNS11
М
MNS22 ]
Far
MNS33
TSEN
—:
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОШНСФУЗИИ 919
трансфузионной медицины наиболее важными считаются антигены М. N.
S> '^акгер (R. Sanger) и соавт. (1948) при тестировании около 200 образцов
обнаружили, что сочетание S+. М+ встречается в 2 раза чаще, чем S -. М*.
■К 25-15 приведены наиболее часто встречающиеся фенотипы системы
IbtNS-
н^ицэ 25-15. Частота встречаемости фенотипов MNS
■ Частота фенотипа, %
монголоиды
28
50
22
44
45
негроиды
25
44
—I
<0,1
Щ
Менее чем у 1% негроидов отсутствуют не только антигены S и s, но и часто
встречающийся антиген U. В этих случаях при введении U-положительных эри-
оцитов у них могут образовываться анти-11-антитела. На S- и s-эритроцитах
«которых лиц в очень небольшом количестве случаев (<01%) может экспресси¬
роваться U-антиген, но его уровень настолько низок, что для детекции антигена
требуются методы адсорбции/элюации.
Генетические и биохимические особенности антигенов системы MNS
Экспрессия антигенов системы MNS кодируется генами, расположенными
на хромосоме 4. Антигены М и N локализуются на гликофорине A (GPA), коди¬
руются геном GPAA, антигены S, s и U — на гликофорине В и кодируются геном
GPAB. В силу неравновесного сцепления, характерного для M, Nn S, s генов, гораз¬
до чаще образуется пара аллелей N и s, чем N и S.
Трансмембранные гликопротеины GPA и GPB, на которых локализуются
антигены системы MNS, однократно пересекают мембрану эритроцитов. Карбо¬
ксильный конец каждого из гликофоринов проникает в цитоплазму эритроцитов,
а гидрофобный участок заключен в липидный слой.
На поверхности эритроцита присутствует приблизительно 500 000 молекул GPA,
на которых локализуются антигены М и N. Молекулярная масса GPA составляет
около 31 кДа, молекула состоит из 131 аминокислоты. Детерминанты антигенов
находятся на внеклеточном участке GPA, который состоит из 72 аминокислот.
Локализация на GPA антигена M (GPAM) характеризуется тем, что первый амино¬
кислотный остаток — серии, а пятый — глицин. При локализации антигена N (GPAN)
серии и глицин в соответствующих позициях заменяют лейцин и глутаминовую
кислоту. Эритроциты, на которых отсутствуют большинство или все молекулы GPA,
обозначаются Еп (а-). Индивидумы с фенотипом Еп (а-) способны вырабатывать
анти-Ena'-антитела, направленные к различным частям внеклеточного участка GPA.
Гликофорин GPB, на котором локализуются антигены S, s и U. В. представлен
меньшим количеством молекул на поверхности эритроцитов - около 100 000.
СРВ содержит на аминокислотном участке фрагмент из 26 аминокислот, иден¬
тичных фрагменту GPAN. Этим объясняется присутствие антигена, обозначае-
мого как N-антиген, на всех эритроцитах нормальных MNS-типов. Эритроциты,
на которых отсутствуют GPB, лишены не только антигенов S, s и U, но и N.
Антитела против антигенов системы MNS
Естественные анти-М-антитела обычно относятся к классу иммуноглобулинов
&М. Но у лиц, которым ранее переливали эритроцитсодержащие среды, обнару-
170 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
живаются антитела, относящиеся к иммуноглобулинам как класса lou
М. Смит (М. Smith) и М. Бек (М. Beck) (1979) обнаружили, что у 79% Т9К^И
тела класса IgG агглютинируют М+-эритроциты в солевой среде °кЛ10дей ан-щ’
анти-М-антитела - холодовые, но иногда могут быть активны при 37 •рПравило,
руют в антиглобулиновом тесте (АГТ), в этом случае антитела несут кл ^
значение. Гемолитическая болезнь новорожденных, обусловленная эп!НИЧеское
телами, встречается редко, но протекает тяжело. Ми анти-
Естественные aHTH-N-антитела встречаются значительно реже, чем
Почти все анти-М-антитела относятся к иммуноглобулинам класса 1еМЗНТИ ^'
тивны при температуре выше 25 °С. Некоторые клинически значимые а
антитела, относящиеся к иммуноглобулинам класса IgG, встречаются v
с редким фенотипом M+N-S-s-U-, поскольку, как было сказано выше v і
»т а ’ У “ИХ QTCVT* I
ствует N-антиген. и образующиеся антитела реагируют со всеми эритроцит,
независимо от присутствия N-антигена.
Антитела к антигенам S, s и U обычно вырабатываются после антигенной сги
муляции, клинически значимые реагируют в АГТ. Анти-Б-антитела относятся
к классу иммуноглобулинов IgM или IgG, а анти-U обычно относятся к классу
иммуноглобулинов IgG, выявляются в АГТ, связывают комплемент, могут быть
причиной ГБН.
Система Р (003)
Подобно антигенам системы MN, таковые системы Р открыли в 1927 г. Ланштейнер
и Левин при иммунизации животных эритроцитами человека. По международной
классификации этот антиген вошел в систему эритроцитных антигенов Р, которая
содержит только один антиген. Позже его стали обозначать как Рг Другие антигены,
которые серологически схожи с антигеном Рг но не контролируются теми же гена¬
ми, что и антиген Р., — это антигены P, Pk, LKE, которые объединены в коллекцию
антигенов GLOBO (209) и также в систему антигенов GLOB.
Антиген Pj присутствует на эритроцитах почти у 80% представителей кавка-
зоидов и 96% негроидов. Антиген по химической структуре относится к сфинго-
липидам, связан с эпителием почек и играет важную роль в патогенезе некоторых
случаев пиелонефрита.
Эритроциты, не несущие Pj-антиген, но на которых присутствует Р-антиген, I
обозначают как Р2-фенотип. Частота фенотипов группы крови Р приведена I
в табл. 25-16.
Таблица 25-16. Встречаемость фенотипов группы крови Р
Фенотип
Встречаемость, %
монголоиды
негроиды
1
79
94
1
21
6
р
0,1
-
в
—
-
1 і
-
“
Эритроциты фенотипов Г,1 и Р2к способны агглютинироваться бактерией
Streptococcus suis, вызывающей менингит.
Антитела против антигенов системы Р
Индивидуумы, на эритроцитах которых присутствует антиген Рк, вьірабагьі
вают анти-Р-антитела, которые взаимодействуют при тестировании с эритр^
теми Р,+Р+ (фенотип Р() и эритроцитами Р -Р+ (фенотип Р2). Анти-Р^антите^
как правило, относят к классу иммуноглобулинов IgM, выявляются в соле
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 971
в реакции агглютинации. Аутореактивные антитела анти-Р (антитела Дона-
^дзндштейнера) у людей с пароксизмальной ночной гемоглобинурией всегда
^ставлены иммуноглобулинами класса IgG. В механизм возникновения гемо-
после кратковременного охлаждения вовлечена также система комплемента,
iJeMibi В-, Т-лимфоцитов, NK и макрофагов.
^ очень редко встречаются индивиды, эритроциты которых лишены всех трех
„«ненов: Р,, Р и Рк. Такие эритроциты относят к Р-фенотипу. В их сыворотках
„пясутствуют гемолизины, антитела, относящиеся к классу иммуноглобулинов
івМ Эти антитела, ранее называвшиеся анти-Tj (Джей)-антителами, обладают
Способностью гемолизировать эритроциты с фенотипом как Р,, так и Р,. Они же
еряде случаев могут стать причиной ГБН.
Система резус (004)
Открытие антигенов системы резус относится к 1939 г., когда Левин и Стетсон
й3учали причины возникновения гемолитических реакций у женщин, разродив-
Ухся мертвым плодом, при трансфузиях им крови их мужей. Сыворотка у 80%
«иод женщин агглютинировала перелитые им эритроциты, полностью идентичные
0 известным к тому времени системам АВО, MN и Р. Левин и Стетсон предположи¬
ли что матери были иммунизированы каким-то еще неизвестным фактором, нахо¬
дящимся на эритроцитах плода, послужившим причиной образования антител.
В1940 г. Ландштейнер и Винер (Wiener) при введении кроликам (позднее - мор¬
ским свинкам) эритроцитов обезьян макака-резус вызывали выработку антител,
которые были названы анти-Йі-антителами. Эти антитела агглютинировали эри¬
троциты обезьян макака-резус, а также эритроциты 85% обследованных жителей
Ныо-Йорка, относящихся к европеоидам. Исходя из результатов своих исследова¬
ний, авторы заключили, что эритроциты этих людей содержат неизвестный ранее
антиген, названный ими Rh-фактор (D-фактор). В том же году Винер и Петерс
(Peters) установили, что антитела, которые образуются при иммунизации кроли¬
ков или морских свинок эритроцитами макак-резус (анти-резус-антитела), близки
по специфичности антителам, которые выявляются в сыворотке матерей при ослож¬
нениях, обусловленных переливаниями крови, идентичной по другим антигенам
эритроцитов. Полученные впоследствии данные показали, что антигены, выявляе¬
мые анти-КЛ-антителами животных и анти-Б-антителами человека, неидентичны.
Эритроциты всех людей принято разделять по наличию в фенотипе антигена D
на резус-положительные D (+) и резус-отрицательные D (-).
К середине 40-х гг. XX столетия к системе антигенов резус стали относить еще 4
антигена: С, Е, с, е. Последующие исследования показали, что к системе эритро-
цитарных антигенов резус относятся свыше 50 антигенов, для многих из которых
характерны как качественные, так и количественные различия.
Однако только 5 основных антигенных детерминант (D, С, с, Е, е) и соответ¬
ствующие им антитела считаются клинически значимыми, и с ними связаны более
99% всех случаев осложнений, обусловленных системой резус.
Генетические и биохимические особенности антигенов системы резус
Система антигенов — полиморфная система. Предположения о механизме.
1 помощью которого осуществляется генетический контроль экспрессии анти¬
чное, были достаточно противоречивы. Существуют три теории наследственной
передачи антигенов данной системы.
А. Винер в начале 50-х гг. прошлого века предположил, что антиген данной
ЦВ кодируется одним геном, который встречается в 8 аллеломорфных вари-
М1| то есть он предполагал существование одного локуса с множественными
Целями, кодирующими поверхностные молекулы, которые заключают в себе
отчисленные антигены.
Примерно в то же время Р. Фишер и Р. Рейс высказали предположение о рецн-
ых аллелях трех индивидуальных, но тесно сцепленных локусов.
972 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
В настоящее время достоверной считается гипотеза, предложенная в ад
ПрОШЛОГО столетия П. Типертом, О наличии двух тесно сцепленных CTDvvJL1
генов, расположенных на одной хромосоме, которые кодируют образован^*
генов системы резус. е анти-
Первый ген включает два аллеля: D, получившего название RHD, котопьй
деляет трансмембранный белок, т.е. D-положительные эритроциты. У п. °П^‘
тельных лиц в этой области генетический материал отсутствует. Отсутствие0^113
аллели объясняется невозможностью обнаружения d-антигена. ПаРиой
Второй ген RHCE представлен четырьмя аллелями: RHCe, RHCE, RHcE rh
которые детерминируют образование антигенов С, с, Е, е.. ’ Нсе-.
Антигены системы резус представляют собой полипептиды, состоящие из 4
іинокислот, которые пересекают мембрану эритроцитов и на ее внешней
роне образуют короткие петли. В пределах мембраны эритроцитов полипептвд
образуют комплексы с частично гомологичными им гликопротеинами, котоп
кодируются генами, находящимися на хромосоме 6. ’ 1 1е
D-антиген несет 36 аминокислотных остатков, которые распознаются какчуж
родные в организме резус-отрицательных лиц.
С- и с-антигены отличаются друг от друга 4 аминокислотными остатками в 16
60, 68 и 103-м положениях, а Е и е характеризуются единственным отличием
в 206-м положении.
Очень редко встречаются особи, эритроциты которых не содержат ни одного
из антигенов системы резус. Изучение таких эритроцитов, названных Rh , при¬
вело к заключению, что белки антигенов системы резус — часть мембранного
комплекса, и их присутствие необходимо для полной экспрессии гликопротеинов
несущих антигены Lw, Duffy и U.
На Щ|-эритроцитах отсутствуют антигены Lw, Duffy и U, а также S и I лока¬
лизующиеся вместе с антигеном U на гликофорине В. Считается, что лица с таким
фенотипом имеют ген Хгв в гомозиготной форме, который подавляет выработку
всех антигенов системы резус. Не проявляя фенотипически резус-антигенов, лица
с фенотипом Rhnu)1 могут передавать их по наследству.
Наследование антигенов системы резус
Фенотип антигенов определяется при выявлении антигенов системы резус путем
тестирования эритроцитов с антисыворотками соответствующей направленности.
Генотип индивида при этом состоит из двух гаплотипов, т.е. комплекса генов. I
Один из двух гаплотипов, кодирующих образование антигенов системы резус, I
передается от отца, другой — от матери. Каждый гаплотип состоит из трех антиген¬
ных детерминант: С или с, Е или e, D или его отсутствие. Примеры наследования
Rh-антигенов приведены в табл. 25-17.
Таблица 25-17. Примеры наследования Rh-антигенов
Отец
Мать
I Дети
CDe/CDe
CDe/CDe
CDe/CDe
CDe/CDe
I CDe/CDe
I COe/CDe
COe/CDe
cde/cde
COe/cde
COe/cde
COe/cde
COe/cde
COe/ccfe
CDe/cde
CDe/CDe
CDe/cde
COe/cde
cde/cde J
У родителей, имеющих одинаковый генотип, все дети будут гомозиготы. У рол*'
телей, из которых один имеет генотип CDe/CDe, а другой cde/cde, все дети будут
гетерозиготы. В случаях когда родители гетерозиготны, двое из четырех будут
гомозиготы и двое — гетерозиготы, один будет резус-отрицательным, а трое
резус-положительными.
Обычно устанавливается фенотип эритроцитов, а на основании семейно
исследования определяется генотип. Более точно генотип можно установ
на основании анализа генов, при использования методов ДНК-типирования-
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГШОТРАНСФШЙ 973
„яен*
яатура антигенов системы резус
несколько номенклатур антигенов системы резус: Фишера-Рейса.
СуЙ^енфельда и номенклатура ISBT.
ГО-5 ' мМ,плиоиикШИ ГЧИТДИУГГ
^более распространенными считаются номенклатуры по Фишеру-Рейсу
„ |цНеРУ'сифИкации Фишера-Рейса антигены резус обозначаются прописными
П°101 р || Е, антитетичные — строчными: сие. буквой d обозначают отсут-
Н резус. Антигены по классификации Розенфельда пронумерованы в порад
'Ш открытия или причисления к системе резус. При большом числе антигенов.
СИ'
—
ст***е обозначал антигены резус буквами RhO, rh\ rh", а антитетичные им бук*
SrO.hr'и hr”.
•&** ссИфикация Розенфельда характеризует серологические различия антигенов
i
Уединённых в систему, данная классификация наиболее удобна по сравнению
буквенными обозначениями в номенклатурах Фишера-Рейса и Винера. В связи
С чтим именно классификация Розенфельда была положена в основу номенклату¬
ры, принятой ISBT (табл. 25-18).
доца 25-18. Антигены системы резус
*74
ЯМНСФУЭМОННАЯ ИММУНОЛОГИЯ
err
Иммиіпум_
Ф«шер*Ре»сз
ЯНЭб
ІЯН37
IRH3S
ІЯН40
|»5Г
RK42
RH43
Винера
Ссе.
Окончу
нщ
Особенности
ассоциирован с с, а
ассоциирован с О
RH44
IRH45
ЯЖ7
№48
RH49
ЯН50
Реагирует с анти-С АТ
ассоциирован с D
Подобен Се-АГ
Ассоциирован с hr'
, присутствует на D
РВА.ассоциирован с О
, отсутствует при 0-, Rh
, ассоциирован с D
*, ассоциирован с Осе
ассоциирован с hr4-, hr-
RH51
, ассоциирован с С" и С*
I Часто встречающиеся антигены.
I Редко встречающиеся антигены.
Распределение фенотипов системы резус у доноров г. Москвы приведено
в табл. 25-19.
Таблица 25-19. Распределение фенотипов системы резус у доноров
Фенотип
Распространенность, %
мужчины (/1=6717)
женщины (/?=1158)
всего (л=7875)
СсОе
31,22
23,06
30,02
CDs
21,60
5,44
19,23
СсОЕе
14,04
26,77
15,91
сОЕв
12,43
8,98
11,92
сОЕ
1,85
3,80
2,13
сОв
1,01
2,59
1,24
С"0в
0,85
1,99
1,02
СОЕв
0,46
0,60
0,48
№1
0,37
0,60
0,41
СОЕ
0,22
0,35
0,24 I
всего Rh-положитвльных
83,04
74,18
82,60 1
СВ
12,12
22,54
13,бГП
Сев
1,99
0,78
IS3
сЕв
0,52
1,64
_____ML-J
СсЕв
0,73
0,26
і
0,48
0,42
0,47
СсЕ
0,10
0.17
0,11
Всего Неотрицательных
15,94
25,82
17,40
В целом распределение большинства фенотипов среди обследованных ДО
г. Москвы соответствует таковому у европеоидов. Обращает внимание дм
более низкая частота фенотипа CDe у женщин (5,5%) по сравнению
нами (21,6%) и более высокая частота фенотипа CcDBe - 26,77 ПР°™ВН
11 женщин достоверно чаще встречается фенотип CwDe ( .
иммунопогичваая безопасность гемотрлкжгзий §71
__ггсгаенно). Среди женщин также отмечено повышение частоты встреча»?
Sr* и С-отрицательных женщин во сравнению с мужчинами (22,54; 12,12%
1955; 27,93% соответственно). Такое неравномерное распределение анти-
р и С считается одним из факторов, способствующих более частой резус*
^сибилизации женщин.
Частота встречаемости фенотипов системы резус неодинакова среди различных
подов. Среди европейского населения резус-отрн на тельные лица свставляют
к-І7%* а среди монголоидов — около 1%.
Частота встречаемости антигенов резус среди европеоидов приведена
, табл. 25-20.
Тайм* 25-20- Встречаемость антигенов резус среди европейцев
Основные варианты
антигеноа
Частота астречаемостн, %
Редаа (стагяинннаса еармнты
■ткенаа
■ b
85
СО УбУбсбу
■—■ с
70
te—Е
30
Ґ С
80
Е
98
С*
1
Р*и D"
2,5
Встречающиеся варианты антигенов С, Е, с, е, которые обозначают символами
С, Е , Е . cw, ех, имеют неизмеримо меньшее клиническое значение.
Характеристика антигенов системы резус
Антигены системы резус, имеющие наибольшее клиническое значение. - D. С.
Е. с, е.
Лиц (потенциальных реципиентов), несущих на эритроцитах антиген 0, причис¬
ляют к резус-положительным, не имеющих антигена D - к резус-отрицательным.
При оценке резус-принадлежности доноров к резус-положительным причис¬
ляют всех лиц, эритроциты которых несут одну из разновидностей антигена: D,
С или Е. Соответственно резус-отрицательными считают доноров, эритроциты
которых не содержат ни одного из данных антигенов.
Такая оценка резус-принадлежности позволяет избежать возможности сенси¬
билизации реципиента к любому из этих антигенов, обладающих высокой имму-
ногенной активностью.
Количество антигенных детерминант на одном эритроците колеблется в боль¬
ших пределах (табл. 25-21) и зависит от генотипа. У гомозигот количество анти¬
генных детерминант больше, чем у гетерозигот.
Таблица 25-21. Количество антигенных детерминант эритроцитов
Генотип
■СОе/сОЕ
[CDVCDe
23—31
14-19
Количество антигенных детерминант (тыс на 1 цштроцит)
Е | ё Т »
Нет данных I 37-53 I 15-14
25-40
46-56
11-24
97S ТИАНОФУЗИОННАЯ ИММУНОЛОГИЯ
По количеству антигенных детерминант антигены резус располагают*
дующей последовательности: с >С >D > Е>е. Если же сравнить со шкалой*1 k ^
1Стано!
гённости трансфузионно-опасных антигенов резус (D >Е >с >е >С), то
очевидным, что нет прямой зависимости между иммуногенностью я»
и количеством его антигенных детерминант. По-видимому, степень имиГИГ?н°>
долм того или иного антигена зависит от его качественного состава, н 0г*н-
нельзя полностью исключить и зависимость степени иммуногенности от*ВСе *е
ства антигена. к°лич*-
Варианты антигена О
D - слабый антиген. В 1946 г. Статтон описал вариант антигена D
гирующий с сывороткой анти-D, и назвал его DU. Эритроциты DU не
слабореа.
в реакции солевой агглютинации с полными IgM антителами анти-D, нГвеа^
ют в коллоидной среде и непрямом АГТ. №•
Было также отмечено, что фенотипы D и DU отличаются еще и тем, что в 9я»
случаев при фенотипе U на эритроцитах присутствует сильно выраженный анти
ген С.
Позже выяснилось, что различия между D и DU носят количественный хаоак-
тер. В среднем количество антигенных детерминант на эритроцитах со слабым
D-антигеном снижено на 5-10% по сравнению с нормальным вариантом анти¬
гена. В настоящее время обозначение DU заменено общим понятием «слабый
D-антиген» — DW (D Weak).
Нормальный вариант антигена D содержит до 36 эпитопов. Количество эпито¬
пов у слабого D-антигена может быть снижено в 3-10 раз, что затрудняет выяв¬
ление этого антигена и приводит к ошибочному заключению об отрицательной
резус-принадлежности индивида:
При введении эритроцитов со слабым D-антигеном резус-отрицательным реци¬
пиентам возможно образование у них анти-О-антител, и у реципиентов со слабым
D-антигеном после введения им донорских эритроцитов с нормальным антигеном
D также могут вырабатываться анти-О-антитела. В связи с сообщениями, свидетель¬
ствующими об иммуногенности слабого D-антигена, было принято следующее пра¬
вило: лица, имеющие слабый D-антиген, считаются резус-положительными, если
они доноры, но их причисляют к резус-отрицательным, если они реципиенты.
D - парциальный антиген. В 1960 г. Симонс (Simmons) и Кригер (Krieger)
сообщили о выявлении анти-О-антител у резус-положительной беременной,
В дальнейшем также появлялись публикации об исследованиях, показавших воз¬
можность образования анти-О-антител у D-положительных лиц. Авторы от
исследований пришли к заключению, что D-антиген мозаичен и его множествен¬
ные эпитопы, представленные на эритроцитах, могут выступать в качестве само¬
стоятельных иммуногенов.
Образцы эритроцитов, у которых отсутствуют некоторые эпитопы антигена D,
обозначают термином «парциальный» (D partial) — Dp. Парциальный D-антиген
отличается от нормального варианта антигена неполным комплектом эпитопов
и способностью вырабатывать антитела к отсутствующим у них компонентам,
иными словами, Dp имеет качественные отличия от нормального антигена D.
Типерт (Tippert) и Сангер (Sanger) разработали классификацию D-антигенов
по категориям на основании исследования сывороток анти-D, выделенных от л®
с парциальным D-антигеном. Авторы выделили 6 категорий антигенов (от ■
к которой отнесли нормальный D-антиген, до VI), отличающихся неодинаковым
перекрестным реагированием.
Эритроциты, содержащие антигены разных категорий, различаются по рШ
реагирования со стандартными анти-О-сыворотками, полученными приимму
зации D-отрицательных доноров.
Обновленную версию своей классификации Типерт и Сангер опу^лиШ^
і 1977 г. Она включает 5 категорий парциальных антигенов (исключена I вщ
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 977
_орой ранее относили нормальный D-антиген). Категории III. IV и V нодразде-
ынасу6категории’ обозначаемые строчными буквами - Illa, lllb, IVb и т.д.
j, васгоящему времени в литературе описано около 20 типов парциальных анти-
0в, чаще встречаются варианты Dll, Dili, DHIa, содержащие наибольшее коли-
эпитопов D-антигена. Меньшее количество эпитопов содержат варианты
<>DVa.DVI.DBT,DFR.DAR.
распространенность фенотипов системы резус неодинакова среди различных
оодов. Среди европейского населения резус-отрицательные лица составляют
?е% а среди монголоидов — около 1%; VI колеблется от 0,01% среди монголои¬
де 1,7% среди негроидов. Распространенность других вариантов парциальных
Вигенов еще ниже (табл. 25-22).
Таблица 25-22. Распространенность парциальных антигенов
—1 Антигены
Распространенность, %
—’ DIVb
0,6
DVa
0.6
—' DVI
1.7
і Dllla
1.0
Шр DAR
1,7
DVII
03
В ответ на введение парциальных D-антигенов у резус-отрицательных реци¬
пиентов вырабатываются анти-О-антитела, как и при трансфузии нормального
D-антигена.
Анти-О-антитела у лиц с парциальным D-антигеном способны вызывать тяже¬
лые посттрансфузионные осложнения, вплоть до смертельного исхода.
В связи с этим кровь донора, имеющая парциальный D-антиген, считается
резус-положительной, кровь реципиента - резус-отрицательной.
Антиген G
G-антиген был открыт в 1958 г., когда Аллен (Allen) и Типерт описали эритро¬
циты, которые взаимодействовали с сыворотками анти-CD, но не реагировали
сизолированными сыворотками анти-D и анти-С.
В настоящее время установлено, что гены, кодирующие антигены С и D. одно¬
временно кодируют образование G-антигена. Именно поэтому почти все эритро¬
циты, несущие антигены С и D, содержат и антиген G; эритроциты, не имеющие
антигенов С и D, не имеют и антигена G.
Иммуногенность антигена G достаточно выражена, примерно 30% сывороток
анти-D и 100% анти-CD содержат и анти-С-антитела.
Присутствием антигена G на эритроцитах, несущих антигены D и/или С, объясня¬
ется, почему у С-отрицательных женщин появляются анти-С-антитела в тех случаях,
когда у мужа и плода отсутствует антиген С на эритроцитах. Таким же образом можно
объяснить, почему при иммунизации D-i-эритроцитами сыворотки С-отрицательных
индивидуумов взаимодействуют с С+-эритроцитами. Это происходит в связи с тем,
иго одновременно с анти-D- вырабатываются анти-С-антитела. которые реагируют
с антигеном G, присутствующем на тест-эритроцитах одновременно с антигеном С.
При выявлении анти-О-антител у резус-положительных интивидуумов с частич¬
ным вариантом антигена D для подтверждения специфичности необходимо дока-
Зать> что реакция не обусловлена анти-С-антителами. Для исключения присут-
|§| анти-О-антител используют редкий тип эритроцитов D-C-G+.
Цнанты антигена С и с
Антиген С открыл Винер в 1941 г. вторым после антигена D системы резус.
Существует слабый вариант антигена С — О-антиген, который не имеет каче-
нных отличий от антигена С.
H обнаружили Calender и Race при исследовании женской сь»
содержащей антитела. которые реагировали с С-положительными эритр0^?°Тк,).
Поскольку эритроциты женщины были гомозиготны по антигену с Ми
характеризовались фенотипом СС, и антитела в ее сыворотке реагин
с С*-эритроцитами, авторы предположили, что это антитела не анти-с, я ^
ю другой специфичности, но имеющие отношение к антигену С. ’ как°й-
Антиген С* чаще встречается у лиц с антигеном С в гомо- или гетерозиг
форме. Частота антигена Су европеоидов составляет около 6%.
Оантиген обнаружили Стратон (Stratton) и Рентон (Renton) в 1954 г ^
антиген встречается с частотой около 0,3%, т.е. гораздо реже, чем антиген с*
c-Антиген открыли Левин и соавт. в 1941 г. Они выявили тесную ассощя
антигенов С и с. Именно открытие с-антигена позволило Фишеру сформулироГ*0
генетическую теорию существования трех индивидуальных, тесно сцеплен
генов, кодирующих образование антигенов резус.
с*Парциальный (с^) антиген выявили и описали в 1964 г. Huestis, Catino и Bush
Они обнаружили анти-с-антитела, которые реагировали не со всеми образцами
с-положительных эритроцитов.
Варианты антигенов Е и е
Антиген Е открыли в 1943 г. Винер и соавт. К вариантам антигена Е относится
слабый вариант Цр который отличается от нормального антигена Е только коли¬
чеством антигенных детерминант. Предполагают, что уменьшение антигенных
детерминант на е-слабом антигене — результат супрессии гена Е.
Антиген е открыл в 1945 г. Морант. Частота этого антигена у европеоидов
достигает 98%.
Встречаются различные варианты антигенов е, относящиеся как к е-слабому,
так и е-парциальным антигенам. Частота встречаемости различных вариантов
антигена е менее 1%.
Различные варианты антигена е [hrs, hrB, STEM, V (ces), VS (es)] чаще встреча¬
ются у негроидов, чем у европеоидов и монголоидов.
Антитела против антигенов системы резус
Антитела против антигенов резус, в отличие от групповых антител, в основ¬
ном иммунные, появляющиеся в результате изосенсибилизации, специфичность
которых определяется антигенами, послужившими причиной их образования.
Различают полные и неполные антитела. Полные резус-антитела бивалентные,
относятся к классу IgM, проявляют агглютинирующие свойства как в солевой, так
и коллоидной среде. Неполные антитела характеризуются большой молекулярной
массой, не проникают через плаценту, встречаются реже, поэтому имеют меньшее
значение при гемотрансфузиях, чем неполные антитела. Полные антитела, монова¬
лентные, относятся к иммуноглобулинам класса IgG; в солевой среде фиксируются
на поверхности эритроцитов, не вызывая их агглютинации. Агглютинация проис¬
ходит только в присутствии протеолитических ферментов, коллоидных растворов
или после предварительной обработки специальной антиглобулиновой преципити-
рующей сывороткой. Неполные антитела обладают значительно меньшей, чем пол¬
ные, молекулярной массой, они легко проходят через непораженную плаценту.
При сенсибилизации к антигенам сначала образуются полные антитела, которые
затем трансформируются в неполные. IgG-антитела к антигенам эритроцитов систе¬
мы резус относятся преимущественно к субклассу IgGl и IgG3 и наиболее часто
становятся причиной посттрансфузионных осложнений и гемолитической болезни
новорожденных, У некоторых лиц частично выявляются субклассы IgG2 и IgG4.
При переливании резус-положительных эритроцитов лицам с противорезусны-
ми антителами возникают посттрансфузионные реакции гемолитического типа.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГШОТРАНСОУЗИЙ g7f
cojtee 90% осложнении связано с резус-несовместимостью донора и реципиент»
антигену D- Частота встречаемости аллоиммунных резус-антител различной
|*° цифичности среди московской популяции доноров приводится в табл. 25-23.
—«з 25-23. Частота встречаемости антирезусньк антител среди доноров г Москвы
Специфичность антител
Частота встрвчаемсоти, %
Анти-D
60.3 1
Анти-DC
т и
Анти-Е
3,5
Анти-DE
гг
Анти-С"
’И
Анти-с
2,8
Анти-С
0,6
Анти-е
0,4
Среди антигенов системы резус трансфузионно опасным считается также антиген с.
при исследовании сывороток лиц, содержащих антиэритроцитные антитела, частота
щда-с-антител составила около 3%. Эти результаты свидетельствуют о выраженных
антигенных свойствах данного антигена. Частота встречаемости антигена с - 80 - 82%.
Эритроциты 18-20% людей не содержат этот антиген и считаются гомозиготами
по аллельному гену С (CQ. Именно эти лица составляют группу повышенного риска
аллоиммунизации и возникновения посттрансфузионных осложнений, поскольку им
в 80% случаев переливают эритроциты, содержащие антиген с.
Моноспецифические анти-С-антитела, по данным различных авторов, встре¬
чаются редко, примерно в 0,6% случаев выявления антиэритроцитарных антител,
что свидетельствует о низкой иммуногенности этого антигена. С более высокой
частотой (около 1%) встречаются анти-О-антитела.
В ряде случаев антирезусные антитела вырабатываются у лиц. не имеющих
в анамнезе гемотрансфузий или беременностей. Естественные антитела характери¬
зуются в основном специфичностью к анти-Е или анти-С, принадлежат к иммуно¬
глобулинам класса IgM и частично IgG.
Система Лютеран (005)
Первый антиген системы Лютеран обнаружили в 1945 г. Фенотипы опреде¬
ляются с помощью антител -анти-Lu (а) и анти-Lu (Ь). Частота встречаемости
фенотипов у европеоидов приведена в табл. 25-24.
Таблица 25-24. Частота встречаемости фенотипов системы Лютеран у европеоидов
Фенотип
Частота встречаемости, %
LU (а+Ь-)
0,15
LU (а+Ь+)
7.5
LU (а-Ь+)
92,35
1 LU (а-Ь-)
<0,1
В большинстве случаев на эритроцитах европеоидов присутствует антиген Lu
(о) - второй открытый в этой системе антигенов. Позже были открыты часто
сличающиеся антигены, которые также были отнесены к этой системе. В настоя-
время к системе Лютеран относят 19 антигенов (табл. 25-25).
Таблица 25-25. Антигены системы Лютеран
N» антигена
Символ антигена
ISBT N: антигена
Симам антигені
Ш LU1
Le1
LU12
Much
LU2
Le*
0113
Hughec
ggQ ТРЙНСФУЗИОННАЯ ИММУНОЛОГИЯ
1
Ген, кодирующий гликопротеины Lu-антигенов, локализован на хромосомен
В 1951 г. было показано, что локусы Lu и Se (секретор) сцеплены между собой Э
стало первым примером сцепленных аутосомных генов у человека.
Антигены системы Лютеран локализованы на двух гликопротеинах, несущи
N- и О-связанные полисахариды. Количество молекул антигена Lu (b),'приходя¬
щегося на один эритроцит, составляет при фенотипе Lu (a+b+) 600-1600 молекул
і на эритроцитах Lu (a-b+) — 1400-3800 молекул.
Антитела против антигенов системы Лютеран
Антитела анти-Lua и Lub встречаются сравнительно редко и без антигенной
стимуляции. Они вырабатываются также в ответ на трансфузию эритроцитов
и при беременности. Анти-Lu (а) не считаются причиной посттрансфузионньц
реакций и развития ГБН. Анти-Lu (Ь) у реципиента могут сокращать срок жизни
перелитых эритроцитов, однако не вызывают посттрансфузионных реакций
или реакция протекает в легкой форме. Анти-Lu (а) и анти-Lu (Ь) агглютинируют
эритроциты, несущие соответствующие антигены в солевом растворе с образова¬
нием мелких неплотных агглютинатов.
Система Келл (006)
Первый антиген системы Келл — К1 — был открыт в 1946 г. при исследовании
причины гемолитической болезни новороженного. Антиген К1 встречается почти
у около 10% кавказоидов и около 2% негроидов. Антиген k (К2) - второй по оче¬
редности открытый антиген этой системы, встречается почти у 90% европеоидов.
Среди других антигенов можно выделить Кр (а) (КЗ), Кр (Ъ) (К4) ,Js.a. (K6),Js(b)(K7).
В настоящее время по международной классификации в системе Келл насчитыва¬
ется 27 антигенов (табл. 25-26).
Таблица 25-26. Антигены эритроцитов системы Келл
r
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИИ ОД
большее значение для трансфузиологии имеет антиген К (К1), который
бается примерно у 10% людей, в гомозиготном состоянии - у 0,3%. Частота
мости основных фенотипов системы Келл приведена ниже (табл. 25-27).
* м 25-27- Частота встречаемости антигенов Келл в среднеевропейской популяции
#1
Частота встречаемости, %
монголоиды
0.2
9
91
<0,1
98
<0,01
100
негроиды
<0,1
100
<0,001
Н
генетические и биохимические особенности антигенов системы Келл
Ген К, кодирующий образование К-антигена, расположен на хромосоме 7-1.
Аллельный ген кодирует образование k-антигена. Антигены Кра (КЗ), Kph(K4), Jr
(Кб), Jsb (К7) наследуются как сцепленные признаки. Не все теоретически возмож¬
ные комбинации генотипов встречаются в системе Келл. Например, Kp'Hjs* никогда
не находятся рядом на одной хромосоме. Гаплотип, который содержал одновремен¬
но К и Кра, также не наблюдался. Крайне редко встречается фенотип КпцГ
С системой Келл связан также антиген Кх, который кодируется геном, сце¬
пленным с полом и находящимся на коротком плече Х-хромосомы. Эритроциты,
на которых отсутствует антиген Кх, характеризуются значительным снижением экс¬
прессии антигенов системы Келл, что заставляет предполагать, что Кх-антиген -
это предшественник антигенов системы Келл. Эритроциты, на которых отсутствует
антиген Кх, характеризуются также более коротким сроком жизни, уменьшением
проницаемости мембраны для воды и морфологическими изменениями. Фенотип
клеток, характеризующихся такими отклонениями от нормальных показателей,
получил название фенотипа McLeod по имени пациента, у которого впервые были
обнаружены подобные эритроциты. Лица, у которых обнаруживают эритроциты
McLeod, страдают нарушением нейромышечной системы, которое проявляется
повышением уровня креатинфосфокиназы в сыворотке и мышечной дистрофией.
Антигены системы Келл по химической природе считаются гликопротеинами,
молекулы которых один раз пронизывают мембрану эритроцитов. Эти молекулы
содержат дисульфидные связи, которые способствуют образованию простран¬
ственной структуры белков. Дисульфидные связи легко разрушаются под действи¬
ем сульфгидрильных реагентов.
Антитела против антигенов системы Келл
Антиген К обладает выраженными иммуногенными свойствами. Сенсибилиза¬
ция к антигену К может стать причиной гемолитического трансфузионного
^ожнения или гемолитической болезни новорожденных, а также аутоиммунной
Политической анемии.
“ большинстве своем анти-К-антитела считаются иммунными, относятся
иммуноглобулинам класса IgG и реагируют в антиглобулиновом тесте. Иногда
^'К-антитела реагируют как солевые агглютинины в сыворотке люден, кото-
ll?1 не переливали эритроцитсодержащие среды. В этих случаях они относятся
m
ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
к классу иммуноглобулинов IgM. Появление ИХ В крови связывают
распространением микроорганизмов, клеточные мембраны котогГ » 1йиРоки
структуры, сходные по строению с антигеном К человека. ?ЬІ* с°Дер*м
Я ко всем антигенам эритроцитов системы Келл могут ста
■осттрансфузионного внесосудистого гемолиза и/или ГБН. Ahth-k** ПричичЭД
I вызывают наиболее тяжелые формы ГБН с внутриутробн ” анти‘к
н мертворождением. ГБН, обусловленная анти-К-антителами, вызыв°И СМертьК)
оно кроветворения, которая приводит к анемии плода. Частота встт
ГБН, обусловленной анти-К, регистрируется в соотношении 1:20 ОООдо
Система Левис (007)
В отличие от большинства иммуногенетических маркеров, система Л
представлена рядом плазменных факторов, адсорбированных на ЄВИС
н
из плазмы. Антигены системы Левис обнаруживаются в плазме, слюне сод50
на лейкоцитах и др. РЖатсч
Первый антиген системы Левис [Le (а)] открыл Mourant в 1946 г. Система л
объединяет 6 антигенов (табл. 25-28). евис
Таблица 25-28. Антигены системы Левис
ISBT
Символ антигена
LE1
Le (а)
LE2
Le (b) —
LE3
Le (ab)
—!
LE4
ALe (a)
LE5
ALe (b)
“I-
LE6
BLe (b)
■
Присутствие антигенов на эритроцитах связано с секреторным статусом
индивидуумов, который, в свою очередь, связан с сочетанием Le~ и Se-генов.
Le (Ь)-антиген экспрессируется Le-геном на эритроцитах лиц, у которых одно¬
временно присутствует Se-ген — так называемый ген выделительства, поэтому они
считаются выделителями, или секретерами, групповых веществ А, В и Н, которые
обнаруживаются в слюне, грудном молоке, моче, сперме, желудочном соке и амни¬
отической жидкости. Le(a)-антиген экпрессируется Le-геном на эритроцитах лиц,
у которых отсутствует Se-ген, поэтому они не секретируют групповые вещества А,
В, Н в жидкости организма, т.е. не считаются выделителями (табл. 25-29).
Выделительство контролируется двумя парами аллельных генов - Se и se, рас¬
положенных на хромосоме 19 в локусе FUT2, который тесно сцеплен с локусом
FUT1.
Ген Se, ответственный за АВН-секрецию, — доминантный по отношению к к
Лица-гомозиготы по гену se — невыделители, т.е. в их секретах отсутствуют фак¬
торы А, В и Н, все выделители положительны по антигену Leb.
Таблица 25-29. Генотипы Le, Se и фенотипы у выделителей и невыделителей
Генотип
Антиген
Фенотип
Частота ветре
монголоиды
наемости, % I
негроидыJ
Шщщ
Le*
Le"
Lede или La/le
Se/Se или Se/se
+
+
Le (a-b+)
22
23 J
Lt/l» или ШІв
se/se
+
0
Le (a+H
72
$5 J
Me
Se/Se или Se/se
0
0
Le (a—b—)
6
Me
se/se
0
0
Le (a-b-)
<01
міая viiv i vmui /Ivor IV (IV иші/u/nvutM iiu — * *
жимются у взрослых и легко удаляются с поверхности при отмывании
ІІрфюііологическим раствором или при инкубации при 37 °С.
эритрочк'
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИИ М3
„тела к эритроцитам антигенов системы Леш
ijjflrreла к антигенам эритроцитов LE чаще обнаруживаются у лиц. имеющих
оТип Le (a-b—), поэтому при изосенсибилизации к факторам Le(a) и Le(b)
^ззуются, как правило, антитела двух специфичностей, относящиеся к клас-
иммуноГЛ0^Улинов К0Т0Рые в сыворотке реципиента нейтрализуются
^субстанцией донорской плазмы, поэтому редко могут быть причиной гемо-
при трансфузиях. Поскольку антигены Левис не выражены на эритроцитах
^рождении, ГБН, обусловленная несовместимостью по антигенам LE, не воз*
""данные о значении цитотоксичности анти-Левис-антител в приживаемости
реплантированной почки разноречивы. В1978 г. при ретроспективном анализе
гдаленных результатов пересадки почек у 255 реципиентов Р. Ориол (R. Oriol)
0 соавт. пришли к заключению, что 2-летняя приживаемость почек была выше
«реципиентов, имеющих фенотип Le (a-b-), чем у положительных по Le-антигену,
шоры предположили, что антигены Левис представляются в качестве гисто-
совмесгимых антигенов при трансплантации почек. Также было установлено,
что при Le-совместимости донора и реципиента приживаемость трансплантиро¬
ванной почки была выше. С. Спиталинк (S. Spitalink) и соавт., используя высоко¬
чувствительные методы, установили, что присутствие анти-Ье*-антител у реципи¬
ентов значительно уменьшает срок жизни трансплантата. Большинство нз этих
антител не обнаруживаются в реакции гемагглютинации. Тем не менее в двух
других проспективных и одном ретроспективном исследовании не было выявлено
существенных различий в приживаемости почек у идентичных и неидентичных
по Le-антигенам пар «донор-реципиент», хотя реципиенты с Le (a-b-) имели
более высокий риск при пересадке почки, без подбора по HLA.
Система Даффи (008)
Первый антиген эритроцитов системы Даффи [Fy(a)J открыли М. Катбаш
(М. Catbush) и соавт. в 1950 г. Спустя год, в 1951 г., Е. Икин (Е. Ikin) идентифици¬
ровал антиген Fy(b).
В настоящее время в системе антигенов Даффи насчитывается 6 антигенов
(табл. 25-30).
Таблица 25-30. Антигены системы Даффи
ISBT
Символ антигена
FY1
Fy*
FY2
Fy*
FY3
Fy*
FY4
Fy4
FY5
Fy5
L FY6
Fy6
• Ген Fy локализован в хромосоме 1, кодирует гликопротеин, который много¬
кратно пересекает цитоплазматическую мембрану эритроцита. Два аллель¬
ных антигена — Fy3 и Fyb — образуют три фенотипа. Среди монголоидов
гомозиготные особи по антигену Fy* встречаются в 17%, по антигену Fy* -
8 34% случаев. Гетерозиготные особи с фенотипом Fy*F)b встречаются в 48%
случаев. Фактор Fy* более иммуногенен, чем фактор Fy . Фенотип Fy (a-b-)
практически не встречается у кавказоидов и с частотой почти 70% встре¬
чается у негроидов (табл. 25-31). У малазийцев частота встречаемости FV*
антигена — 100%. Антигены Fy* и Fy8 чувствительны к действию вротеяз.
тзких как фицин и папаин. Ру3-антиген считается часто встречающимся
и присутствует на эритроцитах, имеющих Fy*- либо Ру^-антиген. Ру^-антиген
■е поражается при обработке эритроцитов ферментами.
984 ШНСФУЗЖЖНАЯ ИММУНОЛОГИЯ
Таблица 26-31. Распространенность фенотипов антигенов системы Даффи
Фенотип
Частота встречаемостіГ%
монголоиды
НвпІомдьГ~ ~
Гу(»Н>-)
: 17
*. 9* j j
1У (*♦!>+)
49
ШШШж
шшш
34
ШШ
*-• Imp ■
Антитела к эритроцитам антигенов системы Даффи
Анти-Ру-антитела, как правило, иммунные, образующиеся при сенсибилиза¬
ции к Ру*-антигену, относятся к иммуноглобулинам класса IgG, могут приводить
к гемотрансфузионным реакциям немедленного или отсроченного типа, иногда
с легальным исходом ГБН развивается редко. Анти-Руь-айтитела встречаются
редко и, как правило, еацбореакционно-способны. Эти антитела могут быть при¬
чиной слабой гйиотрансфузионной реакции; Случаев ГБН, обусловленной ими
не описано. К редко "встречающимся антителам относйтсй ат#и-ру3-антитела'
впервые выявленные в сыворотке индивидуума, фенотипа Fy (a-b“). Анти-Ff-
антитела взаимодействуют также с эритроцитами, несущими по крайней мере
один из антигенов — Fy* или тук;
Система Кидд (009)
Первый антиген системы Кидд — Jka, был открыт Ф. Алленом (F. Allen)-® соавт.
в 1951 г. Двумя годами позже, в 1953 г., G. Plaut et al. открыли аллельный анти¬
ген Jkb. Образцы эритроцитов, несущие одновременно Jka- и Jkfe-днтигены
были найдены Ф. Пинкертоном (F. Pinkerton) и соавт. в 1959 г. В настоящее §ремя
в систему антигенов Кцдд включены 3 антигена (табл. 25-32)’-VM
Таблица 25-32. Антигены системы Кидд
ISBT
Символ антигена
JK1
1 Ж
JK2
цш щ
жз
Антигены Jka и Jkb среди монголоидов встречаются одинаково часто - у /5%.
частота гомозигот составляет 25%. Частота встречаемости фенотипов среди мон¬
голоидов и негроидов приведена в табл. 25-33.
Таблица 25-33. Частота встречаемости фенотипов антигенов системы Кидд
Фенотип
Частота встоечаемости. % В
монголоиды
негроиды
Л(а+ь~)
г. ?6
51.-і ЛИЯ
Jk (іф)
50
41
Jk (аФ+)
23
■ s Нрй
(Jk(a-b-)
<0,01
Образование антигенов Кидд кодируется двумя аллельными генами -ft и ft'
расположенными на хромосоме 18.
Антитела к эритроцитам антигенов системы Кидд
Анти-Jk* и ^-антитела обычно трудно выявляются. Они относятся к
иммуноглобулинов IgG и/или IgM. IgM-антитела агглютинируют
обработанные ферментами, в тесте прямой агглютинации. Анти-IgG-aH’n^
выявляются в АГТ. Иммунные анти-Jk11 и |§р относятся к субклассам имМг
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ Щ
нов IgGl или IgG3, вызывают трансфузионные реакции немедленного
йР^оо^нного типа и затем могут не выявляться на протяжении всей после-
f/fi fi зоїзни. Гемолиз эритроцитов чаще внесосудистый. Внутрисосудистый
f№ вызывают антитела, фиксирующие комплемент.
Tjjib-антитела реагируют с Jk3- и ]кь-эритроцитами, встречаются редко
ВВЯЗ У ЛИЦ С Фенотапом Jk (a_b~)- z
(010)
теМа Диего
С пема Диего состоит из двух независимых пар основных антигенов, обозна-
Dib и Wr"’Wrb (Wri8ht)- Кроме того, к системе Диего относят 17 редко
ВИИ антигенов.
и ^-антигены среди кавказоидов встречаются очень редко, в то время
Ы и yvjb относятся к часто встречающимся антигенам (табл. 25-34).
И!
^цща 25-34. Частота встречаемости основных фенотипов антигенов системы Диего среди
монголоидов
Фенотип
Частота встречаемости, %
Di (э+Ь-)
о*
Di (a+b+)
<0,001
Di(а-Ь+)
100
Wr (а+Ь-)
Wr (a+b+)
Wr (а-Ь+)
• Частота антигена Di* среди монголоидов, включая коренное население Америки, достигает
36%.
Антигены Di\ Dib и Wr3, Wrb локализуются на переносчике антионов (АЕ-1),
кодируемом геном, расположенном на хромосоме 17. Для европеоидов антиген Di'
ІІЙКйрансфузиологическом отношении не имеет большого значения, посколь¬
ку отсутствует практически у европеоидов. Возможна сенсибилизация к этому
антигену у отдельных представителей монголоидов. Особый интерес антиген Di'
представляет для иммуноантропологическйх исследований, так как определяется
с различной частотой преимущественно у монголоидов и индейцев.
Антитела к антигенам эритроцитов системы Диего
Сенсибилизация к антигенам системы Диего возможна как при гемотрансфузи-
юг, так и при беременности. О возможности сенсибилизации к антигенам такого
рода следует помнить в связи с тем, что в России, большом многоэтническом
государстве, заготовка крови и соответственно гемотрансфузии могут быть осу¬
ществлены от доноров одной этнической группы больному другой, у которого
ИЙ иной достаточно иммуногенный антиген не встречается или определяется
крайне редко.
Анти-БР’-антитела способны вызывать гемолиз перелитых Di (а+). эритроцитов
и бьггь причиной ГБН. Антитела иммунные относятся к иммуноглобулинам IgG,
^являются в непрямом АГТ.
Аггти-ЛУг'-антитела — натуральные, вырабатываются без стимуляции эритро-
• в редких случаях могут вызывать гемолиз перелитых эритроцитов и ГБН.
Остена YT (011)
YT включает 2 антигена - YFh Yt*. Частота встречаемости фенотипов
системы YT среди кавказоидов представлена в табл. 25-35.
ЫЙ№йе антигенов Yt кодируется геном, расположенным на хромосоме 7.
ЭсГера ЄНЬ^ локализованы на молекуле фермента эритроцитов — ацетилхолин-
В ТЖИСФУЗИОННАЯ ИММУНОЛОГИЯ
ТМлица 25-35. Частота встречаемости фенотипов антигенов системы YT у кавказоидо*
-
^
I Антитела к антигенам эритроцитов системы YT
В большинстве случаев анти-УГ-антитела не вызывают посттрансфузи
реакций, но в редких случаях анти-УР-антитела способны вызывать гемолиз°ННЬй
литых Yt (а+) эритроцитов и ГБН. Анти-У1:ь-антитела встречаются дойат! "
редко. И нет сообщений О возникновении посттрансфузионных реакций или 4,10
чаев ГБН, обусловленных антителами данной специфичности.
Система XG (012)
Система XG представлена одним антигеном - Xg3, открытым в 1962 г. В послр
нее время к антигенам этой системы относят антиген CD99. Антигены системы X
занимают особое место в системе антигенов эритроцитов, так как они кодируют*
генами, расположенными не на аутосомах, а на половой Х-хромосоме, т.е. сцепле¬
ны с полом.
В исследованиях, проведенных с образцами сывороток представителей кавка-
эоидов. показано, что антиген Xga с большей частотой встречается на эритроцитах
женщин, чем мужчин (табл. 25-36)
Таблица 25-36. Распространенность фенотипов системы XG у кавказоидов
- " ■■■■
Фенотип
Распространенность, %
мужчины
женщины
Хд (а+)
66
89
Хд(а-)
34
11
Анти-Х§*-антитела встречаются редко, обычно реагируют в АГТ, случаев
посттрансфузионных реакций или ГБН, обусловленных данными антителами,
не выявлено.
Система Scianna (013)
Система антигенов Scianna (SC) включала первоначально 3 антигена - Sc1,
Sc2 и Sc3. Впоследствии в эту систему был включен антиген Rd, ранее относимый
к группе редко встречающихся фенотипов системы SC (табл. 25-37).
Таблица 25-37. Частота встречаемости фенотипов антигенов системы SC
Фенотип
Частота встречаемости, %
Sc1, -2
99
Sc1,2
<1
Sc-1,2
<0,01
Sc-1,-2
<0,01 J
Ген, кодирующий образование антигенов системы SC, распложен на хромосоме 1.
Антитела к антигенам системы SC встречаются редко. Анти-Бс'-антитела
не вызывают посттрансфузионных реакций или ГБН. Анти-5с2-антитела способ¬
ны приводить к незначительным проявлениям ГБН.
Система Dombrock (014)
Система Dombrock (DO) первоначально включала два антигена: Do1 и D ■
Предположение, высказанное в 1995 г. Дж. Бэнк (J. Banks) и соавт., о том, что эри
троциты с редким фенотипом Gy (а-). Ну (-), Jo (а-) по сути DO (a-b~), застав
Фенотип
Частота встречаемостіГчГ
Yt (а+0-)
92 ' —
УІ(аИн)
Yt (a-N
<1 —
r
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ $8|
ч-i к заключению, что эти антигены фенотипически и биохимически сходны
І^кгигенами и включить их в систему Dombrock (табл. 25-38).
1 оч эв Антигены системы Dombrock
—І8ВТ
Символ енгигеиа
~~ 001
Оо‘
002
Do*
L> 003
Gy*
U-"" 004
Ну
L- D05
Jo*
шиген Do* встречается с частотой 66, Dob - 82%. Распространенность анти-
нов Gy*. Ну и Jo* — менее 0,01%. Антигены Dombrock локализованы на глнко-
Гоотеине, функция которого неизвестна, не установлено и расположение коди-
пуюЩего их гена.
фенотипы Gy (а+), Ну- и Jo (а-) встречаются исключительно у негроидов.
днти-Do* и Dob антитела обнаруживаются достаточно редко и. как правило,
сыворотке присутствуют антитела другой специфичности. Они способны вызы¬
вать слабопротекающие гемотрансфузионные реакции и ГБН. Антитела к Gy*-. Ну-
]о*-антигенам могут приводить к укорочению жизни перелитых эритроцитов
и вызывать ГБН в легкой форме.
Система Colton (015)
Система Colton (СО) включает 3 антигена: Со*, встречающийся с высокой
частотой, Соь - редко встречающийся и Со3 - антиген, который, по-видимому,
продукт одного из Соа/С&-генов. Антигены Colton локализуются на мембран¬
ном белке эритроцитов, который выполняет роль переносчика молекулы воды,
распространенность фенотипов антигенов системы Colton у кавказоидов пред¬
ставлена в табл. 25-39.
Таблица 25-39. Распространенность фенотипов антигенов системы СО среди кавказоидов
Фенотип
Распространенность, %
СО (а+Ь-)
89
СО (а+Ь+)
« .
СО (а-Ь+)
<1
СО (а-Ь-)
<0,01
Анти-Co*- и Со3-антитела встречаются относительно редко, тем не менее они
могут объяснять развитие постгемотрансфузионных реакций и ГБН. Анти-Со1-
антитела иногда могут вызывать ПГТР, но случаев ГБН, ассоциированных с этими
антителами, не установлено.
Система Landshteiner-Wiener (016)
Система LW включает три антигена: LW, LWb, LW*6. Ген, кодирующий образо-
аание антигенов LW, расположен на хромосоме 19.
Распространенность фенотипов антигенов системы LW у кавказоидов приведе¬
на в табл. 25-40.
Таблица 25-40. Распространенность фенотипов антигенов системы LW среди кавказоидов
1— Фенотип
Распространенность. %
. LW (а+Ь-)
<0,01
■ 1
ggg ТРИНСФУЗИОИНАЯ ИММУНОЛОГИЙ
Сктемв ChWo/Rodfers (017)
Система антигенов CH/RG включает 9 антигенов. Антигены Ch и в
встречающиеся, локализованные на компоненте С4 комплемента у ~
положительных лиц они адсорбируются на поверхности эритроцитов в
«считывают 6 антигенов, а в труппе Rg — 2. Экспрессия 9-го антигена
лнруется взаимодействием Ch6 и Rgl. Распространенность основных
антигенов системы СН/RG приведена в табл. 25-41.
Табяюр 25-41. Распространенность фенотипов антигенов системы CH/RG
Фенотип
Распространенность, %
£W»,R6»
95
СН-. RG+
2
СН». R6-
3
CH-.RG-
<0,01
Антитела к антигенам эритроцитов системы СН/RG не вызывают ПГТРигбн
Система антигенов Нй (018)
Система Hh включает один антиген Н, который считается общим предшестве
ником группоспецифических факторов А, В и 0.
Ген. кодирующий образование Н-антигена, расположен на хромосоме 19
а локусе FUT1. Ген Я с очень высокой частотой встречается во всех популяциях,
и поэтому на эритроцитах большинства людей экспрессируется антиген Н. Лица,
эритроциты которых не содержат Н-антигена. гомозиготны hh.
Н-антиген присутствует также в жидкостях, секретах и выделениях 80% людей
называемых АВН-секреторами (выделителями). Одновременно с Н-антигеном
у лиц, эритроциты которых идентифицируются как клетки А-, В- или АВ-групп,
в секретах обнаруживаются также А-, В- или АВ-антигены.
Антитела к антигену Н вырабатываются у лиц, эритроциты которых имеют
фенотип «Бомбей». Антитела относятся к классу иммуноглобулинов IgM.
Система антигенов Кх (019)
Система Кх включает один антиген, который относится к группе часто встре¬
чающихся антигенов. Антитела к Кх встречаются редко и вырабатываются у инди¬
видуумов с фенотипом эритроцитов McLeod, у которых антиген Кх отсутствует.
Анти-Кх-антитела могут вызывать ПГТР.
Система антигенов Gebrich (020)
Система Gebrich включает 7 антигенов. Антигены Ge2, Ge3, Ge4 относятся к часто
встречающимся, a Wb, LS*. An', Dha встречаются редко. Антигены Ge2, Wb, IS'.
An4, Dh4 разрушаются под действием папаина и фицина, а антиген Ge3 устойчив
к действию протеаз. Антигены системы GE находятся на молекулах гликофоринаС
(GPC), который несет антигены Ge3 и Ge4, и гликофорина D (GPD), несущего Ge-.
Ge' и АгГ; Dh4- и Wb-антигены локализованы на видоизмененных молекулахGPC
І^-антиген находится на измененных молекулах GPD.
Антитела к антигенам Gebrich обнаруживаются у Ge-отрицательных лиц, она
иммунные, обычно относятся к иммуноглобулинам класса IgG и в небольшой
степени к классу IgM.
Система антигенов Cromer (021)
Система Cromer включает 11 антигенов, 7 из них относятся к группе час
встречающихся антигенов, а 4 - достаточно редки (табл. 25-42). Антигены сип*'
мм Cromer локализуются на белке системы комплемента DAF (Іксеу-Ассш^
Factor фактор, ускоряющий разрушение). Белок кодируется одним из генов и
^ИЯІЯиіІІМЙИ»«тівации комплемента, расположенным на хромосоме
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ПМОТМмСФ) МИ Щ
,25-42*
Час
гота встречаемости акшгвиов системы Grower
Честем ктрсчммсп. Ч
41
. 49
[Йг" Тс*
r У ~
«t
От
иа
г—й*
4%
Fc
к 49
► ' ‘ WES*
4
WES^
Г"" ^ имс
>99
SUTI
<t
Антитела к антигенам системы Сгошег считаются иммунными и встречаются редко.
Клютическое значение антител неоднозначно, некоторые образцы могут вызывать
укорочение жизни перелитых эритроцитов. Случаи ПГТР и ГБН не аюканы
Система антигенов Knops (022)
Система антигенов Knops включает 8 антигенов. Антигены Ка5. McC. МсС*. Щ
ylt* локализуются на C3b/C4b (CR1), первичном рецепторе комплементі зритро
щгов. Ген, ответственный за кодирование СК1. расположен на хромосоме I. Все
ашнгены Knops, за исключением МсСь, относятся к группе часто ястречакншш*
антигенов. Частота распространения фенотипов антигенов системы KN приведен»
в табл. 25-43.
Таблица 25-43. Частота встречаемости фенотипов антигенов системы KN
Фенотип
Частей ктрічшмтя, %
кавказоиды ивгрмаы
[toi (at) McC (a+)
83
I ■ Щ I
[Kn (a+) McC (a-)
14
3
|Kn (a-) McC (гн-)
2
j Kn (a-) McC (a-)
2
ft
Антитела к антигенам системы KN не имеют клинического значения
Система антигенов Indian (023)
Система Indian представлена двумя антигенами. Антиген In* встречается редко,
и Шь относится к группе часто встречающихся антигенов. tor- и 1пк аитнгиш
локализованы на молекулах белка CD44, который встречается во многих тканях
Антигены разрушаются под действием ферментов, таких как папайя и фмцмм.
Антитела к In-антигенам вырабатываются редко, описан один случай ПГТР.
Система антигенов Ok (024)
Система Ok представлена одним антигеном - Ok*, относящимся к rpvnne шй-
Гейов с высокой частотой встречаемости. Ок*-негативные эритроциты были обив-
И*ены только у членов 8 японских семей. Анти-Ok-антитела встречаются тина*
стельно редко, описано только два случая ПГТР у представителей из этих семей.
антигенов Raph (025)
истема Raph включает один антиген MER2, который был обнаружен с помо-
моноклональных антител. Анти-МЕК2-антитела не имеют клинического
Учения.
990 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Система антигенов JMN (026)
Система представлена только одним антигеном — JMN, высокой частоты
чаемости. ЫВсгре.
G. Daniels в 1999 г. обнаружил JMN-негативные эритроциты у представит»
только одной семьи. AHTH-JMN-антитела встречаются крайне редко и не и ^
клинического значения. ИМек’
Система антигенов і (027)
Система I представлена одним антигеном. Взрослые индивидуумы в норме со
жат в основном антиген I и незначительное количество і-антигена, который пои
эритроцитам эмбриона человека (антиген і относится к коллекции антигенов 207?
В первые месяцы жизни антиген і практически у всех здоровых лиц заменят
на антиген I (через 18 мес после рождения ребенок приобретает соотношение I*
и і-антигенов, характерное для взрослого). Антиген I присутствует как на клеточных
элементах крови (эритроцитах и лейкоцитах), так и в плазме и секретах организма
При некоторых заболеваниях отмечается изменение соотношения антигенов
I и і на эритроцитах больных. В частности, у больных с большой р-талассемией
на эритроцитах содержится антиген і, и их эритроциты реагируют с сывороткой
анти-і так, как ведут себя эритроциты новорожденного. Увеличение в эритроцитах
антигена і происходит и при гипопластической анемии, что, очевидно, связано
с выбросом в кровеносное русло незрелых эритроцитов. Увеличение количества
і-антигена отмечено также при дисэритропоэзе, у больных при обострении лейко¬
за, тогда как при ремиссии происходит уменьшение содержания этого антигена,
В литературе имеются лишь единичные указания относительно частоты распре¬
деления антигенов этой малоизученной системы у различных народов. Независимо
от популяции у европеоидов, монголоидов, негроидов частота 1-отрицательных
лиц не превышает 0,01-0,02%.
Анти-1-антитела, как правило, холодовые полные аутогемагглютинины в основ¬
ном IgM-класса, реже неполные. Изоиммунные анти-1-антитела выявляются
в очень редких случаях у лиц, не содержащих этого антигена. Аутоиммунные
анти-1-антитела могут находиться в очень высоком титре и приводить к болезни
Холодовых антител. Анти-1-антитела обнаруживаются у больных с приобретенной
гемолитической анемией.
В отличие от анти-І-, анти-і-антитела всегда аутоиммунной природы. Выяв¬
ляются у больных с аутоиммунной гемолитической анемией, при инфекционном
мононуклеозе, часто сопровождают опухолевую прогрессию при лимфомах, мне-
лоидной лейкемии, циррозе печени.
Анти-I- и анти-і-антитела выявляют методами солевой агглютинации и непря¬
мой пробы Кумбса с aHTO-IgM-глобулиновой или противокомплементарной сыво¬
роткой. Они относятся к часто (общие) и редко встречающимся эритроцитным
антигенам.
Система антигенов Cloboside (028)
Система представлена одним антигеном Р. Анти-Р-антитела, как правило, холо¬
довые, но могут проявлять активность при 37 °С и быть причиной ПГТР. Случаев
ГБН, обусловленных этими антителами, не описано, однако они могут вызывать
ранние спонтанные аборты.
Система антигенов 6IL (029)
Система представлена одним антигеном - GIL. Анти-ЭДЬ-антитела клиническ
го значения не имеют.
Часто встречающиеся эритроцитные антигены — Vel, Ge, Lan, San и др.ЧаСТ
их выявления - около 100%. Практически не имеют какого-либо значен
для гемотрансфузий.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГІМОТРМСФУЗИИ 991
о встречающиеся эритроцитные антигены - Wp*. В‘. В-’. Вр*. Значение таких
^ нов в практической трансфузиологии невелико, поскольку вероятность
**|Т*|Грных гемотрансфузий, несовместимых по этим антигенам, ничтожно мала.
° роцитные Группы крови и болезни
Жданные об ассоциации групп крови АВО с заболеваниями основаны на наблю-
ЙЯ гастритом и язвой желудка среди лиц группы О (I) Le» M.J. Telen в 1995 г,
Ш Moulds и соавт. в 1996 г. показали, что возбудители этих заболеваний
^' отрицательные бактерии Helicobacter pilory на клетках слизистой желудка
взываются с антигеном Leb. У людей групп А, В и АВ антиген Leb экранирован
а и В-антигенами и поэтому не может служить эпителиальным рецептором
adicobacter pilory. Определенный интерес представляет установление связи фено¬
ла І1 (а-b-) с повышенным риском ишемической болезни сердца.
111 Ряд антигенов групп крови могут служить рецепторами для паразитов, бакте-
й и вирусов (табл. 25-44), однако внутрь эритроцитов проникают лишь маля¬
рийные паразиты и парвовирус В19.
Таблица 25-44. Антигены групп крови — рецепторы для микроорганизмов
Микроорганизм
Антиген-рецептор
Plasmodium falciparum
MN (гликофорин А)
Plasmodium falciparum
Knops
Plasmodium falciparum
Diego
Plasmodium vivax, Plasmodium knowlesi
Daffy
Helicobacter pilory
Leb
Escherichia coli
P1
Escherichia coli
Cromer
Mycobacterium leprae
Knops
Midi albicans
H, A
Heemophilus influenzae, полиовирус
Indian (CD44)
Вирус гриппа, вирус Сендай
MN (гликофорин A)
Парвовирус 819
P
Некоторые микроорганизмы используют эритроциты как транспорт для дости¬
жения ткани-мишени. Малярийные паразиты проникают в клетку, используя
? качестве рецептора антиген Даффи, поэтому лишенные его Fy (a-b-) лица
резистентны к этим возбудителям. В эндемичных по малярии районах Западной
%ИКИ почти 100% коренного населения имеют фенотип Fy (a-b-). Этот при-
МеР иллюстрирует, как в естественных условиях могли проходить селекция эри-
РВЦйтных фенотипов и формирование полиморфизма групп крови. Различные
п°ДВиды Escherichia coli используют разные молекулы для адгезии. Одни их них
^взываются с белком комплемента DAF, на котором локализуются антигены
эритроцитов системы Cromer, таким образом, антигены Cromer становятся
со//и°РаМИ’ связывание с которыми облегчает инфицирование организма L
„ Молекулы DAF, на которых локализуются антигены эритроцитов системы
в„ ег> находятся не только на эритроцитах, но и на клетках других тканей.
** и Г0™ На эпителиальных клетках мочевыводящих путей, что способствует
пидо °ванию' Некоторые подвиды E. coli связываются со сфингогликоли-
Рок в НЭ КОтоРом локализуется Р-антиген. Р-антиген также считается реиепто-
ДЛя нарвовируса В19.
ШШ ffwriHltfftTHfl ИММУНОЛОГИЯ
Івтвтм i итог emu эрмтроциго* человека
Аялггела к антигенам эритроцитов человека относится к иммуногжй*»*-^
« M, G i A. v
К иммуноглобулинам класса IgM относятся естественные антитела. НзиО, „
К антигенам эритроциов системы АВО. однако встречаю»
яу Других систем эритроцитных антигенов. У молекулы IgM есть десять активны,
центров ДЛЯ сшивания с антигеном, поэтому данные антитела обладают еяосеб.
I вызывать прямую агглютинацию эритроцитов в солевой среде при ко»
натной температуре,
К иммуноглобулинам класса IgG относятся иммунные антитела, образуюао»ес«
дрИ стимуляции эритроцитами, содержащими чужеродные антигены. Молекуле
IgG имеет два активных центра для связывания с антигеном и неспособна выбы¬
вать прямую агглютинацию эритроцитов. Для выявления IgG-антител применяют
непрямые методы с использованием коллоидов, антиглобулиновой сыворотки
и т.д. і иммунным антителам чаще всего относятся антитела к антигенам систем
резус. Келл. Кидд, Даффи и др.
В зависимости от активности антител к эритроцитам в реациях in vitro и темпе¬
ратуры антитела относят к Холодовым или тепловым с оптимумом реагирования
І 20 1 371
По способности взаимодействовать с чужеродными или собственными анти¬
генами эритроцитов индивидуума антитела подразделяются на алло- и аутоантн-
тела.
Аляоентитш
Аллоантитела бывают двух видов: естественные, или регулярные, и иммунные,
или нерегулярные.
Таблица 25-45. Особенности нормальных (естественных) и иммунных антител
Параметры
Нормальные а- и р-антитела
Иммунные анти-А анти-В
Форма
Полные
Чаще неполные
ЩЩ
Преимущественно IgM
Преимущественно IgG
. тг irj..L п.. ■
Сотая среда
Активны
Слабоактивны
Температура 15-25 *С
Активны
Активны
Температура 37 *С
Неактивны
Активны
Коллоидная среда
Активность не усиливается
Активность усиливается
Непрям» реакция Кумбса
Отрицательная
Положительная
Эритроциты, обработанные энзи¬
мами
Не агглютинируют
Агглютинируют
Групповая субстанция (Витебского)
Абсорбируются
Не абсорбируются
Температура 70 *С
Инактивируются
Сохраняют активность
Естественные антитела образуются без антигенной стимуляции, считаются
врожденными, содержатся в сыворотке лиц, не имеющих в анамнезе гемотрансфу-
эий или беременностей и чаще всего направлены к антигенам системы АВО.
Иммунные антитела вырабатываются при попадании в организм чужеродны
антигенов как результат антигенной стимуляции, и чаще всего это происходит
при несовместимых гемотрансфуэиях или беременности.
Наибольшее значение в трансфузиологии имеют клинически значимые анти
тела Как правило, клинически значимыми считаются антитела, ассоциированны*
с гемолитической грансфузионой реакцией, гемолитической болезнью ново*
рожденных или снижением выживаемости перелитых донорских эритроците?-
Тепловые антитела, реагирующие при 37 "С и/или в непрямом АГТ, чаще оказЫ"
Iклинически более значимыми, чем холодовые.
—ewwmeim ммиоист» 'шямшааш щ
встречаем
жги антител к эритроцитйьш ежтитшв литием апжм
Предшествующих трансфузий. У больных. имевших » ипмигм $ а
^Т^ясАузий. частота встречаемости антител составила 1,99%. t warnи
доккядется прямая зависимость между сюншыо здоидоумтцим и i
imrmi
, домдя щщ-
ГфИЦІТМЬШИ
шйсш mmwk
йроаенте случаев сенсибилизированы женщины (4.1 Л
и резус-отрицательные (1033 ш 4,474). у резус
получивших более 5 гемотрансфузмйг. часта выявляв
^ntrefT 1336% у мужчин и 23,184 у женщин.
^удбслгдоаанных доноров антитела значительно чаще обнаруживаете у м
L (79,8,6%). чем у мужчин (21.144) И у женщин, * у мчжчнв. им
"ТіЗ раза чаще выявляются у резус-отрицательных доноров, причем част
'умости антител у доноров одновременно резус-отриагальиш и Кг
Црпртельных была статистически значимо выше (табл. 25-44).
jjjnp 25-46. Частота аллосеї
" контингент
нсибилизации среди различных категорий абсяацашм
Количестве граисфуям % ыммшмрммм
^Щгичвских больных
йнвес
>б
<8 ~ V Й
Иужчнн
>5
<5 І ||
Женщин
>5 j it
<5 j U
Рімс-принадлежность
Всего доноров
Из них:
Rh+ I «j
Rh- j 14
Мужчин
Rh+ |. еж
Rh-
Женщин
Rh+ f |4
Rh- I
Анализ распределения антител по частоте и специфичности у обследованных
лиц показал, что наиболее часто встречаются аити-О-аиптла (6036%), IКЩ
учесть сыворотки, содержащие анти-DC и анти-DE, то их частота составит ТТ.ТКс
частота анти-Е-антител составляет 3,54% (табл. 25-47).
Щр 25-47. Специфичность аллоиммунных антител
Антителе
0
т
Ресаетрешшесть
пг
ЦІ ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Частота встречаемости минорных антигенов составила 24,5%.
Частоту встречаемости антител и приоритет трансфузионно опасных анти
необходимо постоянно мониторировать и учитывать в трансфузионной т?'ГЄНов
(табл. 25-48).
в 25-48. Шкала приоритета трансфузионно опасных антигенов
Шила трансфузионно опасных антигенов
Авторы
І ВВІ С—» 6-* с—» К-* fy*
Dausset J., 1959
j ВИ С-* На Е-» К-» Fy*
Умнова M.A., 1967
ggi
IJ К-» е-» Е-* a-» Fy*-» Le*-» С—» s
Мороков B.A, 1992
1 ВИ К-» С-» •-» Fjl*-» С
Башлай А. Г., 1998 ~ -J
D-* К-» Н Н ВНЯ а-» С—» Fy*, Fy6, Le*, P1, N
Донское С.И. и соавт., 1998
.
ID—»K—► С—»E—»C—» Fy*
червяков В.И., 2000
10-» H H c—»C*-» C—»Fy*-» e—» Le6-» S, s, M
Дашкова Н.Г., 2006
,
Шкала приоритета трансфузионно опасных антигенов, по последним данным
в целом согласуется с результатами предыдущих исследований, за исключением
того, что антиген Fy* занял место перед антигеном е.
Аутоантитела
Аутоантитела, в отличие от аллоантител, реагируют с соответствующими анти¬
генами на собственных эритроцитах индивидуума вне зависимости от того, про¬
исходит реакция только in vitro, и от наличия или отсутствия патологического
процесса in vivo.
Аутоантитела могут присутствовать в сыворотке в свободном виде - так назы¬
ваемые неспецифические аутоантитела или быть адсорбированными на эритроци¬
тах I фиксированные аутоантитела.
Неспецифические аутоантитела обычно не несут клинического значения
и не вызывают гемолиза перелитых эритроцитов, однако они могут экрани¬
ровать присутствие специфических аллоантител, которые имеют клиническое
значение.
Отличить неспецифические аутоантитела от специфических аллоантител можно
при аутоконтроле - исследовании сыворотки реципиента с собственными эри¬
троцитами. В случае присутствия тепловых неспецифических аутоантител отме¬
чается агглютинация в аутоконтроле. В таких случаях, чтобы выяснить наличие
аллоантител у данного реципиента, необходимо перед исследованием провели
аутоадсорбцию аутоантител, для чего используют собственные трижды отмытые
эритроциты реципиента. В зависимости от того, какие неспецифические ауто¬
антитела присутствуют — холодовые или тепловые, аутоадсорбцию проводят
при 1 или 37 °С.
После адсорбции аутоантител выявляют аллоантитела и определяют их специ¬
фичность.
Исследование аутоантител проводят в следующих случаях:
1 при выяснении причин ложноположительных реакций в аутоконтроле
во время иммуногематологических исследований антигенов и антител;
І при диагностике ГБН;
• при выявлении аутосенсибилизации к антигенам эритроцитов при некого і
рых аутоиммунных заболеваниях;
• при исследовании антител к лекарственным средствам. I
Аутоантитела относятся, как правило, к иммуноглобулинам IgG- или Ш|
класса, способны связывать комплемент. Степень гемолиза в организме pL| I
ее всегда коррелирует с продукцией аутоантител или положительной прямой про¬
бой Кумбса.
r
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГШОТРАНСОУЗИЙ 995
V больных с аутоантителами в ряде случаев могут появиться определенные
ости в определении фенотипа эритроцитов, а также при проведении пробы
Смесимость. Это связано с тем. что фиксированные на эритроцитах аутоан-
; t а івоіут являться причиной ложноположительных реакций (неспецифиче-
I ’’’Агглютинация). Причиной неспецифической агглютинации считается сен-
Ализация эритроцитов тепловыми или Холодовыми аутоантителами. В этих
І Ікк!х необходимо использовать для определения группы крови (фенотипа эри-
I ^щпов) моноклональные реагенты и в обязательном порядке проводить перед
*!теделением группы крови контрольные исследования — совмещение собствен-
Тэритроцитов и сыворотки больного. При аутоагглютинации перед иммуноге-
І Логическими исследованиями выполняют элюацию аутоаитител: эритроциты
! [LygaioT теплым 0,9% раствором хлорида натрия или раствором низкой ионной
j Al 37 °С при выявлении холодовых и 56 °С — при выявлении тепловых аутоан-
! А,. Тепловые аутоантитела, реагирующие при 37 °С, могут вызвать гемолиз.
у больных с аутоантителами, нуждающихся в гемотрансфузиях, необходимо
„уводить идентификацию аутоантител и осуществлять гемотрансфузии с учетом
I ^специфичности.
і Если невозможно определить специфичность аутоантител, рекомендуют пере-
I давать донорские эритроциты, фенотип которых идентичен таковому эритроци¬
тов больного.
Антитела против лекарственных средств могут образовываться при приеме
различных медикаментов. Выявляются они в прямой пробе Кумбса. Присутствие
I цдоро рода антител может стать причиной развития иммунно-аллергических
; реакций, сопровождающихся гемолизом различной степени.
! общая характеристика антиэритроцитных антител приведена в табл. 25-49.
Щи 25-49. Общая характеристика антиэритроцитных антител
Интела
Класс lg
Реагируют при:
Иммун¬
ные
Естест¬
вен¬
ные
Обуслов¬
ливают
ІЙГР
._ 1
Частота астре- I
чаемостм,%
IgG
IgM
20 °С
в солевом
тесте
37 °С
в солевом
тесте
UIU
зонды
1
негро¬
иды
Система А80
Анти-А!
—
+
+
Редко
Редко
ф
Редко
37
19
Анга-Н
+
+
Редко
—
ф
—
100
100
Система резус
[Анти-D
Ф
Иногда
Иногда
ф
+
—
+
85
92
Анти-С
+
Редко
Редко
+
ф
—
ф
70
33
Анти-Е
+
Иногда
Редко
+
ф
ф
ф
30
21
[Анти-с
+
Редко
Редко
+
ф
80
97
Анти-е
+
Редко
+
+
ф
90
: 99
шн-С*
+
Иногда
Редко
ф
t
ф
1 1
<1
Система Келл
Анти-К
+
Иногда
Очень
Иногда
♦
Очень
редко
ф
9
2
рйтй-к
+
-
Очень
редко
Редко
ф
—
ф
99.9
>99.9
1%-Кр*
+
Иногда
Иногда
ф
—
♦ -
2
<0.1
; >99,9
tont-Js*
[Антткй*
Ф
-
Очень
Редко
♦
Очень
>99.9
+
+
—
Очень
редко
0
Очень
редко
0
*
1
ф
>98,9
99
996 ТЫМССУЗИОННАЯ иммунология
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ (ТМОТРАНСФУЗИЙ 397
Окончите 736л. 26-49
Частоте кету*!
чаемот. N I
г ——
Класс lg
Реагируют прк
Иммун¬
ные
Естат
•ем
мыв
Обуслов¬
ливают
ПТГР і
IgG
IgM
20 *С
а солевом
тесте
37 "С
в солевом
тесте
■f
♦
♦
1
—
+
Иногда
+•
♦
Г * f-
1 4
иш
зонды
100
негро- :
«ды
Нет
данных i
Hit
данных
♦
—
0
і. 1
1 ♦ 1 667 1 56
— j + I 82.8 j 8Г
(іSjSt-—
+
—
0
0 +
И!
♦
—
—
♦
— 1 ♦ I 99 100
+
—
—
_ j -
+ I 99 I >93
І^тмаК2РтР
айт
+
—
—
+
Очень I ♦ I 9S.7 І 99.7
редко
+
—
—
—
♦
L - I - I 3,1 I 8,4
Ж
+
—
—
—
*
1
93 1 Нет 1
1 данных
+
—
—
—
+
—
.
97 J Нет
1 ДВИНЫ* 1
Ми-Kn1
+
—
—
—
♦
—
рч -1
Анти-МсС1
+
—
—
—
+
—
—
.99 1
Ми-УК1
+
—
—
—
+
L —...
—
1 92 ]
Аити-Cs1
+
—
—
—
+
—
■
[ 98 j
Akth-JMH
+
—
—
—
+
♦
-
1 98 -
Анти-Vel
Очень
редко
. —
Иногда
Иногда
—-
+
1 99,9 I Нет
1 данных
МЕТОДЫ
Определение группы крови системы АВО
Определение группы крови по системе АВО проводят:
• по антигенам исследуемых эритроцитов в реакции прямой агглютинации
со стандартными гемагглютинирующими сыворотками, содержащими пол¬
ные антитела против антигенов А и В, или реагентами с моноклональными
антителами (прямой метод);
і по антигенам исследуемых эритроцитов и антителам, содержащимся в иссле¬
дуемой сыворотке, с помощью стандартных гемагглютинирующих сыворо¬
ток или моноклональных антител и стандартных эритроцитов групп А. В, 0
(перекрестный метод) (табл. 25-50).
Я!25-50. Определение анти-А- и анти-В-антител системы АВО перекрестным методом
Группы крови
Антисыворотки
анти-А
анти-В
акти-АВ
Стандартные эритроциты
%Ий^ЯИ<К '-+> ~ агглютинания (положительный результат). «-* - агглютинация отсутствует
«льный результат)
ggg гмнсФУЗионнАЯ иммунология
внедрение в клиническую практику моноклональных реагентов для оп
кия групп крови позволило стандартизировать и значительно облегчить пооГДбЛе'
позволяя получать резко очерчиваемые результаты реакции «антиген-антит?^’
Моноклональные антитела — цоликлоны, типирующие реагенты нового °*
ления для определения антигенов эритроцитов человека, продуцируются П01С°
алыю сконструированными клеточными линиями мыши, человека или их "fi4"
дами. Каждый реагент абсолютно специфичен, так как не содержит пл
других антител, балластных белков и иных нежелательных компонентов^011
числе инфекционных факторов. ’ Том
Определение антигенов АВО на исследуемых эритроцитах
Определение проводят в помещении с хорошим освещением на пласта
или специальном планшете при температуре 15-25 °С.
Для исследования используют эритроцитосодержащие среды (цельную ш
эритроцитную массу, отмытые эритроциты, эритроциты в плазме, сыворотке
физиологическом растворе).
Порядок проведения исследований:
• предварительно маркируют секции на пластинке или планшете в соответ¬
ствии с наносимым реагентом или сывороткой;
і наносят около 0,1 мл (по 1 большой капле) каждого реагента (анти-А, анти-В
анти-АВ) или гемагглютинирующей сыворотки 0 (1), А (II), В (III));
к наносят около 0,03 мл (по 1 маленькой капле) исследуемой эритроцитсодер¬
жащей жидкости рядом с каждой каплей реагента или сыворотки;
в отдельными чистыми стеклянными палочками смешивают каждый из реа¬
гентов с исследуемой жидкостью;
І мягко покачивая пластинку, оценивают результаты реакции агглютинации.
Наличие или отсутствие четкой агглютинации регистрируется не ранее чем через
3 мин после смешивания. При использовании стандартных реагентов четкая реак¬
ция отмечается уже в первые секунды после смешивания.
Определение естественных анти-А- и анти-В-антител в сыворотке крови
с помощью стандартных эритроцитов
Определение проводят в помещении с хорошим освещением на пластине
или специальном планшете при температуре 15-25 °С.
Для определения используют эритроциты от заранее типированных доноров
групп А и В либо смесь эритроцитов от 2-3 одногруппных доноров.
Эритроциты, используемые для определения групповых изоагглютининов,
могут храниться в холодильнике не более недели. Применение лизированных
эритроцитов недопустимо.
Порядок проведения исследований:
1 готовят 5% взвесь однократно отмытых в 0,9% растворе натрия хлорида
стандартных эритроцитов;
• предварительно маркируют секции на планшете или пластине в соответствии
с наносимыми сыворотками; .
• помещают по 2 капли (около ОД мл) исследуемой сыворотки (плазмы)
на пластину или планшет;
I добавляют к ним 5% взвесь эритроцитов групп А и В (по 0,03 мл);
І отдельными чистыми стеклянными палочками смешивают реагенты;
• мягко покачивая пластину, оценивают результаты реакции.
Определение подгрупп крови Аг(И) и A2B(IV)
Данные о частоте носительства вариантов антигена А во многом зав^в
от метода исследования. В целях сравнения различных диагностических резге
(табл. 25-51) для выявление слабого варианта антигена А были использован
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТОкНСФУЭИЙ §89
tp-карты (ДиаМед) для определения антигенов А, и Н. Их применение позво-
' «лет сделать как качественную, так и количественную (от «*» до «++♦+»)
уценку содержания соответствующих антигенов;
эритротест анти-А, (анти-А, лектин-Dolichos bffloras). При смешивании
* эритротеста с эритроцитами А, наблюдается крупная, четкая агглютина¬
ция в первые секунды. С эритроцитами А2 агглютинации не наблюдается
или отмечается мелкая агглютинация на 5-й минуте;
стандартные изогемагглютинирующие сыворотки;
* ц0Ликлоны анти-А, анти-АВ, анти-А слабый.
даца 25-51- Определение групп крови Аг и АгВ с использованием различных реагентов
Диагностическая систвмз
Группа крови А
Группа крот АВ
количество
исследованных
образцов
из них
группа
Aj,%
количество
исследованных
образцов
из них группа
А,ВЛ
Ю-кзрты _
3564
17.8
1288
26.2
4ИТИ-А,
1592
14,7
357
23,5
^.Ганти-АВ, анти-А слабый
3599
14,5*
357
23.2*
ЩрІ изогемагглютинирующие
ЙЙМОТКИ
1592
13.4
344
.
22.2
.. . .
• Агглютинация слабо выражена.
Исследования с эритроцитами доноров крови и больных показали, что при
использовании эритротеста анти-А, и моноклональных антисывороток выявляе-
мосгь антигена А2 составила 14,5-14,7% в группе А и 23,2-23,5% - в группе АВ.
При применении ID-карт для определения группы крови тех же образцов эритро¬
цитов частота А2-антигена была выше — 17,8 и 26,2% соответственно. Очевидно,
что наиболее точно групповая принадлежность крови определяется при использо¬
вании ID-карт.
Иногда встречается одновременное пребывание в кровеносном русле двух попу¬
ляций эритроцитов, отличающихся по группе крови и другим антигенам - так
называемые кровяные химеры. Различают истинные и трансфузионные химеры.
Истинные химеры встречаются у гетерозиготных близнецов, при обмене родо¬
начальными кровяными клетками, а также при трансплантации аллогенного кост¬
ного мозга.
Истинные кровяные химеры выявляются, как правило, на протяжении всей
жизни. В клинических условиях становление кровяного химеризма наблюдается
при трансплантации аллогенного костного мозга на фоне интенсивной иммуно-
депрессии реципиента, при терапии состояний депрессии кроветворения или лей¬
козах.
Трансфузионные химеры возникают после многократных переливаний крови
универсального донора О (I) реципиентам II и III групп. Такие химеры носят вре¬
менный характер и исчезают после прекращения трансфузий.
Определение группы крови при кровяном химеризме представляет определен¬
ные трудности и требует высококвалифицированного иммуногематологического
^дования. При невозможности определить группу крови гемотрансфузии
I родимо осуществлять подобранными в солевой, коллоидной и пробе Кумбса
I “™ьггыми в физиологическом растворе эритроцитами О (I). а при необходимости
I ЄлЛ?вать плазму от доноров АВ (IV).
феномене полиагглютинации или панагглютинации говорят в тех случаях,
® эритроциты больного агглютинируют в присутствии сывороток всех здо-
людей. Некоторые формы полиагглютинации обусловлены генетическими
(HEMPAS, Cad, NOR), другие имеют приобретенный характер (Т. Тп,
1060 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Irkj Th), что наиболее часто наблюдается при некоторых инфекционных забол
ниях. сопровождающихся септицемией. При инфекции полиагглютинация Шр!
со способностью протеолитических ферментов некоторых бактерий активизи
вать Т-агглютиноген эритроцитов. Такие эритроциты приобретают способное!
агглютинироваться анти-Т-агглютининами, которые содержатся в сыворотке^
здоровых людей. ф
При полиагтлютинации установить группу крови даже с применением монокл
нальных реагентов крайне сложно, а нередко практически невозможно. При *и°
ненных показаниях больному переливают компоненты или кровь от доноров От
группы. 1
Несоблюдение правил определения групп крови может стать причиной опасны
ложноположительных или ложноотрицательных результатов.
Причины ошибок при определении групповой принадлежности
Технические:
❖ неправильная маркировка образцов крови;
❖ ошибочный порядок нанесения цоликлонов на пластину, неправильная
регистрация результатов их исследования;
1 неправильное количественное соотношение сывороток и эритроцитов;
Ц проведение реакции без добавления 0,9% раствора натрия хлорида
что может привести к образованию «монетных столбиков» и ложнополо¬
жительной реакции;
❖ применение недостаточно чистых планшет и пипеток;
❖ проведение исследования при температуре выше 25 °С, что может приве¬
сти к ложноотрицательной реакции.
Использование некачественных реактивов:
❖ слабые стандартные сыворотки;
❖ бактериальное загрязнение реактивов;
❖ применение антисывороток с истекшим сроком годности.
Биологические особенности исследуемых эритроцитов сывороток:
❖ слабые варианты эритроцитов;
❖ образование «монетных столбиков»;
❖ ослабление выраженности или полная утрата антигенных детерминант;
❖ отсутствие анти-А- или анти-В-антител;
❖ изменение антигенов эритроцитов системы АВО, в частности наличие при¬
обретенных В- и Т- антигенов при инфекционных процессах вирусной
или бактериальной этиологии;
Ф приобретенный Т-антиген может приводить к феномену панагглютина¬
ции, т.е. способности эритроцитов агглютинироваться всеми образцами
антисывороток и реагировать с собственной сывороткой (аутоагглютина¬
ция).
Определение резус-принадлежности крови
Реакция агглютинации на плоскости с применением моноклонального
реагента (выявление полных антител). Определение проводят в помещении
с хорошим освещением при комнатной температуре. Исследуемый образец (отмы¬
тые эритроциты, эритроциты в плазме, сыворотке, консерванте, 0,9% растворе
натрия хлорида, цельная кровь) должен содержать достаточное количество эр
троцитов.
Порядок проведения исследования:
І наносят около 0,1 мл реагента (большую каплю) на пластинку;
• наносят рядом около 0,03 мл (маленькую каплю) исследуемых эритроц
• тщательно смешивают капли чистой стеклянной палочкой;
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1001
мягко покачивая пластинку, наблюдают за реакцией.
Результат реакции фиксируется через 3 мин после смешивания эритроцитов
агента. Как правило, четкая агглютинация наступает через 30 с.
I **Йабор 2 цоликлонов — анти-D супер (выявляет полные антитела при определе¬
ния резус-принадлежности в реакции агглютинации на плоскости) и анти-D IgG
а являет неполные антитела в реакции конглютинации с желатином или в реак-
Vі Кумбса) - позволяет определить все антитела (полные и неполные) в иссле-
іом образце.
интерпретация результатов реакции.
при агглютинации кровь маркируется как резус-положительная (Rh+), если
гглютинации нет - как резус-отрицательная (Rh-).
Визуально агглютинация оценивается как:
, ++++ - крупнодисперсная;
+++ - среднедисперсная;
, ++ - мелкодисперсная;
, +- сомнительная.
Если агглютинация выражена слабо (крайне слабо), исследуемые эритроциты
обладают одним из минорных антигенов резус-Dn, и исследование необходимо
повторить с реагентом, содержащим IgG (неполные) анти-Б-антитела.
Реакция агглютинации в присутствии высокомолекулярных субстанций
с помощью неполных анти-Б-антител. Реакцию проводят универсальным
реагентом, включающим полиглюкин или альбумин, или высокомолекулярную
субстанцию вносят в процессе реакции.
Реакцию агглютинации на плоскости проводят так же, как и описано выше.
Поскольку высокомолекулярные вещества, содержащиеся в реагенте, могут
давать ложноположительную реакцию с Rh-отрицательными эритроцитами
и вызывать агглютинацию эритроцитов, нагруженных антителами другой (не
анти-Rh) специфичности, необходимо параллельное определение с контрольным
раствором высокомолекулярной субстанции.
Если контрольный раствор вызывает агглютинацию, результаты считаются
недостоверными и необходимо повторное определение с другим реагентом, содер¬
жащим полные (IgM) антитела (лучше моноклональные).
Реакция конглютинации в присутствии желатина. Реакцию проводят
с помощью моноклональных реагентов или стандартных аллоиммунных анти-Rh
сывороток с неполными антителами:
і помещают в пробирку 1 каплю (около 0,05 мл) исследуемой крови или 50%
взвеси эритроцитов в сыворотке;
і добавляют 2 капли (0,1 мл) 10% раствора желатина, предварительно подо¬
гретого до жидкого состояния;
• добавляют ОД мл (2 капли) реагента анти-D;
I смешав все, помещают пробирку в водяную баню при температуре 37 °С на
10 мин;
і после инкубации доливают в пробирку 5-8 мл физиологического раствора и,
осторожно переворачивая 1-2 раза, перемешивают содержимое пробирки.
Оценку агглютинации проводят на свет невооруженным глазом или с помощью
лупы.
Пробу проводят с параллельным контрольным определением:
• со стандартными Rh-t-эритроцитами;
' стандартными Rh—эритроцитами;
• с исследуемыми эритроцитами и желатином без анти-Б-антител.
Интерпретация результатов реакции:
' если в пробирке нет агрегатов, а видна равномерно окрашенная взвесью эри¬
троцитов жидкость, результат оценивается как резус-отрицательный;
ГЯАМ
|Ц2 ТРАНСФУЗИОННАЯ иммунология
• при резус-положительной крови наблюдаются четко различимые
различной величины. агРегат.
Результаты пробы считаются достоверными, если желатин не вызыв
тинации. а результаты контрольных проб соответствуют ожидаемым ^ агглЮ-
В случаях неадекватных результатов исследования в контроле оп
резус-принадлежности необходимо повторить, сменив реагент и/или**^*1*1"1
При мелкозернистой (сомнительной) агглютинации для выявления D
мо дополнительное определение в непрямом антиглобулиновом тесте" е° 0ДЧ-
Выявление Ow
При исследовании используют:
• пул эритроцитов от 3-5 доноров групп крови 0 Rh+;
• пул эритроцитов от 3-5 доноров групп крови 0 Rh-;
• антиглобулиновую сыворотку (АГС) (анти-IgG);
• анти-D с неполными антителами в титре 1:64-1:128;
• исследуемые эритроциты.
Порядок проведения исследования:
• все эритроциты отмывают стерильным 0,9% раствором натрия хлопни
раза по 3 мин при 3000 об./мин;
• готовят в 3 отдельных пробирках 20% взвесь всех образцов эритроцит
в 0,9% растворе натрия хлорида; 08
• сенсибилизируют все образцы эритроцитов, для чего смешивают chbodotkv
анти-D, 0.9% раствор натрия хлорида и каждый образец взвеси эритроцитов
в соотношении 1:1:1 и инкубируют при температуре 37 °С 30 мин;
• отмывают все образцы 3 раза по 3 мин при 1000 об./мин;
I в пробирках 1,2,3 смешивают сыворотку анти-D и 5% взвесь сенсибилизи¬
рованных эритроцитов в соотношении 1:1;
S центрифугируют 1 мин при 1000 об./мин;
• оценивают результат макроскопически. Контрольные исследования: пробир¬
ка 1 с эритроцитами 0 Rh+ — результат всегда положительный, в пробирке
2 с эритроцитами 0 Rh результат всегда отрицательный. При агглюти¬
нации в пробирке с исследуемым образцом (пробирке 3) следует считать
эритроциты резус-положительными. При отсутствии таковой исследование
продолжают;
• супернатант из каждых 3 пробирок раститровывают на плоскости;
• в каждую каплю добавляют по 1 капле 5% суспензии сенсибилизированных
О Юн-эритроцитов; инкубируют на плоскости 10 мин;
• оценивают результат по поглощению АГС в супернатанте исследуемого
образца по сравнению с поглощением АГС образцом 0 Rh+. Контрольный
образец 1 эритроциты 0 Rh- не поглощают АГС. Чем больше поглощение,
тем меньше ступеней агглютинации. Разница в две и более ступеней - тест
на D„ положительный.
Выявление антиэритроцитных антител
Выявление аллоантител к антигенам эритроцитов происходит в два этапа:
• скрининг антител, т.е. определение наличия или отсутствия антител в иссле¬
дуемой сыворотке;
• идентификацию антител, т.е. определение специфичности выявленных
при скрининге антител.
Скрининг антител проводят с помощью тест-эритроцитов.
При первичном скрининге сывороток на антитела к антигенам эритроци
используют следующие образцы эритроцитов:
• эритроциты групп крови А и В - для выявления иммунных анти-А- и а
В-антител;
• эритроциты группы 0 — три образца с фенотипами ccDEE, CCwDee, ede.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1003
дальню иметь в панели также гомозиготы по генам М. N. S. % F/. iy.Jt.Jt.
пйГидентификации антител необходимо использовать 11-15-клеточиую м-
Гпитооцитов, которые должны нести антигены: D, С, С* Е с e M N S, s Р.
"fJ,K^.Fy-.Fyb*Jk*Hjkb.
1лтиэритр°Цитные аллоантитела образуются в результате трансфузий ино-
вНых эритроцитов. Выявление антиэритроцитных аллоантител проводят
оологических тестах с использованием различных сред (солевых, коллоидных.
8 с№0р°в низкой ионной силы, гелей) и специальных иммунных реагентов (аити-
^булиновой сыворотки). Для выявления гемолизирующих антител используют
' оненты комплемента. Выявление антител выполняют при различных темпе-
С. режимах-+37, *20 и *4 *С.
выявление полных изоиммунных антител проводят в реакции солевой агглю-
аЦИи при различных температурах - комнатной (22 'С), на холоде (-4 X) и в
0Є (37 “С). Для выявления неполных изоиммунных антител различной специ¬
фичности применяют реакции с использованием коллоидов (желатина, полиглю-
La) или непрямой антиглобулиновый тест (НАГТ).
Результатом взаимодействия антител определенной специфичности с соот-
ве1ствующими эритроцитными антигенами считается соединение нескольких
эритроцитов, регистрируемое как агглютинация. Реакция агглютинации протекает
в два этапа:
• присоединение антител к антигенам эритроцита:
• агрегация эритроцитов и формирование межклеточных белковых связей,
факторы, определяющие агглютинацию, делятся на специфические и неспеци¬
фические.
К специфическим факторам относятся:
; природа и строение антигенов;
• строение антител;
• концентрация антител.
К неспецифическим факторам относятся;
• силы сцепления и отталкивания (электростатические, гидрофобные, водо¬
родные), участвующие в ассоциации и диссоциации комплекса «антиген-
антитело»;
І электролитный состав среды;
• pH среды;
• температура.
Изменение температуры и pH среды приводит к более активному взаимодей¬
ствию антигенов и антител. Использование коллоидных и поликатионных доба¬
вок способствует снижению взаимного отталкивания эритроцитов, их сближению
и более активному взаимодействию с антителами.
Добавление ферментов (бромелина, папаина, фицина) модифицирует струк¬
туру антигенов эритроцитов и делает их более доступными для антител. Необ¬
ходимо, однако, помнить, что некоторые антигены эритроцитов (например. Fv*.
№*) разрушаются под действием ферментов, что может привести к ложноотрица-
™ьным результатам исследования.
Основной проблемой при выявлении антиэритроцитных антител остается
выбор метода исследования.
Данные об эффективности различных методов скрининга аллоантител приве-
Д?ны в табл. 25-52.
Мет°Я агглютинации в солевой среде
Наиболее простым методом выявления антител остается агглютинация суспен
Рованных в солевой среде эритроцитов. При этом сыворотку реципиента смеши
с ресуспендированными в солевой среде эритроцитами.
IQQ4 ШНСФУЗШНЙАЯ ИММУНОЛОГИЯ
Таблица 25-52. Эффективность различных методов скрининга антител к эритроцитным
пнам в сыворотке человека
Методы выявления
і Пятой
Г i солевой
среде
с 33% полиглю-
КИНОМ
конглютинация
с желатином
АГТ
гелевый
тест
магвигизациц
эритроцит»
АВ
Да
1
Да и нет, зави¬
сит от титра
Да
Нет
Да
Да
.
ОСЕ
Маловероятно
Да и нет, зави¬
сит от титра
Да
Да
Да
Да
Кк
Маловероятно
Да и нет, зави¬
сит от титра
Да
Да
Да
~тг~~
Ж
Нет
Нет
Нет
Да
Да
Да
Jk*. Jk*
Нет
Нет
Нет
Да
Да
Да
S
Маловероятно
Нет
Нет
Да
Да
Да
Lrte*
Да
Да
Да
Да
Да
Да
і
Да
Да
Да
Маловероятно
Да
Да
MN
Да
Маловероятно
Да
Маловероятно
Да
Да
H
Да
Маловероятно
Да
Маловероятно
Да
Да
После предварительной инкубации при комнатной температуре и/или
при 37 °С проводят центрифугирование. При этом выявляются преимущественно
анти-М*, N-, Р-антитела. Инкубация в течение 30 мин при 37 °С и последующее
центрифугирование позволяют выявить некоторые высокореакционные антитела,
такие как анти-D, К, Е. Кроме того, некоторые антитела (например, анти-Ье*, -Le6)
определяют лизис антигеннесовместимых эритроцитов.
Большинство клинически значимых антител связываются с эритроцитами при
инкубации, но не вызывают агглютинацию в солевой среде и выявляются в АП.
Антиглобулиновый тест
Для проведения антиглобулинового тестирования используют анти-IgG или
полиспецифическую антиглобулиновую сыворотку, содержащую анти-IgG и анти-
C3d, g. Анти-СЗсІ-, g-антитела в состве полиспецифической АГС позволяют
выявить некоторые редкие антитела, которые активируют комплемент, например
aHTH-Jk* и -Jkb.
НАГТ проводят путем инкубации сыворотки больного с эритроцитами донора
в течение 45 мин при +37 °С с последующим троекратным отмыванием эритроци¬
тов и добавлением антиглобулиновой сыворотки. Результат оценивают через 20
мин. Для повышения чувствительности теста эритроциты предварительно обра¬
батывают ферментами, а в качестве отмывающего раствора используют раствор
низкой ионной силы.
В организме иммунные антитела, взаимодействуя с антигенами мембраны эри¬
троцитов, вызывают их лизис, проявляющийся гемолизом различной степени.
Иммунные антитела активны при 37 °С и сохраняют активность при прогрева¬
нии сыворотки в течение 10 мин при температуре 70 °С, т.е. при условиях, когда
нормальные антитела полностью инактивируются. На этом различии основана
реакция определения нормальных и иммунных антител системы АВО.
Порядок проведения исследования. Исследуемую сыворотку (1-2 мл) раз-
водят в 2-4 раза раствором низкой ионной силы или 0,9% раствором натрия
хлорида во избежание коагуляции при нагревании. Сыворотку разливают поров¬
ну в две пробирки, одну из которых помещают в термостат при температур
70 "С на 10 мин. Полученные две порции сыворотки исследуют на антитела в соле*
вой среде и в непрямой пробе Кумбса.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1005
пял опреДеления титРа антител сыворотку предварительно титруют, получая
рдения от 1:4 до 1:1024. Реакции проводят с дважды отмытыми в 0.9% распит
^ атрия хлорида стандартными эритроцитами группы А(11) и В(Ш).
ходе данного исследования определяются три вида антител:
нормальные полные агглютинины (термолабильные):
* иммунные полные антитела (термостабильные);
* иммуНные неполные антитела (термосгабильные).
Общее заключение основывается на сопоставлении результатов всех исследо*
ва1»Й Наличие иммунных, термостабильных антител (полных и или неполных)
свидетельствует о трансфузии эритроцитной массы, несовместимой по сипе-
ме АВО. Титр иммунных антител обычно невысокий - редко превышает 1:8
для полных и 1:32 для неполных антител.
* Отсутствие иммунных антител и выявление естественных, нормальных
полных антител в высоких титрах (выше чем 1:128) отражает состояние
повышенной сенсибилизации организма в результате поступлении антигена,
несовместимого по системе АВО.
3 отсутствие иммунных антител и выявление естественных, нормальных пол¬
ных антител в титрах ниже чем 1:128 свидетельствует об отсутствии иэоим-
мунизации групповыми факторами системы АВО на момент исследования.
Принадлежность антител к тому или иному классу иммуноглобулинов может
быть установлена путем исследования сывороток с раствором унитиола, который
разрушает естественные антитела IgM, но не действует на иммунные антитела IgG.
Тест с раствором унитиола
Сыворотку смешивают с 5% раствором унитиола в соотношении 5:1. В качестве
контроля используют смесь сыворотки и 0,9% раствора натрия хлорида в том же
соотношении. Смесь сыворотки с унитиолом и контроль помещают в термостат
при 37 °С. После 15 мин инкубации смесь сыворотки с унитиолом и контроль
исследуют со стандартными эритроцитами.
При отсутствии агглютинации в опытном образце и ее наличии в контроле
можно сделать заключение, что исследуемые антитела относятся к классу имму ¬
ноглобулинов IgG.
Класс иммуноглобулинов можно определить также в прямом антиглобулино-
вом тесте, используя гелевые ID-карты («ДиаМед»).
Выявление анти-А1-антител
В крови лиц с группой крови А2 и А.,В могут присутствовать избыточные ирре-
гулярные антитела анти-А, По данным различных авторов, частота носительства
энти-А,-антител составляет 1-8% в группе А,, и 20-35% в группе А,В. Антн-А,-
антитела в большинстве случаев считаются холодовими и проявляют наибольшую
активность при низких температурах. Распространенность носительства антй-А,-
знтйтел при различных температурах (4,22 и 37 °С) приведена в табл. 25-53.
*®л*ы<а 25-53. Частота выявляемости анти-А,-антител при различных температурах
Температура
Распространенность, %
гнездования, °С
в сыворотке лиц с группой А2 (л-623)
в сыворотке лиц с группой А2В (№=285)
4
8.6
16,4
2.8
6,6
0
0,9
правило, а нти - А, - естествен н ые антитела относятся к классу иммуноглобу¬
лина^ В Редких слУчаях считаются иммунными и относятся к иммуногдобу-
«ГУМ
1006 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Принадлежность анти-А,-антител к тому или иному классу иммуноглоб
жвкЯ быть установлена с помощью гелевых ID-карт для определения раз ^ЛИй0в
классов иммуноглобулинов или при исследовании сывороток с 5% раствоооИЧНЫх
тиала, который разрушает естественные антитела IgM, но не действует §Р Щ
ные антитела, относящиеся к классу IgG. МмУн-
Ложноотрнцательные реакции при выявлении аллоантител
Ложноотрицательная реакция при выявлении антител к антигенам эритло
может быть обусловлена следующими причинами: Р°читов
• неправильным соотношением сыворотки и тест-эритроцитов;
• применением низкочувствительного метода исследования;
• отсутствием антигена, против которого были выработаны антитела в
эритроцитах. тест'
Аутоантитела
Аутоантитела против собственных (измененных или неизмененных) антиген
образуются при нарушениях в иммунной системе и развитии аутоиммунных забо¬
леваний, в частности аутоиммунной гемолитической анемии.
Для выявления аутоантител применяют прямой антиглобулиновый тест
(ПАГТ). Суть метода заключается в том, что аутоантитела, фиксированные (свя¬
занные с соответствующими детерминантами мембраны) на эритроцитах, отмы¬
тых от собственных плазменных белков (не менее 3 раз в большом объеме 0 9%
раствора натрия хлорида), связываются добавленной антиглобулиновой сыво¬
роткой. Результат оценивают через 10 мин. При аутоантителах, фиксированных
на эритроцитах in vivo, наблюдается агглютинация.
Новые технологии в иммуногематологических исследованиях эритро-
цитарных групп крови
Диагностические карты (Bedside-карты) для определения групп крови по систе¬
мам АВО, резус и соответствия групп крови донора и реципиента.
В последние годы стали доступны специально разработанные карточки с нане¬
сенными на них высушенными группоспецифическими моноклональными
антиэритроцитными антителами, позволяющие определять группу крови АВО
1 резус-фактор, - диагностические карты «Элдонкард» (Дания) или эритротест
«Группокарт» (Россия).
Карты изготовлены из специального пластика и имеют четыре поля для тестиро¬
вания. На поля наносятся моноклональные анти-А-, анти-В- и анти-Б-сыворотки.
Четвертое поле - контрольное.
«Элдонкард» выпускают в нескольких модификациях:
одинарные - для определения группы крови АВО и резус-фактора (D);
двойные - для определения соответствия групп крови донора и реципиента.
Диагностические карты можно использовать для определения группы крови
в практике семейного врача, у постели нетранспортабельных больных, перед гемо¬
трансфузией (подтверждающее определение), в чрезвычайных и экстремальных
ситуациях (боевые действия, конфликты, на транспорте — суда, поезда, в трудно¬
доступных местах - нефтяные платформы, аварии и т.п.), для обучения студентов
методам определения групп крови.
Определение групп крови с помощью карт — не только компактная и дешевая
одноразовая технология, не требующая особого оснащения, но и позволяющая
документировать наглядный результат и сохранять его в течение длительного
(до 6 мес и более) времени. Одним из существенных преимуществ карт для опреде¬
ления групп крови считается также то, что их можно хранить при условиях от +
до -8 “С продолжительное время (до 30 мес) без потери качества.
Следует особо отметить одно важное обстоятельство. Несмотря на высок
качество имеющихся на медицинском рынке карт для определения группы крови
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1007
^уС-фактора, они не могут быть использованы для сертифицированного опре-
иР'я групповой принадлежности донора или пациента.
Щш можно использовать при первичном определении группы крови, перед
^нсфузнєй для подтверждения групповых свойств крови донора и реципи-
а также в экстренных случаях. Для документирования в истории болезни,
яон°рск0^ каРте* жУРнале> паспорте групповая принадлежность индивидуума
§ ||| быть установлена только при исследовании образцов крови в лаборатор¬
ії условиях.
методика
Идентификационные ID-карты «ДиаМед» (Швейцария) используют для спектра
.^гематологических исследований эритроцитов, то есть для одновременного
уделения группы крови АВО и резус-принадлежности, типирования антигенов
0 итроцитов, выявления антител и проведения проб на совместимость. Порядок
определения определен приказом М3 РФ №2 от 09.01.1998 г. («Об утверждении
іструкций по иммуносерологии»).
ID-карты «ДиаМед» представляют собой пластиковые карточки, в которые
напоены по шесть микропробирок. Каждая микропробирка содержит гель
Sephadex либо нейтральный, либо содержащий антисыворотки различной специ¬
фичности.
Принцип метода основан на реакции агглютинации в геле.
При исследовании антигенов эритроцитов исследуемые эритроциты добавляют
в пробирку, содержащую специфические антисыворотки. При соотвествующем
антигене на эритроцитах происходит агглютинация, которая усиливается при цен¬
трифугировании ID-карт. Образующиеся агглютинаты остаются в виде полоски
на поверхности геля в верхней части микропробирки, поскольку не проходят через
гель из-за большого размера (положительный результат).
При отсутствии антигена на исследуемых эритроцитах агглютинации не проис¬
ходит и эритроциты при центрифугировании проходят через гель и оседают на дне
пробирки (отрицательный результат).
Материально-техническое обеспечение метода включает центрифугу на 9,12
или 24 карты.
В лабораториях с большим количеством исследований (свыше 120-150 образ¬
цов в день) целесообразно использование автоматических анализаторов.
Метод магнитизации эритроцитов
Метод магнитизации эритроцитов — это нанотехнология в иммунопатологи¬
ческих исследованиях. Метод разработала в 2004 г. компания Diagast.
Принцип метода основан на использовании намагниченного раствора для закре¬
пления магнитных частиц на эритроцитах образца. На магнитной плате проис¬
ходит агглютинация, и намагниченные эритроциты образуют компактную точку
на дне лунки микропланшета. Использование магнитных пластин исключает
этапы центрифугирования (гелевые технологии) и/или отмывания эритроцитов
(рутинный метод).
Материально-техническое оснащениие метода включает полностью автомати¬
зированный анализатор Qwalys при объеме исследования свыше 120-150 образ¬
ов в день или мини-лаборатории FryLys Nano.
Метод магнитизации эритроцитов используют для всего спектра иммуногема-
хологических исследований:
I определения группы крови ABO/Rh-фенотипа;
I скрининга и идентификации антиэритроцитных антител;
* проведение проб на совместимость крови донора и реципиента.
При определении ABO/Rh-фенотипа микропланшет после раскапывания поме-
1°т на шейкер, включают программу Р1, инкубируют 10 мин при комнатной
1008 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
температуре, помещают на магнитную плату на 3 мин, затем для усиления
микропланшет переносят на шейкер и включают программу Р2. Результат
ляют визуально или автоматически. Компактная точка скопившихся эритт^®6'
на дне лунки регистрируется как положительный результат, при равномеон '®"т°8
пределнии эритроцитов — отрицательный. Цр|
Для выявления антител, определения их специфичности И проведения
на совместимость используют антиглобулиновый тест. пР°б
При антиглобулиновом тесте используют микропланшеты с нанесен
™ по лункам aHTn-IgG-антителами. Затем в лунки последовательно добавля^'"
50 мкл раствора NanoLys, необходимого для освобождения антигенных стп\п»!!
эритроцитов. 50 мкл «Дилюента», 15 мкл стандартных магнитизированных а
троцитов и 15 мкл исследуемой сыворотки/плазмы. После этапа инкубирован
микропланшет помещают на магнитную плату и встряхивают 3 мин по програм
РЗ. Результат определяют визуально или автоматически. Слой равномерно pa I
пределенных по дну лунки клеток регистрируется как отрицательный результат
компактная точка скопившихся клеток — как положительный.
Результаты определения группы крови АВО и резус-принадлежности при тести¬
ровании образцов крови доноров приведены в табл. 25-54.
Таблица 25-54. Определение группы крови ABO/Rh и фенотипа
Тест
Количество
образцов
Количество образцов
с невыявленной группой крови АВО, %
Количество образцов
с невыявленными Rh, %
АВО
1250
8 (0,64%)*
8 (0,64%)**
Фенотип
662
Фенотип определен
* Несоответствие прямой и непрямой реакции.
** DVI были определены как отрицательные.
Сравнение метода магнетизации эритроцитов и гелевого метода
Общие данные по сравнению метода магнетизации эритроцитов и гелевого
метода приведены в табл. 25-55.
Таблица 25-55. Сравнительная характеристика метода магнетизации и гелевой технологии
Метод
Гелевая
магнетизации
технология
Оборудование
Мини-лаборатория, FREELYS, QWALYS
| Центрифуга, инкубатор
Расходный материал
Микропланшеты с сухим реагентом
Гелевые карты ИИ _
Растворы Bromeline, Magnelys
Раствор солевой, раствор Liss, а _
Стандартные эритроциты: I-II-III, А, В
Стандартный яритрпциты І-ll.I-II-III-IV, I-IFIH, Ii, А1В
Расходный материал лля определения группы АВО. резус и Келл-фенотипа
1 микропланшета на 8 образцов: A-B-AB-D-C-c-E-
16 карт на 8 образцов: A-B-AB-D-CDE-Cek-A1-B
e-Kell-Ctr-A1-B
Стоимость 1 исследования — 92 руб.
Стоимость 1 исследования —130 руб.
Скрининг антител
1 микролланшета на 32 образца
6- или 8-канальные карты — 6 образцов
Стандартные эритроциты 1-II-II!
Стандартные эритроциты І-ІІ-Ш ——'
Стоимость 1 исследования — 50 руб.
Стоимость 1 исследования — 95 руб;
При сравнении чувствительности методов выявления антител (табл.
наблюдают некоторое снижение чувствительности метода магнетизации, пос
ку этим методом не выявляются анти-1§М-антитела.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1Щ
25-56. Сравнение чувствительности методов магнетизации и гелевой технологии
выявлении антител
Количество проб.
гМ590
QWAKYS
96
98,96*
DlaMed
96
100
Тйвыявлены АТ, относящиеся к классу иммуноглобулинов IgM.
Однако при определении специфичности при двойном разведении исследуемой
сиворотки более высокие показатели были получены в методе магнетизации эри-
5роцитов (табл. 25-57).
Улица 25-57. Сравнение чувствительности методов магнетизации и гелевой технологии
при определении специфичности антител
^Специфичность
Количество
QWAKYS
DiaMed
Anti-D
26
26
22
Afiti-E
10
8
9
Anti-C
6
6
6
Anti-Є
1
1
1
Anti-K
12
10
12
Anti-Fya
10
10
10
Afiti-Jka
5
5
5
Anti-Jkb
1
1
0
Anti-S
1
1
І
Adti-Lub
2
2
2
Комбинация антител
16
16
16
Всего
90
86
84
Положительных, %
—
95,6
93,2
АНТИГЕНЫ ТРОМБОЦИТОВ
На поверхности мембраны тромбоцитов присутствуют специфические белки -
гликопротеиды (GP), образующие между собой комплексы, самыми значимыми
из которых считаются GPIb/IX/V, GPIa/IIa, GPIIb/IIIa. В настоящий момент
установлено, что на одном тромбоците представлено GPIa в количестве 2000,
GPIIa I 5000, GPIb — 25 ООО, GPIIb/IIIa - 80 000. Мембранные гликопротеиды
играют важную роль в выполнении основных функций тромбоцитов - агрегации,
взаимодействии с эндотелием и субэндотелием сосудов, плазменными фактора¬
ми свертывания крови. Кроме того, в гликопротеиды интегрированы антигены
многих систем: эритроцитных, главного комплекса гистосовместимости (HLA),
собственно тромбоцитных. Внутривидовые различия людей по антигенам тром¬
боцитов имеют большое клиническое значение в таких областях медицины.
Щ трансфузиология, акушерство, трансплантология. При переливании компо¬
нентов крови, во время беременности, при пересадке органов и тканей в организм
человека попадают чужеродные тромбоцитные антигены, которые могут вызвать
иммунный ответ — выработку иммунных антител.
На тромбоцитах представлены антигены эритроцитных систем АВО, Левис. Ii,
- но отсутствуют антигенные детерминанты систем резус, Даффи, Келл, Кидд
и Лютеран. Антигены системы АВО локализованы на десяти гликопротеидах
тромбоцитов - GPIa (CD49b), GPIb (CD42b), GPIIa (CD29), GPIIb (CD41), GPnia
FJl). GPIX (CD42a), PECAM-1 (CD31), GPIV (CD36). GPV (CD42d), гликозил-
т°сфатидилинозитол-якорном протеиде CD109 и гликосфинголипидах. Степень
1010 ТИІНСФУЗИОННАЯ ИММУНОЛОГИЯ
выраженности антигенов системы АВО на тромбоцитах считается генетиче
детерминированным признаком, характерным для каждого конкретного чело*
Необычным свойством тромбоцитов считается пропорциональная коэкспр^^
антигенов А и Н. На тромбоцитах доноров с высокой экспрессией антигена ?
наблюдается и высокая экспрессия антигена Н. Это парадоксальное явление, с**
сгвенное тромбоцитам, можно объяснить следующим образом: Н-эпитопы нед
дятся главным образом на трех мажорных тромбоцитных белках: GPIlb, ср]п
I GPIb. Ha GPIlb и GPIIIa присутствуют цепи 2-го типа N-полисахарида, 8-ю»!
которых могут быть представлены активными Н-эпитопами. Эти Н-эпитоггы
в свою очередь, могут быть модифицированы в А- или В-антигены под действием
соответствующих гликозилтрансфераз, что и происходит на эритроцитах. GPIb
будучи по химической природе сиаломуцином, имеет ограниченное количество
цепей N-полисахаридов (3-4 цепи против 11 на GPIlb и GPIIIa), однако на нем
представлено большое количество цепей О-углеводов (50-60), составляющих 60%
молекулярной массы всей структуры GPIb. Большинство этих углеводов пред¬
ставлено в виде дисиалоолигосахаридов, имеющих два внутренних ответвления
Минимальным структурным компонентом считается фукозилированный моно-
сиалоолигосахарид с Н-подобной активностью, количество которого составляет
75 000 эпитопов на один тромбоцит. Присутствие разветвленных структур и высо¬
кая плотность О-углеводов на GPIb приводят к тому, что Н-подобные эпитопы
не подвергаются дальнейшей трансформации в А- и В-антигены соответствую¬
щими гликозилтрансферазами. Повышенная активность Н-фукозилтрансферазы
может привести к одновременному увеличению экспрессии антигена Н на 0-
н N-углеводах, что приведет к повышенному синтезу антигена А под действием
А-гликозилтрансферазы на N-полисахаридах.
На тромбоцитах лиц с группой крови А2 отсутствует как антиген А, так и анти¬
ген Н. что характерно для такого генетического феномена, как тип «Бомбей»,
описанный для антигенов эритроцитов.
На тромбоцитах доказано присутствие антигенов главного комплекса гисто¬
совместимости (HLA) первого класса локусов HLA-A, -В, -С. Сведения отно¬
сительно происхождения антигенов системы HLA противоречивы, существует
несколько точек зрения относительно их природы. По мнению одних исследо¬
вателей, антигены системы HLA интегрированы в мембранные гликопротеиды,
другие ученые полагают, что антигены системы HLA только адсорбированы
на поверхности тромбоцитов. Исследования Као и соавт. (1990) внесли ясность
в данный вопрос. Они изучили общее количество HLA на тромбоцитах с помо¬
щью меченного р| Fab-фрагмента анти-НЬА-моноклонального антитела W6/32
и показали, что на одном тромбоците содержится от 54 782 до 116 185 (в среднем
81 587120 016) молекул HLA-A, -В, -С, причем 70-80% антигенов адсорбиро¬
ваны на тромбоцитах из плазмы. Количество HLA-A и HLA-В на тромбоцитах
разных людей может сильно различаться. Так, различия между минимальной
и максимальной концентрацией HLA-A2, -В5, -В7, -В27, -ВІЗ детерминант могут
достигать двукратных, HLA-B8 - восьмикратных и HLA-B12 - 35-кратных
значений. Например, количество молекул HLA-A2 колеблется у разных индиви¬
дов от 4400 до 10 000, HLA-Bw4 - от 870 до 8400, HLA-Bw6 - от 1300 до 5800.
Антигены локуса HLA-С выражены слабо, присутствие антигенов HLA II класса
(D-региона) на тромбоцитах не доказано. В последнее время появилось много
доказательств локализации антигенов системы HLA на отдельном тромбоцитном
гликопротеиде, обозначаемом как GPHLA.
Специфические антигены тромбоцитов (система НРА)
Тромбоцитам свойственны свои специфические антигены. Исторически анти¬
гены обозначали начальными буквами фамилий больных, у которых обнару***
іШШШодИВЯии антитела. После накпппрния гнрлрний пб антигенах тромб0
r
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГШОТНАНСФУЗИЙ 1011
- стало ясно, что одни и те же антигены имеют разные обозначения, а смзи
стала очевидной необходимость систематизации накопленных данных
1.990 г. на рабочем совещании по тромбоцитной иммунологии Международного
^ства трансфузиологов была создана новая номенклатура тромбоцитслеци-
^ческих антигенов, которые стали обозначать символами НРА (Нилыл Plaieiet
j с цифровым обозначением локуса и буквенным обозначением аллеля
і д новую номенклатуру включили антигены с расшифрованной молекулярной
^шурой как самой белковой молекулы, так и гена, кодирующего ее синтез.
I 0 настоящее время в систему НРА включены 32 диаллельньи, кодомннантно
^едуемых гена, объединенных в шестнадцать локусов. В исследованиях пока-
1но. что один аллель, как правило, встречается значительно чаще другого. Часто
встречающийся аллель имеет символ а, редко встречающийся - Ь. Наиболее
Щученными считаются аллоантигены шести локусов: НРА-1-НРА-5 и НРА-15.
которые идентифицированы серологическими методами (с помощью иммунных
сывороток, полученных от человека). Среди антигенов локусов HPA-6w~HPA-
14W, HPA-16W с помощью иммунных сывороток можно определить только один
цельный вариант — Ь, поскольку сыворотки к часто встречающемуся антигену
а пока не получены. Однако молекулярное строение всех генов и антигенов, ука¬
занных локусов НРА расшифровано полностью. Установлено, что полиморфизм
НРА обусловлен заменой одного нуклеотида или делецией триплетов нуклеотидов
в молекуле ДНК гена, что соответственно приводит к замене или утрате аминокис¬
лоты в зрелой белковой молекуле антигена. Каждый аллоантиген интегрирован
в определенный гликопротеид тромбоцитной мембраны.
Сводные сведения относительно тромбоцитспецифических антигенов, вклю¬
ченных в новую классификацию, представлены в табл. 25-58.
Антигены локуса НРА-1 локализованы на гликопроггеиде GPllla. Раньше
их обозначали как Zw*-b и PlAU. НРА-la встречается у 97,9% европеоидов, НРА-
1 - у 28,8%. Появление аллельного гена обусловлено заменой тимина на цито¬
зин в 196-й позиции ДНК от начала смыслового кодона. В 33-й позиции зрелого
белка-антигена наблюдается замена аминокислоты лейцина на пролин.
Таблица 25-58. Тромбоцитспецифические антигены системы Human Platelet Antigens, локализа¬
ция и молекулярная основа полиморфизма аллельных генов
Локусы
НРА
Антиген
Альтерна¬
тивное
название
Распростра-I
ненность
у кавказои-
дов,%
Локализация
нагликопро-
теиде
Различия
аллельных I
генов
Различия
аллельных
аитигмоа
j
НРА-1
НРА-1 а
Zw\ PI*'
97,9
GPllla
Vа
Лейцин®
НРА-1 b
Zw», PI*2
28,8
С*
Пролин*
НРА-2
НРА-2а
НРА-2Ь
Ко»
Koa, Sib*
>99,9
13,2
GPtb
С*
T»
Треонин1*
Мотионии1**
НРА-3
НРА-За
НРА-ЗЬ
Bak*, Lek*
Bak»
80,95
69,8
GPIIb
Г*
G““
ИзолоИцинм 1
Серии*0
НРА-4
НРА-4а
НРА-4Ь
Yuk», Pen*
Yuk*, Pen»
>99,9
<0,1
GPllla
G“
А*
Аргинин1* 1
Глутамин1*
НРА-5
НРА-5а
НРА-5Ь
Br*, Zav*
Br*, Zav*, He*
99,0
19,7
GPIa
ш
А’™
Глутаминовая юс-1
лота"
Лизин"»
HPA-6bw
Ca*. Tu*
0,7
GPllla
G’**
А**
Аргинин*
Глутамин"
ПйСГ
HPA-7bw
Mo
0,2
GPllla
с**
G’*
Пролин*
Алании*
HPA-8bw
Sr*
<0,01
GPllla
с**
1 t*cW» 1
4Q^2 трансфузионная иммунология
Окончание
табл.:
! Лвиуеы
j НРА
Антиген
1
і Альтерна¬
тивное
название
Распростра¬
ненность
у кавказои¬
дов, %
Локализация
на гликопро¬
теиде
Различия
аллельных
генов
—
Различия
млелщщ
антигенов
1 НМ-9
I HPA-9bw
{
Max*
0,6
GPIlb
02603
даюэ
Валйй®'~''
Метионин®
І НМ-10
j HM-10bw
La*
<1,6
GPIIIa
СП
Аргиніщв
Глутамин®
1 НРА-И
HPA-ltbw
Gro*
<0,25
GPIIIa
01996
Д1996
Аргинин6^
Гистидин®
І НМ-12
HPA-12bw
ІУ*
0.4
GPIb
ш
ш|
Глицин’5
Глутаминовая
кислота’5
I НРА-13
HPA-13bw
Sit*
0,25
GPIa
02581
J2531
Треонин™
Метионин™
1 НМ-14
HPA-14bw
Oe*
<0,17
GPIIIa
MAG1929'133'
ДЛизин5"
НМ-15
HPA-15a
HPA-15b
Gov*
Gov*
81
74
CD109
Q2108
Д2108
Серии™
Тирозин®
НРА-16
HPA-16bw
Duv*
<1
GPIIIa
0517
pi7
Треонин’*
Изолейцин”1
Антигены локуса НРА-2 находятся на GPIb. НРА-2а, ранее обозначаемый
как Коь, встречается с частотой более 99,9%. НРА-2Ь, обозначаемый ранее сим¬
волами Ко* или Siba, встречается с частотой 13,2%. Появление аллельного гена
связано с заменой цитозина на тимин в 524-й позиции ДНК от начала смыслового
кодона. В белковой молекуле антигена в позиции 145 обнаруживается замена
треонина на метионин.
Антигены локуса НРА-3 расположены на GPIlb. Оба аллельных антигена встре¬
чаются довольно часто: HPA-За (Baka, Leka) можно обнаружить у 80,95% евро¬
пеоидов, а НРА-ЗЬ (Вакь) — у 69,8%. У гена HPA-За в 2622-й позиции ДНК при¬
сутствует тимин, образующийся новый триплет кодирует синтез аминокислоты
изолейцин в 843-й позиции белковой молекулы антигена. У гена НРА-ЗЬ в 2622-й
позиции смыслового кодона присутствует гуанин, что приводит к синтезу амино¬
кислоты серии в 843-й позиции зрелого белка.
Антигены локуса НРА-4 находятся на GPIIIa. НРА-4а (Yukb, Репа) встречается
у 99,9% европеоидов, содержит аминокислоту аргинин в 143-й позиции белковой
молекулы антигена, что связано с присутствием гуанина в 526-й позиции ДНК.
HPA-4b (Yuk*, Репь) встречается крайне редко, в 0,1% случаев у европеоидов,
имеет глутамин в 143-й позиции белковой молекулы, что обусловлено присутстви¬
ем аденина в 526-й позиции ДНК.
Антигены локуса НРА-5 локализованы на GPIa. Распространенность НРА-5а
(Brb, Zayh) у европеоидов составляет 99,0%, a HPA-5b (Bra, Zav6, Не3) В 19,7%.
Наличие аллельного гена обусловлено заменой гуанина в 1648-й позиции ДНК
на аденин. а в белковой молекуле — глутаминовой кислоты в 505-м положении
белковой молекулы на аминокислоту лизин. В 2004 г. в локусе НРА-5 выявлен
третий аллельный ген — НРА-5с, характеризующийся присутствием триплета
нуклеотидов GTG (гуанин-тимин-гуанин) в позиции 1648-1650, что соответству¬
ет аминокислоте валин в 505-й позиции антигена.
У антигенов локусов HPA6w-HPA14w, HPA16w описаны только редко встреча¬
ющиеся аллели, их характеристики уточняются, поэтому антигены локусов имеют
символ w (находящиеся на рассмотрении Рабочего совещания иммуногенетиков).
Для HPA-6bw (Са*. Тиа) распространенность у европеоидов составляет 0,7%-
Антиген расположен на GPIIIa, содержит аминокислоту глутамин в 489-й позиции,
ген НРА-6bw содержит в 1564-й позиции ДНК аденин. Его аллельный ген
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1013
.1^4-й позиции ДНК содержит гуанин, а антиген — аминокислоту аргинин
1позиции зрелого белка.
• 8 Антиген HPA-7bw (Мо) локализован на GPllla, встречается с частотой 0,2%.
і я гене, ответственном за фенотипическую экспрессию антигена, в 1267-й позиции
«НК находится гуанин (у аллельного гена — цитозин), что приводит к синтезу
камина в 407-й позиции белковой молекулы (у аллельного антигена - аминокис-
Й пролина).
Антиген HPA-8bw (Sr®), локализованный на GPllla, встречается крайне редко —
О 01% европеоидов. Ген HPA-8bw имеет в 2004-й позиции ДНК цитозин (аллель-
L$reH — тимин), а в 636-й позиции белковой молекулы — аминокислоту цистеин
Цельный антиген - аргинин).
Антиген HPA-9bw (Мах3) расположен на GPlIb, встречается с частотой 0,6%.
«2603-й позиции гена находится аденин (у аллельного гена - гуанин), что при¬
водит к синтезу аминокислоты метионина в 837-й позиции белковой молекулы
(«аллельного антигена - валина).
Антиген HPA-lObw (La3), расположенный на GPllla, встречается с частотой
16%. содержит аминокислоту глутамин в 62-й позиции белка (у аллельного анти¬
гена Ц аргинин), ген HPA-lObw имеет в 281 позиции ДНК аденин (у аллельного
гена - гуанин).
Антиген HPA-llbw (Gro3), встречающийся с частотой 0,25%, локализован
на GPIHa. Присутствие аденина в 1996-й позиции ДНК (у аллельного гена - гуа¬
нина) определяет синтез гистидина в 633-й позиции белковой молекулы (у аллель¬
ного антигена - аргинина).
Антиген HPA-12bw (Iy3), встречающийся с частотой 0,003-0,004%, располо¬
жен на GPIb, содержит глутаминовую кислоту в 15-й позиции белка (у аллель¬
ного антигена — глицин). Ген HPA-12bw содержит аденин в 141-й позиции ДНК
(у аллельного гена — гуанин).
Антиген HPA-13bw (Sit3), встречающийся с частотой 0,0025%, расположен
на GPIa. В 2531-й позиции ДНК находится тимин (у аллельного гена - цито¬
зин), а в 799-й позиции белковой молекулы антигена - аминокислота метионин
(уаллельного антигена — треонин).
Антиген HPA-14bw (Ое3), встречающийся с частотой 0,17%, расположен
на GPllla. От своего аллельного гена отличается делецией триплета AAG (аденин-
аденин-гуанин) в позиции 1929-1931 ДНК от начала смыслового кодона, в 611-й
позиции белковой молекулы антигена происходит делеция лизина.
Аллельные антигены локуса НРА-15 (Gov3 и Govb), встречающиеся с частотой
81 и 74% соответственно, расположены на гликопротеиде, распознаваемом моно¬
клональным антителом aHTH-CD109. Молекулярная основа аллельности заключа¬
ется в присутствии цитозина или аденина в позиции 2108 от начала смыслового
кодона, что определяет синтез серина или тирозина в 703-й позиции белковой
молекулы антигена.
Антиген НРА-16 (Duv3) локализован на GPllla. Различия аллельных генов
заключаются в присутствии цитозина или тимина в 517-й позиции ДНК, различия
дельных антигенов — в присутствии треонина или изолейцина в 140-й позиции
трипептидсвязывающего домена гликопротеида.
В единую классификацию скоро войдет антиген Swia, обнаруженный в 2006 г.
немецкими тромбоцитологами. Он будет представлять HPA-17bw. Антиген лока¬
лизован на GPIa. Различия аллельных генов заключаются в присутствии цитозина
или тимина в 3389-й позиции ДНК, различия - в присутствии треонина или мети-
иииа в 1116-й позиции белковой молекулы антигена.
Описаны редкие аллели еще двух тромбоцитспецифических антигенов, кото-
j л°ка не вошли в новую классификацию, так как не расшифровано молеку¬
лярное строение ни самих антигенов, ни генов, ответственных за их синтез. Это
JOT4 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
t' антиген Va\ встречающийся с частотой 0,004% и локализованный на С.рпь а
и антиген Мои*. *,а
В настоящий момент идентифицированы не все тромбоцитспецифическиеа
к гены. Продолжается накопление фактов, свидетельствующих о существоваНТИ
■ новых, неизученных антигенных систем тромбоцитов. Обнаружению новых |1р
встречающихся тромбоцитспецифических антигенов способствуют исследова
супружеских пар при рождении у них ребенка с неонатальной аллоиммунГ"
тромбоцитопенией. Исследования сывороток матерей с тромбоцитами оті°И
позволили выявить в 2005 г. еще два новых редких антигена, условно обозначе
ных Aus и Sta. частота которых составила 0,56%.
В настоящее время доказано, что почти каждый гликопротеид несет на своей
поверхности антигенные детерминанты (табл. 25-59). Плотность экспрессии HLA-
детерминант на тромбоците значительно меньше, чем антигенов системы НРА
Эти данные позволяют объяснить факты, свидетельствующие о более сильном
взаимодействии с тромбоцитами анти-НРА-антител по сравнению с анти-HLA-
антителами. и предполагать значительную иммуногенность собственно тромбо-
цитарных антигенов.
Таблица 25-59. Тромбоцитные гликопротеиды и интегрированные в них аллоантигены
Гликопротеид
Количество гликопротеидов на одном
тромбоците
Аллоантигены
GPIa
2000
А, В, НРА-5,13w, Swi*
GPIIa
5000
А, В
GPIb
25 000
А, В, НРА-2,12w
GPIX
25 000
А, В
GPIlb
80 000
А, В, НРА-3, 9w
GPIIIa
80 000
А, В, НРА-1,4, 6w, 7w, 8w, 10w, 11w, 14w, 16w,
Va*
GPIV
10 000
A, В
GPV
?
A, В
PECAM
10 000
A, В
CD109
2000
А, В, HPA-15
GPHLA
348 000
HLA
?
?
Aus, Sta, Mou‘
Аллоиммунизация к антигенам тромбоцитов
Несовместимость по антигенам тромбоцитов между донором и реципиентом,
матерью и ребенком способствует аллоиммунизации и следующим патологиче¬
ским состояниям:
І постгрансфузионной тромбоцитопенической пурпуре;
і пассивной постгрансфузионной тромбоцитопенической пурпуре;
• посттрансфузионным осложнениям негемолитического типа - иммуноло¬
гической рефрактерности к переливанию донорских тромбоцитов, фебриль¬
ным. аллергическим реакциям и осложнениям;
в иммунной тромбоцитопении после трансплантации стволовых клето
или органов;
s неонатальной аллоиммунной тромбоцитопенической пурпуре.
Посттрансфузионная тромбоцитопеническая пурпура (ПТП) развивается
у реципиентов, имеющих в анамнезе беременности или переливания компонентов
крови. В результате аллоиммунизации в крови таких больных могут появитьс
анти-НРА-антитела одной или нескольких специфичностей. Шульман (Schulm ]
в 1961 г. первым заметил, что данная патология развивается после переливані
аллогенных тромбоцитов, имеющих антигены-мишени для существующих а
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ Шб
ajo осложнение чаще возникает у женщин и реципиентов-мужчин с геноти-
Щтірд-lb/b. В течение 4-11 сут после трансфузии донорских тромбоцитов про-
5°** йТ снижение количества тромбоцитов периферической крови ниже уровня,
^сгвенного пациенту, т.е. происходит деструкция собственных тромбоцитов.
тиПИчНЬ,ми клиническими проявлениями данной патологии считаются кож-
геморрагии, мелена и гематурия, продолжающиеся от 3 до 12 дней. Иногда
даются сильные кровотечения из внутренних органов, кровоизлияния
Й д, восстановление количества тромбоцитов до прежних значений происходит
,м°чеНие 3-50 сут после прекращения трансфузий и выведения антител из орга¬
на больного.
Ключевыми звеньями в патогенезе ПТП считаются нарушения в иммунной
Jp реципиента (срыв иммунологической толерантности) из-за стимуля-
чужеродными аллоантигенами тромбоцитов, отсутствующих у больного,
п явление аутореактивных антитромбоцитных антител приводит к деструк-
собственных тромбоцитов реципиента. Исследования сывороток реципи-
с ПТП доказали, что деструкция аутологичных тромбоцитов происходит
за транзиторных панреактивных антитромбоцитных антител, относящихся
lgG3. Другим аспектом патогенеза ПТП считают действие аллоиммунных
зктител класса IgGl. Фрагменты гликопротеидов донорских тромбоцитов с фик¬
сированными антителами могут адсорбироваться на интактных тромбоцитах
реципиента, превращая их из антигенотрицательных в антигенположительные.
Например, действие анти-НРА1а-антител реципиента подразумевает их фикса¬
цию на GPIIb/IIIa донорских тромбоцитов, которые, в свою очередь, соединяются
с такими же гликопротеидными комплексами тромбоцитов больного, превращая
йизНРА-1а-отрицательных в НРА-1а-положительные. Формируется иммунный
комплекс, состоящий из гликопротеидов донора, реципиента и антител реципи¬
ента, Тромбоциты, нагруженные таким иммунным комплексом, подвергаются
деструкции фагоцитами в ретикулоэндотелиальной системе. У аллоиммунизиро-
МИНМУ больных с наследственной патологией структуры тромбоцитов - тромба-
сгенией Гланцманна и Бернара-Сулье, которым свойственно отсутствие GPIIb/IIIa
и GPIb/IX соответственно, посттрансфузионная тромбоцитопеническая пурпура
І возникает, что подтверждает вовлеченность гликопротеидов в патогенез данной
патологии.
Пассивная посттрансфузионная тромбоцитопеническая пурпура встречается
редко, но остается довольно опасным следствием переливания плазмы от доноров,
аллоиммунизированных в процессе беременности или трансфузий компонентов
крови. Описаны случаи пассивного переноса анти-HPAla- и анти-НРА5Ь-антител,
закончившиеся гибелью больных.
^тромбоцитные антитела
Образование антител к тромбоцитным антигенам зависит от основного заболе-
|НИя пациента. Аллоиммунные антитела достоверно чаще выявляют у больных
I Хаотической анемией (63,9%) и миелодиспластическим синдромом (67,2%),
в группе пациентов с разными вариантами острых лейкозов (42,9%). У боль-
с апластической анемией, острым лейкозом и лимфопролиферативными
клеваниями частота обнаружения изолированных анти-НРА достоверно пре¬
дает таковую изолированных анти-НЬА-антител. Следует отметить, что среди
■Хых с острым лейкозом пациенты с изолированными анти-НЬА-антителами
^речаются исключительно редко — 1 случай в год (5,1%). Больные с миелоди-
Кынр1ЧеСКИМ синдромом одинаково часто иммунизированы к антигенам систе-
знтя и И ® группе больных с хроническим миелолейкозом изолированные
и НРА встречаются в два раза чаще анти-НІА-антител, у 44,5 и 22,2% пациен-
гоответственно. Суммарно аллоиммунные изолированные анти-НРА-антитела
im ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
обнаруживают у 28% больных с заболеваниями системы крови, в сочетании
с «гги-НІА-антителами — у 17,13%, изолированные анти-НЬА-антитела выяв¬
ляют у 12,77% пациентов. Аллоиммунизация к антигенам тромбоцитов в Зо*/
случаев обусловлена присутствием у реципиентов антител с высокой частотой
реагирования и в 70% случаев - с низкой. Часто реагирующие антитела выраба¬
тываются у пациентов к часто встречающимся в популяции антигенам НРа, ре«Ко
реагирующие - к редко встречающимся. Самыми уязвимыми в плане аллоимму-
иизации считаются пациенты, гомозиготные по редким аллелям НРА, так как они
иммунизируются часто встречающимися антигенами НРА доноров тромбоцитов
Наоборот, реципиенты с частыми аллельными антигенами системы НРа под¬
вержены иммунизации в отношении редких в популяции антигенов тромбоцитов
доноров.
При трансфузионной терапии компонентами крови образование аллоиммун-
иых антител происходит не у всех больных. Склонность к антителообразованию
зависит от HLA- и НРА-генотипа. Например, несмотря на то что частота лиц,
гомозиготных по НРА-ЗЬ-аллелю, составляет около 20%, анти-НРА-За-антитела
у больных с генотипом НРА-ЗЬ/Ъ встречаются исключительно редко. Для ини¬
циации иммунного ответа на чужеродные белки необходимы определенные анти¬
гены системы HLA у реципиента. Это может быть связано либо с необходимостью
присутствия определенных структур в пептидсвязывающей бороздке иммуноком-
петентных клеток, которым презентируется антиген, либо с наличием неравновес¬
ного сцепления некоторых HLA с генами иммунного ответа. Доказано, что присут¬
ствие HLA-B8, HLA-DRw52, DR3, DRw6 у больного ассоциировано с повышенной
склонностью образования анти-НРА1а-антител.
У значительной части больных анти-НРА-антитела выявляются после 6-8
трансфузий тромбоцитов. Результаты динамического исследования с параллель¬
ным изучением анти-НРА- и анти-НЬА-антител показывают, что у значительной
части пациентов с заболеванием системы крови анти-НРА-антитела появляются
раньше, чем анти-НЬА-антитела.
Аллоиммунизация реципиентов к антигенам систем НРА и HLA происходит
не только при компонентной терапии тромбоцитами, но и эритроцитсодержащи¬
ми средами, недостаточно очищенными от примеси тромбоцитов и лейкоцитов.
Антитромбоцитные аллоантитела часто выявляют у трансфузионно-зависимых
больных с бета-талассемией и серповидно-клеточной анемией.
АНТИГЕНЫ ЛЕЙКОЦИТОВ
Лейкоциты человека наряду с антигенами, аналогичными для эритроцитов,
содержат особые антигены, не зависящие от факторов системы АВО, резус,
MN Ss и др. В системе лейкоцитарных антигенов наиболее известной считает¬
ся система HLA (Human Leukocyte Antigen — лейкоциты ые антигены человека).
Изосерологически идентифицированы специфические для лейкоцитов гранулоци-
тарного ряда антигены нейтрофилов системы HNA.
Система Human Leucocyte Antigen
Первый антиген системы HLA открыл Дж. Даусет (J. Dausset) в 1958 г., в настоя¬
щее время установлено уже более 200 их разновидностей.
Система HLA играет ведущую роль в трансплантации органов и тканей, разви¬
тии чувствительности организма к различным воздействиям окружающей среды,
наследственной предрасположенности к определенной патологии в зависимости
от специфики антигенного состава тканей. По мере изучения биологической
роли антигенов HLA все полнее раскрывается их значение в иммунных реакциях-
Комплекс HLA определяет механизмы переработки антигена и представления его
макрофагам, регулирует процессы взаимодействия иммунокомпетентных клеток.
r
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТМНОУЗИЙ 1І17
тенями, осу-
| контакт между эффекторными клетками и клетками-ми
^ ^ контроль пролиферации иммунокомпетентньи клеток, актива
аци*
Ж
ВКСИ
ІЄТИ
^Гйсгосовмесгимосги, которые расположены в коротком плече Хромосомі
Л ffiA наследуются по кодоминантному типу. т.е. у потомства в HLA-
^пе в равной мере проявляются аллели локусов обоих родителей.
^Г-антигены экспрессируются на всех ядросодержащих клетках - в лимфо*
нейтрофилах, тромбоцитах, а также клетках различных органов и тканей,
шей степени они содержатся на эритроцитах и в плазме крови,
или локусы системы HLA входят в три региона - классы I. II и III
ЛЙ-60).
- . 25.00. Гены главного локуса гистосовместимости человека
гичиости клеток, индуцирует формирование иммунной памяти
арктические и биохимические особенности антигенов системы HLA
эТ0 группа тканевых антигенов, контролируемых генами главного КОЖ¬
НІ^ ^.ГЧРЫЙГТИМОСТИ. которые оасположены В KOOOTKOM ПЛЄЧЙ хппмотмы 6.
DPA
DQB
DQA
DRB
DRA
С4
В(
С2 1 TNF 1 В і С 1' Е 1 А 1 F 1 G
DQ
DR
1 L—1—L L_ L irL
К i классу относятся локусы HLA-A, -В, -С, локусы HLA-E, -F. -G. а также более
20 псевдогенов или генных фрагментов.
HLA-A, -В и -С-гены кодируют тяжелые а-цепи 1 класса гликопротеинов г ММ
І цДд Тяжелая a-цепь вместе с легкой Р2га-цепыо формируют молекулы HLA.
«стоящие из а1-, а2- и а3-доменов трансмембранного региона и цитоплазма ти че-
даго участка. Полиморфизм молекул HLA связан с al- и абдоменами.
HLA-E, -F, -G-гены кодируют протеины, которые экспрессируются с легкими
мелями. Эти гены отличаются низким полиморфизмом. Ген HLA-G преиму¬
щественно экспрессируется на клетках трофобласта и играет важную роль в нмму-
ногенетических механизмах защиты плода в организме матери.
Антигены HLA I класса стимулируют продукцию аллоантител и служат лими-
шрующим элементом в феномене клеточно-опосредованного лнмфолиэиса.
Распознавание и уничтожение чужеродных антигенов возможны только тогда,
когда они ассоциированы с молекулой класса I.
Ко II классу относятся 3 главных локуса (DR. DP и DQ). псевдогены (DNA
к DOB) и еще около 50 новых генов.
Гены DR, DP и DQ кодируют HLA-молекулы, которые имеют ограниченное
тканевое распределение. Их обнаруживают главным образом на В-лимфоцитах,
шрофагах, активированных Т-лимфоцитах, в клетках эпидермиса и сперме.
HLA-молекулы II класса — гликопротеины, образованные легкой а-цепью,
состоящей из а‘-и а2-доменов, и тяжелой (3-цепью, состоящей из б1- и (3:-доменов.
№гены включают неполиморфный DR A-ген, кодирующий a-цепь и 3 или 4 DR
3-гена (DR В1, DR В2, DRB3 и DR В4), которые кодируют (3-цепь.
Молекулы DQ-антигена кодируются DQ-генами: DQA1 и DQB1. Оба гена выср-
Молиморфны. Гены DQ А2 и DQ В2 не экспрессируются.
КШ классу относят 36 генов. Некоторые из них продуцируют протеины, кото¬
рые могут приводить к недостатку клеточной поверхностной экспрессии молекул
*И класса и препятствовать их выявлению.
'Становление фенотипа антигенов гистосовместимости человека осушест-
Млется методом тканевого типирования, включающего серологические методы
^следование краткосрочных культур лимфоцитов.
Л**им из наиболее доступных методов типирования HLA-фенотипа считается
^цитотоксический тест, с помощью которого было выявлено большинство
генов HLA, обладающих иммуногенной активностью. И по сей день этот
остается одним из основных в повседневной работе иммунологических
преторий.
1$1t тРАНС®УЗИОННЛЯ ИММУНОЛОГИЯ
К концу 1990-х гг. номенклатура выявляемых серологически и в клетг*
реакциях HLA-антигенов включала 28 специфичностей локуса HLA-A; 61 - ЧНь,,:
I HLA-B: 10 - локуса HLA-C: 23 - локуса HLA-DR: 9 - локуса HLA-DQ Г?'
локуса HLA-DP.
Важным аспектом иммуногенетических исследований считается популяи
I анализ распределения HLA-антигенов в различных этнических групщГ
Распространенность антигенов гистосовместимости остается важным показателей
для характеристики популяции. Частота - это величина, постоянная для каждого
антигена.
Выполненные во многих странах исследования по международным и наци¬
ональным программам позволили определить и сопоставить распределение
HLA-аитигенов среди отдельных современных народов всех континентов.
Распространенность HLA-антигенов различна у европеоидов, негроидов и монго¬
лоидов (табл. 25-61). Для европеоидов характерна высокая частота HLA-A1, -АЗ,
-В8. -Cw5; негроидов — А23, А28, АЗО, Aw34, Bw42, Bw58, Cw2, DR3; монголои¬
дов - All. A24, Cwl, Cw\ DR4. . .VW
Таблица 25-61. Частота антигенов в различных популяциях
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ШЮЗДНОД* 1919
Ояатлт чйя.2$н
В настоящее время исследователи практически всех стран мира получаютн публи-
данные по иммуногенетическому типированию различных поеулщнй.
Популяционный иммуногенетический анализ используют
* Для проведения антропологических исследований;
' исследования путей миграции и происхождения народностей, населяющих
к ^стоящему времени различные территории;
' !|СТановления региональных и этнических нормативных значений при разре¬
ши0 иммуногенетических критериев раннего дифференциального диагноза
, ИпР°гноза заболеваний;
Давностей Службы крови — планирования забора крови* создания карто*
• Тированных доноров крови;
йсФузионной иммунологии в целях определения иммуногенно* ипгищ
„ ’ РИска возможных реакций и их особенностей ори гемтерапяи у боп*
определенной популяции;
JQ20 ТМНСФУЗИОННАЯ ИММУНОЛОГИЯ
І трансплантологии в целях создания листа ожидания органов, типирбват»
по нмвиртюгенетическим маркерам. Иы?
Значение вред- и послеоперационного мониторинга антител к Ии
Lencocyt* Antigens mQn
До недавнего времени считали, что ведущую роль в отторжении трансп
клеточные лимфоцитарные антигены, в то время как гуыора®^
механизмы отторжения в расчет практически не принимались. Отчасти это бы*,
обусловлено тем, что при гистологическом анализе трансплантата, подвергшего!-0
отторжению, прежде всего выявлялись очаги лимфоцитарной инфильтрации
В 1994 г. в своих работах Feutch впервые описал роль С4с1-фрагмента "ком
племента в реакции капиллярной обструкции сосудов трансплантата. Позднее
всестороннему изучению подверглись HLA-специфичные антитела как на доопе-
рационном этапе, так и в послеоперационном периоде. Суммарные антитела
тив пересаженного Донорского органа генерировались у реципиента по механиз¬
му антителомедиаторной аллореактивности и складывались из циркулирующих
антидонорских HLA-антител и тканевых C4d в биоптате.
В настоящее время различают 'донорспецифичные и недонорспецифичные
антитела, выявляемые у реципиента в посттрансплантационном периоде,
Кдонерспецифическим относят:
• анти-HLA антитела:
• антитела против эндотелиальных клеток;
• антитела против родственных генов МНС I класса (MICA, В);
• антитела против ткакеспецифических антигенов;
• АВО изоагглютининовые антитела.
К недонорспецифическим относят:
V предсуществующие анти-НЬА-антитела недонорских аллелей;
• анти-МІСА-антитела.
Индуцированное антителами поражение трансплантата может быть острым
или хроническим в зависимости от природы антител и механизмов активации ими
комплемента.
Острое отторжение наступает в случае литической активации комплемента,
что в упрощенном виде можно представить следующей схемой; поражение и лизис
эндотелиальных клеток, активация тромбоцитов и клоттинговых факторов, усиле¬
ние воспаления за счет инфильтрации нейтрофилов, тромбоцитов, Т- и В-клеток,
Хроническое отторжение реализуется при сублитической активации компле¬
мента, В этом случае активированные эндотелиальные клетки и тромбоциты
запускают процесс апоптоза с продукцией основного фактора роста фибробластов
и тромбоцитного фактора роста — тромбоспондина 1.
По последним данным, представленным на XV Международной конференции
иммуногенетиков, у 93% пациентов с несостоятельностью почечного транс¬
плантата обнаружен значительный уровень HLA-антител в послеоперационном
периоде. Из них 33% составляют предсуществующие HLA-антитела и 73% -
донорспецифичные. При этом основной вклад в последние вносят антидонорские
DQ-антитела.
Продукция антидонорских антител предшествует как самой почечной несостоя¬
тельности, так и лабораторным показателям, в частности сывороточному креатини*
ну. Проспективный мониторинг HLA-антител и разработка современных методов
их элиминации позволят совершить качественный скачок в достижении максималь¬
ных сроков жизни трансплантата, приближая эти значения к 30-40 годам.
Таким образом, программа обследования послеоперационных больных должна
І обязательном порядке включать мониторинг HLA-антител в сыворотке.
Современные методы позволяют проводить как скрининговое исследование
уровня HLA-антител реципиента, так и их качественный анализ.
ж ft*1. Микрочиповый анализатор
Одной из последних разработок, признашшх на сегодняшний день лучшей
^матизированной станцией для мониторинга HLA-антител, считается микро¬
бный анализатор DynaChlp (Invitrogen Ltd.) (рис. 25-1). На поверхность
одного биочипа, помещенного в лунку стандартного микропланшета, нанесены
одновременно все известные HLA-антигены I и П класса. Оператору необходимо
б внести сыворотку исследуемого образца. По окончании реакции программа
предоставит полный отчет об обнаруженных антидонорских и предсуществующмх
ляителах реципиента.
Human Leucocyte Antigens и болезни
Особый научный и практический интерес вызывают исследования по взаимос¬
вязи иммуногенетических маркеров с различными заболеваниями и их клиниче¬
ским течением.
Накопленный к настоящему времени большой фактический материал о роли
эдогенной дифференцировки тканей в развитии патофизиологических процессе»
указывает на взаимосвязь предрасположенности к ряду заболеваний с наличием
ям отсутствием определенных иммуногенетических маркеров. Наиболее значи¬
тельное количество свидетельств таких связей получено в отношении главного
комплекса антигенов гистосовместимости. Поскольку фенотип тканей организма
надставлен достаточно большим количеством антигенов, то следует ожидать,
лю у каждого индивида могут одновременно присутствовать маркеры, опреде¬
ляющие предрасположенность к заболеванию, и антигены, определяющие его
резистентность к этому же патологическому процессу.
Для объяснения возможных механизмов ассоциации HLA-антигено* с заболе¬
ваниями сформулированы несколько гипотез, которые можно разделить на две
группы:
* непосредственное участие или прямое включение HLA-антигенов в патогенез
заболевания;
* существование Л?-генов, тесно связанных с главным комплексом гистосов¬
местимости (наличие неравновесного сцепления между HLA-антигенами
и генами иммунного ответа).
® первой группе рассматриваются три основные теории:
* рецепторная;
* молекулярной мимикрии;
* модификации антигенов HLA вирусами, а также различные комбинации этих
теорий.
1022 ЛИНСФУЗИОННАЯ ИММУНОЛОГИЯ
Согласно рецепторной теории, HLA считаются своеобразными рецецТора
патогенных вирусов, которые, специфически связываясь с тканевыми антигенам^
поражают клетку.
Под молекулярной мимикрией понимают состояние, когда микроорганизм
в процессе эволюции приобретают в структуре своей мембраны детерминанты,
сходные с тканевыми антигенами человека. Способность маскироваться под анти’
гены человека снижает распознавание макроорганизмом микробов или вирусов
в результате чего они, проникая в организм, оказывают патогенное действие. ’
Рассматривая роль генов иммунного ответа в предрасположенности к различ¬
ным заболеваниям, различают два типа генетического контроля.
• Неспецифический контроль интенсивности гуморального ответа, который
вероятно, осуществляется многими генами.
• Специфический контроль генами IR-клеточного иммунитета.
Полагают, что у человека локализация этих генетических структур по аналогии
с комплексом Н-2 мышей, по-видимому, находится в непосредственной близости
с генами, кодирующими HLA-D- и HLA-DR-антигены. Вероятнее всего, гены IR
находятся в состоянии неравновесного сцепления с генами, кодирующими анти¬
гены локусов HLA.
На сегодняшний день ни одна из предложенных гипотез в отдельности не в
состоянии в полной мере объяснить обнаруживаемые ассоциации HLA-антигенов
с различными заболеваниями. Не исключено,; что в процессе сосуществования
микро- и макроорганизмов у последних выработались системы иммунологиче¬
ских приспособительных механизмов, сконцентрированных в процессе эволюции
в IR-генах на уровне комплекса HLA.
К настоящему времени проведены обширные исследования по распределению
HLA-антигенов при различных заболеваниях.
С рядом заболеваний не удалось получить четких ассоциаций HLA-антигенов.
Полагают, что это связано с гетерогенностью исследованных нозологий или, воз¬
можно, их ассоциацией с другими, неисследованными HLA-антигенами.
Необходимо отметить один из важных моментов, который ясно определился
в последние годы. Оказалось, что одно и то же .заболевание в различных попу¬
ляциях может ассоциироваться с различными HLA-антигенами. Полной ясности
в понимании этого процесса нет. Тем не менее обнаруженное явление указывает
на необходимость исследований по связи HLA с заболеваниями в различных попу¬
ляциях с привлечением к типированию лиц (как больных, так и здоровых) только
онределенной популяции.
HLA-антигены не считаются маркерами какого-либо одного заболевания. Так,
например, HLA-B27 с высокой частотой выявляется при различных патологиях -
ашилозирующем спондилите, болезни Рейтера, ревматоидном артрите. Антиген
HLA-B8 в различных популяциях ассоциируется с заболеваниями, в основе кото¬
рых лежат аутоиммунные процессы — миастения гравис, системная красная вол¬
чанка, ювенильный диабет» хронический активный гепатит и др.
В работах многих исследователей показано, что повышенный риск вирусного
гепатита В имеют лица с антигенами В8 и В12 системы HLA, у них же чаще наблю¬
дается острое развитие болезни. При наличии в фенотипе больных антигенов В1°
и В35 повышен риск перехода заболевания в хроническую форму.
Связь одного и того же антигена с низкой активностью одних факторов проти-
воинфекционного иммунитета и высокой активностью других можно рассматри
вать как направленную синхронизацию различных звеньев иммунной системы
для обеспечения гомеостаза.
Полагают, что повышенная распространенность определенного антигена
при различных заболеваниях связана с тем, что в основе ассоциации лежат обши
этиологические и патогенетические механизмы поражения.
▼
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЩОТМКЖЭИ* | Q23
нение Human Leucocyte Алйцети-диагностики для определения предрве-
яности к некоторым заболеваниям.
^‘положенном«целиакии
«иакия - аутоиммунное заболевание, которое провоцируется употребле-
Й^^чатки (пшеницы, ячменя, ржи) генетически предрасположеммыми
Думами. Мировая распространенность болезни 1:100. Было установлено,
<е индивидуумы, страдающие целиакией, несут в геноме специфические
«л HLA И класса: гены DQA1 *05-DQAl *0201/DQB1 *02 (которые кодируют
HLA-молекулы) и/или DQA1 *03/DQBl *0302 (которые кодируют DQ8-
Ea*молекулы). Наличие такого генетического профиля считается обязательным
вием возникновения целиакии. Около 20-25% человеческой популяции
§1§ pQ2- или DQS-антигены. Около 95% больных целиакией имеют DQ2-
ш ^антигены, остальные 5% имеют DQ8 HLA-антигены.
HLA-аллели II класса, которые свидетельствуют о предрасположенности
„елиакии: DQA1*Q201; DQA1*03; DQA1*05; DQB1*02; DQB1*0302; DRB1*03;
Jl;04;DRBl*07.
ЛЦ-аллели П класса, ассоциированные с целиакией, и дополнительные алле-
л которые позволяют идентифицировать образцы, гомозиготные по DQB1*02-
а’ели: DQA1*0201; DQA1*03; DQA1*05; DQB1*02; DQB1*0301; DQB1*0302;
5*81*03; DRB1*04; DRB1*07; DRB1*11; DRB1*12.
Предрасположенность к артриту
Ревматоидный артрит - аутоиммунное заболевание, которое приводит к хро¬
ническому воспалению суставов, кроме того, поражаются околосуставные и неко¬
торый другие ткани, органы и системы организма, поэтому ревматоидный артрит
отогатк’сийемным заболеваниям. Ревматоидный артрит считается HLA-B27-
асеоциированным заболеванием, т.е. риск возникновения болезни значительно
повышается, если в геноме присутствуют аллели HLA-B27.
Реактивными артритами называются воспалительные негнойные заболевания
суставов, развивающиеся после острой кишечной или мочеполовой инфекции.
Шгігодняшний день считают, что реактивный артрит развивается в результате
нарушений в иммунной системе. Во многих случаях (если инфекция была вызвана
бактериями родов хламидия, шигелла, сальмонелла, иерсиния, кампилобактер)
реактивный артрит считается HLA-B27- ассоциированным заболеванием.
При наличии в геноме аллели HLA-B27 пациент предрасположен к ревматоид¬
ному и реактивному артритам.
Болезнь Бехтерева (идиопатический анкилозирующий спондилоартрит) -
ироническое системное воспалительное заболевание суставов, преимущественно
позвоночника, с ограничением его подвижности за счет анкилозирования меж¬
позвоночных суставов, формирования синдесмофитови кальцинации спинальных
®язок. Помимо поражения позвоночника и периферически суставов, нередко
^Дологический процесс вовлекаются внутренние органы (сердце, почки, органы
^генетической детерминированности болезни Бехтерева свидетельствует нали¬
ну ?ее „чей У 90% больных антигена гистосовмеспшости HLA-B27 (тогда
®0Щей популяции этот антиген встречается лишь у 7%).
чределение гиперчувствительности к лекарственному средству
ИІЧІІ пРовоцирующие аллергию на лекарство, могут быть связаны с осо-
, как лекарственного средства, так и пациента:
ценность препарата — макромолекулы, такие как белки (например, вак-
Ь11 полипептиды (например, инсулин) и декстраны, могут бьггь иммуно-
ными. Небольшие молекулы способны действовать как гаптены и в соче-
Ии с белками организма образовывать антигены;
«024 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
• особенность пациента - существование генетических факторов, Ко
могут быть причиной того, что у некоторых лиц отмечается большая а**
ность к аллергическим реакциям по сравнению с другими; н'
• аллергологический анамнез — больные, в анамнезе у которых есть а
ческие заболевания (экзема, астма или сенная лихорадка), с наследстве*'
ным ангионевротическим отеком более склонны к аллергической вез
на лекарственные средства. ции
Некоторые антигены HLA-комплекса связаны с повышенным риском гипелч
Р стеительносгн на определенные препараты, однако механизм этих патологическот
реакций точно не установлен. Например, у носителей HLA-B8 и DR3 риск неЛоо*
токсичности на бензилпенициллин возрастает, в то время как пациенты с HLA-
DR? защищены от этого воздействия. Риск кожных реакций на пеницилламин
связан с HLA-DRw6. а риск тромбоцитопении — с HLA-DR4. Пациенты с HLA-DR4
подвержены также высокому риску возникновения волчаночноподобного синдро¬
ма при приеме гидралазина (апрессина*). Левамизол более токсичен у носителей
HLA-B27.
Гиперчувствительность к абакавиру
і Абакавир применяют в качестве антиретровирусной терапии при ВИЧ-
инфекции. Он представляет собой нуклеозидный аналог, который ингибиру¬
ет обратную транскриптазу вируса. Таким образом, действие этого вещества
направлено на остановку репликации вируса.
І В 1999 г. абакавир был введен в клиническую практику для лечения ВИЧ-
инфекции I типа. Его назначают как отдельный препарат или в комбинации
с ламивудином и зидовудином.
■ Гиперчувствительность к абакавиру наблюдается примерно у 5-8% пациен¬
тов в течение 6 нед от начала терапии.
І Известны такие проявления гиперчувствительности к абакавиру, как лихо¬
радка (жар), сыпь, тошнота, рвота, головная боль, затруднение дыхания, про¬
блемы с желудочно-кишечным трактом, апатия, боль в мышцах и суставах.
і В 2002 г. была выявлена корреляция между аллелью HLA-B*5701 и гипер¬
чувствительностью к абакавиру у европеоидов.
§ При НЬА-В*5701-аллели пациенту не рекомендуют использовать абакавир
в качестве антиретровирусной терапии.
Типирование по антигенам тканевой совместимости при невынашивании
беременности
Для нормального протекания беременности необходимо, чтобы супруги отли¬
чались HLA-антигенами. Каждый HLA-антиген у человека представлен двумя
аллелями. Одну аллель он получает от матери, другую - от отца.
Если аллель, унаследованная от отца, отличается от аллели матери, то у плода
HLA-антигены отличаются от HLA-антигенов матери из-за присутствия отцов¬
ской компоненты. В результате этого на ранних стадиях развития беременности
HLA-антигены плода, отличающиеся от антигенов матери, вызывают антигенную
стимуляцию иммунной системы матери. В организме матери возникает иммунный
ответ, заключающийся в том, что В-лимфоциты эндометрия вырабатывают защит¬
ные антитела против отцовской компоненты HLA-антигенов плода. Антитела
связываются с HLA-антигенами плода и защищают плод от натуральных киллеров
матери, способствующих отторжению эмбриона.
Если же аллель, унаследованная от отца, не отличается от аллели матери,
то у плода HLA-антигены не отличаются от таковых матери. В результате этого
на ранних стадиях развития беременности не происходит антигенной стимуляци
иммунной системы матери или происходит слабая стимуляция. В результате заро
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГШЩРАНСФУЗЙЙ ЦД5
-яе распознается организмом матери как плод, воспринимается как измененные
долевые) клетки собственного организма. На такие клетки реагируют натураль-
и Происходит самопроизвольное прерывание беременности. '
^.кИм образом, для нормального протекания беременности HLA-анткгены
олжны отличаться от таковых матери.
■ возникновении проблем с зачатием ребенка супругам следует провести
І.генотипирование аллелей I и II класса: А, В. Cw, DR и DQ.
Ни'
йТОДЫ
аПй серологического HLA-типирования следующие.
t выделение из цельной крови популяции Т-лимфоцитов (для типирования
ПО HLA класса I) и В-лимфоцитов (для типирования no HLA класса II).
i Постановка лимфоцитотоксического теста выделенных лимфоцитов пациен¬
та со специфическими сыворотками.
« Считывание результатов реакции с использованием инвертированного
фазово-контрастного или люминесцентного микроскопа.
I Выделение субпопуляций лимфоцитов.
Для выделения необходимых клеточных популяций используют либо центри¬
фугирование в градиенте плотности, либо иммуномагнитную сепарацию с при-
менением парамагнитных частиц с иммобилизованными моноклональными
антителами против специфических рецепторов. Основные недостатки метода
центрифугирования — большой процент потери клеток как количественно, так
I качественно (лизис), а также присутствие в суспензии тромбоцитов и других
компонентов, влияющих на реакцию лимфоцитотоксического теста.
Для серологического типирования фирма DYNAL специально разработала реа¬
генты И магнитные частицы Dynabeads HLA Class I (для выделения Т-лимфоцитов)
«Dynabeads HLA Class И (для выделения В-лимфоцитов), использование которых
обеспечивает эффективность метода и надежность полученных результатов.
Использование этих реагентов позволяет быстро выделить лимфоциты из
образца цельной крови без стадии центрифугирования в градиенте плотности.
В течение короткого инкубационного периода частицы связываются с целевыми
клетками, после чего целевую фракцию выделяют и промывают с помощью маг¬
нита (Dynal МРС). Процедура выделения занимает 15 мин. Все стадии осутцест-
вляют в одной и той же пробирке. Выделенная фракция характеризуется высокой
степенью чистоты (>99%), более 98% клеток сохраняют жизнеспособность.
Дальнейший анализ проводят непосредственно на выделенных клетках по тради¬
ционной методике микроцитотоксического теста.
Серологическое определение антител к HLA-антигенам. В трансплантологии
наряду с HLA-типированием актуальной задачей остается определение в крови
реципиента антител против HLA-антигенов потенциального донора.
Для этих целей разработаны специальные лимфоцитарные панели для опреде¬
ления антител к различным HLA-антигенам классов I и II. Наборы вхлючают
Точные планшеты, содержащие Т- или В-лимфоциты, несущие антигены раз-
аллельных вариантов HLA, 4 лунки отводятся под позитивный и негатив-
я‘5 контроль. В основе метода также лежит микролимфоцитотоксический тест,
настоящее время все более широкое распространение приобретает метод
■генотипирования, которое включает несколько стадий.
Выделение ДНК. Можно проводить ручным методом с помощью магтгг-
ных частиц, которые в случае выделения ДНК из крови добавляют непо¬
средственно к образцу цельной крови. После завершения выделения ДНК
Дается связанной с частицами, что упрощает денатурацию при ПЦР. Таким
Разом, связанную с магнитными частицами ДНК рекомендуют исполъ-
30вать при ПЦР, причем количество ДНК, которое необходимо добавить
Н тМнС«уЭИОННАЯ ИММУНОЛОГИЯ
І реакцию. уменьшается в 13 раза. Выделенную ДНК можно элюцр01ш
с магнитных частиц. Выделение ДНК можно проводить на автоматах (напри¬
мер. на приборе і Prep) для получения высококачественной геномной днк
яри tax генетических методах HLA-типирования: SSP, SSO и секвестриро¬
ван Этт прибор также применяют для выделения РНК, вирусной дня
В также для выделения ДНК из образцов тканей и следовых количеств исход¬
ного материала (засохшего пятна крови, волоса, жвачки, окурка сигареты)
і основе выделения лежит метод иммуномагнитной сепарации. Все этапы
работы являются автоматизированными.
• ПЦР. Метод считается очень чувствительным и требует чистой зоны сме¬
шивания реагентов для реакции и чистой зоны амплификации. Смешивание
реагентов рекомендуют проводить в специализированных ПЦР-боксах
имеющих ультрафиолетовые лампы, которые позволяют ежедневно очищать
ПЦР-бокс от присутствия нежелательных молекул ДНК. Для метода ПЦР
необходим планшетный амплификатор.
I Детекция результатов амплификации.
1 Технология SSP. Название обусловлено принципом выявления - искомые
HLA-участки ДНК улавливаются специфическими праймерами (Sequence
Specific Primers) в процессе амплификации. На первом этапе необходимо
выделить ДНК из исследуемого образца крови, костного мозга или ткани
(от 15 мин до 2 ч в зависимости от метода). Затем следует этап ДНК-
амплификации в термоциклере. Для SSP-HLA-типирования ДНК рас¬
пределяется в лунки ПЦР планшета, каждая из которых содержит прай¬
меры определенной специфичности. Количество лунок (ПЦР-реакций),
таким образом, определяется количеством типируемых локусов и аллель¬
ных вариантов в каждом локусе. Так, например, для низкоразрешающе¬
го (скринингового) типирования локуса DR обычно определяют около
24 специфичностей (24 лунки ПЦР-планшета). После амплификации
(45 мин-1,5 ч) ампликоны переносят в лунки агарозного геля, где прово¬
дят электрофорез (20-30 мин). В тех лунках, где специфичности прайме¬
ров совпали со специфическими участками ДНК, видна полоса продукта
в геле. По таблице интерпретации или с помощью программы определя¬
ют, какой HLA-аллели она соответствует. Основным достоинством SSP-
технологии нужно признать то, что можно осуществлять типирование
как на низком, так и на экстравысоком разрешении, определяя точечный
аллельный полиморфизм (практически сравнимый с секвестрированием).
Основным недостатком SSP HLA-типирования остается его низкая про¬
изводительность. В 96-луночный термоциклер при низкоразрешающем
типировании можно поместить только один образец (DR-локус - 24 про¬
бирки. А-локус - 24 пробирки, В-локус — 48 пробирок). Время, затрачен¬
ное таким образом на типирование одного образца, например по А, В. OR
от выделения ДНК до интерпретации результатов, составит примерно 3 ч.
За день при хорошей организации можно протипировать 2-3 человека.
Для быстроты и автоматизации процесса детекции используют готовые
агарозные гели (от 8 до 96 лунок в 1 геле), подходящие для электрофореза
в системе без жидкого буфера, и специализированные электрофорезные
ячейки со встроенным источником питания. К одной такой электрофорез-
ной ячейке можно подключить несколько дополнительных 96-луночньи
ячеек. Пропускная способность одной ячейки — 96 образцов одновре¬
менно. Ячейка совместима с готовым 96-луночным гелем. В готовом геле
заранее содержится неканцерогенный краситель. SSP HLA-технологию
можно рекомендовать лабораториям, использующим как низко-, та*
и высокоразрешающее типирование: трансплантологическим отделениям.
f
ИММУНОЛОГИЧЕСКАЯ БЕЗОЯАСИОСТЬ ГШШМНШЗіМ К27
^gppiKUi пересадки костного мозга, для тиинроваиий. связанных с выяв¬
лением генетических заболеваний, при средней нагрузке м лабораторию
5-7 человек в неделю.
Технология SSO. Название также обусловлено принципом выявлении
HLA-специфичностей. Аналогично SSP-технололш для SSO необходим!
схадия выделения геномной ДНК, которую затем следует імп пифии при
дать. Однако амплификация образца происходит а одной ПЦР-пробириг.
т.е. никаких специфических HLA-ампликонов пока не получено, i есть
только общая геномная ДНК образца. Искомые специфичности улав¬
ливаются на следующем этапе — бдот-гибридизации, который, условно
говоря, заменяет электрофорез в SSP-теінолоіт Блог-гйбршшйав
представляет собой процесс связывания (конъюгацию) теперь уже специ-
фических участков ДНК с олигонуклеотидными зондами (Зврияог Spedjffc
Oligonucleotides), пришитыми на специальные нейлоновые волоски - стри-
мы. Не связавшиеся участки ДНК отмывают, а конъюгированныефрагмен
ты, соответствующие искомым HLA-аллелям, окрашивают пероксидаэой
Весь процесс блот-гибридизации, окраски и интерпретации результатов
полностью автоматизирован (2 ч) с помощью спедиальшго оборудова¬
ния - процессора BeeBlot 48 и сканера AutoCara. Одними из несомненных
достоинств SSO-технологии считаются ее способность к автоматизации
и большая пропускная способность. Эта технология предполагает исполь¬
зование меньших концентраций ДНК и меньший объем пгпбгмпмпгп
образца, что очень важно при типировании образцов пуповинней крови,
Соответственно за один цикл можно протипировать 48 образцов. Блог-
гибридизатор BeeBlot 48 расчитан на одновременную загрузку от 2 до 48
стрипов, содержит программу для автоматизированной промывки прибо¬
ра, что облегчает работу исследователя. По окончания блот-гибриднзшрш
окрашенные стрипы сканируются прямо в реакционном планшете с помо¬
щью специального сканера AutoCam 48 в течение 3-12 мин. Изображение
передается на внешний компьютер и анализируется программой пир-
претации Reli SSO РМР. SSO-технология остается скрининговым методом,
позволяющим проводить типирование с максимальным разрешением
от низкого к среднему. Образцы, которые будут непосредственно направ¬
лять на трансплантацию костного мозга, необходимо дополнительно
типировать на высоком разрешении с использованием SSP-технологии
или метода секвестрирования.
Антигены гранулоцитов
Гранулоциты — зернистые лейкоциты, содержащие в цитоплазме шерифи-:
! «скую зернистость. По способности зерен окрашиваться гранулоциты подраз-
хляют на эозинофилы (оксифилы), базофилы и нейтрофилы. Впервые грану-
юцнтспецифический антиген описал П. Лютеран (P. Luteran) в соавт. в 1960 г
Антигены гранулоцитов представляют систему органоспецифнческнх факторов.
I Иракгерных для клеток миелоидной ткани. В исследование антигенов гранулоци¬
ти большой вклад внесли отечественные исследователи школы академика РАМН
^■профессора Е.А. Зотикова.
Аятигранулоцита рные антитела были обнаружены в сыворотке больных с ней-
Агнией, имеющих в анаменезе множественные трансфузии, фебрильными
**рР®нсфузионными реакциями, у женщин в послеродовом периоде м в о»
I г*** Доноров, трансфузии компонентов крови которых стали причиной легочных
~А®пнений у реципиентов. Как было показано, антигранужнаггврыые антитела
ключевую роль в патофизиологии различных патологических состояний
НИ ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
ТЮпца 25-82. Клинические состояния, обусловленные антигранулоцитарными антителами
Аллоиммуниые
I Неонатальная иммунная нвйтропения
I Осфая легочная недостаточность, связанная с транс-
jфузией
I Рефрактериость к трансфузии граиулоцитов
j Лиоиммунная нвйтропения после трансплантации кост-
I ното иозта
I Фебрильные трансфузионные реакции
Аутоиммунные
Первичная аутоиммунная нєйтоопрмш.
Вторичная аутоиммунная нвйтропения
Лекарственноиндуцированная
Аутоиммунная нвйтропения после трансїшаГ
тации костного мозга
В настоящее время в наибольшей степени изучены антигены нейт^офил^
которые вошли в номенклатуру, принятую рабочей группой The Granulocyte
Antigen Working Party of ISBT в 1999 г., как система HNA (Human Neutrophil
AHoantigens). Хотя определить присутствие антигенов системы HNA на других
клетках гранулоцитарного ряда не представляется возможным, полностью исклю¬
чить их экспрессию на базофилах и эозинофилах нельзя.
HNA-антигены локализованы на гликопротеинах, названия которых использу¬
ют для их обозначения, например Fcy-рецептор Illb (FcyRIIIb) — HNA-1.
Система HNA включает 7 антигенов, которые входят в 5 групп (табл. 25-63).
Таблица 25-63. Система антигенов нейтрофилов Human Neutrophil AHoantigens
Группы антигенов
Несущие гликопротеины
CD
Антигены
Прежнее
название
Аллели
HNA-t
Fcy-рецептор Illb
CD16b
HNA-1 a
NA1
FCGR3B*01
HNA-1 b
NA2
FCGR3B‘02
HNA-1 с
SH
FCGR3B*03
HNA-2
NB 1 glicoprotein
CD177
HNA-2
NB1
?
HNA-3
GP70—95 (?)
HNA-3a
Sb
?
HNA-4
MAC-1, CR3; a„p,-integrin
CD11 b
HNA-4a
MART
ITGAM*01 (230G)
HNA-5
LFA
CD11a
HNA-5a
OND
ITGAL*01 (2372G)
Частота встречаемости антигенов HNA широко варьирует в различных популя¬
циях (табл. 25-64).
Таблица 25-64. Частота встречаемости Human Neutrophil AHoantigens, %
Антигены
Кавказоиды
Монголоиды
Негроиды
Американские индейцы
HNA-la
59
90
56
87
HNA-lb
88
52
82
46
HNA-tC
5
<1
27
<1
HNA-1NULL
0,15
<1
4
<1
HNA-2
92
95
98
Нет данных
HNA-3a
94
Нет данных
Нет данных
Нет данных
HNA-4a
99
Нет данных
Нет данных
>99
HNA-5a
89
81
88
79
Антигены HNA-la и HNA-lb, ранее имевшие наименования NA-1 и NA-2, были
первыми гранулоцитарными антигенами, которые описали P. Laseran и соавт.
(1960) и L. A. Boxer ef al. (1972) при анализе случаев рождения детей с врожденной
иэоиммунной гранулоцитопенией. Антигены HNA-1 — специфические антигены
нейтрофилов. Значительно позже, в 1997 г. I. Box и соавт. установили причаст¬
ность к этой группе антигенов HNA-lc-антигена, ранее называвшегося SH.
Частота встречаемости антигенов HNA-1 широко варьирует в различных попу¬
ляциях. Среди негроидов и кавказоидов частота встречаемости HNA-lb выше,
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ f 028
1а _ 75-90 и 44-74% соответственно, в то время как среди монголои-
& «тайцев, японцев и корейцев - антиген HNA-lb выявляется со значите»-
ft' |ПЄй частотой, чем HNA-la (36-80 и 83-91% соответственно). Антиген
$ чаше встречается у негроидов (20-30%) и кавказоидов (5-10%). Среда
^ оидов и американских индейцев антиген HNA-c выявляется в единичных
< фенотип HNA-1null у негроидов встречается с частотой около 2%. у как-
^"дов - 0.15% и совсем не регистрируется у представителей американских
<иев И монголоидов.
^кодирующий синтез FcyRIIIb, расположен на длинном плече хромосомы I.
иНА-Интигены локализованы на Fcy-рецепторе Illb, который распознается
клональным антителом CD16b. FcyRIIIb и. следовательно. H N А-1-антигены
^лессируются исключительно на нейтрофилах, количество антигенных детер-
колеблется от 100 ООО до 400 ООО и в среднем составляет 190 ООО. На гемо-
^илеских клетках FcyRIIIb экспрессируется реже, чем на зрелых нейтрофилах,
^большом количестве образуется на метамиелоцитах. У пациентов с парок-
*^іьной ночной гемоглобинурией сниженно количество FcyRIIIb на ней-
^ялах. В небольшом количестве растворимый FcyRIIIb присутствует в плаз-
концентрация FcyRIIIb в плазме коррелирует с количеством нейтрофилов.
^йзующихся в костном мозге. Интересно, что плазма от HNA-lb-позитивнот
деііА-Іа-негативного донора содержит FcyRIIIb в более высокой концентрации,
чем плазма HNA-la-позитивного и HNA-lb-негативного донора, что может быть
результатом различий экспрессии рецепторов на мембране нейтрофилов.
FcyRIIIb принадлежит к иммуноглобулинам-предшественникам. содержит два
^.подобных домена, соединенных дисульфидными связями. Моноклональные
„петела, реагирующие с FcyRIIIb, обозначают как CD16b.
FcyRIIIb относится к тяжелым гликопротеинам с ММ 50-60 и 65-80 кДа. харак-
прными для HNA-la и HNA-lb соответственно.
Аллоантитела против антигенов HNA-1 могут стать причиной аллоиммунной
врожденной нейтропении, острой легочной недостаточности, связанной с трансфу¬
зией, и обусловливать отсутствие эффекта восстановления нейтрофилов у аллоимму-
швированных реципиентов после трансплантации костного мозга. Около 30% алло-
зшмунных HNA-1 направлены против антигена HNA-la. Женщины с фенотипом
НМ-1да11 могут быть сенсибилизированы во время беременности и или при транс¬
фузиях, что может привести к внутриутробному конфликту и рождению ребенка
свровденной изоиммунной гранулоцитопенией. Клиническая картина заболевания
характеризуется повторными бактериальными заражениями кожи, возшгаокм*
* дерматитов, отитов, воспалений дыхательных путей. Течение обычно мягкое
Выздоровление наступает через несколько недель, редко месяцев. Лечение симпто-
*йтическое и антибактериальное. Прогноз в основном благоприятный.
Аутоанти-НКА-1а-антитела становятся причиной хронической аутоиммунной
і «йтропении у детей. Различают две формы аутоиммунной нейтропении - кдио-
I вескую, которой заболевают дети до года, и вторичную, которая возникает
! !~ояее старшем возрасте на фоне иммунодефицита или тяжелых хронических
вдеваний.
і *•_£ Viiuv л ті.|/v<a д. ** » waa** ** ■»■■■■■■—
I нейтропения различной степени, сопровождающаяся повышением
,^оэза в костном мозге.
I "чдШЬ могут быть также вовлечены в образование неоантигенов, опредедяю-
/ д|^*аРственно-индуциро ванную нейтропению.
j fy *'^-антиген, ранее называвшийся NB1 -антиген, считается специфическим
I еиЩфилов, его впервые описали Latesary и соавт. в 1971 г. Он относятся
Детей с идиопатической аутоиммунной нейтропенией наблюдается повышен
восприимчивость к бактериальным инфекциям. Течение заболевания обычнг
ВЫЗЛОПППпеиьгр rnnu'rauun иягч*ипяа*г иехпеч 1-7 тля R ПРГШПЯ ЪябпЛЙОйПШ
■ ТМмСМЭМНИМ ИММУНОЛОГИЯ
к с высокой распространенностью: более 90% представителей всех па
имеют антиген HNA-2.
Геи. кодирующий синтез антигена HNA-2, локализован на хромосоме I9q 13^9
H HNA-2 состоит из цепочки ДНК, содержащей 437 аминокислот, из К(Пг>
рых 21 смысловая. Фенотип HNA-2^^ считается следствием некорректного
сплайсинга РНК, нарушающего генную транскрипцию, в результате чего антиген
HN А-2 на нейтрофилах не экспрессируется.
Антиген HNA-2 локализуется на гликопротеине с молекулярной массой
56 64 кДа. Моноклональные антитела, реагирующие с HNA-2 обозначаются
Адлоаититела против HNA-2, так же как и анти-HNA-l-антитела, могут опреде-
лять развитие аллоиммунной врожденной нейтропении, острой легочной недоста¬
точности, связанной с трансфузией, и объяснять отсутствие эффекта восстановле¬
ния нейтрофилов у аллоиммунизированных реципиентов после трансплантации
HNA-За-антиген, ранее называвшийся 5Ь. впервые описали A. van Leveuwen и
соавт. в 1964 г. HNA-За относится к антигенам с высокой частотой встречаемо-
сти І от 89 до 96% в различных популяциях. Антиген HNA-За экспрессируется
на нейтрофилах и лимфоцитах, возможность его экспрессии на тромбоцитах дис¬
кутируется.
Ген. кодирующий образование антигена HNA-За, расположен на хромосоме 4.
Первичная его структура до сих пор не установлена. Антиген локализован на моле¬
куле протеина с ММ от 70 до 95 кДа.
Аллоантитела к HNA-За были выявлены в единичных случаях врожденной
нейтропении и фебрильных посттрансфузионных реакций у реципиентов гемо¬
компонентов.
Острая легочная недостаточность, связанная с трансфузией, обусловлена анти-
HNA-За-антителами. встречается редко, но характеризуется тяжелым течением.
HNA-4a описали как антиген W.E. Mart Kline и соавт. в 1965 г. Встречается
с частотой более 99% среди кавказоидов и американских индейцев.
1ША-4а-антиген считается полиморфным вариантом аМ (CD 1 lb)-субъединицы
лейкоцитов-р2 (CD18), образуется в результате одиночного изменения цепи ДНК:
В позиции 230 аденин заменен на гуанин.
CDllb/CD18-KOMnneKC экспрессируется на нейтрофилах, моноцитах, клет¬
ках І «натуральных киллерах* и играет важную роль в адгезии лейкоцитов на
эндотелиальных клетках и при фагоцитозе. До сих пор неясно, влияют ли функции
CDllb/CD18 на полиморфизм антигена HNA-4a.
Аллоантитела к HNA-4a могут объяснять развитие врожденной нейтропе¬
нии. Интересно, что эти антитела, индуцирующие нейтропению, могут стать
препятствием для адгезии лейкоцитов, в то время как анти-HNA-4а-антитела,
которые не бывают причиной нейтропении у новорожденных, не препятствуют
этому процессу. Это, возможно, результат различия эпитопов, распознаваемых
на N-концевом участке CDllb.
Комплекс CDllb/CD18 может стать мишенью для выработки аутоантител,
которые не вызывают нейтропению, но способны быть причиной снижения адге¬
зии нейтрофилов.
HNA-5a. первоначально называвшийся OND, обнаружили E. Decary и соавт,
в 1979 г. на нейтрофилах при тестировании с антителами в сыворотке, назы¬
вавшейся OND. Первоначально при изучении распространенности антигена
с использованием OND-сыворотки считалось, что HNA-53-антиген распространен
достаточно широко - до 92%. Но поскольку OND-сыворотка считается поликло¬
нальной, эти данные оказались завышенными. В проведенном позже генотипи-
ромиии показано, что распространенность антигена HNA-5a колеблется от 79%
у американских индейцев до 81-88% в других популяциях.
как CD177.
костного мозга.
кэ»щ»ва ttti
.. локализуется на al (СОПа)-цепи субъединицы л«мюштм-0* (CD)Si
і результате изменения цепи ДИК — в 766-й пшицми трсокин ммемем
* ^>1 lt/CD 1б'комплекс• также имеющий название LFA-1 alJS*. жярегаїрт-
■се* лейкоцитах и играет важную роль в их здгсзм, камятвпм ароив
5а-айтигена, по-видимому, не вызывают нейтропению. У больного t «до-
^ой анемией, у которого были выявлены анги-ННА*5о-аиптлі. в амииг
„егисгрированы множественные трансфузии эритроцитной массы а тромбо¬
ві* Интересно, что анти-HLA- и анти-НРА-антитела у него не обнаруживали
^ того, было показано, что у больного после ожога была остаепвлема тушвс-
HfLpyi кожи от HLA-совместимого донора и, возможно, присутсши аиш-
^5а блокировало интерактивность лейкоцитов при трансплантации.
иТОДЫ ВЫЯВЛЕНИЯ АНТИ-НИА-АНТИТЕЛ
ш детекции антител против антигенов системы HNA используют, ш яра-
a комбинацию двух тестов - реакции агглютинации факулощпов (GAT)
^флюоресцентный тест (GFT). Хотя иммунофлюоресцеипшй ист
So более чвствительный, чем агглютинациониый. некоторые автипикіши
aHTM-HNA-За и анти-HNA-5Ь. лучше выявляются в GAT
Для получения достоверных результатов необходимо использовать тестовую
_У1Ь клеток, выделенную из донорской крови в день исследования. Необходимо
®етьв виду. ЧТО присутствие в высоком титре акти-HLA-антитед и ЦИК может
приводить к ложноположительным результатам при использовании ш GAT, тв*
hGFT.
Наиболее чувствительный для выявления анти-HNA считается метод маяаааю-
нальных антител, специфически связывающихся с гранулоцитарными антигенами
(MAIGA).
В противоположность методам GAT и GFT. в которых используют римо*
клетки для детекции антител, в MAIGA-тесге выявляют только антитела, свеци-
фически связывающиеся с выделенными из мембраны гранулоаитов гликопро¬
теинами.
Фенотипирование может быть выполнено как с использованием тестев GAT
и GFT. так и MAIGA. В настоящее время разрабатываются методы гснрпннфо-
вания, в частности ПЦР. Однако для ряда антигенов метод ПЦР неприемлем,
властности для HNA-За, так как пока неизвестна последовательнопыа*в,иш
HNA-2, поскольку ННА-2Ш[Х-фенотип считается результатом нарушай* транс¬
крипции, а не дефектом гена.
АНТИГЕНЫ ПЛАЗМЕННЫХ БЕЛКОВ
Антигенные различия в группе плазменных белков впервые были выявлены
і гаптоглобине — белке, принадлежащем L-фракцим глобулинов. Гашоглобми
•шеет З фенотипических варианта — Нр (1-1), Нр (2-2). Нр (2-1). которые жтерш-
иируются двумя генами - Нр1 и Нр2. Гаптоглобины формируются после ргаииаи
Р*бенка и не могут играть роль в изоиммунизации матери. Вопрос о том обльав-
®Гли гаптоглобины изоантигенными свойствами и образуются ли к мм иммунные
а1Гйтела при многократных гемотрансфузиях, остается неисследованным. В лнте-
Ире есть единичные сведения о возможной роли антигштогяобиновых акти-
реакциям негемолитического типа при многократныхтрансфузиях плазмы
эти данные требуют уточнения. Случаев серьезных, клинически значимых
^*нений, доказательно связанных с изовариантами геотоглобинд. не описано.
^'Фракции глобулинов была открыта еще одна система антигенов Gc которая
в виде трех фенотипов - Gc (1-1).Gc (2-2) нGc (2-1).Обриваним
Gc детерминируется двумя генами - Gel и Gc2.
1032 ПИНСФУЗИОШАЯ ИММУНОЛОГИЯ
В дальнейшем были обнаружены другие антигенные системы, принадлежат
различным белковым и дипопротеиновым фракциям плазмы крови.
К настоящему времени описано более 10 генетических систем, определяющи
антигенный полиморфизм белков плазмы крови.
Иммуноглобулины несут на себе антигенные детерминанты 3 типов:
1 изотопические — антигены, присутствующие на молекулах иммуноглобули¬
нов всех здоровых людей;
£ • аллотипические - антигены иммуноглобулинов, которые обнаруживаются
у части обследованных и считаются продуктами аллельных генов;
І ндиотипические — антигены,, присутствующие только на определенном Голе
- молекул антител.
Наиболее изучены 4 аллоантигенные системы иммуноглобулинов: Gm - опре¬
деляет антигенные свойства тяжелых цепей IgG; система Inv — контролирует анти¬
генную активность легких цепей; системы Isf и Am — генные системы антигенной
активности, соответственно Н-цепей IgG и Н-цепей IgA.
Система Gm включает 4 локуса, расположенных на одной хромосоме» каждый
из которых кодирует аминокислотную последовательность константного участка
Н-цепи. К настоящему времени описано 25 антигенов системы Gm, большинство
из которых локализуется на Fc-фрагменте и 3 антигена (Gm?, Gm4 и ;G!ml7) -
на Fab-фрагменте.
Система Inv представлена одним локусом, на котором расположено до 4. алле¬
лей. Антигены, продукция которых кодируется этими аллелями,, расположены
в легких цепях иммуноглобулинов классов IgG, IgA и IgM.
Системы Isf и Am контролируют антигены, представленные в тяжелых цепях,
и определяют ик ащоантигенность.
Частота встречаемости специфических антигенов плазмы крови человека пред¬
ставлена в табл. 25-65.
Таблица 25-65. Частота встречаемости антигенов плазмы, крови человека
Система
Антигены
Частота, %
|1 Gjpi (af,
47
Gm
Gm (x) • ■
13
<>Gm(f)
99
- Inv
Ш{\): .
10
Hp(1-1)-
І •'!#.
Нр
Hpf(2-2)
■ 47 •:
Hp (2-1) '
Gc (1-1)
44
1 Gc
I Gc.(2-2) ,.
49
WmB
Помимо специфических антигенов, в плазме содержатся и антигены других
систем. В частности, в плазме 80% людей содержатся антигены системы АВО.
Количество этих антигенов зависит от генов Se и Le. Наибольшее количество анти¬
генов АВО определяется у индивидуумов с геном Se и без 1е-гена. Гликопротеины
плазмы могут нести антигены, присущие эритроцитам; i, Sd, Bg.
В плазме (сыворотке) крови обнаружены также растворимые HLA-антигены
локусов А и В. Растворимые HLA были выявлены методом ингибиции лимфоци-
тотоксических антител. Инкубация образцов плазмы с анти-НЬА-сыворотками
соответствующей специфичности сопровождается снижением активности тесто¬
вых реактивов. При этом образцы плазмы, полученные от доноров, не содержа¬
щих HLA-антигенов той специфичности, против которой были цитотоксические
антитела, не обладали способностью истощать HLA-антисыворотки. С помощь®
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ (ШШДОЗИЙ 1(Ш
ания цитотоксического теста было показано наличие в плазме анти-
локуса: HLA-A2, HLA-A9, HLA-A10 и второго локуса: HLA-B5,
Ш Д-В8. Из плазмы удалось выделить фракции, обладающие свойством
«^'*ически связыват*. amH-HLA.
су пимые HLA-антигены, в отличие от HLA-антигенов мембраны клеток
його ряда и тромбоцитов, неиммуногенны: в сыворотке крови больных
^ ией, имевших в анамнезе многочисленные трансфузии свежезаморожен-
HEL/в течение многих лет, не были обнаружены лимфоцитотоксические
ЯЧМЫ в течение шііи* «пауицп 1 иіиминеікиї
^- агглютинирующие антитела против панели клеток 20-30 доноров крови.
Р- что растворимые HLA-антигены обладают толерагенными свойсгва-
ШрН введение способствует возникновению искусственной толерантности,
» т‘еисИбилизации. Это предположение находит свое подтверждение в экспе-
айЄр«тах на животных. Чешский ученый Гашек показал, что у крыс, получавших
НИВЕЯ кожных участков трансфузии плазмы донора кожи, продол-
ость жизни трансплантата оказалась достоверно выше, чем в контроль-
<*Гпітііе Где плазму не вводили или вводили плазму животных не от доноров
І0ІЄВШИХ
чёМУ!
•ИУПИМ—, JT- ' Г г
пил и анамнезе трансплантацию печени, протекает более благоприятно,
больных только с трансплантированным сердцем. Одно из объяснений этого
їїкта заключается в том, что печень - орган, интенсивно выделяющий в плаэ-
^етворимые HLA-антигены, которые и наводят толерантность. Толерогенная
^явность плазменнорастворимых HLA нуждается в дальнейшем исследовании.
Антитела плазмы (сыворотки), образующиеся при изосенсибилизации (гемо-
яаиефузиях или беременности), обычно относятся к IgG- или IgM-классам имму-
ариюбулинов, реже к классу IgA.
IgD- и IgE-анТитела при гемотрансфузиях имеют гораздо меньшее значение.
ГЕМОПОЭТИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ
Стволовыми клетками называют клетки-предшественники, из которых обра¬
зуются при необходимости все другие типы клеток, составляющие различные
органы и ткани человека. Термин «стволовая клетка» впервые ввел в 1908 г.
русский; гематолог из Санкт-Петербурга А.П. Максимов. В 60-х гг. прошлого
века А.В. Фриденштейн и И.А. Чертков открыли мезенхимальные стволовые
метки (СК) в костном мозге, обладающие уникальной регенерационной спо¬
собностью. Данное открытие оставалось практически незамеченным еще почти
полвека. Исследования в этой области возобновились в 1998 г., когда американ¬
ские ученые открыли эмбриональные стволовые клетки человека и показали
н способность дифференцироваться практически в любые тепы клеток чело-
иеческого организма. Открытие стволовых клеток стоит в одном ряду с такими
ёмкими достижениями человечества, как открытие двуспиральной цепочки
wK или расшифровка генома человека. Журнал Science назвал 1999 г. годом
Аловой клетки.
в Отличие эмбриональных и мезенхимальных стволовых клеток заключается
вдР*’’ЧТ0, эмбриональные СК могут быть получены на ранней стадии развития
РЖ>на человека из внутренней массы бластоциста — оплодотворенной яйце-
fefe'b"# ск встречаются в течение всей жизни человека во всех
обляГаНах И тканях- Эмбриональные СК значительно активнее мезенхимальных,
более высокой способностью к размножению, большим потенциалом
С^^нцировки. Помимо мезенхимальных, выделяют еще гемопоэтические
Предшественники клеток крови. Основным депо гемопоэтических СК счи-
мозг. Отдельно можно выделить также фетальные СК. которые
% 113 абортивного материала. Во многих странах применение этих кле-
запрещено по морально-этическим соображениям. Стволовые клетки
Ш4 ШВЙРР иммунология
встречаются I всех органах и тканях, а не только в костном мозге. Он с0
І мезенхимальные клетки, хотя содержание их в жире, например, заметно
шее. чем • костном мозге. Неправильно думать, что нигде, кроме костного
СТВОЛОВЫХ клеток нет. Исторически СЛОЖИЛОСЬ. ЧТО первые СК были обнаг*40**’
именно I костном мозге, поэтому долгое время и считали, что именно ко
ммгамкржит едва ли не все СК организма. Позже их обнаружили в жире*1**
мышцах, печени, легких, сетчатке глаза - практически во всех ооганя* » L°*e
11 * в* и тканях
организма. Мезенхимальные стволовые клетки, полученные из различных тк -
практически ничем не отличаются. Отличие заключается только в содержа
определенных прогениторных клеток, т.е. клеток, находящихся на пути к диЛаТ
ренцироаке. у каждой ткани они свои.
В сформировавшемся организме человека существует примерно 200 различи
типов клеток. Они требуют постоянного замещения по мере их старения и отм *
рания. Эту восстановительную функцию выполняют стволовые клетки, находя
ккеся во всех тканях и органах. На поверхности СК расположены специфически
рецепторы, чувствительные к цитокинам, выделяющимся в местах поражений
Уникальность и универсальность механизма репарации заключается в том, что СК
сами находят дорогу к местам поражений в организме. С годами количество СК
снижается, потенциал их также угасает. Тем не менее пока жив человек, живы его
стволовые клетки, их можно выделить и вырастить даже у очень пожилых людей
Конечно, у здоровых и молодых людей стволовых клеток, как правило, больше
ко тенденция эта не абсолютна. Состояние СК зависит от состояния здоровья
человека, образа жизни, а не только от возраста.
Применение стволовых клеток для лечения и профилактики широкого
спектра заболеваний привело к активному развитию клеточных технологий.
В настоящее время во многих странах созданы и работают многочисленные
медицинские клиники различной специализации, которые используют стволо¬
вые клетки.
ИСТОЧНИКИ СТВОЛОВЫХ КЛЕТОК
Эмбриональные стволовые клетки
После оплодотворения яйцеклетки сперматозоидом образуется клетка с пол¬
ным набором хромосом — зигота. Через 30 ч после оплодотворения она начинает
делиться, и на 3-4-й день из 16 и более вновь образованных клеток формируется
компактный шарик, называемый морулой. Через 4-5 дней еще после несколь¬
ких делений клетки морулы начинают дифференцировку. Создается пузырек
из клеток - бластоциста, наружные клетки которой в дальнейшем превращаются
в околоплодные образования. Клетки, находящиеся внутри бластоцисты, за свою
возможность развиваться в любые клетки, ткани и органы плода называются
мультипотентными стволовыми клетками. Не все стволовые клетки дифферен¬
цируются в клетки тканей эмбриона. Часть из них накапливается в этот период
в желточном мешке, а к 6-й неделе развития — в печени. Начиная с 12-й неде¬
ли большое количество стволовых клеток перемещается в селезенку и позже
в костный мозг и другие ткани. По своим свойствам эти клетки отличаются
от стволовых, находящихся в бластоцисте. Они частично утрачивают возмож¬
ность дифференцировки в клетки и ткани организма. Требуются определенные
факторы для восстановления их способности к дифференцировке в необходимом
направлении. Считают, что до 12-недельного срока развития эти клетки (рис.
25-2) неиммуногенны и при пересадке таких клеток не возникают реакции оттор¬
жения, в связи с чем их можно использовать без предварительной проверки совме¬
стимости донора и реципиента. В настоящее время применение эмбриональных
стволовых клеток во всем мире, включая Россию, заморожено, так как не доказана
их безопасность в плане онкогенности.
ИММУНОЛОГИЧЕСКАЯ кэолдсиос
8-«ЛвТ0миый эмбрион
'шшййй
Недифференцированные
стволовые клетки
Клетки крое*»
Клетки сердечной
мышцы
Ряс. 25-2. Диффирецировка мультипотентной клетки
Стволовые клетки пуповинной крови
К моменту рождения некоторое количество стволовых клеток ШОДИТСІ
в крови новорожденного. После рождения ребенка в плаценте и пупочном кана¬
тике остается до 100 мл крови, которая содержит значительное количество СК.
По своим возможностям они близки к стволовым клеткам взрослого человека,
йот источник стволовых клеток начинают в наши дни широко исподиоапыоп
он не лишен некоторых недостатков. Существуют трудности выделение н аиф-
ференцировки СК, в связи с чем замораживают цельную кровь, а не стволовые
клетки. Кроме того, невозможно получить фракцию чистых СК, а в полученной
фракции преобладают кроветворные стволовые клетки, которые дифференциру¬
йся только в клетки крови.
Фетальные стволовые клетки
Фетальные СК получают из абортивного материала на 9- 12-й неделе беремен¬
ности. Помимо этических и юридических проблем, использование непровериюо*
й а°°Ртивного материала чревато осложнениями, в частности инфицированием
клиента возбудителями вирусных и/или бактериальных инфекций. В России
пользование фетальных клеток запрещено законодательством.
Минимальные стволовые клетки
озенхимальные СК, клетки взрослого организма, - это недифференциро-
клетки, которые находятся среди дифференцированных клеток и land
Щма. Общее их количество в каждой ткани крайне незначительно. Они могут
ельное время сохраняться в таком состоянии до момента востребоваииш.
1036 тр*исэ¥Змонная иммунология
Сигналом к началу дифференцировки могут послужить травмы или болезни. Эт*
шаепт могут бесконечно возобновляться и дифференцироваться (развиваться»
в специализированные клетки для восстановления утраченных. К настоящей!
Времени стволовые клетки обнаружены В КОСТНОМ мозге, жировой ткани, голов’
мм мозге, периферической крови, кровеносных сосудах, коже, печени, скелетной
мускулатуре. Весьма вероятно их присутствие и в других тканях. Отсюда следует
ІМКШ, что часть стволовых клеток сохраняется для последующего использования
Однако с возрастом или в случае серьезных патологий их естественное количество
омывается недостаточным и становится необходима трансплантация. В отли-
ок от эмбриональных, мезенхимальные СК вызывают реакции отторжения
щт трансплантации, поэтому для каждого реципиента необходим индивидуаль¬
ный подбор донора. Примером может служить трансплантация костного мозга
которую применяют уже более 30 лет. В ее основе лежит использование донорских
стволовых клеток. Для их приживления используют сложные и далеко небезопас-
ные методы подавления иммунной защиты пациента. Возможно также развитие
поздних осложнений по типу синдрома «трансплантат против хозяина». Самым
ЛЮушым источником мезенхимальных СК считается венозная кровь само¬
го пациента, который во многих случаях может быть одновременно и донором,
и реципиентом. Из его собственных тканей можно взять небольшое количество
стволовых клеток, размножить их до необходимого объема и затем дифференци¬
ровать в нужном направлении.
Исследование гемопоэтических стволовых клеток
Использование гемопоэтических стволовых клеток в качестве трансплантаци¬
онного материала при многих гематологических и онкологических заболеваниях
предполагает повышенное внимание к подробному описанию состава клеточной
популяции.
Для идентификации популяции гемопоэтических стволовых клеток используют
два основных способа:
• определение антигенного профиля (фенотипа) на мембране клеток;
я изучение колониеобразующей активности для оценки функциональной
активности и жизнеспособности.
Наиболее используемым фенотипическим маркером для гемопоэтических ство¬
ловых клеток считается СШ4-фосфогликопротеин. Н.Е. Broxmeyer, S. Cooper,
Z.H. Li и соавт. (1995) впервые идентифицировали маркер CD34 на поверхности
клеток специфической линии — человеческой эритролейкемии (KG-la), а позже
он был обнаружен на клетках сосудистого эндотелия. Клетки, имеющие наиболь¬
шую плотность С034-антигена (CD34+++), соответствуют популяции клеток,
высокообогащенной самыми ранними клетками. Для оценки степени зрелости
клетки используют ряд других поверхностных маркеров, включая CD38, thyi, c-kit
и Flt’/Flk2, а также суправитальную окраску родамином 123. Комбинированное
использование этих маркеров считается наиболее информативным для опреде¬
ления подтипов стволовых и клеток-предшественников. Так, С034+-клетки.
будучи также CD38 , thyllow, c-kit з-, Flt3+ и/или родамин 1231ow, рассматрива¬
ются как наиболее ранние клетки в процессе развития. Популяция CD34+CD38+-
клеток содержит более зрелые клетки-предшественники, чем те, которые найдены
в С1)34*(Л)38-популяции. Фенотипическое считывание клеточных типов счита¬
ется более быстрым, чем функциональные исследования, например измерение
пролиферативной способности. Однако фенотипирование несет свойственные ему
ограничения. Фенотип еще не обеспечивает достоверной информации относитель¬
но способности клеток к самообновлению, пролиферации или дифференцировке.
если фенотипический анализ не проведен в комбинации с функциональным иссле¬
дованием клеток в пределах типируемой популяции. Исследователи отмечают.
•W0 гемопоэтические стволовые и клетки-предшественники могут быть также
иммунологическая безопасность гшшшшш 1D7
ы 8 популяции CD34-O€T0K. в результате дальнейших. более глубоких
в^іовавйй было обнаружено, что эта популяция экспрессирует пе один
j^fH CD133. Антиген CD 133 принадлежит к новому семейству арогейіт
rfxl представляет собой трансмембранный глижопротеии размером 120«Да
* 1ЄССИЯ антигена отмечена у 5-недельного человечесяого эмбрша • гемо
тканях, причем в основном на светлых Ш34+-кяетш. В т rpm*v
<jJJcD90 (Thy-1). большинство CD117 (с-kit) и HLA-DR-поло л итгльиых ме-
^роме того, отмечена его стойкая экспрессия на продмферируюакм имптлим
^Желудочно-кишечного тракта, почек и нейроглин. Данный маркер, во мне
а «мюторых авторов. - более ранний признак того, что клеш принадлежит
Сдоями стволовых,
міекулярное фенотипирование стволовых и клет-предшественникоя кахо-
J!g в процессе разработки и, может быть, в конечном итоге позволит получать
мебточную характеристику, чем при поверхностном фенотияяровапм.
функциональная характеристика гемопоэтических стволовых клеток
Jama жизнеспособности
Существует несколько путей для функциональной оценки гемопоэтическнх
д^одовых и клеток-предшественников. Для клеток - предшесгввнмшав я бш»
«елых подтипов стволовых клеток (тех. которые, вероятно* НС имеют да¬
ренной способности к восстановлению популяции от vivo) квашу юг методы
«до клеток в полутвердой питательной среде типа агара,, агарозы или меш-
веллюлозы либо в суспензионной среде. Полутвердые питательные среды позво-
«нот получить характерные колонии. Эти колонии происходят из одоыых
клеток, которые считаются стволовыми клетками с ограниченной способностью
к самообновлению или клетками-предшественниками. Стволовая клеш/клети-
предшественник, дающая начало колонии, может быть распознана ш дкффе*
ренцированному потомству в колонии. При анализе колоний различают мелея,
называемые стволовыми клетками, колониеформирующие клетки с высоким про¬
лиферативным потенциалом (HPP-CFC), мультипотентные колониеформирующие
единицы (CFU-GEMM для гранулоцит-, эритроид-, макрофаг- и мегдаряодатсо-
лержащих компонентов) и более линейно ограниченные предшественник»! тира
CFU-GM (способность к гранулоцитарной и макрофагальной дифференцировке},
CFU-G (способность к гранулоцитарной дифференцировке), CFU-M (способность
к макрофагальной дифференцировке), CFU-Mega (способность к мегшрмоцв-
гарной дифференцировке) и BFU-E (бурстформирующая единица - эритроизная,
шособная к эритроидной дифференцировке).
Обеспечение иммуногематологической безопасности
гемотрансфузий
Совершенствование профилактики посттрансфузионных осложнений, свши-
с антигенной несовместимостью донора и реципиента, остается одной
10 основных задач современной трансфузиологии.
Современный полный иммуногематологический мониторинг при переливании
"^компонентов включает следующие этапы:
* фенотипирование по антигенам эритроцитов, тромбоцитов, лейкоцитов;
* выявление антиэритроцитных, антитромбоцитных и антклейкоцитных анти¬
тел;
* определение специфичности выявленных антиэритроцитных, аитмтромбо-
«нтных и антилейкоцитных антител;
* проведение пробы на совместимость между сывороткой реципиента я фор¬
менными элементами крови донора — эритроцитами, тромбоцитами, лим¬
фоцитами;
1038 ТЯАНСФУЭИОННАЯ ИММУНОЛОГИЯ
контроль гематологических и иммунологических показателей п
трансфузии. Поа*
ПРОФИЛАКТИКА П0СПРАНСФУЗИ0ННЫХ РЕАКЦИЙ ПРИ ПЕРЕЛИВАНИИ
ЭРИТРОЦИТСОДЕРЖАЩИХ СРЕД
Основным фактором безопасности гемотрансфузионной терапии
обеспечение переливания иммунологически совместимой среды. Иммуно 'ИТг1е1’Ся
Эритроцитных антигенов И ИХ генетический полиморфизм создают ПРЄПГЄНН0СТЬ
несовместимых гемотрансфузий. Последствием несовместимой трансфузи °СЫлки
быть либо аллоиммунизация реципиента против эритроцитных антигенов*1 М°Жет
отсутствующих у реципиента, либо посттрансфузионная реакция, если пе Д°Но^'
ух» имеет антитела против эритроцитов донора. ^ і^ВДиент
Основные подходы к подбору пар «донор-реципиент» в настоящее время
дятся к следующему: СВо"
максимальной идентичности донора и реципиента по наиболее трансіуз
но опасным антигенам; он
I выявлению аллоиммунных антител и подбору донора, эритроциты кото
не содержат антигенов к антителам реципиента; ^ го
і разработке алгоритма с учетом трансфузионного, акушерского анамнез
реципиента и количества планируемых трансфузий.
Существующая в настоящее время концепция профилактики постгранефузнон-
ных реакций и осложнений гемолитического типа включает 3 позиции:
• донор и реципиент должны быть идентичны по антигенам А, В, D;
I донор не должен иметь антиген Келл;
І реципиент не должен иметь антител, направленных против антигенов донора.
С.И. Донское и соавт. (2004, 2006) считают необходимым дополнить эту кон¬
цепцию:
І донор и реципиент должны быть идентичны по антигенам А, В, D, Е, с, е;
• донор не должен иметь антиген Келл и Cw;
• реципиент не должен иметь антител, направленных против антигенов донора;
• донор не должен иметь антител, Направленных против антигенов реципиента.
Оптимальным вариантом концепции совместимой крови авторы считают сле¬
дующее:
• донор и реципиент должны быть идентичны по антигенам А, В, D, С, Е, с, е,
Келл и Cw;
• донор и реципиент не должны иметь антигенов, направленных против анти¬
тел друг друга.
Таким образом, по мнению авторов, концепция подбора совместимых эритроци¬
тов должна базироваться на обязательном фенотипировании доноров и больных,
скрининге предсуществующих антител. Однако подбор эритроцитов, идентичных
по столь широкому спектру антигенов, вряд ли возможен и экономически оправдан
ввиду того, что придется искать идентичного донора среди сотен и тысяч человек.
Второй подход к подбору совместимой крови основан на том, что более
целесообразно сосредоточить основные усилия на скрининге антител у боль¬
ных и при их выявлении определять специфичность. При необходимости
гемотрансфузий следует подобрать донора, эритроциты которого не содержат
антигенов к обнаруженным антителам реципиента. Таким образом, и водном,
и в другом случае нет четкого разграничения контингентов реципиентов
в зависимости от объема необходимой трансфузиологической гемокоррекции-
Имеет ли место единичная, однократная гемотрансфузия или же реципие^
нуждается в многократных, постоянных трансфузиях? Очевидно, что в совр
менных условиях, когда необходимо совмещать экономичность, целесииЯ
бразиость, эффективность исследований для максимального обеспеч
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГШОТМИСОУЗИЙ 1039
«яасности проводимой гемотрансфузионной терапии, требуется иной ваш
«лборУ необходимого и достаточного набора исследований при подборе
11 понентов Крови для конкретного больного. Разумеется, в лучшем случае
‘падение донора и реципиента по основным эрмтроцитным антигенам (А. В.
7 Е с. е. К и С") было бы оптимальным, однако возникает вопрос о кодиче-
7 обследованных для подбора подходящего донора. Необходимость научно
рванного метода расчета количества подлежащих обследованию в целях
7ска донора с заданными параметрами для конкретного больного вотребо-
разработки этой проблемы.
Метод расчетз поиска доноров
Подбор донора требует определенных экономических затрат, необходимо либо
давать картотеку типированных доноров, представляющую все возможные
^оианты, либо каждый раз обследовать большое количество людей.
|ели условно принять, что каждый фактор (антиген) встречается у 50% исе-
ения и вероятность его обнаружения равна 0,99, а донор и реципиент должны
Lu» идентичны по 9 антигенам, то объем картотеки типированных доноров будет
„авен сумме всех возможных сочетаний из того количества факторов, которые
Дуется учитывать. Сосчитать это можно по следующей формуле:
N=2», і
щеІЇ- размер «коллекции»; k - количество учитываемых факторов (антигенов).
Таким образом, N-29=512, т.е. картотека должна содержать 512 различных
яшж Если же факторы (антигены) встречаются реже указанного и распростра¬
ненность отдельных факторов на разных территориях различна, а также необ¬
ходима^ большая надежность обнаружения, объем поиска возрастет во много
раз к потребуется метод расчета количества лиц, которых придется обследовать
для поиска подходящего донора.
Определить количество человек, которых потребуется обследовать для поиска
донора с определенным набором антигенов, можно лишь тогда, когда известна
частота встречаемости лиц с таким набором. Если на какой-то территории в недав¬
ней пропілом были проведены исследования по всем факторам (антигенам),
частота встречаемости каждого варианта из сочетаний будет определена непо¬
средственно из фактического материала. Если же частота встречаемости разных
факторов Определялась независимо, то для определения частоты встречаемости
их сочетаний нужны расчеты.
Прежде всего следует определить, связаны факторы между собой или незави¬
симы.
Ориентировочный расчет можно сделать проще (чтобы не усложнять вычис¬
ления, частоту встречаемости надо выражать не в процентах, а в долях единицы),
to этого надо сравнить частоту встречаемости их сочетания (PAJ с часто¬
той их общей встречаемости (F^) и каждого отдельно (FA и FJ. Здесь и далее
с индексом обозначает частоту встречаемости соответствующих факторов
той их сочетаний, D с индексом — частоту встречаемости доноров с соответствую-
факторами или их сочетаниями.
Очевидно, что при полной отрицательной связи, когда = 0, D^M), ті*,
^сочетаемые факторы ни у одного из доноров встретиться не могут. Аналогично,
положительной связи, когда FA/J = FA=FrD• =DA*D,т.е. еслишяе-
jy* жестко связаны, то при расчете сочетании достаточно иаюдьэомтъ
^^встречаемости лишь одного (любого) из них.
же нет ни полной положительной, ии полной отрицательной связи, прда-
Щг®* следующая формула:
(21
1040 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
При равенстве обеих частей этой формулы факторы независимы. Если ле
часть формулы больше правой, между факторами имеется положительная Cea3”
1 обратном случае - отрицательная. Если факторы крови независимы, аеоо3ь'
яость (и соответственно частота встречаемости) доноров с определенным их набГ
ром равна произведению частот каждого отдельного фактора, т.е.:
DMN=FAXFBXFCX-XFlr (3)
Пример 1
Условия: независимые факторы (А, В и С) встречаются со следующими частота
ми: РА ч ОД; FB=0,2', Ес = 0,3.
Задача: определить частоту встречаемости доноров со всеми этими факторами
Решение по формуле (3): DA C = FA х FB х Fc = 0,1 х 0,2 х 0,3 = 0,006,
Ответ: частота встречаемости донора с заданным набором факторов равна 0 006
(0,6%).
При прочих равных условиях, чем больше факторов учитывается (как бы часто
ни встречался каждый из них), тем ниже вероятность их сочетания. Допустим
что каждый фактор, который необходимо учитывать, встречается у 50% доно¬
ров. Если нужен донор, обладающий сочетанием двух факторов, вероятность его
обнаружения равна 0,52=0,25, а вероятность обнаружения донора, обладающего
сочетанием девяти факторов, равна 0,59»0,002.
Если факторы связаны, то формулу (3) следует преобразовать — ввести в нее
частоты встречаемости каждого фактора с учетом наличия (или отсутствия) тех,
с которыми они связаны.
Когда частота встречаемости определенного набора факторов известна (опреде¬
лена эмпирически или путем вычисления), можно вычислить количество потенци¬
альных доноров, которых надо исследовать, чтобы с определенной вероятностью
найти хотя бы одного, соответствующего требованиям.
Для этого используют следующую формулу:
n = logp/log(l - Da+n), (4)
где і — число доноров, которых надо обследовать; р — вероятность отсутствия
донора с заданным набором факторов в числе обследованных доноров.
Логарифмы можно использовать любые, но обязательно в числителе и знаме¬
нателе один и тот же.
Пример 2
Условия: частота встречаемости доноров с заданным набором факторов равна
0,1 (т.е. такие доноры составляют 10%).
Задача: определить количество доноров, которых надо исследовать для поиска
подходящего с вероятностью ошибки 0,01.
Решение по формуле (3): n = (1 - D) - « 44.
Ответ: для того чтобы выявить донора, частота встречаемости которого равна
10%, с вероятностью ошибки 0,01, придется обследовать в среднем 44 человека. ^
Следует учитывать, что фактические данные — лишь выборка из генеральной
совокупности, размер которой столь велик, что можно считать ее бесконечной.
А раз так, как бы много доноров мы ни охватили, результаты содержат ошибку
репрезентативности. Для того чтобы застраховаться от преувеличенного ожида¬
ния, резонно брать значение каждого показателя в нижнем (худшем) варианте
в пределах того доверительного интервала, который разумно использовать.
Так. например, при использовании формулы (2) маловероятно, что факти¬
ческий материал даст полное равенство обеих ее частей. Надо учесть ошибки
репрезентативности и считать факторы связанными лишь тогда, когда различия
превышают доверительный интервал. Если этого нет, факторы можно считат
независимыми.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИИ JЦ]
впмрашаясь к задаче, можно для вычисления количества доноров, которых
90Jобследовать, чтобы найти того, эритроциты которого были бы идентичны
i^*L0цитами реципиента по 9 антигенам, использовать формулу (4):
riffle
л = lgp + lg(l ^
_ количество наблюдений, необходимых для выявления искомых случаев.
$ * примере - количество доноров, которых необходимо обследовать ш поис-
^еитичного с реципиентом по 9 эритроцитным антигенам; р - допустимая
*Іность отсутствия искомого случая, в этом варианте - донора с заданным ЦН
fopoM антигенов - 0,01; D - частота встречаемости (в долях единицы) факто-
(антигенов); А, N - факторы (антигены) от А до N.
Подставляя значения частоты встречаемости каждого антигена в формулу.
получаем;
я = Ig0,01/Ig{l - (0,43 х 0,23 х 0,83 х 0,70 х 0,01 х 0,32 х 0.79 х 0.95 х 0,07)} *
= lg0,01/lg(l-9,66) » (—4,605)/(-9,66А) * 476 730.
Итак, для того чтобы найти донора, эритроциты которого идентичны эритро¬
цитам реципиента по 9 антигенам, с вероятностью ошибки 0,01. придется обследо¬
вать в среднем 476 730 человек!
Поскольку обследовать подобное количество доноров для поиска подходящего
в повседневной трансфузионной практике маловероятно, необходима иная такти¬
ка подбора совместимой крови.
Алгоритм исследований при подборе гемокомпонентов сенсибилизиро¬
ванным и несенсибилизированным реципиентам
Основываясь на более чем 10-летнем опыте работы по обеспечению компо¬
нентами донорской крови больных клинических отделений ГУ РНЦХ им. акад.
Б.В. Петровского РАМН и ММА им. И.М. Сеченова с высокой хирургической
активностью (70-80 операций в неделю, требующих гемокомпонентной коррек¬
ции, из них 25 — с искусственным кровообращением), полагаем, что в повседнев¬
ной трансфузиологической практике целесообразно придерживаться следующего
алгоритма иммуногематологической сертификации,
а Всем реципиентам (и при однократных трансфузиях) после определения
группы крови и резус-принадлежности перед переливанием эритроцитсодер¬
жащих компонентов крови в обязательном порядке следует проводить инди¬
видуальный подбор на совместимость в непрямой пробе с АГС и солевых
пробах, выполненных при 4-8, 20-22 и 37 °С.
I Сыворотки реципиентов с отягощенным трансфузионным и/или акушер¬
ским анамнезом и больных, нуждающихся в многократных гемотрансфу¬
зиях, необходимо дополнительно тестировать на наличие аллоиммунных
антител (тепловых, Холодовых, ферментзависимых) с идентификацией
их специфичности и классов иммуноглобулинов (IgG и IgM). С учетом
выявленной специфичности иммунных аллоантител следует обеспечить
подбор типированной крови, не имеющей антигенов к антителам реципиен¬
та. Перед гемотрансфузией также необходимо проводить индивидуальный
подбор крови на совместимость в непрямой пробе с АГС и солевых пробах
(при 4-8, 20-22 и 37 °С).
выполнение проб на совместимость перед трансфузией необходимо про-
в специализированной лаборатории. В «Инструкции по применению
Абонентов крови» (2002) проведение проб на совместимость вменяется в об*-
ИрЛ0сть врачу, выполняющему гемотрансфузию (раздел 2. п. 2.1.2). «провести
Из J На индивидуальную совместимость крови реципиента и донора одним
способов:
Первый способ: двухэтапная проба в пробирке с антигяобуяином.
J042 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
I второй способ: на плоскости при комнатной температуре и одна щ ^
проб (непрямая проба Кумбса, реакция конглютинации с 10% желатином*
или реакция конглютинации с 33% полиглюкином*)*.
Как показывает многолетний опыт работы, этот пункт инструкции (двухэтап-
ная проба в пробирке с антиглобулином, непрямая проба Кумбса) врачи, осущест.
вляющие гемотрансфузии, как правило, не выполняют, и в большинстве случаев
все ограничивается пробой на плоскости, редко в сочетании с реакцией конглюти¬
нации с пслишокином* при комнатной температуре или с желатином*.
Выходом из положения считается предварительное проведение полного спектра
исследований, в том числе всех проб на совместимость в лабораторных условиях
что значительно повышает качество предтрансфузионных тестов. Обязательное
следование предложенному алгоритму действий в повседневной работе позво¬
ляет избежать использования несовместимой крови в редко встречающихся
и/или шжнодиагностируемых случаях. Так, осложнения могут возникнуть
в случаях, когда предварительный скрининг антител у реципиентов дает отрица¬
тельный результат, а перелитые одногруппные эритроциты донора несовместимы
с кровью больного. Это может быть обусловлено присутствием на эритроцитах
донора IgG и/или комплемента, что выявляется в ПАТ. Однако проведение ПАТ
не регламентировано обязательными требованиями при обследовании доноров,
и такие дозы крови выдаются в лечебную сеть. Положительные реакции при пробе
на совместимость в АГТ обезопасят реципиента от введения таких эритроцитов.
Отрицательный результат скрининга аллоантител у реципиента объясняется очень
слабореактивными антителами определенной специфичности, или у него могут
быть антитела к редко встречающимся антигенам, которые также не выявляются
при скрининговом тестировании. Пробы на совместимость (солевые и непрямой
пробы с АГС) позволяют и в таких случаях установить вероятно имеющуюся несо¬
вместимость крови реципиента с эритроцитами донора. Обязательное проведение
непрямого АГТ и солевых проб при различных температурах (4-8,20-22 и 37 °С)
позволяют определить несовместимость и при наличии у реципиента с группой
крови Aj или AjB анти-А,-антител (холодовых, тепловых) либо антител, реаги¬
рующих при комнатной температуре (например, анти-М), что играет важную роль
для больных, подвергающихся охлаждению (температура тела 18-25 °С) в период
операции.
В ежедневной траисфузиологической практике необходимо решать ряд труд¬
носовместимых задач (экономичность, целесообразность, эффективность, резуль¬
тативность, скорость исследования), направленных на обеспечение безопасности
гемотрансфузий.
Предлагаемый алгоритм исследований позволяет решать проблемы, связанные
и с особенностями ввмотрансфузионного обеспечения больных, оперируемых
в условиях гипотермии. Так, ряд операций у кардиохирургических больных про¬
водят в условиях, когда температура тела снижается до 16-28 °С. В этих ситуациях
наличие у больных холодовых антиэритроцитных антител, которые выявляются
in vitro при 4-8 °С или комнатной температуре (20-23 °С), может спровоцировать
постгрансфузионный гемолиз. Предложенный и апробированный на практике
подбор донорских компонентов ДЛЯ реципиентов-носителей, в частности ХОЛОДО¬
ВЫХ анти-А,-антител, позволяет при гемотрансфузии в условиях искусственной
гипотермии избежать гемотрансфузионных реакций и осложнений у этой катего¬
рии хирургических больных.
Эффективность применения данного алгоритма была подтверждена как при под¬
боре эритроцитсодержащих сред хирургическим больным, нуждающимся в одно¬
кратных гемотрансфузиях в относительно короткий промежуток времени, так
и при гемокоррекции у больных, получающих регулярные многократные гемо-
трансфузии (табл. 25-661
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГШОГМНСФУЗИ*
25-66. общие данные о реципиентах гемокомлононтоо
Реципиенты ГСМОКОИПОИЄИПИ (Д»335И. i том ШМ
1043
<1чест»о предше-
«"Пи»*
мужчины
/»1786
1044
879
163
1786
из них с АТ, %
15,1
1,6
ЖМфИЫ
0*1572
юшіДТЛ
896
394
282*
1572
0.2
2,8
18,4
JH5 трансфузий и/или беременностей^
Клиентам, которые в прошлом отрицали гемоттансфим, . Ш
удались только пробы на совместимость. При
I гемотрансфузии и/или беременностей проводили СКРЩ» и »12
1Іподбор донора, эритроциты когорфе
ІИ ДН™™ ронипиентов. и также в полном объеме пробы ш c^ST
„ротне во всех случаях поспрансфузионвыхреакций™ЇЇЗГ’
(ЯМьотует о правомочности использования данного алгооитшТ? -
^обеспечения безопасности гемотрансфузионйой терапий
Дааный алгоритм подбора применяли также при птерграисфуэноииш В
,|рероЦИТсодержащих сред у больных с бодашой^ЗЗЩ
«ифузионные режимы гемотрансфузи*. способстау, ІЖвіЯ
йшости и улучшению качества жизни зшх больньі, щЩ «ШИ
«ттраисфузионныи риск и становятся главной причиной высойЩШ
районных (иммуногематологических, инфекционных) SrlS
япсгомозиготнои р-талассемией отмечаею. прямая зависниЩМ
л сыворотке крови от количества предшестарощ»,
125-67. Частота выявления эритроцитных антител у больных с большой р-талассемией
в зависимости от количества гемотрансфузий
Антитела
Показа¬
тели
Количество гемотраисфузхй
Веете
сытротм J
0
1-10
11-20
21-30
31-40
>40
я
12
17
16
21
21
11
105
Зркрегглютинины
В солевом (фер¬
ментном) тесте
Тепловые
АбС., %
0
0 |
0
1(4.8)
3(14,3)
4 (ад
В (7,6)
і Холодовые
Абс.,%
0
0
0
1(4,8)
2(9,5)
4 (ад
7(67)
Примечание: п - количество исследованных сывороток.
Хотя у больных не были зарегистрированы поспрансфузионные осложнения,
>8,2% случаев отмечены негемолитические Й отсроченные гемолитические реак¬
ции.
Результаты исследования сывороток \2 больных с большой р*талассемией.
10Дбор крови которым в соответствии с предложенным алгоритмом проводили
с началом темотрансфузионной терапии, т.е. обеспечивали тщательное нмму-
^гематологическое сопровождение (определение фенотипа эритроцитов реци-
!"ентов перед началом темотрансфузионной терапии, постоянный мониторинг
i °' аутоиммунных антиэритроцитных антител у больных, подбор донора.
т*нотиц эритроцитов которого максимально совпадает с фенотипом больного,
^«Дуальный подбор с пробами на совместимость в непрямом АГТ и солевых
jj. l' применение лейкоцитыых фильтров, отмытых эритроцитов), показали,
*;лько у одного из обследованных после 10 гемотрансфузий были обнаружены
^1йЦ|Унные холодовые анти-1-антитела. Избежать сенсибилизации к анти-
И ТИАНСФУЗМОННЛЯ ИММУНОЛОГИЯ
пну I затруднительно в связи с присущим большинству больных с Э-талассемяы!
сохранением эмбрионального антигена і, в среднем же доля активных сывоп^Г
выявляемых в непрямом АГТ, не превышала 3%, оставаясь на таком Достаток
низком уровне даже после 60 трансфузий, что повышало эффективность лечени°
больных (табл. 25-68).
Таблица 25-88. Частота выявления эритроцитных антител у больных с большой 0-талассемйёе
при гемотрансфузиях с обеспечением адекватного иммуногематологичёского сопровождения
Акпггелі
Пока¬
затели
Количество гемотрансфузий
Всего I
I сывороток
0
11-30
31-40
41-50
51-60
>60
я
4
7
8
10
14
26
I бГ~~
1 Эргроатмотинины
Г В солевом (фер¬
Тепловые
Абс.,%
0
0
0
0
0
1 (5,26) 1
иг
ментном) тесте
Холодовые
Абс.,%
0
0
0
0
0
0
0
В непрямом АГТ
Абс.. %
0 ;
о;
1 (7,14)
1 (3,85)
2(2,89)
В прямом АГТ
Абс.,%
0
1
0
0
г0 ,
0
0
Примечание: п — количество исследованных сывороток.
Таким образом, выполненные исследования и анализ полученных результа¬
тов позволили установить, что при условии соответствия донора и реципиента
по основным эритроцитным факторам — системам АВО, резус (D и с) и Келл
(К) - основным критерием, максимально обеспечивающим иммунологическую
безопасность гемотрансфузий эритроцитсодержащих сред, остается подбор пары
«донор-реципиент» в непрямой пробе с АГС и солевых пробах (при температу¬
рах 4-8,20-22 и 37 вС).
Особое значение имеет подбор донора для реципиентов - носителей анти-Aj-
антител, если гемотрансфузии проводят в условиях искусственной гипотермии,
Клинические наблюдения демонстрируют возможность гемолитических реак¬
ций у реципиентов эритроцитной массы при гемотрансфузии во время хирурги¬
ческих операций в условиях искусственной гипотермии. Подбор крови больным
проводили в соответствии с инструкциями без определения наличия и активности
Холодовых антител.
Наблюдение 1
Больному П. (группа крови А2В, резус-положительная) в мае 2000 г. проводили
протезирование аортального клапана и восходящей аорты в условиях искусствен¬
ной гипотермии (до 16 °С). Через 10 мин после начала гемотранефузии было пере¬
лито около 300 мл донорских эритроцитов, 600 мл СЗП (группа крови АВ, резус-
положительная), наблюдали падение АД с 115/70 до 60/35 мм рт.ст,, повышенную
кровоточивость из операционной раны, гемолиз, темную лаковую мочу (гемогло-
бинурию). Проявление внутрисосудистого гемолиза было оценено как резуль¬
тат групповой несовместимости крови донора и реципиента. Трансфузия была
прекращена, кровь больного и контейнер с остатками донорской эритроцитной
массы направлены в лабораторию для исследования причины посттрансфузи-
онной гемолитической реакции. После повышения температуры тела больного
до 36,3 *С гемолиз прекратился. При лабораторном исследовании и анализе
у реципиента выявлены холодовые анти-А^антитела, которые, очевидно, и стали
причиной гемолитической реакции во время гемотрансфузии при искусственной
гипотермии. Гемотрансфузии (300 мл эритроцитной массы, 600 мл СЗП, 5 доз
тромбоконцентрата) в отделении реанимации с учетом групповой особенности
реципиента прошли без реакций и осложнений.
Наблюдение 2
Больному К. в апреле 2001 г. проводили протезирование восходящей дуги аор
тії в условиях искусственной гипотермии (охлаждение до 17 *С). Группа крови
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬтаиташчрудий IQ45
дВ, резус-отрицательная. В анамнезе отмечены гпнлрашфумш но ааю-
і^іГГмарте 1998 г. Во время операции проводили оерелманве дшорооа
dКдов группы АВ. резус-отрщательных. Через 20 мин после намштаК
Ж^яито 500 мл донорских эритроцитов, 15 л СЗП. 8 доз троибоижажтет)
дадение АД с 115/70 до 70/40 мм рт.ст. с одновременным усилением
і^Гчения из операционной раны, признаки внутрисосудистого гшоша та-
цосле прекращения трансфузии и повышения температуры тела боаыюго
явления гемолиза прекратились. Анализ образца кром реципиента паши
кодовых анти-А1-антйтел. В реанимационном отделении
эритроцитной массы, подобранной с учетом групповой принадлежности
анти-Aj-антител, прошли без реакций и осложнений.
'тим*эбразом, в вышеописанных случаях внутрисосудистый гемолиз был pfy
J^eH наличием в сыворотке крови реципиентов избыточных №И-Лг№пта.
^rncHWY при температуре тела (<35 °С), но агглютинирующие дпнпрпгу»
2ооциты, содержащие антиген Аг при более низких температурах (19-22 *С).
jZbie мероприятия не потребовались, поскольку гемолиз прекратился после
^щения температуры тела больных до 37 °С.
Наблюдение 3
Больная Н. в октябре 2002 г. поступила из отделения патологии беременных.
Накануне в связи с анемией ей была проведена однократная трансфузия 250 ыл
ащ^цитной массы. В переводном эпикризе группа крови больной отмечена
йк АВ, резу.с-отрицательная, носительство слабого варианта антигена А эритро*
uiiTOPJEf. фиксировано. В выписке не было указаний, что переливание проведено
Щрвидуально подобранного донора. К моменту поступления, на следующий
т, шиле трансфузии, у больной появились выраженная желтуха, гемоглоби-
нурия. При исследовании: гемоглобин - 14,4 ммоль/л, уровень билирубина -
330 ммоль/л. При изосерологическом исследовании крови определена группа
крови А2В, в .сыворотке обнаружены анти-А^антитела. Титр антител при иссле¬
довании на плоскости — 1:16, при исследовашш в пробирках - 1:128. Анти-А,-
антитела проявляли активность, т.е. вступали в реакцию агглютинации с эритро¬
цитами Aj как при 4 °С, так и при 22 и 37 °С. Следовательно, можно утверждать,
то именно носительство анти-А^антитед, активных при 37 'С и имеющих высо¬
кий титр, стало причиной посттрансфузионного осложнения у этой больной.
Правильный выбор трансфузионной тактики позволяет избежать осложнений
у тащ реципиентов.
Наблюдение 4
Больная Т, в ноябре 2002 г. поступила в отделение хирургии печени, желчных путей
*кщжелудочной железы с приступом острого холецистита, сопутствующее забодева-
Ие т миома матки, в анамнезе — частые мено- и метроррагии. При поступлении -
нмоглобин 42 г/л. Группа крови была идентифицирована ш AjB. выявлены ипи-
А,-ащигела в титре 1:8, активные при 37 °С в пробирш и на плоскости я агаоа*
|®еся к иммуноглобулинам класса IgG. Больной перелили 2 дозы (600 мл) «дии-
подобранных отмьггых донорских эритроцитов группы В. Осложнений после
Шфузии не отмечено, уровень гемоглобина повысился до 60 г/л.
Наблюдение 5
•0^ЛЬНОМУ К. в декабре 2002 г. планировали протезирование восходящей дуги
B условиях искусственной гипотермии (охлаждение до 19 ’Q. Груша хром
«ого АуВ, резус-положительная. Предоперационный анализ образца хром
наличие в сыворотке крови больного анти-А-антител, активных при низ-
в«нературах (4 и 20 °С). Больному были подобраны эритроциты от донора
резус-положительные. Интраоперацногам трансфузии (при сии-
^Иературы тела до 19 °С) индивидуально подобранных эритроцитов
«^). ДРРР мл СЗП, 12 доз тромбоцитиого концентрата прошли без реакций
Падений.
1046 тМнсфузиомная ИММУНОЛОГИЯ
Необходимость идентификации носительства иррегулярных анти-А -31г.
определяется тем. что у реципиентов - носителей таких антител могут возниф^
аосггрансфузионные реакции или осложнения при переливании им дойоппГЬ
эритроцитов, содержащих антиген А,. Особенно велик риск таких ослои^ї
і случаях, когда: Ний
* анти-А,-антитела активны при 37 “С;
* относятся к классу IgG, т.е. иммунные;
* трансфузию проводят реципиенту при хирургических операциях в услови
искусственной гипотермии (ниже 28 °С). Ях
С учетом вышеизложенного необходимо реципиентам с группой крови А
или А2В, имеющим иммунные анти-А,-антитела, подбирать одногруппные доноп
ские эритроциты (А, или AjB Соответственно), а при их отсутствии в соответствии
с инструкцией возможен подбор иногруппных донорских эритроцитов;
І реципиентам с группой А, эритроциты группы 0;
І реципиентам с группой ЩЙ эритроциты групп 0 или В.
В обязательном порядке выполняют индивидуальный подбор на совместимость
крови донора и реципиента в солевых пробах (при 4-8,20-22,37 °С) и непрямой
пробе с АГС.
При переливании компонентов плазмы (СЗП, нативной плазмы, КНП) реципи¬
ентам с группой крови А, и А2В, Имеющим иммунные анти-А1-антитела, следует
использовать одногруппную плазму А и АВ соответственно.
Необходимо также иметь в виду, что при гемотрансфузиях больших объемов
свежезамороженной плазмы от доноров I группой крови ф и А2В, имеющих анти-
А,-антитела, реципиентам с группами крови А, и А,В существует риск возникнове¬
ния гемолитических реакций или осложнений.
В заключение следует еще раз подчеркнуть, что необходимо четкое разграниче¬
ние контингентов реципиентов в зависимости от объема требуемой трансфузио-
логической гемокоррекции. Имеет ли место единичная, однократная гемотранс¬
фузия или же реципиент нуждается в многократных, постоянных трансфузиях?
Очевидно, что в современных условиях, когда необходимо совмещать эконо¬
мичность, целесообразность, эффективность исследований' для максимального
обеспечений безопасности проводимой їеШіїрансфузионной терапии, требуется
точно обоснованный выбор необходимого ^достаточного набора исследований
для подбора компонентов крови для конкретного больного;
Несомненно, максимальный набор исследований будет необходимей случаях
подбора гемокомпонентов больным, нуждающимся в многократных® постоянных
трансфузиях. Таким образом, можно сформулировать несколько выводов; |
Всем больным, даже при однократных трансфузиях, после определения груп¬
пы крови и резус-принадлежности перед гемотрансфузий эритроцитсодержавщх
компонентов крови в обязательном порядке следует проводить индивидуальный
подбор на совместимость в непрямой пробіе с АГС й солевых пробах, выполненных
при 4-8,20-22 и 37*С.
Сыворотки пациентов с отягощенным трансфузионным и/или акушерским
анамнезом и больных, нуждающихся в многократных гемотрансфузиях, необхо¬
димо дополнительно тестировать на наличие аллоиммунных антител (тепловых,
холодовых, ферментзависимых) с идентификацией их специфичности и классов
иммуноглобулинов (IgG и IgM). С учетом выявленной специфичности иммунных
аллоантител следует обеспечить подбор типированной крови, не имеющей анти¬
генов к антителам реципиента. Перед гемотрансфузией также необходимо прово¬
дить индивидуальный подбор крови на совместимость в непрямой пробе с АТС
І солевых пробах (при 4-8,20-22 и 37 "С).
Предлагаемый алгоритм в целом не противоречит основным принципам под¬
бора пар «донор-реципиент», отраженных в инструкции, и позволяет, стандар¬
тизируя подход к шшуногематологическим и изосерологическим исследова-
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГШОТРИНСФУЗИЙ ||47
ШІМ реального времени с минимальными шреимн расходуемых
** 0 пв обеспечить максимальную безопасность гемотрансфузий с иконой
^Сосгью конечного результата - отсутствием срочных и отсроченных
# сфУзи0ННЫХ реакции и осложнений-
^ГайТИКА ПОСТТРАНСФУЗИОННЫХ РЕАКЦИЙ ПРИ ТРАНСФУЗИИ
1|&Г°В
ІІ поофилактики аллоиммунизации и посттрансфузионных осложнений
^ і переливать тромбоциты с учетом антигенной структуры донора
в*0 лиента. несовместимость донора и реципиент по НРА может приводить
імунйзации и развитию многих патологически состояний. Основной
№ШЖ конфликтов, развивающихся вследствие несовместимости по НРА
остается срыв иммунологической толерантности в организме больного.
" п’ятий К тяжелому аутоиммунному процессу. Накопленный опыт миро-
ЩІЙСИ И практики свидетельствует о необходимости переливаний АВО-
рой №HLA* и НРА-совместимых тромбоцитов.
ІННВІЗ выполнять типирование пациентов по НРА и HU на ранних
иях заболевания с последующим поиском НРА- и HLA-совместимых доноров
^Тргистра типированных доноров. Сведения о высокой иммуногенности тромбо-
Хецифических антигенов и незначительной первичной иммунизации к аите-
Ш| системы HLA указывают на целесообразность формирования контингента
Риторов, типированных в первую очередь ш> НРА. Антигены именно этой системы
flvnyT играть основную роль при использовании в качестве трансфузионной среды
^Шоконцентратов, очищенных от примеси лейкоцитов.
Частота аллельных НРА-генов различается у индивидов, принадлежащих
І «азным расам. Особенно различаются частоты редких аллельных вариантов
генов локусов НРА-1, -2, -4, -5 и -15. Внутри одной большой расы народы раз¬
ных стран |i представители узких локальных популяций - имеют свои генные
частоты НРА и свойственные им особенности распределения НРА-гено», т.е.
маркеры популяции. Даже в пределах одной страны население разных районов
отличается по частоте аллельных вариантов генов, что связано с принадлежно¬
стью их к разным этническим группам. Определение величины контингента НРА-
тщшрованных доноров необходимо проводить исходя из иммуногенетичесш
параметров указанных генов у жителей каждой конкретной местности,
Проведены исследования по определению иммуногенетичесш параметров
пселективной выборке московских доноров, представленных в основном русски¬
ми. Данные по частоте аллельных генов и генотипов показаны в табл. 25-69.
Таблица 25-69. Частота аллельных генов и генотипов НРА у московских доноров (л*297)
Локусы НРА
Частота аллелей
Частота гмошт
а
Ь
аа
at)
bb
К
абс..
284
82
215
69
13
і
%
95,62
27,61
72М
23,23
4,38
рг '
абс.,
291
70
227
64
в
2.02
te
абс.
240
207
91
50.t7
19,19
te
te—-——
%
100
0 ,1
100
247~~~
46
4
fer———
%
абс.,
100
0 __
то
ТОО
1
1 __
1048 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Частоты аллелей и генотипов НРА у московских доноров сопоставимы с часто,
тами генов у представителей европеоидов.
По данным частотных распределений генотипов у московских доноров бьш
сделана оценка необходимого объема контингента НРА-типированных людей
На рис. 25-3 приведена расчетная зависимость вероятности неудачи в подбоп
100 НРА-совместимых доноров для одного случайного реципиента от величины
регистра. Если задаться пороговым уровнем неудачи в подборе группы из loo
доноров, равным 10%, то такой уровень обеспечивается регистром из ізоо
доноров, т.е. в 90% случаев удастся подобрать НРА-совместимых по антигенной
структуре доноров тромбоцитов для продолжительного курса трансфузионной
терапии, прежде всего пациентам с аплазией кроветворения, так как именно они
нуждаются в частых переливаниях компонентов крови. Рассчитанное количество
НРА-типированных доноров значительно меньше, чем величина необходимого
контингента HLA-типированных доноров, составляющая более 20 000 для евро¬
пеоидов. Такое количество доноров позволяет обеспечить совместимыми тромбо¬
цитами только 80% больных, имеющих часто встречающийся HLA-генотип.
Формирование контингента НРА-типированных доноров тромбоцитов пред¬
ставляется важным как для профилактики первичной аллоиммунизации, так
и для Предотвращения йостгрансфузионных осложнений у больных с анти-НРА-
антителами.
500 1000 1 500 2000
Объем банка доноров, количество доз тромбоцитов
Рис. 25-3. Расчетная зависимость вероятности неудачи в подборе 100 совместимых доноров
для одного случайного реципиента в зависимости от объема банка доноров
В иммуногематологии принято выделять несколько степеней совместимости
донора тромбоцитов и реципиента - от полной идентичности по антигенной
структуре до простой совместимости, оцениваемой в специальных серологических
тестах. Для предупреждения сенсибилизации и при обнаружении аллоиммунньв
антител доноров тромбоцитов подбирают с учетом как можно большего совпаде-
ния по НРА и HLA с реципиентом. Для обнаружения одного или двух совмести¬
мых доноров высокоиммунизированным больным иногда требуется ВЫПОЛНЯТЬ
перекрестные пробы с тромбоцитами 100 доноров. Ни одна трансфузия не 0$
...... g ^ - ШИ был
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ геиотмнсфуз*' 1048
плоясительный результат. Посттрансфузиоиный прирост тромбоцитов
лче*1 п использовании перекрестных реакций сопоставим с результатами
подобранных по НРА и HLA тромбоцитов, однако такой способ пере-
предотвращает дальнейшую иммунизацию больного к отсутствующим
^«^^можности поиска НРА- и HLA-совместимых доноров одним из
ДО? «вных подходов в лечении высокоиммунизированных пациентов оста-
подходящего донора среди родных братьев и сестер (сибсов) и друпи
е^^гемьи а также среди неродственных HLA-гомозиготных лиц, тапирован-
^полнительно по системе НРА. К сожалению, количество таких доноров
ВШаХ как правило, невелико. При выборе НРА-типированных доноров
і ^ очередь следует учитывать идентичность по HPA-la, НРА-5Ь. НРА-За,
1 к иммунизация чаще развивается именно в отношении этих антигенов,
t* Цельные пробы на совместимость между типированными тромбоцитами
ННВ реципиента необходимы в любых случаях для исключения несовме-
>aiBIсти по неизвестным тромбоцитным антигенам.
Равнение результатов трансфузий тромбоцитов от совместимых в серологи-
пробах и произвольных (без проб на совместимость) доноров у пациентов
Мистической анемией и разными вариантами острых лейкозов с отягощенным
2фузионным анамнезом и иммунологической рефракгерностью к переливае-
2 тромбоцитам показало следующее. После переливаний тромбоцитов от совме-
їдох доноров у пациентов с апластической анемией величина скорректирован-
вогодасггрансфузионного прироста через 18 ч (СПТП-18) была в два раза выше,
чем СПТП-18 при использовании тромбоцитов от произвольных доноров, и соста¬
ва 14J51±2,61x109 против 6,54±1,59хЮ9/л. Успешные трансфузии с СПТП-18
более 4,5х109/л при использовании совместимых тромбоцитов составили 86%.
В14% случаев эффекта от переливаний совместимых тромбоцитов не наблю¬
дали, что можно объяснить неиммунологическими факторами рефрактерности
у больных. При переливании тромбоцитов аллоиммунизированным пациентам
непроизвольных доноров успешные трансфузии наблюдали в 46% случаев, в 54%
наблюдений переливание тромбоцитов сопровождалось снижением количества
тромбоцитов в периферической крови. В группе больных с острыми лейкоза¬
ми, имеющих антитела с низкой частотой реагирования, достоверных различий
в величине СПТП-18 в сравниваемых группах не наблюдали. Иммунологические
методы при выборе доноров позволяют избегать нежелательных ооспрансфузи-
онных реакций, преодолевать состояние рефрактерности и проводить в полном
объеме необходимую программу лечения аллоиммунизированных больных.
Имеются сообщения об успешных переливаниях тромбоцитов, лишенных HLA-
атигенов, которые достигаются обработкой тромбоцитов растворами с pH 3.
Такой подход особенно актуален для лечения пациентов с полиспецифическими
11 часто реагирующими анти-НЬА-антителами. Однако этот метод не получил
широкого распространения из-за сложности сохранения жизнеспособности тром-
ОДитов после их контакта с растворами, имеющими низкую pH.
Д** профилактики аллоиммунизации к антигенам системы HLA часто наюль-
ИВнргры, удаляющие лейкоциты из тромбоцит- и эритроцитсодержащих
|®сФузионных сред. Именно на лейкоцитах локализовано основное количество
Применение фильтров целесообразно только у больных, несенснбилизнро-
к HLA. У больных с иммунологической рефрактерностыо к переливанию
1^ цитов использовать фильтры не имеет смысла, так как HLA на тромбо-
Гг£#вдставлены в достаточном количестве и с ними будут взаимодействовать
ЄСЯ 8 °Рганизме реципиента антитела. Другим способом профилактики
нлй -^Унизации к HLA остается облучение тромбоцитсодержащих сред гамма-
^Фиолетовыми (320-400 нм) лучами перед трансфузией. Облучение
1050 ТИИВМВЮИЙП иммиюпогия
л
смякает экспрессию антигенов системы HLA на лейкоцитах, делая их менее имму
вогеяными. инактивирует лимфоциты, что важно для профилактики появления
таиого грозного осложнения, как траисфуэионно обусловленная реакция «транс¬
плантат против хозяина», и блокирует синтез цитокинов лейкоцитами при храие-
НИИ.
Влияние плазмафереза на активность анти-human leucocyte antigens-
I інтв-humin plttelet antigens-антител
Плазмаферез (ПФ) можно применять для устранения аллоиммунных антител
при постгрансфузионной аллоиммунизации антигенами форменных элементов
крови, и в частности антигенами тромбоцитов. Такая процедура представляет¬
ся особенно актуальной при необходимости трансфузионной терапии больным
і тромбоцитопенией, осложненной иммунологической рефрактерностью, Т.е.
для снижения активности антител. Влияние ПФ на активность аллоиммунных
антител может быть неоднозначным и зависеть от объемов удаляемой плазмы
І сопутствующей трансфузионной терапии в условиях прекращения трансфузий
тромбоцитов или на фоне продолжающегося трансфузионного лечения.
Удаление плазмы в объеме 0,5 ОЦП и более за одну процедуру без сопутствую¬
щей компонентной терапии приводит к уменьшению титра имеющихся аллоим¬
мунных анти-HLA-антител после каждого проведенного афереза. Однако в течение
последующих 5-7 сут наблюдается не только восстановление активности анти-HLA-
антител, но в некоторых случаях увеличение их активности выше исходного уров¬
ня. Упомянутое возрастание уровня анти-НЬА-антител происходит с разведения
1:2-1:4 до разведения 1:16—1:32 и выше. Такое Иммуностимулирующее действие
афереза отмечается у большинства обследованных больных. В наибольшей степени
это касается первых 2-3 аферезов. Увеличение активности антител, как правило,
происходит через 1-13 нед от начала аферезов, т.е. сопровождается стимуляцией
образования внти-НІА-антител, имеющихся у больного, что обозначается как син¬
дром рикошета. Эффект стимуляции образования иммунных антител аферезами,
по-видимому, в большей мере связан с цикличностью происходящих при этом
изменений - снижением активности антител в результате удаления с плазмой
иммуноглобулинов и последующей их пшерпродукцией вследствие репаративной
регенерации изъятых плазменных белков.
ПФ у больных на фоне переливания совместимых тромбоцитов, т.е. показав¬
ших отрицательный результат в серологических пробах с сывороткой пациента,
приводит к снижению активности (титра, частоты реагирования) антител. После
прекращения сеансов плазмообмена активность и титр антител возвращается
І исходному значению.
Сеансы ПФ в сочетании с переливанием тромбоцитов от произвольных доноров
могут оказывать сдерживающий эффект на процесс антителообразования, снижая
частоту реагирования, но не титр антител. Эффект ПФ менее выражен относи¬
тельно высокоиммуногенных антигенов системы HLA (HLA-A2, -В7) и антигенов
средней степени иммуногенности (HLA-B8, -А1, - АЗ), По-видимому, такие антиге¬
ны с большей частотой оказываются и на переливаемых донорских тромбоцитах,
способствуя поддержанию антителообразования за счет стимуляции иммунной
системы реципиента.
Эффект ПФ считается непродолжительным, но нередко оказывается необходи¬
мым и достаточным для проведения адекватной заместительной гемостатическои
терапии больным, особенно АА. во время курсов иммуносупрессивной терапии,
сопровождающихся выраженным геморрагическим синдромом. Курсами ПФ
не удается предотвратить дальнейшую аллоиммунизацию пациентов, нередко
появляются аити-НІА-антитела с новыми специфичностями.
иммунологическая шогмсность ranmwewa
1*1
ддазмаферезов, сочетающихся с трансфузиями тромбоцитов
доноров, на активность тромбоцитспецифтееш антител шщ®
^изучения. Удалось проанализировать изменение активности ти-
!ати-СРНЬ/1Иа-подобных антител у трех больных (тебе. 25*70)
\ Ф -д влияние плазмафереза и трансфузий тромбоците ив активность
:
Направленность аититц»ц мт—mn
анти GPib/ IX подобные ’
титр
частота развития, %
1:4
48,3
>1:4
1 " Ш f
і
flit Га
1:4
48,3
>1:4
-j
2
tl-1:2
20
11 И
—
I
4
Ц-1:2
13
1:4
г—f—1
1:4
46
1:4
65
? fi
>1:4
75
1:8
too
'rX~
>1:4
70
11
w
£-7-10
>1:4
100
1:8
км
■ 0
\2
30
1 - И
It
if?
1:2
37,5 ,
12
г' ■ ■■ ж.»»—ІИВВЯЦІII щ ipj.
зо
"'г
12-1:4
7Q
>114 1
м
3
І 1:2-1:4
64,3
122
щ
4
1:4
60
1:32-144
1 І
5
1:8
88,9
1:32-144
...... щ
|(
0
1:4
30
1:4-1:16
1: - ЛТГГІ
1
1 1
' 1:4
30
1:4
76
І 2
. 12
40
1:4
76
13
1:4
20
1:4
76
4
0
0
1:4
Я Ш
И
1:4
10
1:4 "'I
86
6
0
0
1:4
SO
Г 7 '
1:2
10
1:2 1
» . 9В
8-19
Нет данных
Нет данных
15
ЗО І
Только у одной больной (К.) после семи плазмафереэов наблюдалось снижение
яяра и частоты реагирования как анти-GPIb/IX-, так и анти-СР11Ь/111а-пояобкых
игател. И в том, и другом случае после 7 сеансов плазмафереза удавалось стоить
I мивность антнтромбоцитных антител: титр до 1:2 и частоту реагирования до 10
"«^соответственно. Последующие 12 процедур це влияли на иммунологические
Чиметры анти-СРНЬ/Ша-подобных антител у этой больной.
/^других больных (С. и М.) при плазмаферезахн трансфузиях тром&ир*
Явность тромбоцитспецифических антител нарастала вместе с увеличением
^^рования. Так, у больной С. после кратковременногосниженшчас»*
^*вир°вания с анти-GPIb/IX-подобными антителами до 13-20% набавдмкь
I ыаьР* Врастание частоты реагирования антител к 4-5-му сеансу влаяшфорщ
^ „ г—.«.inv -iav.ivjiDi реагирования
'/5% и до 100% через 5 дней после еще 2 сеансов плазмафереза (спустя
- - —*-GPIIblUa-
іоадЛУ* иосде начала плазмафереэов). Частота реагирования аитя-ОРІ
і *Цки!? а*ггител не менялась в течение первых4сеансовпдазмаферт.
сеансу увеличилась также до 75-100%. Тотальную сшябнммщв
і **’ индуцировавшим данный вид антител, наблюдали уже через 9 сут,
(Ш?^плазмафереза. Расширение частоты реагирования и появление шив*
і У антител совпало с развитием двусторонней пневмонии,
$ ^ного, М. при относительно небольшом повышения титра антител (с 11
^ істота реагировани^анти-СРІЬДХ-подобньи антител уисдшяшіШЬ
1052 ТРАНС«УЗИ0ИНАЯ ИММУНОЛОГИЯ
с 30 сначала до 70. а затем и до 88,9%. Несколько другая динамика огмеча.
В якь • отношении активности анти-СРНЬ/Ша-подобных антител: наблюдали
увеличение титра при пяти сеансах плазмафереза с 1:2 до 1:32-1:64, а частоты
реагирования - с 30 до 100%. У этого больного также последние плазмаферезы
осуществлялись на фоне инфекционного осложнения. Возможно, инфекцион¬
ные агенты стимулировали процесс антителообразования. Полиспецифическая
антн-НРА-сенсибилизация предшествовала в данных случаях тотальной анти-
HLA-аллоиммуннзации. плазмаферез в этих случаях не давал положительного
эффекта.
Приведенные материалы дают основание утверждать, что сеансы плазмафереза
сочетающиеся с продолжающейся трансфузионной терапией, не предотвраща¬
ют сенсибилизацию тромбоцитными антигенами системы как HLA, так и НРА
В связи с этим данный метод лечения следует применять весьма осторожно.
ПРОФИЛАКТИКА ПОСТТРАНСФУЗИОННЫХ РЕАКЦИЙ ПРИ ТРАНСФУЗИИ ПЛАЗМЫ
В лечебной практике используют плазму свежезамороженную (СЗП), плазму
нативную, криопреципитат и препараты плазмы: альбумин, гамма-глобулин, фак¬
торы свертывания крови, антитромбин III, белки С и S, компоненты фибриноли¬
тической системы.
Группа крови по системе АВО переливаемой СЗП должна соответствовать таковой
у реципиента. При отсутствии СЗП одной группы по системе АВО пациенту перели¬
вают плазму группы АВ. если ее нет в наличии — иногруппную СЗП при том условии,
что анти-А- и анти-В-антитела в ней присутствуют в низких титрах. СЗП группы АВ
используют по неотложным показаниям до определения группы крови пациента.
СЗП группы 0 переливают только реципиентам группы 0. Новорожденным и детям
первого года жизни рекомендуют переливать плазму доноров группы АВ.
Соответствие крови донора и реципиента по системе резус не считается обяза¬
тельным при малых объемах переливаемой СЗП, однако при массивных трансфу¬
зиях (>1 л) совместимость по резусу необходима для предотвращения сенсибили¬
зации реципиента.
Использование плазмы следует проводить по строгим показаниям (приказ М3
№363 от 25.11.2002 г. «Об утверждении инструкции по применению компонентов
крови»).
Нативная или СЗП используется в основном для восполнения факторов свер¬
тывания, особенно при врожденных дефицитах (гемофилии, болезни Кристмаса,
недостаточности фактора IX). Терапевтическое действие СЗП более выражено
у пациентов при дефиците фактора IX и при врожденном дефиците других факто¬
ров. но лечебный эффект ограничен у пациентов с ингибиторами любого фактора
свертывания.
Заменные переливания плазмы применяют в целях удаления из организма
токсичных гуморальных факторов и патологических компонентов (например,
ЦИК, аутоантител и др.) или снижения до физиологического уровня количе¬
ственно избыточных нормальных компонентов, для восстановления дефицитных
или угнетенных основным заболеванием факторов.
Заменные переливания СЗП применяют при лечении тромбоцитопенической
пурпуры или гемолитико-уремического синдрома. Для таких больных при отсут¬
ствии эффекта при обычной замене плазмы используют вместо СЗП криопреци¬
питат.
При трансфузии плазмы аллосенсибилизация к антигенам плазменных белков,
обладающих высокой иммуногенной активностью, развивается у значительного
количества реципиентов. Частота аллосенсибилизации зависит от многих факто¬
ров: объема перелитой плазмы, возраста, количества трансфузий, типа сенсибили¬
зирующего антигена и т.д.
^фузионные реакция после мрелтщцц шшш ^ , 2
1 ifflC*T>_ „
Оправленными против липопротеидов или
:Ттяжелые реакции наблюдаются у пациетов савяаГм
ОбУЛин°в класса IgA. При первичной антигенной стент
/^вырабатываются анти-IgA-антитела. При поиорШШ
развиваются анафилактические реакции различно! ЩЩ
ф 110 анафилактического шока. Однако достаточно тяжем вот
>® ак«ии на введение плазмы могут наблюдаться н v некоторщ
’/* кным уровнем IgA, которые продуцируют антитела опшвпн
/^(например, aHTH-IgA2m).
г1йи анафилактического типа наблюдаются также после
гжяхаш-
Кави анафилагіи-іс^ч»» .*.««« паил^мая также после ммлтияч сеи-
^яиоованным больным плазмы, несовместимой во белковым
^ inv Трансфузии Gm- несовместимой крови сеисибклизироаашым боа*
* Іоіуг вызывать снижение титра анти-Ст-антител вшворош mm
^егельствует об иммунологическом конфиликте и возникновении реакция
^ антитело». Клинические проявления при этом не всегда
^кратные трансфузии Gm-несовместимой крови могут привести к савюфо-
I ^ гомологичной крови и стать причиной отдаленных осложняя!, i частот
Ііидоза, вследствие отложения в тканях комплексов «антиген-антитезо».
: ^профилактики посттрансфузионных реакций у сенсибилизировамшхаад*
Job1с дефицитом иммуноглобулина IgA при необходимости повториш трис-
j 2 „лазим следует использовать плазму IgA-отрицательного донора. Одкако
12рать такого донора затруднительно, поскольку частота встречаемое» IgA-
Дательных лиц составляет 1:900.
ПРОФИЛАКТИКА ПОСТТРАНСФУЗИОННЫХ РЕАКЦИЙ У РЕЦИПИЕНТОВ
ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
Для профилактики нежелательных реакций при трансфузия ГСК всем речи-
лентам проводят обязательное иммуногематологическое исследование, которое
иючает:
• определение группы крови АВО перекрестным методом;
• определение резус-принадлежности;
• фенотипирование по антигенам эритроцитов;
• выявление аутоантител в ПАГТ;
• скрининг аллоантител в НАГТ;
• при выявлении аллоантител — идентификация их специфичности.
Трансфузии эритроцитсодержащих сред реципиентам ГСК. так же кап ШЦ
иентам органов и тканей, необходимо проводить только по щивидуиыону
подбору.
Реципиентам ГСК перед трансплантацией от доноров, несовместимых по системе
в обязательном порядке следует определять титры анти-А- к аш-Вчииите*.
Реципиентам ГСК при необходимости трансфузии эрнтроцитсодершиерв
^ет проводить подбор таким образом, чтобы они не свдер*алм антигены.
®Щиеся у донора ГСК и отсутствующие у реципиента в целях диагност»» ПН
ения трансплантата по этим антигенам.
трансплантации ГСК необходимо еженедельно проводить исследования
Реципиента в прямом и непрямом АГТ в целях выявление аутоантитед
, ОИммунных антител и определения их титра. Также еженедельно следует
(цАить обязательное исследование на химеризм по антигенам эритроцитов,
Реви 1 МаРкеРами приживления.
Ч «ентам ГСК после трансплантаций несовместимых по антигенам цшрь-
Шемой v ЯЗательном порядке записывают в эпикриз и выдают справку об сире^
у Них в настоящее время группе крови по системе АВО н резус или наличии
1054 tpammwhchha;* нммунояопм
химеризма эритроцитов с рекомендациями по выбору компонентов для і»*,
трансфузий (табл. 25-71).
Таймир 25-71. Рекомендации по выбору гемокомлонентов при аллогенных трансплат
гемолоэгичесюю стволовых меток, несовместимых по системе АВО* гПЗЦИЯу
і Груоо* кроен
j гещт«па ГСК
т
1
«ВОведено-
І До « после траисопаигацим ГСК
до появлення признаков при¬
живлення ГСК
І После лабораторного подіне»,,-..
! химвризма по антенам apnip^
Шщ в Іт
ЗМ
СЗП
ТК
ЗМ
СЗП
Т
1
L
•
А
0
0,А. АВ
0. А
0*. А
А, АВ
А
0
В
0
ОД АВ
0. в
о», в
В. АВ
=±н
в
АВ
0
0. АВ
0, АВ
0*. А
АВ
АВ
А
0
А, (У
А. АВ
А, 0
0
0, А, В,
АВ
0
А
В
А. 0*
А. АВ
А, АВ
0", В
В. АВ
В
А
АВ
А, 0*
А, АВ
А, АВ
АВ. 0*. В
В
0
В, О1
В. АВ
В.О
0
0, А, В,
АВ
0
в
А
В.О*
В, АВ
В. АВ
А, 0*
А. АВ
А
в
АВ
В.О*
В, АВ
В. АВ
АВ, 0\ В*
АВ
АВ
АВ
0
АВ, 0*
А', В*
АВ
АВ, А. В
0
0, А, В,
АВ
0
АВ
А
АВ, 0*
А1, В*
АВ
АВ
А. 0а
А, АВ
А
АВ
В
АВ, 0*
А, В*
АВ
АВ
СО
о
В. АВ
В
* - эритроциты отмытые.
ИНФЕКЦИОННАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ
С 60-х гг. прошлого столетия основными факторами, ограничивающими алло-
генные гемотрансфузии в клинической практике, стали не столько реакции
и осложнения, связанные с изосенсибилизацией пациента антигенными детер¬
минантами клеток и факторов плазмы донорской крови, сколько инфекционные
осложнения в результате передачи с кровью или ее компонентами возбудителей
гемотрансмиссивных инфекций (ГТИ).
Современные представления о возбудителях
гемотрансмиссивных заболеваний, передающихся
парентеральным путем
В настоящее время кровь донора исследуют на ограниченное количество инфек¬
ций: в России, как и в большинстве стран мира, определяют маркеры только 4
гемотрансмиссивных инфекций (ВИЧ, гепатитов В, С и сифилиса). В то же время
известно, что с кровью, ее компонентами и препаратами может передаваться
значительно большее количество возбудителей гемотрансмиссивных инфекций,
относящихся і различным видам микроорганизмов: бактерий, вирусов, парази¬
тов, риккетсий (табл. 25-72). В последнее десятилетие появились сообщениям
о возможном заражении инфекционными белками — прионами, хотя достовер¬
но доказанных случаев передачи болезни при ретроспективных исследованиях
за 1995-2005 гг. в Центре по контролю заболеваемости в США (Centerfor Disease
Control) не зарегистрировано.
иіямгпиті ятшщ i
"^'ВДЯЦЦІ tw
Основные возбудители инфекционных заболеваний, щттшгтш^.
Г-—ШЯ
1 Тшеозбуятее»
Tpicivirus
i паратми вяааии - ^
Haepadnovims
Phlaivirus
Vtroid
He классифицирован
Крайне или»
Крайне мщцк
Высок, но только а пакьтн— j
Незнмпепеи.
ненты кроем
Phlavivirus
Неизвестен
Circovirus (?)
Неизвестен
Retrovirus
Retrovirus
Крайне незнешепен
[Незначителен
Незначителен
Крайне незитеяен
Крайне высок
Parvovirus В-19
Высок в эндемичных очагах
Незначителен
West line virus
Herpesviridae
Herpesviridae
Herpesviridae
Herpesviridae, tipe 6
Крайне высох i эндиичинх очаги
I Незначителен
І
Незначителен
Незначителен
Незначителен
щ—§Ш
Herpesviridae, tipe 7
Незначителен
и
Herpesviridae. tipe 8
Крайне незначителен, ни допительсте пере- і
дачи реципиентам
і
Herpesviridae zoster
Крайнє незначителен, кет доказательств щр,
дачи реципиентам
гшт. возбудители
хрмса
Treponema pallidum
Незначителен
ирсиниоза
Yersinia enterocjlitica
Высок в эндемичных очагах
I Шаразиты, возбудители
- - - - ■ ‘■■-ha'ij
] шрии
Plasmodium spesies
Высок в эндемичных районах
| морального лейшманиоза
Leishmania donovani
Незначителен, возможен в ицргвпп очках
{мосомоза
Tripanosoma crusi
Высок в эндемичных очках
| очзни Шагаса
Tripanosoma atricanus
Высок в эндемичных очагах
Ихвююза
Babesi microti
Высок в эндемичных очках
I ЭДгозмоза
Toxoplasma gondii
Крайне незначителен описаны случаи при три*
фузиях лейшоицантрата
і і^итсии, возбудители
[рШдки
I Cocsiella burnetti
| Высок в эндемичных очках
ijiHbi, возбудители
| ^""ссивной спонгиформной
і ^Фалопатни
Инфекционный
белок PrPSc
Незначителен, имеются единичные сообщим, |
но без четких доказательств о парады t ари* 1
; ^^Крейтцфельдта-Якоба
нентами или препаратами кроні
ГЕПАТИТЫ
|§№ инфекций, передаваемых трансфузионным _
^вирусные гепатиты (ВГ). Мнение об инфекционной
yW..- печени> известного также под названием катаральной желт».
1Q$f ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
шпершш высказал С.П. Боткин в конце XIX в. Впоследствии гепатиты инфекци¬
онной этиологии стали называться болезнью Боткина. В 40-х гг. прошлого сто-
яетия было установлено, что помимо инфекционного гепатита, передаваемого
фекально-оральным путем (гепатита А), возможна передача инфекции парен¬
терально - через зараженную кровь. В 1963 г. Блунберг (Blunberg) в сыворотке
Кров! австралийских аборигенов обнаружил новый антиген, который назвал
австралийским. В 1966 г. Принц (Prinz) высказал предположение, что австралий¬
ский антиген - это маркер возбудителя сывороточного гепатита В. Но только
11970 г. Дейн (Dein) в сыворотке крови больного гепатитом методами электрон¬
ной микроскопии идентифицировал вирус гепатита В с поверхностным австра¬
лийским антигеном. Позже в честь первооткрывателя он был назван частицей
Дейна. Наряду с гепатитом В были обнаружены и продолжают выявляться воз¬
будители других вирусных гепатитов. Термин «вирусные гепатиты» объединяет
группу болезней со сходной клинической картиной, но различными вирусной
этиологией, эпидемиологическими путями передачи, исходом и тенденцией
к хронизации заболевания.
На современном этапе, как и ранее, сохраняется высокий эпидемический потен¬
циал всех известных вирусных гепатитов — А, В, С, D, G, E, F. В последние годы
благодаря использованию методов вирусологии, биологии, генной инженерии
(в частности, рекомбинантной технологии) раскрылись новые горизонты пони¬
мания проблемы вирусных гепатитов и дальнейшего ее изучения. В частности,
в исследованиях показано, что гепатитный «алфавит» еще не исчерпан. Остается
ниша вирусных гепатитов, вызываемых иными возбудителями. Однако вероят¬
ность появления таких инфекций не слишком велика, поскольку для того чтобы
новый вирус стал опасен в отношении источника посттрансфузионного осложне¬
ния, он должен обладать целым рядом признаков: достаточно широко циркулиро¬
вать в популяции, иметь парентеральный механизм передачи, длительный период
виремии, высокую степень патогенности, достаточно длительный инкубационный
период и/или вызывать бессимптомное носительство.
Несмотря на то что вопрос о посттрансфузионных осложнениях, вызванных
новыми вирусами, остается дискутабельным, он привлекает пристальное внима¬
ние трансфузиологов как один из новых источников гемотрансмиссивных ослож¬
нений.
Гепатиты А и Е передаются фекально-оральным путем. Есть сообщения о пере¬
даче возбудителя гепатита А с препаратами плазмы. Вирусы гепатитов В, С, D, G,
А, ВТТ, SEN с различной интенсивностью могут передаваться парентеральным
путем и становиться причиной посттрансфузионных гепатитов.
Возбудители всех вирусных гепатитов обладают выраженным тропизмом
к клеткам печени, что определяет сходство клинических проявлений, общность
методов диагностики, терапии и систем реабилитации. Классификация вирусных
гепатитов приведена в табл. 25-73.
Таблица 25-73. Классификация вирусных гепатитов
Нозологическая форма
Клиническая форма
Степень тяжести
Характер течения
Вирусный гепатит А
Манифестная:
Легкая
Острое
Вирусный гепатит Е
желтушная
Средняя
Циклическое
Вирусный гепатит В
а) цитолитическая (типичная);
Тяжелая
Затяжное
Вирусный гепатит С
б) холестатинеская (атипичная);
Особо тяжелая
(прогредиентное)
Вирусный гепатит D
в) безжелтушная.
(фульминантная)
Хроническое
Микст-гепатиты
Бессимптомная (латентная):
Вирусный гепатит G
субклиническая;
Вирусный гепатит F
иналларантная
Патогенетические изменения в печени при вирусных гепатитах характеризу¬
ются проявлениями цитолитического, холестатического синдромов, приводящих
П ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГВ*ПР»ИС«3*1 ^7
^киионной интоксикации. Цитолиз может быть обусловлен иммым
А " или иммуноопосредованным действием вируса. В резулшкнаот-
^іболических процессов В клетке происходит накопление на ш».А«ц„
§0% свободных радикалов, усиливается перекисное ОКИГПР^ЗГ
к повышению их проницаемости, выходу из гепатошповвютмв)**
%ґ° ментов и ионов калия, которые заменяются ионами натрия и каш>ши
Л К набуханию клеток, изменению pH. нарушению окншгедыюго
Упования И в конечном итоге угнетению разнообразных функций гш-
ЩЯpj числе детоксицирующей, синтетической, утилизации глшш.
Ґ' переаминирования и дезаминирования аминокислот. Наиболее ранним
iff поражения гепатоцитов считается повышение активности в сыворотке
блочного печеночного фермента - аланинаминотрансферазы (АЛТ).
Ление концентрации билирубина в сыворотке крови происходит
^ «шениея процесса захвата гепатоцитами свободного билирубина, связы-
1 йарУглЮкуроновой кислотой и экскреции в желчные пути.
Упоение синтетической функции приводит к гипоальбуминемиииуменьше-
^ личества факторов свертывания крови, особенно протромбина, что обь-
^возникновением геморрагического синдрома различной степени - пете-
Коизлияний, в тяжелых случаях - кровотечений.
^усилении и распространении процесса цитолиза на внутриклеточные
■Уди наблюдается нарушение целостности лизосомальных мембран и про-
iL массивный выброс протеолитических ферментов - гидродаз. что ведет
^разрушению клеток, которое может приобрести характер цепной реакции
Н печеночной недостаточностью. Холестаз обусловлен нарушением оттока
■^результате снижения секреторной функции печеночных клеш.
Вкрови накапливаются различные фракции билирубина, а также желчные кис-
«холестерин, ферменты — щелочная фосфатаза, гамматлугамилтранспеп-
яваи некоторые микроэлементы, в частности медь.
Свдром общей инфекционной интоксикации в начальном (преджелтушном)
Щ считается отражением фазы вирусемии и характеризуется лихорадкой,
цомоганием и другими свойственными ему общими симптомами. В периоде раз-
I наибольшее значение приобретает цитолитический синдром с нарушением
шсицирующей функции гепатоцитов, проявляющийся анорексией, тошнотой,
дотай, общей слабостью. С углублением цитолитиза и развитием острой печеноч-
Ннедостаточности интоксикация приводит к нарушению функций центральной
рой системы и инфекционно-токсической или печеночной энцефалопапш.
I клиническим проявлениям гепатиты могут быть манифестными (желлущ*
^безжелтушные) и бессимптомными, или латентными (субкдинические, инап-
фнтные).
*№ушные формы относятся к наиболее выраженным вариантам болезни,
^ирактеризуются желтухой (повышением уровня билирубина в крови свыше
*кмоль/л) и увеличением печеночных ферментов. Заболевание протекает
§ типичной цитолитической форме с преджелтушным (начальным), жел-
111 и восстановительным периодами, нередко с выраженным холестазом.
Ш ^типичные формы) ведущим проявлением болезни остается холестати-
w ^ндром, характеризующийся желтухой с увеличением в крови желчных
*21Х0ЛестеРина’ бета-липопротеидов, экскреторных ферментов і щелоч*
V тазы и гамма-глутамилтранспептидазы. Также наблюдается бияирубин-
^«азная диссоциация — значительное увеличение содержания билирубина
невысокой активностью трансаминаз. в частности АЛТ,
Ц|НЫg (Ьппмкт nunwuLiv гопатитпр YanaІТРПИЗУЮТСЯ ОТСУТСТВИЙ! №
*** признаков желтухи при положительных энзимных тестах и слабовыра-
t&ri ИХ проявлениях заболевания, включая увеличение печени и субъек-
т^наки нарушения ее функций.
1058 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
При субклинических (инаппарантных) формах объективные и субъективные
клинические проявления отсутствуют. Может отмечаться незначительная гепато¬
мегалия. Диагноз устанавливают по специфическим маркерам вирусов гепатитов
в сочетании с невысокой активностью в сыворотке крови печеночных ферментов
а также по патоморфологическим изменениям в печени.
Инаппарантные формы болезни устанавливают при выявлении коспецифиче-
ских маркеров возбудителей при полном отсутствии клинических и биохимиче¬
ских признаков гепатита.
По характеру течения различают: острое циклическое — до 3 мес, острое
затяжное (прогредиентное) — до 6 мес и хроническое — более 6 мес. Критериями
оценки характера течения ВГ считаются показатели длительности репликативной
активности соответствующих возбудителей, а также данные гистологического
исследования печеночных биоптатов. Патоморфологические изменения в печени
при вирусных гепатитах оцениваются по результатам прижизненной пункцион-
ной биопсии печени. Она информативна в случаях затяжного (прогредиентного)
и особенно хронического течения болезни. В совокупности с клиническими, лабо¬
раторными и инструментальными методами исследований морфологический кон¬
троль позволяет выявить характер и степень воспалительных изменений в печени,
а также оценить эффективность лечебных мероприятий.
Острые ВГ могут завершиться полным выздоровлением, в том числе с пост-
гепатитными синдромами, или перейти в хронический гепатит. Крайне тяжелые
(фульминантные) формы с острой печеночной недостаточностью, характерные
для ВГВ и D, нередко заканчиваются летальным исходом, особенно при несвоев¬
ременно начатой интенсивной терапии. Полное клиническое выздоровление про¬
исходит практически у всех больных ВГА и Е.
Хроническое течение свойственно только вирусным гепатитам В, С и D, при
этом гораздо чаще хронизация развивается при ВГС.
К клиническому выздоровлению с так называемыми постгепатитными синдро¬
мами относятся астеновегетативный синдром, гепатомегалия, функциональная
гипербилирубинемия, а также дискинезия и воспаление желчевыводящих путей.
Постгепатитный астеновегетативный синдром проявляется нарушениями сна,
повышенной утомляемостью, плохим аппетитом, часто чувством тяжести в пра¬
вом подреберье. Эти явления обусловлены функциональными расстройствами
пищеварительной, нервной, сердечно-сосудистой систем. Несмотря на жалобы,
при морфологическом исследовании биоптатов печени обнаруживается нормаль¬
ная структура, функциональные пробы и энзиматическая активность находятся
в пределах нормы. Синдром купируется обычно в течение 1-3 мес.
Постгепатитная гепатомегалия характеризуется увеличением размеров печени
при отсутствии субъективных жалоб и отклонений в биохимических показате¬
лях ее функций. Эти явления носят, как правило, доброкачественный характер
и не переходят в хронический гепатит.
Постгепатитная (функциональная) гипербилирубинемия проявляется жел-
тушностью склер и изредка кожи, которая может усиливаться после физических
и психических нагрузок. Самочувствие остается хорошим. Содержание билируби¬
на в крови редко превышает 34 мкмоль/л, преимущественно за счет непрямой его
фракции. Функциональные пробы печени в пределах нормы.
Дискинезия желчевыводящих путей сопровождается тяжестью или болями
в правом подреберье, связанными с приемом пищи, чаще при нарушении диеты.
Следует иметь в виду, что эти явления в ряде случаев могут быть обусловлены
заболеванием двенадцатиперстной кишки и поджелудочной железы. Характер
функциональных нарушений желчевыводящих путей может быть уточнен перо-
ральной холецистографией и многомоментным дуоденальным зондированием
с пероральным приемом метиленового синего.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1059
воспаление желчного пузыря и желчевыводящих путей проявляется болью
оааом подреберье с иррадиацией под правую лопатку и в плечо, тошнотой,
* пгчью во рту. обычно появляющимися после погрешностей в диете, повы-
г0Сйем болевой чувствительности в зоне желчного пузыря, положительными
,®\н1но-пузырными симптомами. Могут наблюдаться субфебрилитет, небольшой
и^рофильный лейкоцитоз, повышенная СОЭ. Обнаружение в дуоденальном
НшВ повышенного количества лейкоцитов, слизи, высев микроорганиз¬
мов результаты УЗИ способствуют уточнению характера воспалительных изме-
йеНИИ- о -(.'ці .v
Хронический гепатит (ХГ) — самостоятельная форма заболевания с диффуз-
ним воспалительным процессом в печени длительностью более 6 мес.
Ведущее значение в формировании хронической инфекции, как правило, при¬
надлежит легкопротекающим желтушным, безжелтушным, субклиническим
и инаппарантным формам острых гепатитов В, С, D с затяжным прогредиентным
учением. Предрасполагают к формированию ХГ алкоголизм, наркомания, злоу¬
потребление некоторыми ЛС, неполноценное питание. В ряде случаев острый ВГ
с самого начала протекает как хронический.
В 1994 г. Всемирный конгресс гастроэнтерологов в Лос-Анджелесе поддержал
разработанную Международной рабочей группой экспертов новую классифика¬
цию ХГ. Созданная на ее основе классификация хронического ВГ представлена
в табл. 25-74.
Таблица 25-74. Классификация хронических вирусных гепатитов
Этиология
Фаза/стадия
Степень актив¬
ности
Стадия
Нарушение функ¬
ции печени
ВГВ, ВГО, ВГС
Микст-гепатит
Неверифициро-
ванный
Верифицированный:
репликация
интеграция
Неверифицированный:
обострение
ремиссия
Минимальная
Слабовыраженная
Умеренная
Выраженная
Нет фиброза
Слабовыраженный
фиброз
Умеренный фиброз
Тяжелый фиброз
Цирроз
Без нарушения
Незначительное
Умеренное
Значительное
Микст-гепатит как основной диагноз устанавливают при одновременной реплика¬
ции двух и более вирусов. В противном случае (фаза репликации для одного вируса
и фаза интеграции для другого) один из видов гепатита указывают в основном диа¬
гнозе, а другой — как коинфекцию. Необходимо отметить, что под фазой репликации
понимают активную продукцию вируса в гепатоцитах, а под фазой интеграции -
всіраивание вируса в геном гепатоцита без активной репродукции возбудителя.
Степень активности и стадию патологического процесса определяют при морфо¬
логическом исследовании биоптатов печени. При этом наиболее широко использу¬
ют индекс гистологической активности (ИГА), предложенный R.G. Knodell и соавт.
в 1981 г. (табл. 25-75). Первые три составляющие отражают степень активности,
а четвертая — стадию процесса.
Таблица 25-75. Составные компоненты индекса гистологической активности
Компоненты
Биллы
Перипортальные некрозы с мостовидными некрозами или без них
4 Отсутствуют
0
1 Олабовьшаженные ступенчатые некрозы
1
6' Умеренно выраженные ступенчатые некрозы, захватывающие менее 50% периметра боль¬
шинства поотальных трактов
3
ft Выраженные ступенчатые некрозы, захватывающие более 50% периметра большинства пор¬
тных трактов
4
-
^Умеренно выраженные ступенчатые некрозы плюс мостовидные
5 I
PI 1МИСОУЭИ0ННМ ИММУНОЛОГИЯ
Оиончэние
T*6tl
ИЙИШЭрр Компоненты
11 Выраженные етухичатыв ноирозы пйи|
; ж, Мупьпиобупприые некрозы
If. 1нуЦ1и§ппь«яыв фокальные некрозы
{A. Отсутствуют
П
I I Сяйоаыражвнныв (ацидофильные тельца, баллонная дегенерация и/или рассыпанные фоку
[ СЫ гаяатоцеллюляриых некрозов менее нем в V, долек или узлов)
к Умеренно выраженные. захватывающие У,-*/, долек или узлов ~Щ
II Выраженная, захватывающая более У, долек или узлов
ІЗ Портальноевоспаление
*. Нет портального аоспаления
11 Сяабоеыражениое (единичные еоспалительные клетки менее нем в У, портальных трактов)
Iff, йиараиио выраженное (повышенное количество воспалительных клеток в '/-У портальных
[фаШ&п- j
I Г. Выраженное (плотно заполненные воспалительными клетками болееУ, портальных трактов)
[А Фиброз
А. Нет фиброза
Б. Портальный фиброз
В Портопортальные септы
Г. Портоцентральные септы
Д. Цирроз
Для оценки степени нарушения функции печени пользуются следующими
основными клинико-лабораторными показателями,
а При хроническом ВГ без нарушения функции печени отсутствуют какие-
либо жалобы и клинические синдромы, показатели протромбинового индек¬
са и альбумино-гамма-глобулинового коэффициента находятся в пределах
физиологических колебаний (выше 80% и 3,0 соответственно). Как правило,
диагноз хронического ВГ устанавливают на основании обнаружения в крови
специфических маркеров и морфологических изменений при возможном
слабовыраженном цитолитическом синдроме или даже его отсутствии,
і Для хронического ВГ с незначительным нарушением функции печени харак¬
терны периодическая небольшая тяжесть в правом подреберье, астения,
отсутствие геморрагического синдрома, снижение протромбинового индекса
и альбумино-гамма-глобулинового коэффициента до 60% и 2,5 соответ¬
ственно.
а Хронический ВГ с умеренным нарушением функции печени характеризуется
астеновегетативным синдромом, постоянной тяжестью в правом подреберье,
начальными проявлениями геморрагического синдрома (кровоточивостью
десен, транзиторными носовыми кровотечениями, легкостью возникновения
синяков), снижением протромбинового индекса до 50% и альбумино-гамма-
глобулинового коэффициента до 2,0, клиническими обострениями с обяза¬
тельным повышением АЛТ не менее двух раз в год.
• Хронический ВГ со значительным нарушением функции печени характери¬
зуется выраженными астеновегетативным и геморрагическим синдромами,
возможными клиническими признаками портальной гипертензии и пече¬
ночной энцефалопатии, снижением протромбинового индекса менее 50%
и альбумино-гамма-глобулинового коэффициента ниже 2,0.
Необходимо учитывать, что в зависимости от преобладающего патогенети¬
ческого механизма существуют различные варианты течения хронического ВТ
Особенно это важно учитывать для выбора тактики лечения. Наиболее часто
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ Ш№ШШЙ 1061
вг протекает с преобладанием цитодитичесхого синдрома (каибо-
(У^^чиными считаются синдром интоксикации, повышение активности АЛТ.
^^иепротРом^инового индекса и 8 меньшей степени дисвротеииемия). реже
аются холесгатический (зуд кожи, повышение активности щелочной фос-
ГГГП и увеличение уровня билирубинемии, при этом в меиьшей степени
активность АЛТ) и аутоиммунный (астеновегетативный. артралгни.
^ченочные проявления, диспротеинемия, повышение активности АЛТ. имму-
*пбулинов, ЦИК, различного рода аутоантитела) синдромы.
клиническое течение, методы диагностики и лечения, исходы существенный
Печаток накладывают особенности возбудителей ВГ.
ярусный гепатит А
g^pyc гепатита А — это РНК-содержащий вирус, который был открыт в I973 г,
f instone и соавт. Он относится к семейству пиковирусов, имеет размеры 27-32 нм.
„ .руг устойчив во внешней среде, сохраняется несколько месяцев при темпервту-
4 «с, несколько лет при 20 “С, при комнатной температуре - несколько недель
Инактивируется при кипячении в течение 5 мин.
В настоящее время известен один серологический тип вируса. Вирус гепатита А
характеризуется высокой контагиозностью. Он может попасть в организм в основ¬
ном двумя путями:
• фекально-оральным, например с пищевыми продуктами или водой
• парентеральным, например при переливании зараженных компонентов
крови.
Также возможен вертикальный способ передачи. Watson и соавт. (1994) сооб¬
щили о выявлении у матери гепатита А через 2 нед после рождения ребенка, кото¬
рому она передала вирус.
Низкие концентрации ВГА были обнаружены в слюне, несколько случаев связа¬
ны с передачей вируса через выделения из ротоглотки.
Фекально-оральный путь — наиболее распространенный способ передачи
гепатита А. Источником инфекции считаются больные со всеми формами остро¬
го инфекционного процесса. Наибольшее эпидемиологическое значение имеют
больные с безжелтушными и стертыми формами заболевания. Выделение вируса
начинается во второй половине инкубационного периода и достигает макс имума
в последнюю неделю инкубации и в начале продромального периода. После появ¬
ления желтухи обнаружение вируса в фекалиях резко уменьшается. Особенностью
эпидемического процесса гепатита А считается явно выраженная сезонность.
Рост заболеваемости обычно начинается в июле-августе и достигает максимуме
в октябре-ноябре с последующим снижением в первой половине года.
Парентеральный путь. Поскольку вирусемия при гепатите А возникает
в течение продромального периода, обычно перед появлением желтухи, ТО• Of*
чаях сдачи донором крови в это время высок риск инфицирования препаратов
крови и заражения реципиента.
A. Gerritzen и соавт. в 1992 г. и P.M. Mannucci в 1994 г. опубликовали данные
о вспышке гепатита А среди больных гемофилией, которым переливали компо¬
ненты и препараты крови.
Распространен гепатит А практически повсеместно, но неравномерно по конти¬
нентам и странам, а также в пределах одной страны. Выделяют регионы с высоким
(Азия и Африка), средним (Восточная и Южная Европа) и низким (Скандинавия,
Центральная Европа, Южная и Северная Америка) уровнем заболеваемости, кото¬
рый кореллирует с санитарно-гигиеническим состоянием отдельных регионов.
Наибольшая восприимчивость гепатита А характерна для детей. Инфицирующая доя
вируса составляет 100-1000 ЕД. К группам повышенного риска относят всякого рода
организованные коллективы - интернаты, детские сады, воинские коллективы.
1062 ТНИСЖЮИОИИМ ИММУНОЛОГИЯ
Иммунитет после перенесенного заболевания пожизненный. При клини-*
скм выраженном заболевании формируется более напряженный иммуиит
чем при бессимптомных или субклинических формах.
Вирус ВГ А проникает в организм обычно через слизистую оболочку желудочнг
кишечного тракта, размножается в эпителии тонкой кишки и в мезентериальны:
лимфатических узлах, откуда заносится в печень гематогенным путем. Внедрение
вируса в гепатоциты и его репликация приводят к нарушению метаболизма клеток
I их разрушению. Объем некротических участков печени почти всегда ограничен
Из разрушенных печеночных клеток вирус попадает с желчью в кишечник и затем
выделяется с фекалиями из организма.
Специфическим маркером вируса ВГА считаются антитела класса IgM, кото¬
рые появляются в сыворотке уже в начале заболевания и сохраняются 3-6 мет
Анти-ІйС-аититела регистрируются с 3-4 нед и сохраняются длительно, практи¬
чески пожизненно. В фекалиях больных антиген ВГА обнаруживается за 7-Ю сут
до появления клинических симптомов и в первые дни заболевания.
Инкубационный период при ВГА — 7-50 сут, в среднем от 15 до 30 сут.
Преджелтушный (начальный) период заболевания продолжительностью
5-7 сут характеризуется гриппоподобным, реже диспептическим или астенопо-
добиым синдромом.
При гриппоподобном синдроме заболевание начинается остро с подъема темпе¬
ратуры тела до 38-39 °С, озноба. Больных беспокоят головная боль, боль в мыш¬
цах и суставах.
При диспептическом синдроме отмечают снижение или полное отсутствие
аппетита, тошноту, иногда рвоту, тяжесть и боли в правом подреберье.
При астеновегетативном синдроме состояние больного ухудшается постепенно,
нарастают слабость, сонливость, головная боль, головокружение. Температура
тела остается нормальной.
Смешанный вариант начала болезни наблюдается значительно чаще и характе¬
ризуется появлением нескольких синдромов.
Желтушный период проявляется желтушностью склер, слизистых оболочек,
затем кожи. Интенсивность желтухи достигает максимума уже через неделю. Цвет
мочи становится темным, а испражнения — бесцветными. Симптомы преджел-
тушного периода исчезают, температура тела обычно нормальная, сохраняются
чувство тяжести в правом подреберье и диспептические явления. Печень при паль¬
пации увеличена и уплотнена. У половины больных отмечается увеличение
селезенки. В крови повышено содержание общего билирубина, главным образом
за счет связанного (прямого). Однако необходимо отметить, что у 70-80% боль¬
ных билирубинемия не превышает 100 мкмоль/л. Возрастает также активность
печеночных ферментов, особенно АЛТ, увеличиваются показатели тимоловой
пробы.
При серологическом исследовании крови выявляются анти-ВГА-антитела клас¬
са IgM.
Фаза реконвалесценции при циклическом течении болезни наступает примерно
через 2 нед после периода разгара болезни. Общее состояние улучшается, отмеча¬
ется стойкая тенденция к снижению уровня билирубина и нормализации печеноч¬
ных проб, которые обычно достигают нормальных показателей к 22-25-м суткам
от начала заболевания.
Подобное циклическое течение заболенании наблюдается у 90-95% больных,
В остальных случаях заболевание приобретает волнообразный характер в виде
одного-двух обострений в пределах 1-3 мес от начала болезни. Обострения про¬
являются усилением симптомов, характерных для разгара гепатита. Но, как пра¬
вило, даже при затянувшейся фазе реконвалесценции заболевание заканчивается
полным выздоровлением.
ИММУНОЛОГИЧЕСКАЯ 6ЕЗОПМНаЗЬГВ*ШН1»ЮЙЙ 1QS3
g 1% случаев может возникнуть рецидив болезни. Это происходит
ПИ** крушениях диеты, злоупотреблении алкоголем, ннтеркуррентнш
Ш«ят.п. ':. :»
^^«лные формы гепатита А протекают легко и редко превшают 1 мес.
S*®* jj период заболевания у большинства больных протекает но смешзм-
'^’^стенодиспептическому типу. Отмечаются незначительное повышение
^ атУРы< °бшее недомогание, тошнота, снижение аппетита, чувство тяжести
1^ом,подреберье. При осмотре - увеличение печени на 1-3 см. В разгар забо-
,(^яя общее состояние может ухудшиться, усиливаются тошнота, рвота, появ-
^субиктеричность склер,
i серологическом исследовании крови выявляются анти-ВГА-антител*.
«ышается также в 4-5 раз активность аминотрансфераэ по печеночному типу
активность AJIT выше, чем ACT). Повышается также активность дактатдегидро-
^назы, особенно фракции 5.
(^клинические формы характеризуются незначительным повышением актив¬
ности печеночных ферментов и выявлением в крови анти-ВГА-антател при пол-
ноМ отсутствии клинических симптомов гепатита.
Инаппарантные формы характеризуются только появлением антм-ВГА-антител
при отсутствии и клинических, и биохимических симптомов.
Выявляются субклинические и инаппарантные формы заболевания при обсле¬
дованиях всех контактировавших с больными с желтушными формами в очагах
гепатита А.
В настоящее время можно эффективно бороться с гепатитом А путем активной
вакцинации населения. В качестве вакцины используют инактивированные вирус¬
ные антигены или частицы живого ослабленного вируса, которые стимулируют
выработку антител у реципиента.
Вирусный гепатит В
Впервые сведения о вирусе гепатита В получил в 1963 г. B.S. Blumberg, кото¬
рый открыл так называемый австралийский антиген и был удостоен Нобелевской
премии. D.S. Dane и соавт. в 1970 г. описали сам возбудитель гепатита В - ДНК-
содержащий вирус с предпочтительным тропизмом к печеночной ткани Вирус
гепатита В (ВГВ) относится к семейству HaepaJnovirus. Частицы, циркулирующие
в крови инфицированных ВГВ, подразделяются на три типа:
• мелкие, сферические, полиморфные частицы диаметром около 22 нм.
• тубулярные, разной длины, но примерно того же диаметра:
• крупные сферические частицы (частицы Дейна) диаметром около 42 45 нм.
имеющие ядро и покрытые оболочкой.
Считают, что цитопатическое действие вируса гепатита В может проявляться
только в условиях достаточного количества в крови частиц Дейна при их репли¬
кации. В сыворотке крови больных преобладают дефектные частицы, и только
7% из них полноценны в структурно-функциональном отношении. Вирус гепатита
В (частица Дейна) имеет достаточно сложное строение, включает ДНК. ДНК-
полимеразу и 4 антигена. Он покрыт сферической липидно-белковой внешней
оболочкой, которая содержит поверхностный HB,Ag. Внутренняя оболочка виру¬
са состоит из повторяющихся белковых структур, иммунологически идентифици¬
руемых как cor-антиген - HBcAg. При частичной денатурации НВ .Ag в сыворотке
больных определяется так называемый антиген инфекинозности HBfAg. Менее
изучен антиген HBxAg, Каждый из антигенов ВГВ вызывает гуморальный иммун¬
ный ответ, проявляющийся выработкой соответствующих антител - анти НВ .
анти-НВ^.. анти-НВь и анти-НВг
Вирус гепатита В обладает высокой инфекциозностью Он устойчив к воз¬
действию многих внешних факторов, сохраняется при комнатной температуре
1064 ТМИСФУЗИОННАЯ ИММУНОЛОГИЯ
і течение 3 мес, в холодильнике при температуре от -8 до -100 *С до полу года,
в высушенной плазме или в замороженном виде — годами. Вирус сохраняет
активность после многократного замораживания и оттаивания, инактивируется
при температуре 600 “С в течение 10 ч, при обработке 0,1% раствором формалина
и 3-5% раствором хлорамина, а также при комбинированном воздействии ультра¬
фиолетового облучения и бета-пропиолактона.
В последние годы наряду с обычными штаммами вируса гепатита В появились
его мутантные варианты, что объясняется различными причинами. В частности,
мутация в зоне, кодирующей образование HBsAg, связана, по мнению некоторых
авторов, с широкой вакцинацией против гепатита В, проводимой в ряде стран.
Другая группа мутаций вируса возникла, по-видимому, в процессе лечения
интерфероном и связана с участком генома, кодирующим HBBAg, что приводит
к невозможности его экспрессии. При этом сохраняется продукция анти-НВ -
антител, не нарушается образование cor-антигена и, следовательно, сохраняется
репликация вируса. Появление подобного мутантного штамма вируса определя¬
ется резистентностью к интерферонотерапии и повышением частоты перехода
инфекции в хроническую форму. Схема генома вируса гепатита В представлена
на рис. 25-4.
Рис. 25-4. Схема генома вируса гепатита В
Пути передачи вируса гепатита В многообразны. К естественным путям отно¬
сятся:
• половой, который обеспечивает передачу вируса почти у 20% больных
острым гепатитом В;
І вертикальный — передача вируса от матери ребенку во время родов или вну¬
триутробно во второй половине беременности при нарушении плацентарного
барьера;
• бытовой - при общем пользовании предметами гигиены (мочалками, расче¬
сками, бритвенными приборами и т.п.), что чаще всего наблюдается в семьях
больных хроническим гепатитом В и/или в организованных коллективах,
а также через постельное белье, общие полотенца, носовые платки и при пря-
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФЇЗИЙ 1065
опосредованном контакте с кровью и/или биологическими жидко-
И0м Спермой, слюной, содержимым носоглотки и др.).
сгями v и естестВенных путей передачи ВГВ свидетельствует увеличение
0*«ЯУ® структуре больных острым гепатитом лиц в возрасте І5-30 лет.
#>^!гтвенным, артифициальным путям относятся:
^К^^фузнонный, реализуемый при переливаниях компонентов зараженной
*^пентеральный — при выполнении различных медицинских манипуляций
* ”а|50ре крови, пункциях, получении биоптата органов и т.п.).
' изаиия артифициального пути передачи приводит, в частности, к внутри-
ному заражению. Доля гепатита В в структуре внутрибольничных инфек-
доставляет около 10%.
т болевания гепатитом В регистрируются в виде спорадических случаев
а связаны с сезонами года. У лиц, перенесших инфекцию, вырабатывается
* 1«фическая невосприимчивость к повторным заражениям.
01В различных странах частота носительства вируса гепатита В колеблется
значительных пределах. Выделяют регионы с низкой (<1%), средней (2-7%)
' усокой (8-20%) частотой носительства ВГВ. К 1-й группе относятся Северная,
эдадная и Центральная Европа, Австралия и Северная Америка, ко 2-й страны
Восточной Европы, Россия, Средиземноморье, Центральная и Южная Америка
и к 3-й группе — страны тропической Африки, отдельные регионы Китая и Юго-
Восточной Азии.
В странах со средней частотой носительства ВГВ. к которым относится Россия
и США, ежегодно инфицируются примерно 300 000 человек и из них около 10 000
подлежат госпитализации. У 6-10% пациентов заболевание переходит в хрониче¬
скую форму, в дальнейшем у них могут развиться цирроз и первично-клеточная
карцинома. В США каждый год рождаются 16,5 тыс. детей от женщин, инфи¬
цированных ВГВ. Дети, чьи матери имеют положительную реакцию на HBtAg.
в 70-90% случаев заражаются в пренатальном периоде и практически все (80 90%
инфицированных) становятся носителями ВГВ.
В России заболеваемость в 2001 г. составила 43.3, а в 2003 г. - 42.1 на 100 тыс.
населения, в то время как в 1991 г. этот показатель составлял 17,9-18.0 на 100
тыс. населения. В 1998-2003 гг. особенно неблагополучная ситуация сложилась
в Новосибирской, Самарской, Кемеровской, Свердловской и Иркутской областях,
в Москве и Санкт-Петербурге, где заболеваемость в 1,5-2 раза выше, чем в сред¬
нем по стране, в основном за счет увеличения заболеваемости в возрастной группе
от 15 до 19 лет. Заболеваемость в данной возрастной группе составляет 300-S00
на 100 тыс. населения. Заражение происходит, как правило, при парентеральном
введении наркотиков. К 2000 г. также увеличилась в 2 раза по сравнению с 1991 г.
заболеваемость детей первого года жизни. У детей этого возраста гепатит В про¬
текает в скрытой и хронической формах.
Увеличилась выявляемость гепатита В среди медицинских работников - 3%
всех заболевших составляют заразившиеся при исполнении своих профессио¬
нальных обязанностей. Это в первую очередь представители профессий, входя¬
щих в группу риска, — хирурги, гинекологи, трансфузиологи. работники Службы
крови.
Острый гепатит В
Это наиболее часто встречающаяся форма, которая протекает с клинически
выраженной симптоматикой и характеризуется легким или средней тяжестя тече¬
нием. Важной особенностью больных с клинически выраженной формой острого
вирусного гепатита считается длительность заразного периода. Начало его может
На 45-60 сут предшествовать появлению симптомов заболевании, а окончание
инредко продолжается и после клинического выздоровления.
1066 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
На течение и исход острого гепатита В доминирующее влияние —^
состояние иммунной системы. Адекватным иммунным ответом
выздоровление при этой форме заболевания, как правило, через 6 мес. *
По данным некоторых авторов, острым вирусным гепатитом ежепувщ ы-
вают примерно 20 млн человек, и только у 6-12% взрослых людей
переходит в хроническую форму, что связано с неадекватным иммунныма^!^
О значении состояния иммунной системы при инфицировании ВГВ смц^
ствует характер течения заболевания у детей. Количество больных хроник 1
гепатитом В у них значительно выше, что связано с недостаточной зилос*!?
иммунной системы. Острый гепатит у 90-95% больных детского возраста Jo
текает, как правило, бессимптомно, и очень часто, в 70-80% случаев, врввоа»
к хроническому носительству вируса гепатита Вив 30-50% случаев - к хрошп-
ской форме заболевания.
При неадекватном, неполноценном иммунном ответе недостаточно активно
происходит цитолиз вируссодержащих гепатоцитов, что приводит к неполному
очищению печени и препятствует элиминации ВГВ. Инфекционный процесс щ».
текает в безжелтушной и бессимптомной формах. При высокой репликативной
активности вируса он приобретает длительное течение с постоянным персистиро
ванием и репродукцией вируса, что приводит к еще большему угнетению иммп-
ной системы и хронизации процесса, а в последующем - к хроническому гепапт
При низкой репликативной активности вируса возможна интеграция геномов ВГВ
и гепатоцитов, что выводит вирус из-под контроля иммунной системы и способ¬
ствует переходу заболевания в хроническую форму.
Хронический гепатит В
Проблема хронического носительства вируса гепатита В связана с интеграци¬
ей ВГВ в геном гепатоцитов. В мире около 200 млн носителей HBsAg, при этон
их количество в 150-200 раз превышает таковое больных с клинически выражен¬
ной формой инфекции. В случаях перехода острой инфекции в хроническую гепа¬
тит В развивается годами или сохраняется пожизненно с частым исходом в цирроз
печени и гепатоцеллюлярную карциному. При врожденной инфекции, в ранней
детском возрасте, а также у пожилых и иммунодепрессивных больных хрониче¬
ский гепатит В наблюдается гораздо чаще. В большинстве случаев хроническая
форма заболевания характеризуется доброкачественным течением. В зависимости
от репликативной активности вируса различают хронический интегративный
и хронический репликативный гепатит В.
Хронический репликативный ВГВ характеруется наличием в сыворотке HBig
Определенное значение имеют также высокий (>100 нг/мл) уровень НВ^
и наличие анти-НВс-антител, относящихся к иммуноглобулинам класса IgM
У большинства больных хронический репликативный ВГ протекает безжелтушно
со слабовыраженными клиническими проявлениями: диспептическими расстрой¬
ствами, нерезко выраженной гепатоспленомегалией; признаки гиперспленизю
наблюдаются редко, преимущественно при тяжелом течении болезни. В этих еду-
чаях присоединяются симптомы анемии и тромбоцитопении, сопровождающий
геморрагическим синдромом, характеризующимся петехиями, транзиторнымк
носовыми кровотечениями, кровоточивостью десен и т.п. Выраженную
регистрируют у больных с холестазом, который сочетается с выраженным кшВД
зудом.
Из неспецифических маркеров гепатита В характерным считается умерев
повышение АЛТ.
Хронический интегративный ВГВ протекает, как правило, бесдавяо^
Отсутствуют также сдвиги в биохимических показателях крови, и диагноз
навливают на основании обнаружения специфических сывороточных мартт
(МЙИНМПРЩШ ЫЭОГМСЮСТЬ ГВЯДОЫМШЙ
u ... HB Afl. анти-HB -антител класса IgG, аятя-НВ,, 1МЫИИМ rpomu»
t*Я***®
li* хронического гепатита В характерными счктактя чат»г» в темяеойитрг
s которые могут быть обусловлены снижена?» иммунитета. маминого иигер
^ноентными заболеваниями, нарушением диет и т в. Первоначальным я мав
Йре частым признаком обострения остается ямвйммие уровня АЛТ Реямяиы
болевания могут протекать субилииически идя с мвдовырамитыми миничп.км
т проявлениями. Однако 10 20% всех случаев хронического гатят переходе
вцирро3 печени, и у 1 2% больных отмечаются выраженные обострения вмфпцми
с развитием тяжелых, фульминантых форм печеночной иедсстггочюгт.
фульминантный гепатит В
Редкая, быстротечная и особо тяжелая ферма заболевания с массивным гам-
тоцеллюлярным некрозом печени, как правлю, мкамчмваяшмжгя ягальяым
исходом.
Вирусоносители
Вирусоносители, у которых ннфектя протекает без кдянгичмх проявлений,
играют основную роль в распространении мрусисяо твпгга В
Носители вируса гепатита В могут сохранять свое значение в качестве жточ
ников инфекции в течение всей жизни. С ммоыыв ииинко- мпрфв мнпчеонх.
биохимических и изосерологичесхих тестов можно раиедмтв вярусйиешшжй
на 3 группы:
• больные хроническим активным гепатитом.
• персистирующим гепатитом;
• «здоровые* носители.
Среди последней группы особенно опасны как источим* инфекции ЛМЙ
с активно протекающим процессом в печени Активный промесс совровождветс*
в большинстве случаев наличием в крови HBAg- я аюп-НИУ-ШтВП*. «тмоеяш*4
ся к иммуноглобулинам класса IgM.
Вирусный гепатит 0
Возбудитель гепатита D (BFD) - PH К-совершим! мррс - вЙШМЯШіНКіІВ*
птатах печени больных хроническим гепатитом В в 1977 г М Известно
3 генотипа этого вируса - I. И и Ш. преобладающим ннпчетгв I геям ML ITD
встречается у лиц. инфицированных вирусом reeanri А. Он способен К рМММВ-
ЦИИ ТОЛЬКО В присутствии ВГВ, Т.е. вирус, СВОСОбнЫЙ К .ирлжению. (ТиТОМТ и* РНК
вируса гепатита D (внутреннего антигене) В янешгшЙ.
поверхностный антиген вируса гепатита В (H84Ag).
Заражение могут вызвать одновременно оба возбудителя ВГВ ftl D- коммфе*
Ция (микст-гепатит В t D) или оно произойдет при тфищрямм МП Лйй» мрй-
женных вирусом гепатита В. с возникновением ВГВ ВГПчтпертмфекшж-
Распространение вируса гепатита D кореялирует с уровнем заболевают ВГВ
и регистрируется на различных территориях с частотой от 0,1 до 30% ОЙНЮГО
числа случаев ВГВ-инфекции.
Пути передачи ВГВ аналогичны таковым ВГВ. т «мечена пип мая частота
внутриутробного заражения, что объясняется опкюголыю более низкой авбвяе-
ваемоегью у детей Варианты течения В П> инфекции варьируют от бтццпм
ных, латентных форм до клинически выраженных с крайне тяжелым течением
Течение заболевания зависит от способа зарлжеян*.
ВГВ/ВГО-коинфекция (микст-гтгнг 8*0) характеризуете* острым тгмшпм
заболевания, более высокой и длительней дихорыжой и более частым впяюмчт
ем суставных болей, полиморфной сыпи, увеличением се леденим, чем при хитром
изолированном гепатите В. чаще отмечайте* • крайне тяжелые, фчльмшнмяше
формы течения заболевания.
|m тяанСФУЗИОННАЯ ИММУНОЛОГИЯ
ВГВ/ВГО-суяеринфекция характеризуется редкими случаями клинически
выраженного острого гепатита, однако, когда все же развивается манифестная кар¬
тина. заболевание нередко переходит в тяжелые и фульминантные формы с резко
выраженными болями в правом подреберье, геморрагическим и асцитическим
синдромами й часто возникающими обострениями, которые нередко превышают
по тяжести первую волну заболевания.
Основной формой при ВГВ/ВГО-суперинфекции считается хроническое тече
me заболевания, характеризующееся значительным разнообразием - от клини¬
чески бессимптомных вариантов до выраженных, с прогрессирующим течением.
У больных хроническим гепатитом В после суперинфекции отмечается более
тяжелое течение заболевания с субъективными расстройствами — диспептиче-
скими нарушениями, болями в правом подреберье, быстрой утомляемостью.
Отмечается гепатоспленомегалия. в более поздние сроки заболевания развивается
портальная гипертензия.
ВГВ ВГО-суперннфекция чаще, чем изолированный хронический ГВ, ослож¬
няется циррозом печени, однако угроза малигнизации процесса относительно
меньшая, что ряд авторов объясняют более тяжелым течением хронического
ВГО с высокой летальностью. В таком случае большая часть больных не доживет
до злокачественного перерождения печени.
Вирусный гепатит С
Возбудитель гепатита С — РНК-содержащий вирус, который обнаружили
М. Houghton и соавт. в 1989 г. в результате поиска этиологического фактора гепати¬
та ни А. ни В, Благодаря многолетним исследованиям авторам удалось сконструи¬
ровать искусственный рекомбинантный антиген вируса и на этой основе разрабо¬
тал первую ИФА тест-систему для выявления специфических анти-ВГС-антител.
Возбудитель гепатита С стал первым вирусом, который удалось идентифицировать
иа основе характеристики последовательности нуклеотидов задолго до его выяв¬
ления методами электронной микроскопии. На первом этапе из крови больных,
предположительно заболевших гепатитом ни А, ни В, а также плазмы зараженных
обезьян выделили РНК-содержащую частицу. Затем с помощью обратной транс-
криптазы клонировали комплементарную ДНК-копию и ввели ее в E. coli. На втором
этапе образующиеся белки профильтровали через сыворотку больных вирусным
гепатитом ни А. ни В и выделили вирусслецифический белок. Путем его экспрессии
в дрожжевых клетках удалось получить рекомбинантный пептид С-100-3, исполь¬
зуемый для индикации антител вируса гепатита С. В дальнейших исследованиях
показано, что ВГС - мелкий вирус с однонитчатой линейной РНК.
Отличительной особенностью вируса гепатита С считается высокая гетеро¬
генность его генома, кодирующего структурные белки (core и два оболочечных
белка — ЕІ и Е2) и неструктурные белки (NS2, NS3, NS4a, NS4b, NS5a, NS5b).
К каждому из этих белков вырабатываются соответствующие антитела.
Вирус гепатита С характеризуется генетической неоднородностью. В настоя¬
щее время известно 6 генотипов ВГС, которые были пронумерованы в порядке
их открытия, и 6 подтипов. Особенно много генотипов регистрируется в Африке
и Юго-Восточной Азии. Это служит косвенным подтверждением того, что гепатит
С существует в этих регионах в течение длительного времени, возможно, несколь¬
ко столетий. В Европе и Северной Америке ВГС появился, по-видимому, значи¬
тельно позже, чему и соответствует значительно меньшее количество генотипов
вируса. Для клинической практики значение имеют 5 из них — la, lb. 2а, 2Ь. За.
Установлены определенные географические различия в распространении разных
генотипов. В США регистрируют в основном генотип 1а. В Японии, на Тайване и в
Китае распространены генотипы lb. 2а, 2Ь. В Центральной Европе преобладает
генотип 1а. а на юге возрастает доля генотипа lb. В России чаще других регистри-
^^ИИИІЙЙІШІЬ. затеи с убывающей частотой За. 1а и 2а.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ (ШОТРйНСФУ ШИ
\М%
Клинико-лабораторные показатели у больных и вирусонос цтелей связаны
стмпом генома ВГС. Динамика инфекционного процесса при гепатите С отличает
(«значительной вариабельностью', от бессимптомных, субклинических и инаипа-
райтных форм до выраженной клинической картины с тяжелым поражением пече
м. В 70-80% случаев заболевание переходит в хронический гепатит и у 20 '0%
больных - в цирроз печени.
Пути передачи вируса гепатита С сходны с таковыми возбудителя гепатита В. одна
«о в отличие от вируса гепатита В естественные механизмы и пути распространения
менее характерны. Риск внутриутробного заражения, при половых контактах и в бит
относительно низок, а преобладает парентеральный путь передачи при гемотраи»
фузиях с инфицированной кровью и при медицинских манипуляциях
В связи с наличием множества генотипов вируса гепатита С v лиц, перенес ши\
заболевание, не вырабатывается невосприимчивость к повторным заражено
«м. Возможны повторные заражения различными генотипами возбудителя
Высокой изменчивостью и низкой иммунбгенностью штаммов вируса гепатита
С определяются слабый иммунный ответ на внедрение возбудители н, с ледова
тельно, высокий уровень хронических форм заболевания Необходимо отметить,
что данная особенность возбудителя препятствует созданию вакцины проти»
вируса гепатита С.
Биологическими особенностями возбудителя гепатита С определяется и тече¬
ние заболевания. При гепатите С. в отличие от гепатит* В, М происходит инте-
грации геномов вируса и гепатоцитов. так как в цикл развития вируса не вклю¬
чена промежуточная ДНК, и, следовательно, отсутствуют интегративные формы
хронического ВГС. В отличие от вируса гепатита В, вирус гепатита С обладает
прямым цитопатическим действием на гепатоциты. Но ввиду высокой измен¬
чивости вируса и слабой иммуногенной активности быстрого очищения печени
не происходит.
Высокой изменчивостью возбудителя также определяется наличие у одного
больного множества антигенных вариантов вируса. Это явление получило назва¬
ние «guasispecies*. В результате гипервариабельные штаммы становятся преоб¬
ладающими и поддерживают активную репликацию, обеспечивая характерную
для гепатита С многолетнюю персистенцию инфекции.
Источники гепатита С — больные с острой и хронической формами заболева¬
ния. Наибольшую эпидемическую опасность представляют лица с бессимптомны-
ми формами гепатита.
Инкубационный период при заражении ВГС - от 20 до 120 сут, в среднем
40-45 сут.
Течение гепатита С делится на три последова гельные фазы острую, латент¬
ную и стадию реактивации. Острую фазу, как правило, ме диагностируют, так
как клинические симптомы при первичном заражении слабовыражены или акут-
ствуют, что затрудняет распознавание заболевания. Латентная фаза может проте¬
кать субклинически. При реактивации процесса повышается уровень активности
АЛТ. Однако необходимо отметить, что сведения о прямой зависимости мщщ
уровнем АЛТ и активностью патологического процесса в печени противоречивы.
Неоднозначны и данные о прямой взаимосвязи уровня в сыворотке АЛТ и РНК
вируса. Одни авторы подтверждают эту связь, другие ее отрицают, приводя а дока¬
зательство факты о наличии больных, у которых была подтверждена ашмщш
репликация вируса, а показатели АЛТ оставались в пределах нормы Клинически
выраженный гепатит С протекает преимущественно в легкой, реже в.среяШ'йЗйг
лой форме.
При лечении вирусного гепатита С интерфероном у 50% больных ябЯЮЯМТГя
исчезновение РНК-внруса из сыворотки крови, что анцишсиуіг о выздоров¬
лении.
1(70 ГРМСФУЭИОННАЯ ИММУНОЛОГИЯ
Тяжелые формы гепатита С (фульминантный гепатит) регистрируют впи,
щественно на Дальнем Востоке (в Японии и на Тайване), в США и европей^'
странах - крайне редко, что связано, по всей вероятности, с особенностями
типов вируса.
В 85% случаев заболевание переходит в хроническую форму. Хроничес •
гепатит С регистрируют преимущественно у взрослых. Предвестником ПйГ
хода острого гепатита С в хронический считается более или менее стабилыГ
гилерферментемия при отсутствии клинических или субъективных проявле й
заболевания. Клинически выраженная стадия характеризуется развитием у бо ИИ
ных астении, ухудшением сна, снижением аппетита, болью в области пече
Печень увеличена и уплотнена, нередко в сочетании с увеличением селезенки
Желтуха, как правило, отсутствует. Может отмечаться повторный субфебрилитет
Характерны обострения, сопровождающиеся повышением уровня AJIT. Для хм
нического гепатита С типичным считается латентное или малосимптомное течение
заболевания, длительное время остающееся нераспознанным. Течение ВГС может
продолжаться многие годы.
У 20-30% больных хроническим ВГС развивается цирроз печени. Установлено
более частое развитие цирроза печени у больных ВГС, вызванным генотипом lb
ВГС, как и ВГВ, остается важнейшим этиологическим фактором развития гепа-
токарциномы. Причем доказано, что ассоциация ВГВ/ВГС чаще приводит к этому
осложнению, чем каждый из них в отдельности. По материалам VIII Конгресса
по вирусным гепатитам у больных хроническими гепатитами при индикации
маркеров ВГС гепатокарциному регистрируют в 10% случаев, ВГВ - в 15%
а при их сочетании — в 27%.
При микст-гепатитах С и В наблюдаются также более тяжелое поражение пече¬
ни и склонность к онкогенезу.
Внедрение в практику методов специфической диагностики гепатита С позво¬
лило составить представление о распространенности этой инфекции. В Северной
Америке частота носительства анти-ВГС-антител составила 0,3-1%, в европей¬
ских странах — 1-2%, в Африке — от 3-4 до 57%. В России анти-ВГС-антитела
обнаружены у 1-3% здорового населения. По данным некоторых авторов, виру¬
сом гепатита С в России инфицированы 2-5% доноров резерва, в Прибалтике -
1-3%, в Средней Азии — 8%, в Молдавии — 12%. На частоту обнаружения антител
у доноров влияет количество лиц с повышенной активностью АЛТ и наличием
анти-НВс-антител. Среди таких доноров частота обнаружения анти-ВГС-антител
значительно выше. Антитела к гепатиту С обнаружены у 18,6% доноров плазмы
с повышенным уровнем АЛТ в крови. Высока инфицированность вирусом гепа¬
тита С больных гемофилией (69-77%), венерическими заболеваниями (8-11%),
наркоманией (до 73%), пациентов отделений гемодиализа (19-54%),
Интересно отметить тот факт, что при скрининговых исследованиях в США
была установлена более высокая частота выявления серопозитивных лиц среди
доноров латиноамериканского происхождения, чем среди потомков выходцев
из Европы. На значение иммуногенетических факторов указывают и данные
о повышенной склонности к заражению ВГВ лиц, в фенотипе которых имеется
антиген В8, который был выявлен у 50% ВГВ-позитивных доноров.
Приведенные данные указывают на высокую степень инфицированности насе¬
ления гепатитом С и на необходимость использования в учреждениях Службы
крови высокочувствительных и специфичных методов диагностики. Считают,
что выявление вирусоносителей среди доноров может предотвратить возникнове¬
ние посттрансфузионного гепатита С в 60-80% случаев.
Вирусный гепатит G
Вирус гепатита G (ВГС) относится к семейству флавивирусов, обладает гепато
и лимфотропностью. Геном вируса кодирует структурные (El, Е2) и неструкТУР
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1071
/j4S2, NS3, NS4, NS5) белки. Предполагают наличие, как минимум. 3 генотм-
й нескольких субтипов возбудителя.
*gpG распространен довольно широко, например в регионах с высоким уров-
м заболеваемости гепатитами В и С. В России частота выявления возбудителя
«леблется от 2% в Москве до 8% в Якутии. Источниками распространения вируса
считаются больные острым и хроническим гепатитом G. Основной механизм пере¬
дачи инфекции — парентеральный. Как следствие этого, гепатит G широко расиро-
^раНен среди наркоманов. Установлено, что частота обнаружения вируса среди
_jh категории лиц намного выше, чем в среднем среди населения, проживающего
ра данной территории.
Возможны половой путь передачи возбудителя и вертикальный от инфици¬
рованной матери плоду. Заражение может происходить и при гемотрансфузиях
« парентеральных вмешательствах.
При заболевании гепатитом G отмечаются слабовыраженные клинические
проявления, острая форма протекает, как правило, бессимптомно. Повышение
печеночных ферментов не наблюдается или весьма незначительное. РНК вируса
гепатита G обнаруживают у доноров как с нормальными, так и с повышенными
значениями АЛТ — 1,7 и 1,5% лиц соответственно.
Основным маркером для диагностики гепатита G остается вирусная РНК, выяв¬
ляемая методом ПЦР. Антитела к вирусу ВГС выявляются значительно позже,
когда вирус из крови элиминируется, и служат показателями выздоровления.
Хронический гепатит G характеризуется мягким течением, незначительным
повышением АЛТ и редким исходом в цирроз печени.
Гепатит G часто сочетается с другими видами гепатитов (В и С). В среднем
по популяции 6% носителей вируса гепатита В и 10% гепатита С коинфицированы
ВГС. Среди лиц, получивших множественные гемотрансфузии, 21% носителей
ВГС были позитивны и по BrG.
В1997 г. от больного был выделен вирус, названный TTV (Transfusion-Transmitted
Virus), с предположительно парентеральным и гемотрансмиссивным путями пере¬
дачи. Подтверждением этого служили данные о достоверно более частом его обна¬
ружении у пациентов, имевших в анамнезе гемотрансфузии (26,4%) в сравнении
с теми, кто не имел трансфузий (4,2%). Помимо парентерального пути заражения,
есть данные о вертикальном и пищевом путях передачи. Диагностику осущест¬
вляют методом ПЦР. Существуют данные об обнаружении вируса ТТ в крови
доноров США (до 1%), Италии (22%) Бразилии (>60%). У больных, получающих
множественные трансфузии, частота анти-ТТ-антител достигала 37%, у бальных
гемофилией — 44%. Полученные данные позволяют прийти к заключению о мно¬
жестве путей передачи этого вируса и наличия лиц с вирусемией, однако нет дока¬
зательств его патогенности для человека.
В 1999 г. исследователи выявили новый вирус, связанный с гепатитами неиз¬
вестной этиологии (Sen-V), названный по инициалам человека, в крови которого
он был впервые обнаружен. Предполагалось, что он может быть связан с разви¬
тием посттрансфузионного гепатита. Однако в специально выполненных иссле¬
дований показано, что, так же как и BrG, он не приводит к поражению печени
и, по-видимому, мало связан с гемотрансфузиями. Генетический анализ показал
близость SeN-V к семейству ТТ-вирусов.
Посттрансфузионные гепатиты
Передача вирусов гепатита с кровью доноров в процессе трансфузиологических
операций приводит к посттрансфузионным гепатитам (ПТГ). По распростране¬
нию и тяжести клинических последствий такие гепатиты занимают ведущее место
среди гемотрансмиссивных инфекций.
В различных странах доля гепатитов с парентеральным путем передачи в нача¬
ле 1990-х гг. составляла 2-17%. К 2000-2003 гг. благодаря повышению качества
1872 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
обследования доноров она снизилась до 0,3-7%. Количество случаев ПТГ на*
дится в зависимости от уровня заболеваемости на конкретной территории, часто °
бессимптомного носительства, лабораторного обеспечения Службы крови и од
Основную опасность в качестве источника заражения представляют так над
ваемые здоровые вирусоносители, поскольку, как правило, они остаются
познанными, сохраняют активный образ жизни и могут являться донорами. С
В 2000-2001 гт. около 4 млн человек имели антитела к вирусу гепатита г
а 2,7 млн находились в активной фазе течения инфекции. В Москве с 2001
по 2005 г. заболеваемость гепатитом В возросла в 1,5 раза, гепатитом С - в 27
раза.
В последние годы в связи с повышением качества обследования доноров дол
посттрансфузионных заражений гепатитами в России и в Москве сократилась с 7 5-
13% в 1990-1991 гг. до 0,2-0,8% в 2003-2005 гг., несколько снизилось и общее
количество доноров с маркерами гепатитов В и С. Высокий процент носительства
HBsAg и анти-НсУ-антител выявлен у безвозмездных доноров, у кадровых доно¬
ров эти значения ниже и совсем незначительны у доноров плазмы и тромбоцитов
Наибольшее количество лиц с маркерами гепатитов В и С зарегистрировано среди
безвозмездных доноров и доноров-родственников (табл. 25-76).
Таблица 25-76. Частота выявления маркеров гемотрансмиссивных инфекций у различных кате¬
горий доноров
Контин
гент доноров
Частота
аыявления
доноры крови
платные
доноры
плазмафереза
платные
доноры крови
безвозмездные
доноры-родственники
Гепатита В
0,06
0,02
2,27
2,06
Гепатита С
0,24
0,03
5,58
4,32
Частота регистрируемых посттрансфузионных гепатитов в различных странах
составляет около 10% всех гепатитов с парентеральным путем передачи. В струк¬
туре посттрансфузионных гепатитов доля гепатита В составляет 40-50%, гепати¬
та С - 50-88%.
Профилактика посттрансфузионных гепатитов, вызванных вирусом гепатита С,
остается наиболее трудной проблемой. Отличительной особенностью вируса гепа¬
тита С считается его генетическая неоднородность, приводящая к образованию
большого количества генотипов. Кроме того, при заражении вирусом гепатита С
заболевание часто протекает бессимптомно, частота безжелтушных форм составля¬
ет около 70%. Болезнь нередко прогрессирует без клинических проявлений и в 50%
случаев переходит в вялотекущую хроническую форму. РНК вируса обнаруживают
через 1-2 нед после заражения. Виремию выявляют на 5-10 нед раньше появления
клинических признаков, а антитела обнаруживают через 10-12 нед после зараже¬
ния. У большинства пациентов антитела исчезают через несколько лет после выздо¬
ровления, при хроническом течении болезни они чаще всего сохраняются.
Доля гепатита G в структуре посттрансфузионных гепатитов составляет 7-10%.
Риск возникновения посттрансфузионного гепатита D ниже. Значительно чаше
отмечается сочетанное инфицирование гепатитами В и D.
Существуют данные о возможном парентеральном пути передачи вирус3
гепатита А. Долгое время считалось, что гепатит А передается только фекально
оральным путем. В 1994 г. появились сообщения о вспышках этого заболевания
при парентеральном заражении у наркоманов и гомосексуалистов в Австралии.
М. Mannuccei и соавт. описали случаи заболевания гепатитом А у больных гем
филией, получавших концентрат фактора VIII. То, что в данном случае имел |
именно парентеральный путь передачи, было доказано выделением идентич
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИИ 1073
ных последовательностей вируса гепатита А в пробах препарата фактора VIII
^образцах сывороток заболевших реципиентов.
Й ^Очевидные случаи заболевания гепатитом А больных гемофилией, получаю-
х гемостатическую терапию, заставляют усилить внимание к повышению
^опасности компонентов и препаратов плазмы.
Американские исследователи изучали возможность удаления или инактивации
руса гепатита А при приготовлении фактора VIII. С этой целью они смешивали
человеческую плазму (позитивную и негативную по анти-ВГА) и различные про¬
межуточные продукты с клеточной культурой ВГА и создавали условия для вос¬
производства этого препарата. Результаты экспериментов показали, что комбини¬
рованное воздействие антительной нейтрализации, криопреципитации, обменной
хроматографии и лиофилизации приводит к снижению инфекционного титра
вируса, однако при его высокой концентрации в исходном сырье полного уни¬
чтожения вируса не достигается. Поскольку заболеваемость ВГА среди доноров
составляет 1 случай на 1000 человек в год, то для обычного плазменного пула
(4500 л), суммирующего плазму 18-20 тыс. кроводач, контаминация составляет
1 виремическую единицу, при этом он содержит 107-108 степени инфекционных
единиц ВГА.
В России, несмотря на высокий уровень заболевания гепатитом А (около 85%
населения имеют антитела класса IgG к ВГА), случаев парентерального зараже¬
ния не зарегистрировано. Однако, учитывая данные зарубежных авторов, следует
повысить безопасность получаемых компонентов и препаратов плазмы, а также
усилить контроль за отбором донорских кадров.
Заболеваемость парентеральными гепатитами В, С и D в России по-прежнему
достаточна высокая, насчитывают 4,5-5 млн человек, инфицированных этими
вирусами, и около 150 тыс. больных с хроническими формами. При этом реги¬
стрируются только желтушные формы острых гепатитов, которые составляют 25%
всех случаев заболевания.
При ПТГ наблюдается весь спектр клинических проявлений, характерных
для гепатитов В, С и D. Летальность от острых парентеральных гепатитов состав¬
ляет 1-2% госпитализированных больных, и не менее 1000 человек в год умирают
от хронических гепатитов и цирроза печени.
Частота ПТГ резко увеличивается среди так называемых групп риска.
В группу риска входят:
• лица, объединенные по принципу повышенной вероятности заражения
инфекционным заболеванием в результате более частых, длительных
или тесных контактов с источником инфекции. Эта вероятность определяет¬
ся, с одной стороны, характером профессиональной деятельности и другими
социальными условиями жизни, а с другой - способами передачи возбуди¬
теля инфекции;
І лица, страдающие хроническими заболеваниями, при которых показаны
повторные переливания гемотрансфузионных средств;
I больные, подвергающиеся гемодиализу;
• персонал медицинских учреждений, имеющий контакт с кровью, - сотруд¬
ники гематологических, хирургических, реанимационных отделений, отде¬
лений гемодиализа, учреждений Службы крови и т.п.;
• наркоманы, вводящие наркотические вещества внутривенно;
• проститутки, гомосексуалисты.
В системе мер, направленных на профилактику ПТГ, вызываемого вирусом
гепатита В, важная роль отводится вакцинации. Создание в 1982 г. плазменной
вакцины стало одним из крупнейших достижений медицины. В 1986 г. были
созданы генно-инженерные (рекомбинантные) вакцины. В настоящее время рас¬
пространены вакцины на основе HBjAg, экспрессируемого дрожжами, - Engerix В
1074 трансфузионная иммунология
фирмы Smith&Kline (Бельгия), аналогичные препараты фирмы Merck Sharp and
Dohme (США), НПК Комбиотех (Россия) и др.
Рекомбинантная вакцина, как было показано при клинических испытаниях
и ва практике, вызывает сероконверсию у 95-98% здоровых взрослых людей
Концентрация защитных антител к HBsAg 10 ME в 1 мл сыворотки вакциниро¬
ванных считается пороговой для обеспечения иммунитета. После 3-кратного
введения вакцины в течение 6 мес защитный титр антител сохраняется не менее 5
лет. Осуществление широких программ вакцинопрофилактики в Великобритании
Бельгии. Италии и США позволило снизить показатели заболеваемости в этих
странах до 1-4 на 100 тыс. населения, уменьшить частоту перехода в хронические
формы и летальность.
Вакцинация детей против гепатита В снижает риск заболевания первичным
раком печени. Рекомендуемая Всемирной организацией здравоохранения стра¬
тегия предусматривает тотальную вакцинацию новорожденных и групп высокого
риска в странах, где вирусоносительство превышает 2%, а количество инфициро¬
ванного населения превышает 20%. В странах с уровнем вирусоносительства 0,5%
и инфицированностью населения 5-6% рекомендуют вакцинацию новорожден¬
ных от инфицированных матерей, а также лиц, входящих в группы риска.
Осуществление широкой программы вакцинопрофилактики для России осо¬
бенно актуально в связи со сложившейся в настоящее время крайне неблагопри¬
ятной эпидемической ситуацией. В последние годы наблюдается резкий подъем
заболеваемости гепатитами вообще и гепатитом В в частности. Так, если в 1998
г. показатель заболеваемости составил 56,7, то в 2003 г. он возрос до 68,4 на 100
тыс. населения. Также возрос, но не очень значительно, удельный вес гепатита
В в структуре заболеваемости гепатитами. Если в 2001 г. больные острым гепа¬
титом В составили 49,2% заболевших гепатитами, то в 2005 г. этот показатель
составил 53,3%.
Определенные изменения произошли и в структуре путей передачи гепатита
В. В связи с практически повсеместным скринингом доноров на наличие HBsAg
в ИФА и использованием одноразового инструментария уменьшилась доля пост¬
трансфузионных гепатитов, связанных с переливанием компонентов и препаратов
крови или проведением лечебно-диагностических манипуляций, и увеличилось
количество больных, заразившихся при внутривенном введении наркотиков
или половым путем. Высокий уровень заболеваемости гепатитом у детей младшего
возраста свидетельствует о сохранении в значительной мере перинатального пути
передачи возбудителя.
В специальных исследованиях показан и значительный экономический ущерб
от ВГВ: потери, связанные только с лечением больных с парентеральными форма¬
ми гепатита В. составляют около 700 млн руб. в год.
Острота эпидемической ситуации и низкая эффективность проводимых проти¬
воэпидемических и профилактических мероприятий свидетельствуют о необходи¬
мости внедрения широких программ вакцинопрофилактики.
В России вакцинация против гепатита В была предусмотрена с 1996 г. спе¬
циальным приказом Министерства здравоохранения РФ у лиц, составляющих
определенные группы риска, в том числе у детей, родившихся от матерей - носи¬
тельниц HBsAg. и всех новорожденных в регионах, гиперэндемичных по гепатиту
В, т.е. с уровнем носительства 5% и выше. Накопленный опыт осуществления про¬
грамм вакцинопрофилактики хотя и свидетельствует о положительных резуль¬
татах. однако заставляет признать, что масштабы ее проведения еще очень малы
и не соответствуют остроте эпидемической ситуации. В большинстве регионов
России иммунизируют только лиц, составляющих группы высокого риска ИНф
цирования вирусом гепатита В, в ряде районов вакцинированы только 1,1% Д61* ’
родившихся у носителей Hb4Ag.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ | Qjfg
для обеспечения значительного снижения общей заболеваемости гепатитом В
Іїовня носительства вируса в популяции необходима, как показывает мировой
Lbrr. вакцинация всех новорожденных, что было рекомендовано Всемирной орга¬
низацией здравоохранения для всех стран, независимо от уровня носительства
Hb,Ag-
Кроме того, при интенсивном вовлечении в эпидемический процесс лиц от 15 до 30
леТ ВОЗ рекомендует проведение регулярной иммунизации подростков 12-14 лет.
В России из-за нехватки финансирования невозможно осуществление необ¬
ходимых мероприятий в полном объеме. Учитывая тяжесть и особенности эпи¬
демической ситуации в большинстве регионов России (пути передачи инфекции,
возрастной состав больных и удельный вес гепатита В в структуре гепатитов),
в качестве паллиативной меры можно проводить иммунизацию подростков начи¬
ная с 12 лет в сочетании с вакцинацией лиц, входящих в группы повышенного
риска заражения гепатитом В.
Вакцинация от гепатита В одновременно считается и профилактикой гепатита
D, поскольку вирус гепатита D не может размножаться в организме без поверх¬
ностного HBjAg-вируса гепатита В.
Гепатит В как профессиональная вредность
Возможность профессиональной передачи возбудителя гепатита В впервые была
доказана после того, как у медицинских работников были зарегистрированы случаи
гепатита, связанные со вспышками инфекции у их больных. В дальнейшем было
выявлено, что у медицинских работников показатели заболеваемости гепатитом В
выше, а маркеры гепатитной инфекции встречаются чаще, чем у обычного населе¬
ния. В результате исследования, проведенного Szmuness и соавт. в 1974 г. в Центре
гемодиализа в США, было установлено, что почти у 50% больных и у 30% медицин¬
ского персонала выявляются маркеры текущей или ранее перенесенной инфекции.
В исследованиях, проводимых в европейских странах, показано, что каждый год
свыше 500 медицинских работников в странах Северной Европы и 6423 медика
в Южной Европе заражаются ВГВ. В целом в западноевропейских странах ежегод¬
но заражаются возбудителем гепатита В около 18 тыс. сотрудников медицинских
учреждений, т.е. в среднем 50 человек в день.
В результате этих исследований была сформулирована концепция, согласно
которой гепатит В считается одной из самых опасных профессиональных инфек¬
ций для работников медицинских учреждений, а также для тех сотрудников,
которые по роду своей профессиональной деятельности контактируют с кровью
или другими контаминированными биологическими жидкостями.
Наиболее эффективным средством защиты от гепатита В у лиц, имеющих про¬
фессиональный риск, остается вакцинация, которую медицинские работники
Должны проходить в момент поступления на работу в лечебные учреждения.
Кроме того, в хирургических клиниках эффективной мерой, направленной на сни¬
жение риска заражения медицинского персонала, считается вакцинация поступаю¬
щих на плановые операции больных по экстренной схеме.
По схеме экстренной профилактики гепатита В предусматривается введение
трех доз вакцины в 0-7-21-й день. Реиммунизация (введение бустер-дозы) пред¬
полагается через 12 мес. Данную схему применяют в странах Западной Еврмцв
Целях профилактики гепатита В у больных, которым необходимы плановые опе¬
ративные вмешательства, а также у туристов и других лиц, выезжающих
ны, эндемичные по гепатиту В.
Проводилось определение эффективности применения экстренной схемы
филактики гепатита В по показателям сероконверсий и величине
ческих анти-НВ5-антител.
Под наблюдением находились 226 пациентов (107
в возрасте от 19 до 69 лет), которые дали inn|i ці ііі|іішіщцц ЦДИ
РАЗДЕЛ «V
1076 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
цмю по ускоренной схеме. Вакцинация была проведена у больных, поступивших
для хирургических вмешательств в связи со следующими заболеваниями: ИБС —
82 пациента, калькулезным холециститом — 64, неинфекционными гепатитами
и циррозом печени - 31, патологией легких - 19 больных, 30 человек поступили
с заболеваниями, требующими микрохирургических операций.
Вакцину против гепатита В, содержащую 20 мкг HbsAg (ENGERIX В Smith&Kline
Beecham Biologecals — серии 2629, 2658, 2631), в дозе 20 мкг вводили внутри¬
мышечно в дельтовидную мышцу в соответствии со схемой 0-7-21-е сутки.
Указанный график ускоренной вакцинации был принят в результате анализа
данных литературы, в соответствии с которыми именно эта схема обеспечивала
высокий серопротективный уровень у вакцинированных лиц. В исследование
были включены больные, ранее не вакцинированные против гепатита В. В каче¬
стве контрольной группы по той же схеме были вакцинированы практически
здоровые люди (67 человек), прошедшие медицинское освидетельствование
как доноры первичной кроводачи. Все привлеченные к вакцинации лица были
серонегативны в отношении HbsAg и анти-НВ5-антител. Для выявления Hb Ag
и анти-НВ5-антител использовали тест-системы для ИФА производства SANAFI
DIAGNOSTICS PASTER Monolisa HbsAg Plus, Monolisa anti-HBs и Monolisa anti-
HBS Standards.
Сыворотки вакцинированных больных и лиц, входивших в контрольную груп¬
пу, исследовали на 7,14 и 21-й день после начала прививок, а затем через месяц
после завершения курса вакцинации. Серопротективным титром антител, обеспе¬
чивающим защиту организма от вируса, в соответствии с международным стандар¬
том был принят показатель, равный 10 МЕ/л. Полученные данные подвергались
статистической обработке.
Результаты частоты конверсий у больных, вакцинированных по ускоренной
схеме, приведены в табл. 25-77. Как видно из представленных данных, количество
людей, у которых в сыворотке крови появились антитела к вирусу гепатита В, было
примерно одинаковым как в основной, так и в контрольной группе (12,4 и 13,8%
соответственно). Доля лиц с сероконверсией после первой вакцинации (к 7-10-м
суткам) была незначительной, что согласуется с данными о том, что выработка
антител на появление чужеродного антигена активизируется через 10-14 сут после
его введения. На 14-й день после начала вакцинации (т.е. после введения 2-й дозы)
сероконверсия отмечена практически у половины больных (49,8%) К 21-му дню
(введение 3-й дозы) процент лиц с защитным титром увеличился до 69,4. Через
месяц после завершения вакцинации сероконверсия наблюдалась у 81,1% вакци¬
нированных.
Таблица 25-77. Результаты вакцинопрофилактики больных в многопрофильной хирургической
клинике по ускоренной схеме
Дни исследования после начала вакци¬
нации
Больные
Контрольная группа
N
% сероконверсий
N
% сероконверсий
7-10-й
219
12,4+2,3
67
13,8+4,2
14-й
104
49,8+4,9
67
51,4+6,1
21-й
226
69,4+3,1
67
72,5+5,4
Через 1 мес после введения 3-й дозы
122
81,2+3,5
67
82,6+4,6
В табл. 25-78,25-79,25-80 представлены результаты определения титров анти¬
тел у лиц с сероконверсией.
К 14-му дню после начала вакцинации (после введения 2-й дозы) доля лиц
с высоким защитным уровнем антител (>100 МЕ/л) превысила 20%, а к 21-му дню
достигла 82%.
Симптомы, местные и/или общие (покраснение, зуд в месте введения вакцины,
незначительное повышение температуры до 37-37,1 °С), наблюдались у 12,2%
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1077
нтов, что сопоставимо с частотой реакции, отмечаемых при стандартных
Схемах вакцинации.
Шш 25-78. Результаты определения титров анти-НВ5-антител после вакцинации у больных
Двроконверсией
дни после начала вакцинации
Больные
27
57
157
уровни аити-НВ.
10-100 100-150 >150
96,2-3,6
78,2-5,8
^мес после введения 3-й дозы 199
59,4-3,9
3,7-9,2 0
15,4-5,0
Контрольная группа (л=87)
уровни анти-НВ,
10-100 100-150 >150
98,5-2,4
6,4-3,2 77,9-5,1
29,3-3,6 11,3-2,5 57,7-5,9
1,5-4,4
15,1-4,4
29,8-5,6
0
7,0-3,1
12,5-4,0
18,1-3,9
61,4-4,8 |20,5-4,1 113,0-4,1
64,4-5,8
22,6-5,1
Таблица 25-79. Процент больных с различными уровнями анти-НВ5-антител
Больные
Дни после начала вакцинации
уровни анти-НВ,
п
10-100
100-150
>150
п
%
п
%
л
%
7-10-й
27
26
96,2+3,6
1
3,71+9,2
0
0
14-й
51
0
78,4+5,8
8
15,7+5,0
3
5,9+3,2
21-й
157
93
59,2+3,9
46
29,3+3,6
18
11,5+2,5
Через 1 мес после введения 3-й дозы
99
19
18,2+3,9
61
61,6+4,8
20
20,2+4,1
Таблица 25-80. Процент лиц в контрольной группе с различными уровнями анти-НВ5-антител
Дни исследования
Контрольная группа
л
уровни анти-НВ,
10-100
100-150
>150
N
%
N
%
N
і
7-10-й
67
66
98,5+1,5
1
1,5+4,4
0
0
14-й
67
52
77,5+5,1
10
15,0+4,4
5
7,5+3,1
21-й
67
38
20
29,8+5,6
9
13,4+4,0
Через 1 мес после введения 3-й дозы
67
9
13,4+4,1
43
64,2+5,8
15
22,4+5,1
Полученные результаты согласуются с данными Hans L. Bock и соавт. (1995),
проводивших сравнительные исследования эффективности различных схем уско¬
ренной вакцинации. По их данным, при применении схемы 0—7—21-е сутки доля
лиц с защитным титром антител к 23-25-му дню составила 65,2%, а через 1 мес
достигла 78,4%.
Таким образом, в исследованиях показано, что вакцинация по графику
0-7-21-е сутки безопасна, иммуногенна, достаточно хорошо переносится и можно
применять как у здоровых лиц (доноров крови), так и у больных лечебно-профи¬
лактических учреждений, в первую очередь у пациентов хирургического профиля.
ВИРУС ИММУНОДЕФИЦИТА ЧЕЛОВЕКА
Проблема синдрома приобретенного иммунодефицита (СПИДа), связанно¬
го с инфекцией ВИЧ, относится к числу наиболее важных государственных
и социально-медицинских проблем.
Первые публикации о ВИЧ/СПИД-инфекции относятся к 1981 г., когда Центр
контроля за болезнями США в Еженедельном вестнике в июне 1981 г. опубли¬
ковал данные о 5 случаях заболевания пневмоцистной пневмонией с летальным
1178 wewawoMHWwwwHonon»
исходом I молодых мужчин в возрасте до 30 лет. Происхождение заболевания
оставалось неясным. Однако течение заболевания позволило предположить
(Прогрессирующее поражение иммунной системы. Впервые был сформулирован
синдромный диагноз Acquired Immunodeficiency Syndrome (AIDS) — синдром при¬
обретенного иммунодефицита (СПИД). Позже выяснилось, что СПИД — это лишь
(Мидтая манифестная и по сути терминальная стадия заболевания. Болезнь стали
называть ВИЧ СПИД-инфекцией. Возбудитель был обнаружен лишь в 1983 г.,
хогда почти одновременно в двух лабораториях был выделен вирус иммунодефи-
Н цитэ. В Институте Пастера во Франции L. Montagnier и в Национальном институте
реп в США R.C. Gallo из пунктата лимфоузлов от больных с симптомами СПИДа
выделили возбудителя заболевания.
Французский вариант возбудителя был назван Lymfaadenjpathy-Associated Virus
(LAV), а американский - Human Т-сеП Leukemia Virus (HTLV-III). Позже было
установлено, что это изоляты одного и того же вида. Международный коми¬
тет экспертов по таксономии вирусов в 1986 г. дал ему наименование Human
‘ Immunodeficitena Virus (HIV) - вируса иммунодефицита человека (ВИЧ). В том же
году L Montagnier обнаружил вариант ВИЧ у выходца из Западной Африки, кото¬
рый невозможно было выявить обычными тест-системами. Этот вариант был обо¬
значен как ВИЧ-2, а ранее выделенный — как ВИЧ-1.
К настоящему времени, по данным Всемирной организации здравоохранения,
уже в 160 странах мира официально зарегистрированы сотни тысяч больных.
В США количество больных удваивается через каждые 6-8 мес, в странах Западной
Африки количество инфицированных достигает 40-60% общей численности
населения. В России в последние годы заболеваемость имеет явную тенденцию
к нарастанию - в декабре 1998 г. количество больных перешагнуло десятитысяч¬
ный рубеж. Сегодняшний показатель заболеваемости по России равен 46,41 на 100
тыс. населения, н только за последний год он вырос в 1,8 раза. По количеству ВИЧ-
положительных лиц лидирует Московская область — 9381 человек, Москва зани¬
мает второе место в стране - 8388 человек, на третьем месте Иркутская область -
6142 человек. Однако это только официальные данные. По мнению сотрудников
отдела особо опасных инфекций Госсанэпидслужбы, количество невыявленных
случаев может быть в 5-8 раз больше.
Увеличивается и группа детей, рожденных от ВИЧ-положительных матерей.
С 1987 по 1998 г. их было 15. в 1999 г. — уже 70, в 2000 г. — 150, а к 2005 г. — 280.
Вирус иммунодефицита относится к семейству ретровирусов, подсемейству
лентивирусов (медленных вирусов), для которых характерен многолетний латент¬
ный период, соответствующий первой фазе течения (фазе покоящегося вируса)
с дальнейшим взрывным течением болезни и большей частью летальным исхо¬
дом. Вирус иммунодефицита состоит из сердцевины (сог), покрытой оболочкой
(etmlope). Общий диаметр составляет около 100 нм. Строение вируса кодируется
тремя генами. Схема генома ВИЧ-1 и -2 приведена на рис. 25-5.
£яг-ген кодирует протеин р85 — предшественник гликопротеидов оболочки
массой 160 кДа (gpl60), в которых различают 2 части — gpl20 и gp41.
кодирует образование белка р55, который считается предшественником
основного cor-антигена вируса - р24, а также р9 и р7, входящих в состав серд¬
цевины вируса, белков обратной транскриптазы — р17/18, которые окружают
сердцевину вируса и связывают ее с оболочкой. Pol-ген кодирует протеин р180 -
предшественника белков, среди которых энзимы вируса — обратная транскрипта-
за ипротеазы.
Строение ВИЧ представлено на рис. 25-6.
ВИЧ - внутриклеточный лимфотропный вирус, который поражает в первую
4ШрЮ Т-хедаеры. несущие рецепторы CD4 и CD8, по которым вирус распознает
клетки-мишени. Такие же рецепторы существуют и на других клетках — макрофа-
к под р17/18
транскриптаза к
Рис. 25-6. Строение вируса иммунодефицита человека
гах, эозинофилах, В-лимфоцитах и др. Все они могут стать клепсами-мишенями
ДМ ВИЧ. В последние годы установлено, что некоторые клетки и при отсутствии
на их поверхностях рецепторов CD4 могут адсорбировать и переносить вирус
К ним относятся М-клетки слизистой оболочки прямой кишки и сперматозоиды,
которые играют важную роль при половом пути передачи. В результате поражения
иммунной системы у больных развиваются лимфоцитопения. нейтро- и тромбо
нитопения, отмечается повышенная чувствительность к банальным инфекциям,
приводящим к тяжелым осложнениям, онкологическим заболеваниям.
ВИЧ-инфекция относится к антропонозам. Источником становятся больные
8 л*обом периоде заболевания и вирусоносители. Пути передачи инфеквди рв-
*°°бразны. К естественным путям относятся половой (при гош- и гетеросеису*
^ьных контактах) и вертикальный (от инфицированной матери плоду) Важную
Р°ль играет артифициальный, искусственный, путь (при различных меаишлкхих
^птельствах и гемотрансфузиях).
1030 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Проблема СПИДа во многом была определена передачей вируса с компонентами
и препаратами крови. В странах, где заболеваемость СПИДом носит эндемический
характер, частота посттрансфузионного заражения составляет 2-3% всех зареги¬
стрированных больных. Вероятность заболевания при введении инфицированных
ВИЧ гемокомпонентов превышает 90%. Реципиенты множественных трансфузии
входят в группу повышенного риска. К ним относятся в первую очередь больные
гемофилией, среди которых заболеваемость СПИДом составляет 1 на 300 человек
По данным некоторых американских исследователей, 1% больных гемофили¬
ей. получавших концентрат фактора VIII, и 2% больных после гемотрансфузий
заболели СПИДом. Количество новых случаев СПИДа от любых причин росло
на 65-90% в год в течение первых 10 лет эпидемии. Доля гемотрансмиссивной
ВИЧ-инфекции в распространении эпидемии в мире к середине 1990-х гг. состав¬
ляла 3-5%.
В последнее десятилетие XX в. усилия специалистов-трансфузиологов были
направлены на снижение риска передачи вирусных инфекций: более тщательно
стали подходить к отбору доноров, разрабатывались более совершенные тест-
системы для скрининга возбудителей и методы инактивации вирусов в крови.
Все эти меры позволили снизить частоту вирусных заражений при трансфузиях
Современные методы тестирования крови позволили к 2004 г. снизить риск зара¬
жения ВИЧ примерно до 1 на 670 000, гепатита В - до 1 на 137 000, гепатита С -
до 1 на 100 000 доз гемокомпонентов. Полагают, что внедрение NAT-технологий
позволит уменьшить риск заражения от дозы крови в 5-10 раз.
Таким образом, внедрение новых лабораторных технологий значительно
уменьшает риск посттрансфузионных инфекционных осложнений, однако это
коснулось только тех инфекций, на маркеры которых тестируется кровь доноров.
Необходимо учитывать, что существует целый ряд возбудителей гемотрансмис¬
сивных инфекций, на которые кровь вообще не тестируется. Таким образом, про¬
исходит гемотрансмиссивная передача вирусов группы герпеса.
ГЕРПЕС-ВИРУСЫ
Герпес-вирусы объединены в семейство Herpesviridae и включают более 70
видов, из которых для человека имеют значения цитомегаловирус (ЦМВ), вирус
простого герпеса 1-го и 2-го типа (ВПГ-1 и ВПГ-2), вирус Эпштейна-Барр (ВЭБ),
вирус ветряной оспы и опоясывающего герпеса, вирус герпеса человека VI и VII
типа. Есть сведения об идентификации вируса герпеса VIII типа.
Герпес-вирусы широко распространены в человеческой популяции, могут пора¬
жать все органы и системы организма, вызывая скрытую, острую и хроническую
формы инфекции (табл. 25-81).
Актуальность проблемы герпес-вирусной инфекции возросла с появлением
ВИЧ/СПИД-инфекции. Показано, что вирусы герпеса могут активировать вирус
иммунодефицита и считаются кофактором прогрессирования ВИЧ-инфекции
в СПИД.
Общее количество больных с герпетической инфекцией в мире, согласно дан¬
ным ВОЗ, около 20 млн человек. При множественных трансфузиях инфицируется
10-12% реципиентов. Частота выявления антител к вирусу герпеса VIII типа,
ассоциированного с саркомой Капоши, у здоровых доноров в США достигает
6,1%. У 0.7% первично-негативных реципиентов гемокомпонентов были выявле¬
ны маркеры вирусов герпеса VIII типа. Группами повышенного риска для вирусов
герпеса VI, VII и VIII типа считаются больные с иммуносупрессией, у которых
может развиться тяжелое заболевание со смертельным исходом. По данным ВОЗ.
смертность от герпетической инфекции составляет 15,8% и находится на втором
месте после смертности от гепатитов — 38,5%.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМСТРЯНСФТЗИИ 1081
фдоца 25-81. Характеристика герпес-вирусов человека и основных клинических форм яифвкцш
Герпес-вирусы
человека
Обозначение
Заболевания, ассоциированные
с данным типом герпес-вируса
дотомегаловирус
ЦМВ
Врожденные поражения ЦНС
Гепатиты.
Ретинопатии.
Пневмопатии
[gjipyc простого герпеса 1-го
типа
ВПГ-1
Герпес кожи и слизистых оболочек.
Лабиальный герпес.
Генитальный герпес.
Офтальмогерпес.
Герпетические энцефалиты.
Пневмонии
Вирус простого герпеса 2-го
типа
ВПГ-2
Генитальный герпес.
Неонатальный герпес
Вирус Эпстайна-Барр
ВЭБ
Инфекционный мононуклеоз.
Назофарингеальная карцинома.
Лимфома Беркитта
Вирус опоясывающего гер¬
песа
ВОГ
Опоясывающий герпес.
Ветряная осла
Вирус герпеса человека
VI и VII типа
ВГЧ VI
ВГЧ VII
■ м. и МИ. 1 ■■ ■ ■** 1 иг..." ІМІ 1 1 і . і» ■ « ММИНМ
Лимфотролные вирусы Предположительно ВГЧ VI связан
с внезапной экзантемой. ВГЧ VII — с синдромом хроииче
ской усталости
Вирус герпеса человека
VIII типа
ВГЧ VIII
Саркома Калоши у ВИЧ-серонегатиеных людей
Саркома Калоши, ассоциированная с ВИЧ/СПИД.инфекцией
Представители герпес-вирусов имеют ряд общих особенностей. Это ДНК-
содержащие вирусы, размер которых колеблется от 100 до 300 нм. Для мнх
характерны сферическая форма и наличие 4-структурных компонентов сердце¬
вины, капсида, внутренней и внешней оболочек (мембраны). В составе вирионон
обнаружено более 30 белков (гликопротеидов). 7 из них - gB, gC. gD, gE. gF, gG,
gX — входят в состав мембраны и вызывают образование вируснейтрализующих
антител.
Цитомегаловирусная инфекция
Цитомегаловирус (ЦМВ) — это ДНК-содержащий вирус с выраженным тро¬
пизмом к лейкоцитам. ЦМВ распространен по всему миру. В Европе и Северной
Америке антитела к ЦМВ обнаруживают в среднем у 40-60% лиц старше 35 лет,
а в странах Африки и Азии — почти у 100%.
ЦМВ передается половым путем, а также через биологические жидкости (слюну,
мочу, кровь), при аллотрансплантациях, переливании гемокомпонентов. Риск
заражения возрастает с увеличением количества перелитой крови. При обменном
переливании крови цитомегаловирусная инфекция определяется у 50% ранее
серонегативных новорожденных.
ЦМВ способен инфицировать клетки многих типов, но в основном поражаются
эндотелий, мегакариоциты и клетки, принимающие участие в иммунном ответе.
У иммунокомпетентных реципиентов при трансфузиях ЦМВ-имфициромшшх
компонентов заражение в большинстве случаев протекает бессимптомно.
Тем не менее у небольшого количества больных могут наблюдаться лихорадка,
увеличение лимфатических узлов и гепатоспленомегалия. При исследовании
крови обнаруживаются атипические лимфоциты. Этот снмптомокомплекс поду¬
чил название «постперфузионный синдром» В типичных случаях постперфузиов-
ный синдром развивается между 3-й и 6-й неделей после переливания гемокомпо¬
нентов. Выздоровление обычно наступает через несколько недель.
Гораздо более выраженные клинические проявления наблюдаются у иммуно-
компрометированных лиц в условиях первичного или вторичного кммунолгфици-
1082 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
та. Предрасполагающим фактором для цитомегаловирусной инфекции считается
применение иммунодепрессантов, поэтому часто клинически выраженные случаи
наблюдаются у реципиентов аллогенных органов.
После трансфузии компонентов крови, содержащей ЦМВ, вирус может активи¬
зироваться и вызвать заболевание у ЦМВ-отрицательного реципиента.
Клинические проявления заболевания разнообразны, в подавляющем большин¬
стве они протекают в виде мононуклеозе различной степени тяжести. При этом
отмечаются слабость, боли в мышцах, поражение печени, гепатоспленомегалия
и лимфоцитоз, в осложненных случаях — интерстициальная пневмония, пора¬
жение центральной и периферической нервных систем, перикардит, миокардит,
асептический менингит, тромбоцитопеническая пурпура.
Следует отметить, что первичная цитомегаловирусная инфекция протекает зна¬
чительно тяжелее, чем реинфекция или реактивация.
Доля посттрансфузионных заражений, вызванных ЦМВ, составляет 2-10% всех
заболеваний, обусловленных гемотрансфузиями. При обменных переливаниях
крови ЦМВ-инфекцию определяют у 50% ранее серонегативных новорожденных.
Частота передачи ЦМВ возрастает у реципиентов множественных гемотрансфузий.
Последствиями постгрансфузионной цитомегаловирусной инфекции могут
быть также нарушение процессов регенерации, повышение чувствительности
к банальным инфекционным агентам в результате ЦМВ-индуцированной имму¬
нодепрессии. отторжение трансплантированных органов и тканей, риск онкологи¬
ческих заболеваний. Осложнения, вызванные цитомегаловирусом, могут привести
к летальному исходу у 25% больных с пересаженными почками или послужить
причиной отторжения трансплантата у 20% больных.
Целесообразно ввести тестирование донорской крови на наличие маркеров
ЦМВ-инфекции при подборе крови реципиентам с пересаженными органами.
Инфицированность компонентов крови ЦМВ колеблется от 1 до 12%.
Маркерами цитомегаловирусной инфекции считаются антивирусные антитела
классов IgM, IgG и IgA. При углубленном обследовании методом ПЦР у серо¬
положительных лиц удается обнаружить вирусную ДНК. Однако есть данные,
что в ряде случаев ДНК можно выделить и при отсутствии специфических анти¬
тел. С этим связана возможность передачи ЦМВ с кровью клинически здорового
донора, находящегося в латентном периоде инфекции. По данным некоторых
авторов, носителями инфекции могут быть от 50 до 95% сероположительных
доноров. При исследовании образцов крови доноров суммарные антитела к ЦМВ
идентифицируются у 86-90%, в то время как антитела класса IgM — у 4% обсле¬
дованных. Имеет определенное значение и группа крови доноров: доля серопози¬
тивных к ЦМВ доноров группы крови 0 (I) двукратно превышает этот показатель
у лиц с фенотипом АВ (IV). По-видимому, именно эта категория доноров наиболее
опасна для реципиентов, особенно со сниженным иммунитетом.
Посттрансфузионная ЦМВ-инфекция может протекать в виде реинфекции,
сопровождающейся сероконверсией, и реактивации, приводящей к активации име¬
ющейся у больного инфекции донорскими лейкоцитами. Большинство исследо¬
вателей считают, что риск инфицирования ЦМВ напрямую связан с количеством
перелитых лейкоцитов, поэтому технология получения, переработки и применения
гемокомпонентов играет решающую роль в снижении риска заражения ЦМВ.
Вирус простого герпеса
Вирус простого герпеса достаточно широко распространен в популяции, анти¬
тела обнаруживают у 80-90% взрослого населения. При таком огромном количе¬
стве источников инфекции общее количество больных в мире (по данным ВОЗ)
составляет 20 млн человек, при этом ежегодно госпитализируют около 2,5 млн.
Входные ворота инфекции - кожа и слизистые оболочки; вирус характеризует*
ся выраженной эпителиотропностью. Первичная инфекция чаще характеризуется
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1083
^клиническим течением, но у 10-20% лид отмечаются клинические проявления
g виде герпетических поражений кожи и слизистых оболочек рта, ОРЗ, гениталь¬
ного герпеса, в ряде случаев наблюдаются поражение глаз, развитие энцефалита,
менингоэнцефалита, генерализованного герпеса у новорожденных.
у большинства пациентов первичная острая инфекция заканчивается клини¬
ческим выздоровлением. Однако иногда вирус проникает' в нейроны и ганглии
й персистирует в них в латентной форме. В нервной ткани он может существо-
иать в течение длительного времени, пока какой-либо фактор не вызовет его
активацию. К таким факторам относятся переохлаждение, интенсивная инсоля¬
ция, прием иммуносупрессантов. глюкокортикостероидов, различные стрессовые
ситуации, в том числе оперативные вмешательства. В результате может развиться
генерализованная герпетическая инфекция с летальным исходом. Описаны случаи
летальных исходов при инфицировании вирусами простого герпеса 1-го и 2-го
типа реципиентов почки. На фоне иммуносупрессии вирусы герпеса получают воз¬
можность активно размножаться с последующим угнетением механизмов иммун¬
ного ответа. Причиной генерализованной герпетической инфекции может быть
вирусемия вследствие переливания инфицированной крови. Беременные с ВПГ
могут передать вирус плоду во время его прохождения через родовые пути.
При заражении у новорожденных очень высок риск поражения центральной
и периферической нервных систем. При отсутствии лечения умирают до 65%
детей.
При попадании в организм человека вирус активизирует Т-супрессоры, что при¬
водит к снижению активности иммунокомпетентных клеток, в частности уменьше¬
нию количества лейкоцитного интерферона в 5. а лимфоцитарного - в 30 раз.
Кроме того, значительно снижается количество NK-клеток (естественных килле¬
ров), а также продукция антител.
В течение первых двух недель после заражения появляются антитела класса
IgM, затем они исчезают и появляются антитела класса IgG, которые сохраняются
практически в течение всей последующей жизни. Антитела класса IgA появляются
позже, через 3-6 мес и сохраняются надолго.
Вирус Эпштейна-Барр
Вирус Эпштейна-Барр в странах умеренного климата может стать причиной
инфекционного мононуклеозе, а в жарких странах вызывает лимфому Беркитга.
Заболевание относится к антропонозам, передается воздушно-капельным путем,
В популяции выявляется большой процент иммунных лиц (антитела к ВЭБ
обнаруживают у 80-85% взрослого населения), что определяет большое количе¬
ство стертых и атипичных форм, а клинически выраженные случаи заболевания
наблюдаются у детей 1-3 лет.
У лиц старшего возраста в основе манифестных форм инфекции лежит угнете¬
ние функционального состояния иммунной системы. ВЭБ обладает выраженным
тропизмом к В-лимфоцитам, способен сохраняться в них и размножаться в тече¬
ние длительного времени. При различных факторах, определяющих снижение
иммунитета, возможны активация вируса и развитие клинически выраженно¬
го заболевания. Аллогенная трансплантация при пересадке органов и тканей
или при трансфузиях компонентов крови может сопровождаться как инфициро¬
ванием больного, так и реактивацией латентной инфекции. ВЭБ служит одной
из причин летальности при миелотрансплантациях. Интересно, что у пациен¬
тов с инфекционным эндокардитом снижена распространенность антигена All,
с которым связывается иммунодоминантный эпитоп ВЭБ, а образовавшийся ком¬
плекс распознается цитотоксическими лимфоцитами, что определяет резистент¬
ность All-позитивных лиц к ВЭБ-инфекции. Специфические антитела классов
IgM и IgG служат лабораторным маркером инфицирования. Однако траднщкж-
1084 ТМНСФУЗИОННАЯ ИММУНОЛОГИЯ
ное серологическое обследование имеет определенные ограничения, поскол
в связи с высокой инфицированностью населения наличие антител (у 85-9о<у
здоровых доноров) в крови не считается определяющим признаком активно пп °
гекающего процесса. Принципиально новый подход к диагностике ВЭБ-инфекци
представляет возможность исследования содержания ДНК вируса в мононуклеа
рах периферической крови.
Т-лимфотропные вирусы человека I и II типа
Т-лимфотропные вирусы человека I и II типа (HTLV-I, -II) вызывают злокаче¬
ственные заболевания системы крови и поражение центральной нервной системы
HTLV-I относится к ретровирусам, a HTLV-II — к онковирусам. Они обладают
выраженной лимфотропностью, нейротропностью и особенным сродством с клет¬
ками CD-4.
HTLV-I вызывает пролиферацию Т-лимфоцитов in vitro и считается причиной
возникновения Т-клеточного лейкоза у взрослых. Вирус HTLV-I был выделен
впервые в 1980 г. от больного с Т-клеточным лейкозом.
HTLV-I не является эндемичным для европейских стран. Здесь он выявляется
крайне редко у выходцев из эндемичных стран (Африки, Японии, стран Карибского
бассейна) или у европеоидов, имевших половые контакты с жителями эндемичных
районов. Существуют данные о распространении HTLV-I на Сахалине и в Латвии,
где этот вирус обнаружен у 0,3% доноров, а антитела выявлены у 0,8% лиц.
По материалам отечественных авторов, у жителей Дальнего Востока инфициро-
ванность HTLV-I составляла: у жителей Хабаровского края — 1,7%, Приморского
края — 2,2%, Сахалинской области — 1,6%.
HTLV-II в европейских странах встречается еще более редко. В США проводят
обязательный скрининг антител против HTLV-I у доноров, среди которых коли¬
чество носителей составляет 0,016%. В Бразилии скрининг доноров на вирусы
HTLV-I и II проводят с 1993 г. Частота встречаемости маркеров HTLV-I и II у доно¬
ров колеблется от 0,04 до 1%. Причинами сероконверсий у ранее негативных
доноров стали наличие инфицированных в семье (35%), гемотрансфузии (25%),
многочисленные половые контакты (30%), употребление наркотиков (15%).
К естественным путям передачи вирусов HTLV-I и -II относятся половой путь
и вертикальный - от матери плоду. К артифициальным (искусственным) путям
относится передача вируса при гемотрансфузиях. Впервые передача вируса HTLV-I
с компонентами крови описана в 1984 г., когда была выявлена сероконверсия
у 54-63% реципиентов. Доля лиц, инфицированных вирусом HTLV-I при перелива¬
нии компонентов крови, варьирует в различных странах от 0,2 (в Японии) до 14,4%
(в Англии). Причина таких значительных различий до конца не установлена.
Сероконверсия при гемотрансфузиях от серопозитивных доноров составляет 48%.
При инфицировании инкубационный период у заразившихся реципиентов коле¬
блется от 15 сут до 3 мес. Диагностику проводят методом ИФА. Дифференцировка
вирусов HTLV-I и -II затруднена из-за высокого процента перекрестных реакций.
При положительном тестировании в ИФА результат должен быть подтвержден
в иммуноблоте.
Парвовирус 819
Парвовирус В19 — первый из патогенных для человека парвовирусов, он
был обнаружен случайно в 1975 г. A. Cossart и соавт. в крови здорового донора
при скрининге его крови на гепатит В.
Парвовирус В19 относится к группе односпиральных ДНК-содержащих виру*
сов размером от 15 до 28 нм. Данные, что парвовирус В19 вызывает заболевание
у человека, опубликованы в 1976 г. при наблюдении за донором, у которого была
обнаружена виремия.
V
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1085
риск заражения парвовирусом В19 многократно увеличивается при использова-
препаратов крови, приготовленных из пула плазмы. В частности, инфицирова-
! Ш- больных, получавших фактор VIII, впервые было зарегистрировано в 1980 г.
І ^парвовирус В19 может быть причиной целого ряда заболеваний, начиная
асимптоматических и заканчивая потенциально опасными для жизни прояв-
I ^лиями. Он способен вызвать развитие острого артрита, апластического криза,
Я Политической анемии и болезни плода, заканчивающейся спонтанным абортом,
і ^20-50% случаев заболевание протекает бессимптомно, что повышает вероят-
оргь заражения от инфицированных доноров. Группами риска считаются имму-
нокомпрометированные реципиенты, больные с хронической гемолитической
дНеМИеИ И беременные.
j вирусемия обычно развивается на 5-6-е сутки после инфицирования, а ее пик
■ приходится на 8-9-е сутки. Через 10-12 сут в сыворотке обнаруживают специфи¬
ческие антитела, относящиеся к классу IgM, которые циркулируют в течение
нескольких месяцев. Параллельно через 2-2,5 нед после заражения синтезируются
специфические IgG-антитела, циркулирующие в течение всей последующей жизни
и обеспечивающие пожизненный постинфекционный иммунитет.
Наиболее распространенной и узнаваемой формой проявления В19 считается
эритемная сыпь, чаще всего наблюдаемая у детей. Риск заражения повышается
с увеличением кратности трансфузий. Среди больных гемофилией, постоянно
получающих препараты крови, риск передачи парвовируса В19 с донорской кро¬
вью, по-видимому, будет возрастать, поскольку существующие способы инактиви-
рования компонентов крови неэффективны для этого возбудителя. Альтернативой
может служить внедрение обязательного скрининга донорской крови на наличие
специфических антител к парвовирусу В19. Диагностика инфекции основана
на выявлении специфических антител классов IgM и IgG и/или ДНК-парвовируса
методами ПЦР или гибридизации.
Вирус Западного Нила
Вирус Западного Нила (West Nile Virus) — возбудитель лихорадки Западного
Нила — относится к флавивирусам, переносчиком которого считаются кома¬
ры рода Culex. Основные хозяева WNV — птицы, но он может быть опасен
для млекопитающих и человека. По данным некоторых авторов, передача вируса
лихорадки Западного Нила человеку была зарегистрирована в Африке, странах
Средиземноморья и спорадически в Европе. В большинстве случаев инфициро¬
вание человека WNV протекает бессимптомно, приблизительно в 20% случаев
вызывает субфебрильную реакцию, менее чем в 1% случаев у больных развивается
энцефалит или менингит, которые в тяжелых случаях заканчиваются смертью.
В 1999 г. в США были зарегистрированы вспышки лихорадки Западного Нила
и случаи передачи при гемотрансфузиях. В 2002 г. в Канаде при обследовании
доноров были выявлены лица с виремией.
В России эпидемическая вспышка лихорадки Западного Нила была зареги-
! стрирована в 1999 г. на юге Русской равнины. Случаи заболевания отмечены
і в Волгоградской и Астраханской областях, Краснодарском крае. Всего в 1999 г.
i в Волгограде и Волгоградской области было зарегистрировано 492 серологиче¬
ски подтвержденных (методом ИФА) случая заболевания, при этом летальность
составила 7,3%.
В 2005 г. в Астраханской области наблюдалась вспышка заболеваемости лихо¬
радкой Западного Нила, когда было выявлено свыше 70 заболевших; смертность
составила 4,1%.
В 2003 г. в США введен обязательный скрининг всех доноров крови методом
ПЦР на наличие генома вируса Западного Нила. Серологические маркеры (выяв¬
ление антител в ИФА) появляются спустя довольно продолжительный период
НВ ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
серологического «окна» и используются только для диагностического мониторил
га. В России скрининг доноров на вирус возбудителя лихорадки Западного Нила
в настоящее время не проводится.
I БАКТЕРИАЛЬНЫЕ ИНФЕКЦИИ
Сифилис
Впервые сообщил о заражении сифилисом при переливании крови в 1915 г
J.F. Fordyce. и это первое известное упоминание о гемотрансмиссивной передаче
инфекционного заболевания. С тех пор проблема трансфузионных инфекций
находится под постоянным вниманием врачей. Установлено, что кровь боль¬
ного заразна в любой стадии заболевания, однако действительная опасность
гемотрансфузионной передачи возбудителя сифилиса возникает в период инку¬
бации, до появления клинических симптомов. Это связано с тем, что сероло¬
гическое обследование позволяет предотвратить гемотрансфузии компонентов
крови от больного сифилисом донора в любой стадии заболевания, за исключе¬
нием инкубационного периода и первых трех недель первичного сифилиса, когда
обычно применяемые скрининговые тесты (реакция микропреципитации, РСК)
еще остаются отрицательными. Этот серонегативный период длится 6-7 нед
от момента заражения. Применение ИФА-тестирования крови позволяет сузить
его до 3 нед, поскольку современные тест-системы выявляют антитела класса IgM
к Treponema pallidum через 3 нед после заражения.
Поскольку до настоящего времени практически нет методов, позволяющих
выявить возбудителя сифилиса в организме в течение первых недель после зара¬
жения (серонегативный период «окна»), важным остается вопрос о жизнеспо¬
собности Гг. pallidum в гемокомпонентах в зависимости от условий их хранения
и концентрации микроорганизмов в единице объема. В исследованиях было
установлено, что Гг. pallidum погибают в эритроцитной массе через 72-120 ч ее
хранения при температуре 40 °С. При содержании 5х104 бактерий в 1 мл инфек-
циозность гемокомпонентов составила 48 ч, при 1,25х106 — 72 ч, а при 2,5х107-
120 ч. Фактически переливание эритроцитной массы, даже полученной от донора,
находящегося в серонегативном периоде, становится возможным через 5 сут после
заготовки.
В последние 3-4 года в России и других странах СНГ резко возросла заболе¬
ваемость сифилисом. По данным Министерства здравоохранения РФ, уровень
заболеваемости с 1989 г. возрос примерно в 70 раз и составил к 1998 г. 264,6 на 100
тыс. населения, к 2003 г. заболеваемость снизилась, но остается на достаточно
высоком уровне. Истинные показатели заболеваемости могут превышать заре¬
гистрированные в 2-3 раза. При этом отмечается увеличение количества случаев
со стертой клинической картиной и бессимптомного течения. В этой связи воз¬
растает значение эффективной диагностики данного заболевания путем массового
обследования населения с помощью высокочувствительных методов. Особую роль
приобретает внедрение высокочувствительных и специфичных диагностических
тест-систем на сифилис в практику работы Службы крови.
В то же время за последние 30 лет в США и европейских странах, а также
в Московском регионе за последние 20 лет не было строго документированных
случаев гемотрансфузионного сифилиса. В связи с этим Ассоциация Банков крови
США (ААВВ) в 1995 г. обратилась с предложением отказаться от тестирования
крови доноров на сифилис, однако FDA решила рассматривать его как суррогат¬
ный тест на ВИЧ и вирусные гепатиты и продолжать тестирование. Однако ряд
исследователей, проведя анализ результатов тестирования свыше 4 млн донации.
ие обнаружили увеличения вирусной безопасности от этого суррогатного тести
рования. Рандомизированные исследования по тестированию в ПЦР ДНК и PH
Treponema pallidum в 150 тромбоконцентратах из крови доноров с положительн
▼
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1087
яоДтвеРжденнЫМИ тестами на трепонемные антитела позволили прийти к заклю¬
чению о полной достоверности отрицательного результата тестирования исследо-
„анных образцов.
Посттрансфузиоиные бактериальные инфекции
0 последние 10-13 лет пристальное внимание в развитых странах уделяют
посттрансфузионным осложнениям, вызванным бактериальной контаминацией
компонентов крови. Бактериальное загрязнение может произойти через кожу
или при переливании гемокомпонентов от донора с бессимптомной бактериемией,
тяжелые осложнения в результате бактериальной контаминации зарегистрирова¬
ны при трансфузии каждой 6-й зараженной дозы. Во Франции за 1994 1998 гг.
зарегистрировано 185 осложнений, вызванных бактериальным загрязнением
гемокомпонентов, из них 18 со смертельным исходом. В литературе упоминаются
случаи передачи грамотрицательных бактерий с эритроцитной массой, в частно¬
сти возбудителей сальмонеллеза.
Бактериальное загрязнение тромбоцитов несет потенциальную опасность
быстрого размножения бактерий благодаря хранению тромбоцитов при темпе¬
ратуре 22 °С. В исследованиях Канадского центра крови установлено, что в сред¬
нем в 1 из 1000 тромбоконцентратов выявляется бактериальное загрязнение.
Риск бактериального сепсиса, ассоциированного с трансфузиями, повышается
с увеличением срока хранения тромбоцитов. Поэтому, несмотря на создание
консервантов, позволяющих сохранять полноценность тромбоцитов в течение
длительного времени, к клиническому применению рекомендуют тромбоциты
со сроком хранения 5 сут и менее. В Великобритании с 1995 по 2002 г. зареги¬
стрировано 26 случаев посттрансфузионных бактериальных инфекций, из них
6-е летальным исходом.
Некоторые исследователи в 1997 г. подсчитали, что при микробной контамина¬
ции хотя бы одной дозы тромбоцитов и при условии, что 1% этих трансфузий вызо¬
вет смерть больного, уровень смертности на 100 000 трансфузий будет превосходить
таковой при передаче ВИЧ. В связи с этим проводятся многочисленные исследо¬
вания по совершенствованию методов бактериологического контроля, внедрение
которых позволило установить частоту бактериальной контаминации тромбоцитов
1 на 1000-3000. В США, Канаде и Великобритании бактериальный сепсис наи¬
более частое посттрансфузионное осложнение с летальным исходом до 23%.
Усиление миграции населения в современном мире приводит также к воз¬
можности трансфузионного заражения неэндемичными патогенами, в частности
возбудителем бабезиоза — Babesia microti, эндемичного для прибрежных районов
северо-востока США, возбудителем болезни Шагаса — Tripanasoma crusi, эндемич¬
ной для Латинской Америки, Brucella abortus bovis - возбудителем бруцеллеза,
эндемичного для Испании, Греции, Мексики, и возбудителями малярии Р. vivax.
P. falciparum, P. malaria и P. ovale, характерными для стран так называемого маля¬
рийного пояса.
ПАРАЗИТАРНЫЕ ИНФЕКЦИИ
Малярия
Заболевания различными формами малярии, связанные с гемотрансфузиями,
наблюдаются преимущественно в эндемичных по малярии районах земного шара
(Замбии, Нигерии, Гвинеи).
Трансфузионная малярия может развиться при попадании в организм реципи¬
ента всего 10-15 возбудителей. Инкубационный период при заражении Р. vivax
и P. falciparum — 4 нед, P. malaria и P. ovale — несколько месяцев.
После выявления заболевания донор может оставаться инфицированным
в течение различного периода в зависимости от вида возбудителя малярии.
ж
е
lOgg ТВйНС«*ЭИОИНАЯ ИММУНОЛОГИЯ
Отмечены случаи рецидивов через 3 года после перенесенной трехдневной ttUO-
рип, вызванной Р. vivax, и через 4 года - после заражения P. ovale. После перенесенной
гроничпкой малярии (возбудитель P. falciparum) рецидивы обычно не наблюдаются
по истечении одного года, хотя в литературе есть указания на отдаленные рецидива
через 5 лет. Р malaria может перепетировать в организме в течение многих лет, и реци¬
див может наступить через 40 лет после перенесенной 4-дневной малярии. В послед-
нме годы малярия шагнула далеко за пределы стран малярийного пояса. В связи
с усилением миірации жителей Средней Азии и Закавказья, где малярия считается
эндемичным заболеванием. в России отмечаются случаи местной передачи малярии
TpiMHOCOMOJ
Возбудитель - Trypanosoma cruzi. В эндемичных районах (странах Южной
Америки) инфицированность доноров колеблется от 5% (в Аргентине) до 65%
(в Боливии), Существуют сообщения о заболевании реципиентов после перелива¬
ния инфицированных гемокомпонентов.
Клинически выраженная симптоматика — лихорадка, генерализованная лимфо-
аденопатия, гепатоспленомегалия - появляется через 1-2 нед после трансфузии.
В зндемичных районах проводят скрининг доноров, и при наличии маркеров
трипаносомоза доноры отстраняются от сдачи крови.
Бібезвоз
Возбудитель Babesia microti (bovis). Размножается в эритроцитах, способен
к выживанию н эритроцитной массе, хранящейся 35 сут при температуре 40 °С,
и сохраняется несколько недель в замороженных эритроцитах.
При переливании зараженной эритроцитной массы развивается либо бес¬
симптомное носительство, либо заболевание протекает в легкой форме, однако
у иммунокомпрометированных больных наблюдается тяжелое течение инфекции,
часто заканчивающееся летальным исходом у спленэктомированных лиц и у боль¬
ных, получающих иммунодепрессанты.
І эндемичных зонах проводят скрининг крови доноров на наличие антител
I Babesia Ыт, и при их обнаружении доноры отстраняются от сдачи крови.
Токсоплазмоз
Возбудитель Toxoplasma gondii - облигатный внутриклеточный паразит с ярко
выраженным тропизмом к лейкоцитам. Инфицированность токсоплазмами
у взрослых колеблется от 15 до 85% в различных эндемичных районах.
В г, было описано несколько случаев посттрансфузионного токсоплазмоза,
наблюдавшегося у больных, получавших лейкоконцентрат. О.В. Баранова (1999)
приводит данные, что в восприимчивости к заражению определенную роль играют
нммуногенетические факторы: доля серопозитивных к токсоплазме лиц группы
АВ (IV) оказалась вдвое выше, чем у обследованных с группой крови О (I).
Профилактика посттрансфузионных паразитозов в неэндемичных районах
сводится к тщательному сбору анамнеза у потенциальных доноров, что служит
достаточно эффективной мерой в отношении многих паразитарных инфекций.
БЕЛКОВЫ! ЧАСТИЦЫ (ЛРИОНЫ)
Первое сообщение о потенциальном риске заражения прионами через
крон появилось в 1996 г. (S. Dtaller). В Англии был выявлен вариант болезни
КреИтцфедьлта ЙКоба (БКЯ) - инфекции, считающейся эквивалентом губчатой
энцефалопатии крупного рогатого скота. Позже, в 1997 г., было установлено-
чкН Ф к вызывается тем же штаммом ириона, что и новый вариант БКЯ.
5Ии заболевании входят в группу хронических инфекций ЦНС человека и
■нютиых І так называемых трансмиссивных спонгиформных энцефалойзтий
PH (Wli 35-82)
**VVHCnOr*HfcC*AJi ЫЭОПАСНОСТЬ ГвЮТМИСОТЭИЙ 10М
25-82. Трансмиссивные спонгиформные эмцефамоаям
Чеммта
Животных
j Спонгиформйая энцефалопатия «рулмого
^^мческая бопвзнь Крейтцфепьдта-Якоба I Почесуха (скрвйп») вам и коз
.сирйнзя болезнь Крейтцфельдта-йкоба 1 Энцефалопатия иеео«
ЧС№КЩ_ [цдаый вариант болезни Крейтцфельдта-Якоба | Хроническое игтппщии
(Н86КЯ)
1 ТМ8Й у домашних оявнет
, Болезнь Герстманна-Штраусслерз-Шейнкарз
Клинические проявления ТСЭ различных форм у человека сходны. Болезнь
возникает, как правило, в среднем и старшем возрасте. Однако для нового вари¬
анта БКЯ, описанного в Великобритании, характерен молодой возраст больных
подростки и молодые люди до 20 лет. Предполагалось, что возбудитель способен
передаваться через кровь. В связи с этим европейские страны, ранее подучавшие
донорскую плазму из Англии, отказались от этого источника препаратов крот
R.K. Sobel в 2001 г. высказал мнение, что в донорской крови содержится опреде¬
ленное количество инфекционного белка. Однако позднее выяснилось, что досто¬
верных подтверждений тому, что возбудитель БКЯ передается через компоненты
крови, недостаточно. В литературе есть лишь скудные сообщения о возможном
заражении БКЯ после гемотрансфузий: у 4 реципиентов после переливания крова,
у больного после введения глобулина, полученного из пула, в который входила
плазма больного с БКЯ. у реципиента печени.
Некоторые исследователи приводили данные об инфекционности ТСЭ для чело¬
века и о том, что они могут быть перенесены при различных лечебяш процедурах,
в частности при введении гормона роста (соматотродива человека), транспланта¬
ции твердой мозговой оболочки, роговицы. В апреле 2002 f. был зарегистрирован
первый случай БКЯ в США у гражданина Британии, Но ни в одном из описанных
случаев нет четких доказательств связи возникшего заболевания £ переднваш&м
гемокомпонентов.
Однако, поскольку степень возможного риска подобного пути заражения доста¬
точно высока, в различных странах проводятся тропи ЭИИММММЙМЩР!
исследования болезни Крейтцфельдта-Якоба в целях определения частоад забо^-
левания. географического распространения, семейных очагов, возможных сваэей
с особенностями пищевого рациона и т.д.
Прнонные болезни крупного рогатого скота, кроме Ве.ютпбрии—ц> ЩЩр
стрированы и в других странах: Швейцарии. Ирландии, Португалии. Франции,
Германии, Нидерландах. Италии. Омане. Канаде. Дании и на Фодкагаапои
островах. Все эти случаи связаны либо с импортом этими строям MfVMNNI
животных, либо с ввозом зараженной мясо-костной муки.
Необходимо отметить одну из особенностей болезней, ШИтШШфШшШ
ми. имеющую принципиальное значение. Структурная близость шфййшшюг©
прионного белка и его нормальной (клеточной) изоформы щвШКШКТ к тему,
что при развитии приемных заболевший в іцжиит людей и имветиш иг обт-
руживаются антитела на инфекционный ириояный белок РтРЧ. хитрый вос¬
принимается иммунной системой как свой. Это обстоииыыяоо загрузит* ЛІІ*'
раториую диагностику заболеваний, их аммуякпермано ■ ■шуиоярофииммф.
Действительно, мз очень большого иоти г г ва испытанных иропоюмррсимх
средств и кммуиомолудзггоров лишь яреамшванк ррчисаоое масло в ямммт
мы заметно скижаяи чувствительность мышей к эштерижитвлі йому: мраэигаиа
Многочисленные попытки применения 5 клинической практике игшбагггримь-
1090 ТИЩ&РУЭИОННАЯ ИММУНОЛОГИЯ
ных препаратов, анаболических стероидов, ацикловира или тишина при болезни
Крейтцфельдта-Якоба заканчивались неудачей. По мнению экспертов Всемирной
организации здравоохранения, наиболее перспективными следует признать под¬
ходы, основанные на результатах молекулярно-биологических исследований
трехмерной структуры прионов. Сегодня известно, что молекула нормального
■ (клеточного) нрионного белка состоит из четырех альфа-спиральных доме¬
нов. стабилизированных междоменными электростатическими взаимодействия¬
ми и S-Sl-связью, в то время как в молекуле его инфекционной изоформы
PrPSc два домена (НЗ и Н4) сохраняют свою первоначальную спирализованную
форму, а два других (Н1 и Н2) превращаются в четыре бета-тяжа, связанных друг
с другом и с доменами НЗ и Н4. Подобное превращение оказывается возмож¬
ным под действием самой молекулы инфекционного прионного белка, а также
в результате порой даже незначительных мутационных изменений в РгР-гене или,
может быть, под воздействием каких-нибудь реакционно-активных (например!
фосфорорганических) соединений. Именно поэтому результатами молекулярно-
биологических исследований структуры прионных белков обосновывают новое
направление дальнейших подходов к терапии прионных болезней. Например,
комбинируя трансгенные модели и технику компьютерного моделирования,
можно рассчитывать на использование определенных антисмысяовых олигону¬
клеотидов, способных «выключать* продукцию РгР, что, правда, может приводить
к непредсказуемым последствиям. Возможно, более успешным будет подход, пред¬
полагающий создание некоего «молекулярного клея*, который смог бы преодо¬
левать гемагоэнцефалический барьер и связываться с гидрофобной сердцевиной
РгРС. Такой химиопрепарат смог бы стабилизировать альфа-спирали в молекуле
белка и. таким образом, эффективно предотвращать его трансформацию в PrPSc.
Альтернативный подход основан на конструировании молекул, которые могут
связывать поверхностное взаимодействие инфекционных PrPSc и, таким обра¬
зом, прекращать (или приостанавливать) их способность к взаимодействию
с молекулами нормального (клеточного) РгРС, прекращая процесс конформащи-
онных изменений последних. Если такое нетоксичное лекарство будет разрабо¬
тано, то оно может быть испытано на мышах со спорадической, наследственной
и инфекционной формами прионных болезней.
В заключение следует еще раз подчеркнуть, что все возрастающий мировой инте¬
рес К прионам И прионным болезням обусловлен В первую очередь тем* что прионы
представляют собой совершенно новый класс инфекционных агентов, открытие
которых без преувеличения можно сравнить по своему значению с открытием
А. Левенгуком микроорганизмов или с открытием Д.И. Ивановским вирусов.
По мнению некоторых исследователей, можно не сомневаться в том, что сегод¬
ня мы знакомимся лишь с верхушкой айсберга, в то время как его главная и пока
скрытая от нас часть, по-видимому, связана с проблемой, которая уже сегодня
обозначена как конформационные болезни, когда конститутивные белки подвер¬
гаются изменениям по размеру и/или форме и из жизненно необходимых могут
превратиться в смертельно опасные, вызывающие тяжелые, а порой и фатальные
последствия. Е.А. Зуев (2002) высказалпредположение, что такие конформацион-
ные белки могут выполнять роль главных регуляторов в организме, в том числе
и такого важнейшего процесса, как ограничение самой жизни.
Таким образом, несмотря на убедительные и значительные успехи Службы
крови и трансфузиологии по профилактике посттрансфузионных вирусных ослож¬
нений, опасность передачи с гемокомпонентами возбудителей инфекционных
заболеваний сохраняется. Инфекционно-вирусная безопасность гемотрансфузии
остается одной из важнейших проблем. Дальнейший прогресс трансфуэишшои
медицины, особенно в части гемотрансфузий, в значительной степени зависит
от того, насколько реципиент будет защищен от инфекционно-вирусных ослож¬
нений.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1091
факторы риска инфекционного заражения реципиентов
гемокомпонентов
Хрансфузионный, артифициальный путь заражения возможен при наличии
Уточника инфекции, восприимчивого человека и проникновения достаточной
возбудителя в организм. Риск передачи при этом зависит от концентрации
возбудителя, его инфицирующей способности, частоты и вероятности контакта
Инфекционным материалом. На передачу возбудителей инфекционных забо¬
леваний влияют три основных фактора: распространенность, инфекционность
Жизнеспособность (табл. 25-83).
Таблица 25-83. Распространенность, инфекционность и жизнеспособность 3 основных гемо-
іШ^ИСЄИВНЬІХ вирусов
Вирус
Распространенность, %
Инфекционность, %
Жизнеспособность
ВИН
5-60
0,3-0,7
15-30 сут
Гепатита В
3,5-10
2-30
При 22-25 *С — 3 мес
В СЗП до 2 лет
Гепатита С
50-60
2-3
При 22-25 *С — Змее
В СЗП до 2 лет
Распространенность возбудителя в популяции - это доля зараженных лиц.
находящихся в активной фазе инфекции.
Инфекционность — это вероятность передачи инфекции вследствие произошед¬
шего контакта с возбудителем. У ВГВ инфекционность в 10 раз выше, чем у ВГС,
и в 100 раз больше, чем у ВИЧ.
ВшЁизнеспособность — это срок, в течение которого возбудитель сохраняется
во внешней среде в активном состоянии. ВИЧ может сохраняться в шприцах
до 4 нед, жизнеспособность ВГВ и ВГС значительно выше — при комнатной тем¬
пературе — до 3 мес, в высушенной или замороженной плазме - годами.
Одним из основополагающих показателей, напрямую влияющих на риск воз¬
никновения посттрансфузионных инфекционных осложнений, считается распро¬
страненность инфекции в популяции и, следовательно, у доноров. Подтверждением
этого служат данные о выявлении маркеров гемотрансмиссивных инфекций
у доноров в различных странах (табл. 25-84).
Таблица 25-84. Частота серопозитивных тестов на вирусные маркеры у доноров в различных странах
Страна, автор
Год
ВГВ
ВГС
ВИЧ
Россия, Саливанов ЕА и соавт.
1999
1.5
1.9
0,02
2000
2,1
0,02
США, Walker Е. 0.
1994
0.9
0,3
0,1
Греция, Korsi Р.
2000
1.0
1.0
0,1
Норвегия. Flesland 0.
1999
0,001
і 0.005
—
Латвия, Nemceva G.
1994
0,5
5,9
—»
2000
0,29
0,85
0.003
Эстония, Tamme J.
1996
0,21
1,06
1997
0,27
0,63
-V.
Таджикистан, Bahovadinov В.В.
1997
5,57
3,14
■ —
Гана, Габон, Candotti D.
2000
— .
-
' т- ' .
Бразилия. Congales Т.
2000
—
0.22
—
Египет, Nosair S.
1998
1.6
4Д
Югославия, Domjanovich V.
1994
—
0.27
■ '1
2000
~
0,13
...... И.М. ■ ■ и
Россия. Пашкова Н.Г.
2004
1.6
I «
0.03
1092 ТМНСФУЗИОННАЯ ИММУНОЛОГИЯ
При анализе показателей инфицированности доноров крови по России отмеча¬
ет тенденция более частого выявления маркеров гепатита С. Однако показатели
обследования доноров в г. Москве, напротив, свидетельствуют, что частота реги¬
страции маркеров гепатита В в 2, а гепатита С в 3 раза ниже средних по России,
во в то же время отмечается рост выявления маркеров ВИЧ. Так, по опубли-
iMMUHwiki данным, в структуре брака в Службе крови РФ в 2003 г. доля крови,
забракованной по ВИЧ, по сравнению с предыдущим годом возросла с 0,8 до 1%,
частота выявляемое™ маркеров ВИЧ среди первичных доноров повысилась с 3,5
на 100 000 донаций в 1999 г. до 8,6 на 100 000 в 2002 г. Аналогичные результаты
о значительно более высокой инфицированности первичных доноров как ВИЧ,
так и гепатитами В и С получены и при обобщении результатов обследования
доноров в Сербии в 1997-2004 гг.. Албании, Македонии, Германии, Италии, стра¬
нах Юго-Восточной Азии и Африки, на Украине.
В доступной литературе нет данных о частоте выявляемое™ маркеров ГТИ
среди различных контингентов доноров в целом по России, но, судя по резуль¬
татам исследований отдельных авторов, прослеживается та же тенденция. Так,
разница показателей в частоте выявления HBsAg и анти-НсУ среди первичных
и повторных доноров в 1997-2000 гг. колебалась от 2,5 до 20 раз и от 5,8 до 15,1
раза соответственно.
Многочисленные исследования, проведенные в странах Западной Европы, США
и Японии, подтверждают значительное снижение риска трансфузионной передачи
гепатитов и ВИЧ. Тем не менее остаточный (резидуальный) риск передачи ГТИ
сохраняется, что обусловлено следующими причинами:
я ошибками при инфекционной сертификации крови (лабораторными ошиб¬
ками);
• тестированием крови донора, находящегося в серонегативном периоде - так
называемом периоде «окна».
Первая причина связана с техническими ошибками, допускаемыми медпер¬
соналом: риск пропустить антитела к ВИЧ составляет 6:100 000 000, a HBsAg -
8:10 000 000 сертифицированных контейнеров компонентов крови.
Вторая причина - основной фактор посттрансфузионного заражения — сероне-
гативность донора в инкубационный период заболевания, когда маркеры в крови
донора не выявляются имеющимися методами тестирования крови.
Продолжительность серонегативного периода — фазы «окна» — варьирует
у различных возбудителей инфекций (табл. 25-85).
Таблица 25-85. Продолжительность серонегативного периода при заражении возбудителями
инфекционных заболеваний
Возбудитель
Серонегативный период
(в среднем)
Диапазон продолжительности
серонегативного периода
ВИЧ
25
6-40
Гепатита В
60
30-80
Гепатита С
85
55-190
Сифилиса
20
10-60
ЦМВ
30
15-60
Т-клеточной лимфомы
50
35-70
По данным C.F. Moor (1998), количество кроводач, произведенных в пери¬
од сероконверсии доноров, инфицированных вирусом гепатита В, составляет
25-30%. Распространенность маркеров инфекционных заболеваний у доноров
московской популяции представлена в табл. 25-86.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1083
25-86. Распространенность маркеров инфекционных заболеваний у доноров
ГОД
Маркеры
ВИЧ
гепатита В
гепатита С
сифилиса
0.01
2.27
0.73
і.»
0
1,39
1,82
1.12
jqpl
0,02
1,41
1,85
1.57
2000
0,04
1.42
2.15
1.55
2001
0,05
1,32
2,39
2.03
9002
0,06
2.25
2,72
2.31
гооз
0,06
1,83
3,35
2.67
7004
0,05
1.66
3,21
3.15
2005
0,043
1,64
3,23
2,64
2006
0,03
1,63
3,30
2.41
2007
0,04
1,64
2,23
1,87 |
Вероятность риска инфицирования реципиента при современных рутинных
методах лабораторного обследования составляет:
| вирусом иммунодефицита — 1:700 ООО кроводач (от 1:320 ООО до 1:3 300 ООО);
і вирусом гепатита С — 1:220 ООО кроводач (от 1:100 ООО до 1:588 ООО):
• вирусом гепатита В — 1:118 ООО кроводач (от 1:40 ООО до 1:357 ООО).
В связи с наличием серонегативного «окна» для оценки потенциального риска
заражения был проведен анализ, в основу которого положена частота обнаруже¬
ния сероконверсий для каждого из вирусов, выявленных у постоянных доноров,
а также установленная продолжительность соответствующего серонегативнош
периода. Теоретически рассчитанный риск заражения составил для ВИЧ 2%,
для гепатита С — 9,7%, гепатита В — 15%. Однако важно отличать теоретический
риск от реального клинического риска развития заболевания после трансфузии
зараженных компонентов крови. Он составляет для ВИЧ - 100%. для гепати¬
та С — 75%, для гепатита В — 5%.
По данным ААВВ (American Association of Blood Banks), с внедрением NAT-
тестирования сокращаются период серонегативного «окна» и риск постгрансфу-
зионного заражения при ВИЧ-инфекции до 1 на 1,9 млн трансфузий, гепатите С -
до 1 на 500 000 или 1 на 1 млн трансфузий.
Риск инфицирования ГТИ прямо пропорционален количеству получаемых
гемотрансфузий. В связи с этим особого внимания и разработки специальных
программ профилактики посттрансфузионных осложнений требуют реципиенты
множественных и постоянных трансфузий, к которым относятся гематологиче¬
ские больные, больные гемофилией, некоторые хирургические больные и т.д.
Распространенность маркеров гемотрансмиссивных инфекций у пациентов пред¬
ставлена в табл. 25-87.
Инфицированность амбулаторных больных ВИЧ более чем в 5 раз превышает
таковую у больных клинических отделений; это объясняется тем обстоятельством,
что инфицированные ВИЧ, выявляемые при предварительном амбулаторной
обследовании, как правило, госпитализируются в специализированную клюшку.
Среди амбулаторных больных, по сравнению со стационарными, распростра¬
ненность гепатита С в среднем несколько выше (4.78 и 2.63% соответственно).
Практически не отмечается различий у данных категорий больных в ннфицнро-
ванности гепатитом В (1,73 и 1,50%) и сифилисом (1.33 и 1.41% соответственно).
Профилактика инфекционных осложнений - важнейшая задача при хирурги¬
ческих вмешательствах. Реципиенты должны быть обследованы, помимо обяза¬
тельных инфекций, на цитомегаловирус, вирус Эпштейна Барр, вирус опоясы¬
вающего герпеса. Toxoplasma gondii.
1094 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Таблица 25-67. Распространенность маркеров гемотрансмиссивных инфекций у амбулаторных
І стационарных хирургических больных
Маркеры
Гоа
ВИЧ
гепатита В
renai
гита С
сифилиса
1 *
і- —
I С
А
С
А
С
А
С
И997
0,18
0
1,15
0,74
3,88
0,03
0,13
0,18
(1998
0,11
0
1.84
0,53
3,27
1,31
0,53
0,15
1999
0,12
0
1,86
0,93
3,72
1,91
0,82
0,51
12000
0.19
0
1.78
0,96
2,95
1,90
0,80
0,59
2001
0,59
0,08
2,71
0,33
5,59
4,06
0.77
0,58
2002
0,15
0,19
1,87
1.91
6,49
4,78
1,45
0,76
2003
0,04
0,17
1,68
2,48
7,69
3,85
0,98
1,27
2004
0.21
0,10
1.41
2,06
5,66
2,60
1,77
1,78
2005
0,02
0,04
1,36
1,83
4,39
2,47
1,53
1,04
2006
0,01
0.09
1,39
1,60
4,04
2,22
1,6
1,53
2007
0,53
0,11
0,87
1,41
4,07
2,41
1,74
2,11
Примечание: А - амбулаторные, С - стационарные больные.
У значительного количества кардиохирургических больных при травмирова¬
нии миокарда возможна реактивация латентной вирусной инфекции, в частности
у 30% первично серонегативных и 5% серопозитивных больных наблюдается уве¬
личение титра антител к вирусу Эпштейна-Барр не менее чем в 4 раза. При этом
прослеживается зависимость заражения от количества гемотрансфузий: у полу¬
чивших от 1 до 12 переливаний сероконверсия проявлялась у 6,6% больных,
при более чем 12 гемотрансфузиях — у 16,3%.
Для снижения риска посттрансфузионных инфекционных осложнений требу¬
ются постоянный мониторинг уровня инфицированности населения, в том числе
донорского контингента в конкретных регионах, анализ частоты и характера пост¬
трансфузионных осложнений, и в первую очередь повышение качества лаборатор¬
ного тестирования донорской крови.
Тестирование крови на маркеры
гемотрансмиссивных инфекций
Эволюция методов исследования крови доноров, приведенная в табл. 25-88,
наглядно отражает динамику заболеваемости посттрансфузионными гепатитами
(ПТГ) в мире.
Таблица 25-88. Эволюция методов тестирования крови доноров
I960 І
1972-1974 гг.
1987 г.
1994 г.
2001 г.
Билирубин
Сифилис
Билирубин
Сифилис
НВ,Ад
Сифилис
HBsAg
Анти-ВИЧ-1, -2
АЛТ
Сифилис
HBsAg
Анти-ВИЧ-1, -2
Анти-ВГС
АЛТ
Сифилис
HbjAg
Анти-ВИЧ-1. -2, Гр324
Анти-ВГС АТ
АЛТ
Распространенность ІЇГГ
,
ЗОН ) 10%
1% [ 0.6%
0,3% —J
Значительное снижение заболеваемости ПТГ определялось внедрением все
более чувствительных методов диагностики (табл. 25-89).
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗМЙ 1095
доица 25-89. Чувствительность различных методов тестирования
РПГ
ВИЭФ
РПГА
ИФА
ПЦР
80 тыс. нг/мл
1000 нг/мл
5-20 иг/мл
0,1—1 нг/мл
10 ммоль НК
Так. внедрение в практику Службы крови для тестирования HBsAg реакции пас-
сИВНой гемагглютинации (РПГА, чувствительность 5-20 нг/мл), а затем метода
0фА (ОД нг/мл) позволило уменьшить количество случаев ГТТГ с 30 до 10%.
Внедрение суррогатного теста АЛТ при скрининге донорской крови, а затем
и специфического теста для определения анти-ВГС-антител уменьшило частоту
выявления ГТТГ до 1 и 0,6% соответственно. Внедрение NAT-технологий позволя¬
ет значительно сократить период серонегативного «окна», в частности для выяв¬
ления ВГС примерно на 70% (с 80 до 25 сут); для ВИЧ-1 - на 50% (с 25 до 11-12
сут). Инфекционная безопасность гемотрансфузий обеспечивается рядом меро¬
приятий, основными считаются;
• отбор доноров крови;
• сертификация крови на маркеры гемотрансмиссивных инфекций;
• карантинизация плазмы;
• инактивация компонентов и препаратов крови.
В большинстве стран мира первые два мероприятия считаются обязательны¬
ми, в странах с развитой системой Службы крови внедрен или внедряется метод
карантинизации СЗП. В отдельных центрах крови используется ряд современных
высокотехнологичных и эффективных методов иннактивации (к сожалению, пока
недоступных для большинства учреждений Службы крови).
В настоящее время для тестирования донорской крови используют специфиче¬
ские и неспецифические маркеры. При использовании специфических тестов воз¬
будитель в образцах крови определяется либо прямыми (выявление антигенов),
либо косвенными (выявление антител) методами. Но поскольку кровь доноров
не представляется возможным тестировать на все потенциальные гемотранс-
миссивные инфекции ввиду значительного количества возбудителей заболева¬
ний, передающихся гемотрансмиссивным путем, актуальным становится вопрос
об интегральном маркере, применение которого при скрининге донорской крови
позволило бы снизить риск инфицирования при гемотрансфузиях.
СУРРОГАТНЫЕ МАРКЕРЫ ВОЗБУДИТЕЛЕЙ ГЕМОТРАНСМИССИВНЫХ ИНФЕКЦИЙ
Аланинаминотрансфераза (АЛТ)
Традиционно суррогатным маркером, позволяющим в большей степени судить
о состоянии печени, чем всего организма, считается определение уровня актив¬
ности аланинаминотрансферазы (АЛТ) в сыворотке крови. АЛТ - внутриклеточ¬
ный фермент, участвующий в обмене аминокислот и углеводов и содержащийся
в цитоплазме гепатоцитов. Показатель нормы варьирует в зависимости от мето¬
да: при использовании оптимизированного оптического теста - до 30 МЕ/л
при 30 °С или до 40 МЕ/л при 37 “С, при применении метода Райтмана-
Френкеля — 0,1-0,68 мкмоль/ч. Верхний предельный показатель нормы состав¬
ляет 30-40 ЕД/л. Уровень от 100 до 200 ЕД/л обычно ассоциируется с гепати¬
том С. Однако необходимо отметить, что сведения о прямой зависимости между
Уровнем АЛТ и активностью патологического процесса в печени противоречивы.
После открытия вируса гепатита С и создания специфических тест-систем обяза¬
тельное определение АЛТ при скрининге доноров в США и Европейском союзе
было отменено, но во многих странах, в том числе в России, несмотря на ame-
ное применение специфических тестов на гепатит С. включая ПЦР (например.
в Германии ПЦР считается обязательной при исследовании крови доноров), его
продолжают использовать, хотя многие исследователи оспаривают его эффектив¬
ность. В России в настоящее время обсуждается вопрос о необходимости опре деле-
1096 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
кия АЛТ, и по этому поводу мнения исследователей расходятся, поскольку данные
о взаимосвязи уровня в сыворотке АЛТ и РНК-вируса неоднозначны.
В России определение уровня АЛТ с 1987 г. остается обязательным и регла¬
ментируется приказом М3 РФ от 14.09.01 г. №364 «Об утверждении порядка
медицинского обследования доноров крови и ее компонентов*. Повышение
активности АЛТ менее чем в 2 раза служит основанием для отвода от донорства
на 3 мес с последующим контрольным обследованием. При сохранении повышен¬
ной активности АЛТ или увеличении АЛТ более чем в 2 раза следует отстранение
от донорства и направление на обследование. В структуре брака донорской крови
доля активности АЛТ достигает 20,4%. По данным некоторых авторов, ежегодно
в России около 30 тыс. доз донорской крови утилизируется как относительный
брак в результате повышения активности АЛТ у доноров.
Вопрос об исследовании донорской крови на активность фермента АЛТ играет
важную роль по крайней мере из-за двух аспектов: диагностической значимости
скрининга активности АЛТ в обеспечении уровня безопасности гемотрансфузи-
онной терапии и доли в общем объеме затрат, определяемых стоимостью самого
исследования, утилизированных компонентов и препаратов крови, вследствие
определения повышенного уровня АЛТ.
Несмотря на то что в связи с внедрением в лабораторную практику высоко¬
специфичных тестов в ряде стран при обследовании доноров крови отказались
от этого лабораторного показателя, вопрос о его значимости для обеспечения
безопасности гемотрансфузий остался спорным. В проведенных исследованиях
обобщили данные о диагностической значимости активности АЛТ в комплексном
тестировании донорской крови и оценке связи между повышением АЛТ и декре¬
тированными гемотранмиссивными инфекциями.
Среди 51 167 первично обследованных лиц (мужчин — 36 037, женщин -
15130) уровень АЛТ оказался повышенным у 4146 человек (8,1%), из них
без гемотрансмиссивных инфекций у 3710 (7,25%). При обследовании 42 780
доноров (мужчин - 29 506, женщин — 13 274) в 2001-2004 гг., сдавших кровь
более одного раза, повышение активности АЛТ было выявлено у 2293 человек
(5,36%), из них 2052 (4,8%) имели только повышенный уровень АЛТ, а 241 чело¬
век (0,56%) - в сочетании со специфическими маркерами гемотрансмиссивных
инфекций. Без увеличения уровня активности АЛТ специфические маркеры гемо¬
трансмиссивных инфекций обнаружены у 442 человек (1,03%). У 40 045 доноров
(93,6%) нарушений в состоянии здоровья, оцененных на основании общеприня¬
тых клинико-лабораторных данных, не зарегистрировано (табл. 25-90).
Таблица 25-90. Частота выявления маркеров гемотрансмиссивных инфекций у доноров крови
Показатель
Частота выявления (л=42 780)
абс.
%
Р
Всего обследовано
42 780
100
—
Доноры с АЛТ >N
2052
4,8
4,60-5,00
Доноры с АЛТ >N и маркеры гемотрансмиссивных инфекций
241
0,56
0,50-0,64
Доноры с маркерами гемотрансмиссивных инфекций
442
1,03
0,94-1,13
Доноры без маркеров гемотрансмиссивных инфекций
40 045
93,61
93,37-93,83
Результаты определения частоты выявления маркеров гемотрансмиссивных
инфекций среди доноров с нормальным (группа 1) и повышенным (группа 2)
уровнем активности АЛТ приведены в табл 25-91.
Среди доноров с повышенным уровнем АЛТ частота обнаружения инфекци¬
онных маркеров составила 10,5%, а доля лиц с антителами к вирусу гепатита С -
8,6% (81,3% количества доноров с повышенным АЛТ и инфекционными маркера¬
ми), что несколько ниже, чем по данным других авторов: среди той же категории
доноров были выявлены анти-ВГС-аититела у 10-15% обследованных.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРА
1897
а 25-91. Частота выявления специфических инфекционных маркеров среди ДО
(группа 1) и повышенным (группа 2) уровнем активности АЛТ
Группа 1 (№>40481)
Группа 2(№>2293)
Маркер
абс.
%
9
абс. і
%
f
ВЙЧ-Ї7-2 + АГ
13
0.03
0,02-0,05
6
0,26
0,12-8,57
0
97
0,24
0,204)3
32
1,40
0,99-1.96
-ЯГС
174
0,43
0,37-0.50
196
8,55
7.47-9.7*
-ВТ
173
0,43
0,37-0,50
27
1,18
0,81-1,71
в*
442
1,09
1,00-1,20
241
10,51
9,32-11.83
—
, jjg является арифметической суммой вышеперечисленных инфекционных маркеров, поскольку
«части доноров зарегистрировано сочетание 2 и более инфекций
Среди доноров с повышенным уровнем активности АЛТ доля лиц с марке¬
рами гемотрансмиссивных инфекций увеличена в 9.6 раза. т.е. обнаружива¬
лась положительная связь между наличием АЛТ и выявлением инфекционных
маркеров (R=0,17). Связь слабая, но, несомненно, достоверная. Более сильная
связь установлена между уровнем активности АЛТ и маркерами гепатита С:
среди доноров 2-й группы доля лиц с антителами к вирусу гепатита С почти
в 20 раз выше, чем в 1-й группе. Связь положительная (R=0;2) и достоверная
(х21667,97; р <0,001). Между повышением активности АЛТ и выявлением HB^Ag
связь менее выраженная, слабая (R=0,05), но, несомненно, достоверная (хг 96,94;
1 <0,01). Между повышением AJIT и специфическими маркерами других гемо¬
трансмиссивных инфекций связь также положительная, но еще менее выраженная,
хотя и достоверная (для АЛТ и ВИЧ — R=0,02, х2 25,76; р <0.01. АЛТ и сифилиса
R= 0,02, х2 26,25; р <0,01).
Полная и прямая зависимость между повышением активности АЛТ в крови
и наличием инфекции не обнаружена: инфекционные маркеры выявляются
в группе доноров как с повышенным, так и нормальным уровнем АЛТ. хотя
и в значительно меньшем проценте. Но риск наличия инфицированных среди
доноров с повышенным уровнем активности АЛТ во всех случаях достоверно
выше, чем в группе сравнения (р <0,001).
Для оценки диагностического значения уровня АЛТ через 3-5 мес были повтор¬
но обследованы 995 доноров из 2052 с первично повышенным уровнем АЛ Г
(табл. 25-92).
Таблица 25-92. Частота выявления специфических инфекционных маркеров среди повторно
обследованных доноров с повышенным уровнем активности АЛТ
Маркер
Частота выявления (л=995)
абс.
%
А
Анти-ВИЧ-1. -2 + АГ
0
0
0
НВ,Ад
9
0.90
0.48-1,72
Анти-ВГС
58
5,83
4,51-7,49
Амти-БТ*
3
0.3
0,10-0.89
Всего
64
6,43
5,04-8,17
* Уровень АЛТ остался повышенным (50 МЕ/л) только у одного донора.
Среди повторно обследованных доноров у 174 (17.48%) уровень АЛТ остался
повышенным. Из них у 112 человек (11,3%) увеличение активности АЛТ не было
связано с гемотрансмиссивными инфекциями, а у 62 (6,23%) выявлено сочетание
повышенного уровня АЛТ и инфекционных маркеров (доля гепатита С составила
5,83%, или 93,58% всех лиц с повышенной активностью АЛТ и инфекционными
МапкрпямиХ НопАгплимо отметить, что уровень активности АЛТ у всех 62 ШВІ
1098 трансфузионная иммунология
ров как при первичном, так и повторном обследовании был выше 60 МЕ/л (от 64
до 180 МЕ/л. в среднем 108,98±3,43 МЕ/л).
Таким образом, среди доноров крови, отведенных от кроводачи на основании
повышения уровня активности АЛТ. и повторно обследованных через 3-5 мес
у 6,43% были выявлены маркеры инфекций. При этом частота выявления гепати¬
та С в 13,6, а гепатита В в 3,7 раза превышала аналогичный показатель среди доно¬
ров с нормальным уровнем активности АЛТ. Специфические маркеры гепатитов
выявлены у лиц. у которых уровень активности АЛТ при первичном обследовании
был выше 60 МЕ/л. При первичном обследовании почти 6,5% доноров с повышен¬
ным уровнем АЛТ, очевидно, находились в серонегативном периоде заболевания,
и увеличение АЛТ стало единственным барьерным маркером.
Выполненные исследования и анализ результатов позволяют утверждать,
что в настоящее время в сложившихся социально-экономических условиях целе¬
сообразно оставить определение уровня активности АЛТ в качестве маркера, отра¬
жающего функциональное состояние печени, в арсенале лабораторного обследо¬
вания доноров крови.
Неоптерин
Объективная оценка состояния здоровья потенциального донора, т.е. наличия
или отсутствия других (неинфекционных) заболеваний без яркой клинической
картины, не выявляющихся при общепринятом в Службе крови терапевтическом
обследовании доноров, чрезвычайно актуальна. В этом отношении перспективным
оказывается определение неспецифического белка неоптерина (НП), повышение
уровня которого наблюдается при различных заболеваниях и предшествует выяв¬
лению инфекционных маркеров и клиническим проявлениям. В мировой практике
существует опыт использования НП; впервые его выделили H. Rembold и соавт.
в 1964 г. из личинок и маточного молочка пчел. В дальнейших исследованиях были
определены химическая структура (рис. 25-7) и роль при активации клеточного
иммунитета этого маркера при заготовке крови в системе Службы крови Австрии.
О ОН ОН
HN
ОН
h2n
Рис. 28-7. Химическая структура неоптерина
НП относится к птеридинам, которые представляют собой гетерогенную группу
веществ, производных гуанозинтрифосфата. НП — промежуточный продукт мета¬
болизма гуанозинтрифосфата и биоптерина (рис. 25-8).
НП продуцируется в организме макрофагами при их активации интерфероном у
или фактором некроза опухоли-а (рис. 25-9) и обнаруживается в плазме крови
или моче человека при различных заболеваниях.
Определение уровня НП считается одним из важных лабораторных тестов
для диагностики заболеваний, связанных с активацией клеточного звена иммуни¬
тета. В исследованиях in vitro с участием Т-лимфоцитов и культуры макрофагов
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1099
Концентрация НП в крови считается интегральным маркером, отражающим
^местное действие различных цитокинов на популяцию моноцитов макрофа¬
ге стимулированных интерфероном у (ИФ у). Уровень неоптерина в крови н био-
Г°піческих жидкостях повышается при многих патологических состояниях. НГ1
?Итдстся также одним из ранних биохимических маркеров реакции отторжения
Трансплантата (табл. 25-93).
Рис. 25-8. Биосинтез неоптерина
Острофазный
Рис. 25-9. Секреция неоптерина макрофагами при клеточном иммунном ответе
Данные литературы о возможностях использования концентрации НП в качестве
клинико-лабораторного параметра позволяют сделать заключение, что повышение
Ш концентрации в плазме/сыворотке крови — наиболее адекватный клинико¬
лабораторный маркер активации клеточного иммунитета. Важно, что тест на нео-
птерин позволяет выявить лиц на ранних стадиях вирусных (ВИЧ, гепатиты. ЦМВ,
геРпес и др.), бактериальных, паразитарных инфекций, предшествующих серокон-
Версии, при аутоиммунных, онкологических и сердечно-сосудистых заболеваниях:
ИБС, атеросклерозе аорты, сонных и коронарных артерий, периферических арте¬
рии, наличие которых считается фактором отвода от донорства,
В целях определения возможности использования уровня неоптерина (НП) в каче-
CTB* маркера для оценки состояния здоровья доноров для исключения всех лиц
с любой патологией, вызывающей стимуляцию клеточного иммунитета, был ярд»
Лен анализ результатов обследования 1298 доноров, из них 788 доноров крови (460
**У*чин, средний возраст 35-45 лет. и 328 женщин, средний возраст35-45 лет) н 510
Доноров плазмофереза (276 мужчин, средний возраст 30-40 лет. и 234 женщины,
сРедний возраст 35-40 лет). Перед кроводачей все доноры после осмотра терапевта
надписывали свидетельство об отсутствии у них инфекционной или иной патологии.
i» ■. m
Повышается 8 $тмв стадии, используют
диагностики с нваутоям-
иунныы сахарным диабетом
|Корр*ліФУвт со стадией и активностью процесса
Рюид ум»—ити при обострении процесса
Каррмирц» с активностью процесса
Предиктор наражання клапанов Г
Картирует с тяжестью и активностью процесса
Коррелирует с рентгенологическими параметрами
и ІИ9ИИ—хисмшв симптомами воспаления ■
Прарипар летального исхода, не зависит от стадии
s£wS
Резка маиичиаано г.рн всирти стадиях
Йиррмирурт со стадиен заболевания
figgfe іЦРЯиаМ ШЯЙК9
Коррелирует со стадиен заболевания
ПИМианаенм анмимм мм, мм ачрмм
Коррелирует со стадией ааРамиаим
Яимири у ТІМимаиі. мм—aw»—i|
Коррелирует м піди*, уммгямм стинали
—яеюнршчмм драиагнгама j
Дщаимр иитапаиярмаї—
Не мкн «* спин» мимиа» у лМН Іам**
(^ННІМЙІМІ МмМм
SS*дг
[«ачммаиш ЧИ іцм ІМЦі—и М <мм
“
Т доноров определяя» мармум гпасяуаипаасшмт шфині Ярмсмь МІ
v НП Уровень НП водм 10 миі/мі <JJ т ч») fmnmrnn ш ттшттшшА
f доноров, у которых отмечен»• аояммнмм» урчим Ш і ІДО, § шттщтшт
4-24 жд • целях выявления ітфешномимч. шгшшштж і цгнише afr —
«І мріделш мриры ііуусті шині 4,1 C RІІЩ ЦМІ. ЇМ, Njja»
простого герпеса, краснухи, імамами, нмсиаянмаи ЩШШШЩтт фам«м«
тшаина.
Пі ні іпігіпіг уровня 11П -піт а ТТ ‘Тни ; г" r ти п пгтптге щипп мі щц
Шфкщюмимх маркеро» циЛнапиихі | 1.14 а t>t% Щчиауам •МИвнсмимж
(Я&л. 25-94}
Таблица 25 94, Ітц/фг+ат ирфаииинаш
трансфертны у доносов
Сирними
Гепатита j
Гепатита С
m
,-шЯ
АКТ » аииниричаши иямауи
Ж
ш.з
ІЖ
Гцлиая иоещгигграшея НЙ ара «ftrl .. ..і-,... ,п, »
ьл5.г4,.и миш/мя v 90% жшфм урвищ яаммрш щЩ
5л 43 нмоль ил. У 57 «гнэаг* (4,4%| уриаиі» минут Ш
•» В.Ь ит 102J мипт, кті рсуцвкм ЙМЖ
Сшшсптсш» тягшшшп ішлйчнй шш*щ шммаимам» |
*н* вылядешэ ишиаиааиммау
4 ааиагнмогтм от аоаа < тибд. ХМ5)
Дмапрпи, у метрш вааи ишгимн ааимаиии ^
мам (V2H). в» аш ауи’ма 2Э а нашим 14 «ми *ЯТ^1
«У ааа 4в а а і мани Лі овиниааи мри 1~* «иг
«ранен
ЭД
■
іт
1102 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Таблица 25-95. Результаты определения концентрации неоптерина у разных категорий доноров
Контингент
доноры крови
доноры плазмафереза
Всего
І НП, нмоль/л
I мужчины
(д-460)
женщины
(л-328)
мужчины
(№276)
женщины
(№234)
(№1298)
1 абс.
%
абс.
%
абс.
%
абс.
%
абс.
%
0-2
22
4,78
10
3,05
12
4,35
11
4,70
55
4,24
3-4
134
29,13
72
21,95
74
26,82
54
23,08
334
25,73
5-6
188
40,87
148
45,12
104
37,68
100
42,74
540
41,60
7-0
96
20,9
82
25,00
76
27,54
58
24,79
311
23,96
10-25
9
1,96
8
2,44
6
2,17
4
1,71
27
2,08
26-45
6
1,30
4
1,22
2
0,72
5
2,14
17
1,31
46-100
4
0,87
4
1,22
2
0,72
1
0,43
11
0,85
<100
1
0,22
0
0
0
0
1
0,43
2
0,15
[Всего
460
100
328
100
276
100
234
100
1298
100
Уровень НП остался повышенным у 8 человек (19,1%). Однако показатели
концентрации НП оказались ниже, чем при первичном определении, и колебались
в пределах от 11,9 до 42,3 нмоль/мл (в среднем 23,6±15,0 нмоль/мл).
Тестирование сывороток доноров с первично повышенным уровнем неопте¬
рина на широкий спектр маркеров инфекционных, аутоиммунных и системных
заболеваний показало, что у 76,2% обследованных была выявлена инфекционная
(у 50%) или иная патология (табл. 25-96).
Таблица 25-96. Результаты повторного (через 1-7 мес) обследования доноров с исходно повы¬
шенным уровнем неоптерина в сыворотке
Маркеры
Контингент
Всего
доноры крови
доноры плазмафереза
мужчины
женщины
мужчины
женщины
абс.
%
ВИЧ
0
0
0
0
0
0
Гепатита В
0
0
0
0
0
0
Гепатита С
0
0
1
0
1
2,4
Гепатита А
1
0
0
0
1
2,4
Гепатита Е
0
0
0
0
0
■ft
Гепатита D
0
0
0
0
0
0
Гепатита G
0
0
0
0
0
0
ЦМВ
3
2
1
1
7
16,7
Вируса краснухи
1
0
1
0
2
4,7
Эпштейна-Барр
0
0
0
0
0
0
Хламидиоза
2
2
0
1
5
11,9
Токсоллаэмоза
0
1
0
1
2
2,4
Герпеса
1
0
1
1 ■
3
7,1
Ревматоидного фактора
0
1
1
0
2
4,7
Глиадина
1
0
0
1
2
4,7
Других
2
2
2
1
7
16,7
В обнаружено
4
3
1
2
10
23,8
Зсего
15
11
8
8
42
100
У двух доноров были выявлены маркеры гепатитов А и С. При этом у одного
донора, обследованного через 4 нед, были выявлены антитела к вирусу гепатита
А, относящиеся к иммуноглобулинам класса G.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1103
Поскольку донор не был зарегистрирован как больной гепатитом А и при опро-
отрицал факт заболевания, можно предположить, что инфекция протекала
бессимптомной, скрытой форме, и анти-ВГА класса IgG — это следовые анти-
НИ свидетельствующие о прошлом заражении.
у второго донора анти-ВГС-антитела были выявлены через 6,5 мес при обсле¬
довании после донации крови. Из 7 доноров с антителами к ЦМВ у одного были
выявлены антитела, относящиеся к иммуноглобулинам класса IgM, у всех 5 доно-
00 антитела к хламидиям, относились к иммуноглобулинам класса IgG, так же
как антитела к вирусу простого герпеса и токсоплазме.
у доноров с первично повышенным уровнем АЛТ (72 донора) при повтор¬
ных обследованиях заболевания той или иной этиологии выявлены у 30,6%
(табл. 25-97).
Таблица 25-97. Результаты повторного обследования (через 1-7 мес) доноров с исходно повы¬
шенным уровнем активности аланинаминотрансферазы в сыворотке
- '
Контингент
Маркеры
доноры крови
доноры плазмаферез*
DCCI и
мужчины
женщины
мужчины
женщины
Л
%
ВИЧ
0
0
0
0
0
0
Гепатита В
0
0
0
0
0
0
Гепатита С
1
0
0
0
1
1,4
Гепатита А
0
0
0
0
0
0
Гепатита Е
0
0
0
0
0
0
Гепатита D
0
0
0
0
0
0
Гепатита G
0
0
0
0
0
0
ЦМВ
2
1
2
1
6
8,3
Вируса краснухи
0
0
0
0
0
0
Эпштейна-Барр
0
0
0
0
0
0
Хламидиоза
0
1
1
1
3
4.2
Токсоплазмоза
0
1
0
0
1
1.4
Герпеса
2
1
1
0
4
2,8
Ревматоидного фактора
2
0
1
1
4
5,6
Глиадина
0
0
0
0
0
0
Других
0
0
3
0
3
4,2
Не обнаружено
25
12
8
5
50
69.5
Всего
I 32
16
16
8
72
100
В большинстве случаев повышение АЛТ было обусловлено нарушением функ¬
ции печени, связанной или с особенностями питания (жирная пища), или с алко¬
гольной интоксикацией, и наблюдалось чаще у мужчин. Повышение же уровня
неоптерина не коррелировало с патологией печени, вызванной злоупотреблением
алкоголем.
Таким образом, полученные результаты позволяют прийти к заключению,
что неоптерин можно считать более специфичным маркером, чем АЛТ, и его
определение можно применять в качестве дополнительного критерия при обсле¬
довании доноров. Результаты исследования и данные литературы свидетельствуют
о возможности отстранения от сдачи крови потенциально опасных лиц с повы¬
шенным уровнем неоптерина на ранних сроках заражения вирусными инфекция¬
ми или с иной патологией (аутоиммунными, системными заболеваниями, ново¬
образованиями), что повысит безопасность гемотрансфузий для реципиентов.
Использование этого маркера позволит также снизить количество относительного
брака, что экономически оправданно в условиях дефицита донорских кадров.
g|jjj|g ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
I Специфические маркеры возбудителей гемотрансмиссивных инфекций
Для выявления специфических маркеров возбудителей гемотрансмиссивных
инфекций, регламентированных приказами М3 РФ, при обследовании донорской
крови ведущим методом лабораторной диагностики остается твердофазный ИФА,
который обладает несомненными преимуществами, такими как высокие чувстви¬
тельность (0.1-0.05 нг/мл) и специфичность, инструментальный учет результатов,
возможность автоматизации на всех этапах исследования.
При скрининговых исследованиях в ИФА актуальной остается проблема лож¬
ноположительных и ложноотрицательных результатов.
Ложноотрицательные результаты зависят от чувствительности тест-систем
в области перехода от серонегативности к серопозитивности (т.е. в области
♦окна*), когда уровень потенциальной опасности инфицирования наиболее
высок. Ложноотрицательные результаты достаточно редки, в США, например,
частота ложнонегативных результатов и, следовательно, риск передачи от одного
донора составляет 1 на 500 000 для ВИЧ, 1 на 100 000 для гепатита С и 1 на 63 ООО
для гепатита В. Этот риск возрастает многократно при пулировании плазмы и при¬
готовлении препаратов.
Ложноположительные результаты обусловлены неспецифическими реакци¬
ями. которые могут быть вызваны различными причинами: перекрестными реак¬
циями между антителами и антигенами, гидрофобными связями между иммун¬
ными комплексами и твердой фазой или взаимодействием белков сыворотки
и конъюгатов с твердой фазой.
В настоящее время ложноположительные реакции при скрининговых иссле¬
дованиях на ВИЧ, гепатиты В и С, которые не подтверждаются на последующих
этапах исследований, достигают 10-30%. По мнению М.Р. Busch, доля ложнопо¬
ложительных результатов должна быть в пределах 1%, а причинами такого высо¬
кого уровня неподтверждаемых результатов могут быть, с одной стороны, неком¬
петентность персонала, а с другой, неудовлетворительное качество применяемых
тест-систем. К ложноположительным относятся образцы крови, положительные
в ИФА. но показавшие отрицательный или неопределенный результат в под¬
тверждающих тестах. Значительный их уровень приводит к необоснованному
отводу от кроводачи потенциальных доноров. Поскольку система обязательного
подтверждения результатов скрининга доноров крови на инфекционные маркеры
в РФ и СНГ отсутствует, то, согласно действующей инструкции, положительный
результат иммуноферментного скрининга является основанием для отвода доно¬
ра от кроводачи и выбраковки всех заготовленных от этого донора компонентов
крови, в том числе находящихся на карантинизации.
Анализ ситуации свидетельствует о необходимости внедрения системы обя¬
зательного подтверждения положительно реагирующих в ИФА образцов крови
и возможности возврата в донорский контингент доноров, результат тести¬
рования крови которых в подтверждающих тестах оказался отрицательным.
При получении неопределенного результата в подтверждающих тестах донора
целесообразно обследовать повторно через 1-2 мес. Такая тактика позволит
сохранить около 80% доноров, отстраненных от донорства в результате поло¬
жительного иммуноферментного скрининга крови, но не подтвержденных
в верификационных тестах.
Диагностика вирусного гепатита В
Диагностика вирусного гепатита В основана на определении серологически
маркеров вируса - антигенов HBsAg, НВ( Ag, HBEAg и соответствующих им анти
тел: анти-НВч, анти-НВ( и анти-НВЕ (рис. 25-10). и
Различное сочетание указанных маркеров позволяет в определенной степ
шить о форме инфекции и стадии инфекционного процесса (табл. 25-98).
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТМНСФУЗИ) T Т 05
Концентрация
маркеров Серология HBV
Рис. 25-10. Динамика серологических маркеров гепатита В
Таблица 25-98. Серологические маркеры при различных формах ВГВ-инфмции
Диагноз
HbjAo
I Анти-HBj
1 Аитя-НВ' IgM j Антк-НВс igS КВСА( | Аята-М
Острый гепатит В
+ Н
т т- -- .т—ря
Реконвалесценция
-(+)
-(+)
-м і ♦ f - 1 ♦
Выздоровление
-
+ (-)
Фульминантный
+ Н
+
+ і + і ♦ I ' -
Хронический персистируюїдий
+ Н
-
♦ н f SI
Хронический активный
+ {-)
♦ f ♦ f ♦ i
Здоровые носители
+
-(+)
- (+) j +
Активная иммунизация
-
+
.. шіі i m A.mJrif. - ^ r Гі.л. m ,iri|n.. i i i
Пассивная иммунизация
-
+ 1
f M
Стандартная схема обследования на гепатит В предусматривает определение
HBsAg у доноров и больных. HBjAg обнаруживают в сыворотке, как
спустя 4-6 нед, но иногда через 4-6 мес после заражения и за 3 4 нед до появле¬
ния клинических симптомов, присутствует на протяжении всего ОСТрОГО ШфИОДа
заболевания и, как правило, исчезает в период реконвалесценции. У небольшой
части больных HBsAg продолжают выявлять месяцы и даже годы после выздо¬
ровления. Антитела к HBsAg выявляют в крови через 3-4 мес после исчезновения
антигена и их обнаружение рассматривается как один из критериев выздоровле¬
ния и развития постинфекционного протективного иммунитета против гепа¬
тита В. НВС- и HBg-антигены считаются маркерами активной фазы инфекции,
но присутствуют в крови в разгар заболевания не у всех HBsAg-положительных
больных и выявляются в течение короткого времени. Сог-аитиген обнаружива¬
ют обычно в биоптатах печени, в сыворотке только при тяжелых фульмшмшпг-
ных формах гепатита.
Анти-НВс -антитела начинают обнаруживать параллельно с исчезновением
соответствующего антигена, и их появление свидетельствует о доброюиесжаиии
течении заболевания.
Анти-НВс-антитела класса IgM появляются при остром гепатите я рязлф мбо*
левания у 100% больных и циркулируют в крови 3 5 мес. Эти антитела считайся
важным свидетельством наличия у больного острой инфекции. В случае хроюпе-
ской ВГВ-инфекции их выявляют далеко не всегда и тодыю на стадии ее обворе*
ЯиЦ трмиотэионим иммунология
ям, Аиптяа класса IgG появляются практически одновременно или несколько
дпаииу но сохраняются продолжительное время и их обнаруживают при всех фор¬
мах заболевания. Определение анти-НВС-антител используют в качестве допол-
югтельного маркера для выявления инфекции у HBsAg-HerarHBHbix доноров.
Определение других ИФА-маркеров гепатита В для подтверждения диагно¬
зе і разгар заболевания является менее значимым. Вместе с тем обнаружение
шттл класса IgG к НВС-, НВ5- и НВЕ-антигену может помочь в определении
этиологии ранее перенесенного гепатита и наличия иммунитета к ВГВ-инфекции.
HIL-аитиген считается маркером активной фазы инфекции, но присутствует
в крови в разгар заболевания не у всех НВ^-положительных больных и выявля¬
ется в течение короткого времени.
HBgAg обнаруживают у больных практически одновременно с поверхностным
антигеном, они считаются показателем активной репликации вируса. Анти-НВЕ-
антитела начинают обнаруживать параллельно с исчезновением соответствующе¬
го антигена, и их появление свидетельствует о доброкачественном течении забо¬
левания. Напротив, длительное персистирование в крови HBS- и НВЕ-антигенов
заставляет предполагать затяжное течение патологического процесса и переход
заболевания в хроническую форму.
Хронический гепатит В характеризуется постоянным присутствием таких
маркеров, как HB,Ag, HB^Ag, анти-НВс-АТ класса IgM и анти-НВЕ-АТ класса IgG
в течение 6 мес и более от начала острой фазы инфекции.
Антигенные, иммунологические и генетические маркеры ВГВ определяют
методом иммуноферментного анализа (ИФА) и полимеразной цепной реакции
(ПЦР) с использованием диагностических тест-систем. При традиционной техно¬
логии в качестве исходного вирусспецифического сырья использовали антигенные
препараты, антитела от носителей инфекции или полученные от иммунизирован¬
ных вирусным препаратом животных. Подобная технология имеет существенные
недостатки, связанные как с потенциальной опасностью для здоровья персонала,
так и I трудностями получения воспроизводимых по своему качеству высокоочи-
щенных препаратов вирусного антигена и поликлональных антител.
В новых технологиях в качестве исходных биокомпонентов тест-систем исполь¬
зуются рекомбинантные антигены и моноклональные антитела, специфические
последовательности нуклеотидов вирусного генома, получаемые молекулярно¬
биологическими методами и биоинженерной технологией.
Одним из важнейших условий в обеспечении инфекционной безопасности гемо¬
трансфузий считается выбор диагностикумов для обследования доноров. Следует
использовать реагенты и оборудование, сертифицированные для обследования
крови доноров, выбирать наиболее чувствительные тест-системы, позволяющие
свести к минимуму количество ложноотрицательных и ложноположительных
результатов (перечень в приказе М3 РФ №282 от 28.09.98 г.).
При положительных результатах необходимы повторные исследования реак¬
тивных образцов в ИФА. Одним из подтверждающих тестов считается реакция
нейтрализации. В подтверждающих тестах с нейтрализацией положительно реаги¬
рующая сыворотка смешивается с сывороткой, содержащей антитела, специфичные
к искомому антигену. Если при этом положительная реакция исчезает или выра¬
женность ее сокращается на 50% и более, наличие антигена подтверждается
и результат оценивается как положительный. Если же инкубация с сывороткой,
содержащей специфические для данного антигена антитела, не влияет на реактив¬
ность, то первоначальный результат расценивается как ложноположительный.
При использовании методов NAT-тестирования. в частности полимеразной
цепной реакции (ПЦР), возможно определение ВГВ-инфекции практически во всех
спорных случаях. Метод ПЦР основан на многократном увеличении количества
МИЯЙ МЙЯШШ УЧЙГТИЯ /1 НК ИшЬричшмиимгм ягри'п нугрм пмнимрпяЗНОИ
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТОйНМУЗИЙ it 87
^стройки с помощью термофильного фермента определенных последовательно*
нуклеиновых кислот. Чувствительность метода превосходит все имеющиеся
в ^стоящее время технологии и близка к предельно возможной - детектиру ются
^личные копии генома.
jjMMyHoreнетические исследования позволили определить маркеры, наличие
цди отсутствие которых связано с предрасположенностью к заболеваниям. В част*
gjcm, повышенный риск вирусного гепатита В существует у лиц с антигенами
gg и В12 системы HLA, у них же чаще наблюдается острое развитие болезни.
Лри наличии в фенотипе больных антигенов В18 и В35 повышен риск предрас¬
положенности перехода заболевания в хроническую форму.
диагностика вирусного гепатита D
Поскольку вирус гепатита D способен к репликации только в присутствии ВГВ,
то вирус, способный к заражению, состоит из РНК-вируса гепатита D (внутреннего
антигена) и внешней оболочки, содержащей поверхностный антиген вируса гепа¬
тита В (HBjAg).
Диагноз ВГВ/ВГО-коинфекции ставят на основании выявления антигенов двух
инфекций, причем ВГО-антиген определяется только в ходе ранней стадии пер¬
вичной BrD-инфекции в течение первых 1-2 нед. После появления антител к ВГО
антиген входит в состав иммунных комплексов и в сыворотке не обнаруживается.
Антитела к гепатиту D определяются обычно в низком титре вначале анти¬
тела класса IgM, затем IgG. В отличие от изолированной ВГВ-инфекции при соче¬
тании гепатитов В и D в разгар заболевания HBsAg выявляется у всех больных.
Также у всех больных выявляются анти-НВс-антитела класса IgM.
Иммуноферментный и ПЦР-анализ позволяют одновременно выявлять марке¬
ры ЩВ/ВГО-коинфекции (микст-гепатит B+D) (табл. 25-99).
Таблица 25-99. Серологические маркеры при коинфекции вирусов гепатитов В и D (микс-гепатита
B+D)
Серологические маркеры
Период заболевания
начало инку¬
бации
конец
инкубации
острая фаза ' период еыздо-
заболевания j роялеиия
серологический
статус после
•ыздороелеиия
Длительность
4-12 нед
1 нед
2 нед-3 мес
3-6 мес
Годы
ВГВ-ДНК
-
♦
-
-
НВ,Ад
-
+
♦
♦Н
-
HBcAg
-
+
♦
Анти-НВр-lgM
-
-
+
♦ н
Анти-НВ,, (суммарные)
-
-
+
1
Анти-НВг (суммарные)
_
_
.«
+
♦н
Анти-НВ,. (суммарные)
-
-
-(♦)
♦
ВГО-РНК
-
-(♦)
+ Н
1
HD-Ag
-
*н
-
Анти-ВГО-ІдМ
-
- :
♦
-
Анти-BfD (суммарные)
-
♦
t
-
Диагностика вирусного гепатита С
Диагностика вирусного гепатита С в настоящее время основана ка выявлении
специфических антител к структурным (Соге-белки Е1 и Е2) и неструктурным
(NS2, NS3, NS4, MS5) белкам. Следует иметь в виду, что обнаружение анти-ВГС-
АТ (за исключением антител класса IgM к сог-антигену) не свидетельствует о про¬
должающемся процессе репликации вируса и его активности. Наличие антител
I 1108 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
позволяет установить диагноз, но не характеризует форму заболевания и не с, J
тается прогностическим признаком.
Основным критерием, характеризующим вирусемию, свидетельствующую J
продолжающейся активной репликации вируса, считается обнаружение РНК ВГс
В ПЦР. В острую фазу гепатита РНК выявляется в крови уже через 1-2 нед после
заражения, т.е. задолго до появления антител. В дальнейшем наблюдается опреде¬
ленная корреляция между обнаружением РНК и выявлением анти-ВГС класса IgM
■■ 25-100,25-101).
Таблица 25-1 М. Серологические маркеры прмстрштпатт^^^^^^^^^^^^^^І
Маркеры
Начало
инкубации
4-12 нед
Конец
ннкубации
1-2 нед
Активная
репликация
ВГС 2 нед
Конец фазы
репликации
ВГС 3 мес
Период
выздоровле¬
ния 3-6 мес
После
выздоров¬
ления
ВГС-РНК
-
+
■ +
-
-
Анти-ВГС-IgM
-
-
-/+
jpP50
-
Анти-ВГС-IgG
-
-
-
9Л .•
і ъ ■
щ
Таблица 24-101. Серологические маркеры при хроническом гепатите С
1
Маркеры
Фаза
Отсутствие
репликации
репликации
ВГС-РНК
f +
-
Анти-ВГС-ідМ
' t.
-
Анти-ВГС-IgG
1 ;+ ■
ih ■
Скрининговые тесты, используемые в Службе крови для диагностики гепатита
С, выявляют антитела, относящиеся к иммуноглобулинам класса IgG, структур¬
ным и неструктурным белкам вируса гепатита С методом ИФА. IgG-антитела
появляются спустя 2 мес после инфицирования, в конце инкубационного периода,
а в ряде случаев не обнаруживаются в течение 3-6 мес. Выработке анти-IgG-
антител при первичном гуморальном иммунном ответе предшествует синтез
антител класса IgM. Их можно выявить уже через 2 нед после заражения, когда
клинические проявления отсутствуют, но больной уже контагиозен и представляет
опасность как источник заражения гепатитом С (рис. 25-11).
РНК HCV печени (в ПЦР)
сзз 100%
с22 95% ШвШ
. N35 65% ISSS
— ІрМ-антитела
— IgG-антитела
т АЛТ
Рис. 25-11. Динамика серологических маркеров гепатита С
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 1109
Однако выявление антител класса IgM отмечено только в 50-90% случаев
«тестировании сывороток крови больных острым гепатитом Сив 50-70% слу-
ев при хроническом гепатите С. Вот почему этот тест для диагностики острого
■Іріта С пока не нашел своего места в Службе крови и по-прежнему не приме¬
чет ся, оставаясь предметом научного исследования.
Первые диагностические системы для выявления антигенов вириона ВГС
Ізрились в 1999 г. В настоящее время разработаны скрининговые тест-системы,
-яределяющие одновременно соге-антиген и анти-ВГС-АТ, наиболее чувстви¬
тельные в ранней фазе инфекции в области серологического «окна». Сравнение
с результатами ПЦР определения РНК-вируса при исследовании единичных сыво¬
роток показало, что использование комбинированного АГ-АТ-теста в среднем
отстает всего на 4 сут и опережает результаты наиболее чувствительных скринин¬
говых анти-ВГС-АТ тест-систем на 25 сут.
- Для подтверждения ВГС-инфекции используют рекомбинантный иммуноблот-
гинг, линейный иммуноанализ. Подтверждающие тесты также выявляют антитела
класса IgG. Окончательный диагноз ставится на основании обнаружения РНК-
вируса методом ПЦР и данных биопсии печени.
диагностика ВИЧ-инфекции
;. Сложившаяся в мире практика диагностики ВИЧ-инфекции основана на выяв¬
лении в сыворотке крови специфических анти-ВИЧ-1, -2 АТ методом твердофаз¬
ного ИФА с последующим подтверждением в иммуноблоггингеили ПЦР. С 2001 г.
Ж соответствии с приказом М3 РФ №292 от 10.07.2001 г. «Об использовании
йштюферментных тест-систем для выявления антител к ВИЧ в сыворотке крови
человека» для скрининга донорской крови применяют тест-системы для одновре¬
менного определения антител к ВИЧ-Щі-2 и антигена р24.
f большинства инфицированных лиц антитела к ВИЧ обнаруживают через
1-12 нед после заражения. Примерно у 5—10% антитела появляются через 3-6 мес,
а у 1% — через 1 год и позже (рис. 25-12).
Рис. 25-12. Динамика выработки антител против вируса иммунодефицита человека
Таким образом, инфицированные ВИЧ в течение достаточно длительного времени
остаются серонегативными и потенциально возможными источниками заражения.
І концу 2001 г. зарегистрировано 37 случаев передачи ВИЧ при гемотрансфузиях
I пересадке почек. По данным С. Goodman и соавт. (2003), в 2000-2002 гг. в мире
^Регистрировано 3-5% случаев заражения ВИЧ в результате гемотрансфузий.
1110 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Профилактика посттрансфузионного заражения прежде всего основывается
на 100% серологическом тестировании доноров на антитела к ВИЧ-1 и -2. При¬
менение тест-систем IV поколения, позволяющих определять и АГ, и АТ, сокра¬
щает период серологического «окна* до 14 сут.
В России принята 3-этапная система диагностики ВИЧ-инфекции.
• I этап - скрининговые исследования в ИФА-тест-системах (антитела к ВИЧ-
1. -2). Доноров обследуют методом ИФА (антитела к ВИЧ-1, -2 и АГ - р24 -
белок сердцевины вириона).
• U этап - референтное исследование в 2-3 ИФА-тест-системах. При двукрат¬
ном отрицательном результате его считают окончательным.
• III этап - при положительном повторном результате в ИФА эксперт¬
ное исследование методом иммуноблота, ИФА-контроль в иммуноблоте
для выявления антител к антигенам оболочки вируса - gp41, gpl20, gpl60.
По сравнению с ИФА нммуноблот более информативен, поскольку позволя¬
ет выявить антитела к отдельным антигенам оболочки — белкам gp41, gpl20
и gpl60. Положительный результат в иммуноблоте считается окончательным
подтверждением заражения ВИЧ, отрицательный свидетельствует о ложнополо¬
жительном результате тестирования в ИФА. При выявлении антител к другим
белкам оболочки (кроме gp41, gpl20 и gpl60) результат считается сомнительным.
Такие лица подлежат наблюдению, их кровь исследуют повторно через 3 и 6 мес.
В настоящее время все большее значение приобретает подтверждение позитивных
результатов в ПЦР.
Диагностика сифилиса
В действующем по настоящее время приказе Министерства здравоохранения
СССР №1161 от 2 сентября 1985 г. предусмотрены следующие реакции для серо¬
логической диагностики сифилиса.
, ■ Скрининговые тесты:
❖ микрореакция преципитации (МР) с кардиолипиновым антигеном;
❖ реакция связывания комплемента (РСК) с трепонемным и кардиолипино¬
вым антигеном.
. «Подтверждающие тесты:
❖ реакция иммобилизации бледных трепонем (РИБТ),
❖ реакция иммунофлюоресценции (РИФ) в модификациях.
Реакции с кардиолипиновым антигеном просты в постановке, но обладают
низкой чувствительностью (около 70%) и дают большое количество ложнополо¬
жительных результатов, которые могут быть связаны с различного рода заболе¬
ваниями соединительной ткани (красной системной волчанкой и др.), диабетом,
онкопатологией, возрастными изменениями. Высокий процент ложноположи¬
тельных реакций кардиолипиновые тесты дают при обследовании беременных.
Трепонемные тесты (РИБТ и РИФ) обладают более высокой чувствительно¬
стью, но технически сложны и требуют специального оборудования, поэтому
их применение возможно только в специализированных учреждениях. Кроме
того, эти реакции также могут давать ложноположительные результаты, которые
связаны с заболеванием обследуемого генитальным герпесом, бореллиозом, нали¬
чием в исследуемом образце антител к общим антигенам других видов спирохет
и/или другими факторами.
Прочно вошли в практику и другие тесты, в частности реакция пассивной гемаг-
глютинации (РПГА) и иммуноферментный анализ (ИФА).
ИФА І наиболее удобный тест для скрининга и диагностики сифилиса. По чув¬
ствительности и специфичности ИФА вполне сопоставим с РИФ, а по простоте
постановки имеет значительные преимущества. Сравнение результатов анали^
полученных различными методами, оценивали по совпадению с данными РИ
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ | \ І |
Таблица 25-102. Совпадение различных методов серодиагностики сифилиса с результатами РИФ
—' Образцы
РИФ
МР
РСК
ИФА
р&льные в РИФ
398
289
331
'374
шпниательные в РИФ
186
182
168
179
«.совпадений с РИФ
-
81
85
95
Из всех использованных серологических методов наибольшие совпадения
Наблюдались при ИФА — 95%. Чувствительность и специфичность остальных
методов - МР и РСК - была существенно ниже, 81 и 85% соответственно.
'Серологическим маркером приобретенного сифилиса в ранние сроки счита¬
ются антитела класса IgM, которые появляются уже через 2 нед после зараже¬
ния. Выработка IgM в значительных количествах происходит и при рецидивах,
и при реинфекции, поэтому персистенция IgM свидетельствует о постоянном
Присутствии в организме вирулентного возбудителя. Определение IgM играет
осйовную роль в диагностике врожденного сифилиса. Обнаружение в сыворотке
ребенка иммуноглобулинов данного класса считается серологическим подтверж¬
дением диагноза, тдк как, в отличие от IgG, IgM не передаются от матери плоду,
и их присутствие свидетельствует о наличии возбудителя в организме ребенка.
Иммуноглобулины класса IgG обнаруживают в сыворотке через 4-5 нед после
заражения.
По данным некоторых исследователей, зарегистрированы особенности рас¬
пределения групп крови среди лиц с маркерами инфицирования бледной трепо-
нрмой: у лиц с группой крови А(П) выявлена предрасположенность, при группе
крови AB(IV) — протективное действие к заражению этим возбудителем.
В уровнях подъема уровня заболеваемости проблема гемотрансфузионного
сифилиса остается актуальной. Практические меры, направленные на предупрежде¬
ние заражения с переливаемыми гемокомпонентами, должны предусматривать:
• использование комплекса методов при серологическом тестировании крови
/ доноров - МР, РПГА, ИФА;
• применение эритроцитной массы менее 5 сут хранения только в случаях экс¬
тренной необходимости;
• необходимость выделения реципиентов эритроцитной массы в группу потен-
' циального риска заражения, что предусматривает превентивное лечение
в течение 2 мес после трансфузии либо повторное серологическое обследова¬
ние через 3 мес после трансфузии.
В последние годы разработаны методы ДНК- и РНК-детекции Treponema pallidum.
Дальнейшее совершенствование качества лабораторного тестирования крови пред¬
полагает внедрение методов прямого определения вирусов гепатитов В, С, ВИЧ, ЦМВ
и др. Методы детекции нуклеиновых кислот: NAT-тестирование ВГС, ВГВ и ВИЧ-1
проводят в США с 1999 г. после проведенного G.B. Shrieber и соавт. исследования,
позволившего выявить для ВГВ, ВГС и ВИЧ-1 на 1 млн донаций соответственно 7;
6.75 и 1 NAT-положительных, но серонегативных образцов крови. С 2000 г. NAT-
тестирование в США осуществляется в отношении всей заготавливаемой крови,
и на основании этого анализа возвращаются в донорский контингент те, которые
были отведены на основании сомнительного результата иммуноблота Ш поколения.
В Германии NAT-тестирование донорской крови начато в 1997 г. Стоимость
NAT-тестирования на ВИЧ-1 и ВГС в мини-пулах в США достигает 8 долларов
донацию. В Германии затраты ниже, но цена возросла примерно в 2-8 раз.
Дри тестировании каждого образца отдельно стоимость возрастает многократно.
Преимуществами ПЦР-анализа считаются высокая чувствительность, кото¬
рая позволяет выявлять единичные (10-100) клетки в пробе, и специфичность,
обусловленная тем, что определяется характерный только для исследуемого воз¬
будителя фрагмент ДНК. При исследованиях в ПЦР плазмы от серонепигианых
1112 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
доноров выявляется дополнительно по ВИЧ от 0,006 до 1,3%, по ВГВ — от 0 04
до 41%, по ВГС - от 0,023 до 39% положительных образцов. Высокая чувстви¬
тельность ПЦР-анализа позволяет тестировать не только пробы крови от одного
донора, но и мини-пулы, в которых объединены аликвоты от нескольких десятков
доноров. Однако полностью заменить ИФА методом ПЦР не представляется воз¬
можным в связи с тем, что выброс вируса при хроническом носительстве В ряде
случаев носит флюктуирующий характер. В подобных случаях необходимо опти¬
мальное сочетание обоих методов.
В соответствии с приказом Минздравсоцразвития №513 от 29.11.2007 г.
♦Об усилении мер, направленных на снижение риска развития посттрансфузи¬
онных инфекционных осложнений» в практику Службы крови вводится NAT-
тестирование крови донора на основные гемотрансмиссивные инфекции (ВИЧ,
гепатиты В, С, сифилис).
Внедрение ПЦР-диагностики в Службу крови потребует создания качествен¬
но новых лабораторных подразделений; разработки новой нормативной базы
и системы внешнего контроля качества.
ОЦЕНКА ВЛИЯНИЯ ДИАГНОСТИЧЕСКИХ И ЛЕЧЕБНЫХ
МЕРОПРИЯТИЙ НА РИСК ПЕРЕДАЧИ ВОЗБУДИТЕЛЕЙ
ГЕМОТРАНСМИССИВНЫХ ИНФЕКЦИЙ
Программа профилактики гемотрансмиссивных инфекций в лечебно-профи¬
лактических учреждениях состоит из комплекса санитарно-гигиенических, диа¬
гностических и лечебных процедур, включающих:
• применение исключительно одноразовых инструментов и систем для инва¬
зивных диагностических и лечебных процедур у всех больных;
• дезинфекцию Многоразового инструментария способами, гарантирующими
защиту от возможности передачи возбудителей при их повторном использо¬
вании;
• выполнение исследований по выявлению маркеров гемотрансмиссивных
инфекций высококачественными тест-системами, регламентированными
приказами М3, а также проведение внутреннего и внешнего контроля каче¬
ства лабораторных исследований;
• внедрение новых диагностических лабораторных технологий;
• использование карантинизированной свежезамороженной плазмы.
Для профилактики заражения возбудителями гемотрансмиссивных инфекции,
против которых существует вакцина (в настоящее время вирусом гепатита В),
дополнительно следует проводить:
• вакцинацию больных, нуждающихся в инвазивных диагностических
или лечебных процедурах, методах экстракорпоральной гемокоррекции
и хирургических операциях;
• вакцинацию медицинского персонала клиники (в идеале — всех сотрудников
или на первом этапе — групп повышенного риска);
• вакцинацию доноров регулярной кроводачи;
• при случайном заражении медицинского персонала или больных:
❖ введение специфического гамма-глобулина;
4- вакцинация по экстренной схеме.
Для выбора оптимального комплекса мероприятий целесообразно давать кода
чественный прогноз снижения риска передачи при гемотрансфузиях в зависим
сти от эффективности различных мероприятий и их сочетаний.
Некоторые термины
LlAwrrmuirTua шлАаа Ими — — •♦паялфИТТЯШРНИЕ
заоажения
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ Ц13
доля и вероятность — разные по смыслу значения несут в данной работе одно
«то же количественное выражение. Если известна вероятность какого-то события,
до доля проявления его в серии повторностей в среднем будет равна этой вероят¬
ности. И наоборот, если известна доля проявления какого-то события в серии
довторностей, то вероятность его проявления в конкретном случае в среднем
равна этой доле. Например, если вычислена вероятность заражения одного реци¬
пиента, то средняя доля инфицированных реципиентов, находящихся в тех же
будет численно равна этой вероятности. В обратном случае, если извест¬
на (или предполагается) доля зараженных доноров, то вероятность того, что кон¬
кретный донор окажется зараженным, численно равна этой доле.
Благодаря проводимым профилактическим мероприятиям степень риска зара¬
жения меняется. Его значение в исходном состоянии (до мероприятий) обознача¬
ется R, а то, что вправе ожидать после мероприятий, — г.
. Инфицированная доза — доза, в результате введения которой возможно зара¬
жение реципиента. Исходная доля зараженных доз гемокомпонентов обозначает-
ся Л ^ ^
Лечение — мероприятие, направленное на ликвидацию возбудителя у больных,
но не предохраняющее их от повторного заражения. В силу ряда причин лечение
не всегда приводит к требуемому результату. Именно поэтому различают следую¬
щие варианты обозначений: леченый донор* — Іґ нелеченый донор* — lf
• вероятность того, что лечение донора не дало результата, обозначается bf
Определение категорий доноров, обозначенных знаком «*», требует некоторых
пояснений. Дело в том, что перенесенные инфекционные заболевания, относящие¬
ся к числу так называемых декретированных инфекций, считаются основанием
для отстранения от донорства пожизненно, даже если лечение оказалось успеш¬
ным и в крови не обнаруживаются соответствующие специфические инфекцион¬
ные маркеры. Однако и в подобной ситуации человек может сдать кровь и быть
отнесенным к одной из указанных категорий в силу ряда обстоятельств, как-то:
желание получить компенсацию и поэтому скрыть перенесенное заболевание
из-за незнания того, что он перенес заболевание в детстве или переболел в легкой,
бессиптомной форме, и т.п. Именно поэтому, понимая определенную условность
подобных определений, все-таки сочли возможным принять их в такой форме.
Вакцинация — мероприятие, направленное на предотвращение заражения.
В силу ряда причин она не всегда охватывает весь контингент, подлежащий вакци¬
нации, и не всегда приводит к требуемому результату. Именно поэтому различают
следующие варианты обозначений: вакцинированный реципиент - V, невакци-
нированный реципиент — v,, вакцинированный донор - V, невакцинированный
донор — vf
Вероятность того, что у вакцинированных специфические антитела не достигли
защитного титра, обозначается соответственно wr и wf
Вероятность того, что определенная доза СЗП прошла карантинизацию, обозна¬
чается К, некарантинизированная плазма - к. Вероятность того, что определенная
Доза, прошедшая карантинизацию, осталась инфицированной, обозначается/.
Сертифицированная кровь — М, ^сертифицированная кровь — т.
Вероятность того, что определенная доза прошла сертификацию, но осталась
инфицированной, обозначается с
Эффективность мероприятия — Е — величина снижения риска заражения
реципиента, обеспеченная профилактическими мероприятиями. Она измеряет¬
ся отношением риска заражения реципиента при отсутствии профилактических
мероприятий к риску его заражения при их проведении, т.е. E = R/r.
Вводные условия.
І В исходной ситуации известна (или предполагается) величина исходной
Доли инфицированных доз крови, и отсюда вероятность того, что конкретная дом
«пт
1114 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
будет заразной. Поскольку доля инфицированных доз гемокомпонентов извест
не всегда, в качестве достаточного приближения можно считать ее равной л 3
инфицированных доноров. Ле
2. Все реципиенты считаются здоровыми (незаряженными) и неиммунны
(восприимчивыми). Для зараженных и иммунных реципиентов риска заражени*
не существует. Для первых — так как они и так заражены, для вторых - в си *
их иммунитета. *
3. Трансфузии инфицированных гемокомпонентов всегда вызывают заражени
реципиента.
4. Введение гемокомпонентов, полученных от иммунного донора, не иммунизи¬
рует и не лечит реципиента. Очевидно, эта процедура повышает сопротивляемость
организма реципиента, но, как правило, не настолько, чтобы полностью предот¬
вратить возможность заражения.
Если не принимать никаких мер, то риск заражения реципиента (вероятность
получения возбудителя) при переливании ему одной дозы гемокомпонента равен
вероятности того, что эта доза заразна. А вероятность того, что конкретная доза
инфицирована, равна доле инфицированных доз или (что адекватно, но менее
точно) доле зараженных доноров. Отсюда:
= V (1)
Эта формула показывает вероятность заражения реципиента при переливании
ему одной дозы какого-либо из гемокомпонентов, полученных от одного донора.
При многократных гемотрансфузиях (при использовании нескольких доз) вероят¬
ность заражения возрастает. Она становится равной:
Ял=1-(1-2,)л, (1а)
где п - количество перелитых доз гемокомпонентов.
Даже при малой доле зараженных доз гемокомпонентов многочисленные
повторные трансфузии могут привести к заражению реципиентов. Так, например,
если доля инфицированных доз компонентов крови равна 0,1 (10%), то лишь трое¬
кратное ее переливание создаст риск заражения, равный 0,27 (27%):
H 1 - (11 zdy= 11II10,1)3= 1 - 0,729 = 0,271.
Формула (1а) позволяет определять не только риск заражения. С ее помощью
можно получить данные, отражающие интенсивность гемотрансфузионной тера¬
пии, т.е. можно определить соотношение количества доз компонентов крови, пере¬
литых различным категориям больных. Так, если среди пациентов клинического
отделения «А» частота выявляемое™ маркеров гемотрансмиссивных инфекций
была ниже (например, 1,2%), чем в других отделениях, кровь им переливали реже.
Если принять это значение за единицу, риск заражения в данной клинике в данный
период был равен 0,012. Если инфицированность больных отделения «Б» была
равна 16,4% (0,164), то можно определить относительное количество компонен¬
тов крови, перелитой этим пациентам:
п I lg(l - 0,836)/lg(l - 0,988) = 13,6.
Пациентам отделения «Б» кровь переливали в среднем в 13,6 раза чаще,
чем таковым отделения «А».
Точно так же можно определить этот показатель и для пациентов любых других
отделений.
Для оценки влияния проводимых мероприятий на риск заражения реципиентов
гемокомпонентов рассмотрены некоторые основные, наиболее доступные практи
ческому здравоохранению профилактические меры, направленные на снижение
посттрансфузионных инфекционных осложнений, в частности:
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ЛЕМОТРАНС«УЗИИ 1115
# инфекционная сертификация крови — сертификация включает выбраковку
инфицированных доз гемокомпонентов и/или их обеззараживание:
I использование карантинизированной плазмы;
, вакцинация больных;
• вакцинация доноров.
Приведенные ниже расчеты носят общий характер и могут быть применены
по отношению к тем инфекциям, против которых существует вакцина, в данном
случае против гепатита В.
Как уже указывалось выше, ни одно из мероприятий (и никакое их сочетание)
Я гарантирует абсолютной защиты. Риск заражения остается.
При использовании всех мероприятий в комплексе риск заражения реципиента
равен вероятности того, что совпадут все неблагоприятные возможности; донор
окажется исходно зараженным, невакцинированным и нелеченым (или вакцини¬
рованным и леченым, но безуспешно). При этом переливаемая кровь не будет под¬
вергнута сертификации или инактивации. В этом случае численное значение риска
заражения равно произведению вероятностей каждого из указанных событий:
I = z/тя + Мх 0)0^+ Vdx wd)(v + VrX w)(Jd+ Ldx Ъ}{к | K*f). (2)
При этом эффективность проведенных мероприятий:
Е = R + г- 1 4. [{m + Мх c)(v,+ VjX wrf)(vr+ Vx wr){ld+ Ldx bd)(k + K xf)\. (2a)
Комплекс может состоять не из всех возможных, а лишь из нескольких меро¬
приятий или всего лишь одного из них. Для вычисления риска заражения и эффек¬
тивности неполного набора мероприятий годятся те же формулы (2) и (2а),
но в преобразованном виде.
Отсутствующие мероприятия надо считать заведомо неуспешными (вероят¬
ность неуспеха равна единице). При этом соответствующая часть каждой формулы
(то, что стоит в соответствующей паре скобок) станет равным единице и не будет
влиять на конечный результат.
Так, например, если обеззараживание (или выбраковку) крови не проводят,
то вероятность сохранения возбудителя равна единице (с = 1).
В этом случае М х с = 1 и, поскольку M + m = 1, все выражение в первых скобках:
(m + М х II11. Соответственно риск заражения в такой ситуации будет равен:
г = zdx 1 х (v,+ Vdx M>d)(vr+ Vx wr)(ld+ Ldx bd).
Аналогично изменится и формула эффективности.
Таким способом, преобразуя формулы (2) и (2а), легко оценить риск заражения
и эффективность любого набора мероприятий (или одного мероприятия), напри¬
мер, при проведении только сертификации крови:
r-zjjn + Мхе),
E = 1 + {m + М х с);
при только вакцинации доноров:
r*Zrfx (Vj+VjxwJ,
E=l+ (Vj+VjXWj);
или только при вакцинации реципиентов:
r=ZjX (v+Vxw),
Е= 1ч- (vd+Vxw).
Рассматривая предложенные формулы, надо отметить чисто математические
закономерности, которые из них следуют.
1115 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Если исходный риск заражения отсутствует (R = 0), то эффективность любых
мероприятий равна нулю (R стоит в числителе).
Если какое-то мероприятие полностью успешно (обеспечивает 100% охват
и обеззараживание), то можно ограничиться им одним. В этом случае в формуле
(2) то, что стоит в соответствующей паре скобок, станет равным нулю, и произве¬
дение всех сомножителей (какими бы они ни были) обратится в ноль. Риск равен
нулю. Эти закономерности полностью соответствуют здравому смыслу, что счита¬
ется важнейшим аргументом адекватности предложенных способов расчета.
Эффективность профилактики посттрансфузионных осложнений зависит
от полноты охвата и успеха соответствующего мероприятия. Если есть возмож¬
ности выбора, надо ориентироваться только на них (ведь зараженность крови
во всех вариантах одна и та же). Наилучший метод тот, который позволяет охва¬
тить «материал* наиболее полно и обеспечить максимальное снижение риска
посттрансфузионного заражения.
В табл. 25-103 приводится оценка риска инфицированности реципиентов
в зависимости от комплекса и эффективности проводимых мероприятий. Условно
принято, что в среднем инфицированность равна 0,75%.
Таблица 25-103. Риск заражения реципиентов гемокомпонентов
Мероприятия
а
(в среднем)
Комплекс мероприятий
1
2
3
4
5
6
0,0075
0,0075
0,0075
0,0075
0,0075
0,0075
т
1
0
0
0
0
0
и
1
1
1
1
1
С
0,05
0,05
0,05
0,05
0,01
0
1
1
1
0,5
0.5
0
№
0,5
0.5
1
Mf
0,3
0.3
0,1
иг
1
1
0,5
1
0.5
0
Vf
0,5
0.5
1
т
0,5
0,5
0,2
и
1
1
1
1
1
14
0
В
1
К
1
1
1
1
0
К
1
F
0
Я
0,0075
0,00038
0,00019
0,00011
0,00006
0,0000015
г на 100 ООО гемо-
трансфузий
750
38
19
11
6
0,15
[
1
18
39
69
125
5000
Примечания.
1. Не проводятся - уровень инфицированности в популяции.
2. Лабораторная сертификация крови доноров.
3. Лабораторная сертификация крови доноров и использование карантинизированных (инакти
аированных) гемокомпонентов.
4. Лабораторная сертификация крови доноров и вакцинация реципиентов.
5. Лабораторная сертификация крови доноров и вакцинация доноров.
6. Лабораторная сертификация крови доноров, вакцинация доноров и реципиентов.
На основании расчетов показано, что основой профилактических мероприят
остается сертификация крови. Это мероприятие, выполняемое в полном объеме,
гарантирует наименьшую вероятность ошибок. При условии только инфекцион
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕДОТШЗДЗИЙ 1117
* сертификации донорской крови риск передачи возбудителей гемотранемне-
Й°вных инфекций снижается почти в 20 раз (с 750 до 38 на 100 тыс. трансфузий).
п и этом использование только карантинизнрованиой плазмы снижает риск
еще в 2 раза. Применение же дополнительной комплексной вакцинации боль
«ух и доноров минимизирует риск передачи гепатита В. снижая его в сравнении
первоначальным более чем в 200 раз. Соответственно возрастает эффективность
проводимых профилактических мероприятий.
Все приведенные выше формулы основаны на выборочных или предположи¬
тельных данных, поэтому фактический результат может не совпадать с расчетным.
Вернее, такое совпадение возможно лишь в редких случаях. Для оценки макси¬
мально возможного риска заражения в формулы надо подставить песснмальные
значения параметров: наиболее высокую (из возможных) долю инфицированных
доноров, наихудшие возможности тестирования и обеззараживания лоз кровм
и т.п. В этом случае получается значение гарантированного эффекта или мак¬
симального риска заражения реципиентов. В данном примере 750 ка 100 000
трансфузий, или 0,75%.
Таким образом, при наличии сведений о зараженности доноров возбудителями
гемотрансмиссивных инфекций или инфицированности донорской крови есть
возможность рассчитать риск заражения реципиентов. При наличии сведений
о полноте охвата и результативности профилактических мероприятий есть вол
можность рассчитать их эффективность. Приведенные методы расчета пригодны
для любых контингентов и любых возбудителей. Использование их облегчит
выбор средств защиты в каждой конкретной ситуации.
Обеспечение инфекционной безопасности гемотрансфузий
Основные причины риска инфекционной контаминации реципиентов компо¬
нентами крови следующие.
• Социально-демографические:
-v- тождественность гемотрансмиссивных и болезней, передающихся ПОЛО¬
ВЫМ путем;
•v- пандемия ретровирусных инфекций, рост заболеваемости вирусными
гепатитами:
❖ участие в платном донорстве лиц девиантных груш;
•v- «экологический» иммунодефицит.
• Медико-технологические:
❖ ограниченность системы обязательного обследования доноров;
❖ ограниченность чувствительности и специфичности диагностических
методов обследования доноров;
❖ ограниченность знаний о гемотрансмиссивных инфекциях:
❖ ограниченность методов элиминации и инактивации инфекционных аген¬
тов;
О эволюция микроорганизмов;
Ф технология хранения гемокомпонентов при положительных пемперату-
рах:
Ф отсутствие декретированной системы углубленного обследования ■ лече¬
ния лиц, у которых при скрининге выявлены маркеры гемотраисммсск*-
ных болезней;
О- отсутствие критериев возврата в донорский контингент.
Осуществление комплекса профилактических и противоэпидемических меро¬
приятий, направленных на прерывание естественных и артифяциалышх мевиш*
м°в передачи, позволит уменьшить риск заражения инфекционными заболевай—-
«и при гемотрансфузиях.
1118 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Предупреждение передачи возбудителей инфекций должно осуществляться
на каждом этапе работы учреждений Службы крови — от отбора доноров до кон¬
троля за выпускаемой продукцией.
1 Улучшение санитарно-просветительской работы по увеличению контингента
безвозмездных доноров позволит снизить риск участия в кроводачах платных
М доноров. Именно среди этой категории доноров значительна доля лиц, относящих-
■ ся к группам риска — страдающих венерическими заболеваниями, хроническими
гепатитами, наркоманов, инфицированных ВИЧ. По данным некоторых авторов,
в группах риска процент обнаружения антител, в частности к вирусу гепатита С,
оказался значительно выше (среди наркоманов — от 40 до 80%, у больных с вене¬
рическими заболеваниями - 23%, у алкоголиков — почти 17%), чем у безвозмезд¬
ных доноров (в среднем 2,5-3%). Среди больных алкоголизмом и наркоманией
выше и процент зараженных гепатитом В — 25 и 13% соответственно.
Отбор потенциальных доноров должен сопровождаться внимательным изу¬
чением анамнестических данных и тщательным физикальным обследованием
в сочетании с разъяснительной работой.
При выборе доноров гемокомпонентов для иммунокомпрометированных
больных необходимы дополнительные меры, направленные на повышение инфек¬
ционной безопасности, в частности, расширение обязательного перечня обследо¬
вания на инфекционные заболевания с дополнительным включением тестируемых
маркеров гемотрансмиссивных инфекций — ЦМВ, вируса Эпштайна-Барр, вируса
герпеса 1-го и 2-го типа и т.п.
Важным фактором считается внедрение в практику работы более совершенных
диагностических тест-систем с высокой разрешающей способностью. В настоящее
время серологическое обследование в целях выявления вирусных инфекций вклю¬
чает два этапа:
• первый - скрининговые исследования, направленные на определение марке¬
ров инфекционных заболеваний — антигенов или антител;
• второй — подтверждение положительных результатов, полученных при скри¬
нинге в реакциях нейтрализации, ПРЦ или иммуноблоте.
Система скрининга маркеров гемотрансмиссивных инфекций нуждается в
постоянном качественном совершенствовании. Необходимо применение тест-
систем, способствующих максимальному сокращению периода серологическо¬
го «окна» и, следовательно, повышению процента выявления бессимптомных
и скрытых форм заболеваний. Использование тест-систем, имеющих высокие
чувствительность и специфичность, повысит уровень работы учреждений Службы
крови и экономически оправданно.
Следующим шагом, повышающим технологический уровень оснащения лабо¬
раторий трансфузионной иммунологии, считается внедрение в повседневную
практику работы методов NAT-тестирования.
Повышают безопасность гемокомпонентной терапии такие меры, как использо¬
вание лейкоцитных фильтров, криоконсервирование клеток крови, заморажива¬
ние плазмы, пастеризация препаратов крови. Внедрение в практику Службы крови
методов инактивации вирусов, таких как фотодинамическая обработка, стабили¬
зация крови сольвентами, также способствуют снижению риска инфекционной
контаминации компонентов и препаратов крови.
В целях профилактики заражения гепатитом В в лечебных учреждениях реко¬
мендуют вакцинировать хирургических больных, реципиентов множественных
гемотрансфузий, доноров и медицинский персонал.
При вакцинации больных целесообразно использование экстренной схемы
0-7-21 -е сутки с введением бустер-дозы через 1 год. При этом наиболее опти¬
мально введение пациенту 1-й и 2-й дозы до поступления на стационарное лечение
(на этапе догоспитального обследования), а 3-й — в стационаре. Такой подход.
ИММУНОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ГЕМОТРАНСФУЗИЙ 11 f 8
одной стороны, сокращает пребывание больного в клинике до операции, а с дру-
г0й - позволяет начинать оперативное и гемотрансфузионное лечение на фоне
достаточно высокого уровня протективных антител.
Назначение компонентов и препаратов крови должно быть оправданным,
проводимым по жизненным показаниям. Врачам при выборе тактики лечения
необходимо иметь в виду, что обязательный контроль за качеством выпускае¬
мых гемокомпонентов и препаратов не исключает возможности инфекционной
контаминации продукта. Это может быть обусловлено различными причинами:
бессимптомным носительством возбудителей инфекционных заболеваний, недо¬
статочной чувствительностью тест-систем, техническими ошибками персонала
и т.д. Каждая доза заготовленных компонентов и препаратов крови должна рас¬
сматриваться как потенциально опасная в плане передачи инфекционных заболе¬
ваний, и мероприятия, направленные на обеспечение инфекционной безопасности
выпускаемой продукции, должны сочетаться с рациональным использованием
трансфузионных средств, а именно:
1 переливанием гемокомпонентов только по строгим показаниям;
а пропагандой и расширением показаний к аутодонорству как наиболее безо¬
пасному способу переливания крови и ее компонентов;
• использованием метода реинфузии крови:
• широким внедрением в практику принципа «один донор — один больной*;
I альтернативным использованием кристаллоидных растворов и кристалличе¬
ских коллоидов.
Суммируя вышесказанное, можно отметить, что меры по уменьшению риска
инфекционного заражения при гемотрансфузиях сводятся к следующему:
• повышению требований к отбору доноров компонентов крови;
• активному использованию кадровых доноров;
• использованию высокоспецифичных и чувствительных тест-систем для скри¬
нинга маркеров гемотрансмиссивных инфекций у доноров, внедрению NAT-
технологий;
і расширению спектра инфекций, включенных для обязательного обследова¬
ния донорской крови;
і разработке системы контроля за обследованием доноров и выбраковкой ком¬
понентов донорской крови;
і внедрению методов инактивации гемотрансфузионных сред;
• повышению требований к оценке показаний к переливанию компонентов
донорской крови, ограничение количества гемотрансфузий;
• иммунопрофилактике больных, медперсонала и доноров крови;
• использованию лейкоцитных фильтров для снижения риска передачи виру¬
сов, характеризующихся тропностью к лейкоцитам;
I контролю посттрансфузионных инфекций;
s анализу данных о бактериальном и вирусном обсеменении препаратов
крови.
Глава 26
Гемолитическая болезнь
новорожденных, обусловленная
аллоиммунизацией
к эритроцитным антигенам
Причиной возникновения гемолитической болезни новорож¬
денных (ГБН) считается наличие в крови у матери антиэритроци-
тарных антител, способных проходить через плацентарный барьер
в кровоток плода и взаимодействовать с его эритроцитами, вызывая
вне- или внутрисосудистый гемолиз. Гемолиз эритроцитов и разви¬
вающаяся анемия стимулируют повышенную выработку эритробла-
стов, которые попадают в периферический кровоток, что в тяжелых
случаях приводит к эритробластозу.
Гемолиз эритроцитов способствует повышению уровня били¬
рубина. У плода несвязанный билирубин проходит через плацен¬
ту и нейтрализуется ферментами печени матери, что приводит
к снижению степени билирубинемии плода. После рождения
в связи с недостаточной ферментативной функцией печени ново¬
рожденного переход свободного билирубина в связанный замед¬
ляется, вследствие чего уровень билирубина резко возрастает.
Гипербилирубинемия клинически проявляется желтухой и нако¬
плением билирубина в богатых липидами подкорковых и стволо¬
вых ядрах головного мозга, в результате чего развивается ядерная
желтуха - билирубиновая энцефалопатия. Энцефалопатия харак¬
терна для тяжелой формы ГБН.
Поступление в кровоток плода большого количества антител
матери может привести к поражению капилляров и развитию водян¬
ки плода и плаценты, способствует внутриутробной гибели плода.
Образование и уровень выработки антител у беременной к анти¬
генам эритроцитов плода зависят от присутствия на эритроцитах
плода антигена, отсутствующего у матери, степени его иммуноген¬
ности и количества эритроцитов плода, попадающих в материнский
кровоток, достаточных для стимуляции иммунного ответа.
При нормально протекающей беременности в кровоток матери
проникает небольшое количество эритроцитов плода, как правило,
недостаточное для выработки антител. Так, при первой беременно
сти D-положительным АВО-совместимым плодом менее 1% резус
отрицательных женщин иммунизируются в процессе беременности.
Именно поэтому первая резус-конфликтная беременность закан
чивается в большинстве случаев рождением здорового Pe
Но после родов примерно у 20% таких женщин вырабатываю
антитела. Вероятность появления антител коррелирует с У®
чением объема трансплацентарных кровотечений. Риск тр
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ. ОБУСЛОВЛЕННАЯ АЛЛОИММУНИЗАЦИЕЙ 1121
«дацентарных кровотечений усиливается при токсикозе беременных, наружном
исследовании, мануальном отделении плаценты и кесаревом сечении. Ситуацию
усугубляют многочисленные аборты, а также инвазивные методы исследования,
такие как амниоцентез.
К сенсибилизации беременной и выработке антител может привести гемотранс¬
фузия несовместимой по антигенам эритроцитов крови.
В результате сенсибилизации матери при несовместимости эритроцитов матери
и плода по различным групповым антигенам могут образовываться антитела раз¬
личной специфичности. Антитела, относящиеся к иммуноглобулинам класса М.
не проходят через плаценту и не вызывают ГБН. Основную роль в развитии ГБН
играют неполные антитела, относящиеся к иммуноглобулинам класса G. которые
проникают через плаценту и участвуют в реакциях агглютинации, преципита¬
ции, иммунном лизисе и фиксируют комплемент. Уровень IgG-антител у плода
и тяжесть клинических проявлений ГБН определяются концентрацией мате¬
ринских антител в кровотоке плода. Все четыре субкласса IgG (IgGl. IgG2, |gG3,
IgG4) активно переносятся к плоду и увеличивают уровень материнских антител
в кровотоке плода. До 24 нед беременности перенос антител медленный, поэтому
гемолитическая болезнь плода до этого срока наблюдается редко. В более поздние
сроки перенос антител увеличивается, и в родах гемолиз становится максималь¬
ным. Разрушение фетальных эритроцитов происходит, как правило, экстраваску-
лярно и в основном в печени.
Причиной наиболее тяжелого течения ГБН, нередко заканчивающегося смер¬
тью плода, считаются анти-D-, анти-с- и анти-К-антитела.
Течение заболевания легкой и средней степени тяжести определяется накопле¬
нием анти-С, -E, -d, -е, анти-Кра, -k, -Jka, -Jsa, -Jab, -Fy, -PP, -pk, -LW, -Wr*, а также
при АВО-несовместимой беременности.
Ряд специфических антител, таких как анти-Ье\ -Leb, -N, -Plt -А,, -I, и редко
встречающиеся антитела, даже в высоких титрах, никогда не вызывают ГБН.
ГБН при несовместимости матери и плода по антигенам
эритроцитов системы резус
Антигены системы резус высокоиммуногенны и даже в малых дозах способны
вызывать образование антител, становящихся причиной тяжелых форм ГБН.
Наиболее иммуногенным считается антиген D, затем следуют антигены с, Е, С, е.
ГБН, обусловленная несовместимостью по антигенам системы резус, в
90% случаев развивается в результате иммунизации D-отрицательной матери
D-положительными эритроцитами плода, и тяжелые случаи течения ГБН в
95% случаев обусловлены антигеном D. Иногда сенсибилизация наступает при
1-й беременности, но чаще после 2-й и/или 3-й, а иногда только после 4-5-й бере¬
менности.
Образующиеся анти-О-антитела считаются преимущественно неполными,
относящимися к иммуноглобулинам G-субклассов IgGl и IgG3. ГБН обычно раз¬
вивается при достижении в организме плода определенного титра антител. Как
правило, при первой беременности накопления антител в достаточном количестве
не происходит, и ребенок рождается здоровым. При повторных сенсибилизи¬
рующих беременностях организм матери реагирует образованием более значи¬
тельного количества антител, которые, проникая в кровеносное русло плода,
вызывают гемолиз эритроцитов и ГБН различной степени тяжести. По данным
разных авторов, во время 1-й беременности частота возникновения ГБН состав¬
ляет 9-10%, при 2-й — 42-49%. В случаях когда 1-я беременность заканчивается
неудачно (самопроизвольные выкидыши, аборты, ГБН, асфиксии и другие при¬
чины, не всегда связанные с изоиммунизацией), при 2-й беременности риск раз-
1122 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
вития ГБН с тяжелым течением, заканчивающимся гибелью плода, значительно
возрастает, достигая 96%.
Колебания в тяжести ГБН, обусловленной анти-В-антителами, различны. При¬
мерно у половины новорожденных ГБН наблюдается в легкой форме, и они не нуж¬
даются в лечении. Около 25% детей рождаются живыми, но если не начать лечение
сразу после рождения, у них развивается ядерная желтуха, заканчивающаяся смер¬
тью подавляющего большинства. У выживших (одного из десяти) наблюдаются
тяжелый гемолиз, анемия, нейросенсорная тугоухость, различная степень умствен¬
ной отсталости. У оставшихся 25% развиваются водянка плода и мертворождение.
Изоиммунизация анти-Б-антителами чаще встречается при АВО-совместимых
эритроцитах матери и плода. По данным Н. Дойчиновой (1964), исследовав¬
шей 100 семей, в которых рождались дети с ГБН, вызванной несовместимостью
по антигену D, в 80 случаях наблюдалось совпадение группы крови по системе АВО.
Поскольку продукция анти-О-антител у матери зависит от времени персистирова-
ния в ее кровеносном русле D-положительных эритроцитов плода, то при АВО-
несовместимости анти-А- и анти-В-антитела матери быстро их лизируют и воз¬
можность иммунизации матери не наступает. Однако при АВО-совместимой
беременности D-несовместимые эритроциты плода находятся в организме матери
достаточное время, вызывая выработку анти-О-антител.
В ряде случаев, хотя и нечасто, встречается образование двух или более видов
антирезусных антител у одной беременной. По своему течению и исходу заболева¬
ния новорожденного эти случаи не отличаются от ГБН, обусловленной образова¬
нием антител одного вида.
Анти-с-антитела вызывают ГБН такой же тяжести, как и анти-Б-антитела, она
также может закончиться водянкой плода и мертворождением.
Анти-Е-антитела не приводят к водянке плода, но при рождении может
развиться тяжелая гипербилирубинемия, требующая заменного переливания
и/или фототерапии.
Анти-С, -Се, -(^-антитела редко вызывают ГБН, требующую лечения после
рождения или во время беременности.
Установить ГБН, обусловленную несовместимостью по антигенам резус и дру¬
гим клинически значимым антигенам, можно, если:
• наблюдается клинически выраженная ГБН;
• сыворотка матери содержит антитела, специфичность которых установлена;
• эритроциты новорожденного несут антиген, против которого есть антитела
у матери;
І прямой АГТ у новорожденного положительный — это доказательство того,
что на эритроцитах есть аллоантитела;
і элюат с эритроцитов новорожденного содержит антитела той же специфич¬
ности, что аллоантитела у матери.
Клинически ГБН проявляется в трех формах:
• гемолитической анемией новорожденного;
• желтухой новорожденных;
І фетоплацентарной анасаркой (или геморрагией).
Гемолитическая анемия новорожденных — это самая легкая форма заболева¬
ния. Ребенок рождается нормальным, но в первые же дни жизни у него разви¬
вается анемия, которая длится 1-2 мес. Развиваются ретикулоцитоз (до 300%),
лейкоцитоз. Значительно увеличиваются печень и селезенка.
Тяжесть течения зависит от степени анемии. Более тяжелые случаи, остающие¬
ся без адекватного лечения, обычно заканчиваются смертью.
При второй форме заболевание развивается стремительно. С первых же часов
жиэии у ребенка нарастает желтуха, возникают эритробластоз, лейкоцитоз, уси¬
ливается анемия. Печень и селезенка увеличены, непрямой билирубин достигает
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ, ОБУСЛОВЛЕННАЯ АПЛОИММУНИЗАЩ»Е1* 1123
ыСоких значений. Наступает дегидратация, усиливаются гемморрагические про¬
дления. Прогноз неблагоприятный, особенно при развитии ядерной желтухи -
тяжелого осложнения с поражением центральных ядер мозга, сопровождающегося
-реиором конечностей, судорогами, рвотой, нарушением дыхания.
фетоплацентарная анасарка развивается чаще всего при 3-й или 4-й беремен¬
ности, когда титр анти-Б-антител достигает очень высоких значений.
В этих случаях, как правило, наступает внутриутробная смерть плода.
Диагноз гемолитической болезни ставят чаще всего во время беременности
и реже после рождения ребенка. Для диагностики ГБН решающее значение имеет
типирование эритроцитов родителей.
Динамический контроль при резус-несовместимой беременности дает ВОЗМОЖ¬
НОСТЬ подготовиться к родам, провести адекватную профилактику и при необхо¬
димости лечение ГБН.
При потенциальной возможности развития ГБН при резус-несовместимой бере¬
менности прибегают к антенатальной профилактике путем введения антирезусно-
го иммуноглобулина.
Обычно вводят до 300 мкг антирезусного иммуноглобулина до 28-й неде¬
ли беременности и также дозу вводят матери после родов, если ребенок
D-положительный. Такая профилактика почти во всех случаях предотвращает
выработку антител.
При отсутствии дородовой профилактики и рождении ребенка с ГБН прибегают
к заменному переливанию крови в первые же часы после родов.
Чем раньше проводят замену крови, тем лучше прогноз. Одно-, а при необ¬
ходимости дву- или троекратное замещение проводят свежей АВО-совместимой
D-отрицательной кровью.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ ПРИ НЕСОВМЕСТИМОСТИ МАТЕРИ
И ПЛОДА ПО АНТИГЕНАМ СИСТЕМЫ АВО
ГБН, обусловленная несовместимостью по системе АВО, может наступить
без определенных иммунных стимулов, так как образование иммунных анти-А-
и/или анти-В-антител класса IgG бывает обусловлено самыми различными фак¬
торами независимо от беременности. Именно поэтому ГБН. обусловленная АВ0-
несовместимостью, может наступить даже при первой беременности, достигая 40%
всех иммунологических осложнений, связанных с групповой несовместимостью.
Это особенно часто наблюдается у матерей с группой крови 0(1) и новорожденных
с группой А (II).
ГБН, обусловленная АВО-несовместимостью, развивается достаточно часто, но
тяжелая форма этого заболевания встречается редко — в одном случае на 3000
родов. Этот факт объясняется тем, что структура антигенов А и В у плода и ново¬
рожденных отличается от таковой у взрослых, поэтому даже при значительном
титре антител небольшое их количество связывается эритроцитами плода. Кроме
того, антигены А и В плода в высокой концентрации растворены в тканях пла¬
центы, плазме крови плода, околоплодных водах, что обеспечивает значительное
ингибирование материнских анти-А- и анти-В-антител, проникающих через
плаценту. Изучение сывороток беременных показало, что почти все они содержат
анти-А- и/или анти-В-антитела, относящиеся к подклассу IgG2. т.е. к тем иммуно¬
глобулинам, которые менее эффективно связываются Fc-рецепторами клеток тка¬
ней плаценты, поэтому даже высокие титры IgG2 анти-А- и/или анти-В-антител
не вызовут тяжелую форму ГБН. Этим объясняется тот факт, что в некоторых
случаях у новорожденных прямой АГТ положительный, а клинической картины
гемолитической анемии не наблюдается. Однако встречаются ситуации, когда
ГБН развивается, а прямой АГТ отрицательный. Это обусловлено присутствием
анти-А- и/или анти-В-антител подкласса IgG3. количество которых может быть
ниже, чем уровень, определяемый в прямом АГТ.
f 124 трансфузионная иммунология
Такий образом, прямой АГТ недостаточно информативен при диагностике ГБН.
обусловленной несовместимостью по системе АВО. Установить ГБН, обусловлен¬
ную АВО-несовместимосгью, можно при условии, что:
• есть клинические проявления ГБН;
І ■ сыворотке матери определяются анти-А- и/или анти-В-антитела, направ¬
ленные против антигенов новорожденного;
I сыворотка матери не содержит антител другой специфичности, кроме ан¬
ти-А и анти-В;
І элюат с эритроцитов плода содержит анти-А- и/или анти-В-антитела.
Одоствует корреляция между активностью антител в элюате и тяжестью ГБН.
Прямой АГТ всегда положительный при тяжелой форме ГБН, когда необ¬
ходимы заменные трансфузии. Существуют данные, свидетельствующие о том.
что АВО-несовместимость между матерью и плодом уменьшает возможность
иммунизации другими антигенами эритроцитов.
Частота распространения в различных популяциях и тяжесть течения ГБН
при АВО-несовместимости различны. Достаточно часто и с более тяжелыми
последствиями это заболевание протекает у детей в странах Юго-Восточной Азии,
Среднего Востока и Африки. В Китае неонатальная смерть плода, обусловленная
ГБН при АВО-несовместимости. достигает 20%.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ ПРИ НЕСОВМЕСТИМОСТИ МАТЕРИ
И ПЛОДА ПО ДРУГИМ ЗРИТРОЦИТНЫМ АНТИГЕНАМ
ГБН. обусловленная анти-Кедл-антителами, встречается реже, чем болезнь,
обусловленная несовместимостью по системам резус и АВО, с частотой 1:10 000-
1:20 000 родов. Анти-К-антитела относятся к IgG субкласса IgGl, реже выявляют¬
ся IgM или IgGl и IgM одновременно.
Первичная иммунизация к антигену К происходит или вследствие трансплацен¬
тарного переноса, или при гемотрансфузиях. У 85% иммунизированных женщин
отмечены в анамнезе трансфузии. Прослеживается прямая корреляция тяжести
ГБН и титра антител. При титре анти-К 1:128 наблюдается тяжелое течение забо¬
левания. При более низких титрах, как правило, наблюдается легкое течение,
однако описаны случаи тяжелого течения ГБН при титре антител 1:8.
ГБН, обусловленная анти-Кидд-антителами, как правило, протекает как забо¬
левание средней степени тяжести. Антитела относятся к субклассам IgG3 или IgGl
и lgG3. Практически всегда антитела иммунные и активируют комплемент.
ГБН, обусловленная анти-Даффи-антителами, относится к случаям со средней
степенью тяжести, хотя описаны единичные смертельные исходы. Антитела отно¬
сятся к субклассу IgGl.
ГБН. обусловленная анти-М-антителами, протекает, как правило, с легкой
или средней степенью тяжести. Редко наблюдается развитие ГБН в сочетании
с гидропсом плода.
ГБН, обусловленная анти-И-антителами, встречается крайне редко.
ГБН, обусловленная анти-S, анти-s- и анти-и-антителами, как правило, про¬
текает в тяжелой форме, иногда со смертельным исходом.
СЕРОЛОГИЧЕСКОЕ ТЕСТИРОВАНИЕ В ПЕРИОД БЕРЕМЕННОСТИ
Для профилактики ГБН проводят обязательное предварительное определение
фенотипа эритроцитов потенциальных родителей. Всем беременным проводят
исследование на наличие специфических антител. При положительном результате
скрининга антитела необходимо идентифицировать. При определенных факторах
риска (несовместимость, при которой Наиболее вероятен риск возникновения
ГБН, например, мать резус-отрицательная, отец - резус-положительный)
необходимо динамическое наблюдение за появлением и изменением титра анти¬
тел (рис. 26-1).
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ. ОБУСЛОВЛЕННАЯ АЛЛОИММУНИЗАЦИЕЙ 1125
При первичном
обращении
(12-16 нед
беременности)
Определение антигенов системы АВО.
резус и скрининг антител
Антитела
Антитела
выявлены к антигенам Rh.
выявлены
Антитела
Определение титра
к антигенам АВО
не выявлены
Определение группы
крови отца ребенка
В период
26-32 нед
Повторное определение фенотипа резус.
Скрининг антиэритроцитных антител
Антитела
выявлены
в НАГТ.
Определение титра
Антитела
не выявлены
в НАГТ
Антитела
не выявлены
Тестирование каждые
2 нед
Определение
антигенов АВО
и резус
новорожденного
РОДЫ
Тестирование эритроцитов
Идентификация
новорожденного
выявленных
в прямом тесте Кумбса
антител
Рис. 28-1. Схема поэтапной серологической диагностики по выявлению иммунных антвдритроцв-
ирных антител при беременности
В многочисленных исследованиях показано, что существует определенная корре¬
ляция между уровнем антиэритроцирных антител в кровеносном русле беременной
И возможным прогнозом тяжести ГБН. Помимо определения титра антител, следует
Учитывать и другие факторы, такие как вид и специфичность антител, к какому клас¬
су и подклассу иммуноглобулинов они относятся. Также следует тщательно собрать
подробный акушерский и трансфузиологический анамнез беременной.
Тестирование на антитела и определение их титра следует проводить неодно¬
кратно в течение беременности. Целью повторного тестирования является ДНЩя
1126 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
мнческнй контроль за изменением титра выявленных антител и возможным появ¬
лением антител другой специфичности.
Антитела, выявляемые только в папаиновом тесте, с очень низкой степенью
вероятности будут принадлежать к классу IgG, и в этом случае не требуется
их титрование и частое динамическое наблюдение.
Некоторые антитела, например анти-Р, анти-М, могут не выявляться в непря¬
мом антиглобулиновом тесте. При подозрении на их наличие следует провести
повторные исследования.
При обнаружении антител в непрямом антиглобулиновом тесте повторные тес¬
тирования необходимо проводить ежемесячно до 28-й недели беременности,
далее - каждые 2 нед.
Изменение титра антител в период динамического наблюдения за беременной
требует правильной интерпретации прогноза возникновения и течения ГБН.
Повышение титра в последние недели беременности свидетельствует о серьезном
поражении плода. При повторных беременностях с резус-несовместимостью плод
может быть значительно поражен, а титр антител останется низким. Снижение
титра в III триместре беременности без профилактического лечения считается
неблагоприятным прогностическим признаком.
Наиболее достоверным методом постановки диагноза и прогноза гемолитической
болезни остается исследование крови плода. Однако это достаточно агрессивная
процедура (смертность плода при этом может достигать 5%), и ее следует применять
в случаях острой необходимости и с предупреждением беременной о риске.
Косвенными прогностическими признаками считаются время появления анти¬
тел и нарастание их титра. Появление антител в срок до 28-й недели заставляет
предполагать возможное тяжелое течение гемолитической болезни, которая
потребует обменного переливания крови у новорожденного.
Антитела, которые вырабатываются в более поздние сроки и в низких титрах,
не вызывают ГБН или определяют легкую форму, не требующую обменного пере¬
ливания крови (табл. 26-1).
Таблица 26-1. Корреляция уровня антител и тяжести гемолитической болезни новорожденных
Уровень анти-О-антител
Форма ГБН
Менее 4 нг/мл (титр 1:16)
Легкая форма, не требующая лечения
4-20 нг/мл
Средней тяжести, возможно, требующая лечения
Более 20 нг/мл
Высок риск возникновения тяжелой формы, требующей адекватного
лечения
При выявлении антител иной (не анти-D) специфичности можно ожидать раз¬
вития ГБН при достижении следующих титров антител:
І 1:32 и выше во всех случаях, за исключением анти-К;
• 1:8 и выше при выявлении анти-К-антител.
Для прогноза течения беременности и возможности развития ГБН значитель¬
ную роль играет использование таких методов, как реакция связывания макрофа¬
гов. моноцитов, антителозависимой клеточно-опосредованной лимфоцитотоксич-
ности и хемилюминесценции.
Большое значение имеет также исследование оптической плотности амниотиче¬
ской жидкости, которое рекомендуют проводить между 27-й и 34-й неделей бере¬
менности в случаях, когда уровень анти-Б-антител более 4 нг/мл или титр антител
в непрямом антиглобулиновом тесте выше, чем 1:16 либо в случаях стремительно-
го нарастания титра антител. Определение оптической плотности амниотическои
жидкости при 450 нм позволяет определить уровень билирубина и тем самым
оценить степень гемолиза. Необходимо, однако, иметь в виду, что анти-К- и анти¬
к-антитела могут приводить к гемолитической болезни, несмотря на нормальные
показатели при тестировании амниотической жидкости.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ. ОБУСЛОВЛЕННАЯ АЛЛОИММУНИЗАЦИЕЙ 1127
Тактика трансфузионного лечения гемолитической болезни
новорожденных
При установлении диагноза гемолитической болезни еще в период беременно¬
сти проводят трансфузии небольших объемов крови через эмбриональную пупо¬
вину после 20 нед беременности. С этой целью переливают свежезаготовленную
эритроцитную массу (до 5 сут хранения) с гематокритом 80. а у новорожденных
с ГБН — с гематокритом 50-60.
Для лечения ГБН применяют внутриматочные трансфузии, обменные или замен¬
ные и простые переливания донорской крови. До их осуществления необходимо уста¬
новить фенотип АВО и резус-принадлежность эритроцитов новорожденного.
Внутриматочные трансфузии антигеннегативных донорских эритроцитов обе¬
спечивают хорошую оксигенацию тканей плода: уменьшается тканевая гипоксия,
сокращаются излишки накопленной жидкости, снижается возможность наруше¬
ния сердечной деятельности.
Цель внутриматочных трансфузий - блокирование собственного эригропозза
плода и сокращение процесса деструкции эритроцитов. Снижение продукции соб¬
ственных эритроцитов и, как результат этого, их меньшая деструкция приводят
к уменьшению размеров печени и селезенки. Для терапии анемии внутриматочные
трансфузии используются до срока беременности 32 нед и/или до готовности лег¬
ких плода справляться с транспортом кислорода. Объем трансфузий вычисляют
по формуле:
количество донорских эритроцитов, мл = (гестацяонный возраст - 20) * 10,
Внутриматочные трансфузии проводят с интервалом 2-3 нед, чтобы компенси¬
ровать рост плода, увеличение объема крови и изменение потребностей в транс¬
порте кислорода. Абсорбция плодом эритроцитов составляет 10 12% в день. Если
внутриматочные трансфузии выполнены правильно, то большинство циркули¬
рующих эритроцитов представлено донорскими клетками. В этом случае учиты¬
вается первичное определение группы крови до проведенных внутриматочных
трансфузий.
Требования к донорской крови
I Эритроциты не должны иметь антигенов, антитела к которым есть у матери,
и должны быть совместимыми с ее сывороткой.
• Доноры должны иметь 0(1) группу или одинаковую с матерью и плодом (если
у них одна группа).
• Доноры должны быть Rh-отрицательными, если ребенок Rh-отрицательный
или при наличии анти-Ц-антител.
• Резус-положительную кровь используют при ее совместимости с антителами
матери.
• Кровь облучают в целях предотвращения реакции «трансплантант против
хозяина».
• Применяют замороженные деглицеринизированные или свежие отмытые
эритроциты с гематокритом 80-90%.
• При использовании материнских эритроцитов необходимо их отмыть
или заморозить и деглицеринизировать для удаления плазмы с антителами.
• Кровь отца и его прямых родственников не применяют из-за наличия анти¬
гена D.
• Донор должен быть негативным по цитомегаловирусной инфекции.
Заменные переливания
Абсолютные показания к заменным переливаниям крови у доношенных детей,
не имеющих факторов риска развития ядерной желтухи:
Н тиожаюжм яммйюлоом
• содержание билирубина в пуповинной крови при рождении более 68 МКМОЛЬ/л;
почасовой прирост сывороточного билирубина более 6 мкмоль/л;
I гнпербилирубинемия более 340 мкмоль/л.
f щщивмныт детей обменное переливание проводят при уровне сыворо¬
точного билирубина 200- 300 мкмоль/л. При наличии у новорожденного более
JfinMDOe риска ядерной желтухи процедуру начинают и при меньшем уровне
ІНЯфубина. Вначале переливают 20 мл альбумина для связывания билиру*
Іт. 3№rm многократно выпускают по 20 мл крови новорожденного и влива¬
ют во 20 мл свежей одногруппной Rh-отрицательной донорской крови (всего
500-600 мл крови донора). Обменное переливание проводят в объеме не менее
2 ОЦК (160-180 мл/кг). Это позволяет заменить 80-85% крови новорожденно¬
го и тем самым снизить гипербилирубинемию. что, в свою очередь, уменьшает
нейротоксическое действие непрямого билирубина (удаляется до 25-35% били¬
рубина). Дли этой же цели эффективным считается ультрафиолетовое облучение
крови (УФО), что в ряде случаев при раннем его применении позволяет избежать
обменных переливаний крови.
Показания к повторному обменному переливанию крови — наличие не менее
двух из нижеследующих признаков:
• нарастание признаков гемолитической болезни;
• почасовой прирост билирубина более 6,8 мкмоль/л;
• нарастание анемии (сохраняющийся гемолиз);
• низкая способность к связыванию альбумина крови (менее 80% при норме
100%).
Определены следующие критические уровни билирубина при ГБН;
• пуповинная кровь - 68 мкмоль/л;
• 24 ч жизни - 172 мкмоль/л;
■ 481 жизни 240 мкмоль/л при резус-конфликте и 270 мкмоль/л при АВ0-
конфликте;
• 4-Й день жизни - 265 и 300 мкмоль/л соответственно.
При АВО-несовместимости к обменным переливаниям крови [кровь 0(1) груп¬
пы. совместимая по резус-фактору] прибегают крайне редко.
Требования к донорской крови
• Для новорожденных с 0(1) группой — цельная кровь 0(1) группы.
• Для новорожденных с группами А. В, АВ — эритроциты 0 группы и плазма
АВ группы.
і При резус-конфликте применяют резус-отрицательную кровь (170—
180 мл/кг) той же группы, что и у ребенка.
• При АВО-конфликте переливают 200-400 мл крови 0(1) группы с низким
титром анти-А- и анти-В-антител.
• При несовместимости и по резус, и по АВО-антигенам переливают кровь 0(1)
группы, так как обычно ГБН возникает по групповым антигенам.
• При конфликте но редким антигенам - использование донорской крови
без этого антигена.
• Донор должен быть негативным по ЦМВ.
Просты! переливания
Простые переливания крови применяют при ГБН для коррекции анемии.
Требования к донорской крови такие же. как и при заменном переливании.
Потребность в эритроцитсодержашей среде вычисляют по формуле:
объем •ритрокитов (мл) - дефицит НЬ * ОЦК + содержание НЬ в трансфузионной
среде.
Тде НЬ выражается а r/л, ОЦК в мл.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ ОБУСЛОВЛЕННАЯ АЛЛОИММУЬ
1129
Во избежание осложнений массивных гемотрансфузий объем переливаемой
крови не должен превышать 60% ОЦК.
Применение плазмафереза в лечении гемолитической болезни новорожденных
Некоторые исследователи рекомендуют плазмаферез (до 20-22 сеансов) во
второй половине беременности. При этом за одну процедуру удаляется до 4 л
плазмы, т.е. 1,5-2 ОЦП. Возмещение этого объема осуществляется донорской
плазмой и белковыми препаратами, что предупреждает возникновение гемодина-
шических расстройств и у матери, и у плода.
Основные задачи лечения ГБН с помощью плазмафереза:
• борьба с асфиксией:
• коррекция ацидоза;
• ликвидация анемии;
• предотвращение гипербилирубинемии;
• элиминация антител против эритроцитов плода или новорожденного.
Если во время беременности не удалось достичь снижения титра антител у мате¬
ри, нет возможности их определения у новорожденного в первые минуты после
родов, рекомендуют провести плазмаферез у новорожденного сразу после родов.
Процедуру осуществляют с максимальным удалением плазмы и замещением уда¬
ленного объема донорской плазмой. Надо иметь в виду, что при удалении плаз¬
мы происходит дилюция. удаление половины ОЦП сразу же вызовет снижение
исходных показателей (например, билирубина) до 30%. Дальнейшая эксфузия
становится малоэффективной. Именно поэтому рекомендуют проводить плазма¬
ферез прерывистым способом (2 раза в день) Между процедурами происходят
выход плазмы из микроциркуляторного русла, внесосудистых пространств, отток
плазмозамещающих растворов в ткани, что вызывает увеличение концентрации
патологических веществ в крови.
Развитие желтухи у новорожденного считается абсолютным показанием
к немедленному плазмаферезу. Если нет возможности его осуществления, прово¬
дят обменные переливания крови.
СПИСОК ЛИТЕРАТУРЫ
Adam S., Bringmann G., Bieringer M. et al. Aa acute haemolync transfusion reaction (AHTR)
due to undetectable anti-Jka , / Vox. Sunguinis XXIX-th international congress of ISBT, Cape
Town, 2006. — 188 p.
Aleksioska K.M. Incidence of HBsAg, anti-HCV and HIV antibodies in Wood donors in OHKI
municipality republic of Macedonia // Vox. Sunguinis XXIXі1, international congress of ISBT, Cape
Town, 2006. — 53 p.
Altman LK. Linking West Nile and transplants may take weeks New York Times. 2002.
Amini Kaft-AB-AD S.. Shame-Reez R.. Ferdofshain F. Delta infection and hepatitis В virus rep¬
lication in Iranian patients with chronic hepatitis В // Vox. Sung. XV* Regional Congress of ISBT,
Greece, 2005. - 90 p.
AuBuchon J, P., Kruskall M.S. Transfusion safety Realigning efforts with risks !/ Transfusioni, -
1997. - Vol. 37. - P. 1211-1216.
Barea L., Cariavate С.. Flores M. et al. Seroprevalence of anti-Tripanasoma crozi m blood donors
coming from Chagas disease endemic countries // Vox. Sang., XXVUF* Congress of the ISBT m
conjunction with the BBTS, 2004, Edinburg. UK. - P. 6.
Berberi E.. Borici N.. Seteri C. The elevated alaninaminotransferasa and hepatitis to blood
donors // Vox Sunguinis XXIX-th international congress of ISBT. Cape Town, 2006, - P. 61.
Bhatia M„ Bonnet D.. Murdoch B. et al. A newly discovered class of human hematopoietic cells
with SCID-repopulating activity fi Nat. Med. - 1998. Vol. 4. - N 10. - 1’ 38 45.
Bove J.R. Transmission-transmitted diseases other than AIDS and hepatitis J. Вюі Meti.
1990. -Vol. 63. - N 5. - P. 347-351.
Boxer LA., Yokoyama М.. Lalesuri P. Isoimmune neonatal neutropenia J. Pediatr - 1972. -
Vol. 80. - P. 783-787.
изо ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Bozkurt G., Blood transfusion in Chronic Hemolytic Anemia // VIII European congress of the
ВТ. - 2003. - P. 63-66.
Brown P. Donor pool size and the risk of blood-borne Creutzfeldt-Jacob disease // Transfusion. -
1998. - Vol. 38-P. 312-315.
Braxmeyer H.E., Cooper S.. Li Z.H. et al. Myeloid progenitor cell regulatory effects of vascular
endothelial cell growth factor, a ligand for the tyrosine kinase receptor Flk-1 // Int.J. Hematol. -
1995. - Vol. 62. - P. 203-215.
Braxmeyer H.E.. Lu L, Cooper S. et al. Flt-3-ligand stimulates/co-stimulates the growth of
myeloid stem/progenitor cells // Exp. Hematol. — 1995. — Vol. 23. — P. 1121-1129.
Braxmeyer H.E. Update: Biomolecule-cell interactions and the regulation of myelo-poiesis. -
Dayton, Ohio: Alpha. Med. Press, 1987. — P. 119-1149.
Budka H. Prions and Transfusion Medicine // Vox Sang, 26th congress ISBT, Vena. — 2000.1
Vol. 78. - 12. g P. 231-238.
Busch M.P. Nat and blood safety: what is paradigm? // Transfusion. - 2000. - Vol. 40. - 1157 p.
Bux J. Human neutrophil alloantigens // Vox. Sang. — 2008. — Vol. 94. — N 4. — 277-285 p.
Cameron Ch.,Reeves J., Antonishyn N. West Nile virus in Canadian donors // Transfusion. -
2005. - Vol. 45. - N 4. - P. 487-491.
Cardoso A.A., Li M.L., Batard P. et al. Release from quiescence of CD34+CD38‘ human umbilical
cord blood cells reveals their potentiality to engraft adults // Proc. Nati. Acad.Sci. USA, - 1993.1
Vol. 90. - P. 8707-8711.
Catalan-Soares B.C., Proetti F.A., Cameiro-Proetti A.B. HTLV-I/II seroindeteterminate blood
donors: epidemiological features in 20 cases of seroconversion // Vox. Sang., XXVIIIth Congress of
the ISBT in conjunction with the BBTS, Edinburgh, UK. — 2004. — 110 p.
Cees Th. Smit-Sibinga. Total Quality Management in Blood Transfusion // Vox. Sang. 26th
Congress of the International Society of Blood Transfusion, Vienna. — 2000. — P. 281-289.
Chang M.H., Chen Ц Universal hepatitis В vaccination in Taiwan and incidence of hepatocel¬
lular carcinoma in children // N.Eng. Med. — 1997. — Vol. 336. — 1885 p.
Chin J. Present and future dimensions of the HIV-AIDS pandemic // Science. — 1992. -
N 44. - P. 33-38.
Cicuttini P.M., Welch K. L, Boyd A.W. The effect of cytokines in CD34 Rh-123 and progenitor
cells from human umbilical cord blood // Exp. Hematol. — 1994. — Vol. 22. — P. 1244-1251.
Cohar H., Amiri A.H.,Mazzong A., Yassin М., Molio М., Salim A.M. Prevalence of transfusion-
transmissible viral infection in first-time blood donors // Vox. Sunguinis XXIXth international
congress of ISBT, Cape Town, 2006. - P. 187.
Cohen B. Parvovirus B-19: an expending spectrum of disease // British Med.J. — 1995. -
Vol. 311. - P. 1549-1542.
Contreras M. Immunomodulatory effect of blood transfusion: on overestimated problem //
European School of transfusion medicine. St. Peterburg. — 1993. — P. 35-41.
Cooling L.W., Kelly K., Barton J„ Hwang D. et al. Determinants of ABH expression on human
blood platelets // Blood. - 2005. - Vol. 105. - N 8. - P. 3356-3364.
Cooper S., Braxmeyer H.E. Clonogenic methods in vitro for the enumeration of granulocyte-
macrophage progenitor cells (CFU-GM) in human bone marrow and mouse bone marrow and
spleen //J. Tissue Culture Methods. — 1991. — N 3. — P. 77-82.
Cooper S., Braxmeyer H.E. Clonogenic methods in vitro for the enumeration of granulocyte-
macrophage progenitor cells (CFU-GM) in human bone marrow and mouse bone marrow and
spleen //J. Tissue Culture Methods. — 1991. — N 3. — P. 77-82.
Cooper S., Braxmeyer H.E. Measurement of interleukin-3 and other hematopoietic growth
factors, such as GM-CSF, G-CSF, M-CSF, erythropoietin and the potent со-stimulating cytokines
steel factor and Flt-3 ligand /,/ Current protocols in immunology. — Vol 1. — N18.
Corbin F. Use of riboflavin for photoinarivation of pathogens in blood components // ft,
Regional Western Pacific Congress International Society of Blood Transfusion. - 2001.
VoL 14. - P. 107-109.
Cristenson P.B.,Grombok K.,Kcarup H.V. Estimated risk of hepatitis С infection through blood
transfusion // Transfusion. - 1998. — Vol. 37. - 38-39 p.
Daniels G. Human blood groups // Medical Research Council Blood group Unit, University
College, London. - 1995. — 876 p.
Decary F„ Verheugt F.W. A., Helden-Henningheim L. Recognition of a non-HLA ABC antigen
present on and T lymphocytes and monocytes only detectable with the indirect immunofluorescence
test // Vox. Sang. - 1982. - Vol. 36. - P. 150-158.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ, ОБУСЛОВЛЕННАЯ АЛЛОИММУНИЗАЦИЕЙ 1131
Deguchi М., Kagita M.,Yamashita N. Comparisons of eight screening tests for anti-HCV anti¬
body // Kansenshogaku Zasshi. — 2002 — Vol. 76 — N 9. - P. 711-720.
Delkamp U„ Beyer J„ Adamo W. Prevalence and incident of HBV, HCV and HIV-markers
among 3.8 міп. blood donations given 774187 donors from 1990-1996 // Infufusionsther
Transfusionsmed. — 1997. — Vol. 24. — 217 p.
Diwan A., Stubbs J., Carnahan G. Transmission of hepatitis A via WBC-reduced RBCs and FFP
from a single donation // Transfusion. — 2003. — Vol. 43. — P. 536-554.
Dollard S.C., Nelson K., Ness P. et al. Possible transmission of human herpesvirus -8 by blood
transfusion in a historical United States Cohort // Transfusion. — 2005. — Vol. 45. — P. 500-503.
Dufand E., Piquet Y„ Danic B. Anty-HBc antibody screening in new blood donors // 5th
Regional (4,h European) Congress of ISBT. — 1995. — P. 141.
Duffo V., Abazaj A., Spahin S., Seferi S. Surveillance of transfusion-transmitted infection in
first time blood donors // Vox. Sunguinis XXIXth international congress of ISBT, Cape Town. -
2006. - P. 48.
Duran C. Transfusion complications in patients with thalassemia // VIII European Congress of
the ISBT. - 2003. - P. 121-123.
Evatt B.L. Prions and hemophilia assessment of risk // Hemophilia. — 1999. - Vol. 4. -
P. 627-63.
FDA (Food and Drug Administration) approves first nucleus acid test (NAT) system to screen
whole blood donors for infection with human immunodeficiency virus (HIV) and hepatitis С virus
(HCV) (Internet) Rockville (MD). — FDA, 2002.
Flegel W.,Wagner F. Molecullar biology of parcial D and weak D: implication for blood bank
practice // Clin. Lab. - 2002. - Vol. 40. - N 4. - P. 428-434.
Fordyce J.A. Some problem in the Pathology of syphilis // Am.J. Med. Sci. - 1915. — Vol.
149. - P. 781-778.
Fuchs D. Markers of immune activation and disease activity in systemic lupus erythematosis //
Lupus. - 1995. - Vol. 4 - P. 29-32.
Fuchs D., Baier-Biterlich G., Hauser A. Neopterin as an immunodiagnostic parameter // Dtsch.
Med. Wochenschr. — 1995. — Vol. 120. — P. 567-570.
Gafter U., Kalechman Y., Sredni B. Induction of a subpopulation of suppressor cells by a single
blood transfusion // Kidney Int. - 1992. - Vol. 41. - N12. - P. 143-148.
Garrozzo G., Monando L., Panino E. et al. Prevalence of HBsAg, HCV, HIV among potential vol¬
untary non remunerated blood donors: twelve years of observation (1994-2005) //Vox. Sunguinis
XXIXth international congress of ISBT, Cape Town. — 2006. — 44 p.
Gerlich W.H. Limitation of HbsAg testing in the screening of blood donors // SoGAT XVI,
Langen 3rd. — 2003.
Gilick D„ Maurer C., Kubanec B. For the study group berufsverbund deutscher transfusions-
mediziner HIV-1,HCV and HBV in blood donors // Infusions-Transfusions med. — 1997. —
Vol. 24. - P. 176-180.
Gonzales М., Regine V., Piccinini V., Hassan H. Incidence of transfusion transmitted virus infec¬
tions in Italy // Vox. Sang., XXVIIIth Congress of the ISBT in conjunction with the BBTS. 11-15
July Edinburg, UK. — 2004. — 23 p.
Goodman C., Chan S., Collinset P. Hevit P.E. Ensuring blood safety and availability in US technologi¬
cal, advances, costs and challenges to apyment // Transfusion. — 2003. — Vol. 43. — P. 434-444.
Goodman, Allaine J.P., Hevit P.E., Tedder R.S. Evidence that anti-HBc but not HBV DNA test¬
ing may prevent some HBV transmission by transfusion // BritJ. Haematol - 1999. - Vol. 107. -
P. 186-195.
Grob P., Jilk W., Bornmark H. Serological pattern anti-HBc alone. Report on a Workshop //J.
of Med. Virology. — 2000. — Vol. 62. — P. 450-455.
Gronoviska A., Gavieda J.,Brojer B. Preliminary results of mini-pool and single donation HBV
DNA screening in Poland // 5th Regional (4th European) Congress of ISBT. — 1995. — P. 94.
Hamerlinr F.F. Neopterin a review// Exp. Dermatol. — 1999. — N8. — P. 167-176.
Hao Q.L., Shah A.J., Thiemann F.T. et al. A functional comparison of CD34' CD38 cells in cord
blood and bone marrow // Blood. — 1995. — Vol. 86. — P. 3745-3753.
Hao Q.L., Zhu J., Price M.A. et al. Identification of a novel, human mulfflymphoid progenitor in
cord blood // Blood. - 2001. - Vol. 97. - P. 3683-3690.
Hecimivic A.. Lupret L.J., Purgaric M. Parvovirus B19 - serological status of plasma donors //
Vox. Sang., XXVIIIth Congress of the ISBT in conjunction with the BBTS. 11-15 July, 2004,
Edinburg, UK. — 103 p.
1 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Utptffck В as an occupational hazard // European occupational health series. - 1994 -
N8. 80 p.
M* Fuchs D.. Rebnegger G.. Hausen A. Neopterin screening and cytomegalovirus
Mood donors // J. Clin. Invest. - 1992. — Vol. 70. - P. 63-65.
:^ІИВмІ P.V. Viral safety of blood transfusion- now and then // llrh Regional Western Pacific
Congress International of blood transfusion. — 2001. — P. 1-5.
JfoBblger F.. Hepatitis В virus // Virology. — New York, 1990. — P. 2071-2236.
ЙЫтяпп В. Neopterin and human immunodeficiency virus infection // Eur. 3 Clin. Chem. Clin
Biochern. - 1993. - Vol. 31. - P. 191-195.
Hsu H.. Lee S.. Wang M. Efficacy of hepatitis В immunization after switching to recombinant
hepatitis В vaccine // Vaccine. - 2001. - Vol. 19. — P. 20-22.
Ivanova N.B.. Dimos J.T.. Schaniel C. et al. A stem cell molecular signature // Science. -
2002. I Vol. 298. - P. 601-604.
Jacobs M.R. Do not bug me: the problem of bacterial contamination of blood components-
cballenges and solution // Transfusion. — 2001. — N 11. — P. 1331-1334.
Jahaba H„ Osihima K., Okajama J. TTV materno-infantible infection - a study on the TTV fre-
“i^Sdencyffl Japanese pregnant women and the natural history of TTV mother-to-infant infection //
Nippon Risho. - 1999. - Vol. 57. - N 6. - P. 1406-1409.
Kalm R.A, Diseases transmitted by blood transfusion // Hum Pathol. — 1983. — Vol. 14. -
N 3. - P. 241-247.
Kalinin D., Janatpour K.. Jensen H.M., Holland P.V. Clinical outcomes of ABO incompatible
red blood cell (RBS) transfusion // Vox Sunguinis XXIX-th international congress of ISBT, Cape
Town, 2-7 September, 2006. — P. 312.
Katsoulidon A.S., Moschidis Z.V., Gialeraki R.E. Clinical evaluation of an HIV-1 and HCV assay
and demonstration of significant reduction of the HCV detection window before seroconversion //
Transfusion. - 2004. - Vol. 44. - N 1. - P. 59-66.
Kitcher A.D. Which agents threaten blood safety in the future? // Clin. Haematol. — 2000. -
Vol. 4. - P. 601-614.
Klansa E.K.. Muzala-Bodan B.M., Korsak J.K. Prevention of transfusion-transmitted bacte¬
rial infections // Vox. Sunguinis XXIX-th international congress of ISBT, Cape Town, 2-7
September. - 2006. - 163 p.
Kleinman S.H., Stramer S.L., Mimms L. Comparison of preliminary observed yield of HCV and
HIV mini pool nucleic acid testing with predictions from the incidence/windows period model //
Transfusion (Paris). - 2000. — Vol. 40. — P. 48-51.
Konecity М., Ehman J.. Bartek J. The level of neopterin in blood serum as one of the possible
prognosis markers of Crohns disease activity // Acta Uriv. Palacki. Olamuc. Fac. Med. — 1996. -
Vol. 140. I P. 47-48.
Krause D.S., Fackler M.J., Civin C.I., May W.S. CD34: Structure, biology and clinical utility //
Blood. 1 1996. - Vol. 87. - P. 1-13.
Kreii! A.A. West Nile Virus: One of the Flaviridae // Presented to the FDA Workshop on
Development of donor Screening assays for West Nile Virus, 5 November. — 2002.
Kuci S.. Wessels J.T., Buhring H-J„ Schilbach K. et al. Identification of a novel class of CD
133+CD 34- peripheral blood cells with SCID-repopulating capacity //Journal Macs and more. -
2003. I Vol. 7.1 І 1. - P. 6-8.
Kuzin S.N., Sadicova N.V., Suslov A.P. et al. Evaluation of the system for controlling the qual¬
ity of the HbsAg detection in the system of screening laboratories // Zh. Microbiol. Epidemiol.
Immunobiol, 12002. - N 3. - P. 52-56.
Laiesari P., Nussbaum М., Gelman S.. Spaet T. Neonatal neutropenia due to maternal immuniza¬
tion // Blood. 1960. - Vol. 15, - P. 236-243.
Lalesari P., Murphy G.R.. Allen F. NB1, a new neutrophil specific antigen involved n pathogen¬
esis of neonatal neutropenia // J. Clin. Invest. — 1971. — Vol. 50. — P. 1108-1115.
Lansdorp P.M.. Dragowska W,, Mayani H. Ontogeny-related changes in proliferative potential
of human hematopoietic cells // J.Exp. Med. - 1993. — Vol. 178. — P. 787-791.
LutKhe S., Elghouzzi M.H. Asso-Bonnet M„ Le Marrec N. et al. Combined detection of
ІШ antibody as an alternative to nucleic acid testing in blood screening//
Sunguinis XV' Regional Congress of ISBT. Europe, Athens. Greece, 2-6 July, 2005. - 21P-
Я Pilotnel J. Residual risk of transfusion- transmitted HIV. HCV and HBV infection
tojhtutt and impact of NAT // Vox. Sanguins, XXVIII1'1 Congress of ISBT, Edinburgh. UK. ~
2004 І Vol. 87.1 і і - 23 p.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ, ОБУСЛОВЛЕННАЯ АЛЛОИММУНИЗАЦИЕЙ 1133
Laver J.H., Abboud M.R., Kawashima I. et al. Characterization of c-kit expression by primi¬
tive hematopoietic progenitors in umbilical cord blood // Exp. Hematol. - 1993. - Vol. 23. -
p 1515-1519.
Lee W.M. Hepatitis В virus infection // N. Engl.J. Med. — 1997. - Vol. 337. — P. 1733 -1745.
Leeuven A., Eemise J.G., Rood J. A new leukocyte group with two alleles: leukocyte group
flve // Vox. Sung. - 1964. - Vol. 9. - P. 431-437.
Walker D.H. Global infectious diseases. — Wien: Springer-Verlag, 1992. — P. 49-74.
Libek V. Prevalence of viral markers among blood donors 1997-2004 j j Vox. Sung. XVй'
Regional Congress of ISBT, Europe, Greece, 2-6 July, 2005. - 99 p.
Lu L., Xiao М., Shen R.N. et al. Enrichment, characterization and responsiveness of single primi¬
tive CD34**+ human umbilical cord blood hematopoietic progenitor cells with high proliferative and
replating potential // Blood. — 1993. - Vol. 81. - P. 41 -48.
Lundberg W.B., Gunniss M.N. Delayed hemolytic transfusion reaction due to anti-A,
Transfusion. — 1975. — Vol. 15. - P. 1-9.
Margreiter R., Fuchs D„ Hausen A.. Simger S. Neopterin as a new biochemical marcer lor
diagnosis of all graft rejection. Experience based upon evaluation of 100 consecutive cases
Transplantation. - 1983. - Vol. 36. - P. 650-652.
Marshal D.A., Kleinman S.H., Wong J.B. Cost-effectiveness of nucleic acid screening of volun¬
teer blood donations for hepatitis B, hepatitis С and human immunodeficiency virus in the United
States //Vox. Sung. - 2004. - Vol. 86. - N 1. - P. 28-40.
Mayani H., Lansdorp P.M. Thy-1 expression is linked to functional properties of primitive
hematopoietic progenitor cells from human umbilical cord blood j j Blood. 1994. Vol. 83.
2410-2417.
McCleland D.B. L., Phillips P. Errors in blood transfusions in Britain: survey of hospital hema¬
tology department // Brit.Med. J. — 1994. — Vol. 308. - N 6938. - P. 1205-1206.
McDonald C. P., Robbins S., Shahran M. Monitoring donor arm disinfections: essential tor
blood safety? // Vox. Sang., XXVIIIth Congress of the ISBT in conjunction with the BBTS. 1115
July 2004, Edinburg, UK. — 6 p.
Mincheff M.S., Meryman Y.N. Mechanisms of immunomodulation following blood transfu¬
sion // V. Regional Congress of ISBT. — 1995. — 247 p.
Moor C.F. Transfusion-transmitted diseases: risk, prevention and perspectives 7 Portugal.
Lisbon, Blood safety Europe. — 1998. — P. 16-21.
Mourant A.E., Kopec A.C., Domanievska-Sohczak K. The distribution of the human blood
groups and other polymorphisms. — 2nd edn. — London: Oxford University press. 1976. — 715 p.
Nash D., Mostashary F., Fine A. The outbreak of West Nile virus in the New York city area in
1999 // N. Engl.J. Med. - 2001. - N 344. - P. 1807-1814.
Nelson K.E., Ahmed F„ Ness P., Donahue J.G. The incidence of post transfusion hepatitis /
New Eng.J. Med. - 1993. - Vol. 328. - N 17. - P. 1280-1281.
Ness P.M. Transfusion medicine: an overview and update // Clin. Ghent. - 2000. - N 8. -
P. 1270-1276.
Nugent P. Achieving donors loyalty - the donation review and service excellence Vox.
Sang. - 2004. - Vol. 87. - N 3. - P. 2-6.
Offergeld R., Faensen D., Ritter S., Hamouda O. Epidemiology of HIV. HCV, HBV and syphilis
infections in blood donors in Germany in 2002 // Vox. Sang., XXVIII* Congress of the ISBT in
conjunction with the BBTS. 11-15 July. 2004, Edinburgh, UK. — P. 24.
Offergeld R., Ritter S., Hamouda O. The risk of transfusion-transmitted intection Trans. Med.
and Hematol. — 2006. — Vol. 33. —P. 130-136.
Ogawa M. Differentiation and proliferation of hematopoietic stem cells // Blood. - 1993. -
Vol. 81. - P. 2844.
Okazaki H.,Watanabe Y.,Mazda T. Reevaluation of TRALI cases based on the recommended
criteria // XVth Regional Congress of the ISBT, Europe. Greece. — 2005. - 13 p.
Opelz G., Sengar D.P. S.. Mickey M.R., Terasaki P. Effect of blood transfusion on subsequent
kidney transplants // Transplant. Proc. — 1973. — Vol. 5. - N 1. - P. 253-258.
Opton S.L., Lu H. Dodd R.Y., Williams A.E. Prevalence of circulating Treponema Pallidum
DNA and RNA in blood donors with confirmed-positive syphilis tests / Transfusion. - 2002 -
Vol. 42. - P. 94-99.
Osawa М., Hanada K., Hamada H.. Nakauchi H. Long-term lymphohematopoietic re-consti¬
tution by a single CD34-low/negative hematopoietic stem cell / Science. - 1996. - Vol. 273 -
P. 242-245.
1134 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
Ouwehand A.J., Balk А.Н.. Baan C.C. Cytomegalovirus infection and all specific cytotoxic activ¬
ity of graft-infiltrating cells after heart transplantation //J.Med. Virology. - 1994. - Vol. 42 _
112.1 P. 175-181.
Pealer LN., Marfin S.. Peterson L. Wilson A. Transmission of West Nile virus through blood
transfusion in the United States in 2002 // N. Engl.J. Med. — 2003. — N 349. — P. 1236-1245.
Pearce S.. Hayward M„ Rowe G. et al. Routine bacterial monitoring of platelets // Vox. Sang.,
XXVIII^ Congress of the ISBT in conjunction with the BBTS. 11-15 July 2004, Edinburgh, UK. —'
27 p.
Pena E.. Thoroougraan М.. Baker D.J. et al. Seroprevalence of human herpesvirus 8 in healthy
blood donors if Vox Sang.. XXVIIIth Congress of the ISBT in conjunction with the BBTS. 11-15
July2004, Edinburgh. UK. - 103 p.
Perti W.A. Infections in heart transplant recipients // Europ. Heart J. — 1993. — Vol. 14. -
N 2. -P. 141-146.
Petersen L.R.. Marfin A.A.. Gubler D.J. West Nile virus // JAMA. - 2003. - Vol. 290. -
P. 524-528.
Phillips R.L. Ernst R.E.. Brunk B. et al. The genetic program of hematopoietic stem cells //
Science. — 2000. — Vol. 288. — P. 1635-1640.
Pineda A.A., Taswell H.F., Brzica S.M. Delayed Hemolytic Transfusion Reaction. An immunol¬
ogy Hazard of blood transfusion // Transfusion. — 1978. — Vol. 18. — N 1. — P. 1-6.
Ponte A.Du., Bidoli E.. Talamini R. Pr-storage leukocyte depletion and transfusion reaction rates
in cancer patients // Transfusion Medicine. — 2005. — Vol. 15. — N 1. — P. 37-44.
Popovsky G.P., Tomanoves K.I., Mena S.M. Iregular antibodies to red cells in patients on
chronic haemodialytis // Vox. Sunguinis XXIX-th international congress of ISBT, Cape Town, 2-7
September. - 2006. - 327 p.
Popovsky M. Transfusion-related acute lung injury // Vox. Sung., XVth Regional Congress of the
ISBT, Europe, Greece. - 2005. — 12 p.
Race R., Sanger R. Blood groups in man // 6th ed Oxford Blackwell Scientific Publication. -
1975.-765 p.
Ramalho-Santos М.. Yoon S., Matsuzaki Y. et al. Sternness: Transcriptional profiling of embry¬
onic and adult stem cells // Science. — 2002. — Vol. 298. — P. 597-600.
Rappold I.. Ziegler B.L., Kohler I. et al. Functional and phenotypic characterization of cord
blood and bone marrow subsets expressing Fit3 (CD 135) receptor tyrosine kinase // Blood. -
1997. g Vol. 90.1 P. 111-125.
Rebulla P.. Modell B. Therapy of thalassemia // Lancet. — 1991. — Vol. 337. — P. 277-280.
Rieben R., Bush J.P., Fluddger E., Nydegger U.E. Antibodies in histo-blood group substance
A and В agglutination titers, Ig class, and IgG subclass in healthy persons of different age catego¬
ries // Transfusion. - 1991. - Vol. 31. - P. 607-6150.
Riger Y. Dodd. Overview of infection deasies // 11th Regional Western Pacific Congress
International Society of Blood Transfusion. — 2001. — Vol. 14. — P. 100-105.
Rios М., Bianco C. The role of blood group antigens in infection disease // Semin. Hematol. -
2000. - Vol. 37. - І 2.1 P. 177-185.
Robillard P., Nawej K.I. Four-year cumulative incidents of serious adverse transfusion events
in the Quebec hemovigilance system // Vox Sung., XVth Regional Congress of the ISBT, Europe,
Greece. - 2005. — P. 13.
Rouger P., Notozat-Pirenne F., Le Pennec P. Haemovigilance and transfusion safety in France //
Vox. Sung 26th Congress of the ISBT, Vienna. - 2000. - P. 287-289.
Rutz M.S., Gable A.R., Kaplan E.N. No Time to lose. Getting more from HIV prevention.
Institute of Medicine Committee on HIV Prevention Strategies in the US. — Washington: National
Academy press, 2001.
Saez-Alquezar A., Otani M.M., Sabino E.C. External serology quality control developed in Latin
America with the support of РАНО from 1997 through 2000 // Rev. Panam. Salud Publica. -
2003. і Vol. 13. - N 2-3. - P. 91-102.
Salmon C., Cartron J.P. Rouger P. The human blood groups. — New York: Masson Publishing,
1984.-543 p.
Salmon L.A.. Schwartzenberg L., Andre R. Anemie Hemolytique Post-Transfusionnelle chez un
sujet A, // Rev. Haematol. - 1982. — Vol. 12. -P. 664-668.
Sayers M.H., Gretch D.R. Recombinant immunoblot and polimerase chain reaction testing in
volunteer whole blood donoTs screened by a multy-antigen assay for hepatitis С virus antibodies //
Transfusion. - 1993. - Vol. 133. - N 9. - P. 809-813.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ, ОБУСЛОВЛЕННАЯ АЛЛОИММУНИЗАЦИЕЙ 1135
Schellenberg Е., Findhammer S., Frank К., Zoehr М., Gansendam G. et al. Epidemiology ot H1V.
HCV and HBV infections in 1.4 million blood donation in the year 2005 // Vox. Sunguinis XXIXа
international congress of ISBT, Cape Town, 2-7 September. — 2006. — P. 197.
Schories М., Peters Т., Rasenack J. Isolation, characterization and biological significant ot hepa¬
titis В virus mutant from serum of patients with immunologically negative HBV infection // J. ot
Hepatology. - 2000. - Vol. 33. - P. 799-811.
Schreiber G.B., Busch M.P., Kleiman S.H. The risk of transfusion-transmitted viral infection //
J. Engl. J. Med. - 1996. - Vol. 334. - P. 1685-1690.
Seifried E. Optimal blood donation screening // British J. Haematol. — 2000. - Vol. 109. -
p. 694-698.
Seifried E.t Roth W. Feasibility, efficacy and economy of NAT testing in Germany // VIII
European congress of the ISBT 2003, Istanbul. - P. 27-28.
Shapiro C.N. Transmission of hepatitis viruses // Ann.Int. Med. - 1994. - Vol. 120. — N 1. —
P. 82-84.
Shiray R.S., Boyd J.S., Parvani A.V. et al. Prophylactic antigen-matched donor blood for patients
with warm autoantibodies: an algorithm for transfusion management // Transfusion. - 2002. -
Vol. 42. - N 11. - 1435 p.
Simmonds P., Holme E.C., Cha T.A., Zycett C. Classification of hepatitis С virus into six major
genotypes and series of subtypes by phylogenetic analysis of the NS-5 region // J. Clin. Viol. -
1993. - Vol. 74. - N 11. - P. 2391-2399.
Simmonds P., Davidson F., Zycett C. Holme E.C. Detection of a novel DNA virus (NDV) in
blood donors and blood products // Lancet. — 1998. - Vol. 352. - P. 191-195.
Smit-Sibinga C.T. Total Quality management in blood transfusion // Vox. Sang.. 26th Congress
of the ISBT. I 2000. Я Vol. 78. - N 2. - P. 281-289.
Stuckey M.F., Osoba D., Thomas J.W. Hemolytic transfusion reaction // Can.Med. Assoc. J. -
1964. - Vol. 90. - P. 739-747.
Tabor E., Epstain J.C. NAT screening of blood and plasma donation; evolution of technology and
regulatory policy // Transfusion. - 2002. - Vol. 42. - 1230 p.
Telen M.J. Erythrocyte blood group antigens: not so simple alter all // Blood. - 1995. -
Vol. 85. - N 2. - P. 299-306.
Tilg H., Margreoter R., Scribo М. 1 Clinical prevention of CMV infection in solid organ trans¬
plantation recipients and its impact on graft rejection and neopterin excretion // Clin. Transpl. -
1987. - Vol. 1. - P. 37-43.
Tilz G., Diez-Ruiz A., Bauer-Bitterlich G., Margreoter R. Soluble receptor for tumor necrosis
factors and neopterin as parameters of cell-mediated immune activation // AC1 Intern. - 1997. -
Vol. 9. - P. 110-118.
Traycoff C.M., Abboud M.R., Laver J. et al. Evaluation of the in vitro behavior of phenotypically
defined populations of umbilical cord blood hematopoietic progenitor cells // Exp. Hematol. -
1994. - Vol. 22. - P. 215-222.
Usida T., Gotoh K., Shicata T. Complete nucleotide sequins and the characteristics of two
hepatitis В virus mutants causing serologically negative acute of chronic hepatitis // Brit.J. Med.
Virol. - 1995. - Vol. 45. - P. 247-252.
Vaziri H., Dragowska W., Allsopp R.C. et al. Evidence for a mitotic clock in human hematopoi¬
etic stem cells: Loss of telomeric DNA with age // Proc. Nati. Acad.Sci. USA. - 1994. - Vol. 91. —
P. 9857-60.
Velkova F., Makanovska-Bojadzieva T. Assessment of inregular red cell alloantibodies in vol¬
untary blood donors. Vox. Sunguinis XXIXа international congress of ISBT, Cape Town. 2-7
September — 2006. — P. 283.
Wachter H„ Fuchs D., Hausen A., Albert J. Neopterin:. Biochemistry-Methods-Clinical applica¬
tion. — Berlin. — 1992. — 135 p.
Willianson L., Cohen H., Love E., Fliser V. The serious hazard of transfusion (SHOT) initiative.
The UK approach to haemovigilance // Vox. Sung. — 2000. — Vol. 78. — N 2. - P. 291-295.
Wood J.J. Vaccines to prevent viral hepatitis // New Engl.J. Med. - 1997. - Vol. 336. - N 3. -
P. 196-204.
Wunters J.L., Pineda A., Goired L.D. RBC alloantibody specificity and antigen potency in Olmsted
Country, Minesota // Arch. Pathol. Lab. Med. - 2001. — Vol. 41. - N 11. - P. 14131421.
Yoshida H, Kato N.. Shiraton Y. 1. Weak association between SEN virus viremia and liver dis¬
use //J. Clin. Microbiol. - 2002. - Vol. 40. - N 9. - P. 3140-3145.
1136 ТРАНСФУЗИОННАЯ ИММУНОЛОГИЯ
ІЛикмІЦ М. Trends in incidence and prevalence of major transfusion-transmissible viral infec¬
tion in Ukrainan /,/ Vo*. Sunguinis XXIXth International Congress of ISBT, Cape Town, 2-7
September. - 2006. — 148 p.
Zanjani E.D., Almeida-Porada G., Livington G. et al. Human bone marrow CD34 cells engraft in
vivo ami undergo muitiiineage expression including giving rise to CD34’ cells // Exp Hematol. —
1998. - Vol. 26. - P. 353-360.
Scos P.M., Zaaxaraki V.. Saltamavros A. et al. Transfusion transmitted diseases in multitrans-
fused patients with hematological malignancies // Vox Sung., XVth Regional Congress of ISBT,
Europe, Greece. 2-6 July. — 2005. - P. 88.
Аграненко B.A., Кавешникова Б.Ф. Трансфузионная медицина — современные проблемы
и перспективы // Гематология и трансфузиология. — 1994. — Т. 39, — №1. — С. 41-44.
Аграненко В.А. Дифференциальная диагностика гемотрансфузионных осложнений //
Вестник Службы крови России. — 2001. — N*1. — С. 17-21
Алексеев Л.П. Биологическая роль системы HLA // Иммунология. — 1985. — №3. —
С. 5-10.
Андреева А.В, Совершенствование подбора совместимости по антигенам эритроцитов
крови, сенсибилизированным и несенсибилизированным реципиентам: Автореф. дис. ...
канд. мед. наук. - 2003. — 23 с.
Афонин Н.И. Исторический очерк развития трансфузиологии в России // Вестник
Службы крови России. — 2002. - N*2. — С. 42-52.
Афонин Н.И. Безопасность трансфузий в лечебной практике // Мат-лы конф. «Актуальные
вопросы гематологии и трансфузиологии». Санкт-Петербург. — 2002. — 225 с.
Афонин Н.И. Клинические и иммуносерологические аспекты профилактики гемотранс¬
фузионных осложнений (к 80-летию Института переливания крови им. А.А. Богданова ГНЦ
РАМН) // Вестник службы крови России. - 2006. — №1. — С. 11-13.
Балаян М.С. Вирусные гепатиты // Новое в трансфузиологии. — 2000. — Вып. 25. -
С 67-74.
Баткаев Э.А.. Галлямова Ю.А.. Енгонянц Г.М. Инфекции, передавамые половым путем,
и репродуктивное здоровье населения // Российский журнал кожных и венерических болез¬
ней. - 2003. - №6. - С. 39-42.
Башлай А.Г. Системы АВО, Rh и Келл-Челлано по данным о первичных донорах
г. Москвы /Др. VII Международного конгресса антропологических и этнографических
наук. - 1964. - С. 32-33.
Бродская А.П., Афонин Н.И. Трансфузионный сифилис проблемы и решения //
Материалы конференции «Клиническая и производственная трансфузиология — единство
целей». - М., 2001. — 47 с.
Васильев Н.И. Модернизированная двухэтапная проба на индивидуальную совмести¬
мость при переливании эритроцитов: Автореф. дис.... канд. мед. наук. — 2002. — 24 с.
Виньон Д. Риск, связанный с переливанием крови // Анестезиология и реаниматоло¬
гия. - 1999. - С, 27-42.
Войлокова Р.Я., Посевая Т.А., Карахан Н.М. Диагностика герпес-вирусной инфекции
у больных с аллотрансплантированными органами //Вопросы вирусологии. — 1993. —
Т. 38. N»5. - С. 214-216,
Воробьев А,И. Трансфузиология в гематологии // Новое в трансфузиологии. — 2002. —
Вып. 30. - С. 5-Ю.
Воробьев А. И. Компонентное донорство // Новое в трансфузиологии. — 2003. —
Вып. 34. - С. 3-12.
Гаврилов O.K. Предмет и задачи трансфузиологии как научной дисциплины и ее место
среди других наук // Проблемы гематологии и переливания крови. — 1973. — Т. 18, №8. -
С. 3-8.
Головкина Л Л. Значение антигенов тромбоцитов в трансфузиологии и педиатрии (обзор
литературы) // Повое в трансфузиологии. - 2000. - Вып. 25. — С. 93-101.
Головкина Л.Л., Зотиков Е.А. Аллоиммунизация к антигенам НРА и HLA у гематологиче¬
ских больных с множественными трансфузиями компонентов крови // Новое в трансфузио¬
логии. - 2003. - Вып. 34. - С. 12-22.
Головкина Л.Л., Стремоухова А.Г., Кутьина P.M. и др. Аллоиммунизация к антигенам
тромбоцитов и иммунологическое обеспечение трансфузиями тромбоцитов сенсибилизиро¬
ванных больных /'/ Новое в трансфузиологии. - 2000. - Вып. 26. — С. 45-54.
Голивкнна Л.Л. Значение антигенов тромбоцитов в трансфузиологии и педиатрии (обзор
литературы) // Новое в трансфузиологии. - 2000. — Вып. 25. — С. 93-101.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ, ОБУСЛОВЛЕННАЯ АЛЛОИММУНИЗАЦИЕЙ 1137
Головкина J1.JI., Зотиков Е.А. Антигены тромбоцитов (обозначения, молекулярные
„сяовы построения, частота встречаемости в популяциях) // Клиническая лабораторная
^гностика. - 2002. - №3. - С. 23-24.33-35.
Головкина ЛЛ.. Зотиков Е.А.. Кутьина P.M., Красникова Н.А. и др. Иммунологическое
обеспечение трансфузиями тромбоцитов гематологических больных // Гематология
„трансфузиология. - 2003. - N*6. - С. 5-15.
Голосова Т.В., Туполева Т.А., Сомова А.В. и др. Оценка риска передачи вирусных инфек-
дой при гемотрансфузиях // Вестник Службы крови России. - 2000, - N»2. - С. 25 - 32.
Голосова Т.В.. Никитин И.К. Гемотрансмиссивные инфекции. — МИА. 2003. - 190 с.
Групповые системы крови человека и гемотрансфузионные осложнения / Под общ. ред.
М.А. Умновой. - М.: Медицина, 1989. - 160 с.
Гузовский Е.В.. Афонин Н.И., Суханов Ю.С. Трансфузии компонентов крови: Рациональ¬
ные подходы // Вестник Службы крови России. - 1999. - №3. - С. 30-36.
Дашкова Н.Г., Рагимов АА. Новые технологии в обеспечении безопасности гемотрансфу¬
зий // Хирург. — 1997. — №41. - С. 5-6.
Дашкова Н.Г., Рагимов А.А. Трансфузионная иммунология научно-практическое
направление трансфузионной медицины//Новое в трансфузиологии. 2004. Вып. 36.
С. 43-51.
Дашкова Н.Г. Система обеспечения иммунологической безопасности гемокомпонентной
терапии: Дис.... д-ра. мед. наук. — 2006. - 247 с.
Дектярева И.Н., Данилова Т.Н. Посттрансфузионные осложнения в ЛПУ России в 1947
1999 годах и меры их профилактики // Вестник Службы крови России. 2001. - N*1.
С. 11-14.
Донское С.И., Пискунова Т.М., Липатова И.С. и др. Случай спонтанного антителообра-
зования к антигенам системы резус (возможный механизм феномена) // Вестник Службы
крови России. — 1998. — №4. — С. 27-29.
Донское С.И. Значение минорных антигенов Келл и с при переливании эритроцитной
массы // Вестник Службы крови России. - 2000. - №2. - С. 2.
Донское С.И.. Липатова И.С. Аллоиммунизация антигенами эритроцитов - глобальный попу¬
ляционный процесс// Проблемы гематологии и переливания крови. - 2001. - №3. - С. 33-39.
Донское С.И., Башлай А.Г., Кравчук О.А. и др. К вопросу о пересмотре концепции имму¬
нологической совместимости эритроцитов // Новое в трансфузиологии. — 2002. - №31. -
С. 58-60.
Донское С.И., Башлай А.Г., Судейкина Н.Н. и др. Современный взгляд на концепцию
совместимой крови // Вестник службы крови России. - 2004. - N*1. - С. 15-24.
Донское С.И. Группы крови системы Rhesus. - М.: Теория и практика. 2005. - 392 с.
Жибурт Е.Б. Профилактика посттрансфузионных гепатитов. - СПб.: Герра Медика.
1998. - 48 с.
Жибурт Е.Б., Шавва С.А. Механизм и дифференциальная лабораторная диагностика
иммунного гемолиза // Трансфузиология. - 2003. - №3. - Т. 4. - С. 91 -94.
Жибурт Е.Б., Попова В.И.. Иванова И.В. и др. Скрининг эритроцитарных антител и дру¬
гие практические вопросы иммуносерологии // Трансфузиология. - 2004. - №4. - С. 72.
Зарецкая В.М. Клиническая иммуногенетика. - М.: Медицина. 1983. - 208 с,
Зарецкая Ю.М., Донское С.И. Новые тенденции в обеспечении иммунологической безо¬
пасности гемотрансфузий // Новое в трансфузиологии. - 1999. - Вып. 24. - С. 7-17.
Земсков А.М., Земская В.М. Ассоциация характера иммунологических расстройств
и их коррекция с антигенами систем АВО при различных заболеваниях 'V Иммунопатология,
аллергология, инфектология. — 1999. - №1. — С. 32-38.
Зотиков Е.А. Антигенные системы человека и гомеостаз. - М.. Наука. 1982 236 с.
Зотиков Е.А, Бабаева А.Г. Путешествие в трансфузнологию. - М., 2002. - 108 с.
Зотиков Е.А. Бабаева А.Г., Головкина Л.Л. Тромбоциты и антитромбошггарные антите¬
ла. — М.: Монолит, 2003. — С. 126.
Инструкция по противоэпидемическому режиму лаборатории диагностики СПИД от
5.06.1990 г. Минздрава СССР.
Инструкция по заготовке и консервированию донорской крови от 29.05.1995 г. Минздра¬
ва РФ.
Инструкция по применению компонентов крови от 25.11.2002 г. Минздрава РФ.
Исаков В.А.. Борисова В.В.. Исаков Д.В. Руководство: Герпес - патогенез и шбвриорияв
диагностика: Руководство. — СПб.. 1999. — 245 с.
tl38 'РАнСФУЗЙОННАЯ ИММУНОЛОГИЯ
lAJB. Терентьева Л л. Статистика выявления антител к вирусу гепатита С среди доно¬
ров краем Российской Федерации // Новое в трансфузиологии. — 2004. — Вып. 38. — С. 29-34.
Кашуггяи В.А., Башлай А.Г. Обследование доноров крови на новые вирусы // Вестник
Службы крови России. - 2001. - N«4. - С. 12-13.
Капуст» В.А.. Башлай А.Г.. Бродская А.П. Вакцинация доноров против вирусного гепа¬
тита В / Вестник Службы крови России. — 2001. — №4. — С. 13-15.
Ким ЮЛ.. Потехин О.Е., Токер М. И. Тест на неоптерин как критерий отбора потенциаль-
иых доноров крови // Лабораторная медицина. — 2003. — N*6. — С. 54-57.
Коваяекко А.В. Вечерко А.В.. Жибурт Е.Б. Аллосенсибилизация при трансфузиях различ¬
има зрюроцитосодержащих сред // Трансфузиология. — 2002. — №2. — Т. 3. — С. 51-58.
Косо» А.И.. Гуменова Н.Н.. Волин М.В. Частота выявления маркеров вирусных инфекций
методом ИФА у безвозмездных доноров // Материалы конференции «Клиническая и про¬
изводственная трансфузиология - единство целей*. — М.. 2001. — С. 55.
Косяков П.Н. Иммунология изоантигенов и изоантител. — М., 1965. — 312 с.
Малышев B.C. Взаимосвязь между серологическими маркерами вирусного гепатита
В и антигенами системы АВО у доноров крови // Иммунопатология, аллергология, инфек-
тология. В 2000. - №4. - С. 99-101.
Методические указания «Организация работы при исследовании методом ПЦР мате¬
риала. инфицированного патогенными биологическими агентами III—IV групп патогенно¬
сти*. В М.. 2004. - 87 с.
Минеева Н.В. Посттрансфузионные гемолитические осложнения (причины, изосероло-
гическая диагностика и профилактика): Пособие для врачей. — СПб.. 1997. — 39 с.
Минеева Н.В., Бодрова Н.Н.. Гордеева Н.Ф. и др. Алгоритмы исследования антигенов эри¬
троцитов и антиэритроцитарных антител в сложнодиагностируемых случаях: Методические
рекомендации. - СПб., 2000. — С. 24.
Минеева Н.В.. Приезжева JI.C., Баховединов Б.Б. и др. Выбор совместимых по антигенам
пар «донор-реципиент* // Материалы научно-практической конференции. Актуальные
вопросы гематологии и трансфузиологии. — СПб., 2000. — С. 246.
Минеева Н.В. Группы крови человека (основы иммуногематологии). — СПб., 2004. — 185 с.
Михайлов М.И. Гепатит G - проблемы изучения // Вирусные гепатиты: достижения
■ перспективы. - 1997. - №1. — С. 3.
Михайлов М.И., Кюрегин К.К. TTV - кандидат в возбудители посттрансфузионного гепа¬
тита / Вирусные гепатиты. - 1999. - №3. — С. 3-9.
Михайлова B.C.., Лукичева Т.Н.. Абрамова И.М. и др. Внутрилабораторный контроль каче¬
ства работы оборудования в микробиологических лабораториях лечебно-профилактических
учреждений здравоохранения: Пособие для врачей. — М.. 2004. — 32 с.
Мовшев Б.Е. Об основаниях трансфузиологии // Новое в трансфузиологии. — 2005. —
Вып. 40.1 С. 14-39.
Насонов ЕЛ.. Самсонов М.Ю., Тилэ Г. и др. Неоптерин: новый иммунологический маркер
аутоиммунных ревматических заболеваний // Клиническая медицина. — 2000. — №8. —
С. 43-46.
Никитин И.К., Голосова Т.В. Платные и первичные доноры крови - факторы высокого
риска гемотрансмиссивных инфекций // Новое в трансфузиологии. — 2001. — Вып. 29. —
С. 33-45.
Овчинникова Е.Н., Сомова А.В. Бондаренко И.А. и др. Выявляемость маркеров гепатитов
В и С у ра.чличных категорий доноров // Материалы конференции «Клиническая и произ¬
водственная трансфузиология - единство целей*. — Москва, 2001. —с. 59.
Оловннкова Н.И. Антигены эритроцитов человека // Материалы конференции «100 лет
открытия К. Ландштейнером групп крови человека». — 2001.
Онищенко Г.Г. Эпидемиологическая обстановка в Российской Федерации и основные
направления деятельности по ее стабилизации // VII Всероссийский съезд эпидемиологов
и паразитологов. - М.. 2002. - С. 56-58.
Руководство по общей и клинической трансфузиологии /Под общ. ред. Б. В. Петровского. -
М.; Медицина. 1979. - 463 с.
Петровский Б.В., Рагимов А.А. Учение о переливании крови: время, проблемы, люди //
Вестник Российской академии наук. - 2001. - Т. 71. — N*9. — С. 806-811.
Покровский В.В.. Юрин Щ.Г., Кравченко А.В. и др. Первый случай ВИЧ-инфекции
ИИДИЙЙМмСССР // Журнал микробиологии. - 1992. — N*11-12. — С. 19-22.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ, ОБУСЛОВЛЕННАЯ АЛЛОИММУНИЗАЦИЕЙ 1139
Покровский В.В. Эпидемиология и профилактика ВИЧ-инфекции и СПИД». - М.:
медицина. 1996. -248 с.
Порешина Л.П. Микровариант реакции лейкоагтлютинации для тнпирования «мтиге*
нов полиморфноядерных лейкоцитов // Проблемы гематологии и переливания кроаи. —
1979. - NB2. - С. 52-53.
Об участии клинико-диагностических лабораторий лечебно-профилактических учрежде¬
ний России в Федеральной системе внешней оценки качества лабораторных исследований.
Приказ Минздравмедпрома РФ №117 от 03.05 1995 г.
О введении в номенклатуру врачебных и провизорских специальностей. Приказ
Минздрава РФ №172 от 29.05.1997 г.
Об утверждении инструкций по иммуносерологии. Приказ Минздрава РФ №2
от 09.01.1998 г.
О порядке обмена информацией между МГЦ СПИД. Городским КВД и Единым донор¬
ским центром Станции переливания крови. Приказ Минздрава РФ №336 от 19.07.1999 г.
О номенклатуре специальностей в учреждениях здравоохранения РФ. Приказ Минздрава
РФ №337 от 27.08.1999 г.
О системе мер по повышению качества клинических лабораторных исследований
в учреждениях здравоохранения Российской Федерации. Приказ Минздрава РФ №45
от 07.02.2000 г.
Об использовании иммуноферментных тест-систем для выявления антител к ВИЧ
в сыворотке крови человека. Приказ Минздрава РФ №292 от 10.07.2001 г.
Об утверждении порядка медицинского обследования доноров крови и ее компонентов.
Приказ Минздрава РФ №364 от 14.09. 2001 г.
О применении в практике здравоохранения иммуноферментных тест-систем для выив
ления поверхностного антигена вируса гепатита В (HBsAg) и антител к вирусу гепатита
С (анти-ВГС) в сыворотке крови человека. Приказ Минздрава РФ №322 от 21.10.2002 г.
Об утверждении отраслевого стандарта «Правила проведения внутрилабораторного
контроля качества количественных методов клинических лабораторных исследований
с использованием контрольных материалов*. Приказ Минздрава РФ №220 от 25.05.2003 г.
О мерах по предупреждению посттрансфузионных осложнений, вызванных антигеном
Келл. Приказ №25 от 19.01.2005 г. Департамента здравоохранения г. Москвы.
Об усилении мер. направленных на снижение риска посттрансфузионных осложнений
Приказ №513 от 29.11.2007 г. Департамента здравоохранения г. Москвы.
Рагимов А.А. Комплексная оценка иммунного статуса лиц с наследственными аномалия¬
ми крови (гемоглобинопатиями и дефицитом фермента Г-6-ФДГ): Автореф. дис.... д-ра мед.
наук, 1988. — 44 с.
Рагимов А.А., Дашкова Н.Г. Трансфузионная иммунология. - М.: Медицина. 2000. - 293 с.
Рагимов А.А. Основные проблемы и задачи отечественной трансфузиологии Вестник
Службы крови России. — 2003. — №1. — С. 3-9.
Рагимов А.А. Основные направления трансфузионной медицины / Медицинская кафе¬
дра. - 2003. - №2. - С. 12-19.
Рагимов А.А. Основные направления деятельности трансфузиологии в России / Новое
в трансфузиологии. — 2004. — Вып. 37. — С. 56-68.
Рагимов А.А., Дашкова Н. Г Основы трансфузионной иммунологии. М.: Медицина.
2004. - 279 с.
Рагимов А.А. Основные направления трансфузиологии. Избранные лекции по трансфу¬
зиологии. — М.: Российский ун-т дружбы народов. 2005. - С. 67-75.
Расницын С.П. Связь доли меченых элементов и меченых групп /, РЭТ-инфо. - 2000. -
№2. - С. 36-38.
Рябцева Э.Н. Опыт проведения иммуногематологических исследований в условиях
городской многопрофильной больницы // Новое в трансфузиологии. — 2004. - Вып. 38 -
С. 71-76.
Санитарные правила СП1.2.731-99 «Безопасность работы с микроорганизмами III—IV
группы патогенности и гельминтами*. — М.. 1999.
Санитарно-эпидемиологические правила СП З.І 958-99 «Профилактика вирусных гепа¬
титов. Общие требования к эпидемиологическому надзору за вирусными гепатитами*. - М .
2000.
Сборник нормативно-методических материалов «ВИЧ-инфекция и СПИД*. - М..
1998. - 103 с.
Н ^МНСФУЭИОИИМИММУМОПОГИЯ
Серова Л.Д.. Войтенко Л.М., Мишина Л.В. Индивидуальный подбор крови и ее компонен¬
тов как метод іфрфияактнки посттрансфузионных осложнений // Профилактика и лечение
— i IJHIIH ф) инпнни осложнений. — Л.. 1980. —С. 26-30.
Серова ЯД. Мятей Г.. Южнев М.Г. и др. Распределение тканевых антигенов у славянских
мартов // Материалы VII Международного совещания по тканевому типированию. - л..
1981. І С Ш.
Скудицкий А.Е. Профилактика посттрансфузионных осложнений, обусловленных груп¬
повыми антигенами эритроцитов: Автореф. дис.... канд. мед. наук. — М., 2001. — 25 с.
Скудицкий А.Е. Некоторые аспекты антиэритроцитарной аллоиммунизации доноров //
Вестник службы крови России. - 2005. — N*3. — С. 7-8.
Сомова АЛ.. Голосова Т.В.. Багрянцева С.Ю. и др. Исследование сывороток крови доно¬
ров на вирусные гепатиты В и С с использованием ИФА и ПЦР // Новое в трансфузиоло¬
гии I 2002. - Вып. 30. - С. 30-38.
Соринсаи СН. Вирусные гепатиты. — СПб., 1997. — 145 с.
Стандарты качества в службе крови НПЦ // ИНТЕЛФОРУМ. — 2005. — 251 с.
Стандарт предприятия. Определение вирусных маркеров в плазме и сыворотке крови доно¬
ров и пациенте». ГНЦ РАМН // Новое в трансфузиологии. — 2003. — Вып. 34. — С. 82-95.
Тананов А.Т. Значение системы HLA в оценке степени риска возникновения и прогноза
заболеваний. Автореф. дис.... д-ра мед. наук. — М„ 1982. — 29 с.
Ткачев В.К. Как классифицируются поколения тест-систем для ИФА // Трансфузиоло-
гмя. - 2003. - N*4. - с 106-107.
Туманов А.К.. Томнлин В.В. Наследственный полиморфизм изоантигенов и ферментов
крови в норме и патологии человека. — М., 1969. — 436 с.
Умнова М. А. Иэоиммунные свойства крови человека и их значение в клинической прак¬
тике: Автореф. дис.... д-ра мед. наук. — М., 1967. — 52 с.
Умнова М.А.. Прокоп О., Пискунова Т.М. Распределение различных факторов крови
у населения Москвы // Тр. VII Международного конгресса антропологических и этнографи¬
ческих наук. - М.. 1968. - С. 496-501.
Умиоаа М.А.. Зотиков Е. А, Скачилова Н.Н. и др. Изоиммунология и вопросы клиники
и лечения гемотрансфузионных осложнений. — М.: Медицина, 1979. — 64 с.
Федоров Н.А., Суханов Ю.С., Асади Мобархан и др. Полимеразная цепная реакция
(ПНР): Метод, пособие. - М.. 19%. - 68 с.
Федоров Н.А.. Елов А.А., Суханов Ю.С. и др. Методическое пособие по генотести-
рованню мини-пулов донорской крови и ее компонентов на вирусы иммунодефицита
человека (ВИЧ), гепатитов В и С методом полимеразной цепной реакции (ПЦР). — М.,
1998. - 48 С.
Федоров Е.Н.. Петухова И.И., Суханов Ю.С. и др. ПЦР детекция ДНК и РНК Treponema
pallidum в крови серопозитивных доноров // Вестник Службы крови России. — 2001. -
■ - С. 42-46.
Федоров Н.А., Черкасов Е.Г., Елов А.А. и др. Взаимодействие лабораторий ИФА и ПЦР
в службе крови // Трансфузиология. — 2003. — №3. — Т. 4. — С. 102-106.
Филатов Ф.И., Голосова Т.В. Общие принципы национальной концепции вирусной
безопасности гемотрансфузий // Гематология и трансфузиология. — М.: Медицина, 2001. -
N*3,1 С. 84-86.
Филина Н.Г., Отто B.C. К вопросу об отмене обязательного обследования донорской
крови на определение активности аланинаминотрансферазы // Новое в трансфузиоло¬
гии. - 2004. - Вып. 36. - С. 88-90.
Фукс Д., Самсонов М.Ю., Вейс Г. Клиническое значение неоптерина при заболеваниях
человека /7 Тер. архив. - 1993. - N*5. - С. 80-87.
Хаитов P.M., Чувиров Г.Н. Иммунопатогенетические аспекты ВИЧ-инфекции
и СПИД // Иммунология. - 1994. - №5. — С. 6-120.
Храмова Л.П.. Бондаренко М.П., Бондаренко И.А. Посттрансфузионные гепатиты. - М.:
ВНИИМИ. 1%9. - 71 С.
Хватов В.Б. Трансфузиология - научная дисциплина и медицинская специальность //
Новое в трансфузиологии. - 2002. - Вып. 33. - С. 5-19.
Чеботкевмч В.Н., Селиванов Е.А. Прионы - новая проблема трансфузиологии // Вестник
Сиябм крови России. - 1999. N»2. - С. 51-57.
Червяков В И. Профилактика посттрансфузионных осложнений, обусловленных анти-
геиами Keil и hr (с): Автореф. дис,... канд. мед наук. — М.. 2000. - 29 с.
РАЗДЕЛ V
ПРОИЗВОДСТВЕННАЯ
ТРАНСФУЗИОЛОГИЯ
I Глава 27. Заготовка плазмы и производство
Ї препаратов крови
Глава 27
Заготовка плазмы
и производство препаратов
крови
ВВЕДЕНИЕ
Из четырех основных направлений: Служба крови, клиническая
трансфузиология, трансфузионная иммунология и производствен¬
ная трансфузиология - только последняя не имеет прямого отно¬
шения к лечебно-диагностической деятельности врача.
Производственная трансфузиология — это раздел трансфузионной
медицины, изучающий и реализующий на практике получение про¬
мышленным способом препаратов и реагентов из донорской крови.
В настоящее время производство альбумина, иммуноглобули¬
нов и факторов свертывания из компонентов донорской крови
(один из основных разделов производственной трансфузиологии)
в России развернуто в крупных центрах крови (СПК). За рубе¬
жом это отдельные крупные производства, перерабатывающие еже¬
годно сотни тонн донорской плазмы от нескольких центров крови.
В нашей стране в ближайшие годы будут построены и запущены
такие производства в Кирове и Москве.
Строго говоря, извлечение компонентов из донорской крови
также необходимо отнести к разделу производственной транс¬
фузиологии, поскольку получение гемокомпонентов — это строго
регламентированная технологическая процедура, не относящаяся
к врачебной лечебно-диагностической деятельности. То же самое
можно сказать и о других производственных процедурах, таких,
например, как вирусная инактивация компонентов крови, полу¬
чение концентрата нативной плазмы (КНП) и криопреципитата
из свежезамороженной плазмы (СЗП), процесс карантинизации
СЗП, заготовка, хранение и размораживание эритроцитной массы
и др. С учетом того, что технологическими процедурами с кровью
или ее компонентами традиционно занимается медицинский персо¬
нал учреждений, где и заготавливается донорская кровь, эти вопро¬
сы рассматриваются в разделе о Службе крови (раздел II, глава 7).
Производственная трансфузиология - один из основных разде¬
лов промышленной трансфузиологии, задача которой состоит в том.
чтобы обеспечивать трансфузиологическую службу всем спектром
необходимого для клинической и лабораторной практики обору¬
дования, расходного материала, реагентов и реактивов, кровезаме¬
нителей и др.
Во всем мире предприятия промышленной трансфузиологии.
производящие кровезаменители, синтетические, биотехнолосш^
1146 ПРОИЗВОДСТВЕННАЯ ТРАНСФУЗИОЛОГИЯ
асие или генно-инженерные препараты крови, реагенты, специальное оборудо¬
вание для трансфузиологических процедур, расходный материал, тест-системы
и др. — отдельные производства, которые административно не связаны с центра¬
ми крови, переработки плазмы на препараты крови, лечебными учреждениями
и лабораторной службой.
Основные задачи производственной и промышленной трансфузиологии:
І разработка актуальных теоретических проблем производства препаратов
из донорской крови:
* производство препаратов из компонентов донорской крови;
ж разработка технологической документации для промышленного производ¬
ства трансфузионных сред;
І производство кровезаменителей:
I разработка методов контроля за трансфузионными средами в процессе
их производства и хранения:
а разработка и производство оборудования и реагентов для Службы крови,
клинической трансфузиологии и трансфузионной иммунологии;
і разработка и производство генно-инженерных и биотехнологических транс¬
фузионных гемопрепаратов.
Выделять направление «производственная (промышленная) трансфузиология»
и рассматривать его в рамках трансфузионной медицины, на наш взгляд, необхо¬
димо, поскольку:
Ж основой производства ряда важнейших для клинической медицины пре¬
паратов остается донорская кровь, и от ее количества и качества напрямую
зависят объемы производства препаратов крови (растворов альбумина,
иммуноглобулинов, факторов свертывания и др.);
я повседневная трансфузиологическая практика нуждается в тех или иных
видах кровезаменителей, оборудовании, реагентах и реактивах, расходных
материалах, которые выпускают предприятия промышленной трансфу¬
зиологии, и только согласованные, научно обоснованные совместные усилия
клинической медицины и медицинской промышленности позволят опреде¬
лять потребности трансфузиологии и поставить задачи по объемам и видам
продукции перед производственной трансфузиологией, которая, в свою оче¬
редь, адаптирует их к нуждам Службы крови, клинической трансфузиологии
и трансфузионной иммунологии.
По мере реализации новой парадигмы «от компонентной гемотерапии к пре¬
паратной трансфузиологии» производство препаратов из донорской крови,
высокотехнологичных синтетических, генно-инженерных, биотехнологических
гемопрепаратов будет организовано на предприятиях промышленной трансфузио¬
логии аналогично с производством современных искусственных кровезамените¬
лей. Очевидно, с течением времени понятия производственной и промышленной
трансфузиологии будут рассматриваться как синонимы.
Вопрос, в какой степени врачу-трансфузиологу необходимо знать особенно¬
сти производственной (или промышленной) трансфузиологии, риторический.
Очевидно, что трансфузиологу достаточно иметь основные представления о базо¬
вых принципах производства препаратов крови из компонентов донорской крови.
Что касается вопросов, связанных с промышленной трансфузиологией (производ¬
ством расходных материалов, реагентов и реактивов для исследования крови, раз¬
личных кровезаменителей), то трансфузиологу не нужно изучать технологические
особенности процесса или схемы производства. Врач-трансфузиолог может огра¬
ничиться тем, что получит нужную ему информацию, пройдя специальные курсы
по освоению нового трансфузиологического оборудования или процедуры.
Интенсивное развитие трансфузиологии и накопление опыта клинического
применения плазмы все чаще приводило ученых к мысли о нецелесообразности ее
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОВИ 1147
^пользования в цельном виде. Успехи белковой химии, появление новых методов
исследования значительно расширили представление о физиологических функци-
л важнейших белков плазмы, их роли в трансфузионной терапии.
Белки плазмы крови выполняют огромное количество функций: обеспечивают
постоянство внутрисосудистого объема жидкости, транспорт различных веществ,
поступающих из желудочно-кишечного тракта в кровь, нейтрализацию и выве¬
дение метаболитов, образующихся в процессе жизнедеятельности. - и все они
направлены на сохранение постоянства внутреннего состава организма.
В составе плазмы выявлено более 100 различных биологически активных сое¬
динений сложного химического состава и строения. При применении современ¬
ных физико-химических методов была выделена большая часть этих белковых
компонентов, установлены их количественное содержание в плазме, относитель¬
ная молекулярная масса, электрофоретическая, биологическая и функциональная
характеристики. В лечебной практике используется лишь незначительная часть
белков, содержащихся в плазме (альбумин, иммуноглобулины, концентрат факто¬
ра VIII и др.). Это связано с технологической и экономической целесообразностью
их выделения в производственных масштабах, возможностью изготовления ста¬
бильных и стандартных лекарственных форм.
Непростой задачей было разработать лекарственные формы белковых фракций,
которые должны быть стерильными и стабильными при хранении. Необходимо
было максимально сохранить физико-химические и биологические свойства, обе¬
спечить вирусную безопасность получаемых препаратов.
К одним из первых исследований по фракционированию белков плазмы
крови следует отнести проведенные в 1887 г. эксперименты английского химика
S. Lewith. Применив различные нейтральные соли, он разделил белки плазмы
и определил условия осаждения глобулинов и альбуминов. В конце XIX в. были
проведены исследования, благодаря которым фракционное осаждение белков
получило дальнейшее развитие и стало использоваться в лабораторных целях,
Mellanby в 1908 г. впервые предложил использовать для разделения плазменных
белков органические растворители.
Первая половина XX столетия ознаменовалась развитием химии белка. Были
разработаны методы и аппаратура для электрофореза, хроматографии, седимен-
тационного анализа ультрацентрифугированием. Одновременно были созданы
иммунохимические методы, которые в сочетании позволили достичь высокой
специфичности и селективности при аналитическом разделении белковых компо¬
нентов.
Тогда же и происходило становление трансфузиологии - области медицины,
основанной на переливании крови и ее дериватов. Уже в 1930-х гг. стало понят¬
но, что далеко не во всех случаях следует переливать только цельную кровь.
Предложение использовать в качестве трансфузионной среды плазму и первый
опыт разделения крови связаны с именем российского ученого-трансфузиолога
А.Н. Филатова (1932). Предложение использовать в качестве трансфузионной
среды плазму стало тем краеугольным камнем, который положил начало получе¬
нию и использованию препаратов крови.
Накопление опыта клинического применения плазмы все чаще приводило
к мысли о нецелесообразности ее использования в цельном виде. Успехи белковой
химии, появление новых методов исследования значительно расширили представ¬
ление о физиологических функциях важнейших белков плазмы, их роли в транс¬
фузионной терапии. Появлялось все больше доказательств прямой зависимости
между лечебным эффектом цельной плазмы и особенностями ее белкового соста¬
ва. Это заставило исследователей искать новые, лучшие пути фракционирования
белков плазмы для направленного использования выделенных компонентов,
сложилось полное основание полагать, что лечебное действие изолированных
-f f 48 ПРОИЗВОДСТВЕННАЯ трансфузиология
и сконцентрированных белков будет превышать терапевтический эффект цельной
плазмы. Кроме того, другим немаловажным аргументом в пользу фракционирова¬
ния были экономические соображения. Таким образом, очевидным становилось
преимущество выделения белковых компонентов плазмы и раздельного их при¬
менения. что давало возможность экономно и бережно использовать уникальный
биологический материал.
Все это объясняет активный интерес исследователей многих стран к поиску
способов разделения белков крови, выделения их фракций и индивидуальных
белковых компонентов, очистки и изучения свойств. С этой целью использовали
известные аналитические методы белковой химии, разрабатывали новые способы
и аппаратуру.
Методы разделения, применяемые в белковой химии для препаративных и ана¬
литических целей, многочисленны и разнообразны. В производственном фракцио¬
нировании применимы лишь некоторые из них, обладающие достаточной произ¬
водительностью и возможностью воспроизведения в условиях крупносерийного
технологического цикла.
Физико-химическую сущность процесса упрощенно можно представить следу¬
ющим образом: в плазме или сыворотке создаются условия, при которых опреде¬
ленная белковая фракция в силу индивидуальных свойств переходит в состояние,
отличающееся от исходного. Наиболее удобно влиять на растворимость белковых
молекул, потому что перевод целевой фракции в нерастворимое состояние или,
наоборот, сохранение искомого белкового компонента в растворе позволяют отде¬
лить его от остальных. Такая технология и лежит в основе фракционирования,
отличаются лишь способы ее осуществления:
• осаждение органическими солями, например сульфатом аммония или суль¬
фатом натрия;
я осаждение органическими растворителями (этанолом, эфиром, хлорофор¬
мом, ацетоном);
• разделение с помощью риванола;
І использование растворимых полимеров, таких как полиэтиленгликоль;
і различные виды ионного обмена с применением катион- и анионобменных
смол, целлюлозы или ионообменников на основе сефадекса;
і препаративный электрофорез;
і гельфильтрация на различных типах сефадекса и сефарозы;
І ультрафильтрация на мембранах.
Цели фракционирования определяются выбором метода, поскольку каждый
принцип разделения обладает преимуществами или недостатками с позиций
конкретно поставленной задачи. Так, например, методы осаждения (в частности,
этанолом) удовлетворяют требованиям крупномасштабного фракционирования,
а ультрацентрифугирование или электрофорез незаменимы при аналитических
исследованиях в силу высокой разрешающей способности. Адсорбцию, ультра¬
фильтрацию, хроматографию включают в комбинированные технологические
схемы как вспомогательные методы или применяют для препаративного выделе¬
ния очищенных белковых фракций.
Осаждение белков из растворов проводят следующим образом: белковая моле¬
кула в растворе находится в непрерывном движении, не образует агрегатов
и не выпадает в осадок, так как несет на себе электрический заряд и окружена
водной оболочкой, и чтобы выделить белок из раствора, необходимо дегидрати¬
ровать и изменить заряд белковой молекулы. Добавление вещества, влияющего
на заряд или на гидратационную оболочку глобулы, может стабилизировать бел¬
ковую систему в растворе или перевести ее в нерастворимое состояние.
Молекула содержит как кислотные, так и щелочные группы, которые, диссоци¬
ируя, определяют ее потенциал. Прибавление кислоты к раствору сопровождается
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПР€ПАРАТОв КРОВИ 1149
увеличением количества положительно заряженных молекул за счет снижения
диссоциации групп, создающих отрицательный заряд. Щелочь, напротив, пода¬
вляет диссоциацию групп, придающих положительный заряд, и вся молекула уве¬
личивает свою отрицательную зараженность. Можно достичь равновесия в дис¬
социации этих групп, и молекула станет нейтральной. Такое состояние молекулы,
при котором количество положительно заряженных групп равно отрицательным,
т е. когда заряд отсутствует, называется изоэлектрическим. В изоэлектрической
т0чке белок обладает минимумом растворимости.
Заряд молекулы можно изменить не только кислотой или щелочью, но и добав¬
лением солей, ионы которых определяют ионную силу раствора. Действие много¬
валентных ионов активнее моновалентных.
Добавление кислоты, щелочи или соли может привести к изоэлектрическо-
му состоянию молекулы белка, но не способно создать условия, необходимые
для осаждения, так как практически не влияет на водную оболочку, препятствую¬
щую агрегации.
Органические растворители (спирт, ацетон, эфир, хлороформ и др.) присоеди¬
няют к своим молекулам воду гидратированной глобулы белка, снижая ее стабиль¬
ность. Кроме того, эти вещества обладают низкой диэлектрической постоянной,
и их добавление снижает диэлектрическую постоянную раствора. Заряд глобулы
тем больше, чем выше диэлектрическая постоянная. Следовательно, неэлектро¬
литы не только дегидратируют молекулу белка, но и уменьшают ею заряд. Любое
полярное вещество, например гликокол, при добавлении к раствору повышает его
диэлектрическую постоянную и соответственно заряд глобулы, увеличивая ста¬
бильность белкового раствора.
Определенную роль играет и температура среды, в которой созданы условия
для разделения белковых компонентов. Это легко показать, изменяя температуру
смеси. Белковые частицы находятся в растворенном состоянии при положитель¬
ной температуре даже в условиях, близких к изоэлектрической точке. Снижение
температуры до отрицательных значений сопровождается изменением агрегатно¬
го состояния и переходом белка в нерастворимую фазу — выпадением в осадок.
Это связано с замедлением движения белковых молекул при низкой температуре,
усиливающим действие преципитирующих факторов.
Таким образом, для направленного воздействия на агрегатное состояние бел¬
ковой молекулы необходимо влиять на диэлектрическую постоянную раствора,
создаваемую всеми присутствующими полярными веществами (спиртом, амино¬
кислотами, белком, водой), pH среды, ионную силу и температуру.
Сочетанием перечисленных факторов, при которых заряд глобулы становится
равен нулю, определяется изоэлектрическое состояние белковой молекулы. Так,
в процессе спиртового фракционирования изоэлектрическое состояние иммуно¬
глобулина будет при pH 6,8-7,0, концентрации белка 0,3-0,5%, ионной силе 0.03-
0,05, концентрации спирта 25% и температуре 5 °С. При таких условиях фракция
иммуноглобулинов обладает минимальной растворимостью.
Изоэлектрического состояния иммуноглобулина можно достичь и при других
условиях, например изменив величину ионной силы и концентрацию белка: pH 7.0,
ионная сила — 0,07, концентрация белка - 3-4%, спирта - 25%. Таким образом,
изоэлектрическое состояние конкретного белка можно получить при различных
условиях.
Белковые компоненты крови довольно близки по своим физико-химическим
свойствам, поэтому условия их разделения отличаются незначительно. Это необ¬
ходимо отчетливо понимать и помнить при технологическом процессе, тщательно
соблюдая все регламентированные требования и режим каждой операции и ста¬
дии. В противном случае избирательности выделения искомых фракций не дост¬
ается. Полученный осадок будет содержать примеси загрязняющих белков.
ЗД ПРОИЗВОДСТВЕННАЯ ТРАНСФУЗИОЛОГИЯ
для удаления которых придется прилагать дополнительные усилия, или, наобо¬
рот, целевая фракция останется в растворе, снизятся выход продукта и эффектив-
ность всего процесса. Кроме того, в конечный препарат попадут белковые приме¬
си, которые ухудшат качество продукции.
К методам производственного фракционирования относятся высаливание
(в основном сульфатом аммония), а также разделение белков с помощью ривано¬
ла, полиэтиленгликоля и органических растворителей (этанола).
Стадийное осаждение белков путем увеличения концентрации солей (высалива¬
ние) считается одним из наиболее мягких методов разделения, практически не при¬
водящим к денатурации белковой молекулы. Использование нейтральных солей
весьма заманчиво для промышленного фракционирования белков, так как не требует
отрицательных температур. В то же время способ имеет слишком много отрицатель¬
ных сторон, поэтому в чистом виде не нашел практического применения. Главным
недостатком считается затруднение освобождения от солей: чтобы удалить, напри¬
мер, сульфат аммония из осадка глобулинов, в котором он находится в концентрации
45%, необходимо провести диализ через полупроницаемые мембраны в отношении
проточной воды в течение 3 сут. Отрицательные стороны не ограничиваются только
необходимостью диализа. Поскольку процесс ведется нестерильно, при положитель¬
ных температурах возникает опасность размножения микрофлоры и повышения
пирогенности продукции. Раствор сульфата аммония обладает бактериостатическими
свойствами только при высокой концентрации — около 50% насыщения.
Разделения белков плазмы можно достичь путем использования минеральных
солей (магния сульфата, натрия хлористого, калия фосфорнокислого, натрия
цитрата и др.), в том числе солей тяжелых металлов. Эти методы находят весь¬
ма ограниченное применение и больше упоминаются в описании теоретических
исследований при поиске оптимальных схем фракционирования.
Избирательного осаждения белков можно достичь, используя органические
катионы. Теоретически можно осуществить фракционирование протамином,
цетилпиридином, триметилтриэтиленом и другими органическими основаниями,
но все они, кроме риванола, денатурируют осаждаемые белки, поэтому практиче¬
ское применение нашел только риванол.
В 1954 г. HorejSi и Smetana сообщили, что все белки, кроме у-глобулина, могут
бьггь преципитированы риванолом в нейтральной или слабощелочной среде.
Однако позже было установлено, что трансферрин и некоторые а-глобулины
также не могут быть выделены риванолом.
Преимуществом метода считается бактерицидность риванола, что исключает
возможность размножения микрофлоры в белковой среде и позволяет вести про¬
цесс при положительной температуре. Недостаток — большие рабочие объемы,
так как во избежание денатурации белков фракционирование проводят 0,4% рас¬
твором риванола, который добавляют к плазме в количестве, превышающем ее
объем в 4 раза.
Риваноловый метод используют в комбинированных схемах фракционирова¬
ния для лабораторного выделения биологически активных белковых компонен¬
тов, содержащихся в плазме в незначительных количествах.
В настоящее время внимание многих исследователей обращено на разработку
технологических схем фракционирования с помощью полиэтиленгликоля (ПЭГ).
Условия осаждения отдельных фракций, подобранные экспериментальным
путем, позволили выделить альбумин, у-глобулин и другие белковые компонен¬
ты. Предложены схемы фракционирования с ПЭГ (относительная молекулярная
масса - 4-6 тыс. Да), позволяющие получать антигемофильный глобулин, фибри¬
ноген. IgG, макроглобулины.
Интерес к этому методу связан с тем, что фракционирование можно прово¬
дить ври положительной температуре, и опасность дена турирующего воздействия
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОВИ 1151
на белки значительно меньше, чем при использовании органических раство¬
рителей. В то же время выявлены и отрицательные стороны метода, ограничи¬
вающие его использование: оказалось довольно сложным найти путь удаления
ПЭГ из конечных растворов белков, приемлемый в производственных условиях.
Удовлетворительной очистки удалось достичь только с помощью ионообменных
смол или осаждения ПЭГ сульфатом аммония при 33% насыщении.
Селективное выделение фракций белков достигается взаимодействием плазмы
крови с нерастворимыми в воде полимерами. В США получен патент на способ
получения сывороточного альбумина с использованием полиэлектролитного
сополимера этилена и ангидрида малеиновой кислоты с дополнительным введе¬
нием диметиламинопропиловых функциональных групп. Блок-сополимер, полу¬
чивший фирменное название «Плюроник», содержит более 50% окиси этилена
и гидрофобное полиоксипропиленовое основание с молекулярной массой не ме¬
нее 950 Да. Количество блок-сополимера изменяется в зависимости от фракции
плазмы, подлежащей выделению, и достигает 20-30%. Осаждение осуществляется
при температуре от 4 до 25 °С. Избирательность выделения белков повышается
при сочетании с традиционными осадителями, или адсорбентами, - глицином,
трикальцийфосфатом и диатомитом. Авторы метода рекомендуют применять его
для получения факторов свертывания — антигемофильного глобулина и протром-
бинового комплекса, выделения групповых субстанций крови.
Фракционирование белков возможно под воздействием температуры на плазму
крови. Этот эффект используют при выделении криоглобулинов — белков, нерас¬
творимых при низкой температуре. Криоосаждение белков, которое наблюдается
при замораживании и оттаивании плазмы, применяют не только для получения
фибриногена, антигемофильного фактора, холодонерастворимых глобулинов,
но и для выделения патологических иммунных комплексов криоглобулинов,
таких как IgG/IgM или IgG/IgA, моноклональных иммуноглобулинов.
Практическое применение нашел метод избирательной денатурации неста¬
бильной части белков плазмы под воздействием высоких температур. Нагревание
плазмы или раствора неочищенного альбумина до 60-80 °С позволяет выделять
альбумин, который благодаря введению стабилизаторов (каприлата натрия, аце-
тилтриптофана) выдерживает нагревание. Нестабильные белковые примеси дена¬
турируются и легко удаляются.
Достаточно четкого и полного разделения сывороточных белков жирны¬
ми кислотами и их солями добиться не удалось. Однако каприловую кислоту
и ее натриевую соль часто применяют как дополнительный фракционирующий
фактор при разделении или очистке белков, выделенных другими методами.
Опубликованы схемы фракционирования с использованием каприловой кислоты
для получения IgG. Каприловую кислоту использовали на первых стадиях очистки
церулоплазмина, оц-кислого гликопротеина, преальбумина.
Методы фракционирования, где используют специфические анионы, металлы
и другие перечисленные выше осадители, конечно, представляют теоретический
интерес, но для практического применения в производстве белковых препаратов
своего места не нашли.
Методы фракционирования, которые могут применяться в производственных
Целях, где необходимо обрабатывать большие объемы плазмы, должны соот¬
ветствовать некоторым условиям: возможности получения однородных и кон¬
центрированных фракций, легкости удаления использованных реагентов, а также
экономической эффективности технологии.
Наиболее полно этим требованиям отвечают методы разделения белковой
системы плазмы органическими растворителями.
Разделение белков плазмы возможно с помощью органических осадителей -
метилового спирта и ацетона. Способ фракционирования плазмы эфиром с выше
1152 ПРОИЗВОДСТВЕННАЯ ТРАНСФУЗИОЛОГ ИЯ
лением у-глобулина и альбумина известен как метод Keckwik. Однако для про¬
изводственных целей эти реагенты абсолютно неприемлемы: метиловый спирт
ядовит, а ацетон и эфир легко воспламеняются, токсическое действие паров этих
веществ представляет опасность для персонала.
Впервые получение белковых препаратов плазмы на промышленной основе
стало возможным в годы Второй мировой войны, когда благодаря исследованиям,
проведенным группой ученых Гарвардской медицинской школы в Бостоне (США),
возглавляемой Е. Коном, были разработаны методы фракционирования белков
плазмы этиловым спиртом.
Из всех изученных органических осадителей только этиловый спирт получил
широкое распространение в производстве препаратов крови. Технология, приме¬
няемая в большинстве стран мира, основана на ставших классическими 5, 6 и 9-м
методах Кона.
Как упоминалось выше, растворимость белков зависит от содержания электро¬
литов. т.е. от ионной силы, создаваемой ионами солей, и специфических электро¬
химических свойств самих белковых молекул. При введении в плазму высоко¬
полярных молекул этанола в значительной степени снижается диэлектрическая
константа раствора, что приводит к усилению взаимодействия белковых частиц,
способствует их переходу в нерастворимое состояние. Кроме того, спирт оказы¬
вает дегидратирующее действие, лишая белковую молекулу стабилизирующей
водной оболочки, что приводит к сближению белковых частиц и их агрегации.
Избирательность осаждения достигается титрованием концентрации водородных
ионов, создающих изоэлектрическое состояние белковой фракции.
Важную роль играет и концентрация белка в растворе: малая концентрация
способствует более точному разделению белковой смеси, тогда как при сильном
разведении труднее сблизить молекулы, привести их к агрегации и выпадению
в осадок.
Метод фракционирования этиловым спиртом (этанолом) используют как базис¬
ный в производстве препаратов крови. Модификации его предусматривают лишь
изменение некоторых параметров процесса. В технологическую схему включа¬
ют дополнительные стадии, позволяющие субфракционировать промежуточные
осадки, или центрифугаты, содержащие смеси белков. Повсеместное признание
этанолового метода связано также с тем, что хорошо изучены его достоинства
и недостатки. Преимуществом метода считаются его хорошая воспроизводимость
при крупномасштабном производстве, сравнительная простота и надежность
удаления этанола, удовлетворительный выход и чистота белков, лекарственные
формы которых представляют коммерческий интерес.
Применяемые модификации направлены на устранение таких недостатков
этанолового метода, как необходимость проведения основного процесса при отри¬
цательной температуре, пожаро- и взрывоопасные условия работы, ограниченное
количество выделяемых фракций. Очевидно, что с хроматографией, ультрафиль¬
трацией, фракционированием полиэтиленгликолем можно связывать будущее
технологии производства препаратов белков крови.
Фракционирование этанолом, как и другими органическими растворителями,
осуществляется при отрицательных температурах, что способствует агрегации
молекул и одновременно предохраняет белок от денатурации.
Изменяя условия процесса, Кону и соавт. удалось создать ряд методов, позво¬
ляющих разделять белковую систему плазмы на фракции и получать компоненты
в изолированном виде. В 1946 г. были опубликованы результаты этих исследо¬
ваний. которые легли в основу технологии выделения из плазмы фибриногена,
иммуноглобулина, альбумина и других белков.
Этот метод с пятидесятилетней историей, хотя и несколько модифицирован¬
ный, остается самым популярным, потому что:
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОВ* 1153
• хорошо отработан и, главное, имеет достоверно подтвержденную вирусную
безопасность;
• одобрен к применению всеми регулирующими организациями, включая FDA
(США);
• используются дешевые, легкодоступные и безопасные химикаты;
• основной преципитирующий агент - этанол легко удаляется в процессе изго¬
товления конечного препарата путем хроматографий, диафильтрации или лио-
филизации, он может быть очищен путем дистилляции и использован вновь.
• во время процесса фракционирования происходит лишь умеренное увеличе¬
ние объема, что считается важным экономическим аргументом;
• присутствие этанола и низкие температуры, необходимые для предотвраще¬
ния денатурации белка, угнетают рост бактерий.
Спиртовое фракционирование, тем не менее, имеет и недостатки;
• выделение альбумина и иммуноглобулинов недостаточно полное, существен¬
ное количество ценного донорского материала теряется,
• биологические функции лабильных компонентов могут быть нарушены
этанолом даже в сравнительно небольшой концентрации и при низкой тем¬
пературе.
Любой новый предлагаемый метод фракционировании должен соперничать
с хорошо известной и зарекомендовавшей себя спиртовой технологией. Основным
критерием для такого сравнения считается способность производить безопасные
и очищенные плазматические лекарственные средства при меньших затратах,
чем алкогольное фракционирование.
Сомнительно, что в ближайшем будущем алкоголь в промышленных техноло¬
гиях будет заменен другими средствами.
Фракционирование адсорбцией. Избирательная адсорбция индивидуальных бел¬
ков на органических и минеральных адсорбентах обычно используется как вспо¬
могательная технологическая стадия в этанольном фракционировании. Адсорб¬
ция, а также сочетанная с этим методом экстракция (элюация) зависят от pH
среды, ионной силы и температуры. Адсорбция может быть применена для очист¬
ки целевого продукта от нежелательных примесей и для извлечения искомого
компонента.
Фракционирование адсорбцией используют для получения иротромбинового
комплекса (PPSB), содержащего факторы свертывания II, VII. IX и X. Чаще всего
для фракционирования применяют следующие адсорбенты (указаны также белки,
выделенные с их помощью):
• аэросил — липопротеины, антиген гепатита В;
• гель гидроокиси алюминия — а- и (J-глобулины, протромбин;
• бария сульфат — С-реактивный белок, протромбин;
• бентониты — С3 (^-С-глобулин), липопротеины, фибриноген, факторы свер¬
тывания крови;
• целлиты — фактор Хагемана;
• трикальций фосфат — протромбин. PPSB.
Электрофоретическое разделение белков — электрофорез - стали применять
в биологической химии после того, как Tiselius создал аппарат для электрофоре¬
тического анализа. Метод основан на свойстве белковой молекулы места положи¬
тельный заряд в кислой среде и отрицательный - в щелочной. Под воздействием
электрического поля молекула перемещается к катоду или аноду со скоростью, мм-
сящей от величины заряда, формы молекулы, молекулярной массы. pH, ионной силы
буфера, характера поддерживающей среды и величины электрического потенциала.
При электрофорезе происходит разделение белковой смеси на отдельные компо¬
ненты, что сопровождается перемещением границы раздела «белок растворитель*
и появлением зон раздела между отдельными фракциями белков.
1154 ПРОИЗВОДСТВЕННАЯ ТРАНСФУЗИОЛОГИЯ
С помощью метода подвижной границы, который в различных описаниях назы¬
вают также фронтальным электрофорезом, свободным электрофорезом, опреде¬
ляют важные характеристики белка, такие как изоэлектрическая точка и подвиж¬
ность (скорость миграции).
Оборудование для воспроизведения метода достаточно дорогостоящее и слож¬
ное по своему устройству, что ограничивает его широкое применение, поэтому
возникла идея использовать для электрофореза специальную поддерживающую
среду, что значительно упрощает методику.
Поддерживающей средой для метода, получившего название зонального электро¬
фореза, могут служить фильтровальная бумага, ацетатцеллюлозная мембрана, крах-
мчилилй или агаровый гель, пористые полиуретаны, полиакриламидный гель и др.
Предложено много модификаций электрофоретического разделения белковых,
пептидных и аминокислотных смесей, направленных на достижение максимальной
разрешающей способности метода и повышение его информативности. Меняются
буферные системы, воздействие электрического поля, поддерживающие среды,
У аппаратура. Среди разнообразия методов следует выделить двухмерный электрофо¬
рез, диск-электрофорез, низко-, средне- и высоковольтный электрофорез, изоэлек-
трическое фокусирование в градиенте плотности на амфолинах, изотахофорез и др.
Все предложенные модификации электрофоретического разделения внесли
заметный вклад в методическую вооруженность исследователей, однако для коли¬
чественного фракционирования они неприемлемы.
Технические возможности, появившиеся в последние годы, возродили интерес
к электрофоретическому разделению. Усовершенствование методов мультимем-
бранной электродекантации, электрофореза в свободном потоке, разработка соот¬
ветствующей аппаратуры сделали приемлемым применение электрофоретическо¬
го принципа для препаративного выделения белковых фракций.
Достоинством этих методов считаются высокая разрешающая способность,
сохранность свойств выделяемых биологически активных компонентов.
Ионообменная хроматография белков. Ионообменники, как известно, представ¬
ляют собой нерастворимый материал, содержащий химически связанные заря¬
женные группы и подвижные разноименные ионы. Подвижные ионы могут быть
замещены другими ионами с тем же зарядом без каких-либо изменений нераство¬
римой матрицы. Если матрица несет положительно заряженные группы, то под¬
вижные ионы имеют отрицательный заряд, и такой ионообменник называется
анионообменником. Если матрица заряжена отрицательно, а подвижные ионы
положительно, то ионообменник называется катионообменником. Нерастворимой
основой матрицы могут служить алюмосиликаты, синтетические смолы, полиса¬
хариды и т.д. Природа матрицы определяет механическую стабильность и про¬
точные свойства ионообменника, а также степень неспецифического воздействия
на белки. Заряженные группы характеризуют свойства ионообменника, определя¬
ют тип и активность ионного обмена. Общее количество групп и их доступность
для обмена также влияют на реакционную способность. Фенолгидроксильные,
карбоксильные и сульфоновые группы используют для формирования катионооб-
менников, алифатические или ароматические — для анионообменников.
Наибольшее распространение в аналитической и препаративной химии
белка нашли ионообменники на основе целлюлозы или декстрана (сефадекса).
Эффективность применения этих ионообменников для разделения щелочных
и нейтральных белков обусловила их применение не только в исследовательских
целях, но и в промышленной технологии.
Наиболее часто используют:
• анионит і диэтиламиноэтилцеллюлозу (ДЭАЭ-целлюлозу);
• катионит - фосфоцеллюлозу (Ф-целлюлозу);
• катионит - карбоксиметилцеллюлозу (КМ-целлюлозу).
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОВИ 1155
Гель-хроматография, или гель-фильтрация, находит все большее примене¬
ние при разделении смесей белков благодаря высокой разрешающей способ¬
ности, а также мягкому воздействию на белки без денатурации. Термин «гель-
хроматография» объединяет способы разделения микрочастиц в условиях сегча-
той структуры геля.
Ситевой эффект наблюдается при диализе через полупроницаемые коллоидные
или целлофановые мембраны, при использовании цеолитов, крахмала, полиакри¬
ламида и других гомогенных гелей. Более эффективное разделение достигается
при хроматографии на гранулированных гелях, где, помимо диффузии вещества
в пределах геля, играет важную роль его поведение в условиях двух фаз — геля
и растворителя.
Гранулы геля с растворителем помещают в вертикальную колонку, на поверх¬
ностный слой наносят разделяемое вещество. При промывании колонки раство¬
рителем микрочастицы поступают в гель, который не препятствует диффузии
небольших молекул, распределяющихся равномерно по всему сечению колонки.
Более крупные молекулы не проникают в гранулы, остаются в окружающем
их слое растворителя и движутся вместе с током жидкости. Крупные молекулы
проходят слой геля с большей скоростью, чем мелкие, движение которых задержи¬
вается в результате диффузии в неподвижную фазу. Скорость продвижения моле¬
кул промежуточных размеров также различна за счет частичного проникновения
их в гель. Таким образом, компоненты смеси элюируются с колонки, заполненной
гелем, в порядке уменьшения их относительной молекулярной массы в соответ¬
ствии со степенью торможения, вызванного диффузией в гранулы геля.
Современные методы молекулярной фильтрации и ионообменной хромато¬
графии на гелях стали вновь интенсивно развиваться после того, как в 1959 г.
шведская фирма Pharmacia выпустила полимер декстрана — сефадекс, полученный
из Leuconostoc mesenteroides путем обработки декстрана эпихлоргидрином.
Гель, образованный из гранул этого полимера, представляет собой простран¬
ственное молекулярное сито, построенное из нитевидных молекул полисахарида
декстрана, соединенных через определенные промежутки поперечными связями.
В зависимости от количества поперечных мостиков и их длины образуются раз¬
личные по размеру ячейки. Типы сефадекса различаются по номерам, которые
соответствуют размеру ячеек: чем больше размер ячеек, тем выше номер типа
сефадекса. Правильный выбор типа сефадекса, т.е. оптимального размера частиц
геля, позволяет достичь достаточно полного разделения веществ, отличающихся
относительной молекулярной массой. Первыми элюируются наиболее крупные
молекулы, затем более мелкие.
В настоящее время фирма Pharmacia выпускает большое количество сефа-
дексов, отличающихся друг от друга частотой поперечных сшивок. Используют
колонки различных размеров. В зависимости от величины колонки и соответ¬
ственно количества сефадекса достигается различная производительность гель-
хроматографии. Большие колонки используют для промышленного получения
чистых белковых фракций.
Некоторые типы сефадексов позволяют исследователю чередовать два раз¬
личных принципа разделения белковых смесей - ионообменный и молекуляр¬
ной фильтрации. Они получаются при введении ионных групп в сефадексы G-25
и G-50 и позволяют разделять такие лабильные вещества биологического про¬
исхождения, как ферменты, гормоны и др. Ионообменные сефадексы обладают
высокой обменной емкостью и низкой неспецифической адсорбцией, обеспечи¬
вают быстрое прохождение жидкости и хорошее разделение смеси белков. Ниже
представлены типы ионообменных сефадексов.
• Анионообменные сефадексы:
❖ QAE — сефадекс, А-25, А-50 (0АЕ-аминоэтил-2-оксипропил-аминоэтил):
1156 ПРОИЗВОДСТВЕННАЯ ГРАНСФУЗИОЛОГИЯ
Ц ДЭАЭ - сефадекс, А-25. А-50 (ДЭАЭ-диэтил-аминоэтил).
І Катионообменные сефадексы:
❖ SP - сефадекс. С-25, С-50 (SP-сульфопропил);
и СМ — сефадекс. С-25, С-50 (СМ-карбоксиметил).
Хроматографию эффективно используют при фракционировании плазмы. Отде¬
ление альбумина от этанола и изоляция комплекса, содержащего фактор IX,
демонстрируют возможность хроматографии. Более новые варианты, в особенно¬
сти аффинная хроматография, вероятно, окажут еще большее влияние на будущее
фракционирования благодаря исключительно возросшей специфичности.
Термин «аффинная хроматография» относится к виду хроматографического раз¬
деления индивидуальных белков и групп белков, основанных на их биологическом
сродстве. Для белков плазмы примером таких хроматографических комплексов
могут быть «атиген-антитело», «фермент-субстрат», «ингибитор-фермент» и др.
Хотя концепция аффинной хроматографии была разработана на малых взаи¬
модействующих друг с другом молекулах, она легко может быть адаптирована
и к большим молекулам типа протеинов. Одним из первых коммерческих при¬
менений стало выделение фактора VII с помощью антител к этому фактору
иди к ассоциированной с фактором VIII молекуле фактора фон Виллебранда.
Использование антител разрешило основную проблему аффинного метода — раз¬
работать лиганды, специфичные для отдельного протеина.
Метод иммуноаффинной хроматографии с использованием моноклонального
антитела, специфичного для фактора VIII: R, применяют при производстве кон¬
центрата фактора VIII: С. присутствующего в плазме в виде комплекса.
Когда фактор VIII: R, входящий в состав криопреципитата, связан в аффинной
колонке с иммобилизованным специфичным моноклональным антителом, его
фиксируют, изолируют и элюируют раствором, содержащим Са2\
Герметично закрытые пластмассовые контейнеры с замороженной плазмой
оттаивают в регулируемых условиях, затем вскрывают и плазму собирают
в одной емкости. Объединенная плазма постепенно размораживается, нераство-
ренная фракция остается в виде осадка (криопреципитата), который отделяют
на центрифугах. Крионреципитат растворяют в водно-спиртовой смеси. В обра¬
зующемся растворе температуру и водородный показатель регулируют до уров¬
ней, необходимых для осаждения фибриногена и растворимых в холодном
состоянии глобулинов. Затем добавляют гидроокись алюминия для удаления
остаточных белков.
Методом ультрафильтрации/диафильтрации проводят концентрирование
и диализ очищенного криосупернатанта для удаления спирта и снижения кон-
цен ірации соли до нужного уровня. Затем добавляют стабилизаторы для защиты
фактора VIII ог денатурирования во время последующей инактивирующей виру¬
сы пастеризации. Пастеризованный раствор разбавляют буферным раствором
для снижения концентрации стабилизирующих добавок и подают на хроматогра¬
фическую колонку. Иммуноаффинная смола в колонке состоит из моноклональ¬
ного антитела, действующего против фактора VIII: R, ковалентно связанного с
твердой фазой (агароза). Комплексное соединение фактора VIII селективно погло¬
щается матрицей посредством связывания фактора VIII: R с моноклональным
антителом, действующим против фактора VIII: R. Затем из колонки выделяется
фактор VIII: С. входящий в состав комплекса фактора VIII, посредством обработки
раствором хлористого кальция. Кальций используют для отделения фактора VIII:
С от фактора VIII: R. Для дополнительной стабилизации элюата, содержащего
чистый фактор VIII: С, к нему добавляют пастеризованный альбумин человека.
После элюирования из колонки следует концентрирование ультрафильтрацией,
в результате чеі о получают высокоактивную очищенную фракцию фактора VIII: С,
которую замораживают для хранения.
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОВИ 1157
Впоследствии замороженные фракции оттаивают в строго регулируемых усло¬
виях и объединяют в количестве, необходимом для дальнейшего процесса очистки
и концентрирования.
фактор VIII: С, элюированный из аминогексильной сефарозной колонки, со¬
держит избыток кальция, поэтому препарат подвергают диализу или диафнльтра-
ции.
Материал подвергают стерильной фильтрации, затем расфасовывают в асепти¬
ческих условиях в стерильные емкости, после чего замораживают и лиофилизи-
руют.
При пастеризации молекулярная структура фактора V1U; С ие претерпевает
изменений, сохраняется 80-90% специфической активности.
Термин «специфическая активность» обозначает ту часть общего содержания
продукта, которая способствует достижению желаемого эффекта. В отношении
концентрата фактора VIII: С специфическая активность определяется по сверты¬
ванию крови. Иммуноаффинный процесс обеспечивает получение высокочистого
продукта со специфической активностью, превышающей 3000 ЕД/мг по обще¬
му белку при отсутствии альбумина в качестве стабилизирующей добавки. Это
соответствует коэффициенту очистки, превышающему 192 000 раз в сравнении
с плазмой. Дополнительная проверка на чистоту посредством жидкостной хрома -
тографии высокого давления показала, что единственным посторонним белком
остается стабилизатор — пастеризованный альбумин. Присутствие альбумина обе¬
спечивает получение концентрата со специфической активностью от 5 до 10 ЕД/мг
по общему белку. После растворения лиофизированного белка препарат представ¬
ляет собой прозрачную и бесцветную жидкость, содержащую в 50-150 раз больше
фактора VIII: С в сравнении с аналогичным объемом плазмы.
«Фаг-дисплей»-технологию можно использовать для создания в короткие сроки
большого количества пептидов или небольшого размера белков на заостренном
конце бактериофага. Поскольку бактериофаги легко выделяются современными
методами, они представляют собой идеальный инструмент для идентификации
искомых пептидов или протеинов для избирательного связывания молекулы
определенного белка плазмы.
Комбинаторная химия представляет собой иной путь приготовления лиганд
для аффинной хроматографии. Вначале изучается взаимодействие целевого белка
с естественной лигандой, например, методом кристаллографии. Затем путем
систематического изменения отдельных химических составляющих (блоков) вос¬
создается контактная поверхность лиганды. Оптимальный вариант тиражируется
химическим синтезом для коммерческого использования. Оба метода используют
последовательно: фаг дисплей - как первый этап выбора лиганд, комбинатор¬
ную химию — для синтетического получения более мелких и более стабильных
лиганд.
Недостатки хроматографических методов заключаются в том, что требуется
значительное разведение белка. По сравнению с почти не увеличивающим объем
пула алкогольным фракционированием здесь необходимо существенное увеличе¬
ние объема в сравнении с начальной порцией плазмы. Более того, при отсутствии
спирта белковые растворы становятся идеальной средой для роста бактерий.
Хроматографические носители дороги, поэтому не могут быть одноразовыми
и нуждаются в стерилизации. Методы физической или химической стерилизации
(высокий pH, агрессивные химикаты, высокая температура) часто несовместимы
со сложными и лабильными, особенно белковыми, лигандами.
При хроматографии частицы жира забивают систему, если только не были
предварительно удалены каким-либо способом.
Хроматография прекрасно дополняет, но не заменяет спиртовое фракциошфо~
вание.
1158 ПРОИЗВОДСШННАЯ ТРАНСФУЗИОЛОГИЯ
Представленная на рис. 27-1 схема технологического процесса считается базис¬
ной. комбинирующей различные методы фракционирования, и в модификациях
применяется в производственных схемах крупнейших мировых производителей
препаратов плазмы.
Свежезамороженная плазма
Хранение
в морозильной
камере при -70*
Ресуслендирование
Центрифугирова¬
ние и фильтрация
Фракционирование.
Преципитация
Фильтрация
на фильтрпрессе
Ресуслендирование
пасты I+IMII
Ультрафильтрация
Преципитация I
Фильтрация
на фильтропрессе
С/Д обработка
Хроматография
Фракция V.
Ресуслендирование
Преципитация II
Получение конечной
рецептуры
Центрифугирование
Ультрафильтрация
Асептическое
наполнение
Хранение -30°
Получение
конечной
рецептуры
Закрывание пробками
и установка
защитных колпачков
Ресуслендирование
Фильтрация в сте¬
рильных условиях
Пастеризация
Асептическое
наполнение
Карантин (32°)
С/Д обработка
Фильтрация в сте¬
рильных условиях
Лиофилизация
Визуальная проверка
Хроматография
Закрывание проб¬
ками И установка
защитных колпачков
Маркировка
и упаковка
Инкубация при pH 4
Карантин (4*)
Выпуск продукта
Ультрафильтрация
Визуальная
проверка
Хранение (4-20°)
Получение конечной
рецептуры
Маркировка
и упаковка
Альбумин
Асептическое
наполнение
Выпуск продукта
Хранение (20*)
Хранение (4*)
ВВИГ
Фактор VII)
Закрывание
пробками
и установка
защитных
колпачков
Карантин (4°)
Визуальная
проверка
Маркировка
и упаковка
Выпуск
продукта
Рис 27-1. Схема технологического процесса производства препаратов плазмы
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОВИ 1159
Появление в 1960 — начале 1980-х гг. революционной ДНК-технологии заро¬
дило надежду и привело к распространению точки зрения, что производство
препаратов плазмы прекратится в течение ближайшего десятилетия. Случаи
передачи ВИЧ препаратами крови это мнение только укрепили. Значительные
ресурсы компаний были направлены на улучшение процессов инактивации виру¬
сов. Наблюдался спад исследований следовых или новых белков плазмы. Однако
техника анализа белков продолжала развиваться благодаря пониманию того,
что плазма служит богатым источником белков, обладающих новыми, пока неиз¬
вестными возможностями терапии.
В табл. 27-1 представлены белки, терапевтический потенциал которых при раз¬
работке соответствующих технологий может быть реализован в лекарственных
препаратах.
Таблица 27-1. Белки плазмы, обладающие лечебным потенциалом
Белок плазмы крови
Показания к применению
Антитромбин III
Тромбоэмболичвские нарушения
Ингибитор C-1-эстеразы
Ангионевротический отек
Инфаркт миокарда
Активированный белок С
Врожденный дефицит
ДВС-синдром
Гемоглобин
Транспорт кислорода
Сепсис
Факторы VI и Vila
Врожденный дефицит
Терапия ингибитора фактора VIII
Фактор X
Врожденный дефицит
Фактор XI
Врожденный дефицит
Фактор XIII
Врожденный дефицит
Апотрансферрин
В сочетании со средствами химиотерапии
Фибрин
Средство доставки лекарств
Гаптоглобин
Лечение ожогов
Маннозосвязывающий белок
Иммунодефицитное состояние
а-Кислый гликопротеид
Противоинфекционное средство
С-реактивный белок
Антибактериальное средство
Гемопексин
Лечение гемолиза
Конечно, этот список нельзя считать законченным: известно большое количе¬
ство белков плазмы, исследование которых продолжается. Все это свидетельствует
о долгосрочных перспективах производства и роста потребности в препаратах
плазмы крови для лечения различных заболеваний.
МИРОВАЯ ПРАКТИКА ЗАГОТОВКИ И ПОСТАВКИ ПЛАЗМЫ
ДЛЯ ПРОИЗВОДСТВА ПРЕПАРАТОВ
Всемирная организация здравоохранения (ВОЗ) сообщает, что только 15%
населения Земли используют 91% всех произведенных в мире лекарственных
средств. Препараты плазмы не исключение. Так, в 2006 г. США. Канада и Европа
использовали 83% полученного из плазмы фактора VIII и почти все рекомбинант¬
ные препараты, около3/. внутривенного иммуноглобулина.
Мировой рынок препаратов плазмы крови составляет 5.8 млрд долларов, 37%
приходится на Северную Америку и 30% — на страны Европы. В то же время насе¬
ление Северной Америки составляет лишь 6,7%. Европы — 12% всего населения
Земли. В России из донорской крови производится лишь несколько препаратов
и реагентов крови (табл. 27-2). Так, в 2007 г. из 506 091,1 л СЗП было произ-
^1
H шввшар iium глеєві тнплппія
меня» errro І| 986.7 я 10% альбумина человека. 85 362 доз иммуноглобулина
чивмка нормального и 33 986 доз внутривенного иммуноглобулина. Несмотря
вв9в vae а 2007 І по ряду препаратов плазмы объемы выпускаемой продукции
по сравнению с предыдущим годом, а целом производство
фЯарвтов крови в России остается на очень низком уровне, не позволяющим
вводной мере удовлетворить потребности клинической медицины.
Совет Международном академии рекомендует развитие национальных центров
переработки плазмы. Доказывается целесообразность строительства производств
вод контролем национальных неправительственных организаций или независи¬
ма производителей. Рекомендуют также создать единый мировой центр, ответ-
I за коммерческое производство препаратов крови.
Шам* ГМ Производство препаратов и реагентов крови в Российской Федерации в 2004-2007 гг.
Шшштштт
Год
2007 к 2008,
%
! 2004
2005
2006
2007
[Альбумин человека 104. я
32 650
31 799
27 952
29 986,7
107
ирвшн, в
1096
668
-
-
j Крмопреципвтвт, ДОЗЫ
297 062
244 487
145106
120 202,5
82,8
| Аминикровии* л
14 610
2096
2085.3
-
—
! ГроМЫ*. дозы
5801
6016
2881
4842
168
[ИнмиюлкАупки человека нормальный. ДОЗЫ
189 068
140 973
132 495
85 362
64,4
Шюрмагяовуми человека антистафилококко-
•ЫЙ. ДОЗЫ
39128
33 710
25 740
32 418
126
Иммуноглобулин человека антирезус, дозы
9811
15 737
17 882
18 676
104,4
Иммуноглобулин человека нормальный для вну¬
тривенного надання дозы
8903
14 883
31 892
33 986
107
Стандартные сыворотки для определения.
групп кроем, п
10 899
10 558
9645,5
8759,9
91
резус фактора, л
1549
1485
1439,9
1037,2
72
стандартных эритроцитов. я
2037
2053
2074,0
2245,7
108
R настоящее время при промышленной переработке плазмы приоритетное
внимание уделяется получению внутривенного иммуноглобулина для лечения
иммунодефицита. По данным на июнь 2006 г., в США резко возросла потребность
в альбумине человека. Дистрибьюторы сообщают об увеличении спроса на аль¬
бумин человека на 20-25% . Аналитики прогнозируют дальнейшее увеличение
потребности в альбумине человека.
Доходность на единицу сырья в производстве препаратов плазмы, составляет
45 против 5% в фармацевтической промышленности. Тенденция сохраняется
ВКяеднме семь лег, несмотря на то что затраты на обследование исходной плазмы
повысились на 40% только один ПЦР-анализ добавляет к стоимости одного
литра плазмы от 5 до 15 долларов. Количество бракованной плазмы значительно
уменьшилось. тем не менее потери составляют около 33 млн долларов в год.
Отмечают, что унификация американских и европейских требований качества
поводила за два последних года снизить стоимость внутривенного иммуноглобу¬
лина на 20 -25%, цена альбумина человека за три года уменьшилась на 50%.
Удовлетворение потребности клиник в препаратах плазмы крови остается нере¬
шенной проблемой В связи с этим предложены следующие направления развития
производства:
I увеличение выпуска высококачественных препаратов плазмы;
• получение из 1 д плазмы не менее 3-4 препаратов;
• эффективное масштабирование производства и развитие конкуренции.
С I по 2006 б объем переработки плазмы в мире увеличился на 1,1 млн л
кроше почти 6.2 млн л • предыдущий 3-летний период. Очевидно, что рост ДОС™
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЯМИМО! пиж» 1191
максимума. В 2006 г. в мире было переработано более 35 млн я плазмы, что почти
0 2 раза больше, чем в 1987 г.
С 1999 по 2006 г. общее количество заводов по переработке плазмы сократилось
С 86 до 80.
• В Европе было закрыто пять заводов (Alfa Biotec, Вегпа. Нешашге. Sevac,
NBTS-Латвия). Некоторые коммерческие и некоммерческие предприятия
прошли процедуру слияния (IS1 и Farma Biagini в Kednon. Le» LU» и LiUe
в LFB). Количество предприятий по переработке плазмы в Европе составило
в 2006 г. 32 против 33 в 1999 г.
• В Северной Америке открылись два новых завода- Medlmmune и Nabi
Закрыт завод Bioport. Количество предприятий эв последние три года увели¬
чилось с 10 до 11.
• В Китае закрыты 4 из 16 учреждений по переработке платы Общее количе
ство производств в азиатском регионе сократилось с 26 в 1999 до 22 в 2006 т
• После закрытия завода в Сан-Пауло (Бразилия) в стране продолжают рабо¬
тать три завода (Нешоре и LIP). В других странах Южной Америки количе¬
ство заводов уменьшилось с 9 в 1999 до 8 в 2002 г,
• Завод CSL Bioplasma (Австралия) остается единственным в регионе
Океании.
• В Южной Африке прекратил работу завод южноафриканского Цен фа пере¬
ливания крови в Йоганнесбург».
Отношение объема переработки плазмы к количеству заводов показывает уве¬
личение среднего объема, что стало результатом консолидации промышленности,
наблюдаемой с 1996 г. (табл. 27-3).
Таблица 27-3. Распределение заводов по объему переработки плазмы
Регион
1987 г,
тыс. л/г
-— Т
■ +
2066 г.
тыс. я/г
Европа
162
MS
Северная Америка
570
1064
Азия
116
tts
В среднем в мире
192
440
Заводы Северной Америки каждый год перерабатывают в среднем около
1 млн л плазмы. Заводы, расположенные в европейских странах, фракционируют
в год в среднем 465 тыс. л. Заводы в странах Азин - 313 тыс. л.
В 2006 г. суммарная мощность заводов по переработке плазмы (35.) мчи д) рас¬
пределялась по регионам следующим образом:
• 14,9 млн л (42%) — Европа:
• 11,1 млн л (32%) — Северная Америка.
• 6,9 млн л (20%) - Азия:
• 2,4 млн л (6%) — другие регионы мира.
В ближайшие годы ожидается увеличение общего объема производства, так
как планируется начать производство препаратов ма заводах Btotrust в Тайване,
запустить предприятия в Греции. Турции. Саудовской Аравии. Инвесторы прояв¬
ляют интерес к существующим заводам по переработке плазмы, планируя дивер¬
сификацию производства, расширение номенклатуры препаратов. Заводы с мздой
мощностью и старым оборудованием, не отвечающие международаым требовани
ям. будут ликвидированы.
С 1999 по 2006 г. количество производств по переработке плазмы, на холящихся
в частной собственности, оставалось неизменным и составляло 45 предприятий
Количество некоммерческих заводов уменьшилось С 41 до 35. или ив 44% облиго
количества. В 2000 г. были проданы два некоммерческих завода (TLB Mopkasma
и DRK Springe, Германия).
ї 112 ЛР0И380ДСТКИНАЯ ТРАНСФУЗИОЛОГИЯ
Коммерческий сектор перерабатывает 27,1 млн л плазмы (77% общего количе¬
ства), некоммерческий - 8 млн л (23%) (табл. 27-4). Фракционирование стано¬
вится все более коммерческим, что показывает динамика за 1987-2002 гг.
Таблиц 27-4 Распределение заводов по переработке плазмы по статусу
Статус
Год
1987,%
2008, %
Коммерческие предприятия
68
77
Некоммерческие предприятия
32
23
С1999 по 2006 г. производственные мощности коммерческого сектора возросли
иа 12%. тогда как в некоммерческом произошло снижение на 18%. Это в основном
связано с изменением статуса и переходом в коммерческий сектор ZLB Bioplasma
(2 млн л) и DRK Springe.
Коммерческий сектор более эффективно использует имеющиеся мощности про¬
изводства. В 1999 г. загруженность коммерческих производственных мощностей
составляла 76% против 79% некоммерческих ввиду временного закрытия в конце
1990-х гг. основных заводов в Северной Америке. К 2006 г. коммерческий сек¬
тор вновь достиг более высоких объемов переработки плазмы (80% мощности),
чем некоммерческий (66%).
С1999 по 2006 г. объем переработанной плазмы увеличился на 4% и достиг 27,1
млн л, что составило 77% общего мирового объема заготовки плазмы (35,2 млн л).
Количество плазмы, специально заготовленной для переработки аферезом, увели¬
чилось с 17,65 млн л в 1999 г. до 18,63 млн л в 2006 г. (69% общего количества пере¬
работанной плазмы). Увеличение составило 5,6% (табл. 27-5; вид плазмы «А»).
Объем плазмы, полученной из цельной крови, увеличился на 0,8% с 8,47 млн
л в 1999 г. до 8,54 млн л в 2006 г. - 31% общего количества (табл. 27-5; вид
плазмы «Б»).
Таблица 27-5. Соотношение видов плазмы, переработанной на препараты
Вид пмши
Год
Рост
2006 г.
к 1999 г., %
1999
2006
тыс. л
% общего
ТЫС. л
% общего
>А»
17 648
66
186 334
69
5,6
«Б»
8471
32
8542
31
0,8
Исвго
26119
100
27175
100
4,0
Примечания: вид плазмы «А* - плазма, заготовленная специально для фракционирования; вид
плазмы «Б* - плазма, выделенная из цельной крови.
В 2006 г. коммерческий сектор переработал 21,84 млн л плазмы, включая 16,04
млн I специально заготовленной плазмы и 5,8 млн л плазмы, выделенной из цель¬
ной крови, Некоммерческий сектор переработал 5,38 млн л плазмы, включая
2,59 млн л специально заготовленной плазмы и 2,74 млн л плазмы, полученной
из цельной крови (табл. 27-6,27-7).
Интерес но проследить динамику использования плазмы *А» и «Б» на протяже¬
нии 20 лет в разных регионах мира (табл. 27-8-27-10).
Самые большие объемы переработки плазмы достигнуты заводами Baxter (4
млн лагод), Aventis Behring (3,5 млн л в год), CSL/ZLB Bioplasma (2,75 млн л в год)
н Вауег (2,5 млн я в год). Octapharma занимает пятое место с объемом переработки
> 2002 г. 1,85 млн I плазмы. Эти пять компаний перерабатывают 14,65 млн л плаз¬
мы і год, или 41% всей плазмы, переработанной коммерческим и некоммерческим
секюрамм. Десять крупнейших коммерческих заводов, включая перечисленные,
составляют 78% мировой индустрии препаратов крови, что говорит о концентра¬
ция промышленной переработки плазмы в мире.
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОВИ 11 S3
Таблица 27-6. Количество и вид плазмы, переработанной коммерческими и некоммерческими
предприятиями
Год
- т
Измвмвмп 1
Предприятия
Вид плазмы
199S
2001
2002 г.
ТЫС. я
% общего
тыс. я
% общего
К1998 г, %
Коммерческие
«А»
14 989
82
16 038
73
0
•Б»
3394
18
5800
37
70.0
Всего
18 383
100
21 838
100
18,8
Некоммерческе
«А»
2659
34
2595
49
-2.4
«Б»
5077
66
2742
52
-46
Всего
7736
100
5337
100
-31
Примечания: вид плазмы «А* — плазма, заготовленная специально для фракционирования: вид
плазмы «Б» — плазма, выделенная из цельной крови.
Таблица 27-7. Мощность переработки и загруженность плазмой крупнейших производителей
препаратов крови
Предприятия
Мощность
Загружай- ]
кость,
тыс. я
% зегру-
жониостя
Производители
тыс. п
% общего
количества
Коммер¬
ческие
Baxter
Aventis Behring
CSL/ZLB Bioplasma
Bayer
Octapharma
Alpha Therapeutic
Precision Pharma
Grifols Instituto
Kedrion
Chegdu Institute of Biolo-gical Products
4050
3500
2750
2500
1850
1600
1600
1300
1200
800
14.9
12.9
10.1
9.2
6.8
5.9
5.9
4.8
4.4
2.9
3450
2700
2450
2350
1450
1600
800
1080
1010
350
85.2
77.1
89.1
94.0
78.4
100.0
50.0
83.1
84.2
43,8
Всего
27.146
100.0
21.838
80,4
Некоммер¬
LFB (Франция)
900
11.2
575
63.9
ческие
Red Cross Plasma Fractionation Center (Япония)
800
Ю.О
90
61.3
Bio Products Laboratory
750
9.4
500
66,7
Red Cross Blood Products
Research institute (Южная Корея)
500
6.2
340
68.0
CAF-DCF CVBA (Бельгия)
473
5.9
473
100.0
Shanghai Blood Products Institute (Китай)
400
5.0
300
75,0
Sanquin CLB
250
3.1
220
88,0
Всего
6811
2898
62.9
Итого в мире
33 957
4435
пл
Таблица 27-8. Соотношение видов плазмы, переработанной в Европе
Предприятия
Вид плазмы
Год
1987 1
1990 |
1993 | 1998
1999
20М ]
Коммерческий сектор
«А»
«Б»
Плацентарная
К W
«•
910
2938
8 I
588
3294
282
3550
648
3772
934
1772
Всего
2770
3856
3892
3832
4420
27W
Некоммерческий сектор
•А»
«Б»
Плацентарная
1783
1330
955
2378
1201
1004
588
3294
1200
3658
1586
648
3772
934
1771
Всего
4068
4583
6588
5244 1 6589
j QJflA
ЯШШ.
Суммарно
*А»
«Б»
Плацентарная
2094
3784
96Q
3288
4139
1012
4425
4855
1200
3940 ! 5449 | 6358
I 5136 1 5560 1 5844
- 1 ‘ -
Всего
6938
8439
10480
1 9076 1 11006 f Й Ж !
Примечания: вид плазмы «А» - плазма, заготовленная специально для фраипкмяфОМИК ММ
плазмы «Б» — плазма, выделенная из цельной крови.
ft|4 ПРОИЗВОДСТВЕННАЯ ТРАНСФУЗИОЛОГИЯ
Мир lip Распределение по регионам производства препаратов плазмы (количество и сум
маркая мощность)
ft*
Регион
Количество
%
Мощность, ТЫС. Л/г
Ж
І1999
!Европа
33
38
12 952
38
j Смирная Америка
10
12
10 887
32
(Азия
26
30
8140
24
І Южная Америка
9
10
601
2
І Океания
1
1
600
2
Средний Восток и Африка
7
8
803
2
[Всего
86
100
33 983
100
ІШ
ІЕерола
32
40
14 890
42
Смирная Америка
11
14
11 042
31
Азия
22
28
6894
20
Южная Америка
8
10
807
2
Океания
1
1
750
2
Средний Восток и Африка
6
8
819
2
Всего
80
100
35 202
100
Таблица 27-10. Региональное распределение заводов по статусу и расчетной мощности
г~ —
Коммерческие
Некоммерческие
Год
Регионы
количество
тыс. л/г
количество
тыс. л/г
1999
Европа
20
7744
13
5208
Северная Америка
9
10 637
1
250
Азия
13
4850
13
3290
Южная Америка
2
110
7
491
Океания
1
600
-
-
Средний Восток и Африка
1
300
6
503
Всего
46
34 241
40
9742
2006
Европа
15
10 854
17
4036
Северная Америка
10
10 792
1
250
Азия
12
4170
10
2724
Южная Америка
3
211
5
596
Океания
1
750
-
-
Средний Восток и Африка
2
369
4
450
1
Всего
43
27146
37
8056
В некоммерческом секторе наиболее крупными заводами считаются LFB,
Франция (0,9 млн л ежегодно), завод по переработке плазмы японского Красного
Креста (0.8 млн л) и Bio Products Laboratory, Великобритания (0,75 млн).
Одиннадцать заводов перерабатывают 66% всей плазмы некоммерческого секто¬
ра, что также свидетельствует о стремлении консолидировать производство.
После слияния ряда компаний промышленность будет еще более сконцентри¬
рована. Aventis Behring и Вауег планируют перерабатывать 6 млн л плазмы в год,
достигнув самой большой мощности в мире. Слияние бельгийской CAF-DCF
CVBA и Sanquin позволит перерабатывать более 700 тыс. л в год.
Таблица 27-11. Количество предприятий, выпускающих различные препараты плазмы
Препараты плазмы
Количество предприятий
I Альбумин человека
73
Шш человека нормальный для внутримышечного введения
32
[иммуноглобулин ШИ нормальный для внутривенного введения
43
[Фактор свертывания крови VHI
38
Фактор свертывания крови IX
29 і
Гяяериимуииые иммуноглобулины
36 _
■ШКгажЯ Ю
12 XJ
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАШС® ш»й 11S5
Существует всего несколько предприятий, изготавливающих весь спектр пре¬
паратов плазмы. Такие компании, как Cangene, Precision Pharma. Aventis Pasteur.
Nabi, Medlmmune и Ortho Clinical Diagnostics, не выпускают готовый адъбушш
человека, производят промежуточное фракционирование и передают палуфа-
брикат на другие заводы (Precision Pharma). Ряд заводов выпускает только ода»
или несколько иммуноглобулинов. 43 завода изготавливают внутривенный имму¬
ноглобулин, 38 — фактор VIII. 29 — фактор IX. Гипериммунные иммуноглобулины
выпускают 36 предприятий, 12 - антитромбин III, 31 - а^антитриисин или инги¬
битор эстеразы С1 (табл. 27-11).
Количество плазмы, поставляемой для фракционирования, в среднем состав¬
ляет от 9 до 30 л на 1000 жителей. Шесть стран (Бельгия. Дания. Германия.
Люксембург, Нидерланды и Швеция) из 30 (20%) сообщают о 17 л и более на 1000
жителей (табл. 27-12).
Так, например, Служба крови Чехии поставляет плазму на Immuno (Австрия)
и Griffols (Испания). Венгрия поставляет плазму на Behrmgwerke (Германия),
Польша практикует контрактное фракционирование плазмы на Octaphanaa,
Immuno и Behringwerke. Румыния посылает плазму на переработку в Итальянский
институт сывороток и вакцин, Словения заключила контракт с Octapharrna.
Словакия перерабатывает плазму в Австрии (Immuno).
Таблица 27-12. Заготовка плазмы для трансфузий и производства препаратов в страмах мира.
Плазма для фракционирования
Плазма для трансфузий, дез
иа 1000 населения
Страна
Л
л на 1000 населения
Армения
9049
2,82
1.39
Австрия
59 721
7,31
10,89
Бельгия
207 444
20,74
9.83
Босния и Герцеговина
-
- !
6,22
Болгария
10 833
1,36
10.87
Хорватия
17 575
3.96
21.03
Чехия
79 000
7.67
16,60
Дания
86 751
17,35
12.15
Македония
4784
2.17
.
Финляндия
725 000
13,89
8.25
Франция
576 272
9.57
4.41
Грузия
1000
0,20
4.80
Германия
2 484 216
30,10
15,81
Греция
19 557
1.86
1489
Исландия
0
0
15.08
Ирландия
-
f
5.86
Италия
529 000
9.28
8.83
Латвия
18 469
8.03
20.86
Люксембург
7652
17.59
8,56
Нидерланды
310 449
19,17
6.89
Норвегия
49 824
10,89
8.67
Польша
134 796
3.50
9,24
Румыния
-
-
7.66
Сербия и Черногория
-
-
М.24
Словакия
16 484
3,11
3,63
Словения
10 959
5.58
16,63
Швеция
198167
22.08
13.41
Швейцария
73 474
9.98
11.03
Украина
84 844
1.79
0.42
Великобритания
0
0
6.42
В 1987 г. только 5 из 37 коммерческих организаций перерабатывали «поп*
трактную» плазму в количестве 1 млн л. 9 из 53 некоммерческих производств
получали такую плазму в объеме 0,3 млн л (табл. 27-13). В 2006 г. объем пере¬
работки «контрактной» плазмы 14 коммерческими заводами достиг 16.8 млн л. 8
некоммерческих производителей использовали для фракционкропммя 1 «впал.
і і if произаодствотыя трансфузиология
Самые бояьшие объемы поставки плазмы по контрактам были у Bayer, Biotest
i Nabi в коммерческом секторе и у заводов японского Красного Креста в неком¬
мерческом.
Фракционирование плацентарной сыворотки в Европе до 1996 г. осуществля¬
лось только во Франции фирмой «Мерье». После решений ВОЗ и других междуна¬
родных директивных организаций производство альбумина и иммуноглобулина
из плацентарной крови было прекращено.
Таблица 27-13. Контрактное фракционирование
j щ
Фракционирование
Коммерческое
Некоммерческое
количество
%
количество
%
11967
Я
5
14
9
15
Нет
32
86
53
85
Всего
37
100
62
100
Тыс. л
1000
300
1999
Да
12
26
11
28
I
Нет
34
74
29
73
Всего
46
100
40
100
Тыс. л
2806
1271
12006
Да
14
32
8
22
Нет
30
68
28
78
Всего
44
100
36
100
} ■
гыс. л
16 787
1065
Распределение видов плазмы, используемой для производства препаратов
в основных регионах мира, представлено в табл. 27-14.
Таблица 27-14. Фракционирование плазмы в разных регионах мира
Регион
Сектор
Вид
Год
1987
1990
1993
1996
1999
2006
Европа
Некоммерческий
«А»
311
910
598
282
648
934
«Б»
2454
2938
3294
3550
3772
1772
Плацента
5
8
—
—
—
—
Всего
2770
3856
3892
3832
4420
2706
Коммерческий
-А»
1783
2378
3827
3658
4801
5424
«Б»
1330
1201
1561
1586
1788
4072
Плацента
955
1004
1200
—
—
—
Всего
4068
4538
6588
5244
6589
9496
Общее количество
«А»
2094
3288
4425
3940
5449
6358
«Б»
3784
4139
4855
5136
5560
5844
Плацента
960
1012
1200
—
—
—
Всего
6838
8439
10480
9076
11 009
12 202
Северная
Некоммерческий
«А»
25
5
128
120
100
100
Америка
«Б»
376
460
395
270
100
100
Всего
400
465
523
390
200
200
Коммерческий
«А»
5020
5436
6345
7977
7173
7631
«Б»
1100
1025
635
400
1020
950
Всего
6120
6461
6980
8377
8193
8581
Общее количество
«А»
5045
5441
6473
8097
7273
7731
«Б»
1475
1485
1030
670
1120
1050
g
— ,, г
—L
Всего
6520
6926
7503
8767
8393
8781 .
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОВИ 11 #7
Окончание табл. 27-14
Регион
Сектор
Вид
1987
1990
Год
1993
,
1998
1999
3
2008 J
Азиатский
Некоммерческий
«А»
409
334
951
755
1739
1310
регион
«Б»
275
332
508
853
613
400
Всего
684
666
1459
1608
2352
1710
Коммерческий
«А»
480
725
870
1035
2645
2590
«Б»
34
189
110
110
220
I*
Всего
514
914
980
1145
2865
2840
Общее количество
«А»
889
1059
1821
1790
4384
3900
«Б»
309
521
618
963
833
650
Всего
| 1198
1580
2439
2753
5217
4550
Примечания: вид плазмы «А» — плазма, заготовленная специально для фракционирования; вид
плазмы «Б» — плазма, выделенная из цельной крови.
В последующие годы ожидается дальнейшая консолидация производства
как в коммерческом, так и некоммерческом секторах. Планируется построить
несколько новых заводов по производству препаратов плазмы и увеличить произ¬
водительность существующих.
Ожидается появление новых технологий, которые позволят расширить пере¬
чень продукции, потому что чем больше ассортимент, тем меньше себестоимость
и масштабнее производство.
Объем заготовки исходной плазмы будет возрастать. Количество плазмы
для клинического использования останется на прежнем уровне, а объемы заготов¬
ленной цельной крови снизятся.
По мнению экспертов, коммерческий сектор будет продолжать наращивать
мощность заводов по переработке плазмы, приближаясь к 30 млн л плазмы
в год. Сохранится мировой дефицит плазмы для переработки (около 5 млн л).
В связи с этим отмечается неполная загруженность производственных мощ¬
ностей, сдерживается наращивание выпуска препаратов и, как следствие, воз¬
никает недостаток обеспечения населения высокоэффективными лечебными
средствами.
Переработка плазмы на препараты должна осуществляться на заводах с мощно¬
стью не менее 200 т плазмы в год. Меньшая мощность нерентабельна и экономи¬
чески нецелесообразна.
Пример: в Воронежской области существовала линия по переработке плазмы
на альбумин с мощностью переработки 5 т в год. Содержание этого производства
обходилось в 10 млн рублей в год (цены 2005 г.), а продукции производилось на 2
млн рублей, таким образом, убыток для бюджета составлял 8 млн рублей, кроме
того, оборудование не позволяло извлекать из плазмы лабильные фракции и свер¬
тывающие факторы.
В 2006 г. производство было остановлено, а на освободившиеся деньги обла¬
стью было закуплено альбумина в 5 раз больше, чем производилось на станции.
Исходя из мощностей заводов и потребности ЛПУ легко и объективно рассчи¬
тать количество плазмы для переработки и соответственно сырьевые возможности
субъектов РФ.
При сложении этих двух показателей (плазмы как лекарственного средства
и плазмы как сырья для переработки) определяется необходимое количество
донаций на 1 тыс. населения в зависимости от возможностей каждого субъекта
РФ. Если количество плазмы как лекарственного средства — величина стабильная,
то количество плазмы как сырья — подвижная и регулируемая, вплоть до импорта
ее из-за рубежа при соответствующем правовом сопровождении.
II168 ПРОИЗВОДСТВЕННАЯ ТРАНСФУЗИОЛОГИЯ
Оптимальной представляется работа заводов по переработке плазмы на пре¬
параты по принципу холдинга. Это значит, что для каждого завода определяется
строгое количество сырья, которое используется для производства плазмы в каче¬
стве лекарственного средства и препаратов плазмы. Государство контролирует
и объем конечного продукта, и ценовую политику предприятия.
Плазма для переработки должна поставляться из субъектов на предприятия
без карантинизации: экономически более выгодно вопросы инфекционной безо¬
пасности и хранения решать непосредственно на заводах, что позволяет избежать
многих ненужных исследований и тем самым снизить себестоимость продукта.
С. Waller - один из руководителей РРТА Europe — на III Международном форуме
«Обеспечение больных гемофилией безопасными лечебными продуктами крови»
(2003) на вопрос: «Возможно ли собирать достаточное количество плазмы для обе¬
спечения полноценного лечения больных гемофилией без платного донорства?» —
ответил: «Нет шансов*. В подтверждение своих слов привел следующие данные:
І 75% больных гемофилией получают недостаточно полное лечение
или не получают его вообще:
• для лечения зарегистрированных 300 ООО пациентов с впервые выявленной
гемофилией необходимо от 3 до 50 млрд ME фактора свертывания крови;
• сейчас в мире фракционируют около 23 млн л плазмы, которую собира¬
ют в США - 13 млн л (11 млн плазмаферезом, 2 млн из цельной крови),
в Европе - 4,2 млн л (1,2 млн плазмаферезом, 3 млн из цельной крови),
в остальных странах мира — 6,4 млн л (2,7 млн плазмаферезом, 3,7 млн
из цельной крови);
1 14 млн л плазмы получают от оплачиваемых доноров, что соответствует при¬
мерно 2 млрд ME фактора свертывания крови VIII;
к для удовлетворения мировой потребности в препаратах необходимо удвоить
количество плазмы, собираемой для их производства;
І для получения примерно 14 млн л плазмы требуется 21 млн донаций плазмы
(>1 млн новых доноров плазмы) или 56 млн донаций крови (около 37 млн
новых доноров крови).
Около 70% перерабатываемой плазмы заготавливают на коммерческих пунктах
плазмафереза, остальная часть приходится на некоммерческие Банки крови Я
государственные, Красного Креста.
Наиболее развита система сбора плазмы в США.
Ручной плазмаферез был разработан в США в 1950 г. и сразу стали очевидными
преимущества метода: донор цельной крови за год мог дать максимум 1,1-1,65 л
плазмы, тогда как донор плазмы оказался в 50 раз более продуктивным.
В 1960-е гг. плазмаферез применялся в основном для заготовки плазмы
от иммунизированных доноров в диагностических и терапевтических целях.
Однако преимущества этого метода быстро оценили в отношении быстроразви-
вающейся индустрии фракционирования плазмы.
Внедрение автоматического плазмафереза ознаменовало новую ступень в раз¬
витии метода. Преимущества его были очевидны и заключались в следующем:
■ отсутствует риск ошибки при возвращении эритроцитов донору;
S короткая продолжительность процедуры, комфортные условия для донора;
• больший объем заготовленной от донора плазмы;
1 уменьшение соотношения антикоагулянт/кровь;
s количество цитрата сравнительно меньше, что сокращает вероятность реак¬
ций при гипокальцемии, улучшает стабильность выделяемого фактора VIII-
В настоящее время около половины плазмы, собираемой в США, заготавливают
методом автоматического плазмафереза. В 1970 г. было переработано на препа¬
раты 714 тыс. л плазмы, 66% которой было получено плазмаферезом. Заготовка
исходной плазмы американскими коммерческими центрами плазмафереза быстро
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОВИ 1169
увеличилась до 2,8 млн л в 1976 г. и 4,3 млн л в 1980 г. В 2006 г. коммерческие
компании располагали в США более чем 400 центрами плазмафереза.
В 2006 г. объем коммерческой заготовки плазмы достиг 6,9 млн л. В основном
эта плазма подвергается фракционированию в США, часть продается в другие
страны, прежде всего Европы. Центры плазмафереза, принадлежащие США, рас¬
положены также в Европе и Азии. Количество коммерческой плазмы, собираемой
в Европе, составило 0,7 млн л. Всего коммерческий сектор в 2006 г. заготовил 7,3
млн л плазмы, что составляет около половины мирового объема и 68% плазмы,
перерабатываемой всеми компаниями. В начале 1960-х гг. фирмы США органи¬
зовали центры плазмафереза в развивающихся странах Центральной и Южной
Америки, позднее — в некоторых африканских странах.
Ежедневно индустрия сбора плазмы в США заготавливает ее более чем от 60
тыс. доноров, что составляет около 13 млн процедур плазмафереза в год.
Коммерческие плазма-центры производят в среднем 17 тыс. л плазмы в год
каждый. Для их деятельности необходимо получить лицензию на производство
плазмы от Управления по надзору за качеством пищевых продуктов и медикамен¬
тов (FDA), которое обеспечивает постоянный государственный контроль за дея¬
тельностью центров.
Американская ассоциация ресурсов крови (BRA) объединяет более 450 цен¬
тров сбора плазмы. В члены BRA, основанной в 1971 г., входят крупные объеди¬
нения, такие как Plasma Alliance, производственные фирмы, которые имеют
свою сеть сбора плазмы. Так, например. Armour Pharmaceutical Company имеет
21 пункт сбора плазмы, Bayer Corporation - около 200. Функционируют также
32 компании, в составе которых около 300 центров заготовки плазмы по всей
территории США.
Около 40 лет назад корпорация Baxter (США) «аннексировала» Австрию, впервые
организовав Центр плазмы. В настоящее время ей принадлежат все пять центров, рас¬
положенных в городах Graz, Salzburg, Vienna, Weis и Wiener Neustadt. Эти центры еже¬
годно заготавливают более 230 тыс. л плазмы при населении страны 8 млн человек.
В Европе наряду с такими мощными организациями, как Plasma Alliance Europe,
успешно работают и небольшие центры заготовки плазмы.
В1992 г. была основана Международная ассоциация производителей продуктов
плазмы (International Plasma Products Industry Association — IPPIA). в 1994 г. —
Европейская ассоциация производителей продуктов плазмы (European Association
of the Plasma Products Industry - EAPI). В 2000 г. обе ассоциации объединились
в Plasma Protein Therapeutics Association (РРТА). В январе 2002 г. произошло слия¬
ние ABRA и РРТА, и, таким образом, в настоящее время существует единая между¬
народная организация — РРТА, которая преобразует национальные стандарты
и требования, координирует клиническое применение, регулирует деятельность,
связанную со сбором плазмы, вирусной безопасностью, контактами с населением
и другими направлениями.
В состав РРТА входят объединения РРТА Europe и РРТА North America.
Координацию заготовки и распределения плазмы осуществляет Департамент
РРТА Source.
Вопросы, связанные с обеспечением общего рыночного пространства для плаз¬
мы и получаемых препаратов в странах Европейского Союза, координирует
European Plasma Collectors Committee (ЕРСС).
РРТА с 2001 г. издает информационный журнал The Source, в котором публи¬
куются сведения по вопросам сбора плазмы и ее промышленной переработки.
Ежемесячно выходит бюллетень «IBP» — International Blood/Plasma news.
Одним из слагаемых качества и стандартизации производства препаратов счи¬
тается технология массового сбора исходного материала - донорской плазмы.
Документация и информация, охватывающие весь комплекс мероприятий
по заготовке и транспортировке, обследованию, хранению и подготовке плазмы
1170 ПРОИЗВОДСТВЕННАЯ ТРАНСФУЗИОЛОГИЯ
I переработке, должны быть объединены и оформлены в одно досье, называемое
Plasma Master File (плазма мастер-файл — ПМФ).
Согласно Директиве Европейского Парламента 2000/70/ЕС и Совета Европы
от 16 ноября 2000 г. (Council Directive 93/42/ЕС), каждый центр крови или учреж¬
дение. занимающееся переработкой плазмы, должны готовить и пополнять
свежими данными досье (ПМФ) соответствующей подробной информацией.
Компетентный орган подвергает ПМФ научной и технической оценке и выдает
соответствующий сертификат. Наличие действующего сертификата считается
обязательным условием для получения лицензии на производство и реализацию
продуктов крови.
Столь пристальное внимание и жесткие требования к организации и техноло¬
гии заготовки плазмы для производства лекарственных средств понятны. Если
при применении плазмы как трансфузионного средства риск некачественного про¬
дукта ограничивается линией «одна единица плазмы — один больной», то при про¬
изводстве препаратов опасность многократно возрастает. Одномоментно вовлека¬
ются в технологический процесс тысячи образцов (пулов) плазмы, из которой
изготавливаются сотни тысяч единиц продукции, предназначенной для лечения
многих больных.
Идентификация каждого индивидуального контейнера с плазмой может быть
проведена только на основании этикетки и сопровождающего документа, которые
должны быть правильно оформлены и подписаны лицом, юридически ответствен¬
ным за паспортизацию плазмы. Вся кровь или плазма заготавливается от доно¬
ров по единым требованиям, после чего направляются в лечебные учреждения
или на переработку. Данных этикетки достаточно, чтобы допустить плазму к пере¬
работке.
За рубежом организации сбора плазмы требуемого качества придается большое
значение, поскольку качество и стандартность донорской плазмы имеют решаю¬
щее значение для эффективности технологического процесса.
Этим вопросам уделяется серьезное внимание международными и националь¬
ными органами. Изданы соответствующие рекомендации Всемирной организа¬
ции здравоохранения, действуют законодательные акты Европейского Союза,
Фармакопейный стандарт ЕС.
Международная организация РРТА и производители препаратов приняли про¬
граммы, направленные на обеспечение качества и безопасности продуктов крови,
здоровья больных при лечении с использованием лекарственных средств из крови.
Программы называются «Программа качества плазмы» (International Quality Plasma
Program) и «Стандарт и руководство для достижения высокого качества и безопас¬
ности* (Quality Standards of Excellence, Assurance and Leadership — QSEAL). Эти
программы включают все виды деятельности, влияющие на качество и безопасность
плазмы, - от заготовки и транспортирования до хранения и переработки. Наличие
сертификата QSEAL считается весьма престижным для организации.
В мировой практике при фракционировании плазмы получают четыре основных
лекарственных средства: альбумин человека (1), иммуноглобулин человека нормаль¬
ный (2) и факторы свертывания крови VIII и IX (3,4). Перечисленные белковые фрак¬
ции выделяют последовательно в едином технологическом цикле. Однако (1) и (2)
считаются относительно стабильными белками, а (3) и (4) — это крайне неустойчи¬
вые, лабильные белки, которые моїут быть выделены только из свежезамороженной
плазмы. Хранить плазму необходимо при температуре -20 °С или ниже.
Как известно, чем дольше плазма находится в жидком состоянии, тем меньше
она содержит активных факторов свертывания крови, что определяется техноло¬
гическим выходом активного продукта. Исходя из высокой стоимости факторов
І готовой лекарственной форме (около 0,5 долларов за 1 ME), практикуется раз¬
деление полученной плазмы на категории в зависимости от условий ее получения.
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ КРОвИ і 171
Категории определяют цену плазмы и оговариваются в договорах с поставщиками.
Характеристика различных категорий изложена в описаниях качества исходной
плазмы, предоставляемых фирмой — изготовителем препаратов.
Качество и вирусная безопасность плазмы для производства препаратов опреде¬
ляются Фармакопейным стандартом, который предназначен для входного контро¬
ля качества и безопасности исходной плазмы и на основании которого принимает¬
ся решение о ее передаче для производства препаратов.
ПРОИЗВОДСТВО ОСНОВНЫХ ПРЕПАРАТОВ КРОВИ
Альбумин человека
Препарат содержит по меньшей мере 96% альбумина, остальное приходится
на долю а-глобулинов и следов р-глобулинов. Препарат может производиться
как раствор с 4%, 5,20 или 25% концентрацией белка. 4-5% растворы альбумина
человека имеют осмотическое давление, равное плазме, 20% растворы — анало¬
гичную плазме вязкость. Раствор альбумина человека 25% концентрации объемом
100 мл осмотически эквивалентен двум единицам (*500 мл) цитратной плазмы
и по вязкости близок к крови.
В Советском Союзе, а теперь в России в основном изготавливается 10% рас¬
твор альбумина человека наряду с 5% и 20%. Почему только в нашей стране при¬
меняется 10% раствор альбумина человека, объяснить трудно. С позиций логики
и трансфузиологического мышления такая концентрация белка может заинтересо¬
вать только неонатологов, когда можно предположить нежелательность местного
гиперосмотического эффекта при введении 20% альбумина младенцу.
Не представляет труда изготовить препарат в пределах 5-20% концентрации.
Очевидно, раствор 10% альбумина человека просто более удобен для произ¬
водственной калькуляции и финансового учета. Однако оптимум лекарственной
формы должен определять все-таки врач. Во всем мире лечащие врачи ориентиру¬
ют производственников на изготовление 5% и 20% растворов альбумина.
Все препараты альбумина, независимо от концентрации, выпускают в виде ней¬
трального раствора (pH 6,9±0,5), содержащего от 130 до 160 мЭкв/л Na’ и менее
2 мЭкв/л К+.За рубежом изготавливают растворы альбумина с низким содержани¬
ем солей для лечения почечной патологии.
Растворы альбумина не содержат консервантов с противомикробными ком¬
понентами. Единственным способом стерилизации остается фильтрация через
мембраны, задерживающие микробы. Поскольку раствор белка при нейтральном
pH представляет собой отличную среду для микроорганизмов, строгие требования
чистоты и асептики предъявляются к обработке, наполнению и упаковке готового
стерильного продукта во время производственного процесса. В лечебном учреж¬
дении запрещается использовать препарат, если прошло более 4 ч после вскрытия
контейнера.
Раствор альбумина выдерживает тепловую обработку в течение 10 ч при 60 °С,
что с высокой надежностью инактивирует вирусы. Пастеризация стала возмож¬
ной с открытием надежных и эффективных стабилизирующих агентов — натрия
каприлата и натрия Ы-ацетил-ОЬ-триптофана.
Иммуноглобулины
В соответствии с рекомендацией ВОЗ, вместо ранее применяемых наименова¬
ний «гамма-глобулин», «иммунный сывороточный глобулин», «противокоревой
гамма-глобулин» рекомендуют использовать термин «иммуноглобулин человека
нормальный».
щ ПРОИЗВОДСТВЕННАЯ ТРАНСФУЗИОЛОГИЯ
Коммерческие препараты иммуноглобулина (ИГ), применяемые в настоящее
Ірак, содержат I основном иммуноглобулин G (IgG). Иммуноглобулины других
классов (IgA и IgM) присутствуют в небольших количествах.
Нормы содержания общего белка, установленные ВОЗ для препаратов ИГ,
составляют 10 17%. В Советском Союзе выпускали препараты с 10% концентра-
I в большинстве зарубежных стран — 16%.
Ht крупных производствах каждая серия ИГ изготавливается из смеси плаз¬
мы от большого количества людей. Нормативно-технологическая документация
обязывает выпускать препарат, полученный из смеси образцов плазмы не менее
чем от 1000 доноров. Это требование связано с индивидуальным различием имму-
яодогических свойств крови каждого человека, необходимостью нивелирования
этих свойств в смеси (пуле) и достижения стандартизации препаратов.
В Российской Федерации и странах бывшего Союза преимущественно произ¬
водится только ИГ. предназначенный для внутримышечного введения. Препарат,
который можно вводить больному внутривенно, выпускается в крайне малых
количествах.
Методы фракционирования, применяемые в производственной технологии,
позволяют при выделении внутривенного иммуноглобулина (ВИГ) увеличивать
концентрацию антител не менее чем в 6 раз (10% концентрация белка) и соот¬
ветственно в 10 раз (при 16% концентрации белка) по сравнению с исходным
материалом. Согласно рекомендациям ВОЗ, целесообразно определять степень
концентрации антител в выпускаемых сериях ИГ, поскольку снижение концентра¬
ции указывает на нарушения технологического процесса.
Большое внимание при оценке качества изготавливаемых ИГ уделяется фраг¬
ментации IgG при хранении и агрегации части его молекул, возникающей в резуль¬
тате экстремальных воздействий в процессе фракционирования. Расщепление
(фрагментация) ведет к снижению титров некоторых антител и быстрому выделе¬
нию фрагментов из организма, что сокращает длительность пассивного иммуни¬
тета. К нарушению нативного состояния иммуноглобулина относится и агрегация
его молекул. Наличие агрегатов определяет повышенные антикомплементарные
свойства препаратов и может стать причиной нежелательных реакций при их вве¬
дении.
Фрагментация и агрегация в препаратах ИГ выявляются с помощью ультрацен¬
трифугирования, гель-фильтрации или хроматографии.
Европейская Фармакопея предусматривает максимально допустимое содержа¬
ние фрагментов не более 5% общего содержания белка и не более 15% агрегиро¬
ванных фракций.
Исследователи добиваются повышения эффективности препаратов ИГ, пред¬
лагая методы выделения А- и М-фракций и расширяя, таким образом, спектр
содержащихся антител. Клиницистов в последние годы привлекает возможность
повышения эффективности ИГ при парентеральном введении в количестве, пре¬
вышающем обычные дозы для внутримышечных инъекций. Внутривенному
введению препятствует антикомплементарная активность, вызываемая конфор-
мационными изменениями молекулы иммуноглобулина. Снижение реактоген-
ности иммуноглобулинов при внутривенном введении достигается разрушением
агрегатов.
ИММУНОГЛОБУЛИНЫ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ
Иммуноглобулины для внутривенного введения (ВИГ) выпускаются за рубежом
в производственных масштабах, и их применение в лечебных целях подтверждает
высокую терапевтическую эффективность (табл. 27-15).
Таблица 27-15, Характеристика некоторых иммуноглобулинов для внутривенного введения, циркулирующих
на российском рынке ^
ярмарт ФИРМа’СТРаНЗ Метод получения Состав, свойства
Расщепление гидролитическими ферментами
обменной хроматографией
ЗАГОТОВКА ПЛАЗМЫ И ПРОИЗВОДСТВО ПРЕПАРАТОВ крови 1175
Фактор свертывания крови VII (проконвертин)
Концентраты фактора VII производятся несколькими компаниями в Европе
и опробованы в ходе клинических испытаний в США. При отсутствии этого сред¬
ства для замещения дефицита можно использовать концентрат протромбинового
комплекса.
Рекомбинантный концентрат активированного фактора свертывания VII глнко-
протеином получают из клеточной культуры почки детеныша хомяка, в которую
внесен ген фактора VII. В клеточной культуре фактор быстро активизируется
и приобретает активную форму rFVIIa, затем подвергается хроматографической
очистке. Препарат изучали на больных как обычной, так и ингибиторной гемо¬
филией, эффективность показана в 53-69% случаев. Незначительные побочные
реакции отмечены у 22% больных, появления ингибиторов не отмечено. Таким
образом, rFVIIa эффективен при лечении больных с ингибиторами факторов VII
или IX. Возможным осложнением может быть тромбообраэование.
Фактор свертывания крови VIII (криопреципитат*)
Первые упоминания о заболеваниях с симптомами гемофилии были обна¬
ружены в древнееврейских книгах, датируемых II в. н. э., а первые описания
гемофилии А — в конце XIII в. В 1840 г. впервые была перелита кровь мальчику
с неконтролируемым кровотечением на протяжении 6 дней после операции. Выл
получен положительный эффект, однако объем переливаемой крови был ограни¬
чен. Стало очевидным, что необходимо искать способы выделения, концентрации
и очистки антигемофильного фактора. Исследования в этом направлении привели
к разработке методов получения криопреципитата и технологии изготовления
концентратов антигемофильного фактора VIII.
В 1959 г. Pool и Robinson обнаружили, что после оттаивания замороженной
плазмы образуется осадок, в котором содержится большая часть антигемофиль-
ной активности плазмы. Было высказано предположение, что такой способ кон¬
центрирования фактора VIII может быть использован для изготовления антиге-
мофилических препаратов.
Криопреципитат* образуется при оттаивании свежезамороженнной плазмы
при температуре 2-4 °С. Осадок отделяется на центрифуге и хранится при темпе¬
ратуре -20 °С. Вследствие индивидуальных особенностей доноров качественный
состав получаемого препарата различен.
Возможности применения криопреципитата* были ограничены необходи¬
мостью хранения при температуре -20 °С. Концентраты фактора VIII средней
степени чистоты изготавливают в промышленных объемах из объединенных
образцов свежезамороженной плазмы. В результате фракционирования, очист¬
ки и лиофилизации получают концентрат фактора с активностью 20 -40 МЕ/мл.
Одновременно обрабатывают плазму 2-3 тыс. доноров, вирусная безопасность
достигается тепловым и химическим воздействиями.
Концентраты фактора VIII считаются основным средством лечения гемофи¬
лии.
Концентрат протромбинового комплекса
Концентраты очищенного протромбина в настоящее время не производят¬
ся, коррекция дефицита достигается применением протромбинового комплек¬
са. Концентрат PPSB* (протромбин, факторы IX, X и VII) подвергается соль¬
вент/ детергентной обработке и нагреванию после высушивания для инактивации
вирусов.
1176 производственная ТРАНСФУЗИОЛОГИЯ
PPSB* стабилен при комнатной температуре, его вводят больному сразу после
разведения, редко вызывает аллергические реакции и удобен для самостоятельно¬
го употребления на дому.
PPSB* широко применяется для лечения гемофилии В, но его постепенно заме¬
няет фактор свертывания крови IX.
Высокоочищенные концентраты практически свободны от протромбина, фак¬
торов VII и X и не вызывают тромбоза ни в опытах на животных, ни при хирурги¬
ческих вмешательствах.
СПИСОК ЛИТЕРАТУРЫ
Аяастасиев В.В. Иммуноглобулин для внутривенного введения. — Н-Новгород: НГМА
2000 г.
Руководство по общей и клинической трансфузиологии / Под общ. ред. Б. В. Петровского. -
М.: Медицина. 1979. - 463 с.
Розенберг Г.Я. Современное состояние проблемы фракционирования белков плазмы
крови и направление ее дальнейшего развития // Современные проблемы гематологии и
переливания крови. - М.: Медицина. 1964. — Вып. 36. — 191 с.
Розенберг Г.Я.. Русанов В.М. Фракционирование белков плазмы крови // Итоги науки
ВНИИТИ АМН ССР. і 1976. - С. 12-34.
Русанов В.М., Суханов Ю.С. Перспективы производства препаратов плазмы в Российской
Федерации и международные тенденции развития проблемы // Вестник Службы крови
России. 1 1997. - №2. - С. 8-16.
Справочник по переливанию крови и кровезаменителей Под общ. ред. O.K. Гаврилова. -
М.: Медицина. 1982. - С. 76-93.
Русанов В.М.. Токарев Ю.Н. Структура и функции белков плазмы. — М.: Мир, 1976. —
119-20.
Фром А.А., Скобелев Л.И., Русанов В.М., Никитенко А.А. Белки плазмы и их фракциони¬
рование в производстве препаратов крови. - М.: Медицина, 1974. — 251 с.
Ван-Аккен В.Г. Трансфузионная терапия в третьем тысячелетии // XXVI Конгресс
Международного общества трансфузиологов. — 2000.
Моргенталер Ж. Новые направления во фракционировании плазмы и вирусинактива-
ции // XXVI Конгресс Международного общества трансфузиологов. — 2000.
AJIian J.P., Bianco С., Blajchman V.A. et al. Protecting the blood supply from emerging pathogens:
the role of pathogen inactivation // Transfus. Med. Rev. — 2005. — Vol. 19. — N 2. — P. 110-126.
AuBuchon J.P. Pathogen Inactivation in Cellular Blood Components: Clinical Trials and Implications
of Introduction to Transfusion Medicine // Vox. Sanguinis. — 2002. — Vol. 83. — 227 p.
Bradburne J.M. Blood. Art, Power, Politics and Pathology. — Munich: London: New York,
2001.
Boukef K. et al. Transfusion Today // International Societies for Blood Transfusion. — 1997.
Cohn E.J. The properties and functions of the plasma proteins, with a consideration of the meth¬
ods for their separation and purification // Chem. Rew. — 1941 — Vol. 28. — P. 395-417.
Cohn E.J. The history of plasma fractionation // Advances in Military Medicine. — 1948. -
Vol. g I P. 364-443.
Heier H.E. Personal Perception of the History of Blood and Transfusion // Vox. Sanguinis. —
2002.1 Vol. 83. і 121 p.
Lee D.C. et al. Monitoring plasmaprocessing steps with sensitive Western blot assay for the
detection of the prion protein //}. Virological. Methods. — 2000. — Vol. 84. — P. 77-89.
Roger Y.D. Pathogen Inactivation: Mechanisms of Action and in vitro Efficacy of Various
Agents // Vox. Sanguinis. — 2002. — Vol. 83. — 267 p.
Rizza C.R. et al. Confirmation of viral safety of dry heated Factor VIII concentrate (8Y) prepared
by Bio Products Laboratory (BPL): A report on behalf of UK Hemophilia Centre Directors // Brit.
I Haematol. 1 1993.1 Vol. 84. - P. 269-272.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Аборт 777,840
- септический 776,820
- спонтанный 990
Агароз 376,1156
Аллоантитела 217,753,994,1040,1122
Аллоиммунизация 206,225, 245,438,617,
733,856,1014
Альбумин человека 453,1171
Амилоидоз 453,777,1053
Амниоцентез 405,1121
Ангиогемофилия 431
Ангиоматоз Казабаха-Мерритта 777
Ангиопатия диабетическая 394,783
Анемия
- апластическая 382,434, 658
- Блекфена-Даймонда 728
- гемолитическая 489,730,779
- железодефицитная 727
- Кули 730,736
- постгеморрагическая
- острая 137
- хроническая 144
- серповидно-клеточная 834
- Фанкони 729
Антиоксиданты инфузионные 515
Анурия 527, 567, 833
Аортит Такаясу 777
Апоптоз 121,597,932
Артрит ревматоидный 312,661,846,946,
1023
Астма бронхиальная 179,214,368,493
Асцит 362,455
Атеросклероз 136,308,365,453,650,670,
761, 813,1099
Аутоантитела 930,994,1006
Аутогемотрансфузии 76,406,614,680
- при наследственных аномалиях крови
683
Аутодонация 649,866
Аутодонорство 57,270,305,334,619,630
- в акушерстве и гинекологии 657
- в сердечно-сосудистой хирургии 647
Аутокровь 46, 207,358,415, 621,632, 638,
653, 665,679,715
Аферез 201,313, 621,687,714
Ацидоз
- дилюционный 466
- дыхательный 471
- метаболический 135,398,469,475,
522,586,588,608,751,888
I молочнокислый 891
- респираторный 587
Бабезиоз 261,618,834,867,1087
Бактериемия 639
- грамотрицательная 438
Болезнь
- Бехтерева 1023
- Боткина 1056
- бронхоэктатическая 179
- Вальденстрема 379
- гипертоническая 179,453,650,783
- гранулематозная 948
- Кавасаки 777
- Крейтцфельдта-Якоба 48,261,288,
867
- Кристмаса 1052
- Крона 882
- Лайма 867
- лучевая 181,229,434
- Маркиафавы-Микели 751
- миеломная 379
- мочекаменная 181
- Мошковича 780
І новорожденных гемолитическая 46,
357,406,443,821,967,1120
- ожоговая 370,430
- Рейно 394,494
- Рейтера 1022
- Сен-В 867
- сердца ишемическая 179,362,386,541.
991
- серповидно-клеточная 745
- «трансплантат против хозяина» 861,945
- Ходжкина 862
- холодовых антител 990
- фон Виллебранда 510
- Шага 867
- Шагаса 1087
I Шенлейна-Геноха 776,780
Бронхит обструктивний 179
Бруцеллез 48,179,449,1087
В
Васкулит
- геморрагический 782
1171 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
і кожный 3X2
- системный 379
I хронический 779
Венепункция 80,355, 442,714
Венесекция 98.442
Вены руки 84
Вирус иммунодефицита человека 1077
Вирусные гепатиты 1055
Волчанка системная красная 181.379,846.
1022.1110
Вульиеросорбция 372
Выбраковка готовых компонентов крови
251
Высвобождение кислорода 544,605
Г
Петрит
I атрофический 946
і ахилический 179
Гематурия 444,833,1015
Гемаферез 74.163,195,335,378,630,720
Гемобезопасность 173,320
Гемовиджиленс (haemovigilans) —
гемобезопасность 320
Гемоглобинопатии 269,643, 661,834
Гемодиализ 76,230,343,359,455,485,
510,748.785,814,895.1068
I программный 818
Геыодиафильтрация 345,391
Гемодилюция 76.334,499, 575, 622,854
I изоволемическая 345,508
I интраоперационная 665
1 нормоволемическая 478,509,572
І постинфузионная 494
I предоперационная 630
■ терапевтическая 504
Пмокоррекция
I интракорпоральная 76
- терапевтическая 348
- трансфузиологическая 333
- экстракорпоральная 73
I неэфферентная 391
Гемолиз 128,191,207, 247, 277, 418, 473,
605,749,860.995
I аутокрови 684,711
I внесосудистый 834
- внутрисосудистый 249,378.750,785,
829.831,950
- донорских эритроцитов 37
- ненормальный 218,223
I острый 421
• посттрансфузионный 1042
Пмоперикард 79,104
Гемопоэтические стволовые клетки 1033
Геморрагия
I кожная 764
- тромбоцитопеническая 411
■ фетоплацентарная 1122
- церебральная 506
Гемотрансфузии 46, 294,444, 726,744
852.949.995
- аллогенные 405, 618,641.864
- внутривенные 863
- дополнительные 657
- массивные 198, 605,776
- многократные 1042
- непрямые 406
- при анемиях 724
Гемофилия 411, 643, 658,1052,1168
Гемоэкстракция 347
Гепатаргия 453
Герпес 288. 304, 777, 949
- генерализованный 776
- генитальный 1083,1110
- опоясывающий 1080
- простой 618,1083
Герпес-вирусы 1080
Гйдроперикард 104,362
Гйдроторакс 362, 540,907
Гйпергидратация 362,472,499, 541 590
882
Гйперфибринолиз 458,800
Гйпоксия 135,465,522, 590,660,777,821
870
- анемическая 221
- тканевая 742,1127
- циркуляторная 539
Гйпоплазия костного мозга 438
Гйстиоцитоз 777
Гломерулонефрит 848
- диффузный 453, 776, 870
- хронический 783, 945
Гранулоциты аферезные 244
Д
Дегидратация 506, 541, 590, 745,882,1123
- внутриклеточная 466
- гипотоническая 893
- изотоническая 473
- острая 469
Дерматит атопический 372
Детоксикация экстракорпоральная 803,
839
Диабет
- сахарный 396, 599, 783, 893
- ювенильный 1022
Диатез геморрагический 145, 434,490,
532,808,897
Дизентерия 372, 468, 780
Дистрофия 882
Дифтерия 780
Добавки к препаратам парентерального
питания 534
Доноры крови 156
Доступ
- артериальный 105
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
- интрамедуллярный 104
- по Yoffa 91
- через локтевую ямку 84
Доступность методов инактивации 301
Е
Естественная резистентность 923
3
Заготовка
- аутокрови 338.631,638.647, 673
- крови 183
- плазмы 160,1145
- эритроцитной массы 276
Закон
- изоосмоляльности 588
- поддержания постоянства pH 584
- электронейтральности 586
И
Измерение артериального давления 555
Иммунный ответ 929
Иммуноаферез 354, 376
Иммуноглобулины 455,1171
Иммунодефициты 947
Иммунология трансфузионная 70,916,
1145
Иммуномодуляция посттрансфузионная
826.863
Иммуностимуляция 948
Индекс
- Альговера-Брубера 609
- иммунорегуляторный 368
- кислородного потока 141
- лактат-глюкозный 602
- шоковый 137,567
Инфаркт
- геморрагический 779
- легочный 83
- миокарда 312, 377, 516, 564, 598,642,
677, 776, 777, 893
Инфузия 405
Иридоциклит 181. 848
Ирит 181,312
Искусственные коллоиды 478
Ишемия
- миокарда 668.724
- пальцев руки 110
- тонкой кишки 598
К
Кандидоз 776
Карантинизация свежезамороженной
плазмы 291
Кардиомиопатия дилатационная 376
Кардиопатия обструктивная
идиопзтическая 677
Кардиосклероз
- атеросклеротический 179
- лосгинфярктный 573
Кариорексис 120
Карциноид 777
Катетеризация
артерий 108
- вен 103
Кахексия 639,882
Квашиоркор 877
Кетоацидоз диабетический 445
Кислородный статус организма 539
Кислотно-основное равновесие 582
Классификация
- антител 935
- вирусных гепатитов 1056
- кровопотери 595
- посттрансфузионных реакций 826
- процедур экстракорпоральной
гемокоррекции 345
Розенфельда 973
- ятрогенних гемотрансфузий 868
Клострндноз 776
Коагулопатия 809
- внутрисосудигтая 435
- дилюционная 605. 808. 851
- потребления 760,811
- разведения 238
Кодекс норм поведения при донорстве 162
Коклюш 456, 949
Коллапс 80. 678. 743. 814. 893
Кома
- анемическая 728
- гипогликемическая 398
- печеночная 529
Компоненты энергообеспечения 531
Конглютинация 926
Концентрат
- лейкоцитный гамма-облученный 438
- тромбоцитный 52, 161, 206. 221. 266.
381. 432.576. 715, 791. 841. 1044
Корь 456. 742, 949
Крапивница 206. 225. 481. 844
Краснуха 777, 949
Кривая артериального давлення 559
Криоаферез 346, 380
Криоконсервирование эритроцитной
массы 293
Криопреципитат 242, 431
Кристаллоиды 463
Критерии отбора пациентов 639
Кровезаменители 460
- действия
- дезинтоксикационного 514
- противошокового 476
Кроветворение
- в печени 119
- детское 117
- костномозговое 115 2вЙиМЙЁ1Я11Яи
1180 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
І у пожатых людей 117
Кровопотеря 137,494.567,625,747
В интраоперационная 642.703
- и принципы ее компенсации в
экстренной хирургии 593
I наружная 625
І послеоперационная 575
Кровь
9 консервированная
I донорская цельная 418
- фильтрованная 420
- цельная 204
Ксеноперфузия 346
Ксеноспленоперфузия 347
Л
Лактат-ацидоз 853
Лейкодеплеция 198.294,300,707,866
Лейкоз
- острый 232,307,776,1015
І промиелоцитарный 777,818
I хронический 776
В мегакариоцитарный 778
Лейкопения 449,639,806,843
Лейкоредукция 198,842
Лейкоферез 244,483
Лейкофильтрация 198
Лейшманиоз 179
Лепра 179
В туберкулоидная 945
Ликворосорбция 371
Лимфогранулематоз 949
Лимфолейкоз хронический 383
Лимфостаз 3%
Лимфоцитаферез 347,383
Лихорадка
- геморрагическая 777
- Денге 776
I инфекционная бактериальная 438
б Скалистых гор 776
Лобэктомия 663
М
Макроглобулинемия Вальденстрема 45,
381
Малъдигестия 874
Малярия 383,618.776,777,834.1087
Маразм 877
Медицинское освидетельствование
доноров 173
Менингит
I асептический 1082
І инфекционный 371
Менструация 132, 642
Метаболизм гемоглобина 130
Метод
- карантинизации компонентов крови
290
- Короткова 555
- магнитизации эритроцитов 1007
g разведения красителя 555
- расчета поиска доноров 1039
- Сельдингера 101
- Фика 551
Миелолейкоз хронический 307,383,1015
Миелопоэз 119
Миелофиброз 384
Микроспория 181
Миокардит 179,453,1082
Миома 657,709,836,1045
Мозаицизм 750
Мониторинг парентерального питания 904
Мононуклеоз инфекционный 445,990,
1083
Н
Недостаточность
I дыхательная 88, 639
- легочная посттрансфузионная 211,237
і мультифакторная 783
- острая
- легочная 440
- почечная 454,749,831
- сердечная 389,577
- хроническая
- печеночная 374
- почечная 360,818,882
І сердечно-сосудистая 783
Нейробластома 777
Некроз
і гепатоцеллюлярный 1067
1 красного костного мозга 743
І кумариновый 780
- надпочечников геморрагический
804
- тубулярный 598
Неоптерин 812,1098
Нефрит
- быстропрогрессирующий 379
- геморрагический 780
- хронический 482
Нефросклероз 453
О
Образование врача-трансфузиолога 64
Озена 181
Озонотерапия внутривенная 399
Оказание неотложной медицинской
помощи 179
Опсонизация 926
Оптимальный гематокрит 573
Организация донорства 166
Осложнения
- аутодонороства 674
- парентерального питания 907
I при аутогемотрансфузиях 712
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ Щж!
- при донорстве 177
Основные направления трансфузиологии
72
Остеомиелит 105,181
Осциллометрия 555
Отбор доноров 270
Отторжение
g клеточных элементов донора 139
І трансплантата 945
Оценка
- гемодинамики 546
- количества тромбоцитов 318
- эффективности нутритивной
поддержки 904
П
Панкреатит 494,504,532,759,852
- деструктивный 106,359,370
- острый 533,777,906
Парвовирус 1084
Паротит эпидемический 949
Препараты донорской крови 453
Переливание крови
- непрямое 441
- обменное 443
- прямое 442
Переносчики кислорода синтетические
517
Переработка крови на компоненты 190
Периартериит узелковый 848
Перитонит 494
- гнойный 370
- разлитой 106
Пиодермия 181
Питание парентеральное 406,873
Плазма 584
- антистафилококковая человеческая
431
- нативная концентрированная 432
- свежезамороженная 233,427
Плазмаферез 155,345,378,633,644,792,
1050,1129
Плазмофракциаферез 347
Планирование донорства 182
Пневмония
- абсцедирующая 431
- бактериальная 445
- интерстициальная 1082
- хроническая 493
Пневмоторакс 92,103,540,549,907
Пойкилоцитоз 145,738
Показания к переливанию эритроцитных
сред 219
Полиартрит ревматоидный 776
Полимерный контейнер 279
Полиомиелит 456,949
Полирадикулоневрит Гийена-Барре 379
Положение Тренделенбурга 81,93
Получение гемопоэтических стволовых
клеток 307
Порфирия кожная 382
Посттрансфузионные реакции 825
Поступление кислорода 539
Препараты для парентерального питания
520
Преципитация 346,391,950
Прионы 202,288,1088
Проба
- Бернштейна 451
- Вальсальвы 84
- Квика 631
- Кумбса 424
- на серповидносгь 274
Производственная трансфузиология 1145
Простые переливания 1128
Протеин 455
Противопоказания
I к донорству 179
- к переливанию крови и ее компонентов
453
Псориаз 181,372,385
Пузырчатка 379
Пульсоксиметр 144,542
Пункция
- артерий 106
- подмышечной вены 86
Пурпура
- тромбоцитопеническая
- посттрансфузионная 1015
- тромботическая 296,379,430,780,
834
1 фульминантная 777
Р
Рабдомиолиз 778,809
Рабдомиосаркома 778
Растворы
і гидроксиэтилкрахмала 494
- декстрана 488
- полиэтиленгликоля 493
Регистратура 172
Реинфузия 406,686
- в акушерстве и гинекологии 708
- гемолизированной крови 809
- постоперационная 711
Реоферез 365
Рестернотомия 778
Ретикулоцитоз 138,731,750,811,1122
Ретикулоцитопения 749
Ретинопатия 496
Ришта 179
С
Сальмонеллез 372,1087
Саркоидоз 402,777
Сатурация 144
1182 ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Секция артерий 108
Сепсис 370.375. 396.430.445. 496.726,
778. 804.882
Септицемия 435. 749. 778.804
Сидероз Бету 752
Симптом острого внутрисосудистого
гемолиза 445
Синдром
I HELLP 834
І анемический 726,750
антифосфолилидный 382,761
£ астеновегетативный 1058
І Банти 34
I верхней полой вены 88.566
- Вискота - Олдрича 947
1 гемолитико-уремический 379,777,
1052
І геморрагический 26. 229.239. 384, 432,
729,803.817,870,1050
I гипервентиляционный 178
І гнпервискозный 381
- гиперкоагуляционный 398,704,760
- гиперосмолярный 611
- гиперспленизма 730
- гомологичной крови 214. 387.421. 778
I грудной острый 742
1 Ди Джорджи 947
- диссеминированного
внутрисосудистого свертывания 220,
378.434, 576.605. 647,683, 750, 759.
769,775,815,854
дистресс респираторный острый 251,
573,907
компартмент 105
короткой петли 881
краш 379, 776.792
мальабсорбцин 882
массивной гемотрансфузии 604,807
миелодиспластический 661,1015
невосстановленного кровотока 599
Незелофа 947
нефротический 362,454,770
острой легочной недостаточности 251
периферического артериовенозного
шунтирования 545
пиквикский 907
повышенной вязкости крови 776
полиорганной недостаточности 576
постперфузионный 1081
приобретенного иммунодефицита 862,
1077
рассеянного внутрисосудистого
свертывания 760
Рейно 384,394
реперфузионный 598
рикошета 1050
Сезари 403
сметенного воспалительного ответа
394.867
- сладж 760,781
- «трансплантат против хозяина» 225,
1036
- увеличения вязкости крови 652
- Уотерхауеа-Фридериксена 804
- цитолитический 1061
Синкопа 639
Система
- комплемента 923
- Лютеран 979
- штрихкодирования 257
Сифилис 160,174,179, 206, 261, 289, 618,
631. 681,1086
Склероз рассеянный 376
Служба крови 149
Состав консервирующих растворов 191
Сосудистые доступы 79
Спайк систолический 561
Спленомегалия 436,735
Спондилоартрит анкилозирующий
идиопатический 1023
Т
Тампонада сердца 549, 907
Терапия
- гемокомпонентная 443
- гемотрансфузионная при серповидно¬
клеточной анемии 742
- инфузионная при увеличенной
проницаемости микрососудистого русла
576
- инфузионно-трансфузионная 405
- критических состояний 566
- компонентная при острой кровопотере
572
- острой постгеморрагической анемии 138
Тест
- Аллена 106
- антиглобулиновый 1004
- восстановления нитросинего
тетразолия 450
Тиреотоксикоз 945,946
Тканевое дыхание 134
Токсемия 437,516,748
Токсоплазмоз 261,1088
Тонзиллит 780
Торакоцентез 355
Торможение иммунной системы 942
Транспорт кислорода 543
Трахома 181
Трипаносомоз 179,1088
Трихофития 181
Тромбоз венозный 88,92, 498
Тромбофлебит 83.90,179,385,643
Тромбоцитемия эссенциальная 384
Тромбоцитопения
- гепарининдуцированная эссенциальная
791
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Цитомегаловнрус 227.261,420, 618.777,
949,1080
Цитоскелет эритроцита V27
Цитоферез 161
Цоликлоны 998
- дилюционная 808
- идиопатическая 457
- иммунная 1014
- неонатальная 858
Туберкулез 160.179, 261, 289, 453.776,
949
Тугоухость 366, 496.1122
Туляремия 179
Увеит 181
Углеводы 530, 888
Уравнение
- Гарриса-Бенедикта 878
- Старлинга 408
Уремия 445, 602
Ф
Фавус 181
Фактор
- свертывания крови VIII 458
- Стила 116
- фон Виллебранда 296
- Хагемана 767
Физиогемотерапия 73
Филяриатоз 179
Флебит 85,103,471,868
Флеботромбоз 99,385
Фотофорез экстракорпоральный 393
Фурункулез 37,181
X
Хемокины 942
Хилез 254
Холера 468,949
Холестаз внутрипеченочный 893
Холецистит
- калькулезный 181,1076
- острый 1045
Хориоретинит 181
Хранение компонентов крови 194
Ц
Целиакия 1023
Целлиты 1153
Центральное венозное давление 563
Цирроз печени 181,238,359,455, 753,
852,884,990,1065
Цитаферез 46,334, 345, 354. 378,803
Цитокины 115,198,364.712.804.841,
917, 939
Ш
Шок
анафилактический 568.848
- геморрагический 628
- гемотрансфузиониый 406
- гиповолемический 421, 566
- инфекционно-токсический 519
- ' кардиогенный 569
- ожоговый 569
- септический 443,567
- циркуляторный 566
Э
Экзотоксикоз 344, 3%, 772.882
Эклампсия 778,820
Эксикоз 778
Элюат 629,705,1122
Эмболия
- воздушная 161,540.549,707.855
- жировая 519,777.893
- катетерная 907
- околоплодными водами 238,778
Эмульсии жировые 532.891
Эмфизема легких 136,179,472
Эндоартериит облнтерируюший 179
Эндокардит 179,549
- инфекционно-септический 402
- септический 674,813
Эндотоксемия 817.839
Энцефалопатия
- губчатая 48
- печеночная 528
Эпидермофития 181
Эпилепсия 643,658
Эритема узелковая 848
Эритремия 356.383,778
Эритродермия 181
Эритролейкоз 122
Эритрон 118
Эритропоэз 118,220,393,631,639.660,
727,738.990.1127
Эритропоэтин 57.121,305,638.660.940
Эритроцитная масса 207.421
Эрнтроцитафереэ 346.384.644
Эффективность утилизации кислорода 544
Эхинококкоз 179
О проекте «Национальные руководства»
«Национальные руководства» - серия практических руководств
для непрерывного последипломного образования врачей по ос¬
новным медицинским специальностям.
Аудитория национальных руководств - врачи различных
специальностей, работающие как в учреждениях первичного
звена, так и в стационарах; интерны, ординаторы, аспиранты;
студенты старших курсов медицинских вузов; преподаватели
медицинских вузов и учреждений последипломного образова¬
ния; руководители лечебных учреждений.
К участию в подготовке национальных руководств приглашены
ведущие российские специалисты. В редакционный совет во¬
шли главные специалисты-эксперты Минздравсоцразвития
России, руководители профессиональных медицинских об¬
ществ, академики РАН и РАМН, руководители научно-исследо¬
вательских учреждений и медицинских вузов.
Национальные руководства должны стать основой информаци¬
онного обеспечения непрерывного профессионального образо¬
вания врачей, проводимого под эгидой медицинских обществ.
ЙЖЛ
В данной книге Вы найдете ответы
на важные практические вопросы:
Каковы основные разделы трансфузиологии?
Что такое трансфузиойное й'оробиё? 4 '
Кто, когда и как должен выполнять^трансфувиологические
процедуры? -
Чем должен заниматься врач-тр|чсфузиолбг?
Каковы клеточные основы трансфузиологии?
Как решаются на практике основные задачи Службы крови?
Какие существуют проблемы имфёкционной безопасности
компонентов донорской крови?
Каковы принципы диагностики и лечения острой кровопотери?
Каковы трансфузиологические методы гемокоррекции?
Каковы основные понятия трансфузионной иммунологии?
Какова тактика трансфузионного лечения гемолитической
болезни новорожденных?
ISBN 978-5-9704-231
785970
423103