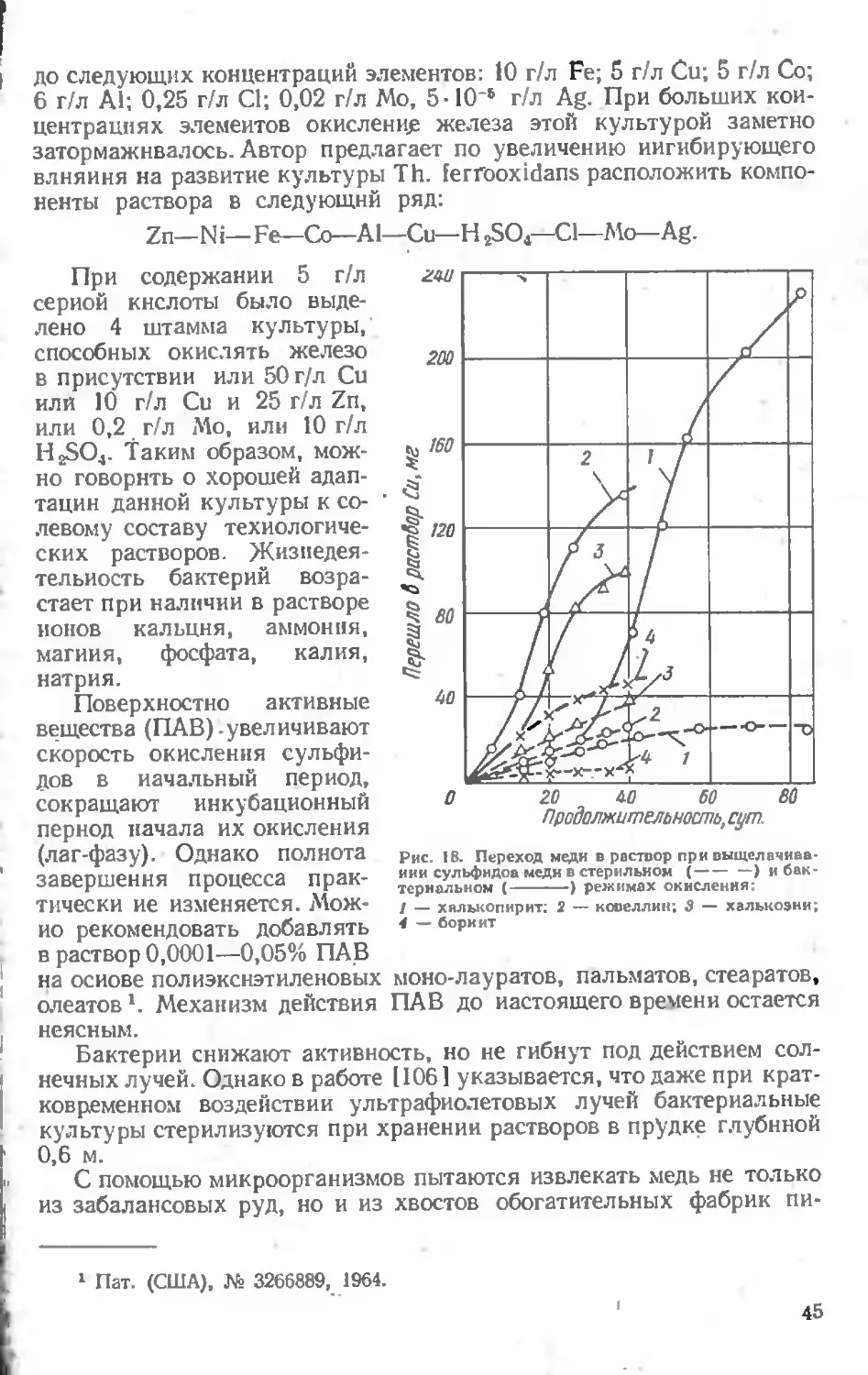
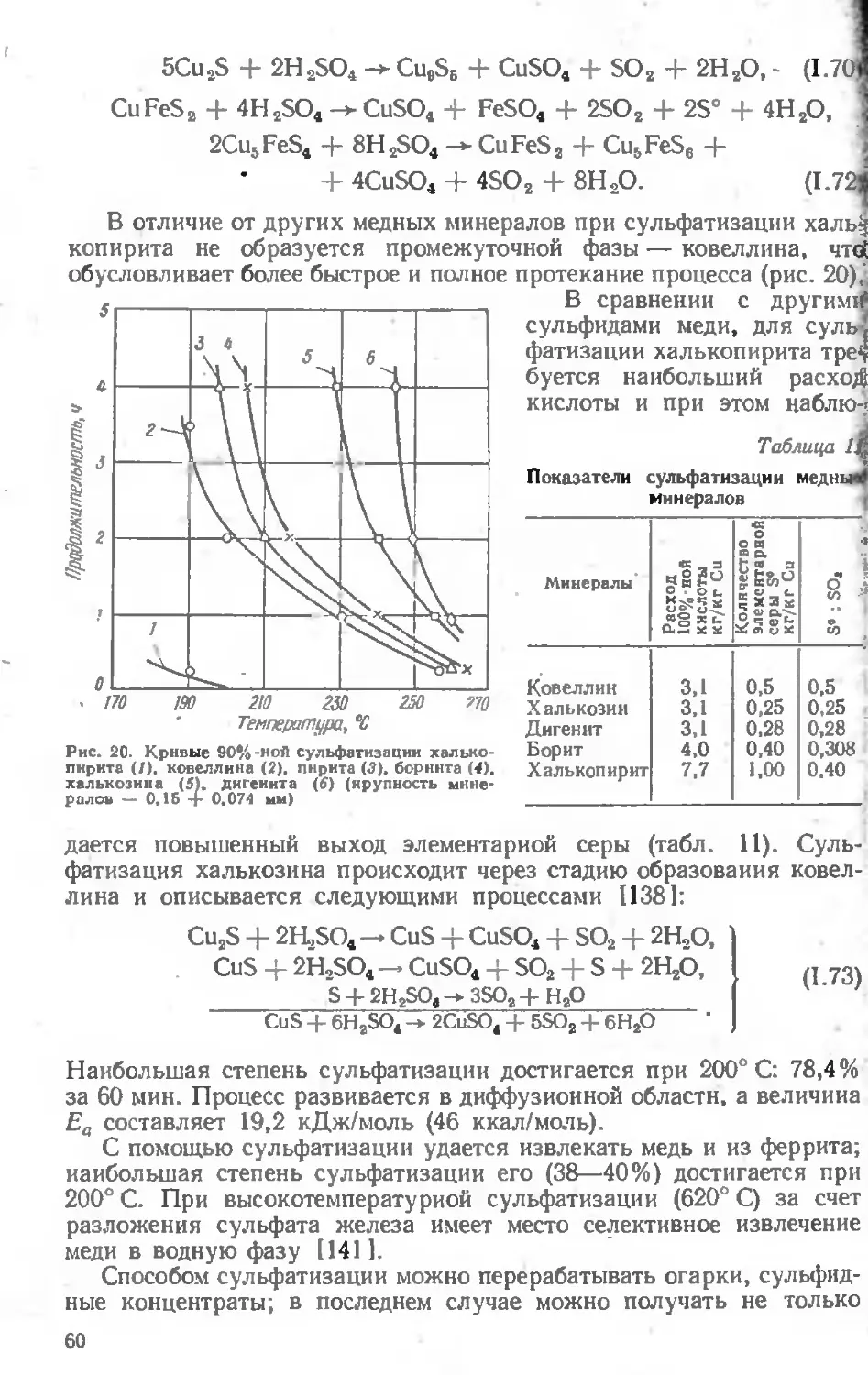
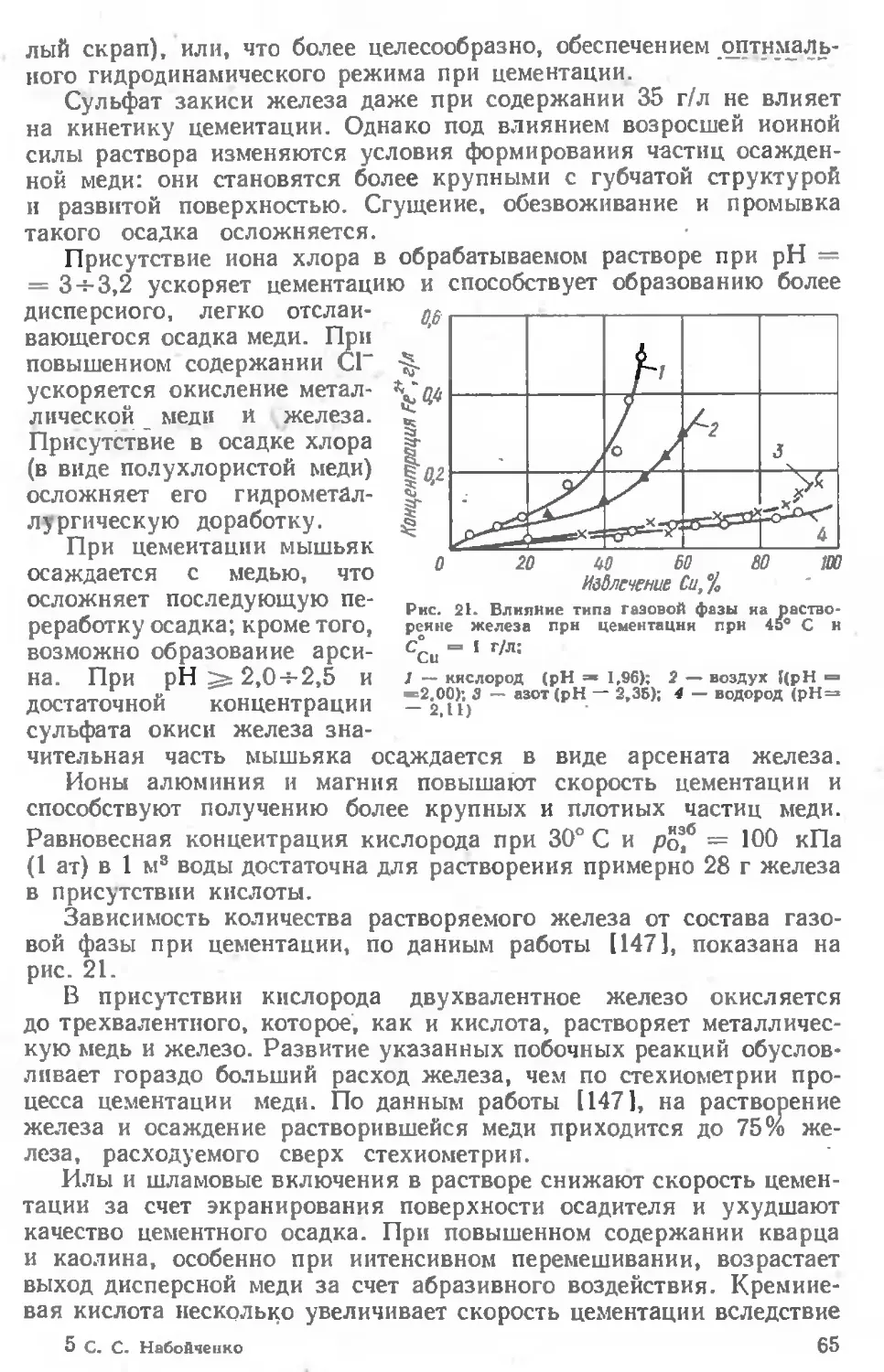
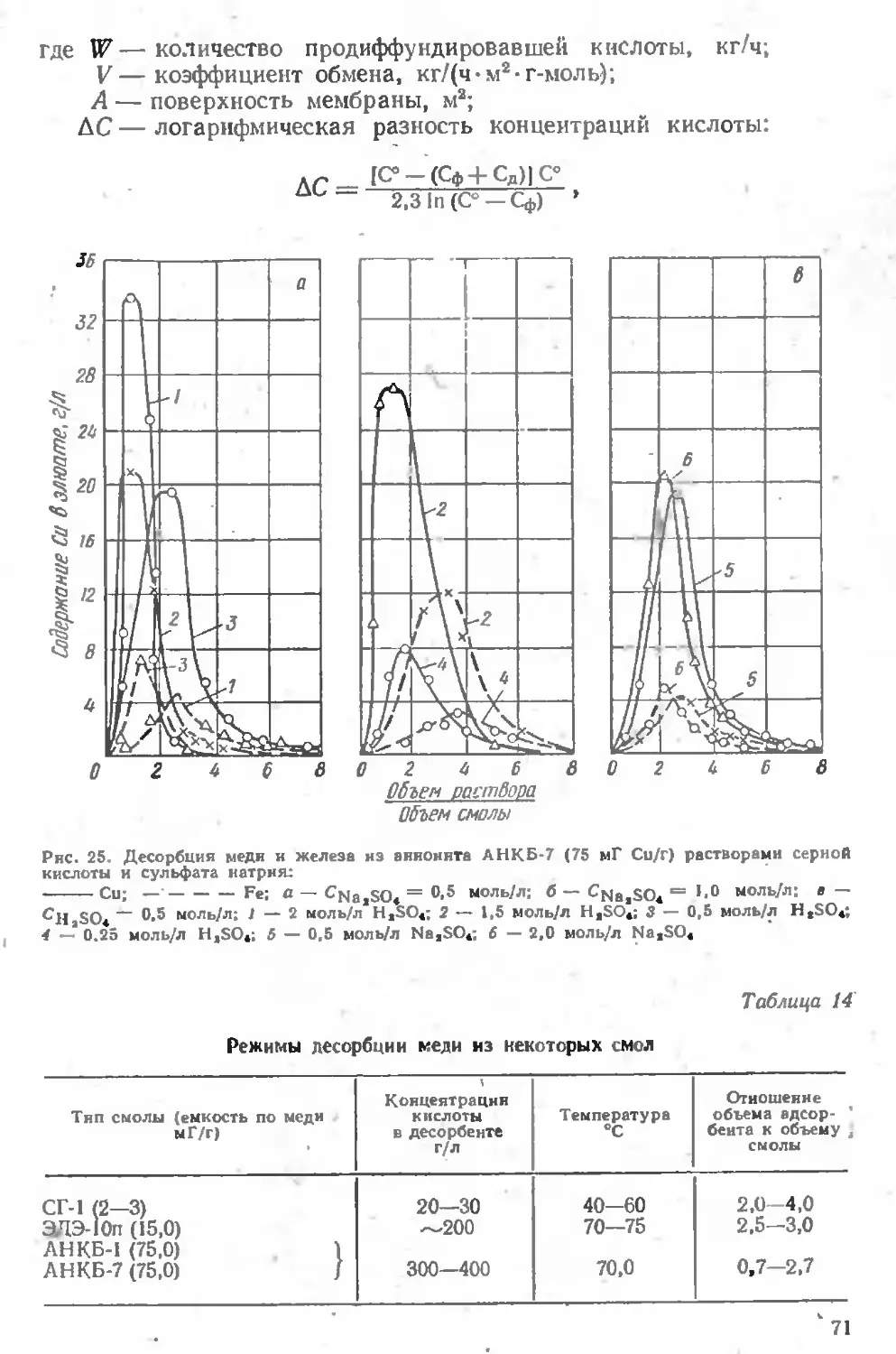
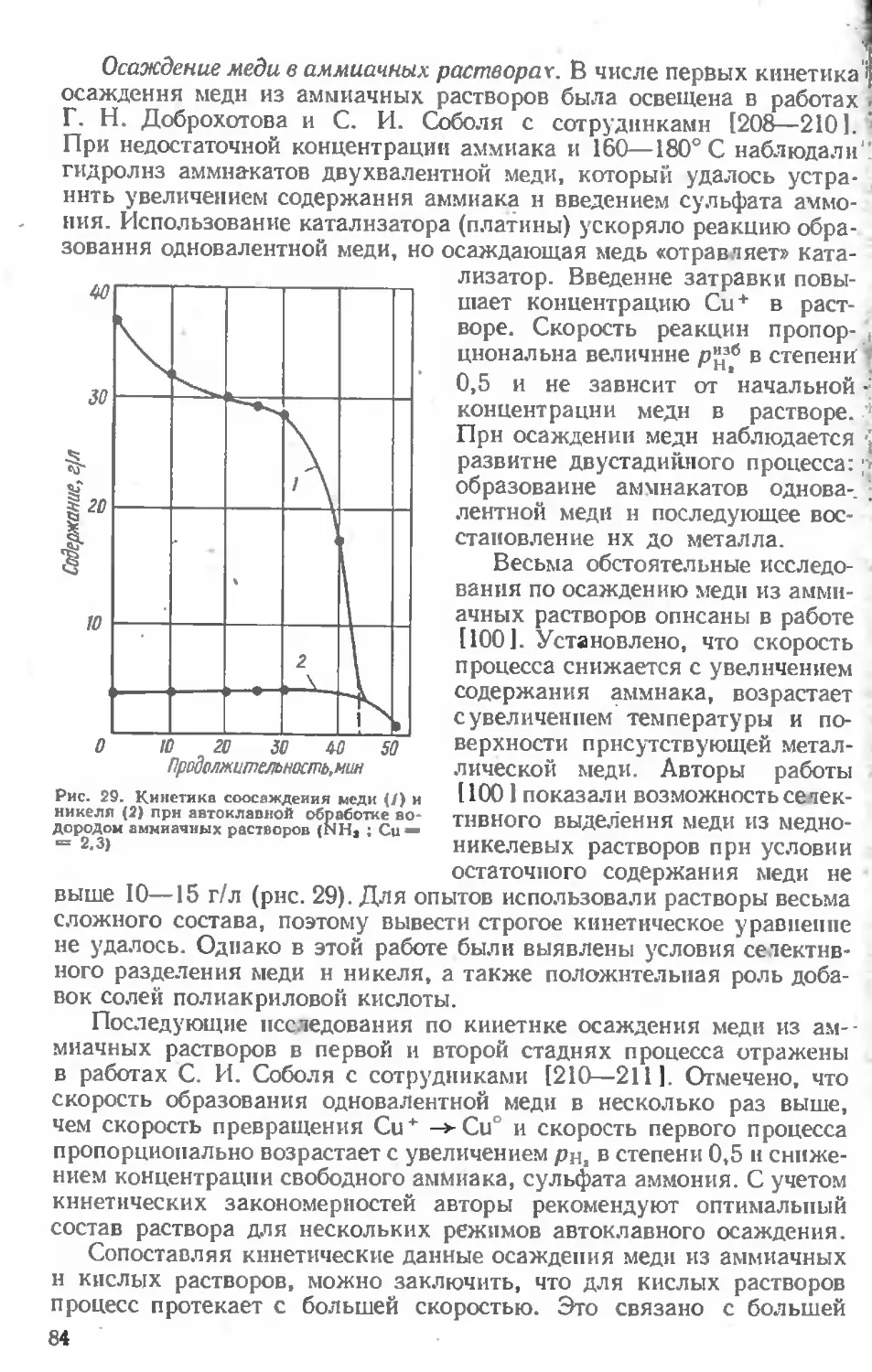
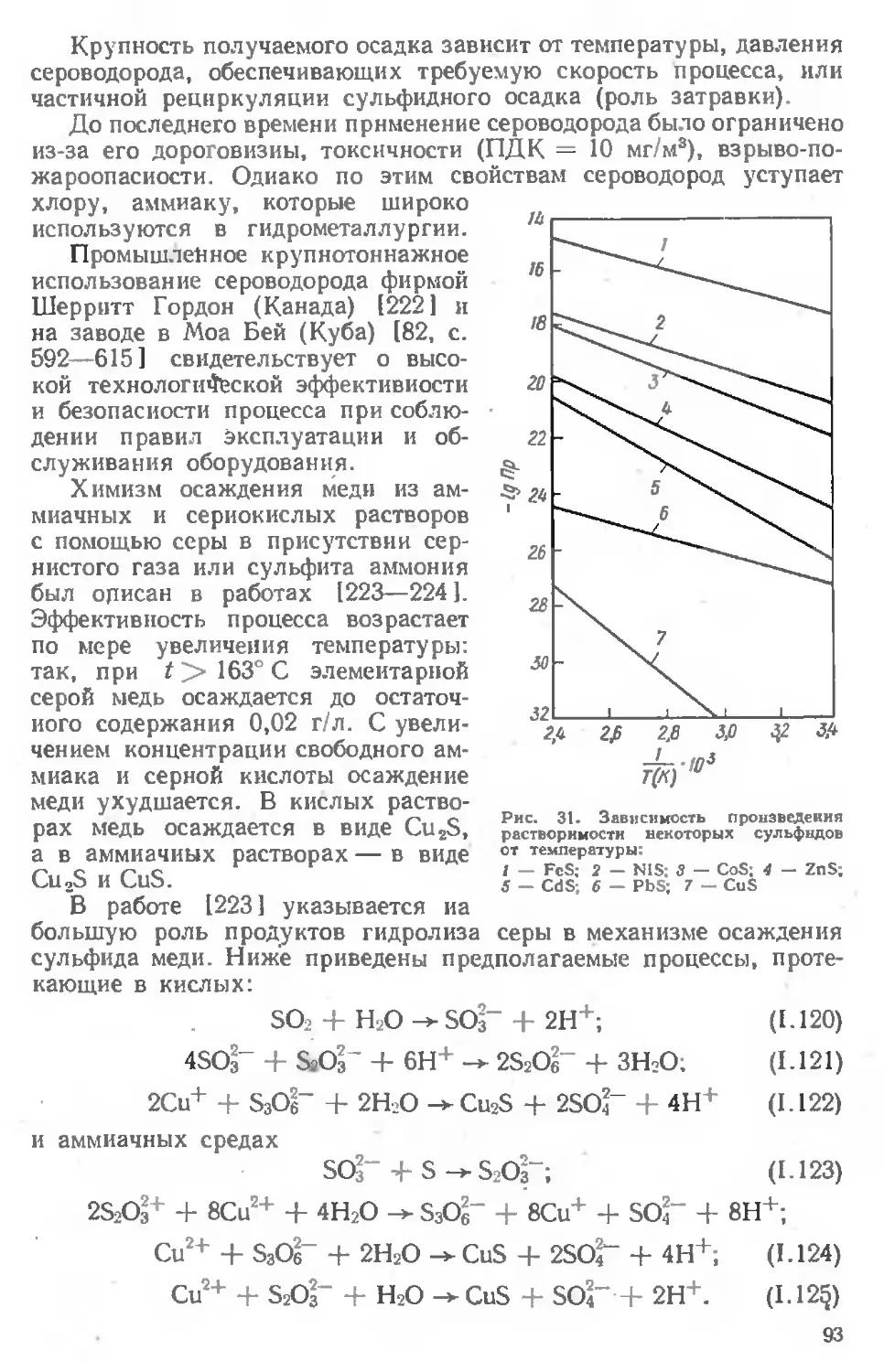
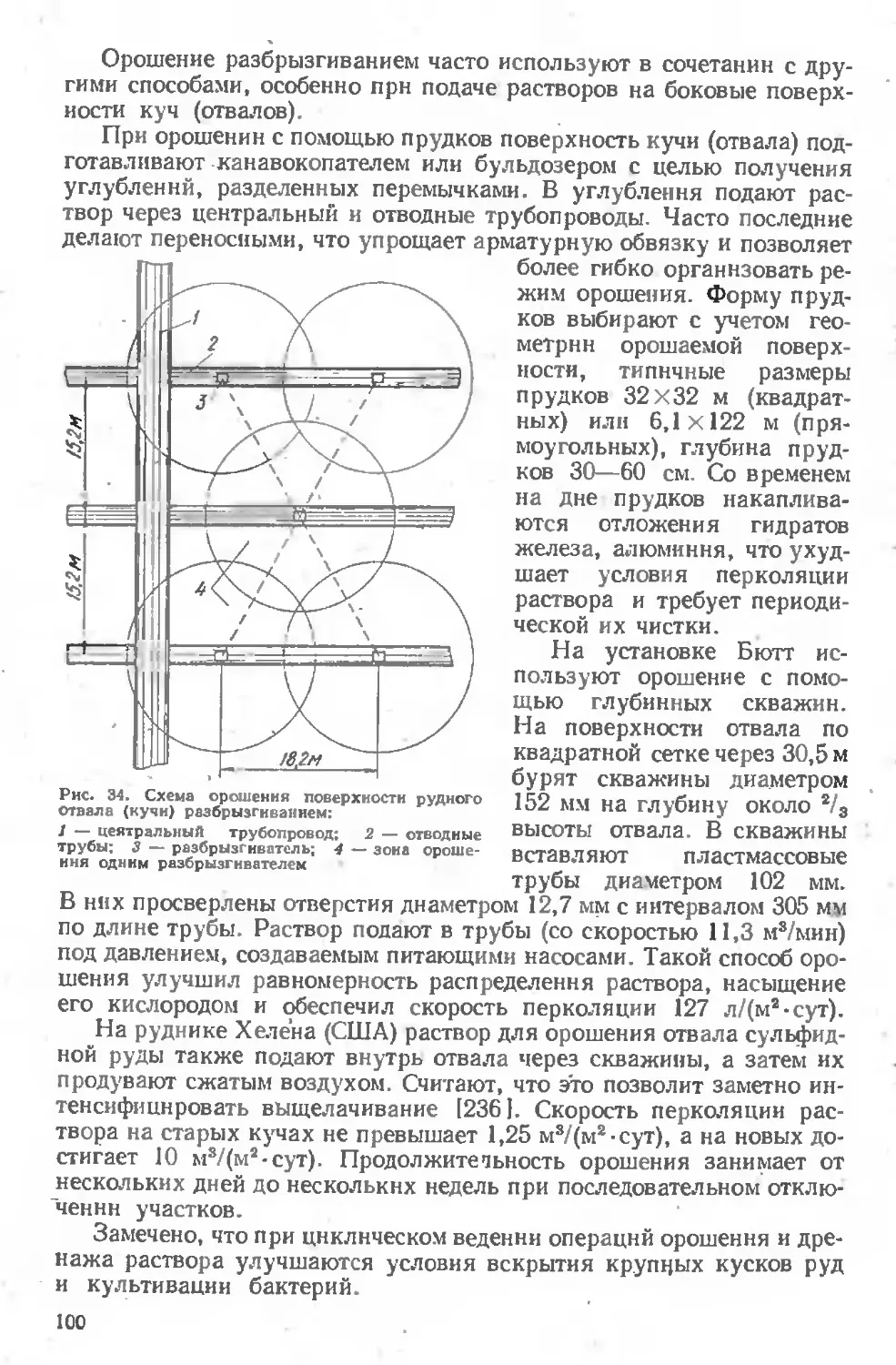
Текст
СО НЛСОЙЧЕНКО. В.И.СМИРНОВ
ГИДРОМЕТАЛЛУРГИЯ
С. С. НАБОЙЧЕНКО, I В. И, СМИРНОВ I
ГИДРОМЕТАЛЛУРГИЯ МЕДИ
I , УДК 669.334 iw&'X -
УДК 669.334
Гидрометаллургия меди. Набойченко С. С.,
[Смирнов В. И. | М., «Металлургия», 1974, с. 272.
Приведены теоретические основы способов выщелачиваний меди и ее выделения из медьсодержащих растворов.
Большое внимание уделено извлечению меди из забалансового сырья, богатых окисленных н смешанных руд, разнообразных концентратов вторичного сырья, а также из типичных полупродуктов от переработки других концентратов. Обобщены и проанализированы литературные данные за 1950—1972 гг. Приведены схемы и описана практика работы ведущих гидрометаллургических предприятий мира. Описаны' новые приемы в гидрометаллургии меди и перспективы ее развития.
Книга рассчитана на инженерно-технических работников, специализирующихся в области гидрометаллургии. Отдельные ее главы будут полезны студентам металлургических вузов и техникумов. Ил. 79. табл. 41. Список лит.: 522 назв.
31006—051
Н 040 (01)—74
64—74
ОГЛАВЛЕНИЕ
Предисловие .................... . . 5
Введение.................................................... ... !
Глава I. ЭЛЕМЕНТЫ ТЕОРИИ ОСНОВНЫХ ПРОЦЕССОВ. ИСПОЛЬ-
ЗУЕМЫХ В ГИДРОМЕТАЛЛУРГИИ МЕДИ . .... 17
Перевод меди в раствор .17
Термодинамика ........................................... 17
Кинетика растворения медн, ее сплавов и соединений .... 21
Особенности окисления -сульфидов меди при повышенной температуре и давлении кислорода.....................'. 35
Окислительные процессы в присутствии микроорганизмов . . 43
Электрохимическое растворение .......................... 46
Особенности выщелачивания кускового материала . 48
Термическая подготовка сырья к выщелачиванию 52
Обжиг ................................................... 52
Сульфатизация .......................................... 58
Выделение меди из растворов 61
Цементация . 61
Сорбция . 68
Экстракция . ............ -72
Электролиз............................................... 76
Автоклавное осаждение ................................... 78
Осаждение в виде химических соединений . . .90
Глава II. ИЗВЛЕЧЕНИЕ МЕДИ ИЗ НИЗКОСОРТНОГО И ЗАБАЛАНСОВОГО СЫРЬЯ ...................................................... 96
Выщелачивание ..................... . .
Выщелачивание руды в отвалах и кучах . . *. . 97
Подземное выщелачивание . . 103
Извлечение меди из растворов 107
Цементация.............................................. 108
Извлечение меди с использованием экстракционно-сорбционной технологии . ‘.................................... ... 128
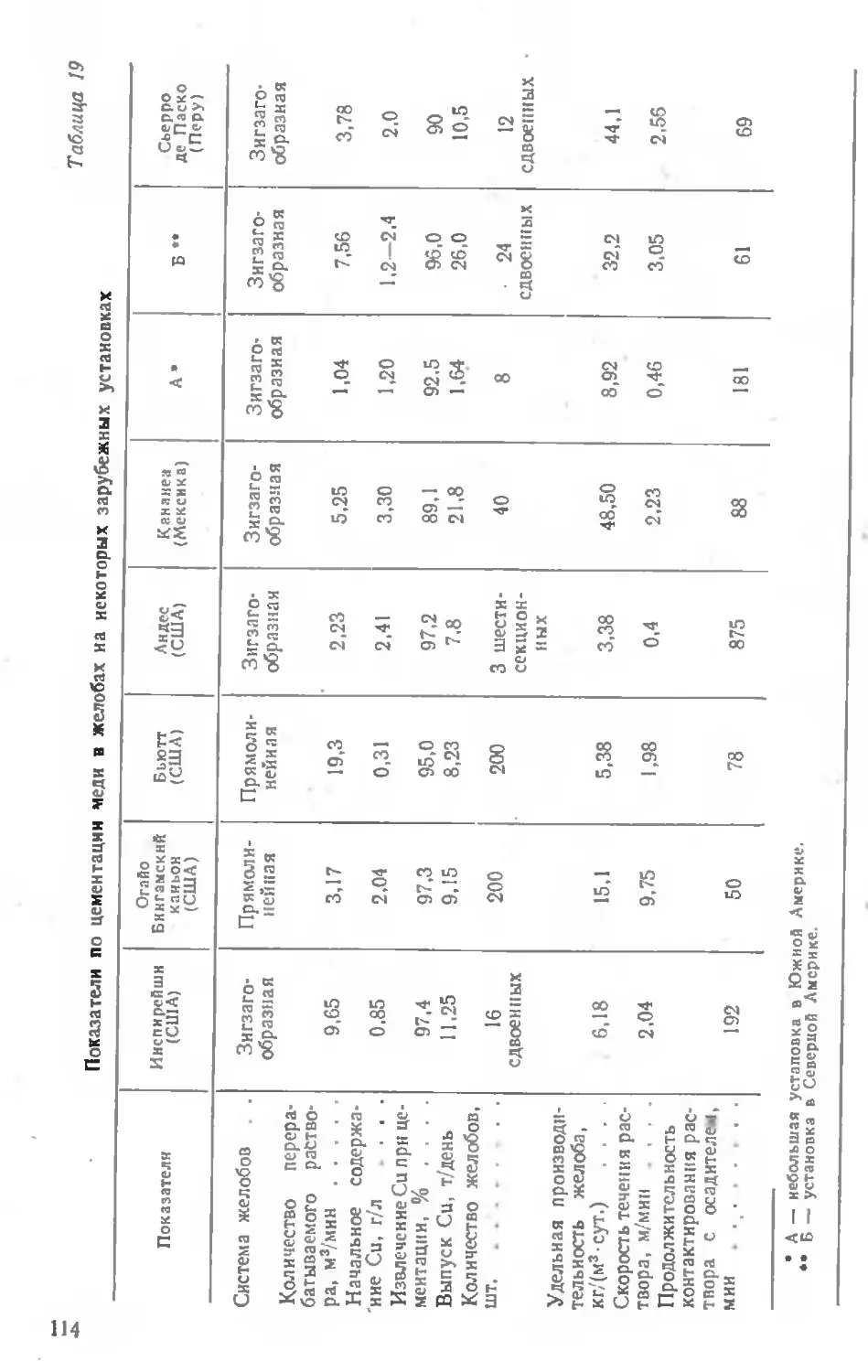
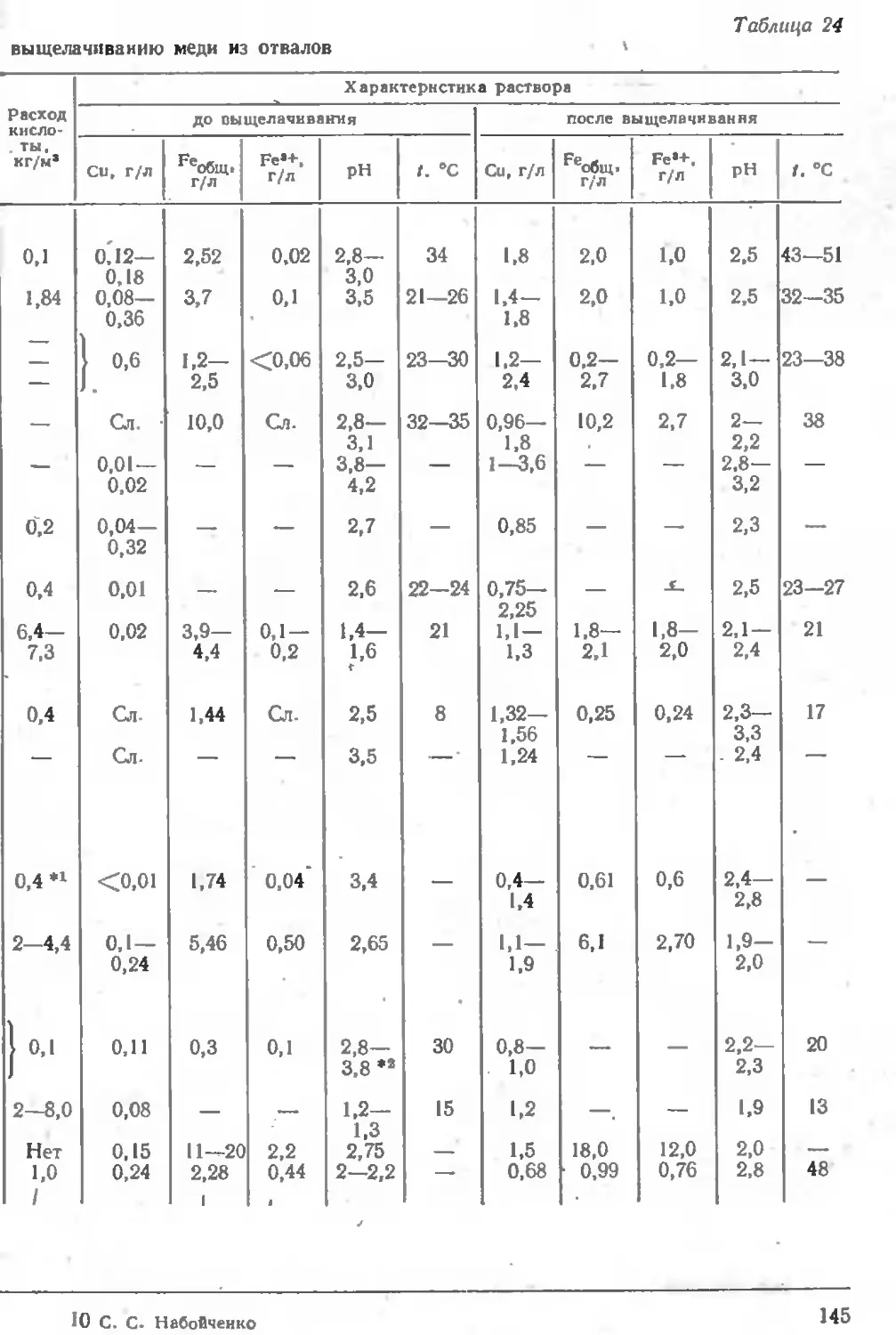
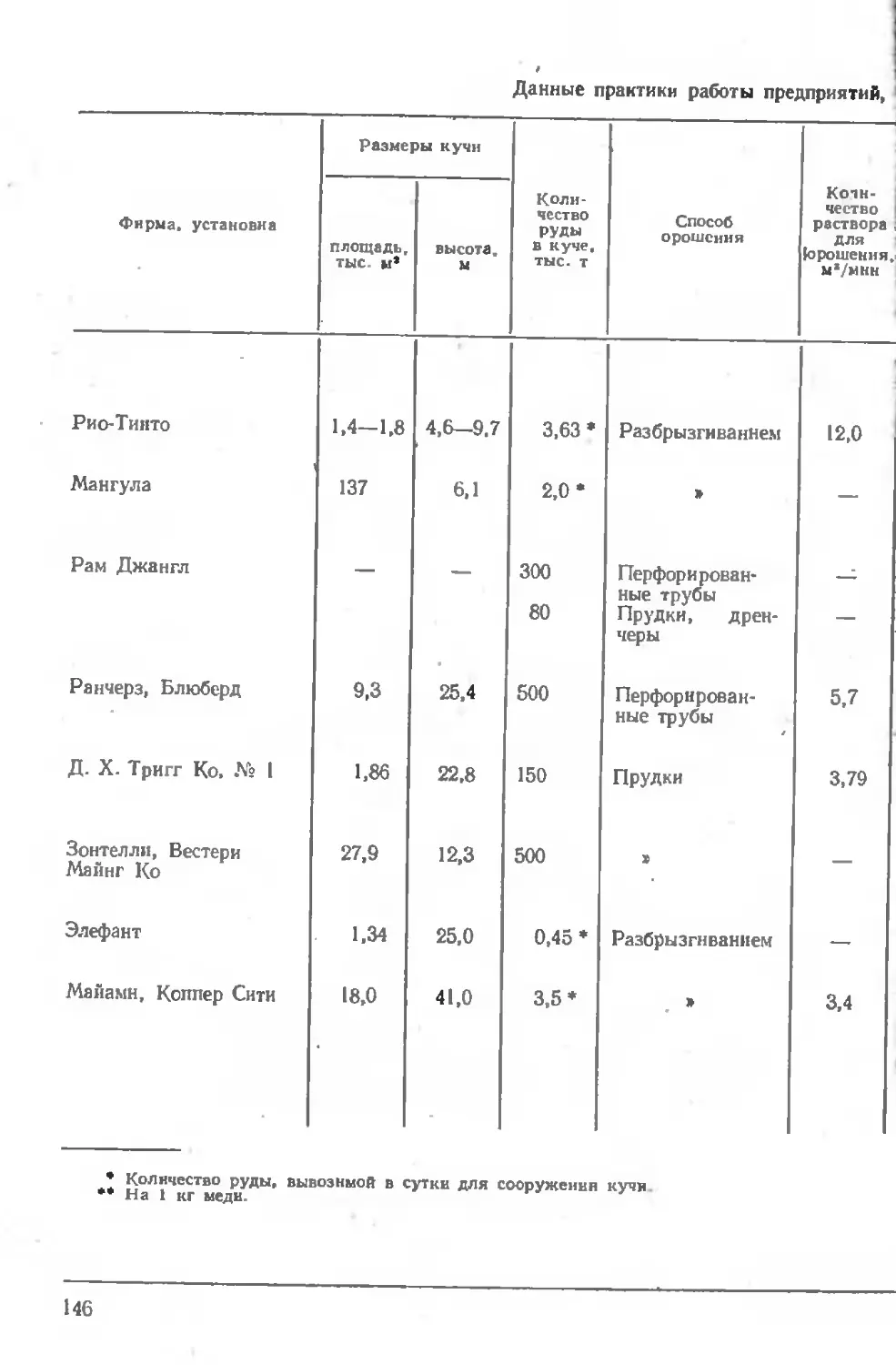
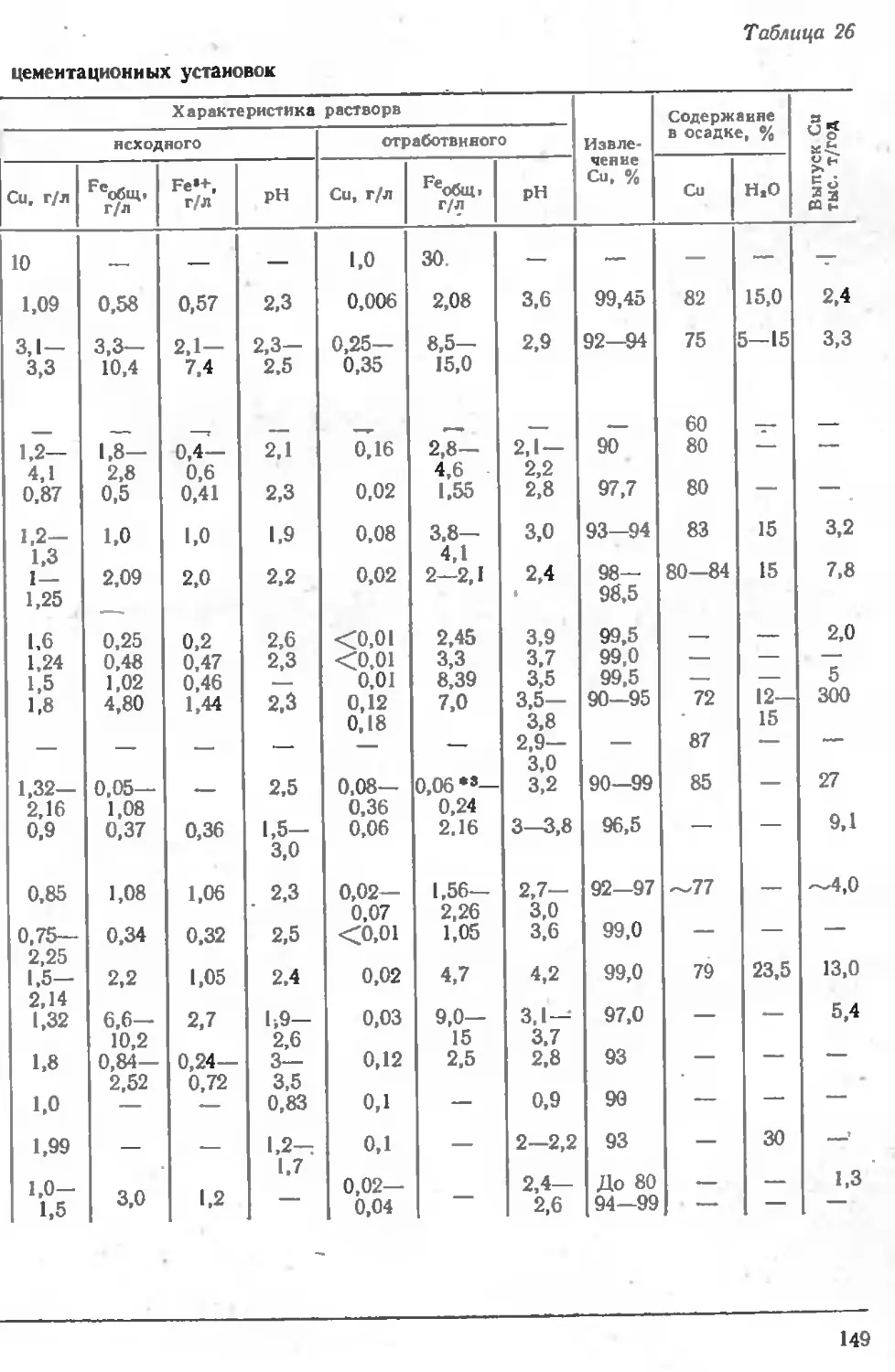
Описание практики работы предприятий 143
Практика переработки отвалов 143
'Практика кучного выщелачивания . . . . ... 155
Практика подземного выщелачивания .... . 158
Новые направления переработки рудного сырья ........... 162
Применение ядерных взрывов прн подземном выщелачивании ................................................... 162
Применение комбинированных реагентов для выщелачивания
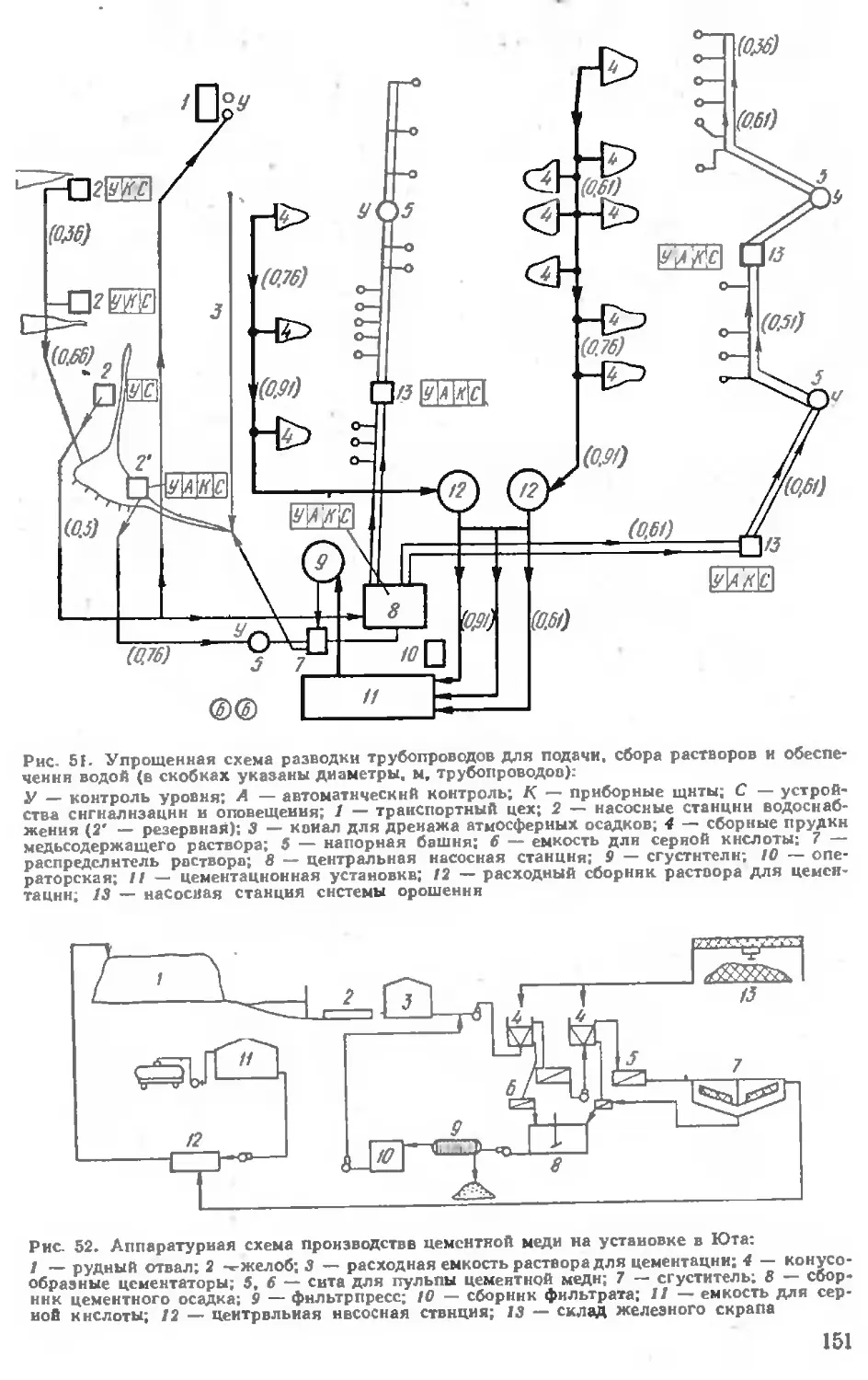
Применение электрофизических приемов обработки сырья . . .' 166 Комплексное использование растворов . . . . 167
Новые технологические процессы ... 168
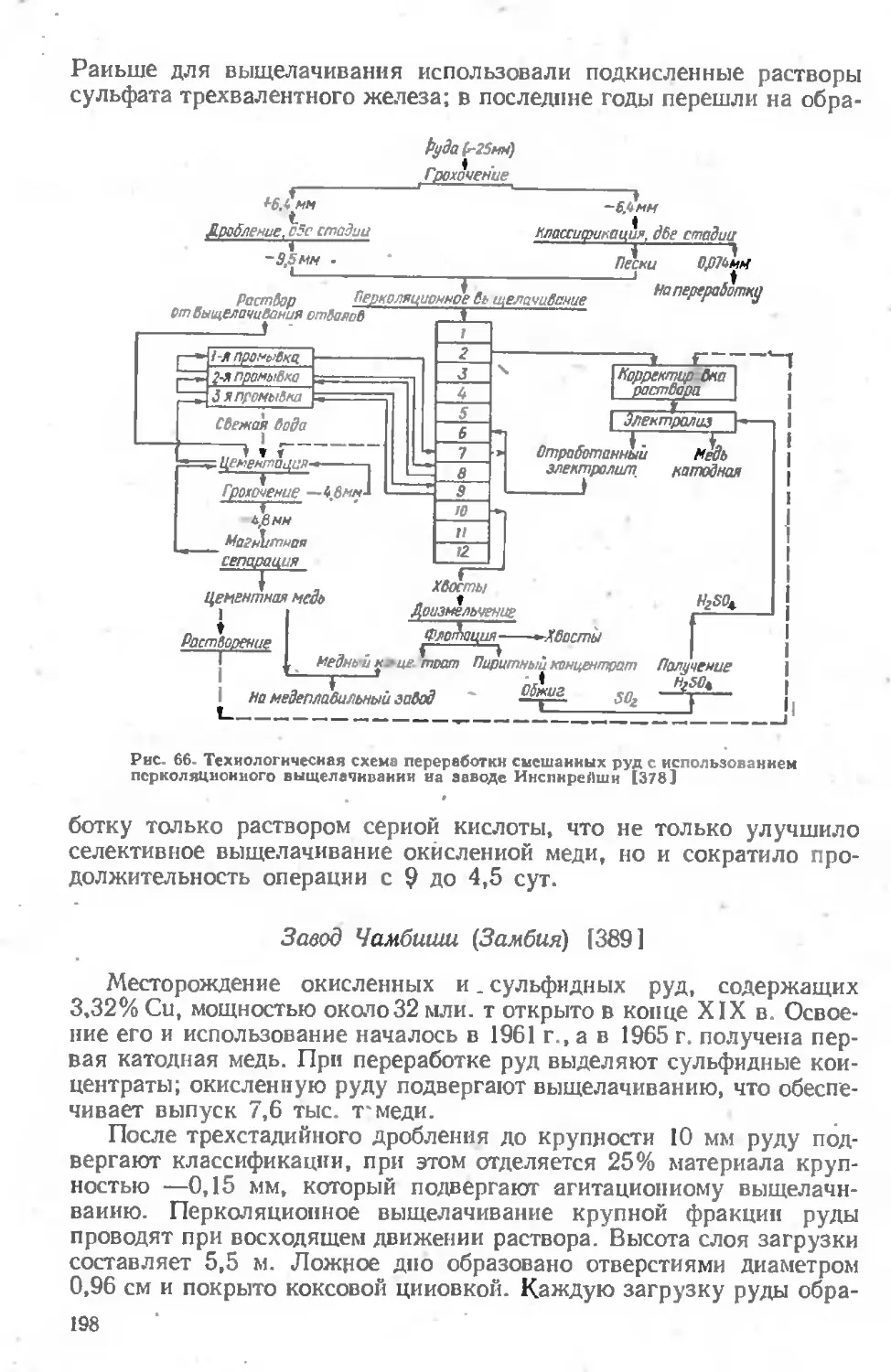
Глава III. ПЕРЕРАБОТКА СМЕШАННЫХ РУД ... .176
Глава IV. ПЕРЕРАБОТКА ОКИСЛЕННЫХ БОГАТЫХ РУД И КОН-
ЦЕНТРАТОВ .......................................... 184
Перколяционное выщелачивание 184
Агитационное выщелачивание ....................... . 192
Выделение меди из растворов .................. 193
Описание практики заводов ........ . ............. 196
Аммиачное выщелачивание руд.......................... 205
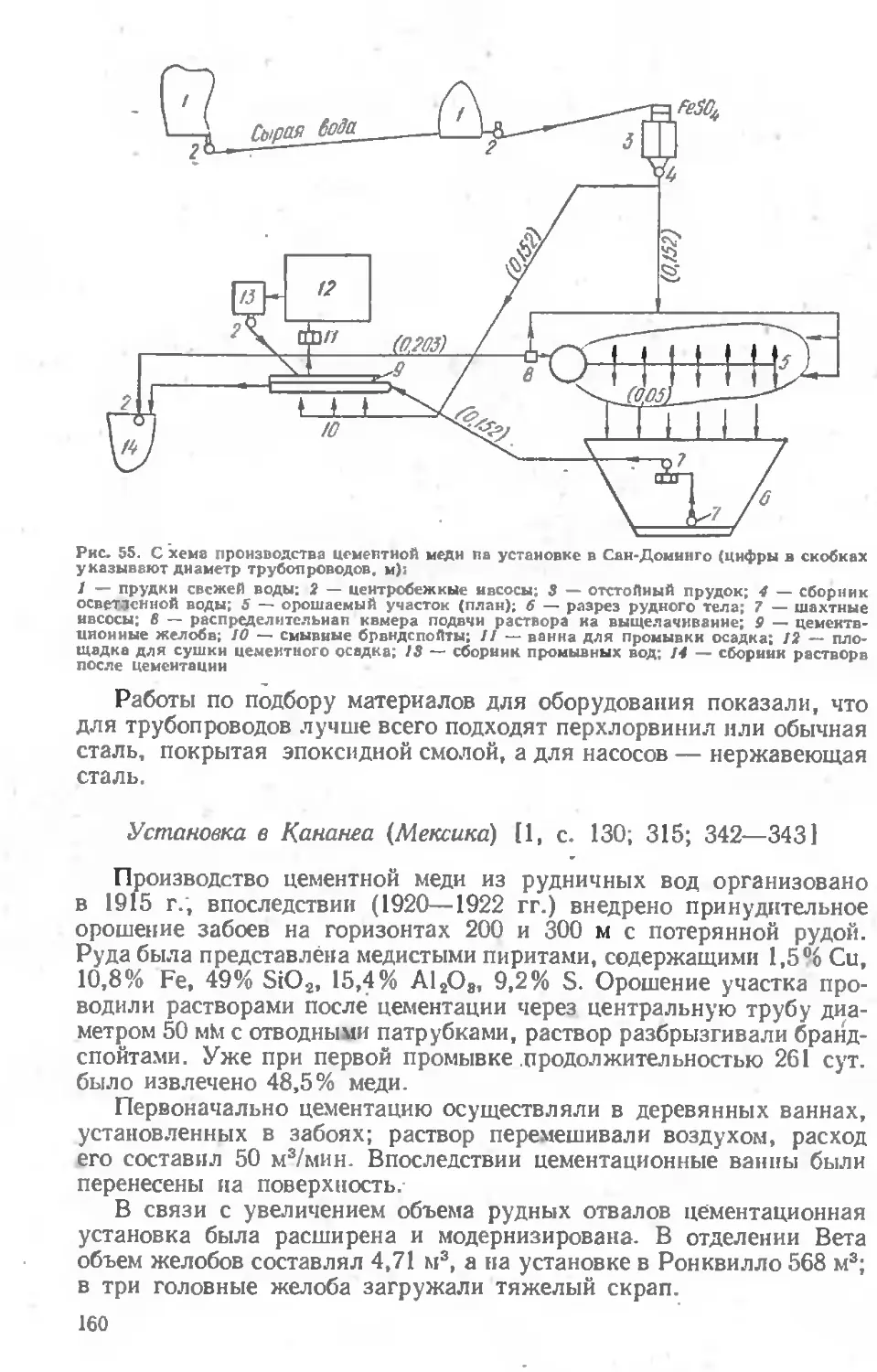
Глава V. ПЕРЕРАБОТКА ЦЕМЕНТНОЙ МЕДИ И МЕДЬСОДЕРЖА- .
ЩЕГО ВТОРИЧНОГО СЫРЬЯ................................ 207
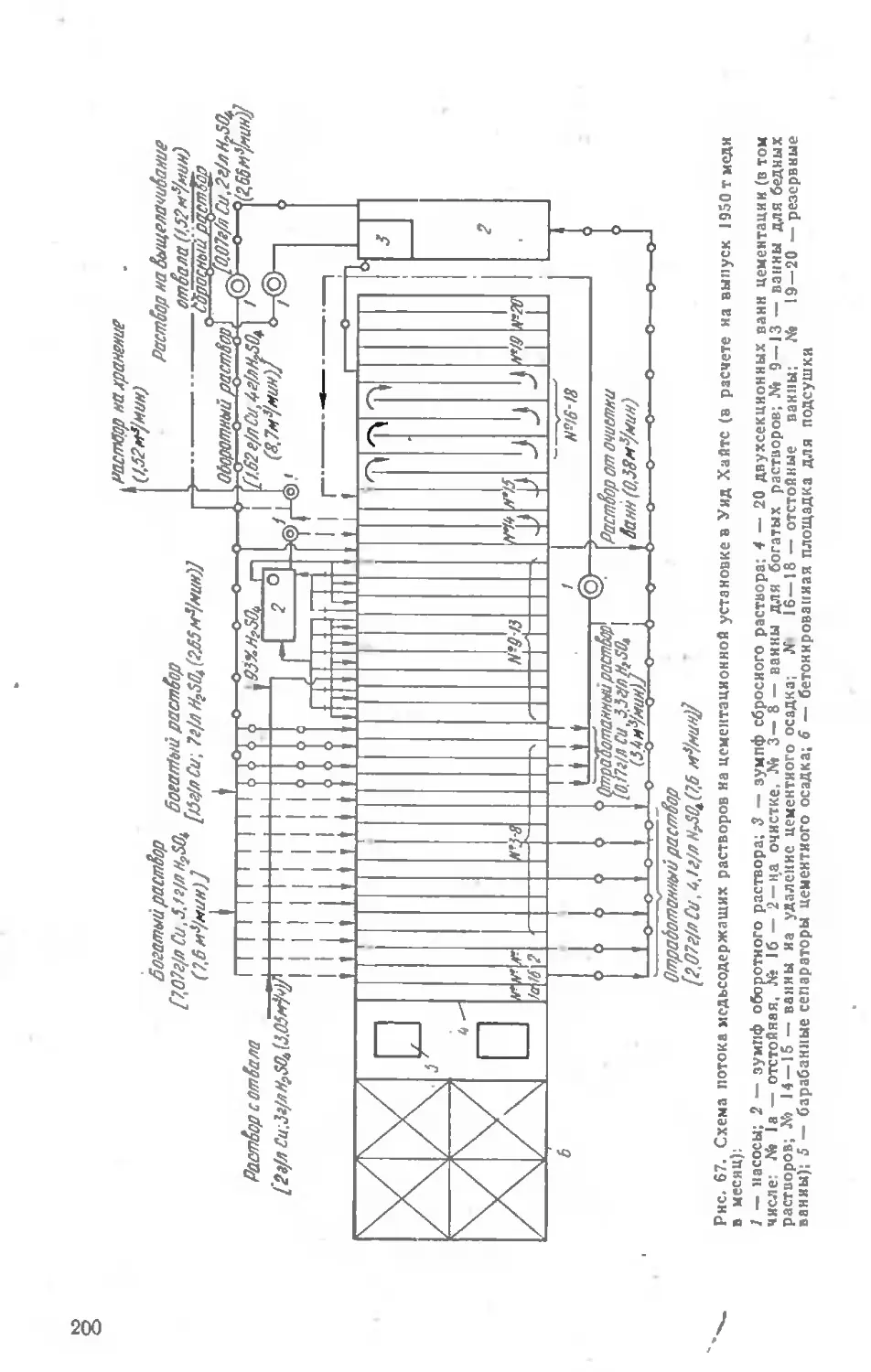
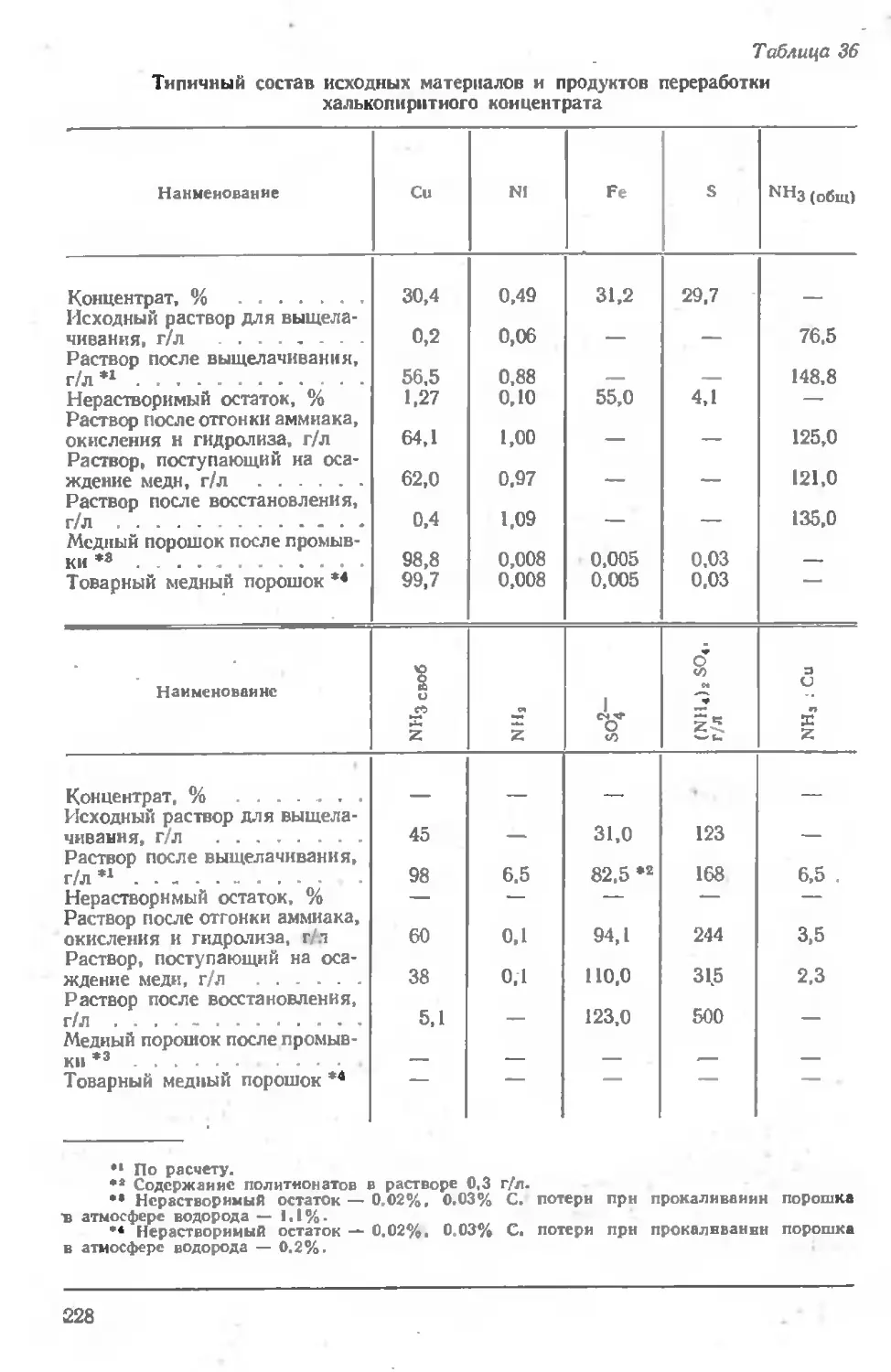
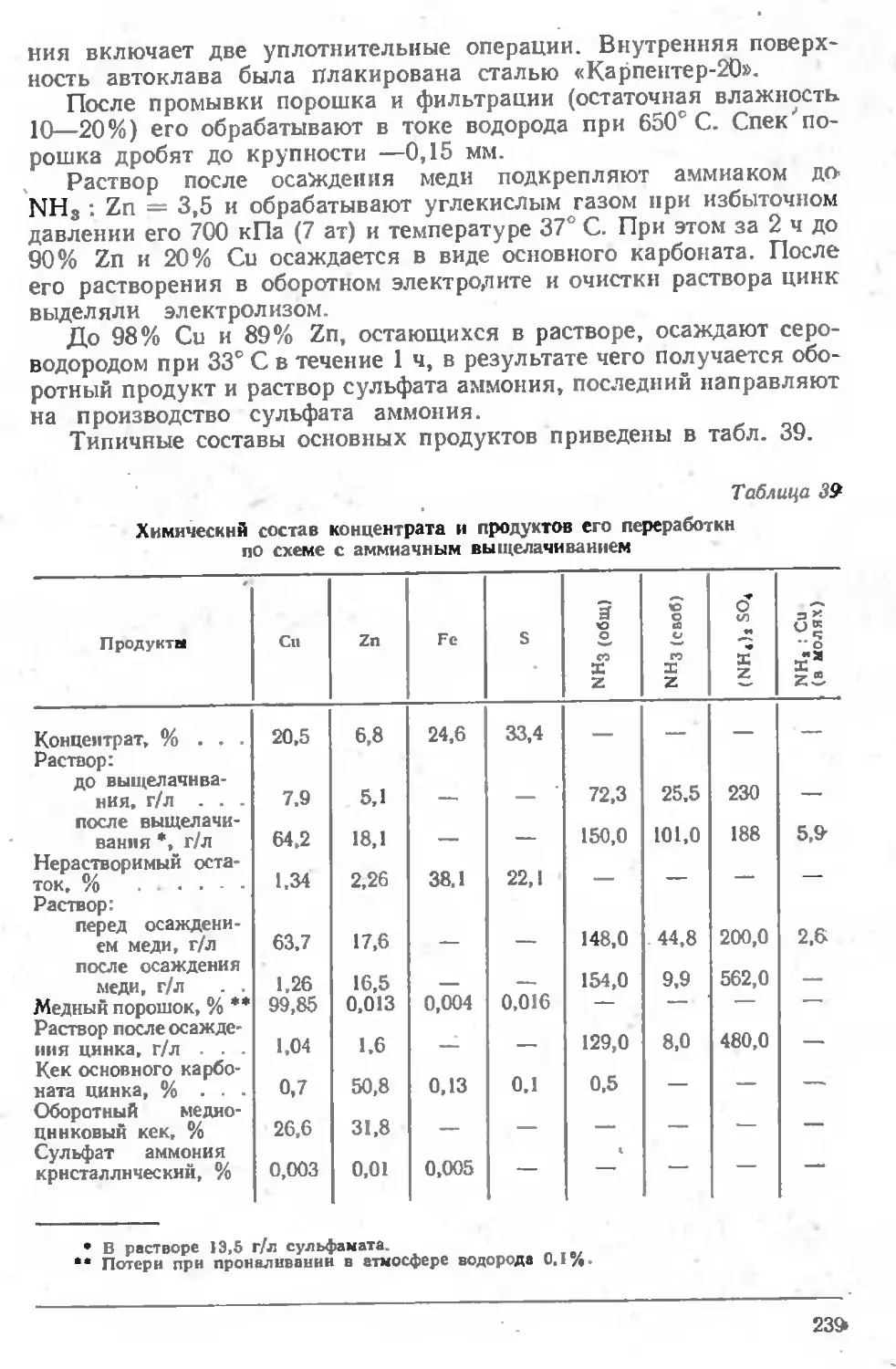
Глава VI. ПЕРЕРАБОТКА БОГАТЫХ СУЛЬФИДНЫХ МАТЕРИАЛОВ ........................................................... 218
Автоклавные способы переработки . . 218
Переработка медных концентратов и штейнов............ 222
Переработка медио-цииковых руд и концентратов........ 234
Переработка медио-ннкелевых концентратов и штейнов 241
Переработка медио-кобальтовых руд н концентратов ... 245
Переработка медно-свинцовых концентратов и штейнов . . 249
Глава VII. ИЗВЛЕЧЕНИЕ МЕДИ ИЗ НЕКОТОРЫХ ПОЛУПРОДУКТОВ ПРОИЗВОДСТВА И ОТХОДОВ ОБРАБОТКИ ЦВЕТНЫХ МЕТАЛЛОВ................................................... 250
Список литературы . . ... 257
ПРЕДИСЛОВИЕ
В общем объеме производства меди на долю пирометаллургического способа приходится около 90% мирового выпуска это^о металла. Однако в последние десятилетия много внимания уделено изучению и развитию гидрометаллургических способов. Подвергаются коренной реконструкции и модернизации старые установки, создаются новые заводы и предприятия, производящие медь и сопутствующие металлы только гидрометаллургическими способами. Это связано с рядом технологических, социально-экономических проблем развития цветной металлургии, возникших в 60—70-х гг. текущего столетия.
Среди этих проблем надо отметить следующие: существенное изменение сырьевой базы, необходимость комплексного использования сырья, удорожание передела и увеличение количества оборотных материалов в связи со строительством громоздких пылеулавливающих и очистных сооружений, которые стали необходимы в результате роста объема выбросов пыли и сернистого газа при увеличении мощности медеплавильных заводов и др.
Значительно сократилось количество добываемых руд с высоким содержанием меди; рентабельный минимум его прн переработке руд составляет 0,6—0,8% Си; а при переработке отвалов — даже 0,25— 0,3% Си. Существенно возросла добыча руд открытым способом, что определило накопление отвалов, содержащих значительное количество меди (в США объем карьерной добычи руды достиг почти 90% общей поставки руды, при этом на 1 т руды приходится 2—3 т вскрышной породы).
По мере увеличения глубины подземных разработок проявляется тенденция ухудшения вещественного состава руд; в результате приемами флотационного обогащения становится все труднее получать качественные одноименные концентраты, определяющие эффективную их переработку пирометаллургическими способами. В связи с неэкономичностью глубоких разработок ряда месторождений возрастает количество закрытых рудников с неизменными потерями руды.
В сырьевом балансе развитых стран существенно возросла роль вторичного сырья, из которого производят до 35—40% всей меди.
Последние успехи в интенсификации выщелачивания сульфидных руд позволили вовлечь в переработку сырье в отвалах, отработанных рудниках или нерентабельных месторождениях.
Основным сырьем в гидрометаллургии служат окисленные руды с небольшим содержанием меди и нерентабельным для извлечения содержанием благородных металлов. Переработка больших объемов сырья и растворов определяет значительные капиталовложения. Поэтому гидрометаллургические предприятия получили широкое
распространение в районах с жарким климатом, где имеется возможность установки оборудования под открытым небом или в зданиях легкого типа.
Вследствие меньшего числа операций до получения конечной продукции, повышенного сквозного извлечения ценных металлов, облегчения условий труда в результате автоматизации имеет большие перспективы и гидрометаллургическая переработка флотационных медных концентратов..
В ряде случаев гидрометаллургические приемы эффективно дополняют флотационные методы обогащения, особенно при переработке руд, содержащих окисленные и сульфидные минералы.
В последние годы дополнительно к ранее изданным [1—31 появился ряд интересных работ, в которых освещены теория и практика гидрометаллургических способов переработки сырья, в том числе н медьсодержащих материалов 14—61. Несколько позднее вышла в свет содержательная книга под общей редакцией проф. С. И. Митрофанова, посвященная проблеме извлечения меди из окисленных руд комбинированными способами [71. В период подготовки данной работы был издан превосходно составленный обзор зарубежного опыта по основным направлениям в гидрометаллургии меди, подготовленный Б. В. Синявер и проф. А. А. Цейдлером 181-
Тем не менее, научно-произродственной литературы по гидрометаллургии меди явно недостаточно. Авторами данной книги сделана попытка в некоторой степени восполнить имеющийся пробел. В основу систематизации излагаемого материала положена классификация гидрометаллургических способов с учетом типа медьсодержащего сырья, поскольку характеристика его и содержание меди во многом определяют выбор конкретной технологии.
.Авторы выражают большую благодарность проф. докт. техн, наук И. Ф. Худякову, докт. техн, наук В. И. Дееву за консультации и помощь при подготовке рукописи.
Авторы признательны проф. докт. техн, наук Н. Н. Севрюкову за .замечания и полезные советы..
ВВЕДЕНИЕ
В настоящее время основными сырьевыми источниками для производства меди гидрометаллургическим способом являются руды, концентраты и штейны, огарки, металлическое вторичное сырье.
В зависимости от формы нахождения меди руды разделяют на сульфидные, окисленные и смешанные. По характеру пустой породы руды делят иа основные, содержащие окислы кальция, магния и Других металлов, и кислые, включающие глинозем, кремнезем. При Содержании медн менее 0,4—0,5% руды считаются забалансовыми.
При флотационном обогащении сульфидных руд получают концентраты. В зависимости от типа исходного сырья известны медные, Медно-ципковые, медно-нйкелевые, медно-кобальтовые, медно-свин-Цово-цинковые,концентраты и др. Содёржание в них меди колеблется Довольно в широких пределах й в среднем составляет'.10—25%.
При плавке богатых сульфидных руд или концентратов получают’ штейны, содержащие 14—40% Си.
Огарки являются продуктом окислительного, сульфатизирую-Щего, хлорирующего, сульфато-хлорирующего обжига сульфидных концентратов или'богатой руДы.
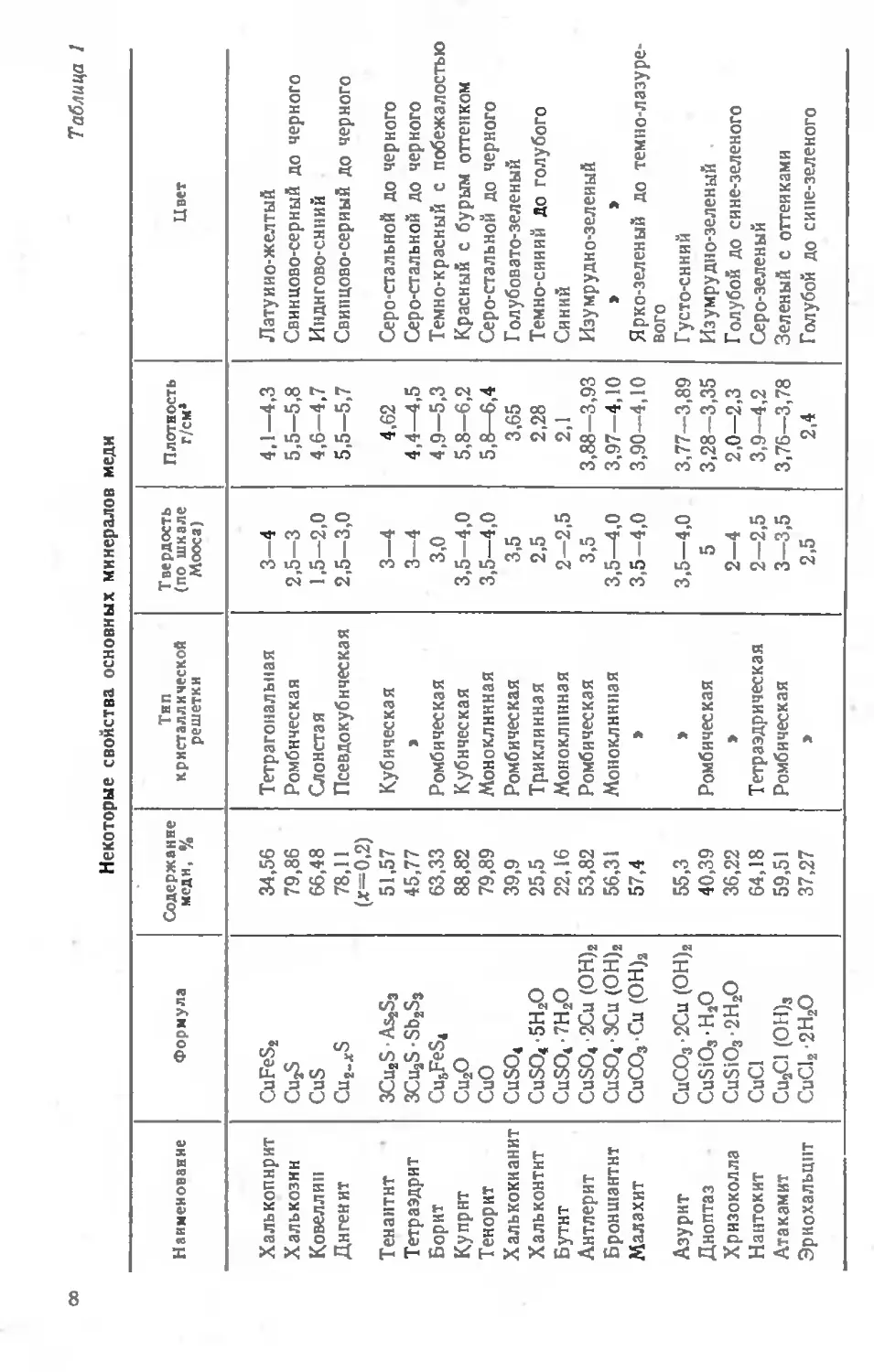
Минералогическая характеристика основных соединений меди, присутствующих в медьсодержащем сырье, приведена в табл. 1 Встречаются и другие сложные соединения меди, которые, как правило, сопутствуют основным минералам, характерным для конкретного типа месторождения. В числе второстепенных медных минералов отметим халькопирротин (CuFeSa-nFeS), карролйт (CojCuSJ, ван-денбрандеит (CuO-UO3-2H2O), делафосит (CuFeO2), креднерит (Cu2MnO5), партцит (Cu^Sbs-j, трйппкёит (Cii As 2О4), актов нит (СиОНС1)2 • ЗН2О, боталлакит [Си2С1 (ОН)31, кальюметит (СиОНС1)2-2Н2О, паратакамиит [Си2С1 (ОН)31, анрихальцит [(ZnCu)5 (СО3)2-(ОН)61, гергардит [Cu2(NO3)(OH)31, крёнкит Na2Cu (SO4)2-2H2O, рансомит Си (FeAl)2 (SO4)4-7H2O, цианохроит К,Си (SO4)2-'6H2O, лейтонит K2Ca2CuSO4-2H2<5. Присутствие этих минералов в перерабатываемом сырье приводит к накоплению в растворах посторонних ионов (Na + , К+, Al3+, S3 + , As3 + , Мпа+, NOr и др.).
Необходимо отметить, что сульфатные или хлбридные соединения меди не только полностью растворяются при выщелачивании, но И служат дополнительным источником соответствующей кислоты, что уменьшает'общий расход растворителя. В рудах и концентратах медь представлена соединениями высшей и низшей валентности; после пирометаллургической обработки сырья основными соединениями меди являются низшие сульфиды и окислы (типа дигенита, куприта), сложные окислы вторичного происхождения (ферриты, силикаты и др.), двойные сульфиды.
00
Таблица 1
Некоторые свойства основных минералов меди
Наименование Формула Содержание меди, % Тип кристаллической решетки Твердость (по шкале Мооса) Плотность г/см* Цвет
Халькопирит CuFeSs 34,56 Тетрагональная 3 4 4,1—4,3 Латуиио-желтый
Халькозин Cu,S 79,86 Ромбическая 2,5-3 5,5-5,8 Свинцово-серный до черного
Ковеллин CuS 66,48 Слоистая 1,5-2,0 4,6-4,7 Инднгово-снний
Ди ген ит Cu2_xS 78,11 (x=0,2) Псевдокубнческая 2,5-3,0 5,5-5,7 Свинцово-серный до черного
Тенантит SCi^S-AsjSa 51,57 Кубическая 3-4 4,62 Серо-стальной до черного
Тетраэдрит 3Cu2S-Sb2S3 45,77 > 3-4 4,4—4,5 Серо-стальной до черного
Борит CujFeS, 63,33 Ромбическая 3,0 4,9-5,3 Темно-красный с побежалостью
Куприт Cu2O 88,82 Кубическая 3,5-4,0 5,8-6,2 Красный с бурым оттенком
Тенорит CuO 79,89 Моноклинная 3,5-4,0 5,8—6,4 Серо-стальной до черного
Халькокианит CuSOt 39,9 Ромбическая 3,5 3,65 Г олубовато-зеленый
Хальконтнт CuSO4-5H2O 25,5 Триклинная 2,5 2,28 Темно-синий До голубого
Бутит CuSO4-7H2O 22,16 Моноклинная 2-2,5 2,1 Синий
Антлерит CuSO4 2Cu (0H)2 53,82 Ромбическая 3,5 3,88—3,93 Изумрудно-зеленый
Броншантнт CuSO4-3Cu (0H)2 56,31 Моноклинная 3,5—4,0 3,97 4,10 » »
Малахит CuCOj -Cu (0H)2 57,4 > 3,5-4,0 3,90-4,10 Ярко-зеленый до темно-лазуревого
Азурит CuCO3-2Cu (0H)2 55,3 » 3,5-4,0 3,77-3,89 Густо-синий
Диоптаз CuSiOj -H20 40,39 Ромбическая 5 3,28-3,35 Изумрудно-зеленый
Хризоколла CuSiO3-2H2O 36,22 > 2-4 2,0-2,3 Голубой до сине-зеленого
Нантокит CuCl 64,18 Тетраэдрическая 2-2,5 3,9-4,2 Серо-зеленый
Атакамит Cu2Cl (OH), 59,51 Ромбическая 3-3,5 3,76—3,78 Зеленый с оттенками
Эриохальцпт CuC122H2O 37,27 > 2,5 2,4 Голубой до сине-зеленого
Во вторичном сырье медь в основном присутствует в свободном металлическом состоянии или в виде эвтектик твердых растворов с другими металлами (цинком, оловом, никелем и др.).
Сульфидные соединения меди являются неплохими проводниками электрического тока.
При выборе растворителя, определяющего последующую технологическую схему переработки сырья, необходимо знать химическое действие его на различные соединения меди. Эти данные для основных соединений меди, нерастворимых в воде, в общем виде приведены в табл. 2.
Таблица 2
Действие различных растворителей на основные соединения меди
Медь я ее соединения HC1 HNO, H,SO* HCN H,S0, NH, Fe, (SO*), FeCI,
Си + (в при- 4- 4- (в при- 4- 4- (в при- 4- (в при- 4- 4-
сутствии сутствин сутствин сутствии
O2) 0») 0.) ад
СиО + 4- 4- 4- 4- 4- Ц- 4-
Си.зО + 4- 4- 4- 4- 4- 4-
Си.О - SiO, 4- 4- -F — -—
Cu2O-Fe4Oa 4- (при 4- 4- (при 4- — — — —
нагре- нагре-
вании) вании)
CuS —— 4- — 4- — — 4-
Cu«S — 4- — 4- — -— -F 4-
CuFeSo -р — —— — —
Cu5Fe£4 — 4- — 4- — —
Примечание. < Ь» — растворяет; «—» — не растворяет; «±» — частично раствор нет.
Рассмотрим более подробно отношение различных форм и соединений меди к действию растворителей.
Металлическая медь. Из кислот наиболее полно и быстро металлическую медь растворяет азотная
ЗСи 4- 8HNO3 -> ЗСи (ЫОЭ)2 4- 2NO + 4Н2О-
При взаимодействии концентрированной серной кислоты и металлической меди происходит выделение сернистого газа по реакции
Си + 2H2SO4 CuSO4 + SO2 + 2Н2О.
Растворы серной и соляной кислот действуют на металлическую медь только в присутствии кислорода:
Си + H2SO4 + 0,502 -> CuS04 4- Н20, -
Си 4- 2НС1 + 0,5О2 -+ СиС12 + Н2О.
Сернистая кислота растворяет медь только при нагревании до 100° С в присутствии кислорода:
Си + H2SO3 + О2 CuSO4 + Н2О-
Металлическая медь хорошо растворяется в подкисленных растворах сульфата и хлорида трехвалентного железа:
Си + Fe2 (SO4)3 -*• CuSO4 + 2FeSO4,
Си + 2FeCl3 СиС12 + 2FeCl2.
Уже при комнатной температуре в присутствии кислорода металлическая медь эффективно растворяется аммиаком, особенно при наличии солей аммония (карбоната сульфата).
Концентрированные растворители — цианиды растворяют медь бурно с выделением водорода ~ ,
2Си .+ 2CN" + 2Н2О 2CuCN + 2ОН’ + Н2.
Окись меди — одно 4лз наиболее легко растворимых соединений меди не только в концентрированных, но и в разбавленных минеральных кислотах и даже в сернистой кислоте. Образующаяся сернистокислая медь ввиду неустойчивости переходит в смесь сульфитов и сульфата меди. В аммиаке окись меди практически нерастворима, однако при введении аммонийных солей растворимость ее увеличивается пропорционально их концентрации.
В сульфате и хлоридах железа окись меди хорошо растворяется, согласно реакциям:
ЗСиО + 2FeCl3 + ЗН2О = ЗСиС12 + 2Fe (ОН)3,
ЗСиО + 2FeCl2 + ЗН2О = СиС12 + 2СиСГ + 2Fe (ОН)3,
ЗСиО + Fe2 (SO4)3 + ЗН2О = 3CuSO4 + 2Fe (ОН)3.
Также хорошо растворяют окись меди растворы цианидов. Слабые растворы щелочей на окись меди не действуют, однако в концентрированных растворах и, особенно, при нагревании она частично растворяется, образуя купрат-ноны.
Закись меди. Поведение ее во многом аналогично окиси медн. В разбавленной серной кислоте закись меди растворяется в присутствии кислорода:
Си2О Ч- H2SO4 —♦ Cu2SO4 + Н2О,
Cu2SO4 -* CuSO4 + Си,
Си + H2SO4 + 0,5О2 -» CuSO4 + Н2О
Си2О + 2H2SO4 + 0,5Ое— 2CuSO4 + 2Н2О.
Закись меди хорошо растворяется в подкисленных растворах солен трехвалентного железа; последнее необходимо для окисления металлической меди, выделяемой при диспропорционировании:
Си 2О 4“ Н 2SO4 —♦ Си aSO4 4- Н лО,
Cu2SO4 —• CuSO4 + Си, Си + 2Fe3+ — Cus+ + 2Fe2+
Си2О + H,SO4 + 2Fe3+ — CuSO4 + 2Fea+ + Cua+ + H,O.
Раствор сульфата закиси железа не'растворяет закись меди, а в растворе хлористого железа извлекается Только часть меди
Cu2O + FeCl2 + Н2О — CuCl2 + Си + Fe (ОН)2.
Так же, как и окись, закись меди хорошо растворяется в цианистых растворах.
Основные карбонаты меди. Эти соединения не растворимы в воде, ио легко разлагаются в разбавленных кислотах (в том числе и в сернистой):
2CuCO3-Cu (ОН)2 + 3H2SO4—, aCuSO4 4- 2СОа + 4Н2О, CuCO3-Cu (ОН)2 + 2H.,SO4 — 2CuSO4 + СО2 + ЗН2О.
Основные карбонаты меди растворяются в концентрированных ще-~лочах, частично — в цианистых растворах и гораздо сильнее в аммиачных.
Силикаты меди. Природные силикаты меди (хризоколла, диоптаз, бисбит) отличаются различной устойчивостью к растворителям. Так, хризоколла в разбавленной серной кислоте растворяется быстрее, чем диоптаз. Растворы сернистой кислоты, аммиака, цианидов, солей грехвалентного железа действуют на эти формы меди незначительно.
Силикаты медн, образующиеся в процессе пнрометаллургической обработки сырья, характеризуются еще меньшей растворимостью по сравнению с природными модификациями.
Ферриты меди. Природные модификации феррита меди, за исключением редко встречающегося минерала делафоснта (CuFeOj, практического значения не имеют. Ферриты меди образуются при обжиге, плавке; при этом различают феррит окиси меди (CuOFeaO3) и феррит закиси меди (Cu2O- FeaO3). При действии на них большинства промышленных растворителей присутствующая медь практически не переходит в раствор. И только при повышенной температуре и использовании концентрированных растворов соляной кислоты (в меньшей степени — азотной и серной кислот) ферриты меди растворяются. Растворы цианидов не действуют иа эти соединения меди даже при кипячении. Ферриты меди относятся к упорным соединениям. Поэтому если сырье перед выщелачиванием подвергают обжигу или плавке, стремятся вести процесс при условиях, обеспечивающих минимальное развитие процессов феррнтообразования, нли же осуществляют дополнительную обработку материала для разрушения ферритов, например восстановительный обжиг.
Сульфаты меди. Кристаллогидраты этого соединения хорошо растворяются в воде, особенно при повышенных температурах. Ниже приведена растворимость пятиводного сульфата меди при различных температурах [9, с. 194, т. 3J:
Температура, °C...........'О 20 40 60 80 100
Растворимость, % (по массе) 14,3 20 5 28,7 39,5 55,5 77,0
Хорошо растворимы безводный сульфат меди в воде, а основные сульфаты меди — в подкисленных растворах.
Хлориды меди. Эти соединения встречаются в природе (см. табл. 1) и образуются при хлорирующем или сульфатохлорирующем обжиге. Высший хлорид меди (СиС12) хорошо растворяется в воде, а низший хлорид меди (CuCl) н оксихлорид меди (CuO-CuCl2) в ней не растворяются, ио легко переходят в раствор при действии разбавленных кисчот или хлористого натрия (калия), особенно с ростом температуры.
Полусернистая медь (Cu2S). Это соединение почти не растворяется в слабых кислотах. При обработке его горячен азотной кислотой медь переходит в раствор и образуется элементарная сера. В концентрированной соляной кислоте полусернистая медь разлагается с выделением сероводорода. Аммиачные растворы на это соединение меди при обычных условиях практически не действуют. Хорошими растворителями для полусернистой меди являются подкисленные соли трехвалентного железа, цианиды (в присутствии кислорода), а также хлориая медь:
Cu2S + 2Fe2 (SO4)2 2CuSO4 + 4FeSO4 + S,
Cu2S + 4FeCl3 -► 2CuClB + 4FeClB 4- S,
Cu2S + 2CuCL -> 4CuCl + S,
2£usS + 6CN“ + O2 + 2H,0 -► 2CuS + 2 [Cu (CN)3)a- + 4OH".
Сернистая медь (CuS). Поведение этого соединения в различных растворителях во многом аналогично низшему сульфиду меди:
CuS + Fe2 (SO4)3 -► CuSO4 + 2FeSO4 4- S,
CuS 4- 2FeCls ->CuCl2 4- 2FeCl2 4- S,
CuS 4- CuCl2 -► 2CuCl 4- S,
2CuS 4- 6CN- 4- 0,5O2 4- H2O -► 2 [Cu (CN)S]2' 4- 2S° 4- 2OH".
Сложные сульфиды меди. Эти соединения встречаются в природе в виде боринта и халькопирита (см. табл. 1). Поведение борнита при действии различных растворителей имеет много общего с простыми сульфидами меди. Особенно хорошо он растворяется в растворах цианидов.
Халькопирит наиболее труднорастворимый из всех соединений меди. При обычной температуре действие на него подкисленных растворов солей трехвалентного железа незначительно. Однако при 12
использовании кипящих растворов хлорного железа достигается достаточно полное вскрытие халькопирита (на 85—90%)
CuFeSa + 2FeCls 2FeCls + CuCl2 + 2S.
Растворимость халькопирита возрастает при повышении температуры и концентрации кислорода в растворе В цианистых растворах при обычных условиях халькопирит практически не растворяется.
Изложенная выше характеристика поведения соединений меди в различных растворителях показывает, что медь довольно легко переходит в раствор из окисленных (кроме ферритов и отчасти силикатов), сульфатных и хлоридных соединений, значительно труднее извлекается из сульфидных соединений, при этом количество типов растворителей весьма ограничено и практически ие извлекается из халькопирита при обычных условиях ни одним из известных растворителей.
Рассмотрим наиболее распространенные промышленные растворители.
Вода — наиболее доступный и дешевый растворитель, однако ее применение ограничено из-за нерастворимости подавляющего числа соединений меди. Как правило, воду используют при обработке сырья и полупродуктов, содержащих медь в виде сульфатов или нормальных хлоридов. Однако н в этом случае предпочитают подкислять растворы для повышения извлечения меди из ее труднорастворимых соединений, а также для получения состава раствора, обеспечивающего последующее эффективное извлечение металла.
При совместном действии воды и кислорода воздуха в условиях естественного выщелачивания сульфидных руд происходит окисление сульфидов железа и меди, в результате чего образуются серная кислота и сульфат окиси железа. Эти соединения в конечном итоге и растворяют сульфиды.
Растворы серной кислоты —наиболее распространенный промышленный растворитель в гидрометаллургии медн. Для него характерны достаточная растворяющая способность, дешевизна. Значительную часть серной кислоты рядом способов можно регенерировать в процессе осаждения меди из растворов. Для сырья с повышенным содержанием основных породообразующих минералов (кальцита, известняка, магнезита и т. д.) применять сернокислые растворы не целесообразно, поскольку в этом случае резко возрастает расход растворителя.
Растворы соляной кислоты относятся к более агрессивным растворителям, поэтому прн выщелачивании в раствор наряду с медью переходят и сопутствующие примеси, что осложняет их последующую переработку. Устойчивость хлоридов одновалентной меди в растворе определяет меньший расход осадителя (при цементации) или электроэнергии (при электролизе).
В связи с повышенной агрессивностью соляная кислота менее транспортабельна, чем серная, а прн ее использовании необходима аппаратура в более стойком антикоррозионном исполнении. Это дорогой растворитель и применение его возможно на месте производства или при условии полной регенерации.
Растворы сернистой кислоты представляют большой интерес для гидрометаллургов, поскольку на всех медеплавильных заводах всегда в значительном количестве имеется сернистый газ. Однако до настоящего времени практического значения в гидрометаллургии меди сернистая кислота не имеет. Это обусловлено специфичностью ее воздействия на ряд соединений меди, неустойчивостью сульфитов меди, что осложняет разделение медьсодержащего раствора и остатков от выщелачивания. Сернистую кислоту (сернистый газ) используют для регенерации серной кислоты из отработанных растворов и восстановления солей трехвалентного железа.
Растворы сульфата окиси железа можно применять для переработки руд с невысоким содержанием основных породообразующих мииералоЬ. В водной среде растворы сульфата окиси железа подвергаются гидролизу, поэтому на практике нх подкисляют.
Перед выделением меди избыточный сульфат железа восстанавливают, обрабатывая раствор сернистым газом или на пиритных или пирротиновых фильтрах:
Fe2 (SOJs + SO2 + 2Н2О -* 2H2SO4 + 2FeSO4, ' . 2Fe2 (SO4)3 + 2FeS2 + 4H2O + 6O2 -ь 6FeSO4.
К существенным недостаткам этого растворителя относится сложность его регенерации из отработанного раствора. Окисление FeSO4 До FeB (SO4)3 осуществляют хлором, тионовыми бактериями, а также аэрацией:
4FeSO4 + О2 + пН2О Fe2 (SO4)3 + Fc.,O3 SO3 «Н2О,
4FeSO4 + O2 + 2H2SO4 -> Fe2 (SO4)8 + 2HSO.
По первому процессу половина железа теряется в связи с образованием нерастворимого соединения Fe2O3-SO3-нН2О, а по второму для полной регенерации Fe2 (SO4)3 требуется высокий расход серной кислоты.
Растворы хлорного железа характеризуются гораздо большей способностью вскрытия минералов меди, в том числе и большинства ее сульфидов, чем сульфат трехвалентного железа. Вместе с тем более эффективно происходит осаждение меди из получаемых растворов, в которых она присутствует в виде купроиона. Однако растворы хлорного железа склонны к гидролизу, имеют повышенную коррозионную активность, что осложняет их использование, регенерацию, а также аппаратурное оформление процесса. При цементации меди часть ее переходит в осадок в виде хлоридов, что в ряде способов переработки цементной меди будет нежелательным. При электролизе хлоридных растворов выделяется газообразный хлор, который не только вызывает быстрое разрушение анодов, но и ухудшает санитарно-гигиенические условия в цехе (ПДК^., — 1 мг/м3). Исполь-
* Здесь и далее величины предельной допустимой концентрация ПДК приведены в соответствии с утвержденными нормами («Предельно допустимые концентрации вредных веществ в рабочей зоне» Министерство здравоохранения СССР. М., 1970).
воваиие хлорного железа в качестве растворителя для переработю медьсодержащего сырья не вышло за рамки опытного производства.
Аммиачные растворы наиболее пригодны для переработки сырья, содержащего медь в элементарной форме или в виде окисленных соединений, особенно для руд с повышенным содержанием основных породообразующих минералов. Эффективность выщелачивания значительно повышается при- использовании смеси аммиака и аммонийной соли (сульфата или карбоната). При аммиачном выщелачивании
Рис. I. Пределы воспламеняемости (а) и области равных давлений при взрыве (б) в системе NH.-O.-Ng:
I — 24* С. ро — 100 кПа (I ат); 2 — 24* С pQ = 700 кПв (7.0 ат); 3 — 150° С. pQ — = 700 кПа (7.0 »т); / - —Е_ =.(;// — -^Е. = 3; III — -^Е. — 4; IV - -^Е_ = 5; ри ₽н
Vi - - 7; vit - ^Е. = 8
₽н ₽и ₽к
возможна регенерация растворителя (карбоната аммония и аммиака) путем нагревания до ПО—130° С с получением чистых соединений меди:
Си (NH3)4CO3 СиО 4- 4Х’Н3 4- СОа.
Аммиачные растворители отличаются высокой селективностью. Кроме того, они не агрессивны, что упрощает аппаратурное оформление процесса.
Однако при использовании токсичных аммиачных растворов (ПДКкн, = 20 мг/м3) требуется герметичная аппаратура, развитая система утилизации газовых потоков. Высокая упругость пара аммиачных растворов ограничивает пределы температурной обработки сырья. Аммиак образует с воздухом взрывоопасные смеси, при содержании 13—28% (объемн.) NH3.
На рис. 1 приведены данные по воспламеняемости смесей аммиака с кислородом (а) и возникающие при этом давления (б) [101. Пунктирная линия относится к смесям воздуха с аммиаком, точки пересечения этой линии с кривыми 1—3 соответствуют нижнему и верхнему пределу взрываемости смесей.
Область воспламенения смесей находится над кривыми 1—3 для смесей с кислородом и выше пунктирной линии для смесей с воздухом.
Величины давлений, возникающих при воспламенении и взрыве аммиачно-кислородных смесей, на рнс. 1, б выражены через «фактор давления» (отношения давлений взрыва рмр к начальному давлению газовой смеси р„). Области с одинаковым фактором давления заштрихованы.
Как и следовало ожидать, наибольшее давление взрыва характерно для составов, близких к стехиометрии взрывоопасных смесей. Данные рис. 1 свидетельствуют о том, что области воспламенения смесей аммиак—кислород расширяются с повышением температуры и давления кислорода. В соответствии с изложенным прн аммиачном выщелачивании более безопасно использовать в качестве окислителя воздух, а не кислород.
Дороговизна растворителя предопределяет минимальные его потери; прн переработке бедного сырья необходимо тщательно промывать большие объемы отвальных хвостов, что представляет большие трудности.
Аммиачные схемы для выщелачивания бедных руд в настоящее время нигде не применяются. Успехи автоклавной металлургии позволили использовать аммиачные растворы для переработки вторичного сырья н сульфидных концентратов.
Цианистые растворы, несмотря на большую экстрагирующую способность и высокую селективность, до последнего времени не имели практического значения в гидрометаллургии .меди. Это объясняется не только их токсичностью (ПДК = 0,3 мг/м3) или дороговизной, но и большим расходом реагента (например, на 1 вес. ед. меди в окисленных соединениях расходуется около 3,5, вес. ед. цианистого калия). Однако в связи с разработкой технологических схем, обеспечивающих практически полную регенерацию растворителя и высокое извлечение меди нз весьма бедных материалов в виде качественных полупродуктов, использование цианистых растворителей вновь привлекло внимание металлургов.
Прн выборе растворителя для выщелачивания медьсодержащего сырья к нему предъявляют следующие требования:
1) он должен обеспечивать селективное высокое извлечение медн в раствор;
2) необходимо, чтобы он был доступный и дешевый;
3) взаимодействие с нерастворимым остатком должно быть минимальным, что обеспечивает наименьшие потерн растворителя.
Глава /
ЭЛЕМЕНТЫ ТЕОРИИ ОСНОВНЫХ ПРОЦЕССОВ, ИСПОЛЬЗУЕМЫХ В ГИДРОМЕТАЛЛУРГИИ МЕДИ
ПЕРЕВОД МЕДИ В РАСТВОР
Термодинамика
Принципы термодинамики позволяют оценить равновесие в исследуемой системе н характер его изменения прн варьировании температуры, концентрации растворителя, давления газообразного агента.
Прн термодинамическом анализе исследуемых реакций наибольший интерес представляют данные расчетов изобарного потенциала и константы равновесия в зависимости от температуры по развернутому уравнению Гнббса—Гельмгольца:
ДО® = ДЯ^ - ТД5?98 + J ДСР &Т - Т J dT, 298 298
к Дбт___________Д°т
*6 Ар — RT 4.575Т '
(1-1
(1.2
где AG® — изменение изобарного потенциала, кДж/моль;
Д//°— изменение энтальпии, кДж/молы,
Т — температура, К;
Д5т—изменение энтропии, кДж/моль;
ДС,— теплоемкость прн постоянном давлении, кДж/(моль К);
Лр — константа равновесия;
R — универсальная газовая постоянная [8,314 Дж/(моль К) ].
Термодинамические характеристики основных соединений меди приведены в табл. 3 [11—161.
Расчеты по уравнению (1.1) существенно упрощаются при использовании метода Шварцмана—Темкина.
В связи с отсутствием температурных зависимостей теплоемкости, теплоты растворения, энтропии для ряда соединений в водных растворах строгость выполняемых расчетов невысокая. Однако поскольку большинство гидрометаллургических процессов проводят прн сравнительно небольших температурах (298—523 К), роль 3-го и 4-го членов в уравнении (1.1) несущественна и удовлетворительную точность прн расчете величины изобарного потенциала можно получить по уравнению
ДС°т = ДН?98— ТД5298. (1-3)
2 С. С. Набойченко
17
Таблицаi
Термодинамические характеристики основных соединений меди
' Формула —Д№, '4 кДж/моль (ккал/молъ) —Дб°. кДж/моль (ккал/молъ) 5*. к Дж/моли (ккал/молъ)
Сц2О 166,0 (39,8) 143,0 (34.2) 96,2 (23,0)
СиО 155,0 (37,1) 129,5 (31,0) 43,6 (10.4)
Cu2S 93,6 (20,0) 89,0 (21,3) 119,0 (28,5)
CuS 48.9 (11,7) 64,5 (15.4) 121.7(29,1) -
CuFeSj 171,0 (40;9) 215,8 (51,5) 147,9 (35,4)
CuSO4 770,0 (184,0) 663,0(158,2) 113,5 (27.1)
CuSO4-3H2O 1690,0 (402,3) 1400,0 (334,6) 225,0 (53,8)
CuS04-5H2O 2270,0 (544.5) 1880,0 (449,3) 305,0(73,0)
CuSO4-2Cu (OH)a 1680,0 (401,1) 1420,0 (339,2) 225,8 (53,9)
CuSO4-3Cu (OH), 2200,0 (525,4) 1813,0 (434.3) 302,4 (72,3)
CuSiO3-H2O 1320.0 (316,1) • 1180.0 (283,0) 128,3 (30,7)
CuSiO3-2H,O 1610.0 (384.4) 1410,0 (337.6) 167,5 (40,1)
CuCO3 Cu (OH)a 1064,0 (255,0) 9С5.0 (216,4) 174,0(41,6)
CuCO3 -2Cu (OH), 1660,0 (397,9) 1434,0 (343,7) 323,0 (77,3)
CuCl 133,4 (31,9) 113,4 (27,1) 87,1 (20.8)
CuCl, -211,0 218,8 (52,3) 131.4 (31,4) 112,9 (27,0)
3CusS • As*S3 413,1 (98,6) 381,2 (91,2) 396,0 (94,7)
3Cu,S • Sb,S3 427,0 (101,7) 392,4 (93,9.) 108,8 (26,0)
Расчеты величины ДСГ для реакций выщелачивания меди и ее соединений в сернокислых 1 и аммиачных * 2 растворах свидетельствуют о большой вероятности протекания процессов особенно для сульфидов. В связи с экзотермнчностью анализируемых реакций вероятность их протекания несколько снижается с увеличением температуры.
Термодинамический анализ реакций растворения моносульфидов в растворах азотной, соляной, серной кислот, сульфата и хлорида трех валентного железа выполнен П. А. Паздниковым [17, с. 3—19]. Ряды повышения устойчивости сульфидов (слева направо) в этих растворителях представлены ниже:
в НС1: FeS — ZnS — CdS — PbS — CuS — FeS2;
в FeCls: FeS — ZnS — CdS — CuS — FeS2 — PbS;
в H2SO4: FeS — ZnS — CdS — PbS — CuS;
в Fe2 (SO4)3: FeS — ZnS — CdS — PbS — FeS2 — CuS;
в HNO3: FeS — ZnS — CdS — FeS 2 — PbS — CuS.
'Матыскин Ю. Д. Возможности интенсификации процесса выщелачивания в гидрометаллургии меди. Канд. дне. Иркутск, 1967.
2НабойчеикоС. С. Исследование автоклавного аммиачного выщелачивания штейнов, получаемых при переработке окисленных никелевых руд. канд. дне. Свердловск, 1966.
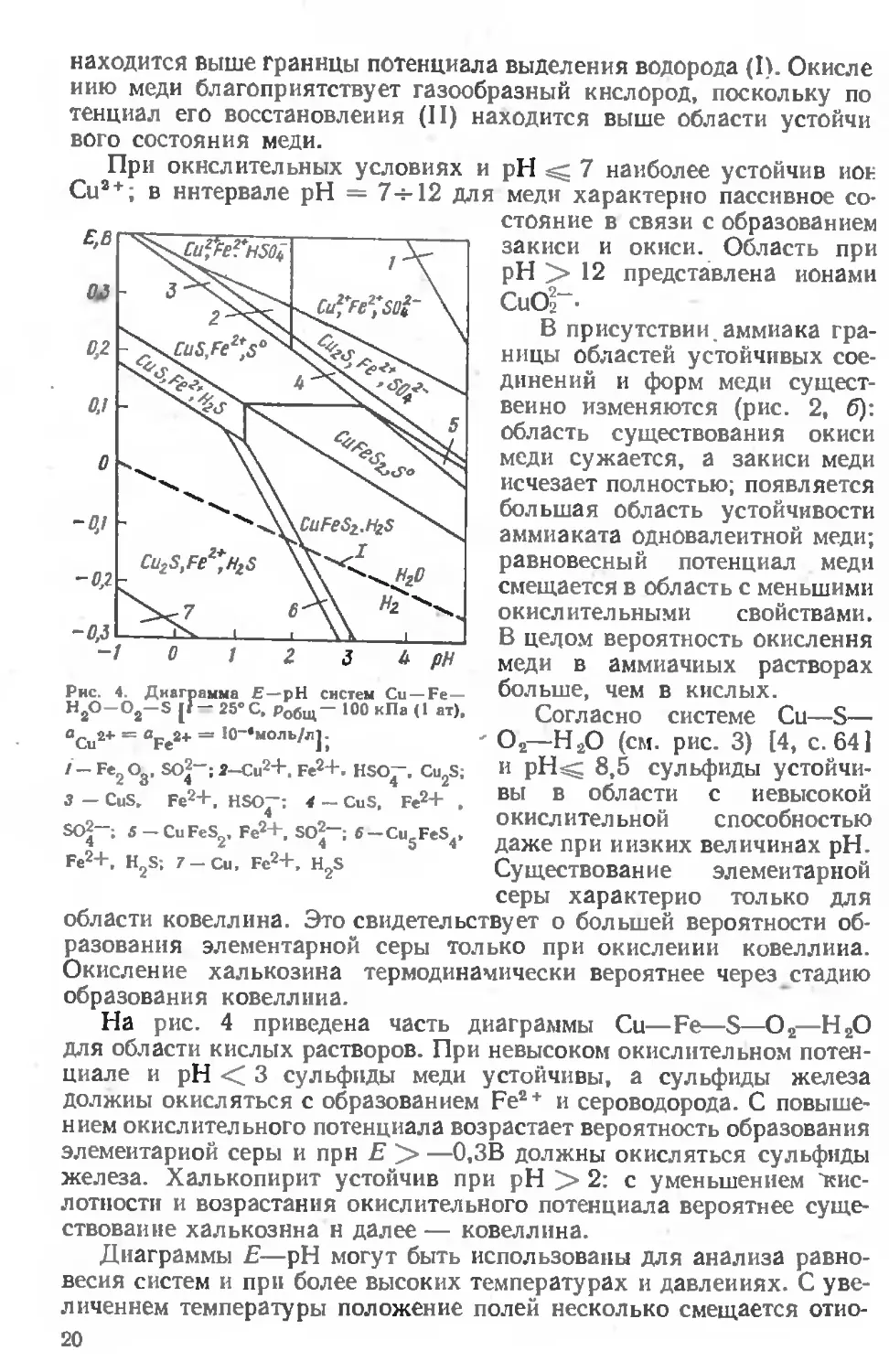
Ряд возрастания агрессивности растворителей удовлетворительно согласуется с повышением их окислительной способности:
НС1 FeCl3 H,SO4 Fe2 (SO4)s — HNO3.
Наибольшая вероятность растворения характерна для простых сульфидов железа, цинка и кадмия, имеющих наименьшую величину произведения растворимости. С увеличением окислительной способности растворителя повышается- вероятность растворения пирита.
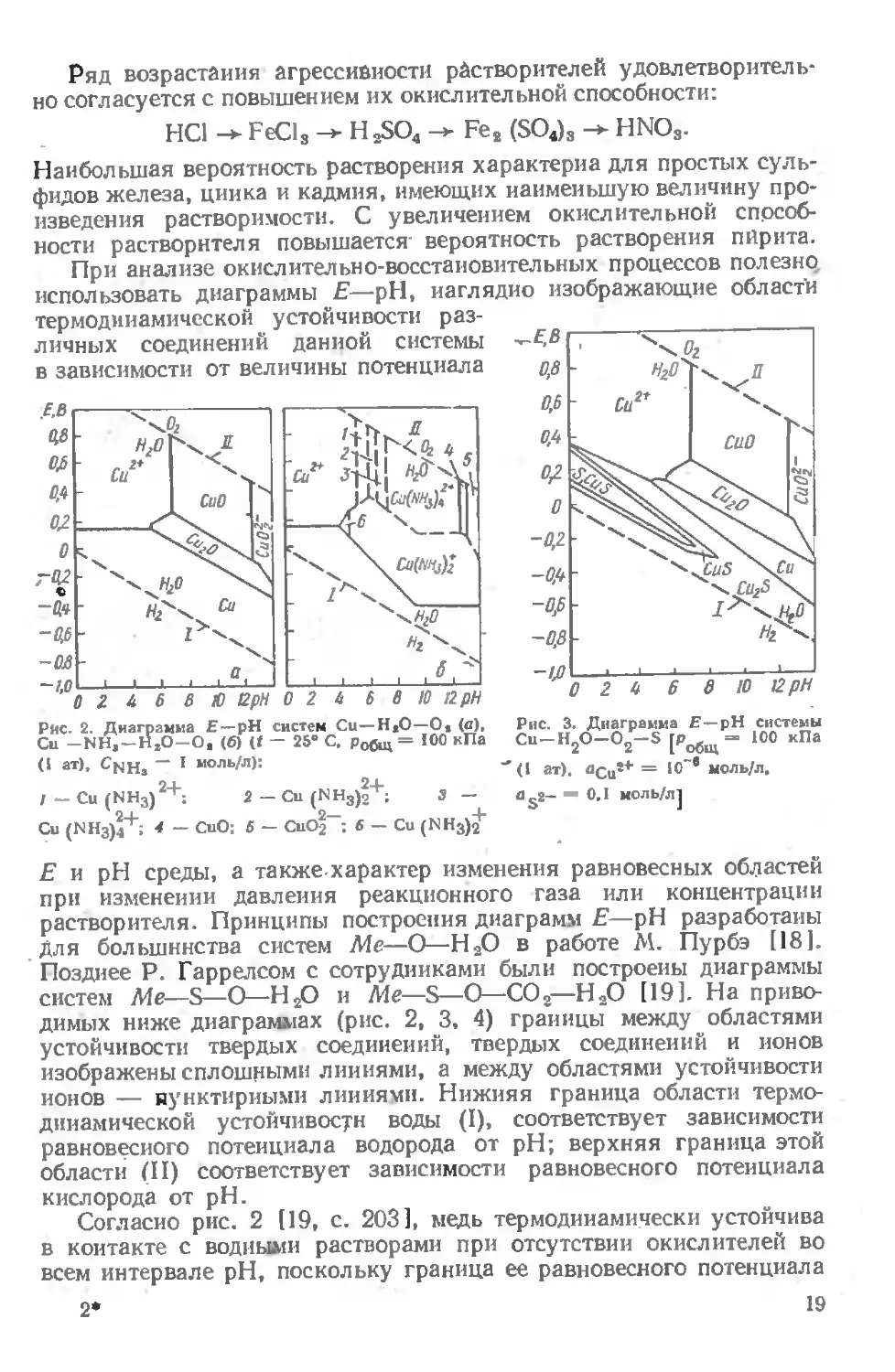
При анализе окислительно-восстановительных процессов полезно использовать диаграммы Е— pH, наглядно изображающие области
Рис. 2. Диаграмма Е—pH систем Си—Н*О—Ов (с), Си -NH, —Н2О-О, (б) (Г — 25е С, Робщ = 100 кПа (I ат), Cnh3 “ 1 моль/л):
/ — Си (NH3)2+: 2 — Си (NH3)|+; 3 —
Си (КН3)4+; 4 — СиО: 5 — CuOj-; 6 — Си (NHg)^
Рис. 3. Диаграмма Е—pH системы Cu-H2O-02-S [Робщ= ЮО кПа (I ат). <>Сиг+ = ,0~в моль/л,
“ 0,1 моль/л}
Е н pH среды, а также характер изменения равновесных областей при изменении давления реакционного газа или концентрации растворителя. Принципы построения диаграмм Е—pH разработаны для большинства систем Me—О—Н2О в работе М. Пурбэ [18]. Позднее Р Гаррелсом с сотрудниками были построены диаграммы систем Me—S—О—Н2О и Me—S—О—СО,—Н2О [19]. На приводимых ниже диаграммах (рис. 2, 3, 4) границы между областями устойчивости твердых соединений, твердых соединений и ионов изображены сплошными линиями, а между областями устойчивости ионов — пунктирными линиями. Нижняя граница области термодинамической устойчивости воды (I), соответствует зависимости равновесного потенциала водорода от pH; верхняя граница этой области (II) соответствует зависимости равновесного потенциала кислорода от pH.
Согласно рис. 2 [19, с. 203], медь термодинамически устойчива в контакте с водными растворами при отсутствии окислителей во всем интервале pH, поскольку граница ее равновесного потенциала
находится выше границы потенциала выделения водорода (I). Окисле иию меди благоприятствует газообразный кислород, поскольку по тенциал его восстановления (II) находится выше области устойчи вого состояния меди.
При окислительных условиях и pH 7 наиболее устойчив нов Си2 + ; в интервале pH = 7-е-12 для меди характерно пассивное состояние в связи с образованием закиси и окиси. Область при pH > 12 представлена ионами
ОСи2+ = — Ю’4моль/л|.
/— Ге2О3, SO2-; J-Cu2+. Fe2+. HSQ—. CUjS; 3 — CuS. Fe2+, HSO~: 4 — CuS, Fe2+ . SO2-; 5 —CuFeS2, Fe2+, SO2~; «-C^FeS^, Fe2+, H2S; 7-Си, Fe2+, H2S
СиОа
В присутствии аммиака границы областей устойчивых соединений и форм меди существенно изменяются (рис. 2, б): область существования окиси меди сужается, а закиси меди исчезает полностью; появляется большая область устойчивости аммиаката одновалентной меди; равновесный потенциал меди смещается в область с меньшими окислительными свойствами. В целом вероятность окисления меди в аммиачных растворах больше, чем в кислых.
Согласно системе Си—S—
O2—H2O (см. рис. 3) [4, c. 64] и pH< 8,5 сульфиды устойчивы в области с невысокой окислительной способностью даже прн низких величинах pH. Существование элементарной
серы характерно только для области ковеллина. Это свидетельствует о большей вероятности об-
разования элементарной серы только прн окислении ковеллина. Окисление халькозина термодинамически вероятнее через стадию образования ковеллина.
На рис. 4 приведена часть диаграммы Си—Fe—S—О2—Н2О для области кислых растворов. При невысоком окислительном потенциале и pH < 3 сульфиды меди устойчивы, а сульфиды железа должны окисляться с образованием Fe2+ и сероводорода. С повышением окислительного потенциала возрастает вероятность образования элементарной серы и прн Е > —0,3В должны окисляться сульфиды железа. Халькопирит устойчив при pH > 2: с уменьшением 'кис
лотности и возрастания окислительного потенциала вероятнее существование халькозина н далее — ковеллина.
Диаграммы Е—pH могут быть использованы для анализа равновесия систем и при более высоких температурах и давлениях. С увеличением температуры положение полей несколько смещается отио-
сительио осей координат, однако формы и размеры полей устойчивости отдельных соединений Остаются прежними.
Влияние повышения давления гораздо меньше, поскольку для используемых в гидрометаллургии давлениях газов изменение коэффициентов их фугативности крайне незначительно.
Расчеты и построение диаграмм осложняются из-за отсутствия температурных зависимостей термодинамических характеристик, особенно коэффициентов активности ионов.
При построении большинства диаграмм приходится использовать термодинамические данные, рассчитанные для химически чистых соединений, что не отражает условия в реальных системах (эффект примесей, отличающегося типа структуры при одинаковой химической формуле). Поэтому для анализа ожидаемых процессов в реальных системах построенные диаграммы Е—pH следует применять с осторожностью.
Анализ термодинамических данных позволяет считать, что процессы выщелачивания проводятся в термодинамически благоприятных условиях.
Кинетика растворения меди, ее сплавов и соединений
Расствореиие—гетерогенный процесс, включающий следующие как минимум трн основные стадии: 1) подвод реагентов в зону реакции на твердой поверхности; 2) собственно химическую реакцию; 3) транспорт продуктов взаимодействия из реакционной зоны.
Скорость реакции определяется скоростью развития наиболее медленной стадии.
Если лимитирующими процессами будут первая и третья стадии, то растворение протекает в диффузионной области. В этом случае скорость растворения зависит от интенсивности гидродинамического режима, концентрации исходных веществ, вязкости раствора и мало чувствительна к повышению температуры. Наблюдаемая макроскопическая кинетика процесса не имеет ничего общего с кинетикой собственно химической стадии.
Прн лимитировании процесса второй стадией растворение протекает в кинетической области. При соизмеримой роли диффузионных и кинетических факторов говорят о развитии процесса в переходной области.
В реальных условиях, тем более при повышенной температуре, большинство процессов растворения развивается в диффузионной области. Поэтому особое значение приобретает гидродинамический режим, определяемый не только формой и размерами аппарата, характеристикой перемешивающего устройства, но и физическими свойствами как раствора (плотностью, вязкостью), так и твердых частиц (крупностью, пористостью, смачиваемостью).
Различают внешне- и внутридиффузиоииый режимы растворения. При первом концентрация реагента на поверхности частицы (тем более внутри ее) гораздо меньше, чем в объеме, а скорость процесса
существенно зависит от интенсивности перемешивания. При внутри-диффузнонном режиме величины концентрации реагента в объеме, раствора и на поверхности частицы сопоставимы, ио по мере удаления, от поверхности в глубь частицы концентрация реагента становится незначительной. Этот режим наиболее часто встречается при интенсивном перемешивании и образовании новых фаз иа поверхности твердых частиц в процессе выщелачивания.
Типичные для гидрометаллургии механизмы процессов окисления — растворения освещены в работах (4, с. 77—94; 20—27]. В последние годы наряду с классической теорией абсолютных скоростей реакций (27 ] механизм протекающих явлений трактуют с позиций электрохимии. Электрохимическая концепция, широко применяемая при исследовании геохимических, флотационных процессов (19, 27—30) и электролиза сульфидных систем [31 I, получила дальнейшее развитие в работах X. Петерса и Маджнмы (27, -28, с. 5—22].
Растворение металлической меди и сплавов на ее основе
В металлической форме медь присутствует в цементной меди, вторичном сырье, некоторых разновидностях штейнов. Месторождения руд, содержащие медь в металлической форме, в настоящее время промышленного значения не имеют.
На практике для выщелачивания сырья, содержащего медь в виде металла илн ее сплавов, наибольшее значение имеют аммиачные, сернокислые, азотнокислые, солянокислые и цианистые растворы.
Аммиачные растворы [32—34 ]. Скорость растворения меди практически не изменяется при Сын, > 0,38 моль/л и возрастает прямо пропорционально поверхности образца и интенсивности перемешивания (п0-65, об/мин). Для развития процесса растворения необходимо наличие кислорода. Реакция растворения меди имеет автокаталитический характер н включает следующие стадии:
О2+2НгО-|-4е—» 4ОН-, ]
4ОН- + 2Ciw2CuO+2H2O + 4е } (1.4)
2Cu + Os2010 ’ )
Си + 4NH3 + Н2О + 0,5О2—»Си (NH3)4+ + 2ОН“, (1.5)
СиО + 4NH3 + Н2О — Си (NH3)’+ + 2ОН~, (1.6)
Си + Си (N1I3)4+ + 4NH3—> 2Си (NH3)4+. (1.7)
Для расчета скорости растворения меди в интервале температур 25—44° С, при концентрации NH3 0,38—1,52 моль/л, периферической скорости вращения мешалки (1,7—24,6)-103 см/мии и продолжительности выщелачивания 20—120 мин в работе 134] было предложено уравнение
llCulNH^r = 1,21.10-5-Ае—^Г V-0-6S{(Cu(NH3)4]2+|0-1, (1.8)
где поверхность образца А составляет 6—11,4 см2, а объем раствора V равен 0,25—1,5 л.
С увеличением давления кислорода скорость растворения меди пропорционально возрастает только до определенной величины, за-, висящей от концентрации аммиака (рис. 5). В области низких давлений кислорода 1=^140 кПа (1,4 ат)] скорость процесса зависит от интенсивности перемешивания, что указывает на диффузионный режим растворения |Еа = 5,56 кДж/моль] с контролем по кислороду. При pOt = 780 кПа (7,8 ат) интенсивность перемешивания не влияет на процесс, что, по мнению Халперна, свидетельствует о лимити
ровании процесса химической стадией {Еа — 23,2 кДж/моль (5,54 ккал/моль)].
Скорость растворения меди возрастает при добавке сульфата аммония особенно при повышенном давлении кислорода. Сульфат аммония не только увеличивает равновесную концентрацию аммиака, но и непосредственно растворяет медь. По мнению автора работы (331, процесс контролируется химической стадией взаимодействия аммиака с поверхностными комплексами медь-кислород. Однако этот вывод имеет частный характер, поскольку в процессе растворения большую роль играет кислород, содержание которого при определенных условиях будет
о гоо . ш 600 800
Давление 0г,н.тга
Рис. 5. Зависимость удельной скорости растворения меди (f ° 26° С; п *= 660 об/мин) от давления кислорода при различном исходном содержании аммиака, моль/л:
/ — 0,26; 2 — 0,52; 3 — 0,74; 4 — 1,00
решающим.
При устранении роли внешней диффузии процесс должен развиваться во виутридиффузиоиной области, в которой скорость растворения контролируется кислородом. Д. Халперном впервые отмечена положительная роль ионов аммония, давления кислорода при растворении меди в аммиачном растворе.
Последующие работы по растворению меди в комплексообразующих реагентах проведены с растворами этилендиамина н аминокислот (351. Характер зависимости скорости процесса от концентрации этилендиамииа, аминокислот и давления, кислорода получен аналогичным, как и для аммиачных растворов.
При температуре 25° С, ро, = 650 кПа (6,5 ат) определены следующие величины константы скорости растворения меди соответственно для этилендиамина, глицина, а-аланииа' и р-аланина, мГ/(см2-ч-моль): 230, 49, 59 и И В таком же порядке снижаются и константы устойчивости комплексов двухвалентной меди с указан
ными растворителями.
По растворяющей способности аминокислоты уступают этилеи-диамину и тем более аммиаку. Различие в агрессивности растворов
аммиака и этилендиамина, а- аланина и f-аланина авторы объясняют ролью структуры радикала растворителя при его взаимодействии с кислородсодержащим поверхностным комплексом меди. Этот процесс является наиболее медленной стадией в общем механизме растворения меди.
По данным И. К. Маршакова 1, для эффективного растворения латуней и оловяиистых бронз в растворах аммиака также необходимо наличие кислорода н соли аммония. Однако и в этом случае скорость их растворения почти в 2 раза меньше, чем для чистой меди. При растворении латуней особенно с повышенным содержанием цинка наблюдали предпочтительный переход в раствор цинка и обогащение поверхностного слоя образцов металлической медью.
Растворы цианидов. Характер растворения меди в циансодержащих растворах во многом идентичен выщелачиванию в других комплексообразующих растворителях (361.
Прн концентрации цианида меньше стехиометрической скорость процесса
2Cu + 4CN- + НгО + 0,502 = 2Cu (CN)F + 2ОН“ (1.9) зависит только от содержания цианида и определяется его диффузией. При избытке цианида лимитирующей стадией становится транспорт кислорода. Таким образом, и при недостатке, и при избытке цианида рассматриваемый процесс протекает в диффузионном режиме.
Растворы кислоты. Растворению меди в азотной, соляной, уксусной и хлорноватистой кислотах, посвящено много работ. При использовании кислот со слабыми окислительными свойствами (уксусной, соляной) обязательным условием для эффективного растворения меди будет наличие окислителя (кислорода, перекиси водорода, соли трехвалентного железа). Высокая скорость растворения меди в растворах соляной кислоты обусловлена образованием более прочных комплексов, большей подвижностью хлор-ионов, выраженным автокаталитическим влиянием образующегося хлорида меди. В азотной кислоте медь растворяется с большой скоростью без внешних окислителей. Ниже будут рассмотрены работы по кинетике растворения медн только в сернокислых растворах (37—41 ].
Скорость растворения меди возрастает пропорционально концентрации растворенного кислорода (парциальному давлению), интенсивности перемешивания, особенно при повышении температуры и увеличении поверхности образца. Отмечается положительное влияние ионов двухвалентной меди, трехвалентпого железа, нитрат-ионов, служащих дополнительными окислителями металлической меди. По мнению авторов работы (40], растворение меди происходит через стадию образования ее закиси (процесс энергетически более выгодный, чем образование окиси меди) с последующим взаимодействием закиси меди с серной кислотой. На возможность образования
1 Ма р ш а к ов И. К- Коррозия твердых растворов и интерметаллических соединений. Автофер. докт. дне. М., 1969.
окисной фазы особенно при недостаточной кислотности указывалось и в работе (381.
Процесс растворения меди складывается из следующих стадий:
2Cu* + 2Н* + О2 + 2е-> 2Cu2* + 2ОН', ]
Си + Си2* -> 2Си* ' (1.10)
Си + 2Н* + О2 4-2еСи2* + 2ОН" ' J
Скорость процесса можно определить по уравнению
АИ.= 4,92.1О-6е-(14,о<)/ет> [Cu2+]°-SPc>.S4-
где А и V — соответственно поверхность образца и объем раствора. Данное уравнение справедливо для следующих параметров про-
цесса:
Температура I, °C ... . 15—55
Продолжительность т, ч 3—30
Концентрация, г-иои/л:
Си2*........................ ... 0,0—2,5-Ю-з
Н* ...... . 0,1—0,75
Избыточное парциальное давление Pg3®, кПа (ат) 21—100(0,21—1,0)
При введении инертных солей (сульфатов аммония или калия) растворение меди замедляется в связи с увеличением вязкости среды и снижением растворимости кислорода [43].
Авторы данной книги показали, что при увеличении давления кислорода и температуры скорость растворения меди значительно возрастает и при ро, = 6 ат и 80° С она будет почти в 20 раз больше, чем по данным работы [41 ].
Скорость процесса не зависит от концентрации серной кислоты в растворе, если она больше 0,05 г/моль, и пропорциональна давлению кислорода. В интервале 60—120°С в зависимости от параметров процесса экспериментальная величина энергии активации равна 28—31,4 кДж/моль (6,3—7,5 ккал/моль), а скорость растворения контролируется диффузией кислорода через поверхностную пленку.
Коррозионная стойкость медных сплавов в ряде растворов обсуждается в работе [44, с. 528—535); растворение латуней, причины их «обесцинкования» более детально изучено И. К. Маршаковым.
Количество специальных исследований по растворению медиых сплавов в серной кислоте весьма ограничено.
По данным работы [45], при обработке сплавов медь—олово 60 % -ной серной кислотой в раствор п редпочтительно переходит олово, а медь выделяется сплошным слоем на поверхности. Предполагается, что окислителем является атомарный кислород, образующийся в результате частичного разложения кислоты при 80° С, который и окисляет медь до окиси с последующим ее взаимодействием с кислотой и образованием сернокислой меди.
При растворении сплавов медь—цинк, содержащих до 15% Zn, в раствор в эквивалентном количестве переходит и медь, и цинк.
При содержании цинка больше 20—30% скорость процесса снижается, при этом наблюдается прогрессирующий переход в раствор циика, а образец пассивируется в связи с образованием тончайшей пленки меди и ее превращением в закись и далее в сульфат меди. С наибольшей скоростью растворяются сплавы, содержащие а-фазу (5—15% Zn) [46].
Растворение окисленных соединений меди
[f4 Тенорит, куприт. Поданным Сюлливана, при растворении образ
цов куприта крупностью — 6,7 мм в растворах сернокислого железа за 3 дня извлекалось до 99°6-меди, а через 8 дней она Полностью
Рис. 6. Зависимость перехода меди в раствор из куприта {I — 19,7 ± •± 0,5° С) от времени выщелачивания" и от концентрации серной кислоты, моль/л:
0.1; 2.— 0.35; 3 — 1,38
переходила в раствор. Для частиц крупностью — 0,15 + 0,074 мм полное извлечение меди было достигнуто за 1 ч. Растворение синтетического куприта в серной кислоте без доступа кислорода исследовали в работе [47]. Коли-
Рис. 7. Кинетика извлечения меди при выщелачивав ннн (/ Q 35° С) малахита (о) и ааурнта (б) различной крупности:
---------1% H,SO* в растворе:-----------------5% Реэ (SO*)3, 2% H,SO4
/----1-2,0 мм; 2-------2,0 + 0.32; 3 — 0,32 + 0.15;
4 — 0,15 + 0,074; 5 — 0,074
чество меди, перешедшей в раствор Q, пропорционально содержанию кислоты (рис. 6) и определяется соотношением скоростей следующих процессов:
Cu2O + H2SO4 — Сиг+ + SO2” + Си0 + Н2О, (1.12) [Си2О • H2SO4] + Н+ — Си2+ + HSO7 + Си0 + Н2О. (1.13)
Энергия активации процесса (1.12) составляет 43,1 кДж/моль (10,3 ккал/моль), а для процесса (1.13) — 41,5 кДж/моль (9,94 ккал/моль). Металлическая медь выделяется в виде пористого слоя и не осложняет развития процесса.
Малахит и азурит [48—51]. По данным Г. А. Агарковой [48] (табл. 4, рис. 7), малахит растворяется более полно в подкисленных растворах сернокислого железа, чем в растворе серной кислоты. 26
Таблица 4
Извлечение меди в раствор при выщелачивании малахита и азурита в зависимости от концентрации и состава растворителя, температуры и крупности частиц
и,so., % Fe. (SO.),, % 1. °C Крупность, мм Т, мни Извлечение Си, % при выщелачивании
малахита азурита
Го 1,5 - 35 —0,15+0,074 15 71.8 85.0 85,0 93,5 98,0 98,0
1,0 - 20 35 50 -0,15+0,074 15 79.0 85,0 88,0 94.0 98,0 98,0
2,0 5,0 20 35 50 -0,15+0,074 15 94,3 97,2 97,7 98,0* 99,0 99,7
2.0 5.0 35 - —2.0+0.32 +0.15 +0.074 —0,074 10 74.0 88,0 97,2 98,5 91,2 95,4 98,0 99,0
• 1= IC мни; Cfe, (SO.). “ 2'°%-
Повышение температуры выше 35° С практически не влияет на полноту и скорость растворения меди.
Для достижения высокого извлечения (>95%) крупность частиц минералов должна быть не более —0,15 мм.
В работе (51] контролировали начальную поверхность образцов малахита. По данным авторов, основное влияние на скорость процесса' оказывает концентрация серной кислоты: при увеличении Ch.so. с 5 до 30 г/л удельная скорость растворения v возросла с 5,17 • 10-в до 1,41 - 10“ь гСи/(см2-с). Средняя величина экспериментальной энергии активации процесса составляет 26 кДж/моль (6,22 ккал/моль).
Хризоколла и диоптаз. По данным Сюлливана, при уменьшении крупности образцов хризоколлы с —13,3 + 6,7 мм до —0,074 мм необходимая продолжительность обработки для полного извлечения меди сокращается с 6 сут. до нескольких часов (рис. 8, а). В более концентрированных растворах (5% H2SO4) из фракции крупностью —13,3 + 6,7 мм за 6 ч меди растворялось51 %, а за 30 ч—100%, а при обработке фракции —2 + 0,59 мм за 6 ч извлекалось 97% меди.
Подробные данные по растворению хризоколлы в условиях интенсивного перемешивания приводятся Г. А. Агарковой [48] и Г. А. Копыловым [50].
Повышение исходной кислотности раствора, добавки сериокис лого железа ускоряют выщелачивание и увеличивают извлечение меди (рис. 8, б, табл. 5). Показатели выщелачивания практически не изменяются прн температуре больше 35° С. .
Рис. 8. Зависимость извлечения меди от крупности частиц при выщелачивании хризоколлы (/ в 35° С), по данным Сюллнваня [1] (в) и Агарковой [48] (б):
CH,SOt “ 1%: CH,SO. “ 2% Я CFe,(SO«), “ 2%: 1 ~ 13,3 + 6,7 Ми;
2 — 6.7 + 2 ; 3 — 2,0 + 0.63; 4 — 0.63 + 0,16; 5 — +2.0; 6 — 2.0 + 0.32: 7 — 0.32 + + 0,16. в — 0,15 + 0,074; 9 — 0.074 им
Растворение хризоколлы осложняется образованием коллоидной кремниевой кислоты. При наличии минералов, содержащих карбо-нат-ионы (например, малахит), скорость растворения хризоколлы возрастает за счет разрушения экранирующего слоя выделяющимся углекислым газом [501.
Извлечение меди в раствор прн различных параметрах выщелачивания хризоколлы (—0,15+0,074 мм)
Таблица 5
H2SO* % Fe± (SO4), % 1, 'С ИНН Извлечение Си % HjSO^ % Fe, (SO.). % t, °C мин Извлечение Си %
1.0 77,5 12 66,5
2.5 —• 35 15 95,0 1,0 — '35 5 77,5
5,0 99,0 50 77,5
1.0 2,0 2,0 2,0 35 15 88,0 99,0 2,0 2,0 20 35 50 5 95,0 97,0 97,4
В работе 17, с. 59—621 приведено эмпирическое уравнение для определения извлечения меди в раствор при выщелачивании ее из малахита, азурита и хризоколлы
е = ат"’1, (1-14)
где в — извлечение Си в раствор, %;
т — продолжительность выщелачивания, мин;
а, п — постоянные.
Таблица В
Значения постоянных коэффициентов а и п в уравнении (1.14) при различной крупности минералов и температуре выщелачивания
Переменные пара-ыетры Азурит Малахит Хризоколла
п~* а Л-’ а Л“* °
Крупность, мм: + 1.65 0,44 16,22 0,90 2,95 1.24 1,0
—1,65+0.3 0,28 37,2 0,68 7,24 0,34 17,0
—0,3+0,15 0,15 60,3 0,28 31,50 0,15 43.6
—0,15+0.074 0,06 81,3 0,19 50,10 0,33 36.3
—0,074 0,06 85,1 0,16 63,10 0,05 69.2
Температура, °C: 20 0,35 30,2 0.34 38.9
30 0,38 33,1 0,23 57.6
40 0,26 52,6 0,19 63,1
60 — — 0.Й7 85,2 0,12 75,9
Примечание. Опыты по определению влияния крупности частиц проведены прн концентрации серной кислоты в растворе 3% и отношении Ж : T = 20; температурная серия опытов проведена прн плотности пульпы 50% н длительности опыта 60 мнн.
Графическая интерпретация кинетических данных, отражающих влияние крупности минерала на извлечение меди, показана на рис. 9, а в табл. 6 помещены вычисленные значения констант а и nJ По растворению диоптаза известны только данные Сюлливана, согласно которым в сернокисных растворах этот минерал вскры-J вается медленно и менее полно, чем хризоколла (рис. 10).
По данным В. И. Смирнова] и А. П. Серикова [1, с. 26], при! увеличении концентрации сер-] ннстой кислоты с 2 до 10% извлечение меди нз силиката за-’ кнси меди повышается с 47,51 до 79%. Силикат закиси меди] достаточно хорошо растворим 1 в растворе сернокислого желе-а за,особенно прн нагревании. ’ Так, при 50° С и 2% ном Fe2ij (SO4)s в раствор извлекается | 47% меди. Менее полно медь] извлекается в аммиачных раст-j ворах: 31% Си за 4 ч в 10%-ном 1 растворе аммиака.
Растворение сульфидов меди ]
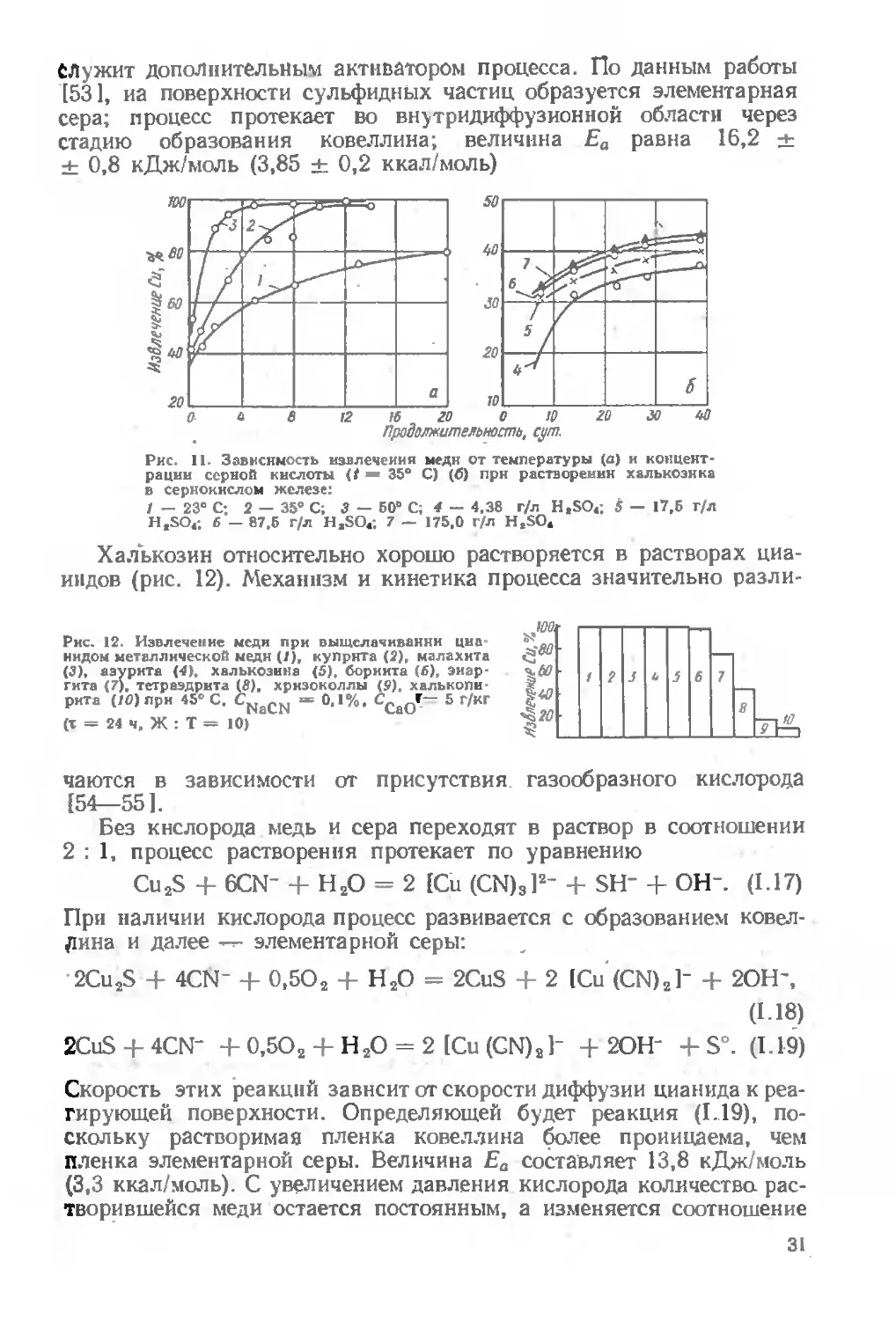
Халькозин. В опытах Сюлли- I вана (рис. 11) при обработке материала крупностью—0,15 + . + 0,074 мм при 35° С за первые
24 ч растворилось примерно 50% медн, а для извлечения оставшейся меди потребовалось почти 20 сут. Столь медленное выщелачивание меди объяснялось двустадийным протеканием процесса: •--
Cu2S + Fe2 (SO4)a = CuS + CuSO4 + 2FeSO4, (1.15)
CuS + Fe2 (SO4)s = CuSO4 + 2FeSO4 + S. (1.16) Образующаяся по реакции (1.15) сернистая медь растворяется гораздо медленнее, чем полусернистая. Так, скорость растворения фракций халькозина — 10 + 0,59 мм и —0,074 мм была почти одинаковой.
Поданным работы [521, искусственные халькозин и дигенит также растворяются по двустадийному механизму. Скорость процесса пропорциональна концентрации трехвалентного железа. На первой стадии халькозин претерпевает последовательные превращения в ряду дьюнрит—дигенит—видоизмененный ковеллин—ковеллин, , процесс быстро протекает при 25° С; Еа = 20,9-=-24,84 кДж/моль (5—7 ккал/моль). Вторая стадия'имеет место при температуре >60° С и зависит от температуры сильнее, чем первая.
Более быстро и полно халькозин вскрывается в растворе хлорного железа, особенно при нагревании. Образующаяся хлорная медь 30
служит дополнительным активатором процесса. По данным работы [531, иа поверхности сульфидных частиц образуется элементарная сера; процесс протекает во внутридиффузионной области через стадию образования ковеллина; величина Еа равна 16,2 ± ± 0,8 кДж/моль (3,85 ± 0,2 ккал/моль)
Рис. 11. Зависимость извлечения меди от температуры (а) и концентрации серной кислоты (/ — 35° С) (б) прн растворении халькозина в сернокислом железе:
/ — 23° С; 2 — 35° С; 3 — 60° С; 4 — 4,38 г/л HtSO4; 5 — 17,6 г/л H,SO4; 6 — 87,6 г/л HaSO4; 7 — 175,0 г/л HtSO4
Халькозин относительно хорошо растворяется в растворах цианидов (рис. 12). Механизм и кинетика процесса значительно разли-
Рис. 12. Извлечение меди при выщелачивании циа нидом металлической меди (/), куприта (2), малахита (3), азурита (4), халькозина (5), борнита (6), энаргита (7), тетраэдрита (8), хризоколлы (S). халькопи рита (/fl) при 45» С. CNaCN — 0.1%, С^Г— 5 г/кг (т = 24 ч, Ж : Т = 10)
,т
чаются в зависимости от присутствия, газообразного кислорода [54—55].
Без кислорода медь и сера переходят в раствор в соотношении 2 : 1, процесс растворения протекает по уравнению
Cu2S + 6CN- + Н2О = 2 [Си (CN)312- + SH- + ОН-. (1.17)
При наличии кислорода процесс развивается с образованием ковел-дина и далее — элементарной серы:
2Cu2S + 4CN- + 0,502 + Н2О = 2CuS + 2 [Си (CN)21- + 2ОН-,
(1.18)
2CuS + 4CN- + 0,5О2 + Н2О = 2 [Си (GN)2]- + 2ОН- + S°. (1.19)
Скорость этих реакций зависит от скорости диффузии цианида к реагирующей поверхности. Определяющей будет реакция (1.19), поскольку растворимая пленка ковеллина более проницаема, чем пленка элементарной серы. Величина Еа составляет 13,8 кДж/моль (3,3 ккал/моль). С увеличением давления кислорода количество, растворившейся меди остается постоянным, а изменяется соотношение
меди и серы в растворе. Это вызвано изменением соотношения дол| реакций образования ковеллина, или элементарной серы, протекающих с одинаковой скоростью: при малых давлениях большее развитие получает первый процесс; с увеличением давления кислорода соотношение их доли изменяется в пользу второго процесса.
В аммиачных растворах в присутствии кислорода и при нагревании халькозин, по данным работы [561, растворяется через стадию образования ковеллина; скорость процесса лимитируется диффузией ионов одновалентной меди в поверхностной пленке.
Рис. 13. Зависимость извлечения меди от крупности и температуры при растворении ковеллине в подкисленном растворе сернокислого железа: а — прн 35° С; б — для франции — 0,16 + 0,074 мм. / — 6,7 + 2,0 мм;
2 — 2.0 4- 0.63 мм: 3 ---- 0,16 4- 0,074 мм; 4 — 0.074 мм; 5 — 35° С;
6 — 50° С; 7 — 98° С
Ковеллин. Ковеллин, как и халькозин, при обычных условиях растворяется в подкисленных растворах солей трехвалентного железа или в растворах цианидов. По данным Сюлливана, с уменьшением крупности зерен и особенно с повышением температуры возрастает полнота вскрытия ковеллина (рис. 13). Скорость его растворения [57 ] прямо пропорциональна концентрации феррисульфата, а процесс контролируется химической стадией при 25—60° С [£п = 92 ± ± 4,2 кДж/моль (22 ± 1 ккал/моль) ] илн диффузией при t 80° С [Еа = 33,5 кДж/моль (8 ккал/моль) 1.
Свежеосажденный сульфид меди при 50—80° С растворяется в присутствии кислорода в кислых растворах с образованием элементарной серы и сульфата меди, в аммиачных растворах — с образованием тетрамминсульфата меди и политионатов, в воде — с образованием только сульфата меди [58].
Борнит. По стойкости в подкисленных растворах солей трехвалентного железа этот минерал не уступает халькозину или ковеллину. Под действием на борнит только воды и кислорода воздуха в раствор через 32 сут. выщелачивания извлекалось около 0,1% меди .'Более быстро выщелачивается медь растворами серной кислоты; так за 24 сут. в раствор переходит в 1 %-ной Н 2SO4 27% Си, а в 5%-ной HjSO4 34% Си. Вскрытие борнита, по данным Сюлливана, заметно 32
Возрастает с повышением температуры (рис. 14). В растворе серпокислого железа из фракции —0,15 4- 0,074 мм при 35° С извлекалось Меди 60% за 1 день, 90% — за 6 дней и около 99% — за 10 дней выщелачивания. Выполнив методически более строгие кинетические исследования, авторы работы [59] определили диффузионный режим растворения, доказали и уточнили стадиальность вскрытия борнита, определили, что величина энергии активации процесса в интервале 30—70° С изменяется с 26,5 кДж/моль (6,34 ккал/моль) до 19,6 кДж/моль (4,69 ккал/моль).
В кипящем растворе подкисленного хлорного железа медь из борнита полностью извлекается за 12 ч. Более поздними работами [601 показано, что уже при концентрации в растворе Fe3+ >0,06 моль/л процесс контролируется диффузией продуктов реакции. В интервале 5—35° С экспериментальная величина энергии активации составляла 26,2 кДж/моль, а прн температурах 40—94° С Еа = 22,4 кДж/моль, что свидетельствует о смещении процесса растворения при 1^40° С из переходного режима в диффузионный. Серная кислота ие участвует в реакции и роль ее сводится к подавлению гидролиза солей железа. В присутствии халь
копирита, дигенита, пирита при температуре 70° С скорость растворения борнита не изменяется вплоть до содержания добавок 25%, в при температуре 15° С заметно влияние только пирита [611.
Халькопирит. Халькопирит выщелачивается в подкисленных растворах солей трехвалентного железа, особенно с ростом температуры и снижением крупности обрабатываемого материала. По данным Сюлливана, из материала крупностью—0,15 + 0,074 мм при обычной температуре за 43 сут. извлекается только 2% меди; При крупности — 0,04 мм в раствор переходит 23—28% меди за 25 сут. И 33—39% — за 57 сут. За 14 сут. при температуре 35° С извлекалось 16% Си, а при 50° С— до 44% Си. При обработке в течение 63 ч Халькопирита крупностью — 0,04 мм в кипящих растворах, содержащих 2 и 5% Fea (SOJs, извлечение меди соответственно составляло 39 и 45%. Сюлливан приводит следующие данные по выщелачиванию халькопирита (при 35° С, крупность частиц —0,04 мм) подкисленном растворе сернокислого железа
Продолжительность обработки.
сут............................ 1 7 14
Увлечение Си, % ............... 8,2 14,8 21,8
3 с. С. Набойчснко
33
Содержание S° в остатке, % 5,4 10,4 15,6
Отношение Си : Fe : S в остатке после удаления S°............. 1:1.17:2,27 1:1,16:2,23 1:1,17:2,25
Продолжительность обработки, сут..................................... 21 42
Извлечение Си, % ...................... 25,5 30,1
Содержание S° в остатке, % 19,1 22,6
Отношение Си : Fe : S в остатке после удаления S° . . 1 : 1,17 : 2,23 1 : 1,17 : 2,17
Постоянное отношение меди к сере в остатке, больший переход меди в раствор, чем образуется элементарной серы S°, указывает на окисление части серы до сульфатной. Можно предполагать развитие следующих процессов при выщелачивании:
CuFeS2 + 2Fe4 (SO4)3 -> CuSO4 + 5FeSO4 + 2S, (1.20)
CuFeS2 + 2Fe2 (SO4)3 + 2H4O + 3O2 ->CuSO4 + 5FeSO4 +
+ 2H4SO4. (1.21)
По мнению Сюлливана, по реакции (1.20) извлекается 65—75% меди, а остальное количество — по реакции (1.21).
В работе [62 ] подтверждается стехиометрия процессов, описанных Сюлливаном. Скорость растворения определяется скоростью диффузии через пленку образующейся элементарной серы и не зависит от начальной кислотности раствора, интенсивности перемешивания. Скорость растворения пропорционально возрастает с увеличением концентрации трехвалентного жетеза до 0,01 г-ион/л, затем она остается без изменений. При CFe>+>0,01 г-ион/л растворение халькопирита зависит от скорости диффузии сульфата закиси железа. В интервале 50—94° С величина Еа составляет 71 ± 12,6 (17 ± ± 3 ккал/моль).
Серная кислота не растворяет халькопирит и роль ее сводится к подавлению гидролиза образующихся солей железа. При добавках в раствор хлористого натрия растворимость халькопирита в серной кислоте становится уже весьма заметной [63].
В подкисленных растворах хлорного железа халькопирит растворяется с образованием элементарной серы, которая, по данным работы [64 I, не влияет на кинетические показатели процесса. Скорость растворения возрастает с повышением концентрации растворителя, интенсивности перемешивания. Полученные зависимости, а также большая величина Еа = 51,6 кДж/моль (12,3 . ккал/моль), по мнению авторов [64 ], свидетельствуют о кинетическом режиме процесса.
Добавки хлорной воды и гипохлорита натрия в раствор для выщелачивания позволяют существенно интенсифицировать окисление сульфидов.
При выщелачивании сульфидов с использованием хлорной воды имеют место следующие процессы [65—66]:
MeS + С12 -> Л1еС12 + S°, (1.22)
AfeS + 4CI2 + 4Н2О Me Cl2 + 6НС1 + H2SO4. (1.23)
Скорость реакций контролируется диффузией хлора через слой серусодержащих продуктов окисления. Повышению выхода элементарной серы способствуют невысокая концентрация хлора, дисперсность материала и повышенная температура. Величина последней ограничена растворимостью хлора в воде, имеющей минимум при 60s С.
В растворах, насыщенных хлором, пирит окисляется очень быстро с образованием сульфата трехвалентного железа; сера ковеллина халькозина борнита окисляется до элементарной, а халькопирита — с образованием монохлорида серы. Основы технологии переработки сульфидных материалов с использованием хлорсодержащих агентов отражены в патенте Австрии (№ 171405, 1952).
Особенности окисления сульфидов меди при повышенной температуре и давлении кислорода
В современной практике автоклавных процессов основные растворители — сернокислые и аммиачные растворы.
Основные положения теории окисления сульфидов прн автоклавных условиях приведены ниже.
1. В кислых растворах при pH ag 1—1,5 и~достаточном давлении кислорода окисление сульфидов, кроме пирита и халькопирита, протекает с предпочтительным образованием элементарной серы и сульфатов металла.
2. Прн отсутствии в системе окислителей сульфиды, способные образовывать элементарную серу, растворяются с выделением сероводорода.
3. При более окислительных условиях и температурах выше точки плавления элементарной серы предпочтительными становятся процессы с окислением сульфидной серы до сульфатной в соответствии со схемой
AleS + 202 -> AlcSO4. (1.24)
В аммиачных (щелочных) растворах сульфиды металлов окисляются с образованием аммиакатов (Си, Ni, Со, Zn, Cd), гидратированных окислов (Fe, Sn) или сульфатов (РЬ). При этом сера окисляется до сульфатной через промежуточные кислородсодержащие анионы по схеме
S!- - S2O3- - SxO'" - sor.
По мере увеличения сравнительных скоростей окисления сульфиды можно расположить в следующие ряды 167—68 ] при выщелачивании в растворах:
кислых [ро, = 870 кПа (8,7 ат), pH = 2,71:
ZnS—PbS— (CuS, Cu2S, CuFeS21 CusFeS4)— FeS2— FeS;
аммиачно-карбонатных [po, = 750 кПа (7,5 ат), pH = 11,1]
Cu2S — (ZnS, FeS) — (FeSa, CuFeS2) — PbS — Cu6FeS4 — CuS;
3* 35
аммиачно-сульфатных [ро, = 750 кПа (7,5 ат), pH = 10,91
ZnS — FeS 2 — FeS — PbS — CuFeSs — Cu5FeS4 — CuS — Cu2S.
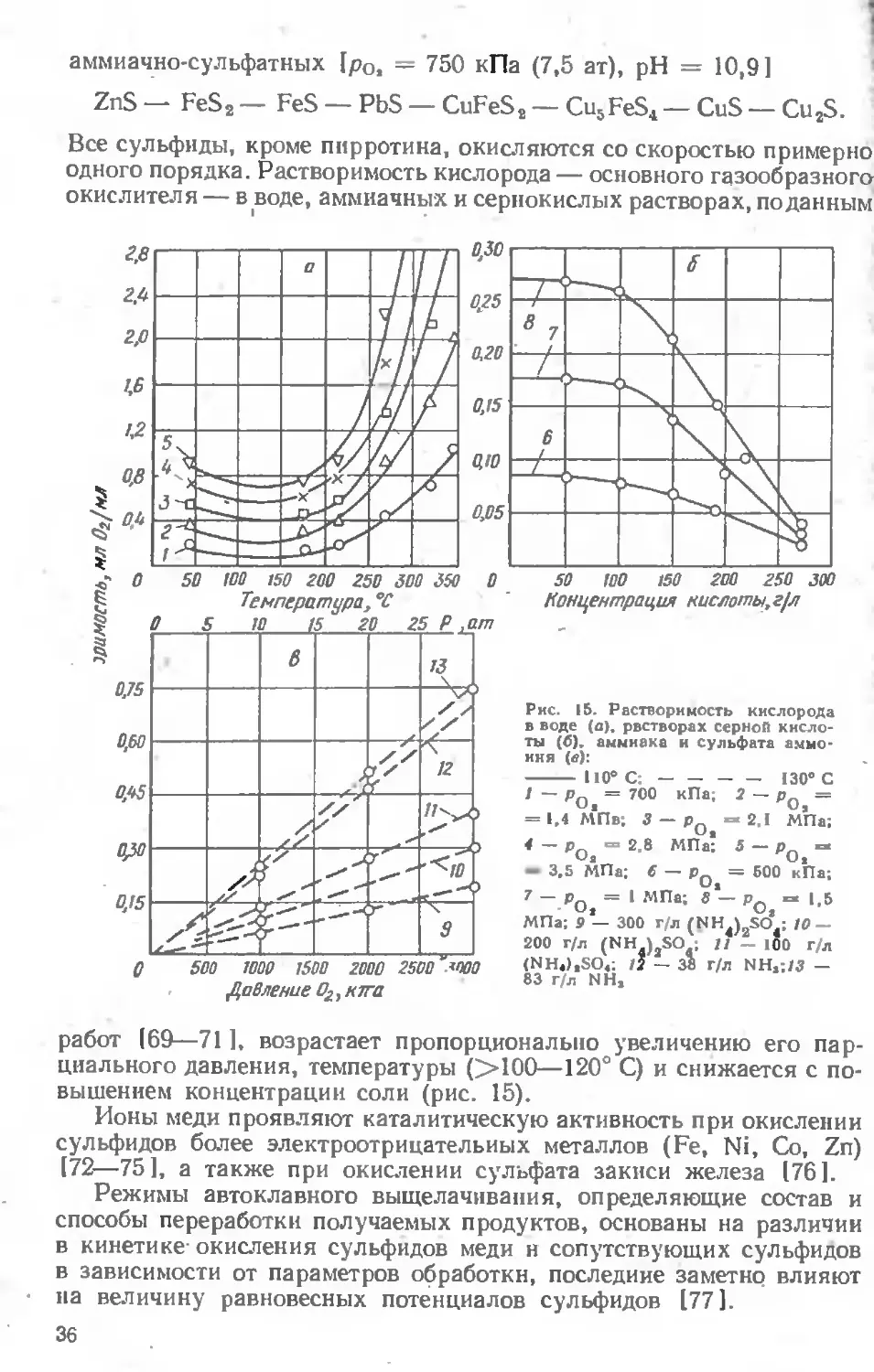
Все сульфиды, кроме пирротина, окисляются со скоростью примерно одного порядка. Растворимость кислорода — основного газообразного окислителя — в воде, аммиачных и сернокислых растворах, поданным
50 100 150 200 250 300
Концентрация кислоты,г/л
Рис. 15. Растворимость кислорода в воде (а), растворах серной кислоты (б), аммиака и сульфата аммония (в):
------ 110° С:-----------130“ С 1 — Ро = 700 кПа; 2 — pQ = = 1,4 МПв; 3 — Ро “2.1 МПа; * — ₽О “ 2,8 МПа; 5 — р® “ “ 3,5 МПа; € — р® = 500 кПа; 7 — Ро = I МПа; S*— pG “1,5 МПа: 9 — 300 г/л (NH ) So' 10 — 200 г/л (NH )2SO 11 - 100 г/л (NH,),SO,; 12 — 38 г/л NH,;/3 — 83 г/л NH,
работ 169—711, возрастает пропорционально увеличению его парциального давления, температуры (>100—120° С) и снижается с повышением концентрации соли (рис. 15).
Ионы меди проявляют каталитическую активность при окислении сульфидов более электроотрицательных металлов (Fe, Ni, Со, Zn) (72—75], а также при окислении сульфата закиси железа (76].
Режимы автоклавного выщелачивания, определяющие состав и способы переработки получаемых продуктов, основаны на различии в кинетике- окисления сульфидов меди и сопутствующих сульфидов в зависимости от параметров обработки, последние заметно влияют на величину равновесных потенциалов сульфидов [771 36
Большинство оригинальных работ по кинетике окисдення сопутствующих сульфидов металлов, содержащихся в медных рудах и концентратах, обстоятельно проанализированы в работе 16, с. 106—33]. Дополнительные сведения можно получить в первоисточниках, посвященных кинетике окисления пирита [78—79] и троил-лита [80], низшего сульфида никеля [81 ], сфалерита (82, с. 45—66, 83—85], галенита [86—88]. Поэтому в данной книге более подробно будет рассмотрено поведение в аммиачных и сернокислых растворах только сульфидов меди.
Растворение ковеллина
Впервые возможность окисления ковеллина и перевода меди в раствор при повышенной температуре под давлением воздуха показана О. Е. Звягинцевым и В. Г. Треневым (1939 г.).
Позднее этот процесс исследовали при температуре 120—180° С и избыточном давлении кислорода p'Sf — 80—700 кПа (2,8—7,0-ат), pH раствора 0,75—1,7 [89]. Установлено, что величина экспериментальной энергии активации равна 49 кДж/моль (11,7 ккал моль), а при температуре 180° С скорость растворения пропорциональна давлению кислорода. При повышенной кислотности (pH = 0,75) и температуре не выше 115° С было отмечено образование элементарной серы
CuS + Н 2SO4 + 0,50s -> CuSO, + S° + Н 2О. (1.25)
В аммиачных растворах растворение ковеллина протекает с более высокой скоростью по схеме
CuS + 4NH3 + 2Ог -> Си (NHs)4SO4. (1.26)
Растворение халькозина
К числу первых работ по кинетике автоклавного окисления халькозина относятся исследования Уоррена [89]. Для опытов использовали природный минерал, измельченный до крупности —0,15 4-+ 0,074 мм. По данным автора, процесс протекал в две стадии с образованием элементарной серы. На первой стадии было отмечено снижение концентрации кислоты, а скорость реакции не зависела от давления кислорода. Величина Еа для первой стадии составляет 27,6 кДж/моль (6,6 ккал/моль), а для второй стадии 7,54 кДж/моль (1,8 ккал/моль). При температуре 200° С с увеличением избыточного давления кислорода в интервале 140—560 кПа (1,4—5,6 ат) скорость процесса пропорционально возрастала.
Авторы работы [90] исследовали растворение меди из литого образца белого штейна (71,96% Си; 4,18% Ni, 1,21% Fe, 17,37% S) при ро, = 250-5-2500 кПа (2,5—25,0 ат), 80—160°' С, Ch.so. = 5-*-' -т-30 г/л. Было отмечено образование пленок серного плава. Скорость перехода в раствор пропорциональна концентрации кислоты и давлению кислорода в степени 0,5; величина Еа составляла
47,6 кДж/моль (11,41 ккал/моль). Авторы [90] отклонили гипотезу о ступенчатом растворении полусернистой меди и предложили следующие одновременно протекающие реакции:
Cu2S + 2,5О2 + H2SO4 -> 2CuSO4 + H3O, (1.27)
Cu2S + O2 + 2H2SO4 -> 2CuSO4 + S° + H2O. (1.28)
Опыты по растворению меди из плавленого сульфида меди 1 крупностью —0,25 + 0,16 мм, проведенные при 95—160° С, ро,6 = = 200-т-2000 кПа (2—20 ат), Cn,so, = 9,2—36,6 г/л, четко показали двустадийный характер процесса [91—92]. Был замечен индукционный период, в течение которого в раствор переходило 10—12% меди, после чего происходило бурное развитие процесса. При температуре меньше 130° С с повышением кислотности и давления кислорода извлекалось не более 45% Си. При более высоких температурах достигалось полное растворение сульфида. Помимо анализа растворов, изучали фазовый состав остатков от первой и второй стадий, который подтвердил двустадийное развитие процесса. В кеке первой стадии не было обнаружено элементарной серы, а в кеке от второй стадии присутствовал ковеллин. Экспериментальные величины энергии активации для первой стадии составляли 41,8 кДж/моль (10 ккал/моль), а для второй 83,6 кДж/моль (20 ккал/моль). Полученные результаты о характере влияния концентрации кислоты (9,2—36,6 г/л) и давления кислорода 250—2000 кПа (2,5—20 ат) на скорость растворения полусернистой меди были идентичны данным, описанным в работе [93]. '
Исследования, проведенные в Гинцветмете, также показали, что окисление халькозина протекает в две стадии. Однако в связи с использованием повышенной кислотности (100—-150 г/л) и невысокой температуры (108—112° С) сера образующегося ковеллина окислялась до элементарной [6, с. 108—109].
Исследования по растворению измельченных плавленых и природных образцов низших сульфидов меди (халькозина, дигенита), а также ковеллина при 40—140° С и Pol® = 0,14-2 МПа (1—20 ат) дали идентичные результаты [90]. Авторы этой работы также установили двустадийный характер растворения низших сульфидов меди с быстрым (в течение нескольких минут при t > 1006 С) образованием на нервой стадии ковеллина:
Cu2S + H2SO4 + 0,5О2 ->-CuS + CuSO4 + Н2О. (1.29)
Влияние температуры особенно заметно на второй стадии, реакции (1.25) (рис. 16); в этом случае величина Еа изменяется с 8 кДж/моль (1,91 ккал/моль) для t <80° С до 86,9 кДж/моль (20,77 ккал/моль) для t > 120° С.
В связи с быстрым протеканием стадии (1.29) влияние давления кислорода было изучено только для процесса (1.25). Оказалось, что
1 Ч у г а е в Л. В. Исследование кинетики окисления плавленых сульфидов меди и никеля с целью установления оптимальных условий их разделения. Канд, дис. Л., 1966.
Рис. 16. Зависимость растворения дигенита от температуры (о) к содержания железа в исходном растворе (б) при pQ = I МПа (10 ат): z
/ — 40е С; 2 - 80е С; 3 - 100° С; 4 — 120е С; 5 - 130° С; 6 - 140° С; 7 - 0,0 моль/л Fe3+: 8 - 0,00175 моль/л Fc3+J 9 — 0,006 моль/л Fc3*; 10 — 0,0105 моль/л Fe3+: II — 0,0179 моль/л Fe3+
количество меди, перешедшей в раствор, пропорционально po.’i Характер этой зависимости одинаков при 100 и 130° С. Растворен щ образующегося ковеллина протекает с образованием элементарной серы с постоянной скоростью только.при содержании серной кислоты не меньше стехиометрического количества. Отмечается одновремен, ное протекание реакций (1.25)
CuS + 2О2.-> CuSO4. (1.30)
Присутствие ионов железа ускоряет растворение ковеллина (рис. 16, б), что вызывается окислением Fe3 + до Fe. Трехвалентное железо способствует развитию процесса
CuS + 2Fe3+ -> Cu2+ + S° + 2Fe2 + . (1.31)
К подобным выводам пришли и авторы работы [94 ]; катализирующую роль Fe3 + они объяснили способностью его повышать хемосорбцию кислорода на поверхности сульфида. Однако полученные величины энергии активации отличаются от вышеприводимых значений: 18,3 кДж/моль (4,38 ккал/моль) при t <• 80е С и 85,3 кДж/моль (20,4 ккал/моль) при t > 120° С. Таким образом, наиболее достоверным можно считать двустадийный механизм растворения халькозина в сернокислых растворах. На первой стадии имеет место быстрое образование ковеллина, на второй стадии — окисление ковеллина с образованием сульфата меди (при повышенной температуре и давлении кислорода) или с дополнительным выделением элементарной серы (при t <112° С и высокой кислотности раствора).
Окисление низшего сульфида меди в аммиачных растворах исследовали в работах [95—96]. По данным А. Я. Наумова и А. А. Цейд-лера скорость растворения меди при Син, > 25 г/л практически не •увеличивается, не зависит от интенсивности перемешивания и возрастает пропорционально pof- Величина Еа равна 31,4 кДж/моль (7,5 ккал/моль). Авторы считают, что процесс протекает в кинетическом режиме, хотя это недостаточно обосновано экспериментальными данными. ч
В работе [96] использовали более строгий гидродинамический режим растворения. По данным авторов [96], скорость растворения пропорциональна давлению кислорода в первой степени и зависит от интенсивности гидродинамического режима. Величина Еа оказалась несколько меньшей, чем в работе [95], и составила 23,9 кДж/моль (5,7 ккал/моль). Было отмечено образование поверхностных пленок. На основании результатов опыта авторы сделали вывод, что скорость растворения сульфида лимитируется диффузией кислорода, которая осложняется из-за наличия- поверхностных пленок. Это более соответствует реальным условиям выщелачивания, которое обычно протекает в условиях кислородной недостаточности. В общем виде процесс растворения протекает по реакции
'CUjS + 6NH3 + (NH4)2SO4 + ЗО2->-2 [Си (NH3)41SO4+2H2O. (1.32)
Растворении халькопирита
При исследовании растворения халькопирита [условия опыта: i = 120—180° С, ро’6 = 175-7-2550 кПа (1,75—25,5 ат), pH = 0,7ч-21 установлено [89], что экспериментальная энергия активации процесса составляет 96 кДж/моль (23 ккал/моль); скорость процесса возрастает-с увеличением давления кислорода, однако прн 180° С роль последнего становится незначительной; при высокой кислотности с увеличением ро. повышается выход элементарной серы; прн ро’6 ниже 0,7 МПа (7 ат) отмечается выделение сероводорода. Указанные процессы описываются реакциями:
2CuFeS« + 8,5О2 + H2SO4 -> 2CuSO4 + Fe2 (SOJ3 + H2O, (1.33)
CuFeS2 + 2,5O2 + FI 2SO4 CuSO4 + FeSO4 + S° + H2O, (1.34)
CuFeS2 + 20 2 + H2SO4 -» CuSO4 + FeSO4 + H2S. (1.35)
Поданным Г. H. Доброхотова и Е. В. Майоровой [97], скорость растворения меди из халькопирита пропорциональна кислотности раствора, давлению кислорода в степени 0,5 и не зависит от интенсивности перемешивания. Величина Еа, равная 30 кДж/моль (7,17 ккал/моль), не зависит от кислотности. Опыты проводили при Си,so. = 4,6ч-28,0 г/л, <= 1254-175° С, ро,6 = 0,25-1,5 МПа (2,5—15 ат). Определив предпочтительный переход железа в раствор, авторы высказали предположение о селективном вскрытии пирита. Возможность промежуточного образования ковеллина была отклонена; отмечено влияние состава халькопирита на показатели его выщелачивания.
Исследуя выщелачивание халькопиритного концентрата, Я- М. Шнеерсон [6, с. 113] на основании результатов фазового химического и минералогического анализов установил, что переход меди в раствор осуществляется через стадии образования борнита, ковеллина:
I0CuFeS2 + 24О2 + 4 (п + 3) Н2О — 2Cu6FeS4 -ф + 4Fe2O3-nH2O + I2H2SO4,
2Cu5FeS4 + 2H2SO4 ф 2,5O2 - 8CuS ф 2CuSO4 ф Fe2O3-nH2O, 8CuS+ 16O2-* 8CuSO4
CuFeS2 4- 4,25O2 - - 0,5 (n -J- 2) H2O -> CuSO4 - 0.5Fe202 nH2O + H2SO4 ’
(1.36)
Румынские исследователи [98] считают, что процесс растворения халькопирита при t= 100^ 180° С, ро® = 0,1^1 МПа (1—10 ат) и Ch.so. = 5-—40 г/л протекает по реакции (1.35). Величина Еа, по данным авторов [98], равна 103 кДж/моль (24,3 ккал/моль). По мнению X. Маджимы [671, халькопирит, так же как и другие сульфиды меди, растворяется по химическому
СиFeS2 ф 4О2 — Си2+ + Fe2+ ф 2501“ (1.37)
и электрохимическому на аноде
Cu FeS 2 Си2+ + Fe2+ + 2S° + 4е, (1.38)1
на катоде
4Н+ + О2 + 4е 2Н 2О (1.39)!
механизмам. Последний предпочтительнее протекает в более кислых ' средах. При химическом механизме величина Еа равна 66,9 кДж/моль (16 ккал/моль), а прн электрохимическом 46 кДж/моль (11 ккал/моль)., Противоречивые результаты, полученные в работах [671 и [98], объясняются не только различной методикой эксперимента, но и сложностью изучаемой системы.
При окислении халькопирита в воде при температуре 200° С в атмосфере воздуха [99] процесс развивается очень быстро: за 30— 60 мин медь полностью переходила в раствор. Одновременно сульфидная сера окисляется до сульфатной, а железо в результате гидролиза остается в твердой фазе. Авторы предполагают, что окисление халькопирита протекает через стадию образования ковеллина:
2CuFeS2 + 4О2—» 2CuS + 2FeSO4, CuS + 2Ог —CuSO4,
2FeSO4 + (n + 2) H2O + 0,50, -► Fe2O3 -nH,0 4- 2H2SO, CuFeS, + 3.250, + 0,5 (n + 2) H2O -> CuSO, +
+ 0,5 (Fe,O3-nH,O) + H,SOt
(1.40)
Поданным работы [100], при автоклавном аммиачном выщетачи-ваиии халькопиритного концентрата медь переходит в раствор достаточно полно и с большой скоростью уже при температуре 8S— 95° С и р™6 = 0,2-s-0,4 МПа (2—4 ат):
2CuFeS2 + 8,5О2 + 12NH3 + (л + 2) Н2О -+
-> 2 [Cu (NH3)41 SO4 + 2 (NH4)2SO4 + Fe2O3- nH2O. (1.41)
Растворение борнита
Кинетике выщелачивания меди из борнита посвящено не так много работ [68, 98—99], что объясняется его ограниченным распространением в медных концентратах и полупродуктах пирометаллургической переработки. Поведение борннта во многом идентично окислению халькозина и для него также установлен двустадийный механизм окисления в кислых средах [68]. Окисление борнита возможно по следующим схемам:
Cu6FeS4 + 6H2SO4 + ЗО2 5CuSO4 + FeSO4 + 4S + 6H2O,
(1.42)
2CusFeS4 + 2H2SO4 + 18.50,, + (n + 2) H20 ->
— 10CuSO4 + Fe2O3-nH2O + 4H2O, (1.43)
2Cu6FeS4 + 36NH3 + 2(NH4)2SO4 +
+ I6,75O2 + (n + 3,5) H20 -> 10 [Cu (NH3)J S04 +
+ Fe2O3 nH 20 + 2H 2O. (1.44)
Окислительные процессы в присутствии микроорганизмов'
Использование микроорганизмов, ускоряющих развитие процесса в десятки раз, — одно из интересных направлений в интенсификации окисления сульфидных минералов. Микроорганизмы либо непосредственно воздействуют на сульфиды, либо ускоряют окисление ферросульфата. В последнем случае регенерируется эффективный растворитель для большинства сульфидов и исключается необходимость в специальном расходе сульфата трехвалентного железа, а также серной кислоты.
С момента выделения культур Thiobacillus (Th) thiooxidans (Ваксман, Иоффе, 1922 г.) и Th. ferrooxidans (Холмер, Хинкель, 1947 г.), относящихся к группе тионовых бактерий, достаточно подробно изучены их свойства, условия жизнедеятельности.
Позднее были открыты культуры Ferrobacillus ferrooxidans (1954 г., источник энергии для жизнедеятельности — сульфат двухвалентного железа), Ferrobacillus sulfooxidans (1960 г., источник энергии S, Fe).
Большинство оригинальных работ по 'вопросу биохимии микроорганизмов, их роли в извлечении металлов из руд, в том числе и нз медных, обобщено в недавно появившейся книге [101]. Дополнительные сведения по теории и практике бактериального выщелачивания в металлургии меди можно получить в работах [102—1181.
Окисление сульфидов микроорганизмами в присутствии пирита по данным С. И. Кузнецова описывается схемой, представленной на рис. 17.
Интенсифицирующее влияние бактерий отчетливо видно пз данных авторов работы [102, табл. 4, 61, приведенных на рис. 18; особенно для халькопирита, ковеллина, халькозина. Роль бактерий в окислении борнита и тетраэдрита менее существенна.
Рассмотрим влияние основных технологических параметров на условия развития культуры Th. ferrooxidans:
. 1) кислотности среды; 2) температуры; 3) аэрации среды; 4) солевого состава среды; 5) присутствия поверхностно активных веществ.
Для развития Th. ferrooxidans необходима кислая среда. Оптимальная величина pH в присутствии железа составляет 1,7—2,5; при pH > 6 бактерии не активны.
При повышенном содержании серной кислоты устойчивость культуры заметно снижается; по данным Н. Н. Ляликовой [103, с. 11 ] при 22 г/л H2SO4 погибли все клетки этой культуры, неадаптированной к кислоте.
Оптимальный интервал жизнедеятельности культуры Th. fer-J rooxidans соответствует 30—35° С. При 40° С активность бактерий’ снижается наполовину, а при 50° С культура стерилизуется. Для роста культур большинство исследователей рекомендуют 28—30° С.' Большое значение для расширения масштабов использования байте-;
риального выщелачивания имеет выведение организмов, работаю-' щих при более низкой температуре (психрофнльные рассы Th. ferrooxidans). Сообщалось о выделении культуры, развивающейся при 4° С, однако железо в этих условиях окислялось гораздо
медленнее.
/ — непосредственное окисление сульфидов (KS) до сульфатов (KSO*); // — регенерация сернокислого железа; /// — окисление пирита и элементарной серы
В результате аэрации среды ускоряется окисление железа не-только за счет повышения окислительно-восстановительного потенциала среды, но и улучшения условий жизнедеятельности бактерий Th. ferrooxidans особенно при обеспечении расхода 1—3 объемов воздуха на I объем среды. Поданным работы 1104], чрезмерная аэрация снижает потребление кислорода клетками. Дополнительная циркуляция раствора еще больше увеличивает скорость окисления.
Th. ferrooxidans — весьма устойчивая культура к повышенным содержаниям меди, железа, цинка, окислов урана, мышьяка, нако например, молибден при содержании в кислой среде более 70—80 мг/л оказывает губительное воздействие на бактерии.
Путем последовательного пересева культур в среды с возрастающим содержанием металла удавалась их адаптация к растворам, содержащим 10—17 г/л Zn. Аналогичными приемами была достигнута адаптация Th. ferrooxidans к растворам, содержащим до 20 г/л Си или до 5—9 г/л Fe. В работе 11051 сообщалось о жизнедеятельности этой культуры даже при содержании 50 г/л Fe. По данным М. Р. Камалова1, культура Th. ferrooxidans сохраняет устойчивость
1 Камалов М. Р. Бактериальное выщелачивание меди из забалансовых руд Коунрадского месторождения. Автореф. канд. дис. Алма-Ата, 1970.
до следующих концентраций элементов: 10 г/л Fe; 5 г/л Си; 5 г/л Со; 6 г/л А1; 0,25 г/л С1; 0,02 г/л Мо, 5-10*6 г/л Ag. При больших концентрациях элементов окисление железа этой культурой заметно затормаживалось. Автор предлагает по увеличению ингибирующего влияния на развитие культуры Th. (errooxidans расположить компоненты раствора в следующий ряд:
Zn—Ni— Fe—Со—Al—Cu—H 2SO4—Cl—Mo—Ag.
При содержании 5 г/л серной кислоты было выделено 4 штамма культуры, способных окислять железо в присутствии или 50 г/л Си или 10 г/л Си и 25 г/л Zn, или 0,2 г/л Мо, или 10 г/л H-SO.,. Таким образом, можно говорить о хорошей адаптации данной культуры к солевому составу технологических растворов. Жизиедея тельиость бактерий возрастает при наличии в растворе ионов кальция, аммония, магния, фосфата, калия, натрия
Поверхностно активные вещества (ПАВ)-увеличивают скорость окисления сульфидов в начальный период, сокращают инкубационный период начала их окисления (лаг-фазу). Однако полнота завершения процесса практически ие изменяется. Можно рекомендовать добавлять в раствор 0,0001—0,05% ПАВ на основе полиэкснэтиленовых олеатов *. Механизм действия
Рис. 18. Переход меди в раствор при выщелачивании сульфидов медн в стерильном (-----) и бактериальном (------) режимах окисления:
/ — халькопирит; 2 — ковеллин; 3 — халькозин;
4 — бори ит
моно-лауратов, пальматов, стеаратов, ПАВ до настоящего времени остается
неясным.
Бактерии снижают активность, но не гибнут под действием солнечных лучей. Однако в работе 1106 ] указывается, что даже при кратковременном воздействии ультрафиолетовых лучей бактериальные культуры стерилизуются при хранении растворов в прудке глубиной 0,6 м.
С помощью микроорганизмов пытаются извлекать медь не только из забалансовых руд, но и из хвостов обогатительных фабрик пи-
Пат. (США), № 3266889, 1964.
ритных огарков, шлаков отражательной плавки и конвертирования [1071, тонкоизмельченных концентратов
Особое значение имеет использование бактерий для окисления железа в растворах после цементации с целью предотвращения его накопления и регенерации растворителя для сульфидных минералов. Установлено [103, с. 59—81, 1081, что лучшие условия для эффективного окисления железа достигаются при температуре 18—20° С, pH = 2ч-3, наличии аэрации раствора (0,1—0,2 м3 воздуха на 1 м® раствора), особенно при введении 0,3—0,4 г/л КН2РО4 и бактериальных затравок.
Таким образом, можно указать следующие необходимые условия для культивирования штамма Th. ferrooxidans: 1) наличие сульфата двухвалентного железа или сульфидов железа; 2) достаточную кислотность (pH = 1,7ч-2,5); 3) температуру в пределах 30—35 С; 4) наличие питательной среды (углекислоты, азота, фосфора, минеральных солей); 5) циркуляцию и достаточную аэрацию раствора; в) адаптацию к солевому составу раствора; 7) защиту раствора от действия ультрафиолетовых лучей.
О способности грибков Penicillium ochrochloroni (культуры WPF-57 и -71) ускорять выщелачивание меди нз сульфндиых руд сообщено в работе [1091. Грибки действуют в слабокислых нли нейтральных растворах при наличии питательной среды, содержащей углерод (глюкоза, сахар) или азот (ряд аминовых кислот, нитрат натрия). Продукты из жизнедеятельности способствуют переводу меди в раствор в виде соединений с хелатными радикалами. .Рентабельность способа выщелачивания с использованием грибков во многом зависит от стоимости требуемой питательной среды.
Электрохимическое растворение
Теория анодного растворения металлов, их сплавов, сульфидов обобщена в работах [29, 31, 44, 119—1231. Основные положения этой теории приведены ниже:
1) поведение металлов, сульфидов и их сплавов определяется стационарным потенциалом, величина которого зависит прежде всего от состава раствора н температуры;
2) скорость растворения сплава возрастает с увеличением плотности тока, при этом в первую очередь в раствор переходят анодные составляющие с более электроотрицательным потенциалом;
3) потенциал сплава определяется потенциалом более электроотрицательного компонента; потенциал твердого раствора по мере растворения изменяется в сторону потенциала электроположительного компонента; потенциал эвтектического сплава в процессе растворения сохраняется неизменным;
4) растворение сплавов металлов или сульфидов осложняется образованием нерастворимых продуктов (окислов, сульфатов свинца, элементарной серы);
5) величины стационарных потенциалов сульфидов и их сплавов сдвигаются во времени или с повышением температуры в область электроотрицательных значений;
6) сульфидная сера в значительной степени окисляется с образованием элементарной серы.
По данным работы 129 ], по мере увеличения стационарных потенциалов сульфиды можно расположить в ряд
ZnS — PbS—NiS—FeS—Cu FeS 2—FeS.
Решеиберг приводит следующие величины стационарных потенциалов сульфидов (по отношению к водородному электроду), измеренных в растворе, содержащем 100 г/л NaCl, 22 г/л СаС12, 0,022 г/л FeClj, 0,74 г/л ВаС12 [28]
FeS2 CtiFeSg
Стационарные потенциалы, мВ: рН-4 658 558
рН-9 540 434
ZnS CuS Со,FeS, PbS
459 448 416-448 395
181 434 453 328
Для плавленых сульфидов меди, никеля, кобальта определены [119, с. 57—58] следующие величины стационарных потенциалов в 1-н. растворе сульфата соответствующего металла, мВ : 520, 235, 145. Значения этих потенциалов при 20° С в растворе, содержащем 100 г, л H2SO4, следующие: 444 мВ для Cu2S, 202 мВ для NiaS2, 146 мВ для CoS. Потенциалы галенита н сфалерита в этих же условиях соответственно равны 213 и 280 мВ.
Таким образом, в растворе серной кислоты потенциалы сульфидов имеют более электроотрицательные значения, чем в растворе сульфата.
В работе [77] определены потенциалы, при которых начинается растворение природных сульфидов меди в 1-н. растворе серной кислоты при 97° С: 400 мВ для CuFeS2; 350 мВ для CuS; 240 мВ для Cu2S (на первой стадии). Полученные данные были использованы при выборе оптимальных параметров селективного выщелачивания цинка из цинковых, медно-цинково-свинцовых, свинцово-медно-цииковых концентратов Начало растворения меди из этих материалов наблюдали при несколько меньших значениях потенциалов, чем в случае моносульфидных образцов.
Растворение полусернистой меди в кислой среде происходит, через стадии образования сернистой меди. При последующем повышении плотности тока последняя растворяется с образованием элементарной серы. Наиболее обстоятельно протекающие процессы изучены в работе [121 1.
Авторы, исследуя электрохимическое растворение сплава на основе сульфида меди в растворе, содержащем 30 г/л Си, 100 г/л H2SO4 прн i = 40° С, DK = 100 А/м2, наблюдали, что в первые 3 ч ие образуется шлам, хотя цвет поверхности анода становится голубым, а на катоде осаждается медь, в следующие 4 ч происходит быстрое выделение элементарной серы; по истечении 10 ч с момента начала опыта электролиз протекает с гораздо меныпей скоростью. Основной фазой в шламе после удаления элементарной серы была сернистая медь. На основе изучения фазового и химического состава про
дуктов окисления анода во времени предложен трехстадийный механизм, объясняющий наблюдаемые явления:
1) . образование дигенита: 5Cu2S —Cu8S5 + Си + + е\
2) разложение дигенита: Cu8S6 -> 4CuS + 5Cu + + 5е;
3) разложение сернистой меди: CuS -► Cu2+ + S + 2е.
По мнению авторов работы 1123], при низкой плотности тока образуется только полусернистая медь, что приводит к повышению анодного потенциала и способствует разряду гидроксил-ионов с образованием атомарного кислорода. Атомарный кислород способствует химическому растворению анода:
CuS + О + Н2SO4 -> CuSO4 + Н2О + S°, (1.45)
Cu2S + 40 + 2H2SO4 -> 2CuSO4 + S02 -h 2H2O. (1.46)
Растворение сульфида железа возможно в результате реакции
FeS + H2SO4 ->- FeSO4 + H.,S. (1.47)
В свою очередь ионы Fe2 + окисляются на аноде атомарным кислородом. Образование Fe3+ благоприятно, поскольку способствует химическому растворению анода, однако развитие процесса
2Fe3 + + CuK 2Fe2 + + Cu2 + (1.48)
снижает катодный выход по току; и кроме того, в электролите накапливается железо, которое необходимо удалять.
Наибольшее растворение сульфида никеля достигнуто при температуре 65° С и анодной плотности тока 90 А/м2.
Приведенные данные свидетельствуют о том, что сульфиды меди имеют более электроположительные потенциалы (по сравнению, например, с сульфидами цинка, никеля, кобальта, железа1) и для их перевода в раствор необходима более высокая плотность тока, поэтому селективное растворение меди с получением чистых растворов практически невозможно.
Особенности выщелачивания куоксвого материала
Физико-химические закономерности растворения дисперсных частиц в условиях вынужденной конвекции детально рассмотрены в работах [124—127]. Поэтому ниже обсуждаются вопросы, касающиеся выщелачивания только кускового материала.
Первые работы по определению характера выщелачивания кусков руды выполнены Сюлливаном с сотрудниками. Авторы установили, что скорость проникновения раствора в пустоты куска руды уменьшается при наличии газов (это более заметно для воздуха, чем для сернистого газа) и с увеличением температуры из-за возрастания поверхностного натяжения и доли газа в объеме канала; повышается с уменьшением крупности кусков и при наличии трещин, изломов, плоскостей спайности; практически не зависит от состава и концентрации раствора.
1 Типа пирротина, троилита.
В последние годы появилось ряд оригинальных работ, в которых сделана попытка описать основные физико-химические процессы, происходящие при выщелачивании кусковой руды [128—131 ]. Показано, что при растворении с поверхности процесс развивается быстро, подчиняясь закономерностям фильтрации, а затем медленно в связи с переходом в область, контролируемую капиллярными явлениями. Поэтому скорость процесса возрастает с увеличением реакционной поверхности, количества изломов, трещин и улучшения условий проницаемости раствора внутрь куска. При перколяционном и кучном вариантах выщелачивания руду предварительно дробят, учитывая ее свойства и выход шламовых фракций. При выборе оптимальной крупности дробления необходимо принимать во внимание взанмопротивоположные гидравлические зависимости — соотношение скоростей проницаемости слоя руды и проникновения раствора в отдельный кусок.
Основным транспортирующим агентом при выщелачивании является вода. Различают гигроскопическую, пленочную и гравитационную воду. Гигроскопическая вода — мономолекулярный ее слой, адсорбируемый из влажного воздуха поверхностью частиц (особенно мелкозернистых и глинистых пород) и удерживаемый поверхностными и электростатическими силами, движение ее не подчиняется законам гидродинамики. Пленочная вода образует тонкий слой над слоем гигроскопической влаги. Этот слой перемещается в направлении от более толстых к более тонким пленкам (процесс выравнивания) особенно с увеличением температуры под влиянием сил межмолекулярного притяжения. Образование пленочной воды особенно характерно для мелкозернистых и глинистых пород. Гравитационная вода уже не поглощается рудной частицей, движение ее подчиняется законам гидравлики. Различают свободную и капиллярную воду: первая заполняет промежутки между твердыми частицами, вторая — присутствует в порах, трещинах частиц. Скорость движения капиллярной воды зависит от внутрикапиллярных сил и заметно снижается при заполнении каналов газами (воздухом, СОг), ухудшающими смачиваемость поверхности частиц.
Движение раствора через пористый слой описывается уравнением Дарси, которое в первом приближении можно использовать для объяснения закономерностей перколяции:
Q = —k^, (1.49)
Н
где Q — объемное количество жидкости, проходящее через поперечное сечение в единицу времени, м3/с;
k—удельная проницаемость слоя, м2;
S — площадь поперечного сечения потока, м2;
р — гидравлический градиент;
р— вязкость раствора, Па-с;
р — плотность раствора, кг/мэ.
Величина k—эмпирическая константа зависит от пористости слоя руды.
4 С. С. Нобойчепко
49
Знак минус в формуле (1.49) указывает на снижение напора в направлении движения жидкости. Пористость слоя зависит от его высоты, крупности кусков, их расположения, вторичных процессов (заиливания, выветривания и разрушения вмещающих пород, оседания слоя).
Пусть Кф = k-^-, где Л'ф— коэффициент фильтрации, тогда
<2 = КфХр. (1.50)!
Скорбеть потока раствора подсчитывают по уравнению
v = ~ = K$p. (1.51)
При повышенной скорости перколяции большая часть растворителя пройдет через слой руды практически неиспользованной в связи с ограниченной продолжительностью контакта его с обрабатываемым материалом. При недостаточной скорости перколяции растворитель быстро расходуется, что замедляет выщелачивание.
В общем виде, скорость растворения сульфидов должна возрастать с увеличением концентрации растворителя (кислоты, сульфата трехвалентного железа), кислорода и температуры.
При кучном выщелачивании температура процесса существенно зависит от климатических условий. В условиях подземного выщелачивания температура сохраняется более постоянной. В связи с большим объемом перерабатываемого сырья специально повышать температуру внешними источниками тепла, экономически нецелесообразно.
Поэтому основным фактором интенсификации выщелачивания кускового сырья является достаточная концентрация растворителя и кислорода (для сульфидных руд), равномерное смачивание кусков породы растворителем. При выщелачивании сульфидного сырья большую роль играет диффузия растворителя, кислорода и продукта реакции (CuSOJ.
При одинаковой кинематической вязкости раствора скорость процесса будет контролироваться диффузией того вещества, у которого наименьшее произведение коэффициента диффузии (£)) и предельной растворимости (Спр) [127, с. 189—2071. Сопоставляя величину £)-Сп₽ для кислорода (£>м = 2,5-10~5 см2/с, Сз£ = 2,5 X X10"4 г моль/л) и сульфата меди (Пг, = 0,9 • 10 5 см2/с, = = 1,525 г-моль/л) [9, т. 3, с. 194], прн условии избыточной концентрации растворителя можно считать роль диффузии кислорода определяющей.
Кислород поступает с орошающим раствором; особенно сложна диффузия кислорода в капиллярах, порах и трещинах частицы. Относительно свободный и равномерный доступ кислорода к поверхности сульфидных частиц возможен при повышенной пористости вмещаемой породы. Для плотных пород и особенно при неравномерной вкрапленности сульфидных частиц условия доступа кислорода к их поверхности наименее благоприятны.
В работе [130] сделана попытка оценить роль кислорода при выщелачивании сульфидной частицы по закономерности, выведенной для квазнгомогениой модели частицы катализатора [132, с. 411—425]. Согласно квазнгомогениой модели, размеры пор малы в сравнении с размерами частицы и поры равномерно распределены в объеме частицы.
С учетом закономерностей массопередачи и химической реакции внутри пор х - / dN \
частицы выражение для объемной скорости I 1 имеет следующим вид:
—г -^г=^Се = Кс^г1< <152>
V at mL
где V — объем частицы;
К — константа скорости реакции, включающая константы диффузионного и химических процессов;
С — концентрация реагента;
е — безразмерный параметр, отражающий долю внутренней поверхности пор, участвующих в реакции;
• т — безразмерный параметр, отражающим взаимосвязь константы скорости
(Кг \а
-&•) ’
а — показатель, отражающий условия диффузии; величина его ^0,5;
L — приведенный параметр, получаемый прн делении объема частицы на наружную ее поверхность, доступную для взаимодействия с кислородом. (dNo \
Выразив объемную скорость реакции через скорость расхода кислорода I ^--1 > концентрацию кислорода (СО1) через постоянную Генри (Л) и давление кислорода (р"3<5) объединив постоянной В параметры размера частиц и характеры их упаковки, получим уравнение, приведенное в работе [130];
* dNO, th mL п ,,
-----у j— Ро„ (153)
где Ki — обобщенная константа скорости реакции.
Для этого уравнения характерны два следующие экстремальные условия (при < = const);
1) а -> 0, т. е. частица не проницаема для кислорода;
2) а -» 0,5, т. е. отсутствуют затруднения с доставкой кислорода в зону реакции. При а -> 0 величина th mL 1 и
1 dNo. К"
V dt L ’
где К' — константа, характеризующая пористость частицы, т. е. скорость выщелачивания зависит только от параметров, характеризующих физическое состояние частицы. Поэтому показатели выщелачивания не будут зависеть от факторов, определяющих развитие химической стадии процесса (температуры, присутствия катализаторов, концентрации меди и др.)
1 dNo В
При а -» 0.5, th mL -- mL и--— — — К, т. е. скорость выщелачива-
ния будет определяться только величиной комбинированной физико-химической константы К и должна быть неизменной во времени; если преобладающей является физическая составляющая, то влияние температуры на скорость процесса будет крайне незначительным и наоборот.
Таким образом, для успешного выщелачивания меди из кусковых материалов необходимы:
1) максимальная пористость слоя руды для свободного дреиани раствора и доступа кислорода; 2) орошение оптимальным количеств вом раствора (предпочтительно в ночное время суток); 3) чередовав ние операций орошения и дренажа раствора для полного вымыв; ния сульфатов и максимального доступа кислорода («проветрив;, ния») в слой руды; 4) тщательный контроль кислотности раствора для предотвращения усиленного разрушения породы или выпадения пи дроокислов; 5) максимальная поверхность слоя руды (в расчете н! единицу его объема).
1
ТЕРМИЧЕСКАЯ ПОДГОТОВКА СЫРЬЯ К ВЫЩЕЛАЧИВАНИЮ 4 Обжиг
Наибольшее значение для гидрометаллургии меди имеют сульфа» тизирующий, низкотемпературный хлорирующий, реже, окисли; тельный и восстановительный виды обжига. j
Сульфатизирующему' обжигу подвергают сульфидные руды ил>| смесь окисленных и сульфидных материалов с целью перевода извлекаемых цветных металлов в сульфаты, а жечеза — в нерастворимые окислы. Процесс ведут в окислительной атмосфере при темпе» ратуре ниже температуры разложения сульфатов извлекаемых металлов.
При хлорирующем обжиге сульфидные (окисленные) материалы обрабатывают хлорсодержащим реагентом в окислительной атмосфере для перевода металлов в растворимые хлориды.
При окислительном обжиге концентратов и штейнов стремятся максимально удалить серу, в противном случае возрастают потери меди при выщелачивании огарка. Поэтому обжиг ведут при избытке воздуха и повышенной температуре (800—850° С). Однако в этом случае заметное развитие получают процессы ферритообразования, что также снижает извлечение меди на стадии выщелачивания. Использование специальных приемов для разрушения ферритов (обработка огарка в восстановительной атмосфере, высокотемпературное выщелачивание) приводит к дополнительным затратам и ухудшает селективность перевода меди в раствор.
Восстановительный обжиг применяли для подготовки богатых трудновскрываемых окисленных руд к последующему аммиачному выщелачиванию. Процесс основан на достаточно легкой восстановимости окисленных соединений меди (в том числе ферритов и силикатов) при температуре 400—450° С в присутствии твердых или газообразных восстановителей. В связи с отработкой месторождений таких руд, а также использованием более эффективных приемов, например сегрегации, в настоящее время восстановительный обжиг медных руд в промышленном масштабе не применяют.
Вопросы теории и практики обжига в металлургии меди подробно рассмотрены в работах [133—1351. Остановимся только на основных положениях процесса обжига сульфидных материалов, имеющих значение для гидрометаллургии.
СульфатиЗирующий обжиг
Результаты процесса обжига зависят от термической устойчивости сульфидов и образуемых сульфатов. Данные по устойчивости этих соединений (—lg ps.) для основных сульфидов приведены в табл. 7, 8.
Таблица 7
Логарифмы давления диссоциации сульфидов
Температуре °C —re ps, 1кПв <мм ₽т- ст >1
FeS CujS Ni.S. PbS ZnS
500 ^11,7 (13,7) 11,6(13,6) 11.1 (13,1) 10,2 (12.2) 18,8 (20.8)
700 7,5 (9,5) 8,5(10,5) 6.1 (8,1) 5.9 (7,9) 12,8 (14.8)
900 4,7 (6,7) 6,3 (8,3) 3.2 (5,2) 3.0 (5,0) 9 1 (11.1)
Таблица 8
Равновесные давления гвзовой смеси У Pjso,. so,, O,)> кПа (мм рт. ст.), при разложении сульфатов по реакции AfeSO, МеО + SO3 (SO2. Ог)
Fe, (S04), • CuS04 ZnSO< NiSO*
t 2 P(SO,. SO,. O,) t °C 2P(SO,.SO,.O,) 4: Sp(so,. so,, o,) t °C 2P(SO„SO,.0,)
553 •3,07 (23) 600 8,26 (62) 675 0,665 (5) 700 1.68(12.6)
592 4,67 (35) 653 13,05 (98) 690 0,80 (6) 800 19,20 (144,0)
614 9,32 (70) 686 16,40 (12’3) 720 3,20 (24) 820 26,10(196)
634 15,05 (113) 705 18,50 (139) 750 8,10(61) 900 137,00 (1030)
650 660 680 707 19,70 (149) 24,50 (182) 38,10 (286) 95,30 (715) 728 745 775 805 23,10 (173) 27,90 (209) 39,70 (298) 72,20 (542) 775 800 14,90 (112) 25,20 (189) 945 296,0 (2220.0)
В общем виде при обжиге сульфидов происходят следующие процессы:
MeS + 1,50^ MeO + SO2, (1.54)
2SO2 + O2^ 2SOa, (1-55)
MeO + S03 MeSO4. (1.56)
Реакция (1.54) практически необратима. Уравнения констант равновесия для второй и третьей реакций (1.55) и (1.56) приведены ниже:
Pso,Po, , „ _
Ар (Г.55) = -----9-----» Ар (1.56) — PSO,-
₽so.
Образование сульфатов будет проходить При условии, если napmiJ альное давление SOs в атмосфере печи.будет больше давления SOJ от диссоциации сульфата, т. е. p.so, |/"> Pso,- При обратной-зависимости предпочтительно образуются окисли. Для успешного^ проведения сульфатизируюгцего обжига необходима ограниченная; температура для предотвращения диссоциации сульфата, высокая1 концентрация серного и сернистого ангидрида в печной атмосфере;-достаточная продолжительность контакта обжигаемого материала; с газами. Показатели сульфатизации улучшаются при введении суль-< фатов щелочных металлов [82, с. 946—970; 1361.
Сульфаты железа наименее устойчивы; заметная их диссоциация* происходит при 480—520° С; сульфаты меди разлагаются при 600—' 650° С. При обжиге в кипящем слое достигается более высокая концентрация сернистого ангидрида в печных газах (15—16%). Поэтому можно вести сульфатизирующий обжиг при 650—680° С без опасности разрушения сульфатов меди. Использование повышенной температуры в печи КС позволяет заметно увеличить производительность операции.
Показатели сульфатизации при обжиге улучшаются с уменьшением крупности частиц, с увеличением расхода воздуха, но не более 20—30% избытка от теоретически необходимого его количества.
Введение в шихту обжига активаторов (сульфатов щелочных металлов, чаще всего натрия) в количестве до 2% также повышает выход кислоторастворимых соединений цветных металлов.
Для уменьшения вероятности образования ферритов необходимо обеспечить повышенное парциальное давление серного ангидрида в газовой фазе, что возможно благодаря контролю соотношения воздух—питание, использованию воздуха, обогащенного кислородом; введению в шихту высокосернистых материалов, например пирита;-использованию при обжиге серусодержащих газов, получаемых в отдельной печи [137].
С целью повышения давления SO2 в газовой фазе практикуют обжнг пульпы концентратов, приготовленной на оборотных сульфатных растворах.
Пирит и троилит в окислительной атмосфере при температурах ниже точки их воспламенения (400—450° С) окисляются с образованием сульфатов железа, а при большей температуре с образованием труднорастворимых окислов.
Сульфиды меди при низкой температуре окисляются до сульфатов первичного, образования; последние в присутствии сульфидов разлагаются. С повышением в газах концентрации сернистого газа происходит сульфатизации окислов меди (вторичное сульфато-образование).
Наибольшая скорость сульфатизации халькозина достигается в интервале 430—540° С по реакции
Cu,S + 2,5О2 CuO + CuSO4.
(1.57)
При температуре 650° С образуются основные сульфаты. 2СиО + 4- SOs -► CuO CuSO4, разрушающиеся при 725е С. Сложные сульфиды (халькопирит, борнит) максимально сульфатизируются при 525° С, а при повышенной температуре (>700® С) склонны к ферри-
Сульфид кобальта CoS, образуемый при диссоциации каролита, наиболее полно сульфатизируется при 450° С. В интервале 470— 825° С сульфат кобальта разлагается в результате взаимодействия с сульфидом или диссоциации. При повышенных температурах обжига образуется труднорастворимая закись — окись кобальта (Со3О4). На рис. 19 приведены некоторые данные по поведению сульфидов меди, кобальта и железа в процессе сульфатизирующего обжига Си—Со концентрата.
Сульфид цинка при сульфатизирующем обжиге ведет себя аналогично простым сульфидам меди. Образующийся сульфат цинка начинает разлагаться при температуре выше 740° С.
Сульфиды мышьяка и сурьмы окисляются с образованием летучих трехокисей и менее летучих пятиокисей, при этом последние способны к образованию арсенатов и антимонатов тяжелых металлов. При сульфатизирующем обжиге мышьяк и сурьма в основном остаются в огарке.
При наличии в медных концентратах молибденита последний окисляется с образованием трехокиси молибдена или молибдатов. Окисел молибдена значительно летуч при температурах выше 700° С.
Благородные металлы в огарке представлены формами, практически нерастворимыми в средах, используемых в гидрометаллургии меди.
Хлорирующий обжиг
Этой операции подвергают малосернистые материалы (3—6% серы) с малым содержанием золота ^хлориды золота отличаются повышенной летучестью).
В качестве хлорирующего реагента используют твердые (хло-!>иды кальция, натрия, магния, аммония, карналлит) и газообразные хлор, хлористый водород) хлоринаторы. Использование первых предпочтительнее при хлоридовозгонке, а газообразных, как правило, при низкотемпературном режиме обжига.
При повышенном содержании серы материал предварительно подвергают окислительному обжигу. При отсутствии последнего возрастает расход хлоринатора и имеет место спекание материала. Спекание происходит и при избыточном расходе хлоридов щелочных металлов. В результате уменьшается реакционная поверхность, затрудняется доступ кислорода, хлора внутрь оплавленных частиц, что ухудшает показатели обжига, особенно по выходу растворимых форм меди.
Логарифмы давлений диссоциации некоторых хлоридов тяжелых цветных металлов при различных температурах приведены в табл. 9.
Таблица 9
Величина IgPci, [кПа (мм рт. ст.)] некоторых тяжелых цветных металлов
СоС1> NiCI. CuCl, CihCl.
t °C -l« ₽Ci, t °C -'e Pci. t °C -'в PCI. t °C -» PCI,
300 18,66 (20,66) 300 17,59 (19.59) 219 1,18(3,18) 250 19,66(21,66)
350 16,52 (18,52) 350 15,47 (17,47) 267 0,71 (2,71) 300 17,02 (19.02)
400 14,67 (16,67) 420 13,00 (15,0) 305 0,34 (2,34) 350 15,15(17,15)
470 12,50 (14,50) 450 12,10(14,10) 340 0,02 (2,02) 402 13,47(15,47)
540 10,69(12.69) 470 11,55(13.55) 375 —0.28 (1.72) 507 10,48 (12,48)
600 9,40 (11,40) 500 10,74 (12,74) 420 —0,64 (1,36) 552 10,20 (12,20)
650 8,43 (10,43) 550 9,71 (11,71) 458 20.90(1,10) 585 9,42 (11,42)
700 7,63 (9,63) — . — 445 —1,42 (0,58) 665 8,39(10,39)
В табл. 10 приведены данные по растворимости хлоридов основных металлов в воде [9, т. 3, с. 180].
При хлорирующем обжиге в окислительной атмосфере сначала происходит окисление сульфидов металлов с образованием окислов н сернистого газа:
MenSm + 4- -у )°а -* пМеО + mSO2. (1.58)
Одновременно в присутствии окислителей и при наличии катализаторов (FejOj, NiO и др.1) происходит разложение хлорирующего реагента с образованием атомарного хлора. Соединения меди, свинца, 56
Растворимость хлоридов в боде (массовые части на 100 частей растворителя)
Таблица !0
Хлориды Растворимость при температуре, °C
20 30 40 60 80 100
CuClj 74,5 78,3 81,8 89,4 98.0 110,5
FeCl2 62,6 — 68,6 78,3 — 94.2
FeCl3 91.9 106,8 — 373.0 526,0 536,0
NiCl2 65,6 « — — 76.6 *• 86,2 *a 87,6
CoCI2 52.9 59,7 69,5 93,8 97,6 106,2
PbCI2 0,978 1 19 — 1,78 »г 2,62 3.23
MgClj 54,8 56,0 58,0 61,3 65,8 73,0
ZnCl2 367 438 453 495 549 614
CdCl2 114.1 128,3 134,7 136,4 140,4 146,9
CaCl, 74.5 100.0 115,0 137.0 147.0 158,4
*1 —26° С- —50° С. —76° С.
серебра хлорируются в первую Очередь. Под действием кислорода менее устойчивые хлориды (FeCl2, NiCl2, СоС12) разлагаются с образованием окислов; частично этому процессу подвержен и хлорид меди:
4СиС12 + О2 72 2CuO-CuCI2 + 2С12, )
2CuOCuCls 4- 4CuO-i-2CI, } (1.59)
2CuCl, + Os^2CuO-t-2Cla ’ )
По уменьшению степени хлорирования окислы можно расположить в ряд
СиО—NiO—CosO4—Fe2Oa—Fe3O4.
При температуре выше 450—500° С заметное развитие получает образование однохлористой меди (2СиС1г —2СиС1 + С12). При низких температурах наряду с хлорированием имеют место процессы суль-фатообразования. С повышением температуры образующиеся сульфаты диссоциируют или вступают в обменную реакцию с хлорирующим реагентом:
Me„/2SO4 + 2л №С1 Na2SO4 + МеС1„. (L60)
При наличии хлорного железа возможно хлорирование окиси меди: ЗСиО + 2FeCl3 -> Fe2O3 + ЗСиС12. (1.61)
При высокотемпературном режиме обжига хлорирование в основном происходит газообразным хлором, а не за счет обменных реакций. С повышением температуры возрастает выход труднорастворимых соединений меди (оксихлорида, хлористой меди), поэтому наиболее предпочтительной температурой обжига будет 360—400° С. Однако с целью увеличения производительности печей на практике исполь
зуют несколько большие температуры (500—550° С). Труднорастворимые формы меди извлекают выщелачиванием подкисленными растворами. В огарке хлорирующего обжига медь и цинк в основном представлены в виде кислоторастворимых соединений (хлоридов, окислов, в меньшей степени — сульфатов), а железо и значительная часть никеля, кобальта — в виде нерастворимых окислов. По степени увеличения стойкости к разложению указанные хлориды можно расположить в следующий ряд:
FeCl 2—CoCi 2—NiCl 2—ZnCl 2—CuCl 2.
При обжиге сырья с высоким содержанием золота необходимы специальные меры для ёго улавливания.
Прн повышенном содержании в сырье породообразующих оснований (окислов кальция и магния) требуется гораздо больший расход хлорирующего реагента, а при выщелачивании увеличивается расход серной кислоты и выход кека. Образующийся сульфат кальция вызывает загипсование технологической арматуры и трубопроводов.
Мышьяк и сурьма в значительной степени возгоняются в виде летучих хлоридов. Большая часть свинца остается в огарке в виде нерастворимого сульфата.
Для способов подготовки сырья с применением обжига характерны сложное аппаратурное оформление, обильные газо- и пылевы-деления, трудность поддержания оптимальной температуры. Поэтому прн разработке новых технологических схем предпочитают использовать обжиг лишь в крайних случаях. Продолжает сохранять значение хлоридовозгонка бедных материалов (например, пиритных огарков) с целью селективного выделения цветных металлов в богатый коллективный продукт с последующей его гидрометаллургической обработкой.
Сульфатизация
Сущность процесса заключается в обработке сульфидных материалов концентрированными растворами серной кислоты при повышенной температуре с целью селективного перевода цветных металлов в растворимые в воде сульфаты. Принципы процесса были описаны Л. Е. Маковецким, X. Морганом* 1, С.- М. Анисимовым. Однако наиболее детальное изучение теоретических основ сульфатизация сульфидных и сложных окисленных соединений цветных металлов выполнено под руководством А. П. Снурникова2.
Основные происходящие реакции приведены ниже:
AfeS + H2SO4 -> MeSO4 + H2S; (1.62)
' A4eS + 2H2SO4 -> Me SO4 +S° + SO2 + 2H2O; (1.63)
1 Пат. (США), Ks 1895811, 1933.
1 Л a p и н В. Ф. Исследование кинетики и химизма взаимодействия сульфидов цветных и редких металлов с серной кислотой. Автореф. канд. дис. Свердловск, 1969.
MeS, + 4H2SO4 MeSO4 + 4SO2 + 4H2O; (1.64)
H2S + H2SO4 -> S° + S02 + 2H2O; (1.65)
S° + 2H2SO4 -> 3SO2 + 2H,O. (1.66)
По данным термодинамических расчетов, по снижению вероятности протекания реакций сульфатизации сульфиды можно расположить в следующий ряд:
FeS—N iS—ZnS—Р bS—CuS—Cu 2S.
Сульфиды меди относятся к числу весьма устойчивых соединений. Вероятность протекания реакции разложения ковеллина незначительна даже при 300° С.
С повышением температуры вероятность протекания реакций окисления сероводорода и элементарной серы кислотой возрастает, а реакций окисления сероводорода сернистым газом — уменьшается.
Согласно экспериментальным данным, устойчивость сульфидов соответствует приведенному ранее термодинамическому ряду за исключением сульфидов, при обработке которых происходят фазовые превращения или образование экранирующих оболочек (например, сульфата свинца при сульфатизации PbS). Реакционная способность искусственных сульфидов, как правило, больше, чем у одноименных природных сульфидов.
Наибольшая степень сульфатизации достигается при 200—300° С, при более высокой температуре показатели процесса ухудшаются в основном из-за разложения серной кислоты. С повышением температуры возрастает степень сульфатизации пирита по реакции:
FeS2 + H2SO4 FeSO4 + S° + H2S, (1.67) что приводит к дополнительному расходу кислоты и образованию сульфата железа (Fea+).
По данным А. П. Снурникова, при разложении пирротина, пирита и халькопирита серной кислотой часть железа окисляется до трехвалентного состояния, особенно при 300° С. В этом случае скорость окисления двухвалентного железа кислотой значительно больше, чем при окислении его кислородом воздуха. Образующееся при сульфатизации сернокислое окисное железо быстрее растворяется и более просто удаляется при гидролитической очистке, чем сульфат закиси железа. Процессы сульфатизации сульфидов развиваются по закономерностям диффузионной кинетики, при этом в начале процесса определяющим будет диффузия продуктов реакции, а в конечной стадии — диффузия серной кислоты в реакционную зону через слой сульфата.
По данным [138—140], сульфиды меди взаимодействуют с серной кислотой по реакциям:
CuS + Н 2SO4 -> CuSO4 + Н 2S, (1.68)
Cu8S6 + 8H 2SO4 -> 5CuS + 4CuSO4 + 4SO2 + 8H 2O, (1.69)
5Cu2S + 2H2SO4 -> CueS6 + CuSO4 + SO2 + 2H2O, - (1.70 CuFeS2 + 4H2SO4 -+ CuSO4 + FeSO4 + 2SO2 + 2S° + 4H2O, 2Cu5FeS4 + 8H2SO4 -* CuFeS2 + CusFeSe +
+ 4CuSO4 + 4SO2 + 8H2O. (I-72|
В отличие от других медных минералов при сульфатизации халь| копирита не образуется промежуточной фазы — ковеллина, чтоЕ обусловливает более быстрое и полное протекание процесса (рис. 20)1
В сравнении с другим^ сульфидами меди, для суль? фатизации халькопирита тре4 буется наибольший расход кислоты и при этом наблю-;
Таблица
Показатели сульфатизации медный минералов
Рис. 20. Кривые 90%-ной сульфатизации халькопирита (/). ковеллина (2), пирита (5)» борнита (4), халькозина (5). дигенита (tf) (крупность минералов — 0.15 4- 0.074 мм)
Минералы Расход 100%» пой кислоты кг/кг Си Количество элементарной серы S0 кг/кг Си 5 О >5 3)
Ковеллин 3.1 0,5 0.5
Халькозин 3,1 0,25 0,25
Дигенит 3.1 0,28 0,28
Бор ит 4.0 0,40 0,308
Халькопирит 7.7 1,00 0,40
дается повышенный выход элементарной серы (табл. 11). Суль-фатизация халькозина происходит через стадию образования ковеллина и описывается следующими процессами 1138]:
Cu2S + 2H,SO4 — CuS + CuSO4 + SO2 + 2H,O,
CuS -f- 2H2SO4 —»CuSO4 -f- SO2 -]- S {- 2H2O, zj
S + 2H2SO4-> 3SO2-f-H2O ’
CuS -f- 6HaSO4 -> 2CuSO4 -f- 5SO2 + 6H2O
Наибольшая степень сульфатизации достигается при 200° С: 78,4% за 60 мин. Процесс развивается в диффузионной области, а величина Ев составляет 19,2 кДж/моль (46 ккал/моль).
С помощью сульфатизации удается извлекать медь и из феррита; наибольшая степень сульфатизации его (38—40%) достигается при 200° С. При высокотемпературной сульфатизации (620° С) за счет разложения сульфата железа имеет место селективное извлечение меди в водную фазу 1141 ].
Способом сульфатизации можно перерабатывать огарки, сульфидные концентраты; в последнем случае можно получать не только 60
элементарную серу, но и регенерировать кислоту за счет использования сернистых газов. Лучше всех минералов подвергается разложению серной кислотой халькопирит, причем селективно извлекается медь, а пирит не вскрывается. По сравнению с сульфатизи-рующим обжигом при сульфатизации нет необходимости тщательно выдерживать температуру: меньше и десульфуризация за счет исключения побочных процессов (например, взаимодействия сульфатов и сульфидов).
ВЫДЕЛЕНИЕ МЕДИ ИЗ РАСТВОРОВ
Цементация
Термодинамика процесса
Цементация меди из раствора основана на различии в величинах нормальных потенциалов меди и металла-осадителя. Согласно ряду напряжений любой металл с более электроотрицательным потенциалом, чем у меди, способен вытеснять ее из раствора. В табл. 12 [9, т. 3, стр. 740—54] приведены значения стандартных потенциалов Е° некоторых элементов, наиболее типичных для медьсодержащих растворов.
Таблица 12
Стандартные потенциалы некоторых элементов при 25° С
Электрод £°. В Электрод Е». В Электрод E°, В
Mg'Mg3* —2,363 Cd/Cd2* —0,403 Cu/Cu* 0,52
Ti/Ti2* —1,63 Co/Co2* —0,277 Ag/Ag* 0,799
Al/Al3* —1,663 Co/Co3* 0,43 Au/Au3* 1,498
Мп/Мп2* —1,179 Ni/Ni2* —0,25 Au/Au+ 1,692
Zn/Zn2* —0,763 Sn/Sn2* —0,136 s/s2- 0,476
Сг/Сг3* —0,744 Ha/2H* 0,0 O2/H2O 1,228
Fe/Fe3* —0,44 As?'As3* 0,247 OjOH 0,41
Fe/Fe3* —0,037 Cu/Cu2* 0,337 Cl/Cl- 1,359
Зависимость потенциала электрода Е от концентрации его ионов в растворе определяется по уравнению Нернста
Е = Е° + ~-\ауС, (1.74)
Где п — валентность иоиа металла;
F — постоянная Фарадея;
у — коэффициент активности;
С — концентрация ионов металла в растворе, моль/л.
Процесс цементации меди описывается следующей общей схемой:
Си2* + Me—Си + Me2*. (1.75)
Данный окислительно-восстановительный процесс может быт 4 отождествлен с работой короткозамкнутого гальванического эче-J мента Д
Cu|Cu2* Me2*! Me. .
Термодинамическая вероятность цементации меди оценивается’ по величине изменения свободной энергии реакции
ДО ;= nbEF.
Поскольку железо является наиболее распространенным осади-? телем, рассмотрим термодинамику процесса цементации с его участием:
Си2* + Fe — Си + Fe2*. (1.76).
Величина свободной энергии реакции (1.76) [151 кДж/моль' (36,2 ккал/моль)! свидетельствует о большой вероятности осажде* ния меди железом.
Для равновесных условий реакции (1.76) потенциалы меди и же* леза будут равны, т. е.:
E°Fe + -^ In flFe-* = £си - 1п аСи» , (1.77)
где Орем-, аСиг+ — активности ионов железа и меди в растворе.
Подставив в это выражение численные значения 7?, F, Е° для Т = = 298 К, получим:
— 0,44 + 0,0295 lgaFe«+ = 0,337 — 0,0295 lg<Zcu.*-
Из этой зависимости можно определить величину равновесной константы Кр реакции (1.76):
КЮ-2б.з, °Fe«+
которая свидетельствует о возможности осаждения меди железом практически полностью.
Однако в реальных условиях, помимо осаждения меди в процессе
цементации, возможны следующие реакции:
2Fe3* + Fe— 3Fe2*, (1.78)
Fe2* + e—Fe8*, (1.79)
2H* + Fe- Fe2* + H2, (1.80)
2Fe8* + Cu — Cti2+ + 2Fe2*, (1.81
Cu + 2H* + 0,5O2— Cu2*4-H2O, (1.82)
Fe + 2H* + 0,5O2—Fe2*4-H2O. (1.83
Развитие указанных процессов не только снижает полноту осаждения меди, но и приводит к значительному увеличению расхода осадителя по сравнению с теоретически необходимым количеством (0,874 единиц на единицу осажденной меди).
По мере протекания процессов (1.80), (1.82), (1.83) снижается концентрация свободной кислоты, а при pH > 2,54-3,5 создаются условия для гидролиза солей как железа, так и алюминия:
2Ме2 (SO4)3 + 4Н2О 4AfeOHS04 + 2H,SO4, (1.84)
Ме2 (SO4)3 + 6Н2О 2Ме (ОН)3 + 3H2SO4. (1.85)
Образующиеся нерастворимые продукты вызывают дополнительные кинетические осложнения при цементации. Очевидно, несмотря на значительную термодинамическую вероятность процесса цементации меди показатели его будут определяться в значительной степени влиянием кинетических факторов.
Кинетика процесса
С позиций электрохимии основные процессы при цементации меди разделяются на катодные:
Си2+ -|- 2е —• Си, Fe3+ + е —»Fe2+, Н+е —> 0,5Н2, 2Н+ + О2—Н2О
(1.86)
и анодные
Fe — 2е —» Fe2+, /О —2ё
О< г-»2О2-
ХО — 2е.
(1.87)
Кинетика этих процессов изучена в работе [142], на основании которой можно Сделать следующие выводы:
1. Потенциал железа не зависит от интенсивности перемешивания, концентрации иона Fe3 + , ио с увеличением pH (с 1,5 до 3,5) становится отрицательнее (с —550 до —620 мВ), по отношению к насыщенному каломельному электроду).
2. Предельная плотность тока при восстановлении Си2* возрастает с увеличением концентрации меди, перемешивания раствора, температуры и не зависит от pH. Экспериментальная величина энергии активации Ея равна 21 кДж/моль (5,06 ккал/моль).
3. Характер кинетики восстановления Fe3+ аналогичен восстановлению Си2 + .
4. Зависимость предельной плотности тока (i) при восстановлении ионов от их концентрации описывается следующими соотношениями:
/си*+ = 174Сси«+;
1рев+- — 83Сре>+ ,
iH<. == 0,037С^ (для обескислороженного раствора); j'i1+ = 0,524р°-31
где 174; 83; 0,037; 0,524—константы скорости соответствующий процессов.
Таким образом, с наибольшей скоростью протекает процесс вое! становления ионов меди. Растворение железа (восстановление ноной водорода железом) зависит от концентрации кислорода в раствор^ и при отсутствии последнего не имеет практического зна>1ений в связи с малым потенциалом железа и большой склонностью erd к пассивированию.
Рассмотрим влияние основных технологических параметров на! скорость осаждения меди и свойства получаемого осадка [143—147, 148, с. 918—941, 149—501: 1) состава раствора; 2) природы осади* теля; 3) гидродинамического режима; 4) температуры.
Состав раствора (содержание меди, кислоты, железа, илов, киЛ слорода, хлора, мышьяка и др.). С увеличением содержания меди в растворе скорость цементации возрастает, а кинетика процесса, подчиняется закономерностям первого порядка. При высоком содержании меди (>20 г/л) получается плотный, трудиоотделяемый от скрапа осадок.
Осаждение меди железом возможно в широком диапазоне кислотности раствора, влияние концентрации II+ на кинетику цементации незначительно. Однако кислотность раствора стремятся поддерживать в относительно узком интервале. При недостаточной кислот/ ности кинетика цементации осложнена развитием гидролиза солей алюминия и железа, продукты которого затрудняют диффузию ионов меди к поверхности осадителя. При высокой кислотности повышается роль конкурирующей диффузии ионов водорода в зону реакции. Кроме того, возрастает растворение железа, особенно после осаждения большей части меди, что уменьшает поверхность осадителя и увеличивает его расход. В кислых растворах образуются чистые, плотные осадки и снижается выход дисперсных фракций (—0,01 мм). Для получения крупнозернистого осадка необходимо, чтобы pH = 1,5-ь2,0. Присутствие трехвалентного железа крайне нежелательно, так как”оно повышает расход осадителя, требует использования более кислых растворов для предотвращения гидро-; лиза иона Fe3+ и служит одной из причин обратного растворения меди. Роль последнего процесса становится особенно заметной после осаждения основного количества меди. Кинетика цементации с учетом процесса обратного растворения меди описывается уравнением
-----* =KCcu»t$Fe — К'Сре‘+5си’ (1.88),
где Spe, SCu — площадь поверхности соответствующей металлической фазы;
К — константа реакции цементации;
К' — константа реакции растворения меди сульфатом окиси железа.
Отрицательное влияние сернокислого железа устраняют или предварительном его восстановлением (обработкой раствора сернистым газом, дренажом раствора через пиритные фильтры или тяже-64
Рис. 21. Влияние типа газовой фазы иа растворение железа прн цементации прн 45° С н Сс 11 - ‘ Г/Л:
J ~ кислород (pH =» 1,96); 2 — воздух ((pH = «2.00); 3 — азот (pH — 2,35); 4 — водород (рН=
лый скрап), или, что более целесообразно, обеспечением „оптимального гидродинамического режима при цементации.
Сульфат закиси железа даже при содержании 35 г/л не влияет на кинетику цементации. Однако под влиянием возросшей ионной силы раствора изменяются условия формирования частиц осажденной меди: они становятся более крупными с губчатой структурой и развитой поверхностью. Сгущение, обезвоживание и промывка такого осадка осложняется.
Присутствие иона хлора в обрабатываемом растворе при pH = = 3 + 3,2 ускоряет цементацию и способствует образованию более дисперсного, легко отслаивающегося осадка меди. При повышенном содержании СГ ускоряется окисление металлической меди и железа. Присутствие в осадке хлора (в виде полухлористой меди) осложняет его гидрометаллургическую доработку.
При цементации мышьяк осаждается с медью, что осложняет последующую переработку осадка; кроме того, возможно образование арсина. При pH 2,0+2,5 и
достаточной концентрации сульфата окиси железа зна
чительная часть мышьяка осаждается в виде арсената железа.
Ионы алюминия и магния повышают скорость цементации и способствуют получению более крупных и плотных частиц меди. Равновесная концентрация кислорода при 30° С и ро’6 = 100 кПа (1 ат) в 1 м® воды достаточна для растворения примерно 28 г железа в присутствии кислоты.
Зависимость количества растворяемого железа от состава газовой фазы при цементации, по данным работы [147], показана на рис. 21.
В присутствии кислорода двухвалентное железо окисляется до трехвалентного, которое, как и кислота, растворяет металлическую медь и железо. Развитие указанных побочных реакций обусловливает гораздо больший расход железа, чем по стехиометрии процесса цементации меди. По данным работы [147], на растворение железа и осаждение растворившейся меди приходится до 75% железа, расходуемого сверх стехиометрии.
Илы и шламовые включения в растворе снижают скорость цементации за счет экранирования поверхности осадителя и ухудшают качество цементного осадка. При повышенном содержании кварца и каолина, особенно при интенсивном перемешивании, возрастает выход дисперсной меди за счет абразивного воздействия. Кремниевая кислота несколько увеличивает скорость цементации вследствие
5 С. С. Набойченко 65
роста площади катодных участков и способствует большему выход рыхлых дисперсных частиц меди.
Природа осадителя. Как уже отмечалось, для цементации меда в основном используется железо, характеризуемое достаточно высо кой электрохимической активностью. Кроме того, железосодержащи! скрап представляет собой достаточно распространенный и дешевы) осадитель. Активность его в значительной степени зависит от со става, удельной поверхности, окислениости и чистоты поверхности В табл. 13 приведены данные по влиянию состава осадителя на ско рость цементации [170] меди из раствора, содержащего 1 г/л Ci (поверхность образца 6,45 м2). Большая скорбеть достигается пр* использовании более чистых сортов железа, при этом требуется го« раздо меньшая интенсивность перемешивания.
Таблица li
Удельная скорость цементации меди (и) для различных типов осадителей
___________________________________________________________________________|
Тип осадителя /. ес я ♦’ об/мин X 2.
Горячекатаная сталь 33,6 1700 ' 1,53 >
Чугун 26,0 3600 3,56
Проволока для термопар . . . 27,3 600 2,87
Армкожелезо (99,9% Fe) . . . 45.0 3600 5,25 < Я
•> Скорость вращения мешалки.
•’ 3.97% С; 0.81% Мп: 2.16% Р; 0.07% S.
Наименьшая сцепляемость осадка меди с поверхностью испытываемых сортов осадителей оказалась также у наиболее чистых образцов. При чистой, неблокированной медью-поверхности у осадителя сохраняется хорошая осаждающая способность в процессе цементации.
При цементации гранулированным чугуном практически полностью используется железо при крупности частиц мельче 0,21 мм. Частицы цементного осадка имеют сферическую 'форму с включениями графита. Поверхность более крупных гранул быстро блокируется осажденной медью, прекращая дальнейшее развитие процесса.
Скорость цементации возрастает пропорционально поверхности осадителя, величина которой зависит от крупности и геометрической формы'его частиц. На рис. 22 показано влияние крупности частиц чугунной стружки на извлечение меди (7, с. 106). При использовании осадителя с геометрически неправильной формой частиц за счет дополнительных завихрений раствора у поверхности показатели цементации улучшаются.
Наличие масла, лака и ржавчины иа поверхности осадителя снижает его активность вследствие уменьшения реакционной зоны, в результате расход железа повышается.
Гидродинамический режим. Цементация меди протекает в диффузионном режиме: при недостаточной интенсивности перемешивания скорость реакции зависит от скорости внешней диффузии, а при интенсивном перемешивании — от скорости диффузии в граничном
слое, которая в ряде случаев осложняется из-за присутствия осажденной меди на поверхности осадителя.
(^увеличением интенсивно ти гидродинамического режима цементация :едн ycijo эяётся. Это объясняется не только улучшением условий массопёредачи, устранением концентрационной поляризации, но и обновлением поверхности осадителя. В случае интенсивного перемешивания, особенно
при аэрации, раствора, получают развитие нежелательные процессы (окисление кислородом воздуха металлической меди и железа, образование трехвалентиого жечеза). Оптимальный гидродинамический режим должен обеспечивать тесный и равномерный контакт раствора с осадителем, высокую скорость движения раствора, что создает условия для быстрой цементации меди и минимального развития побочных процессов.
При интенсивном перемешивании образуются более крупные и менее загрязненные частицы цементной меди.
Температура. С повышением
Рис. 22. .Зависимость извлечения меди от крупности частиц осадителя (чугунной стружки);
1-----3+1.0 мм; 2 — 1.0 + 0.42 мм;
3 — — 0,42 + 0,21 мм; 4 — 0,21 мм
температуры скорость цементации
несколько возрастает вследствие изменения равновесных потен-циалов, снижения концентрационной поляризации и равновесной
растворимости кислорода.
Величина Ея процесса цементации меди, по данным различных авторов, колеблется в пределах 12,5—25 кДж/моль (3—6 ккал/моль). Температура является наименее действенным параметром в промышленных условиях в связи с экономической нецелесообразностью организации специального подогрева огромных объемов перерабатываемых растворов. Поскольку цементация — экзотермический процесс, большего внимания заслуживают мероприятия по снижению потерь тепла прежде всего в результате совершенствования конструкции используемого аппарата.
Таким образом, для обеспечения качественных показателей процесса цементации необходимы следующие, условия:
• В минимальнре-Содержание окислителей (трехвалентиого железа, хлора, растворенного кислорода) и илов в исходном растворе;
2) минимальная кислотность раствора, достаточная для предотвращения гидролиза солей трехвалентного железа алюминия;
5* 67
3) оптимальный гидродинамический режим и достаточная продолжительность контакта раствора с осадителем;
4) высокая чистота осадителя, представляющего собой однородные по крупности частицы с развитой поверхностью; -
5) возможно быстрое удаление металлической меди из реакционного пространства аппарата.
Кинетика цементации меди другими осадителями (цинком, кадмием, алюминием) [151—52] имеет много общего с цементацией железом. При использовании некоторых разновидностей осадителей удается более надежно сохранять его поверхность в процессе цементации свободной от осаждаемой меди, чем при применении железа.
Сорбция
Из известных разновидностей сорбентов в гидрометаллургии меди наибольшее значение имеют синтетические смолы на основе высокомолекулярных полимерных материалов.
К ионообменным смолам предъявляют следующие требования: высокая емкость, селективность извлечения нужного металла, хорошая механическая прочность и химическая устойчивость, невысокая стоимость.
Кинетика, механизм сорбционных процессов, вопросы синтеза и структурные свойства ионообменных смол обстоятельно изложены в работах [153—1631.
С помощью ионообменной технологии в гидрометаллургии меди стремятся селективно извлекать медь из бедных растворов сложного солевого состава. Показатели процесса существенно зависят от свойств смолы и технологического режима сорбции. В ряде случаев селективное извлечение меди основано на способности меди и сопутствующих элементов образовывать с десорбентом соединения, имеющие различною растворимость или устойчивость.
Сорбцию меди с целью ее отделения от ряда сопутствующих элементов из азотнокислых растворов на карбоксильных (СГ-1, СГ-2, КБ-2, КБ-4а-2) катионитах в Н-форме и на сульфокатионитах (КУ-1, КУ-2) исследовали в работах [164—167].
Наибольшая емкость при pH—-4,8-г-4,9 по меди не превышала 51—64 мг/г для карбоксильных ионитов и 72,5 мг/г для сульфокатионитов. Медь десорбировали однонормальным раствором хлорида или нитрата аммония.
Селективная сорбция меди из сернокислых железосодержащих растворов с использованием анионитов АН-1, АН-2, ЭДЭ-10п, АВ-16 впервые описана в работе [168]. Более детальные исследования сорбционных свойств различных смол по отношению к меди и определение оптимальных режимов процесса были проведены в последние годы [169—173].
Емкость по меди почти всех типов исследованных ионитов, за исключением сульфокатиоиитов, зависит от кислотности раствора. Например, при увеличении pH с 2 до 4,0—4,5 емкость ионитов по 68
меди возрастает с 10—12 мг/г до 130 мг/г (для СГ-1) и с 11—13 до 38 мг/г (для КБ-4п); особенно это заметно для среднеосновных смол. Наибольшую емкость по меди смолы АН-31, АВ-16г и ЭДЭ-Юп имеют при pH—3,5; соответственно ПО мг/г, 103 мг/г, 95 мг/г. Повышенная сорбционная емкость по меди характерна для иоиитов, сочетающих в своей структуре амино- н карбоксильные группы (амфолиты, иониты серии АНКБ). Некоторые данные (1711 по сорбируемости меди из сернокислых растворов различными ионитами приведены иа рис. 23.
Рис. 23. Зависимость емкости сорбента содержании меди (б) в растворе:
/ — АНКБ-1; 2 — АНКБ-2; 3 — АН-31; 4 — АВ-16г; 5 — ЭДЭ-Юп; 6 — АНКБ-7;
7 — АН-2Ф
Двухвалентное железо в отличие от трехвалентного практически не сорбируется на смоле АНКБ-7 при pH — l,5-s-2,0; поэтому для повышения селективности при сорбции меди целесообразно или осаждать Fe8 + , или восстанавливать его до двухвалентной формы [170, с. 107—1111.
Не менее важной операцией является десорбция, при которой достигается не только извлечение меди в богатый раствор, но и осуществляется подготовка смолы к новому циклу сорбции меди. При подборе режима десорбции учитывают возможность использования дешевых реагентов, селективность выделения меди в богатый раствор, полноту регенерации смолы.
К основным параметрам, позволяющим управлять процессом десорбции, можно отнести концентрацию кислоты, солевой состав раствора, используемого для промывки смолы, расход и температуру промывного раствора.
Применение концентрированных растворов серной кислоты позволяет ускорить десорбцию, существенно уменьшить объем товар
ной фракции десорбированного раствора и повысить содержание в нем меди. При выборе оптимальной кислотности наряду с кинетическими факторами учитывают химическую стойкость сорбента, способ последующей переработки элюатов. В присутствии сульфата натрия или сульфата аммония в растворе серной кислоты показатели десорбции меди, например из смолы АН КБ-7, практически не ухудшаются.
С повышением температуры десорбирующего раствора снижается его расход и, следовательно, повышается содержание меди в элюате.
сокращается продолжительность операции. Предельно допустимую температуру при десорбции выбирают с учетом термической стойкости сорбента.
Как правило, первыми 2—3 объемами дёсорбента- вымывается основное количество меди и при этом получают наиболее богатые элюаты. При дальнейшем увеличении расхода промывного раствора полнота десорбции меди несколько возрастает, однако содержание ее
О 2 4 0 2 4
Объем paanbopa Объем смолы
в этих порциях элюата невысо-
Рис. 24. Десорбция меди нэ ионита АНК.Ь-1 о Л
(45 мГ Си/г) раствором серной кислоты в за- КОС. В рбЗ^ ЛЬТЗТв СНИЖЗСТСЯ виси мости от температуры^ КОИЦеНТрЗЦНЯ МвДИ И В объвДИ-
‘-20?с?4лЛ’£°г; /- 740»соль/л H,S0*= пенном растворе. Поэтому расход промывного раствора выбирают с учетом достижения максимально возможной отмывки меди при-ограниченном объеме получаемых элюатов.
В качестве примера на рис. 24 , 25 показана кинетика десорбции меди из насыщенных ионитов АН КБ-1 и АН КБ-7. Кинетику десорб-
ции изучали при скорости пропускания промывного раствора 2 мл/(см2/мин), высоте слоя сорбента 70 см (рис. 24) и 45 см (рис. 25).
В табл. 14 приведены режимы десорбции меди из некоторых, смол, установленные в работе [172].
В последние годы ионообменные смолы находят широкое применение для изготовления мембран, используемых прн электродиализе. Мембраны, помимо основных требований, предъявляемых к ионитам, должны йметь хорошую электропроводность (быть эластичными, гибкими, водонепрон ицаемыми).
Электродиализ наиболее часто применяют для селективного выделения меди или сульфатов сопутствующих металлов'из растворов с повышеииой кислотностью. Эффективность электродиализа характеризуется коэффициентом обмена, величину которого можно определить по формуле [174, с. 3561:
W = VA ЬС,
(1.89)
где W—количество продиффундировавшей кислоты, кг/ч;
V—коэффициент обмена, кг/(ч-м2-г-моль);
А — поверхность мембраны, м2;
АС — логарифмическая разность концентраций кислоты:
л г [С°-(Сф+Сд)1С°
~ 2.3 In (С° — Сф) ’
Рис. 25. Десорбция меди и железа из анионита АНКБ-7 (75 мГ Си/г) растворами серной кислоты и сульфата натрия:
-....Си; —'— — — Fe; л — ^NajSO* = моль/л; б — ^•Na1SO< “ ЬО моль/л; в —
Сц so — 0.5 моль/л; 1 — 2 моль/л НЖ8О«; 2 — 1,5 моль/л HaSO4; 3 — 0,5 моль/л HtSO<;
4 — 0.25 моль/л HjSO*; 5 — 0,5 моль/л NajSO*; 6 — 2,0 моль/л NajSO*
Таблица 14
Режимы десорбции меди из некоторых смол
Тип смолы (емкость по меди мГ/г) Концентрации кислоты в десорбенте г/л Температура °C Отношение объема адсорбента к объему смолы
СГ-1 (2—3) адэ-1оп (15,0) АНКБ-1 (75,0) 1 АНКБ-7 (75,0) / 20—30 —200 300—400 40—60 70—75 70,0 2,0 4,0 2,5-3,0 0,7—2.7
или приближенно среднеарифметическое значение
ЛС = 0,5 (С° - Сф + CJ, где С°, Сд, Сф — концентрация кислоты соответственно в исходном растворе, отработанном растворе (диализате), обогащенном растворе (диффузате), г-моль.
Экстракция *
В основе экстракционного метода лежит способность ряда органических соединений селективно образовывать с ионами меди устойчивые комплексы, которые, практически не растворяясь в водной среде, выделяются в объеме раствора самостоятельным слоем.
Теория экстракционных процессов обстоятельно разбирается в специальных работах [175—1761.
При обработке. медьсодержащей органической фазы растворами кислоты (при реэкстракции) происходит разрушение металлоорганических комплексов; при этом получают концентрированные медные растворы и регенерируют экстрагирующие фазы. Происходящие процессы в упрощенном виде могут быть выражены следующими схемами:
[2HR]opr + Cu2+ 4- SO’-— [R-CuJopr + [2H2SO.,1. (1.90)
[2HRJopr + Cu(NH3)1+ + 2OH~ — [R2CuJopr 4- 4NH3o, + 2H2O, (1.91) реэкстракция
[RaCulopr + [2H+ + SOl-]a9— [2RH]opr + CuSO.,. (1.92)
"Регенерируемая органическая фаза используется для извлечения меди. Единственным расходуемым реагентом служит серная кислота. Однако при использовании процессов осаждения меди с регенерацией серной кислоты (электролиза, автоклавного осаждения, электродиализа) потребность и в этом реагенте значительно сокращается и сводится практически к компенсации механических потерь.
Эффективность экстракции оценивают по коэффициенту распределения, т. е. отношению концентрации извлекаемого металла в органической фазе и в водном растворе. Коэффициент распределения зависит от состава экстрагента и предельной его насыщаемости извлекаемым металлом. К экстрагенту предъявляют и дополнительные Требования: он должен селективно извлекать медь, не растворяться в воде и иметь высокую емкость по насыщаемому металлу.
Экстрагент используют в смеси с разбавителем для понижения вязкости и плотности органической фазы, что способствует более лучшему отдепению последней от водного раствора. При выборе разбавителя учитывают характер его взаимодействия с экстрагентом (разбавитель способен оказывать существенное влияние на диссоциацию экстрагента и условия обмена его водородных ионов на ион металла), вязкость, плотность, химическую стойкость, токсичность, пожаро- и взрывобезопасность и стоимость.
Для извлечения меди используют следующие экстрагенты [177— 1841:
1. Азотсодержащие (в основном амины), эффективно действующие в растворах хлоридов, а в сернокислых растворах экстрагирующие только железо. Амины можно использовать для извлечения меди из аммиачных растворов1.
2. Нейтральные органофосфорные соединения (трибутилфосфат) с высокими показателями экстрагирующие медь из хлоридных растворов, не содержащих трехвалеитное железо.
3. Алкилфосфорные кислоты1 2 (дн-2-этилгексилфосфориая кислота, Д2ЭГФК), пригодные для разделения меди и цинка в хлоридных и азотнокислых растворах при отсутствии трехвалентного железа (цинк извлекается при pH = 1,54-4,0, а медь—при pH = 2,54-3,5).
4. Кислоты с карбоксильными группами (нафтеновые 1177—1801, высокомолекулярные с молекулярной массой 165—300), пригодные для разделения меди, никеля, железа, цинка, кадмия,’ кобальта в сернокислых растворах. Наибольшую экстрагирующую способность они проявляют при pH на 0,5 единиц ниже, чем рН-гндрато-образовання. Интересным экстрагентом этого класса является а-бромлаурииовая кислота3 * *, которая позволяет экстрагировать, например, медь из более кислых растворов, что исключает опасность осаждения гидроокиси меди. Экстракция связана с катионным обменом, что приводит к повышению концентрации водородных ионов в системе. Поэтому при обработке растворов с высоким содержанием меди (4—5 г/л) необходима нейтрализация раствора; при меньшем содержании меди (1,0—1,5 г/л) надобность в нейтрализации отпадает. Используя, например, третичную монокарбоновую кислоту («Версатик-9») и специальную подготовку раствора можно селективно извпечь железо прн pH = 2,04-2,6, медь— pH = 3,6^ 4,7; цинк — pH = 4,74-5,6; никель и кобальт при pH = 5,54-6,5.
По данным Г. В. Иллювиевой 1180], нафтеновыми кислотами металлы извлекаются в следующей последовательности:
Fe > Си > Al > Zn > Со > Ni > Мп > Са > Mg > Na. Приводимый ряд неплохо согласуется с порядком увеличения произведения растворимости гидроокисей указанных металлов. Для более растворимых гидроокисей экстракция соответствующих металлов происходит при больших значениях pH. Недостатком этого класса экстрагентов является повышенная растворимость в воде;
5. Жирные кислоты н их мыла1 (С?—С13, олеиновая, линолеи-новая, элеостеариновая), экстрагирующие медь из нейтральных и щелочных растворов.
6. Поверхностно активные экстрагенты (полипропиленглнколь, высокомолекулярные сульфоновые кислоты)6. Алкиларилсульфо-новая кислота экстрагирует более 95% меди нз растворов с pH ₽» 2.
1 Пат. (США), № 3224873, 1965.
2 Пат. (Япония), № 9673, 1962.
8 Пат. (Израиль), № 16017, 1962.
8 Пат. (США), № 3197274, 1962.
• Пат. (Япония), № 9674, 1962.
7. Смешанные реагенты (спирты, простые и сложные эфиры, кетоны). 2-октанол, карболовый спирт, метилизобутилкетон плохо экстрагируют в сульфатных растворах и к тому же имеют повышенную растворимость в воде.
Наибольшее значение и практическое использование для извлечения меди из бедных сульфатных и аммиачных растворов получили экстрагенты, синтезированные фирмой «Дженерал Милз»1. В конце 1963 г. был выпущен экстрагент LIX—63 высоко селективный по меди, одиако его действие проявлялось только при pH > 3 (прн pH = 5,8 извлекалось 98,8% Си, а при pH = 7,14"9,3% Си), что требовало значительных затрат на нейтрализацию раствора и обусловливало потери меди с гидратным осадком железа [1781. На основе дальнейших исследований был синтезирован реагент LIX-64, представляющий смесь 2-гидрохибензо-феноксимов 1179, 182—184]. Этому реагенту' свойственна высокая селективность по меди; при pH = 2 в первую очередь экстрагируется медь, затем частично Fe3*, очень в небольших количествах Мо"*, V4*, a Zn2*, Sn2*, Са2*, Mg2*, As3*, Al3*, Fe2*, Si4*, Co2*, Ni2* совсем не экстрагируется. Благодаря высокой селективности экстракции получают весьма чистый медный раствор, из которого при электролизе выделяют катодную медь, содержащую не менее 99,9% Си. L1X-64 функционирует обратимо относительно
ионов водорода, поэтому при экстракции кислотность среды возрастает. Вмещающей фазой (разбавителем) для L1X-64 служит керосин. Насыщенная медью органическая фаза легко отделяется от водного раствора и практически в нем не растворима.
Емкость экстрагента зависит от соотношения в смеси LIX-64: керосин»; оптимальную емкость экстрагента (2,4—2,5 г Cu/л) получают при содержании 7—10% L1X-64 в смеси.
С учетом емкости органической фазы по металлу выбирают число стадий экстракции, тип и производительность аппаратов, скорость поступления растворов.
На рис. 26 представлен графический расчет каскада экстракций при использовании LIX-64 для извлечения меди из раствора, содержащего 1,11 г/л Си, 2,78 г/л Fe3*. Согласно рис. 26 для насыщения органической фазы медью и достижения ее содержания в отработанной водной фазе (в рафинате) не более 0,03—0,05 г/л требуется 4 стадии контакта экстрагента с обрабатываемым раствором.
Показатели экстракции ухудшаются с повышением содержания кислоты в обрабатываемом растворе. Влияние исходного содержания
1 Пат. (США), № 3224873. 1963; № 3440036, 1969.
меди И кислоты (pH) на извлечение меди в органическую фазу 10% -иым раствором LIX-64 в керосине за 4 стадии контакта приведено ниже:
pH.............................................. 2,20 2,20 1,85
Содержание Си в исходном растворе, г/л ... 1,10 1,63 1,18
Извлечение Си экстрагентом, % ........ 97,5 97,5 94,1
Присутствие трехвалентного железа не влияет на показатели экстракции; отрицательное действие его проявляется только в процессе электролиза. Для предотвращения накопления Fe3 + при организации замкнутого цикла предложено вводить бифторид аммония для связывания железа в менее вредный фторидный комплекс.
В литературе [1851 описаны и другие марки экстрагента серии L1X: LIX-64N н LIX-70. Сообщается [184—186] о разработке эффективных экстрагентов с торговой маркой «Келекс-100» и «Келекс-120». Для этих экстрагентов характерны высокая емкость (до 6 г/л Си), увеличение функциональной активности с ростом кислотности (вплоть до рН=1), устойчивость и низкая растворимость в воде.
0Л1Г — другой высоко-селективный экстрагент на основе алкилфенолов и карбоновых кислот; емкость его при pH = 2,5 достигает до 4,5 г/л меди (при 10%-ном содержании экстрагента в органической фазе). Коэффициёнты распределения при- pH = 2,2 и 5%-ной концентрации экстрагента в органической фазе составляют 46 — для меди, 1 10“3 — цинка, 8-10'3 — железа; кобальт, никель, мышьяк, кальций, магний вообще не переходят в органическую фазу. ОМГ нерастворим в воде и имеет хорошие кинетические характеристики [1871.
Экстрагирующая способность реагентов на основе оксиоксимов, по данным работы [188—189]. возрастает при наличии в их составе ароматической группы и алифатического радикала. Ароматизированный разбавитель способствует снижению растворимости комплексов Меди в водной фазе.
На показатели экстракции влияют: солевой состав раствора, тип аниона соли металла, температура. Способность к экстракции возрастает в ряду Me С1п —Me (NO3)„—Me (SO4)n/2-
Подобная зависимость имеет место и для степени диссоциации указанных солей.
С увеличением концентрации в растворе инертных солей с одноименным анионом экстракция основного металла ухудшается. Это может быть объяснено или образованием сложных комплексов, например Me (SO-i)n + SO’” Me (SO4)n+i, хуже экстрагирующихся, чем простые ионы, или конкурирующим взаимодействием присутствующих солей’ с экстрагентом. Введение комплексообразующих реагентов, особенно при использовании карбоновых кислсл, позволяет улучшить селективность экстракции, так как удается увеличить интервал границ pH гидратообразования и оптимальной экстракции. Однако добавка комплексообразователей загрязняет рафинат и осложняет регенерацию. Поэтому целесообразно использовать комплексообразующие реагенты (лимонную кислоту, тиомо
Чевину, двухнатриёвую соль ЭДТА) в цикле реэкстракции. С повышением температуры растет коэффициент распределения извлекаемого металла в связи с увеличением степени гидролиза соли. Однако одновременно заметно возрастает растворимость органических кислот в воде, что повышает безвозвратные потери экстрагента. Поэтому на практике внимательно следят за постоянством температуры раствора, поступающего на экстракцию, и поддерживают ее в пределах 20—30° С.
Электролиз
Электролитический метод осаждения меди применяют для богатых растворов с ограниченным содержанием примесей при наличии дешевой электроэнергии.
Электролиз проводят с использованием нерастворимых анодов; на поверхности анода образуются вещества, нерастворимые в данном электролизе. Если аноды на основе свинца, то образуется двуокись свинца:
Pb- + SO;~ — 2е -* PbSO4.
PbSO4 + 2НоО — 2е -*• PbO2 + SOl" + 4H+ Pb + 2H2O — 4e-> PbO2 + 4H*.
(1.93)
Потенциал свинцового электрода с пленкой РЬО2 равен 1.75 В (в 2-н. H2SO4), а при поляризации током (100 а/м2) возрастает до 2,1 В. На аноде происходит выделение газообразного кислорода и образование серной кислоты в количествах, эквивалентных массе осаждаемой меди:
Н2О— 2е-* 2Н++ 0,5Ог, (1.94)
Си2' + 2е -» Си°. (1.95)
Энергетические показатели электроэкстракции меди во многом определяются кинетикой анодных процессов.
В кислых растворах величина активности гидроксильных ионов незначительна, поэтому выделение кислорода обусловлено процессом разложения воды. Заметное выделение кислорода имеет место при перенапряжении около 0,3—0,4 В. Перенапряжение кислорода зависит от природы электролита, а также анодного металла, оно возрастает при добавках поверхностно активных веществ. Влияние кислоты на него менее заметно, зато с увеличением температуры перенапряжение падает.
В связи с разложением сульфата меди, высоким омическим сопротивлением раствора и анода, дополнительной пассивации поверхности анода выделяемым кнсвородом электролиз происходит при повышенном напряжении на ванне (2—2,5 В) и связан с большим (по сравнению с электролизом с растворимым анодом) расходом электроэнергии — до 2500—3500 кВт • ч/т.
Наиболее нежелательные примеси — элементы с переменной валентностью, особенно железо из-за повышенного его содержания по
сравнению с другими примесями. Двухвалентное железо окисляется в аноде (потенциал реакции электроотрицательнее потенциала выделения кислорода на свинцовых анодах), а на катоде происходит обратный процесс [потенциал восстановления Fe3 * (0,77 В) электроположительное потенциала осаждения меди 1. Одновременно сульфат трехвалентиого железа вызывает химическое растворение уже осажденной меди, а также дополнительную коррозию оборудования. Указанные процессы резко снижают выход по току и увеличит вают расход электроэнергии. Поэтому содержание железа в исходных растворах стремятся поддерживать не более 1,5—2,5 г/л. При наличии в растворе более 0,5 г/л иона хлора образуется нерастворимая однохлористая медь, которая ухудшает качество катодного осадка, вызывает дополнительные потери меди.
В стандартных условиях потенциал разряда ОН- электроотрицательнее потенциала разряда ионов С1" , однако с учетом величин перенапряжения на аноде преимущественно выделяется хлор. Газообразный хлор попадает в атмосферу цеха, растворяется в электролите с образованием хлорноватистой и соляной кислоты, что приводит к разрушению свинцовых анодов.
Отрицательное влияние иоиов хлора устраняют предварительной очисткой раствора, использованием для изготовления анодов специальных свинцовых сплавов, легированных серебром (до 1%), сурьмой (4—8%) и кремнием. Образующаяся пленка хлорида серебра замедляет растворение свинца. Кроме того, возрастает механическая прочность анодов.
Иногда в электролите присутствуют нитрат-ионы, которые вызывают коррозию свинцовых анодов, способствуют окислению сульфата двухвалентного железа; при наличии в растворе солей молибдена нитрат-ионы восстанавливаются с образованием токсичной двуокиси азота.
Электроотрицательные примеси (никель, железо, цинк, кобальт) практически не восстанавливаются до металла, попадание их в катодную медь возможно в виде межкристаллических включений раствора при значительной концентрации примесей (например, в результате их накопления при замкнутой схеме). Последнее может оказаться одной из причин концентрационной поляризации.
Мышьяк, сурьма и висмут вследствие близости их потенциалов (для MelMe3 * соответственно 0,247, 0,212, 0,226 В) к потенциалу выделения меди способны осаждаться на катоде н ухудшать качество электролитной меди.
Повышение плотности тока интенсифицирует электролитическое выделение меди. Однако при этом заметно возрастают степень со-осаждения мышьяка, сурьмы и висмута, повышается расход электроэнергии (в результате концентрационной поляризации и увеличения перенапряжения кислорода на аноде).
При интенсивном режиме электролиза необходимо увеличить циркуляцию электролита1 и тщательно очищать его от примесей
1 Желательно в результате его принудительной подачи.
(использовать более богатые по меди растворы, поверхностно активные добавки, диафрагмы). Для снижения потерь электроэнергии очень важна совершенная конструкция и схема токоподвода. В работе [1901 для селективного выделения меди из концентрированных сернокислых медно-никелевых растворов предлагается использовать ионы металлов переменной валентности (хром, олово), которые служат восстановителями по отношению к ионам меди,.никеля. Регенерацию восстановительной способности осадителя (например, Сг3 * Сг2~ ) осуществляют при электролитической обработке раствора. Высокий выход по току (>90%) получают за счет перемешивания раствора и использования нейтральной атмосферы, невысокой плотности тока.
Автоклавное осаждение
Применение повышенной температуры и избыточного давления газов-восстановителей обеспечивает селективное выделение меди с весьма высокой скоростью. .Для осаждения пригодны газообразные
(водород, окись углерода,
Рис. 27. Растворимость водорода в воде при различной температуре и давлении газа Рр] » кПа (ат):
/ — 700 (7); 2—1400 (14); 5 — 2100 (21); 4 — 2800 (28); 5 — 3500 (35); 6 — 4200 (42)
,1й газ) или органические (глюкоза, формальдегид [191], древесные опилки1 [192—193]) восстановител и. Орган ичес кие восстановители пока не нашли практического применения из-за плохого качества получаемого порошка, дороговизны реагентов и загрязнения оборотных растворов примесями, вводимыми с осадителем.
Водород, имеющий наибольшую реакционную способность в широком интервале -pH медьсодержащих растворов, не загрязняет раствор примесями. Производство его (электролизом, конверсией природного газа) хорошо освоено промышленностью. Существенный эксплуатационный недостаток водорода— его повышенная взры-
вопожароопасность. .
Применение окиси углерода ограничено не только из-за взрывоопасности этого соединения, но н его токсичности, а также из-за
сложности крупнотоннажного производства.
Сернистый газ — достаточно эффективный и распространенный восстановитель. Однако использование-его в автоклавных процессах
1 Пат. (Германия), № 352783, 1922. Пат. (ЧССР), № 137920, 1970.
ограничено из-за низкого критического давления 375 кПа (3,75 ат) при 25° С. Недавно появилось сообщение1 о возможности осаждения меди сульфитами щелочных или щелочноземельных металлов при температуре 140—190° С; на каждый моль меди расходуется не менее двух молей осадителя.
В современной практике автоклавного осаждения меди наибольшее значение имеет водород. На рис. 27 приведена растворимость водорода в воде при различных температурах и давлениях [691.
Т ермодинамика
Осаждение меди из раствора газами-восстановителями описывается следующими схемами:
Cua* + H2^Cu + 2Н*. (1.96)
Cua + + СО + Н2От±Си + СО2 + 2Н*. (1.97)
Си2* + SO2 + 2Н2О^Си + SOa~ +4Н*. (1.98)
Расчетные данные для констант равновесия этих реакций приведены в табл. 15 [1941.
Таблица 15
Значения 1g К реакций восстановления меди в зависимости от температуры
Реакции Расчетные уравнении {g К прн температуре, °К
298 473
(1.96) Ig/C = 3,36^4-0,1 11,37
(1-97) 1g № 1.48™° 4- 1,77 6,73 4,90
(1.98) IgA - 9,36^-23,9 7,53 - 4,12
Термодинамические расчеты указывают на достаточную вероятность протекания рассматриваемых процессов, однако с увеличением температуры она снижается. Поскольку при восстановлении ионов меди регенерируются водородные ионы, термодинамически более предпочтительно использовать системы (например, аммиачные, этилендиаминовые и т. д.), обеспечивающие нейтрализацию образующейся кислоты. Сравнительные данные по термодинамике реакции осаждения меди, никеля, кобальта свидетельствуют о предпочтительной вероятности восстановления меди как из сернокислых, так и аммиачных растворов.
Пат. (США), № 3573896, 1971,
Термодинамика процесса выделения металлов из раствора в автоклавных условиях рассматривалась Н. Н. Бекетовым, В. В. Ипатьевым с сотрудниками и с позиции электрохимии обобщена в работах [4, с. 114—25; 6, с. 232—40; 82, с. 345—383; 195, с. 250—57].
Вероятность выделения металлов из раствора обусловлена более электроположительным нх потенциалом, чем потенциал водорода. Ниже рассматривается термодинамика осаждения меди водородом по уравнению (1.96).
Реакцию (1.96) представим в виде следующих двух электродных процессов:
0,5Н2 — е->-Н+,
Си2 + + 2е ->- Си, потенциалы которых обозначим соответственно Еи и ECus+. Потенциал водородного электрода (Ен,) зависит от концентрации ионов водорода и газообразного растворенного водорода н описывается уравнением
Еп,—EHj + р 1п?£'н+ 2F п^Рн,> (1.99)
где f — коэффициент фугативностн;
Рн,— парциальное давление водорода.
Ен,—^стандартный электродный потенциал водорода.
Подставив численные значения R, F, заменив —1g Сн+ на pH, учитывая, что Ен, = 0, преобразуем уравнение (1.95) для температуры 298° К: ’
Ен, = —0,0591 (pH + 0,5 1g f + 0,5 1g рн.) =
= —0,0591 pH — 0,0295 (1g f + 1g pH,)-
В интервале 100—10 000 кПа (1—100 ат) величина коэффициента фугатнвности весьма незначительна, поэтому фугативность водорода приравнивается к его парциальному давлению; тогда выражение (1.97) примет вид
Ен, = —0,0591 pH — 0,0295 1g рн,- (1.100)
Наиболее существенно па потенциал водорода влияет кислотность раствора: эффект от изменения величины pH на единицу эквивалентен изменению давления водорода в 100 раз.
Равновесный потенциал иона меди описывается уравнением ^=^ + 4г1п^с.,2+ о-101)
или после преобразований
ЕСц!+ = Е^!+ + 0,0295 1g у + 0,0295 1g CCi?+. (1.102)
При малой концентрации медн коэффициент активности ее ионов в растворе можно принять равным нулю и второй член в уравнении (1.102) исчезает, т. е.
Есг+ =£> + °>02951gccu^- (1.103)
Решая совместно уравнения (1.100) и (1.103), можно определить,
например, зависимость равновесной концентрации меди в растворе
от его pH при заданном давлении водорода
-lgCCu2+= pH--^.(1.104)
или оценить полноту осаждения меди водородом.
Согласно данным рис. 28 [4, с. 1211, осаждение меди может иметь место во всем интервале pH растворов, а вероятность осаждения металлов водородом возрастает с увеличением pH.
В этой связи использование аммиачных растворов для осаждения металлов водородом термодинамически более предпочтительно, поскольку они характеризуются более высоким значением pH, чем кислые растворы; потенциалы аммиачных комплексов металла отличаются от потенциалов простых ионов металла.
При добавлении аммиака в медный раствор последовательно образуются комплексы типа ICu (NH3)nI , где п изменяется от 1 до 4. Константу устойчивости (К) соответствующих комплексов определяют по уравнению
0 2 6 6 В W 12 pH
В,В
0,2
0.1
0
-0J
-ол
-oj
-ЦР
-0,5
—0,6
-V
-0,8
—0.S
кг3 нгг иг'
Не2', моль/л
Рис. 28. Изменение равновесных потенциалов водорода и некоторых металлов в зависимости от их концентрации н pH раствора:
/ — рц — 100 кПа (I вт); 2 — Рн = 1*0 МПа (100 ат)
У _ [Си (ХН3)П)?+ [CulNH^-JH-NHsl ’
(1.105)
где [Cu (NH3)n 12+ [Си (NH^-J2* — концентрация аммиачных комплексов, моль/л;
[NH3]—концентрация аммиака в раствор, моль/л.
Стандартный электродный потенциал (Е) пары Си— [Си (NH3)nl2 + определяется суммой стандартных электродных потенциалов меди и аммиачного комплекса меди. Величина его с учетом равновесной константы аммиачных комплексов (К) подсчитывается по соотношению
23060 пЕ = 2,303 RT 1g К. (1.106)
Потенциал аммиачного комплекса медн Е (без учета коэффициентов активности) рассчитывается по уравнению
6 С. С. Набойченко
81
Прн совместном рассмотрении уравнения (1.100) и (1.107) получают полезную информацию о равновесной концентрации меди, полноте ее осаждения при обработке водородом аммиачных растворов.
С увеличением концентрации аммиака повышается термодинамическая вероятность осаждения меди. Однако одновременно образуются более устойчивые аммиакаты (см. уравнение (1.105)1, потенциал которых сдвигается в более электроотрицательную область (см. (1.107)1.
Полезную информацию о термодинамике процесса осаждения меди дают диаграммы Е — pH (см. рис. 2), согласно которым все окислен-ны^ соединения меди термодинамически восстановимы водородом из кислых н щелочных растворов уже при температуре 25° С и р“Г,в = = 100 кПа (1 ат).
Кинетика
Кинетику автоклавного осаждения меди изучали В. В Ипатьев, О. Е. Звягинцев, В. Г. Тронев, С. М. Бондин, Ф А. Шауфельбергер, В. Н. Макив, Е. Петерс, Д. И. Эванс, С. И. Соболь, Г. Н. Доброхотов. Особое место занимают интересные работы Д. Халперна с сотрудниками по гомогенной активации водорода в растворах солей меди (196—2031. Основные выводы этих работ приведены ниже.
1 Процесс активации молекулярного водорода развивается гомогенно.
2. Лимитирующая стадия — бимолекулярная реакция с образованием активированного комплекса СиН+ с регенерацией Н + .
3. Экспериментальная энергия активации процесса составляет 101,6 ± 1,2 кДж/моль (24,3 ± 0,3 ккал/моль).
4 Недиссоциированные соединения меди отличаются большей каталитической активностью, чем ее ноны (активность Си2 + принята равной 1) такие как CuCl?-, CuClf, Си [EDA 1г+:
Соединения . . CuBu2 CuPr, СиАс2 CuSO4 СиС14~ СиС12 Cu(EDA]2+ Активность (относительные единицы) 150 150 120 6,5 2,5 <0,5 0,1
В приведенной последовательности снижается основность этих соединений, влияющая на полноту нейтрализации водородных ионов, которые образуются при осаждении.
5. Порядок реакции по концентрации меди изменяется по ходу процесса.
Осаждение меди в сернокислых растворах
В работе [2041 отмечали положительное влияние температуры, давления водорода и отрицательную роль серной кислоты на скорость осаждения меди. Прн 177—204“ С, рна6 — до 4,2 МПа (42 ат) медь выделялась с технологически приемлемой скоростью нз растворов, содержащих 10—12 г/л Си и 120 г/л H2SO4.
Данные работы [205] по влиянию основных параметров на осаждение меди нз перхлоратных и сульфатных растворов во многом ана-82
логичны выводам, полученным в работах Шауфельбергера. Мак Грегор и Халперн указывают, что скорость реакции пропорционально возрастает с увеличением содержания медн в растворе. Авторы предложили следующий, механизм процесса:
Cu2++ Hs^>CuH+ + H+, (1.108)
СиН+ + Си2 + *12Си + + Н+, (1.109)
2Си+->Си+Си2 + . ’ (1.110)
Скорость процесса контролируется стадиями (1Д08) и (1.109) н не зависит от количеств вводимого медного порошка.
На основании анализа начальных участков кинетических кривых при 160° Сбыли определены величина Klt равная 7,5-10~3 л/(моль-с), отношение :’Х2 = 1,3 и выведено кинетическое уравнение
dCu2+ K|CH,CCu»*
dt С 4- С
Сси2+ + -кГсн-
(1.111)
Позднее Е. Петерсом с сотрудниками [82, с. 204—226; 206] впервые для кислых растворов выявлена и объяснена роль одновалентной меди в процессе активации водорода.
Большую роль одновалентной меди в сульфатных растворах, чем в перхлоратных, авторы объясняют большей активностью сульфатного комплекса меди и образованием бисульфат-ионов, которые снижают концентрацию ионов водорода. Возможные процессы в этом случае описываются уравнениями:
CuSO4 Сн2+ 4- SO2'
Cu2+ 4- H2^CuH + 4- Н + CuSO4 4- Н2 CuH+ 4- HSOf Н+ 4- SO2' CuH+ 4-Cu2+-> 2Cu+ 4-H +
(I-H2)
CuH+ 4- CuSO4 2Cu+ 4- HSO?
Прн исследовании кинетики осаждения меди из сульфатных медно-никелевых растворов в работе [207 ] определены второй порядок реакции по концентрации меди и первый — по давлению водорода, а также отрицательное влияние затравки на скорость процесса.
Авторы работы [207 ] считают, что исследуемый процесс является гомогенным и лимитируется скоростью образования одновалентной меди.
Ихутверждение отрицает каталитическую способность одновалентного иона меди активировать водород. Полученный первый порядок процесса по водороду при используемых условиях эксперимента [/ = 170° С, рн, = 200—4000 кПа (2—40 ат) 1 указывает иа дефицит водорода, что и тормозило развитие процесса (1.108).
6'
83
Осаждение меди в аммиачных растворах. В числе первых кинетика'!] осаждения меди из аммиачных растворов была освещена в работах . Г. Н. Доброхотова и С. И. Соболя с сотрудниками [208—2101. При недостаточной концентрации аммиака и 160—180° С наблюдали" гидролиз аммнакатов двухвалентной меди, который удалось устранить увеличением содержания аммиака и введением сульфата аммония. Использование катализатора (платины) ускоряло реакцию образования одновалентной меди, но осаждающая медь «отравляет» ката-
лизатор. Введение затравки повышает концентрацию Си+ в растворе. Скорость реакции пропор-цнональна величине р'Д3® в степени * 0,5 и не зависит от начальной концентрации медн в растворе. ?
Прн осаждении медн наблюдается развитие двустадийяого процесса: ;*
образование аммнакатов одновалентной меди н последующее восстановление нх до металла.
Весьма обстоятельные исследования по осаждению меди из аммиачных растворов описаны в работе [100]. Установлено, что скорость процесса снижается с увеличением содержания аммиака, возрастает с увеличением температуры и no-
fl ш 20 зо to 50 верхности присутствующей метал-
Продолжительноапь.мин
лической меди. Авторы работы
Рис. 29. Кинетика соосаждеиия меди (/) и [100 1 ПОКЭЗЭЛИ ВОЗМОЖНОСТЬ ССТеК-
никеля (2) прн автоклавной обработке но дсродом аммиачных растворов (NHj : Си —
тнвного выделения меди из медно-никелевых растворов прн условии остаточного содержания меди не
выше 10—15 г/л (рнс. 29). Для опытов использовали растворы весьма сложного состава, поэтому вывести строгое кинетическое уравнение не удалось. Однако в этой работе были выявлены условия селективного разделения меди н никеля, а также положительная роль добавок солей полиакриловой кислоты.
Последующие исследования по кинетике осаждения меди из аммиачных растворов в первой и второй стадиях процесса отражены в работах С. И. Соболя с сотрудниками [210—211]. Отмечено, что скорость образования одновалентной меди в несколько раз выше, чем скорость превращения Cu+ ->-Сио и скорость первого процесса пропорционально возрастает с увеличением рн, в степени 0,5 н снижением концентрации свободного аммиака, сульфата аммония. С учетом кинетических закономерностей авторы рекомендуют оптимальный состав раствора для нескольких режимов автоклавного осаждения.
Сопоставляя кинетические данные осаждения меди из аммиачных н кислых растворов, можно заключить, что для кислых растворов процесс протекает с большей скоростью. Это связано с большей 84
прочностью соединений Cu+ в аммиачных растворах, что осложняет реакции диспропорционирования и’развитие активации водорода.
Осаждение меди окисью углерода. Принципиальная возможность использования окиси углерода для выделения меди из аммиачных растворов показана в работе [208). В последующих работах уделено внимание изучению кинетики этого процесса. По данным работы [1941, скорость осаждения меди пропорциональна давлению газа в степени 0,5, начальной концентрации меди, а энергия активации составляет 44,5 кДж/моль (11,8 ккал/моль).
В более поздней работе [2121 определены второй порядок реакции по концентрации меди, первый порядок — по давлению окиси углерода п уточнена энергия активации 140 кДж/моль (33,5 ккал/моль). Авторы отмечают образование комплексов Си—СО и существенную роль одновалентной меди в суммарной скорости реакции.
В работе [82, с. 183—203] для начальной стадии процесса определен первый порядок реакции по давлению окиси углерода, второй— по начальному содержанию меди. Установлено, что скорость реакции обратно пропорциональна концентрации ионов водорода. С увеличением концентрации нонов Си+ скорость реакции становится пропорциональной произведению концентраций 0^1+-0^+ и не зависит от давления прн рсо > 7 МПа (70 ат). Авторами получена величина ЕЛ — НО кДж/моль (26,31 ккал/моль), обнаружено влияние на скорость процесса степени и характера закомплексованности ионов Си2 +. Был предложен следующий механизм осаждения меди:
О
Си2+-|-СО-1-НгО
Си—С—ОН
Си—С—ОН
+ Си2+ 2Си+ 4 СО2 + Н-
2Си+ + 2СО 2Си (СО)+
(1.113)
Си(С0)+ + Н3О —
'Си—С—ОНТ )Н*
О
О
II
Си—С—ОН
+ Си2+ — Си+ + СиН- + СО2
СиН+ + Сиг+ —2Си+ + №
Противоречивые кинетические данные во многом обусловлены сложностью протекаемых процессов, особенно в концентрированных растворах в присутствии осажденной меди, н требуют дополнительных исследований.
Осаждение меди сернистым газом. По данным работы [213], скорость осаждения медн из сернокислых растворов сернистым газом прямо пропорциональна давлению сернистого газа, содержанию медн во второй степени, обратно пропорциональна концентрации водородных ионов во второй степени н не зависит от количества вводимой затравки. Энергия активации в интервале 120—180° С составляет 66 кДж/моль (15,8 ккал/моль). Обобщенное уравнение скорости процесса v следующее:
С2 +
V = 2 10-Spso, с,ц8+ е15800/*7; (1.114)
сн.
где pso, — парциальное давление, ат;
CC(J»+, Си+—концентрации соответственно ионов Си2+ п Н + в раствор, г-нон/л.
Процесс складывается из следующих основных стадий:
SOo + Н2О - H2SO3 HSO7 + Н+,
HSOi: + Cu2+ CuSO3 + н+,
CuSO3 -]- Cu2+ + H2O 2Cu+ + HSOF + H+, (I'1
2Cu+ 7±Cu° + Cu2 + .
При добавке ацетата натрия осаждается закись медн (pH раствора 4,5), сульфат натрия повышает полноту и скорость осаждения меди. Увеличение начальной концентрации серной кислоты с 1 до 2% снижает полноту осаждения меди на 2,5%.
Влияние технологических параметров на показатели автоклавного осаждения меди водородом: интенсивности перемешивания, давления водорода, температуры, состава раствора [148, с. 821—907; 214; 215—218]. Поскольку данный процесс протекает с участием газовой, жидкой и твердой фаз, гидродинамический режим должен обеспечивать условия эффективной массопередачи и в первую очередь хорошую аэрацию раствора.
С увеличением давления водорода возрастает его растворимость в жидкой фазе, что способствует ускорению процесса. В большинстве выполненных работ установлено, что в интервале 700—3500 кПа (7—35 ат) скорость осаждения меди пропорциональна рн!- Верхний . предел давления водорода ограничивается конструктивными соображениями при аппаратурном оформлении. При осаждении медн из аммиачных растворов применяют давление водорода 1500—2000 кПа (15—20 ат), а для сернокислых растворов рн, = 2400-^-2800 кПа (24—28 ат).
Повышение температуры наиболее существенно увеличивает скорость и полноту осаждения меди. Однако с повышением температуры возрастает общее давление в автоклаве (особенно при использовании аммиачных растворов), развиваются побочные процессы, ухудшаю-86
щие показатели операции (снижается растворимость солей, имеет место гидролиз в аммиачных средах и агломерация порошка), повышаются агрессивность среды (особенно при использовании сернокислых растворов) и эксплуатационные затраты. Осажденне меди ведут из аммиачных растворов при температуре 200—210° С, а из сернокислых растворов при 130—140° С.
Повышение начального содержания меди в растворе способствует увеличению скорости осаждения и производительности автоклава по порошку. Концентрация меди в растворе ограничивается предельной растворимостью ее соли, которая, помимо температуры, зависит от присутствия других солей.
Для аммиачных систем важной характеристикой раствора является величина отношений концентраций (выраженных в молях) меди к аммиаку. Обычно на практике перерабатывают растворы с величиной NH3 : Си = 2,2-j-2,4. При больших значениях этого отношения возрастает общее давление в автоклаве и несколько уменьшается скорость процесса, а при меньших — снижается устойчивость аммиачных комплексов в результате их гидролиза и повышается агрессивность конечных растворов.
В сернокислых растворах с увеличением исходного содержания свободной кислоты скорость и полнота осаждения меди снижаются. Предельная её концентрация зависит от начальной концентрации меди (при осаждении регенерируется .эквимолярное количество кислоты), буферных добавок, температуры процесса и поддерживается на таком уровне, чтобы кислотность конечного раствора не превышала 120—130 г/л (t = 130—140° С; C(nh.)1so4 = 100—200 г/л).
В процессе обработки аммиачных растворов возможно соосажде-ние никеля и кобальта, а также цинка. Первые два элемента осаждаются в виде металла, а цннк попадает в медный порошок в виде основного карбоната или гидроокиси вследствие гидролиза аммиакатов прн недостаточной концентрации аммиака или высокой температуре. Селективность выделения меди зависит от полноты ее осаждения, концентрации примесей и свободного аммиака. Наиболее вероятно загрязнение порошка никелем в связи с большим его содержанием в растворе и предпочтительной восстановимостью его до металла по сравнению с кобальтом.
Никель начинает соосаждаться при содержании меди менее 10— 15 г/л (рис. 29). С увеличением концентрации аммиака в растворе соосаждеиие никеля уменьшается (1001.
Концентрация NHa в растворе, г/л . . 138 205 235
» Ni в медном порошке, % . . 3,0 0,7 0,4
При варианте выделения меди с несколькими «уплотнительными» 1 циклами значительная часть соосажденного никеля переходит вновь в раствор при разогреве свежезалитого медного раствора (рис. 30) и перемешиваиин согласно реакции:
Ni + (Си (NHS)X I SO4 -> [Ni (NH8)J S04 + Си. (1.116)
1 Уплотнительные циклы — серия последовательных операций осаждения металла с целью повышения крупности частиц порошка.
Скорость процесса цементации зависит от удельной поверхности порошка, температуры, интенсивности перемешивания. При содержании в растворе 2,8 г/л никеля даже после шести уплотнительных циклов получен чистый медный порошок.
Цинк при концентрации в растворе до 50 г/л не снижает скорость осаждения меди и не загрязняет порошок. При попадании окислен-
Рис. 30. Характер изменения содержания никеля в медном порошке, полученном после 3 (/) и 6 (2) уплотнительных циклов, в процессе разогрева оче редкой загрузки автоклава: ---содержание N»
в порошке; —------изменение температуры
ных соединений цинка в по-рошок последний промывают подкисленным раствором.
Прн осаждении медн нз сернокислых растворов никель, иипк железо, кобальт не соосаждаются; присутствие нх в порошке обусловлено механическим захватом раствора и недостаточной отмывкой.
Особую роль при автоклавном осаждении меди играет карбонат или сульфат аммония. Введение их в аммиачные растворы повышает устойчивость комплексов медн особенно прн высокой температуре осаждения и заметно увеличивает скорость процесса. По данным работы [2091, последняя возрастает почти в 4 раза при увеличении концентрации сульфата аммония с 0 до 450 г/л. Учитывая некоторое
снижение растворимости водорода в концентрированных растворах, а также затруднения прн отмывке порошка от сульфатной серы, содержание сульфата аммония в реальных условиях не должно превышать 300—350 г/л.
Еще большее влияние оказывает сульфат аммония при осаждении меди из сернокислых растворов, добавки его («с200—250 г/л) позво-
ляют получать приемлемые технологические показатели и при пониженной температуре (120—130° С). В работе 1205] отмечалось, что также действует и сульфат натрия. Позднее сотрудники института «Унипромедь» и УПИ нм. С. М. Кирова установили, что прн эквимолярном расходе эффективность сульфатов одновалентных катионов (калия, аммония, натрия) больше, чем у сульфатов двухвалентных металлов (никеля, цинка, железа, марганца). Из-за различной степени диссоциации эти сульфаты характеризуются разной способностью образовывать биосульфаты, т. е. по-разному влияют на концентрацию свободных ионов водорода (отрицательная роль последних в суммарном механизме процесса отмечалась выше).
В растворы, направляемые на осаждение меди, вводят поверхностно активные вещества (ПАВ), чаще всего на основе акриловой кислоты \ Они способствуют ускорению процесса, снижают отложение порошка на внутренних поверхностях автоклава и сцепление (агломерацию) частиц. Механизм действия ПАВ пока пе ясен Предполагают [148, с. 831—807; 2171, что онн экранируют образующиеся частицы меди н препятствуют нх дальнейшему росту, а также взаимному сцеплению. Это обеспечивает получение дисперсного порошка с повышенной каталитической активностью. ПАВ — одна из причин загрязнения порошка углеродом, образующимся прн разложении органических веществ Углерод, а также не отмытую серу, достаточно полно удаляют при последующей обработке частично окисленного (2—3% О2) порошка в токе водорода и температуре 300— 700° С.
Прн автоклавном осаждении меди можно эффективно вести процесс без использования затравки или вводимого катализатора (в отличие от осаждения никеля или кобальта) Однако в работе [148, с. 831—9071 отмечается, что затравка ускоряет осаждение меди.
На практике большое внимание уделяют получению порошка с определенными технологическими свойствами, из которых наибольшее значение имеют гранулометрический состав, насыпная масса, текучесть, а также форма частиц.
Статистическая обработка результатов исследований, проведенных в институте «Унипромедь», показала, что все параметры, способствующие увеличению скорости процесса, приводят к получению более дисперсного- порошка с равноосной формой частиц. Учитывая
Таблица 16
Влияние числа уплотнительных циклов на показатели осаждения меди и свойства порошка
р = 150° С, рН1 = 2800 кПа (28 ат), 0,4 г/л ПАВ, 100 г/л (NH4)2SO4J
Показатели Количество циклов
1 2 4 6
Средняя скорость процесса, г,'(л-мии) 1,53 1,525 1,52 1,56
Полнота осаждения меди, % 88,6 87,1 87,5 88,9
Средний размер частиц . 73,3 89,4 114 122
Насыпная масса, г/смэ 1,34 1,56 1,98 2,16
Текучесть, г/с 1,81 2,08 2,50 2,94
Удельная поверхность, см2/г 800 773 Н. о.* 424
•Примечание. Н. о. — Не определяли.
1 В работе ]2191» а также в патенте Японии Кв 5650, 1964 рекомендуют, использовать для этой цели моно- и полисахарозу.
ограниченные возможности варьирования температурой, давлением водорода, интенсивностью перемешивания, концентрациями медн, кислоты, буферных добавок, наиболее реально регулировать свойства порошка непосредственно в процессе осаждения типам и расходом поверхностно активных добавок или числом уплотнительных циклов (табл. 16) [2201. Частицы порошка после осаждения имеют достаточно развитую поверхность. Дальнейшее изменение технологических свойств достигается при последующих операциях, особенно в процессе обжига в токе водорода и размола спека порошка (при >500—600° С).
Осаждение в виде химических соединений
Этот способ выделения меди используют для селективной очистки растворов или получения обогащенных полупродуктов. Процесс основан на различной растворимости соединений меди или разном их выделении по сравнению с показателями для сопутствующих металлов. Наибольшее распространение получили способы осаждения меди в виде гидратов, карбонатов, основных и двойных солей, сульфидов, тиоцианатов, купороса. Особое значение имеет получение хорошо
Таблица 17
Характеристики основных трудкорастворимых соединений некоторых металлов
Металлы П роиэ ведение растворимости pH образования при активности Ме2+ *•
Me СО, Me (ОН)» MeS MeS Me (ОН),
Медь 2,36-IO-10 5,6-1020 8-Ю-3’ —1,5 4,5
Олово - 5.7-10-“ 1 • 10”20 —0,3 1,4
Кадмий — 1,2-10’14 1 -10-28 1,8 7,0
Свинец 3,3-10-11 6,8-10"13 7 10*28 2,2 —
Цинк 6,1-10"11 4,5-10 12 1.6 -10 23 2,5 5,9
Кобальт — 2,7-10"1в 5-Ю"22 2,5 6,4
Никель 1,3-10-’ 1,0 10*14 з-ю-21 3,7 7,1
Железо 2,5 -10-“ 1,7-10-“ 4-10-“ 4,0 6,7
фильтруемых осадков и минимальное соосаждение примесей. Некоторые данные, характеризующие растворимость карбонатов, гидроокисей, сульфидов меди и основных сопутствующих металлов приведены в табл. 17.
Осаждение гидратов, карбонатов, основных солей
Вероятность и последовательность осаждения гидроокисей оценивается по величине pH гидратообразования, которая определяется по зависимости [221, с. 5431
pH = A 1g Пр-1g (1-117)
где Пр — произведение растворимости;
Kw— ионное произведение воды, амеп*' — активность- ионов металлов.
Согласно этому уравнению величина pH гидратообразоваиия должна возрастать с уменьшением активности (концентрации) иона металла и зависеть от температуры, поскольку входящие в уравнение характеристики изменяются с температурой.
Данные табл. 17 свидетельствуют о малой растворимости гидроокиси меди, одиако селективное ее выделение невозможно из-за большого значения pH гидратообразоваиия и близости его к величинам pH гидратообразоваиия основных сопутствующих элементов (цинка, никеля, железа). Проще решается обратная задача — селективная очистка медных растворов от железа, алюминия, кобальта при условии их предварительного окисления. Вероятность выделения чистых гидроокисей снижается с увеличением концентрации металлов. В последнем случае образуются основные соли типа MeSO4-Ale (ОН)2. Эти соли осаждаются при более низких значениях pH, чем гидроокиси металлов: так, CuSO4-Cu (ОН)2 образуется при pH = 3,1, ZnSO4 X X Zn (ОН)2— при pH = 3,8, 3NiSO4-4Ni (ОН)2— при pH = 5,2, Fe2 (SO4)3- Fe (ОН)3 — при pH < 0.
Аналогичные явления имеют место при обработке растворов карбонатсодержащими соединениями: как правило, вместо карбонатов образуются основные карбонаты металлов типа Me (ОН)2-Л1е СО3
Процессы осаждения металлов, основанные на их гидролизе, характеризуются образованием объемных с развитой поверхностью осадков, что не только затрудняет их отделение и промывку, но и вызывает захват ионов других металлов за счет сорбционных явлений. Указанные процессы частично исключаются при повышенной температуре вследствие формирования более кристаллической структуры осадка.
Для нейтрализации и последующего осаждения меди или сопутствующих примесей используют соду, известняк, мел, гашеную известь и реже каустическую щелочь. При использовании последней образуются коллоидные, особенно труднофильтруемые осадки. Кроме того, часть меди остается в растворе из-за образования растворимых купратов.
Осадитель выбирают с учетом его стоимости и «фактора основности» (количества реагента, необходимого для нейтрализации единицы кислоты).
При использовании карбонатов происходит «вскипание» раствора за счет выделения углекислого газа, что вызывает флотацию дисперсных частиц осадка и осложняет разделение составляющих пульпы. Наиболее доступным и достаточно надежным нейтрализатором служит гашеная известь. Однако ее применение связано с внесением в раствор сопутствующих примесей (магния, натрия), загрязняющих раствор. . ...
Кроме того, значительно возрастают выход осадка, а также «загипсование» магистралей.
В институте «Гипроникель» разработан1 интересный вариант осаждения меди из сульфатных растворов в виде основной соли прн 150—160° С и ро3,6 = 250 кПа (2,5 ат) добавкой порошка медн или ее соединений. Способ позволяет исключить загрязнение растворов и улучшить фильтруемость осадка.
Осаждение сульфидов
На основании термодинамики реакции образования сульфида Ме2 + + S‘~ MeS и его гидролиза в водном растворе Л1е2+-|-+ S2- + 2Н2О Me (ОН) о + H2S было выведено [221, с. 5561 следующее выражение для величины pH начала образования сульфидов:
pH = 0,25 Jig(ПрМе(ОН)^ -]- ПрА(й 1g ^л1ег+ + j,
(1.И8)
где Kh,s—константа диссоциации сероводорода.
Растворимость сульфидов с повышением температуры возрастает. Расчетные величины произведений растворимости основных сульфидов при различной температуре приведены на рис. 31 (К. С. Симонс [82, с. 592—6151).
Согласно данным табл. 17 сульфид меди осаждается даже из весьма кислых растворов и отличается весьма низкой растворимостью.
Для оценки равновесных активностей (концентраций) при осаждении сульфидов металлов, двух металлов Me' и Me используют следующее выражение:
аМгг* _ Y1C1 _ Г (ОН),ПРЛк-5~|0,5 (1119)
аМе2* [ПРл<г‘(OH),nPA<f”sJ
Крайне низкая растворимость сульфидов медн по сравнению с сульфидами других металлов определяет большую эффективность полного и селективного отделения меди прн осаждении ее в виде сульфидов. Сульфиды меди осаждаются при обработке растворов сероводородом, элементарной серой и ее соединениями с промежуточной валентностью (—2 + 4) или сульфидами более электроотрицательных металлов (по обменным реакциям).
Наибольшее промышленное значение имеет сероводород. Его получают при контакте водорода с расплавленной серой при температуре 440—455° С К несомненным достоинствам сероводорода относится его высокая осаждающая способность, особенно в аммиачных растворах, при этом в обрабатываемый раствор не вносятся посторонние примеси. Сероводород хорошо растворяется в воде, растворимость его несколько снижается при наличии солей (рис. 32) [82, с. 592— 6151.
1 Авт. свид. № 248223. — «Открытия, изобретения, промышленные образцы», 1969, № 23, с. 73.
Крупность получаемого осадка зависит от температуры, давления сероводорода, обеспечивающих требуемую скорость процесса, или частичной рециркуляции сульфидного осадка (роль затравки).
До последнего времени применение сероводорода было ограничено из-за его дороговизны, токсичности (ПДК = 10 мг/м3), взрыво-по-жароопасиости. Однако по этим свойствам сероводород уступает
хлору, аммиаку, которые широко используются в гидрометаллургии.
Промышленное крупнотоннажное использование сероводорода фирмой Шеррптт Гордон (Канада) (2221 и на заводе в Моа Бей (Куба) [82, с. 592—615] свидетельствует о высокой технологической эффективности и безопасности процесса при соблюдении правил эксплуатации и обслуживания оборудования.
Химизм осаждения меди из аммиачных и сернокислых растворов с помощью серы в присутствии сернистого газа или сульфита аммония был описан в работах (223—224 ]. Эффективность процесса возрастает по мере увеличения температуры: так, при t > 163° С элементарной серой медь осаждается до остаточного содержания 0,02 г/л. С увеличением концентрации свободного аммиака и серной кислоты осаждение медн ухудшается. В кислых растворах медь осаждается в виде Cu2S, а в аммиачных растворах — в виде Cu2S и CuS.
В работе [223] указывается на большую роль продуктов гидролиза
сульфида медн. Ниже приведены предполагаемые процессы, протекающие в кислых:
Рис. 31. Зависимость произведения растворимости некоторых сульфидов от температур ьк
1 — FeS; 2 — NIS: 3 — CoS; 4 — ZnS; S — CdS; 6 — PbS; 7 — CuS
серы в механизме осаждения
SO2 + Н2О sol- + 2Н+;
(1.120)
480з- + S2O^ + 6Н+ 2S20e~ + ЗН2О; (1.121)
2Cu+ + SsOi- + 2Н_>0 Cu2S + 2SO?- + 4H+ (1.122)
и аммиачных средах SO1~ + SS2O3-; (1.123)
2820з+ + 8Cu2+ + 4Н2О S3O^ + 8Cu+ + SO2- + 8Н+;
Cu2+ + SaOl- + 2Н2О CuS + 2SO1~ + 4Н+; (1.124)
Cu2+ + S2O1~ + Н2О CuS + SO4~ + 2H+. (1.12^)
При повышенной температуре элементарная сера взаимодействует с водой с образованием сероводорода — эффективного осадителя меди:
4S + 4Н2О 3HsS + H2SO4.. (I.I26)
Добавка элементарной серы из расчета 1,0—1,5 ч. S на 1 ч Си в присутствии сернистого газа нли сульфитов позволяет быстро и полно осаждать медь в интервале pH - 1 -4-9 и t = 38-4-160° С. В работе 1224] показано большое влияние гидродинамического режима па кинетику процесса.
Рис. 32. Зависимость растворимости сероводорода в воде (о) и сульфатных растворах (б) от его давления:
--------С--2_ = 0,35 моль/л;------------------34%; I - 51’ С; 2 - 71’С; bU4------------------------------------------( nV2SU4
3 — 104’ С; 4 — 138’ С: 5 — 171’ С; 6 - 65’ С; 7 — 104’ С; 8 — 121" С; S — 49° С
Сульфиды более растворимые, чем сульфид медн, способны выделять медь из раствора по реакции
CuSO4 + MeS CuS 4- MeSO4. (1.127)
Наибольшей осадительной способностью отличаются сульфиды щелочных или щелочноземельных металлов, однако прн этом образуются коллоидные гидратированные осадки, весьма плохо фильтрующиеся. Скорость и полнота реакций возрастает с увеличением температуры. В работах [225 ] * сообщается о возможности осаждения сульфида меди халькопиритом прн 160° С по реакции
Си FeS 2 + CuSO4 -> 2CuS + FeSO4,
при этом скорость процесса зависит от крупности частиц осадителя, температуры и продолжительности обработки.
1 Пат. (Англия), № 687523, 1953.
Другие способы выделения меди
Солевая ректификация (высаливание), основанная на снижении растворимости извлекаемой соли при введении в раствор другой соли или соединения [2261 — одно из интересных направлений селективного выделения солей металлов. В качестве высаливателей используют чаше всего соли с одноименным анионом, более растворимые, чем извлекаемая соль. В первом приближении высаливающий эффект ионов оценивается по величине энергии их гидратации. По уменьшению высаливающей способности двухвалентные ионы образуют следующий ряд:
Си г=к Ni > Со > Zn > Fe.
Сульфаты цинка и никеля способны высаливать медь только при очень больших их концентрациях [2271.
Эффективный высаливающий реагент — сульфат аммония выделяет медь в виде CuSO4 (NH4)2SO4-6H2O [2281. Однако и в этом случае высаливание меди происходит менее полно, чем, например, никеля. Поэтому сульфат аммония используют для очистки медно-иикелевых растворов от никеля [229—2301 *.
До настоящего времени многие теоретические закономерности процесса высаливания остаются не ясными. Однако возможность получения достаточно чистого продукта, устойчивые показатели процесса, невысокие энергетические затраты и простое аппаратурное оформление обусловливают повышенное внимание к этому варианту осаждения.
Выпаривание медных растворов с получением кондиционного купороса, несмотря на простоту способа и аппаратурного оформления, имеет очень ограниченное применение в гидрометаллургии меди Эго объясняется высокой энергоемкостью процесса, трудностью получения высококачественного купороса из бедных технологических растворов, наличием других, более эффективных приемов выделения меди (электролизом, автоклавным осаждением). Несколько большее значение имеет фракционная кристаллизация меди для отделения основного ёе количества от сопутствующих металлов (никеля, цинка), а также полная выпарка для выведения накапливающихся примесей и регулирования водного баланса в замкнутой технологической схеме.
Подробную информацию по физико-химическим явлениям и аппаратурному оформлению кристаллизации в том числе и медного купороса можно получить в монографии Л. Н. Матусевича [2311.
Выпариванием (дистилляцией) аммиачных растворов меди при 90—130°С разрушают аммиачные комплексы с образованием весьма чистой гидратированной окиси или основного карбоната меди (при переработке аммиачно-карбонатных растворов) и одновременно практически полностью регенерируют аммиак. Однако при такой обработке комплексных растворов селективное и полное осаждение меди практически невозможно, поскольку прочность аммиачного ком-
1 Пат. (Польша), № 46592, 1963.
плекса меди j-+ = 12,67) больше прочности аммиачных комплексов ' сопутствующих элементов: Р^со (NH j2+ = ’
P^№(nh3)2+ = 8-73; PKZn(NH3)2+ = 9,46 [9, т. 3, с. ’124-125). Можно отделить медь только от аммиакатов трехвалентного кобальта (₽Лсо (nh3)3+ = 32,51 j.
На способности ионов тяжелых цветных металлов образовывать
ряд трудиорастворимых соединений основан метод ионной флотации [82, с. 656—677; 232—233 J. Этот способ представляет особый интерес для извлечения металлов из бедных растворов (0,1—5,0 г/л Си). Он позволяет, с помощью изменения кислотности среды типа осади-
теля и поверхностно активного коллектора селективно разделять металлы. В качестве ПАВ используют мыла — соли жирных кислот, содержащие в углеводородной цепи больше восьми атомов углерода (амины и их производные, алкилсульфаты, алкиларилсульфонаты, алкилсульфонаты и др.). При использовании натриевых мыл карбоновых кислот С,—Св и С10—С1в (молекулярная масса соответственно 153 и 207) при теоретическом их расходе извлекалось до 97—99% Си. Наблюдали, что с увеличением содержания медн в растворе значение рптимального pH изменялось следующим образом [232]:
Содержание Си в растворе . 0,5 1,0 4,5
pH 6.0 5.5 2,0
В работе [233] описано извлечение в пенный продукт до 86— 100% меди из раствора, содержащего 10 мг/л Си с помощью доценил-бензолсульфоната натрия (~100 мг/л) или алкиларилсульфоната натрия (125 мг/л). Эти показатели достигнуты при 18—20° С, расходе воздуха 1,2 л/мнн, pH = 3,0-г-5,5 за 60—80 мин.
Более просто осаждать одновалентную медь в виде труднорастворимых соединений (хлоридов, роданидов и др.), что используется в некоторых технологических схемах для очистки растворов или селективного выделения меди из бедных растворов.
Из рассмотренных химических способов наиболее селективно медь выделяется в виде сульфидов, а из ’бедных растворов методом ионной флотации.
Глава //
ИЗВЛЕЧЕНИЕ МЕДИ ИЗ НИЗКОСОРТНОГО И ЗАБАЛАНСОВОГО СЫРЬЯ
ВЫЩЕЛАЧИВАНИЕ
Исходное сырье — вскрышная порода (складируемая в отвалы при разработке карьеров) и руды забалансовые (труднообогатимые, небольших или труднодоступных месторождений, в заброшенных рудниках и потерянных целиках). В зависимости от места нахождения
сырья различают наземное выщелачивание (в отвалах, кучах) и подземное, или выщелачивание «на месте».
Подземному выщелачиванию подвергают потерянные руды в старых забоях или месторождениях, разработка которых нерентабельна или невозможна по горнотехническим и гидрогеологическим соображениям.
При наземном выщелачивании перерабатывают отвалы старых и новых карьеров, месторождение, для которых организация стандартного цикла (флотационное обогащение— медеплавильное'производство) нерентабельна из-за небольшого запаса руды или невозможности эффективного обогащения.
При определении целесообразности выщелачивания необходимо учитывать: объем сырья и содержание в нем меди; минералогический состав и характеристику вмещающих пород (влаго-кислотоемкость, механическую прочность, способность к выветриванию и декрепта-ции и др.); возможности обеспечения водой и рационального сбора растворов; место нахождения объекта для выщелачивания и рациональный вариант извлечения меди.
Выщелачивание руды в отвалах и кучах
Выщелачивание отвалов и кучное выщелачивание имеют не только много общего в организации процесса, но и ряд принципиальных различий, основные из которых систематизированы ниже:
Объем руды, тыс. т . . . Содержание Си в сырье, %
В отвалах
5-Ю3—5-10«
о, i-о.з
В кучах 100—600 0,3—2,0
Крупность породы, выводимой в отвал, не регулируется, при кучном выщелачивании руду предварительно дробят. Количество отрабатываемого материала в отвалах гораздо больше, чем руды в кучах.
Извлечение меди из старых отвалов за счет естественных условий (атмосферных осадков, выветривания) практикуется с доисторических времен. В начале текущего столетия на ряде американских предприятий были начаты работы по организации специального орошения, сбора растворов и цементации из них меди. В связи с длительной эксплуатацией карьеров, увеличением объема вскрышных работ (на отдельных предприятиях в сутки вывозятся несколько сот тысяч тонн породы) в отвалах накопилось значительное количество меди. Например, в США только в 1966 г. в отвалы вывезено 0,34 млрд, т медь содержащей породы дополнительно к ранее накопившимся 4,5—9,1 млрд, т [2341. Поэтому металлурги были вынуждены более внимательно отнестись к этому сырьевому источнику. Был проведен ряд инженерно-организационных мероприятий: негабариты стали дробить, организовали вывоз и складирование материала, рациональное орошение, усовершенствовали извлечение меди из растворов, ввели тщательный и оперативный технологический контроль процесса.
7 С. С. Набойчеико 97
До последнего времени место Для сооружения отвала выбирали в основном с учетом удобства транспорта и хранения вскрышных пород, что осложняло их дальнейшую гидрометаллургическую обработку. В настоящее время отвалы транспортируют или на площадку из пород с высокой механической прочностью и водонепроницаемостью (скальные породы типа базальта), или на специально подготовленные площадки. Так, на установке Бютт (США) основание отвала подготовили следующим образом: удалили растительный слой бульдозером; спланировали и утрамбовали поверхность; засыпали 100-мм слоем шлака (крупностью 12—25 мм) и уплотнили его; па шлак уложили 86-мм слой асфальта и покрыли его слоем мелкой породы толщиной 300 мм, сверху насыпали крупной породы слоем 1520—1830 мм.
Рис. 33. Типичные формы сечей и Й отвалов руды
Типичные формы сечений отвалов показаны на рис. 33. Отвалы складируют таким образом, чтобы обеспечить одну или две точки для сбора .раствора, при рациональном использовании рельефа местности.
Еще более тщательно готовят площадку и основание куч: необходимы не только прочная опора и эффективный дренаж раствора, но и доступ воздуха в слой руды.
После удаления растительного покрова укладывают водонепроницаемый слон, используя доступные местные материалы (например, асфальт, бетой, смесь гудрона и хвостов обогащения). При сооружении кучи в Рио-Тннто (Испания) на подготовленную площадку укладывали в линию прочные куски породы и валуны размером 250— 300 м.м, сверху их покрывали кусками руды плоской формы, создавая таким образом вентиляционные и дренажные каналы. На руднике Зонтеллн (США) на выравненную площадку насыпали песок слоем 254 мм и для гидроизоляции использовали 10-мм полиэтилен, сверху которого насыпали еще слой песка толщиной 305 мм, на который укладывали параллельными рядами через 4,6 м (по ширине основания) асбоцементные трубы с перфорированной поверхностью (диаметр отверстий 12,7 мм) для сбора раствора. Трубы сверху защищали деревянными настилами.
На руднике Тайроун (США), где в 1972—1973 гг. предполагали начать выщелачивание окисленных и смешанных руд, площадку утрамбовали, покрыли водонепроницаемой глиной слоем в 0,6 м, а сверху уложили специальные плиты [2351.
Крупность руды в отвалах весьма неоднородна: от нескольких миллиметров до 1—1,5 м. В процессе складирования отвала проис-
ходит естественная сегрегация руды; более крупные куски сосредоточиваются у основания, а мелкие фракции — на верхних отметках.
При сооружении кучи руду предварительно дробят до крупности 10—30 мм. Крупность засыпаемой руды по мере продвижения к верхним участкам снижают, что обеспечивает равномерность дренажа раствора, доступа воздуха, распределения весовой нагрузки.
Кучи и отвалы оборудуют подъездными путями для транспорта, обслуживающей техники. Предусматривают ливневые каналы для защиты от затопления в дождливый сезон. Иногда с целью снижения пыления боковые поверхности отвалов укрепляют травяным покровом.
Форма куч и отвалов тождественна усеченной четырехгранной пирамиде или конусу, угол наклона определяется углом естественного откоса породы. Высота (особенно у старых отвалов) колеблется в широких пределах —#от нескольких десятков до нескольких сотен метров. При сооружении новых отвалов и куч высоту их выбирают с учетом удобств подачи раствора, выполнения строительно-монтажных работ, физико-механических свойств породы, обеспечения оптимальной продолжительности контакта раствора с породой и условий для доступа воздуха. В среднем высота куч составляет 10—30 м.
В процессе эксплуатации рудные отвалы и кучи склонны к оседанию, что объясняется уплотнением материала за счет увеличения веса при подаче раствора, выноса мелких фракций, выветривания, разрушения и измельчения породы. Оседание крайне нежелательно, поскольку' ухудшаются условия перколяции раствора.
Показатели выщелачивания существенно зависят от условий контакта растворителя с медными минералами, что во многом определяется способом и режимом орошения, скоростью и равномерностью перколяции раствора.
Способ подачи раствора выбирают с учетом размеров поверхности орошения, минералогической и гранулометрической характеристики породы, высоты кучи (отвала), климатических условий. В современной практике используют орошение с помощью разбрызгивателей, прудков и дренажных вертикальных труб.
При разбрызгивании обеспечивается наиболее равномерное орошение и создаются условия для лучшего насыщения раствора кислородом воздуха. Разбрызгивающие устройства должны обеспечивать перекрытие орошаемых участков (рис. 34). Разбрызгивание раствора осуществляется или через специальные приспособления, расположенные через 15—18 м, или через перфорированные трубы (диаметр отверстий 51—102 мм). Поверхность, орошаемая одним разбрызгивателем, зависит от расхода воды и напора в подводящей магистрали и составляет 4,8—5,6 м2. При орошении разбрызгиванием имеют место большие потери раствора за счет испарения, поэтому этот способ не применим в районах с жарким климатом или ограниченными водными ресурсами. При отложении солей в дренчерах и подводящих магистралях эффективность разбрызгивания существенно ухудшается, поэтому необходимо тщательное обслуживание системы орошения.
7* 99
Рис. 34. Схема орошения поверхности рудного отвала (кучи) разбрызгиванием:
1 — центральный трубопровод; 2 — отводные трубы; 3 — разбрызгиватель; 4 — зона орошения одним разбрызгивателем
Орошение разбрызгиванием часто используют в сочетании с другими способами, особенно прн подаче растворов на боковые поверхности куч (отвалов)
При орошении с помощью прудков поверхность кучи (отвала) подготавливают канавокопателем или бульдозером с целью получения углублений, разделенных перемычками. В углубления подают раствор через центральный и отводные трубопроводы. Часто последние делают переносными, что упрощает арматурную обвязку и позволяет более гибко организовать режим орошения. Форму прудков выбирают с учетом геометрии орошаемой поверхности, типичные размеры прудков 32x32 м (квадратных) или 6,1x122 м (прямоугольных), глубина прудков 30—60 см. Со временем на дне прудков накапливаются отложения гидратов железа, алюминия, что ухудшает условия перколяции раствора и требует периодической их чистки.
На установке Бютт используют орошение с помощью глубинных скважин. На поверхности отвала по квадратной сетке через 30,5 м бурят скважины диаметром 152 мм на глубину около 2/э высоты отвала. В скважины вставляют пластмассовые трубы диаметром 102 мм.
В них просверлены отверстия диаметром 12,7 мм с интервалом 305 мм по длине трубы. Раствор подают в трубы (со скоростью 11,3 м8/мин) под давлением, создаваемым питающими насосами. Такой способ орошения улучшил равномерность распределения раствора, насыщение его кислородом и обеспечил скорость перколяции 127 л/(м8-сут). На руднике Хелена (США) раствор для орошения отвала сульфидной руды также подают внутрь отвала через скважины, а затем их продувают сжатым воздухом. Считают, что это позволит заметно интенсифицировать выщелачивание [2361. Скорость перколяции раствора на старых кучах не превышает 1,25 м8/(м*-сут), а на новых достигает 10 м8/(м2-сут). Продолжительность орошения занимает от нескольких дней до нескольких недель при последовательном отключении участков.
Замечено, что при циклическом ведении операций орошения и дренажа раствора улучшаются условия вскрытия крупных кусков руд и культивации бактерий.
Растворы по трубопроводам перекачивают насосами. Одновременно стараются рационально использовать'рельеф местности для использования естественного гидростатического напора.
Основные контролируемые параметры при выщелачивании — кислотность раствора и содержание в нем меди, а также объем получаемого раствора. Содержание кислоты в растворе для орошения должно быть достаточным для эффективного растворения медных минералов при минимальном вскрытии пустой породы. Одновременно должны быть обеспечены условия для подавления гидролиза солей железа и алюминия, а также учтены условия жизнедеятельности бактерий (при организации бактериального выщелачивания). При повышенном содержании кислоты в конечных растворах заметно возрастает расход железа при последующей цементации меди.
При снижении концентрации меди в растворе прекращают орошение участка и начинают обработку следующего. Попытка увеличить содержание меди в растворе за счет повторного его использования при орошении не дает ожидаемого результата. Это объясняется сорбирующей способностью отдельных разновидностей глин, присутствующих в обрабатываемом материале.
Вследствие развития окислительных процессов при выщелачивании температура конечного раствора на несколько градусов выше, чем у раствора, подаваемого на выщелачивание. Несмотря на то, что повышение температуры заметно интенсифицирует выщелачивание, предварительный подогрев раствора представляется экономически нецелесообразным в связи с большими его объемами. Гораздо большего внимания заслуживает рациональное использование регенерируемого в процессе выщелачивания тепла, прежде всего за счет ускорения обработки раствора и его оборачиваемости.
При установившемся режиме и нормальном протекании процесса объем раствора после выщелачивания сохраняется достаточно постоянным. Снижение его количества свидетельствует или об утечках раствора, или об образовании застойных зон в объеме отвала (кучи), или о значительных потерях его за счет испарения. В районах с умеренным климатом величина последнего не превышает 15—18%. Обильные атмосферные осадки, если ие предприняты специальные меры, способны расстроить установившийся водный баланс процесса выщелачивания.
Наиболее сложную проблему при выщелачивании забалансового сырья представляет борьба с накоплением железа в растворе и предотвращением гидролиза его солей. Накопление железа происходит не только в результате растворения его из руды, но и при цементации с учетом замкнутой схемы использования раствора. В результате ухудшаются условия выщелачивания и возникает опасность отложения солей железа, алюминия, кальция, в магистралях и в слое руды. В последнем случае экранируются целые участки руды от контакта с раствором и заметно ухудшается его перколяция. Поданным работы [234], с 1 м3 раствора отлагается до 1,92—2,04 кг железа.
К специальным мерам предотвращения накопления железа в растворе можно отнести следующие: создание условий для его осаждения
в сборных прудках; использование вместо цементации других способов извлечения меди; периодический сброс части раствора или вывод его на осаждение железа или даже упаривание. Выводимый раствор можно продувать воздухом прн pH = 2; часть железа при этом осаждается или переходит в трехвалептное состояние1. Рекомендуют также выводить г/2—2/3 раствора и окислять железо в течение 24 ч с помощью бактерий, что снижает содержание железа до 2—5 г/л2* *.
Наиболее действенный способ борьбы с отложениями солей — тщательный контроль и поддержание оптимальной кислотности раствора. В случае отложения солей на поверхности отвала (кучи) практикуют удаление (срезание) верхнего слоя руды или специальное его рыхление. Попытки бурить скважины и подавать раствор ниже заиленного слоя (опыт установки в Рам Джангл, Австралия) были безуспешны в связи с быстрым зарастанием скважин. Использование более кислых растворов при орошении также недостаточно эффективно, поскольку возрастает разрушение вмещающих пород с образованием шламовых включении [237].
Для успешного выщелачивания руды в отвалах и кучах необходимо:
1) невысокое содержание пустой породы типа известняка и магнезита;
2) сооружение водонепроницаемого основания и обеспечение направленного дренажа раствора;
3) рациональные размеры, формы и технология отсыпки кучи отвалов (для вновь сооружаемых объектов);
4) доступ воздуха внутрь отвала (кучи);
5) рациональный режим орошения для равномерного контакта растворителя с медными минералами;
6) оптимальная кислотность орошающего раствора для максимального выщелачивания меди при наименьшем растворении железа и предотвращении гидролиза солей железа и алюминия;
7) обеспечение условий эффективной жизнедеятельности бактерий прн переработке сульфидных руд.
Капитальные затраты при выщелачивании руды в отвалах и кучах [238—2401 невысоки. К наиболее значимым относят затраты на сооружение гидроизоляционного покрытия грунта, которые для асфальтового варианта достигают 2160—2400 ** долл, на 1000 м2.
Среди эксплуатационных затрат .основная — стоимость- серной кислоты. Расход ее в 4—6,7 раз превышает теоретически необходимый для растворения меди, что обусловлено потерями раствора, а также взаимодействием кислоты с пустой породой. Затраты, связанные с потерями раствора, достигают 1,56—3,6 долл, в расчете на 1 м2 основания отвала (кучи) при стоимости 1 т кислоты 16,5— 44 долл. В целом затраты на кислоту (в расчете на 1 т меди) составляют 75—287 долл.
1 Пат. (США), № 2563623, 1951.
• Пат. (США), Ко 3330650, 1967.
’* На ноябрь 1973 г. 1 долл, равен 0,715 руб.
Затраты на проведение Горных работ зависят от ряда условий (объема породы, уровня механизации, организации транспорта и др.) и колеблятся от 130 до 285 долл, на 1 т медн. Заметим, что затраты на добычу руды при выщелачивании и старых отвалов в отличне от новых отвалов и куч учтены в стоимости ранее добытой руды.
Прочие затраты иа проведение выщелачивания (электроэнергия, амортизация, вспомогательные материалы) не превышают 200 долл. на 1 т медн.
Подземное выщелачивание
Различают естественный и искусственный режимы выщелачивания. В первом случае медь извлекается под действием продуктов окисления пирита, находящихся в водах естественного притока. Особенно интенсивно выщелачивание происходит в период подземных пожаров. Образующиеся шахтные воды в заброшенных выработках собирают и используют прн цементации или для орошения отвалов. Типичным для естественного выщелачивания является невысокое содержание меди в растворе (в среднем 0,1—0,4 г/л), крайне неравномерный дебит поступающих вод н их повышенная зашламленность (до 2—-3 г/л), что существенно ухудшает показатели последующего извлечения меди. Особенно большая зашламленность шахтных вод характерна для рудников, подвергнутых принудительному заиливанию с целью профилактики эндогенных пожаров илн заполненных хвостами обогащения.
На предприятии Бьютт ежесуточно с шахтными водами выносилось до 50 т шлама, которые осаждались в отвалах, подвергаемых выщелачиванию 12411. Эффективное удаление шламов было достигнуто за счет введения 0,28 г/м3 флокулянтов в виде раствора 4,8 г/л, а также использования подземных отстойников наклонного и вертикального типа (рис. 35).
На одном из рудников этого предприятия установлены 2 наклонных отстойника (длина 14,8 м, ширина 2,44 м, высота 1,22 м и 8,0 м). Шлам скапливается на дне емкости, образованной передней перегородкой высотой 1,82 м и задней стенкой, и периодически сбрасывается в отвал. Осветленный раствор выпускается через сливные шлюзы в задней стенке отстойника. Наклонный отстойник обеспечил осаждение 69% шлама, снижая его концентрацию в растворе с 1,05 до 0,34 г/л (через один отстойник пропускают около 1 м3/мин раствора).
Вертикальный отстойник выполнен в виде цилиндра диаметром 4,9 м и высотой 10,7 м. Раствор в количестве 0,76 м’/мин поступает в отстойник на глубину 4,6 м. Шлам оседает в конической части, а осветленный раствор проходит через горизонтальный отстойник (1,82 х 0,61x9,1 м). Из этого отстойника накапливающийся шлам периодически возвращают в вертикальный отстойник. При введении флокулянта осаждалось до 98% шлама, содержание шлама в осветленном растворе не превышало 0,04 г/л.
Искусственное орошение отличается прежде всего тщательной подготовкой состава исходного раствора, его распределения по обрабатываемому участку, организованной системой сбора медьсодержащего раствора, а также обеспечением условий для жизнедеятель-
иости бактерий. Подземное выщелачивание используют на ряде руд-' ников в США (Майами, Рэй), Португалии (Сан-Доминго), Мексике (Кананеа). В СССР в 40—50-х гг. этот вид выщелачивания успешно применяли на нескольких уральских рудниках [242—2431.
При оценке возможности применения подземного выщелачивания проводят тщательный анализ горно-технической, гидрогеологической и технологической характеристик месторождения, участка, забоя.
Рис. 35. Схема наклон кого (а) и вертикального (б) отстойников для обесшламлнваиия рудничных вод:
1 — сливной порог; 2 — шлюзы для осветленной воды; 3 — шлюз Для выпуска шлама; 4 — задняя стенка отстойника; 5 — насосы; 6 — шламопровод; 7 — узел приготовления и дозировки флокулянта; в — вертикальный отстойник; 9 — горизонтальный отстойник
Горнотехнические характеристики (мощность, минералогический состав, глубина залегания, форма рудного тела, тнп и характер лежащей сверху породы) во многом определяют затраты на подготовку системы орошения и сбора раствора.
Наиболее удобны рудные залежи с крутым падением и достаточной мощностью, а при выщелачивании потерянной руды в старых рудниках — системы с обрушением или магазинированием. В этом случае достаточно равномерная крупность руды создает хорошие условия для циркуляции раствора и воздуха'.
Гидрогеологические критерии (пористость и проницаемость рудного тела, трещиноватость окружающих пород, наличие естественных водоупоров, количество и характеристика движения грунтовых вод) определяют условия сбора медьсодержащего раствора и сокращения безвозвратных потерь .растворителя.
Технологическая характеристика месторождения отражает извлекаемость медн промышленными растворителями, содержание основных и попутных ценных компонентов, тип вмещающей породы.
Подземное выщелачивание и выщелачивание медн из руды в отвалах и кучах имеют много общего: успех процесса во многом зависит от обеспечения проницаемости рудного массива, условий селективности извлечения меди, приемлемой скорости выщелачивания.
В зависимости от глубины залегания рудного тела раствор для орошения подают с помощью разбрызгивателей, канав, прудков (при поверхности залегания), скважин, пробуренных с поверхности или из горных выработок, пройденных над рудным телом (при глубоком залегании). Для выщелачивания рыхлого, хорошо проницаемого слоя руды при наличии естественной гидроизоляции обрабатываемого участка используют орошение методом «затопления». Раствор подают в глубь слоя, а медьсодержащий раствор выводят с верхних горизонтов. При таком режиме орошения достигается равномерное смачива-
Рис. 36 Геометрические схемы сеток бурения нагнетательных (/) и разгрузочных (2) скважин:
а — квадратная; б — треугольная; в — кольцевая; е — сотовая
иие кусков породы и существенно снижаются затраты на проходку скважин, число которых практически сводится к двум (для подачи п вывода раствора). Наиболее типичным способом подачи раствора при подземном выщелачивании будет орошение через скважины.
Как уже отмечалось, показатели выщелачивания во многом зависят от равномерности контакта раствора с обрабатываемой рудой, что, в свою очередь определяется числом скважин, приходящихся на единицу орошаемой поверхности.
Типы сеток бурения скважин показаны на рис. 36 [5, с. 179—81 1. Выбор нх обосновывается технико-экономическими расчетами с учетом характеристики рудного тела и затрат на бурение скважин. Расстояние между скважинами выбирают с учетом характеристики обрабатываемой руды, предполагаемого режима орошения, условий проникновения растворителя и др.
В каждой схеме имеются нагнетательные скважины, куда подают рабочий раствор, и разгрузочные, через которые собирают медьсодержащий раствор Рекомендуется периодически менять назначение
скважин, так как это способствует более равномерному выщелачиванию рудного тела (в нагнетательные скважины раствор подают под давлением, что вызывает большее распространение его в окружающие массивы).
Наиболее эффективна схема с линейным расположением скважин по квадратной сетке, обеспечивающая достаточно равномерное распределение раствора. При расположении разгрузочных скважин — по углам квадрата, а нагнетательных скважин — в центре квадрата, несмотря на более высокие капитальные затраты, производительность возрастает в 3—4 раза по сравнению с обратным расположением скважин.
При кольцевом расположении разгрузочных скважин в зависимости от их числа степень заполнения рудного пласта растворителем достигает 70—80% площади образуемого круга. При кольцевом расположении нагнетательных скважин время продвижения растворителя по рудному телу мало зависит от числа разгрузочных скважин. Однако увеличением количества последних удается регулировать характер движения раствора. Кольцевую систему рекомендуют для обработки месторождения, представленного скоплением мелких залежей, прн этом более предпочтительно кольцевое расположение разгрузочных скважин.
В связи с использованием достаточно агрессивных растворов наиболее предпочтительно изготавливать обсадные трубы из нержавеющей стали. Однако в связи с нх высокой стоимостью в последние годы все шире применяют трубы из полиэтилена, реже — из винипласта и фаолита, в связи с нх меньшей механической прочностью. Нижнюю часть трубы, заводимой в скважину, иногда оборудуют фильтром для снижения выноса шламов с медьсодержащим раствором.
Проницаемость рудного массива зависит от типа пород (например, для порфировых поролона составила 1.67 м®/(м2-ч) [2441), характера трещиноватости. В ряде случаев используют гидравлическое рыхление пород через специальные скважины.
Режим орошения (длительность периода подачи раствора и периода выстаивания для развития окислительных процессов) зависит от вещественного Состава руды, ее проницаемости и определяется в каждом конкретном случае.
При подземном выщелачивании медьсодержащий раствор собирают в штреке и из сборных емкостей откачивают насосами на установку для извлечения меди. Для снижения потерь раствора за счет миграции особенно в трещиноватых породах создают специальную гидроизоляцию выработок.
Управляют процессом изменением графика орошения скважин, напора орошаемого раствора, продолжительности паузы между орошением, остановкой отдельных скважин. Для поддержания требуемой концентрации меди в конечных растворах целесообразно вести обработку двух илн нескольких участков по смещенному графику или попеременным включением отдельных групп скважин в пределах одного участка.
Для успешного применения подземного выщелачивания необходимо: 1) отсутствие вмещающих пород основного характера; 2) плотность и отсутствие декрептирования окружающих пород; 3) пористость рудного массива; 4) присутствие меди в сравнительно легко извлекаемых формах; 5) достаточное количество пнрнтсодержащпх пород; 6) многократная циркуляция раствора без существенного его загрязнения примесями; 7) наличие запасов дешевой воды.
По сравнению со стандартной технологией при подземном выщелачивании себестоимость меди гораздо ниже, интенсивность разработки выше, а условия труда лучше. При дальнейшем повышении извлечения медн этот способ добычи меди представляется весьма перспективным, особенно для эксплуатации труднодоступных месторождений.
По данным работ [ 106, 234 ], затраты на подземное выщелачивание при выпуске в год 8160 т Си в виде цементного осадка распределяются следующим образом, долл/т меди (%):
Горные работы Серная кислота ..........
Электроэнергия . .
Железный скрап ....
Заработная плата ....................
Амортизация, обслуживание, транспортные расходы, плановая прибыть и др.
135,00 (37,90) 71,60 (20,05) 6,20(1,75)
74,20 (20,90) 20,50 (5,80)
48,10(13,60^
Итого. 355,60(100,0)
ИЗВЛЕЧЕНИЕ МЕДИ ИЗ РАСТВОРОВ
Получаемые при выщелачивании забалансового сырья растворы отличаются невысоким содержанием в них меди, повышенной концентрацией железа и шламов. В связи с большими объемами бедных растворов способ осаждения их должен быть эффективным и достаточно простым.
Наибольшее распространение в современной практике работы предприятий получили цементация и экстракция с последующим электролитическим осаждением меди. Другие способы: химическое осаждение, сорбционное концентрирование раствора, электролиз (электродиализ) —• не вышли за рамки полупромышленных испытаний Это объясняется следующими причинами.
При химическом осаждении необходимы дорогие реагенты, в противном случае качество и фильтруемость получаемых осадков оказы-ваются весьма невысокими, что осложняет их последующую переработку. В ряде случаев оборотный раствор загрязняется дополнительными примесями, что требует специальных мер для предотвращения их накопления в замкнутых схемах.
Несмотря на ряд достоинств, использование сорбционного извлечения меди сдерживается отсутствием селективных ионитов с большой емкостью, громоздкостью и дороговизной способа.
Электролитическое осаждение при содержании меди в растворе менее 15—20 г/л оказывается нерентабельным. Получение катодной меди в виде грязной губки илн порошка имеет небольшие преимуще
ства по сравнению, например, с цементацией. Однако сложность производства, повышенные капитальные затраты и расход электроэнергии (учитывая нередко удаленное расположение установок от промышленных центров) затрудняет использование этого способа. В последние годы ведутся интенсивные разработки новых конструкций электролизеров и параметров технологии с целью создания эффективного способа электролитического извлечения меди из бедных растворов.
Более заманчиво для обеднения растворов использовать электродиализ. Это способ позволяет сконцентрировать металлы и получить чистый оборотный раствор серной кислоты. Однако невысокая электропроводность исходного раствора обусловливает повышенный расход электроэнергии, а сложный состав его затрудняет выбор мембран и электродов. Пока ограниченная номенклатура эффективных и дешевых мембран, конструкций электродиализаторов, рассчитанных на большую пропускную способность, дополнительно осложняет промышленную реализацию способа.
Цементация
Осаждение меди цементацией на железе — наиболее распространенный и простой способ извлечения меди из растворов от выщелачивания забалансового сырья. Показатели процесса во многом зависят от способа подготовки раствора, выбора осадителя н используемого аппаратурного оформления.
Подготовка раствора
Типичный состав раствора, получаемого при выщелачивании забалансового сырья, следующий: 0,3—3,0 г/л Си; 2—8 г/л Fe (в том числе до 3—5 г/л Fes+); 0,2—1,0 г/л шлама; pH раствора 1,4—— 3,2.
Операция подготовки раствора включает восстановление трехвалентного железа, осаждение шламов, а также корректировку кислотности.
Трехвалентное железо можно восстановить следующими способами: 1) контактированием раствора с тяжелым скрапом; 2) дренажом раствора через пирротиновые фильтры (кусковую пирротнновую руду): 1 кг руды эквивалентен действию 1,5—2,2 кг железного скрапа; 3) обработкой раствора сернистым газом, особенно в присутствии активированного угля *.
Несмотря на эффективность этих способов, промышленное их использование весьма ограничено в связи с необходимостью дополнительных капитальных и эксплуатационных затрат.
Более простой способ удаления железа (в том числе и трехвалентного) — его' осаждение при поддержании оптимальной кислотности раствора. При pH = 2,5-г-3,0 содержание трехвалентного железа в растворе невелико в связи с гидролизом при этих условиях.
1 Пат. (США), № 2188472, 1940.
Окислить двухвалентное железо наиболее просто в процессе Длительного хранения раствора в прудках-накопителях.
Перед цементацией конечные растворы подкисляют в расходных емкостях для обеспечения хороших показателей осаждения меди. Сложнее подготовить растворы с повышенной кислотностью (3—5 г/л кислоты), поскольку в этом случае необходима предварительная ней- ’ трализация. На практике оптимальную кислотность конечных рас- . творов обеспечивают в процессе выщелачивания руды.
Наиболее действенный способ удаления шламов - использование достаточных по размеру прудков-отстойников, в которых со временем оседает значительная часть шламов. Для интенсификации осаждения шлама используют флокулянты (сепаран, полиакриламид н др.).
При цементации хорошо подготовленных растворов остаточное содержание меди не превышает 50—70 мг/л.
Характеристика промышленных осадителей
Для цементации меди наибольшее значение имеют металлизированные материалы на основе железа в связи с их достаточной активностью, доступностью и невысокой стоимостью. Осадитель должен быть активным, представлен равномерно крупными частицами, должен обеспечивать получение качественного осадка меди и по возможности просто восстанавливать осадительную способность Кроме того, следует учитывать стоимость осадителя, условия его поставки * и хранения.
На практике для цементации используют железный лом, обезлу-женную консервную жесть, жестяную обрезь, губчатое железо.
В настоящее время тяжелый скрап (рельсы, плиты, трубы, отливки и др.), несмотря на низкую стоимость, практически не применяется в связи с малой реакционной поверхностью, большим удельным расходом, повышенным содержанием в нем углерода и трудностями прн его загрузке, ворошении, отделении цементного осадка. При использовании тяжелого скрапа осадитель равномерно не распределяется в аппарате, что ухудшает гидродинамический режим при цементации. Известны случаи применения тяжелого скрапа в головных секциях желобов для снижения кислотности и содержания трехвалентного железа в исходном растворе.
Использование стружки, проволочной обрези упрощает загрузку и выгрузку аппаратов, обеспечивает более равномерное распределение осадителя по сеченню аппарата. Стружку предварительно дробят, а проволочную обрезь измельчают, что повышает их йасыпную массу (у): при крупности 1—10 мм у= 1,5-ч-2,5 т/м3, а при крупности 1 мм у = 3—4 т/м3. К недостаткам осадителя этого типа относятся непостоянный химический состав, наличие масла, лака, что существенно понижает его реакционную способность и затрудняет управление процессом.
Губчатое железо широко применяют при переработке смешанных руд по схеме выщелачивание—цементация—флотация. Сырьем для получения губчатого железа служат окисленные железосодержащие
материалы (руды, пиритные огарки). Технология его производства описана в работах [245—246]. Крупность конечного продукта (80— 90%) составляет —2,5 + 0,5 мм, перед цементацией его дополнительно измельчают. Насыпная масса губчатого железа 2—2,7 т/м3, состав его приведен в табл. 18.
Химический состав губчатого железа
Таблица 18
Исходное сырье Fe в сырье % Содержащие в губчатом железе, %
^еобщ Fe * метал S Si О,
Железная руда 55 60—63 63—67 67,4 75—85 90—97 53,2 60—72 85—94 0,21 0,05—0,07 0,01 28,4 6-12 2—10
Пиритные огарки 58 59,7 70,2 73,8 50,8 52,4 0,75 0,8 24,1 22,6
При использовании губчатого железа для цементации необходимы аппараты с интенсивным гидродинамическим режимом для поддержания осадителя во взвешенном состоянии. В конусных аппаратах используют губчатое железо крупностью —2 + 0,074 мм; при меньшей крупности вследствие развития побочных реакций возрастает расход осадителя [247 ].
Активность губчатого железа существенно сказывается на качестве цементного осадка (рис. 37): для достижения содержания в осадке не менее 70% меди степень металлизации осадителя должна быть на уровне 80% [2471. Однако с увеличением сортности губчатого железа значительно возрастает его стоимость.
Можно получать осадитель типа губчатого железа, и из полупродуктов цветной металлургии (клинкера, цинковых кеков, медных шлаков и штейнов) [248—2581. При цементации используется не только железо, но и благородные металлы, медь, присутствующие в исходном материале, которые переходят в цементный осадок. Затраты иа получение осадителя даже из пиритных концентратов (284 г/т Ag) окупаются стоимостью извлеченного серебра [82, с. 617— 42; 255].
Из пиритных концентратов был получен осадитель с большой активностью (70—75% Fe„ T), позволяющий извлекать до 97—99% меди из раствора, содержащего 1—5,7 г/л Си. Удельный расход осадителя 1,9—2,9, а содержание меди в цементном осадке не менее 60—70% [82, с. 617—42; 248—250; 255—256].
При использовании клинкера (17—20% FeHeT; 1,7—2,5% Си; 2—4% S, 30—50 пустой породы) осаждается 80—95% меди, однако цементный осадок получается крайне бедным (10—15% Си). При до-измельчении и обогащении клинкера удаляется до 90% пустой породы, содержание металлической фазы повышается до 60—80%.
Показатели цементации таким осадителем (измельченным до —0,15 мм) пе хуже, чем при использовании губчатого железа [251—254, 257].
Большой интерес представляет получение активнбго осадителя из шлаков медеплавильного производства после их восстановительной электроплавки, грануляции (распыления) расплава в защитной атмо
сфере . Переплавкой шлаков металлизированный продукт с личие которой упрощает его дробление и измельчение а.
Фирмой «Фелпс Додж» (США) разработана технология получения активного осадителя из бедных медных штейнов |258]. Штейны конвертируют при 1320° С без подачи кварцевого флюса, получая расплав, содержащий 65% Fe, 4,4% Си н 0,83% S. После его грануляции, обработки гранул конверсированным природным газом в конечном продукте содержится 77% Fe (в том числе 57% FeMeT) и 4,9% Си. Стоимость этого осадителя
добавкой пирита и углерода получают ограниченным содержанием серы, не-
Рнс. 37. Зависимость степени осаждения 4иедн и ее содержания в цементном, осадке от активности губчатого железа и расхода осадителя:
------Си в цементном осадке;-----------степень осаждения Си 1 ~ 0,9 кг осадителя на 1 кг меди;
2 — 1.5 кг; 3 — 2.5 кг
сравнима со стоимостью обез-луженного скрапа.
Попытки использовать при цементации гранулированный чугун не были ус-
пешны: наличие карбидов снижает скорость цементации, ослож-
няет отделение меди и ухудшает качество осадка.
Жестяной лом — это отход металлообрабатывающих предприятий или консервная жесть после удаления олова. Для цементации можно использовать жесть, у которой отсутствуют изолирующие покрытия (лак, масло), кроме того, она должна быть гранулометрически однородна, что не только увеличивает скорость осаждения меди, улучшает качество осадка, но и снижает расход осадителя.
В США подготовкой консервной жести для нужд цементации занимаются специализированные предприятия [259, с. 48]. Банки обрабатывают при температуре 400—600° С для удаления органических веществ н оловянного покрытия; последнее можно уделять раствором каустической соды. Обезлуженную жесть дробят, мнут,'что обеспечивает однородную крупность материала, сохраняющего активную поверхность достаточно продолжительное время, и повышает его
1 Пат. (США), № 3023454, 1962. » Пат. (США), Ns 3232742, 1963.
насыпную массу (с 130—140 кг/м3 до 320—480 кг/м3). При использовании качественной жести, например в желобах, удельный съем меди достигает 200 кг/(м3 сут).
При снижении крупности жести возрастает ее активная поверхность, ио ухудшается проницаемость слоя осадителя раствором. В зависимости от аппаратурного оформления цементации крупность жести выбирают с учетом оптимального соотношения активной поверхности осадителя и проницаемого его слоя. Невысокая стоимость, достаточная распространенность и хорошая осаждающая способность определили широкое применение жести иа современных цементационных установках.
Выбор способа загрузки осадителя зависит от его количества, характеристики, условий хранения, аппаратурного оформления и масштаба цементационной установки.
На установках большой мощности загрузку осуществляют с помощью передвижного ленточного транспортера, автокрана с магнитным подъемником, грейфером, вилообразным захватом; напольного крана с питательной тележкой; мостового крана с магнитным, грейферным, ковшовым подъемниками.
Аппаратура
При выборе типа аппаратурного оформления процесса учитывают объем и состав растворов; тип осадителя; продолжительность контактирования раствора с осадителем; удельную производительность аппарата.
Не меиёе важны простота обслуживания, возможность организации непрерывного механизированного процесса и капитальные затраты.
Конструкция аппарата во многом определяет гидродинамический режим, от которого существенно зависят показатели извлечения меди.
В современной практике цементации меди наибольшее распространение получили желоба, вращающиеся барабаны, конусные аппараты, ванны и чаны с механическим перемешиванием.’
Цементационные желоба — наиболее старые и распространенные устройства (рис. 38). Их изготавливают из дерева, а в последние годы предпочтение отдают более прочным бетонным желобам, срок службы которых больше. При использовании бетонных желобов можно механизировать отдельные операции, кроме того меньше потерн раствора. Желоба располагают с уклоном 1—3°, с учетом рельефа местности.
Ширина желобов 0,5—2,0 м, глубина 0,8—1,5 м. Их размеры, особенно длину, определяют с учетом объемов перерабатываемых растворов и необходимой продолжительности их контакта с осадителем.
В нижней части желоба сооружают чаще всего деревянное ложное днище, на которое помещают железный скрап. Кроме того, деревянная решетка предохраняет футеровку от механических повреждений при загрузке скрапа. Иногда по длине желоба сооружают перегородки со сливными шлюзами, расположенными попеременно вверху и внизу перегородок.
Цементный осадок собирается на дне желоба, откуда его периодически удаляют через спускное отверстие.
Применяют два способа расположения желобов: прямолинейное и зигзагообразное. Первый используют на крупных установках, поскольку в этом случае упрощается механизация загрузки и выгрузки скрапа при использовании передвижных кранов или специальных загрузочных машин. При прямолинейном расположении желобов упрощается расширение или модернизация цементационной установки.
Рис. 38. Схемы желобов для цементации меди:
а — простой желоб; б — активированный желоб; /— выход отработанного раствора; 2 — разгрузив пульпы цементной меди; 3 — ввод медьсодержащего раствора
При зигзагообразном расположении упомянутые выше достоинства отсутствуют, однако установка более компактна и обслуживание ее несколько дешевле.
Часто желоба сооружают в виде сдвоеииых секций, имеющих общую боковую стейку, отверстия и шлюзы для управления потоком раствора. Это позволяет в процессе работы установки вывести на обслуживание нужный участок желоба
Желоба просты по устройству и дешевы, цементация в иих не требуют энергетических затрат и характеризуется неплохими показателями по осаждению меди (90% и более) при переработке чистых и достаточно богатых (не меиее 1—2 г/л Си) растворов. Однако по конструктивным соображениям скорость подачи раствора в желоба ограничена (0,5—3 м3/мин). Поэтому для обеспечения достаточного времени его контакта с осадителем увеличивают длину желобов до нескольких десятков метров. В среднем удельная производительность желоба (на 1 м3 объема) составляет 0,7—1,0 м3/ч [239].
Для эффективного осаждения меди в желобах требуется частое ворошение скрапа и его промывка. Обслуживание желобов связано
8 С. С Набойченко 113
Таблица 19
Показатели по цементации меди в желобах иа некоторых зарубежных установках
Показатели Инспирейшн (США) Огайо Бингамскнй каньон (США) Бьютт (США) Андес (США) Канянеа (Мексика) А • Б •• Сьерро де Паско (Перу)
Система желобов Зигзаго- Прямоли- Прямоли- Зигзаго- Зигзаго- Зигзаго- Зигзаго- Зигзаго-
Количество перерабатываемого раство- образная пенная нейиая образная образная образная образная образная
ра, м3/мин Начальное содержа- 9.65 3,17 19,3 2,23 5,25 1,04 7,56 3,78
'нне Си, г/л .... Извлечение Си прн це- 0.85 2,04 0,31 2,41 3,30 1,20 1,2-2.4 2.0
меитацни, % . 97,4 97,3 95,0 97,2 89,1 92.5 96,0 90
Выпуск Си, т/день Количество желобов, 11,25 9,15 8,23 7,8 21,8 1,64 26 0 10,5
ШТ Удельная производительность желоба, 16 сдвоенных 200 200 3 шести -секционных 40 8 24 сдвоенных 12 сдвоенных
кг/(м3сут.) ... Скорость течения рас- 6,18 15,1 5,38 3,38 48,50 8,92 32,2 44,1
твора, м/мин .... Продолжительность контактирования раствора с осадителей, 2,04 9,75 1,98 0,4 2,23 0,46 3.05 2,56
мин 192 50 78 875 88 181 61 69
* А — небольшая установка в Южной Америке.
Б — установка в Северной Америке.
с большими затратами труда особенно на установках небольшой мощности. При крупнотоннажном масштабе производства (несколько тысяч тонн меди в год) экономически оправдана механизация операций загрузки и выгрузки скрапа, его ворошения, гидротранспорта цементного осадка и т. д. Эксплуатация желобов в зимнее время особенно в районах с холодным климатом связана с дополнительными трудностями.
Частицы цементной меди, получаемой в желобах, достаточно крупны. Цементная медь не плохо отстаивается и фильтруется, меньше склонна к окислению при сушке и хранении, но загрязнена остатками скрапа. В желобах невозможно использовать дисперсные более активные осадители типа губчатого железа. При использовании желобов расход железа, как правило, в 2—4 раза больше теоретического.
Некоторые данные практики по цементации меди в желобах приведены в табл. 19 [291—292]. С целью интенсификации осаждения меди за счет повышения турбулентности потока или использования дисперсного осадителя были разработаны «активизированные» желоба (рис. 38, б)1. Их форма обеспечивает снижение скорости потока при сливе через верхние боковые отверстия, что улучшает отделение цементной меди от более тяжелых частиц иепрореагировавшего осадителя.
На дне желоба смонтированы от 1 до 3 перфорированных (отверстия диаметром 16 мм просверлены по образующей через 0,3—0,9 м) трубопровода, по которому под напором подают исходный раствор.
Дополнительное перемешивание происходит в результате выделения водорода. Можно соединять несколько аппаратов по противоточной схеме. Для предупреждения комкования губчатого железа целесообразна периодическая подача сжатого воздуха.
Осаждение меди в активированных желобах протекает весьма быстро, одиако удаление цементного осадка при использовании губчатого железа затруднено. Лучшие результаты получены при цементации однородной по крупности консервной жестью.
Вращающиеся барабаны (рис. 39) впервые были использованы на предприятиях Чили. Их изготавливали из бронзы, футеровали медными плитками в связи с повышенной агрессивностью перерабатываемых растворов. Размеры барабана: диаметр 21 м, длина 3 м. Барабан смонтировали на роликовых опорах, скорость вращения его 8 об/мин.
Позднее подобные аппараты, ио изготовленные из дерева, были установлены иа предприятии «Эмеральд Ислз» 1260]. Аппарат состоял из концентрически расположенных барабанов: наружного (диаметром 1,52 м и длиной 5,2 м) и внутреннего (диаметром 1,37 м и с отверстиями диаметром 6,5 мм). На внутренней поверхности барабанов сделаны спиралеобразные направляющие, которые, помимо транспортирующей функции, увеличили жесткость конструкции.
1 Пат. (США), № 3288598, 19G6.
8*
Деревянные барабаны дийметром 2,45 м и длиной 4,6 м с ремённым приводом установлены на заводе Мангула (Южная Родезия) [2611. В аппарат загружают 4—5 т скрапа; скорость вращения барабана 2 об/мин. Барабанные аппараты компактны, обеспечивают хоро-
Рис. 39. Схема установки вертикальных (о) и горизонтального (б) барв-бакных неыектаторов:
/ — олорно-центрнрующкй узел; 2 — опорные бандвжи; 3 — корпус барабана; 4 — загрузка раствора и скрапа; 5 — узел привода
ший контакт раствора и осадителя, высокое извлечение меди /94—97%).
При вращении за счет истирания возрастает выход дисперсных (вплоть до коллоидных) частиц цементной меди. Это осложняет отстаивание, обезвоживание пульпы цементного осадка и вызывает повышенное окисление меди при его обработке. Дополнительные трудности представляет загрузка непакетироваииого скрапа и удаление его остатков. Кроме того, требуются дополнительные энергетические затраты в связи с необходимостью перемещения не только раствора, осадителя, но и самого аппарата. Барабаны требуют ухода за механическим приводом, размещения в производственном корпусе для районов с Холодным климатом, что увеличивает капиталоемкость установки. При непрерывном режиме работы коэффициент использования объема барабана не превышает 0,40—0,45. Все это снижает эффективность использования барабанов при переработке больших объемов растворов. По этим причинам при расширении цемента-116
ционной установки фирма «Кеннекотт» отказалась от барабанных аппаратов Онн заслуживают внимания при оснащении цементационных установок небольшой мощности и сезонном режиме работы. В этом случае, учитывая компактность установки, можно демонтировать ее и перевезти иа новый участок с небольшими затратами.
Ванны— деревянные или железобетонные бассейны прямоугольной формы шириной 1,5—3,0 м, глубиной 0,8—2,5 м, длиной 3—5. Как и желоба ванны оборудованы ложными днищами. Осаждение меди происходит при меньшей скорости циркуляции раствора, что требует большей, чем в желобах, продолжительности контакта раствора с осадителем. Ванны представляют собой более вместительные и компактные сооружения, чем желоба. Их применяют на установках относительно небольшой производительности.
В конце пятидесятых годов иа цементационной установи? фирмы «Багдад» применяли 10 спаренных глубоких ванн [262] (рис. 40). Аппарат обеспечивал оптимальную продолжительность контакта раствора осадителем в результате увеличения глубины ванны и специально организованного потока раствора. Секции ванны изготовлены из бетона, внутренние размеры секции 4 X 2,9 X 3,05 М; сдвоенные секции имеют общее дно для сбора осадка цементной меди. По мере накопления его откачивают в виде пульпы через встроенную трубу нз нержавеющей стали. Ложное днище изготовлено из деревянных брусков (10,2 X 10,2 см), покрытых металлической решеткой с отверстиями 46 X 102 мм, на решетке уложена металлическая сетка с отверстиями диаметром 12,7 мм. Ванны снабжены шлюзовыми спусками с шиберами для изменения направления потоков раствора. Путь, преодолеваемый раствором через аппарат, составляет около 80 м. Расположение ванн позволяет механизировать операции загрузки и выгрузки железного скрапа.
Испытание подобного аппарата на одной из отечественных установок описано в работе [263]. Однако из-за низкого качества растворов (повышенное содержание ила и невысокое меди) и некоторых конструктивных недоработок получены неудовлетворительные, показатели осаждения меди.
Другая разновидность цементационных ванн — чаны с механическим перемешиванием раствора. Внутри аппарата иа высоте примерно 2/8 от его внутренней высоты расположено ложное днище, под которым смонтировано перемешивающее устройство. Исходный раствор поступает в чан по центральной трубе под ложное днище и удаляется через сливной порог у верхнего уровня наружной стенки. Эти аппараты используют для цементации меди губчатым железом при переработке смешанных руд.
Известны примеры из практики прошлых лет по использованию чанов с воздушным перемешиванием (1, с. 59]. При расходе 0,125 м3 воздуха иа 1 м3 раствора производительность аппарата возрастала на 20—30%. Кроме того, улучшились полнота осаждения меди и состав цементного осадка по сравнению с показателями цементации в ваннах. Однако при воздушном перемешивании ускоряются процессы обратного растворения меди образующимся феррисульфатом
Рве. 40. Схемы ванн для цементации меди:
а — глубокая ванна; б —-сдвоенная вакна; / — ввод раствора; 2 — ложное дннще; 5 — выход отработанного раствора; 4 — разгрузка пульпы цементной меди
Рнс. 41. Схемы конусных цементаторов:
/ патрубок для ввода медьсодержащего раствора; 2 — елнвной трубопровод; 3 — улавливающие перегородки; 4 — загрузка осадителя; 5 — выпуск газа; 6 — круговой слявной порог; 7 ннжняя часть конуса; 8 — регулировочные клапаны; / — зона турбулентности; //—промежуточная зона; ///—зона отстаивания; IV — скрап
и серной кислотой, что увеличивает расход осадителя. Очевидно, испотьзоваиие воздуха для интенсификации цементации требует весьма осторожного подхода.
Конусные аппараты — новая конструкция аппарата для осаждения медн из бедных растворов разработана в середине 60-х гг. текущего столетия американскими металлургами1 (рис. 41)
Вмещающей емкостью для раствора и осадителя служит обратный конус, что позволяет снижать скорость потока раствора по мере его продвижения вверх, к выходу из аппарата. В результате значительно уменьшается унос мелких частиц цементной медн и непро-реагнровавшего осадителя. Одновремеиио это обеспечивает по высоте конуса определенную классификацию осадителя: в нижней части конуса, куда подается богатый раствор, находятся крупные частицы осадителя, а в верхней с бедным раствором продолжают контактировать мелкие более активные классы осадителя. Это способствует более полной цементации меди и лучшему использованию осадителя: так, из растворов, содержащих 0,4—4 г/л Си, осаждается до 99% Си. Угол а, образуемый наклоном стенок, определяют по объему перерабатываемого раствора: при поступлении 80 м3/ч раствора рекомендуют а = 78-=-87°, а при установке двух последовательных конусов — а = 65°. С увеличением объема растворов необходима меньшая величина угла прн вершине конуса.
При сооружении в верхней части конуса ряда концентрических перегородок, также имеющих конусную форму, снижается унос дисперсных частиц с отработанными раствором (газовая флотация) и образуется водородная «подушка». Последняя тормозит растворение железа кислотой, создает защитную атмосферу и позволяет по изменению давления водорода контролировать и управлять процессом.
Конусные аппараты предназначены для дисперсного и кускового осадителей. Однако лучшие показатели достигнуты при цементации жестью крупностью 2 мм за счет более оптимального гидродинамического режима.
На предприятиях фирмы «Кеннекотт» испочьзуют конусные аппараты несколько другой конструкции (рис. 41, б) [264—2651. Единичная секция представляет собой чан диаметром 4,3—5,0 м и высотой 7,3—8,0 м, в котором смонтирован конус высотой 3,1—3,6 м и диаметром у основания 3,05—3,3 м. В чане расположено ложное днище под углом 45°, нисходящее к разгрузочному отверстию. В кольцевом пространстве, образуемом внутренней поверхностью чана и наружной поверхностью конуса, расположена сетка из нержавеющей стали. Исходный раствор по напорному трубопроводу поступает в реакционную зону через несколько вертикальных сопел, расположенных в вершине конуса параллельно его боковой образующей. Это обеспечивает равномерное и весьма интенсивное движение раствора через слой скрапа, загружаемого в количестве до 15 т.
1 Пат. (США), № 3154411, 1964, Xs 3540880, 1967; № 3606290, 1971.
Осажденная медь смывается потоком раствора, проходит через сито для отделения скрапа и скапливается на наклонном днище, откуда ее периодически удаляют через разгрузочное отверстие.
Конструкция конусного аппарата и режим его работы позволяют получить высокие показатели прн цементации меди.
За счет высокой скорости раствора достигаются снижение расхода железа, непрерывная регенерация поверхности осадителя, хороший контакт его с раствором. В результате цементная медь получается более чистой с плотной структурой и округленной формой частиц.
Аппарат характеризуется высокой пропускной способностью: так, на установке диаметром 3,3 м, высотой 3,6 м за сутки обрабатывают до 10 тыс. м3 раствора, а извлечение медн при этом превышает 98%. Для обработки этого количества раствора потребовалась бы установка желобов длиной 330 м (прн ширине 1,3 м и высоте 1,3 м), извлечение медн в которых составило бы 90%.
Компактность установки существенно облегчает управление, механизацию и автоматический контроль процесса.^Ограннченный реакционный объем аппарата позволяет более эффективно использовать выделяющееся тепло в процессе цементации и тем самым еще больше интенсифицировать процесс осаждения медн.
Интересны сравнительные результаты по цементации меди скрапом в желобах и конусных аппаратах, полученные американскими металлургами [247, 265] (содержание меди в растворе 1,8 г/л):
В желобах
В конусных аппаратах
Извлечение Си, % .............* 89,9 93,3
Расход Fe, т/т Си 2,33 1,58
Содержание Си в осадке, % . . Нет данных 1 90—95
Скорость потока раствора (относительные единицы) ........... I 2
Влажность осадка, % .... 35—40 20—25
Площадь установки (относительные единицы) . . 10 1
При последовательном соединении двух конусных аппаратов обеспечивается дальнейшее снижение расхода железа и удается эффективно перерабатывать растворы с содержанием 0,1—1,0 г/л Си.
Иа цементационной установке Чино (фирма Кеннекотт) конусные аппараты диаметром 6,1 м и высотой 7,3 м установлены перед желобами, прн этом в них осаждалось до 80% меди. Такое кооперирование позволило увеличить пропускную способность желобов с 68 м3 до 227 м3 раствора в час.
С некоторыми усовершенствованиями конусные аппараты смонтированы и на других установках.
В литературе описаны исследования по цементации медн в аппаратах, типа отсадочных машин [255]. За счет хорошего перемешивания раствора достигнута высокая скорость процесса, однако полу
* В желобах получают менее чистый осадон.
чаемый осадок меди характеризуется повышенным содержанием Дисперсных частиц (5 мкм и менее).
Анализируя приведенные данные, можно заключить, что наиболее совершенным оборудованием для цементации меди служат конусные аппараты.
Обработка пульпы цементной меди; характеристика цементного осадка и способы его переработки
В аппаратах периодического действия цементный осадок удаляют по мере накопления. В зависимости от конструкции аппарата его выгружают в отстойные ванны, смывая струей воды (вручную брандспойтами или с помощью навесного передвигающегося устройства), или применяют аэролифт и гидроотсос. В ряде случаев осадок пропускают через вращающийся грохот с отверстиями 1,2—3,7 мм для отделения крупных включений скрапа. Прн непрерывном режиме осаждения медн цементный осадок выносится с отработанным раствором. В связи с невысоким содержанием твердого в пульпе (2— 3 г/л) ее предварительно сгущают; осветленный раствор в большинстве случаев возвращают в цикл выщелачивания.
Показатели отстаивания и обезвоживания существенно зависят от наличия шламовых включений,, от крупности и формы частиц цементной медн. В этой связи прн осажденш более предпочтительно получение крупнозернистой меди с округлой формой частиц.
Дисперсность осадка определяется составом раствора, типом осадителя и гидродинамическим режимом в аппарате.
Учитывая большой объем перерабатываемых растворов и необходимость громоздких сооружений для отстаивания, особую акту.-, альность приобретает повышение скорости осаждения цементной медй.
Скорость осаждения возрастает с увеличением кислотности раствора. Однако наиболее действенны добавки поверхностно активных веществ типа полиакриламида, сепарана, панга. Введение полиакриламида в количестве 50—70 г/т увеличивает скорость осаждения в 3 раза, а в отдельных случаях даже в 8—10 раз. Кислый ПАНГ (100—120 г/т) также эффективно флокулирует частицы, однако в этом случае наблюдается обратное растворение медн; щелочным ПАНГ (pH = 5) почти не проявляет положительного эффекта [266]. В ряде случаев отстойники оборудуют специальными перегородками для ускорения осаждения цементной меди.
Из отстойных ванн цементный осадок влажностью до 50% выгружают грейфером и направляют на подсушку.
Обезвоживание пульпы цементного осадка осуществляют подсушкой или фильтрацией (центрифугированием).
Прн естественной подсушке цементный осадок выгружают на наклонную бетонированную (асфальтированную) площадку и выдерживают в. течение нескольких суток (4—6 летом и 10—12 зимой), достигая остаточной влажности осадка 20—30%. Это Дешевый и достаточно надежный способ, особенно в районах с теплым климатом.
Однако из-за применения ручного труда и низкой производительности он пригоден для сравнительно небольших установок.
Более эффективна подсушка на обогреваемых площадках, осо-
бенно при наличии дешевых теплоносителей.
Американские металлурги испытывали вариант подсушки осадка в сушильных барабанах. Несмотря на достигнутую меньшую влажность и большую производительность по сравнению с естественной сушкой, этот способ был отвергнут, по-видимому, в связи с необ
ходимостью создания защитной атмосферы и организации пылеулавливания. Кроме того, прн остаточной влажности осадка ниже 14—
Рнс. 42. Влияние флотационной перечистки на содержание медн (/), влаги (2) и скорость фильтрации (5) цементного осадка
15% возрастают потери меди при транспортировке (за счет пыления), а также энергозатраты.
На современных установках наибольшее распространение получило обезвоживание на фильтрпрессах или барабанных вакуумфнльтрах. Остаточная влажность осадка 8—10%; в ряде случаев для его подсушки практикуют отдувку подогретым воздухом.
В процессе переработки смешанных руд используют совместную фильтрацию цементной меди и сульфидного концент-
рата в соотношении 1:7: 10. Это позволяет значительно ускорить фильтрацию и снизить остаточное содержание влаги на 10—15%.
Фильтруемость цементной меди значительно облегчается с улучшением качества осадка. Прн увеличении содержания медн с 22 до 74,6% скорость фильтрации возрастает с 0,01 до 0,2 т/(м2 ч), а остаточное содержание влаги снижается с 35 до 21% (рнс. 42) 17, с. 240).
Учитывая большую разность плотностей жидкой и твердой фаз, весьма эффективным способом обезвоживания можно считать центрифугирование.
На установке фирмы «Багдад» использовали фильтрующую центрифугу, что увеличило производительность и уменьшило остаточную влажность до 4—8% [2621. Однако центрифуги более дороги, сложны в эксплуатации, а при повышенной дисперсности осадка возрастают потерн медн с фугатом. Качество осадка меди определяют по ее чистоте, гранулометрическому составу и влажности. Основной показатель чистоты осадка — содержание медн. При гидрометаллургической переработке цементной меди важно содержание железа,
мцшьяка, хлора, нерастворимого остатка.
С увеличением содержания меди снижается объем цементного осадка, а следовательно, н транспортные расходы. По этой же при-
чине осадок должен быть стойким к окислению и достаточно подсушенным, особенно при перевозке в зимнее время.
В тех случаях, когда при цементации не удается получать богатый осадок, возможно его обогащение (механическое, химическое или их комбинация).
Крупные включения скрапа и мусор отделяют прн просеивании осадка. Мелкий скрап частично может быть удален при магнитной сепарации, а шламовые включения—в процессе гидросепарации. Однако прн механическом обогащении неизбежны потери меди, особенно при прочном сцеплении ее с скрапом. В последнем случае даже магнитная сепарация не дает положительных результатов.
При обработке цементного осадка подкисленными растворами медного купороса удаляется железо, растворимые примеси, снижается содержание кислорода.
Имеются предложения1 просеивать грязную цементную медь « 60% Си) через сито 0,21—0,42 мм, а минусовую фракцию обрабатывать раствором серной кислоты. В отфильтрованном остатке после промывки, сушки и повторного просеивания через сито 0,1 мм содержание меди повышается до 95%. После двустадийной флотации плюсовой фракции и кислой отмывки пенного продукта в нем содержится 97% меди.
Несколько улучшается качество цементной меди при флотационном обогащении. Принципы флотации цементной меди изложены С. И. Митрофановым с сотрудниками и основные выводы авторов приведены ниже:
1) наличие ионов медн и железа, высокое pH пульпы исключают применение ксантогеиатов;
2) для флотации неокнсленных частиц используют неионогенные, а для окисленных частиц — ионогеиные собиратели;
3) Для флокуляции дисперсных частиц медн и интенсификации флотации применяют дополнительные собиратели (аполярные масла); шла'мы пептизируют введением депрессоров (натриевых солей полн-фосфатных кислот) в количестве 3—10 г/т;
4) показатели флотации цементной меди ухудшаются прн содержании в пульпе ионов хлора бояее 220—300 мг/л (что связано с депрессией флотируемых частиц из-за образования пленки полухлорн-стой медн; кроме того, ионы хлора ускоряют окисление цементной медн и при наличии ионов медн, сульфатов железа, алюминия, марганца из-за ухудшения смачиваемости поверхности частиц меди собирателями и изменения их фюрмы;
4) прн флотации поддерживают pH = 5ч-6,5 и плотность пульпы 20—33 % твердого.
Прн выборе способа использования цементной меди учитывают масштаб ее производства, близость и возможность кооперирования металлургического предприятия, рентабельность реализации.
Наиболее простой и распространенный способ использования цементной медн — ее переработка в виде холодных присадок при
1 Пат. (США), 3282675, 1964.
конвертировании. Однако влажность и дисперсность этого материала осложняют ведение операции и вызывают потери меди за счет пыле-выиоса. Более предпочтительно предварительно гранулировать или брикетировать цементный осадок. Иногда цементную медь шихтуют с огарком и загружают в отражательные печи. Такой вариант использования цементной меди прост, не требует специальной технологии, позволяет извлечь благородные металлы и использовать кремнезем. Он вполне приемлем для установок малой мощности или при близком расположении медеплавильного комплекса.
Однако переработка цементной медн в конвертере и тем более в отражательной печи не может быть признана рациональной: богатый продукт подвергается такой же многостадийной обработке, как и материалы, содержащие 15—30% Си.
Прн большом масштабе производства цементной меди и удалении заводов более рационально организовывать ее переработку непосредственно иа месте получения. Экономическим стимулом при этом служит существенная разница в стоимости медн в цементном осадке и в более чистой продукции.
Американские исследователи изучали возможность переплавки цементной меди с последующим рафинированием [267].
Цементную медь (77,5% Си, 3,4% Fe, 0,8% Pb, 0,05% Ni, 06% Sn, 0,9% S) шихтовали с кремнеземом (~1%) и фтористым кальцием (1—2%) для получения жидкотекучего и хорошо отделяемого шлака. Для плавки рекомендовали нндукционные.или электродуговые печи, футерованные угольными (графитовыми) блоками в связи с меньшей их проницаемостью для расплавленной меди.
После плавки в продукте содержалось 99,8% Си, а - после рафинирования 99,9% Си. Расход на 1 т медных слитков электроэнергии равен 650—700 кВт ч, электродов 3,2—3,8 кг.
По данной схеме, минуя конвертирование, получают достаточно чистую медь. Эта технология заслуживает внимания при наличии дешевой электроэнергии.
Известны попытки получить из цементной медн продукт, пригодный для нужд порошковой металлургии [268—271 ]. Помимо чистоты к порошку, предъявляются требования технологичности при прессовании и спекании (текучесть,1 гранулометрическая однородность, насыпная масса). Отмеченные свойства в значительной степени зависят от формы и размера частиц, которые в свою очередь зависят от условий цементации. С увеличением содержания меди и кислоты пропорционально повышается выход тонких фракций, а плотность и текучесть порошка снижаются. Присутствие железа способствует некоторому увеличению крупиостн порошка.
Из проверенных элементов (Zn, Al, Mg, Мп, Sb, As, Bi, Pb) наиболее загрязняет осадок висмут, в меньшей степени — цинк, сурьма, мышьяк, остальные практически не оказывают влияния. Прн спекании порошка удаляется до 97% As и 53% Sb, a Bi и Zn не отгоняются.
Влияние гидродинамического режима оценивали, используя раз' личные аппараты при цементации (чаны с механическим перемеши 124
ванием, барабан и глубокую ванну) и способы подачи раствора, содержащего 7,1 г/л Си, 11 г/л Fe, 16,4 г/л H2SO4 (табл. 20). Наиболее плотный и крупный осадок получали в глубокой ванне, а также при периодическом или полунепрерывном ведении процесса. Наиболее мелкий и однородный по крупности осадок, загрязненный железом, — в барабанном аппарате (табл. 20).
Таблица 20
Зависимость свойств цементной меди от типа осадительного аппарата
Тип аппарата Режим осаждения Насыпная масса, г/смв Содержание фракции -0,25 мм, % Содержание Fe в осадке, %
Ча» Периодический 3,13 61,5 0,3
Полунепрерывный 1,73 93,7 0,5
Глубокая » 1,40 96,8 0,5
ванна
Барабан Непрерывный 1,10 100,0 2,0
Цементная медь, осажденная жестью или чугуном, не отличалась текучестью и имела наименьшую плотность. Примеси в осадителе загрязняли осадок; так, прн использовании чугуна, жести, высечки в нем содержалось медн соответственно 90,3, 98,5, 99,8%.
Авторами работы [268 ] была рекомендована следующая технология получения медного порошка, пригодного длд порошковой металлургии: цементный осадок обрабатывали в течение часа подкисленным раствором, содержащим 12 г/л Си, pH = 1,8-г-2,5 при температуре 50° С. В отфильтрованном, промытом и подсушенном осадке содержалось 90—95% Си и < 0,1% Fe, а прн сушке его в защитной атмосфере до 98% Си. Прн спекании в атмосфере водорода предварительно подсушенного на воздухе осадка содержание меди повышается до 99,8%. Технологические свойства порошка дополнительно регулируются прн измельчении получаемого спека.
Авторами работы [271 ] предложено после отделения включений крупностью — 0,42 + 0,15 мм восстанавливать просеянный остаток цементной меди в атмосфере водорода. По сравнению со стандартными порошками порошки из цементной медн были менее текучи, более пористы, а для получаемых из них изделий предел прочности оказывался меньше.
Несмотря на заманчивость получения прн цементации порошка, пригодного для нужд порошковой металлургии, это направление нельзя признать рациональным. Свойства цементного порошка, как уже отмечалось, во многом зависят от условий его осаждения, обеспечение которых в ряде случаев влечет за собой меньшую полноту или скорость осаждения медн. Получение качественного осадка (~90% Си) с приемлемыми техиико-экоиомИческими показателями возможно только из чистых и богатых по медн растворов высокосортным осадителем при тщательном технологическом контроле про
цесса. Реализация этих требований осложняется огромным объемом перерабатываемых растворов и относительно небольшим выходом цементного осадка.
Более рационально получение кондиционной продукции в процессе химико-металлургической доработки цементного осадка.
Экономика [82, с. 617—42; 234; 240; 255; 272—273].
В связи с использованием достаточно простого оборудования капиталоемкость цементационного осаждения меди невелика. Структура капитальных затрат на сооружение двух цементационных установок производительностью 454 и 4540 т/год, по данным работы [2721, приведена ниже:
454 т/год 4540 т/год
26,0 19,5
38,0 46,5
24,0 14,0
8,0 10,0
4.0 10,0
100,0 100,0
Цементационные желоба и площадка для сушки осадка...........................
Система распределения и транспортировки раствора..............................
Оборудование для хранения и обработки скрапа ................................
Транспортные и вспомогательные сооружения ...................................
Прочие расходы . .................
Удельная капиталоемкость технологии зависит от масштаба производства и прн выпуске 450—4500 т/год колеблется от 22 до 55 долл, на 1 т меди.
Более существенное значение имеют эксплуатационные затраты, в структуре которых основная доля приходится на железный скрап, кислоту, заработную плату.
Величина эксплуатационных затрат зависит от обеспечения реагентами и их стоимости, уровня механизации, состава растворов. Для ориентировочной оценки затрат можно рекомендовать эмпирическую зависимость вида:
э = д + -|-,
где Э — эксплуатационные расходы;
А, В— постоянные коэффициенты;
q— содержание меди в растворе, г/л.
Для одной из цементационных установок в Перу, перерабатывающей растворы с содержанием 0,25 г/л Си, авторы работы [2551 приводят следующие величины коэффициентов: А = 3,0; В = 1,25. По данным Ф. Коппэ [234 ], для условий работы установок в США А - 13-^22 и В = 1,25.
Прн стоимости скрапа 50—52 долл/т и расходе его 1,5 т на 1 т меди удельные затраты на скрап составляют 84 долл.
Затраты на заработную плату зависят от производительности установки: например 90,7 долл/т — при производительности 454 т/год медн, 13,2 долл/т’— 4540 т/год медн, 2,86 долл — 100 тыс. т/год меди.
Погрузочно-разгрузочные н транспортные расходы составляют 15,4 долл на 1 т меди.
При цементации дополнительно расходуется кислота в среднем иа 2,43—6,57 долл/т меди
Таким образом, затраты на получение 1 т меди с использованием цементации (с учетом энергетических затрат, амортизации, содержания и ремонта оборудования и др.) составляет 445—905 долл.
Осаждение меди из растворов цементацией железным скрапом имеет ряд существенных недостатков, основные из которых приведены ниже:
1) потребность и большой расход качественного железосодержащего осадителя, обеспечение которым особенно для удаленных установок представляет определенную трудность;
2) накопление солей железа в оборотных растворах, что осложняет процесс выщелачивания руды в связи с образованием нерастворимых основных сульфатов.и гидроокисей железа;
3) повышенный расход кислоты из-за взаимодействия ее с железным скрапом;
4) невысокое качество конечной продукции — цементной медн, переработка которой до металла требует дополнительных эксплуатационных и капитальных затрат.
• Новые идеи разработки по совершенствованию цементации
В связи с тем что цементацией извлекается значительная часть меди прн переработке забалансовых руд продолжаются поиски путей совершенствования этого процесса. Работы проводятся в основном в следующих направлениях: использование физических приемов воздействия (ультразвук, магнитная обработка раствора и др.) иа кинетику процесса; снижение расхода осадителя; изыскание более совершенного аппаратурного оформления.
По данным работы [274 ], кратковременное (1—2 мин) наложение ультразвука мощностью 1,8—2,2 Вт/смг в начале цементации увеличивает скорость процесса в 2—3 раза. Это связано с более быстрой дегазацией поверхности осадителя и удалением с нее осевшей-меди.
Скорость осаждения меди при 0,1—1,1-мм амплитуде колебаний пластины осадителя возросла в 12,5 раз по сравнению с показателями, полученными на неподвижной пластине [275]. Наблюдается заметная турбулизация пограничного слоя. Наложение ультразвука, кроме того, способствует ускорению отстаивания осадка цементной меди.
Для увеличения скорости осаждения меди и улучшения качества получаемого осадка предложено использовать осадитель в виде пластин, вибрирующих с частотой около 10 колебаний в секунду 1.
Расход железа при цементации меди снижается за счет введения ингибиторов коррозии железа. Ингибиторы тормозят взаимодействие железа с кислотой, при этом скорость осаждения меди в ряде случаев
Авт. свид. № 191811. Бюлл. изобр. и тов. знаков, 1967, Ks 4, с. 108.
несколько возрастает. В качестве ингибиторов рекомендуют вещества органического происхождения, содержащие серу или азот (например, костный жнр) *. Необходимое pH исходного раствора должно быть в пределах 1,4—3, а по окончании осаждения — не менее 3,5— 4. Расход ингибитора не превышает 0,5—1,0 кг на 1 м3 * s раствора. Имеется предложение окисленный скрап обрабатывать раствором серной кислоты в барабане, после чего вводить ингибиторы коррозии 2.
Для снижения расхода железа прн цементации рекомендуют в аппарате избыточное давление водорода (1,2 ат) за счет гидростатического напора обрабатываемого раствора, применения герметичной аппаратуры или подачи водорода в аппарат извне 3. Некоторые авторы предлагают использовать алюминиевый скрап для цементации медн (276—277]. В связи с большой активностью алюминия (почти в 3 раза, чем у железа) расход его составляет 0,33—0,42 кг/кг медн, при этом получается крупнозернистый, легко отслаивающийся цементный осадок. Применение алюминиевого скрапа будет экономически оправдано прн стоимости его не выше 4,5 кратной по отношению к стоимости железного скрапа.
Конструктивное усовершенствование аппаратов для цементации медн сводится к интенсификации гидродинамического режима и созданию условий, обеспечивающих снижение расхода осадителя. Предлагают вести осаждение медн в аппаратах, состоящих из концентрических труб. В наружное кольцевое пространство загружают губчатое железо, а раствор подают через центральную трубу, что обеспечивает большую скорость движения раствора и лучший контакт его с осадителем ‘.
Имеются сообщения по усовершенствованию барабанных цемеи-таторов 6, например с устройством для наложения ультразвуковых колебаний н возможностью возврата образующихся водородсодержащих газов в реакционное пространство.
Извлечение меди с использованием экстракционно-сорбционной технологии
Положительный опыт извлечения урана и сопутствующих элементов из бедных растворов с помощью использования экстракционно-сорбционной технологии способствовал развитию исследований по изысканию режимов, извлечения меди в растворы, пригодные для электролитического или автоклавного ее осаждения.
Экстракция
О работе установки с использованием экстрагента —бромлаурн-иовая кислота — керосин сообщается в публикации (1811. Исходные растворы содержали 4—5 г/л меди, после реэкстракции содержание
Т Пат. (США), № 3194653, 1963.
’ Пат. (США), Х8 3288599, 1966.
s Пат. (Англия), № 1204549, 1967.
‘ Пат. (США), 3373984, 1965.
» Пат. (США), № 3511488, 1966. Пат. (Япония), № 940, 1966.
медн в обогащенном растворе повышалось до 80 г/л. Извлечение меди в катодный металл достигало 99%. Специфика экстрагента определяла обязательную нейтрализацию раствора, в связи с чем затраты на нейтрализатор (известняк, доломит) достигали 34—36% от стоимости производства 1 т меди. Капитальные затраты на сооружение только экстракционной установки, обеспечивающей получение 15 тыс. т медн в год, составили около 700 тыс. долл
Более широкие исследования и полупромышленные испытания экстракционного варианта извлечения меди из бедных растворов были проведены после появления экстрагентов серии LIX (179, 2781.
С 60-х гг. научными центрами Горного Бюро и в Солт Дэйк Сити (США) ведутся исследовательские работы в этом направлении. За период около 5 лет экстракционная технология прошла, успешные испытания на ряде полупромышленных установок и в настоящее время используется на двух промышленных объектах.
На установке,фирмы «Эльдорадо» (шт. Онтарио, Канада) применяется экстракция для выделения цветных металлов (в том числе и медн) из пульпы (20% твердого) после извлечения урана [279]. Экстракцию проводили при pH = 2,2, общем потоке фаз 30,2 л/ч и соотношении потоков водная фаза — органика, равном единице. Экстрагентом служила смесь, 10% Д2 ЭГФК— 10% LIX—63, 3% изодецилового спирта, 77% разбавителя (реагента с торговой маркой Flach Naphta — 140).
Для нейтрализаций применяли раствор, содержащий 205 г/л аммиака. Из пульпы (6,4 г/л Си, 2,8 г/л Ni, 5,1 г/л Со, 0,05 г/л U), 99% меди извлекали в органическую фазу, содержащую 6,4 г/л Си, 0,017 г/л Со, 0,14 г/л Ni. Реэкстракцию проводили при 50° С раствором, содержащим 80 г/л серной кислоты, с извлечением до 86% медн. После осаждения меди и корректировки кислотности селективно экстрагировали никель и кобальт.
В 1966 г. фирмой «Дженерал Милз» (шт. Колорадо) пущена в эксплуатацию полупромышленная установка, перерабатывающая около 70 м3/ч раствора, содержащего 1,1—1,6 г/л Си (2801. Осуществляя экстракцию при pH = 2,2 в четыре стадии, достигли извлечения меди более 99%. Эксплуатационные затраты были определены в 42— 76 долл, на 1 т меди.
На полупромышленной установке кампании «Дювал Корпорейши» (г. Гаксон, шт. Аризона, США) с применением экстракции перерабатывали около 0,284 м3/мии раствора (1,5 г/л Си), получая 545 кг/сут катодной меди. Упрощенная технологическая схема процесса и составы получаемых продуктов по операциям приведены на рнс. 43 [281—2821. В качестве экстрагента использовали органическую фазу, содержащую 7% (объемн.) LIX-64, в керосине. При че-тырехстаднйиой противоточной экстракции извлекали 97% Си и только 2% Fe. Богатый раствор подвергали электролизу при плотности тока 205 А/м2 и напряжении 2,6 В. Обнаружено отрицательное влияние вносимой органики на показатели электролиза. В расчете на 1 т медн затраты, связанные с потерями L1X-64, не превышали 22—44 долл/т меди при стоимости экстрагента 5,5 долл/кг.
9 С. С. Набсйченко
129
В промышленном масштабе жидкостная экстракция меди из бедных растворов с последующим электролизом впервые была реализована фирмой «Ранчерз Експлорейши» на руднике Блюберд (шт. Аризона, США) [283—2861. Схема установки показана на рис. 44, а показатели извлечения меди приведены в табл. 21. Растворы от кучного выщелачивания осветляли на фильтрпрессе (фильтрующая перегородка — измельченный диатомит и 1 слой полипропиленовой ткани), после чего через теплообменник для подогрева в хо-
Раствор от выщелачивания (1,5г]лСи, 0fi5e]xFe,pH-2.5)
Раствор (0,05 г/л Си, 0,Ыг/лРе,рН=18)
На Выщелачивание
Регенерированный экстрагент
(0,15г/л сидоогг/л Fe)
' Л-х стадиальная__________
экстракция *
Органическая фаза
(1,Бг/лСи, 0,012 г/л Fe) I 3-х стадиальная
~ реэкст^акция
Обогащенный раствор
(ЗУг/лСщг.Ог/лРе, 152г]лНг50^ Электролиз
Отработанный электролит Си катодная
(Зг/лСи, 2.0 г/л Fe, 1В0г/лН250ч) (99,95 % Си)
Рис- 43. Схема технологических операций на полупромышленной установке фирмы «Дювал»
лодиое время года (I = 24—28° С) их направляли в цикл экстракции с использованием LIX-64N. Смесительные чаны диаметром 3,3— 3,9 м и высотой 3,9 м, а также бетонные отстойники (43,5 X 24,6 м) были облицованы стекловолокном. Экстрагентом служила смесь L1X-64N (7—8%) в керосине марки Napoleum-470, противоточную экстракцию проводили в 3 стадии.
Рафинат после корректировки кислотности возвращали на кучное выщелачивание, а органическую медьсодержащую фазу подвергали реэкстракции с получением раствора, который после корректировки кислотности и удаления следов органики 1 направляли иа электролиз. Осаждение медн проводили при скорости циркуляции 56,8 л/мии. Вайны соединены в 4 секции по 12 штук. Раствор поступал параллельным потоком в каждую ванну. В ваине 40 катодов (0,52 X X 0,52 м) и 41 свиицово-сурьмяный анод (6% Sb). Масса выгружаемых катодов 47—63 кг; состав их: 99,9% Си; 0,04% Са, 0,008% Fe, 0,0004% Ni, 0,0007% Zn, 0,00001% Mg, Mn, Sn не обнаружено. Штат
1 Установлено 6 флотационных машин с емкостью камеры 2,83 м3.
обслуживающего персонала составлял 75 человек, в том числе в цикле выщелачивание—экстракция—электролиз<было занято 42 человека.
С пуском в эксплуатацию нового месторождения (4 млн. т руды, 0,74% Си), разрабатываемого способом подземного выщелачивания, годовая мощность установки возросла с 5,2 до 6,2 тыс. т меди 1287—288 ].
В 1967 г. работала опытная установка фирмы «Багдад» (шт. Аризона, США) производительностью 0,334 м*/мин раствора (0,7—1,0 г/л Си). Достигнуто извлечение меди около 97%, а эксплуатационные затраты составили 34 долл на 1 т меди. Успешные результаты испытаний, законченные в 1968 г., способствовали сооружению промышленной установки стоимостью 5 млн. долл, рассчитанную на производительность 125 м3 в мин, или 6530 т/год меди в виде катодов (99,95% Си) [289—294]. Экстракцию проводили в четыре стадии, применяя L1X-64; установлены 4 параллельных линии смесителей (см. табл. 21) (рис. 45). Смесители выбраны из расчета продолжительности пребывания в них раствора 2 мин.
Они оборудованы двумя мешалками диаметром 102 мм по длине вала (импеллер — лопастная турбинка), вращающегося со скоростью 50 об/мин. Отстойники рассчитаны на удельную про-изводительнОсть81,5л/(мин -ма).
Электролиз проводили в 42
Рис. 44. Схема экстракционно-электролизной установки получения медн на руднике Влю-берд:
1 — сборник растворов от выщелачивания руды; 2 — фильтрпресс; 3 — расходная емкость растворов (380 м1); 4 — теплообменник; 5 — смесители; 6 — отстойники цикла экстракции;
7 _ отстойники цикла реэкстрекции; 8 — емкость для экстрагента (190 м*); 9 — емкость для рафината; 10 — распределительная насосная станция; 11 — емкость для кислоты; 12 — установка для доизвлечеиня потерянной органики; 13 — расходная емкость обогащенного раствора; 14 — электролизное отделение
вайнах, на матричном переделе за-
пято 6 ванн. Ванны и трубопроводы футерованы поливинилхлоридом: емкости, экстракционное оборудование и арматура изготовлены из
стали 316L.
С переходом.па экстракционную технологию возрос выпуск меди за счет улучшения показателей при кучном выщелачивании, поскольку было устранено накопление железа в поступающих растворах. По сравнению с автоклавной схемой переработки цементной меди удалось снизить расходы на кислоту, отпала необходимость в дефицитном скрапе, уменьшены капитальные затраты.
Успешная практика установок фирм «Ранчерз» и «Багдад» вызвала повышенный интерес других предприятий к использованию
Таблица 21
Показатели извлечения меди из растворов от выщелачивания руды по схеме экстракция — электролиз
Показатели Фирма «Ранчерз ЕксплореЯшн» Фирма «Багдад»
по проекту 38 ИЮНЬ декабрь 1969 г.
Количество исходного раствора,
м3/мин 3,68 3,53-4,25 3,55—4,1
Содержание в растворе, г/л:
Си 2,5—2,90 4.5 2,7—3,0
H2SO4 2,80 4,0 3,4—4,0
Fe3* 0,90 — 1.1—1.8
Fe2* 0,10 — 0,2—0,3
Отношение потоков органической и
водной фаз па стадии экстракции 2,8 2.5-3,0 2.3-3 0
Содержание в рафинате, г/л:
Си ... 0,2-0,3 1.5 0,33—0,43
HaSO4 7,8 12,0 7,5—8.3
Отношение потоков органической фазы и отработанного электролита иа
стадии реэкстракцни Содержание Си в органической фазе, г/л: 4,2 3,0 4,1—5,7
после экстракции 1,01 — 1,20 1,5 1,0—1,1 0,1—0,17
> реэкстракцин 0,09-0,12 0,5
Содержание в растворе, поступающем
на электролиз, г/л: Си ... . 35,0—36,2 33 32- 44
H2SO4 .... 145,0—150,0 100—150 139—150
Fe3* ' 1,3 — 1,2-2,3
Fe3* . . 0,2 — 0,2—0,8
Выход по току при электролизе, % 83.0—84.25 90 0 70—83
Катодная плотность тока А/м3 190—220 — —
Расход на 1 т медн: HoS04 . . 5,1 2,7—4,7
электроэнергии, тыс. кВт ч Потери органической фазы, л на 1 м3 2,00—2,64 — 2,2
рафината 0 1—0.2 — 0 14—0,17
экстракционной технологии для извлечения меди из низкосортного сырья. Было сообщение [295—296] о проектировании установки кампанией «Нчанга. Консолидейтед Коппер Майнз Лтд» (Замбия) для переработки низкосортных окисленных концентратов и хвостов флотационного обогащения смешанных руд с окончанием строительства в 1974 г. Первая очередь предполагает использовать стандартную схему выщелачивание — цементация с производством около 20 тыс. т меди. Прн пуске второй очереди выпуск меди возрастет до 55—60 тыс. т, при этом завод будет полностью работать по схеме выщелачивание—экстракция—электролиз (рис. 46). Вследствие более полного извлечения меди из сырья можно ожидать практически неизменного уровня горных работ. В качестве экстрагента будет применяться реагент LIX-64N. Большое внимание будет уделено совершенствованию аппаратурного оформления экстракции, дальней-
тему снижению потерь органической фазы и устранению ее влияния на процесс электролиза.' Выбор новой технологии во многом был обусловлен дефицитом серной кислоты, необходимостью ликвидации накопления железа в оборотных растворах, получением более дорогой продукции.
Практика действующих установок показывает, что успех экстракционной технологии во многом зависит от совершенства используемой аппаратуры и обеспечения минимальных потерь экстрагента. Для аппаратурного оформления экстракции используют экстракторы следующих типов: колонные, центробежные, смеситель—отстойник
Рис. 45. Технологическая схема получения катодной меди иа руднике в Багдаде:
1 — смесители; 2 — отстойники; 3 — емкость для LIX-64; 4 — емкость для керосина; 5 — емкость для медьсодержащей органической фазы; 6 — смесители цикла реэкстракции; 7 — отстойники цикла реэкстракции; 8 — емкость для богатого раствора; 9 — теплообменник; 10 — расходная емкость; 11 — матричные ванны; 12 — коммерческие ванны; 13 — емкость отработанного электролита
[176; 297—298; 299, с. 35—411. При выборе аппарата учитывают необходимое число стадий контакта, физико-химические характеристики (гидродинамический режим, продолжительность контакта, показатели расслоения, поверхность) и' стоимость.
Наиболее просты и дешевы колонные аппараты, особенно если необходимое число стадий контакта больше 4—5. Эффективность их работы заметно повышается при использовании пульсационной техники, обеспечивающей простой и надежный контроль гидродинамического режима. Однако в этом случае заметно возрастают энергетические затраты и необходим дополнительный реагент — сжатый воздух.
Центробежные экстракторы компактны, высокопроизводительны и эффективны. Особенно хорошие результаты получают для трудно-расслаивающих фаз при минимальных потерях экстрагента^ Производительность их колеблется в широких пределах (0,5—405 м3/ч), а количество теоретических ступеней контакта достигает 2—12. Устройство этих аппаратов более сложное, что затрудняет их эксплуатацию и обслуживание, кроме того, необходим большой расход электроэнергии.
Наибольшее распространение в практике экстракции меди получили аппараты типа смеситель—отстойник; им свойственны: высокий к. п. д. каждой секции (близкий к 100%) независимо от ее размеров; возможность обеспечения любого соотношения объемов фаз в смесительной н отстойной камерах независимо от соотношения потоков в каскаде; стабильность работы при отклонениях от нормального режима: быстрый вывод на режим или отключение из процесса. Вместе с тем для них характерны большое количество перемешивающих устройств и невысокая компактность.
Рис. 46. Технологическая схема установки кампании «Нчаига»:
I — емкость раствора от выщелачивания; 2 — фильтр; 8 — смесительно-отстойные экстракторы; 4 — аппарат для отделения органики; 5 — реэкстракторы; 6 — емкость для хранения экстрагента; 7 — электролизные ванны; 8 — фильтр оборотного электролита; 9 — емкость для хранения кислоты; Ю — аппарат для отделения органики иэ рафината
Эффективность работы этого типа экстрактора во многом зависит от гидродинамического режима в смесительной камере. Используемые винтовые, турбинные, конусообразные мешалки в ряде случаев приводят к «проскоку» фаз через смесительную камеру в отстойную, что снижает удельную производительность аппарата. Применение смесительно-транспортирующего устройства поршневого [299, с. 35—41] или пульсационного [170’, с. 163—-1741 типа1 при неизменной эффективности массообмеиа и размерах смесительной камеры позволяет уменьшить размеры отстойных камер и повысить тем самым компактность аппарата.
В работе [184 I приведены следующие данные по стоимости основных экстрагентов, пригодных для извлечения меди: нафтеновая кислота 283 долл/т, кислый «Версатик» 489 долл/т, LIX-63 и LIX-64 5870 долл/т, «Келекс» 14 420 долл/т, т. е. например, стоимость 1 т экстрагента L1X-64 в несколько раз превышает стоимость 1 т катодной меди. Поэтому всемерное снижение потерь экстрагента весьма актуально Основные потери связаны с растворимостью и уносом экстрагента в водной фазе из-за недостаточно эффективного разделения водной и органической фаз и проскока неиспользованного экстр
1 Помимо смешивания фаз, выполняется роль нагнетательных насосов для перекачки смеси.
агента в отстойник. Аналогичные явления возможны и на стадии реэкстракции, в результате чего экстрагент попадает в электролизное отделение, где не только ухудшает качество катодных осадков, но и совместно с кислотными испарениями даже в незначительных количествах загрязняет атмосферу цеха. Поэтому зеркало ванн на установке в Багдаде покрывают керосином. При наличии водной фазы в медьсодержащей фазе в последнюю попадает железо, что в итоге осложняет поддержание его концентрации на уровне, определяемом требованиями электролиза (1—1,5 г/л).
Попадание электролита в органическую фазу после реэкстракции не только обедняет раствор, поступающий на электролиз, по и повышает содержание кислоты в экстрагенте, что ухудшает равновесные условия иа стадии экстракции и повышает потери меди с рафинатом.
Условия разделения органической и водной фаз во многом зависят также и от присутствия в растворе шламовых взвесей, которые образуют промежуточный слой между несмешивающими фазами в отстойниках, особенно на второй стадии реэкстракции. Поэтому необходимо
Таблица 22
Некоторые свойства отечественных ионитов, используемых для сорбции меди
Марка яокнта
Коэффициент набухании, %
Активная группа
Аниониты:
ЭДЭ-Юп АН-31
АН-2Ф
АВ-16г
1,4 1,64
1,2 1,7
1,4 1,7
1,2 2,2
Катиониты:
СГ-1 2,0 1,85
КУ-1 1,3 1,76
КУ-2 1,5 1,2
Амфолиты:
АНКБ-1 1,2 1,7
АНКБ-2 АН КБ-5 АНКБ-7
2.3 1.0
2,0 1,75
1,2 2,75
60,7
20,3
40,9
61,1
12,8
18.0
23.6
129,0
115.0
32.0
70.0
3100
4500
1500
5500
1600
1200
2250
Опытное производство То же
90
120—
130
—N (R3) = NH =NH; = N;— - N+(CH3)3 =NH; = N
=NH3; = N,—
__
-COOH
—SO3H;—OH
—SO3H
Амино- и Карбоксильные группы
8»
• Определена для раствора, содержащего 2 г/л Си. 50 г/л Na,SO,, отношение объема раствора (мл] к массе смолы (г) составляет 250, продолжительность контакта раствора и сорбента 7 я [170. с. 72—80].
тщательно фильтровать растворы от выщелачивания, защищать аппараты и емкости от попадания пыли из воздуха, обеспечивать более спокойный режим перетекания раствора в отстойник. Периодически слой шлама отсасывают в отдельную емкость, в которой ои отстаивается в течение нескольких часов. Слой органической фазы декантируют и возвращают в производство. По мере накопления после тщательного отделения органики шлам сбрасывают в отвал
По данным практики работы установок фирм «Багдад» и «Ранчерз» потери органики на 1 м3 раствора составляют соответственно 0,14— 0,16 л и 0,1—0,20 л, из которых
значительная часть приходится на рафинат (табл. 22).
Использование активированного угля для улавливания органики нерентабельно в связи с дополнительными капитальными затратами, дороговизной угля и значительными расходами на его регенерацию. Еще менее эффективным было применение механических коагуляторов.
Наиболее простым и достаточно надежным способом оказалась пенная флотация, которая была осуществлена с помощью флотационных машин. Последние использовали для улавливания органики и из раствора, поступаю-
Рнс. 47. Стоимость экстракционной уста- ЩеГО на ЭЛеКТСОЛИЗ. ЭТО ПОЗВОЛИЛО иовки прн, различием объеме перераба- „ г ...... .
тываемых растворов,, начальное содержа- ПОЧТИ ИЗ ПОЛОВИНу уМСНЬШИТЬ иис си. сСи ~ 1 г/л безвозвратные потери _ органики,
а также во многом решить проблему токсичных сбросов
Для экстракционной технологии извлечения меди характерна высокая экономическая эффективность.
При использовании экстрагента L1X-64 на основании лабораторных данных был определен следующий порядок затрат иа 1 т катодной меди [178]1, долл.:
Потери экстрагента . 22—25
» кислоты . .2,2
Затраты на электроэнергию..............22
Итого . 47—80
Капитальные затраты на экстракционное оборудование установки производительностью 3,79 м3/мии в среднем оценивались из расчета 53—80 долл на 1 л/мнн.
1 В расчетах принято: стоимость экстрагента 5520 долл иа 1 т, потери его 0,05— 0,12 л на 1 м3 обрабатываемого раствора; выход по току >90%, стоимость электроэнергии — 10 долл за 1000 кВт-ч.
Отличительной особенностью экстракционной технологии является то обстоятельство, что мощность установки и затраты на ее сооружение опредепяются объемом поступающего раствора, а также содержанием в нем меди (рис. 47) [300—301 ]. К другим факторам, определяющим величину капиталовложений, относятся число стадий экстракции и осаждения, соотношение раствор : экстрагент, а также место сооружения установки и используемые конструкционные материалы.
Приведем средние данные [300] по структуре эксплуатационных затрат при извлечении 1 т меди с использованием экстракции и цементации (в скобках приведен нижний предел), долл.:
Экстракции с электролизом Цементация с доработкой осадка иа черновую медь
Электроэнергия > > 22,1 (19,6) 4,42(2,21)
Экстрагент . .' 66,3 (44,2) —
Трудовые н накладные расходы 66,3 (48,1) 28.7 (28,7)
Отходы и оборотные материалы 3,30 (2,21) —
Серная кислота 165,2 (48,5) 21,40 (99,3)
Железный скрап — 216,0 (84,0)
Постоянные накладные расходы . . 33,0 (22,1.)
Транспортные расходы и плавка — 154.2 (66,10)
Итого. . . 356,2 (184,7) 617,32 (280,31)
Таким образом, использование технологии экстракция—электролиз позволяет почти в 1,5—1,7 раза уменьшить эксплуатационные затраты на получение 1 т меди по сравнению с технологией цементация—переплавка. С учетом затрат на рафинирование черновой меди (для сопоставимости вариантов) эффективность оказывается еще больше. Приведенные данные позволяют считать экстракционный способ извлечения меди весьма перспективным: сокращается цикл получения катодной меди из руды, успешно решается проблема загрязнения воздушного бассейна, организация механизированного замкнутого производства. Преимущества экстракционной схемы особенно очевидны при разработке небольших месторождений, эксплуатация которых по стандартной технологии нерентабельна.
В ближайшие годы логичным окончанием экстракционной схемы будет, по-видимому, автоклавное осаждение меди — способ более производительный и эффективный, чем электролиз. Это предположение подкрепляется возможностью получения прн реэкстракцни растворов, содержащих до 90 г/л Си.
Экстракционная технология требует более квалифицированных кадров, сложного оборудования и связана с использованием токсичных и пожароопасных реагентов. Неясен пока вопрос о влиянии органики, попадающей в рафинат, на жизнедеятельность микроорганизмов при использовании его в режиме бактериального выщелачивания. Кроме того, необходима частичная нейтрализация рафината для обеспечения баланса в схеме по серной кислоте.
Последующее развитие экстракционной технологии предопределяет разработку эффективных и доступных экстрагентов (повышен-
иой емкости, селективности, минимально растворимых в водной фазе, с улучшенными эксплуатационными характеристиками, невысокой стоимостью), а также более совершенного аппаратурного оформления. В последние годы уделяется внимание разработке экстракции металлов непосредственно из пульп 13021. Основной недостаток этого метода — пока большие потерн экстрагента за счет образования устойчивых эмульсий в присутствии твердых частиц. Решение указанной проблемы рационально осуществлять в направлении выбора оборудования, обеспечивающего минимальное образование эмульсий. Наиболее перспективны для этой цели пульсационные аппараты, контакторы ковшевого типа.
Весьма перспективны поропластовые экстрагенты — пористый материал на основе полйуретана или полиэтилена, вмещающий экстрагирующую фазу высокой концентрации (вплоть до 1ООоо). Малая объемная масса, хорошая плавучесть вмещающего материала обеспечивают самопроизвольное отделение гранул с экстрагентом из пульпы. Испытания поропластовых экстрагентов в металлургии урана, никеля, кобальта свидетельствовали о их хороших кинетических н эксплуатационных характеристиках 1302, с. 68—87 ].
Сорбция и электродиализ
Первые работы по сорбционному извлечению меди из растворов от выщелачивания руд проведены на установке в Сьерро де Паско (Перу) в пятидесятых годах [303].
На сорбцию после предварительной нейтрализации до pH = 3,5 и отделения взвеси поступали растворы, содержащие 0,22— 0,243 г/л Си, 4,38—5,12 г/л Fe Извлечение меди на карбоксильных ионитах составляло 91—95,9%, а остаточное ее содержание в отработанном растворе — не более 0,012—0,006 г/л. Потери меди с последним не превышали 2—4,6%, а со смолой 2,0—4,4%.
После десорбции концентрация меди в элюатах возрастала в 37— 38 раз и достигала 9,8—10,5 г/л; железа переходило в элюаты не более 5—8%, что соответствовало его содержанию 8,6—14,4 г/л. Для регенерации ионита использовали кальциевую воду. Из элюатов медь выделяли электролизом, однако в связи со сложным составом раствора показатели его были неудовлетворительны: выход по току 33—51%, расход электроэнергии 8360—6150 кВт-ч/т. Расход реагентов па 1 т извлеченной меди составлял:
Известняка (74,5 СаСОэ), т 21,54 Серной кислоты (66° Be), т 11,74 Смолы, м3 . . 0.0283
Несмотря на неплохие показатели процесса, испытанный вариант сорбционного извлечения меди оказался неконкурентноспособным с цементацией в связи с большими капитальными и эксплуатационными затратами; последние обусловлены повышенным расходом смолы из-за недостаточной ее механической прочности н низкого качества обрабатываемых растворов.
В СССР проводятся обширные работы под руководством Б. Н. Ла-скорина по применению сорбционной технологии для извлечения медн из бедных растворов. Некоторые характеристики используемых смол приведены в табл. 22 [9, т. 4, с. 148—-51; 159, 170, с. 72—80; 304, с. 81—94].
При укрупненных испытаниях сорбционного извлечения меди из растворов от кучного выщелачивания руды лучшие результаты получены на смолах АВ-16г; АНКБ-7 [170, с. 35—40]:
Извлечение мети при рН=4-:-5, % 98,5—99
Остаточное содержание медн:
в сбросных растворах, г/л.......0,02—0,03
в десорбированном ионите, % . 0,04—0,05
При десорбции 20—30%-ным 'раствором серной кислоты получали товарный элюат (40—50 г/л Си, 50—60 г/л H,SO4), в который переходило до 60—70% от вымываемого количества меди. Остальное ее количество находилось в оборотном элюате, объем которого составлял около 8096.
Анализ работ, посвященных сорбционно-бесфильтрационному извлечению меди из пульп от выщелачивания смешанных руд, будет дан в гл. III. При сорбционно-бесфильтрациониой технологии устраняется необходимость предварительного разделения жидкой и твердой фаз н связанные с этим неизбежные потери меди с раствором, выводимым с осадком. Однако при сорбции из пульп несколько снижается емкость смолы и возрастают ее потерн. Потери ионита от истирания особенно заметны при увеличении плотности пульпы, крупности смолы и температуры [305].
Ряд исследований, описанных в литературе, посвящено сорбционному извлечению меди из рудничных вод. На одном из рудников в Северной Родезии для этой цели испытывали карбоксильную смолу (амберлит, IRC-50) [255]. Растворы, содержащие 0,15—0,3 г/л Си, 0,4 г/л Zn, 1,5—3,0 г/л Fe, 0,5 г/л H2SO4, предварительно обрабатывали известняком до pH = 4. На стадии сорбции извлекали до 95—96% Си и около 20% Zn. В элюаты переходило до 87% Си и 4 0% Fe от их содержания в исходном растворе. Медь из раствора (6 г/л) осаждали электролизом в виде чистого порошка.
В работе [169] описано использование ионитов КУ-1, КУ-2-8, КУ-21, СБС, КБ-4, АГ-3, АГ-5 для извлечения меди из рудничных вод, содержащих 0,518 г/л Си. Наибольшую полную динамическую обменную емкость имеют катиониты КУ-2-8 и КБ-4 в Na-форме соответственно 4,1 и 6,32 мг-экв/г. Для повышения емкости смол по меди необходимо предварительно удалить железо. Для элюирования пригодны 10—20%-ный раствор серной кислоты или 10%-ный раствор сульфата натрия. При использовании смолы КУ-2-8 в статических условиях в элюат извлекают 89—96% меди и 74,5—82% цинка.
В работе [306] сообщается о возможности достаточно селективного выделения меди (на 97%) при использовании амфолита. Исходные растворы, содержащие 0,15 г/л Си, 0,3 г/л Zn, 0,5 г/л Fe2+, 0,2 г/л Fe3+ (pH = 2,7), нейтрализовали содой до pH = 3,7-е-4,2.
Конечный элюат содержал до 50 г/л Си, около 10 г/л Fe и 2—5 г/л H2SO4.
Оценивая сорбционные свойства катионитов (КУ-2, КУ-5, КУ-36, КБ-2 X 2, КБ-51 X 5, СГ-1 в Н-форме), анионитов (АН-31, АН-34, АВ-16, ЭДЭ-ЮП, АН-68-5О4-форме), амфолитов (АНКБ-4,-7,-15,-18 в Н- и БО^-формах) в статических условиях и интервалов pH = = 1,0-?-4,6, авторы работы [1731 установили, что иониты АНКБ-1, -2, -7, -15, КБ-2 X 2, АВ-16 наиболее пригодны для сорбции меди из рудничных вод весьма сложного состава: 1,0 г/л Си, 9,0 г/л Fe2+, 1,0 г/л Fe3+, 0,5 г/л Zn, pH = 1,8--2,0.
Конструкция колонн, аппаратурное оформление сорбционной технологии при извлечении меди во многом идентичны урановому производству и освещены в специальной литературе 1307—311].
До настоящего времени сорбционная технология нигде не используется в промышленном масштабе для извлечения меди, хотя по сравнению с экстракцией это более простой в аппаратурном оформлении, эксплуатации и не менее надежный процесс. Невысокая емкость смол, недостаточная их механическая прочность, высокая стоимость — все это ухудшает экономические показатели сорбционной технологии и сдерживает ее промышленное использование в металлургии меди.
Ионообменные смолы применяют для изготовления ионитовых мембран (гомогенных и гетерогенных пленок, пластин). Они отличаются высокой электрохимической активностью и в зависимости от типа наполнителя проницаемы для ионов только одного заряда. Ионитовые мембраны широко используют для изготовления диафрагм электродиализаторов. Характеристика некоторых мембран, выпускаемых в СССР, приведена в табл. 23 [304, с. 15—241. Применяя,
Таблица 23
Характеристика гетерогенных мембран (0,ЗХ 600Х 1000 мм), выпускаемых в СССР
- Марка мембраны 1 Ион нт П рочность на разрыв кгс/см1 Набухае-мость в воде, % Удельное соп ротн влсн не в 1-я. NaCI Ом. см
марка содержание %
мк КУ-2 65 20—25 14—15 150—165
МА ЭДЭ-Юп 60 20—30 13—15 150-160
МКК КУ-2 65 110—120 7—8 150-170
МАК ЭДЭ-Юп 60 115—130 7—8 145—150
мкл КУ 2 55 150—180 3—4 170—200
МАА ЭДЭ-Юп 60 150—180 3—3,5 200—210
МКВ КУ-2 67 145—160 7—8 140—150
МАВ ЭДЭ-Юп 62 140—160 7—9 130—140
МАК—В АМП 65 120—135 7—8 140—160
МАЛ—В АМП 57 170—185 3—4 165—180
1 Первая буква: М — ыембраиа; вторая: К — каткоиитовая, А — аннонитовая; третья: К — капрон. Л — лавсан, а — вкиол.
например, катионитовые мембраны, при наложении разности потенциалов получают богатый раствор солей (в катодном пространстве) и регенерируют кислоту (в анодном пространстве). Электродиализ бедных растворов характеризуется повышенным расходом электро-
энергии из-за их невысокой электропроводности. Поэтому этот способ наиболее эффективен для частичного обессоливания концентрированных растворов, особенно с повышенным содержанием свободной кислоты, для выделения металлов из подобных растворов другими способами необходима предварительная цх нейтрализация. Присутствующие в исходном растворе взвешенные частицы (шлам, ил) существенно ' затрудняют ведение процесса и ухудшают его показатели.
При электродиализе для получения диффузата требуется свежая вода, что в ряде случаев осложняет водный баланс технологической схемы.
Рнс. 48. Схема диализатора фильтр прессов ого типа: 1 — ввод воды; 2 — мембраны; 3 — ввод раствора; 4 — вывод диффузата; 5 — камера для диализата; б — изоляция; 7 — камера Для диффузата; 8 — рама; 9 — вывод диализата
Наибольшее распространение на практике получили фильтрпрессиые диализаторы; их собирают
из пустотелых рам, в ко-
торые подают воду, и рам с вмонтированными мембранами, куда поступает исходный раствор (рис. 48). Электродиализаторы характеризуются постоянным режимом работы, что упрощает механиза-
цию процесса.
Выделение меди из элюата
Стоимость медьсодержащего продукта во многом определяет эффективность сорбционной технологии. Медь' может быть извлечена в виде солей (в результате химического осаждения, выпаривания) или металла (электролизом, электродиализом, автоклавным осаждением). Помимо капитальных и эксплуатационных затрат при выборе способа извлечения меди, необходимо учитывать возможность получения качественной продукции и регенерацию серной кислоты.
При химическом осаждении меди получают полупродукт, содержащий 40—60% Си. Одновременно теряется серная кислота, а в раствор в большинстве случаев вводятся дополнительные примеси, что осложняет организацию замкнутых схем.
Получение купороса связано с упариванием больших объемов бедного раствора. Учитывая неблагоприятное соотношение меди и железа для достижения приемлемого выхода товарного купороса, необходимо очищать элюаты от железа. При производстве купороса аппаратурное оформление достаточно простое, облегчается водный баланс схемы, устраняется накопление примесей.
Способы электролитического и автоклавного осаждения позволяют выделять медь в виде качественной продукции и регенерировать серную кислоту.
Получение катодной меди из элюатов (температура раствора t = 50 С, катодная плотность тока £>к = 100 А/м2, напряжение на ванне U = 1,7 В) исследовали в работе 1170, с. 112—1181; выход кондиционной продукции не превышал 16—36%; выход по току составлял 54—75%, расход электроэнергии 2,5—2,6 тыс. кВт-ч/т. При использовании большой плотности тока достигнуто глубокое обезмеживанне, но при этом получился губчатый осадок (86— 97% Си).
Наличие железа в растворе (10 г/л) особенно при одновременном присутствии иона хлора (1,0 г/л) снижает выход по току до 60% при DK = 100 А/ма и до 84% при DK = 200 А/м2. Кроме того, СГ ухудшает качество осадка.
Используя предварительное восстановление сульфата Fe3+, перхлорвиниловые диафрагмы для анодов, удается повысить выход по току до 90—95% и снизить расход электроэнергии до 1,7 тыс. кВт-ч/т.
Более удовлетворительные результаты, чем при стандартном варианте электроэкстракццн, имеют место при электродиализе с аниони-товыми мембранами: при £>к = 150 А/ма, U = 2,2ч-2,6 В, t = 50ч-ч-55° С достигнут выход по току 93—98% [3121. Высококачественные катодные осадкн получаются вплоть до концентрации 15 г/л меди при отношении концентрации меди и железа, равном 1,6—2,8. Отработанный регенерат, содержащий 1—5 г/л Си, 12 r/л Fe, 500 г/л H2SO4, пригоден для использования иа стадии десорбции. Расход электроэнергии при электродиализе больше н достигает 3,3— 3,7 тыс. кВт-ч/т меди.
Автоклавное осаждение меди непосредственно из элюатов позволяет не только получать качественный медный порошок и регенерировать серную кислоту, но и создать высокопроизводительное, механизированное производство \ В работе [313] показано, что при 140— 150° С рн, = 26ч-28 ат н C(NH.). so. = 50ч-100 г/л осаждается до 90—95% меди со средней скоростью 0,5—0,7 кг/(м3-мнн) даже из относительно бедных элюатов (20—30 г/л Си, 20—40 г/л H.,SO4). Получаемый порошок по составу не уступает электролитному. Ме-таллы-примеси не осаждаются с медью, а вводимый сульфат аммония
1 Пат. (США), К» 2831763, 1958.
не ухудшает показатели десорбции при использовании оборотных растворов. Технологическая схема извлечения меди из руды с использованием сорбционного обогащения растворов от выщелачивания и последующего автоклавного осаждения меди из элюатов приведена на рис. 49.
Автоклавную технологию в связи с использованием более сложного оборудования целесообразно применять при крупнотоннажном производстве меди. Для небольшого масштаба производства большого внимания заслуживает электролизный вариант осаждения.
Руда
} I
Кучное Выщелачивание
Раствор -----СаО
I I
Нейталиоация -------- ' " i
Сорбция
Насыщенный ионит
Десорбция
—1 |
Иоуит Элюат
Автоклавное осаждение меди
Вода
Регенерированный ионит
--------?---------
ЦентршрцгироВание
Медный порошок
Промывная Води
Сбросовый раствор
Раствор
Рис. 49. Извлечение меди из растворов от выщелачивай ня рудного сырья по схеме сорбция — автоклавное осаждение
В результате совершенствования аппаратуры, гидродинамического и энергетического режимов возможно значительное улучшение показателей электроосаждения *. Одним из основных требований, предъявляемых к сорбционно-экстракционным процессам, является высокая селективность извлечения меди по отношению к железу, поскольку при замкнутых технологических схемах железо накапливается в оборотных растворах, что ухудшает показатели извлечения меди и требует периодической регенерации растворов.
ОПИСАНИЕ ПРАКТИКИ РАБОТЫ ПРЕДПРИЯТИЙ
Практика переработки отвалов
В табл. 24, 25 приведены сводные показатели основных зарубежных предприятий по выщелачиванию меди из отвалов и куч, а в табл. 26 данные по извлечению меди цементацией на этих предприятиях.
J Пат. (Франция), № 1520573, 1967; Пат. (США). № 3616272, 1971.
Фирма, установка (год пуска) Температура, °C Размеры отвала Количество РУДЫ, тыс. т Способ орошении Количество раствора ДЛЯ ороше-- ння, мэ/мнн
летом зимой площадь, тыс. м1 высота, м
Кеннекотт.
Юта (1916) 24—30 5—7 2880 366 4000 Разбрызгнва- 133,0
Чино (1954) 21 7 220 425 ние Прудки 49,2—
Рэй (1967) 30-35 10—21 1116 38 94 56,8 26,5
186 24 31 л
Фелпс Додж: 557 26 44 > —
Бисби (1920) 30—35 10—15 358 51,8 47 » 8,7
Моренси 24—30 5-10 19,0
(1929)
Майами: ы
Кастл Дом (1951) 30—35 10—15 — — 48,0 Разбрызгивание —
Коппер Снтн 30-35 10—15 — 45,7 — Прудки Разбрызгнва- 6,8
Багдад (1959) 35 0,0 222 73,0 40 ние То же 12,5
(Два
Дювал: отвала)
Эсперанца (1959) Минерал Парк (1965) 21 7—12 77,2 67 19,0 » 6,06
23 5 31,6 76 5,5 (два Разбрызгивание 2,84
Американ Смел-тинг Рифай-иннг Ко: отвала)
Силвер Белл 30—35 —10— 525 61 30 Прудки, 3,79—
(I960) 15 (три дренчеры 7,3
Инспирейшн (1963) 38 10-15 69,8 61 отвала) 30,0 Разбрызгивание. 6,45
Анаконда: Прудки
Бьютт (1963) 27—32 —74-7 36,2 59,4 33 | Скважины 18,9
80,0 53,4 — 1 через перфо-
37,2 15,2 — I рнрованные —
Унд Хайтс 27 12 1,86 50,3 30 ' трубы Разбрызгнва- 15,2
Кананеа (1965) — — 49 ♦’ нне 4,55
Бор (1967) 500 40 3200 Прудки, разбрызгивание
** На I нг медн.
До 1,7 г/л шламов.
** Количество руды, выводимой в отвал в сутки.
выщелачиванию меди и отвалов * Таблица 24
Характеристика раствора
кисло? Д° 0Ыи*е-пачива,ГНя после выщелачивания
ты,
кг/м’ Си, г/л реобщ. г/л Fe®+. _ Fe - Fea+ г/л pH t. С Си, г/л "общ. 7/я- pH /. °C
0,1 0J2— 2,52 0.02 2,8— 34 1,8 2,0 1,0 2,5 43—51
0,18 3,0
1,84 0,08— 3,7 0,1 3,5 21—26 1,4 — 2,0 1,0 2,5 32—35
0,36 1,8
— 1 0,6 1,2— <0,06 2,5— 23—30 1.2— 0.2— 0,2— 2,1— 23—38
— J 2,5 3,0 2 4 2.7 1.8 3,0
— Сл 10,0 Сл. 2,8— 32—35 0,96— 10,2 2,7 2— 38
3,1 1,8 2,2
— 0,01— — — 3,8— — 1—3,6 — — 2,8— —
0,02 4,2 3,2
0,2 0,04— — — 2,7 — 0 85 — — 2,3 —
0,32
0,4 0,01 — — 2,6 22—24 0,75— — 2,5 23—27
2,25
6,4— 0,02 3,9— 0,1— 1,4— 21 1,1— 1,8— 1,8— 2,1— 21
7,3 4,4 0,2 1,6 1,3 2,1 2,0 2,4
0,4 Сл. 1,44 Сл. 2,5 8 1,32— 0,25 0,24 2,3— 17
1,56 3,3
— Сл. — — 3,5 — 1,24 — — 2.4 —
0,4 *1 <0,01 1,74 0,04’ 3,4 — 0,4— 0.61 0,6 2,4— —
1,4 2,8
2—4,4 0,1— 5,46 0,50 2,65 — 1,1— 6,1 2,70 1,9- —
0,24 1,9 2,0
| 0,1 0,11 0,3 0,1 2,8— 30 0,8— — — 2,2— 20
3,8 *s 1,0 2,3
2—8,0 0,08 — — 1,2— 15 1,2 — — 1,9 13
1.3
Нет 0,15 11—20 2,2 2,75 — 1,5 18,0 12,0 2,0 —
1,0 0,24 2,28 1 / 1 0,44 2—2,2 — 0,68 0,99 0,76 2,8 48
W С. С» Набойчеико
145
Данные практики работы предприятий,
Фирма, установка Размеры кучи Количество руды в куче, тыс. т Способ орошения КО1Н-чество раствора ДЛЯ (орошения м’/мнн
площадь, ТЫС ы» высота м
Рио-Тинто 1,4—1,8 4,6—9.7 3,63* ** Разбрызгиванием 12,0
Мангула 137 6,1 2,0* » -
Рам Джангл - - 300 80 Перфорированные трубы Прудки, дренчеры -
Ранчерз, Блюберд 9,3 25,4 500 Перфорированные трубы 5,7
Д. X. Тригг Ко, № 1 1,86 22,8 150 Прудки 3,79
Зонтелли, Вестери Мвйнг Ко 27,9 12,3 500 » -
Элефант 1,34 25,0 0,45* Разбрызгиванием -
Майами, Коппер Сити 18,0 41,0 3,5* » 3,4
• Количество руды, вывозимой в сутки для сооружении кучи,
** На 1 кг медн.
использующих кучное выщелачивание руды Таблица 25
Характеристика раствора
Расход кислоты, до выщелачивания после выщелачивания
Си, г/л ^еобщ> г/л Fe®+, г/л (H.SO,) 1, °C Си, г/л реовщ, г/л Fe*+, г/л pH t. °C
— 0,2 5.0 1.0 (1.0) — 1—2 20 2,0 1,1 35—50
3,5— 4,0** 0,5— 1,0 — 6,8 (15—50) — 5—15 - - — -
— 0,3 0,66 3.6 3,0 0,2 0,4 2—2,3 1,2 32 0,66 4,1 3,0 1.8 0,4 0,4 1,2 1 2,1 J 32
20—50 0,25 1,0 — (6-7) 10 0,75 <1.0 0,9 0,9—2.3 20—30
1.7— 1,8 0,18 - — 2,2 5—15 1,8 - - 3-3,5 5—15
14— 15** 0,1 - — - 5 1.0 - — - 8
- - - — (30) — 30 sgl.5 - 3.0 -
0,005 1,52 0,55 0,10 3,0
Характеристика и показатели
Фирма, Тнп аппарата Размеры аппарата •• Расход оседнтел?
установка (количество) м т/т
медн
Мангула Бетонная ванна (4) ба- d = 2,44; 1 = 4,58 1,5
рабан (1)
Силвер Бэлл Двухсекционная ванна 3,6X2,4X1,52 1,6—2,(
0)
Кананеа Желоб (67) 3,05X1,53X1,52 4,0
Двухсекционный желоб 12,2X1,53X1,22—1,83
Саи-Доминго (10) Желоба (6) 45X0,8X0,85
Рам Джангл Бетонная ванна (36) 5.5X2,14X0,63 1,1—1,5
Анаконда, Бьютт Секционированный же- 30,4X2,6X0,76 1,5
лоб (6.5)
Унд Хайтс Сдвоенная ванна (20) 18,3X6,1X1,22 1.3
Багдад * •*! Ванна (22) 3,05 X 3,05X1,82 1,8
Дювал *2:
Эсперанца Ванна (12) 3.66Х 1.22Х 1,52—3.04 1,4
Минерал Парк > 3,66X1,52X3,04 1,4
Инспирейшн Двойная ванна (4) 18,3X6,1X1,52 1,2—1,3
Кеннекотт Желоб (4X12) 24,4Х 1,22Х 1,22 2,5
Юта Конус (26) d = 4,26; Л= 7,3 1,5—1,8
Чино Желоб (30) 12,2x1,52x1,22
Конус (4) d = 5,5; Л = 10,3
Рай Желоб (48-72) 12,2X1,52X1,52 1,7—1,8
Майами:
Кастл Дом Ванна (5) 17,7x3,05x1,44 1,8
Коппер Сити Желоб (24) 8,23x1,37x0,91 1.5
Майами » 8,23X1,37X 0,91 1,3-1,4
Фелпс Додж, Бисбн Ванна (24) 7,6X2,44X0,9—3,05 2,5
Д- X. Тригг, № 1 Желоб (4) 10,8X1,52X1,37 1,5-2,0
Зонтеллн, Вестерн Ванна (13) 8,54X1,22X2,44 1,3
Маркоплер Конус (2) d = 3,05, Л = 4,3 1,1—1,7
Майданпек Желоб ) 2,0
Ванна (24) Зх 1,5X1
*в d — диаметр; I — длина; Л — высота
•* Переведены на экстракционную технологию
•• Трехвалентное железо.
Таблица 26
цементационных установок
Характеристика раствора Иэвле-чей не Си, % Содержание в осадке, % Выпуск Си тыс. т/год
исходного отработанного
Си, г/л Реобщ. г/л Fe’+, г/л pH Си, г/л реобщ. г/л pH Си Н.О
10 — — — 1.0 30. — — — — —
1,09 0,58 0,57 2,3 0,006 2,08 3,6 99,45 82 15,0 2,4
3,1— 3,3 3,3— 10,4 2,1— 7,4 2,3— 2.5 0,25— 0,35 8,5— 15,0 2,9 92—94 75 5—15 3,3
60
1.2— 4,1 1,8— 2,8 0,4— 0,6 2,1 0,16 2,8— 46 2,1 — 2,2 90 80 — —
0.87 0,5 0,41 2,3 0,02 1,55 2,8 97,7 80 — —
1,2— 1,3 1,0 1,0 1.9 0,08 3.8— 4,1 3,0 93—94 83 15 3,2
1— 1,25 2,09 2,0 2.2 0,02 2—2,1 2,4 98— 98,5 80-84 15 7,8
1,6 0,25 0,2 2,6 <0,01 2,45 3,9 99,5 — — 2,0
1,24 0.48 0,47 2,3 <0,01 3,3 3,7 99,0 — — —
1.5 1,02 0,46 .—. 0.0 8,39 3,5 99,5 — — 5
1.8 4,80 1,44 2,3 0,12 0,18 7,0 3,5— 3,8 90—95 72 12— 15 300
— — — — — — 2,9— 3,0 — 87 — —
1,32— 2,16 0,05— 1,08 — 2,5 0,08— 0.36 0,06 •»— 0,24 3,2 90—99 85 — 27
0,9 0,37 0,36 1,5— 3,0 0,06 2.16 3—3,8 96,5 — — 9,1
0,85 1,08 1,06 2,3 0,02— 0,07 1,56— 2,26 2,7— 3,0 92—97 —77 — ~4,0
0,75— 2,25 0,34 0,32 2,5 <0,01 1,05 3.6 99,0 — — —
1.5— 2,14 2,2 1,05 2,4 0,02 4,7 4,2 99,0 79 23,5 13,0
1,32 6,6— 10,2 2,7 I-.9— 2,6 0,03 9,0— 15 3,1 — 3,7 97,0 — — 5,4
1.8 0,84— 2,52 0,24— 0,72 3— 3,5 0,12 2,5 2.8 93 — — —
1.0 — — 0,83 0,1 — 0,9 90 — — —
1,99 1.0- 3,0 1,2 1,2— 1.7 0,1 0,02— — 2—2,2 2,4— 93 До 80 30 1,3
1.5 0,04 2,6 94—99 •— — —
Предприятия фирмы «.Кеннекотт» (США) [314—3231
Фирма располагает тремя отделениями: Бингэм Каньон (шт. Юта), Рэй (шт. Аризона) и Чино (шт. Н-Мексико), производящими около 400 тыс. т меди в цементном осадке. Наибольшее значение по объему производства и совершенству технологического процесса имеет установка на Бингэм Каньоне, где расположен крупнейший в мире карьер.
Получение цементной меди, организованное в 20-х гг., вплоть до 1960 г. осуществлялось из вод естественного притока. Снижение качества добываемой руды, увеличение объема вскрыши (до 200 тыс. т/сут) способствовали расширению работ по извлечению меди из отвалов.
Рис. 50. Ряды конусообразных цсмектаторов на территории завода [322]
Согласно принятой в 1963 г. программе, была подготовлена поверхность отвалов для орошения; организована система распределения, сбора растворов и обеспечения водой; модернизирована цементационная установка. Использование бактериального режима выщелачивания также способствовало улучшению показателей извлечения меди.
Раствор подают на поверхность отвалов по трубопроводам, изготовленным из поливинилхлорида, стекловолокна или нержавеющей стали, с помощью 24 насосов производительностью по 15,2 м3/мнн. По магистрали трубопроводов установлены 5 насосных станций; имеется дополнительно 3 передвижные станции, обеспечивающие подачу до 200 м3/мнн раствора.
Единовременно орошают участок площадью 1500 м2, подавая на него 7,6 м3/мин раствора. В четыре сборника богатого раствора поступает до 80% от количества раствора, подаваемого на орошение. В зумпфе насосной станции, подающей раствор на цементацию, осуществляют его корректировку.
Рис SI. Упрощенная схема разводки трубопроводов для подачи, сбора растворов и обеспечен ни водой (в скобках указаны диаметры, м, трубопроводов):
У — контроль уровня: А — автоматический контроль; К — приборные щиты; С — устройства сигнализации и оповещения; / — транспортный цех; 2 — насосные станции водоснабжения (2' — резервная); 3 — канал для дренажа атмосферных осадков; 4 — сборные прудки медьсодержащего раствора; 5 — напорная башня; 6 — емкость дли серной кислоты; 7 — распределитель раствора; 8 — центральная насосная станция; 9 — сгустители; 10 — операторская; II — цементационная установка; 12 — расходный сборник раствора для цементации; 13 — насосиая станция системы орошении
Рис. 52. Аппаратурная схема производстве цементной медн на установке в Юта:
/ — рудный отвал; 2 -wr желоб; 3 — расходная емкость раствора для цементации; 4 — конусообразные цементаторы; 5, 6 — сита для пульпы цементной медн; 7 — сгуститель; 8 — сборник цементного осадка; 9 — фильтрпресс; 10 — сборник фильтрата; 11 — емкость для серной кислоты; 12 — центральная нвсосная ствнция; 13 — склад железного скрапа
Раствор из двух деревянных сборников (объем каждого 760 м3) поступает в конусные осадители (рис. 50). В первой секции содержание меди снижается до 0,2—0,24 г/л, а во второй секции — до 0,12 г/л. На цементационной установке перерабатывают 38 тыс. м3/сут раствора.
Работу систем орошения, сбора раствора, насосных станций контролируют с помощью телеметрии и датчиков. Управление насосами, вентилями осуществляется с диспетчерского пункта. Схема разводки трубопроводов приведена на рис. 51..
Для подачи 61 м*/мин свежей воды сооружены три заборных прудка, оборудованных отдельными насосными станциями.
Общая схема установки показана на рис. 52. Ниже приведена динамика выпуска цементной меди с 1961—1966 гг.:
Годы........... 1961 1962 1964 1965 1966
Производство Си, тыс. т 9,4 16,6 72,0 100 300
Бисби (шт. Аризона, США) [315, 3241
В 1965 г. вместо ванн для цементации меди были смонтированы три V-образных активированных желоба, работающие в противоточном режиме. Губчатое железо загружали с помощью вибропита-теля. В связи с получением мелкого цементного осадка слив пропускали через емкость с железным скрапом, которую очищали 1 раз в неделю.
Установка полностью автоматизирована, работу ее контролирует один диспетчер.
Багдад (США, шт. Аризона) [262, 314—315, 324—327]
Переработке подвергают забалансовые руды и вскрышные породы, содержащие до 0,45% растворимой меди, основные минералы — азурит, малахит, хризоколла. Схема производства цементной меди приведена на рис. 53.
Отвалы разбиты на участки. После обработки одного участка его подсушивают, а орошению подвергают соседний участок. Раствор для выщелачивания в количестве 18,2 м8/мин подают из сборного прудка по трубе длиной 2290 м и диаметром 0,356 м, футерованной пластиком. В прудке проводят корректировку состава и количества растворов.
Обогащенный по меди раствор из отстойника (80,5 X 35 X 2,2 м), облицованного пластиком, через распределительное устройство поступает в цементационные ванны, заполненные консервной жестью. Пульпу цементной медн центрифугируют, конечный раствор направляют в расходный прудок выщелачивания. Операции загрузки скрапа, выгрузки и обработки цементной медн полностью механизированы, а объем, состав н скорость потоков раствора тщательно контролируются. Установку обслуживали 5—6 человек в смену. 152
В связи с повышенным расходом кислоты при выщелачивании была сооружена сернокислотная установка производительностью (200 т/сут), работающая на привозной сере.
С 1966 г. организовали переработку цементной меди по сернокислотной автоклавной схеме с получением высокочистого порошка,
а в 1970 г. внедрили экстракцию меди из растворов от выщелачивания с получением катодной меди.
Силвер Белл (шт. Аризона, США)
182, с. 803—823; 328, 237;
314—315]
Руду для сооружения отвалов селективно отбирали при вскрышных работах. Медь представлена хризоколлой, азуритом, малахитом, купритом, а также халькозином с проявлениями халькопирита.
Для орошения используют раствор, поступающий из хвостового прудка объемом 5700 м3, и шахтные воды (76—380 л/мии). На поверхность отвала раствор подавали по трубопроводу диаметром 254 мм и отводным трубам диаметром 152 мм и разбрызгивали с помощью дренчеров. Теперь используют ирригационную систему, орошая отвал прудками площадью 230 м2. Раствор от выщелачивания собирают в железобетонный сборник объемом 600 м3, подкисляют до pH = 2,3 и двумя параллельными потоками последова-
Рнс- 53. Схема производства цементной меди иа установке в Багдаде:
I — расходная емкость дли серной ннсло-ты; 2 — отстойный прудок (2X3790 м*); 3 — расходный прудок; 4 — трубопровод раствора для выщелачивания; 5 — отвал РУДЫ; — площадка для сушкн и хранения цементного осадка; 7 — ленточный конвейер; 8 — центрифуга; 9 — пульповый насос; 10 — отстойник пульпы цементной медн; U — площадка для хранения жесты; J2 — пульповые насосы; 13 — цементационные ванны; 14 — расходный прудок богатого раствора (3790 м’); 15 — трубо-провод богатого раствора (L — 1370 м, е 365 мм, 10,2 м’/мнн); 16 — сборный прудок; 17 — насосная станции
тельно пропускают через каскад цементационных вапн. Скрап загружают с помощью автомобильного электромагнитного подъемника.
Первые две ванны, в которых осаждается 60% медн, промывают три раза в неделю, третью и четвертую (осаждается 20% меди) — один раз в неделю, пятую и шестую ванну — через две недели, а седьмую, восьмую, девятую и десятую — раз в месяц. Цементный осадок смывают брандспойтами в пять отстойных ванн, а скрап периоди-
чески перегружают.
Цементный осадок влажностью 40% выгружают из отстойников раз в неделю и рассыпают слоем 250 мм на наклонной бетонированной площадке (45,2 X 18,3 м). Установку обслуживают четыре человека в смену.
Бьютт (США, шт. Монтана) (106, 329—332]
Цементация меди из рудничных вод была организована в 1890 г. В 1939 г. установка была полностью механизирована. Перерабатывали около 30 тыс. м3/сут раствора следующего состава: 0,3 г/л Си, 5 г/л Fe^, 4,5 г/л Fe3+, 3,8—4,8 r/л шлама. В связи с повышенным содержанием шламов большое внимание приходилось уделять предварительной очистке растворов.
Специальная система шиберов обеспечивала равномерную подачу раствора в каждый цементационный желоб. Ниже приведены показатели цементации меди по длине желоба:
№ секций желоба 1 2 3 4 5
Загрузка скрапа, % . 52,9 27,8 10,8 5,2 3,4
Содержание, г/л:
Си................... 0,263 0,120 0,047 0,023 0,017
Fe .......... . 0,49 0.69 0,84 0.8 0,92
Извлечение Си. % . . .... 54,3 27,8 9,3 2,1 1,9
Распределение осадка, % 26,4 27,1 18,9 12,1 7.7
Дополнительно цементный осадок улавливали в отстойной железобетонной ванне. Осадок из желобов смывали брандспойтами, смонтированными иа передвижной напольной установке.
С 1963 г. рудничные воды стали использовать для выщелачивания специально подготовленных отвалов руды. Это потребовало более тщательной очистки растворов от шлама. Автоматическое дозирование флокулянта и серной кислоты (до pH =2,1) позволило снизить содержание шламов до 0,046 г/л.
Вначале орошение куч осуществляли с помощью каналов (46 X X 46 см), проложенных канавокопателем Позднее подачу раствора и аэрацию отвалов стали проводить через глубинные скважины.
Работа установки Бьютт—пример успешной практики выщелачивания в северных районах.
Бассейн Бор (Югославия) [28, с. 116—124; 259; 333]
Выщелачиванию подвергают хвосты обогащения, потерянную руду в подземных выработках, вскрышные отвалы. '
Основные медьсодержащие минералы—халькопирит, халькозин, ковеллин, борнит, энаргит. Для сырья характерно высокое содержание пирита и кремнезема, а также неравномерное распределение меди в объеме руды.
Первые испытания по подземному выщелачиванию старого забоя дали обнадеживающие результаты: за шесть месяцев извлекли до 50% меди от предполагаемого ее количества в обрабатываемом участке. Начальная скорость перколяции 0,24 л/(мин-м2) в дальнейшем была повышена до 0,8 л/(мин -м“) за счет создания мелких шурфов (глубиной 0,5—0,7 м) по поверхности забоя. Позднее выщелачивание организовали еще в шести забоях.
После успешных испытаний на одном из участков было организовано выщелачивание всего отвала, в котором до 29% меди представ-154
лено окисленными минералами. Предварительно был удален заиленный верхний слой (толщиной 0,3—0,5 м), а поверхность отвала вспахали для образования оросительных каналов. Умелое использование естественных условий местности позволило значительно сократить капитальные затраты.
Магистрали для подачи, перекачки и подачи раствора выполнены из пачиэтиленовых труб.
Большое внимание уделяется организации бактериального режима выщелачивания.
Практика кучного выщелачивания
Рио-Тинто (Испания) [106, 334]
Первые сообщения об использовании кучного выщелачивания на этом предприятии относят к XVIII веку. В настоящее время выщелачивают пиритные руды, содержащие 1,26% Си, 42% Fe, 47% S. Медь представлена халькопиритом, халькозином. Сооружают относительно небольшие кучи по 90—140 тыс. т, оборудованные вентиляционными каналами. После 2—2,5 лет выщелачивания кучу разбирают, материал дробят до 9,5 мм и направляют его на сернокислотную установку. В остатках от выщелачивания содержится: 0,4% Си, 0,9% Zn, 41,7% Fe, 48% S.
Раньше раствор для орошения поступал через перфорированные трубы, однако из-за недостаточной равномерности орошения стали использовать переносные разбрызгиватели. Обработку поверхности кучи производят периодически, орошая каждый участок в течение 7 дней.
В связи с большим содержанием пирита возможное разогревание кучи, которое приводит к значительным потерям серы, предотвращают изменением количества раствора для орошения и организованной вентиляцией. По этой же причине высота куч ограничена и не превышает 4,6—9,2 м.
В сутки получают около 16,5 тыс. м8 раствора, который перед цементацией обрабатывают сернистым газом для восстановления трехвалентного железа. Цементацию проводят в ваннах емкостью 1000 м8. После промывки и просеивания получают осадки двух сортов, содержащих 75—80% и 62% Си.
Завод Мангула (Ю. Родезия) Г261, 3351
Основные медные минералы в перерабатываемой руде—хризоколла, малахит, азурит, борнит и халькозин; среднее содержание меди 1,25%. Особенностью технологии является тщательная подготовка руды путем двустадийного дробления с промежуточным выводом шламов (рис. 54). Отсыпка кучи осуществляется с помощью ленточного транспортера. Основание кучи имеет поперечный уклон 4% в обе стороны от продольной оси и продольный уклон 0,5%. Куча оборудована продольными бетонными дренажерами. Исходный рас
твор подается через полихлорвиниловые трубы и разбрызгивается. На переработку поступает 200 т руды в час, цикл выщелачивания 50 сут. Отработанные слои руды удаляют с кучи и используют для заполнения подземных выработок.
Состав раствора, поступающего иа цементацию, регулируют смешиванием богатых (от выщелачивания новой порции руды) и бедных растворов. В связи с высоким содержанием железа в растворе после цементации (до 30 г/л) часть его после глубокого обезмеживаиия (до 0,1 r/л Си) направляют на выпарную установку.
Руда
Первое дробление (—1в0мм) Обесшламливани.
Шлам
Классификация, сгущение
Железный, скрап
Второе дробление
I
Руда(-1Бмм)
I i
Кучное Выщелачивание
В отвал | |
Богатый раствор Бедные растворы
”1 I
Первая ц ментация
Сгущение
Цементная медь Верхний^ слив вторая цементация
Цементная медь Раствор
Сушка
На регенерацию
Готовая продукция
Рис. 54. Технологическая схема производств в цементной меди нв установке в Мангула
Завод Элефант (Замбия) [336]
На этой установке организована эффективная технология переработки окисленных руд, несмотря на небольшой масштаб производства.
Руду, содержащую не менее 2% меди, дробят до крупности — 19 мм и укладывают на шести бетонированных площадках. Из шести куч одновременно работают три по пятидневному циклу. Для выщелачивания используют раствор, содержащий до 30 г/л H2SO4, который закачивают иа кучу. Раствор собирают в 3 зумпфах, имеющих длину 2,74 м, ширину 2,44 м и глубину 1,52 м, и вновь возвращают на выщелачивание, пока содержание в нем меди не достигнет 30 г/л. Тщательно следят за содержанием в растворе железа.
Обогащенный раствор осветляют и направляют иа электролиз, который проводят в четырех секциях по 10 ванн, изготовленных из стекловолокна. В ванну емкостью 0,23 м3 загружают шесть анодов и пять матричных основ. Электролиз ведут при плотности тока 130 А/м3, напряжении 2,2 В до остаточной концентрации в растворе меди, равном 20 г/л. Получают в год 82 т катодной меди, содержащей 99,99% Си.
Рам Джангл (Австралия) [128, 130, 337—338]
В связи с небольшим запасом руд (—1 млн. т) оказалось более рациональным перерабатывать их кучным выщелачиванием, а не по стандартной пирометаллургической схеме.
Руда содержит окисленные (малахит, куприт, азурит) и сульфидные (халькопирит, пирит) минералы. Поэтому сооружали отдельные кучи из окисленной (2% Си) и сульфидной (1,7% Си) руд. Для их размещения была выбрана площадка площадью 40,5 тыс. м2, имеющая естественный уклон 2%, которую на площади 25 тыс. м2 покрыли водонепроницаемым слоем толщиной 102 мм.
Выщелачивание осуществляют в замкнутом цикле: сульфидную кучу подвергают обработке в режиме бактериального выщелачивания, а получаемые растворы используют для орошения окисленной кучи.
Из-за недостаточной прочности руды и склонности к выветриванию, а также сухого климата был проведен тщательный поиск рационального режима орошения. При орошении окисленной кучи с помощью прудков скорость перколяции раствора не превышала 0,38 м3/м2-мин. Использование более кислых растворов (pH =0,5) ухудшило перколяцию из-за прогрессирующего разрушения руды. По этой же причине орошение с помощью скважин не дало желаемого результата из-за сильного уплотнения верхнего слоя кучи и быстрого забивания скважин. Стали периодически «срезать» бульдозером верхний слой кучи (—2 м) н орошать поверхность с помощью дренчеров. Это позволило достигнуть скорость перколяции раствора 0,89 м3 /(м2-мин) и значительно улучшить показатели выщелачивания. Обработка участков кучи (орошение—перколяция) длится 7 Дней.
Раствор на сульфидную кучу подают по перхлорвиниловым трубам диаметром 152 мм из сборника емкостью 3040 м3. Состав раствора, режим выщелачивания, наличие в руде азота, фосфора, калия, магния обеспечивают благоприятные условия для жизнедеятельности бактерий. Получаемый раствор собирают в прудке объемом 1330 м? и подают на кучу окисленной руды. Конечный раствор из сборника емкостью 2920 м3 поступает со скоростью 0,8 м3/мин иа цементацию.
Сборные прудки оборудованы дамбами, внутренняя поверхность которых защищена специальными плитами из многослойного материала (териленового пластика — битума — стекловолокна— битума).
Медь осаждают листовой обрезью в йаниах общей емкостью 153 м3. Ванны изготовлены из железобетона, внутри футерованы битумной 157
мастикой. Ворошение скрапа с помощью специальной установки увеличило производительность почти в 5 раз (раньше она составляла не более 8 кг/(м3-сут). После сушки и грохочения цементную медь отправляют на медеплавильный завод.
Содержание железа в оборотном растворе поддерживают не более 5 г/л, периодически сбрасывая до 50% раствора. Потери раствора за счет испарения в засушливый сезон достигают 265 мэ/сут.
Установка фирмы Маркоппер (Филиппины) 1339]
В обрабатываемом сырье содержатся сульфидные (халькопирит, халькозин, борнит) и окисленные (малахит, азурит, хризоколла, куприт, халькантит) минералы. Общее содержание меди 0,2%, в том числе более 50% кислоторастворимой.
Руду укладывают на естественное основание в кучи высотой около 46 м, раствор для орошения подают по полихлорвиниловым трубам. Несмотря на высокое содержание каолинизированиых пород, скорость перколяции раствора хорошая и составляет 0,12—0,16 л/(ма X X мин).
Раствор после выщелачивания подкисляют до pH = 2,5 и направляют на цементацию, используя обезлужеиный скрап. Скорость восходящего потока раствора в конусных аппаратах составляет 0,244 м/с. Цементный осадок выгружают через 4 ч, подсушивают шихтуют с медным концентратом обогатительной фабрики.
За конусами установлены бетонированные ванны, заполненные скрапом, в которых доизвлекают тонкую взвесь осадка и остаточную медь в растворе В связи с увеличением объема окисленной руды, а также наличием больших запасов бедных сульфидных руд (0,29% Си) предполагают расширить цементационную установку, модернизировать системы орошения и сбора раствора, а также использовать бактериальное выщелачивание.
Практика подземного выщелачивания
Огайо (шт. Юта, США) (1, с. 129; 340]
В связи со снижением содержания меди в руде (до 0,3%) дальнейшая разработка рудника была признана нерациональной и его законсервировали. С 1922 г. на нем было организовано подземное выщелачивание. Руда представлена медистым пиритом и содержала халькозин, а вмещающая порода — кварцевым моноцитом. Орошение вели, чередуя с периодами просушки, на площади 240 X 275 м, разделенной на ряд участков. Использовали для орошения шахтные воды других рудников, хвостовые растворы с цементационной установки, которые подавали со скоростью 9,5—15 м8/мнн.
Растворы, содержащие около 2 г/л Си, поступали на цементационную установку, расположенную под землей. Неизменный температурный режим, хорошее качество консервной жести позволяли получать устойчивые высокие показатели при осаждении меди в те-158
чение всего года: извлечение достигало 97,3%, а содержание меди в осадке — до 90—94%.
Работа установки в последующие годы в литературе не описана.
Рэй (шт. Аризона, США) [1, с. 129—130; 271]
В 1937 г. было организовано подземное выщелачивание на одном из закрытых рудников. Медьсодержащие породы представлены сульфидными и окисленными минералами. После обрушения стали подавать свежую воду в количестве 2 м3/мнн. В связи с высоким содержанием меди (~1%) и пирита получали богатые растворы (до 10 г/л Си). Организация искусственного орошения позволила не только увеличить концентрацию меди в растворе, но и существенно повысить выпуск меди.
Позднее одну из выработок, длина которой 610 м, ширина 305 м, высота 46 м, заполнили вскрышей с близлежащего карьера. Орошение ведут по системе затопления, количество конечного раствора составляет 7,6 м3/мин.
Завод Сан-Доминго (Португалия) (341 1
На заводе используется подземное бактериальное выщелачивание для извлечения меди из забалансовых медьсодержащих пиритных руд. Схема производства приведена на рис. 55.
Орошение осуществляют один раз в неделю с помощью дренажных канав для равномерного распределения раствора, орошаемую поверхность иа глубину 1,8 м покрывают слоем шлака или пустой породы. Температуру в рудном теле непрерывно измеряют н фиксируют на операторском пульте, что позволяет следить за развитием процесса выщелачивания.
Цементационная установка состоит из шести осадительных желобов, имеющих соответственно наклон, %: 0,11, 0,22; 0,36; 0,51; 0,69; 0,88, одного отстойного желоба и осадительной ваниы.
Желоба бетонные, футерованные асфальтом. Отстойная ванна предназначена для улавливания тонких частиц меди; она футерована кирпичом на водостойкой замазке. Цементный осадок промывают в сборной ванне (15 X 4 X 1,7 м), а затем пропускают через вращающийся магнитный сепаратор. Для обезвоживания используют два вакуумных фильтра с площадью фильтрации по 0,28 ма и семидневную подсушку на подогреваемой бетонной площадке длиной 30 м и шириной 7 м. Теплый воздух подается вентилятором в опорную раму из труб диаметром 19 мм. Установку обслуживают 20— 25 человек, капитальные затраты иа ее сооружение составили 80 тыс. долл., а годовые эксплуатационные расходы изменялись с 65 до 30 тыс. долл. За 6 лет было получено 3978 т меди, выпуск ее по годам изменялся следующим образом, т: 1263, 1072, 742, 510, 273 и 118.
Рис. 55. С хеме производства цементной медн на установке в Сан-Доминго (цифры в скобках указывают диаметр трубопроводов, м);
1 — прудки свежей воды: 2 — центробежные ивсосы; 3 — отстойный прудок; 4 — сборник осветленной воды; 5 — орошаемый участок (план); б — разрез рудного тела; 7 — шахтные ивсосы; в — распределительнав квмера подвчн раствора иа выщелачивание; 9 — цементационные желобв; 10 — смывные брандспойты; 11 — ванна для промывки осадка; 12 — площадка для сушки цементного осадка; 13 ~ сборник промывных вод; 14 — сборник раствора после цементации
Работы по подбору материалов для оборудования показали, что для трубопроводов лучше всего подходят перхлорвинил или обычная сталь, покрытая эпоксидной смолой, а для насосов — нержавеющая сталь.
Установка в Кананеа (Мексика) [1, с. 130; 315; 342—3431
Производство цементной меди из рудничных вод организовано в 1915 г., впоследствии (1920—1922 гг.) внедрено принудительное орошение забоев на горизонтах 200 и 300 м с потерянной рудой. Руда была представлена медистыми пиритами, содержащими 1,5% Си, 10,8% Fe, 49% SiO2, 15,4% А12О8, 9,2% S. Орошение участка проводили растворами после цементации через центральную трубу диаметром 50 мМ с отводными патрубками, раствор разбрызгивали брандспойтами. Уже прн первой промывке продолжительностью 261 сут. было извлечено 48,5% меди.
Первоначально цементацию осуществляли в деревянных ваннах, установленных в забоях; раствор перемешивали воздухом, расход его составил 50 м3/мин. Впоследствии цементационные ванны были перенесены иа поверхность.
В связи с увеличением объема рудных отвалов цементационная установка была расширена и модернизирована. В отделении Вета объем желобов составлял 4,71 м3, а на установке в Ронквилло 568 м3; в три головные желоба загружали тяжелый скрап.
Осажденную меДь смывали и пульпу пропускали через барабай-ный грохот (отверстия грохота имели диаметр 3 мм). Минусовая фракция поступала в четыре отстойника, имеющих длину 12,2 м и ширину 3,05 м. После сгущения и сушки цементную медь отправляют на медеплавильный завод.
Майами (шт. Аризона, США) [106, 272—273 J
На руднике Майами [2731 заброшенные подземные выработки орошают па площади 460 тыс. м2 подкисленными растворами (6 г/л H2SO4). Их подают с помощью брызгал или скважин 1 до тех пор, пока содержание меди в продукционных растворах не снизится . менее 0,9 г/л. Продолжительность каждого из последующих циклов сокращают вдвое по отношению к предшествующей длительности орошения участка. Остаточная кислотность поддерживается на уровне 0,25—0,35 г/л H2SO4, чтобы предотвратить выпадание железистых осадков в магистралях, а также интенсивное разрушение асбоцементных труб, применяемых на ряде участков. С запруды на горизонте 305 м раствор по трубе стекает в зумпф, откуда тремя погруженными насосами производительностью 3,785 м3/мин направляется на цементацию. Обезмеженный раствор подкисляют в сборнике, откуда двумя насосами (производительностью по 3,785 м3/мин и одним 5,0 м’/мин) подают в отстойник, затем в расходный зумпф для орошения и после подкисления закачивают с помощью четырех насосов производительностью по 2,58 м3/мин в приемник-распределитель и далее по полиэтиленовым трубам на обрабатываемый участок. В сутки цир-ку.'^ирует около 11 тыс. м3 раствора, потери его не превышают 10%,
Установку обслуживают 9 чел., которые, кроме машинистов насосов (3 чел.), работают в дневную смену.
После завершения эксплуатации рудника в Гила Каунти образовалась подземная выработка диаметром 457 м и высотой 91 м, которую заполнили отвальной породой, содержащей медь в виде окисленных и сульфидных минералов. Особенность этого материала — невысокое содержание пирита.
Забой орошают с помощью скважин, прудков, а на некоторых участках и брызгал. Раствор после цементации, содержащий 4 г/л Fe2+, подкисляют до 0,27—0,3 г/л, чтобы предотвратить гидролиз железа; перед орошением кислотность доводят до 4,8—4,9 г/л. Общий расход кислоты достигает 2,4 т на 1 т меди. Орошение ведут до тех пор, пока содержание меди в конечном растворе не снизится менее 1,3—1,4 г/л, после чего участок выводят для сушки. Скорость движения раствора через слой породы составляет 658,7 м/сут.
Медьсодержащий раствор собирают на глубине 305 м и направляют на цементацию; количество его 7,6 м3/мин, состав: 2 г/л Си, 2 г/л Fe, pH — 2,4.
Обработку руды ведут круглый год, получая около 9 тыс. т меди.
1 Разбуривание выполнено по сетке 15Х 15 м, Н С. С. Набойченко 161
НОВЫЕ НАПРАВЛЕНИЯ ПЕРЕРАБОТКИ РУДНОГО СЫРЬЯ
Тенденция непрерывного увеличения количества отвалов, роли забалансовых и труднообогатимых месторождений медьсодержащих хвостов флотационного обогащения в сырьевой базе для производства меди обусловливает дальнейшее совершенствование приемов извлечения меди из этих сырьевых источников.
Изыскания ведутся в основном по двум направлениям: 1) совершенствование существующих технологий и 2) разработка принципиально новых технологических схем с использованием специфичных растворителей и аппаратурного оформления.
С целью создания оптимального варианта подготовки сырья, орошения и сбора раствора, интенсификации и повышения извлечения меди при кучном и подземном выщелачивании работы ведутся в направлении:
1) разработки эффективного и дешевого способа подготовки основания для отсыпки отвала, кучи;
2) улучшения качества взрывных работ, применения дополнительного дробления крупногабаритных кусков породы, гидравлического разрушения рудных пластов;
3) инженерных мероприятий по гидроизоляции подземного участка выщелачивания руды;
4) улучшения режима и равномерности орошения руды [для чего предлагается сооружение отвала (кучн) оптимальной геометрической формы, улучшение однородности слоя руды, принудительная подача раствора внутрь его];
5) организации автоматического контроля и управления режима орошения и сбора медьсодержащего раствора;
6) применения новых растворителей, штаммов микроорганизмов и специальных катализаторов, ускоряющих выщелачивание и повышающих извлечение в раствор меди и сопутствующих ценных элементов;
7) использования внешнего электрофизического воздействия на обрабатываемый материал;
8) организации комплексной переработки раствора с извлечением не только меди, но и других элементов.
Для иллюстрации некоторых отмеченных направлений ниже приведены примеры по литературным источникам.
Применение ядерных взрывов при подземном выщелачивании
Американскими исследователями был предложен и испытан способ подготовки для выщелачивания рудного тела с использованием атомного взрыва [106, 234, 272, 344—3491. Количество раздробленной руды зависит от мощности взрыва, глубины его заложения и типа породы На рис. 56 приведены эти данные для взрывов в прочной породе, осуществляемых на глубине, исключающей утечку радио-
активных газов в атмосферу. Глубину установки заряда в скважине И можно определять по зависимости
7/ = —^—0,305,
l/~W
Рис 66. Зависимость количества раздробленной руды от мощности и глубины заложения ядер-кого взрыва (штриховой линией отмечена предельная глубина, исключающая выброс из воронки):
1 — w = 60 МН (Б ктс); 2 — W = 100 МН (10 ктс); 3 — W = 200 МН (20 ктс); 4 — W — Б00 МН (50 ктс); 5 — W — 700 МН (70 ктс); 6 — W =» 1000 МН (100 ктс)
где h—г-лубина скважин, м;
1Г — мощность взрыва, ктс;
п = 3; 3,4 — соответственно для глубинного и поверхностного взрывов.
Крупность дробления руды и пористость образовавшегося слоя зависят от прочности породы, естественной трещиноватости, мощности и глубины установки взрыва. Например, для туфовых пород пористость составляет 18— 35%, а для грандодиорита 28%. При испытаниях в штате Невада (мощность взрыва 1,7 ктс) раздроблено 500 тыс. т руды и 200 тыс. т породы; размер кусков не превышал 300 мм, пористость слоя составляла 25%. При неглубоком залегании руды происходит одновременное разрушение вышележащей породы (рис. 57, а). В этом случае существенно улучшаются условия орошения и дробится больше породы. При залегании рудного тела на большой глубине и наличии прочных поверхностных пород образуется цилиндрический кратер (рис. 57, б). Диаметр D его определяется мощностью заряда по фор-з _________________
муле: D = 30,5 ]/ W; высо
та цилиндрической части кратера составляет 2—2,5 D. Стенки образуемой полости оплавляются, а при наличии трещин расплав проникает на глубину до 3—5 м, что обусловливает хорошую гидроизоляцию орошаемого участка. Раствор для орошения подается из специально проложенной выработки.
В результате взрыва происходит не только дробление и разрыхление руды, но и термическое разрушение высших сульфидов и их окисление. Поскольку атомные взрывы связаны с использованием дефицитных изотопов, более предпочтительны термоядерные взрывы. В зависимости от мощности рудного тела величина одного заряда колеблется в пределах 100—1000 МН (10—100 ктс). Равномерная’ подготовка руды для крупных месторождений достигается при при-
11*
163
менении серии взрывов; схема расположения зарядов и обслуживающих выработок для крупных месторождений показана на рис. 58.
При использовании ядерных взрывов возникает опасность радиоактивного заражения.
Кроме того, вызванные взрывом колебания грунта оказывают воздействие на окружающие инженерные сооружения (специальные горные выработки, цементационную установку, насосные станции и др.). Опасность их разрушения особенно вероятна при использовании серии взрывов. Величина колебаний пропорциональна мощности взрыва (№’/•) и обратно пропорциональна расстоянию от центра
Рис. 57. Характер разрушения, организация орошения и сбора раствора при поверхностном (о) и глубинном (б) залегании рудного тела:
1 — подача рвствора для орошения; 2 — система сбора медьсодержащего раствора; 8 — насосная станция; 4 — примерная граница проницаемости раствора в породе; 5 — наружный контур дробленой породы
взрыва (S’/>, км). Эмпирический коэффициент пропорциональности (К) зависит от свойств окружающей породы и возрастает для более плотных пород; для алювия К = 1,4-10~2, а для гранита К = 8,6-10-2.
Радиоактивное заражение может иметь место при утечке образуемых газов (через трещиноватости породы, при близком расположении у поверхности рабочих скважин, штреков), активации медьсодержащего раствора, руды.
Специальными наблюдениями установлено, что радиоактивность в основном остается в грунте; за 16 ч контакта раствора с породой на его долю приходилось не более 2% общей активности. Из радиоактивных элементов цементную медь загрязняет только Ru100, который при переплавке полностью переходит в черновую медь. Его можно выводить в процессе электролитического рафинирования: до 66% рутения переходит в электролит, откуда его можно извлечь экстракцией.
. Выработки для подачи раствора рекомендуют проходить на высоте не менее 40 ± 5ч-10 м от центра взрыва.
Использование ядерных взрывов при подземном выщелачивании представляет особенный интерес для извлечения меди из больших месторождений забалансовых руд 1 или мелких богатых месторождений (0,25—10 млн. т руды), эксплуатация которых с использованием
стандартных схем добычи и переработки нерентабельна. Это позволит не только расширить сырьевую базу, но и сократить срок ввода месторождения в эксплуатацию.
Помимо общих требований, при подземном выщелачивании с применением ядерных взрывов необходимо учитывать: гидрогеологические особенности месторождения, особенно характер движения грунтовых и поверхностных вод; обеспечение безопасности инженерных со-
оружений и организации оро-
шения; возможное влияние радиоактивности на жизнедеятельность микроорганизмов при использовании бактериального выщелачивания: наличие близлежащих населенных пунктов.
Экономичность использования ядерпого взрыва для подготовки руды к подземному выщелачиванию зависит от мощности месторождения и содержания в нем меди. Затраты на собственно .ядерный взрыв
в стоимости переработки 1 т руды зависят от мощности взрыва: при W = 1000МН (100 ктс) они составляют 12,8%, а при W = 100 МН (10 ктс) 55, 2%. При взрыве W'= 300 МН (30 ктс) на глубине 305 м можно ожидать дробления 3,63 млн. т руды. Предполагают, что ка--питальные затраты (на подготовку взрыва, пробивку ствола, штреков, создание цементационной установки, системы сбора растворов и др.) будут составлять около 25 мли. долл. При извлечении 75% меди из руды н 50% из окружающей породы и получении 5,27 м8/мин раствора (1,2 г/л Си) эксплуатационные затраты составят около 450 долл, на 1 т меди.
Эти показатели свидетельствуют о рентабельности всей технологии-.
1 Расчеты показывают эффективность использования ядерных взрывов при содержании меди в руде не меиее 0,182%.
Было проведено сравнение эффективности разработки гипотетического месторождения халькозиновой руды мощностью 24 млн. т, содержащей 1% Си по схемам с применением ядериого взрыва (I вариант) и стандартной технологии, включающей сооружение обогатительной фабрики производительностью 6,7 тыс. т/сут (II вариант). В первом варианте необходимо осуществить 35 взрывов, проходку ствола длиной 213 м и скважин длиной 5,17 тыс. м. Кроме того, необходимо сооружение цементационной установки.
Для обоих вариантов приняты срок эксплуатации месторождения — 1-0 лет, извлечение меди 80%. Получены данные долл/т:
I .вариант / И вариант
Ядерный взрыв 101,4 —
Горные работы . 4,4 11,0
Обогащение руды — 132,0
Металлургическое производство 17,6 59,5
Эксплуатационные затраты . Техника безопасности, страхование, 375,0 569,0
плановые накопления . . 88,3 88,3
Итого.» 586,7 859,8
Таким образом, при использовании подземного выщелачивания с применением ядерного взрыва по сравнению со стандартной технологией разработки месторождения и переработки руды затраты на получение 1 т меди будут снижены почти в 1,5 раза. Фирма «Кение-котт» в шт. Аризона предполагала использовать взрыв мощностью 200 МН (20 ктс) на глубине 366 м при разработке одного из участков месторождения. Ожидалось образование кратера диаметром 61—67 м и глубиной 149 м, вмещающего 1,18—1,36 млн. т руды, содержащей 0,41—0,5% Си. Предполагалось сооружение штрека для сбора раствора ** и ствола шахты на глубину 1067 м. Проектная производительность установки 2,5 т Си в сутки.
Однако из-за недоработки отдельных вопросов, а также недостатка финансирования, реализация проекта приостановлена [350].
Применение комбинированных реагентов для выщелачивания
По данным работы [2341, добавка хлора или гипохлорита к сернокислым растворам увеличивает скорость растворения сульфидных минералов почти в 20 раз. На примере выщелачивания нескольких типов медно-колчеданных руд была показана возможность повышения извлечения из них меди в 1,5—1,8 раза* *2 при использовании «комбинированных» растворителей (сернокислых растворов с добавкой нитратов, хлоридов) [63; 351—352). До выщелачивания на опытном участке применяли растворы, содержащие 8,55 г/л H2SO4 и 13,6 г/л NaCl; в результате содержание меди в конечном растворе возросло почти иа 30%.
•’ Расход раствора на орошение 10 м3/мин.
*! По сравнению с выщелачиванием подкисленным раствором сульфата железа,
166
Однако, более поздними исследованиями установлено, что прн выщелачивании халькопирита раствором, содержащим 5,5 г/л Fes+, 9,8 г/л H2SO4, 6 г/л NaCl, ускоряющий эффект хлорида натрия проявляется только при температуре выше 50е С [353].
Много внимания уделяют интенсификации извлечения меди из сульфидного сырья с помощью использования и совершенствования бактериального выщелачивания. Ведутся поиски новых штаммов микроорганизмов (например, способных окислять азот и тем самым ускорять растворение сульфидов медн или функционирующих в аммиачных растворах *2), пытаются подобрать .условия (крупность сырья, интенсивное перемешивание), способствующие их жизнедеятельности 3. В работе [3541 описана интенсификация бактериального окисления сульфата закиси железа (более чем в 1,5 раза) при магнитной обработке раствора.
Применение алектрофнзнчеокнх приемов обработки сырья
В работе [355—3581 показано положительное влияние ультразвука (УЗ) при выщелачивании окисленных и сульфидных руд. Так, при температуре 25—45° С, плотности пульпы 3,6% твердого, мощности 0,5 Вт/см2 и частоте 19,18 кГц УЗ продолжительность выщелачивания окисленной руды 0,15% раствором серной кислоты сокращается в 3—12 раз, а извлечение меди возрастает на 5—15% в сравнении с показателями простого агитационного выщелачивания [3551.
При выщелачивании халькозиновой руды наложение УЗ ускорило в несколько раз процесс, особенно в первые 15 мин или при дополнительном измельчении материала. Выщелачивание проводили при температуре 50—60° С раствором, содержащим 5% Fe2(SO4)3 и 2% H2SO4. Аналогичные данные получены и для халькопиритной руды и хризоколлы, в работах [356—3581 применяли УЗ колебания с частотой 16,75—18,8 кГц и интенсивностью 2,8 Вт/см2.
Ускорение извлечения меди из сульфидных руд в 1,1—1,4 раза при наложении постоянного электрического тока установлено в работах [359; 360, с. 111—114 и 123—1261; показатели выщелачивания улучшаются с увеличением силы тока и снижения крупности руды. Аналогичное влияние обнаружено при наложении высокочастотного электромагнитного поля; увеличение напряженности поля с 0,12 до 0,2 кВт/см повышает извлечение меди на 23% [360, с. 114— 117].
Комплексное использование растворов
Медные руды, особенно сульфидные, являются комплексными. Помимо меди, в зависимости от типа руд, в них содержатся цинк, кобальт, никель, Молибден, а также сопутствующие редкие элементы: кадмий, селен, теллур, висмут, индий, германий, уран, галлий, тал
41 Пат. (США), № 3272621, 1964.
*2 Пат. (США), № 3455679, 1967.
8 Пат. (США), № 3305353, 1964. - ч
лий, ванадий, благородные металлы. Как правило, редкие элементы представлены в виде изоморфных примесей в сульфидах основных металлов. При выщелачивании значительная часть редких элементов, а также серебро и даже золото наряду с медью переходят в раствор. Последние при цементации переходят в медный осадок и при дальнейшей его переработке извлекаются. Несмотря на незначитель--ные концентрации, учитывая большие объемы растворов, извлечение редких элементов может заметно повысить рентабельность переработки руд. Особенно большое значение имеет попутное извлечение цинка, содержание которого в растворе при переработке ряда типов медно-цинковых руд в несколько раз превышает концентрацию меди. Для ряда месторождений заслуживает внимание и извлечение кобальта. Наиболее эффективными» приемами для извлечения сопутствующих редких элементов служат сорбционно-экстракционные процессы или методы ионной и молекулярной флотации.
При обследовании ряда медных рудников США установлено, что на 14 из них получают около 150 м3 растворов в .минуту, в которых содержится 2—15 мг/л U3Oe (в том числе на 6 установках до 10 мг/л U3O8), что эквивалентно 725 кг/сут U3O3 [3611. Для извлечения урана в полупромышленном масштабе испытывали экстракцию и сорбцию. Более экономичным оказалось сорбционное извлечение (достигнута емкость по U3O8 до 13 г на 1 кг смолы). С учетом расширения практики гидрометаллургической переработки забалансового сырья возможно получать до 2,73 т/сут U3O8 [234].
Новые технологические процессы
Ряд несомненных достоинств других типов растворителей (хло-ридных, цианистых, щелочных, которые по сравнению с сернокислыми отличаются повышенной извлекающей способностью и селективностью) привел к разработке нескольких технологических схем на иХ основе. Несмотря на высокую стоимость этих реагентов, возможность их практически полной регенерации обусловливает рентабельность технологии. Некоторые из них прошли успешную проверку в полупромышленном масштабе.
Солянокислотная схема
Металлургами Чили [362] для переработки окисленных руд предложена технология, основанная на использовании солянокислых растворов (рис. 59). При выщелачивании протекают следующие процессы:
H2SO4 + 2NaCl -> 2НС1 + Na2SO4, CuO + 2HC1 -> CuCl2 + H2O, Cu2O + 2HC1 -> 2CuCl + H2O,
(II 1) CuO-CuCO3-H2O + 4HC1 -> 2CuC12 + 3H2O + CO2, 1 ’
CuSiO3-2HsO + 2HC1 -* CuCl2 + 3H2O + SiO2,
Cu2 (OH3) Cl + 3HC1 -* 2CuC12 + 3H2O.
Хлориды железа, образуемые при вскрытии пустой породы, способствуют выщелачиванию меди, особенно из ковеллина и халькозина:
ЗСиО + 2FeCl3 + ЗН2О -> ЗСиС12 + 2Fe (ОН)3, ЗСиО + 2FeCl2 + ЗН2О -»СиС12 + 2СиС1 + 2Fe (ОН)3, CuzlS 4- 2nFeCl3 -* 2nFeCl2 + nCuCls + So.
(П.2)
Воздух
Известняк
По этой схеме руду крупностью —9,5 +6,4 мм (выход фракции 58—64%) обрабатывают при аэролифтном перемешивании в течение 48 ч до конечной кислотности pH = 2,5. При этом извлекается
Руда.
Проблем
Выщелачивание
Очистка от le.Al
I
Раствор
Осаждение меди
Медный кек
На медеплавильный завод
Гидраты Al,Fe
Раствор Me CL,?
Регенерация PCI i---------------»
CaSO^O НсЦзвг/л)
Рис. 59. Технологическая схема переработки руды с использованием солянокислых растворов
82% Си, а раствор содержит 22—26 г/л Си, 2,5 г/л Fe, 1,8—4,8 г/л А1. Примеси осаждают молотым известняком при контролируемой кислотности и аэрации пульпы
Отфильтрованный раствор обрабатывают известняком (крупностью частиц—0,3 +0,15 мм, расход ПО—118% от стехиометрического количества). Получаемый кек, содержащий 45—50% Си, направляют в медеплавильное производство.
Обезмеженный раствор поступает на регенерацию соляной кислоты. Происходящие при этом процессы описываются уравнениями:
CaCl 2 + Н 2SO4 + 2Н 2О -н CaSO4 • 2Н ,0 + 2НС1; 1
2CaCIz +-2SO, + Oe + 4H2O^^’2CaSO4-2H.3O +2НС1. J
(П.З)
Для предотвращения накопления сульфата натрия каждый цикл выводили 15—20% раствора, восполняя дефицит раствора свежей водой.
Технология пригодна для руд с пониженным содержанием известняка. Достоинства ее— невысокий расход реагентов, незначительные капитальные затраты, возможность механизации.
Цианидные схемы
Технология осаждения меди из кислых и нейтральных растворов в присутствии восстановителей с последующей обработкой осадка щелочью основана на следующих реакциях 1:
2CuSO4 + H2SO3 + 2NH4CNS + Н2О -> 2CuCNS +
+ (NH4)2SO4 + H2SO4;
(II.4) 2CuCNS + 2NaOH -> Cu2O + 2NaCNS + H2O; '
или 2CuCNS + Ca (OH)2 -> Cu2O + Ca (CNS)2 + H2O.
Из руды в медьсодержащий кек, содержащий ~80% Си, извлекается 91—93% меди. Степень регенерации растворителя 97%. Расход натриевой щелочи при регенерации цианида не превышает 0,65 кг на 1 кг извлекаемой меди. Для повышения извлечения меди необходима тщательная промывка остатка от выщелачивания.
Позднее было предложено осаждать медь цианистой кислотой и сернистым газом при pH <4 и t < 100° С*. Этот процесс пригоден для переработки растворов от выщелачивания руды, огарков, скрапа. Он более экономичен, чем цементация или электроосаждение.
Цианид меди практически не растворим в серной кислоте, что обеспечивает полное извлечение металла. Осадок после промывки и сушки обрабатывают водородом при температуре 300—400° С, получая порошок меди, содержащий 99,8% Си, и регенерируя цианистую кислоту:
2CuCN + Н2 -> 2Cu + 2HCN. (II.5)
Технологическая схема, приведенная на рис. 60, рекомендована для переработки руд с повышенной основностью вмещающих пород, содержащих 0,2—0,8% Си.
При выщелачивании меди протекают следующие процессы:
2CusS + 5Са (ОН)2 + 16HCN 4CaHCu (CN)4 +
+ Ca (HS)2 + ЮН20,
2Cu2S + 5Са (CN)2 + 6HCN 4CaHCu (CN)4 + Ca (HS)2,
(II.6) 2Cu2S + 8Са (CN) 2 + 6Н 2О — 4CaHCu (CN)4 +
+ Ca (HS)2 + ЗСа (ОН)», 2HCN + Са (ОН) 2 -> Ca (CN) 2 + 2Н 2О.
1 Пат. (США), № 2390540, 1944.
• Пат. (США). Ns 3231303, 1965, № 3303021, 1965.
.__________________ Pufa нсы
I J
Выщелачивание
Фильтрация, промывка,
CiizSOs Раствор Хвосты
Осаждение, фильтрация
Медный кек Си(нз)} Раствор H2S0^
i ।—1 Са (0н)2
Растворение у щ \ „ J < ~ Осадок
Подкисление -----------------
-------------
Раствор
Регенерация
Ca^CN)z Гипс
В Отвал
___| Флотация
3 г I □ а
Гипс Сульфид меди
На медеплавильный На получение
завод < Cu2S03
Рис. 60. Технологическая схема переработки забалансового сырья с применением цианистых растворов
(Н.7)
Нерастворимый остаток промывают водой и направляют в отвал, а медьсодержащий раствор обрабатывают сульфатом, сульфитом меди или сернистым газом:
4CaHCu (CN)4 + Са (HS)2 + 8Cu2SO3 4- l,5O2 16CuCN + + 2Cu 2S + 5CaSO3 + 3H 2SO4,
4CaHCu (CN)4 + Ca (HS)2 + 16CuSO4 + 8SO2 +
+ 16H2O 16CuCN + 2Cu2S + 5CaSO4 + 19H2SO4.
Коллективный медьсодержащий кек растворяют по реакции
2CaHCu (CN)4 + 4CuCN + Са (ОН)2 3CaCu2 (СИ)4 + 2Н2О.
(II.8)
Получаемый раствор обрабатывают серной кислотой, при этом медь осаждается в виде сульфида:
2CaCu2 (CN)4 k+ 3H2SO4 + Са (HS)2 -> 2Cu2S +
+ 3CaSO4 + 8HCN,
4CaIICu (CN)4 + 6H2SO4 -»-2Cu2S + 4CaSO4 +
+ 16HCN + 4O21
Ca (HS)2 + H2SO4 — CaSO* + 2H2S.
Полученный кек флотируют, получая сульфидный концентрат и отвальные гипсовые хвосты.
(П-9)
Растворитель регенерируют при четырехстадийной обработке обез-меженного раствора известковым молоком-
2HCN + Са (ОН) 2 Ca (CN) 2 + 2Н 2О, 1
H2SO4 + Са (ОН)2 -э- CaSO4 + 2Н2О. | (П10)
На 1 т меди необходимо 0,78 т серной кислоты и 2,3 т извести: цианидный растворитель практически полностью регенерируется.
Подобная технология была предложена 1 для переработки упорных руд и хвостов обогащения, содержащих медь в виде халькозина. Материал крупностью 0,044 мм подвергают вакуумной перколяции растворами цианидов при pH = 7,4 и содержании в пульпе 25% твердого. При выщелачивании извлекается до 85% Си. Богатые растворы, содержащие 5;5 г/л Си, насыщают углекислым газом в каскаде реакторов. Осаждается около 60% меди в виде CuS и 70% кальция в виде СаСО3. После сгущения пульпы в гидроциклонах и фильтрации осадок отправляют на медеплавильный завод, а обезмеженный раствор поступает на регенерацию цианистого растворителя.
Бедные-растворы, содержащие 1,2 г/л Си, получаемые при промывке остатков от выщелачивания, выпаривают и подвергают аналогичной обработке.
На стадии регенерации раствор обрабатывают серной кислотой до pH = 2,5 и бисульфидом натрия, при этом повышают прямое извлечение меди.
На полупромышленных испытаниях [3631 при переработке материала, содержащего 0,214% Си, достигнуто извлечение 91,7% Си, а расход реагентов на 1 кг меди составил: 0,362 кг NaCN, 2,06 кг Са(ОН)2, 3,6 кг Н.ЗО4, 0,099 кг NaHS. Принципиально возможно дальнейшее повышение извлечения меди, но при этом заметно возрастают капитальные затраты.
Для выщелачивания разнообразного сульфидного сырья (руды, песка, шламовых фракций), содержащего 0,5—2,1% Си, можно использовать синильную кислоту, цианиды натрия, калия, кальция, циансодержащие органические соединения (например, лактонитрил) или их смеси 2. Расход растворителя 1,5—4,0 моля на I моль меди. Медьсодержащий раствор обрабатывают сульфидным реагентом (сернистым натрием, кальцием, сероводородом), подкисляют. При этом осаждается не менее 75% меди и снижается расход цианида в связи с образованием сульфида меди:
2Cu (CN)a“ + S2y + 3H2SO4 — Cu2S + 6HCN + 3SOh. (II. 11)
Одновременно регенерируется до 94,4% цианида. Расход цианида натрия составляет 0,2—0,3 кг на 1 кг извлекаемой меди.
На рис. 61 приведена схема селективного выделения меди и серебра из кека, содержащего 30% Си и 4,55% Ag [3641.
1 Пат. (США), № 3224835, 1965.
3 Пат. (США), № 3189435, 1964.
При цианидном выщелачивании извлекается до 90% меди по реакциям за 2 ч:
Cu2S + 6NaCN -* 2Na2Cu (CN)S + Na2S, 1
- 2CuS + 8NaCN 2Na2Cu (CN)3 + 2Na,S + (CN)2. J
Медь из раствора осаждают сульфидом натрия после подкисления: 2Na2Cu (CuCN)s + Na2S + 3H2SO4-«Cu2S + 6HCN + 3NasSO4.
(11.13)
Качественный осадок, содержащий 55% Си, можно получить топько подкислением раствора, однако это связано с потерями цианида в связи с образованием CuCN.
Обогащенный серебром до 8,5% осадок повторно выщелачивают, извлекая при этом до 95% серебра и 50% оставшейся меди. При повы-
Cu-Aq кек
------» М--------
Выщелачивание Си
Фильтрация
Раствор рг50^
♦ Г Naz8
Осаждение Си
Сбросный раствор
Газы
' Иг0---1 I I-----NaOH
Улавливание
Раствор NaCN
i I '
I
Остаток j 4---------Са(он)г
Репцльпация
——1 .
Выщелачивание Ад
Фильтрация,
репцльпация
Раствор
Осаждение Ад
3
Г
Кек
В отвал
Ад цементное Раствор
Рис. 61- Цианидная схема переработки медио-серебряиого кека
шенном давлении кислорода, равном 140 кПа (1,4 ат), сокращается продолжительность операции с 24 ч до 30 мин.
Цианидные растворители позволяют эффективно перерабатывать весьма бедные материалы при обычной температуре; оии селективны, эффективны и имеют высокую степень регенерации. При использовании цианидных схем невысоки капитальные и эксплуатационные затраты. Однако для цианидных реагентов характерны высокая токсичность; образование с воздухом взрывчатых смесей в широком интервале концентраций (6—41% HtN), определяющее применение специального оборудования; необходимость низкой температуры (5—10° С) при их хранении, а также развитой системы вентиляции и утилизации газовых потоков. Все это сдерживает нх применение в гидрометаллургии медн.
Щелочные схемы
В полупромышленном масштабе для извлечения меди из известковых руд была отработана схема с использованием щелочного выщелачивания [365]. По этой схеме медь переходит в раствор в виде купрата (Na2CuO2), устойчивого до 82° С Для выделения меди испытывали вариант сорбции с последующим осаждением этиловым спиртом. Более предпочтительно электролитическое выделение, поскольку в этом случае получают медную губку и регенерируют щелочь.
Дробленую до —0,5 мм руду выщелачивают в барабанном аппарате (скорость вращения которого 0,33 об/мин) при периферической скорости движения материала 2,45 м/мин
Электролиз проводят при температуре раствора 80° С, напряжении на ванне 2—3 В и катодной плотности тока 807 А/м1 2. При этом получают губку, содержащую 80% Си, и регенерируют до 95% щелочи. Губку переплавляют прн 1260° С с добавкой раскислителя, а полученную медь подвергают электролитическому рафинированию.
В случае переработки смешанных руд остатки от выщелачивания направляют на флотационное обогащение.,
К другим перспективным растворителям для переработки медных руд с вмещающей породой основного характера относятся растворы аминокарбоксильных этилендиамииных кислот и их производных *. В связи с большей растворимостью в воде предпочтительнее использовать натриевые, калиевые, аммонийные соли. Выщелачивание этими растворителями осуществляют в течение 50—100 ч при температуре 10—90° С, Ж : Т = 1 : 2. Необходимую величину кислотности pH = 5-т-8 регулируют введением натриевой или калиевой щелочи. Медь из раствора извлекают одним из известных .способов: химическим осаждением, электролизом при плотности тока 150— 250 А/м2 или водородом при давлении 2—4 МПа (20—40 ат) и температуре 100—150° С. При использовании извести (1,8 кг извести иа 1 кг меди) осаждается 96% меди и регенерируется растворитель [366].
В последние годы уделяют внимание использованию аммиачных растворов для извлечения меди из медистых песчаников 2, предварительно восстановленных окисленно-известковых руд или хвостов их обогащения [8, с. 70—71).
Схемы с использованием сернистой кислоты
В работе [8, с. 75—76] сообщалось об испытании фирмой Майами (США) технологии переработки окисленных хвостов флотации на установке производительностью 100 т/сут с использованием в качестве растворителя сернокислых растворов, Содержащих 20 г/л H2SO4 и насыщенных .сернистым газом до 2—4% SO2 Это
1 Пат. (США), № 3438767, 1969.
2 К о б я к Г. Г. Исследование химического и фазового состава пермских медистых песчаников и разработка способа промышленного извлечения из них меди. Кандидатская диссертация, Пермь, 1951.
позволило достигнуть извлечения меди до 90%. В связи с присутствием в обрабатываемом материале 0,1—0,2% меди в виде силикатов, при обработке руды раствором, насыщенным только сернистым газом, извлечение меди не превышало 70—80%. Успех технологии во многом зависит от совершенства конструкции аппарата для выщелачивания, поскольку необходимы быстрое насыщение раствора газом и хороший контакт его с частицами руды. Наиболее подходящими оказались вращающиеся барабаны, оборудованные специальным приспособлением, обеспечивающим хороший контакт раствора с сернистым газом. Достоинство технологии — высокая рентабельность даже при небольшом масштабе производства, особенно при наличии дешевых источников сернистого газа и для руд с повышенной кислотоемкостью.
X арлан-процесс
Особое значение имеет технология переработки окисленных руд, разработанная фирмой Харлан Металз Ко [367—373] *. Отличительная ее особенность — применение несложного оборудования, компактность, мобильность и высокая производительность. Продолжительность цикла переработки руды до конечной продукции составляет^коло 4 ч.
Руду, в которой не менее 2% Си **, дробят до крупности —6,35 мм и подвергают выщелачиванию отработанным электролитом, содержащим 8-—9% H2SO4, 15 г/л Си, при 43—54° С (Ж : Т = 1 : 1) и интенсивной восходящей перколяции раствора. Через 40—90 мин содержание меди в растворе достигает 25—45 г/л. Пульпу фильтруют, а раствор направляют на электролиз. Чаны для выщелачивания и отстойники были изготовлены из стеклопластика.
Электролиз проводят в ваннах особой конструкции при напряжении 6,25—8 В и плотности тока 1350—2700 А/м2 (меньшее значение плотности тока поддерживается в начале процесса). Аноды изготовлены из сплава свинца (88—91%) и сурьмы (9—12%), а катоды — из никелевой жести (99% N1), помещенные в диафрагмы из материала Дайнель—Виньон. Порошок осыпается с катода, что существенно упрощает обслуживание ванн. В ванну объемом 5,2—5,4 м8 помещают 9 анодов и 8 катодов. Одноименные электроды соединены параллельно. Дендрнтообразование устраняется за счет округления торцов катода и его более глубоком (на 2,54 см) погружении, чем анода: Специальная конструкция системы токоподвода ванны, расположение электродов обеспечивают минимальные потерн электроэнергии, эффективное использование джоулева тепла.
Размеры анодов н катодов соответственно 0,762 x 0,99 x 0,013 м и 0,81X1,016x0,0064 м; расстояние между ними 7—8,3 см, изменяя его, регулируют крупность порошка.
• Пат. (США), №№ 3262870, 3282682, 1966.
** Других составляющих не более: 5% FepaCT, 5,0?4 СаОщд., 20?4 А1аОа, 80% SiO,, 1,0% Cl", Zn, Sb, 0,1% Pb, Mo, 0,02% F.
Высокие показатели электролиза были достигнуты за счет тщательного контроля электрического режима, температуры и состава электролита; совершенного оборудования и механизации основных операций; устранения поляризации электродов; рационального типа электродов и расположения их в ванне:
Используемую воду предварительно очищают от хлора, фтора, кальция, магния. В растворе поддерживают определенную концентрацию алюминия, присутствие которого ускоряет осаждение меди. Дефицит сульфат-иона в системе (за счет образования гипса при выщелачивании, например, кальцитсодержащих руд) устраняют введением сульфата натрия.
Для получения порошка, содержащего 99% Си, концентрация трехвалентного железа должна быть не более 1,1 г/л, а при получении еще более чистого порошка (99,9% Си) — не более 0,44 г/л. Вредное влияние железа устраняют добавкой четырехнатриевой соли этилендиаминовой тетрауксусной кислоты (3,44 г на 1г Fe3+ при pH = 4-^5) или фосфорной кислоты (5,5 мл 85%-ной кислоты иа 1 г Fe3+).
Концентрационную поляризацию устраняют интенсивным перемешиванием электролита, подавая раствор со скоростью 8,7 л/с через перфорированную трубу. Особенно тщательно контролируют плотность электролита и содержание в нем иона сульфата.
Пульпу порошка автоматически выгружают из ванны, трижды промывают специально подготовленной водой (pH < 6) при температуре 93° С и сушат при 495° С в атмосфере водорода.
Производительность 1 ванны по порошку составляет около 1300 т/год (по данным работы опытной установки в г. Феникс, шт. Аризона). Данный процесс особенно заманчив при эксплуатации небольших месторождений и пригоден для переработки сульфидных материалов после их обжига или сульфатизации.
Глава III
ПЕРЕРАБОТКА СМЕШАННЫХ РУД
Значительная часть медных месторождений представлена рудами, в которых содержатся окисленные и сульфидные минералы (смешанные руды). Как правило, непосредственное обогащение этих руд приемами флотации не обеспечивает высокое извлечение меди в концентрат. Для их переработки используют комбинированные методы: выщелачивание — осаждение—флотация (ВОФ), сегрегация.
Метод ВОФ был разработай в США фирмой «Анаконда» («Leaching—precipitation—flotation, LPF). В СССР обстоятельные исследования этой технологии выполнены под руководством проф. В Я. Мостовича в 1931 г.
Технология сводится к выщелачиванию измельченной руды серной кислотой, цементации меди, перешедшей в раствор, и последующей флотации цементной меди и сульфидных минералов. Во флотационный продукт, направляемый в медеплавильное производство, извлекается не только медь, но и благородные металлы, ассоциированные с сульфидами.
Для переработки руд с повышенным содержанием основных породообразующих минералов более предпочтителен процесс сегрегации, заключающийся в восстановительном обжиге руды с добавками хлоридов и последующей флотацией металлизированных частиц меди.
Зарубежная и отечественная практика переработки смешанных руд по комбинированным схемам и теоретические основы этих процессов обстоятельно проанализированы в специальных работах С. И. Митрофанова с сотрудниками [7, 374].
Руду, поступающую иа переработку, подвергают дроблению и измельчению. Оптимальную тонину помола выбирают с учетом достижения максимального вскрытия сульфидных зерен. При переиз-мельчении руды ухудшаются показатели по извлечению меди в раствор' в связи с сорбирующей способностью отдельных разновидностей пустой- породы. На большинстве фабрик крупность помола составляет —0,074 мм (выход фракции 50—80%).
Последующая переработка рудной пульпы возможна по двум основным схемам:. 1) непосредственное выщелачивание — цементация—флотация цементной меди и сульфидных минералов, 2) флотационное выделение сульфидной фазы с последующей доработкой хвостов обогащения по методу ВОФ. По второй схеме сокращается объем перерабатываемых материалов, удельный расход кислоты и железа, однако содержание меди в конечном продукте оказывается ниже. Рациональную схему определяют конкретно для каждого месторождения на основании технико-экономических показателей.
Выщелачивают рудную пульпу (35—45% твердого) в аппаратах с механическим перемешиванием при температуре 50—60° С. Продолжительность операции зависит от крупности руды, ее вещественного состава, гидродинамического режима и составляет в среднем 0,7—1,5 ч. Остаточная кислотность не превышает 3—5 г/л; извлечение меди при выщелачивании 85—90%.
Пульпу после выщелачивания разбавляют (Ж : Т = 2,5 — 3,5), при необходимости частично нейтрализуют известью и направляют на цементацию. Цементацию проводят в чанах с механическим перемешиванием пульпы, барабанах, используя в качестве осадителя губчатое железо или дробленую стружку. Осадитель целесообразнее подавать в виде пульпы, так как в этом случае улучшаются условия равномерной его дозировки. Продолжительность цементации составляет 10—25 мин.
На фабрике в Моренси (США) для осаждения меди в последние годы используют сернистый кальций. При флотационном обогащении используют следующие собиратели: S-3302, Минерек А, Мине-рек 1331, Z-200, ксантогеиаты. Основную флотацию проводят в те-
12 С- С- Набойчеико 177
чение 15—25 мин при pH — 4-=-4,5. Хвосты подвергают контрольной флотации для доизвлечения остатков цементной меди и сульфидов. Показатели флотации существ! нно зависят от результатов предшествующих технологических операций и, особенно цементации, поскольку солевой состав раствора и свойства цементного осадка влияют на извлечение меди в медный концентрат.
Хвосты от флотационного обогащения направляют на магнитную сепарацию. Магнитный продукт возвращают на цементацию, что позволяет не только снизить расход осадителя, но и несколько повысить общее извлечение меди (последняя частично остается на скрапе в виде плотных сцеплений).
При содержании в руде заметных количеств сульфатной меди практикуют предварительную ее отмывку. В этом случае продукты отмывки перерабатывают раздельно: раствор поступает на цементацию, а твердый остаток — на стандартное флотационное обогащение. Промывку проводят подкисленными растворами, используя для этой цели сгустители или барабанные аппараты.
Приведенный ниже технико-экономический анализ гидрометаллургической переработки смешанных руд основан на данных работы [7, с. 248—56].
Эффективность комбинированных схем зависит от типа руд, содержания в них меди, а также от расхода и стоимости серной кислоты и осадителя.
Согласно данным табл. 27 по сравнению со схемой прямой флотации комбинированные схемы 1 и 2 позволяют повысить общее извлечение меди на 25—30%. Однако и расходы на переработку 1 т руды возрастают на 23—30%. Поэтому применение комбинированных схем оправдано при условии, если затраты на дополнительную обработку окупаются стоимостью доизвлечеиной меди.
С ростом содержания меди в руде несколько (4—6%) повышаются удельные затраты на ее переработку в связи с увеличивающимся расходом кислоты и осадителя. Вполне понятно, что с учетом содержания меди в обрабатываемой руде и достигаемого ее извлечения характер зависимости удельных затрат в расчете на 1 т меди будет обратным.
Для определения 'рентабельного содержания меди в руде X, перерабатываемой по комбинированной схеме, предложена следующая зависимость [7, с. 255):
v (Л + в + C + D + E) ЮО
где А — удельные затраты прн обогащении руды по схеме прямой флотации;
В, С, D ।— затраты на 1 т руды соответственно серной кислоты, осадителя, вспомогательных материалов;
Е •— дополнительные к схеме прямой флотации удельные амортизационные отчисления;
Y — отпускная цена 1 т меди в концентрате;
т] — извлечение меди в концентрат.
Показатели переработки смешанных руд по схеме прямой флотации и двум комбинированным схемам
Таблица 27
Показатели Содержание Си, усл. ед.
0,56 - 1,00 х •
Извлечение Си, % . Прямая флотация 26,3 I 31,6 38.2 41.8
Себестоимость переработки 1 т руды, % 100,0 100,0 101.7 101.7
Извлечение Си, % .... . Комбинировс 59,0 гнкая схема 62,0 68,5- 74.1
Себестоимость переработки 1 т руды, % 100,0 101,1 104.1 105.6
То же, по сравнению с прямой флотацией 125.7 127,0 128,8 130.3
Себестоимость 1 т меди, до-извлеченной в концентрат, % . . . . ' 100,0 96,8 92,8 72,1
2. Флотация — переработка хвбстов по схеме ВОФ
Извлечение Си, % 59,5 61,4 69,0 74,6
Себестоимость переработки 1 т руды, % . . 100,0 100,7 104,1 104,9
То же. по сравнешно со схемой 1 91,6 91,2 91,4 91,0
Себестоимость 1 т меди, до-извлеченной в концентрат, % 100,0 100,0 90,9 71,6
То же, по сравнению со схемой 1 62,3 64,3 61,0 61,8
При комбинированных схемах обогащения улучшается качество концентратов и сокращается их выход, что обеспечивает более высокие показатели прн металлургическом производстве. Поэтому совместный анализ технико-экономических показателей обогатительного и металлургического переделов дополнительно снижает значение рентабельной сортности руды, вовлекаемой в переработку.
В табл. 28 приведены основные показатели процесса ВОФ для некоторых зарубежных предприятий *. Ниже более подробно описана практика работы фабрик Хайден (наиболее крупная установка) и Коппер Кипрус (как пример, с использованием предварительной' отмывки руды).
1 Практика работы- завода фирмы, «Инспирейшн» (США) будет рассмотрена в следующей главе при анализе технологических схем с использованием перколяционного выщелачивания.
Некоторые данные переработки смешанных руд по схеме ВОФ иа зарубежных предприятиях
Показатели Хайден (США) Бьютт (США) Багдад (США) Огайо (США) Розита (Канада) Майами (США)
Производительность по руде,тыс. т/сут 24,0 42 3,5 1.5 8,0
Содержание Си, %:
общей 0,85 -0,9 0,97—1,6 0,7-1,2 0.42 0,6-0,8
окисленной 0,27 0,18-0,21 0,2-0,3 0,13 0,4 0,5
Выщелачивание:
аппарат (размеры, м) . Реактор Реактор 3 реактора 3 реактора Реакторы 3 реактора
(d-12) (7,8X3,6) (db.l) (ЗХ 3 м) (1,8Х 1,8 м) (6,1X9,15)
продолжительность, ч 1—2 — 1,5 0,5 3-5
расход кислоты, кг/т руды 3,0 1 5 5,5-11,0 2,3-2,7 64 13,4
содержание Си в растворе, г/л 0,5-1,25 — — 0,45 6,0 1,7
pH . . . 2-2,2 — 1,2-2 2-2,5 1,7—2,3
Цементация:
осадитель ... Г убчатое Губчатое Скрап Скрап Скрап-)-губча- Губчатое
железо железо тое железо железо
удельный расход Fe . . 2 — 1,5 2,5 (1,84+0,12) 4,65
продолжительность, мин .... 5 — 10 ——
аппарат (размеры, м) , , , . 1 реактор 2 реактора Реактор 6 чанов 2 барабана 2 барабана
типа фло- (d3,6) (1.8Х 1,8) (3,6X7,2) (d2,7, Й8,4>
томашины
Флотация основная:
плотность пульпы, % 18 — 25 -
рн 3.8—4,0 — 4.5 4,6 4,5-4.9
продолжительность, мин 13 8 14 —.
Вспениватель (расход, г/т) Сосновое Сосновое Крезол (23) — Аэрофлот Сосновое
масло масло (10) 25 (5) масло (20,6)
Собиратель (расход, г/т) . . Мииерек А Мииерек А Минерек А Минерек В Минерек А Минерек А
(15) (45) (45) (30) (44)
Извлечение Си из руды в концентрат,
% . . . 84—89 82 0 >90 75 70,2 76 79
Содержание Си в концентрате, % . . 27,2 30,0 -33 25 65-68 32
Фабрика Хайден (шт. Аризона, США) [250, 375—378]
На обогатительную фабрику поступает руда с рудника в Рее. Медные минералы представлены сульфидными (халькопирит, халькозин) и окисленными (силикаты, куприт, малахит, тенорит) разновидностями, на долю последних приходится до 20% от общего содержания меди.
Руду после дробления измельчают до крупности —0,074 мм (выход фракции 95%), пульпу классифицируют: пески направляют на выщелачивание в барабанные аппараты, а шламы — в чаны с механическим перемешиванием.
Барабан футерован кислотоупорным кирпичом, размеры его 3,6X 6,1 м, скорость вращения 4,23 об/мин. Продолжительность обработки песковой фракции составляет около 10 мин, расход кислоты на 1 т руды 2,72—4,54 кг, pH раствора 1,5—1,7. Пульпу после выщелачивания подвергают противоточной отмывке и классификации; шламовую фракцию и верхний слив направляют на обработку в чан с перемешиванием, а пески после доизмельчения — на флотацию.
Шламовую фракцию обрабатывают в чане (основные параметры процесса приведены в табл. 28), полученную пульпу направляют иа цементацию меди губчатым железом в четырех десятикамерных фло-томашинах. Для предупреждения обратного растворения меди процесс ведут с небольшим избытком осадителя.
Цементный осадок подвергают основной и контрольной флотации. Хвосты последней обесшламливают в гидроциклонах, пески подвергают магнитной сепарации. Немагнитный остаток флотируют для извлечения крупной цементной меди.
Концентрат шламовой секции содержит 26—32,% Си, его объединяют с концентратом сульфидной флотации и перекачивают в фильтровальное отделение медеплавильного завода. На заводе применяется тщательный контроль процесса и автоматическая дозировка основных реагентов.
При сульфидной флотации получают пиритный концентрат (34— 36% Fe), который подвергают обжигу с получением огарка (—1% S) и серусодержащих газов (7% SO2). Последние направляют в сернокислотный цех производительностью 100 т/сут кислоты. Из огарка получают губчатое железо (35—50% Fe^J, которое после измельчения до крупности —0,5 мм применяют для цементации меди. Рациональное использование пиритного концентрата позволило повысить по фабрике извлечение меди и благородных металлов. При реализации схемы ВОФ содержание меди в отвальных хвостах снизилось с 0,42 до 0,19% и удалось увеличить общее извлечение меди почти на 20% (по сравнению со стандартной технологией).
Фабрика объединения Коппер Кипрдс (Кипр) [3, с. 189—90- 7, с. 211—14- 379].
На переработку поступает 2 тыс. т руды в сутки, содержащей 4,2% Си, 43% Fe, 48% S. Особенность руды — тесное взаимопро-растание сульфидов меди (халькопирита, борнита, ковеллина,
халькозина с пиритом), что даже при тонком измельчении не позволяет достигнуть хороших показателей селективной флотации.
Из-за наличия заметных количеств вторичных сульфидов в процессе добычи, транспортировки и хранения.руды происходит окисление их с образованием сульфатов, которые существенно ухудшают
'Туда
Измельчение
-----1----
Классификаций
Основная флотация
Хвосты
Концентрат ДоВодка
В ощелачивание 1 • . I г-=----------баО
Промпрооукт -Кондиционный J концентрат
В оборот
~ I Г-Пульпа
*т-
Сорбция^
Насыщенная смола Хвосты
В отвал
4 промывка
Промывная вода
В отвал
Десорбция
Товарный регенерат Сорбент
выделение меди^ Промывка^
Обезмеженный Медный Промывные воды Сорбент раствор продукт |
~ I Сброс
Приготовление
кислого^ раствора
Рис. 62. Принципиальная технологическая схема переработки смешанных руд с использованием сорбционной технологии
показатели флотации, а также служат причиной повышенного износа оборудования. Поэтому была организована предварительная отмывка руды от сульфатов. Руду дробят до крупности—12,7 мм и обрабатывают в течение 10 мин раствором, содержащим 40 г/л серной кислоты и 2 г/л сернокислого железа. Операцию проводят в двух барабанах (диаметром 2,3 м и длиной 4,9 м), футерованных резиной и базальтовыми блоками.
Пульпу фильтруют, раствор направляют на цементацию, а тщательно промытый остаток — на флотацию. Медь осаждают жестью в восьми сдвоенных вайнах длиной 18,3 и шириной 6,1 м, цементный 182
осадок просеивают в барабанном грохоте диаметром 1,22 и длиной 3,6 м, отверстия диаметром 4,8 мм.
Сульфидный остаток флотируют с последующей двойной перечисткой, йолучают пиритный (49—50% S, 43—44% Fe, 0,65— 0,7% Си) и медный (20% Си, 33% Fe, 42% S) концентраты.
Цементация — наиболее слабое место в схеме ВОФ. Этот способ выделения меди связан с повышенным расходом дорогого осадителя, что ухудшает солевой состав пульпы, поступающей на флотацию. Поэтому в последние годы ведутся поиски более совершенных вариантов извлечения меди. Так, при выборе рациональной технологии переработки смешанных руд месторождения Коппер Маунтейн (пров. Квебек, Канада; фирма Гаспе) и был рассмотрен процесс ВОФ с использованием автоклавного осаждения меди сульфидным концентратом при температуре 160° С 12251. Основные трудности этого варианта осаждения меди связаны со сложностью обработки плотных пульп в непрерывном режиме; необходимы предварительный подогрев и последующее охлаждение пульпы перед флотацией.
При использовании сорбционно-бесфильтрационного способа выделения меди можно ожидать лучших показателен (рис. 62) [170, с 17—25; 380].
По этому методу пульпу (1,5—1,6 г/л Си; 2,5—3,0 г/л H2SO4, 30% твердого) нейтрализовали до pH = 3,5, затем подвергали сорбции смолой АНКБ-7 (загрузка сорбента 30%, соотношение потоков смола : пульпа 1 : 10, продолжительность 30 мин). За шесть стадий сорбции содержание меди в растворе снижалось до 0,006 г/л.
Прн обработке более плотных пульп (40—45% твердого, 2,5— 3,0 г/л Си) за 12 стадий сорбции достигали остаточного содержания меди 0,02 г/л, насыщаемость ионита медью составляла 5,5—6,0%. На стадии десорбции (20%-ной HaSO4) смолу регенерировали на 99,7%.
В результате полупромышленных испытаний сорбционно-бесфильтрационного способа при использовании сорбента СГ-1 были определены следующие параметры основных операций:
Сорбция Отношение потоков смола: пульпа ......... 1 : 5—7
Начальное pH раствора............................ 4,0—4,2
Продолжительность одной стадии контакта, мин . . 40
Емкость насыщенной смолы по меди, % .............1,06—1,60
Регенерация
Концентрация кислоты, г/л . . .... 100—150
Число стадий.......................................... 3
Отношение потоков смола: раствор 3:1
Продолжительность стадии, мин .... 60
Остаточное содержание меди в смоле, % ...........0.03 (ММ
Из-за невысокой емкости применяемого
раствора было незначительным: в элюате содержалось 6,9' г/л Си, которую извлекали цементацией. Общее извлечение меди по всей схеме повышено до 87—88,5%.
Схемы с использованием непосредственного выщелачивания (отмывки) руды и последующего сорбционно-экстракционного выделения из пульпы медн следует считать наиболее перспективными для переработки смешанных руд.
Возможность частичного получения высокочистой продукции из руды, минуя медеплавильное производство, служит дополнительным резервом повышения эффективности переработки смешанных руд. Использование данных схем позволит снизить требования к рентабельному содержанию меди в этих рудах, что расширяет сырьевую базу за счет вовлечения в эксплуатацию месторождений труднообо-гатнмых руд.
Глава IV
ПЕРЕРАБОТКА ОКИСЛЕННЫХ БОГАТЫХ РУД И КОНЦЕНТРАТОВ
Для переработки этого типа сырья используют перколяционное или агитационное выщелачивание, прн этом обеспечивается принудительное движение раствора относительно загружаемого материала. Обязательным условием будет гранулометрическая однородность сырья Как правило, дополнительные затраты на дробление и подготовку руды компенсируются повышенным извлечением меди и интенсификацией выщелачивания.
Для перколяционного выщелачивания необходимы достаточно пористые и механически прочные руды. Руды с повышенной плотностью или способностью к шламообразованию предварительно измельчают и подвергают агитационному выщелачиванию.
Серная кислота — основной растворитель, используемый для выщелачивания меди из окисленных богатых руд и концентратов. В 20—30-х гг. текущего столетня на ряде заводов для переработки богатых руд, особенно содержащих и самородную медь, использовали аммиачно-карбонатные растворы.
ПЕРКОЛЯЦИОННОЕ ВЫЩЕЛАЧИВАНИЕ
Загрузка руды
При перколяционном выщелачивании раствор просачивается через слой руды, расположенной на ложном днище. Различают нисходящую (раствор проходит сверху вниз) и восходящую (раствор поднимается снизу вверх) перколяции Для последнего типа характерно более равномерное распределение раствора по сечению загруженного материала.
По способу подачи раствора известны периодическая и методическая (противоточная) перколяции. В первом случае руду обрабатывают одним и тем же раствором до окончания операции. Это удобно
при небольшом масштабе производства и переработке достаточно однородного по химическому составу сырья.
При противоточной перколяции руду по определенному графику подвергают последовательной обработке раствором с различной концентрацией растворителя. К концу выщелачивания наиболее упорные соединения меди вскрываются самым крепким растворителем. Принципиальная схема противоточной перколяции, используемой в крупнотоннажном производстве, показана на рис. 63.
Показатели перколяционного выщелачивания во многом зависят от проницаемости слоя загруженной руды, напора и характера движения раствора, температуры. Проницаемость слоя руды заметно влияет на скорость перколяции: при увеличении пористости слоя на 25% пропускная его способность по раствору возрастает почти в три раза [82, с. 114—1251.
Поскольку проницаемость слоя снижается с ростом содержания мелких фракций, руду после дробления классифицируют для удаления шламовых включений.
Загрузка неклассифицированной руды приводит к ее сегрегации по крупности, что осложняет равномерную перколяцию раствора по сечению чана. При отсутствии классификации укрупнения мелких частиц руды достигают при водяной «агломерации» (смачивании руды до 5—10% влаги и окатывании). Этот способ разработан в Горном Бюро (США) в 30-х г. текущего столетия. В связи с ограниченной механической прочностью образуемых окатышей высоту слоя руды в чане ограничивают 3—-4 м и раствор подают медленно и равномерно.
Оптимальные условия агломерации руды подыскивают для конкретного материала: например, для порфировых руд рекомендуются крупность —0,074 мм (около 30% фракции) и влажность 8—12%.
В работе [82, с. 114—125] была исследована установившаяся скорость движения раствора в условиях нисходящей перколяции при загрузке сухого, увлажненного и гранулированного материалов.
Лучшие показатели получены прн использовании гранулированного материала: 240 л/(мг-ч); для сухого и увлажненного материала скорость перколяции составляла 23 и 58 л/(м2-ч), при этом наблюдали сегрегацию. Добавка флокулянта ликвидировала сегрегацию и повысила скорость перколяции до 94 л/(мг-ч).
Наибольшую скорость перколяции получали при следующем способе подачи раствора: руду заливали по верхний уровень, затем раствор дренировали, после чего начинали непрерывную подачу свежего раствора.
Скорость нисходящей перколяции раствора снижается при наличии газа в слое руды. Это является одной из причин снижения эффективности переработки руды, содержащей более 3% карбонатных минералов. Вредное влияние газов устраняют при организации восходящей перколяции или же за счет предварительного смачивания руды. Повышение температуры ускоряет процесс химического растворения и перколяцию раствора, последняя возрастает почти в пять раз при увеличении температуры с 5 до 80° С (82, с. 114—125].
Рис. 63. Принципиальная схема противоточного перколяционного выщелачивания руды (на примере завода Чукикамата): /—V — промывные операции е соответствующими объемами поступасмых н получаемых растиоров, тыс. м*
Учитывая последующие способы выделения меди, большие масштабы производства, аппаратурное оформление перколяционного выщелачивания, специальный подогрев раствора экономически не оправдывается.
Промывка остатков от выщелачивания
Поскольку хвосты направляют в отвал или на дополнительную переработку, их тщательно отмывают для снижения потерь меди и растворителя.
Технику отмывки выбирают в зависимости от характера сырья: для этой цели изменяют направление перколяции, способ исполь-
лачнвання:
количество шлама. %; 1 — 0,0; 2 — 5,0;
3 — 10,0; 4 — 15.0; 5 — 25,0
зования промывных вод и продолжительность дренажа. Практикуют периодическую отмывку с оборотом промывных вод в каждой стадии цикла, полу-противоточную декантацию (последовательную обработку восходящим потоком промывной воды), периодическую нисходящую промывку с дренажом промывных вод между промывками. Для качественной отмывки хвостов необходима оптимальная скорость воды при минимальном ее расходе. Пер
коляционная промывка более эффективна и требует меньшего расхода воды, чем полупротивоточная декантация. В первом случае вода проходит через слой загрузки и понижает остаточную влажность до 15—20%.
Расход промывной воды определяют из водного баланса выщелачивания с учетом компенсации потерь раствора за счет испарення, утечек и т. д.
В целом эффективность отмывки хвостов зависит от физических свойств обрабатываемого материала (его пористости, способности к шламообразованию и др.); содержания шламовых фракций; равномерной проницаемости загрузки; температуры промывной воды.
Особенно ухудшаются показатели отмывки при повышенной зашламленности, что иллюстрируется данными рис. 64.
Аппаратурное оформление и режим процесса
Огромные масштабы производства при переработке перколяцией окисленных руд (до нескольких десятков тысяч тонн в сутки) требуют высокого уровня механизации погрузочно-разгрузочных работ.
Поступающую воду подвергают трехстадиальному дроблению с промежуточным грохочением. Крупность загружаемого материала зависит от характеристики руды и в среднем составляет 4—8 мм. Дробленую руду подают в отделение выщелачивания системой лен
точных транспортеров и загружают в чаны с помощью мостового крана, оборудованного транспортерным сбрасывателем или грейфером (рис. 65). В первом случае достигается более производительная и равномерная загрузка по сечению чана.
Форму и размер чана определяют в зависимости от производительности установки. На заводах большой производительности сооружают бетонные чаны прямоугольной формы емкостью до 5—10 тыс. т руды. Длина такого чана достигает 50 м, ширина 30—33 м, глубина
Рис. 65. Общий вид установки чанов для перколяционного выщелачивания на заводе У ид Хайтс [390]
5—5,5 м. При малой производительности выщелачивание осуществляют в деревянных чанах. Поверхность чана, находящуюся в контакте с раствором, покрывают кислотостойким материалом: асфальтом, смолой, реже — листовым свинцом, слоем полимерного материала, кислотоупорного бетона на синтетической замазке.
При выборе антикоррозионной защиты учитывают кнслотостой-кость, прочность, сцепляемость с бетоном, стойкость к абразивному износу и температурным колебаниям используемых покрытий. Специальными исследованиями установлено [385], что прн 52° С и концентрации серной кислоты покрытия из эпоксидных и полистироль-ных материалов отличаются хорошей кислотостой костью, но тверды и не стойки против абразивного износа; для эластомеров характерны хорошая абразивная стойкость и недостаточная адгезионная способность, а для уретановых покрытий — невысокая их кислотостойкость.
При использовании синтетических материалов необходима дополнительная крепящая арматура, что заметно увеличивает общую стоимость антикоррозионной защиты Поэтому на Рэе (США, шт. Аризона) решили использовать асфальтовую эмульсию, упрочненную 188
латексом и инертным мелким порошком (торговая марка смеси «Докал 1150»), что позволило в несколько раз уменьшить затраты по сравнению с известными вариантами защиты.
На расстоянии 0,1—0,2 м от дна перколяционного чана сооружают ложное днище — решетку из взаимно перпендикулярных брусков и планок, образующих отверстия со стороной 15—20 см. Решетку покрывают фильтрующим материалом (волокнами кокосовых пальм, рогожей, синтетическими тканями, реже — кусками прочной сульфидной руды).
Для транспортировки раствора используют центробежные насосы в антикоррозионном исполнении.
Продолжительность обработки руды составляет 8—13 дней (включая операции загрузки, промывки и выгрузки), в том числе непосредственно выщелачивание занимает 6—8 сут. Контакт руды с раствором одной концентрации составляет около 24 ч.т. е. за цикл выщелачивания через каждый чан пропускают 6—8 объемов раствора.
Руду промывают 1—Зсут., используя промывные воды с понижающимся содержанием меди, а на конечной стадии — свежую воду. В зависимости от свойств руды проводят до 5—7 промывочных циклов.
При переработке хорошо подготовленной руды обогащенные по меди растворы не требуют специальной фильтрации или отстаивания. При повышенном содержании шламов растворы подвергают осветлению одним из известных способов. Периодически осуществляют вывод части раствора для очистки от накапливающихся примесей.
Хвосты от выщелачивания системой ленточных транспортеров направляют в отвал.
Основные показатели заводской практики перколяционного выщелачивания приведены в табл. 29.
Достоинства и недостатки перколяционного выщелачивания
Перколяционное выщелачивание в последние годы рассматривают как неэффективную и устаревшую технологию в связи с невысокой ее интенсивностью и громоздкостью. К другим недостаткам способа следует отнести: сложность проведения селективного выщелачивания в связи с развитием побочных реакций при повышенной кислотности; большие затруднения в реализации подогрева раствора; сложность обслуживания и организации автоматического контроля и управления процессом; чувствительность процесса к характеру перерабатываемого сырья.
Однако при перколяционном выщелачивании более гибка технологическая схема: вынужденные остановки, аварии позволяют без ущерба отключить неисправный аппарат; используемые установки легко взаимозаменяемы, проще видоизменить условия загрузки сырья, подачи и дренажа раствора.
Заданный технологический режим поддерживается более устойчиво, проще обнаруживаются отклонения от него. Вполне рентабельно перерабатывать сырье, экономически нецелесообразное для организации агитационного выщелачивания.
Таблица 29
Некоторые данные по перколяционному выщелачиванию окисленных руд
Данные Чукикамата ИиспнреЙшн Чамбишк Потрернллос Унд Хайтс Мантос Т1 Бланкос Рэй Майна Днвнжэн
Год пуска 1914 1926 1927 1928 1953 1961 1969
Производительность по руде, тыс. т/сут 50- 10 Нет данных 7,5 14,0 Нет данных 10
Содержание Си в руде, % . . . 1,00 0,6-0,7 1 » » 1,37 0,6-0,8 1,9 0,8
Количество чанов, шт 14 13 6 9 8 8 14
Размеры чанов, м:
длина 45,7 53,3 13,7 32 37 2,5 d = 33,5
ширина . . 33,8 20,7 9,1 35 41 2,5 Н30.0
глубина 5,6—6,2 5,6 6,1 5,8 5,8 6,1
Емкость чана, тыс. т 10,4-12,5 8,1 Нет данных Нет данных 12,3 3,6 10
Тип футеровки чанов (толщина, см) . . Асфальт (Ю) Свинец Асфальт (7.6) Кирпич • асфальт (21,6) Асфальт (Ю) Асфальт (7,6) «Докал 1150»
Продолжительность обработки руды,. ч 80-100 108 Нет данных Нет данных 85-120 192 / 240—312
Данные Чукикамата Инспирейшн
Содержание в исходном растворе,
г/л:
Си 15 18—26
Р^общ 4,5 7,6
Fe3+ 1,7 4,1
HjSOi 54,0 18,0
Содержание в растворе после вы-
щелачнвания, г/л:
Си 28 23,5-33,5
^еобщ 4,5 7,6
Fe3+ . ... 1.4 0,8
H2SO4 39 9,0
Содержание Си в хвостах, % 0,30 0,115-0,165
Извлечение Си, % . 75-79 87,6
Расход кислоты на 1 т руды, кг — 10,5
Способ извлечения меди из раство-
Ра Электролиз Электролиз
* Окисленной
Продолжение табл. 29
Чамбншк Пот рернллос Уид Хайтс Мантос Бланкос Рэй Майна Дивижэн
Нет данных 10,7 12—13 Нет данных
То же 1,73 13,5 Нет данных » >
» » 1,08 9,3 > » > >
> » 75,9 30-35 45-50 » »
> » 41,60 20-28 35 23-25
» > 7,03 10—13 — —
» > 6,32 7-9 — —
» » 14,1 4—6 10 —
» ж 0,145 0,116 . — —
» » 89,7 86 90 —
» » 27-28 30-36,4 53-55 45
Электролиз Электролиз Цементация С помощью сернистого газа; цементация Электролиз
Но несмотря на это, по-видимому перколяционное выщелачивание имеет ограниченные перспективы для гидрометаллургических заводов и будет применяться на небольших установках.
АГИТАЦИОННОЕ ВЫЩЕЛАЧИВАНИЕ
Этот способ выщелачивания используют при обработке минусовой фракции руды, получаемой при ее подготовке к перколяционному выщелачиванию. В ряде случаев агитационному выщелачиванию подвергают богатые окисленные руды и концентраты. Необходимый гидродинамический режим для достижения однородной плотности пульпы обеспечивают с помощью механического перемешивающего устройства нлн сжатого воздуха, пара («пачуки»). Аппараты с механическим перемешиванием требуют повышенного расхода электроэнергии, более сложны в эксплуатации, приводят к дополнительному
Таблица 30
Технико-экономические данные переработки окисленных руд с использованием агитационного и перколяционного выщелачивания
Показатели Агитационное выщелачивание Перколяционное выщелачивание
I вариант П вариант I вариант Н вариант
Количество руды, млн. т Содержание Си в руде' 10 5 8 4
0,75 1.0 0,68 0,91
тыс. т . . Извлечение Си в продукцию, % Капитальные затраты *: общие, млн. долл, иа I т извлекаемой ме- 75 7 6 50 1 7 54,3 6 5 36,4 > 2
ди, долл. . . Эксплуатационные затраты, включая Добычу и переработку руды: 1750 1310 1680 1260
общие, млн. -долл. на 1 т извлекаемой ме- 34 0 20,5 25,6 15,2
ди, долл Стоимость реализованной продукции (долл /l т руды) при цене 1 т меди, долл' 622.0 563.0 706,0 641,0
662 3.7 4,9 3,0 4,0
815 Прибыль в расчете иа реали зацию 1 т меди (долл.) при цене 1 т меди, долл.: 1,1 5,4 3.3 4,4
662 . 18.25 41,1 113.0 338
815 . 129.0 178 22,6 101,4
• Прн годовой производительности 700 тыс. т руды.
образованию шламов. Поэтому при организации переработки большого масштаба сырья более предпочтительны аппараты-пачуки.
Диаметр пачуков 1,8—7,5 м, высота 5—8,0 м, емкость 20—200 м3. Их изготавливают из дерева, обычной стали и футеруют свинцом, асфальтовой мастикой, кислотостойкой резиной или керамикой, в последние годы аппараты изготавливают нз нержавеющих сталей. Плотность пульпы при выщелачивании выбирают с учетом содержания меди в сырье для получения растворов, определяющих последующее эффективное выделение меди: величина Ж : Т обычно составляет 1,5—4 : 1. Продолжительность операции 2—6 ч.
Промывку остатков от выщелачивания проводят в репульпаторах, а обезвоживание пульпы на фильтрующей аппаратуре.
Показатели агитационного выщелачивания будут подробнее рассмотрены позднее при описании практики заводов.
В отличие от перколяционного агитационное выщелачивание представляет собой более интенсивный процесс и его предпочтительно использовать для переработки материалов с повышенным содержанием медн. Применение агитационного выщелачивания упрощает организацию непрерывного высокомеханизированного процесса.
Оценка экономических показателей перколяционного и агитационного выщелачивания на примере переработки окисленных руд представлена в табл. 30, по данным работы [2251.
В расчете на 1 т извлекаемой меди капитальные затраты при агитационном выщелачивании оказываются больше, в то время как эксплуатационные расходы выше при перколяционном выщелачивании. Рентабельность перколяционного выщелачивания заметно повышается при переработке большого объема бедных руд.
ВЫДЕЛЕНИЕ МЕДИ ИЗ РАСТВОРОВ
В связи с повышенным содержанием меди в растворах, получаемых при выщелачивании богатых окисленных руд и концентратов, как правило, ее выделяют электролизом с нерастворимыми анодами. И только на заводе Уид Хайтс (США) используют цементацию, а на заводе Мантос Бланкос (Чили) — обработку сернистым газом с последующей цементацией для осаждения меди.
Практика цементации меди описана нами ранее; поэтому ниже подробно рассмотрим только электролитический способ осаждения меди.
На электролиз поступают растворы, содержащие не менее 20 г/л Си и 20—30 г/л H2SO4. Концентрация железа не превышает 4—5 г/л; в случае большего его содержания (завод в ИиспнреЙшн) особенно тщательно приходится контролировать температурный режим электролиза. Прн наличии шламовых взвесей в- растворе его осветляют, используя флокулянты или контрольную фильтрацию. Перед электролизом для улучшения качества катодного осадка в раствор вводят 10—500 г/м3 клея.
Электролитные ванны изготавливают из железобетона, деревян-
13 С. С. Набойчевко
193
ные ваниы в современной практике почти не используются. Геоме- ? трические размеры ванньг длина 6—10 м, ширина 1,2—-1,3 м, глубина 1,3—1,5 м. Внутреннюю поверхность, ванны защищают кислотостойким покрытием: асфальтовой мастикой, силикатно-глн-ноземистым кирпичом на кислотостойком цементе, сурьмянистым свинцом, а в последнее время — полимерными материалами (поливинилхлоридом, стекловолокном). Однако применение полимерных-материалов ограничивается из-’за их невысокой механической прочности и недостаточной надежности сварных швов.
Как правило, аноды изготавливают из сурьмянистого свинца (4—8% Sb). На заводе'Чукикамата в 30-х гг. в связи с повышенным содержанием в электролите нитрат- и хлор-ионов использовали аноды, изготовленные из более коррозионностойкого сплава «чилекс» (70% Си, 15—-22% Si, 0—10% РЬ; 2—2,5% Мп, 0—10% Ва), однако этот сплав отличался повышенной хрупкостью.
Кроме того, при использовании анодов из сплава «чилекс» выход по току понижался в связи с более высоким перенапряжением кислорода (почти иа 1 В), чем на свинцовых анодах. Размеры анода: ширина 0,84—1,0 м, высота 1,2—1,3 м, толщина 0,01—0,02 м. Иногда аноды изготавливают перфорированными, что снижает расход свинца (почти па 30%).
В качестве катода используют медные основы, полученные в отдельном матричном переделе. Размер катода: ширина 0,9—1,1 м, высота 1,2—1,25 м; толщина 0,005—0,007 м.
Энергетический режим электролиза во многом зависит от состава исходного раствора и условий процесса.
Напряжение на ванне поддерживают 2—2,3 В, плотность тока [ 150—210 А/м2, а при глубоком обезмеживанин раствора ее повышают ! до 230—250 А/м2; в последнем случае для получения качественного j катодного осадка необходимо дополнительное перемешивание электролита.
Расход электроэнергии на 1 т металла в среднем составляет 2200— 2800 к.Вт-ч, а при переработке растворов с повышенным содержанием железа достигает 3300—3500 кВт-ч. Некоторые показатели электролиза меди из растворов на примере практики конкретных предприятий приведены в табл. 31.
Для предотвращения потерь раствора и снижения загазованности атмосферы цеха поверхность электролита в ваннах покрывают минеральным маслом, производными сульфаматов, а в последние годы на ряде заводов используют шарики из легковесных пластмасс.
Для изготовления трубопроводов и транспортных магистралей вместо ранее используемых деревянных нли свинцовых материалов все чаще применяют полимерные материалы (полихлорвинил, полиэтилен, фуран). Этн материалы отличаются меньшей плотностью, не зарастают солями меди, поэтому необходимость в дополнительной антикоррозионной защите отпадает. Запорную арматуру изготавливают из высоколегированных сталей, сталей, футерованных свинцом, реже кислотостойкой резиной.
S ' Показатели электролитического осаждения медн из растворов выщелачивания богатых окисленных руд
. и концентратов '
Таблица 31
Показатели Чукнкамата ИиспиреАшн Нчанга
1-я стадии 2-я стадия обезмежнваиие
Число электролитных ванн , . 460 148 74 120 480
Размеры ванн, м . . . . Число электродов в ванне 5,85Х 1.195Х 1,474 73 анода, 72 катода 10Х 1.22Х 1,3 96 анодов; 67 анодов;
Состав анода, %. ....... 84,5 РЬ 14,5 Sb 0,6 Ag 95 катодов 95 РЬ; 8 Sb 66 катодов
Расстояние между анодамп, мм 114,2 ' 114,2 114,2 152,5 90
Плотность тока, А/м2 .... Напряжение иа ванне, В 75-183 1,96-2,16 102-156 2—2,12 2—2,12 118-135 2,2-2,4 235 2,2
Сила тока на ванпу, тыс. А . . 10-30 17-25 17-25 36 28
Выход по току, % 87—70 82—68 80-65 71-68 87-90
Расход электроэнергии, тыс. кВт-ч/т . . 2,3-2,5 2,3-2,5 2,3—2,5 3,1—3,7 2,0
Скорость циркуляции раствора, м’/мин . . 1,136 0,98 0,98. 0,36 0,03—0,05
Содержание в исходном растворе, г/л: Си .... 22 20‘ 15 30-37. 55—65
4,8 4,8 4,5 22,1 2,8
FcJ+ . . 1.4 2,3 2,3 3,7 2,2
H.SO, 54 58 55 33 30
Температура исходного раствора, “С .... 28—30 31-33 29-31 35—38 —
Содержание в отработанном электролите, г/л: Си 19 15 8 18-26 30
4,8 4,8 4,5 21-23 3,0
2,6 2,9 2,5 8—10 —
H.so4 60 64 60 38-57 70
Температура электролита, °C 32-34 33-35 32 40-42
ОПИСАНИЕ ПРАКТИКИ ЗАВОДОВ
В табл. 29 систематизированы показатели по перколяционному выщелачиванию руд на действующих заводах. Поскольку практика цементации меди на заводе.Упд Хайтс является уникальной, особенно по составу перерабатываемых растворов, авторы сочли возможным дополнительно к предшествующему материалу по цементации осветить некоторые особенности этого процесса.
Практика агитационного выщелачивания окисленных концентратов разбирается на примере завода Нчанга (Северная Родезия).
Чу кика мата Ко де Кобре Чукикамата (Чили) [174, с. 278—291 и 365—379)
Основные медьсодержащие минералы представлены антлеритом, атакамитом, брошантитом, халькантитом. Среднее содержание меди в руде в последние годы снизилось с 2 до 1% (растворимой меди около 80%). Руду дробят до крупности частиц 9,5 мы и транспортером подают к чаиам; в которых осуществляют периодическое выщелачивание. Чаны расположены в двух секциях, каждую обслуживают одним погрузочным и двумя разгрузочными кранами. Помимо окисленных, выщелачиванию подвергают (до 25% от общего объема) и смешанные руды. В этом случае хвосты направляют на флотационное обогащение. '
На 10,4 тыс. т руды (влажностью 1,5%) требуется 3,5 тыс. м3 раствора, из которых около 1000 м3 адсорбируется рудой. Через 4 ч сливают первый раствор; эту операцию повторяют дважды, получая три концентрированных раствора. Их храпят раздельно, а перед , электролизом объединяют, чтобы поддерживать раствор постоянного состава.
В четвертом периоде выщелачивания продолжительностью 4 ч используют отработанный электролит, а затем материал подвергают семикратной- промывке, после чего хвосты влажностью 9,5%' выгружают. Загрузка чанов длится 4—10 ч, а выгрузка хвостов 10—12 ч.
При обработке смеси сульфидной и окисленной руды используют только две промывки водой, обеспечивая необходимую для последующей флотации кислотность хвостов.
Составы растворов, получаемых прн выщелачивании, приведены в табл. 32. Железобетонные чаны, покрытые кислотостойкой мастикой, армированной металлической сеткой, поставлены на столбы для удобства обслуживания.
Раньше дренаж раствора осуществляли через четыре отверстия диаметром по 0,3 м, расположенные на расстоянии 11,3 м от ближайших стенок чана. В настоящее время все дно чана сделали фильтрующим. Фильтр, помимо дренажа раствора, защищает дно чана от механических воздействий при загрузке и выгрузке руды.
Расходные емкости (70' тыс. м3) расположены иа более высоком уровне, что обеспечивает самотек раствора. Трубопроводы изготовлены из дерева или свинца; последний прн незначительном содержа-196
Таблица 32
Составы растворов отделения выщелачивания и очистки, г/л
Раствор О Ч X £ £ Раствор О ’ и Feo«m £
Исходный для выщелачивания . 15 54 4,5 1,7 Промывной: первый’ 8 60 4,5 2.5
Крепкий после выщелачивания: первый 40 35 5,0 1,6 второй . . . третий . . четвертый' 10 11 9 45 35 25 4,5 4,0 3,5 1.8 1.0 0,8
второй 30 45 4,0 1.0 пятый . . . 5 15 1,5 0,5
третий ... 20 50 3,5 0,7 шестой . 6 16 2,0 0,5
объединенный * . . . после очистки •* . . 28 28 39 39 4,5 4,5 1.4 Сбросовый 0,6 12 6,0
• Содержание хлорв О,ЗБ г/л.
*• Содержание хлора 0.06 г/л.
нин азотной кислоты и хлора предпочтитечьнее из-за большего (в 4 раза) срока службы. Арматура и насосы футерованы свинцом.
Растворы перед электролизом обрабатывают цементной медью в каскаде пяти реакторов для восстановления трехвалентного железа и очистки от хлора.
Осадок полухлористой меди обрабатывают горячим раствором хлористого железа. Полученный раствор подвергают цементации железным скрапом в 14 бронзовых барабанах, установленных попарно. Цементную медь возвращают на операцию дехлорирования, а раствор хлористого железа — на обработку полухлористой меди.
Присутствие в руде молибдена, особенно при его содержании свыше 0,008%, существенно осложняло дехлорирование раствора. Поэтому с 1930 г. практикуется обработка крепкого раствора сернистым газом, получаемым при сжигании серной руды или вулканической серы. Операцию осуществляют в поглотительных башнях, пропускающих 300—400 м3/ч раствора. При этом восстанавливаете^ часть трехвалентного железа, повышается кислотность раствора и удаляется азотная кислота.
В связи с вовлечением в эксплуатацию уникального месторождения с запасами около 153 млн. т. руды, содержащей 1,35% Си (рудник «Экзотика»), расширили отделение выщелачивания, которое теперь включает чаны емкостью 11 (6 шт.) и 14 (8 шт.) тыс. т руды [386].
Инспирейшн - (США)
[1, с. 100—108; 3, с. 176—188; 238, 378, 387—388)
На заводе перерабатывают смешанные руды, содержащие до 60% окисленных и 40% сульфидных минералов. Промытые хвосты от выщелачивания направляют на обогатительную фабрику (рис. 66).
Раньше для выщелачивания использовали подкисленные растворы сульфата трехвалентного железа; в последние годы перешли на обра-
Руда &‘2Smn) Грохочение
-Брмм
Классиднл.ация, две стадии
Песни 0р7Чмм НаперераЬоткд
нм
Дробление, оде стадии - 9,5 мм -
Раствор Перколяционное Вь щелачивамие
От Выщелачивания отвалов *
рлпромыЛм -
Свежая вода
Растворены»
Отработанный электролит.
• Цементация • Грохочение —4find ьвмм
МагнЬгпмая сепарация
Цементная медь
Доизмелъчгние
Фло&ацйя^-—•-Хвосты | Медный хжце. трат Пиритный концентрат № медеплавильный завод ' -др- 30г
Она I
| раствора [
Медь катодная
4
Получение
Рнс= 66= Технологическая схема переработки смешанных руд с использованием перколяционного выщелачивании на заводе Инспирейшн [378]
ботку только раствором серной кислоты, что не только улучшило селективное выщелачивание окисленной меди, но и сократило продолжительность операции с 9 до 4,5 сут.
Завод Чамбиши (Замбия) (3891
Месторождение окисленных и. сульфидных руд, содержащих 3,32% Си, мощностью около32 мли. т открыто в конце XIX в. Освоение его и использование началось в 1961 г., а в 1965 г. получена первая катодная медь. При переработке руд выделяют сульфидные концентраты; окисленную руду подвергают выщелачиванию, что обеспечивает выпуск 7,6 тыс. т'меди.
После трехстадийного дробления до крупности 10 мм руду подвергают классификации, при этом отделяется 25% материала крупностью —0,15 мм, который подвергают агитационному выщелачиванию. Перколяционное выщелачивание крупной фракции руды проводят при восходящем движении раствора. Высота слоя загрузки составляет 5,5 м. Ложное дно образовано отверстиями диаметром 0,96 см и покрыто коксовой циновкой. Каждую загрузку руды обра-198
батывают 4 раза в течение 30 ч, получая четыре различных по составу раствора. При наличии в растворах железа его осаждают известью. Осветленные растворы поступают на электролиз. Расход серной кислоты при выщелачивании составляет 3 т на 1 т извлекаемой меди.
Эмералд Ислз. (США, шт. Аризона) [260]
В 1944 г. завод начал переработку окисленной руды, содержащей ' 2% Си. После дробления и грохочения руду ‘ крупностью —13 мм направляли на перколяционное выщелачивание. Операцию проводили в четырех бетонных чанах, футерованных деревом, пропитанным крезотом. Размеры чана 2,0 x 3,05 x 33,5. Выщелачивание 1%-ным раствором серной кислоты длилось 96 ч. Хвосты промывали в пяти чанах: два из них размером 3,05x15,5 и три 3,05x9,15 м.
У ид Хайтс (Анаконда, США) [238, 316, 390—394]
На переработку поступают окисленные руды, в которых основной медный минерал — хризоколла, а вмещающая порода — кварцевый моноциу; содержание меди в руде 0,6—0,813%, до 84% меди приходится на долю растворимой. Схема выщелачивания и цементации показана на рис. 67.
Руду дробят в две стадии до крупности —10 мм; выход фракции +3,2 мм составляет 40—52%, минусовую фракцию «агломерируют» при влажности 7—9%, после чего крупность материала, загружаемого в железобетонные чаны, составляет —11 мм.
Первый чан заполняют восходящей перколяцией с помощью насоса; в остальные чаны раствор поступает за счет гидравлического напора, который при необходимости поддерживают аэролифтом (0,76 м’/мнн). Загрузка длится 10—15 ч, выгрузка 14 ч, промывка хвостов 32 ч; температура при выщелачивании 36° С. Основные регулируемые параметры: продолжительность контакта раствора с рудой и расход кислоты. Хвосты, содержащие 0,054% кислоторастворимой меди и имеющие влажность 11—13%, направляют в отвал.
Серную кислоту получают контактным способом на установке производительностью 450 т/сут, используя привозную руду (25% S); расход кислоты 320 т/сут.
Растворы после корректировки кислотности поступают на цементацию. Для них характерно повышенное содержание меди, трехвалентного железа и пустой породы. Тем не менее при цементации извлечение меди составляет 99,97% (остаточное содержание меди 0,007 г/л), содержание меди в осадке 80—83%, железа 2,4%, нерастворимого остатка 1%, расход осадителя 1,2—1,25 т/т меди. Такие высокие показатели получены благодаря тщательному контролю состава раствора, совершенному гидродинамическому режиму в аппарате, оптимальной продолжительности контакта раствора с осадителем и высокому его качеству. При цементации поддерживают температуру не выше 30° С, для чего в теплое время года раствор частично охлаждают.
раатюзр на хранение
Рис.67.) Схема потока медьсодержащих растворов на цементационной установке в Уид Хайтс (в расчете на выпуск 1950 т медн
7 — насосы; 2 — зумпф оборотного раствора; 3 — зумпф сбросиого раствора: 4 — 20 двухсекционных ванн цементации (в том числе № 1а — отстойная, № 16 — 2 —на очистке, № 3— 8 — ванны для богатых растворов; № 9 — 13 — ванны для бедных растворов; № 14 — 15 — ванны иа удаление цементного осадка; Я 16—18 — отстойные ванны; № 19 — 20 — резервные ваниы); 5 — барабанные сепараторы цементного осадка; 6 — бетонированная площадка для подсушки
Первоначально проводили трехстадиальную цементацию в 20 сдвоенных железобетонных желобах (18,3x3,05x1,37 м), которые впоследствии заменили «активированными» желобами, что позволило увеличить скорость подачи раствора на 1 № сечения аппарата с 14,5 до 21 л/мин, интенсифицировало процесс и несколько снизило расход осадителя. В качестве осадителя использовали активную обезлу-женную жесть однородной крупности с насыпной массой 354 кг/м3 или высечку, насыпная масса которой составляет 260—275 кг/м3.
Цементный осадок тщательно обрабатывают для отделения остатков скрапа и отмывки сульфатов, в течение суток подсушивают в резервуарах, обогреваемых природным газом, до влажности 12—15% н отправляют на медеплавильный завод. Такая подготовка осадка с учетом значительного расстояния перевозки оказалась более выгодной по сравнению с брикетированием.
Растворы после цементации упаривают в бассейнах или используют для улавливания пыли и охлаждения огарка на сернокислотной установке. Поскольку шлам скрубберов и пульпу огарка направляют в отвал, значительную часть железа таким способом выводят из технологического цикла.
Завод Мантос Бланков (Чили) [3951
Месторождение окисленных руд открыто в 1912 г. Характерная особенность руды — непостоянство состава и большое содержание хлоридов (0,4—15% С1). Медные минералы на 2/3 представлены атакамитом, остальная часть — хризоколлой. Содержание медн в руде 1,9%, нз которых около 97% кислоторастворимой. Пустая порода представлена дацитом, кальцитам (до 1%) и характеризуется пониженной проницаемостью, поэтому необходимо мелкое ее дробление (до —4,5 мм) перед выщелачиванием Однако в этом случае возрастает содержание мелких фракций (до 60% фракции —0,32 мм), поэтому руду увлажняют до 5—6%, окатывают, а затем отделяют мелочь.
Цикл обработки руды включает 108 ч выщелачивания, 36 ч промывки, 48 ч загрузки руды и выгрузки хвостов; схема потоков обрабатываемых материалов приведена на рис. 68.
Выщелачивание растворами соляной и серной кислот проводят в железобетонных чанах, обслуживаемых 10-т мостовым краном. Применяют противоточную ^ерколяцию н промывку. К особенностям данной практики выщелачивания относят:
1. Организацию восходящей перколяции растворителя непосредственно в момент загрузки, что, несмотря, на мелкое дробление руды, устраняет каналообразование и вредное влияние газов, образующихся при растворении кальцита.
2. Удаление 114—152 м3 раствора после загрузки чана в емкости для промывных вод, так как раствор беден н содержит много шламов. Это облегчает последующую перколяцию раствора и устраняет' загрязнение богатых растворов шламов.
3. Разное направление потока раствора в смежных чанах, что улучшает проницаемость слоя руды.
4. Введение флокулянтов для осветления (в течение 6 ч) обогащенного раствора перед осаждением меди, что существенно упрощает обработку получаемого осадка. Используемая арматура, трубопроводы и насосы футерованы кислотостойкой резиной.
Промывочные воды на противоточную промывки
[ Дренаж | Выгрузка
8(7)
_ и "ВО"3
7(6)
1180м3
\5W.
6(5)
ПМ
М I
l_J£W
Bp
6(2)
5(й)
I '
-4(3)
15У0м3 tPW I
I .
П". * 1 >50^
т\/////лЛ :w///a j
.1----;-----.---J 5lilJ мз
2(1)
1(0)
............ I
I выгрузка \очиткп и подгапбА\
Загрузка |
16 • .?4 бУОм^
О
2160м3 (на электролиз)
На цементацию 5У0н3
•Отработанный олентролит
---------2 ........5
4----------3 --------6
Рис. 68. Схема выщелачивания иа заводе Мантос Блан кос 1395 ]:
/ — восходящая перколяция; 2 — крепкий раствор; 3 — циркулирующий раствор; 4 —нисходящая перколяция; 5 — отработанный электролит; 6—промывные воды;
1 — VIII — емкости для хранения промывных вод
Богатый раствор, объем которого составляет 265 м3/сут, обрабатывают в противотоке сернистым газом в пяти стальных башнях диаметром 4 м и высотой 17 м, футерованных полимерным материалом и кислотостойким кирпичом. При этом около 60% меди осаждается в виде полухлористой меди. Сернистый газ (14% SO2) получают при 202
сжигании комовой серы. Пульпу полухлористой меди обезвоживают на центрифуге; фугат возвращают на выщелачивание руды. За сутки осаждается 55—57 т меди в виде хлорида и регенерируется 75—85 т серной кислоты. Ежедневно до 530 м3 раствора выводят на глубокое обезмеживанне цементацией и на удаление накапливающихся примесей (сульфатов и хлоридов' железа, алюминия, магния, натрия). Для цементации используют два барабана объемом по 30 м3 (продолжительность операции 2,5 ч) и два чана с воздушным перемешиванием объемом по 50 м3 (продолжительность 8—9 ч). Получают 15 т/сут цементного осадка, содержащего около 75% Си.
Готовят шихту, состоящую из 60% хлорида меди, 36% известняка, 4% восстановителя; смесь гранулируют, подсушивают при 177° С в течение 20 мин для увеличения механической прочности гранул, переплавляют во вращающихся печах емкостью 13 т. Полученную медь, содержащую 99,5% Си, 0,09—0,3% О2, 0,1% S, 0,003— 0,01 % Fe, подвергают огневому рафинированию для более полного удаления железа, серы, кислорода.
Рэй Майнз Диви, жен {США, шт. Аризона) [396—3981
На заводе организована переработка силикатной руды (0,8% Си, основной минерал — хризоколла). Руду дробят до крупности —12,7 мм, после классификации крупную фракцию подвергают перколяционному выщелачиванию, а шламы (—0,15 мм) направляют на выщелачивание отработанным электролитом в пачуках.
Хвосты промывают декантацией в пяти сгустителях, нижний слив из последнего сгустителя направляют в отвал. Медь, содержащуюся в промывных водах, осаждают цементацией в конусных аппаратах. Полученный осадок растворяют, и раствор, содержащий 50 г/л Си, объединяют с основным раствором перколяционного выщелачивания. Объединенный раствор, в котором концентрация меди уже 30 г/л, подвергают электролизу с получением катодного металла (>98,9% Си).
Половину богатого раствора обезмеживают до 10 г/л, а вторую часть его — до 5 г/л; первый отработанный электролит направляют на перколяционное выщелачивание, а второй — на агитационное.
Помимо матричных ванн, в электролитном отделении установлено 400 товарных ванн.
Электролиз ведут при плотности тока 175—55 А/м2, используют перфорированные аноды; выход по току 70%, а расход электроэнергии 3300 кВт-ч/т меди.
Для борьбы с испарениями в электролит вводят пенообразующее ПАВ анионного типа. Соли железа и алюминия в обезмеженных промывных растворах осаждают известняком; фильтрат используют при промывке хвостов перколяционного выщелачивания. Завод выпускает около 24 тыс. т/год катодной меди. Для удовлетворения потребности в серной кислоте сооружена специальная установка, иа которой получают кислоту контактным способом из смеси газов обжигового и конвертерного отделения близлежащего медеплавильного завода Хэйден.
Нчанга (Нчанга Коксолидейтид Коппер Майнз, Замбия) [174, с. 253—277; 399—400; 401]
При флотационном обогащении руд месторождений Нчанга наряду с сульфидным концентратом получают богатый окисленный и бедный концентраты, содержащие соответственно 11—14 и 2—2,7% кнслоторастворимой меди. Основные минералы: куприт, хризоколла, малахит, азурит и гораздо реже — халькопирит, халькозин, борнит.
Рнс. 69. Схема цепи аппаратов переработки окисленных концентратов на заводе Нчанга: / - чан с механическим перемешиванием для выщелачивания; 2. 3 — сгустители; 4 — сборник богатого растаора; 5 — коммерческие электролизные ванны; 6 — ванны матричного отделения; 7 — сгуститель пульпы бедного концентрата; 8 — расходный чал для инталия фильтра; 9 — фильтр для нейтральных растворов; 1G — чан с механическим перемешивал нем для приготовления пульпы; И — аппараты дли выщелачивания, типа «пачук»; 12, 15 — фильтры; 13, 14 — репульпаторы хвостов выщелачивания; 16 — фильтр; 17 — репульпа-тор; 18 — репульпатор железистого кека; 19, 21 — сгустители; 20 — фильтр; 22 — чан кислой репульпацнн; 23 — чан железоочметкн; 24, 27 — фильтры; 25, 26 — репульпаторы; 28 — сборная емкость для раствора, лаправленного п очистное отделение; 29 — чаны с ме ханкческнм перемешиванием для осаждения гидрата медн; 30 — сгуститель
Руды характеризуются повышенным содержанием шламовых. фракций, особенно после дробления, поэтому в отличие от практики американских заводов, вместо перколяционного используют агитационное выщелачивание (рис. 69).
Богатый концентрат выщелачивают в трех чанах (Т : Ж = 1) в течение 4,5—5,5 ч при аэрации пульпы, достигая извлечения 99% меди. После отстаивания пульпы и фильтрации получают богатый раствор, который после гидролитической очистки от железа в четырех аэролифтных чанах, поступает на электролиз.
Кек подвергают репульпации, фильтрации, промывке и возвращают на флотацию для выделения сульфидных минералов. Медь, содержащуюся в промывных водах, осаждают известью (pH = 5,6). Получаемый кек, содержащий 20% Си, после подсушки (до 20%) используют для очистки основного раствора от железа.
Электролитическое выделение меди проводят в железобетонных ваннах, футерованных свинцом. Поступающие растворы разбавляют до концентрации 22—24 г/л Си.
Бедный концентрат поступает с обогатительной фабрики в виде пульпы (11—14% твердого). Пульпу сгущают, нижний слив (50% твердого) поступает на выщелачивание в два чана диаметром 15,2 м. Получаемые кеки вновь выщелачивают в трех пачуках (диаметром 3,05 м) до остаточной кислотности 5 г/л. Второй кек после репульпации и промывки направляют в отвал. В зависимости от содержания медн с учетом водного баланса схемы растворы направляют нли на электролиз, или на осаждение гидратного кека.
Переработка окисленных руд по схеме сернокислотное выщелачивание—электролиз позволяет получать чистую катодную медь. Эта схема вполне рентабельна даже прн небольшом масштабе производства. Последнее особенно актуально при вовлечении в эксплуатацию мелких месторождений окисленных руд. В работе [402] сообщается, что по этой технологии для переработки руд месторождения Сьерро-Верде (Перу) будет работать установка производительностью 30 т катодной медн в месяц.
АММИАЧНОЕ ВЫЩЕЛАЧИВАНИЕ РУД
Аммиачному выщелачиванию подвергают богатые руды, содержащие окисленную или самородную медь, с повышенным содержанием карбонатных, магнезиальных вмещающих пород. В США работали две установки по аммиачному выщелачиванию: Калюмет энд Гекла (1916—1968 гг.) (шт. Мичиган) и Кеннекотт (1916—1931 гг.) (шт. Аляска). После дробления до —9 мм и гравитационного отделения сульфидного концентрата хвосты (—1% Си) выщелачивали аммиачно-карбонатным раствором в герметичных перколяционных чанах в течение 45—60 ч (с учетом вспомогательных операций). Первый богатый раствор, содержащий 78,5 г/л Си, 103,2 г/л NH3, 122 г/л СО2, направляли на дистилляцию, второй раствор был оборотным для выщелачивания свежей порции руды.
Хвосты выщелачивания подвергали пропарке для отмывки аммиака и направляли в отвал.
Дистилляция богатого медно-аммиачного раствора прн температуре 105—130° С до содержания аммиака в газовой фазе не более 0,01%. Аммиак и двуокись углерода улавливали в скрубберах и возвращали на выщелачивание, а медь переходила в осадок, содержащий до 75% Си. Извлечение меди из руды в раствор составляло около 80%.
Несколько позднее подобная технология была реализована на заводе Бвана М’Кюбва (Замбия). В связи с присутствием в руде,
содержащей 3,5—4% Си наряду с малахитом и фосфатом меди, хризоколлы (минерала, плохо растворимого в аммиаке), по этой схеме был необходим предварительный двустадийный восстановительный обжиг. После измельчения до —3 мм огарок подвергали выщелачиванию. В связи с переработкой более богатого сырья извлечение медн при выщелачивании достигало 90% и выше. Завод был закрыт в 1931 г. При аммиачном выщелачивании необходима специальная аппаратура и высокий расход пара. Эффективность его во многом определяется степенью регенерации растворителя, качеством и составом перерабатываемого сырья. Из-за отсутствия подходящего сырья, а также в результате разработки более рентабельных технологий, аммиачное выщелачивание медных руд в современной практике не применяется.
Таблица 33
Показатели работы заводов, применявших аммиачное выщелачивание медных руд
Показатели Калюмет Эйд Гекла Кенкекотт Бвама АГ'Кюбва
Содержание Си, %: в исходной руде . 0.4—0,7 0,9—1,0 3,9
в отвальных хвостах .... 0,1 0.14 Н. д
Производительность по руде, т/сут 8000 800 1000
Выпуск Си в концентрате, тыс. т/год 6,7 2,0 10,0
Содержание в исходном растворе, %: 5,5-6 10,5 5
СО. 3,8—4 12,4 4
Си 2,8—3 6,3 Н. д
Содержание в богатом растворе, %: NH. ... 3,5—5,3 ' 10,32 5
СО2 3,8—4,0 12,20 5
Си . . . 3,5-5,4 7,85
Количество аппаратов для выщелачивания 16 8 10
Емкость аппарата, т 1000 500 1000
Извлечение Си в раствор, % 79,5 76-80 90
Содержание Си в осадке, % ... 80-82.3 75—76 75,8
В табл. 33 приведены основные показатели работы описанных выше заводов.
Технология переработки более бедного (0,8—1,0% Си) сырья с предварительным восстановлением и последующим аммиачным выщелачиванием заслуживает внимания при наличии руд, хорошо восстанавливающихся при t -g 500—700° С, в противном случае более предпочтительна схема сегрегация—флотация.
Глава г
ПЕРЕРАБОТКА ЦЕМЕНТНОЙ МЕДИ И МЕДЬСОДЕРЖАЩЕГО ВТОРИЧНОГО СЫРЬЯ
Схемы переработки металлического медьсодержащего сырья предусматривают получение купороса, катодного металла, высококачественного Порошка. В последних двух вариантах конечный продукт производят при значительно меньшем числе переделов и комплексном использовании сырья, чем по пирометаллургической технологии. Кроме того, вследствие низкого содержания (или отсутствия) благородных металлов в цементной меди и вторичном сырье целесообразна именно гидрометаллургическая их переработка.
Наибольшее значение имеют схемы с использованием сернокислых или аммиачных растворов. Гидрометаллургическая переработка вторсырья требует предварительной его подготовки с целью достижения однородной крупности, удаления экранирующих веществ (масла, изоляции, лака и др.), усреднения по химическому составу.
Простой и распространённый способ удаления органики — обжиг при 800—900° С во вращающейся печи. Однако в этом случае имеют место большие газовыделения и потери металла за счет угара. Более рациональным способом является химическое обезжиривание, например 10—15%-ным раствором соды при 70—80° С или специальными моющими составами. При использовании кипящих растворов каустической соды одновременно удаляются покрытия олова и ципка, которые в дальнейшем можно извлекать экстракцией алифатическими кислотами х. Оловянные и цинковые покрытия удаляются и при кратковременной обработке скрапа в расплаве каустической соды с добавкой окислителей типа нитратов, хроматов калия или натрия 1 2.
Непосредственная гидрометаллургическая переработка некондиционных классов вторсырья в связи с химической, вещественной и гранулометрической неоднородностью представляется нерациональной. Весьма удобным способом подготовки этого вида материалов служит предварительная восстановительная плавка. В этом случае ряд примесей шлакуется (алюминии, кремний, марганец, железо и др.), сжигается органика, а цинк, свинец, олово, мышьяк в значительной степени отгоняются и концентрируются в возгонах, которые представляют ценный продукт для дальнейшего использования. Расплав меди подвергают грануляции с получением достаточно однородного продукта, пригодного для выщелачивания.
В конце сороковых годов на одном из зарубежных предприятий работала установка по производству 1,1—1,3 т/день купороса в виде раствора, получаемого из цементной меди, который использовали в цикле цинковой флотации [403]. В связи с малой производительностью, низким извлечением меди (до 10% ее оказывалось в трудио-
1 Пат. (Япония), № 5962, 1968.
• Пат. (США), № 2891881, 1959.
растворимой форме) окислительный обжиг (/ = 600° С, т = 2 ч) был отклонен. Лучшие показатели по окислению медн достигаются при обработке слоя цементной меди толщиной 5—8 см и влажностью не более 20—25% раствором, содержащим 120—130 г/л NH3. При расходе около 10 кг 100%-ного аммиака на 1 т цементной меди через 15 ч выдержки около 80—85% меди переходило в кислоторастворимую форму. Этот материал выщелачивали в чане с механическим перемешиванием, получая раствор, пригодный для использования в цикле обогащения.
Затраты на производство этим способом раствора купороса оказались почти на 30% меньше, чем затраты на покупку этого химиката.
Имеются предложения по выщелачиванию цементной меди после флотационного обогащения аммначно-карбонатнымн растворами *. Затем медь восстанавливают до одновалентной формы металлической медью, сернистым газом, и раствор подвергают дистилляции, в результате которой получают чистые окислы н регенерируют растворитель.
Медный скрап, содержащий олово, свинец и никель, перерабатывают на купорос. [40 |. Скрап переплавляют, гранулируют и выщелачивают сернокислыми растворами, содержащими 20—23 г/л Си, 250—270 г/л H2SO4, при температуре 85—90° С в барабанном аппарате; для окисления используют предварительно подогретый воздух. Раствор из барабана непрерывно выпускают через сетку из нержавеющей стали для отделения выносимых гранул.
Взвесь сульфатов свинца и олова улавливают в гндроциклонах, промывают, карбонизируют и отправляют потребителю. После контрольного осветления раствор выпаривают, кристаллизуют с получением высококачественного купороса. Часть маточного раствора периодически выводят на получение никелевого купороса или иа осаждение никеля в виде сульфатаммонийной соли.
Электролитическое рафинирование скрапа [404—4051 позволяет получать катодную медь и извлекать олово, свинец. Однако процесс сопровождается образованием большого количества шламов, что резко замедляет процесс и повышает расход электроэнергии. Кроме того, шлам, попадая на катод, ухудшает качество электролитной меди. При электролизе скрапа, содержащего более 25% Zn, в растворе происходит быстрое накопление этого металла. Для осаждения качественной меди необходима интенсивная циркуляция электролита и повышенная плотность тока. Ряд трудностей вызывает увеличенное содержание олова в скрапе. При введении в электролит 4—8 г/л железа олово заметно растворяется; при наличии мышьяка, сурьмы это явление не наблюдается. Переводя олово в шлам даже при высоком его содержании в скрапе (до 63% Sn), удается получать катодную медь, содержащую не более 0,01—0,05% Sn.
По другому варианту олово связывают во фторидный комплекс (весовое отношение в электролите HF : Sn—1). В этом случае
1 Пат. (США), № 3492115, 1966.
катодный металл содержит менее 0,001% Sn. Однако последующее извлечение олова требует значительных затрат.
Электролитический способ использовали также для выделения меди из медио-серебряного сплава (50% Ag, 40% Си, по 5% Zn, Nt), последний расплавляли в индукционной печи с добавкой оборотной меди для получения в конечном продукте около 20% Ag [406]. Из полученного сплава отливали аноды, которые направляли на электролиз. Электролит содержал 30 г/л Си и 130 г/л Н 2SO4, температура его 75° С. Процесс вели при катодной плотности тока 130—135 А/м1 2 и напряжении на ванпе 0,18 В, получали катодную медь (99,95% Си), а серебро оставалось на аноде в виде скелетного осадка (96% Ag). Это оказалось возможным благодаря отливке анодов определенной толщины с фиксированным соотношением меди и серебра. С целью снижения накопления цинка, никеля в растворе часть электролита выводили на самостоятельную переработку.
Технологические аспекты переработки ломов с выделением меди электролизом из растворов от их выщелачивания были описаны американскими исследователями *. Скрап обрабатывают раствором кислоты (125—200 г/л) при температуре 52—57° С, чередуя кратковременные, в течение 1—2мни, орошения с продувкой (около3—4 мин) горячим (82° С) воздухом. После нескольких циклов (содержание меди за 1 оборот увеличивается на 10—30 г/л) раствор выводят па очистку от олова, а затем выделяют медь электролизом с нерастворимым анодом. Плотность тока принимают с учетом прогрессирующего снижения концентрации меди:
Плотность тока, А/м2 .... 290 145 73 Содержание Си в растворе, г/л 15 10 5
Несмотря на низкий выход по току (—50%) в последних ваннах электролитическое осаждение оставшейся меди оказывается экономичнее, чем использование цинковой пыли. После охлаждения электролита до 35° С и тонкой очистки от меди его направляют иа электролитическое осаждение цинка. Отработанный электролит возвращают на растворение скрапа.
Оценивая схемы переработки вторсырья с получением катодной меди, можно заключить, что известные способы непосредственного электролитического рафинирования лома существенно осложнены из-за наличия окисляющихся примесей в сырье и нуждаются в технологической и аппаратурной доработке. Схемы с предварительным растворением скрапа, очисткой раствора и электролитическим выделением меди представляются более рациональными. Необходимо отметить, что в обоих случаях весьма осложняется извлечение цинка из получаемых после электролиза кислых растворов, что ограничивает и выбор сырья.
Австрийскими металлургами был исследован способ переработки ломов с использованием растворов азотной кислоты и последующим селективным высаливанием металлов в виде сульфатов [407].
1 Пат. (США), № 3014850, 1961; № 3054736, 1962.
14 С. С. НабоПченко 209
Малоцинковистые материалы по этому способу подвергают непосредственному выщелачиванию, а при высоком содержании цинка необходима предварительная переплавка ломов с целью его удаления и попутного шлакования ряда примесей.
Выщелачивание проводят при температуре 80° С, выделяющиеся окислы азота используют иа стадии регенерации азотной кислоты. По увеличению скорости растворения сплавы можно расположить в следующий ряд: медь — монель-мета л.*1—оловянная бронза—латунь—нейзильбер. В 40%-ном растворе азотной кислоты скорость растворения меди составляет 0,5 г/(дм2-мии), из нейзильбера медь растворяется с гораздо большей скоростью— 14 г/(дм!.-мии). Присутствующее в сплавах олово превращается в нерастворимую ме-таоловянную кислоту и отфильтровывается. Раствор нитратов обрабатывают кипящей (140° С) 60%-ной серной кислотой, при этом металлы осаждаются в виде гидратированных сульфатов («дойная фаза»). Осадок растворяют в воде, отделяют присутствующий сульфат свинца и проводят гидролитическую очистку от железа, хрома, алюминия, а цинк при необходимости осаждают сероводородом. Сульфаты меди и никеля из очищенного раствора разделяют фракционной кристаллизацией.
Однократной перекристаллизацией содержание никеля в медном купоросе снижается до 0,025—0,04%. Существенный недостаток этой технологии — громоздкость и энергоемкость переделов на стадии получения готовой продукции.
Йитереснв технология переработки медио-железиого скрапа в 27— 28%-ном растворе хлорного железа при 40° С с последующей селективной цементацией меди [408]. По другой схеме медный скрап растворяют в 20%-ной соляной кислоте при подаче кислорода (воздуха) и температуре 80—90° С; получаемые растворы (150— 160 г/л Сиг+, 32—37 г/л Си+ и 18—20 г/л НС1) пригодны для производства железомедиого порошка [409]. В этих способах используются агрессивные, дорогие растворители, регенерировать которые трудно. Схемы не приемлемы для Комплексного вторсырья в связи с трудностью переработки получаемых растворов.
Американскими металлургами предложена технология получения медного порошка из медьсодержащего вторсырья, для растворения которого использовали аммиачные карбонатные растворы 1. Аммиачные растворы подвергали дистилляции, при этом регенерировался аммиак и двуокись углерода, а металлы концентрировались в гидратном кеке. Кек обрабатывали каустической содой и осаждали цинк в виде карбоната известковым молоком или углекислым газом. Оста.^ ток от щелочного выщелачивания растворяли в серной кислоте с последующим разделением меди и никеля кристаллизацией. При отсутствии никеля гидратный медный кек восстанавливали при 540— 980° С с получением чистого порошка.
Фирмой «Кэпитэл Вайр энд Кэйбл Корп» для переработки лома и цементной меди используется технология с применением аммиачно-
1 Пат. (США), № 2912305, 1959 и Nj 3119690, 1964.
карбонатного выщелачивания с последующей экстракцией и электролизом [285]. Выщелачивание проводят оборотными растворами, содержащими 30 г/л NH3 ОбЩ и 15 г/л Си. Получаемые растворы (30 г/л Си) подвергали двустадийпой экстракции с использованием 10%-ного раствора LIX-64N в керосине. Содержание меди в органической фазе 4' г/л, рафинат возвращают на выщелачивание. На стадии реэкстракции используют отработанный электролит (170 г/л H2SO4, 30 г/л Си); раствор, содержащий 40 г/л Си, подвергают электролизу, полученные катоды содержат 99,9% Си.
Дальнейшее развитие гидрометаллургические способы переработки цементной меди вторсырья получили в скемах с использованием автоклавного осаждения меди в виде порошка, а в ряде случаев, с последующим производством проката на месте 1 [410]. В июле 1953 г. была пущена установка в Канзас-Сити (шт. Миссури, США) по переработке цементной меди и вторсырья производительностью 5—7 т/сут (1300 т/год) порошка с использованием аммиачного выщелачивания. После очистки раствора медь осаждали окисью углерода при 150—160° С и общем давлении 5000—6500 кПа (50—65 ат) в течение 60—90 мин. Дальнейшая переработка раствора включала дистилляцию для отгонки аммиака и осаждения карбоната цинка. Успешная работа этой установки, а также необходимость увеличения выпуска дешевых изделий прокаткой способствовали дальнейшему расширению этого производства. Возможность переработки весьма разнообразного вторсырья, невысокие капитальные и эксплуатационные затраты при производстве проката позволили отдать предпочтение (иа стадии выбора схемы) автоклавной технологии перед стандартной схемой получения чистой меди и проката из нее. К 1960 г. мощность установки достигла 50 т/сут проката. Вместо окиси углерода для осаждения меди начали применять водород [148, с. 821— 907; 214—217; 411—413].
Используемай в настоящее время иа этой установке технологическая схема приведена на рис. 70.
Выщелачивание проводят при температуре 50—60° С и продувке воздухом. В зависимости от типа исходного сырья используют различное аппаратурное оформление этого процесса: крупносортный скрап выщелачивают перколяцией в чанах, мелкокусковой скрап — во вращающихся барабанах, а цементную медь и мелкую высечку — в чанах с механическим перемешиванием. Отдельные виды скрапа подвергают предварительной подготовке (выплавляют припой, удаляют изоляции, измельчают).
Для выщелачивания используют раствор, в котором отношение молярных концентраций Си: l(NH4)2CO3 + 2NH3] составляет 1.25— 1,35; при меньшей концентрации растворителя возможно образование осадка основного карбоната медн [413]. При избыточной концентрации растворителя раствор настолько обогащается мбдью
1 Пат. (Канада), № 502910, 1954; пат. (США), № 2647832, 19ЙЗ; № 2733990, 1956; № 2814564, 1951; пат. (Австралия), № 155412, 1954.
14* 211
(до 200 г/л Си), что из него при хранении выпадают кристаллы аммиаката меди.
Скорость растворения меди почти не зависит от давления кислорода [ро’5 = 35—140 кПа (0,35—1,4 ат)], крупности материала. При увеличении температуры с 52 до 77 и 105' С скорость процесса возрастает соответственно с 1,74 до 4,0 и 5,0 г/(л-мин) Си. Влияние
нн3.ссг
Медьсодержащий лом, цементная медь
Воздух-.
-------------- Выщелачивание
Сгущение
Фильтрация
Сбивальный Раствор --------~ Целестит
кек 4 4 .
Очистка от примесей
Сгущение, контрольная фильтрация
tРттдор Па^ Отвальный кек
Автоклавное осаждение
““ 4———
Центрифугирование и промывка парашка
Раствор (ипячение
Влажный порошок
МН3,С02 Пульпа
Улавливание NH3fO2
Аммиачно-карбоПатный раствор ,
Сушка, спекание, измельчение 'классификация, шихтовка
Товарный порошок
Фильтрация
Раствор Основной карбонат
___Л цинка
Рнс. 70. Принципиальная технологическая схема производства порошка из ломов, цементной меди с использованием аммиачного выщелачивания
перемешивания заметно проявляется при выщелачивании скрапа, содержащего нерастворимые элементы (железо, свинец, олово).
В процессе выщелачивания крупного скрапа в перколяционной башне при температуре 52° С и избыточном давлении кислорода 21 кПа (0,2 ат) скорость растворения меди достигает 0,125— 0,46 г/(л- мин).
При выщелачивании достигают содержания меди в растворе около 140 г/л в том числе до 70—90 г/л в виде одновалентной. Цинк, никель растворяются с такими же показателями, как и медь, а олово, свинец, железо остаются в кеке. Для большинства разновидностей скрапа извлечение меди достигает 99%. В растворе содержится 20— 30 г/л Zn, 140 г/л NH3 и 85 г/л СО2, а также взвесь шлама. Послед-212
ний удаляют * *, добавляя сульфат стронция (природный минерал целестит) *. Скорость осаждения свинца возрастает с увеличением температуры, дисперсности целестита и его расхода. При 43‘ С, расходе целестита (SrSO4 : Pb) = 8 через 15—30 мин осаждалось до 95% свинца; содержание его в растворе снижалось с 0,42 до 0,02 г/л. Осаждение меди проводят при температуре 200—210° С, общем давлении 600—700 кПа (60—70 ат), в течение 90 мин, вводя полиакриловую кислоту (в процессе она превращается в полиакрилат аммония). Цикл восстановления включает четыре «уплотнительные» операции, что позволяет несколько влиять на свойства порошка.
Порошок отделяют на центрифуге, промывают (остаточная влажность около 10%), сушат и обрабатывают при 600—700е С в атмосфере водорода, после чего в зависимости от требований потребителей подвергают разному рассеву, шихтовке. Фугат, содержащий 1,5 г/л Си, 10 г/л Zn, 100 г/л СО?, 150 г/л МНзобщ. 28 г/л SO4 , возвращают на выщелачивание; часть его по мере накопления цинка (до 40 г/л) и сульфат-иона (до 40 г/л) подвергают дистилляции для отгонки аммиака и осаждения основных карбонатов, при остаточном содержании СО, < 10 г/л никель, цинк переходят в осадок.
Используя развитую систему утилизации отходящих газовых потоков, можно практически исключить потери растворителя.
Часть порошка подвергают прокатке, прессованию с получением ленты толщиной 1 мм, тонкостенных труб диаметром 10 мм и длиной 1500 мм. Интересно отметить, что предел прочности для ленты из автоклавного порошка составляет 280 МПа (28 кге/мм2), а для ленты, полученной при прокатке электролитной меди, 245 МПа (24,5 кге/мм2).
Продолжительность обработки скрапа до производства проката занимает около 12 ч.
Используемую в гидрометаллургическом отделении аппаратуру^ в том числе и автоклавы, изготавливают из стали 316 (13,4% Ni; 17,8% Сг; 2,5% Мо; 1,9% Мп; 0,5% Si)
Обширные работы для переработки цементной меди и мало-цииковистого вторсырья по аммиачной схеме проведены в Гинцвет-мете! (210—211, 414]. Особенность их—применение аммиачио-сульфатных растворов, что по сравнению с аммиачно-карбонатными схемами позволило вести автоклавное осаждение при более низком давлении [р"вщ = 4000-е-4500 кПа (40—45 ат)]. Была рекомендована двухстадийиая схема выщелачивания, обеспечивающая не только высокое извлечение меди, ио и присутствие ее в основном в одновалентной форме.
При аммиачной схеме переработки медьсодержащих материалов возможна и более простая, чем автоклавная операция, концовка для выделения меди: раствор после выщелачивания подвергают дистил
1 Можно использовать свежеосажденные гидроокиси железа и титана, обеспечивающие осаждение 80—90% свинца.
* Пат. (США), № 2923618, 2927018, 1960 и .V 3127264, 1964
! Ко н он ов А. В. Исследование автоклавной технологии получения медного . порошка из цементной меди и медного лома. Канд. дне. М.» 1968.
ляции с получением осадка окиси меди; последний сушат и восстанавливают в атмосфере водорода при 700—760° С. Возможно также растворение осадка основного карбоната и электролитическое выделение меди. В последнем случае для получения кондиционного порошка необходим более чистый исходный осадок, чтобы после его растворения в растворе содержалось не более 25 г/л Ni и Zn и 2 г/л Fe.
В табл. 34 приведены свойства медных порошков, полученных при переработке ломов и цементной меди по сернокислотной и аммиачной схеме.
В середине 1966 г. иа заводе компании Аризона Кемкоппер (Багдад, шт Аризона США) начала работать установка по автоклавному получению порошка из цементной меди И48, с. 821—907; 214—217;
Таблица 34
Характеристика медных порошков, полученных при переработке ломов, цементной медй и сульфидных концентратов
Показатели Порошки от переработки ломов, цементной меди Порошки от переработки сульфидных концентратов
Исследования Baft теккер Багдад Шеррнгг-Гордои Марни-дюк
автоклавный электролитный восстановлен’ иый
Химический состав, %:
Си 99,9 99,9 99,4 99,9 99,95 99.51 99,95
Fe 0,002 0 03 0 10 Сл 0 02 0,01 0,004
Sn Сл. Сл. Сл. 0,005 0,002 Нет данных Сл.
S 0.011 0.01 Нет данных 0,032 0,035 0,016
С 0,012 0,006 Сл. 0,041 0,030 0.014
Pb 0,002 Сл. Сл. 0,002 Нет данных Нет данных 0.001
As <0,005 <0,011 0,010 Нет. данных То же То же 0.001
.Sb <0,001 Сл. Сл. То же у у 0,001
H. о. в HNO3 Нет . данных Нет данных — 0,003 » 0.010 0.01
Насыпная мае- 1,8 Сл. Сл. 2,5-2,7 2,37 2.4
ca, г/см3
Текучесть, r/c Нет данных » 1,96 1,54 1,54
Содержание, %, фракций, мм:
0,100 Нет данных > 6,0 4,9 2,8
0.074 То же > 10,0 Х> 14,3 11,1
0 061 » » 10 0 > 2,7 11.6
0.043 у 12,0 > 17,7 16.3
0,043 » > » 62,0 60,4 58,2
Примечание. На заводе Багдад использовали сернокислотную схему для получения порошков, а в остальных случаях — аммиачную-
282; 415—4161. В отличие от завода в Канзас-Сити здесь использовали сернокислотную схему (рис. 71). Проектная производительность установки 7500 т/год, стоимость ее 3,35 млн. долл.
Цементную медь распульповывали оборотным раствором от автоклавного осаждения меди, содержащим ~130 г/л H2SO4 и 125 г/л (NHJcSO^; выщелачивание проводили в течение 4 ч в каскаде из реакторов при температуре 80—90° С и подаче воздуха, обогащенного кислородом. Пенообразование подавляли введением 75%-ного раствора препарата иа основе янтарнокислого натрия (торговая марка Аэрозоль ОТ). Извлечение меди при выщелачивании ~99%.
После фильтрации иа фильтрпрессах раствор, содержащий до 80— 90 г/л Си и 5 г/л Fe, 2,5 H2SO4, 0,2—0,4 г/л полиакриловой кислоты, поступал иа автоклавное осаждение, которое проводили при температуре 126—14Q° С, давление водорода 2400—3000 кПа (24—30 ат)
Автоклавы работали по двухчасовому циклу с интервалом в 1 ч; это позволяло более удобно вести обслуживание агрегатов, а также использовать тепло разгружаемой пульпы для подогрева свежего раствора.
Осаждение меди заканчивали при остаточном ее содержании 8— 14 г/л, достигаемая полнота осаждения (90%) считается оптимальной. За один цикл получают 540—860 кг порошка; после двух циклов автоклав разгружали.
Автоклавы были изготовлены из стали Карпентер-20МЬ —3. При температуре 122—135° С в присутствии сульфата аммония стойкость ее была признана удовлетворительной. Однако в последствии автоклавы были футерованы титаном (2161. В процессе работы были выявлены абразивные свойства медного порошка для ряда испытанных резни, в том числе и для силиконовой при температуре свыше 130° С.
Последующая обработка порошка практически не отличается от ранее описанной.
Продукцией завода является порошок нескольких сортов, а также брикеты (массой около 60 г), пригодные для получения бескислородной меди или сплавов. Содержание меди в порошке достигает 99,95%; в последние годы для повышения его качества раствор перед обработкой в автоклаве очищали от примесей ионообменным способом [2851.
Согласно расчетам при проектной производительности затраты на 1 т порошка составляют 662 кВт-ч электроэнергии, 10,55 тыс. кДж (2,6 тыс. ккал) пара, 0,84 м3 воды, 0,15 т серной кислоты, 10 кг акриловой кислоты, 50 кг сульфата аммония.
Установку обслуживают 37 человек, в том числе четыре инженерно-технических работника.
Позднее сернокислотную схему получения автоклавного порошка нз различных сортов цементной меди исследовали в институте «Унипромедь» [2201. При переработке сырья с повышенным содержанием железа (>3%) несколько снижается извлечение меди в порошок в связи с необходимостью специальной очистки раствора от железа. Некоторые основные показатели аммиачной и сернокислот-215
Ряс. 71. Аппаратурная схема производства порошка из цементной меди с использованием сернокислотного выщелачивания:
/ — водородная установка; // — парокотельная; 1П — генератор инертного газа; IV — установка для подготовки воды; / — аппарат для приготовления пульпы; 2 — каскад реакторов выщелачивания; 3 — емкость для антивспенивателя; 4, 5 — фильтрпрессы; б — емкость промывной воды; 7 — сборник раствора после выщелачивания; 8 — теплообменник; э — емкость для поверхностно активной добавки; Ю — автоклав осаждения; II — аппарат для обработки пульпы порошка; /2 — центрифуга; 13 — сборник оборотного раствора; !4 — сборник промывных вод; 15 — сушильная печь; 16 — конвейерная печь для восстановления порошка; 17 — брикетный пресс; !8 — мельница для размола спека порошка; 19 — установка для классификации порошка; 20 — бункер для монофракцнй порошка-, 21 — смеситель, 22 — склад продукции
Параметры переработки цементной меди по аммиачной и сернокислотной схемам
Показатели Аммиачная схема Се риск нс юти я я схема
Выщелачивание
температура, °C . . 45—55 75—85
продолжительность, ч ... 0,5—2,0 2—3
содержание в конечном растворе, г/л:
Си . 135—140 70-90
NH, . 145—155 —
NH4S04 250—300 150—200
HjSb. -— 2—5
Извлечение Си, % . . 99.0 99,0
Осаждение меди 130—140
температура, °C . . давление, кПа (ат) *: 200—210
общее 6000—7000 (60—70) 2600—3000 (26—30)
водорода Содержание в конечном раство- 3000—3500 (30—35) 2400—2800 (24—28)
ре, г/л; Си
3—12 7—10
NHS (Общ) 150—160 —
HjSO. — 110—125
Средняя скорость осаждения 1,3—1,5 2—2,5
меди, г/(л мин) , .
♦ Прн нммначно-суяьфатноП схеме = 40004-4500 кПа (40—45 ат), = =» 2000 кПа (20 ат).
ной схем на примере переработки цементной меди представлены в табл. 35.
По сравнению с сернокислотной аммиачная технология более гибкая в отношении исходного сырья, так как обеспечивает большую скорость растворения меди при выщелачивании не только дисперсных, ио и кусковых материалов. Более высокое содержание меди в растворе сокращает объем задалживаемой аппаратуры при выщелачивании, а наличие в нем до 2/3 меди в одновалентной форме 1 при организации двустадийного противоточного выщелачивания обеспечивает меньший расход водорода при автоклавном осаждении. Более просто решается последующее извлечение цинка, никеля, свинца в качественные продукты, а также выбор материала для изготовления аппаратуры. •
Однако при аммиачной схеме имеет место большая энергоемкость (на автоклавное осаждение, дистилляцию), усложняются выбор и эксплуатация автоклавного оборудования, получение чистых по
__1 При переводе всей меди в одновалентную форму начинается гидролиз аммиакатов'Си (1) при автоклавной операции, что ухудшает качество порошка.
никелю порошков. При наличии мышьяка в сырье необходима специальная очистка растворов. Применение более дорогого, токсичного и взрывоопасного растворителя требует использования герметичной аппаратуры, развитой системы утилизации газовых потоков. Средняя скорость осаждения меди несколько меньше, чем из сернокислых растворов
Выбор схемы во миого.м определяется стоимостью и доступностью реагентов, типом сырья, условиями реализации конечной продукции.
Учитывая компактность технологии, возможность получения высококачественной продукции (особенно при одновременном производстве из порошка мелкосортового проката) и рациональное использование сопутствующих ценных элементов, переработку ломов и цементной меди с использованием автоклавной технологии можно считать наиболее совершенной и эффективной. '
Глава I/ /
ПЕРЕРАБОТКА БОГАТЫХ СУЛЬФИДНЫХ МАТЕРИАЛОВ
АВТОКЛАВНЫЕ СПОСОБЫ ПЕРЕРАБОТКИ
Для переработки сульфидных материалов применяют непосредственное выщелачивание (солевое, автоклавное, электрохимическое) или комбинированные схемы с использованием сульфатизации, сульфа-тизирующего и сульфато-хлорирующего обжига, хлоридовозгоики, плавки. Отдельные положения обжига, сульфатизации, солевого выщелачивания и электрохимического растворения рассмотрены в гл. II.
Анализ патентной литературы последних лет указывает иа тенденцию к разработке чисто гидрометаллургических приемов, основные из которых рассматриваются ниже.
При солевом выщелачивании достигается комплексное использование составляющих концентратов и штейнов, сера извлекается в основном в виде элементарной. Однако большинство извлекаемых элементов получают в виде полупродуктов (цементной меди, сульфидного свиицово-цинкового концентрата). На электролитическое выделение меди, железа расходуется большое количество электроэнергии. Солевое выщелачивание можно представить как вариант химического обогащения сырья с селективным выделением его составляющих. Известные трудности представляет аппаратурное оформление технологической схемы в связи с повышенной агрессивностью используемых растворов.
Прн электрохимическом растворении получают катодную медь, минуя ряд перелетов, обязательных по стандартной пирометаллурги
ческой схеме и извлекают серу в элементарной форме. Электроотрицательные растворимые в серной кислоте элементы переходят в раствор. Изменением величины плотности тока достигают приемлемой чистоты катодного осадка. Благородные металлы, элементарная сера и свинец концентрируются в анодном шламе.
Получение высококачественного осадка меди, особенно при переработке коллективных концентратов и штейнов даже в электролизной ванне специальной конструкции, представляет большие трудности. Кроме того, для электрохимического растворения характерны большой расход электроэнергии, получение сложного по составу раствора, опасность выделения арсина.
При гидрометаллургической переработке, как правило, благородные металлы концентрируются в нерастворимом остатке (сульфидном шламе, кеке от выщелачивания). Переработка таких остатков в пирометаллургическом производстве не вызывает осложнений; очень часто используют для извлечения благородных металлов цианирование.
Элементарную серу, образующуюся при электрохимическом растворении, солевом и автоклавном сернокислотном выщелачивании сульфидного сырья отделяют с помощью отгонки (дистилляции), флотации, горячего фильтрования, фазового обмена 1, экстракцией органическими растворителями [3631. Наиболее перспективными следует считать способы фазового обмена или экстракции. Помимо известных экстрагентов (четыреххлористого углерода, сероуглерода, тетралина, этиленбромида, ортодихлорбензола), большой интерес представляет тетрахлорэтилен. Этот реагент не пожароопасен, не токсичен, имеет большую плотность, высокую температуру кипения, а также наибольшую растворяющую способность (растворимость в нем серы при 100" С составляет 474 г/л) [419].
Учитывая большую перспективность автоклавных процессов для вскрытия сульфидных материалов, более подробно остановимся иа изложении основных положений автоклавного выщелачивания.
Из автоклавных технологий в металлургии меди наибольшее значение получили схемы с использованием аммиачного, сернокислотного и окислительного выщелачивания.
К числу основных параметров, определяющих показатели автоклавного выщелачивания, относятся температура, давление и расход кислорода (воздуха), концентрация растворителя, интенсивность перемешивания, тонина помола сырья.
Оптимальную температуру выбирают для достижения предельно допустимой скорости процесса Верхний предел температуры ограничивают из-за увеличения агрессивности среды, общего давления в автоклаве, особенно для аммиачных растворов, гидролиза солей, а также повышенных эксплуатационных затрат.
С увеличением давления кислорода свыше 300—700 кПа (3—7 ат) показатели выщелачивания несколько улучшаются, однако возрастают затраты на оборудование и компримирование газа.
1 Пат. (США), № 2429477, 1947.
Перемешивание должно обеспечивать не только получение однородной пульпы, но и насыщения ее газообразным окислителем, что в конечном счете улучшает массопередачу в системе и ускоряет выщелачивание. При использовании быстроходных мешалок происходит переизмельчение образующейся гидратной фазы, усложняется эксплуатация аппарата.
Увеличение дисперсности материала ускоряет процесс выщелачивания. Учитывая трудность тонкого измельчения, выщелачиванию подвергают материал крупностью не более —0,074 мм. Флотационные концентраты, как правило, дополнительно не измельчают.
Аммиачное выщелачивание
В автоклавной технологии наибольшее значение имеют аммиачно-сульфатные растворы. Достоинство аммиачного выщелачивания — относительно невысокая температура процесса, селективное извлечение в раствор металлов, образующих аммиачные комплексы (меди, никеля, кобальта, цинка, кадмия), меньшая агрессивность раствора.
Уже при температуре выше 75—90° С резко возрастает количество аммиака в газовой фазе, что повышает общее давление в автоклаве и увеличивает нагрузку на абсорбционную аппаратуру.
Расход аммиака принимают с учетом связывания извлекаемых цветных металлов в устойчивые комплексы. Для устранения опасности гидролиза при последующих высокотемпературных операциях в раствор добавляют сульфат аммония; последний также необходим для восполнения дефицита в сульфатной сере при выщелачивании низших сульфидов (штейнов, халькозинового концентрата).
Прн аммиачном выщелачивании медь извлекается с высокими показателями (до 96—98%), однако извлечение никеля и, особенно, цинка, кобальта значительно хуже, особенно при взаи.мопрораста-нии минералов этих металлов и железа. При полном вскрытии сульфидов железа или окислении металлизированной фазы (в штейнах) извлечение никеля, кобальта и цинка увеличивается не очень существенно, поскольку имеют место их потери с возросшим количеством гидратированной окиси железа.
Из-за ограниченной растворимости гексоамина трехвалентного кобальта материалы, содержащие более 3% Со, не подвергают аммиачному выщелачиванию.
Теллур, селей, висмут, индий, олово, свинец при аммиачном выщелачивании остаются в железистом кеке, что осложняет их последующее селективное извлечение.
Благородные металлы и платиноиды также остаются в кеке; перевод в раствор на 94—97% Ац и Ag, 75% Pt и 90% Pd возможен только прн полном вскрытии сульфидной серы и весьма жестких параметрах процесса: температуре раствора 150—200° С, и общем давлении в автоклаве 2—2,5 МПа (20—25 ат). Одновременно в раствор извлекается н до 92% Se (6, с. 153; 417), что не только увеличивает расход аммиака и кислорода, ио и осложняет аппаратурное оформление и обслуживание установки.
Сульфидная сера в конечном счете окисляется до сульфат-иона, для связывания которого необходим дополнительный расход аммиака. В растворе также присутствуют политионаты (SxOy~) и сульфаматы. Эти соединения переводят в сульфат-ион (автоклавным окислением и гидролизом), в противном случае оии окажутся источником загрязнения серой порошка металлов, получаемого прн автоклавном восстановлении.
При невысоком содержании медн в аммиачных растворах ее оса--ждают в виде сульфида (в процессе отгонки избыточного аммиака за счет диспропорционирования тиосульфата). При переработке богатых по меди материалов используют только автоклавное осаждение для селективного отделения ее от сопутствующих металлов
Особенность аммиачных схем переработки сульфидного сырья — их незамкнутое™ по растворителю и, как следствие, попутное производство сульфата аммония. Поэтому необходимо предварительное осаждение оставшихся металлов (как правило, сероводородом), что связано с дополнительными операциями. Получение товарного сульфата аммония требует также дополнительных операций (выпаривания, кристаллизации, сушки, затаривания). Таким образом, прн использовании аммиачного выщелачивания необходимы организация весьма сложного производства, связанного с производством аммиака, и развитая система утилизации газовых потоков. Рентабельность аммиачной технологии во многом определяется соотношением цен на аммиак и сульфат аммония, а также условиями рентабельного сбыта последнего.
Сернокислотное выщелачивание
Серная кислота х, а также сернокислое железо, образуемое в процессе выщелачивания, — основные растворители для сульфидов цветных металлов. Отличительной особенностью сернокислотного выщелачивания является образование элементарной серы, поэтому верхний предел используемой температуры ограничивается точкой ее плавления (112,8° С для ромбической модификации; 119,25° С и 120° С соответственно для моноклинной и аморфной).
Расход серной кислоты принимают с учетом связывания в сульфаты извлекаемых цветных металлов. При выщелачивании достигается преимущественное растворение Сульфидов цинка, кадмия, никеля, кобальта. Для полного вскрытия халькопирита, пирита необходимы или более высокие температура, давление кислорода, продолжительность процесса, или предварительная термическая подготовка с целью его активации Более полно медь извлекается из халькозина и ковеллина. При выщелачивании металлизированных штейнов возможно образование взрывоопасных смесей за счет выделения водорода или сероводорода (при недостаточно окислительных условиях).
1 Кислоту вводят с исходной пульпой, часть кислоты образуется при выщелачивании за счет окисления сульфидов железа и их гидролиза.
Несмотря на использование относительно невысоких параметров процесса [/ = 95—110° С, = 200—600 кПа (2—6 ат)], по сравне-
нию с аммиачным выщелачиванием достигается большая скорость процесса и расходуется гораздо меньше кислорода в связи с преимущественным окислением сульфидной серы до элементарной (а не сульфатной).
Благородные металлы, таллий и селен остаются в кеке, индий на 85—88% переходит в раствор.
Если в растворе небольшая концентрация меди — до 1—15 г/л, то ее извлекают цементацией железным, никелевым, кобальтовым, цинковым порошками. При повышенном содержании меди — более 20—30 г/л — используют электролиз или автоклавное осаждение. В этом случае одновременно регенерируется в эквивалентном количестве серная кислота, что позволяет организовать замкнутую по растворителю схему.
При использовании сернокислых растворов для выщелачивания аппаратура должна быть в антикоррозионном исполнении.
Окислительное выщелачивание
В отличие от сернокислотного при окислительном выщелачивании используют нейтральные или подкисленные растворы, а необходимая кислота автогенно образуется в самом процессе. Операцию проводят при более жестких параметрах процесса: температура 180— 200° С, и избыточном давлении кислорода 1—1,5 МПа (10—15 ат), что обеспечивает наибольшую скорость процесса из всех известных вариантов выщелачивания и высокое извлечение цветных металлов. Одновременно достигается практически полное вскрытие сульфидов железа, которое в указанных условиях гидролизуется с выделением кислоты. Окислительное выщелачивание характеризуется повышенным расходом кислорода; в конечных растворах содержится много свободной кислоты, что требует предварительной их нейтрализации. При электролизе или автоклавном осаждении меди возникает проблема использования отработанных растворов и трудности организации замкнутой схемы. Еще более остро, чем’ для сернокислотного выщелачивания, стоит вопрос об аппаратурном оформлении. Поэтому несмотря на определенные достоинства, на сегодняшний день перспективность окислительного выщелачивания сомнительна.
,ПЕРЕРАБОТКА МЕДНЫХ КОНЦЕНТРАТОВ И ШТЕЙНОВ
Гидрометаллургические схемы переработки медно-молибденовых и медно-висмутовых концентратов отличаются в основном способом выделения сопутствующих малых металлов. Поэтому авторы данной книги ограничились описанием технологических схем только для наиболее типичных концентратов.
Способы вскрытия и особенно извлечения медн из растворов при переработке различных медьсодержащих концентратов имеют много общего.
Схемы с использованием обжига или сульфатизации
Для переработки смеси флотационных медных концентратов, содержащих 30—33% Сй, 23% Fe, 26% S, 9% нерастворимого остатка и цементной меди, на заводе Багдад (шт. Аризона, США) применяли сульфатизирующий обж_иг при 670—680° С в печах КС [4201. В процессе обжига до 75% меди переходило в сульфат и около 23% меди—в окись; общее извлечение меди достигало 97— 98,5%.
Растворы от выщелачивания огарка (44—49 г/л Си, 1,8— 3,0 г/л Fe, 35—44 г/л H2SO4) смешивали с растворами от выщелачивания окисленных руд, обеспечивая содержание меди в объединенном растворе, равное 10 г/л.
Электролиз проводили при плотности тока 215 А/м2, при этом содержание меди снижалось до 3 г/л и менее, а концентрация кислоты достигала 60—80 г/л. Отработанный электролит после разбавления водой направляли на выщелачивание окисленных руд и частично — на выщелачивание огарка.
До 83—86% меди извлекалось в катоды, содержащие 99,92% Си, 0,001 % As, 8-10-*% Bi, 2-10"4%Sb и 5-10-4%Мо. Остальная медь переходила в матрицы — до 1,3—2,1% и губчатый осадок — до 6—11%. Выход по току достигал 89—91,4%. Общее извлечение медн — около 96%.
Из остатков от выщелачивания огарка, содержащих —1%Си, 49% Fe, предполагали получать губчатое железо, пригодное для цементации меди из растворов от выщелачивания окисленных РУД- ,
На заводе Чамбиши (Замбия) [4211 медные концентраты подвергают сульфатизирующему обжигу в печах КС при 690° С; производительность отделения 120 т/сут сухого концентрата. Растворы от выщелачивания огарка объединяют с растворами от выщетачива-ния богатых окисленных руд и направляют на электролитическое выделение меди. Отработанный электролит возвращают в цикл выщелачивания окисленных руд.
Подобная технология в полупромышленном масштабе была разработана на заводе Нчанга для переработки промпродукта, содержащего 16—20% Си; 3,2—3,6% Fe; 4,5—5% S [389, 4221. Для перевода меди в кислоторастворимую форму на —95% рекомендуется проводить обжиг прн температуре 650° С и влажности материала 9— 13%. Однако в этом случае до 12,5% железа переходит в раствор; отношение концентраций меди и железа в растворе Си : Fe составляет 34—35.
Для переработки труднообогатимых руд, представленных на 2/3 сульфидными минералами, более рациональной по сравнению с пи-ро.металлургическим вариантом, оказалась схема с использованием сульфатизирующего обжига при 600° С, выщелачивания огарка 10 %-ной серной кислотой и электролиза [4231.,Особенность схемы — получение при электролизе катодного осадка в форме, удобной Для - последующей металлообработки. С этой целью использовали цилин-
дрическую ванну, в которой устанавливали свинцовый анод диаметром 76—102 мм, катод располагали внутри анода.
Вскрытие медных концентратов методом сульфатизации испытывали иа опытной установке фирмы «Анаконда» 1424—4261. Для вы-детения меди из растворов после выщелачивания сульфатизйрован-ного продукта их насыщают сернистым газом, а затем обрабатывают 98%-ным HCN при температуре 45—70° С. Прн этом осаждается цианид меди, который после сушкн прокаливали прн 300—400° С в атмосфере водорода с получением чистой меди и оборотной синильной кислоты.
Другим вариантом извлечения меди из растворов, получаемых после выщелачивания сульфатизированного продукта, является экстракция (LIX—64) с последующим электролизом.
Для переработки вкрапленных сульфидных руд, содержащих 1,7% Си, была проверена технология, включающая окислитетьиый обжиг с последующим выщелачиванием огарка и электролитическим выделением меди из раствора [427 |. Из остатков от выщелачивания получали губчатое железо, пригодное для обезмеживания отработанных растворов. Фирма «Гекла Майиинг Ко» предполагает пуск завода близ Лэйкшо по этой схеме в 1974 г.
Солевое выщелачивание
Непосредственное выщелачивание сульфидных медных концентратов растворами хлорного железа (способ Пайка) было испытано в полупромышленном масштабе в 1925—1926 гг. Способ Пайка включал следующие основные операции [1, с. 137—41]:
1) агитационное выщелачивание концентрата кипящим раствором хлоридов железа, содержащим 40—50 г/л Fe3 * и 50—60 г/л Fe2 * с последующим восстановлением железа в пульпе пирротиновой рудой;
2) цементацию из раствора последовательно серебра (металлической медью) и меди (железным скрапом);
3) осаждение сероводородом остатков цветных металлов с получением оборотного сульфидного продукта и раствора хлористого железа, содержащего 12% FeCl2;
4) выделение электролизом железа из раствора после дополнительной очистки, регенерируя растворитель для выщелачивания.
При выщелачивании извлекали около 91% Си, 84% Ag, 83% Fe; в нерастворимом остатке содержится до 75% элементарной серы от исходного количества и концентрируется золото.
Идеи способа Пайка получили дальнейшее развитие в работах А. Л. Цефта с сотрудниками [428—4301. Авторы предлагали медные концентраты обрабатывать подкисленными (15—20 г/л кислоты) растворами сульфата или хлорида меди при температуре 160—180' С. В результате обменных реакций железо переходило в раствор, после очистки которых его извлекали электролизом. Обогащенный медный осадок выщелачивали оборотными растворами хлорида или сульфата 224
трехвалентного железа при 100—105° С. Медьсодержащий раствор подвергали электролизу.
По другому варианту [429—430|, исходный концентрат обрабатывали раствором железа, содержащим 100 г/л Fe3*, 50 г/л Fe2*, при 100° С. За 2 ч в раствор извлекалось до 99,8% Си, 74% Fe. Затем медь осаждали железом, а раствор направляли на извлечение сопутствующих элементов.
Горным Бюро (США) способ солевого выщелачивания был значительно усовершенствован применительно к переработке халько-пиритного концентрата [419].
Концентрат
I г—
Выщелачивание Фильтрация
Раствор~
| ।------Fe
Цементация
4 у
Си цементная Раствор Переплавка , Кристаллизация
Маточный раствор
Г
Кристаллы
Окисление
-----------------1 Кек
Извлечение 8
4
Остаток S
4
ЦианироВа!
I 4
Благородные Отвальные металлы хвосты
Fe20s на Электролиз
FeCl3
Хлор_
Рис. 72. Технологическая схема солевого выщелачивании халькопиритного концентрата
Технологическая схема процесса приведена на рис. 72. Исходный концентрат, содержащий 26% Си, 29,7% Fe, 33,9% S, 4,4% SiO2, 6,4% А12О3 и 98,9% фракции — 0,044 мм выщелачивали при 106° С раствором, в котором отношение концентраций FeCl3 : CuFeS., составляло 2,7. После 2 ч выщелачивания в раствор извлекалось до 99,9% Си, 73,3% Fe, 33% Мо, 61% Ag, полностью цинк и свинец. В получаемом растворе содержалось 51,9 г/л Си (большая часть в одновалентной форме), 212 г/л Fe2- , 44 г/л Fe3+, 6,4 г/л SOJ-. Выход нерастворимого остатка составил 47,5% от массы концентрата. В остатке содержалось 0,06% Си; 16,5% Fe; 69,2% So6iu (в том числе 50,3 S°) и полностью золото, присутствующее в концентрате.
Поскольку при электроэкстракции меди получались дендритные осадки и имел место низкий выход по току,.перешли на цементацйон-
15 С. С. Набойченцо 225
пое выделение меди губчатым железом. Осадитель вводили в количестве, меньшем стехиометрического, чтобы уменьшить расход кислоты и получить качественный осадок меди.
Железосодержащий раствор охлаждали для выделения кристаллов FeCl2-nH2O, после прокалки которых при.500° С получали продукт, содержащий 70% Fe; 0,08% Си; 0,37% С1.
Маточный раствор в течение 0,5—1,0 ч обрабатывали хлором,, подаваемым под избыточным давлением 14 кПа (0,14 ат). В результате этой операции регенерировали растворитель, который возвращали на выщелачивание концентрата.
Серусодержащий остаток обрабатывали тетрахлорэтиленом для извлечения элементарной серы; количество ее составляло 62,5% от содержания сульфидной серы в исходном концентрате.
Остаток после удаления элементарной серы подвергали цианированию. После 24-ч обработки при Ж : Т = 3, расходе 1,82 кг NaCN, 0,91 кг СаО в расчете на 1 т остатка в раствор извлекали 96% Au и 72% Ag.
С некоторыми изменениями, касающимися извлечения меди и сопутствующих элементов, подобная технология предложена японскими металлургами.1
Автоклавное аммиачное выщелачивание
Фирмой «Шерритт Гордон» (Канада) в полупромышленном масштабе испытана аммиачная технология переработки халькопирит-ного концентрата и сульфидного концентрата, полученного прн осаждении меди сероводородом [1001. Технологическая схема (рис. 73) во многом идентична применяемой в промышленном масштабе для переработки флотационного никелевого концентрата, а позднее и никелевого штейиа.
Конечная продукция представлена высокочистым медным порошком и сульфатом аммония. Составы основных продуктов приведены в табл. 36. Обработку пульпы концентрата с плотностью 20% вели прн температуре 94° С и давлении воздуха 700 кПа (7 ат) в горизонтальном автоклаве из стали 316ELC. За 12 ч в раствор извлекается 98% Си, 90% Со, 92% Ni. При сгущении пульпы использовали Сепаран НП-10, Полиокс, Аэрофлок-550, раствор подвергали окислению и гидролизу (оксигидролизу) для разрушения политионатов и сульфамата. Операцию оксигидролиз проводили в герметичных башнях, изготовленных из стали 316, при температуре 227° С, избыточном давлении 3500 кПа (35 ат) в течение 70 мии.
После корректировки раствора его обрабатывали водородом при избыточном давлении 2,1 МПа (21 ат), робщ = 3,5 МПа (35 ат) и температуре 190° С в автоклаве из 'стали 316ELC, осуществляли 7—20 уплотнительных циклов.
1 Пат. (Япония), № 28788, 1966.
Рис. 73. Аппаратурная схема переработки калькойиритного концентрата с использованием автоклавного аммиачного выщелачивания 1б. с. 151):
1 — реактор с механическим перемешиванием пульпы; 2 — ватоклав; 3 — холодильник; 4 — сгуститель; 5 — сгуститель для промывки; б — аммиачный скруббер; 7 — расходи ап емкость; 8 — фильтр; 9. 10 — аппараты для окисления полнтнонатов и гидролиза сульфамата; И — теплообменник; 12 — чаны для обработки пульпы порошка; 13 — фильтр; 14 — печь для сушки и спекания порошка; 15 — зубчатая валковая дробилка; 16 — аэроклассифн-катор порошка; /7 — циклон; 18 — молотковая мельница; 19 — бункера; 20 — смеситель порошка
Таблица 36
Типичный состав исходных материалов и продуктов переработки халькопиритного концентрата
Наименование Си N1 Fe S NH3 (общ)
Концентрат, % 30,4 0,49 31,2 29,7
Исходный раствор для выщелачивания, г/л Раствор после выщелачивания, г/л * *1 . . . 0,2 0,06 — — 76,5
56,5 0,88 148,8
Нерастворимый остаток, % 1,27 0,10 55,0 4,1 —
Раствор после отгонки аммиака, окисления н гидролиза, г/л 64,1 1,00 — — 125,0
Раствор, поступающий на осаждение медн, г/л 62,0 0,97 — — 121,0
Раствор после восстановления, г/л 0,4 1,09 — —. 135,0
Медный порошок после промывки *® 98,8 0,008 0,005 0,03 —
Товарный медный порошок *4 99,7 0,008 0,005 0,03 —
Наименование I 1 £ с
Z Z ”о <л z^. к Z
Концентрат, % — —
Исходный раствор для выщелачивания, г/л 45 — 31,0 123 —
Раствор после выщелачивания, г/л ** 98 6.5 82,5 « 168 6,5 .
Нерастворимый остаток, % — — — — —
Раствор после отгонки аммиака, окисления и гидролиза, гАт 60 0,1 94,1 244 3,5
Раствор, поступающий на осаждение меди, г/л 38 0,1 110,0 31.5 2,3
Раствор после восстановления, г/л .... - 5,1 — 123,0 500 —
Медный порошок после промывки *3
Товарный медный порошок *4 — — — — —
По расчету.
•2 Содержание политионатов в растворе 0,3 г/л.
•• Нерастворимый остаток — 0о02%, 0.03% С. потерн прн прокаливании порошка в атмосфере водорода — 1.1%.
•< Нерастворимый остаток — 0.02%. 0о03% С. потери прн прокалнваннн порошка в атмосфере водорода — 0.2%.
Остатки цветных металлов осаждали сероводородом при 67° С и давлении газа 35 кПа (0,35 ат); отработанный раствор поступал на производство сульфата аммония.
По данной технологии был запроектирован завод для переработки медных концентратов месторождения Лиин—Лейк. Однако в связи с изменившимися условиями на экспорт медного порошка, экономичность этого предприятия оказалась под сомнением.
Предполагалось сульфидный промпродукт, содержащий 66,8% Си, 1,5% Fe, 1,04% Ni, 19,9% S, выщелачивать при пониженном содержании аммиака (NH3 : Си — 4), повышенных температуре (218°С) и избыточном давлении воздуха 14,2 МПа (42 ат) 1. Это позволило сократить продолжительность выщелачивания до 30 мин и отказаться от проведения отдельных операций окисления и гидролиза. Извлечение меди и никеля в раствор составляло около 99,5%.
В работе (4311 сообщается о возможности извлечения до 96—99% меди прн выщелачивании халькопиритного концентрата растворами сульфата аммония при 75° С, избыточном давлении кислорода 770—-910 кПа (7,7—9,1 ат) в течение 60—90 мин. При выщелачивании борнита, халькозина, ковеллина за 8 ч можно извлечь 97% меди даже при 20° С.
Окислительное выщелачивание халькопиритных концентратов проводили при температуре 160—170° С и общем избыточном давлении 2500 кПа (25 ат) в течение 6—7 ч (432—435 J. Извлечение медн достигало 96—98%. Однако прн выщелачивании образуется значительное количество кислоты за счет окисления сульфидной серы и гидролиза железа. Для получения растворов, пригодных для эффективного осаждения меди, требуется значительный расход нейтрализатора (например, извести), что не только увеличивает выход осадка, но н приводит к потере серы из исходного концентрата.
Подобная технология разработана для медных штейнов [4361 *: выщелачивание проводят водой при 180—200° С и ро*,6 = 2МПа (20 ат). Наряду с высоким извлечением меди железо практически нацело гидролизуется и отделяется в виде хорошо фильтруемого осадка.
Автоклавное сернокислотное выще гачивание
Больший интерес представляют схемы сернокислотного выщелачивания с окислением сульфидной серы до элементарной.
В работе [4371 описана переработка халькозинового концентрата, содержащего 23% Си; 28,8% Fe; 0,114% Zn; 39% S; 7% SiO2, этот минерал не разделяется флотацией из-за тесного взаимопрораста-ния пирита (60,4%) и халькозина (28,8%) **. При режиме аммиачного выщелачивания, рекомендованном для халькопиритных концентратов (1001, за 6 ч в раствор извлекалось 97% Си и 25% S. С целью более рационального использования серы режим серно.
* Пат. (ФРГ), № 888929, 1953; № 1160624, 1958.
'* Пат. (Франция), № 1391743, 1963.
кислотного выщелачивания в дальнейшем был исследован более детально.
При выщелачивании концентрата крупностью —0,044 мм (выход фракции 80,0%) при избыточном давлении кислорода 350 кПа (3,5 ат), температуре 105° С в течение 2 ч извлекали 97% меди, по 9% железа и серы. Раствор имел состав 67 г/л Си; 7,5 г/л Fe и 15 г/л Н 2SO4 (отношение концентраций H2SO4 и Си равно 1). При замкнутой схеме накапливающееся в растворе железо (в среднем за цикл 9 г/л) осаждали обработкой известняком при pH = 24-2,3 и температуре 82° С (расход известняка 68 кг/т концентрата). Осаждалось до 33— 70% железа, потери меди с кеком не превышали 0,1—0,4%.
Технология, предложенная для переработки медных концентратов, получаемых при флотационном разделении медно-никелевого файнштейна (рис. 74), имеет много общего с описанной выше для халькозинового концентрата.
Опыты по выщелачиванию проводили с пробой концентрата, содержащего 65,3% Си; 2,7% Ni; 3,6% Fe; 21,3% S; крупность материала —0,044 мм.
Несмотря на большее содержание меди и меньшее количество железа почти при одинаковых параметрах операции |ро’6 = 300— 400 кПа (3—4 ат) и t = 105—110° С] только за 6 ч в раствор извлекалось 96—98,5% Си, —87% Ni, 95% Со (4381 Сера иа 93—96% окислялась до элементарной; содержание ее в нерастворимом остатке достигало 70—82%. Выход последнего составлял 24—27% от массы исходного концентрата. В остатке содержалось: 3,43—7,35% Си; 1,32—3,4% Ni; 10,9—13,5% Fe; 75—84% S.
Из растворов, содержащих 106—126 г/л Си; 30—41 г/л Ni; 1,5— 2,0 г/л Fe; 0,7—4,7 г/л H2SO4, медь выделяли автоклавным осаждением или электролизом. Последний вариант менее желателен, так как необходима корректировка состава раствора и осложняется водный баланс схемы.
Накапливающиеся в растворе никель и кобальт периодически удаляют высаливанием, для чего вводят сульфат аммония.
По сравнению с пирометаллургической переработкой медного концентрата пег данной технологии на 7,5% возрастает прямой выход меди и до 85% серы извлекается в виде элементарной.
Лучшие результаты по электролизу (выход по току 90—94%, расход электроэнергии 2500 кВт/ч на 1 т меди) получены при содер жании в растворе 20—30 г/л Си, 140—150 г/л H2SO4
Опыты по выщелачиванию халькопиритного концентрата, содержащего 31,5% Си, 31,1% Fe, 33,1% S, показали, что при избыточном давлении кислорода ро, = 3,5 МПа (35 ат), t = 115° С, крупности материала —0,044 мм (99,5%) и отношении концентрации H2SO4 : Си = 0,66 за 2,5 ч извлекается свыше 90% меди и около 85% серы в элементарную форму. Вследствие использования высокого давления кислорода 1,4—3,5 МПа (14—35 ат) и выщелачивания с недостатком кислоты достигается необходимая концентрация меди в растворе для последующего ее автоклавного осаждения (80 г/л Си, <5 г/л Fe). Пирит при выщелачивании не вскрывается 230
и переходит в нерастворимый остаток. Последний подвергают пе-рефлотации для отделения гидратов железа пустой породы, затем обрабатывают с целью выделения элементарной серы. Предлагаемая технологическая схема (рис. 75) является замкнутой, переход серы в раствор не превышает 6%. Экономическая оценка свидетельствует о большой перспективности этой технологии по сравнению с пирометаллургическим вариантом (4391.
Медный концентрат
Пар, воздух-------------1 | ।-----------
Автоклавное выщелачивание
Фильтрация
Вадород, пар
---------1 f-------------
Раствор МдСсг не к
Отделение серы методом фазового обмена
Хвосты Сера
| ।— водо
Промывко
Раствор ГоануЛы
Упорна в конвертеры
____1 никелевого завода
~п « ^Раствор
I вариант И вариант
Электролиз Восстановление
I в автоклаве
------г-
Медный порошок
Оборотный |
раствор Брикетирование
Катодная медь
Осаждение
Сулырат аммония .:.'бя—
Никель- Раствор аммонийный | _________
сулырат
Отделение никеля
I ~Г I
Сулырат аммония Сулырат никеля
1 . В никелевое производство
Рнс. 74. Технологическая схема переработки медного концентрата от флотационного разделения медно-никелевого файнштейна [438]
Жесткие параметры непосредственного сернокислотного выщелачивания халькопиритного концентрата способствовали поиску способов снижения устойчивости (активации) халькопирита. Это оказывается возможным при нагреве концентрата в инертной атмосфере при 825° С в течение 2 ч или при добавке элементарной серы (10% от массы концентрата) и последующей прокалке в инертной атмосфере при 475° С, 2 ч [440]. При этом протекают следующие реакции:
4CuFeS2 -> 2Cu2S 4- 4FeS + S2,
CuFeS2 + S -»-CuS + FeS2.
Автоклавное выщелачивание сульфиднзированного материала за 3 ч обеспечивает извлечение в раствор около 98% меди; заметное растворение железа происходит только после извлечения 95% меди.
Интересный вариант активации высших сульфидов (пирита, халькопирита) был предложен Бьерлингом с сотрудниками. По этому способу сульфиды совместно с металлическим скрапом обрабатывали
Халькопиритный концентрат
I
Доизмельчение
Автоклавное выщелачивание
1
Грануляция I Просеивание
Пульпа Серные гранулы
Фильтрация |
Раствор Остаток -------,
| Флотация
Автоклавное осаждение t-------------- J
[ } Хвосты
Раствор Медный U]°LCuAWLFe
(20г/лСи,5г/лГе195г]лнг50^ порошок ’ ' >
_________J - концентрат
(15,5%Си,2?%Ре, 44%Srf4,W,4%S°j „ я ♦ с» выделение S
5° Сулыридный продукт
Рис. 75 Схема автоклвиной переработки халькопиритиого концентрата с нспольэоааннем сернокислотного выщелачивания
при 480—500° С в нейтральной атмосфере 128, с. 23—34 ]. При использовании чистого медного скрапа достигнута активация халькопирита на 94—96%. Снижение содержания меди в скрапе ухудшает степень активации и требует более высокой температуры (550—650° С). Обязательные условия — механическое перемешивание шихты для обновления реакционной поверхности. В активированном продукте содержится в основном халькозин и сернистое железо, фазы, окисляющиеся с образованием элементарной серы при соответствующих параметрах автоклавного выщелачивания. Фирмы «Дювал Кор.» (США) и «Комнпко» (Канада) собираются проектировать завод по автоклавному выщелачиванию медных концентратов [441 1.
Бактериальное выщелачивание
В работах 128, с. 71—76; 442) показана достаточная эффективность бактериального выщелачивания халькопиритного концентрата при интенсивном перемешивании пульпы.
Для полного вскрытия медных минералов необходимо измельчение до нескольких микрон. В этом случае без введения кислоты медь переходит в раствор со скоростью 0,7 г/л в час вплоть до концентрации в нем 50 г/л Си. Одновременно в раствор переходит железо (5—13 г/л Fe3 + ) и образуется серная кислота. Из растворов от выщелачивания после их очистки медь выделяют электролизом. Данную технологию рекомендуют для переработки труднообогатимых низкокачественных концентратов. Достоинство ее — невысокие капитальные и эксплуатационные расходы, особенно при использовании обез-межениых растворов для выщелачивания меди из окисленного сырья.
Электрохимическое растворение
По данным японских металлургов (443], можно получить раствор,-содержащий более 5 г/л Си, при электрохимическом растворении халькопиритного концентрата крупностью 0,15 мм (выход фракции 82%) при 60° С (pH раствора 2,5, концентрация в нем меди 0,7 г/л, катодная плотность тока 500 А/м2).
В работе (444] сообщается о сооружении в США (шт. Аризона) опытной установки производительностью 50 т/сут халькопиритного концентрата для проверки электрохимической технологии извлечением меди, железа и элементарной серы.
При электрохимическом растворении медных штейнов в растворе, содержащем 30 г/л Си, 150 г/л H2SO4, при температуре 33° С установлено, что (123):
1) наибольшая скорость растворения достигается при низкой плотности тока (50 А/м2);
2) увеличение катодной плотности тока с 50 до 500 А/м2 приводит к снижению выхода по току с 97 до 78,4% и уменьшению выхода шлама (почти в 3 раза), при этом содержание элементарной серы в нем повысилось с 19,6 до 22,7%;
3) изменение начааьного содержания кислоты с 50 до 300 г/л практически не влияет на катодный выход по току и существенно сказывается па величине анодного выхода по току.
Так, при концентрации серной кислоты >100 г/л достигается 100%-ный катодный выход по току, а анодный — только 81—86%.
При обработке ультразвуком с частотой 40 кГц/с заметно возрастает выход по току.
Подобные выводы получены при исследовании растворения белого матта, содержащего 77,85% Си; 0,65% Fe; 0,21 % Zn; 0,26% As; 19,2% S [144]. Рекомендуется следующий режим электролиза: исходное содержание в электролите 30 г/л меди, 100 г/л кислоты, температура 40° С, катодная плотность тока 100 А/м2. Эти параметры меди и наличие анодной диафрагмы позволили получить качествен
ный катодный осадок, содержащий 90,9% Си; 0,0018% Fe; 0,0012% Pb; 0,0017% Zn.
В сернОм шламе, содержащем 13,8% Си; 0,1% Fe; 7,7% S; 7,2% 5Сульфнд, концентрация благородных металлов возрастает в 3—5 раз по отношению к исходному материалу.
Для снижения концентрации меди в шламах с 13 до 2% при электрохимическом растворении медных штейнов предложено вводить азотную кислоту из расчета 35—75 кг на 1 т катодной меди 1445].
ПЕРЕРАБОТКА МЕДНО-ЦИНКОВЫХ РУД И КОНЦЕНТРАТОВ
Схемы с использованием обжига или сульфатизации
Интересная технология переработки медно-цинковых концентратов использовалась иа заводе Касако (Япония) [446—447]. Исходный концентрат (10,6% Си; 16,7% Zn; 2,4% Pb; 39% S; 22% Fe) в виде пульпы плотностью 75—80% подвергали сульфатизирующему обжигу в печах КС при температуре 660—68СГС и избыточном расходе воздуха 50%. Степень сульфатизации меди и цинка составляла соответственно 92 и 75%.
Огарок подвергали двустадийному выщелачиванию: первую стадию проводили при 70° С в течение 5 ч, используя слабокислые растворы (Ch.so, = 5,7 г/л). Остаток от первого выщелачивания обрабатывали раствором, содержащим 50 г/л H2SO4, при 70° С в течение 4 ч. Конечный кек тщательно промывали (медь из промывных вод извлекали цементацией), флотировали, доизвлекая около 20% Au, 60% Ag, 30% Си, 60% Zn, а остаток (1 % Си, 2% Zn, 40—45% Fe) временно складировали. Суммарное извлечение в раствор составляло 97% Си и 90% Zn.
Из раствора, содержащего 54 г/л Си, 100 г/л Zn, 2 г/л Fe, извлекали медь электролизом в три стадии. Параметры электролитического осаждения меди приведена в табл. 37. На первой и второй стадии получали высококачественный металл, а на третьей — порошкообразную губку.
После нейтрализации известняком, очистки от железа, мышьяка н других примесей цинк из раствора извлекали электролизом.
Ряд несомненных достоинств, прежде всего достаточно комплексное использование сырья и высокое извлечение меди, определил повышенное внимание к этой технологии. В Гинцветмете в течение ряда лет исследовали возможность применения технологии завода Касако для переработки нескольких разновидностей медно-цинковых сульфидных материалов [448—450]. Эти работы подтвердили известные литературные данные, а также показали принципиальную возможность извлечения благородных и цветных металлов из остатков от выщелачивания по схеме хлоридовозгонки.
К существенным недостаткам схемы, помимо громоздкости, особенно на стадии извлечения меди, относятся трудности селективного разделения меди н цинка, предпочтительность переработки материа-234
Таблица 37
Параметры и показатели трех стадий электролитического осаждения меди Из медно-цинковых растворов
Наименование I-я стадия 2-я стадия 3-я стадия
Плотность тока. А/ма 120 90 265
Напряжение, В 2,2 2,2 3,7
Содержание меди в растворе, г/л: исходном 54 25 12
конечном 25 12 1 5100 50
Расход электроэнергии на 1 тмеди, кВт ч Выход по току, % Продолжительность операции, сут. 2600 82 2300 80
7 14 5
Число электролизных ванн. шт. 40 50 40
Распределение меди, % 54,7 24.5 20,8
Содержание в катодном осадке, %: Си . . ..... 99,7 99,97 70—80
Zn , . Сл. Сл. 4,0
Fe 0.003 0,003 0,4
Sb . . 5-10-‘ 5 10-* 0,24
As . . Сл. Сл. 2,27
лов с невысоким содержанием цинка, большая энергоемкость процесса. По этим причинам, а также по коньюнктуриым соображениям, в 1966 г. на заводе Касако прекращена переработка медно-цинковых концентратов.
В работе [4511 приведены результаты полупромышленных испытаний сульфатизирующего обжига для переработки труднообога-тимых медно-свинцово-цинковых руд. В исходной руде содержалось: 8,71% Zn; 3,49% Pb; 0,24% Си; 31,4% Fe; 38;2% S; 0,17% As; 10,7% пустой породы, в том числе 1,47% MgO.
Руду дробили, измельчали, добавляли 2% Na^SO,,, распульпо-вывали отработанным электролитом и подвергали обжигу при 630° С и 75%-ном избытке воздуха от теоретического расхода. В результате обжига до 93% Zn; 94% Си; 74% Со; 95% Mg; 9% Са; 2,4% Fe, 68% Мп; 5% Ag, 57% As; 88% Cd от содержания этих элементов в руде переходило в растворимую форму.
Огарок, содержащий около 50% фракции +0,3 мм, выщелачивали 1 %-ным раствором H2SO4 при 60—70 ' С в течение 2—3 ч. Полученный раствор содержал 80—120 г/л Zn; 1—3 г/л Си; 0,1—0,3 г/л Cd, 5—10 г/л Fe; 10—20 г/л Mg; 3—10 г/л Na; 0,02—0,15 г/л As; 1— 2 г/л Мп.
Медь па 96,6% осаждали цементацией железом; состав осадка: 60% Си, 3.8% Zn, 1,8% Fe, 7,9% As.
После гидролитической очистки от железа, цементации кадмия, осаждения кобальта раствор поступал на электролитическое выделение цинка.
Основные трудности возникли при очистке железосодержащих растворов и накоплении в’них магния, который существенно ухудшал качество катодного осадка.
Возможность высокого извлечения цветных металлов из комплексных сульфидных медно-иинковых материалов при обработке их концентрированными растворами серной кислоты и температуре около 200° С показана А. Е. Маковецким и позднее С. М. Анисимовым 1452—4531.
Позднее описано 1454—4551 селективное извлечение в раствор, содержащий 40—60% H2SO4, цинка и кадмия при I'/O—210' С в течение 50—60 мин. Растворение меди прн этом не превышало 5—9%.
Однако при непосредственной сульфатизации сульфидных материалов затруднена селективная сульфатизацпя меди н цинка относительно железа, что приводит к повышенному содержанию последнего в растворах от выщелачивания; получаются сложные по составу газы, затрудняющие их последующее использование; возрастает расход серной кислоты в связи с образованием сероводорода и элементарной серы; осложняется водный баланс схемы при организации замкнутой технологии.
Под руководством А. П. Снурникова были проведены обстоятельные исследования по переработке ряда разновидностей медно-циико-вых материалов, содержащих 4—12% Си, 6—32% Zn, 12—35% Fe, 18—44% S с использованием сульфатизации 1456—4581. Принципиальная технологическая схема включает следующие основные операции:
1) окислительный обжиг;
2) двухстадийную сульфатизацию;
3) выщелачивание сульфатизированного продукта;
4) выделение меди;
5) нейтрализацию и очистку раствора;
6) электролитическое выделение меди.
Окислительный обжиг проводят в печах КС при температуре 700—800е С. Условия обжига принимают с учетом содержания железа для минимального образования ферритов цинка и меди.
Огарок окислительного обжига подвергают низкотемпературной сульфатизации раствором кислоты, содержащим 40—60% H2SO4, или отработанным цинковым электролитом при 150—180° С (Ж : Т = = 1,5—1,6). Сульфатизированиые гранулы обрабатываются в печах КС при 640—650е С. Селективность сульфатизации по железу возрастает с увеличением температуры и расхода воздуха.
Продукт от второй стадии сульфатизации после измельчения до—0,056 мм выщелачивают в подкисленном растворе (5 г/л H2SO4) при 70° С (Ж : Т = 2,5) в течение 1 ч.
Тщательное проведение этих трех головных операций обеспечивает перевод в раствор до 99% Zn, 99% Си и около 96% Cd. В остатке от выщетачиваиия концентрируются благородные металлы, свинец, пустая порода и железо.
Способ изв течения меди зависит от содержания ее в растворах. Цементацию, сорбцию, экстракцию применяют при низкой концентрации меди, а электролиз, автоклавное осаждение—при высокой. При электролизе и автоклавном осаждении регенерируется серная кислота, которую нейтрализуют одним из известных способов. Ней-236
трализованный раствор подвергают тонкой очистке от примесей с последующей переработкой продуктов, принятой в гидроэлектрометаллургии цинка.
Состав типичных продуктов на примере переработки коллективного медно-цинкового концентрата приведен в табл. 38.
Таблица 38
Состав исходного концентрата и продуктов его переработки с использованием сульфатизации
Продукт Си Zn Pb Cd Fe s As
Концентрат, % Огарок от окислитель- 12,3 6.1 0,68 0.03 28,3 38,9 0.26
ного обжига, % . Сульфа тизнроваиный 14,0 6.8 0,80 — 27,2 0,20 —
огарок % Медно-цинковый рас- 11.7 10.5 0,57 0,025 19,6 10.4 —
твор, г/л Остаток от выщелачи- 47,0 52,6 — 0,09 3,7 — 0,23
вания, % Железо-мышьяково1 0.4 0.4 1,57 Сл. 49.6 — 0,10
кальциевый кек, % Кек после рейтрали- 1.5 0,6 — — 15,0 — 0,74
зации, % Раствор для цииково- 10—12 21—22 2.3—4,0 0,24 12—20 — 0,15
го производства, г/л 0,9— 1.1 115—120 — 0,2—0.5 Сл.
В дальнейшем были усовершенствованы операции извлечения меди из раствора, а также обжига, что упростило баланс схемы по сере и способствовало получению более концентрированных по SO» газов [459—4601.
Данная технология характеризуется высокой комплексностью использования сырья и применением достаточно простых и освоенных операций. В связи с пирометаллургической подготовкой в голове схемы показатели сульфатизации зависят от вещественного состава сырья: так, при наличии меди в виде халькопирита степень сульфатизации меди снижается до 90% из-за развития процессов фгёрритообразовання.
После хлорирующего обжига (расход карналлита составляет 70— 80% от массы) медно-цннковых руд и концентратов при температуре 220—230° С, в течение 30—60 мм и выщелачивания огарка в раствор извлекается до 90% Zn и около 3% Си, т. е. имеет место достаточно селективное обесцинкование [461—4621.
Выщелачивание огарка, полученного из руды, содержащей 4,5— 4,9% Си; 3,5—4,0% Zn после окислительного и сульфато-хлори-рующего (при 500° С, добавка 17% NaCl) обжига, позволяет извлечь в раствор до 91—95% Си н Zn [463J.
Медь предложено извлекать цементацией, в полученном осадке содержится 80—87% Си и концентрируется золото и серебро.
Солевое выщелачивание [464 1
Руду, содержащую 2,95% Си; 4,2% Zn; 35,5% Fe; 43,5% S; 0,68% Pb, обрабатывали в две стадии при 106° С в течение 6 ч раствором, в котором концентрация жетеза составляла 100 г/л Fe3 + и 50 г/л Fe2 + при Ж : Т = 2,7. В раствор извлекалось 97,5% Си и 98,5% Zn.
После выделения меди и серебра цементацией остающиеся цветные металлы осаждали сероводородом, а железосодержащие растворы направляли на электролитическое выделение железа. Суммарное извлечение меди в цементный осадок около 97,4%.
Автоклавные схемы
В 1953—1957 гг. С. И. Соболь с сотрудниками доказали принципиальную возможность комплексной переработки медно-цинковых материалов с использованием автоклавного аммиачного выщелачивания [209].
Результаты полупромышленных испытаний во многом подобной технологии1 опубликованы фирмой «Шерритт Гордон» (Канада) в работе [465]. На основании этих исследований предполагалось построить завод на Филиппинах для переработки медно-цинковых концентратов по аммиачной схеме, о чем сообщалось в работах [466— 4711. Особенность технологической схемы — непосредственное получение из медного порошка мелкосортного проката (полос, трубок, лент, прутков) н высокая рентабельность, несмотря на небольшой объем производства.
Пульпу концентратов, приготовленную из расчета получения в конечном растворе 65 г/л Си, 200 г/л (NHJjSO,, [при отношении концентраций NH3 : (Си + Zn) равном 4,5—5,0], обрабатывают в горизонтальном четырехкамериом автоклаве при температуре 83° С и давлении воздуха 770 кПа (7,7 ат). За 9 ч выщелачивания извлекается 95,6% Си, 80% Zn, 58% S.
В конечную пульпу вводят сепаран АР-30 (36 г/т концентрата), что обеспечивает скорость отстаивания 16,5 см/ч. После фильтрации [скорость фильтрации 29 кг/(м2-ч)] осадок промывают и направляют на цианирование для извлечения благородных металлов.
После осветления верхнего слива отгоняют избыточный аммиак [до NH3 : (Си + Zn), равном 3,4 ] и подвергают раствор окислению и гидролизу при избыточном давлении воздуха 4200 кПа (42 ат) и температуре 246° С.
На осаждение меди поступает раствор, содержащий 65 г/л Си, 18 г/л Zn, 300 г/л (NH4)2SO4 (при NH3 : Си = 2,6 после предварительного подкисления). В раствор вводят 0,25 г/л препарата «акри-зол А-3», операцию проводят при рн3,6 — 4,2 МПа, (42 ат) и 205° С. Средняя скорость осаждения меди 0,85 г/(л-мин). Цикл восстановле
1 Пат. (ФРГ), № 1160623, 1963.
ния включает две уплотнительные операции. Внутренняя поверхность автоклава была плакирована сталью «Карпентер-20».
После промывки порошка и фильтрации (остаточная влажность 10—20%) его обрабатывают в токе водорода при 650° С. Спек'по-рошка дробят до крупности —0,15 мм.
Раствор после осаждения меди подкрепляют аммиаком до NH3 : Zn = 3,5 и обрабатывают углекислым газом при избыточном давлении его 700 кПа (7 ат) и температуре 37° С. При этом за 2 ч до 90% Zn и 20% Си осаждается в виде основного карбоната. После его растворения в оборотном электролите и очистки раствора цинк выделяли электролизом.
До 98% Си и 89% Zn, остающихся в растворе, осаждают сероводородом при 33° С в течение 1 ч, в результате чего получается оборотный продукт и раствор сульфата аммония, последний направляют на производство сульфата аммония.
Типичные составы основных продуктов приведены в табл. 39.
Таблица 39
Химический состав концентрата и продуктов его переработки по схеме с аммиачным выщелачиванием
Продукта Си Zn Fe s i о, co X z NH3 (своб) ’OS ’(’HN) NH, : Си (в молях)
Концентрат, % . . . 20,5 6,8 24,6 33,4 — —
Раствор: до выщелачивания, г/л ... 7.9 5,1 72,3 25,5 230
после выщелачивания *, г/л 64,2 18,1 150,0 101,0 188 5,9-
Нерастворимый остаток, % ... 1.34 2,26 38,1 22,1
Раствор перед осаждением медн, г/л 63.7 17,6 148,0 44,8 200,0 2.6
после осаждения меди, г/л . . 1.26 16,5 154,0 9.9 562,0 —
Медный порошок, % ** 99,85 0.013 0,004 0,016 — —. — —
Раствор после осаждения цинка, г/л . . . 1,04 1.6 — — 129,0 8,0 480,0 —
Кек основного карбоната цинка, % . . . 0,7 50,8 0,13 0.1 0.5 — —
Оборотный медио-цинковый кек, % 26,6 31.8 — —
Сульфат аммония кристаллический, % 0.003 0.01 0,005 - - - - -
* В растворе 13,5 г/л сульфамата.
'• Потери при проналиваиии в атмосфере водороде 0.1%.
По проекту стоимость предприятия составила 23 млн. дол.; предполагалось выпускать 13 тыс. т меди, 4,1 тыс. т цинка, 80 тыс. т сульфата аммония. Обслуживающий штат около 1000 человек.
Японские металлурги 14721 предложили несколько нные условия .для автоклавного аммиачного выщелачивания медно-цинковых концентратов, содержащих 18,57% Zn, 9,75% Си. При 115° С, концентрации в растворе 110 г/л NH3, р<£6 = 1 МПа (10 ат) за 3 ч достигнуто извлечение 91% Си; 88,5% Zn. Выщелачивание при 150° С позво-.ляет повысить извлечение цинка до 91%.
Близкие к описанным параметры автоклавного аммиачного выщелачивания были предложены в работе (4731 для переработки свинцово-цинково-медного концентрата, содержащего 6,5% РЬ, 6,36% Zn, 2,16% Си. За 4 ч в раствор извлекается до 97% Си, Ag, Т1 и 80% Zn. Выщелачивание проводили при 120° С, 10% твердого в пульпе и избыточном давлении кислорода в автоклаве 400 кПа (4 ат).
При аммиачном выщелачивании достигается высокое извлечение меди в раствор, что делает предпочтительным его применение для медистых медно-цинковых концентратов. Извлечение цинка иа 10— :20% ниже, чем меди.
В работах 1 [4741 показана возможность извлечения в раствор .до 95—98% Zn и 94—96% Си при окислительном выщелачивании .медно-цинковых концентратов.
При переработке медно-цинковых материалов особенно с невысоким содержанием меди и цинка по схемам, определяющим совместный перевод этих металлов в раствор, возникает ряд трудностей при их селективном извлечении.
Металлурги Горного Бюро (США) для этой цепи предложили2 схем)' с использованием экстракции [4751: после очистки от железа цинк экстрагируют кальциевой солью ди-2-этилгексилфосфорной кислоты (20% ЭГФК, 5% изодецилового спирта, 75% керосина), осуществляя непрерывную корректировку кислотности (добавляют около 21 г извести иа 1 л раствора). Этим же экстрагентом извлекают и медь. После реэкстракции обогащенные растворы направляют на электролитическое выделение.
При автоклавном выщелачивании первичные сульфиды цинка и меди вскрываются с различной скоростью. Поэтому представляет интерес вариант сернокислотного выщелачивания медно-цинковых материалов с селективным переводом в раствор только цинка и кадмия. Возможность такого ведения процесса, по данным работ [476— 477), доказана для медно-цинкового концентрата и промпродукта. Этому вопросу посвящены и другие работы [478-^4791. Прн 100— 105° С, отношении концентраций H2SO4 : Zn = 0,9-е-1,1, РО2 = — 3004-500 кПа (3—5 ат) за 4—5 ч в раствор извлекается до 92— 94% Zn и не более 10—20% Си. В результате последующей операции гранулирования (прн 140—160° С в течение 40—60 мин) практически нацело осаждается медь. Получаемые растворы после очистки
1 Пат. (ЧССР), № 102369, 1962.
’ Пат. (США), № 3573182, 1968.
от железа направляют в Цийковоё Производство, а медьсодержащий кек — на медеплавильный завод. Указанный вариант представляет интерес для переработки коллективных концентратов и промпро-дуктов.
Из других гидрометаллургических способов вскрытия медноцинковых сульфидных материалов следует отметить схемы с использованием азотнокислых [171, солянокислых растворов и полухло-ристой серы [4801. Наряду с высокими показателями по извлечению меди и цинка в раствор в значительном количестве переходит железо, свинец, отдельные элементы пустой породы. Рекомендованные технологические схемы весьма сложны в части селективного извлечения цветных металлов, регенерации растворителя, аппаратурного оформления. Поэтому их разработка до настоящего времени не вышла за рамки лабораторных испытаний.
Имеются сообщения 1 о положительных результатах сернокислотного выщелачивания медно-цинковых концентратов в присутствии бактериальной культуры Th. ferrooxidans. Операцию рекомендуют проводить при 30—35° С, pH = 1,54-3,5 в атмосфере кислорода (21—60% О») и углекислого газа (0,1—10,0% СО2), используя топкоизмельченный концентрат (—0,044 мм).
ПЕРЕРАБОТКА МЕДНО-НИКЕЛЕВЫХ КОНЦЕНТРАТОВ И ШТЕЙНОВ
Схема с применением обжига
Медно-никелевые файнштейны на заводе в Кристианзанде (Норвегия, фирма «Фолкенбридж») перерабатывали по комбинированной схеме («Хибинетт-процесс)2 [4811. Поступающий материал, содержащий 48% N1, 27% Си, 22% S, 0,06% Со, 0,9% Fe, 0,13% As, 0,06% Pb, 0,04% Se, подвергали дроблению до крупности —51 мм и обжигали при 800° С. Отходящие газы очищали с последующим получением сернистого газа в жидком состоянии.
Огарок выщелачивали в пачуках, пульпу разделяли в гидро-циклоНах. Раствор после контрольной фильтрации направляли на электролитическое выделение меди. Отработанный электролит возвращали на выщелачивание огарка. Нерастворимый остаток, в котором отношение концентраций Ni : Си = 5, плавили на аноды, используемые для получения электролитного.никеля.
Показатели процесса, схема которого приведена на рис. 76, во многом зависят от результатов обжига. Прн обжиге сульфиды меди переходят в кислоторастворнмую форму (одислы никеля, железа, кобальта характеризуются пониженной растворимостью). Одновременно часть меди и никеля образует твердые растворы с пониженной растворимостью; доля твердого раствора возрастает с повышением температуры обжига.
1 Пат. (США),- № 3607235. 1971.
* Пат. (США), № 805555, 805969, 1905.
16 С. С. Набойченко
241
Штейн
Обжиг
Газы Огарок
Очистка
I--------1
Пыль Газы
(-------» г-
На производство жидкого SO^ I
В производство Ni
г 1 I ♦
Си цементная I Со-кек
---------1 L -
Ni катодный
Щ
Остаток ____
Раствор
Электролиз Си
|------ ------1
Си катоды Отработанный
электролит
I 4_____
Регенерация
Маточный раствор Hi купорос
Рнс. 76. Принципиальная схема переработки медно-ннкелеиых штейнов по способу Хнбн-
Измельченный файнштейн ------BStyNi^iSelnHCi---------| ;-------- ' Выщелачивание Ni
Фильтрация ;
| Твердое
Оожиг
Раствор
Воздух ——Окисление —- 5
кстракция—-FeCl3
Экстракция——СоП^ на кI ------»• кристаллизация
Центрифугирование ±
Раствор | Кристаллы^
Извлечение серы
80г
j Выщелачивание Си — Фильтрация Твердое Раствор
Рафинирование Электролиз-----
Г О 1
Удаление на -С,а£,е > Извлечение NI
Оборотная кислота
——>-г-<—— изоле' твору - I Абсорбция |
Никель
Металлы _ платиновой группы
Медь
Рмс. 77. Солянокнслотная схема переработан мед но-никелевого фа Л н штейна
Для выделения накапливающегося никеля часть оборотного раствора выводят на регенерацию. Позднее завод был переведен на солянокислотную технологию, которая рассматривается ниже.
Схема с использованием солянокислого выщелачивания
Фирмой «Фолкенбридж» (Канада) испытана технология переработки файнштейна, основанная на селективном выщелачивании никеля концентрированными растворами соляной кислоты [482—4851 х. Медьсодержащий остаток (75,6% Си, 1,8% Ni), в который переходят благородные металлы, до 98% Си и только 1,3% Ni, подвергают обжигу, а затем выщелачиванию с последующим электролизом.
Никельсодержащий раствор очищают экстракцией от железа (трибутилфосфатом), кобальта (тиоизоактиламином), подкисляют соляной кислотой н подвергают кристаллизации с последующей переработкой NiClj 6Н2О до металла. По другому варианту получают закись никеля в процессе высокотемпературного гидролиза в реакторе кипящего слоя. Закись никеля восстанавливают до металла в трубчатой печи.
Промышленное использование схемы (рис. 77) позволит значительно сократить количество оборотных продуктов (по сравнению с Хибинетт-процессом) и высвободить дополнительные мощности
По этой схеме в Канаде (шт. Онтарио) в 1974 г. предполагается пуск нового завода производительностью 13,6 тыс. т никеля, 9,9 тыс. т медн, 6,3 тыс. т элементарной серы и 227 т солей кобальта.
Автоклавные схемы
В процессе автоклавного сернокислотного выщелачивания медно-никелевой шпейзы, содержащей 14,24% Си, 14,14% Ni, 40,4% As, 26,4% Sb, 1,12% Fe, 0,75% Pb, при 140° C = l,5--’2 МПа (15—20 ат), за 1 ч й раствор извлекали 93—95% Си, —100% Ni, 89—92% As. При этом расход серной кислоты не превышал стехиометрического количества для связывания никеля, меди в сульфаты I486].
На полупромышленной установке было испытано автоклавное аммиачное выщелачивание штейна, содержащего 54% Ni, 12,5% Си, 0,5% Со, 6,8% Fe, 22,4% S, крупностью —0,15 мм. При 80° С рнзб = /од кПа (7 ат), C(nh.),so. = 300—335 г/л, в раствор извлекали 98,5% Си и Ni, 95% Со. Из растворов медь осаждали в виде сульфида. При получении растворов, более богатых по меди, возможно селективное автоклавное ее осаждение, аналогично описанному в работе [100]. Последующая переработка растворов была типична для аммиачных схем. Состав получаемых продуктов, по данным работы 1487], приведен в табл. 40.
В работе [6, с. 153] описаны более жесткие параметры [/ = = 95—105° С, Р^ = 1—1,5 МПа (10—15 ат), CNH> = 250 г/л,
* Пат. (США), № 3085054, 1963.
Таблица 40
Состав основных продуктов переработки медно-никелевого штейна по схеме с аммиачным выщелачиванием
Продукты N< Си Со Fe S NH3°
Раствор после выщелачивания, г/л 41,5 8,9 0,4 86 82
Нерастворимый остаток, % 4 1 0,2 40 4 —
Раствор после осаждения меди, г/л 39,9 0,008 0,4 86 25
Медный сульфидный осадок, % 0,2 54,8 0,02 39
Никелевый порошок, % 99,7 0,02 0,07 0.02 0,02 _ —
C(nh,),so, = 100—150 г/л] для выщелачивания штейнов, содержащих 23—36,5% Ni, 14,12—30,43% Cg, 0,41%—0,51% Со, 7,82— 33,8% Fe, 20,18—25,6% S. При указанных условиях за 4—6 ч в раствор извлекается 95—98% Ni, 90—94% Со, 97—99,5% Си, 95—99,5% S.
При сернокислотном двухстадийиом выщелачивании можно селективно извлекать в раствор никель из медно-никиелевых промпро-дуктов флотационного разделения файнштейиа [488—489J.
В работе [4901 сообщалось, что законсервированное в 1959 г. предприятие в Порт-Никеле (США, шт. Луизиана) начнет перера батывать по автоклавной схеме медно-никелевые штейны в количестве 44 тыс. т/год, получаемые из республики Ботсвана. Предполагается выпуск 17 тыс. т/год никеля и 15,5 тыс. т/год меди в виде порошков; последние после брикетирования будут перерабатывать на медные вайербарсы и катодный никель.
Электрохимическое растворение [119, с. 96; 1671
Прн переработке файнштейиа, содержащего 33,86% Си, 41,85% Ni, 22,5% S, 0,66% Fe, медь выделяется в виде порошка, а никель и кобальт переходят в раствор соответственно на 97,5 и 95%. Катодная плотность тока составляет 600 А/мг. В медном порошке содержится 86—90% Си; 0,5—^),6% Ni; 0,01—0,06% Со; 0,02% Fe; 0,5% S. Соосаждение никеля устраняется прн конечной кислотности не менее 12—13 г/л. В растворе содержится 45—55 г/л Ni и 0,6—0,8 г/л Си.
В шлам, содержащий 43—55% Си, 1—2% Ni, 37—47% S (35— 38% S°), переходит до 50% S, 30% Си, 2% Ni и 5% Со. В нем же концентрируются и благородные металлы.
При увеличении концентрации железа в штейнах с 2,7 до 45%, его содержание в растворе возрастает с 1,3 до 22 г/л. Одновременно повышается напряжение на ванне до 3—4 В, падает выход по току 244
с 76 до 62,5% (25,2% Fe) и резко возрастает расход электроэнергии: с 5,7 до 23 кВт.ч в расчете на 1 кг никеля.
При укрупненно-лабораторных испытаниях при напряжении на ванне 4—6 В и DK=750 A/nt достигнут выход по току 75% и расход электроэнергии на 1 т металлов, перешедших в раствор, 5650 кВт ч. На заводе Ньюарк (США) медио-никелевый файнштейн, содержащий 46% Ni, 28% Си, 23% S, 2,7% Fe, переплавляют, разливают в графитовые изложницы и охлаждают прн тщательном соблюдении температурного режима. Получаемые аноды после термической обработки завешивают в ваины; размер анода 0,21 Х0.74Х Х0.019 м, масса 20 кг.
Электрорастворение проводят в сульфатном электролете, содержащем 50—70 г/л Ni, 80—100 г/л H2SO4, прн плотности тока 280 А/м2, напряжении 2,8 В, температуре 50—60° С и циркуляции раствора 0,46 м3/ч.
Медь выделяется иа катоде в виде губчатого осадка, никель пе-' реходит в раствор, в котором содержится 120—130 г/л Ni, 0—2 г/л Си, 5—6 г/л Fe, 8—15 г/л H2SO4; после очистки от железа с использованием карбоната никеля и от меди сульфидом натрия раствор перерабатывают на купорос.
Анодный шлам, содержащий элементарную серу, платиновые металлы, промывают, обезвоживают и подвергают сульфатизирую-щему обжигу. При выщелачивании огарка доизвлекают медь и никель и получают платинусодержащий кек (>20% платиноидов).
Таким образом, при электрохимической технологии на этом предприятии получают не только медь, никель, элементарную серу, но и высокосортный концентрат платиновых металлов [4911.
Для получения катодной меди (2 т/сут) и никеля (0,5 т/сут) из медно-никелевого раствора на медеэлектролитном заводе в Эль-Пазо (США, шт. Техас) принята технологическая схема с использованием экстракции 1492].
Исходный раствор, содержащий 70—90 г/л Си, 25—30 г/л Ni, разбавляют для предотвращения кристаллизации меди, экстрагируют (LIX-64N) медь в две стадии до остаточного содержания ее в рафинате 0,002 г/л; реэкстракцию проводят в две стадии раствором серной кислоты (165 г/л H2SO4). Медь осаждают в шести ваннах конструкции фирмы «Континенталь Коппер энд Стил», обеспечивающих интенсивную направленную циркуляцию электролита. Это позволяет без опасности дендрнтообразования, загрязнения катодного осадка повысить в 4—5 раз плотность тока, тем самым существенно интенсифицировать процесс выделения меди.
Рафинат очищают от остаточной медн, нейтрализуют аммиаком для осаждения железа и алюминия. Из отфильтрованного раствора никель экстрагируют в три стадии до остаточного его содержания в отработанном растворе 0,01 ,г/л. После реэкстракцйи оборотным электролитом из никелевого раствора получают катодный никель прн катодной плотности тока 380 А/м2 или чистые никелевые соли.
После упаривания рафината от экстракции никеля и кристаллизации выделяют сульфат аммония.
ПЕРЕРАБОТКА МЕДНО КОБАЛЬТОВЫХ РУД И КОНЦЕНТРАТОВ
Схемы с использованием сульфатизирующего обжига или_ термической подготовки
На заводе Шитуру наряду с окисленными концентратами перерабатывают сульфидные медно-кобальтовые концентраты, содержащие до 40—55% Си и 1,2—2,5% Со 1401, 493—4951, Особенность их — практически отсутствие благородных металлов, что во многом определило выбор гидрометаллургической схемы (рис. 78).
Сулыридный концентрат
Сулыратизирующий обжиг 6 кипящем слое
Окисленный концентрат ------------------н,вой
П-------------------------------1 I
выщелачивание Выщелачивание
Удаление песков
I 1-------»-Лески-
-Порошок Си
•Промывке
Вторичное с ущение
Первичное сгущение*
Слив Пульпа
Слив
—Гидраты меди из кобальтовой, ветви
Очистка от Fe
Сгущение
Кварцевые песковые фильтры
ЭлектродКстракция меди
Противоточная промывка
п Г
Раствор на электролиз
Раствор в кобальтовую ветвь
Хвосты в отвал
Отработанный электролит
____.___i
------1
Катодная медь
Рнс. 78. Технологическая схема медной ветвн при переработке мсдно-ксбальтовых концентратов
Пульпу концентрата (76—80% твердого) подвергали сульфати-зирующему обжигу при температуре 675—680° С в печи КС диаметром 4,25 м и производительностью 100 т/сут. Заданную температуру поддерживали подачей воды или сжиганием угля. Избыток воздуха от теоретически необходимого достигал 25%, продолжительность операции 6 ч 246
При выщелачивании огарка отработанным электролитом извлекается до 97—98% Си н 95—96% Со, а переход железа в раствор составляет 38—45%. Операцию проводят в аппаратах с пневматическим перемешиванием. После классификации и отстаивания верхний слив осветляют на песочном фильтре и подвергают электролизу.
Типичный состав исходного раствора: 55 г/л Си, 2,8 г/л Fe, 22 г/л Со, 4,7 г/л А12О3, 2,1 г/л Мп, 14 г/л MgO, 4,5 г/л РгОв, 0,13 г/л шламов. Напряжение на ванне 2,15 В, расход электроэнергии 2000 кВт. ч на 1 т меди, расстояние между электродами 90 мм, выход по току 87-—90%.
Для предотвращения накопления железа, снижающего выход по току, часть раствора, поступающего на электролиз, обрабатывают гидратным медным кеком, получаемым в кобальтовом отделении.
Нижний слив сгустителей подвергают противоточной декантации. Часть декантированного раствора, содержащего 30 —40 г/л Си, 20 г/л Со, выводят в кобальтовое отделение, поддерживая тем самым постоянную концентрацию кобальта в медном электролите. В кобальтовом отделении медь выделяют в две стадии э 1ектролизом: в первой стадии содержание- медн снижают до 15—18 г/л (DK = = 160 А/м2), а на второй — до 5—8 г/л (DK = 240 А/м2 при интенсивном перемешивании электролита). Оставшееся количество меди осаждают известковым молоком также в две стадии.
Медно-кобальтовые концентраты (25—59% Си, 1,9—2,3% Со, 12—15% S) стали перерабатывать на заводе в Луилу с 1962 г. (401, 495 ]. Медь в концентрате представлена халькозином, частично борнитом и халькопиритом. Сульфатизирующий обжиг проводят в двух печах КС диаметром 4,9 м при температуре 675—680 С. В связи с невысоким содержанием серы в концентратах для обеспечения теплового баланса при обжиге практиковали подтопку печи углем. До 96—-98% Си и 94—96% Со переходило в растворимую форму.
Выщелачивание огарка проводят в течение 4 ч оборотным электролитом в четырех чанах с механическим перемешиванием. Пульпу сгущают, используя флокулянты (сепараи, ягуар); после фильтрации и промывки хвосты, содержащие 2—5% Си, 0,2—0,3% Со, 0,9— 1,2% S, складируют в отвал.
Раствор, содержащий 60 г/л Си и 17 г/л H2SO4, направляют на электроэкстракцию медн при U = 2,2 В, DK = 200-ь-215 А/м2 (выход по току 82—85%). Отработанный электролит, содержащий 25 г/л Си и до 70 г/л H2SO4, используют при выщелачивании окисленных концентратов (с. 204). По мере накопления в растворе кобальта и других примесей часть отработанного электролита выводят в кобальтовое отделение, где его обрабатывают по схеме, аналогичной практике завода в Шитуру,
Особенность работы завода в Лунлу — высокий уровень механизации, автоматизированного контроля и управления технологическим процессом.
Интересную технологию для переработки медно-кобальтовых' сульфидных руд предложили К. К- Белоглазов с сотрудниками (рис. 79) (496)
при его содержании до 8—10 г/л. В раствор извлекаются медь, железо, никель, цинк, кобальт, мышьяк, а свинец, элементарная сера, благородные металлы концентрируются в нерастворимом остатке. Растворы от выщелачивания нейтрализуют для очистки от железа и мышьяка. В зависимости от содержания меди возможно применение электролиза или автоклавного осаждения. Схема является замкнутой по растворителю.
Нерастворимый остаток после извлечения элементарной серы пригоден для шахтной свинцовой плавки.
Электрохимическое растворение
При электрохимическом растворении медно-свинцовых штейнов 94—99% Zn и 96—100% Fe переходят в раствор, 89—94% Си осаждается на катоде, а свинец остается в шламе в виде сульфата [119, с. 1861.
В медном осадке содержится 73—85% Си; 1,3—1,4% S; 0,1— 0,15% Zn
Выход шламов зависит от содержания свинца и серы в штейне и колеблется от 26 до 40%. В шламе содержится 1,5—3,6% Си, 0,05—0,08% Zn, 24—28% Pb, 0,4—0,7% Fe, 55—65% S.
Лучшие результаты получены при следующих условиях электролиза: t = 50° С, CH,so. = ЮО г/л, Da = 300—500 А/м2, U = — 3-;-3,5 В, т = 48 ч.
Глава VII
ИЗВЛЕЧЕНИЕ МЕДИ ИЗ НЕКОТОРЫХ ПОЛУПРОДУКТОВ ПРОИЗВОДСТВА И ОТХОДОВ ОБРАБОТКИ ЦВЕТНЫХ МЕТАЛЛОВ
При флотационном разделении сульфидных руд наряду с медными концентратами получают, например, цинковые, никелевые, свинцовые, пиритные концентраты, в которые переходит заметное количество меди. Поскольку она является весьма нежелательной примесью при получении чистых металлов, проводят тщательную очистку от меди. Кроме того, извлечение меди из обрабатываемых концентратов диктуется соображениями рентабельности, бережного н комплексного использования природного сырья.
Наибольшее количество меди концентрируется в пиритном, цинковом, никелевом, свинцовом концентратах. Кратко рассмотрим способы вывода меди из технологической схемы, использования получаемого медьсодержащего продукта на примере гидро- и пиро-гидрометаллургических технологий переработки наиболее типичных концентратов.
Как правило, при вскрытии Сульфидных концентратов (по одной из схем обжиг—выщелачивание, автоклавное, солевое выщелачивание, электрорастворение) медь достаточно полно переходит в раствор. Поскольку ее содержание невелико по отношению к основному металлу, очистку от меди проводят осаждением ее в виде труднорастворимых соединений (сульфида, основных карбонатов, сульфата) или цементного осадка.
Особое значение имеет использование пиритных концентратов. Несмотря иа невысокое содержание в них меди (0,1—0,2%) с учетом объема в пиритный продукт переходит до 15—20% меди от ее содержания в руде. В стоимостной оценке продукции, получаемой из пиритного концентрата, ведущее положение занимает сера и железо; в оценке извлекаемых цветных и благородных металлов почти половина стоимости приходится на медь.
Крупнотоннажная переработка пиритных концентратов или огарков осуществляется на заводах в Дуйсбурге (ФРГ), Тобата (Япония), фирмы «Монтекатиии» (Италия), Коккола (Финляндия) [499—505].
На первых трех предприятиях перерабатывают пиритные огарки, а в Коккола — пиритные кобальтсодержащие концентраты.
Для вскрытия сырья используют низкотемпературный хлорирующий обжиг (Дуйсбург) \ хлоридовозгоику (Тобата, Моитека-тини), взвешенную» плавку — сульфатизирующий обжиг штейна (Коккола)1 2 с последующим выщелачиванием огарка или водным улавливанием хлоридиых возгонов.
Указанные способы обеспечивают перевод в раствор до 82—-89% Си Содержание этого металла в растворах составляет 8—22 г/л.
На заводе в Дуйсбурге хлоридные растворы обрабатывают цементной медью, получаемой на второй стадии обезмеживания. Образующийся осадок полухлористой меди отфильтровывают, медь из фильтра осаждают железным скрапом во вращающихся цементаторах грушевидной формы (емкостью 50 т).
Раньше распульпованный осадок одновалентной меди обрабатывали железным скрапом:
2СиС1 4- Fe FeCl2 + 2Cu.
Затем из-за трудностей с использованием раствора хлористого железа стали применять известковое молоко:
2CuCl + Са (ОН)2 Си2О + Catl2 + Н2О.
Медный осадок смешивают с коксом, флюсом н плавят в шахтной печи, получая черную медь (95—96% Си), которую подвергают конвертированию и в дальнейшем — электролизу. Часть хлорида меди перерабатывают на оксихлорид, используемый в химической промышленности или как инсектофунгицид.
1 На этом предприятии также проверяли и вариант хлоридовозгонки.
2 Часть концентратов подвергают глубокому окислительному обжигу, к концентрату подшихтовывают полученный огарок, сульфат натрия (соответственно, %: 79; 18,2 и 2,1) и эту смесь направляют на сульфатизирующий обжиг.
На заводе в Коккола раствор от выщелачивания огарка очищают от железа , а затем осаждают медь сероводородом при 20—30° С и pH = 1,0-=-1,5. После фильтрации и промывки сульфидный осадок, содержащий 45% Си, 4% Zn, 0,4—0,6% Со, 0,3% Ni, направляют на медеплавильный завод в Харьявалте.
Ра'створы, получаемые при улавливании хлоридных возгонов, отличаются повышенным содержанием металлов (20—22 г/л Си), соляной кислоты, дисперсной пыли. На заводе в Тобато эти растворы нейтрализуют известняком, а затем цементируют медь железным скрапом. Извлечение меди в цементный осадок, содержащий —70% Си, составляет не менее 95%, расход осадителя 1,2 т/т меди.
Рентабельность схем с использованием хлорирующего обжига, особенно хлоридовозгонки, заметно возрастает при условии регенерации хлорирующего реагента. В этой связи была изучена возможность электролиза растворов хлоридов меди с попутным получением газообразного хлора.
Фирма «Шеррит Гордон» (Канада) предложила схему переработки пиритных концентратов и бедных штейнов с использованием автоклавных процессов 1506—507].
Исходный концентрат обрабатывают в печи КС при слабовосстановительной атмосфере, температуре 700—815° С, отгоняя до 40— 45% S (в том числе почти 85% в элементарной .форме). Огарок (или штейн) выщелачивают при избыточном давлении кислорода 1,05 МПа (10,5 ат), температуре 110° С, плотности пульпы 40% твердого и концентрации H2SO4, равной 20 г/л. При указанных условиях за 1 ч около 70% S окисляется до элементарной, которая вместе с гидратами железа остается в осадке. После выделения серы горячей фильтрацией или экстракцией органическим растворителем гидратный осадок растворяют в присутствии сернистого газа. Железный раствор подвергают гидролизу, получая осадок, который после прокалки при 1000° - С пригоден для получения высококачественного порошка.
Медь и другие цветные металлы при автоклавном выщелачивании переходят в раствор; последний после нейтрализации обрабатывают или оборотным железным порошком, нли сероводородом (/ — 93° С, т = 30 мин), при этом до 95% цветных металлов осаждается в коллективный продукт.
Рассмотренные выше способы отличаются одним общим признаком: цветные металлы селективно извлекаются в раствор, а железо концентрируется в остатке.
Несколько иначе решена технология, разработанная под руководством К. Ж- Белоглазова [4961, которая применима и для переработки пиритных концентратов.
Принципиальным ее отличием от схемы «Шерритт Гордон» является плавка концентрата при слабо-восстановительной атмосфере, растворение измельченного штейна оборотным сернокислым раствором при избыточном давлении образующегося в процессе сероводорода. В результате железо Переходит в раствор, сера удаляется в виде сероводорода, а цветные и благородные металлы коицентри-252
руются в- нерастворимом остатке. Переработка железных растворов аналогична способу по канадской схеме.
Несомненные достоинства схемы К. К. Белоглазова в металлургическом цикле следующие: удаление пустой породы при плавке, более полное вскрытие сырья, менее жесткие параметры при выщелачивании [ t — 904-95° С, Ровщ = 2504-350 кПа (2,5—3,5 ат)1, более лучший состав кека цветных металлов, значительное сокращение расхода кислорода. Однако ее реализация требует наряду с металлургическим переделом сооружения комплекса по переработке сероводородосодержащих газов на элементарную серу.
В целом переработка пиритных концентратов с использованием автоклавных процессов обеспечивает высокое извлечение цветных металлов, а также железа, серы в более качественные продукты.
При переработке окисленных никелевых руд по схеме восстаио-вителъно-сульфирующая плавка — конвертирование—обжиг—электроплавка—электролиз часть меди выводится при сульфато-хлорирующем обжиге огарка от первой стадии обжига никелевого файн-штейна. Получаемый огарок выщелачивают, а медь, перешедшую в раствор, или цементируют иа железном скрапе, или, что чаще, осаждают содовым раствором в виде основного карбоната. При получении никеля высших марок оставшуюся медь удаляют в процессе электролиза при очистке аналита, используя, как правило, цементацию активным никелевым порошком. Последним способом удаляют медь и при переработке никелевых концентратов от флотационного разделения медно-никелевого файнштейна.
Из растворов, получаемых от автоклавного аммиачного выщелачивания сульфидных концентратов, с небольшим содержанием меди (1—2 г/л) ее осаждают в виде чистого сульфида при операции кипячение (при отгонке избыточного аммиака возрастает осаждающая способность тиосульфатного радикала).
В металлургии кобальта медь удаляют при очистке кобальтовых растворов, осаждая ее содой, известью или, что гораздо реже, цементацией кобальтовым порошком.
При гидрометаллургической переработке сульфидных цинковых концентратов медь удаляют цементацией цинковой пылью из осветленных растворов нейтрального выщелачивания. Этим способом 30—40% поступающей меди концентрируется в медно-кадмиевом (медиом), медио-хлорном кеках. Остальная часть меди находится в кеках кислого выщелачивания в виде труднорастворимых форм (ферритов, сульфидов) и при дальнейшей переработке кеков концентрируется в клинкере.
При производстве титана-медной пудрой очищают четыреххлористый тптаи от ванадия Получаемый медио-ванадиевый кек представляет весьма ценный продукт.
Составы некоторых медьсодержащих продуктов приведены в табл. 41. -I
До настоящего времени их в основном перерабатывают иа медеплавильном заводе.
Таблица 41
Химический состав медьсодержащих материалов, полученных в процессе очистки растворов при производстве некоторых цветных металлов, "4
Материалы Си Zn NI Co
Карбонатный кек от обезме-живания никелевого файн-штейна 52—55,0 0,7-1,4 0,4-0.6
Цементный осадок от обез-межнвания никелевого ана-лита .......... 70—80,0 0,004 9—11,5 0 3—0.35
Сульфидный кек от очистки аммиачного никелевого раствора 65—56,8 0,75—1,04 0,05—0,08
Цементные кеки цинкового производства: медный 30—65 5—11
медно-кадмиевый . 8—20 30-40 0,06—0,08 0,028
Медно-ванадиевый кек . 20-30 — — —
Материалы Fe ’ s П рочие
Карбонатный кек от обезме-живания никелевого файн-штейна ......... 0,2—0,6 2—6,0 0,1—0,22 As. 16—19 Cl
Цементный осадок от обез-межнвання никелевого ана-лнта 1.2—1,6 0,2—1.0
Сульфидный кек от очистки аммиачного никелевого раствора 1,5 ~20
Цементные кеки цинкового производства: медный . . 6—12 Pb, 0,3—0,4 As
медно-кадмиевый 0,03—0,7 0,8—3,0 1,5—2,0 Cl 3,6 Cd, до 0,1—0,8 As
Медно-ванадиевый кек . — 10—14 TiOs, 7—10 VjO,
10—45 Cl
Для этих дисперсных материалов характерны комплексность, обусловленная присутствием ряда ценных примесей, значительное содержание меди и невысокое благородных металлов. Все это позволяет рассматривать их как сырье, наиболее подходящее для гидрометаллургической переработки.
Выбор рациональной технологии для этих материалов осуществляется с учетом их вещественного состава, как и для крупнотоннажных разновидностей сырья (флотационных концентратов/ вторичного сырья и др.).
Одиако при переработке медных осадков, полученных цементацией, в связи с заметным содержанием в иих хлора необходимо предварительное обесхлорирование кеков.
Учитывая небольшой объем медных кеков, получаемых при очистке растворов, наиболее правильно селективно извлечь из них сопутствующие металлы (цинк, кадмий, никель и др.) и подготовить кеки для централизованной переработки на специализируемом медном предприятии.
Рентабельность переработки медных полупродуктов на месте их производства, как правило, обеспечивается получением ценной продукции по максимально простой и компактной технологии.
Следует признать рациональным получение качественных солей, фунгицидов и другой химической.продукции, производство которых на специализированных предприятиях нередко осуществляется нз более дорогого сырья — катодной меди.
Переработка сульфидного кека (см. табл. 41) по автоклавной аммиачной схеме на предприятии фирмы «Шерритт—Гордон» описана в гл. VI.
Ниже рассматриваются некоторые варианты [508—5101 переработки медных кеков, получаемых цементацией при очистке цинковых растворов ’1 2.
Кек растворяют в отработанном электролите в присутствии окислителя; в раствор переходит до 95% Си, 95% Zn, 75—90% Cd, а также хлор, мышьяк, сурьма, железо. Последние при гидролитической очистке (pH = 4,5ч-5,0) осаждаются на 94—99%. Хлор за 1— 2 ч на 98% удаляют в виде CuCl при 50—70° С, расходе цементной меди ПО—120% С от стехиометрического количества. В очищенный раствор извлекают до 85—-90% Си, 80—84% Zn, 83—87% Cd.
Из полученных растворов, проводя повторную цементацию при контролируемых расходе, крупности цинковой пыли, температуре, гидродинамическом режиме, а также степени осаждения, получают медный порошок следующего состава (после промывки, стабилизации, сушки): 98,4—99,0% Си, 0,5—0,7% Zn, 0,06% Cd, 0,027% Pb, 0,069% Fe, 0,006% As, 0,008% Sb. Губчатая природа частиц порошка определяет его повышенную активность, «мягкость», что, несмотря на заметное содержание примесей, позволяет применять порошок в ряде специальных производств. Прямое извлечение медн в порошок из медного кека достигает 70—72%.
В работе [5091 исследовали электролитический способ получения порошка из растворов от выщелачивания медного кека, содержащих 15—16 г/л Си, 70—100 г/л H2SO4. Осаждение вели при DK ~ 1500-е--4-1600 А/м2, t — 25—30° С, U = 3,2-т-3,6 В Выход по току при этом составил 64—78%, расход электроэнергии 3800—4800 кВт.ч/т, прямое извлечение меди в порошок около 75%.
1 Авт. свнд. № 248230 — «Открытия, изобретения, промышленные образцы», 1969, № 23.
2 Л а й к и и А. Я- Разработка гидрометаллургической технологии извлечения меди из промпродуктов цинкового производства. Автореф. каид. дне. Алма-Ата,
На некоторых предприятиях из медного кека получают технический купорос.
Болгарские металлурги получали качественную медь при электролитическом рафинировании медиых кеков при £>к = 300 А/м2, U = 2,2 В, т = 8 ч.
Заслуживает большого внимания рациональная переработка медьсодержащих отходов, образующихся в металлообрабатывающей и химической промышленности: окалина, отработанные катализаторы, пасты. До сих пор эти дисперсные материалы направляют в медеплавильное производство.
Основную часть электролитной меди потребляет кабельная промышленность и количество образуемых отходов т^м довольно заметное. При горячей прокатке, волочении медиых заготовок образуется окалина. Окалина — окисленный материал с развитой поверхностью и высоким содержанием меди (до 85—90% Си) отличается большой активностью и пригодна для нейтрализации технологических растворов (например, в купоросном цехе медьэлектролитиого производства) или специального получения меди и ее солей.
При травлении медной катанки образуются растворы, содержащие до 40—60 г/л Си и 70—120 г/л H2SO4. Наиболее простой способ их переработки—получение медного купороса. С учетом постоянного расхода кислоты для травления проката более предпочтительны электролитические способы выделения меди, обеспечивающие дополнительно и регенерацию травильного раствора.
Таким образом, рациональное извлечение меди— примесн из концентратов или использование медьсодержащих отходов с предприятий-потребителей позволяет не только дополнительно получать тысячи тонн меди, улучшая тем самым комплексность использования сырья, но и повысить рентабельность основного производства.
СПИСОК ЛИТЕРАТУРЫ
1. С м и р н о в В. И. Гидрометаллургия меди. Свердловск — М., Металлургиздат, 1947. 160 с. -с ил.
2. Плаксин И. Н., Юхтанов Д. М. Гидрометаллургия. М., Металлург-издат, 1949. 732 с. с ил.
3. Van А г s d а 1 е G. D. Hydrometallurgy of Base Metals, N. Y. — L., 1953. 370 с. c il.
4 В ur kin A. R. The Chemistry of Hydrometallurgical Processes. L., 1966. 157 c. c il.
5. К а л а б и и А. И. Добыча полезных ископаемых подземным выщелачиванием. М., Атомиздат, 1969. 375 с. с ил.
6. Автоклавные процессы в цветной металлургии. М., «Металлургия», 1969. 349 с. с ил'. Авт.: И. 11. Маслеиицкий, В. В. ДолиВо-Доброволь-с к п й, Г. Н- Д о б р о х о т о в, С. И. С о б о л ь, Л. В. Ч у г а е в, В. В. Бели к о в. '
7. Комбинированные методы переработки окисленных и смешанных руд. М., «Недра», 1970. 286 с. с ил. Авт.: С. И. Митрофанов, Р. Б. Новик, А В. К у р о ч к и н а, В. И. М е щ а н и и о в а, Е. Б. С п е и к е р, В. А. Щ ер-б а к о в. Е. Е. Р о з и и, А. Д. М а й о р о в, М. С. Щ е р б а к о в, П В. Д я т-к о в.
8. С и и я в е р Б. В., Ц е й д л е р А А. Гидрометаллургия меди. М., ЦНИИ ЦМ, 1971. 112 с. с ил.
9. Справочник химика. Т. 1—3. Изд. 2-е. М.—Л., «Химия», 1964—1966 гг.
10. Buckley W. L., Н u s а Н W- —«Chem. Engng. Progr.», 1962, v 58, № 2, p. 82-84.
11. Термические константы неорганических веществ. At , Изд-во АН СССР, 1949.
1011 с. ил. Авт.: Э. В. Б р и ц к е, А. Ф. Капусти некий, Б. К. Ве-с-е л о в с к и й, Л. М. Ш а м о в с к и й, Л. Г. Ч е и ц о в а, Б. Н. А н в а е р.
12. Латимер В. М. Окислительные состояния элементов и их потенциалы в водных растворах. М., ИЛ, 1964. 400 с. с ил.
13. Термодинамические свойства неорганических веществ. М., Атомиздат, 1965. 460 с. ил. Авт.: УД. В е р я т и н, В. П. Маши рев, К. Г. Р я б ц е в, В. И. Тарасов, Б. Д. Рогозин и, И. В;Коробов
14. Л е т и и к о в Ф. А. Изобарные потенциалы образования минералов (химическое сродство) и применение нх в геохимии. М., «Недра», 1965. 116 с. с ил.
15. Карпов И. К, Каши к.С. А., П а м и у р а В. Д. Константы веществ-для термодинамических расчетов в геохимии и петрологии. М., «Науке»,' 1968. 143 с.
16. КарапетьяицН. X., КарапетьянцМ. Л. Основные термодинамические константы неорганических и органических веществ. М., «Химия». 1968. 471 с.
17. Новые методы комплексного извлечения элементов из медио-цииковых концентратов. Свердловск, книжное издательство, 1959 (Научные труды Института металлургии У ФАН СССР. Вып. 6).
18. Р о и г b a i х М. J. N. Atlas d’equilibres electrochimiquts. Paris, 1963. 644 с. c il.
19. Гаррелс Р. М., Крайст Ч. Л. Растворы, минералы, равновесия. М., «Мир», 1968. 386 с. с ил.
20. Halpern J.—«J Metals», 1957, v. 9, № 2ЛР. 280—288.
21. ФорвардФ А.. Халперн Дж. — ЖПХ, 1957, т. 30, № 1. 3—28 с. с ил.
22. Forward F. A., Warren J. К-—«Metallurg. Rev.», 1960, v. 5, № 18, р. 137—164.
23. Gerlach J. — «Metall», 1962, Bd 16, H. 12, S. 1171—1179.
24. Gerlach J., Wuth W.—«Z. Erzbergbau und Metallhuttenwesen», 1967, Bd 20, H. 10. S. 454—459.
25. H a b a s h i F. — «Metall», 1970, Bd 24, H. 10, S. 1074—1082.
26 ГлесстонС.,Лейдлер K-, Эйр Инг Г. Теория абсолютных скоростей реакций. М.. ИЛ 1948. 584 с. с ил.
27. М a j i m а X. — «Canad. Metall. Quart.», 1969, v. 8, № 3, p. 269—273.
28. Восьмой Международный конгресс по обогащению полезных ископаемых. Т. 2. Л., Изд. ин-та «Мехаиобр.» 1969. 591 с. с ил.
29 Свешников Г Б. Электрохимические процессы иа сульфидных месторождениях. Л., Изд-во Ленинградского университета. 1967. 159 с. с ил.
30. С т а щ у к М. Ф. Проблема окислительно-восстановительного потенциала в геологии. М., «Недра», 1968. 208 с. с ил.
31 Wright J. — «AMDEL Bull.», 1971, Ns 12, р. 47—73.
32 L а п е R. W., М а с D о п а 1 d Н. J — «J. Amer. Chem. Soc.», 1946, v. 68, № 9. p. 1699—1704.
33. H a 1 p e r n J. — «J. Electrochem. Soc.», 1953, v. 100, № 10, p. 421—428.
34. L u B. G. — J., G г a у d о n W. F. — «J. Amer Chem. Soc.», 1955, v. 77, № 12. p. 6136—6139.
35. Halpern J., Mil i ants H.. Wiles D. J.—«J. Electrochem. Soc.», 1959, v. 106, № 8, p. 647-650.
36. Каковский И. А., Холманских Ю. Б. — «Изв. АН СССР. ОТН. Металлургия и топливо», 1960. № 5, с. 207—218 с ил.
37. Красильщиков А. Н.,Андреева В. А. — ЖФХ, 1946, т. 20, № 10, с. 1199—1207 с ил.
38. L и В. С. — J. G г а у d о n W. F. — «Canad. J. Chemistry», 1954. v. 32, № 2, р. 153—163.
39. К н н е в с к и й А. И. — ЖПХ, 1955, т. 28, вып. 10, с 1089—1097, 1113—1116.
40. М о 1 у п е и х К. — «Brit. Chem. Engng.», 1961, v. 6, № 2, p. 98—103.
41. Ил ь яшевич И. И., Коси арева И. А., Холманских Ю. Б. — Труды института «УНИИпромедь». Вып. 7. Свердловск, Средне-Уральское изд-во, 1963, с. 393—400 с ил
42. Крестовников А. Н, Куру м чин X. А. — «Металлургия цветных металлов», М., Металлургиздат, 1957 (МИЦМиЗ. Сб. № 26), с. 212—221 с ил.
43. Добровольская В. П., Горобец А. Н., Баранкин В. П. — «Химическая промышленность», 1966, № 10, с. 41—42 с ил.
44. ТомашовН Д. Теория коррозии и защиты металлов. М., Изд-во АН СССР, 1959. 591 с. с нл.
45. Гастев С. С., Крестовников А. Н. — «Труды московского полиграфического института.» N 4. М., НИИполиграфмаш, 1956, с. 154—164 с нл.
46 Гастев С. С. —«Изв. АН СССР. Металлы», 1965, Ns 3, с. 113—119 с нл.
47. Wadsworth М. Е., WadiaD R — «J. Metals», 1955, v. 7, № 6. р. 755— 759.
48. Агаркова Г. А. — «Цветные металлы», 1950, № I, с. 35—41 с ил.
49 Салтыковская Л. А., Стендер В. В — Изв АН Каз.ССР, серия химическая, 1951, вып. 4, с. 90—96 с ил.
50. К о п ы л о в Г. А., О р л о в А. И. — «Труды Института металлургии и обогащения АН Каз.ССР.», Т. 11. Алма-Ата, «Наука», 1964, с. 83—89 с ил.
51. К о п ы л о в Г. А. — «Изв. вузов. Цветная металлургия», 1966, № 5, с. 18— 20 с пл.
52. Т h о m a s G., I п g г a h a m Т. R., М а с D о п а 1 d R. I. С. — «Canad. Met. Quart.». 1967, v. 6, № 3, р. 281—291.
53. Т к а ч е и к о О. Б., Ц е ф т А. Л. — «Труды Института металлургии и обогащения АН Каз.ССР.» Т 30 Алма-Ата, «Наука», 1969 с. 14—23 с ил.
54. Каковский И. А. Поташников Ю. М, — Известия АН СССР. ОТН, 1962, № 5, с. 81—91 с ил.
55. Поташников Ю. М., Каковский И. А. — ДАН СССР, 1962, т. 145, Л» 6. с. 1311—1319 с ил.
56 Gzzedieluch Z., Lekki 1., Wasilewski W. — «Ргасе instyt. hyt-nic.», 1968, v. 20, № 3, p. 181—182.
57. ThomasG.,JngrahamT. R. — «Canad. Met. Quart», 1967, v. 6, p. 153— . 165.
58. Rygaert J., Saelemaeker J.. Van Tiggeien A.—«Bull. Soc. chim. Beiges.». 1959, v. 68, № 1—2, p. 19—29.
59. Копылов Г. А., Орлов А. И.—<Изв. вузов. Цветная металлургия». 1963. № 6, с. 68—74 с ил.
60 DutrizacJ. Е., MacDonald R. 1. С.,Ingraham Т. R. — «Metallurg. Trans.», 1970, v. 1, Ns 1, р. 225—231.
61. DutrizacJ. Е., М а с D о n a I d R.' 1. С., I n gr a h a m Т. R. — «Canad.
Met. Quart.», 1971, v. 10, Ns 1, p. 3—7.
62. Dutr izac J. E„ Mac D о n a 1 d R. 1. С., Ingraham T. R. — «Trans.
Metallurg Soc. А1МЕ», 1968, v. 245, Ns 5 p 955—959.
63 Munoz-R ibadeneiza F. J., Gomberg H. J.—«X'ucl. Technol.», 1971, v. II. № 3, p. 367—371.
64. E p м и л о в В. В., Т к а ч е и к о О. Б., Ц е ф т А. Л. — «Труды Института металлургии и обогащения АН Каэ.ССР». Т. 30. Алма-Ата, «Наука», 1969, с. 3—14 с ил
65. S h е г m a n М. J., S t г i с k 1 a n d J. D. Н. — «J. Metals», 1957, V. 9, Ns .6, р 1186—1188. • . „
66. Jackson К. F., Strickland J. D. Н. — «Trans. Metallurg. Soc. AIME», 1958, v. 112, № 3, p. 373—379.
67. M a j i m a H., Peters E.—«Trans. Metallurg. Soc. А1МЕ», 1966, v. 236, № 10, p 1403—1413.
68. M a i i m a H. —«Flotation», 1967. Ns 32, p. 31—36.
69. Pray H. A.,, «Industr. and Engng. Chem.», 1952, c. 44, Ns 5, p. 1146—1151.
70. Неле иь И. M., С о б о л ь С. И. — «Металлургия цветных металлов». М., Металлургиздат, 1959 (Гннцветмет. Сб. Ns 15), с. 476—480.
71. Турчанинов В. В. — «Обработка золотых, алмазных и редкоземельных руд и россыпей». М., «Недра», 1967 (Иргиредмет. Сб. Ns 16), с. 293—299 с ил.
72 Downes К. W., Bruce R. W., «Canad. Mining Metallurg. Bull.», 1955, v. 48, N« 515, p. 127—132.
73. H e л e и ь И. M., С о б о л ь С. И. — «Металлургия цветных металлов». At., Металлургиздат, 1959 (Гннцветмет. Сб. Ns 15), с. 577—584.
74. Н е n g е 1 е i n F-, И i г s с h Е. Z. Z. — «Erzbergbau und Metallhuttenwesen». 1961, Bd 14. H. 4, S. 172—177.
75 ДоброхотовГ H., О и у ч к и н а И. И. — «Изв. вузов. Цветная металлургия», 1964, № 5, с. 51—57 с ил.
76. Huffman R. Е., D a v i d s о n N. — «J. Amer. Cbem. Soc.», 1956, v. 78, Ns 19, p. 1436—1442.
77. AdzumaK., GotoS., KamataniX. a. o. — «J. Ming. Metall. Inst. Japan», 1969, v. 85, N« 977, p. 795—801. 1970, V. 86. Ns 987. p. 441—446.
78 1 c h 1 k u n i M. —«Bull. Chem. Soc. Japan», 1960, v. 33, S. 1052—1057, 1159— 1165.
79. Warren J. H. — «Austral. J. Appl. Sci.», 1956, v. 7, № 4, p. 396—458.
80. Gerlach J., Hahne H., P a w 1 e k F. — «Z. Erzbergbau und Metall-hiittenwesen», 1965, Bd 18. H. 2, S. 73—79.
81. Чугаев Л. В. — ЖНХ, 1965, т. 10, Ns 8, с. 1777—1781
82. Unit. Process in Hydrometallurgy. N. Y. 1964, 992 p. ill (Труды Международного конгресса в Далласе, Техас (США), 24—28 февраля 1963 г.).
83. Е х n е г F., G е г 1 а с h J., Р a w I е k F. — «Z. Erzbergbau und Metallhut-tenwesen», 1969, Bd 22, H. 5, S. 219—227.
84. P a w 1 e к F. —«J. S. Afric. Inst. Metall.», 1969. № 7, p. 632—654.
85 OpreaF., Moldovan P. —«Rev. Roum. Sci. Techn. Metallurgies, 1971, v. 2, Ns 2, p. 129—140.
86. V i z s о I у i A. — «Trans. Metallurg. Soc. AIME», 1963, v. 227, №l,p. 215—220.
87. V i z s о 1 у i A., Ve I t m a n H., Forward F. A. — Unit. Process Hydrometallurgy. N. Y., 1963, p. 326—342.
88. ExnerF., Gerlach J., PawlekF. — «Z. Erzbergbau und Metallhiit-tenwesen», 1969, Bd 22. Ns 8, S. 379—381.
89. W a r r e n J. H., Austral. — «J. Appl. Sci.», 1958, v. 9, № 1, p. 36—51.
90. Доброхотов Г. H., Майорова Е. В. — ЖПХ, 1963, т. 36, № 10, с. 2148—2154.
91. Ч у г а е в Л. В., М а с л е и и ц к и й И. Н. — «Научные труды (Гипроннкель)», Т. 24. Л., 1965, с. 31—47 с нл.
92 Ч у г а е в Л. В- — «Изв. вузов. Цветная металлургия», 1965, № 4, с. 54—57.
93. Dahins J., Gerlach J.7~P a w 1 e к F. — *Z. Erzbergbau und Metallhut-tenwesen», 1967, Bd 20, H. 5, c. 203—208.
94. Oprea F., Taloi D., Moldovan P. — «Stud. cere, metall», 1971, v. 16, Кв 1, p. 13—26.
95. Наумов А. Я-, Цейдлер A. A. — «Изв вузов. Цветная металлургия», 1958, № 4, с. 83—90 с ил.; «Цветные металлы», 1959, № 5, с. 49—54.
96. НабойченкоС. С., X у д я к о в -И. Ф., С м и р и о в В. И. — «Изв. вузов. Цветная металлургия», 1967, № 5, с. 52—58.
97. Доброхотов Г. И., Майорова Е. В. — ЖПХ, 1962, т. 35, Кв 8, с. 1702—1709.
98. О р г е a F., Т а 1 о i D.— «Metallurgia», 1971, v. 23, № 1. р. 33—35.
99. Stanczyk М. Н., Rampacek С. —«Report Investigations», Кв 6193, (U. S. Bur. Mines), 1963.
100. E v a n s D. J. !., R о m a n c h u к S., M а с к i v V. N. — «Canad. Mining Metallurg. Bull.», 1961, v. 54, № 591, p. 530—538.
101. КаравайкоГ. И.,Кузнецов С. И.,Голомзик А. И. Роль микроорганизмов в выщелачивании металлов нз руд. М., «Наука», 1972. 248 с. с ил.
102. В г у n е г L. С., В е с k J. V., D a v i s D. В. а. о. — Industr. and Engng. Client., 1954. v. 46, Ns 12, p. 2587—2591.
103. Применение бактериального метода выщелачивания цветных металлов из забалансовых руд. М., Цветметниформация, 1968. 96 с. с ил.
104. Silverman И., Rogoff М.—«Nature», 1961, v. 191, р. 1221 — 1228.
105. ГольбрайхтД. М., ИлялетдиновА. Н. — «Изв. АН Каз.ССР, серия биологическая», 1970, К» 1, с. 40—47 с ил.
106. Fletcher A. W.—«Trans. Inst. Mining Metallurg.», 1970, v. 79, № 769, p. 247—252.
107. D u n k a n D. W.-, Walden С. C., TrusselP. C. — «Canad. Mining Metallurg. Bull.», 1966, v. 59, Ns 653, p. 1075—1079..
108. Черияк А. С., Минеев Г. Г. — «Цветные металлы», 1966, Кв 12, с. 22— 24 с нл.
109. Wenberg G. М., Erbisch F. Н., V о 1 i n М. Е. — «Trans. Metallurg. Soc. А1МЕ», 1971, v. 250. № 3, р. 207—212.
ПО. Sutton j. A., CorrickJ. D. — «Mining Engng.», 1962, v. 14, Kb 8, p. 46—48; 1963, v. 15, Kb 6, p. 37—40; Report Investigations № 6423 (U. S. Bur. Mines), 1964.
111. Austral. Mines. 1967, v. 56, Ke 11, p. 21, 23, 25.
112. ГольдбрайхтА. И. — «Вестник АН Каз.ССР, серия биологическая», 1968, Кв 12, с. 61—62 с нл.
113. КаравайкоГ. И., Мубаранова К. Ю. — «Цветная металлургия». (Бюл. ии-та «Цветметниформация»),-1969, Кв 7. с. 17—20 с нл.
114. Каравайко Г. И., Мошнякова С. А.—«Микробиология», 1971, т. 40, Кв 3, с. 551—557 с ил.
115. Мошнякова С. А., Каравайко Г.-И., Щетинина Э. В. — «Микробиология», 1971, т. 40, Кв 6, с. 1100—1107 с нл.
116. Mining Mag., 1968. v. 119, Кв 5, р. 415—417.
117. D i n i ё M., G г b о v i с M., L a z i-ё L. а. о. — «Rudarc. glass.», 1970, Kb 4, s. 35—39.
118. Каравайко Г. И.—«Успехи микробиологии», 1971, Кв 6, с. 576—578.
119. Гидрометаллургия сульфидных сплавов и штейнов. М., АН СССР, 1962. 206 с. с ил. Авт.: Д. М. Ч и ж и к о в, 3. Ф. Г у л я и н ц к а я, Н. А. Г у р о в и ч, И. Н. К а т л е р, Б. П. К р е й н г а у з, В. Н. Н о в о с е л о в а, Л. В. П л и -гннская, Б. 3. Устинский.
120. Sa t о М. —«Economic Geology», 1960, v. 55, Кв 6, р. 1202—1231.
121. Habashi F.. Torres-Acuna N.—«Trans. Metallurg. Soc. А1МЕ», 1968, v. 242, Kb 5, p. 780—787.
122. Habashi F.—«Mineral Sci. Engng», 1971, v. 3, Kb 3, p. 3—12.
123. Venka.tacha la m S., Mallikarjunan R. — «Trans. Inst. Mining Metallurg.», 1970, C. 79, p. 181—188.
124. Здановский А. Б. Кинетика растворения природных солей в условиях вынужденной конвекции. Л., Госхимиздат, 1956. 219 с. с нл.
125. АксельрудГ. А. Теория диффузионного извлечения веществ из пористых тел. Львов, изд-во Львовск. политехи, ин-та, 1959. 233 с. с ил.
126. Доливо-ДобровольскнйВ В. — В кн.: Записки Ленинградского горного института. Т. 42. М., Госгортехиздат, 1963, As 3, с. 3—24 с ил.
127. Франк-Кам енецкийД. А. Диффузия и теплопередача в химической кинетике. М., «Наука», 1967. 491 с. с ил.
128. Andersen J. Е., Allman М. В — «Proc. Austral. Inst. Mining Metallurg.», 1968, № 225, p. 27—37.
129. H a r r i s J. A. — «Proc. -Austral. Inst. Mining Metallurg.», 1969, № 230, p. 81—92.
130. A 1 1 m a n M. В., H a r r i s J. A. — «Ming. Congress J.», 1969, № 7, v. 55, p. 28-31.
131. В h a p p u R. B., Johnson P. H. —«Trans. Metallurg. Soc. А1МЕ», 1969, v. 244, № 9, p. 307—320.
132. Левеншпиль О. Инженерное оформление химических процессов. М., «Химия», 1969. 624 с. с ил.
133. Смирнов В. И., Тихонова. И. Обжиг медных руд н коииеитратов. Изд. 2-е. М., «Металлургия», 1966. 255 с. с ил.
134. Ingraham Т. R., Kerby R.—«Canad. Met. Quart.», 1967, v. 6, №2, p. 89—119.
135. Shah J. D., Khalatalia S. E.—«Report Investigations» Ah 7459 (U. S. Bur. Mines), 1970.
136. H о t z M. С. В., К e r b у R. С., I n g r a h a m T. R. — «Canad. Met. Quart.», 1968. v. 7, № 4 p. 205—210.
137. E s d a i 1 e J. D. — «Proc. Austral. Inst. Ming. Metall», 1968, № 227, p. 39—44.
138. СиурннковА. П., Ларин В. Ф. — В кн.: Исследование в области химии и технологии минеральных солей п окислов. М.—Л., «Наука», 1965, с. 161—166.
139. СиурннковА. П., Ларин В. Ф. — «Металлургия цветных и редких металлов». Усть-Каменогорск, 1967 (ВНИИцветмет. Сб. № 10), с. 3—12.
140. Р г a t-« г J. D., Q u е п е а и Р. В. — «J. Metals», 1970, v. 22, № 12, р. 23—27.
141. Снурннков А. М.. Ларин В. Ф. — «Цветные металлы», 1969, № 9, с. 45—47.
142. RichardR. S..Fuerstenau М. С. — «Trans. Metallurg. Soc. А1МЕ», 1968, v. 242, Ah 8, p. 1487—1493.
143. Wadsworth M. E. — «Trans. Metallurg. Soc. А1МЕ», 1969, v. 245, As 7, p. 1381—1394.
144. П л а к с н и И. H., С у в о p о в с к а я И. А. — «Цветные металлы», 1948, № 4, с. 37—42; Изв. АН СССР, ОТН, 1949, № 3, с. 407—412 с ил.
145. Е п н с к о п о с я и М. Л., Каковский И. А.—«Цветные металлы», 1965, As 10, с. 15—19 с ил.
146. Nadkarni R. М-, JeldenC. Е., Bowles К- С. — «Trans. Metallurg. Soc. AIME», 1967, v. 239, № 4, p. 581—583.
147. N a d k a r n i R. M., W a d s w о r t h M. E. — «Trans. Metallurg. Soc. А1МЕ», 1967, v. 239, № 7, p. 1066—1074.
148. Advance in Extractive Hydrometallurgy, L., 1968, 1023 p. ill. (Материалы симпозиума. Лондон, 17—20 апреля 1967 г.).
149. С а м ы гм и В. Д, Г р и г о р о в и ч С. М.. Г у р и к о вЮ. С. и др. — «Цветные металлы», 1968, № 12, с. 36—38 с ил. ,
150. Левин К. Ф . Митрофанове. И. — «Цветная металлургия» (Бюл. ин-та «Цветметинформация»), 1971, № 7, с. 29—30 с нл.
151. К i n g С. V., Burger М. М.—«J. Electrochem. Soc.», 1934, v. 65, А» 6, р. 403—411.
152. М с. Kinnon D. J-, Ingraham Т. В.—«Canad. Met. Quart.», 1970, v. 9, № 3, р. 443—448.
153. Ионообменная технология (Сб. статей). Пер. с англ. М., Металлургиздат. - 1959. 658 с. с нл.
154. С а л д а д з е К- М., П а ш к о в А. Б., Т и т о в В. С. Ионообменные высокомолекулярные соединения. М., Госхимнздат, 1960. 356 с. с нл.
155. Л а с к о р и и Б. Н., СмирноваН. М., Г о и т м а и М. Н. Ионообмсн-иые-мембраны и их применение. М., Госатомнздат, 1961. 163 с. с ил.
156- Рябчиков Д. И., Ц и т о в и ч И. К- Ионообменные смолы н их применение. М., Изд-во АН СССР, 1962. 187 с. с ил.
157. ГельферихФ. Иониты. М., ИЛ, 1962. 490 с. с нл.
158. Г рисбахР. Теория н практика ионного обмена М., ИЛ, 1963. 499 с. с нл
159. Л у р ь е А. А. Сорбенты н хроматографические носители. И., «Химия», 1972. 320 с. с ил.
160. Кожевников А. В. Электроиоиоиообмениики. Л., «Химия», 1972. 128 с. с. ил.
161. Kunin R. — «Industr. and Engng. Chem.», 1966, v. 58, № 11, p. 104—108.
162. Kunin R., Gustafson R.—«Industr. and Engng. Chem», 1967, v. 59, № 11. p 95—100.
163. Богатырев В. Л Иониты в смешанном слое. Л., «Химия», 1968. 209 с. с нл.
164. Л а с к о р и н Б. Н. — «Атомная энергия», 1960, т. 9. Ns 4, с. 289—294 с. с ил.
165. ЖуковА. И.,Баранов Г. П , Плясунов П. В. — ЖНХ, 1962, т. 7, N» 6, с 1452—1457 с нл
166. Казанцев Е. И., Денисов А И. — ЖНХ, 1963, т 8, No 9, с. 2198— 2205 с нл.
167. Казанцев Е. И. .Панне ч ко А. А.,Сапогов Н. В. и др. — «Изв. вузов, Цветная металлургия», 1965, № 5, с. 43—48 с ил.
168. Плаксин И. Н., Суворовская И. А., Пашков А. Б. — В кн.: Научные доклады высшей школы. М., Металлургиздат, 1958, с. 95—97.
169. Ивановский М Д-, Васильев В. Д. — «Цветные металлы», 1969, Ns 11, с. 18—21 с нл.; —«Цветная металлургия» (Бюл. ии-та «Цветметинфор-мация»), 1969, Ns 14, с. 33.
170. Экстракция и сорбция в металлургии никеля, кобальта, меди. Под общ. ред. Э. Н. Меркина. М., Цветметинформация, 1970, 182 с. с нл. (Материалы по теории и практике).
171. Л а с к о р и и Б. Н., Г о л д о б и и а В. А., Ж У к о в Е. Г. и др. — «Цветные металлы», 1970, № 10, с. 20—22 с ил.
172. Л аскорин Б. Н , Г олдобинаВ. А.,Жукова Н. Г. и др. — «Цветные металлы», 1970, № 11, с. 18—22 с нл.
173. Казанцев Е. И., Ку ДР явский Ю. П., Балакин С. М. н др. — «Цветная металлургия» (Бюлл. ии-та «Цветметниформация»), 1971, Ns 12, с. 30—31 с ил.
174. Металлургия меди, никеля и кобальта Пер. с англ. Г. С. Викторовича. Под ред. А. А. Цейдлера. М., «Металлургия», 1965. 499 с. с ил.
175. D у г s s е п D., L i 1 j п г i п J., RydbergJ. Solvent Extraction Chemistry. Amsterdam. 1967. 682 p., ill.
176. Hanson C., Recent Advances in Liquid—Liquid Exttraction. N. Y.—Toronto-Sydney—Braunshweig, 1971. 584 p., ill.
177. Fletcher A. W., Wilson I. C. — «Bull. Inst. Mining Metallurg.». 1962, v. 71, Ns 666, p. 492—495.
178. Agers D W.. House J. E., Swanson R R. a. o. — «Mining Engng.», 1965, v 17. N" 12. p. 76—80.
179. Agers D. W., H о u s e J. E., Swanson R. R. a. o.—«Trans. Metallurg. Soc. А1МЕ», 1965, v. 235, № 2, p. 191 — 198.
180. И л ю в и e в а Г. В. — В; кн.: Записки Ленинградского горного института. Т. 46. М-, Госгортехиздат, 1966, Ns 3, с. 95—109 с нл.
181. Hanson С. — «Chem. Engng.», 1968, v. 75, Ns 18, p. 76—98.
182. R i t с e у G. M. — «Canad. Mining J », 1969, v. 90. Ns 6, p 73—78.
183. R i t с e у G. M., L u c a s В. H. —«Chem. Canad.», 1970. v. 22, Ns 11, p. 39— 40.
184. Fletcher A. W. — «Chem. Industr.», 1971, Ns 28, p. 776—780.
185. R i n t о u 1 A. H. —«Austral. Mining.», 1971, Ns 5, p. 43—45.
186. Engng Mining J.», 1969, v. 170, Ns 10, p. 93.
187. Зегер И И., Г в г а в о в Г. П, Коваленко Л. В. и др. — «Цветная металлургия» (Бюл. ин-та «Цветметниформация»), 1971, Ns 19, с. 27—28.
188. Л а с к о р и н Б. Н., С к о р о х о д о в Д. М., Шаталов В В. и др. — «Цветные металлы», 1971, Ns 6, с. 19—21.
189. ЛаскорниБ. Н,Улья нова В. С. .Свиридова Р. А. — «Цветные металлы», 1972, № 10, с. 17—18 с ил,
190 F о г d J Н., R 1 z z о F. J. — «J. Metals», 1971, v. 23, № 9, p. 41—44.
191. Burkin A. R., Richardson F. D. — «Powder Aletallurgy», 1907, v. 10, Ke 19, p. 33—57.
192. P e t I i ё k a 1., Kiir L. — «Hutnicke Listy», 1969, ё. 5, s. 354—358.
193. Frata 1., Mouch a V —«Metallurgia», 1972, v. 24,-nr 2, p. 97—101.
194. KnackeO., Pawlek F., Su 0 m u t h E. —«Z. Erzbergbau und Metall-hiittenwesen», 1956, Bd 9, H. 12, S. 566—574.
195. Основы металлургии. T. 1. Ч 2. М., Металлургиздат, 1961. 780 с. с нл.
196. Halpern J,, Dakers R. G. — «J. Chem. Phys.», 1954, v. 22, № 7, p. 1272— 1273.
197. Dakers R. G., Halpern J.—«Canad. J. Chem.», 1954, v. 32, №10, p. 969—978.
198. PetersE,Halpern J. — «Canad. J. Chem.», 1955, v. 33, № 2, p. 356—364.
199. Peters E., Halpern J. — «J. Phys. Chem.», 1955, v. 59, № 4, p. 793—
200. Peters E., Halpern J. — «Canad. Chem.», 1956, v. 34, № 4, p. 554—563.
201. Halpern J., McGregor E. R., P e 1 e r s E. — «J. Phys. Chem.», 1956, v. 60, № 10, p. 1455—1456.
2Ю. Ciccone Hal pern J. —«Canad. J. Chem.», 1956, v. 37, № 10, p. 1903—1910.
203. Von Hahn E. A., Peters E.—«Canad. J. Chem-», 1961, v. 39, № 1, p. 162—170
204. S h a ufe 1 be r ger F. A.—«J. Metals», 1956, v. 8, № 5, p. 695—704; Mining Engng., 1956, v. 8, № 5, p. 539—548.
205. McGregor E. R., Halpern J. — «Trans. Metallurg. Soc. Л1МЕ», 1968, v. 211, № 2, p. 244—247.
206. Von Hahn E. A.,Peters E. —«J. Phys. Chem.», 1965, v. 69, № 2, p. 547— 552.
207. Ратнер 3. Л., Белоглазов К- K. — «Научные труды (Гипроиикель)», T. 32, Л., 1967, с. 74—80 с нл.
208. Блинов Г. И., Доброхотов Г. Н., Певзнер П. Н. — «Сборник технической информации Гипроникеля». Л., 1955, № 12. с. 3—9.
209. Соболь С. 1'1., Спиридонова В. И. — «Цветные металлы», 1955, № 3, с. 26—29 с ил,
210. С о б о л ь С. И., Кононова. В. — «Цветные металлы», 1965, № 1, с. 22— 27.
211. К о и о н о в А. В., С о б о л ь С. И. — «Цветные металлы», 1968, № 2, с. 29— 32.
212. Bauch G., Pawlek F., Р 1 1 t h К. — «Z. Erzbergbau und Metallhutten-wesen», 1958, Bd 11, H. 7, S. 520—527.
213. KnackeO., P a w 1 e k F.. R a h m e 1 W. — «Z. Erzbergbau und Metall-hiittenwesen», 1960, Bd 13, H. 13, S. 424—429.
214. Mackiv V. N„ Benz T. W., E v a n s D. J. 1. — «I. Inst. Metals», 1966, v. 94, № II. p. 143—158.
215. Mackiv V. N.—«Canad. J. Chem. Engng.», 1968, v. 46, № 1, p. 3—15.
216. Mackiv V. N„ Veit manH. - «Erzmetall», 1959, Bd 22, H. 1, S. 43—60.
217. Burkin A. R. —«Powder Metallurgy», 1969, v. 12, № 23, p. 243—250.
218. M e d d i n g s В., E v a n s D. J. I. — «Canad. Mining Metallurg. Bull.», 1971,.
v. 64, № 706, p. 48—57.
219. A be T., H a r a Z. —«J. Inst Industr. Sci. Univ. Tokyo», 1968, v. 20, № 11, p. 551—559.
220. НабойчеикоС. C. — «Цветные металлы», 1971, № 1, с. 26—30.
221. Основы металлургии. Т. 1. Ч. 1. М., Металлургиздат, 1961. 661 с. с ил.
222- Coeburn К- О., L о г е е R. J., Updegraff N. С. а. о. — «Canad. Mining Metallurg. Bull.», 1957, v. 50, № 546, p. 614—618.
223. К u n d a W., M a c k i v V. N. — «Canad. J. Chem. Engng.», 1961, v. 39, № 6, p. 260—264.
224, Л e щ И. Ю., Ш и e e p с о и Я- M., Ф p у м и н а Л. M. —«Вопросы технологии», Л., 1968 (Гипроиикель. Сб. № 38), с. 117—139 с ил.
225. Bryce D. M., C e r i g о D. G., Jennings P. H. — «Canad. Mining Metallurg. Bull.», 1968, v. 61, № 673, p. 641—645.
226. Ци парне И. H., Добросердов Л. П., Коган В. Б. Солевая ректификация. Л., «Химия»-, 1969. 164 с. с ил.
227. Jangg G., Gregory Н. — «Z. annorg. allgem. Chem.», 1967, Bd351, H. 1—2, S. 81—99.
228. А к б a e в А.," Ежов В. В., Маматканов А. — ЖНХ, 1971, т. 1б1 № 11, с. 3172—3173 с ил.
229. Bonarek Е., Hanus О., Ziety J.—«Rudy i Metale Niezelazne», 1965, R. 10, № 2, s. 68—72.
230. Орехов M. А., Тимохова Л. Б. — ЖПХ, 1969, т. 42, № 9, с. 1926— 1931.
231. Мату се в» ч Л. Н. Кристаллизация из растворов в химической промышленности. М., «Химия», 1968. 304 с. с ил.
232. Полтораикина Т. Ф. — «Записки Ленинградского горного института». Т. 42, М., «ГосгОртехиздат». 1963, № 3, с. 78—84 с ил.
233. Евтюхова О. В., Шагаева Н. И., Пушкарев В. В. и др. — «Цветные металлы», 1972, №'2, с. 81—82 с ил.
234. Copper F. D. Reports of investigations Xs 8394 (U. S. Bur. Mines), 1968.
235. Caldwell A. B. — «Mining Engng.», 1969, v. 21, № 12, p. 29—36.
236. Americ. Metal Market, 1972, v. 60, Xs 38, p. 13.
237. Woodcock J. T. — «Proc. Austral. Inst. Mining Metallurg.», 1967, X” 224, p. 47—66.
238. Sheffer H. W., Evans L. G. Information Circular Xs 8341 (US Bur. Mines), 1968.
239. Evans L. G., Sheffer H. W. — «Mining Congr. J.», 1968, v. 54, Xs 9, p. 96—100.
240. Shoemaker R. S., Darrah R. M. — «Mining Engng.». 1968, v. 5o, Xs 12, p. 68—70, 90.
241 О ’ L e a г г у V. D. — «Mining Engng.», 1966, v. 18, Xs 9, p. 63—66.
242. Аглнцкнй В. А., Дынь кина С. Е.—«Горный журнал», 1956, X» 11, с. 35—38 с ил.
243. Юдыцкий А. П. — Бюл. ЦИИН ЦМ, 1958, № 1, с. 23—26.
244. Mining Mag., 1971, v. 125, № I, р. 27—29.
245 Внедоменное получение железа за рубежом. М., «Металлургия», 1964. 363 с. с ил. Авт.: А. Н. Похвиснев, И. Ю. Кожевников, А. Н. Спектор, Е. Н. Ярхо.
246. Кожевников И. Ю. Бескоксовая металлургия железа. М-, «Металлургия», 1970. 336 с. с нл.
247. Back A. F. — «J. Metals», 1967, v. 19, Xs 5, р. 27«-29.
248. Юдыцкий А. П. — «Бюл. ЦИИН ЦМ», 1956, Xs 2, с. 28—30 с ил.
249. Engng. Mining. J., 1959, v. 160, Xs 6, p. 104—107.
250. Franz M. F. — «J. Metals», 1959, v. 11, Xs 6, p. 382—385.
251. Ю д ы u к и й А. П.. Д ы н ь к и и а С. Е. — «Цветная металлургия» (Бюл. ЦНИИ ЦМ), 1961, Хе 6. с. 48—49 с нл.
252. Степанов Б. А., Голиков А. А. — «Цветная металлургия» (Бюл.* ЦИИН ЦМ), 1961, Xs 11, с. 20—21 с ил.
253. Клебанов О. Б., Скробова А. В., Степанов Б. А. — «Цветные металлы», 1962, Хе 11, с. 36—37 с нл.
254. Цветков К. С., Махов М. П., Миллер О. Г. и др. — «Известия АН Уз.ССР, серия технических наук», 1962, Хе 6, с. 64—68.
255. Jacobi J. S. — «Mining Engng.», 1963, v. 15, X> 9, c. 56—62.
256. Паздинков П. A. —«Цветные металлы», 1964, Xs 9, c. 15—18 с ил.
257. L e k t о К. S., W a d 1 а В. H. — «Mining Engng», 1969, v. 21, Xs 9, p.95.
258. Klein L. — «J. Metals», 1966, v. 18, p. 923—931.
259. Hovanec G. TechnoloJko-tehnifke karakteristike kiselinskog luienja bakro-nosnih jedinjenja iz. nlskoprocentnih sizovina, Bor. 1969.
260. Mining World, 1944, v. 6, Xs 9, p. 40—42.
261. S. A. Mining Engng. J. 1966, v. 77, Xs 3814. p. 547—550.
262. H u t I J. B. —«Engng. Mining J.», 1961, v. 162, Xs 6, p. 86—88,
263. Гому б к ob К- H-, Паздников П. A. — «Цветные металлы», 1968, Xs 2, с. 26—28 с нл.
264. Mining Engng., 1966, v. 18, № 4, p. 57—62.
265. Spedden H. H., Mai ouf E. E., P r li a t e r J. Й — «J. Metals», 1966, v. 18, № 10, p. 1137—1141.
266. Зубков A. A., Степанов Б А., Чердынцев И. E. — «Цветная металлургия» (Бюл. ЦНИИ ЦМ), 1963, Ns 4, с. 24—25 с ил.
267. Metal Ind., 1962, V. 100, № 9. р 152—154.
268. Groves Е. D. «US Bur. Mines I. С», № 6486. 1964.
269. Metal Ind., 1964, v. 28, Ns 8,. p. 273—275.
270. Metal Powder Report, 1964, v. 19, № 9, p. 195—196.
271. Grosby R. L., Desy D. H., Doerr R. H.—«S. A. Mining Engng. J.», 1970, v. 81, № 4036, p. 119—133.
272. Hardwick W. R. — «Information Circular № 6996» (US Bur. Mines), 1966.
273. Fletcher J. B. — «Trans. Л1МЕ», 1971, v. 250, Ns 4, p. 310—314.
274. Бойко E Л., Зубков A JI. — «Цветная металлургия» (Бюл. ин-та «Цветметинформация»), 1967, Ns 16, с. 14—16.
275. Ал капе в М. И. — «Известия вузов. Цветная металлургия», 1967, Ns 6, с. 28—31; 1972, № 2, с. 18—20.
276. Me Kinnon D. J, Ingraham Т. R, — «Canad. Metall. Quart.», 1970, v. 9, № 3, p. 443—448.
277. M c Kinnon D. J., Ingraham T. K.—«Canad. Melall. Quart.», 1971, v. 10, Ns 3, p. 197—201.
278. Mining Engng., 1966, Z. 18, N« 2, p. 100—103.
279. Joe E. G., R i t с e у G. M,, A s h b г о о k A. W. — «J. Metals», Г966, v. 18, Ns 1, p. 18-21.
280. Chem. Engng. News, 1967, v- 45, April, 17, p. 62.
281. Engng. Mining J., 1967, V. 168, Ns 10, p. 118.
282. Monhemius A. J. — «Chem. Process. Engng.», 1970, v. 51, Ns 1, p.65—68.
283. World Mining, 1969, v. 31, Ns 12, p. 34—37.
284. Kenneth L. Proc. Extrac. Metall. Div., Sympos. on Copper Metall., Denver—Colorado, 1970, p. 1—26.
285. Rosenbaum J. B., George D. R., MayJ. T. — «Information Circular Ns 8502 (US Bur. Mines), 1971.
286. Skillings D. N. — «Skill. Mining Rev.», 1971, v. 60, Ns 6, p. 8—12.
287. Skill. Mining Rev., 1971, v. 60, Ns 47, p. 6.
288. Mining J., 1972, V. 278, Ns 7122, p. 135.
289. Mining Engng., 1969, v. 21, Ns 6, p. 13.
290. Engng. Mining J., 1969, v. 170, № 4, p; 12.
291. McGar r M. G. —«Engng. Mining J.», 1970, v. 171, Ns 10. p. 79—81.
292. Chem. Engng., 1970, v. 77, № 17, p. 82—84.
293. Mining Mag., 1971, V. J24, Ns 3, p. 245.
294. Dacher J., Power K- — «Engng. Mining J.», 1971, v. 172, Ns 4, p. Ill— 115.
295. Melall. Bull., 1970, Ns 5510, p. 15; 1972. Ns 5664, p. 13.
296. Mining Mag., 1970, V. 123, № 7(1), p 5, 7.
297. Vashist P. N., Beck man R. B, - «Industr. and Engng. Chem.», 1968, v. 60, Ns 11, p. 43—59.
298. Chem. Engng. News, 1968, v. 46, Ns II, p. 44.
299 Применение и перспективы использования в цветной металлургии процессов сорбции и экстракции. М., Цветметниформация, 1969. 85 с. с ил.
300 М с G а г г Н. I., Berlin N. Н., S t о 1 k W. F А. — «Engng. Mining. J.», 1969, v. 170, Ns 12, p. 66—70.
301. Gardner S. A., Warwick G. C. J. — «Engng. Mining J.», 1971, v. 172, Ns 4. p. 108—110.
302. Новые методы в экстракционно-сорбционных процессах переработки металло-содержащпх материалов (Сборник статей под ред. Э. Н. Меркнна). М., «Цвет-метннформация», 1970, 113 с. с ил.’
303. Q u а г m J. А. А. — «Trans. Inst. Mining and Metallurg., 1954—1955, v. 64, Ns 2. p. 109—117.
304. Развитие гидрометаллургических процессов расширения областей применения экстракции, сорбции и ионного обмена в цветной металлургии (Сборник статей). «Цветметниформация», М., 1968, ч. I, 126 с. с нл.
305. Плаксин И. Н., Зубарев Ю. В. — «Известия вузов. Горный журнал», 1966, № 4, с. 138—141 с ил.
306. Старцев В. Н., Я цу к В. В., К н т о к В. Д. — «Бюл. ЦИИН ЦМ», 1960, № 20, с. 20—22 с ил.
307. М i n d 1 е г A., Termini J. —«Engng. Mining J.», 1956, v. 157, № 9. p. 100—105.
308. Ayres D. E. R., Westwood R. J. — «J. S. A. Inst. Mining Metallurg.», 1957, v. 57, Ns 10, p. 591—596.
309. Roland L. D. — «Atomics», 1957, № 4, p. 131—137.
310. Зефиров А. П., Невский Б. В., Иванов Г. ф. Заводы по переработке урановых руд в капиталистических странах. М., Госатомиздат, 1962. 371 с. с ил.
311. С у д а р и к о в Б. Н., Р а к о в Э. Г. Процессы н аппараты урановых производств. М., Машиностроение, 1969. 383 с. с ил.
312. Ласкорин Б. Н., Смирнова М. Н., Аслане иреева Н. М. и др. — «Цветные металлы», 1971, № 3, с. 45—47.
313. Набойченко С. С. — «Цветная металлургия» (Бюл. нн-та «Цветметин-формация»), 1971, Ns 13, с. 27—30 с нл.
314. А г g а 11 G. О.—«Mining World», 1963, V. 25, Ns 10, р. 22—25, № 11,р. 20—24.
315. Mining Engng., 1965, v. 17, Ns 10, p. 77—92.
316. Mining Engng., 1966, v. 18, Ns 6, p. 70—74.
317. Burt W. H. — «J. Metals», 1966, v. 18, Ns 7, p. 819-823.
318. " Engng. Mining J., 1967, v. 168, Ns 1, p. 69, 97—100.
319. Beall J. V. —«Mining Engng.», 1967, v. 19, Ns 6, p. 58—65.
320. Engng. Mining J., 1967, v. 168, № 6, p. 142—144.
321. Seek H. R. —«Engng. Mining J.», 1967, v. 168, Ns 8, p. 75—81.
322. Mining. Minerals Engng., 1968, v. 4, Ns 10, p. 35—40.
323. Engng. Mining J., 1969, v. 170, №> 6, p. 189.
324. Hogue W. G. —«Mining Congr. J.», 1967, v. 53, Ns 1, p. 17—20.
325. В oger t J. R., «Mining World», 1961, v. 23, № 8, p. 26—28.
326. Engng. Mining J.», 1967, v. 168, № 10, p. 114, 118.
327. Chem. Engng., 1970, v. 77, N> 8, p. 66.
328. Skill. Mining Rev., 1970, v. 59, Ns 30, p. 30.
329. Bigley A. C., Frick F. F., McCanna M. a. o.—«Mining Cong. J.», 1951, v. 37, Ns 3, p. 48—53.
330. Mining Engng., 1964, v. 16, Ns 5, p. 58—73.
331. S. A. Mining Engng. J., 1964, Ns 7, p. 455-56.
332. Engng. Mining J„ 1965, v. 166, Ns 4. p. 84-85.
333. Knoerr A. W. — «Engng. Mining J.», 1962, v. 163, № 9, p. 77—78.
334. Dennis W. H.—«Mine Quarry Engng.», 1947, v. 13, Ns 5, p. 140—146.
335. Chamber Mining J., 1965, v. 7, Ns 9, p. 54—58.
336. Sack C. G. — «Chamber Mining J.», 1966, v. 8. Ns 9. p. 37—42.
337. Mining Mag.. 1966, v. 115, Ns 1, p. 59, 61—63.
338. Andersen J. E., Herwig G. L., Mot fit R. B.—«Austral. Mining J.», 1966, v. 58, Ns 4, p. 35, 37—39.
339- T r i ggs W. A., Laird A. M. —«Mining Mag.», 1971, v. 124. № 6, p. 438—455.
340. Wormer F. E. — «Engng. Mining J.», 1923, v. 116, Ns 16, p. 665—670.
341. F i t c h F. H., Davies C. J. V. — «Sulphur», 1965. Ns 61, p. 19—26.
342. Grinvud KK —«Engng. Mining J.», 1926, v. 121, Ns 13, p. 518—521.
343. Mining. Engng., 1956, v, 8, Ns 7, p. 721—723.
344. S. A. Mining Engng. J., 1967, № 11, p. 2934—2942.
345. Engng. Mining J., 1967, v. 168, № 11, p. 116—132.
346. Mining Engng., 1967, V. 19, Ns 11, p. 66—67.
347. World Mining., 1968, V. 30. Ns 1, p. 48—51.
348. Hansen S. M-, Jager A. R. — «Engng. Mining J.», 1968, v. 169, Ns 12, p. 75—81.
349. Ann. Mines, 1969, № 5, p. 29—42-
350. Shock D. A. — «Mining Engng.». 1970, v. 22. N« 2, p. 73.
351. Паздников П. A. — «Цветная металлургия» (Бюл. ин-та «Цветыетии-формацня»), 1965, Ns 22, с. 29—34.
352. Головинкин Н. Т., Паздников П. А., Неживых В. А. и др. — «Цветная металлургия» (Бюл. ин-та «Цветметниформация»), 1966, № 22, с. 9—11.
353. Dutrizac J. Е., McDonald R. J. С.—«Metallurg. Trans.». 1971, v. 2, № 8, р. 2310—2312.
354. Агафонова Г. С., Классен В. Н., Мартяков Ю. А. — «Цветные металлы», 1970, 'Ns 5, с. 89—91.
355. Матыскнн Ю. Д- — «Труды Иркутского политехнического института», Вып. 37. Иркутск, «Недра», 1967, с. 90—98.
356. Оз олив Л. Т., Руснхниа Л. П. — «Совершенствование техники и технологии разработки месторождений полезных ископаемых». М., «Недра», 1968 (Труды Московского горного института), с. 103—110 с нл.
357. Коробейников И. С., Русихниа Л. П. — «Труды по физике». М., Изд-во МГИ, 1968 (Московский горный институт. Вып. 4), с. 84—87 с нл.
358. Руснхниа Л. П., Озолнн Л. Т. — В кн.: Материалы Всесоюзной конференции по физико-химическим методам разработки месторождений полезных ископаемых». М., «Недра», 1970, с. 86—108.
359. Беленький П. Г. Ушаков Ю. А. — «Физика горных пород». М., Изд-во МГИ, 1966 (Московский горный институт. Сб. № 54), с. 34—36.
360. Труды по физике, М., «Недра», 1968 (Московский горный институт Вып. 3).
361. George D. R., Ross J. R., Prater J. D. — «Mining Engng., 1968, v. 20, № 1, p. 73—77.
362. Silo R. S. — «Trans. Metallurg. Soc. AIME», 1966, v. 235, N> 3, p. 225—230.
363. Rose D. H., Lessels V., Buckwaiter D. J. — «Mining Engng.», 1967, v. 19, № 8, p. 60—63.
364. Chamberlain C., Newton J., Clifton D. — «Engng. Mining J.», 1969, v. 170, № 10, p. 90—91.
365. Engng. Mining J., 1963, v. 164, Ns 7, p. 92.
366. Bauer D. J., Lindstrom R. E. — *J. Metals», 1971, v. 23, Ns 5, p. 31— '33.
367. Engng. Mining. J., 1967, v. 168, Ns 1, p. 167.
368. Copper, 1968, Ns 1, p. 24.
369. Iron Age, 1968, V. 262, Ns 3, p. 26.
370. Mining. J., 1969, v. 273, Ns 6985, p. 6.
371. Chem. Engng., 1969, v. 76. Ns 6, p. 65.
372. Mining Mineral Engng., 1969, v. 5, Ns 8, p. 18—19.
373. Canad. Pit Quarry, 1969, v. 70, Ns 8, p. 8.
374. Митрофанов С. И. Переработка окисленных медных руд по методу проф. В. Я- Мостовича. М., Металлургиздат, 1956. 28 с. с ил.
375. Last A. W., Steven J. L., Eaton L. — «Mining Engng.», 1957, v. 9, N° 11, p. 1236—1240.
376. Mining World, 1959, v. 21, № 7, p. 31—33.
377. Hull J. B. —«Engng. Mining J.», 1961, v. 162. Ns 3, p. 84—91.
378. H о u о t R. — «Ann. Mines», 1967, Ns 5, p. 25—53.
379. Schlechten A. W., Bruce J. L. — «Engng. Mining J.», 1952, v. 153, Ns 12, p. 88—91.
380. Ласкорин Б. H., Голдобина В. А., Жукова H. Г. и-др. — «Цветные металлы», 1969, Ns 9, с. 30—32.
381. Н u t 1 Н. В., «Engng. Mining J.», 1952. v. 154, № 1, p. 90—94.
382. Wraith W., F u 1 m о r T. G. — «Mining Engng.», 1964, v. 16, Ns 5, p. 54—73.
383. Plecash J., Hopper R. V. — «Canad. Mining Metallurg. Bull.», 1963, v. 56, Ns 616, p. 624—641.
384. Bean J. J.—«Mining Engng»., 1960, v. 12, Ns 12, p. 1265—1270.
385. Copper J. A. — «Engng. Mining J.», 1969, v. 170, Ns 11, p. 88—91.
386. M a men C. — «Canad. Mining J.», 1970, v. 9 N° 7, p. 59.
387. Engng. Mining J., 1965, v. 166, Ns 11, p. 108.
388. Engng. Mining J., 1967, v. 168, N° 1, p. 69.
389. Mining Mineral Engng., 1965, v. 1, № 10, p. 370—375.
390. Ramsey R. H. — «Engng. Mining J.», 1954, .v. 155, № 8, p. 74—8®.
391. H u t 1 J. —«Engng. Mining J.», 1962, v. 163, Ni 3, p 74—86
392. Monnlnger F. M.—«Mining Congr. J.», 1963, v. 49. № 10, n 48—511
393. Engng. Mining. J., 1966,'v. 167, № 1, p. 76—79.
394. Jacky H. W. — «J. Metal», 1967, v. 19, № 4, p. 22—27.
j 395. Knobler R. R., Joseph W. — «J. Metal», 1962, v. 14, № 1, p. 51—56.1 «Mining Engng.». 1962, v. 12, Nt 1, p. 40—45.
396. Sulphur, 1967, Nt 71, p. 29.
397. Scill. Mining Rev., 1969, v. 58, Nt 30. p. 3, 4.
398. Mining Mineral Engng., 1971. v. 7, Nt 3—4, p. II—12.
399. S. A. Mining. J., 1963, V. 74, № 3684. p. 801—802, 80'4, 814.
400. Mining Mag., 1963, v. 109, Nt 4, p. 201—204.
401. T h e у s L. — «Canad. Mining. Met. Bull.», 1970, v. 63, Nt 695, p. 339—352.
402. Metal Bull., 1972, № 5682, p. 12.
403. Lyle A. G. — «Canad. Mining Metallurg. Bull.», 1951, v. 44, Nt 475, p. 715— 716.
404. Johannsen F., Stockhaus H.,— *Z. Erzbergbau und Metallhiitten-wesen», 1963, Bd 16, H. 5. S. 227—239.
405. L i e b e W., Stockhaus H. — «Z. Erzbergbau und Metalthiittenwesen», 1963, Bd 16, H. 11, S. 558—563.
406. W a 1 d e H. — «Chem. — Ing. — Techn.», 1964, Bd 36, H. 6, S. 647—651.
407. Jangg G., Schutz K.—«Z. Erzbergbau und Metallhuttenwesen», 1968, Bd 21, H. 7, S. 299—305.
408. Toba U.—«Chem. Industr.» (Japan), 1971, v. 22, Nt 7, p. 1007—1013.
409. Rigg T., M a r f 1 i t t W. — «Canad. J. Chem. Engng.», 1971, v. 49, Nt 4, p. 501—505.
410. Connor.J. O. — «Chem. Engng.*, 1952. v. 59, Nt 6, p. 164—168, 368, 370.
411. Whitaker J. F. — «Wire and wire product», 1961, v. 36, Ns 10, p. 1346— 1348, 1456—1457.
412. Iron Age, 1962, v. 186, Ns 20, p. 103—105.
413. К und a W., Veit man H.. Evans D. J. I. Proc. Extrac. Metall. Div., Symp. on Copper Metall., Denver—Colorado, 1970, p. 27—69.
414. Соболь С. И.—«Цветные металлы», 1968, Ns 4, c. 36—42.
415. Chem. Engng., 1965, v. 72, № 1, p. 14—16.
416. Y г к о W. J. — «Chem. Engng.», 1966, V. 73, Ns 8, p. 64—66.
417. Соболь С. И., Спиридонова В. И., Курумчин X. А.— «Цветные металлы», 1956, Nt 4, с. 44—49.
418. Менковский М. А. Природная сера. М., «Химия», 1972.
419. Haver F. Р., Wong М. М. —«J. Metals», 1971, v. 23, № 2, р. 25—29; Report investigations Ns 7474 (U. S. Bur. Mines), 1971.
420. J. Metals, 1959, v. 11, Nt 5, p. 325—327.
421. О ’ M e a r a A. E. — «Mining Mag.», 1968, v. 119, Ns 5, p. 359—369.
422. Desai M. N. — «Indian. Mining" Engng. J.», 1969, v. 8, N> 6, p. 183—194.
423. Skill. Mining Rev., 1969, v. 47, № 52. p. 17.
424. Chem. Engng. News, 1969, v. 47, Ns 52, p. 17.
425. Mining. Engng., 1970, v. 22, Ns 4, p. 64—65.
426. Mining Mag., 1970, v. 121, N« 10, p. 351, 353.
427. Skill. Mining. Rev., 1971, v. 60, Ns 7, p. 1, 8—10, Ns 47, p. 6.
428. Ц e ф т А. Л., Татаринова A. A. — «Вестник АН Каз.ССР». 1958, Nt 8, c. 32—36 с нл.
429. Абланов А. Д. — «Вестник АН Каз.ССР», 1966, N> 8, c. 3—8 с ил.
430. Ц e ф т А. Л-, Ермилов В. В., T a’ p а с к и и "Д. А. и др. — «Гидрометаллургия тяжелых цветных металлов в хлоридиых растворах». Алма-Ата, «Наука», Каз.ССР, 1969 (ИМО АН Каз.ССР. Т. 30), с. 65—72 с ил.
431. Mining J., 1966, v. 267, Nt 6844, р. 287.
432. Гонгл нашив ли А. Н. — «Сообщения АН Груз.ССР», 1962, т. 29, № 4, с. 405—412 с ил.
433. Купермаи Г. М., Гогоришвнли П. В., Заркуа Н.П. и др.— «Сообщения АН Груз.ССР». 1960, т. 25, Nt 4, с. 533—538.
343. Купермаи Г. М.—«Труды института химии АН Груз.ССР», ’Вып..17. Тбилиси, Изд-во АН Груз.ССР, 1964, с. 13—17 с ил.
435. Доброхотов Г. Н. — «Научные труды (Гипропикель)», т. 22. Л., 1965, с. 83—108 с ил.
436. Discher F., Pawlek F. —*Z. Erzbergbau und MetaUh tienweseftl, Mb Bd 10, H. 4, S. 158—166.
437. Vel t man H., Pellegrini S., Mac к i v V. N. — «J. Metals), 1967, v. 19, Ns 2, p. 21—25. ,
438. Соболь С. И. и др.—«Металлургия цветных металлов». М., «Металлургия», 1969 (Гиицветмет. Сб. № 29), с. 137—46 с ил.
439. V i z s о 1 у i А., V е 1 t m a n Н., Warren J. Н. а. о. — «J. Metals», 1967, V. 19, № 11, р. 52—59.
440. Warren- J. Н., Vizsolyi A., Forward F. А.—«Canad. Mining Metallurg. Bull.», 1968, v. 61, № 673, p. 637—640.
441. Mining J„ 1970, v. 275, N- 7049, p. 271.
442. Bruynesteun A., Dunkan D- W.—«Canad. Metall. Quart.», 1971, v. 10, № 1, p. 57—63.
443- Sawamoto H-, Oki T., Nishina A. — «Met. Fac. Engng. Nagoya Univ.», 1962, v. 114, №1, p. 197—208.
444. Skill. Mining Rev., 1972, v. 61, № 17, p. 23.
445. К u x m a n U., В i a 1 b a s s U. — «Z. Erzbergbau und Metallhuttenwesen», 1969, Bd 22, H. 2, S. 53 -64.
446. К u r i s h i m a H., Tsunoda S. — «Trans. Metallurg. Soc. А1МЕ», 1955, v. 203, Ns 4, p. 634—638; «J- Metals», 1955, v. 7, Ns 5, p. 634—638-
447. Tsunoda S. — *J. Mining Met. Inst. Japan», 1956, v. 72, № 4, p. 681—686.
448. Майнц А. Д., Баротнцкая Ф. И. — «Бюл. ЦИИН ЦМ», 1958, N» 7, с. 21—25 с ил.
449. М а я и ц А. Д., Баротнцкая Ф. И. — «Бюл. ЦИИН ЦМ», I960, № 12 с. 30—31 с ил.
450. Баротнцкая Ф. И., Левина Л. К-, М а я н ц А. Д. — «Цветна> металлургия» (Бюл. ЦИИН ЦМ), 1962, № 8, с. 28—31.
451. Lund R.,' W а г n е s D., Morgan J. — «Trans. Metallurg. Soc. А1МЕ» 1962, v. 224, № 4, p. 334—341.
452. M а к о в e ц к и й А. Е.—«Журнал химической промышленности», 1925 т. 1, Ns 4, с. 56—57. •
453. Анисимов С. М.—«Бюл. ЦИИН ЦМ», 1941, № 10, с. 33—37 с нл.
454. Г о л о м з и к А. И. — «Цветные металлы», 1963, № 3, с. 10—14 с ил.
455. Никитин Ю. И., Г о л о м з и к А. И. — «Цветная металлургия» (Бюл ин-та «Цветметинформация»), 1964, № 10, с. 35—38 с нл.
456. Снурннков А. П., Юренко В. М. —-«Цветная металлургия» (Бюл ин-та «Цветметинформация»), 1965, Ns 17, с. 26—30 с ил.
457. Снур ников А. П., Юренко В. М. — «Цветные металлы», 1965 Ns 11, с. 77—80 с ил.
458. Снур ников А. П., Юре и.к о В. М. — «Цветная металлургия» (Бюл. ин-та «Цветметинформация»), 1967, № 15, с. 28—30 с ил.
459. П у с ь к о А. Г.-, Юренко В. М., Снурннков А. П.—«Цветная металлургия» (Бюл. нн-та «Цве- метннформация»), 1969, Ns 15, с. 26—28 с ил.
460. П у с ь к о А. Г., Юренко В. М. — «Цветная металлургия»\ (Бюл. нн-та «Цветметинформация»), 1969, № -16, с. 23—26 с ил.
461 Веллер Р. Л., Никитина И. С., Блинов Л. А. — «Бюл. ЦИИН ЦМ», 1958, № 9, с. 17—20 с ил.
462. Елисеев И. С., Голомзнк А. И., Нагирияк Ф. Иидр. — «Бюл. ЦИИН ЦМ», 1960, № 15, с. 15—19 с ил.
463. - К у.р у м ч и и X. А., Гущина Г. Г., Пятигорская Г. 3. — «Цветные металлы», 1960, Ns 10, с. 32—35 с ил.-
464. Цефт А. Л., Аб ланов Л. Д., Ткаченко О. Б. я др. — «Гидрометаллургия цветных металлов», Алма-Ата, «Наука», 1965 (ИМО АН Каз.ССР.; Т. 14), с. 41—47 с ил.
465. Evans D. J. I., Romanchuk S., М а с k i v V. N- — «Canad. Mining Metallurg. Bull.», 1964, v. 57, Ns 628, p. 857—866.
466. S t a r r a t F. W. — «J._ Metals», 1961, V. 13, Ns 3,. p. 221^222.
467. 'Chem. Process,’1961, V. 7; Ns 9, p. 8—9.
468. Engng.’Mining J., 1961, v. 162, Ni 4, p. 191.
469. Industr. Heating, 1961, v.’ 28, Ns 5, p. 890; 892-, 894, 896-
470. Chem. Engng. News, 1961, v. 39, Ni 2, p. 49, Ns 7,.p. 46—£7.
471. Canad. Mining J., 1961, v. 82, № 7, p. 49—Б2.
472. Иосию к и У. —*J. Mining Metall. Inst. Japan», 1963, v. 79, № 904, p. 905—912
473. Иванов О. А., К e p ц у p В. А., Шведов В Я- — В ни.: Комплексная переработка полиметаллического сырья. М., «Металлургия», 1965, с. 260— 267 с ил.
474. Engng. Mining J., 1965, v. 166, Xs 9. p. 122—123.
475. Engng. Mining J., 1967, v. 168, JSs 3, p. 82—83.
476. Adzuma C.—*J. Mining Metallurg. Inst. Japan», 1963, v. 79, №904, p. 909— 912.
477. P ы с к и н M. Я-. Горячкин В. И., Сннельщикова Е. Н. и др. — «Цветная металлургия» (Бюл. ии-та «Цветметниформация»), 1965, № 11, с. 16—17.
478. Набойченко С. С., Елисеев Е. И., Худяков И Ф — «Цветные металлы», 1969, № 1, с. 39—43 с ил.
479. Набойченко С. С., Пинигин В. К-, Худяков И. Ф. — «Цветные металлы», 1972, № 8, с. 20—23 с ил.
Тарабаев С. И. Соляиокислотный метод в металлургии свинца и цинка. Алма-Ата, Изд-во АН Каз.ССР, 1962. 197 с. с ил.
480. Фортунатов И. С., Комплексная переработка сульфидных руд. Киев, Изд-во АН УССР, 1959. 184 с. с ил.
481. А г с h i b a I d F. R. — «J. Metals», 1962, v. 14, № 9, p. 648—652.
482. Can. Chem. Process., 1971, Xs 2, p. 25.
483. Skill. Mining Rev., 1971, № 4, p 4
484. Metall. Bull., 1971, № 5567, p. 14
485. Thor n*h ill P. G., W i g s t о 1 E., Van W e e r t G. — «J. Metals», 1971, v. 23, Xs 7. p. 13—18.
486. Pawlek F., Pietsch H. — «Erzmetall», 1957, H. 8. S. 373—83.
487. Pearce R. F., Warner J P., Mackiv V. N. — «J. Metals», 1960, v. 12, Xs 1, p. 28—32.
488- Соболь С. И. — «Цветные металлы», 1956, Ns 4, с. 44—49.
489. Масленицкий И. Н., Чугаев Л. В — «Цветные металлы», 1965, Ns 4, с. 33—39 с нл.
490. World Mining., 1972, V. 25, Ns 4, р. 80.
491. Papademe tr iou T., Grasso 1. R. — «Engelhard Industries Technical Bulletin», 1970, v. 10, Ns 4, p. 121—129.
492. Engng. Mining J., 1972, v. 173, Ns 1, p. 94—95.
493- T h e у e s L. F. — «J. Metals», 1958, v. 10, Ns 7. p. 476.
494. Mining Engng., 1962, v. 14, Ns 12, p. 78—81-
495- T h о u m i n F. E., С о u s s e m e n t R. — «J. Metals», 1964, v. 16, Ns 10, p. 831-834.
496. К о ч у р о в Л. П., Белоглазов К- К., Майорова Е. В.— «Вопросы технологии». Л., 1967 (Научные труды Гипроникеля. Вып. 35), с. 213—226.
497. Talbot Н. L. —«Engng. Mining J.» 1955, v. 156, Ns За, p. 52—53.
498- Gerlach J., Pawlek F-, Schade G.—«Erzmetall», 1971, Bd 24, H. 6, S. 270—273.
499. О k u b о J. — «J. Mining Metallurg. Inst. Japan», 1966, v. 82, Ns 939, p. 601— 606.
500. Henrich G., Meyer K-, Pietsch H. und an. «Z. Erzbergbau und Metallhiittenwesen», 1967, Bd 20, H. 1, S. 7—13.
501. О k u b о J- — «J. Metals», 1968, v. 20, Ns 3, p. 63—67.
502. Sulphur, 1969. № 87, p. 34, 35, 38-
503. W a 1 d e n H. — «J. Metals», 1969, v. 21, Ns 8, p. 25—30.
504. Habashl F. — «Engng. Mining J.», 1969, V. 170, № 12. p. 59—64.
505. P a 1 p e r 1 M.. Aaltonen O. — «J. Metals», 1971, v. 23, N° 2, p- 34—38.
506. Sulphur, 1968, Ns 76, p. 33—37.
507. Kun da W., Rudyk B.. Mackiv V. N.—«Canad. Mining Metallurg. Bull.», 1968, v. 61, Ns 675, p. 819-835.
508. Пиков H. X., Лайкни А. Я-, Хаи О. А. и др. — «Цветные металлы», 1969, № 1, с. 31—35.
509. Ярославцев А. С., Сапрыгин А. Ф., Смирнов В. И. и др. «Цветная металлургия» (Бюл- ин-та «Цветметниформация»), 1969, № 20, с. 23—26 с нл.
510. Пиков Н. X., Лайкни А. Я., Хан О. А. и др. — «Цветные металлы», 1969, № 12, с. 9—13.
511. Engng. Mining J., 1971, v. 172, № 12, p. 79—81.
512. Mining Engng.. 1972, v. 24, № 2, p. 97—101.
513. Iron Age, 1972, v. 209, № 2, p. 37—39; № 3, p. 47; № 7, p. 69.
514. Mining J., 1972, v. 278, № 7129, p. 270—271; № 7131. p. 329.
515. Skill. Mining Rev., 1972, v. 61, № 10, p. 11.
516. H о 1 d e r r e e d F. L. — «Mining Engng.», 1971, v. 23, № 9, p. 45—51.
517. L a q u e F. L. —«Canad. Mining Metallurg. Bull.», 1961, v. 54, № 589, p. 361 — 366.
518. Воробьева Г. Я- Коррозионная стойкость материалов. М., «Химия», 1967. 844 с. с ил.
519. Таблицы коррозионной стойкости титана н его сплавов в агрессивных промышленных средах. М., «Цветметниформация», 1968. 249 с. с ил.
520. Р е й б м а и А. И. Защитные лакокрасочные покрытия в химическом производстве. Л., «Химия», 1968, 287 с. с ил.
521. Т у ф а н о в Д. Г. Коррозионная стойкость нержавеющих сталей. М., «Металлургия», 1969. 180 с. с ил.
522. Котлобай А. П., Земляниченко М. А. — «Химическая промышленность», 1972, Ns 5, с. 387—393 с ил.
Станислав Степанович Набойченко
Василий Иванович Смирнов
ГИДРОМЕТАЛЛУРГИЯ МЕДИ
Редактор издательства Г. А. Луцкая
Художественный редактор Д. В. Орлов
Технический редактор В А. Лыкова
Корректоры Н. И. Шефтель, Л. М. Зинченко
Переплет художника М. Д. Бирюкова
Сдано в набор 28/1X 1973 г.
Подписано к печати 24/1 1974 г. Т-00543.
Формат бумаги 60х901/11. Бумага типографская № 3.
Печ. л, 17.0, Уч.-изд. л. 20,28. Тираж 2300 зкз.
Заказ 563. Изд. № 2300. Цена 1 р. 24 к.
Издательство «Металлургия» 119034.
Москва. Г-34, 2-й Обыденский пер., 14
Ленинградская типография № 6 Союзполиграфпрома прн Государств ей ном комитете Совета Министров СССР по делам издательств, полиграфии и книжной торговли 193144, Ленинград. С-144, ул. Моисеенко, 10