Автор: Беркинблит М.Б. Фуралев В.А. Глаголев С.М.
Теги: биология учебник для школы
ISBN: 5-7084-0196-6
Год: 1999
Текст
ПОБЕДИТЕЛЬ КОНКУРСА
по созданию учебников нового поколения
для средней школы, проводимого
НФПК и Минобразования России
М. Б. Беркинблит, С. М. Глаголев,
В. А. Фуралев
ОБЩАЯ
БИОЛОГИЯ
Часть 1
Допущено
Министерством образования
Российской Федерации
в качестве учебника для средней школы
МОСКВА 1999
Подготовлено при содействии
Национального фонда подготовки кадров
Беркинблит М. Б., Глаголев С. М., Фуралев В. А.
Общая биология: Учебник для 10 класса средней школы.—
В 2 ч.—Ч. 1.— М.: МИРОС, 1999.— 224 с.: ил.
ISBN 5-7084-0196-6
Учебник по общей биологии для 10-го класса охватывает воп-
росы клеточной биологии, генетики и эмбриологии. Он состоит из
двух частей. В первой части приводятся современные сведения о
клетке (строение и функция основных клеточных органелл) и о
молекулярной биологии. Вторая часть учебника посвящена клас-
сической генетике и современной эмбриологии.
Изд. № ФЗО (03)
ISBN 5-7084-0196-6
© Беркинблит М. Б., Глаголев С. М.,
Фуралев В. А., 1999
© Московский институт развития
образовательных систем, 1999
ПРЕДИСЛОВИЕ ДЛЯ УЧИТЕЛЯ
Перед вами — экспериментальный учебник, который
продолжает серию учебников биологии, подготовленных
лабораторией биологического образования Московского
института развития образовательных систем (МИРОС).
Этот учебник предназначен для десятиклассников. Он
включает обычные разделы общей биологии, изучаемые
в школьном курсе 10 класса, и обеспечивает базовый
уровень освоения предмета. Поэтому учебник может быть
использован в качестве основного в общеобразовательной
школе, в то же время им можно пользоваться и как до-
полнительным пособием при работе по традиционным
учебникам.
Учебник построен на последовательном рассмотрении
уровней организации живого, их изучение начинается с
молекулярного уровня организации и последовательно
охватывает все более сложные живые системы. Благода-
ря этому складывается представление о механизмах, ко-
торые лежат в основе различных биологических процес-
сов, о сложных взаимосвязях между проявлениями этих
процессов на разных уровнях организации. Особенно это
важно для изучения эволюционной теории и экологии
(в соответствии с построением курса эти интегрирующие
разделы изучаются в 11 классе). Наличие у школьников
знаний, основанных на современных научных концепциях,
3
убережет их от дилетантских, поверхностных представле-
ний по весьма важным вопросам. Тем самым предлага-
емый учебник развивает новый подход к школьному кур-
су общей биологии, который впервые был реализован при
создании учебника под редакцией Д. К. Беляева.
В чем же отличия нашего учебника от уже изданных
многочисленных учебников по общей биологии?
Во-первых, при сохранении традиционных разделов
школьного курса в нем изменены принципы отбора необ-
ходимых знаний и построения взаимосвязей между ними.
Прежде всего, гораздо больше внимания уделено рассмот-
рению не готовых знаний, а путей их получения. Нам
представляется крайне важным, чтобы в рамках школь-
ного учебника учащиеся получили представление о исто-
рии развития теоретических концепций, этапах формиро-
вания научной системы мира, в той или иной степени
понимали особенности труда ученых, знали о решающих
экспериментах, лежащих в основе главных открытий со-
временной биологии.
Сделана попытка усилить взаимосвязи между разны-
ми разделами биологии, которые в сознании школьников
часто изолированы. Поэтому учебник снабжен многочис-
ленными перекрестными ссылками.
Положенные в основу учебника принципы позволяют
достаточно эффективно пользоваться преимуществами
уникального расположения биологии на стыке различных
дисциплин и более глубоко, чем в существующих учеб-
никах, показать ее взаимосвязи с другими науками (преж-
де всего с химией и математикой).
Во-вторых, важным элементом учебника, отличаю-
щим его от существующих, является большое количество
задач. Нам представляется необходимым, чтобы наряду
с обычными контрольными вопросами, требующими до-
вольно-таки механического воспроизведения фрагментов
текста учебника, школьники решали творческие задачи,
предполагающие интегрированное использование и кри-
тический анализ разнообразной информации, самостоя-
4
тельное выдвижение гипотез, моделей биологических яв-
лений и процессов. В рамках работы в МИРОСе уже
издан ряд задачников по разным разделам биологии.
Многие из разработанных методических идей, представ-
ленных нами, в частности, в книге «Биология в вопросах
и ответах», нашли отражение в настоящем учебнике. Мы
считаем, что эти особенности учебника должны учиты-
ваться при работе с ним как учителя, так и учеников.
Первое: далеко не весь материал учебника нужно запо-
минать. Какой фактический материал действительно не-
обходимо заучить, решает учитель (и об этом должно
быть сказано на уроке).
Второе: упор должен делаться не на запоминание ма-
териала, а на владение им. Например, если ученик не
умеет решать генетические задачи, значит, он не освоил
генетику, несмотря на то, что заучил формулировки зако-
нов Менделя. Если ученик не может предложить даже
идеи ответов на большинство творческих задач в конце
параграфа, это сигнал, что материал им не освоен.
Наконец, некоторые разделы учебника (по выбору учи-
теля), выходящие за рамки традиционной школьной про-
граммы, могут быть предложены учащимся для самосто-
ятельной работы (по ним, например, могут быть приготов-
лены доклады сильными учениками).
При изучении курса общей биологии в 10 и 11 клас-
сах мы предлагаем основываться на следующих принци-
пиальных подходах.
70 класс
Основы БИОХИМИИ и цитологии
При изучении раздела школьники знакомятся с ос-
новными фундаментальными достижениями современ-
ной цитологии, биохимии и молекулярной биологии.
На этом материале наиболее ярко может быть проде-
монстрирована сила современной науки — ее методов,
5
научных предсказаний и теори . Важная задача раз-
дела — показать, не впадая в утилитарность, что чисто фун-
даментальные, поначалу кажущиеся бесполезными науч-
ные исследования оказывают колоссальное влияние на
разные сферы человеческой деятельности — практику
медицины и селекцию, сельское хозяйство и промышлен-
ность. Особое внимание уделяется механизмам хранения
и передачи наследственной информации, расшифровка ко-
торых относится к главным научным открытиям
XX века. Знания, полученные при изучении этого раздела,
служат основой для освоения следующих разделов курса.
Генетика
Изучение генетики в нашем курсе предваряет рас-
смотрение эволюционной теории (в отличие от той тра-
диционной схемы, которая была реализована в учебнике
под ред. Ю. И. Полянского). Во-первых, изучение меха-
низмов наследственности позволяет более содержательно
говорить о механизмах и процессах эволюции. Без по-
нимания того, что стоит за словами «наследственная из-
менчивость», «модификации», «чистые линии» и т. п.,
разговор об эволюции будет реально идти на уровне зна-
ний XIX века. Во-вторых, школьники, занимающиеся по
нашей программе, имеют возможность при изучении ге-
нетики систематизировать ранее полученную ими инфор-
мацию о клеточной теории, половом размножении
и жизненных циклах представителей различных групп.
Наконец, генетика с широким спектром апробиро-
ванных и корректно разрешимых задач повышает авто-
ритет биологии в глазах учащихся. Она предстает пе-
ред ними не собранием давно и непонятно как полу-
ченных фактов, а наукой, в которой есть место для
размышлений и четкого анализа.
Индивидуальное развитие организмов
Основной рассматриваемый в этом разделе воп-
рос — как из одной клетки возникает организм, образо-
ванный разными клетками и имеющий сложную фор-
6
му. Эта проблема считается одной из центральных в
современной биологии, но в существующих школьных
учебниках ей уделяется неоправданно мало внимания.
При изучении проблемы школьники сталкиваются с
необходимостью активного использования знаний по
цитологии и генетике. Знакомясь с поведением слож-
ной самоорганизующейся системы, ученики используют
знания о генетической информации, на новом матери-
але рассматривают возможные механизмы и результа-
ты воздействия на клетку регулирующих веществ.
7 7 класс
Эволюционная теория
В первой, вводной, части раздела рассматриваются
идейные истоки дарвинизма и его основное содержание
(теория естественного отбора). Этот материал может быть
хорошо усвоен на основе знакомства с современными
представлениями о наследственности, без обращения к
генетике популяций. В следующей части уже на основе
генетики популяций рассматриваются внутрипопуляцион-
ные процессы и видообразование. Затем излагаются со-
временные взгляды на макроэволюцию, демонстрирующие
тесную связь эволюционной теории и экологии. Объекты
эколога и эволюциониста сходны: разница в том, что
первого больше интересует результат эволюции, а второ-
го — процесс. Все процессы эволюции протекают в сооб-
ществах. Тому, как сообщество влияет на эволюцию вхо-
дящих в его состав видов, посвящена заключительная
часть раздела.
Экология
Крайне важно сформировать у школьников представ-
ление об экологии как о науке, дать им научное пред-
ставление о происходящих в природных сообществах
процессах, «вытеснив» представления обывательски
7
идеологизированные. На этой основе раскрываются
причины и смысл конфликта между человечеством
и природной средой, анализируются возможные пути
разрешения этого конфликта. Раздел в целом построен
по иерархическому принципу — от простых экологичес-
ких структур к более сложным. Однако вслед за изуче-
нием влияния факторов среды на организмы (аутэколо-
гия) рассматриваются интегральные характеристики
сообществ (потоки энергии и веществ, разнообразие, сук-
цессии) и лишь затем взаимодействия между популя-
циями (хищничество, конкуренция и др.). Это позволя-
ет нагляднее показать влияние указанных взаимодей-
ствий на сообщество в целом.
Биосфера
Заключительный раздел курса посвящен эволюции
биосферы (именно в таком аспекте рассматривается ис-
тория развития жизни на Земле) и ее современному со-
стоянию, а также основным экологическим проблемам
современности.
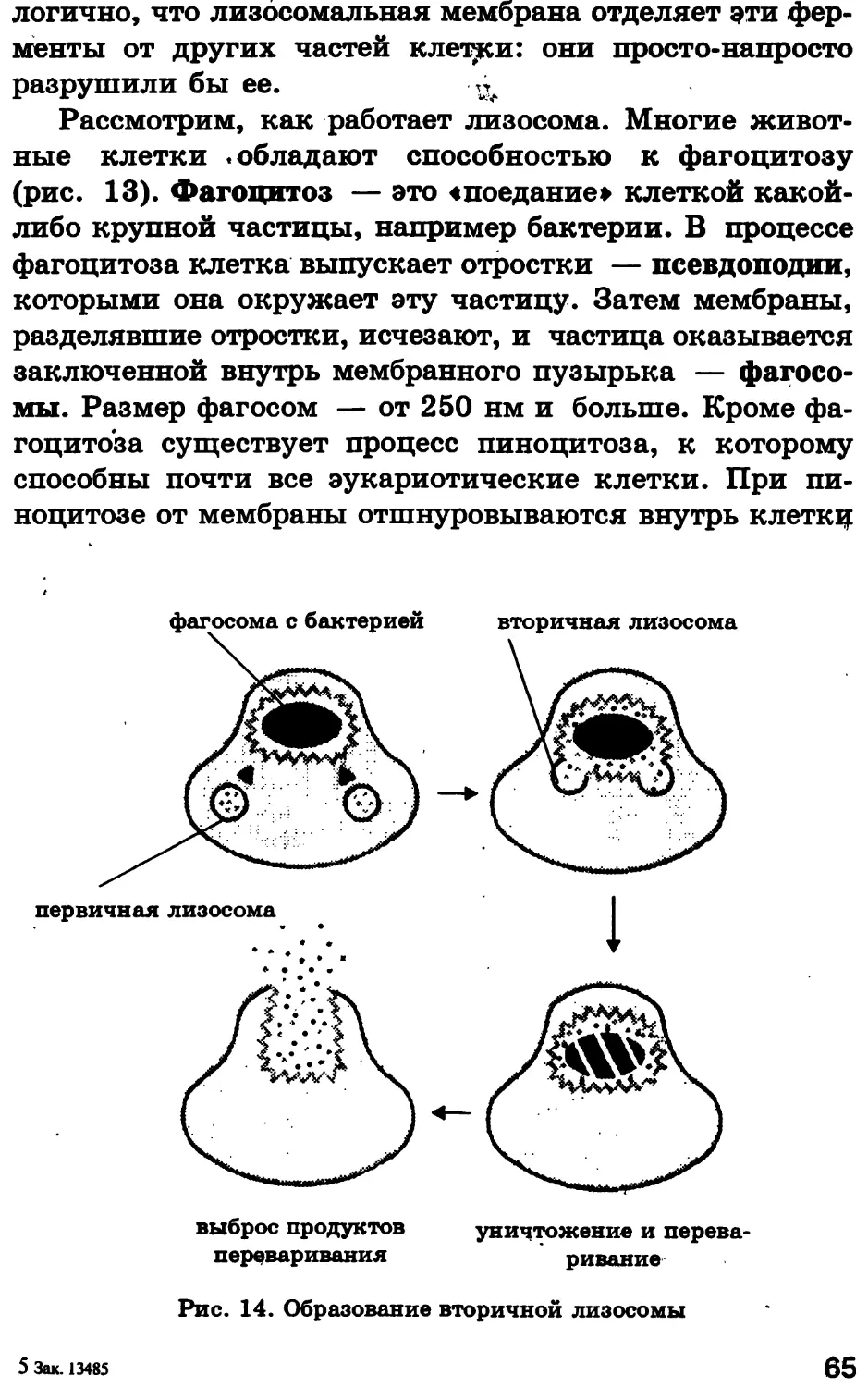
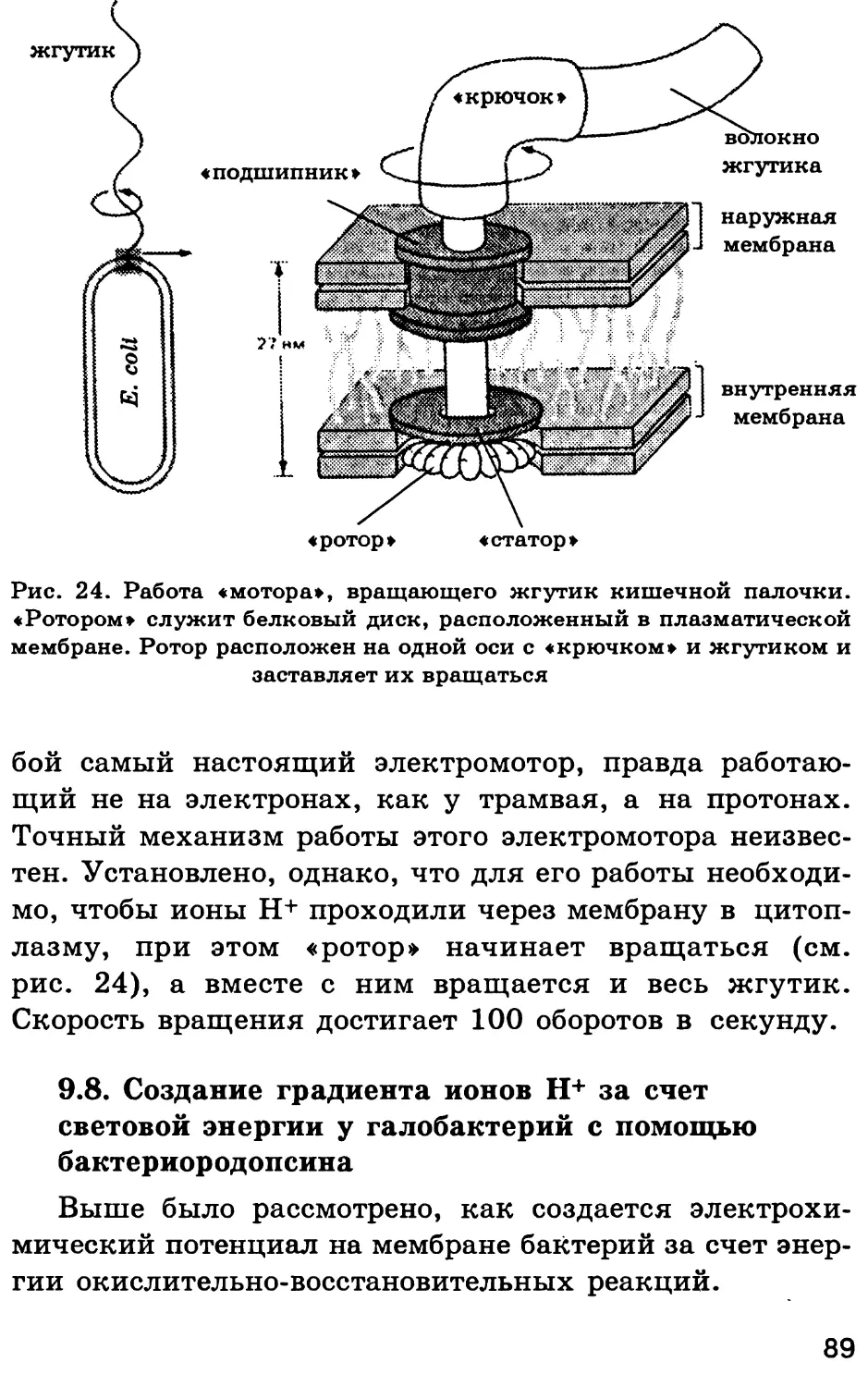
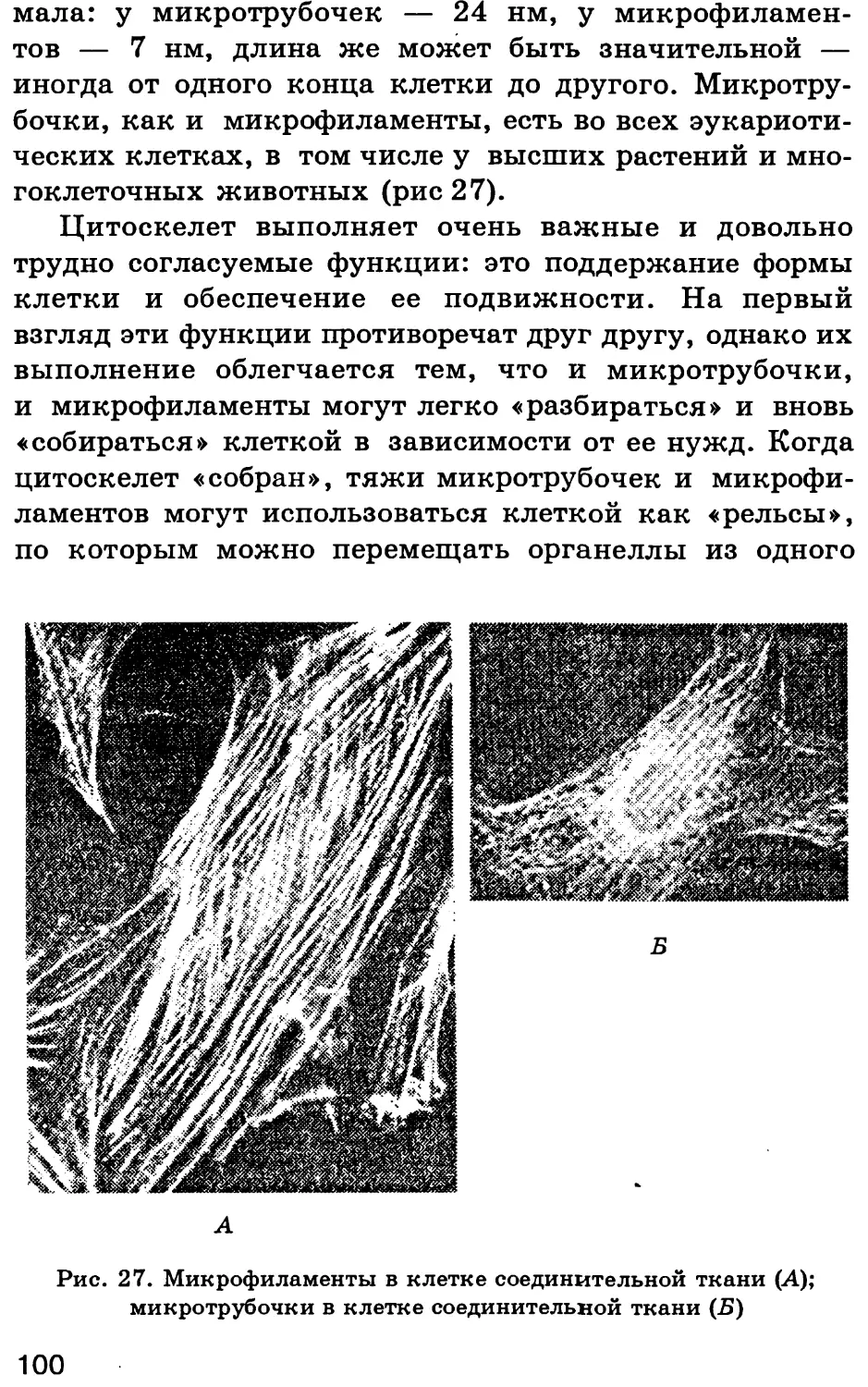
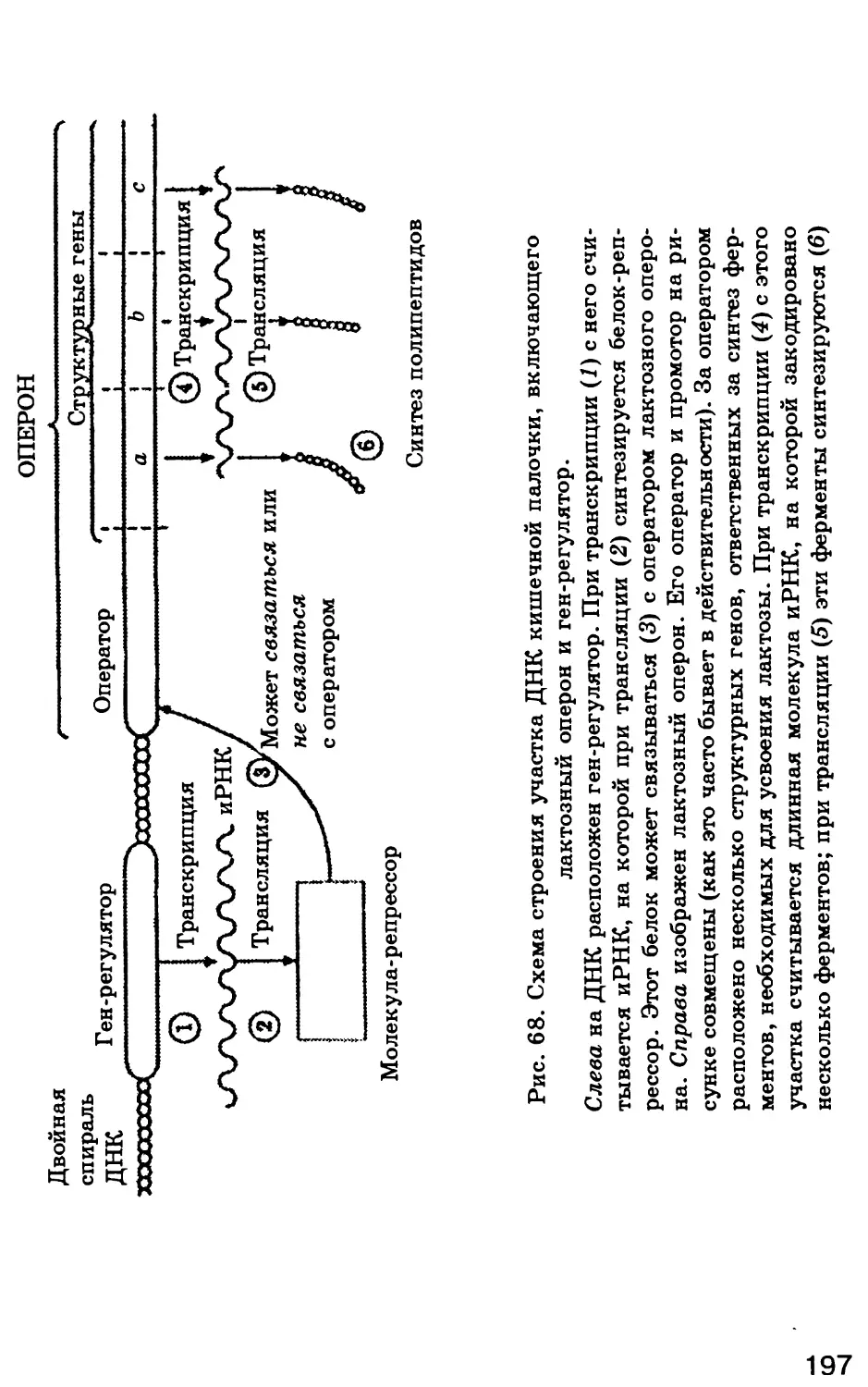
СТРОЕНИЕ КЛЕТКИ И ЕЕ ОРГАНЕЛЛ.
ФУНКЦИИ ОРГАНЕЛЛ
Тлава 1
ХИМИЧЕСКИЙ СОСТАВ КЛЕТКИ.
СОВРЕМЕННЫЕ МЕТОДЫ ИЗУЧЕНИЯ КЛЕТКИ.
ОСНОВНЫЕ КЛЕТОЧНЫЕ ОРГАНЕЛЛЫ
§ 1. Роль воды в клетке
1.1. Свойства молекул воды
Вода абсолютно необходима для всех известных
форм жизни. Так, человеческое тело на 60—70 % состо-
ит из воды. Внутреннее пространство клетки и ее со-
ставных частей — органелл — представляет собой вод-
ный раствор различных молекул и ионов, и почти все
реакции обмена веществ происходят в водной среде
(только очень немногие — в толще мембраны). В науч-
но-фантастических романах можно встретить описания
страшных монстров, которые водятся на дальних плане-
тах и живут, используя не воду, а какие-либо другие
вещества: HF, или NH3> или еще что-нибудь — в меру
фантазии автора. Однако вся наша земная жизнь впол-
не удовлетворяется таким растворителем, как Н2О. В
самом деле, вода растворяет те молекулы и ионы, кото-
рые нужны клетке именно в растворе, и не растворяет
мембраны, клеточные стенки, кости, зубы и т. п. Какие
же свойства молекулы воды позволяют ей выполнять
функцию растворителя в клетке и организме?
Как вы знаете, молекула воды состоит из двух атомов
водорода, присоединенных к атому кислорода. В молекуле
воды связи сильно полярны: атом кислорода оттягивает
9
Водородные связи между молекулами воды
на себя электронную плотность, на нем образуется час-
тичный отрицательный заряд, а на атомах водорода —
частичный положительный заряд.
Между атомом водорода одной молекулы воды и ато-
мом кислорода соседней возникает электростатическое
притяжение, и каждая молекула воды образует с нес-
колькими соседними водородные связи.
Благодаря таким водородным связям вода суще-
ствует в виде жидкости при температурах от 0° до
100°С и образует твердые кристаллы льда при темпе-
ратуре ниже 0°С. (Вещества с менее полярными моле-
кулами и сходной молекулярной массой — такие, как
H2S или СН4,— замерзают при гораздо более низкой
температуре.)
В составе кристаллической решетки льда молекула
воды образует постоянные связи с четырьмя соседними
молекулами. В жидком состоянии вещества эти связи
непостоянны: на какое-то время из нескольких молекул
воды образуются комплексы, затем они распадаются, по-
том образуются вновь и т. д.
'I
1.2. Гидрофильные игидрофобные соединения
Что произойдет, если насыпать в воду порошок ка-
кого-то соединения, молекулы которого тоже поляризо-
ваны? Молекулы воды своими кислородами притянутся
к положительным зарядам на атомах этого вещества,
а водородами — к отрицательным зарядам (такое
10
взаимодействие возможно благодаря наличию элект-
ростатических сил). Дальнейшие события будут за-
висеть от того, какие связи окажутся более прочны-
ми. Если связи молекул данного вещества с молеку-
лами воды сильнее, чем друг с другом, то молекулы
воды облепят каждую молекулу (или ион) этого ве-
щества, и порошок быстро растворится (например, так
будут вести себя кристаллы NaCl). Если же сильнее
окажутся связи молекул вещества друг с другом, то
порошок только намокнет в воде, но не растворится
(пример — BaSO4).
Рассмотрим другой случай: в воду насыпали порошок
соединения, в котором связи неполярны,— допустим,
угля. Молекулы воды с этим веществом взаимодейство-
вать не будут. Им гораздо выгоднее прореагировать друг
с другом: ведь между молекулами воды тоже образуются
водородные связи. Наше вещество с неполярными связя-
ми как бы вытеснится из воды и не будет растворяться.
Если вещество жидкое, оно будет отделяться от воды.
Например, хорошенько взболтав в воде керосин, можно
получить эмульсию, взвесь очень мелких капелек. Но ос-
тавьте эту смесь в покое, и она быстро расслоится (керо-
син окажется вверху, а вода — внизу): настоящий раствор
получить не удастся. Причина заключается в том, что
молекулы воды предпочтут взаимодействовать друг с дру-
гом, вытесняя керосин. А вот глицерин, в котором есть
поляризованные связи, растворяется в воде в любых со-
отношениях.
Итак, соединения с неполярными ковалентными свя-
зями не растворяются в воде. Они называются гидрофоб-
ными (от греческих: гидро — вода, фобос — страх, т. е.
«боящиеся воды»). Твердые гидрофобные вещества несма-
чиваемы водой. Вещества с ковалентными полярными
связями или хорошо растворяются в воде, или хорошо
смачиваются. Их называют гидрофильными (от греческо-
го фило — любить).
11
1.4. Диффузия и осмос
Растворенные вещества перемещаются по объему
клетки за счет случайного, хаотического перемещения мо-
лекул. Если в некотором участке клетки образовалось
много какого-нибудь вещества, а в соседних участках его
мало, то благодаря чисто случайному, вероятностному
движению молекул этого вещества его концентрация
очень скоро станет одинаковой по всей клетке. Такое пас-
сивное перемещение вещества из участка с большей кон-
центрацией к участкам с меньшей концентрацией назы-
вается диффузией. Скорость диффузии частиц тем выше,
чем меньше их размер. Небольшие молекулы легко про-
никают от одного края клетки до другого. Химические
расчеты показывают, что в среднем молекулы массой не-
сколько сотен дальтон диффундируют на 10 мкм (средний
размер животной клетки) приблизительно за 0,1—0,2 с.
Скорость диффузии крупных молекул (белков, нуклеино-
вых кислот) существенно меньше, но все же достаточна
для нужд клетки. Еще более крупные образования —
органеллы — таким способом перемещались бы слиш-
ком медленно, поэтому обычно клетка использует специ-
альные транспортные системы для их перемещения
(о них мы будем говорить ниже).
С диффузией молекул через мембраны тесно связано
явление осмоса. Клеточные мембраны проницаемы для
воды, но непроницаемы для многих веществ, имеющихся
внутри клетки. Если мы поместим клетку в чистую воду,
то концентрация растворенных веществ в клетке, есте-
ственно, будет выше, чем снаружи, а вот концентрация
воды — ниже, поскольку, кроме Н2О, там имеются еще и
другие соединения. В результате вода будет диффундиро-
вать внутрь клетки. Такая диффузия растворителя через
мембрану, непроницаемую для растворенных веществ,
и называется «осмос». Из-за осмоса клетки человека не
могут находиться в дистиллированной воде: вода будет
входить в клетку, клетка набухнет и быстро лопнет.
13
1.3. Неорганические ионы, входящие
в состав клетки. pH
В состав клетки входит большое количество неорга-
нических веществ. Как видно по данным табл. 1, в крови
выше концентрация ионов натрия, хлора и кальция, а
внутри клеток — ионов калия. Это играет важную роль
в возникновении нервного импульса и регуляции ряда
других процессов в клетке.
Таблица 1
Концентрация неорганических ионов в жидкостях
человеческого тела (в миллимолях на литр)
Ион Внутриклеточная жидкость Плазма крови
Na+ 10 160
К+ 160 4
Mg2+ 13 1,5
Са2+ 1 (усредненно по всему объему) 2,5
С1- 3 103
нсо3- 11 27
НРО42- 50 1
SO42- 10 0,5
Для протекания многих реакций очень важна кис-
лотность среды, т. е. концентрация ионов Н+. Как изве-
стно, в нейтральных растворах эта концентрация состав-
ляет 10-7 моль/л, в кислых она больше этого значения,
в щелочных — меньше. В химии для описания кислот-
ности среды часто используют так называемый водород-
ный показатель (его обозначают pH). pH = -lg[H+], где
[Н+] — концентрация ионов Н+. У нейтральных раство-
ров pH = 7, у кислых pH < 7, а у щелочных pH > 7.
Цитоплазма клетки имеет pH = 7,2—7,4, т. е. почти ней-
тральный. В других органеллах pH может быть другой:
так, в лизосомах среда кислая, а в митохондриях —
щелочная. Клетка поддерживает кислотность среды раз-
личных органелл на постоянном уровне.
12
Клетки растении и микробов имеют толстую клеточную
стенку, которая позволяет им сохраниться в целости.
В1. Среди солей, образованных одновалентным катионом и од-
новалентным анионом, гораздо больше растворимых в во-
де, чем среди солей, образованных двухвалентным катио-
ном и двухвалентным анионом. Как вы думаете, почему?
2. Если поместить растительные клетки в раствор с высокой
концентрацией солей, то можно наблюдать процесс так
называемого плазмолиза, в ходе которого клетка «съежи-
вается» и местами отходит от клеточной стенки. Объясни-
те почему.
3. Рассчитайте молярную концентрацию воды в воде и в
физиологическом растворе (0,88 % NaCl).
§ 2. Липиды. Биологические полимеры. Углеводы
Рассмотрим теперь некоторые классы органических
соединений, входящих в состав живой клетки.
2.1. Классификация липидов
Липиды — небольшие молекулы (их молекулярный вес
несколько сотен дальтон) с преобладанием гидрофобных
свойств: иногда в молекулах липидов имеются и гидро-
фильные, и гидрофобные группы. В живых организмах
встречаются разные липиды, в частности фосфолипиды,
жиры и стероиды. Все они выполняют важные функции.
Так, фосфолипиды входят в состав всех клеточных мемб-
ран, выполняя тем самым структурную функцию.
Жиры представляют собой эфиры глицерина и жир-
ных кислот, они весьма гидрофобны. Жиры часто служат
запасными питательными веществами, выполняя энерге-
тическую функцию: при окислении жиров выделяется
9,3 ккал энергии на 1 г жира, т. е. в два с лишним раза
больше энергии, чем при окислении белков и углеводов.
14
У многих животных жировая прослойка выполняет
функцию теплоизолятора.
Стероиды — небольшие гидрофобные молекулы, яв-
ляющиеся производными холестерина. К стероидам от-
носятся многие важные гормоны — регуляторы физио-
логических процессов (например, гормоны коркового
слоя надпочечников и половые гормоны).
Фосфатидилэтаноламин, нейтральный жир
и стероидный гормон тестостерон
н СН, н 1 Н I Н 1
I н—с 4-н 1 н—с 1 -С 1
О I 1 О 1 о 1 о 1 1
с=о с=о с«=о 1 €=О с=о
I сн, 1 СН, сн, сн, 1 СН,
СН. сн, СН, сн, СН,
сн, сн2 сн, сн, СН,
сн, СН| сн 1 сн, СН,
I сн, I сн2 1 СН, 1 сн, сн.
сн, I сн2 1 сн2 сн, сн,
сн, сн, к сн, сн,
сн, сн II сн 1 сн2 1 сн2 1 сн2
сн, I сн2 сн2 1 сн,
СН, сн2 1 1 СН2 сн, СН2 1
СН, сн2 1 1 СН2 1 сн2 1 сн2
СН. сн2 1 1 СН2 1 сн2 1 1 сн,
СН, сн, 1 сн, сн, 1 сн,
^Н, сн, 1 1 сн, 1 сн, 1 сн,
сн, СНз 1 СН, 1 сн3 1 сн,
фосфатидилэтаноламин нейтральный жир
он
тестостерон
15
ШШ4ШШШ
1
WUUl?
3
4
Рис. 1. Устойчивые системы «фосфолипид — вода»:
1 — монослой на поверхности раздела воздух — вода; 2 — бислой в
пленке, разделяющей две части водного раствора; 3 — мицеллы;
4 — мембранный пузырек с липидным бислоем
может замкнуться. Тогда образуется пузырек, внутри и
снаружи которого находится вода (рис. 1). Молекулы
фосфолипидов в стенке такого пузырька образуют бис-
лой, т. е. расположатся в два ряда головками к воде, а
хвосты будут упрятаны внутрь стенки. «Жирные» непо-
лярные части молекул при этом взаимодействуют друг
с другом, а полярные части — с водой. Липидный бис-
лой составляет основу всех клеточных мембран, однако,
кроме липидов, эти мембраны содержат еще и белки.
2.4. Понятие о полимерах и мономерах
До сих пор мы говорили о небольших молекулах —
воде, неорганических ионах, липидах. Помимо них, в клет-
ке обязательно имеются очень большие молекулы: так,
молекулярная масса крахмала, накапливающегося в клет-
ках растений, составляет сотни тысяч дальтон, молекуляр-
ная масса некоторых белков достигает нескольких мил-
лионов, а молекулярная масса молекулы ДНК из хро-
2 Зак 13485
17
2.2. троение фосфолипидов
Главную роль в формировании мембраны играют
фосфолипиды. Молекулярная масса фосфолипидов все-
го несколько сотен дальтон. Посмотрите на структур-
ную формулу одного из фосфолипидов — фосфатидилэ-
таноламина. Что интересного в этой молекуле? У нее
сильно отличаются «головка» и два «хвоста», имеющие
разные свойства. «Головка» явно гидрофильна: в ее со-
став входит кислород и связи поляризованы. Кое-где «го-
ловка» еще и заряжена: так, кислород остатка фосфорной
кислоты несет отрицательный заряд, азот аминогруппы —
положительный. Вода будет охотно взаимодействовать с
«головками» фосфолипидов. «Хвосты» представляют со-
бой остатки жирных кислот, содержащие много СН2-групп.
Нельзя сказать, что связь С—Н вовсе не поляризована,
но поляризация слабая, так как значения электроотрица-
тельности углерода и водорода очень близки. Поэтому
«хвосты» вполне гидрофобны (если отделить «хвосты»,
то из них как раз и получится керосин); они «стремят-
ся» избежать взаимодействия с водой.
2.3. Липидный бислой
Знания того, что молекула фосфолипида состоит из
гидрофильной «головки» и гидрофобных «хвостов», до-
статочно, чтобы представить себе, как фосфолипиды мо-
гут образовывать мембраны. Как поведут себя в воде мо-
лекулы фосфолипидов, если они будут плавать на повер-
хности? Ясно, что «головки» будут обращены в воду,
а «хвосты» — выталкиваться из воды. При этом моле-
кулы фосфолипида образуют монослой — поверхност-
ную пленку толщиной в одну молекулу.
Ну, а если «затолкать» молекулы фосфолипидов в
воду? Тогда «головки» будут обращены к воде (наружу),
а «хвосты» — от воды (внутрь). Такие мелкие скопления
молекул — мицеллы — действительно образуются, но
бывает и по-другому, когда сильно вытянутая мицелла
16
мосомы человека — нескольких миллиардов дальтон! Та-
кие огромные молекулы являются полимерами. Поли-
меры — это сложные молекулы, состоящие из отдель-
ных «звеньев», соединенных друг с другом. Звенья эти
называются мономерами. Все видели и держали в ру-
ках полиэтиленовые пакеты. Полиэтилен — тоже поли-
мер, его формула (-СН2-СН2-)п. Он состоит из отдельных
звеньев -СН2-СН2-, ковалентно соединенных друг с дру-
гом. Таких звеньев в молекуле полиэтилена обычно не-
сколько тысяч. В клетке встречается несколько видов
биологических полимеров, важнейшими из них являют-
ся углеводы, белки и нуклеиновые кислоты (о нуклеи-
новых кислотах пойдет речь в разделе II).
2.5. Структура и функции углеводов
Всем известны крахмал, содержащийся в зернах и
клубнях растений, а также целлюлоза, из которой состо-
ят клеточные стенки растений, и хитин, входящий в сос-
тав панцирей насекомых. Эти вещества являются полиса-
харидами — биологическими полимерами, состоящими из
ковалентно соединенных отдельных звеньев — моносаха-
ридов. Общая формула моносахаридов СпН2пОп, а полиса-
харидов CmH2mOm. Поли- и моносахариды называют об-
щим термином — углеводы. С такими моносахаридами,
как глюкоза и фруктоза, вы хорошо знакомы: это они
придают сладость фруктам и ягодам; остатки моносаха-
ридов рибозы и дезоксирибозы входят в состав нуклеино-
вых кислот. Сахароза (т. е. пищевой сахар) — дисахарид,
он состоит из ковалентно присоединенных друг к другу
остатков глюкозы и фруктозы.
Углеводы выполняет две важные функции: энергети-
ческую и структурную. При распаде и окислении угле-
водов выделяется энергия, которую организм использует
для своих нужд. При окислении 1 г углеводов выделяется
в среднем 4,1 ккал. Для многих клеток человека (напри-
мер, клеток мозга и мышц) главным источником энергии
служит глюкоза, приносимая кровью. Крахмал и очень
18
Формулы глюкозы, рибозы, дезоксирибозы, крахмала
и целлюлозы
глюкоза целлюлоза
крахмал
НО-СН2 н
а»
они
дезоксирибоза
но-сн2 н
о»
онон
рибоза
похожее на него вещество животных клеток — глико-
ген — являются полимерами глюкозы. Они служат для
запасания ее внутри клетки: в случае необходимости
особые ферменты разрушают эти полимеры до отдель-
ных молекул глюкозы, которая затем используется для
нужд организма.
Не все полисахариды так мягки и непрочны, как крах-
мал и гликоген. Целлюлоза тоже относится к полимерам,
построенным из звеньев глюкозы, но химическая связь
между ними несколько иная, чем в крахмале (более под-
робно вы узнаете о различиях целлюлозы и крахмала
в курсе химии). Целлюлоза образует стенки раститель-
ных клеток, отличающиеся твердостью и жесткостью,
она — один из главных компонентов древесины. Хитин,
полимер одного из производных глюкозы (N-ацетил-
глюкозамина), тоже выполняет структурные функции.
19
01. Почему наши клетки обычно запасают глюкозу в виде по-
лимера гликогена, а не в виде собственно глюкозы?
2. Почему при сгорании жиров выделяется больше энергии,
чем при сгорании углеводов и белков?
§ 3. Белки
3.1. Функции белков
Белки также относятся к биологическим полимерам.
Они выполняют целый ряд важнейших функций в орга-
низме, основными из которых являются следующие.
1) Структурная. В качестве примера белка, выпол-
няющего структурную функцию, можно привести кера-
тин. Из этого белка состоят волосы, шерсть, рога, копы-
та, верхний отмерший слой кожи. В более глубоких
слоях кожи расположены прокладки из белков колла-
гена и эластина. Именно эти белки обеспечивают проч-
ность и упругость кожи. Они же содержатся в связках,
соединяющих мышцы с суставами и суставы между
собой. Структурную функцию выполняют и некоторые
белки мембран, кроме того, в любой клетке животных,
растений и грибов есть состоящий из белков внутрен-
ний цитоскелет. Например, амеба вроде бы бесформенна,
но она не растекается по субстрату, как блин, а выпус-
кает ложноножки, округляется в нужных местах
и т. д. Это возможно благодаря цитоскелету, который
состоит из белков (о нем мы будем говорить подробнее
в следующих главах).
2) Каталитическая. Из курса химии вам известно,
что такое катализатор. Это вещество, которое ускоряет
реакцию, оставаясь в конце реакции неизменным (не рас-
ходуясь). Биологические катализаторы называются фер-
ментами, а вещества, участвующие в самой реакции,—
субстратами. Почти все ферменты — это белки.
20
В 80-х годах было обнаружено, что каталитической активно-
стью могут обладать также некоторые молекулы РНК, о ко-
торых мы расскажем ниже, но пока известно лишь очень
немного реакций, которые они катализируют.
Из курса физиологии вы уже знакомы с некоторы-
ми пищеварительными ферментами: пепсином, расщеп-
ляющим белки в желудке; трипсином, выделяемым
поджелудочной железой; амилазой слюны, расщепляю-
щей крахмал.
В клетке постоянно идут тысячи реакций. Если сме-
шать в пробирке органические и неорганические веще-
ства точно в тех же соотношениях, что и в живой клетке,
но без ферментов, то почти никаких реакций с заметной
скоростью идти не будет. Именно благодаря ферментам
осуществляется весь обмен веществ.
Для живой клетки весьма ценными являются такие
особенности работы ферментов по сравнению с известны-
ми вам «химическими» катализаторами, как специфич-
ность, высокая эффективность и регулируемость (не у всех
ферментов). Ферменты работают очень специфично: обыч-
но один фермент узнает только «свой» субстрат и ускоря-
ет одну определенную реакцию. Ферменты, как правило,
значительно превосходят по каталитической активности
неорганические и простые органические катализаторы
и эффективно работают при обычных условиях. (Небио-
логические катализаторы в большинстве случаев хорошо
работают лишь при высокой температуре, тогда как раз-
ные ферменты функционируют при температурах от 100°
у термобактерий и до 0°С. У человека, например, фер-
менты нормально работают при 36,6°С. В этих условиях
хорошо действуют очень немногие органические и не-
органические катализаторы.) Еще одно ценное свойство
ферментов — способность регулироваться, т. е. «вклю-
чаться» и «выключаться». (Это относится не ко всем
ферментам; например, не регулируется амилаза слюны
21
и ряд других пищеварительных ерментов, но их и не
надо регулировать.) Однако у ферментов есть и недос-
татки. Так, они не выдерживают высокой температуры,
теряя свою каталитическую активность.
3) Двигательная. Все известные способы движения
живых организмов основаны на работе соответствующих
белков. Так, сокращение мышц обеспечивают мышечные
белки актин и миозин, они же делают возможным полза-
ние амебы. Другие белки обеспечивают подвижность жгу-
тиков (бактериальные жгутики и жгутики высших орга-
низмов содержат разные белки).
4) Транспортная. Вы помните, что гемоглобин — это
транспортный белок, переносящий кислород. Имеются
специальные белки, переносящие многие другие веще-
ства: ионы железа и меди, некоторые витамины и гор-
моны и т. п.
5) Питательная, или энергетическая. Белки можно
расщепить, окислить и получить энергию, необходимую
для жизни. Правда, это не очень выгодно: энергетическая
ценность белков невысока по сравнению с жирами и со-
ставляет 4,1 ккал на 1 г белка. Обычно белки расходуют-
ся на энергетические нужды в крайних случаях, когда
исчерпаны запасы жиров и углеводов.
6) Защитная. В крови и других жидкостях содер-
жатся белки, которые могут убивать микробы или помо-
гать обезвреживать их. В состав плазмы крови входят
антитела — белки, каждый из которых действует на оп-
ределенный вид микроорганизмов или иных чужеродных
агентов. В слюне и в слезах содержится белок лизо-
цим — фермент, разрушающий клеточные стенки бакте-
рий. Если на слизистую глаз или полости рта попадает
микроб, его оболочка разрушается под действием лизо-
цима и дальше с ним легко справляются защитные
клетки. Защитную функцию выполняют й такие не-
приятные для нас белки, как холерный токсин, токсин
ботулизма, дифтерийный токсин и т. п. Они защища-
ют микробов от нас.
22
7) Регуляторная. Многие (хотя и далеко не все) гор-
моны являются белками — например, все гормоны ги-
пофиза и гипоталамуса, инсулин и др. Гормоны дей-
ствуют на клетку, связываясь со специфическими рецеп-
торами. Каждый рецептор узнает только один гормон.
Рецепторы всех гормонов являются белками. Другим
примером могут служить белки, которые регулируют
образование и рост отдельных органов и тканей в про-
цессе развития организма из яйцеклетки.
3.2. Аминокислоты. Первичная структура белков
Белки — это полимеры, образованные из соединений,
называемых аминокислотами. Белки демонстрируют наи-
большее разнообразие мономеров, из которых построен
полимер. Если известные нам полисахариды состоят из
повторяющейся много раз одной и той же «единицы»
(целлюлоза и крахмал — из глюкозы, хитин — из N-аце-
тилглюкозамина), то белки состоят из 20 разных амино-
кислот. После того как молекула белка собрана, некото-
рые аминокислотные остатки в составе белка могут под-
вергаться химическим изменениям, так что в «зрелых»
белках можно обнаружить до 30 различных аминокис-
лотных остатков (но строятся все белки исходно только
из 201). Строение типичных аминокислот, из которых
состоят белки, можно описать такой формулой:
СООН
h2n— с — н
R
В молекуле белка аминокислотные остатки соедине-
ны так называемой пептидной связью.
Полная последовательность аминокислотных остатков
в такой цепи называется первичной структурой белка.
Разные белки отличаются друг от друга по первичной
структуре: кератин имеет одну последовательность амино-
кислот, пепсин — другую, гормон роста — третью и т. д.
23
Пептидная связь и первичная структура белка
ОН
Н3С сн3
сн
: I
сн2он Н ч н,<^нг Н CfHj снг
H3N—CH— C-N-C- -С- С-bJ -С- C-N -С-СОО'
О Н О н о н о н
пептидная
связь
Н
I
-С— N-
О
Число остатков в разных белках может колебаться от
нескольких штук до нескольких тысяч (впрочем, обычно
небольшие молекулы, состоящие из нескольких амино-
кислот, называются пептидами, а крупные, состоящие из
сотен или, тем более, тысяч аминокислот — белками, или
полипептидами). В первичной структуре белка можно
различить N-конец цепочки, содержащий свободную NH2-
группу, и С-конец, содержащий свободную СООН-группу.
3.3. Вторичная, третичная и четвертичная
структуры белков
Обычно пространственная структура белков не похожа
на вытянутую цепочку — она складывается в более слож-
ные конфигурации. Группы N—Н и С = О, входящие в пеп-
тидную связь, заметно поляризованы: азот обладает боль-
шей электроотрицательностью, чем водород, а кислород —
большей, чем углерод. Кислород группы С = О может обра-
зовывать водородную связь с водородом ^группы N—Н (ра-
зумеемся, расположенной в другой пептидной связи).
За счет таких водородных связей формируется вто-
ричная структура белка. Одной из разновидностей вто-
24
ричной структуры является альфа-спираль (рис. 2), где
каждый кислород связан с водородом четвертой по ходу
спирали NH-группы.
Образование водородной связи между NH- и СО- группами
Любопытно, что эта сложная красивая структура
сперва была предсказана теоретически известным био-
химиком Лайнусом Полингом и лишь потом обнару-
жен ia экспериментально.
Укладка белков нс ограничивается вторичной струк-
турой. Среди аминокислотных остатков есть немало гид-
рофобных, которые стремятся укрыться от водного окру-
жения внутри белковой молекулы. В числе аминокислот
встречаются кислые и щелочные. Их боковые группы
будут заряжены, соответственно, отрицательно и положи-
тельно, и между ними возможно электростатическое вза-
имодействие. Кроме того, многие аминокислотные остат-
ки могут образовывать водородные связи. Наконец, остат-
ки аминокислоты цистеина, содержащие SH-группы,
способны образовывать друг с другом ковалентные связи
-S-S-. Благодаря всем этим взаимодействиям — гидро-
фобным, ионным, водородным и дисульфидным — белко-
вая цепочка образует сложную пространственную конфи-
гурацию (рис. 3), называемую третичной структурой.
Многие белки состоят не из одной, а из нескольких по-
липептидных цепочек. Совокупность их образует четвер-
тичную структуру белка. Эта структура стабилизируется
теми же связями, что и третичная. Пространственная кон-
фигурация белка (т. е. третичная и четвертичная струк-
туры) называется конформацией. Конформация белка оп-
ределяется его первичной структурой: белковая цепочка
с определенной последовательностью аминокислот само-
произвольно укладывается с образованием природной про-
странственной конфигурации (при образовании четвертич-
25
Рис. 2. Структура альфа-спи-
рали. Альфа-спиральная кон-
формация во многом опре-
деляется характером 11-
групп и стабилизируется
водородными связями между
атомами Н и О (показаны
пунктирными линиями)
ной структуры несколько бел-
ковых цепочек специфически
«прилипают» друг к другу).
Поскольку вторичная, тре-
тичная и четвертичная структу-
ры белка создаются, в общем,
более слабыми связями, чем пер-
вичная, то они оказываются ме-
нее стабильными. Например,
при нагревании они легко раз-
рушаются. При этом хотя у бел-
ка и сохраняется в целости пер-
вичная структура, он не может
выполнять своих биологических
функций, становится неактив-
ным. Процесс разрушения при-
родной конформации белка, со-
провождающийся потерей ак-
тивности, называется денатура-
цией.
Белки часто соединяются
с другими молекулами, образуя
гликопротеины (соединения
белков с углеводами), нукле-
опротеины (соединения белков
с нуклеиновыми кислотами),
металлопротеины (соединения
белков с ионами металлов).
Так, гемоглобин, переносящий
кислород в кровеносной систе-
ме, состоит из белковой части —
глобина и небелковой — гема, при этом ион Fe2+ вхо-
дит в состав гема, а глобин состоит из четырех поли-
пептидных цепочек. Для нормальной работы многих
ферментов к ним должны присоединяться небелковые
вещества — так называемые коферменты. Многие ви-
тамины являются коферментами.
26
Рис. 3. Третичная структура фермента лизоцима. В центре
шестиугольниками обозначен субстрат
3.4. Механизм специфического связывания
белками различных молекул
Давайте теперь рассмотрим, каким образом белки
могут выполнять некоторые из своих функций. Мы уже
говорили, что многие белки умеют очень специфично
«узнавать» определенные вещества. Например, на мемб-
ранах клеток имеются белки — рецепторы гормонов.
Каждый рецептор специфически «узнает» только «свой»
гормон и не будет реагировать ни на один другой. Весь-
ма своеобразно действие ферментов: так, амилаза слюны
«узнает» и расщепляет только крахмал, но не белки
пищи, а такие ферменты, как пепсин и трипсин, «узна-
ют» и расщепляют белки, но не могут действовать на
крахмал. Участок молекулы фермента, который непос-
редственно взаимодействует с субстратом, называется
активным центром. Обычно активный центр содержит
27
менее десятка аминокислотных остатков, все же осталь-
ные аминокислоты необходимы для поддержания про-
странственной структуры активного центра, а у некото-
рых ферментов и для других целей (например, для свя-
зывания с мембранами). Как же активные центры
ферментов столь точно «узнают» только свой субстрат
(а центры рецепторов — только свой гормон)?
Любая молекула содержит определенное количество
положительно заряженных, отрицательно заряженных
и неполярных (гидрофобных) участков. Иногда настоя-
щих зарядов нет, а есть лишь «частичные» (вспомним
молекулу воды). С другой стороны, аминокислоты, из ко-
торых состоит белковая молекула, тоже могут содержать
положительно заряженные (или частично положитель-
ные), отрицательно заряженные (или частично отрица-
тельные) и гидрофобные участки. Легко представить себе,
что если положительно заряженный участок субстрата
разместится у отрицательно заряженного участка актив-
ного центра фермента, отрицательно заряженный — око-
ло положительно заряженного, а гидрофобный — около
гидрофобного, то за счет нескольких точек взаимодей-
ствия связывание фермента с субстратом окажется до-
вольно прочным и очень специфичным. В самом деле,
один единственный контакт (+) с (—) дает весьма слабую
связь, но когда таких контактов много, то все вместе они
дают прочное связывание.
Если же вместо субстрата мы возьмем вещество с дру-
гим расположением положительных, отрицательных
и гидрофобных участков, то некоторые положительные
участки встанут около положительных, отрицатель-
ные — около отрицательных, и тогда вместо притяже-
ния получится отталкивание.
В первом приближении контакт фермента с субст-
ратом (или рецептора с гормоном) можно -представить
себе как контакт замка и ключа: в тех местах, где у
ключа выступы, у замка имеются выемки, а там, где
у ключа выемки, у замка — выступы. Разумеется, эта
28
Связывание субстрата в активном центре фермента
карбоксипептидазы А
аналогия очень приблизительна: ключ не притягивает-
ся к замку, а электрические заряды молекул притяги-
ваются друг к другу; у ключа и замка есть только две
возможности (выступ или выемка), а у молекул — три
( +, - и гидрофобный неполярный участок).
Есть и еще одно важнейшее отличие связывания бел-
ков с разными молекулами от «связывания» замков с
ключами. При связывании активного центра с другой
молекулой может измениться вся конформация белка. Мы
говорили, что третичная и четвертичная структуры бел-
ка поддерживаются благодаря тому, что положительно
заряженные остатки одних аминокислот электрически
притягиваются к отрицательно заряженным остаткам
других аминокислот, гидрофобные аминокислотные остат-
ки стремятся друг к другу, чтобы уменьшить контакт с
водой, и т. п. А теперь представьте себе, что некоторые
из этих групп стали реагировать не друг с другом, а с
субстратом. Тогда группы, с которыми они были рань-
ше связаны, также вступят в новые взаимодействия, что
может привести к изменению всей конформации белка.
29
В результате связывание даже с небольшой молекулой
может так повлиять на пространственную структуру бел-
ка, что он сильно изменит свои свойства. Например, пока
рецептор не связан с гормоном, у него «спокойная» кон-
формация, он не активирует никакие клеточные процес-
сы. Но как только гормон свяжется с одним участком
молекулы рецептора, вся конформация рецептора меняет-
ся, он становится активным — начинает катализировать
определенные реакции или пропускать через мембрану
определенные ионы, или связываться с другими белками.
Многие ферменты, кроме активного центра, имеют еще
специальный регуляторный центр. Молекула-регулятор,
связываясь с этим центром, изменяет конформацию все-
го фермента, в том числе и его активного центра. Это
приведет или к ингибированию (т. е. к угнетению) его
работы, или к активации.
3.5. Нуклеиновые кислоты
Кроме перечисленных выше веществ, для жизнедея-
тельности клетки абсолютно необходимы нуклеиновые
кислоты. (С их строением и функциями вы познакоми-
тесь в разделе II.) Здесь же мы скажем только, что нук-
леиновые кислоты представляют собой полимеры и что
в клетке имеются два типа нуклеиновых кислот: рибо-
нуклеиновая кислота (РНК) и дезоксирибонуклеиновая
кислота (ДНК). Главной функцией ДНК является хране-
ние генетической информации: гены представляют собой
участки молекул ДНК. В свою очередь РНК выполняет
в клетке несколько важных функций, все они связаны
с синтезом белка. И ДНК, и РНК являются полимер-
ными цепочками, состоящими из отдельных звеньев —
нуклеотидов.
Сами нуклеотиды тоже имеют довольно сложное стро-
ение: они содержат азотистое основание, моносахарид-
ный остаток и остаток фосфорной кислоты. В состав
РНК входят нуклеотиды, содержащие моносахарид рибо-
зу, а в состав ДНК — нуклеотиды, содержащие дезок-
30
сирибозу. Не ольшое отличие есть и в наборе азотистых
оснований: в РНК могут входить аденин, гуанин, цито-
зин и урацил, а в ДНК — аденин, гуанин, цитозин и ти-
мин. Наконец, еще одним отличием является то, что ДНК
в клетке всегда представляет собой двухцепочечную
структуру (так называемую двойную спираль), а все кле-
точные РНК состоят из одной цепочки. Химические от-
личия между этими молекулами суммированы в табл. 2.
Таблица 2
Нуклеиновая кислота Азотистые основания Моносахарид Количество цепочек
днк Аденин, гуанин, цитозин, тимин Дезоксирибоза 2
РНК Аденин, гуанин, цитозин, урацил Рибоза 1
В1. Какой заряд, положительный или отрицательный, имеет
остаток каждой из приведенных аминокислот в составе
белковой молекулы?
H2N-CH2-CH2-CH2-CH2-CH-COOH — лизин
NH2
НООС-СН2-СН2-СН-СООН — глютаминовая кислота
I
nh2
2. Перед вами формулы трех аминокислот, входящих в сос-
тав белков. Какие из этих аминокислот могут образовы-
вать своими боковыми радикалами ионные, водородные
и гидрофобные связи?
H2N-C-NH-CH2-CH2-CH2-CH-COOH — аргинин
II I
NH NH2
НО-СН2-СН-СООН — серин
NH2
31
GJ
ГО
Строение ДНК
3 Зак.13485
Строение РНК
<^^>-СН2-СН-СООН — фенилаланин
NH2
3. Нарисуйте график зависимости скорости ферментативной
реакции от температуры.
4. Многие патогенные микробы в процессе обмена ве-
ществ используют парааминобензойную кислоту H2N-
СвН4-СООН, их ферменты делают из этого соединения
необходимые им вещества. Для борьбы с этими мик-
робами врачи используют производные сульфаниловой
кислоты H2N-CeH4-SO3H (к ним принадлежат такие
лекарства, как стрептоцид, этазол, норсульфазол, суль-
фадимезин). Известно, что в присутствии этих ле-
карств микроб не может синтезировать необходимые
ему вещества из парааминобензойной кислоты. Как вы
думаете, почему?
§ 4. Обмен веществ и энергии в клетке
4.1. АТФ как богатое энергией соединение
В клетке постоянно протекает множество химических
реакций обмена веществ, и она должна все время обнов-
лять свой состав — расщеплять отслужившие структуры
и синтезировать новые. Весь комплекс реакций обмена
веществ называется метаболизмом, при этом совокуп-
ность реакций распада называется катаболизмом, а син-
теза — анаболизмом. Некоторые из этих реакций экзо-
термичны, т. е. сопровождаются выделением энергии
и могут идти самопроизвольно, а другие — эндотермич-
ны и самопроизвольно не идут. (Обычно распад, гидролиз
сложных молекул идет самопроизвольно, а синтез — нет.)
Строго говоря, не все экзотермические реакции идут самопро-
извольно и не все эндотермические не идут. Правильнее го-
ворить об экзэртонических и эндэргонических реакциях; с
этими терминами можно познакомиться в курсе химии.
34
Как же в клетке происходят эндотермические реакции,
не протекающие самопроизвольно? Хотелось бы сразу же
обратить внимание на то, что ферменты, как всякие ката-
лизаторы, могут лишь ускорять прохождение реакций, но-
не могут сделать экзотермическую реакцию эндотерми-
ческой или наоборот. Природа нашла оригинальный вы-
ход из положения: в клетках эндотермические реакции
всегда сопряжены с сильно экзотермическими, так что
суммарная реакция оказывается все-таки экзотермичес-
кой. Совершенно очевидно, что невыгодно на каждую эн-
дотермическую реакцию «заводить» свою отдельную экзо-
термическую. Гораздо удобнее иметь одну универсальную
сильно экзотермическую реакцию и сопрягать с ней все
эндотермические. И такой универсальной реакцией в клет-
ке служит гидролиз АТФ (аденозинтрифосфата).
Молекула АТФ состоит из азотистого основания аде-
нина, моносахарида рибозы и трех фосфатов. При гид-
Уравнение гидролиза АТФ
NH,
сн,
но он
NH,
N
аденозинтрифосфат
он
ОН
он он он
гО-Р-О-Р-О~Р -0Н + Н.0 =
U
О
II
о
аденозиндифосфат
н
О
N N
фосфорная
ОН ОН кислота
CH," 0-Р-0-Р-ОН + НзРО<
и
О
к
О
НО ОН
35
ролизе АТФ один фосфат отщепляется, при этом высво-
бождается много энергии — около 7 килокалорий на
1 моль.
Итак, допустим, клетке необходимо провести слабо эн-
дотермическую реакцию синтеза X + Y = X- Y + Н2О.
Сама по себе она, разумеется, не пойдет, но ее можно
провести в два этапа:
1) X + АТФ = X - Н2РО4 + АДФ;
2) X - Н2РО4 + Y = X - Y + Н3РО4.
При этом и реакция 1, и реакция 2 будут экзотер-
мическими и могут протекать самопроизвольно. Сум-
марно: X + Y + АТФ = X - Y + АДФ + Н3РО4. Посколь-
ку реакция X + Y = X - Y + Н2О слабо эндотермична,
а реакция АТФ + Н2О = АДФ + Н3РО4 сильно экзотер-
мична, то суммарная реакция будет экзотермичной и,
следовательно, может идти в клетке самопроизвольно.
Мы рассмотрели лишь самый простой случай, когда
эндотермическую реакцию можно пройти всего лишь за
одну стадию. В подавляющем большинстве случаев ме-
таболические процессы гораздо сложнее и, чтобы полу-
чить нужное клетке соединение, приходится проводить
множество промежуточных реакций. Однако общая
стратегия остается в целом такой же: сопрягать реак-
ции, не идущие самопроизвольно, с гидролизом АТФ.
В клетке есть и другие соединения, богатые энергией,
они используются ею для некоторых специфических
реакций, но самым распространенным, самым универ-
сальным источником энергии для метаболизма являет-
ся именно АТФ.
4.2. Роль АТФ в, клеточном метаболизме
Роль АТФ в клетке не ограничивается только ана-
болическими реакциями обмена веществ. Это вещество
обеспечивает энергией такие процессы, как мышечное со-
кращение, движение жгутиков эукариотических клеток
и передвижение органелл внутри этих клеток, транс-
порт ионов через наружную мембрану против градиен-
36
. Анаэробный Окислительное
синтез
Фотрфосфс^;
рилиройниё
фсюфорили-
АТФ
Синтез необ- Механическая * Активный транс-
кодимых клет- работа порт через мем*
.. ке'веществ брану
Рис. 4. Роль АТФ в клеточном метаболизме
та концентрации. Все эти функции АТФ в клетке,
а также способы синтеза АТФ из АДФ и фосфата изоб-
ражены на рис. 4.
Помимо синтеза необходимых клетке веществ, АТФ
нужен и для других процессов, о которых будет сказано
в следующих главах. Несложные подсчеты показывают,
что поскольку человек весом 70 кг при сидячей работе
потребляет в день 2800 килокалорий, то это эквивален-
тно расщеплению почти 200 кг АТФ, а между тем в ор-
ганизме человека содержится всего около 50 г этого ве-
щества. Следовательно, в течение суток эти 50 г АТФ
должны несколько тысяч раз расщепиться до АДФ и
вновь синтезироваться. Рассмотрим теперь способы син-
теза АТФ.
4.3. Анаэробный синтез АТФ
Мы говорили, что для прохождения эндотермической
реакции необходимо ее сопрячь с какой-нибудь сильно
экзотермической реакцией. А что если использовать тот
же принцип для синтеза самого АТФ? В самом деле, в хо-
де реакции
глюкоза —► 2 молочная кислота
С6Н12Ое 2 С3НеО3
37
выделяется очень много энергии — Так много> что хва.
тает на синтез 2 молекул АТФ из 2 молекул АДФ и 2
молекул фосфатов. Очень логично было бы сопрячь пре-
вращение глюкозы в молочную кислоту с синтезом 2
молекул АТФ:
СвН12О6 4- 2 АДФ + 2 Ф 2 С3НвО3 +2 АТФ 4- 2 Н2О.
Вот так выглядит в самом общем виде процесс мо-
лочнокислого брожения. Как видно из уравнения реакции,
этот процесс не нуждается в кислороде, он может проте-
кать в бескислородной среде и относится к анаэроб-
ным процессам (в греческом ан ~~ частица отрицания,
аэр - «воздух»). Это очень древний процесс, появивший-
ся в ходе эволюции значительно раньше, чем два дру-
гих - фотосинтез и окислительное фосфорилирование.
Процесс молочнокислого брожения активно используют
для синтеза АТФ многие клетки; напрИмер, он происхо-
дит в цитоплазме клеток белых мыпщ, в клетках мо-
лочнокислых бактерий (это те, что превращают молоко в
простоквашу) и многих, многих других. Не надо думать,
что процесс превращения глюкозы в Молочную кислоту
сопряженный с синтезом АТФ, происходит в одну или
в две стадии — нет, он очень сложен й насчитывает 11
реакций. Этот процесс называют также гликолизом.
Молочнокислое брожение - не единственный при-
мер анаэробного синтеза АТФ. Дрожжи используют для
этого другую реакцию:
СвН12Ов + 2 АДФ + 2 Ф 2 С2Н5ОН + 2 АТФ 4- 2 СО2.
Этиловый спирт
Этот процесс называется спиртовым брожением, он,
как и гликолиз, протекает в цитоплазме.
4.4. Другие пути синтеза АТФ
Процессы анаэробных брожений служили главным
источником энергий для живого в те далекие времена,
когда в атмосфере Земли еще не было кислорода. Но по-
38
том появились фотосинтезирующие организмы и в ат-
мосфере стал накапливаться кислород. Это открыло
принципиально новые возможности получения энергии.
Дело в том, что кислород — хороший окислитель, и в
ходе реакций окисления органических веществ кисло-
родом обычно выделяется в десятки раз больше энер-
гии, чем в ходе брожения. Так, в ходе реакции
СбН12Об + 6 О2 6 Н2О + 6 СО2
глюкоза
выделяется примерно 684 ккал/моль энергии, тогда как
при реакции
С6Н12О0 2 Н+ + 2 С3Н5О4-
глюкоза лактат-ион
только около 28 ккал/моль (при клеточном pH молоч-
ная кислота диссоциирует, отдавая протон).
Естественно, клетки постарались использовать от-
крывшиеся возможности. Процесс синтеза АТФ за счет
окисления органических веществ кислородом называ-
ется окислительным фосфорилированием. Этот процесс
был открыт В. А. Энгельгардтом в начале ЗО-х годов
в г. Казани. Окислительное фосфорилирование значи-
тельно эффективнее анаэробных синтезов: если в про-
цессах гликолиза и спиртового брожения при утилиза-
ции одной молекулы глюкозы образуется 2 молекулы
АТФ, то в ходе окислительного фосфорилирования при
окислении одной молекулы глюкозы образуется 38 мо-
лекул АТФ. Подробнее об этом процессе рассказано в
главе «Митохондрии и хлоропласты».
Еще одним способом синтеза АТФ является фото-
фосфорилирование — только у клеток, способных к
фотосинтезу. Источником энергии, необходимой для
проведения эндотермической реакции синтеза АТФ из
АДФ и фосфата, служит квант света, поглощаемый мо-
лекулой хлорофилла (см. главу «Митохондрии и хло-
ропласты»).
39
1. На сколько градусов поднимется температура тела челове-
ка весом 70 кг, если прогидролизовать весь его АТФ (счи-
тать теплоемкость человеческого тела равной теплоемкос-
ти воды)?
2. Обычно в клетке концентрация АТФ в несколько сотен
раз выше, чем концентрация АДФ. Какие преимущества
это дает?
3. Сколько энергии выделится при окислении 1 моля лакта-
та кислородом до воды и углекислого газа?
§ 5. Современные методы изучения клетки.
Основные черты строения клеток бактерий,
растений и животных
5.1. Световая микроскопия
Понятие «клетка» вам знакомо, вы знаете о таких ее
частях, как ядро, цитоплазма, хлоропласты. И сама клет-
ка, и ее органеллы были открыты с помощью светового
микроскопа. Но при непосредственном наблюдении в
световой микроскоп многие клеточные структуры было
довольно трудно рассматривать из-за их прозрачности, по-
этому были разработаны специальные методы окраски
(рис. 5), позволяющие получить препараты, на которых
ядро окрашено в один цвет, цитоплазма — в другой.
Другие методы позволяют окрашивать те органеллы
клетки, которые содержали определенные ферменты,
и выяснять распределение этих ферментов в клетке.
Для этого клетки обрабатывают раствором бесцветного
субстрата данного фермента, который в ходе реакции
превращается в ярко окрашенный продукт. К сожале-
нию, далеко не для всех ферментов есть такие удобные
субстраты. На рис. 6 показаны клетки, окрашенные на
фермент кислую фосфатазу. Клетки обработали рас-
твором, содержащим субстрат данного фермента и
Pb(NO3)2. Кислая фосфатаза отщепляет от своего суб-
страта фосфат, который образует с ионами РЬ2+ нера-
40
Рис. 5. Ядра разных типов клеток костного мозга мыши
створимый фосфат свинца. Затем клеточный препарат
обработали раствором Na2S, который превратил бесцвет-
ный фосфат свинца в черный PbS. В результате в тех
местах, где в клетке содержалась кислая фосфатаза, об-
разовались черные зерна, хорошо видные в микроскоп.
Рис. 6. Клетки, окрашенные на фермент кислую фосфатазу
41
5.2. Преимущества электронной микроскопии
Долгое время световой микроскоп оставался главным
инструментом для ученых, изучающих строение клет-
ки. Однако у светового микроскопа есть очень большой
недостаток: с его помощью принципиально невозможно
увидеть предметы, существенно меньшие, чем длина све-
товой волны — свет просто обогнет такие предметы, «не
заметив» препятствия. Длина волны видимого света со-
ставляет 400—800 нм (1 нанометр (нм) — одна милли-
онная доля миллиметра), и эти величины составляют
предел возможностей светового микроскопа.
У физиков возникла идея использовать вместо пуч-
ка света пучок электронов, которые могут отражаться от
мельчайших предметов, невидимых в обычный микро-
скоп. Для этого надо было создать «электронную опти-
ку». В обычном микроскопе увеличенное изображение
создается за счет системы линз, а в электронном мик-
роскопе роль линз играют магнитные и электрические
поля, управляющие движением электронов.
Электронный микроскоп был создан в 1931 г., и в
биологии началась новая эра исследований с невидан-
ными до того возможностями. Благодаря электронному
микроскопу стали видны в подробностях многие внут-
риклеточные структуры, казавшиеся в обычный микро-
скоп едва различимыми точками.
---------------------------
Квантовая механика помогла доказать двойственную кванто-
во-волновую природу материи. Французский физик Луи де
Бройль показал, что любая частица является в то же время
еще и волной; например, частица может огибать препятствия,
сопоставимые по размерам с длиной волны этой частицы,
и др. Таким образом, и для электронного микроскопа суще-
ствует предел разрешения, как и для светового микроскопа.
По уравнению де Бройля длина волны, соответствующая дан-
ной частице, определяется по формуле 1 = h/mv, где h — по-
стоянная Планка, некоторая константа, равная 6,6 • 10 34 дж*с;
т — масса частицы; v — ее скорость. Масса покоя электро-
на равна 9,1 • 10-29 г, Значит, при скорости 1,3 *10в м/с дли-
42
на волны электрона составит примерно 5 • 1012 м. Это значи-
тельно меньше, чем длина волны видимого света (примерно
6- 10 7 м). Поэтому разрешающая способность электронного
микроскопа значительно выше, чем светового, т. е. он позво-
ляет рассматривать предметы гораздо меньшего размера.
---------------------------<2^,
5.3. Метод меченых атомов
и ультрацентрифугирование
Электронный микроскоп тоже не универсальное сред-
ство исследования, и у него есть свои недостатки. Для
электронного микроскопирования препарат приходится
подвергать специальной обработке, приводящей к гибели
клеток, так что наблюдение живых клеток таким спосо-
бом невозможно. Современная биология использует и дру-
гие способы исследования, например, метод меченых ато-
мов. Часто бывает необходимо проследить за каким-либо
соединением в клетке — узнать, куда оно транспортиру-
ется, во что превращается и т. п. Исследователи научи-
лись заменять один из атомов в молекуле на радиоак-
тивный изотоп. Теперь, куда бы ни попала эта молекула,
она будет нести на себе радиоактивную «метку», которую
легко можно «выследить» с помощью счетчика радиоак-
тивных частиц или по способности засвечивать фотопла-
стинки.
Часто бывает необходимо выделить какие-нибудь от-
дельные части клеток — например, ядра или обрывки
клеточных мембран. Здесь на помощь приходит метод
ультрацентрифугирования. Фрагменты клеток обычно
имеют разные размеры и различную плотность, они осе-
дают на дно пробирки с разной скоростью. Чтобы про-
цесс оседания шел быстрее, пробирки крутят на центри-
фуге, где за счет центробежной силы, превышающей силу
тяжести, ускоряется процесс оседания всех частиц. Пер-
вые центрифуги, изобретенные в конце прошлого века,
были ручными: ученый стоял и крутил ручку, соеди-
ненную через систему зубчатых колес с вращающимся
ротором, в который помещались пробирки. Однако в
43
некоторых случаях раствор необходимо центрифугиро-
вать в течение суток и более, да вдобавок со скоростя-
ми вращения 40—50 тыс. оборотов в минуту, так что
современные ультрацентрифуги приводятся в движение
электродвигателями. (Их назвали ультрацентрифугами
за высокую скорость вращения.)
5.4. Органеллы, имеющиеся в животных
и растительных клетках
Знакомясь со строением клеток, мы двинемся не от
простого к сложному, а наоборот, начнем с более слож-
ного — клеток растений и животных. Поскольку эти
клетки обычно имеют ядро, их называют эукариотичес-
кими (эу — по-гречески «настоящий», карион —
«ядро»). Клетки бактерий не имеют четко видимого
ядра, их называют прокариотическими.
На рис. 7 показано строение типичной эукариотичес-
кой клетки. Рисунок разделен на две половины, на ле-
вой изображена типичная животная клетка (А), на пра-
вой — растительная (В).
В их строении много общего: так, и животная, и ра-
стительная клетки окружены наружной мембраной.
У обоих типов клеток есть ядро довольно сложного
строения: оно отграничено от цитоплазмы ядерной обо-
лочкой, состоящей из двух мембран, в которой имеются
поры. Поры весьма избирательны: они пропускают в
ядро и выпускают из ядра определенные вещества.
Внутри ядра имеются одно или несколько ядрышек (в
них образуются рибосомы), хроматин (нити, состоящие
из дезоксирибонуклеиновой кислоты — ДНК и белка),
а также кариоплазма — «ядерный сок», жидкое содер-
жимое ядра. Хроматин — место хранения наследствен-
ной информации и управляющая система клетки.
В ДНК особым способом закодированы белки, которые
может синтезировать клетка.
В цитоплазме и животных, и растительных клеток
имеются органеллы, окруженные двумя мембранами;
это — митохондрии, служащие энергетическими стан-
44
Рис. 7. Комбинированная схема строения эукариотической клетки
(А — животная клетка, Б — растительная):
1 — ядро с хроматином и ядрышками; 2 — плазматическая мембрана;
3 — клеточная стенка; 4 —межклеточные контакты растительных кле-
ток; 5 — шероховатая эндоплазматическая сеть; 6 — гладкая эндоплаз-
матическая сеть; 7 — пиноцитозный пузырек; 8 — аппарат Гольджи;
9 — лизосома; 10 — жировые включения в гладкой эндоплазматической
сети; 11 — центриоль и микротрубочки; 12 — митохондрии; 13 — рибо-
сомы; 14 — вакуоль; 15 — хлоропласт
циями клетки. У обоих типов клеток имеется целая си-
стема соединенных друг с другом трубочек — эндо-
плазматическая сеть, или эндоплазматический ретику-
лум. На некоторых его участках сидят рибосомы —
небольшие органеллы размером около 30 нм. Эти учас-
тки называются шероховатым ретикулумом, а те, на
которых нет рибосом,— гладким ретикулумом. Свобод-
ные рибосомы рассеяны и по цитоплазме эукариотичес-
ких клеток. Рибосомы — «молекулярные машины» для
45
синтеза белка. В цитоплазме клеток животных и расте-
ний присутствует также комплекс мембранных пузырь-
ков и цистерн — аппарат Гольджи. Наконец, имеются
специальные мембранные пузырьки — лизосомы. Эти
органеллы осуществляют внутриклеточное пищеварение.
Все перечисленные органеллы есть и у животных,
и у растительных клеток. Имеются, однако, структуры,
специфичные для каждого типа: так, растительные клет-
ки окружены плотной клеточной стенкой, которой нет
у клеток высших животных (среди простейших она
встречается). Только клетки растений имеют окружен-
ные двойной мембраной пластиды. В зеленых пласти-
дах — хлоропластах — происходит фотосинтез. Встре-
чаются также неокрашенные пластиды — лейкопласты,
и оранжево-красные хромопласты. Наконец, в клетках
растений часто есть вакуоль. Зато в животных клетках
имеется центриоль — органелла, принимающая важное
участие в процессе клеточного деления, которая отсут-
ствует у высших растений.
Словом «органелла» называют отдельные части
клетки, ее «органы» (органелла в переводе и значит
«маленький орган»).
5.5. Строение прокариотической клетки
Клетки прокариот (бактерий) устроены намного про-
ще и имеют меньшие размеры (рис. 8); у них тоже есть
мембрана — обязательный элемент любой клетки (не-
которые бактерии имеют две мембраны, наружную и
внутреннюю). Клетки прокариот всасывают питательные
вещества всей поверхцостью. Над мембраной обычно
расположена клеточная стенка (у внутриклеточных па-
разитов она иногда отсутствует). Имеется один или не-
сколько жгутиков, но многие бактерии их лишены.
В центральной части цитоплазмы есть некий более плот-
ный участок, плохо различимый под микроскопом. Это
нуклеоид — область клетки, содержащая нуклеиновую
кислоту; настоящего ядра с оболочкой нет. В цитоплаз-
46
клеточная мембрана
Рис. 8. Прокариотическая клетка. Строение клетки бактерии
кишечной палочки и более мелких бактерий
ме есть рибосомы. У некоторых прокариотических
клеток имеются внутриклеточные мембранные органо-
иды, но в целом для прокариот они не характерны —
47
наличие внутриклеточных мембран свойственно эука-
риотам.
5.6. Вирусы
Кроме клеток, в природе существуют и более про-
стые организмы — вирусы. Все вирусы — внутрикле-
точные паразиты, они могут размножаться только внут-
ри клетки-хозяина. После проникновения в клетку ви-
рус заставляет ее синтезировать не клеточные,
а вирусные белки и нуклеиновые кислоты, что приво-
дит к гибели клетки и появлению все новых и новых
вирусных частиц. Вирусы состоят из нуклеиновых кис-
лот и белков, некоторые имеют еще и наружную мемб-
рану. Вирусы могут паразитировать на различных клет-
ках: одни на клетках прокариот, другие на клетках ра-
стений, третьи — животных. Вирусы, размножающиеся
в клетках человека, вызывают целый ряд опасных забо-
леваний, среди которых — грипп, корь, бешенство, оспа,
СПИД и др. Важнейшим отличием вируса от клетки
является отсутствие собственной системы синтеза бел-
ка: у вирусов нет рибосом, они заставляют работать на
себя клеточные рибосомы.
; У 1. Какой микроскоп позволяет рассматривать наиболее мел-
кие объекты: световой, инфракрасный или ультрафиолето-
вый?
2. В одну клетку ввели АТФ, меченый радиоактивным 32Р
по последнему, третьему остатку фосфорной кислоты, а в
другую — АТФ, меченый 32Р по первому, ближайшему к
рибозе остатку. Через 5 мин в обеих клетках померили со-
держание неорганического фосфат-иона, меченого 32Р. Где
оно окажется значительно выше?
3. В процессе деления у эукариотической клетки исчезает
ядерная оболочка. По каким признакам ее можно отли-
чить от прокариотической?
4. Существуют ли клетки, в которых одновременно могут
присутствовать хлоропласты и центриоли?
48
1. Вода является абсолютно необходимым веществом для
всех известных форм жизни. Она служит универсальным ра-
створителем для многочисленных соединений, участвующих в
клеточном метаболизме. Свойства воды определяются строени-
ем ее молекулы. Связи атомов кислорода и водорода в ней
поляризованы, на атомах водорода имеется частичный положи-
тельный заряд, а на атомах кислорода — отрицательный. Это
позволяет молекулам воды образовывать друг с другом водо-
родные связи. По отношению к воде вещества можно разде-
лить на гидрофильные и гидрофобные. Гидрофильные вещества
содержат ионные или сильно полярные связи. Они или раство-
ряются в воде, или смачиваются ею: их растворимость зависит
от того, какие взаимодействия окажутся сильнее — молекул
вещества с Молекулами воды или же друг с другом. Гидрофоб-
ные вещества не растворяются в воде и не смачиваются ею,
их молекулы не образуют связей с молекулами воды.
2. Живая клетка содержит большое количество различных
органических и неорганических соединений. В ее цитоплазме
поддерживается pH около 7, в различных органеллах он может
отличаться от этого значения. Растворенные в воде молекулы
перемещаются по клетке путем диффузии. Клеточная мембрана
непроницаема для многих веществ, содержащихся внутри клет-
ки, следовательно, если мы поместим клетку в воду с малым
содержанием растворенных веществ, то вода будет диффунди-
ровать в клетку, «распирая» ее изнутри. Такая односторонняя
диффузия называется осмосом, а возникающее при этом внут-
реннее давление — осмотическим давлением.
3. Важнейшими органическими соединениями, входящими в
состав клетки, являются липиды, углеводы, белки и нуклеино-
вые кислоты. Липиды — небольшие молекулы. Основными клас-
сами липидов являются фосфолипиды, нейтральные жиры и сте-
роиды. Молекулы фосфолипидов содержат гидрофильную «голов-
ку» и два гидрофобных «хвоста». Благодаря такому строению
в водной среде фосфолипиды образуют двойной слой, в кото-
ром «головки» их молекул обращены к воде, а «хвосты» —
друг к другу. Липидный бислой составляет основу всех биологи-
ческих мембран, фосфолипиды выполняют главным образом
структурную функцию. Нейтральные жиры, имеющие гидрофоб-
ные молекулы, обычно служат запасными питательными веще-
4 Зак. 13485
49
ствами и выполняют энергетическую функцию. К классу стеро-
идов (их молекулы тоже гидрофобны) принадлежат некоторые
гормоны, их функция регуляторная.
К углеводам принадлежат моносахариды, примером которых
могут служить глюкоза и фруктоза, и полисахариды, к которым
относятся крахмал и целлюлоза. Полисахариды обычно постро-
ены из повторяющихся звеньев моносахарида одного типа. Угле-
воды выполняют две основные функции — структурную и энер-
гетическую.
4. Белки выполняют в организме и в клетке несколько важ-
нейших функций, а именно: структурную, каталитическую, дви-
гательную, транспортную, энергетическую, защитную, рецептор-
ную, регуляторную. Белки — полимеры, состоящие из амино-
кислот. В синтезе белков участвуют 20 аминокислот, но потом
некоторые из них подвергаются химическим модификациям, так
что в составе белков известно более 30 различных аминокис-
лотных остатков. Аминокислоты могут иметь различные свой-
ства в зависимости от состава бокового радикала: кислые, ще-
лочные, гидрофобные и гидрофильные.
Аминокислоты соединены в белках пептидной связью, кото-
рая образуется между МН2-группой одной аминокислоты и СО-
ОН-группой другой. Последовательность аминокислот в белко-
вой молекуле называется первичной структурой белка. Всего
белки могут содержать от нескольких единиц до нескольких
тысяч аминокислотных остатков. Полипептидная цепочка про-
должает укладываться, и в ходе этого процесса формируется
вторичная структура (за счет водородных связей между группа-
ми NH и СО) и третичная структура (за счет водородных, ион-
ных и гидрофобных взаимодействий между различными группа-
ми, а также S-S-связей). Отдельные полипептидные цепочки
иногда связываются друг с другом, образуя четвертичную струк-
туру, которая стабилизируется теми же связями, что и третич-
ная. Пространственная укладка белковой молекулы называется
конформацией.
Белки обладают способностью весьма специфично связывать
определенные вещества: ферменты — субстраты катализируе-
мой реакции, рецепторы — свои гормоны. Такая* специфичность
достигается благодаря тому, что различным группам субстрата
(или гормона) в активном центре фермента (или рецептора)
соответствуют те группы, которые могут образовывать с ними
водородные, ионные или гидрофобные связи. Конформация бел-
50
ка после связывания с низкомолекулярными веществами или
с другими белками может сильно измениться.
5. В живой клетке постоянно происходит обмен веществ —
метаболизм, в процессе которого должны осуществляться как
экзотермические, так и эндотермические реакции. Для того,
чтобы последние могли протекать, они сопрягаются с сильно
экзотермической реакцией гидролиза АТФ. АТФ служит глав-
ным источником энергии для клетки. За счет энергии его гид-
ролиза протекают такие процессы, как синтез необходимых клет-
ке веществ, движение и активный транспорт через мембрану.
Синтез АТФ из АДФ и фосфата происходит в результате трех
основных процессов: анаэробных процессов, окислительного фос-
форилирования и фотофосфорилирования (последнее идет толь-
ко у фотосинтезирующих организмов). Анаэробные процессы
энергетически менее выгодны, чем окислительное фосфорилиро-
вание: так, в ходе гликолиза и спиртового брожения при утили-
зации одной молекулы глюкозы образуется 2 молекулы АТФ,
а в ходе аэробного окисления — 38. Анаэробные процессы
синтеза АТФ протекают обычно в цитоплазме, окислительное
фосфорилирование — в митохондриях, а фотофосфорилирова-
ние — в хлоропластах.
6. Одним из наиболее распространенных методов изучения
клеточного строения остается световая микроскопия. Некоторые
варианты этого метода позволяют вести прижизненное наблю-
дение клеток, другие варианты требуют проведения жесткой об-
работки, убивающей клетку, зато дают возможность добиться
лучшего различения деталей. Еще одним важнейшим методом
исследования является электронная микроскопия, которая обес-
печивает значительно большее увеличение, чем световая, но
наблюдение живых клеток в электронный микроскоп невозмож-
но. Для изучения транспорта и превращений различных моле-
кул в клетке часто используют метод меченых атомов. Для вы-
деления отдельных фрагментов клетки и ее органелл применя-
ют центрифугирование.
7. По особенностям своей структуры клетки делятся на два
типа: эукариотические, имеющие ядро, и прокариотические, ли-
шенные его. К эукариотическим относятся клетки животных, ра-
стений, грибов и протистов, а к прокариотическим — бактери-
альные клетки. В состав эукариотической клетки входят такие
органеллы, как наружная мембрана, ядро, митохондрии, рибосо-
мы, эндоплазматическая сеть, аппарат Гольджи, лизосомы. Кро-
51
ме того, растительные клетки имеют пластиды, из которых наи-
более важными являются хлоропласты, а также вакуоль и кле-
точную стенку, а животные — центриоли. Прокариотическая
клетка содержит рибосомы, наружную мембрану, часто имеет
клеточную стенку. Внутриклеточные мембранные органеллы для
нее не характерны. Клетки прокариот всасывают питательные
вещества всей поверхностью.
Тлава 2
МЕМБРАННАЯ СИСТЕМА КЛЕТКИ
§ 6. Наружная мембрана клетки
6.1. Функции наружной мембраны
Толщина клеточной мембраны составляет 7—8 нм.
Наружная мембрана обеспечивает целостность клетки,
отграничиваая ее от окружающей среды. Через мемб-
рану клетка поглощает необходимые ей вещества из ок-
ружающей среды и выделяет ненужные. С помощью
мембраны в клетке поддерживается постоянная кон-
центрация определенных ионов: так, внутри клетки
значительно выше концентрация иона К+, чем снару-
жи, а концентрация ионов Na+ — наоборот, значитель-
но ниже (см. табл. 1). Поддерживать эту разницу по-
могает мембрана.
У многоклеточных организмов мембрана служит не
только самой клетке, но и обеспечивает интеграцию все-
го организма: с йомощью мембран клетки «узнают»
друг друга, соединяются друг с другом, реагируют на
сигналы от других клеток. Так, печень представляет
собой довольно плотный орган. Ее не очень просто раз-
дробить на отдельные кусочки. Это происходит благода-
ря тому, что мембраны клеток печени «узнают» друг
друга и тесно сцепляются, обеспечивая прочную связь
52
каждой клетки с соседними. А вот мембраны эритро-
цитов не соединяются прочно ни с какими соседями,
да им это и не нужно: эти клетки должны свободно
плавать в крови. Через мембрану клетка воспринимает
«команды», посылаемые ей организмом: например, на
мембране расположены рецепторы многих гормонов
и нейромедиаторов — веществ, передающих сигнал от
нейрона к нейрону или мышечной клетке.
6.2. Свойства липидного бислоя
Как уже говорилось, все клеточные мембраны состоят
из липидов и белков, и фосфолипиды при формировании
мембраны образуют бислой. То, что эти молекулы в мем-
бране действительно расположены в два слоя, было по-
казано с помощью простого, изящного эксперимента.
Вычислили площадь поверхности эритроцитов — кле-
ток, имеющих постоянные размеры и форму. Известное
число эритроцитов отделили от остальных клеток крови
и экстрагировали липиды их наружной мембраны (внут-
ренних мембран у эритроцитов практически нет). Затем
эти фосфолипиды вылили на поверхность воды, где они
образовали пленку. Когда площадь этой пленки умень-
шили так, чтобы фосфолипиды создавали сплошной мо-
нослой, то оказалось, что его площадь была в два раза
больше заранее известной площади поверхности клеток.
Рассмотрим свойства липидного бислоя. Он представ-
ляет собой вовсе не жесткую, твердую структуру, а ско-
рее напоминает тоненькую текучую пленку между дву-
мя объемами водной среды. Липидный бислой легко
прогибается и выгибается при самых незначительных
усилиях, он не может образовать опорного «скелета».
Этот бислой непроницаем для заряженных ионов: они
не могут «протолкаться» через гидрофобные хвосты
фосфолипидов. Он также непроницаем для крупных
молекул — белков, углеводов, нуклеиновых кислот и для
гидрофильных молекул средней величины — глюкозы,
аминокислот и промежуточных продуктов обмена. Од-
53
нако бислой все же проницаем для воды: молекулы
воды очень маленькие и в них нет настоящих заря-
дов; проницаем он и для небольших гидрофобных мо-
лекул.
6.3. Модель «липидного озера»
Рассмотрение свойств липидного бислоя показывает,
что он может хорошо выполнять функцию отграниче-
ния клетки от окружающей среды, поскольку большин-
ство веществ не проходят через него. Но как же мемб-
рана выполняет остальные свои функции? Дело в том,
что в биологических мембранах кроме липидов имеются
еще и белки. В настоящее время общепринятой моде-
лью структуры мембраны является модель «липидного
озера», согласно которой в «липидном озере» (мембра-
не) плавают айсберги — белки (рис. 9). Некоторые из
них выступают по обе стороны мембраны, пронизывая ее
насквозь; другие «прилеплены» только к внутренней
или только к наружной стороне. Как вы помните, мем-
брана — не жесткая структура, а тоненький текучий
слой. Мембранные белки могут свободно перемещаться
путем диффузии по всей плоскости мембраны.
Как было пояснено в главе 1, специальные белки мо-
гут специфически связывать различные вещества. Это
дает возможность выполнять функции распознавания
химических сигналов от других клеток, интеграции мно-
гих клеток в единый орган, специфического переноса
через мембрану таких веществ, которые не проникают
через бислой. Расположенные на мембране ферменты
могут активно «перекачивать» через нее различные ве-
щества против градиента их концентраций: используя
энергию АТФ, они активно «накачивают» в клетку те
вещества, которых внутри нее больше, чем снаружи;
другие ферменты способны «выкачивать» оттуда ненуж-
ные клетке вещества.
Белки, пронизывающие мембрану и находящиеся по
разные ее стороны, часто выполняют различные функ-
54
Рис. 9. Строение клеточной мембраны согласно модели
♦липидного озера»
ции. Интегральные белки, проникающие сквозь мемб-
рану, иногда участвуют в транспорте веществ. Белки, об-
ращенные внутрь, часто выполняют важные регулятор-
ные функции. Многие из обращенных наружу белков
«узнают» поверхность соседних клеток, именно благода-
ря им клетки формируют цельные органы и ткани.
6.4. Ионные каналы и ионные насосы
Особая группа транспортных белков мембраны —
ионные каналы и ионные насосы. Они создают мемб-
ранный потенциал. На мембранах любых клеток (и уж,
конечно, нервных и мышечных) обнаруживается раз-
ность потенциалов: электрические заряды по разные
стороны мембраны неодинаковы, что связано с разными
концентрациями различных ионов внутри и снаружи
клетки. В проведении нервного импульса и ряде дру-
гих клеточных процессов особую роль играют два
иона — калия и натрия. Натрия много снаружи и ма-
ло внутри клеток; для калия картина обратная. Как
обеспечивается эта разность концентраций? Специаль-
ный мембранный белок — натрий-калиевая АТФ.-аза
55
(читается: «атээфаза») — выталкивает наружу Na+
и закачивает внутрь К+. Делает она это активно: ионы
движутся против градиента концентрации. Естественно,
при этом затрачивается энергия, запасенная в виде
АТФ: транспортный белок сам расщепляет АТФ в про-
цессе переноса ионов через мембрану. Заряд же на мем-
бране возникает потому, что при расщеплении одной
молекулы АТФ фермент выкачивает три иона Na+ и за-
качивает два иона К+. Нетрудно сообразить, что снару-
жи клетки мембрана заряжена положительно, внутри —
отрицательно. (На самом деле образование мембранно-
го потенциала представляет собой значительно более
сложный процесс; за счет работы натрий-калиевой
АТФ-азы образуется меньшая часть потенциала, чем за
счет других механизмов.) У животных клеток в сос-
тоянии покоя разность потенциалов на мембране со-
ставляет около -75 мВ.
Есть и белки, которые осуществляют пассивный
транспорт, т. е. движение без затрат энергии, просто по
градиенту концентрации. Таким способом переносятся
через мембрану некоторые ионы, например С1*. Белки,
пассивно переносящие ионы без затрат энергии, называ-
ются ионными каналами. Путем пассивного транспор-
та проходит в большинство клеток глюкоза. Сквозь ли-
пидный бислой молекулы глюкозы проникнуть не мо-
гут, их переносит специальный белок. В клетке обычно
содержится мало глюкозы (она расходуется на синтез
разных веществ и на получение энергии), а в плазме
крови — много, и по градиенту концентрации глюкоза
проникает снаружи. Но для всасывания глюкозы из
кишечника в кровь ирпользуется активный транспорт.
6.5. Особенности различных клеточных мембран
Липидный бислой образует основу всех клеточных
мембран, а вот белки в разных органеллах различные:
так, описанные выше рецепторы гормонов, натрий-кали-
евая АТФ-аза, глюкозный переносчик и прочие распо-
56
ложены на наружной мембране клетки, на мембранах
митохондрий расположены другие белки, нужные для
работы митохондрий, на мембранах лизосом — свои
белки и т. п.
С помощью специальных белков клетка умеет отде-
лять от мембран небольшие пузырьки, умеет она и сли-
вать такие пузырьки с мембраной. Благодаря этим про-
цессам может осуществляться «перетекание» мембран-
ных пузырьков от одних органелл к другим.
6.6. Особенности ядерной мембраны
В клетках эукариот ядро окружено двумя мембра-
нами. Во время клеточного деления — митоза —
ядерная оболочка как бы распадается на отдельные
мембранные пузырьки, но в промежутке между кле-
точными делениями две мембраны отграничивают
ядро от остальной цитоплазмы. В ядре имеются свои
белки, нужные* именно там, а не в цитоплазме. Эти
белки попадают в ядро через специальные ядерные
поры, представляющие собой сложный белковый ком-
плекс, который служит для транспорта в ядро необхо-
димых ему белков. В ядре имеется свой специфичес-
кий набор белков, необходимых для выполнения им
своих функций: например, ДНК-полимераза, РНК-по-
лимераза, гистоны и т. д. (о их роли см. главу «На-
следственная информация и ее реализация в клет-
ке»). Все эти белки синтезируются на рибосомах в
цитоплазме и переносятся в ядро через ядерные
поры. Первичная структура всех ядерных белков об-
наруживает особую последовательность аминокислот,
которой нет у белков других органелл. Ядерные поры
«узнают» эту последовательность и переносят белки с
такой «меткой» в ядро, а белки, не имеющие этой
последовательности, остаются в цитоплазме. Как
именно ядерные поры делают эту сложную работу,
пока неизвестно.
57
Bl. Как вы считаете, может ли кислород проникать через ли-
пидный бислой?
2. В большинстве клеток человека транспорт глюкозы про-
исходит пассивно. Но в клетках эпителия кишечника
имеется специальный переносчик, осуществляющий актив-
ный транспорт. Зачем природа создала эту особую систе-
му?
3. Какие вещества входят, а какие выходят через ядерные
поры?
§ 7. Эндоплазматический ретикулум (ЭПР).
Аппарат Гольджи. Лизосомы
7.1. Синтез разных белков на шероховатом ЭПР
и на цитоплазматических рибосомах
ЭПР представляет собой систему полостей, цистерн
и каналов, отгороженных от остальной цитоплазмы мем-
браной и соединяющихся друг с другом. Эндоплазмати-
ческая сеть — «государство в государстве»: все ее поло-
сти и цистерны непрерывно соединены, но нигде не от-
крываются ни в цитоплазму, ни во внеклеточную среду.
Более того, и пространство между двумя ядерными мем-
бранами является частью эндоплазматической сети, оно
также нигде не соединено ни с цитоплазмой, ни с яд-
ром.
Как уже упоминалось, часть рибосом свободно пла-
вает в цитоплазме, а другая часть «сидит» на ЭПР.
Зачем нужно разделение рибосом на две группы? Ока-
залось, что эти рибосомы синтезируют разные белки.
На свободно плавающих’ рибосомах синтезируются бел-
ки цитоплазмы, ядра и некоторые белки митохондрий
и хлоропластов (остальные белки этих двух органелл
синтезируются на их собственных рибосомах). На рибо-
сомах шероховатого ЭПР синтезируются белки самого
ретикулума, аппарата Гольджи, лизосом, наружной мем-
браны и белки, секретируемые клеткой. Белки, которые
58
синтезируются на рибосомах шероховатого ЭПР, сразу
же попадают в полость ретикулума. Хотя рибосомы
расположены на наружной (т. е. цитоплазматической)
стороне мембраны ЭПР, белок прямо в процессе синтеза
«проталкивается» через эту мембрану во внутреннее
пространство ретикулума. Уже потом из ЭПР белки
попадут в аппарат Гольджи, лизосомы, на наружную
мембрану или будут секретированы, но первым этапом
их внутриклеточного путешествия служит эндоплазма-
тический ретикулум. Белки, которые должны синтези-
роваться на рибосомах шероховатого ЭПР и попасть
в полость ретикулума, содержат на N-конце особую пос-
ледовательность аминокислот — лидерный пептид. Эта
последовательность служит как бы специальной меткой,
благодаря которой клетка «распознает», какие белки
должны попасть в полость ЭПР, а какие нет (как имен-
но она это делает, объяснено позже).
7.2. Транспорт мембранных пузырьков от ЭПР
к аппарату Гольджи
Помимо рассмотренной лишь одной функции эндоп-
лазматической сети — участия в транспортировке бел-
ков ко многим другим органеллам, у нее есть и другие
важные функции. Пожалуй, важнейшая из них — син-
тез клеточных мембран. Мембраны всех клеточных орга-
нелл, кроме митохондрий и хлоропластов, синтезируют-
ся в эндоплазматической сети. Ядерная мембрана, мож-
но сказать, образована самой эндоплазматической сетью.
К другим органеллам мембранный материал доставля-
ется благодаря тому, что от эндоплазматической сети все
время отшнуровываются небольшие мембранные пу-
зырьки (рис. 10). Эти пузырьки переносятся к аппара-
ту Гольджи и сливаются с ним.
От аппарата Гольджи также отшнуровываются мемб-
ранные пузырьки: одни образуют лизосомы, другие сли-
ваются с наружной мембраной. Путь мембранных пу-
59
Рис. 10. Отшнуровывание мембранных пузырьков от цистерн эндо-
плазматической сети (ЭПР) и слияние их с пузырьками аппарата
Гольджи (АГ)
зырьков можно представить себе таким, как на рис. 11.
Внутри этих пузырьков переносятся и §елки. Из эндо-
плазматической сети они попадают в аппарат Гольджи,
а оттуда — в нужную органеллу: лизосомальные бел-
ки — в лизосому, секретируемые — в специальный
пузырек, который затем сольется с наружной мембра-
ной так, что его содержимое будет выброшено наружу.
ЭПР -----►
Аппарат
Гольджи
Первичные
лизосомы
Секреторные
пузырьки
Рис. 11. Клеточный транспорт мембранных пузырьков с белками
от ЭПР
60
7.3. Другие функции ЭПР в клетке
Еще одной важной функцией эндоплазматической
сети является модификация белков. Эндоплазматичес-
кая сеть умеет, например, присоединять к белкам угле-
водные остатки (как упоминалось, кроме «чистых» бел-
ков, бывают и гликопротеины).
У эндоплазматической сети есть и такая функция
(правда, не во всех типах клеток), как запасание ионов
Са2+. В состоянии покоя в цитоплазме клетки ионов
Са2+ содержится около 10 7 М, а в' полости эндоплазма-
тической сети — 2—3 • 10-3 М. Ионы Са2+ закачива-
ются в полость эндоплазматической сети специальным
ферментом — Са2+-АТФ-азой, естественно, за счет энер-
гии АТФ. Ведь перекачка идет оттуда, где Са2+ мало,
туда, где его много, следовательно, затраты энергии необ-
ходимы. Функция запасания Са2+ особенно важна для
мышечных клеток (сокращение мышцы мы рассмотрим
ниже).
7.4. Строение и функции аппарата Гольджи
Следующей органеллой является аппарат Гольджи.
Он представляет собой целую систему мембранных пу-
зырьков, не образующих внутри клетки единого про-
странства. Внутренность этих пузырьков нигде не со-
единяется с цитоплазмой, но, в отличие от эндоплазма-
тической сети, не образует единой непрерывной
системы: связь между разными частями аппарата Голь-
джи осуществляется благодаря тому, что от одних его
частей отшнуровываются мембранные пузырьки и сли-
ваются с другими частями. Аппарат Гольджи выполня-
ет две очень важные функции: во-первых, он сортирует
все попавшие в него белки, а во-вторых, модифициру-
ет их. Вторая функция похожа на такую же эндоплаз-
матического ретикулума, хотя конкретные химические
реакции, идущие в этих двух органеллах, различаются.
Сортировка белков в аппарате Гольджи происходит
по двум признакам: функциональная и пространствен-
61
ная. От аппарата ольджи отшнуровываются мембран-
ные пузырьки, из которых одни сливаются с наруж-
ной мембраной, а другие превращаются в лизосомы.
Естественно, в них должны попадать разные белки,
и аппарат Гольджи сортирует белки в соответствии
с их функцией: лизосомальные — в лизосомы, секре-
тируемые — в секреторные пузырьки (как он это де-
лает, мы рассмотрим чуть позже). Что же касается про-
странственной сортировки, то иногда клетки имеют раз-
личающиеся полюса. Например, в клетках эпителия
кишечника одна сторона обращена в просвет кишки,
а другая — к кровеносному сосуду. Их поверхности
сильно различаются (одна покрыта ворсинками, дру-
гая — нет); естественно, различаются белки, располо-
женные на разных поверхностях. Аппарат Гольджи как
раз и сортирует белки пространственно: одни отправ-
ляет к одному полюсу, другие — к другому. Впрочем,
процесс пространственной сортировки в разных клет-
ках протекает по-разному: в некоторых клетках белки
распределяются по полюсам уже на мембране, тогда
как в других главная роль принадлежит аппарату
Гольджи.
7.5. Механизм транспорта белков в лизосомы
Каким же образом аппарат Гольджи узнает, какой
белок надо поместить в лизосому, а какой — нет? Дело
в том, что все белки, которые будут транспортироваться
в лизосомы, имеют в своем составе определенную после-
довательность аминокислот. Эта последовательность слу-
жит как бы сигналом: «поместите меня в лизосому».
Особые белки в аппарате Гольджи распознают этот сиг-
нал и направляют содержащие его полипептидные це-
почки в лизосомы, а не содержащие — в секреторные
пузырьки. На мембранах лизосом содержится специ-
альный фермент, который накачивает в лизосому ионы
Н+ за счет энергии АТФ. Благодаря деятельности этого
фермента среда в лизосомах кислая (pH около 4,5—5).
62
В аппарате Гольджи имеется специальный фермент, который
узнает лизосомальную последовательность и прикрепляет
к белку моносахаридный остаток — маннозо-6-фосфат. На
мембране аппарата Гольджи есть особый белок — рецептор
маннозо-6-фосфата. Белки с маннозо-6-фосфатом (т. е. бу-
дущие лизосомальные) связываются с рецептором (рис. 12).
Рецепторы маннозо-6-фосфата вместе со связанными белками
попадают в специальные пузырьки, которые отшнуровывают-
ся от мембраны. В этих пузырьках будут находиться и лизо-
сомальные белки, связанные с рецептором маннозо-6-фосфа-
та. На мембране этих пузырьков имеется фермент, закачива-
ющий внутрь их ионы водорода Н+ (разумеется, закачивает
он их за счет энергии АТФ). Внутри пузырька среда стано-
вится кислой, а в кислой среде лизосомальные белки отделя-
ются от рецептора маннозо-6-фосфата. Теперь лизосома уже
готова к работе, но на мембране еще остаются рецепторы
маннозо-6-фосфата. Было бы непростительным расточитель-
ством терять их при образовании каждой новой лизосомы,
и природа такого расточительства не допустила: рецепторы
маннозо-6-фосфата собираются в определенных участках
Рис. 12. Транспорт белков в ли-
зосомы (а — будущий лизосом-
ный блок; б — маннозо-6-фос-
фат; в — аппарат Гольджи; г —
рецептор маннозо-6-фосфата;
д —отшнуровавшийся от аппа-
рата Гольджи пузырек; е — пер-
вичная лизосома; ж — зрелый
лизосомный белок):
1 — транспорт из ЭПР; 2 —
присоединение маннозо-6-фос-
фата; 3 — связывание с рецеп-
тором маннозо-6-фосфата; 4 —
рецепторзависимый транспорт;
5 — отделение белка от рецеп-
тора при кислом pH; 6 — АТФ-
зависимый транспорт ионов Н+
в лизосому; 7 — возвращение
рецептора маннозо-6-фосфата
63
мембраны лизосомы, от нее отшнуровываются специальные
пузырьки с этими рецепторами, которые затем сливаются с
мембранами аппарата Гольджи, и рецепторы готовы к ново-
му использованию для образования следующей лизосомы.
Вопрос для размышления. В клетке произошла мутация, в
результате которой все лизосомальные ферменты перестали
попадать в лизосомы; однако если в полость аппарата Голь-
джи ввести лизосомальные ферменты из здоровой клетки, то
они окажутся в лизосомах. Какой фермент был поврежден
в результате мутации?
----------------------------
7.6. Процессы фагоцитоза и пиноцитоза
Итак, мы получили мембранный пузырек с лизосо-
мальными ферментами, внутри которого кислая среда —
именно в кислой среде лизосомальные ферменты наибо-
лее активны. Такой пузырек называется первичной ли-
зосомой. В лизосоме содержится большое количество
ферментов, которые могут расщеплять самые различные
вещества: белки, липиды, полисахариды и др. Вполне
Рис. 13. Фагоцитоз пищевой частицы
64
логично, что лизосомальная мем рана отделяет эти фер-
менты от других частей клетей: они просто-напросто
разрушили бы ее.
Рассмотрим, как работает лизосома. Многие живот-
ные клетки .обладают способностью к фагоцитозу
(рис. 13). Фагоцитоз — это «поедание» клеткой какой-
либо крупной частицы, например бактерии. В процессе
фагоцитоза клетка выпускает отростки — псевдоподии,
которыми она окружает эту частицу. Затем мембраны,
разделявшие отростки, исчезают, и частица оказывается
заключенной внутрь мембранного пузырька — фагосо-
мы. Размер фагосом — от 250 нм и больше. Кроме фа-
гоцитоза существует процесс пиноцитоза, к которому
способны почти все эукариотические клетки. При пи-
ноцитозе от мембраны отшнуровываются внутрь клетки
выброс продуктов
переваривания
уничтожение и перева-
ривание
Рис. 14. Образование вторичной лизосомы
5 Зак. 13485
65
небольшие пузырьки, так называемые эндосомы. Они
меньше фагосом (их размер до 150 нм) и обычно не
содержат крупных частиц.
После образования фагосомы или эндосомы к ней
подходит первичная лизосома (рис. 14) и эти два мем-
бранных пузырька сливаются. Образовавшаяся органел-
ла носит название вторичной лизосомы.
7.7. Образование вторичных лизосом
Во вторичной лизосоме есть пищеварительные
ферменты, кислая среда (все это благодаря первичной
лизосоме) и макромолекулы, которые можно расщеп-
лять (крупные пищевые частицы из фагосомы или
растворенные во внеклеточной жидкости молекулы,
попавшие в эндосому). Пищеварительные ферменты
будут расщеплять те макромолекулы, которые оказа-
лись во вторичной лизосоме, а продукты расщепле-
ния — аминокислоты, моносахариды и прочие полез-
ные вещества — будут транспортироваться через ли-
зосомальную мембрану в цитоплазму клетки.
Непереваренные остатки иногда выбрасываются из
клетки путем слияния вторичной лизосомы с наруж-
ной мембраной, а иногда остаются в клетке до самой
ее смерти.
Лизосомы могут расщеплять не только частицы,
попавшие извне, — они способны переваривать соб-
ственные «состарившиеся» и неработающие органел-
лы, например митохондрии. Каким образом лизосо-
мы различают органеллы плохие и хорошие — неиз-
вестно. Наконец, лизосомы могут использоваться для
саморазрушения клетки. Вы помните, что в процес-
се метаморфоза головастика в лягушку у него исче-
зает хвост. Хвост не отваливается от головастика,
просто в клетках хвоста нарушается целостность ли-
зосомальных мембран, ферменты лизосом выходят
в цитоплазму и переваривают клетку изнутри.
66
Bl. На каких рибосомах синтезируются следующие белки:
а) пепсин;
б) глобин;
в) Ма+/К+-АТФ-аза?
2. В процессе митоза ядерная мембрана исчезает. Как вы
думаете, она растворяется, или же просто ее фрагменты
больше не окружают ядро?
3. В каких клетках сильнее развит аппарат Гольджи: в
клетках слюнных желез, в мышечных клетках или в нер-
вных?
4. Какие из клеток обладают большей фагоцитирующей ак-
тивностью: гепатоцит, клетка эпителия кишечника или
макрофаг?
5. Раствор аммиака сильно угнетает способность лизосом пе-
реваривать попавшие в них частицы. Почему?
1. Клеточная мембрана выполняет несколько важнейших
функций: отграничение от окружающей среды, транспорт необ-
ходимых веществ и выведение ненужных, соединение клеток
в целостные органы и ткани, прием сигналов от других клеток.
Мембрана представляет собой липидный бислой, в котором пла-
вают белки. Это не жесткая структура, она легко изгибается
наружу и вовнутрь клетки. Через липидный бислой не могут
проникать крупные полимерные молекулы (белки, нуклеиновые
кислоты, углеводы), гидрофильные молекулы средних размеров
(аминокислоты, глюкоза) и заряженные ионы (Na+, К+, Са2+, CI-
и др.), но проникают небольшие гидрофобные молекулы и во-
да. Транспорт гидрофильных молекул через мембрану осуществ-
ляется специальными белками-переносчиками. Он может быть
пассивным (т. е. без энергетических затрат, при этом вещества
могут перемещаться только из области с большей концентраци-
ей в область с меньшей концентрацией) и активным (т. е. с
затратами энергии, при этом вещества могут перемещаться про-
тив градиента концентрации).
2. Ядро окружено двойной мембраной, в которой белковые
комплексы образуют специальные поры. Через эти поры в ядро
транспортируются белки, необходимые для его работы.
67
3. Эндоплазматический ретикулум (ЭПР) представляет собой
систему полостей, цистерн и каналов, отгороженных от осталь-
ной цитоплазмы мембраной и соединяющихся друг с другом,
причем полости всех цистерн ЭПР образуют единое простран-
ство, соединенное с пространством между двумя ядерными
мембранами, но не связанное ни с цитоплазмой, ни с внутри-
ядерной средой, ни с внеклеточной жидкостью. ЭПР бывает
двух типов: гладкий и шероховатый, названный так из-за сидя-
щих на его мембране рибосом. Основными функциями ЭПР
являются следующие: транспорт белков в аппарат Гольджи, из
которого они затем попадают в лизосомы или секреторные
пузырьки; синтез клеточных мембран; химические модификации
белков, попадающих в полость ЭПР; запасание ионов Са2+ (не
у всех типов клеток).
На рибосомах шероховатого ЭПР синтезируются белки, сек-
ретируемые клеткой, белки наружной мембраны, лизосомные
белки, белки аппарата Гольджи и белки самого ЭПР. На цитоп-
лазматических рибосомах синтезируются белки цитоплазмы, ядра
и некоторые белки митохондрий и хлоропластов. Белки, синте-
зируемые на рибосомах шероховатого ЭПР, содержат на hl-
конце специальную последовательность аминокислот — так на-
зываемый лидерный пептид. Особые рецепторы узнают эту пос-
ледовательность и обеспечивают транспорт несущего ее белка
в полость ЭПР, где она вскоре удаляется.
От ЭПР постоянно отшнуровываются мембранные пузырьки,
которые подходят к аппарату Гольджи и сливаются с его цис-
тернами. Таким способом происходит транспорт мембранного
материала, синтезированного гладким ЭПР, и белков, синтези-
рованных рибосомами шероховатого ЭПР, к аппарату Гольджи.
4. Аппарат Гольджи представляет собой систему замкнутых
мембранных пузырьков, не образующих единого пространства.
Сообщение между разными частями аппарата Гольджи осуще-
ствляется благодаря тому, что от одних его частей отшнуровы-
ваются мембранные пузырьки и сливаются с другими частями.
Эта органелла выполняет две важные функции: во-первых, она
сортирует все попавшие в нее белки, а во-вторых, химически
модифицирует их. Аппарат Гольджи производит сортировку бел-
ков как по органеллам, где они должны находиться (т. е. на-
правляет одни белки в лизосомы, а другие в секреторные пу-
зырьки), так и по пространственному положению в клетке: в
поляризованных клетках он направляет одни белки к одному
68
концу, другие — к другому, но иногда эта сортировка происхо-
дит уже на наружной мембране.
5. Все лизосомные белки имеют в своей первичной струк-
туре особую последовательность аминокислот, которая служит
меткой для ферментов аппарата Гольджи. С их помощью лизо-
сомальные белки попадают в специальные пузырьки, отшнуро-
вывающиеся от аппарата Гольджи. После закисления среды
внутри этих пузырьков они становятся первичными лизосома-
ми — органеллами, играющими важную роль в процессах кле-
точного пищеварения. Первичная лизосома содержит большой
набор пищеварительных ферментов, способных расщеплять раз-
нообразные вещества.
6. Все эукариотические клетки постоянно осуществляют про-
цесс пиноцитоза, при котором от наружной мембраны отшнуро-
вываются внутрь клетки пузырьки с окружающей жидкостью.
Некоторые клетки способны к фагоцитозу, когда клетка окружа-
ет псевдоподиями крупную частицу и также заключает ее в
замкнутый мембранный пузырек. С этими пузырьками сливают-
ся первичные лизосомы, образуя так называемые вторичные
лизосомы. В них происходит переваривание пищеварительными
ферментами различных питательных веществ и последующее
всасывание продуктов расщепления в цитоплазму.
Тлава 3
МИТОХОНДРИИ И ХЛОРОПЛАСТЫ
§ 8. Строение митохондрий и хлоропластов.
Теория симбиогенеза. Транспорт белков
из цитоплазмы в митохондрии и хлоропласты
8.1. Строение митохондрий
Митохондрии представляют собой, как правило, не-
большие органеллы размером примерно 2 х 0,5 мкм.
Они окружены двумя мембранами (рис. 15).
Во многих клетках митохондрии соединены друг с
другом и образуют несколько больших комплексов
69
внутренняя внешняя
кристы
Рис. 15. Строение митохондрии
(а иногда один огромный), которые называют митохон-
дрионами. Они часто располагаются в клетке рядом с
местами интенсивного потребления энергии: в жгутике
сперматозоида, около актин-миозиновых нитей мышеч-
ных клеток и т. п. Внутренняя мембрана митохондрий
обычно образует выпячивания, обращенные внутрь, так
называемые кристы. Отграниченное внутренней мемб-
раной пространство называют матриксом. Наружная
мембрана митохондрий проницаема для небольших мо-
лекул и ионов, поскольку имеет маленькие отверстия,
образованные специальными белками, тогда как внутрен-
няя таких отверстий не имеет. Наружная и внутренние
мембраны митохондрий в некоторых местах соприкаса-
ются.
Главная функция митохондрий — обеспечение клет-
ки энергией в виде АТФ. Митохондрии синтезируют
АТФ за счет энергии окисления различных органичес-
ких веществ кислородом воздуха (как именно они это
делают, будет подробно рассмотрено ниже). Митохонд-
рии служат главным источником АТФ для большин-
ства животных клеток, а для растительных клеток они
необходимы в ночное время: днем растения получают
энергию в процессе фотосинтеза, ночью же они вынуж-
70
дены добывать АТФ за счет окисления органических
веществ кислородом. Кроме того, в митохондриях про-
текают и другие реакции обмена веществ, необходимые
клетке.
8.2. Строение хлоропластов
Хлоропласт — органелла, имеющаяся только в зеле-
ных растениях. Так же, как и митохондрия, она окружена
двумя мембранами, но в отличие от нее внутри хлороп-
ласта имеются замкнутые мембранные пузырьки — ти-
лакоиды (рис. 16). По всей видимости, полости этих пу-
зырьков соединены между собой, так что в хлоропласте
имеются три различных пространственных отсека: меж-
ду наружной и внутренней мембранами, между внутрен-
ней мембраной и мембраной тилакоидов, внутри тилако-
идов.
Главная функция хлоропластов — проведение реак-
ций фотосинтеза. Подробнее мы рассмотрим этот про-
цесс ниже; сейчас важно отметить два факта: 1) в ходе
фотосинтеза получается АТФ, который клетка может ис-
пользовать на энергетические нужды; 2) в процессе
Рис. 16. Строение хлоропласта
71
фотосинтеза из СО2 и Н2О получаются органические ве-
щества и кислород. Органические вещества использует
само растение, а кислород люди, с точки зрения расте-
ний — всего лишь нахлебники (тем более, что и орга-
нические вещества мы в конечном счете получаем в
пищу тоже за счет растений).
В растительных клетках есть и другие пластиды —
бесцветные лейкопласты, служащие для запасания крах-
мала, и окрашенные хромопласты, которые образуются
из хлоропластов в результате их дегенерации при раз-
витии цветков, плодов и других незеленных частей рас-
тения. Все пластиды окружены двумя мембранами.
8.3. Особенности митохондрий и хлоропластов.
Их происхождение
Митохондрии и хлоропласты имеют целый ряд ин-
тересных особенностей по сравнению с другими орга-
неллами: они не синтезируются из материала иных
органелл (лизосомы, например, отшнуровываются от ап-
парата Гольджи), а размножаются делением; у них есть
свои собственные рибосомы, причем они больше похожи
на рибосомы бактерий, чем на рибосомы животных
и растений; наконец, у них имеется своя собственная
ДНК, в которой закодированы некоторые белки этих
органелл. Эта ДНК имеет кольцевую форму, как у бак-
терий, а не линейную, как у животных и растений. Все
эти факты позволяют предположить, что эволюционно
митохондрии и хлоропласты произошли от свободножи-
вущих микроорганизмов.
По-видимому, эти органеллы — митохондрии и хло-
ропласты — появились не ранее полутора миллиардов
лет назад. Как это произошло, в точности установить
нельзя, но наиболее вероятно, что собьГтия развивались
следующим образом. Представьте себе, что одна клетка
попыталась съесть другую. Она выпустила псевдоподии,
окружила ими свою жертву и, наконец, заключила ее в
72
замкнутый мембранный пузырек. Но жертва оказалась
живучей, она не стала перевариваться и распадаться,
благополучно выжила и стала потреблять питательные
вещества клетки-хищницы. Между этими клетками ста-
ли складываться отношения паразитизма. Однако в кон-
це концов победила дружба: поглотившая клетка по-
ставляла питательные вещества, а поглощенная клетка
синтезировала для нее АТФ. Получился самый настоя-
щий симбиоз, а теория, которая постулирует, что мито-
хондрии и хлоропласты возникли из симбиотических
бактерий, была названа теорией симбиогенеза. Эта тео-
рия предполагает, что исходная клетка-хищница полу-
чала энергию с помощью анаэробных синтезов, и фер-
менты гликолиза, расположенные в цитоплазме,— это
ее «наследство». Клетка — предшественница митохон-
дрии использовала для синтеза АТФ энергию окисле-
ния различных веществ кислородом, а клетка — пред-
шественница хлоропласта — энергию света в процессе
фотосинтеза.
8.4. Доказательства теории симбиогенеза
Доказательства этой теории сводятся к следующему:
1) Митохондрии и хлоропласты окружены двойной
мембраной.
2) Эти органеллы размножаются путем деления, а не
отпочковываются от каких-нибудь других мембранных
органелл.
3) Митохондрии и хлоропласты имеют свой генети-
ческий материал, в котором закодированы только их
собственные белки (правда, не все), а не белки цитоп-
лазмы.
4) ДНК этих органелл имеет кольцевую форму, как
у прокариот, а не линейную, как у эукариот.
5) Митохондрии и хлоропласты имеют свой соб-
ственный аппарат синтеза РНК и белков, и их рибосо-
мы больше похожи на прокариотические, чем на эука-
риотические.
73
6) Некоторые белки этих органелл похожи по сво-
ей первичной структуре на аналогичные белки бакте-
рий и не похожи на соответствующие белки цитоп-
лазмы.
Как уже упоминалось, в собственной ДНК митохонд-
рий и хлоропластов закодирована только часть их бел-
ков, а остальные — закодированы в ДНК ядра клетки.
По-видимому, в ходе эволюции происходило «перетека-
ние» части генетического материала из генома (совокуп-
ности генов) митохондрий и хлоропластов в ядерный
геном. В целом, геном хлоропластов более «объемис-
тый», чем геном у митохондрий, а геном митохондрий
низших эукариот (например, дрожжей) более объемис-
тый, чем у млекопитающих, что косвенно подтверждает
высказанное предположение.
8.5. Роль сигнальной N-концевой
последовательности аминокислот
Если часть митохондриальных (и хлоропластных)
белков закодирована в ядре, то как же они попадают
в митохондрию (или хлоропласт)? Мы уже выяснили,
что эти белки синтезируются на свободно плавающих
цитоплазматических рибосомах, а не на шероховатой
сети. Оказалось, что у митохондриальных белков на
N-конце есть особая последовательность аминокислот,
которая необходима для их транспорта в митохонд-
рию. Эта митохондриальная N-концевая последова-
тельность служит меткой: «перенесите меня в мито-
хондрию».
Возникает проблема: как перенести большой белок,
имеющий вторичную и третичную структуру, через ми-
тохондриальную мембрану? Когда белки транспортиру-
ются в эндоплазматическую сеть, полипептидная цепоч-
ка еще не свернута — она переносится через мембрану
сразу же, как только сойдет с рибосомы. Для транспор-
та митохондриальных белков природа выбрала другую
стратегию.
74
8.6. Механизм переноса белков
через митохондриальные мембраны
В цитоплазме будущий митохондриальный белок
сразу же связывается со специальными белками — ан-
фолдазами (от английского unfold — «распутывать»).
При этом связывании компактно упакованная глобула
митохондриального белка становится более развернутой.
Схематически можно представить себе, что полипептид-
ная цепочка митохондриального белка накручивается на
анфолдазу, как нитка на катушку (конечно, это весьма
грубое приближение). N-концевая митохондриальная
последовательность при этом торчит наружу. В местах
контакта двух митохондриальных мембран имеется спе-
циальный белок-рецептор этой последовательности.
Когда митохондриальная последовательность связы-
вается со своим рецептором, в нем открывается канал
и N-конец полипептидной цепочки просовывается в не-
го. Затем полипептидная цепочка митохондриального
белка разматывается с анфолдазы (для. этого нужна
энергия АТФ) и переходит в матрикс митохондрии.
Там N-концевая последовательность отрезается, а мито-
хондриальный белок вновь сворачивается с образовани-
ем вторичной и третичной структуры.
Транспорт в хлоропласты очень похож на описанный
транспорт в митохондрии, только N-концевая последо-
вательность у хлоропластных белков своя.
01. В каких клетках митохондрии более развиты: в клетках
эпидермиса, мышечных клетках или нервных?
2. Сколько мембран должна пересечь молекула вещества, что-
бы пройти из полости тилакоида в матрикс митохондрий?
3. В клетках человека есть две формы фермента супероксид-
дисмутазы — митохондриальная и цитоплазматическая,
различные по структуре. Какая форма имеет гомологию
с микробной супероксиддисмутазой?
4. Зачем нужны участки контакта двух митохондриальных
мембран, внешней и внутренней?
75
§ 9. Роль НАДН в процессах биологического
окисления. Градиент ионов Н+ и его роль
в митохондриях и прокариотических клетках
9.1. Система НАД+— НАД Н как универсальные
промежуточные вещества при окислении
органических веществ кислородом
Итак, митохондрии синтезируют АТФ из АДФ
и фосфатаза счет энергии окисления органических ве-
ществ кислородом. Мы получаем с пищей много раз-
ных органических веществ — аминокислот, моносаха-
ридов, жирных кислот и др. Было бы неразумно созда-
вать специальную систему окисления на каждое из
этих веществ, гораздо логичнее окислять их одним, уни-
фицированным окислителем, а уже его восстановлен-
ную форму окислять кислородом, получая при этом
АТФ. В качестве такого универсального окислительно-
восстановительного промежуточного соединения в клет-
ке используется никотинамидадениндинуклеотид —
сокращенно НАД (примечание для курящих: никотин
не входит в состав этого жизненно важного вещества,
так что жить без курения можно). Это вещество может
существовать в двух формах: окисленной НАД+ и вос-
становленной НАДН.
В самом общем виде катаболизм различных ве-
ществ в аэробных условиях (т. е. в присутствии кисло-
рода) можно представить так:
1) органические соединения + пНАД+окисл » хСО2 +
+ 1/Н2О + пНАДНвосст;
2) НАД.Н^. + 1/2О2 + ЗАДФ + ЗФ—»-НАД+окисл. +
+ Н2О + ЗАТФ.
Реакции пункта 1 идут (в зависимости от того, ка-
кие конкретные органические вещества окисляются)
или в цитоплазме, или в митохондриях, тогда как ре-
акции пункта 2 — только в митохондриях.
76
Как легко увидеть, система НАД+ОКИСЛ — НАД НВОССТ
играет роль окислительно-восстановительного челнока,
переносящего электроны от различных органических ве-
ществ к кислороду: на первой стадии НАД+ОКИСЛ отни-
мает электроны у органических веществ, окисляя их в
конце концов до СО2 и Н2О (разумеется, не в одну ста-
дию, а через многочисленные промежуточные соедине-
ния); на второй стадии кислород окисляет НАД-НВОССТф,
образовавшийся в ходе первой стадии, отнимая у него
электроны и возвращая его вновь в окисленное состо-
яние.
Таким образом, первая стадия окисления проте-
кает для каждого вещества по своему: для жирных
кислот — с помощью одних реакций, глюкозы —
других, аминокислот — третьих, важно лишь, что в
ходе первой стадии образуется НАД-НВОССТ. Вторая
стадия состоит в окислении НАД-НВОССТ- кислородом,
и именно она сопровождается синтезом АТФ из АДФ
и фосфата.
77
9.2. Многостадийность процесса окисления НАД-Н
в митохондриях
Окисление НАД-НВОССТ. кислородом происходит на
внутренней мембране митохондрий. Разумеется, оно
тоже протекает через множество стадий: НАДНВОССТ
отдает свои электроны на некоторые промежуточные
вещества, эти вещества передают электроны на следую-
щие промежуточные соединения и т. д., вплоть до кис-
лорода, который, принимая электроны, превращается
в О2-, и взяв ионы Н+ из среды, образует воду. Схемати-
чески процесс переноса электронов от НАД-Н к кисло-
роду можно представить так:
Цепь промежуточных окислительно-восстановительных
переносчиков, переносящих электроны от НАД.Н к кислороду
Переносчик АН, ~ 1 (восстан.) (окисл.) Переносчик Н» Переносчик Ж 2 i 3 н*° X (восстан.) (окисл.) х/'
Переносчик Н, ) А 1 (окисл.) (восстан.) \ Переносчик У\. Переносчик Нг 2 3 КО* (окисл.) (восстан.)
Таких промежуточных соединений известно больше
десятка. В их ряду НАД-Н является самым хорошим
восстановителем, а НАД+ОКИСЛ — самым плохим окис-
лителем. Соответственно, О2 будет самым сильным окис-
лителем, а вода — самым слабым восстановителем.
(Вспомните курс неорганической химии: чем сильнее
окислитель, тем слабее будет получающийся из него
восстановитель, и наоборот; например, хлор — весьма
сильный окислитель, а образующийся из него хлорид-
ион — очень слабый восстановитель; зато иод — доволь-
но слабый окислитель, а получающийся из него иодид-
ион — неплохой восстановитель.) У промежуточных
переносчиков будут постепенно ослабевать восстанови-
тельные свойства и усиливаться окислительные. Элект-
роны, передвигаясь от НАД-Н к О2, как бы спускаются
по энергетической лестнице. При этом выделяется дос-
78
таточно энергии, чтобы синтезировать три молекулы
АТФ за счет окисления одной молекулы НАД-Н.
9.3. Основные положения теории Митчелла
Мы с вами разобрали, за счет какой энергии мито-
хондрия синтезирует АТФ, но пока еще ничего не гово-
рили о том, как именно она это делает. Пусть электро-
ны передвигаются от НАД-Н к кислороду, но как за
счет этого синтезировать АТФ? Раньше думали, что окис-
лительное фосфорилирование похоже на гликолиз: в
ходе сложной серии биохимических реакций образуют-
ся промежуточные вещества, которые затем передают
свой фосфат на АДФ, образуя АТФ. Ученые стали ис-
кать в митохондриях эти промежуточные вещества с
высокоэнергетическим фосфатом — кто 20 лет, кто 40
лет — но так ничего и не нашли. Тогда английский
биохимик П. Митчелл предложил совершенно новую
идею, которая показалась настолько смешной, что хотя
Митчелл опубликовал ее в самом начале 60-х годов, в
течение 10 лет всерьез она никем не воспринималась.
И вот Митчелл сам, на свои деньги купил необходимое
оборудование и реактивы и стал проверять свою теорию,
которая состояла в следующем. Митчелл предположил,
что митохондрия — это маленькая электростанция.
Когда электроны идут от НАД-Н к кислороду, то за счет
энергии этих окислительно-восстановительных реакций
из матрикса митохондрии через внутреннюю мембрану
выкачиваются ионы Н+ (рис. 17). Из курса химии из-
вестно, что вода обратимо диссоциирует:
Н2О Н+ + ОН ,
и в нейтральной среде концентрации ионов Н+ и ОН-
равны 10-7 моль/л. При откачивании ионов Н+ (прото-
нов) их концентрация внутри митохондрии падает до
10-8 моль/л, в цитоплазме же она возрастает не так зна-
чительно: ведь объем цитоплазмы гораздо больше объе-
ма митохондриального матрикса. Таким образом на
79
внешняя
мембрана
межмембранное
внутренняя
Рис. 17. Процесс окислительного фосфорилирования по теории Митче-
ла. Энергия, высвобождаемая при переносе электронов по цепи пере-
носчиков, используется для перемещения ионов Н+ из матрикса нару-
жу, что приводит к возникновению электрохимического потенциала
внутренней мембране митохондрии создается градиент
протонов: внутри их мало, а снаружи много. Ион Н+ —
заряженная частица, так что можно сказать, что внутри
митохондрии «щелочно» и отрицательно, а снаружи
(и в межмембранном пространстве) — «кисло» и по-
ложительно. Разность потенциалов на внутренней мемб-
ране митохондрии составляет около 220 мВ.
Этот градиент ионов Н+ называют также электрохи-
мическим потенциалом. Как мы видим, митохондрия от-
личается от обыкновенной электростанции не только раз-
мерами и мощностью. Во-первых, электростанция созда-
ет «градиент» электронов, а митохондрия — ионов Н+
(протонов). Во-вторых, к.п.д. тепловой электростанции
составляет около 40%, а митохондрии — около 60%.
80
На внутренней мембране митохондрий, кроме окис-
лительно-восстановительных переносчиков, имеется
еще один чрезвычайно важный компонент — фермент
Н+-АТФ-синтетаза (протонная АТФ-синтетаза). Как
следует из названия, этот фермент синтезирует АТФ
за счет энергии градиента ионов Н+. Внутри фермента
имеется специальный канал для прохождения прото-
нов, но это не просто отверстие, через которое протоны
потекли бы в митохондрию, не принося никакой
пользы. Нет, фермент устроен так, что когда протоны
проходят по каналу, за счет энергии их движения син-
тезируется АТФ из АДФ и фосфата (рис. 18).
На рисунке фермент изображен в виде маленькой
турбинки, на которую сверху падают ионы Н+. Посколь-
ку фермент — это белок, состоящий из уложенных опре-
деленным образом полипептидных цепочек, ионы Н+
связываются с соответствующими аминокислотными ос-
татками, из-за этого меняется конформация фермента,
происходит сближение АДФ и фосфата и, в конце кон-
цов, синтез АТФ (детали этого процесса до конца не изуче-
ны). Для того чтобы синтезировалась одна молекула АТФ,
через Н+-АТФ-синтетазу должно пройти три иона Н+.
Рис. 18. Работа протонной АТФ-синтетазы:
Fo и Fj — различные участки фермента Н+-АТФ-синтетазы
6 Зак. 13485
81
Итак, согласно теории Митчелла, преобразование энер-
гии в митохондриях происходит следующим образом:
энергия окисления НАД-Н кислородом—►-
энергия градиента ионов Н+ —►
энергия химических связей молекул АТФ.
Второй этап — превращение энергии электрохимичес-
кого потенциала в энергию АТФ — мы уже рассмотре-
ли: она осуществляется ферментом Н+-АТФ-синтетазой.
9.4. Механизмы создания электрохимического
потенциала на внутренней мембране митохондрий
Теперь следует обратиться к первой стадии: каким
образом при движении электронов с одного окислитель-
но-восстановительного переносчика на другой получает-
ся градиент Н+?
Имеются два основных механизма транспорта протонов через
мембрану за счет энергии окислительно-восстановительных
реакций: с помощью специальных ферментов и с помощью
Рис. 19. Ферменты, переносящие ионы Н+ через мембрану. НАД-Н-де-
гидрогеназный комплекс, комплекс b — cl и цитохромоксидазный ком-
плекс — три главные ферментные системы, учавствующие в создании
электрохимического потенциала. Убихитон и цитохром с — перенос-
чики электронов, связывающие эти комплексы
82
низкомолекулярных переносчиков. Что касается ферментов,
то главную роль в их работе играет изменение конформации
полипептидных цепочек. Некоторые из промежуточных пере-
носчиков электронов связаны с ферментами, способными вы-
качивать ионы Н+. Когда переносчик находится в восстанов-
ленном состоянии, фермент имеет одну конформацию, при
этом некоторые аминокислотные остатки связывают ионы Н+
из внутреннего пространства митохондрий (рис. 19). Когда пе-
реносчик отдает свои электроны и переходит в окисленное
состояние, фермент меняет конформацию, и аминокислотные
остатки, которые связали протоны внутри митохондрии, ока-
зываются снаружи и отдают там свои протоны.
Второй механизм немного сложнее. Некоторые из промежу-
точных переносчиков, меняя степень окисления, могут прини-
мать или отдавать ионы Н+: X + 2Н+ + 2е- ХН2.
(С подобными реакциями вы встречались и в курсе неорга-
нической химии. Вспомните, например, окислительно-восста-
новительные взаимопревращения серы и сероводорода: S +
+ 2Н+ + 2е* H2S. Разумеется, в мембране митохонд-
рий нет ни сероводорода, ни свободной серы, там в роли пе-
реносчика X выступают совсем другие соединения.) Теперь
представьте себе, что такой переносчик X, а также ХН2 может
свободно перемещаться в толще внутренней мембраны мито-
хондрий. Он будет получать электроны от предыдущего пере-
носчика М и отдавать их следующему переносчику N:
Рис. 20. Создание электрохимического потенциала низко-
молекулярными переносчиками
83
МВОСст + X + 2Н+ —Мокисл + ХН2 + NOKiICJI —X +
+ NBOCCT. + 2Н+. При этом М расположен у внутренней сторо-
ны мембраны митохондрии, a N — у ее наружной стороны
(рис. 20). Переносчик X может получить электроны только
у внутренней поверхности, потому что переносчик М распо-
ложен именно там; значит, и Н+ он может взять только из-
нутри митохондрии — больше неоткуда.
Восстановленный переносчик ХН2 свободно плавает по всей
толщине мембраны за счет диффузии. Он легко доплывет
и до переносчика N, расположенного у наружной поверхно-
сти мембраны. N отнимет у ХН2 электроны, при этом ионы
Н+ могут уйти только наружу — ведь липидный бислой для
них непроницаем. Окисленная форма X также за счет диф-
фузии перемещается обратно на внутреннюю поверхность
внутренней мембраны, где может опять принять электроны
от Мвосст. и т. д.
9.5. Возможность использования энергии
электрохимического потенциала для обогрева
организма
Итак, для того чтобы на внутренней мембране мито-
хондрий происходил процесс окислительного фосфори-
лирования, необходимо, чтобы мембрана не пропускала
ионов Н+, и они проходили бы только через фермент
протонную АТФ-синтетазу. А что будет, если мембрану
сделать проницаемой для ионов Н+? Произойдет как бы
«короткое замыкание»: за счет энергии окисления
НАД Н кислородом ионы Н+ будут выкачиваться из
митохондрии, но через «дырку» тут же заходить обрат-
но (рис. 21). Вся энергия при этом будет рассеиваться
в виде тепла.
В некоторых случаях такой способ обогрева бывает
полезным. Так, у многих грызунов, впадающих в зим-
нюю спячку, имеется специальная ткань — бурый жир.
Просыпаются эти грызуны весной, когда солнышко еще
не слишком часто балует теплой погодой. Вот тут-то
и помогает бурый жир. Митохондрии в этой ткани «ды-
рявые», их внутренняя мембрана проницаема для ионов
84
внутренняя мембрана
Н+. При окислении жира электроны движутся по цепи
переносчиков, ионы Н+ транспортируются через мито-
хондриальную мембрану, но тут же проскакивают обрат-
но через специальные каналы. Вся энергия окисления
жира переходит в тепло, что позволяет грызуну согреть-
ся. По-видимому, митохондрии в других тканях тоже
умеют перестраиваться для нужд обогрева, и когда нам
холодно, некоторая часть протонов (ионов Н+) возвраща-
ется в митохондрию не через Н+-АТФ-синтетазу, а че-
рез «дырочки»; при этом доля энергии протонного гра-
диента переходит в тепло. Это установил с помощью
необычного эксперимента московский ученый В. П. Ску-
лачев: посадив голубей, лишенных оперения, в холодное
помещение, он показал, что в их митохондриях значи-
тельная часть градиента ионов Н+ шла не на синтез АТФ,
а на обогрев организма.
9.6. Разнообразие метаболизма бактерий
Электрохимический потенциал используют для син-
теза АТФ не только митохондрии, но и большинство
бактерий (как тут не вспомнить еще раз теорию симби-
огенеза!). Все аэробные бактерии имеют систему пере-
носчиков электронов от НАД-Н к кислороду, и у боль-
шинства из них эта система схожа с митохондриаль-
85
ной. ри движении электронов по этой цепочке из бак-
терии в окружающую среду выкачиваются ионы Н+
(как вы, вероятно, помните, у бактериальной клетки нет
никаких внутриклеточных органелл: аналог внутрен-
ней мембраны митохондрий — цитоплазматическая
мембрана бактерии). Образуется электрохимический
потенциал, и мембранная Н+-АТФ-синтетаза синтезиру-
ет АТФ за счет энергии этого градиента. У бактерий,
однако, наблюдается гораздо большее разнообразие ти-
пов обмена веществ: так, некоторые бактерии в каче-
стве последнего окислителя в цепи переноса электро-
нов используют не кислород, а нитрат-ион, другие —
сульфат-ион и т. п. Все же главные особенности преоб-
разования энергии по Митчеллу есть и у них: окисли-
тельно-восстановительные реакции, сопровождающиеся
движением электронов по цепи переносчиков —►
градиент ионов Н+ —► синтез АТФ протонной АТФ-
синтетазой.
Казалось бы, градиент ионов Н+ и фермент Н+-АТФ-
синтетаза должны отсутствовать у тех бактерий, которые
живут за счет гликолиза, например у молочнокислых
бактерий. Однако выяснилось, что и у этих бактерий
Рис. 22. Образование градиента Н+ у бактерий, использующих глико-
лиз. АТФ, образовавшаяся в ходе этого процесса, гидролизуется
ферментом, в результате чего ионы Н+ выносятся через мембрану
86
есть градиент ионов Н+, причем он создается специаль-
но за счет расщепления АТФ (рис. 22).
У молочнокислых бактерий АТФ образуется в ре-
зультате сбраживания глюкозы до молочной кислоты
(см. об этом выше), а мембранная Н+-АТФ-синтетаза
у них работает «в обратную сторону»: расщепляет АТФ,
выкачивая ионы Н+ и создавая их градиент (у аэроб-
ных бактерий и митохондрий она синтезирует АТФ,
когда ионы Н+ идут по градиенту). Но зачем же тра-
тится драгоценный АТФ, который с таким трудом был
получен в результате гликолиза?
9.7. Функции электрохимического потенциала
у прокариот
У бактерий электрохимический потенциал играет
чрезвычайно важную роль: он используется для транс-
порта различных веществ и для движения.
Кроме уже знакомого вам вида активного транспор-
та через мембрану — с мембранными АТФ-азами, кото-
рые используют энергию гидролиза АТФ для переноса
веществ против градиента концентрации, возможен и
другой путь: используется не энергия АТФ, а энергия
градиента какого-либо вещества. Бактериям необходи-
мо транспортировать через мембрану различные веще-
ства (например, питательные), и для этого на бактери-
альной мембране есть специальные белки — переносчи-
ки, которые транспортируют определенные вещества
совместно с ионом Н+ (рис. 23).
Переносчик может транспортировать только оба ком-
понента одновременно, что неудивительно, иначе ионы Н+
просто будут входить в цитоплазму бактерии, а энергия
градиента — рассеиваться в виде тепла. Благодаря та-
ким переносчикам, обеспечивающим совместный транс-
порт питательных веществ и ионов Н+, бактерии могут
закачивать молекулы этих питательных веществ против
их градиента. Пусть в цитоплазме бактерии концентра-
ция питательного вещества в пять раз выше, чем сИару-
87
цитоплазма
бактериальная плазматическая
мембрана
Рис. 23. Использование градиента Н+ у бактерий для транспорта
различных веществ через мембрану
жи. Но поскольку транспорт этого вещества происхо-
дит только совместно с ионом Н+, а его концентрация
в цитоплазме в 10 раз меньше, чем снаружи, то пере-
носчик будет закачивать вещество внутрь, а не выбра-
сывать наружу.
Еще одна важнейшая функция электрохимического
потенциала — обеспечить движение бактерии. Вы знаете,
что многие бактерии имеют жгутик (иногда несколько
жгутиков). Это твердая’, негибкая структура, напомина-
ющая штопор (рис. 24).
Когда жгутик вращается, он, как штопор, «ввинчива-
ется» в воду (а при противоположном направлении вра-
щения — «вывинчивается» из нее). Основание жгутика,
расположенное у мембраны бактерии, представляет со-
88
Рис. 24. Работа «мотора», вращающего жгутик кишечной палочки.
«Ротором» служит белковый диск, расположенный в плазматической
мембране. Ротор расположен на одной оси с «крючком» и жгутиком и
заставляет их вращаться
бой самый настоящий электромотор, правда работаю-
щий не на электронах, как у трамвая, а на протонах.
Точный механизм работы этого электромотора неизвес-
тен. Установлено, однако, что для его работы необходи-
мо, чтобы ионы Н+ проходили через мембрану в цитоп-
лазму, при этом «ротор» начинает вращаться (см.
рис. 24), а вместе с ним вращается и весь жгутик.
Скорость вращения достигает 100 оборотов в секунду.
9.8. Создание градиента ионов Н+ за счет
световой энергии у галобактерий с помощью
бактериородопсина
Выше было рассмотрено, как создается электрохи-
мический потенциал на мембране бактерий за счет энер-
гии окислительно-восстановительных реакций.
89
У бактерии Halobacterium halobium, обитающей в соленых
озерах, обнаружен еще один, совершенно уникальный способ
получения градиента ионов Н+. Эти бактерии — аэробы, они
часто используют обычное окисление органических веществ
кислородом для синтеза АТФ. Однако при очень высокой
концентрации соли (более 4 моль/л) растворимость кислоро-
да становится слишком низкой, чтобы полностью обеспечить
энергетические потребности бактерии, и ей приходится ис-
пользовать другой источник — солнечный свет.
На мембране этих бактерий имеется особый белок — бакте-
риородопсин, который, помимо аминокислот, содержит рети-
наль — производное витамина А. Ретиналь придает бактери-
ородопсину пурпурную окраску; он обладает способностью по-
глощать квант света. После такого поглощения изменяется
конформация всего белка бактериородопсина, он переходит
в возбужденное состояние. Затем белок возвращается в обыч-
ное, исходное состояние, и при этом он переносит ионы Н+
через мембрану наружу, создавая электрохимический потен-
циал (рис. 25). Ну, а если имеется градиент ионов Н+, то, как
объяснено выше, его можно использовать для синтеза АТФ
с помощью фермента Н+-АТФ-синтетазы.
наружняя среда
(низкий pH)
цитозоль
(высокий pH)
Рис. 25. Работа молекул бактериородопсина в качестве насоса,
который под действием света выкачивает ионы Н+ наружу
90
Превращения энергии при таком с пос о е жизнеобеспечения
происходят по схеме:
энергия света —энергия возбужденной конформации
бактериородопсина —энергия градиента ионов Н+ —
энергия АТФ.
Следует отметить, что хотя Halobacterium использует энергию
света, этот процесс имеет существенные отличия от фотосин-
теза зеленых растений. Поглощая свет, бактерии Н. halobium
могут только синтезировать АТФ и не могут выделять кисло-
род и восстанавливать СО2 до глюкозы.
В1. Человеку дали подышать меченым кислородом 18О2. В ка-
кое вещество будут главным образом включаться атомы
меченого кислорода?
2. Известно, что в состав некоторых промежуточных перенос-
чиков электронов входят ионы железа. Исходя из этого,
объясните, почему цианистый калий сильно ядовит.
3. Как вы считаете, что сильнее связывает кислород: фермен-
ты окисления НАД-Н или гемоглобин?
4. Какое преимущество дает образование огромных митохон-
дрионов вместо отдельных маленьких митохондрий?
5. При обработке митохондрий определенными веществами,
так называемыми разобщителями, скорость их дыхания
резко возрастает, но синтез АТФ полностью прекращается.
Каков механизм действия разобщителей?
6. На мембране бактериальных клеток есть белки, перенося-
щие различные вещества снаружи внутрь совместно с ио-
ном Н+. А могут ли быть переносчики, которые транспор-
тируют ион Н+ внутрь и одновременно выбрасывают моле-
кулу какого-нибудь вещества? Если да, то зачем это может
быть нужно?
§ 10. Фотосинтез
10.1. Темновая и световая фазы фотосинтеза
Итак, мы рассмотрели механизм синтеза АТФ в ми-
тохондриях. В основе работы этого механизма лежит
использование энергии движения электронов от одного
91
переносчика к другому для создания градиента ионов
Н+, а энергии этого градиента — для синтеза АТФ фер-
ментом Н+-АТФ-синтетазой. Однако этот механизм ис-
пользуется не только в митохондриях, но и хлороплас-
тах. Рассмотрим в самых общих чертах процесс фото-
синтеза.
В первом приближении уравнение фотосинтеза мож-
но записать так:
6 СО2 4” 6 Н2О —CqH^Oq 4- 6 02*
глюкоза
В процессе фотосинтеза различают две стадии:
световую и темновую. На первой стадии, световой, за
счет энергии света в хлоропласте образуются особые
вещества, которые на второй стадии используются для
превращения С02 в глюкозу. Только не надо думать,
что световая фаза приходится на день, а темновая —
на ночь: вещества, образующиеся в ходе световой
фазы, быстро используются клеткой, так что весь фо-
тосинтез протекает днем, а ночью растения живут за
счет дыхания, как и животные. Темновая фаза пред-
ставляет собой ряд сложных последовательных хими-
ческих реакций. Здесь они подробно не рассматрива-
ются, но нужно подумать, что же необходимо для их
протекания.
Во-первых, естественно, АТФ. Как правило, именно это
богатое энергией соединение используется для различ-
ных синтезов в клетке. Но одного АТФ явно недоста-
точно: в С02 степень окисления углерода 4-4, в глюко-
зе — в среднем 0, значит, нужен какой-нибудь восста-
новитель, который мог бы восстановить этот углерод. Вы
уже знакомы с соединением НАД Н — оно играет важ-
ную роль в окислительном обмене веществ. В фотосин-
тезе используется очень похожее вещество НАДФ-Н (ни-
котинамид адениндинуклеотидфосфат). Оно тоже может
существовать в двух формах: НАДФ+ (окисленная фор-
ма) и НАДФ-Н (восстановленная форма).
92
Схематически темновую стадию можно представить
следующим образом:
6 СО2 + 6 Н2О + 12 НАДФН + 18 АТФ —► СвН12Ов +
+ 6 О2 + 12 НАДФ+ + 18 АДФ + 18 Ф.
10.2. Возбуждение молекулы хлорофилла
квантом света
Итак, для протекания темновой фазы световая фаза
должна поставлять АТФ и НАДФ-Н. Вы помните, что
для фотосинтеза необходим пигмент хлорофилл —
именно он поглощает кванты света. Сам по себе хлоро-
филл — плохой восстановитель, соответственно, хлоро-
филл, лишенный электрона (Хл.+) — хороший окисли-
тель. От хлорофилла не так-то просто оторвать элект-
рон, и на первый взгляд это вещество не очень
подходит для окислительно-восстановительных превра-
щений. Однако у хлорофилла есть весьма важное свой-
ство — способность поглощать кванты света. При этом
из обычного состояния он переходит в особое, возбуж-
денное: Хл —Хл*. В этом возбужденном состоя-
нии электрон почти оторван от молекулы хлорофилла
(теперь она легко отдаст этот электрон) и является, со-
ответственно, хорошим восстановителем. Но после того,
как возбужденный хлорофилл отдаст свой электрон
Хл* — ё —Хл.+, он превратится в сильный окисли-
тель. Таким образом мы получили в системе и хоро-
ший восстановитель Хл*, и хороший окислитель Хл+.
Это превращение возможно только благодаря энергии
света, которая переводит обычный хлорофилл в возбуж-
денный Хл*.
Итак, после возбуждения Хл* отдает свой электрон
промежуточному переносчику (он обозначен на схеме
как А), потом этот электрон с помощью еще несколь-
ких переносчиков доходит до молекулы НАДФ+ и вос-
станавливает ее до НАДФ Н. Чем же заполняется «дыр-
93
Восстановление НАДФ+ до НАДФН в процессе фотосинтеза
с помощью электронов, отрываемых от воды за счет
энергии кванта света
ё ё ё
Хл* А В НАДФ+
I
ХЛ 4- НгО
I
02
ка» на хлорофилле? Ведь он превращается в Хл.+, а его
электрон пошел по цепи переносчиков. Оказалось, что
Хл.+ настолько сильный окислитель, что может отнимать
электроны у воды:
4 Хл.+ + 2 Н2О 4 Хл. + 4 Н+ + О2.
В результате из воды образуется кислород, а моле-
кула хлорофилла снова готова к работе.
10.3. Электрохимический потенциал
на мембранах тилакоидов
Изучая митохондрии, мы убедились, что энергия
электрона, переходящего от одного переносчика к дру-
гому, может использоваться для создания электрохими-
ческого потенциала, который служит затем для синтеза
АТФ. Оказывается, природа применила этот принцип не
только в митохондриях, но и в хлоропластах. Система
фотосинтеза расположена на мембранах тилакоидов, и
благодаря ее работе внутрь пузырька-тилакоида закачи-
ваются ионы Н+ из стромы хлоропласта (сравните с ми-
тохондрией: там ионы Н+ выкачивались из матрикса
в межмембранное пространство). В результате на мемб-
ране тилакоидов возникает градиент ионов Н+, а его
энергия используется для синтеза АТФ с помощью Н+-
АТФ-азы (рис. .26).
Преобразования энергии в этом случае происходят
по схеме:
94
строма (высокий pH)
мембрана
тилакоида
Н+
С
внутр и тилакоид ное пространство
(низкий pH)
Рис. 26. Синтез АТФ на мембране тилакоидов в ходе световой фазы
фотосинтеза
энергия света —►
энергия возбужденных молекул хлорофилла —►
энергия градиента ионов Н+ —энергия АТФ.
10.4. Хемосинтез
Фотосинтезирующие организмы могут использовать
СО2 в качестве единственного источника углерода для
получения необходимых им органических соединений,
тогда как гетеротрофы — животные, грибы и многие
бактерии — должны получать органические вещества
с пищей. Однако существует интересная группа микро-
организмов, не способных усваивать энергию света, но
тем не менее синтезирующих все свои органические ве-
щества из СО2.
Как упоминалось, усвоение углекислого газа расте-
ниями происходит в темновой фазе фотосинтеза, а не-
обходимые для этого процесса НАДФ-Н и АТФ постав-
ляет световая фаза. Микроорганизмы, о которых идет
95
речь, имеют все ферменты темновой фазы, а НАДФ Н
и АТФ получают за счет окисления различных неорга-
нических веществ. Процесс усвоения СО2, происходящий
не за счет световой энергии, а за счет энергии окисле-
ния различных молекул, называется хемосинтезом.
Окислительно-восстановительные реакции, составля-
ющие основу обмена веществ этих микроорганизмов,
весьма различны у разных хемосинтезирующих бакте-
рий: одни используют энергию окисления водорода,
другие — закисного железа, третьи — сернистых соеди-
нений и т. п. У фотосинтезирующих организмов есть
одно крупное преимущество перед хемосинтезирующи-
ми: они не зависимы от наличия окисляемых веществ,
что позволило им распространиться везде, где есть свет,
углекислый газ и вода, тогда как хемосинтезирующие
занимают весьма специфические экологические ниши.
В1. Между митохондриями и хлоропластами имеется большое
сходство: обе органеллы окружены двойной мембраной,
в обеих есть цепь переноса электронов, синтез АТФ проис-
ходит за счет энергии электрохимического потенциала
и т. п. Но как тогда объяснить, что в митохондриях ионы
Н+ выкачиваются через кристы из матрикса наружу, а в
хлоропластах они закачиваются в тилакоиды?
2. В листьях, кроме хлорофилла, содержатся и другие пиг-
менты — каротиноиды. Зачем они нужны?
tyicun/cae coqe/глсамие главы
1. Митохондрии и хлоропласты представляют собой органел-
лы, окруженные двойной мембраной. Внутренняя мембрана
митохондрий часто имеет выросты — кристы. Главную функцию
митохондрий составляет синтез АТФ. Хлоропласт, кроме двух
окружающих его мембран, имеет еще и внутри небольшие мем-
бранные пузырьки — тилакоиды. Главная функция хлоропласто-
в заключается в проведении реакций фотосинтеза.
96
2. Эволюционное происхождение этих органелл хорошо объяс-
няет теория симбиогенеза, согласно которой митохондрии и
хлоропласты произошли около 1,5 миллиардов лет назад от сво-
бодноживущих прокариотических клеток, фагоцитированных
«большими» клетками. Затем отношения приобрели характер
симбиоза: клетки-хозяева предоставляли протомитохондриям пи-
тательные вещества и защиту, а те синтезировали АТФ, окис-
ляя эти вещества. Похожие события имели место и при эволю-
ции хлоропластов. В качестве доказательств теории симбиоге-
неза можно рассматривать следующие: наличие у митохондрий
и хлоропластов двойной мембраны; размножение этих органелл
путем деления; наличие у митохондрий и хлоропластов своего
генетического материала, в котором закодированы только их
собственные белки (правда, не все), а не белки цитоплазмы;
кольцевую форму ДНК у этих органелл, что свойственно прока-
риотам, а не эукариотам; наличие собственного аппарата син-
теза белка у митохондрий и хлоропластов, причем по чувстви-
тельности к антибиотикам их рибосомы больше похожи на про-
кариотические, чем на эукариотические; сходство некоторых
белков этих органелл по первичной структуре с аналогичными
белками бактерий, а не с соответствующими белками цито-
плазмы.
3. В геноме митохондрий и хлоропластов закодирована лишь
часть необходимых им белков, остальные синтезируются на
цитоплазматических рибосомах и затем доставляются в орга-
неллы. Эти белки имеют на N-конце особые сигнальные после-
довательности аминокислот, причем у митохондриальных белков
своя последовательность, а у хлоропластных — своя. Такие
последовательности узнаются специальными рецепторами, кото-
рые расположены в местах контакта внешней мембраны этих
органелл и внутренней, после чего белки транспортируются
сразу во внутреннее пространство органеллы.
4. Митохондрия синтезирует АТФ за счет энергии окисления
органических веществ кислородом. Окисление происходит в два
этапа: на первом органические соединения окисляются специ-
альным веществом, так называемым НАД+, которое при этом
переходит в восстановленную форму НАДН; на втором НАДН
окисляется кислородом, снова переходя в окисленную форму
НАД+, а кислород восстанавливается до воды. Каждый из эта-
пов включает много реакций, которые катализируются соответ-
ствующими ферментами.
7 Зак. 13485
97
При окислении молекулы НАД Н электроны поступают к кис-
лороду через систему промежуточных переносчиков. Энергии,
выделяемой при этом, хватает на синтез трех молекул АТФ.
5. В процессе переноса электронов с одного переносчика
на другой из внутреннего пространства митохондрий выкачива-
ются ионы Н+. За счет этого на внутренней стороне внутрен-
ней мембраны митохондрий появляется отрицательный заряд,
а на наружной ее стороне положительный; в матриксе мито-
хондрий среда заметно защелачивается. Энергия окисления
НАД Н кислородом при этом переходит в энергию градиента
ионов Н+, часто называемую энергией электрохимического по-
тенциала. На внутренней мембране митохондрий расположен
фермент Н+-АТФ-синтетаза, который синтезирует АТФ из АДФ
и фосфата, когда через него проходят ионы Н+ по градиенту
внутрь митохондрии. В ходе этого процесса энергия градиента
ионов Н+ переходит в энергию химических связей АТФ.
Похожую систему синтеза АТФ с образованием электрохи-
мического потенциала имеют многие бактерии (градиент ионов
Н+ образуется у них на наружной мембране). У бактерий элек-
трохимический потенциал, помимо синтеза АТФ, выполняет еще
две очень важные функции: активного транспорта различных
веществ через мембрану и движения жгутика. Транспорт ве-
ществ происходит при этом путем совместного переноса с ио-
ном Н+, что позволяет накапливать в микробной клетке нужные
ей вещества. Бактериальный жгутик (жесткая структура), вра-
щается за счет энергии движения ионов Н+ по градиенту. По-
скольку электрохимический потенциал выполняет у бактерий
столь важные функции, даже анаэробные микроорганизмы, не
имеющие систем окисления и живущие благодаря брожению,
тем не менее создают на мембране градиент ионов Н+ путем
гидролиза АТФ.
6. Процесс фотосинтеза, протекающий в хлоропластах, вклю-
чает в себя две фазы: темновую и световую. В ходе световой
фазы образуются НАДФ Н и ДТФ, которые затем в темновой
фазе используются для синтеза глюкозы из СО2 и Н2О. Реак-
ции световой фазы протекают на мембранах тилакоидов, темно-
вой — в пространстве, окружающем тилакоиды, а. иногда и в
цитоплазме. Восстановление НАДФ+ до НАДФ Н происходит бла-
годаря электронам, отрываемым от молекул воды, которая окис-
ляется до свободного кислорода. Энергию для этого сильно эн-
дотермического процесса дают кванты света.
98
7. Молекулы хлорофилла обладают способностью поглощать
световые кванты, переходя в возбужденное состояние.' Возбуж-
денный хлорофилл легко отдает свой электрон на промежуточ-
ные переносчики, а возвращает его, отнимая у молекул воды,
из которых освобождается кислород О2. По цепи промежуточ-
ных переносчиков электрон достигает молекулы НАДФ+, восста-
навливая ее до НАДФ Н.
В процессе переноса электрона от одного переносчика к
другому на мембране тилакоида образуется электрохимический
потенциал подобно тому, как это происходило на внутренней
мембране митохондрий. При этом ионы Н+ закачиваются внутрь
тилакоида, т. е. среда в полости тилакоидов закисляется, а в
окружающем их пространстве хлоропласта защелачивается. Энер-
гия электрохимического потенциала используется ферментом Н+-
АТФ-синтетазой для образования АТФ из АДФ и фосфата.
Тлава Ч
СИСТЕМЫ ЦИТОСКЕЛЕТА
§ 11. Микрофиламенты и их функции. Регуляция
сокращения поперечно-полосатой мышцы
11.1. Понятие о различных системах цитоскелета
После рассмотрения структуры и функции основных
клеточных органелл следует обратиться к самой цито-
плазме. В ней расположены вышеописанные органеллы,
и она отнюдь не является просто бульоном с высоким
содержанием питательных веществ. В цитоплазме име-
ется внутренний скелет — цитоскелет. В прокариоти-
ческой клетке цитоскелет отсутствует, в эукариотичес-
кой же имеются три цитоскелетные системы: микрофи-
ламенты, микротрубочки и промежуточные филаменты
(функция последних почти не изучена, и в дальнейшем
мы их рассматривать не будем). Толщина их очень
99
мала: у микротрубочек — 24 нм, у микрофиламен-
тов — 7 нм, длина же может быть значительной —
иногда от одного конца клетки до другого. Микротру-
бочки, как и микрофиламенты, есть во всех эукариоти-
ческих клетках, в том числе у высших растений и мно-
гоклеточных животных (рис 27).
Цитоскелет выполняет очень важные и довольно
трудно согласуемые функции: это поддержание формы
клетки и обеспечение ее подвижности. На первый
взгляд эти функции противоречат друг другу, однако их
выполнение облегчается тем, что и микротрубочки,
и микрофиламенты могут легко «разбираться» и вновь
«собираться» клеткой в зависимости от ее нужд. Когда
цитоскелет «собран», тяжи микротрубочек и микрофи-
ламентов могут использоваться клеткой как «рельсы»,
по которым можно перемещать органеллы из одного
Рис. 27. Микрофиламенты в клетке соединительной ткани (А);
микротрубочки в клетке соединительной ткани (Б)
100
конца клетки в другой. С помощью специальных
белков органеллы могут скользить по микротрубоч-
кам и по микрофиламентам, перемещаясь в нужную
сторону.
11.2. Строение миофибрилл
поперечно-полосатой мышцы
Для начала нужно узнать, как действует система мик-
рофиламентов, причем в первую очередь весьма специ-
фические клетки — мышечные. Мышечная клетка изу-
чена лучше других и в плане обеспечения подвижности,
и в плане ее регуляции. В клетках поперечно-полосатых
мышц система филаментов не претерпевает сборок и раз-
борок, а присутствует в виде постоянных структур. По-
перечно-полосатая мышца состоит из отдельных воло-
кон — миофибрилл (рис. 28). Под микроскопом видно,
что они как бы поперечно исчерчены: какие-то зоны тем-
нее, какие-то — светлее.
Перегородка, расположенная поперек миофибриллы,
называется Z-линией; нити, отходящие от Z-линии,—
тонкими филаментами, а расположенные между ними
более толстые пучки — толстыми филаментами. При
сокращении мышцы длина филаментов не меняется. Со-
кращение обеспечивается тем, что тонкие филаменты
скользят по толстым. Таким образом, сокращение мыш-
цы (как явление, происходящее на уровне органа), мож-
но свести к скольжению филаментов — явлению кле-
точного масштаба. Ну а чтобы ответить на вопрос, поче-
му филаменты скользят друг по другу, придется
рассмотреть события на молекулярном уровне.
11.3. Белки, входящие в состав тонких
и толстых филаментов
Толстые филаменты образованы белком миозином.
В составе толстого филамента молекулы миозина упа-
кованы «хвост к хвосту», а «головки» торчат наружу
(рис. 29).
101
Рис. 28. Уровни организации скелетной мышцы:
1 — мышцы (а — сухожилие; б — кость); 2 — мышечные волокна;
3 — отдельное мышечное волокно; 4 — миофибрилла (в — Z-линия)
Молекула миозина симметрична и состоит из двух
половинок (рис. 30). Каждая половинка имеет «голов-
ку» и «хвост», соединенные подвижно, как на шарнире.
(Вы знакомы с понятием «конформация белка», вспом-
ните, какие связи стабилизируют конформацию.) В гла-
ве 1 уже объяснялось, что связывание определенных
102
a
Рис. 29. Строение толстого филомента (без соблюдения масштаба):
а — «голая зона»; б — «головки миозина»
веществ может изменять конформацию. В случае мио-
зина связывание тех или иных веществ будет благопри-
ятствовать или конформации с вытянутой «головкой»,
или конформации с согнутой «головкой».
В составе тонкого филамента имеется несколько бел-
ков, в данном случае для нас важен только белок актин.
Его молекулы имеют форму шариков; тонкий филамент
напоминает две цепочки бус, закрученные друг вокруг
друга, где отдельная бусинка — молекула актина.
Мышца сокращается за счет энергии АТФ, который
расщепляется белком миозином до АДФ и фосфата.
Способность миозина гидролизовать АТФ была обнару-
жена еще в 1939 г. В. А. Энгельгардтом — тем самым,
который открыл явление окислительного фосфорилиро-
вания. АТФ-азная активность миозина обеспечивает пе-
реход химической энергии, освобождающейся при гид-
ролизе АТФ, в механическую энергию сокращающейся
мышцы.
Рис. 30. Строение молекулы миозина:
а — «головка»; б — «шейка»; в — «хвост»
103
11.4. Механизм скольжения филаментов
Давайте теперь разберем молекулярные механизмы
скольжения филаментов (рис. 31). Миозин существует
в двух конформациях: с вытянутой и с согнутой «го-
ловкой». Конформация миозина определяется тем, ка-
кое вещество находится в его активном центре: АТФ,
АДФ + фосфат, только АДФ или же ничего. Если в ак-
тивном центре миозина находится АТФ или ничего нет,
«головка» будет изогнута. Если же там АДФ или АДФ
+ фосфат, то «головка» вытянута. Миозин обладает спо-
собностью связываться с актином, причем эта связь
Рис. 31. Механизм передвижения молекулы миозина по актиновому
филаменту:
1—4 — последовательные стадии процесса: а — тонкий филамент;
б — толстый филамент; в — «шарнир»; г — миозиновая головка
104
тоже зависит от того, что находится в активном цент-
ре миозина. Если там АТФ или АДФ + фосфат, то ми-
озин не будет связываться с актином; если просто АДФ
или ничего — будет. Для облегчения запоминания
можно считать, что выпрямленность «головки» опреде-
ляется АДФ: если он там есть (только АДФ или АДФ
и фосфат), то она вытянута, если нет — изогнута. Свя-
зывание с актином определяется наличием третьего
фосфата (в составе АТФ или вместе с АДФ), который
мешает этому процессу; если же его нет, то связывание
возможно.
Пусть в активном центре миозина имеется АТФ
(этап 1 на рис. 31). При этом «головка» миозина
изогнута и сам он не связан с актином. Затем мио-
зин расщепляет АТФ, и в его активном центре ока-
зываются АДФ и фосфат (этап 2). В результате «го-
ловка» миозина выпрямляется, но он по-прежнему не
будет связываться с актином. На следующей стадии
из активного центра уходит фосфат (этап 3). При этом
«головка» миозина останется вытянутой, а сам он
сразу же свяжется с актином. Затем из активного
центра миозина уходит АДФ (этап 4), поскольку АДФ
больше нет, головка «миозина» будет изгибаться. Но
миозин при этом все еще связан с актином, и при
изгибе «головки» он будет подтягивать весь тонкий
филамент. В результате филаменты продвигаются на-
встречу друг другу на один шаг. Наконец, активный
центр миозина связывает новую молекулу АТФ и от-
соединяется от актина (снова этап 1). После этого
цикл повторяется, и тонкий филамент подтягивается
еще на один шаг.
На рис. 31 сокращение мышцы показано на плоско-
сти, но, поскольку в состав толстого филамента входит
множество молекул миозина, он подтягивает все сосед-
ние тонкие филаменты.
105
11.5. Регуляция мышечного сокращения и роль
ионов Са2+ в этом процессе
Если бы не существовало регулирующих систем, то
в соответствии с вышеописанным механизмом мышца
сокращалась бы все время, пока в клетке есть АТФ. По-
добная судорога принесет мало пользы организму. По-
скольку на самом деле мышца сокращается только по
сигналу от нейрона (обычно поперечно-полосатые мыш-
цы сокращаются под контролем сознания, гладкие —
вне контроля), должна существовать регулирующая сис-
тема, которая включает и выключает сокращения. В ре-
гуляции мышечного сокращения очень важную роль
играют ионы Са2+. В состоянии покоя один из белков
тонкого филамента располагается между актином и ми-
озином, препятствуя их контакту и тем самым не да-
вая филаментам скользить друг по другу. Когда не-
рвный импульс подходит к мышечному волокну, мы-
шечная клетка возбуждается и в процессе этого
возбуждения ионы кальция выходят из эндоплазмати-
ческого ретикулума через специальные каналы, их кон-
центрация в цитоплазме резко возрастает. Са2+ связы-
вается с определенными белками тонкого филамента,
после чего они значительно изменяют свою конформа-
цию и больше не мешают контакту актина с миозином.
Происходит мышечное сокращение. Когда возбуждение
проходит, ионы Са2+ опять удаляются из цитоплазмы
в полость ЭПР ферментом Са2+-АТФ-азой, и мышца
возвращается в исходное состояние.
---------------------------------
Чтобы понять процесс регуляции, понадобится разобрать стро-
ение тонкого филамента в деталях (рис. 32). В тонком фи-
ламенте две цепочки актиновых шариков заплетены друг вок-
руг друга. Между участками, содержащими по семь шариков
актина в каждой цепочке, расположены две молекулы белка
тропонина. Длинные тяжи от одной молекулы тропонина до
другой образованы белком тропомиозином. Их два на каж-
дом участке тонкого филамента. (На рис. 33 виден только
106
40 нм
Рис. 32. Строение тонкого филамента:
а — тропомиозин; б — актин; в — тропониновый комплекс
один, другой — за плоскостью рисунка.) Они облеплены ша-
риками актина. Итак, если толстый филамент в первом при-
ближении содержит только белок миозин, то тонкий состоит
из трех: актина, тропонина и тропомиозина. На один учас-
ток тонкого филамента приходится две молекулы тропонина,
четырнадцать — актина и две — тропомиозина.
Сокращения поперечно-полосатой мышцы регулируются с
помощью ионов кальция. Са2+ присоединяется только к тро-
понину, но все белки тонкого филамента тесно связаны друг
с другом. Если какое-то вещество взаимодействует с белком,
он может резко изменить конформацию (вспомните миозин
и АТФ). Связывание Са2+ с тропонином приводит к значи-
тельному изменению его конформации. Но тропонин тесно
связан с тропомиозином, и изменение конформации тропони-
на повлияет на положение тропомиозиновых тяжей. Таким
образом, присоединение Са2+ к тропонину как бы сдвигает
тропомиозин относительно актиновых нитей. Чтобы нагляд-
нее представить эти изменения, рассмотрим поперечный срез
(рис. 33).
На рис. 33 (в отличие от рис. 32) показана еще и «головка»
миозина. Два небольших шарика изображают молекулы ак-
тина. Остальные двенадцать актинов расположены вне плос-
кости рисунка — над ним и под ним. Они образуют две
скручивающиеся нити, как было показано на рис. 30. Два со-
всем маленьких шарика — это поперечный срез тяжей тро-
помиозина, а тропонин расположен вне плоскости — на мес-
те головы человека, рассматривающего рисунок.
При отсутствии Са2+ тропомиозин, вклинившись между акти-
ном и миозином, физически препятствует контакту этих бел-
ков. Теперь абсолютно все равно, связана ли молекула миози-
на с АТФ или АДФ: раз тропомиозин мешает миозину соеди-
ниться с актином, то мышечное сокращение невозможно.
Энергетические расходы сразу же прекращаются. Так как
107
Рис. 33. Поперечный срез филаментов:
а — тропомиозин; б — актин; в — тропониновый комплекс
тропомиозиновые тяжи идут вдоль всех четырнадцати глобул
актина, то в отсутствие Са2+ контакт миозина с актином не-
возможен на всем протяжении тонкого филамента.
Пусть теперь в цитоплазме появился кальций (он выходит
из полости эндоплазматического ретикулума при возбужде-
нии мышцы). Са2+ связывается с тропонином, и тот меняет
конформацию. Но с тропонином связан тропомиозин. Как
только тропонин изменился, он «утягивает» тропомиозин, ос-
вобождая место для контакта актина с миозином. Теперь все
четырнадцать шариков актина могут связываться с миозио-
ном, и происходит скольжение филаментов.
Процесс возбуждения мышечной клетки состоит в том, что ее
наружная мембрана резко деполяризуется — мембранный
потенциал падает до нуля. Затем каким-то образом возбуж-
дение передается на мембраны ЭПР и там открываются ка-
налы для Са2+ (каким способом сигнал от наружной мембра-
ны достигает мембрань^ ЭПР, пока неизвестно).
Итак, при возбуждении поперечно-полосатой мышцы события
развиваются в следующем порядке: сперва нервный импульс
доходит по нейрону до мышечной клетки и вызывает депо-
ляризацию ее наружной мембраны. Затем на мембране эн-
доплазматической сети открываются специальные каналы,
через которые ионы Са2+ выходят в цитоплазму. Там белок
тропонин связывает ионы кальция, изменяет свою конформа-
цию и «вытаскивает» тропомиозиновые тяжи из зоны кон-
108
такта актина с миозином. Миозин начинает расщеплять АТФ,
и толстый филамент ползет по тонкому.
После прекращения возбуждения фермент Са2+-АТФ-аза, на-
ходящийся на мембране эндоплазматической сети, за счет
энергии АТФ закачивает Са2+ обратно. Са2+ выходит из ре-
тикулума без затрат энергии: ведь его концентрация в ци-
топлазме гораздо ниже. Для обратной транспортировки, про-
тив градиента концентрации, нужна энергия АТФ. Са2+-АТФ-
аза не включается специально при мышечном сокращении,
а работает постоянно: ведь пассивный выход через кана-
лы — очень быстрый и эффективный процесс. Пока они от-
крыты, Са2+-АТФ-аза не может накачать Са2+ в ретикулум —
он тут же выходит через каналы. Но как только эти каналы
закрываются (т. е. возбуждение мышцы прекратилось), Са2+-
АТФ-аза быстро транспортирует Са2+ обратно.
--------------------------------
1. Почему у бактериальных клеток нет цитоскелета?
2. Почему вскоре после смерти развивается трупное окочене-
ние мышц?
3. Почему в мышечных клетках цистерны эндоплазматичес-
кого ретикулума расположены рядом с пучками филамен-
тов?
§ 12. Микрофиламенты в немышечных клетках.
Система микротрубочек
12.1. Организация микрофиламентов
в немышечных клетках
Микрофиламенты существуют и в немышечных
клетках, даже у растений. Они очень похожи на тонкие
филаменты поперечно-полосатых мышц толщиной око-
ло 5—7 нм, состоят они в основном из актина. В них
имеются и другие белки, но тропониновая система от-
сутствует. Микрофиламенты немышечных клеток в от-
личие от тонких филаментов поперечно-полосатых
мышц могут собираться и разбираться при необходи-
109
мости, а также прикрепляться к а личным клеточ-
ным структурам.
Немышечные клетки умеют строить упорядоченные
пучки актиновых филаментов, в которых они располо-
жены не под случайными углами друг к другу, а парал-
лельными рядами с ориентированными концами в од-
ну сторону (хотя, конечно, эти пучки не столь регулярны
и упорядочены, как тонкие филаменты поперечно-поло-
сатой мышцы). Иногда такие пучки связываются с кле-
точной мембраной, причем часто в местах прикрепле-
ния клетки к поверхности, по которой она ползает.
Обычно клетки прикрепляются к поверхности с помо-
щью специальных мембранных белков-рецепторов. Ког-
да рецептор клетки связывается с поверхностью, к не-
му с помощью вспомогательных белков присоединяется
конец актинового филамента; в результате такого при-
соединения филамент стабилизируется и уже не растет
и не распадается.
В упорядоченных пучках с актином может связать-
ся миозин, благодаря чему такой пучок будет скользить
по соседнему. Скольжение играет важную роль в разде-
лении двух дочерних животных клеток. Филаменты, со-
держащие эти два белка, образуют кольцо по экватору
клетки, оно постепенно стягивается и разделяет мате-
ринскую клетку на две дочерние.
Миозин способен присоединиться и к какой-нибудь
органелле; тогда эта органелла сможет перемещаться по
актиновому филаменту из одной части клетки в дру-
гую. Благодаря этому процессу осуществляется, напри-
мер, постоянное движение цитоплазмы и органелл в
клетках водорослей Chara и Nitella.
В большинстве животных клеток, кроме цитоплазма-
тических микрофиламентов, имеется густая сеть акти-
новых нитей, которая прикреплена изнутри к ‘цитоплаз-
матической мембране. Эта сеть называется клеточным
кортексом. Строение кортекса различается у разных
клеток, а также в разных участках одной клетки. В
110
живых клетках кортекс находится в постоянно натяну-
том состоянии. Поэтому если клетка не имеет жесткой
оболочки и не прикреплена к какой-нибудь поверхнос-
ти, она приобретает форму шара, так как у шара мини-
мальна поверхность при данном объеме. В этом смыс-
ле кортекс можно сравнить с резиновой оболочкой воз-
душного шарика, которая тоже находится в постоянном
натяжении. Пока неизвестно, что поддерживает натяже-
ние кортекса: то ли взаимодействие актиновых нитей
с помощью миозина, то ли какие-то иные силы.
12.2. Амебоидное движение
Итак, система микрофиламентов обеспечивает движе-
ние многоклеточного организма с помощью мышц. Эта
же система осуществляет один из основных типов дви-
жения эукариотических клеток — амебоидное движе-
ние. Таким способом передвигается знакомая вам из
курса зоологии амеба, фагоцитирующие микробов лейко-
циты — нейтрофилы и макрофаги, клетки соединитель-
ной ткани — фибробласты и др.
Клетка умеет расслаблять кортекс в определенных
участках своей поверхности, что очень важно для амебо-
идного движения. Мы не знаем, как регулируется натя-
жение кортекса, образование и распад микрофиламен-
тов. Поэтому, хотя следует всегда помнить, что клетка
— это всего лишь совокупность различных молекул, мы
будем излагать события так, как будто она умеет ду-
мать. Механизм амебоидного движения раскрыт далеко
не полностью, существует несколько теорий, объясняю-
щих этот процесс: здесь излагается наиболее распрост-
раненная (рис. 34).
Пусть амебоидная клетка ползет в каком-то направ-
лении (на рис. 34 — направо). С этой стороны может
быть некий привлекающий фактор: для амебы, скажем,
градиент аминокислот (она охотно поглощает их из ра-
створа); для макрофага — вещество, выделяемое добы-
чей-микробом. На переднем крае клеточный кортекс
111
Рис. 34. Возможный механизм амебоидного движения
(1—4 — последовательные стадии перемещения; стрелки показывают
направление движения клетки):
а — активный кортекс; б — ложноножка; в — кортекс под натяжени-
ем; г — движение цитоплазмы; д — участки прикрепления ложно-
ножки к поверхности
начнет расслабляться, но на заднем конце клетки натя-
жение сохраняется. В результате содержимое клетки
будет выдавливаться вперед, как крем из тюбика,—
клетка выпускает псевдоподию (ложноножку). При
этом в псевдоподии идет интенсивная полимеризация
актина — удлиняющиеся микрофиламенты буквально
распирают изнутри клеточный кортекс.
По мере выпускания псевдоподии в ней образуются
актиновые филаменты, их концы упираются в мембра-
ну. На следующем этапе движения псевдоподия долж-
на закрепиться на поверхности. На наружной мембране
клетки имеются рецепторы, позволяющие связываться
с поверхностью, по которой она ползет. За счет таких
рецепторов мембрана псевдоподии прикрепляется к под-
ложке. После этого актиновые филаменты закрепляют-
112
ся на этих рецепторах и вся псевдоподия «заякорится»
на поверхности. Псевдоподия оказалась прочно прикреп-
ленной к подложке. Теперь то самое натяжение кортек-
са, благодаря которому она выдавилась, будет подтяги-
вать всю клетку к прикрепившейся псевдоподии. Пред-
ставим себе аналогию: вы разлили по столу липкий
сахарный сироп, положили на лужу надутый воздушный
шарик и сдавили его сзади. Часть воздуха перейдет
в передний конец шарика, и он вздуется на переднем
конце. Теперь прижмите этот передний конец к липко-
му столу, и весь шарик постепенно «подползет» к зак-
репленному переднему краю. Вероятно, в клетке в ходе
этого процесса происходит активный транспорт органелл
к переднему концу клетки по микрофиламентам с по-
мощью миозиновых «моторов».
12.3. Строение и функции микротрубочек
Перейдем ко «второму скелету» — системе микро-
трубочек (рис. 35). Они состоят из белка тубулина. Все
шарики тубулина лежат один над другим, но по гори-
зонтали они расположены со смещением — по спирали.
На срезе микротрубочки (а она в разрезе круглая) вид-
ны тринадцать молекул тубулина. Внешний диаметр
микротрубочки — 25 нм, внутренний — 14 нм.
а
8 нм
1
2
Рис. 35. Схема строения микротрубочки:
1 — вид сбоку; 2 — поперечный разрез. Молекулы тубулина (а),
состоящие из двух субъединиц альфа и бета, образуют 13 продоль-
ных рядов (6)
8 Зак. 13485
113
Спираль микротрубочки асимметрична. У нее мож-
но различить (+)конец и (-)конец. Микротрубочки
способны к самосборке и саморазборке. Белок мик-
ротрубочек — тубулин — связывает богатое энергией
соединение ГТФ (его структура похожа на структуру
АТФ) и может расщеплять его до ГДФ и фосфата.
Тубулин в комплексе с ГТФ может «садиться» на
концы микротрубочек, и спираль будет удлиняться
виток за витком. При сборке и разборке микротрубо-
чек молекулы присоединяются и удаляются только
с (+)конца.
Микротрубочки выполняют в клетке несколько
очень важных функций:
участвуют в поддержании формы клетки (ясно, что
при амебоидном движении микротрубочки должны пре-
терпевать серьезные перестройки);
транспортируют органеллы из одного участка клетки
в другой. В любой эукариотической клетке микротру-
бочки служат «рельсами», по которым органеллы мо-
гут скользить в обоих направлениях. Есть специальные
белки, похожие по принципу действия на миозин,— ки-
незины и динеины. Они осуществляют скольжение
органелл по микротрубочкам. Этот транспорт тоже АТФ-
зависимый: кинезины и динеины расщепляют АТФ.
Микротрубочки с помощью динеина и кинезина могут
скользить и друг по другу. Зачем это необходимо клет-
ке, станет понятно при рассмотрении работы жгутика;
гораздо чаще, чем микрофиламенты, используются
для транспортировки органелл. Более того, оказалось, что
микротрубочки определяют расположение в клетке ци-
стерн эндоплазматического ретикулума и аппарата
Гольджи. Если клетку обработать веществом, разрушаю-
щим микротрубочки, то цистерны ЭПР сосредоточатся
в середине клетки и не будут распределены по всему ее
объему, а пузырьки аппарата Гольджи, наоборот, отой-
дут к краям клетки;
114
участвуют в образовании жгутиков и ресничек.
У человека с помощью жгутиков передвигаются спер-
матозоиды; реснички, по внутреннему строению очень
похожие на жгутики, имеются в эпителии носоглот-
ки — они выгоняют нарушу пыль и микробы. Меха-
низм работы эукариотического жгутика рассмотрен
ниже;
образуют митотическое веретено в процессе деления
клетки.
12.4. Жгутик эукариотической клетки
Жгутик эукариот сильно отличается от жгутика про-
кариот. Жгутик бактерий похож на жесткий вращаю-
щийся штопор, с помощью которого клетка «ввинчива-
ется» в воду или «вывинчивается» из нее. Жгутик эука-
риот скорее похож на гибкий хлыст, бьющийся в воде.
Рис. 36. Поперечный срез эукариотического жгутика:
а — радиальная «спица*; б, в — «ручки*; г — белковые «связки*
между парами микротрубочек; д — плазматическая мембрана; е —
центральная пара одиночных микротрубочек; ж — внутренняя
капсула; з — периферийная пара микротрубочек; и — «полная*
микротрубочка, состоящая из 13 тубулиновых нитей; к — «неполная*
микротрубочка, состоящая из 10 тубулиновых нитей
115
Эукариотический жгутик движется за счет энергии
АТФ, тогда как микробный — за счет энергии электро-
химического потенциала.
На поперечном срезе эукариотического жгутика
(рис. 36) видны две микротрубочки в центре и девять
пар по периферии. Из каждой пары периферических мик-
ротрубочек одна «полная» (в ней по кругу размещены
13 молекул тубулина), а вторая — «уменьшенная»: в
ней всего 10 тубулиновых шариков.
Направленные к центру жгутика белковые «спицы»
необходимы для поддержания структуры; это связыва-
ющий, структурный компонент жгутика. «Ручки», отхо-
дящие от одной микротрубочки и касающиеся соседней,
состоят из белка динеина. Как вы помните, динеин мо-
жет вызывать передвижение органелл по микротрубоч-
кам за счет энергии АТФ и что с помощью динеина
одна микротрубочка может ползти по другой.
Представьте себе, что одна пара микротрубочек в со-
ставе жгутика начала ползти по соседней паре. Если бы
эти микротрубочки не были соединены ни с какими
другими структурами, то, скользя друг по другу, они ус-
Рис. 37. Механизм работы эукаритического жгутика:
а — «полная» микротрубочка; б — «неполная» микротрубочка
116
тремились бы вон из жгутика, о все пары микротру-
бочек связаны друг с другом и с центром жгутика,
никуда уползти они не могут, а скольжение просто изог-
нет жгутик, изменив угол динеиновых «ручек». На
рис. 37 показана часть продольного среза, видны только
две пары микротрубочек. Взаимное скольжение микро-
трубочек приводит к их смещению, если разрушить свя-
зи между ними (1), либо к изгибу жгутика, если связи
удерживают вместе пары микротрубочек (2). Дальше
волна «изгибания» распространяется от основания жгу-
тика к его концу (на рисунке — вверх), и он начинает
вращаться, как хлыст.
В1. Сможет ли амеба ползать, если расщепить все белки на ее
поверхности, не повредив при этом липидный бислой?
2. Почему вещества, препятствующие образованию актиновых
филаментов, ингибируют фагоцитоз?
3. В эукариотическом жгутике разрушили структуры, соеди-
няющие пары микротрубочек друг с другом и с центром,
но не повредили динеин. Сможет ли такой жгутик дви-
гаться?
tyicunicoe соде/гжанае главы
1. В цитоплазме всех эукариотических клеток есть специ-
альные системы, состоящие из белковых нитей и трубочек,—
так называемый цитоскелет. Различают три системы цитоске-
лета, важнейшими из которых являются микротрубочки и мик-
рофиламенты. Большинство клеток умеет разбирать и вновь
собирать свои микротрубочки и микрофиламенты.
Микрофиламенты состоят из белка актина. Шарики актина
формируют нити, которые в составе микрофиламента спирально
закручиваются одна вокруг другой. В некоторых клетках микро-
филаменты содержат и другие белки. Система микрофиламен-
тов обеспечивает два способа движения: мускульное передви-
жение организма и амебоидное движение клетки.
117
В состав клеток поперечно-полосатых мышц входят нити
тонких филаментов, содержащих белок актин, и толстых фила-
ментов, состоящих из белка миозина, молекулы которого состы-
кованы «хвост к хвосту». Тонкие филаменты прикреплены к
специальной поперечной пластинке — Z-линии. В процессе мы-
шечного сокращения толстые филаменты скользят по тонким,
подтягивая их друг к другу, что приводит к уменьшению длины
мышечной клетки. Энергию для этого процесса дает гидролиз
АТФ белком миозином.
2. Молекула миозина состоит из двух частей: «головки»
и «хвоста», соединенных подвижно. Угол между «головкой»
и «хвостом» может меняться в зависимости от того, что нахо-
дится в активном центре миозина: АТФ, АДФ и фосфат, АДФ
или же ничего. Миозин может связываться с актином, и воз-
можность этого связывания также зависит от состояния актив-
ного центра.
Когда в активном центре миозина находится АТФ, «го-
ловка» миозина изогнута, а сам он не связывается с акти-
ном. Затем миозин расщепляет АТФ и в его активном цен-
тре оказываются АДФ и фосфат. При этом «головка» мио-
зина выпрямляется, но он по-прежнему не будет связываться
с актином. На следующей стадии из активного центра ухо-
дит фосфат, головка миозина останется вытянутой, а сам
он сразу же свяжется с актином. Затем из активного цен-
тра миозина уходит АДФ. В результате «головка» миозина
будет изгибаться, но миозин при этом все еще связан с
актином, и при изгибе головки он будет подтягивать весь
тонкий филамент. В ходе этого процесса филаменты продви-
нутся навстречу друг другу на один шаг. Наконец, активный
центр миозина связывает новую молекулу АТФ и отсоединя-
ется от актина, возвращаясь в исходное состояние. После
этого весь цикл может повториться, и тонкий филамент под-
тянется еще на один шаг. Регуляция мышечного сокращения
осуществляется с помощью ионов Са2+. В покоящейся мыш-
це много Са2+ сосредоточено в цистернах ЭПР, в цитоплаз-
ме его мало. Без ионов Са2+ белки, регулирующие мышеч-
ное сокращение, не дают миозину взаимодействовать с ак-
тином. Когда мышца возбуждается под действием нервного
импульса, ионы Са2+ выходят из ЭПР в цитоплазму, и тогда
системы регуляции позволяют актину войти в контакт с ми-
озином.
118
3. В немышечных клетках микрофиламенты могут разбирать-
ся, вновь собираться и прикрепляться к различным клеточным
структурам. Сокращение актомиозиновых структур играет боль-
шую роль в разделении двух животных клеток после митоза.
В большинстве животных клеток имеются как цитоплазматичес-
кие микрофиламенты, так и густая сеть актиновых нитей, при-
крепленная изнутри к наружной мембране. Эта сеть называет-
ся клеточным кортексом. В живых клетках кортекс находится
в постоянно натянутом состоянии, как резиновая оболочка воз-
душного шара. Натяжение кортекса имеет большое значение
для амебоидного движения.
4. В процессе амебоидного движения клеточный кортекс
сперва расслабляется на переднем конце клетки, оставаясь
натянутым на заднем ее конце. Клеточное содержимое выдав-
ливается вперед, образуя псевдоподию. Затем псевдоподия при-
крепляется к поверхности, по которой ползет клетка, с помо-
щью специальных белков-рецепторов. После такого закрепления
натяжение кортекса подтянет заднюю часть клетки к закрепив-
шейся передней части. Затем кортекс опять расслабится на
переднем конце и т. д.
Микротрубочки состоят из молекул белка тубулина, которые
располагаются спирально, на поперечном срезе при этом видно
13 тубулиновых шариков. Микротрубочки выполняют следующие
функции: участвуют в поддержании формы клеток; служат «рель-
сами» для перемещения органелл из одной части клетки в дру-
гую; участвуют в образовании жгутиков и ресничек; образуют
веретено деления при митозе. Для транспортировки органелл
по микротрубочкам в клетке имеются специальные белки —
кинезины и динеины. Передвижение осуществляется за счет
энергии АТФ.
5. Жгутик эукариот — гибкая структура, в процессе движе-
ния он изгибается, как хлыст. На поперечном срезе жгутика
видны две микротрубочки в середине и девять пар микротру-
бочек, расположенных по окружности. Периферические пары
соединены друг с другом и с серединой жгутика специальными
структурными белками. К каждой паре микротрубочек присое-
динены молекулы динеина, которые входят в контакт с сосед-
ней парой. Процесс движения жгутика начинается с того, что
в определенном участке около его основания динеин, гидроли-
зуя АТФ, начинает вызывать скольжение одной пары микротру-
бочек по другой. Однако эти пары соединены друг с другом
119
и с центром жгутика, они не могут уйти одна от другой, и
вместо передвижения пар микротрубочек наблюдается изгиба-
ние жгутика в этом месте. Затем волна изгибания распростра-
няется дальше по жгутику, в результате чего он и начинает
«биться».
Тлава 5
РЕГУЛЯЦИЯ КЛЕТОЧНЫХ ФУНКЦИЙ
В клетке существуют разнообразные механизмы ре-
гуляции ее жизнедеятельности. Есть механизмы, кото-
рые регулируют активность метаболических процессов;
есть механизмы, которые регулируют процессы клеточ-
ного деления, и т. д. В этой главе рассмотрены несколь-
ко примеров работы таких механизмов. Другие приме-
ры регуляции будут рассмотрены в следующих главах.
§ 13. Регуляция процессов самоподдержания
клетки. Механизм действия гормонов
и нейромедиаторов
13.1. Регуляция процессов самоподдержания
В клетке одновременно протекают тысячи реакций.
Многие из них необходимы для поддержания жизнеде-
ятельности самой клетки: удовлетворения ее энергети-
ческих нужд, синтеза молекул, из которых строятся ее
структуры, и др. Другие же вроде бы не нужны данной
клетке, зато необходимы для обеспечения работы всего
организма в целом. Обычно содержание веществ, необ-
ходимых для самой клетки, регулируется по принципу
отрицательной обратной связи, когда конечный продукт
ингибирует свой собственный синтез. Рассмотрим, к при-
меру, регуляцию концентрации АТФ.
120
Как вы помните, одним из способов получения АТФ
является процесс гликолиза. Среди многочисленных
ферментов, участвующих в гликолизе, есть один, кото-
рый катализирует самую медленную реакцию и таким
образом определяет скорость всего процесса. Фермент,
который определяет скорость какого-либо многостадий-
ного процесса, называется ключевым ферментом. Ока-
залось, что ключевой фермент гликолиза ингибируется
(т. е. угнетается) АТФ. Когда в клетке концентрация
АТФ низка, ключевой фермент работает в полную силу,
гликолиз идет с высокой скоростью, и образующийся
при этом АТФ постепенно накапливается. Когда кон-
центрация АТФ становится высокой, ключевой фермент
ингибируется и скорость всего процесса гликолиза па-
дает, что предотвращает бесполезный расход глюкозы.
Таким образом, вся система работает в режиме автома-
тической регуляции: когда АТФ мало, с высокой скоро-
стью идет процесс, приводящий к его синтезу, а когда
АТФ становится много, он сам угнетает процесс своего
образования. Существуют системы регуляции процессов
окислительного фосфорилирования, фотосинтеза и др.
13.2. Регуляция работы ионных каналов
В регуляции процессов, не нужных непосредственно
для жизни данной клетки, но необходимых для орга-
низма в целом, как вы помните, используются две важ-
нейшие системы: нервная и эндокринная. При обеих
типах регуляции на клетку-мишень действуют специ-
альные вещества — нейромедиаторы, выделяемые клет-
ками нервной системы, и гормоны, выделяемые эндок-
ринными железами. Эти вещества могут действовать
различными путями, некоторые из них мы рассмотрим
в этом параграфе. Любой регулятор — гормон или ней-
ромедиатор — сначала связывается со специфическими
белками-рецепторами клетки-мишени, а эти рецепторы
передают сигнал к соответствующим клеточным струк-
турам. Одним из важных механизмов действия рецеп-
121
торов является изменение проницаемости мембранных
каналов.
Мышечное сокращение запускается ионами Са2+, ко-
торые освобождаются из полости эндоплазматической
сети при возбуждении мышцы. (Подробно этот процесс
описан ранее.) Процесс возбуждения начинается с депо-
ляризации наружной мембраны (в главе «Мембранная
система клетки» объяснялось, что на мембранах живот-
ных клеток поддерживается разность потенциалов око-
ло -75 мВ) в участке контакта мышечной клетки
и нервной, а затем распространяется по всей мембране
мышечной клетки. Деполяризация происходит потому,
что на мембранах нервных и мышечных клеток имеют-
ся специальные Na+-каналы, которые открываются при
возбуждении. Поскольку снаружи клетки ионов Na+
много, а внутри мало, то при открывании каналов они
устремятся внутрь клетки, и разность потенциалов на
мембране исчезнет. Затем эти каналы закрываются,
и на мембране восстанавливается прежний потенциал.
Рис. 38. Строение нервно-мышечного синапса:
а — окончание аксона; б — синаптический пузырек с ацетилхолином;
в — пресинаптическая мембрана; г — синаптическая щель;
д — постсинаптическая мембрана (мембрана клетки-адресата);
е — каналы, связанные с рецептором; ж — потенциалзависимый
канал; з — синаптический пузырек, слившийся с мембраной
122
Каким же образом сигнал от нервной клетки может
вызвать деполяризацию мембраны мышечной клетки?
На рис. 38 изображен участок контакта нервного окон-
чания и мышечной клетки. Такой контакт называет-
ся синапсом, а пространство между двумя клетками —
синаптической щелью.
В нервном окончании имеются замкнутые мембран-
ные пузырьки, заполненные концентрированным раство-
ром нейромедиатора — ацетилхолина. При возбужде-
нии нервного окончания эти пузырьки подходят к на-
ружной мембране и сливаются с ней. Ацетилхолин при
этом выделяется в синаптическую щель.
На мембране мышечной клетки, прилегающей к синап-
тической щели, расположены рецепторы ацетилхолина.
Это белки, пронизывающие всю мембрану. Рецептор
ацетилхолина представляет собой регулируемый Na+-Ka-
нал (рис. 39)
Рис. 39. Работа рецептора
ацетилхолина:
1 — ацетилхолин не связан
с рецептором, Ма+-канал
закрыт; 2 — ацетилхолин
только что связался с ре-
цептором, он меняет свою
конформацию; 3 — ацетил-
холин связан с рецептором,
Ма+-канал открыт
123
В «спокойном» состоянии, без ацетилхолина, рецеп-
тор имеет «спокойную» конформацию, внутренний ка-
нал при этом закрыт, ионы натрия через него не прохо-
дят. Когда ацетилхолин связывается с рецептором, то
вся конформация белка меняется, он переходит в «воз-
бужденное» состояние: открывается Ыа+-канал, находя-
щийся внутри белковой молекулы, ионы натрия прохо-
дят в мышечную клетку, начинается ее деполяризация,
распространяющаяся по всей мембране, и мышца сокра-
щается.
Чтобы прекратить возбуждение, в синаптической
щели имеется фермент ацетилхолинэстераза, который
быстро разрушает ацетилхолин. Возбуждающий сигнал
исчезает, и мышца расслабляется до поступления сле-
дующего нервного импульса.
Различные нейромедиаторы могут изменить прони-
цаемость не только натриевых, но и других ионных ка-
налов. Так, гамма-аминомасляная кислота, действуя на
свои рецепторы, увеличивает проницаемость мембраны
нервных клеток для ионов СГ, что приводит к увеличе-
нию потенциала на мембране и уменьшению возбудимо-
сти. Лекарственные препараты на основе этого медиато-
ра ( аминалон и гамалон) используют в качестве успо-
каивающих средств. Регуляция мембранных каналов —
сверхбыстрый процесс: и развитие возбуждения, и его
прекращение после окончания действия нейромедиатора
занимают доли секунды. Обычно этот способ регуляции
характерен для деятельности нервной системы (она реа-
гирует гораздо быстрее эндокринной).
13.3. Механизм действия стероидных гормонов
Некоторые физиологические реакции развиваются
довольно медленно, в течение часов, но зато и длятся
достаточнб долго — несколько суток и более. Для та-
ких длительных перестроек жизнедеятельности клеток
необходимо изменение уровня работы соответствующих
генов: некоторые гены нужно активировать, некото-
124
рые — ингибировать. К числу гормонов, которые дей-
ствуют путем изменения генетической активности, от-
носятся стероидные гормоны (коркового слоя надпочеч-
ников и половые) и гормоны щитовидной железы. Од-
ним из классов стероидов являются глюкокортикоиды.
Это гормоны длительного стресса. Они вызывают силь-
ные изменения всего обмена веществ в организме. Весь-
ма приблизительно их метаболическое действие можно
описать как угнетение синтеза запасных питательных
веществ и активацию их распада на энергетические
нужды. Они как бы мобилизуют организм, делают его
готовым к самым разным ситуациям, но при слишком
длительном действии вызывают истощение.
Стероиды представляют собой небольшие гидрофоб-
ные молекулы. Эти молекулы легко проходят через мем-
Рис. 40. Механизм действия стероидных гормонов:
1 — клетка в состоянии покоя; 2 — гормон связывается с цитоплаз-
матическим рецептором; 3 — гормонрецепторный комплекс транс-
портируется в ядро; 4 — активируется синтез определенных РНК
125
брану (вспомните свойства липидного бислоя, описанные
в главе «Мембранная система клетки»), поэтому рецеп-
торы стероидных гормонов расположены в цитоплазме
(рис. 40).
Стероидные гормоны, проникнув через мембрану в
цитоплазму клетки, связываются со своими рецептора-
ми, после чего рецепторы стероидных гормонов изменя-
ют конформацию и начинают транспортироваться в яд-
ро. В ядре комплексы «гормон — рецептор» узнают спе-
циальные регуляторные участки в молекуле ДНК
и связываются с ними. Эти специфические участки
есть далеко не во всех генах, а только в тех, которые
регулируются стероидными гормонами.
После того как стероидный рецептор свяжется со спе-
цифическими участками на ДНК, активность генов, ко-
торые регулируются этими участками, изменится: у од-
них усилится, у других уменьшится. Изменение актив-
ности соответствующего гена вызывает изменение
концентрации белка, который закодирован в данном
гене. Для развития всего процесса требуется довольно
много времени — несколько часов, зато и ответное дей-
ствие получается длительным.
В1. Во второй половине XIX в. французский ученый Луи Па-
стер обнаружил, что утилизация глюкозы дрожжами пу-
тем спиртового брожения происходит гораздо интенсив-
нее в анаэробных условиях, а в присутствии кислорода
скорость этого процесса резко падает. Объясните эффект
Пастера.
2. Как вы считаете, на каких стадиях в метаболических пу-
тях обычно расположены ключевые ферменты — на на-
чальных или на конечных?
3. Боевые нервно-паралитические ОВ (зарин, зоман, V-газы)
необратимо ингибируют ацетилхолинэстеразу. Отчего на-
ступает смерть при отравлении ими?
4. Яд кураре содержит соединение, связывающееся с рецеп-
торами ацетилхолина, но не вызывающее открывания Na+-
каналов. Отчего наступает смерть при отравлении кураре?
126
5. Рецепторы тиреоидных гормонов расположены в ядре, но
тиреоиды, в отличие от стероидов, весьма гидрофильны
и не проникают через липидный бислой. Как же они дос-
тигают рецепторов?
/tycunitoe соде/гжание главы
1. Все метаболические процессы, протекающие в клетке,
тщательно регулируются. Можно различить два основных спосо-
ба регуляции: 1) поддержание на нужном уровне концентрации
веществ, необходимых самой клетке; 2) ответ клетки на сигна-
лы, поступающие от специальных регулирующих систем (нервной
и эндокринной).
Контроль за метаболическими путями, участвующими в про-
цессах самоподдержания клетки, обычно осуществляется по
принципу отрицательной обратной связи. При этом вещество,
образующееся как продукт некоторой цепи реакций, само угне-
тает собственный синтеа Примером отрицательной обратной
связи может служить регуляция гликолиза. Этот метаболический
путь используется для синтеза АТФ за счет расщепления глю-
козы до молочной кислоты. Один из ферментов гликолиза инги-
бируется высокими концентрациями АТФ, что позволяет поддер-
живать содержание этого вещества на стабильном уровне. Ког-
да энергетические затраты клетки невелики и концентрация АТФ
высока, то активность ключевого фермента существенно подав-
лена, скорость гликолиза невелика, и глюкоза потребляется
в очень небольших количествах. Когда же энергетические зат-
раты возрастают, концентрация АТФ в клетке упадет, ключевой
фермент перестанет ингибироваться, скорость гликолиза повы-
сится и содержание АТФ вскоре восстановится до прежнего
уровня.
Контроль за клеточной активностью со стороны других
клеток обычно осуществляется с помощью специальных хи-
мических веществ: гормонов, выделяемых эндокринными
железами, и нейромедиаторов, выделяемых нервной систе-
мой. Одним из механизмов их действия на клетку является
регуляция проницаемости ионных каналов на наружной мем-
бране. Классическим примером такой регуляции служит ра-
127
бота нервно-мышечного синапса (места контакта нервной
и мышечной клеток).
Когда нервный импульс достигает окончания нейрона, пу-
зырьки, заполненные медиатором ацетилхолином, сливаются с
наружной мембраной, а их содержимое освобождается в синап-
тическую щель. Ацетилхолин связывается с рецепторами на
мембране мышечной клетки, после чего внутри рецептора от-
крывается Ма+-канал. Ионы Na+ входят в клетку, вызывая депо-
ляризацию мембраны; волна деполяризации распространяется
по всей мембране и вызывает мышечное сокращение. После
завершения процесса ацетилхолин расщепляется ацетилхолинэс-
теразой.
2. Другим механизмом действия гормонов является регуля-
ция генетической активности. Таким способом влияют на кле-
точную активность стероидные и тиреоидные гормоны. Стерои-
ды — небольшие гидрофобные молекулы, легко проходящие
через липидный бислой. Стероидный гормон, проникнув через
мембрану, связывается со своим рецептором, расположенным в
цитоплазме. Рецептор изменяет конформацию и переходит в
ядро. В ядре гормонрецепторный комплекс «садится» на опре-
деленные участки ДНК, оказывая сильное влияние на работу
расположенных рядом генов; некоторые гены при этом активи-
руются, а некоторые — ингибируются. В отличие от регуляции
мембранных каналов, такой способ регуляции значительно мед-
леннее, но зато и ответ получается гораздо длительнее.
ТТ НАСЛЕДСТВЕННАЯ ИНФОРМАЦИЯ
Ц И РЕАЛИЗАЦИЯ ЕЕ В КЛЕТКЕ
Тлава 6
ХРАНЕНИЕ И РЕАЛИЗАЦИЯ НАСЛЕДСТВЕННОЙ
ИНФОРМАЦИИ
§ 14. Роль ядра в жизни клетки
и в передаче наследственных признаков
14.1. Отсутствие научных представлений о спосо-
бах появления новых клеток вплоть до середины
XIX в.
Основы современной теории наследственности были
заложены в середине XIX в. Грегором Менделем (см.
§21). Однако работа его осталась практически неизвес-
тной современникам. И не только потому, что она была
опубликована в провинциальном журнале: ученые, ко-
торым Мендель сообщил о своем открытии, не смогли
понять и оценить его. Причины этого были разнообраз-
ны. Одна из главных заключалась в том, что в 1865 г.,
когда была опубликована основная работа Менделя, еще
ничего не было известно о материальных носителях на-
следственности. Мендель предполагал, что от родителей
потомкам передаются «наследственные факторы». Од-
нако эти «наследственные факторы» (впоследствии на-
званные генами) представлялись чем-то совершенно аб-
страктным.
Хотя клетки были открыты еще в XVII в., изучение
их строения шло очень медленно. В 40-е годы XIX в.
появилась клеточная теория — ученые осознали, что
клетки растений и животных представляют собой сход-
9 Зак. 13485
129
ные структурные единицы. Однако ее авторы еще прак-
тически ничего не знали о способах размножения кле-
ток. Так, М. Шлейден полагал, что клетки могут возни-
кать из межклеточного вещества. Лишь в 1861 г. опы-
ты Пастера положили конец спорам о возможности
самопроизвольного зарождения микроорганизмов. Все-
го за семь лет до появления работы Менделя Р. Вирхов
сформулировал главное положение клеточной теории
(«Всякая клетка — из клетки»).
Задание. Подумайте, какова роль этого положения в развитии
взглядов на живую природу.
14.2. Открытие слияния половых клеток
и их ядер при оплодотворении
Исходя из теоретических представлений, Мендель
предполагал, что при оплодотворении происходит слия-
ние двух половых клеток. Однако доказать это он не
смог. Надо отметить, что до конца XVIII в. большинство
ученых считали сперматозоиды паразитическими живот-
ными. До середины XIX в. существовало мнение, что спер-
матозоиды лишь побуждают яйцо к развитию. Только в
1875 г. О. Гертвиг, изучив оплодотворение у морского ежа,
доказал, что сперматозоид сливается с яйцеклеткой, так
что образуется зигота, в которой происходит слияние их
ядер. В дальнейшем было доказано, что эти же процессы
происходят при оплодотворении и у растений (см. § 32).
14.3. Наличие постоянного числа хромосом
у каждого вида. Уменьшение числа хромосом
вдвое при образовании половых клеток
Примерно в этот же период (1873 г.) в ядрах клеток
были открыты хромосомы — окрашенные тельца (хро-
ма — по-гречески «цвет», «краска»), изучено митотичес-
кое деление клеток (см. § 20), а несколько позднее —
мейоз, или деление, которое происходит при образовании
половых клеток у эукариот. Оказалось, что при делении
клеток происходит удивительно точное и сходное у жи-
130
вотных, гри ов и растении распределение ядерных те-
лец — хромосом. При митозе число хромосом в дочер-
них клетках остается тем же, что было в исходной клет-
ке. А вот во время мейоза число хромосом уменьшается
вдвое. Особенно четко это было показано при изучении
хромосом аскариды, у которой в клетках тела (их назы-
вают соматическими, от греч. слова сома — тело) всего
четыре хромосомы (у других видов аскарид их бывает
всего две). Оказалось, что этот набор состоит из двух пар
хромосом. При образовании яйцеклеток и сперматозои-
дов в них попадает по одной хромосоме из каждой пары
(всего две хромосомы). В ходе оплодотворения при сли-
янии ядер половых клеток образуется ядро, снова содер-
жащее две пары хромосом (рис. 41).
X
X
Рис. 41. Наборы хромосом в гаметах и в зиготе аскариды: вверху —
наборы хромосом в гаметах (половых клетках); внизу — набор
хромосом зиготы (клетки, возникающей при слиянии двух гамет).
Of — знак мужского пола (щит и копье Марса), 9 — знак женского
пола (зеркало Венеры)
131
В 80-е годы XIX в. было окончательно установлено,
что для каждого вида животных и растений характерно
определенное число хромосом. Этот факт был установ-
лен немецким цитологом Т. Бовери. Хромосомы клеток
данного вида организмов отличаются по размеру, форме
и строению, так что их можно отличить друг от друга.
В половых клетках хромосом вдвое меньше, чем в сома-
тических. Отсюда возникло убеждение, что хромосомы
сохраняются в клетках постоянно и сохраняют свою
индивидуальность (хотя в промежутках между деления-
ми они не видны в ядре).
Обычно в соматических клетках имеется по две хро-
мосомы каждого типа: одна — отцовская, другая — мате-
ринская. В этом случае число хромосом в соматических
клетках называют диплоидным числом, а вдвое меньшее
число хромосом в гаметах называют гаплоидным чис-
лом хромосом. (Термин «гаплоидный» произведен от
греч. слов гаплос — одиночный и идос — вид; а термин
«диплоидный» — от диплос — двойной и идос — вид).
14.4. Отсутствие делений у безъядерных клеток.
Необходимость для нормального развития
организма всех хромосом
Уже в конце XIX в. было установлено, что ядро необ-
ходимо для жизнедеятельности клетки — в первую оче-
редь для ее деления. Об этом свидетельствовали наблю-
дения: например, такие безъядерные клетки, как эрит-
роциты человека, никогда не делятся. Но основные
доказательства были получены путем экспериментов.
Именно в этот период зародилось экспериментальное
направление в эмбриологии — науке об индивидуаль-
ном развитии организмов (см. главу 9). Один из первых
экспериментов по выяснению роли ядра был поставлен
Е. Вильсоном (рис. 42). Он разрезал на несколько час-
тей клетку инфузории. Результат всегда оказывался
одинаков: все фрагменты клетки погибали без деления
и регенерации, кроме того кусочка, в который попадало
132
Безъядерный
фрагмент
погибает
Фрагмент,
содержащий
ядро,
регенерирует
Безъядерный
фрагмент
погибает
Рис. 42. Схема эксперимента по выяснению роли ядра в регенерации
инфузории. Судьба фрагментов клетки инфузории зависит от нали-
чия в них большого ядра
большое ядро (напомним, что у инфузорий два ядра —
большое и маленькое). Фрагмент с большим ядром вос-
станавливал недостающие части клетки, и получившая-
ся инфузория вновь приступала к делению.
Вскоре были проделаны первые эксперименты и по
выяснению роли хромосом. Когда из делящейся зиготы
морского ежа удаляли одну из хромосом, развитие нару-
шалось и зародыши всегда погибали.
14.5. Половые клетки потенциально бессмертны.
Невозможность передачи наследственных
признаков от соматических клеток половым
(приобретенные признаки не наследуются)
Первым оценил роль новых цитологических данных
для теории наследственности замечательный немецкий
ученый А. Вейсман (1834—1914).
В первой половине жизни Вейсман сам изучал деле-
ние клеток и вел другие микроскопические исследова-
ния (в частности, он открыл мышечные рецепторы). Но
133
1
Рис. 43. Иллюстрация теории «зародышевой плазмы» Вейсмана;
1 — потенциально бессмертные клетки «зародышевого пути», кото-
рые содержат зародышевую плазму; 2 — смертные клетки сомы.
Сверху вниз изображены последовательные поколения
ежедневная многочасовая работа с микроскопом приве-
ла к болезни глаз, и Вейсман был вынужден прекратить
эту работу. Тогда он занялся обобщением данных о де-
лении клеток, известных к тому времени. В 80-е годы
XIX в. Вейсман создал свою теорию наследственности, во
многом предвосхитившую современные взгляды,— тео-
рию «зародышевой плазмы». Согласно этой теории, все
организмы состоят из двух относительно независимых
частей — смертной сомы (тела) и потенциально бес-
смертной зародышевой плазмы, которая содержится в
половых клетках и передается через них из поколения
в поколение (рис. 43).
В зародышевой плазме содержатся сведения обо всех
признаках организма. Вейсман был уверен, что зароды-
шевая плазма находится в ядре и указывал на хромосо-
мы как на вероятные носители наследственных свойств.
Таким образом, понятие зародышевой плазмы было
близко к современному понятию генотипа (см. § 29)*.
>»
* Вейсман считал, что зародышевая плазма практически неиз-
менна (это оказалось ошибочным). Откуда же тогда берутся новые
признаки? Вейсман правильно оценил роль полового размножения
в возникновении изменчивости. Он считал, что при половом раз-
множении смешиваются зародышевые плазмы разных родителей
и возникают новые комбинации генов (вместо этого термина он
использовал несколько других, не прижившихся в науке).
134
Вейсман считал, что сома никак не может повли-
ять на зародышевую плазму. Для проверки своей ги-
потезы он подрезал хвосты мышатам в течение 15
поколений. Это не привело к рождению короткохвос-
тых мышат. (Сейчас этот эксперимент может пока-
заться наивным, но в те времена многие ученые вери-
ли в возможность наследования подобных уродств.)
Так было впервые экспериментально доказано поло-
жение, подтвержденное всем дальнейшим ходом раз-
вития науки — признаки, приобретенные в течение
жизни, не могут наследоваться, если они не затра-
гивают наследственную информацию (генотип) по-
ловых клеток.
При вегетативном или бесполом размножении (см.
§19) могут наследоваться и изменения генотипа сома-
тических клеток.
----------------------------------
Из схем Вейсмана и его пояснений видно, что он предпола-
гал наличие пары факторов, отвечающих за данный признак,
и попадание в гаметы только одного из них. Таким образом,
он независимым путем пришел к тем же выводам, что и Мен-
дель (см. § 21). Он также считал, что гены располагаются в
хромосомах в линейном порядке, предвосхитив тем самым
хромосомную теорию наследственности (см. § 22). Наконец,
одним из первых Вейсман высказал предположение, что на-
следственная информация может быть записана на молеку-
лярном уровне.
14.6. Гены находятся в хромосомах
В 1900 г. сразу три ученых из разных стран переот-
крыли законы Менделя (см. § 21). А уже в 1902 г. два
других ученых — Т. Бовери в Германии и У. Саттон в
Америке — независимо друг от друга предположили,
что гены находятся в хромосомах. Это предположение
основывалось на том, что поведение хромосом в мейозе
и митозе очень хорошо согласуется с поведением менде-
левских факторов (генов). Так, Мендель предполагал, что
135
у всех высших организмов за каждый признак отвеча-
ют два фактора — аллели одного гена (см. § 21). Это
согласуется с наличием в диплоидном (двойном) наборе
хромосомных пар, в которых одна из хромосом получе-
на от отца, другая — от матери. Мендель предполагал,
что из пары факторов в гаметы попадает только один и
из каждой пары хромосом в ходе образования гамет в
каждую клетку попадает лишь одна хромосома из пары.
Предположение, что гены находятся в хромосомах,
было экспериментально доказано группой американс-
ких исследователей, возглавляемой Т. Г. Морганом.
Этой же группой было показано, что гены расположены
в хромосоме линейно — друг за другом. Про эти рабо-
ты мы расскажем в главе 8. К концу 1910-х годов хро-
мосомная теория была полностью построена, но при этом
оставалось совершенно неясным, что же собой представ-
ляет ген и каким способом гены определяют признаки
организма.
14.7. В большинстве соматических клеток
содержится полная наследственная информация
Вейсман думал, что лишь часть зародышевой плаз-
мы попадает в каждую из соматических клеток; разные
части, доставшиеся разным клеткам, определяют их
дальнейшую специализацию. Сначала эти взгляды по-
лучили подтверждение. Наблюдая за развитием аска-
риды, Т. Бовери обнаружил, что при делении зиготы во
всех клетках, кроме одной, кусочки хромосом отвалива-
ются и разрушаются. Из той клетки, где этого не проис-
ходит, формируются половые клетки аскариды. В даль-
нейшем оказалось, что в большинстве случаев подобные
явления не имеют места. Уже в начале XX в. работами
эмбриологов было показано, что у многих животных
каждая клетка раннего зародыша при ее изоляции мо-
жет дать нормальный целый организм. Это означает,
что в такой клетке содержится полная наследственная
информация.
136
Зрелое
растение
растение Зрелое
на агаре растение
Рис. 44. Получение целого растения из отдельной клетки
Впоследствии эти данные полностью подтвердились
для растений. Оказалось, что из одиночной клетки по-
чти любой ткани растения (если только в ней есть ядро)
можно получить в пробирке растительную ткань из не-
дифференцированных (не имеющих признаков опреде-
ленной ткани) клеток (рис. 44). В дальнейшем под дей-
ствием растительных гормонов эта ткань может образо-
вать органы — корни, листья и стебли. Развивающийся
зародыш переносят на среду с агаром (желеобразным
веществом, получаемым из некоторых морских водорос-
137
лей) и питательными смесями (см. рис. 44). Получив-
шееся маленькое растеньице можно пересадить в почву
и получить от него нормальные семена. В настоящее вре-
мя этот метод (метод культуры тканей) широко приме-
няется в растениеводстве — например, при получении
не зараженных вирусами растений или при ускоренном
размножении ценных сортов.
С животными дело обстоит несколько сложнее. Лишь
недавно с помощью довольно сложной методики удалось
показать, что ядра, по крайней мере, некоторых клеток
взрослого организма содержат полную генетическую
информацию (рис. 45).
Для этого с помощью очень тонкой стеклянной пи-
петки из яйцеклетки удаляли ядро или разрушали его
ультрафиолетовыми лучами (как показано на рис. 45),
а ядро другой клетки помещали на его место. Яйце-
клетка, в которую пересаживали чужое ядро, была взя-
та от линии лягушек, в ядре клеток которых имеются
два ядрышка. А пересаживаемое ядро брали от другой
линии лягушек, в ядре клеток которых имеется одно
ядрышко. Разные, хорошо различимые линии были
выбраны для того, чтобы можно было определить, к
какой линии будет принадлежать организм, развив-
шийся из яйцеклетки с пересаженным ядром. Часть
таких яйцеклеток не развивается (отсутствует дробле-
ние); другая часть начинает развиваться, дает нормаль-
ную на вид бластулу (стадия развития яйцеклетки,
имеющая сферическую форму), но в дальнейшем ходе
развития дает аномальные зародыши. И лишь неболь-
шая часть яйцеклеток с пересаженным чужим ядром
развивается нормально (см. рис. 45), так что из нее по-
лучается полноценный организм. Замечательно, что
почти по всем признакам он идентичен той особи, от
которой взято ядро. Такой способ получения генети-
чески идентичных особей был назван клонированием.
Подробнее о перспективах его использования мы рас-
скажем в § 18.
138
1.
2.
Неоплодотворенное яйцо (линия
с двумя ядрышками)
Головастик
(линия с одним ядрышком)
Кишечник
головастика
Эпительные
клетки
Микропипетка
Ядро из клетки
Отсутствие
дробления
Головастик
Аномальный
Взрослая лягушка (ли-
ния с одним ядрышком)
зародыш
Рис. 45. Опыты по пересадке ядер, доказав-
шие наличие полной генетической информа-
ции в клетках животных:
1 — неоплодотворенное яйцо; 2 — головастик
другой линии лягушек; 3 — микропипетка с
ядром, извлеченным из клетки кишечника го-
ловастика второй линии; 4 — яйцеклетка пер-
вой линии с пересаженным ядром второй ли-
нии лягушек; 5 — взрослая лягушка, которая
развилась из такой яйцеклетки. Она принадле-
жит к линии с одним ядрышком, т. е. к той же
линии, к которой относился головастик, из кле-
ток которого было взято пересаженное ядро
139
1 .8. «Управление» жизнедеятельностью клетки
с помощью веществ, выделяющихся в цитоплазму
ядром
В начале 1930-х годов ученый И. Гиммерлинг в ка-
честве объекта для опытов по регенерации выбрал зеле-
ную водоросль ацетабулярию (рис. 46). Эта водоросль,
обитающая в Средиземном море, замечательна тем, что
Рис. 46. Опыты по пересадке ядер у водоросли ацетабулярии: А —
межвидовая пересадка ядер; слева вверху изображены водоросли двух
видов (у первого зонтик слитный, у второго — из раздельных долек);
справа показан опыт, когда от водоросли первого вида'отрезали шляп-
ку и ризоид, содержащий ядро, а затем к оставшейся части приживи-
ли ризоид от второго вида; на стебельке развился зонтик, характерный
для водорослей второго вида; Б — эксперимент с разделением ацета-
булярии на отдельные части
140
представляет собой одну гигантскую (размером до 5 см)
клетку сложной формы. Клетка имеет корнеподобные
ризоиды, тонкий стебелек и сложной формы шляпку, в
которой образуются споры. Имеется единственное круп-
ное ядро, расположенное у основания ножки.
Гиммерлинг пересадил ядро от одного вида ацета-
булярии другому, с иной формой шляпки (см.
рис. 46). Если затем шляпку удалить, она вырастет
снова, но при этом ее форма окажется не такой, как
прежде. Отросшая шляпка будет иметь форму, харак-
терную для вида, от которого взято ядро. Замечатель-
но, что если у молодой ацетабулярии удалить ядро за
несколько недель до образования шляпки, то она все-
таки образуется (хотя потом клетка и гибнет). Если
отрезать кончик стебелька, из него регенерируют сте-
белек и шляпка. А вот из средней части стебелька не
вырастает ничего.
Задание. Прежде чем читать дальше, подумайте, как можно ин-
терпретировать эти результаты.
Гиммерлинг предположил, что ядро управляет раз-
витием шляпки с помощью каких-то веществ, выделяе-
мых в цитоплазму. Эти вещества транспортируются по
стебельку в его верхнюю часть и накапливаются там.
Вот почему даже при удалении ядра может происходить
регенерация. Возникла идея, что ядро управляет жиз-
нью клетки с помощью веществ — «инструкций», посы-
лаемых в цитоплазму.
---------------------------------
Как в дальнейшем выяснилось, такими веществами являются
молекулы информационной РНК (см. § 17). Именно они на-
капливаются в стебельке ацетабулярии и управляют регене-
рацией даже после удаления ядра.
-----------------------------
141
Bl. У гороха диплоидный набор — 14 хромосом. Сколько хро-
мосом содержится в его спермиях?
2. Вспомните, откуда в организме человека берутся новые
эритроциты. Как вы думаете, почему эритроциты у черепа-
хи живут около года, а у человека — всего около 100 дней?
3. У аскариды при первом делении зиготы в одной из обра-
зовавшихся клеток от хромосом отрываются кусочки и
полностью разрушаются, а в другой клетке этого не проис-
ходит. Затем это явление повторяется при каждом после-
дующем делении. Как вы думаете, какие клетки взрослого
организма образуются из клеток зародыша, где не происхо-
дит частичного разрушения хромосом?
4. Из яйцеклетки лягушки-альбиноса (то есть лягушки, клет-
ки кожи которой лишены пигмента) удалили ядро и пере-
садили в нее ядро пигментированной лягушки. Будет ли
полученная из такой яйцеклетки лягушка альбиносом или
пигментированной? Ответ поясните.
5. Захвативший власть в биологической науке в нашей стра-
не в 1940-е годы Т. Д. Лысенко и его сторонники утверж-
дали, что за наследственность отвечают не ядро и не хромо-
сомы, а вся клетка или весь организм в целом. Какие фак-
ты можно привести против этой точки зрения?
§ 15. ДНК — вещество наследственности
15.1. Первые гипотезы о том, что информация
о наследственных признаках организмов
записана в молекулах
Первые предположения о том, что наследственная
информация может быть записана на молекулярном
уровне, высказывались еще в XIX в. Так, на Всероссийс-
ком съезде естествоиспытателей и врачей в 1893 г. хи-
мик А. А. Колли, исходя из сравнения размеров ядра
сперматозоида и рассчитанного им объема белковых
молекул, утверждал, что наследственные признаки пере-
даются через небольшое число молекул. На съезде при-
сутствовал Николай Константинович Кольцов, тогда со-
всем молодой ученый (ему был всего 21 год).
142
Вот что он писал через 40 лет, вспоминая об этом
съезде: «Пришел и сел среди президиума Лев Николае-
вич Толстой, в своей обычной блузе и высоких сапогах.
Он явился в чужой лагерь естествоиспытателей и вра-
чей послушать речь своего друга, профессора В. Я. Цин-
гера — математика, ботаника и философа-идеалиста.
Когда я увидел Льва Николаевича, то вспомнил одну
фразу из его статьи «О назначении науки и искусства»:
«Ботаники нашли клеточку и в клеточках-то протоплаз-
му, и в протоплазме еще что-то, и в той штучке еще что-
то. Занятия эти, очевидно, долго не кончатся, потому что
им, очевидно, и конца быть не может, и потому ученым
некогда заняться тем, что нужно людям...» И вот про-
фессор Колли пытался нас уверить, что в головке сперма-
тозоида может поместиться лишь немного белковых мо-
лекул — почти столько же, сколько хромосом (хотя он и
избегал этого названия). Мысль, что сама хромосома не
что иное, как молекула, представлялась нам настолько
неправдоподобной, что мы отказывались верить его вы-
числениям... Не надо забывать, что в то время белковая
молекула еще не была разложена, да и самое существова-
ние молекул вообще подвергалось сомнению».
Неудивительно, что Кольцов запомнил поразительные
по необъективности высказывания Толстого,— ведь как
раз в тот период учеными были созданы вакцина против
бешенства и противодифтерийная сыворотка, спасшие
десятки тысяч жизней! Но и мысли Колли глубоко запа-
ли ему в память. В течение 35 лет Кольцов обдумывал,
вынашивал, развивал в беседах со студентами, своими
учениками, идею о молекулярной природе наследствен-
ности. И лишь в 1927 г. впервые выступил с докладом
на эту тему перед научной аудиторией. К 1935 г. взгля-
ды Кольцова на наследственные молекулы окончатель-
но сложились. Вкратце они сводились к следующему:
1. Главная часть хромосомы — гигантская нитевид-
ная молекула, в которой и содержится наследственная
информация.
143
Рис. 47. Схема хромосомы согласно
представлениям Кольцова. Хромо-
сома — единая гигантская молеку-
ла, в состав которой входят две
нити-генонемы. В каждой генонеме
в линейном порядке расположены
гены (по Кольцову, 1928)
2. Гены — не что иное, как части этой молекулы,
различающиеся по расположению отдельных составных
элементов.
3. Мутации — химические изменения (замена одних
групп атомов на другие) наследственной молекулы.
(Мутации — это изменения генетического материала,
которые передаются по наследству.)
4. Новые наследственные молекулы возникают по
матричному принципу. «Затравкой», или матрицей, слу-
жит предсуществующая молекула — к ней присоединя-
ются отдельные элементы новой молекулы строго опре-
деленным образом., Так из одной молекулы возникают
две одинаковые, что необходимо для дальнейшей пере-
дачи наследственных признаков при делении клетки
(рис. 47).
Во всех этих предположениях Н. К. Кольцов оказал-
ся совершенно прав. Его гениальные предвидения опе-
редили на целые 30 лет работы экспериментаторов и на
144
20 лет — сходные идеи физика М. Дельбрюка. Ошибал-
ся Кольцов в одном — он считал молекулами наслед-
ственности белки, а не нуклеиновые кислоты. В то вре-
мя считалось, что молекулы ДНК слишком одноообраз-
ны по строению во всех клетках, поэтому они не могут
определять их признаки.
15.2. Способность к удвоению и сложная структу-
ра — свойства молекул наследственности, необхо-
димые для передачи наследственных свойств
Огромное влияние на развитие биологии оказала кни-
га Э. Шредингера «Что такое жизнь. С точки зрения
физика». В ней Шредингер, опираясь на идеи Дельбрю-
ка (о работах Кольцова Шредингер не знал, хотя они
были переведены на немецкий язык), постулировал
свойства молекул наследственности. Во-первых, они дол-
жны быть способны к самоудвоению — только при этом
условии наследственная информация будет передавать-
ся. Во-вторых, они должны представлять собой «апери-
одический кристалл», т. е. иметь достаточно сложную и
стабильную структуру. Эти взгляды были практически
идентичны идеям Кольцова.
Кроме того, Шредингер писал, что генетическая мак-
ромолекула должна кодировать наследственные свойства
и код этот может быть достаточно простым; любое сооб-
щение можно передать азбукой Морзе, т.е. последова-
тельностью точек и тире. Так в биологии появилась идея
генетического кода.
15.3. Передача бактериями друг другу
информации о наследственных признаках
Параллельно с теоретическими развивались и экспе-
риментальные исследования «вещества наследственнос-
ти». Подходящим объектом для них оказались бакте-
рии. Первый опыт, Проложивший путь к открытию
«молекул наследственности», поставил в 1928 г. англий-
ский врач Ф. Гриффит. Он изучал болезнетворные свой-
10 Зак. 13485
145
ства пневмококков — бактерий, вызывающих у челове-
ка пневмонию (воспаление легких). Для этого он зара-
жал мышей, вводя им в кровь мокроту больных людей.
Через сутки мыши погибали, и из их крови можно было
выделить пневмококков. У этих бактерий болезнетвор-
ность связана с наличием особой полисахаридной кап-
сулы. Гриффит обнаружил штамм (разновидность) пнев-
мококков, лишенных капсулы; при культивировании на
искусственной среде они нормально росли, а вот в орга-
низме мыши или человека вскоре погибали, не вызывая
заболевания (рис. 48).
В одном из опытов Гриффит ввел мыши смесь уби-
тых нагреванием пневмококков с капсулой и живых
бескапсульных. Каково же было его удивление, когда
мышь погибла! Ясно, что убитые пневмококки вызвать
заболевание не могли; но из крови погибшей мыши уда-
лось выделить живых пневмококков, обладавших капсу-
лой. При размножении эти бактерии передавали способ-
ность синтезировать капсулу своим потомкам. Значит,
убитые болезнетворные пневмококки каким-то способом
передали живым безвредным наследственный при-
знак — способность к синтезу полисахаридной капсулы.
Такая передача наследственных признаков от одних бак-
терий к другим была названа трансформацией.
Позднее удалось показать, что ни мышь, ни клетки
убитых пневмококков не нужны для трансформации.
Для нее достаточно разрушить клетки убитых бактерий
с капсулой и добавить полученный экстракт к культу-
ре бескапсульного штамма. Стало ясно, что за трансфор-
мацию (т. е. за передачу наследственных свойств) в дан-
ном случае отвечают кркие-то химические вещества.
15.4. Вещество, вызывающее трансформацию,—
ДНК, а не белки
Опыты Гриффита продолжил американский иссле-
дователь Т. Эйвери. Он и его сотрудники решили вы-
яснить, какое вещество вызывает трансформацию. Для
146
S-штамм
Погибает
Выживает
Рис. 48. Опыты Гриффита с передачей наследственных признаков
у пневмококков.
S-штамм — штамм болезнетворных пневмококков с полисахаридной
капсулой; R-штамм — штамм безвредных мутантов пневмококков без
капсулы. А — мышь, которой введена культура штамма S, погибает;
Б — мышь, которой введена культура штамма R, не погибает; В —
мышь, которой введена культура штамма S, убитого нагреванием, не
погибает; Г — мышь, которой введена смесь живой культуры R-му-
танта и убитой нагреванием культуры S-штамма, погибает; в ее крови
присутствуют живые S-бактерии
147
этого они выделили из экстракта у итых пневмококков
с капсулой разные фракции — очищенные белки, поли-
сахариды, РНК и ДНК. Затем изучили способность этих
веществ вызывать трансформацию. Было установлено,
что трансформация происходит только в том случае,
когда к культуре бескапсульного штамма добавляют
ДНК пневмококков с капсулой; другие вещества транс-
формации не вызывают (рис. 49, вверху). Если затем из
трансформированных пневмококков (приобретших спо-
собность образовывать капсулу) выделяли ДНК, она тоже
могла вызывать трансформацию. Это показывало, что
добавленная ДНК, отвечающая за синтез капсулы, про-
никает в клетки бескапсульных пневмококков и переда-
ется их потомкам. А это возможно только в том случае,
если молекулы ДНК каким-то образом размножаются.
15.5. Размножение вируса в клетке бактерий
и роль ДНК в этом процессе
Когда результаты опытов Эйвери были опубликова-
ны (1944 г.), ученые восприняли их с большим недове-
рием. В то время считалось, что ДНК устроена слишком
однообразно и поэтому не может нести наследственную
информацию. Критики утверждали, что в препаратах
ДНК, вызывавшей трансформацию, могла быть неболь-
шая примесь белка. Хотя к 1950 г. была проделана боль-
шая работа по очистке ДНК, полностью очистить ее от
примесей не удавалось. Однако если препарат ДНК об-
рабатывали ферментом нуклеазой, который разрезает
цепочку ДНК на отдельные нуклеотиды («кирпичики»,
из которых состоит молекула ДНК), то способность к
трансформации исчезала. Если же этот препарат обра-
ботать протеазами — ферментами, которые разрушают
белки,— то на трансформацию это никак не влияет
(рис. 49, внизу). Этот результат подтверждал,.что не бел-
ки, а ДНК отвечает за трансформацию.
Дополнительные свидетельства роли ДНК в передаче
наследственных свойств были получены при изучении
вирусов бактерий — бактериофагов.
148
НУКЛЕАЗА
S-штамм,
убитый
нагреванием
Погибает
Рис. 49. Опыты Эйвери по доказательству роли ДНК
в трансформации
149
Вирусы (от лат. вирус — яд) были открыты еще в
XIX в. русским ученым Д. И. Ивановским. Тогда про
них было известно только, что это — инфекционное на-
чало, проходящее через мелкие поры, задерживающие
бактерий. Такие инфекционные агенты были названы
«фильтрующимися вирусами». Стало ясно, что вирусы
являются причиной многих заболеваний животных и
человека (например, бешенства). Одной из их особенно-
стей, отличающих вирусы от большинства бактерий, ока-
залась невозможность культивирования в искусствен-
ных средах.
В самом конце XIX в. русский врач Н. Ф. Гамалея
открыл вирусы, паразитирующие в бактериях. Изучая
сибирскую язву, он установил, что в некоторых условиях
бактерии сибирской язвы в культуре вдруг лизируют-
ся (разрушаются). Среда, в которой произошло разру-
шение бактерий, при добавлении к другим культурам
бактерий также вызывает их лизис. В 1915—1920 гг.
вирусы бактерий были подробнее изучены и названы
бактериофагами (от греч. фагос — пожирающий). Бак-
териофаги оставались невидимыми, но появились спосо-
бы оценки их численности. Постепенно укоренялась
правильная точка зрения на природу вирусов как орга-
низмов очень простого строения, способных размножать-
ся только внутри чужих клеток.
---------------------------
В то время на бактериофагов возлагались большие надежды
как на средство борьбы против бактериальных инфекций. Ис-
пользование культур бактериофагов для лечения и профилак-
тики таких кишечных инфекций, как дизентерия, действи-
тельно давало обнадеживающие результаты. Однако откры-
тые вскоре антибиотики' оказались более дешевыми и
эффективными лекарствами, и интерес к использованию бак-
териофагов в медицине угас.
--------------------:------
К концу 30-х годов уже был известен химический
состав бактериофагов. Оказалось, что в них примерно по
150
50 % белков и ДНК. Непрямыми методами удалось оце-
нить их средние размеры (около 0,1 мкм).
Вопрос. Почему большинство вирусов нельзя увидеть в световой
микроскоп?
Интенсивные исследования бактериофагов продолжа-
лись в 1940-е годы. Изображения бактериофага впервые
были получены с помощью электронного микроскопа в
1940 г. По мере улучшения качества изображений вы-
яснилось, что частицы бактериофага имеют довольно
сложное строение (рис. 50).
Рис. 50. Строение одного из бактериофагов - паразита бактерии
кишечной палочки: А — электронно-микроскопическая фотография;
Б — схема строения вируса:
1 — белковая головка, 2 — молекула ДНК, упакованная в головке ви-
руса, 3 — канал, через который вирус впрыскивает свою ДНК в зара-
жаемую клетку, 4 — стержень, отходящий от головки вируса, покры-
тый чехлом из сократимых белков, 5 — пластинка с шипами, 6 — длин-
ные отростки, с помощью которых вирус прикрепляется к
клетке-хозяину. После прикрепления вируса к клетке белки чехла со-
кращаются, пластинка с шипами упирается в поверхность клетки, стер-
жень протыкает клеточную мембрану и ДНК вируса впрыскивается
в клетку
Б
151
Рис. 51. Электронная микрофотография ДНК бактериофага
Выяснились и многие детали поведения бактериофа-
гов. Оказалось, что бактериофаг неподвижен и сталки-
вается с бактериями случайно, в результате броуновско-
го движения. Для заражения бактерий бактериофаг
должен на некоторое время прикрепиться к ним свои-
ми отростками. Если культуру бактерий резко встряхи-
вать, это препятствует заражению. После заражения бак-
терий из ее клеток нельзя в течение примерно 10 мин
получить бактериофагов, способных заражать новые бак-
терии. Затем они появляются внутри бактерии, их ко-
личество начинает резко расти, а еще через 20 мин клет-
ка бактерии разрушается и из нее выходит около сотни
новых «заразных» бактериофагов.
К концу 40-х годов было установлено, что ДНК бак-
териофага содержится в его головке. Это — одна ги-
гантская молекула (рис. 51). Длина ее различна у раз-
ных вирусов, например у вируса, изображенного на
рис. 50, она составляет около 50 мкм. Это примерно в
500 раз больше, чем длина головки вируса, так что ДНК
находится в головке в сильно упакованном состоянии.
152
ДНК фага,
меченная по 32Р
Белковая оболочка фага,
меченная по 35S 358-белок
Рис. 52. Схема опыта Херши и Чейза по доказательству роли ДНК бак-
териофага в передаче наследственных свойств. Вверху'. ДНК, меченная
фосфором (черная точка внутри головки бактериофага), проникает в
клетки бактерий и остается в них после встряхивания (правый фраг-
мент рисунка). Внизу', белковые оболочки фагов, меченные серой, не
проникают в клетки бактерий и отделяются после встряхивания
Если разрушить головку, то ДНК выходит во внешнюю
среду, а бактериофаг теряет при этом инфекционные
свойства.
Решающий эксперимент, доказавший, что за зараже-
ние бактерий отвечает ДНК бактериофага, поставили в
1952 г. американские ученые А. Д. Херши и С. Чейз.
Выращивая бактерии — кишечные палочки на среде с
соединениями радиоактивных изотопов фосфора или
серы (32Р и 35S), они получили из этих бактерий бакте-
риофагов, у которых были помечены радиоактивным
изотопом либо ДНК (в нее включался радиоактивный
фосфор), либо белки (в которых присутствовала сера).
Затем этих бактериофагов переносили в культуру бак-
терий, не помеченных изотопами. Если помечена была
ДНК, то через некоторое время почти вся она оказыва-
лась внутри клеток бактерий (рис. 52, верхний фраг-
153
мент), что легко было обнаружить по радиоактивности.
Если же помечены были белки бактериофага, то радио-
активная метка оставалась на поверхности клеток и ее
можно было отделить от бактерий встряхиванием
(рис. 52, нижний фрагмент).
Этот опыт показал, что при заражении бактерий в
них проникает только ДНК бактериофага, а не его белки
(впоследствии выяснилось, что бактериофаг умеет про-
делывать дырку в клеточной стенке бактерии и впрыс-
кивает в нее свою ДНК). Значит, именно ДНК отвечает
за образование внутри бактерий новых вирусных час-
тиц, т. е. определяет наследственные свойства вирусов.
Этот опыт заставил многих ученых наконец поверить,
что ДНК — вещество наследственности. Начались ин-
тенсивные исследования структуры ДНК.
15.6. Состав ДНК: нуклеотиды с азотистыми
основаниями четырех типов (аденин, гуанин,
цитозин, тимин)
ДНК была открыта еще в 1868 г. швейцарцем Ф. Ми-
шером, который выделил ее из лейкоцитов. В течение
XIX в. было выяснено, что в состав ДНК входят сахар
дезоксирибоза, остатки фосфорной кислоты и азотистые
основания (аденин, гуанин, цитозин и тимин). Но только
к 1948 г. была установлена структура нуклеотидов —
мономеров ДНК (см. схему на с. 32).
В работах 1948—1950 гг. Эрвин Чаргафф показал, что
содержание четырех нуклеотидов в ДНК разных орга-
низмов различно, так что эта молекула не может иметь
простого, одинакового у всех организмов строения, а зна-
чит, вполне годится в кандидаты на наследственное ве-
щество. В 1950 г. Чаргафф установил, что соотношение
нуклеотидов с разными азотистыми основаниями в ДНК
данной клетки строго постоянно: число Яденинов равно
числу тиминов, число цитозинов — числу гуанинов (А=Т,
Г=Ц). Это открытие сыграло большую роль в постиже-
нии структуры ДНК. Обнаруженную Чаргаффом зако-
154
номерность в соотношении нуклеотидов разного типа на-
зывают правилом Чаргаффа.
Задача. В ДНК, выделенной из клетки, молярный процент цито-
зина равен 23. Каков процент каждого из остальных нук-
леотидов в этой ДНК?
15.7. Молекула ДНК — это спираль из двух цепей
нуклеотидов, удерживаемых вместе водородными
связями между основаниями. Аденин комплемен-
тарен тимину, а гуанин — цитозину
В 1930-е годы было начато изучение сложных
органических молекул с помощью рентгеноструктур-
ного анализа. Этот метод был разработан еще в нача-
ле века для изучения кристаллических решеток со-
лей и основан на том, что рентгеновские лучи, рассе-
иваясь при прохождении через кристаллы, дают на
фотопленке дифракционную картину. Анализ этой
картины позволяет рассчитать взаимное расположе-
ние атомов в кристалле и расстояния между ними.
По рентгенограммам удалось установить, что азотис-
тые основания должны располагаться в ДНК одно над
другим в виде стопки. Но рентгенограммы ДНК ос-
тавались некачественными, так как не удавалось по-
лучить препараты кристаллической структуры —
такие, где все нити ДНК были бы ориентированы в
одном направлении.
Эту задачу удалось решить в 1952 г. М. Уилкинсу и
Р. Франклин из Лондонского университета. На рентге-
нограмме, полученной Розалиндой Франклин, была чет-
ко видна крестообразная структура, по которой можно
было определить, что молекула ДНК представляет собой
спираль (рис. 53).
Однако честь сделать величайшее открытие в биоло-
гии XX в. выпала двум другим ученым — сотрудни-
кам Кавендишской лаборатории Кэмбриджского уни-
верситета Дж. Уотсону и Ф. Крику.
155
Рис. 53. Рентгенограмма ДНК, позволившая установить ее структуру
Уотсон и Крик работали над расшифровкой структу-
ры ДНК с 1951 г. История их открытия описана в заме-
чательной книге Уотсона «Двойная спираль». Сопоста-
вив известные им данные о структурных формулах нук-
леотидов с правилом Чаргаффа и рентгенограммой,
полученной Франклин, Уотсон и Крик в 1953 г. предло-
жили модель строения молекулы ДНК — знаменитую
двойную спираль (рис. 54).
Они установили, что молекула ДНК представляет со-
бой две цепочки из нуклеотидов, спирально закручен-
ные вокруг общей оси. Основу цепочек составляет «са-
харо-фосфатный остов» — соединенные между собой
через остатки фосфорной кислоты остатки дезоксирибо-
зы. Азотистые основания располагаются перпендикуляр-
но оси спирали, при этом основания двух цепочек рас-
полагаются друг напротив друга.
Цепочки ДНК в составе двойной спирали удержива-
ются вместе за счет взаимодействия между азотистыми
156
А Б
Рис. 54. Строение ДНК по Уотсону и Крику (двойная спираль): А —
схема молекулы ДНК; здесь ленты изображают две переплетенные са-
харо-фосфатные цепи, а в центре спирали в виде перемычек располо-
жены пары оснований; Б — схема, показывающая диаметр и другие
размеры двойной спирали (1А = 10® см)
157
основаниями. В азотистых основаниях имеются сильно
электроотрицательные атомы кислорода и азота, кото-
рые имеют частичный отрицательный заряд, а также
атомы водорода, на которых возникает частичный поло-
жительный заряд. За счет этих частичных зарядов воз-
никают водородные связи между азотистыми основани-
ями. Структура этих оснований такова, что водородные
связи могут образовываться отнюдь не между любыми
парами оснований. Некоторые пары не могут образовать
прочных водородных связей друг с другом, некоторые
для образования водородных связей должны были бы
так наклониться, что нарушилась бы правильная струк-
Рис. 55. Комплементарные пары азотистых оснований ДНК. Парал-
лельными черточками показаны водородные связи между комплемен-
тарными основаниями. Видно, что аденин и тимин соединены двумя
водородными связями, а гуанин и цитозин — тремя. Отрезки, около
которых написано «К-цепи», идут от атомов азота к атомам углерода
сахаро-фосфатных цепей молекулы ДНК
158
тура двойной спирали, некоторые слишком велики, что-
бы «вписаться» в двойную спираль, а некоторые —
слишком малы. Полностью удовлетворяют всем требо-
ваниям пары «аденин — тимин» и «гуанин — цито-
зин» (рис. 55), поэтому в двойной спирали ДНК напро-
тив аденина всегда находится только тимин, а напротив
гуанина — только цитозин. Такое строгое соответствие
оснований одной цепочки основаниям другой цепочки
получило название комплементарности (дополнительно-
сти). Правило комплементарности объясняет правило
Чаргаффа — как раз при его соблюдении количества
молей каждого из оснований, образующих пару, окажут-
ся равны.
Главное преимущество предложенной модели состо-
яло в том, что при таком строении ДНК порядок распо-
ложения нуклеотидов в молекуле ДНК может быть про-
извольным — а именно это и требуется, чтобы молеку-
лы ДНК были бесконечно разнообразны и могли нести
генетическую информацию.
Выше (в п. 15.5) мы говорили, что у бактериофагов кишеч-
ной палочки генетическая информация тоже записана в ДНК.
В дальнейшем было показано, что у вирусов генетический
материал более разнообразен, чем у организмов, имеющих
клеточное строение. Кроме двухцепочечных молекул ДНК, у
вирусов могут быть одноцепочечные ДНК, а также одно- или
двухцепочечные РНК.
На сахаро-фосфатном остове цепочки ДНК может
быть выделено определенное направление. У каждой
цепочки есть 3’- и 5’-концы (эти названия объяснены
ниже). Направления двух цепочек, образующих спираль
ДНК, противоположны.
Если пронумеровать углеродные атомы дезоксирибозы, как по-
казано на рис. 56, А, то можно видеть, что азотистое основа-
ние присоединено к первому атому, «свой» фосфат — к пято-
159
фосфат
Рис. 56. Структура цепей ДНК.
А — остаток дезоксирибозы, входящий в цепь ДНК. Его пять углерод-
ных атомов пронумерованы 1’, 2’...5’. К первому атому углерода при-
соединяется одно из четырех азотистых оснований, к третьему атому
углерода присоединяется фосфат от другого звена цепи, к пятому
атому — «свой» фосфат. Б — схематическое изображение двухспираль-
ной молекулы ДНК. От дезоксирибозного остатка показаны только 3’
и 5’ углеродные атомы. Р — фосфаты, А — аденин, G — гуанин, Т —
тимин, С — цитозин. Видно, что две полинуклеотидные цепи имеют
противоположную направленность
Б
му, а по третьему атому данное нуклеотидное звено соединя-
ется с фосфатом другого звена.
Если двигаться по двойной спирали ДНК (рис. 56, Б), напри-
мер, снизу вверх, то по одной цепочке мы будем перемещать-
ся от третьего гидроксила одной дезоксирибозы к пятому
другой дезоксирибозы, тогда как по второй цепочке будет
происходить движение ot пятого гидроксила одной дезокси-
рибозы к третьему другой. Вот почему мы имеем право ут-
верждать, что цепочки в ДНК противоположно направлены.
---------------------:---------
ДНК в клетках может иметь разные формы, напри-
мер, в хромосомах эукариот ДНК линейна: в состав каж-
дой хромосомы только что поделившейся клетки вхо-
160
дит одна длиннющая двойная спираль ДНК. У микро-
бов и митохондрий ДНК кольцевые. ДНК хлоропластов
бывает и линейной, и кольцевой, причем часто кольца
зацеплены друг за друга на манер олимпийских.
Молекулы ДНК имеют огромную длину. Так, у чело-
века одинарный набор из 23 хромосом, содержащийся в
гаметах, содержит около ЗхЮ9 пар нуклеотидов. Если
вытянуть такую цепочку нуклеотидов в нить, то ее дли-
на достигнет почти метра! Как же молекулы такой дли-
ны помещаются в ядре клетки, диаметр которого обыч-
но равен всего нескольким микронам? Оказывается, ДНК
имеет сложную укладку.
Между клеточными делениями ДНК существует в
клетке в виде хроматина, она распределена по всему
объему ядра. При митозе ДНК находится в другом со-
стоянии — в виде очень коротких (порядка 1 мкм) хро-
мосом. Ясно, что это сильно компактизованные структу-
ры. Как же достигается такая компактность упаковки?
Первый ее уровень у эукариот — так называемая нук-
леосомная укладка. Кроме ДНК, в хромосомах содержат-
ся несколько разных белков — гистонов, образующих
Рис. 57. Нуклеосомная
укладка ДНК. Черной
линией показан участок
молекулы ДНК, обвитый
вокруг структуры, обра-
зованной восемью моле-
кулами гистонов (по две
молекулы Н2А, Н2В, НЗ и
Н4). Этот комплекс ДНК
и гистонов называют
нуклеосомой (1). Ма-
ленький шарик — гис-
тон Н1 (2) . 11
11 Зак. 13485
161
нечто вроде бусин. Двойная спираль ДНК намотана на
эти бусины (рис. 57). Комплекс гистонов с намотанным
на него участком ДНК называется нуклеосомой.
Гистонов у человека пять видов: Hl, Н2А, Н2В, НЗ и Н4.
(У птиц гистонов шесть, а у некоторых эукариот — мень-
ше пяти.) По две молекулы Н2А, Н2В, НЗ и Н4 образуют
комплекс-октамер. На него в хромосоме навернуто 1,76
оборота ДНК — примерно 160—170 пар оснований.
Накрученная на гистоны двойная спираль в семь раз
короче свободной. Однако этого недостаточно для обра-
зования хромосомы. «Бусы» из нуклеосом с помощью
гистона Н1 образуют спираль (соленоид, катушку). Про
дальнейшие уровни укладки ДНК известно мало. По-
видимому, ДНК в хромосомах организована в особые
структуры, так называемые петли. Участок ДНК дли-
ной 30—100 тыс. пар нуклеотидов «зажат» у основания
петли специальными белками. Что это за белки, образу-
ют ли они цельную ось хромосомы или же для этого
служат другие структуры — пока неизвестно. Известно
только, что цепочки ДНК по всей длине хромосомы
нигде не прерываются.
Как укладка ДНК влияет на процессы, протекающие
с ее участием? В целом чем компактнее уложена ДНК,
тем она менее активна.
У бактерий ДНК довольно короткая, а митозов не
бывает. Значит, нет и задачи все компактно упаковать,
чтобы точнее распределить по дочерним клеткам.
15.8. Способ удвоения ДНК —
полуконсервативный матричный механизм
Расшифровав структуру ДНК, Уотсон и Крик сразу
же предложили и механизм ее удвоения. Согласно их
модели, двойная спираль по ходу удвоения временно
расплетается и каждая цепочка нуклеотидов служит
162
матрицей для синтеза новой цепи. Свободные нуклео-
тиды, имеющиеся в клетке, присоединяются к матрице
по принципу комплементарности. В результате образу-
ются две одинаковые двойные спирали. После деления
клетки каждая из них попадет в одну из дочерних кле-
ток. При этом каждой клетке достается одна цепь из
состава «старой» (матричной) молекулы ДНК и одна —
вновь синтезированная. Такой способ удвоения был на-
зван полуконсервативным.
В 1957 г. полу консервативность удвоения ДНК была
доказана экспериментально.
Два молодых научных сотрудника М. Месельсон и Ф. В. Сталь
работали в это время в Калифорнийском технологическом
институте. Они разработали метод определения плотности
молекул ДНК. Идею этого метода можно пояснить так. Пред-
ставьте себе стакан с водой, в которую положили много саха-
ра и не перемешивали его. Тогда на дне будет густой сахар-
ный сироп, вверху — чистая вода, а в промежутке между ними
раствор сахара меняющейся плотности. Если в такой стакан
опустить предмет с плотностью немного выше, чем у воды, он
утонет, но не достигнет дна, а остановится на какой-то глуби-
не, а именно на той, где плотность раствора равна плотности
этого предмета. По месту остановки можно узнать плотность
предмета. Месельсон и Сталь таким методом определяли
плотность молекул ДНК. Для разделения разных частиц он
использовался и раньше, но Месельсон и Сталь подобрали
такой раствор (6М раствор CsCl), плотность которого была
близка к плотности ДНК. Однако поскольку молекулы тонут
очень медленно, для ускорения этого процесса они быстро вра-
щали пробирку с раствором, и тогда центробежные силы зас-
тавляли молекулы тонуть быстрее. Специальная центрифуга
вращала пробирку со скоростью 60 тыс. об/мин, возникаю-
щие центробежные силы примерно в 100 тыс. раз превышали
силу тяжести. Используя этот метод, Месельсон и Сталь и
доказали полуконсервативный механизм удвоения ДНК.
Они выращивали бактерии кишечной палочки на среде с ра=
диоактивиьгм изотопом азота 15N. Включение этого изотопа
в ДНК приводило к увеличению плотности молекул, что уско-
ряло их оседание при центрифугировании по сравнению со
скоростью оседания ДНК бактерий, выращенных на обычной
163
Гибридная ДНК
♦Легкая» ♦Тяжелая»
nN-ДНК iSN-ДНК
Конт-
роль J
2
Опыт
Рост в среде с 15N
Исходная «М-ДНК
Рис. 58. Опыт Месельсона и Сталя, доказавший полуконсервативность
удвоения ДНК: А — результаты экспериментов с оседанием ДНК (по-
яснения в тексте), справа схематически изображен ход опыта. Б — схе-
ма, поясняющая, что результаты опыта доказывают полуконсерватив-
ный механизм репликации
среде (рис. 58). Затем культуру синхронно делящихся бакте-
рий с ♦ тяжелой» ДНК переносили на среду с нормальным
изотопом азота 14N. ДНК бактерий после одного деления
имела скорость оседания, промежуточную между скоростями
♦тяжелой» и ♦легкой» ДНК. Именно такой результат и дол-
жен быть получен при полуконсервативном способе удвоения.
164
Разберем рис. 68 детальнее. На фрагменте А слева показаны
результаты экспериментов с оседанием ДНК: 1 — расположе-
ние в пробирке после центрифугирования ДНК, выделенной
из клеток, выращенных на среде с 14N. В следующей пробир-
ке, нарисованной ниже, показано расположение ДНК, выде-
ленной из клеток, выращенных на среде с 16N. Видно, что
более тяжелая ДНК с 16N оказывается ближе к дну пробирки.
2 — расположение в пробирке смеси ДНК, выделенной из кле-
ток, выращенных раздельно на средах с 14N и 16N. Это были
контрольные эксперименты, показавшие, что метод центрифу-
гирования позволяет хорошо отделять «легкую» и «тяжелую»
ДНК.
В следующей пробирке, нарисованной ниже, показано распо-
ложение ДНК, выделенной из клеток, которые исходно были
выращены на среде с 16N, а затем перенесены на среду с 14N,
где произошло удвоение ДНК (I). Еще ниже показаны резуль-
таты опытов после двух делений ДНК в среде с 14N (II) и трех
делений ДНК (III).
На фрагменте Б вверху изображена тяжелая ДНК. Ее цепи
показаны черным цветом. Ниже изображены две молекулы
«гибридной» ДНК, получившиеся после первой репликации;
одна цепь у них тяжелая (черная), другая — легкая (белая).
Еще ниже изображены четыре молекулы ДНК, получившиеся
после второй репликации; две из них гибридные, а две другие
легкие. В самом низу изображены восемь молекул ДНК, по-
лучившиеся после третьей репликации; две из них гибрид-
ные, а шесть — легкие.
----------------------------
15.9. Удвоение ДНК — сложный процесс,
протекающий с участием нескольких ферментов
и требующий затрат энергии
Процесс удвоения ДНК называется репликацией.
Репликация осуществляется специальным ферментом
ДНК-полимеразой, которая наращивает полинуклеотид-
ную цепь, присоединяя новые звенья к З’-концу.
Доказательства участия ферментов в синтезе ДНК
были получены американским ученым А. Корнбергом.
В 1956 г. ему удалось осуществить синтез ДНК в про-
бирке, добавляя туда матрицу — ДНК, «строительный
материал» — нуклеотидтрифосфаты и экстракт белков
из бактерий. Затратив восемь лет труда и переработав
165
сотни килограмм бактерий, Корнберг получил в чистом
виде фермент, осуществляющий матричный синтез
ДНК — ДНК-полимеразу.
------------------------------
Может возникнуть вопрос: а за счет чего между нуклеотида-
ми образуются ковалентные связи? Почему из мономеров об-
разуется полимер — цепочка ДНК? В самом деле, если долго
кипятить в водной среде ДНК или РНК, то полимеры разва-
лятся на отдельные звенья. Сами по себе они и не подумают
сшиваться. Распад цепей нуклеиновых кислот — нормаль-
ная экзотермическая реакция, поэтому самопроизвольно стро-
иться цепи ДНК и РНК не могут.
Именно поэтому для синтеза используются не обычные нук-
леотиды, а нуклеотидтрифосфаты. Как вы помните из курса
химии, кроме метафосфорной и ортофосфорной, существует
пирофосфорная кислота — Н4Р2О7. Она может гидролизовать-
ся на две ортофосфорные с выделением большого количества
энергии. Эту реакцию и использовала природа. При образо-
вании ковалентной связи между нуклеотидтрифосфатами два
фосфата отщепляются, а третий замыкает связь на третьем
атоме рибозы. Отщепившийся пирофосфат потом расщепля-
ется на обыкновенные неорганические фосфаты. Синтез РНК
или ДНК из нуклеотидов (не нуклеотидтрифосфатов!) — про-
цесс слабо эндотермический. Расщепление цепочки из не-
скольких фосфатов — процесс сильно экзотермический, и он
как бы «сопрягается» со слегка эндотермическим. В итоге по-
лучается вполне экзотермический процесс, позволяющий
идти синтезу цепочки из трифосфатов.
Разложение пирофосфата дополнительно сдвигает равновесие
в сторону синтеза полинуклеотидной цепочки (вспомните
курс химии: если выводить конечный продукт реакции, то
равновесие сдвинется в сторону его образования). Как мы
видим, законы химии полностью выполняются и в биологии.
Для репликации нужно сначала расплести двойную
спираль ДНК. Это тоже делают специальные фермен-
ты — геликазы, разрывающие водородные связи между
основаниями. Но расплетенные участки более чувстви-
тельны к повреждающим факторам — и к облучению, и
к многим химическим веществам, вызывающим мута-
ции. Чтобы они оставались в незащищенном состоянии
166
как можно меньше, синтез на обеих цепочках идет одно-
временно.
Новые нуклеотиды присоединяются только к гидро-
ксилу третьего атома рибозы. Цепи и ДНК, и РНК мо-
гут удлиняться лишь таким способом, т. е. только в
одном направлении.
Построение новой полинуклеотидной цепочки про-
исходит в соответствии с принципом комплементарнос-
ти: напротив аденина будет встраиваться тимин, напро-
тив гуанина — цитозин и т. п. Тут, правда, возникает
проблема, поскольку цепь может наращиваться только с
одного конца. Когда цепь ДНК расплетается, на одной
из цепочек оказывается свободным 3'-конец, а на дру-
гой — 5'-конец. Молекула ДНК-полимеразы на первой
цепочке идет сразу вслед за расплетающими фермента-
ми и синтезирует свою цепочку без всяких проблем. На
этой цепочке новые нуклеотиды просто постоянно до-
бавляются, и синтез продвигается вперед. Но вторая цепь
направлена в другую сторону! Как же быть?
Оказывается, на ней синтез ДНК идет прерывисто
(рис. 59). Когда молекула ДНК достаточно расплетется,
молекула ДНК-полимеразы садится на некоторую точку
расплетенного участка второй цепочки и синтезирует
комплементарную ей цепь ДНК. Эта молекула ДНК-
полимеразы двигается не к месту расплетания, как на
первой цепочке, а напротив, к свободному концу. После
того, как молекула ДНК расплетется еще сильнее, новая
молекула ДНК-полимеразы садится на новую точку рас-
плетенного участка и двигается к синтезированному
ранее участку. Нуклеотиды, как и положено, присоеди-
няются в нужном направлении, образуя новые коротень-
кие цепочки (их называют «фрагменты Оказаки»). Ког-
да ДНК-полимераза достроит один фрагмент и «упрет-
ся» в синтезированный ранее другой, она отделится от
ДНК. Затем она (или другая молекула ДНК-полимера-
зы) сможет опять сесть на вновь расплетенный участок
и построить еще один фрагмент Оказаки. Отдельные
167
фрагменты Оказаки соединяются друг с другом особым
ферментом — ДНК-лигазой. Структура, которая обра-
зуется при репликации ДНК, называется репликатив-
ной вилкой (см. рис. 59).
На рис. 59, А показан участок расплетенной ДНК.
По верхней цепочке ДНК-полимераза двигается вправо
к месту расплетения, непрерывно достраивая вторую
(комплементарную) цепочку ДНК; направление синтеза
показано стрелкой. По нижней цепочке молекулы ДНК-
полимеразы двигаются налево, достраивая отдельные
фрагменты комплементарной цепочки; здесь представ-
Рис. 59. Механизм удвоения ДНК (репликативная вилка):
А — участок расплетенной ДНК, на котором начинается реплика-
ция; Б — исходная цепочка ДНК расплетается дальше и процесс
репликации продолжается
168
лены два таких фрагмента (фрагменты Оказаки). Таким
образом, синтез на обеих цепочках направлен от 3’-кон-
ца матричной цепочки к ее 5’-концу. Справа изображен
нерасплетенный участок ДНК. На рис. 59, Б показано,
что исходная цепь ДНК расплелась дальше. По верхней
цепочке ДНК-полимераза продолжает двигаться дальше
(белая стрелка); на нижней цепочке возникает новый
фрагмент Оказаки (белая стрелка). Растущий второй
участок синтеза на нижней цепочке (его рост показан
тоже белой стрелкой) достиг конца первого готового
участка, и оба синтезированных фрагмента сшиваются
ферментом лигазой.
----------------------------------
У прокариот с их небольшой по длине ДНК имеется только
одна точка начала репликации, от которой две репликатив-
ные вилки устремляются в противоположные стороны. Реп-
ликация идет со скоростью около 50 тыс. пар нуклеотидов в
минуту и длится около получаса. На эукариотических хро-
мосомах обычно имеется много (десятки тысяч) точек нача-
ла репликации. Скорость репликации у эукариот ниже (1 —
3 тыс. пар нуклеотидов в минуту); если бы репликация хро-
мосомы начиналась с одной точки, для нее потребовалась бы
неделя; на самом же деле она длится обычно всего около
часа.
Для синтеза ДНК требуется еще целый ряд ферментов, фун-
кции и механизмы действия многих из которых не до конца
ясны. Например, при расплетании целой двойной спирали
ДНК вся молекула должна была бы вращаться со скоростью
5 тыс. об/мин. Но этого не происходит, так как ферменты
топоизомеразы разрезают и сшивают одну из цепей или сра-
зу обе по мере раскручивания. Всего в удвоении ДНК у эука-
риот участвует не менее 20 разных ферментов.
15.10. Нарушения последовательности
нуклеотидов в ДНК — генные мутации
Подробнее о мутациях мы будем говорить в главе 8.
Здесь же рассмотрим только один из их типов — ген-
ные мутации.
169
Изменения порядка расположения нуклеотидов в
гене (а значит, изменение наследственной информа-
ции) называются генными мутациями. Такое измене-
ние порядка может возникать в результате выпадения
пары оснований, вставки новой пары или в результате
замены одной пары оснований на другую.
В некоторых участках ДНК порядок расположения
нуклеотидов удивительно постоянен. Это приводит к
сохранению целого ряда признаков (например, похо-
жих белков у разных организмов) в течение многих
миллионов лет. Большинство нарушений в структуре
ДНК исправляются сложной системой ферментов ре-
парации*. Иногда эта система не срабатывает, и тогда
порядок нуклеотидов меняется. Особенно часто новый,
измененный порядок нуклеотидов возникает в ходе
удвоения ДНК. Мутации возникают постоянно и в лю-
бых условиях среды у всех организмов. Мутации не
всегда приводят к изменению структуры и функции
образуемых белков; поэтому часто мутации не влияют
на признаки и жизнеспособность организма; такие
мутации называют нейтральными мутациями. Одна-
ко многие мутации, приводящие к замене всего одной
или нескольких аминокислот в белке, нарушают его
функционирование и оказываются вредными. Такие
мутации могут быть причиной наследственных болез-
ней. Могут возникать и мутации, которые полезны для
организма. Мутации всегда случайны (не направлены
на приспособление к тем условиям, в которых они
возникают).
* Репарация (от лат. репаратио — восстановление) — восста-
новление структуры ДНК, нарушенной во время репликации либо
под действием физических или химических факторов (например,
ультрафиолета или радиоактивных излучений). Репарация осуще-
ствляется системой ферментов, которые узнают место повреждения,
вырезают поврежденные участки ДНК и др.
170
Bl. Что является мономерами ДНК? Сколько имеется разных
мономеров?
2. Какие связи (по их химической природе) образуются меж-
ду нуклеотидами одной цепи ДНК и между нуклеотидами
разных цепей?
3. При нагревании ДНК, как и белки, денатурирует. Как вы
думаете, что при этом происходит с двойкой спиралью?
4. В чем заключается принцип комплементдрности?
5. Существуют ли какие-то ограничения Порядка чередова-
ния нуклеотидов в одной цепи ДНК?
6. Для чего у эукариот при удвоении ДНК синтез новых це-
пей начинается сразу во многих точках?
7. Бактерии, у которых вся ДНК содержит- радиоактивный
изотоп водорода, дважды поделились в среде, где радиоак-
тивных изотопов нет. Какой процент клеток после этого
будет содержать радиоактивный изотоп?
8. Из сборника «Против реакционного менделизма-морганиз-
ма» (1950): «За последние пять лет все чаще и чаще появ-
ляются результаты, которые свидетельствуют... о наследо-
вании признаков и свойств, возникающих в процессе раз-
вития. В 1944 г. Эвери с сотрудниками опубликовали
работу по направленному изменению пневмококков. Неин-
капсулированные пневмококки R-типа воспитывались в
сывороточном бульоне, в который добавлялся экстракт, по-
лученный из инкапсулированного варианта пневмококков.
При воспитании на такой среде у И-варцантов возникает
типичная капсула, которая стойко сохраняется». Действи-
тельно ли это пример наследования приобретенных свойств?
Если — да, то почему?
§ 16. Генетический код
16.1. Определение признаков организма генами,
направляющими синтез ферментов
(гипотеза «один ген — один фермент»)
Сразу же после переоткрытия законов Менделя встал
вопрос о том, как гены управляют признаками организ-
ма. Уже в 1902 г. врач А. Гэррод, изучавший наслед-
ственные заболевания человека, пришел к выводу, что
171
многие из них связаны с нарушением каких-то хими-
ческих реакций в организме.
Изучая родословные разных семей, Гэррод пришел к выводу,
что болезнь алкаптонурия передается по наследству и связа-
на с нарушениями в одном гене. При этой болезни выделяет-
ся моча красного цвета из-за нарушений азотного обмена.
Гэррод предположил, что дефект одного гена в этом случае
приводит к дефекту фермента, который обуславливает у здо-
ровых людей нужные реакции по переработке соответствую-
щих веществ. Такие случаи наследуемого нарушения способ-
ности осуществлять контролируемые генами ферментативные
реакции Гэррод назвал «врожденными ошибками метаболиз-
ма». Как и открытие основных законов наследственности
Менделем, идеи Гэррода слишком сильно обогнали свое вре-
мя и их значение было осознано только через 30 лет.
Экспериментальный подход к ответу на вопрос о
функциях генов был найден в 1930-е годы, когда нача-
лись работы по изучению мутаций у таких простых
организмов, как плесневые грибы и бактерии. Тогда уже
было известно, что мутации могут возникать под дей-
ствием разных факторов среды и вызывают изменения
самых разных признаков.
работая с плесневым грибом нейроспорой, американ-
ские ученые Д. Бидл и Э. Татум в 1941 г. выяснили, что
нормальные «дикие» разновидности (штаммы) этого гри-
ба могут расти на очень простой питательной среде,
состоящей в основном из смеси минеральных солей и
глюкозы,— «минимальной среде». Бидл и Татум облу-
чали споры гриба рентгеновскими лучами, которые вы-
зывают мутации. Споры высевали на «полную среду»,
т. е. такую, в которую добавляли дрожжевой экстракт,
содержащий аминокислоты, витамины.и другие веще-
ства (рис. 60, вверху).
Затем выросшие колонии пересевали на минималь-
ную среду. Оказалось, что среди этих колоний встреча-
172
Споры «дикого типа» (п)
4»
Рис. 60. Схема опытов Бидла и Татума, которые привели к созданию
теории «один ген — один фермент». Вверху — споры гриба, облучен-
ные рентгеновскими лучами, высеяны на полную среду; все они дали
колонии (обозначено знаком +). В середине — выросшие колонии пе-
ресеяны на минимальную среду; большинство из них растет на этой
среде (знак +), но одна, мутантная, колония на минимальной среде не
растет (правая колония со знаком -). Внизу — эта мутантная коло-
ния способна к дальнейшему росту в полной среде (слева, знак +) или
в минимальной среде, в которую добавлено определенное вещество
(вещество 3 в данном примере)
ются мутантные штаммы, которые не росли на мини-
мальной среде, зато хорошо росли на полной.
Бидл и Татум предположили, что у мутантов нару-
шен синтез одного из необходимых клетке веществ. В
полной среде эти вещества находятся в уже готовом
виде, и мутанты могут поглощать их и использовать.
Чтобы подтвердить эту гипотезу, ученые добавляли в
пробирки с мутантными спорами гриба по одному из
веществ, необходимых клетке (какую-то аминокислоту,
азотистое основание, витамин). Оказалось, что каждый
мутант для роста действительно нуждается в одном
определенном веществе (рис. 60, внизу).
173
Ген 1
I
Фермент 1
Ген 2
l
Фермент 2
Вещество 1 — — Вещество 2 — — Вещество 3
Рис. 61. Схема метаболического пути синтеза
Специальными опытами было доказано, что наруше-
ние синтеза данного вещества вызывается мутацией
одного конкретного гена. А уже было хорошо известно,
что за синтез каждого вещества в клетке отвечает опре-
деленный фермент. На основании этих опытов была
предложена гипотеза «один ген — один фермент». Суть
ее заключается в том, что каждый ген направляет син-
тез одного-единственного фермента.
В дальнейшем опыты были продолжены на бактери-
ях. Выяснилось, что мутации, определяющие неспособ-
ность синтезировать одно и то же вещество, могут про-
исходить в разных генах. Дело в том, что синтез многих
веществ происходит в несколько стадий и за каждую
стадию отвечает отдельный фермент (рис. 61). Мутация
любого из генов, отвечающих за эти ферменты, приводит
к «порче» одного из них, и нужное клетке вещество пе-
рестает синтезироваться.
Задание (к рис. 61). а) Может ли мутант с испорченным фермен-
том 1 расти на среде, в которую добавлено вещество 2?
б) Может ли мутант с испорченным ферментом 2 расти
на среде, в которую добавлено вещество 1?
•ч
Четко сформулировав правило «один ген — один фер-
мент», Бидл и Татум поставили перед молекулярной
биологией важнейшую задачу — определить, как именно
данный ген управляет образованием «своего» фермента?
174
16.2. Генетическая информация — информация
о первичной структуре белков организма
К моменту открытия роли ДНК в наследственности
считалось твердо установленным, что гены направляют
синтез белков. Была уже довольно хорошо изучена и
ферментативная функция белков. Биологи пришли к
выводу, что достаточно записать в генах информацию о
белках, чтобы получить все специфические для организ-
ма вещества. Ведь белки-ферменты направляют синтез
и углеводов, и жиров, и других химических веществ, спе-
цифических для организма. Однако, какая именно ин-
формация о белках хранится в генах, было неясно.
В это же время полным ходом шла расшифровка
первичной структуры белка инсулина. Решить эту
сложнейшую задачу удалось к 1955 г. Ф. Сэнгеру. В хо-
де работ по изучению первичной структуры белков ста-
ло ясно, что уникальные свойства любого белка опреде-
ляются порядком расположения аминокислот в пептид-
ной цепи. Отсюда возникла идея, что в ДНК как-то
зашифрован этот порядок расположения аминокислот и
сформулирована задача расшифровки «генетического
кода» — способа записи в ДНК информации о первич-
ной струкуре белков организма.
Задание. Повторите по § 3, что такое первичная, вторичная и тре-
тичная структуры белка.
Как вы помните, белки — это аминокислотные це-
почки, которые могут быть соединены друг с другом
(см. § 3). Разных видов аминокислот в белках на сегод-
няшний день известно больше 30, но строятся белковые
цепочки всегда из 20 аминокислот, а остальные получа-
ются путем химических модификаций уже готовой
цепочки. Полипептидную цепочку можно представить
себе как слово, для написания которого используется 20
разных букв, хотя всего букв в слове может быть не-
сколько сотен и даже тысячи.
175
Что означает утверждение: «В ДНК закодирована
информация о всех белках организма»? Это значит, что
информация о последовательности аминокислот в бел-
ках организма записана в ДНК с использованием дру-
гого алфавита — не «аминокислотного» с его 20 буква-
ми, а «нуклеинового».
Чтобы понять, как осуществляется такая запись, вер-
немся к строению одной цепочки ДНК. Она содержит
четыре азотистых основания: аденин, гуанин, цитозин и
тимин. Значит, алфавит ДНК состоит из четырех букв,
тогда как белковый алфавит — из 20. Если бы один
нуклеотид ДНК соответствовал одной аминокислоте, то в
ДНК можно было бы закодировать только четыре амино-
кислоты; если бы два нуклеотида ДНК кодировали одну
аминокислоту, то этого хватило бы на 16 аминокислот —
тоже маловато. (Действительно, возможно всего 16 раз-
ных сочетаний из четырех символов, взятых по два; если
символы А, Г, У и Ц, то сочетания: АА, АГ, АУ, АЦ, ГА, ГГ,
ГУ, ГЦ, УА, УГ, УУ, УЦ, ЦА, ЦГ, ЦУ и ЦЦ). Если же три
нуклеотида ДНК кодируют одну аминокислоту, то полу-
чается 64 кодона (т. е. 64 разных сочетания из четырех
нуклеотидов, взятых по три; такая тройка оснований, ко-
дирующих одну аминокислоту, в данном коде называет-
ся кодоном): более чем достаточно для 20 аминокислот
(на самом деле требуется как минимум 21 кодон — ведь
надо еще задавать сигнал «стоп»).
Исходя из этих теоретических рассуждений, эмигрант
из Советского Союза физик Георгий Гамов* предполо-
* Гамову принадлежат три замечательные идеи: 1-я — элемен-
тарная частица может не только перепрыгивать через энергетичес-
кие барьеры, но и с некоторой вероятностью просачиваться сквозь
него; эта идея позволила объяснить радиоактивный распад с выле-
том альфа-частиц; 2-я — наша часть Вселенной возникла в ре-
зультате «Большого взрыва»; эта идея позволила объяснить мно-
гие особенности устройства Вселенной и в частности привела к
предсказанию (затем открытого) реликтового излучения, оставше-
гося от времен «Большого взрыва»; 3-я — о триплетности генети-
ческого кода.
176
жил, что генетический код триплетен: три нуклеотида
кодируют одну аминокислоту. Очевидно еще одно свой-
ство кода — однозначность: каждый триплет кодирует
только одну аминокислоту.
С помощью анализа мутаций (нарушений в структу-
ре ДНК) было выяснено, что большинство триплетов
кодирует аминокислоты, и лишь несколько служат сиг-
налами окончания синтеза. Раз триплетов 64, а амино-
кислот 20, то многие аминокислоты кодируются более
чем одним триплетом. Это свойство кода называется
вырожденностью.
Анализируя аминокислотные последовательности
разных белков, удалось установить, что генетический код
является неперекрывающимся: триплеты «читаются»
подряд, и «прочитывание» каждого триплета приводит
к включению одной аминокислоты в белок. Однако пол-
ностью расшифровать генетический код и установить
его свойства ученые смогли только после того, как было
доказано, что синтез белка идет не непосредственно на
ДНК, а на специальных молекулах-посредниках — ин-
формационной РНК.
16.3. Синтез на ДНК по матричному принципу
молекул-посредников для синтеза белка
(информационной РНК)
Как же осуществляется считывание генетической
информации? Вряд ли стоит использовать саму ДНК как
непосредственную матрицу для синтеза белка — ведь
любое изменение в ее нуклеотидах является мутацией и
в дальнейшем оно будет передано всем потомкам этой
клетки. Разумнее с матрицы ДНК сделать «рабочую ко-
пию» с ограниченным временем жизни. Пусть по ней
ползет синтезирующая белок рибосома (см. § 5): если она
и подпортит эту копию, дефектными будут лишь несколь-
ко молекул белка. Поскольку основная матрица ДНК не
повреждена, то молекулы белка, считанные со следующей,
исправной рабочей копии, будут нормальными.
12 Зак. 13485
177
Функцию такой рабочей копии выполняет инфор-
мационная РНК (иРНК); иногда ее называют также
матричной РНК — мРНК. (Строение молекулы РНК см.
на с. 32.)
Вопрос. Подумайте, в чем еще могут состоять преимущества син-
теза белка не на ДНК, а на иРНК.
Цепочка РНК очень похожа на цепочку ДНК:
тоже состоит из нуклеотидов, и рибонуклеотиды весь-
ма похожи на дезоксирибонуклеотиды, только вместо
дезоксирибозы в их состав входит другой моносаха-
рид — рибоза, а вместо тимина, встречающегося толь-
ко в ДНК, в РНК входит урацил (см. схему на стр. 32,
где показана цепочка РНК с четырьмя азотистыми
основаниями: гуанином — G, цитозином — С, ураци-
лом — Uh аденином — А). Кроме того, клеточные
РНК одноцепочечны, тогда как ДНК состоят из двух
цепочек.
иРНК считывается с участка ДНК, кодирующего дан-
ный белок, в соответствии с принципом комплементар-
ности: напротив аденина ДНК становится урацил РНК,
напротив гуанина — цитозин, напротив тимина — аде-
нин и напротив цитозина — гуанин. У эукариот иРНК
после синтеза подвергается в ядре определенным моди-
фикациям, после чего выходит в цитоплазму и считыва-
ется рибосомами. А у прокариот рибосомы собираются
на иРНК уже во время ее синтеза. При синтезе РНК на
ДНК в качестве исходных мономеров также использу-
ются нуклеотид трифосфаты.
Считывание РНК с матрицы ДНК называется транс-
крипцией («переписыванием» информации с ДНК на
РНК). Она осуществляется специальным ферментом —
РНК-полимеразой.
Представления о роли РНК в синтезе белка начали
складываться еще в 30-е годы нашего века. Кроме опы-
тов с ацетабулярией, описанных в § 15, об этом свиде-
178
тельствовали и биохимические исследования. Было по-
казано, что синтез белка идет в рибосомах — специаль-
ных органоидах диаметром всего около 30 нм, состоя-
щих из белка и особой РНК, расположенных у эукариот
в цитоплазме. У бактерий в клетке от 1,5 тыс. до
15 тыс. этих органоидов, и они занимают большую часть
ее объема. К началу 60-х годов выяснилось, что все ри-
босомы во всех клетках организма одинаковы. То, какие
белки будут синтезироваться в данной клетке, зависит
не от рибосом, а от молекул специальной РНК, связан-
ной с рибосомами во время синтеза белка, но легко отде-
лимой от них. Стало ясно, что код ДНК сначала «пере-
писывается на язык» РНК, а уже потом по коду иРНК
синтезируется белок.
В 1955 г. (за пять лет до открытия РНК-полимера-
зы) удалось выделить из бактерий фермент, который
позволяет синтезировать РНК из нуклеотидов без вся-
кой матрицы. С помощью этого фермента американс-
кий ученый Маршалл Ниренберг в 1961 г. получил
искусственные иРНК, состоящие только из одного нук-
леотида (например, из урацила -УУУУУ-). Эти иРНК
добавляли в пробирку с клеточным экстрактом, в кото-
ром имелись рибосомы и другие необходимые для син-
теза белка компоненты, но были разрушены собственные
иРНК клетки. При этом синтезировался искусственный
белок, состоящий из единственной аминокислоты. Так
был установлен смысл первых триплетов (кодонов)
иРНК: оказалось, что кодон УУУ кодирует аминокисло-
ту фенилаланин, ААА — лизин и т. д.
Затем удалось синтезировать искусственные иРНК
более сложного состава: например, -УГУГУГУГУ-. Ока-
залось, что с такой иРНК считывается белок из двух
аминокислот: валин-цистеин-валин... Значит, кодон УГУ
кодирует валин, а кодон ГУГ — цистеин. Полностью
генетический код был расшифрован, когда оказалось, что
коротенькие фрагменты иРНК всего из трех нуклеоти-
дов, соединенные с рибосомой, могут присоединять свя-
179
занную с особыми транспортными РНК аминокислоту —
именно ту, которую они кодируют. Вскоре после разра-
ботки этой методики (примерно к середине 60-х годов)
была составлена таблица генетического кода.
Таблица
Генетический код
Первый нуклеотид кодона Второй нуклеотид кодона Третий нуклеотид кодона
У ц А Г
У ууу —фен УУЦ — » УУА — лей УУГ — » УЦУ — сер УЦЦ — » УЦА — » УЦГ — » УАУ — тир УАЦ — » УАА — УАГ — УГУ —цис УГЦ — » УГА — УГГ — трп У ц А Г
ц ЦУУ — лей ЦУЦ- » ЦУА — » ЦУГ — » ЦЦУ — про ЦЦЦ- » ЦЦА- » ЦЦГ - » ЦАУ — гис ЦАЦ - » ЦАА — глн ЦАГ — » ЦГУ — арг ЦГЦ - » ЦГА — » ЦГГ — » У ц А Г
А АУУ — иле АУЦ — » АУА — » АУГ — мет АЦУ — тре АЦЦ- > АЦА — » АЦГ — » ААУ — асн ААЦ — " ААА — лиз ААГ — " АГУ — сер АГЦ — » АГА — арг АГГ — » У Ц А Г
Г ГУУ —вал ГУЦ — » ГАУ — » ГУГ — » ГЦУ —ала ГЦЦ - » ГЦА — » ГЦГ — » ГАУ — асп ГАЦ — » ГАА — глу ГАГ — » ГГУ —гли ГГЦ — » ГГА — » ГГГ — » У ц А Г
Обозначения: фен — фенилаланин, лей — лейцин, иле — изо-
лейцин, мет — метионин, вал — валин, сер — серин, про — про-
лин, тре — треонин, ала — аланин, тир — тирозин, гис — гисти-
дин, глн — глутамин, асн — аспарагин, лиз — лизин, асп — аспа-
рагиновая кислота, глу — глутаминовая кислота, цис — цистеин,
трп — триптофан, арг — аргинин, гли — глицин.
В клеточках этой таблицы написаны кодоны (по-
следовательность трех нуклеотидов в иРНК) и амино-
кислота, которая этой последовательностью кодируется.
Например, запись «УУУ — фен» означает, что последова-
тельность из трех нуклеотидов урацила кодирует фени-
180
л аланин. Обратите внимание, что трем кодонам ( АА,
УАГ и УГА) не соответствует никакая аминокислота, они
называются стоп-кодонами. Когда в процессе синтеза
белка рибосома доходит до стоп-кодона, синтез белко-
вой цепи прекращается.
Задача. Пользуясь таблицей генетического кода, определите, ка-
кой белок будет синтезироваться с иРНК состава
-У У ГУ У ГУ У ГУ У Г-.
У большинства организмов на ДНК синтезируются
молекулы РНК. Однако, оказывается, некоторые вирусы
способны осуществлять обратную операцию — синтези-
ровать ДНК на матрице РНК. В их геноме закодирован
специальный фермент, который осуществляет такой
синтез. Этот фермент назвали обратной транскриптазой.
16.4. Свойства генетического кода —
триплетность, однозначность, неперекрываемость,
вырожденность, универсальность
Повторим еще раз основные свойства генетического
кода.
1. Код триплетен — последовательность из трех нук-
леотидов ДНК или иРНК кодирует одну аминокислоту
в белке.
2. Код однозначен — каждый триплет кодирует
только одну аминокислоту.
3. Код неперекрывающийся — триплеты читаются в
одном направлении друг за другом.
4. Код вырожден — большинство аминокислот коди-
руется более чем одним триплетом («значащих» трип-
летов 61, три триплета — стоп-кодоны, означающие ко-
нец синтеза белковой цепи).
5. Код универсален — он оказался одинаков у виру-
сов, прокариот и эукариот.
Универсальность генетического кода — одно из наи-
более ярких свидетельств единого происхождения жи-
181
вых существ. равда, в генетическом коде митохонд-
рий имеются небольшие отличия. Смысл некоторых
триплетов у них не такой, как в приведенной выше таб-
лице.
В1. Повторите свойства генетического кода. Что означают та-
кие свойства, как триплетность, неперекрываемость, вырож-
денность, универсальность, однозначность? Попробуйте сфор-
мулировать это своими словами, не заглядывая в текст па-
раграфа.
2. Дана последовательность нуклеотидов иРНК: АУУГЦ-
ЦАЦЦГЦ. Сколько аминокислот закодировано такой пос-
ледовательностью?
3. а) Дана последовательность нуклеотидов иРНК: -ГЦЦ-ГУУ-
АУУ(черточки указывают границы триплетов). Третий сле-
ва нуклеотид (Ц) в результате мутации заменился на другой.
К каким последствиям для синтеза белка это приведет? (Для
ответа воспользуйтесь таблицей генетического кода).
б) К каким вообще последствиям для синтеза белка и его
дальнейшего функционирования может приводить замена
одного нуклеотида на другой?
4. К каким последствиям для синтеза белка приведет встав-
ка одного лишнего нуклеотида в кодирующую цепь ДНК?
5. На планете Тарабумбия в составе белков у организмов об-
наружено 200 аминокислот, а в составе ДНК — четыре нук-
леотида. Сколько (минимум) нуклеотидов должно кодиро-
вать каждую аминокислоту, чтобы каждой аминокислоте
соответствовал свой кодон?
§ 17. Строение гена и синтез белка
17.1. Ген — участок ДНК, кодирующий
последовательность нуклеотидов одной молекулы
РНК или последовательность аминокислот одной
полипептидной цепи
Участок молекулы ДНК, в котором закодирована
одна полипептидная цепь или одна молекула РНК —
это и есть ген (правда, необходимо учитывать еще регу-
182
ляторные участки, которые сами ничего не кодируют, но
входят в состав генов и важны для регуляции их рабо-
ты). Гены иРНК кодируют белки; есть также гены ри-
босомальных и транспортных РНК, которые белков не
кодируют (см. п. 17.2).
Большинство генов, кодирующих белки, представлены в хро-
мосомах каждой клетки единственной копией, а вот генов
для синтеза каждого типа рибосомальной РНК в клетке боль-
шинства эукариот несколько сотен.
Точное число всех генов можно сейчас определить только для
вирусов и некоторых хорошо изученных бактерий (от десят-
ков до нескольких тысяч генов). У таких организмов, как на-
секомые или позвоночные, число генов известно лишь при-
близительно — от нескольких десятков до нескольких сотен
тысяч.
У высших эукариот (например, человека) около 90% всей
ДНК вообще не кодирует ни белков, ни РНК; функции этой
«молчащей» ДНК еще недостаточно изучены.
Но в ДНК две цепочки. Кодирует ли белки одна из
них или обе? Оказалось, что и у прокариот, и у эукариот
на каждом отдельном участке ДНК только одна це-
почка является кодирующей; на соседнем участке это
уже может быть другая цепочка, но тоже одна. Любой
белок закодирован лишь в одной цепочке ДНК, комп-
лементарная цепочка не кодирует ничего. Участки ко-
дирования белков на разных цепочках нигде не пере-
крываются. Исключение составляют вирусы: у них
часто на одном участке ДНК кодирующими являются
обе цепочки.
Для кодирующей цепочки ДНК и соответствующей
ей цепочки иРНК можно выбрать три способа считыва-
ния триплетов (три «рамки считывания»), и кодоны во
всех рамках получатся разными (рис. 62). И прокарио-
ты, и эукариоты используют на данном участке ДНК
только одну рамку считывания: остальные две рамки
не применяются. Исключением опять-таки являются
183
труктурная часть гена
Начало транскрипции
Промотор
3’
5'
Старт-кодон
Терминатор транскрипции
Рис. 62. Различные рамки считывания одного участка иРНК. Если
считывание начнется с первого основания (урацила), то первой амино-
кислотой в белке будет серин. Если считывание начнется со второго
основания (гуанина), то первой аминокислотой в белке будет глицин.
Если считывание начнется с третьего основания (второго гуанина цепи),
то первой аминокислотой в белке будет аланин
вирусы: они часто используют более одной рамки на
одном участке.
Рассмотрим, как идет транскрипция гена или систе-
мы из нескольких генов. РНК-полимераза садится на
промотор — особый участок в начале каждого гена
(рис. 63). Промоторы разных генов имеют в целом сход-
ное строение, но чем-то различаются. Сходны они пото-
му, что один и тот же фермент (единственный вид РНК-
полимеразы у прокариот или один из типов РНК-поли-
меразы у эукариот) синтезирует все иРНК. Различия же
необходимы, так как в разных клетках должны экспрес-
сироваться («работать», использоваться для синтеза бел-
ков) разные гены. Почему клетки эпителия отличаются
от мышечных? Потому что в них работают разные гены.
В клетках эпителия кожи это, в частности, гены, кодиру-
ющие кератин, а в мышечных клетках — гены актина и
Кодон глицина
Кодон аланина
А ...и т. п.
Рис. 63. Схема строения типичного гена
Кодон серина
184
миозина. Благодаря различиям промоторов регулятор-
ные белки в разных клетках могут «включать» разные
специфичные гены, свойственные именно этим клеткам
(см. п. 17.4).
После промотора в гене идет участок, который слу-
жит для транскрипции (синтеза иРНК на ДНК). В са-
мом начале этого участка закодирована последователь-
ность, необходимая для посадки рибосом на иРНК, за-
тем идет структурная часть гена, кодирующая
аминокислоты. Заключает этот участок стоп-кодон —
триплет нуклеотидов, которому в иРНК соответствует
стоп-кодон, воспринимаемый рибосомой как сигнал ос-
тановки синтеза белка.
Транскрипцию нужно не только начать, но и закон-
чить. Поэтому после структурной части гена есть не-
большой участок — терминатор транскрипции. Он не
идентичен стоп-кодонам ДНК! Стоп-кодоны служат сиг-
налами для прекращения синтеза белка на рибосоме. На
рис. 63 стоп-кодон находится в самой правой части
структурного участка; РНК-полимераза на него не реа-
гирует и спокойно продолжает двигаться дальше по
цепи ДНК. Терминатор же — команда «стоп» именно
для транскрипции; он состоит не из трех нуклеотидов,
как стоп-кодон, а из гораздо большего их числа. Если
терминатор расположен сразу за первым стоп-кодоном,
который встретится на пути РНК-полимеразы, то при
транскрипции будет синтезирована иРНК, которая коди-
рует один белок (этот случай и представлен на рис. 63).
Однако у вирусов и бактерий в ДНК встречаются систе-
мы генов, расположенных друг за другом, имеющих об-
щий промотор и общий терминатор. На такой системе
синтезируется длинная иРНК, в которой закодировано
несколько белков и есть несколько стоп-кодонов.
После того как РНК-полимераза садится на промо-
тор, двойная спираль ДНК частично расплетается. РНК-
полимераза начинает двигаться по кодирующей цепи,
и за ней тянется одинарная цепочка синтезируемой
185
иРНК
РНК-полимераза Кодирующая цепь
3' -
5'
Некодирующая цепь
Рис. 64. Схема транскрипции. Молекула РНК-полимеразы (изобра-
женная овалом) двигается по кодирующей цепи ДНК слева направо;
вверх направлен освободившийся участок иРНК
иРНК. По мере продвижения РНК-полимеразы иРНК
освобождается из комплекса с ДНК, и двойная спираль
ДНК восстанавливается (рис. 64). Дойдя до терминато-
ра, РНК-полимераза отделяется от ДНК, и образовавша-
яся иРНК тоже освобождается.
17.2. Рибосомальные РНК, служащие «скелетом»
рибосом, и транспортные РНК, доставляющие
аминокислоты в рибосомы для синтеза белка
иРНК — это РНК, в которой закодирован какой-то
белок; она служит посредником между ДНК и местом
синтеза белка — рибосомой. Но в клетках есть и другие
типы РНК. Они никаких белков не кодируют, а выпол-
няют другие важные функции. Рибосомальная РНК
(рРНК) входит в состав рибосом (вместе с определенны-
ми белками).
Мы уже упоминали, что в ядрах эукариот имеется
ядрышко, одно или несколько. Функция ядрышка —
синтез субчастиц рибосом. Рибосома состоит из двух
субчастиц, большой и малой. Участок ДНК, входящий в
состав ядрышка, содержит гены рРНК; именно в ядрыш-
ке происходит ее синтез. Рибосомные же белки, как и
все белки, синтезируются в цитоплазме на рибосомах и
транспортируются в ядро — к ядрышку. В этой облас-
186
ти происходит самосборка субчастиц рибосом: рРНК и
рибосомальные белки соединяются друг с другом в еди-
ный комплекс. Таким образом, большая и малая субча-
стицы рибосом собираются в ядре, а затем выходят че-
рез ядерные поры в цитоплазму по отдельности.
Третий тип РНК — транспортная РНК (тРНК) пока-
зана на рис. 65. Она играет важную роль в процессе
синтеза белка. Подобно белку, тРНК имеет сложную вто-
ричную и третичную структуру. Пример вторичной
структуры конкретной тРНК, аланиновой тРНК кишеч-
ной палочки, которая доставляет к рибосоме аминокис-
лоту аланин, показан на рис. 65, А. Эта тРНК, как и дру-
гие тРНК, имеет форму трилистника, которая обеспечи-
вается межнуклеотидными взаимодействиями (связи
между парами комплементарных нуклеотидов изображе-
ны параллельными отрезками), так что некоторые учас-
тки тРНК представляют собой двухцепочечные РНК.
Три петли (две боковых и нижняя) образованы одноце-
почечной РНК; кроме того, в тРНК имеется добавочная
(четвертая) петля, размеры которой у разных тРНК
сильно отличаются — от двух до 24 нуклеотидов (на
рис. 65, А эта петля содержит четыре нуклеотида). В
верхней части тРНК (как она изображена на рисунке)
находится участок, который связывает определенную
аминокислоту, соответствующую данной тРНК. З'-ко-
нец этого стебля всегда несет основания АЦЦ, к чет-
вертому основанию присоединяется та или иная ами-
нокислота (на рисунке к основанию А присоединяется
аланин). На нижней петле тРНК находится антико-,
дон, который связывается с триплетом иРНК, кодиру-
ющим эту аминокислоту. На рис. 65, А это антикодон
ГГЦ. Ниже тРНК показан участок иРНК с кодоном,
комплементарным антикодону данной тРНК. Однако
соединение антикодона и кодона осуществляется толь-
ко с помощью рибосомы.
Около 80% РНК в клетке (по массе), а иногда и боль-
ше — это рРНК; около 15% — тРНК. И лишь очень
187
3
аланин
--------Ц— -Ц- - Г----иРНК
комплементарный кодон
Б
Рис. 65. Структура тРНК: А — вторичная структура аланиновой
тРНК кишечной палочки, Б — пространственная укладка одной из
тРНК
небольшую часть (обычно менее 5%) составляет иРНК.
Синтез рРНК и тРНК происходит подобно синтезу иРНК
(см. рис. 64) — только в рРНК и тРНК не закодированы
никакие белки.
17.3. Синтез белка на рибосомах
Синтез белка идет на рибосомах. Рибосомы находят-
ся в цитоплазме: свободно плавающие или прикреплен-
ные на шероховатом эндоплазматическом ретикулуме.
188
Кроме того, рибосомы есть в митохондриях и хлоропла-
стах. Рибосомы — это органеллы, состоящие из РНК и
белков. У разных организмов рибосомы бывают разные,
однако все они состоят из двух субъединиц — большой
и малой. Эти субъединицы могут легко отделяться друг
от друга и опять воссоединяться. До того, как рибосома
начинает синтезировать белок, ее субъединицы соединя-
ются друг с другом и с молекулой иРНК (рибосома
связывается с определенной последовательностью нук-
леотидов, расположенной в начале иРНК), а когда рибо-
сома заканчивает синтез, она отделяется от иРНК и дис-
социирует на субъединицы.
Бактериальные или прокариотические рибосомы в
целом похожи на эукариотические, но имеют несколько
иное строение и состав. Рибосомы прокариот мельче.
Различается количество молекул РНК в составе рибосо-
мы прокариот и эукариот: у прокариот имеется одна
рРНК в малой субъединице и две — в большой, тогда
как в большой субъединице эукариотической рибосо-
мы — три молекулы рРНК. В состав рибосом входит
несколько десятков белков; количество их и виды так-
же несколько различны у прокариот и эукариот.
Различия между рибосомами человека и бактериаль-
ными рибосомами делают возможным подбор ингибито-
ров (подавителей) синтеза белка, которые действуют на
бактериальные рибосомы и не действуют на наши (а
бывают и такие ингибиторы, которые действуют на наши
и не действуют на бактериальные). Все вы наверняка
принимали такие ингибиторы — например, тетрациклин;
они составляют один из классов антибиотиков. Казалось
бы, их можно применять спокойно — на эукариотичес-
кие рибосомы они никак не влияют. Однако многие из
таких антибиотиков (канамицин, гентамицин, хлорамфе-
никол и др.) обладают неблагоприятным побочным дейт
ствием: к ним чувствительны рибосомы наших мито-
хондрий. По чувствительности к антибиотикам рибосо-
мы митохондрий очень похожи на бактериальные. Это
189
еще один довод в пользу теории симбиогенеза (и наша
плата за симбиоз с прокариотами). Хлоропластные же
рибосомы очень похожи на прокариотические и по раз-
мерам.
Теперь рассмотрим, как происходит синтез белка.
Известно, что каждая аминокислота закодирована опре-
деленным триплетом ДНК. Но как этот нуклеиновый
код перевести в аминокислотный? Мы видели, что при
синтезе иРНК на ДНК используется принцип компле-
ментарности, помогает он и при белковом синтезе. Ока-
зывается, важнейшую роль в процессе синтеза белка
играют тРНК. Именно они позволяют поместить в бел-
ковую цепь ту аминокислоту, которая закодирована в
данном кодоне иРНК. Для каждого кодона иРНК суще-
ствует комплементарный ему триплет нуклеотидов. В
каждой молекуле тРНК имеется участок, называемый
антикодоном (см. рис. 65), который содержит такой
триплет нуклеотидов и поэтому комплементарно взаи-
модействует с «нужным» кодоном иРНК (тем, что коди-
рует ту аминокислоту, которая присоединяется к дан-
ной тРНК). За счет взаимодействия «кодон — антико-
дон» как раз и обеспечивается вставка нужной
аминокислоты в белковую цепь.
Остается еще вопрос о том, как тРНК связывается со
«своей» аминокислотой. Оказывается, эту операцию осу-
ществляет семейство специальных ферментов амино-
ацил-тРНК-синтетазы. Один фермент из этого семейства
узнает определенную аминокислоту и определенную
тРНК и связывает их в комплекс. Этот комплекс и уча-
ствует в синтезе белка.
Теперь мы понимаем, как на основе нуклеинового
кода можно построить белковую цепь. Этот процесс —
трансляция — осуществляется в рибосоме.
Рассмотрим сначала на качественном уровне процесс
синтеза белка, осуществляемый рибосомой. Рибосома
соединяется с начальным участком иРНК. В области
прикрепления рибосомы содержатся два последователь-
190
но расположенных кодона. К первому кодону иРНК в
результате броуновского движения молекул из прото-
плазмы подходят разные молекулы тРНК. Когда к
этому участку подойдет тРНК с антикодоном, соответ-
ствующим первому кодону, она присоединяется к это-
му кодону, доставляя в рибосому соответствующую
аминокислоту. Точно так же присоединяется ко вто-
рому кодону иРНК своя тРНК, несущая свою амино-
кислоту. Рибосома «сшивает» эти аминокислоты друг
с другом, образуя начало полипептидной цепи. Затем
рибосома продвигается по иРНК на три основания, при
этом первый кодон иРНК выходит за пределы рибосо-
мы, второй кодон попадает на место первого, а на месте
второго оказывается новый свободный кодон. Когда на
этот новый кодон садится соответствующая тРНК, рибо-
сома присоединяет принесенную ей аминокислоту ко
второй из ранее доставленных аминокислот, увеличивая
длину полипептидной цепочки на единицу. Потом ри-
босома опять сдвигается по иРНК на три основания и
процесс синтеза продолжается.
Теперь рассмотрим процесс синтеза белка более де-
тально. Вначале субчастицы рибосомы связываются с
иРНК и друг с другом. В малой субчастице рибосомы
есть два тРНК-связывающих участка (рис. 66): так на-
зываемые A-участок и П-участок. Эти участки располо-
жены возле иРНК.
Рассмотрим, как начинает синтезироваться и расти
белок. Пусть возле П-участка находится АУГ (синтез
белка практически всегда начинается с кодона АУГ; он
кодирует у эукариот метионин, а у прокариот — моди-
фицированную аминокислоту формилметионин). К нему
подходит тРНК (на самом деле аминоацил-тРНК, о чем
будет рассказано дальше), несущая метионин, и присое-
диняется благодаря комплементарности своего антико-
дона (рис. 66, 1). К следующему кодону, расположенно-
му возле A-участка, подходит своя аминоацил-тРНК
(рис. 66, 2) . Разумеется, может подойти и не своя, но ее
191
1
Мет
Рис. 66. Стадии трансляции. Показана рибосома с П- и А-участками.
1 — на П-участок «села» тРНК, которая принесла с собой аминокислоту
метионин (Мет), A-участок рибосомы свободен; 2 — к А-участку присо-
единилась тРНК, которая принесла с собой аминокислоту аргинин (Apr);
3 — рибосома соединила аминокислоты между собой, тРНК в П-участке
свободна; 4 — рибосома продвинулась по иРНК на один кодон. тРНК с
П-участка освободилась, вторая тРНК с образующейся пептидной цепью
(она пока состоит всего из двух аминокислот) сместилась из А- в П-
участок. A-участок переместился к следующему кодону иРНК
2
антикодон не будет комплементарен кодону иРНК, эта
тРНК не задержится в A-участке и быстро покинет его.
Если же подойдет тРНК с антикодоном, комплементар-
ным кодону иРНК, то она останется в A-участке и рибо-
сома приступит к следующему этапу трансляции. На
этом этапе, идущем с участием дополнительных белков
и с затратами энергии ГТФ, тРНК, нагруженная второй
аминокислотой, как бы наклоняется к П-участку — и
ферменты, входящие в состав большой субъединицы
рибосомы, «перебрасывают» остаток метионина на сле-
дующую аминокислоту. При этом образуется настоящая
пептидная связь: метионин присоединяется к следую-
щей аминокислоте, образуя дипептид, соединенный с
192
тРНК ( рис. 66, 3). Затем рибосома перемещается на три
нуклеотида (на один триплет) вдоль по молекуле иРНК.
Освободившаяся тРНК вытесняется из рибосомы, а вто-
рая тРНК, несущая дипептид, переходит в П-участок
(рис. 66,4). Цикл повторяется снова. Теперь пептидил-
тРНК расположена в П-участке (он получил свое назва-
ние от слова «пептидил»), а к A-участку (получившему
свое название от слова «аминоацил») подойдет амино-
ацил-тРНК с антикодоном, комплементарным кодону
иРНК, оказавшемуся в этом участке, и т. д. Таким об-
разом, за один «шаг» рибосома смещается по иРНК на
один триплет, а аминокислотная цепь удлиняется на
одну аминокислоту. Обратите внимание на то, что рибо-
сома движется по иРНК от 5'-конца к З'-концу.
Рибосома будет присоединять одну аминокислоту за
другой в соответствии с кодонами иРНК, пока не дойдет
до одного из стоп-кодонов. После этого она прекратит
трансляцию, отделится от иРНК и диссоциирует на
субъединицы.
У прокариот на одной молекуле иРНК может быть
закодировано несколько пептидных цепочек; тогда пос-
ле стоп-кодона из рибосомы удаляется только пептид-
ная цепь, а иРНК остается. Рибосома «проскакивает»
стоп-кодон и начинает синтез следующего белка.
Рассмотрим еще вопрос об энергетическом обеспечении про-
цесса синтеза белка. Известно, что распад белка — процесс
самопроизвольный. При действии пищеварительных фермен-
тов белок легко распадается на аминокислоты, никаких зат-
рат энергии это не требует. А раз гидролиз белка — слегка
экзотермический процесс, то самопроизвольный синтез белка
из аминокислот невозможен. Как же синтезировать белок? В
этом процессе участвует АТФ. Процесс проходит в два этапа:
сначала из АТФ и аминокислоты синтезируется аминоацила-
денилат, а затем из него и соответствующей тРНК образуется
аминоацил-РНК.
Обе эти реакции осуществляет один фермент — аминоацил-
тРНК-синтетаза (иногда его сокращенно называют кодаза).
Таким образом, затратив энергию АТФ, клетка получает бога-
13 Зак. 13485
193
тое энергией соединение аминоацил-тРНК, из которого может
синтезироваться белок. Аминокислот в ДНК закодировано
всего 20, а кодонов для них — 61 (64 минус 3 стоп-кодона).
Ясно, что одна аминоацил-тРНК-синтетаза не обеспечит спе-
цифичное присоединение каждой аминокислоты к нужной
тРНК — в клетке имеется минимум 20 различных аминоа-
цил-тРНК-синтетаз.
-----------------------------
У эукариот не так давно была открыта модификация
иРНК после ее синтеза, которую назвали процессингом
(рис. 67). Иногда эту модификацию иРНК называют
созреванием иРНК. Процессинг включает в себя при-
шивание к иРНК дополнительных участков или удале-
ние ее частей. Оказалось, что внутри генов эукариот есть
участки, не кодирующие аминокислот,— интроны; эти
участки сначала переписываются на иРНК при транс-
крипции (рис. 67, средний фрагмент), но затем выреза-
ются ферментами; концы оставшихся кодирующих уча-
стков — экзонов — сшиваются особым ферментом
(рис. 67, внизу). Этот процесс удаления интронов и сши-
вания экзонов назвали сплайсинг (от англ, сплай-
синг — сращивание концов веревки или каната).
Кроме того, у эукариот иРНК защищается от разру-
шения своими же ферментами с помощью пришивания
нуклеотидов на обоих концах молекулы уже после
транскрипции (рис. 67, средний фрагмент). Не защищен-
ная таким способом иРНК не проживет в клетке и не-
скольких минут. Действительно, не имеющая такой за-
щиты иРНК прокариот существует в клетке всего не-
сколько минут. Из-за этого на иРНК прокариот белок
обычно начинает синтезироваться еще до того, как за-
канчивается процесс транскрипции иРНК, т. е. когда
еще только часть молекулы иРНК отделяется от ДНК.
В то же время иРНК эукариот сохраняется в клетке
часами, а иногда и сутками.
После процессинга зрелая иРНК транспортируется из
ядра в цитоплазму и используется для синтеза белка.
194
Единицы транскрипции
3’
МШ1Н
(удаляются)
(удаляются)
IIIIIIIIIIIIIIIIIIM
зрелая
иРНК
Рис. 67. Схема процессинга иРНК
Иногда из-за разных способов процессинга с одного гена
могут считываться разные иРНК, на которых синтези-
руются разные белки; так что правило «один ген — один
белок» выполняется не всегда.
17.4. Регуляция синтеза белка
Разные клетки многоклеточных организмов отлича-
ются по набору своих белков. Это означает, что в каж-
дой клетке реализуется не вся наследственная инфор-
мация, а лишь ее часть.
По мере дифференцировки клеток (т. е. возникновения раз-
личий между однородными клетками эмбриона в ходе фор-
мирования специализированных клеток и тканей) число ак-
тивно работающих генов сокращается. Так, у морских ежей в
клетках на ранней стадии эмбрионального развития (стадия
гаструлы) работает от 20 до 40 тыс. генов, а в клетках опреде-
ленной ткани взрослого организма — около 2—3 тыс. генов.
--------------------:------------
195
Но и в одной и той же клетке в разные периоды ее
жизни набор белков меняется. Это ярко проявляется при
действии на клетки гормонов. Например, гормон роста и
мужские половые гормоны вызывают усиленный син-
тез белков в клетках мышц. Гормон щитовидной желе-
зы, влияя на синтез РНК и белков, приводит к усиленно-
му потреблению клетками кислорода и к повышению
теплопродукции.
Все эти факты показывают, что в клетках есть систе-
мы регуляции, позволяющие «включать» и «выключать»
синтез определенных белков. Механизмы регуляции
работы генов лучше изучены у бактерий. Назовем лишь
один пример такой регуляции, который был изучен
первым. Он был открыт у бактерии кишечной палочки
французскими биохимиками Ф. Жакобом, Ж. Моно и
А. Львовым в 1961 г.
Как вы помните, превращения веществ в клетке —
это последовательности химических реакций, катализи-
руемых ферментами. Цепь таких реакций называется
метаболическим путем. В работе Жакоба—Моно было
показано, что гены, отвечающие за ферменты одного из
метаболических путей, расположены рядом. В дальней-
шем были обнаружены и другие примеры такого распо-
ложения генов одного метаболического пути. Эти груп-
пы генов образуют функциональную единицу — оперон.
Жакоб и Моно изучили один из оперонов — лактоз-
ный (рис. 68). Ферменты, которые закодированы в его
структурных генах, отвечают за превращения в клетке
лактозы — молочного сахара. Если в среде, где выращи-
ваются бактерии, лактозы нет, то эти ферменты в клетке
не синтезируются. Однако стоит добавить в среду лак-
тозу, как через короткое время начинается синтез фер-
ментов для ее усвоения.
Как же осуществляется эта реакция клетки? Ученые
установили, что в опероне, кроме структурных генов, есть
особые участки — промотор, о котором мы уже говори-
ли, и оператор. Промотор — особая последовательность
196
ОПЕРОН
Двойная
спираль
ДНК Ген-регулятор
Трансляция
Молекула-репрессор
Оператор
Структурные гены
Синтез полипептидов
Транскрипция
иРНК
?УМожет связаться или
не связаться
с оператором
Рис. 68. Схема строения участка ДНК кишечной палочки, включающего
лактозный оперон и ген-регулятор.
Слева на ДНК расположен ген-регулятор. При транскрипции (1) с него счи-
тывается иРНК, на которой при трансляции (2) синтезируется белок-реп-
рессор. Этот белок может связываться (3) с оператором лактозного оперо-
на. Справа изображен лактозный оперон. Его оператор и промотор на ри-
сунке совмещены (как это часто бывает в действительности). За оператором
расположено несколько структурных генов, ответственных за синтез фер-
ментов, необходимых для усвоения лактозы. При транскрипции (4) с этого
участка считывается длинная молекула иРНК, на которой закодировано
несколько ферментов; при трансляции (5) эти ферменты синтезируются (6)
197
нуклеотидов ДНК, с которой связывается РНК-поли-
мераза перед началом синтеза РНК. Таким образом,
чтобы начался синтез, РНК-полимераза должна «уз-
нать» промотор и «сесть» на него. Оператор — учас-
ток ДНК, который находится между промотором и
структурными генами (оператор может составлять
часть промотора).
Вне оперона на ДНК находится ген-регулятор. Этот
ген кодирует белок-репрессор, который может связы-
ваться с оператором. Тогда белок не дает РНК-полиме-
разе связаться с промотором и процесс синтеза иРНК с
оперона подавляется (репрессируется; отсюда и назва-
ние белка-репрессора). Если лактозы в среде нет, то опе-
ратор связан с белком-репрессором (рис. 69). Белок-реп-
рессор не дает двигаться РНК-полимеразе по цепи ДНК
и препятствует синтезу иРНК, а значит, и ферментов.
Если в среде появляется лактоза, то часть ее молекул
проникает в клетку бактерии. Оказалось, что лактоза
соединяется с белком-репрессором и так меняет форму
его молекул, что они уже не могут садиться на оператор.
Теперь путь для РНК-полимеразы открыт — начинает-
ся синтез РНК, с которой считываются ферменты усво-
ения лактозы (см. рис. 69).
Эта система регуляции является очень экономной.
Появление лактозы приводит к синтезу ферментов ее
усвоения, исчезновение лактозы приводит к прекраще-
нию синтеза ферментов. Действительно, как только вся
лактоза исчерпается, белок-репрессор снова сядет на опе-
ратор, иРНК, кодирующая эти ферменты, перестанет син-
тезироваться, а следовательно, прекратится и синтез фер-
ментов со структурных г^нов лактозного оперона.
Синтез ферментов усвоения лактозы практически не идет, если
в среде одновременно имеется более «вкусная» для кишеч-
ной палочки, легче усваиваемая пища — глюкоза. Это объяс-
няется тем, что для хорошего узнавания промотора РНК-по-
лимеразой в клетке должно присутствовать особое веще-
198
иРНК-полимераза
Ген-регулятор
Структурный ген
Трансляция
Лактоза
Транскрипция
Молекула-репрессор
Лактоза
действует как
индуктор
Комплекс индуктора с
репрессором, неспособный
связаться с оператором
о J 'Р
р -галактозидаза
(фермент)
Глюкоза +
галактоза
Рис. 69. Схема регуляции работы лактозного оперона
(схема регуляции работы генов, по Жакобу и Моно)
Ген-регулятор (1) кодирует белок-репрессор. Если в бактерию попадает лактоза, она
связывается с белком-репрессором (2), образуя комплекс, который не может блокиро-
вать оператор (3). Оператор и промотор освобождаются, с промотором связывается
РНК-полимераза и начинается транскрипция (4) иРНК, с которой синтезируются
ферменты, необходимые для усвоения лактозы
199
ство — цАМФ (циклический аденозинмонофосфат). цАМФ
синтезируется из АТФ с помощью особого фермента, работа
которого подавляется глюкозой. После исчерпания запасов
глюкозы этот фермент активируется, начинается синтез
цАМФ, РНК-полимераза садится на промотор лактозного опе-
рона, и начинается усвоение лактозы. цАМФ регулирует и
многие другие реакции клеток на различные сигналы; иногда
это вещество называют «сигналом клеточного голода», так
как оно часто синтезируется в ответ на нехватку питатель-
ных веществ. О роли цАМФ в механизме действия гормонов
на клетки см. § 13.
Существуют и многие другие механизмы регуляции
синтеза белков. Один из них — накопление иРНК в
неактивном состоянии в комплексе с белками. Такие
комплексы получили название информосом. Например,
в яйцеклетках все иРНК, необходимые в период раннего
развития зародыша, накапливаются до оплодотворения
в составе информосом. После оплодотворения иРНК ак-
тивируются и с них начинается синтез белков. Большин-
ство механизмов регуляции работы генов эукариот еще
слабо изучены. Однако уже сейчас ясно, что очень важ-
ную роль в развитии и работе клеток и организма игра-
ют специальные гены-«регуляторы». Закодированные в
них белки умеют узнавать другие гены и «включать»
или «выключать» их работу. Сложные сети таких взаи-
модействий между разными генами и определяют ха-
рактер синтеза белков в клетке, а также ход развития
организма (см. главу 9).
В1. Какие компоненты необходимы для синтеза белка в клет-
ке?
2. Какие вещества в клетках эукариот транспортируются из
цитоплазмы в ядро, а какие — из ядра в цитоплазму и
зачем? Есть ли в клетке вещества, которые .сперва транс-
портируются в ядро, а потом — обратно в цитоплазму?
3. В состав рибосомы эукариот входят четыре разные молеку-
лы рРНК. В клетке около 10 тыс. рибосом. Сколько раз-
200
ных типов молекул рРНК имеется в клетке? А сколько в
клетке разных тРНК? Разных иРНК?
4. Как упоминалось в параграфе, у большинства эукариот есть
несколько сотен генов, кодирующих одну и ту же рРНК.
Как вы думаете, в чем смысл такого «излишества»?
5. Дана последовательность нуклеотидов ДНК: АТТГЦЦТЦГ-
ГАА. Выпишите антикодоны тРНК, переносящие амино-
кислоты, закодированные в этой последовательности.
6. В клетке бактерии произошла мутация гена тРНК, в ре-
зультате которой первый нуклеотид в антикодоне одной
из тРНК был заменен другим нуклеотидом (например,
вместо антикодона ЦЦУ возник ГЦУ). К каким послед-
ствиям для синтеза белка это приведет?
7. Мутации в каких участках ДНК кишечной палочки мо-
гут приводить к появлению бактерий: а) не растущих на
лактозе? б) способных усваивать лактозу в присутствии
глюкозы?
8. Проанализируйте соответствие следующих утверждений
данным современной науки: 1) Белковые молекулы слу-
жат матрицами, вокруг которых кристаллизуются новые
молекулы (Кольцов). 2) Ген может сохраняться в неизмен-
ном или слабо измененном виде в течение миллионов лет
(Серебровский). 3) Гены продуцируют копии самих себя,
которые выходят в цитоплазму, обладают способностью к
самовоспроизведению и контролируют типы и количество
синтезируемых белков (Шпигельман).
§ 18. Клеточная и генетическая инженерия
Открытие механизмов наследственности коренным
образом изменило взгляды ученых на живую природу.
Стало ясно, что в основе многих проявлений жизни ле-
жат химические процессы, происходящие в клетках на
молекулярном уровне. Однако эти открытия имеют и
огромное практическое значение. Уже сейчас они ока-
зывают заметное влияние на развитие медицины и сель-
ского хозяйства. Можно с уверенностью предсказать, что
в XXI в. практическая роль молекулярной биологии
резко возрастет.
201
В основе использования достижении молекулярной
биологии лежит возможность направленно изменять
наследственные свойства клеток и организмов. Эта идея
уже сейчас реализована с помощью нескольких методов.
18.1. Методы клеточной инженерии: получение
гибридных клеток с новыми свойствами
Сейчас появилась возможность искусственно вызы-
вать слияние клеток разных особей, разных тканей и
даже разных (иногда довольно далеких) видов. Клетки
сливаются при действии на них химических веществ,
электрического разряда или некоторых вирусов. Изу-
чение гибридных клеток имеет большое значение для
науки.
Если сливаются клетки эукариот (например, разных
видов), то образующаяся клетка сначала содержит два
ядра. Однако часто оба они одновременно вступают в
митоз, хромосомы их смешиваются и в дочерних клет-
ках каждое ядро содержит наборы хромосом обоих ро-
дительских видов. В дальнейшем большинство хромо-
сом одного из видов обычно утрачивается. Это позволя-
ет определить, какие гены находятся в каждой из
хромосом (ведь белки разных видов различаются, и их
можно выявить). Таким способом удалось узнать, в ка-
кой из хромосом находятся разные гены у человека.
Методы клеточной инженерии имеют и большое
практическое значение. С их помощью можно, напри-
мер, слить раковые клетки человека, которые хорошо и
неограниченно долго размножаются в культуре, и клет-
ки иммунной системы — В-лимфоциты, которые произ-
водят защитные белки — антитела. Образующиеся клет-
ки, гибридомы*, сохраняют свойство неограниченно де-
литься и свойство производить антителд. Важно, что
* Гибридомами называют потомков двух любых соматических
(неполовых) клеток, полученных при их слиянии.
202
таким способом можно получить клон Клеток (т. е.
группу генетически однородных клеток), производящих
антитела одного типа — против строго определенного
возбудителя болезни или белка.
Произведенные таким способом антитела называют-
ся моноклональными. Они могут использоваться как
лечебные сыворотки. Однако на сегодняшний день го-
раздо важнее их роль в диагностике болезней — ведь
при появлении в организме вируса или бактерии появ-
ляются чужеродные белки и антитела против них —
собственные белки, но ранее отсутствовавшие. Монокло-
нальные антитела позволяют обнаружить конкретный
чужеродный белок и надежно определить, присутствует
ли в организме данный возбудитель. Именно с их помо-
щью диагностируется СПИД и большинство других ин-
фекционных болезней. Производство моноклональных
антител в настоящее время — развитая, область промыш-
ленности, приносящая многомиллиардные прибыли.
18.2. Практическое использование методов
культуры тканей: замена подопытных животных
и получение новых ценных растений
Метод культуры тканей — это метод сохранения
жизнеспособных органов, тканей или отдельных клеток
вне организма. Культуры тканей животных и растений
получили широкое распространение, поскольку они по-
зволяют проводить в пробирке или чашке Петри иссле-
дования, которые ранее требовали использования целых
животных и растений. Это во многих случаях позволяет
ускорить и удешевить исследования, а также отказаться
от убийства животных в научных целях.
Особенно широко этот метод используется в селек-
ции и разведении растений. Как уже упоминалось, из
маленького кусочка ткани или даже из одной клетки
можно получить целое растение. Это позволяет быстро
размножать в культуре редкие виды или ценные сорта
растений и быстро увеличивать их количество. С куль-
203
турой ткани гораздо удобнее работать и при изменении
наследственных свойств растений методами генной ин-
женерии. В некоторых случаях этот метод применяется
для того, чтобы получить растения, «очищенные» от ви-
русов и других возбудителей болезней, снижающих уро-
жайность. Например, так можно получить безвирусные
растения картофеля, что очень важно для снижения по-
терь урожая. Наконец, в ряде случаев непосредственно
из культуры ткани можно получать ценные вещества —
лекарства, витамины и др. Это особенно важно, когда
культура тканей позволяет заменить медленно растущие
виды лекарственных растений (как, например, жень-
шень), дающие первый урожай на грядке через многие
годы.
18.3. Принципиальная возможность клонирования
млекопитающих и человека
Уже довольно давно начались опыты по разделе-
нию нескольких первых клеток зародышей млекопи-
тающих. Оказалось, что до стадии 8—16 клеток все
клетки равноценны и могут дать полноценное живот-
ное, если их подсадить (имплантировать) в матку под-
ходящей приемной матери. Этот метод уже сейчас
находит применение в животноводстве: он использу-
ется для ускоренного размножения потомства от осо-
бо ценных производителей. Еще в 1984 г. появилось
сообщение о том, что можно получить млекопитающее,
если в яйцеклетку овцы пересадить ядро из одной
из клеток раннего зародыша. Опыты, проведенные на
овце, позволили получить несколько особей, генетичес-
ки идентичных матери — клон. В 1997 г. эти опыты
были повторены. Оказалось, что можно получить но-
вое животное, пересадив в яйцеклетку ядро клетки
взрослого организма. Следовательно, принципиально
возможно клонировать и человека. Получившиеся
люди будут похожи друг на друга, как однояйцевые
близнецы.
204
Методика клонирования открывает новые перспекти-
вы перед животноводством. Что касается клонирования
человека, пока не ясно, какие оно может иметь послед-
ствия. В настоящее время работы по клонированию
людей запрещены во многих странах мира.
18.4. Современные методы получения генов
и введения их в клетки других организмов
Настоящий переворот в науке и в получении ряда
веществ произошел с появлением методики рекомбинант-
ных ДНК — так называемой «генной инженерии». Спер-
ва разберем основные принципы этого метода, а потом
поговорим об областях его применения.
Возможность развития генетической инженерии
связана с открытием и выделением ряда ферментов.
Главные из них — уже знакомая нам ДНК-лигаза и
обратная транскриптаза, а также ферменты-рестрикта-
зы. Напомним, что ДНК-лигаза способна сшивать
фрагменты цепей ДНК; обратная транскриптаза «уме-
ет» синтезировать ДНК по матрице РНК. Что касается
рестриктаз, то они могут разрезать одно- или двухцепо-
чечные молекулы ДНК, причем в строго определенных
точках — сайтах (англ. — «место») рестрикции. Эти
точки узнаются по специфическим для каждого фер-
мента коротким последовательностям нуклеотидов.
Рестриктазы получают из бактерий, в клетках которых
они служат для «борьбы» с чужеродной ДНК вирусов:
узнавая последовательности нуклеотидов, которых у
бактерии нет, рестриктазы режут чужие молекулы
ДНК и не дают вирусу размножиться. В настоящее
время выделено около 200 разных рестриктаз, разли-
чающихся по узнаваемым последовательностям нук-
леотидов.
Работа генного инженера обычно включает следую-
щую последовательность методических приемов:
1. Из организма (клетки) выделяют нужную иРНК
или все иРНК.
205
2. С помощью обратной транскриптазы получают
комплементарные цепи ДНК; после этого РНК-матрицы
разрушают особым ферментом.
3. На получившихся цепях ДНК с помощью ДНК-
полимеразы достраивают вторые цепи ДНК; образовав-
шиеся ДНК, комплементарные исходным иРНК, назы-
ваются к-ДНК.
Следующая задача — включить эти молекулы ДНК
в клетки, в которых они смогут размножаться. Для пе-
реноса ДНК в клетки существуют различные «векто-
ры» — переносящие агенты, основной из которых —
плазмиды. Это короткие кольцевые молекулы ДНК, су-
ществующие в клетках многих бактерий и автономно
размножающиеся в них. В определенных условиях плаз-
миды могут передаваться от бактерии к бактерии. Они
содержат ряд генов, которые иногда определяют важные
для бактерий признаки, например многие гены устой-
чивости к антибиотикам находятся в плазмидах.
4. Выделяют из бактерий плазмиды, обычно несущие
ген устойчивости к определенному антибиотику
(рис. 70, 1).
5. Эти плазмиды разрезают рестриктазой, оставляющей
«липкие концы» — однонитевые участки ДНК (рис. 70, 2).
6. К полученным к-ДНК присоединяют с помощью
ДНК-лигазы концевые участки — адаптеры, содержащие
сайты узнавания для той же рестриктазы, и обрабаты-
вают ДНК рестриктазой.
7. Полученные ДНК «вшиваются» в плазмиду с по-
мощью ДНК-лигазы, соединяющей комплементарные
липкие концы (рис. 70, 3).
Эта новая молекула ДНК и является рекомбинант-
ной. Теперь задача состоит в том, чтобы «вставить» плаз-
миду обратно в бактерию.
8. Плазмиды вводят в бактериальные клетки
(рис. 70, 4). Эффективность их включения в клетки не-
велика — обычно лишь одна из многих сотен тысяч
клеток заражается плазмидой.
206
Рис. 70. Введение чужеродного гена в плазмиду
9. Получивших плазмиду бактерий отбирают, высеи-
вая на среду с антибиотиком (именно для этого в плаз-
миде должен быть ген устойчивости; получившие плаз-
миду бактерии выживут и размножатся, а все остальные
от антибиотика погибнут).
-----------------------------
Многие стадии и детали метода в нашем описании пропуще-
ны; на деле все, как обычно, намного сложнее, чем на бумаге.
Тем не менее, получение рекомбинантных ДНК сейчас уже
стало довольно рутинной процедурой, которую осуществляют
в сотнях лабораторий.
-----------------------------------------------
ДНК, находящаяся в составе плазмиды, будет удваи-
ваться, передаваться следующим поколениям бактерий
и таким образом наращиваться. Более того, при опреде-
ленных условиях ген человека или животного будет
направлять синтез иРНК и белков в клетке бактерии.
Бактерий, которые содержат именно интересующий нас
207
ген, можно разными способами выделить из общей мас-
сы и дальше работать с ними. Наработанный ими белок
можно выделить и очистить от белков бактерии.
С помощью плазмид и иных векторов можно встраи-
вать чужеродные гены и в хромосомы животных и рас-
тений.
18.5. Получение лекарственных препаратов,
а также новых сортов растений и пород
животных с помощью генной инженерии
Основная роль генной инженерии пока состоит в том,
что она позволяет более подробно изучить гены и белки
разных организмов. Однако уже сейчас некоторые бел-
ки человека, используемые в медицине, выгоднее всего
получать из бактерий, в которых «вставлены» гены этих
белков методами генной инженерии. Так в настоящее
время получают гормон инсулин и гормон роста, защит-
ные белки интерфероны и др.
С помощью генной инженерии полным ходом идет
создание сортов растений и пород животных, в генети-
ческий аппарат которых включены гены других пород
или даже видов. Таким способом созданы, например,
сорта табака и хлопка, обладающие устойчивостью к
вредителям. В хромосомы одного из таких сортов был
включен ген бактерии, отвечающий за синтез ядовитого
для колорадского жука, но совершенно безвредного для
человека токсина. Использование этого сорта и сортов,
устойчивых к другим вредителям, позволяет свести к
минимуму применение дорогих и опасных ядохимика-
тов. В клетки других сортов удалось включить гены,
отвечающие за устойчивость к вирусам. Третьи сорта
приобрели устойчивость к гербицидам — средствам
борьбы с сорняками. Использование этих сортов суще-
ственно повышает урожайность разных культур. Таки-
ми сортами растений сейчас в мире засеяно около
25 млн гектаров.
208
Следует подчеркнуть, что генная инженерия позволя-
ет сочетать гены и признаки самых разных организмов.
Например, в растения табака ученым удалось вклю-
чить гены, отвечающие за свечение жуков-светляков.
Такие растения красиво светились в темноте; представ-
ляете, какие это раскрывает перспективы перед декора-
тивным цветоводством?
18.6. Обнаружение генетических болезней
и идентификации личности с помощью методов
молекулярной биологии. Лечение наследственных
болезней человека с помощью генной инженерии
В настоящее время в США, европейских странах и
России осуществляется международная программа
«Геном человека», одна из целей которой состоит в
полном «прочитывании» (секвенировании) последова-
тельности нуклеотидов всей ДНК человека. Другие
цели — как можно более подробное картирование ге-
нома (определение положения отдельных генов в хро-
мосомах) и определение их функций. Эта программа,
рассчитанная на 15 лет,— самый дорогостоящий про-
ект в биологии XX в.
Если напечатать на бумаге всю последовательность нуклеоти-
дов ДНК человека (около 3 млрд пар нуклеотидов), то она
займет 200 томов по 1000 страниц.
В чем же смысл этого проекта? Сейчас очевидно, что
в основе многих болезней лежат или генетические на-
рушения — мутации, или генетическая (наследственная)
предрасположенность. Выявив гены, вызывающие то или
иное заболевание или увеличивающие риск заболеть им,
можно вовремя диагностировать болезнь и начать лече-
ние или снизить риск.
14 Зак. 13485
209
Выделенную из пробы ткани или культуры клеток пациента
ДНК для этого режут рестриктазами, а затем исследуют с
помощью ♦ зонда» — меченого участка к-ДНК или РНК, со-
держащего последовательность нуклеотидов искомого гена.
В последнее время широко применяется метод полимеразной
цепной реакции, который позволяет в пробирке за несколько
часов размножить единственную исходную молекулу ДНК в
миллиардах копий. Этот метод позволяет брать для исследо-
вания всего одну клетку или небольшую пробу ткани. Это
очень важно, например, для ранней диагностики болезней —
можно взять одну из клеток зародыша, полученного при оп-
лодотворении в пробирке, до его имплантации матери. Этот
же метод используется для установления родства или иденти-
фикации личности погибших по фрагментам ДНК, сохранив-
шимся в костных остатках (последнее возможно при сравне-
нии ДНК погибшего человека с ДНК его родственников).
Одна из наиболее заманчивых перспектив примене-
ния генной инженерии — лечение наследственных бо-
лезней с помощью введения в организм больного нор-
мальных («лечебных») генов. Этот метод наиболее при-
емлем для лечения болезней, вызываемых мутацией
одного гена (таких болезней известно несколько тысяч).
Чтобы ген передавался дочерним клеткам при делении
и сохранялся в организме человека всю жизнь, он дол-
жен встраиваться в клеточную хромосому. Впервые эта
задача была решена в опытах на мышах в 1981 г. А уже
в 1990 г. в США были разрешены клинические испыта-
ния по лечению наследственной болезни — «тяжелого
комбинированного иммунодефицита» — с помощью вве-
дения нормального гена, отсутствующего при данной
болезни. Несколько позднее "тем же методом начали
лечить один из видов гемофилии (наследственной бо-
лезни, приводящей к несвертываемости крови). ш
Главная проблема — найти надежные и безопасные векторы,
которые служили бы для доставки нужного гена в клетку и
210
встраивания его в хромосому. В настоящее время основным
методом служит вставка гена в РНК ретровируса*, лишенно-
го собственных генов и неспособного размножаться в клетке,
формируя новые вирусные частицы. Такие РНК-содержащие
вирусы, попав в клетку, синтезируют ДНК по своей РНК, а
затем эта ДНК встраивается в ДНК клетки-хозяина. Чаще
всего эту операцию осуществляют с клетками, полученными
от больного и размноженными в культуре. Затем эти клетки
подсаживают обратно в организм, где они размножаются.
В настоящее время проводятся клинические испыта-
ния лечения генами примерно десятка наследственных
болезней. Среди них: гемофилия — несвертываемость
крови; наследственная мышечная дистрофия, приводя-
щая к почти полной неподвижности ребенка; наслед-
ственная гиперхолестеринемия (болезнь связана с тем,
что клетки больного не поглощают холестерин из крови,
и это приводит к ранним инфарктам). Во многих случа-
ях уже сейчас достигается заметное улучшение состоя-
ния больных этими и другими ранее неизлечимыми бо-
лезнями.
18.7. Этические и юридические проблемы генной
инженерии
С появлением генно-инженерных методов стало
ясно, что они несут в себе потенциальную опасность. В
самом деле, если в бактерию кишечную палочку —
обычного обитателя кишечника человека — ввести
гены устойчивости к антибиотикам, а потом ген, коди-
рующий сильный яд, и вылить таких бактерий в во-
допровод, то это может привести к малоприятным по-
следствиям. Поэтому опыты по генной инженерии
* Ретровирусы — группа вирусов, у которых генетическая ин-
формация записана на РНК. Эти вирусы имеют ген обратной транс-
криптазы.
211
требуют соблюдения мер предосторожности и государ-
ственного контроля.
Некоторые потенциально опасные исследования (на-
пример, включение генов опухолеродных вирусов в ДНК
плазмид) еще недавно находились под запретом. Однако
постепенно запретительные меры ослабевают. Тем бо-
лее неоправданны предложения о полном запрещении
генной инженерии, которые звучали еще не так давно.
Во-первых, разработаны безопасные векторы, которые
вряд ли могут выживать и размножаться вне лаборато-
рий. Во-вторых, отработаны обычные меры техники бе-
зопасности, при соблюдении которых исключены «утеч-
ки» опасных генетических конструкций. Наконец, сей-
час стало очевидно, что в природе существуют те же пути
переноса ДНК от одних видов другим, что и в лаборато-
рии: а генную инженерию, осуществляемую природой,
нельзя запретить.
Тем не менее генная инженерия рождает множество
юридических и этических проблем. Например, возни-
кает вопрос о праве собственности изобретателей на
новые гены и новые сорта растений и животных, полу-
ченные с помощью генной инженерии. В США и евро-
пейских странах уже развито обширное патентное за-
конодательство в этой области; неоднократно проходи-
ли судебные процессы, связанные с защитой патентов
на тот или иной ген. Задача общества состоит в том,
чтобы охрана подобных патентов не стала препятстви-
ем для дальнейших научных исследований или меди-
цинской практики.
Еще больше рождается этических вопросов. Напри-
мер, можно ли вводить «лечебные» гены в половые клет-
ки, чтобы они передались потомству? А если нет, то не
пострадает ли человечество из-за того, что выжившие
благодаря лечению генами больные передадут свои де-
фектные гены потомству? А можно ли вводить гены в
половые клетки человека не с целью лечения, а с целью
212
улучшения каких-то признаков потомства? Можно ли
проводить диагностику наследственных болезней, если
о результатах может узнать больной, а методов лече-
ния пока не существует? Что лучше — применение
генной диагностики в предродовой период, когда вы-
явление наследственных дефектов может привести к
отказу от рождения ребенка, или отказ от такой диаг-
ностики, из-за чего родители, имеющие гены наслед-
ственной болезни, могут принять решение вообще не
иметь детей?
Эти и другие вопросы сейчас активно обсуждаются.
Их должны решать уже не одни ученые, но и политики,
юристы, все общество. И именно от их разумного реше-
ния зависит, насколько наука сможет способствовать
прогрессу человечества.
01. Известный писатель-энтомолог И. Халифман утверждал,
что в маточном молочке пчел, которым выкармливаются
личинки, содержится ДНК, и поэтому с молочком рабочим
пчелам могут передаваться наследственные признаки мат-
ки. Как по-вашему, возможен ли такой путь передачи при-
знаков?
2. Если вырезать структурный ген и встроить его в случай-
ное место ДНК бактерии, то синтез белка с него практичес-
ки не идет. Почему?
3. Как вы думаете, каковы требования к безопасному вектору
для введения чужеродной ДНК в хромосомы человека?
В чем состоит потенциальная опасность использования ви-
русов в качестве вектора?
4. Обсудите на уроке одну из проблем, связанных с использо-
ванием генно-инженерных методов (из поставленных в па-
раграфе или сформулированных вами).
213
Наследственная информация — это информация о после-
довательности аминокислот во всех белках, синтезируемых
в данной клетке. Эта информация «записана» в виде после-
довательности нуклеотидов в молекулах дезоксирибонуклеи-
новой кислоты (ДНК). У эукариот (растений, грибов, животных)
несколько линейных молекул ДНК содержится в хромосомах
ядра. У прокариот (бактерий и архебактерий) ДНК представлена
единственной кольцевой молекулой. Сходные по строению моле-
кулы ДНК имеются в митохондриях и хлоропластах эукариот.
Предполагается, что эти органоиды возникли в ходе эволюции
из симбиотических бактерий. У некоторых вирусов наследствен-
ная информация записана в молекулах рибонуклеиновой кисло-
ты (РНК), у других — в ДНК.
Молекула ДНК обладает способностью к редупликации
(самоудвоению). Удвоение ДНК происходит по матричному
принципу — исходная молекула служит матрицей для синте-
за новой. Этот принцип осуществляется благодаря комплемен-
тарности азотистых оснований: при построении новой нуклео-
тидной цепи напротив тимина становится аденин (и наоборот),
напротив гуанина — цитозин (и наоборот). Обычно удвоение
ДНК полуконсервативно — каждая из цепей молекулы ДНК
достраивает новую по принципу комплементарности, а в состав
новой двойной спирали ДНК входят одна новая и одна старая
цепь. В результате из одной исходной молекулы образуются две
идентичные. Эта способность ДНК к самоудвоению обеспечива-
ет передачу наследственной информации и лежит в основе де-
ления всех клеток.
Запись о последовательности аминокислот в белках со-
держится в ДНК в виде генетического кода. Генетический
код состоит из троек нуклеотидов — триплетов. Каждый
триплет кодирует одну аминокислоту. Поскольку в ДНК четы-
ре разных нуклеотида, всего триплетов 64. Три из них («бес-
смысленные») используются как сигналы окончания синтеза
белковой цепи. Каждый из остальных 61 триплетов кодирует
одну из 20 аминокислот, поэтому большинство аминокислот ко-
дируется несколькими триплетами. Код непрерывен (триплеты
читаются подряд без «знаков препинания») и универсален —
214
одинаковые триплеты кодируют одни и те же аминокислоты у
самых разных организмов. Универсальность генетического
кода— одно из ярких свидетельств единого происхождения всех
земных организмов.
Изменения порядка расположения нуклеотидов в ДНК (а
значит, наследственной информации) называются генными
мутациями. В некоторых участках ДНК порядок расположения
нуклеотидов удивительно постоянен. Это приводит к- сохранению
многих признаков (например, похожих белков у разных организ-
мов) в течение многих миллионов лет. Большинство нарушений
в структуре ДНК исправляются сложной системой ферментов
репарации. Иногда эта система не срабатывает, и тогда поря-
док нуклеотидов меняется. Особенно часто новый, измененный
порядок нуклеотидов возникает в ходе удвоения ДНК. Мутации
возникают постоянно и в любых условиях среды у всех орга-
низмов. Они не всегда приводят к изменению структуры и
функции образуемых белков и поэтому часто не влияют на
признаки организма и являются нейтральными. Однако многие
мутации, приводящие к замене одной или нескольких аминокис-
лот в белке, нарушают его функционирование и оказываются
вредными; они могут быть причиной наследственных болезней.
С другой стороны, могут возникать и мутации, полезные для
организма. Мутации всегда случайны (не направлены на при-
способление к тем условиям, в которых они возникают).
При синтезе белка наследственная информация считыва-
ется не непосредственно с ДНК, а с молекул-посредников —
информационных РНК (иРНК). Молекулы РНК синтезируются
на ДНК по матричному принципу и также состоят из четырех
нуклеотидов, различающихся азотистыми основаниями (урацил,
аденин, гуанин, цитозин). Каждому триплету ДНК соответствует
комплементарная тройка нуклеотидов иРНК — кодон. В виде
молекул иРНК наследственная информация у эукариот поступа-
ет из ядра в цитоплазму. У всех клеток «расшифровка» генети-
ческой информации, записанной на языке иРНК, осуществляет-
ся при синтезе белка с помощью сложных молекулярных ма-
шин— рибосом и специальных транспортных РНК, доставляющих
аминокислоты к рибосомам. Вирусы не имеют рибосом и поэто-
му способны размножаться только внутри клеток-хозяев.
Итак, наследственная информация передается по направ-
лению ДНК— РНК — белок. У РНК-содержащих вирусов име-
215
ется фермент обратная транскриптаза, спосо ная переписывать
информацию с РНК на ДНК. Однако не известно ни одного
случая передачи информации от белка к РНК или ДНК. Отсут-
ствие обратного пути передачи информации от белков к ДНК —
одна из причин того, что признаки, приобретенные в течение
жизни и не записанные в ДНК половых или иных служащих для
размножения клеток, не наследуются.
Участок ДНК, отвечающий за синтез одной поли пептид-
ной цепи белка или за синтез РНК, называется геном. На-
правляя синтез белков, гены определяют признаки организма.
Поскольку белки выполняют ферментативную функцию и опре-
деляют протекание почти всех химических реакций в клетках,
от их состава зависит и состав всех остальных веществ данной
клетки. Однако есть участки ДНК, которые не кодируют ни
белков, ни РНК. Многие из таких участков выполняют регуля-
торную функцию — от них зависит, когда и сколько белков
будет синтезироваться в данной клетке. Большинство клеток
многоклеточных организмов несут полный набор наследственной
информации, и различия их свойств зависят от того, какие
гены в них активно функционируют.
Открытие роли ядра в наследственности, расшифровка
строения ДНК и генетического кода, а также открытие фер-
ментов, участвующих в удвоении ДНК и синтезе белка, были
крупнейшими открытиями в биологии XX в. Эти открытия
имеют огромное практическое значение для селекции и медици-
ны. На их основе возникла клеточная и генная инженерия —
методы направленного изменения наследственных свойств кле-
ток и живых организмов. С помощью этих методов уже сейчас
получены многие новые сорта растений, а также штаммы (раз-
новидности) микроорганизмов и культуры клеток, из которых
получают лекарственные препараты, ферменты, вещества для
новых научных исследований. В ближайшем будущем с помо-
щью методов генной инженерии можно будет лечить многие
наследственные болезни человека.
216
ОГЛАВЛЕНИЕ
Часть 1
Предисловие для учителя..................3
// СТРОЕНИЕ КЛЕТКИ И ЕЕ ОРГАНЕЛЛ.
/ ФУНКЦИИ ОРГАНЕЛЛ
Глава 1. Химический состав клетки. Современные
методы изучения клетки. Основные
клеточные органеллы............................. 9
§ 1. Роль воды в клетке..................9
§ 2. Липиды. Биологические полимеры.
Углеводы............................14
§ 3. Белки..............................20
§ 4. Обмен веществ и энергии в клетке...34
§ 5. Современные методы изучения клетки.
Основные черты строения клеток
бактерий, растений и животных.......40
Глава 2. Мембранная система клетки............. 52
§ 6. Наружная мембрана клетки...........52
§ 7. Эндоплазматический ретикулум (ЭПР).
Аппарат Гольджи. Лизосомы...........58
Глава 3. Митохондрии и хлоропласты............. 69
§ 8. Строение митохондрий и хлоропластов.
Теория симбиогенеза. Транспорт белков из
цитоплазмы в митохондрии и хлоро-
пласты ........................... 69
217
§ 9. Роль НАД-Н в процессах биологического
окисления. Градиент ионов Н+ и его
роль в митохондриях и прокариотичес-
ких клетках..............................76
§ 10. Фотосинтез.........................91
Глава 4. Системы цитоскелета.................... 99
§ 11. Микрофиламенты и их функции. Регу-
ляция сокращения поперечно-полосатой
мышцы..................................i . 99
§ 12. Микрофиламенты в немышечных клетках.
Система микротрубочек...................109
Глава 5. Регуляция клеточных функций........... 120
§ 13. Регуляция процессов самоподдержания
клетки. Механизм действия гормонов
и нейромедиаторов.......................120
ТТ I НАСЛЕДСТВЕННАЯ ИНФОРМАЦИЯ
11 / И РЕАЛИЗАЦИЯ ЕЕ В КЛЕТКЕ
Глава 6. Хранение и реализация наследственной
информации..................................... 129
§ 14. Роль ядра в жизни клетки и в передаче
наследственных признаков................129
§ 15. ДНК — вещество наследственности .... 142
§ 16. Генетический код..................171
§ 17. Строение гена и синтез белка......182
§ 18. Клеточная и генетическая
инженерия...............................201
218
Часть 2
ш/
ЖИЗНЕННЫЕ ЦИКЛЫ И ДЕЛЕНИЕ КЛЕТОК
Глава 7. Жизненные циклы. Митоз и мейоз
§ 19. Жизненные циклы
§ 20. Митоз и мейоз
IV/
ГЕНЕТИКА
Глава 8. Основы классической генетики
Введение
§21. Работы Г. Менделя. Первый закон
Менделя
§ 22. Неполное доминирование и множественные
аллели
§ 23. Взаимодействие генов
§ 24. Хромосомная теория наследственности
§ 25. Генетика пола
§ 26. Расположение генов в хромосомах
§ 27. «Неклассическое» наследование
§ 28. Изменчивость. Мутации
§ 29. Генотип и фенотип
§ 30. Генетика человека. Генетические болезни
Дополнительный материал:
Из истории отечественной генетики
219
I ЭМБРИОЛОГИЯ
Глава 9. Индивидуальное развитие организмов и его
регуляция
Введение
§31. Гаметогенез
§ 32. Оплодотворение »
§ 33. Дробление
§ 34. Гаструляция. Формирование зародышевых
листков
§ 35. Органогенез (роль индукционных
взаимодействий)
§ 36. Усложнение формы в онтогенезе (простран-
ственная организация и позиционная инфор-
мация)
§ 37. Генетическая регуляция развития
Заключение
Учебное издание
Беркинблит Михаил Борисович
Глаголев Сергей Менделевии
Фуралев Владимир Александрович
ОБЩАЯ БИОЛОГИЯ
Учебник для 10 класса средней школы
Зав. редакционно-издательским отделом Г. Лазарева
Художественный редактор В. Пономаренко
Технический редактор С. Шкляр
Корректор Н. Новикова
Оригинал-макет сверстан в компьютерном центре
МИРОСа Т. Каган
Изд. № ФЗО(ОЗ). Подписано в печать 18.08.99. Формат 60x90/16.
Бумага офсетная. Гарнитура «Школьная».
Печать офсетная. Объем 14 печ. л. Тираж 3000 экз. Заказ 13485.
Цена договорная
Московский институт
развития образовательных систем
109004, Москва, ул. Нижняя Радищевская, д. 10
Тел. отдела реализации:
915-72-55
Отпечатано в ГИПП “Янтарный сказ”,
г. Калининград, ул. К. Маркса, 18.
Экспериментальный учебник по общей био-
логии для 10 класса охватывает вопросы клеточ-
ной биологии, генетики и эмбриологии. Первый
раздел пособия представляет собой изложение
современных сведений о клетке. В нем рассмат-
ривается строение и функции основных клеточ-
ных органелл. Во втором разделе рассказывается
о достижениях молекулярной биологии. Вопро-
сы, входящие в эти разделы, рассмотрены с при-
влечением современных научных данных и изло-
жены глубже, чем в существующих школьных
учебниках. Третий раздел пособия посвящен
классической генетике. Она изложена более тра-
диционно. Четвертый раздел пособия — эмбрио-
логия. Сегодня эмбриология — одна из наиболее
интенсивно развивающихся биологических дис-
циплин. В то же время она очень слабо освещена
в школьных учебниках. В данном пособии впер-
вые сделана попытка донести достижения совре-
менной эмбриологии до школьников. Все части
пособия представляют собой единое целое. Изло-
жение генетики опирается на цитологические и
молекулярно-биологические сведения. Изложе-
ние эмбриологии опирается на сведения по цито-
логии и генетике.
В пособии не просто излагаются достижения
современной биологии, но и рассказывается о
том, как и кем они были получены. В связи с этим
приводится подробное описание ряда ключевых
экспериментов современной биологии, а также
сведения о многих ученых-биологах. В конце
каждой главы приведен ряд контрольных вопро-
сов, а также задачи творческого характера.
Надеемся, что книга будет особенно интерес-
ной и полезной для школьников, которые выбра-
ли специальность, связанную с биологией (наука,
медицина, сельское хозяйство и др.), для школь-
ников, которые хотят получить глубокие’ знания
по биологии, для учителей биологии, особенно
для учителей, работающих в биологических спец-
классах или ведущих биологические кружки для
старшеклассников, а также для всех читателей,
интересующихся современным состоянием био-
логической науки.