Текст
УДК 661.4/.65+661.8
П47
П47 Позин М. Е.
Технология минеральных солей (удо-
брений, пестицидов, промышленных со-
лей, окислов и кислот), ч. I ,изд. 4-е, испр.
Л., Изд-во «Химия», 1974.
792 стр., 51 табл., 211 рис.
В монографии иа современней уровне описана тех-
нология важнейших (крупнотоннажных) минеральных
солей, в том числе минеральных удобрений — фосфор-
ных, азотных, калийных н других, а также некоторых
окислов и кислот (фосфорной, соляной и др.). Рассмот-
рены свойства сырья, полупродуктов и продуктов; из-
ложены фнзнко-химические основы производства; описа-
ны. технологические схемы, режимы и аппараты.
Первая часть монографии посвящена технологии
промышленных минеральных солей и других продуктов.
Книга является практическим и справочным руко-
водством для инженеров, работающих в химической
и смежных с ней отраслях промышленности. Она мо-
жет служить учебным пособием для аспирантов и сту-
дентов старших курсов химнко-технологических вузов.
Третье издание кннгн вышло в 1970 г.
31403—055
П 050(01)—74
55—74
© Издательство «Химия», 1974
ОГЛАВЛ ЕНИЕ
Предисловие к четвертому изданию.....................................17
Предисловие к третьему изданию...................................... 17
Часть I
Глава I. Использование минеральных солей в народном хозяйстве ... 19
Минеральные соли в сельском хозяйстве..............................19
Минеральные удобрения ...........................................19
Классификация минеральных удобрений . . .........................24
Минеральные яды и*другие препараты . . ........................-.31
Минеральные корма................................................34
Минеральные соли в промышленности.................................3,4
Развитие производства солей в СССР.................................36
Краткие сведения о мировом производстве удобрений и солен..........40
Литература...........................................................43
Г лава II. Растворимые соли в природе и методы их добычи............-45
Образование соляных залежей........................................45
Природные рассолы и классификация соляных озер.....................47
Разработка залежей ископаемых солей ...............................52
Горные разработки................................................52
Подземное выщелачивание..........................................53
Получение солей из рассолов и морской воды.........................55
Добыча самосадочных солей...................................... 55
Бассейный способ переработки рассолов............................56
Литература ..........................................................58
Г лава III. Хлористый натрий....................................... 60
Физико-химические свойства.........................................60
Применение ........................................................62
Сырье и методы производства........................................64
Каменная соль.................................................. 65
Самосадочная соль................................................. 66
Получение садочной соли бассейным способом.........................68
Производство выварочной сбли..................................... 70
Получение соли в чренах..........................................71
Вакуумная выварочная соль.................................... . 74
Очистка рассолов ................................................75
Конструкции аппаратов............................................71
Иодированная поваренная соль ..................................... 82
Получение соли вымораживанием......................................83
Получение поваренной соли высаливанием и перекристаллизацией ... 88
1*
4
Оглавление
Получение поваренной солн из галитовых отходов калийных предприятий 89
Брикетироваине н борьба со слеживаемостыо соли.......................91
Специальная (тонкая) очистка соли ................................. 93
Литература............................................................93
Глава IV. Природный сульфат натрии....................................98
Физико-химические свойства .........................................98
Применение .........................................................102
Сырье............................................................... 103
Физико-химические основы получения мирабилита из природных рассолов 108
Обезвоживание мирабилита...........................................114
Обезвоживание мирабилита в естественных условиях.................114
Заводские Способы обезвоживания мирабилита.......................116
Производство сульфата натрия на заводах СССР......................130
Производство сульфата натрия иа комбинате «Карабогазсульфат> . . .130
Производство сульфата натрия на Кучукском сульфатном комбинате . 131
Получение сульфата натрия из твердых солевых отложений............132
Глауберова соль....................................................134
Литература...........................................................135
Глава V. Природные калийные соли............................... 138
физико-химические свойства ........................................138
Применение ........................................................139
Сырье .............................................................142
Получение хлористого калия методами растворения н раздельной кри-
сталлизации .....................................................146
Физико-химические основы переработки сильвииитовых руд .... 146
Растворение сильвина.............................................149
Кристаллизация хлористого калия .............................. 151
Схема производства хлористого калия методом растворения и кристал-
лизации .................................................... . 154
Переработка хартзальцевых руд....................................159
Слеживаемость хлористого калия . . . . '.........................160
Получение хлористого калия из карналлита ..... ................. 161
Защита оборудования от коррозии и эрозии....................... 164
Получение хлористого калия механическим обогащением калийиых руд 164
Метод флотации...................................................164
Комбинированные схемы флотациоииого обогащения с растворением и
кристаллизацией................................................ 167
Другие способы обогащения........................................168
Получение хлористого калия при подземном выщелачивании калийиых руд 170
олучеиие хлористого калия из природных рассолов....................171
Сульфат калия .................................................... 173
Галургическая переработка полиминеральных руд Предкарпатья . . . 173
' Конверсионные способы получения сульфата калия ............ 177
Получение сульфатнокалийных удобрений при флотационном обогаще-
нии и в комбинации с галургическими способами переработки . . .179
Гидротермический метод переработки калийных руд................ 180
Переработка водоиерастворимых калийных руд......................182
Прочие способы получения сульфата калия и сульфатнокалийных удоб-
рений ........................................................ 183
Литература......................................................... 184
Глава VI. Поташ
187
Физико-химические свойства...........................................187
Применение ..........................................................187
Методы производства поташа...........................................189
Оглавление
5
Переработка золы подсолнечника................................. 190
Переработка бардяного угля и золы...............................192
Получение поташа из содо-поташиых растворов глииоземиого производ-
ства ............................................................196
Производство поташа карбонизацией раствора едкого калн..........201
Формиатный метод получения поташа . ............................203
Триметиламиновый метод получения поташа.........................203
Литература ....................................•....................204
Глава VII. Бром и его соли....................................... 206
Физико-химические свойства........................................206
Применение .......................................................208
Сырье.............................................................209
Получение брома...................................................210
Отгонка брома паром.............................................210
Десорбция брома воздухом..............‘.........................213
Поглощение брома из бромо-воздушной смеси.......................221
Другие методы получения брома.................................230
Производство некоторых солей брома................................231
Бромид натрия...................................................231
Бромид калия............................................. . . . 233
. Бромид аммония....................................................233
Бромат калия.................................................. 233
Литература ........................................................ 234
Глава VIII. Иод и его соли......................................... 236
Физико-химические свойства........................................237
Применение . \ ...................................................239
Сырье .... ................'..........................239
Получение иода....................................................240
Извлечение иода из селитрениой породы...........................240
Извлечение иода из водорослей..............j....................241
Извлечение иода из буровых вод....................................242
Адсорбция иода твердыми сорбентами..............................243
Десорбция иода воздухом...........................;.............249
Осаждение иода в виде малорастворимых солей.....................253
Экстракция иода несмешивающимися с водой растворителями .... 253
Электрохимические методы извлечения иода........................254
Очистка иода-сырца................................................255
Получение солей иода..............................................256
Литература .........................................................260
Г лава IX. Соединения магнии..................................... 263
Физико-химические свойства........................................263
Применение .......................................................267
Сырье.............................................................270
Хлористый магний..................................................272
Солнечная выпарка природных вод ................................272
Получение MgCb при переработке карналлита...................... 274
Выпарка хлормагниевых щелоков.................................. 275
Химические способы получения хлористого магния.................. . 276
Безводный хлористый магний......................................278
Магнезии..........................................................281
Тяжелые формы магнезии из магнезита и доломита..................281
Бикарбонатный способ получения магнезий.........................282
Аммиачные способы получения магнезий............................287
Известковый способ получения магнезий.......................... 287
Гидросульфидный способ получения гидроокиси магиия..............296
6
Оглавление
Содовый способ получения легких магнезий..................... . . 296
Гидролиз и окисление хлористого магния ............................ 299
Сульфат магния и его термическое разложение............................301
Получение сульфата магния............................................301
Термическое разложение сульфата магния.......................». . 303
Ньювель и совелит......................................................304
Магниевые удобрения.............1.................................. • 30t>
Литература ..............................................................306
Глава X. Соединения бора............................................... 311
Физико-химические свойства.............................................311
Применение .......................................................... 315
Сырье .............................................................. 319
Методы переработки борного сырья.......................................322
Борная кислота ....................................................... 324
Природная борная кислота ............................................324
Получение борной кислоты из буры.....................................324
Получение борной кислоты из магниевых боратов........................325
Получение бориой кислоты из датолита.................................335
Борат кальция 337
Бура ..................................................................337
Получение буры из борной кислоты.....................................338
Получение буры из боратов содовым методом............................341
Переработка боратов на буру другими щелочными методами .... 343
Обезвоживание буры...................................................344
Борные удобрения.......................................................344
Получение борных удобрений из отходов производства бориой кислоты 344
Получен:, борных удобрений из боратового сырья................/ 346
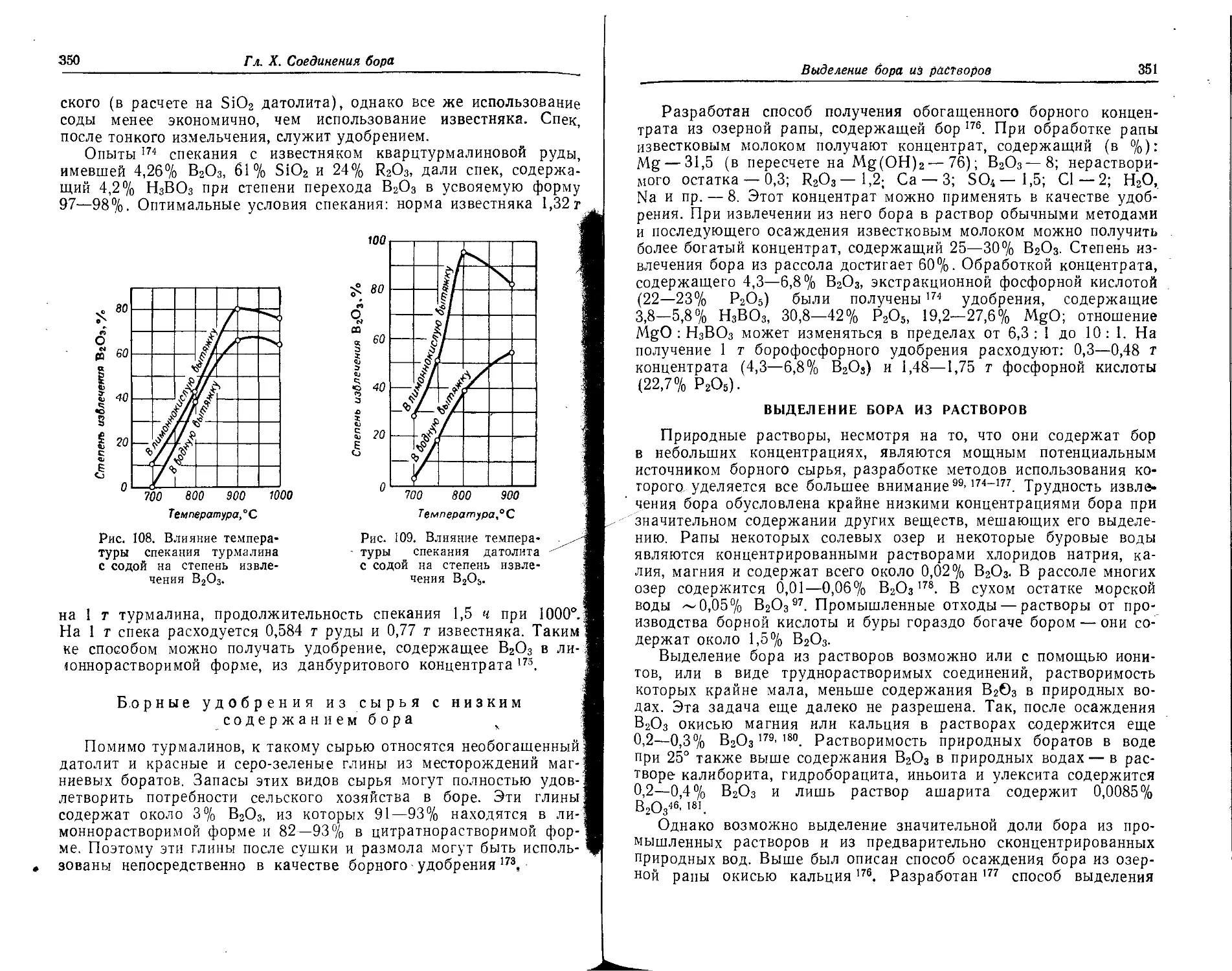
Выделение бора из растворов.......................................... 351
Перборат натрия...................................................I- 353
Борный ангидрид...................................................\- 356
Трехфтористый бор.....................................................\357
Литература .............................................................\358
Глава XI. Соляная кислота............................................ 363
Свойства хлористого водорода и соляной кислоты ....................... 363
Применение ........................................................... 368
Ингибированная соляная кислота ....................................... 370
Получение хлористого водорода........................................ 371
Сульфатный способ . ................................................371
Способ Гаргривса-Робинзона...........................................379
Синтез хлористого водорода из элементов ..................... .... 380
Получение хлористого водорода из хлора и водяного пара в присутствии
угля .............................................................386
Хлористый водород как побочный продукт некоторых производств . . . 387
Получение чистого хлористого водорода................................390
Абсорбция хлористого водорода ........................................ 391
Абсорбция хлористого водорода с охлаждением..........................391
Адиабатическая абсорбция хлористого водорода ........................396
Жидкий хлористый водород...............................................403
Регенерация НС1 из травильных растворов................................407
Переработка хлористого водорода в хлор ............................... 408
Литература ..............................................................412
Глава XII. Соли бария ................................................. 416
Физико-химические свойства.............................................416
Применение ........................................................... 420
Сырье .................................................................424
Сульфат бария..........................................................425
Оглавление
7
Восстановление барита..............................................427
Хлорид бария...................................................... 434
Солянокислотный способ...........................................434
Хлорнатриевый способ.............................................43f
Разложение BaS раствором СаСЬ и карбонизацией....................438
Хлораммониевый способ............................................439
Карбонатный способ...............................................440
Хлормагниевый способ.............................................441
Хлорный способ................................................ 443
Способы горячего хлорирования и гидрохлорироваиия .............. 444
Взаимодействие BaSO4 и СаС12.....................................445
Хлоркальциевый способ.......................................... 447
Нитрат бария .................................................... 451
Получение нитрата бария из BaS и азотной кислоты . . . . . ' . .451
/ Конверсия солей бария.............................................. 452
Карбонат бария ................................................... 453
Карбонизация раствора сернистого бария...........................453
Получение ВаСО3 из нитратного щелока.............................455
Другие способы получения ВаСОз...................................456
Гидроокись бария . . 456
Получение гидроокиси бария из ВаС12 и NaOH.......................456
' Получение гидроокиси бария из сульфида бария........................458
Другие способы получения гидроокиси бария........................459
Окись и перекись бария.............................................460
Литература .........................................................462
Глава XIII. Соли сульфидного ряда........................... ;i:. . . 466
Физико-химические свойства......................................", 466
Применение ........................................................469
Сульфид натрия .................................. . '............470
Физико-химические основы восстановления Na2SO4 углем............470
Получение сульфида натрия восстановлением сульфата натрия углем . 477
Переработка плава в сульфид натрия . ............................483
Получение сульфида натрия восстановлением сульфата натрия газами 491
Другие способы получения сульфида натрия.........................498
Гидросульфид натрия................................................499
Полисульфиды ......................................................501
Литература ...........................................................502
Глава XIV. Соли сульфитного ряда ................................... 506
Физико-химические свойства.........................................506
Применение ........................................................510
Сырье ..........................................................’ 513
Окисляем ость сульфитных солей.................................... 515
Давление SO2 над растворами поглотителей...........................519
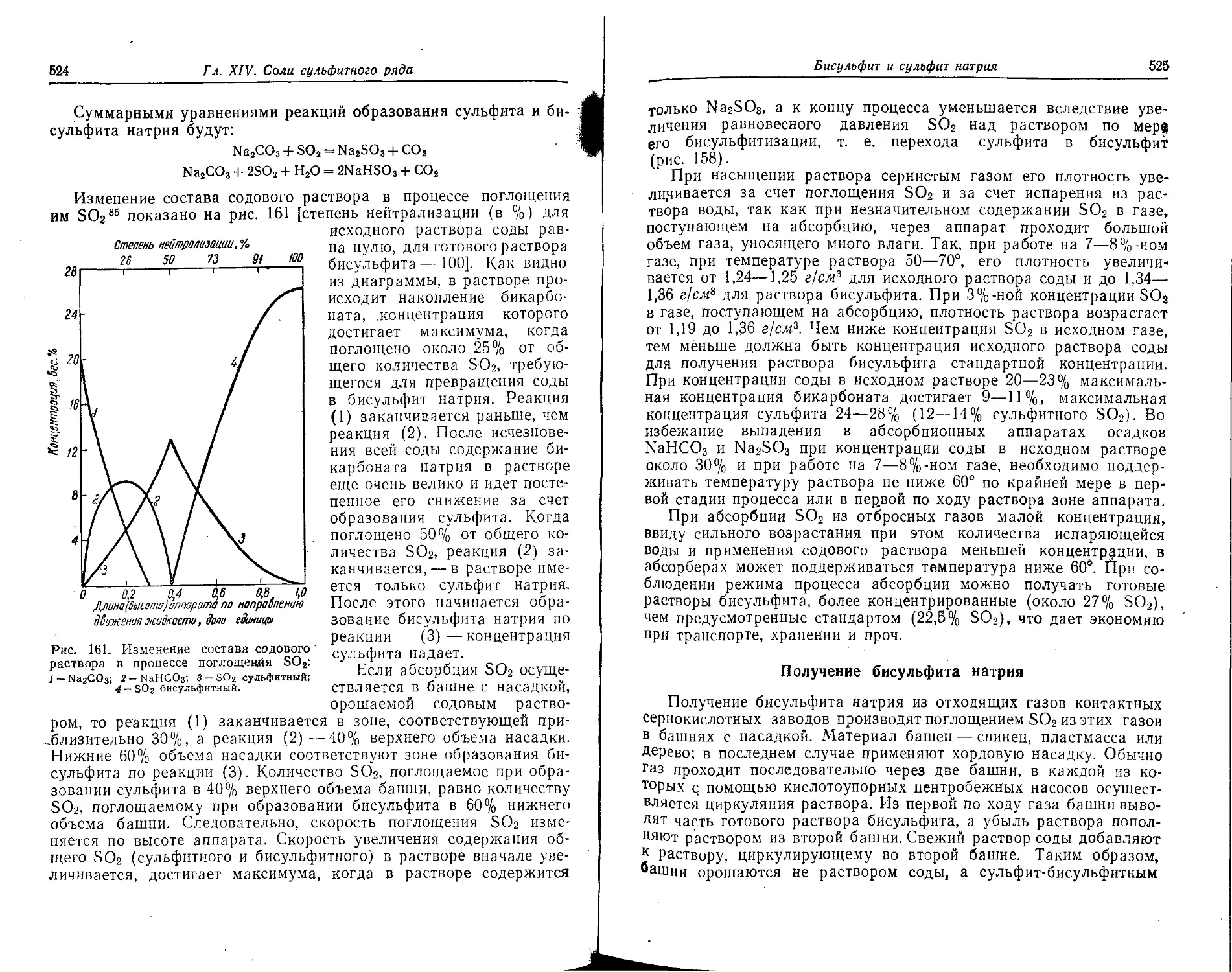
Бисульфит и сульфит натрия.........................................523
Получение бисульфита и сульфита натрия из сернистого газа и щелочей 523
Получение бисульфита натрия .................................. 525
Семиводный сульфит натрия...................................... 527
Безводный сульфит натрия........................................ 529
Получение бисульфита и сульфита натрия взаимодействием SO2 с рас-
твором Na2SO4 или NaCl.........................................532
Бисульфит и сульфит аммония........................................534
Пиросульфиты ..................................................... 535
Получение пиросульфита натрия мокрыми способами...............’ . 535
Сухой способ получения пиросульфита натрия .................. 537
Пиросульфит калия................................................538
8
Оглавление
Гидросульфит (дитиоиит) натрия ............................ . 538
Производство гидросульфита натрия восстановлением сернистой кислоты
цинковой пылью................... ...............................539
Другие способы получения гидросульфита натрия....................543
Ронгалит ..........................................................545
Тиосульфат натрия..................................................547
Химические основы образования тиосульфата........................547
Сульфатный способ ...............................................549
Полисульфидный способ............................................553
Сульфитный способ................................................555
Получение тиосульфата натрия при мышьяково-содовой очистке газов . 556
Другие способы производства......................................557
Тиосульфат аммония.................................................559
Литература .........................................................560
Глава XV. Соли хрома.................................................564
Физико-химические свойства.........................................564
Применение 570
Сырье и методы его переработки.....................................573
Окислительный обжиг хромитов с получением хроматов.................576
Физико-химические основы окислительного обжига хромита...........576
Минералогический состав хроматного спека и расчет шихты..........586
Физико-химические основы выщелачивания хроматного спека............588
Физико-химические основы перевода хроматов в бихроматы.............590
Методы перевода хроматов в бихроматы.............................590
Теория травки хроматов кислотами ............................... 591
Производство бихромата натрия......................................596
Получение бихромата натрия с углекислотной травкой хромата . . . 603
Бихромат калия ................................................. 606
Хромовый ангидрид..................................................611
Сульфаты хрома.....................................................613
Хромовые квасцы .................................................613
Основные сульфаты хрома..........................................614
Гидроокись и окись хрома ?........................................615
Хроматно-серный метод получения окиси хрома................619
Хлорный хром........................' . . . ...................621
Другие методы переработки сырья и отходов, содержащих хром .... 622
Литература ..........................................................625
Глава XVI. Сульфат алюминия и продукты на его основе ....... 632
Физико-химические свойства...................................632
Применение ........................................................634
Сырье ............................................................ 636
Глины ...........................................................637
Другие виды сырья.............................................. 639
Производство коагулянтов.....................................'•••• 640
Неочищенный сернокислый алюминий из каолина......................641
Неочищенный сернокислый алюминий из каолииа и нефелиновой муки 642
Нефелиновый коагулянт............................................643
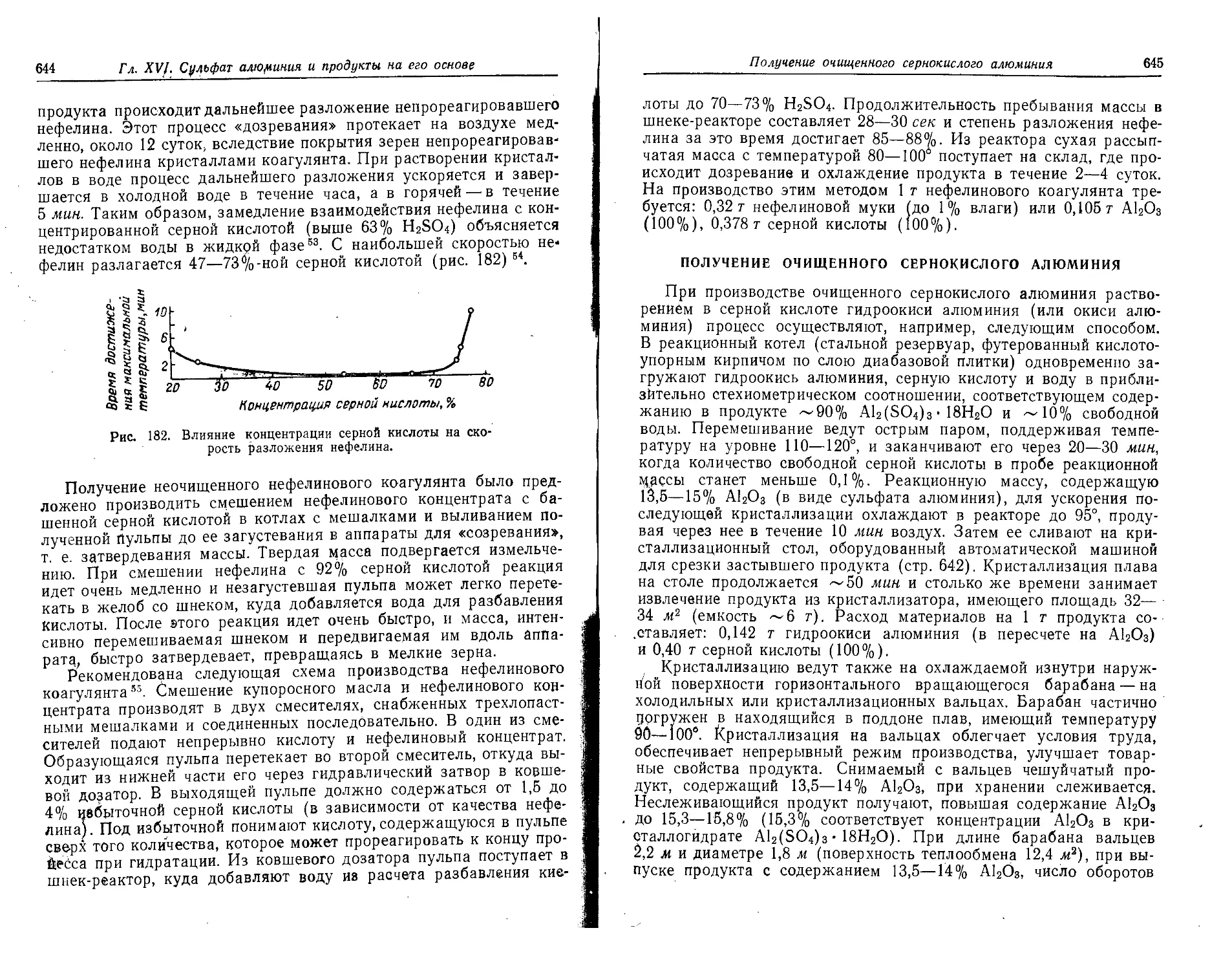
Получение очищенного сернокислого алюминия.........................645
Другие методы получения коагулянта и сернокислого алюминия .... 649
Получение коагулянта из золы.....................................649
Получение коагулянта из глин и каолина методом спекания . . . . 650
Комбинирование производства очищенного сернокислого алюминия с сер-
нистокислотным методом разложения каолинов...................... 651
Получение сернокислого алюминия из боксита.......................652
Использование отбросных травильных растворов для получения суль-
фата алюминия....................................................653
Оглавление
9
Производство квасцов . ............................................ 653
Литература ..........................................................658
Глава XVII. Соединения меди..........................................661
Физико-химические свойства..........................................661
Применение .........................................................664
Сырье и способы производства медиого купороса.......................666
Производство медного купороса из медиого лома......................667
Теоретические основы процесса ................................... 667
Технология процесса ............................................. 670
Получение медного купороса Электролизом ........................ ... 675
Получение медного купороса при окислении меди хлоркой, медью . . . . 676
Производство медного купороса из окиси меди.........................676
Окись меди из белого матта .......................................676
/ Растворение окиси меди в серной кислоте ......................... 679
' Получение медного купороса из окиси меди и сернистого газа . . . 680
Получение медного купороса сульфатизирующим обжигом белого матта 682
Получение медного купороса из окисленных медных руд.................684
Производство медного купороса из колчеданных огарков................685
Выщелачивание меди из огарка......................................685
Хлорирующий обжиг огарка 686
Извлечение меди из отходов медеплавильных заводов.................687
Выделение меди из разбавленных растворов........................ 687
Получение медного купороса из электролитных растворов медеэлектролит-
ных заводов.........................................................688
Получение других соединений меди..................................689
Основной сульфат меди ..........................................689
Основные карбонаты меди...................................... 690
Хлорокись меди .................................................690
Закись меди ................................................... 691
Регенерация солей меди в производстве искусствеииого волокна .... 691
Литература ..........................................................692
Г лава X VIII. Соединения железа.....................................694
Физико-химические свойства..........................................694
Применение ...................................................... 699
Получение железного купороса из травильных растворов................701
Вакуум-кристаллязационные установки...............................703
Получение железного купороса из колчеданных огарков.................705
Сульфат окиси железа................................................706
Хлориды железа......................................................707
Получение окислов железа и их гидратов..............................708
Литература ..........................................................712
Г лава XIX. Сульфат и хлорид цинка.................................. 714
Физико-химические свойства..........................................714
Применение .................................'..................... 718
Сырье ..............................................................720
Сульфат циика .................................................. 721
Получение сульфата цинка растворением материалов, содержащих Zn и
ZnO, в серной кислоте.............................................722
Получение цинкового купороса из медистой окиси циика . . .......... 725
Извлечение цинка из колчеданных огарков хлорирующим обжигом . . . 727
Хлорид цинка . ..................................................728
Литература 729
Глава XX. Сульфат никеля ......................................... . 731
Физико-химические свойства..............................'...........731
Применение ........................*................................733
10
Оглавление
Получение никелевого купороса растворением никеля в серной кислоте . 734
Получение никелевого Купороса из растворов кобальтового производства 735
Получение никелевого купороса из растворов медеэлектролитных заводов 735
Литература ....................................................... 736
Глава XXI. Хлорид кальция ....................................... 738
Физико-химические свойства...................................... 738
Применение ........................................................741
Сырье .........................................'...................742
Получение плавленого хлорида кальция из дистиллериой жидкости содо-
вого производства . ...............................................743
Получение хлорида кальция из маточного щелока хлоратного производства 745
Получение гидрооксихлорида кальция и хлорида кальция из него .... 746
Получение безводного хлорида кальция из соляной кислоты и известняка 747
Литература ... ....................................749
Глава XXII. Соединения марганца . ...................................751
Физико-химические свойства.........................................751
Применение 756
Сырье .............................................................759
Химическая переработка бедных марганцовых руд.................... 761
Искусственная двуокись марганца .................................. 767
Получение двуокиси марганца электрохимическим способом...........767
Производство активированного пиролюзита — ГАПа................. 771
Получение активной двуокиси марганца из бедных руд............. 772
Получение активной двуокиси марганца термическим способом .... 774
Сульфат марганца...................................................775
Хлорид марганца .................................................. 777
Перманганат калия..................................................778
Мажеф . . . .......................................................78э
Литература ......................................................... 788
Часть П
Глава XXIII. Природные фосфаты и фосфоритная мука.....................801 |
- Фосфорные руды......................................................801 j
Минералогический состав апатитовых и фосфоритных руд ............ 802 1
Типы фосфорных руд и месторождения...............................804
Применение фосфатов .............................................808
Физико-химические и механические свойства........................814
Транспортировка и хранение фосфатного сырья......................817
Фосфоритная мука ................................................. 819
Методы и продукты химической переработки фосфатов..................823
Литература ... ........................................824
Глава XXIV. Простой суперфосфат ................................... 828
Состав и свойства суперфосфата.....................................828
Применение ........................................................830
Методы производства................................................831
Физико-химические основы производства..............................832
Химизм процесса..................................................832
Норма серной кислоты.............................................834
Механизм и скорость процесса.....................................835
Влияние температуры..............................................83/
Смешение реагентов...............................................838
Степень измельчения фосфатов..................................... . 839
Коэффициент разложения в конце I стадии реакции...............839
Разложение фосфата фосфорной кислотой (II стадия реакции) .... 840
Фосфатный комплекс суперфосфата и его фазовый состав.............842
Оглавление
11
Дозревание суперфосфата...........................................845
Особенности разложения магнийсодержащих фосфоритов................850
Нейтрализация суперфосфата твердыми добавками.....................853
Аммонизация суперфосфата . .......................................855
Производство суперфосфата...........................................856
Выделение фтористых газов........................................ 858
Основная аппаратура и условия ее работы ......................... 859
Материалы для защиты аппаратуры от коррозии.......................863
Материальный баланс производства суперфосфата.....................854
Технико-экономические данные......................................864
Получение гранулированного суперфосфата.............................867
Литература ...........................................................874
Глава XXV. Производство фосфорной кислоты сернокислотным способом 881
Физико-химические свойства .... 881
Применение .........................................................883
Физико-химические основы сернокислотной экстракции -фосфатов .... 884
Химизм процесса................................................ 884
Скорость разложения фосфатов при сернокислотной экстракции из иих
фосфорной кислоты...............................................886
Кристаллизация сульфата кальция ................................. 895
Методы сернокислотной экстракции фосфорной кислоты из фосфатов . . 904
Производство экстракционной фосфорной кислоты дигидратным способом 908
Технико-экономические показатели..................................920
Концентрирование фосфорной кислоты................................921
Получение концентрированной фосфорной кислоты полугидратиым спо-
собом ..............................................................924
Литература ...........................................................933
Глава XXVI. Производство фосфора и фосфорной кислоты электротермиче-
ским методом ....................................................... 938
Свойства фосфора и его соединения...................................938
Применение фосфора и термической фосфорной кислоты..................940
Теоретические основы возгонки фосфора из фосфатов кальция .... 943
Производство фосфора электровозгопкой из фосфатов.................947
Расходные коэффициенты.......................................... 955
Отходы производства, их утилизация................................955
Получение фосфорной кислоты.........................................957
Литература .......................................................... 966
Г лава XXVII. Концентрированные фосфорные удобрения. Двойной и обога-
щенный суперфосфаты................................................ 971
Состав и свойства.................................................. 971
Применение концентрированных суперфосфатов..........................972
Физико-химические основы производства двойного*суперфосфата .... 973
Химизм процесса...................................................973
Условия равновесия и кристаллизация твердых фаз.................974
Скорость разложения фосфатов фосфорной кислотой...................978
Растворение фосфата в фосфорной кислоте (без кристаллизации твердой
фазы)........................................................... 978
Разложение фосфатов (с кристаллизацией продуктов реакции) в иезагу-
стевающей пульпе................................................ 982
Разложение фосфатов с Образованием загустевающей пульпы .... 988
Производство двойного суперфосфата................................. 991
Камерный способ................................................. ' 992
Бескамерные (поточные) способы....................................997
Циклические методы получения двойного суперфосфата -бескамерным
способом.........................................................1004
12
Оглавление
Некоторые технико-экономические данные...........................1009
Обогащенный суперфосфат........................................... 1010
Литература............................................................Ю13
Глава XXVIII. Концентрированные фосфорные удобрения. Преципитат (ди-
кальцийфосфат) ............................................. • • • Ю17
Физико-химические свойства ........................................Ю17
Применение .........................................................1019
Методы производства............................................... 1020
Физико-химические основы осаждения днкальцийфосфата (преципитирова-
иия) ..............................................................1024
Производство преципитата .........................................1029
Кормовой преципитат ......................... . ;.................1032
Литература ......................................................... 1035
Глава XXIX. Термические фосфаты . ....................................1038
Состав и свойства..................................................1038
Применение ........................................................1042
Производство термических фосфатов..................................1043
Получение обесфторенных фосфатов...............................1043
Получение плавленых магниевых фосфатов.........................1051
Получение термощелочных фосфатов (термофосфатов)...............1053
Получение метафосфата кальция..................................1055
Литература ..........................................................1056
Глава XXX. Промышленные продукты, содержащие фосфор..........1062
Сульфиды фосфора.................................................1032
Хлориды фосфора ....... .3.......................................1063
Фосфиды .........................................................1064
Ортофосфаты натрия и калия.......................................1065
Производство фосфатов натрия...................................1068
Дегидратированные фосфаты натрия.................................1070
Производство трнполифосфата натрия н других дегидратированных
фосфатов ......................................................1076
Фосфаты аммония н двойные фосфорнокислые соли аммония .... 1085
Фосфаты кальция..................................................1089
Литература ........................................................1090
Глава XXXI. Соединения фтора................................... 1095
Физико-химические свойства.......................................1095
Применение ......................................................1105
Сырье ...........................................................1108
Получение фтора..................................................1110
Фтористый водород и плавиковая кислота ......................... 1113
Разложение плавикового шпата и других фторидов.................1113
Абсорбция и конденсация фтористого водорода ......... 1117
Жидкий фтористый водород.......................................1120
' Производство фтористых солей из плавиковой кислоты...............1124
Криолит........................................................1124
Фторид алюминия................................................1126
Фторид натрия..................................................1128
Фторид магния .................................................1129
Щелочные способы получения фторида натрия и криолита из плавикового
шпата............................................................1129
Улавливание фтористых соединений из отходящих газов и их переработка! 134
Получение кремнефтористоводородной кислоты.....................1136
Переработка кремнефтористоводородной кислоты в кремнефториды . 1142
Получение фтористых солей из отходящих газов.....................1148
Фторид натрия..................................................1149
Фторид кальция.................................................1158
Оглавление
13
Криолит н фтористый алюминий....................................1160
Аммиачный способ улавливания и переработки фтористых газов ... 1162
Литература .........................................................1170
Глава XXXII. Соли азотиой кислоты...................................
Нитрат аммония ...................................................
Физико-химические свойства......................................
Применение .....................................................
Сырье и методы производства.....................................
Производство аммиачной селитры с выпаркой растворов.............
Получение нитрата аммония безупарочными способами...............
Получение аммиачной селитры конверсией нитратных растворов . .
Удобрения на основе нитрата аммония.............................
Нитрат аммония....................................................
Нитрат кальция ...................................................
Физико-химические свойства......................................
Применение .....................................................
Методы производства . . . ......................................
Нитрат и нитрит натрия....................................... . .
Физико-химические свойства......................................
Применение .....................................................
ч Способы производства нитрата натрия ..............................
Нитрат калия .....................................................
Физико-химические свойства......................................
Применение ............................................. . . .
Способы производства нитрата калия..............................
Литература . . .............................-.................
Глава XXXIII. Соли аммония . .......................................
Сульфат аммония...................................................
Физико-химические свойства .....................................
1178
1178
1178
1184
1186
1187
1199
1203
1204
1209
1210
1210
1211
12Н
1216
1216
1216
1217
1222
1222
1223
1223
1232
1237
1237
1237
Применение ......................................>..............1238
Производство сульфата аммония...................................1239
Хлористый аммоний.................................................1253
Физико-химические свойства.................................... 1253
Применение .....................................................1253
Производство хлористого аммония.................................1254
Углекислые соли аммония ..........................................1259
Физико-химические свойства......................................1259
Применение ................................................... 1260
Получение углекислого аммония ..................................1262
Получение двууглекислого аммония................................1263
Фосфаты аммония...................................................1264
Физико-химические свойства......................................1264
Применение .....................................................1265
Производство фосфатов аммония...................................1266
Удобрения, содержащие полифосфаты аммония.........................1274
Удобрения, содержащие метафосфат аммонии..........................1274
Литература .........................................................1275
Глава XXXIV. Карбамид.......................................... 1282
Физико-химические свойства........................................ 1282
Применение и агрохимические свойства.............................1285
Методы производства.................................................1287
Физико-химические основы синтеза карбамида из аммиака и двуокиси
углерода ...........................................................1288
Способы производства карбамида из аммиака и двуокиси углерода прямым
синтезом........................................................... 1293
14
Оглавление
Способы регенерации газов дистилляции и режимы синтеза карбамида 1294
Производство карбамида по схеме с жидкостным рециклом .... 1297
Переработка растворов карбамида в готовый продукт ...............1300
Литература ..........................................................1302
Г лава XXXV. Комплексные твердые сложные удобрения...................1307
Физико-химические основы разложения фосфатов азотиой кислотой . 1308
Выделение фтора и редкоземельных элементов из азотиокислотной вы-
тяжки ......................................................... 1311
Переработка раствора, полученного азотнокислотным разложением фос-
фатов ............................................................1314
Физико-химические основы переработки азотнокислотной вытяжки . 1314
Способы переработки азотиокислотной вытяжки......................1321
Переработка азотиокислотной вытяжки в сложные удобрения .... 1325
Карбонатный способ...............................................1329
Сульфатные способы...............................................1331
Фосфорнокислотный способ ........................................1336
Нитроаммофос и нитроаммофоска......................................1337
Получение нитрофоски с вымораживанием части нитрата кальция . . 1339
Получение водорастворимой нитрофоски с частичной регенерацией азот-
ной кислоты ....................................................1346
Производство сложных удобрений на базе фосфорной кислоты .... 1347
Некоторые свойства водных систем, содержащих фосфаты, нитраты ам-
мония, карбамид и др...............................................1347
Способы производства.............................................1349
Литература ........................................................ 1358
Глава XXXVI. Комплексные смешанные и сложно-смешанные жидкие удоб-
рения .............................. 1363
Общие сведения................................................... 1353
Синергизм и антагонизм удобрений...................................1365
Производство смешанных удобрений...................................1367
Расчет состава тукосмесей ........................................ 1370
Литература ..........................................................1374
Г лава XXXVII. Жидкие удобрения............................... 1375
Общие сведения ....................................................1375
Физико-химические свойства.........................................1377
Производство жидких удобрений......................................1387
Схемы производства аммиачной воды н аммиакатов на основе аммиач-
ной селитры .................................................. 1387
Производство жидких комплексных удобрений........................13S0
Суспендированные жидкие комплексные удобрения....................1392
Литература ......................................................... 1392
Глава XXXV111. Солн мышьяка.........................................1396
Физико-химические свойства........................................1.396
Применение мышьяковых препаратов н технические требования к ним . 1402
Сырье ........................................................... 1405
Получение белого мышьяка обжигом мышьяковых руд....................1407
Арсенит кальция................................................... 1408
Мокрый способ производства.......................................1409
Полусухой способ производства .................................. 1410
Арсенит натрия................................................... 1412
Парижская зелень..................................................1413
Мышьяковая кислота ................................................1416
Азотнокислотный способ '. . .....................................1416
Оглавление
15
Другие способы получения мышьяковой кислоты..................1418
Арсенат кальция................................................... 1419
Способ каталитического окисления растворов арсенита воздухом . . 1419
Получение арсеиата кальция из мышьяковой кислоты.............1423
Азотнокислотный способ ...........................................1423
Хлориый способ...............................................1425
Электрохимический способ.....................................1426
Термический способ...........................................1426
Получение арсената кальция из окисленных мышьяковых руд . . . 1427
Литература ......................................... '...............1428
Глава XXXIX. Соли кислородвых кислот хлора ......................... 1430
Физико-химические свойства..........................................1430
Применение .........................................................1437
Производство хлорной извести...................................... 1441
Обжиг известняка..................................................1441
Получение пушонки (гашепие извести)...............................1442
Хлорирование пушонки..............................................1445
Гипохлорит натрия ................................................. 1449
Гипохлорит кальция ............................................. ' 1450
Двуокись хлора......................................................1453
Сернистокислотный способ..........................................1454
Метанольный способ................................................1456
Солянокислотный способ............................................1457
Хлоридный способ . '..............................................1458
Получение двуокиси хлора из хлорита натрия ................... . 1459
' Хлорит натрия..................................................... 1460
Хлораты натрия, калия, кальция и магния.............................1461
Получение хлоратов натрия н калия электрохимическим методом . . 1461
Получение хлората калия известковым методом.......................1464
Хлорат натрия.....................................................1469
Хлораты кальция и магния..........................................1470
Перхлораты натрия, калия и аммония н хлорная кислота..............1471
Перхлорат натрия..................................................1471
Перхлорат калия ................................................. 1473
Перхлорат аммония.................................................1473
Хлорная кислота ................................................. 1474
Литература............................................................1476
Глава XL. Продукты высокотемпературного хлорирования руд .... 1480
Общие сведения ................................................... 1480
Четыреххлористый титан............................................ 1481
Физико-химические свойства.................'......................1481
Применение ... ...........‘..............................1442
Сырье ............................................................1483
Способы обезжелезивания ильменитового концентрата.................1484
Получение четыреххлористого титана нз рутилового концентрата и тита-
нистых шлаков....................................................1486
Получение четыреххлористого титана нз других видов сырья .... 1494
Треххлористый титан . ..............................................1495
Четыреххлористый кремний............................................1495
Физико-химические свойства........................................1495
Применение .......................................................1496
Получение четыреххлористого кремния ..............................1497
Безводный хлористый алюминий...................................... 1500
Физико-химические свойства . . . .............................1500
Применение ..................................................... 1501
Получение безводного хлористого алюминия . . . . . . . . . , 1501
Литература.......................................................... 1504
16
Оглавление
Глава XLI. Цианистые соединения..................................... 1509
Физико-химические свойства.........................................1509
Применение . 1513
Сырье .............................................................1516
Цианамид кальция...................................................1516
Получение цианамида кальция в электрических печах................1518
Получение гранулированного цианамида кальция ................... 1521
Другие методы получения цианамида кальция........................1521
Производство цианидов натрия и калия...............................1523
Получение цианистых солей из синильной кислоты...................1524
Получение цианплава из цианамида кальция .................. 1525
Фиксация азота смесью соды с углем ..............................1525
Восстановление цианатов, полученных из аммиака н карбонатов . . 1526
Сплавление амида натрия с углем..................................1526
Сухая перегонка барды............................................1527
Получение цианидов из коксового газа.............................1528
Получение роданидов натрия и аммония из отбросных растворов мышьяко-
во-содовой очистки газов.................................. . . . 1529
Производство железисто- и железосинеродистых солей................1530
Железистосинеродистые соли.......................................1530
Железосинеродистые соли..........................................1531
Производство синильной кислоты контактными способами............1532
Способы синтеза синильной кислоты................................1532
Производство синильной кислоты контактным окислением метана и ам-
миака ......................................................... 1535
Получение цианистого водорода из аммиака и окиси углерода (форм-
амидный способ)..............................................1540
Получение синильной кислоты плазменным методом...................1540
Литература......................................................... 1543
ПРЕДИСЛОВИЕ К ЧЕТВЕРТОМУ ИЗДАНИЮ
Четвертое издание этой книги является стереотипным — в нем
лишь исправлены опечатки, обнаруженные в третьем издании, а
также данные ГОСТов в соответствии с произведенными в них но-
выми изменениями и дополнениями.
ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
Со времени выпуска предыдущего издания этой книги не про-
шло и десяти лет, а прогресс техники производства многих неор-
ганических продуктов оказался настолько большим, что возникла
необходимость внести в книгу существенные дополнения и изме-
[ения. Это касается всех ее частей, но главным образом тех, в ко-
торых рассмотрена технология минеральных удобрений. Развитие
этой отрасли промышленности во всем мире, и особенно в СССР,
идет чрезвычайно быстро. Выполнение решений XXIII съезда
КПСС и последующих Пленумов ЦК КПСС обусловило рост хи-
мической промышленности, и прежде всего основной химии, как
базы, обеспечивающей непрерывное развитие сельского хозяйства.
Новые методы производства появляются быстрее, чем исчезают
старые, однако наряду с новыми заводами продолжают успешно
действовать и построенные ранее. Поэтому наиболее трудным при
подготовке третьего издания оказалось, не увеличивая и без того
значительный объем книги, дополнить ее обильными новыми све-
дениями, сохранив при этом и весь не утративший своего значения
Материал предыдущего издания.
18
Предисловие к третьему изданию
Глава V написана Ю. Я. Каганович, главы VII и VIII —
Г. С. Клебановым, главы XXXII —XXXV и XXXVII —Л. 3. Ар-
сеньевой и В. А. Клевке, глава XXXVI — с участием Л. 3. Арсенье-
вой. Главы XXIII—XXX написаны Б. А. Копылевым, при этом ча-
стично использован материал, написанный для предыдущего изда-
ния книги А. А. Соколовским. Глава VI и стр. 1154—1157, напи-
санные ранее А. А. Соколовским, подверглись в новом издании
лишь небольшим изменениям. Главы XXXIX—XLI и стр. 1314—1321
написаны Б. А. Копылевым. Всем этим товарищам приношу боль-
шую .благодарность.
Я благодарю также М. И. Муратову и В. А. Рябина за мате-
риалы, предоставленные для IV и XV глав книги.
М. Лозин
Ленинградский технологический институт
имени Ленсовета
Май, 1969 г.
Глава I
ИСПОЛЬЗОВАНИЕ МИНЕРАЛЬНЫХ СОЛЕИ
В НАРОДНОМ ХОЗЯЙСТВЕ
Ассортимент минеральных солей, используемых в промышлен-
ности, в сельском хозяйстве, в медицине и для бытовых целей,
весьма велик. Он исчисляется сотнями наименований и непрерывно
растет. Масштабы мировой добычи и производства некоторых ми-
неральных солей достигают миллионов и даже десятков миллио-
нов тонн в год.
По масштабам производства и потребления первое место зани-
мают соли и соединения натрия, фосфора, калия, азота, алюми-
ния, железа, меди, серы, хлора, фтора, хрома, бария и некоторые
другие. Десятки миллионов тонн минеральных удобрений и боль-
шие количества других минеральных солей используются в сель-
ском хозяйстве.
МИНЕРАЛЬНЫЕ СОЛИ В СЕЛЬСКОМ ХОЗЯЙСТВЕ
Минеральные удобрения 1-25
Минеральными удобрениями (туками) называются соли и дру-
гие продукты, содержащие элементы, необходимые для развития
растений и используемые с целью получения высоких и устойчи-
вых урожаев. Основная масса применяемых удобрений вносится
в почву под посевы. Некоторые виды удобрений используют и для
внекорневого питания растений.
В образовании ткани растения, в его росте и развитии уча-
ствует большинство химических элементов (около 60). Основными
из них, образующими 90% массы сухого вещества растений, яв-
ляются углерод, кислород и водород. 8—9% растительной массы
составляют: азот, фосфор, магний, сера, кальций, калий и железо.
На долю остальных элементов приходится 1—2% веса растения.
Бор, медь, марганец, цинк, иод, бром, мышьяк входят в состав
20
Гл. I. Минеральные соли в народном хозяйстве
растений в тысячных и десятитысячных долях процента, а такие
Элементы, как уран, радий, торий, — в миллионных и миллиард-
ных долях процента 0.
Основную массу кислорода, углерода и водорода растение по-
лучает цз воздуха и воды, остальные элементы оно извлекает из
почвенного раствора.
Особенно важную роль в минеральном питании растения играет
азот, входящий в состав белков; последние являются основой
живей ткани. В растительных белках содержится 15,5—18%
азота. Азот входит и в состав хлорофилла, с помощью которого
растения усваивают углерод из находящегося в атмосфере угле-
кислого газа и солнечную энергию. Растения извлекают азот из
минеральных солей (солей аммония и нитратов). Некоторые рас-
тения (бобовые) могут усваивать азот воздуха благодаря деятель-
ности развивающихся на корнях клубеньковых бактерий.
Из солей аммония азот усваивается растениями с наибольшей
легкостью; нитраты же восстанавливаются в тканях растения сна-
чала до нитритов, затем до аммиака, перерабатываемого в амино-
кислоты и белки
Основными формами азотных удобрений являются: аммиачная
(соли аммония — сульфат, хлорид, фосфаты и др.), нитратная
(соли азотной кислоты — кальциевая, калиевая, натриевая се-
литры), аммиачно-нитратная (NH4NO3) и амидная (карбамид
CO(NH2)2 и др.). Все минеральные азотные удобрения (за исклю-
чением двойных солей типа MeNH4PO4, например, магнийаммоний-
фосфата MgNH4PO4 • Н2О) хорошо растворимы в воде и быстро
переходят в почвенный раствор, что обеспечивает легкую усвояе-
мость азота растением.
Соединения фосфора играют важную роль в дыхании и размно-
жении растений. В пересчете на Р2О3 содержание фосфора в не-
которых частях растений достигает 1,6%. Усиление питания фос-
фором повышает засухоустойчивость и морозостойкость растений
и увеличивает содержание в них ценных веществ — крахмала в
картофеле, сахарозы в сахарной свекле и т. п. Восприимчивость
растением фосфорных удобрений, являющихся солями фосфорных
кислот, зависит от их растворимости и от характера почв, в пер-
вую очередь от кислотности почв. Наличие в почве значительного
запаса подвижной (усвояемой растениями) формы фосфора спо-
собствует хорошему использованию других удобрений — азотных
и калийных. Одним из методов оценки усвояемости содержащейся
в удобрении Р20б является растворимость фосфатных соединений
в искусственных растворах, кислотность которых близка к кислот-
ности почвенных растворов (стр. 30). Содержание фосфора в фос-
форных удобрениях принято выражать в пересчете на P20s.
большую роль в регулировании жизненных процессов, проис-
ходящих в растении, играет калий. Он улучшает водный режим
Минеральные соли в сельском хозяйстве
21
растений, способствует обмену веществ и образованию углеводов,
увеличивая, так же как и фосфор, накопление крахмала в карто-
феле, сахара в сахарной свекле и т. п., и еще в большей мере, чем
фосфор, повышает засухоустойчивость и морозостойкость расте-
ний. Содержание калия в сухом веществе растения достигает
4__5%, а в золе листьев 30—60 % По легкости усвоения калия
растением различают три формы его соединений: 1) содержащие
водорастворимый калий, 2) обменный калий, т. е. переходящий в
почвенный раствор в результате ионообменных процессов, и 3) не-
обменный, входящий в состав безводных силикатов, из которых
калий извлекается растением лишь частично и медленно. Содер-
жание калия в удобрениях выражают в пересчете на КгО.
Кальций содержится в растениях в виде солей минеральных и
органических кислот. Он способствует развитию корневой системы,
нейтрализации избыточной кислотности в клетках растений и их
устойчивости при повышенной кислотности почвы. Кальций вносят
в почву в виде фосфорнокальциевых удобрений, кальциевой се-
литры, извести, гипса и др.
Магний содержится главным образом в зеленых частях ра-
стения. Он входит в состав хлорофилла (~2,7°/о) и фитина, спо-
собствует протеканию восстановительных процессов в растении,
образованию углеводов и переводу фосфора из минеральных в
органические соединения. Магний находится в почве главным
образом в виде силикатов и алюмосиликатов, т. е. в форме, не
усвояемой растениями. В качестве магниевых удобрений приме-
няют доломит, магнезиальные фосфаты, содержащие магний калие-
вые минералы (каинит, лангбейнит) и другие соли.
Сера входит в состав белков и эфирных масел и вносится в
почву в удобрениях, содержащих сульфаты кальция, магния, ка-
лия, а иногда в виде элементарной серы, окисляемой микроорга-
низмами до серной кислоты.
Железо играет роль катализатора при образовании хлорофилла
и участвует в дыхании растений, входя в состав ферментов, регу-
лирующих окислительно-восстановительные процессы. Ввиду до-
статочного содержания железа в почвах соли железа в качестве
удобрений используются лишь в исключительных случаях (прй
чрезмерном содержании в почве извести).
Элементы, жизненно необходимые для растения, но входящие
в его состав в ничтожных количествах (от 1(Н до 10~!2%) и иг-
рающие главным образом роль регуляторов протекающих в расте-
нии сложных процессов, носят название микроэлементов. К ним
относятся бор, марганец, медь, цинк, молибден, кобальт, иод и др.
Удобрения, содержащие эти элементы, называют микроудобре-
ниями. Значение этих удобрений исключительно велико, так как
недостаток микроэлементов, входящих в состав ферментов, вита-
минов, белков, гормонов, вызывает нарушение обмена веществ и
22
Гл. I. Минеральные соли в народном хозяйстве
тяжелые заболевания растений. Особенно велико влияние микро-
элементов на окислительно-восстановительные процессы, проте-
кающие в растении, на их направление, на процессы фотосинтеза,
отток углеводов и др. Роль микроэлементов в жизненных процес-
сах в настоящее время с успехом изучается с помощью меченых
атомов. В особую группу можно выделить ультрамикроэлементы
(содержащиеся в количествах, меньших 10-5%), в том числе ра-
диоактивные вещества.
Некоторые элементы, например, кальций, сера, железо, нахо-
дятся в почве в большинстве случаев в достаточном для растений
количестве. Другие же элементы, в особенности азот, фосфор, ка-
лий, имеющие наибольшее значение для питания растений, необ-
ходимо вносить в почву в виде удобрений. Питательные элементы
частично возвращаются в почву естественным путем. Так, азот,
находящийся в ткани растения в органической форме, при гниении
частично переходит в аммиачную и нитратную формы и вновь
усваивается растениями. Однако эти процессы идут медленно и
значительная часть питательных элементов в почву не возвра-
щается, часть их вымывается из почвы грунтовыми водами или
оказывается в форме, непригодной для усвоения растениями. По-
этому запас питательных элементов в почве требуется восполнять
внесением удобрений.
Если уменьшение содержания питательных веществ в почве не
будет компенсироваться внесением удобрений, почва будет исто-
щаться, что приведет к снижению урожайности. Это может прои-
зойти и тогда, когда в почве содержатся еще весьма большие ко-
личества необходимых для питания растений элементов, так как
урожай зависит не от общего, валового запаса их в почве, а только
от той их части, которая является усвояемой; эта часть составляет
в большинстве случаев лишь долю общего запаса.
В СССР плановая организация круговорота питательных ве-
ществ, базирующаяся на научных основах, созданных Жаном Ба-
тистом Буссенго, А. Н. Энгельгардтом, Д. И. Менделеевым,
К. А. Тимирязевым, В. В. Докучаевым, П. А. Костычевым,
В. Р. Вильямсом, Д. Н. Прянишниковым и другими, обеспечивает
повышение плодородия почв и непрерывный рост урожаев. Опыт
передовиков сельского хозяйства, показывающих замечательные
примеры высоких урожаев, все шире внедряется в практику.
Чем выше урожайность, тем больше выносится из почвы пита-
тельных веществ. О приросте урожая и о влиянии его на вынос
питательных веществ из почвы можно судить по примерным дан-
ным, приведенным в табл. 1 и 2.
При внесении в почву полного удобрения (содержащего азот,
фосфор и калий) урожай повышается в 1,5—2 раза. В среднем
прибавка урожая от применения удобрений составляет ~40%.
Каждый рубль, затраченный на минеральные удобрения, при пра-
Минеральные соли в сельском хозяйстве
23
ТАБЛИЦА 1
Вынос питательных веществ из почвы с урожаем
(в кг/га)
Питательное вещество При урожае .озимой пшеницы При урожае сахарной свеклы При урожае кукурузы, (зе- леной массы)
15 ц/га 30 ц/га 150 ц/га 270 ц/га 600 ц/га
N 46 112 65-85 166 150
Р2О5 22 39 25—28 42 70
к2о 28 77 60-70 157 200
ТАБЛИЦА 2
Повышение урожайности от внесения в почву фосфора, азота и калия *
Культура и вид продукции Прирост урожая, т на 1 т внесенного
N Р2О5 К2о
Хлопок-сырец 10-14 5-6 2
Корни сахарной свеклы 120-160 50-55 40-50
Сахар » » ....... 20 8-9 6-7
Конопля-волокно 5-5,6 4-4,2 —
Семена конопли 2-2,2 1,5-1,8 —
Клубни картофеля 120 40-80 40-60
Крахмал в клубнях картофеля . . . 17-18 6-6,5 5—5,5
Зерно озимой пшеницы 12 — 25 20-25 3-4
* Здесь приведены средние данные. Прирост урожая меняется в зависимости от харак-
тера почв, климатических условий, качества удобрений, агротехнических мероприятий и пр.
вильном их использовании дает прирост урожая в среднем на
10 руб. Следующие примерные цифры показывают, как изменяется
урожай в центнерах с 1 га от применения удобрений в условиях
надлежащей агротехники:
Без удобрений С удобрениями
Хлопок............................ 13 33
Пшеница озимая.................... 15 26
Сахарная свекла.................. 140 282
Количество вносимых удобрений на 1 га посевной площади в
сельскохозяйственной практике колеблется в следующих преде-
лах: азотные удобрения — от 30 до 300 кг N, фосфорные — от 45 до
200 кг' P2Os, калийные — от 40 до 250 кг К?О. В последнее время
наблюдается тенденция увеличивать нормы внесения удобрений.
Микроудобрения вносятся в почву в незначительных количе-
ствах. Например, для повышения урожая волокна и семян льна на
24
Гл. 1. Минеральные соли в народном хозяйстве
заболоченных и известковых почвах на 30% достаточно внести
всего 0,5 кг бора на 1 га.
В качестве микроудобрений не обязательно использовать чис-
тые соли микроэлементов, например, меди, марганца, цинка, бора;
они могут быть заменены природными минералами и отходами про-
мышленности. Так, в качестве источника микроэлементов могут
быть использованы пиритные огарки, содержащие медь и другие
металлы, борсодержащие отходы от производства соединений бора;
шламы от обогащения марганцовых руд и др. Распределение ма-
лых количеств микроудобрений на большие посевные площади за-
труднительно. Поэтому микроудобрения добавляют к главным
формам удобрений еще в процессе их производства. Когда же для
питания растений микроэлементами используют чистые соли, их
предпочитают не вносить в почву, из которой извлекается лишь
незначительная их доля, а питать ими непосредственно растения
путем предпосевного пропитывания семян или опрыскивания рас-
тений растворами солей (внекорневое питание).
В СССР при большом разнообразии почвенно-климатических
условий и выращиваемых культур требуется не только большое
количество удобрений, но и широкий ассортимент их. Поэтому
азотные, фосфорные, калийные и другие удобрения изготовляются
и применяются в виде различных солей и их смесей, в которых пи-
тательный элемент находится в разных формах и количествах.
Классификация минеральных удобрений
Удобрения классифицируют по происхождению, назначению,
составу, свойствам, способам получения и др.
По происхождению удобрения разделяют на минеральные, ор-
ганические, органо-минеральные и бактериальные. Минеральные
или искусственные удобрения — специально вырабатываемые на
химических предприятиях неорганические вещества, главным обра-
зом минеральные соли; однако к ним относят и некоторые органи-
ческие вещества, например, карбамид. Органические удобрения
содержат питательные элементы, главным образом (но не исклю-
чительно) в виде органических соединений, и являются обычно
продуктами естественного происхождения (навоз, фекалии, торф,
солома и др.)- Органо-минеральные удобрения — смеси органиче-
ских и минеральных удобрений. Бактериальные удобрения содер-
жат культуры бактерий, способствующих накоплению в почве
усвояемых форм питательных элементов.
По срокам внесения удобрения разделяют на основные (пред-
посевные), вносимые до посева, припосевные, вносимые во время
посева (например, в рядки), и подкормки, вносимые в период раз-
вития растений.
По видам питательных элементов (табл. 3) удобрения разделя-
ют на азотные, фосфорные (или фосфатные), калийные (калиевые),
Минеральные соли в сельском хозяйстве
25
ТАБЛИЦА 3
Важнейшие минеральные удобрения
Название Главные компоненты Содержание основного питательного вещества Объемный вес» * т/ж^
Суперфосфат порош- Фосфорные Са(Н2РО4)2*Н2О + s 14-21% Р2О5 1,1-1,2
кообразный Суперфосфат грану- + Н3РО4 + CaSO4 То же 19,5-21% Р2О5 1.1
лированный Суперфосфат обога- То же 28 -32% Р2О5 1,1
щенный Суперфосфат двой- Са(Н2РО4)2 • Н2О + Н3РО4 38—50% Р2О5 0,9-1,1
ной и тройной Преципитат СаНРО4 • 2Н2О 27 — 46% Р2О5 0,8-0,85
Фосфоритная мука Ca5F(PO4)3 16-25% Р2О5 1,7-1,8
Костяная мука Са3(РО4)2 СаСО3 30% Р2О5 0,86
Фосфатшлаки (томас- 4СаО • Р2О5 + 5СаО • Р2О5 • SiO2 14-20% Р2О5 2,01-2,05
шлак или марте- новский)
Термофосфат Na2O-4CaO-P2O5 • SiO2 20 -35% Р2О5 1,7
Плавленый фосфат 4(Са, Mg)O-P2O5 + 20-35% Р2О5
Обесфторенный фос- + 5(Са, Mg)O • Р2О5 • SiO2 ЗСаО • Р2О5 + 4СаО • Р2О5 20-38% Р2О5
фат
Метафосфат кальция Са(РО3)2 65-70% Р2О5
Аммиак жидкий Азотные NH3 82,3% N 0,61
Аммиачная вода NH3 + Н2О 16,5-20,5% N 0,92-0,91
Аммиачная селитра NH4NO3 34-35,0% N 0,8—1,1
(нитрат аммония) Сульфат аммония (NH4)2SO4 20,5-21% N 0,7-0,95
Сульфоннтрат аммо- (NH4)2SO4-2NH4NO8 25 -27% N 0,8-1,2
НИЯ
Известково-аммиач- NH4NO3 + CaCO3 16-20,5% N 1-1,2
ная селитра
Натриевая селитра NaNO3 16,1% N 1,1-1,4
(нитрат натрия)
Кальциевая селитра Ca(NO3)2-3H2O 13-15% N 0,9-1,1
(известковая се- литра)
Хлористый аммоний NH4C1 24,5-25% N 0,6-0,8
Бикарбонат аммония nh4hco3 18% N
Цианамид кальция CaCN2 + C 18-23% N 0,6-0,61
Карбамид (мочевина) CC(NH2)2 42-46,6% N 0,65 - 0,У1
Карбамид-формаль- nhconhch2 33-42% N
Дегидное
* В табл. 3 приведены ориентировочные пределы объемного веса для-образцов с разной
ьеличиной зерен и разной степени слежалости. .
26
Гл. I. Минеральные соли в народном хозяйстве
Продолжение
Название Главные компоненты Содержание ОСНОВНОГО! питательного вещества Объемный вес. • т/м3
Хлористый калий Калийные КС1 50-62% К2О 0,73-1,17
30 и 40 % -ная калий- KCl + NaCl 30-40% К2О 0,94-1,2
ная соль
Сильвинит молотый КС1 + NaCl 12-15% К2О 1,07-1,1
Карналлит молотый KCl-MgCl2-6H2O+NaCl 12-13% К2О 0,99-1,06
СульЪат калия k2so4 48-52% К2О 1,25-1,43
Калимаг (лангбейнн- K2SO4-2MgSO4 + CaSO4+NaCl 19-21% К2О 1,5
товый)
Калимаг (шеннто- K2SO4 + MgSO4 28-30% К2О 1
вый)
Каинит KC1 • MgSO4 • 3H2O + NaCl 8-12% К2О 1,3-1,4
Суперфосфат аммо- Комплексные CaHPO4 + NH4H2PO4 + CaSO4 1,5-3% N, 1,2-1,35
визированный CaHPO4 + NH4H2PO4 19-20% Р2О5
Суперфосфат двой- 6-7% N,
ной аммоннзиро- 40 -50% Р2О5
ванный
Аммофос NH4H2PO4 + (NH4)2HPO4 11 — 14% N, 0,9-1
Днаммофос (NH4)2HPO4 + nh4h2po4 48—55% Р2О5 16-18% N,
Нитроаммофос nh4no3 + NH4H2PO4 46 - 48% Р2О5 21—22% N,
Сульфоаммофос (NH4)2HPO4 + (NH4)2SO4 21-22% P2Os 18-20% N,
Метафосфат калия (KPO3)„ 16-20% Р2О6 57-59% Р2О6, 38-40% К2О 16% N,
Калийно-аммначная NH4NO3 + KNO3 + NH4C1
селитра KNO3 26-28% К2О
Калиевая селитра 13,596 N, 1,05-1,27
(нитрат калия) Аммофоска (NH4)2HPO4 + (NH4)2SO4 + 46,5% К2О 11-12% N, 1-1,3
+ KNO3 + NH4C1 11-16% Р2О6, 15-20% К2О 11—20% N,
Нитрофоска NH4NO3 + (NH4)2HPO4 + 0,8-1,3
Нитроаммофоска + kno3+nh4ci или NH4NO3 4- CaHPO4 4- + CaCO3 + KNO3 + NH4C1 или NH4NO3 4-CaHPO4 4- 4- (NH4)2HPO4 4- CaSO4 • 2H2O4- 4- KNO3 4- NH4C1 NH4NO34-NH4H2PO4 4- 8-16% Р2О6, 10-21% К2О 17-18,5% N, ~1
Диаммонитрофоска 4-KNO3 4-NH4C1 NH4NO34- (NH4)2HPO4-|- 17-18,5% Р2О5> 17-18,5% К2О То же
* В табл.3 приведен 4- KNO3 4- NH4C1 & ы ориентировочные пределы объемно го веса для образце в с разной
ос^хпчинои зерен н разной степени слежалостн.
Минеральные 'Соли в сельском хозяйстве
27
магниевые, борные и т. д. Удобрения, содержащие только ми-
кроэлементы, объединяют в общую группу микроудобрений.
По агрохимическому значению удобрения разделяют на пря-
мые являющиеся источниками питательных элементов для ра-
стений, и косвенные, служащие для мобилизации питательных
веществ из почвы путем улучшения ее физических, химиче-
ских и биологических свойств (например, для нейтрализации кис-
лотности почвы известкованием, или для мелиорации гипсова-
нием и др.).
Деление удобрений на прямые и косвенные является в извест-
ной мере условным, так как все. прямые удобрения оказывают и
косвенное действие, а элементы, входящие в состав косвенных
удобрений, в той или иной степени используются в питании рас-
тения.
Прямые минеральные удобрения могут содержать один или не-
сколько разных питательных элементов. Три главных питательных
элемента — азот, фосфор и калий — вносятся под посевы в наи-
больших количествах. По их содержанию удобрения разделяют на
простые, в состав которых входит только один из главных пита-
тельных элементов, и комплексные, содержащие два и более пи-
тательных элемента. По числу главных питательных элементов
комплексные удобрения называют двойными (например, типа РК)
и тройными (NPK); последние называют также полными. Удобре-
ния, содержащие значительные количества питательных элементов
и мало балластных веществ, называют концентрированными, а
удобрения, все компоненты которых служат для питания расте-
ний— безбалластными. К последним относятся, например, соли,
и катион и анион которых содержат питательные элементы, такие
как KNO3, NH4NO3 и др. Концентрированные и безбалластные
удобрения обладают высокой эффективностью, а их перевозка об-
ходится дешевле, чем неконцентрированных удобрений. Так как
любой питательный элемент находится в удобрении в форме ка-
кого-либо соединения, т. е. в связи с другими элементами, в той
или иной мере используемыми растением, то, строго говоря, про-
стых удобрений нет. Применяя термины простые, двойные и трой-
ные удобрения, имеют в виду содержание в них одного, двух или
трех главных элементов — азота, фосфора и калия или вообще
тех элементов, ради внесения которых в почву удобрение исполь-
зуется; сопутствующие элементы, хотя и извлекаемые растениями,
этой классификацией не учитываются.
По конституции удобрения разделяют на простые, смешанные и
сложные. Простыми называют удобрения, содержащие только один
питательный элемент в одной форме (например, азот в NaNOa).
Смешанными удобрениями называют механические смеси удобре-
ний, состоящие из разнородных частиц, получаемые тукосмеше-
нием. Если же удобрение, содержащее несколько питательных
28
Гл. I. Минеральные соли в народном хозяйстве
элементов, получается в результате химической реакции в завод-
ской аппаратуре, его называют сложным.
Сложные удобрения состоят из однородных частиц, содержа-
щих питательные элементы в нескольких формах. Деление удобре-
ний на смешанные и сложные в значительной мере условно. Сме-
шанные удобрения при хранении нередко становятся сложными
в результате реакций, протекающих между составляющими смесь
компонентами. Иногда называют сложно-смешанными удобрения,
получаемые в результате «мокрого тукосмешения» — смешения
твердых продуктов с жидкими (плавами, растворами) и последую-
щего отверждения смесей, сопровождающегося перекристаллиза-
цией и другими процессами. (Такие удобрения за границей назы-
вают также тукосмесями мокрого смешения.)
Количества питательных веществ и их соотношения в комп-
лексных удобрениях могут быть различными. Удобрения, в кото-
рых соотношение питательных элементов соответствует агротехни-
ческим требованиям (для определенной культуры, почвы и т. д.)
называют уравновешенными.
По агрегатному состоянию удобрения разделяют на твердые,
жидкие (например, аммиак, водные растворы и суспензии) и газо-
образные, применяемые под укрытиями (например, двуокись угле-
рода).
Усвоение удобрений растениями зависит от их растворимости
и от характера почв, в первую очередь от концентрации ионов во-
дорода в почвенном растворе. Например, некоторые почвы обла-
дают свойствами, позволяющими растениям усваивать Р2О5 (хотя
и медленно) из практически не растворимого в воде трехкальцие-
вого фосфата, особенно из тонкодисперсных его разновидностей —
фосфоритной и костяной муки. Концентрация ионов водорода в
почвенном растворе, необходимая для усвоения Р2О5 из разных
видов фосфорных удобрений, различна. Методом оценки усвояе-
мости Р2О5 является определение растворимости фосфатных со-
единений в искусственных растворах, кислотность которых близка
к кислотности почвенных растворов — в аммиачном растворе ци-
трата аммония (реактив Петермана) и в 2%-ном растворе лимон-
. ной кислоты. Для определения усвояемой Р2О5 применяют также
0,05 н. раствор серной кислоты и Н-катиониты. Усвояемость кор-
мовых фосфатов, используемых в животноводстве (см. ниже), опре-
деляют по их растворимости в 0,4 %-ном растворе соляной кислоты.
По степени растворимости фосфорные удобрения разделяют на
водорастворимые, цитратнорастворимые (т. е. растворимые в ци-
трате аммония), лимоннорастворимые (растворимые в лимонной,
гуминовой и других слабых органических кислотах) и трудно или
нерастворимые. Почти все азотные неорганические удобрения рас-
творимы в воде, так же как и применяемые в качестве искусствен-
ных удобрений соединения калия.
Минеральные соли в сельском хозяйстве
29
Водорастворимые удобрения наиболее легко усваиваются рас-
тениями, однако значительная их часть вымывается из почвы грун-
товыми и дождевыми водами и исчезает непроизводительно. Из
азотных удобрений растения извлекают 50—70% N, из калийных —
40__60% КгО. Еще в меньшей степени используется фосфор, кото-
рый частично переходит в форму трудно усваиваемую растениями
в результате идущих в почве химических и биологических про-
цессов.
Эффективность легко растворимых удобрений значительно воз-
растает при применении их в крупнокристаллическом или в гра-
нулированном виде. При этом удобрение размещается в почве оча-
гами и медленнее переходит в почвенный раствор, вследствие чего
уменьшаются потери питательных веществ и увеличивается ис-
пользование их растениями. Повышенная эффективность гранули-
рованных удобрений обусловлена также возможностью их внесе-
ния малыми дозами совместно с семенами в рядки 12.
Большим преимуществом гранулированных удобрений являются
их хорошие физические свойства — они не комкуются, не слежи-
ваются, не пылят. Эти удобрения можно вносить в почву с по-
мощью туковых или комбинированных сеялок, применяемых для
одновременного высева семян и минеральных удобрений 18’19, что,
помимо облегчения труда и повышения его производительности,
значительно улучшает использование удобрений.
Для создания в почве запаса питательных веществ применяют
удобрения долговременного действия. Длительно сохраняющимися
в почве фосфатами являются цитратно-, лимонно- и, особенно,
труднорастворимые фосфаты. Для создания в почве запасов азота
служат естественные и искусственные органические азотсодержа-
щие соединения. К последним относятся, например, оксамид (ди-
амид щавелевой кислоты H2NCOCONH2), медленно разлагаю-
щийся в почве с образованием NH4 и NO3; производные пири-
дина C5H5N; мочевино-формальдегидные высокомолекулярные
композиции — уреаформы, карбамиформы (диметилентримочевина,
триметилентетрамочевина и другие)—продукты совместной кон-
денсации карбамида (мочевины) CO(NH2)2 и формальдегида
СН2О; они могут служить источником азота в почве в течение дли-
тельного времени. Для этой же цели могут служить цитратнорас-
творимые двойные соли типа MeNH4PO4, например, магнийаммо-
нийфосфат MgNH4PO4 • Н2О. Медленный переход любых водорас-
творимых веществ в почвенный раствор может быть достигнут
также при покрытии гранул удобрения пленками из высокомоле-
кулярных соединений или при применении гранулированных удоб-
рений; полученных из порошков с добавками этих же соединений
(например, полиакриламида) или полимеризующихся веществ.
Исследование10 скорости растворения в воде некоторых
минеральных удобрений — NaNO3, NH4NO3, КС1, CO(NH2)a —
30
Гл. I. Минеральные соли в народном хозяйстве
в условиях, аналогичных естественным, показало, что это диффу-
зионный процесс, характеризующийся температурными коэффи-
циентами в пределах 1,1 —1,8. Коэффициенты скорости растворе-
ния для этих солей в диапазоне линейной скорости воды от 2 до
50 смЫин имеют значения от 0,1 до 0,25 см/мин. В пределах 0—30°
эти коэффициенты увеличиваются почти пропорционально повыше-
нию температуры. Покрытие зерен удобрения полимерной пленкой
позволяет регулировать скорость их растворения, так как послед-
няя не зависит ни от вида удобрения, ни от скорости потока, а
определяется диффузионной проницаемостью пленки, обусловлен-
ной природой полимера, его концентрацией и типом использован-
ного растворителя. Так, скорость раствопения в воде CO(NH2)2,
КС1 и других солей уменьшается в ’00—200 раз при покрытии их
зерен пленкой, образованной из 27%-ного раствора полистирола
в бензоле или 10°А-ного раствора поливинилапетата в ацетоне, или
из 6%-ного раствора нитроцеллюлозы.
Внесение удобрений не только повышает количество усвояемых
растениями питательных веществ в почве, но влияет и на физиче-
ские, физико-химические и биологические свойства почвы, от кото-
рых также зависит ее плодородие. Одним из важных факторов
является изменение pH почвенного раствора. Внесение в почву
веществ, обладающих кислыми или щелочными свойствами, соот-
ветствующим образом влияет на реакцию почвенного раствора.
Однако вследствие неодинакового использования растениями ка-
тионов и анионов растворенных солей изменение pH может прои-
зойти и при внесении в почву нейтральных солей. Например, при
систематическом внесении в почву таких веществ как (NFL'S 2SO4.
NH4C1, почвенный раствор приобретает кислую реакцию: взамен
извлекаемых растением катионов раствор обогащается ионами во-
дорода, что приводит к накоплению в почве свободной кислоты.
Другие удобрения, наппимер. NaNO,, Са(НОз)г, являются источни-
ками накопления в почве ионов ОН-. Поэтому только химическая
характеристика реакции удобрений недостаточна. Они должны
различаться и по физиологическим свойствам, обусловленным не-
одинаковой степенью использования катионов и анионов. По этому
признаку удобрения классифицируют на физиологически кислые,
физиологически щелочные и Физиологически нейтральные.
Волыпое значение имеют физические свойства удобрений. Во-
дорастворимые удобрительные соли не должны быть сильно гигро-
скопичными. не должны слеживаться при хранении, они должны
быть сыпучими, легко рассеваться на почву, но в то же время
сохраняться на ней в течение некоторого времени, не сдуваясь
ветром и не слишком быстро вымываясь дож левой водой. Этим
требованиям в наибольшей мере отвечают гранулированные удо-
брения, производство и применение который непрерывно возра-
стает.
Минеральные соли в сельском хозяйстве
31
Минеральные яды и другие препараты9-23~52>59
Использование минеральных солей в сельском хозяйстве не
ограничивается применением их в качестве удобрений. Задачей, не
менее важной, чем получение высоких урожаев, является их сохра-
нение. Это требует защиты растений от уничтожения и порчи вре-
дителями (насекомыми, грызунами) и предохранения их от забо-
леваний. Массовое появление вредителей (саранчи, клопа-чере-
пашки, колорадского ( жука, полевых грызунов и др.) может
привести к полной гибели урожая. В США при общей годовой стои-
мости урожая 13 млрд, долларов потери сельскохозяйственной
продукции в некоторые годы от болезней растений оценивают в
1,75 млрд, долларов, а от вредных насекомых — в 4 млрд, долла-
ров, т. е. они составляют более одной трети урожая9’59. Прибли-
зительно такие же потери урожая вызываются сорняками. По дру-
гим данным46, сельскому хозяйству США приносят ущерб более
6000 видов вредных насекомых, уничтожающих около 10% урожая
пищевых продуктов и прядильных культур. Там погибает ежегод-
но около 8% урожая картофеля, уничтожаемого колорадским жу-
ком, которым заражена площадь, превышающая 6 млн. км2. Коло-
радский жук дает в один сезон потомство, превышающее 30 млн.
особей, способных съесть больше 20 т зеленой массы картофеля.
Распространение этого вредителя идет очень быстро — за 15 лет
(1859—1874 гг.) он переместился на 3200 км через весь северо-
американский материк с запада на восток и заразил все карто-
фельные поля 33. Если бы не велась борьба с колорадским жуком,
он мог бы уничтожить урожай картофеля полностью.
Широкое применение в сельском хозяйстве ядовитых препара-
тов для борьбы с вредителями и болезнями растений позволяет
значительно (иногда в несколько раз) увеличивать урожаи и по-
вышать качество продуктов. Каждый рубль, затраченный на ядо-
витые препараты при правильном применении агротехники, сохра-
няет продукции, т. е. дает прирост урожая, по зерновым и овощ-
ным культурам на 5—10 руб., по хлопку, техническим и ягодным
культурам — на 15—30 руб., по цитрусовым — на 30—40 руб.
Препараты, используемые для защиты растений, носят общее
название пестицидов. («Пестицид» в дословном переводе означает
«убивающий заразу».) Их также называют сельскохозяйственными
ядами или ядохимикатами. Ядовитые препараты,применяемые для
уничтожения вредящих растениям насекомых, называют инсекти-
цидами. В их число входят овициды — средства, уничтожающие
яйца насекомых, ларвициды — вещества, уничтожающие личинок
и гусениц, афициды — уничтожающие тлей. Вещества, уничтожаю-
щие круглых червей называют нематоцидами, уничтожающие мол-
люсков— моллюскоцидами, уничтожающие голых слизней — лима-
Цидами, уничтожающие растительноядных клещей — акарицидами.
32
Гл. 1. Минеральные соли в народном хозяйстве
Инсектициды, поражающие паразитов через наружные покровы,
называют контактными, через органы дыхания — трахейными, а
убивающие только при попадании в кишечник насекомого — ки-
шечными. Системными или внутрирастительными называются ин-
сектициды, проникающие через корни и листья внутрь растения и
делающие его ядовитым для паразитов.
Препараты, предназначенные для борьбы с паразитирующими
на растениях грибками и вирусными заболеваниями, называют
фунгицидами, а для борьбы с возбудителями бактериальных бо-
лезней растений — бактерицидами. Некоторые препараты являются
одновременно и инсектицидами и фунгицидами. Независимо от
этой классификации под названием инсектофунгициды часто под-
разумевают вообще все вещества, применяемые для борьбы с вре-
дителями и болезнями растений.
Многие препараты используются в качестве антисептических
средств для обеззараживания почв, зерна и хранилищ продукции,
а также в качестве консервирующих средств для пищевых продук-
тов и животного сырья. Фунгициды, используемые для обеззара-
живания семян, называют протравителями.
Для уничтожения вредных теплокровных животных приме-
-няются препараты, называемые зооцидами. Препараты, применяе-
мые для борьбы с грызунами, называют также родентицидами,
для борьбы с крысами — ратицидами, для борьбы с птицами —
авицидами. Отпугивающие средства, служащие для защиты людей
и животных от нападения птиц, клещей, кровососущих двукрылых
насекомых (комаров, гнуса и др.), называются репеллентами.
Средства, привлекающие полезных насекомых, называют аттрак-
тантами.
Все шире стали использовать вещества, называемые стимуля-
торами или регуляторами роста растений29’44. Это препараты, ак-
тивно влияющие на физиологические процессы растительного орга-
низма. В зависимости от условий и дозы стимуляторы роста могут
по-разному влиять на растения: в малых дозах они обычно акти-
вируют рост растений, а в больших дозах замедляют или
полностью подавляют их развитие.
Стимуляторы роста используются для обработки семян и рас-
тений с целью повышения урожая, а также для получения бессе-
мянных плодов; для ускорения созревания плодов; для торможе-
ния развития семян, клубней, почек и цветов, например, для пред-
отвращения вредного влияния на них весенних заморозков или для
удлинения срока цветения декоративных растений; для задержки
прорастания картофеля и других плодов при их длительном хра-
нении; для активирования корнеобразования при вегетативном
размножении черенками; для предотвращения преждевременного
предуборочного опадания плодов; для предуборочного удаления
листьев и высушивания растений и пр.
Минеральные соли в сельском хозяйстве
33
Применение дефолиантов, т. е. веществ, вызывающих опадение
листьев, позволяет механизировать уборку урожая хлопка, ово-
щей и других культур; применение дессикантов, т. е. высушиваю-
щих веществ, облегчает уборку корне- и клубнеплодов, например
картофеля. В качестве стимуляторов роста применяются главным
образом органические соединения, но также и некоторые мине-
ральные.
Особенно широко применяются стимуляторы роста для унич-
тожения сорняков. Такие препараты называются гербицидами.
В зависимости от свойств и нормы применения гербицидов они
разделяются на гербициды сплошного действия, т. е. действующие
на все виды растений, и селективные, т. е. избирательно уничто-
жающие одни виды растений и безопасные для других. Химиче-
ская прополка полей с использованием авиации или наземных ма-
шин позволяет в сотни раз ускорить этот трудоемкий процесс и
резко повысить производительность труда в сельском хозяйстве.
Гербициды, предназначенные для уничтожения сорных кустарни-
ков и деревьев, называют арборицидами, а для уничтожения водо-
рослей — альгицидами.
Большинство минеральных гербицидов обладает сплошным
действием, т. е. уничтожает все виды растений, и непригодно для
химической прополки посевов. Они могут применяться для унич-
тожения растительности на невозделываемых участках, в между-
рядьях садов и ягодников, на дорогах, парковых площадках, же-
лезнодорожных путях, для подготовки земель под плантации и т.п.'
и расходуются при этом в значительных дозах (до 1000 кг на
1 га), в сотни раз превышающих дозы органических гербицидов
избирательного действия, используемых для химической прополки.
Из неорганических гербицидов избирательным действием обла-
дают, например, соли меди — нитрат, хлорид, смесь хлорида и
сульфата. Они уничтожают сорняки (преимущественно однолет-
ние) и не уничтожают культурные посевы (злаки) 48.
В качестве пестицидов используются многие химические веще-
ства в твердом, жидком (растворенном) или газообразном состоя-
нии. Часто растения подвергают опрыскиванию суспензиями или
эмульсиями, а также опыливанию тонко размолотыми препарата-
ми—дустами, которые представляют собой смеси активно дей-
ствующих веществ с инертными носителями (наполнителями). Ве-
щества, оказывающие токсическое действие в газообразном или
парообразном состоянии, называются фумигантами. К ним отно-
сятся и твердые вещества, выделяющие ядовитые пары (например,
Цианид кальция, выделяющий под действием атмосферного воз-
духа пары синильной кислоты).
Вследствие биологической активности пестициды обладают то-
ксичностью по отношению к теплокровным животным и человеку.
Но степени токсичности, определяемой средне-смертельной дозой
2 М. Е. Позин
34
Гл. I. Минеральные соли в народном хозяйстве
на 1 кг веса животного, их условно делят на четыре группы:
1) сильнодействующие вещества, средне-смертельная доза кото-
рых меньше 50 мг/кг\ 2) высокотоксичные, при дозе 50—200 мг/кг;
3) среднетоксичные, при дозе 200—1000 мг/кг и 4) малотоксичные,
при средне-смертельной дозе, превышающей 1000 мг/кг50.
Катионы металлов по степени токсичности могут быть распо-
ложены в следующий ряд51:
Ag > Hg > Си > Cr > Ni > Pb > Со > Zn > Fe > Са
Раньше в качестве сельскохозяйственных ядов применяли глав-
ным образом неорганические вещества. В настоящее время нахо-
дят широкое применение более эффективные и менее вредные для
человека и животных органические препараты. Однако и неорга-
нические яды не утратили своего значения и используются в зна-
чительных количествах. Наиболее распространенными неорганиче-
скими пестицидами являются соединения мышьяка, меди, бария,
серы, фтора, циана, кислородных кислот хлора.
Минеральные корма 17’53’54
Минеральные соли применяются и в качестве кормовых
средств — для подкормки скота и птицы. Добавки минеральных
солей к кормовым рационам ускоряют развитие животных, увели-
чивают продуктивность скотоводства и птицеводства. Для этой
цели используют поваренную соль, карбонат кальция, фосфаты
кальция —дикальцийфосфат (преципитат) и трикальцийфосфат,
соли железа, меди, цинка, кобальта и другие, а также карбамид.
Кормовые фосфаты в отличие от удобрительных не должны содер-
жать вредного для животного организма фтора и поэтому изго-
товляются специально. Медь, цинк, кобальт и многие другие
элементы требуются для животного организма в ничтожных коли-
чествах, но влияют на его развитие существенным образом. Так,
подкормка овец и других животных солями кобальта и меди зна-
чительно увеличивает продуктивность по мясу и шерсти.
МИНЕРАЛЬНЫЕ СОЛИ В ПРОМЫШЛЕННОСТИ 55
Различные отрасли промышленности используют в своих произ-
водственных процессах большое количество разнообразных мине-
ральных солей. Среди всех отраслей промышленности, потребляю-
щих соли, особое место занимает химическая промышленность,
являющаяся не только производителем минеральных солей, но и
крупнейшим их потребителем. Здесь минеральные соли исполь-
зуются в качестве сырья для получения кислот, щелочей, газов и
других солей, а также в качестве сырья и вспомогательных мате-
риалов для многих химических производств. Так, химическая про-
мышленность потребляет колоссальные количества поваренной
Минеральные соли в промышленности 35
соли для получения хлора, едкого натра, соды и других солей нат-
рия и соединений хлора. Сульфат натрия перерабатывается в сер-
нистый натрий и другие содержащие серу соли. В производства
красителей применяют сернистый натрий, нитрит натрия, хлорат
калия, сульфат натрия, бихроматы калия и натрия и многие дру-
гие соли. Значительный ассортимент солей и окислов используется
в качестве катализаторов при синтезе органических продуктов,
для беспламенного горения и других процессов.
В металлургической промышленности соли используют при из-
готовлении черных, цветных и легких металлов и изделий из них,
в качестве сырьевых материалов, флюсов, присадок, реагентов для
обработки руд и изделий, компонентов электролитов и пр.
Многие соли применяют при обработке металлов, в частности
в машиностроительной промышленности, для придания поверхно-
сти деталей тех или иных свойств (прочности, твердости), для за-
калки инструментов, для пайки и сварки металлов и сплавов, для
зашиты изделий от коррозии и пр.
Для шлифовки и полировки металлических изделий, а также
стекла и изделий из пластмасс абразивная промышленность изго-
товляет специальные материалы, используя для этого окислы же-
леза (крокус), алюминия, хрома, олова, а также карбонаты каль-
ция, магния, силикат натрия и другие соли.
В горнорудной промышленности, во флотационных процессах
также применяют некоторые соли, например, сернистый натрий,
медный и железный купоросы.
В нефтяной промышленности при бурении скважин используют
сульфат бария, а при переработке нефти — минеральные катализа-
торы, например, хлорид алюминия.
Различные соли применяются в электропромышленности, в
электродной, в аккумуляторной и элементной промышленности, в
гальванотехнике и пр.
Стекольная промышленность является крупным потребителем
соды и сульфата натрия — основных компонентов шихты для варки
стекла. В производстве стекла и эмалей применяются и многие
другие минеральные соединения, придающие изделиям те или
иные специальные свойства (механическую прочность, термическую
и химическую устойчивость, плотность, цвет, степень прозрачности,
электропроводность и др.).
Большие количества окислов и солей используют в производ-
стве керамических изделий и огнеупоров, при изготовлении термо-
изоляционных материалов, в цементной промышленности и в про-
мышленности строительных материалов.
Потребителем разнообразных минеральных солей является тек-
стильная промышленность, использующая их для беления тканей
и протравки их перед крашением и печатанием в качестве различ-
ных аппретур и утяжелителей.
2*
36
Гл. I. Минеральные соли в народном хозяйстве
Различные соли и окислы металлов используются в резиновой
промышленности в качестве наполнителей для резиновых смесей,
в качестве усилителей механической прочности резин, для ускоре-
ния процесса вулканизации, для придания изделию необходимого
цвета.
Окислы, карбонаты, сульфаты и другие соли применяются и
в производстве пластических масс; для изготовления взрывчатых
веществ и порохов используют нитраты, хлораты и др.
Различные соли и окислы применяются в пищевой, кожевенной,
фармацевтической и во многих других отраслях промышленности.
Чем выше технический уровень различных отраслей промыш-
ленности, тем обширнее и разнообразнее перечень применяемых
ими солей. В увеличении ассортимента солей значительную роль
играет также постоянный рост требований к качеству изделий про-
мышленности, обусловливающий более широкое применение раз-
нообразных химических продуктов.
Большой ассортимент химикатов, в частности солей высокой
чистоты, потребляют новые отрасли промышленности, например,
производство полупроводниковых, ядерных материалов и др.
Во многих случаях одни и те же соли применяются для разно-
образных целей. В соответствии с этим устанавливаются опреде-
ленные требования к качеству солей, узаконенные государствен-
ными общесоюзными стандартами (ГОСТ) или согласованными
между производителем и потребителем специальными техниче-
скими условиями (ТУ), предусматривающими также определен-
ные виды тары и методы анализов продукта.
Следует отметить общую тенденцию к повышению чистоты со-
лей и других технических продуктов, выпускаемых химической
промышленностью как за рубежом, так и в СССР.
РАЗВИТИЕ ПРОИЗВОДСТВА СОЛЕЙ В СССР56-61
Солевые промыслы являлись старейшими химическими произ-
водствами в России. Производство поваренной соли из природных
рассолов возникло в России еще в XII в., а с XIV в. началось
селитроварение. Кроме поваренной соли и селитры, в допетровской
Руси вырабатывался поташ, который экспортировался и в другие
страны. В небольших количествах вырабатывались купоросы и не-
которые минеральные краски. Выработка селитры особенно увели-
чилась к началу XVIII в. в связи с расширением пороходелия.
В течение XIX в. были построены заводы, производившие мине-
ральные кислоты (серную, соляную) и соли (сульфаты, сернистый
натрий и др.). В 1850 г. был основан Кокшанскнй завод, выраба-
тывавший соли хрома, медный и железный купоросы, поташ. Бон-
дюжский завод (основанный в 1868 г.) производил сернокислый
глинозем и квасцы. В 1875 г. в Петербурге был построен Тентелев-
Развитие производства солей в СССР
37
ский химический завод, цо тому времени наиболее совершенный,
вырабатывавший серную, азотную и соляную кислоты и на их
основе минеральные соли — сернокислый глинозем и др. В 1896 г.
на этом заводе было освоено производство суперфосфата. В 1900 г.
в России насчитывалось 526 химических предприятий, многие из
которых вырабатывали различные минеральные соли.
Тем не менее масштабы химического производства были срав-
нительно небольшими. Политика царского правительства, покро-
вительствовавшего иностранному капиталу, не способствовала раз-
витию отечественной химической промышленности. Расширение
источников химического сырья и рост русского производства не
поощрялись, а химические товары ввозились из-за границы по по-
вышенным ценам. В нашей стране, в недрах которой скрывались
самые богатые в мире залежи солей калия, глауберовой соли и
других, добыча этих солей не производилась. Калийные соли вво-
зились из Германии (за исключением поташа, вырабатывавшегося
из золы растений). Глауберова соль также ввозилась, хотя некото-
рое количество ее производилось путем растворения и кристаллиза-
ции сульфата натрия, получавшегося при выработке соляной кис-
лоты и переработке импортной натриевой селитры на азотную
•кислоту. Ввозились и другие соли и сырье для их производства,
в частности фосфориты, борные минералы и пр.
В 1913 г. в Россию были ввезены (в числе прочих):.
тыс. т
Калиевые соля............. 77,0
Натриевая селитра......... 43,4
Суперфосфат...............196,7
Фосфориты................. 53,6
Борные минералы . '........ 3,8
На отечественных заводах в 1912 г. было выработано:
ТЫС. т
Суперфосфата...............150,1
Сульфата натрия............ 71,0
Хлорной извести............ 26,3
Сернокислого глинозема и
квасцов................... 19,6
Поташа..................... 16,4
Сернистого натрия........... 2,9
Хлористого бария............ 2,1
Медного купороса............ 1,0
тыс. т
Силикатов Na и К...........12,8
Сульфата аммония ..........11,0
Хлористого цинка ......' 6,7
Железного купороса......... 1,7
Сульфата магния............ 1,0
Хромпика натриевого .... 0,9
Тиосульфата натр.чя........ 0,04
Кремнефторида натрия .... 0,04
Фторидов и HF.............. 0,02
После Октябрьской революции вместе с созданием в СССР
мощной химической промышленности получило широкое развитие
и производство минеральных солей.
В период гражданской войны большинство химических пред-
приятий было полностью или частично разрушено. В 1920—1921 гг.
было произведено всего около 25 тыс.т разных солей. В связи.с
38
Гл. 1. Минеральные соли в народном хозяйстве
выполнением плана ГОЭЛРО были восстановлены и построены но-
вые солевые производства на ряде химических заводов, превратив-
шихся в крупные предприятия (Щелковский, Чернореченский, Бон-
дюжский и др.). Были пущены новые производства сернистого нат-
рия, тиосульфата, магнезии, квасцов, хлористого цинка и пр.
В результате широко развернувшихся геологоразведочных ра-
бот уже в годы первой пятилетки (1928/1929—1932/1933 гг.) основ-
ная химическая промышленность получила возможность использо-
вать хибинские апатиты, Соликамские калиевые соли, карабогаз-
ский сульфат и многие другие виды отечественного сырья. Это
создало предпосылки для широкого развития производства мине-
ральных солей, в первую очередь минеральных удобрений. Наряду
с коренной реконструкцией старых предприятий в годы первой
пятилетки построили крупные химические комбинаты (Воскресен-
ский, Невский, Константиновский, азотно-туковые заводы — Берез-
никовский, Новомосковский, Горловский, Соликамский калийный
комбинат и др.), производящие значительные количества мине-
ральных удобрений и других солей. За первую пятилетку произ-
водство суперфосфата увеличилось почти в 4 раза, а минеральных
солей для промышленных нужд — на 30%. Заново организовали
и значительно расширили производства плавиковой кислоты и фто-
ристых солей, борной кислоты, солей мышьяка и хрома, сернокис-
лого глинозема и др.
В 1933—1937 гг. выпуск фосфорных удобрений вырос в 3,2 раза,
а азотных — в 18 раз. Всего в 1937 г. было выработано около
3,2 млн. т минеральных удобрений (в условных единицах*), в том
числе ~1,5 млн. т суперфосфата. За счет широкого использова-
ния апатитового концентрата среднее содержание усвояемого Р2О5
в суперфосфате повысилось с 14,6 до 18,5%. В эти годы также рас-
ширилось производство калийных удобрений, солей бария, солей
сульфитного ряда, медного купороса и др.
XVIII съезд ВКП(б) объявил третью пятилетку (1938—1942гг.)
пятилеткой химии. За эти годы продукция химической промыш-
ленности должна была вырасти в 2,4 раза. В первые годы пяти-
летки вошли в строй многие химические предприятия, в том числе
Кемеровский и Днепродзержинский азотно-туковые комбинаты
(1939 г.), Чирчикский комбинат (1940 г.) и др. Производство су-
перфосфата в 1940 г. по сравнению с 1913 г. увеличилось в 66 раз
(в натуре). К началу Великой Отечественной войны СССР распо-
лагал развитой основной химической промышленностью и мощ-
ными сырьевыми ресурсами для ее дальнейшего роста. Были от-
* При подсчете общего баланса удобрений их весовые качества принято вы-
ражать в условных единицах: для азотных удобрений в пересчете на азот стан-
дартного коксохимического сульфата аммония (20,5% N); для фосфатных —
в пересчете на содержание 18,7% усвояемой РгО5; для калийных — в пересчете
на 41,6% К2О.
Развитие производства солей в СССР
39
крыты новые месторождения природных солей и минералов — фос-
форных, калийных, борных и многих других.
Ущерб, нанесенный химической промышленности войной, был
быстро ликвидирован. Уже в 1944 г. продукция химической про-
мышленности превысила довоенный уровень. В последующие годы
были построены новые предприятия (Кокандский, Джамбульский,
Сумской, Северодонецкий, Руставский, Навоийский, Кейдайнский
и другие заводы и комбинаты, Березниковские и Солигорские ка-
лийные фабрики и прочие предприятия), вырабатывающие мине-
ральные удобрения и разнообразные соли.
Резко изменилась техника производства. Были освоены непре-
рывные способы производства (в частности, суперфосфата), новая
мощная аппаратура, в значительной мере механизированы трудо-
емкие работы, стала широко использоваться автоматизация. Стали
выпускаться новые виды удобрений и солей, в частности гранули-
рованные продукты (суперфосфат, аммиачная селитра и др.).
В 1954 г. производилось уже 14 видов минеральных удобрений и
16 видов неорганических ядохимикатов (а вместе с органиче-
скими 45).
Большое значение для дальнейшего развития производства
минеральных удобрений и многих других солей имели решения
сентябрьского (1953 г.) Пленума ЦК КПСС по развитию сельского
хозяйства, майского (1958 г.) Пленума ЦК КПСС по ускоренному
развитию химической промышленности и утвержденные XXI съез-
дом КПСС (1959 г.) контрольные цифры развития народного хо-
зяйства СССР на 1959—1965 гг. В соответствии с этими реше-
ниями производство минеральных удобрений в 1965 г. достигло
31,3 млн. т в условных единицах или 7,4 млн. т в виде питатель-
ных веществ (N + Р2О5 + К2О). В 1966 г. сельскому хозяйству
были поставлены (в условных единицах): 12,9 млн. т азотных,
ТАБЛИЦА 4
Динамика роста производства минеральных удобрений в СССР
(в условных единицах)
Годы Млн. т Годы Млн. т Годы Млн. т Годы Млн. т
1913 0,2 1955 9,6 1960 13,8 1965 31,3
1928 о,з 1956 10,9 1961 15,3 1966 35,8*
1932 1,0 1957 Н,7 1962 17,3 1967 40,1 **
1937 3,2 1958 12,4 1963 19,9 1968 43,43*
1950 5,5 1959 12,9 1964 25,6 1969 46,0 4*
* 8,4 млн. т питательных веществ.
** 9,4 млн. т питательных веществ.
’* 10,2 млн. т питательных веществ.
10,8 млн. т питательных веществ.
40
Гл. I. Минеральные соли в народном хозяйстве
Рис. 1. Производство минеральных удо-
брений в СССР (в млн. т).
4,6 млн. т калийных, 8,9 млн. т фосфорных удобрений и 4,0 млн. т
фосфоритной муки61. Динамика роста производства минеральных
удобрений в нашей стране показана в табл. 4 и на рис. 1.
Директивами XXIII съезда КПСС (1966 г.) было предусмотрено
дальнейшее значительное увеличение выпуска минеральных удо-
брений. В соответствии с постановлением ЦК КПСС и Совета Ми-
нистров СССР (май 1968 г.) общая мощность производств, вы-
рабатывающих удобрения за
период с 1968 по 1972 гг., дол-
жна увеличиться на 48 млн. т.
Дальнейший рост произ-
водства минеральных удобре-
ний и солей должен будет со-
провождаться глубокими усо-
вершенствованиями в методах
их получения, ростом произво-
дительности труда, повышени-
ем степени использования
сырья и энергии, улучшением
качества продукции и сниже-
нием ее стоимости. Развитие
промышленности минеральных
удобрений должно, в частно-
сти, идти по пути увеличения
выпуска комплексных, высококонцентрированных удобрений, рас-
ширения их ассортимента. Важной задачей является освоение
новых видов сырья и строительство новых туковых предприятий
в районах значительного потребления удобрений, особенно .на
востоке страны.
Некоторым резервом поставок удобрений сельскому хозяйству
является устранение их потерь при доставке от производителей
к потребителям за счет рационализации методов транспорта, пере-
грузок и т. п. Эти потери пока еще чрезвычайно велики — они со-
ставляют 15—20%. Их уменьшение равнозначно повышению по-
лезной мощности предприятий без капитальных затрат.
КРАТКИЕ СВЕДЕНИЯ О МИРОВОМ ПРОИЗВОДСТВЕ УДОБРЕНИЙ
И СОЛЕЙ62-76
Производство минеральных удобрений во всем мире в 1965/66 гг.
составило 48,1 млн. т питательных веществ (N + Р2О5 + КгО) 62.
Средняя концентрация питательных веществ в удобрениях
(1966 г.) —в США 37,6%, в ФРГ 31,5%. На основании данных ко-
миссии по пищевым и сельскохозяйственным ресурсам (FAO) при
Организации Объединенных наций, учитывающих рост населения
земного шара, прогнозируется следующая мировая годовая по-
Сведения о мировом производстве удобрений и солей
41
требность в питательных веществах для растений, необходимая
для предотвращения голода во многих странах мира (в млн. т)63:
в 1975 г. 86 млн. т (39N + 28P20s + 19KzO); в 1985 г. 144 млн. т
(67N + 47Р20г + ЗОКгО). На эти же годы общая потребность в
фосфоритной руде (в натуре) должна составить соответственно
130 и 220 млн. т, потребность в сере (все виды сырья для произ-
водства серной кислоты и др.) 53 и 93 млн. т, потребность в ам-
миаке 60 и 102 млн. т.
Мировое производство азотных удобрений (в пересчете на эле-
ментарный азот) составило в 1967/68 г. 24,6 млн. т, а мощность
заводов аммиака достигла 36 млн. т №4. Около трех четвертей
вырабатываемого аммиака расходуется на производство удобре-
ний65. Особенно значительно растут производства аммиачной се-
литры, карбамида и комплексных азотных удобрений. Доля жид-
ких азотных удобрений превысила 15%N. В США потребление
жидких удобрений составило в 1964/65 г. 4,9 млн. т, т. е. 18% от
общего количества удобрений (питательных веществ); около
2 млн. т или 47% внесенного в почву азота поступило в виде
жидких удобрений, из них более 1,3 млн. т в виде безводного ам-
миака и более 0,5 млн. т в виде солевых растворов 66’67. Потребле-
ние последних превысило 1 млн. т и составило ~6% от общего
потребления тукосмесей в США 68.
Мировая добыча фосфоритов в 1967 г. составила 76,6 млн. т,
в том числе в США 35,4 млн. т и в странах Африки 19,3 млн. т71.
80% от общего количества фосфоритов добывается в США, СССР
и Марокко. Общее производство фосфорных удобрений к 1967 г.
достигло 18 млн. т Р2О5, в том числе в Америке 5,7 (в США ~5),
в Западной Европе 4,9 (из них ~25% в виде основных шлаков),
в Азии 1,5, в Океании 1,3 (в Австралии ~1), в Африке 0,6 млн. т.
В последние годы резко увеличивается производство фосфорной
кислоты, двойного суперфосфата, фосфатов аммония и непрерыв-
но снижается выпуск простого суперфосфата. Доля Р2О5, выпус-
каемая в виде смешанных и сложных удобрений, значительно воз-
растает. Производство кормовых фосфатов колеблется в пределах
2—3 млн. т в год Р2О5 72.
В США для производства удобрений используют около 50%
добытого фосфорита, 25% расходуют для нужд других отраслей
промышленности и 25% экспортируют. Производство простого су-
перфосфата в США уменьшилось с 1,63 млн. т P2Os (80% от всего
РгО5) в 1952 г. до 0,9 млн. т Р2О5 (20%) в 1966 г.; в виде двойного
суперфосфата и аммофосов выпускают около 80% Р2О5. В 1967 г.
мощность цехов двойного суперфосфата достигла 2,17 млн. т
РаО5, а фосфата аммония — 3,08 млн. т Р2О5. Число установок су-
хого смешения удобрений достигло в США 2500, на них смешивают
более 20% всех вырабатываемых удобрений73. Мощность устано-
вок по производству фосфора к 1970 г. 720 тыс. т74. 80% всей
42
Гл. I. Минеральные соли в народном хозяйстве
производимой в США фосфорной кислоты получают экстракцион-
ным способом 74.
Мировое производство калийных солей составило в 1965 г.
13,4 млн. т К2О, в том числе в США 2,85, в ФРГ 2,38, в ГДР 1,83,
во Франции 1,81, в Канаде 1,25 млн. т. В 1966 г. во всех странах
было выработано 14,4 млн. т К2О 75. Большая часть калийных удоб-
рений выпускается в виде хлористого калия, содержащего 50—60%
К2О. Меньше 10% от общего количества К2О выпускается в виде-
сульфата калия.
Среднее потребление всех видов удобрений (сумма питатель-
ных веществ) в кг на 1 га пахотной земли составляет: в Голландии
более 500, в Бельгии, ФРГ, Японии 300—400, в Англии, Франции
ТАБЛИЦА 5
Производство некоторых минеральных солей
и других продуктов в США в 1966 г.
Название Тыс. т
Нитрат аммония для твердых удо- брений Нитрат аммония для жидких удо- брений . . . . Нитрат аммония для взрывчатых веществ , , . Нитрат аммония Триполифосфат натрия Кислый пирофосфат натрия .... Пирофосфат натрия Метафосфат натрия Тринатрийфосфат Тетракалийпирофосфат Фосфор элементарный Фосфорная кислота (100% Р2О5) . . в том числе термическая . . . » » » экстракционная . . Простой суперфосфат (100% Р2О5) Двойной суперфосфат (100% Р2О6) Фосфат аммония (100% Р2О6) . . . Преципитат Сульфат алюминия » натрия Карбид кальция Соляная кислота (100% НС1) . . . Фтористоводородная кислота (100% HF) Азотная кислота (100% HNO3) . . Серная кислота (100% H2SO4) . . . 2070* 1800 * 369 * 5040 ** 936 24,3 103,5 78,3 52,2 51,3 6! > ** 4023 873 3159 900 1360 1360 230* 963 1379 1035* 1327,5 148,5 4455* 21802,5*
* 1965 г.
** 1967 г.
Литература
43
и некоторых других странах Западной Европы 150—200, в США
50—60. В СССР в 1967 г. среднее потребление питательных ве-
ществ составило около 50 кг!га (при общей посевной площади
207 млн. га).
В табл. 5 приведены данные____________о производстве некото-
рых минеральных солей вТША в 1966 г.'7В.
ЛИТЕРАТУРА
1. Д. Н. Прянишников, Избранные сочинения, т. I, II и III, Сельхозгиз,
1952—1953. — 2. Агрономическая химия, под ред. А. Г. Шестакова, Сельхоз-
гиз, 1954. — 3. Д. А. Сабинин, Минеральное питание растений, Изд. АН СССР,
1940.—4. А. В. Владимиров, Физиологические основы применения азотистых
и калийных удобрений, Сельхозгиз, 1948. — 5. А. В. Соколов, Агрохимия фос-
фора, Изд. АН СССР, 1950. — 6. Е. И. Ратнер, Питание растений и примене-
ние удобрений, Изд. АН СССР, 1955. — 7. Справочник агронома по удобрениям,
Сельхозгиз, 1955. — 8. Т. П. У н а н я и ц, Минеральные удобрения, Госхимиздат,
1949. — 9. К. М. Малин, Химия и урожай, Госхимиздат, 1955.— 10. Л. А. Пен-
ч е в а, Б. А. Ко пыл ев, М. Е. П о з и и, Изв. вузов. Хим. и хим. техиол., 10, 319
(1967); 12, 54 (1969).
11. Гранулированные удобрения, Сборник работ ВИУАА за 1950 г., 1952. —•
12. Н. С. Авдонин, Гранулированные удобрения, Сельхозгиз, 1952.—
13. М. Я. Школьник, Значение микроэлементов в жизни растений и в земле-
делии, Изд. АН СССР, 1950. — 14. М. В. Каталымов, сб. «Исследования по
прикладной химии», Изд. АН СССР, 1955, стр. 325. — 15. О. К. Добролюб-
ркий, ЖПХ, 28, № 9, 1022 (1955). — 16. М. В. Каталымов, Микроэлементы
й их роль в повышении урожайности, Госхимиздат, 1957. — 17. Микроэлементы
В жизни растений и животных, Изд. АН СССР, 1952. — 18. М. Л. Кругляков,
Машины для внесения удобрений в почву, Машгиз, 1953. —19. Н. А. М и и х,
Машины для внесения удобрений в почву, Сельхозгиз, 1954. — 20. Техника вне-
сения удобрений, под ред. Е. В. Бобко, Сельхозгиз, 1938.
21. Сб. «Усовершенствование техники внесения удобрений», Изд. АН УССР,
Киев, 1955. — 22. И. П. Сердобольский, Химия почвы, Изд. АН СССР,
1953. — 23. С. И. Вольфкович, Н. Н. Мельников, В. И. Орлов, Хим.
пром., № 6, 321 (1954). — 24. Н. Е. Пестов, Физико-химические свойства зер-
нистых и порошкообразных химических продуктов, Изд. АН СССР, 1947. —
25. Т. П. У н а н я н ц, Словарь по удобрениям, Госхимиздат, 1948.—
26. С. И. Вольфкович, Химия в сельском хозяйстве, Изд. АН СССР, 1963.—
27. П. В. П о п о в, Справочник по ядохимикатам, Госхимиздат, 1956.—•
28. Д. фрир, Химия иисектисидов и фунгисидов, ИЛ, 1948. — 29. Н. Н. Мель-
ников, Хим. пром., № 1, 20 (1951). — 30. Ю. А. Баскаков, Н. Н. М е л ь н и-
ков, Там же, № 7, 435 (1955).
31. И. И. Г у и а р, М. Я. Березовский, Химические средства борьбы
с сорняками, Сельхозгиз, 1952. — 32. В. Ф. Верзилов, Н. Н. Долгополов,
Стимуляторы роста растений и их применение в зеленом строительстве, Изд. АН
СССР, 1951. — 33. Е. G. Lodeman, The Spraying of Plants, New York, 1916.—
34. Д. Альгреи, Г. Клиигмэн, Д. Вольф, Борьба с сорными растениями,
ИЛ, 1953. — 35. L. М. Stabler, J. Agr. Food. Chem., 1, 193 (1953).—
36. H. E. Д e к а т о в, Химические средства борьбы с сорной растительностью
в леснрм хозяйстве, Гослесбумиздат, 1958. — 37. А. Л. Ефимов, Химический
метод борьбы с вредителями и болезнями сельскохозяйственных растений, Сель-
хозгиз, 1949.— 38. В. И. Орлов, П. В. П о п о в, М. А. Морозова, М. Г. Г а б-
риелова, Ядохимикаты (инсектисиды и фуигисиды), Краткий справочник, Гос-
химиздат, 1946. — 39. Д. Г. Хорсфолл, Фуигисиды и их действие, ИЛ, 1948. —
44
Гл. I. Минеральные соли в народном хозяйстве
40. А. Л. Е ф им о в, Справочник по применению ядов для борьбы с вредителями
и болезнями растений, Сельхозгиз, 1956.
41. В. С. Чувахин, К. С. Муш ников а, Б. Н. Пастухов, С. Д. По-
пов, Б. А. Герасимов, П. В. 3 а р и н г, Пособие по борьбе с вредителями и
болезнями сельскохозяйственных культур, Сельхозгиз, 1945. — 42. А. Л. Ефи-
мов, И. А. К а з а с, Инсектициды и фунгициды, Сельхозгиз, 1940.— 43. А. М. Н и-
к и ф о р о в, Борьба с вредителями и болезнями сельскохозяйственных культур,
Сельхозгиз, 1954.—44. Н. Н. Мельников, Ю. А. Баскаков, К- С. Бока-
рев, Химия гербицидов и стимуляторов роста растений, Госхимиздат, 1954.—
45 В И Орлов, Хим. пром., № 6, 377 (1956). — 46. R. С. Roark, Chem. Eng.
News, 22, № 17, 1464 (1944). — 47. В. И. Орлов, Хим. пром., № 11, 23 (1945).—
48. В. И. Орлов, К. А. Г а р, Там же, № 9, 1 (1946). — 49. В. И. Орлов,
К. А. Г а р, М. Г. Габриелов а, Там же, № 11, 341 (1947). — 50. Л. И. М е р-
ведь, Журн. ВХО, 9, № 5, 561 (1964).
5/. С. Н. Иванова, Там же, 9, № 5, 496 (1964). — 52. Н. Н. Мельни-
ков, Хнм. пром., № 6, 181 (1950). — 53. И. С. Попов, Кормление сельско-
хозяйственных животных, Сельхозгиз, 1951. — 54. М. М. Дьяков, Ю. В. Голу-
бенцева, Минеральное питание сельскохозяйственных животных, Сельхозгиз,
1947. — 55. А. И. Ш е р е ш е в с к и й, Т. П. У н а н я н ц, Г. Я. Б а х а р о в с к и й,
Химические товары, Справочник, ч. 1, Изд. «Химия», 1967. — 56. П. М. Лукья-
нов, История химических промыслов и химической промышленности России,
т. I—III, Изд. АН СССР, 1948—1951. — 57. М. А. Блох, Развитие и значение
химической промышленности, НХТИ, 1920.— 58. Н. Н. Калмыков, С. А. В а й с-
б е й н, Экономика социалистической химической промышленности, Госхимиздат,
1955. — 59. Н. Н. Некрасов, Химизация в народном хозяйстве СССР, Гос-
политиздат, 1955. — 60. Н. Н. Некрасов, Экономика химической промышлен-
ности, Изд. «Советская наука», 1957.
61. Союз Советских Социалистических Республик. 1917—1967, Изд. «Совет-
ская энциклопедия», 1967, стр. 234. — 62. Bombay Market, 30, № 23, 89 (1967);
Agr. Chem., 23, № 5, 48 (1968). — 63. C. J. Pratt, Chem. Eng. Progr., 63, № 10,
37 (1967). — 64. Nitrogen, № 51, 1, 14 (1968); Chem. Eng. Progr., 64, № 5, 49
(1968); H. А. Симулин, Хим. пром., № 2, 106 (1969). — 65. D. E. C h a 1 k 1 e у,
W. Turner, Viland Gas Internet., 7, № 10, 49 (1967). — 66. W. C. Scott,
J A. Wilbanks, Chem. Eng. Progr., 63, № 10, 58 (1967). — 67. Nitrogen,
№ 49, 25 (1967). — 68. Ibid., № 43, 13 (1966); Agr. Chem. 22, № 10, 32
(1967). — 69. С. И. Вольфкович, Агрохимия, № 9, 3 (1965). — 70. Г. Л. Ко-
реньков, Н. А. Устинова, Горнохимическое сырье зарубежных стран, Изд.
«Химия», 1965, гл. 17-
71. Phos. a. Pot., № 32, 1 (1967) № 34, 1 и 3 (1968). — 72. Chem.
Age (India), 18, № 7, 482 (1967); Chem. Eng. News, 46, № 37, 107A (1968). —
73. T. McBride, J. R. Camp, World NPKS, № 7, 3 11967). — 74. Chem. Eng.
News. 46, № 13, 29 (1968). — 75. M. R. Freeman, Mining Ann. Rev., 80 (1967).—
76. Chem. Eng. News, 43, № 36, 100 (1965); 44, № 36, 72 (1966).
Глава II
РАСТВОРИМЫЕ СОЛИ В ПРИРОДЕ И МЕТОДЫ
ИХ ДОБЫЧИ
Отрасль химической технологии, изучающая способы получе-
ния и первичной переработки растворимых природных солей, на-
зывается галургией. Основным галургическим методом является
тепловая обработка естественных и искусственно приготовленных
водных растворов природных солей. Нагреванием, испарением и
охлаждением этих растворов, их смешением и обработкой ими ис-
копаемых солей при определенных температурах достигают выде-
ления тех или иных продуктов. Иногда галургические приемы со-
вмещают с более глубокой химической переработкой. Главными
продуктами галургических производств являются: хлорид и суль-
фат натрия; соли калия, магния, бора; бром, иод и их соли; при-
родная сода и др.
Галургия базируется на классических работах Я- Г. Вант-Гоф-
фа, Н. С. Курнакова и их школ по физико-химическому анализу
солевых систем. Эти работы позволили выявить условия кристал-
лизации солей из рассолов. На их основе Я. Г. Вант-Гофф создал
теорию образования природных соляных залежей.
ОБРАЗОВАНИЕ СОЛЯНЫХ ЗАЛЕЖЕЙ
В земной коре и на ее поверхности наряду с залежами различ-
ных не растворимых в воде минералов находятся залежи раство-
римых минералов — солей, встречающихся как в виде твердых
отложений, так и в виде растворов. Эти залежи возникали на про-
тяжении многих геологических периодов жизни земли, когда созда-
вались благоприятные для их появления геохимические, гидрогео-
логические и климатические условия. Источником этих залежей
является морская вода, из солей которой образовались и место-
рождения ископаемых солей, и соляные озера, и подземные рас-
солы '
46
Гл. II. Растворимые соли и методы, их добычи
При испарении морской воды, проникавшей в бессточные кот-
ловины, концентрация солей постепенно повышалась. Из насыщен-
ных рассолов кристаллизовались соли, образовавшие в течение
длительного времени мощные напластования. Часто испарение
воды происходило при последовательном перемещении через не-
сколько котловин с ограниченным стоком, что приводило к обра-
зованию солевых залежей различного состава, соответствующих
составу солей, выделявшихся в разных стадиях испарения. Соле-
отложение продолжалось и в зимние периоды, при понижении тем-
пературы рассолов, что также приводило к изменению состава
кристаллических фаз.
Концентрации и соотношение солей в воде мирового океана в
разные геологические эпохи не оставались неизменными. Менялась
и последовательность кристаллизации солей. К изменению состава
первичных соляных отложений и к образованию вторичных место-
рождений приводило размывание уже образовавшихся первичных
залежей грунтовыми водами и рассолами. Существенную роль в
этих процессах играют химические взаимодействия растворов с
окружающими их материковыми породами. Наконец, значительное
влияние на формирование солевых залежей и на последующие
изменения их оказывают тектонические явления 2.
Все эти процессы, продолжающиеся и в настоящее время, при-
вели к образованию многочисленных месторождений растворимых
солей — соляных озер и их донных отложений, подземных с. опле-
ний рассолов и мощных твердых залежей, состоящих из покры-
вающих друг друга солевых пластов различного состава. Вслед-
ствие осадочного происхождения твердые солевые отложения, на-
ходящиеся в геологически не нарушенных районах, залегают в
виде пологих пластов разной толщины, измеряемой десятками и
сотнями метров и распространяющихся на значительных простран-
ствах. Твердые хлориды натрия и калия обладают пластичностью,
вследствие чего они часто встречаются в месторождениях, имею-
щих форму соляных куполов, которые образовались в результате
выдавливания этих пластичных горных пород к земной поверхно-
сти. Такие соляные купола, обычно овальной формы, достигают
2—3 км в длину и опускаются в глубь земли на сотни и даже ты-
сячи метров.
Главными компонентами солевых залежей являются хлоридные
и сульфатные соединения натрия, магния, калия и кальция. В твер-
дых отложениях они встречаются в виде различных минералов —
простых и сложных солей, безводных и кристаллогидратов. Осо-
бенно распространены: галит NaCl, мирабилит Na2SO4- ЮН2О, те-
нардит Na2SO4, эпсомит MgSO4 • 7Н2О, астраханит Na2SO4 • MgSO4 •
»4Н2О; сильвин КС1, карналлит КС1 • MgCl2 • 6Н2О, каинит КС1 •
*MgSO4-3H2O и др. Во многих отложениях находятся соли бро-
Природные рассолы и классификация соляных озер
47
ма, бора, кцрбонаты (например, сода NaCO3 • IOH2O) и др. Реже
встречаются нитраты (например, NaNO3).
Солевые залежи—природные рассолы и твердые отложения —
во всех случаях содержат основные компоненты морской воды3-6.
В морской (океанской) воде находится в среднем около 3,5% раз-
личных солей (34—38 г/л при плотности океанской воды 1,024—
1,029 г!смй). Около 78% солевой массы морской воды прихо-
дится на долю хлорида натрия. Если бы из морской воды могли
быть извлечены все соли и распространены на площади всех мо-
рей и океанов (360 000 000 км2), то толщина такого солевого пласта
превышала бы 60 м, из которых 48 м приходилось бы на долю
NaCl. Четыре соли, связанные уравнением
2NaCl + MgSO4 Na2SO4 + MgC12
составляют 93% от веса сухого остатка океанской воды; на долю
солей калия, кальция и брома приходится около 6%, а всех осталь-
ных соединений, в том числе газообразных и органических, око-
ло 1%.
Вода океанов более концентрированная, чем вода морей, так как
последние питаются пресными водами рек*.
Запасы природных солей на территории СССР практически не-
исчерпаемы. Распространение отложений солей натрия, калия, маг-
ния в нашей стране связано с определенными геологическими пе-
риодами, главным образом Пермского моря, простиравшегося на
нынешней территории Европейской части СССР от Белого до Кас-
пийского морей, а также Арало-Каспийского бассейна и др. Древ-
ние моря, покрывавшие громадные поверхности Земли, оставили
после своего исчезновения мощные залежи ископаемых солей и
многочисленные соляные озера. По своему географическому распо-
ложению соляные месторождения образуют так называемый соля-
ной пояс, охватывающий большую часть территории СССР, от
нижнего течения Дуная до Якутии, и переходящий в пределы
Монголии и Китая7. Озерные месторождения солей относятся к
наиболее молодым месторождениям полезных ископаемых, насчи-
тывающим около 8—40 тыс. лет. Многие из соляных озер образо-
вались в современную эпоху. В то же время соляные пласты неко-
торых озер (например, Баскунчак, Эльтон и др.) образовались в
межледниковые эпохи и возраст их исчисляется десятками ты-
вяч лет.
ПРИРОДНЫЕ РАССОЛЫ И КЛАССИФИКАЦИЯ СОЛЯНЫХ ОЗЕР
В современных условиях главными источниками соленакопле-
ния в СССР являются соляные озёра. Под влиянием внешних
* Состав и концентрацию солей в некоторых водоемах см. в табл. 12 на
стр. 109. '
48
Гл. II. Растворимые соли и методы их добычи
।
факторов в них непрерывно протекают постоянные, периодические
и циклические процессы, направленные в сторону достижения рав-
новесных состояний8. Постоянные процессы вызываются воздей-
ствием среды на озерный рассол, которое ведет к односторонне
направленному постепенному изменению его химического состава.
Такие процессы называются процессами метаморфизации рассо-
лов; они сопровождаются образованием, постоянных осадочных
отложений — малорастворимых продуктов метаморфизации: СаСОз,
MgCO3, CaMg(CO3)2, CaSO4 • 2НоО и др. Периодические процессы
обусловлены многолетними колебаниями климата, а циклические —
изменением климатических факторов в течение года. Под влия-
нием этих процессов образуются периодические твердые фазы —
легкорастворимые соли. Периодические процессы косвенно отра-
жаются и на метаморфизации.
Природные воды, в том числе и воды озер, по концентрации
содержащихся в них растворенных веществ (в вес.%) делятся на
три группы: пресные — меньше 0,1, солоноватые — от 0,1 до 3,5 и
соленые или соляные — больше 3,5. Вода соляных озер называется
рапой, или рассолом. Так называют и жидкую фазу соляных си-
стем.
По химическому составу воды соляных озер, как и другие ми-
нерализованные воды, разделяются на три основных типа: карбо-
натный, ' - - —
твора к
жанием в нем главных ионов: СО.Г, НСОз, SO4-, СГ, Са2+, Mg‘
и Na+.
сульфатный и хлоридный9. Принадлежность озерногорас-
tomv или иному типу определяется относительным содер-
.2+
Она устанавливается по так называемым коэффициентам Я
метаморфизации Км — характерным отношениям концентраций Я
(в %) главных солей в растворе. Изменение коэффициентов мета-Я
морфизации по времени года (уменьшение и возрастание) повто- Я
ряется циклически в течение многих лет (годичные циклы). Изме- 1
нение величины коэффициентов метаморфизации в годичном цикле |
является следствием изменения температуры и состава рапы, а из- I
менения за длительные периоды времени обусловливаются воздей- 1
ствием материка на питание водоема, влиянием донных отложений, |
а также биологическими процессами 10. |
В качестве коэффициентов метаморфизации пользуются следую- |
Na2CO3 + NaHCO3 Na2SO4 MgSO4 MgCl2 |
щими отношениями: —2-cri----------; .- . ]
N&2SO4 M.gSO4 M.gC12 CsClj я
Озера карбонатного типа («содовые» озера) содержат в каче- |
стве основных компонентов Na2CO3, NaHCO3, Na2SO4 и NaCl; они |
характеризуются величиной коэффициента метаморфизации I
„ Na2CO3 + NaHCO3 Я
Км =------кг-сп-----> значение которого может изменяться в ши- Я
л .» N а 2 SO 4 я
роких пределах — от 0 до оо; для этих озер /См = <*°* ТЭК 1
как MgSO4 в них не содержится. Я
Природные рассолы и классификация соляных озер
4Ь
Озера сульфатного типа, в которых главными компонентами
являются сульфаты и хлориды натрия и магния, разделяются на
два подтипа: сульфатнонатриевый и сульфатномагниевый (хлор-
магниевый). Первый из них не содержит MgCl2 и характеризуется
, , л, а Na2SO4 MgSO4
коэффициентом метаморфизации 0 < < оо; здесь =
= оо. Второй содержит MgCl2, но не содержит Na2SO4, поэтому
=» 0, а характерный для этого случая коэффициент мета-
MgSO4
морфизации называемый коэффициентом Курнакова11 /<мК,
a ^MgSO4 .
меняется в пределах 0<~MgCj2' <°°-
Для озер хлоридного типа, не содержащих сульфатов натрия и
магния. Дмк = 0; для них характерным коэффициентом является
0<-cfci7<o°-
По величине коэффициента Курнакова соляные озера делят так-
же на озера первого и второго класса. Для океанской воды
Кмк = 0,7. Соляные озера, в которых Кмк < 0,7 (от 0,7 до 0) от-
носят к первому (морскому) классу; бессульфатные озера, для ко-
' торых КмК = 0, относят ко второму классу. При такой классифи-
кации к сульфатным озерам относят те, в которых Кмк > 0,7.
Главными среди многих природных явлений, приводящих к ме-
таморфизации рассолов, являются:
1) взаимодействие компонентов двух рассолов при их смеше-
нии с образованием осадков;
2) ионообменные процессы, протекающие при участии кол-
лоидных частиц иловых отложений, которые накапливаются на
дне озер в результате разрушения окружающих почв и горных
пород;
3) биохимические процессы, протекающие с участием микро-
организмов в рассолах и илах, содержащих органические веще-
ства.
Рассмотрим в качестве примеров некоторые пути метаморфиза-
ции. Пресные воды, питающие озеро, несут в него Са(НСО3)2, об-
разующийся при выщелачивании известковых пород с участием
СО2 воздуха. Взаимодействие бикарбоната кальция с сульфатом
магния
MgSO4 + 2Са(НСО3)2 CaSO4 • 21ДО + CaMg(CO3)2 + 2СО2
приводит к уменьшению содержания в рапе MgSO4 и может пони-
вить коэффициент метаморфизации MgCjy Д° нуля, — озеро ста-
йет бессульфатным. Дальнейшее взаимодействие бикарбоната
кальция с хлоридом магния
MgCl2 + 2Са(НСО3)2 CaMg(CO3)2 + СаС12 + 2Н2О + 2СО,
1
50
Гл. II. Растворимые соли и методы их добычи
приводит к появлению в рассоле СаС12. Таким образом осуществ-
ляется постепенный переход озер из сульфатных в хлоридные с од-
новременным образованием осадочных пород. Питание же озера
морского типа речной водой, содержащей сульфат натрия, приво-
MgSO4
дит к увеличению отношения ~д^С12 > т. е. к превращению озера
в сульфатное. В этом процессе большую роль играют ионообмен-
ные реакции. Биохимические процессы приводят, в частности, к
восстановлению сульфатов и выделению сероводорода под влия-
нием СО2 воздуха; в резуль-
тате этого содержание суль-
фатов в озере уменьшает-
ся.
Направление процессов
метаморфизации зависит и
от климатических условий.
В сухом климате происхо-
дит постепенное изменение
типа рассола от карбонат-
ного к сульфатному и затем
к хлоридному, — это прямой
или нормальный путь мета-
морфизации; во
климате процесс метамор-
физации идет в обратном
направлении (рис. 2) и.
в озерах других, не основных
Na2SO4
S»/\ натриевый/\2.
Na2CO3(NaHCO3)
М8С12
СаС 12
Рис. 2. Схема главных типов природных
рассолов и путей их метаморфизации.
влажном-
Для характеристики содержания
элементов — калия, брома, бора и пр.—пользуются коэффициен-
тами, показывающими отношение концентрации этих элементов
(ионов или солей) к концентрации одной из основных солей или
суммы всех солеи (2С0лей, /о), например —=------- (умножение на
^солей
10я производят, чтобы оперировать с целыми числами). При зна-
чительном содержании К+, Вг_ и других элементов озеро соответ-
ственно называют калийным, бромным. Так, озера, в которых
КС1 • 103 on КС1 • .
—2------->20 и N с— > 1, называют хлоркалиевыми.
По соотношению содержащихся в озере жидкой и твердых фаз
различают рапные, сухие и подпесочные озера. Рапные озера
сохраняют в течение всего года поверхностный слой рапы, покры-
вающий илистбе дно или донные отложения солей; порядок напла-
. стования солей в этих отложениях соответствует последователь-
ности их политермической кристаллизации, вследствие чего в верх-
них слоях оказываются наиболее растворимые соли12. В сухих
озерах уровень рапы находится ниже обнаженной поверхности
донных отложений, — она покрывается небольшим слоем рапы
Природные рассолы и классификация соляных озер
51
лишь во влажный период года. В подпесочных озерах уровень дон-
ной рапы в течение всего года значительно ниже поверхности твер-
дых солевых отложений, которая обычно покрыта слоем наносов
(песка и др.); эта стадия существования соляного озера предше-
ствует переходу в соляную залежь. В сухих и подпесочных озерах
нижние пласты соляных отложений могут содержать более рас-
творимые соли, чем верхние.
Слой соли, выкристаллизовавшейся в озере в течение опреде-
ленного периода года, соответствующего по климатическим усло-
виям садке этой соли (например, галита летом или мирабилита
зимой), называется новосадкой13. Слой новосадки может частично
или полностью растворяться в течение этого же года в сезон, сле-
дующий за садочным, когда рапа озера вновь окажется ненасы-
щенной этой солью. Соль, оставшаяся нерастворенной в течение
годичного цикла, слой которой сохранился в донном отложении,
называется старосадкой. Она появляется, когда донная рапа до-
стигает насыщения. Отложения старосадки характеризуются слоис-
тостью, соответствующей годичным циклам ее образования. Под
слоем старосадки образуется корневая соль, появляющаяся в ре-
зультате вторичных процессов перекристаллизации. Корневая соль
может быть представлена минералами, образовавшимися при
взаимодействии старосадки с донной рапой в результате измене-
ния ее состава, температуры и др. Корневая соль (соляной пол)
может состоять из галита, эпсомита, астраханита, глауберита и
мирабилита. Она играет большую роль как регулятор насыщения
рапы и садки солей. В период влажного лета в озерах без корне-
вой соли рапа может сильно обводниться с прекращением садки —
насыщение рапы и садка соли произойдет лишь в следующем
засушливом сезоне. Это нарушает равномерную работу про-
мысла.
Озера, в которых отложения солей представлены только перио-
дически образующейся и растворяющейся новосадкой, называются
самосадочными. Озера же, имеющие, кроме новосадки, отложения
старосадки и корневые, называются корневыми.
В тех озерах, в которых при образовании новосадки рапа ухо-
дит под уровень соли, ее испарение продолжается путем капилляр-
ного поднятия на поверхность новосадки, хотя оно и происходит
в этом случае в 100—200 раз менее интенсивно, чем с открытой по-
верхности озера 14.
При садке солей в озерах имеет место увлечение других солей,
относительно которых раствор не насыщен. При садке галита ко-
личество увлекаемых солей меньше, чем при садке других солей.
При совместном образовании льда и садке солей лед увлекает
около 30—40% выделившихся солей, а остальная их часть обра-
зует донные отложения. В зимних условиях в озерах Забайкалья
и Якутской АССР, а также в Северном Ледовитом океане
62
Г л. II. Растворимые соли и методы их добычи
образуются соляные выцветы на льду — «гуджир», или «ледяные
цветы». Это объясняется увеличением объема при замерзании1S.
Объектами промышленной эксплуатации являются как твердые
озерные отложения, так и рапа — поверхностная, а в сухих озерах
подкорковая, называемая также межкристальной.
Изучение явлений метаморфизации рассолов и законов солена-
копления не только облегчает поиски природных солевых залежей,
но открывает возможность интенсифицировать медленные есте-
ственные процессы, ускорять выделение из природных растворов
полезных минералов, искусственно создавая их месторождения.
Такие методы основаны, например, на перекачке рассола мощными
насосами из одного озера в другое (с рассолом другого состава)
или рассолов из нескольких озер в одну котловину, наиболее вы-
годно расположенную для промышленной разработки солевых от-
ложений, образовавшихся при таком искусственном сливании при-
родных рассолов.
РАЗРАБОТКА ЗАЛЕЖЕЙ ИСКОПАЕМЫХ СОЛЕЙ
Горные разработки
Добыча солей из давно сформировавшихся твердых залежей
производится обычными горными работами. Таким путем извле-
кают из недр каменную соль, тенардит, сырые соли калия: сильви-
нит, карналлит, каинит и др.
Когда верхний горизонт соляного пласта находится на неболь-
шой глубине, его разработку можно производить открытым спо-
собом. В этом случае устраивают карьер или разнос, т. е. удаляют
слой покровных пород и производят выемку соли. На крупных
разработках для этой цели используют экскаваторы, скреперы
с лебедками или с тракторной тягой, механические лопаты и дру-
гие механизмы. Обычно пласт соли предварительно разрыхляется
(дробится) механическим или взрывным способом.
Для мощных пластов, залегающих на большой глубине, откры-
тый способ разработки непригоден. Кроме того, его недостатком
является загрязнение соли наносами пыли, а особенно заливание
карьера атмосферными осадками и почвенными водами. Поэтому
разработку пластовых месторождений ведут обычно подземным
способом путем устройства шахт и выемки соли из галерей или
камер, вырабатываемых в толще соляного пласта 16. Проходка
широких ходов при закладке подземных камер осуществляется
штрекопроходческими комбайнами, врубовыми машинами; про-
ходка скважин — сбоечно-буровыми машинами17; выемка соли и
погрузка — скреперными установками; для транспорта и подъема
соли на поверхность в крупных шахтах используют подземные
вагонеточные электропоезда и лифты 18-2°,
Разработка залежей ископаемых солей
63
Подземное выщелачивание
Грунтовые воды, проникая в залегающий в недрах пласт соли,
размывают его — образуется естественный подземный рассол21.
Такие рассолы могут извлекаться на поверхность через колодцы
или буровые скважины и служить источниками добычи солей22.
Извлечение соли на поверхность в виде рассола проще и дешевле,
чем в твердом виде, и особенно удобно, когда эта соль подвер-
гается дальнейшей переработке в растворе. Поэтому в ряде слу-
чаев оказывается целесообразным осуществлять подземное выще-
лачивание соли из соленосной породы. Этот метод не дает воз-
можности рлиять на состав извлекаемого рассола и поэтому
широко используется пока только для извлечения из недр пова-
ренной соли.
Подземное выщелачивание осуществляют разными способами!
систематическим орошением водой и постепенным размыванием
подземных камер в солевом пласте или затоплением камер; обра-
зующийся концентрированный рассол выкачивается насосами.
В СССР применяют более совершенный способ выщелачивания
через буровые скважины. В скважину, закрепленную колонной
•стальных обсадных труб диаметром 150—250 мм, вставляется
труба меньшего диаметра (75—100 мм). По одной из этих труб
с помощью центробежного насоса высокого давления (20—25 аг)
в пласт соли нагнетается вода. Она растворяет соль и в виде рас-
сола выдавливается на поверхность по другой трубе. Различают
два режима работы скважин — противоточный, когда воду подают
по наружной трубе, а рассол поднимается на поверхность по внут-
ренней (рис. 3), и прямоточный, когда по внутренней трубе подают
йоду, а рассол выдавливается по наружной трубе. Глубина сква-
жин и давление, под которым в нее подают воду, зависят от глу-
бины залегания пласта соли или подземного источника рассола.
Производительность скважины 10—25 м3 рассола в 1 ч. (Иногда
воду подают в скважину самотеком; в этом случае рассол, который
имеет большую плотность, не может достигнуть поверхности за
счет давления столба воды, и его откачивают глубинным насосом,
опущенным в скважину до уровня, определяемого разностью плот-
ностей рассола и воды.)
Камера, образующаяся в пласте соли при размывании его
водой через буровую скважину, постепенно приобретает форму,
близкую к форме опрокинутого конуса, так как в результате
естественной конвекции боковая поверхность, а особенно потолок
камеры, растворяется быстрее, чем дно, покрытое насыщенным
рассолом и шламом механических примесей. Поэтому боковая по-
верхность становится все более пологой и затем покрывается слоем
пустой породы, препятствующим дальнейшему выщелачиванию.
Интенсивность рассолообразования уменьшается, и эксплуатацию
я
64
Гл. II. Растворимые соли и методы их добычи
скважины приходится прекращать, когда образующая конуса до-
стигает угла 30—40°. В результате этого запасы месторождения
при таком способе эксплуатации используются не больше чем
на 5—15%.
Эксплуатацию скважин осуществляют также комбинированным
противоточно-прямоточным методом23. Основная стадия здесь пря-
моток, когда происходит «размыв» слоя соли с образованием
большого количества рассола; при более короткой стадии работы
Рис. 3. Схема выщелачивания пласта Рис. 4. Схематический разрез буровой
•соли через буровую рассольную скважины с гидрозрубом.
скважину, работающую противотоком.
противотоком происходит «промывка» скважины с удалением из
нее большей части нерастворимых частиц. Продолжительность
дикла чередования направления потоков внутри скважины равна, ;
например, 2 ч при соотношении продолжительности режимов «раз- 1
мыва» и «промывки» в пределах от 7 : 1 до 3: 1. 1
Более совершенной является эксплуатация скважин с гидро- ?
врубом (рис. 4) 24_26. В этом случае вместе с водой в скважину
нагнетают воздух или нефть. Вначале поддерживают уровень воды
на постоянной высоте 1—1,5 м от забоя. При этом растворение «
идет только по окружности камеры, потолок же предохраняется
«от действия воды тонким слоем «нерастворителя» — воздуха или
нефти. Образуется вруб—приблизительно плоская цилиндриче- s
ская камера высотой 1—1,5 м и диаметром 100 м и больше. (Бо-
лее вероятно, что при выщелачивании гидровруба форма обра- '
аующейся полости в соляной залежи соответствует форме гипер- -
болоида вращения.) После этого воздух или нефть выдавливают
на дневную поверхность, повышая уровень рассола, причем про- ;
Получение солей из рассолов и морской воды
55
исходит интенсивное растворение потолка камеры. Осаждение пу-
стой породы на растворяющейся поверхности при этом исключено
и использование запасов месторождения возрастает.
Наиболее прогрессивным является ступенчатое выщелачива-
ние27, особенно для разработки пластов соли, содержащих много
нерастворимых включений. В этом случае вначале производят
размыв не в форме вруба, т. е. плоской щели, а в форме конуса,,
обращенного вершиной вниз. Затем, периодически повышая уро-
вень подвода воды и изменяя уровень отбора рассола, производят
ступенчатое растворение соли, так что камера выщелачивания
принимает форму, близкую к цилиндру, с основанием в виде во-
ронки и сводчатой кровлей. Нерастворимые включения скапли-
ваются в нижней части камеры. Степень использования пласта
соли резко возрастает.
Питание пласта соли водой для его размыва и откачку рас-
сола производят и по разным скважинам — по одним подают
воду, по другим откачивают рассол. При такой групповой системе
эксплуатации скважин коэффициент извлечения соли особенно
возрастает при последовательной отработке запасов по падению
пластов и при использовании провальных воронок, образовавших-
ся в результате выщелачивания, для подачи воды к разрабатывае-
мым верхним пластам соли28. Это позволяет сократить число во-
доприемных скважин и значительно увеличить количество пода-
ваемой воды.
Образующиеся при подземном выщелачивании пустоты могут
явиться причиной обрушения кровли камер — опускания и обвалов
надсолевых пород. Поэтому этот метод извлечения солей может
использоваться лишь при достаточной прочности покровных пла-
стов.
ПОЛУЧЕНИЕ СОЛЕЙ ИЗ РАССОЛОВ И МОРСКОЙ ВОДЫ
Добыча самосадочных солей
В СССР широко развита промысловая добыча самосадочных
солей (Na'Cl, Na2SO4 • 10Н2О), кристаллизующихся из рапы озер
и лиманов в результате естественного испарения воды под дей-
ствием солнечного тепла (NaCl) или в результате охлаждения
рапы в зимнее время (NasSOv 10Н2О).
Добыча самосадочной соли производится ручным и механиче-
ским способами. Ручной способ добычи соли требует тяжелого
физического труда. Поэтому на крупных соляных промыслах при
значительной толщине слоя соли пользуются исключительно меха-
ническими способами добычи соли: применяют скреперы, трактор-
ные погрузчики, бульдозеры, одно- или многоковшовые экскавато-
ры, солесосы. Солесосами пользуются при толщине слоя рапы не
Менее 0,5 м. Они монтируются на железнодорожных платформах
58
Гл. II. Растворимые соли и методы, их добычи
(сухопутные) и на понтонах (плавучие). Солесос (рис. 5)
представляет собой центробежный насос 1 с подвижной всасы-
вающей трубой 2, на устье которой имеется резак-разрыхлитель 3
е ножами. Разрыхлитель вращается со скоростью 36 об]мин. При
этом он разрывает слабо спаянные в пласте кристаллы соли, по-
лучаются куски 5—35 мм, которые засасываются вместе с рапой
солесосом. На грохоте 7, соль отделяется от рапы и ила, стекаю-
щих по лотку 8 обратно в озеро. С помощью транспортера 9~
бесконечной цепи с гребками — соль передвигается к краю грохота
Рис. 5. Солесос:
/ — центробежный насос; 2 — подвижная всасывающая труба; 3 —резак-разрыхлитель;
4 —двигатель; 5 —нагнетательная труба; 6 и 3“ лотки; 7 — грохот; р —транспортер.
и ссыпается в кучу или на транспортное устройство. Для всасы-
вания кристаллов соли в трубу требуется большая скорость дви-
жения рапы, при которой кристаллы поддерживаются во взвешен-
ном состоянии. Энергичное всасывание начинается при скорости
около 2 м)сек. Часовая производительность солесосов от 30 до
116 т соли. При незначительной толщине слоя рапы, а особенно
при эксплуатации сухих озер, для сбора новосадки пользуются
скреперами с лебедками. Экскаваторы применяются для сбора
выломанной соли при толщине пласта не меньше 0,5 м, когда
ковш экскаватора не захватывает вместе с солью подстилающий
слой ила.
Бассейный способ переработки рассолов
Способ добычи соли из рапы соляных озер и лиманов с по-
мощью бассейнов, в которых происходит естественное испарение
или охлаждение рапы и кристаллизация (садка) солей, называют
бассейным. В качестве бассейнов могут быть использованы также
находящиеся близ озера естественные впадины. Грунт, в котором
находится бассейн, должен обладать очень малой фильтрующей
способностью, чтобы рассол не разбавлялся грунтовыми водами
и не просачивался в почву.
Для механизированного сбора соли с применением бульдозе-
ров, скреперов и других машин необходимо, чтобы слой соли имел
Получение солей из рассолов и морской воды
57
большую толщину, что при бассейном получении поваренной соли
практически невозможно осуществить, так как для интенсивного
испарения слой рапы в бассейне должен быть небольшим.
Высокий слой рапы в бассейне (1—4 м и более) поддерживают
при зимней садке мирабилита. В этом случае рапу сульфатного
озера накачивают в садочные бассейны летом, когда концентра-
ция сульфата натрия наиболее высока. Осенью при похолодании
происходит садка мирабилита. Зимой маточный раствор сливают,
а остающийся толстый слой мирабилита (0,3—1 .и) собирают с
помощью механизмов и бугруют для более полного стока маточ-
ного раствора.
Размеры бассейнов выбирают соответственно величине про-
мысла с учетом местных климатических, почвенных условий, со-
става и концентрации рапы. При ручной ломке соли площадь,
отводимая под садку соли, разбивается на много небольших бас-
сейнов (1—4 га), имеющих форму прямоугольника. В бассейнах
больших размеров ветер развивает волны, обнажает слой соли,
что вызывает неравномерную садку. При механизированной ломке
соли перемычки между бассейнами мешают работе механизмов,
следовательно, садочные бассейны должны иметь большие раз-
меры. Подготовительные (отстойные) и запасные бассейны вместе
занимают приблизительно такую же площадь, как и садочные.'
Перекачка рапы из бассейна в бассейн производится рапокачкой
(насосами) по желобам и канавам.
Важнейшим фактором, определяющим продуктивность бассей-
ного промысла, является испаряемость рапы 29’30. Рапа испаряется
медленнее, чем вода, так как давление водяного пара над рассо-
лом меньше, чем над водой. Отношение высоты слоя испарившейся
рапы к высоте слоя воды, испарившейся в тех же условиях, на-
зывается коэффициентом испаряемости рапы. Величина коэффи-
циента испаряемости, очевидно, всегда меньше единицы; она
зависит от состава и концентрации рапы, а также от климата и по-
годы и может быть различной для одной и той же рапы, испа-
ряющейся в разных условиях, например при разной влажности
воздуха. Коэффициент испаряемости может быть и отрицательной
величиной, что соответствует поглощению рапой влаги из воздуха.
Для крымских рассолов коэффициенты испаряемости имеют сле-
дующие средние значения:
(Вода)
Плотность рапы, г/сл8........ 1,0 1,075 1,116 1,210 1,291 1,320
Ковффициент испаряемости .... 1,00 0,90 0,73 0,50 0,24 0,08
Испаряемость воды сильно меняется по месяцам года и колеб-
лется, например в районе Крымских промыслов, от 35 мм вод. ст.
в декабре до 300—330 мм вод. ст. в июле и августе.
58
Гл. II. Растворимые соли и методы, их добычи
Скорость испарения воды с поверхности водоема площадью
более 100 .и2 может быть рассчитана по эмпирической формуле
Е = В (Н - h)
где Е — скорость испарения, кг)м2 • сутки-,
В — коэффициент, кгЦм2 • сутки • мм рт. ст.), зависящий от
скорости ветра (рис. 6);
{Н — h) — дефицит влажности, т. е. разность между давлением
насыщенного пара при температуре поверхностного слоя
воды и давлением пара в воздухе на высоте 2 м над
водоемом, мм рт. ст.
Более точно расчет испарения воды с поверхности садочного
'соляного бассейна производится по тепловому балансу, учиты-
Скорость ветра,м/сен
Рис. 6. Величина коэффи-
циента В в зависимости от ско-
рости ветра иа высоте 4,5 м
над поверхностью озера.
вающему солнечную радиацию, излу-
чение атмосферы, тепловое излуче-
ние водной поверхности, конвекцию
и др.3,1 32.
Испарение рапы и садка соли за-
медляются выпадением атмосферных
осадков. Среднегодовое количество
осадков сильно колеблется для раз-
личных, даже сравнительно близких,
районов (например, в районе Гениче-
ска — 328,8 мм вод. ст., а в районе
Керчи — 439,1 мм вод. ст.).
Бассейны используются не только
для испарительной садки солей в
летнее время, но и для зимней садки.
При понижении температуры рапы
происходит вымораживание солей.
Так, при охлаждении концентрирован-
ных растворов NaCl из них при тем-
пературах ниже +0,15° кристаллизу-
ется дигидрат хлорида натрия NaCl-
• 2Н2О, а при охлаждении сульфатных
растворов—мирабилит Na2SO4- 10Н2О.
Соли, добываемые бассейным способом, более чисты, чем из-
влекаемые из донных отложений озер, так как содержат значи-
тельно меньше ила и других механических примесей. Однако су-
щественным недостатком бассейного способа, так же как и добычи
самосадочной соли, является сезонность и зависимость от клима-
тических явлений. О методах расчета бассейных промыслов см. 33>34,
ЛИТЕРАТУРА
1. А. А. Иванов, Основы геологии и методика поисков, разведки и оценки
месторождений минеральных солей, Госгеолиздат, 1953. — 2. М. П. Фи вег,
Труды ВНИИГ, в. 23, 1952, стр. 3; в. 32, 1956, стр. 102. — 3. Н. С. Курна ко в,
Литература
59
В. Г- Кузнецов, А. И. Дзеис-Литовский, М. И. Равич, Соляные озера
Крыма, Изд. АН СССР, 1936. — 4. В. П. Ильинский, Труды ГИПХ, в. 40,
1948, стр. 5. — 5. Б. Л. Р о н к и н, Наши соляные озера и их богатства, ГОНТИ,
1931. — 6. J. Cook, Discovery, 17, № 2, 71 (1956). —7. А. И, Дзенс-Литов-
ский, Труды ВНИИ Г, в. 34, 1957, стр. 5. — 8. М. Г. В а ляшко, Там же,
в. 23, 1952, стр. 10.—9. М. Г. В а л я ш к о, Там же, стр. 13. — 10. Н. С. Домб-
ровская, ИСФХА АН СССР, 22, 293 (1953).
11. Экспериментальное исследование процессов метаморфизации природных
соляных вод. Труды ВНИИГ, в. 23, 1952, стр. 147.— 12. О. Д. К а ш к а р о в,
Там же, в. 32, 1956, стр. 3, 49. —13. М. Г. В а ляшко, Там же, в. 23, 1952,
стр. 25. — 14. Я- И- Тычино, М. Г. В а л я ш к о, Там же, в. 24, 1952, стр. 247. —
15. О. Д. К а ш к а р о в, Бюлл. ВИГ, № 1—2, 13 (1940). — 16. А. М. Пенько в,
А. А. В о п и л к и н, Расчет опорных целиков при добыче каменной соли, Киев,
Изд. АН УССР, 1950. — 17. С. Е. Шарапов, Н. Г. Шешуяов, Хим. пром.,
№ 6, 183 (1953). —18. Л. Д. Шевяков, Разработка месторождений полезных
ископаемых, Углетехиздат, 1953, гл. XVIII. — 19. А. Н. А н д р е и ч е в, Разработка
калийных и каменносоляных месторождений, Госхимиздат, ч. I, 1953; ч. И,
1954. — 20. А. Н. А н д р е и ч е в, Пути механизации трудоемких работ в горно-
химической промышленности, Госхимиздат, 1953.
21. А. Е. Ходьков, Труды ВНИИГ, в. 28, 1953, стр, 3. — 22. А. И. Дзенс-
Литовский, А. А. Иванов, Н. А. Корчебоков, Бюлл. ВИГ, № 6—7, 3
(1939). — 23. И. А. Л е г е н ч е н к о, Хим. пром., № 8, 469 (1956).— 24. П. А. К У л-
л е, Труды ВНИИГ, в. 30, 1955, стр. 3, 49. — 25. П. А. Ку л ле, Там же, в. 20,
1049.—26. М. В. Сыроватко, Сборник статей ВЗПИ, в. 9, 1955, стр. 28.—
27. П. С. Бобко, Труды ВНИИГ, в. 35, 1959, стр. 365, 509. — 28. П. С. Бобко,
Хим. пром., № 2, 41 (1952). — 29. О. Д. К а ш к а р о в, Труды ВНИИГ, в. 24, 1952,
стр. 229, — 30. Б. Г. Иванов, Испарение в естественных условиях, Гидромет-
издат, 1939.
31. О. Д. К а ш к а р о в, сб. «Вопросы производства калийных удобрений»,
Изд. «Химия», 1964, стр. 79.—32. О. Д. Кашка ров, сб. «Технология пере-
работки природных солей и рассолов», Изд. «Химия», 1964, стр. 67, 77,—
33. W. Free Kevin, Trans. Inst. Chem. Eng., 36, № 2, 115 (1958).—
34. D. M. Myers, C. W. Bony ton, J. Appl. Chern., № 4, 207 (1958).
Глава III
ХЛОРИСТЫЙ НАТРИЙ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Хлористый натрий, получивший название поваренной соли, так
как с давних времен эта соль добывалась путем вываривания (вы-
парки) ее из растворов, встречается в природе в виде растворов и
кристаллических отложений, главным образом каменной соли, ми-
нерала галита NaCl. Он кристаллизуется из чистых растворов
в виде правильных кубов; кристаллы, образующиеся в растворах,
содержащих примеси, могут иметь форму октаэдра или ромбиче-
ского додекаэдра. Плотность кристаллов при 20° 2,16 г/с.и3. Тем-
пература плавления 800,8°. В плотных природных массах (в ка-
менной соли) зерна галита обычно имеют неправильные огранения
и характеризуются мелкими размерами (от долей до нескольких
миллиметров).
В присутствии модифицирующих агентов хлористый натрий
может кристаллизоваться в форме трехмерных дендритов с объем-
ным весом 0,7 г)см3. В таком виде он выделяется из концентриро-
ванных растворов хорошо растворимых в воде хлоридов или гидро-
окисей, в которых растворяется лишь 1—2% NaCl, или при выпа-
ривании под вакуумом при медленном перемешивании рассола,
содержащего 0,05% ферроцианида щелочного металла1'2.
При температуре ниже +0,15° соль кристаллизуется в виде
двухводного кристаллогидрата NaCl-2H2O (гидрогалит), выше
этой температуры — в виде безводного NaCl. Растворимость NaCl
мало изменяется с температурой. Насыщенный водный раствор
содержит (рис. 7):
NaCl, %
NaCl, %
При —21,2° (эвтектическая
точка)...................... 24,42
При 0°........................ 26,28
» 20°....................... 26,39
» 40°....................... 26,68
. При 60°........................ 27,07
» 80°...................... 27,55
» 100°...................... 28,15
» 140°..................... 29,63
» 180°..................... 30,99
Физико-химические свойства
61
(органические вещества)
Рис. 7. Растворимость в си-
стеме NaCl—Н2О.
Насыщенный водный раствор под давлением 760 мм рт. ст. ки-
пит при 108,7° (содержит 28,41% NaCl).
Чистый галит бесцветен и обладает стеклянным блеском; при-
меси окрашивают его в различные цвета — от серого до темно-
серого (примеси глинистых веществ), в желтый, розоватый и крас-
новатый цвет (окислы железа), в бурый
и др. Галит, встречающийся одновре-
менно с калийными солями, имеет часто
голубую, синюю или фиолетовую окрас-
ку, исчезающую при нагревании до 200°;
возможно, что она появляется вслед-
ствие выделения металлического натрия
под влиянием радиоактивного излучения
калия 3'4.
В зависимости от месторождения по-
варенная соль может содержать в каче-
стве примесей песок, породы полево-
шпатового и каолинитового характера,
растворимые соли щелочных и щелочно-
земельных металлов, включения маточ-
ног.о раствора и др.5. Отмечается корре-
ляция между содержанием примесей и
размером частиц соли6. О содержании
микропримесей в поваренной соли раз-
ных месторождений см.7 Чистая соль об-
ладает весьма небольшой гигроскопич-
ностью, увеличивающейся при наличии
некоторых примесей, например хлористо-
го магния. Другие примеси, например
равномерно распределенный дисперсный
ил, несколько снижают гигроскопич-
ность поваренной соли8.
Давление водяного пара над раствором хлористого натрия
с возрастанием его концентрации при низких температурах умень-
шается незначительно (например, при 20° для 5%-ного раствора —
17 мм рт. ст., а для насыщенного—-14 мм рт. ст.), а при
высоких температурах заметно снижается (при 100° для 5%-ного
раствора — 736 мм рт. ст., а для насыщенного — 566 мм
рт. ст.)9.
Дигидрат хлористого натрия кристаллизуется в интервале от
+ 0,15 до —21,2°. При медленной кристаллизации образуются тон-
кие иглы, а при быстрой — хорошо ограненные и развитые моно-
клиннощризматические кристаллы плотностью 1,6 г!см3. Объемный
вес 0,8—1 т)м\ В интервале от +0,15 до —21,2° давление водяного
пара над NaCl • 2Н2О изменяется от 3,48 до 0,69 мм рт. ст., а гиг-
роскопическая точка — от 75,2 до 100% 10>п.
62
Гл. Ill. Хлористый натрий
ПРИМЕНЕНИЕ
Поваренная соль играла большую роль в истории развития че-
ловечества. Применение ее как приправы к пище известно с древ-
нейших времен. В Тибете и Монголии глыбы соли использовались
в качестве денег. В древней Руси солеварение являлось широко
распространенным промыслом.
Поваренная соль с давних пор применяется также в качестве
консервирующего средства, предохраняющего от гниения, — для
засолки рыбы, мяса, овощей, кож и др. С развитием промышлен-
ности соль находит широкое применение в различных, производ-
ствах в качестве исходного или вспомогательного сырья 12. В на-
стоящее время для пищевых целей расходуется меньше половины
мировой добычи соли. Средняя годовая норма пищевого потреб-
ления соли на одного человека составляет 8—10 кг, а общее по-
требление, включая промышленное, достигает в отдельных странах
25—75 кг в год. Соль идет также в пищу животных. Ее, в част-
ности, используют при заготовке силоса для скота. В качестве
корма расходуется 5—10% добываемой соли.
По способу добычи и обработки пищевая поваренная соль де-
лится на: 1) мелкокристаллическую — выварочную; 2) молотую,
разных видов (каменная, самосадочная) и различной крупности
помола; 3) немолотую — комовую (глыба), дробленку и зерновую
(ядро); 4) иодированную. Требования к качеству пищевой соли
обусловлены ГОСТ 13830—68 (табл. 6); методы испытаний см.
ГОСТ 13685—68.
ТАБЛИЦА 6
Состав пищевой соли (в %) по ГОСТ 13830—68
Сорт Содержа- ние NaCl в сухом веществе, , не менее Содержа- ние не ра- створимых в воде веществ в сухом веществе, не более Максимальное содержание влаги Предельное содержание в сухом веществе
Са2+ Mg2+ SO2” 4 Fe2°3
Экстра . . 99,7 0,03 0,1 0,02 0,01 0,16 0,005
Высший . . 98,4 0,16 Каменная соль 0,25 Садочная и само- садочная . . 3,2 Выварочная . . 5,0 0,35 0,05 0,8 0,005
Первый . . 97,7 0,45 Каменная . . . 0,25 Садочная и само- садочная . . 4,0 Выварочная . . 5,0 0,5 0,1 1,2 0,01
Второй . . 97,0 0,85 Каменная . . . 0,25 Садочная и само- садочная . . 5,0 Выварочная . . 6,0 0,65 0.25 1,5 0,01
Применение
63
Поваренная соль не должна иметь запаха (для иодированной
соли допускается слабый запах иода). Цвет соли сорта экстра бе-
лый; для прочих сортов допускаются оттенки сероватый, желто-
ватый и др. Максимальное содержание Na2SO4 в пересчете на су-
хое вещество для сорта экстра 0,2%, для других сортов 0,5%.
В соли Артемовского месторождения допускается наличие тем-
ных частиц в пределах норм иона SO4~, а для Солотвинской соли
в пределах норм нерастворимого остатка. В соли «глыба» Нахиче-
ванского месторождения допускается содержание NaCl (в пере-
счете на сухое вещество) не менее 93% и не растворимого в воде
остатка не более 5%. В выварочной соли заводов западных обла-
стей УССР и калийных комбинатов допускается содержание ка-
лия до 0,42% (в пересчете на сухое вещество). Соль сорта экстра
должна полностью просеиваться через сито со стороной квадрат-
ного отверстия 0,8 мм и не менее чем на 95% через сито — 0,5 мм.
Соль молотая делится на следующие номера помолов в зави-
симости от просева через сита разных размеров:
Размер стороны квадратного отверстия сита, мм Количество соли, проходящей через сито (в %), не менее
Для высшего и первого
сортов помол:
№ 0 0,8 90
№ 1 1,2 90
№ 2 2,5 90
№ 3 4,5 85
Для второго сорта помол:
№ 1 1,2 90
№ 2 . 2.5 90
№ 3 4.5 85
Соль «экстра» должна полностью проходить через сито со сто-
роной квадратного отверстия 0,8 мм и на 95% через сито со сто-
роной 0,5 мм.
Соль «дробленка» или «зерновая» выпускается с величиной
зерна до 40 мм. Глыбовая соль имеет куски весом от 3 до 50 кг.
Содержание иодида калия в иодированной соли всех сортов
25 г на 1 т соли или 0,00191% свободного иода; для стабилиза-
ции KI в иодированную соль (кроме выварочной «экстра») до-
бавляют тиосульфат натрия — 250 г на 1 т соли. Отклонение этих
норм допускается до ±20%. Предельное содержание влаги в иоди-
рованной соли 0,5%.
Техническая соль должна содержать не менее 93% NaCl. Допу-
стимое содержание примесей устанавливается в зависимости от
назначения соли.
В химической промышленности NaCl является основным
сырьем для получения соды, хлора, едкого натра, хлорной извести
84
Гл. III. Хлористый натрии
и пр.; кроме того, применяется в производстве пластмасс, в орга-
ническом синтезе и пр. Хлористый натрий используют более чем
в 1500 производствах5’13.
Хлористый натрий, имеющий дендритную структуру и объем-
ный вес ~ 0,8 г/см3 при избыточном давлении 1,7 ат, может быть
Применен в качестве пламягасящей добавки при изготовлении
безопасных аммонитов малой плотности (0,9 г/см3 при избыточном
давлении 1,7 ат)14.
В СССР наибольшее количество поваренной соли получают,
добывая каменную и самосадочную соль. Выварочной и бассейной
соли производят незначительное количество — менее 5%. Основ-
ным потребителем поваренной соли в США является химическая
промышленность (~70%); пищевая промышленность расходует
6—6,5% соли; для кормления скота и других сельскохозяйствен-
ных нужд ~ 5°/о15-17.
, Мировая добыча и производство поваренной соли составляли
в 1961 г. 89 млн. т, в том числе в США 23,4 млн. т.
СЫРЬЕ И МЕТОДЫ ПРОИЗВОДСТВА
Основными типами месторождений поваренной соли являются:
1) пласты и штоки каменной соли; 2) океанская и морская вода,
озерные рассолы; 3) растворы в соляных источниках и грунтовых
водах; 4) солончаки; 5) возгоны соли на кратерах вулканов и в
трещинах лавовых потоков.
Главнейшие месторождения каменной соли в Европейской ча-
сти СССР расположены в отложениях бывшего Пермского моря 18.
Каменносоляные месторождения Восточной Сибири относятся
к Кембрийским отложениям. Туркменские соляные месторождения
приурочены к пограничной зоне между меловой и юрской геоло-
гическими системами19. Соленосные отложения Северного Края"
(Котлас, Сольвычегодск и др.) связаны с различными подразделе-
ниями палеозоя, от девона до верхней перми 20.
Крупнейшими месторождениями каменной соли в СССР яв-
ляются: Артемовско-Славянское в Украинской ССР, мощность
пластов которого превышает 200 м; Илецкое в Оренбургской обла-
сти, где пласт соли разведан на глубину 1,5 км; Усольское в Ир-
кутской области 21 и многие другие 22’23.
В СССР весьма распространены соляные озера, многие из ко-
торых служат источниками добычи поваренной соли 24~39. В При-
каспийской низменности насчитывается до 2000 озер, из них более
200 крупных, в том числе таких, как Баскунчак и Эльтон. Котло-
вина оз. Баскунчак имеет овальную форму площадью около
115 км2. Запасы соли в озере за счет вод впадающих в него источ-
ников возрастают ежегодно более чем на 800 тыс. т или на ~ 100 т
в час36. Оз. Эльтон занимает площадь 180 км2 и является вели-
Каменная соль
65
чайшим из соленых озер Европы37. В Казахской ССР количество
известных соляных озер превосходит 2500. Наибольшее количество
поваренной соли находится в морской воде (стр. 47).
Методы производства (добычи) соли разделяются на четыре
основные группы; 1) добыча каменной соли; 2) добыча самосадоч-
ной соли из соляных озер; 3) добыча садочной поваренной соли
бассейным способом из морской и озерной вод; 4) получение вы-
варочной соли путем выварки ее из естественных и искусственных
рассолов.
Для технических целей применяют каменную и самосадочную,
а для пищевых — выварочную, самосадочную и садочную соль.
Кроме того, производят специальные сорта соли — иодированную,
брикетированную и неслеживающуюся, а также соль высокой чи-
стоты (99,9% и больше NaCl).
КАМЕННАЯ СОЛЬ
Каменная соль встречается преимущественно в виде мощных
пластов или крупных штоков и линз, толщина которых достигает
иногда сотен и тысяч метров 4°-43. Большей частью она имеет плот-
ное компактное строение и сопровождается залежами и мощными
толщами ангидритовых, гипсовых и других пород. Поэтому ка-
менная соль зачастую содержит различные примеси — ангидрит,
глину, а также воду, битумы, газы (табл. 7).
ТАБЛИЦА 7
Состав некоторых образцов каменной соли
Образец NaCl CaSO4 MgCl2 Qadg Нераство- римый остаток Влага
Илецкая крупная . . 98,94 0,81 0,05 0,2 0,24 1,10
» - глыба , . . 96,93 0,85 0,07 0,33 0,39 1.П
Брянцевская серая . 94,42 0,29 — — 0,1 в 0,10
» белая . . 99,02 0,42 — — 0,14 0,22
Артемовская .... 97,7-99,6 1,3-0 0,35-0 0,15-0 0,65-0 0,1-0,4
По морфологическому признаку различают следующие типы
залежей каменной соли; пластовые (например, Артемовско-Сла-
вянское месторождение), пластово-линзообразные, линзообразные
(например, в Ишимбаевском районе Башкирии), куполо- и што-
кообразные (например, Илецкое) и гнездообразные — в виде мел-
ких линз и блоков.
Подземную добычу каменной соли обычно ведут на глубине до
500 м, так как при больших глубинах стоимость работ значительно
увеличивается. Вследствие пластичности каменной соли44 разра-
ботку осуществляют в камерах до 30 м высотой без креплений;
3 М. Е. Познн
66
Гл. 111. Хлористый натрий
длина камер достигает 500 м, ширина 20 м, при ширине целиков
8—12 м. О методах подземной разработки пластов каменной соли
см.41-50. При подземных разработках имеет большое значение учет
режима вод, природных рассолов и газов соляного месторождения.
Предложено обогащать каменную соль в электростатическом
сепараторе после предварительного опрыскивания ее раствором
смеси жирных кислот с шеллаком (3:1) или раствором салици-
ловой и фталевой кислот (1:1) в органическом растворителе, ко-
торый испаряется до ввода соли в сепаратор51.
САМОСАДОЧНАЯ СОЛЬ
Промысловая добыча самосадочной соли составляет в СССР’
около половины добываемой соли. 1
Состав рассолов соляных озер весьма различен и зависит от.
геологических, климатических, почвенных условий, а также от вре-i
мени года. Кроме того, рассол представляет собой сложный ком-;
плекс в микробиохимическом отношении52. В качестве примера;
в табл. 8 приведен минеральный состав рапы некоторых крымских
озер.
ТАБЛИЦА 8-
Содержание солей в рапе некоторых крымских озер (в %)
Озеро Плотность рапы, г!см$ NaCl KCf MgCf2 MgSO4 CaSO4 С/мма солей
Гсническое (весной) „• . . 1,154 15,29 0,15 2,74 1,08 0,20 19,52
» (в сентябре) . . . 1,237 13,80 0,45 9,43 3,69 — 27,41
Сиваш (весной) 1,084 8,50 0,21 0,92 0,74 0,33 10,74
Сасык-Сиваш 1,077 7,48 0,18 1,22 0,74 0,39 10,30
Поваренная соль добывается из бессульфатных озер хлорид-
ного типа, а также из сульфатных озер (стр. 49 ) 53~56.
Кристаллизация NaCl из рапы озер хлоркальциевого типа оп-
ределяется равновесием в системе СаС1$—MgCl2—NaCl—Н2О57,
политерма которой до настоящего времени изучена еще не пол-
ностью. Поле кристаллизации NaCl на изотермических диаграм-
мах значительно больше полей кристаллизации других солей. На-
пример, при 25° кристаллизуется только NaCl даже из растворов,
содержащих всего 0,6 вес.% NaCl при концентрации СаС12 и MgCl2
35,6 Вес.%. Концентрации (в вес.%) СаС12 и MgCl2 четверной си-
стемы в насыщенных растворах NaCl могут быть определены по
данным растворимости NaCl в хорошо изученных тройных систе-
мах СаС12—NaCl—Н2О и MgCl2—NaCl—Н2О по следующим фор-
мулам:
rcaci2“ A+kC'< cMgoi2= л+ Мб57/в
Самосадочная соль
67
где С — число молей обеих солей в 100 г раствора, определяемое
по тройным системам при данной растворимости NaCl;
k и / — весовые количества (в %) СаС1г и MgClj (по раствори-
мости в тройных системах при данной растворимости
NaCl)57-59.
При испарении рапы морского типа из хлорид-сульфатных озер
вначале выделяются карбонаты кальция и магния, затем гипс,
а потом поваренная соль.
Из самосадочных озер добывают как новосадку, так и старо-
садку, которая по своим качествам превосходит новосадку. Иногда
под старосадкой залегает так называемая гранатка, представляю-
щая собой слой рыхлой, рассыпчатой поваренной соли в виде не-
сцементированных крупных кристаллов, загрязненных илом. После
отмывки ила рапой получается соль с высокими пищевыми каче-
ствами (табл. 9)29. Гранатка обычно образуется в озерах, где со-
ляная масса целиком пропитана рапой (корневая соль отсутствует)
и является одним из основных объектов разработки. Некоторые
соляные озера, например Баскунчак, очень мелководны. В жар-
кое время года почти вся вода из озера испаряется, что облегчает
добычу соли60. Вывозку соли из озера производят в открытых
вагонах. Рельсовый путь укладывают непосредственно по пласту
соли.
ТАБЛИЦА 9
Состав некоторых образцов самосадочной и бассейной поваренной соли67
Соль NaCf CaCls MgCl2 CaSO4 MgSO4 Нераство- римый остаток
Крымская бассейная 98,10-99,17 0,05-0.4 0,3-0,95 0-0,3 0,05-0,14
Туркменская само- садочная (оз. Куу- ли) 91,7—98,3 . 0-1,14 0,24-1,27 0-0,50 0,19-0,5
Баскунчакская само- садочная 97 2? -99,32 0-0,24 0,48 0-0,85 0-0,25 0,07-0,6
Павлодарская само- садочная 97,91—99,22 — 0,0 Г-0,44 0,01—0,43 0,03-0,24 0,6-0,7
Добытая соль, например баскунчакская, содержит 0,5—0.6%
илистых примесей, которые придают ей грязно-желтый цвет. Про-
мывкой дробленой соли рапой можно получить столовую (освет-
ленную) соль с содержанием всего 0,04—0,05% примесей. Строи-
тельство заводов по осветлению соли более рентабельно, чем по-
стройка вакуум-выпарных заводов: капиталовложения снижаются
в 2 раза, расход топлива в 23 раза, затраты рабочей силы
в 3 раза61. Для осветления соль измельчают до размера зерен
0,8 мм и подвергают противоточной промывке в логуошере чистым
3
68 Гл. III. Хлористый натрий
насыщенным раствором. Промытую соль с 10—12% влаги центри-
фугируют, после чего ее влажность снижается до 4,5—5%. Затем
ее высушивают до влажности 0,2% и классифицируют на грохоте
по размерам, предусмотренным ГОСТом.
Промывку поваренной соли можно производить также в буг-
рах, складываемых на берегу озер82, но при этом теряются зна-
чительные количества ееез. Потери крупнокристаллической соли
в буграх при стекании с них в грунт насыщенного раствора NaCl
могут быть рассчитаны по уравнениюв4:
где р — потери в % от веса бугра;
/( — растворимость NaCl;
’ S —площадь основания бугра;
Н — годовое количество атмосферных осадков, мм;
у—насыпной вес соли;
V — объем бугра.
Потери мелкокристаллической соли, удерживающей влагу в ре-
зультате действия капиллярных снл, зависят от влагоемкости
боли q и могут быть вычислены по формуле85:
где H'S' — количество испарившейся влаги;
г] -6(4—N), здесь N— номер помола соли (стр. 63).
Максимальная влагоемкость неслежавшейся соли, равная
сумме сорбционной и капиллярной влагоемкости, зависит от гра-
нулометрического состава и от объемного веса соли в буграх, рав-
ного для неслежавшейся садочной соли 1,18—1,28 т/м3 и 1,2—
1,3 т/м3 для каменной соли (в зависимости от помола). Объемный
вес слежавшейся соли на 5—10% больше 64’вв.
Содержание некоторых примесей в соли можно уменьшить пу-
тем ее измельчения и фракционирования. Например, установ-
лено88, что при измельчении природной поваренной соли, содер-
жащей до 7% сульфата натрия, последний переходит главным об-
разом в мелкие фракции, с которыми и может быть удален (до
90% от общего количества Na2SO4).
ПОЛУЧЕНИЕ САДОЧНОЙ СОЛИ БАССЕЙНЫМ СПОСОБОМ
Бассейный способ (стр. 56) получения садочной соли приме-
няют в тех случаях, когда по гидрохимическим и другим условиям
не происходит самопроизвольной садки соли из рассола. Получе-
ние соли бассейным способом дороже, чем добыча самосадочной
соли, так как связано с необходимостью сооружения искусствен-
Получение садочной соли бассейным способом
69
них или приспособления естеетвенных бассейнов; кроме того, при
бассейном способе затруднена механизация процесса, и потому он
утрачивает свое значение.
Для добычи поваренной соли бассейным способом 87> 69-71 из не-
насыщенной рапы континентальных озер, из воды лиманов и при-
морских водоемов (озер) обычно сооружают бассейны трех типов:
1) подготовительные или гипсоотстойники, 2) запасные и 3) садоч-
ные. Вначале рапу из озера накачивают в подготовительные бас-
сейны, где ее держат небольшим слоем 25—40 см и где она, испа-
ряясь в жаркое время года (апрель — сентябрь), сгущается почти
до насыщения и отстаивается от механических примесей, а также
от кристаллизующихся солей: гипса и карбонатов кальция и же-
леза. Затем рапу перекачивают в запасные бассейны, где хранят
до следующей весны возможно более высоким слоем (60—60 см)
для уменьшения разбавления атмосферными осадками. (При по-
лучении поваренной соли из сульфатных озер рапу перекачивают
в запасные бассейны в холодное время года после садки мираби-
лита72.) В конце мая или начале июня следующего года рапу из
запасных бассейнов перекачивают в садочные бассейны, где вскоре
начинается садка соли, продолжающаяся до сезона ломки (конец
августа — начало сентября). В садочных бассейнах поддерживают
толщину слоя рапы 10—15 см, а к концу сезона садки 20—25 см.
По мере испарения садочные бассейны пополняют рапой ив запас-
ных бассейнов. К концу сезона садки пласт соли, осевшей на дно
садочного бассейна, достигает 5—6 см. Ломку (сбор) соли произ-
водят при этом ручным способом — простыми лопатами или чал-
пами (дырчатыми лопатами) — после откачки рассола обратив
в озеро. Выломанную соль собирают в кучи на дне бассейна, а за-
тем вывозят на берег и складывают в бугры трапецеидальной
формы высотой 3—4 м для стекания маточного рассола. Сложен-
ная в бугры соль содержит 8—10% рассола, в котором находятся
магнезиальные и другие примеси, придающие свежедобытой соли
горьковатый привкус. При длительном вылеживании эти примеси,
особенно соли магния и хлорид кальция, стекают с рапой, благо-
даря тому, что они сильно гигроскопичны и увлажняются влагой
воздуха.
Некоторые рассолы в бассейнах покрываются сверху коркой
кальциевой соли (карбоната), что замедляет процесс испарения и
кристаллизацию соли. Рассол, предварительно очищенный от
Са(НСО3)2 пропусканием его через анионит и катионит, кристал-
лизуется значительно быстрее неочищенного73. Для интенсифика-
ции испарения рапы предложено74 устраивать в бассейнах брыз-
гальные установки, например, форсуночного типа75.
Хранить рассолы можно в больших ямах, облицованных тон-
кими (40 мк) политеновыми листами, — это предохраняет от раз-
бавления атмосферными осадками и грунтовыми водами76.
70
Гл. 111. Хлористый натрий
Бассейная соль имеет размеры зерен 10—15 мм. В таком виде
ее иногда отгружают. В большинстве случаев соль из бугров из-
мельчают на солемельницах — вальцовых, дезинтеграторах или
жерновых. Поваренная соль, полученная бассейным способом, со-
держит 98—99% NaCl и примеси, зависящие от состава рапы
(табл. 9). Для получения более чистой соли ее промывают иногда
на центрифугах морской водой или неконцентрированной рапой
или предварительно очищают рапу химическими способами77.
В тех случаях, когда соль получается из сильно загрязненных рас-
солов и содержит много примесей, ее иногда подвергают перекри-
сталлизации 78.
Для получения биологически полноценной поваренной соли, со-
держащей минеральные вещества морской воды, включая микро-
элементы, предложено маточный раствор после кристаллизации
NaCl испарять досуха в специальных бассейнах и образующийся
твердый остаток смешивать с NaCl. Уменьшение гигроскопичности
продукта достигается добавкой фосфата натрия Na3PO4 или кар-
боната натрия 79.
ПРОИЗВОДСТВО ВЫВАРОЧНОЙ соли
Выварочная соль получается в результате выпаривания искус-
ственных или естественных рассолов, добываемых из недр земли.
Такие рассолы отличаются сравнительно высокой концентрацией
NaCl и малым содержанием примесей. Для получения выварочной
соли непригодны рассолы любых поверхностных озер вследствие
высокого содержания в них кальциевых солей и других примесей.
Растворимость CaSO4 в растворах поваренной соли больше, чем
в воде. Максимум растворимости CaSO4 и СаСО3 в растворах
NaCl соответствует концентрации приблизительно 2 моль NaCl
в 1000 г воды80’81. Обычно рассол содержит (в г на 1 л):
NaCl.............
CaSO4............
280-310
5-6
MgCl2 и MgSO4 . . 0,2 — 4
СаС12..............0,2-0,8
Плотность рассола при 15° равна 1,19—1,20 г/см3. Высокое со-
держание MgCl2 в рапе не препятствует выварке из нее поварен-
ной соли, так как последующая промывка соли позволяет снизить
концентрацию MgCl2 в межкристальной жидкости и получить соль
высокого качества (стр. 113).
При выпарке рассолов морского типа (являющихся концентра-
тами морской воды) при температуре кипения под атмосферным
давлением после достижения насыщения кристаллизуется NaCl.
На рис. 8 показана равновесная диаграмма растворимости при
100° в водной взаимной бФстеме
2NaCl + MgSO4 - Na2SO4 +MgCl2
Производство выварочной соли
71
состоящей из главных компонентов морской воды. Фигуративная
точка солевой массы жидкой фазы по мере кристаллизации NaCl
движется из начального положения 1. В стабильной области кри-
сталлизации выделяется около 70% NaCl, когда точка состава
жидкой фазы достигает границы полей кристаллизации NaCl и
левеита Na2SO4 • MgSO4 • 2,5Н2О в точке 2. Однако при дальней-
шем выпаривании вместо смеси галита и левеита продолжает кри-
сталлизоваться один галит в метастабильной области (подобно
Рис. 8. Изотерма растворимости
системы NaCl — MgSO4—Н2О при
100°.
тому, как это происходит и при
солнечном испарении рассолов, ко-
гда NaCl кристаллизуется в мета-
стабильной области без астрахани-
та Na2SO4‘MgSO4-4H2O — см.
рис. 83 на стр. 272). Примерный
ход кристаллизации показан пунк-
тирной линией. Задержка выделе-
ния сульфатов вследствие достаточ-
но большой стойкости метастабиль-
ного состояния повышает общую
степень извлечения NaCl при кипе-
нии раствора до 91%. При выпари-
вании же обессульфаченного кон-
центрата морской воды можно вы-
кристаллизовать до 96% поварен-
ной соли82-85. Стабильные фазы
выделяются лишь при добавке боль-
шого количества затравки.
Выпаривание рассолов в заводских условиях осуществляют
‘либо в чренах, обогреваемых топочными газами, либо в вакуум-
выпарных аппаратах, обогреваемых паром. На чренных установ-
ках очистку рассола от примесей производят в процессе его упа-
ривания. Соль получается в виде более крупных кристаллов, чем
при вакуумной выпарке. Для выварки соли в вакуум-выпарных
аппаратах в ряде случаев необходима предварительная очистка
рассола от кальциевых и магниевых солей.
Температуры кипения рассолов морского типа различного со-
става могут быть определены расчетным путем. О методе расчета
см.7S.
Получение соли в чренах
Это старый метод, который сохранился и до настоящего вре-
мени. Имеются чренные солеварни (варницы), действующие
с XVJ в. (солеварни в районе Соликамска и др.)69. В США чрен-
ную выварку соли осуществляют, например, на заводе в Манисти
(штат Мичиган) производительностью более 1000 т!сутки, 87. Рас-
сол, подогретый с 10—15° до 60—70°, поступает в выпарной чрен,
72
Гл. III. Хлористый натрий
Рис. 9. Растворимость CaSO<
в насыщенном растворе NaCl.
представляющий собой открытый прямоугольный резервуар (ско- 1
вороду), изготовленный из котельной стали толщиной 6—8 мм. j
Размеры его: длина 15—20 м, ширина 8—10 м, глубина 0,4—0,5 м. 1
В процессе выпарки в чрене поддерживают постоянный уро- I
вень рассола 18—20 см. При нагревании рассола в чрене до 80° из I
него выделяются сероводород и другие растворенные газы, а также I
выпадает сульфат кальция (рис. 9). По достижении температуры |
кипения (108°) происходит разложение бикарбоната кальция и 1
образующийся СаСО3 выделяется в ,1
осадок; продолжается выпадение твер- I
дого CaSO4. Твердые примеси уда-
ляются специальными гребками через
борт чрена. По достижении насыще-
ния (через 6—8 ч) начинает кристал-
лизоваться NaCl. Магнезиальные соли
остаются в растворе, попадают в го-
товую поваренную соль с маточным
раствором, понижая ее качество. Для
получения мелкокристаллической соли
температуру рассола в процессе кри- .
сталлизации поддерживают в преде- 1
лах 90—100°. Для получения крупно- |
кристаллической соли температуру по- 1
нижают (50—60°) и выгребают соль 1
1—2 раза в сутки. 1
Соль, кристаллизующаяся в про- 1
цессе выпарки, механизированными I
гребками выгребается через наклонный борт чрена и отжи- I
мается на центрифугах (до влажности 3—5%) или высушивается (
в сушилках. ;
Температуру в топке под чреном поддерживают на уровне j
1000—1200°; температура газов, уходящих из последнего газохода, |
350—400°. При содержании в рассоле 24—25% NaCl расходуется 1
0,45—0,5 т условного топлива на 1 т готовой соли; при понижении I
концентрации рассола до 15—16% NaCl расход топлива возрас- j
тает до 1,1—1,2 т/т. Среднесуточный съем соли с 1 м2 поверхности j
нагрева чрена составляет 80—100 кг при исходной концентрации |
рассола 300 г/л NaCl; при этом интенсивность испарения воды со- |
ставляет 11 —12 кг в 1 ч на 1 м2 поверхности нагрева чрена. ~1
При интенсивном выпаривании раствора в чренах получается j
соль с размерами зерен 0,1—0,2 мм. При снижении температуры 1
до 60° (для получения крупнозернистой соли) производительность |
чренов уменьшается почти в 10 раз по сравнению с производитель- ' ]
ностью при интенсивном кипении. Однако более важным считают <
не интенсивность выпарки, а получение крупнозернистой соли, по-
этому до сих пор пользуются чренным способом вываривания j
Производство выварочной соли
73
соли, несмотря на его Примитивность. Крупнозернистую соль
можно получить и при высокой температуре выпаривания рассола
(90—9б9), для этого необходимо добавить к нему поверхностно-
активное вещество — мыла, жиры, спирты и др.88’89 (0,0002% от
веса получаемой соли). В качестве добавок предложены также
такие, как бромистый цетилпиридин 90 или 0,002% Мп в виде
MnSO4 и 0,001% смеси сексвиолеата сорбитапа и монолаурата
Рис. 10. Схема механизированной, чренной выварки соли:
2—скважина! 4 — насосы; 3 — резервуар; 5 —бак; 6, /3 — сигнальные лампы; 7—вентиль
S —скребок; Р — годки; 10 — мешалка; 11 — солесборннки; 12, 18 — вакуум-монтежю; 14 — центри-
фуга; 18, 16 — сборники; 17 -транспортер; 19— весы; 20 -ловушка; 21 - барометрический кои*
денсатор; 22 — ресивер; 23 — вакуум-насос.
полиоксиэтилен-сорбитана91. Более экономичным является брике-
тирование мелкокристаллической соли, полученной интенсивными
методами выварки, с последующим дроблением брикетов до зерен
требуемых размеров (стр. 91).
В зависимости от качества выпариваемых рассолов чрен оста-
навливают на чистку через 7—12 дней. За это время в маточном
растворе накапливается много примесей, а полотно чрена покры-
вается накипью — плотной коркой солей (называемой в Сибири
чренным камнем или ширеем, а на Украине омокой) толщиной
7—10 см, производительность чрена сильно понижается (иногда
до 50%), и создается опасность его прогара, а расход топлива зна-
чительно возрастает.
Накипь состоит из смеси кристаллов NaCl (86—90%), неболь-
шого количества других растворимых солей и 5—8% нераствори-
мых осадков, главным образом сульфата кальция. Коэффициент
74
Гл. III. Хлористый натрий
теплопроводности соляной накипи равен 2—2,5 ккал)(л • ч • град),
т. е. в 25—30 раз меньше, чем стали. Очистку от накипи можно
производить механическими способами и размыванием ее струями
воды 91.
На рис. 10 показана схема осуществляемой на Усольском за-
воде выварки соли в круглых чренах с механизированным удале-
нием соли 88. Выгрузка соли со дна чрена в солесборники произво-
дится при помощи скребков и проволочных щеток, укрепленных на
мешалке, вращающейся со скоростью 2—3 об/мин. Отфугованную
соль с 5—6% влаги направляют по транспортеру на склад или во
вращающуюся барабанную сушилку. Выпарной чрен изготовляют
из стальных листов толщиной 6—7 мм. Он имеет диаметр 10 м и
высоту борта 0,5 м, сверху покрыт деревянным колпаком, снаб-
женным двумя вытяжными трубами высотой 10 м для отвода пара
и люками, служащими для наблюдения за работой мешалки и для
ремонта чрена. Благодаря непрерывному удалению солей со дна
чрена образование чренного камня происходит значительно мед-
леннее, и длительность работы чрена между остановками для
чистки достигает 30 суток, т. е. в 3 раза больше, чем при выварке
соли в иемеханизированных чренах.
Вакуумная выварочная соль
Вакуум-выпарка значительно рентабельнее, чем чренная, вслед-
ствие многократного использования тепла греющего пара. Она
выгодно отличается и меньшей затратой рабочей силы. Обычно
для выварки поваренной соли применяют концентрированные рас-
солы и лишь в районах, очень удаленных от залежей соли, исполь-
зуют для ее получения морскую воду. Вследствие того что раство-
римость NaCl очень мало зависит от температуры (рис. 7), соль
получают изотермической кристаллизацией при температуре кипе-
ния насыщенного рассола, удаляя растворитель — воду. В резуль-
тате быстрого пересыщения раствора в процессе интенсивного ки-
пения в вакуум-выпарных аппаратах образуется мелкозернистая
соль.
В процессе выпаривания рассола происходит осаждение соли
на теплопередающей поверхности — греющих трубках. Поэтому
необходимо периодически (1—2 раза в сутки) промывать аппа-
раты водой. Кроме того, образуется плотноструктурная накипь из
выделяющихся в осадок нерастворимых солей — сульфата и кар-
боната кальция и кремнекислых соединений. Пересыщение жидко-
сти сульфатом кальция достигается прежде всего на греющей по-
верхности, которая и инкрустируется осадком сульфата кальция.
Сульфат кальция, кристаллизующийся в массе жидкости, образует
высокодисперсную взвесь, которая в дальнейшем также принимает
участие в образовании отложений на греющих поверхностях и
Производство выварочной соли
75
стенках аппаратов93. Возможно, что образование твердой накипи
связано также с процессами перекристаллизации сульфата каль-
ция и перехода его при этом из одной модификации в другую. До-
бавка к рассолу сульфитцеллюлозного щелока замедляет переход
CaSO4 • VzHjO как в CaSO4-2H2O, так и в CaSO4, что, по мнению
некоторых исследователей, должно способствовать уменьшению от-
ложения накипи94. Образование накипи вызывает необходимость
тщательной химической и механической чистки аппаратов раз!
в 7—10 дней.
Для получения более чистого продукта, а главным образом для
предохранения аппаратов от накипи рассолы перед выпаркой сле-
дует очищать от ионов Са2+, Mg2+ и SO4~.
Очистка рассолов
Существуют разные способы очистки рассолов 95-97: 1) содо-
вый, при котором в рассол добавляют соду, осаждающую Са2+ и
частично Mg2+; 2) известково-содовый, при котором в рассол од-
новременно вводят соду и известь (известковое молоко); при этом
рассол освобождается достаточно полно и от кальциевых и от
магниевых солей; 3) известково-сульфатно-содовый, осуществляе-
мый в две фазы. В первой фазе в рассол вводят сульфат натрия
и известь, причем происходит освобождение рассола от раствори-
мых солей магния и кальция. Во второй фазе рассол освобо-
ждается от гипса путем карбонизации его двуокисью углерода
(дымовым газом) или введения в него соды.
При очистке рассола этим способом идут следующие реакции!
Первая фаза
Вторая фаза
Na2SO4 + Са(ОН)2
MgCl2 + 2NaOH
MgSO4 + 2NaOH
CaCl2 + 2NaOH
2NaOH + CO2
CaSO4 + Na2CO3
CaSO4 +2NaOH
Mg(OH2) + 2NaCl
Mg(OH)2 + Na2SO4
Ca(OH)2 + 2NaCl
Na2CO3 + H2O
CaCO3 "Ь Na2SO4
После очистки рассолы отстаиваются от осадков и поступают
на выпарку. Содовый способ очистки наиболее прост, но пригоден
для рассолов, содержащих мало Mg2+, так как Mg2+ плохо оса-
ждается содой. Очистка этим способом протекает наиболее удов-
летворительно при температуре около 100°. Преимущество этого
способа — в быстроте отстаивания рассола от осадка.
Если часть соды заменить едкой щелочью, содовая очистка
даст хорошие результаты и без нагревания рассола — при пере-
мешивании в течение 30—80 мин. Концентрация катионов Са2+ и
Mg2+ в растворе NaCl может быть снижена до 30—40 ммоль/л98.
76
Гл. III. Хлористый натрий
О растворимости СаСО3 и Mg(OH)2 и пересыщении ими рассола
см.".
При наличии значительных количеств Mg2+ очистку рассола
производят известково-содовым или известково-сульфатно-содо-
вым способом. В обоих случаях очистку можно производить без
подогрева рассола (при 15—25°). Однако повышение температуры
рассола до 40—50° при известково-содовой очистке приводит к бо-
лее быстрому отстаиванию осадков — время отстаивания сокра-
щается на ~25%.
Рекомендуют вводить вместе с осаждающими реагентами
0,5—2% от их веса поверхностно-активных веществ (соли алкил-
аминов с 10—18 атомами С) 10°.
Предложено много вариантов содовой и известково-содовой
очистки рассола 101, а также другие методы предотвращения оса-
ждения CaSO4 в процессе выпарки, например добавка в рассол
СаС12 в количестве, соответствующем молярному отношению
Са : SO4 > 2,4 : 1 |02-103. При этом вследствие положительного зна-
чения температурного коэффициента растворимости CaSO4 в при-
сутствии СаС12 осаждение CaSO4 при выпаривании рассола не
происходит. Очистку насыщенного раствора NaCl от CaSO4 можно
осуществлять, выдерживая раствор над слоем твердой поваренной
соли при температуре выше точки перехода гипса в ангидрит
(95—100°) 104. Для уменьшения растворимости CaSO4 можно вво-
дить в раствор 2—6 г/л Na2SO4105 или MgS04Ioe. В последнем
случае Mg2+ выделяется из рассола в одной из стадий выпарива-
ния в виде кизерита MgSO4-7H2O, который возвращают в про-
цесс.
Наиболее совершенным, обеспечивающим хорошую очистку
при минимальном расходе соды (в 2—2,5 раза меньшем, чем по
известково-содовому способу), является известково-сульфатно-со-
довый способ, широко применяемый на современных предприя-
тиях 107’108. Однако он требует наиболее продолжительного от-
стаивания осадков. Продолжительность очистки этим способом со-
ставляет 25—40 ч летом и 60—75 ч зимой95. Ускорение отстаивания
осадков может быть достигнуто введением в рассол коагулянтов.
Представляет интерес термический способ очистки рассола от
CaSO4, основанный на уменьшении растворимости CaSO4 при на-
гревании (рис. 9). Некоторые рассолы, например рассолы из
иркутских и славянских скважин, могут быть очищены от гипса
на 50% нагреванием их до 200° при 15 атъъ’ 109. При отделении
CaSO4 за счет изменения его растворимости до кристаллизации
NaCl и при применении обычных методов химической очистки от
хлоридов кальция и магния, получается выварочная соль, содер-
жащая 99,8% NaCl110. Об использовании осадков, получаемых
жри ечистке рассолов, см.111
Производство выварочной соли
77
Конструкции аппаратов
При вакуум-выпарке рассолов NaCl для уменьшения отложе-
ния накипи на греющих поверхностях применяют выпарные аппа-
раты 88’ 1|2~'16 с энергичной принудительной циркуляцией жидкости.
Циркуляция осуществляется или с помощью внутренней пропел-
лерной мешалки (внутренний или встроенный насос) (рис. 11),
Рис. 11. Выпарной аппарат
с внутренним циркуляцион-
ным насосом:
/ — насос; 2-греющая камера;
<4 —направляющие перего-
родки.
Рис. 12. Выпарной аппарат с наружным
циркуляционным насосом:
/ — Испаритель; 2 — солеотделитель; 3 — фильтр для
соли; 4 — циркуляционный насос.
или с помощью наружного насоса (рис. 12). Скорость движения
жидкости в таких аппаратах устанавливают в пределах 1,5—
4 м/сек. При этом жидкость закипает в верхней части трубок. При
скорости меньше 1 м/сек уровень закипания смещается книзу и
вффективность от принудительной циркуляции резко падает —
процесс идет почти так же, как и при выпаивании с естественной
78
Гл. III. Хлористый натрий
циркуляцией. Увеличение скорости циркуляции раствора больше
4 м/сек не приводит к дальнейшему повышению коэффициента
теплопередачи. Обычно рассолы, выделяющие накипь, выпаривают
при скорости циркуляции, не меньшей 2,5 м/сек.
При выпаривании морских рассолов в аппаратах с принуди-
тельной циркуляцией интенсивность накипеобразования значитель-
но снижается при вынесении кипения раствора из греющих труб
в испарительную камеру, т. е. при использовании аппаратов с вы-
носными кипятильниками 117.
Для получения при вакуум-выпарке более крупной кристалли-
ческой соли предложено осуществлять классификацию солевой
пульпы, выходящей из испарителя аппарата с принудительной
циркуляцией. Рассол с мелкими кристаллами, выходящий из верх-
ней части классификатора, направляют обратно в испаритель; в
нижней части классификатора оседают крупные кристаллы П6’>19.
Другим путем является циркуляция рассола между вакуум-испа-
рителем, где достигается небольшое пересыщение (до 1,6 г/л), и
непрерывнодействующим кристаллизатором, работающим по прин-
ципу взвешенного слоя, где происходит снятие пересыщения и
выращивание кристаллической затравки до размера зерен
~2 мм 12°, >21.
Для укрупнения кристаллов поваренной соли, получаемой при
выпаривании рассолов, предлагают также добавлять к растворам
карбокси метил целлюлозу и некоторые другие высокомолекуляр-
ные соединения >22’123.
В солеваренной промышленности нашли также применение кон-
струкции выпарных аппаратов с механической очисткой теплопе-
редающей поверхности при помощи скребков или щеток. Приме-
нение таких аппаратов целесообразно лишь для выпарки неочи-
щенных рассолов, содержащих значительные количества гипса.
Наряду с этими типами выпарных аппаратов для выпарки
рассола применяют и аппараты с естественной циркуляцией. Ши-
роко распространен аппарат корзиночного типа с подвесной грею-
щей камерой. Недостатком его, как и других аппаратов с есте-
ственной циркуляцией, являются большие габариты.
Хорошо оправдали себя в эксплуатации также вакуум-аппа-
раты барометрического типа; в них питание рассолом и выгрузка
соли осуществляются так называемым открытым путем через сбор-
ник соли, в который опущены барометрические трубы. Эти аппа-
раты имеют греющие камеры с горизонтальными трубками. Уро-
вень рассола в аппарате зависит от разрежения в нем. Поэтому
для заполнения необходимым количеством рассола, т. е. несколько
выше греющей камеры, такие аппараты в многокорпусной бата-
рее располагаются на разной высоте, каскадом, что требует боль-
шего объема здания, чем при аппаратах других конструкций
.(рис. 13).
Производство выварочной воли
79
Очищенный рассол подогревается до 50—60° за счет тепла
конденсата из второго и третьего корпусов и поступает в общий
рассоло- и солесборник 4, откуда автоматически происходит пита-
ние вакуум-аппаратов 5—7. Кристаллизующаяся поваренная соль
поступает черве барометрическую трубу в общий сборник, откуда
транспортируется шнеком через приемник и солеизвлекатели в
центрифуги 11. При поверхности нагрева системы около 600 м2
и расходе пара (1,2 ат) 4300—4400 кг/ч производительность трех-
корпусной батареи составляет 85—90 т]сутки. Для получения 1 т
Рис. 13. Схема трехкорпусной выпарной станции с аппаратами барометрия -
' скоро типа:
/, 15 — насрсы; 5, 3 — теплообменники; 4 — солесборник; 5—7 — вакуум-аппараты; 8, 25 —баро-
метрические конденсаторы; 9 —водоотделитель, 10, 12 — ^акуум-насбеы; // — центрифуга;
14 — вакуум-регулятор; 16 — отвод конденсата.
$ухой соли расходуется 1,2 т пара, а 1 т греющего пара испаряет
2,5 т воды. После каждых 3—4 суток работы аппараты останав-
ливают на 1 сутки для очистки.
Для предотвращения образования накипи при выпаривании
рассолов морского типа и морской воды можно перегревать
жидкость под давлением, а затем испарять ее в испарителе при
пониженной температуре под вакуумом. Выделяющийся при испа-
рении сульфат кальция остается суспендированным в жидкости
вместе с кристаллами соли. При концентрировании морской воды
без кристаллизации соли предложено загружать в испаритель гра-
нулированный известняк, на котором осаждается сульфат а&ль-
ция 124.
В течение длительного времени большие затруднения в произ-
водстве выварочной соли возникали из-за коррозии аппаратуры.
80
Г л. 111. Хлористый натрий
Даже рассолопроводы, работающие при обычной температуре, из-
готовленные из простой стали, сильно разрушаются и требуют
частых ремонтов. Коррозия уменьшается при содержании в рас-
соле 0,05—0,1 г/л NaOH. Наиболее стойкими в насыщенном соля-
ном рассоле являются такие металлы как ниобий, титан, а из
более доступных — хромоникелевые и хромоникелевомолибдено-
вые стали; из неметаллических материалов стойкими являются
текстолит (до 100°) и импрегнированный графит (до 170°) 88> 125’12в.
Современные солеваренные заводы оборудованы 4—5-корпус-
ными выпарными станциями с аппаратами из нержавеющей стали
с выносными греющими камерами и принудительной циркуляцией.
В них используют мятый пар от турбогенераторов и других ма-
шин. Для предотвращения образования накипи—инкрустации
CaSO4— в рассол перед выпаркой вводят кристаллический CaSO4,
на поверхность которого выделяется сульфат кальция из рассола
в процессе выпарки. (Аналогично введение СаСО3 предотвращает
образование накипи из СаСО3.) Соль, отжатая на центрифугах,
имеет влажность 4—5%.
Для получения чистой соли, содержащей 99,5% NaCl, ее пос-
ле фильтрации промывают чистым насыщенным рассолом. При
этом магний удаляется почти полностью, а кальций на 60—70%.
Содержание магния в промытой соли пропорционально его со-
держанию в промывной жидкости127. При получении поваренной
соли вакуум-выпаркой из рапы некоторых озер, например озера
Кучук, промывка соли позволяет получать высокие ее сорта даже
без предварительной очистки рассола128. После сушки во вра-
щающихся барабанных сушилках горячим воздухом или дымо-
выми газами влажность соли снижается до 0,2—0,4% или до сотых
долей процента 110’130’181.
Перспективной является сушка поваренной соли в аппаратах
со взвешенным слоем120. В опытном аппарате поваренная соль
высушивалась от 3 до 0,03% влажности воздухом, подогретым
до 200° и поступавшим в аппарат под давлением 575 мм вод. ст.
Расход топлива был меньше, чем при сушке во вращающихся
барабанах, на 65—70% 132,133.
На некоторых американских заводах применяют вакуум-
фильтр-сушилку для одновременной фильтрации и сушки соли.
Отжатая от маточного раствора лепешка соли продувается на
фильтре горячим воздухом (150—160°), после чего влажность соли
снижается до 0,1%. Фильтр-сушилка при диаметре 1,8 м и ширине
барабана 0,6 м дает в сутки до 200 т соли; при ширине барабана
1,2 м — до 380—400 т.
Высушенную соль просеивают на цилиндрических вращающихся
ситах (буратах) для отделения комков (окатов), образующихся
при высушивании влажной соли. Просеянную мелкую сухую соль
передают с помощью ленточного транспортера в расфасовочное
Производство выварочной сол^
81
отделение склада. Один из барабанов ленточного транспортера
является магнитным сепаратором — в него вмонтирован электро-
магнит. При проходе через сепаратор из соли извлекаются могу-
щие попасть в продукт металлические частицы.
Сухую вакуумную выварочную соль расфасовывают в картон-
ные коробки, бумажные пакеты (по 0,5 и 1 кг) и в многослойные
крафтцеллюлозные мешки (до 50 кг).
В качестве примера приводим анализы (в %) двух образцов
выварочной соли, полученных чренной и вакуумной выпаркой из
одного и того же сырого рассола:
Нераство-
NaCl NaaSO4 MgCfe CaCls CaSO4 MgSC>4 римый Влага
остаток
Чреииая соль . . 98,51 — Следы 0,03 0,50 — 0.22 0,60
Вакуумная соль 99,49 0,15 — — 0,19 0,16 0,05 0,05
Для некоторых районов целесообразно комбинирование есте-
ственного концентрирования рассолов бассейным способом с по-
следующей вываркой соли из концентрированного рассола 1341133.
Таким путем, в частности, целесообразно извлекать соль из мор-
ской воды, так как полная выварка морской воды в вакуум-вы-
парных аппаратах требует большого расхода тепла, и поэтому
соль получается дорогой. Тем не менее выпарку морской воды
производят. В Японии на некоторых угольных шахтах, располо-
женных у морского побережья, получают соль выпариванием мор-
ской воды, используя в качестве топлива низкокачественный уголь
и рудничный газ 13®. При ступенчатом испарении морской воды под
вакуумом можно одновременно с поваренной солью получать ди-
стиллированную воду, конденсируя пары холодной воды из глу-
бин моря 137.
Представляет интерес получение выварочной соли с использо-
ванием тепла термальных соляных источников, находящихся в
районе Камчатки и Чукотского полуострова 138.
Мелкую поваренную соль, обладающую повышенной скоростью
растворения, можно получать, высушивая раствор NaCl в распы-
лительных сушилках при прямоточном движении снизу вверх теп-
лоносителя и раствора, подаваемого через форсунку сжатым воз-
духом. Высушенная соль должна улавливаться в циклонном пы-
леуловителе 139.
Предложено 140 получать кристаллическую поваренную соль из
рассола, выпаривая его в прямоточном аппарате, где он контак-
тируется с топочными газами при пенном режиме. Поток суспен-
зии NaCl в рассоле движется в восходящем направлении, если
получают мелкую (пищевую) соль и в нисходящем — при получе-
нии соли с частицами крупнее 0,165 мм. Вспененный рассол про-
ходит сепараторы для отделения насыщенного водяным паром
газа, который затем эжектируется. С пеной выводится осадок
82
Гл. III. Хлористый натрий
солей жесткости, образующийся при повышенной температуре под
влиянием содержащейся в топочном газе СО2. В ходе непрерыв-
ной кристаллизации размеры кристаллов и скорость их роста ре-
гулируются автоматически за счет непрерывного возврата оборот-
ного рассола после отделения сгущенной суспензии в конической
части аппарата.
ИОДИРОВАННАЯ ПОВАРЕННАЯ СОЛЬ
Употребление иодированной поваренной соли, содержащей
примесь KI, предупреждает болезнь щитовидной железы — зоб-
ную эндемию, развивающуюся при недоетатке иода в питьевой
воде. Ежедневная потребность человека в иоде составляет 0,06—
0,1 мг.
С течением времени иодид калия окисляется с выделением бы-
стро улетучивающегося иода. Разложение KI значительно уско-
ряется в присутствии влаги и в особенности окислителей. Имеются
попытки применения йодата калия, который в присутствии некото-
рых иодорганических соединений ие разлагается в течение дли-
тельного времени141.
Добавка в соль различных веществ, так называемых стабили-
заторов— фосфатов и карбонатов кальция или магния и других —
увеличивает стойкость иодированной соли. Лучшим стабилизато-
ром оказался тиосульфат натрия, восстанавливающий элементар-
ный иод до Nal. Введение тиосульфата натрия в количестве 1%
от KI или 0,00001% от веса соли позволяет хранить иодирован-
ную соль в течение шести месяцев без потерь иода. Без стабили-
затора KI полностью исчезает в течение 2—3 месяцев 1и'143. Для
предупреждения потерь иода при хранении иодированной соли
предложено также добавлять к ней активированный уголь 144.
Иодированную соль приготовляют мокрым и сухим способами.
Мокрый способ заключается в опрыскивании соли раствором KI,
содержащим тиосульфат натрия, из форсунок или капельниц. Кон-
центрация раствора KI должна быть такой, чтобы влажность соли
не возрастала более чем на 1%. Обычно применяют раствор, со-
держащий 2,5—5 г/л КБ Для увеличения срока хранения иоди-
рованной соли предложено иодировать ее опрыскиванием водным
раствором иодинола (1 г/л 12 и 3 г/л KI), приготовляемого из по-
ливинилового спирта и раствора иода в иодиде калия 145.
Иодирование производят на разных стадиях производства
соли. Например, каменную и озерную соль удобно иодировать пе-
ред ее помолом (рис. 14). В процессе дальнейшего измельчения
соли достигается равномерное распределение иодида калия в про-
дукте88. Иодирование выварочной соли мокрым способом может
быть осуществлено перед сушкой в сушильных барабанах, а также
в элеваторах или на транспортерах.
Получение соли вымораживанием
83
Рис. 14. Схема получении иодиро-
ванной соли:
I—ленточный транспортер; 2 —бункер
крупнокристаллической соли; 3 — наклон-
ный желоб; 4 — подвод раствора йоди-
стого калия с ниппелями для Опрыски-
вания соли; 5 —горловина вальцового
станка; 6 — вальцы; 7 —выход молотой
и иодированной соли.
Попытка плавить иодированную соль для получения кусковой
иодированной соли показала, что при этом теряется значительное
количество иодида калия146. Для получения крупнокристалличе-
ской иодированной соли рекомендуют прибавлять KI к соляному
рассолу до бассейной кристаллизации из него NaCl1471 148.
Сухой способ иодирования соли 88- 149 заключается в смешива-
нии сухой соли с концентратом иодида калия, представляющим
собой поваренную соль, содержа-
щую в 100 раз больше стабилизи-
рованного KI, чем предусмотрено
нормой, т. е. 1 г на 1000 г соли. Не-
обходимость предварительного при-
готовления концентрата обусловле-
на невозможностью равномерного
смешения твердых веществ в соот-
ношении 1 : 100000. Влажность кон-
центрата должна быть не больше
0,1%. Для смешения концентрата с
солью применяют шнековые и ба-
рабанные смесители. Более совер-
шенными являются смесители цен-
тробежного и каскадного ти-
пов 88, 149,150.
На заводе фирмы Canadian Salt
Со. недавно стали использовать
вибрационные питатели непрерыв-
ного действия с весами, для введе-
ния в соль (со скоростью 10—
750 г! мин') малых количеств СаЮ4, СоСО3 и KI в смеси с алюмо-
силикатами (снижающими клейкость добавок). Эти питатели, как
сообщают181, позволяют отказаться от предварительного смешения.
Сухой способ иодирования соли одно время применялся более
широко, чем мокрый способ, так как сухая иодированная соль бо-
лее устойчива, чем влажная. Считают, однако, что после разра-
ботки метода стабилизации влажной иодированной соли целесо-
образнее применять мокрый способ иодирования, отличающийся
большей простотой 88>149.
ПОЛУЧЕНИЕ СОЛИ ВЫМОРАЖИВАНИЕМ
Добыча соли из концентрированных рассолов возможна путем
кристаллизации соли при охлаждении рапы 82'152. Зимой, при низ-
ких температурах, из насыщенных рассолов вымерзает дигидрат
хлористого натрия NaCl-2H2O. Кристаллизация его идет тем ин-
тенсивнее, чем ниже температура, вплоть до температуры выде-
ления криогидрата (—21,2°). Если дигидрат извлечь из рапы, то
84
Г л. III. Хлористый натрий
при повышении температуры воздуха выше 4-0,15° происходит era
разложение и переход в чистую поваренную соль (рис. 7).
Дигидрат хлористого натрия выделяется в зимнее время в со-
ляных источниках Якутской АССР, а также во многих других
озерах. Выделяющийся дигидрат не содержит примесей, и его вы-
мораживание из рассола является одним из методов получения
чистой соли. При плавлении 1 т NaCl-2H2O при 25° можно по-
лучить 481,5 кг безводного хлористого натрия с выходом NaCl,
равным 77,8% п’1Б3.
Вымораживание соли зимой может производиться в таких же
бассейнах, как и садка соли летом. Максимальный выход безвод-
0 -5 -10 -15 -20
Температура, *С
Рис. 15. Вымораживание
льда из морской воды.
ной соли из насыщенного рассола до-
стигает 20% от начального содержания
ее в исходном рассоле.
Однако получение поваренной соли
вымораживанием является весьма слож-
ным, громоздким процессом, требующим
больших площадей бассейнов. При нали-
чии дешевой электроэнергии метод ис-
кусственного вымораживания может ока-
заться выгодным для получения пище-
вой соли сорта экстра. Более эффектив-
ным является концентрирование морской
воды в условиях холодного климата вы-
мораживанием льда.
Степень выделения льда в зависимо-
сти от температуры охлаждения пока-
зана на рис. 15 82. Охлаждением морской
воды до —17° с последующим отделе-
нием льда можно получить рассол, содержащий 9—12% со-
лей154’155 (по другим данным156 19%). Такой рассол после очи-
стки от CaSO4 пригоден для выделения NaCl методом выпарива-
ния. Из 1 м3 морской воды получается 30—32 кг соли 157. Качество
зтой соли различно: лучшие сорта могут содержать до 97—99%
NaCl, а худшие 80—82% 158. В среднем она содержит ~10% при-
месей.
Непосредственная заводская выпарка морской воды требует
много различного оборудования, т. е. больших капитальных вло-
жений и значительного расхода топлива. Для получения из мор-
ской воды, содержащей 3,5% солей (из которых 80% NaCl), 1 т
поваренной соли нужно выпарить ~45 т воды. Для этого необ-
ходимо израсходовать при использовании четырехкорпусной ва-
куум-выпарной батареи 3 т, а при чренной выпарке 7 т условного
топлива. С увеличением концентрации рассола количество выпа-
риваемой воды на 1 т соли резко уменьшается; так при концен-
трации рассола 8% нужно выпарить 15 т воды, а при 12% только
Получение соли вымораживанием
85
9 т. Поэтому предварительное вымораживание льда из морской
воды с последующей выпаркой оставшегося рассола экономически
более выгодно.
Плотность пресной воды максимальна при +3,95°, максимум
же плотности морской воды наблюдается при более низких тем-
пературах. При концентрации суммы солей 2,47% температура на-
чала выделения льда (—1,332°) становится равной температуре
максимальной плотности такого рассола (рис. 16). Более соленые
воды (океана, соляных озер) замерзают
при температурах выше температур их мак-
симальной плотности. Например, океан-
ская вода, соленость которой равна 3,5%,
вамерзает при —1,91°, а максимальная
плотность ее при —3,52°.
Эти свойства соленых вод имеют важ-
ное значение как для биологических, так и
для галургических процессов. В то время
как при замерзании поверхности пресного
водоема подледная вода сохраняет темпе-
ратуру около +4° ввиду ее повышенной
плотности, образование льда на поверхно-
Ри-с. 16. Температуры
замерзания (1) при наи-
большей плотности (2)
морской воды.
сти соленых вод сопровождается конвек-
цией подледных рассолов из-за разности
их плотностей, пока плотность не достигает
максимума, для воды океана при —3,52°.
Это может оказаться гибельным для неко-
торых видов фауны и флоры, но весьма благоприятно для галур-
гических процессов, так как циркуляция подледных рассолов и
низкая температура их максимальной плотности ускоряет охла-
ждение. Это приводит к увеличению степени вымораживания льда,,
укреплению рассолов и к повышению выхода солей, кристалли-
зующихся при понижении температуры. В бассейнах для зимней
садки солей температура рассолов уже через несколько суток до-
стигает средней температуры воздуха 156.
На рис. 17 приведена диаграмма глубокого охлаждения мор-
ской воды. На оси абсцисс отложены значения коэффициента кон-
центрирования К, равного отношению количества исходного рас-
твора к количеству конечного раствора. Его величина может быть-
определена по отношению содержания иона магния, являющегося
постоянным (неизменным) компонентом. Равновесными линиями-
диаграмма разделена на несколько областей кристаллизации. Об-
ласти I и II, а также IV и VIII отделены двумя линиями: пунктир-
ная относится к охлаждению морской воды обычного состава,
содержащей сульфат кальция; сплошная линия характерна для
морской воды, очищенной от сульфата кальция. С увеличением
концентрации растворов эти линии сближаются, так как
вв
Гл. HI. Хлористый натрий
растворимость сульфата кальция уменьшается. В растворах, на-
сыщенных хлористым натрием, растворимость сульфата кальция
столь мала, что кривые сливаются.
Как видно из диаграммы, на которой линия АВ (АВ')—путь
кристаллизации льда, а линия ВС (В'С)—мирабилита, вымерза-
ние льда из морской воды начинается при —1,8°. При —7,3° вме-
сте со льдом кристаллизуется мирабилит NagSC^ • ЮН2О, а при
—15° начинает выделяться
Коэффициент концентрирования, К
Рис, 17. Диаграмма глубокого охлажде-
ния морской воды.
Области кристаллизации:
I — льда; II - льда + КазЗОд • IOHjOj
///-льда + NajSO4 • 10Н2О + NaCl • 2HqO;
/V- Na»SO4 . fOH20;
V - NaCl . 2H2O + Na2SO4 • 10H2O;
V/— NaCl + Na2SO4 10H2O; K//-NaCI;
VIII — область ненасыщенных растворов.
сульфат кальция. При —22,4°
к этим твердым фазам при-
соединяется NaCl-2H2O. Если
при —22,4° отделить жидкую
фазу от твердой и продолжать
ее охлаждать, то при —34°
раствор станет насыщенным
хлоридом кальция. Таким об-
разом, по мере понижения
температуры раствор обога-
щается хлоридами магния и
кальция, кристаллогидраты ко-
торых выделяются в осадок
при еще более глубоком охла-
ждении. Конечный рассол за-
мерзает при температуре око-
ло —60°.
В зависимости от темпера-
туры вымерзания льда из мор-
ских рассолов выделяющийся
лед может содержать разное
количество твердых солевых
примесей, т. е. иметь различ-
ную «соленость». До темпера-
туры —7° образуется доста-
точно чистый лед, а ниже этой температуры он все больше загряз-
няется примесями. По разным источникам соленость морского
льда характеризуется величинами от 0,3 до 1%.
Из 1 т морской воды при охлаждении до начала кристаллиза-
ции мирабилита (—7,3°) вымерзает ~720 кг льда. При охлажде-
нии до —16° выделяется в твердые фазы 80—85% сульфат-иона и
получается ~ 175 кг рассола. При вымораживании до —35е из
1 т морской воды остается всего ~26 кг рассола.
В Японии и других странах концентрирование морской воды
осуществляют непосредственным вымораживанием льда15Э. Кон-
центрировать морскую воду вымораживанием льда можно, раз-
брызгивая ее при 0° в вертикальной башне, через которую цир-
кулирует минеральное масло, с температурой —10°, В нижней
Получение соли вымораживанием
87 '
Рис. 18. Схема переработки морской
воды и ее концентратов испарением пр»
100° и охлаждением до —10°.
части башни накапливается рапа плотностью 1,134 г!смА, а вверху
над маслом — лед160.
Заслуживает внимания получение поваренной соли из морской
воды комбинированием испарения и охлаждения с одновременным
выделением мирабилита164. Изменение состава получающихся при
этом растворов показано на рис. 18. Морскую воду (/, /°) или ее
концентраты (/, 1' или 1, 1"),
полученные вымораживанием
или другим методом, выпари-
вают при 100° вначале до на-
сыщения (/, а затем с
кристаллизацией NaCl (/—2).
Остающийся маточный рас-
твор (2, 2') после отделения
NaCl разбавляют водой (2,2")
и охлйждают до —10°, причем
кристаллизуется мирабилит
(2—3). Маточный раствор пос-
ле отделения мирабилита (3,
3') выпаривают вторично при
100° для дополнительной кри-
сталлизации NaCl (3—4). Ко-
нечный раствор состава 4, 4'
остается в небольшом количе-
стве и может быть использо-
ван для извлечения магниевых
солей.
Важной проблемой челове-
чества является расширение
ресурсов пресной воды, запа-
сы которой на земном шаре
весьма ограничены. В связи с
этим интенсивно разрабаты-
ваются различные методы
опреснения соленых вод161.
Помимо пресной воды при
обессоливании морской воды :
более концентрированные рассолы, чем исходные. Они могут слу-
жить источниками выделения NaCl рассмотренными выше спо-
собами.
Опреснение морской воды в крупных масштабах производят
различными путями. Широко применяют дистилляцию в вакуум-?
испарителях 162 и вымораживание льда 157’189> 1вз-1вв Применяют
различные источники холода, в чаетности, вымораживание льда-
ведут за счет испарения небольшой части воды (0,5%) под ваку-
умом (абсолютное давление в вакуум-аппарате 3 мм рт. ст.) или?
других соленых вод
«8
Гл. III. Хлористый натрий
за счет испарения под атмосферным давлением примешиваемых к
воде легкокипящих веществ, например: бутана, изобутана 166, про-
пана, фреонов и др.168. Кристаллизующийся лед можно отделять
от остающейся воды фильтрованием, центрифугированием или
флотацией 1ез. Все шире распространяется обессоливание электро-
диализом 161 и фильтрованием под давлением через мембраны,
проницаемые для воды и почти не пропускающие растворенные
в ней соли. Мембраной служит, например, пленка из ацетатной '
целлюлозы с модифицирующими добавками (перхлорат магния,
ацетон) 169. Используют и ионообменные смолы 17°-171.
ПОЛУЧЕНИЕ ПОВАРЕННОЙ СОЛИ ВЫСАЛИВАНИЕМ
И ПЕРЕКРИСТАЛЛИЗАЦИЕЙ
Рис. 19. Изотермы растворимости в систем»
NaCl — MgCl2 — Н2О при 10, 40 и 100°.
Уделялось много внимания разработке новых способов полу-
чения поваренной соли из рассолов путем высаливания ее хло-
ристым магнием (рис. 19) или хлористым кальцием172. Преиму-
щества этих способов со-
стоят в относительной
простоте технологическо-
го процесса (заключаю-
щегося в смешении рас-
солов, отделении выпав-
ших кристаллов соли и
сушке их), в отсутствие
расхода топлива на вы-
паривание рассола, в от-
сутствие необходимости
предварительной очистки
рассола и др.
При смешении, напри-
мер, 1 л«3 рассола, содер-
жащего 20,7% NaCl, 1,3%
MgSO4, 4,3% MgCl2,
73,7% Н2О (плотность
1,23 г/см3) с 1 м3 хлор-
магниевого рассола, со,-
держащего 27,6% MgCl2,
4,4% MgSO4, 1% NaCl,
€7,0% Н2О (плотность 1,25 г/см3), выход кристаллизующейся по-
варенной соли составляет около 78 кг.
Разработаны способы перекристаллизации каменной соли, по-
зволяющие получать чистую соль более дешевым путем, чем ва-
куум-выпаркой. Например, каменную соль смешивают с маточным
раствором, остающимся после вторичной кристаллизации. Соле-
вую пульпу перемешивают острым паром, конденсация которого
приводит к растворению кристаллов соли при 100—105°. Нерас-
Получение поваренной соли из галитовых отходов
89
творившаяся часть, содержащая примеси (ангидрит и др.), от-
деляется в отстойнике, а горячий раствор направляют на кристал-
лизацию в две стадии—при охлаждении его до 80°, затем до 50°.
Соль из кристаллизаторов отжимают на центрифугах и высуши-
вают173.
Другой способ заключается в обработке каменной соли цир-
кулирующим насыщенным раствором NaCl при температуре от 0
до —20°; при этом соль переходит в дигидрат, который отфиль-
тровывают и нагревают. Дигидрат плавится и выделяется чистая
соль; рассол возвращают в процесс 174.
Из каменной соли, сильно загрязненной ангидритом, можно-
получить поваренную соль сорта «экстра» перекристаллизацией
из растворов хлорида кальция. Каменную соль перемешивают в-
течение 30 мин с исходным раствором, содержащим 24% СаС12.
В кристаллизаторе раствор охлаждается от 112 до 20°. Выход
NaCl из 1 м3 раствора около 50 кг. Получаемая после промывки
соль содержит 99,2% NaCl. Расход СаС12 (100%) при 50-кратном
использовании составляет 11 кг на 1 т получаемой соли 175.
ПОЛУЧЕНИЕ ПОВАРЕННОЙ СОЛИ ИЗ ГАЛИТОВЫХ ОТХОДОВ
КАЛИЙНЫХ ПРЕДПРИЯТИИ
При переработке сильвинита на хлорид калия (стр. 154) в ка-
честве отхода (отвала) получается загрязненный примесями хло-
рид натрия. Количество его очень велико — до 80% от перера-
батываемого сильвинита. Галитовые отходы содержат (в сухом
веществе) 92—96% NaCl, 1,2—2,5% КС1, 0,6—2% CaSO4, 0,05—
0,2% MgCl2, 0,3—3% нерастворимых веществ: влажность их 5—
10% 176.
Технические сорта поваренной соли могут быть получены из
отходов путем их промывки насыщенным раствором хлорида нат-
рия, например на реечном классификаторе. При этом содержание
NaCl повышается до 98%, а содержание примесей снижается
(КС! до 0,30—0,32%). Этот метод переработки отходов наиболее
прост и дешев.
Получение более чистой пищевой соли может быть осуществ-
лено растворением отходов 177, химической очисткой полученного-
рассола и вакуумной выпаркой его, а также флотацией отходов 178.
Последний метод имеет преимущество перед вакуум-выпаркой,
так как не требует расхода пара. Из отходов флотируют примеси,
а не основной продукт — так называемая обратная флотация. (Воз-
можна и прямая флотация в присутствии солей свинца или вис-
мута 179.) Хотя флотация и дает продукт е высоким содержанием
NaCl (99,7%), но он загрязнен флотореагентами и имеет неудов-
летворительный внешний вид, так как представляет собой не
бесцветный (красноватый) тонкий порошок (содержание класса
0,15 мм составляет ~57%).
90
Гл. III. Хлористый натрий
Промывка галитовых отходов от переработки верхнекамских
сильвинитов по специальной технологической схеме180 позволяет
экономично получать пищевую соль хорошего качества. По этой
схеме (рис. 20) отходы смешиваются с рассолом NaCl и подвер-
гаются мокрой классификации на дуговых ситах 181 с целью отде-
ления средней фракции с размером —3 + 0,5 мм, содержащей наи-
меньшее количество примесей. Эта фракция при Ж:Т равном 0,7
Рис. 20. Схема получения соли 1 сорта помола № 0 из галитовых отходов: J
I, 6 и 8 —мешалки; 2, 9 и 21 — насосы; 3, 5, 10 и 14 — дуговые сита; 4 - планфильтр; 7 — дро-1
вйлка; р-Напорный бак; 12 -контактные чаны; 13 и 15 -гидросепараторы; 16 - горизонталь-1
наЯ мешалка; 17— центрифуга; 18 — транспортер: 19 — отстойник; 20 — сборный бак. 1
доизмельчается до крупности, соответствующей помолу № 0, и пе- з
ремешивается в контактных чанах 30—40 мин. При этом раство-1
римые примеси переходят в раствор, а затем пульпа обесшламли-1
вается в гидросепараторах и на дуговом сите. Загрязненный рас- 5
сол сливают, а сгущенную пульпу направляют на центрифугу. ।
В ней соль промывается небольшим количеством воды для оконча- I
тельного вытеснения хлорида калия. Промытую соль высушивают. '
Загрязненный оборотный рассол после осветления возвращается
в процесс, но часть его удаляется для вывода из цикла хлорида ;
калия. При вакуум-выпарке этой части рассола из него можно по-
лучать соль «экстра». Наибольшая удельная производительность
отстойной площади для оборотного рассола достигается при кон-
Брикетирование и борьба ео слеживавмостью соли
91
центрации суспензии 5 а/л; при этом она равна 1,5 м3/(м2'Ч) при
расходе коагулянта крахмала 0,7 кг на 1 т ила, или 1,9 м3/(м2-ч)
при таком же расходе полиакриламида 182. Получаемая соль со-
ответствует по составу первому сорту. Она содержит (в %):
NaCl..............
CaSO4.............
MgCl2.............
98,5 — 99,0 Нерастворимый оста-
0,5—0,6 ток................0,3—0,4
0,02-0,07 КС1................ Нет
Техническая поваренная соль может быть получена и из от-
ходов флотации КС1 из сильвинита.
Содержание токсичных жирных аминов (используемых в каче-
стве коллектора-собирателя сильвина) во флотационных отходах
составляет ~8 г/т, но в солевой фракции их практически нет, так
как они адсорбируются на глинистом шламе (в 1 т нераствори-
мой части отходов содержится ~325 г аминов). Поэтому в гото-
вой технической соли, полученной из отходов флотации, амины от-
сутствуют 183.
Для отмывки флотационных отходов галита от аминов пред-
ложено также обрабатывать их в классификаторах оборотным ма-
точным раствором; из циркулирующего раствора частицы амина,
имеющие размеры 1 —100 мк, отделяются фильтрованием через
несколько слоев стеклоткани 184. О приготовлении из отходов фло-
тации сильвинита технического рассола см.185.
Для внутризаводского перемещения можно использовать гид-
ротранспорт поваренной соли в ее насыщенном растворе с по-
следующим отделением соли в гидроциклоне. Влажность соли и»
гидроциклона 18—20% 186.
Предложена скоростная разгрузка сухой соли из опрокиды-
вающегося вагона в бетонный бассейн с рассолом, находящийся
под колеей. Пульпу (Ж : Т =1:1) перекачивают насосом в хра-
нилище, где кристаллы отделяются от рассола, возвращаемого в:
бассейн 187.
БРИКЕТИРОВАНИЕ И БОРЬБА СО СЛ ЕЖИВАЕМОСТЬЮ СОЛИ
Крупнокристаллическая соль, содержащая меньше 5% зерен с
размерами менее 5 мм, схватывается весьма слабо. Наибольшей
слеживаемости подвержена соль с размерами зерен менее 1,2 мм.
Слеживаемость соли резко повышается во влажном воздухе, осо-
бенно при колебаниях влажности. Сильнее слеживается соль с по-
ниженным содержанием Mg2+ 188.
Надежным путем предотвращения слеживаемости соли яв-
ляется высушивание и прокаливание ее до остаточной влажности
менее 0,1 или 0,05% (в районах со среднегодовой относительной
влажностью воздуха не выше 75%) и упаковка в сухом виде во
влагонепроницаемую тару 189.
62
Гл. III. Хлористый натрий
Во многих странах, особенно в странах с влажным климатом,
вызывающим слеживание и расплывание срли, соляную пыль и
часть мелкозернистой соли брикетируют, брикетированная соль
употребляется в качестве пищевой соли. Изготовляют также кор-
мовые брикеты для животных («лизальные камни» или «лизун-
цы») , иногда с добавкой кормовых фосфатов и микроэлементов 19°.
Брикеты, изготовленные из соляной пыли, могут быть размолоты
на крупнозернистую соль на рифленых валках, причем количество
получаемой вновь пыли очень невелико (66,6% зерен имеют круп-
ность более 5 мм).
Можно изготовлять легкие пористые блоки из поваренной соли
плотностью меньше 0,7 г]см\ Для этого приготовляют из кристал-
лической поваренной соли и рассола (или другой жидкости) пасту
или суспензию, в которую вводят связующий агент — желатину,
алкилцеллюлозу, казеин (0,1—0,5% от веса сухой соли) и насы-
щают ее воздухом или двуокисью углерода. Последнюю можно
генерировать непосредственно в смеси, добавляя к ней бикарбо-
нат натрия или аммония. Насыщенную воздухом кремоподобную
массу выливают в формы и высушивают при 150° 191.
Предложены различные способы предотвращения слеживаемо-
сти соли при открытом хранении на воздухе, в основном с приме-
нением разных добавок, понижающих гигроскопичность соли или
препятствующих схватыванию ее в сплошной конгломерат или
плотные комки. В качестве таких добавок предложены: водоне-
растворимые соединения марганца и железа (окись марганца и
фосфат железа или 9МпО • 4FeO • PsOj) в количествах, допусти-
мых при применении соли в пищу (--0,6—0,7 % )192, водораство-
римый комплексный фторид, например фторсиликат, в таком ко-
личестве, чтобы содержание фтора в соли было не больше
0,01 % 193; тонкодисперсный осажденный силикат кальция или ги-
дратированная кремневая кислота с размерами частиц менее 1 мк
в количестве 0,5—5% от веса соли 194-195; алифатические амины с
числом атомов углерода от 6 до 22 (о-октиламин, дециламин) в
количестве 0,023—1,8 кг на 1 т соли, предварительно растворенные
в нефти или керосине с добавкой поверхностно-активных веществ
(0,5—3%), вносимые при 65—120° 196; и другие добавки 197’198. За
границей часто в качестве таких добавок используют ферроциа-
ниды и феррицианиды (5—10 ч. на 1 млн. ч. NaCl); для уменьше-
ния их вымывания атмосферными осадками при хранении соли
в буграх предложено ферроцианид, феррицианид или нитрило-
триацетамид предварительно обрабатывать органическим силокса-
ном (0,1—5% от веса добавки), содержащим группы RR'SiO —
(где R, R'—алкильный или арильный радикал)199. Для этой же
цели предложено добавлять к рассолу при получении из него соли
поверхностным испарением моноэфир лауриновой кислоты и по-
лиоксиэтиленсорбитан 20°. Показана эффективность добавки
Литература
93
A1(OHS) (0,005—0,1%), введенной мокрым способом — опрыски-
ванием соли растворами А1С1з (0,1%) и щелочи201. Запатентован
способ получения быстрорастворяющейся в воде и исслеживаю-
щейся поваренной соли путем добавки к выпариваемому рассолу
0,0015—0,1% гексаметафосфата натрия с примесью 2—40% от
веса последнего поливалентного катиона в водорастворимой фор-
ме— в виде окислов, гидроокисей, сульфатов или хлоридов Al, Fe,
Ba, Bi, В, Cd; в получаемой соли содержится меньше 0,3% фос-
фата и меньше 0,0005% металла 202. Для придания поваренной
соли гидрофобности рекомендуют обрабатывать ее пищевым жи-
ром (меньше 1%)203 или парафином 204, или жидкими неорганиче-
скими галогенидами кремния, имеющими связь Si—Н, например
силикахлороформом 2М.
СПЕЦИАЛЬНАЯ (ТОНКАЯ) ОЧИСТКА СОЛИ
Соль высокой чистоты с содержанием NaCl 99,9% и больше
готовят или перекристаллизацией стандартных (продажных) сор-
тов соли 200 или другими методами — промывкой и пр. Чистоту
соли можно определять измерением ее электрического сопротивле-
ния207. Очистку NaCl от таких примесей, как например Na2SO4,
можно осуществлять промывкой соли соляным раствором 72-208.
Хлористый натрий с содержанием 99,97—99,98% NaCl может
быть получен перекристаллизацией NaCl^HaO, а также обработ-
кой поваренной соли концентрированной соляной кислотой 209.
Предложено очищать поваренную соль от примесей раство-
рением ее в ненасыщенном растворе чистой соли под давлением
при 115—140° и последующей кристаллизацией NaCl из получен-
ного насыщенного раствора, не содержащего примесей, при атмо-
сферном давлении210.
Представляет интерес очистка поваренной соли от органиче-
ских и бактериальных примесей плавлением. Затраты на очистку
соли этим методом, вероятно, могут быть ниже затрат на пере-
кристаллизацию, так как затраты тепла на плавление соли зна-
чительно меньше, чем на однократное испарение воды из рас-
твора211.
ЛИТЕРАТУРА
1. W. Е. May, Т. R. S к о 11, пат США 2642335, 1953; канад. пат. 497203,
1953.— 2. Австрал. пат. 153929, 1953.— 3. В. Н. Дубинина, Труды ВНИИГ,
в. 29, 1954, стр. 3.—4. К. Przibram, Kali, 30 (1936).—5. А. А. Иванов,
Основы геологии и методика поисков, разведки и оценки месторождений мине-
ральных .солей, Госгеолиздат, 1953. — 6. R. Bruno, Ann. chimica. 56, № 11, 1287
(1966). — 7. Л. Л. Панченко, Н. Д. Ивашенко, Е. Л. Волченко, Труды
НИИ соляной пром., в. 2 (10), 1959, стр. 97. — 8. Е. И. Ах умов, Е. И. Нико-
лаева, Т. Н Ш е в л я к о в а, ЖПХ, 29, № 10, 1599 (1956). — 9. Н. А. Купина,
Труды ЛТИ им. Ленсовета, в. 40, 19о7, стр. 92. —10. В. П. Ильинский,
В. Ф. Королев, Е. И. Ах умов, ЖПХ, 25, № 5, 507 (1952).
84
Гл. III. Хлористый натрий
11. А.
П. Николаевский, ИСФХА АН СССР, 4, в. 2, 217
(1930).—’
12. М. Кучеров, Поваренная соль и ее техническое использование, Химтеорет, я
1933. —13. В. Н. Енько, Поваренная соль, Химтеорет, 1933. — 14. J. Taylor,
канад. пат. 490245, 1953. — 15. Т. П. Унанянц, Хим. наука и пром., 2, № 6, 'j
774 (1957).— 16. А. И. Дзенс-Лнтовский, В. А. Иванов, Поваренная
соль. Требования промышленности к качеству минерального сырья, в. 77, Изд. Ч
«Недра», 1965. —17. Г. Л. Кореньков, Н. А. Устинова, Горнохимическое 1
сырье зарубежных стран, Изд. «Химия», 1965. — 18. И. А. Е Гунов, сб. «Источ- з
ники минерального сырья для химической промышленности», т. II, 1928, стр. 213.— 3
19. А. А. Иванов, П. И. Алексеевский, Минерально-сырьевая база СССР, j
вып. 36, ОНТИ, 1935. — 20. А. Е. Первухина,- Труды Сев. базы АН СССР, J
в. 5, 1940. 1
21. П. М. Татаринов и др., Курс нерудных месторождений, ч. I, Гор-
геолнефтеиздат, 1934. — 22. 3. А. Горелик, Залежн каменной соли в Домано-
вичском районе и перспективы поисков соли и нефти в БССР, Минск, 1947,— ,
23. А. И. Д з е н с - Л и т о в с к и й, Бюлл. ВИГ, № 1—2, 9 (1940).— 24. Б. Л. Р о н- 3
кин, Наши соляные озера и их богатства, ГНТИ, 1931. — 25. Н. С. Курнаков,
Соляная проблема и химическая промышленность, ГНТИ, 1931. — 26. М. Г. В а-
ляшйо, Труды ВНИИГ, в. 23, 1952, стр. 25. — 27. Г. Г. Уразов, И. Н. Ле-
пешков, Труды Ин-та химии АН УзбССР, т. 2, 89 (1949). — 28. А. А. Пер-
ротте, Соль, 1936. — 29. Е. В. Посохов, Минеральные богатства соляных
озер Казахстана, Алма-Ата, 1949. — 30. Я. Д Фридман, А. А. Зиновьев,
Организация солепромыслов в Киргизской ССР, Фрунзе, 1948.
31. О. И. Д е й н е к а, Д. М. Корф, Бюлл. ВИГ, № 4—5 (1939) и № 6—7
(1940). — 32. Л. В. Николаев, Кулундинские соляные озера и пути их освое- ’
ния, Новосибирск, 1935.— 33. Н. Ф. Поярков, Автореф. канд. дисс., АН
УзбССР, Ташкент, 1955. — 34. Н. С. Курнаков, В. Г. Кузнецов,
А. И. Дзенс-Литовский, М. И. Равич. Соляные озера Крыма, Изд. АН
СССР, 1936, —35. В. П. Б л ид ин, ЖПХ, 24, № 10, 1096 (1951).—36. А. А. И в а-
нов, Природные минеральные соли, Госгеолиздат, 1951. — 37. Проблемы озера
Эльтон, под ред. Н. С. Курнакова, ч. II, Труды ВИГ, в. 16, 1939.—
38. Г. С. Клебанов, Д. М. Корф, Л. В. Еловская, сб. «Приаральский
соляной район», Изд. АН СССР, 1937. — 39. Л. Насруллнн, Нар. хоз. Ка-
захстана, № 4—5, 23 (1940). — 40. Инструкция по применению классификации
запасов к месторождениям калийных солей и каменной соли, Госгеолиздат,
1951.
41. Л. Д. Шевяков, Разработка месторождений полезных ископаемых, \
Углетехиздат, 1953. — 42. А. Н. А н д р е и ч е в. Разработка калийных и каменно-
соляных месторождений, ч. I, 1953. — 43. А. Н Дегтярев, Д. П. Духовли-
н о в, Хим. пром., № 2, 65 (1955). — 44. Ш. А. П а н а х и, Труды Азербайджанск.
индустриального ин-та, в. 12, 1956, стр. 61 —45. А. И. Дзенс-Литовский,
Бюлл. ВИГ, № 6—7, 21 (1940). — А. Н. Андреичев, Пути механизации
трудоемких работ в горнохпмической промышленности, Госхимиздат, 1953. —
47. А. П. Лысов, В. М. Сталин, К- А. Лохани и, Электрическая породо-
погрузочная машина ЭПМ-1, Углетехиздат, 1952.—48. И. Д. Костев, Стаха-
новские методы работы в бурении соли, Пищепромиздат, 1940.— 48a. П М. Цим-
баревич, Труды Московск. горного ин-та, № 6, 1941, стр. 36. — 49. Труды
Украинск. н.-и. ии-та соляной пром., в. 5 (13), 1962.—50. И. В. Остроухое,
Там же, в. 2 (10), 1959, стр. 34, 48.
51. Е. Martkowski, К- Lipinski, польск. пат. 53883, 1965.—52. П. Ка-
шинский, И. Славский, Методы химического анализа соленой воды и озер-
ной грязи, ГНТИ, 1931. —53. А. Г. Бергман, Н. П Л у ж н а я, Физико-хими-
ческие основы изучения п использования соляных месторождений хлорид-суль-
фатного типа, Изд. АН СССР, 1951. — 54. Н. С. К У р н а к о в, Собрание избран-
ных работ, т. II, ОНТИ, 1939, стр. 339.—55. И. Н. Лепешков, Усп. хим., 21,
Литература
95
№ 9 1079 (1952). — 55. Н. С. Курнаков, С. Ф. Жемчужный, ИСФХА АН
СССР, 1, № 1, 185 (1919). —57. В. Я. Р у Д и н, Н. Л, Я рым-Аг а ев, ЖПХ, 30,
Ns 6, 941 (1957). —58. М. К- Файзнев, ДАН УзбССР, № 3, 17 (1954).—
59. Е. И. Познер, ЖФХ, 21, № 7, 863 (1947). — 60. М. К. Воротницкий,
Механизмы для добычи и погрузки соли, Пищепромиздат, 1946.
61. Н. П. Кузьмин, Труды Всесоюзн. и.-и. ин-та соляной пром., № 1 (9),
1954, стр. 4. — 62. В. И. Николаев, Б. И, Степанов, Н. Е. С а л и ш е в а,
Труды н.-и. станции НКМП КалмАССР, 1940, стр. 105. — 63. Е. И. А х у м о в,
ЖПХ, 30, № 8, 1246 (1957). — 64. Б. Ф. Вьюнов, Труды Всесоюзн. н.-и. ин-та
соляной пром., № 1 (9), 1954, стр. 72.— 65. Е. И. А х у м о в, Е. И. Николаева,
ЖПХ, 27, № 5, 480 (1954). — 66. Е. И. А х у м о в, Л. А. Б а к к, Там же, 32, № 6,
1225 (1959). — 67. Б. Ю. Пр асе, Руководство для мастеров-солеваров (вахте-
Ибассейных промыслов, Пищепромиздат, 1937. — 68. Rao С. Sivaprasada,
n. Age (India), 16, № 6, 518 (1965). — 69. Б. Ю. Пресс, С. Ф. В ер со ц-
к и й, Добыча соли простейшими способами, Пищепромиздат, 1943. — 70. Н. П р е-
словски, Минно дело, 10, № 1, 68 (1955).
71. М. J. F е 1 i z а г d о, Philippine J. Sci., 84, № 2, 177 (1955). — 72. М. Pei-
sak, S. Afrik. Industr. chemist, 9, № 11, 210 (1955). — 73. Z. Czerwinski,
A. Narebska, Przem. Chem., 10, № 6, 299 (1954). — 74. П. А. К У л л e, Труды
Цнисл, в. 2, 1940, стр. 3. — 75. Ф. А. П е т р а ч к о в, М. В. Гончарова,
Труды Украинск. н.-и. ин-та соляной пром., в. 5 (13), 1962, стр. 119.—
76. G. G. Jain a. oth., Salt Res. a. Ind., 4, № 1, 10 (1967). —77. J. P. Jassa-
walla, Chem. Age (India), 7, № 1, 53 (1956). —78. R. T. T h a m p y, N. R. К u-
1 о о r, D. N. Daruvalla, Chem. Age (India), 5, № 3, 99 (1954). — 79. Пат.
ФРГ 931168, 1955. — 80. Э. Б. Штерн ин а, Е. В. Фролова, ИСФХА АН
СССР, 21, 271 (1952).
81. J. D'Ans, Kali und Steinsalz, 4, № 4, 109 (1965). — 82. К. Э. Гнттер-
м а н, В. Ф. Королев, Труды соляной лаборатории АН СССР, в. 15. ч. 1,
1937. — 83. И. К- Пуха, Труды ВНИИГ, в. 36, 1959, стр. 322. — 84. В. П. Иль-
инский, А. И. Данюшевская, Труды Дальневосточного филиала АН СССР.
Сер. хим., в. 2, 1956, стр. 43, 54.—85. А. И. Данюшевская, Там же,
стр. 75. — 86. A. S. Hester, Н. W. Diamond, Ind. Eng. Chem., 47, № 4, 672
.(1955). — 87. D. W. К о u f m a n n, Sodium Chloride, New York—London, 1960.—
88. А. И. Зиновьев, Технология выварочной и иодированной соли, Пищепром-
издат, 1957.—89. V. J е n i s t a, Prumysl Potravin, 7, № 1, 25 (1956).—
90. D. A. Crooks, T. R. Scott, канад. пат. 498284, 1953.
91. Суги, Симидзу, Сакура и, япон. пат. 1823, 1955; Bull. Soc. Salt
Sci. Japan, 10, № 1, 27 (1956). — 92. В. H. Айзенберг, И. Н. Гладкий,
Н. Г. П а х м у р а, Труды Украинск. н.-и. ин-та соляной пром., в 5 (13), 1962,
стр. 115.—93. И. 3. Макин ский, Труды Азерб. индустриального ин-та, в. 5,
1953, стр. 41. — 94. М. Б. 3 е л и к н н, А. Я. Бакулина, Н. К. Лукьянова,
Э. С. Нен но, Труды ВИСП, т. 8, 1955, стр 56. — 95. А. В. В ас сервер г,
А. Е. Кругликов, Труды ЦНИСЛ, сб. № 1 (в. 6—8), 1941, стр. 187.—
96. А. Ф. Б о р я ч е к, Е. К- Овечкин, С. С. У р а з о в с к и й, Труды ВИСП,
т. 5, 1949; стр. 71. — 97. А. А. Фурман, С. С. Ш р а й б м а н, Приготовление и
очистка рассола, Изд. «Химия», 1966. — 98. Хагино, Кобаяси, Bull. Soc.
Salt Sci. Japan, 9, № 5, 10 (1955).—99. А. Ф. Боря чек, E. T. Громова,
О. H. Кулагина, Труды НИОХИМ, т. 19, 1969, стр. 48. — 100. Мац у но
Т а к э о, япон. пат. 743, 1961.
101. D. W. Hengerer, канад. пат. 506130, 506131, 1954. — 102. A. Hirsch,
пат. США 2683649, 1954. — 103. Дат. пат. 77720, 1954,— 104. Ф. В. Королев,
Труды соляной лаборатории, т. 15, 1937. —105. R. М. Hunter, R. D. Blue,
М. Р. Neipert, канад. пат. 511795, 1955. — 106. А. С. Н. Arens, англ. пат.
1054594, 1954. — 107. D. Y. G е г г i t s е n, Chem. Weekbl., 50, № 9, 159 (1954).—^
108. A. E. Кругликов, Труды ВНИИГ, в. 36, 1959, стр. 244, 376. — 109. Т. Oh-
96
Гл. III. Хлористый натрий
к a w а, япон. пат. 2279, 1953. — ПО. W. L. Badger, F. С. Standiford,
Chem. Eng., 62, № 3, 173; № 4, 180 (195В).
П1. В. Н. Айзенберг, И. Н. Гладкий, Труды Украинск. и.-и. ин-та со-
ляной пром., в. 2 (10), 1959, стр. 87, — 112. Н. И. Гельперин, Выпарные ап-
параты, Госхимиздат, 1947. — 113. А. Г. Касаткин, Основные процессы и ап-
параты химической технологии, Госхимиздат, 1960. — 114. А. Н. Плановскнй,
В. М. Р а м м, С. 3. Коган, Процессы и аппараты химической технологии, Изд.
<Химия», 1968. — 115. В. Ф. Ассмус, Труды ЦНИСЛ, сб. 1 (в. 6—8), 1941,
стр. 49. — 116. Кода Н а б у о, Plant a. Progress., 7, № 12, 23 (1965).—
117. Е. М. Ковалев, В. С. Фокин, И. М. Коваль, Хим. и нефт. маш., № 10,
19 (1965). — 118. Швейц, пат. 289976, 1953. — 119. Н. Domning, швед, пат.,
192439, I960, — 120. Chem. Age, 82, № 2104, 648 (1959).
121. Кониси Такэо, Bull. Soc. Sea. Water Sci. Japan, 19, № 3, 178
(1965).— 122. Голланд, пат. 88978, 1958. — 123. Англ. пат. 822893, 1959.—
124. К. Sugimoto, Т. Jawataya, япон. пат. 1266, 1954. — 125. С. С. Ш р а й б-
м а н, Хим. пром., № 4, 17 (1947). — 126. А. И. Кунина, Т. М. Пелен, сб.
<К°ррозия и борьба с ней», № 12, Машгиз, 1952, стр. 105. — 127. Симидзу
С а т к о, Chem. Techn. a. Eng., 3, № 2, 28 (1959).— 128. Я. М. Хейфец, ЖПХ,
34, № 3, 473 (1961). — 129. П. Г. Романков, Н. Б. Рашковская, Сушка во
взвешенном состоянии, Изд. «Химия», 1968. — 130. Food Eng., 27, № 7, 102 (1955).
131. J. A. Lee, Chem. Eng., 58, № 1, 102 (1951). — 132. C. W. Jobes, Chem.
Eng., 61, № 1, 165 (1954).— 133. Ю. Я- Каганович, Хим. наука и пром., 2,
№ 6, 764 (1957). — 134. П. Ф. С л а в н о в а, Соц. строительство, № 1, 42 (1941,
Якутск). —135. R. Н. Buchanan, Chem. Process (Australia), 13, № 4, 49
(i960). — 136. J. Coal Res. Inst., Japan, 7, № 1, 7 (1956). — 137. L. N i s о 11 e,
пат. ФРГ 899937, 1953. — 138. A. M. Жирмунский, Б. Я. Розен, Сообщение
Дальневосточного филиала АН СССР, в. 6, 1954, стр. 5.— 139. В. Г. Я р о ц к и й,
А. И. Науменко, Р. М. Самельзон, Труды ВНИИСП, в. 9 (17), 1965, 4
стр. 162. —140. Англ. пат. 1091723, 1965. 1
141 R. Т. Th a mpy, N. R. К u 1 о о г, D. N. Daruvalla, Chem. Age (In- i
dia), 5, № 3, 99 (1954). — 142. А. И. Зиновьев, Труды ВСНИИ, № 1 (9), |
1954, стр. 39. — 143. J. Та novice a nu, Rev. igienS microbiol. si epidemiol., № 2, 3
37 (1954). — 144. W. H. Engels, канал, пат. 501309, 1954. — 145. Л. E. Олиф- I
сон, В. И. Зак, Л. Ф. Михайлова, авт. свид. 198353, 1966. — 146. С. Р. S h а г- |
da, D N Daruvalla, Chem. Age (India), 6, № 1, 91 (1955). — 147. Франц. I
пат. 1043831, 1953. — 148. Австрал. пат. 158218, 1954. — 149. А. И. 3 и н о в ь е в, |
Труды ВСНИИ, № 1 (9), 1954, стр. 66. — 150. М. М. Р а т н е р, Н. Г. П а х м у р а, |
Труды Украинск. н.-и. ин-та соляной пром., в. 2 (10), 1959, стр. 78. |
151. Н. Е. Sills, Chem. Process (USA), 29, № 7, ПО (1966).— 152. Д. С. H а- |
деждин, М. В. Гончарова, М. Е. Купличенко, Труды Украинск. н.-и. |
ин-та соляной пром., в. 2 (10), 1959, стр 72. — 153. В И. Николаев, 1
Б. И. Степанов, Труды н.-и. станции (1935—1940), Изд. Местпрома, Калм. |
АССР, Кануково, 1940, стр. 100. — 154. Е. И. А х у м о в, ЖПХ, 29, № 4, 569 1
(1956). — 155. А. И. Данишевская, Сообщение о научно-исследовательских 1
работах членов Приморского отд. ВХО им. Д. И. Менделеева, в. 3, 1957, Щ
стр. 89. — 156. В. П. Ильинский, Труды Дальневосточного филиала АН
СССР. Сер. хим., в. 2, 1956, стр. 5. — 157. J. Nakano, япон. пат. 2277, 1953.—
158. И. В. Кизеветтер, Труды Дальневосточного филиала АН СССР. Сер.
хим., в. 2, 1956, стр. 83. —159. Ayai Masao, Furusama Masoru, Bull.
Soc. Salt Sci. Japan, 12, № 1, 3 (1958). — 150. T. Sakaguchi, япон. пат. 2278,
1953. ।
161. О. С. Ленчевский, Журн. ВХО, 5, № 6, 609 (I960). —162. Hud- I
son Т., Irvine, Chem. a. Process Eng., 42, № 9, 387 (1961).— 163. Chem. Eng. I
News, 37, № 2, 28 (1959). — 164. R. С. H i m e s a. oth., Ind. Eng. Chem., 51, № 11, I
Литература
97
13^5 (1959). —165. S. Kiesskalt, Chem. Ingr. Techn., 38, № 2, 108, A105
(1966).— 166. Chem. Eng., № 12, 152 (I960).— 167. К- C. Himes, S. E. Mil-
ler W. H. M i n к, H. L. G о 1 r i n g, Ind. Eng. Chem., 51, Ns 11, 1345 (1959).—
168. E. R. Gilliland, W. K- Lewis, пат. США 3137554, 1956.— 169. Brit.
Chem. Eng., 9, № 12, 829 (1964).— 170. A. J. Weinberger, D. F. De Lapp,
Chem. Eng. Progr., 60, № 11, 56 (1964).
171. В. П. Мелешко, H. С. Анпилова, M. H. Романов, О. В. Чер-
винская, ЖПХ, 33, № 11, 2481 (1960). —172. В. П. Ильинский, Н. А. В а-
р ы па ев, К. Э. Г иттерма н, Е. Шмидт, Труды Соляной лаборатории АН
СССР, в. 7, 1936. — 173. И. Н. Гладкий, И. Г. Кальнина, Труды ВНИИСП,
в. 9 (17). 145 (1965). — 174. G. G. Turner, англ. пат. 1009736, 1963.—
175. И. Н. Гладкий, О. К. Ж у р и д, И. Г. К а л ь и и н а, Труды ВНИИСП,
в. 9 (17), 149 (1965). — 176. В. Ф. Ассмус, Э. А. Гуревич, Труды ЦНИСЛ,
сб. 1 (в. 6—8), 1941, стр. 281. — 177. А. Г. Злобннский, М. Б. П о з и н а,
Труды ВНИИГ в. 49, 55 (1966). — 178. Н. Н i г s е, G. Schulz, Freiberger Fors-
chungsh., A, № 354, 29 (1965). — 179. Пат. ФРГ 875631, 1953, — 180. В. В. Вязо-
вое, Г. Н. Попов, сб. «Технология переработки природных солей и рассолов»,
Изд. «Химия», 1964, стр. 79.
181. В. В. В я з о в о в, Г. Н. Попов, Там же, стр. 91.— 182. В. В. Вязо~
вов, Г. Н. Попов, Там же, стр. 97. — 183. Г. Н. Попов, Хим. пром., № 8,
600 (1965). —184. М. И. Мазель, Н. С. Иванова, сб. «Калийные соли н
методы их переработки», Изд. ИОНХ АН БССР, 1963, стр. 60. —185. Г. Н. П о-
п о в, Т. Н. Полторацкая, сб. «Вопросы технологии переработки галургнче-
ского сырья», Изд. «Химия», 1967, стр. 3. —186. К- С. Бессмертный и др.,
Хим. пром., № 4, 306 (1966). —187. Chem. Process. (USA), 30, № 9, 117 (1967).—
188. Ц. Мас уд зава, Bull. Soc. Sea Water Sci. Japan, 20, № 3, 122 (1966).—
189. Хкачаку, Chemistry (Japan), 14, № 1, 46 (1959).— 190. Ф. А. Петрам-
к о в, Л. Д. Панченко, А. С. С а ц ю к, Труды Украинск. н.-и. ин-та соляной
пром., в. 2 (10), 1959, стр. 62.
191. Е. G. Cooke, англ. пат. 978712, 1962. — 192. Н. W. Diamond, канад.
пат. 504154, 1954. — 193. Швед. пат. 155225, 1956. — 194. Англ. пат. 735014, 1955.—
195. Пат. США 2768898, 1956.— 196. В. Е. В а а г s о п, D. Т. Ohlsen, пат. США
3486828, 1962. — 197. L. CreangS, Е. Serba п, Rev. chim. (Рум.), 12, № 4,
202 (1961). — 198. L. Phoenix, Brit. Chem. Eng., 11, № 1, 34, 2a (1966).—
199. J. D. Bicrhall, англ. пат. 1009196, 1963; M. P. Bhatt, D. S. Data?,
Salt Res. a. Ind., 5, 3—4, 57 (1968). — 200. W. K. Gilkey, A. C. S h у m a n,
пат. США 2655438, 1953.
201. Л. Б. Токарский, О. П. Куницкая, Т. Е. Лифшиц, Труды
ВНИИСП, в. 9 (17), 1965, стр. 157. —202. R. S. Р1 о s s, пат. США, 3148023,
1963. — 203. Наотаке Сато, япон. пат. 2228, 1960. — 204. J. Sci. Ind. Res.,
А15, № 12, 539 (1956). — 205. J. В. Rust, L. S p i a 11 e г, пат. США 2869166,
1954, — 206. R. R. Oliver, Philippine J. Sci., 83, № 3, 245 (1954). — 207. J. S u-
g i, T. Ogawa, япон. пат. 2950, 1954. — 208. Инд. пат. 45907, 1953. — 209. Тоя-
ма, Bull. Soc. Salt Sci. Japan, 9, № 3, 124 (1955). —2/0. С. M. Hopper,
R. R. В e v e п, канад. пат. 499538, 1954.
211. П. А. Кул ле, В. Ф. Ассмус, Труды ВНИИГ, в. 24, 1952, стр. 278.
4 М. В. Позии
Глава IV
ПРИРОДНЫЙ СУЛЬФАТ НАТРИЯ*
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Сульфат натрия Na2SO4 встречается в природе в составе мно-
гих минералов: тенардита Na2SO4, мирабилита Na2SO4 • ЮН2О,
астраханита Na2SO4-MgSO4• 4Н2О, глауберита Na2SO4 • CaSO4,
глазерита Na2SO4-3K2SO4, беркеита 2Na2SO4 • Na2COs и др.
Тенардит в обычных условиях представляет собой бесцветные
ромбические кристаллы с плотностью 2,68 г/см3. При нагревании
претерпевает ряд полиморфных превращений, при 890° плавится.
Природный тенардит и тенардит, полученный из горячего насыщен-
ного раствора и высушенный при 110°, имеет структуру, отличную
от переплавленного тенардита. Для последнего характерны следую-
щие фазовые переходы:
180-200°. 240°. 570 - 600°.
a-Na2SO4 <-----— p-Na2SO4 < — y-Na2SO4 <----- d-Na2SO4
* При нагревании тенардита (Г), выделившегося из водных рас-
творов, происходят следующие превращения:
одпо 570—600°
Т ----> y-Na2SO4 < " + d-Na2SO4
а при охлаждении:
fi-Na2SO4 у570 60°°-> y-Na2SO4 p-Na2SO4 , ииже.18°и a-Na2SO4 —> Т
Переход a-Na2SO4 в тенардит происходит при обычных усло-
виях медленно в присутствии влаги. Полное обезвоживание сопро-
вождается переходом в y-Na2SO41-3. Со многими солями (Li2SO4,
K2SO4, Na2CO3 и др.) Na2SO4 образует изоморфные твердые рас-
творы.
* Производство сульфата натрия из поваренной соли см. в гл. XI.
Физико-химические свойства
99
Из водных растворов при температурах от 32,384 до 233° кри-
сталлизуется безводный сульфат натрия в ромбической системе,
выше 233° — в моноклинной. Ниже 32,384° выделяются прозрачные
моноклинные кристаллы Na2SO4-10H2O— глауберовой соли или
мирабилита (от латинского слова mirabilis — удивительный). Плот-
ность мирабилита 1,464—1,481 г)см\ Существует также метаста-
Na2SO4,%
Рис. 21. Диаграмма растворимости
в системе Na2SO4—Н2О.
бильный семиводный кристал-
логидрат NasSCU • 7Н2О.
При 32,384° мирабилит ин-
конгруэнтно плавится — раз-
лагается на безводный сульфат
натрия и его насыщенный рас-
твор. Растворимость Na2SO4 в
воде (рис. 21 и табл. 10) при
повышении температуры от
32,384 до ~120° уменьшается,
затем возрастает, а выше 233°
резко убывает, приближаясь к
нулю при критической темпе-
ратуре воды (365°) 4~6. Рас-
Рис. 22. Давление дис-
социации Na2SO4- 10Н2О.
творение безводного сульфата натрия в воде сопровождается вы-
делением тепла вследствие гидратации. Растворение мирабилита
происходит с поглощением тепла, затрачиваемого на разрушение
гидратных связей7.
На рис. 22 показана кривая давлений водяного пара над мира-
билитом. Если влажность окружающего воздуха меньше давле-
ния диссоциации, кристаллы мирабилита выветриваются — покры-
ваются слоем безводного сульфата. Давление пара насыщенных
растворов Na2SO4 при высоких температурах:
t, °C ............................ 200 250 300 350. 362
Р, кгс/см2 ...................... 14,3 38 85 167 195
4»
100 Гл. IV. Природный сульфат натрия ТАБЛИЦА Растворимость сульфата натрия в воде
Темпе- ратура, °C Концентрация насыщенного раствора, вес. % Твердая фаза Темпе- ратура, °C Концентрация насыщенного раствора, вес. % Твердая фаза
-0,6 -1,2 0 10 16 20 25 30 32,4 1,96 3,85 4,5 8,2 11,7 16,1 21,9 28,8 33,2 Лед Лед 4* Na2SO4* ЮН2О Na2SO4-10H2O » » » » » Na2SO4- ЮН2О + + Na2SO4 (ромб,) 40 59 70 100 120 140 233 280 32,5 31,9 80,5 29,9 29,5 29,6 32.0 25,3 Na2SO4 (ромб.) > » » > > Na2SO4 (ромб.)+ + Ка25О4(монокл.) Na2SO4 (монокл.)
Растворимость сульфата натрия в насыщенных водных раство-
рах NaCl с повышением температуры непрерывно возрастает вплоть
до температуры плавления
безводной эвтектики NaCl—
Na2SO4 (рис. 23). При этом
максимум давления пара эвто-
нических растворов тройной
Рис. 23. Политерма растворимости
в системе Na2SO4—NaCl—Н2О при
температурах от 100 до 700°.
Рис. 24. Кривые зависимости давле-
ния водяного пара от температуры
растворов, насыщенных Na2SO4, NaCl
и смесью солей (эвтоника).
системы Na2SO4—NaCl—Н2О (228—230/сгс/с.и2) намного (на 170—
175 кгс/см2) ниже максимума давления пара насыщенных раство-
ров системы NaCl—Н2О (рис. 24) 5.
Физико-химические свойства
101
На рис. 25 приведены изотермы растворимости в системе
Na2SO4—NaCl—Н2О. При 25° эвтоцический раствор, равновесный
с Na2SO4 и NaCl, содержит 6,85% Na2SO4 и 23,14% NaCl, а в рав-
новесии с Na2SO4H Na2SO4-
• ЮН20 находится раствор,
содержащий 15,61% Na2SO4
и 14,4% NaCl.
Растворимость мираби-
лита в системе Na2SO4—
—NaOH—Н2О при 25°
имеет минимум (рис. 26) и
затем плавный подъем к
точке превращения Na2SO4-
• ЮН20 в Na2SO4, соответ-
ствующей содержанию в
растворе 7,73% NaOH. При
более высоких температу-
рах, вплоть до 350°, в твер-
дую фазу выделяется без-
водный сульфат натрия.
Растворимость Na2SO4 при
25° при увеличении концен-
трации NaOH от 0 до 48%
уменьшается от 21,8 до
0,45%. В системе Na2SO4—
—NaCl—NaOH—Н2О рас-
творимость Na2SO4 при 25° в том же диапазоне концентраций
NaOH (от 0 до 48%) уменьшается от 6,98 до 0,03%. При этом
растворимость NaCl в этих
растворах снижается с 22,86
до 0,95%. В системе Na2SO4—
Рис. 26. Растворимость в системе
Na2SO4—NaOH—Н2О при 25°.
В растворах сульфата натрия растворяется значительное коли-
чество сульфата магния при всех температурах, вплоть до 300®.
Нагреванием этих растворов нельзя отделить Na2SO4 от MgSO4 !1> 1Я.
Рис. 25. Растворимость в системе
Na2SO4—NaCl—Н2О при температурах от 0
до 100°:
Г —галит; М — мирабилит; Г —тенардит.
—NaOH—Н2О в диапазоне
концентраций от 47,5 до 63,5%
NaOH при 70—200° кристалли-
зуется 3Na2SO4 • 2NaOH 8. В си-
стеме Na2SO4—NaOH образуют-
ся инконгруэнтно плавящиеся
соединения вероятного состава
3Na2SO4- 2NaOH и Na2SO4-
• 2NaOH. Первое существует
ниже 485° и при 418° имеет по-
лиморфное превращение, вто-
рое существует ниже 316°9'10.
102
Гл. IV. Природный сульфат натрия
ПРИМЕНЕНИЕ
Развитие добычи природного сульфата натрия в России в срав-
нительно крупных масштабах, по-видимому, относится к началу
второй половины XVIII в. и связано с использованием при варке
стекла найденной близ Барнаула глауберовой соли13. И в настоя-
щее время сульфат натрия используется в стекольной промышлен-
ности. Наибольшие же его количества расходует целлюлозно-бу-
мажная промышленность (например, в США ~70% от общего по-
требления сульфата натрия). Его применяют для производства
моющих средств, а также в цветной металлургии, текстильной,
кожевенной и других отраслях промышленности. Кроме того, в
Медицине и ветеринарии также используют глауберову соль.
В химической промышленности сульфат натрия служит сырьем
при выработке сернистого натрия, ультрамарина, силиката натрия
И др. ’4. Разработаны способы переработки сульфата натрия на
серную кислоту, серу, кальцинированную и каустическую соду,
сульфат аммония и другие продукты 15~20. Однако в промышлен-
ности эти способы пока не используются, так как получение пере-
численных продуктов из других видов сырья экономически вы-
годнее.
Основными производителями сульфата натрия являются СССР.
США, Япония, ФРГ, Канада и Франция21. В СССР, США и Канаде
значительные количества сульфата натрия получают из природных
месторождений, в США, в частности, — при комплексной перера-
ботке рапы оз. Сирлз. Сульфат натрия вырабатывают также в хи-
мической промышленности как побочный продукт многих произ-
водств. В США наибольшее количество «химического» сульфата
натрия получают из отбросных растворов производства вискозного
волокна и целлофана. Значительные количества его производят
вместе с соляной кислотой из поваренной соли (см. гл. XI), осо-
бенно в странах, не располагающих природными ресурсами суль-
фата натрия. Его получают как побочный продукт при производстве
бихромата натрия, фенола, борной кислоты, карбоната лития, ре-
зорцина, некоторых пигментов и проч.
Несмотря на то, что многие потребители используют сульфат
натрия в виде растворов, товарным продуктом является безводная
соль. Добываемый из природных источников мирабилит содержит
около 50% воды (в чистом Na2SO4-10H2O 55,9% кристаллизацион-
ной воды); кроме того, хотя в отличие от тенардита мирабилит
практически не гигроскопичен22, но он плавится при невысокой тем-
пературе и из-за этого легко слеживается в монолитную массу.
Поэтому, перевозка мирабилита на большие расстояния нерента-
бельна, и его подвергают обезвоживанию в естественных или в за-
водских условиях вблизи от места добычи. В связи с этим наиболь-
ший интерес представляет непосредственная добыча безводной со-
Сырье
103
ли — тенардита; его залежи, однако, сравнительно редки, глав-
ным источником природного сульфата натрия является мирабилит.
Состав и количество примесей в сульфате натрия зависят от
состава рапы, из которой образовались мирабилит или тенардит,
от условий их кристаллизации, добычи и хранения (табл. 11).
ТАБЛИЦА 11
Требования к химическому составу сульфата натрия из мирабилита
(ГОСТ 6318—68)
[Приведенные нормы (в %), за исключением влаги,
относятся к сухому веществу]
Высший сорт 1 сорт П сорт
Сульфат натрия, не менее 99,3 97,5 94,0
Не растворимый в воде остаток, не более . . , 0,5 1,5 4,5
Хлориды в пересчете на NaCl, ие более .... 0,2 1,0 2,0
Сульфат кальция, не более 0,05 0,5 1.0
Железо (Fe2O3), не более 0,01 0,01 0,03
Влага, не более 0,5 3 7
Тенардит, добываемый из донных отложений озер, должен
иметь влажность не более 15% и содержать в сухом веществе не
менее 92% Na2SO4 и не более 5% NaCl, 0,5% CaSO4, 2,5% не
растворимых в воде веществ и 0,03% окислов железа. Тенардит в
кусках разной величины перевозят навалом.
Согласно ГОСТ 5.1135—71, кристаллический сульфат натрия,
получаемый в качестве отхода в производстве вискозного шелка
(в результате взаимодействия серной кислоты с едким натром и
натриевыми солями), должен содержать не менее 99,8% Na2SO4
и не более 0,01 % хлора, 0,01 % Са и Mg в пересчете на CaSO4,
0,01% железа в пересчете на Fe2(SO4)3, 0,1% ZnSO4, 0,02% нера-
створимого в кислой среде остатка, 0,2% веществ, теряемых при
прокаливании, и 0,04% воды.
Сульфат натрия перевозят навалом в полиэтиленовых мешках.
Представляет интерес холодное брикетирование сульфата натрия
с получением брикетов, пригодных к перевозке без тары. Сульфат,
подвергаемый брикетированию, должен содержать 4—5% воды.
Этого можно достигнуть смешением 93—91 вес. ч. сухого суль-
фата натрия с 7—9 вес. ч. мирабилита. Расходы на брикетирова-
ние сульфата и последующее его измельчение с помощью дезин-
тегратора не превышают стоимости бумажных мешков 23’24.
СЫРЬЕ
По'морфологическому строению месторождения сульфата раз^
деляются 25-26 на ископаемые тенардито-мирабилитовые и озер-
ные; последние представляют собой периодические временные ново-
садки мирабилита (или тенардита) и постоянные донные корневые
104
Гл. IV. Природный сульфат натрия
отложения мирабилита, тенардита, астраханита и глауберита в
виде пластов и линз под рассолами или илами озер.
Большинство месторождений сульфата натрия состоит из соче-
тания разных сульфатных минералов с примесью галита, гипса,
эпсомита и др.
Тенардит залегает в виде пластов, линз и желваков в донных
озерных месторождениях25. В сульфатных озерах, рапа которых
насыщена хлористым натрием, но содержит достаточное количе-
ство SOV,ежегодно осенью и зимой при температурах около 0° и
ниже выпадает мирабилит. В озерах с высококонцентрированной
рапой садка мирабилита иногда наблюдается и летом в прохлад-
ную погоду, при понижении температуры рапы ниже 18°. При по-
вышении температуры выпавший мирабилит вновь растворяется.
Летом же из рапы озер с весьма высокой концентрацией SOi~ про-
исходит садка тенардита (например, из рапы оз. Балхаш26). Озер-
ные рассолы морского происхождения (1 класса) представляют
практический интерес с точки зрения возможности извлечения из
них сульфата натрия, если коэффициент метаморфизации
MgSO4: MgCl2 больше единицы. В некоторых озерах слой оседаю-
щего мирабилита достигает 0,5 м и более при выходе, превышаю-
щем 100 кг Na2SO4 • 10Н2О из 1 м3 рассола.
В сульфатных озерах степей Казахстана и Кулунды ежегодно
в осенне-зимние месяцы выпадают миллионы тонн новосадки ми-
рабилита, который частично садится на дно, частично же выбрасы-
вается волнами на берег. Если создаются условия, при которых не
весь мирабилит вновь растворяется в летнее время, происходит
накопление донных отложений с образованием перекристаллизо-
вавшегося пласта мирабилита «стеклеца» — плотного слоя с глад-
кой поверхностью и малой пористостью27. Встречаются месторож-
дения мирабилита, сцементированные песками или переслаиваю-
щиеся иловыми отложениями, которые образовались в результате
высыхания озер.
Астраханит встречается в виде донных корневых отложений в
ряде сухих озер и водоемов повышенной солености. Например,
средняя мощность пластов астраханита приаральских соляных озер
(Джаксы-Клыч, Восточного и др.) составляет 2 л<28. Встречаются
также линзы и прослойки астраханита в залежах ископаемых со-
лей. Залежи астраханита в СССР исчисляются многими десятками
миллионов тонн29-31.
Глауберит образует пласты в месторождениях ископаемых со-
лей и содержится в донных отложениях некоторых солевых озер.
Значительные месторождения глауберита находятся в солевых по-
родах Тянь-Шаня, в Киргизии. При взаимодействии глауберита с
водой он разлагается и сульфат натрия переходит в раствор, а
сульфат кальция остается в нерастворенном остатке32”34. Разрабо-
Сырье
105
тан гидротермический способ получения сульфата натрия и цемен-
та из глауберита. При нагревании до 750—800° в присутствии во-
дяного пара глауберитовой породы, содержащей примеси галита,
кремнезема, глины и другие, осуществляется реакция 35’36:
Na2SO4 • CaSO4 + 2NaCl + SiO2 + H2O = 2Na2SO4 + CaSiO3 + 2HC1
Важное значение имеют месторождения сульфатных рассолов,
пропитывающих погребенные солевые отложения. Встречаются
сульфатные рассолы карстового происхождения, образовавшиеся в
результате выщелачивания поверхностными и подземными водами
погребенных солевых пород.
Наша страна располагает богатейшими в мире месторожде-
ниями природного сульфата натрия в виде твердых отложений и
папы многочисленных озер в Сибири, Казахстане и Средней Азии37.
Важнейшими месторождениями являются залив Кара-Богаз Кас-
пийского моря, оз. Кучук в Алтайском крае и озера Аральской
группы. Значительные количества сульфата натрия содержатся в
рапе озер Анж-Булат, Эбейты, Тениз и других, а также в ископае-
мых глауберитовых породах Тянь-Шаня (Когкорка, Кетмень-Тюбе,
Джелды-Су). Практически не исчерпаемыми источниками его яв-
ляются воды Каспийского33, Аральского морей и оз. Балхаш. Со-
левой состав этих водоемов, не имеющих связи с океаном, сильно
зависит от состава речных вод; последние же богаче сульфат-ионом,
чем океанская вода. Поэтому Каспийское и Аральское моря и
оз. Балхаш, а также генетически связанные с ними многочислен-
ные озера этого обширного района, содержит значительно больше
SOi", чем моря и озера, связанные с океаном (например, Черное
море, Крымские озера).
Залив Кара-Богаз («Черная пасть»), расположенный на восточ-
ном побережье Каспийского моря в районе с пустынным, засушли-
вым климатом, является величайшим в мире месторождением суль-
фатных солей. Залив, соединяющийся с морем узким проливом,
при небольшой глубине (несколько метров) имеет поверхность
18346 км2. Это громадный испарительный бассейн, в котором под
влиянием солнечного тепла в летние месяцы испаряется большое
количество воды. В результате этого уровень воды в заливе ниже,
чем в море, и происходит непрерывное пополнение залива морской
водой и накопление в нем солей. Концентрация солей в воде за-
лива в 20 раз больше, чем в море. Основными ионами являются
Na+, Mg2+, SOl- и СГ. Запасы сульфата натрия в заливе огромны.
Они исчисляются миллиардами тонн.
На комбинате «Карабогазсульфат» получали сульфат натрия из
рапы зйлива бассейным способом путем выделения мирабилита при
зимнем охлаждении рапы и последующего естественного обез-
воживания его летом 39~42. Однако уровень Каспийского моря ци-
клически изменяется. Вследствие его понижения, начавшегося
106
Гл. IV. Природный сульфат натрия
б двадцатые годы XX в., приток морской воды в залив уменьшает-
ся, а концентрация рапы в заливе увеличивается (рис. 27). Так,
с 1921 до 1961 г. приток воды уменьшился с 25 до 10,5 км^год и
глубина залива снизилась с 10 до 3,5 ж43"46. (Площадь высохшей
поверхности залива сейчас превышает 2000 км2). Это привело к
тому, что уже в 1939 г. рапа насытилась хлоридом натрия, а затем
сульфатом магния (эпсомитом MgSO4-7H2O) и астраханитом
(Na2SO4 • MgSO4 • 4Н2О), которые и
стали осаждаться. Вследствие та-
кого обессульфачивания рапы вы-
ход мирабилита резко снизился
„ (как видно из рис. 27 максималь-
ный выход мирабилита соответ-
* ствует притоку воды в залив, рав-
/00 g"
ному 13—14 км3/год). Это обусло-
вило необходимость изменить спо-
соб получения мирабилита: рапу
залива, направляемую в бассейны
для зимней садки,стали разбавлять
морской водой. Затем и этот способ
производства пришлось оставить,
так как вследствие продолжающе-
гося понижения уровня рапа ото-
шла на слишком большое расстоя-
ние от места производства и состав
ее, даже при разбавлении морской
водой, стал непригоден для садки
чистого мирабилита 47~52.
Повышение концентрации рапы
привело к образованию твердых со-
левых отложений «смешанной со-
25 20 15 Ю
Приток Воды, км3/го§
Рис. 27. Изменение концентрации
NaCl и MgCl2 в рапе Карабогаз-
ского залива (сплошные линии),
и выхода мирабилита из 1 м3
рапы при ее охлаждении до 0°
(пунктирная линия) в зависи-
мости от величины притока кас-
пийской воды.
ли» — смеси галита, астраханита, эпсомита, а также гипса и глау-
берита, а понижение уровня рапы обнажило значительную часть
этих отложений. Разведкой дна залива установлено существова-
ние четырех солевых пластов, в том числе трех погребенных,
свидетельствующих о том, что в прошлом в заливе происходили
гидрохимические изменения, аналогичные современным. Солевые
пласты пропитаны межкристальными рассолами. Межкристальные
рассолы, запасы которых весьма велики, представляют собой
ценный источник для промышленного получения сульфата нат-
рия 53-54.
Первый рассольный горизонт пропитан рапой, состав которой
близок к составу поверхностной рапы залива. Второй рассольный
горизонт расположен во втором, погребенном соляном пласте и
гипсовых песках, слагающих его кровлю. Этот пласт отделен от
первого и третьего солевых пластов практически нефильтрующими
Сырье
107
прослойками илов. Он сложен в основном галитом и глауберитом и
обладает большой пористостью (22—34%). Мощность этого пласта
в среднем составляет 10 м при глубине залегания 5—5,5 м. Из вто-
рого рассольного горизонта в. настоящее время производят откачку
рассолов для получения сульфата натрия. Эти рассолы не являются
концентратами морской воды, а образовались в результате раство-
рения твердых отложений глауберита и галита. Рассолы обладают
напором—их пьезометрический уровень близок к дневной поверх-
ности В среднем концентрация ионов (в вес. %) рассолов второго
горизонта колеблется в следующих пределах:
Ci~ .................12,5-15
SO*- . ............2,5-8
НСОу ...... .0,04-0,11
Na+.............
Mg2+ . . .......
5-8,5
1,5-3,9
Кроме того, в них находятся (в мг/л):
К+................. 2500 Вг .......... . . . 350
В2О3 ............... 380 Li+ ...............1-10
Эти рассолы в отличие от поверхностной рапы содержат до
300 мг/л сероводорода. Их температура 15—17°.
Третий солевой пласт и пропитывающие его рассолы несколько
отличаются по минералогическому и химическому составам. В со-
став минералов, слагающих этот пласт, кроме галита и глауберита,
входит астраханит. Пористость пласта ~15—25%, мощность в
среднем 3,8 м, залегание на глубине 18 м. Четвертый солевой пласт
изучен пока недостаточно.
Оз. Кучук 55~58 — крупнейшее сульфатное озеро, расположен-
ное в наиболее низкой части Кулундинской степи (Западная Си-
бирь). Площадь озера около 175 км2, средняя глубина 1,62 л. Сред-
ние составы рапы (в вес. %):
Na2SO4 NaCl MgClj
Зимой................. 0,6 16,4 5,0
Летом................. 3,9 16,4 4,7
Около 80% площади дна озера покрыто пластом слежавшегося
мирабилита-стеклеца толщиной 2,5—3 м. Количество его исчис-
ляется сотнями миллионов тонн 59’60, но экономичные методы до-
бычи донного мирабилита пока отсутствуют. В засушливые годы
концентрация солей в рапе повышается настолько, что она насы-
щается Na2SO4 и NaCl уже при +5° и ниже этой температуры про-
исходит совместная садка мирабилита и галита.
В Приаральском районе расположено Джаксы-Клычское суль-
фатное месторождение, представленное группой сухих озер —
«сульфатников», образовавшихся в результате испарения воды
Аральского моря 37’61-64.
108
Гл. IV. Природный сульфат натрия
В оз. Анж-Булат (Павлодарская обл.) в засушливые периоды
образуется донный пласт тенардита. Это вторичный процесс, за-
ключающийся в обезвоживании мирабилита под слоем концентри-
рованной рапы65. В оз. Эбейты (Омская обл.)66-69 садка мираби-
лита происходит в начале осени при охлаждении рапы ниже 15—20°.
К зиме слой новосадки в центре озера достигает 20—30 см.
В качестве примера приводим средний состав (в %) рапы и
пластовой соли оз. Эбейты:
Состав рапы
Na2SO4........................Н,64
NaCl.........................13,27
MgCl2........................2,39
КС1..........................0,04
KB-..........................0,032
Ca(HCOs)2 ...................0,063
Состав мирабилита в пласте
Na2SO4 • ЮН2О.............95,69
Na2SO4.....................2,00
NaCl.......................0,25
K2SO4.....................0,013
CaSO4 - 2H2O..............0,39.
Нерастворимые примеси . . . 1,66
Состав тенардита из донных отложений сульфатных озер севе-
ро-восточного побережья Каспийского моря (в %):
Na2SO4...................96 — 98,5
NaCl................. 0,4-1,2
MgSO4.................... 0,2-0,5
CaSO4...................0,3-1,0
Са(НСО3)2...............0,4-0,6
Нерастворимые примеси . . 0,7—1,5
Следует также упомянуть тенардитовое месторождение Узун-Су, i
Ходжентские соляные месторождения, сульфатные озера Гуз-Кане,
Муллалы, Денгиз-Куль, Куули и многие другие 70-77. j
Наиболее распространенным является бассейный метод зимней ;
кристаллизации мирабилита с последующим естественным или ;
искусственным обезвоживанием. Иногда вместо естественного зим- 1
него вымораживания в бассейнах осуществляют заводское искус-
ственное вымораживание мирабилита, например, на комбинате
«Карабогазсульфат» и на заводе Монэхенс в Техасе (США) 79.
Твердые сульфатные породы разрабатывают горными методами.
При залегании пласта на большой глубине применяют шахтные
способы (например, в месторождении Узун-Су в ТуркмССР). В за-
висимости от состава добываемой породы ее или высушивают на
воздухе, или перерабатывают заводскими методами в сульфат
натрия 80.
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПОЛУЧЕНИЯ МИРАБИЛИТА
ИЗ ПРИРОДНЫХ РАССОЛОВ
Мирабилит можно получить из рассолов почти всех морей и
озер и тем с большим удельным выходом, чем больше коэффи-
циент метаморфизации MgSO4: MgCl2. В табл. 12 приведено со-
держание солей в воде океана, некоторых морей и соляных водое-
мов. Составы солей отдельных водоемов нанесены на диаграмму
растворимости в системе NaCl—MgSO4—Н2О (рис. 28)82>83. При
испарении в испарительных бассейнах воды океана 1, Средизем-
Физико-химические основы получения мирабилита
109
ТАБЛИЦА 12
Состав воды океана, некоторых морей н соляных водоемов
Химический состав, вес. % Msso. MgC12
Са(НСО8)2 CaSO4 MgSO4 MgCl2 MgBr2 KCI NaCl сумма солей
Океан .... 0,017 0,12 0,22 0,33 0,007 0,07 2,80 3,56 0,67
Средиземное море .... 0,016 0,13 0,24 0,31 0,05 2,84 3,63 0,77
Черное море . 0,027 0,058 0,12 0,16 0,003 0,04 1,45 1,87 0,75
Сиваш (южная часть) . . . 0,020 0,38 0,86 1,14 0,022 0,27 9,61 12,30 0,75
Сакское озеро 0,028 0,31 0,94 1,93 0,029 0,36 7,76 11,36 0,49
Каспийское море .... 0,011 0,09 0,31 0,061 0,0008 0,013 0,81 1,29 5,1
Аральское море 0,02 0,154 0,26 0,007 — 0,018 0,56 1,03 37,2
Оз. Балхаш . . — 0,036 0,142* — м 0,143 0,321 —
Залив Кара- Богаз (осень . 1938 г.) . . . 0,08 0,09 5,55 3,05 — — 18,74 27,51 1,82
* Na2SO4.
ТАБЛИЦА »3
Выход мирабилита и расход воды и рассолов нз разных водоемов81
Каспийское море Аральское море Оа. Балхаш Черное море Сиваш
Расход воды (в м3) для по- лучения 1 м3 раствора, на- сыщенного NaCl: без кристаллизации NaCl 29 45 125
с кристаллизацией NaCl — — — 66 8£
Расход воды (в л3) для по- лучения 1 т мирабилита. . 182 196 256 538 69,5
Расход насыщенного рассола (в м3) для получения 1 т мирабилита 6,28 4,85 2,05 8,2 8,2
Выход (в кг): мирабилита из 1 м3 насы- щенного рассола .... 160* 230* 490* 122,4** 122,4 **
NaCl при получении 1 м3 насыщенного рассола . 0 0 9 710 710
NaCl на 1 т мирабилита 0 0 0 5,8 6,8
• При охлаждении рассола до 0°.
** При охлаждении рассола до —10*,
ио
Гл. IV. Природный сульфат натрия
ного 2, Черного 3 и Каспийского 6 морей, Сиваша 4, Сакского озе-
ра 5 и Карабогазского залива 9 образуются растворы, насыщенные
поваренной солью, которая при дальнейшем испарении и будет
кристаллизоваться в качестве первой твердой фазы. При концен-
трировании воды Аральского моря 7 получается раствор, насыщен-
ный астраханитом, а воды оз. Балхаш 8 — тенардитом. Таким об-
Рис. 28. Диаграмма растворимости в системе NaCl— MgSO4—Н2О:
при 25* (сплошные линии) и 0° (пунктирные линии).
разом, из всех перечисленных здесь вод в летний период можно по-
лучить сульфат натрия только из воды оз. Балхаш. Выход тенар-
дита из 1 м3 балхашского рассола составляет ПО—120 кг, а сте-
пень использования SO^- всего 50—55%; при зимней же садке ми-
рабилита степень использования SO4 достигает 90—95%.
При охлаждении упомянутых насыщенных растворов до 0° все
они становятся насыщенными мирабилитом, который и выделяется
в твердую фазу. Выход сульфата натрия и расход начального и
насыщенного рассола на 1 т мирабилита зависят от исходной кон-
центрации солей и БОГ (табл. 13).
Физико-химические основы получения мирабилита
11!
При охлаждении 1 м3 насыщенного NaCl рассола Сиваша до
—5° выделяется всего 32 кг мирабилита, что в 5 раз меньше вы-
хода мирабилита при охлаждении до 0° насыщенного рассола Кас-
пийского моря. Малый выход мирабилита при охлаждении кон-
центрированной воды Сиваша и Черного моря объясняется низкой
Рис. 29. Диаграмма растворимости в системе
NaCl—MgSO<—Н2О при + 2,5, 0 и —2,5°.
концентрацией SO4-b этой воде. Для увеличения выхода мираби-
лита из черноморских рассолов необходимо предварительно выде-
лить из них часть поваренной соли путем более глубокого испаре-
ния, а затем охлаждать их до более низкой температуры, напри-
мер до —10°.
Выход мирабилита при охлаждении сульфатной рапы опреде-
ляется относительным и абсолютным содержанием в ней солей.
Оптимальное содержание суммы солей, соответствующее макси-
мальному выходу мирабилита, не загрязненного галитом, может
112
Гл. IV. Природный сульфат натрия
быть определено графически по диаграмме растворимости в си-
стеме NaCl—MgSO4—Н2О. На рис. 29 представлена такая диа-
грамма, составленная для карабогазской рапы83. Концентрации
SO4 и Mg выражены в индексах. На диаграмме нанесены изотермы
растворимости для +2,5, 0 и —2,5° и содержание воды в насыщен-
ных растворах в молях на 100 моль солей (в верхней части диа-
граммы). Шесть лучей кристаллизации мирабилита, проведенных
из точки N до пересечения с линиями растворимости, соответ-
ствуют следующим значениям хлормагниевого коэффициента, ха-
рактеризующего весовое отношение ионов хлора и магния:
Луч............NT NS NR NQ NP NO
Cl-
...... 4,0 4,2 4,4 4,6 4,3 5,0
В качестве примера определим оптимальную концентрацию
рапы, характеризующейся коэффициентами: м~г+ = 4,0 и ~м,гС1 • =
= 2,0. Положение точки Л состава рапы на диаграмме опре-
деляется индексами: SO4 — 30,8, Mg — 50,0. Проводя из точки Л
вертикальную линию до пересечения в точке а с водной проекцией
луча кристаллизации,, находим оптимальное содержание воды в
рапе данного солевого состава, равное 1515 Л1/100 М солей. Прак-
тически необходим небольшой избыток воды для предотвращёния
загрязнения мирабилита галитом, так что содержание воды в рапе
перед ее охлаждением можно принять равным 1525 M/100 М со-
лей. Пересчитывая индексы на весовые количества, находим вес
100 М рапы и процентное содержание в ней солей:
SO^~ . . . 30,8-96 = 2 957 г или 7,6%
СГ . . . . 69,2 71 = 4 913 » » 12,7%
Mg2+ . . . 50-24,3= 1 215 » » 3,1%
Na+ ... 50-46 = 2300 » » 5,9%
Н2О. . . .1525-18 = 27 450 » » 70,7%
38 835 г 100,0%
Следовательно, оптимальное и предельно допустимое содержа-
ние суммы солей в данной рапе перед ее охлаждением для садки
мирабилита равно 29,3% •
Выход мирабилита (х кг) из 1 л3 можно рассчитать по отно-
шению длин отрезков AM : NM, пользуясь формулой
_ AM 100a-322d-10
* NM ’ с-96
где 100 — индекс мирабилита по SO4; d — плотность охлаждаемой
рапы; 322 и 96 — мол. веса мирабилита и SO4; а — содержание
SO4~ в охлаждаемой рапе, %; с — индекс по SO4 охлаждаемай
рапы. Для приведенного выше примера AM : NM = 0,142, с = 30,8,
Физико-химические основы получения мирабилита
113
а — 7,6, d = 1,25; после подстановки этих величин в формулу по-
лучаем х = 150 кг/м3.
На рис. 30 показан выход мирабилита из рапы разного состава
при оптимальном содержании солеи
эффициента метаморфизации рапы.
Изменение хлормагниевого коэффи-
циента Cl": Mg2+ в пределах от 4
до 5 мало влияет на величину вы-
хода и показано на диаграмме за-
штрихованной площадью в преде-
лах «от» и «до»83.
При использовании рассолов с
большим содержанием MgSO4 их
разбавляют до охлаждения более
слабыми растворами или раство-
ром поваренной соли84.
Рапа, остающаяся после кри-
сталлизации мирабилита, содержит
большое количество MgCl2 и дру-
гие ценные компоненты и может
служить объектом дальнейшей пе-
реработки 47’85-88.
Сгущенная хлормагниевая рапа
Рис. 30. Выход мирабилита из
эксплуатационной рапы разного
состава при оптимальном содер-
жании солей.
может служить материалом для по-
лучения хлористого магния (а из
него окиси магния и соляной кис-
лоты), брома, бора и других про-
дуктов. Рассмотрим в качестве при-
мера комплексную схему переработки Кучукской рапы. Эта рапа
после зимней садки мирабилита содержит, например (в %):
NaCl................16,52
MgCl2.......... 4,78
MgSO«............ 0,69
CaSO4 . . . . ь . . . 0,08
Ca(HCO3)2 ..............0,066
KC1.....................0,029
KBr.....................0,045
B2O3....................0,013
При вакуум-выпарке до 23% MgCl2 из рапы кристаллизуется
чистая поваренная соль, без примеси MgSO4 и CaSO4. Полученный
рассол содержит ~ 1,9 кг/м3 брома, после отгонки которого из
него можно осадить хлористым кальцием полуводный гидравличе-
ский гипс. При дальнейшей выпарке обессульфаченной рапы до
32% MgCl2 выделяется дополнительное количество NaCl. После
репульпации кристаллов NaCl, полученных в 1-й и 2-й стадиях
выпарки, с почти насыщенной NaCl рапой, поступающей на вы-
парку из рапохранилища, концентрация MgCl2 в межкристальной
жидкости снижается до 8—9%, а после центрифугирования в по-
варенной соли остается меньше 0,6% MgCl:2. При промывке ее'на
114
Гл. IV. Природный сульфат натрия
центрифуге водой получается соль высшего сорта, почти соответ-
ствующая соли сорта экстра; она содержит всего по ~ 0,04 % Mg
и Са. После отделения поваренной соли концентрированный рас-
твор MgCl2 окончательно выпаривается до шестиводного, а затем
до двухводного хлористого магния (см. гл. IX). Последняя стадия
выпарки сопровождается частичным гидролизом MgCl2, и выде-
ляющийся хлористый водород может быть поглощен известковым
молоком для получения хлористого кальция, частично используе-
мого для обессульфачивания рапы.
Разработаны и другие схемы комплексного использования ма-
точных рассолов морского типа после садки мирабилита 59. В част-
ности, путем их выпаривания при температуре кипения (126°) и
последующего охлаждения до 70° и разделения образующихся
твердых солей из них можно выделить шенит K2SO4 • M.gSC>4 • 6Н2О,
используемый в качестве удобрения (см. гл. V)87.
При испарении в лабораторных условиях маточных растворов,
остающихся после кристаллизации мирабилита из охлажденных
астраханитовых растворов, при 20—25° выделяется эпсомит не
только в стабильном поле его кристаллизации, но и в метаста-
бильной области, захватывающей часть поля астраханита. Напри-
мер, из 1 т астраханитового сырья оз. Куули можно получить 1 т
мирабилита и 0,3 т эпсомита 31.
Переработкой твердых отложений астраханита приаральских
озер путем водной обработки, охлаждения полученного смешан-
ного раствора с выделением мирабилита и с последующим его
плавлением, и выпарки маточных растворов с кристаллизацией
NaCl, можно получить из Гт астраханитовой породы 0,45 т без-
водного сульфата натрия, 0,17 т поваренной соли и 0,18 т
MgCl2 • 6Н2О
ОБЕЗВОЖИВАНИЕ МИРАБИЛИТА
Наибольшее количество сульфата натрия получают обезвожи-
ванием мирабилита. При наличии ресурсов природного сульфата
натрия производство его из поваренной соли и серной кислоты
(см. гл. XI) является экономически менее целесообразным.
Различные методы обезвоживания дают продукт, сильно отли-
чающийся по своим качествам. Например, при обезвоживании в
барабанных сушилках получается сильно комкующийся и слежи-
вающийся сульфат; при обезвоживании распылением — пушистый,
легкий материал с насыпным весом 450—500 кг/м3.
Обезвоживание мирабилита в естественных условиях
Выветривание мирабилита, т. е. удаление кристаллизационной
воды, происходит только, когда давление его диссоциации больше
парциального давления водяного пара в окружающей атмосфере.
Обезвоживание мирабилита
115
Чем больше разность этих давлений, тем быстрее разлагается кри-
сталлогидрат. На рис. 31 заштрихованная площадь соответствует
периоду выветривания, а расстояние между изохронными точками
дает понятие об относительной его интенсивности (которая зависит
и от силы ветра). Из этой диаграммы видно, что наибольшей ин-
тенсивности выветривание мирабилита в районе Кара-Богаза мо-
жет достигать в июле и августе. В зимние месяцы влажность воз-
духа больше давления диссоциации, и находящийся на открытом
воздухе сульфат будет поглощать влагу. Это происходит иногда
и летом в ночное время, ко-
гда влажность воздуха зна-
чительно возрастает.
Естественное обезвожи-
вание мирабилита можно
осуществлять в штабелях
или в бассейнах. В первом
случае мирабилит склады-
вают на специальных пло-
щадках на берегу в штабе-
ли высотой 30—40 см, по-
верхность которых тщатель-
но выравнивают. Обычно в
Рис. 31. Характеристика условий есте-
ственного обезвоживания мирабили®*-киа
промыслах Кара-Богаз-Гола:
Температри,
/ — среднемесячные температуры воздуха в районе
карабогазскнх сульфатных промыслов; 2 —давле-
ние диссоциации мирабилита (построено по рис. 22);
3 — среднемесячная абсолютная влажность воздуха.
течение лета происходит
полное выветривание мира-
билита. Недостатком этого
метода является необходи-
мость больших площадей для штабелей мирабилита (на каждые
100 т сульфата натрия необходима площадь в 10000 м2). Выход
сульфата натрия с 1 м2 эксплуатируемой площади составляет
85—98 кг 89’90. Этот метод в настоящее время уже не имеет про-
мышленного значения.
При бассейном методе обезвоживания 91>82 мирабилит сосредо-
точен в одном месте, благодаря чему возможна механизация про-
цесса.
По окончании зимней садки мирабилита из бассейна сбрасы-
вают (сливают) маточный раствор с помощью системы дренаж-
ных устройств. Оставшийся в бассейне мирабилит слеживается
в монолитный пласт, который подвергается выветриванию в лет-
нее время. Периодически с поверхности пласта удаляют тонкий
слой порошкообразного сульфата. Ускорению выветривания мира-
билита способствует периодическое боронование (разрыхление)
верхнего горизонта пласта.
Посыпка каменным углем93 увеличивает интенсивность обез-
воживания почти в 3 раза, однако снижает качество суль-
фата, поэтому не применяется. Предложена 94 схема механизации
сбора сульфата натрия, предусматривающая распиловку пласта
116
Гл. IV. Природный сульфат натрия
мирабилита циркульными пилами и вывозку кусков на берег тя-
гачами.
Для разрыхления пласта мирабилита и интенсификации обез-
воживания предлагается фрезерование его посредством вращаю-
щихся лопастных шнековых фрезеров и ворошение кусков при по-
мощи подметательно-уборочной машины с круглой вращающейся
щеткой. Эта же машина может производить сбор сульфата, пода-
ваемого при помощи транспортерных лент на прицепы самораз-
гружающейся конструкции. Скорость обезвоживания при работе
по этой схеме значительно увеличивается.
Таким методом может быть получен либо полностью обезво-
женный сульфат, либо частично обезвоженный, с 20—30% воды,
который может быть без особых трудностей досушен заводскими
способами (см. ниже).
Сульфат, полученный методом выветривания, содержит от 92
до 98% Na2SO4. Существенными недостатками естественного обез-
воживания мирабилита являются значительные потери сульфата
натрия за счет развеивания ветром и загрязнение его пылью (пе-
ском). Потери обусловливают повышенный расход мирабилита —
на 1 т сульфата натрия расходуется 3 т мирабилита вместо теореД
тически рассчитанных 2,27 т. ’
Возможно осуществлять летнее обезвоживание мирабилита
с образованием тенардита в бассейнах под слоем рапы, содержа-
щей NaCl89-97. (Этот же процесс протекает и в естественных усло-
виях в некоторых сульфатных озерах Кулундинской степи и др.).
Недостатком этого метода является загрязнение сульфата пова-
ренной солью и солями магния.
Обезвоживание мирабилита в естественных условиях является
сезонным, связано с климатическими условиями, требует большой
затраты тяжелого физического труда и больших площадей.
Заводские способы обезвоживания мирабилита
Разработано и предложено много способов заводского обезво-
живания мирабилита89, в основу которых положены следующие
приемы и их комбинации: 1) плавление мирабилита, 2) выпарка
растворов в аппаратах с теплопередающей поверхностью, 3) вы-
парка при непосредственном соприкосновении растворов с горя-
чими газами, 4) автоклавирование, 5) сушка воздухом и дымо-
выми газами, 6) высаливание, 7) обезвоживание с применением
летучих растворителей.
Плавление мирабилита
При нагревании до температуры превращения (32,4°) мираби-
лит плавится — разлагается на Na2SO4 и Н2О; освобождающаяся
кристаллизационная вода растворяет часть С}р1ьфата натрия с об-
Обезвоживание мирабилита
117
разованием насыщенного раствора, а остальная часть его (35,8%)
остается в твердой фазе и может быть отделена отстаиванием,
центрифугированием и т. д. Можно несколько увеличить выход
сульфата натрия, нагревая расплавленную массу, так как раство-
римость его при этом уменьшается (рис. 21); например, при 90°
в осадке остается 45,9% Na2SO4, содержавшегося в исходном де-
кагидрате. Вследствие уменьшения растворимости Na2SO4 с по-
вышением температуры происходит зарастание плотной коркой
сульфата теплопередающих поверхностей плавильных аппаратов 88.
Этого можно избежать, осуществляя плавление мирабилита при
непосредственном соприкосновении с продуктами сгорания топ-
лива. Однако в этом случае сульфат загрязняется золой и сажей.
Расход топлива составляет ~ 23 кг на 1 т сульфата 89.
Обычно применяют плавители мирабилита с циркулирующим
маточным щелоком, который нагревают паром в трубчатом подо-
гревателе.
Получение сульфата натрия путем только плавления мираби-
лита отличается низким коэффициентом использования сырья: рас-
ход мирабилита на 1 т безводного Na2SO4 практически достигает
4,5 т. Значительная доля сульфата сбрасывается с маточным рас-
твором. Поэтому в современных производственных схемах плавле-
ние мирабилита сочетается с выделением сульфата натрия из рас-
твора разными методами — выпаркой, высаливанием, выморажи-
ванием.
Выпарка растворов сульфата натрия в аппаратах
степл опередаю щ е й поверхностью
Кристаллизация сульфата натрия при выпаривании его раство-
ра в аппаратах, обогреваемых паром, затруднена зарастанием по-
верхности нагрева коркой сульфата. Особенно сильно инкрусти-
руются греющие поверхности при выпарке сульфатных растворов,
загрязненных примесями, вызывающими коррозию стальных кипя-
тильников". Греющие поверхности выпарных аппаратов должны
изготовляться из хромистых или хромоникелевых сталей, наиболее
устойчивых в условиях выпарки сульфатного раствора.
Для уменьшения зарастания солью греющих поверхностей ре-
комендуется применять аппараты с интенсивной принудительной
циркуляцией раствора или с механической очисткой поверхности
нагрева (например, движущимися скребками или щетками). Не-
смотря на интенсивную циркуляцию (3 м/сек), в течение суток на-
растает слой накипи до 0,5 мм и коэффициент теплопередачи умень-
шается с 3470 до 900 ккал/(м2 • ч град). Поэтому интенсивная цир-
куляция не исключает необходимости частых промывок аппаратов,
что снижает производительность выпарной станции.
118
Гл. IV. Природный сульфат натрия
Вследствие склонности сульфата натрия к образованию пере-
сыщенных растворов отложение соли происходит не только в зоне
подогрева и кипения раствора, но и на всех поверхностях цирку-
ляционного контура. Поэтому наиболее радикальным средством
борьбы с зарастанием солью выпарных аппаратов является вы-
парка интенсивно циркулирующей суспензии мелких кристаллов
Na2SC>4 в насыщенном растворе. В этом случае пересыщение ра-
створа снимается главным образом за счет роста взвешенных
в жидкости кристаллов. При содержании в суспензии 5—10% твер-
дой фазы выпаривание в опытном аппарате при скорости циркуля-
ции 1,8—-1,9 м/сек проходило в течение 1,5 суток без заметного
снижения коэффициента теплопередачи 10°.
Зарастание теплопередающей поверхности значительно умень-
шается, если она хорошо отполирована; при этом коэффициент
теплопередачи в 1,5—2,5 раза больше101.
Подвергаемый выпариванию горячий раствор Na2SO4 обычно
используют и для плавления мирабилита. Загружаемые в плави-
тель куски мирабилита при смешении с подогретым маточным рас-
твором «тают», рассыпаются и образующаяся суспензия безвод-
ного сульфата натрия направляется на выпарку.
На заводе в Троне (США) рапу концентрируют в трехкорпус- ;
ной вакуум-выпарной батарее, а затем кристаллизуют мирабилит <
при охлаждении до 5—6°. Отфильтрованный мирабилит плавят и >
образующийся концентрированный раствор сульфата натрия на- )
правляют в двухступенчатый испаритель, где кристаллизуется без- 1
водный сульфат натрия. Кристаллы выводятся из испарителя при ;
60° и высушиваются в барабанной сушилке (см. ниже) при 135°.
Выпарка растворов сульфата натрия при
непосредственном соприкосновении с горячими
топочными газами
Преимущество этих методов — в отсутствие .греющих поверхно-
стей, зарастающих сульфатом. Пропускание топочных газов над
зеркалом жидкости в пламенной печи дает более интенсивное вы-
паривание раствора и лучшее использование тепла, чем при обо-
греве открытого чрена через днище. Более рационально можно
осуществлять выпарку сульфатного раствора в огневой башне
(рис. 32). Такая башня из листовой стали имеет вертикальную
плоскопараллельную насадку из тонкой листовой стали. Стекаю-
щий по насадке раствор выпаривается в токе идущих снизу горя-
чих дымовых газов, поступающих из расположенной рядом топки.
Температура входящих газов около 1000°, уходящих— 100°. Плот-
ность орошения башни раствором 10—15 м?/ч на 1 м смоченного
периметра насадки. Производительность башни сечением 1 X 8 м
и высотой 8 .и приблизительно 12 т сульфата натрия в 1 ч.
Обезвоживание мирабилита
119
Еще более интенсивно идет процесс при использовании метода
погруженного горения 102‘103, когда смесь горючего газа или распы-
ленного жидкого топлива и воздуха подается в горелку, находя-
щуюся под уровнем сульфатной суспензии. В этом случае тепловой
коэффициент полезного действия установки достигает 90% и боль-
ше. На рис. 33 показана схема непрерывного обезвоживания мира-
билита методом погруженного горения на заводе Монэхенс в
Техасе (США) 79-89’104. Мирабилит плавят горячим маточным рас-
твором. Насыщенный раствор Na2SO4 перекачивается в выпарной
аппарат погруженного горения 2. В горелки подают газо-воздуш-
ную смесь. Расход газа в одной горелке 52 м?1мин. Температура
факела 1300—1500°; барботирующие газы уносят испаряющуюся
воду и выбрасываются в атмосферу. Выходящая из выпарного ап-
парата суспензия, имеющая температуру 90° и содержащая 5%
кристаллического Na2SO4, отстаивается; осветленный маточный рас-
твор переливают обратно в выпарной аппарат, а частично возвра-
щают на плавление мирабилита. Сгущенная пульпа, содержащая
~70% Na2SO4, поступает на центрифуги 4, из которых маточный
раствор возвращается на выпаривание, а сульфат с содержанием
5—6% влаги направляется в барабанную сушилку5, обогреваемую
дымовыми газами. Готовый продукт содержит 99,3—99,9% Na2SO4
и менее 0,01% железа. Выпарные аппараты изготовлены из стали;
внутренние стенки отполированы и после 15 лет работы не пока-
зали никаких признаков разрушения59.
При погруженном выпаривании суспензий Na2SO4 в насыщен-
ном растворе, содержащих 10—15 вес. % кристаллов, тепловая
нагрузка горелок достигает 175—200 тыс. ккал!ч '°5.
Можно осуществить процесс, используя вместо погруженного
горения барботаж горячего топочного газа (1000°) через выпари-
ваемый сульфатный раствор. Этот метод позволяет использовать
вместо газообразного, низкосортное твердое топливо, но требует
больших капитальных затрат.
Обезвоживание мирабилита в автоклавах
Этот способ основан на резком понижении растворимости суль-
фата натрия при высоких температурах (рис. 21). Если мирабилит
или раствор сульфата натрия нагреть в автоклаве почти до крити-
ческой температуры воды, то практически весь сульфат окажется
в твердой фазе. Так как растворимость примесей с ростом темпе-
ратуры увеличивается и они остаются в жидкой фазе, то сульфат
получается более чистым, чем при других методах обезвоживания
мирабилита. Этот метод, весьма экономичный в тепловом отноше-
нии, пока не нашел практического применения из-за трудности
аппаратурного оформления.
Обезвоживание мирабилита
121
Обезвоживание мирабилита сушкой воздухом
и дымовыми газами
Низкотемпературная сушка
Низкотемпературное обезвоживание мирабилита сушкой за-
ключается в искусственном выветривании его воздухом при темпе-
ратурах ниже точки плавления мирабилита (32,4°) в полочных или
барабанных сушилках. Процесс аналогичен естественному вывет-
риванию. Интенсивность сушки в этих условиях очень низка, про-
цесс идет медленно и требует применения аппаратуры с большими
габаритами.
Низкотемпературная сушка мирабилита воздухом в полочных
сушилках, осуществляемая периодически на сульфатном промысле
на оз. Эбейты (при благоприятных климатических условиях, не
требующих расхода топлива на подогрев воздуха), дает среднесу-
точный съем сульфата с 1 м2 сушильной площади всего 0,5 кг.
Применение вакуума при низкотемпературной сушке106 уско-
рило бы процесс, но не настолько, чтобы оправдать более высокую
стоимость оборудования и повышенный расход энергии.
Низкотемпературную сушку мирабилита можно осуществлять
также и дымовыми газами, разбавленными воздухом, например в
аппарате с движущейся лентой. Благодаря быстрому отводу влаги
с мощным газовым потоком возможно вести процесс при темпе-
ратуре, на 10—12° превышающей температуру плавления мираби-
лита, т. е. при 45°107. Интенсивность низкотемпературной сушки
значительно повышается при осуществлении процесса во взвешен-
ном слое. Все же при больших масштабах производства низко-
температурная сушка неприменима.
Высокотемпературная сушка
Для интенсивного обезвоживания мирабилита сушкой необ-
ходимо осуществлять процесс при температурах, значительно пре-
вышающих температуру плавления мирабилита. Для этого ис-
пользуются вращающиеся барабанные сушилки. Предотвращение
схватывания и комкования за счет плавления достигается путем
смешения поступающего на сушку мирабилита с обезвоженным
сульфатом, выходящим из сушилки. Такой способ сушки назы-
вается ретурным (возвратным)—часть готового продукта цирку-
лирует через сушило. Кроме того, для раздавливания комков и
сдирания материала, прилипшего к стенкам, внутри сушильного
барабана помещают длинную цепь, только один конец которой
закреплен 108’10э.
Технологическая схема процесса изображена на рис. 34. Смесь
мирабилита с сульфатом, подаваемая в сушилку, имеет темпера-
туру около 30° и представляет собой зерна 1—2 мм или гранулы
122
Гл. IV. Природный сульфат натрия
размером до 1 см. Количество оборотного сульфата натрия, добав-
ляемого к мирабилиту, должно быть таким, чтобы в смеси, посту-
-яающей на сушку, содержание воды не превышало 20—25%. При
большем содержании воды материал сильно комкуется и налипает
на стенки сушилки. Практически при содержании в мирабилите
5% гигроскопической влаги (общее содержание воды 58%) для
получения смеси, содержащей 25% воды, соотношение между ми-
рабилитом и оборотным сульфатом равняется 1 : 1,4. При этом в
сушилку возвращается больше половины выгружаемого из нее
сульфата. Это требует дополнительной затраты тепла на его на-
гревание до температуры сушки, так как сульфат натрия, имею-
щий при выходе из сушилки температуру около 120°, охлаждают
до возврата в сушилку.
Дымовые газы поступают в сушилку с температурой 650—850°;
температура уходящих газов 170—190°. Отходящий газ выносит из
сушилки до 30% Na2SO4 в виде пыли; для ее улавливания газ про-
пускают через пылеуловитель (циклон, батарейный циклон). Ды-
мовые газы могут проходить через сушилку прямотоком или про-
тивотоком материалу. При прямоточном режиме обеспечивается
большая скорость испарения воды в начальной стадии сушки, что
препятствует прилипанию сульфата к поверхности футеровки су-
шильного барабана. Недостатками ретурного способа являются:
1) необходимость возврата в печь более половины получаемого
сульфата, 2) в связи с этим низкая производительность сушила,
3) необходимость шихтовки материалов с предварительным охла-
ждением обезвоженного сульфата во избежание образования ком-
ков при смешении и 4) образование комкующегося и пылящего
продукта, слеживающегося при хранении.
Ретурный способ сушки — один из наиболее громоздких, тре-
бующий большого расхода металла на сооружение сушилок и
транспортных устройств и большого расхода энергии и топлива.
На 1 т готового сульфата натрия расходуется до 250 кг условного
топлива (7000 ккал/кг) и больше 40 квт-ч электрической энергии.
При диаметре сушила 2,8 м и длине 14 м удельный влагосъем
с 1 м3 объема сушила составляет 35 кг/ч (при температуре входя-
щих газов 850°, уходящих 180°).
На одном из заводов в США 89’108 применялся «трехстадийный»
способ обезвоживания мирабилита, состоящий из трех последова-
тельных процессов: 1) плавления мирабилита во вращающейся
печи (55°), 2) выпарки-сушки смеси плава и сульфата в трубчатой
паровой сушилке (103°) с превращением этой смеси в твердый про-
дукт, содержащий 27% воды, и 3) окончательной сушки в бара-
банной сушилке (140°), обогреваемой дымовыми газами. При та-
кой схеме обезвоживания расход тепла меньше, чем при сушке
с оборотным сульфатом. Кроме того, основная масса тепла, рас-
ходуемого при трехстадийном способе обезвоживания, получается
Обезвоживание мирабилита
123
за счет использования отработанного пара низкого давления, т, е.
обходится дешевле, чем тепло, получаемое при сжигании угля.
В Канаде на сульфатных предприятиях на оз. Чаплин (Саска-
чеван) обезвоживание мирабилита осуществляют во вращающейся
печи в комбинации с испарителем. Последний представляет собой
камеру, в которой поступающий мирабилит плавится в токе горя-
чих газов. У днища камеры расположен быстро вращающийся
шнек с лопастями, разбрызгивающими сульфатную суспензию.
При контакте с горячим газом брызги подсыхают и получается ма-
териал с влажностью ~25%, который досушивается во вращаю-
щейся печи с небольшим ретуром110. Эти методы связаны с усло-
жнением аппаратуры.
Безретурная высокотемпературная сушка мирабилита 111 в ба-
рабанной сушилке требует меньших расходов тепла и энергии на
перемещение сульфата, чем сушка с ретуром. Сущность безретур-
ного способа сушки заключается в обезвоживании мирабилита на
подушке высушенного материала (толщина слоя которого зависит
от диаметра барабана). Создание подушки достигается с помощью
специального выгрузочного устройства. Влажный продукт забра-
сывается на эту подушку на расстояние 4—5 м при помощи пита-
теля, состоящего из трефеля (дозатора) и метательной лопатки.
Такой способ сушки широко используют в содовом производстве
(для кальцинации бикарбоната)112. Процесс осуществляют в печах
с внешним обогревом. Находящаяся внутри тяжелая цепь, закре-
пленная с одного конца, способствует разрушению комков и хоро-
шему смешению свежих порций загружаемого материала и горя-
чего высушенного продукта.
Опыт показал, что обезвоживание мирабилита в содовых печах
с безретурным питанием не сопровождается обрастанием стенок
печи сульфатной коркой. Продукт получается крупнокристалличе-
ский без комков с насыпным весом ~ 1,2 т/ж3 и влажностью 0,05%
и меньше.
С большей интенсивностью безретурное обезвоживание мираби-
лита осуществляется в сушильных барабанах с внутренним обо-
гревом. В опытах по безретурному обезвоживанию мирабилита,
проведенных в барабане длиной 7,62 м, диаметром 0,9 м, устано-
вленном под углом 3°, делающим 2,5 об/мин и отапливаемом
генераторным газом, влагосъем достигал 72 кг/(ж3-ч). Это при-
близительно в 3 раза больше влагосъема при безретурном обезво-
живании мирабилита в сушилках с внешним обогревом и прибли-
зительно в 2 раза больше влагосъема при ретурном обезвожива-
нии в барабанных сушилках с внутренним обогревом.
Опытом безретурной сушки сульфата натрия с повышенной
влажностью на стекольных заводах в барабанных печах с внут-
ренним обогревом, отапливаемых генераторным газом, установ-
лено, что если температура отходящих из печей газов не снижается
124
Гл. IV. Природный сульфат натрия
ниже 150°, то налипание сульфата на стенку барабана не проис-
ходит. Сульфат на выходе из барабана имеет при этом темпера-
туру 90—100°. Все же периодически (каждые 1 — 1,5 ч) приходится
очищать течку и приемную часть барабана от накопившихся от-
ложений. Очистку производят ручным способом в течение 10—
12 мин. Суточная производительность печи диаметром 0,95 м и
длиной 8,25 м, делающей 4—5' об)мин, при начальной влажности
сульфата 35—40% и температуре поступающих газов 550—600°
составляет 18—20 т сульфата с влажностью 1 —1,5% 113.
Одним из наиболее совершенных и экономически выгодных
способов обезвоживания мирабилита является безретурная сушка
во взвешенном слое в сушилках КС («кипящего слоя»)114"117. Та-
кие сушилки с выносными мазутными топками работают на ком-
бинате «Карабогазсульфат». При площади газораспределительной
решетки 6 м2 производительность сушилки 6 т/ч обезвоженного
сульфата. Температуры: в слое около 120°; входящего газа
750—800°, отходящего газа 100—110°. Решетки чугунные с диамет-
ром отверстий 6 мм и живым сечением 10%. При скорости газа в
слое 2—2,5 м/сек сопротивление слоя и решетки 550—600 мм вод. ст.
Конечная влажность сульфата меньше 0,1%. Продукт почти цели-
ком состоит из гранул с размерами от 0,25 до 2 мм (96%). Частиц
с размерами меньше 0,25 мм всего ~0,3%. Около 20% материала
выносится из сушилок газом, улавливается в циклоне и возвра-
щается в бункер для мирабилита. С отходящим газом теряется
~2% продукта.
Перед подачей в сушилку КС мирабилит следует дробить на
куски меньше 25 мм. Подачу его на «кипящий слой» рекомендуется
осуществлять с помощью пневнозабрасывателя — наклонной течки
с воздушной струей. При площади решетки 2—7 м2 высота слоя
~0,7 м, а высота сепарационной зоны аппарата должна состав-_
лять 4—7 м. Газораспределительная решетка может быть щеле-
вой (из колосников). В верхней части аппарата должно поддер-
живаться разрежение 5—8 мм вод. ст., обеспечиваемое дымо-
сосом.
Энергетические затраты на обезвоживание мирабилита в аппа-
ратах КС (как и другими способами) зависят от его начальной
влажности. При начальном содержании воды 56%, температуре под
решеткой 700° и температуре слоя 120° на 1 т продукта расхо-
дуется 140 кг мазута (с рабочей теплотворной способностью
9400 ккал/кг), 50 кет • ч электроэнергии, 4 м3 воды, 15—20 кг пара
(на мазутную форсунку). При использовании в качестве топлива
природного газа энергозатраты на обезвоживание мирабилита во
взвешенном слое приблизительно такие же, как и при его плавле-
нии с последующей выпаркой сульфатного раствора, но капиталь-
ные вложения меньше. По сравнению же с барабанными сушил-
ками, работающими с ретуром, сушилки КС требуют на 25—30%
Обезвоживание мирабилита
125
меньше энергозатрат, в 5—7 раз меньше металла и в 2—3 раза
меньше производственной площади.
Обезвоживание мирабилита в распылительных сушилках в по-
токе горячих газов было испытано в заводских условиях89118, но
не нашло распространения. Для получения этим способом продук-
та с влажностью 0,1—0,5% температура газов в средней части
камеры не должна быть ниже 250—300°. При более высокой тем-
пературе газов увеличивается интенсивность процесса, но при тем-
пературе, превышающей точку плавления сульфата, расплавленный
сульфат проникает через кирпичные стенки камеры и инкрустирует
их наружную поверхность.
Предложены разные видоизменения обезвоживания мирабилита
с помощью распылительной сушки. Так, например, насыщенный
раствор сульфата натрия можно выпаривать в распылительной
сушилке не досуха, а получая текучую суспензию сульфата натрия,
и после отделения кристаллов его маточный раствор возвращать в
процесс119. Можно высушивать также в распыленном состоянии и
частично обезвоженный мирабилит с содержанием менее 30% воды,
вводя его в сушилку через сопло. При такой влажности исходного
материала не происходит его налипания на стенки сушилки 12°.
В СССР были проведены опыты по ретурному обезвоживанию
мирабилита в пневматической сушилке — вертикальной трубе в по-
токе горячих топочных газов (800—850е). Газы вводились в ниж-
нюю часть трубы, несколько выше в нее подавали с помощью
охлаждаемого водой сопла шихту из мирабилита и сульфата на-
трия в отношении 1 :2. Шихта высушивалась в потоке газов, пере-
мещаясь со скоростью 10—20 м/сек, и собиралась в ловушке и ча-
стично (~10%) в циклоне121. Этот метод обезвоживания мира-
билита также не использован в промышленности.
Обезвоживание мирабилита высаливанием
Извлечение сульфата натрия из его растворов может быть осу-
ществлено методами высаливания, основанными на понижении
растворимости сульфата со смещением переходной точки в присут-
ствии других веществ.
Наиболее дешевый высаливающий реагент — NaCl; к тому же
он часто является естественной примесью к сульфатным раство-
рам. На рис. 35 изображена политермическая диаграмма равно-
весия для системы Na?SO4—NaCl—Н^О (содержание Na2SO4 и
NaCl дано в сухом остатке). Если в отсутствие NaCl точка пере-
хода Na2SO4 • IOH9O в Na2SO4 лежит ппи 32.38®, то при добав-
ке NaCl'температура перехода уменьшается и становится равной
17,0е когда содержание NaCl в растворе достигает 22.3%. В этой
тройной точке А в солевой массе эвтонического раствора 25,4%
Na2SO4 и 74,6% NaCl, а сам раствор содержит всего 7.57%
126
Гл. IV. Природный сульфат натрия
Рис. 35. Проекционная политермическая
диаграмма равновесия в системе
Na2SO4—NaCl—Н2О.
Na2SO4, в то время как в точке В в насыщенном растворе 33,2%
Na2SO4. Ниже 17,9° выделение в осадок безводного Na2SO4 не про-
исходит, а при повышении температуры поле кристаллизации
Na2SO4 несколько расширяется и степень его высаливания увели-
чивается. Так, при 50° в отсутствие NaCl растворимость Na2SO4
составляет 31,9%, а эвтонический раствор содержит 23,89% NaCl
и всего 5,17% Na2SO4 (в сухом остатке 17,8% Na2SO4 и 82,2%
NaCl).
Таким образом, добавка к растворам сульфата натрия NaCl
приводит к кристаллизации Na2SO4 и позволяет получить в без-
водном виде значительную до-
лю сульфата. После отделения
Na2SO4 отстаиванием и филь-
трованием остающийся маточ- ‘
ный раствор может быть под-
вергнут выпариванию для'
кристаллизации из него NaCl,
возвращаемого на высалива-
ние. Отфильтрованный суль-
фат для удаления из него при-
меси NaCl необходимо про-
мыть насыщенным раствором
Na2SO4 (в 1,5-кратном коли-
честве к твердой фазе) 89.
Способ высаливания суль-
фата натрия галитом исполь-
зуется на предприятии имени
Тельмана в ГДР. Расчетные
расходные коэффициенты применительно к обезвоживанию этим
способом Аральского сульфата натрия следующие (на 1 т суль-
фата): галита --0,65 т, пара 0,88 т, электроэнергии 36 кет ч,
условного топлива 0,015 т. Этот способ получения безводного
сульфата натрия экономически оправдывается при использовании
дешевого отбросного галита, не добываемого специально для вы-
саливания.
В качестве высаливающих реагентов для выделения безводного
сульфата натрия из растворов могут быть использованы смеси со-'
лей: NaCl + КС1122, NaCl + MgSO4, а также Na2S, NaOH и др.
При использовании в качестве высаливающего средства едкого
натра вода, содержащаяся в сульфатном растворе, из которого
высаливается Na2SO4, разбавляет раствор NaOH и должна быть
удалена из него выпариванием. После выпаривания концентриро-
ванный раствор NaOH вновь возвращается на высаливание. Пре-
имущество этого способа по сравнению со способом непосредствен-
ной выпарки сульфатных растворов заключается в том, что при
выпарке растворов NaOH греющая поверхность не инкрустируется
Обезвоживание мирабилита
127
сульфатом натрия, хотя и происходит его дополнительная кристал-
лизация по мере увеличения концентрации NaOH 123.
В табл. 14 приведена растворимость Na2SO4 в водных раство-
рах едкого натра при разных температурах.
ТАБЛИЦА 14
Растворимость Na2SO4
в водных растворах NaOH
Концентрация NaOH, % г Na2SO4 в 100 г Н2О при температуре
50° 70° 90° 100° 120° 140°
0 46,8 43,9 42,7 42,4 41,8 42,0
5 28,4 26,5 24,9 24,5 23,5 2 ,2
15 11,7 11,0 10,7 10,0 9,6 10,1
25 3,7 3,5 3,3 2,9 2,6 2,6
35 1,9 1,6 1,5 1,3 1,3 1,3
45 0,6 0,6 0,6 0,6 0,6 о,6
55 0,3 0,3 0,3 0,2 0,2 0,3
По диаграмме рис. 36 можно определить степень высаливания
Na2SO4 из его насыщенного раствора при 60° растворами NaOH
Количество раствора NaOH, л/ л насыщ раствора сульсрата
Рис. 36. Степень высаливания Na2SO4 из его насыщенного
раствора при 60° растворами NaOH разной концентрации:
—.. — концентрация исходного раствора NaOH, %.------концентра-
ция NaOH в жидкой фазе получаемой суспензии
разной концентрации. При смешении 0,4—1 объема 40—50%-ного
раствора NaOH с 1 объемом насыщенного раствора сульфата на-
трия степень высаливания Na2SO4 составляет 85—90%, а раствор
128
Гл. IV. Природный сульфат натрия
после отделения осадка сульфата содержит 20—25% NaOH и
2,5—5% Na2SO4.
Непосредственное растворение твердого мирабилита в растворе
едкого натра приводит к образованию тонкодисперсного осадка
Na2SO4, трудно отделяемого от жидкой фазы. Лучшие результаты
получаются при предварительном расплавлении мирабилита. На-
греванием мирабилита до 60° можно выделить 42% сульфата на-
трия. При смешении отделенного от кристаллов раствора с равным
объемом 40%-ного раствора NaOH высаливается еще 52% Na2SO4.
Наконец, при выпаривании полученного разбавленного раствора
щелочи выделяются остальные 6% Na2SO4.
Для получения в процессе плавления крупнокристаллического,
хорошо фильтрующего безводного сульфата натрия плавление
необходимо вести медленно при перемешивании массы с такой ин-
тенсивностью, чтобы выделяющийся безводный Na2SO4 оставался
во взвешенном состоянии. Затем суспензия должна быть нагрета
до 70—85°. При соблюдении этих условий образуется осадок с раз-
мерами кристаллов 200—250 мк, оседающий при 85° со скоростью
8—9,5 м]ч. В процессе высаливания крупнокристаллический, хо-
рошо фильтрующий осадок образуется при медленном приливании
нагретого до 70—80° раствора NaOH к нагретому до этой же
температуры, интенсивно перемешиваемому раствору сульфата
натрия.
Находящиеся в сульфате натрия примеси соединений магния,
полуторных окислов, кремневой кислоты и другие образуют в ра-
створе едкого натра гелеобразные осадки, затрудняющие отстаи-
вание и фильтрацию кристаллов Na2SO4. Поэтому эти примеси
должны быть отделены до высаливания. При этом возможно по-
лучение продукта, содержащего до 99,5% Na2SO4 (в пересчете на
сухое вещество).
Предложено 124 получать безводный сульфат натрия из мираби-
лита нагреванием последнего в смеси с двойной солью Na2SO4-
• НН4НСОз • 4Н2О до 60°. Образующийся осадок NaaSO4 отфиль-
тровывают, а из фильтрата охлаждением до 20° выделяют Na2SO4-
• NH4HCO3 • 4Н2О. Концентрированием маточного раствора, остаю-
щегося после отделения четырехводной двойной соли, кристалли-
зуют сульфат аммония.
Обезвоживание мирабилита с применением
летучих растворителей
Для высаливания сульфата натрия из его растворов, получен-
ных при плавлении мирабилита, могут быть использованы летучие
реагенты — аммиак, метиловый и этиловый спирты и др.125’128. По-
сле отделения осадка Na2SO4 эти реагенты могут быть регенериро-
ваны из водного раствора отгонкой. Эти методы пока не нашли
Обезвоживание мирабилита
129
промышленного применения в связи с тем, что они связаны с поте-
рями относительно дорогих реагентов. Однако они интересны тем,
что требуют малого расхода тепла. Так, при использовании в ка-
честве высаливающего средства аммиака расход тепла на 1 т про-
дукта в 2 раза меньше, чем при плавлении мирабилита и выпари-
вании воды из образующегося раствора.
Конденсат Сулырат на упаковку
Рис. 37. Схема обезвоживания мирабилита аммиачным способом:
/—дробилка; 2 —грохот; 3 — бункер; 4 — реактор-аммонизатор; 5 — фонарь; 6 — буферный резер*
вуар; 7 — уплотнитель суспензии; 8 — диафрагменный насос; 9—центрифуга; 10 — сушилка»
// — калорифер; 12 — вентилятор; 13 — насос; 14 — дистиллер; /£ —подогреватель жидкости/
16 — холодильник газа; 17 — экспанэер; 18 — скруббер; 19, 20 — гидравлические регуляторы
давления; 21 — эксгаустер; -------жидкости и суспензии; —• — • — твердые вещества;
----- — газы и пары.
Растворимость сульфата натрия в воде в присутствии аммиака
сильно уменьшается 127’128. Поэтому при взаимодействии регене-
рированной аммиачно-паровой смеси, имеющей температуру 60°,
с мирабилитом, имеющим температуру 10°, выход сульфата натрия
достигает 90—95% без дополнительного нагревания или охлажде-
ния реакционной смеси.
На рис. 37 показана возможная схема обезвоживания мираби-
лита аммиачным способом 12Э. Реактор по высоте разделен двумя
ложными днищами, препятствующими падению крупных кусков
мирабилита на дно. Снизу в реактор поступает аммиачно-паровая
смесь при 50—60° под давлением 20—50 мм рт. ст., а сверху —
аммонизированный раствор. Соприкасаясь с холодным мирабили-
том, водяные пары конденсируются. Таким образом, обезвоживание
5 М. Е. Позин
130
Гл. IV. Природный сульфат натрия
сульфата натрия происходит в водном растворе аммиака. Суспен-
зия Na2SO4 в водно-аммиачном растворе удаляется из нижней
части реактора через фонарь, позволяющий следить за плотностью
суспензии. После отстаивания и центрифугирования получаемый
сульфат натрия с влажностью 4—6% высушивают в барабанной
сушилке. Маточный раствор направляется на дистилляцию ам-
миака. Горячую жидкость, выходящую из дистиллера, направляют
в экспанзер, где образуется пар, используемый для пропарки
сульфата натрия на центрифуге. Уходящая из экспанзера отброс-
ная жидкость содержит всего 50—60 г/л Na2SO4.
Другим вариантом обезвоживания мирабилита с помощью ле-
тучих веществ может быть выпарка с кристаллизацией Na2SO4 и
одновременной отгонкой высаливающего агента. Так, например,
для устранения инкрустации поверхности нагрева выпарных аппа-
ратов при кристаллизации Na2SO4 из водного раствора предло-
жено 130 производить кристаллизацию сульфата натрия в выпари-
ваемом водном растворе органической жидкости (60—90%-ном
растворе этиленгликоля или в 40—50%-ном растворе спирта). От-
гоняющиеся при выпарке пары органической жидкости и воды
подвергают ректификации и образующийся водный дистиллят воз-
вращают в процесс. Кристаллы Na2SO4 выделяют из суспензии,
промывают и высушивают.
ПРОИЗВОДСТВО СУЛЬФАТА НАТРИЯ НА ЗАВОДАХ СССР
Производство сульфата натрия на комбинате «Карабогазсульфат»
Межкристальный рассол второго погребенного горизонта
(стр. 160) из скважин, расположенных в районе Кургузульской
бухты карабогазского залива, с помощью двух насосных станций
поступает на завод по чугунному трубопроводу диаметром 600 мм
в два железобетонных резервуара емкостью по 1000 л/3. Отсюда он
подается в кристаллизаторы цеха мирабилита. Охлаждение рас-
сола осуществляют в две ступени — в предкристаллизаторах до 10°
сбросным маточным раствором, остающимся после отделения кри-
сталлов мирабилита, и в кристаллизаторах до 0° испаряющимся,
жидким аммиаком аммиачной холодильной машины. Маточный
раствор, нагревшийся в предкристаллизаторах до 8°, используют
для переохлаждения жидкого аммиака и для кондиционирования
воздуха в производственных помещениях в жаркое время года.
Кристаллизаторы представляют собой вертикальные цилиндри-
ческие резервуары, снабженные внутри четырехсекционной систе-
мой трубчатых теплообменников и лопастными мешалками, а так-
же скребками для очистки поверхности трубчатки от прилипшего
мирабилита.
Производство сульфата натрия на заводах СССР
131
Параллельно работают две батареи кристаллизаторов. Каждая
состоит из двух предкристаллизаторов и пяти кристаллизаторов,
расположенных каскадом. Мирабилитовая пульпа поступает из
них самотеком через мешалку в дисковые фильтры-сгустители, за-
тем на центрифуги, откуда мирабилит ленточным транспортером
передается в цех сульфата натрия.
Плавление мирабилита осуществляется в камере плавления
циркуляционного плавителя в восходящем токе горячего щелока
(—70°), который возвращается вниз через подогреватель, где ис-
пользуется соковый пар вторых корпусов выпарной станции. Из
них щелок, содержащий — 30% сульфата натрия, направляется на
выпарку в двухкорпусные выпарные батареи. Греющий пар в пер-
вом корпусе имеет давление 5,5 ат. Здесь выпаривается — 50%
воды. Пульпа из первого корпуса поступает во второй, обогревае-
мый соковым паром первого. Сюда же подают маточный щелок
после центрифуг для поддержания постоянного отношения Т : Ж-
Сульфатная пульпа из вторых корпусов, пройдя самоиспарители
и сгуститель вместе со сгущенной пульпой, полученной при плавле-
нии мирабилита, поступает на центрифуги,
Отфугованный сульфат, содержащий 5% влаги, высушивают
топочным газом, разбавленным воздухом в аппарате КС с мазут-
ной топкой. Уносимая газом сульфатная пыль улавливается в цик-
лонах и электрофильтре.
Производствоосульфата натрия на Кучукском сульфатном
комбинате
Из рапы оз. Кучук мирабилит получают -бассейным способом
(стр. 115), а затем его обезвоживают плавлением и выпаркой в за-
водских условиях. В качестве садочного бассейна используют кот-
ловину высохшего оз. Селитренного, расположенного в 2,4 км от
оз. Кучук. Работу промысла ведут в двухгодичном цикле, т. е. на-
качку рапы в садочный бассейн производят один раз в два года
(40 млн. м3). Высота налива — 7 м. Выход мирабилита из 1 м3
рапы 117—130 кг. В засушливые годы, в период наибольших кон-
центраций кучукской рапы, для предотвращения совместной садки
с мирабилитом NaCl и NaCl-2H2O рапу разбавляют менее кон-
центрированной рапой из близрасположенного оз. Кулундинского,
уровень воды в котором выше, чем в оз. Кучук.
Плавление мирабилита раствором сульфата натрия ведут при
60° в горизонтальном реакторе с рамной и шнековой мешалками.
Циркулирующий между плавителем и подогревателем раствор
содержит некоторое количество взвешенных кристаллов Na2SO4,
что предотвращает зарастание греющих поверхностей подогрева-
телей, где температура раствора повышается до 100° соковым па-
ром из второго корпуса выпаркой батареи. Пульпа из плавителя
132
Гл. IV. Природный сульфат натрия
поступает на центрифуги, а слив из плавителя и фильтрат с цен-
трифуг в первый корпус выпарной батареи. Во избежание зара-
стания греющих поверхностей кристаллами в циркулирующем рас-
творе в первом корпусе поддерживают содержание твердой фазы
10—20%. Циркуляция осуществляется с помощью пропеллерных
насосов. Пульпа, поступающая на центрифугу из второго корпуса,
содержит 35% твердой фазы. Отфугованный сульфат натрия высу-
шивают во вращающихся барабанных сушилах дымовым газом,
который затем очищается от сульфатной пыли в циклонах, муль-
тициклонах и скрубберах.
ПОЛУЧЕНИЕ СУЛЬФАТА НАТРИЯ ИЗ ТВЕРДЫХ СОЛЕВЫХ ОТЛОЖЕНИЙ
В большинстве случаев извлечение сульфата натрия из твер-
дых солевых отложений связано с довольно сложной их переработ-
кой. Сульфат натрия получают при этом наряду с другими продук-
тами. Только при добыче тенардита, если порода достаточно чиста,
ограничиваются ее выламыванием или извлечением из рапы (на-
пример, на оз. Джаксы-Клыч) и естественной сушкой в буграх.
Часто, однако, и тенардит подвергают перекристаллизации для
удаления примесей других солей и органических загрязнений 131.
Наиболее крупным производством сульфата натрия из твердых
солевых отложений является комплексная переработка хартзаль-
цевых пород на заводе имени Тельмана в ГДР (стр. 159). Полу-
чающийся при этом галитовый отвал содержит кизерит, который
отмывают. После конверсии
MgSO4 + 2NaCl = Na2SO4 + MgCl2
безводный сульфат натрия высаливают галитом.
Предложено много схем переработки на сульфат натрия астра-
ханитового сырья. Например, одна из схем заключается в раство-
рении породы с последующим выделением мирабилита выморажи-
ванием (после добавки NaCl для повышения выхода) и в обезво-
живании мирабилита выпаркой или высаливанием. Другая схема
предусматривает растворение с последующим прямым высалива-
нием Na2SO4 галитом при 50° и т. д.
Разработаны способы получения сульфата натрия из глаубери-
товых пород132. При комплексной переработке полиминеральных
руд Предкарпатья возможно получение значительных количеств
сульфата натрия из лангбейнитового отвала (см. гл. V).
Запасы твердых солей в Карабогазском заливе практически
неисчерпаемы. В настоящее время обнажилась значительная часть
дна залива почти вдоль всего побережья (за исключением восточ-
ного и части южного). Ширина прибрежной полосы солевых отло-
жений достигает 20—30 км, а мощность пласта смешанной соли
доходит до 2,5 м. Средний состав солевых отложений в северо-за-
Получение сульфата натрия из твердых солевых отложений
133
падной части залива в районе действующего промысла комбината
«Карабогазсульфат» (в %):
NaCl.......................73,14
MgSO4.............. 9,80
Na2SO4............. 6,89
CaSO4 ............. 0,8
CaCO3.............. 0,26
Нерастворимый остаток 0,67
Н2О . . . . .........8,44
Северные отложения более богаты сульфатами и содержат в
среднем (в о/о) 55, из, 134.
NaCl........... 58 CaSO4.............. 0,7
MgSO4..............20,5 Н2О............... 15,6
Na2SO4............4,2
Получение мирабилита из смеси NaCl и MgSO4 было разрабо-
тано еще в 1929 г. применительно к Крымским соляным промыс-
лам 135. Разработаны и способы переработки карабогазской сме-
шанной соли («Sei mixt»). Она может быть растворена в морской
воде с последующим выделением из раствора мирабилита бассей-
ным способом или переработана на сульфат натрия заводским спо-
собом. Однако технико-экономические показатели этих способов
переработки смешанной соли несколько уступают показателям су-
ществующего производственного процесса получения сульфата на-
трия из межкристальных карабогазских рассолов. Поэтому эти
способы пока не реализуются, и ниже дается лишь их краткое опи-
сание.
Бассейный способ переработки смешанной соли на мирабилит
заключается в растворении смешанной соли в морской воде с по-
лучением отношения MgSO4: NaCl, равного 0,4—0.6. Такое отноше-
ние солей обеспечивает максимальный выход мирабилита при по-
следующем охлаждении раствора (стр. 111) в садочном бассейне.
В основу схемы заводской переработки смешанной соли136 по-
ложены также процессы растворения ее в морской воде и кристал-
лизации мирабилита. При растворении смешанной соли при 20—
25° получаемый раствор должен содержать 27,5% солей (раство-
римость смешанной соли при этой температуре ~30,5%). При со-
держании в смешанной соли 80% сухих солей для растворения 1 т
соли требуется 1,9 т воды, причем образуется 2,3 м3 рассола плот-
ностью 1,25 г!см3. Потери рассола со шламом при отстаивании со-
ставляют 2%. При охлаждении 1 м3 осветленного рассола до 0°
образуется около 280 кг мирабилита, а до —5° около 295 кг. Ниже
—5° из рассола может выделиться также гидрогалит NaCl-2HaO.
Маточный раствор после садки мирабилита может быть использо-
ван для получения эпсомита. Отфугованный мирабилит содержит
5% влаги. При его расплавлении при 55—60° выделяется ~40%
безводного сульфата натрия или 0,15т на 1т мирабилита. После
отделения сульфата натрия к оставшемуся щелоку можно доба-
вить .смешанную соль (из расчета 0,33 т на 1 т мирабилита). При
134
Гл. IV- Природный сульфат натрия
этом в результате высаливания выделится 0,21 т N2SO4 на 1 т
мирабилита. Маточный раствор от высаливания в количестве
0,78—0,8 т возвращают в процесс на охлаждение. Сульфат натрия,
промытый раствором от плавления мирабилита, высушивают.
Упомянем о производстве сульфата натрия из твердых отложе-
ний Большого Соленого озера в США, которое меньше Карабо-
газского залива, но аналогично ему по характеру солей. Здесь раз-
рабатывается береговой пласт мирабилита длиной несколько кило-
метров, толщиной 0,6—3 м и шириной 0,6—2,4 км, прикрытый
слоем песчаника. Взорванная порода, доставляемая в вагонах на
завод, содержит приблизительно 20% сульфата натрия, 20% воды
и 60% пустой породы. Измельченную руду обрабатывают горячей
водой (80—85°) и после отстаивания песка раствор упаривают.
Кристаллизующийся при выпарке сульфат натрия отделяют в от-
стойниках, центрифугируют и высушивают во вращающейся бара-
банной сушилке. Маточный раствор возвращают на выпарку137.
Запатентованы 138 способы очистки сульфата натрия от соеди-
нений железа. По этим способам расплавленный сульфат нагре-
вают до 1200° в присутствии кремнийсодержащих материалов
(SiOs, Na2SiO3) и щелочей (NaOH, Na2CO3). Затем расплав декан-
тируют с осадка, в который переходит более 90% железа. Fe2O3
снимают также с поверхности расплава, а для более полного уда-
ления железа охлажденный сульфат измельчают и подвергают
магнитной сепарации.
О правилах и нормах техники безопасности в производстве
природного сульфата натрия см.139.
ГЛАУБЕРОВА СОЛЬ
К чистоте десятиводного сульфата натрия, применяемого под
названием глауберовой соли для медицинских целей, предъяв-
ляются повышенные требования. Согласно ГОСТ 6319—52*, глау-
берова соль должна содержать не менее 99% Na2SO4- ЮН2О, и не
более: 0,005% не растворимых в воде веществ, 0,1% хлоридов
(NaCl), 0,0005% Fe, 0,003% солей аммония (NH4), 0,0005% тяже-
лых металлов сероводородной группы (РЬ), 0,03% солей кальция.
Мышьяк, сульфиты и тиосульфаты, а также гигроскопическая
влага должны отсутствовать. Реакция водного раствора должна
быть нейтральной.
Из мирабилита, содержащего большие загрязнения, глауберову
соль получают перекристаллизацией. Мирабилит растворяют в
воде при 40°. Теплый (во избежание закристаллизовывания в тру-
бах) раствор, имеющий концентрацию 30% Na2SO4, отфильтровы-
вают от шлама и направляют в кристаллизатор, например, бара-
банного типа. Кристаллическая пульпа собирается в корыто с
мешалкой (10—12об/лшн) у нижнего конца кристаллизатора и от-
Литература
135
сюда поступает на центрифугу. Маточный раствор с центрифуги
используют при растворении новых порций мирабилита.
Кристаллизатор с наружным водяным охлаждением, имеющий
диаметр 0,5 м и длину 10 м, дает в сутки 13 т глауберовой соли.
Расходные коэффициенты на 1 т глауберовой соли: мирабилита
1,095 т, воды 0,215 л3, пара (2 ат)— 0,28 т, электроэнергии
67 кет • ч.
ЛИТЕРАТУРА
1. А. Н. Хлапова, ДАН СССР, 105, № 3, 500 (1955).— 2. F. С. Кгасек,
J. Phys. Chem., 33, № 9, 1281 (1929). — 3. F. С. Кгасек, R. Е. Gibson, ibid,
34, № 1, 188 (1930). — 4. Н. S. Dooth, R. М. Bidwell, J. Am. Chem. Soc,
72, 2570 (1950). — 5. M. И. P а в и ч, Ф. Е. Боровая, В. Я. Кет кович,
ИСФХА АН СССР, 22, 240 (1953). — 6. W. L. Marshal, Н. W. Wright,
С. Н. Sec о у, J. Am. Chem. Edtlc, 31, № 1, 36 (1954). — 7. G. В г о d а 1 е,
W. Gianque, J. Am. Chem. Soc, 80, 2042 (1958). — 8. В. М. Еленевская,
Автореф. канд. дисс, ИОНХ АН СССР, 1955. — 9. М. И. Р а в и ч, В. М. Еле-
невская, ИСФХА АН СССР, 25, 176 (1954). — 10. А. Г. Б е р г м а н, В. А. X и т-
р о в, Там же, 21, 199 (1952).
11. М. Л. Гавриш, И. С. Г а л и н к е р, Зап. Харьковск. сельскохоз. ин-та,
14 (51), 29 (1957). — 12. И. Н. Бочкарева, сб. «Технология переработки при-
родных солей и рассолов», Изд. «Химия», 1964, стр. 228. — 13. П. М. Лукья-
нов, История химических промыслов и химической промышленности в России,
т. Ill, Изд. АН СССР, 1951. — 14. В. М. Букштейн, Б. В. Яснопольский,
Хим. пром, № 5, 133 (1948). — 15. А. И. Горбанев, ЖПХ, 27, № 8, 804; № 9,
921 (1954). — 16. Г. М. Куперман, Д. X. Гварамадзе, С. И. Д ж и к и я,
Н. П. 3 а р к у а, Труды Ин-та химии АН ГрузССР, т. II, 1953, стр. 117.—
17. Н. L. Bittrich, Е. Leibnitz, J. prackt. Chem, 3, № 3—4, 126 (1956).—
18. А. И. Горбанев, В. Я. Николина, Труды ВИСП, т. 7, 1954, стр. 5.—
19. Т а к и м о т о, Хатт ар и, J. Chem. Soc. Japan. Ind. Chem. Sec, 58, № 9,
654 (1955). — 20. H. Siebourg, W. Moll, пат. ГДР 4944, 1953.
21. К. X. Спивак, В. Н. Белов, Хим. пром, № 5, 391 (1968).—
22. Б. А. Б е р е м ж а н о в, С, К. Нурланова, сб. «Химия и химическая тех-
нология», № 3—4, Изд. МВ и ССО КазССР, 1965, стр. 27. — 23. Н. Е. Кири-
ченко, А. Ф. Б о р я ч е к. Хим. пром, № 6, 178 (1950). — 24. О. И. Пудов-
кина и др, Труды УНИХИМ, т. 7, 1958, стр. 87. — 25. А И. Дзенс-Литов-
с к и й, Труды ВНИИГ, в. 32, 1956, стр. 87.— 26. Б. А. Б е р е м ж а н о в, Реф. докл.
и сообщ. VHI Менделеевского съезда, 1, 51 (1959). —27. А. И. Дзенс-Литов-
ский, Хим. пром, № 6, 1 (1947). — 28. Р. А. Дыишиц, сб. «Технология пере-
работки природных солей и рассолов». Изд. «Химия», 1964, стр. 150.—
29. В. И. Николаев, А. И. Качалов, ЖПХ, 15, № 1—2 (1942); ДАН СССР,
№ 6, 57 (1941).—30. В. И. Николаев, Л. С. Д ы н к и н а, Труды Калмыцкой
н.-и. станции, Изд. Местпрома Калм. АССР, 1940.
31. В. М. Букштейн, Р. С. Р о с к и н а, Труды ВНИИГ, в. 31, 1956,
стр. 83. — 32. В. Н. Щербина, Глауберит, глауберитовые породы и их кора
выветривания, Кирг. ФАН СССР, Фрунзе, 1952. — 33. М. А. Штерн, Труды
ВНИИГ, в. 31, 1956, стр. 99.—34. Я. Д. Фридман, А. А. Зиновьев,
М. Д. Лапина, Двойные сульфаты натрия и кальция и переработка их при-
родных отложений, АН КиргССР, Фрунзе, 1956.—35. В. И. К с е н з е н к о,
С. Исмаилов, Н. А. 3 а н е м о н е ц, ЖПХ, 39, № 12,2622 (1966).—
36. Я. Д. Фридман, В. М Одинцов, М. Д. Лопина, Труды ин-та химии
АН КиргССР, в. 8, 1957, стр. 57. — 37. Б. В. Я с н о п о л ь с к и й, сб. «Сульфат
натрия в СССР», Изд. АН СССР, 1946, стр. 5.—38. В В. Геце у, Труды Ин-та
геологии Министерства геол. СССР, в. 6, Махачкала, 1966, стр. 154.—
136
Гл. IV. Природный сульфат натрия
39. В. П. Ильинский, Г. С. Клебанов, Труды Соляной лаборатории АН
СССР, т. 1, 1932; т. 4, 1934. — 40. В. П. Ильинский, Г. С. Клебанов,
Я. Б. Б л ю м б е р г, Там же, т. 5, 1936.
41. Я. Б. Блюмберг, Труды Комиссии по комплексному изучению Кас-
пийского моря, т. 11, 1940, стр. 83. — 42. А. В. Николаев, ИСФХА АН СССР,
18, 259 (1949). — 43. Г. С. Седельников, Д. В. Буйневич, сб. «Проблемы
комплексного использования минеральных богатств Кара-Богаз-Гола, Ашхабад,
1959, стр. 97. — 44. Д. В. Буйневич, И. Н. Л е п е ш к о в, Г. С. Седельни-
ков, В. Д. Поляков, В. К- Соловьев, П. А. Г р е к о.в, Л. А. Андреева,
Там же, стр. 40. — 45. Г. С. Седельников, Л. С. Ефименко, В. К- Со-
ловьев, Е. И. Азарова, Д. В. Буйневич, П. А. Греков, Изв. АН
ТуркмССР, № 3, 30 (1958). — 46. Г. С. Седельников, Хим. пром., № 7, 501
(1963).—47. Я. Б. Блюмберг, Там же, № 7, 4 (1947). — 48. Я. Б. Блюм-
берг, Там же, № 6, 342 (1954).—49. Б. Ч. Чарыев, Кара-Богаз-Гол. История
исследования и промышленного освоения, Ашхабад, 1950.—50. А. Д. П е л ь ш,
Труды ВНИИГ, в. 23, 1552, стр. 118.
51. В. М. Б у к ш т е й н, М. Ю. Гаркав и, Н. С. Гаркав и, Ж.ПХ, 25,
№ 8, 826 (1952). — 52. С. Ю. Геллер, Изв. АН СССР. Сер. географ., № 2
(1954). — 53. В. А. Вахрамеева, Труды ВНИИГ, в. 32, 1956, стр. 67; в. 35,
1959, стр. 7. — 54. А. И. Д з е н с - Л и т о в с к и й, М. Ю. Г а р к а в и, Г. А. Ва-
сильев, Л. В. Еловская, Там же, в. 35, 1959, стр. 16. — 55. В. М. Бук- |
Ш т е й и, ЖПХ, 14, № 23, 1587 (1937). — 55. А. И. Горбанев, Хим. пром.,
№ 9, 310 (1953). — 57. А. И. Дзенс-Литовский, Наука и жизнь, № 6,1
(1944). — 58. В. М. Букштейн, Труды ВНИИГ, в. 21, 1949, стр. 243. —Л
59. А. Д. П е л ь ш, Хим. наука и пром., 2, № 6, 734 (1957). — 60. В. М. Бук-J
штейн, сб. «Технология переработки природных солей и рассолов», Изд. «Хи-
мия», 1964, стр. 3. ’
61. К. А. Б а л л о д, ЖХП, №3, 17 (1939). — 62. Г. С. Клебанов,
Д. М. Корф, Л. В. Еловская, Труды Соляной лаборатории АН СССР, т. 12,
1937.—-63. Ф. Ф. Бадер, сб. «Исследования озер СССР», в. 6, 1934.—
64 Л. М. Гроховский, Сборник работ Мосгеолнеруд., в. 1, 1950, стр. 43,—
65. А. Ф. Горбов, ДАН СССР. 74, № 5, 975 (1950). — 66. С. 3. Макаров,
И. Г. Д р у ж и н и н, ИСФХА АН СССР, 9, 356 (1939). — 67. И. Г. Дружинин,
ДАН СССР. 31, № 1, 901 (1941). — 68. И. Г. Дружинин, сб. «Сульфат натрия
в СССР», Изд. АН СССР, 1946, стр. 103. — 69. А. Б. Здановский, Труды
ВНИИГ, в. 27, 1953, стр. 193. — 70. А. И. Дзенс-Литовский, Сульфатные
месторождения СССР, Изд. АН СССР, 1947.
71. Е. В. Посохов, Изв. АН КазССР. Сер. энергет.. в. 2 (1949).—
72. О. Д. Кашка ров, И. Д. Карпюк, Я. И. Т ы ч и н о, Труды ВНИИГ,
в. 23, 1952, стр. 131. — 73. М. Г. В а л я ш к о, А. А. Нечаева, Т. Б. П а л е-
н о в а, Там же, в. 24. 1952, стр. 106. — 74. А. Г. Б е р г м а н, сб. «Сульфат натрия
в СССР», Изд. АН СССР, 1946, стр. 40. — 75. С. М. М у к и м о в, Р. И. Кап-
ка е в а, А. Г. Бергман, Труды Ин-та химии АН УзбССР, т. 2, 1949, стр. 145.—
76. И. Н. Лепешков, сб. «Сульфат натрия в СССР», Изд. АН СССР, 1946,
стр. 76. — 77. Г. Г. Уразов, И. Н. Лепешков, Труды Ин-та химии АН
УзбССР, т. 2, 1949, стр. 89, —78. С. М. Кореневский, Труды ВНИИГ, в. 35,
1959, стр. 84. — 79. W. L. Weisman, R. С. Anderson, Min. Eng., 5, № 7,
711 (1953). — 80. А. И. Горбанев, В. Я. Николина, Сульфат натрия, Гос-
химиздат, 1954.
81. Я. Б. Блюмберг, Хим. пром., № 4, 209 (1954). — 82. A. R. Пельш,
сб. «Технология переработки природных солей и рассолов», Изд. «Химия», 1964,
стр. 291. — 83. Р. С. Р о с к и н а, Труды ВНИИГ, в. 27, 1953, стр. 205.—
84. Chem. Eng., 60, № 8, 242 (1953). — 85. А. Д. Пельш, Труды ВНИИГ, в. 24,
1952, стр. 99. — 86. А. Д. Пельш, Там же, стр. 86. — 87. Н. М. Абд ул га-
Ниев, сб. «Технология переработки природных солей и рассолов», Изд. «Химия»,
Литература
137
1964, стр. 254. — 88. Я. М. Хейфец, ЖПХ, 34, № 3, 473 (1961). — 89. С. 3. Ма-
каров, Л. С, И т к и в а, Промышленные методы обезвоживания мирабилита,
Изд. АН СССЙ, 1946. — 90. В. Я. Бернасовский, Вести. АН КазССР, № 12
(1953).
91. В. П. Ильинский, В. М. Филиппе о, ЖХП, 6, № 1, 3 (1929).—
92. В. И. 3 а п о р о ж ч е н к о, Там же, № 6, 560 (1935). — 93. О. Д. Кашка-
ров, Бюлл. ВИГ, № 3 (1939). — 94. Р. А. Мандель, Там же, № 3, 7 (1940).—
95. В. П. Ильинский, ЖПХ, 3, № 14 (20), 1135 (1926). — 96. С. 3. Мака-
ров, Материалы к физико-химическому изучению соляных озер Кулундинской
степи, Изд. АН СССР, 1935. — 97, С. 3. Макаров, Усп. хим., 5, № 7—8. 1031
(1936). — 98. Г. И. Белов, И. П. Калинин, ЖХП, Кв 6, 21 (1940).—
99. К. Н. Шабалин, IQ. П. Каретников, ЖПХ, 24, № 1, 11 (1951).—
100. Н. А. У ш а т и н с к и й, С. И. Голуб, В. М. Б у к ш т е й н, Хим. пром., № 6,
324 (1956).
101. Л. Н. Матусевич, В. В. У х л о в, ЖПХ, 40, № 9, 1935 (1967).—
102. К. Ф. Павлов. В. А. К о п ы л е в, ЖХП, № 6, 29 (1938). — 103. К. A. Ko-
be, С. W. Hauge, Power, № 8 (1933). — 104. Е. W. Douglas, С. О. А п d е г-
s о’п, Chem. Met. Eng., № 5, 135 (1941). — 105. L. Lesniewicz, Chem. stosow.,
2, № 3, 291 (1958). — 106. В. И. Николаев, А. К. Сен ют а, ДАН СССР, 16,
№ 4, 219 (1937). — 107. А. Л.. П е р е п е л и ц а, Новые способы комплексного энер-
гохимического использования углей, переработки мирабилита и получения соды,
Иркутск, 1947, стр. 91. —108. Pierce, Chem. Met. Eng., № 12, 718 (1937).—
109. P. А. Мандель, Бюлл. ВИГ, № 6—7, 1939, стр. 36. —110. A. A. Hol-
land, Chem. Eng., 58, № 1, 106 (1951).
111. Ю. Я. Каганович, Хим. пром., № 7, 404 (1955). —112. В. Ф. Чер-
нов, Производство кальцинированной соды, Госхимиздат, 1956.—ИЗ. С. М. Бре-
хов с к и й, Стекло и керамика, № 8, 17 (1949). — 114. Ю. Я- Каганович,
Хим. наука и пром., 2, № 6, 764 (1957). — 115. Ю. Я. Каганович, А. Г. Зло-
бин с к и й, Хим. пром., № 5, 389 (1960). — 115. Ю. Я. К а г а н о в и ч, А. Г. Зло-
бин с к и й, сб. «Техника сушки во взвешенном слое», в. 2, изд. ЦИНТИХим-
нефтемаш, 1966, стр. 44. — 117. О. Д. К а ш к а р о в, Труды ВНИИГ, в. 50, 1967,
стр. 102. —118. В. Е. Грум-Гржимайло, ЖХП, № 2, 13 (1925).—
119. A. Zieren, J. Rupp, пат. ФРГ 929366, 1955. — 120. Баба, Иноуэ, япон.
пат. 70, 1955.
121. А. И. Горбанев, Б. Ю. Миг ул ин, Труды ВИСП, т. 6, 1952,
стр. 56. — 122. В. И. Николаев, Т. И. Арнольд, ЖПХ, 15, № 3, 83
(19.42). —-123. А. Н. Вишневский, А. Ф. Борячек, Труды ВИСП, т. 6, 1952,
стр. 44. — 124. К. Oda, япон. пат. 1979, 1954. — 125. А. А. Я к о в к и н, Изв. Рос.
ин-та прикл. хим., 1, № 2, 7 (1923).— 126. А. А. Яковкин, Там же, 1, № 3, 1
(1925). —127. А. А. Яковкин, Труды ГИПХ, в. 8, 1927, стр. 5. —128. А. П. Б е-
лопольский, П. И. Александров, ЖПХ, 4, № 5, 576 (1931); Труды
НИУИФ, т. 144, 1940, стр. 57.-129. А. Н. Вишневский, А- Ф. Борячек,
3. К. Зубахина, Труды ВИСП, т. 7, 1954, стр. 55. —130. R. Е. V е п е г,
A. R. Thompson, Ind. Eng. Chem., 42, № 3, 464 (1950).
131. К. К. Sapre, Chem. Age (India), 7, jNe 1, 55 (1956).—132. M. А. Ш т e p h,
Труды ВНИИГ, в. 31, 1956, стр. 99. —/33. И. Г. Дружинин, В. И. Нико-
лаев, И. С. Чел яд и н а, А. И. Лазарева, ЖПХ. 22, № 8, 787 (1949).—
134. В. И. Николаев, сб «Сульфат натрия в СССР», Изд. АН СССР, 1946,
стр. 139. — 135. В. П. Ильинский, Г. С. Клебанов, Труды ГИПХ, в. 13,
1929, стр. 45- — 136. Р. С. Р о с к и н а, Труды ВНИИГ, в. 31, 1956, стр. 34.—
137. В. .С. Егоров, сб. «Сульфат натрия в СССР», Изд. АН СССР, 1946,
стр. 161. — 138. W. Simon, G. A n d е 1 f i п g е г, пат. США 3190724 и 3190722,
1965. — 139. Правила и нормы техники безопасности и промышленной санитарии
в производстве содовых продуктов и природного сульфата натрия, Госхимиздат,
1959.
Глава V
ПРИРОДНЫЕ калийные соли
Важнейшими солями калия являются хлорид и сульфат и обра-
зуемые ими минералы.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Хлорид и другие галогениды калия кристаллизуются из водных
растворов по типу NaCl. Выше 0° (за исключением KF-2H2O)
кристаллизуются безводные соли. Существует кристаллогидрат
КС 1 • Н2О, плавящ шея при —5,30°; эвтектическая температура
КС1-Н2О + лед — 9,80°’.
Плотность кристаллов КС1 1,99 г1см?\ теплота плавления
6,41 ккал/моль; теплота сублимации (КС1Кр—КС1Г) 53,4 ккал/моль.
Температуры плавления и кипения галогенидов калия повышаются
в ряду I—>F:
Т. плавл., °C Т. кип., °C
KI....................... 682 1330
КВг...................... 728 1376
КС1 ..................... 768 1417
KF....................... 856 1505
Калий также образует полигалогениды, например КЬ-ЗНгО,
К1С14 И др.
Насыщенные водные растворы галогенидов калия содержат
следующие количества растворенного вещества (в вес. %):
0° 25° 100°
KI . . 56,2 59,8 67,35
КВг . . 34,92 40,7 51,20
КС1 . . 21,90 26,45 35,90
KF . . 30,70 48,90 ‘59,80
Диаграмма растворимости дена на рис. 38. в системе КС!- -NaCl—Н2О привв-
Применение
139
Сульфат калия K2SO4 образует четыре полиморфных модифи-
кации с температурами превращений 300, 350, 449 и 585°2; пла-
вится он при 1069°. Существует ряд кислых солей сульфата ка-
лия, температура плавления которых значительно ниже, чем у
средней соли; так, например, для КзН(ЗО4)2 она равна 350°3.
Растворимость сульфата калия в воде при 0° — 6,71%; 25° —
10,75% и 100°— 19,4%- Из водных растворов кристаллизуется без-
Рис. 38. Политермическая диаграмма растворимости в системе
КС1—NaCl—Н2О.
водная 1оль, а ниже 9,7° K2SO4-H2O; температура плавления эв-
тектики K2SO4>H2O + лед— 1,55°4.
Давление водяного пара над насыщенными растворами при
100° для КС1 — 567,8 мм рт. ст., для K2SO4— 723,8 мм рт. ст. О да-
влении пара над растворами системы К+, Na+, Mg2+|Cl , SO2
см.5’6. О давлении при высоких температурах см.7.
ПРИМЕНЕНИЕ
Калийные соли применяют главным образом в качестве мине-
ральных удобрений. Основным видом продукции калийной промы-
шленности является хлористый калий, около 95% которого ис-
пользуют в качестве минерального удобрения, а остальные 5% пе-
рерабатывают на едкое кали и другие соединения калия.
Из общего количества калийных удобрительных солей 8—10%'
вырабатывают в виде сульфата калия и двойной соли сульфатов
калия и магния (K2SO4>MgSO4), калимагнезии, используемых
140
Гл. V. Природные калийные соли
для удобрения почв под хлорофобные культуры (табак, цитрусо-
вые и др.), качество которых ухудшается под влиянием иона хлора.
Основными производителями калийных солей до последнего i
времени являлись СССР, США, ГДР, ФРГ и Франция. Начиная с
1965 г. быстро развивается калийная промышленность в Канаде
на базе Саскачеванского месторождения; предполагается, что уро-
вень производства в Канаде в ближайшее время превысит таковой
в США. Сравнительно небольшие количества калийных солей вы-
пускается в Испании, Израиле и Италии; ведется подготовка к ос-
воению калийных месторождений в Конго и Эфиопии. Общая вы-
работка калийных солей за последние десять лет возросла более
чем в 2 раза и составляет в настоящее время (в пересчете на КгО)
15 млн. т в год.
Соответственно росту производства увеличилось потребление
на единицу сельскохозяйственной площади, которое в ряде высоко-
развитых стран достигло оптимального для данного вида почв
уровня. Количество вносимых солей в пересчете на КгО в кг на
1 га сельскохозяйственной площади составляет: в США — 70,
Бельгии—120, Японии—103, ФРГ — 80. Однако во многих стра-
нах эта величина не превышает 1—1,5 кг.
В незначительном количестве в качестве удобрения используют
добываемые из недр сырые (т. е. не обогащенные) калийные соли,
содержащие около 20% КгО.
Качество хлористого калия, производимого в СССР, регламен-
тируется ГОСТ 4568—65; в зависимости от способа производства,
выпускается хлористый калий двух марок; К — получаемый кри-
сталлизацией из раствора и Ф — флотационным обогащением ка-
лийиых руд (табл. 15).
ТАБЛИЦА 15
Содержание хлористого калия по ГОСТ 4568—65
Хлористый калий (КС1): в пересчете на сухое ве- щество в %, не менее в пересчете на КгО в %, не менее Влага в %, не более .... Хлористый натрий (NaCl) в пе- ресчете на сухое вещество в %, не более Не растворимый в воде остаток в пересчете на сухое веще- ство в %, не более .... Марка К Марка Ф
сорт сорт
высший первый второй второй третий
99,0 0,3 0,9 0,1 98,3 1,0 1,4 0,15 95,0 60,0 1,0 4.5 Не 95,0 60,0 1,0 4,5 нормируе 92,0 58,1 1,0 7,0 тся
Применение
1141
Хлористый калий, поставляемый сельскому хозяйству, должен
быть не слеживающимся; в целях устранения слеживаемости, до-
пускается обработка его аминами или другими реагентами.
Наряду с выпуском мелкокристаллического хлористого калия
предусматривается также производство гранулированного или
крупнокристаллического продукта, получаемого кристаллизацией
из растворов и флотационным обогащением; для 3 и 2 сортов со-
держание класса 4—2 мм должно составлять не менее 80% и
класса 1—2 мм — не более 20%.
Сульфатнокалийные удобрения в СССР выпускаются в виде
сульфата калия, калимагнезии (двойной соли сульфатов калия и
магния с примесями хлоридов калия и натрия) и калийно-магние-
вого концентрата, получаемого флотационным обогащением каи-
нито-лангбейнитовой руды.
Калимагнезия в соответствии с техническими условиями содер-
жит в пересчете на сухое вещество: в 1 сорте КгО не менее 30%,
во 2 сорте 28%; MgO, соответственно, 10 и 8%; содержание иона
хлора не должно превышать 5% для 1 сорта, для 2 сорта — не
регламентируется. Содержание влаги для 1 и 2 сортов должно быть
не более 5%, в том числе гигроскопической — не более 2%. Ма-
териал должен проходить через сито с отверстиями 5 мм.
Калийно-магниевый концентрат выпускают также двух сортов:
Сорт 1 Сорт 2
КгО в пересчете на обезвоженное
вещество в %, не менее........... 19,0 17,5
MgO в пересчете на обезвоженное
вещество в %, не менее........... 9,0 8,0
Влага в %, не более................ 4,0 4,0
Остаток на сите с отверстиями 3 мм
в %, не более....................... 10 10
Сульфат калия, получаемый при переработке полиминеральных
руд по регламенту, разработанному ВНИИГом, выпускается 1 и
2 сортов. Содержание (в %, в пересчете на сухое вещество): КгО
для 1 сорта не менее 50, для 2 — 45; иона хлора не более 0,5 и 2,
соответственно. Влаги не более 0,5% для обоих сортов.
Хлористый калий, производимый в зарубежных странах, выпу-
скается с содержанием не менее 60—61% КгО в виде так назы-
ваемого, стандартного (мелкокристаллического с минимальным со-
держанием пылевидных фракций), крупнокристаллического, со
средним размером зерен (0,5—2,3 мм) и гранулированного—
(0,8—3,3 мм). По специальным заказам вырабатывают мелкий
хлористый калий (0,1—0,2 мм).
Хлористый, калий, производимый для технических целей, ис-
пользуют для получения едкого кали, хлората и перхлората калия,
применяемых в качестве отбеливающих препаратов и в производ-
стве взрывчатых веществ, бромида и иодида калия, используемых
142
Гл. V. Природные калийные соли
в фармацевтической и фотографической промышленности, карбо-
ната калия, применяемого для получения специальных стекол и
глазури, силиката калия (KsSisOs), используемого для пропитки
дерева, отбеливания тканей и других целей, цианида калия — ре-
агента для извлечения золота из руд, перекиси калия (КОг) и про-
чих перекисных соединений для регенерации воздуха, и других
калийных соединений. Кристаллы КС1 обладают очень высокой
прозрачностью для инфракрасных лучей, поэтому их применяют
в некоторых оптических приборах.
СЫРЬЕ
Содержание калия в земной коре составляет ~1,5%. Калий
входит в состав алюмосиликатов, слагающих многие породы, поле-
вых шпатов, гранитов, лейцитов, гнейсов, твердых ископаемых со-
левых отложений и рассолов морского и континентального проис-
хождения. Составные части почв, особенно глинистые вещества,
активно удерживают (путем сорбции) калий, что, в частности,
имеет очень важное значение для жизни растений. Благодаря та-
кой способности почв вымывание калия идет сравнительно мед-
ленно, в результате чего содержание его солей в природных водах,
как правило, во много раз ниже, чем солей натрия и магния.
В табл. 16 представлены основные, наиболее распространенные
калийные минералы.
ТАБЛИЦА 16
Состав и свойства наиболее распространенных калийных минералов
Минерал Состав Плотность, г1см$ Твер- дость
Сильвин КС1 . . 1,97-1,99 2
Карналлит КС1 • MgCl2 • 6Н2О 1,57
Арканит K2SO4 2,66
Каинит KCl-MgSO4-3H2O 2,070-2,19 2-3
Бромкарналлит КВг • MgBr2 6Н2О 2,176 2
Шенит K2SO4-MgSO4-6H2O 2,03-2,15 2,5
Леонит K2SO4 • MgSO4 • 4H-,0 2,25 3
Лангбейнит K2SO4-2MgSO4 2,83 3-4
Калушнт K2SO4 • CaSCh • H2O 2,58-2,60 2,5
Калиборит K2o • 4MgO •11B2O3• 18H2O 2,13 4-5
Глазерит • 3K2SO4 • N82^04 2,70 3
Полигалит K2SO4 • MgSO4 • 2CaSO4 2H2O 2,72-2,78 2,5-3
Нефелин (K, Na)2O • A12O3 • 2SiO2 2,60 5-в
Алунит (K, Na)2SO4 • Al2(SO4)3 • 4A1(OH)3 2,60-2,80 3,5-4
Лейцит K2O • A12O3 • 4SiO2 2,45-2,50 5-6
Глауконит [(K,Na)2O +(Mg, Ca, Fe)O].(Fe, A1)2O3.4S1O2.2H2O 2,2-2,8 2-3
Калийные руды определяют по преобладающему содержанию
в них тех или иных минералов. Сильвинитом называют породу,
состоящую из сильвина (10—60%) и галита (25—70%) с приме-
Сырье
143
сями ангидрита, карбоната магния и глинистых веществ. Встре-
чаются сильвиниты с прожилками карналлита или смесь сильви-
нитов с карналлитами.
Крупнейшее в мире Верхнекамское месторождение калийных
солей представлено сильвинитовыми и карналлитовыми рудами;
происхождение его связано с испарением бассейнов Пермского
моря. Примерная схема геологического разреза месторождения
района Соликамска показана на рис. 39 (по А. А. Иванову). Под
покровными породами наносного слоя (известняки, глины и анги-
дрит) находится слой покровной каменной соли, ниже его лежит
Рис. 39. Примерный геологический разрез Верхнекамского месторождения
калийных солей:
/ —наносный слой; 2 —известняки; 3 — сильвнннтовая порода; 4 — ангидрит; 5 —каменная соль;
6 —глины; 7 — карналлитовая порода.
карналлитовая зона, мощность которой достигает в ряде участков
100 м. В ней пласты желтой карналлитовой породы, содержащей
50—85% карналлита, прослаиваются каменной солью. В верхней
и нижней части карналлитовой зоны местами залегает сильвинито-
вая порода. Под карналлитовой зоной лежит основная сильвини-
товая зона, средняя мощность которой достигает 30 м. Верхний
горизонт этой зоны состоит из пестрого сильвинита — смеси кри-
сталлов молочно-белого сильвина с серыми, голубыми и синими
кристаллами галита. Под пестрым сильвинитом залегает горизонт
красного сильвинита — смеси сургучно-красного сильвина с голу-
бой каменной солью. Содержание КС1 изменяется в зоне пестрых
сильвинитов от 40 до 55%, в зоне красных сильвинитов от 10 до
35%. Под сильвинитовой зоной залегает мощный пласт каменной
соли. Верхняя поверхность соляной толщи располагается ниже
земной поверхности на глубинах от 100 до 350 м. Соляная залежь
имеет форму большой линзы, вытянутой в меридианальном напра-
влении. Добыча калийных руд Верхнекамского месторождения
производится из пласта пестрых сильвинитов. Содержание КС1 в
добываемом сильвините изменяется в среднем от 23 до 30%, NaCl
144
Гл. V. Природные калийные соли
от 65 до 75%, нерастворимых глинистых веществ — 0,5—3%; со-
держание брома, находящегося в рудах в виде бромкарналлита,
составляет от 0,06 до 0,17% 8.
Одной из отличительных особенностей Верхнекамского место- ;
рождения является сравнительно большое содержание газов в
виде микровключений и «свободных» газов — в порах и пустотах
породы 9’10. В состав газов входят водород, метан, азот и двуокись
углерода; горючие газы (Н2 и СН4) встречаются главным образом
в карналлитовых рудах.
В последние годы начата эксплуатация крупного месторожде-
ния калийных руд в Белоруссии — Старобинского (верхне-девон-
ские отложения). Месторождение представлено сильвинитами с не-
большими примесями карналлита, содержание глинистых веществ
составляет от 4—5 до 10—12%.
Предкарпатские месторождения калийных солей (эпоха мио-
цена) представлены рядом калиеносных линз, сложенных сульфат-
нокалийными минералами. Калийные породы переслаиваются гли-
нистой или чистой каменной солью. Наибольшее промышленное
значение имеют Калуш-Голынское и Стебниковское месторожде-
ния, представленные сульфатно-хлоридными минералами; руды
сложены из каинитовой породы (галит 20—40%, каинит 35—60%,
полигалит 3—7%, глинистый материал 6—15%) и лангбейнит-каи-
нитовой породы (галит — 30%, каинит 20—30%, лангбейнит 10—
20%, сильвин 5—10%, кизерит 5—10%, глинистые материалы —
до 20%) Ч-13.
Кроме перечисленных, месторождения водорастворимых калий-
ных руд в СССР находятся в Средней Азии (Гаурдакское и Кар-
люкское), в Волго-Эмбинском районе и ряде других.
Месторождения калийных солей в ГДР и ФРГ содержат, на-
ряду с сильвином, галитом и карналлитом, значительные количе-
ства кизерита, ангидрита, а также примеси каинита, лангбейнита,
тахгидрита (СаС12 • MgCl2 • 12Н2О). Присутствие значительных ко-
личеств сульфатно-хлоридных минералов связано с условиями об-
разования месторождения, солеродным бассейном которого было
Цехштейновое море с относительно низкой степенью метаморфи-
зации рассола. Руды месторождения подразделяются на хартза.ть-
цевые и карналлитовые.
Примерный состав хартзальцевых пород (в %):
Кизеритовый Ангидритовый
хартзальц хартзальц
Сильвии......... 20—24 20—23
Галит........... 40—60 50 — 61
Кизерит ..... 17—28 0,5
Ангидрит .... 1,5 15—20
Одно из крупнейших в мире месторождений калийных солей
находится в Канаде (Саскачеван), его эксплуатация начата в
Сырье
145
60-х годах. Месторождение представлено сильвинитовыми и кар-
наллитовыми рудами, залегающими на значительной глуби-
не 14.
Впервые в мировой практике на этом месторождении, наряду
с шахтным способом, организована добыча калийных солей под-
земным выщелачиванием 15.
В США калийные месторождения сложены сильвинитовыми и
карналлитовыми рудами, в некоторых участках имеются пласты
лангбейнита (штат Нью-Мексико).
Калийные месторождения Франции и Испании представлены
сильвинитовыми и карналлитовыми рудами. В Италии перераба-
тываются руды, содержащие каинит, карналлит и сильвинит.
В воде океанов и морей содержится ~ 0,05 % калия. При
объеме воды мирового океана 1370- 106 км3 содержание в нем ка-
лия составляет примерно 7 • 1014 т КгО, что превышает известные
запасы месторождений калийных солей более чем в 10 миллионов
раз. Таким образом, мировой океан является, практически, неисчер-
паемым источником солей калия. Некоторые виды водорослей
(макроцистис и др.) активно извлекают калий из морской воды,
поэтому зола этих растений может служить источником калия.
С площади моря в 400 км2 можно ежегодно собирать такое коли-
чество водорослей, при переработке которых получается более
1 млн. т КгО 1в.
В последние годы значительно возросло производство калий-
ных солей из сгущенной рапы Мертвого моря 17-18. Калийные соли
получают при комплексной переработке рапы оз. Сирлз (США,
Калифорния)19. Это месторождение представлено, так называе-
мым, сухим озером — рапа пропитывает соляной пласт озера и
добывается из скважин. Пласт солей состоит из галита, глазерита
(ЗКгЗО4 • Na2SO4), троны (Na2CO3 • NaHCO3 • 2Н2О) и борных
минералов. Значительное количество калийсодержащих рассолов
находится в оз. Индер (СССР), которое также относится к типу
сухих озер20.
Источником для промышленного производства калия могут
служить полигалитовые руды, месторождения которых в СССР
находятся в Жилянском и Волго-Эмбннском районе. Промышлен-
ное извлечение солей калия из полигалитов пока не производится.
Установлено, что отмытая от NaCl полигалитовая порода — хо-
рошее минеральное удобрение.
Дополнительным источником калийных солей является пыль,
отделяемая в электрофильтрах цементных печей. В сырой шихте,
идущей на приготовление цемента, содержится 0,2—1% КгО, зна-
чительная часть которого возгоняется в процессе прокалки и вы-
деляется при понижении температуры в электрофильтрах. Содер-
жание К2О в водорастворимой форме в этом продукте составляет
20-30%.
146
Гл. V. Природные калийные соли
Переработку сильвинитовых, хартзальцевых и карналлитовых
руд на хлористый калий осуществляют:
1) Методом растворения и раздельной кристаллизации, осно-
ванной на различии температурных коэффициентов растворимости
солевых составляющих руды (этот метод называют еще тепловым
или галургическим).
2) Механическим обогащением породы, главным образом фло-
тацией; гравитационная сепарация при обогащении калийных руд
не нашла широкого распространения.
3) Комбинацией флотационного обогащения с растворением и
кристаллизацией мелких фракций руды; такого рода схемы начи-
нают широко применяться в последние годы в зарубежной прак-
тике.
4) Подземным выщелачиванием руды с последующей перера-
боткой рассола выпаркой и кристаллизацией; этот способ приме-
няется пока только в Канаде при переработке руды, залегающей
на большой глубине.
ПОЛУЧЕНИЕ ХЛОРИСТОГО КАЛИЯ МЕТОДАМИ РАСТВОРЕНИЯ
И РАЗДЕЛЬНОЙ КРИСТАЛЛИЗАЦИИ
Физико-химические основы переработки сильвинитовых руд
В основе получения КС1 методами растворения и кристаллиза-
ции лежат свойства системы КС1—NaCl—НгО (рис. 38). Из со-
поставления изотерм 25 и 100° (рис. 40) видно, что содержание
NaCl в эвтоническом растворе при понижении температуры уве-
личивается. Фигуративная точка системы, соответствующей соста-
ву эвтонического раствора Ei00 при 100°, при охлаждении оказы-
вается в поле кристаллизации КС1. Следовательно, при охлажде-
нии раствора, насыщенного NaCl и КС1, в осадок выпадает только
КС1. При добавлении к насыщенному раствору КС1 твердого NaCl
часть КС1 вытесняется из раствора в осадок.
При охлаждении эвтонического раствора £100 от 100 до 25°,
вследствие выделения в осадок КС1, состав раствора будет ме-
няться— его фигуративная точка переместится вдоль луча кри-
сталлизации Сп от £юо ДО п. Если после отделения осадка КС1
раствор п снова нагреть до 100°, то он окажется сильно ненасы-
щенным КС1 и лишь очень немного недонасыщенным NaCl. По-
этому если этим горячим раствором обработать сильвинит, то бу-
дет растворяться преимущественно КС1. (Впрочем, это зависит от
условий растворения; например, при противоточной обработке
сильвинита щелоком, когда раствор встречается с материалом,
уже почти не содержащим КС1, вначале будет растворяться боль-
ше NaCl, чем КС1, а затем будет растворяться только КС1 при
одновременном высаливании NaCl из раствора). После отделения
Получение КС1 методами растворения и кристаллизации
147
твердого остатка NaCl вновь будет получен горячий эвтонический
раствор fioo, из которого при охлаждении выделится КС1. С по-
мощью такого циклического процесса можно осуществлять разде-
ление сильвинита на КС1 и NaCl.
Для полного выделения КС1 из сильвинита необходимо, чтобы
количество его, вводимое в цикл, соответствовало количеству цир-
кулирующего щелока. Если принять округленно состав сильвинита
25% КС1 и 75% NaCl (точка S), то точки смесей его с маточным
раствором п расположатся на линии nS. Необходима такая смесь,
которая полностью разделялась бы на раствор Дюо и твердый
NaCl. Этому условию соответ-
ствует смесь состава К, лежа-
щего на пересечении линий
nS и Е\00В. Таким образом,
для полного растворения КС1
и получения при этом эвтони-
ческого раствора Еюо необхо-
димо обрабатывать сильвинит
таким количеством маточного
щелока состава п, чтобы от-
ношение количеств п : S рав-
нялось отношению отрезков
SK:Kn.
Принципиальная схема пе-
реработки сильвинитовых руд
состоит из следующих основ-
ных операций:
1) выщелачивание измель-
ченного сильвинита горячим
Рис. 40. Растворимость в системе
КС1—NaCl—Н2О при 25 и 100°.
маточным раствором, получен-
ным после кристаллизации КС1; при этом из сильвинита в рас-
твор переходит КС1, a NaCl почти полностью остается в отвале;
2) отделение горячего щелока от отвала и осветление его от
мелких увлеченных твердых частиц (ил и солевой шлам);
3) охлаждение щелока, сопровождающееся кристаллизацией
КС1;
4) отделение кристаллов КС1 от маточного раствора, сушка|
5) нагревание маточного раствора, возвращаемого на выще-
лачивание КС1 из новых порций сильвинита.
Эта принципиальная схема лежит в основе всех производств
хлористого калия из сильвинитовых руд по методу растворения и
кристаллизации. Некоторые различия в технологических схемах
и режимах процесса вызваны главным образом изменением со-
става сырья и применением аппаратов различных конструкций.
Практически получаемые составы твердых и жидких фаз после
выщелачивания и кристаллизации несколько отличаются от
148
Г л. V. Природные калийные соли
характерных для рассмотренного выше хода процесса. Состав го-
рячего щелока после выщелачивания сильвинита отличается от
эвтонического — степень насыщения его хлористым калием, в за-
висимости от способа выщелачивания, составляет 90—96%; по-
этому при охлаждении щелока вначале кристаллизуется только
NaCl. После достижения температуры, соответствующей насыще-
нию, начинает кристаллизоваться КС1, а выделившийся ранее
NaCl при активном перемешивании мог бы вновь раствориться,
но он обычно прикрывается кристаллами КС1 и поэтому не рас-
творяется. Это является причиной загрязнения продукта хлори-
стым натрием. Так, при степени насыщения горячего щелока хло-
ристым калием на 96% его содержание в кристаллизующейся
соли составляет 99,3%, а из щелока, насыщенного только на
90,6%, получается соль, содержащая 94,3% КС121. Это показывает
важность достижения максимальной степени насыщения горячего
щелока хлористым калием, как и использования прямоточного вы-
щелачивания, когда в щелоке содержится меньше мелкокристал-
лической трудноотделяемой взвеси NaCl, образующейся в больших
количествах в результате высаливания NaCl хлористым калием
при противоточном выщелачивании.
В производственных условиях в процессе осветления горячего
щелока он несколько охлаждается и из него кристаллизуется не-
которое количество NaCl, удаляющееся вместе с солевым и гли-
нистым шламами, — происходит так называемое самоочищение го-
рячего щелока, повышается степень его насыщения хлористым
калием.
При вакуум-охлаждении щелока от 100 до 20° теоретически
может быть испарено 12% воды без загрязнения кристаллизую-,
щегося КС1 хлористым натрием. Практически выделяющийся в;
начале кристаллизации с испарением воды хлористый натрий
прикрывается затем слоем хлористого калия и не может перейти
обратно в раствор; поэтому маточный щелок остается недонасы-
щенным по NaCl, хотя последний и находится в твердой фазе. Для
предотвращения загрязнения хлористого калия хлористым нат-
рием к щелоку добавляют в начале кристаллизации (или перед
ней) воду — конденсат.
Если сильвинит загрязнен карналлитом, то вследствие цирку-’
ляцпи щелока в нем постепенно накапливается MgCl2. В этом слу-
чае щелок нужно обновлять, так как в присутствии MgCl2 раство-
римость КС1 уменьшается, а при концентрации MgCl2 больше
100 s/1000 г Н2О растворимость NaCl в насыщенных растворах
КС1 с понижением температуры уменьшается (а не увеличивается,
как в отсутствие MgCl2). Это приводит к загрязнению КС1, кри-
сталлизующегося при охлаждении горячего щелока, хлористым
натрием. По данным Я. М. Хейфеца, при содержании в сильвините
1,106% MgCl2 и при испарении в процессе охлаждения щелока
Получение КС1 методами растворения и кристаллизации 149
4% воды содержание КО в продукте равно 87% при концентра-
ции MgCl2 в маточном растворе 137 г/1000 г Н2О и 80% при
213 г/1000 г Н2О; извлечение КО из сырья в первом случае 90,3,
во втором 92%.
Растворение сильвина
При растворении сильвина в оборотных щелоках требуется
получить близкий к насыщению по КС1 щелок при минимальном
содержании калия в отвале22. Необходимо также обеспечить до-
статочно высокую интенсивность растворения. При прочих равных
условиях интенсивность растворения возрастает при увеличении
степени измельчения руды. С другой стороны, крайне нежелатель-
ным является присутствие фракции —0,2 мм, так как тонкодис-
персные частицы, содержащие сильвин, выносятся со щелоком из
растворителей в виде солевого шлама и уходят в отвал.
Кроме того, появление мелких частиц руды связано с раскры-
тием глинистых компонентов, обладающих весьма тонкой струк-
турой и известной способностью к набуханию, что резко ухудшает
условия осветления щелоков. Оптимальная степень измельчения
определяется составом и структурой породы. Для верхнекамских
сильвинитов в качестве оптимального принято дробление до круп-
ности частиц 5—0,25 мм; остаток на сите 5 мм не должен превы-
шать 5%.
Температурный режим растворения играет чрезвычайно важ-
ную роль, поскольку при повышении температуры увеличивается
концентрация насыщения КС1 и возрастает скорость растворения.
Так как растворение проводят в аппаратах под атмосферным дав-
лением, предельная температура горячих щелоков составляет
100—103°; этой температуре соответствует концентрация насыще-
ния, равная 270 г/л КС1 и 210 г/л NaCl. При понижении темпера-
туры горячего щелока на 5—10° содержание КС1 снижается до
245—250 г/л, что вызывает соответственное уменьшение выхода
калия из единицы объема циркулирующего щелока.
Степень насыщения щелока и количество нерастворенного КС1
в отвале зависят от принятого режима растворения, которое осу-
ществляют противотоком, прямотоком и по комбинированным схе-
мам. При оценке эффективности различных режимов растворения
необходимо учесть также происходящее при растворении высали-
вание хлористого натрия. Шламообразование отрицательно ска-
зывается на показателях процесса в целом, так как при этом воз-
растают нагрузка на аппаратуру для отстаивания и обработки
шламов и потери калия с отвалом.
В режиме противотока средняя разность концентрации рабо-
чего раствора и концентрации насыщения значительно выше, чем
при прямотоке, что обеспечивает повышение интенсивности раство-
рения. С другой стороны, при противотоке высаливание NaCl
150
Гл. V. Природные калийные соли
значительно увеличивается. В идеальных условиях растворения
верхнекамского сильвинита скорость растворения при прямотоке в
2 раза меньше, чем при противотоке, но количество высоленного
NaCl при этом возрастает в 1,5 раза. В промышленном аппарате,
учитывая несовершенство перемешивания, эффективность противо-
точного растворения несколько снижается, главным образом в ре-
зультате частичного экранирования сильвинита выделяющимися
кристаллами NaCl, но увеличение шламообразования в указан-
ном соотношении сохраняется 23.
В большинстве случаев в качестве оптимальной выбирают ком-
бинированную схему растворения, по которой в первом по ходу
руды растворителе движение щелока и породы происходит пря-
мотоком, а в последующих — противотоком. По такой схеме в пер-
вый растворитель подают щелок после выщелачивания во втором
растворителе, в который поступают нагретый маточный щелок и
слабые щелока после выщелачивания отвала в третьем раствори-
теле (при промывке водой); во втором растворителе происходит
дорастворение руды, передаваемой из первого растворителя. Ко-
личество солевого шлама, выделяющегося на 1 м3 осветленного
щелока при переработке верхнекамских сильвинитов, составляет
в среднем 250—260 кг и может быть снижено на 20% при подаче
части маточного щелока (~15% от общего количества) в первый
растворитель.
На большинстве современных калийных фабрик выщелачива-
ние сильвинитовых руд осуществляют в шнековых растворителях,
представляющих собой горизонтальную корытообразную мешалку
длиною до 22—24 м; перемешивание и транспортирование пульпы
осуществляется шнековой спиралью, вращающейся на горизон-
тальном валу. Расход тепла, вызванный эндотермическим эффек-
том растворения КС1, вводом холодного сильвинита и отдачей
тепла в окружающую среду стенками аппарата, компенсируют
подачей пара или перегревом под давлением растворяющего ще-
лока. В последнем случае, при вводе щелока в растворитель, про-
исходит выделение растворного пара за счет самоиспарения. Ввод
острого пара осуществляют через дюзы; в некоторых конструк-
циях шнековых растворителей внутри корпуса размещены нагре-
вательные элементы, обогреваемые глухим паром. Последний ва-
риант является менее удачным — трубчатки нагревательных эле-
ментов быстро выходят из строя в результате коррозии и эрозии,
кроме того, нагревательные элементы не обеспечивают быстрого
нагрева сырой соли, что снижает интенсивность растворения. Удель-
ная производительность шнековых растворителей 1,7—3 т/(м3-ч)
руды (в зависимости от ее состава).
При небольших масштабах производства применяют барабан-
ные растворители, в которых руда и щелок движутся параллель-
но24. Удельная производительность барабанных растворителей
Получение КС1 методами растворения и кристаллизации
151
ниже, чем шнековых примерно на 30—40%, расход электроэнергии
в несколько раз выше и составляет ~ 1 кет • ч на 1 г руды (вместо-
~0,25 кет ч на 1 т в шнековых). Недостатком барабанных рас-
творителей является также невозможность проведения противо-
точного растворения и вынос тонких фракций сильвина с щелоком.
Значительная интенсификация растворения калийных руд ожи-
дается при проведении процесса в условиях турбулентного по-
тока по трубам25. Этим способом осуществляют растворение от-
валов галита на калийных предприятиях ГДР. Время полного-
растворения галита составляет ~2 мин при скорости потока в
трубе ~ 1 м!сек.
Проведены исследования, показавшие возможность растворе-
ния галитового отвала и калийных солей в кипящем слое26.
Кристаллизация хлористого калия
На современных калийных предприятиях кристаллизацию про-
изводят в многоступенчатых вакуум-кристаллизационных установ-
ках с рекуперацией тепла растворного пара. На некоторых из них
сохранились устаревшие комбинированные схемы с охлаждением1
в вакуум-кристаллизаторах и башнях типа градирен. Охлаждение-
в башнях происходит при самоиспарении распыленного раствора;
выделившиеся кристаллы хлористого калия и маточный щелок
собирают внизу башни и направляют на отстойную станцию. Раз-
ность температур между наружным воздухом и охлажденным рас-
твором составляет летом 10—15°, а зимой 25—35°.
При охлаждении в башнях исключается возможность исполь-
зования тепла растворного пара; недостатком этого метода яв-
ляется также мелкокристаллическая структура получаемого про-
дукта, который вследствие этого сильно слеживается. При ком-
бинированном охлаждении в вакуум-кристаллизаторах и башнях
кристаллы из башен имеют линейные размеры в 1,5 раза меньшие,
чем в вакуум-кристаллизаторах. Средние размеры получаемых
кристаллов колеблются в пределах 0,11—0,16 мм 27.
Непрерывнодействующие многоступенчатые вакуум-кристалли-
зационные установки обеспечивают возможность рекуперации 40—
70% тепла, затраченного на нагрев щелоков при выщелачивании
руды. Рекуперация тепла осуществляется путем нагревания ма-
точных щелоков растворным паром в поверхностных конденсато-
рах или конденсаторах смешения. Скорость охлаждения и перепад
температур при ступенчатой кристаллизации значительно сни-
жаются, что способствует увеличению размеров кристаллов.
При укрупнении кристаллов, наряду с улучшением товарных
качеств хлористого калия, обеспечивается повышение производи-
тельности центрифуг и сушилок за счет снижения влажности
осадка.
162
Гл. V. Природные калийные соли
С увеличением числа ступеней охлаждения повышается сте-
пень использования тепла растворного пара, возрастает общая
площадь зеркала испарения и уменьшается перепад температур
в каждой ступени. С Другой стороны, многоступенчатые вакуум-
кристаллизационные установки имеют очень большие габариты,
удельный расход металла значителен, велик также объем произ-
водственных помещений. Увеличение числа ступеней свыше 14—
15 почти не дает дальнейшего повышения температуры нагревае-
мого щелока (рис. 41) 28. При нагревании в поверхностных конден-
саторах конечная температура щелока на 7—10° ниже, чем при
•нагревании в конденсаторах смешения, однако качество хлористого
калия в последнем случае несколько хуже.
Влияние числа ступеней на размеры кристаллов может быть
-определено по эмпирической формуле, предложенной Вязововым:
4сР = 0,1№-25
где d — средний размер кристаллов, мм;
N — число ступеней.
В вертикальных вакуум-кристаллизаторах обеспечивается ма-
лый унос брызг щелока с паро-воздушной смесью. Горизонталь-
ные вакуум-кристаллизаторы с мешалками дают более равномер-
ное и медленное охлаждение, что способствует укрупнению кри-
сталлов.
Присутствие в растворе взвешенных частиц шлама повышает
вероятность образования центров кристаллизации и поэтому вле-
чет за собой уменьшение размеров кристаллов. Диспергирующее
воздействие шламов может быть подавлено введением добавок, из
которых особенно активное влияние оказывают соли свинца, пер-
вичные алифатические амины, пектин, альгинат натрия и дру-
гие 29-31.
При эксплуатации 14-ступенчатых вакуум-кристаллизационных
установок, в которых перепад температуры в каждой ступени со-
ставляет в среднем 4—5° и скорость охлаждения около 2 град/мин,
получаются кристаллы, средний размер которых не превышает
0,200 мм при значительном содержании фракции 0,150 мм (80%).
Получение КС1 методами растворения и кристаллизации
155
Присутствие этой фракции повышает пыление продукта при скла-
дировании и внесении в почву. Для получения хорошо рассевае-
мого хлористого калия размер зерен 0,15 мм является предельным
и содержание этой фракции должно строго контролироваться.
Описаны вакуум-кристаллизационные установки с 24 ступе-
нями охлаждения, состоящие из 8 горизонтальных корпусов с
тремя ступенями в каждом корпусе. Первые 19 ступеней снаб-
Рис. 42. Кристаллизатор „Кри-
сталл" для регулируемой кри-
сталлизации.
Рис. 43. Кристаллиза-
тор ДТВ для регулируе-
мой кристаллизации.
Жены поверхностными конденсаторами, последние 5 ступеней ра-
ботают в общем цикле с конденсаторами смешения, орошаемыми
свежей водой. Увеличение числа ступеней до 24 дает некоторый
рост среднего размера кристаллов, однако содержание фракции
—0,15 мм составляет 15—30% 29.
Укрупнение кристаллов достигается при введении ретурной за-
травки в виде кристаллов средней фракции, отделенных от основ-
ной массы на классификаторах. Наиболее благоприятные резуль-
таты получены при введении затравки в количестве 40—70% от
выкристаллизовавшегося хлористого калия с дополнительной до-
бавкой алкиламина для подавления образования новых центров
кристаллизации29.
В последние годы на зарубежных калийных предприятиях все
шире используется так называемая регулируемая кристаллизация,
454 Г л. V. П риродные калийные соли
обеспечивающая получение крупнокристаллического продукта 32-35.
Известны два типа аппаратов для этой цели: кристаллизаторы со
взвешенным слоем типа «Кристалл-Осло» и кристаллизаторы с
циркулирующей суспензией типа «ДТВ» с мешалкой и- всасываю-
щей циркуляционной трубой. Схематическое изображение обоих
типов кристаллизаторов показано на рис. 42 и 43. В кристалли-
заторе со взвешенным слоем снятие пересыщения происходит при
контакте раствора с массой взвешенных в потоке кристаллов, при
этом кристаллизующаяся соль отлагается на поверхности частиц
слоя. Укрупненные кристаллы непрерывно отводятся из нижней
части аппарата. Свежие порции раствора смешиваются с цир-
кулирующим потоком и далее поступают в вакуум-испаритель,
где за счет самоиспарения образуется пересыщенный раствор,
который по центральной трубе направляется в нижнюю часть
.аппарата.
В кристаллизаторах типа «Кристалл» обеспечивается получе-
ние весьма крупных (до 2—3 мм) зерен хлористого калия, но
производительность их довольно низка, так как для образования
взвешенного слоя необходимо поддерживать сравнительно не-
большую (1,5—2 см/сек) линейную скорость раствора, что требует
установки для многотоннажных производств кристаллизаторов
весьма большого диаметра. В кристаллизаторах с циркулирующей
суспензией типа «ДТВ» производительность повышается в не-
сколько раз, но размер получаемых кристаллов меньше. В настоя-
щее время используются 4- и 8-ступенчатые установки с диамет-
ром аппаратов 5 м при производительности 600 тыс. т хлористого
калия в год3®.
Схема производства хлористого калия методом
растворения и кристаллизации
Примером современного производства хлористого калия яв-
ляется предприятие, перерабатывающее сильвинит верхнекамского
месторождения. Схема производства изображена на рис. 44.
Дробленный до крупности 0,25—5 мм сильвинит из солемель-
ницы подают в бункеры на склад сырых солей, откуда с помощью
лоткового качающегося питателя забирают на ленточный транс-
портер с автоматическими весами и направляют в шнековые рас-
творители длиной 21,5 м, диаметром 2,76 м; число оборотов
шнековой спирали 8 в минуту. Сильвинит последовательно транс-
портируется через два шнековых растворителя, причем первый ра-
ботает по принципу параллельного тока, а второй — противотока.
Передача сильвинита из первого во второй аппарат и удаление от-
вала из второго аппарата осуществляются наклонными элевато-
рами с дырчатыми ковшами, из которых щелок сливается обратно
в растворители. Для компенсации тепловых потерь в растворители
156
Гл. V. Природные калийные соли
вводится через дюзы острый пар (1,5—2 ат). Горячий маточный
щелок после вакуум-кристаллизации (растворяющий щелок), на-
гретый до 105—115°, поступает во второй растворитель, движется
противотоком руде и вытекает в виде «среднего» щелока с плот*
ностью 1,220—1,236 г/см?, который поступает в первый раствори-
тель, где движется в одном направлении с сильвинитом. Выте-
кающий из первого растворителя горячий (97—107°) концентри-
рованный щелок содержит 245—265 г/л КС1. Для окончательного
извлечения КС1 отвал из второго растворителя элеватором пере-
дают в третий, более короткий растворитель шнекового типа (дли-
ною Им), куда направляют промывные воды и фильтраты, полу-
ченные при обработке отвала и шлама на план-фильтре и при
противоточной промывке. Движение отвала и щелока в третьем
растворителе происходит также противотоком. Кроме дополни-
тельного извлечения КС1, в третьем растворителе обеспечивается
рекуперация тепла отвала, передающего частично свое тепло ще-
локу; этот щелок присоединяют к растворяющему щелоку, а отвал
элеватором передают на фильтрование. Отвал после промывки го-
рячей водой на элеваторе содержит ~15% маточного раствора.
Для уменьшения потерь хлористого калия его промывают горячей
водой на план-фильтре — фильтре непрерывного действия с гори-
зонтальной поверхностью фильтрации; в отвале после фильтрации
содержится 4,5—6% Н2О и около 2,5% КС1. Осадок сбрасывается
с план-фильтра на скребковый транспортер и удаляется из цеха.
Горячий щелок, вытекающий из первого растворителя, содер-
жит глинистый и солевой шламы. Отделение этих примесей осу-
ществляют в шестиконусном отстойнике — шпицкастене 22; в ка-
ждом конусе отстойника имеется мешалка (1 об/мин), предназна-
ченная для уплотнения шлама и облегчения его выгрузки.
Для увеличения скорости осветления раствора в него вводят
коагулянт, способствующий осаждению мелкодисперсных илистых
частиц. В последнее время крахмал заменяют более эффектив-
ными коагулянтами, главным образом полимерными вещества-
ми36’38. Получает широкое распространение полиакриламид, рас-
ход которого в 5—6 раз меньше крахмала (100—120 г на 1 т гли-
нистого ила), при значительно большей скорости осаждения. При
использовании подобного высокоэффективного коагулянта стано-
вится реальной переработка калийных руд, содержащих большие
количества (до 20%) не растворимых в воде веществ.’
При осветлении щелока в отстойнике 22 происходит некоторая
классификация шлама: в первых конусах оседает главным обра-
зом солевой шлам, который возвращают в первый растворитель
или подвергают фильтрации на барабанных вакуум-фильтрах, а в
последних — илистый шлам. Отношение жидкости и твердой фазы
(Ж: Т) в выгружаемом солевом шламе не должно превышать
0,8—1. Илистый шлам из последних конусов отстойника при Ж : Т,
Получение КС1 методами растворения и кристаллизации
157
равном 2—2,5, передают на противоточную промывку, состоящую
из батареи сгустителей Дорра.
Вытекающий из отстойника щелок, имеющий температуру 87—
98°, охлаждается до 17—27° в 14-ступенчатой вакуум-кристалли-
зационной установке. Вакуум создается за счет отсоса паро-воз-
душной смеси, образующейся при самоиспарении раствора, си-
стемой паровых эжекторов, установленных на конденсаторах.
Вакуум-кристаллизационная установка состоит из одного верти-
кального корпуса 28 (I ступень) и шести горизонтальных корпусов
29—34, имеющих 13 ступеней охлаждения (II—XIV). Горизон-
тальные корпуса имеют лопастные мешалки (16 об/мин).
Осветленный щелок из отстойника засасывается в первый кор-
пус вакуум-кристаллизационной установки и далее перетекает по
переточным трубам вместе с образующимися кристаллами КС1 из
одной ступени в другую. Из последней XIV ступени пульпа хло-
ристого калия самотеком по барометрической трубе сливается в
приемный бак. Растворный пар из первых девяти ступеней конден-
сируется в поверхностных конденсаторах, нагревая при этом ма-
точный щелок, направляемый на растворение сильвинита. Щелок
проходит последовательно конденсаторы от IX ступени до I, на-
греваясь от 17—27° до 65—75°.
Дальнейшее нагревание растворяющего щелока до 113—115°
осуществляют в трубчатых подогревателях, обогреваемых паром.
Растворный пар из последних пяти ступеней вакуум-кристалли-
зационной установки конденсируют в конденсаторах смешения,
орошаемых водой. Свежая вода подается в конденсатор XIV сту-
пени и затем самотеком перетекает из одного конденсатора в дру-
гой до конденсатора X ступени, из которого по барометрической
трубе сливается в приемный бак. Система отсоса паровыми эжек-
торами несконденсированной паро-воздушной смеси построена та-
ким образом, что паро-воздушная смесь перекачивается из по-
следней в предшествующую. Из вспомогательного конденсатора
паро-воздушную смесь отсасывают поршневыми вакуум-насосами
и через брызгоуловитель выбрасывают в атмосферу.
Конечное охлаждение щелока определяется давлением в XIV
ступени, которое, в свою очередь, зависит от температуры воды,
поступающей на конденсацию паров; поэтому режим работы ва-
куум-кристаллизационной установки в зимних и летних условиях
оказывается несколько отличным.
Для уменьшения кристаллизации хлористого натрия при охла-
ждении в процессе вакуум-испарения к раствору, поступающему
на кристаллизацию, присоединяют часть конденсата растворного
пара из. первых четырех поверхностных конденсаторов.
Из сборного бака пульпу хлористого калия перекачивают в
шестиконусный отстойник 48 такой же конструкции, как отстой-
ник 22 для осветления горячего щелока. Осветленный холодный
158
Гл. V. Природные' калийные соли
маточный щелок направляют на подогрев в поверхностных конден-
саторах 36, а сгущенную пульпу хлористого калия — в горизон-
тальную мешалку, откуда ее перекачивают шламовыми насосами
в расходные мешалки над автоматическими центрифугами полу-
непрерывного действия 54. Влажность осадка после центрифуги-
рования, в зависимости от величины кристаллов, изменяется от
5 до 8%.
Рис. 45. Схема установки для сушки хлористого калия в кипящем
слое:
/ — ленточный питатель; 2 — бункер; 3 — транспортер; 4 — бункер для сухой соли;
5 —печь КС: 6 — выгрузочная течка; 7 — шиек для выгрузки; 8 — батарейный
циклон; 9 — пеииый аппарат; /0— бак для раствора соды; 11 — дымосос; 12 — шнек;
13 — ленточные конвейеры; 14 — вентилятор.
Сырой хлористый калий по ленточному транспортеру направ-
ляют на сушку, которую производят в барабанных вращающихся
сушилках. Мелкий хлористый калий, увлекаемый дымовыми га-
зами, отделяют в циклонах и присоединяют к общему потоку го-
товой продукции, направляемой на склад. Величина удельного
влагосъема при сушке равна 35—45 кг/(м3'Ч), конечная влаж-
ность хлористого калия не выше 1%.
В последние годы в СССР и в США для сушки калийных со-
лей начали применять аппараты кипящего слоя 39'40. Новый спо-
соб позволил значительно повысить качество сушки благодаря
большей равномерности и степени высушивания, а также снизить
на 20—30% удельный расход топлива. Схема сушильной уста-
новки для сушки хлористого калия, производительностью 100—
120 т/ч, представлена на рис. 45.
Получение КС1 методами растворения и кристаллизации
159
При сушке хлористого калия в кипящем слое продукт может
быть получен в обеспыленном виде. Это достигается или возвра-
том циклонного продукта на смешение с влажной солью (такой
прием эффективен при начальной влажности не менее 8—10%),
или совмещением сушки с классификацией путем отдувки пыле-
видных фракций из слоя с последующей грануляцией пыли, от-
деляемой в циклонах.
На 1 т готового хлористого калия расходуют: около 5 т сильви-
нита (в расчете на содержание в нем 22% КС1), 0,5 мгкал * пара,
30 кет *ч электроэнергии, 14 м3 воды и топлива (условного) при
сушке в барабанных сушилках— 12 кг, при сушке в аппаратах ки-
пящего слоя — 8 кг. Количество отвала на 1 т продукции состав-
ляет 2,5—3 т, а мелкокристаллического солевого шлама с влаж-
ностью 15% ~0,5 т.
Величина потерь КС1 с галитовым отвалом зависит от крупно-
сти помола сырой руды и степени промывки отвала на план-
фильтре. Потери с отвалом заметно возрастают при увеличении
содержания фракции +5 мм в сырой руде, поэтому грануломет-
рическая характеристика последней строго контролируется.
Потери КС1 с осадком с барабанных фильтров зависят от ко-
личества выносимого солевого шлама и его состава. Для умень-
шения количества солевого шлама, образующегося в результате
высаливания мелкокристаллического NaCl при растворении, можно
часть нагретого маточного щелока направлять в первый раствори-
тель (стр. 156); должно быть обращено также внимание на умень-
шение содержания мелких фракций в сырой руде.
Сокращение потерь КС1 с глинистыми шламами обеспечивается
поддержанием заданной плотности выгружаемых сгущенных илов
с последующей противоточной промывкой. Прочие механические
потери составляют около 1,5—2%. В процессах растворения, сгу-
щения, фильтрации и промывки шламов в соответствии с требова-
ниями оптимального режима общая величина потерь составляет
8-10%.
В настоящее время разработано автоматическое регулирование
всех основных технологических операций схемы 41-43.
Переработка хартзальцевых руд
Переработка на хлористый калий хартзальцевых пород Стас-
фуртского месторождения также основана на растворении руды в
оборотном маточном растворе и кристаллизации из горячего насы-
щенного раствора хлористого калия 44-46.
Некоторые различия в технологическом режиме и аппаратур-
ном оформлении процесса связаны с особенностями солевого и
* 1 мгкал = 106 кал.
160
Гл. V. Природные калийные соли
минералогического состава сырья, содержащего наряду с сильви-
ном и галитом значительные количества кизерита, ангидрита,
карналлита.
Растворение хартзальца ведется таким образом, чтобы воз-
можно полнее растворить сильвин и вместе с тем предупредить
переход в раствор кизерита, для которого характерна незначи-
тельная скорость растворения при сравнительно большой раство-
римости в данной системе. Для растворения обычно применяют
два или три шнековых растворителя длиною не более 14—15 м,
через которые пропускают соль последовательно, а растворяющий
щелок распределяют параллельными потоками. Примерно 30—
40% направляют в первый растворитель. Все растворители рабо-
тают прямотоком. Накопление в оборотных маточных растворах
MgCl2, неизбежное из-за наличия карналлита в перерабатывае-
мом сырье, снижает растворяющую способность щелоков по отно-
шению к КС1 и увеличивает относительную растворимость NaCl
(стр. 149). Это обстоятельство вызывает необходимость сброса
части маточных растворов, в результате чего общая степень из-
влечения калия из хартзальцевой руды составляет не более SO-
82 %. По этой же причине при переработке хартзальца выпускают,
в основном, соль, содержащую 40—50% КеО; получение продукта,
содержащего 60% КгО, требует специальной промывки.
Растворы, поступающие на вакуум-кристаллизацию, в зависи-
мости от накопления хлористого и сернокислого магния в оборот-
ном щелоке почти всегда являются пересыщенными по отноше-
нию к лангбейниту или глазериту, а при понижении температу-
ры — и к шениту или леониту. Образование двойных солей при
кристаллизации является нежелательным, поэтому их выделение
минуют, проводя процесс в метастабильной области26.
Отвал, получаемый при переработке хартзальца, содержит зна-
чительное количество кизерита. При комплексном использовании
сырья из отвала получают целый ряд продуктов; MgSOf7H2O,
MgSO4, Na2SO4 • ЮН2О, Na2SO4, K2SO4-MgSO4 и K2SO4.
Слеживаемость хлористого калия
Хлористый калий, полученный методами растворения и кри-
сталлизации, слеживается, что вызывает значительные потери при
хранении, транспортировании и весьма затрудняет рассевание при
внесении в почву. Слеживаемость является результатом сцепления
отдельных частиц при кристаллизации КС1 из пленки насыщен-
ного раствора, обволакивающей кристаллы47. Образование пленки
связано с гигроскопичностью продукта, а также с недостаточной
степенью сушки.
Один из путей уменьшения слеживаемости — глубокая сушка
до содержания влаги не выше 0,1—0,2%. Последующее увлажне-
Получение КС1 методами растворения и кристаллизации 161
ние при хранении, неизбежное при повышении относительной
влажности воздуха, значительно снижает эффективность глубокой
сушки.
Размеры кристаллов хлористого калия определяют степень
слеживаемости. Установлено, Что нагрузка на раздавливание
спрессованных образцов, являющаяся косвенным показателем сле-
живаемости, составляет для частиц со средним размером 0,05 мм—
18,9 кгс/см2, 0,38 мм — 0,6 кгс/см2-, частицы размером 0,75 мм прак-
тически уже не слеживаются; (образцы прессовались под давле-
нием 1 кгс/см2 в течение 3 суток при подсушивании).
Для устранения слеживаемости хлористого калия вводят до-
бавку алифатических аминов в количестве 200 г на 1 т хлористого
калия. Наряду с этим, в последние годы все шире применяют гра-
нулирование хлористого калия на валковых грануляторах48’4®.
Получение хлористого калия из карналлита
В системе КС1—MgCh—НгО карналлит КС1 • MgCh • 6Н2О ста-
билен в интервале температур от —21 до +167,5° (рис. 46). Он
растворяется инконгруэнтно — при обработке ограниченным коли-
чеством воды в раствор переходит MgCh, а КС1 остается в твердой
фазе. При испарении раствора карналлита кристаллизуется сна-
чала КС1, а затем карналлит с растворением ранее выпавшего
КС1. Если до начала кристаллизации карналлита отделить выкри-
сталлизовавшийся КС1, а оставшийся раствор продолжать выпа-
ривать или охлаждать, то в обоих случаях будет кристаллизо-
ваться карналлит.
Природный карналлит загрязнен примесями сильвина и га-
лита. При переработке карналлита методами растворения и кри-
сталлизации щелоки насыщены хлористым натрием, который вы-
деляется вместе с КС1, загрязняя продукт. При кристаллизации
КС1 из горячего раствора, насыщенного КС1 и NaCl, он будет тем
чище, чем меньше в растворе хлористого магния.
Все существующие методы переработки карналлита основаны
на большей растворимости хлористого магния по сравнению с рас-
творимостью хлористого калия и делятся на способы полного и
Неполного растворения 48’50-52. Первые способы заключаются в
полном растворении карналлитовой руды горячим оборотным ще-
локом, в котором содержится значительное количество MgCl2 и
Мало КС1 (например, 280 г/л MgCh, 40 г/л КО и 40 г/л NaCl).
При охлаждении полученного раствора большая часть хлористого
калия кристаллизуется (с примесью NaCl). Маточный раствор вы-
паривают и охлаждают; при этом кристаллизуется карналлит
КС1 • MgCh • 6Н2О, называемый, в отличие от прирбдного, искус-
ственным. Его используют для получения магния, или для
б М. Е. Познн
162
Гл. V. Природные калийные соли
извлечения КО тем же путем, как и из природного карналлита.
В конечном щелоке содержится большое количество MgCl2.
Способы неполного растворения, при которых КС1 полностью
не растворяется, а остается частично в шламе, называют также
«шламовыми». Основными из них являются способы холодного
разложения, растворения «на конечный щелок» и «конечным ще-
локом».
Холодное разложение карналлита ведут обработкой его водой
или оборотным щелоком без нагревания, причем большая часть
Рис. 46. Растворимость в системе КС1—MgCl2—Н2О.
КС1 извлекается в виде тонкого шлама, взвешенного в жидкости.
После удаления галитового отвала шламовый хлористый калий
отделяют от щелока, из которого выпариванием и охлаждением
кристаллизуют искусственный карналлит, присоединяемый к при-
родному карналлиту, идущему на разложение. Остающийся рас-
твор хлористого магния, содержащий мало примесей, перераба-
тывают на твердый плавленый хлористый магний (см. гл. IX).
Растворение «на конечный щелок» или горячее шламовое раз-
ложение заключается в обработке карналлитовой руды маточным
щелоком при ~100°. При этом в раствор переходит весь MgCl2
и часть КС1 из карналлита, а остальная часть КС1 из разложен-
ного карналлита выделяется в виде шламового хлористого ка-
лия. После отделения галитового отвала (в котором остается и
находившийся в руде сильвин), а затем шламового хлористого ка-
Получение КС1 методами растворения и кристаллизации
163
лия, раствор охлаждают для кристаллизации возвращаемого в
цикл искусственного карналлита, а затем выпаривают для полу-
чения плавленого хлористого магния. Преимуществом этого спо-
соба является возможность получения без выпарки конечного ще-
лока, богатого хлористым магнием и бедного хлористым калием.
По способу растворения «конечным щелоком» шламовому раз-
ложению подвергают предварительно полученный из природного
карналлита искусственный карналлит, мало загрязненный галитом
и потому отделение шлама КС1 от NaCl не производят. Галитовый
отвал отделяют в первой стадии, после горячей обработки при-
родного карналлита оборотным маточным щелоком, перед кри-
сталлизацией искусственного карналлита.
Имеется много вариантов этих схем.
Способы холодного разложения отличаются тем, что в них
практически весь КС1 остается нерастворенным; в горячих же
способах КС1 полностью или частично растворяется.
Использование способов холодного разложения, как и горячих
способов неполного растворения карналлита, приводит к получе-
нию менее ценного продукта, загрязненного глинистыми и дру-
гими нерастворимыми примесями, содержащимися в сырье, однако
вполне пригодного как удобрение. Использование этих способов
оказывается целесообразным при наличии сравнительно чистого
карналлита.
Наиболее распространены способы полного растворения кар-
наллита, они дают возможность получать наиболее чистый про-
дукт, но требуют примерно в 1,5 раза большего расхода тепла,
чем способы холодного разложения и почти в 2 раза больше тепла,
чем способ растворения «на конечный щелок». Поэтому в тех слу-
чаях, когда состав природного сырья допускает возможность их
использования, способы неполного растворения карналлита яв-
ляются более экономичными.
Сложность выделения хлористого калия из карналлита значи-
тельно удорожает технологический процесс по сравнению с пере-
работкой сильвинита. Переработка карналлита на хлористый ка-
лий более экономична, если она производится с использованием
других компонентов, входящих в состав природного карналлита,
и в первую очередь хлористого магния с целью получения соеди-
нений магния, металлического магния, хлора, хлорпроизводных
и др.53
В СССР хлористый калий из карналлита не вырабатывают.
Карналлитовую руду перерабатывают способом неполного (шла-
мового) растворения на необходимый для получения металличе-
ского магния искусственный карналлит,- Отходом в производстве
магния электролизом карналлита является калийная соль, содер-
жащая 75—80% КС1; ее выпускают в качестве удобрения под
названием «электролит».
6*
164
Гл. V. Природные калийные соли
При переработке карналлита применяют такую же аппаратуру,
как и при переработке сильвинита. Растворение карналлита идет
с большой скоростью, поэтому его ведут и в вертикальных рас-
творителях; по-видимому, целесообразно вести его в трубах, сов-
мещая этот процесс с гидротранспортом.
Защита оборудования от коррозии и эрозии
Растворы и пульпы, перерабатываемые в производстве хло-
ристого калия из калийных руд, действуют разрушающе на ап-
паратуру. Значительный коррозийный и эрозийный износ имеет
место в трубопроводах, растворителях, отстойниках для горячих
щелоков, насосах, ковшах элеваторов и др. Для защиты аппара-
туры применяют различного рода покрытия. Растворители покры-
вают диабазовой обмазкой по сетке Рабица. Вакуум-корпусы гум-
мируют или футеруют, например антегмитовыми плитками. Пере-
точные желоба, лотки, кожухи для термоизоляции изготовляют из
пластмасс или защищают обмазками на основе асбовинила (ас-
бест с этинолевым лаком). Металлические трубопроводы защи-
щают фарфоровыми вкладышами на специальных цементах или
гуммируют.
ПОЛУЧЕНИЕ ХЛОРИСТОГО КАЛИЯ МЕХАНИЧЕСКИМ ОБОГАЩЕНИЕМ
КАЛИЙНЫХ РУД
Метод флотации
Этот метод переработки в настоящее время широко приме-
няется в СССР, США и Канаде. Он основан на флотационном или
флотагравитационном разделении водорастворимых минералов
руды в среде насыщенного солевого раствора, при этом, пенным
продуктом является, как правило, сильвин или другие калийные
минералы. Основные стадии производственного процесса вклю-.
чают следующие операции:
1) сухое и мокрое измельчение руды;
2) «оттирка» глинистых примесей от частиц руды в специаль-
ных мешалках;
3) выделение глинистых шламов путем механического обес-
шламливания в гидроциклонах и гидросепараторах;
4) обработка солевой пульпы специальными реагентами де-
прессорами с целью подавления вспенивания шламов и сорбции
флотореагентов на поверхности глинистых частиц (наиболее рас-
пространен прием обработки шламов, сочетающий механическое
обесшламливание основной массы глинистых частиц с последую-
щей обработкой пульпы реагентами депрессорами);
5) обработка солевой пульпы реагентами флотации, которые
подают в специальные мешалки и, частично, непосредственно во
Получение КС1 механическим обогащением калийных руд
165
флото-машины. В состав реагентов флотации входят: основной
компонент — собиратель, в качестве которого при флотации силь-
вина применяют водорастворимые соли алифатических аминов с
углеродной цепочкой С!6—С20, депрессоры и деактиваторы (крем-
невая кислота, полиакриламид и др.) и вспениватели (сосновое
масло, спирты и др.). Иногда дополнительно вводят реагенты для
поддержания оптимального значения pH среды и для других це-
лей;
6) основная флотация, которую осуществляют в машинах с
механическим или пневматическим перемешиванием;
7) перечистка концентрата, полученного при основной флота-
ции с целью повышения содержания в продукте хлористого
калия;
8) контрольная флотация хвостов основной флотации для сни-
жения потерь калия с отвалом;
9) обезвоживание концентрата перечисткой флотации на
фильтрах или центрифугах и сушка;
10) обезвоживание хвостов и подача их в отвал;
И) отработка глинистых шламов, выделенных в голове про-
цесса, путем их сгущения и противоточной промывки. Для ликви-
дации сброса жидких отходов необходимо обезвоживать шламы
на специальных фильтрах или центрифугах отстойного типа 54-55.
Используется схема флотационного обогащения сильвинитов
с предварительным выделением глинистых примесей с помощью
пенной флотации — основной и перечистной.
В качестве реагентов пенной флотации применяют смесь кар-
боновых кислот, полученных при окислении уайт-спирита, так на-
зываемого, ФР-2 56'57. После перечистной флотации требуется под-
вергать глинистые шламы сгущению и противоточной промывке,
однако трудности, связанные с процессом разрушения пены, обра-
зующейся при шламовой флотации, затрудняют проведение этих
операций, что приводит к значительным потерям хлористого ка-
лия с жидкой фазой. На некоторых зарубежных предприятиях пе-
реработку руды производят комбинированием флотогравитацион-
ного обогащения с пенной флотацией 58-59.
С целью повышения степени извлечения калия производят тер-
мообработку хвостов, содержащих некоторое количество силь-
вина. Для этого нагревают галитовую пульпу до 60—70°, твердый
хлористый калий растворяется, так как раствор при повышении
температуры становится ненасыщенным КС1. Затем производят
обезвоживание хвостов и сброс их в отвал, а маточный раствор
охлаждают с выделением хлористого калия. На современных ка-
лийных фабриках охлаждение и кристаллизацию хлористого калия
при термообработке производят в вакуум-кристаллизаторах с ре-
гулируемой кристаллизацией, обеспечивающей получение крупно-
кристаллического продукта 54-60.
Рис. 47. Схема обогащения сильвинита с получением крупнозернистого и стандартного хлористого
калия:
J—цикл подготовки руды к обогащению: II — цикл крупнозернистой флотации; /// — цикл мелкозернистой флотации.
Получение КС1 механическим обогащением калийных руд
167
Существенным достижением в технологии обогащения калий-
ных руд в последние годы является крупнозернистая флотация,
обеспечивающая получение части продукции, с размерами частиц
1—3 лл81-85. Возможность флотации материала такой крупности
определяется, в первую очередь, величиной отдельных зерен силь-
вина и галита в руде и степенью их взаимного прорастания.
Оптимальная крупность частиц сильвина при его выделении в
пенный продукт крупнозернистой флотации составляет 3,3 мм.
Для крупнозернистой флотации потребовалась разработка спе-
циальных флотомашин 66’67.
Применение крупнозернистой флотации позволило значительно
повысить качество продукции, так как хлористый калий, разме-
рами— 1—3 мм не слеживается, не пылит и хорошо рассевается
при внесении на почву; его агрохимическая эффективность значи-
тельно выше для ряда почв и культур, чем стандартного по-
рошкообразного хлористого калия. Наряду с этим удельная про-
изводительность основного оборудования — дробилок, сгустителей,
фильтров и сушилок возрастает при получении крупнозернистого
материала.
Эффективность крупнозернистой флотации в значительной сте-
пени определяется показателями операции дробления, так как
весьма важно максимально уменьшить переизмельчение руды на
стадиях сухого и мокрого помола.
Схема переработки с получением части продукции в крупно-
зернистом виде изображена на рис. 47. Солевую пульпу, предва-
рительно подвергнутую механическому обесшламливанию, разде-
ляют по классу 1 мм. Фракции +1 мм направляют на специаль-
ную реагентную обработку и дал'ее на крупнозернистую флотацию.
Пенный продукт крупнозернистой флотации подвергают перечи-
стке, а хвосты — контрольной флотации. Переработка фракции
руды—1 мм протекает по обычной схеме.
В СССР получение хлористого калия методом флотационного
обогащения осуществляется при переработке руд Верхнекамского
и Белорусского месторождений. Используются схемы с отделением
шламов способом пенной флотации, депрессией шламов и меха-
ническим обесшламливанием руды в гидроциклонах. Показатели
процесса в значительной степени определяются содержанием шла-
мов в руде — с повышением содержания глинистых примесей резко
возрастает расход реагентов и снижается степень извлечения
калия.
Комбинированные схемы флотационного обогащения
с растворением и кристаллизацией
Такие схемы успешно применяются на некоторых канадских
предприятиях. Установлено, что наиболее целесообразно их ис-
пользование для переработки руд с повышенным содержанием
168
Гл. V. Природные калийные соли
иловых примесей88. При переработке по комбинированным схемам i
на растворение направляют ту часть руды, в которой концентри- S
руется большая часть илов; как правило, это наиболее мелкиеJ
классы, выделяемые на стадии механического обесшламливания. <
Применение галургического способа переработки для этой части
руды обосновано резким ухудшением структуры шламовых осад-
ков в присутствии флотореагентов, а также повышенной вязко-
стью и значительным количеством оборотных щелоков во флота-
ционных способах переработки. По этим причинам при флотацион-
ных способах обогащения возрастает требуемое число отстойников,
ухудшаются показатели по противоточной отмывке шламов и,
соответственно, снижается степень извлечения хлористого калия;
кроме того, с ростом содержания шламов резко возрастает рас-
ход реагентов.
В комбинированных схемах, как правило, используют регули-
руемую кристаллизацию, поэтому на ряде предприятий к сырью,
направляемому на растворение, присоединяют пылевидный хло-
ристый калий, отделенный от основной массы продукции путем
рассева или воздушной классификации.
Другие способы обогащения
Наряду с флотацией и флотогравитационным разделением, обо-
гащение калийных руд осуществляют также гравитационными ме-
тодами на основе разницы в плотностях сильвина и галита. Для
повышения эффективности обогащения процесс необходимо прово-
дить в среде с высокой плотностью, для чего применяют суспензии
тонкоизмельченных магнетита, барита, пирита и других минералов.
На одном из французских предприятий методом гравитацион-
ного разделения обогащают сильвинитовые руды эльзасского ме-
сторождения, содержащие ~10% нерастворимых веществ69. Руду
измельчают до крупности —30 мм 4-3 мм и разделяют в статиче-
ском сепараторе в магнетитовой суспензии. Сепаратор представляет
собой ванну, на дне которой имеются конусообразные выводы для
промежуточного продукта и хвостов. При подаче и выводе потоков
стремятся исключить завихрения; высота сепаратора сравнительно
невелика, что сокращает время контакта глины с раствором, тем
самым уменьшая разбухание и расслоение глинистых частиц; кон-
центрат выделяют из слива. При переработке руды таким методом
получают концентрат, содержащий 65% КС1; извлечение калия со-
ставляет ~90%. Гравитационное разделение в статических сепара-
торах из-за небольшой разности в плотности минералов (КС1—1,98,
NaCl — 2,14 г/сж3) представляет значительные трудности. Кроме
того, при разделении таким путем возможно обогащать руду толь-
ко сравнительно крупного измельчения, поэтому содержание основ-
ного вещества в концентрате из-за неполного раскрытия зерен по-
лучается довольно низкое.
Получение КС1 механическим обогащением калийных руд
169
Разделение минералов на основе центробежного ускорения в
гидроциклонах дает возможность обогащения сильвинитовых руд
сравнительно мелкого дробления и при значительном эффекте раз-
деления70. Пульпу, приготовленную из измельченного сырого силь-
винита и тяжелой магнетитовой суспензии, пропускают через
гидроциклон, в котором более тяжелый галит отбрасывается к пе-
риферии и выгружается из нижней конической части, а сильвин
концентрируется ближе к центральной части и выводится через
верхний слив гидроциклона.
На первой фазе разделения получают концентрат и промежу-
точный продукт, который подвергают повторной сепарации с выда-
чей хвостов, содержащих минимальное количество сильвина. Верх-
ний продукт, образующийся при повторной сепарации, может быть
переработан флотационным методом или другими способами.
Концентрат и хвосты направляют на обезвоживание на гро-
хоты, где отделяется основная часть тяжелой суспензии, возвращае-
мой в цикл. Дренируемый на грохоте материал содержит некоторое
количество суспензоида, который отмывают в оборотном растворе,
насыщенном по отношению к солевым составляющим породы. По-
лученную разбавленную суспензию сгущают до требуемой плотно-
сти и возвращают в основной процесс. Часть суспензии требуется
выводить из цикла на регенерацию для удаления окисленных ча-
стиц магнетита, присутствие которых снижает плотность разделяю-
щей среды. Регенерацию осуществляют с помощью магнитного се-
паратора. В нем отделяют магнетит от накопившегося глинистого
шлама и окисленного суспензоида, потери которого компенсируют
добавкой свежих порций магнетита.
Все известные способы механического обогащения калийных руд
не требуют применения технологического пара (за исключением
сравнительно малого расхода на термообработку галитового от-
вала), поэтому при строительстве перерабатывающих фабрик иск-
лючается необходимость сооружения дорогостоящих ТЭЦ. По-
скольку все технологические операции протекают без нагрева,
резко снижается коррозия аппаратуры и улучшаются условия труда.
Хлористый калий, получаемый таким образом, меньше слеживается
и лучше рассевается, чем получаемый путем растворения и кри-
сталлизации.
С комбинированными методами обогащения, например флота-
цией и флотогравитацией или флотацией и гидросепарацией,
Удачно сочетается возможность переработки части руды при более
крупном дроблении, что позволяет снизить расход электроэнергии
на измельчение породы, а также удельный расход флотореагентов.
Обогащение сильвинитовых руд может быть осуществлено элек-
тростатическим разделением сильвина и галита. Сущность метода
заключается в разделении в электрическом поле частиц, поверх-
ность которых заряжается разноименными зарядами.
170
Гл. V. Природные калийные соли
Обогащение таким способом предложено осуществлять либо при
предварительном нагреве руды до 400° с последующим охлажде-
нием71’72, либо путем реагентной обработки руды при 100°. В ка-"
честве реагентов используют салициловую кислоту и аммиак 73’74.
Разделение сильвина и галита осуществляют в сепараторах при на-
пряжении порядка 100 000 в. Электростатическое обогащение может
быть использовано для отделения нерастворимых примесей; в этом
случае руду нагревают до 120—150° и направляют на сепарацию.
Этот способ испытан на сильвинитовых и лангбейнитовых рудах75.
ПОЛУЧЕНИЕ ХЛОРИСТОГО КАЛИЯ
ПРИ ПОДЗЕМНОМ ВЫЩЕЛАЧИВАНИИ КАЛИЙНЫХ РУД
Таким способом перерабатывают калийные руды пока только на
одном предприятии в Канаде 76’77; схема процесса показана на
рис. 48.
На склад готовой
продукции
12 13 14- 15
Рис. 48. Схема переработки рассолов, полученных при подземном выще-
лачивании калийной руды:
/ — выпарные аппараты (четырехкорпусная выпарка); 2 —сгуститель; 3 — аппараты
четырехступенчатой вакуум-кристаллизации; 4 — центрифуга; 5 — репульпатор; 6 — цен-
трифуга; 7 —барабанная сушилка; 3 —циклон; Р —гранулятор циклонной пыли; 10 — дро-
билка; 11 — грохота; 12 — гранулированный КС1; 13 — крупнозернистый КС1; /^-средне-
зернистый КС1; 15 — стандартный КС1.
При подземном выщелачивании через скважины получают рас-
сол хлористых натрия и калия, который направляют на выпарку
Получение хлористого калия из природных рассолов
171
в многокорпусную выпарную батарею. При выпарке кристалли-
зуется хлористый натрий: его отделяют от маточного раствора и
направляют в сброс. Горячий упаренный раствор, насыщенный хло-
ристыми натрием и калием, направляют на вакуум-кристаллиза-
цию. Для этой цели используют четырехступенчатую установку с
регулируемой кристаллизацией Маточный раствор после кристал-
лизации присоединяют к свежим порциям рассола и возвращают в
цикл выпарки. Кристаллы хлористого калия после сушки рассе-
вают с получением стандартного продукта и двух сортов крупно-
кристаллического хлористого калия крупностью —2,4 +0,8 мм и
—3,3 +1,1 мм. Циклонную пыль подвергают грануляции на меха-
нических валках.
Описан ряд других способов переработки рассолов, получаемых
при подземном выщелачивании руды; так, например, предлагается
аммонизировать растворы. Растворимость хлористого калия в при-
сутствии аммиака снижается, и из раствора кристаллизуется КС1;
хлористый калий отделяют в специальных отстойниках, и на цен-
трифуге сушат и выпускают в виде готовой продукции. Из маточ-
ного раствора отгоняют аммиак, возвращаемый в цикл, а раствор
через теплообменник направляют в сброс77.
ПОЛУЧЕНИЕ ХЛОРИСТОГО КАЛИЯ ИЗ ПРИРОДНЫХ РАССОЛОВ
Применяемые способы извлечения калия из рассолов представ-
ляют интерес в связи с разработкой схем комплексного использо-
вания галургического сырья, особенно сгущенной морской воды,
являющейся неисчерпаемым источником солей калия и других цен-
ных элементов.
При переработке рапы оз. Сирлз78 получают: соду, сульфат нат-
рия, хлористый калий, сульфат калия, жидкий бром, бромиды,
очищенную буру, борную кислоту, пироборат натрия, карбонат и
фосфат лития. Выделение солей основано на выпаривании, вакуум-
кристаллизации и кристаллизации из сильно пересыщенных раство-
ров. Выпаривание осуществляют в трехкорпусной выпарной бата-
рее при принудительной циркуляции и противоточном движении
раствора и греющего пара. При выпарке кристаллизуются: NaCl,
Na2CO3-H2O, Na2CO3 • 2Na2SO4 (беркеит) и в небольших количе-
ствах Li2NaPO4. При последующей вакуум-кристаллизации полу-
чают хлористый калий. Образующийся маточный раствор является
пересыщенным по отношению к буре, но самопроизвольного выде-
ления буры не происходит.
Рапа Мертвого моря в сравнении со сгущенной океанской во-
дой других водоемов отличается высоким содержанием хлористого
кальция. Солевой состав рапы (в %): СаС12—14,0, NaCl — 27,8,
MgCl2— 51,4, КС1 — 4,6 и MgBr2 — 2,2; сумма солей изменяется от
23 до 33%, причем в более глубоких слоях концентрация выше, чем
172
Гл. V. Природные калийные соли
у поверхности. Извлечение из рапы солей осуществляют 17>18 при
испарении в системе искусственных бассейнов. Для интенсификации
испарения подкрашивают рапу небольшим количеством красите-
лей, в результате чего интенсивность поглощения солнечных лучей
возрастает во много раз. Применяется так называемая динамиче-
ская бассейновая система, при которой испарение происходит при
медленном зигзагообразном течении потока рассола по ряду бас-
сейнов.
В первом, по ходу рапы, бассейне происходит кристаллизация
поваренной соли, во втором — кристаллизация смеси карналлита
и хлористого натрия, в третьем, в самые жаркие месяцы, из ма-
точных растворов после осадки карналлита, выделяются игольчатые
кристаллы бишофита (MgCl2 • 6Н2О). В маточном растворе после
садки бишофита содержится значительное количество хлористого
кальция. Сбор карналлита производят солесосами в период садки
как только высота слоя выпавших кристаллов достигнет примерно
10 см.
Карналлит подвергается холодному разложению; образую-
щуюся при этом смесь сильвина и галита разделяют флотационным
способом. В последние годы для переработки смеси галита и силь-
вина используют метод растворения и кристаллизации в аппаратах
с регулируемой кристаллизацией типа ДТВ 79.
В Бонневиле (США) хлористый калий получают из грунтовых
рассолов, пропитывающих рыхлые илы, подстилающие солончаки
района Большого Соленого озера. Для извлечения рассолов со-
здана широкая дренажная система на площади около 243 000 га,
глубина канав достигает 4—4,5 м. Собираемые в центральном кол-
лекторе рассолы перекачивают в ряд испарительных бассейнов;
кристаллизация смеси сильвина и галита происходит в главном
испарительном бассейне.
Маточные рассолы сбрасывают при приближении состава рапы
к насыщению по карналлиту. Сезон испарения продолжается около
100 дней. Солевой пласт, образовавшийся в главном испаритель-
ном бассейне, представляет собой искусственный сильвинит
(30—35% КС1 и 65—67% NaCl). Соль собирают бульдозерами и
грейдерами, грузят на мотовозы и направляют на перерабатываю-
щую фабрику для получения хлористого калия методом флота-
ции 80’81.
Разработана схема получения калийных солей из рапы оз. Ин-
дер. Рапу сгущают в бассейнах; вначале кристаллизуется галит,
при этом состав рапы приближается к насыщению калийными со-
лями. Сгущенный рассол перекачивают в сборные бассейны для
хранения. При зимнем охлаждении сгущенного рассола кристалли-
зуется сильвин с примесью галита (содержит больше 85% КС1).
Дополнительное извлечение калийных солей возможно при повтор-
ном летнем испарении и охлаждении зимой. Общее извлечение
Сульфат калия
173
КС! при этом достигает 76% от содержания его в исходной рапе.
Дальнейшее испарение следует осуществлять уже в заводских усло-
виях с получением при охлаждении карналлита.
Возможна комплексная переработка рассолов Кара-Богаз-Гола
с получением мирабилита, эпсомита, бишофита и калийных солей.
Выделение калийных солей в виде карналлита происходит при
выпарке и охлаждении обессульфаченных хлормагниевых рассо-
лов после садки эпсомита. Карналлит может быть переработан на
хлористый калий известными способами 80’82.
Выделение калия из рассолов может быть осуществлено мето-
дом прямого осаждения дипикриламином (гексанитродифенилами-
ном)83. Морскую воду обрабатывают раствором кальцийдипикрила-
мина, при этом в осадок выпадает нерастворимый калийдипикрила-
мин, который отделяют фильтрацией с промывкой. Из фильтрата
при подкислении выделяют непрореагировавший дипикриламин.
Промытый калийдипикриламин разлагают кислотой (серной, соля-
ной, уксусной) — образуются раствор соответствующей соли калия
и осадок дипикриламина, который возвращают в цикл 80.
СУЛЬФАТ КАЛИЯ
Известны следующие пути получения сульфата калия:
I) переработкой галургическими методами — растворением и
кристаллизацией полиминеральных сульфатнокалийных руд Пред-
карпатья;
2) конверсионным и ионитным способами на основе взаимодей-
ствия хлористого калия и различных сульфатных солей, например,
эпсомита, мирабилита, лангбейнита и др.;
3) комбинированием флотационного обогащения сульфатно-
калийных руд с переработкой концентрата галургическим спо-
собом;
4) при производстве соляной кислоты из серной кислоты или
сернистого газа и хлористого калия (см. гл. XI);
5) гидротермическим методом на основе взаимодействия суль-
фатных солей (например, гипса, сульфата натрия, эпсомита, алу-
нитов) с хлористым калием с получением побочной соляной кис-
лоты;
6) переработкой водонерастворимых калийных руд (полигали-
тов, лейцитов, глауконитов и др.);
Сульфатнокалийные удобрения с пониженным содержанием
КгО, получают при флотационном обогащении лангбейнитовых и
каинито-лангбейнитовых руд.
Галургическая переработка полиминеральных руд Предкарпатья
Сложность и пестрота минералогического состава и колебания
в содержании основных минералов в различных участках место-
рождения, а также значительные примеси глинистых веществ,
174
Гл. V. Природные калийные соли
весьма осложняют переработку этого вида сырья. Существование
метастабильных равновесий в пятикомпонентной системеК+, Na+,
Mg2+Hcr,SOt, Н2О еще более осложняет переработку 84’85. Одна
из схем получения сульфата калия из каинитовых руд88 заклю-
чается в растворении руды в оборотном щелоке при ~ 100—107°.
Получается раствор, насыщенный хлористым калием и лангбейни-
том; твердая фаза после выщелачивания содержит вторичный ланг-
бейнит, образовавшийся из каинита породы. Из горячего насыщен-
ного раствора при охлаждении кристаллизуются КС1 и NaCl.
Маточный раствор направляют на растворение вторичного лангбей-
нита (при 60—65°). При охлаждении полученного раствора кри-
сталлизуется шенит, который может быть переработан на сульфат,
калия. Отвал после первого растворения состоит из галита, кизе-
рита, полигалита с примесью лангбейнита. Галит растворяют в
холодной воде, а оставшиеся калийные соли перерабатывают на
калийное удобрение.
На Калушском химико-металлургическом комбинате осуществ-
лен вариант схемы переработки полиминеральных руд, разрабо-
танный ВНИИГом 87~89. Технологическая схема, предусматриваю-
щая комплексное использование сырья с получением калийных
удобрений, сульфата натрия, поваренной соли и бишофита, состоит
из четырех основных циклов:
а) производства сульфата калия;
б) производства сульфата натрия;
в) флотации нерастворенного остатка;
г) регенерации солей из избыточных щелоков.
По схеме ВНИИГ (рис. 49), породу, измельченную до —5 мм,
обрабатывают оборотным горячим щелоком при 65—70°. В про-
цессе выщелачивания в щелоке растворяются каинит, сильвин, ше-
нит и леонит и другие легкорастворимые минералы, в отвале
остаются галит, лангбейнит, полигалит и гипс. Горячий щелок
осветляют от нерастворимых примесей и направляют на вакуум-
кристаллизационную установку для выделения шенита.
Для кристаллизации чистого шенита без примеси NaCl к ще-
локу добавляют маточные растворы, получаемые при последующем
разложении шенита на сульфат калия. Кристаллизация шенита
заканчивается при 20°, полученную пульпу сгущают и подвергают
фильтрации; часть маточного раствора после кристаллизации ше-
нита возвращают в начало процесса на выщелачивание руды, дру-
гую часть подвергают выпарке для регенерации солей калия. Весь
шенит, или часть его, разлагают водой при 50°, при этом полу-
чаются сульфат калия и маточный раствор, присоединяемый к ще-
локу, направляемому на кристаллизацию шенита.
При высоком содержании лангбейнита в руде необходима пере-
работка отвала, так как основная часть лангбейнита при выщела-
s
о
о
оз
cu
(D
Q«
(D
c
176
Гл. V. Природные калийные соли
чивании оборотными маточными щелоками ие растворяется. Извле-
чение лангбейнита из отвала может быть осуществлено флотацией,
разделением в тяжелых суспензиях или отмывкой галита водой.
Последний способ наиболее прост, однако его применение связано
с необходимостью переработки больших количеств растворов хло-
ристого натрия.
Выделенный тем или иным методом лангбейнит содержит зна-
чительные примеси полигалита. Эту смесь после сушки можно вы-
пускать в качестве калийно-магниевого удобрения (16,0—18,0%
К2О). С целью получения концентрированных калийных удобрений
лангбейнитовый флотоконцентрат растворяют при 75—90°, щелок
охлаждают до 20° и отделяют кристаллизующийся при этом шенит
(K2SO4 • MgSO4 • 6Н2О). Разложением шенида водой при 50° полу-
чают сульфат калия (50% К2О).
Неразложенный обезвоженный шенит (K2SO4 • MgSO4) также
является высококачественным бесхлорным удобрением (28—30%
КгО). Щелок, оставшийся после отделения шенита из лангбейни-
тового щелока с высокой концентрацией сульфата магния, можно
использовать для получения сульфата натрия.
Технологическая схема переработки калийных руд предусмат-
ривает регенерацию солей, содержащихся в выводимых из про-
цесса избыточных маточных щелоках. С этой целью щелока под-
вергают выпарке последовательно в 3—4 стадии, выделяя после
первой стадии поваренную соль пищевых сортов, после второй и
третьей, смешанные калийные соли (каинит, карналлит), после
четвертой — бишофит (MgC12-6H2O) различной сортности.
Таким образом, по данной схеме получают удобрения в виде:
сульфата калия, калимагнезии I и II сорта.
Соотношение этих видов продукции определяется составом ис-
ходной руды. Для характеристики зависимости соотношения суль-
фата калия и калимагнезии в товарной продукции от состава
исходной руды предложен так называемый сильвинитовый коэффи-
циент р, равный отношению весового содержания сильвина к каи-
ниту в породе: при отсутствии в руде сильвина ((5 = 0) в результате
переработки может быть получен только шенит. При р = 0,15 (по-
рода содержит на 1 моль каинита 0,5 моль сильвина) 2/3 продук-
ции в расчете на КгО получают в виде сульфата калия и '/з в
форме шенита. При эквимолярном отношении сильвина и каинита
(Р = 0,30) продуктом является только сульфат калия.
Присутствие в породе лангбейнита позволяет проводить про-
цесс при значительно больших значениях р. Отношение весового
количества КС1 в сильвине и каините к общему содержанию MgSO4
во всех водорастворимых минералах породы обозначается коэффи-
циентом а. При а=1,24 переработка породы на сульфат калия
возможна при значении (5 = 0,6, т. е. в 2 раза большем, чем для
предельного случая в отсутствие лангбейнита.
Сульфат калия
177
Соотношение между сульфатом калия и калимагнезней в гото-
вой продукции определяется также объемом производства бишо-
фита и сульфата натрия. Если процесс ведется по варианту схемы
с максимально возможным выходом бишофита и сульфата нат-
рия,— калимагнезия в качестве готовой продукции не произво-
дится. При сокращении производства бишофита и сульфата нат-
рия, доля калимагнезии в готовой продукции возрастает.
Переработка руды с получением только бесхлорных калийных
удобрений осуществима при значении а=1,24. При а>1,24 содер-
жание MgSO4 недостаточно для превращения КС1 в K2SO4. Если
а>1,24, КС1 при вакуум-кристаллизации выделяют в виде товар-
ного продукта. Кристаллизация КС! происходит из растворов, ле-
жащих на стабильной диаграмме растворимости в поле глазерита,
однако выделение глазерита при вакуум-испарении не наблю-
дается— кристаллизация КС! происходит в метастабильной обла-
сти. Примесь сульфатов в кристаллах КС! незначительна, если
время кристаллизации не превышает 45 мин, а конечная темпера-
тура не ниже 30—28°90.
Содержание К2О в кристаллизующемся продукте, определяемое
примесью NaCl, зависит от количества воды в исходном щелоке.
Максимальное содержание КС1 (~52% К2О) получается при уве-
личении отношения ®= экв'Н2° до 14—15. При w > 15 содержа-
•^ЭКВ. K2 + M3
ние КС1 падает за счет увеличения примеси NaCl91. Расходные ко-
эффициенты на 1 ,т КгО при получении товарной продукции с со-
держанием 38% К2О составляют: руды 12 т, пара 5,5 т, электро-
энергии 220 квт-ч, топлива — 0,066 т.
Конверсионные способы получения сульфата калия
Рассмотрим конверсионный способ получения сульфата калия
иа примере взаимодействия хлористого калия с эпсомитом:
2КС1 + MgSO4 ^=± MgCl2 + K2SO4
Процесс ведут в две стадии с образованием на первом этапе
шенита92. Для получения максимального выхода шенита точка С\
(рис. 50) состава исходной смеси должна лежать на луче кристал-
лизации ШР, идущем из полюса шенита Ш в точку Р, положение
которой соответствует составу маточного раствора, насыщенного
шенитом, КС1 и каинитом. Раствор Р — шенитовый щелок сбрасы-
вают, а шенит обрабатывают хлоридом калия в водной среде с об-
разованием сульфата калия и маточного раствора А, насыщенного
хлоридом калия, сульфатом калия и шенитом. Этот раствор пол-
ностью используют в первой стадии конверсии и цикл, таким об-
разом, замыкается. Для получения высококачественного сульфата
178
Гл. V. Природные калийные соли
калия (~52% КгО) целесообразно использовать хлорид калия с
высоким содержанием основного вещества 93.
Разработан ряд вариантов рассмотренной схемы. Для повыше-
ния степени использования калия проводят выпарку и охлаждение
шенитовых щелоков с выделением калийных солей в виде хлорида
калия и леонита, возвращаемых в цикл. Выпарка и охлаждение
Рис. 50. Растворимость в водной системе 2K.Cl+MgSO4 7—
K2SO4 + MgCl2 при 25°.
маточных растворов с выделением возвратных солей могут быть
проведены также при одностадийной конверсии с прямым получе-
нием сульфата калия. При выпуске части шенита без разложения,
степень использования калия повышается, так, например, при по-
лучении всей продукции в виде сульфата калия она составляет
70%, а при выпуске только товарного шенита — 87%. Повышение
степени использования калия до 87% с выработкой только суль-
фата калия возможно при выпарке шенитового щелока; расход
пара при этом составляет 0,45 т на 1 т КзО.
Процесс конверсии мирабилита (или безводного сульфата) с
хлористым калием аналогичен рассмотренному выше. Конверсию
осуществляют в две стадии с образованием промежуточного соеди-
нения—глазерита. Глазерит полностью или частично разлагают
на сульфат калия. Маточные растворы после выделения глазерита
Сульфат калия
179
могут быть переработаны на поваренную соль, при этом выделяются
возвратные калийные соли (смесь глазерита и хлористого калия),
которые используют в основном цикле переработки94> 95.
Промышленное получение сульфата калия на основе хлористого
калия и эпсомита осуществляется на калийных предприятиях ГДР
при комплексной переработке хартзальцевых руд45. Отвал после
переработки руд на хлористый калий, содержащий галит, кизерит
и ангидрит, подвергают быстрой промывке водой, при этом галит,
скорость растворения которого значительно выше, чем у кизерита,
практически полностью растворяется. Затем растворяют кизерит
при 75°. При охлаждении раствора кристаллизуется эпсомит, ко-
торый конвертируют с КС1 в K2SO4 в две стадии, через шенит.
Часть шенита смешивают с ангидритом, сушат и выпускают в ка-
честве товарной продукции под названием «реформкалий»; содер-
жание К2О в этом продукте составляет 26—30%. В товарном суль-
фате калия содержится после сушки 48% КгО.
Конверсионные методы получения сульфата калия в США осно-
ваны на переработке хлористого калия с лангбейнитом или беркеи-
том79.
В последние годы в Канаде организовано производство суль-
фата калия на базе природного сульфата натрия и хлористого
калия79. При конверсии на сульфат калия астраханитовых солей
процесс можно вести через промежуточные соединения — шенит и
глазерит или их смеси.
Сульфат калия может быть получен также из стехиометриче-
ской смеси хлористого калия и сульфата аммония. Образующийся
при этом хлористый аммоний возгоняется в токе инертного газа
или водяного пара96.
Сульфат калия может быть получен ионообменным способом,
например, при пропускании горячего (90°) раствора MgSO4 через
К-катионит:
2RK + MgSO4 х - > R2Mg+K2SO4
При охлаждении раствора до 10° из него кристаллизуется K2SO4.
Регенерацию катионита можно осуществить, обрабатывая его рас-
твором хлористого калия:
R2Mg + 2КС1 2RK + MgCl2
Суммарное уравнение процесса:
2KCl + MgSO4 K2SO4 + MgCl2
Получение сульфатнокалийных удобрений при флотационном
обогащении и в комбинации с галургическими способами
переработки
Флотационное обогащение сульфатнокалийных руд осуществ-
ляют на базе переработки каинито-лангбейнитовой породы Стеб-
никовского месторождения. Руду, измельченную до —0,5 мм,
180
Гл. V. Природные калийные соли
подвергают флотации в присутствии коллектора — жирных кислот
(С7—С9) и депрессора — смеси кремневой кислоты и полиакрил-
амида; оптимальное значение pH среды, равное ~7, регулируют
добавкой щелочи. Пенный продукт сгущают, фильтруют и сушат в
аппаратах кипящего слоя. Хвосты флотации разделяют в гидро-
циклонах— слив направляют на противоточную промывку, а пе-
сковую часть, после фильтрации, сбрасывают в отвал97. Серьезные
трудности при осуществлении этого процесса связаны с высоким
содержанием илов в руде, в среднем 14—18%.
В ГДР разработан способ флотационного обогащения харт-
зальцевых руд. Породу измельчают до —0,4 мм; в процессе дроб-
ления отделяют более крупные фракции, в которых содержание
К2О составляет ~ 13%, эта часть руды выпускается в виде товар-
ного продукта под названием «каинит». Измельченная руда флоти-
руется в две стадии — на первой стадии в пенный продукт перехо-
дит преимущественно сильвин, на второй — кизерит. После сгуще-
ния и фильтрации, эти продукты смешивают и сушат с получением
двух видов товарной продукции: «Катех» К2О—38'—42%, MgSCU—
10% и «Emgekali» —К2О —33—37%, MgSO4— 14% 98.
Комбинированная схема осуществлена в последние годы в Си-
цилии на базе переработки каинитовых руд, содержащих кроме
каинита — карналлит, сильвин и галит. Руду измельчают до —0,6 мм
с предварительной воздушной классификацией и направляют на
отделение глинисто-солевого шлама в гидроциклонах. Слив гид-
роциклонов сгущают в отстойниках и подвергают противоточной
промывке с целью извлечения калия. Флотация проводится в при-
сутствии алифатических аминов со средним числом атомов С, рав-
ным 12, при расходе 120 г на 1т руды; пенным продуктом яв-
ляется каинит. Состав щелока регулируют таким образом, чтобы
практически исключить возможность конверсии каинита в шенит
в цикле флотации. Отфильтрованный концентрат присоединяют
к части исходной руды с повышенным содержанием КзО и направ-
ляют на переработку на сульфат калия. Сульфат калия получают
в две стадии: на первой — происходит превращение каинита в ше-
нит, на второй — разложение шенита водой на сульфат калия; ще-
лок после этой стадии используется на первой стадии конверсии
(при превращении каинита в шенит)99.
Гидротермический метод переработки калийных руд
Метод гидротермической переработки основан на реакциях:
MgSO4 + 2KCl(NaCl) + Н2О = MgO + K2SO4(Na2SO4) + 2НС1
CaSO4 (в виде гипса) 4- 2KCl(NaCl) + mSiO2 + Н2О =
= CaO • mSiO2 + K2SO4(Na2SO4) + 2HC1
Исследование условий гидротермической переработки калий-
ных солей Предкарпатья показало, что при нагревании до 800° от-
Сульфат калия
18Г
дельных минералов, входящих в состав породы, и их смесей, про-
исходит, главным образом, дегидратация. В присутствии кисло-
рода воздуха и, особенно, водяного пара, конверсия солей уско-
ряется, особенно в том случае, когда нагреву подвергается смесь
хлоридов и сульфатов щелочных металлов; степень конверсии при
этом в 2,5—4 раза больше, чем в отсутствие водяного пара.
Это объясняется тем, что при взаимодействии с кислородом
MgCl2 разлагается с выделением хлора и образованием MgO, а в-
результате гидролиза водяным паром MgCl2 также превращается
в MgO с выделением хлористого водорода. При нагревании каинитр
или смеси хлорида калия и сульфата магния реакция идет тем ин-
тенсивнее, чем больше пропускается водяного пара. В отходящем
газе содержится хлористый водород, а в остатке окись магния и
сульфат калия. Введение в реакционную смесь добавок—SiO2
(трепела), MgO и других в количестве 20—25% облегчает про-
цесс— в этих условиях реакционная масса остается рыхлой, рас-
сыпчатой, что позволяет поднимать ее температуру до 800—900°
без превращения в жидкий плав. Это ускоряет реакцию с газовой
фазой (паром) и облегчает транспорт шихты. При 800—900° сте-
пень превращения КС1 в K2SO4 достигает 90—95%. Более высокие
температуры приводят к потерям КС1 вследствие его летучести.
Реакция с гипсом протекает при более высоких температурах,
причем трепел является обязательным реагентом для связывания
СаО в СаО • mSiO2. Летучесть хлоридов магния и натрия в при-
сутствии трепела незначительна и не может неблагоприятно по-
влиять на ход основной суммарной реакции 100’101.
При гидротермической переработке пород Предкарпатья про-
дуктами конверсии являются: водорастворимая солевая часть, со-
стоящая из сульфатов натрия и калия, и нерастворимая часть, со-
стоящая из трепела, окиси магния и силиката магния. Растворимые
соли выщелачивают из продуктов обжига при 100—106° в оборот-
ных маточных растворах, разбавленных промывными водами. Об-
разующийся горячий раствор подвергается ступенчатому охлажде-
нию в вакуум-кристаллизаторе с испарением части воды; в интер-
вале 100—30° кристаллизуется глазерит. При охлаждении до 20°
кристаллизуется мирабилит; мирабилитовый маточный раствор
возвращают на выщелачивание. Количество оборотных щелоков на
1 т K2SO4 составляет 12—14 т. В качестве готовой продукции по
этому методу получают глазерит и сульфат натрия. Глазерит,
содержащий 40% К2О, может быть использован непосредственно
как удобрение или-переработан на сульфат калия 102.
Подобным же гидротермическим способом можно получать суль-
фат калия из алунита K2SO4 • A12(SO4)3 • 4А1 (ОН)з103. При получе-
нии окиси алюминия из алунита сульфат калия является побочным
продуктом, однако количество его невелико, так как теоретическое
содержание K2SO4 в алуните равно 23%, а в алунитовых породах.
182
Гл. V. Природные калийные соли
еще меньше. Но если подвергать обработке водяным паром при
700° смесь алунита с хлористым калием, выход K2SO4 можно зна-
чительно увеличить за счет реакции:
6КС1 + AI2(SO4)3 + ЗН2О = 3K2SO4 + А12О3 + 6НС1
Гидротермический метод получения сульфата калия может ока-
заться экономичным только при условии использования на месте
производства получаемой соляной кислоты; количество ее, обра-
зующееся на 1 т К2О, составляет 6,8 т (в расчете на 27% НО).
Переработка водонерастворимых калийных руд
Предложено много способов получения сульфата калия из по-
лигалитовых руд. Во всех способах, кроме способа, основанного на
восстановлении калийных солей до сульфидов, первоначальной
операцией является отмывка от галита и последующее прокалива-
ние руды для перевода полигалита в водорастворимую форму 104.
В ряде способов предусматривается горячее выщелачивание
прокаленной руды при ~-100°; в раствор переходят сульфаты ка-
лия и магния, в отвале остается гипс. Выделение сульфата калия и
леонита из раствора осуществляют при выпарке и вакуум-кристал-
лизации.
В других способах выщелачивание прокаленного полигалита
производят при 30°. В раствор переходит только MgSO4, твердая
фаза состоит из сингенито-гипса (K2SO4 • CaSCX • Н2О); ее прока-
ливают и выщелачивают при 100°. Сульфат калия при этом раство-
ряется, из раствора его выделяют выпаркой и вакуум-кристалли-
зацией.
Имеются способы, комбинирующие горячее и холодное выще-
лачивание прокаленного полигалита. Часть руды направляют на
горячее выщелачивание, а часть на холодное, — сопровождающееся
образованием сингенито-гипса. Процесс осуществляют при мокром
измельчении прокаленной руды в среде оборотного рассола. Полу-
ченные кристаллы сингенито-гипса промывают, сушат и выпускают
как товарную продукцию (~25% КгО).
Наконец, существуют способы, основанные на обработке газо-
образным восстановителем сульфатов, содержащихся в руде. По-
лученный при восстановлении сульфид калия хорошо растворяется
в воде, благодаря чему при холодном выщелачивании происходит
отделение калийных солей от магниевых и кальциевых. Раствор
сульфида калия подвергают карбонизации с образованием К2СО3.
Предложен способ переработки на сульфат калия лейцитовых
пород путем обжига тонкоизмельченной руды с известняком и га-
литом. Хлористый калий возгоняется; его извлекают в системе
охлаждающих и пылеулавливающих устройств.
Сульфат калия
18»
В настоящее время полигалиты, а также другие водонераство-
римые калийные породы, на сульфат калия не перерабатывают, так
как технико-экономические показатели предложенных способов ока-
зались неблагоприятными.
Целесообразна простейшая переработка полигалитовых руд —
отмывкой водой галита. Полученный при этом продукт содержит
14—15% КгО и может быть с успехом применен в качестве удоб-
рения. Проведены исследования отделения галита от полигалита
путем флотации.
Прочие способы получения сульфата калия и сульфатнокалийных
удобрений
Сульфат калия может быть получен восстановлением лангбей-
нита. Сырая лангбейнитовая соль, предварительно отмытая от хло-
ристого натрия, смешивается с углем илн коксом в барабанном
смесителе (92% лангбейнита и 8% угля) и восстанавливается а
шахтной печи в течение 4 ч при 800—900°:
K2SO4 • 2MgSO4 + 2С = K2so4 + 2MgO + 2СО + 2SO2
Обогрев печи осуществляется газами, содержащими 95% ме-
тана, который восстанавливает SO2 до серы:
6SO2 + 4СН4 = 3S2 + 4СО + 8Н2О
Из полученного твердого остатка сульфат калия выщелачи-
вается при 100° водой. Окись магния отжимается на фильтрпрессе,
a K2SO4 кристаллизуется из щелока при его охлаждении в отстой-
никах-кристаллизаторах. Из 1 т лангбейнитовой соли получается
100 кг K2SO4 (96%), 75 кг AAgO (85%) и 20 кг серы.
Разработан способ получения сульфата калия при переработке
алунитов на глинозем и серную кислоту по восстановительной
схеме ВАМИ 105. По этой схеме при выпарке оборотных алюми-
натных растворов выделяется смесь сульфатов калия и натрия с
отношением K2SO4: Na2SO4 примерно 1 : 1. Смесь сульфатов перера-
батывают на сульфат калия конверсией с хлоридом калия. Отли-
чием данного процесса от известных схем конверсионной перера-
ботки через глазерит является выпарка и вакуум-кристаллизация
глазеритовых маточных щелоков с выделением возвратных солей
(глазерита и хлористого калия) и получение из конечного щелока
пищевой соли и дополнительной порции возвратных солей. Послед-
няя стадия процесса протекает также при выпарке и вакуум-кри-
сталлизации с использованием оборотного раствора в замкнутом
цикле106.
При переработке на глинозем нефелинов, калийные соли выде-
ляют из сбросного раствора 107, содержащего ионы Na*, К+, СО?' и
SOt (см. гл. VI).
184
Гл. V. Природные калийные соли
Предложен способ переработки каинитовых руд с получением
нового удобрения калушита K2SO4 • CaSO4 • Н2О 108. Процесс со-
стоит из растворения каинита и хлористого калия, обработки рас-
твора гипсом с получением калушита и выпарки раствора после от-
деления калушита. На первой стадии выпарки кристаллизуется
NaCl, при последующем выпаривании выделяется смесь КС1 и
NaCl, которую возвращают в начало процесса; в конечном щелоке
содержится MgCl2.
Установлена возможность отделения глазерита от галита фло-
тацией при применении в качестве флотореагента соединений типа
R — О — SO3H, где R — алкил-группа с числом атомов углерода в
цепи не ниже 5 109. Описан способ получения K2SO4 из КС1 и CaSO4
через промежуточный продукт — сингенит Кг§04 • CaSO4 • Н2О — в
водном и водо-метанольном растворе110.
ЛИТЕРАТУРА
/•Я. А. Ф и а л к о в, В. Б. Черногоренко, ДАН СССР, 102, Ns 4, 739
(1955).—2. М. Bernard, Jaffrey, Compt. rend., 240, № 10, 107 (1955); 242,
№ 21, 2512 (1956). — 3. H. С. Банных, Я Е. В и л ь н я н с к и й, ЖОХ, 26, № 4,
952 (1956).—4. А. Б. Здановский, Е. Ф. Соловьева, Л. Л. Эзрохи,
Е. И. Л я х о в с к а я, Справочник экспериментальных данных по растворимости
солевых систем, т. III, Госхимиздат, 1961, стр. 1930. — 5. Л. Л. Эзрохи, Труды
ВНИИГ, в. 31, 1956, стр. 164. — 6. А. И. Мун, В. В. Т а р т а к о в с к а я, Изв.
АН КазССР. Сер. хим., № 8, 35 (1955). — 7. М. И. Р а в и ч, Ф. Е. Боровая,
В. Я. Кетковнч, ИСФХА АН СССР, 22, 225 (1953); 23, 258 (1953).-
8. А. А. Иванов, Зап. Всероссийск, минералогическ. общества, 61, Ns 3
(1932).—9. Ю. В. Морачевский, Бюлл. Ин-та галургии, № 5 (1938).—
10. А. А. Черепенников, Газоносность солей Соликамского калийного руд-
ника, Углетехиздат, 1949.
11. А. А. Иванов, Хим. пром., Ns 1—2 (1946). — 12. С. М. Коренев-
с к и й, ДАН СССР, 88, № 6 (1953). —13. В. В. Лобанова, Труды ВНИИГ,
в. 32, 1956, стр. 164. —14. W. Pearson, J. Canad. Min. Metal. Bull., October
(1960). — 15. Canad. Chem. Proc., June, 63 (1964). — 16. E. F. Armstrong,
L. M. Mi a 11, Kaw Materials from the Sea (England). —17. D. E. Garrett,
Cjiem. Eng. Progr., 10 (1963).— 18. Phos. a. Pot., № 27, 37 (1967).—
19. J. W. Hightower, Chem. Eng., 8 (1961). — 20. M. Г. В а л я ш к о, Труды
ВНИИГ, в. 23, 1953, стр. 93.
21. Ф. Ф. Вольф, В. С. Ятлов, Труды Центр, лаб. Севхимтреста, т. 1,
1929, стр. 5.-22. О. Д. Кашка ров, Труды ВНИИГ, в. 31, 1956, стр. 107. —
23. А. Б. Здановский, Там же, в. 33, 1956, стр. 185. — 24. А. Б. Зданов-
ский, Там же, в. 31, 1956, стр. 132. — 25. Г. А. Аксельрод, О применении
гидродинамики в кинетике растворения твердых частиц, Львов, 1955. — 26. Пат.
ФРГ 956303, 1957.—27. А. Б. Здановский, Л. Л. Эзрохи, ЖХП, № 2, 9
(1948).—28. А. Б. Н у д е л ь м а н, Там же, № 1, 10 (1951). — 29. Н. Auten-
rieth, Н. Rieke, Н. Dust, Chem. Ing. Techn., № 11, 29 (1957). — 30. Франц,
пат. 65544, 1956.
31. Пат. ФРГ 108351, 1956. — 32. A. W. В a m f о г 11, Chem. Proc. Eng., 46,
№ 2, 81 (1965). —33. L. E. Garret, Ind. Eng. Chem., 53, № 8, 623 (1961).—
34. В. А. Постников, ЖХП, № 11, 853 (1963). — 35. J. Houghton, Chem.
Proc. Eng., 46, № 12, 639 (1965).— 36. V. K- LaMer, R. H. Smellie,
P. K. Lee. J. Coll. Sci., 11, 704 (1956); 12. 230, 566 (1957). —37. Л. И. Обрей-
Литература
185
Нова, А. К- Лившиц, сб. «Флотация», Госметаллургиздат, 1956, стр. 36,—
38. А. М. Swift, Tappi, 40, № 9 (1957). — 39. Ю. Я Каганович, А. Г. Зло-
о л н с к и й, Техника сушки во взвешенном слое, изд. ЦИНТИХИМНефтемаш,
1966. — 40. Min. Eng., 18, № 10, 106 (1966).
41. И. С. Лурье Г. Г. К о л п и к о в, А. Г. Злобинский, Хим. наука и
пром., 2, № 6, 767 (1957). — 42. Н. И. Забродин, Б. П. Туркин, Там же, 3,
№ 1, 104 (1958).—43. Правила и нормы техники безопасности и промышленной
санитарии для проектирования, строительства и эксплуатации производства хло-
ристого калия и обогащенного карналлита, Госхимиздат, 1961. — 44. Герм. пат.
325398, 1918; 355979, 1919; 374017, 1920; 347371, 1921; 278694, 1921, — 45. F. S е-
г о w у, Verarbeitungsmethoden der Kalirohsalze, Halle, (Saale) 1952.—
46. A. Jacob, Kali, gewinnung and anwendung der Kalidiingesalze, Hannover,
1955. — 47. J. Ordonnaun, Annal. mineral et carb., 139, № 1 (1950).—
48. Aufbereitungs Technik, № 2, 80 (1967). — 49. Phos. a. Pot., № 36, 49 (1968).—
50. Англ. пат. 408419, 1934; 425326, 1935; 544675, 1942; франц, пат. 799242, 1936;
герм. пат. 687571, 1940; 650240, 1937; пат. США 2174950, 1938; К- Н. Шабалин,
сб. «Соликамские карналлиты», 1935, стр. 109.
51. А.. С. Л е о н т и ч у к, сб. «Соликамские карналлиты», 1935, стр. 133.—
52. Я. С. В и л ь н я н с к и й, Там же, стр. 148.— 53. Я- М. Хейфец, Там же,
стр. 25.—54. R. Noyes, Potash a. Potassium Fertilizer (USA), 1966.—
55. H. Schubert, Aufberlitungs Technik, № 6, 305 (1966); № 7, 406 (1967).—
56. Пат. США 2984348, 1961. —57. Пат. США 2733809, 1960. — 58. М.М. Павлю-
ченко, Э. Ф. К о р ш у к, Калийные соли и методы их переработки, Минск,
1963. — 59. Ю. Е. Могульская, Т. В. К а п л я н с к а я, Е. И. Соловьев,
сб. «Вопросы механического обогащения калийных солей», Изд. «Химйя», 1966.—
60. Phos. a. Pot., № 36, 46 (1968).
61. W. Wilson, Eng. Min. J, 167, № 8, 86 (1966). —52. P. Merrit, Min.
Eng., 18, № 10, 103 (1966). —53. H. С. Ульянов, И. Ф. Мещеряков,
VIII Международный конгресс по обогащению, 1968. — 64. И. Ф. Мещеряков,
Ю. В. Рябов, М. А. Подвигни, Хим. пром., № 12, 909 (1968). — 65. Авт.
свид. 199125, 1967. — 66. Авт. свид. 185783, 1965. — 57. И. Ф. Мещеряков,
Цветные металлы, № 3 (1968). —58. Phos. a. Pot., № 29—32 (1967).—
69. R. Burr, Rev. de 1’indust. mineral., № 1 (1954). — 70. В. M. Борисов,
H. А. Афанасьев, Хим. наука и пром., 1, № 2, 146 (1956).
71. Пат. США 2997171, 1961. —72. Пат. США 3052349, 1962. —73. Пат. ФРГ
1095762, 1961, — 74. Авт. свид. 178318, 1965.— 75. Пат. США 3052349, 1965.—
76. Phos. a. Pot., № 30, 38 (1967); Canad. Chem. Proc., June, 63 (1964).—
77. R. A. Gaska, R. D. Goo den a ugh, G. A. Stuart, Chem. Eng. Proc., Jan.
(1965). 78. J. V. Hightower, Chem. Eng., 8 (1961). — 79. Phos. a. Pot., № 29’
(1967). — 80. А. Д. П e л ь ш, Хим. наука и пром., 2, № 6, 734 (1957).
81. Pit. a. Quarry, 47, № 6, 136 (1955). — 82. А. Д. П е л ь ш, Труды ВНИИГ,
в. 24, 1952, стр. 86. — 83. Е. F. А г m s t г о n g, L. М. М i а 11, Raw Materials from
the Sea (England). — 84. О. Д. К а ш к a p о в, Ю. M. Аллабердыев, Изв. АН.
ТуркмССР, № 5, 84 (1958); № 1, 118, № 2, 58 (1959). —85. Ю. М. Аллабер-
дыев, О. Д. К а ш к а р о в, Изв. АН ТуркмССР, № 3, 15 (1959).—
85. Д. Ленг а у ер, ИСФХА АН СССР, 14, 411 (1941). —87. Авт. свид. 189876,
1966. —88. Авт. свид. 186991, 1966. —89 Авт. свид. 184820, 1966. — 90. М. Е. По-
з и н, М. И. М у р а т о в а, ЖПХ, 30, № 9, 1380 (1957).
91. М. Е. П о з и н, М. И. Муратова, Там же, 1383. — 92. Н. С. Курна-
к о в, Е. И. Лукьянова, Изв. АН СССР, Сер. хим., в. 1, 39 (1938).—
93. Я. Б. Блюмберг, Е. Ф. Соловьева, Труды ВНИИГ, в. 24, 1952,
стр. 77. — 94. А. И. Заславский, С. С. С и н а н и, А. А. Соколова, Изв.
АН СССР, Ks 1, 47 (1938).— 95. Я Б. Блюмберг, Ю. Я- Каганович,
В. А. Останина, Е. Д. Ярушевич, Труды ВНИИГ в. 31, 1956, стр. 66.—
186 Литература
96. Пат. ФРГ 873838, 1953. — 97. А. А. Желнин, Л. А. Образиделова,
В. Г. Егорова, Вопросы механического обогащения калийных солей, Изд. «Хи-
мия», 1966. — 98. Phos. a. Pot., № 21 (1966). — 99. G. Marullo, J. Vaccari,
Freiburg Forschung, A-267, № 39 (1963).— 100. Я. А. Фиал ко в, сб. «Местные
минеральные удобрения УССР», в. 1, 1954. стр. 319.
101. С. Д. Ш а р г о р о д с к и й, И. О. Шор, Там же, стр. 334. —
102. С. И. Я к у б с о н, Н. К- Давиденко, Там же, стр. 328. — ЮЗ. С. Д. Ш а р-
городский, О. И. Шор, А. С. Баранова, ЖПХ, 29, № 4, 492 (1956).—
104. J. Conley, Е. Р a t г i d g е, Соли калия из месторождения полигалитов в
Техасе и Нью-Мексико, 1944. — 105. Г. В. Лабутин, Труды • ВАМИ, № 42,
1959; Авт. свид. 106048, 1955. — 106. А.. Ф. Б оря чек, Д. И. К У х а р е в, Труды
НИОХИМ, т. 10, 1957, стр. 67.— 107. Г. С. Седельников, А. И. Лазаре-
ва, Хим. пром., № 5, 401 (1959). — 108. Г. П. Александров, В. С. Тихо-
нов, ЖПХ, 31, № 10, 1445 (1958).— 109. С. А. Кузин, Там же. 12, № 3, 381
(1939).— ПО. Н. Schnabel, G. Liebma п n, W. May, Bergakademie, 20, Xs 5,
292 (1968).
Глава VI
ПОТАШ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Углекислый калий, поташ, К2СО3 — белый кристаллический по-
рошок плотностью 2,43 г/см3, плавится при 896°, теплота плавле-
ния 7800 ккал/кг-мол. Из водного раствора выше —6,2° кристал-
лизуется К2СО3 • 1,5Н2О с плотностью 2,13 а/сл/3от — 6,2 до —36,5°
(криогидратная точка) выде-
ляется К2СО3 • 6Н2О. Теп-
лота растворения при 18°
в 400 моль воды: для К2СО3
+ 6490 ккал!кг-мол, для К2СО3 •
• 1,5Н2О —380 ккал/кг-мол.
Насыщенный водный раст-
вор содержит при 0° 51,8,
при 15° 52,9, при 100° 60,9%
К2СО3 (рис. 51). Темпера-
тура кипения 50% раствора
К2СО3 113,1°.
Поташ сильно гигроскопи-
чен. Равновесная относи-
тельная влажность над
Рис. 51. Политерма системы К2СО3—Н2О-
К2СО3 • 1,5Н2О при 25° всего
43%, на воздухе поташ расплывается, а при длительном хранении
поглощает двуокись углерода и превращается в твердый бикарбо-
нат калия КНСО3:
ПРИМЕНЕНИЕ
Поташ используют в производстве стекла. Высококачествен-
ные сорта его применяют для изготовления медицинского, оптиче-
ского, электровакуумного, художественного стекла, а также
188
Гл. VI. Поташ
хрусталя. Поташ употребляют для производства некоторых солей,
фармацевтических препаратов, жидкого калийного мыла, при по-
лучении жидкой и твердой двуокиси углерода ’•2; при крашении
и отбелке тканей, для промывания шерсти, для изготовления
печатных красок из индантреновых красителей и т. д. Его приме-
няют для очистки промышленных газов от сероводорода по ва-
куум-поташному способу, особенно в коксохимической промышлен-
ности для очистки коксового газа3. Возможно использование по-
таша (в смеси с содой) в качестве противопожарного средства.
Поташ используют в строительном деле в качестве морозозащит-
ной добавки в растворы и бетоны, имеющей преимущества перед
другими солями — он не вызывает коррозии, образования высолов
и проч.4. В сельском хозяйстве5’6 его применяют как щелочное
бесхлорное удобрение, однако пока в небольших количествах не
только из-за высокой стоимости, но и из-за плохих физических
свойств, обусловленных сильной гигроскопичностью. Ведутся по-
иски способов улучшения физических свойств этого удобрения.
Пока же предпочитают транспортировать и использовать поташ в
виде жидкого удобрения — концентрированных растворов, или
предварительно перерабатывают его в бикарбонат калия7’8, об-
ладающий лучшими физическими свойствами (но почти в 1,5 раза
меньшей концентрацией калия). Бикарбонат получают карбони-
зацией печным газом концентрированного горячего (130°) поташ-
ного раствора и кристаллизацией при охлаждении.
Высокая стоимость поташа пока органичивает его применение
в строительном деле и в сельском хозяйстве, в перспективе же эти
отрасли (так же как и производство оконного, тарного и других
видов технического стекла) должны стать самыми крупными по-
требителями поташа.
Получение поташа является старейшим химическим производ-
ством9. На Руси оно возникло в XV в. Главнейшими потребите-
лями поташа были стекольное производство и мыловарение.
Сырьем для получения поташа с древнейших времен была расти-
тельная зола. Производство поташа из золы растений носило ку-
старный характер, и поташ мог конкурировать с другими щело-
чами лишь до появления дешевой соды, которую начали выпу-
скать с 1865 г.
Наибольшее количество поташных заводов (около 200) и наи-
большая его выработка в России (17 000 т) падают на третью
четверть XIX в. Затем производство поташа сократилось. Значе-
ние русского поташа упало также потому, что в Германии было
создано промышленное его производство из калийных солей Стас-
фуртского месторождения 10.
К качеству поташа, вырабатываемого на современных пред-
приятиях. предъявляются различные требования. Например, со-
Методы производства поташа
189
гласно ГОСТ 10690—63 поташ из минерального сырья должен
содержать (в %):
ПотаШ кальцини- рованный Поташ полутора- водный
сорт I сорт 2 сорт I сорт 2
КаСО3, не менее Натрия в пересчете на Na2CO3, 98 93 97,5* 92,5*
не более 0,9 4,0 0,9 6,0
Хлоридов в пересчете на хлор,
не более Сульфатов в пересчете на SO4, 0,07 1,5 0,07 2,0
не более 0,4 1,0 0,5 1,5
Железа в пересчете на Fe2O3,
не более Не растворимого в воде ос- 0,005 Не опреде- ляется 0,005 Не опреде- ляется
татка, не более 0,1 То же 0,1 То же
♦ В пересчете на прокаленное вещество.
Тарой для поташа служат многослойные бумажные битумиро-
ванные или прорезиненные мешки, или мешки из пластиковой
пленки.
МЕТОДЫ ПРОИЗВОДСТВА ПОТАША
Лишь некоторые из многих способов получения поташа нашли
практическое применение п.
Один из старых способов — извлечение поташа из раститель-
ной золы 12-17 — почти полностью потерял прежнее свое значение
вследствие недостаточной экономичности. В ряде стран (ГДР, Че-
хословакия, Польша, Италия и др.) существует производство
поташа из бардяного угля (продукта коксования упаренной па-
точно-спиртовой барды) 13’1в’17. Бардяной уголь содержит около
60% К2СО3, но наряду с углекислым калием в нем находятся сода,
сернокислый и хлористый калий и др.
Поташ можно выделять и из золы, получаемой после выпарки
и полного сжигания паточно-спиртовой барды 18>1э.
Производство поташа из золы растений, бардяного угля и
золы, овечьего пота имеет сейчас лишь местное значение5. В на-
стоящее время поташ вырабатывают главным образом из мине-
рального сырья. В СССР его производят при комплексной пере-
работке нефелинов. При этом получают глинозем, цемент и содо-
поташные растворы, перерабатываемые на соду и поташ 20-25.
В небольших количествах поташ получают из озерной рапы.
За рубежом наиболее распространены способы получения по-
таша из хлорида калия — электролитический, заключающийся в
карбонизации раствора едкого кали26, полученного электролизом
хлорида калия, и аминовый13, аналогичный аммиачному способу
получения соды, но с заменой аммиака различными аминами. Эти
190
Гл. VI. Поташ
способы дорогие, стоимость продукта высока и поэтому его выра-
батывают в небольших количествах.
Хлорид калия можно переработать в поташ магнезиальным
способом Энгеля — Прехта 13127~29. Он заключается в карбониза-
ции под давлением (5—18 ат) суспензии активного карбоната
магния в растворе хлорида калия:
3(MgCO3 • ЗН2О) + 2КС1 + СО2 2(КНСО3 • MgCO3 • 4Н2О) + MgCl2
Образующуюся двойную соль Энгеля, отделенную от маточного
раствора, разлагают при нагревании водой или суспензией гидро-
окиси магния — получают раствор поташа, перерабатываемый на
твердый продукт, и магнезию, возвращаемую в процесс. В настоя-
щее время этот способ, позволяющий получать весьма чистый по-
таш, имеет ограниченное применение (в СССР не применяется)
вследствие своей сложности, связанной главным образом с обес-
печением условий образования активного карбоната магния.
Для получения легко фильтрующейся соли Энгеля и более пол-
ного использования магния рекомендуют заменить СО2 бикарбо-
натом натрия30. Вместо КС1 можно использовать содо-поташные
щелока, подвергаемые карбонизации в присутствии MgCO3 • ЗН2О 31„
Из хлорида калия можно получать поташ через кремнефторид
калия одновременно с фторидом натрия32 (см. гл. XXXI).
Поташ производят переработкой природного сернокислого ка-
лия формиатным способом 26- 33. Известны и другие11-12 способы
получения поташа, например, способ Леблана, цианамидный, ба-
риевый (из сульфата калия), но на практике они не исполь-
зуются.
Переработка золы подсолнечника *
Зола подсолнечника 13 содержит в растворимой части от 15 до
35% К2СО3, 3,5—4,1% K2SO4 и 3,8—5.1% КС1. Не растворимый
в воде остаток составляет от 40 до 61%. Выщелачивание подсол-
нечной золы осуществляют в стальных резервуарах с ложным дном
емкостью до 10 т золы по методу «настаивания». В цикле обычно
работают четыре выщелачивателя. Процесс ведут по принципу
противотока: первый аппарат, загруженный свежей золой, зали-
вают раствором, полученным из второго, этот выщелачиватель за-
ливают раствором из третьего и т. д. Последний аппарат заливают
горячей водой. Заливку раствором каждого выщелачивателя про-
водят в 3—4 приема. На 1 т золы расходуется около 0,7—1 м?
воды. Выщелачивание заканчивают при остаточном содержании
в сухом подзоле не более 1,5% К2СО3, что дает степень извлече-
ния К2СО3 около 95%. Получается концентрированный раствор
* Данные по технологическому режиму производства представлены 3. П. Ве-
ретенниковой.
Методы производства поташа
191
(плотность 1,19 г)см3) среднего состава (в %): К2СО3—15,0,
КС1 — 3,3, K2SO4—1,7. Этот раствор осветляется от взвешенных
частиц в отстойниках.
На диаграмме растворимости84 в системе К2СО3—КС1—
—K2SO4—Н2О при 75° (рис. 52) точка Н состава раствора после
выщелачивания (в пересчете на сухое вещество) лежит на вторичной
Рис. 52. Диаграмма растворимости в системе К2СО3—КС1—K2SO4—Н2О
при 75° и и системе К2СО3—КС1—Н2О при 25° (по способу вторичных
. проекций36).
проекции (точка Т) в поле кристаллизации K2SO4. Вспомогатель-
ные построения показывают, что начальный раствор Н является
ненасыщенным. В процессе выпарки этого раствора по лучу ОТ
первой кристаллизующейся фазой на участке отрезка LD является
K2SO4. На отрезке луча выпарки DK. кристаллизуются одновре-
менно K2SO4 и КС1. В точке К выпарка должна быть прекращена
во избежание выделения также и К2СО3 • 1,5Н2О. В этот момент
состав жидкой фазы определяется положением точки Е (Е'), в ко-
торой раствор насыщен тремя твердыми фазами35. Выпарку рас-
твора заканчивают при достижении плотности 1,57—1,60 г/см3
при температуре его кипения 75—85° (давление 0,2—0,1 ат).
Наиболее чистый сульфат калия (без примеси КС!) выделяется
при выпарке до плотности 1,40—1,45 г)см3. На практике выпарен-
192
Гл. VI. Поташ
ный раствор имеет следующий примерный состав (в %): К2СО3 —
50,0 4-50,6; КС!—3,54-4,4; K2SO4— 0,6 4-1,0. В производственных
условиях выпаривание заканчивают несколько ранее достижения
состава тройной точки Е (Е').
Растворимость КС1 в двойной точке В системы К2СО3—КС1—
—НоО при 25° составляет 0,97% 36. Из рис. 52 видно, что точки
состава выпаренного раствора лежат вблизи предельного луча
кристаллизации КС1 — В; следовательно, при этой температуре
возможно выделение КС1 или же смеси КС1 и К2СО3 • 1,5Н2О.
Одновременно, вследствие снижения растворимости K2SO4 в чет-
верной системе34, при охлаждении будет осаждаться в небольших
количествах и эта соль. Выкристаллизовавшуюся смесь солей про-
мывают для уменьшения потерь К2СО3. После промывки смесь
содержит 65—70% КС1, 20—30% K2SO4 и 5—7% К2СО3. Практи-
чески раствор поташа после охлаждения до 25—30° и кристалли-
зации солей имеет средний состав (в %): КгСО3 — 50,6; КС1 — 2,2;
K2SO4—1,0 (плотность 1,56 г/см3). Раствор подогревают и выпа-
ривают до плотности 1,60—1,64 г/см3, после чего его направляют
в напольные печи для прокаливания.
При переработке золы с содержанием 20% К2СО3, 4% KCI
и 2% Кг5О4 расходуют на 1 т поташа: золы — 5,125 т, пара —
4,5 т, топлива условного на прокалку — 0,24 т, электроэнергии —
75 квт-ч, воды—10 м3. При этом получается отходящих солей:
хлорида калия (65—70% КС1)—0,2 т, сульфата калия (94%
K2SO4) — 0,1 т.
Переработка бардяного угля и золы
Бардяной уголь и зола получаются выпариванием и, соответ-
ственно, неполным или полным сжиганием барды, являющейся
отходом после сбраживания патоки свеклосахарных заводов и от-
гонки спирта. Присутствие в бардяной золе Na2COs, кроме К2СО3,
K2SO4 и КС1, усложняет ее переработку. Соотношение между ко-
личествами основных солей в бардяном угле и золе очень разно-
образно: при колебаниях в содержании К2СО3 от 30 до 80% от-
ношение Na2CO3: К2СО3 находится в пределах 0,03—0,50;
KCI: К2СО3 0,06—0,67; K2SO4: К2СО3 0,07—0,63.
На одной из действующих установок13’ 17 бардяной уголь из-
мельчают и выщелачивают водой при 80°. После отделения и про-
мывки шлама 19 полученный раствор плотностью 1,19—1,22 г)см3
выпаривают до плотности 1,39—1,45 г/см3, при этом выделяется
большая часть сульфата калия. Маточный раствор охлаждают до
22—25° для кристаллизации КС1. Сухое вешество жидкой фазы
содержит около 81% К2СО3, 2,5% K2SO4. 6,4% КС1 и 10% Na2CO3.
При высушивании такого раствора можно получить низкокаче-
ственный 80 %-ный поташ.
Методы производства поташа
193
Для получения поташа высокого качества раствор, после от-
деления КС1, дополнительно охлаждают для выделения двойной
соли ККаСОз. Для получения 96%-ного поташа раствор охла-
ждают до 0°; при охлаждении до 5—6° готовый продукт может
содержать лишь 90% К2СО3. Раствор после отделения двойной
соли дополнительно выпаривают до плотности 1,69 г/см3, при этом
Рис. 53. Диаграмма водной системы КгСОа + 2МаС1 Na2CO3 + 2КС1 при 75*
(по способу вторичных проекций35).
выделяется кристаллический поташ. К концу выпаривания тем-
пература кипения раствора достигает 140° Концентрированный
раствор, содержащий взвесь кристаллов углекислого калия, охла-
ждают до 96°, благодаря чему дополнительно выделяются кри-
сталлы поташа, затем смесь пропускают через центрифугу. Отфу-
гованный поташ высушивают. Маточный раствор плотностью
1,58—1,60 г/см3 смешивают со свежим раствором, идущим на вто-
рое выпаривание. По мере накопления в этой смеси примесей
посторонних солей она выводится из цикла и поступает в прока-
лочную печь для получения поташа пониженного качества. Поташ
высшего качества, получаемый описанным методом, содержи!'
7 М. Е. Позин
194
Гл. VI. Поташ
около 96% К2СО3, 0,5% ЫагСОз, 0,5% K2SO4 и 1% КС1. Выделен-
ную двойную соль подвергают переработке для получения низко-
качественной соды (75%) и поташа пониженного качества (около
90% К2СО3).
Имеющиеся неполные данные34 по равновесию в системе
NaCl—КС1—Na2SO4—K2SO4—Па2СОз—К2СО3—Н2О показывают,
что в важных для данного процесса точках при 25—80° в жидкой
фазе содержатся лишь следы K2SO4, поэтому без большой по-
грешности можно пренебречь наличием в исходных растворах
K2SO4. При выпарке этих растворов сернокислый калий будет
выделяться практически полностью и в первую очередь.
Вследствие этого можно ограничиться исследованием 13 взаим-
ной системы К2СО3 + 2NaCl Na2CO3 + 2КС1 при 75° (рис. 53
и табл. 17) 34.
ТАБЛИЦА 17
Система К2СО3 + 2NaCl Na2CO3 + 2KCI при 75°
I Точки (см. рис. 53) 1 Состав жидкой фазы, вес. % Твердые фазы
состав раствора состав раствора в пере- счете на сухое вещество
О» О О сч * со о и м Z NaCl K2CO3 Na-ЮОз О NaCl
61 33,3 100 КС1
24 — — — 27,5 — — 100 NaCl
25 — 31,2 — — — 100 — — Na2CO3 • H2O
62 57,6 — — 100 — — К2СО3-1,5Н2О
74 — 18,45 17,75 — 50,9 49,1 NaCl + КС1
54 56,1 — 2,17 — 96,3 3,7 — К2С03- 1,5Н2О + КС1
27 — 11,13 — 20,9 — 34,7 — 65,3 Na2CO3 • Н2О + NaCl
22 44,4 8,48 — — 83,9 16,1 — — Na2CO3 • Н2О + KNaCO3
93 55,9 2,14 — 26,3 3,7 — — К2СО3- l,5H2O+KNaCO3
94 — 9,81 17,4 11,82 — 25,1 44,6 30,3 NaCl + КС1 + Na2CO3 • H2O
95 41,3 8,2 3,5 — 78,0 15,4 6,6 — КагСОз • H2O + KNaCO3 + KC1
96 55,3 1,65 2,0 — 93,8 2,8 3,4 — K2CO3 • 1,5H2O + KNaCO3 + KCl
ТАБЛИЦА 18
Состав образцов растворов, полученных из бардяной золы
Точка (см. рис. 53) Состав раствора, вес. % Na2CO3 KCi K2SO4 K2CO3 Состав раствора в пере- счете на сухое вещество (без K2SO4)
К2СО3 ИагСОз КС! K2SO4 K2CO3 K2CO3 К2СО3 NagCOs КС1
H7(T7) 12,48 3,41 1,44 0,80 0,273 0,115 0,064 72,0 19,7 8,3
H9 (7g) 10,43 1,85 3,70 3,00 0,181 0,354 0,288 65,3 11,5 23,2
Методы производства поташа
195
Вее точки состава растворов, полученных из бардяной золы и
угля (без учета содержания K2SO4), ложатся в правой части
диаграммы, несмотря на разли-
чия в соотношении солевых ком-
понентов. Для рассмотрения
взяты два типичных раствора
(табл. 18).
При выпаривании начального
раствора Hi(Tt) при 75° первой
выделяющейся фазой (после оса-
ждения K2SO4) будет NagCOs-
• Н2О, а затем смесь МагСОз-НгО
и КС1. В точке 95 (95') в твердой
фазе появляется двойная соль
KNaCO3. Температура выпарива-
ния 75° выбрана потому, что в
этих условиях отпадает после-
дующая кристаллизация солей
при более низкой температуре.
Точка состава второго рассмат-
риваемого начального раствора
H9(TS) лежит в поле кристалли-
зации КС1. Выпадение этой соли
заканчивается вблизи переход-
ной точки 95(95'), т. е. до начала
выделения двойной соли.
Таким образом, первый этап
выпаривания заканчивается при
приближении состава жидкой
фазы к точке 95(95'), после чего
выпавшие твердые фазы отде-
ляют. Следующей стадией яв-
ляется выпаривание при 75° для
выделения двойной соли в смеси
с КС1. В точке 96 (96') выпарку
прекращают и выпавшие кри-
сталлы KNaCO3 + КС1 отделяют.
Температура 75° для этой стадии
выпаривания тоже является оп-
тимальной, так как маточный ра-
ворвяюя зола
Промывная вода
К?СО31,5НвО\
Фиго6аиие~
и ПрОМывно
потаит?
Промывная
вода
поТпаит
створ в этих условиях содержит Рис. 54. Схема производства поташа
наименьшее количество примесей из бардяной волы.
солей.
Точка 96 (96'), определяющая состав конечного маточного
раствора при 75° (табл. 17), лежит в поле кристаллизации КС1
для 25°. Следовательно, охлаждением раствора 96 (96') до 25°
7*
196
Гл. VI. Поташ
(при небольшом разбавлении водой) можно снизить содержание в
нем КС!. После дополнительного выделения КС! солевой состав
жидкой фазы будет: 95,5% К2СО3, 2,85% Na2CO3 и 1,65% КС1.
На основе анализа равновесных диаграмм системы предложена
и экспериментально проверена 18 технологическая схема производ-
ства поташа, приведенная на рис. 54. В этой схеме использовано
свойство двойной соли растворяться в воде при 35° и выше ин-
конгруэнтно, т. е. с разложением. При соответствующем количе-
стве воды в раствор переходит К2СО3, а большая часть Na2CO3 и
КС! остается в осадке. Раствор карбоната калия возвращается
в процесс.
Изучен 18 также вариант переработки бардяной золы, заклю-
чающийся в выделении натрия в виде фторида. По этой комбини-
рованной схеме первоначальный раствор бардяной золы предва-
рительно выпаривают с целью возможно более полного выделения
K2SO4 и КС!. После отделения смеси солей маточный раствор
смешивают с раствором фторида калия, получаемого конверсией
кремнефторида калия оборотным раствором поташа (см. гл. XXXI).
При этом частично осаждается фторид натрия. Фильтрат подвер-
гают вторичной выпарке для полного отделения оставшегося в
растворе фторида натрия. Дальнейшей задачей является кристал-
лизация поташа; для этого осуществляют третью ступень вы-
парки.
Экспериментально установлена возможность получения этим
способом как высококачественного поташа (не ниже 96% К2СО3),
так и фторида натрия (в среднем 97% NaF). Степень извлечения
поташа из бардяной золы достигала 94%.
Получение поташа из содо-поташных растворов глиноземного
производства
При получении глинозема из нефелина образуются побочные
растворы (плотность 1,15—1.18 г/сл?3) следующего среднего со-
става20 (в г/л): Иа2СОз—157; К2СО3 —62; K2SO4 (включая не-
окисленные соединения серы) — 16: собственно K2SO4—15; R2O3 —
0,1; С!~ — 0,07 Эти растворы перерабатывают на содо-поташную
смесь и на поташ. Исходные растворы содержат частично бикар-
бонаты Na и К (свыше 7 г/л в пересчете на NaHCO3), наличие ко-
торых вызывало значительную коррозию стальной аппаратуры37
и загрязняло поташ окислами железа. Нейтрализация начальных
щелоков раствором NaOH резко уменьшила коррозию оборудова-
ния, и содержание железа в поташе снизилось с 0,06—0,14% до
0,001—0,002% 25. Поташ получают из содо-поташных щелоков по
следующей упрощенной схеме20. Производится предварительное
концентрирование щелоков в вакуум-выпарных аппаратах Кест-
нера до суммарного содержания солей 400—440 г/л (плотность
Методы производства поташа
197
1,29—1,33 г/см3). Затем ведется вторая выпарка при 130—132° до
точки насыщения раствора солями Na2CO3, K2SO4 и KNaCO3 (кон-
центрация солей в растворе 750 г!л, плотность его 1,51 —1,53 г/сл3).
В процессе второй выпарки выделяется смесь из соды и сернокис-
лого калия, которая отделяется на центрифугах и высушивается.
Пример анализа этой смеси: 79,06% Na2CO3, 11,27% К2СО3 (при-
месь из жидкой фазы), 9,28% K2SO4, 0,001% Fe2O3 и 0,31% по-
тери при прокаливании.
При расчете выпарки следует иметь в виду, что давление во-
дяного пара над растворами, содержащими К2СО3, Na2CO3 и до
5 вес.% K2SO4, практически равно давлению пара над чистым
раствором КгСО3, концентрация которого равна сумме концен-
траций этих трех солей38.
Маточный раствор после второй выпарки смешивают с маточ-
ным раствором после кристаллизации К2СО3-1,5Н2О (см. ниже)
и выпаривают при 105—112° до точки насыщения солями K2SO4,
KNaCO3 и КгСО3- 1,5Н2О (третья выпарка). Такой раствор (плот-
ность 1,64 г/сл3) содержит 1060 г/л К2СО3, 28,8 г/л Na2CO3,
45,2 г/л К25О4общ и 6,8 г/л K2SO4.
В процессе третьей выпарки выпадает смесь KNaCO3 и K2SO4
(фактический состав: 26,2% Na2CO3, 64,6% К2СО3, 3,41 % K2SO4).
Этот осадок отделяют фильтрованием, растворяют в конденсате
и возвращают на смешение с начальным щелоком.
Раствор поташа после третьей выпарки охлаждают до 45—50°
для выделения К2СО3 • 1,5Н2О. Поташ отжимают на центрифугах
и отгружают потребителям без сушки, а маточный раствор воз-
вращают на третью выпарку.
Продукт имеет средний состав (в % на сухое вещество) :
К2СО3...............97,63
Na2CO3........... 0,82
К2504О6щ ....... 0,68
K2SO4................. 0,46
С1-.......................0,07
А12О3................... 0,043
Fe2O3.....................0,002
Н2О......................17,22
Об автоматическом регулировании кристаллизации поташа в
однокорпусной вакуум-кристаллизационной установке см.39
Разработан способ гранулирования поташа, содержащего 5—
6% гигроскопической влаги в тарельчатом грануляторе, на кото-
рый подают смесь К2СО3 • 1,5Н2О, мелкую и крупную фракцию
К2СО3 после дробления гранул и воду в отношении 1 :0,45—
0,8:0,12—0,2. Гранулы могут быть высушены в барабанной су-
шилке до полного обезвоживания, причем их прочность не умень-
шается 40.
В циркулирующих растворах постепенно накапливаются ионы
хлора и неокисленные соединения серы. Для выделения соединений
хлора раствор поташа эпизодически подвергают охлаждению до
температуры ниже 45°, при этом выделяется поташ, загрязненный
хлором (до 1%), а очищенный фильтрат вновь поступает на третью
198
Гл. VI. Поташ
выпарку. Единственной возможностью уменьшить загрязнение по-
таша неокисленными соединениями серы при работе по описан-
ной схеме является промывка поташа конденсатом. Однако про-
мывка не обеспечивает получение поташа без примесей неокис-
ленных соединений. В приведенном выше анализе поташа коли-
чество неокисленных соединений серы составляет 0,22% (на
K2SO4). Остается нерешенным еще вопрос использования промыв-
ного раствора, содержащего после промывки поташа значитель-
ные количества углекислого калия, загрязненного неокисленными
соединениями серы.
к2ссъ.%
Рис. 55. Диаграмма водной системы К2СО3 + Na2SO4 NaaCO3 + K2SO4
при 75° (по способу вторичных проекций 35).
В ряде исследований изучался процесс разделения содо-поташ-
ных щелоков с применением карбонизации растворов 23-24 41 43.
Эти способы требуют для своего осуществления аппаратуры из
нержавеющей стали. В других работах 22>25’38-44 разделение солей
осуществлялось на основе анализа взаимной системы К2СО3 4-
+ Na2SO4<iNa2CO3 + K2SO4, изученной при 2536, 35, 50, 7534,
100 45 и 150° 46-47. Привлекались также данные, доказавшие су-
ществование двойной соли KNaCOs в системе К2СО3—КагСОз—Н2О
при температуре выше 100° 48>49. Равновесие в данной системе
позволяет осуществить последовательное выделение солей по схеме,
показанной на примере диаграммы для 75° (рис. 55). Точка со-
става нейтрализованного едким натром начального раствора Н
(Н') лежит в поле кристаллизации соды. Следовательно, сода бу-
дет первой твердой фазой, выпадающей в процессе изотермической
выпарки. На этом этапе сода может быть выделена наиболее
полно (свыше 80%) при 150°. В процессе дальнейшей выпарки
солевой состав жидкой фазы изменяется вдоль изотермы от точки
М (М') до точки Е (Е7) и затем до точки F (F'). На этом пути
Методы производства поташа
199
в твердую фазу выделяется смесь соды и глазерита. В точке Е
(£') глазерит взаимодействует с К2СО3, превращаясь в Na2CO3 и
K2SO4. По окончании этого превращения в твердую фазу выде-
ляются сода и сернокислый калий. В точке F (£') раствор насы-
щен содой, сернокислым калием и двойной солью (табл. 19).
ТАБЛИЦА 19
Состав растворов в точке F (F') насыщения солями
Na2CO3 • хН2О + KNaCO3 • ДН2О + K2SO4 при разных температурах
Состав раствора,
вес. %
Состав раствора
в пересчете на сухое
вещество, вес. %
Твердые фазы
25 17,02 21,00 0,75 54,16 43,90 1,94
35 45,60 6,70 Следы 87,20 12,80 Следы
50 45,10 7,22 86,30 13,70
75 44,20 8,14 84,50 15,50
100 43,59 9,18 0,31 82,12 17,30 0,53
150 45,82 8,95 0,74 82,50 16,10 1.40
Na2CO3.7H20 + Na2CO3.K2CO3.6H2O + K2SO4
Na2CO3«H2O + Ка2СОз.КаСОз 4- K2SO4
То же
Na2CO3 + Na2CO3« К2СО3 + K2SO4
Из данных табл. 19 следует, что K2SO4 выделится наиболее
полно при проведении второго этапа выпарки при температуре не
выше 75°, так как уже при 100° содержание K2SO4 в жидкой фазе
начинает увеличиваться. После отделения соды, загрязненной
сульфатом калия, маточный раствор F (£'), имеющий плотность
1,52 г!см3, подвергается дальнейшей выпарке. На этой третьей
стадии выпарки состав жидкой фазы изменяется вдоль изотермы
от точки F (F') до точки G( G') (табл. 20).
габл ицд»о
Состав растворов в точке G (О') насыщения солями
К2СО3 • Na СО3 • уН2О + K2SO4 + К2СО3 • 1,5Н2О при разных температурах
Состав раствора
вес. %
Состав раствора
в пересчете на сухое
вещество, вес. %
Твердые фазы
25 48,10 5,02 0,63 89,45 9,35 1,17
35 49,95 4,17 Следы 92,28 7,72 Следы
50 52,10 3.21 94.20 5,80
75 56,00 2,01 96,55 3,45
100 59,38 1,03 0,07 98,18 1,70 0,12
150 66,81 1,15 0,25 97,94 1,70 0,36
K2CO3.Na2CO3.6H2O + K2SO4 + К2СО3.1,5Н2О
КгСОз’ЫагСОз + K2SO4 4- К2СО3.1,5Н2О
То же
> >
Наиболее целесообразна выпарка на третьей стадии при 100°
(жидкая фаза содержит 98,18% К2СО3 в пересчете на сухое ве-
щество, ее плотность 1,62 г/см2).
200
Гл. VI. Поташ
Моточ/wS p!?cmffop
Исходный щепок
Рис. 56. Принципиальная схема
получения чистого поташа из
содо-поташных растворов
глиноземного производства (с
применением окислительной
прокалки поташа).
Выделившуюся в осадок в процессе третьей выпарки двойную
соль, загрязненную сульфатом калия, отделяют и возвращают на
смешение с начальным щелоком. Даль-
нейшая переработка маточного рас-
твора зависит от способов борьбы с
накоплением примесей — главным об-
разом иона хлора и неокисленных со-
единений серы. Эти соединения легко
растворимы и остаются в растворе до
завершения процесса, накапливаясь в
товарном продукте, если производст-
венный цикл является замкнутым.
Получение поташа высокого каче-
ства из неокисленных растворов воз-
можно посредством систематического
вывода маточного раствора после кри-
сталлизации углекислого калия (не
замкнутый производственный цикл).
Отводимый маточный раствор высу-
шивают для получения поташа, за-
грязненного неокисленными соедине-
ниями серы25. Маточный раствор пос-
ле третьей выпарки и отделения двой-
ной соли дополнительно выпаривают
при 75—100°, в результате чего частич-
но выделяется КгСОз-1,5Н2О (осадок
собирается в солесборнике выпарного
аппарата). Жидкую фазу охлаждают
до 25°, при этом кристаллизуется до-
полнительное количество КгСОз-
•1,5Н2О. Смесь обоих осадков кристал-
лического поташа промывают насы-
щенным раствором поташа, получен-
ным в предыдущей операции. Промыв-
ка идет полнее при предварительном пе-
ремешивании осадка с частью промыв-
ного раствора. Вторичную промывку
осуществляют непосредственно на
фильтре или центрифуге. По этой схеме
частично получается кристаллический
поташ, содержащий (в % на сухое
вещество): К2СО3—99,0, Ма2СОз—0,3,
K2SO4—0,2, окисляемых соединений (в
пересчете на K2SO3)—0,05, Ре20з—0,001.
Второй возможный путь, позволяющий выпускать весь поташ в
виде высококачественного продукта, — окисление соединений серы.
Методы производства поташа
201
Из испытанных25 средств окисления (перекись водорода, персуль-
фаты, воздух в присутствии катализаторов и окислительная про-
калка) наиболее эффективна окислительная прокалка поташа.
Схема получения поташа с окислительной прокалкой (рис. 56)
одинакова с другими вариантами вплоть до третьей выпарки и от-
деления двойной соли, далее раствор высушивают и прокаливают
в течение 3 ч при 600° с доступом воздуха. В этих условиях степень
окисления соединений серы до сульфата калия достигает 96—98%.
Прокаленный поташ растворяют в воде при 25° с таким расчетом,
чтобы образовавшийся K2SO4 остался нерастворенным. Последний
отфильтровывают, а раствор выпаривают при 75° и охлаждают до
25°, как это описано выше. После промывки кристаллический по-
таш является готовым продуктом. Маточный раствор возвращают
в процесс (замкнутый производственный цикл).
Поташ, полученный по описанной схеме, имел следующий со-
став (в % на сухое вещество): К2СО3— 99,4, Na2CO3— 0,2, K2SO4—
0,05, окисляемых соединений (в пересчете на K2SO3)—до 0,01,
Fe2O3— до 0,001, Сг2О3— 0,00004, V2O5 — 0,0001. Такой поташ при-
годен для производства хрусталя. \
Производство поташа карбонизацией раствора едкого кали
При электролизе хлорида калия по диафрагменному способу
получается раствор, содержащий 145 г/л КОН и 180 г/л КС1. Для
отделенит КС! раствор концентрируют до 44,6—47,1% КОН (плот-
ность 1,47—1,50 г/см3) и затем охлаждают. При 20—30° в растворе
остается лишь около 1% КС1. После отделения выделившегося хло-
рида калия раствор разбавляют до концентрации около 30% КОН
(плотность 1,3 г/см3) и подвергают карбонизации в колонне с на-
садкой из керамических колец 13’26’50. (При электролизе хлорида
калия в ванне с ртутным катодом получается раствор КОН, содер-
жащий лишь сотые доли процента хлоридов, и его карбонизуют
без предварительной очистки.)
Запатентован51 способ двухступенчатой карбонизации концен-
трированного 50% раствора КОН; при этом с большей полнотой
используется СО2 из топочного газа. В I ступени в противоточном
абсорбере карбонизации газом, содержащим ~10% СО2, подвер-
гается циркулирующий здесь раствор смеси КОН и К2СО3. К выте-
кающему раствору добавляют свежий раствор КОН и 90% этого
абсорбента возвращается в абсорбер, а 10% передается во II сту-
пень абсорбции, где точной дозировкой СО2 (например, жидкой СО2
Из баллонов) достигается полная нейтрализация КОН до К2СО3.
Во избежание кристаллизации К2СО3 в I ступени ведут процесс
при 40—100°, подавая в абсорбер раствор с отношением
КОН: К2СО3, равным 1 : 1, и карбонизуя здесь 90% КОН.
202
Гл. VI. Поташ
Дальнейшую переработку карбонизированных растворов произ-
водят по схеме рис. 57. Раствор углекислого калия выпаривают в
трехкорпусной вакуум-выпарной батарее. Концентрированный рас-
твор высушивают на непрерывно действующих вакуум-вальцах,
обогреваемых паром. Высушенный продукт прокаливают в вакуум-
ных барабанных сушилках периодического действия с паровой ру-
башкой (давление пара 12 ат). Этим методом получают поташ с
Рис. 57. Схема получения поташа карбонизацией растворов КОН:
1 — карбонизационная колонна; 2 н 7 —сборники; 3 — напорный бак; 4 — вакуум-выпарной аппа-
рат; 5 - конденсатор; 6 — барометрический ящик; 8 — вакуум-вальцы; 9— циклон; 10 и 13 - транс-
портеры; —барабанная сушилка; 12 — конусный ящик; 14 — элеватор; 15 — бункер.
содержанием 98 % КгСО» и около 1% КС1. Для выпуска более чи-
стого поташа (по содержанию хлоридов) последний очищают пе-
рекристаллизацией.
В ГДР поташ получают также из смеси растворов, содержа-
щих КОН и КгСОа (отходные растворы от производства перманга-
ната, бихромата калия и др.). Растворы карбонизуют в цилиндри-
ческих сосудах и очищают от взвешенных частиц фильтрованием
на фильтрах Келли. Очищенный раствор выпаривают до выделения
кристаллов К2СО3 • 1,5Н2О. Маточный раствор из солесборника
(с ложным дном) возвращают обратно в процесс. Кристаллы из
солесборника смывают сырым раствором и пульпу перекачивают
насосом на центрифугу. Поташ поступает затем в прокалочный ба-
рабан, обогреваемый газовым топливом. Газы из барабана очи-
щают в циклоне и орошаемой водой башне, насаженной коксом.
Прокаленный поташ охлаждают в барабане, орошаемом снаружи
водой и измельчают в дезинтеграторе.
Методы производства поташа
203
Формиатный метод получения поташа
Этот метод состоит 26’31,82 в каустификации известковым моло-
ком в присутствии окиси углерода природного промытого K2SO4.
Окись углерода образует с выделяющейся щелочью муравьино-
кислый калий:
K2SO4 + Са(ОН)2 + 2СО = CaSO4 + 2НСООК
Реакцию осуществляют в автоклаве с мешалкой при 200° (на-
грев паром под давлением 32 ат). Очищенный от H2S, SO2 и СО2
генераторный газ подают в автоклав под давлением 30 ат. Время
реакции составляет 45 мин. Работают поочередно два автоклава.
Реакционная пульпа поступает в резервуар-экспанзер, где выде-
ляется пар, используемый для подогрева смеси, идущей в автоклав.
Затем раствор декантируют, а сгущенную пульпу, содержащую
осадок CaSO4, отфильтровывают и промывают на барабанных ва-
куум-фильтрах. Осветленная жидкость содержит (в г/л): НСООК
165—175, СаО 6—8, K2SO4 9—11. Для отделения СаО к раствору
добавляют К2СО3, и образовавшийся углекислый кальций отде-
ляют на фильтрпрессе. Раствор концентрируют до плотности
1,55 г/см3 в четырехкорпусной выпарной батарее, после чего его
охлаждают до 20° для выделения K2SO4, который снова используют
в производстве. Раствор выпаривают при 190° в открытых котлах
с змеевиками, обогреваемыми паром высокого давления. В котлах
получают расплав следующего состава (в %): НСООК — 90;
КС1 — 0,4; К2СО3 — 2,5; K2SO4 — 0,1; ЫагСОз— 0,3. Горячий рас-
плав сохраняют в промежуточных сборниках с змеевиками при
температуре не ниже 160°, откуда его подают во вращающиеся печи
на кальцинацию и окисление воздухом при 800°. Образование угле-
кислого калия происходит по реакции:
2НСООК + О2 = К2СО3 + Н2О + СО2
Плав К2СО3 выгружают из печи специальным скребком. Гото-
вый продукт имеет следующий состав (в %): КгСОз — 98;
КО— 0,25; K2SO4 — 0,2; ЫагСОз — 0,3; Fe — 0,0005; не раствори-
мый в воде остаток — 0,01.
Триметиламиновый метод получения поташа
Этот метод 13’53-55 заключается в обработке раствора хлорида
калия (1 часть) и триметиламина (4 части) двуокисью углерода
под давлением и при перемешивании:
КС1 + N(CH3)3 + СО2 + Н2О = КНСО3 + N(GH3)3 • HG1
При охлаждении выпадает кристаллический бикарбонат калия,
который легко отделяется от раствора солянокислого триметил-
204
Гл. VI. Поташ
амина. Последний снова превращают в свободный триметиламин
2[N(CH3)3 • НС1] + Са(ОН)2 = 2N(CH3)3 + СаС12 4- 2Н2О
а бикарбонат переводят в карбонат прокаливанием.
Предложен 56-58 аналогичный процесс с применением гексаме-
тиленимина (отхода производства гексаметилендиамина)—от 1 до
1,4 части на 1 часть КС1. Концентрация водного раствора гексаме-
тиленимина 42—50%. При температуре реакции 20—40° степень
использования КС1 70—90%. После отделения бикарбоната калия
к раствору добавляют известь и регенерируют гексаметиленимин
отгонкой при 93—95°.
ЛИТЕРАТУРА
1. В. М. Р о м м, Абсорбция газов, Изд. «Химия», 1966, стр. 53, 669, 679. —
2. М. А. Людковская, С. Д. Фрид май, В. А. Клевке, Хим. пром., № 5,
339 (1965). — 3. Н. Н. Егоров, М. М. Дмитриев, Д. Д. 3 ы к о в,
Ю. Н. Бродский, Очистка от серы коксовального и других горючих газов,
Госметаллургиздат, I960.— 4. И. А. Токмакова, Применение растворов и бе-
тонов с добавкой поташа при производстве строительных работ в зимнее время,
Госстройиздат, 1963. — 5. А. А. Трипольский, Л. Г. Чериега, Хим. пром.,
№ 9, 675 (1963). — 6. И. М. Стребков, Химия в сельском хозяйстве, № 4,
16 (1964). — 7. Chem. Week, № 2, 38 (1963). — 8. А. В. Петербургски^
Производство и применение сложных удобрений во Франции, Сельхозгиз, I960.—
9. П. М. Лукьянов, История химических промыслов и химической промышлен-
ности России, Изд. АН СССР, т. I, 1948; т. II, 1949; т. III, 1951. —10. В. W а е-
s е г, Chem. Ind., 5, № 5, 413 (1953)
11. В. Waeser, Chem. Ztg., 77, № 10/11, 323, 359 (1953).— 12. П. М. Лукь-
янов, Курс химической технологии минеральных веществ, ч. II, Химтеорет,
1932. — 13. Н. Д. Деркачев, Поташное производство, Химтеорет, 1932.—
14, В. О. Седли с, Химические товары и строительные материалы, Изд. Кубуч,
1933. — 15. П. Н. Коваленко, Уч. зап. Ростовск. на Дону ун-та, 25, № 7, 99
(1955). —16. П. Н. Рощин, Жури, сахари, пром., № 4—5 (1928).—
17. А. И. С к и р с т ы м о и с к и й, сб. «Пищевая промышленность СССР», № 3,
1946. —18. А. А. Соколовский, Автореф. докт. дисс., ЛТИ им. Ленсовета,
1955. — Iff. Т. И. Кузнецова, К- Л. Павлова, Труды НИИХП, в. 4, 1956,
стр. 61. — 20, И. Л. Талмуд, Хим. наука и пром., 2, № 6, 692 (1957).
21. С. И. Белозуб, Тезисы докладов и сообщений на Всесоюзном совеща-
нии работи. содовой пром., Пермь, 1958, стр. 93. — 22. А. Ф. Борячек,
Д. И. К у х а р е в, Труды НИОХИМ т. 10, 1957, стр. 67. — 23. Г. С. С е д е л ь и и-
к о в, Автореф. докт. дисс., ИОНХ АН СССР, 1954. — 24. Г. С. Седельников,
А. И. Лазарева, Хим. пром., № 5, 401 (1959). — 25. А. А. Соколовский,
Т. И. Кузнецова, К- Л. Павлова, Хим. наука и пром., 2, № 4, 533 (1957) .—
26. В. Ф. Чернов, Производство кальцинированной соды, Госхимиздат, 1956,—
27. Г. И. Чуфаров, В. С. Киутарев, ЖХП, № 3, 232 (1931).—
28. Н. Н. Heimann, Bull. Res. Council Israel, C5, № 1, 113 (1955). — 29. Bull.
Res. Council Israel, C5, № 1, 115 (1955).—30. H. M. Bhavnagary, Chem.
Age (India), 19, № 2, 110 (1968).
31. В. А. Лобанов, В. А. Шестакова, авт. свид. 209426, 1966. —
32. А. А. Соколовский, И. М. Богуславский, Т. И. Кузнецова,
Труды НИИХП, в. 2, 1955, стр. 3. — 33. И. С. Га линкер, А. С. Потер яйко,
Труды ВИСП, т. 6. 1952, стр. 27. — 34. J. Е. Т е е р 1 е, The Industrial Development
Searles Lake Brines. 1929. — 35. А. А. Соколовский, ЖПХ, 29, № 5, 743
(1956). -36. W. S. Biasdale, J. Am. Chem. Soc., 45, 2938, 2944 (1923).—
Литература
205
37. В. Г. И и ж е ч и к, А. В. Я и у ш, Хим. поом., № 1, 39 (1955).— 38. JX.1A. Гинз-
бург, ЖПХ, 38, № 1, 55 (1965); 42, № 5, 994 (1969).— 39. М. И. Руиов,
А. С. Романец, В. К. Дружинин, Труды НИОХИМ, т. 19, 1969, стр. 284. —
40. К. И. Дворниченко, Е. Е. Мареиич, авт. свид. 181066, 1964; сб. «Хи-
мическая промышленность Украины», № 4 (26), 1966, стр. 20.
41. С. У. Гор и ев, Автореф. каид. дисс., Харьковский политехи, ин-т, 1953;
Труды ВИСП, т. 9, 1956, стр. 36. — 42. Н. П. Л у ж и а я, С. Н. К о с я ч к о в а,
ИСФХА АН СССР, 25, 345 (1954); 26, 259 (1955); 27, 358 (1956); С. Н. К о с я ч-
к о в а, АвтореФ. канд. дисс., ИОНХ АН СССР, 1954. — 43. П. С. Богоявлен-
ский, А. С. Мананникова, Сборник научных трудов Львовского гос. вете-
ринарно-зоотехнич, ии-та, № 6, 1953, стр. 376. — 44. G. Ervin, С. Е. McCart-
hy, Ind. Eng. Chem., 36, № 5, 415 (1944). — 45. А. Ф. Борячек, H. H. Д р о-
зии, 3. К- Зубахина, М. И. Купи и а, ЖПХ, 28, № 1, 100 (1955).—
46. Л. С. И тки на, В. Ф. Кохова, ИСФХА АН СССР, 26, 242 (1955).—
47. Л. С. Иткина, В. Ф. Кохова, ЖНХ, 1, № 7, 1665 (1956). — 48. С. 3. Ма-
каров, М. П. Шульгина, Изв. АН СССР. ОХН, № 4, 510 (1940).—
49. М. И. Р а в и ч, Л. С. Иткина, В. Ф. Кохова, ИСФХА АН СССР, 25, 350
(1954). — 50. М. X. Кишиневский, ЖПХ, 30, № 2 (1957).
51. Пат. США 3254946, 1964; Англ. пат. 1050410, 1964; Норвеж. пат. 109199,
1964. — 52. Ost-Rassow, Lehrbuch der Chemischen Technologie, 1941,
S. 311, — 53. Орт ли б, герм. пат. 5786, 1878; 9376, 1879; 13397, 1880. — 54. Австр.
пат. 178910, 1954. — 55. Австр. пат. 178911, 1954.— 56. С. А. Крашенинников,
И. Н. Ш окии, В К. Новиков, авт. свид. 186407, 1965.— 57. В. К. Нови-
ков, И. Н. Шоки и, Г. А. Крашенинников, Труды МХТИ им. Д. И. Мен-
делеева, в. 56, 1967, стр. 152. — 58. Л. В. Киреева, И. Н. Шок ин, С. А. Кра-
шенинников, Там же, в. 60, 1969, стр. 7.
Глава VII
БРОМ И ЕГО СОЛИ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Бром Вг2— красновато-бурая жидкость, образующая бурье
пары; плавится при —7,25°, кипит при 58,78°. Плотность жидкого
брома 3,187(1—0,0010860 ja/сл*3. Теплоемкость: кристаллов
0,0898 кал/г (—20,7°), жидкости 0,1071 к.ал]г (0—57°) и пара
0,0553 кал!г (83—228°). Теплота плавления 16,14 кал!г\ теплота
парообразования 44,8 кал)г. Коэффициент расширения 0,0011 на
1 градус (20—30°).
Бром растворим в воде и во многих органических растворите-
лях— эфире, сероуглероде, четыреххлористом углероде, хлоро-
форме, керосине. Растворимость брома в 95%-ной серной кислоте
при 25° 0,75%. Растворимость воды в броме при 22°0,046%. Насы-
щенный водный раствор содержит при 760 мм рт. ст. 3,22—3,41%
брома в интервале 20—50°. Из насыщенного водного раствора ниже
5,84° выделяется Вг-8Н2О.
Константа гидролиза 1 брома
Вг2 4- Н2О = НВгО + Н+ + Вг“
[НВгО] [Н+] [Вг~]
[Вг2]
при 0° равна 0,7-10“9, при 20° — 5,2-10-9 и при 35° — 11,3- ЮЛ
При нагревании бромноватистая кислота переходит в бромно-
ватую:
ЗНВгО = НВгО3 + 2НВг
Сульфаты и нитраты понижают растворимость брома в воде, а
хлориды и бромиды ее повышают, так как бром с ионами Вг~ иС1“
образует комплексные соединения:
Вг2+ВГ=Вгз; 2Вг2 + Вг" = Brj; Вг2 + СГ = Вг2СГ
Физико-химические свойства
207
Для разбавленных растворов бромистого калия (0,01—1,0 н.)
константа равновесия для первой из этих реакций ~ 16, а для вто-
рой ~40.
Давление пара жидкого брома при 0° 65,9, при 20° 173, при 40°
392 мм рт. ст. Давление пара брома над его водными растворами
подчиняется закону Генри — Дальтона при учете количества гид-
ролизовавшегося брома или при подавлении гидролиза2-4. Коэф-
фициент распределения брома Н (равновесное отношение концен-
трации брома в газовой фазе к концентрации его в растворе) для
его водных растворов4 зависит от температуры:
t, °C..............
Н..................
0 10 20 30 40 50 60
0,0158 0,0287 0,0434 0,0653 0,0935 0,1275 0,1652
Бром сильно разрушает кожу; пары его даже в малых концен-
трациях разрушают слизистые оболочки. Предельно допустимая
концентрация брома в воздухе
0,002 мг в 1 л; смертельная кон-
центрация (при 30—60-минутном
воздействии) 0,05 мг в 1 л.
Бромистый натрий NaBr об-
разует кристаллогидраты (рис.
58). Насыщенный водный рас-
твор кипит при 12Г. NaBr-2H2O
кристаллизуется в моноклинной
системе и имеет плотность
2,18 г!см\ безводная соль кри-
сталлизуется в кубической систе-
ме, имеет плотность 3,2 г/см^ и
плавится при 755°.
Бромистый калий КВг кри-
сталлизуется в безводной форме
в кубической системе с плотно-
стью 2,75 a/cjH3; температура пла-
вления 730°.
Бромистый аммоний NH^Br
кристаллизуется в безводной фор-
ме в кубической системе с плотно-
стью 2,43 г! см?. При 542° возгоняет -
Рис, 58. Растворимость бромидов
калия, натрия и аммония в воде.
ся,частично при этом разлагаясь.
Бромистое железо FeBr2 — кристаллы зеленого цвета, от при-
сутствия бромного железа приобретают красный или красновато-
бурый оттенок. Бромистое железо образует ряд кристаллогидратов 5
(рис 59). Насыщенный раствор FeBr2 кипит при 132°. Безводная
соль кристаллизуется в гексагональной системе, имеет плотность
4,64 г)см? и плавится при 684°; гексагидрат кристаллизуется в ром-
бической системе.
208
Гл. VII. Бром и его соли
Бромноватокислые калий КВгО3 и натрий NaBrO3 кристалли-
зуются в безводной форме, при нагревании до 370—380° разла-
гаются с выделением кислорода. КВгО3 образует кристаллы триго-
нальной системы с плотно-
стью 3,27 г)см\ NaBrO3 —
кубической системы с плот-
ностью 3,34 г!см?.
ПРИМЕНЕНИЕ
Элементарный бром яв-
ляется исходным веществом
для получения его органиче-
ских и неорганических со-
единений. Бромиды приме-
няют в медицине, фотокино-
технике, производстве неко-
торых красителей и фарма-
Рис. 59. Политерма растворимости в системе
FeBr2—Н2О.
цевтических препаратов.
Для медицинских целей ис-
пользуют и многие органи-
ческие соединения брома (бромалин, бромистую камфару, бром-
урал, ксероформ и др.). Броматы используют в аналитической хи-
мии (броматометрия) и в хлебопечении. Наибольшее количество
брома и его солей (NaBr, FeBra) применяют для синтеза бром-
органических соединений, используемых в качестве антидетонирую-
щих добавок к моторному топливу (бромистый этил, дибромэтан
и др.), хладагентов (бромфреоны), огнетушащих средств (броми-
стый метилен), фумигантов (бромистые метил, этил и др).
В США начали использовать бром для санитарной обработки
воды. Расширяется применение бромидов для получения металлов
высокой чистоты,
Технический бром выпускают трех сортов, содержащих не ме-
нее 99,9, 99,7 и 99,2% брома; ГОСТ 454—70 регламентирует нали-
чие в нем примесей хлора, сульфатов, воды, органических и
нелетучих веществ. Перевозка и хранение жидкого брома
требует соблюдения больших предосторожностей. Жидкий
бром транспортируют в стальных баллонах емкостью 40—320 л,
футерованных свинцом, или в специальных цистернах, плакирован-
ных никелем или футерованных свинцом. Тарой для малых коли-
честв брома служат толстостенные стеклянные бутыли с притер-
тыми пробками, защищенные от света6-9. Осушенный жидкий бром
(содержащий меньше 0,01% воды) можно транспортировать при
температуре ниже 20—25° в баллонах из углеродистой стали (Ст. 3)
и при 25—50° в баллонах из хромистой стали (1Х13)10’11. Для за-
щиты нержавеющей стали рекомендуют12 добавлять в жидкий
Сырье
209
бром малые количества двуокиси азота или крепкой азотной кис-
лоты.
В СССР основным продуктом, в виде которого выпускается
бром, является плав бромистого железа, состоящий из смеси че-
тырех- и шестиводного кристаллогидратов. Согласно ГОСТ
9814—61, плав должен содержать не менее 49% брома, не более
3% хлора (от количества брома) и 0,3% Fe3+. Тарой для плава
служат стальные барабаны с двойным швом емкостью 100—130 кг.
’Продукт, более богатый бромом, — бромисто-бромное железо
(Fe3Brg • иН2О), почти не выпускают из-за большой агрессивности
по отношению к стальной таре. Бромистое железо может транспор-
тироваться в обычных железнодорожных цистернах в виде кон-
центрированных растворов (содержащих 31,3—33,6% Вг зимой и
35,2—38,1% Вг летом), если содержание Fe3+ в растворе не превы-
шает 0,3% и в него в качестве ингибитора добавлен уротропин
(0,25%)13. При перевозке в футерованных цистернах уротропин не
добавляют, а количество бромного железа в растворе не ограничи-
вается.
Мировое производство брома в настоящее время находится на
уровне 150 тыс. т в год (без СССР)!4-16.
СЫРЬЕ
Содержание брома в земной коре составляет 1 • 10-3 вес. %.
Бром находится в природе в виде солей. Основными источниками
Для промышленного получения брома являются: воды океанов, со-
держащие в среднем 67 г брома в 1 м3; некоторые рассолы соля-
ных озер и буровые воды нефтеносных районов, содержащие
0,2—3,5 кг брома в 1 м3, а также маточные щелоки, получающиеся
при переработке карналлита и сильвинита, содержащие 0,6—4,5 кг
брома в 1 м3. Все эти растворы помимо бромидов обычно содержат:
Cl , SO2 , НСОз, СО2 , Na+, К+, Са2+, Mg2+, а также довольно
часто I-, В4О2 , HS~, S2 , NH4, Fe2+, Мп2+ и органические веще-
ства. Соленость рассолов колеблется от 30 до 390 а/л, а темпера-
тура от —20° (озерные рассолы зимой) до 75° (высокотермальные
буровые воды).
Извлечение брома обычно выгоднее производить из рассолов,
более богатых бромидами. Но не только содержание брома в ис-
ходном сырье определяет экономические показатели процесса;
практически очень важными факторами являются температура, со-
леность, щелочность и состав рассола. Так, при повышении темпе-
ратуры и содержания иона SO2-, а также при уменьшении соле-
ности (или при очень большой солености рассола) в процессе
извлечения брома увеличивается давление его пара над рассолом
и тем самым снижается расход пара или электроэнергии на произ-
водство. Повышение щелочности рассола увеличивает расход
210
Гл. VII. Бром и его соли-
кислоты, требующейся для подавления гидролиза брома. Неблаго-
приятным фактором является наличие в рассолах веществ (HS-,
S2-, NH+, Fe2+, Мп2+, органические вещества и т. д.), взаимодей-
ствующих с хлором, который вводится для окисления бромидов,
ибо это связано с возрастанием его расхода. Присутствие в исход-
ном рассоле органических веществ затрудняет извлечение, снижает
выходы и загрязняет получающийся бром (из-за образования
бром- и хлорорганических веществ), особенно при отгонке паром.
ПОЛУЧЕНИЕ БРОМА
Все применяемые в промышленности способы получения брома
из природных вод основаны на окислении бромидов до элементар-
ного брома с последующим извлечением последнего из раствора.
Окисление бромидов обычно производят хлором или хлорной во-
дой. При наличии в исходном рассоле, помимо бромидов, еще и
иодидов извлечение брома можно осуществлять как до, так и после
извлечения иода (см. гл. VIII). При этом следует учитывать, что
если сначала извлекают иод, применяя для этого твердые сорбенты
(активированный уголь, аниониты), то последние могут поглощать
до 6% содержащегося в растворе Вг" (количество теряемого при
этом брома зависит ог солености и состава раствора, видов окисли-
телей и сорбентов) 17’18.
Извлечение элементарного брома из рассолов после окисления
производят отгонкой паром или десорбцией воздухом6'18-24.
Отгонка брома паром :
Извлечение брома по этому способу осуществляют в колоннах
непрерывного действия при одновременном хлорировании рассола
и отгонке выделяющегося брома водяным паром. Часто применяют
колонны системы Кубиершского — башни высотой 5,5—6 м, сло-
женные из толстых (18—20 см) гранитных, андезитовых или беш-
таунитовых плит и имеющие внутреннее сечение 1,5X0,8 м. Внутри
колонна разделена горизонтальными перегородками на 7—8 камер.
Для сообщения камер между собой в перегородках имеются отвер-
стия, перекрытые керамиковыми колпачками, образующими гид-
равлические затворы. Для свободного прохода газа в двух отвер-
стиях каждой перегородки установлены широкие керамиковые
трубы. В каждой камере горизонтально уложены керамиковые
дырчатые плиты (на расстоянии 4—5 см), служащие насадкой.
Бромсодержащий рассол, нагретый в теплообменнике и в подо-
гревателе до 80—90°, поступает в колонну сверху. Газообразный
хлор подают в третью снизу камеру, а в нижнюю — водяной пар
(1,5—2 ат) для нагрева рассола до кипения (106—120°); пар дви-
жется по тому же пути, что и хлор. Хлор, растворяясь в рассоле,
вытесняет из его солей бром, переходящий в газовую фазу.
Получение брома
211
Наличие в исходном рассоле ионов НСО3_ и СО|~ приводит при
хлорировании (при ~100°) к образованию хлоратов;
ЗСО2- + ЗС12 = CIO3 + 5СГ + ЗСО2
6НСО3 + ЗС12 = СЮз + 5СГ + 6СО2 + ЗН2О
Хлораты при высоких значениях pH не являются окислителями,
и затраченный на их образование хлор теряется. Для снижения
расхода хлора рассолы предварительно подкисляют25 до рН =
= 2,5—6,0 серной (иногда соляной) кислотой, вводя ее в рассоло-
провод после подогревателей или в поглотительную колонну. Выхо-
дящий из колонны отработанный рассол стекает в резервуар, за-
полненный железными стружками, где оставшиеся в рассоле сво-
бодные галогены и их кислородные соединения частично (на
40—50%) связываются и превращаются в соли железа.
Для окончательного удаления свободных галогенов и предот-
вращения коррозии теплообменника отработанный рассол нейтра-
лизуют тиосульфатом натрия:
Na2S2O3 + 4Вг2 + 5Н2О = Na2SO4 + 8HBr + H2SO4
Во избежание повышения кислотности рассола в нейтрализатор
добавляют раствор соды или магнезиальное молоко (если в рас-
соле содержится мало SO? —известковое молоко) до слабощелоч-
ной реакции (рН = 8—10).
Пары брома, воды и остаток газообразного хлора поступают из
колонны в керамический водяной холодильник, где бром и вода
конденсируются. Содержание хлора в сыром броме составляет
3—5%. После разделения несконденсировавшийся хлор и бромная
вода (3,1—3,4 % Вг2) поступают обратно в колонну, а жидкий бром
рафинируется в небольшой керамической колонне с насадкой, обо-
греваемой горячей водой (65—75°). Содержащийся в сыром броме
хлор испаряется и поступает обратно в колонну, а частично испа-
рившийся бром конденсируется в керамическом обратном холо-
дильнике. Количество хлора в жидком броме зависит от темпера-
турного режима рафинера, так как температура кипения жидкого
брома понижается от содержания в нем хлора (рис. 60)26; ее под-
держивают в интервале 45—54°.
Колонна Кубиершского перерабатывает 200—270 м3 рассола в
сутки на 1 м2 поперечного сечения; количество переработанного
рассола снижается с увеличением начального содержания в нем
брома, но производительность при этом повышается. В этих колон-
нах эффективно работает сравнительно небольшая часть объема.
Более эффективны колонны Кальтенбаха27, в которых паро-газовая
смесь переходит из камеры в камеру не по трубам, а по каналам
внутри стен, что увеличивает реакционный объем и равномерность
контакта фаз. Колонны Кальтенбаха перерабатывают около 500 м3
212
Гл. VII. Бром и его соли '
Рис. 60. Состав пара и жидкости при
температурах кипения смесей брома и
хлора:
1 — жидкость; 2 — пар.
рассола в сутки на 1 л2 сечения. На американских заводах отгонку
брома из рассола паром производят в башнях с насадкой из колец
Рашига. Выход по брому при
отгонке его мало зависит от
применяемой аппаратуры и ко-
леблется в пределах 80—95%,
в зависимости от состава сырья
и содержания в нем брома.
В сбросном рассоле, в зависи-
мости от конструкции колонны,-
содержится 0,05 — 0,15 кг/м3
брома (приблизительно поров-
ну в виде Вг~ и Вг2). Иногда
вследствие забивания аппа-
ратуры (колонн, трубопрово-
дов и т. д.) твердыми отложе-
ниями, а также сильного вспе-
нивания рассола происходит
снижение производительности
колонн. Это обычно вызывает-
ся наличием большого количе-
ства взвеси, пересыщенностью
поступающих рассолов и на-
личием поверхностно-активных
веществ. Поэтому рассолы предварительно отстаивают или фильт-
руют и разбавляют водой (в случае пересыщения). Иногда причи-
ной забивания аппаратуры яв-
ляется выделение малораство-
римых веществ в процессе на-
гревания, подкисления и хло-
рирования исходных рассолов.
Последнее в основном связано
с разрушением бикарбонатов,
образованием гипса и двуокиси
марганца, гидролизом солей
трехвалентного железа и т. д.
Когда в исходном рассоле на-
ходится значительное количе-
ство органических веществ, по-
лучаемый бром может содер-
жать до 3,5—4% броморгани-
ческих веществ (бромоформа,
тетрабромметана, бромуксус-
ной кислоты и др.) 28~30, которые отделяют дистилляцией, иногда с
предварительной обработкой брома концентрированной серной ки-
слотой или бромидами31.
Рис. 61. Расход пара иа 1 т брома в за-
висимости от его содержания в рассоле.
Получение брома
218
Экономическая эффективность способа отгонки брома паром в
основном определяется расходом пара, который увеличивается с
уменьшением концентрации брома в исходном рассоле и с пониже-
нием его температуры. На рис. 61 приводятся данные по расходу
пара на 1 т брома для рассола из Сакского озера (10—20°), из ко-
торых видно, что при концентрации брома менее 1 кг в 1 м3 расход
тепла становится столь большим, что извлечение брома этим мето-
дом оказывается экономически не целесообразным. Для получения
1 т брома в зависимости от состава исходного рассола расходуют;
хлора 0,53—1 т, серной кислоты 0—3 т; соды кальцинированной
60—200 кг, тиосульфата натрия 12—45 кг, стружек железных
10—40 кг, электроэнергии 150 — 300 квт-ч, воды пресной
100—200 м3. Расход исходного рассола составляет 106—130% от
теоретического.
Десорбция брома воздухом
Этот способ более распространен в промышленности, чем от-
гонка паром, так как дает возможность извлекать бром из низко-
процентного сырья, не требует сложной аппаратуры и легко может
быть автоматизирован.
Рис. 62. Схема извлечения брома из рассолов методом воздуш-
ной десорбции:
1 — напорный бак для рассола; 2— регулирующее устройство для кислоты;
3 — регулирующее устройство для хло,ра; 4 — хлоратор; 5 — десорбер; 5—брызго-
уловитель; 7 —башня для хлорочистки; 8 — бак для хлорочнстнтельного ра-
створа; 9 — насос; 10 — хемосорбер; /У —вентилятор для воздуха; /2 —бак
для сорбента; 13 — нейтрализатор,
Бромсодержащие рассолы подкисляют серной или соляной кис-
лотой до рН = 3—3,5, а затем в них вводят окислитель для пере-
вода Вг~ в Вг2 (на некоторых заводах, где исходный рассол имеет
pH <5,5, его не подкисляют)32-33.
Рассол, содержащий растворенный бром, поступает в верх-
нюю часть башни выдувания (десорбер, рис. 62), где стекает по
«14
Г л. VII. Вром и его соли
насадке. Навстречу рассолу из окон, находящихся у днища десорбе-
ра, поступает мощный поток воздуха, который извлекает растворен-
ный бром. Полученная бромо-воздушная смесь, содержащая некото-
рое количество хлора и другие примеси, проходит брызгоуловитель и
хлороочистительную башню, а затем поглотительные башни (хемо-
сорберы), где бром улавливается. Отработанный воздух выбрасы-
вается хвостовым вентилятором в атмосферу или направляется
вновь в десорбционную башню. Во избежание проникновения брома
в атмосферу цеха вся аппаратура работает под вакуумом, за иск-
лючением воздуховода после хво-
стового вентилятора.
Подкисление исходного рассо-
ла и окисление бромидов хлором
осуществляют в хлораторе, пред-
ставляющем собой вертикальную
асбоцементную или покрытую
эбонитом стальную трубу диа-
метром 250—600 мм. Кислоту вво-
дят в нижнюю часть трубы. Для
перемешивания кислоты и рассо-
ла над подающей кислоту труб-
кой устанавливают диафрагму
из кислотоупорного материала,
чем создается турбулентность по-
тока. Для облегчения регулиров-
Рис. 68. Изменение галогеиопогло-
щаемости Челекенской буровой воды
от времени.
ки подачи кислоты ее иногда предварительно разбавляют до кон-
центрации 5—10%. Ввод хлора осуществляют на расстоянии 2—4 м
от ввода кислоты, обеспечивающем полное смешение кислоты с
рассолом. Газообразный хлор поступает из стальных цистерн или
ресиверов, где поддерживают давление на 0,7—1 ат выше, чем со-
здает столб жидкости в хлораторе. Если используют разбавленный
хлор, например, отходящий газ от других производств, подаваемый
под небольшим давлением, его вводят в верхнюю часть хлоратора.
При хлорировании происходит растворение хлора и взаимодействие
растворенного хлора (или продуктов его гидролиза) с составными
частями рассола.
Скорость растворения хлора практически не зависит от концен-
трации Вг~ в рассоле и хлор-газа34. Увеличение поверхности кон-
такта и понижение температуры, вязкости и солености раствора
ускоряют процесс растворения хлора. Скорость взаимодействия ме-
жду растворенным хлором и Вг велика, а с другими составными
частями рассола (что характеризуется так называемой галогено-
поглощаемостью35 рассола) относительно мала (рис. 63). При ра-
боте с теплыми и концентрированными рассолами, содержащими
большое количество С1”, скорость растворения хлора уменьшается.
В этих случаях неполностью растворившийся хлор может попасть
Получение брома
215
в десорбционную башню и загрязнить бромо-воздушную смесь. По-
этому окисление таких рассолов целесообразно вести не газообраз-
ным хлором, а хлорной водой 36’37. Последнюю получают, погло-
щая хлор холодной пресной или морской водой в асбоцементной
трубе высотой ~8 м. Хлорная вода, содержащая в 1 м? 5—7 кг
хлора, смешивается в хлораторе с бромсодержащим рассолом. При-
менение хлорной воды снижает расход хлора на 7—20%.
При взаимодействии хлора с бромсодержащим рассолом, по-
мимо основной реакции окисления Вг- до Вг2, идет ряд побочных
Рис. 64. Зависимость степени окисления бром-ио-
на от дозировки хлора (эквиваленты) при pH 4.
реакций 38-43 (Вг2 + С12 = 2ВгС1; Вг2 + ЗС12 = 2ВгС13), а также ги-
дролиз Вг2, Cl2, BrCl, ВгС13 и реакции комплексообразования. При
хлорировании подкисленных рассолов гидролиз брома подавляется,
а гидролиз остальных соединений идет тем в большей мере, чем
выше температура.
При введении в подкисленный бромсодержащий рассол поло-
вины теоретического количества хлора идет только реакция окисле-
ния Вг_ до Вг2. Увеличение количества вводимого хлора до 90—
96% приводит к частичному образованию BrCl; дальнейшее повы-
шение количества вводимого хлора приводит к образованию
ВгС13 44. По другим данным45, при окислении хлором 80—82% Вг-,
от его начального содержания в рассоле, выделяется бром с не-
большой примесью BrCl (до 10%) 46. Повышение дозировки хлора
приводит к взаимодействию его с бромом и образованию BrCl, при-
чем ВгС13 не образуется даже при двухкратном количестве хлора
от стехиометрического. Побочные реакции и летучесть образую-
щихся соединений хлора с бромом приводят к тому, что в бромо-
воздушной смеси всегда присутствует некоторое количество хлора,
а для окисления бромидов требуется вводить избыток хлора (рис.
64, 65). Зависимости, приведенные на этих рисунках, для
216
Гл. VII. Бром и его соли
различных рассолов неодинаковы, но характер кривых не меняется.
На практике окисление Вг~ ведут на 75—94% 17’47’48, затрачивая на
это 115—160% хлора от теоретического. Процесс хлорирования45-52
контролируют или замером окислительно-восстановительного по-
тенциала рассола, поступающего из хлоратора в десорбер, или
определением содержания бром-иона в вытекающем из десорбера
отработанном рассоле.
Десорбцию брома из рассола осуществляют в деревянных, же-
лезобетонных или кирпичных облицованных кислотоупорными плит-
ками башнях, заполненных
Рис. 65. Зависимость содержания хлора
в бромо-воздушной смеси (в % к сумме
Вг2 + С12) от степени окисления бром-иоиа
н pH рассола (7 = 2б°):
1 - pH = 6; 2 - pH = 5; 3 - pH < 4.
керамическими кольцами
(50x50 мм) или хордовой
насадкой. Высота башен ко-
леблется от 12 до 30 м; се-
чение зависит от их произ-
водительности *. На бром-
ных заводах СССР башни
обычно имеют высоту ~ 14 м,
высоту насадки Юли диа-
метр до 4 м.
Промышленное извлече-
ние брома из рассолов осу-
ществляют при содержании
его не менее 65—70 мг/л
(океанская вода). Коэффи-
циент распределения брома
между воздухом и рассолом
зависит от температуры, со-
става и концентрации рассо-
ла и при подавлении гидро-
лиза не зависит от концен-
трации брома59. Повышение температуры и содержания SOl”, а
также снижение концентрации рассола увеличивают коэффициент
распределения. Повышение концентрации С1~ в растворе до 5 н.
уменьшает коэффициент распределения из-за процессов комплексо-
образования, а более высокое содержание хлоридов приводит к
его повышению. На коэффициент распределения влияет и состав
катионов, но в меньшей степени, чем указанные анионы.
На рис. 66 приведена зависимость коэффициента распределения
брома от температуры для некоторых природных рассолов, состав
которых дается в табл. 2159.
Из океанской воды, содержащей ~ 70 г/л3 Вг-, при 18° извле-
кать бром не менее выгодно, чем из рассола оз. Кучук при 0° (зи-
мой), где содержание брома ~ 270 г/л3. Это связано с тем, что ко-
* О расчете производительности десорбционных башеи см.и-ю.
Получение брома
21Т
ТАБЛИЦА 2»
Состав некоторых природных рассолов, содержащих бром
Состав рассола, г/л Концен- трация рассола, н„
CaSO4 СаС12 MgSO4 MgCla MgBr2 NaCl
Океанская вода 1,3 2,2 3,6 0,08 29,7 0,63
Оз. Кургузул Следы — 51,1 362 1,31 24,1 8,8
Оз. Кучук (летний рассол) . . 4,0 — 59,7 6,1 0,31 145 5,3
Оз. Кучук (зимний рассол) . . 4,6 — 5,2 55,5 0,31 194 4,8
Оз. Старое 2,6 16,1 — 133 0,85 104 4,8
эффициент распределения брома для океанской воды при 18° равен
0,03, а для рассола оз. Кучук при 0° 0,0074, и потому равновесное
Содержание брома в газовой фазе для первого случая -равно
0,03-70 = 2,1 г/л3, а для второ-
го 0,0074-270= 2 г/л3.
Коэффициент десорбции
брома зависит от температуры,
скорости воздуха и плотности
орошения башни, он пропорци-
онален скорости воздуха в сте-
пени 0,7—0,9 и плотности оро-
шения в степени 0,3—0,5. В
производственных условиях ве-
личина его обычно колеблется
в пределах 2,0—4,8 л/ч54-60 и
уменьшается с повышением
температуры.
На производительность де-
сорбционной башни сильно
влияют коэффициент избытка
воздуха (т. е. отношение фак-
тического количества воздуха
к тому его количеству, которое
Рис. 66. Зависимость коэффициента рас-
пределения брома от температуры для
различных рассолов:
Z — океанская вода; 2—оз. Кургузул; <? —оз. Ку-
чук (летний рассол); 4 — оз. Кучук (зимний рас-
сол); 5 — ОЗ. Старое.
требуется для получения рав-
новесной концентрации брома) и коэффициент извлечения брома
(т. е. отношение количества брома, перешедшего в воздух, к на-
чальному количеству его в рассоле). При увеличении коэффициента
избытка воздуха возрастает движущая сила (так как снижается
концентрация брома в воздухе), что уменьшает величину необхо-
димой поверхности насадки (при постоянной производительности).
С другой стороны, повышение количества воздуха (при постоянной
скорости его) потребует увеличения сечения башни, а это приведет
к уменьшению плотности орошения, снижению коэффициента
218
Гл. VII. Бром, и его соли
десорбции и необходимости увеличения объема насадки. Отсюда
следует, что существует определенный коэффициент избытка воз-
духа, при котором десорбционная башня будет иметь минималь-
ный объем. Обычно работают с коэффициентом избытка воздуха,
равным 2,5—3,5. Этот коэффициент является условным, а не истин-
ным, ибо не учитывает образования соединений брома с хлором,
которые имеют более низкое давление пара, чем бром.
Повышение коэффициента извлечения брома связано с увели-
чением площади насадки или с увеличением скорости воздуха. На
Рис. 67. Зависимость величины поверхности
насадки от коэффициента извлечения брома
из рассола.
рис. 67 приведена зависи-
мость изменения относи-
тельной величины поверх-
ности насадки от коэффи-
циента извлечения брома,
если за единицу принять
ту величину поверхности,
которая требуется при
коэффициенте извлечения,
равном 0,75. При деше-
вом сырье и неограничен-
ных его запасах в неко-
торых случаях экономи-
чески выгоднее идти на
некоторое снижение коэф-
фициента извлечения. На
действующих заводах ко-
эффициент извлечения в большинстве случаев равен 0,82—
0,95 47 ’48,61~65. Для увеличения коэффициента извлечения на
1,5—3% предложено добавлять немного хлора к воздуху, посту-
пающему в десорбер, — это вызывает добавочное окисление Вг~66.
Другим средством, дающим возможность повысить коэффициент
извлечения (не изменяя поверхности насадки), является увеличе-
ние скорости воздуха, которая обычно составляет 0,5—0,6 м/сек (на
полное сечение башни), а на некоторых заводах достигает 1,2 м/сек.
Увеличение скорости воздуха создает возможность повысить плот-
ность орошения и работать на режимах, близких к захлебыванию,
что приводит к повышению производительности башен примерно в
2 раза67 при увеличении расхода электроэнергии на 1 т брома в
1,5—1,6 раза.
Десорбция брома воздухом может быть осуществлена не только
в башнях с насадкой, но и в аппарггах работающих на пенном ре-
жиме68, в частности в пенных аппаратах с провальными тарел-
ками69. В этих аппаратах коэффициент десорбции во много раз
больше, чем в башнях с насадкой, а объем пенного аппарата зна-
чительно меньше насадочной башни. Для этой же цели предложено
использовать аппарат со взвешенным слоем насадки70.
Получение брома
219
В процессе десорбции брома воздухом в газовую фазу перехо-
дят и другие летучие компоненты, содержащиеся в исходном рас-
соле, а потому в бромо-воздушной смеси помимо брома всегда со-
держится хлор (в основном, в виде ВгС1), двуокись углерода, во-
дяной пар, а иногда органические вещества. Содержание брома в
газовой фазе колеблется в очень широких пределах (в зависимости
от состава исходного рассола) и составляет 0,7—12 г/м3, т. е. для
извлечения 1 кг брома в заводских условиях требуется от 80 до
1500 м3 воздуха. Для уменьшения расхода воздуха стремятся под-
держивать повышенную температуру как рассола, так и воздуха.
Десорбцию брома при температуре рассола ниже 2—3° производить
нецелесообразно. Поддержание повышенной температуры воздуха
зимой на некоторых заводах осуществляют за счет подачи в де-
сорбционную башню отработанного воздуха, выбрасываемого хво-
стовым вентилятором из хемосорберов.
Содержание хлора обычно составляет 3—10% от количества
брома в воздухе и зависит от степени окисления бромида и коэф-
фициента извлечения, при этом чем они выше, тем больше содер-
жится в бромо-воздушной смеси хлора. При определении содержа-
ния хлора в последовательных порциях воздуха, пропускаемого
через хлорированный раствор, было установлено, что при дозировке
хлора 100—120% от теоретического (по отношению к содержанию
брома в рассоле) первые фракции содержат меньше хлора, чем
последние. Это объясняется меньшим давлением пара ВгС1, чем
брома. При дозировке хлора более 150% от теоретического первые
фракции содержат наибольшее количество хлора, а затем оно
уменьшается. Это объясняется тем, что над раствором давление
хлора больше, чем давление брома. При дозировке хлора около
150% от теоретического содержание хлора по отношению к брому
остается практически неизменным. Это подтверждается и завод-
скими данными, когда при увеличении дозировки хлора при окисле-
нии рассола выше определенного предела (при прочих равных ус-
ловиях) процесс десорбции ухудшается, и содержание брома в бро-
мо-воздушной смеси уменьшается 4]-46> 47
Содержание СО2 в бромо-воздушной смеси зависит от чистоты
воздуха и содержания СО*~и НСО^ в исходном рассоле. При под-
кислении и хлорировании рассолов содержащиеся в них карбонаты
и бикарбонаты разрушаются, а выделяющаяся двуокись углерода
десорбируется. Молекулярное отношение СО2: Вг2 в бромо-воздуш-
ной смеси колеблется от 1 до 5 (иногда и больше).
, Бромо-воздушная смесь после отделения брызг и капель посту-
пает в уловительную систему, состоящую из одной или нескольких
башен-хемосорберов. Для выбора способа улавливания брома из
газовой фазы существенно, в виде какого продукта он в дальней-
шем будет применяться. Если бром будет применяться в виде со-
лей, то бромо-воздушную смесь следует предварительно очистить
220
Гл. VII. Бром и его соли
от хлора; при отсутствии хлороочистки, для получения кондицион-
ных солей, количество брома, извлекаемого из сырья, должно быть
снижено на 15—20% 47’48’71, и экономические показатели производ-
ства при этом ухудшаются. Если же продуктом производства яв-
ляется элементарный бром, то очистку бромо-воздушной смеси про-
изводить нецелесообразно, так как примеси удаляются в процессе
его получения.
Очистку бромо-воздушной смеси от хлора производят раство-
рами бромидов, получаемыми в хемосорберах. При питании хлоро-
очистительных аппаратов растворами бромидов щелочных и ще-
лочноземельных металлов идут реакции: 2Вг“ + Ch = 2С1- + Вгг,
Вг" + BrCl = С1_ + Вгг. При очистке растворами бромистого же-
леза процесс усложняется — вначале Fe2+ окисляется до Fe3+ и соли
железа гидролизуются по следующим суммарным реакциям:
2Fe2+ + Br2 [С12] = 2Fe3+ + 2Вг“[СГ]
2Fe2+ + BrCl = 2Fe3+ + Br“ + СГ
12Fe2+ + 3O2 + 2H2O = 8Fe3+ + 4FeOOH
Лишь после окисления ионов Fe2+ более чем иа 90% идут при-
веденные выше реакции выделения элементарного брома7’’72
В процессе хлороочистки из бромо-воздушной смеси извлекается
80—95% содержащегося в ней хлора. Скорость абсорбции хлора
мало зависит от концентрации Вт- в абсорбенте (если она больше
0,05 г-экв/л) и от плотности орошения насадочных башен (0,5—
4 м/ч) 73~76. Исходные растворы для хлороочистки обычно содержат
от 100 до 400 г/л Вг-. Повышение концентрации Вг- в этих раство-
рах приводит к накоплению в них Вгз и Brs, что увеличивает аг-
рессивность среды и потери брома с отработанным раствором. Этот
раствор (содержащий менее 5 г/л Вг- и некоторое количество Вг2)
направляют после хлорирования в десорбер для извлечения брома
или сбрасывают в канализацию.
При хлороочистке растворами бромистого железа выделяется
шлам, состоящий в основном из гидратированных окислов железа;
-его накапливание ухудшает гидродинамический режим работы хло-
роочистителя77’78. Для уменьшения количества образующегося
шлама используют растворы, содержащие только Fe3+, снижают
температуру хлороочистки, уменьшают содержание кислорода в
бромо-воздушной смеси (работая на циркулирующем в системе воз-
духе) Осаждение шлама в хлороочистителе можно предотвратить,
пропуская часть циркулирующего здесь раствора через фильтр или
отстойник. Отстаивание шлама ускоряется при введении в хлоро-
очистительный раствор аммонийного мыла или полиакриламида
(35—50 л 0,025% раствора на 1 -и3) —скорость осаждения дости-
гает 5-10~4 см/сек при степени осветления 96—97%.
Получение брома
221
Хлороочистку обычно осуществляют в башнях из кирпича или
железобетона, футерованных кислотоупорными плитками, запол-
ненных керамической (высота слоя 2—10 м) или деревянной хор-
довой насадкой, и снабженных брызгоуловителями. Трубопроводы
изготовляют из дерева, эбонитированных, стальных труб или вини-
пласта, насосы из керамики, термосилида, эпоксида и фаолита.
Очистку бромовоздушной смеси от хлора осуществляют также в
полочной колонне, работающей на пенном режиме 72’79 со скоро-
стью газа 1,2—1,5 м/сек. При высоте колонны 2—Зм и при содер-
жании Вг- в орошающем растворе 20—25 г/л степень очистки до-
стигает 98—100%. Гидравлическое сопротивление колонны равно
80—90 мм вод. ст., т. е. близко к сопротивлению насадочных ба-
шен; вследствие интенсивного перемешивания в пенных аппаратах
шлам не оседает. На некоторых заводах хлороочистку осуще-
ствляют в идущем от десорбера к хемосорберу газоходе, в кото-
рый под давлением через распылитель вводят раствор бромистого
железа 80~82; затем его улавливают в отдельном брызгоуловителе
и используют вновь. Степень очистки от хлора 50—60%.
Поглощение брома из бромо-воздушной смеси
Очищенная от хлора бромо-воздушная смесь поступает в хемо-
сорбер для улавливания брома. Улавливание брома производят
железными стружками, растворами бромидов, едких и карбонат-
ных щелочей (иногда с добавлением восстановителей) и серни-
стым газом.
Поглощение брома железными стружками основано на реак-
ции Fe + Вгг = FeBra, идущей очень энергично в присутствии па-
ров воды. Образующееся бромистое железо поглощает влагу из
воздуха и переходит в раствор.
Хемосорбер — полая башня высотой 6—7 м, сложенная из беш-
таунита или кирпича, футерованного кислотоупорной плиткой.
Применяют также башни из железобетона83, ничем не футерован-
ные. Диаметр хемосорбера определяют исходя из скорости газа
0,25—0,4 м/сек (на полное сечение). На некотором расстоянии от
дна башни имеется деревянная или керамическая колосниковая
решетка, на которую укладывают слой железной стружки высотой
до 4 м. Верх башни закрыт деревянной крышкой, в которой имеют-
ся люки для загрузки стружки. Бромо-воздушная смесь поступает
в верхнюю часть башни; воздух, освобожденный от брома, выхо-
дит снизу. Обратное направление воздушного потока приводит к
накоплению в растворе ионов Fe3+ вследствие того, что более бога-
тая бромом газовая смесь встречается с концентрированным ра-
створом бромистого железа. Отработанный воздух поступает че-
рез брызгоуловитель в вентилятор, которым выбрасывается в
атмосферу или передается в десорбционную башню, так как его
температура в хемосорбере повышается на 10—30°. Хемосорбер
822
Гл. VII. Бром и его соли
периодически догружают железной стружкой, причем она должна
быть мало углеродистой, свободной от других металлов, не содер-
жать масла, тряпок и других инородных включений и иметь объ-
емный вес 300—450 ке/м3. Раньше стружку предварительно акти-
вировали травлением в слабой серной кислоте. Опыт действующих
заводов показал, что от операции травления можно отказаться,
если применять стружку, удовлетворяющую указанным выше тре-
бованиям, и если она не сильно окислена.
В процессе улавливания брома происходит окисление железа
кислородом воздуха, в результате чего образуются гидраты окис-
лов— шлам, обволакивающий поверхность стружек. Наличие шла-
ма приводит к ухудшению контакта между железной стружкой и
бромо-воздушным потоком и потому увеличивается проскок брома,
который обычно не превышает 1—2%. Кроме того, образование
шлама повышает сопротивление движению воздуха во всей систе-
ме, которое в конце цикла достигает 500—600 мм вод. ст., вместо
нормального 250—300 мм вод. ст. Поэтому стружки периодически
(иногда непрерывно) промывают водой или слабыми раство-
рами бромистого железа и через определенный промежуток вре-
мени (1—2 месяца) вместе со шламом выгружают. Перед выгруз-
кой шлам тщательно промывают, но даже при этом потери брома
-составляют 3—4% от веса шлама84, а иногда достигают 10% 85.
Промывные воды используют для орошения хемосорбера или для
.хлороочистки. Раствор бромистого железа, стекающий со дна хе-
мосорбера, содержит 400—700 г/л бром-иона и некоторое количе-
ство трехвалентного железа. Для удаления Fe3+ раствор нагревают
или выдерживают в баках с железными стружками; при этом Fe3t
. восстанавливается:
2Fe3+ + Fe = 3Fe2+ + 45,6 ккал
Получаемый раствор бромистого железа после отстаивания вы-
паривают в чугунных или эмалированных чашах до тех пор, пока
.температура кипения не достигнет 132—134°, что соответствует со-
,держанию 49—51% Вг~. Затем полученный плав через сифон или
вручную сливают в стальные барабаны, в которых он застывает в
монолитную массу. Чаши обогревают топочными газами или глу-
хим паром. Выпарку топочными газами проводят в чугунных кот-
лах с толщиной стенок 50 мм, паровую — в стальных эмалиро-
ванных чашах с рубашкой. Производительность чаш определяется
паросъемом 10—15 кг/ч с 1 м2 поверхности нагрева. Превращение
раствора бромистого железа в плав возможно и выпаркой под
вакуумом 85; при этом процесс ускоряется почти в 2 раза и вслед-
ствие более низкой температуры кипения плава (55° при вакууме
670 мм рт. ст.) уменьшается коррозия. Кроме того, этот процесс
в большей мере удовлетворяет требованиям техники безопас-
ности 86.
Получение брома
223
Барабаны из кровельного железа, применяемые для транспор-
тировки бромистого железа, должны быть герметичны и в плаве не
должно быть раствора, иначе происходит окисление Fe2+ до Fe3+,
что приводит к быстрому разрушению тары и вытеканию продукта.
Получение плава бромистого железа связано с быстрым изно-
сом выпарной аппаратуры из-за образования корок основных
солей и коррозии, вызываемой выделением НВг и НО, образую-
щихся при гидролизе бромида и хлорида железа. В связи с труд-
ностями, возникающими при выпарке растворов бромистого
железа, их целесообразно не выпаривая перевозить в железно-
дорожных цистернах после добавления ингибитора (уротропина).
Выход брома в товарный продукт при наличии, хлороочистки
составляет 75—86% от содержания его в исходном рассоле и сни-
жается до 58—72% при отсутствии хлороочистки; потери по ста-
диям производства распределяются следующим образом: хлориро-
вание 7—20%, десорбция 3—30% (более высокие потери в этих
двух стадиях относятся к процессам без хлороочистки); хлоро-
очистка 1—2%, улавливание 2—3%, выпарка и затаривание 1 —
2%. Для получения плава бромистого железа расходуют (в пере-
счете на 1 т брома): серной кислоты 0—Зт (в зависимости от ще-
лочности рассола); хлора 0,55—0,9т (в зависимости от галогено-
поглощаемости рассола); железной стружки 0,8—1 т; электроэнер-
гии от 1000 до 10 000 кет - ч (в зависимости от применяемого сырья);
воды 20—50 м3; топлива 0,6—1 т (в пересчете на уголь); кровель-
ного железа 50—60 кг.
Поглощение брома из бромо-воздушной смеси более целесооб-
разно вести концентрированными растворами бромистого желе-
за87-94. В этом случае улавливание брома производят в хемосор-
берах, имеющих те же размеры и конструкцию, что и хемосорберы,
применяемые при улавливании железной стружкой, но вместо
стружки их загружают керамическими кольцами размером 50 X
X 50 мм на высоту 3—4 м. Насыщение бромом раствора броми-
стого железа производят при рециркуляции его (плотность ороше-
ния насадки 1,5—3 м/ч) до тех пор, пока 80—95% Fe2+ не перейдет
в Fe3+: 2FeBr2 + Br2 = 2FeBr3. После этого раствор бромного же-
леза выводят из цикла и вместо него вводят свежий раствор бро-
мистого железа. Коэффициент абсорбции брома не зависит от кон-
центрации брома в бромо-воздушной смеси и определяется скоро-
стью движения газовой фазы и химической емкостью поглотителя,
т. е. концентрацией ионов Fe2+; присутствие Fe3+ практически не
влияет (если отношение Fe3+: Fe2+ меньше 20). Для указанных
выше условий при 18° и скорости газа 0,3—1 м!сек коэффициент
абсорбции соответственно равен 45—70 м/чп.
Полученный раствор бромного железа восстанавливают желез-
ными стружками в железобетонных резервуарах, футерованных
кислотоупорными плитками, причем скорость процесса зависит от
224
Гл. VII. Бром, и его соли
количества железной стружки, загруженной в аппарат, состояния
ее поверхности, отношения Fe3+ : Fe2+ в растворе, его концентра-
ции, а также начальной температуры. Продолжительность восста-
новления составляет 3—5 ч при содержании в растворе 700—800 г
Вг~ в 1 л, начальной температуре 30—34° и весовом отношении
.рестружм __5_7 . J Полнота восстановления 97—99%. Во избежа-
Вграствор
ние сильного вспенивания стружка не должна быть загрязнена
маслом.
В процессе восстановления бромного железа выделяется боль-
шое количество тепла и температура раствора повышается на 40—
60° (в зависимости от концентрации). При питании хемосорбера
растворами, содержащими -~750 г Вг~ в 1 л, они становятся после
восстановления столь концентрированными, что при охлаждении
выделяется FeBr2-6H2O. Для получения чистых кристаллов ра-
створ перед охлаждением должен отстаиваться для осаждения
взвеси. Охлаждение раствора ведут при перемешивании, во избе-
жание прилипания кристаллов к стенкам. Отделение от жидкости
производят на нутч-фильтрах.
При поглощении брома по этой схеме выход брома увеличи-
вается на 2—3% (по сравнению с поглощением железной струж-
кой), так как уменьшаются потери со шламом, а расход стружек
снижается до 0,5 т на 1 т брома. Кроме того, можно получать до
30% кристаллического бромида железа без выпарки.
Делались попытки поглощать бром из бромо-воздушной смеси
путем распыления раствора бромида железа непосредственно в
газоходе, но из-за чрезмерных потерь вследствие брызгоуноса этот
способ не применяют 95'96.
Поглощение брома из бромо-воздушной смеси растворами бро-
мида натрия основано на образовании полибромидов (Brj, Btg),
что приводит к понижению давления брома над растворами59. Та-
кой метод абсорбции брома применяют на бромном заводе в рай-
оне Мертвого моря97, использующем бромсодержащий щелок
(0,8—1% Вг_) после извлечения калийных солей. Из бромо-воз-
душной смеси (200 г брома в 1 м3) бром поглощают охлажден-
ным до —18° раствором бромида натрия (350 г/л). Раствор содер-
жит после абсорбции до 35% брома. Его отгоняют, нагревая ра-
створ глухим паром. Регенерированный раствор NaBr возвращают
на абсорбцию. Этот способ эффективен лишь при переработке теп-
лых природных рассолов, богатых бромом.
Поглощение брома из бромо-воздушной смеси едкими щело-
чами в большинстве случаев не рационально и не выгодно, так
как при относительно высоком содержании в бромо-воздушной
смеси двуокиси углерода (СО2:Вг2>1) много щелочи превра-
щается в карбонат. Для абсорбции брома применяют растворы
Получение брома
225
соды61 и известковое молоко98, которые взаимодействуют с бро-
мом по следующим суммарным уравнениям:
2ОН~ + Вг2 = Вг“ + ВгО~ + Н2О
2СОз~ + Вг2 + Н2О = ВГ + ВгСГ + 2HCOJ
2HCOJ + Вг2 = Вг“ + ВгО- + 2СО2 + Н2О
Первые две реакции проходят в растворах практически пол-
ностью, а третья при 20° только на ~90%. Повышение темпера-
туры и снижение щелочности в конце процесса приводят к тому,
что гипобромиты посте-
пенно переходят в брома-
ты, а бикарбонаты в кар-
бонаты:
ЗВгО- = ВгОд + 2Вг~
2НСРз - СО|- + Н2О + СО2
Полученные растворы,
содержащие гипоброми-
ты, броматы и бромиды,
могут быть использованы
как для получения бро-
ма, так и его солей. Вы-
деление брома произво-
дят путем добавления к
раствору кислоты (обыч-
но серной):
• NaBr,%
ВгОз + 5Вг 4-6Н+=ЗВг2+ЗН9О Рис. 68. Изотермы растворимости в системе
NaBr—NaBrO3—Н2О при 0, 25, 35 и 80°.
ВгО" + Вг“ + 2Н+= Вг2 + Н2О
При подкислении концентрированных бромид-броматных ра-
створов часть брома выделяется в жидком виде и отделяется от
водного раствора декантацией. Оставшийся в водном растворе
бром отгоняют острым паром в колоннах с насадкой. Из бромид-
броматного раствора можно получить бромид натрия, а если
нужно, то и бромат натрия, различными методами. Одним из мето-
дов является выпаривание раствора с последующим его охлажде-
нием (рис. 68) 10°, причем кристаллизуется до 80% бромата, со-
держащегося в растворе. Оставшийся щелок со сравнительно
небольшим количеством бромата обрабатывают восстановителями
(например, железными стружками при кипячении), затем отде-
ляют от нерастворимого остатка и из раствора выделяют броми-
стый натрий.
Для поглощения брома щелочными растворами применяют
насадочные башни из железобетона или дерева, заполненные
керамическими кольцами или хордовой насадкой. Для лучшего
й М. Е. Позин
228
Г л. VII. Бром и его соли
использования поглотителя раствор непрерывно циркулирует.
В процессе поглощения брома растворами соды образуется бикар-,;
бонат натрия, который сравнительно мало растворим в бромид-1
броматном растворе (рис. 69),00_ Поэтому, во избежание забивания!
насадки осадком, применяют растворы, содержащие в начале про-
цесса только 30—50 г/л соды. Для получения более концентри-;
Рис. 69. Изотермы растворимости в системе
NaBr—NaBrO3—NaHCO3—Н2О при 25 и 35°.
рованных растворов NaBr + NaBrO3 в них можно дополнительно
вводить в процессе абсорбции твердую соду или раствор NaOH
(для перевода бикарбоната в карбонат). Степень абсорбции брома
достигает 98,5—99% 93- Расход кальцинированной соды составляет
0,75—0,8 т на 1 т брома.
Описаны методы 40’100-106 поглощения брома из бромо-воздуш-
ной смеси щелочными растворами, содержащими NaOH, КОН,
Са(ОН)2, Na2CO3 и др., в присутствии восстановителей — амми-
ака. формиатов, уротропина, карбамида — в результате чего полу-
чаются почти чистые бромиды, не содержащие кислородных соеди-
Получение брома
227
нений брома. В присутствии этих восстановителей процессы идут
по следующим суммарным уравнениям:
6ОН~ + 3Br2 + 2NH3 = 6Вг” + 6Н2О + N2
2ОН" + 2Вг2 + 2НСОО” = 4ВГ + 2Н2О + 2СО2
36ОН~ + 18Вг2 + N4(CH2)e = 36Вг“ + 24Н2О + 6СО2 + 2N2
60 Н" + ЗВг2 + CO(NH2)2 = 6Вг“ + 5Н2О + С02 + N2
Во всех случаях при использовании щелочных абсорбентов,-со-
держащих Na+, следует учитывать возможность образования в ка-
честве промежуточного соединения относительно плохо раствори-
мого бикарбоната натрия и поддерживать такую концентрацию
раствора, чтобы избежать выделения его в осадок.
Поглощение брома известковым молоком производят в барбо-
тажных колоннах, имеющих четыре полки, на которых установ-
лены колпаки. Жидкость перетекает с полки на полку по перелив-
ным.трубам. Применение насадочных башен нецелесообразно, так
как образующийся карбонат кальция [за счет взаимодействия С02
с Са(ОН)2] осаждается плотной коркой на насадке и башня зара-
стает. Хемосорбер орошают раствором, содержащим 5—5,5% ак-
тивной окиси кальция, в который постепенно вводят 10—25%-ный
раствор аммиака. Добавление аммиака сразу в больших количе-
ствах приводит к его десорбции и образованию аэрозоля бромида
аммония. Вытекающие из хемосорбера щелока содержат 140—
170 г/л Вг-. Недостатком этого метода является то, что образую-
щийся шлам увлекает значительное количество раствора (~50%
от веса шлама) и ротор вентилятора забивается бромидом аммо-
ния; это требует промывки, усложняет технологический процесс
и приводит к дополнительным потерям брома (2—3%). Кроме
того, применение барботажных колонн вместо насадочных башен
увеличивает гидравлическое сопротивление системы на 150—
250 мм вод. ст., что повышает расход электроэнергии. Расход окиси
кальция (100%) на 1 т брома составляет 0,8—1 т и зависит от со-
держания двуокиси углерода в бромо-воздушной смеси.
Абсорбцию брома из бромо-воздушной смеси щелочными по-
глотителями в присутствии восстановителей наиболее широко при-
меняют при получении КВг. В этом случае вследствие большой
растворимости КНСО3 можно поддерживать высокую концентра-
цию поглотителя. Раствор, вытекающий из хемосорбера, содержит
До 500—520 г/л КВг. В нем содержится также ~0,1 г-экв/л ще-
лочи и 5—15 г/л бромата, который разрушают добавкой брома и
формалина в присутствии катализатора — ионов железа.
Поглощение брома путем взаимодействия с сернистым газом
Br2 + SO2 + 2Н2О = 2НВг + H2SO4
нашло применение на самых крупных заводах в США и Англии.
Оно может быть осуществлено двумя методами: 1) взаимодействием
8*
228
Г л. VII. Бром и его соли
в газовой фазе с образованием капель жидкости, состоящей
из смеси НВг и H2SO4, улавливаемых в брызгоуловителях; 2) аб-
сорбцией брома водным раствором смеси НВг + H2SO4 с после-
дующим взаимодействием растворенного брома (Br2, Brj, Вг^) с
сернистой кислотой в растворе. Абсорбция брома водными раство-
рами бромидов связана с резким понижением давления его пара
из-за образования комплексных соединений (рис. 70) 59’107. Более
целесообразным является осуществление взаимодействия в газо-;
вой фазе108, так как объем аппа-;
ратуры при этом меньше, упро-^
щается регулирование процесса nj
снижается расход сернистого!
газа, который составляет 0,5—;
0,6 т на 1 т брома. Взаимодейст-:
вне между сернистым газом, по-*
лучаемым сжиганием серы или.
колчедана, и бромом происходит
практически мгновенно и осуще-
ствляется в воздухопроводе меж-
ду десорбционной башней и уло-
вителем. Концентрация сернисто-
го газа практического значения
не имеет, так как он все равно
сильно разбавляется воздухом
при содержании брома в нем
0,7—12 г/м3. Воздухопровод вы-
полняют из кислотоустойчивого
материала, обычно из стали, по-
крытой эбонитом, резиной и т. д.
Уловитель представляет собой
железобетонную или кирпичную
башню, футерованную кислотоупорными плитками и заполненную
стеклянной ватой или керамическими кольцами. Для лучшего ула-
вливания башня орошается (периодически или непрерывно) не-
большим количеством раствора (НВг + H2SO4). Башни имеют тот
же диаметр, что и десорбционные, а высоту 4—6 м. После улови-
тельной башни устанавливают брызгоуловитель, орошаемый водой
и исходным рассолом. Стекающая из брызгоуловителя жидкость
поступает в десорбционную башню. Степень улавливания брома
составляет 98,5—99%. Стекающий из уловительной башни раствор
содержит 10—20% НВг, 8—18% H2SO4 и до 1% НС1. Концентра-
ция получающегося раствора зависит от содержания брома в ис-
ходном растворе и давления водяного пара над ним. Чем ниже
давление водяного пара и выше содержание брома в исходном
растворе, тем больше содержание бромистого водорода в полу-
чающейся жидкости.
0.07
ООО
10.05
1
$
ао/
О
/23400
Концентрация раапйора,г-экО Вг~/л
Рис. 70. Зависимость коэффициента
распределения брома от содержа-
ния Вт” в растворе при 0, 25 и 50°.
Получение брома
229
Раствор смеси кислот (НВг + H2SO4 + НС1) перерабатывают
на бром1™-111 хлорированием или на бромистоводородную кис-
лоту фракционной перегонкой. Хлорирование производят в кера-
мических сосудах, где часть брома выделяется в жидком виде и
затем декантируется. Водный раствор, содержащий растворенный
бром, нагревают острым паром в колоннах с насадкой, Вг2 отго-
няется, а отработанный раствор, содержащий НС1 и H2SO4 и не-
большие количества брома, стекает снизу башни. Получаемый та-
ким образом бром содержит не менее 98,5—99% Вг2. Отработан-
ную смесь кислот (4,5—9% НС1 и 5—10% H2SO4) используют для
подкисления исходного бромсодержащего рассола; количество от-
работанной смеси кислот (в пересчете на 100% H2SO4), получаю-
щейся на 1 т брома, составляет 1,5—1,8 т. При этом на 1 т брома
расходуется 0,48—0,5 т хлора и 5—8 т пара.
Для получения бромистоводородной кислоты необходимо вести
фракционную перегонку. I фракция с температурой кипения <123°
представляет собой очень разбавленный раствор соляной и броми-
стоводородной кислот, в котором содержится до 90% НС1 и 1,5—
2% НВг от их начального количества (поступившего на дистилля-
цию). II фракция с температурой кипения 123—126° содержит
19—22% НВг и 0,13—0,3% НС1. С этой фракцией отгоняется до
12% НВг и 8% НС1 от их начального количества. III фракция с
температурой кипения 126—127° содержит ~45% НВг, 0,1% НС1
и 0,07% H2SO4; с ней отгоняется ~85% НВг от веса загружен-
ного. Кубовый остаток содержит 78% H2SO4, 0,02% НВг и
0,01% Вг2.
Первая фракция может быть использована для подкисления
исходного рассола, кубовый остаток которого получается до 0,9 т
(в пересчете на 100% H2SO4) на 1 т брома, может быть также ис-
пользован либо для подкисления исходного рассола, либо в каче-
стве товарной кислоты (там, где не вредна примесь НВг и Вг2).
Во II и III фракциях содержится 96—97% уловленного брома. При
отсутствии жестких требований по содержанию хлора в продукте
они могут быть смешаны, и тогда получается раствор, содержащий
НВг — 40%, НС1 — 0,2% и H2SO4 — 0,06%, который используется
для получения бромистых солей *.
В США бромистоводородную кислоту получают также из смеси
НВг и H2SO4, образующейся при взаимодействии брома с серой и
водой по экзотермической реакции
S + ЗВг2 + 4Н2О = 6НВг + H2SO4
идущей достаточно быстро при 90—100°; вначале сера бронируется
и S2Br2 далее реагирует с бромом и водой.
* О материалах для аппаратуры и приборах для контроля бромного произ-
водства CM. 4S- S1> 52' в1> в2> 112-118
230 Гл. VII. Бром и его соли
Для многих потребителей необходим элементарный бром, а I
при извлечении его воздушной десорбцией получаются его соеди- 1
нения. Наиболее простым методом получения жидкого брома яв- |
ляется обработка бромид-броматной смеси кислотами (стр. 225). I
В СССР жидкий бром обычно получают обработкой газообразным
хлором раствора FeBr2 (350—550 г/л Вг") в асбоцементных или ;
железобетонных аппаратах и последующей отгонкой его за счет i
теплоты реакции и с помощью острого пара. Пары брома конден-
сируются в холодильнике и жидкий бром через автоматические до-
заторы сливается в тару. Все коммуникации изготовляются из
стеклянных труб, соединенных с помощью химически стойкой ре-
зины и фторопластовой пленки. Выход брома составляет 95—98%
от его содержания в бромистом железе118-122.
Другие методы получения брома
Некоторое количество брома выделяли раньше из природных
рассолов в виде труднорастворимых органических соединений —
триброманилина, трибромфенола, тетраброманилина 123-125. Однако s
это оказалось мало экономичным из-за трудности регенерации ис- }
ходных органических соединений. ,|
Были предложены методы экстрагирования брома из хлориро- 4
ванных рассолов несмешивающимися с водой органическими рас- j
творителями 126~129. Экстракция керосином, бензином, дихлорэта- !
ном и другими приводит к их бромированию (и частично хлори- ;
рованию) и потому нерациональна. Применение для экстракции
предварительно бронированных экстрагентов (керосина) дает бо- |
лее благоприятные показатели, но при этом в ряде случаев наблю-
дается образование стойких эмульсий, что создает большие потери
брома и экстрагента. ।
Извлечение брома из окисленных растворов взаимодействием с j
Этиленом с целью получения дибромэтилена мало экономично, так
как из-за малых концентраций брома в рассоле образующийся •
С2Н4ВГ0 практически полностью растворяется и для его извлечения
требуется экстракция. Возможно извлечение брома из рассолов
осаждением хлоридом серебра 130 с выходами около 90%. Весьма
небольшое применение нашел электрохимический метод получения
брома 131-134.
Одним из перспективных методов является извлечение брома j
из природного сырья с помощью анионитов 135-140 *. Окисленные
(хлорированные) рассолы, содержащие свободный бром, контакти-
руются с анионитом (в СССР применяют АВ-17), который после
насыщения бромом обрабатывают сернистым газом или сульфи- ;
том натрия для восстановления в бромид, а затем концентриро- t
• Подробнее этот метод описан в главе VIII.
J
Производство некоторых солей брома
231
ванным раствором хлорида натрия для десорбции бромида. Полу-
ченный раствор, отделенный от анионита, хлорируется и бром
отгоняется водяным паром при 80—90°. Пары брома конденси-
руются в жидкий бром. Степень сорбции брома анионитами соста-
вляет 95—97% и не зависит от температуры (в пределах 2—50°)
и его концентрации в растворе. Насыщение ионита зависит от со-
держания в растворе Вг- и СП и составляет 0,2—1 г/г при концен-
трации брома в исходном растворе 0,1 — 1 кг!м\ Общий выход
брома зависит от степени окисления бромида и может достигать
80-85%.
ПРОИЗВОДСТВО НЕКОТОРЫХ СОЛЕЙ БРОМА
Бромид натрия
Бромид натрия может быть получен непосредственно из
бромо-воздушной смеси при поглощении брома растворами соды
(стр.* 225). Его также получают из растворов бромида кальция,
образующегося при улавливании брома известковым молоком в
присутствии аммиака. К раствору бромида кальция (140—170 г/л
Вг-) добавляют сульфат натрия (или соду)40’,41>142
СаВг2 + Na2SO4 = CaSO4 + 2NaBr
Пульпу перемешивают 1—2 ч, отфильтровывают сульфат каль-
ция, щелок выпаривают до плотности 1,40—1,42 г/ди3 и вторично
фильтруют от осадка, выделяющегося при выпарке (CaSO<,
СаСО3). Затем щелок окончательно выпаривают до образования
густой массы, содержащей 15—20% маточного рассола. Массу по-
дают на центрифуги, где производят отделение кристаллов при
температуре выше 70°. Недостатком этого метода являются значи-
тельные потери брома (2—5%) за счет увлечения раствора осад-
ком сульфата кальция.
Небольшие количества бромида натрия получают взаимодей-
ствием бромида железа с растворами соды:
FeBr2 + Na2CO3 + (n + 1) Н2О — Fe(OH)2 • nH2O + 2NaBr + СО2
Благодаря наличию в растворе Fe3+, а также окислению кисло-
родом воздуха, в осадке всегда содержится Fe(OH)3. В чугунных
котлах с мешалкой и паровой рубашкой раствор соды нагревают
почти до кипения и небольшими порциями приливают раствор
бромида железа. Из-за выделения СО2 происходит сильное вспени-
вание, и потому необходимо интенсивное перемешивание реакцион-
ной массы при заполнении аппарата не более чем на 50%. Выде-
ляющиеся гидраты окислов железа отделяют от раствора, промы-
вают разбавленными промывными водами и водой до практически
232
Гл. VII. Бром, и его соли
полного удаления Вг~. Первые порции промывных вод смешивают
с основным раствором бромида натрия и выпаривают в чугунных
эмалированных чашах. Кристаллы бромида натрия отделяют на
центрифугах, сушат, просеивают и упаковывают.
Другим широко применяемым методом получения бромида
натрия является взаимодействие брома с раствором едкого натра
(или соды) в присутствии восстановителей — формиата натрия 143
или аммиака 144’,45:
Na2CO3 + 2HCOONa + 2Br2 = 4NaBr + ЗСО2 + H2O + 121,8 ккал
3Na2CO3 + 2NH3 + 3Br2 = 6NaBr + ЗСО2 + ЗН2О + N2 + 157,4 ккал
Процесс ведут в закрытых эмалированных аппаратах, в которые
вначале заливают раствор соды (или едкого натра), добавляют к
нему восстановитель, а затем при перемешивании под слой рас-
твора приливают бром. Ввиду большого выделения тепла и газов,
на крышке аппарата, во избежание потери брома, устанавливают
ловушки, заполненные железными стружками или орошаемые ра-
створом соды. После окончания реакции раствор фильтруют от
взвешенных частиц, а затем перерабатывают, как было указано
выше. Для получения 1 т бромида натрия этим методом расхо-
дуют: брома 0,8—0,о2 т, едкого натра (технического) 0,45—0,48 т,
аммиака 0,07—0,08 т или муравьиной кислоты (100%) 0,23—
0,25 т.
Одним из перспективных методов получения бромистого нат-
рия является взаимодействие соды (или едкого натра) или хло-
рида натрия с бромистоводородной кислотой. Бромистоводород-
ная кислота может быть получена фракционной разгонкой смеси
НВг + H2SO4 или синтезом из элементов 148’147.
Получение бромида натрия из хлорида натрия и бромистово-
дородной кислоты
NaCl + НВг = NaBr + НС1
* Л
основано на более низкой температуре кипения азеотропной смеси
НС1—Н2О (110°), чем смеси НВг—Н2О (126°) 148. Реакцию ведут
при 110°, добавляя к твердому хлориду натрия бромистоводород-
•ную кислоту в количестве 120% от стехиометрического. В реак-
торе остается твердый бромид натрия, а соляная кислота отго-
няется и после конденсации может быть использована для под-
кисления исходных бромсодержащих рассолов. Получающийся по
этому методу бромид натрия после промывки небольшим количе-
ством воды содержит 0,5—0,8% NaCl. Выход по НВг составляет
96—98%. При производстве безводного бромида натрия необхо-
димо все операции, где имеется жидкая фаза, вести при темпера-
туре выше 70°, иначе будет получаться дигидрат, который в даль-
нейшем необходимо обезвоживать,
Производство некоторых солей брома
233
Бромид калия
Получение бромида калия может быть осуществлено всеми
методами, указанными для бромида натрия. Исходным сырьем
при этом служит едкое кали или поташ. Чаще всего осуществ-
ляют их взаимодействие с растворами бромида железа или бро-
мом в присутствии восстановителей. Ранее широко применявшийся
метод взаимодействия раствора едкого кали с бромом
6КОН + ЗВг2 = КВгО3 + 5КВг + ЗН2О
с последующим восстановлением броматов углем при высокой тем-
пературе149 в настоящее время утратил свое значение. Получение
бромида калия несколько проще, чем бромида натрия, так как
КВг при всех температурах выделяется из растворов в безводной
форме. Для получения 1 т КВг расходуют: 0,7—0,72 т брома, 0,54—
0,58 т едкого кали, 0,06—0,065 т аммиака или 0,20—0,22 т му-
равьиной кислоты (100%).
Бромид аммония
Бромид аммония получают взаимодействием концентрирован-
ного раствора аммиака с бромом-
8NH3 + 3Br2 = 6NH4Br + N2 + 104,8 ккал
Для ведения этого процесса реактор вначале охлаждают, а
бром приливают небольшими порциями. Выделяющийся из рас-
твора аммиак и образующийся дым бромида аммония улавливают
водой или слабым раствором бромида аммония. В растворе дол-
жен всегда присутствовать избыток аммиака во избежание обра-
зования взрывчатых галогенных соединений азота. Полученный
раствор выпаривают, а затем охлаждают, и выделившиеся кри-
сталлы бромида аммония отфуговывают, сушат при 90—95° и упа-
ковывают. На получение 1 т бромида аммония расходуют: 0,9—
6,95 т брома и 0,25—0,27 т аммиака.
Бромид аммония может быть получен при взаимодействии
растворов бромида железа и аммиака или карбоната аммония,
а также раствора бромида кальция с карбонатом аммония 15°.
Бромат калия
Бромат калия можно получить взаимодействием нагретого рас-
твора едкого кали с бромом, но при этом полезно используется
только !/6 часть брома. Поэтому бромат калия получают окисле-
нием бромида калия или брома в щелочной среде хлором151:
6КОН + КВг + ЗС12 = КВгОз + 6КС1 + ЗН2О
12КОН + Вг2 + 5С12 = 2KBrO3 + 10КС1 + 6Н2О
Реакцию ведут в эмалированном аппарате, куда вначале за-
ливают раствор едкого кали плотностью 1,32 г/см3 '(~450 г/л
234
Гл. VII. Бром и его соли
КОН) и в него постепенно приливают жидкий бром при непре-
рывном перемешивании. Затем в раствор пропускают хлор до
нейтральной реакции, фильтруют, а затем охлаждают до 15°. Вы-
делившуюся смесь КВгО3 и КС1 промывают малыми порциями
холодной воды до практически полного растворения хлорида ка-
лия. Выход по брому составляет ~90—94%.
'Бромат калия может быть получен также анодным окислением
раствора бромида калия 152’153. Выход по току при этом составляет
80—90%, расход электроэнергии 4000—5000 квт-ч на 1 т бромата
калия.
ЛИТЕРАТУРА
1. Н. A. Liebha f sky, J. Am. Chem. Soc, 56, 1500 (1934); 61, 3513 (1939).—
2. Г. П. Лучинский, ЖОХ, 9, 708 (1939).—3. L. W. Winkler, Chem. Ztg,
23, № 67, 687 (1899). — 4. A. H a n t z s c h, A. V a g t, Z. phys. Chem., 38, 705
(1901). —5. В. П. Ильинский, A. T. У в e p с к а я, Труды ГИПХ, в 41, 1958,
стр. 112. — 6. Encyclopedi of Chemical Technology, Ed. R. E. Kirk, D. E. Oth-
mer, vol. II, 1952, p. 629. — 7. G. S. Haines, Ind. Eng. Chem, 31, As 12, 2702
(1949). —8. А. А. Поп а дюк, ИБП ГИПХ,* № 11—12, 51 (1967). —9. Chem.
Eng, 38, № 22, 136 (I960). — 10. В. Ф. Бойцова и др. БТИ ГИПХ** № 7, 3
(1958).
11. В. М. Верен бл ит, Т. Ф. Куранова, Там же, № 4, 23 (1957).—
12. А. В о d е n h е i m е г, I. Epstein, I. S с h n е г b, Israel J. Chem, 5, № 4а,
145 (1967). —13. В. М. Беренблит, Т. Ф. Куранова, Труды ГИПХ, в. 41,
1958, стр. 210. —14. Е. Ю. Левина, БТИ ГИПХ, № 16, 3 (1962).—
15. Г. А. Яковкин, ИБП ГИПХ, № 2, 3 (1964); № 11—12, 4 (1967).—
16. Г. Л. Кореньков, И. А. Устинова, Горнохимическое сырье зарубежных
стран, Изд. «Химия», 1965, гл. 4. —17. Ф. Ф. Герма и, БТИ ГИПХ, № 9, 25
(I960). — 18. М. Л. К о й ф м а н, Г. Р. 3 а л к и н д, Р. И. Гуревич, Труды
ГИПХ, в. 48, 1965, стр. 104. —19. Л. А. Амром, Д. С. Стаси не в ич, Журн.
ВХО, № 1, 47 (1962). — 20. Ind. Eng. Chem, № 7, 50 (1964).
21. W. Miller, Bull. Bur. Mines, № 630, 447 (1968). —22. R. Korn, Freiber-
ger Fosschungsh, № 534, 53 (1965). — 23. L. E. Jolies, Bromine and its Com-
pounds, London, 1966. — 24 Inform. Chim, № 42. 37, 43, 47, 53- (1966).—
2,5. В. П. Ильинский, В. M. Филиппео, ЖХП, № 16, 833 (1928).—
26. В. J. Karsten, Z. anorg. Chem, 53, 63 (1907). —27. М. Kaltenbach,
Chim. e. Ind, 25, № 3, 1 (1931). — 28. M. С.' P о ж д e с т в е н с к и й. Л. М. Бро-
Уде. ЖПХ, 10, № 4—6, 722 (1937). — 29. П. Г. Данильченко, М. И. Р а в и ч,
ЖРФХО, № 59, 953 (1927). — 30. М. С о d е 11, G. Norwitz, Chem. Ind, А» 19,
580 (1957).
31. Пат. США 3145084, 1964, — 32. О. В. Лебедев, ИБП ГИПХ № 13,
72 (1967). — 33. С. И. Гришко, БТИ ГИПХ, № 14, 27 (1962).— 34. М. Е. П о-
з и н, М. Л. Ш а б а ш о в а, С. Д. Г о л ь д е н б е р г, ЖПХ, 22, № 5, 467 (1949).—
35. В. Ф. Бойцова, Г. С. Клебанов, И. П. Кузьмина, ИБП ГИПХ,
№ 7—8, 28 (1965). — 36. И. О. Эверт, БТИ ГИПХ, № 1, 35 (1955).—
37. Ф. Ф. Герман, ЖПХ, № 3, 171 (1956). — 38. И. П. Гринвуд, Усп. хим,
22. № 4, 445 (1953). — 39. Я. А. Ф и а л к о в, Межгалоидные соединения, Изд.
АН УССР, 1958.—40. В. И. Ксензенко, Д. С. Стасиневич, Технология
брома и иода, Госхимиздат, 1960.
41. Д. С. Стасиневич, ЖПХ, 31, № 5, 701 (1958). — 42. Д. С. Стаси-
невич, Там же, № 6, 844 (1958). — 43. Л. С. Лилич, ЖОХ, 22, 730 (1952).—
* Иодо-бромная промышленность, Сб. обзорной информации ГИПХ.
** Бюлл. техн, информации ГИПХ по иодо-бромной промышленности.
Литература
235
44. С. И. Яворский, БТИ ГИПХ, № 1, 28 (1955). — 45. О. Ф. Клочко,
В. П. Зобнин, Труды ГИПХ, в. 41, 1958, стр. 171,— 46. R. М a g a i, J. Soc.
Chem. Ind. Japan, 46, 358, 1217 (1943). — 47. H. О. Эверт, M. A. T a p а б p и-
на, ИБП ГИПХ, № 1, 4 (1964). — 48. Г. Р. 3 а л к и н д, М. Л. К о й ф м а н,
Там же, № 11—12, 59 (1967). — 49. R. М a g a i, J. Soc. Chem. Ind. Japan, 47, 33,
309 (1944). — 50. J. J. Ronco, Chem. Abs., 42, № 14, 5176 (1948).
51. И. M. Полищук, БТИ ГИПХ, № 14, 21 (1962).—52. А. Д. Кутний,
Ю. Е. Г о л ь б е р г, ИБП ГИПХ, № 1, 16; № 3—4, 70 (1964).— 53. М. Е. П о з и н,
К. И. Хренников, ЖПХ, № 2, 45 (1948). — 54. J. J. Ronco, Chem. Abs., 42,
№ 15, 5623 (1948). —55. М. Е. Позин, ЖПХ, 29, № 9, 1336 (1956).—
56. С. И. Яворский, БТИ ГИПХ, № 5, 12 (1957). —57. М. Г. Гусев, ИБП
ГИПХ, № 1, 48 (1964). — 58. С. И. Яворский, Там же, № 5—6, 56 (1965).—
59. Г. С. Клебанов, Е. П. Басова, Э. М. В о л н я н с к а я, И. М. Гуревич,
Сборник трудов ГИПХ, в. 40, 1948, стр. 119.— 60. В. П. Ильинский, К.. Д. Ру-
синова, Е. Г. Дроздова, Там же, в. 41, 1958, стр. 153.
61. L. С. Steward, Ind. Eng. Chem., 4, Ns 26, 361 (1934). — 62. Manuf.
Chem., 25, № 7, 305 (1954). —6'5. R. Bock, Chem. Ind. Techn.. 25, № 5, 245
(1953). — 64. E. Lawson, World Petrol., 25, № 4, 64 (1954). — 65. Civil Eng. a.
Public; Works, 49, 577, 709 (1954). — 66. О. В. Лебедев и др., ИБП ГИПХ,
Ns 13, 69 (1967); № 14, 61 (1968). — 67. А. Е. Ш н о л ь, Хим. пром., № 9, 318
(1953).—68. М. Е. Позин Б. А. Ко пыл ев, Г. В. Бельченко, Изв. вузов.
Хим. и хим. технол., № 5, 142 (1958).—69. М. Г. Гусев, ИБП ГИПХ, № 7—8,
75 (1965). — 70. И. И. Гельперин, В. И. Савченко, В. 3. Гринько, Хим.
Пром, № 5, 372 (1967).
71. И. Ш. Мастеровой, ИБП ГИПХ, № 2, 24 (1964). —72. М. Г. Гу-
сев, Е. В. Мовчан, БТИ ГИПХ, Ns 5, 29 (1957). — 73. Ф. Ф. Герман, ИБП
ГИПХ, № 3—4, 34 (1964). — 74. Л. Д. Полякова, Там же, № 3—4, 10
(1964). — 75. Е. А. Дианов, В. И. Ксензенко и др. Там же, № 3—4, 29
(1964); № 7—8, 24 11965). — 76. В. И. Ксензенко, А. Нуриев, Хим. пром,
№ 3, 183 (1966). —77. Т. К- Лукина, ИБП ГИПХ, № 3—4, 20 (1964).—
78. Г. Р. 3 а л к и н д, Т. К. Лукина, Труды ГИПХ, в. 48, 1965, стр. ПО.—
79. М. Е. Позин, И. П. М у х л е н о в, Е. С. Тумаркина, Э. Я. Т а р а т, Пен-
ный способ обработки газов и жидкостей, Госхимиздат, 1955, стр. 231.—
80. Ф. Ф. Герман, Л. Я. Ткаченко, БТИ ГИПХ, № 10, 19 (1960).
81. Ф. ф. Герман, Там же, № 12, 22 (1961). — 82. И. П. Якубовский,
ИБП ГИПХ, № 7—8, 88 (1965). —85. Ф. Ф. Герман, ЖХП, № 2, 105 (1956).—
84. Н. О. Э в е р т, Л. М. К о й ф м а н, БТИ ГИПХ, № 3, 2 (1956).— 85. И. Ш. М а-
стеровой, Там же, Ns 14, 24 (1962).—86. Правила и нормы техники безопас-
ности и промышленной санитарии для проектирования, строительства и эксплуа-
тации производства бромистого железа по методу выдувания, Госхимиздат,
1961. — 87. В. П. Ильинский, Я. М. Сеферович и др., Труды ГИПХ, в. 41,
1958, стр. 193. — 88. М. П. Мочулкин Н. О. Эверт и др., БТИ ГИПХ, Ns 5,
25 (1957).— 89. Н. П. Якубовский, Там же, № 6, 38 (1958); № 7, 41 (1958).—
90. Ф. ф. Герма н, Там же, Ns 6, 43 (1958).
91. Л. А. Кочаловский, Там же, № 6, 47 (1958). — 92, И. П. Якубов-
ский, Г. Р. 3 а л к и н д, Там же, № 6, 52 (1958). — 93. М. Е. П о з и н, Е. С. Т у-
м ар кин а, ЖПХ, 23, № 4, 396 (1950). — 94. В. И. Ксензенко, К. А. Еро-
феева, Хим. пром., Ns 3, 207; Ns 4, 260 (1964); ИБП ГИПХ, № 7—8, 45
(1965).— 95. С. Н. Титов, Н. П. Якубовский, БТИ ГИПХ, Ns 12, 27
(1961). — 96. Ф. Ф. Герман, Там же, № 14, 30 (1962). — 97. Chem. Ztg., 81,
757 (1957). — 98. К. Г. Ж и в о т о в с к и й, Н. А. Бабушкина, ЖПХ, 36, Ns 11,
2343 (1963). — 99. Н. И. Гельперин, В. И. Ксензенко и др., Хим. пром.,
№ 11, 832 (1965). —100. Г. С. Клебанов, Е. П. Басова, ЖПХ, 12, № 11,
1601 (1939).
236
Гл. VII. Бром и его соли
101. М. Г. Гусев, БТИ ГИПХ, № 9, 14 (I960). — 102. Л. В. А л е н т ь е в а,
Там же, № 10, 15 (1960). — ЮЗ. Н. О. Эверт, М. М. Шиманова, Там же,
№ 16, 21 (1962). —104. Ф. Ф. Герман, А. М. Б анвер, Там же, № 2, 1955,
стр. 10. — 105. В. П. Ильинский, Я. М. Сеферович, Сборник рефератов
ГИПХ за 1945 г., 1946, стр. 48. —106. В. И. Ксензенко, Труды МИТХТ, № 8,
1958, стр. 104. — 107. М. А. Менковский, Н. А. Петров и др., ЖНХ, № 1,
1658 (1956). —108. В. П. Ильинский, В. Ф. Бойцова, Труды ГИПХ, в. 41,
1958, стр. 129. — 109. В. Hart, Instruments, 20, 956 (1947).— 110. В. Ф. Бой-
цова, К. Д. Русинова и др., ИБП ГИПХ, № 3—4, 42 (1964); № 7—8, 18
(1965).
111. Г. Р. Залкинд, О. Н. Богатырева и др., ИБП ГИПХ, № 14, 49
(1968). — 112. О. Ф. К л о ч к о, В. П. 3 о б н и н, БТИ ГИПХ, № 3, 1956, стр. 24,—
ИЗ. С. К- Афанасьев, М. А. Портнов, Ю. И. Чепелкин, ЖПХ, 10, № 8,
1421 (1937). —114. М. А. Портнов, С. И. Элькина, Зав. лаб., 10, № И,
527 (1945). —115. А. В. Фомичев, БТИ ГИПХ, № 6, 66 (1957).—
116. И. Е. Орлов, Методы анализа рапы, буровых вод и контроль производства
иода и брома, ГОНТИ, 1939. — 117. Ц. А. А джем ян, А. И. Аккерман,
Хим. пром., № 6, 14 (1945). — 118. Б. Д. Матюшенко, БТИ ГИПХ № 14, 32
(1962).— 119. Б. П. Алешин, ИБП ГИПХ, № 11—12, 28 (1967).— 120. О. В. Ле-
бедев, Н. Е. Чумичева, Там же, № 11—12, 33, 38 (1967).
121. Ф. ф. Герман, Там же, № 11—12, 47 (1967). — 122. Б. П. Алешин,
Там же, № 11—12 (1967). — 123. к. Г. Байчиков, Л. Демидова, Е. Ефре-
мов, ЖХП, № 1, 58 (1934). — 124. А. Г. Байчиков, А. Г. Забродкин, Там
же, № 3, 59 (1934). — 125. А. Корнилов, ЖПХ, 5, 567 (1932). — 126. Б. Г. П а н-
телеймонов, ЖХП, 4, № 9, 713 (1927); 5, № 11—12, 484; № 21—22, 1220
(1928). — 127. А. Ф. Сагайдачный, Н. Захарова и др., Труды ГИПХ,
в. 18, 1933, стр. 44. —128. А. Г. Байчиков, ЖХП, № 12, 63 (1934).—
129. П. Го гор ишвили, М. Кар кор а швил и. Труды Ин-та химии АН
ГрузССР, № 11, 1953, стр. 87, — 130. Пат. США 2622966, 1952
131. J. J. Ronco, Chem. Abs., 42, № 15, 5349 (1948). —132. Япон. пат.
177354, 1949; 7008, 1951. — 133. М. S chiotter, Ober electrc-lytische Gewinnung
Von Brom und lod, Halle, 1907. — 134. M. H. Мачулкина, В M. Маркова
и др., Труды ГИПХ, в. 48, 1965, стр. 153. — 135. Япон. пат. 1511, 1952; 4464, 1952 —
136. Пат. США 3174828 1960. — 137. Г. Р. 3 а л к и н д, М. Л. Койфман, ИБП
ГИПХ,№ 11—12, 59 (1967).— 138. В. И. Ксензенко, Н. С. Г а р к а в и, Там
Же, № 11—12, 67 (1967). —139. J. Aveston, D. Everest, Chem. Ind., 14,
№ 37, 1238 (1957). —140. M. Ziegler, Angew. Chem, № 8, 283 (1960).
141. Авт. свид. 102805, 1954; 138231, 1961, — 142. E. Я. Д и а н о в,
В. И. Ксензенко, Н. К- Соловьева, сб. «Проблема комплексного исполь-
зования минеральных богатств Кара-Богаз-Гола», Изд. АН ТуркмССР, Ашхабад,
1959, стр. 206. — 143. В. П. Ильинский, А. И. Ч е р т о к, С. Л. Рахмиле-
вич, Калий, № 4, 29 (1934). —144. М. Г. Гусев, Р. И. Аров, А. Г. Лысый,
БТИ ГИПХ, № 4, 20 (1957). — 145. Правила и нормы техники безопасности и
промышленной санитарии для проектирования, строительства и эксплуатации
производства бромистого калия и бромистого натрия аммиачным методом, Гос-
химиздат, 1961. —146. В. П. Ильинский, В. Ф. Бойцова и др. Сборник
трудов ГИПХ, в. 41, 1958, стр. 161. —147. В. П. Ильинский, А. В. Попова,
БТИ ГИПХ, № 7, 25 (1958). — 148. В. П. Ильинский, А. В. Попова, Труды
ГИПХ, в. 41, 1958; стр. 183. — 149. В. X ю т н е р, Получение бромистых солей й
бромистых препаратов, Берлин, 1918. — 150. Авт. свид. 106540, 1956.
151. А. Ильин, Реактивы и препараты лабораторного назначения, ГОНТИ,
1938, стр. 131, 169. — 152. М. П. Мо чулкин, Труды ГИПХ, в. 41, 1958,
стр. 232. —153. А. М. Межерицкий,Я-К. Смирнова и др., ИБП ГИПХ,
№ 7—8, 82 (1965).
Глава VIII
ИОД И ЕГО СОЛИ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Иод — серовато-черные кристаллы с металлическим блеском
плотностью 4,93 г/см3. Плавится он при 113,6° и кипит при 184,4°.
Теплоемкость кристаллов
,05058+4,688 • 10"5/ кал/г (25—
—113°), жидкости 0,0756 кал/г
(113,6—184°) и пара 0,0350
кал/г (25—1200°). Теплота пла-
вления 14,85 кал/г (113,6°). Теп-
лота парообразования 56,9 кал/г
цри 113,6° и 39,3 кал/г при
184,4°.
Давление пара иода при
25° 0,31 мм рт. ст. и при 113,6°
90,5 мм рт. ст. Он легко возго-
няется; пары имеют фиолето-
вый цвет. При конденсации па-
ров на холодной поверхности
образуются кристаллы. Рас-
творимость иода в 1000 г воды
Рис. 71. Изменение коэффициента рас-
пределения иода между газовой фазой
и водными растворами солей и водой
в зависимости от температуры.
при 20° 0,28 г, 50° — 0,71 г и
100° — 4,5 г. В присутствии
сульфатов растворимость иода
уменьшается, а в присутствии
I", Вг-, С1_ — увеличивается вследствие образования комплексных
полигалогеновых ионов:
I + I2—I3, 13 + 12 = 15, Вг +12 = Вг12
и т. п. Это сильно влияет на коэффициент распределения иода
между газовой и жидкой фазами (рис. 71), что существенно для
238
Г л. VIII. Иод и его соли
извлечения иода из растворов воздушной десорбцией1-4. Лучше,
чем в воде, иод растворяется в этиловом спирте, эфире, хлоро-
форме, сероуглероде, тетрахлорметане, дихлорэтане, керосине и
других органических жидкостях, образуя окрашенные растворы.
Растворение иода в воде сопровождается гидролизом: 12 +
4- НгО = Н+ + I- + НЮ, константа равновесия5 которого при 20°
[Н+Пг|[Н1О] 1П-13 - 1П-13
U2J
Образующаяся иодноватистая кислота неустойчива и
вышеиии температуры и под действием света легко
80
70
60
50
60
L
$00
N al
Na 1-2
О3НС-1
го Z
yes J,/
°-20 0 20 40 60 60 Ю0
Гемге/хтура’С
Рнс. 72. Растворимость Nal, NH4I, KI и
КЮ3 в воде.
при по-
перехо-
дит в йодноватую кислоту:
ЗНЮ = ЗН+ + 2Г + Юз (этот
переход происходит легче,
чем у аналогичных соедине-
ний хлора и брома). Поэто-
му суммарное уравнение ги-
дролиза иода:
312 + ЗН2О = 6Н+ + 5 Г + 107
Его константа равнове-
сия при 20° равна в:
[Н+]6[г]5[Юз1
К = ----гт~Гз1 --- = 2.45 • Ю
U2]3
Крепкой азотной кисло-
той иод легко окисляется до
I2O5 при комнатной темпе-
ратуре. Пятиокись иода
сильно гигроскопична и под
действием влаги воздуха пе-
реходит в HI3Os. При 280°
I2O5 необратимо разлагает-
ся на 12 и О2. (После про-
должительного нагревания
при 250° наблюдается не-
значительная сублимация
I2O5.)
Йодноватая кислота при 100—130° разлагается с образованием
Н13О8. Дальнейшее разложение Н180в с образованием 120з идет
при 195—220° 5\
Иод вызывает ожоги на коже, а его пары раздражают сли-
зистые оболочки. Содержание иода в воздухе рабочих помещений
не должно превышать 0,001 мг/л.
Из неорганических соединений иода наибольшее значение
имеют иодистые натрий, калий, аммоний и иодноватокислый ка-
ю
Сырье
239
лий. Все эти соли образуют бесцветные кристаллы. Йодистый нат-
рий Nal кристаллизуется в кубической системе с плотностью
3,67 г/см3-, плавится при 651° (по другим данным при 682°). Рас-
творимость его в воде показана на рис. 72. NaI-2H2O кристалли-
зуется в моноклинной системе с плотностью 2,45 г/см3. Йодистый
натрий сильно гигроскопичен. При длительном хранении кристал-
лы его окрашиваются в желтый цвет из-за выделения свободного
иода. Йодистый калий KI и иодистый аммоний NH4I кристалли-
зуются только в безводной форме в кубической системе. Плот-
ность KI 3,13 г/см3, плавится он при 723°; плотность NH4I
2,51 г/см3. Йодноватокислый калий КЮз образует безводные кри-
сталлы кубической системы с плотностью 3,89 а/сл3; плавится при
560°. При нагревании разлагается с выделением кислорода. Об-
разует кислую соль КЮз-НЮз. Насыщенный водный раствор при
15° содержит 1,33% КЮ3-НЮ3.
ПРИМЕНЕНИЕ
Иод применяют в медицине в виде иодной настойки (5 и 10%
раствор в спирте) или раствора Лиголя (водный раствор иода,
содержащий иодистый калий) и в виде солей и органических со-
единений (йодоформ, иодгност, сайодин, сергозин, иодол и др.).
Иод используют при синтезе органических красителей, при по-
лучении титана, при изготовлении некоторых металлов высокой
степени чистоты (через иодиды). 70—75% иода перерабатывают
в иодистые соли, применяющиеся, кроме медицины, в фотографии,
лабораторной практике, в сельском хозяйстве и для иодирования
поваренной соли. Мировое производство иода составляет
~4000 т/год7-1
Согласно ГОСТ 545—71, технический иод 1- и 2-го сортов
должен содержать соответственно не менее 99 и 97,5% иода и не бо-
лее: 0,010 и 0,015% хлора и брома, 0,1 и 0,2% органических веществ
и 0,05 и 0,15% золы. Иод упаковывают в полиэтилено-лавсановые
мешки, помещаемые в картонные барабаны или деревянные бочки.
СЫРЬЕ
Иод широко распространенный в природе, но очень рассеянный
элемент. Содержание его в земной коре составляет 1 • 10~4 вес.%.
Минералы, содержащие иод, встречаются редко и в очень малых
количествах. В рассеянном состоянии иод находится повсеместно.
Содержание иода в горных породах и минералах колеблется от
1,7 • Ю"5' до 1,2'10~4%, в природных водах от 3 • 10~5 до 150 мг/л
и в воздухе 0,001—0,002 мг/м3. Наиболее богат иодом воздух при-
морских районов, так как в морской воде содержится 0,01—
0,04 мг/л иодидов или йодатов. Иод содержится во всех
240
Гл. VIII. Иод и его соли
растительных и животных организмах, особенно в морских (неко-
торые губки содержат до 8,5% иода).
Сырьем для промышленного получения иода являются некото-
рые природные отложения селитры, морские водоросли и буровые
воды нефтяных и газовых месторождений. Селитроносные породы,
содержащие иод, находятся в северной части Южной Америки
(Чили, Боливия, Перу). Содержание иода в них составляет от 0,05
до 1%. Из морских водорослей особенно богаты иодом ламина-
рия, фукус и филлофора. В Китае эти водоросли выращивают
специально для извлечения из них иода. Содержание иода в воз-
душносухих водорослях 0,02—0,5%. Буровые воды нефтяных ме-
сторождений— основное сырье для получения иода в СССР, Япо-
нии, США и других странах. Содержание иода в них 10—60 мг/л
(в отдельных случаях до 150 мг/л). Буровые воды, используемые
для промышленного извлечения иода, имеют сложный солевой
состав, различные соленость и термальный режим. Получение
иода выгоднее производить из вод, богатых иодом, но все сооб-
ражения, приведенные об извлечении брома, остаются в силе и
для извлечения иода (стр. 209, 216).
Иод, попутно с бурой и другими компонентами, можно извле-
кать из сопочных грязей, содержащих 50—200 г/м3 иода 12.
ПОЛУЧЕНИЕ ИОДА
Извлечение иода из селитренной породы13
Маточные рассолы, получающиеся при выщелачивании при-
родной натриевой селитры из породы, содержат 5—12 г/л иода
6 виде йодата и иодида натрия и кальция; их обрабатывают
бисульфитом или сульфитом натрия:
2IOg + SHSOg = 3HSO4 + 2 SO2- 4- Н2О+12
5Г + 1O3 + 6hso; = 6so|_ + зн2о + 3i2
или
2IOg 4-3SO|~ + 2HSO3 = 5SO|“ + Н2О + I2
Выделяющийся в виде илистой массы иод отделяют на фильтр-
прессах. Полученный иод-сырец содержит 50—70% иода и при-
меси Н2О, S1O2, CaSO< и др.; после его очистки получают про-
дукт, содержащий ~99% 12.
По другому методу маточные рассолы обрабатывают сульфи-
том натрия и сульфатом меди:
IOg+3SO|- = r + 3SO|-
21“ + Cu2+= Cul2
2CuI2 = 2CuI 4-
Получение иода
241
Выделившийся иод реагирует с избытком сульфита
I2 + SO2- + Н2О = 2Г + so|- + 2Н+
и потому практически полностью осаждается в виде малораство-
римого иодида меди. Его промывают и перерабатывают на иод
или иодистые соли
2CuI + ЗМпО2 = I2 + 2СиО + Мп3О4
2CuI + 6H2SO4 + 2Fe2O3 = I2 + 2CuSO4 + 4FeSO4 + 6H8O
2CuI + K2CO3 = 2KI + Cu2O + CO2
а соединения меди переводят в сульфат и возвращают в процесс.
Выделение иода из маточных рассолов можно производить об-
работкой их тиосульфатом натрия и серной кислотой, но этот ме-
1од применяется редко из-за высокой стоимости тиосульфата.
Извлечение иода из селитренных щелоков на действующих за-
водах составляет всего 60—75%. Это связано с тем, что количе-
ство иода в маточных рассолах, получаемых при переработке се-
литры, значительно превышает потребности капиталистических
стран в иоде, и многие заводы их вообще не утилизируют.
Извлечение иода из водорослей
При сжигании морских водорослей получается 18—40% золы
(от веса воздушносухой водоросли), содержащей от 0,1 до 2%
йода13-22. При озолении теряется до 50% иода; для уменьшения
потерь рекомендуют предварительно обрабатывать водоросли сла-
бым раствором щелочи или известковым молоком (1—2%), в
результате чего в золе остается 95—96% иода. Расход извести
(100% СаО) составляет ~ 6 кг на 1 кг иода.
Золу выщелачивают и растворы (иногда после выпарки для
выделения из них КС1, NaCl и др.) подкисляют серной кислотой
с целью разрушения карбонатов и сульфидов; затем для выделе-
ния свободного иода в них вводят окислитель — хлор, хлораты,
йодаты, двуокись марганца, перманганат калия и т. д. При окис-
лении йодатом, хлором, перманганатом выделение иода происходит
быстро и образуются мелкие кристаллы (в виде темного ила),
увлекающие большое количество примесей из раствора. Хлорат
калия выделяет иод при комнатной температуре медленно (15—
20 ч) и потому образуются крупные кристаллы, легко отделяю-
щиеся от раствора и увлекающие малые количества примесей.
Маточный рассол декантируют, кристаллы иода загружают в
бязевые мешки, промывают и прессуют. Полученный иод-сырец
содержит 75—90% иода, 0,5—1% хлора, 10—25% воды и ~1%
солей. Оставшийся в маточном рассоле элементарный иод (0,3—
0,5 г/л) адсорбируют активированным углем. Из угля его извле-
кают раствором каустической соды, а полученные щелока
242
Гл. VIII. Иод и его соли
смешивают с основным раствором, идущим на выделение иода.
Иод из раствора извлекают также отгонкой паром.
Извлечение иодистых солей из золы может быть осуществлено
обработкой ее спиртом (растворимость в 90%-ном спирте при
18—25° KI — 6,5 и Nal — 31%). После отгонки спирта остаются
почти чистые иодиды. Хотя извлечение иода достигает 95—97%,
метод не нашел применения из-за относительно большого рас-
хода спирта.
Осуществляют и комплексную переработку водорослей с ис-
пользованием органической их части, применяя для этого различ-
ные методы. Первый из них — сухая перегонка при 700—800°.
Остающийся в ретортах уголь, содержащий 35—40% углерода и
60—65% золы, обрабатывают водой, подкисленной НС1, при этом
большинство солей (в том числе иодиды) переходит в раствор;
из него выделяют соли калия, а затем иод. Выход иода состав-
ляет 85—87% от его содержания в водорослях. Полученный уголь
обладает высокой адсорбционной способностью. Из 1 т сухих во-
дорослей получается 150—160 кг угля, 70—80 кг смолы, 20—25 кг
^сернокислого аммония и 50—150 я3 горючего газа.
Второй метод комплексной переработки водорослей — сбражи-
вание их в присутствии фермента; в течение 15—20 суток водо-
росли почти полностью растворяются, а в растворе образуются
уксусная, валериановая, пропионовая кислоты и ацетон. Для вы-
деления кислот в форме кальциевых солей к раствору добавляют
мел. Раствор отфильтровывают на вакуум-фильтрах, выпаривают
и после выделения из него органических веществ и калийных со-
лей извлекают иод. При таком способе переработки используется
~70% сухого вещества водорослей, но стоимость иода оказывается
высокой, и потому метод требует дальнейшего усовершенство-
вания.
Третий метод — обработка водорослей водой с небольшим со-
держанием хлорной извести или гипохлорита натрия (возможно
Ch, Н2О2 и др.); при этом в раствор переходит 85—90% иода,
большая часть минеральных солей, маннит и органические азотсо-
держащие вещества. Из раствора, содержащего ~0,5 г/л иода
в виде иодноватокислых солей, извлекают иод и маннит или
только иод. Из оставшихся «отбеленных» водорослей получают
агар-агар.
ИЗВЛЕЧЕНИЕ ИОДА ИЗ БУРОВЫХ ВОД
Извлечение иода из буровых вод осуществляют адсорбцией
твердыми сорбентами, десорбцией воздухом, осаждением в виде
малорастворимых солей и экстракцией несмешивающимися с во-
дой растворителями.
При одновременном извлечении из буровых вод иода и брома,
сначала обычно извлекают иод, но имеются заводы, где вначале
Извлечение иода из буровых вод
243
извлекают бром, а потом иод23’24. В последнем случае содержа-
щиеся в буровой воде иодиды переходят в йодаты, которые перед
извлечением иода предварительно полностью или частично вновь
Восстанавливают до иодидов. В качестве восстановителя обычно
применяют сернистый газ, расход которого в несколько раз пре-
вышает теоретический, так как в сбросных рассолах бромного
производства всегда содержатся свободный бром, хлор и их вза-
имные соединения, которые тоже восстанавливаются. Иногда ис-
пользуют и другие восстановители.
Адсорбция иода твердыми сорбентами
Для адсорбции иода могут быть использованы активирован-
ный уголь, иониты, крахмал, некоторые высокомолекулярные со-
единения и т. д.8.1з, 25-31 Обычно применяют активированный
уголь и иониты, обеспечивающие высокие выходы иода.
Адсорбция иода активированным углем
К подкисленной буровой воде добавляют окислитель (нитрит
натрия, хлор, йодаты, гипохлориты и иногда хлорное железо 32-36),
в результате чего выделяется свободный иод:
2Г + 2NO" + 4Н+ = I2 + 2NO + 2Н2О
2Г + С12 = 12 + 2СГ
- 5Г + IO3 + 6Н+= 312 + ЗН2О
2Г + СЮ- + 2Н+ = 12 + СГ + Н2О
2Г + 2Fe3+ = I2 + 2Fe2+
Выделившийся иод адсорбируют активированным углем.
Насыщенный иодом уголь, называемый в производстве «иод-
уголь», промывают водой и направляют на десорбцию иода, за-
ключающуюся в нагревании иод-угля с раствором едкого натра
или сульфита натрия:
3I2 + 6NaOH = 5N al + Nalb3 + ЗН2О
I2 + Na2SO3 + H2O = 2NaI + H2SO4
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + H2O
Полученный щелок, содержащий иодиды и немного йодатов
(йодаты в процессе десорбции частично37 восстанавливаются),
подкисляют и обрабатывают окислителем (бертолетовой солью,
иодатами, хлором и иногда бихроматами 38’39) для выделения сво-
бодного иода:
6Г + СЮз + 6Н+ = 312 + СГ + ЗН2О
6Г + Сг2о|- + 14Н+ = 312 + 2Сг3+ + 7Н2О
244
Гл. VIII. Иод и его соли
Выделившийся кристаллический иод отделяют от раствора и
отжимают на прессах или центрифугах из титана или его спла-
вов 40’41.
Важнейшим процессом в этом способе извлечения иода яв-
ляется адсорбция его активированным углем 42-46. В СССР при-
меняют активированный уголь КАД, получаемый из каменного
угля, и очень редко березовый уголь БАУ. Уголь марки БАУ
имеет большую адсорбционную емкость, чем уголь КАД, но он ме-
нее механически прочен, имеет меньший объемный вес и стоимость
его значительно выше. Перед применением активированный уголь
обрабатывают разбавленной кислотой, что уменьшает его золь-
ность и повышает активность46.
Активность угля определяют по уменьшению содержания иода
в растворе йодистого калия через 30 мин и 24 ч после внесения в
раствор навески угля. Такой метод определения активности угля
дает сильно завышенные результаты (иногда в 2—2,5 раза), так
как уменьшение содержания иода в растворе происходит не только
за счет его адсорбции, но и за счет частичного восстановления 12
до I- активированным углем. Поэтому адсорбционную способ-
ность целесообразно определять по количеству иода, извлекае-
мого из угля после обработки его раствором сульфита или едкого
натра.
Уголь КАД адсорбирует иод при температуре ниже 45°, а
БАУ — при температурах ниже 60—65°. При более высоких тем-
пературах адсорбционная емкость их сильно понижается. Увели-
чение содержания иода в буровой воде повышает степень насы-
щения угля иодом, которая на практике для угля КАД состав-
ляет от 20 до 120 г иода на I л угля.
Чистота и состав применяемой буровой воды являются очень
существенными факторами, влияющими на адсорбцию. При пе-
реработке огромного количества буровой воды (для извлечения
1 т иода требуются десятки тысяч м3 буровой воды) на активи-
рованном угле осаждаются почти все взвешенные в воде при-
меси, а также адсорбируются многие вещества, находящиеся в
растворенном виде. Это приводит к снижению адсорбционной ем-
кости угля, усложняет десорбцию иода и ухудшает его качество.
Особенно вредные примеси — соли нафтеновых кислот и другие
органические вещества, содержащиеся в буровых водах нефтяных
скважин 46’47. Буровая вода, поступающая из скважин, вначале
проходит через нефтяные ловушки, а потом отстаивается в есте-
ственных или искусственных бассейнах от механических примесей.
На некоторых заводах буровую воду после отстаивания фильт-
руют через песчаные, сенные или другие быстродействующие
фильтры. При большой щелочности буровой воды ее выдерживают
в открытых водоемах 10—30 дней, в результате чего содержание
Извлечение иода из буровых вод
245
бикарбонатов уменьшается на 30—60% (иногда и на 90%):
2НСО3 = СО% + Н2О + СО2
Для этой же цели иногда буровую воду обрабатывают извест-
ковым молоком или обожженным доломитом; образующийся кар-
бонат осаждается на дно бассейна.
При хранении буровой воды в естественных водоемах, на дне
которых имеются грязевые отложения, в теплое время года на-
блюдается активная бактериальная деятельность, что приводит к
накоплению легко окисляющихся веществ (H2S, HS- и т. п.) и по-
тому извлечение иода усложняется, а расход окислителя увеличи-
вается. Иногда к буровой воде добавляют сернокислый алюминий,
соли железа (окисные) или известковое молоко 48’49; содержание
нафтеновых кислот в воде уменьшается при этом иногда на 80%.
Осветленная буровая вода поступает в смеситель, где ее под-
кисляют серной или соляной кислотой, а затем обрабатывают
окислителем. При подкислении выделяются свободные нафтеновые
кислоты, всплывающие на поверхность, и потому на некоторых
заводах после подкисления вода отстаивается, а затем уже в нее
вводят окислитель.
Расход кислоты зависит от щелочности буровой воды, содер-
жания в ней нафтенатов и применяемого окислителя. Для окис-
ления иодидов требуется, чтобы в буровых водах, содержащих
мало нафтенатов (чистая вода), кислотность была равной 1,1—
3 мг-экв!л, а для загрязненных нафтенатами вод 5—7 мг-экв1л.
При окислении с помощью Юз, Cl2, CIO- требуется меньшая ис-
ходная кислотность, а при окислении нитритами она должна быть
повышенной.
Количество вводимого окислителя регулируют таким образом,
чтобы содержание свободного иода в буровой воде составляло
92—97% от его начального содержания (в зависимости от чи-
стоты буровой воды и концентрации I"). Расход окислителя за-
висит от присутствия других восстановителей (H2S, органических
веществ и др.) и для чистых вод составляет 130—200% от теоре-
тического (по отношению к содержанию Г), а для загрязненных
достигает 400—900%.
После смесителей буровая вода по деревянным или асбоце-
ментным желобам или трубам поступает в систему адсорберов —
деревянных или железобетонных, защищенных кислотоупорным
покрытием резервуаров с ложным дном, на котором помещается
слой активированного угля. Полезная емкость адсорбера 4—20 м3
при заполнении его объема углем на 60—80%. Адсорберы уста-
навливают группами по 3—4 шт., при этом осуществляется про-
тивоток— через свежий уголь протекает буровая вода, прошедшая
другие адсорберы, а через наиболее насыщенный уголь —свежая
246
Гл. VIII. Иод и его соли
буровая вода. В зависимости от чистоты, солености и температуры
буровой воды, а также от качества применяемого угля скорость
протекания ее через адсорберы устанавливают от 2 до
4,5 м3/(м2-ч), а количество свободного иода на сбросе не более
0,5—1,5 мг!л.
Насыщенный иод-уголь после промывки его водой передают
гидротранспортом или вручную на десорбцию 50-52. Для десорбции
иод-уголь загружают в стальные котлы, обогреваемые глухим или
острым паром. Вначале иод-уголь промывают горячей водой для
удаления солей и кислоты, а потом нагревают до 90—102° с 10—
15% раствором едкого натра. Полученный раствор сливают и
иод-уголь неоднократно промывают промывными растворами от
предыдущих операций, а затем пресной водой.
При наличии на иод-угле большого количества адсорбиро-
ванных нафтеновых кислот, отмывку иода иногда производят рас-
твором сульфита натрия, который с ними практически не взаимо-
действует53. Но так как при взаимодействии иода с сульфитом
образуется эквивалентное количество кислоты (стр. 243), то для
избежания разрушения стальной аппаратуры к раствору суль-
фита добавляют едкий натр или соду. В полученные после де-
сорбции растворы, содержащие 20—35 г/л иода, после отстаивания
от частиц гипса, угля и других веществ добавляют сернокислый
глинозем или закисленную серной кислотой глину54 для выделе-
ния нафтеновых кислот. При этом осаждается шлам, с которым
теряется некоторое количество иода (при работе с загрязненными
буровыми водами потери иода достигают 5%).
Очистку растворов от нафтеновых кислот можно осуществлять
высаливанием их поваренной солью в кислой среде. Так как в
растворах помимо иодидов содержатся йодаты, то при создании
кислой среды может выделяться свободный иод. Во избежание
его потерь йодаты в этом случае предварительно восстанавливают
сульфитом натрия.
Выделение иода из очищенного раствора ведут в кристаллиза-
торах, изготовленных из дерева, кирпича или стали, футерован-
ных кислотоупорным материалом. Раствор подкисляют и вводят
в него окислитель55. При окислении бертолетовой солью кислот-
ность раствора должна быть не ниже 0,7—1 н., а при применении
других окислителей значительно ниже. Применение в качестве
окислителя йодата ускоряет выделение иода в 2—3 раза по срав-
нению с бертолетовой солью, улучшает его качество и снижает
расход кислоты.
В маточном растворе после кристаллизации остается 0,3—
1,2 г/л свободного иода, который извлекают активированным уг-
лем. Выделившийся в кристаллизаторе иод отфильтровывают и
полученную иод-пасту, содержащую 70—85% иода, заворачивают
в матерчатые салфетки или мешки и отжимают на гидравлических
Извлечение иода из буровых вод
247
прессах под давлением 450—600 ат. Лепешки иода-сырца весом
5—Ю кг упаковывают в деревянные бочки.
Этот метод получения иода-сырца трудоемок и тяжел вслед-
ствие токсичности перерабатываемого материала56. Поэтому по-
степенно переходят на непрерывную кристаллизацию иода 57-58 и
заменяют отжим иод-пасты на прессах центрифугированием59-61
или сушкой при 52°62. Реактор-кристаллизатор непрерывного дей-
ствия представляет собой вертикальный аппарат типа «труба в
трубе». В наружную трубу сверху поступают реагенты. Образую-
щаяся суспензия кристаллов иода поднимается по внутренней
трубе и сливается в непрерывно действующий отстойник. Сгущен-
ная суспензия подается на центрифугу. Часть маточного раствора
направляют на подкисление буровой воды. Съем иода с 1 л объ-
ема непрерывно действующего реактора составляет 2,5—3,5 кг/ч,
а в реакторе периодического действия всего 0,01—0,02 кг/ч.
Активированный уголь после десорбции из него иода, про-
мывки и замачивания в кислоте вновь возвращают на адсорбцию.
Уголь можно использовать не больше 4—6 раз, затем его подвер-
гают реактивации или направляют в отвал.
Реактивацию угля63 ведут при ~700° в атмосфере водяного
пара в стальных или чугунных ретортах. В процессе реактивации
органические вещества разрушаются, а гипс восстанавливается
до сульфида кальция, который затем удаляется из охлажденного
угля при обработке его разбавленной соляной кислотой. Актив-
ность реактивированного угля составляет 35—60% от активности
свежего угля.
На некоторых заводах адсорбцию иода проводят не путем
фильтрации буровой воды через слой угля, а взмучиванием его
в резервуарах с мешалкой64. Это упрощает дозировку кислоты
и окислителя, иод-уголь получается более чистым, так как не за-
гипсовывается и не замазывается осадками (глиной, песком). При
этом также сильно уменьшается количество активированного угля,
находящегося в процессе производства, т. е. объем незавершен-
ного производства. Недостатком этого способа является прерыв-
ность процесса, увеличение объема адсорбционной аппаратуры в
2—3 раза по сравнению с фильтрацией и большой расход электро-
энергии *.
Выход иода в товарный продукт составляет 75—92%. На 1 т
иода-сырца расходуют: 4—65 т серной кислоты, 1—3,6 т нитрита
натрия, 1,1—2 т едкого натра, 0,23—0,27 т бертолетовой солиг
0,2—0,5 т сульфита натрия, 0,5—2 т сернокислого глинозема,
1,2—4 т активированного угля, 8—14 т топлива (условного); рас-
ход электроэнергии составляет 5000—8000 кет ч. Широкие пре-
делы значений расходных коэффициентов обусловлены различным
* О контроле иодного производства см.
248
Гл. VIII. Иод и его соли
качеством буровой воды. Для уменьшения расхода кислоты на
26—35% можно периодически через активированный уголь филь-
тровать отработанную буровую воду. При этом происходит ней-
трализация щелочности угля и адсорбция им Н+.
Применение в качестве окислителя для буровой воды йодата
или хлора вместо нитрита натрия дает возможность снизить расход
кислоты в 2—3 раза71.
Практический интерес представляет адсорбция иода из буровых
вод углем без предварительного окисления 1“ до П72. Из сравни-
тельно чистой буровой воды при начальном содержании в ней кис-
лоты 1,4—3,8 мг-экв/л адсорбция ниже 28° идет на 92—100%.
88—96% адсорбированного иода находится на угле в молекулярном
виде, хотя он и поступает в виде I"; это объясняют образованием в
активированном угле при низких значениях pH перекиси водорода
(за счет адсорбции кислорода).
Предложены электрохимический, термический и паротермиче-
ский методы десорбции иода с угля73’7ъ Электрохимическая75 де-
сорбция основана на пропускании электрического тока через на-
гретый электролит (растворы NaCl, NasSCU и пр.), в котором на-
ходится иод-уголь; иод переходит в раствор, а затем, благодаря
повышенной температуре, возгоняется. При этом возможно достичь
100% извлечения.
Иод может быть десорбирован с иод-угля нагреванием его без
доступа воздуха при 200—400°. В зависимости от температуры, чи-
стоты иод-угля и степени его насыщения степень десорбции состав-
ляет 72—83%. Степень десорбции может быть увеличена до 92%,
если процесс вести под вакуумом. Иод, остающийся в угле в виде
иодида, может быть отмыт водой.
Паротермический метод десорбции 76-78 основан на пропускании
перегретого водяного пара через нагретый до 350—400° иод-уголь.
При этом десорбируется 55—96% иода, а остальной иод переходит
в иодид благодаря присутствию в угле восстановителей. Степень
десорбции зависит от насыщения угля иодом. При содержании иода
в угле 220 г/л степень десорбции 92—96% и расход Пара ~7 / на
1 т иода, а при 50 г/л десорбируется 55% и расход пара возра-
стает до 76 т/т иода.
Для улучшения качества иода и освобождения его от органи-
ческих примесей (без дополнительной очистки иода-сырца) пред-
ложена отгонка его паром из растворов после десорбции или ЙЗ
иод-пасты 79’80.
Выделение иода с помощью анионитов
В последнее время стали широко применять ионитный метод
извлечения иода из природных вод (СССР, Япония) 81-88 Этот ме-
тод в отличие от угольно-адсорбционного дает возможность пере-
рабатывать щелочные воды (pH ~8), содержащие 7—120 мг/л I-,
Извлечение иода из буровых вод
249
до 150 г/л С1“ и значительные количества органических веществ, и
имеющие температуру 5—60°. Вода предварительно очищается от
соединений железа и, в отдельных случаях, от органических ве-
ществ, отстаивается или фильтруется (стр. 244), затем хлорируется
для перевода Г в 12 и пропускается через один или несколько ад-
сорберов с анионитом. Окисление хлором осуществляют, в зависи-
мости от экономических соображений, или после предварительного
подкисления воды серной кислотой до pH — 2—3, и тогда потери
иода на этой стадии производства составляют 1—4%, или без
подкисления, причем потери иода достигают 30—40%. Расход
хлора в первом случае составляет 120—130% от стехиометриче-
ского, во втором — 300—500%.
В качестве анионита в Японии применяют амберлит IRA-400
или IRA-900 (тип I) с основным характером, а в СССР — смолу
АВ-17 в С1_ форме. Насыщение амберлита IRA-400 иодом при
содержании в исходной воде ~100 мг/л I- достигает 700—800 г
на л смолы; насыщение анионита АВ-17 при концентрации 1“ в
исходной воде 27—35 мг/л составляет 180—300 г/л. Потери иода
на стадии сорбции 1—7%. По окончании сорбции, для «докрепле-
ния» иод-ионита через него пропускают маточный рассол, остаю-
щийся после выделения иода, и слабые растворы (менее 2 г/л иода)
от предшествовавшей десорбции; одновременно в них вводят
5%-ный раствор нитрита. Десорбцию ведут при 50—60°, обрабаты-
вая вначале иод-ионит раствором едкого натра (100—120 г/л) или
сульфита натрия (70—100 г/л), а затем 10% раствором хлорида
натрия; иногда применяют-смешанные растворы NaOH + NaCl или
Na2SO3+NaCl. Полученные растворы, содержащие 20—25 г/л иода,
направляют на выделение иода, а слабые (промывные) растворы —
на доукрепление иод-ионита.
После десорбции иода раствором едкого натра выделение кри-
сталлического иода из концентратов производят подкислением их
серной кислотой, а растворы, полученные при десорбции с помощью
сульфита, хлорируют, причем содержание I- понижается в них
до 0,6 г/л. Отделение кристаллов иода, их промывку и укупорку
производят так, как описано выше (стр. 244). Потери на этой ста-
дии составляют 1,5—2%. Общий выход иода 85—92% (при подкис-
лении воды).
На 1 т иода-сырца расходуется: 4—12,5 т 75%-ной серной кис-
лоты, 0,7—0,75 т хлора, 0,8—0,9 т сульфита натрия (100%
Na2SOs), ~0,5 т хлорида натрия, 0,05—0,08 т нитрита натрия,
0,02—0,1 л ионита.
Десорбция иода воздухом
Извлечение иода десорбцией воздухом основано на том
же принципе, что и извлечение брома, и осуществляется в той
же аппаратуре (стр. 213), но здесь исключаются башни для
250
Гл. VIII. Иод и его соли
хлороочистки2’б9’ 89~97. Для извлечения иода по этому методу не-
обходимо содержащийся в буровой воде иодид окислить в свобод-
ный иод. Для окисления иодидов в кислой среде буровую воду
вначале подкисляют серной или соляной кислотой до pH = 2—3,5.
Затем вводят окислитель — хлор или растворы гипохлоритов; ни-
трит натрия не применяют, так как образующиеся в процессе ре-
акции окислы азота также десорбируются воздухом. Степень окис-
ления обычно составляет 95—98%.
При высокой щелочности буровой воды, обусловленной нали-
чием НСО3_, во избежание большого расхода кислоты окисление I-,
в отличие от Вт", можно вести и в щелочной среде. Растворы гипо-
хлоритов натрия или кальция дают более высокую степень окисле-
ния, чем хлор. Высокощелочные воды Бакинского района (щелоч-
ность 30—40 мг-экв/л), содержащие большое количество органи-
ческих веществ, окисляются гипохлоритом на 89—91%, а хлором
на 60—70%. Повышение температуры уменьшает степень окисле-
ния I-, так как при этом увеличивается скорость гидролиза 12 и
Происходит разрушение бикарбонатов, а образовавшиеся карбо-
наты взаимодействуют с иодом. При окислении растворами гипо-
хлоритов необходимо хорошее перемешивание и малая концентра-
ция окислителя (не более 2 г/л активного хлора), так как иначе
может происходить локальное переокисление Г до Юз- Кроме
того, окисление гипохлоритами идет сравнительно медленно—мак-
симальная степень окисления достигается через 2—3 мин.
Окисленная буровая вода поступает в десорбционную башню,
Где растворенный иод извлекается встречным потоком воздуха. Де-
сорбцию осуществляют в башнях с насадкой при скорости воздуха
0,5—1 м/сек (считая на полное сечение башни), но ее можно про-
водить и в пенных аппаратах98. Количество затрачиваемого воз-
духа зависит от давления пара иода над рассолом и будет тем
меньше, чем больше содержание иода в буровой воде, выше тем-
пература и ниже ее соленость (рис. 71) (или, наоборот, при очень
высокой солености).
Содержание иода в уходящем из десорбера воздухе колеблется
•от 0,05 до 0,25 мг/л, при этом расход воздуха в 1,1 —1,8 раза боль-
ше теоретического (вычисленного на основании коэффициента рас-
пределения09). Степень десорбции обычно составляет 92—97%.
В получающейся иодо-воздушной смеси помимо пода содер-
жатся и другие вещества, обладающие заметным давлением пара
над буровой водой. При извлечении иода из кислой буровой воды в
иодо-воздушной смеси содержатся двуокись углерода (из-за раз-
рушения СОз- и НСОз) и нафтеновые кислоты. Содержание СО2
зависит от количества карбонатов в исходной буровой воде; содер-
жание нафтеновых кислот достигает 0,5 кг на 1 кг иода. При из-
влечении иода из щелочной буровой воды количество СО2 и
Извлечение иода из буровых вод
251
нафтеновых кислот в иодо-воздушной смеси относительно неве-
лико.
Извлечение иода из иодо-воздушной смеси производят с по-
мощью сернистого газа69’100 в присутствии паров воды:
SO2 + I2 + 2Н2О = 2HI + H2SO4
Образующуюся смесь кислот улавливают в башнях с насадкой
из керамических колец, стеклянной ваты и др. Для уменьшения
потерь иода насадка должна быть влажной и потому башни перио-
дически или непрерывно орошаются циркулирующим раствором
смеси кислот. Плотность орошения не превышает 1 м*/(м2-ч).
Получающаяся смесь кислот HI и H2SO4 легко окисляется кис-
лородом воздуха с выделением свободного иода и потому во избе-
жание его потерь расход сернистого газа увеличивают до 170—250%
от теоретического. Содержание свободного иода в циркулирующем
растворе не должно превышать 0,1 г/л. Концентрация получаю-
щейся смеси кислот (80—120 г/л HI, 55—90 г/л H2SO4) зависит от
давления водяного пара в иодо-воздушной смеси.
Степень улавливания иода достигает 98%. Повышение темпера-
туры и концентрации смеси HI и H2SO4 в адсорбционной башне
выше указанного предела увеличивает потери иода из-за роста дав-
ления пара йодистого водорода над раствором. Содержащиеся в
иодо-воздушной смеси нафтеновые кислоты почти не улавливаются
сорбентом и по данным, полученным на Нефтечалинском заводе,
содержание их в растворе по отношению к иоду равно 2—4: 1000,
тогда как в газовой фазе это соотношение равно 15—45:100.
В дальнейшем иод выделяют из раствора путем введения окисли-
телей (хлора, йодата, бертолетовой соли). Выход иода составляет
95—98%. Получающиеся после выделения иода маточные рассолы,
содержащие 25—35 г/л НС1 и 80—120 г/л H2SO4, используют для
подкисления исходной буровой воды или для других целей.
Сорбент может быть также использован для получения иоди-
стоводородной кислоты или ее солей. Прямое разделение HI и
H2SO4 дистилляцией невозможно, так как при нагревании этой
смеси до 30—60° (в зависимости от концентрации раствора) идут
следующие реакции:
2HI + H2SO4 = I2 + SO2 + 2Н2О
6Ш + H2SO4 = 3I2 + S + 4Н2О
8HI + H2SO4 = 4I2 + H2S + 4Н2О
Для получения чистой иодистоводородной кислоты из смеси
кислот101 последнюю предложено обрабатывать хлоридом бария,
в результате чего выделяется осадок сульфата бария, а в растворе
остается смесь HCI и HI. Сульфат бария отфильтровывают и про-
мывают— он является побочным продуктом. Водный раствор-
НС! и HI подвергают затем фракционной дистилляции. В первой
' 252
Гл. VII/. Иод и его соли
фракции, кипящей ниже 125—126°, содержится практически весь
НС1, 0,002—0,04% Ь и 0,3—0,9% HI. Кубовый остаток имеет состав
55—56% HI, 0,1—0,2% НС1 и кипит выше 126° (азеотроп HI—НгО
кипит при 127° и содержит 57% HI). Выход HI достигает 96—98%.
Степень извлечения иода из подкисленных буровых вод состав-
ляет 77—92%, а из щелочных — 72—84%.
Производство иода десорбцией воздухом имеет ряд преиму-
ществ по сравнению с угольным методом: возможность использо-
Концентраиия бедного раствора HI,%
Рис. 73. Коэффициент распределения иода
между газовой Аазой и водным раство-
ром HI при 18—20°.
вания загрязненных и
высокощелочных буровых
вод, меньшая трудоем-
кость и простота автомати-
зации процесса 68’69> "•102,
малый объем незавер-
шенного производства;
поэтому метод десорбции
постепенно вытесняет
угольный.
При работе на тер-
мальных водах с повы-
шенной концентрацией
иода десорбция его воз-
духом является не менее
эффективным методом,
чем сорбция ионообмен-
ными смолами. Для низ-
котермальных вод с малым содержанием иода в большинстве
случаев целесообразнее использовать ионообменный метод.
Извлечение иода из природных вод десорбцией воздухом позво-
ляет получать иодистые соли, минуя стадию получения иода. Для
этого в качестве сорбента, при улавливании иода из газовой фазы,
могут применяться или растворы соответствующих иодидов (если
они растворимы) 10°, или растворы иодистоводородиой кислоты 103.
При взаимодействии 1г с растворами, содержащими I-, образуются
полииодиды—I3, Is, в результате чего давление пара иода над
раствором резко понижается (ср. рис. 73 и 71). Затем полииодиды
переводят в иодид действием сероводорода 194 или соответствую-
щего основания совместно с перекисью водорода 108:
1з +H2s = 3I“ + S+2Н+
1з + 2ОН” + Н2О2 = ЗГ + 2Н2О + О2
Указанные схемы прямого получения иодистых солей по лабо-
раторным данным дают благоприятные технико-экономические по-
казатели.
Извлечение иода из буровых вод
253
Имеются указания3-106;107 на возможность использования для
абсорбции иода из газовой фазы водных растворов тиосульфата,
сульфита натрия, щелочей, смеси сульфита с содой. Следует учи-
тывать, что содержащиеся в иодо-воздушной смеси нафтеновые
кислоты также улавливаются растворами этих сорбентов, имею-
щими щелочную реакцию.
Осаждение иода в виде малорастворимых солей
Выделение иода из буровых вод возможно на основе образова-
ния малорастворимых иодидов меди (стр. 241), серебра и ртути.
Осаждение иода в виде иодида меди целесообразно вести из буро-
вых вод, в которых содержание С1~ не превышает 4—5%, так как
при более высоких концентрациях хлоридов образуются раствори-
мые комплексные соединения, что приводит к увеличению потерь
меди и иода.
Извлечение иода в виде иодида серебра осуществляют по двум
схемам: или к буровой воде добавляют раствор нитрата серебра,
или буровую воду фильтруют через слой хлорида серебра. Полу-
чаемый иодид серебра отделяют от буровой воды, промывают, а за-
тем восстанавливают железом, цинком или электрохимически до
металлического серебра. Из регенерированного серебра получают
соответствующие соли, которые вновь используют в производстве.
Остающиеся после выделения металлического серебра растворы,
содержащие иодид железа или цинка, перерабатывают в соли иода
или из них выделяют иод путем введения окислителя.
Извлечение иода из буровых вод осаждением его в виде Cui и
Agl почти всюду прекращено из-за сравнительно больших потерь
меди и серебра (и иода).
Для извлечения иода в виде иодида ртути 108 к буровой воде
добавляют соли одновалентной ртути. Выделяющийся осадок гало-
генных соединений ртути отделяют от буровой воды и обрабаты-
вают сероводородом. Раствор HI и НС1 отфильтровывают и выде-
ляют из него иод введением окислителя. Осадок, содержащий со-
единения ртути, регенерируют. Выход иода достигает ~90%.
Экстракция иода несмешивающимися с водой растворителями
Извлечение иода по этому методу возможно вести как из кис-
лых, так и щелочных вод109-112. В качестве экстрагентов могут
применяться вещества, очень мало растворимые в воде, химически
не взаимодействующие с иодом и окислителями, вводимыми для
перевода 1~ в 1г, а также обладающие высоким коэффициентом
распределения для иода К, т. е. отношением концентрации иода в
растворителе к концентрации иода в водном растворе при рав-
новесии из—из Коэффициент распределения для одного и того же
254
Гл. VIII. Иод и его соли
экстрагента зависит от температуры, состава буровой воды, ее со-
лености и концентрации иода. Последнее связано с изменением
растворимости иода и образованием комплексных ионов 1з, Is- Для
различных экстрагентов коэффициент распределения изменяется в
широких интервалах. Так, при 20° для буровых вод Бакинского
района с плотностью 1,058—1,093 г/см3, содержащих 20—35 мг I- в
1 л и имеющих щелочность 12—16 мг-экв/л, коэффициент распре-
деления для дихлорэтана равен 80—85, керосина 30—45 и четырех-
хлористого углерода 35—45. Для системы иод—керосин — чистая
вода К— 120.
Извлечение иода из буровой воды осуществляют в эмульгато-
рах, в которых обе жидкости тщательно перемешиваются, а затем
разделяются отстаиванием, при этом основная масса иода перехо-
дит в органический растворитель. Для 95—97% извлечения иода
теоретически достаточно 2—3 экстракций, осуществляемых проти-
вотоком. Например, при соотношении между буровой водой и экс-
трагентом, равном 10: 1, и при /( = 50 извлечение иода после одно-
кратной экстракции достигает 83,3%, после двукратной 96,8%,
после трехкратной 99,4%. Из органического растворителя иод из-
влекают обработкой его раствором сульфита натрия, в результате
чего иод переходит в водный раствор в виде иодида, а экстрагент
после промывки водой возвращается в процесс.
При наличии в буровой воде значительных количеств органиче-
ских веществ (особенно нафтенатов) этот метод становится мало-
рациональным, так как в процессе экстракции образуются стойкие
эмульсии, что приводит к большим потерям экстрагента и иода,
увеличению объема аппаратуры и затратам реагентов на разруше-
ние эмульсии.
В промышленности в качестве экстрагента применяют керосин
или его смесь с петролейным эфиром, которые при этом частично
иодируются, что приводит к потере 15—20% иода. Для уменьшения
потерь иода и снижения расхода окислителя можно последний вво-
дить не в буровую воду, а в экстрагент. В качестве экстрагента
целесообразно применять вещества не иодирующиеся, но по стои-
мости и другим показателям близкие к керосину, как, например,
дихлорэтан и др.
Электрохимические методы извлечения иода
В основе этих методов лежит электролиз буровой воды, содер-
жащей I-, с выделением иода на медном или угольном ано-
де 75> 116-118 на медном аноде иод выделяется в виде иодида меди.
Выделение иода на угольном аноде может осуществляться по не-
скольким схемам. Так, анодом может служить активированный
уголь, который и адсорбирует выделившийся иод; по другим схе-
мам выделяющийся на аноде иод растворяется в буровой воде, а
Очистка иода-сырца
255
затем извлекается из нее активированным углем или выдуванием
воздухом. Электролитические методы не нашли промышленного
применения из-за высокого расхода электроэнергии и трудности
технологического оформления.
ОЧИСТКА ИОДА-СЫРЦА
Иод-сырец обычно содержит большее количество примесей орга-
нических веществ и минеральных солей, чем это допускается ГОСТ,
и поэтому подвергается очистке. Для отделения водорастворимых
солей лепешки иода промывают, для отделения остальных приме-
сей иод сублимируют или обрабатывают сырец концентрированной
серной кислотой.
Наиболее широко применяемый метод очистки — сублимацию
осуществляют в стальных, чугунных или керамических ретортах,
обогреваемых топочными га-
зами. Пары иода кристалли-
зуются на стенках холодиль-
ников, представляющих собой
систему керамических или ас-
боцементных труб, охлаждае-
мых воздухом. Для уменьше-
ния влажности получающегося
иода трубы-холодильники
укладывают с небольшим на-
клоном, а в стыках труб оста-
вляют отверстия для стока во-
ды. Иногда иод-сырец перед
сублимацией смешивают с 8—
12% негашеной извести. Для
Рис. 74. Растворимость иода в серной
кислоте.
получения крупных кристал-
лов, легко отделяемых от стенок холодильника119, температура па-
ров иода в зоне конденсации ие должна быть выше температуры
плавления иода (113,6°).
На некоторых заводах возгонку иода производят пропусканием
перегретого водяного пара (ПО—120°) через слой иода-сырца.
Пары иода и несконденсировавшиеся пары воды охлаждают в пря-
моточном холодильнике. Полученную пульпу, состоящую из кри-
сталлов иода и воды, фильтруют через бязь и прессованные уголь-
ные плитки, а затем кристаллы иода отжимают на гидравлическом
прессе. Расход пара 3,6 мгкал на 1 т иода.
Для очистки иода-сырца применяют также плавление его под
слоем серной кислоты при 120—150° или промывку его 90—93%
серной кислотой — при этом содержащиеся в сырце органические
вещества обугливаются120’121. Использование более концентриро-
ванной кислоты не улучшает очистки, но увеличивает потери иода
256
Гл. VII1. Иод и его соли
из-за повышения его растворимости (рис. 74) 122. Обработанный
серной кислотой иод измельчают и промывают водой для удале-
ния включений и серной кислоты. Потери иода составляют 2—3%,
а расход серной кислоты 2—3 т на 1 т иода. Отработанную сер-
ную кислоту используют на других стадиях получения иода.
Для получения особо чистого иода123 иод-сырец возгоняют в
вакууме или перекристаллизовывают его из раствора в четырех-
хлористом углероде; захват примесей предотвращают с помощью
стеклянной ткани.
ПОЛУЧЕНИЕ СОЛЕЙ ИОДА
Получение иодистых солей прямым взаимодействием иода с рас-
творами гидроокисей в промышленности не применяется из-за труд-
ности отделения от йодатов. Из диаграмм растворимости в систе-
Рис. 75. Изотермы растворимости в системе KI—КЮз—Н2О.
мах KI—КЮз—НгО и Nal—ЫаЮз—НгО (рис. 75 и 76) видно, что
в чистом виде можно выделить только иодат калия или натрия124.
О 10 го 30 40 50 60 70
Nal,%
Рис. 76. Изотермы растворимости в системе Nal—NalOs—Н2О.
Йодиды же всегда будут загрязнены иодатами, и для удаления
последних необходимо применять дополнительные операции.
По наиболее распространенному методу для получения иоди-
дОВ 125,126 приготавливают раствор иодисто-иодного железа Fe3I8.
Последний получают при взаимодействии железных стружек с
Получение солей иода
257
иодом в присутствии воды: 3Fe + 4I2 = Fe3I8. Затем к раствору
Fe3I8 прибавляют растворы гидроокисей или карбонатов:
Fe3I8 + 8М0Н = Fe3O4 + 8MI + 4Н2О
Fe3I8 + 4М2СО3 = Fe3O4 + 8MI + 4СО2
где М —К, Na, NH4.
Получение иодидов ведут в чугунных или стальных реакторах с
мешалкой и паровой рубашкой. Раствор карбоната или гидроокиси
нагревают до кипения, а затем медленно прибавляют раствор иоди-
стоиодного железа. После 3—6-часового нагревания, с целью по-
лучения легко фильтрующего осадка Fe3O4, последний отделяют
декантацией или фильтрованием, отжимают на фильтрпрессах и
промывают водой до практически полного извлечения иодидов.
Первые промывные воды смешивают с основным раствором и вы-
паривают до получения насыщенного раствора, из которого выкри-
сталлизовывают иодид. Кристаллы иодида центрифугируют, про-
мывают и сушат при 100°. При получении иодида аммония,
последний частично разлагается и окрашивается иодом, а потому
реакцию ведут при избытке аммиака в растворе, а окрашенные
кристаллы промывают небольшим количеством спирта или отбе-
ливают пропусканием через них паров аммиака. На некоторых за-'
водах вместо Fe3I8 готовят раствор йодистого железа FeK и ре-
акцию ведут по уравнению:
3FeI2 + I2 + 8MOH = Fe3O4 + 8MI + 4H2O
Йодиды также получают взаимодействием иодо-воздушной сме-
си 100-105 (стр. 249) или иода 127 со щелочными растворами в при-
сутствии перекиси водорода при 8—10° или в присутствии серо-
водорода:
I2 + 2МОН + Н2О2 = 2MI + 2Н2О +О2 ,
I2 + 2МОН + H2S = 2MI + 2Н2О + S
Выход иодида (в пересчете на иод) составляет 96—98%. Кон-
центрации исходных растворов КОН, К2СО3 и Na2CO3, а также-
оптимальные условия кристаллизации иодидов натрия и калия мо-
гут быть установлены с помощью диаграмм растворимости в си-
стемах Nal—Na2CO3-NaHCO3—Н2О, KI—К2СО3—КНСО3—Н2О,
KI—КОН—К2СО3—Н2О (рис. 77—79)128. Йодиды натрия и калия
высаливают карбонаты из растворов и в двойных и тройных эвто-
нических точках в пределах температур 0—25° содержание Nal
в солевой массе растворов составляет 98,3—99,3 мол. %, a KI—
87,7—91,1 мол.%. Для получения чистых иодидов карбонаты дол-
жны быть предварительно удалены из растворов добавкой Fe3I8
или HI. В системе KI—КОН—Н2СО3—Н2О наибольшим высали-
вающим эффектом обладает КОН. Применяемые для получения KI
поташ и едкое кали всегда содержат соединения натрия (1—5°/о),
9 М. Е. Поэин
NajOQ, KiCOs
Получение солей иода
259
которые накапливаются в производственных растворах и загряз-
няют готовый продукт. Пути разделения КД и Nal могут быть
выявлены с помощью диаграммы растворимости в системе
KI-Nal—Н2О (рис. 80) 129’130.
Перспективным является изготовление иодидов 125-131~134 взаи-
модействием иодистоводородной кислоты (получаемой при извле-
чении иода из рапы десорбцией воздухом, стр. 249) со щелочами,
карбонатами или хлоридами:
МОН + HI = MI + Н2О
М2СО3 + 2HI = 2MI + Н2О + СО2
МС1 + Н1 = М1 + НС1
___По последней реакции можно производить и очистку иодидов
щелочных металлов от примесей хлоридов и бромидов, обрабатывая
Рис. 80. Растворимость в системе KI—Nal—Н2О
при 0, 25 и 50°.
соли раствором HI при нагревании. Количество HI должно со-
ответствовать ~1,5 эквивалентам от содержащихся в солях Вг“
и С1-.
В лабораторных условиях разработан метод прямого получения
иодида натрия реактивной квалификации из иод-углей ,35. После
промывки иод-угля пресной водой из него извлекают иод раство-
ром щелочи или сульфитно-содовым раствором. Полученный кон-
центрат-выпаривают досуха и прокаливают при 350—450° для уда-
ления органических веществ. Остающийся плав обрабатывают
небольшим количеством воды и получают раствор, содержащий
64—65% Nal, 0,2—0,3% NaCl, 0—1% NaBr и 0,03—0,05% Na2SO4.
9*
260
Гл. VIII. Иод и его соли
В этом растворе может содержаться и 0,02—0,03% нафтеновых
кислот, если не прокаливать остаток после сульфитно-содовой об-
работки. Далее удаляют из раствора SCU карбонатом бария и
добавляют иодистоводородную кислоту (150% от эквивалента Вг_+
+ С1"). Нагреванием до кипения (128°) отгоняют смесь кислот
(НС1 + НВг + HI + Н2О), после чего остается чистый иодид натрия.
Иодат калия получают по реакциям 136.
6КС1 + 3I2 + 10HNO3 = 6КЮ3 + 6НС1 + 10NO + 2Н2О
КЮ3 • НЮ3 + КОН = 2КЮ3 + Н2б
Иодат калия может быть также получен раскристаллизацией
смеси К1 + КЮ3.
ЛИТЕРАТУРА
1. В. П. Ильинский, А. Н. Стрельникова, Труды ЛХФИ, в. 5, 1958,
стр. 32. — 2. Г. С. Клебанов, А. А. Гинзбург, Труды ГИПХ, в. 41, 1958,
стр. 8. —3. R. F. Taylor, Chem. Eng. Sci., 10, № 1—2, 68 (I960). — 4. F. Nek-
vasil, Chem. prflmysl., 16, № 4, 197 (1966). — 5. Angelescu, Popelescu,
Z. phys. Chem., Abt., A156, 3041 (1931).—6. С. И. Яворский, Г. P. Зал-
к и и д, Труды ГИПХ, в. 48, 1965, стр. 10.—6а. К- S е 11 е, A. Kjekshus, Ada
Chem. Scand., 22, № 10, 3309 (1968). —7. Chem. Age, 94, № 2616, 660 (1965).—
8. Г. А. Яковкин, ИБП ГИПХ*, № 11—12, 4 (1967). — 9. Там же, № 13, 79
(1967). — 10. W. М i 11 е г. Bull. Bur. Mines, № 630, 447 (1965).
11. Г. Л. Кореньков, Н. А. Устинова, Горнохимическое сырье зару-
бежных стран, Изд. «Химия», 1965, гл. 5. — 12. В. П. Григорович, Экономика
и культура Крыма, № 1—2 (1933). — 13. Б. П. Денисович, Иод и его произ-
водство, ГОНТИ, 1938. — 14. Б. П. Пентегов, Изв. Тихоокеанской научно-про-
мысловой станции, 3, 5 (1929). — 15. Н. Д. Аверкиев, Хим.-фарм. вести.
№ 3—4 (1936). — 16. И. Д. Аверкиев, ЖХП, 7, № 4 (1930); № 8—9 (1930). —
17. А. Мамуровский, Хим. и соц. хоз., № 9 и 10 (1931). —18. А. Марии-
н о в с к и й, Севери, хоз. (Архангельск), № 2 (1930). — 19. Ф. К- Р е в з а, БТИ
ГИПХ**, № 4, 38 (1957). — 20. В. П. Ильинский, К. И. Булгакова,
Там же, № 4, 42 (1957).
21. Rev. prod, chim., № 1314, 546 (1963). — 22. Chem. Eng., 42, № 12, 98
(1964). —23. В. П. Ильинский, К- И. Булгакова, БТИ ГИПХ, № 6, 17
(1958). — 24. К- И. Булгакова, В. П. Ильинский, Труды ЛТИ им. Леи-
совета, в. 41, 1957, стр. 145. — 25. А. П. Харин, ЖФХ, 30, № 8, 1776 (1956). —
26. J. W. Watson, Ind. Eng. Chem., 47, № 5, 1053 (1955). —27. П. В. Афа-
насьев, ЖПХ, 12, № 7, 1006 (1935). — 28. Б. П. Денисович, Там же, 11,
№ 1, 15 (1934). — 29. О. Ю.Магндсон, Там же, 12, № 4 (1935).—30. О. Ю. Ма-
ги д с о и, Там же, 4, № 1 (1927).
31. В. И. Ксензенко, Д. Е. Стасиневич, Технология брома и иода,
Госхимиздат, 1960.—32. О. И. Андреева, Б. Б. Васильев, ЖХП, 14, № 15,
1097 (1937). — 33. С. В. Горбачев, И. А. Касаткина, Бюлл. Н.-и. хим.-
фарм. ин-та, № 2, 1930.—34. К Seubert, A. Dorrer, Z. anorg. Chem., 15,
339 (1894). — 35. В. П. Толстиков, Сборник статей по общей химии, Изд. АН
СССР, в. 2, 1953, стр. 1249. — 36. С. И. Яворский, Г. Р. Залкинд, БТИ
ГИПХ, № 15, 26 (1962); № 16, 15 (1962); Изв. АН Туркм. ССР, № 2 и 3 (1962);
Труды ГИПХ, в. 48, 1965, стр. 3 и 10. — 37. И. Ш. Мастеровой. Б. М. Жеп-
* Иодо-бромная промышленность, Сб. Обзорной информации ГИПХ.
** Бюлл. техи. информации ГИПХ по иодо-бромной промышленности.
Литература
261
линский, БТИ ГИПХ, № 9,,25 (1960). — 38. к. S с а п г о, Gazz. chim. ital., 63,
58 (1933). — 39. N. S c h 1 u n d t, J. Am. Chem. Soc., 17, 754 (1895). —40. Г. Г. П o-
чепцова, С. В. Тимченко, ИБП ГИПХ, № 5—6, 34 (1965).
41. Г. Г. По чепцов а, С. В. Тимченко, Там же. № 5—6, 3 (1965).—
42. А. Н. Алексеева, Автореф. каид. дисс., ЛТИ им. Ленсовета, 1949.—
43. А. Г. Б ай чиков, ЖПХ, 15, № 4, 228 (1942). — 44. В. И. Верещагина,
А. И. Харни, Изв. вузов. Хим и хим. технол., 3, № 6, 1011 (1960).—
45. И. Ш. Мастеровой, БТИ ГИПХ, № 13, 14 (1961). — 46. С. П. Тевосов,
О. В. Андрейко, ДАН АзССР, № 2 (1953). — 47. Ф. Ф. Герман, ИБП
ГИПХ, № 5—6, 9 (1965). — 48. С. И. Яворский, К- И. Петрова, Труды
ГИПХ, в. 48, 1965, стр. 68.—49. М. А. Шейкер, Л. М. Койфман, Там же,
стр. 76; БТИ ГИПХ, № 15, 3 (1962); ИБП ГИПХ, № 1. 38 (1964).—
50. С. И. Яворский, В. Г. Тимофеева и др., ИБП ГИПХ, № 1, 7 (1964).
5/. Ф. Ф. Герман, Н. Н. Лысенко, БТИ ГИПХ, № 15, 37 (1962).—
52. И. Ш. Мастеровой, Н. П. Якубовский, Там же, № 15, 42, 46
(1962). — 53. С. И. Яворский, Э. Я- Ф а р ф е л ь, Труды ГИПХ, в. 48, 1965,
стр. 56.-54. С. И. Яворский, Е. Ф. П а ш н е в а, ИБП ГИПХ, № 5—6. 14
(1965). —55. Г. П. Третьякова, В. С. Люткевич, Там же, № 5—6, 5
(1965). — 56. Правила и нормы техники безопасности и промышленной санита-
рии для проектирования, строительства и эксплуатации производства воды по
угольному методу, Госхимиздат, 1961. — 57. И. П. Якубовский, ИБП ГИПХ,
№ 5—6, 22 (1965).—58. Ф. Ф. Герман, Там же, № 13, 20 (1967).—
59. П. В. 3 и м н и ц к и й, Там же, № 13, 25 (1967); А. Ф. Б о г и ч, Н. К. Гузев,
Там же, № 13, 27 (1967). — 60. А. К. Гузев, Ф. Ф. Герман, Там же, № 5—6,
25 (1965).
61. В. И. Волховская, Ф. Ф. Герман, Там же, № 5—6, 37 (1965).—
62. М. С. Г о б е р м а н, Л. С. Котелков, Там же, № 5—6, 38 и 45 (1965).—
63. А. X. Паиах-Заде, М. И. Попов, БТИ ГИПХ, № 4, 26 (1959).—
64. R. Robertson, Ind. Eng. Chem., 26, 36 (1934). — 65. И. E. Орлов, Ме-
тоды анализа рапы, буровых вод и контроль производства иода и брома, ГОНТИ,
1939. — 66. В. И. Ильинский, К. И. Булгакова, Труды ГИПХ,
в. 41, 1958, стр. 92. — 67. О. Ф К л ю ч к о, В. П. Зобнин, Там же, стр. 171;
БТИ ГИПХ, № 3, 24 (1956). — 68. В. П. 3 о б н и и, Там же, № 7, 33 (1958).—
69. F. G. Sawyer, М. F. О h m a n, F. Е. Lusk, Ind. Eng. Chem., 41, № 8, 1547
(1949). — 70. M. А. Л e о н о в, ИБП ГИПХ, № 5—6, 20 (1965).
71. Г. В. Сергеев, БТИ ГИПХ. № 1, 15 (1955). —72. В. П. Ильин-
ский, К. И. Булгакова, К- Ф. Русинова, Труды ГИПХ, в. 41, 1958,
стр. 83.— 75. В.'А. Пья и ков, ЖПХ, 9, № 2, 238 (1935). — 74. М. В. Т о в-
б и и, О. М. Барам, Укр. хим. ж., 21, № 2, 205 (1955). — 75. С. П. Тевосов,
Исследование электрохимических методов получения иода из нефтяных вод. Изд.
АН АзССР, Баку, 1959. — 76. В. П. Ильинский, К- И. Булгакова, Труды
ГИПХ, в. 41, 1958, стр. 75. — 77. А. X. П а н а х - 3 а д е, Уч. зап. Азерб. ун-та,
№ 1, 31 (1955); № И, 73 (1957). —78. А. X. Паиах-Заде, ИБП ГИПХ.
№ 14, 79 (1968). — 79. М. И. П о п о в, БТИ ГИПХ, № 3, 17 (1956).—80. Г. В. С е р-
геев, Там же, № 3, 22 (1956).
81. Авт. свид. 76779, 1949; 136720, I960; япон. пат. 1511, 1952; 6619, 1953;
11454, 1961; 11455 1961; пат. США 3177050, 1963; франц, пат. 1401113, 1964;
англ. пат. 1058429, 1964. — 82. Л. Г. Давыдов, Ю. А. Толмачева,
ЖПХ, 32, № 9, 1979 (1959). —85. V. Е. Mariani, Ann. chim., № 2, 158 (1961).—
84. С. И. Яворский, Э. Я. Фарфель, БТИ ГИПХ, № 12, 10 (1961); № 15,
12 (1962); ИБП ГИПХ, № 7—8. 5 (1965); Труды ГИПХ, в. 48, 1965, стр. 36,—
85. ИБП ГИПХ, № 5—6, 68 (1965). —86. С. И. Яворский, В. И. Волкова
и др., Там же, № И—12, 80 (1967); № 13, 45 (1967). — 87. С. И. Яворский,
М. С. Г о б е р м а н, Там же, № 11—12, 88, 99 (1967). — 88. К- И. Булгаков а,
Д. А. Гильманова и др., Труды ГИПХ, в. 48, 1965, стр. 46. — 89. Г. С. К л е-
262
Гл. VIII. Иод и его соли
банов, Там же, в. 41, 1958, стр. 4. — 90. Г. С. Клебанов, А. А. Гинзбург,
БТИ ГИПХ, № 2, 14 (1955).
91. Д. И. Зульфугорлы, М. И. Абдулаева, А. X. Панах-Заде
и др., Уч. зап. Азерб. ун-та, X» 4, ц (1955). — 92. С. Д. Гусейнов н др. Там
же, № 3, 17 (1955). — 93. М. И. Абдулаева, Автореф. ианд. дисс., Азерб.
ун-т, 1954. — 94. Т. Ragozinsky, Przem. Chem., Ks 9, 12, 639 (1953).—
95. Ц. А. А д ж e м я н и др., Хнм. пром., № 6, 14 (1945). — 96. С. И. Я в ор-
ский, В. И. Волкова и др., ИБП ГИПХ, № 11 — 12, 108 (1967); № 13, 12
(1967). — 97. Л. Д. Штутман, Там же, № 13, 8 (1967). — 98. М. Е. П о з и н,
Б. А. К о п ы л е в, Г. В. Бельченко, Изв. вузов. Хим. и хим. технол., № 5
(1958). —99. С. И. Яворский, В. И. Волкова и др., БТИ ГИПХ, № 13, 3
(1961); Труды ГИПХ, в. 48, 1965, стр. 86.— 100. Г. С. Клебанов, А. А. Г и н з-
б у р г, Там же, в. 41, 1958, стр. 17.
101. Г. С. Клебанов, А. А. Гинзбург, БТИ ГИПХ, № 5, 21 (1957). —
102. Э. Д. Кутний, Ю. Е. Гольберг, ИБП ГИПХ, № 1, 16 (1964).—
103. Г. С. Клебанов, А. А. Р е й х а р д, Труды ГИПХ, в. 41, 1958, стр. 40.—
104. Г. С. Клебанов, А. А. Р е н х а р д, Там же, стр. 52. — 105. Г. С. Клеба-
нов, А. А. Р е й х а р д, Там же, стр. 63. — 106. В. И. Ксензенко, Е. А. Диа-
нов. ИБП ГИПХ, № 5—6, 48 (1965).- 107. R. F. Taylor, Chem. Eng. Sci. 10,
№ 1—2, 68 (1959).— 108. Z. Szabo, M Beck, Chem. Zbll, 27, 7463 (1967). —
109. G. Rovesti, Chem. Abs., 4279 (1947); 9641 (1950).— 110. О. Ю. Магид-
сон и др., Бюлл. Н.-и. ЛХФИ, № 1—5 ,1930—1931).
111. О. Ю. Магидсон, ЖХП. 6. № 10, 1699 (1929). — 112. Б. Г. Панте-
леймонова, ЖПХ, № 9, 713 (19.27); № 11—12, 484; № 21—22, 1220 (1928).—
ИЗ. В. П. Ильинский, А. Н С т в е л ь н и к о в а, Труды ЛХФИ. в. 5, 1958,
стр. 47. — 114. А. Г. Б а й ч и к о в, ЖХП, 12, № 10, 1062 (1935). — 115. М. И. К о р-
ш у и, Там же, 7, № 10. 698 (1930). — 116. Е. И. Виноградова. ЖПХ, 12,
№ 8, 1115 (1939); 13, .№ 3. 390 (1940). — 117. А. А. Ш м у к, А. П. Харин, Там
же. 10, № 2, 223 (1937) — 118. Я. И. Г а м з у л о в, Там же, 32, № 1. 104 (1959).—
119. Е. И. Ш а в е р д о в а, Там же, 25, № 9, 919 (1952). — 120. Н. Н. Л ы с е и к о,
ИБП ГИПХ. № 5—6. 45 (1965).
121. Польск, пат 35632. — 122. Г. С. Клебанов, А. В. Морозова, ЖПХ,
37, № 1. 207 (1964).— 123 Ф. В. Денисов. Р. Г Лепидина. Там же, 39,
№ 9 (1931); № 10. 2166 (1966). — 124. С. И. Яворский, БТИ ГИПХ, № 2, 21
(1955). — 125. Л. С. М а й о ф и с, Химия и технология химфармпрепаратов. Изд.
«Медицина», 1964. — 126. F. Chemnitius, Chem. Z., 61, 587 608 (1927).—
127. К). В. Карякин, И. М. Ангелов, Чистые химические реактивы, Госхим-
издат, 1955. — 128 Г. С. Клебанов, Г. Я. Пинчук, ЖПХ. 39, № 6, 1291
(1966); 40, № 11. 2431 (1967); 41, № 1, 94 (1969). — 129. Г. С. Клебанов,
Г. Я Пинчук, ЖПХ. 37, № 2, 289 (1964). — 130. A. Hill, Н. Willson,
J. В i sh о р, J. Am Chem, Soc., 55, 521 (1933).
131. А. А. Гинзбург, Н. Г. В и с л е н е в а, БТИ ГИПХ, № 6, 24 (1958). —
132. В. П. Ильинский, Л. И. Коковкина, Мед. пром. СССР, № 2, 20
(1959) — 133. Н В. Лутугина, Л. И. Коковкина, ЖПХ, 37, № 7, 1487
(1965). — 134. Л. И. Кислякова, Автореф. канд. днсс., ЛХФИ, 1967; Н. В. Лу-
тугина, Л. И. Кислякова, ЖПХ, 41, № 1. 218 (1969).— 135. С. И. Явор-
ский, Э. Я. Ф а р ф е л ь, Труды ГИПХ, в. 48, 1965, стр. 62. — 136. А. Кац,
Реактивы и препараты лабораторного назначения, в. 1, ГОНТИ, 1938, стр. 178.
Глава IX
СОЕДИНЕНИЯ МАГНИЯ
Важнейшими соединениями магния, применяемыми в различ-
ных отраслях промышленности, являются: хлористый магний и
магнезии — окись магния и основной углекислый магний, а также
сульфат магния и некоторые другие соли.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Большинство солей магния хорошо растворяется в воде.-
Ион Mg2+ придает растворам горький вкус. Галогениды магния, за
исключением MgF2, сильно гигроскопичны — на воздухе расплы-
ваются.
Хлористый магний MgCl2 безводный плавится при 718°. В при-
сутствии следов воды «дымит» на воздухе — разлагается на НС1 и
MgO. Из водного раствора выделяются бесцветные кристаллогид-
раты с 1, 2, 4, 6, 8 и 12 молекулами воды (рис. 81). В интервале
температур от —3,4 до 116,7° устойчив кристаллогидрат
MgCl2-6H2O— бишофит, имеющий плотность 1,56—1,59 г!см\
Давление водяного пара (в мм рт. ст.) над насыщенным раствором
MgCl2 • 6Н2О: при 15°—4,11, при 30° — 9,95, при 60° — 44,33, при
100°— 165,06. Давление пара над кристаллогидратом MgCl2-4H2O:
при 100°—12,3, при 160° —228,6, а над системой MgCl2-6H2O —
MgCl2-4H2O: при 100° — 72, при 150° — 423,5 ’>2. Дигидрат стаби-
лен от 181,5 до 240°; при 240° он переходит в моногидрат
MgCl2-H2O, при нагревании которого выше 285° образуется основ-
ной хлорид магния Mg(OH)Cl. Выше 500° последний разлагается
на MgO и НС1.
В системе MgO—MgCl2—Н2О в пределах 0—110° и при кон-
центрациях MgCl2, меньших 45%, образуются кристаллогидраты
оксихлорида магния MgCl2• 3Mg(OH)2• 8Н2О и MgCl2• 5Mg(OH)2-
•2Н2О, выделяющиеся ниже 100°, и MgCl2-9Mg(OH)2-5H2O и
MgCl2-2Mg(OH)2-4H2O, выделяющиеся выше 100°. Чем выше
264
Гл. IX. Соединения магния
отношение Mg(OH)2: MgCl2 в этих соединениях, тем они устойчи-
вее при малых концентрациях MgCl2. Октогидраты образуются так-
же в системах MgO—СаС12—Н2О и CaO—MgCl2—Н2О3. Образую-
щаяся при кипячении суспензии MgO в концентрированном раство-
ре MgCl2 основная соль MgCl2 • 3Mg(OH)2 • 8Н2О переходит при
200° в тетрагидрат и при 240° в безводную соль MgCl2 • 3Mg(OH)2,
Рис. 81. Растворимость в системе MgCl2—Н2О:
/-МеС12-12Н2О: II - a-MgCl2.8H2O; /7'-p-MgCl2-8H2O;
III — MgCl2 6H2O; IV — MgC12 • 4Н2О» V — MgC12 • 2H2O.
не разлагающуюся до 320°. Начиная с 330 [температура разложе-
ния Mg(OH)2] до 360° происходит отщепление последних трех мо-
лекул воды 4,
При взаимодействии MgBr2 с гидроокисью магния образуются
соединения MgBr2• 5Mg(OH)2• 8Н2О и MgBr2-3Mg(OH)2-8H2O,
изоморфные соответствующим хлоридам и устойчивые — первое в
интервале концентраций 1,6—2,06 и второе 2,13—2,7 моль в 1000 г
раствора. Растворимость их в воде ~0,005 моль на 1000 г раствора.
При взаимодействии концентрированных растворов MgCl2
со щелочами возможно образование комплексного основания
{Mg[Mg (ОН) 2]3} (ОН) 2 4.
Растворимость MgCl2 в водных растворах, насыщенных хлори-
стым водородом, 30% при 25° и 0,7% при 0°5. (О растворимости
в водных системах, содержащих MgCl2, см.6-!0)
Физико-химические свойства
265
MgCl2 образует комплексные соединения типа М[М§С1з] • 6Н2О,
например, карналлит K[MgCl3] • 6Н2О или КО • MgCl2 • 6Н2О и.
Растворимость в системе MgCl2—КС1—Н2О приведена на стр. 162.
Разложение аммониевой соли NHJMgCh] • 6Н2О при нагревании
происходит без гидролиза и образования основных солей, что дает
возможность получить таким путем безводный MgO2. В безводных
системах МО—MgO2 (где ЛА —щелочной металл) для К и Na
известны только соединения KAAgCl3 и NaMgCl312.
Окись магния MgO встречается в природе в свободном состоя-
нии в виде минерала периклаза. Искусственная — представляет со-
бой рыхлый порошок плотностью 3,65—3,9 г/см3\ плавится при
2800°. Полученная при невысоких температурах — легко раство-
ряется в кислотах с образованием солей, соединяется с водой, об-
разуя гидрат Mg(OH)2. При сильном прокаливании становится
очень твердой и приобретает кислото- и водостойкость. Рекристал-
лизация окиси магния при нагревании начинается выше 500°, и при
1200—1600° образуются крупные кристаллы периклаза. Поэтому
активность MgO уменьшается с повышением температуры прока-
ливания до 1600°. Активность материала, обожженного выше 1600°,
вновь немного возрастает, что объясняется появлением трещин
спайности13. (О равновесии в системе 2MgO^2Mg + O2 см.14)
Гидроокись магния Mg(OH)2 встречается в природе в виде ми-
нералов брусита и немалита. Искусственно получается при дей-
ствии щелочей на растворы солей магния в виде объемистого бе-
лого студенистого осадка; величина pH осаждения 10,5; плотность
осажденной Mg(OH)2 2,36—2,40 г/см3. Она легко поглощает из
воздуха двуокись углерода. При 20° насыщенный водный раствор
содержит 0,019 г/л. а при 100° 0,04 г/л Mg(OH)2. Произведение
растворимости Mg(OH)2 при 25° равно 5,5-10~12. Вторая константа
гидролиза Mg(OH)2=^Mg2+-l-2OH_ равна 3• 10-3. Давление Н2О
над Mg(OH)2 при 300° равно лишь 10 мм вод. ст. Выше 500°
Mg (ОН) 2 теряет воду и переходит в MgO. Гидроокись магния
легко растворяется в кислотах, а также в растворе NH4C1 вслед-
ствие реакции:
Mg(OH)2 + 2NH4C1 ч=± MgCl2 + 2NH4OH
Углекислый магний MgCO3 в свободном состоянии встречается
в природе в виде минерала магнезита (а также в виде гидратов
AAgCO3 • ЗН2О и MgCO3 • 5Н2О). Плотность магнезита 3—3,12 г/см3.
Давление диссоциации MgCO3 MgO + СО2 — 28,1 ккал/г-мол
равно 1 ат при 650° 15. При 25° и давлении СО2 0,0001 ат раствори-
мость MgCO3 в воде равна ~0,5 мг/л, при 0,968 ат — 22 мг/л, а
при 15 ат — 55 мг/л. С повышением температуры растворимость
уменьшается. MgCO3 выделяется из водных растворов только, если
в них содержится большой избыток СО2; в противном случае вы-
деляются основные соли, которые образуются и при кипячении
26В
Гл. IX. Соединения магния
водного раствора MgCO3 и при взаимодействии растворов солей
магния с карбонатами щелочных металлов. Основные соли превра-
щаются в нейтральный MgCO3 при нагревании с концентрирован-
ными растворами бикарбонатов.
При насыщении двуокисью углерода водной суспензии карбо-
ната магния последний растворяется с образованием бикарбоната
MgCO3 + СО2 + Н2О = Mg(HCO3)2
который можно рассматривать как комплексную кислоту типа
H2[Mg(CO3)2]. При взаимодействии MgCO3 с карбонатами щелоч-
MgSO4, бес. °/о
Рис. 82. Растворимость в системе MgSO4—Н2О.
ных металлов образуются соли этой гипотетической кислоты — пло-
хо растворимые двойные соли, например, K2[Mg(CO3)2] • 4Н2О,
KH[Mg(CO3)2] • 4Н2О, доломит Ca[Mg(CO3)2] или CaCO3-MgCO3.
Растворимость доломита при повышенном давлении СО2 увеличи-
вается в присутствии Na2SO418.
При взаимодействии в растворе эквимолекулярных количеств
MgCl2 и КгСО3 или КНСО3 ниже 80°, а также при многосуточном
нагревании раствора Mg(HCO3)2 до 100° образуется метастабиль-
ная твердая фаза MgCO3-3H2O, устойчивая при 40° и переходящая
при 60—80° в аморфный основной карбонат 5MgO • 4СО2 • иН26
(где «=6—7). Последний разлагается при 100° с образованием
Применение
267
Mg(OH)217-19. При более высокой температуре (~200°)
MgCO3-3H2O, а также MgCO3-4H2O превращаются в MgO20-21.
Сульфат магния образует 1, 2, 3, 4, 5, 6, 7 и 12-водные кристал-
логидраты (рис. 82). При комнатной температуре из водных рас-
творов кристаллизуется эпсомит MgSO4-7H2O, а выше 48° — са-
киит MgSO4 • 6Н2О, который в интервале 87—92° плавится инкон-
груэнтно с образованием метастабильных пяти- и четырехводной
солей. Твердый MgSO4-4H2O при 106° переходит в MgSO4-3H2O,
последний — в MgSO4 • 2Н2О при 122—124°. От 161 до 169°MgSO4-
• 2Н2О переходит в MgSO4-H2O — кизерит. Из водных растворов
стабильный кизерит кристаллизуется при температурах выше 67,5°.
Обезвоживание кизерита наблюдается при 320—330° 22-24. По дру-
гим данным25, первые шесть молекул воды из эпсомита удаляются
при нагревании до 285°, последняя — при 420°. Чистый безводный
MgSO4 разлагается с заметной скоростью выше 1100°, причем ско-
рость разложения увеличивается в присутствии SiO2 26’27. При тер-
мическом разложении MgSO4-7H2O под давлением паров воды
50—200 мм рт. ст. были получены фазы с 6; 4; 2,5; 2; 1 и 0 моле-
кулами воды28.
При взаимодействии MgO, Mg(OH)2 и MgCO3 при температу-
рах 20—100° в водной среде с водным гелем кремневой кислоты
образуется нерастворимый гидросиликат магния (сепиолит).
С кристаллическим кварцем это взаимодействие идет с трудом (при
длительном нагревании при 120° в автоклаве29).
ПРИМЕНЕНИЕ
Главными потребителями соединений магния являются произ-
водство огнеупоров, строительная и металлургическая промышлен-
ность.
Значительные количества соединений магния перерабатывают
на металлический магний, используемый для получения сплавов
с алюминием и другими металлами. Введение магния (/—0,05%) в
чугун повышает его ковкость и сопротивление разрыву. /Металли-
ческий магний используют также для магнийтермического восста-
новления титана и кремния30. Магний получают восстановлением
магнезии или доломита ферросилицием или углем при ~2000° и
электролизом расплавленного безводного хлористого магния31.
В последнем случае электролитом служит или обезвоженный кар-
наллит или безводный MgCl2 с добавками КС1 и NaCl для пони-
жения температуры плавления и повышения электропроводности.
Безводный хлористый магний получают хлорированием окиси маг-
ния хлором, выделяющимся при электролизе32.
Хлористый магний применяют для изготовления цементов (на-
пример, цемента Сореля: 1 вес. ч. MgCl2+2 вес. ч. MgO + вода)
и на их основе различных строительных материалов. Магнезиаль-
ный цемент состоит из оксихлоридов магния, состав которых
268
Гл. IX. Соединения магния
зависит от условий приготовления и хранения (температуры и
влажности атмосферы). Устойчивыми в обычных условиях яв-
ляются 3MgO • MgCl2 • ЮН2О, 5MgO • MgCl2 • 12Н2О и 7MgO-
• MgCl2 • 14Н2О 33-35. Магнезиальные цементы — основа многих
строительных материалов. Производство половых покрытий из
ксилолита (магнезиального цемента с опилками), стенных пере-
городок из фибролита (магнезиального цемента со стружками) и
других обходится дешевле, чем из древесины. Применение магне-
зиальных и гипсо-магнезиальных цементов представляет особый
интерес для южных безлесных районов СССР, богатых в то же
время соляными озерами 36’37. Магнезиальные цементы исполь-
зуются также и в качестве связки в абразивной промышленности.
Хлористый магний служит одним из видов сырья для получе-
ния магнезий, применяется в качестве аппретуры в текстильной
промышленности и для пропитки деревянных конструкций с целью
придания им огнестойкости, используется для производства дефо-
лианта; его растворы применяют в качестве антифриза для пре-
дупреждения замерзания стрелок на железнодорожных путях.
Технический твердый хлористый магний представляет собой ше-
стиводный кристаллогидрат с примесью небольших количеств четы-
рехводного. Согласно ГОСТ 7759—55, он должен содержать не
меньше 45,0% MgCl2 и не больше 2,0% щелочных хлоридов, 1,6%
сульфатов (MgSO4), 0,2% солей кальция (СаО) и 0,1% нераство-
римого остатка.
Хлористый магний упаковывают в барабаны из кровельного
железа, закрашенные асфальтовым или кузбасским лаком.
Различные сорта окиси магния или жженой магнезии, называе-
мой также магнезией уста, отличаются по своим физико-химиче-
ским свойствам — легкости (объемному весу), химической актив-
ности, адсорбционным свойствам, теплопроводности и пр. Чем бо-
лее дисперсна и пориста магнезия, тем меньший объемный вес она
имеет; о ее качестве судят по ее легкости. В резиновой промыш-
ленности качество магнезии определяют так называемой лиофиль-
ностью, характеризующей адсорбционные свойства материала. Так
как адсорбционная способность усиливается с увеличением удель-
ной адсорбирующей поверхности, т. е. дисперсности и пористости,
то лиофильность и легкость магнезии являются в известном смыс-
ле однозначными терминами. Лиофильность определяется объемом,
который занимает 1 г MgO в 25 мл толуола.
Наиболее легкая и рыхлая «белая» магнезия или магнезия
альба (от лат. albus — белый), представляющая собой основную
соль карбоната магния или гидроокись магния, применяется в
качестве наполнителя и усилителя в резиновых смесях, для изго-
товления высококачественных теплоизоляционных материалов и в
медицине. Объем, занимаемый 1 г белой магнезии в 25 мл то-
луола, должен быть не меньше 6 мл. Легкие сорта магнезии уста
Применение
269
используются в качестве наполнителей в резиновых смесях и уси-
лителей свойств резины, а также в нефтяной промышленности
для отбеливания нефтепродуктов. Менее легкие сорта магнезии
(например, каустический магнезит) применяют для изготовления
цементов, строительных материалов, искусственных камней (на-
пример, мельничных жерновов). Тяжелые сорта магнезии (метал-
лургический порошок) идут на изготовление огнеупорных тиглей
и кирпичей для футеровки печей, а также раствора для их
связки 38.
По внешнему виду магнезии представляют собой белые тонкие
порошки. Требования к их составу приведены в табл. 22.
TAB ЛИЦА 22
Требования к качеству магнезий
(Содержание компонентов в %)
Магнезия жженая для резиновых смесей (ГОСТ 844-41) Каустический магнезит* (ГОСТ 1216—41)
I сорт II сорт I класс II класс III класс
MgO, не менее , Примеси, не более: СаО 89 89 87 83 75
1,25 1,25 1,8 2,5 4,5
r2o3 0,1 ** 0,3 ** 2
SiO2 1,8 2,5 4,0
Сульфаты (SO3) 0,4 0,7
Хлориды (Cl) . 0,035 0,08
Марганец Не растворимые в соляной кис- 0,003 0,007
лэте 0,2 0,25
Потери при прокаливании . . 8,5 8,5 6 8 18
Влага 1,5 1,5 1,5
* Содержание компонентов в каустическом магнезите — в пересчете на сухой продукт.
•* Fe2O3.
Легкие сорта магнезии упаковывают в многослойные крафт-
целлюлозные мешки, которые помещают в мешки из прорезинен-
ной ткани или другого водонепроницаемого материала. Другие
сорта магнезии упаковывают в мешки, фанерные барабаны, бочки
и т. п.
Сульфат магния, подобно хлориду, применяют для производ-
ства цементов, более водоупорных, чем содержащие MgClj30, его
используют в производстве искусственного шелка и др. MgSOt все
шире используют в качестве магнезиального удобрения. Пред-
ставляет интерес использование в качестве местного магнезиаль-
ного удобрения озерных рассолов и остаточных щелоков от
270
Гл. IX. Соединения магния
соледобычи. Двойная соль (NH4)2SO4-MgSO4-6H2O (соль Тут-
тона) является удобрением и фунгицидом, предупреждающим не-
которые болезни зерновых культур 40.
СЫРЬЕ
По своей распространенности в природе магний занимает
восьмое место — на его долю приходится 2,35% веса земной коры.
Он встречается большей частью в виде силикатов, карбонатов,
сульфатов и хлоридов. К силикатам относятся, например, оли-
вин (Mg, Fe)2SiO4, тальк 3MgO • 4SiO2 • Н2О, серпентин 3MgO •
• 2SiO2 • 2Н2О (серпентиниты — продукты метаморфизации оливи-
нитовых пород; волокнистой разновидностью серпентинита являет-
ся асбест); к карбонатам — магнезит MgCO3 и доломит MgCO3 •
• СаСО3; к сульфатам — кизерит MgSO4 • Н2О, каинит MgSO4 •
• КС1: ЗН2О, лангбейнит 2MgSO4 • K2SO4, шенит K2SO4-MgSO4-
• 6Н2О, эпсомит MgSO4 • 7Н2О, сакиит MgSO4 • 6Н2О, леонит
K2SO4 • MgSO4 • 4Н2О, полигалит K2SO4 • MgSO4 • 2CaSO4 • 2Н2О,
астраханит Na2SO4 • MgSO4 • 4Н2О; к хлоридам — бишофит MgCl2-
•6Н2О, карналлит КС1 • MgCl2 • 6Н2О.
Наиболее распространенными соединениями магния являются
вулканические образования — первичные силикатные и алюмоси-
ликатные породы. В качестве сырья для производства соединений
магния используют обычно вторичные твердые минералы и при-
родные растворы: растворимые соли магния и их растворы (вода
морей и соляных озер), осадочные породы морского происхожде-
ния— доломиты, магнезиты и вторичные, преимущественно гидра-
тированные силикаты — змеевики, асбесты, тальки.
Магнезит (плотность 2,9—3,1 г/см3, твердость 4—4,5) встре-
чается в двух разновидностях — плотной («аморфной») и кристал-
лической. Плотный магнезит содержит обычно больше кремнезема
и меньше других примесей (окислов железа, алюминия, кальция),
чем кристаллический. Последний часто содержит изоморфную
смесь карбонатов Fe, Са, Мп. В СССР имеются месторождения
магнезита на Урале, в Восточной Сибири, в Средней Азии, в Баш-
кирии, в районе Средней Волги и в других районах страны41. По
американским данным, мировые запасы магнезита составляют
приблизительно 8,3 млрд, т, из которых 5 млрд, т в Китае,
2 млрд, т в Корее, 65 млн. т в США42. В США бедные магнезиты,
содержащие много примесей, обогащают флотацией и разделе-
нием в тяжелых суспензиях. В качестве тяжелой жидкости плот-
ностью 2,9 г/см3 применяют суспензию 1 вес. ч. молотого ферро-
силиция в 2 вес. ч. воды. В этой суспензии магнезит (плотность
~3 г! см3) тонет, а кварцит и другие примеси (плотность
~2,6 г/см3) всплывают. По этому методу работает обогатитель-
ная фабрика мощностью 3000 t)сутки82>48,
Сырье
271
Природные доломиты (плотность 2—2,86 г/см3, твердость 3,5—•
4), помимо основного минерала доломита CaMg(CO3)2 содержат
примеси кварца, кальцита, гипса, глин и другие, придающие по-
роде различную окраску. Имеется много месторождений доломи-
тов в разных районах СССР.
Ценным магниевым сырьем являются ископаемые калиево-маг-
ниевые минералы44 — карналлит, каинит, лангбейнит, полигалит
и др. (см. гл. V). Морская вода, содержащая ~ 1,3 г/л Mg2+,—
практически неисчерпаемый сырьевой источник для производства
соединений магния45. В больших концентрациях сосредоточен Mg2+
в рапе Крымских озер, оз. Эльтон, озер Кулундинской степи, в
воде Сиваша, Каспийского моря и особенно примыкающего к нему
Кара-Богаз-Гола. Концентрация солей магния в рапе озер иногда
достигает 30%, например, в оз. Эльтон в июле-августе 46’47. Рапа
этого озера представляет собой хлормагниевый щелок с малым
содержанием других солей 48’40. Концентрированный хромагние-
вый щелок получается и при переработке карналлита (см. гл. V),
после извлечения из Карабогазской рапы мирабилита50’51, при
комплексной переработке рапы оз. Кучук 52’53 и др. Одним из
видов магниевого сырья является астраханит; в корневых отло-
жениях астраханитовых озер находится эпсомит54.
Конверсия природных двойных солей позволяет искусственно
получать щелоки, содержащие соли магния 55’56. Примером может
служить превращение карналлита в каинит:
КС1 • MgCl2 6Н2О + MgSO4 • 6Н2О = КС1 • MgSO4 • ЗН2О + MgCl2 + 9Н2О
Потенциальным сырьем для производства соединений магния
являются весьма распространенные в природе силикаты магния}
некоторые из них содержат больше магния, чем, например, кар-
наллит. Наиболее распространенным силикатом магния является
оливин (Mg, Fe)2SiO4, представляющий собой изоморфную смесь
форстерита Mg2SiO4 и файялита Fe2SiO4, а также других орто-
силикатов. Под действием гидротермальных растворов оливин
разлагается с образованием серпентина. Известны большие мас-
сивы дунита — горной породы, содержащей 50—75% оливина —
на Урале. Крупное месторождение оливина имеется на Кольском
полуострове. Волокнистая разновидность серпентинита — асбест
имеет самостоятельное техническое значение и так как содержание
его в серпентинитовой породе обычно не превышает нескольких
процентов, то при добыче асбеста на Урале, Кавказе, в Сибири
получают значительные количества отвалов серпентинита32.
В СССР и за границей проводились опыты по получению хлори- .
стого магния обработкой серпентинитов соляной кислотой или
хлорированием при 500—1000°. Основная трудность заключается
в отделении раствора хлористого магния от образующейся при
этом кремневой кислоты. Молотый серпентин применяют в каче-
стве медленно действующего магниевого удобрения57.
272
Гл, IX. Соединения магния
ХЛОРИСТЫЙ МАГНИЙ
Солнечная выпарка природных вод
Производство хлористого магния (MgCl2-6H2O) из морской
солеи и
воды, рапы озер и лиманов осуществляют после садки
извлечения брома 58.
Процесс испарения морской воды и рапы соляных озер мор-
ского типа можно проследить по диаграмме (рис. 83) изотермы
Рис. 83. Изогерма растворимости водной си-
стемы 2NaCl + MgSO4 MgCl2 + Na2SO4
при 25° (сверху — водная диаграмма).
25° взаимной водной си-
стемы 59-63
2NaC| + MgSO4 =
<= Na2SO4 + MgCl2
Эта система является
весьма сложной как по
’количеству твердых фаз,
так и по их склонности
кристаллизоваться в ме-
тастабильном состоянии.
Метастабильные участки
мирабилита, тенардита,
галита и эпсомита вкли-
ниваются внутрь поля
астраханита (области,
ограниченные пунктирны-
ми линиями). Состав со-
левой массы исходной
морской воды и рассолов
большинства соляных
озер морского типа при-
ближенно можно изобра-
зить точкой 1 — в процен-
тах ион-эквивалентов;
Mg/2 —22,3, Na —77,7,
Cl —92,5, SO4/2—7,5.
При изотермическом ис-
парении этого раствора
первой в твердую фазу
будет выделяться пова-
ренная соль. Состав рас-
твора в процессе кристал-
лизации NaCl изменяется
по лучу кристаллизации
1—2. В точке 2 состав раствора: Mg/2 — 58, Na — 42, Cl — 77,
SO4/2 — 23. Количество испаряемой воды в последовательных
стадиях’ кристаллизации можно определить по водной (верх-
Хлористый магний
273
ней) диаграмме (рис. 83). Если бы кристаллизовались только
стабильные фазы, то при дальнейшем испарении воды состав
раствора изменялся по отрезку кривой 2—3, что сопровожда-
лось бы совместной кристаллизацией галита и астраханита. Так
как точка 3 инконгруэнтная, то при дальнейшем выпаривании
воды в этой точке про-
изошло бы растворе-
ние выкристаллизовавше-
гося ранее астраханита с
выделением в осадок сме-
си NaCl и MgSO4-7H2O,
называемой смешанной
солью. Однако вследствие
того, что в природных
условиях имеет место дли-
тельное и устойчивое су-
ществование лабильных
равновесий, при испаре-
нии морской воды в боль-
шинстве соляных озер
астраханит не выпадает,
а вместо него, после не-
которого еще выделения
NaCl, начинает кристал-
лизоваться смесь NaCl и
MgSO4 • 7Н2О (ср. с про-
цессом, описанным на
стр. 71 и рис. 8.)
Состав этой смеси
изменяется по мере уве-
2NaCl ' MgCl2
Рис. 84. Изотерма 0° водной енст емы
2NaCl + MgSO4 MgCl2 + Na2SO< (с вид-
ной диаграммой).
личения концентрации
хлористого магния. По
достижении тройной точ-
ки 4 MgSO4-7H2O теряет
вследствие обезвоживающего действия хлористого магния 1 моле-
кулу воды, превращаясь в MgSO4 • 6Н2О.
При дальнейшем увеличении концентрации рассол достигает
конечной эвтонической точки Е с составом жидкой фазы (в моле-
кулах на 1000 мол. воды): MgCl2—101,0; MgSO4 — 9,5; Na2C12 —
1,1; кроме хлористого натрия и MgSO4 • 6Н2О, начнет выделяться
бишофит MgC12-6H2O и состав рассола не изменится вплоть до
полного высыхания. Такой состав плюс некоторое количество со-
лей калия и брома будет иметь «солнечный» хлористый магний,
получаемый методом естественного испарения рапы при 25°. При
0° содержание в нем MgSO4 понизится приблизительно в 2,5 раза.
Изотерма 0° изображена на рис. 84 м. (При 65° в диапазоне
274
Гл. IX. Соединения магния
весовых концентраций 7,88—6,79% MgSO4, 7,71—0,9% MgCl2,
21,14—21,82% NaCl кристаллизуется двойной сульфат
9Na2SO4-MgSO4 65.) Практически рапу обычно выпаривают более
интенсивным заводским способом, используя солнечное тепло
только для начальной стадии концентрирования природных вод
до ~20% MgCl2 66-67.
Получение MgCl2 при переработке карналлита
Независимо от способа разложения карналлита (стр. 161) хлор-
магниевые щелоки, получаемые после кристаллизации искусствен-
Рис. 85. Изотерма 25° системы
NaCl—КС1—MgCl2—Н2О.
ного карналлита, могут
подвергаться выпарке на
шестиводный хлористый
магний и дальнейшему
обезвоживанию. Содер-
жание MgCl2 в таких ще-
локах обычно 28—31%.
На рис. 85 изображе-
на изотерма 25° для кар-
наллитовой системы 58’68.
Большую часть поверх-
ности кристаллизации за-
нимают поля NaCl и КС1.
Значительно меньше поле
более растворимого кар-
наллита и меньше всего
поле бишофита. Эти че-
тыре поля сходятся в двух
тройных точках. В пер-
вой — карналлитовой с
насыщенным раствором,
имеющим состав (в
вес. %) MgCl2 —25,54,
NaCl —2,36, КО — 3,29, в
равновесии находятся три
твердых фазы: NaCl, КС1
и KCl-MgCl2-6H2O. Вто-
рая тройная точка — би-
шофитная имеет состав
MgCl2 — 35,56, NaCl —
0,32, КС1 — 0,12; в этой
точке с насыщенным рас-
твором в равновесии находятся КС1 • MgCl2 • 6Н2О, MgCl2-6H2O и
NaCl. Линия, соединяющая карналлитовую и бишофитную точки,
соответствует конечным хлормагниевым щелокам, получаемым
Хлористый магний
275
при различных способах переработки карналлитов. Чем выше при
выпарке хлормагниевых щелоков их концентрация, тем меньше
в них примесей NaCl и КС1. Обычно эти соли отделяют после
выпарки раствора до ~35% MgCl2, а затем выпарку продолжают
для получения шести-, четырех-
или двухводного хлористого маг-
ния.
Очистка карналлитового хлор-
магниевого щелока от NaCl и
КС1 может быть произведена вы-
саливанием этих солей с по-
мощью газообразного хлористо-
го водорода. КС1 высаливается
легче, чем NaCl. Уже при малых
концентрациях НС1, наряду с
NaCl и КС1 в донную фазу вы-
падает также карналлит. При
больших концентрациях НС1
(~300 г/л) выделяется очень чи-
стый MgCl2-6H2O (рис. 86). По-
следующей продувкой раствора
воздухом можно регенерировать
практически безводный хлористый
Рис. 86. Растворимость в системе
MgCl2— НС1- Н2О.
водород69. Получение чистых
продуктов этим методом дает наилучшие результаты при сочета-
нии высаливания хлористым водородом с ионным обменом70.
Выпарка хлормагниевых щелоков
Независимо от способа получения щелок, содержащий MgCl2
и некоторое количество различных примесей, выпаривают. Выпа-
ренный щелок разливают в тару, где он при охлаждении закри-
сталлизовывается в твердую массу — MgCl2-6H2O. Выпарка до
более высоких концентраций, связанная с повышением темпера-
туры кипения раствора при атмосферном давлении выше 160°, не
практикуется, так как при этом MgCl2 начинает гидролизоваться
с выделением хлористого водорода.
Для выпарки хлормагниевых щелоков применяют как вакуум-
выпарные аппараты, так и аппараты, работающие по принципу
погруженного горения 32’71-73. Выпарной аппарат погруженного го-
рения 1 (рис. 87) представляет собой чугунный или стальной фу-
терованный цилиндр с помещенной в него горелкой 2. Горение
газообразного топлива происходит в камере сгорания 3, располо-
женной ниже уровня раствора. Продукты сгорания, соприкасаясь
с раствором, вызывают сильную циркуляцию его. Выпаривание
воды из раствора происходит при температуре, соответствующей
парциальному давлению водяного пара в паро-газовой, смеси, т. е.
276
Гл. IX. Соединения магния
при температуре более низкой, чем при передаче тепла через по-
верхность нагрева. Температура отходящих газов может быть
выше температуры кипения раствора всего на 1—2°. Термический
коэффициент полезного действия весьма высок (~95%). В вы-
парной батарее из 3—4 последовательно включенных (по жидко-
сти) аппаратов хлормагниевый щелок выпаривают до концентра-
ции 34—35% MgCh- Дальнейшее выпаривание до 45—57% MgClg
Рис. 87. Выпарной аппарат с погру-
женной горелкой (разрез):
/ — выпарной аппарат; 2 — горелка; 3 — ка-
мера сгорания.
производят после отделения вы-
делившихся солей и (если тре-
буется) очистки раствора от каль-
ция (добавлением к нему раство-
ра MgSO4) в аппаратах с погру-
женным горением или в откры-
тых стальных футерованных ре-
зервуарах, обогреваемых паром
25—30 ат. О математическом опи-
сании выпарки хлормагниевого
щелока в аппаратах погружен-
ного горения см.74.
! При розливе выпаренного ще-
лока непосредственно в тару —
барабаны из кровельного желе-
за— требуются большие площа-
ди для их охлаждения. Кроме
того, извлекать монолит из бара-
банов трудно, а сами они сильно
разрушаются вследствие корро-
зии, обусловливаемой действием
хлористого магния на железо.
Эти- затруднения исключаются
при получении хлористого маг-
ния в виде чешуек75. В этом
случае в качестве тары могут применяться деревянные или фа-
нерные ящики или бочонки, или многослойные крафтцеллюлозные
мешки. Для получения чешуйчатого хлористого магния выпарен-
ный щелок (с плотностью 1,56 г/см3) кристаллизуют на вращаю-
щемся стальном барабане, охлаждаемом внутри водой.
Химические способы получения хлористого магния
Химическая переработка морской воды
Хлористый магний получают из морской воды также без ее
предварительного концентрирования и садки NaCl, непосредствен-
ным осаждением известковым молоком гидроокиси магния
(стр. 287) и растворением ее в соляной кислоте. Осадок (кек),
Хлористый магний
277
содержащий ~25% Mg(OH)2, смешивают с разбавленным рас-
твором MgCl2 и нейтрализуют соляной кислотой. Полученный рас-
твор, содержащий ~15% MgCh, выпаривают. Этот способ позво-
ляет получать Mg(OH)2, а затем и хлористый магний, не содер-
жащие соединений бора, которые не осаждаются при больших
значениях pH. Хлористый магний, перерабатываемый на метал-
лический магний, не должен содержать больше 0,001% бора.
Источником хлора для перевода суспензии Mg (ОН) 2 в MgCl2
может служить раствор СаС12 — дешевый отход содового произ-
водства. Суспензию Mg(OH)2 в растворе СаС12 подвергают76 кар-
бонизации:
Mg(OH)2 + СаС12 + СО2 = MgCl2 + СаСО3 + Н2О
После отделения осадка получается раствор, содержащий около
10% MgCl2 и некоторое количество NaCl. При выпаривании рас-
твора до 35% MgCl2 основная часть NaCl выкристаллизовывается
и отделяется.
Получение хлористого магния из доломита
Полностью обожженный доломит гасят водой при 95—100°.
Полученную пульпу, содержащую ~11% твердой фазы, подвер-
гают карбонизации при 60—40°. При этом карбонизуется только
гидроокись кальция, переходящая в углекислый кальций77. Кар-
бонизованную пульпу подвергают селективной нейтрализации со-
ляной кислотой при pH = 7 — 8 во избежание растворения СаСОз.
Соляную кислоту приливают медленно, чтобы скорость нейтрали-
зации ОН- не превышала скорости растворения Mg(OH)2. После
отделения осадка отстаиванием получаемый раствор содержит
около 16% MgCl2. Часть этого раствора возвращают на взмучи-
вание после первого отстаивания, а часть направляют на вторич-
ное отстаивание, а затем на выпарку32.
Предложено78 подвергать карбонизации при температуре ниже
40° суспензию из доломитового молока, сульфата кальция и хло-
рида щелочного металла (при молярном отношении MgO : CaSO4:
:MCI = 1:1:1). К концу карбонизации суспензию нагревают до
кипения. Образовавшийся СаСОз отделяют от раствора, затем из
него выкристаллизовывают сульфат щелочного металла, а маточ-
ный раствор, содержащий MgCl2, выпаривают.
Для получения MgCl2, не содержащего СаС12, рекомендуют79
производить карбонизацию доломитового молока, полученного ra-
in ением обожженного доломита раствором NH4CI, взятым в ко-
личестве, необходимом для обменного разложения половины окис-
лов доломита. При карбонизации в осадок выделяется основная
двойная углекислая соль кальция и магния СаСОз• Mg(OH)2, а
в растворе остается MgCl2. Осадок также обрабатывают раствором
278
Гл. IX. Соединения магния
NH4C1 для перевода Mg (ОН) 2 в MgCl2. Возможно использо-
вать для регенерации аммиака в содовом производстве вместо из-
весткового молока доломитовое молоко, с образованием при этом
MgCl280,81. При обработке жидкости теплообменника дистилляции
доломитовым молоком вначале реагирует с NH4C1 гидроокись
кальция. Гидроокись магния вступает в реакцию во вторую оче-
редь и может прореагировать при 95° полностью лишь при отгонке
аммиака. Без отгонки NH3 реакция между Mg(OH)2 и NH4C1
протекает лишь на 45—50%, идет медленно и зависит от актив-
ности окиси магния (стр. 287).
Хлористый магний из сульфатных растворов
Отбросный щелок в производстве сульфата калия, содержащий
2,9—3,2% К+, 5,5—6,5% Mg2+, 17—18% С1~ и5- 12% SOt, пред-
ложено перерабатывать следующим методом82. Вначале щелок
выпаривают и кристаллизуют лангбейнит, причем удаляете^ до
80% SOt. Оставшийся Sot осаждают хлористым кальцием, от-
деляют CaSO4 и раствор выпаривают и выкристаллизовывают из
него карналлит и галит. Полученный раствор хлористого магния
направляют на выпарку.
В Техасе (США) хлористый магний, необходимый для произ-
водства металлического магния, получают из лангбейнитовой руды
и из доломита83. Обменным разложением лангбейнита с КО вы-
деляют K2SO4. Из оставшегося раствора, содержащего около 13%
MgCl2 (при общем содержании солей ~30%), вакуум-кристалли-
зацией извлекают карналлит, а раствор MgCl2 концентрируют в
аппаратах с погруженным горением, причем он окончательно очи-
щается от КО и других солей. Обезвоженный хлористый магний
направляют на электролиз, а выделяющийся при электролизе
хлор перерабатывают в соляную кислоту, которую используют
для нейтрализации бикарбоната магния, получаемого из доломита.
Образовавшийся при этом раствор MgCl2 концентрируют и после
обезвоживания также направляют на электролиз.
Безводный хлористый магний
Обезвоживание хлористого магния
Безводный хлористый магний, содержащий до 99% MgCl2,
можно получить84 ступенчатым обезвоживанием гексагидрата до
дигидрата с дегидратацией последнего в токе НС1 при постепен-
ном повышении температуры до 350—375°, с выдержками при
250 и 305°. В производственных условиях обезвоживание
MgCl2-6H2O осуществляют таким образом, чтобы избежать его
Хлористый магний
279
плавления в кристаллизационной воде. Обычно процесс ведут в
две стадии, удаляя 4—5 моль воды в токе горячего воздуха (100—
200°), а затем окончательно обезвоживая в токе хлористого во-
дорода при 620—650°. При выпарке раствора хлористого магния
в аппаратах с погруженным горением концентрацию раствора до-
водят до 57% MgCl2, что соответствует MgCl2-4H2O, а обезвожи-
вание MgCl2-4H2O до MgCl2-2H2O осуществляют во вращаю-
щейся печи горячим воздухом. Двухводный хлористый магний
окончательно обезвоживают в токе НС] в шахтной печи, предва-
рительно брикетируя материал, или во вращающейся печи с внеш-
ним обогревом. Получаемый продукт содержит до 90% MgCl2,
4—5% MgO, 0,1—0,15% Н2О, остальное — СаС12 и примеси. Для
освобождения от MgO обезвоженный продукт подвергают пере-
плавке 85> 86.
Обезвоживание хлористого магния возможно с помощью кар-
бида кальция путем внесения его в расплавленный кристаллогид-
рат при температуре не ниже 180°87.
Предложено обезвоживать MgCl2 добавкой к его растворам
NaCl и КС1 (50% от веса MgCl2) и кипячением смеси при 350—
400° под слоем минерального масла, плавающего на поверхности.
За 1 —1,5 ч происходит полное обезвоживание88.
В США применяют метод получения безводного MgCl2 на-
греванием MgO с хлористым аммонием, получаемым в произвол-,
стве соды76. Фирма „Dow Chemical Со“ запатентовала в ряде
стран 89’80 непрерывное получение безводного хлористого магния
высокой чистоты (99,5% MgCl2) путем обработки водного рас-
твора MgCl2 аммиаком в присутствии NH4C1— выделяющийся
гексааммиакат хлорида магния отделяют и подвергают терми-
ческому разложению с регенерацией аммиака. Концентрацию ам-
миака в реакционной смеси поддерживают в пределах 35—65%
при температуре от —20 до +10°. Процесс осуществляют в си-
стеме реакторов непрерывного действия по двухступенчатой схеме.
Выход гексааммиаката хлорида магния составляет 70%. Прока-
ливание отфильтрованного и промытого осадка ведут при 400°
в течение 4 ч.
Известны и другие варианты, например, обезвоживание
MgCl2-2H2O газообразным аммиаком при 200° и 2 ат в кипящем
слое; образующийся аммиакат разлагают во 2-й зоне аппарата
ири 400° и 1 ат на MgCl2 и NH391. Запатентован92 способ, по
которому 20—50%-ный раствор MgCl2 обрабатывают при 105®'
хлоридом аммония, в кипящем слое при 215° в токе азота полу-
чают безводную соль NH4Cl-MgCl2 с избытком 20% NH4C1, затем
при 480° отгоняют NH4C1 и получают безводный MgCl2. Обезво-
живание твердого гидрата хлорида магния можно вести, нагре-
вая его суспензию в углеводородах с температурой кипения 110—
500°93.
280
Гл. IX. Соединения магния
Концентрация хлора, одъемн.
Рис. 88. Равновесие в системе
MgO + Cl2 MgCl2 + */2 О2.
Хлорирование окиси магния
Образование MgC12 по реакции MgO + Cl2 ^MgCb + V2O2
при низких температурах возможно при малых концентрациях
хлора в газовой фазе, а при высоких температурах (500—700°)
необходима большая концентрация хлора (рис. 88). Практически,
в связи с малой скоростью реакции ниже 500°, процесс ведут при
высоких температурах 85-94’95. Образование MgCl2 ускоряется в
присутствии восстановителя, так как при этом выводится из сферы
реакции кислород. В каче-
стве восстановителя приме-
няют твердый углерод или
окись углерода:
MgO (тв.) + С (тв.) + С12 (г.) =
= MgCl2 (ж.) + СО (г.) + 25,7 ккал
MgO (тв.) + СО (г.) + С12 (гЛ=
= MgCl2 (ж.) + СО2 (г.) 4- 66,5) ккал
С твердым углеродом ре-
акция протекает с достаточ-
ной полнотой при 800—
900°; с окисью углерода —
при более низкой темпера-
туре. Окись магния должна
содержать минимальное ко-
личество примесей. Особен-
но вредны примеси А1оО3 и
SiO2, продукты хлорирования которых уносятся из печи с газом.
Кроме того, они частично реагируют друг с другом и с MgO, об-
разуя силикатную корку, препятствующую диффузии хлора к ча-
стицам окиси магния.
Хлорирование ведут в шахтной электрической печи32, подобной
печам, применяемым для хлорирования титанистого и другого
минерального сырья (см. рис. 448, стр. 1490). Электрический ток
подводят к насадке из угольных цилиндриков (100X100 мм), рас-
положенных двумя рядами (верхний и нижний) в пространстве
между электродами. В печь загружают брикеты, изготовленные
из тонкоизмельченного каустического магнезита, углеродистого ма-
териала и пека. В нижней части печи имеются фурмы для подачи
хлора и летка для периодического выпуска (каждые 3—4 ч) рас-
плавленного хлористого магния.
Для брикетирования шихты можно применять хлористый маг-
ний96, но, по-видимому, это не имеет особых преимуществ. Хло-
рирование ведут при 1000—1050° в верхней части насадки и 800—
850° — в нижней, так, чтобы выходящий MgCl2 имел 700—750°. При
более высокой температуре происходит значительное испарение
Магнезии
281
MgCl2. Производительность печи, перерабатывающей в начале
кампании 13—16 т брикетов и 9—12 т хлора в сутки, постепенно
снижается вследствие загрязнения угольной насадки окислами и
уменьшения ее электропроводности. Поэтому периодически через
1,5—6 месяцев печь останавливают для чистки от шлаков и за-
мены насадки и одновременного ремонта огнеупорной футеровки.
На производство 1 т безводного хлористого магния расходуют:
550 квт-ч электроэнергии, 90 кг угольной насадки, 3 кг угольных
электродов, 800—950 кг хлора.
Представляет интерес хлорирование окиси магния, суспенди-
рованной в расплаве хлоридов, в присутствии восстановителя;
процесс может быть осуществлен в барботажном тарельчатом ап-
парате97’ 98.
Безводный хлористый магний образуется также в качестве по-
бочного продукта при восстановлении магнием титана из "ПСБ".
МАГНЕЗИИ
Существует много способов производства окиси магния и дру-
гих форм магнезий 100’101. Тяжелые формы получаются при обжиге
магнезита и доломита, термическом разложении сульфата магния
и гидролизе хлорида магния. Магнезии с различной степенью
активности получают осаждением из растворов гидроокиси магния
и основных карбонатов магния и их последующей термической
обработкой.
Тяжелые формы магнезии из магнезита и доломита
Обжигом высокосортного магнезита при относительно невысо-
ких температурах (~700°) получают магнезию, содержащую все
примеси, имевшиеся в магнезите. Под названием «каустический
магнезит» такую магнезию используют для изготовления цементов
и строительных материалов. При высокотемпературном обжиге
магнезита (1500—1800°) получается неактивная форма окиси маг-
ния, состоящая из крупных зерен периклаза, она носит название
металлургического порошка и применяется для изготовления огне-
упоров. Обжиг магнезита осуществляют в шахтных, вращающихся
и механических полочных печах 32-102, а также в печах со взвешен-
ным слоем. Для получения металлургического порошка предло-
жено 103’104 обжигать во вращающихся печах при 1500—1800° и
другие магнезиальные материалы — брусит, доломит или магнезит
в смеси с небольшим количеством гидратирующихся окислов
(MgO или СаО).
Известны разные способы получения окиси магния из доломити-
зированных материалов, загрязненных силикатами и кремнеземом.
282
Гл. IX. Соединения магния
Так, предложено обжигать доломит в смеси с силикатом и не-
большим количеством окиси железа, улучшающей спекаемость
сырья 105. Обожженный материал затем обрабатывают водой, при-
чем гидратируется и отмывается основная масса СаО, не вошед-
шей в образовавшийся при обжиге феррит. От последнего окись
магния очищают магнитной сепарацией, а затем освобождают от
остатков Са(ОН)2 обработкой соляной кислотой и промывают во-
дой 106.
На заводе фирмы «Kaiser Refractories» (США)107 кусковой доло-
мит отделяют от примесей песка в сепараторе, заполненном измель-
ченной смесью ферросилиция и магнетита, через которую проду-
вают сжатый воздух. Плотность смеси 2,72—2,76 г)см\ а доломита
2,85 г/см3-, поэтому он опускается на дно и отводится, а песок и
другие более легкие примеси остаются на поверхности материала,
заполняющего сепаратор. Доломит очищают от захваченных ча-
стиц ферросилиция и магнетита в виброкамерах и промывают. За-
тем его обжигают во вращающихся барабанных печах длиноф91 м.
При прокаливании до 1800° с добавкой 5% окислов железа полу-
чается «пережженный доломит» с большой плотностью; его измель-
чают и обрабатывают при 80° нефтяным битумом для предотвра-
щения гидратации. Этот материал используют в качестве метал-
лургических флюсов. Доломит, предназначенный для получения
окиси магния, прокаливают не выше, чем при 1100°. Предложено
также осуществлять избирательную кальцинацию загрязненного
силикатами и кремнеземом доломита во взвешенном слое с одно-
временной сепарацией продукта. Образующийся порошок окиси
магния имеет зерна меньше 0,25 мм и увлекается газовым потоком
в сборник, а более крупные зерна примесей остаются и выводятся
из зоны обжига 108.
При получении каустического магнезита освобождение от при-
меси SiO2, присутствующей в сыром магнезите, также может быть
достигнуто в процессе обжига. При быстром нагревании магнезита
до 600—800° примесь p-модификации кварца при 575° переходит
в a-модификацию с превращением его в тончайший порошок, ко-
торый легко выносится из печи проходящими через нее газами 109
Бикарбонатный способ получения магнезий
Путем дальнейшей химической обработки продуктов обжига
магнезита и доломита можно получить из них легкие формы маг-
незий. Одним из методов такой обработки является перевод мало-
активной окиси магния в раствор в форме бикарбоната магния с
последующим осаждением из него активной магнезии. Окись маг-
ния, полученную при обжиге магнезита, размалывают и гасят во-
дой. Образующуюся суспензию—магнезиальное молоко подвер-
гают карбонизации двуокисью углерода в автоклавах под давле-
Магнезии
283
нием выше 5 ат. При этом образуется раствор бикарбоната
магния
Mg(OH)2 + 2СО2 = Mg(HCO3)2
который после отделения от твердых примесей при дальнейшем ки-
пячении гидролитически разлагается:
2Mg(HCO3)2 = MgCO3 + Mg(OH)2 + ЗСО2 + Н2О
Образующийся осадок основного карбоната магния отделяют
и после сушки получают в виде тончайшего порошка — магнезии
альба.
Рис. 89. Термограммы диссоциа-
ции карбонатов кальция и магния
в атмосфере СО2 при нормальном
давлении:
I — известняк; 2 — доломит; 3 — магнезит.
Время, мин
Рис. 90. Скорость диссоциации доло-
мита при 620°:
I — е добавкой NaF; 2-с добавкой NaCl;
3— без добавки.
Аналогичным путем получают магнезию и из доломита. При об-
жиге диссоциация доломита
MgCOj • СаСО3 = MgO + СаО -ь 2СО.> — 74 кка ?
протекает в две стадии (рис. 89). Разложение MgCO3 доломита
происходит при ~730°, т. е. на ~80с выше, чем разложение
MgCOs магнезита. Это обусловлено тепловым эффектом образова-
ния CaMg(CO3)2. Опытным путем установлено отсутствие стадии
предварительного распада доломита на образующие его карбона-
ты110. При 730° доломит разлагается с образованием MgO и твер-
дого раствора карбонатов, обедненного углекислым магнием111:
»CaMg(CO3)2 = (и — l)MgO + MgCO3-nCaCO3 + (n- 1)СО2
Повышением температуры до 910° достигается дальнейшая дис-
социация твердого раствора:
MgCO3 • яСаСО3 = MgO + «СаО + (п + 1)СО2
Скорость диссоциации доломита меньше, чем магнезита; ©на
увеличивается в присутствии 1% фторида или хлорида натрия
284
Гл. IX. Соединения магния
(рис. 90)32>112>113. Обжиг доломита ведут при 700—800° или
1100—1250° в зависимости от назначения получаемого продукта.
При неполном обжиге разлагается лишь MgCO3 и получается так
называемый полуобожженный доломит. Его можно, в частности,
получить при быстром нагревании доломита в закрытой зоне вра-
щающейся печи до 750—800° в атмосфере СО2 в течение 15 мин и
дальнейшем охлаждении до 500° в течение 30 мин 114.
При гашении водой полностью обожженного доломита обра-
зуется суспензия гидроокисей магния и кальция:
(MgO + СаО) + 2Н2О = Mg(OH)2 + Са(ОН)2
Скорость гидратации MgO уменьшается с повышением темпе-
ратуры обжига и особенно резко выше 1300° (рис. 91); она умень-
шается также в присутствии
примесей СаО, S1O2, А12О3 и
других и зависит от размеров
частиц окиси магния115. При
отстаивании суспензии гидро-
окись магния оказывается в
верхнем слое, что позволяет
производить этим методом гру-
бое отделение ее от других
твердых компонентов. Неболь-
шие добавки MgCl2 ускоряют
гидратацию, но при этом воз-
можно образование оксихло-
ридов И6.
Время гидратации, сутки
Рис. 91. Скорость гидратации окиси Для получения относитель-
магния, обожженной .при разных тем- но крупных кристаллов
„ср.уур.у, Н.™ь„, 25%; Mg(0H)2 „ суслензии ваше-
температура . пие ведут при 95-100", иагре-
вая пульпу, содержащую ~17% твердой фазы, острым паром.
Для разделения гидроокисей магния и кальция пульпу разбавляют
до содержания твердой фазы 11%, охлаждают до 60° и подвергают
карбонизации. При этом Са(ОН)2 переходит в СаСО3, a Mg(OH)2
остается без изменения:
Са(ОН)2 + Mg(OH)2 + СО2 = СаСО3 + Mg(OH)2 + Н2О
В интервале 40—60° карбонизация гидроокиси кальция идет с
максимальной скоростью. Осаждение СаСО3 осуществляют в сталь-
ных аппаратах под атмосферным давлением, подавая в них турбо-
газодувками газ из обжиговых печей, содержащий до 40% СО2.
Конец карбонизации гидроокиси кальция определяют по электро-
проводности пульпы — после окончания карбонизации Са(ОН)2
электропроводность резко увеличивается вследствие начала карбо-
низации Mg(OH) 2 32. Полученную пульпу направляют на дальней-
шую карбонизацию, причем образуется раствор бикарбоната маг-
Магнезии
285
ния. Растворимость MgO в, воде, насыщенной двуокисью углерода,
показана на рис. 92. Во избежание выделения в осадок карбоната
магния при получении бикарбоната магния температуру не подни-
мают выше 26°. Бикарбонатный раствор, отделенный от шлама
(СаСО3, SiO2 и др.), разлагают, нагревая его при перемешивании
до 45—50°. При этом образуется основной карбонат магния
3MgCO3 • Mg(OH)2, который высушивают и выпускают в качестве
легкой магнезии. Очистка раствора от соединений железа и мар-
ганца может быть осуществлена добавкой
к раствору гидратированного углекислого
магния 117.
Скорость растворения Mg(OH)2 при
карбонизации водной суспензии опреде-
ляется скоростями процессов растворения
и гидратации двуокиси углерода 118. Прак-
тически скорость карбонизации гидроокиси
магния зависит от интенсивности переме-
шивания суспензии и от парциального дав-
ления СО2 в газе. Оптимальное давление
СО2 — 2,5—3 ат; при таком давлении рас-
творяется 80—90% MgO и образуется пе-
ресыщенный раствор бикарбоната, содер-
жащий 25—30 г/л MgO. Добавка к магне-
зиальной суспензии 25 г/л MgSO4-7H2O
облегчает растворение MgO и способствует
стабилизации пересыщенного бикарбонат-
ного раствора 11В. Средняя скорость раство-
рения гидроокиси магния и концентрация
образующегося пересыщенного раствора
Mg(HCO3)2 растут с увеличением концен-
трации MgO в суспензии до 30 г/л, а затем уменьшаются. На
степень возможного пересыщения раствора сильно влияют также
размеры частиц гидроокиси магния, зависящие от условий об-
жига исходного магниевого минерала (прежде всего от темпе-
ратуры обжига120). При карбонизации полуобожженныхдоломитов
наблюдается большая растворимость бикарбоната магния при ма-
лой длительности карбонизации (вследствие пересыщения раство-
ра), но с увеличением продолжительности процесса содержание
его в растворе уменьшается, а в осадок выделяется основная угле-
кислая соль магния, смешивающаяся с нерастворимыми состав-
ными частями доломитов121. В суспензии обожженного доломита
при обработке СО2 под давлением образуется двойная соль
Mg(HCO3)2 • MgCO3; при давлении 16 ат в твердой фазе нахо-
дится MgCOs-3H2O, а в растворе Mg(HCO3)2; при 60 ат выде-
ляется в осадок MgCO3, а количество магния в растворе — 24 г/л
(в пересчете на MgCO3 • ЗН2О)122.
Рис. 92. Растворимость
MgO в воде, насыщен-
ной двуокисью углерода.
286
Гл. IX. Соединения магния
Декарбонизация раствора бикарбоната магния с получением
основной соли ускоряется при продувке через раствор воздуха.
Однако этот воздух значительно снижает концентрацию выделяю-
щейся в этом процессе двуокиси углерода, что затрудняет ее воз-
врат на карбонизацию. Поэтому вначале разложение раствора ве-
дут только при механическом перемешивании с использованием
выделяющегося газа. После снижения концентрации MgO до 4 г/л
через раствор начинают продувать воздух, причем выделяющийся
газ выбрасывают в атмосферу.
Для получения основного карбоната магния разложение бикар-
бонатного раствора ведут при температуре выше 45°, потому что
при 25° из пересыщенного метастабильного раствора Mg(HCO3)2
выделяется не основная соль, a MgCO3 • ЗН2О (кристаллы ромби-
ческой системы), а при 10° —MgCO3-5H2O (кристаллы моноклин-
ной системы); превращение MgCO3-5H2O в MgCO3-3H2O происхо-
дит при 13,9° 120’123~125. Предложено производить разложение би-
карбонатного раствора, «мгновенно» нагревая его до 100° инжекти-
рованием струей пара в реакционную камеру, где в мельчайших
капельках раствора образуются частицы со средним размером
~2 мк, имеющие состав 5MgO • 4СО2 • Н2О, т. е. 4MgCO3-
• A1g(OH)2123. Предложено также обрабатывать раствор Mg(HCO3)2
при 80—90° 2—5%-ным щелочным или канифольным мылом;
выделяющийся при этом осадок основной соли MgCO3 • Mg(OH)2,
зерна которого покрыты мылом, рекомендуется в качестве напол-
нителя тля резиновых смесей 126.
Карбонизацию суспензий, содержащих Mg(OH)2, с последую-
щим разложением Mg(НПО,)9 можно использовать и для очистки
технических окиси или гидроокиси магния; в этом случае после от-
деления примесей от раствора Mg(HCO3)2 его высушивают и про-
каливают или прокаливают полученную из него магнезию. При
энергичном перемешивании раствора бикарбоната магния с водной
суспензией гидроокиси магния ниже 50° получается карбонат
магния:
Mg(HCO3)2 + Mg(OH)2 = 2MgCO3 + 2Н2О
Для увеличения активности рекомендуется выдерживать его при
температуре ниже 27° 127.
Из руд, содержащих брусит (MgO • Н2О) можно извлекать
окись магния выщелачиванием раствором, насыщенным СО2 и SO2
(рН = 4,5—5,5); при повышении pH полученного раствора MgHSO3
до ~9 добавкой MgO или Mg(OH)2 осаждается MgSO3-6H2O,
который затем перерабатывают в окись магния с регенерацией
SO2. Часть окиси магния возвращают в процесс 128.
Предложено 129 получать окись магния из обожженного магне-
зита или брусита циклическим способом с помощью этаноламина.
Исходный материал диспергируют при 30° в течение 8 мин в про-
Магнезии
287
карбонизированном 30%-ном растворе моноэтаноламина. После
отделения от шлама на фильтре остается пересыщенный раствор
(15—17 г/л MgO). Через 45—50 мин из него начинает выделяться
чистый MgCO3, который отфильтровывают и прокаливают, а филь-
трат вновь насыщают двуокисью углерода и возвращают в цикл.
Продукт содержит больше 95% MgO.
Аммиачные способы получения магнезий
В Пейнсвилле (Охайо, США) крупное производство окиси маг-
ния из доломита, содержащего 20% MgO, комбинируется с произ-
водством кальцинированной соды. Газ, получаемый при обжиге
доломита в шахтных печах и содержащий до 40% СО2, исполь-
зуется в содовом производстве и для переработки гидроокиси маг-
ния. Доломитовое молоко направляют на станцию дистилляции
содового завода, где оно взаимодействует с раствором хлористого
аммония (с фильтровой жидкостью). При достаточном количестве
доломитового молока, обеспечивающем эквивалентное соотноше-
ние между СаО и NH4CI, гидроокись магния не вступает в реак-
цию, остается неизменной, а Са(ОН)2 превращается в СаС12:
Mg(OH)2 + Са(ОН)2 + 2NH4CI = Mg(OH)2 + СаС12 + 2NH3 + 2Н2О
После отгонки NH3 суспензия Mg(OH)2 в растворе СаС12
уплотняется, гидроокись магния отфильтровывают, промывают и
прокаливают для превращения в окись магния76. Для получения
таким способом окиси магния, удовлетворяющей требованиям
стандарта на металлургический порошок 2-го класса, необходима
тонкая очистка известково-магнезиального молока и работа без
избытка окиси кальция 77.
По другому варианту дистиллерная жидкость, полученная при
обработке фильтровой жидкости доломитовым молоком, подвер-
гается карбонизации, в результате которой осаждается СаСОз,
a Mg(OH)2 превращается в MgCl2:
Mg(OH)2 + Са(ОН)2 + 2NH4CI + СО2 = MgCla + СаСО3 + 2NH3 + ЗН2О
Затем полученный раствор хлористого магния перерабатывают
на магнезию.
Гидроокись магния может быть получена одновременно с суль-
фатом аммония при обработке раствора MgSO< аммиаком и дву-
окисью углерода 130-133.
Известковый способ получения магнезий
Этот- способ заключается в осаждении гидроокиси магния
из растворов хлористого магния известью (известковым моло-
ком). Вследствие того, что растворимость Mg(OH)2 (стр. 265>
288
Гл. IX. Соединения магния
значительно меньше, чем Са(ОН)2 (1,6г/л при 25°), реакция
MgCl2 + Ca(OH)2= CaCl2 + Mg(OH)2
идет в сторону образования Mg(OH)2. Гидроокись магния отфиль-
тровывают, тщательно промывают водой и прокаливают при не-
высоких температурах. В зависимости от режимов осаждения и
прокаливания получаются разные сорта магнезии. При обработке
известью непосредственно морской воды SO^- не осаждается
вследствие относительно высокой растворимости CaSO4, и в оса-
док выделяется чистая гидроокись магния, но ее концентрация
всего 3 г/л. После отстаивания в сгустителях концентрация повы-
шается до 100 г/л, а с помощью вакуумной фильтрации она может
Трудность получения гидроокиси Я
магния этим способом заклю-
чается в том, что без соблюдения I
специальных условий осадок *
Mg(OH)2 выделяется в коллоид- |
ной форме, что сильно затруд- |
няет его отстаивание, отфильтро- J
вывание и промывку. Для полу- Я
чения легко фильтрующего осад- Я
ка необходимо создать условия Я
для медленной кристаллизации Я
при малом пересыщении раство-
ра и при относительно неболь- '’1
шом количестве центров кристал- |
лизации. I
Для замедления кристаллнза- 1
молотую малоактивную известь, I
Рис. 93. Зависимость коэффициента
фильтрации от продолжительности
осаждения Mg (ОН)2 известковым
-- молоком.
ции Mg(OH)2 применяют сухую
получаемую из соответствующих сортов известняка при особых ;
условиях обжига, а также известковые макароны (в ФРГ); для i
этой же цели в США гашение извести производят не водой, а ма- 1
точным раствором. При использовании для осаждения Mg(OH)2l
сухой малоактивной извести производят очистку магнезиального J
молока от непрореагировавшей извести и других твердых приме- >
сей гидромеханическими способами. -1
На рис. 93 показана зависимость коэффициента фильтрации
К = ДДт см1сек (гДе Q — количество см3 фильтрата, получаемого!
с поверхности S см2 за т сек при напоре Н см. вод. ст. и толщине |
слоя осадка I см) осадка гидроокиси магния от длительности I
приливания известкового молока к раствору MgCl2135. При бы- I
стром приливании известкового молока pH раствора в зоне обра- ]
гования осадка больше, чем для Mg(OH)2 — в этих условиях (на 1
кривой участок /) рост кристаллов затруднен и фильтруемость I
Магнезии
289
осадка незначительная. По мере увеличения длительности прили-
вания щелочи величина pH в зоне реакции все меньше отличается
от pH для Mg (ОН) 2, торможение роста кристаллов уменьшается и
коэффициент фильтрации возрастает (участок II). После того как
длительность приливания известкового молока становится столь
большой, что каждая капля щелочи полностью используется пре-
жде чем в раствор попадает следующая капля, дальнейшее замед-
ление приливания молока уже не влияет существенно на фильт-
рующие свойства осадка (участок ///). Гидроокись магния, полу-
ченная при одночасовом приливании известкового молока, хорошо
отстаивается, через 2—4 ч после осаждения легко отмывается аг
иона хлора и содержит 0,08—0,1% Са. После двухдневного стоя-
ния осадок не удается отмыть от ионов хлора, а содержание каль-
ция в нем превышает 1%. При вливании раствора магниевой соли
в щелочь частицы осадка представляют собой студенистые обра-
зования. Наоборот, при приливании щелочи к раствору магниевой
соли частицы получаются в виде плотных и прочных пластинок
с резко очерченными краями и легко отфильтровываются 133>137.
Для получения более плотного и в 5—7 раз менее загрязнен-
ного окисью кальция осадка Mg(OH)2 рекомендуют вводить в рас-
твор MgCl2 (до приливания к нему щелочи) различные добавки,
например, 0,03% (NaPO3)6,138 или формалин139. Предварительное
подкисление морской воды соляной кислотой до pH = 4 и про-
дувка ее воздухом для удаления СО2 также позволяет получить
более крупные кристаллы и, следовательно, легко отстаивающийся
осадок Mg (ОН) г140. Существенное значение для образования хо-
рошо отстаивающегося осадка имеет энергичное турбулентное пе-
ремешивание реагирующих растворов, при котором стехиометриче-
ским количеством известкового молока удается в течение 15—
20 мин при pH = 10,7—11,3 получить осадок Mg(OH)2, состоящий
из мелких хлопьев, оседающих со скоростью ~250 см/ч 141.
При осаждении гидроокиси магния из разбавленных растворов,
например, из морской воды, можно применять метод наращивания
кристаллов Mg (ОН) 2, заключающийся в том, что осадок, получаю-
щийся после первого осаждения в виде геля, вносится в раствор,
предназначенный для дальнейшего осаждения и т. д. После не-
скольких наращиваний осадок приобретает зернистую структуру.
По мере увеличения числа наращиваний улучшается фильтруе-
мость осадка и уменьшается количество удерживаемой им жидкой
фазы. Практически достаточно 3—4 операций наращгзания для
приготовления осадка, пригодного для внесения в раствор MgCl2
перед приливанием к нему известкового молока. Затем можно
часть выделенной из суспензии, легко отстаивающейся гидроокиси
магния переработать на продукт, а часть использовать для обра-
ботки новой порции раствора и т. д. Легкая магнезия, получаемая
методом наращивания, имеет насыпную плотность 200—300 кг/м3.
Ю М. Е. Позин
290
Гл. IX. Соединения магния
Метод этот, однако, непригоден для переработки рассолов с высо-
кой концентрацией MgC12142> 143.
Для получения магнезий известковым способом применяют ма-
точные растворы после кристаллизации солей из естественной
рапы, карналлитовый щелок, морскую воду и др. В зависимости
от концентрации растворов, режима осаждения, промывки и высу-
шивания получаются различные сорта магнезии. Рапы, содержа-
щие ионы SO4 , предварительно обессульфачивают, добавляя к
ним раствор СаС12, получаемый после осаждения Mg(OH)2 изве-
стковым молоком. При медленном добавлении (~30 мин) ра-
створа СаС12 в перемешиваемую рапу, имеющую слабощелочную
реакцию, при 20° осадок гипса образуется в виде спаянных друз,
что обеспечивает быстрое его отделение отстаиванием 144.
Производство гидроокиси магния из морской воды известковым
способом осуществляется в США с 1928 г. Морскую воду обраба-
тывают вначале небольшим количеством Са(ОН)2 в аппарате с
вращающимися лопастями с целью флокуляции органических
примесей. После осветления в отстойнике воду пропускают через
песочный фильтр и направляют в реактор-отстойник, куда подают
и известковое молоко. Раствор из отстойника сбрасывают в море,
а пульпу, состоящую из 12% Mg(OH)2 и 88% морской воды, со-
держащей ~3% солей, промывают противотоком в батарее де-
кантеров пресной водой. В результате промывки концентрация
Mg(OH)2 в пульпе снижается до 10%, а содержание солей умень-
шается до 0,05%. Часть пульпы подвергают карбонизации с даль-
нейшей переработкой в легкую магнезию. Другую часть пульпы
пропускают через сито с 16 000 отв/см2 и выпускают в виде про-
дукта— магнезиального молока [с содержанием 9% Mg(OH)2].
Третью часть пульпы обрабатывают паром и фильтруют на бара-
банном вакуум-фильтре — полученную пасту, содержащую 30%
Mg (ОН) 2, также выпускают в виде готового продукта. Эту же па-
сту перерабатывают в другие товарные продукты — высушиванием
ее в распылительной сушилке получают сухую гидроокись магния,
а прокаливанием ее — тяжелую окись магния145. Обжигом отфиль-
трованной гидроокиси магния при 750—800° получают легкую маг-
незию с объемным весом 0,55 кг/л. Тяжелую магнезию с объемным
весом 1,9 кг/л получают в результате продолжительного обжига
гидроокиси магния с присадкой Fe2O3 при 1700°146. Кроме извест-
кового молока, для осаждения гидроокиси магния применяют так-
же доломитовое молоко и обожженный доломит 147.
На рис. 94 показана схема производства окиси магния из мор-
ской воды, по которой работает завод фирмы «Kaiser Refractories»
(США) 148. Профильтрованная морская вода (76 мл’/мин) допол-
нительно фильтруется через слой обожженного доломита в трех
резервуарах 3 диаметром по 38 м. При этом удаляются растворен-
ная СО2 и бикарбонат кальция (в виде карбоната кальция) и
10*
Dgoe donation
292
Гл. IX. Соединения магния
содержание СОг в воде снижается в 4 раза, а концентрация магния
уменьшается на 10%. Осаждение Mg(OH)2 и отделение S1O2, ЕегОа
и других твердых примесей производят в двух последовательно
работающих первичных реакторах 5, в которые вводят обожжен-
ный доломит. Суспензия Mg (ОН) 2 поддерживается мешалками во
взвешенном состоянии и идет в слив, а пульпа поступает во вторич-
ный реактор 6, где образуется добавочное количество Mg(OH)2,
возвращаемого в первичные реакторы. Шлам из вторичного реак-
тора (SiO2, РегО3) направляется в гребковый классификатор 7, а
оттуда в отвал. Суспензия Mg (ОН) 2 поступает в три параллельно
работающие сгустителя 8 диаметром 75 м. Верхний слив сгустите-
лей сбрасывают в море, а шлам Mg(OH)2 подвергают противоточ-
ной промывке в двух сгустителях 9 (диаметром 75 .и), а пульпу,
содержащую 25% Mg(OH)2, направляют на пять барабанных
вакуум-фильтров 10 диаметром 4,2 м, длиной 5,4 м, работающих
при 500 мм рт. ст. Фильтрат возвращают в сгустители, а кек, со-
держащий 50% Mg(OH)2, перерабатывается в магнезию. Часть
кека с добавками, понижающими температуру спекания, вводи-
мыми в шаровой мельнице 12, обжигают в печи 13 при 1850° в те-
чение 2,5—4 ч для получения гранул периклаза (84—97% MgO).
Основную часть кека обжигают в 11-подовой печи 14, где полу-
чается активная окись магния. Ее измельчают и выпускают в ка-
честве готового продукта с размером частиц меньше 0,04 мм.
Часть выгружаемой из печи окиси магния перерабатывается на
зерненый продукт с размерами частиц 9 мм. Для этого ее пропу-
скают через шаровую мельницу, смешивают с водой в смесителе 17
и брикетируют в прессе 20 под давлением 140 ат; затем брикеты
с размерами 15 X 18 мм прокаливают во вращающейся печи в те-
чение 2 ч, охлаждают и дробят. Продукт содержит больше 98%
MgO. По описанной схеме 1 т MgO получают из 273 .я3 морской
воды и 1 т обожженного доломита (содержащего 38—40% AlgO).
В 1967 г. в Мексике пущен завод149 по получению MgO из мор-
ской воды, которую сначала обрабатывают серной кислотой для
регулирования pH и суспензией Mg(OH)2 из осветлителя. Затем
классифицированной известью осаждают Mg(OH)2, который отде-
ляют в сгустителях диаметром 100 м. Сгущенная суспензия про-
ходит последовательно через три противоточных декантационно-
промывны.х аппарата и затем обезвоживается на крупнейшем ба-
рабанном вакуум-фильтре диаметром ~3,5 м, длиной ~8,5 м.
Кек, содержащий 55% твердого, сушат и прокаливают в двух
12-подовых печах. Продукт содержит 98% MgO. Извлечение маг-
ния 95%.
Описан способ высушивания суспензии гидроокиси магния на
поверхности вальцов, обогреваемых паром (7 аг)150.
Обессульфаченные рассолы морского типа могут служить ис-
точником окиси магния, предназначенной для изготовления огне-
Магнезии
293
упоров. Рапу обрабатывают мелкоизмельченной негашеной из-
вестью181 (или известковым или доломитовым молоком162), обра-
зовавшийся осадок промывают, высушивают, размалывают и обжи-
гают. Продукт, полученный из рапы Сиваша, содержит 95% MgO,
0,5% СаО, 1,6% R2O3, 1,9% SiO2; изготовленные из него огнеупоры
по качеству превосходят огнеупоры, изготовленные из Саткинского
магнезита.
Раствор хлористого магния для осаждения магнезии получают
также из доломита. Обожженный при 800—900° доломит размалы-
вают и обрабатывают водой. Полученное доломитовое молоко кар-
бонизуют газом, выходящим из обжиговых печей. При карбониза-
ции получается значительно более активная, чем доломит, смесь
карбонатов магния и кальция. Эту смесь подвергают обработке
раствором хлористого кальция при нагревании в автоклавах под
давлением около 4 ат, причем MgCO3 переходит в MgCl2 по ре-
акции:
MgCO3 + СаС12 = MgCl2 + СаСО3
Полученный раствор хлористого магния отделяют от осадка
СаСОз и перерабатывают в магнезию осаждением известковым
молоком. Осаждение магнезии из растворов хлористого магния
может быть произведено и доломитовым молоком, содержащим
Са(ОН)2:
MgCl2 + Mg(OH)2 + Са(ОН)2 = CaClj + 2Mg(OH)2
После отделения гидроокиси магния раствор, содержащий хло-
ристый кальпий, может быть использован для обработки прокар-
бонизованного доломитового молока и превращен в MgCl2. Изучен
процесс получения окиси магния из доломита и содержащих СаС12
отработанных щелоков содового производства 153. Недостатком из-
весткового способа получения магнезий является загрязнение про-
дукта значительным количеством окиси кальция. Для получения
Mg(OH)2. с малым содержанием СаО следует применять свеже-
приготовленное разбавленное известковое молоко при низкой тем-
пературе, а также удалять СО2 из воды и рапы. При взаимодей-
ствии разбавленной рапы и доломитового молока с концентрацией
10% твердой фазы получается гидроокись магния с содержанием
4—5% СаО. Такое содержание СаО в 2—3 раза меньше, чем в
гидроокиси, полученной с помощью известкового молока. Магне-
зиальный клинкер, пригодный для основных магнезиальных огне-
упоров, содержащий меньше 1—2% СаО, можно получить, если
предварительно удалять из рапы ионы So!-’ обрабатывая ее до-
ломитовым молоком 154.
Отделение гидроокиси магния от непрореагировавших частиц
и примесей (СаО, S1O2) можно производить гидромеханиче-
скими методами — отстаиванием, центрифугированием и т. д.
294
Гл. IX. Соединения магния
Предложено, например, разделять суспензию отстаиванием на две
фракции — тонкую, в которую переходит 60—70% Mg(OH)2, с со-
держанием СаО и SiO2 на 20—30% меньше, чем в исходном мате-
риале, и грубую, в которой СаО и SiO2 на 30—40% больше, чем
в исходном шламе155. Очистку суспензии гидроокиси магния от
крупки (т. е. от непрореагировавшей и окклюдированной извести)
можно осуществлять в классификаторе непрерывного действия, а
сгущение суспензии в 7—9 раз — в отстойнике непрерывного дей-
ствия. Однако при этом очень велик расход промывной воды — он
составляет ~ 150—200 м3 на 1 т твердой фазы. Уменьшения рас-
хода промывной воды до 40—90 м3/т и сокращения площади от-
стойников можно достичь при предварительном сгущении суспен-
зии в осадительной или фильтрующей центрифуге|66.
По сравнению с отстаиванием и фильтрацией центрифугирова-
ние дает наилучшие результаты. При отношении в исходной сус-
пензии Ж. Т, равном 10:1, удельная производительность отжим-
ной (осадительной) центрифуги составляет 386 кз/(Ч'М2), степень
разделения 97% и влажность отжатого осадка 50%. Удельная
производительность центрифуги в ~4 раза больше производитель-
ности барабанного фильтра ,57.
Изучено электроосмотическое обезвоживание пасты гидроокиси
магния. Оно позволяет понизить влажность осадка в 3—5 раз и
довести ее до ~20%. Расход энергии на электроосмотическое обез-
воживание в 15 раз меньше, чем при испарении воды 157'158.
Одним из перспективных способов получения окиси магния с
малым содержанием окиси кальция является двухфазный процесс
обработки морской или озерной рапы известью или обожженным
доломитом189. Сущность способа заключается: 1) в неполном (на
85%) осаждении гидроокиси магния известью из раствора хлори-
стого магния и 2) в завершении взаимодействия непрореагировав-
ших MgCl2 и Са(ОН)2, а также СаСО3 при обжиге:
Ca(OH)2 + MgCl2«MgO + CaCl2 + H2O
СаСО3 + MgCl2 = MgO + СаС12 + СО2
После отмывки хлористого кальция из обожженного продукта
водой получается паста гидроокиси магния, содержащая (в прока-
ленном веществе) 97—99% MgO, 0,1—0,4% СаО, 0,5—1,8% SO3,
0,3—0,7% С1_. На рис. 95 представлена схема производства этим
способом. Обожженный доломит (или комовую известь) орошают
небольшим количеством рассола хлористого магния и гасят в ма-
шине для безотходного гашения160-161. При этом получается кру-
питчатая пульпа (—0,5 мм). Рассол дозируют таким образом, что-
бы пульпа имела достаточную текучесть, а парообразование при
гашении, производящемся при ~80°, не было чрезмерно интенсив-
ным. Выходящую из гасильной машины 2 горячую пульпу
Магнезии
295
разбавляют дополнительным количеством рассола (до 90% от
его общего расхода) и направляют в батарею агитаторов 5, где
она перемешивается в течение 1,5 ч,
а.затем фильтруют. Осадок (кек) про-
питывают рассолом хлористого маг-
ния в количестве 10—15% от общего
его расхода, составляющего 105—
110% от стехиометрического по отно-
шению к извести. Кек, пропитанный
рассолом, обжигают в течение 1 ч во
вращающейся печи 8 при 800°. Отхо-
дящие печные газы содержат неболь-
шое количество НС1 (они могут быть
направлены на подкисление рапы пе-
ред извлечением из нее брома или
очищены перед выпуском в атмосферу
другим способом). Выходящий из пе-
чи спек смешивается в холодильном
барабане с раствором, полученным
при последующей промывке его водой.
Магнезиальная паста, полученная пос-
ле отмывки спека от СаС12, идет на
изготовление магнезитового кирпича.
Применительно к обессульфачен-
ной рапе Сиваша разработана другая
схема 162’163. Хорошо обожженный до-
ломит (не менее чем на 98%) гасится
небольшим количеством рапы в га-
сильном барабане, и полученную пуль-
пу направляют в шаровую мельницу,
куда добавляют рапу. Здесь происхо-
дит гидратация окиси кальция, взаи-
модействие гидроокиси кальция с хло-
ристым магнием и частичная гидра-
тация окиси магния из обожженного
доломита. Эти процессы завершаются
в 4-х последовательно работающих ре-
акторах с мешалками, где происходит
формирование частиц гидроокиси маг-
ния определенной структуры и разме-
ров. В реакторы поступает слив из
классификатора, работающего в зам-
кнутом цикле с шаровой мельницей, а
также остальное количество рапы (из
расчета общего расхода, равного
110% от стехиометрического по окиси
296 Гл. IX. Соединения магния
кальция). Выходящую из последнего реактора магнезиальную я
пульпу перерабатывают в пасту методами отстаивания, фильтра- 1
ции, центрифугирования и электроосмотического обезвоживания 1
и затем прокаливают. Окись магния, полученная по этой схеме ]
из рапы Сиваша в лабораторных условиях, содержала 99,5% MgO, I
0,1% СаО, 0,2% SiO2, 0,1% R2O3, следы R2O. |
Предложено также получать гидроокись магния из морской 1
воды смешением ее с продуктом неполного гашения обожженного
доломита [Са(ОН)2 + MgO], предварительно очищенным воздуш- 1
ной сепарацией от крупных частиц примесей СаСО3 и CaSO4. Маг- )
незиальную пульпу фильтруют на дисковом фильтре через ткань
из найлона 164. Запатентован 165 следующий процесс: гашение тонко
измельченного обожженного доломита водой при 80—100° в тече-
ние 2 ч, добавка к полученной суспензии рассола MgCl2 в количе-
стве 103—110% от стехиометрического для связывания Са(ОН)2,
перемешивание 6—12 мин, гидравлическая классификация с целью
вывода из суспензии тяжелых примесей, затем фильтрование и
промывка Mg(OH)2. Предложено 166 получение Mg(OH)2 из обож-
женного доломита с размером частиц 0,1—0,6 мм, суспендирован-
ного в растворе MgCl2, вести при 20° в псевдоожиженном слое без
репульпирования и фильтрования. После прокаливания Mg(OH)2
образуется продукт, содержащий 88—92,5% MgO, 2,8—4% СаО,
1,85—2,25% SiO2, 0,9—1,65% R2O3.
Гидросульфидный способ получения гидроокиси магния
Получение магнезии может быть совмещено с производством
хлористого бария из сернистого бария. При обработке BaS раство-
ром СаС12 образуются хлорид и гидросульфид бария:
2BaS + СаС12 + 2Н2О = ВаС12 + Ba(HS)2 + Са(ОН)2
Раствор ВаС12 и Ba(HS)2 после отделения осадка Са(ОН)2
обрабатывают раствором MgCl2:
Ba(HS)2 + MgCl2 + 2Н2О - Mg(OH)2 + ВаС12 + 2H2S i
Отфильтрованный и промытый осадок Mg(OH)2 прокаливанием |
превращают в магнезию. Для получения из BaS осадка Mg(OH)2, I
легко отделяемого от раствора, предварительно уменьшают pH 1
раствора, насыщая его сероводородом (стр. 441). (
Содовый способ получения легких магнезий ’
Этот способ, наиболее старый, заключается в осаждении основ- {
ного карбоната магния из растворимых солей магния (MgSO4, )
Mg(NO3)2 и MgCl2) содой. В качестве сырья используют при-
родные и промышленные растворы магниевых солей, а также маг-
незит.
Магнезии
297
Магнезит измельчают в шаровой мельнице до размера частиц
0,2—0,1 мм и растворяют в 28%-ной серной кислоте при нагре-
вании до температуры кипения острым паром. Полученный раствор
сульфата магния очищают от железа окислением Fe2+ в Fe3+ хлор-
ной известью и осаждением в виде Fe(OH)3. Очищенный раствор
MgSO< обрабатывают 10—12% раствором соды. Суспензию вы-
делившегося осадка основного карбоната магния нагревают ост-
рым паром до кипения — пропаривают, после чего состав осадка
приблизительно соответствует формуле соединения, образующе-
гося по реакции:
4MgSO4 + 4Na2CO3 + 4Н2О = 3MgCO3 • Mg(OH)2 • ЗН2О + 4Na2SO4 + СО2
Осадок отфильтровывают, промывают и сушат — получается
легкий белый порошок — магнезия альба.
Этот способ может быть использован и для получения магнезии
из озерных рассолов 167.
. Осаждение основного карбоната магния из растворов хлори-
стого магния или карналлита производят следующим образом.
В стальной реактор с паровым барботером и мешалкой заливают
раствор соды концентрацией 130—140 г/л. При перемешивании на-
гревают раствор до кипения и приливают к нему небольшой струей
хлормагниевый щелок или раствор карналлита (150—160 г/л
MgCl2). Температуру поддерживают выше 90°, так как при пони-
жении температуры, так же как и при быстром сливании раство-
ров, образуется плохо фильтрующий осадок. Подачу раствора
MgCl2 прекращают, когда в реакционной массе содержание
Na2CO3 не превышает 5 г/л при отсутствии в жидкой фазе Mg2+.
Затем суспензию кипятят в реакторе в течение 15 мин для разру-
шения бикарбонатов, осадок отфильтровывают и промывают на
фильтре. Промывку пасты ведут водой, подогретой до 50—60° и
содержащей не более 25 мг/л С1_ и 30 мг/л SOl". После промывки
паста содержит ~30% MgCO3 (~15% MgO) и не более 0,055%
С1- и 0,5% Na2CO3.
Сушку магнезии альба осуществляют в камерных сушилках на
алюминиевых противнях. Более совершенным способом является
применение сушилок ленточного типа. Сырую углекислую магне-
зию с фильтров подают шнеком на бесконечную ленту из прово-
лочной сетки с отверстиями 10 мм. При помощи 16 барабанов
лента 8 раз поднимается вверх и опускается вниз (8 петель) вну-
три камеры сушилки, а затем вдоль нижней части сушилки дви-
жется горизонтально. За время движения магнезия высыхает в по-
токе горячего воздуха и сбивается с сетки в бункер при помощи
специального механизма.
Сушку производят до содержания остаточной влаги меньше
0,5%. Затем магнезию размалывают в мельнице кулачково-'
Ударного действия, оборудованной воздушным сепаратором и
298
Гл. IX. Соединения магния
расфасовочным бункером. Выход продукта по MgCl2 составляет
60—70% от теоретического, а содержание в нем основного веще-
ства в пересчете на MgCO3 должно быть не меньше 50%. На про-
изводство 1 т основной углекислой магнезии расходуют: 1,47—
1,74 т MgCl2 (Ю0%), 1,73 т кальцинированной соды (95%), 1,75 т
условного топлива, 6,2 мгкал пара, 230 квт-ч электроэнергии, 25—
50 м3 воды.
Прокаливанием основной углекислой магнезии из нее удаляют
двуокись углерода и воду и превращают ее в легкие сорта жженой
магнезии (магнезии уста) MgO. Гидратная вода удаляется из ос-
новного карбоната магния при 320°, а при 430° диссоциирует кар-
бонат. Дегидратация гидроокиси магния также идет при 400—
420° 168-169. При 500° одновременно с диссоциацией Mg(OH)2, осво-
бождающейся из основного карбоната магния, происходит ее кар-
бонизация двуокисью углерода, образующейся при диссоциации
карбоната. В результате получается смесь MgO и MgCO3,7°. (Если
вести этот процесс под большим давлением СО2, например 50 ат,
то при 500° образуется MgCO3). Окись магния с наибольшей ак-
тивностью (с удельной поверхностью ~ 100 .и2/г) получается при
прокаливании основного карбоната магния и гидроокиси магния
при 500—600°. В обоих случаях активность продуктов приблизи-
тельно одинакова. Если прокаливание вести ниже 500 и выше 600°,
то активность магнезии, полученной из основного карбоната маг-
ния, больше, чем из гидроокиси магния при одинаковых темпера-
турах их обработки (особенно выше 1000°).
В производственных условиях прокаливание основного карбо-
ната магния ведут в полочных механических печах при 700—800°.
В них материал перемещается со свода на свод сверху вниз с по-
мощью гребков, передвигающих его по сводам от периферии к
центру (на нечетных сводах, считая сверху) и от центра к периферии
(на четных сводах). Верхний свод — чугунная плита служит для
предварительной подсушки материала. Внутри кладки остальных сво-
дов Имеются каналы для обогревающих топочных газов. В вал, на
котором вращаются гребки, подается вентилятором воздух для ох-
лаждения металла с целью предохранения его от деформаций.
На верхнем своде содержание в пасте MgCO3 повышается от
26—32 до 36—40%. На втором своде содержание MgO в матери-
але увеличивается до 36—40%. Окончательное разложение дости-
гается на четвертом своде, откуда магнезия через течку поступает
в шнек и направляется на склад. Магнезиальную пыль, выносимую
из печи уходящими газами, содержащую 60—70% MgO, улавли-
вают в рукавных фильтрах, в электрофильтрах или в других ап-
паратах и возвращают на прокаливание. Для производства 1 т
жженой магнезии из раствора MgCl2 или из карналлита расхо-
дуют: 2,55 т MgCl2 (100%), 3,05 т соды (95%), 2 т условного топ-
лива, 6,4 мгкал пара, 335 квт-ч электроэнергии, 65 м3 воды. При
Магнезии
299
получении окиси магния содовым способом из магнезита расход-
ные коэффициенты особенно велики: на I т MgO затрачивается
около 4 т серной кислоты и около 4 т соды, которые превращаются
в отбросный сульфат натрия. Этим способом пользуются только
для производства окиси магния высокой степени чистоты.
Осадки карбонатов магния, полученные из природных вод, за-
грязнены примесями хлоридов натрия и калия. Для освобождения
от них предложено 171 промывать карбонаты магния 0,005% раство-
ром NH4C1; последний замещает адсорбированные хлориды нат-
рия и калия, переходящие в раствор. При последующем прокали-
вании карбонатов магния NH4C1 улетучивается и готовый продукт
содержит всего ~ 0,03 % хлора. Расход промывной воды при этом
сокращается на 50—60%.
При получении жженой магнезии содовым способом из отброс-
ного раствора сульфата магния, образующегося в производстве
борной кислоты (стр. 329), необходимо предварительно осадить из
раствора бораты магния каустическим магнезитом 172.
Легкая магнезия может быть получена вместе со смешанным
удобрением из морской рапы плотностью 1,32 г)см9, остающейся
после кристаллизации NaCl и содержащей MgSO4, MgCl2 и не-
большие количества NaCl и КС1173. Рапу обрабатывают одновре-.
менно аммиаком и двуокисью углерода при 50° последовательно
в трех реакторах. Из суспензии, вытекающей из каждого реактора,
отфильтровывают осадок основного карбоната магния, промывают
его водой от аммониевых солей. Фильтрат и промывные воды на-
правляют в следующий реактор. При некотором избытке карбо-
ната аммония извлечение магния из рапы достигает 90—95%
(0,32 кг из 1 л рапы). Высушенный продукт MgCO3• Mg(OH)2•
•ЗН2О имеет насыпную плотность 180 кг/м3. При прокаливании
этого продукта при 600—700° получается легкая магнезия с на-
сыпной плотностью 80 кг/м3. Фильтрат из третьего реактора обра-
батывают гипсом, и после отделения СаСО3 выпаркой и кристал-
лизацией раствора можно получить удобрение, состоящее из
NH4CI, (NH4)2SO4 и КС1 и содержащее 21—22 %N и 3% К2О. Из
1 л рапы получается 0,7 кг такого удобрения.
Для получения окиси магния, имеющей повышенную совмести-
мость с органическими веществами, слабообожженную MgO сме-
шивают в среде инертного органического растворителя с амином
с числом атомов СЖ20, затем отфильтровывают, промывают инерт-
ным летучим растворителем, сушат при 65—100° и измельчают.
Продукт содержит 1—25% органических веществ174.
Гидролиз и окисление хлористого магния
Окись ма! пия может быть получена из MgClj путем его гидро-
лиза 175'18?
MgCl2 + н2О MgO + 2НС1
300
Гл. IX. Соединения магния
и окисления 174> 181-188:
2MgCl2 + О2 2MgO + 2С12
При нагревании шестиводного хлористого магния до 500° вна-
чале, после частичного обезвоживания MgCl2, образуется MgO •
• 2MgCl2 • 2Н2О, а затем гидрооксихлорид магния Mg(OH)Cl:
MgCl2 + H2O Mg(OH)Cl+HCl
Выше 500—510° Mg(OH)Cl разлагается176:
Mg(OH)Cl MgO + HC1
Если вести нагревание MgCl2 в токе инертного газа и таким об-
разом удалять выделяющийся хлористый водород, хлористый маг-
ний полностью превратится в
Концентрация НС1 6 еазобой (разе,%
Рис. 96. Поля твердых фаз в системе
MgO-НС1-Н2О:
/ —Mg(OH)Cl; //-твердый раствор MgCl(Cl, ОН),
цифрами обозначено содержание в нем
Mg(OH)Cl в мол. %; III— MgO. Р — суммарное
, давление реакционных газов в ат.
магнезию.
Проведение гидролиза MgCl2
с предотвращением распла-
вления его в кристаллизацион-
ной воде возможно при исполь-
зовании в качестве исходного
материала магнезиального це-
мента Сореля. При 500—600°
степень гидролиза за 1 ч со-
ставляет 95—98% 184,186. Окись
магния, полученная таким пу-
тем при 600—650°, удовлетво-
ряет требованиям на каусти-
ческий магнезит, а при 1000°—
требованиям на металлургиче-
ский порошок для огнеупо-
ров 186. В США получение
MgO гидролизом хлористого
магния осуществляют в круп-
ных масштабах 187. Разработано проведение этого процесса распы-
лением концентрированного раствора MgCl2 в потоке горячего
газа 188. Запатентовано189 использование для гидролиза MgCl2
реакционной камеры с фонтанирующим слоем огнеупорного инерт-
ного материала с частицами 3—8 мм; в камеру подают раствор
или кристаллический хлорид магния, продукты реакции — MgO
и НС1 — выносятся топочным газом и отделяются от него в ула-
вливающих устройствах.
В процессе гидролиза хлористого магния могут образоваться
твердые растворы MgCl(Cl, ОН). При 550° давление НС1 над гид-
рооксихлоридом достигает 1 ат и его разложение протекает с мак-
симальной скоростью. Выделяющийся НС1 частично реагирует с
Mg(OH)Cl, образуя твердый раствор MgCl2 в Mg(OH)Cl. Этот
Сульфат магния и его термическое разложение
301
процесс протекает на 40—45° выше температуры устойчивого со-
стояния Mg(OH)Cl (510°), т. е. при метастабильном, перегретом
состоянии Mg(OH)CL После исчезновения Mg(OH)Cl температура
повышается. При этом может происходить разложение твердого
раствора с образованием MgO и обогащением газовой фазы хло-
ристым водородом, а твердого остатка хлористым магнием. На
рис. 96 представлена политермическая диаграмма равновесия в си-
стеме MgO—НС1—Н2019°.
При термическом разложении кристаллогидратов оксихлоридов
магния 2Mg(OH)2-MgCl2-5H2O, 3Mg(OH)2.MgCl2-8H2O, 5Mg(OH)2-
• MgCl2-8H2O и 9Mg(OH)2 • MgCl2 • 6H2O вначале также происхо-
дит частичная их дегидратация, а затем процесс идет по схеме191:
nMg(OH)a • MgCl2 — Н2О + (« — 1)H2O • «MgO + MgCl2
MgCl2 + HjO - MgO + 2HC1
Окись магния, полученная гидролизом MgCh, гидратируется
очень медленно. Полученная гидролизом цемента Сореля окись
магния гидратируется при 15° за 48 ч на ^5%, а при 85° за 11 ч
на ~90% 192.
Окисление расплавленного хлористого магния кислородом193
идет по реакции (рис. 88):
MgCl2 4- - MgO 4- Clд
Для интервала температур 750—950° значение константы рав-
новесия этой реакции КР =—оТ может быть вычислено по фор-
р62
муле 181> т:
lgKP = 4-y = 1,450--^-
Для случаев, когда в жидкой фазе кроме MgCl2 присутствуют
другие хлориды, значения А и В будут:
Состав расплава А В
KCl-3MgCl2..................1,507 1183
KCl-MgCl2 ................. 0,944 1288
2KCl-MgCl2 ................ 0,103 1451
NaCl • MgCl2 (750-850)° . , . 1,799 2000
СУЛЬФАТ МАГНИЯ И ЕГО ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ
Получение сульфата магния
Сульфат магния может быть получен из природных растворов
морского типа и твердых солевых отложений. Например, при ком-
плексном использовании карабогазских рассолов можно, удалив
некоторую часть галита из маточного рассола после садки
802
Гл. IX. Соединения магния
мирабилита (см. гл. IV), кристаллизовать из него эпсомит. MgSOr
• 7Н2О. Эпсомит выделяется не только в стабильном поле его кри-
сталлизации (рис. 83), но в значительной степени (20—50% от ко-
личества, выделившегося в стабильной области) в метастабильной
области, захватывающей часть поля кристаллизации астраханита.
Из 1 т астраханитового сырья озер Куули, Джаксы-Клыч, Чумыш-
Куль могут быть получены 1 т мирабилита и 0,3 т эпсомита, а из
сырья Аральского месторождения — 0,9 т мирабилита и 0,2 т эпсо-
мита195. Из сивашской рапы, выпаренной до начала выделения
эпсомита, имеющей состав 9,76% MgSO4, 14,06% MgCl2, 2,94%
КС1, 5,72% NaCl, выход MgSO4 при +5° 58,2%, при —5° 75% 196.
Технически чистый эпсомит можно получить охлаждением до —5°
рассола с плотностью 1,29—1,31 г/см3, полученного испарением мор-
ской воды, с добавлением к нему 6 объемы. % морской воды. Мак-
симальный выход эпсомита (65—68% от MgSO4 в морской воде)
получается из раствора, содержащего 9,1% MgSO4, 14,7% AAgCl2,
9,8% NaCl197.
Обезвоживанием эпсомита получают кизерит MgSO4 • Н2О, а
затем и MgSO4. Первые шесть молекул воды из эпсомита уда-
ляются при температуре ниже 70° (рис. 82). Кизерит получают в
качестве нерастворимого отхода при водной обработке природных
калийных солей (гл. V). Предложено производить его очистку фло-
тацией с последующим обезвоживанием, что позволяет изготов-
лять продукт, содержащий 98% MgSO4198. Обезвоживание кизе-
рита во вращающихся печах, обогреваемых дымовыми газами,
практически начинается при 200° и заканчивается при 440°199.
Чистый сульфат магния может быть получен нагреванием маг-
незита и доломита в растворе сульфата аммония. Образуется рас-
твор MgSO4, который после отгонки аммиака концентрируется для
осаждения CaSO4, а затем перерабатывается на MgSO4 или другие
соединения магния 200"202. Предложено получать сульфат магния
обработкой водной суспензии (Ж:Т=1:1 по весу) тонкоизмель-
ченного серпентина (с размером частиц меньше 0,075 мм) кон-
центрированной серной кислотой (плотность 1,84 г/с.и'!). Получен-
ную массу разбавляют водой и фильтруют; образовавшийся рас-
твор MgSO4 подвергают выпарке и кристаллизации 203. Раствор
MgSO4 можно также получать карбонизацией суспензии окиси маг-
ния и гипса 204.
Очистку растворов сульфата магния от ионов Ni2+, Fe2+, Fe3+,
Mn2+, Ca2+, Al3+ и других, по-видимому, целесообразнее всего про-
изводить осаждением этих ионов с помощью Mg(OH)2. Если ис-
пользовать Са(ОН)2, то это приведет к загрязнению продукта суль-
фатом кальция; применение в качестве окислителя КМпО4 при ще-
лочной обработке, так же как и реакций двойного обмена с Na2S
и K3Fe(CN)6, приводит к образованию коллоидных гидрооки-
сей205. -
Сульфат магния и его термическое разложение
303
Термическое разложение сульфата магния
Сульфат магния, подобно сульфату кальция, служит сырьем для
сернокислотного производства 206. Получаемый при обжиге суль-
фата магния сернистый газ перерабатывается на серную кислоту,
а огарок представляет собой высококачественную окись магния,
пригодную для изготовления огнеупоров и ксилолита.
Термическое разложение MgSO4 протекает с достаточной пол-
нотой и скоростью при 1100—1200°. При более низких темпера-
турах, в отсутствие восстановителей и особенно при наличии ката-
литически действующих окислителей, например Бе20з, происходит
сульфатизация окиси магния газом, содержащим SO2 и Ог- Так,
в присутствии 9% Fe2O3 при соприкосновении с газом, содержа-
щим 5% 'Ю?. пои 600° MgO превращается на ~50% в MgSO4 в
течение 30 мин 207. В присутствии восстановителей С, S, Н2, СО,
СП. температура термического разложения MgSO4 снижается до
650° 208, а в присутствии МпО даже при 500°20э. Восстановление
MgSO4 углем ведут практически в интервале 700—900°. Основной
реакцией является:
2MgSO4 + С = 2MgO + 2SO2 + СО2
В результате побочных реакций, особенно при избытке угле-
рода. SO2 частично восстанавливается до серы, a MgSO4 до MgS.
Оптимальный выход МцО достигается при молярном отношении
MgSO4:C, равном 1 : 1. В этих условиях при 800° выход МпО со-
ставляет 99%, а выход серы: в SO2 — 81%, вееру— 16.5%, в
MgS — 2% и остается в виде MgSO4— 0,3% 210. Благоприятным
для увеличения выхода MgO и SO? является создание в зоне реак-
ции окислительной атмосферы при 900—950°. При избытке кисло-
рода получается окись магния, практически свободная от суль-
фидов 211.
Восстановление сульфата магния углем осуществляют в меха-
нических печах, применяемых для обжига колчедана 212. Могут быть
использованы барабанные и другие печи, в частности, при восста-
новлении окисью углерода, водородом и другими газами — печи со
взвешенным слоем материала213. Содержание окиси магния в огар-
ке зависит от зольности восстановителя. Воздушная классифика-
ция огарка позволяет выделить мелкие фракции, содержащие 75—
80% MgO. Водная седиментация, а также флотация с примене-
нием мыла дают продукт с 90% MgO. Кониентоат, получаемый пои
отмучивании, содержит 89—90% MgO, 3—4% R?O3, 2—2,5% CaSO4,
2—3% SiO2 и силикатов и до 1% MgSO4 209.
Восстановление MgSO4 природным газом идет по реакции:
4MgSO4 + СН4 = 4MgO + 4SO2 + СО2 + 2Н2О
При использовании безводного MgSO4 с размерами зерен 0,2—г
0,6 мм и природного газа с содержанием 97,8% СН4 восстановление
304
Гл. IX. Соединения магния
начинается при 700—720°, а полное восстановление MgSO4 до
MgO происходит при 750—950°. В газообразных продуктах реак-
ции, помимо SO2 и СОг, находятся также S, H2S и CSj, количество
которых зависит от температуры и скорости газа214,
Предложено осуществлять восстановление MgSO4 при помощи
непрерывно циркулирующего газа, содержащего Н2 или H2S и од-
новременно служащего теплоносителем. Реакция протекает при
большом избытке водорода или сероводорода. В первом случае из
циркулирующего газа вымывается H2S, во втором извлекается вы-
деляющаяся сера215. Восстановление твердого сульфата магния
можно производить также в распыленном состоянии, в потоке
газа 21е.
В известных условиях может представить интерес обменное
взаимодействие между MgSO4 и КС1 (или NaCl) в присутствии
водяного пара217. Реакция
MgSO4 + 2КС1 + Н2О = MgO + K2SO4 4- 2HC1
протекает при ~800°. Она может иметь значение для производства
бесхлорного калиевого удобрения из КС1. Обработкой твердых
продуктов реакции водой можно разделить KzSO4 и MgO. Однако
при этом на 1 т К2О получается около 6,8 т 27%-ной соляной кис-
лоты; для таких больших количеств кислоты трудно найти приме-
нение в районе расположения калийных фабрик.
НЬЮВЕЛЬ И СОВЕЛИТ
Ньювель и совелит — высококачественные теплоизоляционные
материалы, применяемые в судостроении, котлостроении и др. Они
представляют собой смесь магнезии с асбестом. Ньювель содержит
магнезию альба и 14—19% асбеста. Содержание в нем MgO (в пе-
ресчете на сухое вещество) должно быть не менее 32%, СаО не
более 2%, влаги 10—15%. Объем сухого порошкообразного мате-
риала не более 200 кг!м3, а коэффициент теплопроводности при
средней температуре 200° не должен превышать 0,07 ккал/(м - ч-
•град). Его выпускают и в виде пасты с 70% влаги. Совелит также
содержит 12—17% асбеста, но изготовляется не из магнезии альба,
а из смеси карбонатов магния и кальция218.
Порошкообразный ньювель имеет объемный вес меньше 200 кг/м3.
Изготовленная из него изоляция при разности температур 300° имеет
коэффициент теплопроводности не больше 0,08 ккал!(м • ч • град),
а сопротивление разрыву не менее 1 кгс/см2 219-220. Совелит в по-
рошке содержит 7—8% влаги. Объемный вес ньювеля и совелита
в изделиях (плитах) 350—450 дг/.и3, коэффициент теплопроводно-
сти 0,08—0,09 ккал!(м • ч • град), временное сопротивление на из-
- гиб 2—2,5 кгс/см2.
Магниевые удобрения
305
МАГНИЕВЫЕ УДОБРЕНИЯ
Магний является необходимой составной частью растений. Он
способствует образованию углеводов в растительном организме и
плодообразованию. Содержание MgO в золе большинства расте-
ний не превышает 0,2—0,5%, но иногда достигает 3% (в золе тур-
непса). Обычно в большей части почв содержится достаточное
количество магниевых минералов (0,4—4% MgO), но урожай
многих культур на песчаных и супесчаных почвах значительно по-
вышается от внесения магниевых удобрений 221'222.
Простыми магниевыми удобрениями являются эпсомит, кизе-
рит, магнезит, дунит, серпентинит (стр. 270)223. К калиево-магние-
вым удобрениям относятся калимагнезия и калимаг, каинит, кар-
наллит, полигалит и другие соли (см. гл. V). Доломит является
известково-магниевым удобрением. Добавляя доломит к расплав-
ленной аммиачной селитре, можно получить азотно-магниевое удо-
брение.
К фосфорно-магниевым удобрениям относятся димагнийфосфат
и магнийсиликофосфат, который получают обработкой дунита или
серпентинита слабой фосфорной кислотой. При переработке этим
методом смеси силиката магния и фосфорита получается магние-
во-кальциевый фосфат. К этому же виду удобрений относятся то-
масшлак (стр. 1041), в состав которого входит 2,5—3,2% MgO, а
также серпентиновый суперфосфат — смесь суперфосфата с дуни-
том или серпентином в количестве около 10% к весу суперфосфата.
В состав последнего удобрения, помимо обычных компонентов су-
перфосфата, входят MgHPO4 и SiO2; содержание в нем MgO~
~40/о 224,225. При нейтрализации свободной кислотности суперфос-
фата (стр. 853) доломитом или магнезитом улучшаются физические
свойства суперфосфата, а количество усвояемой Р2О5, в отличие
от нейтрализации известняком или мелом, не уменьшается даже
при добавке к суперфосфату 10—20% доломита и в особенности
магнезита 226.
Сложным магнезиальным удобрением является магнийаммоний-
фосфат .MgNH4PO4 • Н2О. Используя это удобрение можно создать
запас азота в почве, так как он находится здесь в цигратнораство-
римой форме (другие же азотные соли водорастворимые)227-228.
Многосторонними удобрениями, содержащими магний, являются
также навоз и древесная зола. Удобрения, содержащие, кроме азо-
та, фосфора и калия, также и магний, с различными соотноше-
ниями питательных веществ могут быть получены азотиокислотной
переработкой фосфатов, содержащих магний, например каратаус-
ких фосфоритов (см. гл. XXXIV).
В качестве магнезиально-азотного удобрения применяют также
соль Туттоиа MgSO4- (NH4)2SO4 • 6Н2О. В ФРГ ее получают взаи-
модействием сульфата аммония с кизеритом, в СССР ее изготовляют
806
Гл. IX. Соединения магния
в небольшом количестве из отбросного сульфата аммония и магне-
зита. Предложены способы ее получения обработкой пульпы от-
бросного фосфогипса (стр. 914) и обожженного доломита аммиа-
ком и СО2 или бикарбонатом аммония по реакции
2CaSO4 + MgO • CaCOj 4- 2NH4HCO3 = ЗСаСО3 4- MgSO4 4- (NH4)2SO4 4- H2O
с последующей кристаллизацией двойной соли из раствора 226’229.
Из других удобрений, содержащих магний, в СССР производят
заводскими способами бормагниевое удобрение (стр. 345) и ка-
лийно-магниевые удобрения.
ЛИТЕРАТУРА
1. Н. В. Кондырев, Г. В. Березовский, Труды ВАМИ, № 11—12,
1935, стр. 29.—2. В. В. Сергеев, И. С. Качановская, ЖПХ, 32, № 8,
1671 (1959).—3. Т. Demedink, W. F. Cole, Н. W. Hueber, J. Chem., 8,
№ 2, 215 (1955). — 4. Q. Wehner, Z. ancrg. Chem., 272, № 1—4, 201 (1953).—
5. А. П. Обухов, В. П. Лавров, Труды ГИПХ, в. 25, 1934, стр. 81.—
6. А. Б. Здановский, М. И. Ляховская, Р. Э. Шлеймовнч, Справоч-
ник по растворимости солевых систем, Госхимиздат, т. I, 1953 и т. II, 1954. —
7. А. Н. П е р о в а, Сообщение о научных работах Всес. хим. об-ва им. Д. И. Мен-
делеева, в. 2, 1955, стр. 46.-8. Н. С. Кур каков, А. В. Николаев, Изв. АН
СССР. Сер. хим., № 2, 403 (1938). — 9. Е. И. Лукьянова, В. И. Сокол,
Г. Н. Соколова, ЖНХ, 1, № 2, 208 (1956). — 10. G. О. As за гоп, А, В а 1-
der, J. Phys. Chem., 59, № 7, 631 (1955).
11. А. И. Мун, В. Е. Т а р т а к о в с к а я, Изв. АН КазССР. Сер. хим., № 8,
35 (1955). —12. Б. Ф. Марков, И. Д. Панченко, ЖОХ, 25, № 11, 2038
(1955). —/3. П. П. Будников, ДАН УССР, № 5, 339 (1950). — 14. J. Weber,
Kohasz. lapok, 2, Ns 4, 174 (1956).—/5. E. Cremer, W, Allgener, Radex
Rundschau, № 2, 54 (1953). — 16. О. К- Я н а т ь e в а, ЖНХ, 1, № 4, 751 (1956).—
17. О. К. Я н а т ь е в а, Г. С. Рапопорт, И. С. Р а с с о н с к а я, М. Б. Усти-
нова, ЖПХ, 34, № 2347 (1961). — 18. Т. A to da, J. Sci. Res. Inst., 47, 244 (1953);
48, 173 (1954); 49, 117 (1955).— 19. Л. H. Щ er ров, В. H. С к p о б о т у н,
А. Г. Р я д ч е н к о, сб. «Исследования в области химии и технологии минераль-
ных солей и окислов», Изд. «Наука», 1965, стр. 59. — 20. Б. В. Ефремов,
В. А. Протащик, Сборник научных работ Ин-та химии АН БССР, в. 5 (1),
1956, стр. 58.
2/. П. И. Бельке вич, Б. В. Ерофеев, Изв. АН БССР, № 4, 127
(1952). —22. J. Kamecki, S. Paley. Roczn. chem., 29, № 2—3, 691 (1955).—
23. Л. Г. Берг и др., Термография, Изд. АН СССР, 1944. — 24. R. W. Ford,
Q. В. Frost, Canad. J. Chem., 34, № 5, 591 (1956). —25. Lorant Bela, Z.
analyt. Chem., 219, № 3, 256 (1966).—26. E. Kowalska, Przem. chem., 12,
№ 8, 442 (1956). — 27. N. J. Knopf, H. S t a u d e. Z. phys. Chem., 204, Ns 5—6,
265 (1955). — 28 M. Lallemant, G. Watelle-Marion, Compt. rend. C265,
№ 12, 627 (1967). — 29. N. Hast, Arkiv kemi, 9, Ns 4, 343 (1956). — 30. W. Rut-
kowski, Pract. inst. Min-wa hutn., 8, № 2, 85 (1956).
31. Г. А. Яковкин, Хим. пром., Ns 7, 12 (1947). — 32. X. Л, Стрелец,
А. Ю. Тайн, Б. С. Гул ян и цк ий, Металлургия магния, Госметаллургиздат,
1960.—33. А. Г. Бергман, И. П. Выродов, ЖПХ, 31. Ns 1, 19 (1958).—
34. А. Г. Бергман. И. П. Выродов, Там же, 32, № 3, 504 (1959).—
35. И. П. Выродов, Там же. 34, № 6, 1208 (1961). —36. Я- М. Хейфец, Со-
ликамские карналлиты, ОНТИ, 1935.—37. Д. О. Берштейн, Я- Р. Красс,
Строит, пром., 6, 32 (1956). — 38. Я. В. Ключаров, Н. В. Мешалкина,
Литература
807
Цемент, № 5, 14 (1957). — 39. Л. Г. Берг, С. Г. Ганелина, Каустический до-
ломит, Таткннгоиздат, 1957. — 40.' Н. Keitel, франц, пат. 1024071, 1953.
41. П. М. Татаринов, Е. И. Д в о р ш а н, Магнезит, Минерально-сырьевая
база СССР, в. 2, ОНТИ, 1935,—42. L. R. W 111 i a nfs, Bull. Bur. Mines, №630,
537 (1965). — 43. H. F. Utley, Pit a. Quarry, 46, № 12, 90 (1954).—
44. И. H. Лепешков, Хим. наука и пром., 2, № 6, 687 (1956). — 45. J. Cook,
Discovery, 17, № 2, 71 (1956). — 46. Б. Л. Ронкин, Озеро Эльтон как источник
натуральных магнезиальных солей, Госхимиздат, 1933. — 47. Проблемы озера
Эльтон, Труды ВИГ, в. 16, 1939, ч. II. — 48. А. П. Палкин, М. А. О п ы х т и н а,
Труды ГИПХ, в. 18, 1933, стр. 36. — 49. И. Б. Фейгельсон, А. П. Ларина,
Бюлл. Ин-та галургии, № 4—5, 42 (1939). — 50, Ю. Б. Айзенберг, Строитель-
ные материалы Туркменистана, Ашхабад, 1951, стр. 51.
51. В. Н. Еремин, Труды Научной конференции по изучению и освоению
производительных сил Сибири, т. 2, Томск, 1940, стр. 526. — 52. Я. М. Хейфец,
ЖПХ, 34, № 3, 473 (1961). — 53. В. М. Букштейн, сб. «Технология перера-
ботки природных солей и рассолов», Изд. «Химия», 196,4, стр. 3. — 54. Б. И. Сте-
панов, В. И. Николаев, ДАН СССР, 27, № 3, 224 (1940). — 55. Н. И. Кор-
нилов, Изв. СФХА АН СССР, 20, 8 (1950). — 56. В. И. Николаев, Там же,
19, 335 (1949). —57. A. F. Burns, А. М. Smith, Agr. Chem., 20, № 9,
23 (1965). — 58. А. Г. Бергман, А. П. Обухов, Труды ГИПХ, в. 25, 1934,
стр. 9. — 59. Н. С. Курнаков, С. Ф. Жемчужный, ЖРФХО, 51, 28 (1919);
сб. «Карабугаз н его промышленное значение», Изд. АН СССР, 1930.—
60. А. Г. Бергман, Н. П. Л у ж н а я, Физико-химические основы изучения и
использования соляных месторождений хлорид-сульфатного типа, Изд. АН
СССР, 1951.
61. А. Д. Пелып, Труды ВНИИГ, в. 21, 1949, стр. 160, 186.—
62. Д. Пельш, Там же, в. 27, 1953, стр. 3. — 63, М. М. Викторов, Графи-
ческие расчеты в технологии минеральных веществ, Госхимиздат, 1954,
стр. 348. — 64. А. Д. Пельш, Труды ВНИИГ, в. 27, 1953, стр. 17.—
65. Е. Ф. Соловьева, Там же, в. 31, 1956, стр. 180.—66. В. П. Ильин-
ский, Труды ГИПХ, в. 40, 1948, стр. 5, 55.-57. А. Ф. Сагайдачный, Там
же, в. 5, 1927, стр. 18. — 68. Н. С. Курнаков, Д. П. М а н о е в, Н. А. О с о к о-
р е в а, Калий, № 2, 25 (1932). — 69. Ф, Серова, Труды ВНИИГ, в. 36, 1959,
стр. 136,—‘70. В. К a s s п е г, Bergakadernie, 7, № 4, 190 (1955).
71. К. Ф. Павлов, Б. А. Коп ы л е в, ЖХП, № 6, 29 (1938).— 72. Н. С. С п и-
р и н, М. А. Б е д ю х, сб. «Вопросы производства калийных удобрений», 1964,
стр. 42. — 73. Н. К u г m е i е г, Chem. Ingr. Techn., 38, № 4, 484 (1966).—
74. Л. Н. М а т и й к о, Л. В. Л о п а ч е н о к, сб. «Вопросы добычи и переработки
галургического сырья», Изд. «Химия», 1966, стр. 17. — 75. Г. С. Клебанов,
В. М. Букштейн, Н. О. Эверт, Бюлл. ВИГ, № 7, 1938, стр. 24.—
76. J, М. Avery, R. F. Е v а п s, Chem. Met. Eng., 52, № 4, .94 (1945).—
77. ф. К. Михайлов, Труды НИОХИМ, т. 11, 1958, стр. 5.'—78. J. К a m 1 е t,
пат. США 2705185, 1955. — 79. Дат. пат. 76988, 1954. — 80. А. Н. Вишнев-
ский, ЖХП, 10, № 2, 23 (1939).
81. Ф. К- Михайлов, Д. М. Гинзбсрг, Труды НИОХИМ, т. 10, 1957,
стр. 39, —82. С. Н. Fuchsmann, пат. ФРГ 944426, 1956. — 83. Р. D. V. Man-
ning, S. D. Kirkpatrick, Chem. Met. Eng., 51, Ns 5, 92, 142 (1944).—
84. R. Ma nocha, Q. Sternheim, J. Sci. Ind. Res., (B—C) 15, № 7, В 375
(1956). — 85. А. И. Беляев, Металлургия легких металлов, Госметаллургиздат,
1954. — 86. Е. И. Савинкова, Я- Е. Вильнянский, Изв. вузов. Хим. и
хим. технол., 2, № 1, 59 (1959). — 87. S. Mrowec, польск. пат. 37688, 1955.—
88. S. М. Heins, В. Strauss, пат. США 3201208, 1963. — 89. V. J. Chris-
tensen, G. С. Egleson, Е. L. Carlson, пат. ФРГ 1183.485, 1963, — 90. Нор-
веж. пат. 105491, 1963.
308
Гл. IX. Соединения магния
91. Пат. США 334726, 1965, — 92. Пат. США 3347625, 1965.-53. Пат. США
3345128, 1965. — 94. Т. Л. Лукманова, Я. Е. Вильнянский, Изв. вузов.
Хим. и хим. технол., 7, № 3, 510 (1964).—95. Е. И. Савинкова, Т. Л. Лук-
манова, Изв. вузов. Цвета, металлург. № 3, 105 (1964). — 96. Ind. Chem., 21,
№ 246. 351; № 247, 419 (1945). — 97. А. И. Тетеревков, Я. Е. Вильнян-
ский, ЖПХ, 32, № 2, 438 (1959). — 98. Я. Е. Вильнянский и др., Реф.
докл. VIII Мендел. съезда. Секции неорг. хим., 149 (1959). — 99. I. J. К г е m а,
пат. США 2668750, 1954. — 100. А. А р о s t о 1 i d е, Rev. chim., 6, №8, 425 (1955).
101. И. К. Пуха, сб. «Технология переработки природных солей и рассо-
лов», Изд. «Химия», 1964, стр. 114. —102. А. М. Кузнецов, Производство кау-
стического магнезита, Промстройиздат, 1948. — 103. V. V. Hughey, пат. США
2640759, 1953. — 104. J. С. Hicks, L. W. Austin, англ. пат. 719623, 1954.—
105. F. Nadachowscki, Szklo i ceramika, 4, № 3, 99 (1953).—
106, R. A. S c h о e n 1 a u b, пат. США 2636809, 1953. — 107. C. R. H a v i g h о r t s,
S. L. Swift, Chem. Eng., 72, № 15, 150, A-l (1965).— 108. F. E. Lathe, пат.
США 2694620, 1954. —109. E. Bieneck, E. Schroth, пат. ФРГ 930738, 1955;
франц, пат. 1109716, 1956,— 110. П. В. Гельд, О. А. Ес и и, ЖПХ, 21, № 3, 240
(1949).
111. А. А. Байков, Ж. русск. металлург, общ-ва, 1, 311 (1913).—
112. А. А. Байков, Собрание трудов, т. V, Изд. АН СССР, 1948, стр. 49. —
ИЗ. А. А. Б а й к о в, А. С. Т у м а р е в, Изв. АН СССР, ОТН, № 4, 565 (1937). —
114. М. Н i с g n е t, пат. США 2637545, 1953. — 115. А. Н. Ясиновский,
В. В. Гончаров, Огнеупоры, № 4—5, 7 (1946). — 116. П. П Будников,
X. С. Воробьев, ЖПХ, 32, № 2, 253 (1959). — 117. Q. М. Armstrong,
Н. A. Cook, пат. США 2631923, 1953. — 118. В. К. Shukla, Salt. Res. a. Ind., 5,
№ 2, 34 (1968). —119. В. А. Клементьев, Труды ВАМИ, № 18, 1939,
стр. 11, — 120. J. Horiguchi, J. Sci. Res. Inst., 47, 99, 294, 301, 319, 341 (1953);
48, 27 (1954).
121. H. А. Осокорева, Труды ГИПХ, в. 25, 1934, стр. 94. —122. J. Mil-
fa а и е г, J. V1 a s a k. Cl. Sci. math., natur. et med., 51, 1 (1953).—
123. P. И. A p а в, Л. И. Колосова, Комплексное использование ресурсов Си-
ваша и Перекопских озер, Киев, 1958, стр. 80.— 124. Р. И. А р а в, Е. Г. Ч у-
б а р ь, сб. «Исследования в области химии и технологии минеральных солей и
окислов», Изд. «Наука», 1965, стр. 24. — 125. Р. И. А р а в, Укр. хим. ж., 32, №5,
521 (1966). — 126. К. Hobold, W. Hacker, пат. ФРГ 949563, 1956.—•
127. A. Tomi ока, япон. пат. 1370, 1954. — 128. Т. С. Atchison, канад. пат.
497409, 1953. — 129. Р. W. Т г u b е у, J. В. В о у а с к, англ. пат. 965081, 1960.—
130. Е. А. Р г и d h о m m е, франц, пат. 1027683, 1953.
131. Б. А. Ко пыл ев, И. Г. Л е с о х н н, А. М. Б а л я с н а я, Труды ЛТИ
им. Ленсовета, в. 10, 1941. — 132. A. Q. Wintershall, франц, пат. 1022581,
1953.— /33. Н. Keitel a. oth., англ. пат. 693108, 1953; пат. ФРГ 913535, 1954. —
134. R. N. Vohra, R. N. Patel, В. К. Shukla, Chem. Age (India), 19, № 6,
441 (1968). — 135. А. В. Николаев, ЖПХ, 20, № 3, 187 (1947).—
136. Ю. А. Клячко, Н. П. Кондратюк. Зав. лаб., № 8, 912 (1947).—
137. Н. П. Кондратюк, Ю. А. К л я ч к о, Хим. наука и пром., 2, № 2, 267
(1956). 138. J. Sugi, К- Shimizy, япон. пат. 1065, 1955. — 139. J. Schroe-
der, К. Boron, A. Mi lews k a, Przem. chem., 45, № 1, 14 (1966).—
140. S. I s h i z а к а, М. Т е г a d а, япон. пат. 3665, 1953.
141. Q. Wehner, пат. ГДР 4400, 1953. — 142. Н. С. Спиро, Хим. пром.,;
№ 5, 137 (1948). — 143. Н. С. Спиро, Труды ВНИИГ, в. 36, 1959, стр. 281,—
144. А. Д. Пельш, Там же, в. 24, 1952, стр. 99. —145. Chem. Eng., 54, № 8, 132
(1947).— 146. Tidsskr. kjemi, bergves og metallargi, 13, № 5b, 83 (1953).—
147. W. C. Gilpin, N. He acme n, Cloy Prod. J., 20, № 3, 33, 35 (1953).—
. 148. C. R. Havighorst, S. L. Swift, Chem. Eng., 72, № 16, 84, A-l (1965).—
Литература
30»
149. Eng. a. Mining J., 168, Ks 3, 104 (1967). —150. G. H. Weyermuller,
R. R. К 11 ch e n, Chem. Process,' 31, № 11, 39 (1968).
151. Я. Д. Козин, П. T. Данильченко, A. M. Пон изо век и й, Вести.
АН СССР, Кв 11, 63 (1954). — 152. Ц. Дяковска, X. Козарев, Тежка пром.
4, № 10, 45 (1955).— 153. D. Marcus, J. Weiser, Rev. chim., 18, № 2, 114
(1967).— 154. Нага и, Есидзаки, Накаяма, J. Ceram. Assoc. Japan, 62,
№ 694, 248; № 695, 325 (1954).- 155 J. A. Robertson. С. B. Miles,
D. C. Linton, пат. США 2703273, 1955. — 156. П. Г. Р о м а н к о в, Н. Б. Р а ш-
ковская, 3. А. Березовская, Инф. бюлл. ЛТИ им. Ленсовета. Аннотации
н.-и. работ, в. 1, 1956, стр. 191. — 157. И. К- П у х а. Аннотации работ ВНИИГ,
№ 1, 1956, стр. 52. — 158. И. К. Пуха, Труды ВНИИГ, в. 36, 1959, стр. 315.—
159. А. Д. П е л ь ш, Там же, в. 31, 1956, стр. 3. — 160 Ю. С. 3 а я ч к о в с к и й,
Строит, пром., № 8, 13 (1953).
161. Н. Д. Ча лый, Механизация строительства, № 10, 31 (1953).—
162. И. К. Пуха, Труды ВНИИГ, в. 31, 1956, стр. 28. — 163. И. К. Пуха,
В. В. Тархова, Е. Я- Грязина, Н. Ф. С е д н е в а, сб. «Технология пере-
работки природных солей и рассолов», Изд. «Химия», 1964, стр. 10.4. —
164 Л. L. Ь г a d 1 е у, Eng. u. Foundryman, 21, № 1, 62 (1956). — 165. R. A. Pat-
ton, С. Baugh, англ. пат. 972323, 1962. — 166. В. С. С т о й и о в а, Г. Р. По-
пов. Г. С. М о н е в, авт. свид. НРБ 10319, 1963.— 167. В. Г. Эд ибер, Труды
ВНИИГ, в. 36, 1959, стр. 344. —168. А. Я. Вайвад и др., Изв. АН ЛатвССР.
Сер. хим., № 2, 163, 171 (1962); № 6, 643 (1965).— 169. Gregg, Packer,.
Wheatley, J. Chem. Soc., 1965, № 1, 46.— 170. А. С. Суслейменов, Тру-
ды I совещания no термографии, Изд. АН СССР, 1955, стр. 200.
171. И. К. Пуха, Р. Э. Натинская, авт. свид. 183724, 1964.—
172. А. А. Соколовский, Т. И. Кузнецова, К- Л. Павлова, Труды
ГНИИХП, в. 3, 1955, стр. 66.— 173. К. S е s h a d г i, J. Gupta, J. Sci. Ind Res.,
13, № 3, 204 (1954). — 174. R. A. Patton, пат. США 3211567, 1962.—
175, W. Moldennauer, Z. anorg Chem., 51, 369 (1906). — 176. А. П. Обу-
хов, M. H. Михайлова, В. И. Копосова, А. А. Бук в ин, Труды ГИПХ,
в. 25, 1934, стр. 84. — 177. Я. Е. Вильнянский, Е. И. Савинкова, ЖПХ,
26, № 8, 808 (1953). —178. Г. Т. К о с н ы р е в, Е. И. Савинкова, В. Н. Рас-
сохина, сб. «Физическая химия расплавленных солей», Изд. «Металлургия»,
1965, стр. 331. — 179. Е. И. Савинкова, Г. Т. К о с н ы р е в, Г. А. Партина,
Цветные металлы, № 4, 56 (1966). — 180. Г. Т. К о с н ы р е в, Е. И. Савин-
кова, Я. Е. Вильнянский, Изв. вузов. Цветн. металлург.. № 5, 58 (1966).
181. И. Л. Резников, ЖПХ, 23, № 9, 897 (1950). — 182. F. Haber,
F. Fleischmann, Z. anorg. Chem., 51, 336 (1906). — 183. В. А. Суходский,
А. П. Обухов, А. И. К P я г о в а, Труды ВАМИ. № il—12, 1935, стр. 47.—
184. А. Г. Бергман, В. А. Клементьев, Е. Б. Певзнер, Труды ГИПХ,
в. 16, 1932, стр. 3; в. 25, 1934, стр. 20. — 185. А. Г. Бергман. А. И. Ляшен-
ко, А. П. Обухов, Там же, в. 25, 1934, стр. 39. — 186. А. П. Обухов,
М. И. Михайлова, В. Н. Копосова, Там же, стр. 69. — 187. Chem. Eng.,
№ 8, 346 (1956). — /88. Н. Hoppe, В. Maurer, Chem. Techn., 18, № 5, 257
(1966).— 189. К- В В е n g t s о n, L. N. J о h a n s о n, J. С. A 1 m о n d, пат. США
3251650, 1963. — 190. Я. E. Вильнянский, E. И. Савинкова, ЖПХ, 27,
№ 8, 864 (1955).
191. W. F. Cole, Т. De me dink, Austral. J. Chem., 8, № 2, 234 (1955).—
192. В. А. Клементьев, Труды ГИПХ, в. 25, 1934, стр. 78. — 193. Ф. К- Ми-
хайлов и др., Труды НИОХИМ, т. 12, 1959, стр. 59, 71. — 194. R. Ts u ch id а,
Sci. Rep. Tohoku Univ., Ser. I, 37, № 1, 9 (1953). — 195. В. M. Б у к ш т е й н,
Р. С. Р о с к и н а, Труды ВНИИГ, в. 31, 1956, стр. 83. — 196. Н. К. Давиден-
ко, Укр. хим. ж., 21, № 6, 773 (1955). —197. В. П. Ильинский, Труды Даль-
невосточн. филиала АН СССР, в. 2, 1956, стр. 89.—'198. F. Busch. Freiberger
310
Гл. IX. Соединения магния
Forschungsh., А, № 354, 23 (1965). —199. R. Burmeister, ibid., 41 (1965).—
200. R. Reissner, H. S u 1 d а, австр. пат. 177406, 1954.
201. H. Suida, австр. пат. 178091, 1954. — 202. Т. Весене, А. Каушпе-
д а с, Научи, труды вузов ЛитССР. Хим. и хим. технол., № 6, 225 (1965).—"
203. Аюкава, Мариам а, яподт. пат. 420, 1955. — 204. Л. Г. Берг, С. Г. Га-
нелина, Э. Ф. Губанов, ЖПХ, 32, № 11, 2576 (1939). — 205. L. R о v i г а,
Ind, minera, 12, № 143, 21 (1953). — 206. A. Les, Ind. chim., 40, № 431, 167
(1953). — 207. В. В. Печковский, ЖПХ, 29, № 8, 1137 (1956); 30, Кб 11. 1579
(1957). — 208. R. Kaiser, Chem. Technik, 6, № 4, 207 (1954). —209. А. Б. Суч-
ков, Б. А. Борок, 3. И. Морозова, ЖПХ, 32, № 6, 1382 (1959).—
210. A. Beerwald, Z. anorg. Chem., 261, № 1—2, 52 (1950).
211. В. Schatzel, Chem. Technik, 5, № 7, 394 (1953). — 212. В. Schat-
zel, ibid.. 4, № 3, 114 (1952), — 213. H. A. Lehman, G. Diekers, пат.
ГДР 33284, 1962. — 214. Я. П. Беркман, С. В. Кушнир, ДАН СССР, 104,
№ 3, 448 (1955). — 215. Н. Zirngibl, пат. ГДР 5167, 1953. — 216. К- Ebner,
яат. ФРГ 887196, 1953. — 217. В. В. В я з о в о в, Хим. наука и пром., 2, № 6,
700 (19Вб). — 218. О. К- Я н а т ь е в а, Г. С. Рапопорт, И. С. Р а с с о н с к а я,
М. В. Устинова, ЖПХ, 34, № 10, 2347 (1961).—2/9. Б. А. Шойхет,
Б. Ю. Ланге, Хим. пром., № 6, 380 (1958). — 220. Б. И. И с а ч к и н, сб. «Тер-
моизоляционные материалы», № 2, 1941, стр. 9.
221. К. П. Магницкий, Магниевые удобрения, Сельхозгиз, 1952.—
222. К. П. Магницкий, Хим. пром., № 5, 131 (1950). — 223. М. М. М а з а е в а,
Удобрение и урожай, № 11, 38 (1956). — 224. Н. Е. Пестов, ЖХП, 14, № 3,
185 (1937). — 225. Н. Е. Пестов, Л. Ф. Гревцева, Труды НИУИФ, в. 129,
1936, стр. 12. — 226. В. И. Зелиоцкайте, И. В. Я н и ц к и й, С. В. Вайра ft-
те, Труды АН ЛитССР, Сер. Б, 2, 75, 85 (1968). — 227. Удобрения, перев. с англ,
под ред. А. В. Петербургского, Изд. «Колос», 1965, стр. 294. — 228. В. Л. Вар-
шавский, Г. Я- Попова, Б. А. Ко пыл ев, М. Е. П о з и н, Труды НТК
«Ободовые фосфориты», Таллин, 1968, стр. 181. — 229. И. 3. Вальд штейна с,
С. В. Вайрайте, В. И. Зелнонкайте, Научные труды вузов ЛитССР. Хим.
и хим. технол., т. XI, 1968.
ГлаваХ
СОЕДИНЕНИЯ БОРА
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Бор — весьма активный элемент, не встречающийся в природе
в свободном виде. Элементарный бор восстанавливается из бор-
ного ангидрида магнием1-4 (и алюминием), причем образуются
также бориды магния 5-7. Более чистый бор можно получить, вос-
станавливая его из ВС13 металлическим цинком8, или электролизом
расплава В2О3 в криолите9. В воздухе бор загорается при 700°,
образуя борный ангидрид В2О3. Выше 900° бор соединяется с азо-
том, образуя нитрид бора BN, имеющий высокую тугоплавкость
(плавится под давлением выше 3000°)10-12 При нагревании до
2500° смеси В2О3 (или В) с углем без доступа воздуха образуются
черные кристаллы карбида бора (плотностью 2,52 г/см3)13. Карбид
бора устойчив в азотной кислоте, в хлоре и в кислороде до 1000°;
при сплавлении со щелочами в присутствии воздуха — разлагается.
Карбид бора В6С по твердости близок к алмазу, а В4С и В3С—
тверже алмаза. Бориды металлов тоже обладают большой твер-
достью; так, борид хрома в смеси с железом является наплавоч-
ной смесью, придающей поверхности стальных изделий повышен-
ную износоустойчивость14-18. Трифторид бора BF3 образуется19
при взаимодействии В2О3 и HF в присутствии концентрированной
серной кислоты или при нагревании до 500° тетрафторбората ба-
рия20 Ba(BF4)2. Трифторид бора — газ (кипит при —100,4°, пла-
вится при —127,1°), хорошо растворимый в концентрированных
серной, азотной, фосфорной кислотах21’22, а также в органических
растворителях. В воде разлагается, образуя борную и борофтори-
стоводородную (тетрафтороборную) кислоты:
4BF3 + ЗН2О = Н3ВО3 + 3HBF4
1 мл воды при 0° и 762 мм рт. ст. поглощает 1057 мл газообраз-
ного BFs, а 1 мл серной кислоты плотностью 1,85 .г!см2—50 мл
312
Гл. X. Соединения бора
BF3. Плотность газообразного BF3 при 760 мм рт. ст. и 20° 3,0 г/л, ^fl
а при 88° — 4,613 г/л; плотность жидкого BF3 равна 2,6999—^fl
€,00642 Т. Давление пара BF3 выше температуры кипения вычис- ^fl
ляется по формуле lgP = 5,1009—889,6/7" (где Р в ат), а ниже
—101,4° — по формуле lg Р = 8,928—1023,5/7’ (здесь Р з '|fl
ММ рт. СТ.) 23’ 24. Jfl
С HF и фторидами BF3 образует борофтористоводородную кис- fl
лоту HBF4 и ее соли — фторбораты, например, KBF4 26. Предло- fl
жены методы получения B2F4 26. Трихлорид бора ВС13 кипит при fl
+ 18°, плавится при —108°; о методах его получения см. 27-29; о по- fl
лучении ВВг3 и В13 см.30; о получении монофосфида бора ВР, ис- fl
пользуемого в качестве огнеупорного материала и полупроводника, fl
CM.31-3®. fl
О свойствах и получении фосфата бора, используемого в каче- fl
стве катализатора (при гидратации этилена и проч.), см.36’37. fl
С водородом бор образует различные гидриды бора — борово- fl
дороды (бораны). Последние способны образовывать многочислен- fl
ные комплексные соединения — полигидрополибораты и др.38. fl
Борный ангидрид В2О3 имеет две кристаллические модифика- fl
ции, плавящиеся при 294 и 465° (плотность 1,85 и 2,46 г/с.и3), но fl
обычно находится в стеклообразной форме (плотность 1,78— jfl
1,85 г/слг3; плавится при 557°); кипит при ~1860° (по другим дан- jfl
ным при ~2200°39); гигроскопичен, с водой образует борные кис- ifl
лоты. |fl
Борная (ортоборная) кислота Н3ВО3 (или В2О3 • ЗН2О) выде-
ляется из растворов в виде бесцветных кристаллов (плотность 1,43— fl
1,49 г'см3). При нагревании постепенно теряет воду и переходит fl
(при 70—110°) в метаборную кислоту НВО2 (или В2О3-Н2О), су- fl
шествующую в трех кристаллических формах с температурами fl
плавления 176, 201 и 236°. При дальнейшем прокаливании превра- fl
щается в борный ангидрид В2О3. Насыщенный водный раствор fl
содержит при 0° 2,6%, при 21° 4,9%, при 100° 27,6% Н3ВО3. При fl
кипячении водных растворов борная кислота улетучивается вместе fl
с парами воды. Константы диссоциации Н3ВО3: К?5’= 5,84- 10“’° jfl
(по другим данным К?о° = 7,3 • 10“10), кГ = 1,8 • 10~13 и К32о° = 'Н
= 1,6-10” ; Н3ВО3 легко вытесняется из ее солей минераль- Ifl
ными кислотами, даже такими слабыми, как Н2СО3 h.H2S. Недав-
ними исследованиями установлено39а, что в водных растворах ион (fl
•бората находится в форме В(ОН)~. Поэтому диссоциация борной fl
кислоты протекает по уравнению fl
В(ОН)3 + 2Н2О = В(ОН); + Н3О+
Тетраборная кислота Н2В4О7—более сильная; для нее К2а°— 2 • 10”4 ,i
и К25 ^2- 10~5 (по другим данным /С25°~ 10”®). ]
Физико-химические свойства
31S
Соли борных кислот носят общее название боратов; к ним
относятся ортобораты, метабораты и многочисленные соли поли-
борных кислот, имеющих общую формулу тНзВОз • пН2О или
Нзт-2пВтО3т_п (для тетраборатов m = 4, п == 5; для гексаборатов
m = 6, п = 7; для декаборатов m = 10, п = 12 и т. д.40).
Бура — тетраборат (пироборат) натрия Na2B4O7, кристалли-
зуется из водных растворов выше 56° в виде Na2B4O7 • 5Ь12О; ниже
56° — в виде Na2B4O7 • 10Н2О. Последний образует крупные моно-
клинные призматические кристаллы, выветривающиеся на воздухе
(плотность 1,70 г/см3). Насыщенный водный раствор содержит при
0° 1,3%, при 100° 34,3% Na2B4O7, При прокаливании буры при
350—400° получается безводный Na2B4O7, который при 742° пла-
вится, превращаясь в прозрачное хрупкое стекло (плотность
2,34 г/см3). При спекании буры с борной кислотой при 140—180°
получаются полибораты с отношением Na2O : В2О3 < 1 : 4 41’42. Ме-
табораты образуют с Н2О2 пербораты 43’44. Известны истинные пер-
бораты натрия NaBO3, калия 2КВО3-Н2О и аммония 2NH4BO3-
• Н2О. Техническому продукту, называемому перборатом натрия,
неправильно приписывали формулу NaBO3 • 4Н2О, на самом деле
он является пергидратом метабората натрия NaBO2 • Н2О2 • ЗН2О.
Он представляет собой бесцветные гигроскопические кристаллы,
содержит 10—10,4% активного кислорода, обладает окислитель-
ными свойствами. В 100 мл воды при 18° растворяется 1,17 г. Вод-
ные растворы имеют щелочную реакцию; при действии на них раз-
бавленных кислот выделяется перекись водорода. Выше 50° раз-
лагается с выделением кислорода. В сухом состоянии при обыкно-
венной температуре хранится длительное время без разложения
(потеря активного кислорода ~0,1 % в год). О тиоперборатах нат-
рия и калия см.45.
Малорастворимые бораты щелочноземельных металлов являют-
ся основными солями 46’47. Например, кальциевая соль гексабор-
ной кислоты имеет строение:
НОСаОч ,ОЧ ,Ох /ОН
ХВХ ХВХ ХВХ
I I I
ОН он он
При удвоении этой структуры получается Са2В60ц • 5Н2О или
2СаО • ЗВ2О3 • 5Н2О — формула минерала колеманита. Если к одно-
му из гидроксилов присоединить дополнительно молекулу воды, то
после удвоения получится формула мейергофферита Са2В60ц • 7Н2О
или 2СаО • ЗВ2О3 • 7Н2О. При присоединении по молекуле воды к
каждому из четырех гидроксилов аниона полиборной кислоты по-
лучится СаН(Н3О)4ВзО8, а после удвоения формула минерала
иньоита Са2В6Ои • 13Н2О или 2СаО • ЗВ2О3 • 13Н2О. Примером со-
лей гетероиоликислот бора (т. е. кислот, содержащих, кроме бора,
314
Гл. X. Соединения бора
кислорода и водорода, атомы других элементов) являются бороси-
ликаты, например датолит 2СаО • В2О3 • 2SiO2 • Н2О.
При смешении борной и плавиковой кислот 48-53 образуется ком-
плексный ион BF4 тетрафторборной кисло’гы HBF4. Известны двой-
ные соли, получающиеся из фтористого натрия и буры (или мета-
бората натрия или борной кислоты) и из фтористого аммония и
борной кислоты 54-55. Растворимость Н3ВО3 и NaF при совместном
присутствии, т. е. в системе Н3ВО3— NaF — Н2О, по сравнению
с растворимостью их в воде, резко возрастает58; например, при 25°
Н3ВО3 в растворе, % . . . . — 4,27 34,46 44,3 4 35,44 14,12 5,29
NaF в растворе, %...... 3,86 4,19 9,85 12,63 10,68 2,70 —
Твердые фазы NaF NaF+H3BO3 Н3ВО3
Это указывает на комплексообразование в растворе с появле-
нием фторзамещенных полиборатов.
При извлечении бора аммиаком из отработанных растворов в
производстве борной кислоты образуются гексабораты аммония-
магния57. При 20—25° образуется семиводный гексаборат(NH4)2О •
♦ MgO • ЗВ2О3 • 7Н2О; ниже 20° существует (NH4)2O • MgO • ЗВ2О3 •
♦ 15Н2О. Гексаборат аммония-магния гидролизуется — вода вымы-
вает из него борат аммония:
2(NH4)2MgBeOn • aq 4- 9Н2О = Mg2B3O12 • aq + (NH4)4B30n
О получении полиборатов аммония см.58.
Гидролизу подвержены и другие бораты59. В 0,02 М водном рас-
творе, насыщенном изоамиловым спиртом, моноборат натрия гид-
ролизуется незначительно, а пента- и тетраборат почти полностью
разлагаются до моноборатов:
NaB5O8 4- 6Н2О = NaBO2 + 4Н3ВО3
ЫазВзОу + ЗН2О ~ 2NaBO2 + 2Н3ВО3
Разложение гексабората магния MgB6Oi0 начинается при кон-
центрации меньше 0,002 М; диборат магния в 0,01 М растворе гид-
ролизуется на 30%:
MgB2O4 + 4H2O Mg(OH)2 + 2Н3ВО3
Индерит Mg2B60n • 15Н2О при концентрации 0,002 М целиком
разлагается:
Mg2B60u + ЗН2О = 2MgB2O4 + 2Н3ВО3
Бораты кальция разлагаются легче, чем бораты магния.
При взаимодействии В2О3 с SiO2 и Р2О5 получаются стекла.
Первичной фазой, кристаллизующейся в системе В2О3—SiO2—Р2О5
для значительной части треугольника составов, является, по-види-
мому, ВРО469. Линия ликвидуса для составов с 30—70 вес.% SiO2
Применение
815
имеет эвтектический характер61. В этом гГйтервале концентраций
стекла имеют малую устойчивость к атмосферной влаге.
Описаны полимеры на основе бора 62’63, для которых характерна
связь бора с кислородом =В—О—В = , дающая длинные цепи и
замкнутые кольца. Эта связь сравнительно легко разрушается во-
дой. Такое же строение имеют, возможно, и полимеры метафосфата
борила (ВО)РО3, который является солью, образующейся в виде
белого порошка из НРО3 и Н3ВО3 (в присутствии концентрирован-
ной уксусной кислоты), причем борная кислота проявляет в этом
случае нехарактерные для нее основные свойства.
Обнаружено64 наличие полимеров борной кислоты в ее раство-
рах, особенно в концентрированных65. Полимеризационные свой-
ства бора позволяют использовать некоторые его соединения
(например, арилборные кислоты) в реакциях конденсации для полу-
чения пленок и волокон66. При взаимодействии боранов с серово-
дородом получается высокомолекулярный полимер (BHS)n, даю-
щий бесцветные, прозрачные пленки67. Нитрид бора образует поли-
меры (BN)n со слоистой структурой; они могут быть получены в
виде мягких чешуек (аналогично графиту). Стеклообразный бор-
ный ангидрид (В2О3)П относится к полимерам, имеющим простран-
ственную структуру68. Некристаллизующийся полимерный продукт
можно также получить при выпаривании раствора тетрабората
с фосфатом и щелочью; этот продукт предложено использовать
для защитных покрытий металлов.
ПРИМЕНЕНИЕ69-88
Бор используют в ядерной физике — в связи с его способностью
поглощать нейтроны, он препятствует ядерным цепным реакциям70.
В металлургии элементарный бор применяют для изготовления ли-
гатур. Поверхностный слой стали, насыщенный бором, приобретает
высокие механические и антикоррозионные свойства. Такая сталь
оказывается достаточно устойчивой в смеси соляной и азотной кис-
лот. Используют также содержащие бор сплавы алюминия, меди,
никеля, оловянные и алюминиевые бронзы и др. Способность буры
растворять окислы металлов позволяет применять ее в качестве
плавня при сварке и пайке металлов (для этой цели используют
и борат цинка).
Вследствие высокой твердости большое значение как абра-
зивы приобрели карбиды бора. Использование нитрида бора осно-
вывается на его высокой огнеупорности (до 3000°) в нейтраль-
ной или восстановительной среде. Из него изготовляют, например,
жаростойкие подставки и изоляторы для индукционных высоко-
частотных печей. Бориды титана, циркония, ванадия, ниобия, тан-
тала, молибдена, вольфрама, марганца и других тугоплавких ме-
таллов характеризуются высокими температурами плавления и
316
Гл. X. Соединения бора
твердостью71’72, положительными температурными коэффициен-
тами электросопротивления, способностью переходить в сверхпро-
водимое состояние73 и другими ценными свойствами. Это обусло-
вило разработку методов их получения 74’76. Трехфтористый бор и
его производные все шире используются как высокоактивные ката-
лизаторы в органическом синтезе, в частности в процессах пере-
работки нефти, а также в гальванотехнике и литейном деле76.
Бура и борная кислота издавна применяются в стекольной про-
мышленности, в частности для изготовления стекловолокна, опти-
ческого стекла и химической посуды. Из применяемых для произ-
водства борного стекла боратов щелочных металлов R2O • 2В2О3,
R2O • В2О3 и 2R2O • В2О3 (где R—Li, Na, К) наиболее прочными
в расплавах являются соединения типа R2O • В2О3, которые улету-
чиваются при 1300—1400° без разложения77. В керамической про-
мышленности бура и борная кислота используются для изготовле-
ния глазурей. Некоторые природные борные соединения, например,
пандермит 2СаО • ЗВ2О3 • ЗН2О, в смеси с полевым шпатом приме-
няют для пропитки керамических изделий с целью придания им
водонепроницаемости. В эмаль для металлической посуды добав-
ляют буру для уменьшения разницы между коэффициентами тер-
мического расширения эмали и металла. В присутствии небольших
количеств В2О3 значительно уменьшается вязкость эмалевого стек-
ла и облегчается смачивание им стали78.
В текстильной промышленности буру используют при мытье
тканей, для растворения жиров, для фиксации на тканях некото-
рых минеральных протрав; она заменяет мыло при очистке шелка
в процессе размотки коконов; ее примешивают к крахмалу для
придания блеска накрахмаленным тканям. Буру применяют в ко-
жевенной и в целлюлознобумажной промышленности. В электро-
химических производствах буру и борную кислоту применяют в ка-
честве добавки к электролитам, например, при получении катод-
ного никеля (7—16 г/л Н3ВО3), в резиновой промышленности для
замедления вулканизации каучука, а также в мыловаренной и в
парфюмерной промышленности и в органическом синтезе79,
В США выпускают более 50 наименований борных соединений
неорганических и органических, в том числе полимерных. Важной
областью применения соединений бора стало производство топлив
для ракетных двигателей — боранов и их алкильных и других про-
изводных, обладающих высокой теплотворной способностью80.
Из неорганических соединений бора в капиталистических стра-
нах в наибольшем количестве выпускают и потребляют различные
бораты натрия, затем борную кислоту, бораты калия, аммония,
кальция, свинца, бария и др.
Борную кислоту и буру используют для пропитки деревянных
конструкций с целью защиты их от гниения и для придания им
огнестойкости. Благодаря антисептическим свойствам борную кис-
Применение
317
доту и буру применяют в медицине. Их используют также в ка-
честве консервирующего средства в пищевой промышленности.
При этом следует учитывать, что соединения бора могут быть
вредны для человеческого организма при систематическом их
принятии внутрь даже в малых дозах (1—2 г в сутки вызывают
быстрое, а доза 4 г — немедленное отравление81).
Буру упаковывают в бумажные мешки, а борную кислоту в
деревянные бочки или матерчатые мешки. Требования к составу
буры и борной кислоты приведены в табл. 23 и 24.
ТАБЛИЦА 23
Качество технической и пищевой буры (в %) по ГОСТ 8429—69
Техническая Пищевая
№28467, не менее . 49,5 51.5
Не растворимый в воде остаток, не более 0,2 0.02
Na2SO4, не более 0,4 0.1
№гСОз » 0.4 Отсутствует
Хлориды в пересчете на хлор, не более Не нормировано 0,005
Тяжелые металлы сероводородной группы в пере- счете на свинец, не более » 0,01
Железо, не более > 0,004
Мышьяк •» » » 0,001
Остаток после просева: на снте 0,15 мм, ве более » 10
» » 0,6 > > > > Отсутствует
ТАБЛИЦА 24
Качество борной кислоты (в %) по ГОСТ 2629—44
I сорт II сорт
НзВОз, не менее • • . 99,5 98,5
Нерастворимый в воде остаток, не более. ..... 0,005 o.i ч
СГ, не более 0,00! 0,2
SO2- » » 0,008 0,6
Fe » » ..................... 0,001 0,005
Тяжелые металлы группы H2S, ие более 0,001 0,005
Влага, не более — 1
Техническая бура, предназначенная для экспорта по ГОСТ
10.60—71, должна содержать не менее 99,5% Na2B4O7-10Н2О и
не более: 0,004% Fe, 0,0025% Са, 0,0015% тяжелых металлов се-
роводородной группы (РЬ), 0,0012% А1, 0,01 % SO4, 0,005% хло-
ридов (С1).
Борную кислоту, применяемую для электротехнических кон-
денсаторов, получают перекристаллизацией технического продук-
та; к ее чистоте предъявляют более высокие требования (ГОСТ
5281—50).
Перборат натрия82, обладающий белящими свойствами, при-
меняют в качестве мягкого белителя для Отбелки шерсти, шелка,
бархата, соломы, а также для изготовления моющих средств.
818
Гл. X. Соединения бора
Окислительные свойства пербората натрия позволяют использовать
его в качестве заменителя водных растворов перекиси водорода.
В некоторых производствах источником бора служит борный
ангидрид. Например, применение его вместо борной кислоты в ка-
честве сырья для выплавки карбида бора снижает расход электро-
энергии. Бораты цинка используют в качестве люминофоров, ката-
лизаторов в органическом синтезе, для производства огнеупорных
волокнистых веществ и др.
Борсодержащие вещества являются эффективными микроудо-
брениями— среди всех микроэлементов бор имеет наибольшее зна-
чение83-89. В большинстве почв содержание бора колеблется от 20
до 200 мг/кг, но обычно только около 5 % его находятся в усвояе-
мой форме90. Отсутствие или недостаток бора в почве вызывает
заболевания растений, приводящие к снижению урожая (гниль cep-i
дечка у сахарной и кормовой свеклы, отмирание верхушки льна и
люцерны и др.). Помимо профилактического действия, бор повы-
шает урожайность, например, внесение борных удобрений в коли-
честве 6—9 кг/га (в пересчете на Н3ВО3) дает прирост клевера и
люцерны 0,5—1 ц/га, кормовой свеклы 4—7 ц/аа, овощей 2—5 ц/га
и т. п.871 88.
Наиболее концентрированными борными удобрениями являются
борная кислота и бура, но обычно в качестве удобрений приме-
няют промышленные отходы, содержащие небольшие количества
бора, некоторые природные бораты или продукты их простейшей
переработки. Например, по ГОСТ 9595—61, борат магния, получае
мый осаждением каустическим магнезитом из маточных растворов
от производства борной кислоты и используемый в качестве микро
удобрения, должен содержать не менее 9% лимоннорастворимых
соединений бора в пересчете на Н3ВО3. Для предпосевного опудри-
вания семян применяют порошок, содержащий бор; это механиче
ская смесь тонкоизмельченных (меньше 0,15 мм) борной кислоты
и талька. Согласно СТУ 76—650—62, в кем должно быть 14—16%
Н3ВО3 и менее 1% влаги.
Для получения борных удобрений целесообразно использовать
также такие виды бедного борного сырья, как сопочные грязи,
нефтяные буровые воды91, отходы от обогащения борных руд, тур-
малиновые руды, содержащие 2—3% В2О3, гипсы, содержащие
примеси борных минералов и др.92, Местные удобрения — зола,
торф и навоз — также имеют значение в качестве источников бора:
1 кг золы древесины содержит от 200 до 700 мг бора, 1 кг сухого
вещества навоза и торфа — около 20 мг. Небольшие количества
бора содержатся в сырых калийных солях (4—8 мг/кг) и в доломи-
тах (3—8 мг/кг). Чаще всего соединения бора добавляют к другим
удобрениям, например к суперфосфату, так как распределение
малых количеств борного удобрения на большую площадь посева
затруднительно. Соединения бора вводят и в жидкие удобрения в
Сырье
319
виде буры или полибора 2 — частично дегидратированного пента-
или тетрабората натрия93. В США и в Канаде рекламируются бор-
ные и другие микроудобрения в виде фриттов — размолотых спла-
вов соединений микроэлементов со стеклом. В таком виде микро-
элементы не поглощаются почвой, а медленно вымываются и по-
степенно поступают в растения94.
СЫРЬЕ
Распространенность бора значительна — его весовой кларк для
земной коры 5- 1СН%. Однако борные минералы (табл. 25) весьма
рассеяны, и имеется мало месторождений с высокой концентра-
цией бора, представляющих практический интерес.
Турмалин — борсодержащий алюмосиликат переменного со-
става, относящийся к первичным породам. В табл. 25 приведен его
Некоторые борсодержащие минералы
ТАБЛИЦА 25
Химическая формула Твер- дость Плотность, г1см$
Борацит (стасс- MgCls • 5MgO • 7В2О3 7 2,9-3,2
фурит)
Сульфоборит 3MgSO4 • 6MgO • 4В2О3 4 2,32-2,45
Пинноит MgO • В,О3 • ЗН2О 3-4 2,29
Ашарит (ссай- 2MgO • Ё2О3 • Н2О или MgHBOa 3-4 2,69
белеит)
Индерит 2MgO-3B2O3- 15Н2О 1,5-2 1,79
Курнаковит 2MgO-3B2O3- 13Н2О 3 1,85
Натерноит MgO • 4В2О3 • 4Н2О 2,H
Гидроборацит СаО • MgO • ЗВ2О3 • 6Н2О . 2-3,5 1,9-2,17
Калиборит К2О 4MgO • 11В2О3 18Н2О 4-5 2,13
Боронатрокаль- Na2O • 2СаО • 5В2О3 • 16Н2О 1-1,5 1,65-1,95
цит (улексит)
Иньонит 2СаО • ЗВ2О3 • 13Н2О 2 1,88
Мейергофферит 2СаО • ЗВ2О3 • 7Н2О 2 2,12
Колеманит (бо- 2СаО ЗВ2О3 • 5Н2О 4-4,5 2,41-2,44
рокальцит)
Пандермит 2СаО • ЗВ2О3 • ЗН2О * 3-3,5 2,26-2,48
(прицеит)
Тннкал (бура) Na2O-2B2O3- 10Н2О 2-2,5 1,69-1,76
Тинкалкернит Na2O • 2В2О3 • 5Н2О 1,88
Кернит (разо- Na2O • 2В2О3 • 4Н2О 2,5 1,9
рит)
Сассолин (бор- В2О3-ЗН2О или Н3ВО3 3 1,5
ная кислота)
Данбурит СаО • В2О3 • 2SiO2
Датолит 2СаО • В2б3 • 2SiO2 • Н2О 5-5,5 2,9-3,6
Турмалин Na2O • (Fe, Mg)O • 10А12О3 • 18SiO2 • 4B2O3 • 5H2O 7-7,5 2,9-3,2
• Пандермиту приписывают также составы 8СаО.ЮВ203,15Н20 и 5СаО-6В203.9Н2О.
820
Гл. X. Соединения бора
приблизительный состав, который выражают также приблизитель-
ной формулой: (Na, Са) (R, Al)6 [Si6Al3B3(О, ОН)30], где R—Mg,
Fe, Мп, Li. Турмалиновые руды сопровождаются другими ценными
минералами, после обогащения которых могут быть получены тур-
малиновые отходы, содержащие около 3% В2О3, 75% SiO2, 8%
Fe2O3, 9% А12О3 и др. Обогащением этих отходов могут быть полу-
чены концентраты, содержащие до 8% В2О3. Датолит — водный
боросиликат кальция — образовался, вероятно, в результате разру-
шения водой первичных пород. Датолитовые руды содержат, на-
пример, 9—13% В2О3, 30—32% СаО, до 3% MgO, 3—6% А12О3,
5—8% Fe2O3 + FeO, 40—42% SiO2, до 5% СО2"’96. Путем обога-
щения получают датолитовый концентрат: 15,5—16,5% В2О3 (вме-
сто 21,9% в чистом минерале), 33,8—34,5% СаО, 39,6—40,5% SiO2,
3,5—4,5% Fe2O3 + FeO и др.
Под действием воды и двуокиси углерода первичные породы
разлагаются с выделением свободной борной кислоты и ее раство-
римых солей, попадающих в океан, в воде которого, по данным
А. П. Виноградова, содержится бора 4,5 а/Л!3. (Приводят также
цифру 3,6 • 1О-40/о.) По другим данным, в сухом остатке морской
воды ~0,05% В2О3 97. Зола некоторых морских растений содер-
жит98 в 20 раз больше бора — до 1% В2О3. При испарении мор-
ской воды до эвтонической точки бор остается в растворе, в твер-
дые фазы переходит небольшая его часть: концентрация В2О3 в
карбонатных твердых фазах составляет 0,02%, в гипсах 0,006—
—0,007%, галит кристаллизуется без бора99. Бораты магния-каль-
ция, натрия-магния и другие образовались при высыхании морей,
и их месторождения расположены обычно над пластами галита и
сильвина под слоем гипса, карбонатов и других пород 46'100’101.
Первично выделившиеся из морской воды преимущественно маг-
ниевые бораты в результате метаморфизации переходили в каль-
циевые. Растворимые бораты, такие как боронатрокальцит и дру-
гие, явились источником накопления отложений буры, кернита и
других твердых солей, а также накопления буры и борной кислоты
в рассолах из нефтяных скважин и других буровых и минераль-
ных водах, а также в рапе озер. Эти рассолы, несмотря на малую
концентрацию в них бора (сотые доли процента), составляют зна-
чительные запасы борного сырья. Борная кислота содержится в|
парах некоторых горячих источников, куда она проникает в резуль-|
тате разложения парами воды турмалинов, находящихся в глубо-!
ких слоях почвы. |
Большая часть запасов борного сырья находится в Западном
полушарии, главным образом в США (около 90%). На долю США!
приходится 95% добычи и больше 85% мировой продукции борных!
соединений. Ежегодная добыча боратов в США (в пересчете на
В2О3) превышает 300 тыс. т. (По другим данным, в 1965 г. в США’
выработано 425 тыс. т борных соединений в пересчете на В2О3.)
Сырье
321
Добывают и перерабатывают только богатые бором бораты — тин-
кал, кернит, колеманит, улексит, пандермит, сассолин, борацит.
Борным сырьем в США служит также рапа оз. Сирлз. Значитель-
ные запасы боратов находятся в Южной Америке (в Аргентине,
Чили, Перу, Боливии), а также в Турции. Борсодержащее сырье
имеется в ФРГ, Швеции, Иране, Индии, Японии, Шри Ланка и во
франции. Общие запасы борсодержащего сырья капиталистиче-
ских стран оцениваются в 115—120 млн. т (в пересчете на
В20з) 80'102-108-
В Западной Европе промышленная добыча борного сырья ве-
дется лишь в Италии — в провинции Тоскана — извлекают борную
кислоту из паров вод горячих источников (соффионов), содержа-
щих несколько десятых долей процента Н3ВО3. Природные сква-
жины дают пар с температурой около 100° и давлением 3 ат, а
пробуренные — 145° и 6 ат. Суммарный дебит скважин составляет
(1965 г.) ~3000 т пара в 1 ч. Пары и воды источников, кроме бор-
ной кислоты, содержат СО2, H2S, СН4, NH3, Не, Аг, Ne.
До открытия боратов в СССР буру и борную кислоту произво-
дили из импортного сырья — боронатрокальцита и кернита109.
В настоящее время используют отечественное сырье, главным об-
разом ашаритовые, гидроборацитовые, ашаритово-гидроборацито-
вые и ашарито-улекситовые руды. Наиболее богатые породы этих
руд содержат до 37% В2О3; среднее содержание В2О3 в эксплуати-
руемых породах 17—20%, главным образом в виде ашарита. Бед-
ные руды, в которых преобладает гидроборацит, содержат от 1
до 6,5% В2О3 и должны подвергаться обогащению. Борным мине-
ралам сопутствуют примеси гипса, кальцита, магнезита и др. Фло-
тация гидроборацитовой руды дает концентрат, содержащий до
34% В2О3 при степени извлечения до 86%. Обесшламленную руду
после измельчения и классификации перемешивают с реагентами
и подвергают только основной флотации. Реагентами служат: ски-
пидар (2 кг/т) и эмульсии аполярных масел, в частности керосина
(74 г/т) 110-119.
Согласно техническим условиям, боратовые руды, отгружаемые
химическим предприятием для переработки, подразделяются на
следующие виды и сорта:
Виды руд Содержание В20з, %
I сорт II сорт III сорт
Ашаритовая....................Выше 27,5 22—27,5 16,5 — 22
Неашаритовая..................Выше 27,5 20 — 27,5 16 —20
Обычно на заводы поступает120 ашаритовая руда III сорта с
содержанием (в %): В2О3 18,9—21,2, СаО 13,2—16,8, MgO 14,1 —
-21,4, А12О3 0,9—1,7, Fe2O3 0,8—1,6, SO3 4,2—6,4, СО2 4,3—5,8,
Н2О 13,9—22,2. Встречаются также боратовые руды, содержащие
значительные количества галита112’121. Такая руда может быть
П М. Е. Поэин
322
Гл. X. Соединения бора
обогащена путем выщелачивания NaCl холодной водой. Так, из
образца солевого бората, содержащего 9,84% В20з и 45,6% NaCl,
путем промывки его холодной водой и высушивания был получен
концентрат с содержанием 44,5% В2О3 и лишь следов хлора. По-
тери В2О3 составили при этом 2,4% 122.
Перспективным сырьем являются сопочные грязи, содержащие
до 0,5% В2О3. Для извлечения В2О3123 сопочную грязь прокали-
вают в течение часа при 500° и выщелачивают водой при 80—90°.
Жидкую фазу, содержащую 0,35—0,45% В2О3, декантируют и об-
рабатывают в течение часа при 95° окисью кальция (4 моль СаО
на 1 моль В2О3) — полученный продукт представляет собой бораты
кальция с 15—20% В2О3. Он может служить борным удобрением
или быть переработанным на борную кислоту сернокислотным ме-
тодом.
МЕТОДЫ ПЕРЕРАБОТКИ БОРНОГО СЫРЬЯ
По условиям химической переработки борсодержащее сырье
может быть разделено на три группы:
1) легко разлагаемые минералы, главным образом осадочного
происхождения — натриевые, калиевые, натриево-кальциевые и
‘ магниево-кальциевые бораты (около 60 видов);
2) трудно разлагаемые минералы изверженного происхожде-
ния— сложные борсодержащие силикаты и алюмосиликаты (око-
ло 25 видов);
3) водные растворы, содержащие буру и борную кислоту.
В настоящее время в мировой борной промышленности приме-
няется главным образом сырье, отнесенное к группе 1.
Методы переработки природных боратов на борную кислоту и
буру разделяют в основном на кислотные и щелочные.
Для разложения боратов могут применяться различные реа-
генты: кислоты — H2SO4, HNO3, HCi, Н3РО4, HF, Н2СО3(СО2),
H2SO3(SO2); щелочи и щелочные соли — NaOH, Na2CO3, NaHCO3,
Na2SO4, Na2S, Na2SO3, NH4C1, (NH4)2CO3 и др. В качестве приме-
ров ниже приведены реакции разложения ашарита некоторыми
кислотами и щелочами:
2MgO • В2О3 • Н2О + 2H2SO4 • aq = 2НЭВОЭ + 2MgSO4 + aq
2MgO • B2O3 • H2O + 4Н3РО4 • aq = 2Н3ВО3 + 2Mg(H2PO4)2 + aq
2(2MgO • B2O3 • H2O) + ЗСО2 + aq = 4Н3ВО3 + 3MgCO3 Mg(OH)2 -t- aq
2(2MgO • B2O3 H2O) + Na2CO3 + 3CO2 -f- aq = Na2B4O7 + 4MgCO3 + aq
2Mgo • B2O3 • H2O + 2NaOH + aq = 2NaBO2 + 2Mg(OH)2 + aq
При выборе той или иной кислоты, кроме ее активности, до-
ступности и стоимости, следует учитывать и возможность использо-
вания ее магниевой соли, получаемой в качестве побочного про-
дукта.
Методы переработки борного сырья
323
Разложение некоторых боратов двуокисью углерода 124> 125 пред-
ставляет экономический интерес, благодаря возможности исполь-
зования дешевой (отбросной) двуокиси углерода и связывания ее
в виде карбоната магния или кальция. Солянокислотное разложе-
ние, так же как и использование для этой цели HF, связано с по-
терями Н3ВО3 при кристаллизации ее из раствора и с затрудне-
ниями, вызываемыми коррозией аппаратуры. Это же относится и
к разложению азотной кислотой 126-128. Нагревание с раствором
карбоната и бикарбоната натрия, иногда при повышенном давле-
нии, широко используется за границей при переработке в буру
легко разлагаемых минералов — боронатрокальцита, кернита и др.
Разработаны условия разложения гидроборацитовой и ашаритовой
руд раствором сернистого натрия ,29. В СССР, где главными ви-
дами промышленных борных руд являются ашарит, гидроборацит
и датолиты, применяют сернокислотную переработку боратов с по-
лучением борной кислоты. Буру же вырабатывают из борной кис-
лоты и соды, однако в ограниченных количествах, так как бура и
борная кислота почти всегда взаимозаменяемы и нет надобности
тратить средства на нейтрализацию борной кислоты. Серная кис-
лота дает возможность вскрытия всех видов борного сырья, за
исключением трудно разложимых турмалиновых пород, которые
предварительно должны быть подвергнуты щелочно-термической
обработке. Фосфорнокислотное разложение природных боратов
магния, кальция и натрия 130 позволяет получать наряду с борной
кислотой удобрения. Так, после выделения Н3ВО3 из раствора, по-
лученного в результате разложения фосфорной кислотой датолита
и содержавшего 4,3% В2О3, 26,5% Р2О5, 5% MgO, оставался ма-
точный раствор, в котором было 1,2% В2О3, 26,5% Р2О5, 5% MgO.
В этом растворе остаются фосфаты магния и кальция, и после об-
работки его известняком или аммиаком получаются ценные фос-
форно-магниевые и фосфорно-магниево-аммиачные удобрения, со-
держащие бор. Обычно при кислотном разложении боратов полу-
чают пульпу, которую разделяют на шлам и раствор, идущий на
кристаллизацию борной кислоты. Если боратовое сырье содержит
много растворимой кремневой кислоты, разложение ведут так,
чтобы получить густую пульпу, и борную кислоту извлекают из
нее выщелачиванием водой; в такой пульпе кремневая кислота ко-
агулирует и при выщелачивании не переходит в раствор.
Извлечение бората из руды, содержащей борат кальция, мож-
но производить, например, обрабатывая ее горячим раствором
(NH4)2CO3, NH4HCO3 или смесью NH3 и СО2131. Раствор отделяют
от неразложившегося остатка и образовавшегося СаСОз и при его
охлаждении кристаллизуют борат аммония. Для регенерации NH3
и СО2 раздельно нагревают борат аммония и СаСО3 до температур
их разложения. После регенерации NH3 из раствора или кристал-
лического бората аммония остается Н3ВО3.
И*
824
Гл. X. Соединения бора
Из реакционной массы, образующейся при разложении борато-
вой руды, борную кислоту можно извлекать спиртами (или фено-
лами). При этом образуются эфиры борной кислоты (например,
при использовании метанола — триметилборат). Эфир отгоняется и
при последующем его гидролизе спирт регенеруется. При охлаж-
дении образовавшегося концентрированного водного раствора кри-
сталлизуется борная кислота, а маточный раствор возвращается
в процесс.
Представляет интерес способ отгонки борной кислоты водяным
паром при 400—500° из пульпы, полученной, например, сернокис-
лотным разложением боратовой руды |20. Отгонку можно вести в
аппарате с кипящим слоем материала, в этом случае пульпа пред-
варительно гранулируется с использованием ретура. Смесь паров
борной кислоты и воды после очистки от пыли охлаждается в кон-
денсаторах и получаемый здесь раствор борной кислоты перера-
батывается на твердый продукт выпаркой и вакуум-кристаллиза-
дией.
О технике безопасности в производстве бориой кислоты см.|32.
БОРНАЯ КИСЛОТА
Природная борная кислота
В Тоскане (Италия) борную кислоту добывают примитивными
методами из фумарол — струй газов и паров, выделяющихся из
земных расщелин. Пары направляют для конденсации в бассейны
с водой. Летом, при испарении из них воды, на дно выпадают кри-
сталлы борной кислоты. Оставшийся раствор затем концентри-
руют при 85° до начала выпадения кристаллов. После этого при
медленном охлаждении раствора в течение 3—4 суток из него кри-
сталлизуется борная кислота. Полученную «сырую» борную кис-
лоту, содержащую 80—82% Н3ВО3, 6—8% (NH4)2SO4, 3—4%
MgSO4, 1 — 1,5% Na2SO4 и K2SO4, примеси Fe2O3, песка, глины,
гипса и другие, подвергают перекристаллизации.
Маточный щелок после первой кристаллизации сырой борной
кислоты содержит 5—9% (NH4)2SO4 и 3—5% Н3ВО3. Его возвра-
щают на выпаривание и после накопления в нем 15—20%
(NH4)2SO4 обрабатывают щелочью; отгоняющийся аммиак погло-
щается серной кислотой — образуется чистый сульфат аммония.
Получение борной кислоты из буры
При обработке буры кислотами образуется борная кислота, на-
пример:
Na2B4O7 + H2SO4 + 5Н2О = 4Н3ВО3 + Na2SO(
Кроме серной и соляной кислот, можно применять и сернистую.
В последнем случае через раствор буры или через'водную суспен-
Борная кислота
325
зию содержащего буру минерала пропускают SOj. Этот способ по-
лучения борной кислоты в настоящее время в СССР не приме-
няется.
Получение борной кислоты из магниевых боратов120' 121> 124-150
Магниевые бораты сравнительно легко и полностью разлагают-
ся серной, соляной, азотной и фосфорной кислотами. Ашарит трудно
и недостаточно полно разлагается сернистым газом, а двуокисью
углерода и растворами бикарбоната и соды ашарит практически
не разлагается. Гидроборацит сравнительно легко и в достаточной
степени разлагается сернистым газом, бикарбонатом и содой, но
труднее двуокисью углерода.
Для переработки ашаритовых пород применяют сернокислот-
ное разложение. Несмотря на то, что гидроборацитовые породы
разлагаются щелочами, последние нецелесообразно применять для
этой цели, так как в породе содержится значительное количество
сульфата кальция. При обработке содой сульфат кальция перехо-
дит в сульфат натрия:
CaSO4 + Na2CO3 + aq = Na2SO4 + CaCO3 + aq
Это приводит к повышенному расходу соды. Получаемые ра-
створы содержат много сульфата натрия, и после выделения из
них буры требуется затрачивать много тепла для переработки
оставшегося раствора сульфата натрия путем его выпаривания.
Поэтому гидроборацитовые породы, как и ашаритовые, и ашарито-
улекситовые, подвергаются сернокислотному разложению.
Разложение ашарита и гидроборацита серной кислотой идет
по следующим реакциям:
2MgO • В2О3 • Н2О + 2H2SO4 + aq — 2MgSO4 + 2Н3ВО3 + aq
СаО • MgO • ЗВ2О3 • 6Н2О + 2H2SO4 -f- aq = CaSO4 + MgSO4 -f- 6H3BO3 -f- aq
Присутствующие в породе примеси, реагируя с серной кис-
лотой, превращаются в сернокислые соли — CaSO4, MgSO4,
A12(SO4)3, Fe2(SO4)3 и др. Сульфат кальция практически весь пе-
реходит в осадок, что облегчает дальнейшую переработку маточ-
ных растворов, остающихся после кристаллизации борной кислоты.
При обработке ашаритовой породы серной кислотой примеси
минералов с повышенным, против ашарита, отношением MgO : В20з
(в ашарите это отношение равно 1,14) разлагаются быстрее аша-
рита, особенно при невысоких температурах. Поэтому при опти-
мальных условиях, обеспечивающих хорошее разложение ашарита,
отношение MgO : В2О3 в полученных растворах соответствует от-
ношению этих компонентов в исходном сырье. Скорость разложе-
ния ашарита (рис. 97) резко возрастает с повышением темпера-
туры до 80°. Дальнейшее повышение температуры незначительно
326
Гл. X. Соединения бора
увеличивает скорость процесса. Величина частиц минерала в пре-
делах от 0,2 до 0,6 мм не оказывает значительного влияния на
степень и скорость перехода В2О3 и MgO в раствор.
Кальциевые бораты разлагаются серной кислотой значи-
тельно медленнее, чем магниевые, так как на поверхности их зе-
рен образуется корка из кристаллов сульфата кальция. В зави-
симости от условий разложения она имеет разную плотность упа-
ковки и состоит из CaSO4’2H2O, p-CaSO4-0,5H2O или
CaSO4 • H2SO4. Эта корка затрудняет диффузию кислоты к
Рис. 97. Влияние продолжительности
перемешивания на степень разложе-
ния ашарита серной кислотой.
поверхности растворяющегося
минерала и продуктов реакции в
раствор, что и лимитирует ско-
рость разложения. С повышением
температуры концентрация сер-,
ной кислоты, при которой дости-
гается максимальная скорость
разложения кальциевых боратов,
увеличивается. При сернокислот-
ном разложении ашаритовой по-
роды содержащиеся в ней при-
меси кальциевых боратов при
размере зерен 2 мм к момент}'
полного разложения ашарита
успевают разложиться в сравни'
тельно небольшой мере ,48.
При одновременном присут-
ствии в сырье магниевых бора-
тов, углекислого кальция и соединений железа оказывается возмож-
ным дозировать серную кислоту из расчета только на MgO, без
практического снижения скорости и уменьшения степени разло-
жения боратов. Это позволяет вести процесс с уменьшенным про-
тив стехиометрических количеств расходом серной кислоты за
счет уменьшения степени разложения примесей. Оптимальными
условиями являются: температура в реакторе не ниже 80° (обыч-
но до 95°), количество серной кислоты 85—90% по отношению
к стехиометрической норме, рассчитанной по анализу сырья на
связывание MgO, СаО, Fe2O3 и А12О3 в сульфаты (за вычетом
содержащегося в сырье SO3); продолжительность перемешивания
30—60 мин\ величина частиц сырья —2 мм. Серную кислоту вво-
дят постепенно, при начальной температуре не выше 60°. По
окончании разложения пульпа должна иметь кислотность 0,2—
0,5% H2SO4. При таких условиях в раствор переходит 98—99,5%
В2О3, а степень разложения примесей значительно ниже — в рас-
творе содержится меньше 0,4% R2O3 [в виде R2(SO4)3]. При боль-
шей кислотности пульпы сильнее разлагаются примеси, увеличи-
вается расход фильтровальной ткани, затрудняется отмывка бор-
Борная кислота
327
при невысоких температу-
разложения относительно
повышением температуры
о, даже
степени
Рис. 98. Влияние температуры на сте-
пень разложения гидроборацита (круп-
ность частиц ~ 1 мм):
/—5 мин; 2 — 15 мин; 3 — 25 мин.
ной кислоты. При недостатке кислоты пульпа может иметь щелоч-
ную реакцию, при этом уменьшается степень извлечения В2О3, а из
раствора могут выделяться полуторные окислы.
В отличие от ашарита гидроборацит хорошо разлагается го-
рячим содовым раствором, а при кипячении — даже водой; серной
кислотой он легко растворяется на холоду. Измельченная до тон-
кости меньше 0,15 мм руда разлагается за 5 мин после смешения
с кислотой больше, чем на 95г'
рах. Ускорение и увеличение
крупных зерен (~ 1 мм) дос
до 60°. Дальнейшее повышение
температуры увеличивает ско-
рость и степень разложения
уже в меньшей мере (рис. 98).
Отношение MgO: В20з в
гидробораците равно 0,19, т. е.
значительно меньше, чем в
ашарите. Если бы разложению
подвергался чистый гидробо-
рацит, то получались бы рас-
творы борной кислоты, мало
загрязненные примесями, что
уменьшило бы потери В20з
при их отделении. Однако ги-
дроборацитовое сырье содер-
жит большое количество при-
месей, разлагающихся вместе
с гидроборацитом. Но гидроборацит разлагается значительно легче
других компонентов руды. Поэтому можно осуществлять разложе-
ние неполной нормой серной кислоты (25—50% от стехиометриче-
ского); при этом борная кислота почти полностью переходит в ра-
створ, а магниевые (не боратные) соединения разлагаются частич-
но. Это приводит к уменьшению отношения MgO: В2О3 в растворе
по сравнению с сырьем (при учете магнийсодержащих примесей
пустой породы). В растворе, полученном при переработке гидро-
борацитовой руды, MgO : В2О3 равно 0,4—0,5.
Борную кислоту получают по следующей схеме’51. Ашарито-
вую руду, содержащую ~25% В2О3 и ~ 17,5% MgO, дробят, вы-
сушивают при ~400° во вращающейся барабанной печи топоч-
ным газом, затем размалывают. Боратовую муку разлагают в си-
стеме реакторов с мешалками серной кислотой в течение 1 ч при
90—95°. В 1-й реактор одновременно с мукой подают 75—78%-ную
серную кислоту, маточный раствор от кристаллизации борной
кислоты, воду и промывную воду. Пульпа из последнего реактора
поступает на ленточный вакуум-фильтр. Шлам, после промывки
на фильтре горячей водой, удаляют в отвал, он имеет влажность
328
Гл. X. Соединения бора
~30% И содержит 1—1,5% MgO и 0,7—0,8% В2О3 (около поло-
вины этого количества в водорастворимой форме). Для улучше-
ния фильтрации в пульпу добавляют коагулянт —0,5%-ный рас-
твор полиакриламида. После контрольного фильтрования на
фильтрпрессе основной фильтрат (содержащий более 6% В2О3 и
~ 6 % MgO) охлаждают в системе вакуум-кристаллизаторов
до 15°.
Во избежание выделения вместе с кристаллами борной кис-
лоты полуторных окислов фильтрат, поступающий на кристалли-
зацию, должен быть слабокислым (0,2—0,6% свободной H2SO4).
Кристаллы Н3ВО3 отделяют от маточного раствора на центри-
фуге, на которой затем промывают чистой холодной водой — кон-
денсатом (1 —1,5 м3 на 1 т сырой борной кислоты). Промывную
воду возвращают в реактор. Влажность сырой борной кислоты
после промывки 5—8%. Сушку борной кислоты во вращающейся
сушилке с барабаном из нержавеющей стали осуществляют воз-
духом с температурой 90—100°. Более высокая температура сушки
недопустима, так как вызывает потери Н3ВО3 и частичный переход
ее в метаборную кислоту. Для получения борной кислоты повы-
шенной чистоты (реактивной, химически чистой, медицинской и
особо чистой) ее перед сушкой подвергают перекристаллизации,
приготовляя растворением в воде при 95° 16—25%-ный раствор
и затем охлаждая его.
При переработке гидроборацитового концентрата из описанной
схемы исключается измельчение сырья и добавляется операция
нейтрализации и слабого подкисления серной кислотой фильтрата
(до кислотности 0,2—0,5%) после отделения от него шлама, так
как в этом случае фильтрат имеет слабощелочную реакцию. Кроме
того, для замыкания цикла по балансу воды необходимо осу-
ществлять выпарку раствора (промывной воды), в противном
случае увеличатся потери В2О3.
Возможно разделение смесей Н3ВО3 и MgSO4>7H2O, а также
Na2B4O? • ЮН2О флотацией |36’137.
Борная кислота способна флотироваться без специальных реа-
гентов. Суспензия боратовой руды в маточном растворе после от-
деления кристаллов сульфата магния разлагается серной кислотой
при 90—95°. Шлам отделяется и промывается, промывные воды
возвращаются на разложение, а концентрированный раствор охла-
ждается (например, в вакуум-кристаллизаторе), причем из него
выделяется смесь кристаллов борной кислоты и сульфата магния.
При разделении этой суспензии во флотационной машине борная
кислота поступает в пенный продукт, а сульфат магния — в хвосты.
Суспензия сульфата магния сгущается и кристаллы отфуговывают-
ся или отфильтровываются; маточный раствор возвращается на
разложение руды. Пенный продукт подвергается нескольким пере-
чисткам, а затем полученная борная кислота репульпируется в про-
Борная кислота
329
мывной воде (для растворения увлеченных кристаллов сульфата
магния), отфуговывается, промывается водой и высушивается.
При разложении боратов, содержащих большие количества
MgO, серной кислотой, получаемый раствор содержит борную кис-
лоту и сульфат магния. При возврате маточного раствора после
кристаллизации борной кислоты на разложение новых количеств
боратов раствор быстро насыщается сульфатом магния. Это делает
невозможным его дальнейшую циркуляцию в замкнутом цикле для
использования остающейся в нем борной кислоты, так как в кри-
сталлизаторах вместе с борной кислотой начинает выделяться
MgSO4 • 7Н2О. Поэтому в цикл возвращают лишь часть маточного
раствора, а другую его часть, содержание магния в которой равно
количеству магния, извлекаемому из породы, выводят из произ-
водства.
С выводимым из цикла маточным раствором, содержащим 21 —
22,5% MgSO4, 0,4—0,8% H2SO4 и 1,8—3,5% Н3ВО3, теряется часть
борной кислоты. Для того чтобы потери были наименьшими, рас-
твор, поступающий на кристаллизацию борной кислоты, должен
содержать 20—21% MgSO4 и 10 — 12% Н3ВО3. Снижение концен-
трации MgSO4 увеличивает растворимость Н3ВО3 и количество ма-
точного раствора, а следовательно, количество Н3ВО3 в отбросном
маточном растворе; повышение же концентрации MgSO4 может вы-
звать его кристаллизацию при охлаждении раствора, т. е. загряз-
нение кристаллизующейся борной кислоты. Увеличение концентра-
ции Н3ВО3 в растворе может вызвать ее кристаллизацию еще в
процессе фильтрации пульпы, т. е. возрастание потерь В2О3.
Доля маточного раствора, возвращаемая в реактор при пере-
работке ашаритовой руды, зависит от отношения MgO : В2О3 в
сырье — если это отношение больше единицы, маточный раствор в
процесс не возвращается; при MgO : В2О3 < 1 количество М ма-
точного раствора, возвращаемого в процесс в кг на 100 кг сырья,
вычисляют по формуле
М = +-Д. юо
/ — п
где А и Б — содержание В2О3 и MgO в сырье, %;
В и Г — В2О3 и MgO в маточном растворе, %;
п — количество В2О3, возвращаемого в процесс с промыв-
ными водами, кг на 100 кг сырья (обычно п 1,4).
Для гидроборацитовых руд, при полном разложении бората,
важна лишь степень превращения MgO в сульфат, отношение же
MgO : В2О3 в сырье не имеет значения. Потери В2О3 с долей ма-
точного раствора, выводимой из производственного цикла, состав-
ляют 15—30% при переработке ашаритовых руд и 2—8% —гидро-
борацитовых.
Для уменьшения потерь борной кислоты путем возврата в цикл
всего маточного раствора были предложены различные методы
330
Гл. X. Соединения бора
отделения сульфата магния из циркулирующих щелоков. Вследст-
вие понижения растворимости сульфата магния в присутствии сер-
ной кислоты можно вводить серную кислоту, требующуюся для
разложения сырья, не в варочный котел, а в маточный щелок после
выделения из него борной кислоты; при этом из щелока выде-
ляются кристаллы MgSO4 • 7Н2О.
Как видно из диаграммы растворимости, в системе Н3ВО3—
MgSC>4—H2SO4—Н2О при 25° (рис. 99) повышение концентрации
Рнс. 99. Изотерма 25° растворимости в системе
H3BO3-MgSO4-H2SO4-H2O.
препятствует
как содержа-
температуры
H2SO4 сильно уменьшает растворимость MgSO4; 'растворимость
MgSO4 в 50 %-ной серной кислоте по сравнению с растворимостью
в воде понижается почти в 10 раз.
При содержании в растворе 50% H2SO4 концентрация эвтони-
ческого раствора, насыщенного и MgSO4j и Н3ВО3 при 35° равна:
3,75% MgSO4 и 2,02% Н3ВО3. При высаливании сульфата магния
серной кислотой, вследствие выделения тепла разбавления серной
кислоты, температура поднимается до 60—65°. Это
одновременной кристаллизации борной кислоты, так
ние Н3ВО3 в эвтоническом растворе с
увеличивается:
Состав эвтонического раствора, %
H2SO4............... .
MgSO4...................
Н3ВО3...................
повышением
35° 45° 55° 65°
. 50 50 50 50
. 3,75 3,75 3,75 3,75
. 2,02 2,38 2,86 3,71
Щелок после высаливания сульфата магния может быть раз-
бавлен возвращаемыми в реактор промывными водами, что снизит
концентрацию в нем серной кислоты до пределов, требуемых для
Борная кислота
331
разложения бората. Одновременно снизится и концентрация ионо!
Mg2+, оставшихся в растворе, — это устранит опасность выпадения
из раствора сульфата магния при кристаллизации борной кислоты.
Другой метод выделения сульфата магния из циркулирующего
щелока основан на уменьшении его растворимости при повышении
температуры от 70 до 180—200° (рис. 82). Это позволяет выделить
значительную долю сульфата магния из раствора, остающегося по-
сле кристаллизации борной кислоты. Для этого маточный раствор
нужно сначала концентрировать выпариванием, причем содержа-
ние в нем MgSO4 возрастет до 34—36%. Затем при нагревании до
160—165° под давлением из раствора кристаллизуется сульфат маг-
ния в виде MgSO4 • Н2О.
Маточный раствор, выводимый из производства борной кис-
лоты, может быть переработан на теплоизоляционный материал
обработкой известковым молоком (стр. 287). Наиболее целесооб-
разна переработка его на боромагниевые удобрения (см. ниже).
Использование маточного раствора для получения магнезии
или других термоизоляционных материалов 138 заслуживает вни-
мания лишь при предварительном выделении борной кислоты. Бор
может быть извлечен из маточного раствора осаждением в виде
боратов магния окисью магния (4,5—6 моль MgO на 1 моль В20з
в растворе); такой метод (стр. 344) требует значительно меньше
топлива, энергии и пара, чем другие способы переработки маточ-
ных растворов ,39’ 14°. Маточный раствор (40—50 г/л Н3ВО3) от
производства реактивных сортов борной кислоты используют так-
же для производства стирального порошка — борщелока 141. Для
этого к раствору добавляют соду в количестве, необходимом для
образования тетрабората
4Н3ВО3 4- Na2CO3 =* Na2B4O7 4- СО2 4- 6Н2О
и для получения продукта с отношением Иа2СОз: Na2B4O7 • ЮН2О
не более 10. Масса полностью затвердевает в течение 3—7 дней,
после чего ее высушивают, измельчают и расфасовывают.
А. Н. Костюковский предложил раздельное получение борной
кислоты и сульфата магния без вывода маточных растворов так
называемым методом биборации. Метод основан на обработке ма-
точного раствора, полученного после кристаллизации борной кис-
лоты, небольшим количеством окиси магния (14% от В20з в рас-
творе). После отделения осадка, состоящего из гидратов окисей
железа и алюминия, раствор выпаривают до концентрации
10,5—11% MgO, и при охлаждении его до 15—20° кристаллизуется
сульфат магния, а В2О3 остается в растворе, который возвращают
в процесс. Недостатком этого метода является разбавление рас-
твора, направляемого на кристаллизацию борной кислоты, в
1,3—1,5 раза и увеличение объема кристаллизаторов почти в 2
раза. Впоследствии А. А. Соколовский предложил осуществлять
332
Гл. X. Соединения бора
двухфазное раздельное получение борной кислоты и сульфата маг-'|
ния путем проведения изотермической кристаллизации борной кис-1
лоты вакуум-выпаркой при 65—75° и политермической кристалли-1
зации сульфата магния. Однако и в таком варианте процесс зна- |
чительно усложнен (необходимость выпарки и др.), вследствие!
чего раздельное получение борной кислоты и сульфата магния не 1
нашло практического применения. . |
Рис. 100. Диаграмма для расчета политермической кри-
сталлизации борной кислоты. Точки составов кристалло-
гидратов:
А - MgSO4 • 7Н2О; Б - MgSO4 • 6Н2О; В - MgSO4 • Н2О.
. Существенное значение в производстве борной кислоты имеет 1
правильный режим кристаллизации Н3ВО3, базирующийся паевой- |
ствах системы Н3ВО3—MgSO4—Н2О 126’142’ нз. От 0 до 48° сульфат |
магния в твердой фазе находится в форме MgSO4 • 7Н2О, от 48 до а
68—69° — MgSO4-6H2O; при более высоких температурах ста- |
бильной фазой является кизерит MgSO4 • Н2О, причем с ростом
температуры выше 68° содержание MgSO4 в эвтонических раство-
рах уменьшается (рис. 100). Однако следует учитывать, что равно- 1
весное состояние достигается медленно (десятки часов), и в усло-
виях производства борной кислоты, когда процесс ограничен
несколькими часами, система находится в метастабильном со-
стоянии.
Определение выхода В2О3 при кристаллизации борной кислоты
из растворов, содержащих MgSO4, можно производить графиче-
ски144 с помощью диаграммы растворимости (рис. 100), на кото-
Борная кислота
333
рой нанесены изотермы в пределах от 0 до 100° для стабильного
состояния системы, лучи кристаллизации Н3ВО3 и линии составов
начального раствора с постоянным отношением MgO : В2О3. На
этой диаграмме нанесены предельные лучи кристаллизации бор-
ной кислоты и кристаллогидратов сульфата магния, заканчиваю-
щиеся в эвтонических точках раз-
личных изотерм. Количество G (в
кг на 100 кг начального раствора)
твердой борной кислоты, кристал-
лизующейся при охлаждении рас-
твора, определяется по формуле
G= —• 100, где — — отношение
'длины отрезка луча кристаллиза-
ции Н3ВО3 от точки начального
раствора до соответствующей изо-
термы к длине луча кристаллиза-
ции борной кислоты от точки, соот-
ветствующей 100%-ному содержа-
нию Н3ВО3 (или 56,4% В2О3), до
пересечения с изотермой. Выход
В2О3 (в %) (степень перехода В20з
из жидкой фазы в твердую) вычис-
ляется по формуле
а 5б>4 .пл
Ч = — • ,п г~ • 100
с [В2Оз]н
где [В20з]й — начальная концентра-
ция В2О3 в растворе.
Например, если раствор, содер-
жащий 5,38% В2О3 и 7,0% MgO
(MgO : В2О3 = 1,3), охладить до 10°,
то G = 7,65 кг на 100 кг раствора и
т| = 80,1%. Как видно из рис. 100,
с увеличением концентрации В2О3 и
уменьшением отношения MgO : В2О3
30
^L-L----.---,---,---,-,----,---J5
0J 0,5 0,7 0,9 и 1,3 1,5 1Г
MgO В,оэ б начальном раапборе
Рис. 101. Содержание В2О3 в ма-
точных растворах (в % от содер-
жания в начальных растворах)
и максимальные концентрации
В2О3 в начальных растворах (в %)
в зависимости от содержания MgO
при температурах кристаллизации
борной кислоты 10 и 20° (для
прямых линий —левая шкала, для
кривых — правая).
количество выкристаллизовы-
вающейся борной кислоты и выход В2О3 возрастают. Практически
расчет ведут не по «предельному» лучу кристаллизации, а по лучу,
пересекающему изотерму в точке, находящейся на некотором рас-
стоянии от эвтонической, соответствующей реальным условиям. На
рис. 101 показана зависимость содержания В2О3 в маточном рас-
творе, выводимом из кристаллизатора, от отношения MgO: В2О3 в
начальном растворе при расчете кристаллизации по предельному
лучу при 10° (1,15% В2О3 в маточном растворе) и 20° (1,4% В2О3),
а также по лучу, пересекающему изотерму 20° в точке, соответст-
вующей содержанию 1,6% В2О3. Приведены также значения
334
Гл. X. Соединения бора
максимальной концентрации В2О3 в начальном растворе для раз-
личных отношений MgO : В2О3.
Количество G выкристаллизовавшейся борной кислоты из 100кг.
раствора можно также вычислить из уравнения материального
баланса кристаллизации
G =
[В2О3]Н — [В20з]м .
56,4—[В2О3]М ’*
где [В2О3]Я и [В2О3]м — концентрации В2О3 в начальном и маточном
растворах.
При содержании в боратах соединений калия возможно загряз-
нение борной кислоты сульфатом калия. С повышением темпера-
туры до 90° в эвтонических растворах системы Н3ВОз—K2SO4—Н2О
Рис. 102. Политерма растворимости в системе
КН2РО4-Н3ВО3-Н2О.
содержание борной кислоты увеличивается значительнее, чем суль-
фата калия 145,146, поэтому сернокислотное разложение боратов, со-
держащих калий, целесообразно производить при высокой темпера-
туре (80—90°).
При фосфорнокислотной переработке калиборатов получаемый
раствор содержит борную кислоту и фосфаты калия. В системе
Н3ВО3—КН2РО4—Н2О тройная эвтектика с составом 11,7%
КН2РО4+2,6% Н3ВО3+85,7% Н2О образуется при—3,3° (рис. 102).
От температуры тройной эвтектики до 40° на диаграмме состоя-
ния имеются поля кристаллизации только исходных компонентов.
При постоянной температуре растворимость Н3ВО3 и КН2РО4 в
воде при взаимном присутствии компонентов увеличивается. С по-
вышением температуры в раствор переходит относительно больше
Н3ВО3, чем КН2РО4147.
О кинетике солянокислотного разложения боратов см, 15°,
Борная кислота
335 /
Получение борной кислоты из датолита ,20> ,21>,34> »s2—154
Датолит 2СаО • В2О3 • 2SiO2 • Н2О и сопутствующие ему мине-
ралы (гранат ЗСаО • Fe2O3 • 3SiO2, геденбергит СаО • FeO • 2SiO2,
кальцит СаСОз) не содержат магния; но в датолитовом сырье много
СаО, SiO2 и окислов железа. Датолит, плохо разлагаемый щело-
чами, легко разлагается кислотами; наиболее целесообразно при-
менение серной кислоты, так как кальций отделяется при этом
в виде осадка сульфата кальция CaSO4 • 2Н2О. При обработке да-
толитового сырья серной кислотой датолит разлагается сравни-
тельно быстро и полно (96—100% за 60 мин при 95° и расходе на
1 т сырья 0,55 т моногидрата серной кислоты), а другие минера-
лы— медленно и лишь частично (гранат на 12—20%, геденбер-
гит на 2—4%, кальцит на ~50%). Вследствие этого в раствор
переходят значительные количества Н3ВО3 и SiO2 • хН2О и немного
сульфатов железа и кальция. Из-за перехода в раствор кремневой
кислоты невозможно перерабатывать датолиты по схеме, приме-
няемой для ашаритов и гидроборацитов, так как при высокой кон-
центрации SiO2 раствор постепенно превращается в студнеобраз-
ную массу, трудно отделимую от нерастворившегося остатка; из
этой массы трудно также извлечь и борную кислоту. Фильтрация
несколько облегчается, если добавлять в реакционную смесь ще-
лока MgSO4 или Na2SO4, или маточный раствор после выделения
Н3ВО3153, или получать разбавленные растворы, но тогда после
отделения шлама борную кислоту необходимо перед кристаллиза-
цией выпаривать, причем SiO2 будет выделяться в осадок или
в процессе выпарки или в процессе кристаллизации, в первом слу-
чае вызывая значительные потери Н3ВО3, а во втором — загрязняя
продукт.
Поэтому для переработки датолитов разработана другая схема
(рис. 103). Сырье разлагается серной кислотой, разбавленной на-
столько, чтобы получилась густая пульпа. Последнюю направляют
в сушильный барабан после смешения в горизонтальных смеси-
телях с ретуром. При подсушке до влажности 20—26% происходит
коагуляция кремневой кислоты, перешедшей при разложении в
жидкую фазу. Подсушенный материал подвергается противоточ-
ному выщелачиванию, причем избыточную кислотность нейтрали-
зуют добавкой карбоната кальция, что приводит к удалению в оса-
док полуторных окислов и остатка кремневой кислоты. Шлам
легко отделяется и подвергается противоточной промывке на ва-
куум-фильтрах (затем он может быть использован для изготов-
ления строительных материалов), а полученный раствор содержит
лишь борную кислоту без примесей SiO2 и окислов железа, что
позволяет получать более чистые сорта борной кислоты. После под-
кисления и контрольной фильтрации раствор направляют в ва-
куум-кристаллизаторы для получения борной кислоты, кристаллы
Бура
337
которой отделяют на центрифуге и там же промывают холодной
водой. Промывные воды и часть маточного раствора возвращают
для разбавления поступающей в реактор серной кислоты, другая
часть маточного раствора поступает на выщелачивание подсушен-
ной пульпы, — отходы маточных растворов в этой схеме отсут-
ствуют. Поэтому степень использования бора превышает 90%. На
1 т борной кислоты (98,5% Н3ВО3) расходуют: 4,35 т датолитового
концентрата (16% В2О3), 2,4 т серной кислоты (100%), 0,6 т из-
вестняка (100% СаСО3) и приблизительно 130 м3 воды, 8 т пара
и 800 кет ч электроэнергии; количество отбросного шлама с 50%
влаги—12,2 т.
Извлечение бора из датолитовой руды можно осуществить, об-
рабатывая водную суспензию прокаленного сырья двуокисью угле-
рода 125 или двуокисью серы |55, а также гидротермическим спосо-
бом. При 1350—1400° реакция
2СаО В2О3 2SiO2 Н2О + 2Н2О = 2CaSiO3 + 2Н3ВО3
идет почти количественно — выход Н3ВО3 из зерен руды 0,1—0,5 мм
за 8—9 ч достигает 90%, но из-за медленности процесса расход
пара очень велик154.
БОРАТ КАЛЬЦИЯ
Борат кальция получают нейтрализацией борной кислоты из-
вестью. В промышленных условиях для его получения используют
датолит.
Шихта из молотой датолитовой руды или концентрата и моло-
того известняка спекается в барабанной печи при 950—1050°; про-
должительность нахождения шихты в реакционной зоне 15 мин.
Датолитовый спек измельчается в валковой дробилке, гасится обо-
ротными растворами и подвергается мокрому размолу. Получен-
ная пульпа (Ж : Т = 8—12 : 1) подогревается острым паром до 80°
и карбонизуется. Затем она сгущаетс-я и фильтруется. Шлам ре-
пульпируется и после вторичной карбонизации сгущается, филь-
труется, промывается и сбрасывается. Вторичный фильтрат и про-
мывные воды возвращаются на мокрый помол датолитового спека
и на разбавление пульпы, а из основного фильтрата — раствора
борной кислоты — известковым молоком (100 г/л СаО) осаждается
борат кальция. Суспензия бората кальция сгущается и поступает
на центрифугу. Затем борат кальция высушивается при 100—150°
в сушилке кипящего слоя.
БУРА120, 157—161
Из отечественных видов сырья лишь гидроборацит легко раз-
лагается содовым раствором и из гидроборацитового сырья мож-
но получать щелочным методом непосредственно буру (стр. 342).
338
Гл. X. Соединения бора
Однако основным сырьем до сих пор являются ашаритовые и сме-
шанные руды, трудно разлагаемые щелочами. Поэтому в СССР
буру вырабатывают из сырой технической борной кислоты варкой
ее с содой (использовать для этой цели растворы борной кислоты
до ее кристаллизации невозможно, так как они содержат MgSO4,
который реагирует с содой, образуя осадок магнезии; это увели-
чивает расход соды и вызывает потери буры в осадке).
Возможно и непосредственное получение буры, например, из
датолитов. В автоклаве при 300° и 140—150 ат датолит в значи-
тельной мере разлагается даже водой (выход В2О3 в раствор за
1 ч составляет 19%). В присутствии соды (0,5 М раствор) разло-
жение значительно ускоряется и выход буры по реакции
2(2СаО • В2О3 • 2SiO2 • Н2О) + Na2CO3 = Na2B4O7 + 4CaSiO3 + 2Н2О + СО2
из руды, содержащей 7,5% В20з и измельченной до
рен 0,152 мм, достигает за 1 ч 92% ,56.
размера
Получение буры из борной кислоты
Процесс основан на реакции
Na2CO3 + 4Н3ВО3 = Na2B4O7 + СО2 + 6Н2О
В реакторе, снабженном мешалкой, приготовляют раствор
соды, нагревают его до 95—100° и загружают борную кислоту. Во
избежание выброса раствора из-за сильного вспенивания, обуслов-
ленного выделением углекислого газа, борную кислоту добавляют
небольшими порциями. Соотношение между загружаемыми компо-
нентами должно быть таким, чтобы полученный раствор содержал
14—20% Na2B4O7 и 0,5—1,0% Na2CO3. Избыток соды затрудняет в
дальнейшем отмывку буры и увеличивает количество промывных
вод; недостаток соды уменьшает выход В2О3 в буру (часть В2О3
переходит в более растворимые соли) и затрудняет ее кристалли-
зацию. На 1 т буры расходуют 0,65 т технической борной кислоты
и 0,307 т кальцинированной соды.
После 30-минутного нагревания при 100° раствор отделяют от
шлама — нерастворимых загрязнений, попавших из сырья, и на-
правляют для охлаждения от 90° до 15—20° в кристаллизаторы,
где из него кристаллизуется бура Na2B4O7 • ЮН2О. Кристаллы
буры отделяют от маточного раствора на центрифуге. Здесь же их
промывают водой. Маточный раствор и промывные воды возвра-
щают в реактор на растворение соды. Вследствие этого в растворе
накапливается сульфат натрия, образующийся из содержащегося
в сырой борной кислоте сульфата магния:
MgSO4 + Na2CO3 = Na2SO4 + MgCO3
На рис. 104 приведены некоторые изотермы системы Na2B4O7—
Na2SO4—Н2О (сплошные линии) 157 и изотермы 15 и 35° той же
Бура
33»
системы в присутствии 1,5% Na2CO3 (пунктирные линии). Влияние
такого количества соды не существенно. Накопление же сульфата
натрия может привести к загрязнению буры мирабилитом. При 25°
в эвтоническом растворе содержится 21,9% Na2SO4. В присутствии
примеси Na2CO3 и NaCl эта концентрация несколько понижается.
Если раствор буры при кристаллизации охлаждается до 25°, то
практически недопустимо содержание в исходном растворе больше
12% Na2SO4; при этом в маточном растворе не должно быть боль-
ше 20% Na2SO4. Чем больше в растворе Na2SO4, тем выше должна
Рнс. 104. Система Na2B4O7—Na2SO4—Н2О.
быть конечная температура кристаллизации буры. Следовательно,
часть маточного раствора должна выводиться из цикла. Кроме
того, в присутствии в растворе более 2,5% Na2SO4 образующиеся
кристаллы буры уменьшаются в размере 157',59. Удовлетворитель-
ные по размерам кристаллы буры получаются, если в исходном
растворе, содержащем 1,5% Na2CO3 и 0,5 % NaCl, не больше 5%
Na2SO4; маточный раствор при этом не насыщен сульфатом нат-
рия— он содержит ~8% Na2SO4. В выводимом из цикла маточ-
ном растворе содержится 1,3—1,7% Na2B4O7. А. А. Соколовским
разработан способ, позволяющий возвратить этот раствор в цикл
после извлечения большей части Na2SO4. Этот способ заключается
в переводе содержащегося в растворе тетрабората в более раство-
римый пентаборат натрия, в выпарке раствора и кристаллизации
из него сульфата натрия; обедненный сульфатом раствор, содер-
жащий В2О3 в форме пентабората, может быть возвращен в цикл.
340
Гл. X. Соединения бора
На рис. 105 показана изотерма 30° системы Na2O—В2О3—Н2О.
Линия АБ — растворимость пентабората натрия Na2Bi0Oi6 • ЮН20
или Na2O • 5В20з-10Н2О; растворимость тетрабората имеет мини-
мум в точке В. С более щелочными растворами в равновесии нахо-
дятся метабораты натрия Na2O • В20з • 8Н2О и Na2O • В2О3 • 4Н2О.
Перевод тетрабората в пентаборат добавкой к раствору борной кис-
лоты неприемлем, так как состав полученного раствора неблаго-
приятен для кристаллизации из него сульфата натрия. Этот перевод I
можно осуществить добавкой к раствору такого количества серной 1
Рис. 105. Изотерма 30° системы
Na2O-B2O3-H2O.
Na2SO4)%
Рис. 10о. Изотермическая проек» я
ция (20,5°) пространственной ДИ£- |
граммы для системы |
Na2SO4— Н3ВО3—Na2B4O7—Н2О. J
кислоты, которое требуется для нейтрализации Na2CO3 и перевода 1
буры в пентаборат натрия; при этом содержание Na2SO4 в растворе 1
увеличивается. После выпарки раствора до достижения концентра- |
ции Na2SO4 23—24%, при охлаждении до 20° выкристаллизовы- J
вается мирабилит Na2SO4-10H2O (рис. 106) 160. Выход сульфата |
натрия (50—60%) зависит от начального состава маточного рас- 1
твора и может быть увеличен до 80% и более путем повторения |
операций с добавкой к вторичному маточному раствору после выде- 1
ления мирабилита новых порций исходного маточного раствора. 1
Недостатком описанного выше процесса получения буры из бор- I
ной кислоты является его периодичность. Наибольшие трудности I
при переходе на непрерывный процесс вызывает кристаллизация 1
буры. Применяемые на заводах периодически действующие кри- 1
Бура
34 Г
сталлизаторы представляют собой резервуары с мешалками, охла-
ждаемые водой через металлические стенки или с помощью змее-
виков. Они требуют частой чистки от налипающих кристаллов -и
малопроизводительны. Попытка применения вакуум-кристаллиза-
торов оказалась неудачной вследствие обильного вспенивания в-
них растворов буры и переброса пены в коммуникации. Образова-
ние пены объясняется выделением СО2 при взаимодействии буры,
с остатками соды:
Na2B4O7 + Na2CO3 — 4NaBO2 4- СО2
Метаборат натрия образуется медленно, и для полного завер-
шения этого процесса с образованием непенящегося раствора
буры требуется длительное время. Кроме того, работа с раство-
ром, содержащим вместо небольшого избытка соды эквивалентное-
ему количество метабората, нецелесообразна из-за ухудшения,
условий кристаллизации буры и увеличения содержания В20з в ма-
точном растворе. Поэтому важной задачей является разработка
конструкции непрерывно действующего кристаллизатора с водя-
ным охлаждением или вакуумного типа, пригодного для пеняще-
гося раствора. •
При производстве буры из датолитового сырья для реакции
с содовым раствором можно использовать не кристаллическую
борную кислоту, а получаемый при кислотном разложении датоли-
тов раствор борной кислоты, так как он не содержит сульфата
магния. (Таким образом исключаются стадии кристаллизации
Н3ВО3 и ее медленного растворения в содовом растворе). Оба
раствора можно одновременно подавать в реактор непрерывного
действия; после 30—60-минутного перемешивания в реакторе при
95—100° и контрольной фильтрации раствор буры должен в этом
случае подвергнуться выпарке для удаления избытка воды, после
чего может быть направлен на политермическую кристаллизацию.
Получение буры из боратов содовым методом
Получение буры из боронатрокальцита
Этот вид сырья применяется за рубежом и применялся раньше
в СССР. Извлечение буры из породы, содержащей 40—42% В2О3,
производится путем варки ее с содой и бикарбонатом. Содержа-
щаяся в боронатрокальците окись кальция переходит в нераство-
римый осадок СаСО3, а бура — в раствор по реакции:
2(Na2O • 2СаО • 5В2О3. 16Н2О) + Na,CO3 + 4NaHCO3 =
= 5Na2B4O7 + 4СаСО3 + СО2 + 34Н2О
Варку производят в два приема. Вначале ее проводят при
90—95° с использованием оборотных щелоков, содержащих в 1 л
130—185 г Na2B4O7 и 20—35 г соды.
342
Гл. X. Соединения бора
Полученный раствор отстаивается и отфильтровывается от не-
растворившейся части породы и образовавшихся СаСО3 и Fe(OH)3.
Отфильтрованный раствор содержит 290—325 г/л Na2B4O7 и
4—10 г/л Na2CO3. Твердый остаток в реакторе размешивают с во-
дой и переводят в автоклав для второй варки, куда добавляют
соду и бикарбонат.
Вторую варку проводят при 120—130°, азатем раствор отделяют
от твердого остатка, идущего после промывки в отвал; он содер-
жит 1—3% В2О3. Раствор идет на первую варку, а промывную
воду возвращают в автоклав на вторую варку.
Из горячего концентрированного раствора буры, полученного
после первой варки, при охлаждении до 45—48° кристаллизуется
бура. Раствор не должен быть слишком концентрированным, его
плотность не должна превышать 1,15 г!см3, так как при большей
концентрации из него при температуре выше 56° будет кристалли-
зоваться не десятиводная, а пятиводная соль. Щелок после кри-
сталлизации возвращают в производственный цикл, поэтому по-
степенно в нем накапливаются примеси — до 10—15% NaCl, 2—3%
Na2SO4 и др. Время от времени щелок должен обновляться.
Получение буры нз кернита (разорит а)
Кернит отличается от буры только меньшим содержанием кри-
сталлизационной воды.
В США (Калифорния) кернитовую руду (~25% В2О3) выще-
лачивают при 90—95° слабым раствором буры или маточным рас-
твором после кристаллизации. Отделенный от примесей раствор
направляют в вакуум-кристаллизатор. Отфугованный продукт вы-
сушивают в турбосушилках, состоящих из расположенных одна
лад другой вращающихся тарелок. Высушиваемый материал пе-
ресыпается с тарелки на тарелку.
Если в кернитовой породе содержатся бораты кальция, товарку
ведут в автоклавах в присутствии соды, переводящей борат каль-
ция в борат натрия.
Получение буры из гидроборацита
Схема переработки гидроборацитового концентрата в буру за-
ключается в следующем. Концентрат смешивают в реакторе с ма-
точным раствором и с промывными водами от промывки шлама
и буры; затем вводят смесь соды и бикарбоната натрия и осуще-
ствляют варку 2—3 ч при 95—100°. После этого шлам отделяют
ла ленточном фильтре или фильтрпрессе, промывают горячей во-
дой и отправляют в отброс. Фильтрат (раствор буры) после кон-
трольного фильтрпресса направляют на политермическую кристал-
лизацию. Часть маточных растворов, во избежание накапливания
в цикле переходящего из сырья SO4” выводят из процесса (концен-
трация SO3 в растворе не должна превышать 10%),
' Бура
343
Получение буры из гидроборацитового концентрата можно осу-
ществлять и по кислотно-щелочному методу, т. е. с предваритель-
ным получением из него борной кислоты и последующей ее обра-
боткой содой. Потери В2О3 с выводимым из процесса маточным
раствором в обоих методах (щелочном и кислотно-щелочном) при-
близительно одинаковы. При учете потерь В2О3 только с маточ-
ными растворами и при содержании в сырье 34,3% В2О3 и 7,78%
SO3 расход реагентов на 1 т В2О3 в буре составляет: при щелочном
методе (с выходом В2О3 в продукт 97,5%) соды (100%)—0,83 т
и бикарбоната натрия (100%)—0,41 т; при кислотно-щелочном
методе серной кислоты (100%) —0,76 т. Стоимость этих реагентов-
в обоих методах приблизительно одинакова. Производство буры
из бората щелочным методом проще, чем кислотно-щелочным, но-
по последнему методу получается бура лучшего качества, так как
примеси отделяются при изготовлении полупродукта — борной
кислоты.
Переработка боратов на буру другими щелочными методами 117
Разложение боратов едким натром происходит легче, чем содой-,
но он дороже, и поэтому его не используют. Для переработки аша-
ритовых боратов, плохо разлагающихся содовым раствором, пред-
ложен известково-содовый способ, при котором в растворе обра-
зуется NaOH. Боратовую муку, проходящую через сито 0,15 мм,
прокаливают в течение 2 ч при 600—650°, затем обрабатывают
3,5 ч в реакторе смесью извести и содового раствора при темпера-
туре кипения. Пульпу фильтруют и шлам подвергают вторичному
разложению во втором реакторе, а затем в третьем, после чего
шлам, отфильтрованный и промытый горячей водой (6 л на 1 кг
бората), идет в отвал. В третьем реакторе шлам разлагают прог,
мывными водами, во втором — фильтратом от пульпы из третьего,
в первом — свежим раствором соды в фильтрате от пульпы из вто-
рого реактора. Фильтрат от пульпы из первого реактора перера-
батывают в буру, для чего содержащийся в нем метаборат нат-
рия переводят в тетраборат, например, путем обработки раствора
двуокисью углерода и кипячения, и направляют на кристалли-
зацию.
Другой вариант этого способа заключается в спекании размо-
лотой ашаритовой руды с известью при 600—700° в течение 1 ч.
Охлажденный спек разлагают в реакторах содовым раствором1
с добавкой промывных вод и маточного раствора. После фильтра-
ций и промывки шлам может быть подсушен и использован в ка-
честве борного удобрения или добавки к суперфосфату. Фильтрат
обрабатывают углекислым газом и кристаллизуют буру. По этой
схеме выход бора в буру больше, чем при получении буры через;
борную кислоту, причем не расходуется серная кислота.
344
Гл. X. Соединения бора
Предложено несколько способов переработки боратов щелоч-
ным спеканием. Так, при спекании (сплавлении) бората с содой
ъ течение 1—3 ч при 600—1200° получается масса, из которой вод-
ным выщелачиванием извлекают в раствор метаборат; для пере-
вода его в буру раствор обрабатывают борной кислотой или дву-
окисью углерода.
Бораты, содержащие кальций, могут перерабатываться на буру
путем спекания с сульфатом натрия. Например, при спекании ко-
леманита происходит следующая реакция:
2(2СаО • ЗВ2О3 • 5Н2О) + 3Na2SO4 = 3Na2B4O7 + 3CaSO4 + СаО + ЮН2О
Бура выщелачивается из полученного спека водой и кристалли-
зуется из раствора.
Обезвоживание буры
Для получения обезвоженного продукта кристаллогидрат пред-
варительно обезвоживают во вращающихся барабанных сушилках
и окончательно в плавильных печах. Расплавленную массу кри-
сталлизуют на охлаждающих вальцах ,61.
Другой метод обезвоживания 162 — распыление раствора тетра-
бората натрия во вращающейся печи над непрерывно движущимся
перемешивающимся слоем безводного Na4B2O7, нагретым до
450—650°. Происходит испарение воды из капелек раствора и осе-
дание частиц на движущийся слой; при этом продукт не агломе-
рируется.
Запатентован способ обезвоживания буры в две стадии163 —
сначала жидким аммиаком в автоклаве при 20° и 8 ат для получе-
ния промежуточного продукта с двумя-пятью молекулами воды на
1 молекулу соли, который затем отфильтровывают под давлением,
отдувают из него остатки аммиака воздухом и прокаливают
при 450°.
Обезвоживание буры можно осуществить путем постепенного
многостадийного ее нагревания в аппарате с кипящим слоем в по-
токе горячего воздуха при температурах ниже точки плавления.
80—90% воды удаляется в пределах 100—200°, а остальная — при
220— 700°. При этом отпадает надобность в размоле продукта, ко-
торый получается порошкообразным; он содержит 98—99,8%
Ма2В4О7164.
БОРНЫЕ УДОБРЕНИЯ
Получение борных удобрений из отходов производства
борной кислоты132
Маточные растворы, содержащие (в %): В2О3 1,3—1,6, MgSO4
21—23, H2SO40,2—0,6, R2O3 0,2—1,2, нейтрализуют до слабощелоч-
ной реакции мелом или известняком в вертикальных резервуарах
с мешалками периодического действия. Полученную суспензию вы-
Борные удобрения
345-
сушивают в распылительной сушилке (диаметр 5,5 м) дымовыми,
газами (350—450°), Распыливание суспензии производят форсун-
ками, работающими на остром паре, что исключает их закупори-
вание и по расходу энергии экономичнее, чем распыление сжатым
воздухом. Дымовые газы очищаются от уносимой из сушилки пыли,,
проходя через циклон и скруббер, орошаемый суспензией (маточ-
ным раствором). Такой способ получения бормагниевого удобре-
ния позволяет полностью использовать содержащиеся в маточном
растворе Н3ВО3 и MgSO4. Продукт содержит 6—8% Н3ВО3>
65—75% MgSO4, 29—17% кристаллизационной воды, CaSO4 и дру-
гие примеси и имеет небольшой объемный вес 0,2—0,3 т/м3, зави-
сящий от тонкости распыления высушиваемого раствора. При гру-
бом распылении продукт получается влажным. Преимуществом
распылительной сушки маточного раствора перед выпариванием
его через теплопередающую поверхность в аппаратах с огневым
или паровым нагревом является отсутствие затрат труда на дроб-
ление застывающей после выпарки монолитной массы, которая
к тому же содержит больше влаги, чем продукт, получаемый &
распылительной сушилке. Однако для получения 1 т продукта тре-
буется удалить из маточного раствора ~3 т воды. Поэтому более-
рациональна переработка маточного раствора в борное удобрение-
осаждением бора окисью магния (каустическим магнезитом) в-
форме боратов магния хВ2О3 pMgO • zH2O, малорастворимых в
воде, но хорошо растворимых в 2%-ной лимонной кислоте. При
95°, норме MgO 4,5 моль на 1 моль В2О3 и 2-часовом перемешива-
нии осаждается более 90% бора и в фильтрате после отделения'
осадка содержится 0,26% В2О3. Осадок промывают, высушивают
и измельчают до —2 мм. Промывные воды идут в отброс, а филь-
трат может быть переработан на сульфат магния или магнезии.
Получаемый продукт содержит больше 5% лимоннорастворимого
В2О3, 20,5% MgO (общ.), 12,5% SO3 (в виде MgSO4). Его объем-
ный вес 0,8 т/м3 (ГОСТ 9595—61 нормирует содержание в про-
дукте только лимоннорастворимых соединений бора в пересчете-
на Н3ВО3 — не менее 9% и степень его измельчения — продукт
должен полностью проходить через сито с ячейками 4,5 мм).
Себестоимость 1 т В2О3 в таком удобрении значительно ниже,
чем в удобрении, получаемом путем высушивания всего маточного-
раствора.
Сырой осадок бората магния может быть использован не только
как удобрение, но возвращен в производство борной кислоты в-
виде добавки к боратовому сырью. Но в этом случае необходимо
до осаждения бората очищать маточный раствор от полуторных
окислов углекислым кальцием, а осадок бората хорошо отмывать
от MgSO4.
При обработке отбросного маточногб раствора аммиаком и
Двуокисью углерода или углекислым аммонием можно получить-
346
Гл. X. Соединения бора
боросульфатаммоний и магнезию:
4Н3ВО3 + (NH4)2CO3 = (NH4)2B4O7 + СО2 + 6Н2О
4MgSO4 + 4(NH4)2CO3 + ЮН2О = 3MgCO3 • Mg(OH)2 • 9Н2О + 4(NH4)2SO4 + СО2
Осадок основной углемагниевой соли отделяют от раствора,
промывают и высушивают, причем получается магнезия альба
3MgCO3 • Mg(OH)2 • ЗН2О (стр. 297). Раствор нейтрализуют сер-
ной кислотой и высушивают — получается удобрение (боросуль-
фатаммоний), содержащее около 6% бора (в пересчете на В2О3),:‘;
около 70% (NH4)2SO4 и около 20% MgSO4.
Предложено также растворять в нагретом до 85° маточном рас-
творе после кристаллизации Н3ВО3 сульфат аммония (0,8 моль
>на 1 моль MgSO4). При охлаждении раствора до 20° кристалли-
зуется двойная соль сульфатов магния и аммония (см. стр. 270,
305), содержащая после высушивания при 100—105° 36%
(NH4)2SO4, 33% MgSO4, ~2% Н3ВО3, 29% Н2О. Она является
удобрением с хорошими физическими свойствами. Конечный ма-
точный раствор возвращают в цикл 165’166. После накопления в нем
•борной кислоты она может быть извлечена.
Получение борных удобрений из боратового сырья
Получение борных удобрений из датолитов134
Маточные растворы из производства борной кислоты являются
•весьма ограниченным источником сырья для борных удобрений;
..при росте их потребления сырьем будут служить природные бора-
ты, главным образом датолитовые руды, нуждающиеся в перера-
ботке, так как датолит не растворяется ни в воде, ни в лимонной
кислоте. Возможно получение борного удобрения из датолито-
вого сырья с применением аппаратуры, используемой в суперфос-
фатном производстве. С помощью серной кислоты содержащийся
в датолите В20з переводится в водорастворимую или усвояе-
мую форму. Измельченную датолитовую руду (размер зерен
<0,25 мм) перемешивают в течение нескольких минут с 50%-ной
серной кислотой (норма кислоты 90% от стехиометрического коли-
чества в расчете на СаО); начальное отношение Т: Ж = 1. Пульпа
поступает в камеру, где происходит вызревание массы в течение
1 ч, причем вследствие экзотермичности реакций температура по-
вышается до 105—115°. После выгрузки затвердевшей массы она
представляет собой готовое удобрение с хорошими физическими
свойствами (сухость, рассыпчатость и др.) и не требует вылежи-
вания на складе, так как степень разложения датолита в камере
достигает 97—99%. Датолитовое удобрение содержит 8—10%
Н3ВО3, 0,5—0,6% H2SO4, сульфат кальция, кремневую кислоту.
.На 1 т удобрения расходуется ~0,26 т H2SO4 (100%).
Борные удобрения
347“
При переработке флотационного датолитового концентрата’
(15—16% В2О3) в получаемом удобрении по нормам ГОСТ
10347—63 должно содержаться не менее 13% водорастворимой
борной кислоты; свободная кислотность в пересчете на H2SO4 не-
должна превышать 1,5%.
Разработан способ получения борной кислоты из этого датоли-
тового удобрения. Для этого его репульпируют 15 мин при 20—30°“
в оборотном щелоке, насыщенном борной кислотой. Затем пульпу
подвергают флотации. При этом борная кислота поступает в пен-
ный продукт, а гипс и другие примеси остаются в хвостах. После-
фугования и сушки пенного продукта получается 90—92%-ная бор-'
ная кислота, а перекристаллизацией неотфугованного пенного про-
дукта можно получить стандартную техническую борную кислоту.
После отделения хвостов раствор возвращается в цикл. Хвосты
могут быть перефлотированы для получения гипсового концен-
трата, пригодного для переработки в строительный гипс 167.
Получение б ор ос у п е р ф о с ф а т а 134>168
Введение соединений бора в наиболее распространенное удоб-
рение— суперфосфат дает ценное удобрение — боросуперфосфат..
Его можно получать или совместным сернокислотным разложе-
нием смеси фосфатного сырья и датолитовой муки, или добавкой
датолитовой муки к готовому суперфосфату, или смешением супер-
фосфата с датолитовым борным удобрением.
Совместное разложение апатита или каратауского фосфорита
и датолитового сырья серной кислотой связано с технологическими'
трудностями. Выделяющаяся при разложении датолита кремневая-
кислота обволакивает частицы апатита и препятствует их взаимо-
действию с серной и фосфорной кислотами, так что даже при дли-
тельном хранении на складе степень разложения сырья остается
недостаточно высокой. При разложении же смеси фосфорита Кара-
тау с датолитом последний разлагается недостаточно потому, что
температура в процессе хранения ниже оптимальной температуры
разложения датолита (95°). Такие же неблагоприятные условия-
для разложения датолита создаются и при добавке его к вызрев-
шему суперфосфату, температура которого обычно ниже 55° —
степень разложения датолита свободной фосфорной кислотой су-
перфосфата не превышает 85%. Кроме того, для разложения
датолита требуется дополнительное хранение боросуперфосфата на
складе в течение 5 суток, т. е. необходимо увеличение размеров
суперфосфатного склада. Добавка же датолита к свежему (камер-
ному) суперфосфату нецелесообразна, так как ухудшает условия
доразложения апатита. Наиболее полное использование фосфат-
ного и датолитового сырья достигается при смешении готового бор-
ного датолитового удобрения с суперфосфатом как- вызревшим.
348
Гл. X. Соединения бора
так и свежим, так как готовое датолитовое удобрение не влияет
на доразложение фосфата. В связи с различной потребностью рас-
тений в фосфоре и боре отношения Н3ВО3: Р2О5 в боросупер-
фосфате должны составлять от 1 : 6 до 1 : 20.
Содержание Р2О5 и Н3ВО3 могут колебаться для апатитового
4оросуперфосфата в пределах от 18 до 14,6% Р2О5 и от 0,9 до 2,5%
Н3ВО3 ; для фосфоритового — от 13 до 11,1% Р2О3 и от 0,7 до 1,9%
НзВО3. Боросуперфосфат обладает лучшими физическими свой-
ствами, чем суперфосфат, а себестоимость бора в нем меньше, чем
ц бормагниевом удобрении.
Получение концентрированного
б о р о с у п е р ф о с ф а т а
(бородвойного суперфосфата)!21"169 j
Датолитовая руда почти полностью разлагается слабой эк- I
«тракционной фосфорной кислотой, содержащей 20—24% Р2О5 1
{или 27,6—33,1% Н3РО4). При этом протекают следующие реак- |
дай: '.1
«СаО • В2О3 • 2SiO2 • Н2О + 4Н3РО4 +2Н2О = 2Ca(H2PO4)2+2H3BO3+2[SiO2 . H2OJ Я
3[СаО • FeO . 2SiO2] + 8Н3РО4 -= ЗСа(Н2РО4)2 + Fe3(PO4)2 + 6[SЮ2 Н2О] 1
ЗСаО • Fe2O3 • 3SiO2 + 8Н3РО4 = ЗСа(Н2РО4)2 + 2FePO4 + 3[SiO2 H2OJ + ЗН2О i
Оптимальные условия разложения: норма кислоты 110—115%
от стехиометрической и 3-часовое перемешивание при 95°. Разло- j
.жение датолитовой руды производят непрерывно в серии верти-
кальных реакторов с мешалками, соединенных перетоками 1
(рис. 107). Избыток фосфорной кислоты нейтрализуют добавкой |
к горячей пульпе углекислого кальция. Нейтрализованная пульпа I
поступает в барабанный гранулятор, где смешивается с ретуром — 1
измельченным сухим материалом — в отношении ретур : пульпа, |
равном 1,5. Гранулы высушивают в сушильном барабане до влаж- I
ности 2—3%. Затем материал измельчают и рассеивают на фрак- |
ции —3 +0,5 мм и —0,5 мм. Фракция —3 +0,5 мм является про- I
дуктом, который в случае необходимости до упаковки нейтрали- I
зуют известняком. Фракцию —0,5 мм возвращают на смешение 1
с пульпой. Продукт содержит 35—41% общей Р2О5, 34—40,3% i
усвояемой Р2О5, 28—33,6% водорастворимой Р2О3, 6,3—8% общего j
и 6—7,6% водорастворимого бора в пересчете на Н3ВО3. Влаж- 1
ность продукта, определенная высушиванием при 85°, равна2—3%. i
Разработан также способ получения борофосфорного удобре- i
ния фосфорнокислотной переработкой предварительно прокален-
ной данбуритовой руды или ее концентрата и смеси его с фосфо-
ритом. Данбурит (СаО • В2О3 • 2SiO2) содержит 28% В2О3, а кон-
Борные удобрения
349
центрат 20—22% В2О3. Разложение идет в течение 1 ч при 95°,
продукт содержит до 55% питательных веществ 170-171.
Изучено выделение бора из датолита в виде борнометилового
эфира. Для этого раствор, датолита в серной (~ 52% H2SO4) или
Рис. 107. Схема производства бородвойного суперфосфата:
Г —хранилище фосфорной кислоты; 2-насос; 3- напорный бак для фосфорной кислоты:
4 -дозатор кислоты; 5-реакторы; в-питатель для датолитовой муки; 7 —элеватор; 8 — Пита-
тель для ретура; 9 — барабанный смеситель-гранулятор; 10 - барабанная сушилка; 11 — ЙИЛе-
уловитель; 12 — вибрационный грохот; /J —дробилка; 14 — питатель для известняка; 13 — бара-
банный нейтрализатор.
в соляной кислоте (~7% НС1) обрабатывают метиловым спиртом,
который затем регенерируют на 98—99% и снова возвращают в
процесс 172.
Производство борных удобрений методом
спекания 173-175
При спекании турмалинов и датолитов с известняком или со-
дой В2О3 переходит в усвояемую растениями форму. Из спека, по-
лученного при 1100° из турмалина (6,5% В2О3 и 37,1% SiO2) и уг-
лекислого кальция (130% от стехиометрического в расчете на SiO2
турмалина), извлекается в лимоннокислую вытяжку 72,5% В20з-
Оптимальная температура спекания турмалина с содой 900°
(рис. 108). При стехиометрическом количестве соды (по SiO2) из
содержащегося в спеке В2О3 66% извлекается в водную вытяжку
и 80,3% в лимоннокислую; при норме соды 110% от стехиометри-
ческой степень извлечения В2О3 в водную вытяжку возрастает до
81,5% и в лимоннокислую до 92,3%. При спекании датолита с
СаСОз (Ю0% от стехиометрического количества) при 1000° сте-
пень превращения В2О3 в лимоннорастворимую форму 90—98,5%;
те же результаты достигаются при спекании датолита с содой, но
при более низкой температуре (800°) (рис. 109). Спекание можно
производить с количеством соды, на 20% меньшим стехиометриче- *
350
Гл. X. Соединения бора
ского (в расчете на SiO2 датолита), однако все же использование
соды менее экономично, чем использование известняка. Спек,
после тонкого измельчения, служит удобрением.
Опыты 174 спекания с известняком кварцтурмалиновой руды,
имевшей 4,26% В2О3, 61% SiO2 и 24% R2O3, дали спек, содержа-
щий 4,2% Н3ВО3 при степени перехода В2О3 в усвояемую форму
97—98%. Оптимальные условия спекания: норма известняка 1,32т
Рис. 108. Влияние темпера-
туры спекания турмалина
с содой на степень извле-
чения В2О3.
Рис. 109. Влияние темпера-
туры спекания датолита
с содой на степень извле-
чения В2О3.
на 1 т турмалина, продолжительность спекания 1,5 ч при 1000° :
На 1 т спека расходуется 0,584 т руды и 0,77 т известняка. Таким
ке способом можно получать удобрение, содержащее В2О3 в ли- {
юннорастворимой форме, из данбуритового концентрата 175.
Борные удобрения из сырья с низким )
содержанием бора * )
Помимо турмалинов, к такому сырью относятся необогашенный-
датолит и красные и серо-зеленые глины из месторождений маг-:
ниевых боратов. Запасы этих видов сырья могут полностью удов-:
летворить потребности сельского хозяйства в боре. Эти глины;
содержат около 3% В2О3, из которых 91—93% находятся в ли-1
моннорастворимой форме и 82—93% в цитратнорастворимой фор-
ме. Поэтому эти глины после сушки и размола могут быть исполь-
зованы непосредственно в качестве борного удобрения173,
Выделение бора из растворов
351
Разработан способ получения обогащенного борного концен-
трата из озерной рапы, содержащей бор 176. При обработке рапы
известковым молоком получают концентрат, содержащий (в %):
Mg — 31,5 (в пересчете на Mg(OH)2—76); В2О3—8; нераствори-
мого остатка — 0,3; R2O3—1,2; Са — 3; SO4—1,5; Cl—2; Н2О,
Na и пр. — 8. Этот концентрат можно применять в качестве удоб-
рения. При извлечении из него бора в раствор обычными методами
и последующего осаждения известковым молоком можно получить
более богатый концентрат, содержащий 25—30% В2О3. Степень из-
влечения бора из рассола достигает 60%. Обработкой концентрата,
содержащего 4,3—6,8% В2О3, экстракционной фосфорной кислотой
(22—23% Р2О5) были получены174 удобрения, содержащие
3,8—5,8% Н3ВО3, 30,8—42% Р2О5, 19,2—27,6% MgO; отношение
MgO : Н3ВО3 может изменяться в пределах от 6,3: 1 до 10: 1. На
получение 1 т борофосфорного удобрения расходуют: 0,3—0,48 т
концентрата (4,3—6,8% В2О3) и 1,48—1,75 т фосфорной кислоты
(22,7% Р2О5).
ВЫДЕЛЕНИЕ БОРА ИЗ РАСТВОРОВ
Природные растворы, несмотря на то, что они содержат бор
в небольших концентрациях, являются мощным потенциальным
источником борного сырья, разработке методов использования ко-
торого уделяется все большее внимание 99’174*177. Трудность извле-
чения бора обусловлена крайне низкими концентрациями бора при
значительном содержании других веществ, мешающих его выделе-
нию. Рапы некоторых солевых озер и некоторые буровые воды
являются концентрированными растворами хлоридов натрия, ка-
лия, магния и содержат всего около 0,02% В2О3. В рассоле многих
озер содержится 0,01—0,06% В2О3178. В сухом остатке морской
воды '-—0,05% В2О3 97. Промышленные отходы — растворы от про-
изводства борной кислоты и буры гораздо богаче бором — они со-
держат около 1,5% В2О3.
Выделение бора из растворов возможно или с помощью иони-
тов, или в виде труднорастворимых соединений, растворимость
которых крайне мала, меньше содержания В2О3 в природных во-
дах. Эта задача еще далеко не разрешена. Так, после осаждения
В2О3 окисью магния или кальция в растворах содержится еще
0,2—0,3% В2О3179' 18°. Растворимость природных боратов в воде
при 25° также выше содержания В2О3 в природных водах — в рас-
творе калиборита, гидроборацита, иньоита и улексита содержится
0,2—0,4% В2О3 и лишь раствор ашарита содержит 0,0085%
В2О346’ 181.
Однако возможно выделение значительной доли бора из про-
мышленных растворов и из предварительно сконцентрированных
природных вод. Выше был описан способ осаждения бора из озер-
ной рапы окисью кальция176, Разработан177 способ выделения
352
Гл. X. Соединения бора
бора с помощью сульфата марганца из маточных растворов от
производства борной кислоты 134-182 и растворов, получающихся
после выпарки буровых вод 12°:
Na2B4O7 + MnSO4 = MnB4O7 + Na2SO4
Na2B4O7 + MnSO4 + 5H2O = Mn(BO2)2 • 2H2O + Na2SO4 + 2Н3ВОЭ И
2H3BO3 + MnSO4 Mii(H2BO3)2 + H2SO4
Образующуюся серную кислоту необходимо нейтрализовать
окисью кальция или магния. После обработки сульфатом мар-
ганца при 70—95° маточных растворов от производства борной
кислоты, содержавших 1,3—2% В2О3, 21—24% MgSO4, 0,2—1,2%
R2(SO4)3, 0,2—0,6% H2SO4 и незначительные количества других
примесей, концентрация В2О3 в конечных фильтратах была
0,37—0,6% при нейтрализации окисью кальция и 0,4—0,55% при
нейтрализации окисью магния. Обработка сульфатом марганца
при 20° нейтрализованного окисью кальция концентрата буровой
воды, содержащего после выпарки и выделения бикарбоната нат-
рия и буры 0,82% Na2B4O7 (0,57% В2О3), 17,8% NaCl и 0,55%
Na2CO3, дала фильтрат с 0,3% В2О3.
Образующиеся осадки — бораты марганца — после их под-
сушки могут быть использованы непосредственно как микроудоб-
рения, или как добавки к суперфосфату, а так же как сырье для
получения борной кислоты. Сушка этих осатков при 500° приводит
к разложению боратов марганца с образованием борной кисло-
ты— при выщелачивании водой в раствор переходит 70—80% В2О3
' и до 30% Мп.
Метод осаждения борной кислоты из маточных растворов
окисью магния 139'140 дает осадок с отношением MgO : В2О3, рав-
ным 3:1. Осаждение бора в виде боратов кальция 67’69-176 также
дает удовлетворительные результаты только для сравнительно бо-
гатых бором растворов, так как в конечной жидкой фазе содер-
жится ~ 0,25 % В2О3.
Совместное осаждение боратов кальция и меди позволяет вы-
делить из раствора, содержащего 0,2—0,4% В2О3, 85—93% В2О3.
В растворе после осаждения содержится всего 0,03% В2О3, а в
осадке 22,4% В2О3, 18,3% СиО, 36,25% СаО и 23,1% Н2О. Осаж-
дение должно проводиться известковым молоком, к которому до-
бавлена соль меди. Аналогичные, но несколько худшие результаты
получаются при соосаждении бората кальция с другими микро-
элементами — марганцем, кобальтом 183.
Борная кислота в водных растворах образует комплексные
кислоты с винной и триоксиглутаровой кислотами. Можно выде-
лять бор из очень разбавленных растворов, осаждая его в виде со-
лей этих кислот: боротартратов /:Ме2О • тМеО • В2О3 • 2С4Н4О5 • aq
и бородитартратов пМе2О • тМеО • В2О3 • 4С4Н4О5 • aq, боротри-
Перборат натрия
353
оксиглутаратов пМе2О • znMeO • В2О3 • 2С5Н6О6 • aq и диборотритри-
оксиглутаратов «Ме2О • тМеО • В2О3 • ЗС5Н6О6 • aq. Здесь Me1 —
щелочной металл или аммоний, Me11 — щелочноземельный металл,
цинк, кадмий, марганец. Некоторые из этих солей, например, боро-
дитартраты и диборотритриоксиглутараты щелочноземельных ме-
таллов, очень мало растворимы в воде, но хорошо растворимы в
кислотах, в том числе и в лимонной, и могут быть использованы
в качестве микроудобрений 184.
Форма боратов, выделяющихся из растворов, зависит от вели-
чины pH 185.
Возможно выделение борной кислоты из нефтяных вод адсорб-
ционными методами — активной окисью магния и активированным
углем; 1 г угля адсорбирует из раствора борной кислоты до 15 лее
В2О3. Десорбция осуществляется кипячением суспензии адсорбен-
та в воде69>".
Имеющиеся в настоящее время иониты мало селективны и не-
достаточно эффективны для выделения бора из солевых растворов.
Но они могут оказаться полезными при извлечении В2О3 из раство-
ров борной кислоты, не содержащих солей. Так, иониты ММГ-1,
МГ, TH, Н извлекают из раствора, содержащего 0,2% В2О3, до 90%
борной кислоты — в растворе остается 0,02—0,03% В2О3. Это поз-
воляет использовать аниониты для регенерации борной кислоты из
растворов, не содержащих солей, когда невозможно осуществить
осаждение при помощи СаО и MgO. Регенерацию анионита лучше
всего производить водой или 5% раствором NaOH.
По отношению к бору наибольшей селективностью обладают
гидроксилсодержащие иониты (ПВГ, АВ-17, АВ-27, ЭДЭ-10,
ЭДЭ-10П). Ионы тетрабората поглощаются с наибольшей актив-
ностью при pH 7,5—9,5. Максимальная степень поглощения бора
в форме комплексных ионов (из растворов, содержащих компо-
ненты, необходимые для комплексообразования) достигается при
pH 2—3,5 ,86-,87.
Взаимодействие Н3ВО3 с анионитами протекает очень медлен-
но— в отличие от сильных кислот, поглощающихся в течение не-
скольких минут, для достижения равновесия при поглощении бор-
ной кислоты требуется 5—7 суток. Проблемой большой важности
является синтез новых ионообменных смол, пригодных для погло-
щения В2О3 из солевых растворов.
ПЕРБОРАТ НАТРИЯ
Перборат натрия получается43 при взаимодействии буры или
борной кислоты с едким натром и с перекисью водорода:
Na2B4O7 • ЮН2О + 2NaOH + 4Н2О2 + Н2О = 4(NaBO2 • Н2О2 • ЗН2О)
Н3ВОз + NaOH + Н2О2 + Н2О = NaBO2. Н2О2 • ЗН2О
12 М. Е. Позии
834
Гл X. Соединения бора
К 30% раствору NaOH добавляют буру в количестве, превы-
шающем стехиометрическое на 20%. В полученный раствор мета-
бората натрия NaBO2 медленно приливают 3% раствор перекиси
водорода в воде с 10—15%-ным избытком. Реакцию ведут при тем-
пературе не выше 10°. В реактор добавляют поваренную соль для
высаливания полученного пербората натрия при охлаждении до 0°.
Перборат натрия отжимают на центрифуге и высушивают при не-
высокой температуре. Выход продукта составляет 93—95%; на 1 т
пербората натрия затрачивается 0,67 т буры.
Вместо NaOH можно применять менее дорогую соду. В 5% рас-
твор перекиси водорода при 15° вводят теоретические количества
буры и соды. Образование пербората натрия протекает по реакции:
Na2B4O7 • ЮН2О + 2Na2CO3 + 4Н2О2 + ЗН2О = 4(NaBO2 • Н2О2 • ЗН2О) + 2NaHCO3
Процесс заканчивается в течение 1 ч с использованием буры
и перекиси водорода до 68%; количество активного кислорода в
продукте 8,5%, вместо теоретических 10,38% в перборате натрия.
Усовершенствованный содовый способ получения пербората
натрия188 заключается в применении 1,5% раствора перекиси водо-
рода (вместо 5%), с которым бура и сода взаимодействуют в при-
сутствии сульфата цинка. После перемешивания в течение
20—25 мин при 10° реакционную массу охлаждают до 5° и вводят
в нее насыщенный раствор NaCl. Выделившийся осадок отфильтро- ,
вывают и сушат при 40—50° в токе воздуха. Степень использования!
Н2О2 при таком способе получения пербората натрия составляет!
86%, а буры 89,5%. На 1 т пербората натрия (100%) расходуют:!
0,25 т Н2О2, 0,69 т буры, 0,48 т соды, 0,72 т поваренной соли и|
0,05 т сульфата цинка. 1
Для получения пербората натрия может быть использован ма-
точный раствор от производства борной кислоты (стр. 344). Для
осаждения из этого раствора Fe, Al, Са, Мп и других металлов его
обрабатывают при 80—85° небольшим количеством каустического
магнезита с одновременным окислением Fe2+ и Мп2+ хлорной из-
вестью. После дополнительного нагревания до кипения и удаления
шлама к раствору добавляют соду для осаждения основного кар-
боната магния, перерабатываемого на магнезию. Остающийся
фильтрат содержит около 80% бора от количества его в маточном
растворе после производства борной кислоты. К фильтрату добав-|
ляют NaOH или Na2CO3 — образуется раствор метабората натрия.1
ГГдсле охлаждения до 10° в него вводят Н2О2 (7—8 кг на 1 ж31
фильтрата). Затем охлаждают до 5° или добавляют NaCl для вы-1
саливания пербората натрия. Кристаллический перборат отфиль-1
тровывают и высушивают при 45—60°. ]
Основным компонентом шлама, получаемого при очистке исход-]
ного маточного раствора, является борат магния. Для извлечения]
Перборат натрия
355
бора шлам можно обработать 5% раствором NaOH, отделенную от
осадка жидкость упарить и добавить -к фильтрату, используемому
для получения пербората.
1"Нрборат натрия получают также сплавлением борной кислоты
с перекисью натрия и электрохимическим способом 43-189-19°. Элек-
тролизу Подвергают раствор, содержащий в. 1 л ~40 г Na2B4O7,
~140 г Na2CO3 и 0—40 г NaHCO3. Анод — платиновый; катод —
оловянные или стальные спиральные змеевики с охлаждающей во-
дой. Плотность тока на аноде 1500—2000 а!м2, на катоде
500—1000 а 1м2. Образование пербората натрия идет через проме-
жуточные продукты. Вначале у анода образуется перкарбонат
2СО% -2е = C20f~
который, реагируя с водой, образует перекись водорода:
• С2О|" + 2Н2О= 2НСОз + Н2О2
Имеются предположения и об ином механизме этого процесса191.
Перекись водорода образует с боратом перборат (пергидрат бо-
рата). На катоде выделяется водород, а на аноде небольшое коли-
чество кислорода и двуокиси углерода. Эти потери ССК должны
компенсироваться периодическим введением в электролит бикарбо-
ната натрия, во избежание повышения концентрации ОН- и усиле-
ния их разряда. Напряжение на ванне 6—7,5 в\ нагрузка иногда
достигает 11000 а. Расход энергии на 1 т продукта ~5500 квт-ч.
Выход по току 40—50%. При больших плотностях тока выход по
току увеличивается с повышением температуры. Однако темпера-
тура не должна быть выше 16°; она не должна опускаться и ниже
14°, так как ппи этом вместе с перборатом натрия кристаллизуются
бура и сода. Выход резко уменьшается при загрязнении растворов
ионами тяжелых металлов, каталитически разлагающих перекись
водорода. Поэтому циркулирующий электролит очищают кипяче-
нием с силикагелем (8 г на 1 л раствора), лучше под давлением до
3 ат. Ввиду отсутствия в ванне диафрагмы в электролит вводят не-
много хромовокислой соли и ализаринового масла или жидкого стек-
ла, что препятствует восстановлению пербората на катоде. В процес-
се электролиза электролит пересыщается перборатом натрия, кото-
рый кристаллизуется. Периодически часть суспензии кристаллов
выводят на центрифугу и отделенные кристаллы пербората натрия
высушивают. В полученном продукте 10—10,5 % активного кисло-
рода-.
За рубежом перборат натрия выпускается в нескольких фор-
мах192. Более распространен тетрагидрат NaBO--4H2O, т. е.
NaBO2 • Н2О2 • ЗН2О, содержащий 10% активного кислорода; вы-
пускают также NaBO2 • Н2О2 • 2Н2О 193; менее распространен моно-
гидрат NaBO3-H2O, т. е. монопергидрат NaBO2-H2O2, с 15—16%’
активного кислорода, получаемый обезвоживанием тетрагидрата,
12*
356
Гл. Л. Соединения бора
который легко теряет кристаллизационную воду. Давление пара над
ЫаВО2 Н2О2• ЗН2О вычисляют по уравнению lgP=12,19—3286Т-’.
Производство и потребление перборатов за границей исчисляется
десятками тысяч тонн в год. Помимо пербората натрия, имеющего
наибольшее применение, известны способы получения пергидратов
боратов калия, аммония, лития, рубидия и цезия, а также истин-
ных перборатов аммония, калия и бериллия 43’194-196. Более под-
робные сведения о свойствах и методах получения пербора-
тов см.43.
БОРНЫЙ АНГИДРИД
Борный ангидрид получают дегидратацией борной кислоты, на-
греванием ее до 400—500°lS9. При этом часть борной кислоты уле-
тучивается с парами воды. При 500°, 1 ат и продолжительности
Рис. НО. Дегидратация борной кислоты:
/ — содержание В2О3 в плаве; 2 —потери BsOs-
Сплошные линии —прн атмосферном давлении;
пунктирные линии — прн вакууме 15 мм рт. ст,
(без поглощения паров воды).
нагревания 3 ч197 дегидрата-
ция протекает полностью (рис.
НО), а потери В2О3 состав-
ляют около 6%. Под вакуу-
мом (остаточное давление
15 мм рт. ст.) можно осуще-
ствить дегидратацию Н3ВО3
при 200—250°.
Предложен способ обезво-
живания Н3ВО3 в сушильном
барабане в токе воздуха или
других газов в три последова-
тельные стадии при 100—120°,
170—185° и 215—225°. Продол-
жительность каждой стадии
1 ч. Получается порошкообраз-
ный продукт, содержащий
99% В2О3’93.
Система В2О3—Н2О может
находиться в метастабильном
состоянии. В зависимости от
борных кислот в газовой фазе, а
борной кислоте примесей других борных
Н3ВО3 может протекать разными путями 199
давления водяного пара и
также от присутствия в орто-
кислот,
дегидратация
. При общем давлении
водяного пара и борной кислоты в газовой фазе 10—15 мм рт. ст.
чистая борная кислота непосредственно переходит в борный анги-
дрид:
2Н3ВО3 -= В2О3 + ЗН2О
Реакция начинается при 96°.
20 до 50 мм рт. ст. дегидратация
При общем давлении паров от
Н3ВО3 идет с образованием двух
Трехфтористы^ бор
387
промежуточных соединений — НВО2 и гидрата неопределенного
состава: \
\ Н3ВО8 = НВО2 + Н2О (84 - 96°)
\ НВО2 = хВ2О3 • </Н2О (118 — 143°)
хВ2О3 • </Н2О = хВ2О3 + (/Н2О (148 - 150°)
При общем давлении паров 65—988 мм рт. ст. дегидратация
идет через метаборную кислоту с дальнейшим образованием рас-
творов, из которых при удалении воды получаются вязкие, пуча-
щиеся жидкости. Превращение Н3ВО2 в НВО2 при этих условиях
наблюдается от 101 до 156°, а образование растворов — от 147 до
178°. Содержание в ортоборной кислоте примеси |3-формы НВО2
способствует образованию растворов при общем давлении паров от
175 до 750 мм рт. ст. В этих условиях HSBO3 переходит в НВО2 от
118 до 144°, а дальнейшее разложение НВО2 с образованием вяз-
ких жидкостей идет от 179 до 194°.
ТРЕХФТОРИСТЫЙ БОР
Наиболее простой способ получения BF3 заключается в обра-
ботке концентрированной серной кислотой вмеси плавикового
шпата и борного ангидрида:
3CaF2 + В2О3 + ЗН28О4 e 2ВР3 4- 3CaSO4 + ЗН2О
Однако продукт, полученный этим способом, загрязнен значи-
тельным количеством SiF4, удаление которого является очень труд-
ным. При разложении олеумом смеси флюоритового концентрата с
боратом кальция при 150—180° и 150%-ном избытке H2SO4 выход
BF3 составляет 90%; продукт содержит 2—3 мол. % SiF4 200. Более
чистый продукт получается при замене плавикового шпата фторбо-
ратом натрия, аммония или калия201, содержащим меньше
кремния:
6N aBF4 + В2О3 + 6H2SO4 » 8BF3 + 6NaHSO4 + ЗН2О
Чистый фтористый бор можно получить термическим разложе-
нием фторборатов щелочных металлов7в-202. Разложение фторбо-
рата фенилдиазония идет по реакции 203.
c6h5n2bf4 = c6h5f + n2 + BFS
При разложении фторборатов арилдиазония 204 получается фто-
ристый бор с содержанием лишь 0,14 мол. % SiF4. Из фторборатов
щелочных металлов наиболее легко диссоциирует LiBF4, труднее
NaBF4, очень трудно KBF4. Давление диссоциации (Р в мм рт. ст.)
может быть вычислено по формулам:
1g Лы)---+ 4.28; 1g P(Na) = - + 6,63; 1g р(к) — -^ + 8,15
358
Гл. X. Соединения бора
Диссоциация KBF4 ускоряется добавками MgClj, CaCh, MgSO4
или ВаС12 20.
Наиболее экономичный и распространенный за рубежом способ
получения BF3 состоит из двух стадий — получения фторбората
натрия или аммония по реакциям
Na2B4O7 • ЮН2О + 12HF = Na2O(BF3)4 + 16Н2О
6NH4HF2 + 4Н3ВО3 = 4NH3 + 11Н2О + (NH4)2O(BF3)4
12NH4F + 2В2О3 = 10NH3 + 5Н2О + (NH4)2O(BF3)4
и обработки их серной кислотой:
Na2O(BF3)4 + 3H2SO4 = 2NaHSO4 + H2SO4 • H2O + 4BF3
Процесс осуществляют следующим образом. Буру или борную
кислоту медленно добавляют к стехиометрическому количеству
фтористоводородной кислоты или бифторида аммония. Смесь на-
гревают и кипятят для удаления воды (и аммиака при приготовле-
нии фторбората аммония). Фторборат загружают в реактор, куда
на холоду добавляют рассчитанное количество олеума, содержа-
щего 20% свободной SO3. При нагревании реактора выделяется
BF3, который собирают в газгольдере, а из него компрессором на-
качивают в баллоны под давлением 140 ат76.
Трехфтористый бор можно также получить взаимодействием
борной и фторсульфоновой кислот:
3SO3HF + Н3ВО3 = BF3 + 3H2SO4
Части аппаратуры, соприкасающиеся с BF3, изготовляют из ма-
териалов, содержащих кремнезем: стекла, керамики, фарфора; наи-
более подходящим материалом является кварц.
ЛИТЕРАТУРА
1. Л. Я. Марковский, Ю. Д. Кондрашев, Г. В. Капустовская,
ЖОХ, 25, № 3, 433 (1955). —2. Л Я. Марковский, М. П. Белов, ЖПХ,
37, № 8. 1658 (1964); 38, № 1. 17 (1965); 40, № 4. (1967).— 3. Г. В. Самсонов,
Л. Я. Марковский, А. Ф. Ж и г а ч; М. Г. В а л я ш к о, Бор. его соединения
и сплавы, Изд. АН УССР, Киев. 1960. — 4. А. С. М и к у л и н с к и й. В. В. Е р е м-
кин и др., Труды УНИХИМ. в. 5. 1957, стр. 152, 166, 206. 211. 232.—
5. В. И. Михеева и др., ДАН СССР. 91, № 5, 1133 (1953); ЖНХ. 2, № 6,
1223, 1232, 1242, 1248 (1957). — 6. А. М. Поляк и до.. Труды УНИХИМ, в. 5.
1957. стр. 222. 228. — 7. Л Я. Марковский. Г. В. Капустовская, ЖПХ,
35, № 4. 723 (1962). — 8. J. С u е i 11 е г о п, Ph. Р i с h a t, франц, пат. 1403135,
1964. — 9. R. Monnier, Р. Tissot, Р. Pearson, Helv. chim. acta, 49, 67
(1966).— 10. A. A. Wood, пат. США, 3189412, 1959
11. X. T а г а в а, К. И с и н. япон. пат. 747, 1962. — 12. В. М. Слепцов,
Г. В. Самсонов, ЖПХ, 34, № 3.501 (1961). — 13. A. Lipp, Techn. Rundschau,
57, № 33, 5, 7 (1965). — 14. И. И. Искольдский, С. Л. Черкинская,
ЖПХ, 31, № 1, 25 (1958). — 15 И. И. Искольдский. А. Е. Горбунов,
Там же, 38, № 7, 1428 (1965). — 16. J. L. A n d г i е u х, S. Marion, Compt. rend.,
Литература
359
236, № 8, 805 (1953). — 17. Л. Я. Марковский, Н. В. Векшина, ЖПХ, 31,
1293 (1958); 34, 16, 242, 2171 (1961); 35, 30 (1962).— 18 Т. И. Серебрякова,
Г. В. Самсонов, Там же, 40, № 1, 3 (1967). —19. Н. S. Booth, D. R. М а г-
tin, Boran Triffuoride and its Derivatives, 1949. — 20. И. Г. P ы с с, E. M. По-
лякова, ЖОХ, 18, № 2, 286 (1948).
21. M. И. Винник, Р. Н. Круглов, Н. М. Чирков, ЖФХ, 31, № 4, 832
(1957). — 22. Н. А. Е. MacKenzic a. oth., J. S. Afric. Chem. Inst., 5, 123
(1951); 6, № 1, 4, 8 (1953). — 23. А. В Топчиев, Я. М. П о у ш к и н, С. В. 3 а-
городний, Усп, хим., 21, № 4, 422 (1952), 24. И. Г. Р ы с с, Химия фтора и его
неорганических соединений, Госхимиздат, 1956. — 25. S. Pawlenko, Z. anorg.
Chem., 340, № 3, 201 (1965). — 26. A. L. McCloskey, H. M. Manasevit,
R. J. Brotherton, пат. США 3180707, 1961; 3180708, 1964,—27. M. Васса-
redda, G. F. Nencetti, Chim. e ind., 42, № 10, 1084 (1960). — 28. E. L. D a n-
c e, T. E. D г i s k о, E. A. McLain, пат. ФРГ 1163300, 1959. — 29. Пат. США
3152869, 1960; 3144306, 1961; 3148030, 1961. — 30. Б. Н. Иванов-Эмин,
Л. А. Нисельсон, И. В. Петрусевич, ЖПХ, 34, № 11, 2378 (1961).
31. Г. В. Самсонов, Ю. Б. Т и т о в, Там же, 36, № 3, 669 (1963).—
32. F. Thevenot, J. С u е i 11 е г о n, Bull. Soc. chim. France, 1968, № 8, 3204.—
33. J. С и e i 11 e г о n, F. T h e v e n о t, ibid., 1965, № 2, 402. — 34. G. Gastello,
E. В i a g i n i, S. M и п a г i J. Chromatogr., 20, № 3, 447 (1965). — 35. Пат. ФРГ
1242580, 1963. — 36. M. Baccaredda, G. F. Nencetti, R. Tartarelli,
Chim. e ind., 47, № 2, 148 (1965); 48, № 1, 24, 30 (1966). —37. J. B. Moffat,
H. L. Goltz, Canad. J. Chem., 43, № 6, 1680 (1965). — 38. Сб. «Неорганические
полимеры», ИЛ, 1961, стр. 379. —39. F. Т. Greene, J. L. Margrave, J. Phys.
Chem., 70, № 7, 2112 (1966). — 39a. A. Kankaanpera, P. Saloman, Acta
chem. Scand., 23, № 2, 712 (1969). — 40. p. H. Kemp, The Chemistry of Borates,
London, 1956.
41. К. H. S chi er, P. W a n g e, пат. ГДР 31302, 1962. — 42. Голланд, пат.
111135, 1955. — 43. Перекись водорода и перекисные соединения, под ред.
М. Е Позина, Госхимиздат. 1951, стр. 129, 340, 381.— 44. А. П. К а з р а г и с,
А. Ю. П р о к о п ч и к, сб. «Химия перекисных соединений», Изд. АН СССР,
1963, стр. 156. — 45. F. Chopin, Р. Hagenmuller, Bull. Soc. chim. France,
1965, № 10, 3031. — 46. А. В. Николаев, Физико-химическое изучение природ-
ных боратов, Изд. АН СССР, 1947. — 47. Н. A. Lehmann, К- Schaarsch-
midt, I. Gunther, Z anorg. Chem., 346, № 1, 2, 12 (1966). — 48. И. Г. P ы с с,
ДАН СССР, 52, 421 (1946). — 49. И. Г. Р ы с с, М М. Слуцкая, Там же 57,
689 (1947). — 50. И. Г. Р ы с с, М. М. Слуцкая, ЖФХ, 21, 549 (1947).
51. И. Г. Рысс, М. М. Слуцкая, С. Д. П а л е в с к а я, ДАН СССР 22,
1322 (1948). —52. А. Р. А 11 s с h u 11 е г, J. Am. Chem. Soc., 77, № 23, 6187
(1955). — 53. И. Г. Рысс, А. Г, Элькенбард, ДАН СССР, 91, № 4, 865
(1953). — 54. A. Bazaroff, Вег., 7, 1121, (1874). —55. Г. И. Петренко,
ЖРФХО, 34, 37 (1902). — 56. И. Г. Рысс, М. М. Слуцкая, Б. С. Витухнов-
ская, ЖПХ, 25, № 2, 148 (1952). —57. А. Д. К е ш а н, Е. М. Шварц, Изв.
АН ЛатвССР, № 8, 107, 137 (1954). — 58. G. Heller, J. Inorg. a. Nucl. Chem.,
27, № 11, 2345 (1965). — 59. Е. М. Шварц, А. Ф. И е в и н ь ш, Изв. АН
ЛатвССР, № 9, 135 (1956). — 60. W. J. Englert, F. A. Hummel, J. Soc. Glass
Technol., 39, № 187, T 121 (1955).
61. W. F. Horn, F. A. Hummel, ibid., T 113.— 52. А. А. Берлин,
В. П. П a p и н и, Хим. наука и пром., 1, № 1, 44 (1956). — 63. W. Н. Zacha-
rias е п, G. Е. Z i g 1 е г, Z. Krist. (А), 83, 354 (1932). — 64. J. Edwards, J.
Am. Chem. Soc., 75, 6151, (1953). — 65. P. J. Antikainen Suomen Kem 30,
№ 4, 1374 (1957). —55. Chem. Eng. News, 55, № 21, 28 (1957). —57. A. Burg,
R. Wagner, J. Am. Chem. Soc., 76, 3307 (1954). — 68. L. M a z e t, Chim. et ind.,
64, № 4, 423 (1950).— 69. А. Д. Ke шан, Синтез боратов в водном растворе и
Их исследование, Изд. АН ЛатвССР, 1955. — 70. \. L. McKinney, Т. Rock-
360
Гл. X. Соединения бора
well, A. S. К i t z е s, W. Q. H u 11 i n g s, U. S. Atomic Energy Comm. Repts
AECD-3625, 40 (1954).
71. Г. В. Самсонов, ДАН СССР, 86, № 2, 329 (1952). —72. A. Roos,
Chim. et. ind., 82, № 3, 339 (1959). — 73. В. Л. Гинзбург, Сверхпроводимость,
Изд. АН СССР, 1946. — 74. Г. А. М е е р с о н, Г. В. Самсонов, ЖПХ, 27, № 10,
1115 (1954). — 75. Л. Я. Марковский, Н. В. Векшина, Там же, 31, № 9,
1293 (1958). — 76. Г. Вуз, Д. Мартин, Химия фтористого бора и его произ-
водных, ИЛ, 1955. — 77. Н. В. Соломин, Л. В. Потемкина, ДАН СССР
90, № 1, 91 (1954). —78. Г. И. Беляев, ЖПХ, 31, № 2, 306 (1958).—
79. Н. И. Г е л ь п е р и н, К. Н. С о л о п е н к о в, Хим. наука и пром., 1, № 3,
324 (1956). — 80. Г. Л. Кореньков, Н. А. Устинова, Горнохимическое'
сырье зарубежных стран, Изд. «Химия», 1965.
81. В. Г. Хлоп ин, Бор и его соединения, ОНТИ, 1919. — 82. J. R е m о n d,
Rev. Prod, chim., 57, № 1208, 451 (1954). — 83. В. В. Яковлева, Борные удоб-
рения и их применение, Сельхозгиз, 1954. — 84. Микроэлементы в жизни растений
и животных, Изд. АН СССР, 1952. — 85. М. В. К а т а л ы м о в, Значение бора в
земледелии СССР, Сельхозгиз, 1948. — 86. Микроэлементы. Тезисы докладов Все-,
союзн. совет, по микроэлементам, Изд. АН ЛатвССР, 1955.— 87. М. В. К а т a-j
лымов, Хим. наука и пром., 1, № 2, 155 (1956). — 88. И. А. Поспелов, Бор-1
ные удобрения на подзолистых почвах СССР, Сельхозгиз, 1947. — 89. К. М. М а-1
лин, ЖПХ, 27, № 3, 230 (1954). — 90. Удобрения, пер. с англ., Изд. «Колос»,
1965.
91. И. А. X р и з м а н, Сообщения о научных работах ВХО им. Д. И. Мен-
делеева, в. 2, 1955, стр. 33. — 92. Н. П. Набоков, И. И. Халтурина, сб.
«Геология и ресурсы агрохимического сырья Казахстана», Алма-Ата, Изд. «Нау-
ка», 1965, стр. ПО. —93. Т. R. Fischer, С. К. McIntyre, Comm. Fertili-
zer, 94, № 6, 34 (1957).—94. Т. П. Унанянц, Вести, техн, и эконом, информ.
ЦИИТЭХИМ, № 5 (1963). — 95. Й. М. Курман, сб. «Большая Эмба», т. I, Изд.
АН СССР, 1937. — 96. С. С. Смирнов, ДАН СССР, 45, № 1, 22 (1944).—
97. А. Е. Ферсман, Геохимия, т. IV, Госхимиздат, 1939, стр. 51. — 98. Н. W al-
ien b е г g, Z. anorg. Chem., 236, 339 (1938). — 99. Т. В. Г а л а х о в с к а я, Труды
ВНИИ Г, в. 52, 1967. стр. 84. —100. Сб. «Химия боратов», Изд. АН ЛатвССР,
1953.
101. Н. A. Lehmann, G. R i е 1 z, Z. anorg. Chem., 350, № 3, 4, 168 (1967).—
102. T. П. Унанянц, Хим. наука и пром., 2, № 6, 774 (1957). — 103. М. L. L е о-
п а г d i, Mining Eng., 6, M 2, 203 (1954). — 104. G. H. В i k 1 e г, D. C. S a w e п e r,
Ind. Eng. Chem., 49, № 3, 322 (1957).— 105. T. П. Унанянц, Хим. пром., № 1,
69 (1961).— 106. И. М. Курман, сб. «Минеральные ресурсы капиталистических
стран», Главгеолтехниздат, 1959, раздел «Бор».— 107. И. С. Львова, сб. «Про-
изводство и потребление минеральных удобрений, фосфора, фосфорной и серной
кислот и борных продуктов в зарубежных странах», изд. НИУИФ, 1964, стр. 115,—
108. W. С. Miller, Bull. Bur. Mines, № 630, 149 (1965).— 109. И. Я К а б а ч-
н и к, Я- Я- Л и д а к, Борная кислота и бура, ГНТЙ, 1931. — 110. Сб. «Бор и ка-
лий в Казахстане», Йзд. АН СССР, 1935.
111. Сборник под ред. П. М. Татаринова, ГОНТИ, 1938.— 112. А. В. Н и^|
колаев, Изв. АН СССР. Сер. хим., № 2, 410 (1938). — 113. И. Н. Л е п е ш-Я
ков, ДАН СССР, 22, № 9, 591 (1939).— 114. А. А. Иванов, Я. Я. Я Р ж е м-1
скнй, Труды ВНИИГ, в. 29, 1954, стр. 210. —115. В. В. Герасимова, Там]
же, в.’29, 1954, стр. 215. — 116. Л. Е. Берлин, Хим. пром., № 4, 98 (1949). — I
117. В. И. Классен, Л. Д. Р а т о б ы л ь с к а я, Там же, № 2, 84 (1954).—1
118. И. А. Щукин, В. П. Соколов, Г. С. Александрова, А. П. Кон-']
стантинова, Обогащение борсодержащих руд, 1937. — 119. В Й. Классен,]
Труды ГИГХС,’195О, стр. 51. — 120. Л Е. Берлин, Производство борной кис-3
лоты, буры и борных удобрений, Госхимиздат, 1950. J
Литература
361
121. Л. Е. Берлин, Хим. наука и пром., 2, № 6, 726 (1957).—
122. Л. Е. Берлин, М. И. Лазарева, Сообщения о научно-технических ра-
ботах НИУИФ, Госхимиздат, 1957, стр. 63.— 123. Т. Я. С а р У х а н я н,
И. В. Фадеева, Сообщения о научно-технических работах НИУИФ, Госхим-
издат, 1957, стр. 64. — 124. В. Е. Г р у ш в и ц к и й, А. Н. Ремина, Билл. Ин-та
галургии, № 8, 18 (1939). — 125. Ю. С. Плышевский и др., Труды УНИХИМ,
в. 7, 1958, стр. 140; в. 8, 1959, стр. 73; Реф. докладов на VIII Менделеевском
съезде, № 1, 141 (1959).— 126. В. Е. Г р у ш в и ц к и й, сб. «Большая Элба»,
т I, Изд. АН СССР, 1937, стр. 651. — 127. Л. Е. Берлин, Там же, работы
НИУИФ. — 128. М В. Голошанов, ЖПХ, 26, № 3, 303 (1953).—
129. А. Б. Б е к т у р о в, В. И. Антонова, Труды Ии-та хим. наук АН КазССР,
т. 1, 1957, стр. 52, 60. — 130. С. И. Вольфкович, Л. Е Берлин, ДАН СССР,
43, № 6, 264 (1944).
131. Франц, пат. 1391910, 1964; Пат. ГДР, 42960, 1961. —132. Правила и
нормы техники безопасности и промышленной санитарии для проектирования,
строительства и эксплуатации производств борной кислоты, буры и борных удоб-
рений, Госхимиздат, 1963. — 133. Л. Е. Берлин, Хим. пром., № 4, 2 (1949).—
134. Л. Е. Б е р л и н, ЖПХ, 28, № 8, 785 (1955). — 135. Л. Е. Берлин, А. А. Со-
коловский, ЖХП, 17, № 8, 21 (1940). —136. А. М. Андреева, С. А. Ку-
зин, ЖПХ, 10, № 5, 845 (1937).— 137. Л. Д. Р а т о б ы л ь с к а я. Хим. пром.,
№ 4, 234 (1958).— 138. М. Р. X а й к и н, Там же, № 3, 82 (1947).—
139. Л. Е. Берлин, Л Ф. Ветрова, Сообщения о научно-исследовательских
работах НИУИФ, Госхимиздат, 1957, стр. 61. — 140. J. D’Ans, К. Н. Behrendt,
Kali u. Steinsalz, 2, № 4, 121 (1957).
141. А. И. Горячкин, Хим. пром., № 3, 82 (1949). — 142. Л. Е. Берлин,
Т. А. С а р у х а н я н, Там же, № 3, 74 (1950). — 143. Б. А. Манол е - Бежав,
Труды НИИ хим. пром., в. 2, Росгизместпром, 1955, стр. 82; ЖПХ, 29, № 8, 1147
(1956). — 144. А. А. Соколовский, Труды ВЗПИ, в. 2, 1952, стр. 35.—
145. А. П. Перова, ЖПХ. 27, № 12, 1275 (1954). — 146. А. П. Перова, Сбор-
ник статей по общей химии, Изд. АН СССР, 1953, стр. 91. — 147. Я. А. У г а й,
ЖПХ, 23, № 5, 482 (1950).— 148. А. Б. Здановский, В. М. Имамутди-
н о в а и др., сб. «Исследования в области химии и технологии минеральных со-
лей и окислов», Изд. «Наука», 1965, стр. 12, 17, 21. —149. Е. Л. Яхонтова,
А. Г. Кузнецова, ЖПХ, 38, № 11, 2401 (1965).— 150. А. Б. Здановский,
В. М. Имамутдинова, Там же, 36, № 8, 1675 (1963); Труды ВНИИГ, в. 52,
1967, стр. 75.
151. G. Schmutzler, J. Kircheisen, Chem. Fechn., 29, № 8, 468
(1968). — 152. Л. E. Берлин, E. M. Абрамова, А. И. Лазарева, Сообще-
ния о научно-исследовательских работах НИУИФ, Госхимиздат, 1957, стр. 58.—
153. G Schmutzler, J. Kircheisen, пат. ГДР 34074, 1963 и 39801, 1964.—
154. Е. П. Ожигов и др., сб. «Материалы по исследованию химического сырья
Дальнего Востока», Изд. АН СССР, 1958, стр. 75.— 155. Е. П. Ожигов и др.,
Реф. докладов на VIII Менделеевском съезде, № 1, 140 (1959). — 156. А. М. По-
ляк, Э. М. Моргунова, Труды УНИХИМ, в. 7, 1958, стр. 124. — 157. U. S b о г-
g I, Е. Bova 1 ini, L. С а р р е 1 i n i, Gazz. chim. ital., 54, 298 (1924).—
158. А. Б. Здановский. Труды ВНИИГ, в. 21, 1949. — 159. D. Е. Garrett,
G. P. Rosenbaum, Ind. Eng Chem., 50, № 11, 1681 (1958). — 160. J. E. T e e p-
1 e, The Industrial Development ol Searles Lake Brines, 1929.
161. Eng. Min. J., 159, № 4, 101 (1958). — 162. Пат. СШД 3336103, 1962,—
163. Швейц, пат. 441247, 1964. — 164. Л. Е. Берлин, М, В. Лыков, Б. Ф. Фе-
дюшкин, А. П. Данилова, авт. свид. 219582, 1964. — 165. J. Kircheisen
пат. гдр 34859, 1964. — 166. G. Schmutzler, J. Kircheisen, Chem. Techn.,
20, M 4, 239 (1968).— 167. Д. Ф. Ризе, А. С. К о р о б и ц ы и, Т. Ф. Куль-
кова, Сборник рефератов докладов IX Менделеевского съезда, № 7, 1965.
СТР- 14. — 168. Л Е. 6 е р л и Н, сб. «Исследования по производству минеральных
362
Гл. X. Соединения бора
удобрений», 1957. —169. Л. Е. Берлин, Н. И. Николаева, Сообщения ’
о научно-исследовательских работах НИУИФ, Госхимиздат, 1957, стр. 55. —'
170. М. Н. Набиев, В. К- Дубовая, Р. А. Манн а ко ва, Узб. хим. ж., № 2 з
(1963).
171. Р. А. М а н н а к о в а, сб. «Физико-химические и технологические иссле-
дования минерального сырья», Ташкент, Изд. «Наука», 1965, стр. 37.—
172. А. В. Николаев, В. Л. Богатырев, Изв. СО АН СССР. Сер. хим. н.,
№ 11, вып. 3, 150 (1965).—173. А. М. Поляк, Л. И. Д е в я т о в с к а я, Труды
УНИХИМ, в. 4, 1957, стр. 50; А. М. Поляк, М. Е. Воронкова, Там же,
стр. 128. — 174. В. Т. Микеров, Т. И. Завертяева, Сообщения о научно-
исследовательских работах НИУИФ, Госхимиздат, 1957, стр. 36.— 175. Л. Е. Бер-
лин, Е. М. Абрамова, Б. Ф. Федюшкин, Сборник рефератов IX Менде-
леевского съезда, № 7, 1965, стр. 16. — 176. К- И. Хренников, В. И. Гутер-
ман, Е. Д. Ярушевич, Л. А. Постникова, Аннотации научно-исследова-
тельских работ ВНИИГ, сб. 1, Госхимиздат, 1956, стр. 36; сб. 2, 1958, стр. 90.—
177. Л. Е. Берлин, сб. «Химия боратов», Изд. АН ЛатвССР, 1953.—
178. Д. И. К У з н е ц о в, ЖПХ, 13, № 9, 1332 (1940). — 179. А. Г. К У р н а к о в а,
сб. «Химия боратов», Изд АН ЛатвССР, 1953. — 180. А. Г. Курнакова, Изв.
СФХА АН СССР, 18, 221 (1949).
181. А. И. С пир яг и на, Труды ВНИИГ, в. 27, 1953, стр. 77.—
182. А. Д. Пельш. Аннотации научно-исследовательских работ ВНИИГ 1951—
1956 гг., 1958, стр. 92. — 183. Е. П. Ожигов, В. С. Лозинская, Сборник
рефератов докладов IX Менделеевского съезда, № 7, 1965, стр. 61. —
184. Е. М. Ш в а р ц, А. Ф. И е в и н ь ш, Там же, стр. 111. — 185. М. Г. Валя ш-
к о, Г. К- Годе, ЖНХ, 5, № 6, 1316 (1960). — 186. Б. П. Никольский,
Е. А. М а т е р о в а, М. Г. В а л я ш к о, Д. С. П о р ы в к и и, А. Л. Г р е к о в и ч,
М. Д. Аникеева, сб. «Современные методы анализа», Изд. «Наука», 1965,
стр. 312.—• 187. А. С. Смирнов, 3. В. Архангельская, ЖПХ, 39, № 10,
2295 (1966). — 188. Н. Н. Д р о з и н, Там же, 25, № 12, 1301 (1952).—
189. П. П. Ф е д о т ь е в, В. С о л н ы ш к и н, Сборник исследовательских работ,
Химтеорет, 1936. стр. 104. — 190. Н. Н. Др оз ин. ЖПХ, 24, № 1, 86 (1951).
191. Н. Е. Хомутов, М Ф. Сорокин, Л. С. Филатова, сб. «Химия
перекисных соединений», Изд. АН СССР, 1963. стр. 140. — 192. G. Remond,
Rev. prod, chim., 57, № 1207, 401 (1954). — 193. Пат. ФРГ 1078101 и 1079603,'
1955. — 194. С. Girsewald, A. Volokitin, Вег., 42, 865 (1906); Chem. Ind.,
33, 100 (1910); 35, 35 (1912). — 195. М. И. Ц а л. Труды ЛТИ им. Ленсовета,
в. 40, 1957, стр. 53. — 196. G. Bretschneider, пат. ФРГ 940348, 1956.—
197. М. С. Максименко, В. Н. Крылов, М. А. Липинский, Труды ЛТИ
им. Ленсовета, в. 15, 1947, стр. 91. — 198. Л. Е. Берлин и др., авт. свид. 199120,
1966. — 199. В. В. Урусов. Е. Н. Дергачева, Сообщения о научно-исследо-
вательских работах НИУИФ, обмен опытом, в. 3, 1957, стр. 61. — 200. Г. А. Ло-
паткина, Г. Н. Богачев, Н. Г. Бляхе р, В. Л. Закутинский, Изв. СО
АН СССР. Сер. хим. н„ № 2, в. 1, 88 (1968).
201. Н. S. Booth, К. S. Wilson, J. Am. Chem. Soc., 57, 2273 (1935).—
202. M. И. Винник, Г. В. Манелис и др., ЖНХ. 1, № 4, 628 (1956).—
203. И. В. Андреева, ЖПХ, 32, № 8, 1855 (1959). — 204. Г. М. П а н ч е н к о в,
В. М. Моисеев, Ю. А. Лебедев, ДАН СССР, 100, № 6, 1103 (1955).
Глава XI
СОЛЯНАЯ КИСЛОТА
Этот так называемый сульфатный
Рис. 111. Общее давление паров над
соляной кислотой разных концентраций
(в вес. %); (пунктирная линия —изоба-
ра 760 мм рт. ст.).
Водный раствор хлористого водорода назвали соляной кисло-
той потому, что издавна его получали из поваренной соли, дей-
ствуя на нее серной кислотой,
способ производства соляной
кислоты долгое время был
единственным. Затем стали по-
лучать синтетический хлорис-
тый водород из хлора и водо-
рода. В настоящее время оба
эти способа утрачивают свое
значение, так как большие ко-
личества хлористого водорода
получаются в качестве побоч-
ного продукта при хлорирова-
нии органических веществ и в
других производствах. В связи
с этим возникла необходимость
изыскания новых путей утили-
зации хлористого водорода и
соляной кислоты.
Во всех случаях производ-
ство соляной кислоты 1 состоит
из двух стадий 1) получения
хлористого водорода и 2) по-
глощения (абсорбции) хлористого водорода водой. Производят
также безводный жидкий хлористый водород.
СВОЙСТВА ХЛОРИСТОГО ВОДОРОДА и соляной кислоты
Хлористый водород НС1 — бесцветный газ. 1 л при 0° весит
1,639 г; плавится он при —114,2°, кипит при —85,1°. Критические
температура и давление равны 51,5° и 81,6 ат. Плотность жидкого
хлористого водорода 0,831 г/см3 при 20° и 1,194 г/см3 при —85,8°.
804
Гл. XI. Соляная кислота
**- -- —
Давление пара над жидким хлористым водородом:
Температура, °C ... . —85,0 —20 0 20 40 51,5
Давление, ат.......... 1,0 14,53 25,46 41,58 64,52 81,6
При 30° жидкий хлористый водород растворяет меньше 0,1%
воды. Молярная теплоемкость газообразного хлористого водорода
при постоянном давлении вычисляется по формуле Ср = 6,5+ 0,001 Т.
Рис. 112. Давление НС1 над соляной
кислотой в зависимости от температуры
> и содержания НС1 (в вес. %) в ра-
Во влажном воздухе хлори-
стый водород образует густой
туман — мельчайшие капли со-
ляной кислоты. Вредно дей-
ствует на организм, раздражая
и разрушая слизистые оболоч-
ки и дыхательные пути. Пре-
дельно допустимая концентра-
ция НС1 в воздухе рабочей зо-
ны производственных помеще-
ний 0,01 мг)л (С12—0,001 мг/л).
Безводный хлористый во-
дород почти не действует на
металлы, соляная же кислота
растворяет большинство метал-
лов. В соляной кислоте устой-
чивы платина, золото, тантал,
ниобий, некоторые силикатные
минералы (андезит, диабаз,
кварц) и изделия (стекло, ке-
рамика, фарфор), а также эбо-
нит, резина, некоторые пласти-
ческие массы, например, фао-
лит, винипласт, тефлон и др.
Углеродистая сталь, нагретая
до 300—400°, и нержавеющие
стали 1Х18Н9Т и ЭИ-496, на-
гретые до 500°, удовлетвори-
тельно устойчивы к соляной ки-
слоте2’3. Окислы металлов
превращаются газообразным
хлористым водородом в хлори-
створе. ды; реакции ускоряются в при-
сутствии водяного пара 4.
Растворимость хлористого водорода в воде очень велика и
еильно зависит от температуры; при общем давлении 760 мм рт. ст.-.
'емпература, °C......... 0 10 20 30 40 50 60 .1
1исло литров НС1, погло- :Я
щаемых 1 л воды . . . 506,5 473,9 442,0 411,5 385,7 361,6 338,7 я
Свойства хлористого водорода и соляной кислоты
365
При парциальном давлении НС! в газе 760 мм рт. ст. 1 л воды
при 0° растворяет 525,2 л НС1 (в растворе 46,15 вес.% НО), при
18° — 451,2 л НС1 (в растворе 42,34 вес. % НС1). Общее давление
паров и давление НС! над соляной кислотой приведены на рис. 111
и 112. Теплоты растворения НС1 в воде могут быть вычислены с
помощью рис. 113.
Равновесное давление НС1 над соляной кислотой понижается
при внесении в раствор CuCl, NH4CI и повышается в присутствии
TiCh, SnCl2, SnCU. Предпола-
гают, что в системах CuCl —
НС1 - Н2О, CuCl — NH4CI —
— НС1 —Н2О, NH4CI — НС1 —
— Н2О образуются соединения
соответственно: 2СиС1 • НС],
CuCl • 2NH4CI, NH4CI • пНС!
(и—зависит от температуры) 6.
В системе СиС12—НС!—Н2О
при неизменной температуре
давление пара Н2О уменьша-
ется с возрастанием содержа-
ния в растворе как НС1, так и
СиС12. Это указывает на то, что
в системе происходит высали-
вание СиС12 и НС1. В системе
ZnCl2—НС1—Н2О взаимодей-
ствие компонентов более слож-
ное—в области Одних концент- Рис. 113. Интегральная S и дифферен-
раций происходит высалива- циальиая Ф теплоты растворения газо-
ние, в области других - всали- образного НС1 в соляной кислоте,
вание отдельных компонентов6.
Для давления паров в системе НС1—Н2О характерен минимум,
соответствующий азеотропной смеси, состав которой зависит от
температуры кипения (давления). Азеотропная смесь, кипящая при
ТАБЛИЦА 28
Концентрации азеотропных растворов в системе НС1—Н2О
Давление, рт» ст. НС1, % Давление, мм рт. ст. НС1, % Давление, мм рт. ст. HOI, и Давление, ММ рт. ст. НС1, %
50 23,2 700 20,4 1200 19,3 2000 18,5
100 22,9 760 20,24 1400 19,1 II 2100 18,4
200 22,3 800 20,2 1600 19,0 2200 18,3
300 21,8 900 19,9 1600 18,9 2300 18,2
400 21,4 1000 19,7 1700 18,8 2400 18,1
500 21,1 1100 19,5 1800 18,7 2500 18,0
600 20,7 1200 19,4 1900 18,6
366
Гл. XI. Соляная кислота
110° (под давлением 760 мм рт. ст.), содержит 20,24 вес. % НО,
при 75,9—22,15%, при 55,2—23,2%, при 19,9—24,6% 7 (см. также
табл. 26).
Температуры кипения соляной кислоты при давлении
760 мм рт. ст. приведены в табл. 27.
ТАБЛИЦА 27
Температуры кипения соляной кислоты при 760 мм рт. ст.
Концентрация кислоты, мол. % НС1 Температура кипения, °C Концентрация кислоты, мол. % НС1 Температура кипения, °C
2,0 101,8 12,0 109,0
4,0 103,3 14,0 105,2
6,9 105,3 17,0 92,0
8,0 108,0 18,5 82,7
10,5 109,7 26,3 19,0
активности
соляной кислоты приведены в
Коэффициенты
табл. 28 (см. также8).
ТАБЛИЦА 28
Средние коэффициенты активности HCI
в водных растворах
Концентрация НС1 в молях иа 1 кг воды Температура, °C
0 20 40 60
0,01 0,9065 0,9052 0,9016 0,8987
0,1 0,8027 0,7985 0,7891 0,7813
0,5 0,7761 0,7616 0,7432 0,7237
1,0 0,8419 0,8162 0,7865 0,7541
2,0 1,078 1,024 0,9602 0,9072
3,0 1,452 1,345
4,0 2,000 1,812
В системе НС1—Н2О установлено существование двух эвтектик:
при -74,7° с 23,0% НС1 и при —73,0° с 26,5% НС1. Между эвтек-
тиками находится ветвь кристаллизации конгруэнтно плавящегося
при —70° гексагидрата НС1 • 6Н2О. Метастабильная эвтектика
лед — НС1 4Н2О находится при —87,5° и содержит 24,8% НС19.
В системе НС1—Н2О существуют кристаллогидраты10’11:
НС1 • 8Н2О, НС1-4Н2О, НС1-ЗН2О" (/пл -24,4°), НС1 • 2Н2О
,(/Пл —17,7°), НС1 • Н2О (/пл —15,35°). Лед кристаллизуется из
40%-ной кислоты при —20°, из 15%-ной при —30°, из 20%-ной при
— 60°, из 24 %-ной при —80°.
Свойства хлористого водорода и соляной кислоты
367
Плотность соляной кислоты при 15°:
Концентрация НС1, % . . 10,17 20,01 30,65 39,11
Плотность, г'см^....... 1,050 1,100 1,155 1,200
Удельная теплоемкость с соляной кислоты, содержащей п мо-
лей воды на 1 моль НС1
п . . ....... 5,2 10 20 50 100 200
с.............. 0,660 0,749 0,855 0,932 0,9б4 0,970
Вязкость 2 н. соляной кислоты в 1,12 раза, а 12 и. кислоты в
2,14 раза больше вязкости воды.
Растворимость хлора в соляной кислоте при 21® и парциальном
давлении хлора 760 мм рт. ст.-.
Концентрация кислоты, г-экв НС1/л . . 0 0,1 1,0 3,0 6,0 9,0
Объем хлора (0°, 7б0 мм рт. ст.), раст-
воряющийся в 1 объеме кислоты . . 2,117 1,48 1,61 2,16 2,90 3 85
Давление хлора над его раствором в 36,3%-ной соляной кислоте
при 20° и при концентрации хлора 1,об г/л составляет 141 мм рт. ст.,
а при 7,82 г/л— 551,8 мм рт. ст., н в этих пределах изменяется
пропорционально концентрации хлора ’2.
Отношение равновесной концентрации хлора в газовой фазе к
концентрации его в 1 н. соляной кислоте (коэффициент распреде-
ления) при 20° является величиной постоянной, равной
5,3- 105 мм рт. ст./мольные доли 13.
Число объемов (0°, 760 мм рт. ст.) водорода, кислорода и дву-
окиси углерода, растворяющихся в 1 объеме соляной кислоты при
25°, при парциальном давлении этих газов 760 мм рт. стл
Концентрация кислоты, г-экв НС1/л 0
Растворяется Н2....................0,01754
» О2 ........................ 0,02831
» СО2........................0,759
0,5
0,0170
0,0271
0,738
1
0.0164
0,0263
0,732
2
0,0154
0,0345
0,728
3
0,0146
О растворимости НС1 в серной кислоте можно судить по дан-
ным’4 равновесия в системе НС1—H2SO4—Н2О (табл. 29).
В водной системе Na2SO4-l-2HCl«»2NaCl-|-H2SO4 при 25° уста-
новлено наличие поля насыщения у газообразного компонента
—НС1. В растворе с максимальной концентрацией серной кислоты,
находящейся в равновесии с NaCl и соляной кислотой при парци-
альном давлении НС1, равном 1 ат, содержится (в вес. %):
H2SO4 — 53,8, NaCl — 5,5, НС1- 0,8. При взаимодействии газооб-
разного хлористого водорода с декагидратом сульфата натрия вы-
деляется поваренная соль и в растворе образуется серная кис-
лота, содержащая 28% H2SO4,18% НС1 и 2,3% NaCl. Выход H2SO4
достигает 90—97% 1В.
368
ТЦ. XI. Соляная кислота
ТАБЛИЦА 29
Равновесные концентрации в системе HCl—H2SO4—Н2О
(в вес. %; рНС1 — в мм рт. ст.)
t = 0° РНС1 ~ 760 i — 25° t - 70° PHC1 “ 760 f-25° PHC1 “ 230 t = 25°
РНС -760 PHC1 = 45
H2SO4 НС1 H2SO4 НС1 H2SO4 HCl H2SO4 HCl H2SO4 HCl
30,60 25,83 32,5 18,7 20 22,3 29,1 16,8 21,9 12,2
57,36 9,81 68,1 2,7 36,2 13,2 40,0 11,2 31,8 9,1
65,76 4,94 81,75 0,142 48,0 6,99 51,9 5,6 42,3 5,9
68,96 3,27 89,23 0,092 62,7 1,56 58,0 3,3 53,5 2,8
74,66 1,48 94,03 0,108 67,6 0,54 64,0 1,5 59,2 1,4
82,97 0,26 98,45 0,197 80,7 0,05 69,7 0,4 64,7 0,5
95,82 0,188 99,6 0,402 83,4 0,032 76,3 0,1 69,9 0,1
Газообразный НС1 при парциальном давлении НС1, меньшем
0,1 мм рт. ст., быстро сорбируется смесью Na2SO4+Na2SO4 • ЮН2О,
по-видимому, с образованием твердого раствора NasSC^ + NaCL
Безводный Na2SO4 не взаимодействует с газообразным НС1 при
низких давлениях и начинает медленно реагировать лишь при дав-
лении НС1, превышающем 2 ат 16.
ПРИМЕНЕНИЕ
Соляную кислоту применяют в химической промышленности
для выработки хлористых солей цинка, кальция, бария, аммония и
других и органических продуктов — анилина, дифениламина и про-
чих, для выработки синтетического каучука (хлоропрена), краси-
телей, для омыления жиров и масел. Соляную кислоту применяют
йри получении гидролизного спирта и глюкозы из крахмала, в про-
изводстве сахара, желатина и клея, при дублении и окраске кож,
в производстве активированного угля, при крашении тканей, для
травления металлов (снятия окислов с их поверхности) при метал-
лообработке, в различных гидрометаллургических процессах, в
гальванопластике, в нефтедобыче для увеличения дебита скважин,
для консервирования кормов (в Японии) и т. д. Жидкий и газооб-
разный хлористый водород применяют для гидрохлорирования раз-
личных органических соединений с целью получения хлористого
этила C2H5CI, хлорвинила СН2СНС1 из ацетилена, этиленхлоргид-
рина, синтетической камфоры и др.
В США производят более 1,3 мли. т в год соляной кислоты
(100% НС1)17.
Выпускают несколько сортов техничеекой соляной кислоты
,(табл. 30). г'"~'
Применение
369
ТАВЛИЦА зо
Требования к качеству соляной кислоты
(содержание компонентов в %)
Содержание НС1,не менее
Максимальное содержание
примесей:
серной кислоты (SO3)
серной кислоты (SO4)
железа (Fe)........
мышьяка (As) ....
свободного хлора (С12)
остаток после прока-
ливания ..........
ртути (Hg).........
Техническая
по ГОСТ
1382-69
1-й
сорт
31,0
0,4
0,1
0,005
Синтетическая техническая
по ГОСТ 857-69
по ГОСТ 5.1691-72
(аттестованная про-
дукция)
2-й
сорт
27,5
0.8
0,3
0,01
марка
0,005
0,02
0,005
0.003
35,0—
38,0
марка Б марка В марка А марка Б марка В
31,5 31,0 35,0 33,0 32,0
0,005 0,03 0,005 0,005 0,008
0,003 0,02 0,003 0,003 0,008
0,0001 0.0001 0,0002
0,005 0,01 0,003 0,003 0,008
0,02 0.15 0,015 0,015 0,08
0,0005 0,0005 0,0005
Очистка разбавленных растворов соляной кислоты (до 5 М) от
соединений железа может быть произведена с помощью анионооб-
менной смолы, которую регенерируют промывкой водой 18. Очистку
концентрированной технической соляной кислоты (с концентра-
цией больше 32% НС1) от ионов Fe3+, Fe2+и SO2-— предложено про-
изводить катионообменной смолой, приготовленной на основе фе-
нола 19.
Показана возможность очищать соляную кислоту от железа
экстракцией бутилацетатом — при содержании Fe(III) 10—‘IZzJa
степень извлечения его превышает 99,9% 20. Летучие примеси можно
выдувать из соляной кислоты воздухом.
Соляную кислоту транспортируют в стальных гуммированных
цистернах и бочках и в фаолитовых контейнерах, а также в стек-
лянных бутылях емкостью не более 40 л. Бутыли помещают в пле-
теные из прутьев корзины или деревянные обрешетки, выложенные
соломой или древесной стружкой. Хранят соляную кислоту в сталь-
ных гуммированных резервуарах, а также в резервуарах, защищен-
ных' фаолитом и винипластом21. Использование гуммированных
цистерн и резервуаров сильно упрощается при осуществлении вул-
канизации обкладки без давления при низкой температуре22.
В отдельных случаях для транспортировки и хранения НС1, а
также для санитарных целей может представить интерес поглоще-
ние хлористого водорода сульфатом меди или свинца, из которых
он потом выделяется при нагревании23.
870
Гл. XI. Соляная кислота
К техническому сульфату натрия, получаемому в соляно-суль-
фатном производстве, по ГОСТ 1363—47 предъявляются следую-
щие требования (в %):
I сорт П сорт
Na2SO4, не менее................................ 95 91
H2SO4, не более............................... 1,5 3,5
NaCl » » . . ............................ 1,2 3,5
Fe » » ................................. 0,2 0,25
Не растворимый в воде остаток, не более ... 0,3 0,8
ИНГИБИРОВАННАЯ СОЛЯНАЯ КИСЛОТА
Некоторые органические вещества, добавленные к соляной кис-
лоте, сильно тормозят растворение ею металлов. Такие вещества
называются ингибиторами 24-33. Чем концентрированнее кислота,
тем с меньшей скоростью она растворяет металл в присутствии не-
значительного количества ингибитора, но тем более стойким дол-
жно быть вещество, применяемое в качестве ингибитора. К числу
распространенных относятся ингибиторы ПБ — полимеры бутил-
имийа. Тормозящее действие ингибиторов объясняется адсорбцией
органического вещества на поверхности .металла, в результате ко-
торой образуется защитный слой, повышающий перенапряжение
выделения водорода на металле. Большинство ингибиторов прояв-
ляет свое защитное действие ниже 70—80°30. Представляют инте-
рес ингибиторы, стойкие при более высоких температурах (до
100—110°); к ним относятся, например, уротропин, акридин, «пе-
нореагент» ПР-1 и др.31 Так как стойкость ингибиторов в концен-
трированной и горячей кислоте невелика, то ингибированную кис-
лоту выпускают с концентрацией 19—20% НС1 в летнее время и
до 25% НС1 зимой. Она содержит 0,8—1% ингибитора ПБ-5 и
0,01—0,015% соли мышьяка (в пересчете на As), усиливающей
действие ингибитора. Содержание свободного хлора не должно
превышать 0,1%, а солей железа — 0,01%. Цвет кислоты — светло-
коричневый. Процесс приготовления ингибированной кислоты за-
ключается в следующем: кислоту разбавляют водой, добавляют
раствор Na3AsO3 или AsCl3 и смешивают с раствором ингибитора
в кислоте.
Ингибированная кислота растворяет сталь в десятки и в сотни
раз медленнее, чем неингибированная. Средняя скорость растворе-
ния стали в ингибированной кислоте не превышает 0,15 г/(ж2-ч),
что соответствует уменьшению толщины стенок резервуара всего на
0,16 мм в год. Однако пары ингибированной кислоты разрушают
не защищенную от коррозии сталь. Ингибиторы не оказывают за-
щитного действия также на линии раздела фаз (жидкой и газо-
вой) ; относительно менее устойчивы и сварные швы. В этом отно-
шении гуммированные емкости имеют преимущества.
Применение ингибированной кислоты особенно удобно, когда
оно не связано с необходимостью растворять металлы; в последних
Получение хлористого водорода
371
случаях ингибитор предварительно должен быть разрушен на-
греванием кислоты. В процессах травления ингибированная
кислота легко (с такой же скоростью, как и неингибированная)
очищает поверхность черного металла от ржавчины, окалины, на-
кипи и других отложений, растворимых в соляной кислоте; в от-
сутствие ингибитора этот процесс может сопровождаться разруше-
нием металла, особенно в местах клепанных и сварных швов изде-
лий из углеродистых и некоторых легированных сталей.
Ингибированную соляную кислоту перевозят в стальных желез-
нодорожных цистернах и в автоцистернах, окрашенных изнутри
химически стойкой эмалью ХСЭ-93 в три слоя и лаком ХСЛ-93 в
два слоя. Ими же окрашивают хранилища ингибированной кис-
лоты.
ПОЛУЧЕНИЕ ХЛОРИСТОГО ВОДОРОДА
Сульфатный способ
Сырье
Сырьем для получения хлористого водорода и сульфата натрия
служат поваренная соль (обычно измельченная каменная соль —
бузун) и купоросное масло — 92—93%-ная серная кислота. Менее
концентрированную серную кислоту не применяют, так как в этом
случае хлористый водород был бы чрезмерно разбавлен парами
воды, что затруднило бы получение концентрированной соляной
кислоты. Применение крупнозернистой выварочной соли предпо-
чтительнее вследствие ее пористости — она легко пропитывается
кислотой с образованием однородной массы. Однако выварочная
соль содержит переменное количество влаги, что затрудняет дози-
ровку сырья и регулирование температурного режима печей. Ка-
менная соль характеризуется постоянной влажностью, но она бо-
лее загрязнена примесями CaSOi, Fe2O3 и другими (см. гл. III),
переходящими в сульфат натрия. Помимо этого, применение камен-
ной соли связано с необходимостью ее измельчения и более интен-
сивного перемешивания с серной кислотой34.
Физико-химические основы взаимодействия
хло'ристогонатрия с серной кислотой
Реакция между хлористым натрием и серной кислотой
2NaCl + H2SO4 = Na2SO4 + 2НС1
— эндотермическая. При применении серной кислоты концентра-
цией меньше 100% расход тепла на реакцию увеличивается за счет
дегидратации серной кислоты. В табл. 31 приведены значения теп-
лового эффекта Д/7 и изменения изоба? ого потенциала AZ для
372
Гл. XI. Соляная кислота
некоторых реакций взаимодействия NaCl с серной кислотой и кис-
лыми сульфатами натрия при различных температурах88.
ТАБЛИЦА 31
Значения АН и AZ реакций взаимодействия хлористого натрия с серной
кислотой и кислыми сульфатами натрия
№ Реакция i, °C ДЯ, кал/моль. ДИ, кал/моль
1 2NaCI + H8SO4 (ж., 100%) - Na2SO4 + 2НС1 (г.) 25 12 130 -3 120
227 9615 -12 820
2 2NaCl + H8SO4 (ж., 03%) = 25 19 560 -290
= Na2SO4 + 2НС1 (г., 0,83 ат) + 0,41 Н2О (г., 0,17 ат) 100 18 370 -5 190
227 16 080 -13 020
327 . 13 960 -18 670
8 NaCl + H2SO4 (ж., 100%) = 26 -950 -6 990
= NaHSO4 + HCl (г., 1 ат) 186 — 2 580 -9 960
4 NaCl + H2SO4 (ж., 93%) = NaHSO4 + 26 6 400 -4 000
+ НС1 (г., 0,71 ат) + 0,41Н2О (г., 0,29 ат) 186 4 100 -9 150
б NaCl + 2NaHSO4 = Na3H(SO4)2 + НС1 (г.) 25 10 450 2 930
138 9 840 170
144 9 800 0
186 9 580 -950
в NaCl + Na3H(SO4)2 = 2Na2SO4 + HC1 (r.) 25 15710 4 850
127 15 240 1 270
160 15 260 120
227 15 440 -2 230
270 15 690 -3 760
Взаимодействие хлористого натрия с серной кислотой начи-
нается даже при 0° с выделением в газовую фазу почти безводного
НС1, но быстро прекращается; жидкая фаза представляет собой
раствор образовавшегося сульфата натрия в серной кислоте. При
нагревании реакция возобновляется — одновременно с хлористым
водородом удаляется водяной пар вследствие дегидратации серной
кислоты. Обезвоживание жидкой фазы облегчается тем, что рас-
творение образующегося сульфата натрия в серной кислоте повы-
шает равновесное давление водяного пара.
В системе Na2SO4—H2SO4—Н2О при 25° существуют следую-
щие твердые фазы: Na2SO4 • 10Н2О, Na2SO4 • 4,5Н2О, Na2SO4,
NasH(SO4)2, NaHSO4-H2O, NaHSO4 и NaH3(SO4)2• H2O. При 0s
существуют эти же фазы и H2SO4-H2O; NaH3(SO4)2 • Н2О нахо-
дится в метастабильном состоянии, имеется метастабильная фаза
Na2SO4-5,5Н2О36. Однако поскольку реакцию с хлористым нат-
рием ведут при высокой температуре и используют концентриро-
ванную серную кислоту, содержащую очень мало воды, вскоре
удаляющейся в газовую фазу, практически процессы идут в без-
Получение хлористого водорода
373
водной системе. В зависимости от температуры реакционной массы
образующийся сульфат натрия может полностью оставаться в
жидкой фазе или частично кристаллизоваться из нее в виде кис-
лых солей: 2Na2SO4 • 9H2SO4, Na2SO4 • 2H2SO4, Na2SO4-H2SO4 (би-
сульфат или гидросульфат натрия NaHSO4) и 3Na2SO4 • H2SO4
[тринатрийгидросульфат Na3H(SO4)2]. Нейтральный сульфат кри-
сталлизуется только в заключительной стадии процесса37.
На рис. 114 дана диаграмма растворимости в двойной системе
H2SO4—Na2SO4 37. Молярные проценты Na2SO4 (верхняя шкала)
численно равны степени превращения NaCl в Na2SO4. Раствори-
мость сульфата натрия в серной кислоте сильно возрастает, начи-
ная от 4% (вес.) при 0° до 59% при 186°. При повышении темпе-
ратуры до 270° растворимость увеличивается до 67%. . ,
Во избежание преждевременного затвердевания реакционной
массы необходимо, чтобы температура на каждой стадии процесса
была не ниже той, при которой исчезает жидкая фаза. Реакция в
сульфатных печах протекает с высокой интенсивностью, если тем-
пературные условия не допускают значительной кристаллизации
промежуточных кислых сульфатов натрия. Так, если успела проре-
агировать третья часть хлористого натрия, а температура при этом
еще не достигла 109°, вся масса затвердевает в смесь кристаллов
NaCl и Na2SO4 • 2H2SO4. Когда в некоторой зоне печи, где темпе-
ратура ниже 186°, NaCl прореагировал на 50%, там будут нахо-
диться в твердом состоянии хлористый натрий и бисульфат нат-
рия— жидкая фаза будет отсутствовать. Если NaCl прореагировал
на 75% и температура будет ниже 270°, реакционная масса пол-
ностью затвердевает, образуя конгломерат, состоящий из остатка
NaCl и Na3H(SO4)2. Последний особенно часто образуется в суль-
фатных печах. Выше 270° тринатрийгидросульфат инконгруэнтно
плавится, и освобождающаяся серная кислота реагирует с остав-
шимся хлористым натрием — появляется кристаллический ней-
тральный сульфат натрия.
ТАБЛИЦА 32
Примерное содержание NaCl и NaaSO<
в реакционной массе при различной степени
разложения NaCl
NaCl, вес. К NajSOj, вес. К Степень разложения NaCl, %
25,2 38,3 55,6
22,0 61,0 69,6
9,3 81,7 88,0
5,7 86,7 92,6
2,8 90,7 96,4
374
Гл. XI. Соляная кислота
Изменение содержания NaCl
и Na2SO4 в реакционной массе
и
степень разложения хлористого натрия по мере взаимодействия
с серной кислотой показаны в табл. 32 37.
Реакции, рассмотренные в табл. 31, являются обратимыми, т
его
газообразный хлористый водород может вытеснять серную кислот
из нейтрального и кислых сульфатов. Равновесное давление НС1 :
Рис. 114. Политерма растворимости в си-
стеме H2SO4—Na2SO4.
Вес. %
Рис. 115. Политерма раство-
римости в системе
H2SO4-K2SO4.
системе
lgP=*-
при 144°
NaCl + 2NaHSO
2241,2т-1+5,37;
1 ат, при 186°
4 (реакция 5) вычисляется
оно равно при 25° 0,007 ат, при
по формуле
138°
3,09 ат.
Равновесное давление
0,83 ат
НС! в си
стеме NaCl—Na3H(SO4)2 (реакция 6):
t, °C.............. 25 127 160 227 270
Р, ат..............27-10“4 0,202 0,87 9,4 32,6
Получение НС1 взаимодействием H2SO4 с КС1,
в отличие от
NaCl, требует несколько более высоких температур (на 100—
для своего завершения. На рис. 115
H2SO4—K2SO438’39. Для полного
150°
приведена политерма
разложения остатков
системы
фазы в этой системе требуется нагреть ее до 700—750°.
жидкой
Получение хлористого водорода
375
Сульфатные печи 40 48
Реакцию между поваренной солью и серной кислотой осуществ-
ляют в механических или во вращающихся печах. Механическая
сульфатная печь (рис. 116) представляет собой муфель, под (чаша)
12 и свод 11 которого сложены из фасонных огнеупорных и кисло-
тостойких шамотных плит. Под муфелем и над ним расположены
дымоходы. Толщина плит пода 120 мм; свод муфеля для облегче-
ния передачи тепла к реакционной массе делают более тонким —
30 мм. Внутреннюю кладку печи и топки выполняют из шамотного,
а наружную — из простого кирпича. Под печью расположен привод
мешалки. Наиболее распространены печи с диаметром муфеля
4,25 м; длина и ширина печи равны 5,7 м, высота 5,2 м; поверх-
ность нагрева свода 14 ,ч2, реакционный объем 1,8 ,ч3. Поваренная
соль через загрузочную воронку непрерывно поступает в центр
муфеля с помощью шнекового питателя 8. .Туда же по трубе по-
дается купоросное масло. Оно поступает в укрепленный на головке
вала и вращающийся вместе с ним распределитель 13 кислоты —
«гусек», имеющий форму чайника, через носик которого сливается
в муфель. Перемешивание поваренной соли и кислоты и передви-
жение реакционной массы по поду муфеля от центра к периферии
производится укрепленной на чугунном валу 15 мешалкой с че-
тырьмя плечами, расположенными крестообразно, на каждом из
которых имеется по два (всего восемь) термосилидовых или чугун-
ных гребков с керамическими41 или карборундовыми наконечни-
ками (ножами, зубьями)42. Вращение вала (0,75—1,25 об/мин)
производится через зубчатую передачу электромотором мощностью
4,5 кет при диаметре муфеля 4,25 м и 6,8 кет при диаметре муфеля
5,5 м.
Обогрев муфеля, температуру в котором поддерживают в пре-
делах 500—550°, производят дымовыми газами, имеющими темпе-
ратуру 950—1100°. Газы поступают из топки 1, примыкающей к
муфельной печи. Дымовые газы уходят из-под чаши муфеля с тем-
пературой ~700° через два борова. Образовавшийся в муфеле
сульфат натрия попадает через люк 17 в холодильно-размольный
барабан 18 или в трубчатую шаровую мельницу с водяной рубаш-
кой. Измельченный и охлажденный сульфат натрия ссыпается на
транспортер (или в вагонетку) и отправляется на склад. При нор-
мальном режиме сульфат натрия перед выходом из печи имеет
лимонно-желтый цвет, в отличие от сероватого цвета, характерного
Для «сырого» сульфата, образующегося при низкой температуре
в муфеле. Уходящий из муфеля хлористоводородный газ имеет
температуру 375—400° Теоретический состав этого газа при ис-
пользовании для разложения поваренной соли 93%-ной серной
Кислоты — 83% НС1 и 17% водяного пара; в сухом же газе дол-
жно содержаться 100% НС1. Однако вследствие того, что внутри-
378
Гt. XI. Соляная кислота
Дымовые газы
Рис. 116. Механическая сульфатная печь (вертикальные разрезы):
J —шахтная топка: 2 —загрузочная коробка для топлива; 3 — колосниковая решетка:
4 — зольник; 5 —топочный Порог; 6 — канал для вторичного воздуха: 7 — загрузочная
воронка для соли; 8 - загрузочный шнек для солн; 9 — солевая труба; 10 - кислотная
труба; 11 — свод Муфеля; 12 — под муфеля; 1'1 — питатель-распределитель кислоты («гусек»
нли «чайник»); И —головка мешалки; 15 — вал мешалки; 16 — коронная шестерня при-
вода мешалки; 17 — люк для выхода сульфата натрия; 18 — холодильно«размольный
барабан для сульфата; 19 -труба для отвода хлористого водорода.
Получение хлористого водорода
377
муфеля поддерживают вакуум 1—2 мм вод. ст. (во избежание про-
никновения газа в атмосферу цеха), происходит подсос в муфель
воздуха и дымовых газов и фактическая концентрация НС1 в сухом
газе колеблется на уровне 30—40%. При хорошем уплотнении му-
феля концентрация НС1 в газе может быть повышена до 50% и
выше43. Газ из сульфатной печи загрязнен парами серной кислоты,
сульфатной пылью, летучими соединениями мышьяка, переходя-
щими из серной кислоты.
Производительность сульфатной механической печи зависит от
размеров муфеля, от числа оборотов вала, температуры в муфеле
и других условий режима работы. При диаметре муфеля 5,5 м печь
дает до 12—14 т, а при диаметре муфеля 4,25 м 9—Ют сульфата
натрия в сутки. Выработка сульфата натрия составляет 0,59—0,64 т
на 1 т 27,5% соляной кислоты. Суточная производительность 1 м2
пода печи достигает 500—540 кг перерабатываемой поваренной
соли. При замене шамотного свода муфеля карборундовым, имею-
щим большую теплопроводность, производительность сульфатной
печи возрастает примерно на 30% 44 (по другим данным, на
35—40%). Аналогичные результаты дает и свод, выполненный из
ферросилициевых плит.
Механические сульфатные печи работают в очень жестких усло-
виях, — детали их подвергаются действию агрессивной среды при
высокой температуре. Это вызывает необходимость их ежегодной
остановки на ремонт.
Муфельный свод работает до 10 лет45. Под муфеля перести-
лают чаще — он подвергается механическому износу под влиянием
работы гребков и периодических чисток печи от сульфата натрия
(через 2,5—3 месяца) и может служить без ремонта до трех лет46.
Недостаточно хорошие условия теплопередачи через стенку му-
феля механической печи не обеспечивают интенсивного протекания
последней стадии процесса — превращения тринатрийгидросуль-
фата в сульфат, требующего высокой температуры. Интенсивно
протекает лишь образование тринатрийгидросульфата, не требую-
щее температуры выше 200—250°. Процесс можно значительно ин-
тенсифицировать, осуществляя в механической печи только первую
его стадию и перенеся вторую в трубчатую вращающуюся печь с
противоточным нагревом массы непосредственно дымовыми газами
до 600—700°. При этом 70—75% НС1 будет выдаваться из муфель-
ной печи в виде газа высокой концентрации (выше 50%), а осталь-
ные. 25—30%—из вращающейся печи, разбавленные продуктами
горения топлива37. Впервые вращающаяся печь была использована
в соляно-сульфатном производстве именно для второй стадии про-
цесса ".
Получение сульфата натрия и хлористого водорода в одну ста-
дию во вращающихся трубчатых печах с внутренним нагревом ре-
акционной массы топочными газами47 осложнено образованием
3Z8
Гл. XI. Соляная кислота
в зоне печи, где реакционная масса имеет температуру 186—270°,
налипающего на стенки твердого тринатрийгидросульфата. Силь-
ный прогрев и хорошее перемешивание массы в той зоне печи, где
степень превращения повышается от 50 до 75%, устраняет это на-
липание. Хлористый водород из вращающихся печей сильно раз-
бавлен топочными газами — концентрация НС1 в газе около 5%,
что, однако, достаточно для получения стандартной кислоты.
Преимуществом вращающихся печей является их большая про-
изводительность— при работе на 93%-ной серной кислоте печь,
имеющая длину 12 м и диаметр 1,5 м, выдает 25 т сульфата в сут-
ки. Площадь печного цеха, оборудованного вращающимися печами,
в 3—3,5 раза меньше площади цеха равной производительности,
оборудованного механическими муфельными печами.
В США в производстве сульфата натрия и соляной кислоты
получила сравнительно большое распространение вращающаяся
печь типа Лоури. На одном конце эта печь имеет откатывающуюся
нефтяную или газовую топку, на другом, холодном, конце произво-
дится загрузка сырья — поваренной соли и бисульфата натрия.
Холодная часть печи служит для смешения сырья и отделена от
горячей части чугунной пластиной, в центре которой имеется от-
верстие (0,6 м) для прохода газов и прорези у периферии для про-
хода реакционной массы; в этой части печи выделяется около 25%
Реакция протекает в основном
высокой
хлористого водорода.
при
температуре в горячей части печи, что предотвращает налипание
больших количеств материала на стенки печи. Для получения ка-
чественного, т. е. рыхлого и пористого сульфата натрия темпера-
туру в горячем конце печи поддерживают выше 600°, но ниже точку
плавления сульфата, т. е. 890°48.
На выработку 1 т 27,5%-ной соляной кислоты и соответствую-
щего количества сульфата натрия затрачивается: 0,47—0,53 т солг
(97% NaCl), 0,40—0,42 т серной кислоты (93% H2SO4); расхо;
условного топлива (7000 ккал/кг) в механических муфельных пе-
чах 0,19—0,22 т (во вращающихся печах 0,12 т), электроэнергии ~
~43 кет • ч, воды ~ 14 м3.
При переработке в механических сульфатных печах хлористого'
калия на 1 т 100%-ного НС1 в виде соляной кислоты получают 1,22 т
К2О в виде сульфата калия; при этом расходуется: 2,21 т хлори-
стого калия (95% КС1), 1,62 т серной кислоты (98% H2SO4), 0,665 т i
мазута, 0,67 мгкал пара, 105 кет • ч электроэнергии. При пере-
работке хлористого калия происходит более сильная коррозия
печей (муфеля), чем при работе с NaCl.
Предложен видоизмененный сульфатный способ получения НС1.
Он заключается в смешении при температуре ниже 150° NaCl с
H2SO4, например, в шнековом смесителе с греющей рубашкой, в
молярном отношении 2:1с целью получения эквимолекулярной
смеси NaCl и NaHSOi, образование которой заканчивается в
Получение хлористого водорода
379
течение 5 мин. Затем эту смесь вводят на слой расплавленного
сульфата натрия толщиной 1 —1,2 м, находящийся в вертикальной
печи, где температура (до 1100°) поддерживается с помощью элек-
трической дуги. Хлористый водород непрерывно отводят сверху, а
снизу выгружают Na2SC>4 и гранулируют его. Тепло, выделяющееся
при охлаждении плава Na2SO4, используется для проведения пер-
вой''стадии процесса — образования бисульфата натрия49.
Способ Гаргривса-Робинзона
По этому способу50 сульфат натрия и малоконцентрированный
хлористый водород (8—10% НС1) получают из поваренной соли,
содержащей ~0,2% окиси железа, являющейся катализатором,
по суммарной реакции:
4NaCl (тв.).+ 2Н2О (г.) + 2SO2 (г.) + О2 (г.) — 2Na2SO4 (тв.) + 4НС1 (г.) + 99 ккал
В начале XX в. этот способ довольно широко применяли в За-
падной Европе, особенно в Англии. По этому способу увлажнен-
ную поварешто соль с добавкой небольшого количества сульфата
железа и глины прессуют для получения пористых брикетов с
соломой и опилками. Последние потом выгорают, образуя пори-
стую массу. Просушенные брикеты загружают в несколько чугун-
ных котлов—камер, имеющих высоту 4—5 м, диаметр 5—6 ж и
емкость 50 т каждая, обогреваемых снаружи топочными газами.
Через камеры последовательно проходит смесь сернистого газа с
воздухом и водяным паром. Реакционная масса прогревается до
350°, затем начинается выделение тепла экзотермической реакции
и дальше процесс протекает самостоятельно. Процесс ведется при
оптимальной температуре в наиболее горячей зоне около 540° и
проходит очень медленно — в течение 15—20 суток; выход суль-
фата достигает 90—97%. Значительного повышения температуры
сверх оптимальной не допускают, так как уже при 640° в системе
NaCl—Na2SO4 появляется эвтектический расплав, содержащий
32,6% NaCl. Корка спекшейся массы вокруг расплава препят-
ствует проникновению газов к непрореагировавшей соли и в этом
случае из камеры вместе с сульфатом натрия выгружают глыбы,
содержащие много NaCl. Периодически из камер выгружается
сульфат и они вновь загружаются брикетами соли. При этом осу-
ществляется противоток — свежая газовая смесь поступает в ка-
меру с наиболее отработанной массой и выходит из вновь загру-
женной камеры.
Процесс очень громоздок. Экономичность этого способа опре-
делялась дешевизной сырья — использованием больших количеств
отбросных сернистых газов медеплавильных и других метал-
лургических заводов. В настоящее время этот способ почти не
880
Гл. XI. Соляная кислота
применяется. В некоторых случаях его испольвуют для получения
сульфата калия 51.
Раньше считали52, что образование сульфата натрия при суль-
фатизации хлористого натрия влажной смесью сернистого газа
с воздухом идет через сульфит натрия
SO2 + Н2О + 2NaCI = Na2SO3 + 2НС1
быстро окисляющийся кислородом воздуха в сульфат, и предпо-
лагали, что образование сульфита лимитирует общую скорость
процесса. Позднее было доказано53, что вначале происходит окис-
ление SOs в SO3, который переводит хлорид в сульфат:
SO3 + Н2О + 2NaCl = Na2SO4 + 2НС1
Это позволяет значительно интенсифицировать процесс путем
добавки к поваренной соли катализаторов, ускоряющих окисление
SO2. Лучшим катализатором в этих условиях является окись же-
леза. Так, добавка к NaCl 1% колчеданного огарка сокращает
длительность процесса с 15—20 суток до 1—1,5 ч при 95—96%-ном
выходе сульфата натрия. Проведение процесса с увеличенным ко-
личеством катализатора позволяет значительно рационализиро-
вать старый способ, заменив громоздкую аппаратуру более про-
изводительной. В условиях СССР, располагающего большими ко-
личествами отбросных сернистых газов, такой модернизованный
способ может оказаться экономичным для получения сульфата
калия, являющегося ценным удобрением, качество которого не
снижается от содержания в нем небольших количеств соединений
железа.
Этот процесс может быть осуществлен в печи со взвешенным
слоем. Горячие газы, содержащие SO2, О2 и Н2О, пропускают че-
рез слой хлорида со скоростью 0,3—1,5 м!сек, достаточной для
уноса частиц образующегося сульфата калия. Уносимую сульфат-
ную пыль отделяют от газа, содержащего НС1, до его охлаждения,
л часть газа возвращают в нижнюю зону печи. При 600° степень
превращения КС1 в K2SO4 достигает 98% 54>55. Может представить
интерес и видоизменение этого процесса при осуществлении его
в отсутствие водяного пара
2КС1 4- SO2 4- О2 K2SO4 4- С12
с получением хлора или хлористого сульфурилавв.
Синтез хлористого водорода из элементов
Синтез из элементов дает концентрированный хлористоводо-
родный газ, содержащий 80—90% и больше НС1, легко поддаю-
щийся сжижению, а поглощение его дистиллированной водой поз-
воляет получать чистую реактивную кислоту, концентрация кото-
Получение хлористого водорода
381
рой при необходимости может достигать 38% в7-90. Реакция взаи-
модействия хлора с водородом 50
Н2 + Cl2 2НС1 + 44 ккал
обратима. Константа равновесия реакции
7 _2
„ /’hci
Др — -------
₽Н2 Pci2
(гдер — парциальные давления компонентов) вычисляется по
уравнению
1g Кр = - 0,533 lg Т + 2,42
где Т — абсолютная температура.
По другим данным91:
1g 0,44 1g 7- +2,16
Обозначив через х долю диссоциированного НС1, получим для
константы равновесия реакции выражение
4(1-х)*
^2
с помощью которого вычислены следующие значения xt
t, °с х t, °C х
17" 2,51 • 10~17 1227 6,10-IO-4
.427 1,12- 10 7 1727 0,41 • 10-2
727 1,34-10 2227 1,30- 10-2
Таким образом, распад НС1 на элементы становится заметным
лишь при очень высоких температурах — выше 1500°.
Теплота реакции синтеза, равная при 0° 44 ккал, несколько уве-
личивается с повышением температуры:
<7^= 44 + 0,0011/ ккал
При адиабатическом сгорании стехиометрической смеси хлора
и водорода, имеющей температуру 0°, теоретическая температура
факела пламени равна ~2500°. Практически, вследствие неко-
торой диссоциации НС1, температура пламени снижается при-
мерно до 2400°. Избыток в газовой смеси одного из компонентов —
хлора или водорода — еще несколько понижает температуру го-
рения.
При обычной температуре, в отсутствие сильных световых лу-
чей, реакция образования НС1 из элементов идет очень медленно.
При нагревании смеси хлора и водорода или под действием яркого
света происходит взрыв вследствие цепной реакции92:
* С12 + ftv = Cl + С1;. С1+Н2 = НС1+Н;
Н + С12 = НС1 + С1; С1 + Н2 = НС1 + Н и т. д.
382
Гл. XI. Соляная кислота
Цепная реакция могла бы прерваться в результате таких ре-
акций: Н + Cl = HCl; Cl + Cl = CI2; Н + Н = Н2. Однако вероят-
ность этих реакций очень мала, так как концентрация атомов
ничтожно мала по сравнению с концентрацией молекул.
Присутствие кислорода замедляет соединение хлора с водоро-
дом. По-видимому, имеет место обрыв цепи реакций вследствие
соединения кислорода с атомарным водородом63. Скорость реак-
ции обратно пропорциональна концентрации кислорода в газовой
смеси; в отсутствие кислорода реакция практически протекает
мгновенно. Зависимость скорости фотохимической реакции от кон-
центрации компонентов может быть выражена эмпирической фор-
мулой Тона
d [HCl] [С12]2 [Н2]
dx ’ [02]{[Н2]+0,1 [С12]}
где К — константа скорости реакции, зависящая от. интенсивности
возбуждающего светового луча’ или теплового импульса.
Реакции, возбуждаемые световым или тепловым импульсом, но
скорость протекания которых в дальнейшем, в отличие от чисто
фотохимических реакций, зависит от температуры, называются
темновыми.
Считают, что определяющей стадией рассматриваемого тем-
нового процесса является реакция Cl + Н2 = HCl + Н. Если обо-
значить константу скорости этой реакции Ki, а константу диссо-
циации молекул хлора /Ср, то константа скорости образования НС1,
равная К = ЧгКр • Ki, может быть вычислена по эмпирической
формуле64:
35 370
К=1,18-102е RT
Скорость реакции зависит также от присутствия катализато-
ров — влаги, твердых пористых тел (губчатой платины, древесного
угля) и некоторых минеральных веществ (кварца, глины и т. п.).
Абсолютно сухие хлор и водород не взаимодействуют между со-
бой. Присутствие следов влаги ускоряет реакцию столь интенсив-
но, что она может произойти со взрывом. Повышение содержания
влаги сверх 5 10-5 уже не отражается на скорости реакции.
В производственных установках осуществляется спокойное, не
взрывное горение водорода в токе хлора. Водород подается с из-
бытком 5—10%, что позволяет полностью использовать более цен-
ный хлор и получить незагрязненную хлором соляную кислоту.
Возможно, однако, вести процесс и при подаче стехиометрических
количеств водорода и хлора или очень малого избытка водорода
(до 1%); при этом получаемый хлористый водород содержит до
1% С12 и 2% Н2. Очистку газа от хлора можно осуществить, про-
пуская его через активированный уголь при 450° с объемной ско-
Получение хлористого водорода
888
ТАБЛИЦА 33
Пределы взрывных концентраций водорода
в газовых смесях (в объемн. %)
Температура, °C Н2 + С12 Нг + Ог Н2 + воздух
-20 4-91,5 4-96 4-72
0 3,5-92 4-96 4-73
20 3-92,5 4-96 4-75
50 3-93 4-96 8,7-76
100 . 3-93 4-97 3-80
ростью 250 м3/ч на 1 ж3 угля65. Избыток
опасен, так как может привести к взрыву
НС1 вследствие образования гремучей сме-
си. В табл. 33 приведены пределы взры-
ваемости смесей водорода с хлором, кис-
лородом и с воздухом (при исходном об-
щем давлении 0,5—1,5 ат) 66.
Температура самовоспламенения смеси
хлора с водородом в воздухе равна 240°.
Сжигание смеси хлора и водорода про-
изводится в печах различных конструкций,
представляющих собой небольшие каме-
ры из огнеупорного кирпича, плавленого
кварца, графита или из металла. Неотъем-
лемой частью печей являются горелки для
сжигания водорода в токе хлора. Устрой-
ство горелки показано на рис. 117. Она
состоит из двух стальных трубок, вмонти-
рованных в стальной патрон. Хлор подает-
ся по внутренней трубке, водород — по на-
ружной. В наружной трубке горелки укреп-
лен жаростойкий динасовый наконечник 4.
Газы, сгорающие в горелке, образуют
длинный факел пламени, температура
которого понижается по длине печи
от 1800—2000° до 800—1200°. Регулировка
подачи газов производится с помощью рота-
метров или шайб с дифференциальными ма-
нометрами и контролируется по анализу от-
водорода выше 20%
в процессе абсорбции
Рис. 117. Горелка:
1 — трубка для ввода хлора;
2 — трубка для ввода водо-
рода; 3 —патрон; 4 — динасо-
вый наконечник.
ходящего газа.
Простейшими печами являются полые кирпичные камеры, фу-
терованные внутри огнеупорным кирпичом. При внутренних раз-
мерах камеры: ширина 0,61 м, длина 2,16 м, высота 0,71 м, объем
ее составляет 0,94 .и3 и производительность — от 3,5 до 7,5 т соляной
384
Гл. XI. Соляная кислота
кислоты в сутки. Иногда реакционные камеры таких печей запол-
няются контактным материалом — графитом, коксом, кварцем,
огнеупорной глиной и т. п.
Несколько большее распространение получили вертикальные
печи, монтируемые из кварцевых труб. Кирпичные и кварцевые
печи работают под небольшим вакуумом во избежание проник-
новения хлористого водорода в атмосферу цеха. Недостатком
этих печей является отсутствие условий для хорошего отвода
тепла, вследствие чего газ уходит из них с очень высокой темпера-
турой.
Наиболее совершенными являются печи, построенные из спе-
циальных или простых сталей, которые достаточно устойчивы, не-
смотря на содержание в хлористоводородном газе влаги, так как
температура газа выше точки росы. Металлические печи устраи-
ваются, как и кварцевые; в форме вертикальных труб, но обла-
дают значительно большей производительностью 1 м3 объема, так
как отвод реакционного тепла из них через наружные стенки идет
во много раз интенсивнее, чем через стенки печей из силикатных
материалов. В ряде случаев стальные печи снабжаются сна-
ружи водяными кожухами и охлаждаются проточной водой. Это
позволяет дать на них значительно большую нагрузку. Стальная
печь при диаметре 0,25 м и высоте 2,5 м дает от 6 до 25 т соляной
кислоты в сутки (в зависимости от способа отвода тепла). Кроме
того, стальные печи могут работать под давлением, что увеличи-
вает концентрацию НС1 в газе, вследствие устранения подсосов
воздуха59. При водяном охлаждении температура воды в кожухе
стальной печи не должна быть ниже 90—95°, т. е. ниже точки росы
газа, во избежание конденсации из него влаги на стенке печи 67-69.
Выходящий газ обычно име^т температуру не ниже 400°. При со-
держании в газе ~5% влаги не следует допускать дальнейшее
его охлаждение в отводных железных трубах ниже 200°. При не-
обходимости охлаждать газ до 30—60° его транспортируют по
трубам из пропитанного фенольной смолой графита. При необхо-
димости получить сухой хлористоводородный газ его сушат в
стальной насадочной колонне концентрированной серной кислотой,
причем он охлаждается до ~250°59.
Опубликованы патенты, предусматривающие использование по-
даваемого в печь избыточного водорода из отбросного газа после
абсорбции НС1, путем инжектирования этого газа свежим водо-
родом в добавочную печь70.
В СССР применяют двухконусные печи с естественным воздуш-
ным охлаждением (рис. 118). Благодаря тому, что форма печи
близка к форме факела пламени, обеспечивается равномерная
тепловая нагрузка стенок печи. Корпус печи сварен из 8-милли-
метровой листовой стали (Ст. 3). Нижняя цилиндрическая часть
корпуса и съемное днище футерованы огнеупорным кирпичом.
Получение хлористого водорода 385
zU Us
Верхний конец печи прикрыт зажатой между фланцами предохра-
нительной мембраной из листа паранита или асбеста, которая вы-
талкивается в случае внезапного взрыва газовой смеси.
Водород, освобожденный от влаги охлаждением его до 25—
30°, последовательно проходит гравийный пламягаситель, водоот-
делитель, гравийный искрогаситель, обратный клапан и поступает
в печь. Скорость подачи газов в печь составляет, в
зависимости от нагрузки, 40—120 м3/ч хлора и
43—130 м3/ч водорода, что почти в 1,5 раза выше
скоростей газовых потоков в цилиндрической печи.
Давление хлора и водорода в подводящих трубо-
проводах должно быть не меньше 800 мм рт. ст.
В печи поддерживают давление около 600 мм вод. ст.
Температура наружной стенки печи достигает
400°, а температура отходящего газа в газопро-
воде перед абсорбционной колонной (см. ниже)
должна быть не больше 250°. Автоматическая ре-
гулировка подачи газов обеспечивает нужное со-
отношение между хлором и водородом, поступаю-
щими в горелку. Помимо этого, процесс контроли-
руют по цвету пламени, который должен быть
молочно-белым. В случае избытка хлора, что не-
допустимо, цвет пламени приобретает зеленоватый
оттенок, при большом избытке водорода — го-
лубой.
Технические газы, используемые для синтеза
НС1, должны быть по возможности чистыми. Кон-
центрация водорода не должна быть ниже 95%, а
концентрация хлора — не ниже 90%. В получае-
мом хлористоводородном газе содержание НС1 не
должно быть меньше 80%. Производительность
описанной печи достигает 10 т 100%-ного хлори-
стого водорода в сутки. Расход газов на 1 т
31 %-ной соляной кислоты составляет: хлора
(100%-ного) 0,305—0,312 т; водорода (100%-ного)
110—112 л3; расход электроэнергии 35 кет • ч, воды
20 м3, пара 0,014 мгкал.
Представляет интерес осуществление синтеза
НС1 из элементов в графитовой горелке, погру-
женной в соляную кислоту, находящуюся в сталь-
ном 'резервуаре, футерованном кислотоупорным
кирпичом по слою резины. Температуру кислоты
несколько ниже равновесной, соответствующей кипению кислоты
при данном парциальном давлении НС1 в газе. Тёплота горения
и растворения отводится путем циркуляции кислоты через во?
Д5цюй холодильник. Непрореагировавшие водород и хлор перед
Рис. 118. Схема
стельной печи
для синтеза
хлористого во-
дорода:
1 — корпус печи;
2 — го 1елка; 3 — за-
пальный люк;
4 — смотровый
штуцер с кварце-
вым стеклом;
5 — шт цер для от-
вода ллэристого
-водорода, 6 — пре-
дох]5^ните;/Ы{Ый ‘
лис?: ? —опорная
к .нструкция.
поддерживают
13 М. Е. Позин
386
Гл. XI. Соляная кислота
отводом из аппарата разбавляют воздухом во избежание образо-
вания взрывчатой смеси. Недостатком этого способа является
большой расход воды на охлаждение кислоты59.
Получение хлористого водорода из хлора и водяного пара
в присутствии угля
При пропускании смеси хлора с водяным паром через слой
раскаленного угля образуется хлористый водород по реакции:
2С12 + 2Н2О(пар) + С = 4НС1 + СО2 + 67 ккал
Степень превращения С12 В Н С1,
Температура ,*С
Рис. 119. Зависимость степени превра-
щения С12 в НС1 от температуры:
/—древесный уголь; 2 —кокс; 3 —древесный
уголь с примесью окиси железа; 4— активиро-
ванный уголь.
Ввиду большой экзотермичности реакции она протекает без
внешнего подвода тепла 71>72. В отходящих газах содержится
65--78% НС1, 15—18% СО2, 2—4% СО. При выходе из реакци-
онной зоны газы могут содер-
жать также небольшие коли-
чества фосгена (СОС12), кото-
рый затем, гидролизуясь во-
дяным паром, превращается в
СО2 и НС1. С повышением
температуры степень превра-
щения С12 в НС1 увеличивает-
ся. Она зависит также от сор-
та угля и от наличия в нем
примесей, являющихся ката-
лизаторами, например окиси
железа. Как видно из рис. 1 1973,
для достижения 95—97%-ного
выхода НС1 при работе с ак-
тивированным углем, с коксом
и с древесным углем, содержа-
щим примесь Бе20з, в реакци-
онной зоне должна поддержи-
ваться температура 400—450°;
при работе с древесным углем
550—600°.
Расход кокса или древесного угля составляет 10—11% от веса
получаемого хлористого водорода. Процесс осуществляют в ге-
нераторах шахтного типа, построенных из стали и футерованных
внутри кислотоупорным и огнестойким кирпичом.
По сравнению с прямым синтезом НС1 из элементов, угольный
метод обладает крупным недостатком — здесь получается менее
концентрированный хлористый водород, причем не сухой, а с при-
месью вдуваемого в генератор водяного пара. Это вызывает кор-
розию металлических деталей генератора, в частности загрузоч-
ного устройства. Поэтому в СССР угольный метод не приме-
няется.
i
Получение хлористого водорода
887
Хлористый водород как побочный продукт некоторых
производств
Хлористый водород образуется при хлорировании многих ор-
ганических соединений. Этот источник хлористого водорода с раз-
витием промышленности органического синтеза приобрел главен-
ствующее значение. Например, в 1965 г. в США было выпущено
1179000 т соляной кислоты (100% НС1), причем ~80% этого ко-
личества было получено в виде отхода от производства органи-
ческих хлоропродуктов74. Наибольшие количества хлористого во-
дорода образуются при реакциях заместительного хлорирования
и гидрохлорирования. Примером может служить получение НС1
при производстве хлорбензола из бензола по реакции:
С12 + СбН6 = СбН5С1 + НС1
Еще одним примером, имеющим большое перспективное зна-
чение, может служить хлорирование метана и других алифатиче-
ских углеводородов. Хлористый водород образуется в результате
цепной реакции 75: С12 = Cl + Cl; Cl + СН4 = СН3 + НС1; СН8 +
+ С1 = СН3С1 и т. д.
В подобных процессах в большинстве случаев получается кон-
центрированный хлористый водород. Иногда он значительно раз-
бавлен воздухом и почти всегда загрязнен органическими веще-
ствами и хлором.
Хлористый водород образуется и при реакциях конденсации в
присутствии А1С1з и РС13 (конденсация фталевого ангидрида с
толуолом и др.), при реакциях фосгенирования и проч. В этих
процессах выделяются небольшие количества НС1, и установки
для его улавливания очень компактны. Так, например, установка
производительностью около 1 т соляной кислоты в сутки занимает
всего 20 м2 площади76.
При сульфохлорировании углеводородов образуется смесь SO2,
НС1 и SO2CI2. Из этой смеси возможно выделить НС1, если до-
бавить к ней хлор в количестве, эквивалентном количеству SO2,
и пропустить ее через активированный уголь (при 20°). При этом
образуется хлористый сульфурил SO2CI2, который отделяют кон-
денсацией. Затем хлористый водород для очистки от SO2 и SO2CI2
промывают концентрированной серной кислотой 77.
Хлористый сульфурил также может служить концентрирован-
ным источником соляной кислоты (одновременно и серной кис-
лоты), так как под действием воды он разлагается на смесь этих
кислот:
SO2G12 + 2Н2О = H2SO4 + 2НС1
При ограниченном количестве воды НС1 выделяется в газо-
образной форме. Так как хлористый сульфурил — жидкость, не
действующая на сталь, то его легко транспортировать в стальных
13,
868
Гл. XI. Соляная кислота
бочках или цистернах к потребителям, нуждающимся в серной и
соляной кислотах.
Предложены различные способы очистки хлористого водорода
от летучих органических веществ. Например, можно, добавив к
загрязненному хлористоводородному газу хлор, а затем водород и
воздух или водяной пар, сжечь такую хлороводородную смесь;
при этом органические примеси также сгорят и останется чистый
хлористый водород78’79.
Другим методом очистки хлористого водорода от органических
примесей является его промывка в скруббере концентрированной
или разбавленной соляной кислотой. В последнем случае кислота
концентрируется за счет хлористого водорода из газа. Очищенный
газ поступает во второй скруббер, где поглощается с образова-
нием соляной кислоты. Промывную кислоту из первого скруббера
направляют на регенерацию для выделения примесей. Если тем-
пература кипения этих примесей выше температуры кипения азео-
тропйЪи смеси НС1—Н2О, то вначале отгоняют хлористый водород,
затем азеотропную смесь. В противном случае вначале отгоняют
примеси с некоторым количеством НС1 и оставляют в жидкой
фазе чистую азеотропную смесь, а выделившийся загрязненный
хЛоррстый водород очищают от примесей поглощением водой с
последующей фракционированной перегонкой полученного рас-
твора .
Хлористый водород является побочным продуктом и в ряде
процессов неорганической технологии, например, при гидролизе
хлористого магния с целью получения окиси магния (стр. 299),
при некоторых способах конверсии хлоридов в нитраты азотной
кислотой, при переработке хлористого калия и полиминеральных
калийных руд (см. гл. V) на бесхлорные удобрения и пр. На не-
которых заводах в США при производстве металлического магния
из хлористого магния в электролизеры загружают не полностью
обезвоженный хлористый магний (приблизительно MgCU-1,25Н2О).
На этих заводах 40% хлора выделяется в виде хлористого водо-
рода, улавливаемого водой с образованием слабой соляной кис-
лоты 81 •
Возможно каталитическое хлорирование сероводорода
Нг8 + С12 - S + 2НС1
на катализаторе из окиси алюминия, при объемном соотношении
C12:H2S 0,9—0,95. Максимальный выход серы (90%) достигается
при 4б0° и объемной скорости 20 .м3/ч на 1 м3 катализатора82.
Хлористый водород может быть получен при регенерации ам-
миака в производстве соды по некоторым новым схемам, например,
путем обработки твердого хлористого аммония расплавленным
бисульфатом натрия83. В первой стадии процесс осуществляется
при 220—270°, причем в газовую фазу выделяется НС1; во второй
Получение хлористого водорода
389
стадии при 330—380° происходит диссоциация образовавшейся в
первой стадии двойной соли с выделением в газовую фазу ам-
миака, а оставшийся плав бисульфата натрия возвращают в про-
цесс. Таким образом бисульфат натрия является средой, с по-
мощью которой удается разделить аммиак и хлористый водород,
образующиеся при диссоциации хлористого аммония. Давление
паров (в мм рт. ст.) над NH4C1 в пределах 100—400° может быть
вычислено по уравнению:
lgP = _ °>05223r-»3486 +i0,0164
Оно равно при 209,8°—10 мм рт. ст., 246° — 40 мм рт. ст.,
271,5°—100 мм рт. ст., 316,5° — 400 мм рт. ст. и при 337,8° —
760 мм рт. ст. Давление паров NH3 над (NH4)2SO4 равно:
2,33 мм рт. ст. при 225°, 10,44 мм рт. ст. при 255°, 22,26 мм рт. ст.
при 280° и 50,84 мм рт. ст. при 300°.
Другой вариант этого способа предусматривает переработку
растворов хлористого аммония с использованием в качестве теп-
лоносителя органической жидкости с высокой температурой ки-
пения, пары которой стойки до 500°84. Исходный раствор NH4C1
смешивают с нагретым теплоносителем, в результате чего про-
исходит выпаривание и образуется безводная пульпа, содержащая
20—25% NH4C1 и 80—75% теплоносителя. Пульпу смешивают с
расплавленным бисульфатом натрия и отгоняют из смеси НС1,
затем NH3. Хлористый водород сушат в башне, орошаемой серной
кислотой, и пропускают через низкотемпературный холодильник
для конденсации паров теплоносителя, который, так же как и би-
сульфат натрия, непрерывно циркулирует в системе.
Еще один способ регенерации аммиака из хлористого аммония
в содовом производстве с получением при этом хлористого водо-
рода заключается в следующем 85. Сухой хлористый аммоний раз-
лагают при 335—350° и полученную смесь газов NH3. и НС1 про-
пускают через нагретый до 500° платиновый или железоокисный
катализатор для разложения аммиака на водород и азот. После
отмывки следов аммиака фосфорной кислотой из газовой смеси
выделяют НС1 сжижением его под давлением 200 ат, а оставшуюся
азото-водородную смесь очищают от следов НС1 окисью кальция
и направляют на синтез аммиака. В результате этого кругового
процесса для производства соды требуются только NaCl и СО2 и
не.образуется никаких отбросов; на 1 т соды получается 0,7 т НС1
(~2 т соляной кислоты).
Получение хлористого водорода из КС1 при переработке его
на бесхлорное удобрение—КгЗО4 возможно не только по способу
Гаргривса — Робинзона (стр. 379), но и другим путем. При раз-
ложении хлористого калия большим избытком концентрированной
^серной кислоты при сравнительно низкой температуре (~80°)
390
Гл. XI. Соляная кислота
выделяется концентрированный и достаточно сухой хлористый во-
дород, а образовавшиеся кислые сульфаты калия направляются на
разложение фосфата86. Аналогичный способ разработан87 и при-
менительно к хлористому аммонию — с образованием НС1 и би-
сульфата аммония, который затем используется для разложения
фосфата с целью получения азотно-фосфорного удобрения. В раз-
личных металлургических процессах, в которых никелево-медные,
оловянные и другие руды подвергаются хлорированию в присут-
ствии водяного пара, выделяется хлористый водород и в качестве
побочного продукта может быть получена соляная кислота.
Хлористый водород образуется при взаимодействии хлоридов
щелочных или щелочноземельных металлов с глиноземистым или
силикатным материалом в присутствии водяного пара при 500—
800°88>89. К горючему газу добавляют пар (40%) и обрабатывают
им шихту во взвешенном слое90.
В связи с проблемой утилизации отбросного хлористого каль-
ция от производства соды установлена возможность получения
соляной кислоты гидролизом СаС12. При 728° и давлении водя-
ного пара 1 ат в системе
СаС12 + Н2О СаО + 2НС1
давление НС1 равно 6,2 • 10-4ат, а в системе
СаС12 + Н2О + SiO2 CaSiO3 + 2HCl
давление НС1 равно 0,35 ат. При гидролизе Cafcl2-6H2O в смеси
с глиной (1 :2,5 по весу) при 700° и 10-кратном избытке пара вы-
ход НС1 составляет 80—90%, а концентрация получаемой кислоты
25—28%. Подсчитано, что расход пара на 1 т соляной кислоты со-
ставит ~ 0,25 т91.
Наконец, следует упомянуть о возможности получения газа,
содержащего 85,7% НС1, взаимодействием сухого хлора с аммиа-
ком при 800° в присутствии СаС12 как катализатора92:
2NH3 + 3C12 = 6HC1 + N2
Реакция происходит самопроизвольно и полностью, но нельзя
допускать смешения С12 и NH3 при низких температурах, так как
это приводит к образованию сильно взрывчатого треххлористого
азота.
Получение чистого хлористого водорода
Для получения реактивной соляной кислоты в настоящее вре-
мя пользуются наиболее чистым хлористым водородом, синтези-
руемым из элементов. При малых масштабах производства доста-
точно чистый хлористый водород может быть получен из техни-
ческой соляной кислоты, даже основательно загрязненной нелету-
чими примесями, по способу Газенклевера. Этот способ применяли
Абсорбция хлористого водорода
391
раньше для получения реактивной кислоты. Он заключается во
вливании струи соляной кислоты в концентрированную серную
кислоту (купоросное масло), которая связывает воду, освобождая
выделяющийся хлористый водород. Получающуюся разбавленную
серную кислоту использовали в различных производствах, а хло-
ристый водород поглощали дистиллированной водой; образую-
щаяся соляная кислота содержит всего ~ 0,0015 % H2SO493.
Чистую соляную кислоту (38,2% НС1) предложено получать
десорбцией НС1 при 110° из технической кислоты (37% НС1), к
которой добавляют 0,01—0,1% триэтаноламина, связывающего
примеси соединений Fe, Си, А1 и Мп в прочные комплексы, отхо-
дящие с кубовым остатком (28,2% НС1). Отгоняемый хлористый
водород проходит через насадочную колонну, в середину которой
подают пар, получаемый из дистиллированной воды; пары из
верха колонны пропускают через конденсатор, из которого отби-
рают чистую кислоту94.
Чистый хлористый водород получают также, выдувая его воз-
духом из технической соляной кислоты. Непосредственно из газа
сульфатных печей получают реактивную соляную кислоту после
очистки этого газа от сернокислотного тумана, SO2, соединений
мышьяка, железа и других загрязнений95. Такую очистку осуще-
ствляют сначала, промывая газ соляной кислотой, затем пропуская
его через несколько поглотителей с активированным углем и вновь
промывая чистой соляной кислотой.
АБСОРБЦИЯ ХЛОРИСТОГО ВОДОРОДА
Абсорбцию хлористого водорода осуществляют двумя способа-
ми— с отводом и без отвода тепла, выделяющегося при гидрата-
ции НС1. В качестве материалов для абсорбционной аппаратуры
используют пропитанную смолой древесину, естественные кисло-
тоупорные камни (гранит, песчаник), кислотоупорные керамику и
эмаль, плавленый кварц, графит, графолит и антегмит (АТМ-1 —
теплопроводный материал из графита и феноло-формальдегидной
смолы) и некоторые виды пластических масс (фаолит, винипласт,
полиэтилены, фторопласты, найлон и др.), абсорберы из которых
отличаются легкостью и малыми габаритами 96-102. Для изготовле-
ния кислотог.роводов, запорных приспособлений, насосов и т. п.
применяют железокремниймолибденовый сплав (антихлор,
МФ-15) !03’104.
Абсорбция хлористого водорода с охлаждением
Раньше считали, что для получения концентрированной соля-
ной кислоты газ, содержащий хлористый водород, перед абсорб-
ацней должен быть обязательно охлажден и сам процесс абсорбции
392
Гл. XI. Соляная кислота
должен вестись при возможно низкой температуре — из абсорбе-
ров должно отводиться тепло, выделяющееся при растворении НС1
в воде. Это убеждение было основано на опасении, что при недо-
статочном отводе тепла из абсорберов жидкость в них закипит и
при этом невозможно будет получить кислоту, содержащую более
20,24% НС1, т. е. более концентрированную, чем постоянно кипя-
щая смесь хлористого водорода с водой.
Действительно, пользуясь рис. 113 (стр. 365), можно подсчи-
тать, что, например, при получении из НС1 и Н2О 20%-ной соля-
ной кислоты выделяется 89 ккал на 1 кг раствора. Этого тепла
вполне достаточно, чтобы образующаяся кислота закипела, так
как при ее теплоемкости ~0,7 ккал! {кг-град) этого тепла хва-
тило бы для повышения температуры на 127°.
В соответствии с этим абсорбционные установки сооружены
таким образом, чтобы обеспечить наиболее полный отвод тепла
гидратации НС1. Обычно газ вначале охлаждают в длинных га-
зопроводах и керамических холодильниках. Охлаждение совме-
щают с осушкой газа, что дает возможность получать более кон-
центрированную соляную кислоту. Осушку производят в башнях
с насадкой, где конденсируются пары H2SO4 и влага и задержи-
вается сульфатная пыль, уносимая из сульфатных печей. В дру-
гих случаях газ в башнях высушивают концентрированной серной
кислотой.
Синтетический хлористый водород по выходе из печей синтеза
охлаждают в холодильнике из графолитовых или кварцевых труб.
При охлаждении до 38—40° образуется некоторое количество кон-
денсата— 36 %-ной соляной кислоты105. Охлажденный газ направ-
ляется на абсорбцию водой. Абсорбцию газа осуществляют в фао-
литовых, керамических или футерованных стальных башнях с на-
садкой. Газ проходит последовательно две башни. Вторую башню
орошают водой, из первой отбирают готовую соляную кислоту?
Газ по выходе из последней башни выбрасывается в атмосферу:
керамическим вентилятором. При абсорбции газа из сульфатных
печей содержащийся в нем сернокислотный туман проходит через
всю установку и частично конденсируется лишь под действием
центробежной силы хвостового вентилятора, из которого выпу-
скается небольшое количество кислоты. Кислота циркулирует в
каждой башне с помощью насосов — центробежных керамических
и др. Тепло, выделяющееся при абсорбции, отводится с помощью
установленных под башнями керамических змеевиков или графо-
литовых холодильников, по которым циркулирует кислота. Змее-
вики опущены в резервуары с проточной холодной водой. Для
поглощения хлористого водорода водой значительное распро-
странение, особенно за рубежом, получили установки, оборудо-
ванные кварцевыми и графолитовыми холодильниками и абсор-
берами 106.
Абсорбция хлористого водорода
393
Кварцевые холодильники (рис. 120) представляют собой S-об-
разные трубы (называемые иногда «интегралами») длиной 2 м
с внутренним диаметром 200 мм. Холодильники соединяются по-
следовательно в вертикальной плоскости и орошаются сверху
(снаружи) водой. Абсорберы (рис. 121) соединяются, как холо-
дильники, и также орошаются снаружи водой. В верхний абсорбер
подается вода (слабая соляная кислота), переливающаяся в на-
Рис. 120. Кварцевые холодильники.
ходящиися под ним, и т. д.
У сливного конца абсорбера име-
ется порог, определяющий уро-
вень жидкости в абсорбере. Газ
впускается в нижний абсорбер и
движется противотоком жидко-
сти. На верхней поверхности аб-
сорбера имеется пережим, спо-
Рис. 121. Кварцевый абсорбер (внешний
вид и разрез).
собствующий лучшему соприкосновению газа с жидкостью. Такие
же абсорберы изготовляются и из графолита.
На рис. 122 изображена схема установки для охлаждения и
абсорбции синтетического хлористого водорода. Газ из печи син-
теза, имеющий температуру около 1000°, проходя по газоходу 1,
остывает до ~200°, затем входит сверху в секцию холодильни-
ков 2. Из последних с температурой около 100° он поступает снизу
в секцию абсорберов 3, после которых промывается водой в не-
большой керамической башне 4 с насадкой. Конденсат из холо-
дильников смешивается с продукционной кислотой, содержащей
32—35% НС1.
Большим преимуществом кварцевых и графолитовых абсорб-
ционных установок является компактность, обусловленная ин-
тенсивным охлаждением. Помимо этого, в кварцевых абсорберах
394
Гл. XI. Соляная кислота
получается чистая кислота, не загрязненная примесями, извлекае-
мыми из керамики, в частности железом. Недостатком их является
высокая стоимость и малая механическая прочность. Так как ско-
рость абсорбции НС1 водой очень велика, то число абсорберов, из
которых монтируют абсорбционную установку, определяют, ис-
ходя из условий, необходимых для полного отвода тепла гидра-
тации НС1. Для производства 7 т соляной кислоты в сутки доста-
точна поглотительная установка из 13 кварцевых холодильников
Рис. 1212. Схема установки охлаждения и абсорбции хлористого
водорода:
/—газоход; 2 —холодильники; з — абсорберы; 4 — хвостовая башня; 5 —венти-
лятор; 6 — слнвная труба; 7 —сливной штуцер для кислоты; 5—-сливная труба
для конденсата.
и 11 абсорберов. Используют и кварцевые абсорберы, имеющие
форму вертикальной трубы — скруббера с насадкой, собранного
из отдельных кварцевых частей 66.
Вполне стойкими по отношению к соляной кислоте вплоть до
330° являются тантал и ниобий. Эти металлы хорошо проводят
тепло и легко поддаются механической обработке. В абсорбере из
вертикальной танталовой трубы диаметром 150 мм и высотой 2 м,
помещенной в стальной кожух для охлаждения водой, можно по-
глотить более 225 кг НС1 в час. Однако тантал (так же как и ни-
обий) является дорогим металлом и поэтому танталовые абсор-
беры для хлористого водорода используют пока, по-видимому, на
очень немногих заграничных предприятиях. Но имеются указания,
что, благодаря простоте устройства танталовых абсорберов и боль-
шой продолжительности их службы, капиталовложения и эксплуа-
тационные расходы на 1 кг 100%-ного хлористого водорода при
использовании танталовых абсорберов ниже, чем при использова-
Абсорбция хлористого водорода
395
нии абсорберов из других материалов 107. Описана установка не-
большой мощности для получения соляной кислоты из синтетиче-
ского хлористого водорода, в которой
из тантала выполнены лишь немногие
детали абсорберов67. Выходящий из
печи синтеза хлористый водород охла-
ждают сначала воздухом в стальных
трубах, потом в трубах из графита,
пропитанного фенольными смолами.
Затем по гуммированной стальной
трубе газ поступает' в двухступенча-
тый абсорбер (рис. 123). Первая сту-
пень абсорбера представляет собой
трубу из тонкого гофрированного лис-
та тантала, помещенную в стальной
кожух — водяную рубашку. Газ здесь
идет прямотоком со слабой соляной
кислотой, поступающей из второй сту-
пени. Остаток газа, не поглощенный
в первой ступени, поступает во вто-
рую ступень — керамический абсор-
бер, также снабженный танталовой
трубой с водяным охлаждением и
насадкой. Во второй ступени осуще-
ствляется противоток газа с посту-
пающей сверху дистиллированной во-
дой. Отходящий газ разбавляют
воздухом для снижения концентрации
водорода ниже опасного предела и
выпускают в атмосферу.
Абсорбция хлористого водорода из
разбавленных газов, содержащих вла-
гу (например, из отходящих газов от
выпарки хлористого магния), затруд-
няется образованием тонкодисперс-
ного тумана соляной кислоты, кото-
рый абсорбируется с большим трудом.
Разработан метод акустической коа-
гуляции аэрозоля соляной кислоты из
таких газов, полнота которой, при по-
вышении их относительной влажности
до 97%, достигает 94 %108.
Из .отбросных газов можно извле-
Рис. 123. Двухступенчатый
абсорбер хлористого водорода:
1 — трубопровод для охлаждающей
воды; 2 — трубопровод для дистил-
лированной воды; 3 н 5 —гофриро-
ванные танталовые трубки; 4 — ввод
хлористого водорода в первую сту-
пень абсорбера; 6 — вывод абгаза из
второй ступени абсорбера; 7 — водя-
ная рубашка; 8 — керамический
скруббер (вторая ступень абсорбера);
Р —стальной кожух первой ступени
абсорбера; /0 — трубопровод для
выпуска кислоты.
кать НС1, пропуская их через колонну с синтетическим цеолитом.
Адсорбционная емкость его в среднем равна 6 г НС1 на 100 а
Долита. Стойкость цеолита к НС1 значительно возрастает после
896
Гл. XI. Соляная кислота
его обработки водным раствором хлорида цинка или кальция. Де-
сорбцию НС1 осуществляют при нагрёвании до 300—800° или про-
дувкой сухим воздухом 109.
Адиабатическая абсорбция хлористого водорода
Наиболее совершенным является способ абсорбции хлористого
водорода без отвода тепла, называемый также способом Гаспа-
ряна110’111, доказавшего ошибочность мнения о невозможности по-
лучить при этом соляную кислоту концентрированнее 20,24%.
Принцип, лежащий в основе способа, заключается в следующем.
Если пропускать в воду хлористый водород, то за счет теплоты
растворения температура образующейся соляной кислоты начнет
повышаться, что приведет к увеличению давления ее паров. Когда
общее давление пара станет равным внешнему, например, атмо-
сферному давлению, жидкость закипит и начнется интенсивное ис-
парение воды. Затрата тепла на испарение воды в адиабатических
условиях вызовет снижение температуры, кипящей кислоты и по-
этому концентрация ее, являющаяся функцией температуры, нач-
нет при дальнейшей подаче хлористого водорода возрастать.
На рис. 111 приведены кривые общего давления пара над со-
ляной кислотой разных концентраций. Пересечение кривых с
пунктирной линией соответствует точкам кипения под атмосфер- :
ным давлением (760 мм рт. ст.'). С понижением температуры ки-
пящей кислоты ее концентрация, начиная от 20,24%, может и воз-
растать и убывать. Это же видно из рис. 124. При общем давле-
нии 700 мм рт. ст. азеотропная смесь кипит при 105,8° и содержит 1
20,4% НС1. При более низкой концентрации кислоты ее пары обо-
гащены водяным паром, а при более высокой — хлористым водо- ,s
родом. Охлаждение кислоты азеотропного состава вследствие ее
испарения при абсорбции, т. е. переход от изотермы ta3, например,
к ti, может привести к образованию как более разбавленной (точ- 1
ка А), так и более концентрированной (точка В) кислоты. Возра- ?
стание или убывание концентрации кислоты будет зависеть от со-
става газовой фазы. Если парциальное давление НС1 в газе пре-
вышает давление HCI над постоянно кипящей смесью, то концен- (
трация кислоты должна возрастать. Поэтому при подаче хлори-
стого водорода кипящая в адиабатических условиях кислота будет
концентрироваться.
По мере укрепления соляной кислоты содержание НО в ухо-
дящих из абсорбера парах также будет повышаться. На рис. 125
показано, например, изменение давления паров Н2О и НО над
соляной кислотой, получаемой по мере насыщения воды с началь-
ной температурой 30° при общем давлении 700 мм рт. ст. 100%-ным j
хлористым водородом без охлаждения абсорбера. Пока концен- •
трация кислоты невелика, в паровую фазу переходит, главным ;
Абсорбция хлористово водорода
897
образом, вода, и раствор концентрируется как вследствие про-
должающегося поглощения хлористого водорода, так и вследствие
Рис. 124. Кривые состав — температура кипения системы
НС1—Н2О прн различных давлениях.
Цифры на изобарах:
Р “ РНС1
+ р
н2о
в мм рт. ст. (масштаб абсцисс вправо от пунк-
тирной линии в 2 раза меньше).
удаления воды. При достижении концентрации кислоты 14% НС1
(молярная концентрация НС1 в жидкости х = 0,072) и темпера-
туры 102,5° раствор закипит. Дальнейшее насыщений раствора
898
Гл. XI. Соляная кислота
хлористым водородом будет идти при постоянном давлении паров 1
над кислотой, равном 700 мм рт. ст., но по мере возрастания кон- ]
центрации кислоты парциальное давление водяного пара над ней
будет уменьшаться, а парциальное давление хлористого водоро-
да—увеличиваться. Поэтому при получении концентрированной
кислоты в одноступенчатом абсорбере большая часть хлористого
водорода останется неабсорбированной.
700
ООО
^500
§
I
щгоо
I
too
0050072 0./0 0,15 0,20 025 № о а/ и , jw
Кшшнтраиия HC1 6 живкоспи.моли Концентра^соляной.кислоты, М
Рис. 125. Изменение давления паров НС1 (кри- Рис. 126. Число теоретиче-
вая 1) и Н2О (кривая 2) в процессе насыще- ских тарелок, обеспечиваю-
ния воды хлористым водородом (начальная щее получение соляной
температура воды 30°, давление 700 мм рт. ст.). кислоты заданной концен-
трации.
• Наиболее рационально процесс горячей абсорбции может быть^И
осуществлен в тарельчатой или насадочной абсорбционной ко-
лонне. Для получения стандартной соляной кислоты, содержащей Щ
27,5% НС1, требуются всего 4 теоретические тарелки (рис. 126),^Н
а 31% НС1 — 5. На практике применяются не тарельчатые, а на-^И
садочные колонны, более простые и удобные в эксплуатации.
Понижение температуры, подаваемой на верх абсорбера воды.^И
немного уменьшает количество уходящего из него водяного пара,^И
а следовательно, и потери уносимого им хлористого водорода. Не^И
должна быть слишком высокой и температура поступающего на^р
абсорбцию газа. Увеличение содержания в газе инертных компо-
нентов также влияет на абсорбцию благоприятно (несмотря на
понижение концентрации НС1 в газе), так как понижает темпера- В
туру в абсорбере. Но высота абсорбера должна быть при этом 1
больше, так как увеличивается высота слоя насадки, эквивалент-
Абсорбция хлористого водорода
399
мая одной теоретической тарелке. Если поступающий на абсорб-
цию хлористый водород содержит водяные пары, то максималь-
ная концентрация получаемой соляной кислоты одинакова с кон-
центрацией кислоты, конденсирующейся при охлаждении газа до
точки росы. Если хлористый водород разбавлен инертным газом
(воздухом), то максимальная концентрация соляной кислоты бу-
дет соответствовать концентрации кислоты, находящейся в равно-
весии с поступающим на абсорбцию газом. Эту концентрацию
можно определить по рис. 112 или вычислить по формуле112
с = (0,304/ — 0,0016) р0'15, где с — концентрация кислоты, г НС1
на 1 г Н2О; t-—температура кислоты, °C; р— парциальное давле-
ние НС1, мм рт. ст. Так, при содержании в поступающем на аб-
сорбцию газе 30% НС1 (парциальное давление НС1 — 228 мм
рт. ст.) максимальная концентрация соляной кислоты при 80° бу-
дет 28,5%, при 60° —31,8%, для 50%-ного газа — соответственно
30,5 и 33,3%.
Производственные колонны для абсорбции хлористого водо-
рода без охлаждения изготовляют из фаолита и заполняют насад-
кой из керамических колец (25X25 мм). Широко применяют также
абсорбционные колонны из графитовых блоков, пропитанных тер-
мореактивными смолами с последующей термообработкой). При
диаметре колонны 0,45 м и высоте 6,4 л в ней можно получить из
синтетического хлористого водорода до 30 т в сутки 31 %-ной со-
ляной кислоты. Температура поступающего в колонну газа не
должна превышать 250°, а концентрация НС1 в нем должна быть
не меньше 80%. Воду подают в колонну через фэолитовый ороси-
тель. Вытекающая из колонны соляная кислота должна иметь тем-
пературу не выше 60° и плотность 1,155—1,160 г/см3 при 20°. Она
поступает в оросительный холодильник из графолитовых трубок
(диаметром 78/102 мм, длиной 3,6 м) и течет по трубкам, орошае-
мым снаружи холодной водой. Охлажденная до 40° соляная кис-
лота направляется в хранилище готовой продукции, например,
стальные, футерованные диабазовой плиткой резервуары. При по-
вышении температуры выходящей из колонны кислоты уменьшают
количество подаваемой воды, так как это указывает на избыток'
воды. При понижении температуры ^зеличивают расход воды на
орошение, во избежание получения слишком концентрированной
кислоты и увеличения потерь НС1 с газом.
Уходящая из верхней части абсорбционной колонны паро-га-
зовая смесь содержит незначительное количество НС1. Перед вы-
бросом в атмосферу содержание НС1 в ней снижают до санитар-
ной нормы, для чего ее пропускают через промывную, также фао-
литовую колонну диаметром 0,6 м и высотой 4 м, с насадкой из
керамических колец, орошаемую водой. Стекающая из промыв-
ной колонны кислая вода, содержащая всего ~ 1,5% НС1, не ис-
пвльзуется и является отбросом производства. Перед спуском в
400
Гл. XI. Соляная кислота
канализацию ее нейтрализуют известняком. Иногда нейтрализа-
цию осуществляют в промывной башне, орошая ее раствором соды.
Имеется опыт40’113 горячей абсорбции газа (выходящего из
сульфатных печей и содержащего 30—50% НС1) в системе из ше-
сти последовательно соединенных фаолитовых барботажных аб-
сорберов, расположенных каскадом.
Аналитический расчет адиабатической
абсорбции HCl111-”4
Состав жидкой и паровой фаз, а также температурный режим
на каждой тарелке (сечении колонны) можно определить из по-
стоянства в адиабатических условиях для любого сечения аппа-
рата разности теплосодержаний AQ поднимающихся в колонне
паров и нисходящей жидкости. Значение AQ определяется из ма-
териального и теплового потоков между (п + 1)-й и п-й тарел-
ками (счет тарелок снизу вверх):
AQ = b Г—(га— А/ Са) + (гв- А/ Св'1 - Ьс^п+1
Уп ~ хп+1 I * ~ Уп J
здесь А/— разность температур между (и + 1)-йи n-й тарелками;,
b — количество воды в получаемой кислоте, кг-.иол/ч;
у и х— молярные концентрации НС1 в газовой и жидкой фа-
зах;
га — молярная теплота сжижения НС1 (тепло конденсации
и диссоциации), ккал/жоль;
гв— молярная теплота конденсации Н5О, ккал!моль\
са и св—молярные теплоемкости НС1 и Н2О, ккал/моль • град.
Пусть, например, производительность абсорбера 365 кг/ч НС1,
температура поступающего газа 50°, начальная температура воды
36° и давление в колонне 700 мм рт. ст. При получении 30%-ной
кислоты (0,174 мольных долей) температура вытекающей кислоты
будет 88,3° (рис. 127), а концентрация НС1 в парах, поднимаю-
щихся с первой тарелки, т. е. равновесных с вытекающей жидко-
стью, у\ = 0,725 мольных долей. Величина AQ, т. е. разность ме-
жду теплосодержаниями Q поступающего газа и q отбираемой
кислоты: AQ = Q — q = 16500- 10 + 7- 10-50 — 88,3(18-47,3 +
+ 7-10) = 87300 ккал]ч [здесь: 16500 ккал!моль — средняя моляр-
ная теплота сжижения (абсорбции) НС1; 10 моль/ч — количество
абсорбируемого НС1; 7 ккал!моль — молярная теплоемкость НС1;
18 ккал!моль — молярная теплоемкость воды; 47,3 = -1 ° *Q~74 > —
количество воды в отбираемой кислоте, моль/ч]. Подставляя зна-
чение AQ и других известных величин в приведенное выше урав-
нение, получим при п=1,т. е. для первой тарелки:
87300 = -7’3 (* ~ °’725) Г (16 500- 7АО + (10000- 18ДГ)]-47,3. 18/,
U,/20 — «Ц L * V»’ ~О J
Абсорбция хлористого водорода
401
Это уравнение содержит два неизвестных Xj и 1г и ввиду от-
сутствия аналитического выражения функции t = f (х) (рис. 127)
решается методом подбора. Прих2 = 0,146 /2 = 101,5°. Первый мно-
47,3 (1 -0,725)0,146 о
житель правой части уравнения ---0725- о Мб'— =3,29 выражает
количество воды (моль/ч), уносимой с первой тарелки. Произве-
0 726
дение этого множителя на величину } > т- е- 3,29 • 2,64 = 8,68,
Рис. 127. Определение состава жидкости и
пара в системе НС1—Н2О по диаграмме х, у, t
при давлении 700 мм рт. ст.
представляет количество уходящего с 1-й тарелки газообразного
хлористого водорода (моль/ч). Следовательно, на 1-й тарелке аб-
сорбируется 10—8,68 = 1,32 моль/ч или 13,2% от поступающего
на абсорбцию НС1. По температуре /2 = 101,5° определяем содер-
жание НС1 в парах над второй тарелкой: у2 = 0,41. Далее, анало-
гично приведенному выше, определяем: /3 = 104,3°, Хз = 0,093, у3 =
= 0,043, /4 = 97,7°, х4 = 0,011, t/4 ~ 0. Таким образом, требуется
колонна с четырьмя теоретическими тарелками, причем на первой
абсорбируется 13,2% от общего количества НС1, на второй —
29,8%, на третьей — 50% и на четвертой — 7%.
Графический расчет адиабатической
абсорбции НС1114-116
Схема диаграммы I, i — х, у, энтальпия — состав, для двухфаз-
ной трехкомпонентной системы (поглощаемый компонент, рас-
творитель и инертный газ) изображена на рис. 128. Диаграмма
построена для постоянного приведенного давления
* % = Р--Ро=-Рд + Рв
402
Гл. XI. Соляная кислота
где Р — общее давление;
р°— давление инертного газа;
рА и рв — давление паров поглощаемого компонента и раствори-
теля.
Линия АВ — энтальпия i жидкости при кипении в зависимости
от ее состава х, линия CD — энтальпия 1 пара состава у при кон-
денсации. Эти линии ограничивают двухфазную область ACDB и
пересекающуюся изотермами, например MN. Жидкость состава х
в точке М находится в равновесии с паром состава у в точке N.
Рис. 128. Схема диаграммы эн-
тальпия — состав.
ретических тарелок на диаграмме
энтальпия — состав.
Если заданы количества поступающего на абсорбцию газа Vi
(без инертного компонента) и уходящей с абсорбции жидкости Li,
а также их составы и температуры, то для определения числа тео-
ретических тарелок противоточного абсорбера при помощи диа-
граммы /, i — х, у необходимо сначала найти координаты хр и ip
п - В . С Q
точки Р, называемой полюсом: Хр^-д-, 1р = ~д- зДесь разности
А Cn'f В = Епул LrlXri, С V nJ п J/n^n являются по-
стоянными для любой тарелки (сечения) аппарата, следователь-
но и для места ввода газа в аппарат, для которого легко опре-
деляются их значения, так как все параметры с индексом п = 1
известны.
Через полюс Р и точку начального состояния газа Н(!\,у\)
проводят прямую (рис. 129), которая пересекает линию кипения
раствора в точке А. Эта точка характеризует состояние жидкости,
уходящей с первой (нижней) тарелки. Через точку А проводят
изотерму АВ'. Точкой В' определяется состав газа у\, уходящего с
Жидкий хлористый водород
403
1-й тарелки и находящегося в равновесии с жидкостью состава х\.
Затем из точки В' проводят луч В'Р к полюсу Р, пересекающий ли-
нию кипения раствора в точке В. Точка В определяет состояние
жидкости Х2, уходящей со 2-й тарелки и равновесной с газом со-
става У2- Последний определяется по изотерме ВС'. Из точки С'
снова проводят луч к полюсу Р и т. д. Построение продолжают до
тех пор, пока луч, проведенный через полюс, не пройдет через точ-
ку N', соответствующую конечному составу газа ук, или через точ-
ку N, соответствующую начальному составу поступающей на аб-
сорбцию жидкости хн. Число изотерм между начальной и конечной
точками построения диаграммы равно числу теоретических тарелок.
На рис. 130 показано графическое определение числа теорети-
ческих тарелок на диаграмме I, i — х, у для абсорбции хлористого
водорода при концентрации получаемой соляной кислоты 31%
(хк = 0,31), температуре поступающего газа 50°, температуре воды
t = 30° и общем давлении 760 мм рт. ст. Построение выполнено для
случая, когда абсорбции подвергается чистый НС1, не содержащий
инертных газов и водяного пара, т. е. z/n=l, и хлористый водород
полностью поглощается, т. е. ук = 0, Так как ун=1 и хк = 0,31 изве-
стны, то направление первого луча к полюсу определяется при со-
единении этих точек прямой линией. Кроме того, имеем ук = 0 и
лн = 0, что обусловливает хр = 0. Для определения ip необходимо
продолжить линию ys — хк до пересечения с осью ординат, это
дает значение ip =—100 ккал/кг. Как видно из построения, тре-
буются четыре теоретические тарелки. На диаграмме видно также
распределение температур по тарелкам (снизу вверх): 82, 96, 108,2
и 103,5°. Количество тепла, которое необходимо отвести в дефлег-
маторе: —ip — tB = 100 + 30 = 130 ккал на 1 кг добавляемой
воды или 130(1 — 0,31) = 90 ккал на 1 кг соляной кислоты.
ЖИДКИЙ ХЛОРИСТЫЙ ВОДОРОД
На рис. 131 приведена схема производства жидкого хлористого
водорода, содержащего 99,9% НС1. Горячий газ, содержащий
94—95% НС1, охлаждается в кварцевом холодильнике, в котором
конденсируется небольшое количество соляной кислоты. Эта соля-
ная кислота образуется из воды, получившейся в печи синтеза из
кислорода, загрязняющего хлор. Затем газ осушают концентриро-
ванной серной кислотой.
Вся аппаратура, расположенная после кварцевого холодильника
и соприкасающаяся с влажным газом, изготовляется из сплавов,
стойких в присутствии влажного НС1 (хромоникелевые и меднони-
келевые сплавы с добавкой молибдена и вольфрама, алюминиевые
бронзы и др.). В сухом хлористом водороде железо не подвержено
коррозии. Поэтому всю аппаратуру и трубопроводы, расположен-
ные после сушильной башни, изготовляют из стали.
Жидкий хлористый водород
405
Сухой газ сжимают до 60 ат и охлаждают в холодильнике —
змеевике, погруженном в воду. Образующийся жидкий НС1 со-
бирается в сборнике, откуда разливается в тару — стальные бал-
лоны.
Помимо сернокислотной сушки предложено много других спо-
собов получения безводного хлористоводородного газа, пригодного
для ожижения, из разбавленных газов или из растворов (соляной
кислоты). Из газов, образующихся при разложении NaCl серной
кислотой, можно путем абсорбции и последующей десорбции НС1
Рис. 131. Схема производства жидкого хлористого водорода:
/ — печь для синтеза HCI; 2 — газовый холодильник; 3 — сепаратор конденсата соляной
кислоты; 4 — вентилятор; 5 — сушильная башня; 6 — насос; 7 —резервуар для серной
кислоты; 8 — компрессор; 9 - конденсатор; 10 -сборник жидкого хлористого водорода;
11 — баллон для жидкого хлористого водорода; 12 — показатель уровня; 13 — уравнитель-
ная трубка.
получить газ, содержащий больше 99% НС1. Абсорбентом служит
соляная кислота азеотропного состава; поглощенный ею хлори-
стый водород отгоняется при дистилляции в виде почти 100%-ного
НС1, а оставшийся азеотропный раствор охлаждают и вновь воз-
вращают на абсорбцию НС] из печного газа 117' 118.
Другой способ119 заключается в выпаривании соляной кислоты,
содержащей больше 20% НС1, под давлением ~15 ат. Пары
охлаждают до —10, —18°, причем конденсируется концентрирован-
ная соляная кислота, а в паровой фазе остается безводный хлори-
стый водород. Можно осуществлять процесс и не используя повы-
шенное давление, проводя его в две стадии в двух ректификацион-
ных колоннах. В первой колонне из соляной кислоты отгоняется
НС1 при нормальном давлении; остающаяся азеотропная смесь
разделяется во второй колонне при пониженном давлении на водя-
ной пар и более концентрированную кислоту, из которой вновь
406
Гл. XI. Соляная кислота
можно отогнать НС1 при нормальном давлении. Этот процесс
можно осуществлять непрерывно и циклически, используя тепло
уходящего из первой колонны хлористого водорода для подогрева
Кислоты, подаваемой на разделение во вторую колонну |20“123.
С целью получения безводного хлористого водорода из соляной
кислоты, содержащей больше НС1, чем в азеотропной смеси, реко-
мендуют также применять для обезвоживания концентрированный
раствор гигроскопической соли, например, 30—60%-ный раствор
СаС12. Процесс солевой экстрактивной ректификации можно осу-
ществлять в отгонной колонне, в верхнюю часть которой поступает
исходная соляная кислота, а в нижнюю — греющий пар. На уровне,
где соляная кислота достигает азеотропного состава, в колонну
вводится горячий раствор соли. Нижняя часть колонны является
.исчерпывающей, а безводный хлористый водород отводится из
верха колонны. Вытекающий из колонны разбавленный раствор
•соли выпаривают и возвращают в колонну 124-126 Тепло, выноси-
мое уходящим хлористым водородом, можно использовать для по-
догрева поступающей в колонну соляной кислоты. Подобный же
способ с применением MgCl2 разработан для получения чистого
НС1 из абгазов, образующихся при термическом разложении хло-
рида магния 127.
Предварительное концентрирование хлористого водорода из
слабых водных растворов может быть осуществлено и экстрак-
ционными методами. Предложено, например, после предваритель-
ного концентрирования слабой соляной кислоты выпариванием, до
содержания в ней 10% НС1, экстрагировать НС1 пентанолом или
изоамиловым спиртом. Регенерацию спирта, т. е. выделение из него
.концентрированного водного раствора (~30% НС1) производят
при помощи бензола, разделяя затем спирт и бензол разгонкой;
степень регенерации спирта достигает 98—99% 128.
Для получения концентрированного хлористого водорода из без-
водной смеси с другими газами рекомендуется обрабатывать газ
хлористым или бромистым тетраметиламмонием (СНз)4МС1 или
(CH3)4NBr. При соприкосновении газа с этими реагентами в тече-
ние 10—100 сек при 60° образуются продукты присоединения НС1,
которые легко разлагаются при нагревании до 135—150° с выде-
лением концентрированного хлористого водорода и с регенера-
цией поглотителя. Поглощение НС1 может осуществляться как
при пропускании газа через неподвижный или подвижный слой
реагентов, так и через их суспензию в инертной жидкости, напри-
мер, в четыреххлористом углероде, 1,2, 4-трихлорбензоле и др.129
Сульфаты тяжелых металлов (Pb, Си, Cd, Ag, Hg, Sn, Bi, Sb, Ti) и
некоторые фосфаты также поглощают хлористый водород из раз-
бавленного газа и при нагревании выделяют чистый хлористый во-
дород ос.
Регенерация HCl из травильных растворов
407
РЕГЕНЕРАЦИЯ НС1 ИЗ ТРАВИЛЬНЫХ РАСТВОРОВ
Использование соляной кислоты для травления стали все уве-
личивается, так как по эффективности удаления окалины соляная
кислота в 5 раз превосходит серную, а регенерация солянокислых
травильных растворов легче сернокислых. При солянокислотном
травлении ~0,4% железа переходит в раствор, содержащий в
конце процесса около 10% HCI и 15% FeCh.
В США, Канаде, Англии и в других странах регенерацию
травильного раствора осуществляют, распыляя его в печи, обогре-
ваемой горелками. Капли раствора испаряются и образующиеся
твердые частицы FeCl2 в нижней части печи при 300—800° превра-
щаются в НС1 и Fe2O3. Окись железа выгружают из печи, а обжи-
говый газ освобождается от частиц Fe2O3 в циклоне и проходит
через абсорбционную колонну, где образуется 20%-ная соляная
кислота, возвращаемая на травление. Обжиговый газ после цик-
лона содержит еще 3—10% Fe2O3 от количества, образовавшегося
в печи. Для того чтобы эта часть окиси железа не растворялась в
соляной кислоте в абсорбере и не возвращалась бы в травильные
ванны в виде FeCl3, газ между циклоном и абсорбером проходит
через промывную колонну, орошаемую частью травильного раство-
ра, направляемого в обжиговую печь. При этом раствор насы-
щается хлористым водородом и частично упаривается, а улов-
ленная им Fe2O3 превращается в FeCl3. Используют также про-
мывную насадочную и абсорбционную колонны, объединенные
в один агрегат. Установка работает под разрежением, создавае-
мым хвостовым вентилятором, выбрасывающим абгаз в атмо-
сферу 130’ 131.
Канадская фирма Stelco предложила аппарат, в котором про- ,
дукты разложения регенерируемого травильного раствора отде-
лены от продуктов сгорания топлива. Раствор разбрызгивают на
крышку вращающегося цилиндра, под которым сжигают газ.
Стенки цилиндра погружены в проточную воду, образующую ги-
дрозатвор. В результате мгновенного испарения травильного рас-
твооа и разложения при 480—540° FeCl2 превращается в НС1 и
Fe2O3. которая непрерывно удаляется скребком с крышки цилин-
дра. Удельная производительность установки 0,6 м3/(м2‘Ч). HCI
извлекается из газов с образованием соляной кислоты, возвра- .
щаемоей на травление. Такой аппарат в 10 раз ниже распылитель-
ной печи с одинаковой производительностью |32.
Описана установка |33, в которой часть обработанного травиль-
ного раствора упаривается и поступает в реактор с кипящим слоем
песка, где при 800° в присутствии кислорода воздуха идет конвер-
сия FeCl? в Fe2O3. После очистки отходящего газа в циклоне от
частиц Fe2O3 его промывают в адиабатическом абсорбере второй^
частью травильного раствора для извлечения НС1.
408
Гл. XI. Соляная кислота
Описаны несколько вариантов метода регенерации НС1, заклю-
чающегося в кристаллизации FeCl2 при охлаждении травильного
раствора. Кристаллы отделяют на центрифуге и разлагают в печи
на Fe2O3 и НС1134.
Предложен также способ регенерации, заключающийся в окис-
лении содержащегося в травильном растворе FeCl2 в FeCl3 возду-
хом под давлением или хлором. Затем раствор обрабатывают в
насосе-смесителе раствором трибутилфосфата в керосине. Смесь
поступает в отстойную колонну, в которой водная фаза, содержа-
щая НС1, собирается внизу и возвращается на травление, а орга-
ническая фаза, содержащая FeClg, отводится вверху. FeCl3 экстра-
гируют из нее водой, нейтрализуют известью и сбрасывают, а ре-
генерированную органическую фазу возвращают на обработку
окисленного травильного раствора 135.
ПЕРЕРАБОТКА ХЛОРИСТОГО ВОДОРОДА В ХЛОР
Все большие количества хлористого водорода получаются в
виде отхода от других производств. Наряду с этим непрерывно
растет потребность в хлоре для органического синтеза. Поэтому
Созданию рациональных методов переработки хлористого водорода
в хлор уделяют значительное внимание. До сих пор, однако, отсут-
ствуют методы регенерации хлора из НС1, которые были бы эко-
номичнее получения хлора электролизом поваренной соли.
В прошлом веке, до развития промышленного электролиза хло-
ридов, хлор получали из НС1 по способу Вельдона (4НС1 + МпО2 =
= МпС12+ 2Н2О + С12) 136. а затем по способу Дикона (4НС1 + О2 =
= 2Н2О + 2С12). Впоследствии эти способы были полностью вы-
теснены электрохимическими, но в настоящее время химические
способы получения хлора вновь возрождаются на новой техниче-
ской базе. Все они основаны на прямом или косвенном окислении
НО (или хлоридов), причем наиболее распространенным окисли-
телем является кислород воздуха 137~139.
Равновесие реакции Дикона 50> 186
4НС1 + О2 5=± 2Н2О (г.) + 2С12 + 27,3 ккал
смещается в сторону хлора при пониженных температурах и повы-
шенных давлениях и может рассматриваться как совместное рав-
новесие систем: 2НС1 5=F С12 + Н2 и 2Н2 + О2 2Н2О.
Константа равновесия реакции Дикона может быть вычислена
по формуле:
lgK“lg
•2 2
Рн2о ’ РС12
4
/?НС1 Ро2
5750 _т .
-------2,136 lg Т - 0,0008577 + 0,683 • 10 Г + 0,296
7
или по упрощенной, но достаточно точной для технических расче-
тов формуле 1g К = 6034 Г-1 — 6,972.
Переработка хлористою водорода в хлор
40»
Значения 1g/С:
t, °C............ 25 469 600 650 1984
IgAT.......... . +13,28 +1,5 -0,05 -0,4 -4,3
Константа равновесия в наибольшей мере зависит от парци-
ального давления НС1 в равновесной газовой смеси, так как эта
величина входит в уравнение изотермы реакции в четвертой сте-
пени. В меньшей мере влияет давление водяного пара и совсем
мало парциальное давление кислорода, так что выходы реакции
при сжигании НС1 в кислороде и в воздухе отличаются незначи-
тельно. Например, при 430° смесь из 40 объемн. % НС1 и 60 объ-
емн. % воздуха дает в состоянии равновесия 70—71% превраще-
ния. Если освободить эту смесь от азота, то начальный ее состав
будет 76,1% НС1 и 23,9% Ог, а равновесная степень превращения
вследствие увеличения парциального давления НС1 повысится до
76,1%. Если же при прежней начальной концентрации НС1 (40%)
повысить соответственно парциальное давление кислорода, то вы-
ход возрастет только до 72%. Если из равновесной газовой смеси
(полученной из 40% НС1 и 60% воздуха), степень превращения в
которой 70—71%, удалить водяной пар, то степень превращения
возрастет до 82,5—85%. Увеличение выхода реакции за счет повы-
шения давления НС1 или удаления водяного пара связано со зна-
чительными техническими осложнениями, поэтому стремятся по-
высить выход, понижая температуру окисления НС1. Это связано
с необходимостью использования катализаторов, так как без них
реакция при низких температурах идет чрезвычайно медленно.
В диконовском процессе в качестве катализатора использовали
хлорную медь, 50%-ным раствором которой (иногда с добавкой
NaCl) пропитывали пористый керамический носитель. Оптималь-
ная температура реакции на таком катализаторе была обычно в
пределах 430—490°. Этот катализатор легко отравляется соедине-
ниями мышьяка, с которыми образует неактивный арсенат меди, а
также двуокисью и трехокисью серы. Присутствие в газе даже не-
больших количеств паров серной кислоты вызывает резкое умень-
шение выхода хлора в результате последовательно идущих ре-
акций:
H2SO4 = SO2+1/2O2 + H2O
SO2 + С[2 + 2Н2О = 2НС1 + H2SO4
С12 + Н2О = ‘/2О2 + 2НС1
Таким образом, серная кислота является катализатором, спо-
собствующим обратному превращению СЬ в НС1. Поэтому хлори-
стоводородный газ до окисления на медном катализаторе должен
подвергаться тщательной очистке от примесей, снижающих выход
хлора.
Установка Дикона состояла из подогревателя газа, газового
фильтра и контактного аппарата — стального цилиндрического
410
Гл. XI. Соляная кислота
кожуха, внутри которого находились два концентрически располо-
женных керамических цилиндра с отверстиями; кольцевое про-
странство между ними заполнено катализатором. Хлористый водо-
род окисляли воздухом, поэтому хлор получался разбавленным.
В контактный аппарат подавали смесь, содержавшую 25 объемн.%
НС1 и 75 объемн.% воздуха (~16% О2), а газ, выходивший из
аппарата, содержал около 8% С12, 9% НС1, 8% водяного пара и
75% воздуха. Такой газ, после отмывки из него НС1 и осушки
серной кислотой, использовали обычно для получения хлорной из-
вести.
Реставрация процесса Дикона в настоящее время базируется
на окислении хлористого водорода не воздухом, а кислородом, что
позволяет получать концентрированный хлор при применении вы-
сокоактивных катализаторов. Образующуюся хлорокислородную
смесь отмывают от остатков НС1 последовательно 36- и 20 %-ной
соляной кислотой и осушают серной кислотой. Затем хлор сжи-
жают, а кислород возвращают в процесс. Отделение хлора от кис-
лорода производят также, поглощая хлор под давлением 8 ат хло-
ристой серой, которую затем регенерируют, получая 100%-ный
хлор:
CI2 4- S2CI2 ч- * S2CI4
Используют низкотемпературные катализаторы, например, дву-
хлористую медь, активированную солями редкоземельных метал-
лов, что дает возможность вести процесс даже при 100° и поэтому
резко увеличить степень превращения НС1 в Ch 137-139. На окисно-
хромовом катализаторе сжигание НС1 в кислороде производят при
340—480’14°. Описано применение при 250—420° катализатора из
смеси V2O5 с пиросульфатами щелочных металлов и активаторами
на силикагеле141. Изучены механизм и кинетика этого процесса и
установлены оптимальные условия его осуществления 142-143, в ча-
стности в псевдоожиженном слое 144.
Окисление хлористого водорода кислородом производят также
с помощью расплавленной смеси FeCh + КС1 в две стадии, осу-
ществляемые в отдельных реакторах137. В первом реакторе проис-
ходит окисление хлорного железа с образованием хлора:
2FeCl3 4-1V2O2 = 4- ЗС1д
Во втором реакторе хлорное железо регенерируется из окиси
железа хлористым водородом:
Fe2Os 4- 6НС1 = 2FeCl j 4- ЗН2О
Хлористый калий добавляют для уменьшения давления пара
хлорного железа. Этот процесс предложено 145’148 осуществлять
также в одном аппарате, в котором контактная масса, состоящая
из РегОз, КС1 и хлорида меди, кобальта или никеля, нанесенных
Переработка хлористого водорода в хлор
411
на инертный носитель, перемещается сверху вниз аппарата.
Вверху аппарата она проходит горячую зону хлорирования, где
регОз превращается в FeCh, взаимодействуя с НС1, находящимся
в потоке идущего снизу вверх газа. Затем контактная масса опу-
скается в зону охлаждения, где под действием кислорода обра-
зуется элементарный хлор, a FeCh переходит в F&sO3. Окисленная
контактная масса снова возвращается в зону хлорирования.
Подобное же косвенное окисление НС1 в С12 осуществляется
по схеме:
2НС1 + М₽О = MgCl2 + Н2О
MgCl2 + */2О2 ~ MgO + С12
Представляет интерес сочетание этого процесса с регенерацией
аммиака окисью магния в производстве соды (стр. 287). Предло-
жено одновременно получать хлор и серную кислоту, пропуская
через ванадиевый катализатор при 400—600° газ, содержащий
HCl, О2 и большой избыток SO2. Затем из газа конденсируют
H2SO4 и HSO3CI и абсорбируют SO3 серной кислотой — хлор ос-
тается в газовой фазе. HSO3C1 гидролизуется и выделяющийся
НС1 возвращают в процесс147.
Окисление С1" с целью получения С1г можно осуществлять и
и электролизом соляной кислоты или получаемых из нее хлоридов
металлов. В последнем случае регенерацию хлора можно комбини-
ровать с извлечением из руд чистых металлов, в частности порош-
кообразных. Промышленный электролиз соляной кислоты ,36’|48; 149
был освоен в небольших масштабах в США еще в 30-х годах.
В Германии во время второй мировой войны работала опытная
установка по электролизу соляной кислоты. В США получены удо-
влетворительные результаты на полупромышленной установке по
электролизу СиС12, оборудованной ванной мощностью 4000 а.
Электролиз водного раствора СиС12 ведут при 80°, при плотности
тока 11 а'дм? и напряжении на ванне 1,8 в, с графитовыми анодом
и катодом:
2CuC12 = 2CuCl + Cl2
Двухлористая медь легко регенерируется при обработке смеси
CuCi и соляной кислоты воздухом в абсорбционной колонне при
83—87°:
2CuCl + 2НС1 + 1 /2О2 = 2СиС12 + Н3О
Для установки производительностью 35 т хлора в сутки на 1 т
Хлора требуется затратить 1600 квт-ч постоянного тока и
155 квт-ч переменного, т. е. расход энергии на 1 т хлора прибли-
зительно в 2 раза меньше, чем при электролизе раствора хлори-
стовр натрия13711Я0. Помимо меди, в качестве «переносчика» при
412
Гл. XI. Соляная кислота
электрохимической регенерации хлора могут быть использованы
любые другие поливалентные металлы —Fe, Сг, Мп, Ni и пр.
Напомним, что хлор может быть получен и окислением хлори-
дов. Например, при взаимодействии NaCl и SO3 идут реакции:
2NaCl + 2SO3 = 2NaSO3Cl
2NaSO3Cl = Cl2 + SO2 + Na2SO4
Распад NaSO3Cl происходит при 275°. Смесь газов SO2 и С12
можно разделить, поглощая хлор S2CI2 или СС14 или подвергая ее
ректификации, в результате которой получается азеотропная смесь,
содержащая 88 мол. % С12 и 12 мол. % SO2. Азеотропную смесь
можно далее разделить, переводя SO? в SO2CI2 и отделяя избыточ-
ный хлор, a SO2CI2 разлагая при 200° на SO2 и С1г, которые до-
бавляют к смеси, направляемой на ректификацию.
Хлор можно получить и окислением хлорида или хлористого
водорода азотной кислотой, а также двуокисью азота (см. гл.
XXXII):
3HCI + HNO3 = Cl2 + NOCI + 2Н2О
Разложение хлористого нитрозила может быть достигнуто его
окислением:
2NOC1 + О2 = 2NO, + С12
Предложено, например, окислять NOC1 75 %-ной азотной кис-
лотой 151:
2NOC1 + 4HNO3 = Cl, + 6NO2 + 2Н2О
Смесь хлора и двуокиси азота разделяют, перерабатывая NO2
в слабую азотную кислоту, используемую затем для окисления
НС1 в первой стадии процесса с образованием С12 и NOC1. Основ-
ным затруднением при осуществлении этого процесса в промыш-
ленных масштабах является устранение коррозии. В качестве ма-
териалов для аппаратуры применяют керамику, стекло, свинец,
никель, пластмассы. По этому методу в США в 1952—1953 гг.
работала установка производительностью 75 т хлора в сутки137.
Разработан циклический способ получения хлора окислением
хлористого водорода азотной кислотой без образования хлори-
стого нитрозила по реакции:
2НС1 + 2HNO3 = Cl, + 2NO2 + 2Н2О
Процесс идет в жидкой фазе при 80°, выход хлора достигает
100%, NO2 получается в жидком виде152.
ЛИТЕРАТУРА
1. М. Е. По зин, Технология минеральных удобрений и солей, Госхимиздат,
1957, гл. XIII. — 2. X. Л. Цейтлин, ЖПХ, 21, № 1, 35 (1948). —3. X. Л. Цейт-
лин, С. М. Бабицкая, Там же, 31, № 1, 84 (1958). — 4. А. В о и 11 ё, С ba-
be г о и х, Compt. rend., 242, № 25, 2947 (1956). — 5. И. С. М о р о з о в, Изв. СССР
Литература
413
ОХН, № 1, 37 (1946). — 6. Л. С. Лилич, В. И. Тимофеев, Веста. ЛГУ, № 10,
Сер. физ. и хим., в. 2, 68 (1956). — 7. М. С. Вревский, Работы по теории
растворов, Изд. АН СССР, 1953.— 8. А. К. Covington, J. Е. Prul, J. Cheni.
Soc., 1957, 1930. — 9. G. Vuillard, Compt. rend., 241, № 19, 1308 (1955).—
10. M. А. Клочко, M. Ш. Курбанов, ИСФХА АН СССР, 24, 237 (1954).
11. H. А. Лоури, Соляная кислота и сульфат натрия, Химтеорет, 1934.—
12. И. И. Ангелов, М. Ф. Володина, Труды ИРЕА, в. 20, 1951, стр. 190.—
13. М. Е. П о з и и, Труды ЛТИ им. Ленсовета, в. 20, 1931, стр. 3.— 14. А. Б. 3 д а-
н о в с к и й, Е. И. Л я х о в с к а я, Р. Э. Ш л е й м о в и ч, Справочник по раствори-
мости солевых систем, т. 1, Госхимиздат, 1953, стр. 27. —15. Д. М. Корф,
А. П. Шатровская, ЖОХ, 10, № 13, 1231 (1940).— 16. S W. Benson,
R. L. Richardson, J. Am. Chem. Soc., 77, № 16, 4206 (1955).— 17. Chem. Eng.
News, 44, № 36, 72A (1966). —18. F. X. McGarvey, пат. США 2695875, 1954.—
19. G. Mobius, пат. ГДР 7361, 1954, — 20. П. В. Д ы б и н а, ЖПХ, 33, № 10,
2184 (1960).
21. S. Schein, Chem. Met. Eng., 35, № 11, 673 (1928). —22. И. В. Бирю-
ков, Хим. пром., № 4, 113 (1952). —23. Пат. США 2234738, 1941. — 24. И. Н. Пу-
тилова, С. А. Балезин, В. П. Баранник, Защита металлов от разъеда-
ния кислотами, Госхимиздат, 1945. — 25. И. Н. Путилова, С. А. Балезин,
В. П. Баранник, Ингибиторы коррозии металлов, Госхимиздат, 1958. —-
26. В. П. Баранник, И. Н. Путилова, Хим. пром., 266 (1948).— 27. С. А. Б а-
лезин, В. П. Баранник, И. Н. Путилова, Применение ингибиторов кис-
лотной коррозии, Госхимиздат, 1948.—28. X. Л. Цейтлин. Хим. пром., № 7,
199 (1951). — 29. В. П. Баранник, И. Н. Путилова, Там же, № 4, 103
(1949). — 30. С. А. Балезин, Уч. зап. МГПИ, в. 76, 5 (1953).
31. И. П. А н о щ е н к о, ЖПХ, 30, № 3, 393; № 4, 523 (1957).— 32. В. А. X и т-
р о в, В. П. Задорожный, Там же, 37, № 3, 574 (1964). — 33. Т. Д. Колп а-
кова, В. П. Баранник, Хим. пром., № 7, 596 (1960). — 34. А. И. Горба-
нев, В. Я. Николина, Сульфат натрия, Госхимиздат, 1954. — 35. Я. Е. В и л ь-
нянский, 3. Л. Персии, Труды УНИХИМ, в. 4, 1957, стр. 83.—
36. Е. И. Лукьянова, Сборник статей по общей химии, т. 1, Изд. АН СССР,
1953, стр. 106. — 37. Я. Е. Вильи янский, 3. Л. Персии, Хим. пром., № 6,
19 (1946).—38. J. Kendall, М. L. London, J. Am. Chem. Soc., 42, 2131
(1920). — 39. H. С. Б а н н ы х, Автореф. канд. дисс., Свердловск, 1951; Н. С. Б а н-
иых, Я- Е. Вильнянский, Труды УНИХИМ, в. 7, 1958, стр. 94,—
40. И. М. Вассерман, Производство минеральных солей, Госхимиздат, 1962,
гл. II.
41. С. А. Жихаревич, С. Д. Лукова, ЖПХ, 9, № 7, 1230 (1936).—
42. С. В. Лозовой, Хим. пром., № 4, 244 (1957). — 43. Я. Е. Вильнянский,
В. П. 3 а б и я к о, Там же, № 1, 22 (1945). — 44. А. М. Г и н с т л и н г, Хим. маш.,
№ 2, 3 (1939); ЖХП, № 9, 31 (1939). — 45. М. И. Ц а л, Я. Е. Клейман, Хим.
пром., № 4, 120 (1951). — 46. Н. В. Гвоздев, Производство соляной кислоты и
сульфата, Химтеорет, 1933. — 47. Н. В. Гвоздев, А. М. Г и и с т л и н г,
Д. М. Зильберман, ЖХП, 17, № 8, 34 (1940). — 48. Хим. пром., № 7 21
(1944). — 49. Франц, пат. 1397699, 1964; пат. США 3363977, 1963. — 50. П. Па-
скаль, Синтез и катализ в основной химической промышленности ГОНТИ,
1938.
51. Chem. Eng., № 5, 132 (1954). — 52. В. Neumann, Н. Kunz, Z. ang.
Chem., 42, № 47, 1085 (1929). — 53. С. И. Вольф кович, Ф. Г. Марголис,
Изв. АН СССР, ОХН, № 5, 322 (1942). — 54. Г. В. Лабутин. А. М. Маль-
цев, Труды ВАМИ, № 40, 1957.—55. С. Cannon, пат. США 2706144, 2706145,
1955. — 56. .С. М. Вольфкович, Ф. Г. Марголис, ДАН СССР, 51, № 1, 23
(1943) . — 57. В. Г. Ф л е й ш м а н, Хим. пром., № 7, 411 (1957). — 58. Л. В. Г а и т-
м а н, Е. П. Ш в е д о в, Там же, № 4, 19 (1947). — 59. А. Н. Maud е, Chem. Eng.
Progr.. 44, № з, 179 (1948). — 60. А. Н. Maude, Chem. Ind., № 9,-348 (1942).
414
Гл. XI. Соляная кислота
61. С. Д. Бесков, Техно-химические расчеты, Госхимиздат, 1950, стр. 246.—
62. A. W. U m 1 a n d, J. Electrochem. Soc., 101, № 12, 626 (1954). — 63. А. И. Роз-
л о в с к и й, ЖФХ, 29, № 1, 13 (1955). — 64. А. И. Розловский, ДАН СССР,
92, № 3, 621 (1953). — 65. Суэла, Асайо, япон. пат. 6561, 1954. — 66. J. Van
Blest, R. De G r u f, Ind. chim. beige, 30, № 11, 1195 (1965). — 67. Ind. chemist,
№ 314, 115 (1951); № 333, 451 (1952). — 68. W. Runzen, W. Rasche, пат.
ФРГ 923844, 1955. — 69. Франц, пат. 1070017, 1954. — 70. A. Czernotzky,
пат. ГДР 7039, 1954; 10779, 1955.
71. W. Hirschkind, Ind. Eng. Chem., 17, № 10, 1071 (1925).—72. A. A. 4 h-
жик, ЖХП, Ns 9, 37 (1932). — 73. B. Neumann, R. D о m k e, Z. ang. Chem.,
№ 11, 368 (1926). — 74. Б. Д. Мельник, Хим. пррм., № 7, 548 (1966).—
75. H. О. Pritchard, J. Am. Chem. Soc., 76, № 4, 1201 (1954).— 76. Я- С. Д e-
миховский, Пром. орг. хим., 7, № 2, 107 (1940). — /7. A. Weidemann,
В. В r u z s, пат. ГДР 4698, 1953. — 78. U. Kopsch, англ. пат. 695063, 1953 —
79. G. Sly, австрал. пат. 159181, 1954. — 80. H. C. Wohlers, пат. США
2730194, 1956.
81. Chem. Met. Eng., 52, № 4, 130 (1945). — 82. M. H. К h u d k a r, M. R a k i-
boddowla, Chem. Ind., № 5, 128 (1954). — 83. Haller, англ. пат. 716754,
1954: франц, пат. 1107573, 1956.— 84. С. F. Р г u 11 о n, W. S. М i 11 е г, L. С. Н i г d-
1 е г. пат. США 2735749, 1956. — 85. К. Herod, польск. пат. 37981, 1955.—
86. Б. Д. Мельник, Хим. пром., № 6, 330 (1957). — 87. М. Г. М а н в е л я н,
Г. О. Григорян, С. С. Караханян, Изв. АН АрмССР. ОХН, 17, № 5, 573
(1964); 18, № 1, 92 и № 5, 516, 521 (1965). — 88. Е. Berl, Н. S tandinger,
Z. ang. Chem., 43, № 46, 1006 (1930). — 89. Англ. пат. 478851, 1938. — 90. Франц,
пат. 1072599, 1954.
91. Ф. К. Михайлов, Л. М. Волова, Л. С. Коваленко, Хим. пром.,
№ 8, 595 (1964). —92. S. G. Osborn, пат. США 2126803, 1338, — 93. В. Анд-
реев, Г. Креймер, ЖХП, № 2, 146 (1927). — 94. Пат. ЧССР 118613, 1965. —
95 М. Н. Мер лис, ЖПХ, № 17, 1043 (1936). — 96. W. Sobievanski, Chernik,
7, № 2, 34 (1954). —97. S. Н. Friedmann, Chem. Eng., 69, № 14, 133 (1962).—
98. А. В. Горяйнова, Журн. ВХО, 10, № 1, 58 (1965). —99. А. П. Прозо-
ров, Я- Е. Н у с и н о в, И. К. Шмелев. Хим. пром., № 2, ЮЗ (1955) —
100. И. Я. Клинов, Дерево, как материал для химической аппаратуры, Гос-
химиздат, 1956.
101. И. Я. Клинов, Хим. наука и пром., № 4, 492 (1958). — 102. И. А. Его-
ров, Фаолит и его применение в химической промышленности. Госхимиздат,
1956. — 103. К. А. Поляков, Ф. Б. С л о м я н с к а я, К. К. Полякова, Кор-
розия и химически стойкие материалы. Госхимиздат, 1953. — 104. И. М. Корни-
лов, Хим. наука и пром., № 2, 238 (1957).— 105. С. С. Brumbaugh, А. В. Т 111-
m a n n R. С. S u 11 е г, Ind. Eng. Chem., 41, № 10, 2165 (1949). — 106. W. Peck,
Ind. Chem., 14, № 166, 445 (1938). — 107. F. Hunter, Ind. Eng. Chem., 30, № 11,
1214 1938). — 108. M. Л. Варламов, К. К. Белен авичус, ЖПХ, 36, № 4,
697 (1963).— 109. R. W. Haisty, J. W Ross, пат. США. 3197942, 1964.—
НО. А. М. Гаспарян, Абсорбция хлороводорода в колонных аппаратах, изд.
Ереванск. политехи, ин-та. 1940; А. М. Гаспарян, Труды Ереванского поли-
технического ин-та, в 1, 1941.
111. В. Haase, Н. Koch, Chem. Techn.. 20, № 12, 738 (1968) —
112. В. Н. Шульц, Расчеты по технологии соляной кислоты и сульфата, ОНТИ,
1934. —113. П. С. Артамонов, В. Н. Извеков, Хим. пром., № 3, 13 (1946).—
114. В. М. Р а м м, Абсорбция газов, Изд. «Химия», 1966, стр. 275, 281, 731, 732. —
115. В. М. Р а м м, Абсорбционные процессы в химической промышленности, Гос-
химиздат, 1951, стр. 124, 314. — 116. G. Hellemanns, Н. Seibring, Chem.
Ingr. Techn.. 38, № 10, 1046 (1966). — 117. W. Bey, швейц, пат. 288158, !953.—
118. R. C. Sutter, пат. США 3165453. 1959. — 119. С. C. Brumbaugh, пат.
США, 2665240, 1954, — 120. Финск. пат. 26930, 1954.
Литература
415
121. Фраиц. пат. 1040338, 1953. —122. С. Gerdes, С. Hamman п, пат.
ГДР 878487, 1953,— 123. Т. Riehm, канад. пат. 514290, 1955, — 124. Н. Р. Ro-
berts, канад. пат. 490323, 1953. — 125. R. V i е w е g, Chem. Techn., 12, № 14, 188
(1960). — 126. О. В. Тышецкая, И. М. Г р и н ш т е й н, Труды Всесоюзн. н.-н.
ин-та гидролизной и сульфитноспиртовой пром., т. 14, 1965, стр. 225, 280. —
127. J. S у п о w i е s, Ind. chim. beige, 33, As 4, 351 (1968). — 128. E. D. C r i t ten-
den, A. N. H i k s о n, Ind. Eng. Chem., 46, № 2, 265 (1954). — 129. D. H. Camp-
bell, пат. США 2717199, 1955. — 130 Sheet Metal Ind, 43, № 473, 718 (1966).
131. A. Hake, Blech, 13, № 5, 264 (1966).— 132. Canad. Chem. Process, 49,
№ 7, 93 (1965). — 133. Chem. Age (India), 17, № 8, 635 (1966), — 134. A. Hake,
Sheet Metal Ind, 42, Ks 461, 696 (1965). —/35 Франц, пат. 1417037, 1964.—
136. В. В. Стендер, Электролитическое производство хлора и щелочей. Хим-
теорет, 1935, —/37. Tekn. tidskr, 83, № 32, 653 (1953). —/33. F. Wolf, F. Run-
ge, R. Korn, Z. anorg. Chem, 304, № 1, 2, 48 (I960). — 139. Галланд. пат.
112095, 1960; пат. ГДР 33098, 1961; пат. США 3201201, 1962; англ. пат. 993496,
1963. — 140. R. Banner, Т. Perrin, пат. США 2678259, 1954.
141. Пат. ФРГ 1240830, 1961. — 142. А. А. С о л о ш е н к о, Я- Е. В и л ь н я н-
скнй, ЖПХ, 37, № 3, 535 (1964); Кинетика и катализ, V, № 5, 881 (1964).—
143. A. A. Jones, Н. Bliss, С. A. Walker, J. Am. Inst. Chem. Eng, 12, № 2,
260 (1966). —144. К. H. Fleurke, Trans. Inst. Chem. Eng, 46, № 2; Chem. Eng,
№ 216, 41 (1968). — 145. D. J. Pye, W. J. Joseph, пат. ФРГ 888386, 1953.—
146. A. Abbey, аигл. пат. 689370, 1953.— /47. R. Bauwens, J. Mol Here,
франц, пат. 1430215, 1965. —148. W. Gardiner, Chem. Eng, 54, № 1, 100
(1947). — 149. P. Galione, G. Messner, Electrochem. Technol, 3, № 11, 12,
321 (1965). — 150. С. P. Roberts, Chem. Eng. Progr, 46, 456 (1950).
151. W. J. Congdon, S. W. Grossmann, пат. США 2665195, 1954.-—
152. Chem. Age, 88, № 2246, 131 (1962).
Глава XII
СОЛИ БАРИЯ
Важнейшими промышленными солями бария являются хлорид,
карбонат и сульфат. Выпускают также гидроокись, окись и пере-
кись бария, нитрат, хромат, манганат, хлорат и другие соли, а так-
же сульфид бария, который служит полупродуктом для производ-
ства других соединений бария.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Окись бария ВаО обычно получается в виде аморфной, пори-
стой массы с плотностью 4,73—5,46 г/сж3; могут быть получены
кубические кристаллы с плотностью 5,72 г)см\ Плавится при 1923°.
Довольно хорошо растворяется в расплавленных хлоридах и суль-
фатах щелочных металлов, не вступая с ними в реакции обмена;
так, например, растворимость ВаО при 1200° в NaCl 5,33, а в
Na2SO4 7,58 мол. % Окись бария энергично соединяется с водой
ВаО + Н2О = Ва(ОН)2 + 22,3 ккал
образуя гидроокись бария — белый, аморфный порошок с плотно-
стью 4,5 г!см3. При 20° в воде растворяется 3,75%, а при 80°
53,17% Ва(ОН)2; в присутствии хлоридов и нитратов щелочных
металлов растворимость увеличивается, а в присутствии гидрооки-
сей — уменьшается.
Из водных растворов системы Ва(ОН)2—Н2О кристаллизуется
Ва(ОН)2-8Н2О с плотностью 1,66 г/сж3, конгруэнтно плавящийся
при 78,3°. Растворение Ва(ОН)2-8Н2О в воде идет с поглощением
тепла (—15,2 ккал/моль). Из концентрированных растворов, содер-
жащих 57—62,2% Ва(ОН)2, кристаллизуется Ва (ОН2) • ЗН2О; кон-
центрации 62,2% соответствует перитектическая точка при 88°. При
более высоких концентрациях выделяется Ва(ОН)2-Н2О, имеющий
точку полиморфного превращения при 185° и перитектического пе-
рехода в безводный Ва(ОН)2 при 199° (концентрация в точке пе-
Физико-химические свойства
417
рехода 88,2% Ва(ОН)2). Безводная гидроокись бария при 250°пре-
терпевает полиморфное превращение и плавится без разложения
при 408°2. При нагревании до 900—1000° получается безводная
окись бария 3.
Перекись бария4 ВаО2— белый порошок с плотностью
4,96 г/см3, весьма устойчивый в сухом виде. Технический продукт
содержит 80—90% ВаО2 и окрашен соединениями железа в желто-
ватый или зеленоватый цвет. Перекись бария обладает парамаг-
нитными свойствами. При нагревании с углем действует как депо-
ляризатор, при этом протекает реакция:
2ВаО2 + С = 2ВаО + СО2
Элемент ВаО2 — уголь развивает электродвижущую силу, рав-
ную 1 в. При нагревании выше 700° ВаО2 переходит в тестообраз-
ную массу и разлагается по обратимой реакции:
2ВаО2 2ВаО + О2 — 34,2 ккал
Эта реакция ускоряется в присутствии влаги, гидроокиси бария
и других веществ.
Многочисленные литературные данные4 о давлении диссоциа-
ции ВаО2 при разных температурах весьма противоречивы. Веро-
ятно, равновесное давление кислорода равно 1 ат приблизительно
при 840°.
Перекись бария является сильным окислителем. Она окисляет
SO2 в сульфат (на холоду), N2O и NO в нитрат (при нагревании),
разлагает сухой хлористый водород с выделением С12, С12О и даже
О3. Окисление органических веществ может сопровождаться взры-
вом и воспламенением. С водой ВаО2 образует сначала ВаО2 • 8Н2О,
затем Ва(ОН)2 и Н2О2. При действии перекиси водорода на слабо-
щелочные растворы бариевых солей ниже 30° или на октагидрат
перекиси бария (при 0°) образуются белые кристаллы ВаО2 • 2Н2О2.
Выше 30° образуется ВаО2 • Н2О2. В системе Ва(ОН)2—Н2О2—Н2О
в пределах температур от —10 до +50°, помимо октогидрата пе-
рекиси бария ВаО2 • 8Н2О, выделяющегося только при температу-
рах, близких к 0°, и малых концентрациях Н2О2, в твердых фазах
существуют дипероксигидрат ВаО2 • 2Н2О и монопероксигидрат
ВаО2 • Н2О5. Установлена возможность получения надперекиси ба-
рия Ва(О2)2 при взаимодействии перекиси бария с кислородом под
давлением больше 3000 ат6.
Хлористый барий ВаС12 • 2Н2О кристаллизуется из водных рас-
творов с двумя молекулами воды в виде бесцветных пластинок с
плотностью 3,05 г/см6. Выше 113° теряет кристаллизационную
воду. Безводный имеет плотность 3,86 г/см6 и плавится при 962’.
Насыщенный водный раствор содержит при 0° — 24,0%, при
100°—37,0% ВаС12. Водные растворы, содержащие ВаС12 и
Вв(ОН)2, обладают хорошими буферными свойствами в облает^
14М. Е. Позин
418
Гл. XII. Соли бария
pH = 13,62 -ь 13,821. В присутствии НС1 и особенно СаС12 раство-
римость ВаС12 в воде резко уменьшается (рис. 132)8.
Изучены свойства растворов ВаС12 в расплавленных солях —
нитратах9, хлоридах и других10. В системе ВаС12—СаС12, имею-
щей эвтектику с 35 мол. % ВаС12 при 605°, обнаружено соединение
ВаС12 • СаС12 с ^пл 632° ".
В системе ВаС12—КС1—NaCl существует двойная соль ВаС12-
• 2КС112.
Нитрат бария Ba(NO3)2 представляет собой бесцветные окта-
эдрические кристаллы плотностью 3,21 г/см3, плавящиеся при 592°.
При нагревании разлагается с образова-
Рис, 132. Растворимость
ВаС12 в воде в присут-
ствии СаС12.
нием вначале нитрита бария, затем окиси
бария. Насыщенный водный раствор при 0°
содержит 4,8%, при 20° — 7,9%, при 100°—
25,5% Ba(NO3)2. В присутствии нитрата
и хлорида кальция растворимость Ba(NO3)a
значительно понижается. Составы эвто-
нических растворов при 100° (в мол.%):
для системы Ba(NO3)2—Ca(NO3)2—Н2О
меньше 0,1 Ba(NO3)2 и больше 99,9
Ca(NO3)2, количество воды 140,9 М на
100 М солей; для системы Ba(NO3)2—
ВаС12—Н2О 28,5 Ba(NO3)2 и 71,5 ВаС12, ко-
личество воды 1320 М на 100 М солей. Вы-
саливающее действие СаС12 объясняется,
по-видимому, его гидратацией 13’ 14.
Карбонат бария ВаСО3 имеет три модификации: ниже 81Г —
a-модификация, кристаллы ромбической системы (витерит) с плот-
ностью 4,3 г!см\ выше 811° стабильна гексагональная модифика-
ция, выше 982° — кристаллы кубической системы. Карбонат бария
устойчив при достаточно высоких температурах. Давление диссо-
циации при 1200° равно 92 мм рт. ст., при 1400°~ 1 ат. Несколько
ниже 1400° ВаСО3 начинает спекаться; плавится при 1740°. В воде
почти не растворим — при 18° в 1 л воды растворяется ~0,02 г
ВаСО3. Растворимость его повышается в присутствии угольной кис-
лоты или солей аммония, а особенно в концентрированных рас-
творах Na2SO4, MgSO4, ZnSO4, Ca(NO3)2, СаС12, K2CO3, MgCl2.
В водной системе ВаСО3 + Na2SO4 ** BaSO4 + Na2CO3, при 33° и
оптимальном отношении ВаСО3: Na2SO4, равном 11:5, после 7-ча-
сового перемешивания выход Na2CO3 в виде 5—6%-ного раствора
достигает 89% 15. В системе BaSO4 — К2СО3— Н2О при всех тем-
пературах стабильной парой солей является ВаСО3 и K2SO4. Опи-
саны условия превращения ВаСО3 в окись, феррит и другие
соединения бария 1б. При нагревании смеси ВаСО3 и SiO2 взаимо-
действие начинается выше 700° с образованием метасиликата ба-
рия, а выше 800°— ортосиликата. При 1000° и избытке ВаСО3 на-
Физико-химические свойства
419
ряду с ортосиликатом образуется трехбариевый силикат. В смвсях,
богатых SiO2, метасиликат образуется только выше 1000°17. Взаи-
модействие эквимолекулярных количеств ВаСО3 и ТЮ2 начинается
выше 400° с образованием ВаТЮ3. В интервале 1150—1250° обра-
зуется тетрагональная модификация ВаТЮз. Титанат бария обла-
дает сегнето-электрическими свойствами в широком диапазоне тем-
ператур и в этом отношении имеет ряд преимуществ перед другими
сегнето-электриками. Монокристаллы титаната бария могут быть
получены из расплавленных систем титаната бария и фторидов,
хлоридов, сульфатов, силикатов, карбонатов и других соединений
щелочных металлов; титанат бария плохо растворим в расплавах
большинства галогенидов щелочных металлов, за исключением
фторидов натрия и калия 18,19.
Сульфат бария BaSO4 имеет плотность 4,5 г/см3, при ~1150°
претерпевает полиморфное превращение, при ~1400° начинает за-
метно диссоциировать, плавится при 1580°. Искусственно осажден-
ный в виде белого, тонкого, почти аморфного порошка называется
бланфиксом. Почти совершенно не растворим в воде20 — насыщен-
ный водный раствор при 18° содержит 0,00023% BaSO4. Раство-
ряется в расплавленных щелочах, в концентрированной серной
кислоте с образованием кислого сернокислого бария, немного рас-
творяется в кипящей соляной кислоте. В системе BaSO4 — NaCl
наблюдается полная смешиваемость в жидком состоянии при от-
сутствии соединений и твердых растворов; в эвтектике при 741° со-
держится 33,3 вес.% BaSO421. При длительном кипячении измель-
ченного барита в растворе соды образуется двойная соль сульфата'
и карбоната бария.
Сульфид бария BaS при кристаллизации из расплавленного со-
стояния образуется в виде кристаллов кубической формы с плот-
ностью 4,25 г/см3. Технический продукт представляет собой пори-
стую массу серого или черного цвета (цвет зависит от количества
примеси угля). При растворении в воде BaS гидролизуется с об-
разованием гидроокиси и гидросульфида бария, т. е. ионов ОН*
и HS-;
2BaS + 2Н2О = Ba(HS)2 + Ва(ОН)2
Из водного раствора может быть выкристаллизован BaS • 6Н2О.'
Кислоты, в том числе и СО2 воздуха, выделяют из BaS сероводо-
род. При нагревании с концентрированными кислотами BaS раз:
лагается с выделением SO2 и S. В чистом виде сернистый барий
обладает люминофорными свойствами.
При взаимодействии раствора Ва(ОН)2 с сероводородом обра-
зуются полисульфиды бария с примесью небольших количеств тио-
сульфата, сульфида и сульфита. Полисульфиды образуются также
при растворении в воде смеси тонко размолотых плава сернистого,
бария и серы. Образовавшиеся вначале низшие полисульфиды,.
420
Гл. XII. Соли бария
реагируя с серой, переходят в высшие — BaS-Ss, BaS-S*22. Поли-
сульфиды бария достаточно устойчивы: температуры плавления
BaS2 —925°, BaS3 — 554°.
Фторид бария BaF2 имеет плотность 4,83 г! см? и плавится при
1280°. При 18° в 1 л воды растворяется 1,63 г BaF2.
Кремнефторид бария BaSiF6 получают взаимодействием рас-
творов кремнефтористоводородной кислоты и хлорида бария, а так-
же по реакции23
BaS + H2SiFe = BaSiFe + H2S
при небольшом избытке H2SiFe во избежание образования BaF2 по
реакции:
BaSiF6 + 2BaS + 2Н2О = 3BaF2 + SiO2 + 2H2S
При 25° в l л воды растворяется 0,25 г BaSiFg.
Все растворимые соединения бария ядовиты. Смертельная доза
~0,8 г бариевой соли. Средство первой помощи — прием внутрь
разбавленного раствора сульфата магния. О технике безопасности
в производстве бариевых солей см.24.
ПРИМЕНЕНИЕ
Хлорид бария применяется в качестве яда для борьбы с вреди-
телями полевых, огородных и садовых культур, в частности для
уничтожения свекловичного долгоносика25. Его применяют также
в керамической промышленности, в текстильном производстве, для
изготовления некоторых минеральных красок, для очистки котель-
ной воды и рассолов от иона SOF, при получении некоторых ред-
ких металлов (например, радия) в качестве соосадителя при выде-
лении их солей из растворов и т. д.
Нитрат бария применяют для получения окиси и перекиси ба-
рия, в пиротехнике при изготовлении осветительных составов (Ва
окрашивает пламя в желтовато-зеленый цвет), в производстве не-
которых взрывчатых веществ. Системы, содержащие нитрат бария
и хлориды натрия и калия, представляют интерес в качестве низко-
температурных соляных ванн для термической обработки метал-
лов 2fS.
Карбонат бария используют для изготовления карбюризаторов,
применяемых для науглероживания (цементации) стальных изде-
лий при высоких температурах. Они представляют собой зерна дре-
весного угля или активированного каменноугольного полукокса
(ГОСТ 5535—50), покрытые слоем ВаСО3; содержание последнего
10—25%. Карбонат бария применяют в керамической промышлен-
ности, в производстве оптического стекла, эмалей, а также в радио-
ламповом производстве для покрытия катодов 27’28. Карбонат ба-
рия используют также в качестве зооцида — для борьбы с грызу-
нами. '
Применение
421
Окись, гидроокиси и перекись бария производятся в небольших
количествах. Окись бария добавляют к материалам, из которых
изготовляют сердечники электромагнитов. Перекись бария приме-
няют для изготовления запалов, используемых при термитной свар-
ке. Гидроокись бария в некоторых странах употребляют в сахар-
ной промышленности для выделения сахара из мелассы.
Природный сульфат бария — барит служит в СССР основным
сырьем для производства всех солей бария. Тонкоизмельченный
барит используют как утяжелитель глинистых растворов при глу-
боком бурении нефтяных и газовых скважин. В США для этой
цели используют около 80% потребляемого барита 29-30. Помимо
этого, его применяют для производства бланфикса и литопона, а
также при изготовлении специальных сортов стекла, эмалей, гла-
зури и др. Бланфикс и лучшие сорта барита используют в качестве
наполнителя при производстве высших сортов бумаги, при произ-
водстве резины, пластмасс, при изготовлении аппретуры в тек-
стильной промышленности, для получения огне- и кислотоупорных
красок и замазок, в электротехнической и парфюмерной промыш-
ленности, а также в рентгенотехнике. Литопон — эквимолекулярная
смесь BaSO4 и ZnS, осаждающаяся при сливании растворов BaS
и ZnSO4, имеет Наибольшее значение как стойкая против действия
щелочей и сероводорода белая краска31-32. Однако производство
литопона резко сокращается — его вытесняют титановые пигменты,
имеющие лучшую укрывистость, светостойкость и др.
Сульфид бария является промежуточным продуктом при изго-
товлении соединений бария из барита и применяется в кожевенной
промышленности, а также при изготовлении инсектофунгицидов,
в особенности сольбара — полисульфидов бария. Сольбар получают
смешением размолотого до тонкости частиц меньше 0,1 мм плава
сернистого бария с молотой серой. Сольбар, в отличие от извест-
ково-серных отваров, обладает транспортабельностью и незначи-
тельной фитоцидностью33. Фунгицидное и инсектицидное действие
сольбара (и других полисульфидов) обусловлено не только поли-
сульфидами, но и тонкодисперсной элементарной серой, являю-
щейся продуктом их разложения. Сернистый барий особой чистоты
используют при изготовлении люминофоров.
Фтористый барий является антисептиком для древесины и ин-
сектицидом. Более широкое распространение в качестве инсекти-
цида получил кремнефтористый барий, в отличие от BaF2 не ожи-
гающий растения.
Хлорат бария применяют в пиротехнике и в производстве взрыв-
чатых веществ, перхлорат бария — в качестве обезвоживающего
средства, ацетат бария — при крашении тканей, манганат бария —
в малярном деле и проч.
Титанат и ферриты бария, обладающие сегнето-электрическими
явойствами, применяют в радиоэлектронике. . Как тугоплавкий
422
Гл. XII. Соли бария
Применение
423
полупроводниковый материал представляет интерес дисилицид ба-
рия BaSiz34-
Требования к качеству важнейших технических солей бария
приведены в табл. 34 и 35 (в %).
1 ТАБЛИЦА 35
Требования к качеству сернокислого бария
(содержание компонентов в %)
Для баритования (ГОСТ 5694—68) Аккумуля- торного (ГОСТ 11380—65)
марка А марка Б
Содержание сернокислого бария: в пересчете на сухое веще- ство, не менее 98,5 98 98,5
в натуральном продукте, не менее 69 68,6 —
Содержание влаги, не более . . 30 30 0,2
Потери при прокаливании, не более ч 1,0
Содержание примесей в пере- счете на сухое вещество, не более: железа 0,002 * 0,006 * 0,01 **
хлоридов в пересчете на хлор 0,04 0,05 0,04
CaSO4 — — 0,5
водорастворимых сульфатов (SO4) • 0,1 0,1
SiO2 — — 0,4
* В пересчете на РегОз.
♦♦ В пересчете на Fe.
Сульфат бария, предназначенный для аккумуляторной промыш-
ленности, не должен содержать примесей соединений тяжелых ме-
таллов, за исключением свинца, и должен иметь определенную
дисперсность: общий вес частиц крупнее 5 мк не должен превы-
шать 20%, а вес частиц размером 1 мк и менее допускается в пре-
делах 10—40%; остаток после просева на сите № 016 не должен
превышать 1%. Наличие твердых комков не допускается. Насып-
ная плотность продукта 0,73 г/см^. Для некоторых потребителей из-
готовляется продукт с повышенной дисперсностью (30—40% веса
составляют частицы меньше 1 мк).
Бланфикс, выпускаемый в виде пасты для баритования бумаг,
должен иметь белизну не менее 97% (для марки А) и 96% (для
марки Б) от белизны эталона, не содержать веществ, восстанавли-
вающих КМпО4, сульфидов, сульфатов и тиосульфатов, за исклю-
чением тех случаев, когда его выпускают подкрашенным в сирене-
вый, голубой, кремовый цвета. Продукт должен удовлетворять
424
Гл. XII. Соли бария
требованиям предусмотренного ГОСТ испытания на дисперсность;
остаток после просева на сетке № 008К не должен превышать
0,01%. Для марки А количество металлических вкраплений по ба-
ритовому слою на площади 9 X 12 см не должно превышать шести.
СЫРЬЕ
Атомный кларк бария 0,005%. Он входит в состав силикатных
и других пород, но сырьем для получения соединений бария слу-
жат только минералы барит или тяжелый шпат BaSO4 и витерит
ВаСО3. Мировая добыча барита в 1966 г. составила 3,44 млн. т35.
Витерит более ценное сырье, чем барит, так как легко растворяет-
ся в кислотах, что значительно упрощает производственный про-
цесс. Однако месторождения витерита встречаются значительно
реже и менее богаты, чем месторождения барита. Крупные залежи
витерита имеются только в Англии. В СССР основным видом ба-
риевого сырья является барит. Месторождение витерита имеется
в Туркменской ССР; добываемый здесь витерит после сортировки
и отборки содержит 75—80% ВаСО3 36.
Наибольшее промышленное значение имеют месторождения ба-
рита, происхождение которых связано с магматическими изверже-
ниями. В таких месторождениях барит является одним из основ-
ных минералов жилы и сопровождается кварцем, флюоритом, кар-
бонатами и сульфидами тяжелых металлов. Барит встречается в
виде вторичных скоплений в осадочных породах в форме желва-
ков, прожилок, иногда пластов. Соединения бария адсорбируются
отрицательно заряженными частицами гидроокислов марганца и
поэтому являются спутниками коллоидальных марганцовых руд.
Например, чиатурские марганцовые руды содержат до 1,5% окиси
бария.
Наиболее мощные месторождения барита сосредоточены в За-
кавказье (Кутаисское, Ганджинское, Шамхорское, Катар-Коварт-
ское, Актальское и др.), где содержание BaSO4 в рудах иногда
доходит до 97%, в Средней Азии и в примыкающих к ней районах
Западной Сибири. Имеются также месторождения BaSO4 на Урале.
На Алтае барит встречается в месторождениях полиметаллических
или свинцово-цинковых руд, при выделении из которых сульфидов
свинца, цинка, меди, железа, серебра получается баритовый кон-
центрат (Змеиногорское, Лениногорское, Белоусовское, Березов-
ское, Салаирское и другие месторождения) 37. Сортировка руды
Змеиногорского месторождения дает барит с содержанием 98%
BaSOi38.
Помимо промывки, грохочения и сортировки на классифика-
ционных столах широко применяют флотационное обогащение ба-
ритовых руд. Отделение барита от пирита возможно только фло-
тацией, причем содержание барита в пирите может быть снижено
Сульфат бария
425
от Ю до 1% 39. Для разделения смесей барита и флюорита с суль-
фидами необходима трехступенчатая селективная флотация в при-
сутствии лаурилсульфоната с добавками растворимого стекла и
лимонной кислоты. Вначале отделяют сульфиды, затем барит и,
наконец, флюорит. Окислы, силикаты, карбонаты и кварц остаются
в отходах 40. Предложено очищать тяжелый шпат от CaF2 кипяче-
нием измельченного сырья в концентрированном растворе А1С1з41.
В Западной Европе в последнее время для отбеливания барита и
удаления сульфидов железа стали применять подкисление (обыч-
но одновременно с дроблением).
В зависимости от применяемых методов первичной обработки
руды получают кусковой, молотый барит или баритовый концен-
трат; все эти виды сырья выпускают четырех сортов (табл. 30).
ТАБЛИЦА Зв
Требования к качеству баритового сырья
(Содержание компонентов в сухом веществе в % по ГОСТ 4682 — 49)
Высший сорт I сорт II сорт III сорт
BaSO4, не менее ......
SiO2, не более ............
Fe2O3 » » ............
Вещества, растворимые в воде,
не более ..................
Влага в баритовом концен-
трате, не более ...........
Влага в молотом барите, не
более .....................
Реакция водной вытяжки . .
Цвет по шкале белого цвета,
не выше ‘..................
95 90 85 80
1,5 2,5 4,0 Не нормировано
0,5 1,5 3,0 » »
0,3 1,0 1,0 1,0
3 5 5 10
1 1 2 Не нормировано
I Тейтральна1 я
№ 1 № 3 № 5 » »
Молотый барит всех сортов по гранулометрическому составу
подразделяют на класс А (наполнитель), для которого остаток на
сите 0,085 мм должен быть не более 1% и на сите 0,15 мм — не
более 0,1%, и на класс Б (утяжелитель), для которого остаток на
сите 0,085 мм должен быть не более 5%.
Лучшие сорта кускового барита и высококачественный моло-
тый барит применяют в лакокрасочной промышленности. Для про-
изводства солей бария используют обычно кусковой барит I и II
сортов и баритовый концентрат.42
СУЛЬФАТ БАРИЯ
Искусственный сульфат бария изготовляют в виде тонкодис-
персного порошка следующими способами:
। 1) осаждением из водных растворов солей бария серной кисло-
той или сернокислыми солями;
426
Гл. XII. Соли бария
2) обработкой природного барита различными способами.
Сульфат бария получается также в качестве побочного про
дукта при сульфатной очистке соляных рассолов, при получени!
перекиси водорода разложением перекиси бария серной кислота!
(или другими кислотами с последующей обработкой продукта]
реакции серной кислотой); его можно получать из отходов очистк!
от сульфатов дистиллерной жидкости содового производства 43.
Для осаждения BaSO4 из растворов часто используют различ
ные отбросные растворы и промывные воды, получаемые при про
изводстве соединений бария и содержащие растворимые соли —
BaS, ВаС12, Ba(NO3)2 и др. Лучшие сорта сульфата бария полу
чают обычно из специально приготовленных растворов хлорид]
бария путем осаждения серной кислотой или сульфатом натрш
по реакциям:
ВаС12 + H2SO4 = BaSO4 + 2НС1
ВаС12 + Na2SO4 — BaSO4 + 2NaCl
При осаждении из горячих растворов при низких значениях рЬ
(т. е. при осаждении серной кислотой) получается менее дисперс
ный кристаллический осадок, легко оседающий на дно аппарата
Осаждение из растворов с высоким значением pH (например, и;
растворов BaS или из растворов нейтральных солей с помощьк
Na2SO4), особенно при невысоких температурах, приводит к обра
зованию очень медленно оседающих осадков. Подбором соответ
ствующих условий осаждения можно получить осадки любой сте
пени дисперсности, вплоть до коллоидных44.
Осадки BaSO4, отделенные от жидкости, подвергают тщатель
нои промывке, иногда неоднократному кипячению в воде и пропа
риванию с целью удаления примесей, особенно С1_ и других, спо
собных окрашивать продукт. Затем осадки отжимают на фильтр
прессах и выпускают в виде пасты, содержащей 20—30% воды
Если требуется сухой продукт, то промытый осадок отжимают ш
гидравлическом прессе и затем сушат при ПО—120°, а иногда про
каливают при 300—350°. После сушки и прокалки скомковавшийс?
продукт размалывают на вальцовой мельнице.
Для получения осадка BaSO4, легко отмываемого от окклюди-
рованного SO4”, рекомендуют45 производить осаждение при бы-
стром размешивании непрерывно поступающих в реакционный]
аппарат растворов ВаС12 и Na2SO4, причем в реакционной зоне,
молярная концентрация SO4~ должна быть все время больше,;
чем Ва2+. Осажденный BaSO4 можно получать в процессе каусти-
фикации Na2SO4 с помощью раствора Ва(ОН)2 или Ba(OH)(HS)J
Выход NaOH в виде 10%-ного раствора достигает 87% 46. Предло-
жено47 получать BaSO4 со свойствами, характерными для блан-s
фикса, путем тончайшего размола тяжелого шпата (лишь ~2%
помола с размером частиц больше 4 мк). Очищенный BaSO4 мохшт’
Восстановление барита
427
быть получен из природного барита обработкой тонкоизмельчен-
ного минерала серной или соляной кислотой с целью удаления из
него примесей. Так, при обработке барита олеумом BaSO< раство-
ряется, а затем, после отделения нерастворившегося остатка, вы-
деляется при разбавлении раствора водой. При обработке природ-
ного барита соляной кислотой в раствор переходят соединения
алюминия, железа, кальция, а в осадке остаются BaSCU и SiC>2.
Для такой обработки целесообразно использовать богатые бариты.
Так, из минерала, содержащего 95—98% BaSO4, 1—2% SiC>2 и
1—3% CaO, AI2O3, Fe2O3, после двухкратной обработки соляной
кислотой с плотностью 1,19 г/см?, разбавленной 1 : 10, в течение
2 ч при кипячении с последующей отмывкой ионов хлора водой
был получен продукт, содержащий 99% BaSO4 и 1% SiO2. Устано-
влено, что примесь инертного SiO2 не препятствует использованию
продукта для рентгеноскопии48.
Очистку природного барита можно производить также раство-
рением его в расплавленных солях — NaCl или СаС12; после от-
стаивания примесей и декантации расплава его охлаждают, и по-
сле обработки застывшей массы водой получают чистый BaSO4 49.
Таким путем можно получить BaSO4, пригодный для бумажной и
аккумуляторной промышленности, лишь из первосортной барито-
вой руды50.
ВОССТАНОВЛЕНИЕ БАРИТА
Для перевода практически не растворимого ни в воде, ни в кис-
лотах барита в растворимое соединение его восстанавливают в
сернистый барий. В дальнейшем сернистый барий легко перера-
батывают на любые соединения бария. Восстановление барита
ведут почти исключительно в трубчатых вращающихся печах с по-
мощью угля и природного или генераторного газа.
Несмотря на то, что шихта состоит из барита и угля, BaSO4
восстанавливается главным образом окисью углерода:
BaSO4 + 4СО = BaS + 4СО2
Двуокись' углерода восстанавливается углеродом до СО по
реакции СО2 4- С^?2СО. Выше 1000° в составе равновесной газо-
вой смеси в присутствии углерода СО2 практически отсутствует.
Поэтому восстановление барита выше 900—1000° протекает по
суммарной реакции
ВaSO4 + 4С = BaS + 4СО — 138,5 ккал (1)
а при 600—800° по суммарной реакции:
BaSO4 + 2С = BaS + 2СО2— 56,1 ккал (2)
Вследствие эндотермичности этих реакций необходим подвод
тайла, для чего сжигают в печи природный или генераторный газ,
428
Гл. XII. Соли бария
компоненты которого (СН4, Н2, СО) при неполном их сгорании
также восстанавливают барит.
С точки зрения расхода угля и затраты тепла выгоднее вести
процесс восстановления при низких температурах, по реакции (2),
но так как он при этом протекает медленно, то предпочитают осу-
ществлять его по реакции (1), идущей значительно быстрее, и для
этого температуру в «горячем» конце печи поддерживают выше
1000°.
В трубчатых печах осуществляется противоток восстанавливае-
мого материала и греющих газов. Поэтому практически в газах,
Рис. 133. Восстановление барита камен-
ным углем при разных температурах:
1 — кислоторастворимые соли бария 2 — водо-
растворимые соли бария.
Рис. 134. Зависимость восстано-
вления барита от вида восстано-^
вителя: |
/—древесный уголь; 2 —кокс; 3—аитра-j
цит; 4 — каменный уголь. |
уходящих из «холодного» конца печи, соприкасающихся с шихтой,
богатой углеродом, СО почти не содержится, а содержание СО2
достигает 20—25%. Этому способствует также соответствующее
регулирование подачи в горелку печи воздуха, необходимого для
сжигания газа. Таким образом, суммарной реакцией процесса вос-
становления является реакция (2). При интенсивных режимах
обжига, с целью увеличения температуры факела горящего газа,
работают с недостатком воздуха; в этом случае СО полностью не
сгорает, и в отходящих газах содержится иногда до 5% СО.
Скорость восстановления барита сильно зависит от темпера-
туры (рис. 133) и сорта твердого углеродистого восстановителя
(рис. 134). В лабораторных опытах, результаты которых приве-
дены на рис. 133 и 134, использован барит, содержащий (в %):
ВаО —64,98, SO3 —34,13, СаО — 0,26, Ре2О3 — 0,06, SiO2 — 0,65,
Н2О — 0,08. Восстановители содержали: высушенный древесный
уголь—18,8% летучих и 3,8% золы; кокс—1% летучих, 0,6% вла-
ги, 9,2% золы; антрацит — 5,4% летучих, 2,6% влаги, 2,7% золы?
Восстановление барита
429
каменный уголь — 27,4% летучих, 1,2% влаги, 7,5% золы. Дисперс-
ность барита и восстановителей — 0,13 мм. Количество восстано-
вителя брали с 50—55%-ным избытком по углероду51-52. Как вид-
но, каменный уголь—более активный восстановитель, чем древес-
ный уголь, кокс и антрацит. Поэтому предпочитают употреблять
каменный уголь, например марки ПЖ, несмотря на то, что расход
его больше, чем тощих углей (например, антрацита), содержащих
мало летучих веществ. При невысоких температурах скорость вос-
становления барита увеличивается в присутствии карбонатов нат-
рия и калия, особенно Na^CO3 53.
Барит восстанавливается вначале до BaSO3
BaSO4 + СО = BaSO3 + СО2
а лишь затем до BaS — в получаемом плаве сернистого бария со-
держится некоторое количество BaSO3. Выше 600° сульфит бария
с большой скоростью диссоциирует54-57
BaSO3 ВаО + SO2 :
поэтому содержание его в плаве незначительно. Но с еще большей
скоростью ВаО реагирует с парами элементарной серы, образо-
вавшейся в результате восстановления 80г
2SO2 -В 4СО ~ 4СО2 -В S2
2ВаО + l’/2S2 = 2BaS + SO2
поэтому ВаО в плаве не обнаруживается. BaSO3 образуется также
по реакции:
BaS -В SO2 -В Н2О = BaSO, -В H2S
Может иметь место и обратное окисление BaS сернистым га-
8ом до BaSO4 58:
BaS -В 2SO2 = BaSO4 + S2
Частичное взаимодействие BaSO3 и BaS с COj
BaSO3 -В CO2 = ВаСОз + SO2
BaS -В 4CO2 = BaCO3 -в SO2 -В ЗСО
- приводит к появлению в плаве ВаСО3, а взаимодействие BaSO3 0
S — к появлению тиосульфата
BaSO3+1/2S2=BaS2O3
Содержащиеся в барите примеси (SiOz, AI2O3, CaFz, Fe2O3)'
выше 1000° вступают в реакции, затрудняют процесс восстановле-
ния-и снижают выход BaS. Поэтому бедные бариты следует пред-
варительно обогащать, Кремнезем . образует с сульфатом бария
430
Гл. XII. Соли бария
мета-, орто- и трехбариевый силикаты и способствует появлению
в газовой фазе SO2 и S:
BaSO4 + 8iO2 = BaSiOj + SO3
BaSO4 + BaSiO3 = Ba2SiO4 + SO3
, 2BaSO4+BaSiO3 = Ba3SiO5 + 2SO3
SO3 + CO = SO2 + CO2
2SO2 + 4CO = 4CO2 + S2
Ортосиликат и трехбариевый силикат при выщелачивании пла-
ва водой разлагаются с образованием гидроокиси и метасиликата
бария:
Ba2SiO4 + Н2О = BaSiO3 + Ва(ОН)2
Ba3SiO5 + 2Н2О = BaSiO3 + 2Ва(ОН)2
При выщелачивании BaS из плава водой нерастворимые при-
меси BaSOg, ВаСОз и силикатов бария являются вредными, так
как ведут к потерям бария в остаю-
щемся после выщелачивания шламе.
При кислотном выщелачивании плава
барий из этих кислоторастворимых
соединений также переходит в раствор.
Окислы алюминия и железа в про-
цессе восстановления барита реагиру-
ют с сульфидом и сульфатом бария,
образуя алюминаты и ферриты бария
(ВаО-АЬОз и ВаО-Ре2Оз). При взаи-
модействии окиси железа с сульфидом
бария образуется также тиоферрит
BaFe2S4. Эти побочные реакции так-
же приводят к уменьшению выхода
растворимых бариевых соединений.
Если, однако, выщелачивание плава
водой вести не по обычной противоточ-
Рис. 135. Зависимость степени
перехода BaSO4 и BaS (кри-
вая 1) и содержания BaS
в плаве (кривая 2) от коли-
чества угля в шихте.
ной схеме, а при повышенных температуре и давлении, то выход
бария в раствор повышается на 10—15% за счет разложения сили-
катов, алюминатов и ферритов. Для дополнительного извлечения
бария предложено шлам после водного выщелачивания BaS спе-
кать с твердым СаС12 при 300° и затем нагревать в течение 0,5—1 ч
при 600—800°, после чего из охлажденного спека водой извлекается
ВаС12 59. Для обезвреживания отбросного шлама его предложено
обрабатывать хлорной известью60.
На рис. 135 показано изменение степени перехода BaSO4 в BaS
при восстановлении природного барита и содержания BaS в плаве
в зависимости от количества каменного угля в шихте, Эти дан-
Восстановление барита
431
ные61 получены для барита, содержавшего 81,5% BaSO4, 0,4%
СаО, 4,2% S1O2, 5,2% R2O3, 0,2% CaF2, и малозольного каменного
угля, подвергавшихся прокаливанию при 950° в течение 3 ч. При
оптимальном составе шихты (22% угля) достигается выход BaS
~97% и плав содержит ~67% BaS. Увеличение содержания SiO?
в барите до 12,6% при снижении BaSO4 до 77,66% приводит в тех
же условиях к уменьшению выхода BaS до 81,4% и содержания
BaS в плаве до 40,2%. Аналогичные результаты получаются,
когда шихта содержит 9,7% Fe2O3 и 73% BaSO4.
Для предотвращения образования силикатов бария при ис-
пользовании баритов, содержащих много S1O2, к шихте можно до-
бавить известь или известняк. При этом SiO2 связывается в не ра-
створимый в воде силикат кальция. Это имеет смысл лишь в том
случае, если плав подвергается водному выщелачиванию, так как
при кислотном выщелачивании это лишь увеличивает расход кис-
лоты па связывание окиси кальция.
Присутствие в шихте примеси известняка ускоряет процесс вос-
становления, так как выделяющаяся при разложении карбоната
двуокись углерода способствует перемешиванию шихты, а окись
кальция препятствует сплавлению шихты легкоплавкими приме-
сями, находящимися в барите. В результате увеличивается степень
восстановления барита. Кроме того, кальций заменяет часть бария
при взаимодействии с примесями, находящимися в природном ба-
рите. При восстановлении баритов, в состав которых входит кар-
бонат бария, целесообразно добавлять в шихту CaSO4, это повы-
шает содержание серы в газовой фазе и способствует переходу
карбоната бария в сульфид, т. е. увеличивает содержание водо*
растворимых соединений бария в плаве62.
Производственный процесс получения плава сернистого бария
сводится к следующему. Измельченные барит (до крупности 0,2—
0,3 мм, иногда 4—5 мм) и уголь (до крупности 2—3 мМ) посту-
пают через автоматические дозаторы в барабанный или лопастной
смеситель. Тонкое измельчение барита не обязательно, так как
крупнозернистый барит при температуре восстановления растрес-
кивается и распадается на частицы меньше 0,5 мм, а основная
масса их имеет размеры 100—300 л/к63’64. Шихта поступает в бун-
кер, откуда через автоматический питатель, например, тарельча-
того типа, подается в печь для восстановления. Трубчатая вра-
щающаяся печь, расположенная с уклоном 3—6°, делает от 1 до
5 об/мин. В зависимости от производительности (до 40—50 т ба-
рита в сутки) устанавливают печи длиной до 40 м с внутренним
диаметром до 1.5—2 м. Стальной корпус печи футерован внутри
двумя слоями шамотного кирпича. Нижняя торцевая часть бара-
бана печи введена в неподвижную каретку; в ней имеется горелка,
через которую подают газообразное топливо и воздух. Из бара-
бана печи в каретку поступает и выгружается из нее раскаленный
432
Гл. XII. Соли бария
плав сернистого бария. Противоположный конец печи входит в
пыльную камеру.
С этой же стороны в печь введена течка от тарельчатого пита-
теля для шихты. Течка охлаждается водяной рубашкой. Иногда
вместо газа для обогрева печи используют пылевидное твердое
топливо (уголь) или жидкое топливо (мазут). При температуре |
в реакционной зоне вблизи факела горящего газа 1050—1100° про- 1
должительность прохождения шихты через печь составляет 1,5— J
2 ч. Повышением температуры можно значительно сократить дли- |
дельность восстановления и повысить производительность печи I
(это потребует соответствующего увеличения числа оборотов |
печи). Отходящие газы выносят из печи большое количество пыли, ;
которая улавливается в пыльных камерах, циклонах или электро-
фильтрах и возвращается на приготовление шихты. Тепло газов
утилизируется в паровых или водяных котлах. Раскаленный плав
выходит из печи в виде сыпучей массы, состоящей из пористых
гранул величиной с горошину. Он проходит через холодильник —
вращающийся стальной барабан, снаружи охлаждающийся возду-
хом или орошаемый водой. Нагретый воздух из холодильника по-
ступает в печь. По остывании плав имеет черный или темно-серый
цвет. Он содержит 63—75% BaS (водорастворимый барий),
15—-20% кислоторастворимых соединений бария (BaSOs, ВаСО3,
BaSiO3) и примеси, в состав которых входит и некоторое количе-
ство непрореагировавшего угля.
Во влажном воздухе плав сернистого бария карбонизуется и
выделяет сероводород по реакции BaS + CO2 + H2O = ВаСОз + Н23,
в результате чего содержание водорастворимого бария пони-
жается. Кроме того, BaS постепенно окисляется кислородом воз-
духа. Поэтому в случае необходимости транспортирования за пре-
делы завода плав укупоривают в деревянные бочки.
Восстановление баритового концентрата, имеющего высокую
дисперсность (средний размер частиц ~40 мк, 10% меньше
10 лк) и, особенно, содержащего меньше 92% BaSO4, труднее, чем
измельченного кускового барита, так как шихта при этом сильно
спекается, приплавляется к стенкам печи, а газ уносит много ба-
ритовой пыли (до 10%). Опыт восстановления шихты из барито-
вого концентрата (93—94% BaSO4) и кокса в соотношении 4 : 1 во I
вращающейся печи диаметром 2,2 м, длиной 20 м с рабочим объе- 1
мом 50 м3 и поверхностью нагрева НО м2 при степени заполнения 1
барабана 6—9% и температуре в передней части 1050—1100° по- 1
казал, что степень восстановления в среднем равна 92% и дости- |
гает 95%, а нагрузка печи 35—40 кг/(м3-ч), т. е. почти такая же, 1
как при восстановлении молотого барита 41 кг/(м3-ч). Плав выхо- I
дит из печи в виде гранул 2—15 мм. Отмечено, что материал дви- Я
жется в печи концентрическими слоями — мелкая фракция нахо-1
дится в ядре потока и оказывается плохо восстановленной. Расчет ]
Восстановление барита
433
Рис. 136. Зависимость степени
вдсстановления BaSO4 водо-
рбдом (зерна барита меньше
0,3 мм) и метаном (зерна ба-
рита меньше 0,5 мм) от темпе-
ратуры при продолжительности
процесса 1 ч в лабораторных
условиях.
показывает, что расход тепла на восстановление BaSO4 составляет
приблизительно 32%, на испарение и перегрев пара 4%, с отходя-
щими газами 36%, с плавом 10%, теряется излучением 15% и в
результате химического недожога 4—5% 65. Предварительная гра-
нуляция баритового концентрата в зерна 3—5 мм с добавкой свя-
зующих уменьшает пылеунос из печи.
Заводскими опытами показана целесо-
образность гранулирования шихты из
флотационного барита и коксика (с
размером зерен меньше 3 мм) с добав-
кой в качестве связующего 8%-ного
раствора сульфитного щелока (8—10%
от веса шихты) 66. Благодаря пористо-
сти гранулированного барита его вос-
становление идет быстрее, чем дробле-
ного, и равная степень восстановления
достигается при температуре на ~ 100°
более низкой. Исследовано восстанов-
ление барита электротермическим спо-
собом в лабораторной однофазной пе-
чи (d = 300 мм) мощностью 25 кет67.
Большие преимущества имеет вос-
становление барита газами. При этом
получается чистый плав, не загрязнен-
ный углем и золой, что значительно
облегчает его дальнейшую перера-
ботку.
При взаимодействии BaSO4 с СО
в интервале 700—1000° образуется
главным образом BaS и лишь немного
ВаСО3. Скорость восстановления барита окисью углерода прибли-
зительно равна скорости восстановления коксом. Равновесие ре-
акции
BaSO4 (тв.) + 4СО (г.) BaS (тв.) + 4СО2 (г.)
в отсутствие свободного углерода сильно сдвинуто в сторону обпа-
зования BaS даже при высоких температурах. Так, при 1200° в
равновесной газовой смеси 91% СО2 [lg Кд “ lg(Pco2 Pqq)^
= - 76907“’ + 1,2]55’68.
Восстановление BaSO4 водородом ниже 700° идет очень мед-
ленно, при 850—900° — быстро. Восстановление BaSO4 метаном
идет медленнее, чем водородом, и требует более высоких темпера-
тур (рис. 136) 69. Начальная скорость восстановления BaSO4 водо-
родом или окисью углерода растет пропорционально давлению
г&ва (изучено до 600 мм рт. ст.)', энергия активации этих реакций
434
Гл. XII. Соли бария
составляет соответственно 47 000 и 56 000 кал/моль70. Для реакции
BaSO4 (тв.) + 4Н2 (г.) = BaS (тв.) + 4Н2О (г.)
в интервале 800—1000° 1g/Ср = 5,447+ 69^;—.
Перспективно восстановление барита природным газом в печах
с кипящим слоем. При 900° за 30—40 мин степень восстановления
достигает 94%, а степень использования восстановителя (газа)
32—36% 72. По другим данным73, при восстановлении барита про-
дуктами неполного сгорания природного газа (~13% Н2 и 10%
СО) в течение 70—80 мин при 800—900° и высоте кипящего слоя
1 м получается «плав», содержащий 62—64% BaS и 10—12%
ВаСО3. Степень использования газов в процессе восстановления:
СО — 74% и Н2— 52%. Гранулометрический состав плава прибли-
зительно такой же, как исходного барита. 1
ХЛОРИД БАРИЯ ’’
Из многих способов получения хлорида бария74 наибольшее
промышленное распространение получили солянокислотный и
хлоркальциевый способы. Хлорнатриевый, хлораммониевый, хлор-
магниевый, хлорный и другие способы получения хлорида бария
не имеют широкого применения, хотя некоторые из них в опреде-
ленных условиях используются или могут быть эффективно ис-
пользованы.
Солянокислотный способ
. В основе этого способа лежит реакция:
BaS + 2НС1 = ВаС12 + H2S
Охлажденный плав сернистого бария размалывают в шаровой
или трубчатой мельнице и направляют на разложение соляной ки-
слотой. При размоле плава в мельницах мокрого помола выгру-
жаемый из печи плав не охлаждается, а поступает по желобу в
мельницу, в которую подается вода или слабый щелок в количе-
стве, достаточном для образования густой шламообразной массы.
При этом отпадает необходимость в улавливании вредной пыли и
уменьшаются потери от окисления плава воздухом.
Разложение плава соляной кислотой производят в стальных
реакторах, футерованных кислотоупорным кирпичом или диабазо-
вой плиткой в два слоя. Подачу плава в соляную кислоту произ-
водят в течение 1,5—2 ч при перемешивании реакционной массы
до тех пор, пока раствор не приобретет щелочную реакцию, при
содержании 18—20 г избыточного BaS в 1 Л. Это приводит к оса-
"Хлорид бария
435
ждению из раствора примеси железа
FeCl2 + BaS = FeS + ВаС1>
и других тяжелых металлов. .
Для полного разложения кислоторастворимых соединений
(BaSOs, ВаСОз, силикатов бария) и для того чтобы выделяю-
щаяся при разложении силикатов кремневая кислота не перехо-
дила в раствор, используют соляную кислоту с концентрацией не
ниже 13% НО, лучше 15% НС1. Применение более концентриро-
ванной кислоты нежелательно, так как это способствует выделе-
нию элементарной серы, теряемой с отвалом.
По окончании разложения в реактор добавляют горячие про-
мывные воды для разжижения реакционной массы с целью уско-
рения отстаивания раствора от нерастворимых компонентов плава
и в особенности от тонкодисперсного илистого осадка сернистого
железа. После отстаивания осадка раствор декантируют, остав-
шийся шлам, содержащий до 5% ВаСЬ • 2НоО, промывают горячей
водой (~80°). Полученные при промывке шлама слабые растворы
хлористого бария используют для следующих промывок, для раз-
жижения реакционной массы перед отстаиванием и для мокрого
помола плава сернистого бария. Щдам после промывки смывают
струей воды и отправляют по желобу в отвал.
Запатентована75 непрерывно действующая установка для раз-
ложения раствора BaS соляной кислотой, состоящая из двух по-
следовательно включенных реакторов. Первый из них представляет,
собой трубу, в которой смешиваются растворы, а второй — резер-
вуар, разделенный на две камеры вертикальной перегородкой, не
доходящей до крышки; реакционная смесь поступает в нижнюю
зону одной камеры, а удаляется из другой.
Отделение щелоков от шлама и промывку его производят так-
же на центрифугах, добавляя предварительно к пульпе древесные
опилки, что облегчает отжим илистого осадка. Отделенный от
шлама щелок для освобождения от взвешенных частиц пропу-
скают через фильтр-пресс и направляют в стальной закрытый .ре-
зервуар с мешалкой, где щелок нейтрализуют соляной кислот,о.".
Для удаления растворенного сероводорода щелок продувают ост-
рым паром. Полученный чистый раствор, содержащий 260—300 г/л
ВаС12, смешивают с маточными щелоками, оставшимися после
кристаллизации, и подвергают выпариванию до концентрации
400—600 г/л ВаС12, а затем при охлаждении до 25—35° кристал-
лизуют ВаС12-2НгО. Иногда выпаривают только маточные ще-
локи, которые затем сливают с чистым раствором, полученным
после выщелачивания, и смешанный щелок направляют на кри-
сталлизацию. На современных заводах солянокислотное разложе-
ние пульпы сульфида бария ведут непрерывным способом в кас-
каде реакторов. Затем шлам отделяют с помощью автоматических
436
Гл. XII. Соли бария
фильтрпрессов76. Выпарку растворов хлористого бария осуществ-
ляют в многокорпусных вакуум-выпарных аппаратах. Температура
кипения раствора в первом корпусе равна 105—106°; в послед-
нем— около 65°. Иногда выпаривание в вакуум-аппаратах совме-
щают с кристаллизацией.
Кристаллизацию часто осуществляют в непрерывно действую-
щих кристаллизаторах, имеющих форму желоба с двойными стен-
ками, между которыми циркулирует охлаждающая вода. Длина
желоба 16 м, ширина 1,5 м, высота 0,5 м. Раствор течет по желобу
противотоком охлаждающей воде. Выпадающие на дно желоба
кристаллы передвигаются с помощью механических гребков к
концу кристаллизатора и сваливаются
в приемник, из которого посту-
пают на центрифугу. Для кристалли-
зации применяют также барабанные
кристаллизаторы с воздушным охлаж-
дением.
Отжатый на центрифугах от маточ-
ного раствора кристаллический хлори-
стый барий промывают водой. Кри-
сталлы, выгружаемые из центрифуги»
содержат обычно не более 4% гигро-
скопической влаги и укупориваются в
бочки. Иногда продукт подвергают
сушке горячим воздухом (110—120°)
Рис. 137. Растворимость в си-
стеме ВаС12—НС1—Н2О.
в барабанных вращающихся сушилках для понижения содержа-
ния гигроскопической влаги до 1%.
При получении хлористого бария описанным солянокислотным
способом на 1 т 97%-ного ВаС12-2Н2О расходуют: 1,25—1,35 т ба-
рита (100% BaSO4), 0,4—0,5 т реакционного угля (7000 ккал)кг)
и 1,4—1,6 т 27,5 %-ной соляной кислоты. В качестве отхода на
каждую тонну хлористого бария из реактора удаляется 0,11—
0,13 т сероводорода, который перерабатывают на элементарную
серу, сернистый газ (серную кислоту), гидросульфид или тиосуль-
фат натрия и пр. Вследствие ядовитости сероводорода должны
быть обеспечены условия, препятствующие его проникновению в
производственные помещения; предельно допустимая концентра-
ция H2S в воздухе рабочей зоны 0,01 мг[л.
Выделение кристаллов хлористого бария из щелока может быть
произведено высаливанием путем добавления к щелоку соляной
кислоты. Растворимость ВаС12 в воде при 25° равна 27,1%. В рас-
творе, содержащем 21,66% НС1, растворимость его понижается до
0,1% (рис. 137). При смешении равных объемов ~27%-ного рас-
твора НС1 и насыщенного при 25° раствора ВаС12 выкристалли-
зуется около 86% соли. При повышении температуры эффектив-
ность высаливания увеличивается. Для уменьшения содержания
Хлорид бария
437
кислоты в кристаллическом осадке кислоту следует добавлять мед*
ленно при 60°. Затем кристаллы отмывают от кислоты двухкратной
промывкой нейтральным раствором хлористого бария. Оставшийся
после высаливания кислый щелок (соляную кислоту с примесью-
ВаС12) направляют на разложение плава сернистого бария.
Хлорнатриевый способ
В солянокислотном способе получения хлористого бария соля-
ная кислота может быть частично заменена поваренной солью 77-79.
При этом разложение плава сернистого бария производится умень-
шенным в 2 раза количеством
соляной кислоты по реакции:-
2BaS + 2НС1 = ВаС12 + Ba(HS)2
Из полученного гидросуль*
фидного щелока — раствора
гидросульфида и хлорида ба-
рия — хлооид бария высали-
вается поваренной солью:
ВаС12 + Ba(HS)2 + 2NaCl + 2Н2О =
= 2ВаС12 • 2Н2О + 2NaHS
Одновременно получается
гидросульфид натрия без за-
траты едкого натра.
При обработке водной сус-
пензии плава сульфида бария,
нагретой до 70°, рассчитан-
ным количеством соляной кис-
лоты можно получить гидро-
сульфидный щелок любой концентрации вплоть до насыщенного
хлоридом бария раствора. Несмотря на уменьшенное количество
соляной кислоты, растворение плава происходит быстро, так как
равновесие
н2о
BaS (тв.) BaS (раств.) <--— Ba(HS)2+ Ва(ОН)2
сдвинуто вправо вследствие нейтрализации ионов ОН~ соляной
кислотой.
На схеме диаграммы растворимости водной системы Ba(HS)2
i+ 2NaCl = ВаС12 + 2NaHS при 20° (рис. 138) видно, что поле кри-
сталлизации хлористого бария занимает большую часть квадрата
и что точка Е> совместного существования NaCl, Ba(HS)2 и
ВаС12*2Н2О является инконгруэнтной. Наибольший выход кри-
сталлического хлористого бария получится в случае кристаллиза-
уии по лучу DEb Фигуративные точки комплексов, получающихся
438
Гл. XII. Соли бария
смешением Ba(HS)2 и NaCl, лежат на диагонали АС. Следова-
тельно, наивыгоднейший состав исходной смеси Ba(HS)2 и NaCl
будет изображаться точкой гр, лежащей на пересечении диагонали
и луча кристаллизации. Введение в систему хлористого бария сдви-
нет положение точки исходной смеси к точке D и путь кристалли-
зации удлинится, что является признаком увеличения выхода кри-
сталлов.
Если процесс вести, применяя растворы, не содержащие ВаС12,
т. е. при начальном составе системы, изображаемом точкой ф, то,
согласно диаграмме, молярное соотношение 2NaCl : Ba(HS)2 равно
0,54:0,46 (при содержании в исходном растворе 9,5 моль воды на
1 моль суммы солей). Для устранения совместной кристаллизации
NaCl и Ba(HS)2 конец пути кристаллизации не должен доходить
до точки Еь оканчиваясь вблизи ее, например, в точке S.
Для получения раствора состава точки ф необходимо исходить
из 35% раствора гидросульфида бария. Даже насыщенный серо-
водородом при 100° раствор сульфида бария не даст раствора гид-
росульфида такой концентрации. Однако такой раствор, содержа-
щий 35% Ba(HS)2 при 90°, можно получить, если выщелачивать
плав сульфида бария не водой, а раствором гидросульфида бария'.
Необходимый же для выщелачивания раствор гидросульфида ба-
рия можно получить, насыщая раствор BaS сероводородом.
Для соблюдения оптимального соотношения необходимо ввести
в 1 кг 35% раствора гидросульфида бария 0,234 кг поваренной
соли. При этом выход ВаС12 • 2Н2О в твердую фазу при охлажде-
нии смеси до 20° достигает 72,6%.
Сероводород, необходимый для предварительного получения
раствора гидросульфида бария, может быть получен, например, по
реакции
NaHS + NaHCO3 = Na2CO3 + H2S
из. маточного раствора после кристаллизации хлористого бария.
Остающийся в этом растворе ВаС12 (27,4% от начального коли-
чества) можно предварительно осаждать содой, образующейся по
указанной реакции, что приводит к получению второго продукта —
углекислого бария. Из 1 т барита по такой схеме можно получить
•0,34 т хлористого и 0,36 т углекислого бария.
Разложение BaS раствором СаС12 и карбонизацией
Разработаны методы получения гидросульфидного щелока и из
него хлористого бария и без применения (или с очень малым рас-
ходом) соляной кислоты80’81. Так, например, можно производить
высаливание ВаС12-2Н2О (до 70%) при 30—40° 32% раствором.
СаС12 из гидросульфидного щелока [около 28% ВаС12 + Ba(HS)2],
получаемого при выщелачивании плава сернистого бария 10% рас-
Хлорид бария
43»
твором СаС12 при 60—100°. Остающийся маточный раствор исполь-
зуют для выщелачивания новых порций плава.
Можно также производить полукарбонизацию суспензии суль-
фида бария. При этом по реакции
2BaS 4- Н2О 4- СО2 = ВаСО3 4- Ba(HS)2
получаются карбонат и гидросульфид бария в равных количествах.
Однако образующийся раствор Ba(HS)2 имеет низкую концентра-
цию и требует выпарки. При многократном, например, трехкрат-
ном, выщелачивании плава и карбонизации суспензии, с использо-
ванием растворов для повторного выщелачивания плава можно по-
лучить раствор с содержанием 27% Ba(HS)2. Такая концентрация
достаточна для высаливания хлорида бария поваренной солью с
выходом не меньше 75%. Остальные 25% бария можно осадить
в виде карбоната или сульфата81.
Способ получения хлористого бария карбонизацией углекислым
газом раствора, содержащего эквивалентные количества BaS и
СаС12
BaS 4" СаС12 4- СО2 4" Н2О = ВаС12 4" СаСОз 4" H2S
не нашел применения из-за больших потерь бария в форме ВаСО3>
образующегося наряду с СаСО3 (по-видимому, в виде двойного
соединения — барито-кальцита). Этого можно избежать, если под-
вергнуть карбонизации щелок, получаемый после выщелачивания
плава сернистого бария раствором хлористого кальция и отделения
выпавшего осадка гидрата окиси кальция24:
2BaS 4- 2СаС12 4- 2Н2О = ВаС12 4- Ba(HS)2 4- СаС12 4- Са(ОН)2
ВаС12 4- Ba(HS)2 4- СаС12 4- Н2О 4- СО2 = 2ВаС12 4- СаСО3 4- 2H2S
При содержании в растворе избытка СаС12 [150% от стехиоме-
трического по отношению к Ba(HS)2] потери бария в шламе СаСО3
весьма невелики. Из получаемого раствора, содержащего ВаС12 и
некоторое количество СаС12, после выпарки кристаллизуют ВаС12 •
•2Н2О. По этой схеме расход СО2 на карбонизацию в 2 раза мень-
ше, чем при, карбонизации щелока без отделения Са(ОН)2.
Хлораммониевый способ
Производство хлористого бария может быть экономично орга-
низовано в комбинации с регенерацией аммиака из хлористого ам-
мония, содержащегося в жидкости теплообменника дистилляции
содовых заводов82"84:
BaS 4- 2NH4C1 = ВаС12 4- 2NH3 4- H2S
При этом для образования хлористого бария используется от-
бросный ион хлора содового производства (вместо ценных мате-
риалов— НС1 или СаС12) и, кроме того, аммиак регенерируется
440
Гл. XII. Соли бария
с помощью BaS, а не Са(ОН)2. В результате этого затраты на про- ;
изводство ВаС12 оказываются меньше на 20—30%.
Попутно, кроме ВаС12, могут быть получены и другие товарные
продукты—сульфид аммония, гидросульфид натрия, сера, серная
к'йслота. Это позволяет комплексно использовать сырье, применяе-
мое для получения хлористого бария и соды. Однако масштабы
потребления хлористого бария значительно меньше масштабов со-
дового производства.
Жидкость теплообменника дистилляции имеет состав (в %):
NaCl— 5,8, Na2SO4-—0,2, NH4C1—14, (NH4)2CO3— 0,24, свобод-
ного NH3~2 и остальное вода. Предварительно в специальной ко-
лонне отгоняют из жидкости свободный аммиак. Взаимодействие
плава BaS с жидкостью теплообменника дистилляции должно про-
изводиться при температуре не ниже 95° и при 5—7%-ном избытке
BaS от стехиометрического количества. Это обеспечивает полную
отгонку аммиака и сероводорода и получение раствора, не содер-
жащего ионов HS", присутствие которых снижает степень исполь-
зования бария и приводит к загрязнению продукта. Отгонка
связанного аммиака этим методом, происходит примерно в 5 раз
медленнее, чем при обработке жидкости известковым молоком. Ос-
ветленный раствор, содержащий около 17% ВаС12, 5,5—6% NaCl и
0,6% СаС12, направляют на вакуум-выпарку, в процессе которой
происходит кристаллизация хлористого бария, завершающаяся при
охлаждении выпаренного раствора до 20°. Выпаренный раствор,
направляемый на охлаждение, содержит (в %): ВаС12—13,7,
NaCl —20,9, СаС12 —0,12. Маточный раствор, полученный после
кристаллизации охлаждением, содержит приблизительно 3,5%
ВаС12, 25% NaCl и 2,4% СаС12.
Для возврата аммиака в содовое производство отгоняемая па-
ро-газовая смесь должна быть промыта раствором NaOH, причем
сероводород связывается в гидросульфид.
Карбонатный способ
-Этот способ получения хлористого бария является по существу
видоизменением солянокислотного способа. Он заключается в рас-
творении в соляной кислоте природного витерита или ВаСО3, осаж-
денного из раствора BaS (или других растворов, содержащих Ва2+):
BaS + Н2О + СО2 — ВаСО3 4- H2S
ВаСО3 + 2НС1 = ВаС12 + Н2О + СО2
При использовании природного ВаСО3 получение из него хлори-
стого бария отличается большой простотой, дающей преимущества
перед другими способами. При необходимости получать углекис-
лый барий осаждением из BaS экономичность метода сильно по-
нижается. Его преимуществом перед описанным выше солянокис*
Хлорид бария
441
лотным методом является лишь то, что продукт получается более
чистым, так как при осаждении ВаСО3 все растворимые примеси,
содержавшиеся в плаве сернистого бария, остаются в растворе и
растворению в соляной кислоте подвергают чистый ВаСО3.
Хлормагниевый способ 24
При взаимодействии BaS с раствором MgCl2 при нагревании
идет реакция:
BaS + MgCl2 + 2Н2О = ВаС12 + Mg(OH)2 + H2S
Используя отход калийной промышленности — щелока хлори-
стого магния, можно при этом получить три ценных продукта —
хлористый барий, сероводород и гидроокись магния, которая может
быть переработана на окись магния. Эта реакция, однако, долго не
могла найти промышленного применения из-за трудности отстаива-
ния, фильтрации и промывки получающегося коллоидального осад-
ка гидроокиси магния.
Вследствие гидролиза BaS в водных растворах при сливании
растворов BaS и MgCl2 протекает реакция:
2BaS + MgCl2 + 2Н2О === Ba(HS)2 + ВаС12 4- Mg(OH)2
Наличие в растворе значительного количества ионов ОН- ведет
к мгновенному выделению нерастворимого, вязкого, не отстаиваю-
щегося осадка Mg(OH)2. По мере его образования происходит
дальнейшее гидролитическое расщепление BaS до полного его ис-
чезновения. Активность ионов ОН- в растворе определяется про-
изведением растворимости [Mg2+] [ОН ]2 = Лмв(он),- Так как 7Сн,о =
= [Н+][ОН~], то
[Mg2*] = —[н+]2
*н2о
Принимая, что [Mg2+] = fMg2+CMg2+ (где fMg2+ - коэффициент
активности, a CMg2+ — концентрация ионов магния), имеем:
„ ^Mg(OH)2 [pj+12
Mg2+~ 42оГм^
Приняв для упрощения/Mg2+= 1 и логарифмируя, получим:
1В%.»-1г'<мион,,-21еЧо + 21'1н*1
При 20° Лмг(он)2 = 1,2 • 10-п и ТГн2о = Ю-14; подставив эти зна-
чения в последнее уравнение и меняя знаки для перехода к вели-
чине pH, имеем
PMg2+ = 2рН “17,08
442
Гл. XII. Соли бария
где pMg2+— логарифм концентрации ионов магния (в г-ионах/л),
взятый с отрицательным знаком.
Пользуясь этим равенством, легко вычислить максимально воз-
можное содержание Mg2+ (в г/л) в растворах с различным значе-'
нием pH при насыщении гидроокисью:
pH.................... 8 9 10 11 12
Содержание Mg8+, г/л . . . . 2,92.10s 2,92 2,92-10-2 2,92• 10-4 2,92• 10~в
Эти данные показывают, что при pH < 9 раствор может содер-
жать достаточное количество Mg2+, не выделяя его в виде гидро-
окиси. Понижение pH среды или, что то же, уменьшение количества
ионов ОН" может быть достигнуто путем предварительного насы-
щения сероводородом раствора сернистого бария для превращения
его в Ba(HS)2. При приливании к такому раствору MgCl2 осадка
не образуется. При постепенном нагревании раствора, содержа-
щего Ba(HS)2 и MgCl2, в силу повышения равновесного давления
H2S последний медленно удаляется; одновременно с этим концен-
трация ОН~ медленно нарастает и происходит выделение хорошо
Отстаивающегося и отфильтровываемого осадка гидроокиси магния.
Вместо раствора сернистого бария, получаемого при выщела-
чивании плава сернистого бария водой, можно пользоваться гид-
росульфидным щелоком, образующимся при выщелачивании плава
BaS раствором СаС12 по реакции:
2BaS + СаС12 + 2Н2О = Ba(HS)2 + ВаС12 + Са(ОН)2
Образующийся при этом Са(ОН)2 выпадает в осадок и его
отделяют, а раствор насыщают сероводородом до требуемой вели-
чины pH и сливают с раствором хлористого магния. Выщелачива-
ние плава сернистого бария растворами СаС12 позволяет получить
растворы с высокой концентрацией бария. Плав сернистого бария
подвергают выщелачиванию при 65° 10% раствором СаС12, количе-
ство которого берут с таким расчетом, чтобы перевести весь BaS,
содержащийся в плаве, в Ba(HS)2 и обеспечить добавочное извле-
чение бария из карбоната и силиката бария в виде ВаС12. Для этой
цели шлам, оставшийся после выщелачивания, дополнительно раз-
варивают при 100°.
Отстоявшийся щелок, содержащий 12—13% Ba(HS)2, 15—16%
ВаС12 и 0,5—1,5% СаС12, поступает на реакцию с MgCl2 в аппарат
колонного типа. В верхней части колонны происходит донасыщение
стекающего вниз щелока поднимающимся кверху отходящим серо-
водородом с доведением pH раствора до 8—8,5. Ниже поступает
30—35%-ный раствор MgCl2 в количестве 125—150% от стехиомет-
рического по отношению к Ba(HS)2. При нагревании раствора по
мере прохождения его вниз по колонне от 60 до 100° происходит
постепенное удаление H2S и выделение Mg(OH)2. Остатки H2S
удаляют кипячением раствора в нижней части колонны при 103—
Хлорид бария
443
104°. Горячий раствор ВаС12 с осадком Mg(OH)2 поступает на от-
стаивание и фильтрацию на вакуум-фильтрах. Прозрачный рас-
твор ВаС12 идет на вакуум-выпарку и кристаллизацию, а маточные
щелоки после кристаллизации возвращают в производство.
Получение раствора хлористого бария менее высокой концен-
трации, чем по описанному способу, осуществляют по более про-
стой схеме. Раствор сернистого бария в воде насыщают сероводо-
родом. К полученному гидросульфидному раствору добавляют
хлормагниевый щелок. При нагревании этой смеси из нее удаляет-
ся сероводород, частично возвращаемый вновь на насыщение ис-
ходного раствора BaS, и выделяется осадок Mg(OH)2. После отде-
ления осадка остается раствор ВаС12. Расходные коэффициенты
на 1 т 97%-ного ВаС12-2Н2О составляют: 1,14 т барита (100%
BaSO4), 0,29 т СаС12 (100%), 0,19 т MgCl2 (100%) и 0,34 т реак-
ционного угля (7000 ккал/кг); в качестве побочных продуктов по-
лучают 0,13 т сероводорода (100%) и 0,08 т MgO (100%).
Хлориый способ
Этот способ заключается в обработке газообразным хлором
раствора, полученного водным выщелачиванием плава сернистого
бария 85-87. Суммарная реакция процесса имеет вид:
BaS 4- С12 = ВаС12 4- S
Вследствие гидролиза сернистого бария и хлора образуются
промежуточные соединения: Ва(ОН)2, Ba(HS)2, НС1, НСЮ,
Ва(С1О)2. Помимо этого, в процессе хлорирования протекают мно-
гочисленные побочные реакции, ведущие к образованию некоторых
количеств BaSO4, BaS2Oa и других соединений, что понижает вы-
ход хлористого бария и серы. Наибольшие выходы ВаС12 и свобод-
ной серы достигаются при хлорировании раствора, содержащего
около 170 г/л BaS, при 85—90°. При этом выход ВаС12 равен 95%,
а серы — 90%. Необходимую температуру поддерживают теплом,
выделяющимся в процессе хлорирования (при начальной темпера-
туре раствора 90°).
Избыток хлора ведет к образованию большего количества
BaSO4, уменьшая выход ВаС12 и серы:
ВаС12 + S + ЗС12 + 4Н2О = BaSO4 + 8НС1
Кроме того, перехлорирование щелока до кислой реакции вы-
зывает коррозию стальных аппаратов и трубопроводов, применяе-
мых в дальнейших стадиях переработки раствора хлористого бария.
Поэтому хлорирование ведется до нейтральной или слабощелочной
реакции (до обесцвечивания щелока, имеющего желто-зеленый
цвет)-. Содержание BaS в прохлорированном щелоке не должно
превышать 0,5—1 г/л.
•444
Гл. XII. Соли бария
Хлорирование ведут в керамических резервуарах или в башнях,
или в другой аппаратуре, устойчивой по отношению к влажному
хлору. Прохлорированные щелоки продувают воздухом для удале-
ния растворенных газов (сероводорода, хлора) и направляют на
•отстаивание от серы. При содержании в них более 0,5% BaS по-
следний осаждают раствопом хлорного железа в виде FeS. Щелок,
отстоявшийся от тонкого осадка серы и сернистого железа, под-
вергают переработке на кристаллический хлористый барий (вы-
париванию, кристаллизации, сушке) теми же методами, как и в
Других способах, описанных выше. Отвал, оставшийся после вод-
ного выщелачивания плава сернистого бария, обрабатывают соля-
ной кислотой для извлечения бария, содержащегося в виде кисло-
торастворимых соединений, и промывают водой. Полученные слабые
растворы хлористого бария присоединяют к основному раствору
поступающему на хлорирование. На производство 1 т 97%-ного
ВаС12-2Н2О расходуют: 1,25—1,35 т барита (100% BaSO4), 0,31 —
0,32 т хлора (100%), 0,1—0,12 т соляной кислоты (27,5% НС1),
‘0,4—0,5 т реакционного угля (7000 ккал/кг); в качестве побочного
продукта получается 0,12 т серы (100%).
Способы горячего хлорирования и гидрохлорирования
Разработаны способы получения хлористого бария из сухого
плава сернистого бария действием на него газообразного хлора
«ли хлористой серы при высоких температурах:
BaS + С12 = ВаС12 + S
BaS + S2C12 = BaCl2 + 3S
Применение этих способов затрудняется сильной коррозией
аппаратуры хлором и хлористой серой 85-87.
Показана возможность получения ВаС12 хлорированием BaSO-
в расплаве хлоридов, например, в расплаве ВаС12, в присутствии
восстановителя (кокса). Растворенный в хлориде сульфат бария
вначале восстанавливается до BaSO3 или до BaS и эти продукты
восстановления хлорируются. Процесс идет с достаточной интен-
•сивностью уже при 800°. Можно получить плав, содержащий до
94% ВаС12 88. На одном из индийских заводов хлористый барий
получают пропусканием хлора или хлористого водорода через рас-
каленную до 600° шихту, состоящую из барита и кокса. Попутным
продуктом является сера89. Взаимодействие барита с хлористым
-водородом90-92
BaSO< + 2НС1 = ВаС12 + Н2О + SO2 + V2O2
резко ускоряется выше 600°, особенно при осуществлении его во
-Взвешенном слое и с увеличением концентрации НС1 в применяе-
•мом газе.
Хлорид бария
44S
Взаимодействие BaSO4 и СаС12
Константа равновесия реакции
BaSO4+CaCl2 < t CaSO4+BaCl2
в водной среде определяется отношением произведений раствори-
мости BaSO4 и CaSO4: К = ПР„яЧ0 : ПР = 2+: СГя2+. При
р Ddj'-'4 \ja0\J4 Du V_zd х
25° nPBaSo4 = 9,9 • 10-11, nPcaso4 = 6,3 • 10~5и Kp ~ 1,6 • 10-6. Таким
образом, в водном растворе при не очень больших концентрациях
СаС12 и низких температурах концентрация ионов бария ничтожно
мала по сравнению с концентрацией ионов кальция и равновесие
реакции сдвинуто влево.
Но если обрабатывать BaSO4 концентрированным водным рас-
твором СаС12при повышенных температурах^эта реакция протекает
слева направо. Это обусловлено уменьшением растворимости
CaSO4 и увеличением растворимости BaSO4 при повышении тем-
пературы, а также малой растворимостью CaSO4 и ВаС12 в концен-
трированных растворах СаС12, имеющих высокую температуру
кипения. Кроме того, с повышением температуры быстро возра-
стает активность СаС12. Поэтому, обрабатывая BaSO4 концентри-
рованным раствором СаС12, можно получить ВаС12. Так, после
2—3-часовой выдержки при 170° выход ВаС12 составляет —90%.
Он возрастает с увеличением избытка СаС12 и уменьшением коли-
чества поды в реакционной смеси. Поэтому извлечь ВаС12 из реак-
ционной смеси выщелачиванием водой невозможно — реакция прой-
дет в обратном направлении. Предложено экстрагировать ВаС12
из этой смеси метанолом93. При сплавлении безводной смеси BaSO4
и СаС12 сульфат кальция образуется в неактивной, слабо раство-
римой форме94. Это позволяет осуществить выщелачивание ВаС12
не только метанолом, но и во пой, которая успевает извлечь ВаС12
раньше, чем неактивный CaSO4 вступит в реакцию.
Возможность обменного разложения между расплавленными
BaSO4 и СаС12 в условиях, когда реакция идет с достаточной для
Практических целей скоростью, определяется равновесием:
BaSO4 (ж.) + СаС12 (ж.) — CaSO4 (ж.) + ВаС12 (ж.)
т. „ [CaSO4l [ВаС121
Константа равновесия этой реакци л% = ^СаС11 » где ве-
личины в скобках — активности. Ввиду отсутствия для этой систе-
мы данных о степенях ионизации и о коэффициентах активности,
можно допустить, что активности пропорциональны молярным до-
лям и. распада на ионы не происходит95. Молярные доли N в рав-
новесной системе при степени превращения BaSO4 в ВаС12, равной
*,**и при исходном составе смеси гц молей BaSO4 и п2 молей СаС12
446
Гл. XII. Соли бария
будут:
«1(1“*). V «1*
"BaSO4 - П1 + П2 ! ЛВаС12
. _ «J — «1*, дг «1*
CaCI2 — n, + n2 ’ CaSO4 = + raj
Подставив эти значения в выражение для Кр и обозначив отно-
шение CaCU: BaSO4 в исходной смеси, т. е. п2: «ь через Го, получим:
к nix2 - *2
Р (1 — X) <П2 — П]Х) (I — х) (Го -*)
Отсюда:
(г0+ 1) Кр ± [(г0 + I)2- 4(Ур- 1) Г(,КрР
Х~ 2(Кр-1)
Значения Кр можно вычислить из уравнений изменения изобар-
ного потенциала:
Д2»=-ЯГ1пКр и \Z° = \H-T AS
Если принять для всех компонентов, участвующих в реакции,
жидкое состояние в качестве стандартного, то уравнения функций
= H&Z° = f'(T) будут такими:
ЛЯ = 9777 - 2,737 + 3,68 • 10~3Г2 + 1,57 • ю’г-1
- AZ° = 9777 - 6,297 lg Т + 3,68 • 10"372 - 0,785 • 1057“1 + 12,757
При 1144° К (871° С) —AZ° = 7129 кал и Кр = 22,9. Это дает при
г0 = 1 значение х = 0,823 и при г0 = 2 х = 0,965. Таким образом,
при 870° возможно превращение BaSO4 в ВаС12 на 82,3% в стехио-
метрической смеси и на 96,5% при двукратном избытке СаС12. Эти
вычисленные величины хорошо подтверждаются эксперименталь-
ными данными93. При 870° степень превращения BaSO4 в ВаСЬ
при г0 = 1 оказалась равной 82,9%, а при г0 = 298,2%.
Присутствие в смеси BaSO4 и безводного СаС12 плавней (NaCl,
КС1 и пр.) значительно ускоряет реакцию при низких температу-
рах. Так, синтетический BaSO4, взаимодействуя с эквивалентным
количеством СаС12, при 500° за 28 мин превращается в ВаС12 на
48%, а в присутствии в смеси 9 вес.% NaCl — на 79%, причем
NaCl не является хлорирующим агентом. Аналогичные результаты
получаются и с природным баритом. Интенсифицирующее действие
плавня проявляется в интервале температур, в котором присутст-
вие плавня вызывает появление жидкой фазы, т. е. 500—600°. Ниж-
ний предел этого интервала (500°) соответствует эвтектике NaCl
и СаС12 (505°, 51.5 мол. % СаС12)л >а затем тройной эвтектике, тем-
пература которой на 5—10° ниже, а верхний предел (605°) —эвтек-
тике СаС12 и ВаС12. При использовании в качестве плавня Ca(NO3)2
жидкая фаза появляется уже при 409°. Оптимальным является не-
большое количество добавки, обеспечивающее появление в реак-
Хлорид бария
447
ционной смеси всего 10—-15 вес. % жидкой фазы, что позволяет
вести процесс при относительно низкой температуре, сохраняя сы-
пучесть реакционной массы. При более высоких температурах до-
бавка плавня не имеет смысла, так как жидкая фаза появляется и
в смесях, не содержащих плавня. Так, уже при 600° в отсутствие
плавня степень превращения в лабораторных условиях при раз-
ных молярных соотношениях СаС12 : BaSO4 достигает следующих
величин:
CaCl2:BaSO4 .................. 1,6 1,3 1,0 0,9 0,8 0,7 0,6
„ / за 13 мин 87,3 83,9 78,7 76,7 70,3 66,3 55,4
Степень превращения. | мин 958 92 9 89 2 86)3 80,1 69,8 60,2
Степень превращения за 43 мин, при соотношениях СаС12:
: BaSO4, равных 0,8—0,6, достигает теоретических пределов.
Хлоркальциевый способ
На практике рассмотренную выше реакцию
BaSO4 + СаС12 < * CaSO4 + ВаС12
осуществляют, прокаливая компоненты в присутствии восстанови-
теля— угля для восстановления сульфатов в сульфиды. А так как
растворимость BaS значительно больше, чем CaS, растворимость
которого при 20° всего около 0,2 г/л, то при выщелачивании плава
обратная реакция не идет.
Взаимодействие BaSO4 с СаС12 и углем, лежащее в основе хлор-
кальциевого способа получения ВаС12, известного также под наз-
ванием способа Дюфло, является сложным процессом, состоящим
из многих реакций, протекающих с разной скоростью. Наряду с
основными реакциями обменного разложения BaSO4 и СаС12 и вос-
становления CaSO4
BaSO4 + CaClj = CaSO4 + ВаС12 + 7,8 ккал
_______CaSO4 + ЗС = CaS 4- 2СО + СО2 — 80,2 ккал_
BaSO4 + ЗС + СаС12 = ВаС12 + CaS + 2СО + СО2 - 72,4 ккал
идут приводящие к тем же результатам реакции восстановления
BaSO4 и обменного разложения BaS и СаС12:
BaSO4 + 4С = BaS + 4СО — 138,3 ккал
BaS + СаС12 = ВаС12 + CaS + 24,9 ккал
BaSO4 + 4С + СаС12 = ВаС12 + CaS + 4СО — 113,4 ккал
Степень перехода BaSO4 в ВаС12 и скорость процесса зависят
от качества барита, от дисперсности компонентов и состава шихты,
от температуры и др.95-98- Примеси, содержащиеся в низкосорт-
ном сырье, образуют побочные продукты, обволакивающие зерна
BaSO4- и препятствующие взаимодействию их с хлористым каль-
цием и углем. Поэтому степень перехода BaSO4 в ВаС12 возрастает
448
Гл. XII. Соли бария
с увеличением содержания BaSO4 в барите и с ростом моляр-
ного отношения CaCl2:BaSO4. Повышение температуры до 1100°
резко интенсифицирует процесс. Дальнейшее повышение темпера-
туры до 1200° приводит к некоторому снижению выхода хлористого
бария, очевидно вследствие значительного роста доли побочных
реакций. По этой же причине уменьшается степень перехода BaSO4
в ВаС12 при значительном увеличении длительности прокалки ших-
ты. Применение мелкоизмельченных барита и угля (—0,15 juju)
приводит к увеличению выхода ВаС12, сокращению длительности
процесса и, следовательно, к увеличению производительности пе-
чей. ('Однако высказывалось мнение, что измельчение барита не
обязательно, так как кусковой барит при нагревании до ~250° рас-
трескивается и рассыпается — см. стр. 431.) Консистенция плава
обусловлена главным образом содержанием в нем ВаС12 и СаС1а.
При переработке барита, содержащего 95% BaSO4, подвижная
масса, легко выгружаемая из печи, получается при 10%-ном из-
бытке СаС12 (выход ВаС12 91%). Из низкокачественных руд, содер-
жащих 57—79% BaSO4, можно получить достаточно подвижный
плав лишь при применении большого избытка (—20%) хлористого
кальция. Выход хлористого бария при этом составляет 88—91%.
Однако плавы, полученные из низкосортных баритов, отличаются
после охлаждения повышенной плотностью и труднее поддаются
выщелачиванию. Кроме того, содержание в них большого количе-
ства СаС12 приводит к увеличению потерь ВаС12 с отбросным ма-
точным раствором при кристаллизации. В общем же, примеси, со-
держащиеся в сырье, значительно меньше влияют на процесс вос-
становления барита в присутствии СаС12, чем без него.
Схема получения хлористого бария хлоркальциевым способом
изображена на рис. 139. Прокаливание реакционной смеси ведется
в периодически действующих коротких барабанных вращающихся
печах (тамбурах), расположенных горизонтально. Топливом слу-
жит мазут, подаваемый в печь форсункой. Длина печи 6—7 м, вну-
тренний диаметр 1,5 м; толщина огнеупорной футеровки 250 мм;
число оборотов печи— 1,6 в 1 мин. Полезный объем печи 3,6—5 м3.
В средней части барабана имеется люк, через который произво-
дится загрузка шихты и выгрузка плава. Для загрузки барабан
поворачивают люком кверху, для выгрузки — люком книзу.
В печь загружают 1,5—2 т барита, измельченного до 0,5—5 мм,
и уголь в количестве 13—15% (в пересчете на углерод) от веса
барита. Загрузка длится 10 мин, после чего люк закрывают; печь
приводится во вращение и из резервуара, обогреваемого отходя-
щими из печи газами, через трубу, входящую в заднюю горловину
печи, в течение 30—40 мин подают концентрированный раствор
хлористого кальция, содержащий 800—900 г/л СаС12. Обогрев ре-
вервуара с раствором хлористого кальция требуется во избежание
кристаллизации последнего. Количество хлористого кальция (в пе-
15 М. Е. Позин
450
Г л. XII. Соли бария
ресчете на 100%), загружаемого в печь, составляет 48—49% от
веса барита. Требуемый раствор хлористого кальция получают
выпариванием в вакуум-выпарных аппаратах дистиллерной жид-
кости содового производства (содержащей ~100 г/л СаС12) или
маточных щелоков, получаемых в качестве отхода в производстве
бертолетовой соли (содержащих ~400 г/л СаС12).
В течение 1,5—2 ч после загрузки температуру в печи поддер-
живают на уровне 770—780°—происходит испарение влаги и
шихта превращается в расплавленную массу. Затем температуру
повышают до 900—950° — расплавленная масса сильно пенится;
через 1—1,5 ч реакция заканчивается. К концу процесса темпера-
туру повышают до 1000—1100°, происходит усадка массы, она ста-
новится однородной. Температура отходящих газов колеблется
ют 200 до 800° (в среднем 300—400°). Длительность одной опера-
ции плавки 4—5 ч. Она зависит от количества загруженной шихты,
качества сырья, тонкости его помола. Передержка плава в печи,
помимо снижения содержания в нем ВаС12, приводит к его загу-
стеванию, что может вызвать козлообразование и затрудняет по-
следующее выщелачивание плава.
Когда плав готов, вращение печи прекращают, поворачивают
ее люком книзу и в течение 5 мин сливают плав в находящийся
под печью плоский чугунный резервуар («паром») или в пере-
движные тигли, ковши, установленные на вагонетках. Здесь плав
застывает в течение 1,5—3 ч (в зависимости от его качества и тем-
пературы плава и окружающего воздуха). Плав содержит 55—
60% ВаС12, 4—12% СаС12, около 7% CaS, около 3% BaSO4, около
0,5% BaS, 20—25% других примесей — непрореагировавшего угля
(6—8%), ВаСОз, FeS, SiO2 и проч. Выход хлористого бария в
плаве составляет около 90% от теоретического по отношению к
загруженному бариту. Остывший плав разбивают на куски, дро-
бят на щековой дробилке до крупности меньше 3 см и направляют
на выщелачивание.
Выщелачивание плава производят горячей водой (60—80°). По-
вышенную температуру в процессе выщелачивания поддерживают
острым паром. Применяют выщелачиватели различных типов —
резервуары с мешалками на вертикальном валу, желобы с лопаст-
ными мешалками на горизонтальном валу, барабанные вращаю-
щиеся выщелачиватели и др.
После выщелачивания раствор отделяют от шлама на центрифу-
гах. Шлам промывают водой и выбрасывают в отвал. Он содержит
более 20% CaS, 8—*10% BaSO4 и другие нерастворимые веще-
ства, а также 18—(20% влаги и около 1% ВаС12. Количество от-
вала составляет 0,8—1,1 т на 1 т готового продукта. Промывные
воды с центрифуг смешивают с основным раствором. Раствор, со-
держащий 300—350 г/л ВаС12, отстаивается от мути и поступает
на выпарку и кристаллизацию хлористого бария.
Нитрат бария 451
Маточные щелоки после кристаллизации хлористого бария со-
держат в среднем 80—120 г/л ВаС12 и 100—150 г/л СаС12. Их при-
соединяют к раствору, идущему на выпарку. Постепенно содержа-
ние в них СаС12 повышается, а содержание ВаСЬ понижается, так
как хлористый кальций обладает большей растворимостью и выса-
ливает ВаС12 (рис. 132). Когда содержание ВаС12 в маточных ще-
локах снижается до 25—50 г/л ВаС12-2Н2О, они выводятся из ни-
кла и выбрасываются.
На 1 т хлористого бария (94% ВаС12-2Н2О), получаемого
хлоркальциевым способом, расходуется 1,07—1,08 т барита (100%),
0,35—0,38 т топлива (7000 ккал/кг), 0,53—0,70 т хлористого каль-
ция (100%), 2,7—2,8 мгкал пара, 54 квт-ч электроэнергии.
Для осуществления непрерывного выщелачивания плава пред-
ложено его предварительно отверждать на охлаждаемой поверх-
ности в тонком слое".
Преимуществом хлоркальциевого метода получения хлористого
бария перед солянокислотным является большая простота процесса,
так как в одну стадию обжига получается плав хлористого бария,
причем различные примеси — соединения железа, SiO2, CaS и дру-
гие при выщелачивании не переходят в раствор, что исключает
необходимость специальной очистки раствора.
Серьезным недостатком хлоркальциевого метода является при-
менение печей периодического действия. Попытки осуществить про-
цесс в непрерывно действующих вращающихся печах пока не дали
положительных результатов в связи с сильным приплавлением
шихты к футеровке печи. Другим недостатком хлоркальциевого ме-
тода является потеря серые уходящим в отвал сернистым кальцием.
НИТРАТ БАРИЯ
Из способов получения нитрата бария 100 наибольшее техниче-
ское значение имеют:
1) разложение сернистого бария азотной кислотой;
2) обменное разложение солей бария и нитратов.
Получение нитрата бария из BaS и азотной кислоты
Процесс получения Ва(МОз)2 из плава сернистого бария и азот-
ной кислоты аналогичен солянокислому разложению сернистого
бария. Здесь, однако, должна применяться аппаратура из специаль-
ных материалов, устойчивых в присутствии азотной кислоты и
окислов азота. Для разложения раствора, полученного после вод-
ного выщелачивания плава сернистого бария (— 125 г/л BaS), ис-
пользуют разбавленную азотную кислоту (30—35% HNO3). При-
менение концентрированной кислоты приводит к большим потерям
окислов азота в результате восстановления HNO3 сероводородом:
BaS + 2HNO3 = Ba(NO3)2 + H2S
- 2HNOj + 3H2S = 4H2O + 2NO+3S>
15*
452
Гл. XII. Соли бария
При этом выделяется элементарная сера, загрязняющая полу-
чаемый продукт, так как ее трудно отделить от раствора.
Исходные растворы смешивают в стальном цилиндрическом ре-
акторе, футерованном кислотоупорными плитками, снабженном ме-
шалкой (120 об/мин). Компоненты дозируют так, чтобы в выходя-
щем из реактора щелоке имелся избыток кислотности 1—5 г/л
HNO3. Далее в «разварнике» с помощью острого пара при темпе-
ратуре не ниже 95° производят отдувку из кислого щелока серо-
водорода и коагуляцию выделившейся в твердую фазу серы. Затем
производят нейтрализацию кислотности щелока при 95—97°, доба-
вляя к нему сульфидный раствор (BaS) при перемешиваний до
•избыточной щелочности 0,16—0,5 г/л BaS. Большее повышение ще-
.лочности и понижение температуры раствора вызывают накопле-
ние в растворе H2S, т. е. Ba(HS)2, чем создаются условий для раз-
ложения нитрата бария:
2Ba(HS)2 + Ba(NO3)2 + H2S = 2NO + Ва(ОН)2 + 2BaS + 2Н2О + 3S
Нейтрализованный щелок осветляется в отстойнике Дорра при
температуре не ниже 90°. Шлам, содержащий элементарную серу,
сульфит бария и другие примеси, идет в отвал. Осветленный щелок
выпаривают в двухкорпусном вакуум-аппарате. Выделившуюся во .
втором корпусе соль через солесборник спускают на центрифугу. |
Маточный раствор выводят из цикла при накоплении в нем болыйе |
3 г/л примесей, содержащих серу. Выгружаемые из центрифуги 1
кристаллы азотнокислого бария имеют влажность ~ 1,5%. При вы- |
работке продукта I сорта, содержащего меньше 0,5% влаги, соль |
сушат воздухом (90—95°) в барабанной сушилке. На произвол- |
ство 1 т продукта расходуют: 1,7—1,8 т барита II сорта (в пере- |
счете на 100% BaSO4), 0,5 т азотной кислоты (в расчете на НМОз), ’
0,4—0.42 т условного топлива. 0,18 т каустической соды (92%),
137 л3 воды, 4,5 мгкал пара, 23,5 квт-ч электроэнергии, —4500
газообразного топлива. На каждую тонну продукта получается
0,5 т шламов; шлам, из отстойников содержит 4% BaS, 10—15%
ВаСОз. 15—20% BaSO4, 10—15% С. 30—40% золы; шлам из реак-
торного отделения представляет собой серу, смоченную раствором
Ba(NO3)2.
Конверсия солей бария
Поэтому способу концентрированный раствор хлористого бария |
при 80—90° обрабатывают NaNCh ИЛи KNO3: ,1
BaCI2 + 2NaNO3 - Ba(NO3)2 + 2NaCl I
При охлаждении раствора до 30—35° из него кристаллизуется 1
Ba(NO3)2, который отделяют На фильтре, промывают и высуши- 1
вают. |
Для получения нитрата бария, содержащего только 0,1—0,3% 1
хлоридов, необходимо продуйт Йервой кристаллййации перекри- 1
Карбонат бария
453
сталлизовывать. Этот способ отличается простотой, возможностью
использования аппаратуры из стали (Ст. 3) и малым расходом
пара и электроэнергии. Однако он связан с применением дорогого
сырья — ВаС1г и NaNOs.
Для конверсии хлорида бария в нитрат может быть использо-
ван нитрат аммония 101:
ВаС12 + 2NH4NO3 = Ba(NO3)2 + 2NH4C1
Рис. 140. Растворимость в водной сис-
теме ВаС12 + 2NH4NO3”=Ba(NO3)2 +
+ 2NH4C1 при 25°. (Цифрами отме-
чены моль Н2О на 100 моль солей.)
На рис. 140 изображена диаграмма растворимости в этой си-
стеме при 25°. Аналогичный вид имеют диаграммы для 0 и 100°.
При сливании насыщенных рас-
творов NH4NO3 и ВаС1г при 25°
кристаллизуется около 65%
Ва(ЫОз)2- Если выпаривать при
100° раствор, содержащий 2 моль
NH4NO3 на 1 моль ВаС1г, до на-
сыщения NH4CI, выход Ва(МОз)2
составит ~73%.
Для обменного разложения
можно использовать также вод-
ную систему:
ВаСО3 + Ca(NO3)2 = СаСО3 + Ba(NO3)2
Вследствие меньшей раствори-
мости СаСОз по сравнению с
ВаСО3 реакция идет слева на-
право.
Нитрат, хлорид и другие чи-
стые водорастворимые соли бария
могут быть изготовлены из рас-
твора, получаемого при выщела-
чивании плава BaS, пропуска-
нием его при 50—70° через сильно
кислый катионит в Na+- или К+-форме (или сильно основной ани-
онит). Для извлечения 100% бария катионит не доводят до пол-
ного насыщения и регенерируют раствором соли натрия или калия
с соответствующим анионом, добавляя к нему и маточный раствор,
остающийся после кристаллизации соли бария. Из раствора, со-
держащего сульфиды щелочных металлов, выделяют соответствую-
щие сульфиды, а маточный раствор возвращают на выщелачива-
ние плава BaS 102.
КАРБОНАТ БАРИЯ
Карбонизация раствора сернистого бария
Наиболее распространенный способ получения технического
Углекислого бария основан на карбонизации раствора сернистого
<&рия (160—170 г/л BaS) при 30—40° двуокисью углерода,
464
Гл. XII. Соли бария
содержащейся в газах, отходящих из известково-обжигательных
печей, из печей в производстве сернистого бария и др. В применяе-
мых для этой цели печных газах не должно содержаться заметных
количеств кислорода во избежание окисления сернистого бария, а
содержание СО2 желательно не ниже 20%.
Ввиду того, что сернистый барий в растворе гидролизован
2BaS + 2Н2О = Ва(ОН)2 + Ba(HS)2
при карбонизации идут две последовательные реакции. Вначале
карбонизуется Ва(ОН)2:
Ва(ОН)2 + СО2 = ВаСО3 + Н2О
При дальнейшей карбонизации выделяется сероводород по ре-
акции:
Ba(HS)2 + СО2 + Н2О = ВаСО3 + 2H2S
Таким образом, процесс идет по суммарному уравнению:
BaS + СО2 + Н2О = ВаСОз + H2S
Печной газ проходит последовательно через 3—4 цилиндриче-
ских резервуара с коническим днищем, где барботирует через
предварительно отстоявшийся от шлама раствор сернистого бария.
Это обеспечивает хорошее использование содержащейся в газе
двуокиси углерода. Вместе с СО2 газ приносит в последующий
карбонизатор H2S, выделившийся в предыдущем по ходу газа ап-
парате. H2S поглошается сульфидом бария с образованием гидро-
сульфида:
BaS + H2S = Ba(HS)2
В дальнейшем гидросульфид бария карбонизуется. По оконча-
нии реакции в первом по ходу газа аппарате его отключают и
дают отстояться образовавшемуся осадку ВаСО3. Затем жидкость
сливают и направляют на выщелачивание плава сернистого бария,
а осадок промывают несколько раз горячей водой, отжимают на
фильтрах (а иногда под прессом) и сушат.
Получаемый таким путем углекислый барий всегда, даже при
хорошей промывке, содержит небольшое количество сульфидов и
серы. С целью получения продукта, не содержащего серы, осаж-
денный ВаСО3 смешивают с водой, добавляют небольшие коли-
чества щелочей (NaOH, NH4OH, К'а2СО3, NaHCO3 и т. п.) и нагре-
вают до кипения. При этом образуются сульфиды, легко отмывае-
мые от осадка горячей водой. Более полная очистка осадка ВаСО3
от сульфидной серы достигается при нагревании его в слабых
растворах щелочей до 140—150° в автоклавах. Общее содержание
серы становится при этом ниже 0,2% в пересчете на BaSOi.
Карбонат бария
455
Осаждение ВаСО3 из растворов BaS производят также содой
по реакции:
Ва(ОН)2 + Ba(HS)2 + 2Na2CO3 = 2ВаСО3 + 2Na2S + 2Н2О
Для получения более чистого осадка следует к 15—16% рас-
твору соды, нагретому до 70—80°, медленно приливать 11—15%
раствор BaS, не допуская полного израсходования соды (избыток
соды должен равняться 1—2%). Полученный осадок ВаСО3 легко
отстаивается и промывается.
Получение ВаСО3 из нитратного щелока
Для производства ВаСО3 используют, например, раствор, со-
держащий 140—160 г/л Ba(NO3)2— осветленный нитратный щелок
из производства азотнокислого бария. К щелоку, после контроль-
ной фильтрации на вакуум-фильтре, добавляют раствор NaOH
с концентрацией 500 г/л до свободной щелочности 1—2 г/л (в пере-
счете на NaOH). Подщелачивание ведут при 60—70° в резервуаре
с змеевиками для подогрева паром и барботером для перемеши-
вания раствора воздухом. Затем нитратный раствор обезврежи-
вают (удаляют из него сернистые соединения), медленно добавляя
раствор гипохлорита натрия (120 г/л активного хлора) до появ-
ления свободного активного хлора, определяемого пробой на иодо-,
крахмальную бумажку. При этом идут следующие реакции:
BaS + 4NaC10 = BaSO4 + 4NaCl
S + 3NaClO + H2O = H2SO4 + 3NaCI
H2SO4 + Ba(NO3)2 = BaSO4 + 2HNO3
После отстаивания раствора от BaSCh и других примесей его
приливают к перемешиваемому, подогретому до 80—90° раствору
соды (200 г/л Na2CO3). Конец реакции
Ba(NO3)2 + Na2CO3 = ВаСО3 -Ь 2NabJO3
устанавливают по щелочности реакционной смеси — около 0,5 г/л
(в пересчете на ОН-). По окончании осаждения карбоната бария
продолжают перемешивание при 85—90° в течение 10—15 мин,
затем дают осадку ВаСО3 отстояться в течение 20—30 мин. Рас-
твор NaNO3 декантируют и отправляют на выпаривание, а осадок
промывают на вакуум-фильтре горячей водой (80—909) от нитрата
натрия и ионов хлора. Затем осадок разваривают при 80—90°, от-
фильтровывают, окончательно промывают, сушат и укупоривают.
На 1 т продукта (в пересчете на 100% ВаСО3) расходуют: 0,59—
0,6т кальцинированной соды (95% Na2CO3), 2,4 т барита (100%),
0,675—0,71 т азотной кислоты (100%), 0,22—0,25 т едкого натра
<32%), 0,02—0,025 т гипохлорита натрия (100% активного хлора).
456
Гл. XII'. Соли бария
Другие способы получения ВаСО3
При небольших масштабах производства для осаждения угле-
кислого бария используют производственные растворы хлористого
бария, обрабатывая их содой:
ВаС12 + Na2CO3 — ВаСО3 + 2NaCl
Обычно раствор содержит 180—200 г/л ВаС12. Его предвари-:
тельно очищают от ионов кальция и железа обработкой раствором
NaOH или промывными водами, получаемыми при производстве
гидроокиси бария, содержащими 30—40 г/л Ва(ОН)2. Для осаж-
дения берут раствор соды, содержащий 180—200 г/л Na2CO3. Про-
цесс ведут так же, как и при осаждении ВаСО3 из Ba(NO3)2. Про-
мывку осадка на фильтре горячей водой ведут до содержания-
в нем С1" не больше 0,05%. На 1 т 100%-ного углекислого бария
расходуется 1,276—1,29 т ВаС12 • 2Н2О (100%), 0,553—0,575 т каль-
цинированной соды (95%), 0,011 т едкого натра (92%), 100—
120 кет -ч электроэнергии, ~3мгкал пара, ~ 100 м3 воды.
Существуют и другие способы получения ВаСО3, например
осаждение его из растворов BaS или ВаС12 углекислым аммонием
или разваривание BaSO4 в концентрированном растворе углекис-
лого калия под давлением 5 ат.
При перемешивании 12—15 мин суспензии BaSO4 в 20% рас-
творе Na2CO3 (с небольшой добавкой NaOH) в автоклаве при 8—
10 ат и 200° выход ВаСО3 достигает 90%103.
Возможно получение ВаСО3 взаимодействием BaSO4 и Na2CO3-
в среде расплавленного NaCl104. '
ГИДРООКИСЬ БАРИЯ
Получение гидроокиси бария из ВаС12 и NaOH
Реакцию обменного разложения
ВаС12 + 2NaOH = Ва(ОН)2 + 2NaCl
осуществляют в цилиндрических обменниках-кристаллизаторах из
нержавеющей стали, снабженных водяной рубашкой для охлажде-
ния и мешалкой (45 об/мин). В аппарат загружают раствор хлори--
стого бария, имеющий концентрацию 365 г/л ВаС12 и темпера-
туру 40°, и затем, при непрерывном размешивании, спускают из.
мерника раствор едкого натра (650 г/л) с 18%-ным избытком про-
тив стехиометрического количества. Массу размешивают 1 ч и за--
тем пускают в рубашку воду для охлаждения. После охлаждения
до 25° (продолжающегося 12—15 ч) массу спускают на фильтр для
отделения кристаллической гидроокиси бария Ва(ОН)2 • 8Н2О.
Продукт промывают на фильтре водой до содержания хлора
Гидроокись бария
457
30 и NaOH 30—60, а также
20—25 г/л Ва(ОН)2) исполь-
35
30
25
го
15
а.
Ю
ДО
И
I
Ва
! NaOH
(ОН),
I
2NaCl
Na26
. 0,9
ZW
0,7
! 0,6
> 0,5
1 0,4
5 0,3
> й?
> а/
i С12Л
_ I и |\
- Ва(ОН); 8НгО
^твердая comJ
Bad, 0j 0^05 0,40505 0,7050^Ъ^Л\}г
ЭкВиОаленты.йоли единица
Рис. 141. Диаграмма системы
ВаС!2 — NaOH —Н2О при 30°.
1
!
и
Исходный рас тЛор)
меньше 0,09% и отжимают под вакуумом. Степень перехода бария
в продукт составляет ~72%. Маточный раствор, содержащий
(в г/л): NaCl 180—200, Ва(ОН)2
промывные воды (30—40 г/л NaC
зуют для растворения хлористого
бария, направляемого для оса-
ждения углекислого бария.
На 1т технического продукта
расходуют: 0,92 т хлористого ба-
рия (95%), 0,37 т жидкой каусти-
ческой соды (92%). 0,085 т каль-
цинированной соды (для исполь-
зования бария из маточного
раствора и промывных вод),
1,41 мгкал пара, 50 м3 воды,
57 квт-ч электроэнергии; в каче-
стве побочного продукта полу-
чается 0,15 т ВаСОз (100%). Как
показали исследования105, опи-
санный здесь производственный
режим не является оптимальным
и может быть улучшен.
В системе ВаС12—NaOH—Н2О
при 30° могут присутствовать
следующие твердые фазы:
ВаС12 • 2Н2О, ВаС1 (ОН) • 2Н2О,
Ва (ОН)2 • 8Н2О, Ва(ОН)2 • ЗН2О,
Ва(ОН)2.Н2О, NaCl и NaOH •
• Н2О (рис. 141). Наибольший
выход Ва (ОН) 2 • 8Н2О получается
из раствора, содержащего экви-
молекулярные количества ВаС12
и NaOH (точка В) при заверше-
нии кристаллизации в точке А и
при водном числе исходного рас-
твора 22—23. Описанным же выше
производственным условиям соответствуют водное число 16,4
и 18%-ный избыток NaOH. Хотя избыток NaOH и увеличивает
очень немного выход гидроокиси бария, но влечет значительное
увеличение расхода щелочи, а уменьшенное водное число приво-
дит к загрязнению осадка примесями, отмывка от которых влечет
за собой потери гидроокиси бария. Исходный раствор оптималь-
ного состава при использовании жидкой каустической соды с кон-
центрацией 650 г/л NaOH получается при добавлении ее к 22%
раствору ВаС12. Дозировать NaOH следует с избытком ~1% во
избежание потерь ВаС12. Если, кроме этого, после отделения основ-
I
5
468
Гл. XII. Соли бария
ной Массы кристаллов Ва(ОН)2-8Н2О при 25° центрифугирова-
нием, охладить маточный раствор до —5° и выделившиеся допол-
нительно кристаллы вместе с основной их массой перекристалли-
зовать растворением в воде при 80° и охлаждением до 25°, то
можно получить технический продукт со значительно меньшими
затратами сырья на 1 т; 0,785 т хлористого бария (95%), 0,265 т
жидкой каустической соды (92%), 0,027т кальцинированной соды
(95%), 0,85 т пара, 2,2 т конденсата, ~20 м3 воды, 100 кет • ч элек-
троэнергии; в качестве побочного продукта получается всего 47 кг
ВаСО3 (100%)105.
О расчете степени использования бария и NaOH см.106.
Разработан метод ступенчатой вакуум-кристаллизации
Ва(ОН)2-8Н2О достаточно крупных размеров из горячего рас-
твора (75—80°), полученного взаимодействием 40% раствора
NaOH с 19—20% раствором ВаС12-2Н2О. При расходе воды на
промывку кристаллов 1—1,5 кг на 1 кг продукта содержание
в нем С1_ меньше 0,05% 1W.
Возможно непрерывное осаждение Ва(ОН)2-8Н2О 42—44%
раствором NaOH без подогрева исходного раствора ВаС12 (24—
28% ВаС12 2Н2О) при скорости потока последнего не более 6 л/ч
на 1 л рабочего объема аппарата. Избыток щелочи в реакционной
смеси —10%, а ее температура 20—25°, но при 5—6° достигается
наибольший выход продукта. Такой «холодный» способ повышает
производительность аппаратуры 108.
Запатентован109 способ дегидратации продукта горячим воз-
духом (100—225°) в распылительной сушилке, куда подают рас-
плав Ва(ОН)2-8Н2О или раствор Ва(ОН)2. Для уменьшения со-
держания ВаСО3 в продукте воздух рекомендуют очищать от СО2.
Получение гидроокиси бария из сульфида бария
Гидроокись бария можно получить обработкой щелока BaS
марганцовыми рудами или отходами, содержащими МпО2. При
этом идут реакции
Ba(OH)(HS) + 2MnO2 = Ва(ОН)2 + Мп2О3 + S ' (1)
Ba(OH)(HS) + 1,5МпО2 = Ва(ОН)2 + >/2Mn3O4 + S (2)
Ba(OH)(HS) + MnO2 = Ва(ОН)2 + MnO + S (3)
2Ba(OH)(HS) + MnO2 = 2Ва(ОН)2 + MnS + S (4)
константы равновесия которых при 25°: = 1033, Д2 = 1034,
Л’з = 1021 и Ка = Ю9. Следовательно, равновесие этих реакций
резко сдвинуто вправо и процесс обессеривания щелока должен
идти практически до конца. Действительно, при осуществлении
противоточной обработки марганцовой руды щелоком (27—69 г/л
Гидроокись бария
459
BaS) в аппаратах с мешалками при 25—40° в течение 60 мин, при
молярном отношении МпО2 : Ва от 4 до 2,4, выход Ва(ОН)2 соста-
вляет около 99%. Увеличение количества МпО2 против приведен-
ной выше оптимальной величины приводит к снижению выхода,
вероятно вследствие протекания реакции:
Ва(ОН)2 + МпО2 = ВаМпО3 + Н2О
Раствор Ва(ОН)2 получается разбавленным и до кристаллиза-
ции его требуется выпаривать110’111.
Гидроокись бария может быть получена (с выходом 95—98%)
взаимодействием водной суспензии ZnO и BaS. После отделения
ZnS, охлаждая раствор, выделяют Ва (ОН)2 • 8Н2О 112. Лучшие ре-
зультаты дает осаждение гидроокиси бария с помощью Си2О —
осадок Cu2S меньше по объему и фильтруется в 10—20 раз быст-
рее, чем ZnS, поэтому меньше потери раствора Ва(ОН)2, кроме
того он менее загрязнен 113.
Запатентован 114 способ изготовления гидроокиси бария непо-
средственной ее кристаллизацией из раствора, получаемого выще-
лачиванием плава BaS, при охлаждении до 13°. При двухкратной
промывке кристаллов насыщенным раствором Ва(ОН)2 при 22°
(при Т: Ж = 1 : 1 по весу) получается продукт с отношением
Ва(ОН)2: Ba(HS)2 = 48 : 1.
Другие способы получения гидроокиси бария
Гидроокись бария может быть получена из осажденного кар-
боната бария и тонкоизмельченного (—10 000 отв/см2) кремнезема
любого сорта, например кварцевого песка. При спекании в течение
1 ч этих материалов при 1100° в присутствии 1—2% ускоряющих
процесс добавок (марганцовый шлам или свежеосажденная окись
железа) образуется трехбариевый силикат 115:
ЗВаСО3 + SiO2 = Ba3SiO5 + ЗСО2
Его подвергают 3—4-минутной обработке водой при 80°:
Ba3SiO5 + 2Н2О = 2Ва(ОН)2 + BaSiO3
Полученный после выщелачивания раствор перерабатывают на
кристаллическую гидроокись бария, а метасиликат бария возвра-
щают на спекание с карбонатом бария, причем также образуется
трехбариевый силикат:
BaSiO3 + 2ВаСО3» Ba3SiO5 4- 2СО2
Выход' продукта достигает 90—95% 116.
Гидроокись бария можно получать одновременно с литопоном3.
Сначала получают цинкат бария взаимодействием раствора
460
Гл. XII. Соли бария
сернистого бария с суспензированной в нем окисью цинка при
80—90°i
2BaS + 3ZnO = 2ZnS + 2BaO • ZnO
2BaS + 4ZnO = 2ZnS + 2BaO • 2ZnO
Затем в реакционную массу добавляют новую порцию BaS и
сернокислый барий — происходит осаждение литопона:
2ВаО • ZnO + BaS + BaSO4 + ЗН2О = ЗВа(ОН)2 + ZnS + BaSO4
После отделения литопона гидроокись бария выделяют из рас-
твора охлаждением 117.
Предложено получать гидроокись бария прокаливанием смеси
тонкоизмельченных барита и пирита (FeS2: BaSO4 = 2—5) при
750—950° с пропусканием через шихту водяного пара. При обра-
ботке полученного огарка водой образуется раствор Ва(ОН)2. Ре-
комендуется вести выщелачивание под давлением при 150°118.
Разработаны способы получения гидроокиси бария из щелоков
BaS 119 или из растворов хлорида, нитрата или ацетата бария 120
с помощью сильнокислотных (К+- или Ыа+-форма) или сильно-
основных (ОН~-форма) ионитов, которые регенерируют раство-
рами едких щелочей. Для сорбции бария из сульфидных раство-
ров рекомендуется фильтровать его через катионит КУ-2 при 60°
и элюировать его при этой же температуре раствором NaOH; этим
способом можно получить продукт, содержащий больше 99% гид-
роокиси бария 121.
Разработан способ получения гидроокиси бария электролизом
раствора ВаС12. При концентрации исходного раствора ВаС12
330—335 г/л и катодной плотности тока до 2500 а/м2 образуется
амальгама с концентрацией 0,1—0,15% Ва; при температуре в раз-
лагателе больше 80° получается раствор, содержащий 300 г/л
Ва(ОН)2. Напряжение на ванне 5 в; катод — ртутный; выход
Ва (ОН)2 по току превышает 90% 122.
ОКИСЬ И ПЕРЕКИСЬ БАРИЯ
Окись бария получают прокаливанием азотнокислого или угле-
кислого бария в тигельных или в муфельных печах различных кон-
струкций (углекислый барий прокаливают также и в других печах,
например шахтного типа).
Реакция
2Ba(NO3)2 = 2ВаО + 4NO + ЗО2
протекает при нагревании до 1000—1050°. После нескольких часов
прокаливания получается пористая масса, содержащая более 96%
ВаО. Выделяющиеся сильно разбавленные воздухом окислы азота
улавливают щелочными растворами. При прокаливании Ва(ЫОз)2
в стальных тиглях высотой 0,5 м и диаметром 0,4—0,5 м (слегка
Окись и перекись бария
461
конической формы) на внутреннюю и наружную поверхность тиг-
лей наносят слой шамотной обмазки. Тигли закрыты крышкой с от-
верстием для выхода газов. Нагрев ведут медленно, в течение 30—
35 ч, во избежание бурного выделения газов и уноса материала из
тиглей. Затем печь охлаждают 10—11 ч и выгружают тигли. После
дополнительного охлаждения из них выбивают окись бария, кото-
рую помещают в герметически закрываемые стальные ящики для
предотвращения карбонизации на воздухе.
Разложение ВаСОз на ВаО и СОг начинается выше 900°. Для
полного разложения требуется накаливать углекислый барий до
1400°. Снижение температуры в печи приводит к обратному обра-
зованию ВаСОз из продуктов его диссоциации. Частичное оплавле-
ние поверхности прокаливаемых кусков материала также сильно
затрудняет процесс. Эти трудности устраняются при прокалива-
нии карбоната бария в смеси с углем. Вследствие того, что угле-
род восстанавливает СО2 до СО реакция протекает по схеме:
ВаСО3 + С = ВаО + 2СО
Отсутствие в газовой фазе СО2 исключает обратный ход реак-
ции, что дает возможность вести ее при температурах ниже 1200°
и избежать оплавления материала 123. Для этого процесса предло-
жено применять аппаратуру из карборунда с присадкой корунда 124.
Предложено также осуществлять процесс в псевдоожиженном
слое 125.
Получение перекиси бария основано на способности окиси ба-
рия поглощать кислород при не очень высоких температурах
(стр. 417). Выше 900° перекись бария целиком разлагается на
окись бария даже в атмосфере чистого кислорода. Интенсивное
поглощение кислорода окисью бария идет при 450—700°. Процесс
осуществляют нагреванием окиси бария в муфельных печах до
этих температур в струе воздуха или путем нагнетания кислорода
под давлением 2—3 ат в герметически закрытую реторту из нержа-
веющей стали, снабженную электрообогревом. В реторту, предва-
рительно нагретую до 200°, быстро загружают свежеприготовлен-
ную окись бария, содержащую не меньше 96% ВаО. Затем реторту
закрывают, продувают для удаления воздуха и нагнетают в нее
кислород, очищенный от СО2 и влаги. В дальнейшем через каждые
1,5—2 ч производят продувку реторты, удаляя через продувочный
кран накапливающиеся в процессе поглощения кислорода инерт-
ные газы (примеси в кислороде). После достижения ~700° элек-
трообогрев выключают и температуру поддерживают на этом
уровне за счет тепла реакции около 4 ч. Когда процесс близок
К Завершению, температура начинает снижаться, и при достиже-
нии 600—580° включают подогрев. После 4-часовой выдержки элек-
Ирообогрев прекращают и массу охлаждают при подаче кислорода
462
Гл. XII. Соли бария
до 350—380°. Затем прекращают подачу кислорода и выгружают
продукт в подставленный под реторту барабан из оцинкованной
стали. Продукт размалывают в шаровой мельнице и просеивают
(1600 отв/см2). Отсев содержит 83—87% ВаО2 и идет в отход
(112 кг на 1 т продукта I сорта). Продукт содержит более 90%
ВаО2. Выход ВаО2 из ВаО составляет ~92% от теоретического.
Для получения 1 т продукта расходуют (при производстве окиси
бария прокаливанием азотнокислого бария в тиглях): 2,2 т азотно-
кислого бария (99%), 645 .и3 кислорода, 7,05 7- условного топлива
и 1500 квт-ч электроэнергии.
Описанный способ является малопроизводительным и громозд-
ким. Предложены способы получения ВаО2 окислением кислородом
или воздухом при 400—700° расплавленной гидроокиси бария. Раз-
работан также способ окисления твердой, нерасплавленной гидро-
окиси 126. Процесс заключается в обезвоживании октагидрата гид-
роокиси бария и окислении Ва(ОН)2 при 550—600°. Окисление
вдет быстро и получаемый продукт содержит 93—95% ВаО2.
Л)ожно получать ВаО2 через дипероксигидрат ВаО2 • 2Н2О2, обра-
зующийся при действии Н2О2 на Ва(МОз)2 в аммиачной среде при
обычной температуре. При этом сначала образуется гидроокись,
которая сразу же реагирует с перекисью водорода. После высуши-
вания при НО—115° получается продукт, содержащий 92—95%
ВаО2 127.
Предложено получать из Ва(ОН)2 и Н2О2 водную суспензию
ВаО2 • 8Н2О и затем обезвоживать перекись бария, нагревая сус-
пензию выше 55°, отфильтровывать ВаО2 и высушивать при ПО—
150°128.
ЛИТЕРАТУРА
1. Н. К. Воскресенская, Г. Н. Кащеев, ИСФХА, 25, 168 (1954).——
2. М. М 1 с h a n d, Compt. rend., С262, № 14, 1143 (1966). — 3. Д. А. Дымчи-
шин, Производство бариевых солей, ГОНТИ, 1938.—4. Перекись водорода и
перекисные соединения, под ред. М. Е Позина, Госхимиздат, 1951.—
5. Н. К. Григорьева, Т. И. Арнольд, С. 3. Макаров, сб. «Химия пере-
кисных соединений», Изд. АН СССР, 1963, стр. 94.—6. И. П. Вольнов,
А. Н. Шатунина, ДАН СССР, 110, № 1, 87 (1956). —7. М. Brook, Chemist-
Analyst, 42, № 2, 28 (1953). — 8. А. М. Голуб, Г. М. К и л и м н и к, ЖПХ, 29,
№ I, 17 (1956). — 9. J. Doucet, N. Bizouard, Compt. rend., 242, № 17, 2137
(1956). — 10. И. H. Беляев, М. Л. Ш о л о х о в и ч, ЖПХ, 25, № 8, 818 (1952).
11. П. П. Будников, П. А. Володин, С. Г. Тресвятский, Укр.
хим. ж., 22, № 3, 292 (1956). —12. Г. А. Бухалова, Е. С. Ягубьян, Изв,
вузов. Хим. и хим. технол., 3, № 5, 783 (1960). —13. Л. Н. Успенская,
А. Г. Бергман, ЖОХ, 25, № 7, 1277 (1955). —Я. Л. Н. Успенская,
Н. П. Глушкова, А. Г. Бергман, Там же, 25, № 9, 1658 (1955).—
15. Г. М. Ку пер май, Д. X. Гварамадзе, С. И. Джи к и я, Н. П. 3 а р«
к у а, Труды Ин-та химии АН ГрузССР, т. 11, 1953, стр. 117. — 16. А. Р а о 1 о п 1,
J. electr. Ind. electrochimi, 58, 55, 82 (1949). —/7. Э. К. Келлер, В. Б. Глуш-
кова, ЖНХ, 1, № 10, 2283 (1956). —/8. Н. Н. Беляев, М. Л. Ш о л о х о в и ч,
ЖПХ, 25, № 6, 657 (1952).--19, М. Л. Шолохович, Н. Н. Беляев, ЖОХ,
Литература
463
24, № 2, 218 (1954). — 20. К. Н. Leiser, Z. anorg. Chem., 335, № 5, 6, 225
(1965).
21. J. Bye, J. Holder, Bull Soc. chim. France, 1953, № 4,' 399.—
22. M. Г. Г а б p и e л о в а, ЖХП, № 10, 38 (1939). — 23. К. И. Заславский,
Сборник статей к 20-летию ГИПХ, Госхимиздат, 1939, стр. 87. — 24. Правила и
нормы техники безопасности и промышленной санитарии для проектирования,
строительства и эксплуатации производств сернистого бария, хлористого бария
и гидроокиси бария, Госхимиздат, 1963. — 25. М. Г. Габриелов а, М. А. Мо-
розова, Производство неорганических ядохимикатов, Изд. «Химия», 1964,
гл. 5. — 26. В. П. Радищев, Научно-иссл. работы хим. ин-тов и лаб. АН
СССР за 1940 г., Изд. АН СССР, 1941, стр. 21.— 27. А. А. Иванов, Электро-
вакуумная технология, Госэнергоиздат, 1944. — 28. Г. Герман, С. Вагенер,
Оксидный катод, Гостехиздат, 1960. — 29. Г. Л. Кореньков, Н. А. Устино-
ва, Горнохимическое сырье зарубежных стран, Изд. «Химия», 1965, гл. 2.—
30. R. W. Lewis, Bull. Bur. Mines, № 630, 91 (1965).
31. E. Ф. Беленький, И. В. Р и с к и н, Химия и технология пигментов,
Госхимиздат, 1960.—32. Е. Ф. Беленький, Производство минеральных кра-
сок и лаков, ГНТИ, 1931. — 33. В. И. Орлов, К. А. Г а р, Хим. пром., № 9, 3
(1946). —34. В. С. Нешпор, В. Л. Ю п к о, ЖПХ, 36, № 5, 1139 (1963).—
35. Mining Ann. Rev., 81, 83 (1967).— 36. А. И. Майоров, ЖХП, № 7, 13
(1940). — 37. Ю. В. Морачевский, Труды ГИПХ, в. 37, 1946, стр. 120.—
38. П. Д. Набоков, Хим. пром., № 8, 20 (1950). — 39. J. А. С a d d i е k, Mining
Mag., 90, № 5, 280 (1954).— 40. L. Stragiotti, Ind. mineraria, 5, № 8, 451
(1954).
41. F. Vogel, пат. ГДР, 10091, 1953.—42. Ф. И. Стригунов, Цвета,
металлы, № 2, 18 (1968). — 43. Н. Ш. Сафиуллин, Сборник научно-техн,
информ, материалов НИОХИМ, в. 1, 1960, стр. 74.—44. U. F г а n с a i s. англ,
пат. 724272, 1955, —45. G. М. Hood, пат. США 2685499, 1954. —46. Г. М. Ку-
пе р м а н, С. И. Д ж и к и я, Н. П. 3 а р к у а, Труды Ин-та химии АН ГрузССР,
т. 11, 1953, стр. 127. — 47. R. Albert, пат. ФРГ 907102, 1954. —48. И. С. Ша-
пиро, Хим. пром., № 12, 14 (1944). — 49. Н. S. Boots, Е. F. Pollard,
М. J. Rentschler, Ind. Eng. Chem., № 10, 1981 (1948). — 50. О. И. Пудов-
кина, Э. М. Моргунова, Труды УНИХИМ, в. 3, 1955, стр. 130.
51. Н. Ф. Юшкевич, П. М. Спиридонов, Минеральное сырье н его
переработка, 1, № 5, 374 (1926). — 52. П. В. Д ы б и н а, Технология минераль-
ных солей, Госхимиздат, 1949, гл. III. — 53. В. В. Печковский, С. А. Ами-
рова, А Н. Кет о в, Уч. зап. Пермского гос. ун-та, 17, в. 1, 45 (1960).—
54. А. Н. К е т о в, В. В. Печковский, Хим. и хим. технол., № 4, 667 (1958).—
55. В. В. Печковский, А. Н. К е т о в, Труды Пермского политехи, ин-та,
№ 10, 1961, стр. 3; ЖПХ, 33, № 8, 1719 (I960). — 56. С. А. Амирова,
В. В. Печковский, А. Н. К е т о в, Там же, стр. 33. — 57. А. Ф. Ложкин,
В. В. Печковский, Н. Л. Субочева, Там же, стр. 57. — 58. В. В. П е ч-
ковскнй, Там же, 32, № 10, 2189 (1959). — 59. Польск. пат. 48579, 1963.—
60. Н. Ш. Сафиуллин и др., авт. свид. 179287, 1965.
61. W. Steinmetzer, Н. Plischke, Chem. Techn., 9, № 1, 38 (1957) —
62. А. Ф. Л ожкин, В. В. Печковский, Н. Л. Субочева, Уч. зап.
Пермск. гос. ун-та, 17, в. 1, 55 (I960). — 63. И. Н. Аверко-Антонович,
Труды Казанск. хим.-техн, ин-та, № 7, 1938, стр. 3. — 64 L. L е р i n s k i Che-
rnik, 18, № 1, 23 (1965). — 65. Ф. И. Стригунов, Н. Ш. Сафиуллин,
3. Ф. Гаврилова, Хим. пром., № 3, 227 (1967); Труды НИОХИМ, т. 19, Изд.
«Химия», 1969, стр. 123. — 66. В. И. М у м л а д з е, Тезисы докладов VI Всесоюз-
ной конференции по технологии неорганических веществ, Тбилиси, 1968,
стр. 117. — 67. Г. М. Купер м ан, С. И. Д ж и к и я, Труды Тбнлисск. хим.
ин-та АН ГрузССР, т. 3, 1938, стр. 125. — 68. Н. Ф. Юшкевич, П. М. Спи-
ридонов, Минеральное сырье и его переработка, 2, № 12, 803 (1927).—--
464
Гл. XII. Соли бария
69. В. П. Ильинский, Г. С. Клебанов, Труды соляной лаб. АН СССР,
в. 2, 1932. — 70. В. А. Шушунов, Г. И. Садовников, Б. Я. Андреев,
ЖПХ, 28, № 8, 1472 (1954).
71. R. V. Culver, С. J. Hamdorf, J. Appl. Chem., 5, № 8, 383 (1955).—
72. Н. Ш Сафиуллин, Э. Ф. Гаврилова, Х1м. пром. 1нформ. иаук техи.
зб„ № 3 (23), 32 (1965). —73. В. Н. Чазов, Л. К. Удалов, О. Б. Клеба-
нов, Хим пром., № 2, 113 (1966). — 74. М. Е. Поз и и. Технология минераль-
ных удобрений и солей, Госхимиздат, 1957, гл. IX. — 75. Польск. пат. 53368,
1965. — 76. Г. А. Ткач и др.. Труды НИОХИМ, т. 19, 1969, стр. 269.—
77. М. К. Гольдберг, ЖХП, № 18, 1115 (1936). — 78. Д. В. Безуглый,
Ф. М. Кунаков, Там же, № 8, 37 (1939).— 79. В. М. К а к а б а д з е, И. Г. Бу-
чу к у р и, Там же, № 8, 240 (1950). — 80. Г. Н. К у п е р м а н, С. Н. Д ж и к и я,
Труды Тбилисск. хим. ин-та АН ГрузССР, т. 7, 1944, стр. 117.
81. В. М. К а к а б а д з е, Я. Г. Буч у кур и. Хим. пром.. № 1, 16 (1951).—
82. Ф. К- Михайлов, Там же, № 7, 393 (1956). — 83. В. Ф. Чернов, Про-
изводство кальцинированной соды, Госхимиздат, 1956, стр. 300.— 84. Д. М. Г и н з-
бург, Н. П. Красильникова, С. С. Демирская, Труды НИОХИМ,
т. 10, 1957, стр 146. — 85. Ф. Н. Строков, Труды ГИПХ, в. 11, 1928,
стр. 167.—86. Ф. Н. Строков, Там же, в. 10, 1928, стр. 36.—87. В. М. Гри-
невич. ЖПХ, 14, № 1, 63 (1941). — 88. В. В. Печковский, А. Л. Софро-
нов, ЖПХ, 34, № 10, 2153 (1966).— 89. S. S. В г a t п a g а г, S. Р а г t h a s а-
rathy, A. L. Sundara Rao, J. Sci. Ind. Res. (India), № 3, 108 (1944).—
90. Франц, пат. 64928, 1928.
91. M. О. X а р м а д а р я н, К. И. Б р о д о в и ч, Укр. хим. ж., 8, 1 (1933). —
92. Я. Г. Бучукури, Сообщение АН ГрузССР, 10, № 6, 329 (1949).—•
93. R. N. Sc hr eve, R. К. Toner, Ind. Eng. Chem., 32, № 4, 568 (1940).—
94. R. N. Schreve, M. F. W i e g a n t. ibid., 35, № 5, 608 (1943). — 95. P. Вен-
нер, Термохимические расчеты, ИЛ, 1950, стр. 196. — 96. О. И. Пудовкина,
Е. И. Толстикова, Труды УНИХИМ, в. 3, 1955, стр. 133.— 97. А. М. Г и н ст-
л и н г, А. Д. Волков, ЖПХ, 33, № 8, 1700 (1960). — 98. Ф. И. Стригунов,
Хим. пром., № 11. 856 (1968). — 99. Ф. И. Стригунов, авт. свид. 215908,
1966. — 100. М. А. Миниович, Соли азотной кислоты (нитраты), Госхимиз-
дат, 1946, стр. 87.
101. К. Б. Здановский, Бюлл. ВИГ. № 3, 1940; Труды ВНИИГ, в. 21,
1949, стр 348. — 102. J. Р. Leaver, М. Т. Pope. англ. пат. 1017341, 1963.—
103. Е. Zirngiebl, пат. ФРГ 1177122, 1963. — 104. Н. S. Booth, Е. F. Pol-
lard, Ind. Eng. Chem., 40, № 10, 1983 (1948).— 105. M Б. 3 e л и к и н, С. С. Де-
мирская, Труды НИОХИМ, т. 10, 1957, стр. 126. — 106. В. И. Панов и др.,
Хим. пром., № 11, 849 (1968). — 107. Н. Ш. Сафиуллин, С. К. С о л я н и к,
сб. «Химическая промышленность Украины», № 6 (30), 1966, стр. 8.—
108. В. Л. Сокол, Е. А. Риф, А. В. Бромберг, Л. И. Ушакова, Труды
ИРЕА, в. 27, 1965, стр. 365. — 109. S. К. May, R. J. Sinnott, англ. пат.
1000301. 1962. — ПО. В. М. Какабадзе, П. И. Гагиидзе, ДАН СССР, 105,
№ 5, 1053 (1955).
111. П. И. Гагнидзе, Автореф. канд. дисс., Грузинск. политехи, ин-т,
Тбилиси, 1955. — 112. В. М. Какабадзе, Т. А. Иванова, И. П. Чача-
н и д з е, Реф. докл. VIII Менделеевского съезда, № 1, 145 (1959). — 113. R. S с h о-
b е г, пат. ФРГ 1181188, 1963. —114. J. G. Marshall, А. Е. Oates англ. пат.
980813, 1962 — 115. В. Б. Глушкова, Э. К. Келлер, ЖНХ, 2, № 5, 1001
(1957). —116. В. М. Какабадзе, Г. Д. Чачанидзе, ЖПХ, 26, № 8, 787
(1953). —117. В. М. Какабадзе, Г. Д. Чачанидзе, Труды Грузинск. по-
литехи. ин-та, № 28, 1953, стр. 3. — 118. F. W. Jahn, пат. США 2724639, 1956.—
119. J. G. Marshall, А. Е. Oates, N. A. McDonald, аигл. пат. 992793,
1961. — 120. J. Р. Leaves, М. Т. Pope, аигл. пат. 1013711, 1963.
Литература 465
121. Л. Л. Коша кош ви л и, Я. Г. Б у чу кур и, В. Д. Э р и с т а в и, Те-
зисы докладов VI Всесоюзной конференции по технологии неорганических ве-
ществ, Тбилиси, 1968, стр. 54. — 122. Л. А. И с а р о в, Труды НИОХИМ, т. 10,
1969, стр. 155. —123. С. N. Satterfield, F. Feakes, Chem. Eng. J., 5, № 1,
122 (1959). —124. К fl s b e r g, пат. ФРГ 881494, 1953, —/25. W. H. Kahn,
J. C. Sindlinger, франц, пат. 1076381, 1954. — 126. Л. А. И с a p о в, сб. «Хи-
мия перекисных соединений», Изд. АН СССР, 1963, стр. 101. —127. С. 3. Ма-
каров, Н. К. Григорьева, ЖПХ, 32, № 10, 2184 (1959). —128. Э. М. М и т-
кевич, И. П. Книгавко, В. В. Чеснокова, сб. «Химическая промышлен-
ность Украины», № 6 (42), 1968, стр. 17.
Глава XIII
СОЛИ СУЛЬФИДНОГО ряда
К солям сульфидного ряда относятся производные сероводо-
рода (сульфиды), полисернистых водородов (полисульфиды),
а также оксисульфиды типа RO • RS. Они широко распространены
в природе и являются сырьем для получения цветных металлов и
серной кислоты. К ним относятся сульфиды меди, свинца, серебра,
цинка, никеля, кобальта, железа, мышьяка, сурьмы, ртути и др. *.
Природные сульфиды не растворимы в воде. Важнейшими суль-
фидными продуктами, получаемыми заводскими способами или об-
разующимися при очистке промышленных газов от сероводорода,
являются растворимые соединения щелочных металлов. В этой
главе рассматриваются производства сернистого натрия, гидро-
сульфида натрия и некоторых полисульфидов.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Сернистый натрий Na2S в безводном состоянии имеет плот-
ность 1,86 г!см\ плавится при 1180°2. Сильно гигроскопичен. На-
сыщенный водный раствор содержит при 18° 15,3%, при 90° 36,4%
Na2S. Из водных растворов ниже 48° кристаллизуется Na2S • 9Н2О,
выше 48° — Na2S • 6Н2О. Водные растворы имеют сильно щелоч- ‘
ную реакцию вследствие гидролиза:
Na2S + H2O NaOH + NaHS
В 0,1 н. растворе при 25° степень гидролиза Na2S составляет
86,5%. Дальнейший гидролиз по схеме NaHS + H2O^NaOH + H2S
практически не идет; в 0,1 н. растворе при 25° NaHS гидролизуется
лишь на 0,12%.
Гидросульфид (сульфгидрат) натрия NaHS устойчив только в
растворах. Кислород воздуха медленно окисляет эти растворы, ве-
роятно, по следующей схеме3:
HS“ + O2 = HSO2; 2HSO2 = S2O|“+H2O; 2HSO2+О2 = 2Н5Оз
Физико-химические свойства
467
Образование тиосульфата идет быстрее, чем сульфита, поэтому
главным продуктом окисления является тиосульфат. Кроме того,
продуктами окисления являются также сульфат и полисульфиды.
Сульфид натрия окисляется медленнее гидросульфида; механизм
его окисления сложнее — помимо тиосульфата, сульфита и суль-
фата образуются политионовые кислоты, преимущественно тритио-
новая (см. гл. XIV). При нагревании растворов NaHS переходит
в Na2S и выделяется сероводород:
2NaHS Na2S + H2S
Растворимость NaHS в воде при 20° равна 42% 4.
Сульфид аммония устойчив при температуре ниже —15°, выше
этой температуры разлагается:
(NH4)2S = NH3 + NH4HS
Поэтому при взаимодействии газообразных NH3 и H2S без
охлаждения образуется гидросульфид аммония, устойчивый до
~32°. Давление диссоциации твердого NH4HS (с выделением эк-
вимолекулярной смеси NH3 и H2S) равно:
Температура, °C......... 4,2 9,5 22 25 32,6 >44,4
Давление, мм рт. ст...... 132 175 410 501 772 1560
О системе NH3—H2S—Н2О см.'5>6, а о получении (NH4)2S см.7.
Гидросульфиды натрия или калия образуются при поглощении
сероводорода 8 из промышленных или природных газов водными
растворами почти всех применяемых поглотителей — карбонатов,
фосфатов, фенолятов натрия или калия, солей аминокислот (на-
пример, диметиламиноуксусного калия):
Na2CO3 + H2S ^=± NaHCOj + NaHS
K3PO4 + H2S K2HPO4 + KHS
C6H5ONa + H2S C6H5OH + NaHS
(CH3)2NCH2COOK + H2S (CH3)2NCH2COOH + KHS
При регенерации растворов выделяется сероводород, который
может быть использован.
При поглощении сероводорода водными растворами идут сле-
дующие равновесные процессы:
H2S (г.) 7=± H2S (раств.) Н+ + HS"
Левое из этих равновесий зависит от парциального давления
H2S в газе и от температуры, а правое, также зависящее от тем-
пературы, устанавливается в соответствии с константой диссоциа-
ции /С — — . При 25° К=1,2-10-7. Для хорошего погло-
Щения сероводорода нужно, чтобы концентрация H2S в растворе
била малой, что достигается при значительной диссоциации, когда
468
Гл. XIII. Соли сульфидного ряда
отношение [HS-]: [H2S] велико. Это осуществляется в растворе
с малой концентрацией ионов Н+. Если, например [HS~] : [H2S] =
— К : [Н+] = 100, то [Н+] = 1,2 • КГ9, что соответствует значению
pH 9. Приблизительно такой порядок значений pH и имеют рас-
творы упомянутых выше поглотителей. Еще лучшими поглотите-
лями были бы растворы с большими значениями pH, однако по
этой же причине регенерация таких растворов с выделением погло-
щенного сероводорода была бы затруднена. Хорошо поглощают
сероводород и легко отдают его при регенерации вещества, для
реакции которых с H2S изменение изобарного потенциала Д-^гэз
находится в пределах от +15 до —1 9.
Константы равновесия для систем H2S—К2СО3—КНСО3—
KHS—Н2О (I) и H2S—Na2CO3—NaHCO3—NaHS—H2O (II) при
25° ю.П:
_ [KHCO,j[KHS| _ w •
JK2CO.J pH1S л • мм рт. (*т.
v [NaHCO3][NaHS] ПЛЛ„ г-мол
Л [I гг;—---------“= 0>048--------
[Na2CO3]pH2S л-ммрт. ст.
Их зависимость от температуры в пределах 25—60°:
4,5767’ 3,2; = 4,576Т 3,16
Равновесное давление сероводорода над раствором для этих си-
стем:
Ph2s = 0.714 (/ + 43) С2-88 и ph2s = 5,4 (/+ 48) С3,04
где С — концентрация раствора, н. 1
Полисульфидными называются соединения типа M2Sn или 1
M2S • Sn_], так как предполагается, что атомы серы здесь связаны I
с сульфидом. В водных растворах полисульфиды гидролизуются 12, |
найример: 1
2 (S • S4)2- + 6Н2О = 2S2O|~ + 6H2S
Способность к гидролизу понижается с уменьшением числа ато- 1
мов серы в молекуле полисульфида, вероятно вследствие уменьше- ]
ния при этом степени диссоциации13. Полисульфиды в твердом |
виде сильно гигроскопичны и во влажном воздухе окисляются i
с выделением свободной серы j
S2- + 1,5О2 = S2O2" + Sn_2 I
и далее
S2O|’+'/2O2 = SO|’ + S
• Применение.
469
В присутствии двуокиси углерода полисульфиды наряду с се-
рой выделяют также сероводород:
S*' + СО2 + Н2О = СО|“ + H2S + S„_1
Полисульфиды образуются при взаимодействии сульфидов с се-
рой, а также при медленном окислении кислородом воздуха гид-
ро’сульфидных растворов, например:
4MHS + О2 = 2Н2О + 2M2S2
Для натрия известны полисульфиды с числом атомов серы да
п = 5. Как видно из рис. 142, в системе NagS—S .полисульфиды мо-
Рис. 142. Система Na2S—S.
гут существовать до 920° (по новейшим данным2 до 1180°); выше
этой температуры существует только моносульфид натрия. Для
калия известны полисульфиды с числом атомов серы до 6. Поли-
сульфиды кальция менее устойчивы, чем полисульфиды натрия и
калия и сохраняются лучше всего в растворах, но известны и су-
хие препараты полисульфидов кальция. Еще менее стабильны
полисульфиды аммония.
ПРИМЕНЕНИЕ
Сульфид натрия служит сырьем для производства сернистых
красителей, применяется в текстильной промышленности при кра-
шении этими красителями хлопчатобумажных тканей, в кожевен-
ной промышленности для удаления волоса со шкур, в производстве
красок. Его используют также для получения тиосульфата и гид-
росульфида натрия и во флотационных „процессах, в частности при
флотации цинковой обманки и руд, содержащих железо, цинк и
470
Гл. XIII. Соли сульфидного ряда
свинец. Описаны опыты по замене сульфидом натрия едкого натра
при химической обработке глинистых растворов для выщелачива-
ния гуминовых веществ из бурых углей14. Сульфид натрия яв-
ляется полупродуктом в некоторых способах получения соды и
едкого натоа из сульфата натрия.
Технический сернистый натрий выпускают в виде плавленого
продукта в железных барабанах или в чешуированном виде в поли-
этиленовых мешках, вложенных в бумажные. Согласно ГОСТ
596—70, он должен содержать (в %):
Высший 1-й
сорт сорт
Сернистого натрия (Na2S), не менее ... 70 66
Не растворимых в воде веществ, не бо-
лее .................................. 0.2 0.5
Железа (Fe), не более................... 0.08 0.15
2-й
сорт
63
1,5
0.45
Гидросульфид натрия применяют главным образом в производ-
стве искусственного шелка, а также в кожевенной промышленно-
сти. Его выпускают в виде раствора, содержащего 22% NaHS и
не более 3% Na2S и транспортируют в стальных цистернах, кон-
тейнерах и бочках.
Полисульфиды также используют в кожевенной промышленно-
сти и при флотации руд и особенно в качестве средств борьбы
с вредителями растений15’16. Наиболее распространенным поли-
сульфидным инсектофунгицидом является известково-серный от-
вар, содержащий полисульфиды кальция; реже применяются по-
лисульфиды натрия или калия, называемые иногда серной печенью,
а также аммония и бария, в том числе и сольбар (стр. 421).
Токсичность полисульфидов объясняется действием свободной
серы, выделяющейся при разложении препаратов на воздухе. По-
лисульфиды натрия нашли также широкое применение в производ-
стве полимеров, используемых для получения полисульфидных кау-
чуков (резинит, тионол и др.).
СУЛЬФИД НАТРИЯ
Сульфид натрия получают, главным образом, восстановлением
сульфата натрия углем. Полученный плав содержит, помимо Na2S,
значительные количества примесей, для освобождения от которых
его подвергают выщелачиванию. Образовавшийся раствор серни-
стого натрия отделяют от непрореагировавшего угля и других не-
растворимых веществ и подвергают выпариванию, в процессе ко-
торого происходит очистка раствора от растворимых соединений.
Концентрированный раствор разливают в барабаны, где он засты-
вает в продукт, называемый плавленым сернистым натрием.
Физико-химические основы восстановления Na2SO4 углем
Восстановление Na2SO4 осуществляют чаще всего в коротких
горизонтальных барабанных вращающихся печах периодического
действия, в которых смесь сульфата с углем нагревается топоч-
Сульфид натрия
471
ними газами до 1200°. При этом проходят следующие суммарные
реакции:
Na2SO4 (тв.) + 2С (тв.) = Na2S (тв.) + 2СО2 (г.) — 53,8 ккал!г-мол (1у
Na2SO4 (тв.) + 4С (тв.) = Na2S (тв.) + 4СО (г.) - 136,2 « (2)
Na2SO4 (тв.) + 4СО (г.) = Na2S (тв.) + 4СО2 (г.) — 28,6 « (3)
Значительная масса сульфата натрия восстанавливается, ви-
димо, по реакции (1). Образующаяся при этом СО2, реагируя
с углеродом, превращается в СО, так как выше 800° равновесие
в системе CO24-C=pt2CO— 41,2 ккал/г-мол сдвинуто вправо. Неко-
торое количество сульфата восстанавливается окисью углерода по
реакции (З)17, а образующаяся двуокись углерода, реагируя с угле-
родом, вновь превращается в СО; в итоге это приводит к частич-
ному протеканию процесса по реакции (2). Окись углерода и часть
реакционного угля при содержании в топочных газах кислорода
сгорают до СО2; поэтому газы, выходящие из печей, содержат
много СО2 и мало СО, а газы из плохо герметизированных печей
могут совсем не содержать СО. Однако это не доказывает, что-
восстановление идет только по реакции (1). То, что оно идет и по-
реакциям (2) и (3) и сопровождается простым выгоранием угля,,
подтверждается расходом угля, который в заводских условиях зна-
чительно превышает количество, требующееся теоретически по ре-
акции (1), т. е. 0,17 т углерода на 1 т сульфата натрия (100%).
Механизм восстановления сульфата натрия достаточно сложен.
В первой стадии восстановления Na2SO4 переходит в Na2SO3„
В дальнейшем протекает реакция диспропорционирования 18-23
4Na2SO3 = Na2S +3Na2SO4 (4).
идущая и в отсутствие восстановителей; она суммирует следующие
процессы:
Na2SO3 = Na2O + SO2 (5>
2Na2SO3 + SO2 = 2Na2SO4 + '/2S2 (6>
Na2O + 72S2 = Na2S + 72O2 (7)
Na2SO3 + I/2O2 = Na2SO4 ’ (8>
В присутствии же восстановителей образование серы из SO^
особенно облегчается, так как реакции SO2 + 2СО = V2S2 + 2СО?
и SO2 + С = V2S2 4- СО2 идут со значительной скоростью, что-
ускоряет и реакции (5) и (7).
Восстановление сульфата натрия начинается при температурах
ниже температуры его плавления (890°) в основном окисью угле-
рода и другими компонентами газовой фазы; но в производствен-
ных условиях, при применении в качестве восстановителя сравни-
тельно крупнозернистого каменного угля, интенсивный процесс вос-
становления твердым углеродом протекает лишь после появления.
472
Гл. XIII. Соли сульфидного ряда
жидкой фазы, смачивающей поверхность частиц угля. Наобо-
рот, восстановление газами замедляется при плавлении шихты, так
как жидкая фаза затрудняет доступ газа внутрь реакционной
массы — газ может проникнуть в нее только растворяясь и мед-
ленно диффундируя. Процесс может быть разбит на три периода
(рис. 143). Период I начинается после загрузки шихты в печь. Он
характеризуется нагреванием и постепенным плавлением сульфата
натрия, сопровождающимся нарастанием скорости процесса.
Основной период II характери-
зуется «кипением» плава, т. е.
бурным выделением газа. Этот
Рис. 143. Кривая нарастания са-
держания Na2S в плаве.
Рис. 144. Диаграмма плавкости в си-
стеме Na2SO4—Na2S.
период, когда плав остается жидким, соответствует наибольшей
скорости процесса. Период III, наступающий к концу процесса,
характеризуется загустеванием шихты и снижением скорости нара-
стания количества Na2S в связи с уменьшением концентрации
Na2SO4 в жидкой фазе.
Если в шихте имеются примеси (сульфаты и сульфиды щелоч-
ных и щелочно-земельных металлов и др.), играющие роль плав-
ней, расплавляющих часть сульфата натрия ниже 890°, то интен-
сивность процесса возрастает уже при низких температурах. Роль
такого плавня выполняет и Na2S. Вследствие появления его, хоть
и в небольшом количестве в начале процесса (а также из остаю-
щегося на стенках печи плава после выпуска предыдущей за-
грузки), жидкая фаза эвтектического состава (рис. 144) образуется
уже при 665 ±10°24 и в дальнейшем реакция сильно интенсифици-
руется.
На рис. 144 изображена диаграмма плавкости в системе
Na2SC>4—Na2S. Эвтектическая смесь, имеющая температуру плав-
ления около 665°*, содержит приблизительно 57% Na2SO4 и 43%
Na2S (точка Е). Проследим ход процесса восстановления в изо-
термических условиях при 950°. Состав жидкой фазы будет не-
* По разным данным температура этой эвтектики находится в пределах
665-740°.
Сульфид натрия
473
прерывно изменяться по пунктирной прямой ас до пересечения ее
с кривой плавкости BE в точке с. В этой точке начнется выделение
в твердую фазу сернистого натрия, т. е. начнется загустевание
плава. В дальнейшем состав жидкой фазы будет оставаться по-
стоянным (точка с). Количество жидкой фазы этого состава будет
непрерывно уменьшаться, а количество твердой фазы — возрас-
тать. При полном восстановлении исчезнет весь сульфат натрия и'
вместе с ним исчезнет вся жидкая фаза — плав затвердеет.
Плав в печи обычно несколько перегрет. Вследствие высокой
температуры топочных газов по мере выделения Na2S в твердую
фазу температура плава не остается постоянной, а непрерывно
повышается. Изменение температуры и состава жидкой фазы со-
вершается вдоль кривой плавкости BE. Если плав выгружается
при 1050°, то изменение температуры жидкой фазы идет вдоль
отрезка cd до точки d.
Для уменьшения вязкости плава, предотвращения его налипа-
ния на стенки печи и для облегчения выгрузки плава из печи не-
обходимо, чтобы он обладал достаточной подвижностью. С этой
целью в печи поддерживают высокую температуру (1100—1200°).
Если в конце процесса температура в печи выше температуры за-
твердевания Na2S, то сульфат натрия может быть восстановлен:
полностью. В этом случае плав имеет достаточную текучесть для
выпуска его из печи. При более низких температурах часть Na2S
находится в плаве в твердом виде и для того, чтобы плав содер-
жал достаточное количество жидкой фазы и не был слишком гу-
стым, необходимо оставлять часть сульфата невосстановленной.
Количество невосстановленного сульфата должно быть тем
больше, чем ниже температура в печи.
Кроме сульфата и сульфида натрия в плаве содержатся сода
и метасиликат натрия (см. ниже), которые также находятся в.
жидкой фазе. Содержание сульфата в выгружаемом плаве может
быть тем меньше, чем больше в нем соды и метасиликата, которые
заменяют часть сульфата в жидкости, обеспечивающей подвиж-
ность плава.
Избыток угля в шихте значительно увеличивает вязкость плава-
и сильно уменьшает его теплопроводность. Реакция восстановления
сульфата протекает очень быстро, в течение нескольких минут или
даже долей минуты. Общая же продолжительность процесса, из-
меряемая часами, определяется длительностью прогрева шихты..
Чем больше угля в шихте, тем медленнее она прогревается, тем
больше продолжительность пребывания плава в печи и тем ниже-
производительность печи. Уголь должен быть пористым и мало-
зольным (содержать не более 15% золы) во избежание чрезмерного
загрязнения плава и уменьшения выхода продукта. Лучшим вос-
становителем является древесный уголь, обладающий большей по-
ристостью, однако в производстве пользуются более дешевым.
474
Г л. XIII. Соли сульфидного ряда
рядовым каменным углем. Торф восстанавливает сульфат натрия
в 2 раза быстрее, чем уголь, но для этого требуется брикетировать
шихту, а расход торфа в 2 раза больше, чем угля25.
Вредными примесями в применяемом для восстановления тех-
ническом сульфате натрия являются кислотность и повышенное
содержание NaCl, а в природном — повышенная влажность, NaCl
и нерастворимые вещества. При повышенной влажности сульфата
затрудняется приготовление шихты и усиливается разрушение фу-
теровки восстановительных печей. Поэтому сульфат, содержащий
больше 5% влаги, подвергают сушке.
При соотношении в шихте NaoSCU : С, равном 3 : 1, при 850°
в лабораторных условиях 95°/о-ный выход Na2S достигается за
2—3 мин, причем часть этого времени затрачивается на прогрев
реакционной массы до температуры реакции; при 1100° выход в
88,6% был достигнут за 40 сек.26-34. Излишняя продолжительность
процесса в производственных условиях, связанная с необходи-
мостью прогрева больших масс шихты, ухудшает результаты, так
как возникают побочные реакции, при которых расходуется уже
.образовавшийся сульфид натрия.
Продолжительность процесса восстановления в заводских усло-
виях зависит также от интенсивности перемешивания шихты, со-
хла в а и температуры греющих газов и т. п. Она колеблется в пре-
делах от 1 до 2,5 ч. При этом степень восстановления сульфата
составляет 80—85%. При крупном угле получается плав с мень-
шим содержанием Na2S и с большим содержанием примесей.
Помимо основных реакций, ведущих к образованию Na2S, про-
текают побочные процессы, в результате которых в плаве обнару-
живаются некоторые количества Na2SO3, Na2CO3, Na2SiO3, Na2S2O3
л др. Na2SO3 появляется в результате неполного восстановления
сульфата; Na2CO3 — в результате взаимодействия Na2S с СО2 и
родяным паром, имеющимся в топочных газах:
Na2S + СО2 + Н2О = Na2CO3 4- H2S
Образование соды термодинамически возможно35 и по реак-
циям
Na2SO4 + СО = Na2CO3 + SO2
Na2SO4 + ЗСО = Na2CO3 + 2СО2 +'/2S2
а в присутствии водорода, образующегося из влаги шихты и топ-
лива, по реакциям:
N a2SO4 + Н2 + ЗСО = Na2CO3 + H2S + 2СО2
Na2SO4 + 2Н2 + 2СО e Na2CO3 + H2S -у Н2О + СО2
В результате этих реакций содержание соды в плаве посте-
пенно возрастает, особенно при недостатке угля в шихте. Однако
|с концу процесса количество ее в плаве уменьшается. Приведен-
Сульфид натрия
473.
ные реакции обусловливают потерю серы в газах. В результате
взаимодействия SO2 с СО, а также с H2S образуется элементарная
сера. В газах обнаруживаются также небольшие количества COS.
Газы, интенсивно выделяющиеся из плава в процессе восста-
новления, изолируют его от непосредственного соприкосновения
с топочными газами. В период дозревания плава, когда интенсив-
ное выделение из него газов прекращается и соприкосновение с то-
почными газами облегчается, при наличии подсосов в печь воз-
духа, а также кислорода в топочном газе, может происходить
частичное выгорание серы из плава с одновременным образова-
нием соды:
2Na2S + ЗО2 = 2Na2O + 2SO2
2Na2O + 2СО2 = 2Na2CO3
2Na2S + 3O2 + 2CO2 = 2Na2CO3 + 2SO2
Окисление сульфидной серы кислородом воздуха до SO2 идет,,
по-видимому, с образованием в качестве промежуточного продукта
моноокиси серы SO36; цепная реакция
2SO = SO2 + S; S + О2 = SO + О; ...
обусловливает образование атомарного кислорода, что способ-
ствует окислению Na2S.
Потеря серы в виде газообразных соединений приводит при пе-
редержке плава в печи к уменьшению содержания в ием Na2S.
Появление в газовой фазе SO2 обусловливает возможность реак-
ции:
Na2S + SO2 + Н2О = N a2SO3 + H2S
Содержащийся в плаве метасиликат натрия образуется из соды
и кремнезема, находящегося в золе реакционного угля или попа-
дающего в шихту в виде загрязняющего сырье песка, а также из.
футеровки печи:
Na2CO3 + SiO2 ~ Na2SiO3 -Ь СО2
Чем больше кремнезема в шихте, тем меньше выход сернистого
натрия и тем больше в плаве метасиликата натрия и соды37. Это
можно объяснить тем, что, помимо образования Na2SiO3 из соды,
кремнезем взаимодействует с первичным продуктом восстановле-
ния — сульфитом:
Na2SO3 + SiO2 = Na2SiO3 + SO2
Обнаруживаемый при анализе плава тиосульфат натрия обра-
зуется, в качестве быстро исчезающего промежуточного продукта,
По реакции
Na2SO3 + “ Na2S2O3
476
Гл. XIII. Соли сульфидного ряда
за счет сульфита и серы, возникающих в процессе восстановления.
Кроме того, он, вероятно, образуется при растворении плава в
воде за счет взаимодействия с имеющейся в плаве свободной серой
® присутствии кислорода воздуха:
2Na2S 4- 2S + ЗО2 " 2Na2S2O3
Помимо примесей, образовавшихся в результате побочных ре-
акций, плав содержит остатки неизрасходованного реакционного
угля и минеральные вещества из угля (золу), а также примеси из
сульфата. Обычно в плаве содержится: 70—76% Na2S, до 2%
Na2SiO3, 0,5—2,5% Na2SO3, 1—3% Na2S2Os, 5—13% Na2CO3, до
15% нерастворимых минеральных веществ и до 8% углерода (не-
выгоревший уголь). Сульфат натрия в плаве из механических пе-
чей обычно отсутствует или содержится в количестве, меньшем
1—1,5%, а содержание NaCl зависит от количества его в исход-
ном сульфате. Чем меньше золы содержится в реакционном угле,
тем более высокопроцентным получается плав. Из-за примеси угля
,плав имеет черный цвет.
Помимо сульфата натрия, восстановлению с целью получения
/сернистого натрия могут подвергаться сульфит и тиосульфат на-
-трия. Заводы, производящие анилиновые красители, получают в
качестве отхода от производств фенола, бета-нафтола и других
^значительные количества загрязненного сульфита натрия, содер-
жащего до 80% Na2SO3 (в сухом веществе) и примеси Na2SO4
и Na2S2O3. Этот сульфит используют, примешивая его к сульфатно-
угольной шихте в производстве сульфида натрия. Сырьем для про-
изводства сульфида натрия может служить также тиосульфат на-
трия, являющийся побочным продуктом при очистке газов от
.сероводорода мышьяково-содовым способом (стр. 556). Восстано-
-вление технического тиосульфата углеродом протекает с образо-
ванием сульфида натрия и элементарной серы
2Na2S2O3 + ЗС = 2Na2S + ЗСО2 + S2
.или
2Na2S2O3 + 6С = 2Na2S + 6СО + S2
Для получения моносульфида требуется осуществлять процесс
выше 920° (рис. 142); при 700—800° получается сульфид натрия,
.содержащий некоторые количества полисульфида. Обстоятель-
ством, затрудняющим осуществление этого процесса, является не-
обходимость извлечения серы из газообразных продуктов реак-
ции — образующаяся при восстановлении тиосульфата сера в при-
сутствии угля и вносимой с тиосульфатом влаги большей частью
превращается в сероводород, частично в другие газообразные со-
единения (COS и CS2), частично остается в элементарном виде38.
Сульфид натрия
477
Получение сульфида натрия восстановлением сульфата натрия
углем
Если сульфид натрия получают из природного сульфата, влаж-
ность которого иногда достигает 15—18%, то его подвергают
сушке разбавленными воздухом топочными газами во вращаю-
щейся барабанной сушилке до влажности меньше 5%. Затем его
измельчают в дезинтеграторе до размера зерен 4 мм и меньше и
смешивают, например, в двухвальном лопастном смесителе с из-
мельченным 39 и просеянным углем. Весовое отношение твердого
углерода к Na2SO4 в шихте составляет 0,25—0,27.
Рис. 145. Внешний вид вращающейся печи перио-
дического действия с камерой горячего выщела-
чивания.
На рис. 145 и 146 показана реакционная печь. Для загрузки
шихты и слива плава в барабане печи имеется люк, крышка кото-
рого с внутренней стороны футерована. Тепло уходящих из печи
газов, имеющих высокую температуру (выше 900°), используют для
обогрева котлов, в которых концентрируют щелок сернистого на-
трия, полученный после выщелачивания плава. Барабаны печей
изготовляют из 10—14-миллиметровой стали, они имеют диаметр
2—3 м, длину 5—8 м. Например, печь с диаметром барабана 3,1 м
и длиной 5,5 м имеет суточную производительность ~ 17 т плава,
содержащего 70—79% Na2S, при расходе газа на отопление до
2000м3/ч (при нормальных условиях); барабан печи вращается со
скоростью 2,6 об!мин электромотором мощностью 25 кет.
Для футеровки печей сернистого натрия следует применять као-
линитовый или очень плотный высокоглиноземистый шамотный
кирпич горячего прессования, содержащий больше 50% глинозема,
478
Гл. ХП1. Соли сульфидного ряда
имеющий пористость 14—17%, с временным сопротивлением
сжатию не ниже 250 кгс!см2 и дополнительной усадкой при 1400°
не больше 0,5% 4а-43- Используют также форстеритовый кирпич,
основным веществом которого является Mg2SiO4 и хромомагнези-
товый кирпич. Предложены и другие материалы, показавшие до-
статочную устойчивость к расплавленному сернистому натрию при
лабораторных испытаниях44 — хромитовый огнеупор на глинистой
3000--------------f-—2/00
Рис. 146. Продольный разрез вращающейся печи периодического действия
с камерой горячего выщелачивания плава:
7 — барабан печи (диаметр 2500 мм); 2 —опорный ролик; 3 — привод печи; 4 — камера для гаше-
ния И выщелачивания плава; 5 —газовая горелка; б —пыльная камера; 7—газовая горелка
(подтопок).
связке, высокоглиноземистые огнеупоры, изготовленные из ко-
рунда, двуокиси титана и глины. В строго восстановительной ат- ’
мосфере возможно применение углеродистой (графитовой) футе- j
ровки с гарниссажем на ее внутренней поверхности 45. 3
При повернутом кверху люком барабане печи производят за- |
грузку печи шихтой через люк в течение 5—7 мин. Затем люк за- I
крывают, приводят печь во вращение и в течение 30—40 мин на- ]
гревают реакционную массу до 850—900°. При этом происходит
частичное выгорание угля и полное расплавление сульфата. При |
дальнейшем повышении температуры до 1000—1200° реакционная I
масса вспенивается (вследствие выделения газов) и увеличивается '
в объеме. Во избежание перелива массы через горловины в топку :
и в пыльную камеру, в печь забрасывают через люк пыльной ка-
меры 2—3 лопаты мелкого угля или прекращают на некоторое ;
Сульфид натрия
479
время вращение печи. По прекращении вспенивания наступает пе-
риод интенсивного «кипения» массы, продолжающийся 10—15 мин.
При этом масса быстро уменьшается в объеме, загустевает и при-
липает к внутренней поверхности печи. Дальнейшим нагреванием
массу доводят до жидкокашеобразной консистенции, после чего
плав готовят к сливу. Слив реакционной массы производят в те-
чение 15—30 мин через надеваемый на люк ограничитель — диа-
фрагму диаметром 100—130 мм. При жидком плаве пользуются
диафрагмой 60—70 мм. Плав спускают небольшими порциями в
камеру гашения, куда предварительно заливают нагретый до ки-
пения слабый щелок.
В качестве реакционного угля для восстановления сульфата
натрия чаще применяют жирный уголь с зольностью не больше
12% и содержанием летучих 30—33%. Активность этого угля
выше, чем тощих углей, а летучие, выделяясь, способствуют пере-
мешиванию реакционной массы и, сгорая, ускоряют ее прогрев;
в результате производительность печей, оборудованных угольными
топками (не дающими очень высокой температуры), при работе на
жирном реакционном угле оказывается больше. Но при обогреве
вращающихся печей газовым топливом или мазутом легко дости-
гается высокая температура входящих в печь газов (1250—1270°)
и поэтому в качестве реакционного угля можно применять более
дешевые виды топлива, например антрацитовую мелочь. При этом
реакция протекает без существенного вспенивания массы и оказы-
вается возможным увеличить количество единовременно загру-
жаемой в печь шихты. Плав получается однородным (жидким), не
налипающим на стенки. Расход антрацитового угля на 15—20%
меньше, чем жирного угля 4в. Недостатком антрацитового угля яв-
ляется высокая абразивность его золы.
При отоплении механических печей мазутом форсунки лучше
располагать в специальных камерах сжигания мазута, так как
температура факела слишком высока (больше 1500°), и это приво-
дит к быстрому разрушению футеровки перегретым плавом серни-
стого натрия. Лучше, чтобы температура поступающего в печь го-
рячего газа была не больше 1300°.
В коротких печах (~5л) съем плава с 1 м3 полезного объема
достигает 0,8—0,9 т в сутки, в то время как в длинных печах
(7—8 м) — немногим более 0,5 т. Это объясняется большей про-
должительностью плавки в длинных печах, необходимой для за-
вершения реакции в конце печи, противоположном вводу горячих
газов. В коротких печах реакционная масса прогревается быстрее
и равномерней, и продолжительность одной операции плавки
(включая время загрузки шихты и выгрузки плава) составляет
~2,5 ч, вместо 4 ч в печах с длиной барабана 7—8 м.
Механические вращающиеся печи периодического действия зна-
чительно совершеннее, чем применявшиеся ранее для восстановле-
480
Гл. XIII. Соли сульфидного ряда
Рис. 147. Зависимость необходимого
времени пребывания в печи от содер-
жания твердого углерода в шихте
(уголь ПЖ.).
ния сульфата натрия ручные пламенные подовые печи 47-54, однако
и они имеют существенные недостатки. Основные из них — невоз-
можность выпускать и выщелачивать плав непрерывным способом
и низкий тепловой коэффициент полезного действия вследствие
того, что барабан печи короткий и газы уходят из него с очень
высокой температурой (900—950°). Эти недостатки могли бы быть
устранены применением вращающихся печей непрерывного дей-
ствия, что, однако, связано с рядом пока еще непреодоленных за-
труднений.
Во вращающихся печах непрерывного действия тепло могло бы
быть использовано лучше, так как шихта и греющие газы дви-
жутся противотоком и уходя-
щие газы имеют температуру
600—750°. Во избежание коль-
цеобразования шихту требует-
ся составлять на неспекаю-
щемся угле. При этом сокра-
щается и продолжительность
восстановления. Чем больше
угля в шихте, тем больше вяз-
кость плава и необходимое для
восстановления время пребы-
вания его в печи (рис. 147).
Съем плава с 1 .и3 внутрен-
него объема печи составляет
1,2—1,3 т в сутки31. Выпуск
плава из печи производится в
зоне с наиболее высокой температурой, на небольшом расстоянии
от нижнего конца печи, где имеется специальное звено с несколь-
кими отверстиями, через которые при вращении печи плав выте-
кает в приемник или в камеру выщелачивания. Как показал
опыт, несмотря на высокую температуру в реакционной зоне
печи непрерывного действия (до 1250°), оказывается трудным
избежать кольцеобразования, т. е. налипания шихты на футеровку
в средней зоне печи. Это нарушает устойчивость ее работы. По-
этому, а также из-за быстрого разрушения футеровки в наиболее
горячей зоне восстановление сульфата натрия в таких печах не
получило распространения. Снижения температуры восстановления
с сохранением при этом подвижности реакционной массы во вра-
щающейся печи непрерывного действия можно было бы достичь
добавкой в тонкодисперсную шихту порошкообразных инертных
наполнителей, в присутствии которых жидкая фаза распределяется
в большом количестве твердого материала и реакционная масса
остается сыпучей. Наполнителем может служить, в частности, и
значительный избыток реакционного у1ля 55-57. Добавка в шихту
извести резко повышает скорость реакции восстановления суль-
Сульфид натрия
481
фата углем при низких температурах (ниже 750°) вследствие уда-
ления СО2 из сферы реакции в виде твердого углекислого каль-
ция 58.
Для получения плава сернистого натрия используют также не-
прерывно действующие шахтные печи 59> ®°. Восстановлению в них
подвергают природный кусковой сульфат натрия. Шихта из кокса
и сульфата натрия, содержащего
2,5—25% Н2О, поступает в печь че-
рез бункер и питатель (рис. 148).
Количество кокса в шихте — 50—
55% от веса натурального сульфата.
. Можно восстанавливать также бри-
кеты, изготовленные из увлажнен-
ного сульфата или из его смеси с
реакционным каменным углем. Печь
представляет собой цилиндрическую
шахту высотой 6 .и с внутренним
диаметром 1,2 м. Нижняя часть пе-
чи с подом является горном; он опи-
рается на колеса и при ремонте пе-
чи откатывается в сторону. В горне
имеются три летки для выпуска пла-
ва в стальные тигли, вмещающие
около 80 кг плава. Летки и нижняя
часть шахты печи — кессон, т. е.
зоны наиболее высоких температур,
имеют снаружи водяные рубашки
для отвода тепла. В зоне наиболее
высоких температур (горн и кессон)
печь футерована хромомагнезито-
вым кирпичом, в остальной части —
шамотным кирпичом. Непосредст-
венно над горном расположен фур-
менный пояс с отверстиями, через
которые в печь засасывается воздух, необходимый для горения кок-
са; количество воздуха (2000—2800 м3/ч) регулируют таким обра-
зом, чтобы в печном газе было не больше 1,5% кислорода. Печной
газ отсасывается из печи в стальную башню, где он очищается от
пыли и охлаждается водой, причем из него конденсируется водяной
пар. Охлажденный газ отсасывают из башни эжектором (гидро-
автоматом), создающим разрежение в колошниковой части печи
400—800 мм вод. ст.61 Рабочей жидкостью в эжекторе является
вода с примесью известкового молока для нейтрализации компо-
нентов газа, содержащих серу. Вода, циркулирующая с помощью
центробежного насоса, перед возвратом в эжектор частично обно-
вляется с выводом части загрязнившейся жидкости.
16 М. Е. Позин
Рис. 148. Схема установки шахт-
ной печи для восстановления суль-
фата натрия:
/ — бункер для шихты; 2— питатель;
3 — шахта печи; 4 — горн; 5 —тигель;
башня для охлаждения печного
газа; 7 — гидравлический затвор под
башней; 8 — гидроавтомат; 9 — газоводо-
отделитель; 10 — брызгоуловитель;
Ц - насос.
482
Гл. XIII. Соли сульфидного ряда
Описанная шахтная печь может выпускать в сутки больше
25 т плава, содержащего 67% Na2S. Однако практически, вслед-
ствие больших подсосов воздуха (~50%) и недостаточности дутья,
такие печи дают 20—22 т плава в сутки с содержанием всего 60%
Na2S. Количество же примесей, образующихся в результате окис-
ления Na2S кислородом, проникающим в печь с подсасываемым
воздухом, в особенности сульфата натрия, значительно выше (на
5—6% и больше), чем в плаве из механических печей. При этом
расходные коэффициенты в пересчете на 1 т 63%-ного плава со-
ставляют: 2 т натурального сульфата натрия, 0,7 т кокса, 0,015 т
извести, 300 кет • ч электроэнергии.
Для приготовления брикетов сульфат натрия увлажняют до со-
держания 10—-15% Н2О. Увлажнение порошкообразного сульфата
сопровождается выделением тепла гидратации. При увлажнении
всего лишь с 3 до 10% этого тепла достаточно чтобы в адиабати-
ческих условиях температура сульфата повысилась на 31,1°. Это
вызывает необходимость отводить тепло в процессе увлажне-
ния, не допуская перегревания продукта выше точки превращения
(32,4°), а практически, поддерживая температуру при гидратации
на уровне 23—28°. При хранении гидратированного сульфата или
брикетов летом их также следует предохранять от нагревания окру-
жающим теплым воздухом. Охлаждение в процессе гидратации
можно осуществлять в аппарате с псевдоожиженным слоем в по-
токе воздуха (если требуется — предварительно охлажденного)62.
Брикетирование осуществляют на непрерывно действующем валь-
цевом прессе. По выходе из пресса брикеты для созревания (упро-
чнения) вылеживаются 12—18 ч в системе небольших подвижных
бункеров, объединенных в рампы, оборудованные транспортными
механизмами.
Разработан способ низкотемпературного восстановления ..суль-
фата натрия в виде брикетов из шихты, содержащей Na2SO4 и спе-
кающийся каменный уголь (Na2SO4 : С не больше 2) или торф (при
отношении торфа к сульфату больше 1,6). Наибольшую прочность
имеют сульфатно-угольные брикеты с примесью 10% торфа в ка-
честве связующей добавки. Восстановление при 750—800° идет без
видимого плавления брикетов. Поэтому оно может быть осуществ-
лено в непрерывно действующей вращающейся печи, а также в
шахтной печи. В опытах на модельной вращающейся печи, при
продолжительности процесса 40—50 мин был получен полупродукт,
содержавший до 75% Na2S21>63.
При наличии дешевой электроэнергии восстановление сульфата
натрия углем можно осуществлять в электрических печах 64’65.
В последнее время в промышленность внедряются высокоэф-
фективные печи циклонного типа. В них восстановление порошко-
образного сульфата натрия, смешанного с тонкоизмельченным ре-
акционным углем, происходит при 1400° за короткое время в
Сульфид натрия
483
пленке расплавленной шихты, омываемой быстро движущимся га-
зом. Шихта из бункеров вводится струей сжатого воздуха в цик-
лонную камеру тангенциально со скоростью 20—25 м/сек. Туда же
подается жидкое или газообразное топливо. Воздух для сжигания
топлива и поддержания интенсивного вращательного движения
вводится тангенциально со скоростью 100—120 м/сек. За 10 мин
степень восстановления сульфата достигает 95—97%. Съем плава
с 1 ж3 объема циклонной печи значительно выше, чем в механиче-
ской и шахтной печах, а циклонный эффект в сочетании с жидкой
пленкой расплава дает высокую степень улавливания пыли в са-
мой печи. Испытание циклона с водяным охлаждением стенок по-
казало, что стойкость гарниссажа (слоя плава, застывшего на
стенках) настолько велика, что, вероятно, возможно будет обой-
тись без специальной футеровки печи. Так как циклонная печь
работает непрерывно, то облегчается проведение в непрерывно дей-
ствующей аппаратуре последующих операций переработки плава.
Плав стекает по стенке камеры через диафрагму в копильник, где
завершается восстановление («дозревание») и откуда он непре-
рывно удаляется через леткувв’87.
Переработка плава в сульфид натрия
Выщелачивание сульфида натрия из плава холодным спосо-
бом, т. е. после его охлаждения и затвердевания теперь почти везде
прекращено и заменено более рациональным горячим выщелачи-
ванием.
При холодном выщелачивании плав из печей выливается (из
ручных печей — выгружается) в котелки (тигли, бадейки и т. п.),
закрываемые затем крышками, застывает в них и охлаждается
10—12 ч. Высказывалось мнение30-08> *9, что в процессе охлаждения
плава содержание в нем NagS уменьшается вследствие протекания
побочных реакций. В действительности это уменьшение происходит
лишь в поверхностном слое горячего плава, соприкасающемся с
воздухом — Na2S окисляется в Na2SO4. Поэтому выгрузка из ко-
телков еще не остывшего плава приводит к потерям Na2S.
Слитки застывшего плава выгружают из котелков опрокидыва-
нием и разбивают ручным способом. Затем плав дробят вначале
на щековых, затем на валковых дробилках и направляют на выще-
лачивание. Для выщелачивания твердого плава применяют резер-
вуары с мешалками, дырчатые вертикальные барабаны, вращаю-
щиеся на вертикальном валу в неподвижных цилиндрических ре-
зервуарах47, неподвижные и вращающиеся автоклавы, в которых
процесс осуществляется под давлением пара 5—6 ат и др. Выще-
лачивание производят горячими щелоками сначала более, затем
менее концентрированными, постепенно укрепляя их. и горячей во-
дой, которой окончательно промывают шлам перед его удалением
16*
484
Гл. XIИ. Соли сульфидного ряда
из выщелачивателей. При методическом (последовательном) вы-
щелачивании получают щелоки четырех-пяти концентраций:
Первый щелок (крепкий) — плотность при 50—80° 1,26-1,32 г/см-
Второй » (средний) — » » » 1,22-1,24 »
Третий » (слабый) — » » » 1,14-1,16 »
Четвертый » » » 1,08-1,10
Пятый » » » » 1,02- 1,04 »
Четвертый и пятый щелоки получают при промывке шлама во-
дой.
В системе Na2S—Na2SO4—Н2О70-72 при 30—90° с увеличением
концентрации Na2S и с ростом температуры растворимость Na2SO4
уменьшается (табл. 37). При температуре не ниже 80—90° воз-
можно получить щелок, содержащий 32,5—35,5% Na2S и меньше
0,5—0,8% Na2SO4 70. В интервале температур 90—140° содержание
Na2S в насыщенном растворе растет от 35,8 до 47,2%, а концентра-
ция Na2SO4 уменьшается с 0,81 до 0,20% 7I. Это указывает на целе-
сообразность осуществления выщелачивания плава при темпера-
туре выше 100°.
таблица з
Растворимость Na2SO4 в водных растворах Na2S (вес. %)70
(Жирным шрифтом обозначены составы эвтонических растворов)
30° 40° 60е 80° 90°
Na2S Na2SO4 Na2S NagSO^ Na2S Ma2SO« Na2S Na2SO4 Na2S Na2SO4
28,80 32,50 31,01 30,39 30,00
6,00 21,00 4,60 21,22 5,60 18,02 6,11 14,03 9,91 12,02
10,31 13,60 6,43 18,40 9,00 14,42 13,62 7,05 13,62 6,29
12,24 10,76 10,01 13,02 12,41 8,91 20,71 3,59 20,39 2,59
13.15 7,05 12,82 8,20 18,01 6,30 27,22 2,32 28,19 0,92
15,10 6,40 16,00 5,61 23,71 4,39 30,61 0,92 32,21 0,72
17,31 5,85 17,62 4,50 28,69 2,00 32,40 0,80 35,51 0,50
20,00 — 21,02 — 29,92 __ 33,50 — 36,42 —
Горячее выщелачивание жидкого плава осуществляют сразу
после выпуска его из печи без промежуточного охлаждения и за-
твердевания. Это дает экономию в расходе топлива, электроэнер-
гии и значительно повышает производительность труда, так как
устраняет громоздкие операции розлива, охлаждения, дробления
и перегрузки плава, создающие к тому же тяжелые условия труда
вследствие обильного тепло- и газовыделения. При горячем выще-
лачивании плава используется его физическое тепло, вследствие
чего почти в 2 раза сокращается расход пара на подогрев щелоков
и уменьшаются потери Na2S, вызываемые окислением кислородом
и карбонизацией СО2 воздуха. Сокращаются производственные
площади, особенно за счет того, что отпадает необходимость иметь
Сульфид натрия
483
большие площадки для охлаждения слитков плава. Сокращаются
количество оборотных щелоков и емкости для их хранения.
Горячее выщелачивание плава позволяет получить щелок высо-
кой концентрации, не требующий выпаривания. После фильтрации
такого щелока при 190—200° через металлическую сетку для отде-
ления от непрореагировавшего угля и- других твердых примесей
щелок мог бы быть разлит по барабанам, где он застынет в гото-
вый продукт. Этот прием, однако, не получил промышленного рас-
пространения из-за большой вязкости щелока и возможности кри-
сталлизации его при охлаждении в процессе фильтрации, что за-
трудняет отделение от него нерастворимого шлама. По этим же
причинам не получило осуществления и предложение предвари-
тельно (до выщелачивания) фильтровать через металлическую
сетку под вакуумом горячий жидкий плав69. Вследствие этого по-
лучают щелок, содержащий в 1 л 300—320 г Na2S. После отделе-
ния от него шлама отстаиванием и с помощью фильтров или цент-
рифуг щелок выпаривают и разливают в тару (барабаны), где он
и застывает.
В цехах, оборудованных периодически действующими вращаю-
щимися печами, горячее выщелачивание плава осуществляют по-
сле окончания плавки — печь останавливают и выпускают через
разгрузочное отверстие жидкий плав в камеру гашения или горя-
чего выщелачивания 46-50. Камера представляет собой стальную
сварную коробку емкостью около 10 м3, снабженную паровыми
барботерами и вытяжными трубами для отвода паров воды. Пере-
мешивание пульпы производится мешалкой или циркуляционным
насосом. Камера смонтирована в одном блоке с вращающейся
печью и обхватывает печь поясом (рис. 145 и 146); она устанавли-
вается под печью так, что плав не может быть слит за' пределы
камеры. Перед выпуском плава из печи в камеру до половины ее
объема (4—5 ж3) заливают средний щелок (15—20% Na2S) и на-
гревают его острым паром до 100—105° (лучше почти до кипения).
Затем постепенно сливают плав из печи — происходит гашение и
выщелачивание щелоком плава, имеющего температуру около
1000°, сопровождающееся интенсивным парообразованием, так что
по окончании операции объем полученной пульпы на 15—20%
меньше объема исходного щелока (при гашении 1 т плава из ще-
лока испаряется 650—700 кг воды). После окончания слива содер-
жимое камеры перемешивают 15—20 мин при одновременном
подогреве для завершения выщелачивания Na2S. Завершение выще-
лачивания можно производить и в специальном агитаторе. Затем
полученный щелок, содержащий 28—32% Na2S, отделяют от шлама
на центрифуге или нутч-фильтре или отстаиванием. Соотношение
между' количествами среднего щелока и плава регулируют с уче-
том их состава так, чтобы крепкий щелок не был слишком-кон-
центрированным. Оптимальной концентрацией крепкрго щелока
486
Гл. XIII. Соли сульфидного ряда
при современном аппаратурном оформлении процесса, по-види-
мому, следует считать ~30% Na2S; плотность такого щелока
~ 1,35 г/см?, температура кипения ~125°, а температура кристал-
лизации выше 70° (70° — для чистого 30% раствора Na2S). При
более высокой концентрации затрудняется дальнейшая перера-
ботка щелока, так как вследствие значительной его вязкости за-
медляется отстаивание шлама и создается опасность выпадения
кристаллического сернистого натрия в процессе отделения шлама
вследствие некоторого охлаждения щелока. Если, однако, обеспе-
чить сохранение высокой температуры крепкого щелока в процессе
отделения шлама, которое производить не отстаиванием, а прину-
дительным способом, например центрифугированием, то оптималь-
ная концентрация крепкого щелока окажется значительно выше.
Следует, однако, учитывать, что в суспензии из выщелачивателя
отношение Ж: Т колеблется от 20 : 1 до 45 : 1. Для разделения этой
суспензии применение нутч-фильтров и вакуум-фильтров затруд-
нено вследствие того, что шлам, получаемый после горячего выще-
лачивания плава, имеет очень тонкую структуру и забивает поры
фильтрующих тканей. Использование центрифуг для таких разбав-
ленных суспензий также нецелесообразно. Поэтому лучше освет-
лять крепкий щелок отстаиванием, например, в сгустителях типа
Дорра, а сгущенный шлам окончательно отжимать и промывать на
центрифуге, куда он может быть подан диафрагмовым насосом.
При промывке шлама на центрифуге или путем репульпации
слабым щелоком (60—80 г/л Na2S) получают средний щелок, ко-
торый используют вновь для горячего выщелачивания плава. Вто-
рую и третью промывки шлама производят горячей водой, получая
растворы, содержащие соответственно 60—80 и 25—40 г/л Na2S.
Промывные воды смешивают с частью крепкого щелока, получая
средний щелок для выщелачивания плава. Удаляемый в отвал
промытый шлам представляет собой илоподобную массу, содержа-
щую непрореагировавший уголь, золу, сульфиды тяжелых метал-
лов (главным образом FeS) и влагу, в которой растворены соли.
Его состав в пересчете на сухое вещество: 10—30% угля, 0,3—0,8%
Na2S, 0,6—1,5% Na2S2O3, 0,7— 1 % Na2SO3, 0,2—0,8% Na2SO4, 0,4—
0,6% Na2CO3; остальное — нерастворимые минеральные соедине-
ния. Влажность шлама, отделенного отстаиванием ~50%, а цент-
рифугированием — 30—35 %.
Применение метода горячего выщелачивания плава в комби-
нации с периодически действующими печами связано с некоторыми
затруднениями. Большие порции жидкого плава нельзя сразу на-
правлять в воду (в щелок), так как это вызывает мгновенное паро-
образование и разбрызгивание, сопровождающиеся хлопками и
ударами, подобными взрывам. Поэтому выпуск плава производят
медленно, через ограничительные шайбы — это неизбежно приво-
дит к уменьшению производительности печи. Для более спокойного
Сульфид натрия 487
гашения плава концентрация щелока, поступающего в гаеитель,
должна быть не ниже 20% Na2S. Заливать в камеру перед выпу-
ском в нее плава лучше только небольшую часть щелока, а основ-
ное его количество подавать одновременно с плавом через систему
трубок, создающих в камере жидкостную завесу (сетку); проходя
через нее, плав гасится и гранулируется, а затем уже выщелачи-
вается. При горячем выщелачивании плава из печи непрерывного
действия легче организовать процесс так, чтобы плав, выпускаемый
из печи тонкой струей, сначала гасился малым количеством ще-
лока и лишь затем смешивался с основной его массой. Можно так-
же выливать плав на вращающийся стальной барабан, частично
погруженный нижней своей частью в резервуар со щелоком. Струя
плава растекается по верхней части барабана и застывает на нем
в виде тонкой пленки, легко растворяющейся при вращении бара-
бана. При этом тепло плава используется так же, как и в камере
гашения.
Упомянутые выше затруднения при горячем выщелачивании
плава из печей периодического действия послужили основанием
для предложений 73-74 производить выщелачивание плава, частично
охлажденного в изложницах. По этому способу изложницы, имею-
щие отверстия в боковых стенках, с несколько охлажденным пла-
вом, застывшим с поверхности и у стенок, с помощью мостового
крана переносятся от печи и устанавливаются на поддон, распо-
ложенный в верхней части выщелачивателя — резервуара с мешал-
кой. Плав орошается слабым щелоком, а образующийся крепкий
щелок стекает с поддона в расположенный рядом с выщелачива-
телем отстойник. В процессе выщелачивания щелок, соприкасаю-
щийся с плавом, кипит, но он отделен от раскаленного (жидкого)
плава коркой застывшего плава, поэтому выщелачивание происхо-
дит спокойно, без хлопков. Скорость выщелачивания плава умень-
шается при увеличении содержания в нем (или в исходном суль-
фате натрия) хлористого натрия. Слиток плава весом 170—450 кг,
полученный из сульфата, содержащего меньше 3% NaCl, выщела-
чивается полностью за 1 —1,5 ч73.
Состав получаемого крепкого щелока зависит от качества
сырья и условий восстановления и выщелачивания. Обычно он со-
держит 28—30% Na2S, 1—6% Na2CO3, 0,5—1% Na2SO4, 0,2—1%
Na2SO3, 0,5—1,5% Na2S2O3 и имеет плотность 1,26—1,32 г/см? при
70°. Если щелок не подвергался фильтрации, то его осветляют от
взвешенных твердых частиц отстаиванием в стальных цилиндриче-
ских резервуарах большой емкости с коническим днищем. Отстой-
ники покрыты снаружи тепловой изоляцией и снабжены паровыми
змеевиками для периодического подогрева, чтобы температура ще-
лока не снижалась ниже 70° во избежание кристаллизации серни-
стого натрия. Профильтрованный или отстоявшийся щелок на-
правляют на выпарку.
488
Г л. XIII. Соли сульфидного ряда
При выпаривании чистого раствора Na2S под атмосферным да-
влением температура его кипения повышается до 186,5°. При этой
температуре появляются кристаллы, после чего она понижается
до 184,5° и в процессе дальнейшей кристаллизации остается неиз-
менной 75.
Выпарку технического крепкого щелока производят в откры-
тых чугунных котлах, обогреваемых газами, отходящими из вос-
становительных печей. Часто выпаривание ведут в две стадии, в
последовательно работающих котлах. Предварительное выпарива-
ние производится до ~40% Na2S, когда температура кипения до-
стигает 135°. По мере испарения воды котлы доливают щелоком.
При окончательном выпаривании температура щелока повышается
до 175—185°, что соответствует концентрации 63—65% Na2S. Более
рациональной является выпарная установка из 4 котлов, через ко-
торые щелок проходит непрерывным потоком и упаренный сли-
вается в сборник готового щелока, откуда разливается в тару.
Размеры котлов разные, например диаметр 2 м, высота 2,5 м.
Наиболее стойким материалом для выпарной аппаратуры, осо-
бенно при высоких концентрациях Na2S, являются высокохроми-
стые и хромоникелевые стали76, например, следующие (по сни-
жающейся стойкости): Х28, Х28НА, Х25Т, Х25Н4Т, 0Х21Н5Т,
1Х21Н5Т, 0Х21Н6М2Т, 1Х18Н10Т, Х17Н13М2Т, Х17Г9АН,
Х14Г14НЗТ, Х17, Х1377. Предложено также применять котлы из
стали (Ст. 3), выложенные цинком78. На современных установках
удаляющийся из котлов в процессе выпарки водяной пар отводят
в водяной конденсатор; получаемая здесь теплая вода исполь-
зуется в производстве (например, для промывки шлама).
В процессе выпаривания из щелока выделяются осадки солей,
содержащие главным образом 1^а2СОз, а также Na2S2O3, Na2SO3,
Na2SO4. Эти соли кристаллизуются в результате сильного уменьше-
ния их растворимости в концентрированных растворах Na2S. Осад-
'ки раньше вычерпывали дырчатыми черпаками, и так как они содер-
жали значительные количества (до 65%) Na2S — их направляли
в выщелачиватели. Осадки, вычерпывание которых является тяже-
лой и трудоемкой операцией, образуют на стенках котлов корку,
ухудшающую теплопередачу. Помимо ухудшения использования
тепла, это ведет к тому, что стальные котлы прогорают, а чугун-
ные лопаются. Во избежание этого котлы снабжают мешал-
ками— выделяющиеся осадки остаются взмученными в щелоке,
но продукт содержит больше примесей79. Периодически корку,
образовавшуюся на стенке котла, растворяют развариванием ее
в воде.
Продолжительность выпарки щелока на разных заводах раз-
лична и зависит от концентрации поступающего на выпарку рас-
твора, размеров котла, температуры греющих газов и т. д.
При наличии специальной топки, при емкости котла 7—8 т готового
Сульфид натрия
489
продукта и при работе в две стадии с доливкой продукцион-
ного котла продолжительность одного цикла выпарки равна
35—40 ч.
На новых предприятиях предусмотрена выпарка крепкого ще-
лока до 50% Na2S в вакуум-выпарных аппаратах с выносной
греющей камерой и принудительной циркуляцией (с последующей
выпаркой до 65% в уварочных котлах). Наибольшее значение ко-
эффициента теплопередачи в вакуум-аппаратах /С = 1 000—
1100 ккал/(м2 чград) достигается при следующих условиях: ва-
куум в сепараторе г = 550—600 о рт. ст., температура греющего
пара tn = 127—128°, температура кипения щелока iK = 114—122°.
Если аппарат выполнен из углеродистой стали, то для замедления
коррозии лучше вести выпарку до 55% Na2S (при ta~ 138—143°,
г = 500—550 мм рт. ст. и tK = 123—130°, К, = 800—900 ккал! (м2- чХ
Хград). Опытами на модели вакуум-выпарного аппарата показана
возможность одностадийной упарки щелока от 30 до 65—72%
Na2S, что позволит отказаться от выпарных котлов; в качестве оп-
тимальных рекомендуются: /к = 164—167° (пар с избыточным да-
влением 6—6,5 ат), г = 500—550 мм рт. ст., tK = 145—152°, при этом
К=800—1000 ккалЦм2- ч-град). Существенной инкрустации грею-
щей поверхности не наблюдалось.80
Щелок, упаренный до 63—65% Na2S, разливают в барабаны из
кровельного железа, в которых он застывает (закристаллизовы-
вается) при естественном охлаждении в течение 24 ч в сплошную
монолитную массу, после чего крышки барабанов запаиваются.
Емкость барабана 160—170 кг продукта. Разливка щелока в бара-
баны производится через спускной штуцер по короткому сталь-
ному желобу или с помощью вертикального центробежного насоса,
смонтированного на одной оси с электромотором. Такой насос с
помощью тали опускают сверху в котел, погружают в жидкость и
выкачивают ее в разливной желоб.
Продукт — плавленый сернистый натрий — обычно содержит
63—68% Na2S, 3—5% Na2CO3, 0,5—1% Na2SO4, 0,5—1,5%
Na2S2O3+Na2SO3, 0,2—3% NaCl, 0,1—0,2% Al2O3 + Fe2O3, 0,3—
0,4% SiO2, 0,5—1,5% не растворимого в воде остатка (в том числе
до 1% углерода) и 20—30% Н2О. В отдельных случаях содержа-
ние соды в продукте может достигать 10%. Находящаяся в про-
дукте вода связана' с Na2S в виде кристаллогидрата Na2S-2H2O,
содержание которого достигает 90—95%.
Для получения более чистого сернистого натрия крепкий щелок
может быть подвергнут перед выпаркой обработке твердым пла-
вом (или раствором) сернистого бария. При этом щелок не только
очищается от примесей карбоната, сульфата, сульфита и тиосуль-
фата, образующих с BaS не растворимые в воде соли бария, но в
нем значительно повышается концентрация Na2S (за счет обра-
зующегося из BaS), что приводит к уменьшению количества
490
Г л. XIII. Соли сульфидного ряда
выпариваемой воды и соответствующему уменьшению расхода топ-
лива на выпарку.
Выход сернистого натрия по отношению к израсходованному
сульфату в цехах, оборудованных механическими печами периоди-
ческого действия с горячим выщелачиванием плава, составляет
75—80% от теоретического. Потери распределяются приблизитель-
но так: при шихтовке ~0,5%, от уноса пыли из печи ~ 1 %, от по-
бочных реакций при восстановлении 7—10%, при выщелачивании
и хранении щелоков 6—8%, со шламом из выщелачивателей за
счет недостаточной отмывки шлама 0,2—0,3%, с осадками солей
при выпарке 1—2%, при разливе готового продукта в барабаны и
другие механические потери 1,5—3%. При этом расходные коэффи-
циенты на 1 т стандартного продукта составляют: 1,35—1,5 т суль-
фата натрия (100% Na2SO4), 0,5—0,6 т реакционного угля
(7000 ккал), 0,3—0,4 т топлива (7000 ккал), 0,4—0,6 т пара, 3—7 ж3
воды, 100—200 кет • ч электроэнергии.
Затраты на сырье составляют ~50% себестоимости сернистого
натрия, в то время как энергетические затраты—15%, зарплата
с начислениями—13%, амортизация — 2% и цеховые расходы —
20%. Поэтому дальнейшее снижение себестоимости должно идти
главным образом по пути сокращения расхода сырья (уменьшение
потерь) и затрат на его перевозку81. Осуществление непрерывного
воссстановления сульфата натрия в сочетании с горячим выщела-
чиванием плава и возвратом избыточного угля в производственный
процесс может привести к дальнейшему снижению расходных ко-
эффициентов по сульфату и по реакционному углю45.
Технический сернистый натрий можно выпускать не только в
виде сплавленной монолитной массы, но и в виде мелких чешуек,
получаемых при срезании с наружной поверхности вращающегося
горизонтального барабана застывшего на ней слоя расплавленного
сернистого натрия. Ванна с расплавленным продуктом, в которую
опущена нижняя часть барабана, должна иметь температуру 110—
120°. Температура охлаждающей воды, подаваемой внутрь бара-
бана, 39—40°. Потери сернистого натрия в этом процессе незначи-
тельны (~0,1—0,2%).
Гранулированный сернистый натрий можно получить охлажде-
нием на бесконечной металлической ленте расплавленного техни-
ческого продукта, подаваемого на ленту в виде капель. Для уско-
рения затвердевания капель и сокращения длины ленты между
местами загрузки и выгрузки ленту можно обдувать воздухом.
В этом процессе потери сернистого натрия несколько больше, чем
при получении чешуйчатого продукта82.
При охлаждении крепкого щелока, содержащего 28—30% Na2S,
получаемого после выщелачивания плава, из него выделяются кри-
сталлы Na2S-9H2O, слегка окрашенные в желтый цвет примесью
сернистого железа. Прибавление к щелоку небольшого количества
Сульфид натрия 491
---------------------;------------------------------------------
цианистого натрия дает возможность получить прозрачные бес-
цветные кристаллы83. Те же результаты достигаются добавкой
цинкового купороса (10 г на 1л щелока) —сернистое железо бы-
стро осаждается вместе с сернистым цинком84. Кристаллический
сернистый натрий содержит в 2 раза меньше Na2S (31—32%), чем
плавленый, но он менее гигроскопичен.
Путем плавления кристаллов Na2S • 9Н2О при температуре выше
60° и выдерживания расплава при 5'0—55° можно получить кри-
сталлы Na2S-6H2O. Обезвоживание кристаллического сернистого
натрия (Na2S-9H2O) при 150° под вакуумом позволяет получить
продукт, содержащий 95—98% Na2S.
Безводный сернистый натрий получается путем восстановления
Na2SO4 водородом (см. ниже). Его можно также получать обра-
боткой при 600—850° соды или ее смеси с твердым едким натром,
сероводородом или сероокисью углерода в среде восстанавливаю-
щих газов.
Получение сульфида натрия восстановлением
сульфата натрия газами
Восстановление сульфата натрия не твердым углем, а газооб-
разными восстановителями (природным, генераторным и другими
газами) по суммарным реакциям
Na2SO4 4- СН4 = Na2S 4- СО2 4- 2Н2О
Na2SO4 4- 4СО = Na2S 4- 4СО2
Na2SO4 + 4Н2 = Na2S 4- 4Н2О
дает возможность сразу получать продукт, не загрязненный углем,
и устраняет необходимость громоздких операций по переработке
плава — выщелачивания, отделения шлама, выпаривания щелоков.
Помимо этого, газ является более дешевым восстановителем, чем
твердое топливо.
Выход Na2S при восстановлении сульфата натрия водородом и
водяным газом при 800° в течение 1 ч составляет ~85% от теоре-
тического. Восстановление окисью углерода идет медленнее, чем
водородом, а метаном еще медленнее85. Отсутствие конструкций
печей, в которых можно было бы осуществлять достаточно полное
восстановление газом жидкой реакционной массы — расплавленно-
го сульфата, затрудняло организацию этого процесса в заводских
масштабах. Восстановление сульфата натрия газами при низкой
температуре, исключающей возникновение жидкой фазы, протекает
сравнительно медленно86.
Из многих газовых восстановителей — окиси углерода, водо-
рода, метана, генераторного и природного газа — в настоящее вре-
мя для получения Na2S в промышленном масштабе используется
лишь водород. Это объясняется тем, что в присутствии примеси
492
Гл. XIII. Соли сульфидного ряда
небольших количеств катализаторов (меньше 0,2% соединений же-
леза, никеля, меди и др.) сульфат натрия восстанавливается водо-
родом в сернистый натрий при температурах более низких, чем
температуры плавления сульфата и его эвтектических смесей. Вос-
становление начинается при 500° и протекает с достаточной ско-
ростью при 600°, что позволяет избежать оплавление материала.
Получается безводный продукт, содержащий больше 95% Na2S,
называемый сульфиграном (сульфид гранулированный) 27’87. С по-
вышением содержания водяного пара в газе равновесие основной
реакции
Na2SO| + 4Н2 Na2S + Н2О
сдвигается влево и ее скорость резко уменьшается. При 20% НгО
в газе и 630° довести реакцию до конца невозможно. Кроме того,-
повышенное содержание водяного пара ускоряет побочную реак-:‘
цию, приводящую к потере серы в виде H2S: «
Na2S + 2Н2О 2NaOH + H2S .
Поэтому если осуществляется рециркуляция водорода, подавае-
мого в восстановительную печь в большом избытке, то по выходе
газа из печи водяной пар должен быть сконденсирован в процессе
рекуперации тепла (см. рис. 149).
Восстановление сульфата натрия природным газом или мета-
ном, вероятно, связано с диссоциацией последнего, происходящей
при высоких температурах (800—1000°). Разложение метана уско-
ряется в присутствии древесного угля, кокса, железа, никеля
и др. Выход Na2S при 600° незначительный, сильно возрастает
выше 750°, при 800° за 3 ч достигает ~88%, а при 850° — 95%. Бо-
лее высокая температура приводит к загрязнению продукта угле-
родом, выделяющимся при разложении метана, а более длитель-
ное нагревание —к образованию побочных продуктов. При восста-
новлении не выше 850° содержание углерода в продукте меньше
1 % 88’89.
Восстановление сульфата натрия окисью углерода начинается
около 700°, уже при 730° протекает со значительной скоростью, а
при 850° практически заканчивается в течение 25 мин. Процесс со-
провождается побочными реакциями, приводящими к образованию
соды и серы90:
3Na2SO4 + Na2S + 8СО = 4Na2CC>3 + 4СО2 + 4S
В присутствии водяного пара образование соды из побочного
процесса превращается в основной; восстановление окисью угле-
рода идет по реакции
Na2SO4 + 4СО + Н2О = Na2CO2 + ЗСО2 + H2S
Сульфид натрия
493
а восстановление полуводяным газом по реакциям
Na2SO4 + Н2 + ЗСО = Na2CQ3 + H2S + 2СО2
Na2SO4 + 2Н2 + 2СО = Na2CO3 + H2S + СО2 + Н2О
причем с увеличением парциального давления водяного пара пред-
отвращается плавление материала и ускоряется образование соды.
Полуводяной газ при 630° и рНгО“0,35 ат за 4 ч восстанавли-
вает сульфат на 97,2% с выходом Па2СОз 92,7%. Это послужило
Рис. 149. Схема производства сернистого натрия восстановлением суль-
фата натрия водородом во вращающейся печи:
/ — бункер для сульфата; 2 — печь с вращающимся подом для предварительной про-
калки сульфата; 5-пэчь для восстановления сульфата; 4 — циклон; 5 — теплообмен-
ник; 6 — скруббер с керамической насадкой для охлаждения газа и конденсации водяного
пара; 7 и 5 —скрубберы со стальной насадкой для поглощения H2S и осушки газа;
9 — газодувка; /0 —подогреватель водорода.
основанием для разработки метода получения соды восстановле-
нием сульфата натрия газами91-94.
Скорость восстановления сульфата натрия в сульфид газами
растет с увеличением расхода газа и дисперсности частиц Na2SO4,
а при относительно низких температурах также в присутствии ка-
тализаторов— при высоких температурах скорость реакции стано-
вится настолько большой, что роль катализаторов оказывается
несущественной. Однако, если относить скорость реакции не к еди-
нице поверхности раздела фаз, а ко всей массе сульфата, то уско-
рение реакции с повышением температуры идет лишь до некоторого
предела. По мере оплавления частиц реакционная поверхность
Уменьшается и процесс замедляется. Так, восстановление водородом'
пРи температурах выше 650° дает меньшие выходы- Na2S, чем
494
Гл. XIII. Соли сульфидного ряда
при более низкой температуре (полное восстановление при 650°
достигается лишь за 15 ч). Выше 800s наблюдается полное сплав-
ление реакционной массы. Предотвратить отрицательное влияние
плавления материала на ускорение процесса с повышением темпе-
ратуры можно, если в начале процесса поддерживать 600—610° и
повышать температуру до 700—710° только после того, как сте-
пень восстановления превысит ~50%, когда содержание Na2S в
реакционной смеси будет больше, чем в эвтектике (стр. 472), и
температура плавления начнет возрастать. Таким способом за 8 ч
можно получить продукт, содержащий 96% Паг5 85. Уменьшение
оплавления материала достигается также при предварительном
гранулировании или брикетировании сульфата. Предложено до-
бавлять к сульфату натриевую соль алифатической кислоты с
целью осуществления процесса во вращающейся печи без спека-
ния с получением зерненого продукта95.
Изучено восстановление брикетов сульфата натрия газами пи-
ролиза нефти в стационарном и в псевдоожиженном слое’. В усло-
виях восстановления сульфатных брикетов при 700—725° в шахт-
ной печи основными восстановителями в этих газах являются водо-
род и олефины. Парафиновые углеводороды участвуют в восста-
новлении в меньшей степени. В присутствии соединений железа
скорость восстановления увеличивается 96.
При промышленном восстановлении сульфата натрия водоро-
дом в качестве катализатора используют обычно железо. При со-
держании в сульфате всего лишь 0,07—0,08% Fe скорость процесс#
уже достаточно велика при 600—650°87. Для равномерного распре-
деления катализатора его следует вводить в сульфат в виде вод-1
ного раствора какой-либо соли, например, FeSO4.
Предложено также получать сульфат, легко восстанавливае-1
мый водородом при 700° во вращающейся печи, смачиванием смеси!
сульфата с колчеданным огарком 35%-ной серной кислотой (1,5 ка
огарка и 20.кв кислоты на 100 т сульфата) и последующим брике-
тированием97.
На рис. 149 показана принципиальная схема производства сер-
нистого натрия восстановлением сульфата натрия водородом на
заводе в Леверкузене98. Восстановление осуществляется в горизон-
тальной вращающейся (1 об/мин) печи длиной 20 л с наружным
диаметром барабана 3,1 м. Концы барабана имеют форму усечен-
ных конусов с диаметром малых оснований 1,6 м, что обеспечиваем
толщину слоя перемещающегося в печи материала 0,75 м. Печы
футерована шамотным кирпичом по слою теплоизоляции из стек!
лянной ваты. Герметичное уплотнение между барабаном и непод!
рижными головками печи достигается с помощью лабиринтов, за!
Полненных под давлением вязкой (хлорнафталиновой) смазкой!
Загрузка и выгрузка материала из печи производится с помощью!
торцовых шнеков. Сульфат натрия из сульфатных печей, размоло!
Сульфид натрия
495
тый до тонкости 1—2 мм, для освобождения от серной кислоты об-
рабатывается небольшим количеством сульфита натрия и для
окончательного удаления H2SO4 прокаливается при 600° в обогре-
ваемых коксовым газом печах с вращающимся подом. Затем он
с температурой 400—450° поступает в восстановительную печь. Ка-
тализатор— пыль из электрофильтров колчеданных печей — добав-
ляется в сульфат перед прокалкой. Водород, поступающий из про-
изводства хлора, подается в восстановительную печь нагретым до.
820° в трубчатом подогревателе из жароупорной стали, где сжи-
гается коксовый газ. Количество водорода (720 м3/ч) в 6—8 раз
превышает теоретическое. Газ, выходящий из печи, очищают в ци-
клоне от сульфатной пыли, возвращаемой в прокалочную печь, и
охлаждают в теплообменниках с 530 до 150—170°, затем для даль-
нейшего охлаждения и конденсации водяного пара промывают хо-
лодной водой, а для поглощения H2S и осушки 35 и 50% раство-
рами NaOH. После этого вместе со свежим водородом циркули-
рующий водород через теплообменники (в которых подогревается
до 400°) и через нагреватель возвращается в печь. В системе под-
держивается избыточное давление в несколько сотых долей ат.
Сернистый натрий выходит из печи в виде кусков 10—15 см с тем-
пературой 750° и охлаждается в стальном барабане, а затем в
шнеке с водяной рубашкой. В этих аппаратах и в элеваторе между
ними продукт находится в атмосфере азота. Затем перед тариро-
ванием его измельчают в молотковой дробилке до размера кусков
5 мм. Готовый сульфигран содержит 95% Na2S, 2% Fe2O3, 0,5—1%
Na2CO3, 1% NaCl и 1—1,5% Na2S2O3 и Na2SO3. На 1 т сульфи-
граиа (в пересчете на 98% Na2S) расходуют 1,85 т сульфата нат-
рия, 1350 м3 водорода, 820 кет ч электроэнергии и ~ 1300 м3 коксо-
вого (или генераторного) газа.
На другом заводе (в Вольфене) восстановление сульфата нат-
рия водородом производят в шахтных печах 45-89’97. Горячий суль-
фат из механических сульфатных печей охлаждается в холодиль-
нике до 40—50°, а затем в наклонном шнеке, где он смачивается
водой (3—4%); после этого его брикетируют. Сульфат должен со-
держать 0,2—0,3% Fe. Брикеты овальной формы размером 40—
50 мм с плотностью 1,8—2 г/сж3 для усиления прочности вылежи-
ваются на складе 24 ч. Затем через сито для отсева мелочи и пыли
брикеты поступают в отапливаемую генераторным газом наклон-
ную вращающуюся печь, где нагреваются до 550—600°, причем из
них удаляется влага, а содержание NaCl за счет реакции с H2SO4
(бисульфатом) снижается до 0,1% (большее содержание NaCl не-
желательно). Нагретые брикеты поступают через питатель в шахт-
ную восстановительную печь производительностью 7—8 т сульфи-
гРана в сутки. Шахта печи цилиндрической формы футерована
Шамотом. Между футеровкой и стальным кожухом кизельгуровая
изоляция. Шахта разделена вертикальной шамотной стойкой на
496
Гл. XIII. Соли сульфидного ряда
три вертикальные секции, к каждой из которых подводится водо-^Н
род. Водород поступает с хлорного завода; он подогревается до^Н
400° в теплообменниках за счет тепла уходящего из печи газа, а^Н
затем до 700—710° в электрическом подогревателе, в котором со-^Н
противлением служат графитовые шары диаметром 40 мм. Подо-^И
греватель представляет собой футерованную камеру с электро-^Н
дами, присоединенными к однофазному трансформатору (6000
60 б). Водород, выходящий из печи с температурой 560°, очищается^И
от сульфатной пыли в циклоне, охлаждается в теплообменниках до^Н
~150°, затем в водяном скруббере до 25—30°, где освобождается^И
от основной массы водяного пара. После этого, вместе со свежей^И:
долей водорода, с помощью компрессора газ возвращается в цикл.^И
Он должен содержать не меньше 97% Н2 и не больше 30 г водя-^И
ного пара в 1 м3; количество проходящего через печь водорода в^Н
5 раз больше теоретического. Выгрузка сернистого натрия из печи^П
производится с помощью вращающегося стола (1 об/ч). Продуктов
представляет собой гранулы серо-коричневого цвета и содержится
96—97% Na2S, 0,4% Na2S2O3, 0,7% Na2SO3, 0,36% NaHS, 0,4%И
Na2CO3, 0,4—0,6% Fe2O3, 1,4% нерастворимых веществ. На 1 т про-^И
дукта расходуется 1,9 т сульфата натрия, 1320 м3 водорода, 720
генераторного газа, ~ 1000 квт-ч электроэнергии, 60 м3 воды (по^Н
другим данным, 15 л3) и 15 чел.-часов рабсилы.
Недостатком этой схемы является необходимость гранулирова-^И
ния сульфата натрия, что, помимо затрат на этот процесс, приво-^Н
дит к уменьшению реакционной поверхности материала, к замед-^И
лению восстановления (продолжительность пребывания материалами
в печи достигает 20 ч) и увеличению необходимых размеров печи.^И
Восстановление сульфата газами может быть значительно^И
интенсифицировано и усовершенствовано при осуществлении егс^И
в циклонных печах", а также в печах со взвешенным слоем^И
(рис. 150). Здесь можно подвергать восстановлению сульфат
.размерами зерен меньше 2 мм. Имеется много предложений по^Н
осуществлению восстановления сульфата натрия во взвешенном^И1
слое, направленных главным образом к предотвращению агломе-^И
рации частиц 45’100-105. Так, например, для этого предложено
реакционное пространство, заполненное в основном сульфидом^И
натрия, вводить сульфат в таком количестве, чтобы его содержа-^И.
ние в массе составляло 5—10%. Это позволяет вести процесс без^И
спекания частиц при постоянной и оптимальной температуре, пре-^И
вышающей эвтектическую, находящейся в пределах 675—750‘^И
(в зависимости от вида катализатора). При размере зерен суль-^И
фата 0,2—0,3 мм в присутствии 1% железного катализатора, дли-^Н
дельность восстановления водородом составляет 8 мин. Рекомен-^И
дуют поддерживать температуру стенок печи ниже или равно$^И
температуре реакционной смеси, чтобы исключить частичное шлако-^Н
вание, особенно на стенках. Это достигается подачей в печь суль-^И
Сульфид натрия
497
фата и газа, предварительно нагретых до температуры, превы-
шающей реакционную.
Одним из существенных преимуществ восстановления суль-
фата натрия водородом является прямое получение продукта с со-
держанием 96—98% Na2S без необходимости производить перера-
ботку плава, дающую к тому же продукт, содержащий только 65%
Na2S, перевозка которого требует повышенных транспортных рас-
ходов. Однако этот способ имеет и недостатки: большой расход
водорода; необходимость организации установки для получения
Рис. 150. Принципиальная схема производства сернистого натрия
восстановлением сульфата натрия во взвешенном слое:
J — бункер для сульфата; 2—автоматический питатель сульфата; 3 — шнек;
4 — реактор-восстановительная печь со взвешенным слоем сульфата; 5 — холо-
дильный барабан для охлаждения сернистого натрия; 6 — газовый теплообмен-
ник; 7 — электрофильтр для улавливания пыли, уносимой водородом из реактора;
8 — водяной скруббер для охлаждения водорода и конденсации водяного пара;
9 — скруббер для отмывки водорода от H2S; /0 —газодувка; 11 — нагреватель
водорода.
азота, требующегося для промывки аппаратуры перед пуском и
остановкой, во избежание образования гремучей смеси; необходи-
мость применения сульфата, не содержащего хлористого натрия
(понижающего температуру появления жидкой фазы в системе
Na2SO4—Na2S). В связи с большой стоимостью водорода использо-
вание этого способа рационально пока лишь в районах с избыточ-
ным балансом водорода, особенно при наличии там природного
сульфата.
Более перспективным, и потому заслуживающим дальнейшей
разработки и производственного освоения, является восстановле-
ние сульфата натрия природным газом и газами, содержащими
СО — отходящими из производств фосфора, карбида кальция
и др., — а также коксовым газом. Помимо того, что эти газы де-
шевле водорода, а вернее, именно поэтому, можно не возвращать
В цикл непрореагировавшую часть газа, а использовать ее в каче-
стве топлива; это значительно упростит технологическую схему и
снизит капитальные и эксплуатационные затраты.
498
Гл. XIII. Соли сульфидного ряда
Другие способы получения сульфида натрия
Сравнительно малые количества сернистого натрия полу-
чаются не восстановлением сульфата натрия, а другими способами.
При улавливании раствором едкого натра отбросного сероводо-
рода 106'107, получающегося, например, при производстве хлори-
стого бария, сероуглерода, при очистке нефти, или сероводорода,,
извлеченного из коксового и других промышленных газов, обра-
зуется гидросульфид натрия (см. ниже) или сернистый натрий по
реакции:
2NaOH + H2S = Na2S + 2Н2О
Вместо едкого натра для поглощения сероводорода можно
пользоваться известковым молоком с примесью соды:
Na2CO3 + Са(ОН)2 + H2S = Na2S + СаСО, + 2Н2О
Сернистый натрий получается при сливании растворов гидро-
сульфида и едкого натра:
NaHS + NaOH = Na2S + Н2О
Na2S получается также путем переработки содержащих CaS
отвалов, образующихся в производстве соды из сульфата натрия,
известняка и угля или в производстве хлористого бария хлоркаль-
циевым методом. При разваривании этих отвалов в растворе, со-
держащем соду и сульфат натрия, происходит гидролиз CaS по
уравнению:
2CaS + 2Н2О = Ca(HS)2 4- Са(ОН)2
Са(ОН)2 каустифицирует соду по реакции:
Са(ОН)2 + Na2CO, = 2NaOH + СаСО,
а в результате реакции
Ca(HS)2 + Na2SO4 = CaSO4 + 2NaHS
получается гидросульфид натрия, образующий с едким натром
Na2S. Общее уравнение процесса имеет вид:
2CaS + N а2СО3 + N a2SO4 — CaSO4 + CaCOs + 2N a2S
Полученный раствор сернистого натрия отделяют от осадков и
выпаривают.
Предложено производить Na2S одновременно с сульфитом нат-
рия взаимодействием серы с кипящим 50% раствором едкого на-
тра. Нагревание продолжают пока температура кипения раствора
не достигнет 1лг>—150°. При этом Na2S остается в растворе, а суль-
фит натрия выделяется в твердом виде и после охлаждения смеси
до 120—110° Na2SOa отделяют центрифугированием. Затем раствор
охлаждают до 20—25°, отделяют выделившийся кристаллический
сернистый натрий, а маточный раствор возвращают в процесс103.
Гидросульфид натрия
499
Так как восстановление сернокислого бария в промышленных
условиях осуществляется с меньшими трудностями, чем восстано-
вление сернокислого натрия, то сернистый натрий можно получать
обработкой плава сернистого бария раствором сернокислого нат-
рия по реакции:
BaS + Na2SO< = BaSO< + Na2S
Осадок сернокислого бария, отделенный от раствора Na2S, мо-
жет быть вновь возвращен на восстановление10э. Сернистый нат-
рий получают также в качестве побочного продукта при производ-
стве углекислого бария по реакции:
BaS + Na2CO3 = Na2S + ВаСО3
Раствор Na2S, остающийся после отделения осадка ВаСОз, вы-
паривают.
При обработке смеси поваренной соли с углем концентрирован-
ной серной кислотой в механических муфельных сульфатных печах
или в пламенных печах при 650° получается плав, содержащий
больше 60—62% Na2S 11 °. Процесс идет по схеме:
2NaCl + 2С + H2SO4 = 2НС1 + Na2S + 2СО2
Здесь совмещаются две реакции: образование сульфата натрия
и хлористого водорода и восстановление сульфата углем. Таким
образом, можно получать сернистый натрий непосредственно из
поваренной соли, минуя стадию предварительного производства
сульфата. Выделившийся при этом хлористый водород, как и при
получении сульфата, поглощается водой с образованием соляной
кислоты.
Описано получение Na2S, основанное на разложении амаль-
гамы натрия, образующейся при электролизе поваренной соли с
ртутным катодом, раствором полисульфида натрия или серой по
реакциям:
6Na + Na2S4 = 4Na2S; 2Na + S = Na2S
При обработке амальгамы, содержащей 0,2% Na, раствором
состава: 10—11% Na2S и 11 —12% полисульфидной серы, полу-
чается раствор, содержащий 29—30% Na2S и 0,2—0,3% Na2S2C>8,
который без дальнейшей переработки используют в производстве
красителей93.
ГИДРОСУЛЬФИД НАТРИЯ
Гидросульфид натрия получают улавливанием сероводорода
при промывке содержащих сероводород промышленных газов рас-
твором едкого натра8
H2S + NaOH = NaHS + НаО
SOO Г л. XIII. Соли сульфидного ряда
или раствором сернистого натрия;
H2S + Na2S = 2NaHS
Промывку содержащих сероводород газов производят в баш-
нях с насадкой, орошаемой сверху поглощающим раствором.
Концентрация сероводорода в промываемом газе не имеет боль-
шого значения. От нее зависят размеры абсорбционной башни. Что
касается конечной концентрации получаемого раствора гидросуль-
фида, то при рециркуляции поглощаемого раствора она мало за-
висит от концентрации H2S в газе. Это позволяет улавливать серо-
водород из газов, содержащих десятые доли процента H2S, и полу-
чать при этом растворы, содержащие до 30% NaHS. Если, однако,
промываемые газы содержат много влаги, а концентрация серово-
дорода в них невелика, то это ведет к значительному разбавлению
раствора конденсирующейся из газа водой.
При поглощении щелочью сероводорода из промышленных га-
зов (например, из коксового газа) из них вымываются и некоторые
другие примеси, загрязняющие раствор, в частности цианистые
соединения
HCN + NaOH = NaCN + Н2@
и сероуглерод:
CS2 + 2NaHS = Na2CS3 4- H2S
Na2CS3 +3H2O = Na2CO3 + 3H2S
При содержании в газах кислорода растворы легко окисляются
2NaHS + 2О2 = Na2S2O3 4- Н2О
а цианистые соединения переходят в роданистые:
2NaCN + 2H2S + О2 = 2Na \CS + 2Н2О
Промышленные газы, из которых улавливается сероводород,
обычно содержат СО2, а технический едкий натр — соду. Поэтому
растворы гидросульфида, получаемые промывкой газов раствором
едкого натра, содержат некоторое количество NaHCO3. Раствор
гидросульфида, не содержащий бикарбоната, может быть получен,
если вести поглощение сероводорода известковым молоком по ре-
акции
Са(ОН}2 + 2H2S = Ca(HS)2 + 2Н2О
с последующим обменным разложением содой:
Ca(HS)2 + Na2CO3 = 2NaHS 4- СаСО3
При этом содержащаяся в газе двуокись углерода связывается
известью.
При поглощении сероводорода известковым молоком можно по-
лучить почти насыщенный раствор гидросульфида кальция, кото-
рый в ряде случаев может с успехом применяться вместо гидро-
Полисульфиды
501
сульфида натрия. При обработке этого раствора сухой содой полу-
чаются растворы, содержащие до 385 г/л NaHS.
Более концентрированный продукт, содержащий свыше 50%
NaHS, получается при действии сероводорода на твердый плавле-
ный сернистый натрий при 80—90°. При этом масса плавится и
образуется раствор гидросульфида.
Описано111 получение гидросульфида действием серной кислоты
на Na2S по реакции:
2Na2S + H2SO4 = 2NaHS + Na2SO4
Гидросульфид и сульфид натрия содержатся в щелоках — отхо-
дах нефтеперерабатывающих заводов. Перед сбросом эти щелоки
необходимо обезвреживать. Разработан метод регенерации NaOH
из этих щелоков с выделением из них серы с помощью окисли-
теля— двуокиси марганца по реакциям:
NaHS + МпО2 = NaOH + МпО + S
Na2S + МпО2 + Н2О = 2NaOH + МпО + S
При отношении Na2S : Мп2О, равном 1 : 2,5, и 30° процесс за-
вершается за 2 ч. Из отработанной марганцовой руды серу можно
извлечь перегретым паром или органическим экстрагентом112.
Растворы NaHS используют для получения чистого сероводо-
рода по реакции:
2NaHS + H2SO4 = Na2SO4 + 2H2S
Разложение раствора NaHS можно производить стехиометриче-
ским количеством серной кислоты с доведением pH отработанного
раствора до 8—3. Процесс сопровождается выделением неболь-
шого количества элементарной серы (до 3%), причем, чем выше
pH, тем меньше выделяется серы113.
ПОЛИСУЛЬФИДЫ
Полисульфиды натрия, вследствие сильной гигроскопичности их
кристаллов, обычно производят и применяют в виде растворов,,
имеющих желто-бурый цвет. Их можно получать разными спосо-
бами114; наиболее распространенным является растворение тонко-
измельченной серы (серного цвета) в растворе щелочи:
6NaOH + 2nS = 2Na2Sra_] + Na2S2O3 + 3H2O
Во избежание окисления нагревание суспензии серы в растворе
Щелочи можно вести в атмосфере азота. Образующиеся полисуль-
фиды содержат от 2 до 4,5 атомов серы. Присутствие тиосульфата
натрия обычно не мешает использованию полисульфидного рас-
твора, в частности и в процессах полимеризации. Если полисуль-
фидный раствор предназначен для использования в качестве
802
Гл. XIII. Соли сульфидного ряда
инсектофунгицида, его готовят 8—10-кратным разбавлением водой;
суспензии, полученной из серы и 20% раствора NaOH, взятых в вв*$'
совом соотношении 0,35: 1.
Дисульфид натрия можно получить взаимодействием серы с го?
рячим раствором сернистого натрия
N 02S Т S ® Ыа2§2 1
или с раствором, содержащим NaOH и NaHS:
NaOH + NaHS + S> NajSj 4- H2O
Получаемые этими способами растворы содержат дисульфид
или дисульфид и сульфид натрия; они получаются быстрее, чем
при разварке элементарной серы в растворе едкого натра, требую-
щей длительного кипячения суспензии.
Чистые полисульфиды натрия получают из элементов:
2Na + 2S = НагЗг
В качестве реакционной среды используют спирт или жидкий
аммиак и6.
Полисульфиды калия (и твердые полисульфиды натрия) полу-
чают сплавлением серы с углекислым калием (или содой). Полу-
чаемая «серная печень» имеет вид комьев желто-бурого цвета. Она
хорошо растворима в воде, и поэтому ее иногда называют «раство-
римой серой».
Полисульфиды кальция изготовляют продолжительным кипя-
чением тонконзмельченной серы в известковом молоке. Весовой
состав суспензии — S : СаО : Н2О= 10 : 5 : 85. Полученный раствор
отстаивается от осадка извести и применяется под названием изве-
стково-серного отвара. В его состав входят тетрасульфид и пен-
тасульфид кальция,5. Сухие препараты полисульфндов кальция
получают выпариванием концентрированного известково-серного.
•отвара, добавляя к нему в качестве стабилизатора сахар16, или
сушкой отвара в распылительной сушилке. Эти препараты содер-
жат 64—67% полисульфидов кальция, 23—28% CaSgOg, 5—11% S
й 0,3—1,1 % СаСОз. О полисульфидах бария (сольбаре) см. стр. 421.
ЛИТЕРАТУРА
1. Минералы СССР, т. II, под редакцией А. Г. Бетехтииа, Изд. АН
•СССР, 1940. — 2. Е. J. Kohemeyer, G. Lohrke, Z. anorg. Chem., B281,
H. 1-2 (1956).— 3. С. А. Щ укарев, E. M. Киреева - Тузул ахова, ЖОХ,
1, № 8—9, 1126 (1931). — 4. Д. В. Безуглый, Ф. М. Куца ко в, ЖХП, № 8,
37 (1939). — 5. В. М. О р а т о в с к и й, А. М. Г а м о л ь с к и й, Н. Н. К л и м е н-
-К о, ЖПХ, 37, № 11, 2392 (1964). — 6. Д. М. Гинзбург, Н. С. П и к у л и и а,
В. П. Литвин, ЖПХ, Там же. 38, № 9, 2117 (1965); 39, № 10, 2371 (1966).—
7. М С. Литвиненко, М. Б. Хват, Н. А. Гуревич, Кокс и химия, № 8,
4>1 (1965).—8. В. М. Р а м м, Абсорбционные процессы в химической промыш-
Литература
503
ленности, Госхимиздат, 1951, стр. 255. — 9. №.. С. Литвиненко, С. П. Лун-
дин, ЖПХ, 29, № 4, 543 (1956). —/0. М. С. Литвиненко, Там же, 25, № 5,
516 (1952).
11. М. С. Литвиненко, Там же, 25, № 7, 696 (1952). — 12. Е. S с h u 1 е к,
Е. Kords, L. Maros, Acta chim. Acad. Sci. Hung., 10, № 1—3, 291 (1956).—
13. G. R. Levi, V. Riga nt i, Ann. chimica, 46, № 1—3, 174 (1956).—
14. И. Л. Багбанлы, M. M. Гуревич, А. К. M и ска p л и, Труды Инсти-
тута химии АН АзССР, в. 13, 1954, стр. 114. — 15. А. Л. Ефимов, Химический
метод борьбы с вредителями и болезнями сельскохозяйственных растений, Сель-
хозгиз, 1949. — 16. Д. Фри р, Химия инсектисидов и фунгисидов, ИЛ, 1948. —
17. П. П. Будников, М. И. Н е к р и ч, Хим. пром., № 7, 18 (1955).—
18. F. Foerster, К. Kubel, Z. anorg. Chem., 139, 261 (1924).— 19. А. П. Бун-
тин, Т. М. Сосинатров, Труды Хим.-металлург, ин-та, Зап.-Сиб. филиала
АН СССР, № 5, 1951, стр. 57. — 20. А. Б. Бе кт у ров, В. В. Тихонов, Труды
Ин-та хим. наук АН КазССР, т. 1, 1957, стр. 20.
21. В. А. Никитин, Т. И. Кунин, Журн. ВХО, 5, № 3, 350 (1960).—
22. Н. Н. Севрюков, Е. М Сергиевская, ЖПХ, № 1, 54 (1961).—
23. А. А. Фотиев, Там же, 35, № II, 2402 (1962).—24. С. J. Nyman,
Т. D. O’Brien, Ind. Eng. Chem., 39, № 8, 1019 (1947). — 25. T. И. Кунин,
В. А. Никитин, Изв. вузов. Хим. и хим. технол., № 5, 61 (1958).—
26. В. И. М и н а е в, Изв. Томск, технол ин-та, 44, в. 1, 11 (1923).— 27. Е. А. III и-
лов, П П. Будников, Изв. Ив.-Вознесенск. политехи, ин-та, 10, 57 (1927).—
28. П. П. Будников, А. Н. Сысоев, Укр. xiM. ж., 3, № 2, 113 (1928).—
29. П. П. Будников, ДАН СССР, 1, № 6, 330 (1934).— 30. С. К. Чирков,
ЖХП, № 6, 9 (1938).
31. А. А. Порет, Труды ГИПХ, в. 35, 1941, стр. 22.—32. М. Е. П о з и н.
Хим. пром., № 12, 10 (1944).—33. А. Г. Репа, Е. П. Данильченко, ЖПХ,
24, № 1, 20 (1951).—34. А. П. Б у н т и н, Т. М. Сосипатров, Труды Хим.-
металлург. ин-та Зап.-Сиб. филиала АН СССР, № 8, 1954, стр. 39.— 35. Р. В. М и-
ролюбов, Ф. А. Кульков, М. А. Серебренникова, Хим. пром., № 7,
206 (1950). — 36. Н. П. Диев, А. И. Окунев, В. В. Падучев, В. В. Топо-
рова, В. С. Мокроносо в, ДАН СССР, 107, № 2, 273 (1956).—
37. Н. С. Лапшии, Хим. пром., № 4, 122 (1951). — 38. 3. С. Банных,
Е. М. Полякова, Труды УНИХИМ, в. 4, 1957, стр. 64. — 39. Т. И. Кунин,
В. А. Никитин, Труды ИХТИ, в. 5, 1956, стр. 85; в. 7, 1958, стр. 61.—
40. Б. В. Федосеев, К. Л. Добрусин, Л. И. Шапиро, Хим. пром., № 12,
377 (1949).
41. С. В. Глебов, Труды ГИПХ, в. 35, 1941, стр. 52,— 42. П. П. Будни-
ков. В. И. Ендовицкий, ДАН УССР, № 4 , 35 (1940).—43. Н. С. Лап-
шин, Хим. пром., № 7, 16 (1948).—44. Л. В. Юманова, М. С. Герман д-
зе. Труды УНИХИМ, в. 2, 1954, стр. 187.—45. К. И. Макарьин, Труды
Московск. и-нж.-экон. ин-та, в. 1, 1954, стр. 83. — 46. В. П. Филиппов.
И. М. Вейсбаид, Хим. наука и пром., 2, № 6, 752 (1957). — 47. М. Е. П о-
зин, Технология минеральных удобрений и солей, Госхимиздат, 1957, гл. XI.—
48. И. Шейнберг, Химстрой. № 7, 207 (1929). — 49. П. В. Дыбина, Тех-
нология минеральных солей, Госхлмиздат, 1949.—50. И. М. Вассерман,
Производство минеральных солей, Госхимиздат. 1962.
51. Л. О. Черкасский, Сернистый натр, Свердловск, 1931.—52. А. Н. По-
ном а р е в, Хим. пром., № 5, 146 (1949). — 53. Н. Н. Ч ер ейская. Там же,
7, 193 (1951). — 54. М. Д. Либерман, Тезисы докладов на отраслевом
совещании работников основной и горнохимической промышленности, 1958,
стр. 129 —55. Г. Я. Тарасов, А. С. Изотова, ЖПХ, 6, № 4, 673 (1933).—
??• G. А. Р i г s, Brit. Abs., 1, 410 (1946). — 57. Ю. П. Никольская, Труды
^им.-металлург. ин-та Зап.-Сиб. филиал АН СССР, в. 1, хим., 1949, стр. 61. —
J- F. White, А. Н. White, Ind. Eng. Chem., 28, № 2, 244 (1936).—
504 Гл. XIII. Соли сульфидного ряда
69. О. И. Пудовкина, Тезисы докладов иа отраслевом совещании работни-
ков основной и горнохимической промышленности, 1958, стр. 127; О. И. Пудов-
кина и др., Труды УНИХИМ, в. 7, 1958, стр. 87, 91.—60. И. П. Щербак
и др., авт. свид. 194066, 1965.
61. П. В. Бурдуков, Цветные металлы, № 1, 47 (1951). — 62. В. Ф. В о л-
кови др., Хим. пром., № 9, 687 (1967). — 63. Т. И. Кунин, В. А. Никитин,
Изв. вузов. Хим. и хим. технол., 1, № 3, 93; № 5, 61 (1958); 3, № 2, 324 (I960);
Труды Ивановского хим.-технол. ин-та, в. 5, 1956, стр. 85; в. 7, стр. 61 и 64. —
64. В. П. Ильинский, Г. Я. Тарасов, О. Я. К а л а н и, Труды ГИПХ,
в. 16, 1932, стр. 89. — 65. В. П. Ильинский, Труды соляной лаборатории
АН СССР, в. 2, 1932.—66. Ф. А. Кульков, Тезисы докладов на отраслевом
совещании работников основной и горнохимической промышленности, 1958,
стр. 125. — 67. В. Г. Б р е к с о н, Труды УНИХИМ, в. 14, 1967, стр. 87; сб.
«Циклонные энерготехнологические процессы и установки», изд. ЦНИИинформ.
Мин. цвет, мет., 1967, стр. 264. — 68. Л. Черкасский, Техник на производ-
стве, № 14, 140 (1932). — 69. В. Заболоцкий, Б. П. Полетаев, Труды
Днепропетровск, химико-технол. ин-та, т. 2, в. 2, 1941, стр. 58. — 70. Б. А. Бе-
гремжанов, Г. Г. Пронина, Уч. зап. Казахск. ун-та, 22, 30 (1956).
71. Б. А. Б е р е м ж а н о в, Изв. АН КазССР. Сер. хим., в. 10, 104 (1956).—
72. А. И. Мун, Там же, в. 10, 22 (1956). — 73. Ф. А. Кульков. Е. М. Поля-
кова, Е. И. Толстикова, Труды УНИХИМ, в. 3, 1955, стр. 74.—
74. Т. И. Кунин, Н. С. Лапшин, В. А. Никитин, Труды ИХТИ, в. 7,
1958, стр. 64. — 75. Ю. П. Каретников, В. Н. Тарасова, К. П. Ж ид и-
-Л е в а, ЖПХ, 34, № 3. 682 (1961). — 76. А. И. Аккерман, Труды ГИПХ,
в. 35, 1941, стр. 60. — 77. Л. А. П о л у б о р ц е в а, А. А. Р е й ф е р. Т. М. М а н-
торова, И. Г. Воликов а, 3. Ф. Метрика, Хим. пром., № 3, 230 (1966).—
'78. S. N а к а у а, япон. пат. 1866, 1953. — 79. П. Михайленко, Н. Трилев,
Производство сернистого натрия, Химтеорет, 1933. — 80. Ю. С. Шмелев,
И. В. Костарева, Ф. И. Китаева Труды УНИХИМ. в. 19, 1967, стр. 84.
81. Н. Н. Черейская, Труды Московск. инж.-экон. ин-та, в. 1, 1954,
стр. 75. — 82. Т. И. Кунин, Н. С. Лапшин, Хим. пром., № 3, 9 (1948).—
83. И. Г. П о в а р н и и. Производство сернистого натра на малых установках,
Гизместпром, 1946. —84. Раб. химик, № 10, 14 (1934).— 85. В. П, Ильинский,
Г. Я. Тарасов, А. А, Гинзбург, Труды ГИПХ, в. 16, 1932, стр. 80.—
86. R. Ley, Chem. Ztg., № 85, 859 (1934).— 87. С. J. Nyman, T. D. O’Brien,
Ind. Eng. Chem., 39, № 8, 1019 (1947). — 88. Д. E. Д и о н и с ь е в, ЖПХ, 9, №8,
1378 (1936). — 89. А. И. Горбанев, В. Я. Николина, Сульфат натрия, Гос-
химиздат, 1954. — 90. Okuno, Masumi, Fukuyoma, J. Soc. Chem. Ind.,
Japan, 36, № 8. 466B (1933).
91. А. И. Горбанев, ЖПХ, 27, № 8, 804 (1954).— 92. А. И. Горбанев,
Лам же, 28, № 9, 921 (1954). — 93. А. И. Горбанев, Там же, № 10, 1033
(1954). — 94. В. В. Чичков, А. П. Шурыгин, Хим. пром., № 12. 898
(1965). — 95. К. Wintersberger, О. Kondela, пат. ФРГ 878197, 1953,—
96. В. Т. Кунин, В. А. Никитин, И. П. Кириллов, Изв. вузов. Хим. и
хим. технол., 8, № 6, 974 (1965); 9, № 4, 609 (1966); 10, № 7, 792 (1967)'. —
97. Zirngibl, пат. ГДР 6592. 1954. — 98 L’ind. chim., 36, № 379, 25 (1949).—
99. А. П. Шурыгин, В. В. Чичков, сб. «Циклонные энерготехнологические
-процессы», Цветметинформация, 1966. — 100. О. Kondela, К. Wintersber- ,
ger, пат. США 2719076, 1955.
101. Франц, пат. 1031456, 1954. — 102. Франц, пат. 1080224, 1954.—
103. Англ. пат. 738702, 1955. — 104. К. Wintersberger, G. Kondela, пат.
ФРГ 344605, 1956. — 105. Я. Циборовский, С. Вронский, ЖПХ, 32, №3,
-473 (1959). — 106. Г. Джамбо в, Г. Папуджиков, В. Николов а. Химия
и индустрия (болт.), 38, № 1, 31 (1966). — 107 L. Eckert, F. Wolf, М. Far-
kas, Chem. Techn., 18, № 5, 293 (1966). — 108. G. N. Terzi ev, пат. США
Литература 505
2705187, 1955. —109. В. Г!.. Ильинский, Г. С. Клебанов, Труды Соляной
лаборатории АН СССР, в. 2, 1932. — ПО. Ульященко, Раб. химик № 10
10 (1934).
111. С. Bandrowska, Przem. Chem., 45, № 5, 271 (1966). — 112. В С Пе-
телина, Б. А. Старцев, ЖПХ, 38, № 6, 1212 (1965). — 7/3. Т. Д. Авер-
бух, Н. П. Бакина, Л. И. Булычева, Труды УНИХИМ, в. 14, 1967,
стр. 137.— 114. Е. М. Fettes, J. S. J о г с z a k, Ind. Eng. Chem., 42, № 1Г
2217 (1950).—/75. D. М. Jost, Н. Russell, Systematic Inorganic Chemistry*
N. Y., 1944, p. 152. *
Глава XIV
СОЛИ СУЛЬФИТНОГО РЯДА
К солям сульфитного ряда относятся соли кислот, образован-
ных комплексными ионами: SO3- (и НЗОз-), S2O2~, 82Оз“,32О4-,
SzOs", 52ОГ, 5„ОГ, т. e. сернистой (сульфиты и бисульфиты), тио-
сернистой (тиосульфиты), серноватистой или тиосерной (тиосуль-
фаты), гидросернистой (гидросульфиты или дитиониты), пиросер-
нистой (пиросульфиты или метабисульфиты), дитионовой (дитио-
наты) и политионовых (политионаты).
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
При растворении SO2 в воде образуется сернистая кислота
H2SO3, которая в свободном состоянии выделена только в форме
кристаллогидрата H2SO3 • 6Н2О. Большинство ее средних солей,
сульфиты (за исключением сульфитов щелочных металлов), в воде
не растворимы. Бисульфиты устойчивы только в растворах; при их
выпаривании в твердую фазу выделяются пиросульфиты, вслед-
ствие равновесия такого типа: 2NaHSO3^Na2S2O5 + H2O. Пиросер-
нистая кислота H2S2O5 не получена. В сернистой кислоте и боль-
НО\
шинстве ее солей сера четырехвалентна ^S = O; допускают
но/
НО' zO
также существование в некоторых случаях структуры S"
н/ ^0
•с шестивалентной серой. Сульфиты являются сильными восстано-
вителями. В водных растворах ион SO2- окисляется даже кисло-
родом воздуха, но медленно: 230з + 02 -j2S0?~. Процесс этот
каталитический, сопровождающийся цепной реакцией; ничтожные
количества ионов тяжелых металлов резко ускоряют процесс, а
некоторые органические добавки (например, спирты) —замедляют.
Физико-химические свойства
507
Сульфиты присоединяют серу е образованием тиосульфатов:
§Оз~ + S = SjOl-. При действии на раствор тиосульфата кислотами
эта реакция идет в обратном направлении с выделением серы и
H2SO3, так как H2S2O3 в свободном состоянии неустойчива.
В ионе тиосульфата один атом серы шестивалентный, а другой
двухвалентный, чем объясняются сильные восстановительные свой-
ства тиосульфатов. Сильные окислители окисляют 520з~ до суль-
фата SOf, слабые — до тетратионата S4O1~. Так, например, иод
окисляет 520з“ до тетратионата в водном растворе при окисли-
тельном потенциале иода меньше 540 мв; в спирто-водных рас-
творах при потенциале иода, большем 540 мв, окисление идет
до сульфата и серы, а при потенциале иода больше 650 мв, когда
становится возможным окисление свободной серы, продуктом окис-
ления является только сульфат *.
При взаимодействии водных растворов SO2 и H2S происходит
образование тиосерной и политионовых кислот, причем первичным
продуктом, вероятно, является не полученная в свободном состоя-
нии тиосернистая кислота H2S2O2 Это взаимодействие можно
представить следующим рядом реакций:
SO2 + H2S = H2S2O2
SO2 + Н2О = H2SO3
H2S2O2 4- H2S » 3S + 2HjO
H2SO3 + S = H2S2O3
HjSjOj + 2H2SOj = H2S4O, + 2H2O
H2S4O6 + H2SO3 == H3S3Oe + H2S2O3
HsS4O„ + H2S = 2H2S,O3 + S
H2S2O2 + 2H2S2O3 == H2S8O6 + 2H2O
H2SgO3 = H2S8O8 + S и т. д.
При этом образуются политионовые кислоты H2SnO6 с п —
= 3—6. Ион дитионовой кислоты 520б- может быть получен окис-
лением водного раствора SO2, например, двуокисью марганца. По-
литионовые кислоты мало устойчивы, существуют только в рас-
творах в сильно диссоциированном виде, но образуют хорошо кри-
сталлизующиеся соли, легко растворимые в воде. В политионовых
кислотах атомы серы образуют цепочку НО—SO2—S—S—S—
—SO2—ОН; центральные атомы серы двухвалентные, поэтому поли-
тионаты легко окисляются. Политионовые кислоты (в частности,,
с п > 6) могут образовываться и в результате разложения не вы-
деленной В свободном СОСТОЯНИИ сульфоксиловой КИСЛОТЫ S(OH)2-
или H2SO2, играющей роль промежуточного продукта, например 2:
2H2SO2 H2S2O3 + Н2О
H2SO2 + 2H2S2O3 = H2S6®s + 2H2O
H2S5Oe + (n- 5)H2S2O3 H2S„Oe + (n - 5)H2SO, •
808
Гл. XIV. Соли сульфитного ряда
I
Гидросернистая кислота H2SO4 очень неустойчива; в водных
растворах идет реакция диспропорционирования:
2H2S2O4 + Н2О = 2H2SO3 + H2S2O3
Однако эта кислота образует достаточно устойчивые, но легко
окисляемые кристаллические соли — гидросульфиты.
Приведенные выше соображения о строении соединений суль-
фитного ряда вероятны, но не бесспорны; химическая структура
этих соединений окончательно не уста-
Рис. 151. Растворимость в си-
. стеме Na2SO3—Н2О.
новлена и, как и их свойства, является
предметом многочисленных исследова-
ний 3’4. Из соединений сульфитного
ряда наибольшее значение имеют
сульфит и бисульфит натрия, тиосуль-
фат и гидросульфит натрия, а также
ронгалит5.
Сульфит натрия кристаллизуется
из водных растворов ниже 33,4° в виде
Na2SO3-7H2O, а при более высоких
температурах — в безводной форме
(рис. 151). Давление водяного пара
в системе Na2SO3- 7H2O^Na2SO3+
+ 7Н2О (г.):
L °C...................15 20 25 30
Р, мм рт. ст. . . . 8,76 12,99 18,59 26,83
Насыщенный раствор бисульфита
натрия содержит при 15°—39,2, при
97,2° —49,1% Na2S2O5.
Сульфит аммония кристаллизуется
из водных растворов в форме моноги-
драта (NH4)2SO3 • Н2О. Температура
полной диссоциации сульфита аммо-
ния при 760 мм рт. ст. 160—180°. Пиросульфитом аммония
(NH4)2S2O5 насыщен раствор, содержащий при 20° 76%, при 60°
S6% NH4HSO3 (рис. 152, 153) 6->2.
Растворимость в воде MgSO3 при 23° равна 0,6%, а при содер-
жании в растворе 400 г/л Mg(HSO3)2 растворимость MgSO3 уве-
личивается до 1,6% (20 г/л)13. О растворимости в системах
MgSO3—MgSO4—Н2О, Mg(HSO3)2—MgSO4—Н2О и MgSO3—
J4g(HSO3)2—Н2О см. 14.
Сульфит кальция кристаллизуется из водного раствора в виде
CaSO3 • 0,5Н2О 15. Растворимость в воде при 18° равна 0,0043%.
Тиосульфат натрия Na2S2O3 • 5Н2О плавится при 48° и перехо-
дит в дигидрат Na2S2O3 • 2Н2О. Очень хорошо растворим в воде:
в насыщенном растворе при 0° 34,4%, при 100° 72,7% Na2S2O316-
Фивико-химичввкив свойства
609
Рис. 152. Растворимость в системе
(NH4)2SO8-NH4HSO8-H2O.
(nh4j2so8
(NHjaSOftSO 60 70 00 50 40 30 20 /Z?NH4HSOj
— (NH,)2SO4,%
i
Рис. 153. Изотерма 30° системы
(NH4)2SO3—NH4HSO3—(NH4)2SO4—H2O. (Концентрации даны
в вес. %; цифры на изогидрических линиях —содержание
воды в насыщенном растворе в % от веса сухих солей.)
810
Гл. XIV. Соли сульфитного ряда
В присутствии железа17 образуются окрашенные соединения —
комплексный ион [РеБгОзф, а также возможно [Fe(OH)2 • FeS2O3]2+.
Тиосульфат аммония (NFU^SzOs кристаллизуется в безводной
форме; насыщенный раствор содержит при —10° 60,3%, при 60°
69,4% (NH4)2S2O3. Сильно гигроскопичен (гигроскопическая точка
~64°/о). Концентрированные растворы выше 50° разлагаются с вы-
делением серы.
Гидросульфит (дитионит) натрия Na2S2O4 ниже 52° кристалли-
зуется в виде Na2S2O4 • 2Н2О. В форме кристаллогидрата и в вод-
ных растворах гидросульфит натрия в присутствии кислорода (воз-
духа) весьма неустойчив. При 0° насыщенный водный раствор
содержит 19,3%, при 60° — 29,4% Na2S2O4. С повышением темпера-
туры растворимость увеличивается, но точно она не установлена
вследствие разложения Na2S2O4. Добавка NaCl в количестве 25%
от веса насыщенного раствора понижает растворимость Na2S2O4
в 3 раза. Плотность технического гидросульфита 2,3—2,4 г!см\ на-
сыпная плотность 1,2 г/см3. При нагревании до 250° гидросульфит
натрия самовоспламеняется и горит.
Ронгалит (формальдегидсульфоксилат натрия) NaHSO2-
• СН2О-2Н2О — натриевая соль ронгалитовой кислоты, в свобод-
ном состоянии не существующей. При 63° плавится в кристаллиза-
ционной воде, выше 120° разлагается. В 1 л холодной воды рас-
творяется 500 г ронгалита.
ПРИМЕНЕНИЕ
Применение солей сульфитного ряда в разных отраслях техники
основано главным образом на их восстановительных свойствах.
Сульфит натрия применяют в кожевенной и в фото-кинопромыш-
ленности, в фармацевтической промышленности и в медицине,
а также во многих производствах химической промышленно-
сти, в частности в производстве искусственного волокна, являю-
щемся основным потребителем сульфита. Сульфит натрия исполь-
зуют в качестве реагента при флотации руд цветных металлов, в
аиилокрасочной и парфюмерной промышленности, при деаэрации
котловой воды 18 и в качестве добавки к цианистым электролитам
в гальванических ваннах 19. Бисульфит натрия применяют в коже-
венной промышленности, в пищевой промышленности в качестве
консервирующего средства, в текстильной промышленности при
белении и крашении тканей и т. п. Беление с помощью бисульфит-
ных растворов (или с помощью SO2, H2SO3) основано на присоеди-
нении SO2 или SO3~ к органическим красящим веществам с обра-
зованием бесцветных продуктов и применяется для материалов
(шерсти, шелка, соломы), разрушающихся при белении сильными
окислителями20. Бисульфит аммония используют в производстве
капролактама, в синтезе дубителей, для варки целлюлозы и др.
Применение
511
В бумажной промышленности для получения целлюлозы из
древесины по сульфитному способу применяют большие коли-
чества сульфитной кислоты — раствора бисульфита кальция
Ca(HSO3)2 с избытком SO2, получаемого взаимодействием SO2 с
известняком и водой. Обычно раствор содержит 2,7—3,5% SO2, из
них 52—65% в свободном состоянии, и 0,8—1,3% СаО. За грани-
цей наметились тенденции к замене в производстве целлюлозы би-
сульфита кальция бисульфитом аммония, что повышает произво-
дительность завода на ~ 10% вследствие увеличения выхода цел-
люлозы из древесины и сокращения продолжительности варки;
кроме того, улучшается качество целлюлозы и сокращается время
ее отбелки и расход белящих материалов. Бисульфит аммония ис-
пользуют также в качестве источника 100%-ного SO2. Растворы
сульфита и бисульфита аммония (а также натрия) могут быть
использованы как эффективные поглотители при очистке газов от
малых количеств сероводорода2I.
Пиросульфит натрия, называемый также метабисульфитом, при-
меняют для тех же целей, что и бисульфит натрия. Он является
эффективным консерватором зерна, зеленых кормов и кормовых
промышленных отходов.
Тиосульфат натрия часто неправильно называют гипосульфи-
том. Его применяют в фото-кинопромышленности в качестве закре-
пителя. В текстильной промышленности его используют для унич-
тожения остатков активного хлора после хлорного беления тканей
(и поэтому называют антихлором). Тиосульфат натрия используют
также в кожевенной промышленности, в медицине и ветеринарии,
в целлюлозно-бумажной, фармацевтической, химической промыш-
ленности.
Гидросульфит натрия применяют в текстильной промышлен-
ности и в пищевой — для обесцвечивания сахара, патоки и др,-
Ронгалит — сильный восстановитель. Его применяют для от-
белки шерстяных тканей, сахара, жиров, мыла и т. п. В текстиль-
ной промышленности с его помощью получают на тканях вытра-
вочные узоры. Он обесцвечивает почти все красители, не действуя
на волокно, в том числе и на хлопчатобумажное.
Требования к качеству технических продуктов, установленные
ГОСТами, приведены в табл. 38.
Сульфит, тиосульфат и пиросульфит натрия упаковывают в по-
лиэтиленовые мешки, помещаемые в фанерные, картонные бара-
баны или в деревянные бочки, или в многослойные бумажные
мешки; гидросульфит натрия — в герметически закрываемые же-
лезные барабаны, которые для предохранения от порчи вставляют
в фанерные барабаны.
Бисульфиты натрия и аммония выпускают в виде растворов,
окрашенных примесями в светло-желтый цвет. Раствор бисульфита
натрия должен содержать (ГОСТ 902—68) не менее 22,5% SO2,
512
Гл. XIV. Соли сульфитного ряда
Требования к качеству сульфитных солей (содержание компонентов
натрия —68) техни- ческий ' * О 00 о 0,05 О.ООЗ3* вне 1 - 1 1 1
Тиосульфат (ГОСТ 244 фотографи- ческий 99.0—100,17* 0,04 0,002 3* 1 Отсутст 1 1 1
ульфит )ИЯ 246—67) , сорт 2 1Л 00 1,0 0,154* 0,4 1 IJ
ь. О и н & к О Э о сорт 1 8 0,5 0,14* 0,2 0,2
Сульфит натрия безводный (ГОСТ 5644—66) техни- ческий
фотогра фический СО'
<
кристалли ческий (ГОСТ 903—66) техни- ческий
фотографический ' £0
<
« to * ю »— О 1 1 1 1 i 1
5 • о о о
« «о % « ю ю о о о 1 1 1 1 ,0001 1
94 о о о
% СО ю 00 о о о S 1 1 1
:92 о о о" о о
О * ю сч о ©о* o’o' о* >> (М о о * ю СЧ 8 О* 1 1
% ю — О о о о ю о о 1 *9 100' 1 1
oi о о о о о
% *
♦ со ю 1 1 1 1 1
о о <м
% *
* ео о 0,02 0,005 0,6 1 о о 1 1 1
% %
* Ю ~ о о о СО 1 о 1 1 1
о о о'о о о
Основное ве- щество, не 1 менее . . . | Примеси, ие более не раствори-1 мые в воде железо . . щелочь в пересчете на 1 Na2CO3-10H2O из еч Л Z 1 сч со о сч (Z) тяжелые металлы . мыщьяк . цинк . . .
Сырье
513
связанного в виде NaHSO3, т. е. не менее 36,5% NaHSO3. Несвя-
занный SO2 должен отсутствовать. Содержание Na2SO3 (в пере-
счете на SO2) должно быть не больше 1,0%, соединений железа
(FeO)—не больше 0,01%. Плотность этого раствора 1,31 г/с-и3.,
Раствор бисульфита аммония содержит ~820 г!л NH4HSO4, плот-
ность его при 20° не более 1,35 г)см3, а кислотность в пересчете на
H2SO4 должна быть не меньше 3 г/л. Бисульфиты натрия и аммо-
ния перевозят в гуммированных цистернах, а также в стальных
цистернах и бочках.
В США выпускают22 разные сорта гидросульфитов и сульфо-
ксилатов: гидросульфит натрия, содержащий ~90% Na2S2O4 и не-
много стабилизатора — соды или Na2S2O3, гидросульфит натрия
с добавкой соды, смесь гидросульфита натрия с Na4P2O? в от-
ношении 2:1; формальдегид-сульфоксилат натрия (ронгалит),
Н-формальдегид-сульфоксилат цинка Zn(HSO2 • CN2O)2, Н-ацет-
альдегид-сульфоксилат цинка (дектролин) ZnSO2 • СН3СНО.
СЫРЬЕ
Основным сырьем для производства разнообразных солей суль-
фитного ряда является сернистый ангидрид, получаемый при об-
жиге серного колчедана, серы и других видов серного сырья. Газ,
отбираемый из колчеданных печей, содержит 7—12% SO2. Значи-
тельно более экономичным является использование отходящих га-
зов, содержащих SO2, в частности выхлопных газов из производ-
ства серной кислоты контактным методом, содержащих 0,3—0,8%
SO2. Основными компонентами этих газов являются азот и кисло-
род. Промывка их щелочными растворами, поглощающими SO2,
позволяет обезвреживать газы, выбрасываемые в атмосферу, и од-
новременно получать ценные продукты — сульфит, бисульфит нат-
рия и др. Возможно использование газов с любой концентрацией
S'O2, даже и очень малой, например получаемых при сжигании
топлив дымовых газов, содержащих десятые и даже сотые доли
процента SO2. Однако утилизация SO2 из отбросных газов цвет-
ной металлургии и работающих на твердом топливе электростан-
ций осложнена необходимостью охлаждения и особенно очистки
этих газов. Это не всегда оказывается экономичным и, например
в Англии, имеется несколько установок, на которых очищают ды-
мовые газы от SO2 известью или известняком, но получающиеся
растворы бисульфита кальция выбрасывают. В СССР известковый
способ был испытан для очистки дымовых газов электростанций 23.
Его рентабельность зависит от того, будет ли возможно рациональ-
ное использование, например для строительных целей или в про-
изводстве целлюлозы24, получающегося шлама, состоящего из
CaSO3 • 0,5Н2О, CaSO4-2H2O и золы и содержащего 50% влаги.
Водные суспензии некоторых сортов известняков с размерами
17 М. Е. Позии
514
Гл. XIV. Соли сульфитного ряда
частиц меньше 0,09 мм поглощают SO2 с такой же скоростью, как
известково-магнезиальное молоко. При размерах частиц ~0,2 мм
скорость абсорбции уменьшается на 10—15%. Доломитизирован-
ные известняки абсорбируют SO2 медленнее, так как СаСО3 • MgCO3
имеет меньшую реакционную способность по отношению к SO2,
чем СаСОз25.
Предложены и в разной степени разработаны многие методы
извлечения SO2 из газов с помощью абсорбентов — водных рас-
творов и суспензий химически активных поглотителей, таких как;
известь (известковый метод), известняк, окись магния (магнези-
товый метод), сульфит аммония (аммиачный метод), окись цинка
(цинковый метод), сульфит натрия и окись цинка (содо-цинковый
метод), ксилидин, фосфаты, нефелин, основной сульфат алюминия,
основной сульфат хрома и другие, а также каталитические методы,
основанные на поглощении SO2 и окислении SO3” в SO4- ввод-
ном растворе кислородом в присутствии ионов Мп, Fe, Си и дру-
гих металлов6’ 26~29. Подавляющее большинство этих методов
очистки газов от SO2 связано с образованием сульфитов и бисуль-
фитов, причем наиболее эффективными являются циклические ме-
тоды, при которых абсорбция S'O2 чередуется с регенерацией аб-
сорбента десорбцией или другими способами. В СССР эксплуати-
руется аммиачный метод очистки дымового газа ТЭЦ 30-35. Он
основан на равновесии:
(NH4)2SO3+SO2 + H2O 5=* 2NH4HSO3
Рабочий раствор содержит сульфит и бисульфит аммония. Этот
раствор поглощает SO2 из дымовых газов при ~30°, а при нагре-
вании до кипения выделяет чистый SO2 с примесью водяного пара,
который легко конденсируется. Степень отгонки SO2 зависит от мо-
лярного отношения SO2 : NH3 в исходном растворе, от плотности
орошения колонны и температуры кипения раствора в ее нижней
части. Из 1 м3 раствора бисульфита аммония можно выделить ма-
ксимально 140 кг SO2; теоретический расход пара на отгонку будет
при этом равен 1 т на 1 т SO2. При выделении 100 кг 1м3 SO2 тео-
ретический расход пара 1,5 т/т SO2; практический расход пара
1,9—2,7 т/т SO2 36-40.
Аммиачный метод используется также на металлургическом за-
воде в Трейле (Канада), где очищают 8500 м31мин газа с содержа-
нием 0,75% SO2; после абсорбции в газе остается 0,1% SO2. Полу-
чаемый раствор бисульфита аммония (240 г/л серы) перерабаты-
вают с помощью серной кислоты на сульфат аммония и 100%-ный
SO241. Этот вариант в ряде случаев можно предпочесть, так как-
циклический аммиачный метод с регенерацией поглотителя имеет/
существенные недостатки — окисление SO3- до SOI", а также;
саморазложение раствора вследствие его термодинамической
Окисляемость сульфитных солей
515
неустойчивости с образованием SO<"h элементарной серы:
4HSO7 - S4O?" + SO?- + 2Н,0
ООО *i А
S,O?- + Н,0 = SO?- + S9O?- + 2Н+
О U А Ч АО
S2O|- + 2HSOJ = 2SO2- + 2S + Н2О
Сера, реагируя с бисульфитом, дает тиосульфат, образующий
с бисульфитом еще большие количества SO? и серы и т. д. По-
этому необходимо выделять из циркулирующего раствора сульфат
аммония и выводить часть раствора из цикла во избежание на-
копления тиосульфата, компенсируя эти потери добавкой свежего
аммиака. Эти вредные процессы усиливаются содержащимися в
газе примесями — пылью окислов металлов, соединениями селена,
мышьяка, что обусловливает необходимость тонкой очистки газа,
еще больше усложняющей и удорожающей процесс. Поэтому ра-
ционально дальнейшее усовершенствование этого метода, которое
может идти как по пути изыскания мощных ингибиторов, заторма-
живающих реакции окисления, и сокращения длительности про-
цесса применением высокоинтенсивной аппаратуры32, так и по пути
выбора оптимальных соотношений между количеством регенери-
руемого и перерабатываемого на другие продукты поглотителя.
Заслуживает внимания вариант аммиачного метода с термиче-
ской диссоциацией получающегося твердого сульфата аммония для
регенерации аммиака42. Сульфат аммония разлагают при нагре-
вании до 200—300°. а образующийся бисульфат взаимодействует
с сульфит-бисульфитом аммония, причем регенерируется SO2:
(NH4)2SO4 = NH, (г.) + NH4HSO4
3NH3 + 2SO2 + 2Н2О = NH4HSO3 + (NH4)2SO3
NH4HSO3 + (NH4)2SO3 + 3NH4HSO4 = 2SO2 + 3(NH4)2SO4 + 2H2O
ОКИСЛЯЕМОСТЬ СУЛЬФИТНЫХ СОЛЕЙ
Вследствие легкой окисляемости сульфитных солей (в особенно-
сти солей аммония) получаемые продукты — бисульфит, сульфит —
содержат некоторые количества сульфата. Процесс окисления
продолжается и при хранении продуктов. При хранении кри-
рталлического сульфита в нем иногда накапливается до 20% суль-
фата. что делает продукт нестандартным. Крупнокристаллический
сульфит лучше противостоит окисляющему влиянию атмосферы
вследствие меньшей поверхности кристаллов, приходящейся на еди-
ницу веса. Его окисление усиливается во влажной атмосфере и под
Действием света, а также в случае использования в производстве
ноды, загоязнений ионами металлов 6’43~45. В сухой атмосфере
^а25Оз-7НгО теряет кристаллизационную воду и переходит в
17*
516
Гл. XIV. Соли сульфитного ряда
безводный Na2SO3, но не окисляется. На этом основании рекомен-
дуется изготовлять безводный продукт и хранить его в условиях,
препятствующих гидратации46.
В растворе окислительные процессы происходят, по-видимому,
в результате цепной реакции. Начальными центрами цепи, воз-
можно, являются одновалентные ионы SO3, образующиеся из
ионов 80з” в результате потери ими отрицательного заряда (на-
пример, под действием ультрафиолетовых лучей). При этом об-
разуется гипотетическая монотионовая кислота HSO3. В дальней-
шем цепная реакция идет по следующей схеме:
HSO3 + О2 + Н2О + SO^' = 2SO^“ + ОН- + 2Н+
ОН + SO^ + Н+ = HSO3 + ОН' и т. д.
. Обрыв цепи в отсутствие кислорода происходит в результате
димеризации 2SO3 = S2O6- — образуется стабильная дитионовая
кислота.
Образование сульфата в бисульфите в процессе его изготовле-
ния тем меньше, чем больше концентрация SO2 в газовой смеси,
так как на количественную сторону окисления влияет главным об-
разом длительность процесса. Наиболее сильное окисление проис-
ходит при pH раствора 7—9, т. е. при регенерации раствора и уда-
лении SO2. Этому способствует также повышение температуры.
В диапазоне 25—100° скорость разложения возрастает в 25 раз.
Значение pH для чистого раствора бисульфита аммония по разным
-данным находится в пределах 2,2—4,7; вероятное значение 3,5 47-48.
Об окислении сульфитов кальция и магния и бисульфита магния
см.49’ 50.
Окисление сульфита кислородом при pH = 5 — 8 протекает, как
реакция второго порядка, а при меньших и больших значениях
pH — как реакция первого порядка. В присутствии сильных окис-
лителей, например двуокиси марганца, окисление сульфита значи-
тельно ускоряется, причем максимум скорости наблюдается в кис-
лой среде, при pH = 4 81-54. При поглощении кислорода раствором
сульфит-бисульфита аммония окисляются и 50з~ и HSO3, но пре-
имущественно бисульфит. Несмотря на это, содержание его в рас-
творе не изменяется, а содержание сульфита уменьшается. Это
объясняется тем, что образующийся при окисленииНЭОз hohHSO4,
являясь более сильной кислотой, реагирует с сульфитом, вновь
образуя бисульфит, так что из раствора исчезают только ионы*
SO3" В диапазоне изменения содержания бисульфита 63—100% ’
от суммы сульфита и бисульфита скорость окисления раствора |
возрастает приблизительно в 6 раз. Когда в растворе сверх бисуль- ’
фита содержится свободная сернистая кислота, т. е. значение pH;
Детвора понижено, скорость окисления резко падает до нуля. Ско- :
Окисляемость сульфитных солей
517
рость поглощения кислорода раствором сильфит-бисульфита аммо-
ния [Go,, «)], эквивалентная скорости образования сульфата
аммония, может быть вычислена по формуле
lg Go2 = 6 1gA + °,325
где S —содержание SO2 в сульфите и бисульфите, г-мол/л-,
С — содержание NH3 в сульфите и бисульфите в пределах
7,5—3 г-мол/л, при постоянном общем содержании NH3 в
растворе в виде сульфита, бисульфита, сульфата, тиосуль-
фата и тритионата, равном 8 г-мол/л.
Для С<3 г-мол/л-.
lg со2 = 6 IgA + 0,118
Эти формулы выведены55 для поверхностной абсорбции кисло-
рода сравнительно концентрированными растворами и отличаются
Концентрация NHSeftu, г-иол/л
Рис. 154, Изохроны скоростей поверхностного
поглощения кислорода воздуха растворами
сульфит-бисульфита аммония при 20—22° и при
начальном CsoyCNHs = 0,78—0,8.
от кинетических закономерностей, наблюдаемых для разбавленных
растворов в иных гидродинамических условиях 56-59. По мере уве-
личения общей концентрации солей скорость поглощения кисло-
рода вначале возрастает, затем убывает (рис. 154). Максимум
наблюдается при общей концентрации солей 2—3 г-мол/л, но сме-
щается в сторону больших значений этой концентрации с увеличе-
нием относительного количества сульфата (изохроны 2 и 3 для
больших значений времени располагаются правее, чем /). Наличие
максимума, очевидно, объясняется тем, что в разбавленных рас-
творах процесс окисления лимитируется скоростью реакции в рас-
творе, а в концентрированных — скоростью абсорбции кислорода
из воздуха. С увеличением парциального давления кислорода ско-
рость окисления возрастает60, но абсолютный прирост концентра-
ции SOt в растворе зависит от того, какая стадия лимитирует
общую скорость процесса. Так, в пенном аппарате скорость
518
Гл. XIV. Соли сульфитного ряда
поглощения SO2 в 10—15 раз больше, чем в насадочном скруббере,
а скорость поглощения кислорода — в 2—3 раза. В итоге степень
окисления раствора в пенном аппарате в 5 раз меньше, чем в на-
садочном скруббере61.
В результате обобщения производственных данных предло-
жена 62 эмпирическая формула для определения скорости окисле-
ния растворов сульфит-бисульфита аммония, натрия, кальция, маг-
ния в процессе извлечения SO2 из газов в скрубберах с насадкой
(хордовой, реечной или из керамических колец):
0’8Q°’7^(^)6
50 \ С )
-------
Здесь Gor, — скорость поглощения кислорода, а/(л42-ч), отнесенная
к 1 м2 поверхности насадки; t — температура, °C; Q — плотность
орошения, м3/(м2-ч); у — плотность раствора, кг/м3-, р—вязкость
раствора, кг -сек/м2; S/C— среднее молярное отношение содержа-
ния SO2 в жидкой фазе к содержанию связанного с ним основания.
Это уравнение получено для следующих пределов изменения
условий; Q — от 52 до 2, t — от 50 до 25°, у — от 1 до 1,3, ц — от
1,1 до 3, S/C — от 0,7 до 0,9, скорости газа в полном сечении скруб-
бера— от 0,3 до 3 м/сек, исходной концентрации SO2 в газе — от
0,06 до 0,35 объемн.%, содержание кислорода в газе —от 8 до 19
объемн.%, общего содержания растворенного SO2 (в виде суль-
фит-бисульфитных солей) —от 0,016 до 7 моль/л, pH раствора —
от 4,0 до 6,0.
Окислительные процессы могут быть подавлены введением в
производственные растворы отрицательных катализаторов — ве-
ществ, каталитически препятствующих окислению, антиокислите-
лей или ингибиторов. Механизм ингибиторного действия объяс-
няют образованием комплексов из молекул реагента и ингибитора.
Так, при ингибировании спиртами процесса окисления SO2 возду-
хом образуются комплексные соединения между SO2 и спиртом.
По эффективности ингибиторного действия фенолов на реакцию
окисления слабых водных растворов NaHSO3 при 40—60° их можно
расположить в следующий ряд: гидрохинон > пирогаллол > р-наф-
тол > а-нафтол > пирокатехин > резорцин > фенол > флороглю-
цин. Особенно эффективными антиокислителями являются диме-
тилпарафенилендиамин и парафенилендиамин — они предохраняют
от окисления даже при концентрации 1 :200 000 61-65. Следы окис-
лов азота сильно ухудшают действие ингибиторов 66.
Накопление сульфата в производственных растворах при обра-
ботке их сернистым газом происходит не только за счет их окисле-
ния, но и вследствие поглощения S'O3, обычно содержащегося в
сернистом газе.
Давление S02 над растворами поглотителей
519
ДАВЛЕНИЕ S02 НАД РАСТВОРАМИ ПОГЛОТИТЕЛЕЙ
В основе образования соединений сульфитного ряда лежит про-
цесс растворения SO2 в воде. В системе Н2О—SO2 устанавли-
ваются следующие равновесия:
Н2О + SO2 H2SO3 Н+ + HSOj 2Н+ + SO3~
Для первого из этих равновесий давление SO2 над раствором
Pso2 = tf[H2SO3]
где Я —константа Генри;
[H2SO3] — концентрация недиссоциироваиных молекул H2SO3.
Для двух других равновесий
[H+][HSO3] . . 25О [H+][SOM _7
К?5------L---и. = 1 3.10 2. К25 = _^_L--3J--3 п t 10-7
[H2SO3] 11 [HSO3]
(№/ = 3,36-10 3; №ii° =4,0-Ю-7). Приводят также67 значение
Кн° = 6,28 • 10~8. Так как общая концентрация SO2 в растворе
S = [H2S Оз] + [HSO3] + [S ОГ],
то 7000
гн+12 600
Рзо2-^-Гн+12--^и„„- /да
IH J +ai1H J + aiah §477
Следовательно, равновесное
давление pSO2 над раствором §200
(рис. 155) * зависит от общей <5
концентрации SO2 в растворе 3
и от температуры, определяю- | во
Щей величины Н, Ki и Кы, а 147
также от кислотности раство- 30
ра — чем меньше pH, тем дав- <?0
ление SO2 больше. Поэтому в
тех случаях, когда поглощение
SO2 из газов сопровождается Рис.
последующей регенерацией по-
глотительного раствора нагре-
ванием, необходимо выбирать поглотительные растворы с такими
значениями pH, для которых равновесное давление SO2 мало при
15—25° и резко повышается при нагревании до 60—100°. Это рас-
творы солей слабых кислот или слабых оснований, обладающие
буферными свойствами — сульфит-бисульфитов аммония и натрия,
фосфатов натрия, основных сульфатов алюминия и хрома и др.
70 20 30 40 50 60 70 ВО 90100
Температура °C
155. Давление SO2 иад водными
растворами.
См. также м.
520
Гл. XIV. Соли сульфитного ряда
В системе SO2—NH3—Н2О равновесие устанавливается в ре.
зультате следующих реакций:
SO2 (г.) + Н2О SO2-H2O H+ + HSO3 2H++SO2"
NH3(r.) + H2O NH3-H2O NHj + OH"
И
H2O TZt H* + OH"
При 25° в системе в заметных количествах присутствуют сле-
дующие ионы и молекулы67:
При pH < 4,2..................S02.H2O, HSO“, NH+ Hb
» » 4,2-7,0.................HSO3“, SO7-, NH+
» » 7,0-9,5.................HSO3“, SO^-, NH+, NH3 • H2O
» » >9,5....................SO|“, NH4+, NH3 • H2O, OH~
На рис. 156 и 157 показано изменение давлений SO2 и NH3, от-
несенных к единице концентрации NH3, над растворами суль-
Рис. 156. Давления SO2 и NH3 (в мм рт. ст.) над раство-
рами (NH4)2SO3 и NH4HSO3i отнесенные к единице концен-
трации NH3 в растворе.
(Сплошные линии — pso2. пунктирные — pNH..)
фит-бисульфита аммония. Здесь Cso2 — общее содержание SO2 в
растворе сульфита и бисульфита и Cnh3 — содержание NH3 в
г-мол/]00 г-мол воды. Для раствора сульфита аммония отношение
Cso2/Cnh3 = 0,5, а для бисульфита Cso2/Cnh3 = 1- Парциальные да-
вления SO2 и NH3 над раствором сульфит-бисульфита аммония
Давление S02 над растворами поглотителей
521
могут быть вычислены по формулам:
„ (2CSO2-CNH3)2 (>3.51--^)
PSO, = —7Г--р-----е ММ рт. ст.
gnh3“ cso2
CNH3 (CNH3 ~ CSO2) (31,51 f~)
pNH3= 2CSO2-CNH3 e MM PT. CT.
где T—абсолютная температура 6>70-78.
Эти приближенные формулы выведены71 из равновесий
SO2 (г.) + Н2О + sof" 2HSO;
NH4OH + HSC>3 nhJ + so|~+h2o
и могут применяться для растворов любых концентраций, имею-
щих практическое значение, — погрешность этих формул обычно
меньше 10%, но сильно возрастает при больших значениях pSOi.
Давление SO2 (в мм рт. ст.) над растворами сульфит-бисуль-
фита аммония может быть также вычислено по эмпирическим фор-
мулам 72:
lg Pso2 = 9,096 1g ? при CSO2:CNH3 = 0,7-0,87
lg PsO2 “ 20,541 1g ~ + 9,997 при CSO1: CNHs = 0,87 - 1
В присутствии сульфата в растворе сульфит-бисульфита аммо-
ния, парциальное давление SO2 над раствором возрастает73.0 дав-
лении SO2 над растворами сульфит-бисульфита магния в присут-
ствии MgSO4 см.74-75.
На рис. 158 приведены изотермы равновесного давления SO2
над раствором Na2SO3+NaHSO3. На оси абсцисс отложена степень
превращения Na2SO3 в NaHSO3 по мере насыщения раствора SO2,
т. е. величина CsoJC^a- Значения psOi (в мм рт. ст.) отнесены к
единице концентрации На(СыаИСзо2в г-лгол/ЮО г-мол воды) и
должны умножаться на CNa. Диаграмма построена по данным для
Сыа = 8, что соответствует ~20% SO2 при насыщении раствора га-
зом до образования NaHSCh.
На рис. 159 приведена зависимость давления SO2 над раствора-
ми бисульфита кальция при 25°, которые могут существовать только
в области между линиями АВ и АС, т. е. в присутствии свободной
$О2. Линия АВ — растворимость SO2 в воде, линия АС — раство-
римость сульфита кальция. Давления SO2 над растворами
Ca(HSO3)2, насыщенными CaSO3, показаны на рис. 160 79’80. В от-
личие от бисульфита кальция растворы бисульфита магния могут
Бисульфит и сульфит натрия
523
существовать в отсутствие избытка SO213,81; в этом отношении
растворы бисульфита цинка подобны растворам бисульфита каль-
ция82,83. О давлении SO2 над растворами основного сульфата алю-
Рис. 160. Давление SO2 над растворами Ca(HSO3)2>
насыщенными CaSO3.
Линии одинакового содержания Са в растворе:
1-0,62; 2-1,24; 3-1,86; 4-2,48 г/100 г воды.
миния, основного сульфата хрома, фосфатов натрия, ксилидина
см.6’78. О составе водных растворов SO2 при небольших концент-
рациях и различных pH см.84.
БИСУЛЬФИТ И СУЛЬФИТ НАТРИЯ
Получение бисульфита и сульфита натрия из сернистого газа
и щелочей
Теория процесса
При поглощении SO2 раствором едкого натра в зависимости от
степени его насыщения образуется сульфит или бисульфит натрия.
Обычно поглощение сернистого газа производят более дешевым
раствором соды. При этом вначале образуются бикарбонат и суль-
фит натрия по реакции:
2Na2CO3 + SO2 + Н2О = 2NaHCO3 + Na2SO3 (1)
Затем происходит постепенное разрушение бикарбоната, уда-
ляется углекислый газ и получается раствор сульфита натрия:
2NaHCO3+ SO2 = Na2SO3 + Н2О + 2СО2 (2)
При последующем поглощении SO2 раствором сульфита обра-
зуется бисульфит:
N a2SO3 + SO2 + Н2О = 2N аН SO3 (3)
524
Гл. XIV. Соли сульфитного ряда
Степень нейтрализации, %
Рис. 161. Изменение состава содового
раствора в процессе поглощения SO2:
1 ~ Na2CO3; 2 — NaHCO3; 3 — SO2 сульфитный;
4—SOj бисульфитный.
Суммарными уравнениями реакций образования сульфита и би- i
сульфита натрия будут: 1
Na2CO3 4- SO2 Na2SO3 4- СО2
Na2CO3 4- 2SO2 4- Н2О = 2N aHSO3 4- СО2
Изменение состава содового раствора в процессе поглощения
им SO2 85 показано на рис. 161 [степень нейтрализации (в %) для
исходного раствора соды рав-
на нулю, для готового раствора
бисульфита—100]. Как видно
из диаграммы, в растворе про-
исходит накопление бикарбо-
ната, .концентрация которого
достигает максимума, когда
поглощено около 25% от об-
щего количества SO2, требую-
щегося для превращения соды
в бисульфит натрия. Реакция
(1) заканчивается раньше, чем
реакция (2). После исчезнове-
ния всей соды содержание би-
карбоната натрия в растворе
еще очень велико и идет посте-
пенное его снижение за счет
образования сульфита. Когда
поглощено 50% от общего ко-
личества SO2, реакция (2) за-
канчивается,— в растворе име-
ется только сульфит натрия.
После этого начинается обра-
зование бисульфита натрия по
реакции (3)—концентрация
сульфита падает.
Если абсорбция SO2 осуще-
ствляется в башне с насадкой,
орошаемой содовым раство-
ром, то реакция (1) заканчивается в зоне, соответствующей при-
_близительно 30%, а реакция (2)—40% верхнего объема насадки.
Нижние 60% объема насадки соответствуют зоне образования би-
сульфита по реакции (3). Количество SO2, поглощаемое при обра-
зовании сульфита в 40% верхнего объема башни, равно количеству
SO2, поглощаемому при образовании бисульфита в 60% нижнего
объема башни. Следовательно, скорость поглощения SO2 изме-
няется по высоте аппарата. Скорость увеличения содержания об-
щего SO2 (сульфитного и бисульфитного) в растворе вначале уве-
личивается, достигает максимума, когда в растворе содержится
Бисульфит и сульфит натрия
525
только Na2SO3, а к концу процесса уменьшается вследствие уве-
личения равновесного давления SO2 над раствором по мер$
его бисульфитизации, т. е. перехода сульфита в бисульфит
(рис. 158).
При насыщении раствора сернистым газом его плотность уве-
личивается за счет поглощения SO2 и за счет испарения из рас-
твора воды, так как при незначительном содержании SO2 в газе,
поступающем на абсорбцию, через аппарат проходит большой
объем газа, уносящего много влаги. Так, при работе на 7—8 %-ном
газе, при температуре раствора 50—70°, его плотность увеличи-
вается от 1,24—1,25 г/см? для исходного раствора соды и до 1,34—
1,36 г! см3 для раствора бисульфита. При 3%-ной концентрации SO2
в газе, поступающем на абсорбцию, плотность раствора возрастает
от 1,19 до 1,36 г!см3. Чем ниже концентрация SO2 в исходном газе,
тем меньше должна быть концентрация исходного раствора соды
для получения раствора бисульфита стандартной концентрации.
При концентрации соды в исходном растворе 20—23% максималь-
ная концентрация бикарбоната достигает 9—11%, максимальная
концентрация сульфита 24—28% (12—14% сульфитного SO2). Во
избежание выпадения в абсорбционных аппаратах осадков
NaHCO3 и Na2SO3 при концентрации соды в исходном растворе
около 30% и при работе на 7—8%-ном газе, необходимо поддер-
живать температуру раствора не ниже 60° по крайней мере в пер-
вой стадии процесса или в первой по ходу раствора зоне аппарата.
При абсорбции SO2 из отбросных газов малой концентрации,
ввиду сильного возрастания при этом количества испаряющейся
воды и применения содового раствора меньшей концентрации, в
абсорберах может поддерживаться температура ниже 60й. При со-
блюдении режима процесса абсорбции можно получать готовые
растворы бисульфита, более концентрированные (около 27% SO2),
чем предусмотренные стандартом (22,5% SO2), что дает экономию
при транспорте, хранении и проч.
Получение бисульфита натрия
Получение бисульфита натрия из отходящих газов контактных
сернокислотных заводов производят поглощением SO2 из этих газов
В башнях с насадкой. Материал башен — свинец, пластмасса или
Дерево; в последнем случае применяют хордовую насадку. Обычно
газ проходит последовательно через две башни, в каждой из ко-
торых с помощью кислотоупорных центробежных насосов осущест-
вляется циркуляция раствора. Из первой по ходу газа башни выво-
дят часть готового раствора бисульфита, а убыль раствора попол-
няют раствором из второй башни. Свежий раствор соды добавляют
к раствору, циркулирующему во второй башне. Таким образом,
башни орошаются не раствором соды, а сульфит-бисульфитным
526
Гл. XIV. Соли сульфитного ряда
щелоком, что предотвращает выделение в твердую фазу бикарбо-
ната натрия.
На каждую тонну моногидрата серной кислоты, вырабатываем
мой на сернокислотном заводе, можно получить 0,15—0,18 т стан- 1
дартного раствора бисульфита натрия. Впрочем, его количество |
тем меньше, чем лучше работает контактный завод (чем выше сте- 1
пень контактирования). J
При использовании газов ватержакетных печей6 газы, имею- |
щие температуру ~250°, предварительно промывают от пыли и |
охлаждают до 30° водой в футерованной башне с насадкой, затем |
пропускают через брызгоуловитель — деревянную башню с насад- 1
кой, после чего направляют в деревянную поглотительную башню с
хордовой насадкой, орошаемую вначале 22—23% раствором соды
при 35—40°. Получается раствор, содержащий 23% SO2 (38% I
NaHSO3). Количество его 2,5—3 т в сутки при размерах башни: 1
диаметр 1,3 м, высота 8 я, поверхность насадки 380 я2. Продолжи-
тельность одного цикла около 6 ч, причем в течение первых 4 ч SO2
поглощается практически полностью, а затем, после того как со-
держание SO2 в растворе достигает ~16%, появляется проскок
SO2, резко увеличивающийся. Более рациональна описанная выше •
непрерывная схема производства. По-видимому, вследствие недо-
статочной очистки газа от пыли на описанной установке около 10%
от пропускаемого SO2 окисляется до Na2SO4. При получении би-
сульфита из газа колчеданных печей, содержащего, кроме SO2, де-
сятые доли процента SO3, горячий печной газ, после очистки от
огарковой пыли в электрофильтрах необходимо промывать серной
кислотой для извлечения SO3. При работе по такой схеме на 1 т
стандартного раствора бисульфита расходуют: 208 кг соды (100%),
240 кг SO2, 20 кг серной кислоты (100%), 21 кет - ч электроэнергии,
0,18 мгкал пара, 18 ж3 воды86.
Бисульфит натрия может быть получен с помощью ионообмен-
ников 87, причем этот процесс сочетается с очисткой газа от H2S.
Ионообменная смола должна содержать активный водород и яв-
ляться кислотой более слабой, чем сернистая, но более сильной,
чем H2S. Сероводород извлекают из газа раствором соды и полу- j
ченный раствор гидросульфида натрия обрабатывают смолой, при-
чем выделяется концентрированный сероводород, который окис-
ляют до SO2. Взаимодействием последнего с образовавшейся на-J
триевой солью ионообменной смолы получают раствор бисульфит»
при одновременной регенерации смолы: Я
2H2S + Na2CO3 = 2NaHS + Н2О + СО2
RH + NaHS = RNa + H2S
H2S + p/2o2 = so2 + H2O
RNa + SOa+ H2O = NaHSO3+ RH 1
Бисульфит и сульфит натрия
527
Семиводный сульфит натрия
Нейтрализация раствора соды сернистым газом приводит к об-
разованию сравнительно разбавленных растворов сульфита. Это
усложняет процесс кристаллизации. Поэтому кристаллический
Na2SO4-7H2O получают из концентрированного раствора, обра-
зующегося при нейтрализации содой раствора бисульфита натрия,
содержащего 45—47% NaHSO3:
2NaHSO3 + Na2CO3 = 2Na2SO3 + H2O + CO2
Во избежание выделения NaHCO3 реакцию ведут в кислой сре-
де, приливая раствор соды к раствору бисульфита. Концентрации
растворов должны быть такими, чтобы получаемый раствор суль-
фита был близок к насыщению при 38—40°. Приливание раствора
соды к бисульфиту ведут медленно вследствие сильного вспенивания
массы выделяющейся двуокисью углерода. Теплоту нейтрализации
отводят с помощью находящегося в реакторе водяного змеевика,
поддерживая 38—40°. После нейтрализации раствор должен иметь
нейтральную или слабокислую реакцию. Он отстаивается и на-
правляется в кристаллизаторы. При кристаллизации сульфита в
барабанных кристаллизаторах с воздушным охлаждением, имею-
щих длину 12—20 м, диаметр 0,75—0,9 м и вращающихся со ско-
ростью 8—12 об!мин, съем кристаллов с 1 ма полного объема кри-
сталлизатора составляет 0,5—0,75 т в сутки, в зависимости от тем-
пературы воздуха и температуры и концентрации поступающего на
кристаллизацию раствора. (Для этого процесса очевидно рацио-
нальнее использовать более производительные вакуум-кристалли-
заторы.) Кристаллы Na2SO3-7H2O отжимают на центрифуге, а ма-
точный сульфитный раствор возвращают на растворение соды или
направляют на поглощение SO2 для получения раствора бисуль-
фита. На 1 т семиводного сульфита натрия расходуют: 0,26—0,27 т
S02 и 0,44—0,46 г кальцинированной соды.
Запатентован способ непосредственного получения твердого
сульфита натрия обработкой концентрированного раствора би-
сульфита твердой содой при 50°, после чего раствор выливают в
форму, в которой он затвердевает; продукт содержит 52,6% Na2SO3,
44 1_% Н2О и 2,3% Na2SC>4 88.
Некоторая экономия соды в производстве сульфита может быть
Достигнута при переработке бисульфита с помощью СаСО3 — мела
или известняка. Этот процесс, возможно, представит интерес для
очистки отработанных и дымовых газов с частичной регенерацией
SO2 или, выпуском двух продуктов — сульфитов натрия и кальция.
По этому способу89 вначале SO2 поглощают из газов раствором
сульфита и бисульфита натрия (аммония). Затем рдствор переме-
шивают' с известняковой пульпой (СаСО3: Н2О = 5,2) при
40—70°;
2NaHSO3 4- СаСО3 -I- Н2О == Na2SO3 -I- CaSO3 * 2Н2О 4- СО2
528
Г л. XIV. Соли сульфитного ряда
Значительные количества сульфита натрия получаются в каче-
стве отхода при производстве фенола. Фенол изготовляют из бен-
золсульфокислоты, которую вначале нейтрализуют раствором
сульфита натрия. Полученный 50% раствор бензолсульфокислого
натрия сплавляют с едким натром при 300—315° в стальных кот-
лах с огневым обогревом, причем образуется фенолят натрия и
сульфит натрия. Плав гасится водой и из него выщелачивается
фенолят натрия, а большая часть менее растворимого сульфита
натрия остается в твердом виде и отфильтровывается. Раствор фе-
нолята натрия нейтрализуют сернистым газом, который выделяется
при обработке сульфокислоты сульфитом. При этом образуются
фенол и раствор сульфита натрия, который вновь возвращают на
нейтрализацию сульфокислоты. Таким образом, весь процесс вы-
ражается реакциями:
2C6H5SO3H + Na2SO3 = 2C6H6SO3Na + SO2 + H2O
2C6H;SO3Na + 4NaOH = 2C6HsONa + 2Na2SO3 + 2H2O
2C6H5ONa + SO2 + H2O = 2CeH5OH + Na2SO3
2CeH5SO3H + 4NaOH = 2CeH3OH + 2Na2SO3 + 2H2O
Сульфит натрия, отфильтрованный от раствора фенолята нат-
рия, выпускают в качестве товарного технического продукта.
Сульфит натрия можно получить, насыщая сероводородом сус-
пензию Fe(OH)3 в 5% растворе Na2S:
6H2S + 6Fe(OH)3 = 6FeS + 15H2O + l,5O2
NagS 4" 1,502 ~ NagSOj
Процесс следует вести при 10—20°, так как в горячем растворе
выделяется сера:
3Na2S + 2Fe(OH)3 = 2FeS + S + 6NaOH
Отделенное от раствора сульфита сернистое железо может
быть регенерировано в H2S и Fe(OH)3. Из 1 г Na2S (100%) этим
методом можно получить 1,16 г Na2SOs или 2,32 т Na2SO3 • 7Н2О90
Окисление сульфида натрия в сульфит может быть осуществлено
и воздухом. Для этого смесь концентрированного раствора Na2S с
инертным компонентом (например, продуктом), представляющую
собой хлопьевидную рыхлую массу, продувают при перемешивании
влажным воздухом с температурой 120—150°91.
Запатентован способ получения сульфита натрия из отбросного
сульфидного щелока целлюлозных заводов; содержащийся в ще-
локе Na2S окисляют кислородом (воздухом) при 155—180° и дав-
лении 5,5—8,5 ат92.
Бисульфит и сульфит натрия
529
Безводный сульфит натрия
Безводный сульфит натрия весьма устойчив против окисления.
При хранении в течение нескольких месяцев содержание Na2SO3 в
продукте практически не изменяется. Кроме того, егоперевозка де-
шевле, чем Na2SO3-7H2O, так как он содержит больше SO2 и
имеет больший насыпной вес (1,2—1,3, вместо 0,8—0,9 г/,и3 для
Na2SO3 • 7Н2О).
Безводный сульфит натрия можно получить кристаллизацией из
концентрированного раствора при 95—100° или плавлением
Na2SO4-7H2O. В последнем случае получается минимальное коли-
чество маточных растворов. При плавлении Na2SO3-7H2O полу-
чаемую кристаллическую пульпу выдерживают в обогреваемом
паром реакторе в течение 30 мин для образования более крупных
кристаллов, затем повышают температуру до 75—80° (так как при
повышении температуры растворимость Na2SO3 уменьшается) и
выпускают пульпу на центрифугу. Отфугованный продукт высуши-
вают при 75—80°. Этот метод 44, однако, не используется в про-
мышленности вследствие его громоздкости (двойная кристаллиза-
ция, малая производительность реактора, периодичность процесса).
Поэтому безводный Na2SO3 получают преимущественно кристалли-
зацией из насыщенного раствора, приготовленного при темпера-
туре ~35°, соответствующей наибольшей растворимости соли.
Раствор очищают от железа, нейтрализуя его кислотность содой и
подщелачивая едким натром до содержания 25—28 г/л NaOH и
отделяя шлам после отстаивания. Затем раствор нагревают при
перемешивании в течение 1 ч до 95—100°, причем из него кристал-
лизуется около Vs части содержащегося в нем Na2SO3. Кристалли-
ческую пульпу разделяют на нутч-фильтре, который служит и су-
шилкой. Маточный раствор возвращают в цикл (на растворение
соды), а кристаллы, после промывки на фильтре спиртом, сушат
воздухом, нагретым в паровом калорифере до 80—90°. При сушке
300 кг сульфита в течение 1,5 ч выгружаемая соль содержит 0,5—
1 % влаги. Ее подвергают дополнительному досушиванию в сушил-
ке полочного типа. Спирт применяют для ускорения сушки с це-
лью уменьшения окисления продукта, но при добавке к нему анти-
окислителей (стр. 518) от промывки спиртом можно отказаться.
На производство 1 т безводного сульфита натрия этим способом
расходуется: 3,76 т* бисульфита натрия (36,6%), 0,133 т кальци-
нированной соды (100%), 0,185 г** каустической соды (100%),
76 л этилового спирта (96%), 190 кет - ч электроэнергии, 2 мгкал
пара, 300 м3 воды86.
* Эта величина, приведенная по практическим заводским данным, в 2 раза
больше теоретической, что объясняется, по-видимому, неправильным учетом
Количества маточного раствора, возвращаемого на растворение соды.
** Этот расход может быть снижен путем частичной замены каустической
соды кальцинированной.
530
Гл. XIV. Соли сульфитного ряда
Запатентован93 способ сушки безводного сульфита натрия воз-
духом в псевдоожиженном слое при температуре ниже 120°. В свя-
зи с быстрым высыханием продукта значительного образования
Na2SO4 не происходит.
Гипрохимом разработана типовая схема производства сульфита
натрия из отработанных газов контактных сернокислотных систем
(рис. 162). SO2 из газов извлекается в башне циркулирующим
Рис. 162. Схема производства безводного сульфита натрия:
1 — сульфитная башня; 2 — циклон-брызгоуловитель; 3 — сборник для'.сульфит-биауль-
фитного раствора; 4 — распределительный бачок для сульфит-бисульфнтй’бго
створа; 5 —расходный бак для сульфит-бисульфитнрго раствора; 6 — питательный
бак для сульфит-содового раствора; 7— расходный бак для сульфит-содового ра-
створа; 8 — нейтрализатор; 9 — обезвоживатель; 10 — центрифуга; 11, /3 —бункеры;
12 — автоматические весы; 14 — тара; 15 — растворитель соды; 16 — фильтрпресс;
17 — сборник фильтрованного сульфйт-содового раствора; 18 — колонна разложения;
19 — сборник раствора сульфата натрия; 20 — насос.
сульфит-бисульфитным раствором, избыток которого выводится из
цикла и нейтрализуется сульфитно-содовым раствором при 33° в
аппарате с мешалкой и паровым змеевиком. Нейтрализованный
сульфитный раствор нагревается в обезвоживателе — резервуаре с
мешалкой, снабженном паровой рубашкой, до 90—95°. Образую-
щаяся сульфитная пульпа передается на центрифугу, с которой
отжатые кристаллы с влажностью 3—6% выгружаются в бункер,
затем поступают на автоматические весы и тарируются. Маточный
раствор направляют на растворение соды. В связи с накоплением
в нем сульфата натрия, часть его выводится из цикла и заменяется
соответствующим количеством воды. Выводимый раствор обраба-
тывают в колонне разложения серной кислотой; выделяющийся при
Бисульфит и сульфит натрия
531
этом SO2 отводят в контактную систему, а образующийся раствор,
содержащий ~25% Na2SO4— в кремнефтористое отделение супер-
фосфатного цеха, где он используется взамен NaCl (стр. 1142). Сте-
пень улавливания SO2 ~90%; доля SO2, удаляемая в виде отво-
димого маточного раствора, достигает 20—23%. Переработку полу-
чаемого при абсорбции SO2 раствора, т. е. нейтрализацию, обез-
воживание и отжим кристаллов, можно осуществлять в аппаратах
периодического действия и небольшой емкости при малой мощ-
ности установок (2—4т/сутки). При производительности более
10 т/сутки сульфита целесообразно осуществление процесса по не-
прерывной схеме.
Раствор сульфита натрия для производства безводной (и семи-
водной) соли можно получать нейтрализацией бисульфита извест-
ковым молоком 94:
2NaHSO3 + Са(ОН)2 = Na2SO3 + CaSO3 2Н2О
После отделения осадка CaSO3>2H2O отстаиванием или фильт-
рацией получается раствор, содержащий до 23% Na2SO3. Во избе-
жание потерь Na2SO3 со шламом температура раствора до его от-
деления должна быть в пределах 25—70°, в которых растворимость
Na2SO3 относительно высока.
Безводный Na2SO3 выделяется при смешении растворов каусти-
ческой соды с концентрацией больше 35% NaOH и бисульфита
с концентрацией больше 35% NaHSO3 в молярном соотношении
NaOH : NaHSO3>2 ; 1 при температуре выше 70°. Выход продукта
в расчете на бисульфит натрия превышает 80%. Если содержание
железа в растворах не больше 25 мг/л, то в образующемся осадке
сульфита содержится 2—3 мг Fe на 100 г соли. Такое содержание
железа не вызывает окрашивания продукта и не препятствует его
использованию в фототехнике95.
Безводный сульфит натрия можно получать «сухим» способом,
насыщая твердую соду сернистым газом. Реакция /
N а2СО3 4- SO2 — N а2СО3 4- СО2
идет лишь в присутствии влаги, поэтому газ должен быть увлаж-
нен (~8% Н2О). Наилучшим образом процесс осуществляется в
аппарате с кипящим слоем при 120—170°. При более низких
температурах образуется пиросульфит натрия (стр. 537), а выше
200° — главным образом сульфат натрия и сера (в результате раз-
ложения пиросульфита)
2Na2S2O5 = 2Na2SO4 4- SO2 4- S
В интервале 120—170° пиросульфит разлагается по реакции
Na2S2O5 = Na2SO3 + SO2
н получаемый продукт содержит больше 90% Na2SO3 и незначи-
тельное количество Na2SOi (до 3%) и Na2CO3 (до 8%)96-в7#
532
Гл. XIV. Соли сульфитного ряда
Получение бисульфита и сульфита натрия взаимодействием SO2
с раствором Na2SO4 или NaCl
Делались попытки замены содовых продуктов в производстве
бисульфита натрия сульфатом натрия или хлористым натрием.
Взаимодействие SO2 с Na2SO4 идет в присутствии извести. При
этом вначале образуется суспензия мелкокристаллического осадка
сульфита кальция
Са(ОН)2 4- SO2 == CaSOg 4" Н2О
который при дальнейшем поглощении SO2 переходит в раствори-
мый бисульфит кальция, вступающий в реакцию с Na2SO4 с выде-
лением в осадок гипса. Общее уравнение процесса:
Na2SO4 4- Са(ОН)2 4- 2SO2 4- 2Н2О = 2NaHSO3 4- CaSO4.2Н2О
'Его осуществление возможно лишь для разбавленных раство-
ров, содержащих меньше 17% Na2SO4, с получением раствора би-
сульфита натрия, содержащего до 15% SO2. Получение же стан-
дартного раствора бисульфита (22,5% SO2) требует, чтобы в ис-
ходном растворе было не меньше 25% Na2SO4, а при такой
концентрации происходит загустевание реакционной массы, за-
трудняющее дальнейшее ее взаимодействие с SO2 и отделение осад-
ка от раствора. Эти трудности устраняются при двухступенчатом
осуществлении процесса 98. В первой стадии известково-сульфатная
суспензия, содержащая в жидкой фазе 17% Na2SO4, насыщается
сернистым газом с отводом реакционного тепла для поддержания
30—35°. В течение 2—3 ч достигается 95—100%-ное превращение
сульфата по реакциям:
Са(ОН)2 4- 2SO2 = Ca(HSO3)2
Ca(HSO3)2 4- Na2SO4 4- 2H2O = 2NaIiSO3 4- CaSO4 • 2H2O
- • Реакционная пульпа, содержащая крупнокристаллический осадок
гипса, остается подвижной. Во второй стадии в пульпу, кристаллы
гипса в которой являются хорошей основой для дальнейшей кри-
сталлизации, вводят вторую порцию сульфата в количестве, рас-
считанном на закрепление раствора бисульфита до концентрации
22—23% SO2. Затем продолжают насыщение пульпы сернистым
газом при непрерывной подаче в реактор сухой извести или
пушонки (1 моль СаО на 1 моль введенного во второй порции
Na2SO4). Загрузка извести производится со скоростью, обеспечи-
вающей слабокислую реакцию массы, т. е. присутствие свободной
H2SO3, что препятствует появлению CaSO3 и ведет к образованию
Ca(HSO3)2 (рис. 159). Процесс завершается без загустевания
пульпы. Осадок гипса может быть отделен от раствора бисульфита
натрия отстаиванием и фильтрацией на вакуум-фильтрах. Впервой
ступени известь может быть заменена эквимолекулярным количе-
Бисульфит и сульфит натрия
533
ством сульфита кальция, являющегося отходом некоторых произ-
водств.
Способ получения сульфита натрия из поваренной соли, серни-
стого газа и аммиака" используется в Канаде100. В основе этого
способа лежит реакция
2NaCl + (NH4)2SO3 = Na2SO3 + 2NH4C1
Равновесие в этой системе при 60—85° сдвинуто таким обра-
зом, что наибольшую площадь занимает поле кристаллизации
ЫагЗОз (рис. 163). Поэтому мелкокристаллический хлористый нат-
рий при внесении в горячий раствор сульфита аммония будет легко
и в значительных количествах растворяться, а в осадок перейдет
Рис. 163. Изотерма раствори-
мости водной системы 2NaC14-
+(NH4)2SO3 ^=± Na2SO3+
+ 2NH4C1 при 60°.
Рис. 164. Изотерма раствори»
мости водной системы NaCl +
+NH4HSO3 NaHSO3+
+NH4C1 при 25°.
безводный сульфит натрия. После отделения этого осадка в рас-
творе останется хлористый аммоний. Кристаллизация NH4C1 до-.
стигается насыщением раствора сернистым газом с целью перевода
оставшегося сульфита в бисульфит и охлаждением раствора до25°.
Как видно из рис. 164, поле кристаллизации NH4C1 при этом зна-
чительно увеличивается. Это позволяет подобрать такие концент-
рации раствора, при которых удается произвести кристаллизацию
NH4C1. Оставшийся раствор, содержащий некоторое количество
КН4С1 и бисульфита натрия, насыщается аммиаком, причем би-
сульфит вновь превращается в сульфит, раствор нагревается и
вновь обрабатывается NaCl и т. д. Таким образом, можно осущест-
вить замкнутый цикл с периодической кристаллизацией Na2SO3 и
NH4CI.
Конечный щелок, получаемый после кристаллизации хлористого
аммония,содержит приблизительно 7% NHt, 12—13% СГ, 19% HSOj_
534
Гл. XIV. Соли сульфитного ряда
Он насыщается аммиаком до содержания 0,5% свободного
NH3,— получается так называемый исходный раствор. При опти-
мальных концентрациях растворов, позволяющих вести замкнутый
процесс, в исходном растворе должно содержаться 10,5% NHJ
(при этом в нем содержится 17—18% SO|”, 4 — 5% Na+). Этот
раствор обрабатывается стехиометрическим количеством NaCl.
Выход Na2SO3 в одном цикле составляет около 55% по отноше-
нию к БОз”, содержащемуся в исходном растворе; выход NH4C1 —
около 38% по отношению к связанному аммиаку.
При изучении растворимости в четверной системе NaCl—
(NH4)2SO3—Н2О при 20 и 60° помимо исходных компонентов были
обнаружены и другие твердые фазы, вероятно твердые растворы
присутствовавшего в качестве примеси Na2SO4 в Na2SO3101. При
осуществлении циклической схемы конечный щелок (раствор после
кристаллизации NH4C1) должен периодически очищаться от на-
капливающегося в нем сульфата (например, осаждением > SO4~
хлористым кальцием).
БИСУЛЬФИТ И СУЛЬФИТ АММОНИЯ
Концентрированные растворы бисульфита аммония содержат
70—75% NH4HSO3; в ряде случаев их целесообразно использовать
в качестве источника 100%-ного SO2 (см. стр. 514). Бисульфит
аммония получают насыщением водного раствора аммиака серни-
стым ангидридом, содержащимся в хорошо очищенных выхлопном
л производственном газах контактных сернокислотных систем.
Выхлопной газ из контактной системы проходит последова-
тельно через две башни с насадкой — сульфит-бисульфитную и
сульфитную, каждая из которых работает на замкнутом цикле
орошения. Сульфит-бисульфитный раствор поступает на циркуля-
цию в абсорбер распыливающего действия, куда подается крепкий
газ. В абсорбере крепкого газа сульфит-бисульфитный раствор
превращается в концентрированный бисульфитный раствор, насы-
щаясь очищенным сернистым газом, отбираемым после компрессо-
ров контактного сернокислотного цеха. Газ из этого абсорбера воз-
вращается в контактную систему. Соотношение между сульфитом
и бисульфитом в растворе сульфитной башни поддерживают
равным 0,3 (по весу), в абсорбере крепкого газа циркулирует рас-
твор, состоящий только из бисульфита аммония; в сульфит-бисуль-
фитной башне устанавливается среднее соотношение между суль-
фитом и бисульфитом. Часть раствора бисульфита аммония, цир-
кулирующего через абсорбер крепкого газа, выводится из цикла в
качестве продукта. Этот раствор пропускают через центрифугу для
отделения взвешенных в нем кристаллов сульфата аммония, кото-
рый является побочным продуктом производства. Для произвол-
Пиросульфиты 535
ства 1 т бисульфита аммония (в пересчете на 100%-ный) расхо-
дуется 30 000 нм3 выхлопного газа с содержанием 0,3% SOz,
2370 нм3 крепкого газа (7,5% SO2), 0,226 т аммиака в виде амми-
ачной воды с концентрацией не ниже 18% NH3, 124 кет • ч электро-
энергии и 1 м3 воды. В качестве отхода получается 0,068 т сульфа-
та аммония (в пересчете на 100%-ный).
Кристаллический моногидрат сульфита аммония (N1I4)2SO3>
. Н2О можно получить, высаливая его газообразным аммиаком из
раствора сульфита аммония. Маточный раствор после разбавления
служит для абсорбции SO2, которую ведут так, чтобы в растворе
оставался свободный аммиак, не превращая его полностью в суль-
фит аммония; затем раствор возвращают в процесс на поглощение
аммиака102. Описан способ получения (NH4)2SO3 при взаимодей-
ствии пирита с кислородом (воздухом) и аммиаком в присутствии
добавки NaCl; при 500° и двухчасовой обработке выход сульфита
составляет 82—87% 103.
ПИРОСУЛЬФИТЫ
При растворении в воде пиросульфита (метабисульфита) нат-
рия образуется раствор бисульфита натрия. Следовательно, во
всех случаях применения эти продукты взаимозаменимы. Однако
пиросульфит является более ценным веществом, так как он полу-
чается в виде сухой соли Na2S2O5, выгодно отличающейся от би-
сульфита своей транспортабельностью.
Существует несколько способов получения пиросульфита нат-
рия— так называемые мокрые и сухой методы. Основой всех мок-
рых методов является кристаллизация пиросульфита и растворов,
достигаемая: 1) выпариванием растворов бисульфита; 2) насыще-
нием сернистым газом сульфитной пульпы — суспензии твердого-
сульфита натрия в его насыщенном водном растворе; 3) насыще-
нием сернистым газом пульпы, получаемой смешением кальцини-
рованной соды с бисульфитом. Сухой метод заключается в
обработке сернистым газом увлажненной кальцинированной содьг
или бикарбоната натрия.
Получение пиросульфита натрия мокрыми способами
Метод получения пиросульфита натрия выпариванием раствора-
бисульфита требует расхода топлива; кроме того, при выпаривании-
раствора вместе с водяным паром улетучивается 20—25%’ SO2..
В результате реакции
2NaHSO3 = Na2SO3 + Н2О + SO2
8 растворе появляется сульфит, сильно загрязняющий кристалли-
зующийся пиросульфит. Хотя фракционированной кристаллиза-
536
Гл. XIV. Соли сульфитного ряда
цией можно получить часть продукта, содержащего до 93%’
Na2S2O5, но с очень низким выходом — 25—30%.
Получение пиросульфита натрия насыщением сернистым газом
сульфитной пульпы производят следующим образом. В реактор
заливают маточный бисульфитный раствор, оставшийся после
кристаллизации пиросульфита, и загружают кристаллический
Na2SO3-7H2O. Пульпу нагревают паром до 40° и подвергают об-
работке сернистым газом из колчеданных печей, подаваемым в
аппарат через барботер. По мере поглощения SO2 сульфит раство-
ряется, превращаясь в бисульфит, и одновременно из раствора
кристаллизуется пиросульфит:
Na2SO3 + SO2 ”Na2S;O5
По окончании обработки газом пульпу охлаждают. При этом
в осадок переходит дополнительно некоторое количество пиросуль-
фита натрия. Кристаллы пиросульфита отделяют от маточного
раствора на центрифуге и сушат воздухом при 70—80°, так как
влажный пиросульфит легко окисляется. В связи с тем, что с
Na2SO3-7H2O в процесс вводится большое количество воды, объем
получаемого маточного раствора значительно превышает количе-
ство раствора, загружаемого в реактор. Поэтому часть маточного
раствора (раствор бисульфита) выводят из производственного про-
цесса. Этим обусловлены высокие расходные коэффициенты: на
1 т пиросульфита расходуется до 7 т семиводного сульфита нат-
рия и до 1 т 100%-ного SO2.
Наиболее рациональным является насыщение сернистым газом
содово-бисульфитной пульпы, получаемой введением твердой каль-
цинированной соды в насыщенный раствор бисульфита натрия (ма-
точный раствор после кристаллизации пиросульфита) 104’105. При
этом идут следующие процессы:
NaHSO3 + Na2CO3 = Na2SO3 + NaHCO3
NaHSO3 + NaHCO3 = Na2SO3 + CO2 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
Так как исходный маточный раствор бисульфита является насы-
щенным, а температурный коэффициент растворимости пиросуль-
фита натрия в пределах производственных температур (25—40°)
невелик, то при последовательном или одновременном проведении
процессов нейтрализации раствора содой и насыщения реакцион-
ной массы сернистым газом происходит кристаллизация пиро-
сульфита. Оптимальная температура процесса 35—45°. Концентпа-
ция поступающего в абсорбер сернистого газа может быть любой.
Даже при содержании в газе десятых долей процента SO? при до-
статочных размерах абсорбционной колонны поглощение SO2 будет
практически полным. Оптимальное весовое соотношение между ко-
личествами соды и маточного бисульфитного раствора при приго-
Пиросульфиты
537
товлении исходной пульпы равно 1 : 4. Это соответствует 40—50%
соды от стехиометрического количества, требующегося для полной
нейтрализации всего бисульфита. Загрузка соды в большем коли-
честве приводит к сильному загустеванию пиросульфитной пульпы,
что затрудняет ее движение в аппаратах и трубах. В пульпу необ-
ходимо добавлять некоторое количество воды для компенсации
потерь воды в виде маточного раствора, смачивающего кристаллы
выводимого из цикла пиросульфита и в виде паров, уносимых га-
зом, уходящим из абсорбера.
Производство значительных количеств пиросульфита натрия
рационально лишь непрерывным способом. При этом поглоще-
ние SO2 можно осуществлять, например, в механических абсорбе-
рах с последующим разделением пиросульфитной пульпы в непре-
рывнодействующих центрифугах; сушку пиросульфита во избежа-
нии его разложения следует производить в течение очень малого
времени, измеряемого секундами, например, распыляя продукт в
потоке теплого воздуха.
Об опыте насыщения сернистым газом сульфит-бисульфитной
пульпы см.106, а о получении пиросульфита натрия сульфитно-
известковым способом см.107
Наибольшей стойкостью в средах, перерабатываемых
при производстве пиросульфита, обладают стали 1Х18Н9Т,
0Х23Н28МЗДЗТ, X17HI3M2T и 0Х21Н6М2Т 108.
Сухой способ получения пиросульфита натрия 109-пз
Этот способ основан на реакции:
Na2CO3 + 2SO2 — Na2S2O5 4- СО2
Вначале образуется сульфит натрия8, который при дальнейшем
поглощении SO2 переходит в пиросульфит, если температура под-
держивается на уровне ~60° (не выше 80° — см. стр. 531) 97. Со-
вершенно сухие вещества — сода и сернистый газ — не вступают
во взаимодействие. Наилучший выход пиросульфита достигается
при влажности соды 14—16%, т. е. соответствующей составу
Na2CO3-H2O, содержащему 14,52% воды. Сода, увлажненная до
такой степени и растертая для уничтожения образовавшихся при
этом комков, остается сухим, сыпучим, легко подвижным материа-
лом. При взаимодействии с сернистым газом образуется продукт,
содержащий 90—94% Na2S2O5 и несколько процентов влаги. При
более значительном увлажнении соды (2—3 моль Н2О на 1 моль
\та2СО3) выход пиросульфита не понижается, но продукт содержит
больше влаги. Вместо моногидрата соды может применяться би-
карбонат натрия.
Сернистый газ должен быть также увлажнен. Сухой газ подсу-
шивает соду быстрее, чем образуется пиросульфит. Чем меньше
содержится в газе SO2, тем большей должна быть его .влажность.
538
Гл. XIV. Соли сульфитного ряда
При пользовании отбросными сернистыми газами, содержащими
0,4—0,5% SO2, относительная влажность их должна быть не
ниже 20%.
При содержании в газе кислорода к соде должен примеши-
ваться в незначительном количестве ингибитор, препятствующий
окислению продукта в сульфат, например диметилпарафенилендиа-
мин (0,05%). Количество сульфата в продукте зависит от содер-
жания кислорода в газе, от количества и рода ингибитора и т. п.
В продукте содержится также незначительное количество непро-
реагировавшей соды, которая при растворении продукта в воде
реагирует с бисульфитом, образуя сульфит. Для реакции между
твердой содой и сернистым газом могут применяться аппараты не-
прерывного действия шнекового или полочного типа и аппараты с
кипящим слоем 112.
Пиросульфит калия
Пиросульфит калия в небольших количествах получают113 на-
сыщением 35—40% раствора К2СО3 сернистым газом, содержащим
6—7,5% SO2. Температуру раствора поддерживают на уровне 55—
60° за счет теплоты газа и теплоты нейтрализации; к концу про-
цесса раствор охлаждают водой для кристаллизации пиросульфита
калия. Отжатые на нутч-фильтре кристаллы содержат 20—25%
влаги. Их сушат в чугунных эмалированных чашах, имеющих шту-
церы для ввода и вывода газа. Сушильным агентом служит серни-
стый газ, содержащий 6—7,5% SO2 и не больше 0,03% влаги.
Температура газа 80—90°, так как выше 100° возможно частичное
разложение верхнего слоя продукта. Выходящий газ имеет темпе-
ратуру около 50°. Пиросульфит натрия также сушат сернистым
газом.
ГИДРОСУЛЬФИТ (ДИТИОНИТ) НАТРИЯ
Получение гидросульфита натрия связано с большими трудно-
стями, обусловленными чрезвычайной нестойкостью этого продукта
в двухводной форме и во влажном состоянии, особенно в присутст-
вии кислорода воздуха вследствие окисления по реакциям
2Na2S2O4 + О2 + 2Н2О = 4NaHSO3
или
Na2S2O4 + О2 + Н2О = NaHSO4 + NaHSO3
Гидросульфит разлагается и в отсутствие окислителя114. В ней-
тральном растворе он сравнительно быстро распадается на тио-
сульфат и бисульфит
2Na2S2O4 + Н2О “ N a2S2O3 4- 2N aHSO3
причем в качестве промежуточного соединения образуется сульф-
оксиловая кислота H2SO2 или в слабощелочной среде сульфокси-
Гидросульфит (дитионит) натрия
539
лат NajSOs. В щелочной среде образуются тиосульфат и сульфит:
2Na2S2O4 + 2NaOH = Na2S2O3 + 2Na2SO3 + H2O
При избытке щелочи гидросульфит количественно взаимодейст-
вует с тиосульфатом (так же как и с полисульфидом):
Na2S2Ot + Na2S2O3 + 4NaOH = 3Na2SO3 + Na2S + 2H.0
Поэтому в сильнощелочном растворе, при 6—9-кратном избытке
щелочи по отношению к гидросульфиту, он медленно разлагается
по суммарной реакции:
3Na2S2O4 + 6NaOH = 5Na2SO3 + Na2S + 3H2O
Производство гидросульфита натрия восстановлением сернистой
кислоты цинковой пылью
Наиболее распространенный промышленный способ получения
гидросульфита натрия основан на восстановлении сернистой кис-
лоты цинковой пылью. Суспензия цинковой пыли в воде обрабаты-
вается 100%-ным сернистым газом; при этом образуется раствор
гидросульфита цинка:
Zn + 2Нг8О3 = ZnS2O4 + 2Н2О
Полученный раствор смешивают с раствором соды:
ZnS2O4 + Na2COa= Na2S2O4 + ZnCO8
После отделения нерастворимого углекислого цинка фильтро-
ванием гидросульфит натрия высаливают из раствора поваренной
солью в форме Na2S2O4 • 2Н2О. Ввиду сильной неустойчивости двух-
водного гидросульфита его подвергают дегидратации и затем су-
шат. Продукт выпускают в виде безводного Na2S2O4, который в от-
сутствие влаги выдерживает длительное хранение.
Цинковая пыль должна просеиваться через сита, имеющие
3600—4900 отверстий на 1 см2, и содержать не менее 95% актив-
ного цинка (определяемого йодометрическим способом) и не более
3% ZnO и 0,05% тяжелых металлов. Водная суспензия цинковой
пыли должна содержать 25% цинка (по весу). Суспензия насы-
щается сернистым газом в стальном реакторе с мешалкой и змее-
виком для охлаждения при непрерывном перемешивании при 40—
50° в течение 1—2,5 ч115. Более быстрое и более медленное насы-
щение ведет к разложению гидросульфита цинка (который еще
более нестоек, чем гидросульфит натрия), в первом случае вслед-
Ствие перекисления раствора сернистым газом, во втором — вслед-
ствие чрезмерного затягивания процесса. Необходимый для
540
Г л. XIV. Соли сульфитного ряда
процесса 100%-ный SO2 получают разложением бисульфита кон-
центрированной серной кислотой (купоросным маслом) в «газовом»
аппарате, представляющем собой стальной котел, футерованный
диабазовой плиткой, со стальной крышкой. О конце процесса гази-
рования судят по изменению цвета суспензии гидросульфита цин-
ка, который из серого переходит в светло-желтый. Получение
100%-ного SO2 разложением бисульфита натрия серной кислотой
является нерациональным методом. Более выгодно производить
обогащение сернистого газа до 100%-ного с помощью циклических
методов (стр. 514).
Полученный раствор гидросульфита цинка вливают в стехио-
метрическое количество 22,5% раствора соды (плотность 1,24 г/см3),
загруженного в стальной аппарат с мешалкой и змеевиком для
охлаждения. Для получения крупнокристаллического, легко отфиль-
тровываемого осадка углекислого цинка, реакционную массу пере-
мешивают 30 мин при 25—35°. При более высокой температуре об-
разуется липкий, плохо фильтрующий осадок основного углекис-
лого цинка. В полученном растворе должно быть не меньше 170г/л
Na2S2O4 и избыток Na2CO3 5—35 г/л. В осадке содержится около
5% Na2S2'O4B виде малорастворимой двойной соли Na2S2O4 • ZnS2O4,
что приводит к потерям гидросульфита с углекислым цинком. От-
фильтрованный осадок промывают сначала слабым 3% раствором
гидросульфита натрия (промывной водой от предыдущей опера-
ции) в количестве 25% от объема фильтрата, а затем водой. Пер-
вую промывную воду добавляют к фильтрату; вторую промывную
воду (содержащую ~3% Na2S2O4) используют для промывки
осадка в последующих операциях. Для стабилизации раствора гид-
росульфита натрия путем увеличения pH раствора в приемник
фильтрата предварительно заливают 35% раствор едкого натра
в количестве 5% от объема фильтрата. Раствор должен содержать
55—65 г/л NaOH и не меньше 120 г/л Na2S2O4.
Раствор гидросульфита (фильтрат, смешанный с первой про-
мывной водой), содержащий около 16% Na2S2O4, передается в ре-
зервуар с мешалкой и змеевиком для охлаждения, где произво-
дится высаливание при понижении температуры от 33—36° до 20—
25°. При непрерывном перемешивании раствора в него вносится
поваренная соль в количестве 28—30 кг на 100 л раствора. Во из-
бежание выделения мелких кристаллов Na2S2O4-2H2O соль добав-
ляют к раствору небольшими' порциями. После 45 мин перемеши-
вания основная масса гидросульфита оказывается в суспензии
в виде относительно крупных кристаллов Na2S2O4 • 2Н-О; маточ-
ный раствор, содержащий 12—16% NaCl, 1,5—2% NaOH, про-
дукты разложения гидросульфита (сульфит, сульфат, тиосульфат)
и от 1 до 25 г/л Na2S2O4 (в системе NaCl—Na2S2O4—Н2О эвтони-
ческий раствор при 25° содержит 1,65% Na2S2O4), декантируется
и сливается в отброс (содержащийся в нем тиосульфат натрия
Гидросульфит (дитионит) натрия
541
может быть выделен и выпущен в качестве побочного продукта
производства).
Кристаллы, содержащие небольшое количество маточного рас-
твора, быстро нагреваются с помощью паровой рубашки при мед-
ленном вращении мешалки до температуры выше 52°, являющейся
точкой перехода дигидрата в безводную соль. При нагревании
до 58—62° дегидратация заканчивается в течение 15—30 мин. Без-
водный гидросульфит отделяют от горячего маточного раствора,
содержащего около 3,4% Na2S2O4; при охлаждении этого раствора
до 25—20° из него можно выкристаллизовать Na2S2O4 • 2Н2О в ко-
личестве 4% от дигидрата, полученного в основном процессе
Дегидратированный гидросульфит натрия с целью удаления
межкристальной жидкости подвергают двукратной промывке эти-
ловым спиртом — сначала 80%-ным, затем 96%-ным — и сушат
в течение 1,5—2,5 ч под вакуумом в токе воздуха, входящего с
температурой 80—100° ( в замкнутом цикле с промежуточной кон-
денсацией паров спирта). Скомковавшийся при сушке продукт раз-
малывают и укупоривают в тару — металлические барабаны. Го-
товый продукт представляет собой порошок сероватого цвета,
содержащий 80—90% Na2S2O4. Вследствие больших потерь от раз-
ложения общий выход гидросульфита составляет 30—40% от тео-
ретического по израсходованному количеству цинковой пыли. Овод-
ненный этиловый спирт регенерируют ректификацией. Расходные
коэффициенты на производство 1 т гидросульфита натрия этим
способом составляют: 0,78 т цинковой пыли (100%), 1,94 г каль-
цинированной соды (100%), 0,51 т каустической соды (100%),
2,3 т серной кислоты (100%), 8,0 т бисульфита натрия (22,5%),
2,2 т поваренной соли (100%), 133 л этилового спирта (96%),
440 квТ'Ч электроэнергии, 2,65 мгкал пара, 330 м2 воды. В каче-
стве отходов на 1 т продукта получаются: 9 т сырого углекислого
цинка, содержащего 20—30% общего цинка, 15—20% общего СО3,
0,35—0,4% железа, 35—45% воды; 0,12 т не вступившего в реак-
цию металлического цинка; 8,5 т раствора из газового аппарата,
содержащего смесь сульфата и бисульфата натрия (1:2); 5,5 м3
холодного маточного раствора после высаливания; 1,75 м3 горя-
чего маточного раствора после дегидратации гидросульфита.
Более совершенный и современный способ освобождения от ос-
татков влаги после дегидратации гидросульфита натрия заклю-
чается в следующем. В центрифугу, где производят отделение кри-
сталлов дегидратированного гидросульфита натрия от маточного
раствора, подают СО2, которая превращает содержащийся в меж-
кристальной жидкости NaOH в Ыа2СОз. Образующийся карбонат
натрия связывает оставшуюся в отфугованной лепешке влагу и
превращается в кристаллогидрат — это приводит к исчезновению
свободной влаги в кристаллах гидросульфита натрия. Приме-
шанный к продукту карбонат натрия помимо этого является и
542
Гл. XIV. Соли сульфитного ряда
стабилизатором гидросульфита. Продукт, выгруженный из центри-
фуги, сушат в вакуум-сушилке при 80®, затем охлаждают, просеи-
вают и укупоривают.
Для высаливания гидросульфита можно вместо NaCl приме-
нять Na2CO3, NaOH или Na2SO3; тогда холодный маточный рас-
твор не будет содержать NaCl и обработкой сернистым газом его
можно превратить в бисульфит натрия, что значительно понизит
затраты на сырье.
Для уменьшения потерь гидросульфита натрия от разложения
в процессе его производства предложено 116 изолировать производ-
ственные растворы, содержащие гидросульфит, от действия атмос-
ферного воздуха, сохраняя их под тонким слоем (10—20 мм)
бензола. При отделении кристаллов гидросульфита от маточного
раствора они также остаются под слоем бензола, а при сушке про-
дукта бензол отгоняется, так же как и спирт. При этом выход про-
дукта может быть повышен до 50—60%94.
За границей имеются установки, производящие до 900 т в ме-
сяц гидросульфита и выпускающие в качестве побочного продукта
500—600 т окиси цинка 117. Для получения ZnO пигментной квали-
фикации предложено перед дальнейшей переработкой очищать рас-
твор ZnS2O4 от тяжелых металлов (железа) катионитом в форме
цинковой соли118. Предложено также вместо цинковой пыли ис-
пользовать гранулированный сплав, содержащий цинк и 1—3,5%
натрия119. Для приготовления гидросульфита цинка применяют
медные реакторы, а для высаливания гидросульфита натрия — эма-
лированные котлы с рубашкой, в которой циркулирует, в зависи-
мости от условий процесса, холодная или горячая вода 12°. Дегидра-
тацию гидросульфита предложено осуществлять парами органиче-
ских жидкостей, температура кипения которых немного выше
температуры дегидратации (СН3ОН, С2Н5ОН, СС14, С6Н6) 121. Для
предотвращения загрязнения гидросульфита цинка примесями, со-
держащимися в цинковой пыли, газирование суспензии рекомен-
дуют вести до достижения установленного заранее определенного
значения окислительно-восстановительного потенциала 122. Предло-
жены также добавки к гидросульфиту натрия с целью уменьшения
его разложения на воздухе — жидкие эфирьщполученные из спир-
тов с пятью и более атомами углерода 123.
Для снижения потерь гидросульфита натрия от разложения при
сушке, необходимо предотвратить гидратацию дегидратированного
Na2S2O4 при его фильтровании и промывке, для чего эти процессы
следует осуществлять при температурах выше температуры пре-
вращения двухводного вещества в безводное, не допуская охла-
ждения фильтруемой суспензии. Можно также вести промывку го-
рячим спиртом, при этом получается продукт, содержащий больше
98% Na2S2O4124. Сушка в атмосфере СО2 также предохраняет про-
дукт от разложения 125.
Гидросульфит (дитионит) натрия
543
Другие способы получения гидросульфита натрия
Гидросульфит натрия может быть получен восстановлением
раствора бисульфита натрия различными восстановителями — цин-
ковой пылью, порошкообразным железом или алюминием, амаль-
гамами цинка или натрия, муравьинокислым натрием или аммо-
нием и др. Наиболее распространенным восстановителем является
цинковая пыль. Применяется концентрированный раствор бисуль-
фита, содержащий 47% NaHSO3. Реакция протекает при 15—25°
по уравнению:
4NaHSO3 4- Zn ™ Na2S3O4 4- Na2SO3 4- ZnSO3 4- 2Н3О
При одновременном насыщении сернистым газом реакция идет
по уравнению:
2NaHSO3 + SO2 4- Zn ™ Na2S2O4 4- ZnSO3 4- Н2О
В отличие от предыдущей реакции, натрий используется пол-
ностью и получаются более концентрированные растворы гидро-
сульфита. При этом образуются также нерастворимые двойные
соли гидросульфита натрия и сульфита цинка, сульфита натрия и
сульфита цинка. Для разрушения двойных солей реакционную
смесь обрабатывают известковым молоком. При этом образуются
осадки Zn(OH)2 и CaSO3, а в растворе остается гидросульфит
натрия, который перерабатывают по способу, описанному выше.
При использовании в качестве восстановителя порошкообраз-
ного железа (электролитического, губчатого) наилучшие резуль-
таты получаются, когда ведут восстановление при 15° раствора,
содержащего около 25% NaHS'O3 и 1 —1,3% свободной H2SO3, что
соответствует рН = 2,4—2,45 126. Для поддержания такой кислотно-
сти в процессе восстановления реакционную массу подпитывают
сернистым газом в количестве 50—65% от стехиометрического
по реакции:
2NaHSO3 4- SO2 4- Fe = Na2S2O4 4- FeSO3 4- H2O
Получаемый раствор содержит 15—17% NagSgCU Лучшим спо-
собом очистки его от примеси растворимых соединений железа
является обработка его гашеной известью-пушонкой при 30-минут-
ном перемешивании. Вследствие каустификации сульфита известью
раствор содержит 1,3—1,4% NaOH; поэтому отпадает необходи-
мость в специальной добавке едкого натра для стабилизации рас-
твора. Осадок сульфита железа, отделенный от раствора гидро-
сульфита, может быть разложен серной кислотой с целью возвра-
щения SO2 в производственный процесс.
Представляют интерес электрохимические способы получе-
ния гидросульфита натрия прямым восстановлением иона HSO3
на твердом катоде или восстановлением амальгамой натрия,
544
Гл. XIV. Соли сульфитного ряда
получаемой электролизом в ванне с ртутным катодом 127-128. Нор-
мальный потенциал окислительно-восстановительной реакции
S2Of~ + 2H2O 2Н5Оз+2Н+ + 2е
равен —0,009 в 129.
Электролиз водных растворов SO2 на твердом катоде очень
сложен. При рН = 0,6—6,2 образуется H2S2O4. При pH < 0,6 на
поверхности катода образуются желто-коричневые маслообразные
сульфаны, а в электролизере появляется тестообразная масса —
смесь сульфанов и серы. Первоначальным продуктом восстанов-
ления при этом также является H2S2O4, которая превращается
в сульфан и SO2. В зависимости от молярного отношения SOo и
H2S2O4 состав сульфанов различен, например, H2S33—H2S,7.
H2S,0-H2S12 и др.130.
Восстановление бисульфита натрия в гидросульфит на твер-
дом катоде происходит в кислой среде, в которой гидросульфит
весьма нестоек. Это приводит к серьезным затруднениям: электро-
лиз приходится вести при высокой объемной концентрации тока
(т. е. при малом объеме католита), при небольшой катодной плот-
ности тока и низкой температуре. Так как процесс образования
гидросульфита сопровождается одновременным образованием ще-
лочи, необходимо непрерывно вводить в катодное пространство
газообразный SO2, разбавленный инертным газом во избежание
перекисления раствора в местах введения газа. Анолитом служит
раствор сульфита натрия. Наиболее целесообразно применение
проточного электролизера с диафрагмой, который дает возмож-
ность получать растворы, содержащие до 180 г Na2S2O4 в 1 л.
Лучшими материалами для катода являются платина, золото, мо-
либден, серебро, свинец, никель. На этих материалах водород вы-
деляется с большим перенапряжением (потенциал восстановления
HSO3 равен —0,163 в, потенциал выделения водорода —0,157 в).
Однако некоторые из этих металлов каталитически ускоряют даль-
нейшее восстановление гидросульфита до тиосульфата:
S2O^ + 2Н+ + 2е = S2O2- + Н2О
При серебряных, титановых и свинцовых катодах потери от
этого процесса минимальны.
Имеется много патентов на использование в качестве восстано-
вителя амальгамы натрия. Необходимость обеспечения при этом
тесного и быстрого контакта амальгамы с раствором NaHSO3 и
раствора с газообразным SO2 связана с довольно сложным кон-
структивным оформлением реакционных аппаратов, снабженных
мешалками с большим числом оборотов. Для интенсивного разме-
шивания предложен, например, аппарат в форме барабана с бы-
стро вращающимся полым валом, через который вводят SO2 и на
Ронгалит
545
наружной поверхности которого имеются щетки для разбрызгива-
ния амальгамы 131',32.
Раствор бисульфита натрия (NaHSO3: Na2SO3 = 10: 1) разла-
гают, перемешивая его с амальгамой натрия при 40°. Выделив-
шиеся кристаллы Na2S2O4-2H2O отфильтровывают и обезвожи-
вают быстрым нагреванием до 60—65°, промывают спиртом и суш-
кой в вакууме. Выход продукта по SO2 70—75%, но он содержит
до 0,002% ртути и поэтому не может применяться в фотографии.
Предложены способы получения гидросульфита натрия и дру-
гих щелочных металлов восстановлением жидким или газообраз-
ным SO2 их боргидридов при температурах от —70 до 70°,33’134.
РОНГАЛИТ
Ронгалит, или сульфоксилатформальдегид ПаНЗОг-СНгО-
•2Н2О, * получают при взаимодействии бисульфита натрия с цин-
ковой пылью в присутствии формалина:
NaHSO3 + СН2О + Zn + Н2О = Zn(OH)2 + NaHSO2 • СН2О
При смешении бисульфита с цинковой пылью е большой ско-
ростью идет реакция
4N aHSO3 4- Zn — N a2S2O4 4- ZnSO3 4- N a2SO3 4- 2H2O
и частично протекают реакции:
2ZnSO3 4- Zn 4- 2H2O = ZnS2O4 4- 2Zn(OH)2
ZnS2O4 4- Na2SO3 = Na2S2O4 4- ZnSO3
При введении в смесь формалина образуется ронгалит
Na2S2O4 4- СН2О 4- Н2О = NaHSO2 • СН2О 4- NaHSO3 \
а выделяющийся при этом бисульфит снова вступает в реакцию
с цинком, но частично (весьма медленно) соединяется с формали-
ном:
NaHSO3 4- CH2O=NaHSO3 • СН2О
Для производства ронгалита 13Б> 136 используют раствор бисуль-
фита, цинковую пыль и раствор формалина. Лучшие выходы по-
лучаются при последовательном вводе в реактор воды, цинковой
пыли, бисульфита и затем, приблизительно через 10 мин, форма-
лина. При этом уменьшается количество образующегося бисульфит-
* Ронгалитом называюттакжегидросульфитформальдегидМа25204 • 2СН2О • 2142О,
.1® М. Е. Позин
540
Г л. XIV. Соли сульфитного ряда
формальдегида NaHSO3-CH2O, который восстанавливается мед-
ленно. Оптимальные условия: температура процесса 90—95°,
содержание SO2 в растворе бисульфита 15—20%. Количество фор-
малина должно быть стехиометрическим. Цинковую пыль вводят
с большим избытком; ее расход достигает иногда 200—205% от
теоретического, причем степень восстановления бисульфита равна
~85%. При смешении реагентов в реакторе с мешалкой восста-
новление идет вначале с большой скоростью, но затем резко за-
медляется вследствие экранирования реагирующей поверхности
частиц цинка образующейся гидроокисью цинка. Этим и объяс-
няется большой расход цинковой пыли. Скорость, а следовательно,
и степень восстановления возрастают при увеличении дисперсно-
сти цинковой пыли. При использовании пыли со средним разме-
ром частиц 22 мк (95%) в количестве 130% от теоретического при
оптимальных условиях за 3 ч степень восстановления NaHSO3 рав-
нялась ~40% и степень использования цинка ~30%; при среднем
же размере частиц 4 мк (92%) степень восстановления увеличи-
лась до 81%, а степень использования цинка до 63%. Для ускоре-
ния процесса предложено137 осуществлять его в вибрационных
мельницах с цинковыми шарами, где создаются условия для уда-
ления Zn(OH)2 с поверхности частиц цинка. Здесь при загрузке
цинковой пыли в количестве ПО—120% от теоретического за 3 ч
степень восстановления NaHSO3 равна 92—95%. Так как при этом
расходуется и цинк, из которого изготовлены шары, общий расход
цинка составляет 150—160% от теоретического. Но изготовление
цинковых шаров дешевле, чем цинковый пыли. Замена цинковых
шаров стальными невозможна, так как при этом степень восста-
новления не превышает 20%.
Безводный ронгалит весьма устойчив, но во влажной атмосфере
постепенно разлагается. Двухводный ронгалит разлагается с вы-
делением кристаллизационной воды, которая далее еще больше
ускоряет разложение. Разбавленные растворы разлагаются значи-
тельно быстрее концентрированных, так как уменьшение величины
pH ускоряет разложение 138’*39 Гигроскопическая точка двухвод-
ного ронгалита равна 60%. Давление водяного пара над двухвод-
яым ронгалитом можно подсчитать по приближенной формуле140
2125
1g Р = 8,26---jr- (здесь Р в мм рт. ст.) .В атмосфере, насыщенной
водяными парами, двухводный ронгалит разлагается со скоростью
в ~6 раз большей, чем в сухой среде.
Отход от производства ронгалита, так называемая окшара, со-
держит гидроокись и окись цинка с примесью соединений серы.
Ее перерабатывают в цинковые белила. Разработан электрохими-
ческий способ регенерации цинка из окшары; его получают в фор-
ме губки, которая по активности в процессе производства ронга-
лита не уступает цинковой пыли 141.
Тиосульфат натрия
847
ТИОСУЛЬФАТ НАТРИЯ
Химические основы образования тиосульфата
Существует много способов получения тиосульфата натрия, в
основе которых лежат разные реакции. Производственное значение
имеют главным образом следующие:
сульфитный способ
Na2SO3 4- S = Na2S2O3
гидросульфидный способ
2NaHS + 4NaHSO3 = 3Na2S2O3 + ЗН2О
сульфидный способ
2Na2S 4- Nа2СО3 4- 4SO2 ™ 3Na2S2O3 4“ СО2
сероводородный способ
2H2S 4- 2Na2SO, 4- 2NaHSO3 = 3Na2S2O3 4- 3H2O
дисульфидный (полисульфидный)
2Na2S2 4- 6NaHSO3 = 5Na2S2O3 4- 3H2O
или, в общем виде:
2Na2Sn 4" 6NaHSO3 4- (2п — 4) Na2SO3 — (2ft 4- 1) Na2S2O3 4- ЗН2О
Кроме того, тиосульфат натрия получается в качестве побоч-
ного продукта в производстве гидросульфита и при очистке про-
мышленных газов от серы. Его можно получать также сульфат-
ным способом, используя NazSO.}. Из методов, уже утративших
промышленное значение, следует упомянуть действие смеси серни-
стого газа и кислорода (воздуха) на раствор сернистого натрия
(2Na2S + 2SOo + O2 = 2Ма2820з) и окисление сернистого кальция
(отвала от производства соды) кислородом воздуха в тиосульфат
кальция с последующим обменным разложением с сульфатом
натрия.
Механизм образования тиосульфата был предметом многочис-
ленных исследований Высказывались предположения, что в по-
строении сульфоксиловой, тиосерной и политионовых кислот уча-
ствует моноокись серы:
H2SO2 H2S2O, - H2S|Og HgS^.Og
SO-H2O 2SO • H2O 3Sp-SO2 -H2O 5SO-H2O
На -основании этого следовало бы считать, что ангидридом
тиосерной кислоты является димер (SO)2. Присутствие в газооб-
разной- моноокиси серы ассоциированных молекул, в частности
(SO)2, было установлено спектрографически’42. Однако изучение
Рефракции содержащих серу соединений 143 приводит к выводу, что
18:*
548
Гл. XIV. Соли сульфитного ряда
тиосульфат является продуктом сочетания сульфита с атомарной
серой. Это согласуется со взглядами Менделеева, считавшего тио-
серную кислоту продуктом присоединения серы к сернистой кис-
лоте, подобно серной кислоте — продукту присоединения кислорода
к сернистой кислоте 144.
На этом основании механизм образования тиосульфата при
получении его гидросульфидным способом представляется следую-
щим 145. Вначале гидросульфид, взаимодействуя с бисульфитом,
образует в качестве промежуточного продукта тиосернистую кис-
лоту:
HS~ + HSOj S2O^ + Н2О
Ионы водорода, появляющиеся вследствие диссоциации бисуль-
фита
8HSOJ 3SO|" + ЗН*
вступают в реакцию с новым количеством гидросульфида и с тио-
сернистой кислотой, образуя элементарную серу:
HS~ + S2O|_ + ЗН+ = 38 + 2Н2О
Выделяющаяся сера в активном состоянии реагирует с сульфид
том, образуя тиосульфат!
3SO|_ + 3S-3S2O|_
Суммарное уравнение процесса:
2HS" + 4HSO3 = 8S2O|" + ЗН2О
При отношении HS_ : HSO.7, равном 1 : 2, в результате проме-
жуточных реакций образуются эквивалентные количества сульфита
и серы, связывающиеся в тиосульфат, чем исключается появление
побочных продуктов.
При получении тиосульфата сульфидным способом 1461 147 по об-
щему уравнению
2S2’ + СО2- + 4SO2 = 3S2O^~ + СО2
вначале образуются сульфит и гидросульфид:
СО?“ + SO2 = SOf- + СО2
S2- + 8О2 + Н2О = so|~ + H2S
S2- + H2S = 2HS_
Гидросульфид, реагируя с SO2, Также превращается в сульфит:
2HS" + SO2 + Н2О = SO2-+ 2H2S
Тиосульфат натрия
549
Выделяющийся сероводород, взаимодействуя с сернистым га-
дом, образует тиосернистую кислоту, которая далее окисляет серо-
водород до серы:
H2S + SO2 + Н2О = H2S2O2 + Н2О
H2S + H2S2O2 = 3S + 2H2O
И, как и в предыдущем способе, тиосульфат образуется в ре-
зультате реакции сульфита с серой:
3SO^~ + 3S = 3S2O^“
Наибольший выход тиосульфата достигается при отношении
исходных реагентов Na2CO3: Na2S, равном 1 : 2, когда образуются
эквивалентные количества сульфита и серы.
Образование тиосульфата натрия при взаимодействии сульфита
,натрия с серой является частным случаем целого класса реакций.
Подобно тиосульфатам получаются селеносульфаты при взаимо-
действии серы или селена с сульфитом щелочного металла, аммо-
ния или кальция 148.
При образовании тиосульфата (так же как и полисульфидов)
имеет важное значение гидролиз серы как первичная стадия про-
цесса. Установлено149, что при кипячении порошка серы с водой
гидролиз идет по реакции:
2S + 2Н2О = H2S + H2SO2
Вследствие крайней неустойчивости сульфоксиловая кислота
разлагается при pH < 7 по реакции
2H2SO2 = SO2 + S + 2Н2О
а при pH > 7 по реакции:
2H2SO2 = S2O|" + Н2О + 2Н*
Нагревание серы в щелочном растворе в токе азота приводит
к образованию полисульфидов:
12S + 6ОН~ = 2(S • S4)2-+ S2O2f + ЗН2О
При этом вначале, очевидно, образуется сульфид, связываю-
щий затем свободную серу. Максимальное количество серы, свя-
зываемое Na2S, вероятно, соответствует образованию Na2S5, что
следует из опытов по диализу. С течением времени идет дальней-
ший гидролиз полисульфида:
2(S • S4)2- + 6Н2О = 2S2O|- + 6H2S
Сульфидный способ
Этим способом в СССР производили раньше значительные ко-
личества тиосульфата натрия. В настоящее время его производят
Другими способами. Применявшаяся и описанная ниже схема
550
Гл. XIV. Соли сульфитного ряда
производства является несовершенной. Использование этого спо-
соба в отдельных случаях может оказаться рациональным при
более современном аппаратурном оформлении.
Рис. 165. Схема производства тиосульфата
натрия сульфидным способом:
'Z — резервуар для щелока сернистого натрия; 2 — на-
порный бак для щелока; 3 — бак для горячей воды;
4 — абсорбционная башня; 5 —сборник тиосульфатного
щелока; 6 — фнльтрпреСс; 7 —сборник фильтрован-
ного щелока; 8 — напорный бак; 9 — подварочный ко-
тел; 10 — уварочный котел; // —холодильник; — кри-
сталлизатор; ]3 — центрифуга; 14 — выщелачиватель
шлама.
Схема производства тиосульфата натрия сульфидным способом
показана на рис. 165. Исходный щелок, содержащий 120—130 г/л
Na2S и 60—ВО г/л Ыа2СОз, готовили растворением соды в щелоке Я
сернистого натрия или по- Я
лучали при растворении Я
осадков, образующихся в Я
производстве сернистого Я
натрия и извлекавшихся Я
из выпарных котлов (стр. >Я
488). Щелок насыщали Я
6—7%-ным сернистым га- Я
зом в керамической аб- Я
сорбционной башне, наса- Я
женной керамическими Я
кольцами. Щелок, стекая Я
по насадке навстречу га- Я
зовому потоку, в нижней ;Я
части башни поглощает Я
SO2, а в верхней — H2S Я
(стр. 548). Башня должна Я
иметь высоту, достаточ- Я
ную для полного поглоще- И
ния сероводорода (6м при .
диаметре 1 м). Макси- Я
мального выхода тиосуль- Я
фата достигали ири плот- Я
ности орошения насадки Я
~ 1 м3/(м2 • ч); уменыпе-. Я
ние плотности орошения Я
от 6 до 1 м3/(м2 • ч) уве- Я
личивало выход от 63 до Я
84%, дальнейшее умень- Я
шение интенсивности оро- Я
шения приводило к сни- Я
жению выхода. После Я
8—10-дневной непрерывной работы башню промывали горячей Я
водой, так как насадка забивалась шламом, вносимым со щело- Я
ком, и осадком кремневой кислоты, содержащейся в щелоке сер- Я
нистого натрия в виде силиката натрия и выделяющейся , из ще- Я
лочного раствора во время его нейтрализации сернистым газом. Из Я
башни вытекал разбавленный тиосульфатный щелок (250—300 г/л Я
Na2S2Os), нагретый вследствие экзотермичности реакции до 35—45°. Я
Щелок после фильтрации иа фильтрпрессе поступал на выпарку. Я
Тиосульфат натрия
551
Выпарку производили в открытых котлах с паровым обогревом в
две стадии. В первой стадии щелок выпаривали до концентрации
/~450 г/л Na2S2O3. Конечная концентрация Na2S2O3 в щелоке на
разных заводах была в пределах 48—57% (700—900 г/л). Щелок
отстаивали от осадка, содержащего Na2SO3, Na2SO4, NaCl, Na2S2O3,
и сливали. Чем выше конечная концентрация щелока, тем больше
выделяется осадка и тем больше теряется с ним тиосульфата. Оса-
док собирали и перерабатывали отдельно разваркой в горячей воде
с целью растворения тиосульфата. Полученные при разварке рас-
творы присоединяли к щелоку, вытекающему из башни. При пред-
варительном выпаривании щелока в подварочном котле (первая
стадия) его кипятили 28 ч при 101—104°, затем подвергали от-
стаиванию от осадка в течение 8 ч. Окончательное выпаривание
вели также 28 ч при 104—110°. После вторичного отстаивания от
осадка в течение 2 ч выпаренный щелок охлаждали до 60—62° в
течение 2—2,5 ч в холодильнике, а затем направляли в кристалли-
заторы. Выделившиеся при охлаждении щелока до 20—30° кри-
сталлы Na2S2O3-5H2O сортировали на три сорта (реактивный, фо-
то, технический) и каждый сорт в отдельности отделяли от рас-
твора на центрифуге. Маточный раствор возвращали на выпарку.
Растворимость как сульфита, так и сульфата натрия значи-
тельно снижается при увеличении концентрации тиосульфата (рис.
166). Так как растворимости сульфата и сульфита отличаются не
сильно, можно выразить условно суммарную концентрацию Na2SO4
и Na2SO3 в щелоке, поступающем на выпарку, через концентра-
цию Na2SO3. Затем, сопоставляя растворимости в системе
Na2S2O3—Na2SO3—Н2О при температуре выпарки и при конечной
температуре кристаллизации, можно определить состав получае-
мого тиосульфата. При этом содержание в нем Na2SO4 и Na2SO3
будет выражено через Na2SO3.
На рис. 167 даны изотермы растворимости в системе Na2S2O3—
Na2SO3—Н2О при 80 и 25° (изотерма 80° расположена выше изо-
термы 25°, потому что растворимость сульфита натрия, как и суль-
фата, с повышением температуры несколько понижается). Состав
исходного щелока изображается точкой тх. Выпариваемой при 80°
Щелок вскоре насыщается сульфитом (точка т2), после чего при
Дальнейшем выпаривании выделяется осадок безводного сульфита.,
а состав раствора изменяется вдоль изотермы от т2 по направле-
нию к эвтонической точке Bso- Допустим, что выпарка прекращает-
ся, когда точка системы достигла т3, а состав раствора изобра-
жается .точкой п. После отделения выпавшего осадка Na2SO3 ос-
тавшаяся новая система (и) охлаждается до 25°. При этом точка
п оказывается в области abE2s, соответствующей совместной кри-
сталлизации Na2S2O3-5H2O и Na2SO3-7H2O. Поэтому при охлаж-
дении до 25° состав раствора окажется в эвтонической точке Е25,
а состав выделившихся кристаллов изобразится точкой к. Таким
552
Гл. XIV. Соли сульфитного ряда
образом, кристаллы будут состоять из тиосульфата с небольшой
примесью сульфита (и сульфата). Соотношение между тиосульфа-
том и примесью определяется отношением отрезков ак : Ьк. При ме-
нее глубокой выпарке примеси будет меньше или даже она будет
совершенно отсутствовать (когда точка п окажется в поле кри-
сталлизации Na2S20s • 5Н2О), однако уменьшится и выход тиосуль-
фата при кристаллизации.
Рис. 166. Изотерма 25° растворимости в системе
Na2S2O3—Na2SO3—Na2SO4—Н2О (концентрации растворов
выражены в г на 100 г воды).
Поли кристаллизации:
/-Na2SO4 • 10H2O; II - Na2SO4 • 7Н2О; III - Na2SO4 • 10Н2О+
+ Na2S2O3 • 5Н2О (смешанные кристаллы); IV — Na2S2O3 • 5Н20.
Количество выпариваемой воды может быть сокращено в 1,5—
2 раза, если применять исходный щелок с содержанием не 120—
130, а 250—270 г/л Na2S и разбавлять его до концентрации 120 г/л
маточными щелоками от кристаллизации тиосульфата, вместо того
чтобы направлять их на выпарку. Присутствие тиосульфата в ще-
локе не мешает протеканию основной реакции.
На 1 т товарного тиосульфата, получавшегося по описанной
выше схеме, расходовали 0,56 т 62,5%-ного Na2S в виде щелока,
0,68 г 45%-ного серного колчедана для получения необходимого
количества сернистого газа и 0,05 г кальцинированной соды (в рас-
чете на 95%-ную).
Тиосульфат натрия
553
При получении тиосульфата в результате побочных реакций
образуются политнонаты, разлагающиеся с течением времени с вы-
делением серы. Это приводит к пожелтению кристаллов тиосуль-
фата иногда уже прн их кристаллизации, иногда при хранении.
Рис. 167. Схема определения состава получаемого тиосульфата натрия
по изотермам равновесия в системе Na2S2O3—Na2SO3—Н2О.
Предотвратить это можно148 добавкой соды в горячий щелок перед
его фильтрованием (~3 кг на 1 т готового продукта):
Na2S3Oe 4- Na2CO3 ™ Na2S2O3 + Na2SO.| 4- СО2
Полисульфидный способ
Для 'Приготовления раствора полисульфида Na2S2 используют
горячий раствор сернистого натрия (70°), обычно щелок, получае-
мый при выщелачивании плава сернистого натрия. Этот щелок
имеет плотность 1,264 г!смъ и приблизительно следующий состав
(в °/о): 20 — Na2S, 2 — Na2S2O3, 2,5— Ыа2СОз, 1,5 — Na2SO-4. В нем
554
Дл, XIV. Соли сульфитного ряда
растворяют стехиометрическое количество молотой комовой или
базовой серы. Применение тонкоизмельченной серы нежелательно,
так как при этом увеличивается выделение сероводорода. К рас-
твору полисульфида прибавляют медленно (во избежание силь-
ного его вспенивания и выброса) раствор бисульфита натрия до
нейтральной реакции. Получение полисульфида и нейтрализа-
цию его бисульфитом осуществляют в стальном варочном котле,
снабженном паровым змеевиком и мешалкой, вращающейся со
скоростью 30 об]мин. Полученный разбавленный раствор тио-
сульфата фильтруют и перерабатывают на кристаллический про-
дукт теми же приемами, которые применяются в сульфидном
методе.
Степень использования сырья в производстве тиосульфата по-
лисульфидиым методом составляет: сернистого натрия 84—85%,
бисульфита ~92%, серы ~90%. На 1 г тиосульфата натрия рас-
ходуют: 0,235 г сернистого натрия (62%), 0,056 г комовой серы,
1,45 т бисульфита натрия, 3,5 г пара, 2,5 л3 воды, 40 кет • ч электро-
энергии. Так как сырье (сернистый натрий, бисульфит) вводится
в производство в виде водных растворов, то на каждую тонну вы-
пускаемого продукта необходимо выпаривать ~870 кг воды — по-
чти половину количества воды, содержащейся в слабом растворе
тиосульфата. Однако производство тиосульфата полисульфидным
методом может быть организовано по замкнутой циклической схе-
ме, позволяющей полностью устранить из производственного про-
цесса выпарку тиосульфатного щелока 15°. По этой схеме раство-
рение соды для приготовления бисульфита должно вестись не в
воде, а в оборотном маточном растворе от кристаллизации тио-
сульфата. Полученный тиосульфатно-содовый раствор обрабаты-
вают обычным способом сернистым газом, после чего тиосульфат-
но-бисульфитный щелок направляют на реакцию с полисульфидом
натрия. При этом образуется концентрированный раствор тио|
сульфата, который после фильтрования можно направлять непо]
средственно на кристаллизацию. I
Несмотря на отсутствие выпарки, при работе по этой схеме из
раствора тиосульфата также выделяются загрязняющие его при!
меси в виде осадков, отделяемых фильтрованием перед кристалли-
зацией. В тиосульфатном маточном растворе, почти независимо от
его концентрации, можно растворить значительное количество со-
ды (~150 г/л). В процессе обработки сернистым газом сода пере-
ходит в бисульфит, растворимость которого в присутствии тиосуль-
фата также очень высока и который высаливает из раствора суль-
фат, являющийся постоянной примесью в маточном растворе.
Когда после реакции бисульфита с полисульфидом образуется
тиосульфат, то, переходя в раствор, он высаливает то же количе-
ство примесей (Na2SO3, Na2SO-i, NaCl), которое выделяется и при
выпарке раствора до той же концентрации тиосульфата.
Тиосульфат натрия
555
Сульфитный способ
Сульфитный способ получения тиосульфата натрия заключает-
ся в растворении тонкоизмельченной серы в горячем растворе
сульфита натрия. Эта реакция протекает с малой скоростью осо-
бенно вначале, когда идет медленное смачивание серы; для уско-
рения этого процесса рекомендуют добавлять в раствор катионно-
активные вещества — бромиды амил-, октил-, децил-, додецил-, тет-
радецил-, бензил- и цетилпиридина 151 и другие, или производить
предварительное измельчение серы в смеси с маточным раствором
тиосульфата 152.
Варку раствора сульфита с серой производят в чугунном реак-
торе с мешалкой и паровой рубашкой. В реактор загружают воду,
безводный сульфит, 40—41% раствор NaOH (4 л на 100 л воды)
для предотвращения разложения сульфита и серу. Варку ведут
3—5 ч при 90—100°. К концу варки плотность раствора достигает
1,57 г/см3 и содержание сульфита в нем снижается до 1 —1,5% По-
лученный раствор имеет щелочную реакцию и усредняется раство-
ром бисульфита натрия, к которому предварительно добавляют
кальцинированную соду (3 кг на 50л раствора бисульфата).Усред-
нение продолжается 1 ч при 60—80°. Его производят для пере-
вода избыточной щелочи и образующихся в процессе варки суль-
фида и дисульфида натрия в сульфит и тиосульфат:
NaOH + N aHSOs = Na2SO3 + Н2О
2N a2S 4- 6N aHSO3 = 3N a2S2O3 4- 2N a2SO3 4- ЗН2О
2Na2S2 + 6NaHSOj = 5Na2S2O3 4- ЗН2О
Присутствие некоторого количества ЫагЗОз в растворе необ-
ходимо как стабилизатора для создания определенного значения
pH, а также для перевода политионатов в устойчивый тритионат и
тиосульфат:
S5°6~ + 2S0= S3°6~ + 2S2°3-
S4Og 4- SO3 = S3O2 4- S2O|
Усредненный раствор отфильтровывают от примесей и направ-
ляют на кристаллизацию.
Сульфитный способ получения тиосульфата отличается боль-
шой простотой и высокой степенью использования сырья. Для про-
изводства 1 г тиосульфата натрия расходует 0,61 т сульфита нат-
рия сорта «фото» (в расчете на 90%-ный), 0,2 т серы (100%),
Ч>01 т кальцинированной соды (100%), 0,04 т каустической соды
vO0%) и од т бисульфита натрия (22,5%).
see
Гл. XIV. Соли сульфитного ряда
Получение тиосульфата натрия при мышьяково-содовой
очистке газов
В процессе очистки от сероводорода коксового и других газов
мышьяково-содовым методом, помимо основной реакции
Na3AsS3O + HgS — Na3AsS4 -I- HgO
протекают побочные реакции, в частности взаимодействие серово-
дорода со щелочами, приводящее к образованию NaHS. При реге-
нерации рабочего раствора кислородом воздуха тиомышьяковый
натрий переходит в тиооксимышьяковый натрий с выделением
серы
2Na3AsS4 + О2 = 2Na3AsS3O + 2S
а гидросульфит окисляется в тиосульфат:
2NaHS -Ь 2О2 ~ NagSgOs + HgO
Помимо тиосульфата в растворе накапливаются также сульфат
и роданид натрия (образующийся из содержащихся в очищаемом
газе цианистых соединений). Содержание в рабочем растворе тио-
сульфата больше 250 г/л и сульфата натрия больше 40 г/л заметно
снижает поглотительную способность мышьяково-содового рас-
твора, часть которого поэтому должна выводиться из цикла и за-
меняться свежим. Из отработанного раствора выделяют тиосуль-
фат натрия. Для этого часть регенерированного раствора, после
отделения от него серы на вакуум-фильтре, выпаривают в вакуум-
выпарном аппарате до плотности 1,48—1,52 г/сл3. Образующийся
при выпарке осадок, содержащий в частности Na2SO4, отделяют
отстаиванием или на друк-фильтре и раствор охлаждают в шнеко-
вом кристаллизаторе до 25—30°. Выделившиеся кристаллы тио-
сульфата натрия отделяют от маточного раствора центрифугиро-
ванием и выпускают в качестве технического продукта 153.
Чистый тиосульфат натрия (сорт «фото») получают перекри-
сталлизацией технического продукта. Для этого приготовляют рас-
твор тиосульфата плотностью 1,45 г!см3 при нагревании до 65—80°
и обрабатывают его 3—4 ч двуокисью углерода для осаждения
сернистых соединений мышьяка. После отделения осадка из рас-
твора выкристаллизовывают чистый тиосульфат. Если технический
продукт загрязнен роданистыми соединениями, то для получения
из него фотографического тиосульфата необходима двойная пере-
кристаллизация 154—156 д0 перекристаллизации в продукте содер-
жится 94—98% Na2S2O3-5H2O, 2—4,5% NaCNS, 0,17—1,7%
NaHCO3. 0,03—0,17% As2O3; после первой перекристаллизации
97—98,5% Na2S2O3 • 5Н2О, 0,2—1,45% NaCNS, 0-0,4% NaHCO3 и
0,015—0,05% As2O3; после второй перекристаллизации 99,2—99,7%
Na2S2O3• 5Н2О, от следов до 0,03% As2O3, NaCNS и NaHCO3 от-
сутствуют.
Тиосульфат натрия
557
В процессе выпарки раствора тиосульфата содержащиеся в нем
политионаты могут быть разложены сульфидом натрия; оптималь-
ными для такого разложения являются температура 45—55° и
рН = 8157.
Другие способы производства
Среди других способов получения тиосульфата прежде всего-
следует обратить внимание на сероводородный способ, так как он,
в отличие от описанных выше, не требует в качестве сырья ценных
материалов — сернистого натрия и серы, а использует сероводород
любой концентрации, который является отбросом многих произ-
водств. Путем насыщения в абсорбционной башне сернистым га-
зом раствора соды подготовляется исходный сульфит-бисульфит-
ный раствор, содержащий около 220 г/л Na2SO3 и 180 г/л NaHSOe.
Этот раствор направляют в другую башню, где происходит абсорб-
ция сероводорода. Вытекающий из башни раствор тиосульфата
фильтруют и направляют, как обычно, на выпарку и кристалли-
зацию.
Важным условием проведения реакции поглощения сероводо-
рода является эквимолекулярное соотношение Na2SO3: NaHSO3 в
исходном растворе. Оптимальное значение pH раствора равно 6,3.
Без заметного понижения выхода допустимы колебания лишь на
0,05 pH в ту и другую сторону. При значительном отклонении от
эквимолекулярного соотношения (больше 10%) выход тиосуль-
фата сильно падает, а содержание в растворе примесей (главным
образом политионатов) увеличивается. Оптимальная температура
реакции 20—30°.
Сероводородный способ также возможно осуществить без вы-
парки. Для этого соду растворяют в тиосульфатном маточном рас-
творе и полученный раствор обрабатывают сернистым газом до
образования раствора, содержащего сульфит и бисульфит в экви-
молекулярном соотношении.
Сульфатный метод позволяет получать тиосульфат без затраты
соды или продуктов, из нее изготовляемых (сульфита, бисуль-
фита) 158. В основе его лежит реакция:
Na2SO4 + СаО + S + SO, = Na2S2O3 + CaSO4
В раствор сульфата натрия вводят известь и серу и суспензию
перемешивают при 70—80° в течение 3 ч. Затем реакционную массу
обрабатывают сернистым газом при температуре не выше 65° во
избежание потери серы в виде сероводорода. Вначале, вероятно, об-
разуются сульфид, полисульфид и тиосульфат кальция, которые
вступают в обменное разложение е сульфатом натрия, давая тио-
сульфат натрия, а также сульфид и полисульфид натрия. Послед,-
Ние, взаимодействуя с сернистым газом, также переходят в тио-
сульфат. Помимо ^того сульфат натрия частично каустифицируется
558
Гл. XIV. Соли сульфитного ряда
известью с образованием едкого натра и гипса. Едкий натр, реа-
гируя с сернистым газом, образует сульфит, переходящий в при-
сутствии серы в тиосульфат.
Источником тиосульфата могут служить сточные воды произ-
водств некоторых органических продуктов159' 18°. Так, сточные воды
производства тиокарбанилида содержат 19—20% Na2S2O3, 4—5%
NaHS, 11 — 12% Na2SO3 и 2—3% органических веществ. Их смеши-,
вают с раствором щелочи в варочном котле, снабженном рамной
мешалкой, змеевиком и барботером. В котел вводят серу и желез-
ный купорос (для обесцвечивания), перемешивают реакционную^
массу 3 ч и продувают через нее при 94—96° в течение 3 ч воздух.
По окончании окисления раствор отфильтровывают от примесеи
и направляют на кристаллизацию тиосульфата натрия.
Фильтраты из производства сернистых красителей содержат
18—27% Na2S2O3161; очисткой их от примесей, выпариванием и
кристаллизацией можно получить тиосульфат сорта «фото».
При взаимодействии сульфита натрия с пента- и тетратионатом
натрия образуются тиосульфат, а также тритионат:
Na2S3O3 -f- 2Na2SO3 == 2Na2S2O3 Н- Na2S3O3
N a2S4O6 -Ь Na2SO3 — Na2S2O3 + Na2S3O3
При кипячении раствора 1 —1,5 ч в присутствии сульфита три-
тионат почти полностью разлагается с образованием тиосуль-
фата 162. В этих условиях тиосульфат образуется в результате гид-
ролиза тритионата, а сульфит натрия служит буфером, защищаю-
щим ионы S2O3~ от дальнейшего распада под влиянием ионов Н+.
В некоторых иностранных патентах предложено получать тио-
сульфат натрия распылением расплавленного натрия в атмосфере
SO2 с помощью вращающегося диска или сопла, через которое по-
дается струя SO2, или взаимодействием амальгамы натрия с раз-
ными растворами.
Обычный товарный продукт, пятиводный тиосульфат натрия
Na2S2O3 • 5Н2О, содержит 36,3% кристаллизационной воды. Безвод-
ный тиосульфат натрия вырабатывается пока в небольших коли-
чествах нагреванием пятиводной соли до полного обезвоживания.
При этом вследствие сильных местных перегревов происходит зна-
чительное разложение тиосульфата с выделением элементарной
серы. Поэтому при растворении безводного тиосульфата, получен-
ного таким методом, образуются мутные растворы. ;
Обезвоживание без разложения может быть произведено 163 пла!
влением пятиводной соли при 48° в аппарате открытого типа или
в вакуум-аппарате. Расплав выпаривают до содержания в нем
78—82% Na2S2O3 и выливают на холодильные вальцы, где он за-
стывает в прозрачную, стекловидную массу, состав которой соот-
ветствует примерно двухводному тиосульфату. Застывшую соль в
виде чешуек направляют на вторую стадию обезвоживания в су-
Тиосульфат аммония
559
шилку, где ее сначала подсушивают при температуре не выше 62®
(во избежание плавления); затем температуру сушки поднимают
до 80—100° и продукт досушивают до безводного состояния.
Безводные или малогидратированные тиосульфаты натрия и
аммония можно получать обработкой их растворов органическими
веществами, хорошо растворимыми в воде, но не образующими с
водой азеотропных смесей и не растворяющих тиосульфатов. Если
обрабатывать пятиводный тиосульфат метиловым спиртом, нагре-
тым до 60°, то при охлаждении массы до 30° будет выкристалли-
зовываться малогидратированный тиосульфат, который затем мо-
. жет быть окончательно обезвожен сушкой в вакууме при 50°. Ме-
тиловый спирт после отделения тиосульфата можно подвергнуть
дистилляции.
ТИОСУЛЬФАТ АММОНИЯ
Промышленные способы получения тиосульфата аммония анало-
гичны способам получения тиосульфата натрия или сводятся к об-
менным реакциям между тиосульфатом натрия и солями аммония;
однако во всех случаях продукт образуется более загрязненным.
Чистый продукт получается по сложному и дорогому способу, в
основе которого лежит обменная реакция между тиосульфатом
кальция и карбонатом аммония.
Высококачественный тиосульфат аммония может быть получен
при действии концентрированного сероводорода при невысокой
температуре на раствор сульфит-бисульфита аммония по реакции:
2NH4HSO3 + 2(NH4)2SO3 + 2H2S = 3(NH„)2S2O3 + ЗН2О
Выпарка растворов тиосульфата аммония, во избежание его
разложения с образованием сульфата и серы, должна произво-
диться в вакууме при температуре ниже 80°164.
Тиосульфат (как и сульфат) аммония можно получить, пропу-
ская воздух при 150—160° и давлении 20—30 ат через содержащую
сероводород аммиачную воду коксовых и газовых заводов. Про-
цесс ускоряется в присутствии катализаторов — переносчиков кис-
лорода—солей меди, кобальта, никеля и других или активирован-
ного угля 165> 168.
Тиосульфат аммония можно также получать обработкой
раствора сульфита аммония элементарной серой в присутствии сво-
бодного аммиака, который предохраняет сульфит от разложения
при повышенной температуре (выше 80°) и высаливает часть тио-
сульфата. Маточный раствор после отделения этой части высолен-
ного тиосульфата возвращают в процесс. Для его ускорения тем-
пературу после начала реакции повышают до ПО—130°187.
Запатентован способ получения тиосульфата аммония насы-
щением NH3 и SO2 раствора, получаемого смешением в отноше-
нии 1;5— ю 65% раствора полисульфида аммония и раствора,
560
Гл. XIV. Соли сульфитного ряда
содержащего 800 г/л (NH4)2S2O3. Насыщение газами ведут при из-
бытке аммиака и при температуре не выше 80°. Затем, охлаждая
раствор, выкристаллизовывают тиосульфат аммония, а маточный
раствор возвращают в процесс 168. Запатентован способ предотвра-
щения разложения безводного тиосульфата аммония добавкой к
нему (0,01—10%) аммонийной соли слабой кислоты (угольной,
фосфорной, фталевой, лимонной) 169.
При производстве солей, рассмотренных в настоящей главе, че-
рез неплотности в аппаратах в воздух рабочих помещений могут
проникать сернистый газ и сероводород. Эти газы вредны для здо- 1
ровья. Поэтому аппараты должны быть герметичными или соеди- 4
няться с вентиляционным устройством. Предельно допустимыми j
концентрациями у рабочего места являются: для сернистого анги-j
дрида 0,02 для сероводорода 0,01 мг в 1 л воздуха. 1
ЛИТЕРАТУРА
1. П. А. Ходунов, Автореф. канд. дисс., ВММА, 1950. — 2. Э. И. Па-’
цаускас, Автореф. канд. дисс., АН ЛнтССР, Вильнюс, 1952. — 3. N. К о п о-
р i k, Monatsch. chem., 84, № 6, 1243 (1953).—4. R, Н. Sahasrabudney,
Current Sci., 22, № 3, 74 (1953). — 5. Я. Й. Зильберман, Труды ГИПХ, в. 35,
1941, стр. 3. — 6. 3. П. Р о з е н к н о п, Извлечение двуокиси серы из газов, Гос-
химиздат, 1952. — 7. Н. А. Василенко, ЖПХ, 21, № 9, 917 (1948); 22, № 4,
337 (1949); 23, № 5, 472 (1950); 26, № 6, 650 (1953). — 8. Н. А. Василенко,
Научио-техн. информ, бюлл. НИУИФ, в. 5—6, 105 (1957). — 9. Е. Т е г г е s,
Е. Hahn, Gas u. Wasserfach., 70, 309, 339, 363, 389 (1927). — 10. F. I s c h i k a-
w a, H. H a g i s a w a, Bull. Inst. Phys. Chem. Res. (Tokyo), 10, 166 (1931).
11. F. Ischikawa, T. Mur о ok a, Sci. Rep. Tohoky, Imp. Univ., 22, 201
(1933). —/2. И. H. Кузьминых, E. Л. Яхонтова, В. Г. Воробьева,
Труды МХТИ, в. 22, 1956, стр. 202. — 18. Е. М. Я к и м е ц, М. С. Архипова,
Труды УНИХИМ, в. 1, 1954, стр. 112. —14. В. А. П и и а е в, ЖПХ, 37, № 6,
1361 (1964). —15. А. Н. К е т о в, В. В. Печковский, Там же, 31, № 12, 1783
(1958). — 16. Н. С. Mel, Z. Z. Hugus, М. W. Latimer, J. Am. Chem. Soc.,
78, № 9, 1822 (J956).—17. J. Das, D. P a t n a k, J. Indian Chem. Soc., 33, № 4,
243 (1956). — 18. M. Darrin, Can. Chem. Proc. Ind., 33, № 6, 512 (1949).—
19. J. Haas, Metal. Finish, 49, № 4, 64 (1951). — 20. Польск. пат. 35331, 1953.
21. Я. Зильберман, Л. А. Запутряева, Труды ГИПХ, в. 39, 1947,
стр. 3. — 22. G. В г е a k 1 у, J. S t а г к i е, Am. Dyest Rep., 38, № 22, 775 (1949). —
23. Н. Г. 3 а л о г и н, Труды совещания по очистке промышленных газов, Гос-
металлургиздат, 1941. — 24. А. Г. Павлович, авт. свид. 58179, 1940.—
25. Н. П. Слотвинскнй-Сндак, Автореф. канд. дисс., МХТИ, 1953. —
26. Н. Г. 3 а л о г и н, С. М. Шухер, Очистка дымовых газов, Госэнергоиз тат,
1954.-27. Chem. Eng., 66, № 12, 147 (1959)'. — 28. R. Dermerdonk, Chem.
Ing. Techn, 37, № 11, 1136 (1965). —29. D. Henrich, Staub, 25, № 10, 429
(1965). — 30. А. П. Андрианов, M. И. Левин, M. А. Гурфинкель, Хим.
пром., № II, 339 (1950). .
31. А. П. Андрианов, В. А. Чертков, Хим. пром., № 7, 394 (1954).-9
32. Б. А. Чертков, Г. Е. Аристов, Д. Л. П у х л и и а. Там же № 1 19
(1956).— 33. Б. А. Чертков, ЖПХ, 32, № 8, 1695 (1959); Кокс и химия, № 19
48 (1959). — 34. Б. А. Чертков, Д. Л. П у х л и н а, ЖПХ, 33, № 1, 5 (I960).—9
35. Б. А. Чертков, Там же, 37, № И, 2437 (1964).— 36. Б. А. Ч е р т к о в9
Хим. пром., № 1, 44 (1964). — 37. Б. А. Чертков и др., Там же, № 1, 49
Литература
561
(1964). — 38. Б. А. Чертков, Там же, № 9, 685 (1966). — 39. Л. С. Гордеев,
Б. А. Чертков, Там же, № 2, 129 (1967). — 40. И. Н. Кузьминых,
Д. М. П о п о в, Б. И. Г о р б а ч е в. Там же, № 2, 128 (1960).
41. R. A. King, Ind. Eng. Chem., 42, № 11, 2241 (1950).— 42. H. В. Се-
дов, Научно-техн, информ, бюлл. НИУИФ, в. 5—6, 79 (1957).—43. Я. Зиль-
берман, П. Иванов, ЖПХ, 13, № 4, 541 (1940). — 44. В. Фридман,
Н Т н м к и н, Хнм. пром., № 5, 25 (1945). — 45. S. J. Pirt, D. S. Callow,
W. A. Gillett, Chem. Ind., № 23, 730 (1957).— 46. А. Б. Пакш в ep,
T И Кунин, А. В. Куконкова, Хим. пром., № 7, 209 (1950).—
47. Б. А. Чертков. ЖПХ. 32, № 8, 1695, 1707 (1959); № 12. 2609 (1959).—
48. Б. А. Чертков, Д. Л. Пухлина, Г. И. Пекарева, Там же, № 6.
1385 (1959). — 49. Б. А. Чертков, Там же, 33, № 8, 1708; № 10, 2165
(I960). — 50. С. А. Сапотницкий, Н. В. Глущенко, Там же, 35, № 10,
2191 (1962).
51. А. М. К а га но век нй, П. Н. Таран, Укр. хем. ж., 21, № 4, 472
(1955). —52. D. Winkelmann, Z. Elektrochem., 59, № 9, 891 (1955).—
53. С. Н. Barron, Н. A. O’Hern, Chem. Eng. Sci., 21, № 5, 397 (1966).—
54. К. J- A. Waal, ibid., № 6—7, 559.—55. Б. А. Чертков, ЖПХ, 30,
№ 10, 1496 (1957). — 56. М. Т е г г е s, А. Н е i n s е n, G. W. F., 994 (1929).—
57. F. S. W а г t m a n, U. S. Dep. Inter. Btiro Mines Rep. Inv., № 3339, 47
(1937). — 58. E. C. Fuller, R. H. Grist, J. Am. Chem Soc., 63, № 6, 1644
(1941). — 59. С. И. Вольфковнч, Д. Л. Ц ы p л н н, ЖПХ, № 18, 1323
(1929). — 60. Б. А. Ч е р т к о в, ЖПХ, 32, № 1, 78 (1959).
61. Б. А. Чертков, Там же, 32, № 5, 952, 960 (1959); Вести, техн, и экон,
инф., № 5 (10), 7 (1958). — 62. Б. А. Чертков, ЖПХ, 34, № 4, 771 (1961).—
63. Т. Д. Авербух, Хим. пром., № 11, 1 (1948). — 64. Л. И. Каштанов,
А. Б. Лукьянов, Труды Московск. инж.-экон. ин-та. Химия н химические
производства, № 1, 1954, стр. 135. — 65. М И. Дорыкнна, Там же, стр. 143,—
66. М. Г. Манвелян и др., ЖПХ, 34, № 4, 934 (1961). — 67. W. D. Scott,
J. Z. McCartney, Ind. Chem. Fundament., 6, № 1, 40 (1967). — 68. J. V o-
solsobe, A. Simecek, J. M i c h a 1 e k, B. Kadlec, Chem. prumysl., 15, №7,
401 (1965). — 69. T. К. Д ж а б а г и н, Д. К. Рой, П. А. Семенов, Хим. пром.,
№ 11, 870 (1963). — 70. Н. F. Johnstone, Р. Leppla, J. Am. Chem. Soc.,
№ 56, 2233 (1934).
71. H. F. Johnstone a. oth., Ind. Eng. Chem., 27, № 5, 587 (1935); 27,
№ 6, 659 (1935); 29, № 3, 286 (1937); 29, № 12, 1396 (1937); 30, № 1, 101 (1938);
32, № 8. 1037 (1940). — 72. P. А. Бердянская, С. M. Г о л я н д, Б. А. Черт-
ков, ЖПХ, 32, № 9, 1930 (1959). — 73. Б. А. Чертков, Н. С. Добромыс-
лова, Там же, 37, № 8, 1718 (1964). — 74. В. А. П и н а е в. Там же, 36, № 10,
2116 (1963). — 75. В. А. П н н а е в, Н. П. Пителина, Там же, 38, № 8, 1652
(1965) —76. И. Н. Ш о к и н, И. М. Егоркин, М. И. X а й т о в и ч, ЖХП,
№7, 11 (1938). — 77. В. М. Рамм, Абсорбция газов, Изд. «Химия», 1966.—
78. Т. Д. Авербух, Труды УНИХИМ, в. 1, 1954, стр. 92.-79. F. Н. Con-
rad, W. L. Beuschlein, Paper Trade J., 105, № 4, 37 (1937); J. Am. Chem.
Soc., 56, 2554 (1934). — 80. И. H. Кузьминых, M. Д. Бабушкина, ЖПХ
29, № 10, 1488 (1956)'.
81. И. H. Кузьминых, М. Д. Бабушкина, Там же, 30, № 3, 466
(19571.-^82. И. Н. Кузьминых, А. Г. Кузнецова, Там же, 27, № 8
(1954). — 83. И. Л. Пейсахов, В. Д. Карамзина, Там же, 32, № 1, 70
(1959). — 84. Г. П. Архипова, И. Е. Флис, К- П. Мищенко, Там же,
37, № ю, 2306 (1964); 38, № 7, 1494 (1965). —85. М. Е. П о з и н, Хнм. пром.,
№ 6, 14 (1944). — 86. И. М. Вассерман, Производство минеральных солей,
Госхимиздат, 1954. — 87. К. R. Gray, Н. L. Crosby, пат. США 2656249,
1953. — 88. Япон. пат. 8176, 1954.—89. R. Griessbach, Н. Hohmann, пат'
562
Гл. XIV. Соли сульфитного ряда
ГДР 7483, 1954,— 90. В. И. Николаев, Т. И. Арнольд, ЖПХ, 16, Xs 7—8
(1943).
91. R. S. Aries, A. Pollak, пат. ФРГ 900335, 1953; канад. пат. 504058,
1954; швейц, пат. 297007, 1954.—92. I. Е. D г е е n a w а 11, пат. США 3165378,
1961. — 93. W. Spormann, J. Н е i n к е, пат. ФРГ 1152386, 1962.—
94. И. Л. Гофман, Р. Е. О ш е р о в и ч, Хим. пром., № 12, 13 (1944).—
95. Е. Р а е г s с h, пат. ГДР 5657, 1954. — 96. Т. И. Кунин, В. С. Епифанов,
Изв. вузов. Хим. и хим. технол., 4, № 6, 992 (1961); 5, № 5, 770 и № 6, 864
(1962). — 97. И. Г. Бляхер, М. М. В а й с б е й н, И. С. Черный, авт. свид.
197536, 1966.—98. И. Л. Гофман, Р. Е. Ош ер о в ич, Хим. пром., № 2—3,
24 (1944). — 99. Я. И. Зильберман, П. Т. Иванов, В. М. Фридман,
Сборник статей к 25-летию ГИПХ, Госхимиздат, 1944, стр. 223, 236.—
100. J. Cook, Chem. Trade J., № 3029 (1945).
101. J. A. L a b a s c h, G. R. Lusby, Canad. J. Chem., № 5, 774, 787
(1955). — 102. D. A. Skinner, пат. США 2666687, 1954. — 103. N. Bhuiyan,
Pakistan J. Sci. Res., 16, № 2, 74 (1964). —104. Я- И. Зильберман,
В. M. Фридман, Труды ГИПХ, в. 39, 1947, стр. 52. — 105. L. Kraus, М. R и-
ску, В. Hayek, пат. ЧССР 115249, 1963. — 106. И. Г. Бляхер, Т. Д. Авер-
бух, М. М. В а й с б е й н, Н. И. Кротова, Труды УНИХИМ, в. 14, 1967,
стр. 25. — 107. Л. С. Ефименко, А. Аширова, А. Атаджанова, Изв.
АН ТуркмССР. Сер. физ.-техн., хим. и геол, наук, № 2, 24 (1963).—
108. Е. С. Л едких, Н. В. Бойкова, Е. Я. Зверева, Хим. пр.ом., № 4,
309 (1967). — 109. Е. М. Я к и м е ц, Л. М. Гольдвассер, Ж.ХП, № о
(1934). — 110. Л. К. Ахрап-Симонова, Я. И. Зильберман, К- Ф. Пав-
лов, Труды ГИПХ, в. 35, 1941, стр. 38; ЖПХ, 12, № 3, 346 (1939).
111. 3. С. Банных, Е. М. Полякова, Труды УНИХИМ, в. 8, 1959,
стр. 91, 101, — 112. И. Г. Бляхер, А. Г. Л а р ю ш к и н а, ЖПХ, 35, № 3, 503
(1962). — 113. М. А. Черняк, И. А. Генкин, Хим. пром., № 6, 178 (1950). —
114. Е. М. Маршак, Хим. наука и пром., 2, № 4, 524 (1957). — 115. Т. И. Ку-
нин, Ю. А. Лобанов, Изв. вузов. Хим. и хим. технол., 8, № 6, 921 (1965).—
116. Я. И. Зильберман, И. Л. Хмельницкая, В. р. Чудинов,
А Ф. Павлова, Труды ГИПХ, в. 37, 1946, стр. 21. —117. Chem. Trade J.,
119, № 3086, 35 (1946). — 118. V. L. H a n s 1 ё у, L. F. Moormeier, пат. США
3216791, 1962. — 119. V. L. H a n s 1 e у, L. F. Moormeier, S. Schott, пат.
США 3205038, 1961. —120. Ind. Chemist a. Chem. Manufact., 29, № 343, 355
(1953).
121. Франц, пат. 1065095, 1954, — 122. Франц, пат. 1024671, 1953,—
123. Англ. пат. 695375, 1953. — 124. Ю. А. Лобанов. В. А. Ш о р м а н о в,
Т. И. Кунин, Изв. вузов. Хим. и хим. технол., 9, № 1, 10 (1966).—
125. И. Б. 3 и л ь б е р б е р г, М. И. С т у л ь, М. И. Галкин, Б. И. Ястре-
бов, авт. свид. 175047, 1964. — 126. Я- И. Зильберман, Н. Г. Маркова,
Труды ГИПХ, в. 37, 1946, стр. 5. — 127. В. Г. Хомяков, В. П. М а ш о в е ц,
Л. Л. Кузьмин, Технология электрохимических производств, Госхимиздат,
1946. — 128. В. К. Бейдин, Труды НИОХИМ, т. 19, 1969, стр. 176.—
129. R. J е 11 i n е k, Elektrochem. angew. phys. Chem., 17, 157 (1911)'.—
130. F. Feher, E. Schliep, H. Weber, Z. Elektrochem., 57, № 10, 916 (1953).
131. Норвеж. пат. 84483, 1954.— 132. A. Wurbs, Chem. Age (India), 16,
№ 10, 825 (1965). —133. J. A. D у a n, T. P. Whaley, пат. США 3226185,
1961. — 134. J. H. M u r i 1, пат. США 3216790, 1962. — 135. В. Ф. Постников,
Т. И. Ку ни и, ЖПХ, 13, №2, 185 (1940). — 136. В. Ф. Постников, Т. И. Ку-
нин, Труды Ивановск. химико-технол. ин-та, в. 3, 1949, стр. 126. —137. Т. И. Ку-
нин, М. А. Власюк, Изв. вузов. Хим. и хим. технол., 4, № 4, 636 (1961).—
138. Т. И. Кунин, Труды Ивановск. химико-технол. ин-та, в. 5, 1956, стр. 90.—
139. Т. И. Кунин, ЖПХ, 21, № 6, 685 (1948).— 140. Т. И. К у н и н, М. А. В л а-
сюк, Труды Ивановск. химико-технол. ин-та, в. 5, 1956, стр. 97.
Литература
563
141. В. В. Буданов, Т. И. Кукин, Г. И. Куракин д, Изв. вузов. Хим.
и хим технол., 10, № 5, 546 (1967). — 142. Schenk, Platz, Z. anorg. Chem.,
222, 177 (1935). —143. А. А. Гринберг, ЖПХ, 21, № 5, 425 (1948).-
144. Д. И. Менделеев, Основы химии, т. II, изд. 13, 1947, стр. 538.—
145. И. М. Вассерман, Труды ИРЕА, в 20, 1951, стр. 176.—146. Я. И. Зиль-
берман, К. Г. Круглякова, Н. Д. Черткова, ЖПХ, № 9, 6 (1941).—
147. Франц, пат. 1077539, 1954. —148. Е. Schulek, Е. К б г б s, L. Maros,
Acta chim. Acad. Sci. Hung., 10, № 1—3, 291 (1956). — 149. Г. П. Л у ч и н с к и й,
М И. Попова, ЖПХ, 12, № 11, 1664 (1939). —150. Я. И. Зильберман,
ЖХП, № 11, 21 (1940).
151. G. I. Р. L even son, J. Appl. Chem., 4, № 1, 13 (1954). — 152. T. Г. Ах-
метов, Л. И. Кузнецов-Фетисов, Труды Казанск. хим.-технол. ин-та,
в. 34, 1965, стр. 18; в. 36, 1967, стр. 26; авт. свид. 172729, 1964; 181059, 1965. —
153. И. Я. Аз бе ль, Мышьяково-содовая очистка газа от сероводорода, Госхим-
издат, 1956. —154. Н. Н. Поляков, А. Ф. Ложкин, ЖПХ, № 4—5, 55
(1940). — 155. Н. Н. Поляков, А. В. Г р а н ж а н, Хим. пром., № 7, 199
(1950). —156. А. Е. Телепнева, Т. Д. Авербух, Труды УНИХИМ, в. 8,
1959, стр. 122. —157. Т. Г. Ахметов, Л. И. Кузнецов-Фетисов, Труды
Казанск. хим.-технол. ин-та, в. 34, 1965, стр. 25. — 158. Г. П. Л учинский,
Труды ГИПХ, в 35, 1941, стр. 35. — 159. П. В. Д ы б и н а, Технология мине-
ральных солей, Госхимиздат, 1949, стр. 166. — 160. Р. И. Л е в е н з о н, В. В. Ка-
фа р о в. ПОХ, 7, № 8, 439 (1940).
161. П. В. Д ы б и н а, ЖХП, № 1, 58 (1940). — 162. И. Л. Хмельницкая,
Труды ГИПХ, в. 37, 1946, стр. 64. —163. Я. И. Зильберман, В. М. Фрид-
ман, Там же, в. 39, 1947, стр. 47. —164. Я. И. Зильберман, В. М. Фрид-
ман, Сборник статей к 25-летию ГИПХ, 1944, стр. 203. — 165. Англ. пат. 718675,
1954, — 166. Пат. ФРГ 902973, 1954; 925408, 1955. — 167. Норвеж. пат. 81235,
1953; дат. пат. 76777, 1953. — 168. W. Muller, пат. ФРГ 1184330, 1963.—
169. Пат. США 3350168, 1963.
Глава XV
СОЛИ ХРОМА
Из соединений хрома наибольшее промышленное значение при-
обрели натриевые и калиевые соли хромовых кислот, в особен-
ности соли двухромовой кислоты — хромпики — NaaCrsO? • 2Н2О и
К2СГ2О7, а также хромовые квасцы и основные сульфаты хрома
(сухие хромовые дубители), хлорный хром, окись хрома и хромо-
вый ангидрид. Современная технология этих продуктов разрабаты-
валась в СССР главным образом в Уральском научно-исследова-
тельском химическом институте и на предприятиях и наиболее
полно отражена в монографии
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Хром образует с кислородом окислы СгО, Сг20з, СгО2, СгО3 и
перекиси СгО4, СгО5; из них наибольшее практическое значение
имеют Сг2О3 и СгО3 и их соединения.
Закись хрома СгО черного и красного цвета, не растворима в
воде и в разбавленных кислотах. Гидрат закиси хрома Сг(ОН)2
желто-коричневого цвета, разлагается в воде и при нагревании;
растворим в концентрированных кислотах.
Окись хрома Сг2О3 зеленого цвета кристаллизуется в гексаго-
нальной системе, имеет плотность 5,21 г/см3, плавится при 2435°2.
Температура кристаллизации окиси хрома несколько изменяется
в зависимости от условий ее получения3. Состав гидратов окиси
хрома окончательно не установлен. По разным данным гидраты
окиси хрома могут содержать от одной до девяти молекул воды, в
зависимости от условий получения 4. Разноречивы и данные о тем-
пературных интервалах существования отдельных гидратов 5~10.
Так, например, по одним данным8 в системе Сг2О3—Н2О сущест-
вуют три стабильные фазы: Сг(ОН)3, СгООН и а-Сг2О3; граница
между Сг(ОН)з и СгООН лежит при ~55°, а между СгООН и
а-Сг2О3 при ~540° и мало смещается при повышении давления.
Физико-химические свойства
565-
По другим данным 9 стабильной является и Сг2О3 • 5Н2О, устойчи-
вая между 68 и 85—95°, а Сг(ОН)3 устойчива до 150°, СгООН об-
разуется при 320—360° под давлением 320—350 ат. Данные дру-
гих авторов отличаются от приведенных. Прокаленная окись хрома
в воде не растворима и плохо растворяется в кислотах. Гидроокись
хрома растворяется в кислотах с образованием солей трехвалент-
ного хрома, а с сильными основаниями образует хромиты:
Сг(ОН)3 + 3NaOH = Cr(ONa)3 + ЗН2О
Зеленая или фиолетовая окраска солей трехвалентного хрома,
их кристаллическая форма и свойства зависят от возникновения
тех или иных комплексных структур. Например, гексагидрат хлор-
ного хрома СгС13-6Н2О имеет две структуры — зеленую
[СгС12(Н2О)4]С1 • 2Н2О и фиолетовую (называемую также серой}
[Сг(Н2О)е]С13 п> 12. Безводный хлорный хром образует красно-фио-
летовые кристаллы (/пл 1152°), легко возгоняющиеся в токе хлора;
начинает реагировать с кислородом при 350° (СгС12 — при 404°);
при 514° восстанавливается водородом до СгС12; перегретым водя-
ным паром при 350—450° разлагается на Сг2О3 и НС113. Раствори-
мость СгС13 в воде очень мала (почти не растворим), но увеличи-
вается в присутствии следов СгС12. Растворимость зеленого
СгС13 • 6Н2О при 15° около 130 г в 100 г воды. Гидролиз СгС13 в
водных растворах приводит к образованию при 20—30° Сг(ОН)С12,
а при 40—50° Сг(ОН)2С1,4’15 • О Na3CrCl6, К3СгС16, КзСг2С19 см. Ч
Сульфат хрома, получаемый растворением гидроокиси хрома в
серной кислоте, выделяется из раствора в виде темно-фиолетовых
кристаллов Cr2(SO4)3 • 18Н2О 17>18. Они плавятся при 80—85° с от-
щеплением 10 молекул воды; остальные 8 молекул воды удаля-
ются при НО—115°. Сообщают также19, что Cr2(SO4)3 • 18Н2О при
нагревании отщепляет только 16 молекул воды, при дальнейшем
же обезвоживании выделяется SO3 и образуется основная соль
Cr2O(SO4)2 устойчивая в интервале температур 460—640°. По дру-
гим данным 20 фиолетовый сульфат хрома, полученный введением
. эквивалентного количества H2SO4 в охлажденный раствор
Cr(NO3)3, имеет состав Cr2(SO4)3 • 15Н2О; при 90—95° он перехо-
дит в девятиводный, при 120° — в шестиводный кристаллогидрат, а
полная дегидратация протекает при 400° и не сопровождается гид-
ролизом. Разложение обезвоженного сульфата до Сг2О3 протекает
при 700—735°.
Зеленая модификация сульфата Сг3+ получается при восстанов-
лении СгОз в сернокислом растворе. При этом обычно образуется
пересыщенный раствор, превращающийся при выпаривании в тем-
но-зеленую 21 вязкую массу, а после высушивания ее в стекловид-
ное вещество состава Cr2(SO4)3 • 8Н2О. Эта соль теряет 2,6 моле-
кулы воды при 120—125°, остальная вода удаляется только при
440—445°18. Описаны22 кислые сульфаты трехвалентного хрома
566
Гл. XV. Соли хрома
3Cr2(SO4)8 • S03, Cr2(SO4)3-SO3, 3Cr2(SO4)8 • 2H2SO4 • ЗН2О серо-
зеленого цвета, не растворимые в воде, выделяющиеся в мелкокри-
сталлическом виде при кипячении с серной кислотой бихроматов К,
NH4 и окиси хрома.
Хромовые квасцы — двойные соли сульфата трехвалентного
хрома и сульфатов Na, К, NH4 и других — имеют состав
M2SO4 • Сг2($О4)3 • 24Н2О. Растворимость квасцов в воде резко
возрастает с повышением температуры. Они кристаллизуются в
виде темно-фиолетовых октаэдров. Водные растворы также имеют
фиолетовую окраску, но при нагревании они становятся зелеными
вследствие диссоциации двойных солей (для хромово-калиевых
квасцов выше 78°). При выпаривании растворов выделяется
аморфная зеленая масса. Калиевые квасцы имеют плотность
1,84 г/см\ плавятся при 89°; в 1 л насыщенного водного раствора
содержится при 25° 243,9 г КгЗО4 • Cr2(SO4)3 • 24Н2О (иди 1'25,1 г
безводной соли). Аммониевые квасцы имеют плотность 1,72 &[см\
разлагаются при 100°; растворимость при 25° 21,2 г в 100 в воды.
Описано получение некоторых аммиакатов трехвалентного хро-
ма - [Cr(NH3)6]2(SO4)s • 2H2SO4 • ЗН2О, [Cr (NH3)е]2 (SO4)8 • H2SO4,
[Cr (NH3) e]2 (SО4)з • 5Н2О, [Сг (NH8) 5Н2О] (NO8) 3, (Сг (NН8) SH2O]C18 •
• CuCl2. Последний, в отличие от нитратного комплекса, устойчив
при хранении. Осажденная аммиаком из хромовых квасцов гидро-
окись хрома при нагревании в течение 1 ч до 40—45° образует рас-
твор аммиаката 23.
В системе Сг2О3—SiO2 установлено существование соединения
Сг2О3 • 3SiO2, плавящегося без разложения при 1995°; имеются две
эвтектики — при 1750° (65 мол. % Сг2О8) и при 1680° (5 мол. %
Сг2О3)
Хромовый ангидрид СгО3 красного цвета кристаллизуется в
ромбической сингонии, имеет плотность 2,7 е1см3, при 170° незна-
чительно разлагается в твердом состоянии, в связи с чем плавится
при непостоянной температуре в пределах 180—202°; расплавлен-
ный склонен к переохлаждению и затвердевает около 170°8. Яв-
ляется сильным окислителем. Растворимость в воде при О°61,7°/о,
при 100° 67,46% СгО3 25. При растворении в воде образует хромо-
вую кислоту Н2СгО4, в свободном виде неизвестную. В системе
СгО3—H2SO4—Н2О существуют твердые фазы СгО8 и СгО3 • SO3 2в.
При растворении СгО3 в разбавленной серной кислоте (до
~30% H2SO4) протекают процессы полимеризации с образова-
нием иона Сг2О7“ и ассоциации с образованием иона НСг2О7 и не-
ДиссоциированнОй двухромовой кислоты:
2НСгСГ Сг2О27~ + Н2О
Сг2О2- + Н+ НСг2О7
НСг2О7 + Н+ Н2Сг2О7
Физико-химические свойства
5в7
В растворе, содержащем от 30 до 55% H2SO4, кроме двухро-
мовой кислоты, образуется, по-видимому, также хромосерная кис-
лота 27>
СгОз + H2SO4 H2CrSO7
Предполагают, что в растворах с концентрацией больше 55°/о
H2SO4 идет дальнейшее присоединение серной кислоты к хромосер-
ной кислоте
H2CrSO7 + H2SO4 CrO2(HSO4)2 + Н2О
дальнейшая полимеризация
2H2Cr2O7 + H2SO4 H2Cr4OI3 + H2SO4-H2O
H2CrSO7 + Н2Сг2О7 < . ?_ H2Cr3SOi3 + Н2О
и дегидратация хромосерной кислоты:
2H2CrSO7 + H2SO4 2(СгО3 • SO3) + H2SO4 • 2Н2О
В растворах, содержащих H2SO4-2H2O, т. е. при концентрации,
большей 73% H2SO4, хромовый ангидрид неустойчив. Цвет таких
растворов постепенно из оранжевого переходит в зеленый. Вообще
при взаимодействии с сильными кислотами при нагревании СгО9
образует зеленые или фиолетовые соли этих кислот, например
Cr2(SO4)3. При нагревании водного раствора хромовой кислоты до
300—325° в закрытом сосуде (при равновесном давлении кислорода
50—200 ат) она разлагается с образованием осадков СгО2 и
НСгО2 29.
При термическом разложении хромового ангидрида при нор-
мальном давлении образуются: декахромат хрома Сг2(Сг10О31)з =
= СгО2,90б, бихромат хрома Сг2(Сг2О7)з = СгО2>625 и монохромат
хрома Сг2(СгО4)з=СгО2г40> а также твердые растворы в пределах
от СгОз до СгО2,98 и от СгО1,54 до СгО1,50. Под давлением обра-
зуется также двуокись хрома СгО2 3’30’31. О перекисях и перекис-
ных соединениях хрома см.32-34.
Оксихлорид хрома СгО2С12, или хлористый хромил, — темно-
красная жидкость с плотностью 1,911 г[см? при 20°, плавится при
‘—96,5°. Давление пара в (ммрт. ст.): 10 при 13,8°, 100 при 58°, 400
при 95,2°, 760 при 117,1° Цк). Водой, а также на свету и при нагре-
вании разлагается. Образуется при взаимодействии газообразного
НС1 и СгОз или при обработке концентрированной серной кисло-
той смеси бихромата и хлорида.
В системе СгО3—HF—Н2О при 0° существуют две твердые фа-
зы— СгО3 и CrO2F2 35. Последний плавится (под давлением)
При 31,6°.
Соли хромовой кислоты имеют желтую окраску, двухромовой —
оранжево-красную. Концентрированные растворы Na2CrO4 и
К2СгО4 имеют pH 9, Na2Cr2O7 и КгСг2О7 — около 4 36. Кислая
Реакция двухромовокислых солей обусловлена взаимодействием
568
Гл. XV. Соли хрома
иона Сг2О? с.водой с образованием ионов Н+ и СгО4~,причем уст
навливается равновесие:
Сг2О% + Н2О 2НСгО4“ 2Н+ + 2СгО^
При прибавлении к раствору какои-либо кислоты (ионов Н+)
равновесие сдвигается влево; при прибавлении какой-либо щелочи
Рис. 168. Растворимость хроматов и
бихроматов в воде.
(ионов ОН")—вправо. Это по-
зволяет переводить монохроматы
в бихроматы и наоборот путем
изменения pH раствора. В кислой
среде бихроматы являются силь-
ными окислителями; при их вос-
становлении образуются соедине-
ния трехвалентного хрома.
Хромат (монохромат) натрия
Na2CrlO4 кристаллизуется из вод-
ных растворов до 19,52° в виде
моноклинных сильно гигроскопич-
ных (расплывающихся на воз-
духе) кристаллов декагидрата
Na2CrO4 • ЮН2О с плотностью
1,483 г/см3', в пределах от 19,52 до
26,6° (25,9°) кристаллизуется гек-
сагидрат Na2CrO4 • 6Н2О, от 26,6
до 62,8° — Na2CrO4 • 4Н2О. Выше
62,8° образуются ромбические
кристаллы безводного a-Na2CrO4,
переходящие при 413° в гексаго-
нальные p-Na2CrO4, плавящиеся
при 792°. Растворимость хромата
натрия в воде 24,2% при 0°,
44,3% при 20° и 56,1% при 100°
(рис. 168). В системе Na2CrO4—
Na2SO4—Н2О при 15° твердая фа-
за представляет собой непрерывный ряд смешанных кристаллов
декагидратов хромата и сульфата натрия, а при 25° кристалли-
зуются твердый раствор Na2SO4-10H2O—Na2CrO4 • 6Н2О, безвод-
ный Na2SO4 и Na2CrO4-6H2O (рис. 169) 37>38. В системе Na2CrO4—
Na2CO3—Н2О при 35° кристаллизуется Na2CrO4 • 4Н2О, Na2CO2-
• Н2О и твердый раствор беркеитового типа, образуемый двойной
солью 2Na2CrO4• Na2CO3 и исходными безводными солями39.
Хромат калия К2СгО4 кристаллизуется безводным. Ниже 669°
устойчива ромбическая модификация, выше этой температуры—
гексагональная. Плотность при 18° 2,73 г!см3', плавится при 975°
Растворимость в воде 37,1% при 0°, 45,2% при 100° (рис. 168).
В системе К2СгО4—K2SO4—Н2О при 25° выделяется одна твердая
Физико-химические свойства
Рис. 169. Изотерма растворимости
в системе Na2CrO4—Na2SO4—Н2О
при 25°:
/ — твердые растворы Na2SO4 • 10Н2О и,
Na2CrO4 • 6Н2О; II - Na2SO4;
III- Na2CrO4 6Н2О.
фаза изоморфных солей. В системе K2CrO4—Na2CrO4—Н2О
при 25° выделяются три твердые фазы: Na2CrO4 • 6Н2О,
ЗК2СгО4 • Na2CrO4 (хромовый глазерит) и К2СгО4. Хромовый гла-
зерит, в отличие от сернокислого, образует двусторонний твердый
раствор с пределами концентраций 3,16К : Na и 2,39К: Na. В си-
стеме КгСгО4—Na2SO4—Н2О при 25° имеется пять полей кристал-
лизации: 1) непрерывного твердого раствора хромата и сульфата
калия, 2) сложного тетрагенного твердого раствора глазерита,
3) твердого раствора Na2SO4-10H2O—Na2CrO4 • 6Н2О, 4) без год-
ного Na2SO4 и 5) Na2CrO4-
. 6Н2О ЗД 40 При 208—220° К2СгО4
взаимодействует с расплавлен-
ным СгОз с образованием КгСггОу.
При 270—280° К2СгО4 реагирует
с продуктом разложения СгО3 —
бихроматом хрома:
ЗК2СГО4 + Сг2(Сг2О7)з =
= ЗК2Сг2О7 4- Сг2(СгО4)3
При этом выход К2Сг2О7 по
обеим реакциям составляет 80—
85%. Для полного превращения
хромата в бихромат требуется из-
быток СгОз против стехиометри-
ческого количества 41. О свойствах
безводных систем, содержащих хроматы и гидроокиси, сульфаты,
нитраты, фториды натрия и калия, см.42-45.
Хромат аммония (NH4)2CrO4 выделяется из водных растворов
в форме моноклинных кристаллов; плотность при 12°— 1,917 г! см3.
Выше 180° и в горячих водных растворах разлагается. Раствори-
мость в воде при 30° 28,8%.
Хромат кальция существует в пяти модификациях: СаСгО4,.
СаСгО4 • 0,5Н2О, СаСгО4-Н2О, а- и 0-СаСгО4 • 2Н2О. Наиболее
. растворим в воде а-дигидрат (14,75% СаСгО4 при 0°), наименее-
растворим безводный хромат кальция (4,3% СаСгО4 при 0°). С уве-
личением температуры их растворимость несколько уменьшается.
Безводный хромат кальция образуется выше 400°, двухводные гид--
раты — ниже 25°.
Бихромат натрия Na2Cr2O7 кристаллизуется выше 84,6° в без-
водном виде, а ниже этой температуры — с двумя молекулами во-
ды (Na2Cr2O7 • 2Н2О) в виде моноклинных призм или тонких игл,,
имеющих плотность 2,35 г)см3. Сильно гигроскопичен, на воздухе-
расплывается. Безводный плавится при 357°; при 400° разлагается
с выделением кислорода. Растворимость Na2Cr2O7 в воде при 20°'
^3,18%, при 100° 91,43%. Растворимость в присутствии Na2SO4 в.
NaCl см.46. Существуют три- и тетрахроматы натрия Na2Cr3O10 и
570
Гл. XV. Соли хрома
NaaCr^is, которые плавятся (соответственно) при 232 и 168° и раз-
лагаются при 337 и 320°47.
Бихромат калия К2СГ2О7 кристаллизуется из водного раствора
безводным в триклинической системе, негигроскопичен, плотность
при 25° 2,68 г/см3. Существует в трех модификациях — устойчивая
при обычной температуре модификация А превращается при 269°
в модификацию С с увеличением объема на 5,2%; последняя при
охлаждении переходит в метастабильную при обычной температуре
модификацию В, которая при нагревании до 255° переходит в С с
уменьшением объема на 0,1 %48. Плавится при 398°.
Бихромат калия до 800° практически не разлагается. Изополи-
хроматы К2Сг301о и К2СГ4О13 плавятся соответственно при 243 и
210° с одновременным разложением на К2СГ2О7 и СгОз, при даль-
нейшем нагревании разлагается СгО3 49. Растворимость К2СГ2О7 в
воде при 0° 4,3%, при 20° 11,7%, при 100° 50,2%. Составы эвтони-
ческих растворов в системе К2СГ2О7—K2SO4—НгО50'51: при 20°
6,24% К2Сг2О7 и 8,23% K2SO4, при 40° 14,40% К2СГ2О7 и 8,20%
K2SO4. О растворимости в системе К2СГ2О7—КС1—Н2О см.52. О си-
стемах (NH4)2Cr2O7— (NH4)2SO4—Н2О и (NH4)2Cr2O7—NaCl—Н2О
см.53’ 54.
Бихромат аммония (NH4)2Cr2O7 кристаллизуется из водного
раствора в виде дигидрата и безводной соли. Плотность при 25° ,
2 15 г/см3. При нагревании до 185° разлагается. Растворимость |
в воде при 0° 15,16%, при 20° 26,67%, при 100° 60,89% (N^hCrsCb- j
Обладает способностью к внутримолекулярному горению. Темпе- 1
.ратура вспышки 240°. В простейшем виде механизм горения пред- |
ставляется совокупностью следующих реакций55: |
(NH4)2Cr2O7 — 2NH3 + Н2О (пар) + 2СгО3 — 64,5 ккал I
2СгО3 = Сг2О3 + 1,5О2 — 5,6 ккал
2NH3 + 1,5О2 = N2 + ЗН2О (пар) + 151,3 ккал
* Бихромат кальция СаСг2О7 кристаллизуется из водного рас-
твора от 0 до 10° в виде гексагидрата СаСггО? • 6Н2О, при 20—40°
в виде СаСг2О7 • 5Н2О, при 50—60° в виде СаСг2О7 • 4Н2О; выше
70° вследствие гидролиза
СаСг2О7 + Н2О у СаСгО4 + Н2СгО4
кристаллизуется смесь бихромата и монохромата кальция56. Рас-
творимость в воде при 0° 53,47%, при 20° 57,87%, при 60° 65,54%,
при 100° 72,7% СаСггСБ. Бихромат кальция гигроскопичен и на
воздухе расплывается. О растворимости в системе СаСггО?—
К2СГ2О7-Н2О см. 57- 58.
ПРИМЕНЕНИЕ
Хром и его соединения широко используются в различных от-
раслях промышленности59. Металлургической промышленностью
выпускаются специальные хромистые стали, отличающиеся высо-
Применение
571
кой механической прочностью, жаростойкостью и антикоррозион-
ными свойствами. Хром входит также в состав сплавов — алюми-
ниевых, кобальтовых, титановых и др.60. Получаемый восстановле-
нием окиси хрома углем в атмосфере водорода карбид хрома
СгзС2 служит для изготовления химически и термически стойких
металлокерамических сплавов (керметов), а также режущих и на-
плавочных твердых сплавов61’62. Соединения хрома используются
для получения хромомагнезитовых и других огнеупоров, применяе-
мых в металлургических печах.
Окись хрома служит сырьем для получения металлического
хрома (обычно алюмотермическим путем), карбида хрома, шлифо-
вальных паст и красок, стойких к свету, огню и кислороду воздуха.
Ее применяют также для окрашивания стекла и керамики. Окись
хрома является компонентом весьма часто применяемых в неорга-
ническом и особенно органическом синтезе хромовых катализато-
ров (для дегидрогенизации алифатических углеводородов, арома-
тизации парафиновых углеводородов, гидрирования и крекинга,,
конверсии нефтяных газов и проч., а также для реакций изотоп-
ного обмена)8’63. Для производства металлического хрома в по-
следнее время все шире стали использовать в качестве полупро-
дукта хлорный хром.
Хромовые квасцы, основной сульфат хрома, хромпики и неко-
торые другие соединения хрома используются в качестве дубиль-
ных веществ в кожевенной промышленности и в качестве протрав
и пропитывающих средств при крашении, печатании тканей в тек-
стильной промышленности.
Хромпики служат сырьем для производства хромовых красок—•
желтого крона РЬСгО4, красного крона РЬСгО4 • РЬ(ОН)2, оранже-
вого крона (смеси средней и основной солей хромата свинца), жел-
тых хромовых солей цинка и др. Соли хромовых кислот дают жел-
тые, оранжевые, красные и коричневые краски; соли окиси
хрома — зеленые; синие и черные краски получаются из соедине-
ний хрома и железа.
Хромпики используют также при получении некоторых органи-
» ческйх красителей и для приготовления катализаторов. Хромпики
применяют в жировой, спичечной, бумажной промышленности, в-
электротехнике, в пиротехнике, в фотографии и в других отраслях
техники, а также в сельском хозяйстве (для протравливания се-
мян). Из хромпиков в наибольших количествах используют более
Дешевый бихромат натрия.
Соединения шестивалентного хрома (хромовый ангидрид,
хромпики, хлористый хромил) используют в качестве сильных
окислителей, в частности во многих процессах органического син-
теза— при получении ализарина, сахарина, бензойной кислоты,
антрахинона, гидрохинона, в производстве резин, пористых пла-
стиков.
.572
Гл. XV. Соли хрома
Хромовый ангидрид используют при получении синтетического
каучука, органических красителей, для очистки жиров и масел.
Его водные растворы применяют для травления и гальваническо-
го хромирования металлов, для получения цветных пленок на по-
верхности сплавов, для электролитической полировки металлов,
для электрохимической обработки режущего инструмента. Элек-
тролизом растворов хромовой кислоты получают металлический
хром высокой степени чистоты.
Хромат натрия является хорошим ингибитором коррозии стали
водой, содержащей до 1% NaCl®4.
Технический бихромат натрия выпускают в виде безводного
кристаллического или гранулированного, водного гранулирован-
ного, а также плавленого продуктов, которые должны удовлетво-
рять требованиям ГОСТ 2651—70 (табл. 39). Технический бихро-
мат калия по ГОСТ 2652—71 и ГОСТ 5.991—71 выпускают выс-
шего и первого сортов, содержащих соответственно (в %):
К2СГ2О7 не менее 99,7 и 99,3; сульфатов (SO4) не более 0,02 и
0,08; хлоридов (С1) не более 0,07 и 0,02; не растворимого в воде
остатка не более 0,03 и 0,1; влаги не более 0,05 и 0,1.
ТАБЛИЦА 39
Состав технического бихромата натрия (по ГОСТ 2651—70)
(содержание компонентов в %)
Кристаллический безводный Гранули- рованный безвод- ный Гранулированный водный Плавле- ный
высший сорт * I сорт 1 сорт 11 сорт
Хромовый ангидрид, не менее 75,5 75,0 74,0 72,5 71 70
или NagCrgO?. не менее Сульфаты (SO4), не более 98,9 0,1 98,25 0,2 0,5 0,5 0,7 0,7
Хлориды (С1). не более. 0,2 0,4 0,6 0,6 0,7 0,7
Железо, не более . . . . 0.0Э2 0,003 0,005 0,005 0,005 0.005
Не растворимый в воде остаток, не более . . . 0,01 0,02 0,05 0,03 - 0,05 0,05
pH водного раствора . . * Не ниже 3,5
* Этот сорт соответствует также регламенту по ГОСТ 5.1493—72 на аттестованный
продукт»
Технический хромовый ангидрит, согласно ГОСТ 2548—62,
выпускается в виде чешуек или гранул (не более 3 мм) и должен
содержать в высшем, I- и 2-м сортах, соответственно, не менее
99,5, 99,0, 98,5% СгО3 и не более 0,03, 0,06, 0,10% не растворимых
в воде веществ и 0,10, 0,20, 0,40% SO4. К качеству аттестованно-
го продукта ГОСТ 5.1599—72 предъявляют следующие требова-
ния: содержание не менее 99,6% СгО3 и не более: 0,02% не раст-
воримых в воде веществ, 0,06% SO.4 и 0,005% натрия.
Требования к качеству технической окиси хрома представ-
лены в табл. 40. Помимо приведенных в ней, ГОСТ предусматри-
вает следующие показатели; содержание цветных металлов
Сырье и методы его переработки
573
ТАБЛИЦА 40
Состав технической окиси хрома (по ГОСТ 2912—66)
(содержание компонентов в %)
«Металлургическая» «Пигментная» «Часовая»
Показатели сорт
ОХМ-1 ОХМ-2 ОХП-1 ОХП-2 ОХЧ-t ОХЧ-2
Общий хром (Сг2О3), не меиее Соли хрома-VI (СгО3), не более . . Сера (S), не более . Железо (FeO), не более Углерод (С), не бо- лее Влага, не более . . Не растворимые в воде вещества, не более в том числе суль- фаты (SO4), не более .... pH водной вы- тяжки .... 98,0 0,5 0,015 0,15 0,05 0,15 Не норм » » 98,0 0,5 0,03 0,20 0,10 0,15 нроваио » » 99,0 0,02 Не норм » » 0,15 ’ 0,3 0,04 6—8 99,0 0,05 нровано » » 0,15 0,5 0,08 6-8 98,0 Не норм .» » » 0,15 0,5 Не норм » 98,0 ировано » » » 0,15 . 0,5 нровано
в'ОХМ-1; удельную поверхность и класс чистоты поверхности по-
сле полирования для ОХЧ; pH водной вытяжки, красящую способ-
ность, цвет и оттенок, укрывистость и крупность зерен для ОХП.
В окиси хрома ОХМ-2, получаемой из хромового ангидрида, приме-
няемой в других производствах (не для выплавки металлического
хрома), допускается общее содержание серы (S) не более 0,06%.
Тарой для хромпиков, хромового ангидрида и окиси хрома
служат стальные барабаны или полиэтиленовые мешки.
, СЫРЬЕ И МЕТОДЫ ЕГО ПЕРЕРАБОТКИ
Сырьем для производства соединений хрома служит хромит или
хромистый железняк — минерал состава РеО-Сг2Оз или Ре(СгО2)г,
являющийся нерастворимой солью хромистой кислоты НСгО2. Он
относится к группе шпинелей с общей формулой RnO • RmO3. В чи-
стом виде хромит, содержащий, согласно приведенной формуле,
около 68% окиси хрома, встречается крайне редко. Природный ми-
нерал, представляет собой различного вида хромшпинелиды с об-
щей формулой (Fe, Mg)O-(Cr, Al, Fe)2O36S. Их можно рассмат-
ривать как изоморфные твердые растворы солей: Fe(CrO2)2,
e(FeO2)2, Mg(CrO2)2 и Mg(A102)2. Помимо хромшпинелидов в
РУДе имеются примеси других пород (серпентина, талька и проч.)66,
г
574 Гл. XV. Соли хрома
так что содержание Сг20з обычно составляет 35—57%. Содержа-
ние других компонентов: FeO + Fe2O3 15—25%, А120з 7—20%,
MgO 5—18%, SiO2 3—8%, СаО 1—3%. Бедная руда, содержащая'
меньше 35% Сг20з, называется железо-хромовой. На химические
заводы хромит поступает в виде кусковой руды, а также в виде
концентрата, получаемого обогащением бедных руд67>88 (табл. 41).
ТАБЛИЦА 41
Марки и сорта хромитовой руды
Марка Наименование руды Сорт Содержание, % \ /среди
СгзОз S1O2 СаО
I Маложелезнстая I 60 6 3
II 56-59 6 3
III 50-55 6 II и 3
IV 45-49 6 3
V 40-44 6 — 3
VI 60 6 — 2.8
II Маложелезнстая VII 55—59 6 — 2,8
VIII 50—54 6 2,8
IX 46-49 6 — 2,8
X 40—45 6 — 2,8
III Среднежелезнстая XI 40—44 8,5 — 2,3
XII 38-39 8,5 — 23
XII 35-37 8.5 3,0 23
XIII 32-34 8,5 3,0 2,3
IV Железистая XIV 35-39 11,0 3,0 1,8
XV 32—34 11,0 3,0 1,8
Хромитовые концентраты 40-60 — — —
Нормальная влажность руд б%, концентратов — 8%. По харак-
теру подготовки руды подразделяют на четыре класса:
Класс Метод подготовки Размер кусков, мм
1 Дробленые н грохоченые 10—75 (мельче 10 мм не более 10%)
2 Грохоченые мелкие До 10 (крупнее 10 мм не более 5%)
3 Рядовые (не дробленые н не
грохоченые) До 250
4 Концентраты
По содержанию Сг2О-а хромиты (руды) делят также на следую-
щйе классы89:
СгаОз, %
Весьма высокохромистый . . . . Высокохромистый Среднехромистый Низкохромистый Обогатительный , . . . 50-54 . . . 38-50 ... 32-37 . . . 5-38
Сырье и методы его переработки 575
Требования к составу хромитовой руды, применяемой для про-
изводства магнезито-хромитовых огнеупоров, указаны в табл. 42.
ТАБЛИЦА 42
Требования к хромитовой руде (по ГОСТ 10154—82)
Содержание, вес. % Марка
К-ПШС к-мхс с-мхс
Сг2О3. не менее 50 50 36
SiO2, не более 5,5 5,5 6
СаО, не более 1 1 1.5
)Келеза (Fe2O3), не более 14 14 —
В СССР имеются богатейшие запасы высококачественных хро-
митов. Месторождения хромовых руд находятся в Казахской ССР
в Актюбинской областиб5-66 и на всем протяжении Уральского
хребта: на Северном Урале — Сарановское, Гологорское, Ключев-
ское, на Южном Урале — Верблюжьегорское, Халиловское и др.
Имеются также месторождения хромовых руд в Закавказье 70-74.
Промышленные месторождения хромитов имеются в Индии, в
Югославии, в Румынии и в других странах. Наиболее крупные
месторождения хромитов имеются в Южно-Африканской Респу-
блике, в Южной Родезии, в Турции и на Филиппинских островах,
где сосредоточено ~90% всех достоверных запасов хромитов в
капиталистических и некоторых других зарубежных странах. США
обладают небольшими запасами низкосортных хромовых руд
(8,1 тыс. т) 75. В 1953 г. импорт хромовой руды в США превысил
2 млн. т, а в 1962 г. снизился до ~ 1,3 млн. т. В 1962 г. в США из
.общего количества потребленных хромитов 52% израсходовано в
металлургии, 32% в керамической промышленности и 16% перера-
ботано в химической промышленности главным образом в бихро-
мат натрия, из которого затем получают другие соединения. В США
40% хромовых химикатов потребляют в виде пигментов, 18% —в
виде дубильных веществ, 18% в виде хромового ангидрида75.
Богатые хромиты подвергают плавке в электропечах для полу-
чения феррохрома (~60% Сг), применяемого в качестве присадки
при выплавке хромистых сталей. При получении феррохрома дро-
- Исходит восстановление хромита углеродом:
FeCr2O4 С = Fe + СО -ь Сг20д
Сг2О3 + ЗС = 2Сг + ЗСО
576
Гл. XV. Соли хрома
В процессе восстановления, помимо сплавов Fe—Cr—С, обра-
зуются карбиды хрома (Сг<С, Сг7С3, Сг3С2) 77’78.
Спеканием хромитов с окислами кальция, магния, алюминия
получают хромитовые или хромомагнезитовые огнеупоры, приме-
няемые в качестве футеровочных материалов для металлургиче-
ских и других печей. Для изготовления этих огнеупоров обычно
используют маложелезистые и малокремнеземистые хромиты, со-
держащие не более 20% FeO и 7% SiO2. Связкой служит глинозе-
мистый цемент, содержащий однокальциевый алюминат СаО-
• А12О3. Температура плавления СаО-А12О3 1600°, а СаО-Сг2О3
2090°.'
В системе СаО • Сг2О3—СаО • А12О3 образуется ряд твердых рас-
творов (линия ликвидуса не имеет экстремумов). Хромомагнезито-
вый кирпич плавится при 2000—2050° 79~81.
Сырьем для производства соединений хрома могут служить
феррохром — полупродукт, получаемый из хромитовых руд метал-
лургической промышленностью, вырабатывающей хромистые стали,
а также шлаки, получаемые в производстве феррохрома и хроми-
стых сталей.
Получение солей окиси хрома путем кислотного выщелачивания
хромита не имеет пока промышленного значения. Даже в присут-
ствии сильных окислителей не удается быстро достичь хорошего
разложения руды. Щелочное разложение хромита, сопровождаю-
щееся окислением, позволяет получать растворимые соединения
шестивалентного хрома с большим выходом. Этот метод и приме-
няется в промышленности. Из хромита получают хроматы и би-
хроматы; соединения же трехвалентного хрома изготовляют их
восстановлением. (В последнее время, однако, некоторое распро-
странение получает электрохимическое окисление трехвалентного
хрома.)
Главным продуктом в производстве солей хрома является би-
хромат натрия. Для его получения тонкоизмельченный хромит под-
вергают окислительному обжигу в смеси с содой и окисью кальция
в виде доломита или известняка. При этом образуется монохромат
чатрия, который выщелачивают из прокаленной шихты (спека) и
переводят в бихромат натрия введением в раствор кислоты.
ОКИСЛИТЕЛЬНЫЙ ОБЖИГ ХРОМИТОВ С ПОЛУЧЕНИЕМ ХРОМАТОВ
Физико-химические основы окислительного обжига хромита
Химизм процесса
Химизм процесса окислительного обжига хромита не может
быть описан одной или несколькими простыми реакциями. Шихта,
составленная из хромита, соды и доломита вместе с газовой фазой,,
с которой она взаимодействует, является очень сложной многокрМ-
Окислительный обжиг хромитов с получением хроматов 577
понентной системой. В ней при высоких температурах помимо га-
зовой и жидкой фаз имеется большое число твердых фаз, состав
которых зависит от режима обжига (стр. 586). Условно окисли-
тельную прокалку хромита в присутствии соды можно представить
уравнениями реакций:
4(FeO • Cr2C3' + 8Na2CO3 + 7О2 = 8Na2Ci О4 + 2Fe2O3 4- 8СО2
4(MgO • Cr2O3) + 8Na2CO3 + 6О2 = 8\а2СгО4 + 4MgO + 8СО2
Одновременно идут реакции, в результате которых появляются
многие другие соединения (см. ниже), в первую очередь ферриты,
алюминаты, силикаты натрия и кальция и хроматы кальция.
Окись железа, находящаяся в шихте в свободном состоянии и
в составе хромшпинелида, взаимодействует с Na2O, СаО, MgO с
образованием ферритов и алюмоферритов. Образуется также фер-
рат(1У) натрия
Na2O • Fe2O3 + 3Na2CO3 T 0,~О2 = 2Ха4РеО! + ЗСО2
который растворяется в жидкой фазе прокаливаемой массы и оки-
сляет хром(III); это интенсифицирует окислительный обжиг, так
как, расходуясь на окисление хромита, многократно регенерируясь,
феррат служит переносчиком кислорода из газовой фазы к поверх-
ности зерен хромита 82’83.
Окисление Сг(Ш) в Cr(VI) идет очевидно последовательно
через Cr(IV) и Cr(V). Наличие в спеке хроматов(У) натрия и
кальция установлено84; они растворены в жидкой фазе шихты и
участвуют в передаче кислорода — образуясь в результате окисле-
ния хромита(III) хроматом (VI), они затем окисляются газообраз-
ным кислородом до хромата (VI).
Образование хромата из хромита является эндотермическим
процессом, требующим затраты значительных количеств тепла.
Чем более высок температурный уровень прокаливания шихты и
чем больший избыток кислорода в печи, тем быстрее идет оки-
сление.
Взаимодействие хромита с содой и окисью
кальция
Окислительный обжиг производят в трубчатых вращающихся
печах при температурах, достигающих 1100—1200°. Хромат натрия
появляется при нагревании шихты еще при сравнительно низких
температурах и образует с содой эвтектический расплав, содержа-
ний 62,5% Na2CrO4. Появление жидкой фазы в системе Na2CrO4—
Na2CO3 возможно уже при 655°85. При дальнейшем нагревании ре-
акционной массы жидкая фаза обогащается содой, причем состав
Расплава вначале изменяется от эвтектической точки вдоль линии
ликвидуса. по направлению к точке плавления соды (рис. 170). Но
9 М. Е. Поаин
578
Гл. XV. Соли хрома
одновременно с возрастающей скоростью происходит образование
хромата натрия, замещающего соду в жидкой фазе. Сода расхо-
дуется не только на основную реакцию, но и на реакции с другими
компонентами шихты — на образование феррита, алюмината и си-
ликата натрия (см. ниже), которые затем в свою очередь реаги-
руют с хромитом, известью и кислородом, давая хромат натрия и
кальциевые неплавкие соединения. До 1000° скорость образования
хромата натрия больше скорости взаимодействия соды с другими
окислами (SiO2, AI2O3, РегОз) 85. По мере исчезновения соды из
жидкой фазы происходит растворе-
ние новых количеств соды. В ре-
зультате этих процессов твердая
сода исчезает задолго до достиже-
ния шихтой температуры плавления
соды. На рис. 170 схематически изо-
бражено измерение состава жидкой
фазы по мере повышения темпера-
туры; момент исчезновения твердой
соды выражен изломом кривой в
точке А.
Диаграмма условно не учиты-
Рис. 170. Схема изменения со-
стааа жидкой фазы. вает возможность растворения в
жидкой фазе других компонентов
прокаливаемой шихты. Поэтому на диаграмме жидкая фаза в кон;
це процесса прокаливания состоит из чистого хромата натрия. На
самом деле в жидкой фазе содержится некоторое количество хо-
рошо растворимого в хромате натрия хромата кальция — при 1000°
растворимость хромата кальция в хромате натрия достигает 80%.
Практически, однако, в расплаве растворено небольшое количе-
ство хромата кальция, так как растворенные ионы кальция всту-
пают в реакции, приводящие к образованию нерастворимых каль-
циевых соединений — силикатов, ферритов, алюминатов и др. Толь-
ко при большом недостатке соды в шихте возможно появление
значительного количества хромата кальция в жидкой фазе.
На рис. 171 приведена диаграмма плавкости системы СаСгС>4 +
4-Na2CO3 = Na2CrO4 + CaCO3 при невысоких температурах и в ат-
мосфере углекислого газа, когда еще не происходит разложение
углекислого кальция85. В этих условиях система является трехком-
понентной. (Составы даны в молярных процентах.) В равно-
весии с расплавом находятся следующие твердые фазы: CaCrCh,
СаСОз, Na2Ca(CO3)2 и твердые растворы mNa2CO3-пСаСОз и
pNajCrC^ • <7СаСгО4. На диаграмму нанесены изотермы и обозна-
чены температурные минимумы (точки плавления двойных и трой-
ных эвтектик) и максимумы. Как видим, появление жидкой фазы
в прокалочной печи возможно уже при 645°. По мере повышения
температуры состав жидкой фазы меняется. Одновременно меняет-
Окислительный обжиг хромитов с получением хроматов
57»
ся и состав реагирующих твердых фаз, диссоциирует карбонат
кальция. В системе NazCrO4—СаСгО4 имеется максимум при 812°,
обязанный образованию твердых растворов; двойная эвтектика
содержит 48,4 мол. % СаСгО4, плавится при 740° и состоит из
твердого раствора (Na2, Са)СгО4 и чистого хромата кальция87.
Наиболее легкоплавкие смеси расположены вдоль пограничных ли-
ний, соединяющих точки тройных эвтектик (668, 645 и 648°) и
точку двойной эвтектики соды и хромата натрия (655°). Из этих
смесей образуется жидкая фаза в шихте, содержащей соду, ниже
Рис. 171. Диаграмма плавкости системы
СаСгО4+Ма2СО3 = МагСгО4 + СаСО3.
700°. Прн прокаливании бессодовых (известковых) шихт образова-
ние хромата кальция ниже 800° идет медленно88, а при более высо-
ких температурах образуются хромито-хроматы, снижающие вы-
ход хромата (см. ниже).
В промежуточных стадиях обжига в жидкой фазе содержится
‘ также некоторое количество силиката натрия. Na2CrQ4 и NasSiOa
образуют эвтектику при 770°, содержащую 10% NasSiOj. Однако
содержание силиката натрия в жидкой фазе не может быть боль-
шим, так как хромитовая шихта составляется из материалов с ма-
лым содержанием силикатов, и кроме того, силикат натрия, по-
добно алюминату и ферриту натрия, образуется только в качестве
промежуточного продукта. Анионы кремневой кислоты довольно
быстро извлекаются из жидкой фазы катионами кальция с обра-
зованием нерастворимых и труднорастворимых силикатов, заме-
чаясь анионами хромата. Только при большом избытке соды в
Шихте возможно значительное содержание силиката натрия в рас-
плаве88. г
19*
580
Гл. XV. Соли хрома
Примеси, содержащиеся в хромитовой руде, не влияют суще-
ственно на предельную степень окисления окиси хрома. От при-
сутствия окислов кремния, алюминия и железа степень окисления
Сг2О3 не уменьшается, если прокаливаемая шихта содержит окись
кальция в количестве, достаточном для связывания кислотных оки-
слов. Следует однако отметить, что примеси влияют на скорость
окисления хрома — снижение содержания Сг2О3, т. е. повышение
содержания примесей (SiO2, Fe2O3, А120з) приводит к увеличению
продолжительности обжига хромитовых шихт в производственных
условиях (см. стр. 584).
Наполнители в с одо в о-хромитной шихте
Составные части шихты и кислород газовой фазы образуют ге-
терогенную систему. Скорость реакции в такой системе зависит от
развития межфазной поверхности. Поэтому большое значение,
имеет тонкость помола хромита. То обстоятельство, что сода нахо-1
дится в жидкой фазе, значительно ускоряет процесс, — в этих ус-1
ловиях частицы хромита смачиваются расплавом, содержащим
соду, и реакционная поверхность увеличивается во много раз. Пра’
вда, при наличии жидкой фазы, обволакивающей твердую частицу,
газообразный компонент должен диффундировать через пленку
жидкости. Тем не менее наличие ограниченного количества жилкой
фазы сильно ускоряет процесс. При большом же количестве жид-
кой фазы происходит спекание шихты, налипание ее на стенки
печи, что мешает ее продвижению, затрудняет доступ кислорода к
реагирующим частицам руды из-за слипания их в крупные комья.
В результате этого процесс сильно замедляется, и выход хромата
понижается89. При относительно низких температурах, когда коли-
чество расплава в шихте невелико, происходит, по-видимому, непо-
средственное окисление окиси хрома газообразным кислородом;
выше же 900° окисление идет с участием расплава, в котором воз-
растает содержание реакционно-способных частиц—ионов кисло-
рода, образующихся в результате диссоциации карбоната и хро-
мата натрия и при посредстве промежуточных веществ — ферра-
та (IV) и, вероятно, перекиси натрия. При большем содержании
окиси железа в шихте ее положительное влияние, как передатчика
кислорода через феррат(IV) натрия уменьшается и не компенси-
рует ухудшение процесса вследствие уменьшения концентрации ос-
новных реагентов — Сг2О3 и Na2CO3; при этом затрудняется и об-
разование феррата натрия90.
Твердые составные части шихты хорошо смачиваются образую-
щейся в процессе прокалки жидкой фазой89. Помимо поверхност-
ного смачивания, под влиянием капиллярных сил происходит по-
чти полное заполнение пор между отдельными частицами матери-
алов. В разных стадиях обжига твердые фазы удерживают 0.15--
Окислительный обжиг хромитов с получением хроматов
581
0,35 г расплава на 1 г твердого вещества. Во избежание спекания
реакционной массы в шихту необходимо добавлять какие-либо
тонкоизмельченные вещества (их обычно называют наполните-
лями, хотя они и не являются инертными компонентами) в таком
количестве, чтобы слой жидкой фазы на поверхности твердых ча-
стиц был очень тонким 91~93. В реальных соотношениях компонен-
тов в хромитовой шихте толщина жидкой пленки на поверхности
твердых частиц не превышает 1 мк. В этих условиях шихта остает-
ся практически сухой, рассыпчатой, легко подвижной, не спекается
и обладает большой газопроницаемостью. Однако при этом по-
верхность добавки удерживает часть жидкой фазы и использова-
ние последней может быть обеспечено только при условии хоро-
шего перемешивания шихты, что и осуществляется в реакционных
прокалочных печах.
Таким образом, добавка наполнителя к шихте приводит, с од-
ной стороны, к положительному эффекту, уменьшая толщину жид-
кой пленки на поверхности частиц, а с другой — к отрицательному,
устраняя часть жидкой фазы с реакционной поверхности хромита.
Очевидно, что существует оптимальное соотношение между коли-
чеством хромитовой руды и наполнителем, при котором полезный
эффект от введения наполнителя оказывается максимальным. Мак-
симальное окисление наблюдается при содержании в шихте 16,2—
16,5% СГ2О3. С повышением температуры диапазон концентраций
СггОз в шихте, при которых достигается максимальное окисление,
расширяется. При 1200° степень окисления практически одинакова
для шихт, содержащих от 12 до 19,5% окиси хрома 94’95.
Среди доступных реальных наполнителей отсутствуют такие
твердые вещества, которые в условиях высокотемпературного про-
каливания хромитовой шихты были бы инертными ко всем компо-
нентам шихты. Это обусловливает протекание побочных реакций,
сопровождающих основную реакцию образования монохромата
натрия. Из ряда возможных наполнителей — СаО, СаСО3, MgO,
MgCO3, РегОз, AI2O3, S1O2 — наилучшим из простых является из-
вестковый (жженая известь, мел или известняк), а из ком-
бинированных, как показал производственный опыт, доломит
(MgCO3 • СаСО3) и его смесь с известняком 95~97. Положительная
роль извести заключается в том, что окись кальция вытесняет
окись натрия из феррита, алюмината и силиката натрия, образо-
вавшихся из компонентов шихты; освобождающаяся же окись нат-
рия образует хромат натрия, выход которого поэтому увеличи-
вается. Но вместе с тем работа с доломитовым и известковым иа-
полнителями предопределяет и появление в прокаливаемой шихте
хромата кальция. Хромат магния практически не образуется, так
как это соединение разлагается выше 500°, и около 90% MgO,
с°Держащейся в прокаленной шцхте, находится в свободном со-
стоянии. Давление диссоциации MgCrO4, равное 1 ат, достигается
582
Гл. XV. Соли хрома
уже при ~535°; [Ig/’ (в мм рт. ст) = 23,271 — 16488/7]. Термиче-
ское разложение MgCrO4 сопровождается образованием вначале
неустойчивого 2M.gO-Cr2O3, постепенно разлагающегося на MgO
и MgO-СггОз98. Вследствие высокого давления диссоциации при
сравнительно низких температурах MgCrO4 не может находиться
в прокаленной шихте. Для полного же разложения СаСгО4 тре-
буется очень высокая температура. Чистый хромат кальция при
нагревании на воздухе начинает заметно разлагаться при темпера-
туре около 1000° с выделением кислорода. В присутствии 0,1 моль
СаО разложение ускоряется уже при 800°. Однако даже при на-
гревании в течение 4 ч при 1300° хромат кальция полностью не
разлагается". В заводских условиях максимальная температура
Прокалки шихты обычно не превышает 1200° и содержание СаСгО4
в прокаленной шихте составляет 5—8% от получаемого хромата
натрия.
Хроматы кальция образуются из окиси хрома и окиси кальция
при нагревании их на воздухе при 600—1000°. При молярном отно-
шении СаО: Сг2О3 от 2 до 3 вся окись хрома практически окис-
ляется уже при 600—700° за 2 ч и переходит в СаСгО4 и оксихро-
миты кальция. Оксихромиты также интенсивно окисляются. При
600—700° за 2 ч монохромит СаО • Сг20з окисляется на 2/3, давая
смесь 2СаСгО4 + Сг2О3, двухкальциевый оксихромит 2CaO-Cr2Os
окисляется полностью с образованием СаСгО4, а трехкальциевый
оксихромит 3CaO-Cr2Os окисляется на 75% с образованием
ЗСаО -2СгО310°~105.
Хромат кальция выше 1000° диссоциирует с образованием хро-
мито-хроматов 104>106, например, по реакции
12СаСгО4 = 3(СаО • Сг2О3) + 9СаО • 4CrOs • Сг2О3 + 6О2
В присутствии свободной извести хромито-хромат образуется
по реакциям:
3MgCr2O4 + 9СаО + ЗО2 = 9СаО • 4СгО3 • Cr2O3 + 3MgO
3FeCr2O4 + 9СаО + 3,75О2 = 9СаО • 4СгО3 • Cr2O3 + l,5Fe2O3
Из других хромито-хроматов кальция в прокаленной шихте
вероятно присутствие ЗСаО • 2СгО3 • 2Сг2О3.
При не очень высоких температурах хромито-хроматы окис-
ляются кислородом с образованием СаСгО4, например
9СаО • 4СгО3 • Сг2О3 + 1,5О2 = 6СаСгО4 + ЗСаО
Окись кальция расходуется также на образование клинкерных
минералов — алюмоферритов (браунмиллерита 4СаО • А12О3 • Fe2Os
и др.), алюминатов кальция—12Са0-7А1203 (которому раньше
приписывали формулу 5СаО-ЗА12О3) и других, дикальциевого си-
ликата p-2CaO-SiO2, феррита кальция 2CaO-Fe2O3. Количе-
ство ее должно быть достаточным для связывания А12О3, Fe2O3,
SiO2.
Окислительный обжиг хромитов с получением хроматов
583
При прокаливании шихты, содержащей соду, она реагирует
с хромит-хроматами даже при 600°. Это послужило основанием для
предложения способа переработки хромита, заключающегося в
предварительном получении Хромит-хромата кальция при 1000°
с последующей обработкой полупродукта содой при 600—700°.
В этом способе исключается необходимость в наполнителе (окиси
магния, доломите), а следовательно, уменьшается количество от-
бросов, которое при возврате окиси кальция в процесс становится
незначительным 107.
При применении в качестве наполнителя доломита количество
остающегося в прокаленной шихте хромата кальция значительно
меньше, чем при известковой шихте. Кроме того, доломитовая
шихта меньше спекается. Оплавление шихты при замене доломита
карбонатом кальция связано с образованием карбонатной эвтек-
тики86. Преимуществом доломита, который содержит 52—54%
СаСОз и 30—40% MgCO3, является то, что диссоциация карбона-
тов здесь происходит по всей реакционной зоне печи, в темпера-
турном интервале от 650 до 1100° 108’109. При нагревании доломита
в пределах 650—750° происходит выделение СО2 из MgCO3, а в
пределах 800—1100° — из СаСО3. Это обеспечивает сравнительно
равномерное выделение СО2 из шихты по всей длине печи. Ско-
рость разложения известняка и магнезита определяется диффу-
зионной кинетикой и зависит от скорости прохождения газа через
слой карбоната. При увеличении скорости газа до 7—8 м/сек ско-
рость разложения карбонатов возрастает, затем процесс контроли-
руется химической кинетикой и дальнейшее увеличение скорости
газа не вызывает интенсификации разложения. Скорость же раз-
ложения доломита практически не зависит от скорости газа, так
как процесс контролируется не диффузионной, а химической кине-
тикой уже при малых скоростях газа в конвективном потоке110.
Выделяющийся углекислый газ, пронизывая шихту снизу вверх,
производит ее перемешивание и обеспечивает ее рыхлость, что
облегчает доступ кислорода к нижним слоям реагирующей массы.
Лабораторными опытами установлено, что еще лучшим напол-
‘ нителем, чем карбонат кальция и доломит, является карбонат
бария ш.
Как уже указывалось выше, максимальный полезный эффект
от введения в шихту наполнителя, дающий наибольший выход во-
дорастворимых хроматов, соответствует определенному оптималь-
ному содержанию наполнителя в шихте95. На рис. 172 показана
кривая зависимости выхода водорастворимых хроматов от соотно-
шения йежду Na2CO3 и СаО, при содержании в шихте 15% Сг2О3
(в виде 34,9%-ной руды), при прокаливании в течение 30 мин
при 1000°. Максимальный выход соответствует соотношению
Na2CO3:CaO, равному 60:40. Увеличение общего содержания
Сг2О3 в шихте с 16 до 20% нли частичная замена доломита окисью
584
Гл. XV. Соли хрома
или карбонатом магния не влияет на окисление, если имеется
достаточно СаО для связывания кислотных окислов. При недо-
статке СаО степень окисления хромита снижается. То же отно-
сится и к влиянию нерудных компонентов хромита, содержащих,
кроме MgO, главным образом окислы алюминия, железа и крем-
ния,— изменение их количества не влияет на предельную степень
окисления хромита, если содержание СаО достаточно для свя-
зывания кислотных окислов112,
а продолжительность прокалки
велика. В промышленных ус-
ловиях влияние их заметно.
Следует отметить, что в ших-
тах, содержащих мало соды и
много извести, обнаруживает-
ся повышенный против теоре-
тического выход водораствори-
мых хроматов. Пунктирная
прямая AN (рис. 172) показы-
вает стехиометрическое коли-
чество соды, необходимое для
перевода окиси хрома в хро-
w мат натрия. Точка В соответ-
Na2CO3 50 Вес.% СаО ствует количеству соды, равно-
му 100% от стехиометрическо-
Рис. 172. Кривая выхода водораствори- го. Кривая выхода в правой
мых хроматов в присутствии СаО. части диаграммы лежит выше
стехиометрической прямой AN.
Как видно из расположения кривой, степень использования соды
в присутствии СаО (или СаСОз) может достичь ~140%. Это свя-
зано с переходом хромат-иона в раствор не только в виде хромата
натрия, но и в виде некоторого количества хромата кальция. Рас-
творимость безводного хромата кальция в воде равна 4,3% при 0°,
1,11% при 50° и 0,42% при 100°.
При выщелачивании прокаленной шихты большим количеством
воды в раствор переходит заметное количество СаСгО4, что и дает
повышенную цифру выхода. При применении неизвестковых напол-
нителей кривая выхода растворимого хромата лежит всегда ниже
стехиометрической! линии AN.
Выход хроматов зависит не только от состава нерудной части
шихты, но, естественно, и от состава руды95. Различные руды окис-
ляются с разной скоростью. Быстрее окисляются руды с малым
содержанием А1 и Fe2+. Бедные руды, содержащие меньше 30%
СгзОз, дают наибольший выход хроматов при прокаливании в
смеси с одной содой. Частичная замена ее в шихте карбонатами
кальция и магния снижает выход. Степень окисления хрома г>
шихте, содержащей повышенные количества SiOa, меньше, чем для
Окислительный обжиг хромитов с получением хроматов
585
железистой руды или руды, не содержащей каких-либо примесей.
Помимо химического состава на реакционную способность разных
хромитовых руд влияют и их физико-химические свойства 89’93’ 113-115.
Процесс образования хромата из хромита является эндотерми-
ческим и требует затраты значительных количеств тепла 116. Чем
более высок температурный уровень прокаливания шихты, тем
быстрее идет окисление. На рис. 173 показана зависимость степени
окисления Сг20з в СгОз от про-
должительности прокаливания
при разных температурах при из-
вестковой (пунктирные линии) и
доломитовой шихте (сплошные
линии)117.
Применявшийся для опытов
хромит содержал: 44,61% Cr2Os,
24,28% FeO, 9,86% А12О3, 4,04%
Продолжительность пр окали-
дания, ч
Рис. 173. Зависимость степени окисле
ния хромита в хромат от продолжи-
тельности прокаливания шихты.
SiOa; обожженная известь содер-
жала: 90% СаО, 6,43% MgO и
2,04% А12О3 + Ре2Оз. Исходные
вещества смешивали в соотноше-
нии хромит : известь : сода, рав-
ном 1:1:0,64. При составлении
доломитовой шихты применялся
обожженный доломит, содержав-
ший 65,04% СаО, 29,7% MgO и
4,2% SiO2.
Из диаграммы видно, что
равная степень окисления при
высоких температурах достигает-
ся на доломитовой шихте быстрее,
чем на известковой. Работа на
доломитовой шихте дает более
благоприятные результаты и в отношении степени перехода СгОз
в раствор при последующем выщелачивании прокаленной шихты.
Скорость и степень окисления хромитовой шихты зависят от
интенсивности поглощения кислорода из газовой фазы, в частно-
сти от концентрации кислорода в газе. При обжиге хромита в
смеси с содой и доломитом содержание кислорода в выходящем
Из печи газе должно быть не ниже 7,5—10% 118.
Скорость процесса зависит также от активности образующейся
яри диссоциации карбонатов окиси кальция. Наличие примесей в
карбонатных наполнителях приводит к образованию неактивной
извести. Если в карбонатном сырье содержится меньше 3% при-
месей, то заметное количество неактивной окиси кальция обра-
зуется лишь при температурах выше 1350°119. О кинетике окисле-
ния хромитовых шихт см. также99’ 120-1М.
586
Гл. XV. Соли хрома
Минералогический состав хроматного спека и расчет шихты
Минералогический состав хроматного спека зависит от коли-
чества соды в шихте, количества окиси кальция, введенной в шихту
с доломитом, и от содержания А12О3, Fe2O3 и других компонентов
в исходной руде. Кроме того, состав спека зависит от температуры
обжига, хотя, по-видимому, равновесие в системе не достигается.
Он зависит также от скорости охлаждения прокаленной массы;
при быстром охлаждении в спеке могут присутствовать метаста-
бильные фазы. По этим причинам минералогический состав спека
не является однозначным и сведения о нем, полученные в разных
исследованиях, не идентичны. Несомненно8S'87>123, что в спеке на-
ходится (35—40%) твердый раствор Na2CrO4—СаСгО4 с содержа-
нием ~8О°/о Na2CrO4. Установлено также присутствие сле-
дующих соединений: p-2CaO-SiO2, 12СаО • 7А12О3, 2CaO-Fe2O3,
4СаО • А12О3 • Fe2O3, в чистом виде или в виде твердых растворов.
В спеке содержатся также хромшпинелиды, хромит(III) и хро-
мат (V) кальция и алюминат натрия, неразложенные карбонаты
кальция и натрия. Большая часть окиси магния находится в спеке
в свободном состоянии, а около 10% в виде твердого раствора
с 4СаО • А12О3 • Fe2O3123. Возможно, что в спеке присутствует также
магниевый браунмиллерит 4СаО • 2MgO • А12О3 • Fe2O3124.
Практикой эксплуатации хроматных печей установлена неце-
лесообразность введения в шихту стехиометрического количества
соды, так как степень использования соды не выше степени окис-
ления хромита. Вследствие этого количество соды в шихте рассчи-
тывают по формуле
[NasCO3] = 1,395А[СгаОа]
где [Na2CO3] — кг соды на 100 кг руды; [Сг2О3] — вес. % Сг2О3
в руде; 1,395 —стехиометрический коэффициент; к — степень окис-
ления.
Для расчета количества СаО, необходимого для составления
шихты, предложены различные полуэмпирические формулы, исхо-
дящие из возможного образования тех или иных соединений в про-
каленном спеке 96’106-'о?, из, 123-127 ПрИ переработке хромитов, со-
держащих 47—56% Сг2О3, рекомендуются1 формулы (для доло-
митовых шихт):
при [А12О3]: [Fe2O3]>0,64
[СаО] = I,88[SiOa] 4- 0,91[А1аО3] + 0,82[Fe2O3] + 0,2б[Сг2О3]
при [А12О3]: [Fe2O3] < 0,64
[СаО] = 1,88[SiOa] + 1,10[А1аО3] + 0,70[Fe203] + 0,2б[СгаО3]
Здесь [СаО] в кг на 100 кг руды; [SiO2], [А12О3], [Fe2O3],
[Сг2О3] — вес. % окисла в руде. -
Окислительный обжиг хромитов с получением хроматов
587
В промышленных печах степень окисления хромита умень-
шается с понижением содержания Сг2О3 в шихте и с увеличением
их загрузки шихтой 127. Так, для шихты, содержащей 16,5% Сг2О3,
изменение степени окисления (Л%) в зависимости от загрузки
(С кг/ч) можно представить эмпирической формулой:
А = 130,4-0,01125С
Условная производительность печи Р, т. е. количество Сг2О3
(в кг), окислившееся в печи в течение 1 ч, при содержании Сг2О3
в шихте В %, будет:
Р - АВС 10-4
Например, для шихты с содержанием 16,5% Сг2О3:
Р = С (130,4 — 0,01125С) • 16,5-10"4
Из этого выражения видно, что условная производительность Р
возрастает с увеличением нагрузки, хотя при этом степень окисле-
ния уменьшается. В зависимости от конструкции печи и режима
ее работы существует оптимальная концентрация окиси хрома в
шихте, при которой достигается максимальная степень окисле-
ния 9з. юб, из наших заводах она принята равной 16,5—17,5%
Сг2О3.
Для определения производительности печи в зависимости от ее
размеров предложена эмпирическая формула 128
Р = 3,5 (100 — Д)0,45 £>',5Д
здесь Р — производительность печи по хроматным щелокам, кг!ч
Na2Cr2O7-2H2O; D — внутренний диаметр печи, м; L — длина
печи, м.
В заводской практике делались попытки полной и частичной
замены щелочного компонента шихты — соды более дешевым —
сульфатом натрия 129. Эти попытки не привели к удовлетворитель-
‘ ным результатам — выходы хромата оказывались более низкими,
а худшие физические свойства прокаленной шихты (спекаемость
и вязкость при обжиге, твердость при выщелачивании) затрудняли
проведение производственных процессов. Описаны и опыты замены
соды на Na2SO4 или NaCl, давшие положительные результаты.
Рекомендуется оптимальное соотношение в шихте (мол.)
Сг2О3: Na2SO4: СаО, равное 1: 1,8: 4,4, или Сг2О3: NaCl: СаО, рав-
н°е 1 :3,6: 4,4. Температура прокаливания 900—950°, т. е. ниже,
чем для содовой шихты. Степень окисления Сг2О3 85—90% 13°.
Установлена возможность замены соды нефелином !14'131.
Добавка наполнителей к хромитовой шихте наряду с их поло-
жительным влиянием приводит к возрастанию расходов на
588
Гл. XV. Соли хрома
транспортировку, размол и увеличивает количество неиспользуемых
отходов132. Поэтому предлагаются различные видоизменения схемы
окислительной прокалки хромитов. Одно из них рассмотрено выше
(стр. 583). Другое заключается в осуществлении процесса в три
стадии с уменьшенным количеством наполнителя (завод в Левер-
кузене). В первой стадии прокалке подвергают шихту, составлен-
ную из руды и 25% стехиометрически необходимой соды. Полу-
ченный после выщелачивания спека шлам с добавкой еще 25%
соды прокаливают во второй стадии. Образовавшийся спек снова
выщелачивают и оставшийся шлам после подсушки смешивают
с остальными 50% соды и половинным количеством доломита
(в расчете на первоначальное количество руды) и вновь прокали-
вают (третья стадия). При такой схеме расход доломита ^умень-
шается в 2 раза, а степень окисления хромита повышается 133.
Описан опыт прокалки хромитовых шихт в модели печи со
взвешенным слоем 134. Хромито-содово-доломитовую шихту с влаж-
ностью 18% гранулировали 3 мин в тарельчатом грануляторе и
гранулы (3—5 мм) прокаливали в цилиндрической печи с двумя
слоями на решетках из жароупорных труб, охлаждаемых воздухом.
Топочный газ поступал под нижний слой с температурой 1150° со
скоростью 3,5 м!сек. При степени окисления 90% интенсивность
по шихте равнялась 500 кг/(м2-ч). Достаточно большая степень
окисления была достигнута и на содово-известковой шихте. Фир-
мой „ Chemische Fabrik Galvachrom S. A.“ (ФРГ) разработан метод
окисления в кипящем слое хромито-содовой шихты при 600—
1200°13s.
О прокалке хромитовых шихт в кольцевой печи см.136.
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ВЫЩЕЛАЧИВАНИЯ
ХРОМАТНОГО СПЕКА
При обработке прокаленной шихты — хроматного спека водой
из него выщелачиваются твердый раствор хроматов натрия и каль-
ция, алюминат натрия и сода. Другие твердые составные части
спека под действием воды превращаются в новые минеральные
фазы, остающиеся в шламе или взаимодействующие с компонен-
тами системы. Так, в результате медленной гидратации и гидролиза
силикатов кальция образуются гидросиликаты кальция и в раствор
переходит гидроокись кальция, которая реагируя с ионами С Оз"
пли Mg2+ образует нерастворимые СаСО3 или Mg(OH)z— это
ускоряет гидролиз. Аналогично этому при взаимодействии с водой
алюминатов кальция образуются гидроалюминаты кальция и гид-
роокись алюминия. Вследствие гидролиза клинкерных минералов,
главным образом алюмоферритов, происходит деградация водо-
растворимых хроматов с образованием гидрохромалюмината калЬ-
Физико-химические основы выщелачивания спека
589
ция ЗСаО АЬОз • СаСгС>4 • I2H2O !37~141. например, по схематиче-
скому уравнению:
4СаО • А12О3 • Fe2O3 + Na2CrO4 + 16Н2О = ЗСаО • А12О3 • СаСгО4 • 12Н2О +
+ 2Fe(OH)3 + 2NaOH
В результате этого потери хрома в шламе могут быть значи-
тельными, так как в хроматных спеках содержится до 20% браун-
миллерита 142.
Во избежание потери хромового ангидрида в виде малораство-
римых соединений — основных хромито-хроматов (стр. 582) и гид-
рохроматалюмината кальция — в процессе водного выщелачивания
суспензию хроматного спека обрабатывают углекислым газом. При
сатурации (карбонизации) суспензии идут реакции, приводящие
к образованию СаСО3 и А1(ОН)3 и способствующие переходу хро-
мата в раствор:
Са(ОН)2 + СО2 = СаСО3 + Н2О
Na2O • А12О3 + СО2 + ЗН2О = Na2CO3 + 2А1(ОН)3
Са(ОН)2 + Na2CO3 = СаСО3 + 2NaOH
СаСгО4 + Na2CO3 = Na2CrO4 + СаСО3
В начальной стадии сатурации в результате гидролиза браун-
миллерита и алюминатов кальция могут образоваться гидроалю-
минаты кальция, а также карбоалюминаты кальция, например, по
уравнению:
4СаО • А12О3 • Fe2O3 + СО2 + 14Н2О = ЗСаО • А12О3 • СаСО3 • 11Н2О + 2Fe(OH)s
При дальнейшей сатурации эти соединения разрушаются угле-
кислым газом
ЗС О - AI О,-6 12О 1-ЗСО. =ЗСаСО3 -t-2А1(ОЧ)3 + ЗН2О
ЗСаО • А12О3 • СаСО, 11Н2О + ЗСО2 = 4СаСО3 + 4А1(ОН)3 + 8Н2О
что полезно, так как предотвращает в дальнейших стадиях пере-
работки хроматной пульпы гидролиз этих соединений с образова-
‘ нием нерастворимых гидрохромалюминатов кальция.
Более полное извлечение хрома в раствор в результате обра-
ботки пульпы углекислым газом сводится, в основном, к следую-
щим процессам141:
2ОН" + СО2 = СО|“ + Н2О
СаСгО4 + СО3' = СгО4“ + СаСО3
ЗСаО • А12О3 • СаСгО4 • 12Н2О + Na2CO3 + ЗСО2 = Na2CrO4 + 2А1 (ОН)3 +
+ 4СаСО3 4-9Н2О
Таким образом при сатурации гидролиз минералов, входящих
в состав хроматных спеков, направляется в сторону образования
590
Гл. XV. Соли хрома
соединений, не содержащих хрома. После отделения этих соедине-
ний в виде шлама, получается монохроматный щелок.
Установлено 143, что потери хрома со шламом можно снизить,
добавляя к поступающему на выщелачивание спека оборотному
раствору хромата натрия метасиликат натрия.
ФИЗИКО-ХИМИЧЕСКИЕ основы
ПЕРЕВОДА ХРОМАТОВ В БИХРОМАТЫ144
Методы перевода хроматов в бихроматы
Этот процесс, носящий в промышленной практике название
«травки» монохроматных щелоков, осуществляют с помощью сер-
ной кислоты:
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 4- Н2О
При этом более 60% затраченной на производство соды пере-
водят в менее ценный продукт — сульфат натрия, что является
существенным недостатком этого метода. Обычно в сульфате
остается 2—3% хромпика; это увеличивает потери хрома и обусло-
вливает необходимость очистки сульфата для его использования.
В производстве хромового ангидрида (стр. 611) травку монохро-
матного щелока ведут бисульфатом натрия.
Предложен ряд других методов травки. Из них наибольшего
внимания заслуживает углекислотный 145’14s. Он заключается в об-
работке монохроматных щелоков углекислым газом под давлением.
Выделяющийся в осадок бикарбонат натрия
2Na2CrO4 + 2СО2 + Н2О Na2Cr2O7 + 2NaHCOa
может быть использован взамен соды при прокалке хромита. Это
обстоятельство, а также то, что угольная кислота дешевле серной,
делает углекислотный метод травки весьма экономичным. Его при-
меняют на некоторых зарубежных заводах.
Травка монохроматных щелоков плавиковой кислотой позво-
лила бы совместить производство хромпика с производством фто-
ристых солей, например
2Na2CrO4 + 2HF = Na2Cr2O7 4- 2NaF + Н2О
2Na2CrO4 + NaA102 + 6HF = Na2Cr2O7 + N a3AlFe + 3H2O
И T. П.
При этом исключается расход серной кислоты в производстве
хромпика и соды в производстве фтористых солей. Образующийся
при травке хроматного щелока плавиковой кислотой или фтористо-
водородным газом труднорастворимый фтористый натрий промы-
вают на фильтре водой. При содержании в нем 5—7% NaCr2O7 его
предложено использовать для получения антисептика («уралита»),
состоящего из NaF, Na2Cr2O7, и динитрофенола, предназначенного
для пропитки деревянных шпал и телеграфных столбов Н7.
Физико-химические основы перевода хроматов в бихроматы
59F
Аммиачно-углекислый метод травки 148’149’, аналогичный амми-
ачно-содовому процессу, заключается в обработке монохроматных
щелоков аммиаком и углекислым газом (при обычном давлении):
2Na2CrO4 + 2NH3 + 2СО2 + 2Н2О q=± 2NaHCO3 + (NH4)2CrO4 + Na2CrO4
Затем путем кипячения хроматный раствор переводят в бихро*
матный с одновременной регенерацией аммиака:
(NH4)2CrO4 + Na2CrO4 == Na2Cr2O7 4- 2NH3 + H2O
Степень перехода хромата в бихромат составляет 90—92%, и
получение стандартного продукта возможно при дополнительной
обработке щелока серной кислотой 133. Этот метод используется в
Чехословакии. ;
Перевод хроматов в бихроматы можно осуществлять и электро-
химическим путем 15°; при этом на аноде выделяется кислород, а
иа катоде водород:
2Н2О 2Н+ + 2ОН"; 2СгО^- + 2Н+ 5=± Сг2О^- + Н2О
Выход по току для насыщенных растворов хромата натрия до-
стигает 92—95% при 15—25° и 75% при 50—60°.
Разработан также хлорный метод травки, состоящий в обра-
ботке хроматного раствора при 70—80° газообразным хлором, при-
чем наряду с бихроматом образуется хлорат натрия:
6Na2CrO4 + ЗС12 = 3Na2Cr2O7 + 5NaCl + NaClO3
Для разделения солей может быть использована их различная
растворимость.
Хлорный метод может быть совмещен с электролизом: при
электролизе совместного раствора монохромата и хлорида обра«
зуется бихромат, а в качестве побочных продуктов получаются,
хлорат и едкая щелочь.
Наиболее экономичен, по-видимому, метод травки плавиковой
кислотой: он может дать наивысшую эффективность капиталовло-
жений и лучшую производительность труда, не сопряжен с боль-
. шими капитальными затратами, что приводит к меньшей стоимости
продукции. Применение для травки отбросной двуокиси углерода
приводит к значительной экономии соды, но требуеЬ' больших капи-
таловложений в оборудование.
Теория травки хроматов кислотами144
Перевод монохроматов в бихроматы основан на равновесии:
2CrO4~ + 2Н+ 2НСгСф Cr2O2f + Н2О
В результате гидролиза в растворе монохромата содержат-
ся ионы СгО|", НСгО7 и ОН”. При введении в этот раствор
692
Гл. XV. Соли хрома
кислоты НА в нем появляются также ионы Н+ и А-. Очевидно, си-
стема будет стремиться к состоянию равновесия, определяемому
в общем случае константами равновесия протекающих между
ионами обратимых реакций и растворимостями компонентов. При
расчете равновесий между хроматами и кислотами можно допу-
стить, что практически соли как сильные электролиты полностью
диссоциированы и что в растворе отсутствуют гидробихроматные
ИОНЫ НСГ2О7.
При условии, что все компоненты системы хорошо растворимы,
т. е. не выпадают в твердую фазу, как, например, бывает при
травке серной кислотой, ионный состав и степень перехода опреде-
ляются следующими уравнениями:
константа
диссоциации травящей кислоты:
„ [Н+][А~]
Kl [НА]
константа диссоциации гидрохроматного иона:
К tH+HCr0<1
2 [нею;]
константа гидролиза бихроматного иона:
„ [нею;]2
- [Сг2ОГ]
(1)
(2)
(3)
Значения /<2 и Кз пока точно не установлены. Приводятся зна-
чения: для Кз от 0,9-10-7 до 1,26-10-6, для Кз от 0,91-Ю”2 до
3,03- IO'2 (при 25°).
Если обозначить начальную молярную концентрацию кислоты а
и начальнуюконцентрацию хромата с, то
а — [НА] + [А-] (4)
с = [СгО2-] + [HCrOj] + 2 [Сг2О|-] (5)
Условие электронейтральиости раствора (концентрацией Н+ и
он- можно пренебречь) отвечает уравнению
[м+] = 2[СгО2-] + 2 [Сг2О2~] + [HCrO;] + [А'] - [СгО*’] +с + [А']
откуда, учитывая, что [М+] = 2с, получаем;
««[СгО|-] + [А-] (6)1
Степень перехода: !
с с
Физико-химические основы перевода хроматов в бихроматы
593
Совместное решение уравнений (1 — 7) приводит к выражению
2К2 (1 - х)2 (а - сх)2 + K^Kfax (1 - х) (а - сх) = К^сх3 (8)
из которого можно определять х методом последовательного при-
ближения или графически.
Допущение отсутствия бихроматных ионов в растворе (прене-
бречь ими можно уже при величинах Кз, больших единицы) при-
водит к более упрощенному урав-
нению для степени перехода
К, (а + с) - УК- (с - а)2 + 4KtK2ac
х =
2 (К, - Кг) е
степень
зависит
из которого видно, что
перехода практически не
от концентраций, а лишь от мо-
лярного отношения кислоты и
хромата.
В практически важном случае,
когда а —с, уравнение (9)
преобразований дает:
после
х =
(Ю)
Рис. 174. Зависимость степени пере-
хода хромата в бихромат от кон-
станты диссоциации травящей кисло-
ты при а = с:
/-Кг = 1О~7;2-я2 = 8-1о~7; J-fa-lo'7
• и 0,05 с.
На рис. 174 нанесены кривые, '
показывающие зависимость сте-
пени перехода х монохромата в -
бихромат от —1g К\, т. е. от кон-
станты диссоциации травящей кислоты для-у= 1 и Хг = 10~7 (кри-
вая /) и 8 • 10~7(кривая 2).
Если травку производят хорошо растворимой кислотой, но с
образованием малорастворимой соли, выпадающей в твердую фазу
(например, при травке плавиковой кислотой), то ионный состав
и степень перехода определяются уравнениями (1) и (2) (нали-
чием Сг2От~ можно пренебречь) и уравнением, характеризующим
растворимость МА. По закону действующих масс равновесие
МА М+ + А"
(Твердая фаза) (Раствор)
определяется константой (произведение растворимости):
S = [M+][A’]
594
Гл. XV. Соли хрома
В первом приближении можно принять линейную зависимость
растворимости МА в хроматно-бихроматных растворах от степени
перехода. По значениям для крайних точек можно найти
гл-1 5 S s\ 'dl
А]-у—pr-— + |6-------x Ц
1M+] 2c \ 2c /
ИЛИ Я
[A-] = + ьгх (11Я
s
где ^i = ’27~ растворимость MA в хроматном, b — в бихроматном |
растворе, a bi = b — b{. ' |
Уравнение (5) в данном случае будет иметь вид |
[НА] + [А"]-(1-0) а (12)
где у — степень перехода кислоты в виде соли МА в твердую фазу.
Так как [М+] = 2с— уа, то из условия электронейтральности
раствора следует:
с + [НА] = а+[СгО4~] (13)
Совместное решение уравнений приводит к квадратному урав-
нению:
(Н)
О| — I
Если bi — 0 (растворимость МА постоянна) и а = с, то I
г 2^ic + ~ V+ 4А,с) ,..v
----------------------------- (15)|
На рис. 174 нанесена кривая 3 степени перехода для а==с,‘1
bi = 0,05с и Кг = Ю-7. При травке монохроматного щелока плави- I
ковой кислотой можно принять Ki = Ю“3 и Ь[ — 0,05с, при этом I
уравнение (15) даст х = 0,998. I
Если травку производят малорастворимой кислотой (например J
угольной), то можно принять [НА] = const: Д
К2 = [Н+] [СгО*-] Ki [НА] [CrQ2-] Kt [НА] (1 -х) 5|
[НСгО4] [A-] [нСгО4] (6, + &2х) х
При bi = 0 „ А, [НА] (1-х) biX
откуда (16)
Ki [НА] + Kih
Физико-химические основы перевода хроматов в бихроматы
595
Пока насыщение раствора солью МА еще не достигнуто, можно
принять:
[А-] + [НСгО;] = сх
Тогда
к Ъ [НА] (1-х)
2 сх2
И ___________________
- [НА] + [НА]2 + [НА]
Х 2К1С
Если применяемая для травки кислота (или ангидрид) газо-
образна, то в результате наличия равновесия
[НА]газ [НА]р.р
на степень перехода должно влиять давление. Если для первого
приближения допустить, что система подчиняется закону Генри, то
[НА] = КР
где р — парциальное давление кислоты или ее ангидрида в газовой
фазе.
Подставив это значение [НА] в уравнения (16) и (17), можно
найти зависимость х от давления. При наличии МА в твердой
фазе
X К'КР
KtKp + Kibi
при отсутствии МА в твердой фазе
_ - KiKp + VК2К2р2 + Ж^Кср
Х 2KzC
Из уравнения (18) следует
(18)
(19)
(20)
откуда видно, что с повышением давления степень перехода моно-
хромата в бихромат растет.
Влияние температуры сказывается, главным образом, на изме-
нении растворимости НА и МА, так как отношение можно при-
нять не зависящим от температуры. Вследствие того, что раство-
римость газов сильно уменьшается с повышением температуры,
а растворимость солей обычно увеличивается, то, как видно из
Уравнения (20), степень перехода с повышением температуры дол-
жна уменьшаться.
Когда все компоненты хорошо растворимы, степень перехода х,
как мы видели выше, не зависит от концентрации. Иначе обстоит
Дело при малорастворимой кислоте. Так как Ь\ сильно уменьшается
® Ростом концентрации то, как видно из уравнения (18),
5Э6
Гл. XV. Соли хрома
значение х должно существенно повышаться с ростом концентра-
ции при наличии МА в твердой фазе (изменением [НА] с концен-
трацией можно пренебречь). Наоборот, при отсутствии МА в твер-
дой фазе величина х уменьшается с ростом концентрации, как это
видно из уравнения (19).
Что касается влияния «силы» травящей кислоты, то на рис. 162
видно, что с уменьшением константы диссоциации кислоты до
Ki = 10~4 степень перехода снижается с 1 до 0,97—0,99; при
= Ю“5 Л'= 0,91 — 0,97; с дальнейшим снижением до 10-9
значение х падает по S-образной кривой до 0,09—0,2 и асимптоти- ;
чески приближается к нулю. I
ПРОИЗВОДСТВО БИХРОМАТА НАТРИЯ151 (
Схемы производства бихромата натрия отличаются аппаратур-
ным оформлением. Одна из них изображена на рис. 175. Хромит
(51—53% Сг2О3) и доломит подвергают вначале грубому дробле-
нию в щековых дробилках до 40—50 мм, и, в случае их повышен-
ной влажности, высушивают дымовыми газами в барабанных су-
шилках до влажности менее 1%. Затем их измельчают в шаровых
мельницах до тонкости, соответствующей остатку 1—2% при про-
сеивании через сито с 4900 отверстиями на 1 см2 92’ 133’ 151~156. По-
мимо доломита в шихту подают пыль, улавливаемую в электро-
фильтрах из газов прокалочных печей, выносящих до 10% шихты,
и пыль от размольных механизмов, улавливаемую в рукавных
фильтрах, а также высушенный шлам после второй фильтрации
(см. ниже), полученный в процессе дальнейшей переработки про-
каленного спека (15—20% доломита заменяют шламом). Хромит,
соду и наполнители смешивают в шнеках, затем в двухвальных
лопастных смесителях. (Можно производить смешение в кипящем
слое 154.)
Для прокаливания хромитовой шихты служат барабанные вра-
щающиеся печи, установленные с уклоном 3—6°, делающие 0,7—
1,5 об!мин. Шихта проходит через печь в течение ~3 ч.
Противотоком шихте движутся греющие газы, получающиеся
сжиганием пылевидного угля, или газа, или нефти. Количество
кислорода, подаваемого в печь с воздухом, должно быть достаточ-
ным не только для сжигания топлива, но и для окисления хромита.
Оно должно в 3 раза превышать стехиометрическое количество,
необходимое для окисления окиси хрома, — отходящие газы долж-
ны содержать не меньше 7,5% О2 155’ *56. Топливо должно быть
малосернистое во избежание понижения степени окисления вслед-
ствие взаимодействия хромата натрия с двуокисью серы:
2Na2CrO4 + 2SO2 = Cr2O3 + 2Na2SO4 + 0,5O2
При использовании низкокалорийного топлива требуется по-
догревать подаваемый в печь воздух. Температуру в нижней частд
598
Гл. XV. Соли хрома
печи поддерживают в пределах 1100—1200°; температура отходя-
щих газов 500—750°. Тепло этих газов используется под паровыми
котлами, снабжающими паром дальнейшие стадии производства.
Пыль, уносимая газами из печи, улавливается в электрофильтрах,
в которые газ поступает с температурой 250—300°.
Газы из электрофильтров вентилятором (дымососом) частично
выбрасываются в дымовую трубу, частично подаются в сатуратор
для карбонизации шлама, получающегося в результате выщела-
чивания прокаленной шихты, а часть газов смешивается со струей
воздуха, подающей в печь угольную пыль. Смешение печного газа
•с воздухом, необходимым для подачи в печь пылевидного топлива
и для его сжигания (или для сжигания газообразного или жидкого
топлива), позволяет регулировать температуру в печи.
Нормальная работа печи в значительной мере зависит от усло-
вий, предотвращающих образование «козлов» или настылей1!7.
Важно поддерживать постоянный состав шихты, влияющий на по-
явление в печи жидкой фазы. Вредным является наличие большого
количества жидкой фазы в начале процесса (приблизительно в се-
редине печи) и уменьшение ее по мере завершения химических
реакций. Чтобы избежать больших количеств расплава на проме-
жуточных стадиях процесса предложено в шихтах, составленных
на богатой руде, заменять значительную часть соды карбонатом
кальция, т. е. работать на «малосодовой» шихте. Примеси в шихте
и топливе окислов железа, кремнезема и глинозема образуют с со-
дой вязкий и липкий плав. Поэтому при отоплении печей газом,
вместо угольной пыли, образование настылей уменьшается.
Уменьшение вязкости хромитовой шихты может быть также
достигнуто добавкой разрыхляющих материалов — древесных опи-
лок, рисовой шелухи и др.
Уменьшению настылеобразования способствует применение фу-
теровки, химически инертной к компонентам прокаливаемой шихты,
например из глиноземистого, хромитового или хромомагнезитового
-огнеупоров.
Применение гранулированной или брикетированной шихты по-
зволяет полностью исключить налипание частиц на футеровку и
•устранить кольцеобразование. Гранулирование шихты легко до-
стигается окатыванием предварительно увлажненной шихты в ба-
рабане или на наклонно расположенном круглом диске с невысо-
кими бортами 157>158.
Существенным является не перегружать печь. Перегрузка печи
приводит к увеличению длительности прогрева шихты, к уменьше-
нию степени окисления хромита, к увеличению расхода топлива и
к опасности «закозления» печи 159.
Производительность печи, имеющей длину 44 м и внутренний
диаметр 2,5 м, составляет 160—190 г шихты в сутки при степени
•окисления Сг2О3 в СгО3, равной 89—91%. В печи, имеющей длину.
Производство бихромата натрия
59»
55 л и внутренний диаметр 2,3 м, реакционная зона больше
и при той же производительности степень окисления достигает
92-93%.
О материальном и тепловом балансах прокалочной печи
см. 16°.
При содержании в исходной шихте 16—17,5% Сг2О3 концентра-
ция общего хрома в прокаленной массе в пересчете на СгО3 со-,
ставляет 26—30%, причем доля СгО3 в водорастворимых соедине-
ниях равна 88—90%. Выходящий из печи в виде гранул прока-,
ленный спек, имеющий температуру 800—900°, проходит через-
барабанный воздушный холодильник, измельчается в вальцовых
дробилках и поступает в шаровые мельницы мокрого помола, где:
происходит гашение, размол и выщелачивание хроматного спека.
Мельница представляет собой вращающийся стальной барабан,
выложенный панцырными плитами, внутри которого находятся-
стальные измельчающие шары. Для гашения и выщелачивания
спека применяют слабые щелоки, содержащие 20—50 г/л Na2CrO<,.
получающиеся при промывке на фильтрах горячей водой шлама,
идущего в отвал. В мельнице образуется пульпа (Т:Ж=1:3),:
жидкая фаза которой является раствором монохромата натрия^,
Температура пульпы 80—85°.
Пульпа из мельницы поступает в сатуратор, где происходит-
насыщение ее углекислым газом.
Применяют барботажные и барабанные сатураторы. Последние-
менее эффективны — они представляют собой вращающийся гори-
зонтальный цилиндрический стальной барабан длиной 20 м и диа-
метром 1,6 м, снабженный внутри продольными полками из швел-
леров, которые при вращении зачерпывают шламообразную массу
и по мере поднятия вверх разбрызгивают ее. Концы сатуратора-
соединены с загрузочной и разгрузочной головками, через которые
производится ввод и вывод пульпы и сатурационного газа. Головки-
установлены на роликовых тележках и откатываются во время
чистки сатуратора.
, Карбонизация пульпы производится очищенным в электрофиль-
трах дымовым газом из прокалочной печи, содержащим 10—16%.
СО2. Использование углекислого газа в сатураторе составляет
25—35%. Пульпу разделяют на барабанных вакуум-фильтрах. По-
лучаемый здесь монохроматный, или так называемый желтый-
«крепкий» щелок первой фильтрации содержит 230—270 г/л
Na2CrO4 и 6—10 г/л Na2CO3. Шлам на фильтре промывают горя-
чей водой или подогретым до 80° фильтратом второй фильтрации.
При промывке получают слабый щелок, содержащий 80—85 г/л*
Na2CrO4, который смешивают с промывной водой второй фильтра-
ции и используют для выщелачивания прокаленной шихты в мель-
Цице мокрого помола. Средняя производительность 1 м2 фильтрую-
щей поверхности составляет 100 кг шлама в час.
€00
Гл. XV. Соли хрома
В качестве фильтрующего материала используют капроновую
ткань, но она служит не более 2—3 суток, так как засоряется. При-
чиной засорения является главным образом выделение кальцита
из раствора монохромата натрия. Промывка капроновой ткани
слабой соляной кислотой позволяет в несколько раз увеличить
срок ее службы. Работы, проведенные в СССР и за рубежом, по-
казывают, что непрерывная регенерация капроновой фильтрующей
ткани может быть осуществлена при применении фильтров со схо-
дящим полотном 161.
Шлам с первых фильтров смывается водой на вторые (диско-
вые) вакуум-фильтры, откуда после промывки смывается в шламо-
вые пруды. Промытый шлам, уходящий в отвал, содержит 162 28—
35% СаО, 26—33% MgO, 6—10% Fe2O3, 5-8% А12О3, 3—6% SiO2,
5—8% Сг203общ, 1% С; в нем содержится 1 — 1,5% водораствори-
мого СгОз и 1—1,2% кислоторастворимого СгО3. Со шламом те-
ряется 15—17% хрома исходной руды. Показана возможность
уменьшения этих потерь путем автоклавного окисления трехва-
лентного хрома кислородом воздуха в процессе выщелачивания
спека при добавке соды, что способствует полному связыванию
содержащейся в спеке окиси кальция в карбонат и повышает вы-
ход хрома в раствор163’164. Одной из важных проблем хроматного
производства является утилизация шлама, накапливающегося в
•очень больших количествах. Частично этот шлам может быть ис-
пользован взамен части наполнителя (доломита) при составлении
хромитовой шихты 165’166. Его можно использовать для строитель-
ства дорог в качестве добавки при укреплении грунтов 167. Шлам,
получаемый при переработке известковых (бездоломитовых) шихт,
т. е. шлам с пониженным содержанием MgO, после прокалки с уг-
лем для восстановления Cr(VI) до Сг(Ш), может быть использо-
ван для получения силикатного кирпича (искусственного камня) и
портланд-цемента 'в8-170.
Желтый хроматный щелок подвергается «подтравке» — предва-
рительному травлению серной кислотой с целью нейтрализации
щелочности и разложения оставшегося в растворе алюмината нат-
рия:
2NaOH + H2SO4 = Na2SO4 + 2Н2О
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2
2NaA102 + H2SO4 + 2H2O = 2A1(OH)3 + Na2SO4
Полное превращение алюмината в гидроокись алюминия дости-
гается при pH = 8,2171. Подкисление щелока производится 73—
77%-ной серной кислотой при интенсивном перемешивании паром
де начала покраснения щелока так, чтобы в растворе образовалось
не более 10 г/л Na2Cr2O7 • 2Н^О. Предварительно щелок нагревают
острым паром до 75—80°, так как при Этом получается осадок
гидроокиси алюминия, более плотный и легче отстаивающийся.
Производство бихромата натрия
601
Монохроматный щелок фильтруется и отстаивается от осадка
гидроокиси алюминия. Осадок после отжатия и промывки водой
имеет вид пастообразной желто-зеленоватой массы и содержит
10-18% А12О3, до 3% СгОз, 0,5-9% SiO2, 2—16% СаО, 1-6%
MgO и до 85% воды. Он носит название хромаль и идет в отброс,
но может быть использован в кожевенном производстве или пере-
работан на алюмогель, пригодный в качестве адсорбента для осуш-
Рис. 176. Политерма растворимости
в системе Na2Cr2O7—Na2SO4—Н2О.
ки воздуха, очистки масел и
т. п.172. Алюмогель из хромаля
имеет следующий примерный
состав (в % на сухое веще-
ство): 63,6 — А120з, 8,5 — SiO2,
7,7 —Сг2О3, 9,4 —СаО, 8,9 —
MgO, 0,8 — SO4~- Для получе-
ния I т хроматного щелока, со-
держащего 195 г/л Na2CrO4,
расходуют: 202 кг хромовой
руды (50% Сг2О3), 288 кг до-
ломита (30% СаО), 71 кг со-
ды (95% Na2CO3), 7,4 кг сер-
ной кислоты (100% H2SO4),
512 м3 генераторного газа,
0,112 мгкал пара, 8,5 я3 воды.
Выход хрома в монохромат-
ный щелок составляет 75—81%.
Потери распределяются следу-
ющим образом: с неразложен-
ным хромитом 10—14%, со
шламом 6—10%, потери пои
размоле и пылеунос 1,5—3%.
Отстоявшийся монохроматный щелок подвергают травлению —
обработке 73—77%-ной серной кислотой для перевода монохро-
мата в бихромат. После травки в раствор добавляют гипохлорит
кальция (или хлорную известь) для окисления хрома, содержаще-
гося в хроми-хроматах. Полученный раствор бихромата натрия,
(«красный» щелок) выпаривают в две стадии в многокорпусных
вакуум-выпарных батареях. После первой выпарки до концентра-
ции Na2Cr2O7 600—660 г/л отделяют на центрифуге выпавшие кри-
сталлы безводного сульфата натрия и щелок упаривают вторично-
до ^лнпентрапии Na2Cr2O7 1100—1350 г/л.
На рис. 176 приведена политермическая диаграмма раствори-
мости в’системе Na2Cr2O7—Na2SO4—Н2О 173. Поверхность ACHE
, отвечает растворам, насыщенным Na2Cr2O7 • 2Н2О; поверхность-
FHMN — растворам, насыщенным Na2Cr2O7; поверхность CBDE —
Na2SO4 • ЮН2О; поверхность EDPMH—Na2SO4. При испарении
воды из раствора, в котором молярное отношение . Na2Cr2O7 г
602
Г л. XV. Соли хрома
: Na2SO4 равно 1:1, будет происходить кристаллизация Na2SO4.
При повышенных температурах луч, проведенный в плоскости изо-
термического сечения диаграммы из начала координат, пересекает
линию насыщения безводным сульфатом натрия, например при
98° — в точке К. При дальнейшем испарении воды, по мере выде-
ления в осадок Na2SO4 точка состава раствора будет перемещаться
по этой линии (КЛ1) в направлении к эвтонической точке М, в ко-
торой раствор окажется насыщенным обеими солями. Так как в эв-
тоническом растворе содержание сульфата натрия весьма мало, то
в процессе травки и последующей выпарки в осадок выделяется
почти весь сульфат натрия. В осадок переходит также некоторое
количество гидроокисей алюминия и железа.
Сульфат натрия подсушивают во вращающейся барабанной
сушилке и используют как товарный продукт, содержащий в I сорте
не меньше 78% Na2SO4 и не больше 1% ИагСггОт • 2Н2О и во
П сорте — не меньше 55% Na2SO4 и не больше 4% ИагСггОу • 2НгО.
На 1 т бихромата натрия получается до 700 кг сульфата.
Крепкий бихроматный щелок (~1100 г/л СгОз) после отстаива-
ния перерабатывается на твердый продукт. Для этого его увари-
вают в однокорпусных вакуум-выпарных аппаратах или в откры-
тых плавильных котлах, снабженных паровыми змеевиками и ме-
шалкой, до концентрации 67,5—69% СггОз и более. В таком плаве
содержится 0,4—0,7% SO4” и столько же С1". Для получения плав-
леного продукта плав разливают в стальные барабаны, где он пол-
ностью застывает (закристаллизовывается) при охлаждении на
воздухе, после чего барабаны укупоривают. Из плава изготовляют
также гранулированный и чешуйчатый продукты. Гранулирование
плава осуществляют в двухвальном лопастном грануляторе, дей-
ствующем периодически. Освоен и непрерывный способ получе-
ния гранулированного продукта из бихроматного раствора
(1100 г/л СгОз) распылением его на кипящий слой гранул в по-
токе топочных газов 174. Небольшую часть бихромата натрия вы-
пускают в кристаллическом виде. Для этого охлаждают горячий
красный щелок, выпаренный до концентрации 1200—1300 г/л СгОз-
Кристаллы отделяют на центрифуге, а маточный раствор присоеди-
няют к щелоку, идущему на выпарку 175-17е.
Причиной загрязнения бихромата натрия небольшим количе-
ством сульфата (и хлорида) натрия является недостаточно полное
•отделение наиболее мелкой фракции этих солей при отстаивании
бихроматного щелока. При получении кристаллического продукта
содержание этих примесей может быть незначительным при хоро-
шем отстаивании бихроматного раствора перед его кристаллиза-
цией. При плохой очистке этого раствора значительная часть взве-
шенного сульфата натрия может быть отделена от более крупных
кристаллов бихромата натрия классификацией кристаллической
пульпы на ситах. Наконец незначительное разбавление бихромат-
Производство бихромата натрия
60S
ного раствора перед кристаллизацией (от 1120 до 1070 г/л СгО3)
может обеспечить растворение примесей, а охлаждение раствора
при кристаллизации до 35°—предотвратить их выпадение из рас-
твора в процессе кристаллизации 177.
Отделение бихромата натрия от менее растворимого сульфата
натрия рекомендуют производить высушиванием раствора, содер-
жащего обе эти соли, например, в распылительной сушилке, с по-
следующим выщелачиванием водой бихромата и отделением суль-
фата натрия на центрифуге. Вторичное высушивание полученного-
концентрированного раствора бихромата натрия в распылительной
сушилке дает сыпучий, не пылящий и легкорастворяющийся про-
дукт 130. Эти операции, однако, значительно усложнят и удорожат
проивводство.
Предложено 178 также отделять от бихроматного раствора суль-
фат натрия и примеси добавлением к щелоку после травки серной'
кислотой крепкого паствора бихромата с повышением концентра-
ции до 800 г/л Na?Cr2O7 2Н?О. После отфильтровывания осадка
щелок упаривают.
На 1 т плавленого бихромата натрия (67,1% СгО3) расхо-
дуется 1,38—1,41 т хромита /50% Сг?О3'), 2,0—2,15 т доломита,
6,93—0,95 т кальцинированной соды (95% Na2CO3), 0,32—0.40 т
серной кислоты (100%) и 0.005—0,01 т гипохлорита кальция. Рас-
ход условного топлива (7000 ккал{кг} составляет 0,78—0,95 т,.
электроэнергии 400—500 квт-ч, пара 6—8 т, воды 20—40 т.
Получение бихромата натрия с углекислотной травкой хромата-
При травке раствора хромата натрия угольной кислотой сте-
пень перехода хромата в бихромат по реакции
2Na2CrO< + 2СО2 + Н2О < Na2Cr2O7 + 2NaHCO3
зависит от температуры, концентрации раствора хромата натрия
давления двуокиси углерода. С понижением температуры увели-
чивается растворимость СО? и уменьшается растворимость NaHCO3,
что способствует протеканию реакции слева направо. В то же-
время с понижением температуры уменьшается растворимость хро-
мата натрия, что может повлиять неблагоприятно на степень пере-
хода ,7Э. Степень превращения н бихромят насыщенного р.аствора
хромата, содержащего j6,98% Сг, при 23° под давлением СО2 4 ат
Достигает 66% за 5 ч. В ненасыщенном растворе 614,3% Сг) сте-
пень превращения под давлением 8 ат достигает 65% за 2 ч.
Повышение давления СО2 до 40 ат приводит к сравнительно-
небольшому увеличению выхода бихромата. При содержании в-
'00 мл раствора 16,6 г Сг и 10° степень превращения за 8—12 ч со-
ставляет под давлением 10 ат ~68%, а при 40 ат ~83% .
604
Гл. XV. Соли хрома
С повышением температуры до 30° степень превращения умень-
шается до 50% при 10 ат и до ~72% при 40 ат. С увеличением
концентрации хрома в растворе степень превращения возрастает
в большей мере при небольших давлениях и в меньшей мере при
повышенных давлениях 180.
Остающийся в растворе при однократной травке угольной кис-
лотой непрореагировавший хромат натрия (25—35% от общего
количества хрома) может быть переведен в бихромат при дотравке
Рис. 177. Растворимость в системе
Na2CrO4 — Na2Cr2O7 — Н2О.
раствора серной кислотой (после отделения бикарбоната). Для со-
кращения расхода серной кислоты предложено травленый раствор
выпарить и выкристаллизовать из него при охлаждении часть хро-
мата. При этом доля бихроматного хрома в растворе может повы-
ситься до 91%, а расход серной кислоты сократиться в 2,5—3,5
раза181. Это объясняется тем, что при кристаллизации хромата из
насыщенных растворов, содержание бихромата в которых мало,
происходит обогащение их бихроматом (рис. 177). Так, при 10°
эвтонический раствор содержит 6,73% ПагСгО4 и 55,7% Na2Cr2O7,
т. е. относительное содержание в растворе хрома в виде Na2CrO4
равно 8,89%, а в виде Na2Cr2O7— 91,11%. При выпаривании рас-
твора до концентрации 82% Na2Cr2O7, соотвётствующей темпера-
туре кипения его ~ 145° практически весь хромат удаляется из
раствора, а остающийся насыщенный раствор бихромата при ох-
лаждении застывает в твердый продукт 182.
Преимущества комбинированной травки угольной и серной кис-
лотами по сравнению с сернокислотной'травкой заключаются в
уменьшении расхода серной кислоты почти в 5 раз, соответствен-
ном сокращении количества образующегося сульфата натрия и по-
Производство бихромата натрия
605
терь с ним хромпика, в двукратном уменьшении расхода соды
вследствие возврата бикарбоната в процесс.
Возможна и полная замена серной кислоты угольной при двух-
стадийном осуществлении процесса травки с промежуточным от-
делением бикарбоната натрия. По такой схеме травка хромата
угольной кислотой в крупных заводских масштабах осуществлена
Рис, 178. Схема производства бихромата натрия с углекислотной травкой
монохроматного щелока:
/ — мельница для размола руды; 2 — шихтосмешеиие; 3 — печь для обжига извести; 4 — коль-
цевая печь для обжига шихты; 5 —приемный бак; 5 —мельница мокрого помола; 7 —фильтр;
5 —сгуститель; 9 —трехстадийная выпарка; 10 — двухстадийная выпарка; 11 — травочиые авто-
клавы; /2 — компрессор.
в Германии в 30-х годах. На рис. 178 показана схема производ-
ства бихромата натрия с углекислотной травкой 132> 133>183. Про-
калку шихты с известковым наполнителем осуществляют в кольце-
вых печах. В этих печах с горизонтальным вращающимся подом
исключается налипание спека на стенки печи. Благодаря быстрому
прогреву шихты и отсутствию непрерывных перевалок сохраняется
пористая, структура спека. Это обусловливает возможность приме-
нения извести вместо доломита и, следовательно, снижение рас-
хода наполнителя. В этом случае расход наполнителя составляет
0,755 т на 1 т бихромата натрия вместо 1 т/т при трехстадийной
прокалке (стр. 588) и вместо 2 т/т при одностадийной прокалке
Шихты.
606
Гл. XV. Соли хрома
Травку раствора хромата натрия производят под давлением
15—16 ат в две стадии смешанным газом (из известково-обжига-
тельных печей и из печей кальцинации бикарбоната), содержащим
50% СО2. В автоклавы первой стадии карбонизации поступает рас-
твор при 70° с содержанием 820 г/л хромата натрия. В процессе
карбонизации раствор охлаждается до 20° и хромат переходит в
бихромат на 86—87%. Затем раствор отделяют от выделившегося
бикарбоната на центрифуге и выпаривают до концентрации 1300 г/л
в пересчете на хромат натрия; выделившийся частично в осадок
хромат натрия отделяют отстаиванием. Щелок подвергают второй
карбонизации, причем температура его снижается от 70 до 30°, а
степень перехода хромата в бихромат достигает 94—96%. Вторая
стадия карбонизации завершается в течение 6 ч, причем повыше-
ние давления СО2 сверх 6 ат на выходе бихромата практически
не отражается. Выделившийся бикарбонат также отделяют на
центрифуге, а раствор поступает на дальнейшую переработку. Би-
карбонат натрия промывают водой, кальцинируют и полученную
«желтую» соду (содержащую ~1% Na2CrO4) возвращают на ших-
товку с хромитом. Расход соды при этом методе производства со-
ставляет 500 кг на 1 т хромпика вместо 920 кг при травке серной
кислотой.
БИХРОМАТ КАЛИЯ
Калиевый хромпик может быть получен путем поташного вскры-
тия хромитов, т. е. аналогично натриевому хромпику, но с приме-
нением поташа взамен соды. Этот способ в настоящее время не
применяется, так как рациональнее пользоваться более дешевыми
источниками калия, чем поташ, а именно хлоридом или сульфатом
калия, получая калиевый хромпик обменным разложением этих ка-
лиевых солей с бихроматом натрия по реакциям:
Na2Cr2O7 4- 2КС1 = К2Сг2О7 4- 2NaCl
Na2Cr2O7 4- K2SO4 = К2Сг2О7 4- Na2SOj
Поташный способ вскрытия хромитов может, однако, найти
применение в сочетании с травкой хромата угольной кислотой с
возвратом поташа в шихту, по схеме:
4К2СО3 4- 2(FeO • Сг2О3) 4- 3,5О2 = 4К2СгО4 4- Fe2O3 4- 4СО2
4К2СгО4 4- 4СО2 4- 2Н2О = 4КНСО3 4- 2К2Сг2О7
4КНСО3 = 2К2СО3 4- 2Н2О 4- 2СО2
При содержании в шихте 17,55% Сг2О3, стехиометрического ко-
личества поташа, 5%-ного избытка СаО (в виде доломита) сте-
пень окисления хромита за 60 мин составила в лабораторных усло-
виях ~95% 184. Увеличение продолжительности прокаливания до
2 ч повышает степень окисления на 1—2%. Уменьшение содержа-
ния К2СО3 в шихте до 50% от стехиометрического количества, не,-
Бихромат калия
607
обходимого для образования хромата, обусловливает понижение
степени окисления лишь на ~4°/о.
Описано 132> 1331135’178’185 получение бихромата калия на заводе
в Биттерфельде по щелочному способу спеканием хромита с едким
кали:
2Сг2О3 + 8КОН + ЗО2 = 4К2СгО4 + 4Н2О
Тонкоизмельченный хромит (7—10% остатка на сите с отвер-
стиями 0,044 мм) смешивают с 50% раствором КОН, не содержа-
щим больших количеств КС1. Полученную пульпу подвергают мок-
рому спеканию в течение 9—10 ч при 400—500° в печи, обогревае-
мой водородным пламенем. Обогрев печи водородным пламенем
исключает образование К2СО3, который налипает на стенки печи.
Плав выщелачивают раствором бикарбоната калия. Получаемый
раствор, содержащий 150—220 г/л К2СгО4 и 120—185 г/л К2СО3,
выпаривают до концентрации 670 г/л К2СО3. Выделившийся при
этом в осадок хромат калия растворяют в воде и подвергают трав-
ке двуокисью углерода под избыточным давлением 4 ат:
2K2CrO4 + 2СО2 + Н2О К2Сг2О7 + 2КНСО3
Осадок бихромата калия отделяют, промывают и высушивают,
а раствор бикарбоната калия направляют на выщелачивание плава.
Раствор поташа, полученный после отделения хромата калия, очи-
щают от остатков хромата, выпаривают и выпускают в виде то-
варного продукта. Степень использования хрома по этому методу
составляет 92—96%, т. е. выше, чем по другим методам, и мало
зависит от качества руды. На 1 т бихромата калия (67,1% СгОз)
расходуется около 2000 м3 водорода и получается 1,2—2 т поташа.
В СССР бихромат калия производят обменным разложением
бихромата натрия с хлоридом калия, более дешевым, чем сульфат
калия. Помимо этого, сульфаты натрия и калия образуют глазе-
ритовые твердые растворы в широком интервале концентраций, что
осложняет осуществление процесса 132’186. Процесс может быть
также осуществлен с применением сильвинита, т. е. смеси КС1 и
* NaCl. Однако в этом случае несколько уменьшается выход КгСг2О7
и возрастает количество воды, которое необходимо выпарить 187.
На рис. 179 изображена диаграмма растворимости в системе
Na2Cr2O7 + 2КС1 = К2Сг2О7 + 2NaCl при 25 и 100° 188~191. При
этих температурах стабильной парой солей являются КгСг2О7 и
NaCl; эти соли обладают и наибольшими полями кристаллизации.
Поле кристаллизации КгСг2О7при низких температурах сильно уве-
личено, поэтому обменное разложение Na2Cr2lO7 и КС1 можно было
бы проводить при обычной температуре (20—25°), причем в твер-
дую фазу выделялся бы К2Сг2О7. Однако при этом значительные
количества К2Сг2О7 оставались бы в маточном растворе, содержа-
щем NaCl. С целью более полного разделения этих солей обменное
608
Гл. XV. Соли хрома
разложение лучше проводить при повышенной температуре, когда
при соответствующем соотношении компонентов в твердую фазу
будет удаляться NaCl. После отделения осадка NaCl путем охла-
ждения щелока из него можно выкристаллизовать К2СГ2О7.
В качестве примера рассчитаем выход К2СГ2О7 при 25° из экви-
молекулярной смеси, содержащей (в г-ионах): 0,5 — К, 0,5 — Na,
0,5 — Cl и 0,5 — Сг2О7 (точка А на рис. 179). Этому составу соот-
ветствует содержание воды в насыщенном растворе 26 М на 1 г-мол
Рис. 179. Изображение цчкличгских методов получе-
ния бихромата калия на диаграмме система
Na2Cr2O7 + 2КС1 K2Cr2O7 + 2NaCl.
солей. Весовой состав раствора (в г): 29,25 — NaCl, 73,55 — К2Сг20т
и 468— Н2О. Он может быть получен растворением 37,28 г КС! и
65,5 Na2Cr2O7 в 468 г Н2О и будет содержать 11,5% Na2Cr2O7.
(Аналогично, в насыщенном растворе точки А — при 100° 29,9%
Р^агСггОу.)
При смешении указанных количеств солей с меньшим количе-
ством воды, например с 8,5 моль или 153 г Н2О, из системы будет
выкристаллизовываться бихромат калия, а состав жидкой фазы
будет изменяться по лучу кристаллизации К2Сг2О7 — А до точки
В, которая соответствует насыщенному раствору, содержащему
8,5 моль воды, 0,876 моль NaCl и 0,124 моль К2СГ2О7. Если обозна-
чим количество этого раствора у, а х — количество выкристаллизо-
Вихромат калия
609
вавшегося на участке А — В К2СГ2О7, то уравнение материального
баланса будет:
0,5К2Сг2О7 + 0,5NaCl = «К2Сг2О7 + у (0,876NaCl + 0,124К2Сг2О7)
Учитывая, что количество NaCl в рартворе не изменяется, т. е.
0,5 NaCl = у • 0,876 NaCl, находим у — 6,571 и х = 0,429. Следова-
0 429
тельно, выход К2СГ2О7 в твердую фазу составит• 100 = 85,8%.
Это максимальный выход К2СГ2О7, достигаемый при 25° из опти-
мальной (стехиометрической) смеси исходных солей при исключе-
нии опасности загрязнения продукта вследствие кристаллизации
NaCl, начинающейся в точке С.
Дополнительное извлечение К2СГ2О7 из маточного раствора
можно осуществить путем его концентрирования, например, при
100°. Раствор состава В при 100° находится в-поле кристаллизации
NaCl. Поэтому при выпаривании из раствора будет кристаллизо-
ваться NaCl, а состав раствора будет меняться по линии NaCl — В
по направлению к точке D, по достижении которой выпаривание
следует прекратить, во избежание выделения наряду с NaCl также
К2СГ2О7. Состав раствора в точке D (в молях): 0,609 — NaCl,
0,391 — К2СГ2О7 и 5,67—Н2О. По уравнениям материальных ба-
лансов для точки D легко найти что будет испарено 6,7 моль воды
(из 8,5 моль) и выделится 0,683 моль NaCl, или 78% от содержа-
щегося в исходном растворе (0,876 моль). При охлаждении маточ-
ного раствора (после отделения NaCl) до 25° возможно дополни-
тельно выделить 0,305 моль К2СГ2О7, или 78% от содержащегося
в растворе. Общий выход К2СГ2О7 в результате двухступенчатой
кристаллизации будет 85,8 + = 96,9% .
Циклическое получение бихромата калия обменным разложе-
нием бихромата натрия и хлорида калия может быть осуществлено
разными путями. Например, по циклу К—G — L — К. исходный
раствор, соответствующий по составу точке К при 100°, охлаждают
до 25°. Во избежание выделения NaCl маточный раствор должен
иметь состав точки G; при этом из первоначального раствора вы-
деляется 0,346 г-экв бихромата калия на 1 г-экв суммы солей. Ма-
точный раствор нагревают и выпаривают при 100° до получения
раствора состава L. При этом выделяется в осадок 0,346 г-экв
NaCl на 1 г-экв суммы солей. К отделенному от NaCl раствору до-
бавляют 0,692 г-экв смеси состава А. В результате снова полу-
чается 1 г-экв исходного раствора К и цикл возобновляется.
Возможно также получение бихромата калия по циклу Е —
'~~G—Н—Е. Однако в этом случае выход бихромата меньше и
требуется удалять при выпарке раствора большее количество
в°Ды, но аппаратурное оформление процесса проще.
20 М. Е. Позин
610
Гл. XV. Соли хрома
Выход бихромата по обоим циклам легко определить графиче-
ски. Прямые отрезки ЕЕ^ и параллельные прямой G —
— Na2Cr2O7, образующиеся при пересечении со стороной квадрата
K2Cr2O7—Na2Cr2O7 в точках Е, и Ki, соответствуют (в масштабе)
количеству бихромата калия, кристаллизующегося при охлажде-
нии растворов £ и Л до точки G.
Практически реакция между Na2Cr2'O7 и КС1 проводится в реак-
торе, куда предварительно заливают промывные воды и маточный
раствор и выпаривают их до плотности 1,37—1,38 г)смг. Затем
в реактор добавляют раствор бихромата натрия, содержащий не
менее 925 г/л СгОз, и в горячий раствор (~105°), содержащий
260—280 г/л СгО3, вводят эквивалентное количество КО. Раствор
слегка подкисляют серной кислотой для перевода примеси хромата
в бихромат и окисляют хроми-хроматы хлорной известью. После
отстаивания горячего раствора от выделившегося NaCl осветлен-
ный раствор направляют в кристаллизаторы, где при охлаждении
до 30—35° из него выделяется КаСг2О7. В процессе кристаллизации
раствор несколько раз разбавляют водой от промывки кристаллов
К2Сг2О7, чтобы избежать выпадения NaCl вместе с К2Сг2О7. Выход
бихромата калия по хрому достигает 96% |88,189-
На получение 1 т бихромата калия (98% К2Сг2О7) расходуется:
1,004 т бихромата натрия (100%), 0,55 т хлорида калия (95%),
0,017 т серной кислоты (100%), до 0,001 т хлорной извести, 5,2 т
пара, 300 квт-ч электроэнергии.
Другой путь разделения солей заключается в выпаривании ще-
лока после обменного разложения, причем NaCl выделяется в оса-
док; его отфильтровывают и промывают. Промывные воды возвра-
щают в производство. Отфильтрованный раствор К2Сг2О7 концент-
рируют (до 500—525 г/л КгСггО?) и после отстаивания направляют
на кристаллизацию в стационарные или вращающиеся кристалли-
заторы. Кристаллы КгСг2О7 подсушивают при 40—50°.
Кристаллизация бихромата калия (так же как и бихромата
натрия) сопровождается инкрустацией охлаждающих поверхностей
выделяющимися кристаллами. Для устранения или уменьшения
инкрустации требуется осуществлять интенсивное перемешивание
раствора, перемещающее процесс образования и роста кристаллов
с охлаждающих поверхностей в массу раствора, и обеспечить ма-
лую разность температур между раствором и охлаждающей водой.
Наиболее легко это достигается в кристаллизаторах непрерывного
действия192. Использование вакуум-кристаллизаторов приводит к
получению мелких кристаллов, как и при чрезмерно интенсивном
перемешивании раствора в механических кристаллизаторах. Кри-
сталлизация бихромата в аппаратах с охлаждением и перемеши-
ванием раствора барботирующим воздухом исключает инкруста-
цию, дает возможность использовать для сооружения кристалли-
затора или его облицовки нетеплопроводные, но химически стойкие
Хромовый ангидрид
611
материалы —пластмассы, резину и др. Однако расход энергии
в барботажных кристаллизаторах в несколько раз больше, чем
в вакуум-кристаллизаторах 193.
ХРОМОВЫЙ АНГИДРИД
Применяемые методы получения хромового ангидрида основаны
на обработке хромпиков концентрированной серной кислотой:
Na2Cr2O7 + 2H2SO4 = 2CrO3 + 2NaHSO4 + H2O
В стальной реактор с мешалкой и наружным электрообогревом
загружают плав бихромата натрия (60—65% СгО3) и добавляют
92—93%-ную серную кислоту (несколько меньше стехиометриче-
ского количества). Реакционную массу нагревают в течение 1,5—
2 ч, при этом вначале она вспенивается в результате интенсивного
удаления водяного пара, с которым уходят и образующиеся (из
содержащейся в исходном бихромате примеси NaCl) газы — С12,
НС1 и СгО2С12‘, отходящий газ для улавливания этих веществ про-
мывают в скрубберах раствором соды. По окончании вспенивания
добавляют остальное количество серной кислоты (до ~ 105% от
стехиометрического) и поднимают температуру в реакторе немно-
го выше 200°. Это обусловлено температурами плавления бисуль-
фата натрия (186°) и хромового ангидрида (~200°). Нагревание
массы выше 205° приводит к быстрому разложению СгО3 с выде-
лением кислорода и образованием соединений СгО3 с Сг2О3 8’194.
Реакция образования СгО3 на самом деле сложнее, чем приве-
денная выше, так как в системе Na2O—СгО3—SO3—Н2О могут су-
ществовать при разных температурах, помимо представленных в
уравнении, и другие соединения, например, Na2SO4, Na3H(SO4)2-
•Н2О, Na3H(SO4)2177. Кроме того, в небольшой мере идут побоч-
ные реакции диссоциации СгО3 и образования сульфата хрома
и его двойных соединений с сульфатом натрия и серной кислотой.
Соединения трехвалентного хрома появляются вследствие реакций:
2Na2Cr2O7 + 10H,SO4 = 2Cr2(SO4)3 + 4NaHSO4 + 8H2O + 3O2
4CrO3 + 6H2SO4 = 2Cr2(SO4)3 + 6H2O + 3O2
Сульфат хрома образует с серной кислотой нерастворимые без-
водные кислые сульфаты хрома 2Cr2(SO4)3 • H2SO4, Cr2(SO4''3-
•H2SO4 и другие, а также соли Na[Cr(SO4)2] и Na3[Cr(SO4)3] и
кислые соли х Na2SO4 • у Cr2(SO4)3 • z H2SO4.
После завершения реакции плав сливают в отстойник, снабжен-
ный наружными электроподогревателями. Вследствие разности
плотностей расплавленных хромового ангидрида и бисульфата
натрия (при 200° плотность СгО3 ~2,30 г]см\ плотность NaHSO4
~2,05 г/см3) и незначительной взаимной растворимости этих ве-
ществ, они расслаиваются. Скапливающийся в низу отстойника
20*
612
Гл. XV. Соли хрома
жидкий хромовый ангидрид направляют на охлаждаемые изнутри |
водой полые барабаны — вальцы, на поверхности которых он за- 1
стывает и снимается ножами в виде чешуйчатого продукта, кото- 1
рый укупоривают в стальные барабаны. После слива хромового |
ангидрида из отстойника выпускают бисульфат натрия — его ис- |
пользуют для травки хромата натрия, которую осуществляют в |
этом случае здесь же, в цехе хромового ангидрида ввиду трудно- |
сти транспорта расплавленного бисульфата в бихроматный цех. .1
Из 1 т хромового ангидрида получают более 1,5 т бисульфата нат- |
рия. Он содержит ~3,5% СгО8, 2% Сг2О3 и 32—33% титруемой I
H2SO4. 1
Полученный продукт содержит более 99% СЮ3. Использование 1
хрома составляет ~96%. На 1 т хромового ангидрида (98% CrO3) i
расходуется: 1,52 т бихромата натрия (67,1% СгО3) и 1,29 г серной I
кислоты (100%). Я
Применение бихроматного плава с содержанием 68—70% СгОз 1
(вместо 63%) позволяет сократить продолжительность плавки на |
20—40%, а замена купоросного масла олеумом (103—104% Н28О4) |
приводит к сокращению продолжительности процесса в 3 раза 195. |
Предложено производить очистку хромового ангидрида добав-
кой к нему кристаллического бихромата и его насыщенного вод-
ного раствора и нагреванием массы до плавления. При этом плав
расслаивается, — в нижний слой переходит чистый СгОз, а в верх-
ний — загрязнения |96.
Из общего количества Сг2О3, содержащейся в бисульфате, до
0,5% (абсол.) находится в форме водорастворимых соединений.
Можно уменьшить их содержание (до 0,05% Сг20з) выдержива-
нием бисульфата в смеси с 15% Na2SO4 (для предотвращения раз-
ложения СгОз) при 185° в течение 1 ч. При этом разлагается лишь
5—10% от содержавшегося в бисульфате СгОз, а Сг2О3 почти пол-
ностью переходит в нерастворимые соединения, которые могут
-быть отделены при приготовлении раствора бисульфата 197. При ис-
пользовании бисульфата для травки желтого щелока содержа-
щиеся в нем нерастворимые примеси отделяются после травки вме-
сте с выделяющимся сульфатом натрия. Оставшиеся в щелоке во-
дорастворимые соединения Сг3+ окисляют гипохлоритом 198’
За рубежом запатентован и осуществлен, так же как и в СССР,
непрерывный способ производства хромового ангидрида 200’201. Би-
хромат и серная кислота смешиваются и взаимодействуют, про-
ходя последовательно шнековые аппараты, в последнем из кото-
рых поддерживают температуру выше точки плавления СгОз, за-
тем плав разделяется в непрерывно действующем отстойнике; из
него хромовый ангидрид поступает на охлаждаемые вальцы для
получения чешуйчатого продукта, а бисульфат используется для
травки хроматного щелока. Непрерывный способ обеспечивает воз-
можность полной автоматизации производства.
Сульфаты хрома
613
Хромовый ангидрид может быть получен из монохроматных
(желтых) щелоков через хромат кальция по следующей схеме:
хромат кальция осаждают обработкой хроматного щелока хлори-
дом кальция при кипячении; отфильтрованный и промытый хромат
кальция разлагают серной кислотой, причем образуются гипс и
раствор СгО3; гипс отделяют на фильтре и раствор выпаривают
для получения твердого СгО3 202. Материалом для выпарного ап-
парата может служить титан.
Описано много других путей получения СгО3 (например, разло-
жение хромата натрия азотной кислотой 195), но они пока не имеют
промышленного значения.
СУЛЬФАТЫ ХРОМА
Сульфаты хрома применяются главным образом в качестве ду-
бителей203. Раньше для этой цели вырабатывали хромовые квасцы,
которые использовались для приготовления дубильных соков, те-
перь они заменены готовыми сухими хромовыми дубителями — ос-
новными сульфатами хрома, содержащими к тому же больше Сг2О3.
Хромовые квасцы
Хромовые квасцы могут быть получены любым методом, при
котором в растворе образуется смесь сульфата хрома и сульфата
натрия, калия или аммония. Так, например, квасцы могут быть
получены растворением феррохрома в серной кислоте с последую-
щим отделением от железа и введением в раствор сернокислого
хрома сульфата щелочного металла.
Промышленное производство хромовых квасцов 153 основано на
восстановлении хромпиков в водном растворе серной кислоты.
Восстановление производится органическими веществами, которые,
окисляясь, полностью переходят в углекислый газ и воду, не за-
грязняя квасцы продуктами своего окисления. В качестве восста-
, новителей могут применяться щавелевая кислота, спирт, сахар,
патока, ржаная или пшеничная мука, древесные опилки, каменно-
угольная смола и т. п.
Реакция образования квасцов выражается схематическим урав-
нением
2Na2Cr2O7 + 8H2SO4 + 40Н2О + ЗС = 2 [Na2SO4 • Cr2(SO4)3 • 24Н2О] + ЗСО2
и протекает со значительным выделением тепла. В аппарат зали-
вают бихроматный щелок, содержащий 1100—1200 г/л Na2Cr2O?, а
' затем 6.5—75%-ную серную кислоту. Количество кислоты коррек-
тируют по анализу массы в конце процесса. После заливки кис-
лоты при непрерывном перемешивании в реактор очень медленно
вводят восстановитель, например каменноугольную смолу. При
614
Гл. XV. Соли хрома
этом масса разогревается, сильно вспенивается вследствие выде-
ления СО2 и увеличивается в объеме. Поэтому полезная емкость
аппарата составляет лишь около 30% его объема.
Температура реакционной массы не должна превышать 60—65е,
так как перегретая масса после выпуска из реактора застывает
чрезмерно долго.
Вследствие того что квасцы кристаллизуются с 24 молекулами
воды, твердый продукт может быть получен простым охлаждением
реакционной массы. Поэтому по окончании реакции масса выпус-
кается из аппарата непосредственно в тару — деревянные бочки, в
которых и застывает в твердый продукт — хромо-натриевые квас-
цы. На 1 т 100%-ных хромо-натриевых квасцов расходуется 0,3 т
100%-ного бихромата натрия, 0,41 т 100%-ной серной кислоты и
несколько десятков килограммов восстановителя (в зависимости
от его состава).
Хромо-калиевые квасцы производятся (из бихромата калия)
тем же методом, как и хромо-натриевые. Разница лишь в том, что
хромо-калиевые квасцы образуются не в виде загустевающей
массы, а кристаллизуются из раствора 204. Они лучше по качеству,
чем хромо-натриевые квасцы, так как являются более чистым про-
дуктом, но стоят дороже.
Хромовые квасцы можно получать, пропуская сернистый газ
через охлажденный до 0° насыщенный раствор бихромата.
Изучена распылительная сушка водных растворов хромовых
квасцов подогретым воздухом при 95 и 120°. Расход тепла составил
~2700 ккал на 1 кг удаленной влаги и ~3900 ккал на 1 кг сухого
продукта 205. Уменьшение удельного расхода тепла возможно при
использовании в качестве сушильного агента смеси воздуха с то-
почными газами.
Сернокислый раствор хромо-аммониевых квасцов используют в
качестве электролита в производстве металлического хрома 206.
Для получения хромо-аммониевых квасцов восстанавливают хро-
мат натрия сернистым газом и отделяют кристаллизацией сульфат
натрия или растворяют в серной кислоте (отработанном электро-
лите) феррохром и очищают раствор от сульфата железа.
Основные сульфаты хрома
Основной сульфат хрома получают так же как и хромовые
квасцы — восстановлением раствора бихромата натрия органиче-
скими веществами или сернистым ангидридом и его производными.
Восстановление органическими веществами ведут в кислом рас-
творе. Например, при использовании мелассы, реакция идет по
схеме:
8Na2Cr2O7 + 24H2SO< + Ci,H22On - 16Cr(OH)SO4 + 8Na2SO4 + 12CO2 + 27H2O-
Гидроокись и окись хрома
615
Полученный раствор выпаривают до концентрации 300 г/л
СггОз, затем высушивают. Продукт содержит до 30% Сг2Оз 207. Его
основность зависит от количества вводимой в процесс серной кис-
лоты. Поэтому, а также из-за явлений гидролиза и других факти-
ческая формула основного сульфата хрома отличается от формулы
Cr(OH)SO4, согласно которой его основность равна 33,3% 208.
В США выпускают продукты с основностью от 33 до 52% при со-
держании Сг20з около 25%.
Пока менее распространенным, но более совершенным методом
является восстановление бихромата двуокисью серы (а также со-
лями сернистой и тиосерной кислот). Восстановление по реакции
N а2Сг2О7 + 3SO2 + Н'2О = 2Cr(OH)SO4 + Na2SO4
идет в отсутствие свободной серной кислоты и дает продукт с ос-
новностью 33,3%. После отдувки избыточного сернистого газа
острым паром полученный концентрированный раствор высуши-
вают в распылительной сушилке.
При восстановлении монохромата натрия по реакции
2Na2CrO4 + 3SO2 + 2Н2О = Cr2(OH)4SO4 + 2Na2SO4
можно получить продукт с основностью 66,7%, а при использова-
нии смеси бихромата и монохромата получаются сульфаты хрома
с основностью 40—45%, представляющие наибольший интерес как
дубители 209.
Основные сульфаты хрома, так же как и хромовые квасцы, мо-
гут быть получены из феррохрома210. Предложены, но не нашли
широкого распространения методы кислотного вскрытия хроми-
тов211-215. Существенным осложнением этих процессов является не-
обходимость отделения железа216 и других примесей.
ГИДРООКИСЬ И ОКИСЬ ХРОМА
Гидроокись хрома обычно получают из бихромата натрия. Рас-
твор Na2Cr2O7, нагретый до 60°, подкисляют соляной кислотой и
• затем вводят отдельными порциями смесь, состоящую из форма-
лина (32—35%) и соляной кислоты (плотность 1,19 г/см3). Полу-
чается раствор хлорного хрома, который обрабатывают избытком
аммиака для осаждения гидроокиси хрома. Осадок, после отделе-
ния от маточного раствора и промывки водой для удаления С1_,
содержит 40—60% воды и подвергается высушиванию. В зависи-
мости от условий осаждения и высушивания получаются разные
гидраты окиси хрома: Сг2О3-7Н2О, Сг2О3 • 5Н2О, Сг2О3 • 4Н2О
и др.8.
Окись хрома, предназначенную для полировальных паст и для
Малярных целей, получают дегидратацией гидратов окиси хрома217
или прокаливанием смеси бихромата калия или натрия с серой или
616
Гл. XV. Соли хрома
углем131 (древесными опилками) при 700—800°. Восстановление
протекает по суммарным реакциям:
К2СГ2О7 + S = K2SO4 + СГ2О3
КгСггОу 4- 2С = К2СО3 + СО 4* СГ2О3
Процесс осуществляется при первоначальном нагревании смеси
и затем протекает бурно без подвода тепла. Прокаленную массу
по остывании измельчают и обрабатывают водой, или сразу гасят
водой, которая отмывает от окиси хрома растворимые соли. Отмы-
тую окись хрома высушивают и иногда прокаливают при 700—800°
для выжигания органических примесей, а затем, после охлажде-
ния, вновь промывают водой при 50—60°. При получении окиси
хрома из бихромата натрия, серы и древесных опилок (с золь-
ностью 7,4%) или древесного угля (с зольностью 5,5%) наиболь-
ший выход СггОз, равный 96,6%, получается при шихте состава
Na2Cr2O7: S : уголь = 15 : 2 : 3. В продукте содержится ~82%
Сг2О3. В отсутствие серы выход Сг2О3 не превышает 87% 218.
Прокаливание бихромата калия с 9—11% древесного угля от
веса бихромата осуществляют в футерованных камерах, а также
на непрерывно движущейся ленте, заключенной в стальном ко-
жухе. Часть кожуха футерована внутри огнеупорным кирпичом,
накаливаемым снаружи топочными газами. При движении через
раскаленную футерованную часть шихта воспламеняется и в ней
идет реакция образования окиси хрома. Выделяющаяся окись
углерода сгорает в этой части печи за счет засасываемого воздуха.
Образующаяся окись хрома сгружается у конца ленты через спе-
циальный люк; ее отмывают от поташа и высушивают 131-|32.219_
Восстановление бихромата калия углем может быть совмещено'
с получением бихромата калия поташным способом (стр. 606), с
использованием получающегося поташа для приготовления хроми-;
товой шихты. Расход поташа в этом случае определяется лишь ве-
личиной производственных потерь |84.
Аналогичным образом процесс можно осуществлять, применяя
вместо бихромата хромат натрия. В этом случае образование оки-
си хрома идет через метахромит натрия NaCrO2, содержание кото-
рого в спеке достигает 10—15%. При выщелачивании спека мета-,
хромит натрия гидролизуется с образованием едкого натра и гид-,
роокиси хрома. Это приводит к необходимости повторной прокалки,
выщелоченной массы с последующей отмывкой продукта от обра-;
зовавшегося монохромата натрия 220.
Содержание свободного и карбонатного углерода в окиси хрома,;
полученной восстановлением К2Сг2О7 древесным углем, составляет)
0,3—0,5%. Для получения металлургической окиси хрома, содер-;
жащей не более 0,15% углерода, производят его выжигание при-
650—700° в электрических вращающихся печах. Этот процесс про-
текает крайне медленно из-за плохой теплопроводности материала)
Гидроокись и окись хрома
617
и малого содержания выжигаемого углерода. Процесс возможно
осуществить при более низкой температуре с применением окисли-
теля, например NH4NO3 или СгОз221. В присутствии 10% NH4NO3
(от веса СггО3) выгорание углерода за 1 ч при 350° протекает на
85—90%.
Удаление углерода происходит в результате следующих реак-
ций:
2NH4NO3 + С = СО2 + 2N2 + 4Н2О
2NH4NO3 + К2СО3 = 2NH3 + СО2 + Н2О + 2KNO3
Образовавшийся нитрат калия реагирует с окисью хрома, да-
вая хромат (и, возможно, бихромат):
Сг2О3 4- 4KNO3 = 2ГСг^--гО4 4- N2O3 4- 2NO2
Непрореагировавший нитрат аммония разлагается (стр. 1183).
Окись хрома может быть получена восстановлением твердого
бихромата или хромата газообразными восстановителями — водо-
родом 222'223, окисью углерода 224 и другими, например в печи со
взвешенным слоем 225. Запатентованы методы восстановления хро-
матов газами (Н2, СО) в растворах под давлением 150—
200 ат 22S~2№. Окись хрома получается также обработкой хлорного
хрома при 500° кислородом воздуха 229’230, или водяным паром231.
Чистую окись хрома можно получать прокаливанием гидро-
окиси хрома, осажденной из солей трехвалентного хрома аммиа-
ком или едкими щелочами, а также при нагревании бихромата
аммония или смеси бихромата калия или натрия с хлоридом или
сульфатом аммония. В основе последних процессов лежит реакция:
(NH4)2Cr2O7 = Сг2О3 4- N2 4“ 4Н2О 4-123 ккил
Образование окиси хрома происходит, очевидно, за счет вос-
становления Сге+ до Сг3+ аммиаком, входящим в состав бихромата
аммония.
Непосредственное восстановление бихромата натрия аммиаком
‘ идет при 300° до хроми-хромата натрия. Хромат натрия при этой
температуре не реагирует с аммиаком. При 700° бихромат и хро-
мат натрия восстанавливаются аммиаком до хромитов:
Na2Cr2O7 4- 2NH3 = Na2O • Сг2О3 4- ЗН2О 4- N2
2Na2CrO4 4- 2NH3 = 2Na2O • Cr2O3 4- ЗН2О 4- N2
Однако гидролиз хромитов натрия протекает с трудом и при
выщелачивании их большим количеством горячей воды удается пе-
ревести в раствор не более 30% щелочи 232.
Окись хрома может быть получена восстановлением щелочного
раствора хромата натрия сернистым газом 233’234. При этом осаж-
дается хромат хрома (хроми-хромат) 2Сг2О3 • СгОз • хН2О, который
618
Гл. XV. Соли хрома
при дальнейшем прокаливании переходит в окись хрома. Послед-
ний процесс основан на том, что при нагревании СгОз выделяет
кислород и переходит в Сг20з:
2(2Сг2О3 • СгОз • хН2О) = 5Сг2О3 + 1,бО2 + 2хН2О
Взаимодействие бесщелочного раствора хромата с двуокисью
серы при pH = 9,2 протекает с частичным образованием бихро-
мата:
7CrO^~ + 6SO2 + хН2О = 2Сг2О3 • СгО3 • хН2О + 6SO^~ + Сг2О3~
Максимальная степень восстановления хромата достигается при
рН = 5,3; она равна ~57%, а максимальная степень осаждения
хрома 71,4%. При дальнейшем введении SO2 ион Сг2О72- восста-
навливается до ’/з-основного сульфата хрома CrOHSO4, переходя-
щего затем в нейтральный сульфито-сульфат хрома. Одновременно
может происходить растворение ранее выделившегося осадка хро-
мата хрома, также переходящего в сульфито-сульфат хрома.
При восстановлении сернистым газом кипящего щелочного рас-
твора монохромата натрия (с добавкой Na2COs или NaOH) дости-
гается практически полное осаждение гидроокиси хрома (при по-
нижении pH до 5,3) по реакции
2СгО2- + СО2- + 3SO2 + хН2О = Сг2О3 • хН2О + 3SO2" + СО2
или по реакции:
2СгО4~ + 2ОН” + 3SO2 + (х - 1)Н2О = Сг2О3 • хН2О + 3SO|‘
Окись хрома получается после прокаливания отфильтрованной
и отмытой гидроокиси; маточный раствор может быть переработан
на товарный сульфат натрия.
Помимо способов, кратко рассмотренных выше, окись хрома
можно получать прокаливанием хлоридов хрома 235 или основных
сульфатов хрома или карбонизацией их в водных суспензиях с
последующим прокаливанием образующейся гидроокиси хрома238
и другими путями. В СССР в настоящее время окись хрома полу-
чают главным образом двумя способами — термическим разложе-
нием хромового ангидрида и восстановлением хромата натрия в
растворе серой и тиосульфатом (хроматно-серный метод).
Термическое разложение хромового ангидрида 131 позволяет по-
лучать тонкодисперсную окись хрома для шлифовальных матери-
алов и для лакокрасочной промышленности. В результате прока-
ливания расплавленного хромового ангидрида при 850—900° окись
хрома образуется по реакции:
2СгО3 — Сг2О3 + 1,бО2
Гидроокись и окись хрома
619
Однако при этом появляются промежуточные продукты (стр.
567), разлагающиеся по мере повышения температуры по схеме8:
180-200° 200-270° 285-300° 340- 370°
СгОз > CrO2,ge -------> СгО2,д06 ----* СгО2>625 ------*
___k 450—490° Выше 800°
По более поздним данным238:
г \ 197°^ г г, i \ 218- 307° 330- 370°
СгО3(тв.)----> СгО3(ж.)-------> СгО21в2(тв.)------>
„ 370 - 432°
—* СгО2>43 (тв.)-----> СгО1г5 (тв.)
Полученный спек гасят водой (промывными растворами) и
систематически промывают (для извлечения растворимых веществ,
главным образом сульфата натрия). В хромовом ангидриде содер-
жатся примеси соединений SO% — бисульфата натрия и кислой
соли сульфата хрома xNa2SO4- yCr2(SO4)3 • zH2SO4 (стр. 566). Кис-
лый сульфат хрома образуется и при прокаливании в результате
взаимодействия окиси хрома с бисульфатом. Во избежание загряз-
нения окиси хрома нерастворимым кислым сульфатом хрома
предложено 238 добавлять к хромовому ангидриду соду, которая
переводит и бисульфат натрия и сульфат хрома в сульфат натрия:
2NaHSO4 + Na2CO3 = 2Na2SO4 + Н2О + СО2
Cr2(SO4)2 + 3Na2CO3 = 3Na2SO4 + Cr2O3 + 3CO2
Отфильтрованную после выщелачивания и промытую пасту
окиси хрома высушивают в барабанной сушилке с наружным обо-
гревом. Окись хрома, получаемая термическим методом, содержит
99—99,5% Сг2О3, 0,01—0,015% S, -0,03% С, 0,02—0,07% FeO,
0,03—0,07% Н2О.
Хроматно-серный метод получения окиси хрома
Этим методом, заключающимся в восстановлении водного рас-
твора хромата натрия серой 200, производят наибольшее количе-
ство окиси хрома, главным образом, для переработки на металли-
‘ ческий хром. Преимущество метода — использование сравнительно
дешевого сырья — раствора монохромата натрия и, вследствие
этого, низкая себестоимость продукта (на 13—17% ниже себестои-
мости окиси хрома, полученной термическим разложением хромо-
вого ангидрида 200; см. также 230).
Щелочной раствор монохромата натрия, содержащий НО—
140 г/л СгОз и около 10 г/л щелочи (в пересчете на NaOH), обра-
батывается в каскаде реакторов при кипячении (103°) тонкоиз-
мельченной (0,2 мм) серой, добавляемой в виде суспензии в части
хроматного щелока, приготовленной в шаровой мельнице. По дру-
гому варианту восстановление осуществляют в автоклавах рас-
плавленной серой.
620
Гл. XV. Соли хрома
Вследствие гидролиза серы в горячем щелочном растворе обра-
зуются ионы (S-Sn)2' и другие (см. гл. XIV), которые восстанав-
ливают шестивалентный хром до трехвалентного, а сера превра-
щается главным образом в S2O3 • Общее уравнение реакции вос-
становления:
4Na2CrO4 + 6S + (2х + 1)Н2О = 2(Сг2О3 • хН2О) + 3Na2S2O3 + 2NaOH
Выделившийся осадок гидроокиси хрома отфильтровывают на
барабанных вакуум-фильтрах, промывают и прокаливают для по-
лучения окиси хрома в барабанной печи при —1100° в потоке га-
зов, полученных сжиганием топлива в избытке воздуха для созда-
ния окислительной атмосферы. При этом примеси сернистых соеди-
нений и щелочи превращаются в водорастворимые соли Na2SO4 и
Na2CrO4. Для их извлечения выходящий из печи спек окиси хрома
выщелачивают, затем несколько раз промывают на фильтрах с
промежуточными репульпациями и высушивают в барабанной су-
шилке с наружным обогревом.
Щелочной раствор тиосульфата натрия, полученный после отде-
ления гидроокиси, перерабатывают с помощью серной кислоты на
сульфат натрия и серу по реакции:
3N a2S2O3 + H2SO4 = 3Na2SO4 + 4S + H2O
Более рациональным является использование этого раствора
для восстановления хромата натрия по реакции 240-243:
10Na2CrO4 + 3Na2S2O3 + 7H2SO4 + (2х - 7)Н2О =
= 2(2Сг2О3 • СгОз • хН2О) + 13Na2SO4
При этом окись хрома получают по так называемой упрощен-
ной схеме хроматно-серного метода, заключающейся в двухстадий-
ном восстановлении монохромата — сначала часть щелочного рас-
твора монохромата восстанавливают жидкой серой в автоклаве,
затем к полученной суспензии окиси хрома в щелочном тиосуль-
фатном растворе добавляют остальную часть монохроматного рас-
твора и серную кислоту и смесь кипятят. После этого дополни-
тельно обрабатывают раствор в автоклавах при 150°. Отфильтро-
ванный осадок хроми-хроматов прокаливают, при этом он превра-
щается в окись хрома, не содержащую адсорбированной щелочи,
так как процесс восстановления завершается в кислой среде. Эта
окись хрома не требует дальнейшей обработки и выпускается в
качестве готового продукта. Раствор, оставшийся после отделения
хроми-хроматов, перерабатывают на товарный сульфат натрия.
В упрощенном варианте хроматно-серного метода отсутствует ряд
операций, имеющихся в основном варианте — выщелачивание,
фильтрование с репульпациями и сушка окиси хрома.
На производство 1 т окиси хрома хроматно-серным методом
расходуется 2,02 т монохроматного щелока (67,1% СГ2О3), 0,85 т
Хлорный хром
021
серы и 0,06 т кальцинированной соды, а по упрощенному варианту
2,05 т монохроматного щелока, 0,175 т серы, 1 т серной кислоты
(100%) и 0,02 т кальцинированной соды. Получаемая окись хрома
содержит 98—99% Сг2О3, меньше 0,01 % S, 0,03% С, ~0,1 % FeO,
до 0,08% Н2О.
ХЛОРНЫЙ ХРОМ
В связи с трудностью получения металлического хрома непо-
средственно из железистой хромитовой руды, ее сначала перераба-
тывают на соединения хрома, которые (главным образом Сг2О3)
и служат сырьем для металлургов. Одним из перспективных видов
такого сырья является безводный хлорный хром СгС13 — он обра-
зуется при хлорировании газообразным хлором хромитов, в част-
ности низкопроцентных, в присутствии восстановителя при 800—
1000° 244-247. При хлорировании брикетов руды с каменным углем,
например в шахтной печи, образуется СгС13 наряду с другими ле-
тучими и нелетучими хлоридами: FeCl3, А1С13, SiCl4, MgCl2 и др.
При небольшом избытке хлора низшие хлориды хрома и железа
не образуются. В отсутствие восстановителя хлорируется только
закись железа. Летучие хлориды могут быть разделены дробной
конденсацией вследствие различного давления их пара.
Хлорирование при 900—1000° обеспечивает практически полное
извлечение хрома из руды в виде СгС13, Восстановителем является
главным образом окись углерода. В указанном интервале темпе-
ратур при размерах частиц угля меньше 0,15 мм, а частиц руды
меньше 0,07 мм, скорость процесса лимитируется реакцией газифи-
кации углерода. Если частицы руды крупнее 0,15 мм, лимитирую-
щей становится реакция хлорирования. В последнем случае резко
возрастает расход углерода, так как отношение СО : СО2 в отходя-
щем газе увеличивается 248’249.
Удаление железа из хромитовой руды или концентрата позво-
ляет использовать их для непосредственной переработки в хром
металлургическими методами. Такое обогащение хромита может
быть достигнуто селективным хлорированием в присутствии огра-
.ничейного количества углерода 248’250’251. Входящие в состав руды
окислы могут быть расположены в следующий ряд по уменьшению
своего сродства к хлору (в присутствии углерода при 800—1000°):
MgO, Fe2O3, FeO, Cr2O3, A12O3, SiO2. Окислы железа хлорируются
легче окиси хрома и потому, если в шихте содержится лишь такое
количество углер'ода, которое необходимо для связывания кисло-
рода окислов железа, то в результате хлорирования почти пол-
ностью удаляется железо и только небольшая доля хрома (менее
10 отн. %), которая может быть извлечена из газовой фазы в виде
СгС1з его фракционной конденсацией. Например, при лаборатор-
ном хлорировании руды, содержавшей 51,6—55,0% Сг2О8, 1,6—
Ю,3% Fe2O3, 3,1-9,9% FeO, 13,7—17,4% MgO, 8,8—8,4% А12О3,
622
Гл. XV. Соли хрома
4,4—5,9,% SiO2 и до 1,1% СаО, получался продукт — безжелези-
стый хромовый концентрат, в котором было 60—64% Сг20з и
меньше 0,2% железа; содержание углерода не превышало 0,02%,
а хлора — 2,3% 250.
Хлорный хром можно получать хлорированием феррохро-
ма 252—256^ При хлорировании углеродистого феррохрома избытком
хлора при 900—1000° образуются газообразные СгС1з и FeCl3. Без
избытка хлора образуется также жидкий FeCl2. Процесс может
быть осуществлен автотермично. Хлорирование можно вести и в
среде расплавленных хлоридов (Na, К, Mg, Са, Ва, Fe)253’257. Для
хлорирования хромита и феррохромита может быть использован
также хлористый водород 258'259.
ДРУГИЕ МЕТОДЫ ПЕРЕРАБОТКИ СЫРЬЯ И ОТХОДОВ, СОДЕРЖАЩИХ
ХРОМ
Несмотря на то что в промышленности получила распростране-
ние окислительная прокалка хромита с целью переработки его в
соли шести- и трехвалентого хрома, в отдельных случаях могут
представить интерес и другие методы переработки хромовых руд.
Следует также отметить, что щелочная прокалка хромита с окис-
лением его кислородом воздуха экономична лишь при использова-
нии высококачественных руд с малым содержанием кремнезема.
Низкокачественную хромитовую руду предложено перерабаты-
вать кислотным методом, заключающимся в следующем. Руду, из-
мельченную до размера частиц меньше 75 мк, растворяют в 75 % -
ной серной кислоте при 140—160° в присутствии СгО3 (10% от
веса руды), который служит катализатором. Степень разложения
руды за 4 ч составляет 90%. Образующийся раствор зеленого
цвета разбавляют водой, отфильтровывают от неразложенного хро-
мита и кремнезема и после дополнительного разбавления до кон-
центрации 45 г/л Сг2О3 подвергают электрохимическому окисле-
нию. Электролиз осуществляют в ванне с диафрагмой и с элек-
тродами из двуокиси свинца при плотности тока ~2а/дм2 и
напряжении 3,2 в. Степень окисления раствора составляет 95%,вы-
ход по току 50—55%. Полученный раствор красного цвета выпа-
ривают до концентрации 750 г/л SO Ад причем из него выделяется
85—90% содержащегося в нем сульфата железа и 60—80% суль-
фата алюминия. После отделения сульфатов фильтрат выпари-
вают до концентрации, соответствующей температуре кипения 150°.
Охлаждением выпаренного раствора из него выкристаллизовывают
СгОз. Отфильтрованный и промытый продукт содержит до 95%
СгОз (или до 99% СгО3 в сухом веществе). Фильтрат, содержащий
значительное количество СгО3 и H2SO4, возвращают на разложе-
ние руды. Степень извлечения хрома из руды, содержавшей 37 7%
Сг2О3, 12,5% FeO, 26,8% А12О3, 18,8% MgO и 4,6% SiO2, на опыт-
ном заводе составляла 75% 26°.
Другие методы переработки сырья и отходов
623
Представляет интерес применение пористых сорбентов для раз-
деления соединений хрома и железа при помощи ферроцианида ка-
лия, как осадителя, и древесного активированного угля в качестве
сорбента (носителя) 261.
Хромовый ангидрид, полученный кислотным методом из бедных
руд, может быть использован без дальнейшей очистки для произ-
водства дубильных солей, хроматов, бихроматов и красок. При до-
полнительной перекристаллизации можно получить продукт, при-
годный для хромирования.
Изучение выщелачивания хромита серной кислотой в присут-
ствии К2СГ2О7 в качестве окислителя показало, что растворение
определяется окислением Fe2+ в Fe3+ и зависит от отношения содер-
жащегося в руде общего количества FeO к количеству FeO, свя-
занному с Сг20з. Для высокосортной руды, содержавшей 43,95%
СггОз и 18,7% FeO (FeOoom: FeOxp = 0,9), извлечение хрома из
руды достигло 94,5%; из низкосортной руды, содержавшей 37,41%
Сг20з и 11,66% FeO (FeOoom FeOxp = 0,66), было извлечено около
46% хрома 268.
Предложено перерабатывать сырье, содержащее хром, при по-
мощи кислого сульфата аммония. При этом в раствор переходят
Сг2(8О4)з, (NH4)2SO4 и сульфаты других металлов. После отделе-
ния нерастворимого остатка из раствора осаждают аммиаком в
отдельности гидроокиси металлов и Сг(ОН)3. Последний раство-
ряют в серной кислоте для получения Сг2(8О4)з. Из фильтрата,
после отделения Сг(ОН)з кристаллизуют (NH4)2SO4, который нагре-
ванием до 370° переводят в NH4HSO4, возвращаемый в процесс 263.
Представляет интерес получение соединений трехвалентного
хрома, а также металлического хрома из феррохрома, получаемого
непосредственно при плавке руды. Предложено перерабатывать
феррохром в Na2CrO4 и СаСгО4 путем определенной дозировки в
шихте соды и окиси кальция. Соду вводят в шихту в количестве,
необходимом для превращения половины хрома, содержащегося в
сырье, в хромат натрия. Окись кальция вводят в количестве, боль-
шем, чем это требуется для связывания остальной части хрома в
хромат кальция. Процесс ведут с тонкоизмельченным феррохро-
мом, прокаливая шихту при температурах, близких, но не превы-
шающих температуру плавления феррохрома. Продукт обжига
содержит Na2CrO4 и СаСгО4 приблизительно в одинаковых моле-
кулярных количествах 264.
Хромат и хромит кальция могут служить исходным материалом
для производства металлического хрома алюмино- и силикатер-
мическйми методами94. В связи с этим патентовались и разраба-
тывались способы их получения из хроматного щелока, а также ив
хромита и из феррохрома 265~267.
На заводах анилино-красочной промышленности, широко
использующих бихроматы в качестве окислителей; получают
624
Гл. XV. Соли хрома
в качестве отходов производства значительное количество кислых
фильтратов, содержащих сульфат хрома (~ 100 г/л Сг2О3 и 350 г/л
H2SO4). Из этих растворов сульфата хрома регенерируют электро-
лизом двухромовую кислоту с возвратом ее в производство в смеси
с серной кислотой. Электролиз ведут в ванне с диафрагмой и со
свинцовым анодом. На поверхности анода образуется двуокись
свинца, играющая роль передатчика кислорода. Электролиз ведут
при плотности тока на аноде 120—300а/ж2 и температуре 30—50°.
Напряжение на ванне около 3,5 в. Выход по току 85—90%. Малые
плотности тока на аноде и большие плотности тока на катоде при-
водят к высоким выходам по току. С повышением плотности тока
на катоде уменьшается восстановление. На 1 т окиси хрома расхо-
дуется около 3400 кет • ч 268.
Электрохимическое окисление трехвалентного хрома в концен-
трированных растворах хромо-натриевых квасцов изучено в преде-
лах концентраций 40—170 г/л Сг3+ и 45—850 г/л H2SO4 269- Оно мо-
жет быть осуществлено в электролизере с диафрагмой или без
диафрагмы со свинцовыми электродами. Наибольшие выходы по
току (~91%) получаются при содержании в исходном растворе
около 80 г/л Сг3+ и 55 г/л H2SO4, при плотности тока 3 а/дм? и тем-
пературе 55°. Напряжение на ванне 3,5—4 в; степень окисления
Сг3+ в Сг6+ 90—95%. Об электрохимическом окислении сульфата
хрома в разбавленных растворах см. 270~272.
Электролиз отработанных растворов соединений хрома, содер-
жащих ионы СггОт", СгОГ, Сг3+ и другие, с применением желез-
ных электродов в ванне без диафрагмы в присутствии веществ, де-
поляризующих железный анод (например, NaCl), приводит к вы-
делению из электролита нерастворимого осадка, соответствующего
по составу хромиту железа Fe(CrO2)2- При плотности тока на
аноде 10—12 а/дм\ напряжении 10—15 в и температуре электро-
лита 20—30° хромпиковый раствор с содержанием 2 г/л Сг2О3, алю-
мо-хромовый с содержанием ~10 г/л K2AlCr(SO4)4 и хромовый с
содержанием И г/л Cr2(SO4)3 порознь и в смеси из равных весо-
вых количеств осветляются полностью при электролизе в течение
10—12лшн. Образующийся на дне электролизера осадок желто-
бурого цвета содержит до 30—35% Сг2О3. Этот метод может ока-
заться пригодным для извлечения хрома из сточных вод кожевен-
ной промышленности, гальванотехнических производств и др.273.
Предложены различные методы регенерации отработанных рас-
творов после хромирования. Так, осаждение ионов загрязняющих
металлов можно осуществить добавкой раствора едкой щелочи.
После нагревания до кипения раствор хромата отделяют от
осадка 274.
Очистка отработанных хромовых растворов после анодной об-
работки алюминия, хромирования металлов или снятия медных
Покрытий с регенерацией хромовой кислоты может быть осущест- -
Литература
625
влена с помощью ионообменной смолы типа сульфированных поли-
меров поливинилароматических соединений 275.
Большинство соединений хрома вредны, а соединения шести-
валентного хрома ядовиты, и работа с ними требует тщательного
соблюдения условий, обеспечивающих сохранение здоровья рабо-
тающих. Проникая в кожу через незначительные повреждения, со-
единения хромовых кислот разрушают белковые вещества клеток,
вызывают язвы. Особенно сильному разрушению подвержены сли-
зистые оболочки. Вдыхание пыли и испарений, содержащих соеди-
нения хрома, приводит к поражению слизистой оболочки носа и к
прободению его хрящевой перегородки.
Важнейшим мероприятием, обеспечивающим безопасность ра-
боты, является устранение выделения в атмосферу цеха пыли из
мельниц, смесителей, прокалочных печей и паров, содержащих
соединения хрома. Это достигается герметизацией аппаратов и ис-
пользованием санитарной вентиляции 275. Сточные воды должны
подвергаться очистке от соединений хрома 277. В качестве средств
индивидуальной защиты должны применяться респираторы, за-
щитные очки, резиновая обувь, перчатки, передники. Соблюдение
правил техники безопасности, а также правил личной гигиены и
использование профилактических средств (смазывание кожи рук
умягчающими мазями и др.) вполне предохраняют работающих от
поражений.
ЛИТЕРАТУРА
1. Т, Д. Авербух, П. Г. Павлов, Технология соединений хрома, Изд.
«Химия», 1967. — 2. М. Y. Udy, Chromium, v. I, Chemistry of Chromium and its
Compounds, N. Y. — London, 1956. — 3. T. В. Роде, Труды 1-го Совещания по
термографии, Казань, 1953, Изд. АН СССР, 1955, стр. 154.—4. М. С. Ковель,
Труды Уральск, политехи, ин-та, № 152, 1966, стр. 5.—5. С. И. Дьячков-
ский, В. К. Рубцова, ЖОХ, 10, № 4, 380 (1940). — 6. С. И. Дьячков-
ский, В. М. Офицеров, Там же, 11, № 5—6, 371 (1941). — 7. М. W. S h а-
t е г, R. Roy, Z. anorg. Chem., 276, № 5—6, 275 (1954).—8. Т. В. Роде, Авто-
реф. докт. дисс., ИОНХ АН СССР, 1956; Кислородные соединения хрома и
хромовые катализаторы, Изд. АН СССР, 1962.—9. М. А. Миниович, ЖХП,
№ 7, 34 (1939). —10. Г. Трассер, Краткий курс хромового производства,
* Гизлегпром, 1934.
11. А. А. Гринберг, Введение в химию комплексных соединений, Госхим-
издат, 1951, стр. 231. —12. А. В. Памфилов, Н. Н. Гуменюк, ЖОХ, 23,
№ 7, 1065 (1953). — 13. В. В. Печковский, С. А. А л перова и др., ЖАК,
9, № 9, 2059 (1964). — 14. S. N. Tewari, С. С h о s h, Kolloid Z., 138, № 2, 87
(1954). — 15. S. N. Tewari, S. Ghosh, Z. anorg. Chem., 279, № 3—4, 225
(1955). — 16. И. В. В а с и л ь e в а, А. И. Ефимов, Б. 3. П и т е р и м о в, ЖНХ,
9, № 3, 754 (1964). — 17. Н. Н. Пучкова, Автореф. канд. дисс., Черновицк.
гос. ун-т, 1954. — 18. А. В. Памфилов, Н. Н. Пучкова, ЖОХ, 26, № 4,
955 (1956). — 19. Lor a nt Bela, Z. analyt. Chem., 219, № 3, 256 (1966).—
20. И. Д. Музыка, О. И. Шор, ЖОХ, 26, № 5, 1277 (1956).
21. А. В. Памфилов, А. И. Л опуши иска я, А. М. Белая, Укр. хим.
ж., 30, № 2, 173 (1964).—22. О. Quadrat, V. Bahensky, J. Fafe, Sbornik
vysoke skoly chemicko-technologicke, Praze, 1957, — 23. M о r r y, J. Chem. Soc.
626
Гл. XV. Соли хрома
Japan. Pure Chem. Sec., 74, № 4, 253 (1953). — 24. В. Ф. Смачная, П. Я. Сал fa-
ll а у, Зап. ЛГИ им. Г. В. Плеханова, 32, № 3; 313 (1956). —25. W. Н. Hart-
ford, Ind. Eng. Chem., 41, № 9, 1933 (1949). — 26. А. В. Раковский,.
Д. Н. Тарасенков, ЖРФХО, 60, 7 (1929). —27. В. Н. Васильева,.
Автореф. канд. дисс., Ивановск. хим.-технол. ии-т, Иваново, 1955. — 28. К. Б. Я Ц и-
мирский, В. Н. Васильева, ЖНХ, 1, № 5, 984 (1956). — 29. В. J. Т h а-
m е г, R. М. D о п g 1 a s s, Е. Staritsky, J. Am. Chem. Soc., 79, № 3, 547
(1957). — 30. С. M. Ария, С. А. Щ у к a p e в, В. Б. Глушкова, ЖОХ, 23г
№ 8, 1241 (1953).
31. О. G 1 е m s е г, U. Н a u s с h i 1 d, F. T г й p e 1, Naturwissenshaften, 40,.
№ 11, 317 (1953). — 32. Перекись водорода и перекисные соедииеичя, под реп.
М. Е. Позина, Госхимиздат, 1951.—33. R. С. Rai, S. Prakash, Z. anorg.
Chem., 275, № 1—3. 94 (1954).— 34. R. C. Rai, J. Indian Chem. Soc., 34, № 1.
59 (1957).—35. H. С. Николаев, Ю. H. Буслаев, ИСФХА ИОНХ AH
СССР, 26, 270 (1955).— 36. H. J. Kaufmann, W. B. Lauder, R. К- К e p-
n e r, Ind. Eng. Chem., 32, № 3, 423 (1940).—37. Isakichi Takenchi, Me-
moirs of the College of Science Kyoto Imper. Univ., 1, № 5, 249 (1915).—
38. И. Г. Дружинин, Изотерма растворимости 25° и твердые растворы чет-
верной системы: сульфаты — хроматы калия и натрия, Изд. АН СССР, 1938. —
39. И. Г. Дружинин, Изв. АН СССР.- Отд. мат. и ест. наук. Сер. хим.,
№ 5—6, 1141 (1938).—40. С. 3. Макаров, И. Г. Дружинин, Там же.
№ 6. 1291 (1937).
41. В. И. Спицын, Н. С. Афонский, В. И. Цирельников, ЖНХ,
5, № 9 1970 (1960). — 42. А. Г. Бергман, В. А. X и т р о в, ИСФХА АН СССР,
24, 204 (1954).— 43. И. С. Рассонская, ДАН СССР. 78, № 2, 279 (1951).—
44. И. С. Рассонская, А. Г. Бергман, ЖОХ, 23, № 1. 7 (1953).—
45. Е. П. Дергунов, А. Г. Бергман, ИСФХА АН СССР, 21, 184 (1952).—
46. А И. Жуков, В. М. Шутова, Труды УНИХИМ, в. 1, 1954, стр. 29.—
47. В. И. Спицын, Н. С. Афонский. ЖНХ. 8, № 10, 2412 (1963).—
48. J. J a f f г а у, A. Lab а г у, Compt. rend.. 242, № 11, 1421 (1956).—
49. В. И. Спииын, Н. С. Афонский, В. И. Цирельников, ЖНХ, 5, № 7,
1505 (1960). — 50. А. В. Раковский, А. В. Бабаева, Труды ИРЕА, в. 11,
1931, стр. 15.
51. П. С. Богоявленский, ЖОХ, 22, № 4, 551 (1952). —52. П. С. Бо-
гоявленский, Изв. Воронежск. гос. пед. ин-та, 5, в. 2, 49 (1939).—
53. А. Д. Шевелева, ЖНХ, 1, № 8, 1883 (1956). — 54. Я. И. Герасимов,
Труды ИРЕА, в. 11, 1931, стр. 34. — 55. А. А. Шидловский, С. А. Оран-
жерее в. ЖПХ. 26, № 1, 25 (1953). —56. Д. Н. Тарасенков, 3. И. К о-
нопкина. Там же, 27, № 2, 198 (1954).—57. 3. И. К о и о п к и н а, Там же,
29, № 1, 22 (1956). —58. А. Я- Д е й г, ЖНХ, 5, № 2, 503 (I960). — 59. Р. Н е li-
ke!, Bayer-Ber.. № 17, 24 (1966).—60. М. Y. U d у, Chromium, v. II, Metallurgy
of Chromium and its Allays, N. Y. — London, 1956.
61. Г. В. Самсонов, Я- С. Уманский. Твердые соединения тугоплав-
ких металлов. Госметаллургиздат, 1957.—62. Т. Я. Косолапова, Г. В. Сам-
сонов. ЖПХ. 32, № 1, 55 (1959). — 63. W. Weller. S. Е. Foltz, Z. phys.
Chem.. 5, № 1—2. 100 (1955).— 64. М. Darrin, Ind. Eng. Chem., 38, № 4 368
(1946). —65. M. Ш. Кац, Труды УНИХИМ, в. 12. 1966. стр. 25,- 66. С. М. 3 у б-
ков, Б. В. К а р л ы ш е в, Э. Н. Юсупова, сб. «Металлургия, обогащение,
огнеупоры», Изд. АН КазССР, 1960. — 67. С. А. С ы с о л я т и н, Труды Ин-та
УРАЛМЕХАНОБР, в. 12, 1965, стр. 89.-68. Л. И. К р У п и и, Там же, '
стр. 531.—69. С. С. Горланов. Требования промышленности к качеству ми- .
нерального сырья. Хромит, в. 15. Госгортехиздат, 1963. — 70. Сб. «Хромиты
СССР», т. 1, Изд АН СССР, 1937; т. 2, 1940. i
71. Н. А. Д ю к а л о в, Хромит, 1931. — 72. Г. Н. Богачев, Тоуды
УНИХИМ, в. 7, 1958, стр. 18. — 73. Н. В. Володомоиов, Хромит, Мине-"
Литература
627
ральио-сырьевая база СССР, в. 8, ОНТИ. 1935.— 74. Ф. Ф. Вольф, Е. Н. Пи-
иаевская, ЖХП, № 10, 949 (1931). —75. Г. Л. Кореньков, Н. А. Усти-
нова, Борнохимическое сырье зарубежных стран, Изд. «Химия». 1965, стр. 330.—
76. R. W. Holliday, Bull. Bur. Mines, № 630, 211 (1965). — 77. П. В. Гель д,
О. А. Есин, ЖПХ, 23, № 12, 1260 (1950). — 78. П. В. Г е л ь д, О. А. Есин,
Там же, 23, № 12, 1271 (1950). — 79. Ф. И. Васенин, Там же, 12, № 5, 651
(1939). — 80. Я В. Ключаров, С. М. Зубаков, Труды ЛТИ им. Ленсовета,
в 34, 1955, стр. 32.
81 В. А М о л е в а, Вопросы петрографии и минералогии, т. 2, Изд. АН
СССР. 1953, стр. 350.—82. С. А. Паюсов, Я. Е. В и л ь н я н с к и й, Труды
УНИХИМ, в. 12, 1966, стр. 14; в. 16. 1967, стр. 41; Труды Уральск, политехи,
ин-та. № 152. 1966, стр. 37; ЖПХ. 40, № 4. 805 (1967); 42, № 9, 1974 (1969). —
83. Я. Е. В и л ь н я н с к и й. О. И. Пудовкина, ЖПХ, 22, № 7. 683
(1949). — 84. В. В. Т е л ь п и ш, Я. Е. В и л ь н я н с к и й. ЖПХ, 42, № 5, 1180 и
№ 10, 2337 (1969). — 85. Я. Е. Вильнянский, О. И. Пудовкина, ЖПХ,
20, № 8. 794 (1947). — 86. Я- Е. Вильнянский, О. И. Пудовкина, Там
же, 21, № 12, 1242 (1948). — 87. Я. Е. Вильнянский, О. И. Пудовкина,
ЖОХ, 18, № 6, 1033 (19481. — 88. В. А. Рябин, Труды УНИХИМ. в. 12, 1966,
стр. 35. — 89. Т. Д. Авербух, М, А. Серебренникова, Н. Д. Маслова,
Труды УНИХИМ. в. 1. 1954. стр. 3: в. 3, 1955. стр 45; в. 7, 1958, стр. 23. —
90. Ю. И Кротов, Я. Е. Вильнянский. ЖПХ, 38, № 6, 1206 (1965).
91. Н. Ф. Юшкевич, ЖХП, 1, № 3. 51а (1925). — 92. Л. И. Попова,
Там же, 2, № 6 (12), 465 (1926). — 93. М. В. Киреева, ЖПХ, 31, № 10, 1484
(1958); Труды конференции по усовершенствованию технологии производств
хромовых и фтористых солей, Госхимизлат. 1959, стр. 38. — 94. Н. С. Масало-
вич, Г. Н. Б о г а ч о в, Труды УНИХИМ. в. 12. 1966, стр. 75.—95. С. К- Чир-
ков, ЖПХ, 13, № 4. 521.' 528 (1940); ЖХП. № 4—5; 41; № 7, 39 (1939П № 3,
29 (19401.-96. НИ X ай дуков, ЖХП, № И. 38 (1939).-97. Ф. ф Вольф,
Л И. Попова. Сборник оабот по химической технологии, минеральных ве-
ществ, в. 1, Свердловск, 1929, стр. 109.—98. И. Г Р ы с с, Р. Г. Урицкая,
ДАН СССР. 4, 213 (19341.-99. М. Raman N а у а г, Н. Е. Watson,
J. J. Sudboroagh, J. Ind. Inst. Sei,, 7, № 4, 53 (1924). - 100. V T. Atha-
v a 1 e, S. K. J a t k a r, J. Indian Inst. Sci., 20A, № 8, 55 (1937); 21A, 199 159,
179. 273 (1938).
101. W. F. Ford, W. J. Rees, Trans. Brit. Ceram. Soc. 45, 125 (1946)- 47,
№ 6, 207 (1948); 48, № 8, 291 (1949). — 102. W. F Ford, J. White, Trans. Brit.
Ceram. Soc., 48, № 11, 417 (1949). — 103. Я. В. К л ю ч а р о в. В. Г Егер ЖПХ,
35, № 9, 1916 (1962); Огнеупоры, № 3, 126 (1963). — 104. Ф. И. Васенин,
ЖПХ, 21, № 5. 429 (1948).— 105. П. Д. П я т и к о п. Там же, 34, № 4, 766
(1961).—106. М. В. Киреева, Автореф канд. дисс., УПИ, Свердловск, 1959.—
*107. М. В. Киреева, А. А. Солошенко, ЖПХ 33, № 1, 43 (I960) —
108. R. J. Harker, О. F. Tuttle, Am. J. Sci., 253, № 3. 274 (1955).—
109. M. В. Киреева, Т. В. Стратонова. Труды УНИХИМ, в. 16, 1967,
стр. 142.—110. А. П. Любая, В. Г. Манчинский, ЖПХ, 25, Ns 8 808
(1954).
111. И. Я. Федосеев, А. А. Перемышлева, М. А. Макарова,
Труды Воронежск. ун-та, т. 40, 1956, стр. 35. — 112, Т. Д. Авербух, М. А. Се-
ребренникова. Н. Д, Маслова, ЖПХ, 29, № 4. 498 (1956); 31, № 6. 835
(1958). — ИЗ. М. В. Киреева и др., Труды УНИХИМ. в. 8, 1959, стр. 5, 13;
сб. «Исследования в области химии и технологии минеральных солей и окислов»,
' Изд. «Наука», 1965, стр. 101; Труды УНИХИМ, в. 12, 1966, стр. 3 и 8.—
114. В. А. Ряби н, Автореф. канд. дисс., УПИ, Свердловск, 1962. —1
115. Н, Р. Кузнецов, В. А. Рябин, В. В. Т е л ь п и ш, ЖПХ, 36, № 12. 2754
(1963). —116. Я. Е. Вильнянский, Л. А. Боровских, Труды УНИХИМ,
628
Гл. XV. Соли хрома
в. 7, 1958 стр.. 3. —117. Н. Ф. Юшкевич, А. Л. Уразов, ЖХП, 4, № 5,
387 (1927)’. — 118. О. И. Пудовкина, Н. А. Гущина, ЖПХ, 24, № 11, 1136
(1951). —119. Н, П. Табунщиков, В. В. Тимошенко, Труды ВИСП, т. 6,
1952, стр. 5; т. 7, 1954, стр. 44. —120. М. Bogitsh. Compt. rend., 178, № 14,
2254 (1924).
121. Ю. И. У а т е н к о, Е. А. К л и м к о в и ч, Труды Днепропетровск. ХТИ,
т. 5, 1956, стр. 156. — 122. С. А. Паюсов, Я. Е. Вильнянский, Труды
УНИХИМ, в. 16, 1967, стр. 30. —123. О. И. Пудовкина, М. В. Киреева,
ЖПХ, 29, № 6, 828 (1956); 32, № 3, 499 (1959). —124. Н. И. Хай дуков,
А. Э. Заярный, Е. П. Подтымченко, Труды УНИХИМ, в. 4, 1957, стр. 24 —
125. М. В. Киреева, А. А. Солошенко, ЖПХ, 33, № 2, 337 (1960).—
126. М. В. Киреева, Э. П. Клюкина, Там же, 34, № 6, 1348 (1961).—
127. Г. Н. Б о г а ч о в, Н. С. Банных, М. Я. Попильский, Труды УНИХИМ,
в. 4, 1957, стр. 3.— 128. М. Я. Попильский, Л. И. Девятовская, М. Т. Ав-
деева, Там же, в. 12, 1966, стр. 56,— 129. А. А. Федоров, Хим. пром., № 10,
22 (1945). —130. F. Schatzler, К- Plassmeyer, Chemiker-Ztg. Chem.
Apparat., 90, № 19, 661 (1966).
131. В. А. Рябин, ЖПХ, 38, № 7, 1600 (1965). — 132. Г. Н. Б о г а ч о в,
Хим. наука и пром., 2, № 6, 714 (1957).— 133. Р. D i 11 е у, Chem. Techn., 459
(1950). — 134. Г. Н. Б о г а ч о в, В. М. Павлов, В. И. Черных, Э. П. Клю-
кина, Хим. пром., № 9, 655 (1961). — 135. С. Bandrowska, Chernik, 21, № 9,
328 (1968). — 136. В. М. Павлов, Г. А. Богачов и др., Труды УНИХИМ,
в. 5, 1963, стр. 72. — 137. В. А. Рябин, А, А. П о т о р о ч и н, П. С. Ремпель,
И. А. Леонтьева, Там же, в. 12, 1966, стр. 43. —138. В. А. Рябин,
А. А. Пот ор очин, Там же, стр. 50. — 139. Н. П. Левченко, В. А. Рябин,
П. С. Ремпель, Там же, стр. 53. — 140. В. А. Р я б и н и др., Изв. АН КазССР.
Сер. хим., № 2 (1967).
141. Б. В. Миролюбов, В. А. Рябин и др., Труды УНИХИМ, в. 14,
1967, стр. 66. — 142. Б. В. Миролюбов, В. А. Рябин и др., Там же, в. 16,
1967, стр. 75. — 143. Б. В. Миролюбов, В. А. Рябин и др., Там же,
стр. 82.— 144. Т. Д. Авербух, Хим. пром., № 11, 13 (1946).— 145. Я. Р. Гольд-
штейн, ЖХП, № 7 (13), 564 (1926); № 6—7, 495 (1927). — 146. В. Neumann,
С. Е k s s п е г, Angew. Chem., 43, 440 (1930).— 147. И. Г. Рысс, С. С. Орлов,
ЖХП, № 4, 53 (1933). —148. Ф. Ф. Вольф, Л. И. Попова, Труды Центр, лаб.
сев. хим. треста, в. 1, Свердловск, 1929, стр. 97. — 149. Е. Н. Пинаевская,
Н. Л. Антошкина и др., ЖПХ, 37, № 5, 989; № 12, 2553 (1964).—
150. И. Г. Щербаков, О. Есин, Z. Elektrochem., 32, 396 (1926).
151. Д. А. Дым чи шин, Производство хромовых солей, Госхимиздат,
1934.— /52. М. В. Киреева, Л. А. Дунаевская, С. И. Ремпель, сб.
«Исследования в области химии и технологии минеральных солей и окислов»,
Изд. «Наука», 1965, стр. 105.— 153. М. В. Киреева, Л. А. Дунаевская,
ЖПХ, 37, № 1, 204 (1964).— 154. В. М. Павлов, И. И. Ш и ш к о, Хим. пром.,
№ 11, 781 (1961).— 155. П. Л. Мясников, О. И. Пудовкина, Э. М. Мор-
гунова, Труды УНИХИМ, в. 7, 1958, стр. 32. — 156. О. И. Пудовкина,
М. Я. По нильский, Э. М. Моргунова, Н. В. Горбунова, Там же,
стр. 41.—157. Т. Д. Авербух, Л. В. Юманова, А. С. Микулинский'
Труды УНИХИМ, в. 1, 1954, стр. 36. — 158. П. М. Лукьянов, ЖХП, № 1 11
(1924).— 159. Л. М. Стрибман, Там же, № 7, 17 (1939). — 160. В. С. Шер-
ман, Р. Н. Суханова, Труды УНИХИМ, в. 14, 1967, стр. 175.
161. Л. Г. Ш и р и н к и н, Л. С. С к а т и н а, В. М. Павлов, Труды
УНИХИМ, в. 12, 1966, стр. 82, 89. 93. —/62. В. А. Рябин, А. А. Шибаева,
Там же, в. 12, 1966, стр. 157. — 163. М. Я. Попильский, Р. А. Горохова,
Ю. К. К а с и л ь и др., Там же, в. 16, 1967, стр. 23, 191. — 164. М. В. Киреева,’
Р. А. Горохова, Г, С. Краснова и др., Там же, стр. 201. — /65. Б. А. Р я-
б и и. Я. Е. Вильнянский, Там же, стр. 107. —166 В. А. Рябин и др.,
Литература
629
Там же, стр. 123. —167. Н. Г. Ех л а ков а, Там же, в. 12, 1966, стр. 151.-—
168. %. Е. Вильнянский, авт. свид. 18247, 1929. —169. В. А. Рябин и др.,
Труды УНИХИМ, в. 14, 1967, стр. 103. —170. В. А. Пьячев, М. Ф. Чебуков,
Изв. вузов. Хим. и хим. технол., 8, № 1, 118 (1965).
171. Д. И. Мильман, Ю. Б. Смирнов, Хим. пром., № 7, 540 (1965).—
172. Г. К. Магаршак, В. Н. Тарасова, Б. П. Волгин, Труды УНИХИМ,
в. 1, 1954, стр. 55.— 173. А. В. Раковский, Е. А. Никитина, Труды ИРЕА,
т. 2, 1931, стр. 5. — 174. В. Ф. Волков и др., Хим. пром., № 6, 450 (1966); № 6,
449 (1968).— 175. В. А. Одинцов, Л. Н. Матусевич, Там же, № 9, 687
(1965). —176. Л. Н. Матусевич и др., Там же, № 12, 927 (1966).—
177. А. А. Солошенко, Ю К К а с и л ь, М. Я. Попильский Труды
УНИХИМ, в. 16, 1967, стр. НО. — 178. Н. Schafer, Р. Henkel, М. W е i s t,
пат. ФРГ 1205508, 1962. — 179. Н. Ф. Юшкевич, М. Н Левин, ЖХП, 2,
№ 3 (9), 247 (1925); № 4—5 (10—11), 329 (1926). — 180. G. A g d е. К- Е. Fet-
ter, Angew. Спет., 48, № 5, 92 (1935).
181. Н. Ф. Юшкевич, В. А. К а р ж а в и н, И. Н. Ш о к и н, ЖХП, № 12
(18), 951; № 14 (20), 1119 (1926). — 182. Н. Ф. Юшкевич, И. Н. Ш о к и и,
Там же, № 3, 204 (1927). —183. О. Nydeggei, Chimia, 4, № 12, 288 (1950).—
184. Г. Н. Б о г а ч о в, Е. М. Полякова, М. А. Грязных, Труды УНИХИМ,
в. 4, 1957, стр. 13. —185. Р. В. Миролюбов, Труды конференции по усовер-
шенствованию технологии производств хромовых и фтористых солей, Госхим-
издат, 1959, стр. 42. — 186. Л. А. Боровских, Я. Е. Вильнянский, Там же,
стр. 46, — 187. В. С. Ятлов, ЖПХ, 2, № 5, 561 (1929). —188. J. В. Robert-
son, J. Soc. Chem. Ind., 43, № 47, 334T (1924). — 189. Г. H. Б о г а ч о в, Хим.
пром., № 5, 144 (1952). — 190. 3. С. Банных, Г. А. Лопаткина, Труды
УНИХИМ, в. 7, 1958, стр. 50.
191. Я. Е. Вильнянский, 3. С. Банных, Там же, в. 8, 1959, стр. 46. —
192. Ю. П. Каретников, Г. Н. Богаче в, Г. Ф. Фефелова, Труды
УНИХИМ, в. 1, 1954, стр. 85. — 193. В. М. Павлов, Там же, в. 5, 1957;.
стр. 291. — 194. И. Г. Рысс, А. И. Зе ля иска я, Acta phys., 8, № 5, 623
(1938).— 195. Т. Д. Авербух, Труды Конференции по усовершенствованию тех-
нологических производств хромовых и фтористых солен, Госхимиздат, 1959,
стр. 23. — 196. Австрал. пат. 157986, 1954; 164665, 1955. — 197. М. А. Остро-
у м о в. Автореф. канд. дисс., Уральск, политехи, ин-т, Свердловск, 1953. —
198. М. Я. Попильский, Труды Конференции по усовершенствованию тех-
нологических производств хромовых и фтористых солей, Госхимиздат, 1959,
стр. 17.—199. М. Я. Попильский и др., Труды УНИХИМ, в. 16 1967,
стр. 23, — 200. Пат. США 1872588, 1873889, 1932; герм. пат. 565156, 1932 и 742797,
1943; пат. ФРГ 1203748, 1961; пат. ЧССР 101948, 1961; англ. пат. 959745.
1964.
201. А. М. Поляк, Журн. ВХО, 7, № 1, 56 (1962). — 202. И. Г. Рысс,
* А. Э. 3 а я р н ы й, А. И. 3 е л я н с к а я, ЖПХ, 14, № 1, 46 (1941).— 203. А. Н. М и-
хайлов, Химия дубящих веществ и процессов дубления, Гизлегпром, 1963.
гл. III. — 204. С. К. Чирков, ЖПХ, 10, № 17—18, 1257 (1937).—
205. Н. И. Г е л ь п е р и н, Н. Г. Крохин, К. И. Богачева, Труды Всесоюзн.
и.-и. ин-та синтет. и натур, душистых веществ, № 2, 1954, стр. 165. — 206. А. Сал-
ли, Хром, Госметаллургиздат, 1958. — 207. Ф. Б Бланше, авт. свид. 149178,
1962.— 208. И. Н. Головастиков, ЖПХ, 29, № 4, 553 (1956).—
209. С. Д. Кац, авт. свид. 61020, 62191, 1942. —210. Г. Д. Мазалецкий Труды
УНИХИМ, в. 12, 1966, стр. 269.
211. П. Чекин, ЖПХ, № 6, 555 (1926). —2/2. К. И. Л о с е в, К. А. М а х о-
нин, Там же, 11, № 12, 1564 (1938). —2/3. Герм. пат. 369816 1923; 390602, 1924;
444798, 1927. — 214, W. J. Biermann, М. Heinrichs, Canad. J. Chem., 38,
№ 9, 1449 (1960). — 215. H. F; Johnstone, R. W. Derbyshire, Ind. Eng.
Chem., 34, 280 (1942).—216. Д. П. Зосимович, К. Б. КладницкаЯ,
630
Гл. XV. Соли хрома
Н. Д. Иванова, ЖПХ, 36, № 2, 333 (1963). — 217. Е. Ф. Беленький,
И. В. Рискин, Химия и технология пигментов, Госхимиздат, 1960.—
218. D. R. Dhingra, S. N. К а р о s г, V. Paul, J. Sci. Soc., 2, 21 (1953).—
219. О И П у д о в к и н а, В. М. П а в л о в, М. Я. П о п и л ь с к и й, Н. В. Г а р-
к у н о в а, Труды УНИХИМ, в. 8, 1959, стр. 53 — 220. Н. С. Б а н н ы х, В. Ф. Б е з-
р у к о в а, Труды УНИХИМ, в. 3, 1955, стр. 52.
221. А. М. Поляк, М. Т. Серебренникова, М. Я- Попильский,
Там же, в. 4, 1957, стр. 25; в. 7, 1958, стр. 46. — 222. В. М. Власенко,
Л. А. Кухарь, М. Г. Розенфельд, М. Т. Русов. Хим. пром., № 8, 955
(1962).— 223. Англ. пат. 748610, 749097, 1956; пат. США 2854313, 1958,—
224. Р. Мандель, Новости техники, № 21, 37 (1938).—225. J. С. К а 1 b а с h,
канад. пат. 512959, 1955.—226. А. Н. Т о р о к и и, Т. Д. Авербух, Труды
УНИХИМ, в. 12, 1966, стр. 219. — 227. Е. A. Hahn, Е. Peters, Canad. J. Chem.,
39, № 1, 162 (1961). — 228. В. H. Ипатьев и др., Вег., 59, № 7, 1418 (1926)
и 60, № 8, 1980 (1927); Bull. Soc. chim. France, 39, 1384 (1926); Compt. rend., 183,
505 (1926).— 229. Л. Г. Булатова, Я- E. В иль ня некий, Труды УНИХИМ,
в. 8, 1959, стр. 41; в. 12, 1966, стр. 267. — 230. Л. И. Девятовская,
Я. Е. Вильнянский, Там же, в. 8, 1959, стр. 23.
231. В. П. Ива иц о в, Труды Томск, ун-та, т. 154, 1962, стр. 32, 42.—
232. А. М. Поляк, Л. И. Девятовская, Труды УНИХИМ, в. 4, 1957, стр. 80.—
233. Я- Е. Вильнянский, Н. С. Банных, Хим. пром., № 10, 19 (1945).—
234. Я. Е. Вильнянский, Л. А. Боровских, М. С. Ковель, Журн. ВХО,
8, № 1, 116 (1963); ЖПХ, 39, № 10, 2266 (1966); Труды Уральск, политехи, ин-та,
№ 152, 1966, стр. 13, 28. — 235. Л. Г. Булатова, Я- Е. Вильнянский, Труды
УНИХИМ, в. 16, 1967, стр. 129. —236. Г. Д. Мозалецкий, Р. С. Байта-
кова, Там же, стр. 3.’—237. R. Rich elm i, М. Z a f f i 11 е, Compt. rend., C265,
№ 10, 541 (1967). — 238. M. Я. Попильский, авт. свид. 77540, 1949.—
239. С. Л. Крапивнер, Труды конференции по усовершенствованию техно-
логических производств хромовых и фтористых солей, Госхимиздат, 1959,
стр. 55. — 240. Б. П. Середа, Труды УНИХИМ, в. 12, 1966, стр. 191.
241. Б. П. Середа, 3. А. Самоделкина, Там же, стр. 199.—
242. Б. Н. Середа, 3. А. Самоделкина, А. Г. Никулин, А. М. 3 а г у-
даев, Там же, стр. 208. — 243. Б. П. Середа, М. Я. Попильский и др.,
Труды УНИХИМ, в. 16, 1967, стр. 146, 152, 164. —244. В. С. Я т л о в, А. В. По-
пова, ЖПХ, 6, № 6, 1049 (1933). — 245. С. G. Maier, Sponge Chromium,
U. S. Bur. Mines Bull., № 436, 109 (1942). — 246. E. A. Pokorny, Extraction
and Refining of Rarer Metals, London, 1957, p. 34.— 247. R. L. A n n i s, R. G. В a n-
n e r, J. G. К о u r i 1 o, F. S. M a h n e, F. S. Perri n, Mines Magazine, 49, № 8,
21 (1959). — 248. И. А. Магидсон, Г. В. Карсанов, М. И. Герасимова,
Т. В. Калмыкова, ЖПХ, 34, № 5, 953; И, 2391 (1961). — 249. И. А. Магид-
сон и др., сб. «Металлургия и химическая промышленность Казахстана», № 4,
1961, стр. 15; ЖПХ, 36, № 10, 2132 (1963).— 250. Т. С. Ш и б н е в а, Г. Ф. Фе-
фелова, Труды УНИХИМ, в. 12, 1966, стр. 174.
251. Т. С. Ш ибн ев а, С. П. С о л я к о в, А. В. Покровский, Н. И. Син-
цов, Г. Ф. Фефелова, Труды Ключевского завода ферросплавов, Металло-
термия, № 2, 1965. — 252. Л. И. Девятовская, Я. Е Вильнянский,
Труды УНИХИМ, в. 8, 1959, стр. 23; в. 12, 1966, стр. 255; сб. «Металлургия и
химическая промышленность Казахстана», № 3, 1961, стр. 59. — 253. Т. Е. Ш и б-
нева, Г. Ф. Фефелова, А. В. Покровский, Труды УНИХИМ, в. 12, 1966,
стр. 262. — 254. Л. Г. Булатова, Я- Е. Вильнянский, Там же, стр. 267.—
255. А. А. Солощенко, Я. Е. Вильнянский, Л. Г. Раевская, Г. В. Сай-
фуллина, Там же, в. 16, 1967, стр. 61.— 256. Л. И. Д е в я т о в с к а я, С. П. Со-
ля к о в, Т. А. Якимец, Т. Н. Колосова, Там же, стр. 89. — 257. И. В. Ва-
сильева, М. П. С у с а р е в, И. В. К р и в о у с о в а, сб. «Исследования в об-
ласти химии и технологии минеральных солей и окислов», Изд. «Наука», 1965,
Литература
631
стр. 139. —258. А. А. Солошенко, Я. Е. Вильнянский, ЖПХ, 37, № 3,
535 (1964).—259. А. И. Тетеревков, Я- Е. Вильнянский, Труды УНИХИМ,
в. 16, 1967, стр. 52, 116; сб. «Металлургия и химическая промышленность Казах-
стана», № 5, 1961, стр. 58. — 260. J. L. Clay, J. F. Pearse, D. Н. Tret he-'
we у, J. Soc. Chem. Ind., 69, № 9, 275 (1950).
261. И. Д. Музыка, В. А. Молодцова, ЖПХ, 32, № 9, 1936 (1959).—
262. Накадзава, J. Mining Inst. Japan, 72, № 814, 207 (1956).—
263. N. H. В run din, швед. пат. 142749, 1953. — 264. M. Y. U d у, пат ФРГ
919287, 1954. — 265. E. M. Полякова и др., Труды УНИХИМ. в. 12, 1966,
стр. 162, 284. — 266. А. М. Поляк, М. А. Серебренникова и др., Там же,
tTp. 170 184. — 267. Е. Н. Пинаевская и др., Там же, в. 8, 1959,
стр. 19; ЖПХ, 34, Ns 8, 1722 (1961).— 268. В. Г. Хомяков, В. П. Машовец,
Л. Л. Кузьмин, Технология электрохимических производств, Госхимиздат, 1949,
стр. 406.-269. Б. И Томилов, ЖПХ, 30, № 12, 1785 (1957).— 270. V. Engel-
hard t, Handbuch пег technishen Elektrochemie, Leipzig, 1939, S. 133.
271. R. H. McKee, S. T. Leo, Ind. Eng. Chem, 12, № 1, 16 (1920). —
272. H. С. Дроздов, ЖОХ, 3, № 3, 345 (1933). — 273. А. Ф. Богоявлен-
ский, M. И. Г а р к а в и, Г. 3. Афанасьев, К. Ш. Ш а м с у т д и н о в, Уч.
Зап. Каз. ун-та, 113, кн. 8, 23 (1953). — 274. Н. Clippers, пат. ГДР 6402,
1954. — 275. R. L. Costa, пат. США 2733204, 1956. — 276. Правила и нормы тех-
ники безопасности промышленной санитарии для строительства и эксплуатации
предприятий производства хромовых соединений, Госхимиздат, 1961.—
277. 3. А. Филиппова, В. Ф. Пл ехоткин, Техн.-экой, информ. НИИТЭХИМ.
Охрана труда и техника безопасности, № 6, 17 (1966).
Глава XVI
СУЛЬФАТ АЛЮМИНИЯ И ПРОДУКТЫ НА ЕГО ОСНОВЕ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Сульфат алюминия Al2(SO4)g безводный представляет собой
-белые кристаллы, имеющие плотность 2,71 г/см3. Растворимость
при 0° равна 31,2, при 100° 89 г в 100 г воды. Из водного раствора
кристаллизуются бесцветные моноклинные кристаллы Al2(SO4)s-
• 18Н2О, имеющие плотность 1,69 г!см3 (17°) и обезвоживающиеся
при 86,5°.
Алюминиевые квасцы имеют общую формулу M2SO4* A12(SO4)3*
• 24Н2О или MAI(SO4)2 • 12Н2О.
Алюмо-аммониевые квасцы NH4A1(SO4)2- 12Н2О — бесцветные
кристаллы с плотностью 1,64 г/см3, плавятся при 93,5° без разло-
жения. При нагревании расплавленной массы до 120° отщепляются
10 молекул воды, а при 200° происходит полное обезвоживание.
Растворимость при 0° равна 2,6 г, при 80° 35,2 г NH4A1(SO4)2-
• 12Н2О в 100 г воды.
Алюмо-калиевые квасцы KAI(SO4)2• 12Н2О — бесцветные кри-
сталлы с плотностью 1,76 г[см3, плавятся при 92°. Растворимость
при 0° — 2,96, при 20° — 5,75, при 70° — 35,9, при 90°—109, при
100°—154 г KA1(SO4)2 в 100 г воды. Безводный сульфат алюми-
ния-калия KA1(SO4)2 гигроскопичен, на воздухе расплывается,
имеет плотность 2,75 г/сл3.
Алюмо-натриевые квасцы NaAl(SO4)2- 12Н2О — бесцветные кри-
сталлы с плотностью 1,675 г!см\ плавятся при 61°. Растворимость
при 0° — 37,4, при 20° — 40,8, при 40°—44,3 г NaAl(SO4)2 в 100 г
воды. В системе Na2SO4—A12(SO4)3—Н2О при 0° эвтонический рас-
твор состава (в вес.%): 3,74 — Na2SO4 и 21,58 — A12(SO4)3 нахо-
дится в равновесии с твердыми фазами: Na2SO4 и инконгруэнтно
растворимых квасцов Na2SO4 • A12(SO4)3 • 24H2Q. Точке перехода
соответствует состав раствора 1% Na2SO4 и 27,12% A12(SO4)3, рав- -
Физико-химические свойства
633
новесный с твердыми фазами Na2SO4 • A12(SO4)3-24H2O и
A12(SO4)3-18Н20‘.
При взаимодействии сульфата алюминия с содержащимися в
естественных водах бикарбонатами кальция и магния образуется
гидроокись алюминия, которая является коагулирующим агентом.
В результате гидролиза2’3 сульфата алюминия из водных раство-
ров вначале выделяются промежуточные основные соли, а затем
гидроокись алюминия:
A12(SO4'3 + 2Н2О = A12(SO4)2(OH)2 + H2SO4
A12(SO4)2(OH)2 + 2Н2О = A12(SO4)(OH)4 + H2SO4
A12(SO4)(OH)4 + 2H2O = 2A1(OH)3 + H2SO4
A12(SO4)3 + 6H2O = 2A1(OH)3 + 3H2SO4
Гидролиз A12(SO4)3 даже при высоких температурах в интер-
вале 200—300° (при повышенном давлении) протекает с малой
скоростью и не превышает
50%. При добавке 15 г/л
Na2SO4 гидролиз значитель-
но ускоряется. В получаю-
щемся основном сульфате
алюминия содержится до
3% Na2O.
По другим данным4,
продуктом гидролиза
A12(SO4)3 при повышенных
температурах и давлении
является основной сульфат
состава ЗА12О3 • 4SO3 • 7Н2О,
выход которого возрастает
при увеличении давления до
70 ат и продолжительности
процесса до 30 мин5.
Основной сульфат А12О3• 4SO3-ЗН2О изоморфен с NH4A1(SO4)2-
• и, вероятно, имеет структуру, отвечающую формуле [Al (SO4)2]OH3.
. Соединение ЗА12О3 • 4SO3 • 9Н2О переходит при определенных усло-
' виях в ЗА12О3 4SO3 • (NH4)2О • 6Н2О 6.
Основные соединения алюминия образуют истинные или колло-
идные растворы в воде7, весьма нестойкие. С течением времени
или при повышении температуры они разлагаются с образованием
осадка переменного состава8, превращающегося в устойчивый
комплексный ион [AIa(OII )?/(112О)-]<3х—г/)+. В системе А1(ОН)3—
A12(SO4)3 — Н2О (рис. 180) 9 образуются твердые фазы: 4А12О3-
, '«3SO3-24H2O — при разбавлении водой, так называемый гидроли-
тический осадок (с 75% щелочности), ЗА12О3• 4SO3 31Н2О — рас-
творимый осадок, медленно выделяющийся ниже 56° (с 55,6°/»'
634 Гл. XVI. Сульфат алюминия и продукты на его основе
щелочности), А12О3• SO3• 3,5Н2О — нерастворимый осадок, выде-
ляющийся при кипячении раствора (66,7% щелочности), и ЗА12О3-
-5SO3-R2O-ЮН2О (где R—Na, К, NH4) — откладывающийся в
виде накипи при кипячении в присутствии щелочных солей (55,6%
щелочности). Под щелочностью здесь имеется в виду отношение
количества алюминия в виде А1(ОН)3 к общему его количеству.
Стойкость растворов основного сульфата алюминия зависит от спо-
соба их приготовления. Наиболее стойкие растворы образуются
при обработке растворов сульфата алюминия водной суспензией
мела или известняка при кипячении.
Начало разложения A12(SO4)3 при нагревании наблюдается при
530°. Заканчивается оно при 860°, причем продуктом разложения
является у-А12О310. Процесс интенсифицируется добавкой 5—10%
Fe2O3 или Сг2О3 и особенно в восстановительной среде, например
в потоке окиси углерода и. По другим данным 12, разложение суль-
фата алюминия при нагревании идет по следующим стадиям:
До 610°................AJ2(SO4)3=SO3+A12O(SO4)2
» 810°.................Al2O(SO4)2=O2+AbO(SOj)2
» “910°................A12O(SO3)2 = 2SO2+A12O3
Термохимическое разложение сульфата алюминия представляет
интерес для переработки алунита 13. Образующийся при этом гли-
нозем обладает высокой активностью и способностью к спеканию,
вследствие большой дисперсности и дефектности кристаллов14.
Аналогично протекает и термическое разложение сульфитов алю-
миния 16.
При обжиге во взвешенном слое обезвоживание основных алю-
мо-аммониевых квасцов происходит при 460—520°, а выделение
окислов серы при нагревании до ~ 1100°. При 1000° в течение 5,5-
минутного обжига получается продукт, содержащий 90% А12О3,
а в течение 12-минутного — 95% А12О3. Максимальная концентра-
ция окислов серы в лабораторных условиях была 14,5% 16.
Продукты термического разложения различных солей алюми-
ния отличаются разной удельной поверхностью и активностью.
Продукт разложения A12(SO4)3 при 400—700° имеет удельную по-
верхность 20—25 м21г, продукт разложения А1С13 в тех же усло-
виях— 80—160 м2/г, а продукт разложения A1(NO3)3 — 100—
170 м2/г 17.
ПРИМЕНЕНИЕ
Сульфат алюминия является наиболее распространенным коа-
гулянтом, применяемым в водоочистке для обработки питьевых и
промышленных вод, и используется в ряде других отраслей тех-
ники. Коагулирующие свойства A12(SO4)3 обусловлены образова-
нием коллоидной гидроокиси алюминия и основных сульфатов в
результате гидролиза. В процессе коагуляции А1(ОН)3 коллоидные
Применение
635
частицы примесей, находящиеся в воде, захватываются и выде-
ляются вместе с А1(ОН)3 в виде студенистых хлопьев. После хими-
ческой обработки воду фильтруют.
Помимо водоочистки сернокислый глинозем применяется в
больших количествах в целлюлозно-бумажной промышленности
для проклейки бумаги и других целей; его используют в текстиль-
ной промышленности в качестве протравы при крашении хлопчато-
бумажных, шерстяных и шелковых тканей, при дублении кож, для
консервирования дерева, в производстве древесно-волокнистых
плит, в промышленности искусственных волокон и др.
Алюмо-калиевые квасцы применяют в мясной, кожевенной, тек-
стильной промышленности, в меньших количествах — в меховой,
фармацевтической и проч.18> 19. Алюмо-аммониевые квасцы служат
сырьем в производстве камней синтетического корунда.
Основной сульфат алюминия может быть использован для обо-
гащения бедных сернистых газов (см. гл. XIV) 20.
Предложено использование сульфата алюминия и квасцов в ка-
честве фунгицидов для зеленых растений в виде 0,5—2%-ного рас-
твора при pH 3,5—4 21.
В США ежегодно производят около 1 млн. т сульфата алюми-
ния 22.
По химическому составу сульфат алюминия и квасцы должны
удовлетворять требованиям, приведенным в табл. 43.
ТАБЛИЦА 43:
Требования к химическому составу технических сернокислого алюминия
и квасцов
(содержание компонентов в %)
Технический сернокислый алюминий Квасцы алюмокалие- вые технические (ГОСТ 15023 — 69)
очищен- ный (ГОСТ 5.740-71) очищенный (ГОСТ 12966-67) неочи- щенный (ГОСТ 5155-49)
I сорт II сорт Ш сорт высший сорт I сорт В сорт
А12О3, не менее . . 16,3 15,0 14,5 13,5 9 10,60 10,50 10,30
H2SO4 (своб.), ие бо- лее Железо (Fe2O3), ие более Отсут- ствие 0,02 0,05 0,04 0,10 0,10 ' 0,10 1,5 2 0,8 0,0015 0,002 0.035-
As2O3, не более . . Нерастворимый оста- ток, не более . . . 0,001 0,3 0,003 0,5 0,003 0,7 0,003 1,0 0,003 23 0,03 0,035 0,1
Технический сернокислый алюминий очищенный, получаемый
из гидроокиси алюминия или из обогащенного каолина имеет вид
плотных кусков мелкокристаллического строения белого цвета с
зеленоватым оттенком, сообщаемым примесью солей закисного»
636
Гл. XVI. Сульфат алюминия и продукты на его основе
железа (FeSO4). При длительном хранении на воздухе куски
сульфата алюминия окрашиваются с поверхности в желтоватый
цвет из-за окисления примеси закисного железа в окисное.
Неочищенный сернокислый алюминий, получаемый обработкой
серной кислотой каолина с последующей добавкой нефелинового
концентрата (ГОСТ 5155—49), содержит кроме сульфата алюми-
ния также квасцы, примеси других сульфатов и нерастворимых
веществ. По внешнему виду — это плотные куски кристаллического
строения неопределенной формы, серого цвета.
Иногда под названием коагулянтов выпускают и другие про-
дукты, содержащие в качестве основного вещества, помимо суль-
фата алюминия, и сульфат трехвалентного железа, обладающий
таким же коагулирующим действием, как и сульфат алюминия.
Поэтому для производства коагулянтов можно применять глины и
другие виды сырья, содержащие соединения железа, в частности,
колчеданный огарок.
Коагулянты и нечищенный сернокислый алюминий более деше-
вые, но худшие продукты, чем очищенный сернокислый алюминий,
так как содержат много нерастворимых примесей и меньше AI2O3.
Удаление примесей из водоочистительной аппаратуры требует до-
полнительных затрат. Недостатком сернокислого алюминия яв-
ляется его способность слеживаться при хранении. Наряду с твер-
дым сульфатом алюминия используют «жидкий коагулянт» — рас-
твор сульфата алюминия, содержащий 8,3% А12О3. Такой раствор
дешев, он устойчив при низких температурах (кристаллизация на-
чинается ниже —20°), его легко применять23.
Взамен сульфата алюминия в качестве коагулянта предложено
употреблять оксихлориды алюминия, в частности пентаоксихлорид
А12(ОН)5С1. В воде он диссоциирует на A12(OH)j и СГ. Его полу-
чают действием NaOH на А1С13 или обработкой А1(ОН)3 слабой
соляной кислотой. После упаривания раствора и сушки продукт
содержит 80% А12(ОН)5С1, т. е. более 40% А12О3, что намного
больше, чем в сернокислом алюминии 23-27.
СЫРЬЕ
Сырьем для производства сернокислого алюминия 28'29 во мно-
гих странах служит наиболее дешевый и доступный вид природ-
ного материала — глина. Разложение глины производят серной
кислотой, которая растворяет содержащуюся в глине окись алю-
миния по реакции:
А12О3 + 3H2SO4 = А 12( SO4)3 + ЗН2О
В СССР сернокислый алюминий получают из каолина, а также
растворением в серной кислоте гидроокиси алюминия, вырабаты-
Сырье
637
маемой в больших количествах на заводах цветной металлургии.
Сернокислый алюминий или содержащие его коагулянты получают
и из других глиноземистых материалов — нефелина (стр. 639),
уртита, кианита (А12О3 • SiO2), а также из высококремнистых бок-
ситов и золы от сжигания углей.
Глины
Основными минералогическими компонентами глин являются30
водные алюмосиликаты: каолинит А120з • 2SiO2 • 2Н2О, галлуазит
А120з-2SiO2-2H2O + aq, аллофан А12О3-SiO2 + aq, пирофиллит
А12О3 • 4SiO2 4Н2О, монтмориллонит А120з • 4SiO2 • Н2О + aq, се-
рицит К2О • ЗА120з* 6SiO2 • 2Н2О или КА12[81зА1Ою](ОН)2 и их кол-
лоидные аналоги. Некоторые глины в основной своей части образо-
ваны слюдистыми минералами. Помимо этого, в глинах встречаются
полевые шпаты, кальцит, доломит, гипс, рутил, турмалин, глау-
конит, роговые обманки и другие минералы, а также иногда и
свободный глинозем в виде диаспора или гиббсита, соединения
ванадия и редких элементов.
Каолинитовые глины или каолины в основном состоят из вод-
ных алюмосиликатов и кремнезема. Другие минералы обычно при-
сутствуют в ничтожных количествах. Из водных алюмосиликатов
в каолин входит в основном каолинит в кристаллическом состоянии
или в виде геля, а также Диккит и накрит, имеющие тот же
состав А120з • 2SiO2 • 2Н2О, но отличающиеся рентгенографической
характеристикой. В небольших количествах содержатся галлуазит,
аллофан, пирофиллит и монтмориллонит. Кремнезем присутствует
в каолинах главным образом в форме кварца; встречаются также
опал и халцедон. Примеси в каолинах представляют собой поле-
вые шпаты, слюды, железосодержащие минералы (лимонит, гема-
тит, магнетит, сидерит), а также ильменит, рутил, кальцит, доло-
мит, гипс и др.
Сырье, используемое для производства сульфата алюминия,
должно содержать значительное количество глинозема и легко раз-
лагаться кислотами. Таким требованиям удовлетворяют нефели-
новые породы и каолинитовые глины. Эти глины содержат 15—40%
А12О3, 55—75% SiO2, 1—2% Fe3+ и 0,5—1% Fe2+. Обычно исполь-
зуют глины, содержащие после обезвоживания 30—40% А12О3.
Бокситы, хотя и содержат большие количества глинозема, труднее
разлагаются кислотами. Трудно разлагаются кислотами и глины,
содержащие значительные количества полевошпатовых пород. Для
решения вопроса о пригодности того или иного сорта глины обычно
производят пробную варку сернокислого алюминия.
Месторождения каолинитовых глин весьма распространены,
хотя не все они достаточно изучены в качественном и технологиче-
ском отношении. Наиболее богаты разведанными месторождениями
каолинов Украина, затем Урал31.
638
Гл. XVI. Сульфат алюминия и продукты на его основе
Многочисленные месторождения огнеупорных глин, богатых
каолинитом, также могут быть использованы как источники сырья
для производства сульфата алюминия.
Обжиг глин
При обработке серной кислотой непрокаленной глины, даже
при продолжительном кипячении, в раствор переходит лишь часть
окиси алюминия. Выход AI2O3 в раствор различен для разных
сортов глин, но редко превышает 60% (при 5-часовом кипячении),
а обычно значительно ниже. Для облегчения процесса растворения
окиси алюминия в кислоте раздробленную глину подвергают об-
жигу при 700—800°. Обжиг обычно производят во вращающихся
трубчатых печах, в которых глина нагревается газами, получен-
ными сжиганием топлива при большом избытке воздуха.
После прокаливания глин степень извлечения из них А120з
значительно повышается и достигает для некоторых сортов 99%
при варие с 63—65%-ной серной кислотой в течение 6—8 ч при
115°. Коагулянт, полученный аналогичным путем из суворовских
глин Подмосковного района, содержащих 38—43% А12О3, 1,4—
2,75% Fe2O3 и 44—45% SiO2, имеет 0,1—0,2% железа и может
быть использован не только для очистки воды, но и бумажной про-
мышленностью 32-33.
По данным разных исследователей, обезвоживание каолинов
при прокаливании наблюдается при различных температурах в
пределах 500—600°34, а обезвоживание боровичских глин — даже
при 400°35. Термический анализ показывает, что обезвоживание
каолинов и глин происходит в интервале 400—500°36.
При нагревании выше 500° молекула каолинита распадается:
А12О3 • 2SiO2 • 2Н2О = Д]2О3 + 2SiO2 + 2Н2О
Вначале, при частичной потере воды образуется водный мета-
каолинит А12О3 • 2SiO2 • (1—п) Н2О, в дальнейшем переходящий в
безводный метакаолинит. При более длительном прокаливании он .
диссоциирует на А120з и SiO2, которые остаются в аморфных фор-
мах37-38. Поэтому обожженная глина резко отличается от необож-
женной легкостью растворения А120з в кислотах. В действитель-
ности процессы, протекающие при нагревании каолина, весьма
сложны. Продуктом эндотермической реакции при 500—550° яв-
ляется аморфное вещество, близкое по своим свойствам к алло-
фану и аллофаноидам, представляющим собой механические смеси
из гелей SiO2 и А120з, с переменным их отношением, образовав-
шиеся в результате совместной коагуляции39.
Кривые, приведенные на рис. 181, по данным А. М. Соколова,
показывают влияние температуры прокаливания каолина в тече- '
Сырье
639
Температура, °C
Рис. 181. Влияние температуры прокали-
вания каолина на потерю в весе (пунктир-
ные линии) и количество А12О3, растворяю-
щееся в кислоте (сплошные линии).
серной кислоте. При обработке про-
ние 1 и 5 ч на потерю в весе вследствие удаления воды (пунктир-
ные линии) и на долю А120з, переходящую в раствор при после-
дующей обработке прокаленного каолина соляной кислотой (сплош-
ные линии). Чем выше температура прокаливания, тем сильнее
разрушается каолин, теряя воду, и тем большая доля окиси алю-
миния растворяется в кислоте. Наилучший эффект достигается при
700—800°, даже при сравнительно непродолжительном обжиге —
около 1 ч. Прокаленная обезвоженная глина обладает наибольшей
пористостью, что также спо-
собствует ускорению раство-
рения AI2O3 при кислотной
обработке 4°-42.
Выше 800° образуются
новые кристаллические фа-
зы— у-АЬОз и нераствори-
мые соединения AI2O3 и
SiC>2, в частности силлима-
нит AI2O3 -8102, муллит
3A12O3-2SiO2 и др.40-43. По-
этому температура обжига
не должна превышать 800°.
При нагревании глин
кроме воды удаляются и
другие летучие вещества —
СО2, SOs и т. п.
При обжиге содержа-
щаяся в глине закись желе-
за окисляется кислородом,
находящимся в топочных
газах, и переходит в РезО4,
которая плохо растворима в
каленной глины кислотой небольшие количества железа все же
переходят в раствор. Выделение железа из раствора в виде
Ре(ОН)з достигается путем так называемой основной варки, в
конце которой, благодаря избытку глины, pH раствора повышается
до такого предела, когда железо осаждается в виде гидроокиси.
Соли окисного железа гидролизуются легче, чем соли алюминия:
pH осаждения гидроокиси железа около 2, а гидроокиси алюми-
ния 4,1. Это позволяет выделить железо из раствора сульфата алю-
миния при достижении в конце варки незначительной кислотности
раствора.
Другие виды сырья
Различные сорта сернокислого алюминия, в частности коагу-
лянты, могут быть получены из золы некоторых углей, содержа*
щих много А120з — иногда до 35%, а также из сланцев44.
640
Гл. XVI. Сульфат алюминия и продукты на его основе
Хорошим сырьем для получения коагулянта и квасцов является
нефелин (К, Na)2O-Al2O3-2SiO2. Крупнейшие залежи нефелина
находятся на Кольском полуострове, где он входит в состав сиени-
тов и образует сплошные массы вместе с апатитом. Нефелиновые
породы залегают в Ильменских горах в районе Миасса, в Каслин-
ском районе Урала, в районе Жданова, в Восточной Сибири, в
Узбекистане и др.31.
Средний состав нефелинового концентрата, получаемого при
разделении апатито-нефелиновой породы Кольского полуострова
(в %):
SiO2 ............. 43,22 TiO2
А12О3 ............. 29,00 СаО
Р'е2О3................ 3,00 Р2О5
FeO................... 0,80 MgO
0,37 Na2O..............12,00
1,70 К2О................7,12
0,65 Потери при про-
0,80 каливании ... 1,26
Нефелиновый концентрат представляет собой тонкий материал,
90% которого проходит через сито 1300 отв!см2 и около 40% —
через сито 6400 orejcM2.
' Особый интерес представляют встречающиеся в природе основ-
ные алюминиевые квасцы КгЗО4 • A12(SO4)3 • 4А1 (ОН)3, относя-
щиеся по своему минералогическому характеру к алунитам. В их
состав вместо калия или наряду с ним может входить и натрий.
Примерный химический состав алунитовой породы, содержащей
50—55% алунита (в %): 20—22 А12О3, 3—4 Fe2O3, 35—40 SiO2,
1,5—2 Na2O, 2,5—3 К2О, 20—21 SO3, 6—7 H2O 45.
В результате обжига алунитовой породы при 500—550° про-
исходит дегидратация и разложение молекулы алунита с образо-
ванием безводных алюминиевых квасцов и у-А12О3:
K2SO4 • А12( SO4)3 • 4А1(ОН)3 == K2SO4 • A12(SO4)з + 2А12О3 4- 6Н2О
После выщелачивания обожженной породы получают раствор
квасцов, содержащий 28 г/л A12(SO4)3, подвергаемый дальнейшей
переработке 13’46-48. При выщелачивании с добавкой серной кис-
лоты в течение 24 ч при 90—95° можно повысить концентрацию
раствора до ~60 г/л A12(SO4)3 49.
При водном выщелачивании алунита, обожженного при 800°
до прекращения выделения сернистых газов, образуется раствор
сульфатов щелочных металлов, окись алюминия остается в шламе.
Обработка этого шлама серной кислотой позволяет получить
A12(SO4)3 • 18Н2О50.
ПРОИЗВОДСТВО КОАГУЛЯНТОВ
Наиболее простым и наиболее старым способом получения не-
очищенного сернокислого алюминия является варка непрокален-
ного, но подсушенного каолина с серной кислотой. Степень превра-
щения А12О3 глины в сульфат не превышает 70—80%. Усовершен-
Производство коагулянтов
641
ствованием этого метода явились разложение каолина избытком
серной кислоты для повышения степени извлечения А12О3 и ней-
трализация избыточной кислоты нефелином. Успешное применение
нефелина в качестве добавки к каолину послужило основанием для
производства нефелинового коагулянта из одного нефелина (без
каолина).
Получающиеся по всем этим способам продукты — неочищен-
ный сернокислый алюминий или коагулянты — после варки за-
твердевают и не подвергаются дополнительной переработке. Они
содержат все примеси сырья, в частности и нерастворившиеся ве-
щества. Для получения очищенного сернокислого алюминия про-
изводят отделение нерастворимых примесей, что значительно
усложняет производственный процесс.
Неочищенный сернокислый алюминий из каолина
Неочищенный сернокислый алюминий раньше получали2-51 из
необожженной каолинитовой глины, которую подвергали сушке;
в пламенной печи при 300—400°. При этом химически связанная
вода удаляется лишь частично. После сушки охлажденный до
50—80° каолин разлагали в варочном котле 65—67%-ной серной
кислотой 6—8 ч при 105—110°. По окончании варки массу, содер-
жавшую не более 6—8% свободной серной кислоты спускали в
зрельники, где количество свободной кислоты понижалось до 2—
2,5%, затем спускали на кристаллизационный стол (лоток)—пло-
скую прямоугольную плиту с бортами высотой 0,25—0,5 м, выло-
женную кислотоупорными плитками. На столе масса в результате
охлаждения закристаллизовывалась — полностью затвердевала, по-
сле чего ее выбивали вручную с помощью лома и отправляли на
склад в виде кусков весом 15—20 кг. Для получения 1 т неочи-
щенного сернокислого алюминия по этому способу расходовали:
0,42 т каолина (с 15% влаги), и 0,32 т серной кислоты (100%), •
0,2—0,3 т пара и 6—6,2 кет • ч электроэнергии.
При использовании каолина, прокаленного при 700—800°, раз-
ложение в варочных котлах завершалось, и надобности в дозре-
вании массы в зрельниках не было. Были предложены различные
способы механизации процесса кристаллизации сернокислого алю-
миния— путем распыления массы до ее застывания, кристаллиза-
ции на вращающихся барабанах с внутренним охлаждением или
в шнеках, в вагонетках с откидными полыми стенками, охлаждае-
мыми водой, на пластинчатых бортовых транспортерах, в ковше-
вых конвейерах и др. Рациональный способ механизации удаления
застывшего глинозема удалось разработать при получении глино-
зема с определенной структурой, при которой остывший и за-
твердевший продукт легче извлекается из кристаллизаторов. Это
достигается разложением каолина избытком серной кислоты,
21 М. Е. Позин
642
Гл. XVI. Сульфат алюминия и продукты на его основе
нейтрализуемой в дальнейшем нефелином. Автоматически дейст-
вующая машина для снятия сернокислого алюминия с плоских кри-
сталлизационных столов представляет собой сдвоенную пластинча-
тую цепь с ножами и гребками. Беспрерывно перемещаясь попе-
рек кристаллизатора, имеющего размеры 9 X 2,7 м, она срезаег
материал слой за слоем и сбрасывает его гребками на ленточный
транспортер, расположенный вдоль кристаллизатора52.
Процесс получения неочищенного сернокислого алюминия из
каолина, требующий сушки каолина и вызревания продукта, яв-
ляется малоинтенсивным и громоздким. Более рационально про-
изводство коагулянта из смеси каолина и нефелина или из одного
нефелина.
> Неочищенный сернокислый алюминий из каолина
и нефелиновой муки
Сущность метода заключается в почти полном разложении сы-
рого природного каолина избыточным количеством серной кислоты
в течение короткого времени и нейтрализации избытка кислоты не-
фелиновой мукой:
А12О3 • 2SiO2 • 2Н2О + 3H2SO4 = A12(SO4)3 + 5Н2О + 2SiO2
(Na, К)2О • А12О3 • 2S1O2 + 4H2SO4 = (Na, K)2SO4 • A12(SO4)3 + 4H2O + 2SiO2
Повышение температуры реагирующей массы за счет взаимо-
действия кислоты с водой каолина и добавляемой водой также спо-
собствует более быстрому и полному разложению каолина. Обра-
зующиеся при разложении нефелина квасцы сообщают продукту
способность схватываться в плотную прочную массу. Скорость
схватывания и прочность массы тем больше, чем больше избыток
кислоты и соответствующий расход нефелиновой муки на ее ней-
трализацию.
1 Степень извлечения глинозема в раствор из сырого каолина
зависит от сорта глины, концентрации и нормы кислоты. Отмучен-
ный положений каолин (содержащий 35% AI2O3 и 47,5% SiOs),
высушенный и измельченный до величины зерен 0,5—1 мм, раз-
лагается с наибольшей скоростью в избытке 54—55%-ной серной
кислоты. Обработка каолина двойной нормой кислоты (по отноше-
нию к стехиометрической) в течение 2 ч при 105—120° переводит
в раствор около 85% исходного глинозема53. При использовании
концентрированной кислоты реакция замедляется вследствие обра-
зования на зернах корок труднорастворимого безводного сульфата
алюминия или кислых сульфатов и увеличения сопротивления диф-
фузии.
- Процесс может быть также осуществлен путем подачи купорос-
ного масла в водную суспензию каолина (Ж:Т = 3:2),
Производство коагулянтов
643
При получении неочищенного сернокислого алюминия из као-
лина и нефелиновой муки51 в варочный котел — стальной цилиндр
е диабазовой футеровкой, снабженный мешалкой, — загружают
воду и купоросное масло для разбавления кислоты до 75—76%
Й2ЗО4. Затем загружают каолин и производят варку массы в те-
чение 15—35 мин при непрерывном перемешивании. Температуру
100—110° поддерживают подачей в котел острого пара. По окон-
чании варки массу, содержащую 4,5—7,5% А12О3 и 20—25% сво-
бодной кислоты, разбавляют водой и вводят в котел в течение
15 мин отдельными порциями (по 5—10 кг) нефелин. Реакционную
массу перемешивают еще 2—3 мин, затем быстро, во избежание
схватывания, сливают на кристаллизационный стол.
Степень перехода А12О3 в сернокислый алюминий составляет из
каолина 65—75%, а из нефелина около 90%. Для получения 1 т
продукта по этому методу расходуют: 0,17 т каолина (с 15% вла-
ги), 0,18 т нефелиновой муки сухой (или 0,12 т А12О3 в каолине
и нефелиновой муке), 0,31 т серной кислоты (100%), 0,21 т пара,
2,5 квт-ч электроэнергии и 0,12 м3 воды.
Нефелиновый коагулянт
При смешении нефелинового концентрата с башенной серной
кислотой без последующего разбавления водой смесь быстро за-
густевает, так как находящаяся в ней вода связывается с образо-
вавшимися солями в твердые кристаллогидраты. Это сопровож-
дается сильным повышением температуры, вызывающим значитель-
ное парообразование, что приводит к резкому увеличению объема
смеси, которая превращается в твердую пористую массу, легко
рассыпающуюся в порошок. Этот продукт, состоящий из смеси
калиевых, натриевых квасцов, SiO2 и прочих примесей, находив-
шихся в нефелине и образовавшихся при обработке его серной
кислотой, называется нефелиновым коагулянтом. Его правильней
было бы назвать неочищенным нефелиновым коагулянтом в отли-
тие от очищенного нефелинового коагулянта, которым является
смесь квасцов, полученная кристаллизацией раствора после отде-
ления от него кремнеземистого осадка.
Температура реакции, количество испарившейся воды, выход и
свойства коагулянта зависят от концентрации исходной кислоты53.
В продукте, полученном при разложении нефелина 63—84,5%-'
ной кислотой, обнаружен бисульфат алюминия. Это объясняется
неполной нейтрализацией серной кислоты:
2(R2O • А1гО3 • 2SiOa) + 8H2SO4 + 8Н2О = Al2(SО4)3 • 3H2SO4 • 12НгО + 2RHSO4 +
+ 2SiO2+R2O- Al2O3.2SiO2
Наличие в коагулянте гигроскопичных кислых солей обусловли-
вает поглощение им влаги из воздуха. В результате Ойоднения
211*
644 Г л. XVJ. Сульфат алюминия и продукты на его основе
продукта происходит дальнейшее разложение непрореагировавшего
нефелина. Этот процесс «дозревания» протекает на воздухе мед-
ленно, около 12 суток, вследствие покрытия зерен непрореагировав-
шего нефелина кристаллами коагулянта. При растворении кристал-
лов в воде процесс дальнейшего разложения ускоряется и завер-
шается в холодной воде в течение часа, а в горячей — в течение
5 мин. Таким образом, замедление взаимодействия нефелина с кон-
центрированной серной кислотой (выше 63% H2SO4) объясняется
недостатком воды в жидкрй фазе53. С наибольшей скоростью не-
фелин разлагается 47—73%-ной серной кислотой (рис. 182) 54.
Рис. 182. Влияние концентрации серной кислоты на ско-
рость разложения нефелина.
Получение неочищенного нефелинового коагулянта было пред-
ложено производить смешением нефелинового концентрата с ба-
шенной серной кислотой в котлах с мешалками и выливанием по-
лученной Пульпы до ее загустевания в аппараты для «созревания»,
т. е. затвердевания массы. Твердая масса подвергается измельче-
нию. При смешении нефелина с 92% серной кислотой реакция
идет очень медленно и незагустевшая пульпа может легко перете-
кать в желоб со шнеком, куда добавляется вода для разбавления
Кислоты. После этого реакция идет очень быстро, и масса, интен-
сивно перемешиваемая шнеком и передвигаемая им вдоль аппа-
рата, быстро затвердевает, превращаясь в мелкие зерна.
Рекомендована следующая схема производства нефелинового
коагулянта55. Смешение купоросного масла и нефелинового кон-
центрата производят в двух смесителях, снабженных трехлопаст-
ными мешалками и соединенных последовательно. В один из сме-
сителей подают непрерывно кислоту и нефелиновый концентрат.
Образующаяся пульпа перетекает во второй смеситель, откуда вы-
ходит из нижней части его через гидравлический затвор в ковше-
вой дозатор. В выходящей пульпе должно содержаться от 1,6 до
4% ивбыточноЙ серной кислоты (в зависимости от качества нефе-
лина). Под избыточной понимают кислоту, содержащуюся в пульпе
сверх того количества, которое может прореагировать к концу про-
Йесса при гидратации. Из ковшевого дозатора пульпа поступает в
шнек-реактор, куда добавляют воду из расчета разбавления кие-
Получение очищенного сернокислого алюминия
645
лоты до 70— 73% H2SO4. Продолжительность пребывания массы в
шнеке-реакторе составляет 28—30 сек и степень разложения нефе-
лина за это время достигает 85—88% • Из реактора сухая рассып-
чатая масса с температурой 80—100° поступает на склад, где про-
исходит дозревание и охлаждение продукта в течение 2—4 суток.
На производство этим методом 1 т нефелинового коагулянта тре-
буется: 0,32 т нефелиновой муки (до 1% влаги) или 0,105 т А12О3
(100%), 0,378 т серной кислоты (100%).
ПОЛУЧЕНИЕ ОЧИЩЕННОГО СЕРНОКИСЛОГО АЛЮМИНИЯ
При производстве очищенного сернокислого алюминия раство-
рением в серной кислоте гидроокиси алюминия (или окиси алю-
миния) процесс осуществляют, например, следующим способом.
В реакционный котел (стальной резервуар, футерованный кислото-
упорным кирпичом по слою диабазовой плитки) одновременно за-
гружают гидроокись алюминия, серную кислоту и воду в прибли-
зительно стехиометрическом соотношении, соответствующем содер-
жанию в продукте ~90% А12(8О<)з • 18Н2О и ~10% свободной
воды. Перемешивание ведут острым паром, поддерживая темпе-
ратуру на уровне 110—120°, и заканчивают его через 20—30 мин,
когда количество свободной серной кислоты в пробе реакционной
массы станет меньше 0,1%. Реакционную массу, содержащую
13,5—15% А12О3 (в виде сульфата алюминия), для ускорения по-
следующей кристаллизации охлаждают в реакторе до 95°, проду-
вая через нее в течение 10 мин воздух. Затем ее сливают на кри-
сталлизационный стол, оборудованный автоматической машиной
для срезки застывшего продукта (стр. 642). Кристаллизация плава
на столе продолжается ~50 мин и столько же времени занимает
извлечение продукта из кристаллизатора, имеющего площадь 32—
34 м2 (емкость ~6 т). Расход материалов на 1 т продукта со-
ставляет: 0,142 т гидроокиси алюминия (в пересчете на AI2O3)
и 0,40 т серной кислоты (100%).
Кристаллизацию ведут также на охлаждаемой изнутри наруж-
ной поверхности горизонтального вращающегося барабана — на
холодильных или кристаллизационных вальцах. Барабан частично
догружен в находящийся в поддоне плав, имеющий температуру
90—100®. Кристаллизация на вальцах облегчает условия труда,
обеспечивает непрерывный режим производства, улучшает товар-
ные свойства продукта. Снимаемый с вальцев чешуйчатый про-
дукт, содержащий 13,5—14% А120з, при хранении слеживается.
Неслеживающийся продукт получают, повышая содержание А12О3
до 15,3—15,8% (15,3% соответствует концентрации А120з в кри-
сталлогидрате А12(8О4)з • 18Н2О). При длине барабана вальцев
9,2 м и диаметре 1,8 м (поверхность теплообмена 12,4 м2), при вы-
пуске продукта с содержанием 13,5—14% А120з, число оборотов
646
Гл. XVI. Сульфат алюминия и продукты на его основе
барабана составляет 4,3 в минуту и средняя рабочая производи-
тельность вальцев равна 2,4 т/ч; при выпуске продукта, содержа-
щего 15,3—15,8% А12О3, барабан делает 1—1,2 об!мин и произво-
дительность снижается до ~ 1 т/ч.
Для получения исслеживающегося продукта предложено5ба
также смешивать пульпу гидроокиси алюминия с 60%-ной серной
кислотой, взятой в количестве 95—97% от стехиометрического и
образующийся раствор с температурой 100° направлять для кри-
сталлизации на холодильные вальцы. Продукт содержит примесь
основной соли.
Запатентован56 непрерывный способ получения сульфата алю-
миния, в котором водная суспензия А1(ОН)з и серная кислота в
стехиометрическом отношении подаются с большой скоростью до-
зирующими насосами в смесительные форсунки реактора, в кото-
ром масса находится не менее 30 сек. Затем она охлаждается до
температуры ниже 100° в проточном холодильнике и продавлива-
ется через сопла или прорези для образования мелкогранулиро-
ванного продукта.
Предложено обрабатывать гидроокись алюминия серной кис-
лотой во вращающихся автоклавах при 145—165° в течение 5—
20 мин с последующим завершением реакции во вращающейся
печи при 175—500°; из печи выходит обезвоженный, гранули-
рованный сульфат алюминия, легко транспортируемый и дози-
руемый.
Производство сульфата алюминия из каолина заключается в
следующем®7’08. Обогащенный мокрым способом каолин дробят
(а мелочь гранулируют) в частицы 2—7 мм, обжигают при 750—
800°, затем обрабатывают в реакторе циркулирующей через слой
крупки серной кислотой для выщелачивания А120з. Процесс начи-
нают при 70°, отводя от раствора тепло реакции, а затем подни-
мают температуру до 104—105°, т. е. выше температуры плавления
в кристаллизационной воде сульфата алюминия, содержащего
13,5% А120з. Полученный плав перекачивают насосами из реак-
тора в сборник, откуда он поступает на кристаллизационные валь-
цы. Получаемый здесь чешуйчатый продукт, содержащий 13,5%
А120з- транспортируется на склад. На 1 т сернокислого алюминия
(13,5% А12О3) расходуется 0,6 т каолина мокрого обогащения (при
15% влажности) и 0,43 т купоросного масла. После слива из реак-
тора плава сульфата алюминия, в оставшемся сиштофе задержи-
вается до 40% продукта, который извлекают трехкратной система-
тической промьщкой, направляя полученный водный раствор,
содержащий ~6,3% А12Оз, на разбавление купоросного масла; по-
лучаемая кислота с концентрацией 31% Н2$Оз поступает в реак-
тор. Промытый сиштоф, содержащий 0,4 % А120з, удаляется гидро-
транспортом, отделяется от воды и используется для производства
цемента.
Получение очищенного сернокислого алюминия
647
Для кристаллизации сульфата алюминия применяют также от-
крытые плоские металлические ванны с двойным днищем, где
циркулирует охлаждающая вода и вращающиеся барабанные холо-
дильники, в которых плав гранулируется. Непрерывную кристалли-
зацию с получением стекловидного сульфата алюминия рацио-
нально осуществлять на движущейся конвейерной ленте из нержа-
веющей стали (или на горизонтальном диске). В этом случае на
кристаллизацию подают раствор (плав), содержащий 17% А12'Оз,
и в него вводят в качестве затравки измельченный сульфат алюми-
ния. Раствор с температурой 130° поступает на ленту, охлажден-
ную до 10—30° и смоченную водой. Нижняя поверхность ленты
охлаждается водой (первые 32 м ленты рекомендуют охлаждать
водой, подогретой до 70°). Раствор начинает загустевать при 110°.
При толщине слоя 5—10 мм его верхняя поверхность отвердевает
через 4—6 мин. При проходе ленты вокруг вала твердый слой суль-
фата трескается и ссыпается. Затем его охлаждают воздухом и
измельчают. Лента длиной 60 м и шириной 0,72 м имеет произво-
дительность 3 т сульфата алюминия в час. Этот способ, как и при-
менение кристаллизационных вальцев, позволяет полностью механи-
зировать процесс, снизив затраты на оборудование, требует малых
площадей для его размещения59.
Запатентовано60 и воздушное охлаждение ленты с помощью не-
скольких сопел; скорость воздушной струи 40—50 м/сек. В плав
предварительно добавляют 2% твердой пыли сульфата алюминия
в качестве затравки. В плаве содержится 17,3% А12О3; его темпе-
ратура 110°. При длине ленты 18 м, ширине 0,8 м, толщине слоя
плава 19 мм и скорости движения ленты 3,25 м/мин, ее производи-
тельность равна 2,2 т/ч.
Возможно61 использование прорезиненной ленты; в этом,слу-
чае плав перед подачей на ленту охлаждают до 83—88°.
Старый способ получения сернокислого алюминия из глин
в СССР утратил свое значение. Он заключался в следующем.
Обожженную и размолотую до тонкости 1—2 мм глину варили
с 65—70%-ной серной кислотой 4—8 ч при кипячении до получения
нейтрального раствора сульфата алюминия, что достигалось до-
бавлением в котел избытка глины. В конце варки содержание сво-
бодной серной кислоты в растворе не превышало 0,3% г/л. Рас-
твор содержал около 45% А12(8О4)з. Из такого раствора уже при
90° начинает кристаллизоваться A12(SO4)3 • 18Н2О.
Во избежание кристаллизации сульфата алюминия при даль-
нейшей переработке раствор по окончании варки разбавляли водой
до плотности 1,2—1,25 г/см3. Получение такого раствора сразу,
путем применения более разбавленной кислоты, нерационально,
так как'извлечение А12О3 из глины при этом ухудшается. После
разбавления раствор сульфата алюминия отфильтровывали на
фильтрпрессе с деревянными рамами (применение чугунного
648
Гл, XVI. Сульфат алюминия и продукты на его основе
фильтрпресса привело бы к загрязнению раствора железом). Оса-
док на фильтрпрессе промывали водой и удаляли в отвал. Промыв-
ные воды возвращали в производство — на разбавление концентри-
рованного раствора после варки. Профильтрованный раствор со-
держал еще значительное количество мути. После отстаивания его
дополнительно фильтровали через контрольный фильтрпресс и вы-
паривали до плотности 1,53—1,58 г! смг. Эта плотность соответ-
ствует концентрации, при которой раствор при охлаждении пол-
ностью закристаллизовывается. Кристаллизацию производили на
кристаллизационных столах. Застывший продукт разламывали на
куски и отправляли на склад. Расход серной кислоты (моногид-
рата) на 1 т стандартного продукта (13,5% А120з) составлял
0,44—0,5 т, а расход прокаленной глины 0,5—0,6 т.
Суммарная потеря А12О3 во всех стадиях производства дохо-
дила иногда до 40%. Столь высокие потери окиси алюминия объ-
ясняются главным образом низкой степенью извлечения АКОз из
глины при ее основной варке, когда процесс ведется почти до ней-
тральной реакции, при которой переход А12О3 в раствор прекра-
щается. Нерастворенная в кислоте А12О3 остается при этом в твер-
дом отвале.
Потери А12О3 значительно меньше при двух последовательных
варках — кислой и основной, когда нерастворившаяся глина после
основной варки, отделенная от раствора, подвергается кислой вар-
ке с добавкой к ней кислоты и порции свежей глины. Раствор
с кислой варки при этом направляется на основную варку с до-
полнительным количеством глины, добавляемым для нейтрализа-
ции кислоты.
В дальнейшем были предложены пути рационализации отдель-
ных стадий этого процесса 62~67: кальцинация глины, смоченной во-
дой и небольшим количеством серной кислоты; более тонкий раз-
мол обожженной глины; систематическое выщелачивание окиси
алюминия из глин кислотой повышающейся концентрации; исполь-
зование для фильтрации слоя листовой целлюлозы; замена фильт-
ров отстойниками; замена выпарных котлов пламенными ванными
печами и аппаратами с погруженным горением; замена кристалли-
зационных столов конвейерным ковшевым кристаллизатором; хо-
лодильными вальцами, распылительной сушкой и др.
Предложено получать кристаллический сульфат алюминия вы-
сокой чистоты выдерживанием в специальном сборнике пульпы,
полученной при выпарке раствора, до ее охлаждения, с целью об-
разования более крупных частиц примесей. После отделения при-
месей массу охлаждают для кристаллизации68.
Был предложен способ получения сернокислого алюминия без
выпарки раствора, заключающийся в том, что обожженная глина,
раздробленная на зерна величиной 4—7 мм, выщелачивается сер-
ной кислотой69. Раствор после выщелачивания сразу застывает в
Другие методы получения коагулянта и пр.
549
твердый стандартный продукт. Выщелачивание должно вестись при
100° путем заливки крупки горячей кислотой такой концентрации
(45—47%), чтобы сразу получался продукт с содержанием 13,5%
AI2O3. После завершения реакции полученный концентрированный
раствор сливают через ложное дно, и в аппарат заливают свежую
кислоту. Эти операции повторяют до тех пор, пока не будет достиг-
нуто почти полное извлечение AI2O3 из глины. По окончании выще-
лачивания шлам в том же аппарате промывают водой и промыв-
ную воду используют для разбавления концентрированной серной
Рис. 183. Растворимость сульфата алюминия в серной
кислоте при 25°.
кислоты. Полное извлечение кислоторастворимого AI2O3 дости-
гается за 20—25 ч. Расчетная производительность 1 выщелачи-
вателя 1,5—2 т стандартного продукта в сутки.
Растворимость сульфата алюминия в присутствии серной кис-
лоты сильно понижается (рис. 183). Поэтому в некоторых случаях
может представить интерес выделение кристаллического сульфата
алюминия из растворов высаливанием концентрированной серной
кислотой. Имеется указание70, что при этом получается продукт
•с малым содержанием железа.
Предложено много способов очистки растворов сульфата алю-
миния и квасцов от железа71’72. Большинство из них основано на
добавке окислителей (МпО2, Н2О2, С1г, Вг2 и др.) для перевода
Fe2+ в Fe3+ с последующим выделением Fe3+ в виде нерастворимых
соединений (например, Fe(OH)3, Fe4[Fe(CN)6]3) или экстракцией
органическими растворителями.
ДРУГИЕ МЕТОДЫ ПОЛУЧЕНИЯ КОАГУЛЯНТА И СЕРНОКИСЛОГО
АЛЮМИНИЯ
Получение коагулянта из золы
Коагулянт может быть получен из золы некоторых углей, со-
держащей много А12О3. В золе подмосковных углей, например,
имеется 25—35% A120j, 8—15% Fe2O3, 43—60% SiO2. Из такой
650
Гл. XVI. Сульфат алюминия и продукты на его основе
золы получают коагулянт, содержащий 8—10% R2O3. Извлечение
AI4O3 из золы, однако, ниже (60—80%), чем из специально обож-
женной глины, так как при сгорании топлива развиваются значи-
тельно более высокие температуры и часть окиси алюминия в золе
связывается в форме алюмосиликатов и других соединений, не рас-
творяющихся в серной кислоте 73-75.
Получение коагулянта из глин и каолина методом спекания
При варке неочищенного сернокислого алюминия или коагу-
лянта из сырой глины в ряде случаев получаются сравнительно
низкие выходы AI2O3 и низкое содержание AI2O3 в продукте при
повышенной его кислотности, что связано с содержанием в глинах
полевошпатовых пород. В этом отношении большими преимуще-
ствами обладает способ получения коагулянта из сырых глин спе-
канием с серной кислотой, дающий возможность получать коагу-
лянт с более высоким содержанием AI2O3 и лучшим выходом его,
не содержащий свободной кислоты.
По этому способу сырую глину смешивают с 75 %-ной серной
кислотой, взятой в количестве 50—70% от того, которое требуется
для связывания в сернокислые соли AI2O3, Ре20з, СаО, MgO, Na2O,
К2О. Смешение производят в глиномялках или в аппаратах шнеко-
вого типа. Затем смесь прокаливают в течение 2—5 ч в подовых
или вращающихся печах при 300—500°. Получается рассыпчатый
продукт, содержащий до 15% R2O3. На 1 т такого продукта рас-
ходуют: около 1 т низкосортной сырой глины (содержащей 20%
AI2O3 и 12% Ре^Оз) и 0,48 т серной кислоты (100%-ной).
Помимо того, что метод спекания позволяет получать коагулянт
из необожженной низкосортной глины, он имеет и другие преиму-
щества по сравнению с методом варки коагулянта из глины. К ним
относятся возможность легкого осуществления процесса непрерыв-
ным способом в шнеке или вращающейся печи, получение рассып-
чатого продукта и возможность получать продукт с любой свобод-
ной кислотностью, вплоть до отсутствия кислотности, что имеет
большое значение для ряда потребителей, например для бумажной
промышленности. Полученный этим методом из каолина или белых
глин неочищенный коагулянт, не содержащий свободной серной
кислоты, пригоден для частичной замены в бумажной промышлен-
ности более дорогого очищенного сернокислого алюминия76.
Спек, изготовленный описанным выше способом, можно под-
вергнуть выщелачиванию; после фильтрования получается-сравни-
тельно чистый раствор сульфата алюминия, содержащий лишь
небольшое количество соединений железа и сульфатов щелочных
металлов. Вследствие термической диссоциации Fe2(SO4)s в печи
основная масса железа в виде окиси железа переходит в шлам
вместе с кремнеземом и отделяется при фильтровании77.
Другие методы получения коагулянта и пр.
651
Спеканием можно получить сульфат алюминия и из каолинов.
В СССР разработан метод двухстадийной сульфатизации каоли-
нов, заключающийся в спекании их с серной кислотой (20% нор-
мы) при 600° и в последующем выщелачивании спека серной кис-
лотой при температуре кипения78.
Комбинирование производства очищенного сернокислого
алюминия с сернистокислотным методом разложения каолинов
Производство очищенного сернокислого алюминия может быть
организовано с использованием алюминиевого концентрата, полу-
чаемого при предварительном обогащении каолина или глин.
Одним из таких методов обогащения является разложение кремне-
земистых соединений алюминия сернистым газом. Представляет
интерес использование при этом отбросного сернистого газа метал-
лургической и химической промышленности и получение высоко-
концентрированного газа при гидролизе сульфита алюминия.
При взаимодействии окиси алюминия с водным раствором дву-
окиси серы протекают реакции:
А120з 4- 6H2SO3 = 2A1(HSO3)3 4- ЗН2О
А12о3 + 3H2SO3 = A12(SO3)3 4- ЗН2О
Процесс идет в основном с образованием бисульфита алюминия
(при 20° константы диссоциации H2SO3 следующие: Ki — 2-Ю-2,
К2 = 1-10-7).
Разложение каолина сернистой кислотой в интервале 25—65°
при атмосферном давлении протекает медленно. Степень извлече-
ния AI2O3 в раствор в течение 5—7 ч не превышает 8,5%. В этих
условиях степень извлечения окиси железа составляет ~22,5%.
Повышение давления и температуры способствует резкому уве-
личению скорости разложения каолина и степени перевода А120з
в водорастворимое состояние. При 20 ат и 170° степень перехода
AI2O3 в раствор из водной суспензии каолина с отношением по весу
Т : Ж, равным 1 : 10, достигает за 8—10 ч 95—96%. Опыты прово-
дились с каолином предварительно прокаленным в течение 1 ч
/при 600°, измельченным до полного прохождения через сито с от-
верстиями 0,25 мм и имевшим состав (в %): 38,10 — А12О3; 47,11 —
SiO2; 1,61 — Fe2O3; 1,10 —СаО; 0,40 —TiO2, 0,60 —MgO, 11,18 —
потери при прокаливании 79'80.
После отделения нерастворимого осадка, представляющего со-
бой в основном кремнезем, раствор сульфита и бисульфита алюми-
ния подвергают гидролизу:
A12(SO3)3 4- 6Н2О = 2А1(ОН)3 + ЗН2О 4-3SO2
A1(HSO3)3 4-ЗН2О = А1(ОН)3 4-ЗН2О 4-3SO2
В действительности в результате гидролиза образуются
основные сернистокислые соли алюминия различного состава!
652
Гл. XVI. Сульфат алюминия и продукты на его основе
Al(0H).(HS0a)2, A1(OH)2(HSO3), A1(OH)SO3, A12(OH)4SOs и др.
Некоторые из образующихся основных солей трудно растворимы
в сернистой кислоте и не подвергаются дальнейшему гидролизу.
Вследствие этого продукт гидролиза состоит из гидроокиси и ос-
новных солей алюминия и может служить прекрасным сырьем для
получения сернокислого алюминия, попутно с обогащением серни-
стого газа.
Процесс упрощается, если раствор сульфит-бисульфита алюми-
ния, отделенный от примесей, обработать серной кислотой. При
этом образуется довольно концентрированный раствор сульфата
алюминия и почти чистая двуокись серы:
А12(80з)з + 3H2SO4 = A12(SO4)3 4- ЗН2О 4- 38О2
Этот процесс аналогичен переработке сульфит-бисульфитных
растворов в процессе очистки газов от двуокиси серы по аммиач-
ному способу (стр. 520).
Следует, однако, отметить, что для переработки каолина опи-
санный метод является мало перспективным вследствие малой ско-
рости взаимодействия каолина с сернистой кислотой. Более пер-
спективным является получение по этому способу квасцов из нефе-
лина (стр. 655).
Получение сернокислого алюминия из боксита
Разложение боксита производят81 в стальном реакторе, футеро-
ванном кислотоупорными плитками или покрытом стекловидной
эмалью. В реактор вначале загружают 93%-ную серную кислоту,
которую разбавляют слабыми растворами от промывки шлама и
нагревают до кипения. Боксит вводят в реактор периодически не-
большими порциями во избежание обильного вспенивания. Варку
осуществляют при ~135°. По окончании варки пульпа поступает
в отстойники, где раствор отделяется от нерастворимых примесей.
Осветленный раствор или выпаривают с получением твердого про-
дукта, или используют непосредственно.
В последнем случае, когда установка для получения раствора
сульфата алюминия соединена с системой очистки воды, продол-
жительность реакции и объем реактора меньше, чем в случае по-
лучения раствора при стехиометрическом соотношении реагентов,
предназначенного для переработки в твердый продукт. При за-
грузке в раствор боксита, 93%-ной кислоты и воды приблизительно
в весовом соотношении 1:2:1 уже в течение 3-минутного переме-
шивания массы без внешнего подогрева достигается 92% извлече-
ние А12О3 82.
Сообщают и другие режимы варки боксита с серной кислотой,
например, перемешивание в течение 30—60 мин при 150—200°83
Или осуществление этого процесса в шаровых мельницах м.
Производство квасцов
653
Описана85 сравнительно недавно построенная в США уста-
новка для получения из боксита 120 т/сутки 17%-ного сульфата
алюминия. Измельченный боксит разлагают в футерованном кис-
лотоупорным кирпичом котле с диаметром 6,1 м и глубиной 5,5 м.
В него заливают 22 м3 воды, затем 16 м3 90%-ной серной кислоты
и, поддерживая острым паром температуру, равной 118°, посте-
пенно засыпают 19 т боксита. Перед окончанием реакции добав-
ляют холодную воду для понижения температуры до 82°. В течение
суток проводят две варки. После отстаивания в котле жидкость и
Шлам фильтруют отдельно. Фильтрование производят на барабан-
ном вакуум-фильтре, применяя в качестве вспомогательного филь-
трующего материала диатомит. Фильтрат, содержащий 8,3% А120з,
выпаривают в течение 4 ч до 17% А120з в футерованном стальном
резервуаре с паровым змеевиком и направляют на кристаллиза-
ционный стол с поверхностью 93 м2. Затвердевший материал дро-
бят на куски и выдерживают в бункере 24 ч, что способствует бо-
лее легкому последующему измельчению в дезинтеграторе.
Использование отбросных травильных растворов для получения
сульфата алюминия
Запатентован 86'87 способ получения сульфата алюминия с ути-
лизацией травильных растворов, содержащих до 10% H2SO4 и
~25% FeSO4. Эти растворы упаривают, продувают воздухом для
окисления Fe2+ в Fe3+ и обрабатывают ими глиноземсодержащий
материал (глину и др.) в автоклаве при 100—350° и давлении
200—350 ат. При этом в растворе Fe2(SO4)3 заменяется на
А12(ЗО4)з, а в шламе остаются SiO2 и Fe(OH)3. Профильтрован-
ный раствор подкисляют и обрабатывают'сернистым газом для
восстановления небольшой примеси Fe3+ в Fe2+, после чего из него
кристаллизуют сульфат закиси железа, а оставшийся раствор суль-
фата алюминия перерабатывают в твердый продукт. Очистка рас-
твора сульфата алюминия от FeSO4 достигается при нагревании
раствора выше 50° (до температуры кипения) —это приводит к
«эстолько значительному выделению в осадок сульфата закиси же-
леза, что получаемый раствор может быть переработан в продукт,
пригодный в качестве коагулянта для сточных вод. Осуществляя
вторую стадию кристаллизации сульфата железа при температуре
ниже 50°, получают чистый сульфат алюминия88.
ПРОИЗВОДСТВО КВАСЦОВ
Для получения алюмо-калиевых квасцов KzSO4 • A12(SO4)3-
• 24Н2О к концентрированному горячему раствору сульфата алю-
миния, содержащему 8% А12О3, добавляют сульфат калия и пере-
мешивают в течение 1 ч при 80—90°. Затем раствор направляют на
654
Гл. XVI. Сульфат алюминия и продукты на его основе
кристаллизацию, например, в вакуум-кристаллизационную уста-
новку. Кристаллы квасцов отделяют на центрифуге и промывают
водой. Маточный раствор и промывную воду используют, возвра-
щая их на разбавление раствора сульфата алюминия перед до-
бавкой к нему сульфата калия, пока содержание примеси сульфата
железа в них не повысится до 1,1% Fe2O3. После этого их направ-
ляют на разбавление купоросного масла, используемого для варки
сульфата алюминия 57.
Алюмо-калиевые квасцы могут быть получены при видоизме-
нении процесса производства очищенного сульфата алюминия.
Вначале производят варку каолина с серной кислотой. По оконча-
нии нейтрализации серной кислоты в реактор добавляют сульфат
натрия из расчета получения натриевых квасцов. Последние, вслед-
ствие своей большой растворимости, находятся в растворе. После
разбавления раствора до плотности 1,33 г/см3 его отделяют от
осадка кремнезема, охлаждают и смешивают с насыщенным рас-
твором хлорида калия. При этом в осадок выделяются алюмо-ка-
лиевые квасцы, плохо растворимые при невысокой температуре.
В маточном растворе после отделения кристаллов алюмо-калиевых
квасцов остаются растворимые примеси — соединения железа и
хлорид натрия 89.
В настоящее время алюмо-калиевые квасцы производят по сле-
дующему варианту этого способа. Полученный из пульпы гидро-
окиси алюминия и серной кислоты раствор сульфата алюминия,
разбавленный водой до концентрации ~29% А12(5О4)з, смеши-
вают со стехиометрическим количеством 15% раствора Na2SO4 и
с 25% раствором КС1. Последний загружается с 10%-ным избыт-
ком для высаливания квасцов, образующихся по реакции:
A12(SO4)3 + 2КС1 + Na2SO4 = 2KA1(SO4)2 + 2NaCl
Реакционную смесь нагревают до 70°, затем раствор, содержа-
щий 18,5—19% KA1(SO4)2, пропускают через фильтрпресс для
очистки от шлама и направляют в четырехкорпусную вакуум-кри-
сталлизационную установку. Остаточное давление в 4-м корпусе —
7 мм рт. ст., что позволяет снизить температуру раствора до 10°.
При такой температуре насыщенный раствор содержит ~4%
KA1(SO4)2. Кристаллизуется ~86% квасцов. Кристаллы поддер-
живаются во взвешенном состоянии при помощи мешалок, кото-
рыми снабжены вакуум-кристаллизаторы; отношение Ж:Т в чет-
вертом корпусе равно 2; 1. Отсюда пульпа направляется на цент-
рифугу, маточный раствор возвращается на производство сульфата
алюминия, а кристаллы транспортируются в бункер готовой про-
дукции II сорта. Для получения продукта I сорта отфугованные
кристаллы высушивают в барабанной сушилке горячим воздухом
(120—130°). На 1 т продукта расходуют: 0,14 т гидроокиси алюми-
ния (100%), 0,23 т хлорида калия (100%), 0,192 т сульфата натрия
Производство квасцов 655
(100%), 0,40 т серной кислоты (100%), 0,015 т кальцинированной
соды (используемой для нейтрализации свободной кислотности
раствора сульфата натрия), 168 кет • ч электроэнергии, ~60 м3
воды, 1,27 мгк пара.
Хорошим сырьем для получения квасцов является нефелин. При
взаимодействии нефелина с серной кислотой образуется смесь ка-
лиевых и натриевых квасцов по реакции:
(К. Na)2O • А12О3 • 2SiO2 + 4H2SO4 + 20Н2О =
= (К, Na)2SO4 • A12(SО4)3 • 24Н2О + 2SiO2
Этот процесс осуществляют следующим образом. В кипящую
40—50%-ную серную кислоту постепенно всыпают нефелин. Рас-
твор по мере загустевания разбавляют водой. После полной ней-
трализации кислоты раствор некоторое время кипятят, затем раз-
бавляют водой до плотности 1,16—1,23 г/см3 и отфильтровывают от
шлама — кремневой кислоты. Затем раствор подвергают выпари-
ванию и охлаждению в лотках, причем он полностью закристалли-
зовывается в квасцы. Недостатком этого способа является плохая
фильтруемость пульпы, полученной после варки. Это объясняется
присутствием геля кремневой кислоты. Часть шлама проходит с
раствором через фильтр, вследствие чего готовый продукт иногда
содержит нерастворимого остатка больше, чем допускается стан-
дартом.
Для получения легко отделяемого на фильтре осадка разложе-
ние нефелина необходимо вести 74—76%-ной серной кислотой при
повышенной температуре54. В этих условиях происходит дегидра-
тация кремневой кислоты, вследствие чего она не переходит в кол-
лоидную форму и не затрудняет фильтрацию. Кроме того, при бо-
лее низкой концентрации кислоты разложение идет слишком бы-
стро (рис. 182), что может затруднить осуществление процесса.
При концентрации кислоты выше 76% реакция резко замедляется.
Кислота указанной концентрации берется в количестве 83—88%
от теоретического. Температура смеси к концу процесса повы-
шается до 140°. По окончании реакции получается рыхлая, пори-
стая масса, из которой квасцы легко выщелачиваются горячей во-
дой. Оптимальное соотношение воды и нефелина при выщелачи-
вании квасцов составляет 2:1.
Ввиду высокой температуры в реакционном аппарате, возни-
кающей вследствие сильной экзотермичности реакции, выделяю-
щаяся кремневая кислота находится в коагулированном виде. Од-
нако, ввиду того что реакция не проходит количественно и продол-
жается при выщелачивании квасцов, в растворе обнаруживается
и некоторое количество золя кремневой кислоты. Несмотря на это,
раствор легко отфильтровывается — в 7—10 раз быстрее, чем при
разложении нефелина 40—50%-ной серной кислотой. Разложение
нефелинового концентрата кислотой, созревание массы и ее
656
Гл. XVI. Сульфат алюминия и продукты на его основе
выщелачивание можно производить в одном аппарате — варочном
котле, снабженном подъемной мешалкой. Как только после смеше-
ния нефелина с кислотой, продолжающегося 1—2 мин, температура
начинает повышаться, мешалка должна быть поднята. После со-
зревания массы в течение 14—15 мин в котел подают горячую про-
мывную воду для выщелачивания растворимых солей. Выщелачи-
вание производят 20—25 мин при постепенном опускании мешалки.
Полученный раствор содержит около 8% KA1(SO4)2, 23%
NaAl(SO4)a и 1% сульфатов
KA1(SO4)2,2M /Z7Z7sH2O
Рис. 184. Изотермы раствори'
Мости KA1(SO4)2 в растворах
NaAl(SO4)2(20, 80, 40 и 50°).
закисного и окисного железа. Для
того чтобы железо содержалось в
основном в виде сульфата окиси
(что требуется при применении ква-
сцов для очистки воды),необходимо
к серной кислоте, идущей на разло-
жение нефелина, добавлять неболь-
бое количество окислителя — азот-
ной кислоты.
Полученный раствор квасцов мо-
жет быть подвергнут выпарке до
концентрации А12О3 10,5—12,5%, по-
сле чего при охлаждении получает-
ся готовый твердый продукт. При
выпарке раствора имеет место силь-
ный гидролиз квасцов, в результате
которого образуется осадок основ-
ных солей и кислотность раствора
повышается. Во избежание получе-
ния продукта с кислотностью выше
допускаемой (0,1%) в конце выпар-
ки необходимо производить нейтра-
лизацию раствора гидроокиси алю-
миния нефелином или содой. Примерный состав получаемого таким
способом продукта следующий: 40,2% A12(SO4)3 (12% А12О3), 1,7%
Fe2(SO4)3 (0,7% Fe2O3), 11,3% Na2SO4, 4,6% K2SO4, 40,4% кри-
сталлизационной воды и 1,8% примесей.
Калиевые квасцы являются значительно более ценным продук-
том, чем натриевые, так как в отличие от последних они путем пе-
рекристаллизации могут быть получены в очень чистом виде, что
важно для многих потребителей. Поэтому раздельное получение
калиевых и натриевых квасцов более рационально, чем получение
смешанных квасцов путем прямой выпарки раствора. Раствори-
мость калиевых квасцов резко уменьшается по мере увеличе-
ния концентрации натриевых квасцов и понижения температуры
(рис. 184). Путем охлаждения раствора, полученного сернокислот-
ным разложением нефелина, до 30® можно выделить в твердую
фазу до 90% калиевых квасцов, Оставшийся раствор содержащий
Производство квасцов
637
в основном натриевые квасцы, может быть переработан на твер-
дый продукт выпаркой и охлаждением.
Из раствора квасцов, полученного из нефелина, можно выде-
лить до 90% алюминия в виде калиевых квасцов путем обработки
натриевых квасцов хлоридом калия по реакции:
NaAl(SO4)2 + КС1 ^=* KA1(SO4)2 + NaCl
Получение квасцов из нефелина можно осуществить разложе-
нием водной суспензии нефелиновой муки сернистым газом90. При
этом образуется раствор бисульфитов:
(К, Na)2O • А12О3 • 2SiO2 + 8SO2 + 4Н2О
\ * NaHSO3 4- KHSO3 4- 2A1(HSO3)3 + 2SiO2
В отличие от сернистокислотного разложения каолина, разло-
жение нефелина идет с практически достаточной скоростью при
обычных температуре и давлении. При отношении Т : Ж в пульпе,
равном 1 : 5, степень извлечения А120з из нефелиновой муки в рас-
твор при 20° за 3 ч составляет около 90%. Для получения хорошо
отфильтровывающегося осадка SiO2 с предотвращением гелеобра-
зования взаимодействие двуокиси серы из отбросных газов с вод«
ной суспензией нефелина следует осуществлять ступенчато, с посте-
пенным увеличением количества жидкой фазы путем разбавления
водой или оборотными растворами91. В начале процесса величина
Т :Ж должна быть равной 1:1, а в конце 1 :5. Раствор, получен-
ный после отделения кремнезема, может быть переработан в ква-
сцы обработкой его серной кислотой с последующим выпарива-
нием и кристаллизацией. В качестве побочного продукта обра-
зуется почти 100%-ная двуокись серы.
Очистку растворов алюмо-калиевых квасцов от железа можно
осуществлять с помощью материалов, содержащих глинозем, на-
пример дегидратированной алунитовой породой и др. При этом в
результате гидролиза железо-калиевых квасцов образуются труд-
норастворимые основные железо-калиевые квасцы:
7 3[K2SO4 • Fe2(SO4)3] + 14Н2О
ч=± K2SO4 • 3Fe2O3 • 4SO3 • 9H2O 4- 5H2SO4 + 2K2SO4
Нейтрализация образующейся свободной серной кислоты ма-
териалом, содержащим глинозем, способствует сдвигу реакции ги-
дролиза в сторону нерастворимых основных соединений железа92.
Получение не содержащих железа алюмо-аммониевых квасцов
из загрязненных железом растворов сульфата алюминия можно
осуществить осаждением их сульфатом аммония. К раствору суль-
фата алюминия добавляют вначале раствор бисульфата аммония,
содержащий ~26% SO2, нагревают смесь до 60—70s и выдержи-
вают при этой температуре 30—40 мин. При этом содержащийся в
658
Гл. XVI. Сульфат алюминия и продукты на его основе
растворе сульфат окиси железа восстанавливается в сульфат за-
киси железа. Это восстановление необходимо осуществить потому,
что сульфат окиси железа образует с сульфатом аммония изомор-
фные с алюмо-аммониевыми квасцами железо-аммониевые квасцы,
совместно выделяющиеся из раствора.
После восстановления бисульфитом аммония к охлажденному
раствору сульфата алюминия, содержащему ~20—25% A12(SO4)3,
прибавляют раствор сульфата аммония с концентрацией ~35% |
(NH4)2SO4. Для более полного осаждения алюмо-аммониевых ква- ]
сцов берут 10—12%-ный избыток сульфата аммония по отношению I
к стехиометрическому количеству согласно уравнению: ’
A12(SO«,'$ t- (NH4)2SO4 + 24Н2О = (NH4)2SO4 • A12(SO4)3 • 24H2O ।
Вследствие экзотермичности реакции раствор разогревается до |
50—60°. Его охлаждают до 15—20° с целью увеличения выхода |
квасцов. Отделенные кристаллы промывают и высушивают. |
Этот способ переработки сульфата алюминия представляет, в 1
частности, интерес при получении из него гидроокиси, а затем I
окиси алюминия. В этом случае алюмо-аммониевые квасцы вто- 1
рично перекристаллизовывают и затем обрабатывают их водным |
раствором аммиака для осаждения гидроокиси алюминия, а обра-
зующийся раствор сульфата аммония возвращают в процесс 93’94.
ЛИТЕРАТУРА J
1. J. A. Skuralis, Н. А. Наг an, R. М а 1 е е и у, J. Am. Chem. Soc., 76,
№ 5, 1450 (1954).—2. П. В. Дыбина, Технология минеральных солей, Госхим-
издат, 1949. — 3. П. В. Дыбина, Сборник статей ВЗПИ, № 3, 1953, стр. 37.— 1
4. S. Bretsznajder, J. Boczar, J. Piskorski, J. Porowski, Przem. j
chem., 11, № 2, 89 (1955). — 5. S. Bretsznajder, W. Kawecki, Poczn. Chem., |
29, № 2—3, 287 (1955). — 6. E. А. Крогиус, Научный ежегодник за 1954 г. I
Саратовск. ун-та, Саратов, 1955, стр. 534. — 7. Chem. Ind., 44, № 2, 171 (1939).— А
8. Т а и а б э, J. Pharm. Soc. Japan, 75, № 8, 954 (1955). — 9. Т. Д. Авербух,;®
И. В. Стрежнев, Н. П. Бакина, Хим. пром., № 6, 6 (1948). —10. А. К. Т р о- ,1
фи мо в, ДАН СССР, 104, № 3, 427 (1955).
11. В. В. Печковский, А. Н. Кетов, ЖПХ, 30, № 10, 1506 (1957).— Я
12. Lor ant Bela, Z. analyt. Chem., 219, № 3, 256 (1966). — 13. И. Л. Баг-Я
банды, А. К. Посадовская, Изв. АН АзССР, 1, 13 (1955). —14. Г. В. К у-
колев, Е. Н. Леве, ЖПХ, 28, № 9; 909 (1955). — 15. П. В. Д ы б и н а, Там же, Н
37, № 8, 1711 (1959). — 16. L. L е s n i е w i с z, S. Bretsznajder et al., Przem. I
chem., 12, № 7, 371, 378 (1956). —17. В. Vm e 1 i k, M. Mathien, M. Prettre,
Compt. rend., 242, № 6, 773 (1956). — 18. M. A. M и н и о в и ч, Хим. пром., № 7, I
19 (1944) —19. Там же, № 3 22 (1946) . — 20. S. Bretsznajder, Przem. chem., ”
10, № 5, 250; № 6, 295 (1954); 11, № 3, 115 (1955); 12, № 1, 33 (1956); Roczn.
chem., 29, № 2—3, 227 (1955).
21. Англ. пат. 784706, 1953. — 22. Chem. Eng. News, 44, № 36, 72 A (1966).—
23. Ю. П. Вейцер, Журн. ВХО, 5, № 6, 628 (1960). — 24. Э. А. Левицкий,
Хим пром. № 7, 557 (I960). —25. Э. А. Левицкий, В. Н. Максимов,
И. Ю. Марченко, ДАН СССР, 139, № 4; 141, № 4 (1961).— 26. Э. А. Л е в и ц-
к и й, Б. М. Щепачев, Изв. вузов. Цвета, металлург., Ns 2 (1961).—
Литература
659
21. Б. М. Щепачев, Труды НИОХИМ, т. 19, 1969, стр. 133.—28. В. М. Куз-
нецов, Производство сернокислого глинозема, ОНТИ, 1932. — 29. G. Schmutz-
1 ег, Chem. Technik, 17, № 12, 720 (1965). — 30. П. М. Татарицов, С. Ф. М а-
лявкин, А. Н. Гейслер, Курс нерудных месторождений, ч. II, ОНТИ, 1935.
31. Ю. В. Морачевский, Труды ГИПХ, в. 37, 1946, стр. 120.—
32. П. В. Д ы б и н а, Хим. пром., № 5, 15 (1945).— 33. В. К. Першк е, Н. Н. Л а-
шин, ЖХП, № 14—15, 954 (1930). — 34. Технология керамики и огнеупоров, под
ред. П. П. Будникова, Госстройиздат, 1955. — 35. Г. Г. У р а з о в, Н. И. В л о д а-
вец, Изв. Ин-та физ.-хим. анализа, 3, № 2 (1927). — 36. П. В. Д ы б и н а, Сбор-
ник статей ВЗПИ, № 6, 49 (1954). — 37. А. С. Г и н з б е р г, X р. С. Н и к о г о с я н,
А. В. Ч и т а е в, Труды Института прикладной минералогии и металлургии, в. 22,
1926 стр. 5. — 38. Э. К. Келлер, А. И Леонов, Усп. хим., 22, № 3, 334
(1953).— 39. Д. С. Белянкин, ИСФХА АН СССР, 19, 51 (1949).—40. А. М. Со-
колов, Изв. СПБ технол. ин-та, 22, 1 (1913).
41. Н. Ви денов, Л. Димитрова, Г. М о н е в, Тежка пром., 4, № 6, 33
(1955). — 42. Р. Murray, J. White, Clay Minerals Bull., 2, № 13, 255 (1955).—
43. А. И. Ab rye th ник, Л. В. Козловский, ЖПХ, 25, № 3, 265 (1952).—
44. Chem. Ind., 14, № 6, 313 (1962). — 45. В. А. М азе ль, Производство глино-
зема, Госметаллургиздат, 1955.—46. Н. Н. Николаев, Водоснабж. и сантех-
ника, № 3, 54 (1938). — 47. Г. Кутерман, Труды Ин-та химии АН ГрузССР,
в. 14, 1958, стр. 203. — 48. Т. В. Панцулая, М. С. Мерабишвили,
Т. Н. Бегиашвили, Труды Кавказ, ин-та минерального сырья. Сер. технол.,
в. 6 (X), 1965, стр. 107. — 49. И. Л. Багбанлы, Научно-иссл. работы хим.
институтов и лаборат. АН СССР за 1941—1943 гг., 1945, стр. 300. — 50. И. Баг-
банлы, Труды Ин-та химии АН АзССР, в. 15, 1956, стр. 5.
51. И. М. Вассерман, Производство минеральных солей, Госхимиздат,
1962. — 52. К. В. Иванов, Хим. пром., № 1, 48 (1955). — 53. С. И. Савчук,
Автореф. канд. дисс., НИУИФ, 1955. —54. С. С. Марков, Труды ГИПХ, в. 34,
1940, стр. 22.— 55. Н. К. Саракуз, Хим. пром., № 6, 361 (1955).— 55а. Ф. К. Ми-
хайлов, Ю. В. Ласточкин, А. Д. Соколова, В. А. Немов, авт. свид.
223077, 1967, — 56. Австр. пат. 213375, 1961, —57. Б. Д. Мельник, ЖПХ, 10,
№ 10, 2165 (1967). — 58. П. В. Д ы б и н а, А. А. Соловьева, Ю. И. Вишняк,
Расчеты по технологии неорганических веществ, Изд. «Высшая школа», 1967,
стр. 415. — 59. Пат. ФРГ 946436, 1956; австр. пат. 154214, 1953; франц пат
1220251, 1959.— 60. Пат. ГДР 36653, 1964, пат. США 3011878, 1961.
61. Пат. ФРГ, 1146042, 1963. — 62. И. Л. Багбанлы, X. Л. Зейпалова,
Труды Ин-та химии АН АзССР, в. 13, 1954, стр. 104. —63. Н. Kretzschmar,
пат. ФРГ 930871, 1955.—64. В. W. Hammare n, Р. A. Florio, R. V. Tow-
ne nd, канад. пат. 492396, 1953. — 65. S. К о j i m а, япон. пат. 2627, 1953.—
66 L. Lesniewicz, S. Bretsznajder, J. Lis, J. Piskorski, Przem.
chem., 12, № 10, 566 (1956). — 67. Кувата, Сугахара, япон. пат. 318, 1955. —
68. H. Kretzschmar, пат. ФРГ 920964, 1954. —69. С. С. Марков, С. О. Ре з-
иикова. Труды ГИПХ, в. 39, 1947, стр. 69. — 70. Н. W. Schmidt, пат. ФРГ
886597, 1953.
71. Г. Б. Ш а х т а х т и н с к и й, А. Н. Халилов, Азерб хим ж. № 1 109
(1967). —72. Пат. США 3141733, 1961; 3148024, 1962; 3211521, 1962; 3254948,
1963. — 73. П. В. Д ы б и н а, Хим. пром., № 4, 19 (1948). — 74. П. В. Дыбина,
Там же, № 8, 16 (1944). — 75. П. В. Д ы б и н а, Труды МХТИ, в. И, 1947,
стр. 61, — 76. Г. К. Магаршак, Хим. пром., № 3, 18 (1946). — 77. А. Воз-
ницка, Przem. chem., 42, № 11, 649 (1963). — 78. Л. В. Гладушко, В. С. С а-
»ин, А. К. Запольский, Хим. пром. Украины, № 6 (1967); № 7 (1968); сб.
«Исследования по комплексной переработке нефелиновых пород и каолинов
Украины на глинозем и другие продукты», Изд. АН УССР, 1968. — 79. П. В. Д ы-
0 и н а, Хим. пром., № 3, 9 (1953). — 80. П. В. Д ы б и н а. Сбооник статей ВЗПИ,
в- 2, 1952, стр. 28.
660 Гл. XVI. Сульфат алюминия и продукты на его основе
81. Chepi. Eng., 57, № 12, 172 (I960). — 82. U. §• At. Commission 73, 747
(1962). — 83. Пат. ФРГ 1126894, 1962-— 84. Пат. США Зб7>228, 1963, — 85. Chem.
Eng., 68, Mi 6, 132 (1961).— 86. Пат- СЩА 3078146, 1963, — 87. Франц, пат.
1347556, 1963. — 88. Польск. пат. 44574, 1961. — 89. п. М. Токарский, ЖХП,
Mi 6, 57 (1940). — 90. И. И. ИскоЛьдский, В. В. Гр о мой, К проблеме
окиси алюминия, ОНТИ, 1934.
91. 3. П. Розенкноп, авт. свид. 65934; Бюлл. цзобре^., № 2, |1 (1946),—
92. Б. К. Шварцман, Автореф. канд. дисс., ВАМИ, 1949.—93. Л. Г. Кбб-
л е н ц, Получение окиси и металлического алюминия из глин Бобриковсйого
месторождения подмосковного каменноугольного бассейна, изд. Мосхимэнерго-
строй, 1932. — 94. Польск, пат. 46752, 1961.
Глава XVII
СОЕДИНЕНИЯ МЕДИ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Медь легко соединяется с кислородом при нагревании 2, обра-
зуя окислы Си2О и СнО. Давление кислорода над СиО при 4500,
равно 6,963 • 10~25, при 1000°—118, а при 1070° — 458 мм рт. ст.
Давление кислорода над Сп2О при 450° равно 7,561 • 10~26 мм рт. ст.
и 760 мм рт. ст. при 1935°.
Закись меди Сп2О образует красные кристаллы кубической син-
гонии с плотностью 6,0 г!см\ плавящиеся при 1235°. Окись меди
СиО черного или коричнево-черного цвета кристаллизуется в три-
клинической и кубической сингонии; плотность 6,4—6,45 г) см3.
Окислы меди в воде не растворимы.
При взаимодействии растворов солей меди с основаниями об-
разуются осадки зеленого или коричневого цвета. Считают, что.
осадки зеленого цвета являются гидратами гидроокисей, а корич-
невого— гидратами окислов меди3. Гидрат закиси меди СиОН
образует желтые кристаллы с плотностью 3,4 г/см3, не растворим
в воде, дегидратируется при 360°. Гидрат окиси меди Си (Oil) 2
окрашен в цвета от синего до желтого, имеет плотность 3,4 г/см\
при нагревании обезвоживается с образованием окиси меди. В хо-
лодной воде плохо растворим, в горячей воде разлагается. Произ-
ведение растворимости гидратированной окиси меди, соответст-
вующее равновесию
СиО • пН2О + Н2О Си2+ + 2ОН“ + пН2О
при 25—28° равно 4 1,5 • 1О~20; по другим данным 5 ПРси <он>2 “
=4,8-Ю"20, ПРси (он)!-н2о = 2,0 • 10~19. Гидратокиси меди раство-
ряется в водных растворах аммиака с образованием темно-синего
комплекса [Си(ЫНз) J(OH)2 5. Аналогичные комплексы образуют
и соли меди. Гидроокись меди растворяется также в водных рас-
творах NaOH. С солями меди неорганических и сильных органиче-
ских кислот гидроокись меди образует зелено-желтые основные
соли типа CuSO4-3Cu(OH)2e или CuSO4- 2Cu(OH)27.
€62
Гл. XVII. Соединения меди
Карбонат одновалентной меди С112СО3 имеет желтый цвет и
плотность 4,4 г/см3. Карбонат двухвалентной меди СиСОз не вы-
делен в свободном состоянии, но существует в виде основных солей.
Основной карбонат меди—азурит (медная лазурь) 2CuCO3-Cu(OH)2
образует моноклинные кристаллы синего цвета с плотностью
3,88 г/см3-, разлагается при нагревании до 220°. Основной карбонат
меди — малахит CuCO3-Си(ОН)2 образует моноклинные кристал-
лы темно-зеленого цвета, свежеосажденный окрашен в голубой
цвет; плотность 4,0 г/см3. Эти основные соли не растворимы в хо-
Рис. 185. Давление водяного
пара над кристаллогидратами
сульфата меди:
лодной воде (растворимость малахита
0,0008%, азурита 0,006%), а в горячей
воде разлагаются.
Хлорид одновалентной меди Си2С12
выделяется в виде кубических кри-
сталлов белого цвета с плотностью
3,53 г/см3, плавится при 422°, кипит
при 1366°; при 0° в 100 г воды раство-
ряется 0,0062 г Си2С12. Растворим в
соляной кислоте и аммиаке с образо-
ванием Н[СиС1]2 и [Cu(NH3)2]C1.
Хлорид двухвалентной меди
СиС12 — коричнево-желтый порошок с
плотностью 3,05 г/см3, плавится при
498°, при 993° разлагается с образова-
нием Си2С12. Из водных растворов
выделяются: ниже 15° СиС12 • 4Н2О, ни-
1-CuSO4 5Н2О
cuso4 • зн2о + гн2О;
2 — CuSO-4 • ЗН2О
ч-* CuSO4 Н2О + 2Н?О;
3-C11SO4 • 5Н2о
CuSO4 • Н2о + 4Н2О.
же 26° СиС12 • ЗН2О, ниже 42° СиС12 •
• 2Н2О (ромбические кристаллы сине-
го цвета) и до 117° СиС12 • Н2О. Насы-
щенный водный раствор содержит
при 0° 40,7%, при 101,8° 52,8%
СиС12.
Основной хлорид меди СиС1г • 2СиО • 4Н2О сине-зеленого цвета
не растворим в воде; при нагревании до 140° отщепляет ЗН2О. Из-
вестны и другие основные хлориды меди: ЗСиО • СиС12 • Н2О,
ЗСиО • СиС12 • 4Н2О (минерал атакомит), ЗСиО • СиС12- 5Н2О,
4СиО • СиС12 • 6Н2О, 4СиО • СиС12 • 8Н2О и др.8’9.
В концентрированных водных растворах СиС12 образуется ком-
плексное соединение [CuClJCu, которое не диссоциирует на ионы
и обусловливает зеленую окраску растворов. При их разбавлении
происходит разложение:
[CuCl4]Cu 2Си2++4СГ
С повышением температуры равновесие этой реакции сдвигается
влево10. Ионы Си+ и Сц2+ образуют комплексы и с другими хлори-
Физико-химические свойства
663
дами, например кальция, ртути, цинка — СиС12 • СаС12, CuCl2 •
.HgCl2, CuCh-ZnCb11-12.
Пятиводный кристаллогидрат сульфата меди CuSO4-5H2O
(хальконтит), называемый медным (синим) купоросом, образует
асимметричные ярко-синие кристаллы триклиноэдрической системы
с плотностью 2,29 г/см\ При нагревании он плавится при 110° с
потерей части кристаллизационной воды и переходит в трехводный
(голубого цвета) и одноводный (белого цвета) сульфат меди. Выше
258° образуется безводный
сульфат меди белого цвета,
сильно гигроскопичный. При
819—860° CuSO4 разлагается
по реакции
2CuSO4 = SO3 + CuO • CuSO4
а при 897—934° полностью дис-
социирует на CuO и SO313-15.
Давление водяного пара над
кристаллогидратами сульфата
меди показано на рис. 185.
При обычной температуре кри-
сталлы медного купороса на
воздухе не выветриваются 16.
Насыщенный водный рас-
твор медного купороса содер-
жит при 0°— 12,9%, при 20° —
17,4%, при 55° — 26,9%, при
100° — 42,4% CuSO4. Безвари-
антное равновесие CuSO4*
• 5Н2О + CuSO4 • ЗН2О + рас-
твор + пар существует при 96°
.и 540 мм рт. ст. Раствори-
мость медного купороса в при-
Рнс. 186. Изотермы растворимости мед-
ного купороса в присутствии свободной'
серной кислоты.
сутствии свободной серной КИС-
ЛОТЫ понижается (рис. 186); в растворе образуется 17-19 комплекс-
ный ион [Си (SO4)2]2-. При повышенных температурах из кислых
растворов кристаллизуется CuSO4 • ЗН2О (в области, лежащей
правее и выше пунктирной линии).
В системе CuSO4 — FeSO4 — H2SO4 — Н2О в интервале 27—95°
и диапазоне концентраций H2SO4 от 7 до 37 г/л и FeSO4 от 10 до
300 г/л твердые фазы представляют собой три типа твердых рас-
творов (Си, Fe)SO4• 5Н2О с содержанием FeSO4 (в вес. %): 0—2,6,
2,7—4,7 и 8,5—9,2. С повышением температуры растворимость твер-
дого раствора уменьшается, а содержание FeSO4 в нем возрастает.
В растворах с увеличенной кислотностью повышается содержание
FeSO4 в кристаллах, но понижается их растворимость20.
664
Гл. XV 11. Соединения меди
ПРИМЕНЕНИЕ
Из соединений меди в наибольших количествах применяется
медный купорос. Его используют в гальванических элементах в
качестве электролита, в гальванотехнике, для консервирования де-
рева, для изготовления некоторых минеральных красок, в произ-
водстве искусственного волокна и при обогащении руд.
Растворимые соединения меди ядовиты. Этим обусловлено ши-
рокое использование в сельском хозяйстве препаратов, содержа-
щих медь21. Преимущественное применение находят сульфат меди,
основной сульфат меди, хлорокись меди, основные карбонаты меди,
закись и окись меди. Препараты меди, предназначенные для опры-
скивания, содержат 16—55%, а иногда до 80% Си. За границей
выпускают также медные препараты с повышенной фунгицидной
активностью в форме высокодисперсных веществ под общим на-
званием «коллоидная медь». Например, препарат «Duphar Colloi-
dal Copper» представляет собой пасту, состоящую из коллоидной
хлорокиси меди (с размерами частиц 0,01 мк) и поверхностно-ак-
тивного вещества. По рекламным данным, этот препарат, содержа-
щий 27% Си, дает экономию меди по сравнению с сульфатом меди
в 4 раза, по сравнению с хлорокисью меди — в 3 раза и по срав-
нению с закисью меди — почти в 2 раза. Выпускают также мине-
рально-масляную эмульсию — пасту, с 40% меди в виде одной из
солей. Соединения меди входят также в комбинированные фунги-
циды, содержащие коллоидную или молотую серу (5—25% Си и
40—50% S). Соединения меди добавляют к органическим фунги-
цидам, заменителям медных, для усиления их эффективности и
придания универсальности действия 22.23. Закись меди используют
как компонент красок для подводной части морских судов с целью
защиты от обрастания водорослями.
Среди неорганических веществ медный купорос является одним
из наиболее эффективных препаратов для борьбы с болезнями
плодовых деревьев, виноградников и других растений, и из всех
медных препаратов применяется в СССР в наибольших количе-
ствах. Чаще всего его используют в смеси с известью или другими
наполнителями. Смесь водного раствора медного купороса с из-
вестью (1 кг CuSO4- 5Н2О и 0,75 кг свежегашеной извести на 100 л
воды) известна под названием бордосской жидкости, представляю-
щей собой водную суспензию основного сульфата меди ЗСи(.ОН)2«
• CuSO4 и CaSO4. Основная соль полностью разрушается в щелоч-
ной среде. Для образования суспензии стойкой основной соли мо-
лярное отношение СиО : СаО должно быть равным 1 : 0,75, а ве-
совое отношение 1:0,53, или весовое отношение СиО:Са(ОН)2,
равным 1 :0,7. В связи с частичной карбонизацией извести при
хранении и перевозках, при изготовлении бордосской жидкости
принимают весовое отношение медного купороса к извести 1 :0,-7$.
Применение
665
При смешении раствора медного купороса с раствором соды
получается бургундская жидкость — суспензия основного карбо-
ната меди ЗСи(ОН)2• 2СиСОз. Преимуществом ее перед бордос-
ской жидкостью является хорошая прилипаемость и отсутствие
комков, забивающих распылительные устройства. Медный купорос
применяют для изготовления парижской зелени (см. гл. XXXVI).
Описано 24’25 применение медного купороса для борьбы с чрез-
мерным развитием водной растительности в водохранилищах, при-
дающей воде запах и привкус.
Требования к качеству медного купороса представлены в табл. 44»
Состав медного купороса (в %)
ТАБЛИЦА 44
По гост 5.1688-72 (со знаком качества) Марка А Марка Б
сорт I О. О о сорт III ,
1 сушеный не суше- ный сушеный 6 а ° « о 3 к и
CuSOi’SHjO, не менее 99,0 95,0 98 94 94 92 96
в пересчете на Си, не менее . 25,19 24,17 24,9 23,9 23,9 23,4
Железо (Fe), не более 0,035 0,03 0,06 0.03 0,1 0,3 0,02
Свободная H2SO4, не более . . Не растворимый в воде остаток, 0,25 0,25 0,25 0,25 0,25 0,25 0,25
не более 0,05 0,04 0,1 0,05 0,1 0,4 0,05
Мышьяк (As), не более .... 0,005 0,001 0,015 0,015 0,015 0,03 0,015
Медный купорос I и II сортов марки А предназначается для
сельского хозяйства, III сорта — для обогатительных предприятий,
марки Б — для предприятий искусственного волокна. Тарой для
медного купороса служат деревянные бочки, фанерные барабаны
или ящики с бумажными или полиэтиленовыми вкладышами, а-
также двойные полиэтиленовые и джутовые мешки и четырехслой-
^ные бумажные мешки.
Все большее значение приобретает хлорокись меди, которая со-
держит 55—56% Си и имеет ряд преимуществ по сравнению с мед-
ным купоросом. Расход меди при применении хлорокиси на 30%
меньше, чем при употреблении медного купороса и при этом нет
надобности в расходовании извести, необходимой для изготовления
из медного купороса бордосской жидкости. Помимо этого хлор-
окись меди и препараты на ее основе оказывают меньшее ожигаю-
щее действие на растения26.
Согласно ГОСТ 13200—67, 90%-ный смачивающийся порошок:
хлорокиси меди, представляющий собой смесь хлорокиси меди,,
концентрата сульфитно-спиртовой барды и декстрина, применяю-
«66
Гл. XVI1. Соединения меди
щийся в виде водных суспензий в качестве фунгицида, должен со-
держать 51 ± 2% Си и не более 0,8% С1_ и 2% влаги.
Медь является одним из микроэлементов, необходимых для
жизни всех растений и животных. В качестве медных микроудоб-
рений могут быть использованы низкопроцентные руды, содержа-
щие медь, а также пиритные огарки27.
СЫРЬЕ И СПОСОБЫ ПРОИЗВОДСТВА МЕДНОГО КУПОРОСА
Основным сырьем для получения медного купороса служат сер-
ная кислота и медь: медный лом или отходы металлообрабатываю-
щей промышленности — стружка, опилки и т. п., а также отходы
или полупродукты металлургии меди — белый матт и окись меди,
ватержакетная пыль, шлаковые отходы, электролитные растворы
медеэлектролитных заводов, цементная медь, извлекаемая из руд-
ничных вод и из колчеданных огарков и др.
Важным видом сырья для получения солей меди является ва-
тержакетная пыль, представляющая собой тонкий порошок и со-
держащая 0,5—5% Си в форме сульфида и сульфата, 40—50% Fe,
3—5% А120з, 3—6% Zn, до 15% S, 7—10% SiO2 и др. Перспектив-
ным видом сырья являются шлаковые отходы медеплавильных за-
водов, накапливаемые в течение многих лет в виде отбросов. Медь
в этих отходах содержится в окисной, сульфидной и силикатной
формах, а также в форме металла и ферритов. Примерный состав
шлаковых отходов следующий: 2—7% Си, 5—7% Fe2O3, 15—25%
А12О3, 45—50% SiO2, 1—5% СаО, 5—10% MgO, 1—3% S и 1—2%
прочих примесей.
Некоторый интерес в качестве сырья для производства медного
купороса представляют рудничные воды, образующиеся при вы-
щелачивании отвалов атмосферными осадками и содержащие до
•0,7 г/л меди 28’29.
Большим резервом сырья для производства солей меди яв-
ляются накапливаемые массы огарков от обжига колчедана на сер-
нокислотных заводах. В старых огарках от сжигания рядового кол-
чедана содержится до 1,5% меди в виде CuSO4, СиБОз, СиО, Cu2S,
CuS, CuFeS2. Необходимость извлечения соединений меди из огар-
ков диктуется условиями их использования металлургической
промышленностью в качестве заменителя железной руды.
Указанные виды сырья в основном перерабатывают в медный
купорос, который, помимо непосредственного употребления, служит
также исходным материалом для получения всех других солей
меди.
Способы производства медного купороса различают главным
-образом по видам применяемого сырья:
1) из медного лома и отходов меди (стружки, высечки, прово-
локи, опилок и т. п.) с окислением меди кислородом воздуха,’элек-
тролизом или раствором хлорной меди;
Производство медного купороса из медного лома 667
2) из окиси меди, получаемой из белого матта;
3) из окиси меди и сернистого газа;
4) из окисленных медных руд, содержащих незначительное ко*
личество меди, переработка которых на металлическую медь плав-
кой в печах является неэкономичной;
. 5) из колчеданных огарков и других отходов;
6) из отбросных электролитных растворов медеэлектролитных,
заводов.
За рубежом основными производителями медного купороса яв-
ляются Франция и Италия, где в качестве сырья используют глав-
ным образом медный лом и окисленные руды. В отличие от этого*
в США используют в основном электролитные щелоки, из которых
производят больше половины в&ех солей и препаратов меди.
ПРОИЗВОДСТВО МЕДНОГО КУПОРОСА ИЗ МЕДНОГО ЛОМА
Теоретические основы процесса
В отсутствие окислителей, в частности кислорода воздуха, в.
разбавленной серной кислоте медь практически не растворяется.
Она с достаточной скоростью растворяется в горячей концентриро-
ванной серной кислоте, но осуществлять этот процесс нерациональ-
но, так как при этом половина затрачиваемой кислоты восстанав-
ливается до SO2, окисляя медь в окись меди, которая и раство-
ряется в серной кислоте, образуя медный купорос. Схема этого--
процесса может быть выражена следующими уравнениями реак-
ций:
Си + H2SO4 = СиО 4- Н2О + SO2
СиО + H2SO4 = CUSO4 + Н2О
Си + 2H2SO4 — CUSO4 + 2Н2О + SO2
С целью экономии серной кислоты окисление меди производяг
кислородом воздуха одновременно с процессом «натравки», т. е.
растворения в серной кислоте. Медный лом предварительно пере-
плавляют для рафинирования (очистки от примесей Fe, Zn, Al, Pb-
и др.) и придания ему формы, удобной для растворения — пусто-
телых гранул, обладающих большой поверхностью, что ускоряет
растворение в кислоте в 5—10 раз.
Очистка и грануляция медного лома
Чистая медь плавится при 1084°, а в присутствии примесей —
при более низкой температуре. Примеси летучих металлов и окис-
лов — металлический цинк, трехокиси мышьяка и сурьмы — уда-
ляются при нагревании меди до ее расплавления. При расплавле-
нии медь окисляется до закиси меди, устойчивой выше 1100°. За-
кись меди накапливается на поверхности расплавленной меди-
668
Гл. XVII. Соединение меди
в твердом (до 1200°) и в жидком (выше 1235°) виде и частично
растворяется в меди, а затем вступает во взаимодействие с приме-
сями, например:
Cu2O + Fe = FeO + 2Cu
По мере расходования растворенной закиси меди новые ее ко-
личества переходят с поверхности в раствор, и медь подвергается
дальнейшему окислению.
Образующиеся окислы железа, магния, кальция и других ме-
таллов не растворимы в меди и переходят в шлак, всплывающий
на поверхность металла. Вследствие взаимодействия закиси меди
-в некоторыми окислами (например, с окисью железа с образова-
нием феррита меди) часть ее также переходит в шлак и содержа-
ние в нем Си2О достигает 30—40%.
После окисления, ошлакования примесей металлов и удаления
шлака температуру в печи немного снижают с целью окисления
присутствующей в меди полусернистой меди:
Cu2S + 2Си2О 6Cu + SO2
Эта реакция протекает бурно, и выделяющаяся двуокись серы
увлекает брызги меди с образованием «медного дождя» («кипение»
массы).
6 производстве медного купороса дальнейшая очистка меди не
требуется, а присутствие в ней кислорода и двуокиси серы необхо-
димо для получения пористых и пузыристых гранул. Растворимость
газов в расплавленной меди возрастает с повышением темпера-
туры. В твердой меди, нагретой даже до температуры плавления,
растворимость газов незначительная. Процесс гранулирования
с получением пузыристой и пористой меди основан на быстром вы-
делении газов при внезапном охлаждении и затвердевании рас-
плавленной меди. Это осуществляется выливанием ее тонкой стру-
ей в холодную воду.
Серы, содержащейся в меди, обычно недостаточно для образо-
вания полых гранул. Поэтому в период «кипения» расплава в него
Добавляют некоторое количество полусернистой меди или комовой
серы (1 —1,5%). Образующаяся при этом двуокись серы раство-
ряется в меди, а при ее грануляции выделяется и раздувает капли
меди в пустотелые шарики с тонкими стенками.
Растворение меди в серной кислоте (натравка)
При взаимодействии гранул меди с разбавленным раствором
серной кислоты, содержащим также сульфат меди, в присутствии
воздуха, кислород воздуха растворяется в кислоте, диффундирует
к поверхности меди и окисляет ее до закиси меди:
4Cu + О2 e 2Си2О
Производство медного купороса из медного лома
669
Закись меди растворяется в серной кислоте:
С112О 4" H2SO4 s C112SO4 + Н2О
Образующийся сульфат закиси меди легко окисляется в суль-
фат окиси меди:
2C112SO4 + 2H2SO4 + О2 “ 4CUSO4 + 2Н2О
Общая скорость процесса лимитируется наиболее медленной
его стадией — окислением меди до закиси меди. Это объясняется
малой растворимостью кислорода и медленной его диффузией
к поверхности гранул меди. Процесс значительно ускоряется, когда
в растворе уже присутствует медный купорос. .В результате депо-
ляризации
Cu + Cu2+ = 2Cu+
C11SO4 восстанавливается медью до C112SO4, а затем C112SO4 вновь
окисляется растворенным кислородом до CuSO4. Таким образом,
медный купорос играет роль переносчика кислорода.
В присутствии металлической меди в растворе медного купороса
эдожет находиться лишь ничтожное количество одновалентной меди.
Константа равновесия реакции Cu2+ + Cu з=е 2Си+ при 25° К=[Си+]2:
[Cu2+]=0,62-10-6. В растворе, содержащем 50 г/л H2SO4 и 32 е/л
Си в виде CuSO4, имеется только ~0,022 г/л одновалентной меди,
т. е. меньше 0,1% от общего ее количества 30-32.
Повышение температуры, как и в других случаях, ускоряет
химические реакции, но вызывает уменьшение растворимости кис-
лорода, что замедляет окисление. Поэтому в натравочной башне
поддерживают температуру не выше 80—85°. При этом на окисле-
ние меди используется приблизительно ’/л кислорода, поступающего
в башню с воздухом, расход которого составляет около 1000 нма
на 1 т медного купороса.
Растворимость кислорода уменьшается с ростом концентрации
CuSO4 в растворе. Поэтому при повышении концентрации CUSO4
скорость растворения меди сначала увеличивается за счет катали-
тического действия CuSO4, а затем уменьшается вследствие недо-
статка кислорода. Максимум скорости растворения наблюдается
при концентрации 120 г/л CuSO4 (для раствора, содержащего
~ НО г/л H2SO4) 33>34. Но даже при содержании в растворе 300 г/л
CuSO4 скорость растворения меди в 1,6 раза больше, чем в отсут-
ствие медного купороса34. С увеличением концентрации серной кис-
лоты растворимость кислорода в ней уменьшается, но усиливаются
ее окислительные свойства. Поэтому повышение кислотности
раствора вызывает не очень большое уменьшение скорости рас-
творения меди — всего на 10% при повышении концентрации
H2SO4 е 2,5 до 20% 33. Растворение меди значительно ускоряется
670
Гл. XVI1. Соединения меди
в присутствии в растворе ионов железа вследствие деполяризации |
4Fe2+ + О2 + 4Н+ = 4Fe3+ + 2Н2О
2Cu + 4Fe3+ = 2Cu2+ + 4Fe2+ -j
Ионы Fe2+ вновь окисляются в Fe3+ и служат, таким образом, I
катализатором процесса. Доля растворяющейся меди под дей- 1
ствием ионов Fe3+ в растворе, содержащем ~110 г/л H2SO4, 60 г/л |
CuSO4 и 20—22 г/л FeSO4, составляет около 60% от всего количе- 1
ства меди, перешедшей в раствор34. 1
Ионы железа попадают в циркулирующий при растворении меди 1
раствор с серной кислотой и вследствие растворения оставшихся 1
в меди примесей. Содержание сульфатов железа в растворе непре- I
рывно возрастает и достигает иногда 70 г/л и более. Вследствие 1
этого при кристаллизации медного купороса выделяется также и |
сульфат железа, загрязняющий продукт (см. ниже). Поэтому, ко- |
гда концентрация железа в растворе становится столь большой, 1
что создается опасность получения нестандартного по содержанию |
железа медного купороса, раствор полностью выводят из обра- |
щения. I
Существенным является обеспечение равномерного орошения |
(смачивания) гранул меди раствором. В местах, плохо орошаемых |
кислотой, образовавшаяся окисная пленка растворяется непол- I
ностью, появляется основной сульфат меди CuSO4 • 2Cu (ОН)2, ко- |
торый вследствие малой своей растворимости кристаллизуется из |
раствора и цементирует при этом гранулы и шлам. I
Технология процесса 1
Производство медного купороса из медного лома делится на три
стадии: 1) получение гранулированной меди; 2) получение рас-
твора сульфата меди; 3) кристаллизация и сушка медного купо-
роса.
Получение гранулированной меди
Медный лом («тяжелую» медь) плавят в медеплавильной печи.
Проволоку, стружку, высечку и т. п. («легкую» медь) перед пода-
чей в печь брикетируют 33. Плавку лома ведут обычно в пламен-
ных печах из огнеупорного шамотного кирпича, отапливаемых ма-
зутом 35.
Плавка меди в печи продолжается, в зависимости от количе-
ства примесей, 4,5—6 ч. После удаления шлака в «кипящую» медь
забрасывают серу, затем ее выпускают тонкой струей в воду, на-
ходящуюся в гранулировочном бассейне. Он представляет собой
бетонированную яму высотой 1,6 м и диаметром 2,5 м. В бассейн
помещают стальную корзину с дырчатыми стенками высотой 1 н
и диаметром 1,6 м; в последней собираются гранулы. При подъеме
Производство медного купороса из медного лома
671
корзины с гранулированной медью вода стекает через отверстия
в стенках корзины. Образующиеся гранулы имеют диаметр
5—15 мм. Вес 1 л гранул не должен превышать 2 кг. 1 кг таких
гранул имеет поверхность до 1500 см2.
«Натравка» и получение медного купороса
Гранулированную медь загружают в натравочную башню
(рис. 187), высота которой около 6 м, диаметр 2,5 м. Башня изго-
товлена из листовой стали, внутри футерована кислотоупорным
кирпичом и диабазовыми плитками. На высоте 0,5—0,9 м от дна
в башне имеется ложное днище, лежащее на колосниковой решетке
Рис. 187. Схема производства медного купороса из гранулированной меди:
1 и J2 —ковшевые элеваторы; 2 — иатравочная башня; 3 —бак с постоянным уровнем;
4 — сборник маточного раствора; 5 —расходный бак для серной кислоты; 6 и 7 —центро-
бежные насосы; 8 — вращающийся кристаллизатор; Р и 14 — вентиляторы; IP— сборник
с мешалкой; Л — центрифуга; 13 — сушилка; 15 — нагреватель воздуха; 16 — разгрузоч-
ный бункер.
из стальных балок, опаянных свинцом. На ложном днище нахо-
дится слой меди, высоту которого поддерживают периодическими
загрузками на уровне 0,25 м от крышки башни. Под крышкой по-
мещена турбинка, с помощью которой медь непрерывно орошается
смесью серной кислоты с маточным раствором. Количество нахо-
дящейся в башне меди составляет 22—28 т.
В башне происходит одновременно окисление и растворение
меди. Эти процессы идут с выделением тепла, достаточным для
повышения температуры до необходимого уровня, т. е. до 70—85°.
Для окисления меди в башню под колосниковую решетку вдувают
воздух в смеси с паром. Пар подают для нагревания воздуха. Вду-
вание холодного воздуха вызвало бы охлаждение щелока и выде-
ление из него кристаллов медного купороса, что привело бы к за-
кристаллизовыванию нижнего слоя гранулированной меди. Пода-
чей пара регулируют и температуру в башне. Уходящая из нее
паро-воздушная смесь выбрасывается в атмосферу.- С 1 м3
672
Гл. XVII. Соединения меди
натравочной башни можно получить в сутки более 1,3 т медного
купороса.
Орошающий щелок имеет 55—60° и содержит 20—30%
CuSO4-5H;O и 12—19% свободной H2SO4. Оптимальная плотность
орошения натравочной башни, равная 1,5—2,1 м3/(м2-ч), обеспечи-
вает образование на поверхности медных гранул очень тонкой
жидкостной пленки, через которую кислород диффундирует к меди
с достаточной скоростью. При большей плотности орошения
[4—5л3(л12-ч)] происходит снижение производительности башни
вследствие замедления диффузии кислорода через толстые жидко-
стные слои. При этом снижение производительности башни про-
исходит после кратковременного ее возрастания, башня как бы
«вымывается».
Жидкость подают в башню при переменном режиме, создавае-
мом или периодическим изменением вращения разбрызгивателя
в обратном направлении или периодическим выключением и вклю-
чением орошения через каждые 10—15 мин (при непрерывной по-
даче горячего воздуха). Это приводит к возникновению по всему
объему башни миграционных участков окисления и растворения,
в результате чего растворение меди идет в 1,5—2 раза быстрее,
чем при постоянном орошении башни 36’37.
Вытекающий из натравочной башни горячий щелок (74—76°)
представляет собой почти насыщенный раствор медного купороса —
он содержит 42—49% CuSO4-5H2O и 4—6% свободной H2SO4.
Этот щелок подают центробежным насосом из хромоникелевой
стали во вращающийся кристаллизатор непрерывного действия
с воздушным охлаждением раствора. Смесь кристаллов медного ку-
пороса с маточным раствором через сборник с мешалкой поступает
в центрифугу из нержавеющей стали, где кристаллы, отжатые о г
маточного раствора, промываются водой. На центрифугирование
поступает пульпа с соотношением Т: Ж от 1 : 2 до 1 : 1,5. Отфуго-
ванный продукт, содержащий 4—6 %влаги и 0,15—0,2% кислоты38,
высушивают в барабанной сушилке воздухом при 90—100°. Маточ-
ный раствор и промывную воду после смешения с серной кислотой,
возвращают в производственный цикл.
В маточном растворе происходит постепенное накопление при-
месей, все больше загрязняющих продукт. Содержащийся в мед-
ном купоросе сульфат никеля можно удалить с достаточной пол-
нотой при однократной перекристаллизации. Для удаления FeSO4
необходима многократная перекристаллизация. Получение медного
купороса с содержанием 99,9% CuSO4 • 5Н2О однократной пере-
кристаллизацией из раствора, насыщенного при 70°, возможно при
содержании в нем не более 0,3% NiSO4 и не более 0,15% FeSO439.
Если в растворе больше 40 г/л FeSO4, то количество железа в
продукте больше 0,4%, т. е. выше нормы, допускаемой ГОСТ для
продукта III сорта (рис. 188). Из растворов, содержащих больше
Производство медного купороса из медного лома
673
100—120 г/ FeSO4, выделяются смешанные кристаллы железного
и медного купоросов с характерной сине-зеленой окраской40.
Содержание железа в кристаллах медного купороса можно
уменьшить предварительным окислением Fe2+ в Fe3+. Окислителем
может служить воздух (длительный барботаж), азотная кислота,
перекись водорода и др. Степень очистки повышается в 2—4 раза
при добавке к раствору незначительного количества HF (плавико-
вой кислоты), что приводит к образованию фторидных комплексов
Рнс. 188. Зависимость между содержанием FeSOi в рас-
творе медного купороса и содержанием Fe в кристаллах
CuSO4-5H2O при разных концентрациях раствора.
Содержание CUSO4•5Н2О в растворе (в г/л): 1—400; 2-500:3 — 550;
4-600.
Fe3+ 4*. Установлено также, что при усилении перемешивания в
процессе кристаллизации получаются кристаллы с меньшим со*
держанием железа, но и размеры их уменьшаются. Присутствие
ионов никеля также уменьшает размеры кристаллов, а мышьяка—<
'увеличивает42.
На производство 1 т кристаллического медного купороса рас-
ходуют: 0,27—0,29 т металлической меди и 0,39—0,40 т серной кис-
лоты (100%).
На заводе имени Войкова общие затраты тепла на производство
медного купороса составляли43 0,76 мгкал на 1 т продукта. Расход
тепла распределяется следующим образом. В натравочную башню
через инжекторы вводится 47% тепла, на подогрев воздуха в
калориферах сушильного агрегата затрачивается 26% тепла и
27% тепла расходуется на подогрев раствора в сборниках, на
разогрев мазута в цистернах и т. д. Как видно из теплового ба-
ланса натравочной башни (табл. 45), для обеспечения необходи-
мого ее температурного режима подвода тепла извне в йиде
пара не требуется. Количество тепла, выводимого с паро-воздушцой
22 М. Е. Позии
674
Гл. XVII. Соединения меди
смесью, больше тепла, вводимого с паром вследствие дополнитель-
ного парообразования, обусловленного выделением тепла реакций.
Поэтому вместо паро-воздушной смеси можно вдувать в башню
теплый воздух из кристаллизатора с добавкой 20—25% пара от
обычного количества, при температуре смеси, исключающей за-
кристаллизовывание нижнего слоя гранул в башне.
ГАВ ЛИЦА 45
Тепловой баланс натравочной башни
(на 1 т 100%-ного CuSO4-5H2O)
Приход тепла, тыс. ккал расход тепла, тыс. ккал .
От химических реакций 304 С орошающим раствором .... 134 G паро-воздушной смесью . . . 362 Всего . . 800 С паро-воздушной смесью . . , 810 С раствором . 27э На нагрев загружаемых гра- нул и содержащейся в них воды 3,2 В окружающую среду ..... 11,8 Всего . . 800
Ввод пара в натравочную башню может быть и вовсе исключен
при осуществлении процесса с рециркуляцией паро-воздушной
смеси. Отходящую из башни паро-воздушную смесь с температурой
~80° направляют при помощи вентилятора из нержавеющей стали
под ложное дно башни. Необходимое для реакций окисления коли-
чество воздуха подсасывается через штуцер в нижней части башни.
Избыток паро-воздушной смеси отводят через специальную трубу
из верхней части башни. При осуществлении процесса по такой
схеме возможно введение в цикл газообразного кислорода, что
значительно интенсифицирует растворение меди.
Отходом производства медного купороса являются илы, скап-
ливающиеся в резервуарах с производственными растворами. Ко-
личество илов составляет 1—2% от перерабатываемой меди. Со-
став их различен; они могут содержать до 8,5% Ag2O, до 5% Bi20s,
0,05—0,1% Au, Pt, Pd. Такие илы могут быть переработаны гид-
рометаллургическими методами для извлечения из них ценных
металлов44.
Предложено получать медный купорос из натравочного шелока
добавкой к нему серной кислоты (башенной, купоросного масла,
олеума или SO3) до содержания свободной H2SO4 60% й более.
При этом быстро осаждается мелкокристаллический белый безвод-
ный сульфат меди, примеси же остаются в растворе. CuSO4 отфу-
говывают и растворяют в чистом маточном растворе медного купо-
роса, из которого кристаллизуется CuSO4 • 5Н2О. Кислый щелок
после осаждения безводного CuSO4 возвращается на растворение
меди. После накопления в нем значительного количества ценных
Получение медного купороса электролизом 675'
примесей (никель, цинк, серебро и пр.) их можно извлечь. Преиму-
щество этого способа — в простой и быстрой кристаллизации мед-
ного купороса без затраты тепла и холода и высокой чистоте про-
дукта 45.
Можно вообще отказаться от выпуска пятиводного сульфата
меди и выпускать безводный продукт, концентрация меди в кото-
ром больше (39,8% вместо 25,5% в CuSO4-5H2O). Производство
и транспорт его будут дешевле, хотя он и потребует более тща-
тельной упаковки из-за гигроскопичности. Впрочем, даже при не-
брежной упаковке на поверхности белого порошка появится лишь
синеватая окраска вследствие гидратации влагой воздуха, но это
не ухудшит качества продукта, который предназначен для раство-
рения в воде. Однако во избежание слеживания упаковка должна
быть герметичной.
ОчИсткя сточных вод, сбрасываемых в водоемы из производств
медного купороса и других медных солей, от ионов меди может
быть осуществлена на 70—90% с помощью сульфата алюминия.
Выделяющаяся при гидролизе сульфата алюминия гидроокись алю-
миния адсорбирует ионы меди 46.
ПОЛУЧЕНИЕ МЕДНОГО КУПОРОСА ЭЛЕКТРОЛИЗОМ
Может представить интерес электрохимическое окисление меди
с растворением ее в серной кислоте. При проведении электролиза
с растворимым медным анодом в растворе любой соли щелочного
металла получающаяся на аноде медная соль, реагируя с образую-
щейся на катоде щелочью, дает гидроокись меди с одновременной
регенерацией электролита.
Можно получить электролизом и непосредственно раствор мед-
ного купороса, осуществляя процесс в ванне, в которой анод, нахо-'
дящийся на дне ванны, состоит из спрессованных или сплавленных
обрезков меди. Через полый катод, помещенный сверху, подается
серная кислота. Движением раствора от катода к аноду не до-
пускается нежелательное в данном случае осаждение меди на'
^атоде.
При проведении электролиза с растворимым медным анодом
в Растворе сульфата натрия в ванне с диафрагмой можно одновре-
менно получать медный купорос и едкий натр. Особый интерес это
может представить при применении ртутного катода с получением
из образовавшейся амальгамы натрия концентрированной щелочи.
Анодная жидкость, кроме медного купороса, будет содержать суль-
фат натрия, однако медный купорос и сульфат натрия могут быть
легко отделены друг от друга (как известно, трудность разделения
серной кислоты и сульфата натрия является одним из сложных
вопросов в проблеме электролиза сульфата натрия). Таким обра-
зом, этот способ позволяет получать щелочь и медный купорос без
затраты кислоты.
22*
676
Гл. XVII. Соединения меди
ПОЛУЧЕНИЕ МЕДНОГО КУПОРОСА ПРИ ОКИСЛЕНИИ МЕДИ
ХЛОРНОЙ МЕДЬЮ
Этот метод основан на образовании хлористой меди из хлорной
и металлической меди:
Си + CuCl, = 2СиС1
(Хлористую медь получают также хлорированием цементной меди
в растворе поваренной соли.) Хлористую медь окисляют воздухом
с образованием оксихлорида меди:
6CuCl + l,5Ot + 3HtO = 3[Cu(OH)2 • CuCl2]
Оксихлорид растворяют в серной кислоте, в результате чего
образуется раствор сульфата меди и регенерируется хлорная медь:
3[Си(ОН)2 • CuC 12] + 3H2SO4 = 3CuSO4 + ЗСиС12 + 6Н2О
Получение оксихлорида меди осуществляют в бетонном баке,
куда загружают медь и заливают раствор хлорной меди. После
этого продувают массу воздухом, пока вся металлическая медь не
перейдет в нерастворимый оксихлорид. После отстаивания и декан-
тации пульпу растворяют при нагревании в серной кислоте. При
охлаждении раствора из него кристаллизуется CuSC>4-5HjO. Ма-
точный раствор возвращают в процесс.
Этим способом можно получать также хлорокись меди
(стр. 690) 47.
ПРОИЗВОДСТВО МЕДНОГО КУПОРОСА ИЗ ОКИСИ МЕДИ
До распространения способа получения медного купороса из
медного лома в натравочных башнях медный лом предварительно
окисляли в печах в окись меди, которую затем перерабатывали в
медный купорос.
В настоящее время медный лом перерабатывают в медный ку-
порос только методом «натравки», а производство медного купо-
роса растворением окиси меди в серной кислоте базируется на
окиси меди, получаемой из полупродуктов и отходов медеплавиль-
ных заводов.
Окись меди из белого матта
• Белый матт образуется при извлечении меди из сульфидных
руд в результате дальнейшей переработки штейна, состоящего из
сульфидов меди и железа и получающегося после первой плавки
сырья с отделением пустой породы. При добавке к штейну кварца
и продувке воздухом сульфид железа окисляется и переходит в
силикат. После удаления шлака остается полусернистая медь,
имеющая в изломе серебристый белый цвет, поэтому ее называют
белым металлом или белым маттом.
Производство медного купороса из окиси меди
677
Белый матт получается в виде плит толщиной 6—8 см. Он со-
держит, кроме Cu2S, до 10% металлической меди и 0,5—3% же-
леза; общее содержание меди 75—78%. Он служит для получения
черновой, а затем рафинированной меди.
Рис. 189. Обжиговая печь (разрез):
/ — неподвижный под; 2 —подвижный под; 3 —гребки; 4-верхний свод.
Для переработки на медный купорос белый матт измельчают и
подвергают обжигу в печах, с целью окисления сульфида в окись
меди. Для обжига используют печи разных конструкций. Разрез
одной из них показан на рис. 189. Печь имеет четыре пода, из ко-
торых два неподвижны, а два, находящиеся между ними, вра-
щаются вокруг предполагаемой вертикальной оси, совпадающей
с осью печи. Все металлические части печи вынесены наружу. Под-
вижные поды 2 опираются на ролики и опоясаны зубчатыми
678
Гл* ХУ11. Соединения меди
кольцами, с помощью которых приводятся во вращение. Поды вы-
ложены в форме пологих сводов из кислотоупорного кирпича. В
каждый свод при кладке печи вставляются гребки 3, расположен-
ные таким образом, что при вращении подвижных подов материал
перемещается по сводам от периферии к центру или в обратном на-
правлении и пересыпается со свода на свод. Разогрев печи про-
изводится топочным или генераторным газом, поступающим под
нижний свод печи. Наиболее распространены печи с диаметром
4,5 м. Производительность печи составляет 6—7 т обожженного
матта в сутки при продолжительности пребывания материала в
печи 10—12 ч. Обжиг белого матта ведут с добавкой 1,75—2%
угля, обеспечивающего снижение температуры воспламенения суль-
фида меди, что ускоряет его окисление. Для предотвращения спе-
кания в . шихту добавляют до 15% измельченного «нагара». (На-
гар — комочки спекшегося, плохо обожженного белого матта, отде-
ляемые при просеивании обожженного матта). Температурный
режим в печи устанавливается за счет тепла, выделяющегося при
горении белого матта и угля. Обычно температуру поддерживают
в следующих пределах: 670—700° на первом поде (сверху), 740—
760° на втором, 650—675° на третьем и 450—475° на четвертом33.
При обжиге белый матт превращается в окись меди по реак-
ции:
Cu2S + 2О2 == 2CuO + SO2
Небольшая доля сернистого газа, в связи с присутствием в бе-
лом матте железа, каталитически окисляется до SO3, который
сульфатизирует окись меди. Поэтому в продукте обжига белого
матта, помимо основного компонента — окиси меди, а также остат-
ков сульфида, содержится некоторое количество CuSO4. С учетом
этого общая реакция окисления белого матта может быть записана
так 48’4S:
2Cu2S + 4,5О2 = 2CuO-I-CuO • C11SO4 + SO2
При недостатке кислорода или при плохом перемешивании мо-
жет образоваться некоторое количество закиси меди:
. 2Cu2S + ЗО2 — 2Си2О 4" 2SO2
Закись меди растворяется в серной кислоте хуже, чем- окись,
поэтому наличие ее в обожженном матте (огарке) нежелательно.
Обожженный продукт содержит 87—90% CuO и 8—10% Cu2S или
70—72% Си и 2—2,5% S. В нем несколько меньше меди, чем
в исходном белом матте, что объясняется загрязнением продукта
нагаром и золой угля. Основная масса серы уходит из обжиговой
печи в виде сернистого газа, содержащего 1,5—2% SO2, 0,5—1%
СО2, 15—17% О2, имеющего температуру 250—300°.
Производство медного купороса из окиси меди
679
Растворение окиси меди в серной кислоте
Продукт обжига белого матта, огарок — окись меди — просеи-
вают для отделения спекшихся комочков—«нагара» и подают в
варочный чан для растворения в серной кислоте (рис. 190 ) 33. От-
сеянный «нагар» после измельчения возвращают в печь, добавляя
его к идущему на обжиг белому матту. Варочный чан изготовляют
из андезитовых плит с внутренней свинцовой футеровкой. Исполь-
зуют также чаны из нержавеющей стали, выложенные кислото-
упорным кирпичом и футерованные внутри листовым свинцом тол-
Серная
„Нагар"па повторное
измельчение
Рис. 190. Схема производства медного купороса из белого матта:
/и 3 — дробилки; 2 —шихта; 4 — элеватор; 5 —обжиговая печь; 6 — сита; 7 —электрический
тельфер; 8 — варочный чан; 9 — напорный бак; /0 — сборник; 11 — промежуточный бак; 12 — насос;
13 — питательный бак; 14 — кристаллизатор; 15 — вентилятор; 16 — сборник пульпы; /7 —сборник
маточных растворов; 18 — центрифуга. > -
щиной 5 мм. Вначале в чан загружают маточный раствор, содер-
жащий 28% сульфата меди, затем серную кислоту до получения
раствора с концентрацией 15—20% H2SO4. Массу подогревают до
кипения острым паром, подаваемым через опущенные в раствор
свинцовые трубы. В кипящий раствор загружают огарок неболь-
шими порциями в течение 30—40 мин при перемешивании массы
острым паром. Растворение ведут до образования раствора, содер-
жащего 43% CuSO4 и 3—4% H2SO4.
/ Окись меди легко растворяется в серной кислоте. Содержа-
щиеся в огарке металлическая медь и неокислившийся белый матт
(Cu2S) практически не растворяются в серной кислоте и образуют
нерастворимый шлам. В шлам частично переходит и плохо раство-
ряющаяся в серной кислоте закись меди. По окончании варки от-
стоявшийся раствор направляют на кристаллизацию. В зависимо-
сти от качества обжига белого матта очистку реакционного чана
от шлама производят или после каждой варки или после 3—4 ва-
рок. В сухом веществе шлама содержится ~50% меди, а также
некоторые количества золота и серебра, зависящие от содержания
их в исходной руде. Этот шлам возвращают для переработки на
медеплавильные заводы. • :
680
Гл. XVII. Соединения меди
Получение медного купороса из окиси меди и сернистого газа
Этот способ производства медного купороса50 является весьма
экономичным. Однако применение его целесообразно главным об-
разом в районах расположения медеплавильных заводов, где
имеется соответствующее сырье — окись меди и отбросный серни-
стый газ.
В связи с этим особый интерес приобретает получение медного
купороса из белого матта. При окислительном обжиге белый матт
превращается в окись меди. Выделяющийся при этом сернистый
газ рационально использовать для превращения полученной окиси
меди в медный купорос. Недостающее количество SO2 может быть
пополнено за счет сернистых газов медеплавильных печей. Таким
образом, белый матт может быть переработан на медный купорос
без затраты серной кислоты и с полным использованием его ком-
понентов — меди и серы.
Способ производства медного купороса из окиси меди и серни-
стого газа основан на взаимодействии при 85—95° суспензии окиси
меди в водном растворе медного купороса со слабым сернистым
газом, содержащим SO2 и кислород. Отбросный сернистый газ, в
случае необходимости, должен разбавляться воздухом. Это уско-
ряет процесс, так как концентрация SO2 в газе не имеет сущест-
венного значения, а увеличение содержания кислорода ускоряет
реакцию.
Образование медного купороса происходит в результате двух
независимо идущих процессов. Первый из них заключается в том,
что сернистый газ в присутствии каталитически действующих ионов
меди окисляется кислородом в серную кислоту:
2SO2 + О2 + 2Н2О = 2H2SO4
Образовавшаяся кислота растворяет окись меди, причем полу-
чается медный купорос:
H2SO4 + CuO = CuSO4 + Н2О
Второй, параллельно идущий процесс заключается в частичном
восстановлении сернистым газом двухвалентной (окисной) меди
в одновалентную (закисную) с образованием плохо растворимой
в воде соли Шевреля51 — комплексной окисно-закисной соли сер-
нистой кислоты Си (Си50з)г • 2Н2О или CuSO3 • Си230з • 2Н2О:
3CuSO4 + 3H2SO3 + ЗН2О = CuSO3 • Cu2SO3 • 2Н2О + 4H2SO4
Эта соль в отсутствие кислорода при кипячении суспензии разла-
гается с выделением закиси меди:
3(CuSO3 • Cu2SO3 • 2Н2О) = CuSO4 + 2Cu2O + 5SO2
Одиако под действием сернистого газа и кислорода в резуль-
тате дальнейшего образования серной кислоты закись меди снова
Производство медного купороса us окиси меди
681
переходит в раствор, н осадок солн Шевреля постепенно исчезает
из суспензии, также превращаясь в медный купорос:
CuSO3 • Cu2SO3 • 2Н2О + SO2 + 2О2 = 3CuSO4 + 2Н2О
Окисление соли Шевреля при действии SO2 и О2 протекает с
образованием вначале основного сульфата меди:
2(CuSO3 • Cu2SO3 • 2Н2О) + ЗО2 = 2Си(ОН)2 • CuSO4 + 3CuSO4 + 2Н2О
Эта реакция идет с большей скоростью, чем образование сер-
ной кислоты под каталитическим влиянием ионов меди. По мере
накопления H2SO4 основной сульфат меди переходит в раствор:
2Си(ОН)2 • CuSO4 + 2H2SO4 = 3CuSO4 + 4H2O
В результате этих процессов из суспензии исчезают все твер-
дые фазы — и СиО и СиЗОз • CU2SO3 • 2Н2О и 2Си(ОН)2 • CuSO4—
и суспензия превращается в раствор медного купороса. Таким об-
разом, в общем процессы сводятся к окислению четырехвалентной
серы (SO2) в шестивалентную и могут быть выражены суммарным
уравнением:
2CuO + 2SO2 + О2 = 2CuSO«
Растворимость соли Шевреля возрастает с повышением темпе-
ратуры и содержания в растворе CuSO4. При 20° растворимость
этой соли в воде равна 0,042%, а при 60° — 0,14%. В 30% рас-
творе CuSO4-5H2O при 20° растворимость повышается до 0,1%,
а при 60° — до 0,379%. Поэтому, будучи суспендирована в рас-
творе медного купороса, комплексная соль окисляется быстрее,
чем в водной суспензии. Следовательно, для приготовления исход-
ной суспензии окиси меди целесообразно брать не воду, а раствор
медного купороса.
Скорость окисления соли Шевреля возрастает с уменьшением
концентрации SO2 в газе. Последнее объясняется, вероятно, тем,
что в газовых смесях с высоким содержанием SO2 количество кис-
лорода недостаточно для окисления. При содержании в газе 1—4%
SO2 и температуре 95° соль Шевреля окисляется полностью за
15—20 мин. Однако длительность процесса увеличивается за счет
времени, необходимого для предварительного растворения окиси
меди н образования соли Шевреля. При 95° и достаточном содер-
жании кислорода в газе (при объемном отношении О2: SO2 > 4)
степень использования меди за 1 ч составляет 94—97%, а за 1,5 ч
больше 99%.
Технологическая схема производства медного купороса этим
способом весьма проста. Окись меди суспендируют в маточном рас-
творе, оставшемся после кристаллизации медного купороса, суспен-
зию нагревают до 85—95° и насыщают отбросным сернистым
682
Гл. XVII. Соединения меди
газом, разбавленным воздухом. Из полученного раствора при охла-
ждении до 20° кристаллизуется медный купорос. Кристаллы отжи-
мают на центрифуге, и маточный раствор возвращают в процесс.
ПОЛУЧЕНИЕ МЕДНОГО КУПОРОСА СУЛЬФАТИЗИРУЮЩИМ ОБЖИГОМ
БЕЛОГО МАТТА
Существенным недостатком способа получения медного купо-
роса из белого матта путем его окислительного обжига и после-
дующего растворения полученной окиси меди в серной кислоте
является то, что основное количество серы, содержащейся в белом
матте, не используется. Между тем за счет этой серы теоретически
возможно было бы перевести в медный купорос 50% меди, находя-
щейся в белом матте, и тем самым снизить в 2 раза расход серной
кислоты при последующей обработке продукта обжига. С этой
целью белый матт должен подвергаться не простому окислитель-
ному, а сульфатизирующему обжигу, т. е. длительной прокалке при
сравнительно невысоких температурах (400—500°) при достаточном
избытке кислорода. В этих условиях реакции
2SO2 + О2 ** 2SO3
CuO + SO3 C11SO4
смещены направо и 60—70% сульфидной серы переходят в суль-
фатную, что соответствует превращению 30—35% меди в сульфат
меди. Для обработки продукта обжига расходуется в 1,5 раза мень-
ше серной кислоты, чем при простом окислительном (не сульфати-
зирующем) обжиге, а общее использование меди достигает 90%.
Механизм образования сульфата меди при сульфатизирующем
окислении белого матта можно представить следующими элемен-
тарными реакциями52. Часть сульфида непосредственно окисляется
в сульфат:
с и.2 3 -t- 2,5О2 = Си SO4 + СиО
Наряду о этим происходит окисление сульфида меди с образо-
ванием двуокиси серы и окиси меди:
Cu2S + 1,6О2 — Cu2O + SO2
Си2О -Г 0.5О2 < 2СиО
Окись меди далее реагирует с серным ангидридом, образую-
щимся при каталитическом окислении SO2 в присутствии содержа-
щейся в белом матте окиси железа, а частично аульфатизируетоя
по реакциям
CuO+SO2 = CuSO3
4CiiSO3 = 3CuSO4 +CuS
с последующим окислением образующегося CuS. Для успешной
сульфатизации белого матта необходимо обеспечить достаточно
Получение медного купороса обжигом белого матта
683
высокую концентрацию кислорода в газовой фазе. Этого можно до-
стигнуть или использованием обогащенного кислородом воздуха
или применением добавок, обладающих высоким равновесным дав-
лением кислорода в температурных условиях обжига.
Степень перехода серы в газовую фазу в виде двуокиси серы
значительно возрастает при добавке окиси меди (рис. 191) 53. Зави-
симость степени перехода сульфидной серы в сульфатную от тем-
пературы выражается кривой с максимумом (рис. 192), что объяс-
няется разницей в скоростях образования и разложения сульфата
Рис. 191. Степень перехода серы
в газовую фазу при окислении
сульфида меди в зависимости от
температуры:
/ — без добавки СиО; 2 — при добавке
к сульфиду меди 10% СиО; 3 — то же
при 25% СиО.
Рис. 192. Влияние темпера-
туры на переход Cu2S в
CuSO4 при разном содер-
жании окиси меди в смеси.
Содержание СиО в смеси (в %):
/ — 0; 2—10; 3-25; 4-50.
меди (и промежуточных продуктов) при различных температурах.
£тепень окисления сульфида меди при 450° в течение 60 мин в от-
сутствие добавки составляет 29,5%. С увеличением температуры
выше 450° в этих условиях степень перехода сульфидной серы в
сульфатную резко падает и при 750—800° практически равна нулю.
В присутствии добавок окиси меди увеличивается степень пере-
хода сульфидной серы в сульфатную, а температура, отвечающая
максимуму сульфатообразования, сдвигается в сторону более вы-
соких температур. При добавке 25% СиО в интервале 500—550°
за 60 мин 35—40% сульфидной серы переходит в сульфатную, а
общее количество окислившейся серы достигает 90—95% 53.
Наиболее интенсивно сульфатизирующий обжиг сульфидов и
окислов меди идет в кипящем слое, особенно при предварительном
мелком измельчении материала54-55.
684
Гл. XVII. Соединения меди
Изучена сульфатизация C112S крепкой серной кислотой. До
300° она идет по реакциям:
Cu2S + 2H2SO4 = CuS + C11SO4 + SO2 + 2Н2О
CuS + 2H2SO4 = CuSO4 + SO2 + S + 2H2O
S + 2H2SO4 = 3SO2 + 2H2O
Наибольший выход CuSO4 достигается при 200°. При высоких
температурах частично улетучивается серная кислота и в резуль-
тате взаимодействия CuSO4 с Cu2S образуется C112SO4, а затем
Си2О56.
Изучены условия превращения Cu2S в C11SO4 путем автоклав-
ного выщелачивания белого матта слабой серной кислотой в при-
сутствии кислорода. При этом параллельно идут следующие реак-
ции:
Cu2S + 2,5О2 + H2SO4 = 2CuSO4 + Н2О (1)
= Cu2S + О2 + 2H2SO4 = 2CuSO4 + S + 2Н2О (2)
Скорость растворения Cu2S пропорциональна давлению кисло-
рода в степени 0,5. Для преимущественного (на 93%) осуществле-
ния процесса по реакции (1), т. е. с полным использованием серы
и с меньшим расходом серной кислоты, оптимальными условиями
являются: давление кислорода ~4 ат, концентрация серной кис-
лоты 0,01 моль!л, температура 140°57.
Аналогичным способом можно получать медный купорос из
водной суспензии халькопиритного концентрата (Т: Ж = 1:3)
с добавкой СаО или СаСО3 для регулирования гидролиза образую-
щегося сульфата железа и выделения H2SO4 58.
ПОЛУЧЕНИЕ МЕДНОГО КУПОРОСА ИЗ ОКИСЛЕННЫХ МЕДНЫХ РУД
Из общих запасов медных руд 10—15% составляют руды,
содержащие медь в окисленной форме. При незначительном содер-
жании меди в руде извлечение металлической меди методами плав-
ки оказывается зачастую неэкономичным. В таких случаях целесо-
образно перерабатывать эти руды гидрометаллургическими мето-
дами, заключающимися в извлечении (выщелачивании) меди
каким-либо растворителем. Содержащаяся в окисленных рудах
окись меди хорошо растворяется в серной кислоте. Полученные
разбавленные растворы сульфата меди или выпаривают, или выде-
ляют из них медь цементацией (стр. 687). Из выпаренных раство-
ров получают кристаллизацией медный купорос, а цементную медь
также Перерабатывают в медный купорос.
Выщелачивание измельченной руды 10—15%-ной серной кисло-
той осуществляют в растворителе, снабженном мешалкой,- куда
предварительно заливают разбавленную кислоту, подогревают ее
глухим паром до 50—80°, а затем загружают руду в таком коли-
Производстве медного купороса ив колчеданных огарков
685
честве, чтобы отношение Т : Ж в пульпе составляло 1 : 3. Раство-
рение ведут при перемешивании и 60—70° в течение 30—40 мин.
При содержании в руде 3—5% Си выщелачивание ведут 3—5%-
ной серной кислотой в течение ~ 2 ч.
Очистку раствора медного купороса перед его дальнейшей пе-
реработкой от примесей сульфатов железа, алюминия и других
можно осуществлять с помощью известняка и обожженной медной
руды, пропуская его затем через гравийный фильтр для отделения
образовавшихся осадков3415В’60.
ПРОИЗВОДСТВО МЕДНОГО КУПОРОСА ИЗ КОЛЧЕДАННЫХ ОГАРКОВ
Медь в колчеданных огарках содержится в виде различных
соединений — CuSO4, C11SO3, Cu2O, CuO, CU2S, CuS, CuFeS2. Это
затрудняет полное ее извлечение каким-либо одним простым ме-
тодом.
Сульфат и сульфит меди легко выщелачиваются водой, а окись
меди — разбавленной серной кислотой. Сульфиды меди, в виде
которых находится до 20% меди огарков, не растворяются в воде
и В растворах серной кислоты, но переходят в раствор при нагре-
вании в результате взаимодействия с сульфатом (или хлоридом)
трехвалентного железа:
CuS + Fe2(SO4)3 = CuSO4 + 2FeSO4 + S
Cu2S + 2Fe2(SO4)3 = 2CuSO4 + 4FeSO4 + S
Этим же способом извлекают медь из сульфидных медных
руд61. Интенсивность выщелачивания увеличивается при бакте-
риальном окислении сульфидов 62. Из получаемого раствора мед-
ного купороса удаляют железо окислением Fe2+ в Fe3+ пиролюзи-
том или кислородом воздуха и обработкой известняком:
Fe2(SO4)3 + ЗСаСО3 + ЗН2О = 2Fe(OH)2 + 3CaSO4 + ЗСО2
Халькопирит с помощью сульфата железа растворить нельзя.
Его можно превратить в растворимые соединения хлорированием:
' 2CuFeS2 + 7С1, = 2CuCl2 + 2FeCl3 + 2S2C12
Наиболее разработанными способами получения медного купо-
роса из огарков и являются водно-кислотное выщелачивание83,
применяемое на некоторых заводах, и хлорирующий обжиг в при-
сутствии NaCl.
Выщелачивание меди из огарка
При выщелачивании огарка 1% раствором серной кислоты иа
холоду в течение 1 ч при отношении Т : Ж, равном 1 :3, переходит
в раствор от 60 до 80% меди. В результате шестикратного выще-
лачивания могут быть получены щелоки, содержащие 15—18 г/л
68S
Гл. XVII. Соединения меди
меди. Эти щелоки загрязнены соединениями железа (5—6 г/л Fe),
которые удаляются из раствора осаждением мелом, после их окис-
ления бертолетовой солью или хлором. Выпариванием очищенного
щелока до концентрации меди 82 г/л и последующей кристаллиза-
цией можно получить медный купорос. Без предварительной очи-
стки щелока от железа получается продукт, содержащий 2—2,5%
Fe. Непосредственное получение фунгицидных препаратов из ще-
лока может оказаться более экономичным, чем переработка его
на медный купорос64.
Извлечение водо- и кислоторастворимых соединений меди из
огарка можно осуществлять, орошая свалку огарка подкисленной
водой (3—5% H2SO4). Для сбора образующегося раствора, содер-
жащего 5—15 г/л CuSO4 • 5Н2О, необходим колодец, откуда рас-
твор откачивается на цементацию65. Аналогичным образом можно
производить выщелачивание огарка, находящегося в плоских пря-
моугольных ямах, имеющих большую площадь. Загрузку и вы-
грузку огарка можно осуществлять при этом с помощью мостового
крана, движущегося по опорам, уложенным вдоль краев ямы.
Хлорирующий обжиг огарка
Хлорирующий обжиг огарка заключается в обработке его хло-
ристым натрием при высокой температуре с целью превращения
нерастворимых сульфидов меди в водорастворимые соединения66:
CuS + 2NaCl + 2О2 = CuCl2 + Na2SO4
К огарку добавляют 4—5% NaCl (в зависимости от содержа-
ния в нем меди), смесь измельчают на вальцовой мельнице до
размера частиц не более 2 Мм и обжигают в механической колче-
данной печи при 550—600°. Развитие требуемой температуры обес-
печивается сжиганием генераторного газа или другого горючего.
В качестве горючего можно применять серу или серный колчедан.
В этом случае шихту составляют с соблюдением молярного отно-
шения Си:3S : 6NaCl. Огарок состоит из окислов железа и
CuCB, CuCl, CuO, CuSO4 и Na2SO4. Часть хлорида натрия реаги-
рует с серой и водяными парами, образуя хлористый водород. В
отходящих газах, помимо продуктов сгорания топлива и хлори-
стого водорода, содержится некоторое количество Cl2, SO2, SO3,
водяных паров и мышьяковистых соединений. Газы из печи посту-
пают в башню, орошаемую водой. Здесь получается 10%-ная со-
ляная кислота с примесью серной кислоты и хлора. Ее используют
для выщелачивания обожженного огарка.
Медноколчеданные огарки, содержащие 0,5—1% меди, можно
хлорировать газообразным хлором67. Систематическое выщелачи-
вание растворимых соединений меди из обожженного огарка, ведут
при 20—25°. Общая продолжительность выщелачивания состав-
ляет 4—5 дней3\.
Производство медного купоросу ив колчеданных огарков
687
Извлечение меди из отходов медеплавильных заводов
К отходам производства меди относятся: ватержакетная пыль,
шлаки, рудничные отвалы и др. Эти материалы содержат, как й
колчеданные огарки, различные соединения меди и перерабаты-
ваются аналогичными методами — непосредственным выщелачива-
нием или выщелачиванием после сульфатизирующего или хлори-
рующего обжига. Полученные растворы подвергают цементации.
При наличии отбросного тепла их можно выпаривать для кристал-
лизации из них медного купороса.
Водное выщелачивание ватержакетной пыли при 76—80° позво-
ляет извлечь из нее в течение 4 ч от 20 до 70% меди в раствор
в виде сульфата меди. При последующей обработке остатков от
выщелачивания водой в течение 4 ч 4 %-ной серной кислотой в рас-
твор переходит еще 15—30% меди68.
Выщелачиванием шлаков 5%-ной серной кислотой при 90—
95° и Т : Ж, равном 1 : 8, с продувкой воздухом удается извлечь
в раствор только 50—53% меди. Путем предварительного сульфа-
ТиЭируюЩего обжига шлака в смеси с 50 %-ной серной кислотой
при Т : Ж, равном 1 : 1, и 600° в течение 1 ч можно увеличить из-
влечение меди в раствор до 80% 60.
В рудничных отвалах обычно содержится 1—2% меди. Она мо-
жет быть извлечена в раствор теми же методами, как и из других
Отходов, а также обработкой водной пульпы сернистым газом60.
Степень извлечения меди достигает при этом 98% в течение 1 ч,
если предварительно произвести хлорирующий обжиг материала
при 300°, с добавкой к нему 20% NaCl.
, Выделение меди из разбавленных растворов
При извлечении меди из колчеданных огарков, отходов меде-
плавильных заводов, рудничных отвалов, а также из окисленных
медных руд получаются разбавленные растворы медного купороса
(или хлорной меди). Рудничные воды, образующиеся на медных
рудниках в результате медленного окисления сернистой меди кис-
лородом воздуха, также представляют собой слабый раствор мед-
ного купороса. Так как концентрирование таких слабых растворов
не экономично, медь выделяют из них цементацией70’71. Этот про-
цесс заключается в вытеснении меди из растворов железными
стружками и железным ломом:
Cu2+ + Fe = Fe2+ + Си
Электродный потенциал меди значительно выше, чем железа —
в М растворах, содержащих ионы Си2+ или Fe^+, при обычной
температуре и давлении водорода 1 ат он равен для Си +0,34 в,
для Fe —0,44 в. Поэтому железо вытесняет медь из ‘раствора в виде
Тонкого металлического шлама, называемого цементной медью.
683
Гл. XVII. Соединения меди
Цементацию осуществляют в стальном футерованном или освин-
цованном баке, куда загружают очищенный от грязи и ржавчины
железный лом. Затем в бак подают разбавленный раствор суль-
фата меди. Для полноты осаждения меди раствор не должен
содержать значительных количеств серной кислоты. Оптималь-
ная концентрация серной кислоты равна ~0,05% или около
5 • 10-3 г-мол/л 72. При такой кислотности практически не происхо-
дит растворения железа серной кислотой и обеспечивается наибо-
лее полное удаление меди из раствора, до содержания Си2+
~5 • 10~6 г-ионов/л 73.
Образующийся в результате цементации разбавленный раствор
сульфата железа спускают в канализацию, а в реактор заливают
другую порцию исходного раствора, содержащего медь. Обработку
Одной и той же загрузки железа проводят 10—12 раз. После этого
оставшееся железо удаляют и выгружают осевшую на дно цемент-
ную медь, которую затем промывают от частиц железа 10—15 %-
ной серной кислотой при непрерывном перемешивании. По удале-
нии железа медь промывают водой до полной отмывки от серной
кислоты. Промытая цементная медь получается в виде пасты крас-
новато-бурого цвета; она содержит 65—70% Си, до 35% влаги и
около 1 % примесей и перерабатывается в медный купорос теми же
методами, что и медный лом. Дисперсность цементной меди возра-
стает с увеличением pH раствора и при уменьшении концентрации
в нем CuSO4 и С1"74. Цементацию меди можно осуществлять и в
псевдоожиженном слое железных гранул. Разработан способ из-
влечения цементной меди флотацией78. Порошкообразную медь
можно получить из кислых растворов солей меди, добавляя к ним
растворимые в воде полисахариды (~1%) и обрабатывая газооб-
разным восстановителем под давлением, например, водородом при
30 ат и 140°76.
Медь может быть извлечена из разбавленных растворов CuSO4
обработкой их слабой аммиачной водой. При этом образуется оса-
док Си(ОН)г • CuSO4, который после отделения от раствора можно
растворить на фильтре серной кислотой для получения медного
купороса. Если в растворе присутствуют, кроме меди, ионы железа
и никеля (например, при переработке полиметаллических руд),
возможно ступенчатое осаждение их аммиаком при нейтрализации
раствора последовательно до pH = 3, затем 4,5 и б77-73.
Разработаны методы извлечения меди из разбавленных рас-
творов экстракцией органическими растворителями 79~31.
ПОЛУЧЕНИЕ МЕДНОГО КУПОРОСА ИЗ ЭЛЕКТРОЛИТНЫХ РАСТВОРОВ
МЕДЕЭЛЕКТРОЛИТНЫХ ЗАВОДОВ
При электрохимическом рафинировании меди применяют-элект-
ролит, содержащий в 1 л 30—45 г меди в виде сульфата и около
200 г свободной серной кислоты. Помимо этого, в электролите >прн-
Получение других соединений меди
689
сутствуют примеси NiSO4, FeSO4, Аэ^Оз, ZnSO4, CaSO4 и др.
В связи с накоплением этих примесей и переходом в раствор меди
часть электролита должна выводиться из процесса. Наиболее эко-
номичным способом утилизации выводимого из цикла электролит-
ного раствора является переработка его на медный купорос, так
как стоимость последнего выше, чем стоимость затраченных на
его производство меди и серной кислоты82.
Поэтому находящуюся в выведенном электролите серную кис-
лоту нейтрализуют материалами, содержащими медь, — катодным
скрапом, стружкой, гранулированной катодной и анодной медью,
шлаком анодных печей и т. п. Нейтрализацию производят при цир-
куляции раствора через слой материала, содержащего медь, загру-
женного в резервуары, называемые окислителями. В них вдувают
воздух, требующийся для окисления меди в процессе ее растворе-
ния в серной кислоте. Здесь происходит тот же процесс, что и опи-
санный выше, идущий в натравочных башнях. Температуру рас-
твора поддерживают около 70—80° нагреванием через паровые
змеевики или острым паром. После снижения содержания свобод-
ной кислоты в растворе до 0,5%, для чего обычно требуется от 12
до 24 ч, раствор поступает на выпаривание, причем из него ча-
стично выделяются соли железа и кальция. Затем раствор охла-
ждается в кристаллизаторах, где из него выделяются кристаллы
медного купороса. Из оставшегося маточного раствора извлекают
никелевый купорос, загрязненный сульфатом меди.
Содержащиеся в меди примеси при рафинировании переходят -
в шлам, в котором находятся значительные количества меди. Из-
влечение меди из шлама производят выщелачиванием серной кие-
лотой при 85° с продувкой воздухом. Несмотря на длительность
этой операции (до 18 ч), в шламе остается 8—10% меди. Для уско-
рения этого процесса предложено применять в качестве интенсив-
ного окислителя меди персульфат аммония83.
ПОЛУЧЕНИЕ ДРУГИХ СОЕДИНЕНИИ МЕДИ
1 Основной сульфат меди
Основной сульфат меди можно применять в качестве фунгицида
вместо бордосской жидкости. Так как он не растворим в воде, то
для опрыскивания растений его используют в виде водных суспен-
зий. Для получения смачивающегося порошка к продукту добав-
ляют порошкообразный сульфитный щелок, а для удерживания
его на листьях — декстрин.
Основной сульфат меди получают осаждением содой и мелом
из раствора медного купороса по реакциям:
4CuSO4 + 3Na»CO3 + (3 + чг)НаО = 3Cu(OH)2 • CuSO4 • mH50 + 3Na2SO4 + ЗСО»
4CuSO4 + ЗСаСО3-1- (9 + т) Н,0 = 3Cu(OH)2- CuSO4- mH2O+ 3CaS04-2H,O+3COt
690
Гл. XVII. Соединения меди
Мел дешевле соды, но при осаждении мелом образующийся
нерастворимый сульфат кальция разбавляет продукт. Поэтому для
получения препарата, содержащего 27—29% меди, необходимо 40%
меди из раствора CuSO4 осадить содой, а остальные 60% — моло-
тым мелом. Осаждение производят при 80—85° из раствора, содер-
жащего ~ 160 г/л CuSO4 и 5—10 г/л H2SO4. Отфильтрованный оса-
док с влажностью 25—35% поступает в барабанную сушилку, где
высушивается топочными газами при 150° до влажности 3%. Затем
в' шаровой мельнице производят его размол и смешение с сульфит-
ным щелоком и декстрином 84’85.
Запатентован способ получения основного сульфата меди
CuSO4 • 3Cu(OH)2 • 5Н2О медленным осаждением из раствора, со-
держащего 50—60 г/л CuSO4, аммиаком или аммиачной водой. При
pH в конце процесса 7—8 выход меди в осадок 100%. Отфильтро-
ванный и промытый осадок высушивают при температуре ниже
150°. Гранулометрический состав продукта зависит от концентра-
ции реагентов и продолжительности осаждения. Примером может
служить продукт, в котором 80% частиц меньше 5 мк, 18% —от 5
до 8jhk и 2%—больше 8 мк 86.
Основные карбонаты меди
Основные карбонаты меди получают взаимодействием раство-
ров медного купороса и соды. В зависимости от температуры и
других условий осаждения образуется или голубая соль
2СиСО3 • Си (ОН) 2 или зеленая СиСО3 • Си (ОН2). При смешении
растворов вначале выделяется студенистый осадок голубого цвета,
переходящий затем в кристаллический, имеющий состав СиСО3 •
• Си(ОН)2 • х Н2О, зеленого цвета. Для получения продукта такого
состава исходные растворы с концентрацией ~ 1 т должны сме-
шиваться в отношении Na2CO3: CuSO4, равном 1,1:1; реакцион-
ная масса должна умеренно перемешиваться в течение длитель-
ного времени для старения осадка и перехода студня в кристалли-
ческое СОСТОЯНИе 63’ 87-89
Хлорокись меди
Из различных основных соединений хлорной меди — оксихлори-
дов (стр. 662) наибольшее значение имеет соль ЗСиО • СиС12 • 4Н2О
или ЗСи(ОН)2 • СиС12 • Н2О, которая известна под названием хлор-
окиси меди90’91. Ее получают осаждением из растворов хлорной
меди известковым молоком или мелом:
4СпС12 + ЗСа(ОН)2 + Н2О = ЗСиО • СиС12 • 4Н2О + ЗСаС12
или
4СиС12 + ЗСаСОз + 4Н2О = ЗСиО СиС12 • 4Н2О + ЗСаС12 + ЗСО2 .
Для получения хлорокиси меди могут быть использованы также
растворы хлористой меди, которые окисляют воздухом при 45—50°,
Регенерация солей меди . .691
По этому способу получается соединение CuO • CuCU или
ЗСиО • СиСЬ • пН2О (в зависимости от длительности окисления92).
Процесс может быть осуществлен путем взаимодействия металли;
ческой меди с хлорной медью при продувке воздухом (стр. 6'76).
В частности для этой цели могут быть использованы растворы, со-
держащие медь, полученные при выщелачивании хлорированных
пиритных огарков.
Хлорокись меди можно также получить взаимодействием ме-
таллической меди с водным раствором хлоридов кальция и аммо-
ния, через который продувают воздух. Выделяющийся осадок хлор-
окиси меди отделяют фильтрацией93.
Для переработки медного скрапа в хлорокись меди его обраба-
тывают раствором CuSO4 и NaCl при 80°. Медь растворяется в ре-
зультате восстановления Си2+ в Си+. Затем окислением раствора
воздухом при 30—40° осаждают основной хлорид меди. При этом
содержание меди в растворе уменьшается с 60 до 2 г/л94.
Закись меди
Закись меди получают электролизом раствора поваренной соли
с медными катодами и анодами95. На катоде выделяется водород,
образуются ионы ОН-, на аноде медь растворяется с образованием
ионов Си+. В результате вторичного взаимодействия
2Си+ + 2ОН~ = Си2О + Н2О
осаждается порошкообразная безводная закись меди. Процесс ве-
дут при температуре не ниже 70° во избежание образования гид-
рата закиси меди. Напряжение на ванне ~4 в, катодная и анод-
ная плотности тока 200 а/.ч2. Выход по току 99%, расход энергии
1600 кет • ч на 1 т закиси меди. Материал электролизера — дерево.
Закись меди промывают водой, затем спиртом и высушивают
в вакууме.
/ РЕГЕНЕРАЦИЯ СОЛЕЙ МЕДИ В ПРОИЗВОДСТВЕ
ИСКУССТВЕННОГО ВОЛОКНА
При производстве медно-аммиачного штапельного волокна на
1 кг волокна расходуют 0,5—0,6 кг медного купороса (без учета
регенерации его). До 60% израсходованной меди извлекается из
волокна при отделочных операциях в виде раствора CuSO4, кото-
рый используют для приготовления солей и гидроокиси меди. Около
*/з меди удаляется в промышленную канализацию с раствором пря-
дильной ванны.
Регенерация меди (и аммиака) может производиться двумя
способами:
692
Гл. XVII. Соединения меди
1) кипячением отработанного раствора прядильной ванны под
вакуумом — при этом медь выделяется в виде окиси медв, обра-
зующей медный шлам;
2) фильтрацией раствора через Н-ионитовый материал — в ре-
зультате ионного обмена медь оседает на ионите, а раетвор на-
правляется на отгонку аммиака.
Первый способ, позволяющий одновременно регенерировать
медь и аммиак, наиболее эффективен при переработке растворов
из прядильных ванн, второй — при извлечении меди из сточных и
промывных вод96.
Предложено извлекать медь из отработанного медно-аммиач-
ного раствора осаждением ее в виде основного сульфата меди
после подкисления раствора серной кислотой и доведения вели-
чины pH до 6—797.
ЛИТЕРАТУРА
1. J. Р. Baur, D. W. Bridges, W. М. F a s s е 11, J. Electroehem. Soc., 103,
№ 5, 273 (1956). — 2. A. Goswami, J. N. T r e h a n, Trans. Faraday Soc., 53,
№ 3, 358 (1956).—<3. C. Ott, Compt. rend., 238, № 10, 1111 (1954). — 4. С. C. S i r-
c a r, B. Prasad, J. Indian Chem. Soc., 33, № 5, 361 (1956).—5. M. И. Архи-
пов, A. Б. П а к ш в ер, H. И. П о д б о р и Q в а, ЖПХ, 23, № 6, 650 (1951). —
6. J. G a n t h i е г, Bull. Soc. chim. France, 1956, № 4, 661. — 7. E, III. Ганелина,
ЖПХ, 37, № 6, 1358 (1964).—8. Д. Фрир, Химия инсектисидов и фунгисидов,
ИЛ, 1948. — 9. L. Walter-Levy, А.-М. G о г е о u d, Compt. rend., С265, № 23,
1314 (1967). — 10. Е. В. Киселева, ЖФХ, 27, № 3, 443 (1953).
И. W. Savelberg, Chem. Ztg., 77, № 10, 317 (1953).— 12. J. G u z о, Chem.
zvesti, 11, № 2, 107 (1957).— 13. A. H. К e т о в, В. В. П е ч к о в с к и й, Б. Н. В а р-
с к и й, Н. П. Старков, ЖПХ, 34, № 3, 517 (1961). — 14. В. В. Печковский,
А. Н. Кетов, Труды Пермск. политехи, ин-та, № 10, 1961, стр. 3. —15. Ldrant
Bela, Z. analyt. Chem., 219, № 3, 256 (1966). —16. С. B. Frost, R. A. Camp-
bell, Canad. J. Chem., 31, № 2, 107 (1953). — 17. Я. А. Ф и а л к о в, 3. А. Шека,
ЖНХ, 1, № 6, 1238 (1956). — 18. R. Nasanen, Suomen kemisti lenti, 26,
№ 5—6, 67 (1953). — 19. S. Fronaens, Acta chem. Scand., 8, № 7, 1174 (1954).—
20. Н.Д. Мазовер, ЖПХ, 26, № 6, 612 (1953).
21. С. H. Иванова, Журн. ВХО, 9, № 5, 496 (1964),— 22. В. И. Орлон,
Хим. пром., № 6, 377 (1956).— 23. В. И. Орлов, М. А. Морозова, М. Н. Кру-
тицкая, Жури. ВХО, 5, № 3, 270 (1960). — 24. R. L. Derby, D. W. Graham,
Proc. Am. Soc. Civil Eng., 79, № 203, 1 (1953). — 25. Water Works Eng., 106,
№ 8, 709 (1953). — 26. С. И. Вольфкович, H. H. Мельников, В. И. Ор-
лов, Хим. пром., № 6, 321 (1954). — 27. М. В. К а т а л ы м о в, сб. «Исследования
по прикладной химии», 1955, стр. 325. — 28. И. И. Хита ров, ЖХП. № 1, 50
(1937). — 29. А. И. Соловьев, Там же, № 8, 779 (1935). — 30. В. Г. Хомя-
ков, В. П. Машовец, Л. Л. Кузьмин, Технология электрохимических про-
изводств, Госхимиздат, 1949.
31. М. Р о u г b a i х, Thermodynamics of Dylute Aqueous Solutions, London,
1950. — 32. H. H. Милютин, ЖПХ, 34, № 4, 848 (1961). — 33. И. M. Вассер-
ман, Производство минеральных солей, Госхимиздат, 1954. — 34. А. И. Кине в-
с к и й, ЖПХ, 28, № 10, 1088, 1113 (1955). — 35. П. В. Д ы б и н а, Технология
минеральных солей, Госхимиздат, 1949. — 36. А. И. Ки невский, ЖПХ, 33,
№ 3, 608 (1960). — 37. Б. Д. С теп ни, И. А. Гильденблат, С. А. Грин-
штейн, Хим. пром., № 3, 175 (1957).—38. Б. Д. Степин, Там же. М 6, 376
(1954).— 39. Н. Eckstein, A. L i s s п е г, Chem. Technik, 6, № 1, 18 (1954).—
40. А. Ф. Горбатова, Б. С. Кав натекая, Хим. пром., № 11, 344 (1949).
Литература
693
41. Авт. свид. 149412, 1962. — 42. Л. М. Матусевич, Цветные металлы, 31,
№ 9 32 (1958); 32, № 11, 37 (1959); 33, № 9, 46 (I960). — 43. Б. Д. Степин,
И А. Гильденблат, С. А. Гринштейн, Хим. пром., № 5, 303 (1956).—
44. R. Stratta, Chim. Ind., 21, № 11, 612 (1939).— 45. Fogel, Chem. Ztg., 8L
№ 21, 705 (1957). —46. Б. А. Скопинцев, M. T. Голубева, ЖПХ, 12, № 6,
813 (1939).— 41. В. В. Мих а й лов, ЖХП, № 4—5, 91 (1940) .— 48. Н. П. Диев,
Ю. В. Карякии, ЖПХ, 12, № 5, 655 (1939).—49. Д. М. Чижиков,
Г. С. Ф р е и ц, Б. Я. Трацевицкая, Изв. АН СССР ОТН, № 4, 523 (1953). —
50. Я. М. П е с и и, М. Л. Ш а б а ш о в а, ЖПХ, 23, 278, 350, 461 (1950).
51. Е. П. Ожигов, Сообщ. Дальневост. фил. АН СССР, № 6, 10 (1954).—
52. В. И. Смирнов, А. И. Тихонов, Обжиг медных руд и концентратов, Гос-
металлургиздат, 1958. — 53. В. В. Печковский, ЖПХ, № 8, 802 (1955); 32,
№ 8, 1857 (1959).—54. А. Бабенко, В. Смирнов, Труды Уральск, политехи,
ин-та, № 73, 1958, стр. 259. — 55. Кришна Мурти, J. Sci. Ind. Res. (India),
20D, № 5, 175 (1961), — 56. А. П. С курников, В. Ф. Ларин, сб. «Исследова-
ния в области химии и технологии минеральных солей и окислов», Изд. «Наука»,
1965, стр. 161. — 57. Г. Н. Доброхотов, Е. В. Майорова, ЖПХ, 36, № 10,
2148 (1963).— 58. Авт. свид. 158871, 1963. — 59. Т. В. Заболотский, С. М. Ве-
зя й к о, ЖХП, № 22, 18 (1941).—60. Т. В. Заболотский, С. М. Безяйко,
Там же, № 23, 13 (1941).
61. Н. Veit man, S. Pellegrini, V. N. M а с К i w, J. Metals, 19, № 2,
2'. (\9&7). — 62. F. H. Fitsh, C. J. V. Davies, Sulphur, № 61, 19 (1965).—
63. И. H. Померанцев, Д. Э. Соркина, Труды НИУИФ, в. 123, 1935,
стр. 144. — 64. К. Sungun, Demir ve ?elik, 4, № 2, 25 (1955). — 65. П. В. Д ы-
б и и а, ЖХП, № 12, 42 (1938). — 66. С. А. Амирова, А. М. Поляк, Труды
УНИХИМ, в. 7, 1958, стр. 217. — 67. Д. М. Чижиков, Ш. Ш. Марголина,
ЖХП, № 8, 811 (1935). — 68. Н. Н. Ефремов, М. М. Наркевич, сб. «Ра-
боты по химической технологии минеральных веществ», Свердловск, 1929,
стр. 125. —69. П. В. Дыбииа, Хим. пром., № 3, 79 (1947); № 9, 276 (1949);
№ 12, 367 (1950). — 70. Mining Eng., 18, № 6, 70 (1966).
71. А. И. Годес, В. Н. Пантелеев, В. А. Пехович, сб. «Порошко-
вая металлургия», Рига, 1958, стр. 58. — 72. И. Н. Плаксин, Н. А. Суворов-
ская, Цветные металлы, № 3, 37 (1948). — 73. И. Л. Агафонов, ЖПХ, 29,
№ 2, 295 (1956).— 74. В. Д. Самыгии и др., Цветные металлы, № 12, 36
(1968). — 75. С. М. Гуревич и др., авт. свид. 192708, 1963. — 76. Япон. пат.
&650, 1964. — 77. Н. Suwa, К. М i h а г а, япон. пат. 5175, 1953. — 78. М у к о я м а,
япон. пат. 854, 1955. — 79. D. W. Agers a. oth., Mining Eng., 17, № 12, 76
(1965).-—80. Япон. пат. 9674, 1962.
81. М. О 11 е а п u, J. Moldovan, Rev. chim. (рум.) 17, № 1, 20 (1966).—
82. В. А. Аюлицкий, А. К. Шарова, ЖХП, № 8, 591 (1937).— 83. А. Г. Лош-
карев, В. С. Калеватова, ЖПХ, 21, № 9, 954 (1948). — 84. М. Моро-
зова, Н. Кольцов, Н. Трушвииа, Е. Лазарева, Сборник работ НИУИФ,
в. 167, 1960, стр. 151.—-t6. С. Deer 0 1 у, М. Ghodsi, Ind. chim. belg., 82, № 3,
265 (1967).— 86. Франц, пат. 1124612, 1956, — 87. С. Т. Hsu, J. Appl. Chem., 6,
№ 2, 84 (1956). — 88. В. И. Орлов, П. В. Попов, М. А. Морозова,
М. Г. Габриелов а, Ядохимикаты (иисектпсиды и фунгисиды), Госхимиздат,
1946. — 89. А. Л. Ефимов, Химические методы борьбы с вредителями и болез-
нями сельскохозяйственных растений, Сельхозгиз, 1949.—90. М. А. Морозова,
Н. С. Кольцов, Сборник работ НИУИФ, в. 167, 1960, стр. 133.
91. М. Ф. Зубов, Там же, стр. 146.—92. D. Lazarov, G. В 1 i z п а к о v,
Z. phys. Chem. (DDR), 233, № 3, 4, 255 (1966). — 93. P. K- Anderson, пат.
США 2655432, 1953. — 94. E. I r m i s c h, пат. ГДР 34170, 1964, — 95. H. П. Ф е-
Дотьев и др., Прикладная электрохимия, Госхимиздат, 1962, стр. 462.—
96. П. В. Михайлов, Л. Е. Окунев, Вести, техн, и экон, информ., № 5, 34
(1958). — 97. Е. М u п е k a t а, англ. пат. 728520, 1955.
Глава XVIII
СОЕДИНЕНИЯ ЖЕЛЕЗА
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Сульфат закиси железа, ферросульфат, FeSO4 в пределах от
— 1,82 до 90° кристаллизуется из водных растворов в форме
FeSO4 • 7Н2О, FeSO4-4H2O и FeSO4-H2O (рис. 193) ’. Семиводный
сульфат закиси железа, называемый в технике железным (зеле-
ным) купоросом, кристаллизуется в интервале от —1,82 до 56,8°
в форме моноклинных кристаллов
голубовато-зеленого цвета с плот-
ностью 1,899 г!см3 (15°). На возду-
хе выветривается, окрашиваясь в
желтый цвет, вследствие образова-
ния с поверхности Fe(OH)SO4. Че-
тырехводный кристаллогидрат с
плотностью 2,2 г/сл3, окрашенный в
зеленый цвет, стабилен от 56,8 до
64,0°; при других температурах он
может выделяться в метастабиль-
ном состоянии. Выше 64° кристал-
лизуется FeSO4-H2O белого цвета.
При нагревании FeSO4 • 7Н2О он те-
ряет шесть молекул воды. Обез-
Рис. 193. Политерма растворимости
в системе FeSO4—Н2О.
воживание FeSO4-H^O сопровождается разложением с выделением
SO2 и образованием основного сульфата железа; прокаливание же
на воздухе сопровождается окислением Fe(II) в Fe(III) с образо-
ванием Fe2O(SO4)22. Концентрация насыщенных водных раство-
ров: в криогидратной точке (—1,821°) — 14,91%, при 20° —21,01 %,
при 56,7° —35,06%, при 64° — 35,57%, при 90,1° —27,15% FeSO4.
Давление диссоциации одноводного сульфата закиси железа
FeSO4 • Н2О FeSO4 + Н2О составляет 0,4 мм рт. ст. при 50°,
0,8 мм рт. ст. при 70°, 3,8 мм рт. ст. при 90°. В обычных условиях
Физико-химические свойства
695
FeSO4-H2O полностью обезвоживается при 300°, частично разла-
гаясь при ЭТОМ.
Растворимость сульфата закиси железа уменьшается в присут-
ствии свободной серной кислоты, которая высаливает кристалло-
гидраты FeSO4 из растворов (рис. 194) Уменьшается также и пре-
дельная концентрация раствора, соответствующая точке перехода
Рис. 194. Растворимость FeSO4 • 7М2О в зависи-
мости от содержания в растворе свободной
H2SO4 при различных температурах.
FeSO4-4H2O, FeSO4-H2O и FeSO4 и метастабильных
FeSO4-7H2O и FeSO4-4H2O. При концентрациях H2SO4, лежащих
за стабильной областью существования гепта- и тетрагидрата, ив
пересыщенных растворов в первую очередь выделяется метаста-
бильный гептагидрат, который затем превращается в метастабиль-
ный тетрагидрат с большей скоростью, чем последний переходит
в стабильный моногидрат. При 60° гептагидрат не образуется, а
при 70 и 90° не выделяется также и тетрагидрат.
В интервале 50—90° при концентрации H2SO4 меньше 27,2%
температурный коэффициент растворимости FeSO4-H2O отрицате-
лен, а при более высокой концентрации серной кислоты — положи-
телен (в пределах 50—70° температурный коэффициент снова ста-
новится отрицательным при концентрациях выше 76% H2SO4).
При высоких температурах растворимость FeSO4 в серной кислоте
Резко уменьшается. Так, при 200—240° в растворе, содержащем
Гл. XVIII. Соединения железа
~91% H2SO4, находится всего 0,2—0,3% FeSO4. При этом FeSO4
частично переходит в Fe2(SO4)2 в результате реакции:
2FeSO4 + 2H2SO4 = Fe2(SO4)3 + SO2 + 2H2O
Растворимость Fe2(S'O4)3 в концентрированной серной кислоте
до 200° немногим превышает 0,1% 3.
Сульфат окиси железа, феррисульфат, Fe2(SO4)s кристалли-
зуется из водных растворов в форме 12, 10, 9, 7, 6 и 3-водных кри-
сталлогидратов. Десятиводный кристаллогидрат и безводная соль
встречаются в природе в виде минералов квенстетита и коквим-
сбита. Желтые кристаллы девятиводной соли Fe2(SO4)3 • 9Н2О
имеют плотность 2,1 г/см3. Ромбические кристаллы безводной соли
имеют плотность 3,1 г/см3 (18°). При 20° в 100 г воды может рас-
твориться 440 г Fe2(SO4)3 • 9Н2О. В водных растворах сульфат
окиси железа сильно гидролизуется, особенно при повышенных
температурах. Он очень гигроскопичен, на воздухе расплывается.
С сульфатами щелочных металлов и аммония он образует двойные
соли M[Fe(SO4)2] • 12Н2О, из которых наиболее распространены
железные квасцы NH4[Fe (SO4)2) • 12Н2О.
Давление диссоциации сульфата окиси железа по реакции
Fe2(SO4h Fe2O3 + 3SO3 равно при 614° 70 мм рт. ст., при 650°
149 мм рт. ст.
Давление диссоциации сульфата закиси железа по реакции
2FeSO4 Fe2O3 + SO2 + SO3 равно при 614° 254 мм рт. ст., при
€50° 600 мм рт. ст.
В отсутствие кислорода FeSO4 разлагается с достаточно боль-
шой интенсивностью и полнотой при 700°. В токе воздуха его раз-
ложение значительно ускоряется в присутствии восстановителей —
угля и пирита. При взаимодействии FeSO4 с FeS или FeS2 (700—
800°) образуются Fe3O4 и SO24. Смесь из 82,3% FeSO4-H2O, 15,2%
FeS2 и 2,5% угля разлагается в токе воздуха при 600° за 40—
60 мин на 98%. С увеличением содержания кислорода в газовой
фазе скорость разложения FeSO4 уменьшается в отсутствие вос-
становителей (колчедана, угля), но возрастает в их присутствии.
Это объясняется тем, что восстановители, сдвигая реакцию
SO3 SO2 + */2О2 вправо, ускоряют тем самым диссоциацию
FeSO4s~10. О термическом разложении сульфата закиси железа во
взвешенном слое см.11.
Сульфат окиси железа в присутствии углерода восстанавли-
вается до сульфата закиси железа »
Fe2(SO4)3 + С = 2FeSO4 + СО2 + SO2
а сульфат закиси железа при не очень высоких температурах^
только частично разлагается до закиси железа:
2FeSO4 + С = 2FeO + СО2 + 2SO2
Физико-химические свойства
697
Степень превращения Fe2(SO4)3 в FeSO4 возрастает с увеличе-
нием температуры, длительности взаимодействия и поверхности
частип угля. При 300° и диаметре частиц угля меньше 3 мм сте-
пень превращения за 60 мин составляет 53%, за 90 мин — 76%, за
120 мин — 90% 12.
На отличии свойств сульфатов железа (давление диссоциации,
растворимость) от сульфатов других металлов основано обогаще-
ние руд и концентратов в цветной металлургии сульфатиза-
цией 13- н. Материал, гранулированный с серной кислотой, подвер-
гают сульфатизирующему обжигу во взвешенном слое. При этом
железо переходит в нерастворимые соединения, и при последую-
щем выщелачивании получают растворы, в которых отношение
Fe к Со, Си, Zn и другим ценным металлам в десятки раз меньше,
чем в исходных материалах.
В присутствии воздуха или водяного пара FeSO4 конвертирует
хлориды щелочных металлов в сульфаты 15.
В присутствии кислорода в водном растворе происходит по-
степенное окисление FeSO4. В присутствии серной кислоты и с по-
вышением ее концентрации скорость окисления ферросульфата
в феррисульфат значительно уменьшается 16. Окисление FeSO4
ускоряется при пропускании через раствор газа, содержащего SO2
и Oj,7. При этом происходит образование Fe2(SO4)3:
2FeSO4 + О2 + SO2 = Fe2(SO4)3
В свою очередь, Fe2(SO4)3 восстанавливается двуокисью серы
до FeSO4 с одновременным образованием свободной серной кис-
лоты:
Fe2(SO4)3 + SO2 + 2Н2О = 2FeSO4 + 2H2SO4
Образующийся по последней реакции Fe2+ вновь окисляется в
Fe3+. В зависимости от условий взаимодействие FeSO4 с SO2 мо-
жет быть направлено в сторону образования Fe2(SO4)3 илиН28О4.
На этом основан каталитический метод окисления SO2 в водном
рйстворе в присутствии ионов железа. При 80°, концентрации SO2
в газе 3% (а также и при меньших концентрациях), отношении
SO2: О2, равном 1 :4, и содержании Fe2+ в растворе 30 г/л можно
получать растворы, содержащие 20—25% H2SO413'19.
В гидрометаллургии цинка окисление Fe2+ производят при его
концентрации в растворе всего ~2г/л Fe2+ (в виде FeSO4) и при
pH ~ 5—5,2 в присутствии твердой фазы из продуктов гидролиза,
окисленных соединений железа. В этом случае значительную роль
в процессе окисления Fe2+ играет адсорбция кислорода осадками
окисиых соединений железа20.
Запатентованы методы бактериального окисления солей двух-
валентного железа в кислых растворах21.
€98
Гл. XV111. Соединения железа
В водных растворах ион Fe3+ может гидролизоваться' по еле- |
дующим схемам22: |
Fe3+ + Н2О Fe(OH)2+ + Н+ |
Fe3+ + 2H2O Fe(OH)* + 2H+ |
2Fe3+ + 2H2O Fe2(OH)2++ 2Н+ ' 1
В’ соответствии с этим из растворов солей трехвалентного же- я
леза выделяются разные основные соли 23’24. ]
Железо-аммонийные квасцы NH4Fe(SO4)2-12Н2О— фиолето-|
вые кристаллы октаэдрической формы с плотностью 1,71 г/см3. 1
Плавятся при 40°. Растворимость в 100 г воды равна при 25° 124 г, 1
при 100° 400 г. I
Хлористое железо FeCl2 образуется в виде зеленовато-серых I
гексагональных кристаллов с плотностью 2,98 г/сж3; на воздухе]
они желтеют вследствие окисления. Плавится при 672°, кипит при 1
1026° (760 мм рт. ст.). Давление пара при 700° 10 мм рт. ст., при ]
842° 100 мм рт. ст. В паре при температуре кипения находятся |
FeCl2 и Fe2CU, а выше 1500° только FeCl2. Образует кристалле- |
гидраты с 1,2,4 и 6 молекулами воды. Температура превращения |
FeCl2-2H2O в FeCl2-4H2O (голубовато-зеленые моноклинные кри- 1
сталлы с плотностью 1,93 г/см3) 76,5°, температура превращения
FeCl2-4H2O в FeCl2-6H2O равна 12,3°. В насыщенном водном рас-
творе при 20° содержится 40,5%, при 117,5° (/КИп) 50,3% FeCI2.
Водные растворы FeCl2 слабо гидролизованы. С хлоридами щелоч-
ных металлов FeCl2 образует три типа комплексов: MfFeCIg],
МДРеСЦ и МДРеОб], например, KFeCl3 • 2Н2О, К3На[РеС1б].
Хлорное железо FeCl3— сильно гигроскопичные коричневато-
черные кристаллы гексагональной формы с плотностью 2,8 г]см3.
Плавится при 309°, кипит при 319° (760 мм рт. ст.). Давление пара
при 194° 1 мм рт. ст., при 235,5° 10 мм рт. ст., при 272,5° 100 мм
рт. ст., при 298° 400 мм рт. ст. Пары при 400° состоят из Fe2Cl6, при
750° — из FeCl3. Выше 500° под разрежением FeCl3 разлагается на.
FeCl2 и хлор. Хлорное железо образует ряд сильно гигроскопиче-
ских кристаллогидратов, расплывающихся на воздухе, из которых
конгруэнтно плавятся коричнево-желтые кристаллы FeCl3 • 6Н2О
при 37°, FeCl3 • 3,5Н2О при 32,5°, FeCl3 • 2,5Н2О при 56°, FeCl3 -2Н2О
при 73,5°. Ниже 0 ± 2е существует плавящийся инконгруэнтпо
FeCl3 • ЮН2О25. Криогидратная точка водного раствора —5,5°. На-
сыщенный водный раствор содержит при 20° 47,9% FeCl3.
В разбавленных растворах FeCl3 гидролизуется до Fe(OH)2+
(константа гидролиза при 20° равна 24,8- 10~4), а в очень разбав-
ленных (10-3—10'4 М) до Fe(OH)2 ’ , Из разбавленных и концен-
трированных растворов выделяются основные соли — оксихлориды,
например 7Ге2О3• FeCI3• 21Н2О, 8Fe2O3-FeCl3- 16Н2О28. Хлорное |
Применение
69S
железо образует комплексы типа [РеС14]~ и [FeCle]2-- В солянокис-
лых растворах, насыщенных хлоридом щелочного металла, ион
-29
Fe3+ находится только в виде FeCl3 и FeCh .
Окислы железа в воде не растворимы. Закись железа FeO (вюс-
тит) имеет черный цвет и плотность 5,7 г!смг. Закись-окись железа
Fe3O4 (магнетит) также черного цвета, плотность 5,2 г/см3. Окись
железа Fe2O3 (гематит) красного цвета, плотность 5.24 г/с.ч3. Тем-
пература диссоциации FeO (р0 = 0,21 ат) равна 2500°. Давление
О? над FeO при 750° равно 1,602-10-17 мм рт. ст., а при 950° —
1,49 • 10-11 мм рт. ст.
Окись железа диссоциирует при не очень высоких температурах
11350—1500°) с образованием твердых растворов Fe2O3—Fe3O4 и
Fe3O4. Давление О2 над Fe2O3 при 427° равно 2,241 • 10~26 мм рт. ст.
Закись и закись-окись железа при нагревании (в присутствии воз-
духа) пеоеходят в окись железа. Давление О2 над Fe3O4 при 725°
равно 4.25- 10~'7 мм рт. ст.
Гидрат закиси железа Fe(OH)2 имеет зеленоватый цвет и плот-
ность 3,4 г/см*. Растворимость при 18° 0.00015 г в 100 г воды. Рас-
творяется в кислотах и в растворе NH4C1. При 150—2ПП° пязла-
гается3?’31:
4Fe(OH)2 = Fe + FesO4 + 4Н2.О
Гидрат окиси железа Fe(OH)3 красно-коричневого цвета, плот-
ность 3,4—3,9 г!см\ При нагревании до 500° отщепляет 1,5 Н2О.
Растворимость при 18° 0,000048 г в 100 г воды.
ПРИМЕНЕНИЕ
Железный купорос, являющийся контактным ядом, используют
в сельском хозяйстве для борьбы с вредителями садов и слизнями.
Его применяют также для уничтожения мхов, лишайников и гриб-
ных спор, которые он убивает уже при концентрации 0,14%. По
своим фунгицидным свойствам железный купорос в 10 раз слабее
медного купороса 32'33. Железный купорос используют и для пита-
ния растений. Железо необходимо растениям как катализатор для
образования хлорофилла. При недостатке железа растения забо-
левают хлорозом, и листья теряют зеленую окраску. Помимо этого,
железо входит в состав многих окислительных ферментов и играет
большую роль в дыхании растений.
Железный купорос применяют в текстильной промышленности,
Для изготовления чернил, в фотографии и др. Наряду с окислами
желоза его используют для приготовления минеральных красок.
Отбросные растворы сульфатов железа можно переработать в
изоляционный материал — феррон или ферри-гипс, представляю-
щий собой смесь гидратов окислов железа и гипса с наполнителем
Этот материал пригоден для тепловой изоляции химической
fO9
Гл. XVI11. Соединения железа
аппаратуры, из него могут быть изготовлены и строительные пли-
ты 34. В США значительные количества сульфата окиси железа
применяют для травления металла; выпускаемый для этой цели
препарат «Феррисул» содержит 90% Fe2(SO4)3 и примеси — 0,5—
2% FeSO4, 3% Fe2O3 (нерастворимой), 2% SiO2, 1,5% A12(SO4)3,
~3% свободной H2SO4, 0,5% CaSO4 и др.35.
Сульфат окиси железа, а также хлорное железо используют в
качестве коагулянтов при очистке воды. Хлорное железо является
хорошим коагулянтом в щелочной среде. За рубежом его приме-
няют также для очистки вод, содержащих серу, сульфиты и суль-
фиды, и как добавку при сушке осадков, отделяемых фильтрацией
при очистке канализационных вод. Применяемое для этой цели
хлорное железо выпускают под названием «перхлорид железа» в
баллонах в виде 41% раствора и разбавляют перед использова-
нием36. Для очистки сточных аммиачных вод на небольших газо-
вых заводах рекомендуют применять железный купорос37. Его же,
так же как и хлорное железо, можно использовать для очистки
промышленных газов от сероводорода с получением при этом эле-
ментарной серы38. Сульфат окиси железа может применяться в ка-
честве протравы при крашении шерсти и в качестве среды для обо-
гащения многосернистых углей. Кислые растворы сульфата окиси
железа используют как окислительную среду при извлечении по-
лезных компонентов из руд39.
Окислы и гидраты окислов железа служат пигментами. Гидро-
окись железа обладает сорбционными свойствами, которые исполь-
зуются в гидрометаллургии при очистке растворов от примесей
некоторых катионов. Ферромагнитные окислы железа — магнетит,
у-окись железа, а также ферриты применяют в электротехнике, в
Частности в производстве магнитных звуковых лент40.
Технический железный купорос, согласно ГОСТ 6981—54, дол-
жен содержать (в %):
Марка А Марка Б
FeSO4, не менее............ 53,0 47,0
Свободной серной кислоты,
не более................... 0,25 1,0
Нерастворимого остатка, не
более.................... 0,4 1,0
Продукт упаковывают в деревянные бочки, фанерные барабаны
или деревянные ящики.
Аккумуляторный железный купорос, получаемый перекристал-
лизацией технического продукта, должен содержать не менее
19,5% железа и не более (в % от Fe): 0,1—Мп, 0,02 — Са, 0,03—
Сг, 0,03 — Ti, 0,02 — V, 0,02 — Al, 0,03 — Mg и 0,04 Си; сумма при-
месей в продукте (без Мп и Си) не должна превышать 0,03%.
Хлорное железо безводное, получаемое хлорированием при вы-
сокой температуре, выпускают 1 и 2 сорта. По ГОСТ 11159.—65,
Получение железного купороса из травильных растворов
701
оии должны содержать соответственно не менее 97 и 95% FeCb
и не более 1 и 2% FeCh; не растворимых в воде примесей в про-
дукте 1 сорта должно быть не более 2%. Тарой для хлорного же-
леза служат стальные барабаны, покрытые внутри лаком этиноль.
ПОЛУЧЕНИЕ ЖЕЛЕЗНОГО КУПОРОСА ИЗ ТРАВИЛЬНЫХ РАСТВОРОВ
Способ получения железного купороса специальным растворе-
нием железа в серной кислоте в настоящее время утратил свое
значение в связи с тем, что на металлообрабатывающих заводах в
числе отходов производства имеются большие количества травиль-
ных растворов, которые легко могут быть переработаны на желез-
ный купорос. Травильные растворы получают при обработке (тра-
влении) серной кислотой стальных изделий с целью удаления с
них окалины (окислов железа) перед дальнейшей обработкой по-
верхности. Для травления применяют разбавленную 20—25%-ную
серную кислоту. Отбросные травильные растворы содержат глав-
ным образом железный купорос (15—20% FeSO4) и несколько
процентов свободной серной кислоты (2—10%).
С развитием металлургии и металлообработки до современных
масштабов проблема утилизации отбросных травильных растворов
стала очень острой. Удаление больших количеств кислых жидко-
стей в естественные водоемы невозможно. Очистка сточных тра-
’ вильных растворов нейтрализацией их известью представляет боль-
шие трудности вследствие образования объемистых трудно отстаи-
вающихся осадков. Объем осадка сульфата кальция и гидрата
I закиси железа в 20—25 раз превышает объем расходуемой на
I травление металла серной кислоты (в расчете на моногидрат).
В связи с этим на многих заводах утилизируют травильные рас-
творы, выделяя из них сульфат железа кристаллизацией с получе-
нием товарного продукта — железного купороса, при одновремен-
ном возврате остающейся маточной жидкости — серной кислоты в
— травильные ванны. Однако потребность в железном купоросе пока
зйачительно меньше, чем количество его, которое можно получить
при полной утилизации травильных растворов, поэтому эта проб-
лема остается нерешенной. Эти трудности однако постепенно пре-
одолеваются. Описан способ обработки отбросного травильного
раствора водной суспензией Са(ОН)2 при 90°, позволяющей полу-
чить быстро отстаивающийся осадок, состоящий из смеси Fe3O4
и гипса, которую разделяют магнитной сепарацией 4I-42.
Железный купорос является также побочным продуктом при
. производстве двуокиси титана из титановых руд. На некоторых
заводах за рубежом железный купорос используют в качестве
вторичного сырья для получения серной кислоты, примешивая его
(~20%) к поступающему на обжиг серному колчедану.-
702
Гл. XVI11. Соединения железа'
Сульфат железа содержится и в сточных жидкостях некоторых
других производств, например в отработанных красящих раство-
рах, из которых он также может быть регенерирован43.
• Кристаллический железный купорос может быть выделен из
травильных растворов при охлаждении их до —5°, —10° или вы-
паркой с последующей кристаллизацией при охлаждении до 20—
25°. Можно также производить высаливание железного купороса
из травильной жидкости серной кислотой (см. рис. 194) и после
отделения кристаллического осадка возвращать маточный раствор
на травление железа.
Обычно выделение железного купороса из травильных раство-
ров производят охлаждением их воздухом или водой, или в ваку-
ум-кристаллизационных установках. Предназначенную для трав-
ления металла серную кислоту часто используют при этом предва-
рительно в качестве высаливающего средства. Вымораживание
железного купороса при охлаждении травильного раствора холо-
дильным рассолом или выпаривание его с последующим вымора-
живанием 44 являются менее экономичными способами.
Высаливание железного купороса можно также производить
ацетоном и бутиловым спиртом. При смешении 1 л ацетона с 1 л
травильного раствора можно выкристаллизовать до 85% желез-
ного купороса 45’46.
Заслуживает внимания предложение47 регенерировать травиль-
ные растворы их нагреванием. При этом сульфат железа, раство-
римость которого с повышением температуры выше 64° умень-
шается, выделяется в виде FeSO4-H2O, а маточный раствор воз-
вращается на травление. Из раствора, насыщенного FeSO4-H2O,
можно выделять это соединение в твердую фазу высаливанием,
добавляя при 65—85° FeSO4 • 7Н2О48.
Если выделение железного купороса производится охлажде-
нием отработанного травильного раствора, содержащего а%
FeSO4, а в остающемся маточном растворе b°/0 FeSO4, то из
1000 кг травильного раствора будет получено 1,83хкг FeSO4-7H2O
или х кг FeSO4, причем
(а —6)-1000
Х~ 100— 1,836
10х
а степень извлечения FeSO4 из травильного раствора будет—%.
Если производить охлаждение отработанного травильного рас-
твора с одновременным введением в кристаллизатор серной кис-
лоты в количестве т кг на 1000 кг травильного раствора, то:
(а — Ь) • 1000 — Ьт
Х~ 100—1,836 . ..
Т.ак; если отработанный травильный раствор, имеющий , плот-
ность 1,275 г[см\ содержащий 300 г/л или 23,5% FeSO4 и 1—2%
Получение железного купороса из травильных растворов 703
H2SO4, охладить до ~30°, он станет насыщенным (см. рис. 194,
табл. 46). При дальнейшем охлаждении до 3—4° концентрация
маточного раствора станет равной 14% FeSO4. При этом из 1 т
травильного раствора будет получено 234 кг FeSO4-7H2O, а сте-
пень извлечения FeSO4 составит 54%. Если же охладить раствор
только до 30°, но с одновременной добавкой в кристаллизатор
0,25 т 75%-ной серной кислоты на 1 т отработанного травильного
раствора для повышения кислотности маточного раствора до
~ 16% (200г/л H2SO4), то из 1 г травильного раствора будет полу-
чено 75 кг FeSO4-7H2O, а степень извлечения FeSO4 составит в од-
ном цикле 17,5%. Но при высаливании серной кислотой с одно-
временным охлаждением до 3—4° выхрд железного купороса из
1 т травильного раствора составит ~290 кг, а степень извлечения
FeSO4 в одном цикле ~67%. При работе на замкнутом цикле,
т. е. с возвратом всего маточного раствора на травление, весь об-
разующийся сульфат железа может быть выделен в виде желез-,
кого купороса.
ТАБЛИЦА 46
Растворимость FeSO4 в водных растворах серной кислоты
Темпера- Растворимость FeSO4 (в %) при содержании в-растворе H2SO4 (в X)
тура, 0 2 4 7 . 10 15 20 35 ’
0 13,6 12,9 12,0 10,8 9,5 7,2 5,5 3,4
5 15,2 14,4 13,5 12,0 10,7 8,0 6,5 4,7
10 17,2 16,1 15,2 13,7 12,3 16,1 8,2 6,6
20 ' 20,9 19,7 18,4 16,8 15,7 13,3 11,2 9,5
25 23,0 21,4 20,4 18,6 17,3 15,0 12,8 11,4
30 24,8 23,1 22,0 20,5 19,2 16,9 14,8 13,2
Воздушное охлаждение травильного раствора, предварительно
отстоявшегося в течение 2—3 ч от окалины и других примесей, осу-
ществляют иногда в установленных вне здания под навесом ба-
ках-кристаллизаторах 49. Кристаллы железного купороса оседают
на стенках кристаллизаторов и на опущенных в них щитах. Сте-
пень извлечения FeSO4 составляет 48%. Перемешивание раствора
способствует его охлаждению и ускоряет кристаллизацию. Воздуш-
ное охлаждение протекает медленно и может быть использовано
лишь на установках малой производительности. Поэтому во мно-
гих случаях осуществляют кристаллизацию с применением водя-
< ного охлаждения 50'51.
Вакуум-кристаллизационные установки
Наиболее эффективным методом выделения сульфата железа
из травильных растворов является вакуум-кристаллизация50. При
остаточном давлении в кристаллизаторе 25—10 мм рт. ст. раствор.
704
Гл. XVIII. Соединения железа
Рис. 195. Вакуум-кристаллизационная уста-
новка непрерывного действия:
1 — мерник отработанного травильного раствора*
2— мерник серной кислоты; 3 — вакуум-кристалли;
затор; 4 — главный эжектор первой ступени сжатия*
5 —главный конденсатор; 6, 7 и в— эжекторы вто-
рой, третьей н четвертой ступеней сжатия; 9 — яро
межуточный сдвоенный конденсатор; 10— баро-
метрический сборник; 11 — водоотделитель;12 — кон-
денсационный горшок; 13 — насос; 14 — сборник
кристаллической пульпы; 15 — центрифуга.
кипит при 5—10°. Охлаждение раствора достигается за счет его]
самоиспарения. Вакуум создается в аппаратах при помощи паро- ]
струйных эжекторов, в которых смешиваются пар высокого и низ-]
кого давлений. Применением многоступенчатых эжекторов повы- ]
шается их коэффициент полезного действия и значительно сокра-1
щается расход пара. Другим способом сокращения расхода пара 1
является ступенчатое испа- 1
рение раствора при разных 1
температурах. 1
В растворе, поступаю-]
щем на кристаллизацию из ]
травильных ванн с темпе- |
р ату рой 63—65°, содер- ?
жится ~ 10% H2SO4 и 18% I
FeSO4. В кристаллизатор
добавляют серную кислоту
в количестве, необходимом
для получения маточного
раствора с концентрацией
~ 23% H2SO4. Получающий-
ся маточный раствор со-
держит 6,9—7% FeSO4. При
этом на 1 т расходуемой на
травление 76 %-ной серной
кислоты получается 8,7—
8,8 г травильного раствора,
из которого испаряется при
кристаллизации 0,73 т воды.
Теоретический выход железного купороса на 1 т перерабатывае-
мой кислоты равен 2,16 т. Вследствие потерь раствора с металлом,
с парами воды и других, практический выход составляет 1,8—2 т.
Вакуум-кристаллизационные установки периодического дейст-
вия позволяют выдерживать раствор в кристаллизаторе в течение
любого времени. Их используют в травильных цехах небольшой
производительности при расходе на травление металла до.2000 т
76%-ной серной кислоты в год. Каждый кристаллизатор рассчиты-
вают на производительность, соответствующую годовому потреб-
лению 500—750 т 76%-ной серной кислоты. Расход пара на эжек-
цию составляет 0,825 т на 1 т железного купороса.
При непрерывном процессе вакуум-кристаллизации расход па-
ра значительно сокращается. Он зависит от числа корпусов уста-
новки. В четырехкорпусной установке он составляет ~0,5 т на
1 т железного купороса. Однако установки непрерывного действия
более сложны в эксплуатации. На рис. 195 показана схема одной
из таких установок. Охлаждение раствора происходит в четырех .
последовательно соединенных кристаллизаторах. Кристаллизаторы
Получение железного купороса из огарков
705
снабжены якорными или пропеллерными мешалками. Аппараты
изготовляют из нержавеющей стали, их внутренняя поверхность
гуммируется для защиты от коррозии. Однако защитный слой ре-
зины сравнительно быстро изнашивается; эрозия вызывается пере-
мешиванием.
Смесь отработанного травильного раствора и свежей серной
кислоты охлаждается в первом корпусе от 60 до 40°, во втором —
до 30°, в третьем — до 22° и в четвертом — до 10°. Пары из пер-
вого и второго корпусов поступают в главный конденсатор, разде-
ленный по высоте на две части, работающие под разным давле-
нием (45 и 34 мм рт. ст.), что позволяет эффективней использовать
охлаждающую воду. В нижнюю часть конденсатора входит пар
из первого корпуса, в верхнюю — из второго. Пары из третьего и
четвертого корпусов вначале сжимаются до 34 мм рт. ст. в первой
ступени сжатия в двух параллельно работающих эжекторах, а
затем идут в верхнюю часть главного конденсатора. Несконденси-
ровавшаяся часть пара, выходящая из основного конденсатора,
после сжатия эжекторами второй ступени направляется последо-
вательно на промежуточную конденсацию, затем на сжатие в
третью ступень, на дополнительную конденсацию и, наконец, после
сжатия в четвертой ступени выбрасывается в атмосферу. Выходя-
щая из четвертого корпуса кристаллизационной установки пульпа
поступает на центрифугирование для отделения железного купо-
роса от маточного раствора.
За рубежом работают несколько установок, на которых выде-
ленный из отработанных травильных растворов железный купорос
подвергается термохимическому разложению; получающийся сер-
нистый газ перерабатывают в серную кислоту.
Отработанные травильные растворы предложено 52'53 перераба-
тывать в азотно-железистые удобрения аммонизацией их аммиа-
ком или аммиачной водой. В результате реакции
FeSO4 + 2Н2О + 2NH3 = (NH4)2SO4 + Fe(OH)2
получается суспензия, которая может содержать до 300 г/л суль-
фата аммония. Травильный раствор можно предварительно ис-
пользовать для улавливания окислов азота из выхлопных нитроз-
ных газов, а затем его аммонизировать.
Описан способ обработки кислого травильного раствора коксо-
вым газом, содержащим NH3. Ион железа при этом окисляется
кислородом с образованием магнетита, который отфильтровы-
вают— остается раствор сульфата аммония54.
ПОЛУЧЕНИЕ ЖЕЛЕЗНОГО КУПОРОСА ИЗ КОЛЧЕДАННЫХ ОГАРКОВ
Для этой цели лучше использовать колчеданный огарок, охлаж-
денный после обжига колчедана без доступа воздуха40, обладаю-
щий магнитными свойствами и содержащий некоторое количество
М. Е. Позин
ТС6
Гл. XVIII. Соединения железа
сульфида. Его примерный состав: 45% Fe2O3, 25% FeO и 10—15%
FeS. При обработке его серной кислотой образуются сульфаты за-
киси и окиси железа:
FeO + H2SO4 = FeSO4 + Н3О
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Наряду с этим образующийся при разложении сульфида серо-
водород восстанавливает сульфат окиси железа:
Fe2(SO4)3 + H2S = 2FeSO4 + H2SO4 + S
При недостатке сульфида для восстановления сульфата окиси
железа применяют металлическое железо:
Fe2(SO4)3 + Fe = 3FeSO4
Разложение огарка серной кислотой проводят в котле с мешал-
кой в течение 5—10 мин. Перемешивание прекращают и массу вы-
держивают в реакторе еще 30 мин. За это время она превра-
щается в твердый пористый продукт — частично оводненный суль-
фат закиси железа. Его растворяют в воде и раствор после
отстаивания направляют на кристаллизацию семиводного желез-
ного купороса. Для получения 1 т железного купороса расходуют:
0,3—0,35 т колчеданного огарка, 0,45—0,5 г серной кислоты (100%),
0,13—0,14 т металлического железа и 1,5 г пара.
Изучено взаимодействие сульфидов железа с серной кислотой.
Сульфатизация FeS с выделением H2S протекает бурно уже при
50—60°, сульфатизация FeS2 начинается при 200° и идет медленно
с выделением SO2 и S; для полного превращения FeS2 при 300°
необходим большой избыток кислоты55.
Железный купорос может быть получен из колчеданного огарка
сульфатизацией его в присутствии воды сернистым газом56:
2Fe2O3 + 6H2SO3 + ЗО2 = 2Fe2(SO4)3 + 6Н2О
Fe2(SO4)3 + SO2 4- 2Н2О = 2FeSO4 + 2H2SO4
СУЛЬФАТ ОКИСИ ЖЕЛЕЗА
Сульфат окиси железа получают обычно растворением окиси
железа в 75—80 %-ной серной кислоте.
Растворы сульфата окиси железа могут быть получены окисле-
нием серного колчедана азотной кислотой 57’58:
2FeS2 + 10HNO3 = Fe2(SO4)3 + H2SO4 + 4H2O + 10NO
Железный коагулянт (стр. 706) с низким содержанием суль-
фата закиси железа и свободной серной кислоты предложено по-
лучать обработкой колчеданного огарка горячей серной кислотой.
Просеянны-й огарок предварительно должен быть обработан кон-
центрированной азотной. кислотой (в количестве 8—10 кг на 1 т
Хлориды железа
707
коагулянта). Окисленный огарок перемешивают и выдерживают
перед варкой коагулянта в течение 5—6 ч59.
Основной сульфат окиси железа может быть получен в про-
цессе переработки концентрата сульфидов металлов, состоящего
главным образом из сульфида железа и содержащего сульфиды
меди, никеля, кобальта. Водную пульпу концентрата с 10—40%
твердой фазы перемешивают I—3 ч в автоклаве при 220—240° и
давлении 30—100 ат в присутствии кислорода. При этом сульфиды
Си, Ni, Со окисляются в растворимые сульфаты, а железо осаж-
дается в виде основного сульфата 60.
ХЛОРИДЫ ЖЕЛЕЗА
Самый простой способ получения хлоридов железа—это рас-
творение металлического железа, закиси или окиси железа в соля-
ной кислоте. Раствор FeCl2 получается также при травлении сталь-
ных изделий соляной кислотой. Хлорное железо можно получить
из хлористого хлорированием суспензии или раствора FeCl2 или
окислением его кислородом воздуха. Получаемый раствор FeCU
выпаривают до концентрации, при которой он при остывании за-
твердевает в кристаллический продукт FeCl3 • 6Н2О. Такой продукт
получается и в качестве отхода от некоторых производств, в част-
ности в производстве брома в процессе очистки бромо-воздушной
смеси от примеси хлора раствором бромида железа.
Прямое получение хлоридов железа утратило свое значение в
связи с развитием производства различных продуктов (Т1С14, А1С1з
и др.) горячим хлорированием руд (см. гл. XL) с образованием
значительных количеств хлоридов железа, являющихся побочными
продуктами. В связи с ограниченностью потребности в них возни-
кает необходимость дальнейшей их переработки с целью регене-,
рации хлора.
За границей все большее распространение получает изготовле-
ние безводного хлорного железа FeCl3 горячим хлорированием
окиси железа или железной руды в присутствии восстановителя61.
Хлористое железо получается при обработке материала, содер-
жащего окись железа, смесью равных объемов хлористого водо-
рода и водорода. Температура твердой фазы повышается в печи
за счет тепла реакции от 260 до 650° 62-63. Описано получение без-
водного хлористого железа по реакции
2FeCl3 + С6Н.С1 = 2FeCl2 + СвН4С12 + НС1
при 140° в стальном реакторе (футерованном стеклом) с обратным
холодильником; в атмосфере азота выход 99,6% 64.
Получаемая при хлорировании никелевой руды в присутствии
восстановителя смесь FeCl2 и NiCl2 может быть разделена пропу-
сканием через металлическое железо при 1200—1300°. При этом
23*
708
Гл. XVIII. Соединения железа
хлористый никель восстанавливается до металла и единственным 1
газообразным продуктом является хлористое железо65. э
Предложены разные способы регенерации хлора или хлори-
стого водорода из отбросных хлоридов железа. При взаимодей-
ствии хлорного железа с воздухом при 600—800° образуются окись
железа и хлор 66. Выделение хлорида железа из отработанного со-
лянокислого травильного раствора можно производить высалива-
нием его хлористым водородом. Образующийся при этом соляно-
кислотный раствор используется для травления металла 67’68 (см.
гл. XI).
Запатентован69 способ регенерации сернокислого травильного
раствора насыщением его хлористым водородом (после упарива-
ния). Образующаяся по реакции
FeSO4 + 2НС1 = FeCl2 + H2SO4
серная кислота возвращается на травление, a FeCl2 подвергается
гидротермической обработке для превращения в окислы железа и
хлористый водород, возвращаемый на регенерацию травильного
раствора. Гидролиз хлористого железа водяным паром по реакции
3FeCl2 + 4Н2О = Fe3O4 + 6НС1 + Н2 + 75,44 ккал
целесообразно проводить при 450—650° (при 300° в равновесной
газовой фазе содержится всего ~1% НС1). При 650° скорость
гидролиза очень велика и реакция практически завершается за
15—20 мин70.
Описана регенерация солянокислых травильных растворов
с помощью жидкого анионообменника 71 и ионообменных смол 72.
О других способах регенерации солянокислых травильных раство-
ров см.73’ 74.
Хлорное железо может быть извлечено из солянокислых рас-
творов (с целью их очистки от железа) некоторыми сложными
эфирами и кетонами, в частности трибутилфосфатом 75 и диэтило-
вым эфиром. Сущность механизма экстракции заключается в из-
менении диэлектрической проницаемости водной фазы под влия-
нием кислот или солей, в результате чего работа отрыва молекул
гидратированного хлорного железа становится равной работе
сольватации их эфиром. На основании этого высказано мнение,
что появление в эфирной фазе HFeCl4 является вторичным про-
цессом, не имеющим, вопреки установившимся взглядам, непосред-
ственного отношения к механизму реакции 76.
ПОЛУЧЕНИЕ ОКИСЛОВ ЖЕЛЕЗА И ИХ ГИДРАТОВ 1
При окислении свежеосажденного гидрата закиси железа кис- *
лородом воздуха образуются не растворимые в воде основные соли
окиси железа и некоторые формы гидратированной окиси железа.
Они применяются в качестве пигментов, называемых марсами.
Получение окислов железа и их гидратов
709
В зависимости от относительного содержания Fe2O3, SO3, Н2О, от
температуры осаждения и от pH среды, в которой происходит окис-
ление гидрата закиси железа, окраска марсов изменяется от жел-
той до красной. Осаждение гидрата закиси железа производят
обработкой раствора FeSO4 (200—250 г/л) 10% раствором соды
или 10%-ной суспензией мела в воде. Осаждение следует вести на
холоду, при pH, равном в конце процесса 5,5—5,8. Окисление про-
изводят при этом же значении pH с постепенным добавлением
осадителя по мере снижения pH в процессе окисления. При сус-
пендировании гидрата закиси железа в воде, т. е. в отсутствие ма-
точного раствора, окисление протекает значительно быстрее77.
Из гидратов окиси железа наибольшее значение имеет моно-
гидрат окиси железа FeO • ОН или Fe2O3- Н2О, применяемый в ка-
честве желтого пигмента. Он имеет очень яркий и чистый охряно-
желтый цвет с оттенками от лимонно-желтого до оранжевого.
Выше 150—200° желтая окись железа обезвоживается и переходит
в красную окись железа. При 275—300° этот процесс протекает
весьма быстро.
Желтую окись железа получают в производственных условиях
путем окисления воздухом металлического железа, погруженного
в зародышевую суспензию — раствор сернокислого (или хлори-
стого) железа, содержащий взвесь свежеосажденной гидроокиси
железа. Процесс ведут при 65—70° в течение 48 ч и более. Жел-
тую окись железа получают также в качестве побочного продукта
в процессе образования ароматических аминов восстановлением
нитросоединений металлическим железом (в частности, при полу-
чении анилина) в присутствии солей Al, Cr, Sn и некоторых других
1 элементов 78.
Желтый гидрат окиси железа Fe(OH)3 или Fe2O3 • ЗН2О (жел-
тый марс) получают или взаимодействием хлористого железа
с мелом и окислением осадка воздухом или непосредственным
окислением углекислого железа воздухом.
При осаждении хлористого железа и окислении образующегося
осадка протекает реакция:
2FeCl2 + 2СаСО3 + ЗН2О + 0,5О2 = 2Fe(OH)3 + 2СаС12 + 2СО2
Для ускорения окисления к раствору хлористого железа кон-
центрацией 50—100 г/л FeCl2 добавляют 3—5% NaNO2 или ZnCl2.
Мел вводят в количестве 100—120% от веса FeCl2. Затем через
массу пропускают воздух. Образующийся осадок промывают, филь-
труют и сушат при температуре не выше 80°.
По другому методу желтый гидрат окиси железа получают пу-
тем предварительного выделения углекислого железа взаимодей-
ствием FeSO4 и Na2CO3 и последующего его окисления:
2FeSO4 + 2Na2CO3 = 2FeCO3 + 2Na2SO4
2FeCO3 + пН2О + 0,5O2 = Fe2O3 nH2O + 2CO2
710
Гл. XVIII. Соединения железа
Окисление ведут или воздухом при 20—25° в течение 10—12 ч
или раствором бертолетовой соли при 50—60°. В последнем случае
окисление заканчивается в течение 3—4 ч.
Окись железа — красный железоокисный пигмент — в зависи-
мости от условий получения может иметь различные оттенки — от
оранжево-красного до синеватого и даже фиолетово-красного.
Красную окись железа получают либо прокаливанием железного
купороса или гидрата окиси железа, либо из колчеданных огарков.
Разложение железного купороса при 650—700° идет до конца
с образованием окиси железа:
2FeSO< = + SO2 4- SOg
При более низких температурах (400—600°) продуктами раз-
ложения являются основные сернокислые соли Fe2O3 • /nSO3 • nH2O.
Для получения окиси железа железный купорос вначале обезво-
живают в барабанных сушилках воздухом, нагретым до 250—300°,
а затем прокаливают в муфельных или пламенных печах. При
сушке с ретуром (возвратом части обезвоженного сульфата) воз-
можно применять воздух, нагретый до 350°.
На современных предприятиях красные железоокисные пиг-
менты получают, просасывая через перемещающийся на конвейере
слой железного купороса горячий топочный газ и перегретый во-
дяной пар. При этом последовательно идут процессы дегидратации,
окисления и разложения сульфата до окиси железа. Таким же спо-
собом готовят желтые железоокисные пигменты, но с другим ре-
жимом прокаливания 79. Чем выше температура прокаливания, тем
меньше в продукте примеси сульфата. Но прокаливание при 850°
и выше вызывает наряду с уменьшением содержания сульфата
резкое снижение удельной поверхности окиси железа за счет спе-
кания частиц — размеры частиц увеличиваются до ~3000 А. При
более низкой температуре получается продукт с частицами раз-
мером 150—200А 80.
Природная окись железа — железный сурик — является одним
из важнейших пигментов. Его производство базируется главным
образом на красковых рудах Криворожского месторождения. Пиг-
ментные свойства (перетираемость, цвет, коррозионная стойкость)
зависят от степени измельчения и содержания окиси железа. Вы-
сококачественный сурик получают путем термической обработки
природного при 600° и микроизмельчении на пароструйных мель-
ницах 79.
Для получения окиси железа из колчеданных огарков их под-
вергают классификации для выделения наименее загрязненных
фракций. Последние размалывают и промывают водой для удале-
ния примесей. После высушивания продукт содержит 90% Fe>03,
6% SiO2, 2,5% А12О3 и имеет темный фиолетово-красный цвет.
Получение окислов железа и их гидратов
711
Получение закиси-окиси железа Fe3O4 основано на взаимодей-
ствии гидратов окиси и закиси железа:
2Fe(OH)3 + Fe(OH)2 = FeO • Fe2O3 + 4H2O
Обычно исходят из гидрата закиси железа, который подвергают
окислению. Образующийся гидрат окиси железа при этом вступает
во взаимодействие с еще не окислившимся гидратом закиси же-
леза. Источником гидрата закиси железа может служить углекис-
лое железо, которое гидролизуется при нагревании:
FeCOj f- Н2О = Fe(OH)2 + СО2
Углекислое железо получают взаимодействием раствора же-
лезного купороса (концентрацией 200—300 г/л FeSO4 • 7Н2О) и
раствора соды (концентрацией 100—150 г/л). Образующуюся сус-
пензию нагревают до 80—90° и затем через нее пропускают воз-
дух. Окисление длится 20—30 ч 81.
Окись-закись железа Fe3O4, пригодную для приготовления масс,
применяемых в магнитной звукозаписи, можно получить осажде-
нием Fe(OH)2 при обработке раствора FeSO4 10 н. раствором
NaOH с последующим окислением Fe(OH)2 водным раствором
NaNO3 82. Fe3O4 получают также восстановлением окиси железа
водородом и другими восстановителями83. Магнетит и окись же-
леза с магнитными свойствами получают окислением металличе-
ского железа или термическим разложением карбоната или окса-
лата железа.40’84, или термической обработкой окиси железа выше
600° для изменения ее кристаллической структуры; обычно при
этом материал подвергают последовательному восстановлению до
Fe3O4 и окислению до Fe2O3 85.
Окись железа может быть получена из растворов солей двух-
валентного железа при окислении газообразными окислителями
под давлением. Предварительно понижая pH раствора до 2—6,
отделяют примеси, затем раствор подщелачивают до pH ~ 9,6,
подогревают его до 95° и обрабатывают окислителем под давле-
нием ~2 ат. После промывки и сушки образовавшегося осадка
Fe(OH)3 получается темно-коричневая с красным оттенком окись
железа 86.
Окись железа Fe2O3 можно также получить при гидролизе FeCl3
с небольшим избытком пара при 400—800° на контактной поверх-
ности частиц огнеупорного материала (из Fe2O3, SiO2, А12О3 и др.),
находящихся во взвешенном состоянии87.
Предложено перерабатывать железный купорос на гидроокись
железа и твердый сульфат аммония без выпаривания. Для этого
железный купорос FeSO4-7H2O окисляют кислородом воздуха
в оксисульфат Fe2O(SO4)2. Последний загружают в насыщенный
Раствор сульфата аммония и обрабатывают суспензию газообраз-
ным аммиаком в молярном отношении 1 : 1 88.
712
Гл. XVIII. Соединения железа
Железоокисный пигмент коричневого цвета, пригодный для ма-
лярной краски, может быть получен из пыли, накапливающейся
в электрофильтрах при очистке сернистого газа колчеданных пе-
чей. Для этого пыль, представляющую собой тонкодисперсную
окись железа, содержащую разные примеси, обрабатывают слабой
аммиачной водой или маточным раствором аммонийных солей для
перевода находящихся в ней сульфатов в гидраты 89’90.
ЛИТЕРАТУРА
1. А. П. Б ел о п о л ь с к и й, С. Я. Шпунт и др., ЖПХ, 14, 716 (1941); 21,
781, 794 (1948); 23, № 2 (1950). — 2. Lorant Bela, Z. analyt. Chem., 219, № 3,
256 (1966). — 3. Г А. Захарченко, В. А. Цицорин, ЖПХ, 22, Ns 7, 703
(1949); 24, Ns 7, 779 (1951). — 4. H. Ш. Сафиулин, Там же, 32, № 10, 2178
(1959). — 5. М. Е. П о з и н, А. М. Г и н с т л и н г, Там же, 23, № 11, 1149 и
№ 12, 1245 (1950); 24, № 2, 134 (1951).— 6. С. А. Амитова, В. В. Печков-
ский, Б. С. Камеко, А. Ф. Степанова, Уч. зап. Пермск. гос. ун-та, 17, 61
(1960). — 7. В. В. Печковский, ЖПХ, 23, 2613 (1959). — 8. В. В, Печков-
ский, А. Г. Звезд ин, С. В. Островский, Там же, 36, Ns 7, 1454 (1963).—
9. В. В. Печковский, А. Н. К е т о в, Труды Пермск. политехи, ин-та, Ns 10,
1961, стр. 3. —10. С. А. Амирова, В. В. Печковский, А. Н. Кетов,
Гам же, стр. 33.
11.3. Dankiewicz, J. Kopczynski, W. Stelmachowski, Przem.
Chem., 10, № 3. 121 (1954). — 12. С. А. Гордон, M. А. Менковский, ЖНХ,
2, № 1, 30 (1957). — 13. Л. С. Гецкин, А. Г. Батюк, П. П. Ц ы б, Цветные
металлы, 7, 23 (1957). —14. В. В. Печковский, Н. Л. Субочева, ЖПХ,
32, № 8, 1857 (1959).— 15. С. Д. Шаргородский, Р. И. Заславская,
Укр. хем. ж., 21, № 6, 694 (1955). —16. А. П. Богуславский, В. В. Уру-
сов, ЖПХ, 21, № 9, 903 (1948). —17. И. Н. Кузьминых, Хим. пром., № 10,
24 (1945). — 18. Н. Е. Keyes, Chem. Met. Eng., 57, № 5, 126 (1946).—
19. M. E. П о з и н, И. П. М у х.л е н о в, Л. С. Василеску, ЖПХ, 28, № 6, 573;
Ns 7, 681 (1955). — 20. Л. С. Гецкин, В. Д. Пономарев, Там же, 29, № 7,
981 (1956).
21. Англ. пат. 1056262, 1963.—22. В. О. А. Н е d s t г о m, Arkiv kemi, 6,
№ 1—2, 1 (1953). —23. Б. А. Рязанов, ЖОХ, 24, № 9, 1477 (1954).—
24. Н. В. Шишкин, И Г. Шубцова, Уч. зап. Саратовск. ун-та, 34, 29
(1954). —25. W. F. Link, J. Phys. Chem., 60, № 1, 91 (1956). —26. А. Н. Ива-
нов, С. Н. Алешин, Доклады Московск. с.-х. акад. им. Тимирязева, в. 22,
1956, стр. 386. — 27. В. Р. G у а п i, М. Rani, J. Indian Chem. Soc., 31, № 7 499
(1954). — 28. В. Ф. Бойко, ЖОХ, 25, № 7, 1250 (1955). — 29. G. A. Gamlen,
D. О. Jordan, J. Chem. Soc., 1953, Ns 5, 1435. — 30. К- H. Gayer, L. Woont-
n e r, J. phys. Chem., 60, Ns 11, 1569 (1956).
31. F. J. S h i p k o, D. L. Douglas, ibid., 1519, 1522.—32. В. И. Орлов,
П. В. Попов, M. А. Морозова, М. Г. Габриелов а, Ядохимикаты (ин-
еектисиды и фунгисиды), Госхимиздат, 1946.— 33. А. Л. Ефимов, Химический
метод борьбы с вредителями и болезнями сельскохозяйственных растений, Сель-
хозгиз, 1949. — 34. Н. Н. О тв аги н, Хим. пром., Ns 8, 19 (19451. — 35. J. О. Per-
cival, С. Р. Dyer, М. Н. Taylor, Ind. Eng. Chem., Ns 12 (1941). — 36. R. L e-
v i e 1, Ind. Chim., 4, № 6, 499, 45 (1959). — 37. J. P r c h 1 i k, L. H 1 i n 3 k, D. К a r-
t a k о v a, Paliva, 35, № 6, 157 (1955). — 38. Г. П. Г p и г о p ь e в, Д. Г. Т р а б е р,
Труды ЛТИ целлюлозно-бумажной промышленности, Ns 3, 1955, стр. 107.—
39. Р. Н. Johnson, Mining Eng., 17, № 8, 64 (1965).—40. R. R о b 1, Ang.
Chem., 70, № 12, 367 (1958),
Литература
713
' 41. R. К. Rathmelle, пат. США 3261655, 1962. —42. Sulphur, № 70, 33
(1967). — 43. Ив. Радулова, П. Брайкова, Лека пром., 5, № 1, 41
(1956). — 44. П. В. Дыбина, Технология минеральных солей, Госхимиздат,
1949. — 45. Chem. Met. Eng., 1003 (1943). — 46. Е. Б. Конюхова, И. Н. Шо-
хин, А. Г. Кузнецова, Труды МХТИ, в. 56, 1967, стр. 120, 202; в. 60, 1969,
стр 36, 40.—41. R. Н а а г m а п п, пат. ФРГ 918428, 1954. — 48. Голланд, пат.
111813, 1958. —49. Н. И. Шефтель, Сталь, № 7, 655 (1954). — 50. Н. Ф. С е р и-
к о в, Там же, 651.
51. Sulphur, № 75, 30 (1968). — 52. С. Н. Г а н з, А. И. Лукьяница,
Л. А. Бе л ьч и на, ЖПХ, 37, № 7, 1606 (1964). — 53. J. Illinicz, Probl.
projekt. huln. i przem. maszyn., 16, № 5, 155 (1968). — 54. К. Там аки и др.,
«Фудзи Сэйтецу Гихо, Techn. Rep. Fuji Iron and Steel Co», 14, № 3, 370
(1965). — 55. А. П. С н у p н и к о в, В. Ф. Ларин, ЖПХ, 39, № 12, 2634 (1966).—
56. Цзян Жун-гуан, Лэй Цзы-ци, Лэй, X у и - к а н, Хуасюэ Шицзе,
№ 10, 475 (1955). — 57. С. А. Г о р д о н, М. А. М е н к о в с к и й, Сборник научных
работ Московск. горного ин-та, в. 1, 1957, стр. 61. — 58. В. С. Каминский,
С. Я. Л е й т к е, Хим. пром., № 2, 138 (1960). — 59. А. И. Эттингер, 3. Я. Г о-
ро дишер, Д. М. Корф, Н. И. Самарин, авт. свид. 80463, 1949; Бюлл.
изобрет., Ns 3, 1941 (1950). — 60. W. R. McCormic, пат. США 2718455, 1955.
61. J. Heubel, Bull. Soc. chim. France, 1954, № 11—12, 1473.— 62. M. E. G r a-
h a m, A. S. Henderson, J. P. Whitehouse, пат, США 2665191. — 63. Австр.
пат. 153627, 1953. — 64. К. L. Piggott, A. F. Reid, Р. С. W a i 1 е s, Austral.
J. Appl. Sci., 15, Ns 3, 186 (1964). — 65. M. E. Graham, E. A. В e i d 1 e г, пат.
США 2677594, 1954. — 66. R. H. Sawyer, пат. США 2642339, 1953, — 67. Metal
Progress, 64, № 4, 134, 136 (1953). — 68. O. R u n t h e г, англ. пат. 703142, 1954.—
69. Пат США 2785957, 1955.-70. М. В. Ионин и др., ЖПХДЗЗ, № 12, 2651
(1960); 35, № 4, 900 (1962).
71. Н. Wiedmann, Wasser, Lull u. Betrieb, 10, № 3, 154, 159, 183 (1966).—
72. X. Tamura a. oth., J. Chem. Soc. Japan. Ind. Chem. Soc., 69, № 5, 1018
(1966). —73. А. H а к e, Sheet Metal Ind., 42, Ns 461, 696 (1965); 43, № 474, 718..
(1966); Metallurgie et constr. mec., 97, Ns 7, 553 (1965). — 74. G. Diez, P. N i e d-
ner, Ind.-Anz., 87, Ns 56, 1303 (1965). — 75. О. Д. Л я x, И. А. Ш e к а, А. И. Пер-
фильев, ЖПХ, 39, Ns 8, 1799 (1966). — 76. E. И. Денисов, А. С. X а л о н и н,
Там же, 38, № 2, 295 (1965). — 77. Я. М. Песин, М. А. Штерн, Е. М. Горо-
децкий Хим. пром.. Ns 6, 11 (1948). — 78. И. Р и с к и н, Т. Великое л а-
винская, ЖПХ, 19, 149, 263. 271 (1946). — 79. М. А. Штерн, И. С. Ша-
пиро, Лакокрасочные материалы и их применение, № 5, 28 (1967).—
вО. Н. М. Сорокина, И. Г. Бляхер, Л. Н. К а л и т и н а, ЖПХ, 38, Ns 12,
2844 (1965).
81. Е. Ф. Беленький, И. В. Рискни, Химия и технология пигментов,
Госхимиздат, 1960. — 82. Р. Р. Zaponni, англ. пат. 701433, 1953.—
вЗ. В. И. Рождественский, В. Г. К о с я г и н, Л. М. Г асанова, Труды
Саратовск. ин-та «Гипрониигаз», Ns 5, 1966, стр. 343. — 84. W. Wolski,
A- Kwiatkowski, Przem. chem, 46, № 7, 407 (1967). — 85. Япон пат 11733
I960; 10307, 1961, —86. С. С. Clarke, пат. США 2656282, 1953. — «7. L. Ree-
ve, англ. пат. 701797, 1954. — 88. F. Limmerhakl, чехосл. пат. 84026, 1955.—
°9. А. А. Коринфский, Хим. пром., № 10—11, 35 (1944). — 90. Правила и
нормы техники безопасности и промышленной санитарии для строительства и
эксплуатации производств железоокисных пигментов, Госхимиздат, 1962.
Глава XIX
СУЛЬФАТ И ХЛОРИД ЦИНКА
Соединения цинка имеют большое значение в металлургиче-
ской, лакокрасочной и химической промышленности. Важнейшими
из них являются цинковый купорос и хлорид цинка. Другие со-
единения — окись и гидроокись, сульфид цинка и прочие — играют
роль сырья, полупродуктов и продуктов в ряде производств. Здесь
рассмотрены некоторые свойства главнейших соединений цинка и
технология цинкового купороса и хлорида цинка.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Окись цинка ZnO — порошок белого цвета с плотностью
5,42 г]см3. При нагревании ZnO принимает желтую окраску. Выше
1100° начинает возгоняться. Плавится под давлением 52 ат при
2000°. Восстановление ZnO углеродом и окисью углерода начи-
нается при температуре возгонки металлического цинка (910—
920°) и протекает полностью при 1200—1300°.
Окись и гидроокись цинка Zn(OH)2 легко растворяются в кис-
лотах. Zn(OH)2 растворяется в водных растворах аммиака, при-j
чем ее растворимость возрастает с увеличением концентрации NHJ
вследствие образования комплексных гидроокисей [Zn(NH3)2](.OH)2 *1
При взаимодействии 1 н. растворов ZnSO4 и NaOH при 20°|
выделяется осадок основной соли ZnSO4 • 3Zn (ОН)2 • хН2О, мед-1
ленно реагирующий со щелочью. Выше 68° осаждается Zn(OH)22.l
При растворении Zn(OH)2 в разбавленных растворах NaOH обра-1
зуются ионы HZnO2 и ZnO2C При 25° первая константа кислот-1
ной диссоциации3 Zn(OH)2[Zn(OH)2 (тв.) = Н++ HZnO2] равна!
1,2 • 10'17. Вторая константа диссоциации [Zn(OH)2 (тв.) - 2Н++|
+ ZnO2”]paBHa 2,2 • 10"30. Соответственно, константа диссоциации
HZnO2 [HZnO2 = Н++ ZnO2~] равна 1,83 • 10-13. При нагревании
Zn(OH)2 начинает разлагаться на ZnO и Н2О уже при 35°, ,но ин-
Физико-химические свойства
715
тенсивно процесс идет при 100—160° и заканчивается при 200°4.
По другим данным5, температура разложения Zn(OH)2 130°.
Сульфид цинка ZnS имеет плотность около 4 г]см\ Он не пла-
вится, но с другими сульфидами (Cu2S, FeS, PbS и пр.) образует
легкоплавкие штейны6. При нагревании ZnS сублимируется. Так,
например, при 1000° за 30 мин потеря в весе составляет 0,4%. При
давлении 10-4 мм рт. ст. за 1 ч улетучивается -~23% ZnS при 900°
и 78% при 975°. В присутствии восстановителей наряду с суб-
лимацией имеет место также восстановление сульфида цинка. Ско-
рость сублимации уменьшается, а скорость восстановления увели-
чивается с повышением давления окиси углерода. В водородной
среде при повышении давления Н2 возрастают и скорость субли-
мации и скорость восстановления. Это связано с большей ско-
ростью диффузии молекул сульфида от твердой поверхности в га-
зовый объем. Давление пара над сульфидом цинка (в мм рт. ст.)
вычисляют по формуле7 lg Р = —11 ЗОО/Т + 7,9.
При окислении кислородом воздуха суспензий искусственного
сульфида ZnS (так же как и сульфидов других металлов и неко-
торых природных сульфидных минералов) в растворах едкого
натра скорость перехода сульфидной серы в ион SO4“ ниже 100°
мала, но резко возрастает в пределах 150—250°8.
Сульфат цинка ZnSO4 кристаллизуется из водных растворов
в пределах от —5,8° (криогидратная точка 27,87% ZnSO4) до 38,8°
в виде бесцветных ромбических кристаллов цинкового купороса
ZnSO4’7H2O. Между 7,6 и 24,9° образуется также метастабильная
моноклинная модификация ZnSO4-7H2O, а между 11,4 и 38,8° —
метастабильные моноклинные кристаллы ZnSO4-6H2O, стабиль-
ные от 38,8 до 70°. Ниже 11,4° метастабильная соль ZnSO4-6H2O
необратимо переходит в моноклинную форму ZnSO4 • 7Н2О. Выше
70° кристаллизуется ZnSO4-H2O. Насыщенный водный раствор
содержит при 0° — 29,4%, при 25° — 36,7%, при 75° — 40,9%, при
99° — 37,7% ZnSO4. Водные растворы ZnSO4, не содержащие сво-
бодной кислоты, иногда мутнеют вследствие выделения осадка ос-
новного сульфата цинка 3Zn (ОН)2-ZnSO4 • 4Н2О 9>10.
В системе ZnSO4—H2SO4—Н2О при 20° и общей концентрации
сульфата и кислоты 0,25—0,5 г-мол/л образуются 11 комплексные
ионы [Zn (SO4)2]2-. На рис. 196 представлена диаграмма раствори-
мости в этой системе 10, позволяющая рассчитать кристаллизацию
ZnSO4- 7Н2О.
Из 100 кг исходного раствора кристаллизуется
= кг ZnSO4 или 1.78Х кг ZnSO4 • 7H2Q '
1UU — 1,/оХ -
где А и а — содержание ZnSO4 в растворе до и после кристалли-
зации, вес.%. О плотности, вязкости и электропроводности серно-
кислых растворов сульфата цинка см. 12.
716
Г л. XIX. Сульфат и хлорид цинка
Рис. 196. Растворимость в системе
ZnSO4—H2SO4—Н2О. Твердые фазы:
ниже acd — ZnSO4 • 7Н2О; в области
abc — ZnSO4 • 6Н2О; выше bed—
ZnSO4 • Н2О.
В системе Z11SO4—(NH4)2SO4—Н20 образуется двойная соль.
При 50° поле ее кристаллизации больше, чем при 35°. При нагре-
вании до 360° эта соль полностью обезвоживается, а выше 370°
разлагается9’13. В системе ZnSO4—(NH4)2SO4—Na2SO4—Н2О при
35° могут существовать твердые фазы: ZnSO4 • (NH4)2SO4 • 6Н2О
(наименее растворимая), ZnSO4 • Na2SO4• 4Н2О, Na2SO4- (NH^SOr
• 4Н2О, ZnSO4-7H2O, Na2SO4 и (NH4)2SO4. В системе ZnSO4—
Na2SO4—H2O образуются двусторонние ограниченные твердые рас-
творы ZnSO4 • Na2SO4 • 4Н2О с су-
льфатами натрия и цинка14. В си-
стеме ZnSO4—CuSO4—FeSO4—
—H2SO4—H2O в интервале 25—60°
образуются твердые растворы
(Си, Fe, Zn)SO4-5H2O, содержа-
щие от 0 до 4% ZnSO4 и от 0 до
2% FeSO4. Растворимость твердо-
го раствора возрастает с повыше-
нием температуры и уменьшается
с ростом концентрации ZnSO4 в
жидкой фазе. Содержание ZnSO4
и FeSO4 в твердом растворе воз-
растает при повышении темпера-
туры и при увеличении концентра-
ции ZnSO4 в жидкой фазе 15.
В системе ZnSO4—Na2SO4
установлено существование двух
твердых растворов на основе а-
и p-Na2SO4 и соединений 3ZnSO4-
• Na2SO4, ZnSO4 • Na2SO4, ZnSO4«
• 2Na2SO4 и ZnSO4 • 3Na2SO416.
В системе ZnSO4—K2SO4 образуются два соединения: 2ZnSO4 •
-*K2SO4 с /пл = 487° и ZnSO4 • K2SO4 с /пл = 470°. При 510° и
60 мол.°/о K2SO4 образуется твердый раствор. Во взаимной системе
ZnSO4—KCI обнаружены три гетероионных конгруэнтно плавя-
щихся соединения: цинковыи каинит ZnSO4* КС1 с /пл ж 485°,
2ZnCl2 • KsSO4 с /пл = 450° и КС! • K2SO4 • 4 ZnCl2 с /пл = 350°. В си-
стеме ZnSO4—NaCl в широком интервале температур вплоть до
комнатной устойчивы ZnCl2-2NaCl, ZnSO4-Na2SO4 и 3ZnSO4-
•Na2SO4. В системе ZnSO4—ZnCl2 образуется соединение ZnSO4«
•ZnCl2, существующее, по-видимому, в узком интервале концентра-
ций (от ~ 10 до 30 мол. % ZnSO4) и плавящееся инконгруэнтно
при 437°. С увеличением концентрации ZnSO4 это соединение рас-
падается с образованием 3ZnSO4 • ZnCl2. В тройной взаимной си-
стеме под влиянием третьего компонента ZnSO4-ZnCl2 становится
более устойчивым 16. В системе Na, К, Zn || SO4, Cl понижение тем-
пературы кристаллизации достигает 282°17.
Физико-химические свойства
717
Разложение сульфата цинка в струе сухого воздуха наблю-
дается уже при 600° и идет с образованием промежуточного про-
дукта ZnSOi-ZnO18. (По другим данным, его состав 2ZnSO4 •
. ZnO19-21.) Интенсивное разложение с образованием ZnO и SO2
идет при 800—900°. Разложение ускоряется при добавке 1—2%
Fe2O3 и при 900° в течение 15 мин достигает -—80%. Присутствие
SO2 в исходном газе (при отсутствии катализаторов, способствую-
щих превращению SO2 в SO3) не влияет на скорость разложения
Рис. 197. Система ZnCl2—Н2О.
сульфата цинка. В присутствии Fe2O3 скорость разложения ZnSO4
ниже 700° уменьшается, а выше 800° увеличивается с ростом кон-
центрации SO2 в исходном газе, что связано с условиями равнове-
сия SO2 + '/гОгч^1 SO3 22.
Хлорид цинка ZnCl2 существует в двух формах — ас/ш = 315°
и р с 4л = 326° 23; кипит при 730°. На рис. 197 показана политерма
растворимости ZnCl2 в воде. Из концентрированных растворов
выше 28° ZnCl2 кристаллизуется в безводной форме, при низких
температурах — с 1, Р/г, 27г, 3 и 4 молекулами воды. Насыщенный
раствор содержит при 25° 81,2%, при 100° —86% ZnCl2. В системе
ZnCl2—NH3 образуются комплексы: ZnCl2 • 7eNH3, ZnCl2 •’/гМНз,
ZnCl2-NH3 и ZnCl2 • 1,5NH3. Первый из них наиболее прочен; он
Дистиллируется без разложения при 590—680°. Комплекс ZnCl2-
' 7гМН3 метастабилен. ZnCl2-NH3 плавится при 164°, а сплавы
ZnCl2 с ZnCl2 • NH3 и ZnCl2-l,5NH3 характеризуются еще более
низкими температурами плавления, а также малым давлением
Диссоциации. Поэтому они могут быть использованы в качестве
718
Гл. XIX. Сульфат и хлорид цинка
теплоносителей24’25. Плавление смеси моноаммиаката хлорида цин-
ка с металлическим цинком (2:1) при 280—470° до прекращения
выделения водорода с последующим охлаждением плава, обработ-
кой водой и сушкой дает моноамид хлорида цинка ZnClNH2 (он мо-
жет найти применение в производстве неорганических полимеров)26.
Известны гидрооксихлориды цинка Zn5(OH)8Cl2 • Н2О и ZnOHCl.
Первый из них при нагревании в пределах НО—147° теряет кри-
сталлизационную воду, а выше 167° разлагается на ZnO, ZnCl2 и
Н2О. Второй разлагается на эти же компоненты выше 227°5.
ПРИМЕНЕНИЕ
Сульфат цинка применяется в текстильной промышленности,
в гальванотехнике, для изготовления минеральных красок, в част-
ности литопона — смеси эквимолекулярных количеств ZnS и
BaSO4, и проч. Окись цинка используют для изготовления цинко-
вых белил, в производстве резиновых изделий, в фармацевтиче-
ской промышленности. Сульфат и хлорид цинка служат для кон-
сервирования древесины. Хлорид цинка во многих случаях
заменяет сульфат. Его используют также в качестве водоотнимаю-
щего средства. Расплавленный хлорид цинка применяют в каче-
стве катализатора гидрокрекинга каменного угля и его экстрак-
тов 27.
Сульфат цинка является полупродуктом при производстве ме-
таллического цинка гидроэлектрометаллургическим методом, ко-
торым производят приблизительно одну треть мировой продукции
цинка. По этому методу цинк получают электролизом раствора
ZnSC>4 28, приготовленного растворением в серной кислоте окиси
цинка — продукта обжига цинковой руды. Регенерированную при
электролизе серную кислоту (~1,5 кг на 1 кг осажденного цинка)
возвращают на растворение окиси цинка — выщелачивание
спека 29. Сульфат цинка используют также в качестве электролита
при цинковании изделий из черных металлов.
Цинк является микроэлементом, необходимым для питания
растений. Содержание цинка в сухом веществе растений составляет
5—30 мг]кг, а в некоторых культурах доходит до 45—50 (торох,
вика) и даже до 60—70 (плоды томата) мг!кг. Содержание цинка
в урожае ячменя составляет 70—75 г на 1 га, а в урожае сахар-
ной свеклы — до 120 г на 1 га. Отсутствие или недостаток цинка
приводит к замедлению роста и заболеванию растений, выражаю-
щемуся в уменьшении размера листьев и в обесцвечивании их.
Восполнение недостатка в цинке производят внесением цинковых
удобрений в почву и опрыскиванием растений растворами цинко-
вых солей. В качестве цинковых удобрений могут быть использо-
ваны различные отходы промышленности, содержащие цинк30’31.
Препараты цинка применяют также для борьбы с болезнями рас-
тений (цинеб — цинковую соль этилен-бас-дитиокарбаминовой кис-
Применение
719
лоты, цирам — цинковую соль диметилдитиокарбаминовой кислоты
й др.) 32. Фунгицидным действием обладают основные хроматы
цинка, а арсенаты цинка могут служить антисептиками для древе-
сины. Фосфид цинка используют в качестве зооцида 33.
Согласно ГОСТ 8723—58, в цинковом купоросе должно содер-
жаться (в %):
I сорт II сорт
Цинка, не менее Железа, в пересчете на FeO, 22,5 21,8
не более Серной кислоты свободной, 0,02 0,1
не более Веществ, не растворимых в 0,05 0,1
воде, не более Хлоридов, в пересчете на С1, 0,04 0,3
не более Марганца, в пересчете на МпО, 0,2 0,3
не более Меди, свинца, кадмия и ни- келя в пересчете на РЬ, не 0,04 0,2
более 0,01 0,03
При содержании в цинковом купоросе меньше 7 молекул воды
отношение количества примесей к цинку не должно быть больше,
ТАБЛИЦА 47
Требования к качеству хлористого цинка по ГОСТ 7345—68
(содержание компонентов в %)
Марка А Марка В Марка В
1-й сорт 2-й сорт
Внешний вид Пластинки Бесцветный или светло- Мутный
серого цвета желтый раствор раствор
толщиной 1—2 мм прозрачный допускается бурого цвета
Содержание: муть
хлористого цинка,
не менее .... 97 49 47 40
железа, не более . сульфатов, не более 0,3 0,008 0,15 2,0
0,05 Отсутствие 0,02 —
остатка, не раство-
римого в соляной кислоте, не более 0,1 0,01 0,1 1,0 .
свинца, не более . . —— 0,002 —
меди, не более . . —— 0,002 — —
мышьяка, не более —- 0,001 — ——
свободных кислот . величина pH, не ме- — — —• Отсутствие
нее — 3,7 3,7 —
720
Г л. XIX. Сульфат и хлорид цинка
чем в семиводном продукте. Цинковый купорос упаковывают в по-
лиэтиленовые и бумажные мешки, фанерные барабаны и деревян-
ные бочки. Растворы цинкового купороса перекачивают по сталь-
ным трубам, но присутствие примеси медного купороса вызывает
сильную их коррозию.
Хлорид цинка выпускают в виде растворов (табл. 47) и в виде
твердого пластинчатого продукта— затвердевшего плава. (Раньше
плав выпускали в виде монолитной массы, застывшей в таре.)
Твердый продукт упаковывают в герметические стальные или кар-
тонные барабаны с вкладышами из полиэтилена; загрузку в тару
производят в среде сухого азота или воздуха. Растворы хлористого
цинка перевозят в стальных цистернах и бочках, а также в поли-
этиленовых канистрах и стеклянных бутылях.
СЫРЬЕ
Сырьем для производства цинкового купороса служат серная
кислота и металлический цинк (пуссьера, отходы переработки
лома цветных металлов и пр.), цинковая зола, являющаяся отхо-
дом при оцинковке металлов, а также сульфидные руды. Пуссьера
представляет собой цинковую пыль — отход, образующийся при
дистилляции цинка в ретортных печах в процессе конденсации суб-
лимата. Получение цинковой пыли объясняют образованием
пленки ZnO, которая обволакивает мельчайшие капельки цинка,
препятствуя их слиянию34. Пуссьера содержит 60—75% цинка
в виде металла и окиси, уголь, поваренную соль и другие примеси.
В отходах от переработки лома цветных металлов содержится
45—65% Zn. Лучшим сырьем для выработки сульфата цинка яв-
ляются поддувальные отходы производства цинковых белил. Они
состоят почти целиком из окиси цинка, содержат незначительные
количества силиката цинка и металлического цинка и легко реаги-
руют с серной кислотой.
Главными рудами, используемыми для выплавки металличе-
ского цинка, служат цинковая обманка (сфалерит) ZnS, силикат
цинка (каламин, галмей) Zn2SiO4-H2O или Zn4(Si2O7) (ОНЦ • Н2О,
цинковый шпат (смитсонит) ZnCO3, а в последнее время и мате-
риалы, содержащие цинк в форме феррита (ZnO-РегОз). Мине-
ралы цинка встречаются обычно в полиметаллических рудах со-
вместно с соединениями свинца, серебра, меди. Цинковые руды
обогащают флотацией35.
•Сырьем для получения хлорида цинка служат соляная кислота
и те же материалы, содержащие цинк, которые используют для
получения цинкового купороса, в частности отход текстильной про-
мышленности— окшара, содержащая до 20% ZnS, ~20% Na2SO4,
— 20% Na2CO3 и 10% Н2О.
Сырьем для получения окиси цинка могут служить разные
цинксодержащие отходы химической, медеплавильной и металло-
Сульфат цинка
721
обрабатывающей промышленности. Эти отходы представляют со-
бой в большинстве случаев шламы, содержащие цинк в виде ме-
таллического цинка, окиси, хлорида, сульфата или карбоната. Для
получения окиси цинка из отхода карбоната цинка, образующегося
в производстве гидросульфита натрия, его необходимо предвари-
тельно отмыть от водорастворимых солей (Na2SO4, Na2SO3 и др.),
содержание которых доходит до 15%. Промытый карбонат цинка,
содержащий до 65% влаги, подсушивают до влажности 25—27%
и прокаливают при 500—600°. При использовании шламов, содер-
жащих металлический цинк, их целесообразно обрабатывать соля-
ной кислотой и из полученного раствора ZnCl2 осаждать содой
ZnCO3, который затем прокаливать для получения окиси цинка 36.
Потенциальным источником цинкового сырья являются колче-
данные огарки. Целесообразность извлечения цинка из огарков
определяется не только использованием его для производства со-
единений цинка, но и необходимостью удаления цинка до перера-
ботки огарков в металлургии37. Цинк из колчеданных огарков мо-.
жет быть извлечен в виде сульфата цинка или в виде хлорида
цинка (при хлорирующем обжиге огарка).
СУЛЬФАТ ЦИНКА
Наиболее распространенным способом производства цинкового
купороса является растворение в серной кислоте различных мате-
риалов, содержащих цинк и окись цинка. Примеси меди, железа,
никеля, свинца, олова и другие обусловливают необходимость спе-
циальной очистки растворов.
Сульфат пинка может быть получен в качестве побочного про-
дукта при улавливании отбросных сернистых газов цинковым ме-
тодом 38, из полиметаллических руд обработкой их раствором суль-
фата окиси железа, а также окислительным обжигом цинковой
обманки в муфельных и других печах при температуре около 600°.
Перекаливание материала приводит, вследствие диссоциации
ZnSO4, к образованию ZnO. Из обожженной массы сульфат цинка
выщелачивают водой и выкристаллизовывают из раствора цинко-
вый купорос.
С большей легкостью сулыЬат цинка получается при сульфати-
зирующем обжиге цинковой обманки в атмосфере сернистых га-
зов, а также при сульфатизации сернистым газом окиси
цийка 39~42.
Сульфид цинка легко сульфатизируется серной кислотой по
реакции:
ZnS + H2SO4 = ZnSO4 + H2S
Выделяющийся сероводород окисляется до серы:
H2S + H2SO4 = SOj + 2Н2О + S
722 Гл. XIX. Сульфат и хлорид цинка
При 160—200° степень сульфатизации цинка достигает 97% 43.
При более высоких температурах она уменьшается за счет улету-
чивания серной кислоты, а выше 600° за счет реакции:
3ZnSO4 4" ZnS — 4ZnO 4" 4SO2
Водная суспензия ZnS (флотационного концентрата цинковой
обманки) может быть превращена в раствор ZnSO4 окислением
кислородом при давлении 10 ат и температуре ~200° в автоклаве
в присутствии CuSO4 в качестве катализатора (Си :Zn = 1 : 10).
Процесс описывается уравнениями:
ZnS + CuSO4 — ZnSO4 + CuS
CuS + 2O2 = CuSO4
Менее, чем за 2 ч выход цинка в раствор достигает 98% (в от-
сутствие CuSO4 — только 40%) 44.
Получение сульфата цинка растворением материалов, содержащих
Zn и ZnO, в серной кислоте
Цинковое сырье, содержащее цинк и окись цинка, размалы-
вают в шаровой мельнице, а затем растворяют в 18—25%-ной сер-
ной кислоте46. Растворение производят в резервуарах, футерован-
ных кислотоупорным материалом и снабженных мешалками.
Тепло, выделяющееся при предварительном разбавлении серной
кислоты до указанной концентрации, а также тепло экзотермиче-
ских реакций
ZnO + H2SO4 = ZnSO4 + Н2О (ж.) + 25,1 ккал
Zn + H2SO4 = ZnSO4 + Н2 + 40,0 ккал
обеспечивает повышение температуры реакционной массы до 80—
100° без дополнительного подогрева. При содержании в сырье зна-
чительного количества металлического цинка процесс сопрово-
ждается интенсивным пенообразованием вследствие выделения
водорода. Реакционные резервуары должны быть сообщены с силь-
ной вытяжной вентиляцией, предотвращающей накопление-водо-
рода в атмосфере цеха.
Для ускорения нейтрализации серной кислоты, которая замед-
ляется к концу процесса, в реактор загружают избыток цинкового
сырья. Образующиеся при этом основные соли цинка разрушаются
впоследствии добавкой серной кислоты после удаления раствора.
По окончании реакции, когда содержание свободной серной кис-
лоты в растворе понизится до 1—2 г/л, раствору дают отстояться
и фильтруют его через барабанный вакуум-фильтр, а в реактор
с остатком сырья заливают новую порцию серной кислоты и до-
бавляют цинковое сырье. При содержании в сырье значительных
количеств свинца и олова, не переходящих при сернокислотной
Сульфат цинка
723
переработке в раствор, твердый остаток после промывки направ-
ляют на переработку для извлечения этих металлов.
При содержании в сырье олова образуются плохо фильтрую-
щие осадки. Поэтому считают целесообразным46 при переработке
отходов, содержащих олово, отделять нерастворившийся остаток
не фильтрацией, а отстаиванием. При разбавлении суспензии до
плотности 1,2—1,21 г/см3, что соответствует содержанию в рас-
творе 200—250 г/л Z11SO4, отстаивание идет с достаточной
скоростью (рис. 198). Полное от-
стаивание достигается только в
нейтральной среде. При отстаи-
вании кислых растворов в сливе
содержится муть. При продол-
жительности отстаивания 10—
15 ч получается пульпа с отно-
шением Т : Ж, в пределах от 1 : 1,2
до 1 : 1,5.
Профильтрованный раствор
содержит 400—420 г/л ZnSOi и
примеси FeSCh, C11SO4, CdSO.4,
NiSOi, количества которых за-
висят от содержания соответст-
вующих металлов в сырье. Очи-
стку раствора цинкового купоро-
са от этих примесей производят
в несколько приемов. Вначале
очищают раствор от железа, до-
бавляя окислитель для перевода
Fe2+ в Fe3+. В качестве окисли-
теля обычно применяют раствор
гипохлорита натрия. После окис-
ления железо осаждают известью
Рис. 198. Влияние плотности суспен-
зии на скорость ее осаждения.
в виде основных солей окиси
железа. Избыток извести вреден, так как он осаждает также ос-
новные соли цинка. Произведения растворимости: Zn(OH)2
(1,80 • 10~14) и Fe(OH)2(l,64 • 10*14) почти равны; произведение
растворимости Fe(OH)3 значительно меньше (1,1 • 10-36).
После выделения в осадок соединений железа раствор кипятят
Для разрушения небольшого избытка гипохлорита натрия и от-
фильтровывают от осадка. Осадок этой второй фильтрации, как и
осадок от предыдущей, первой фильтрации, промывают на фильтре
водой для извлечения из него ZnSO4; промывные воды используют
Для разбавления серной кислоты в реакторе.
После очистки от железа раствор поступает на очистку от Си2+,
Ni2+, Cd2+. Эту очистку производят путем интенсивного перемеши-
вания раствора с добавленной к нему цинковой пылью в течение
4—6 ч. Потенциал у Zn более электроотрицательный, чем у Си, Ni
724
Г л. XIX. Сульфат а хлорид цинка
и Cd. Поэтому металлический цинк вытесняет эти металлы из рас-
творов их солей по реакциям: .
Zn + CuSO4 = Си + ZnSO4 + 49,9 ккал
Zn + NiSO4 — N1+ZnSO4 + 20,9 »
Zn + CdSO4 = Cd + ZnSO4 + 12,5 »
Наиболее полно и быстро протекает цементация меди. Выделе-
ние из раствора никеля и кадмия сопряжено со значительными
трудностями вследствие того, что они близко стоят к цинку в ряду
напряжений. При повышенной температуре и интенсивном пере-
мешивании быстро протекает обратный процесс — окисления и
растворения кадмия. В то же время для достижения полноты це-
ментации никеля требуются большой избыток цинковой пыли и
высокая температура47.
Применяемую для цементации цинковую пыль обрабатывают
предварительно небольшим количеством слабой серной кислоты
для удаления с поверхности металла тонкого слоя окиси. Выпав-
шие в виде тонкого шлама металлы отделяют от раствора на
фильтре, после чего раствор подвергают вторичной очистке от же-
леза, которое в небольших количествах содержится в цинковой
пыли. Профильтрованный после вторичной очистки раствор содер-
жит 300—350 г/л ZnSO4 и до 10 г/л С1~.
Полученный раствор цинкового купороса содержит некоторое
количество основных солей сульфата цинка. Для их разрушения
в очищенный раствор цинкового купороса добавляют немного сер-
ной кислоты. После этого раствор направляют на кристаллизацию
цинкового купороса или используют для производства литопона и
других продуктов48. Сушку цинкового купороса можно вести во
взвешенном слое. На изготовление 1 т цинкового купороса расхо-
дуют: 0,47 т цинка (в пересчете на металл) и 0,72 т серной кис-
лоты (100%).
Из твердого остатка, получающегося при растворении цинка
в серной кислоте, извлекают свинец и олово 49.
Наибольшее количество сульфата цинка изготовляют сейчас из
маломедистой пыли, получаемой при вторичной переработке цвет-
ных металлов, содержащей 65—70% цинка, 1—6% олова, 7—10%
свинца и — 0,6% меди. Суспензию пыли в оборотном растворе под-
вергают «нейтральному» выщелачиванию — обработке серной кис-
лотой при 90° и при продувке барботирующим воздухом. Количе-
ство добавляемой кислоты недостаточно для извлечения из сырья
всей окиси цинка и в раствор переходит —90% ZnO. Избыток
окиси цинка и окисление Fe2+ в Fe3+ кислородом воздуха обеспе-
чивают хорошую очистку раствора от железа. Величину pH регу-
лируют так, чтобы избежать осаждения меди, перешедшей в рас-
твор из сырья.
Сульфат цинка
725
После «нейтрального» выщелачивания пульпа сгущается в от-
стойниках, и сгущенная пульпа поступает на «кислое» выщелачи-
вание, а слив проходит контрольную фильтрацию через фильтр-
пресс и очищается от меди цементацией цинковой пылью при
60—70° в аппарате с мешалкой. После отделения цементной меди
на фильтрпрессе полученный раствор содержит 130—140 г/л цинка
в виде ZnSO4 и направляется на выпарку в двухкорпусную вы-
парную батарею, работающую под давлением. Давление в I и
II корпусах составляет соответственно 3 и 1,5 ат, и температуры
кипения раствора в них 140 и 120°. Из II корпуса выводится смесь
насыщенного раствора и взвешенных в ней кристаллов ZnSO4 • Н2О,
причем общая концентрация соответствует отношению ZnSO4 : Н2О,
равному 1 : 5—6. Суспензию охлаждают до полного отверждения
на поверхности барабана, внутри которого циркулирует вода, и
получают чешуйчатый продукт, состоящий из ZnSO4 • 7Н2О с при-
месью ZnSOi • Н2О.
«Кислое» выщелачивание пульпы, сгущенной после «нейтраль-
ного» выщелачивания, осуществляют серной кислотой также при
нагреве до 90° и с продувкой — перемешиванием воздухом. Пр»
этом окись цинка практически полностью переходит в раствор, со-
держащий —-100 г/л Zn и 1 г/л H2SO4. После фильтрации на
фильтрпрессе этот оборотный раствор используют для приготов-
ления суспензии исходной пыли. Отделенные на фильтре евинцово-
оловянные кеки направляют на дальнейшую переработку.
Получение цинкового купороса из медистой окиси цинка
К неиспользуемым отходам в производстве вторичной меди
принадлежит так называемая медистая окись цинка, содержащая
35—45% ZnO, до 10% закисной и окисной меди, до 20% SiO2. Ее
не используют для выплавки меди из-за образования вязких шла-
ков и настылей, а для выработки цинкового купороса — из-за вы-
сокого содержания меди.
Получение цинкового купороса из медистой окиси цинка воз-
можно следующим способом 50, основанным на переводе большей
части окиси цинка в раствор, а окиси меди в осадок в результате
Реакции:
CuSO4 + ZnO = ZnSO4 + CuO
Очевидно, реакция протекает через стадию гидратации окиси цин-
ка с образованием гидроокиси меди.
Процесс осуществляют в две стадии, проводимые в разных
реакторах. В первом реакторе происходит образование конечного
Раствора, содержащего 45—47% ZnSCU направляемого на кри-
сталлизацию. В этот реактор поступает содержащий медь ней-
тральный 37% раствор из второго реактора, цинковое сырье и
7*26
Гл. XIX. Сульфат и хлорид цинка
40—80% от общего количества серной кислоты, необходимого для
сульфатизация ZnO, РЬО и СаО (без учета расхода H2SO4 на'
взаимодействие с CuO, FeO, Ре20з, которые остаются в кеке в виде
окислов). Твердый остаток (промежуточный кек) из первого реак-
тора обрабатывают серной кислотой во втором реакторе, где из
него извлекается остаток окиси цинка и растворяется некоторое
количество окиси меди. Оптимальная температура во втором реак-
торе 70°. Основная масса меди,
поступающей в сырье выводится
из второго реактора с конечным
кеком, который промывают водой
Рнс. 199. Влияние длитель-
ности процесса на очистку
растзоров ZnSO4 от меди
при 50 и 70°.
Время, ч
Рис. 200. Содержание меди
в кристаллах ZnSO4 в за-
висимости от длительности
первого выщелачивания при
50, 60 н 70°.
для уменьшения потерь растворимого сульфата цинка. Промыв-
ную воду возвращают во второй реактор. Содержание цинка
в остаточном кеке колеблется в пределах 6—8%, выход кека
— 55% от веса сухой исходной пыли. Степень извлечения ZnO со-
ставляет 90—92,5%.
Взаимодействие окиси цинка с сульфатом меди замедляется
с увеличением концентрации ZnSO4 в исходном растворе. Так, при
повышении концентрации с 31 до 36% ZnSO4 продолжительность
процесса увеличивается в 2 раза. Таким способом можно получить
раствор ZnSOi, содержащий всего 0,05 г/л меди, без затраты ме-
таллического цинка на очистку раствора (рис. 199 и 200).
Удаление железа из раствора основано на предварительном
окислении Fe2+ в Fe3+ и взаимодействии сульфата окиси железа
с окисью цинка:
Fe2(SO4)3 + 3ZnO + ЗН2О = 2Fe(OH)3 + 3ZnSO4
Сульфат цинка
727
0,4-
л
О 0,01 0,02 0,03
Содержание Fe В кристаллах, %
Рис. 201. Влияние содержа-
ния железа в исходных раство-
рах на качество сульфата
цинка.
Окисление можно производить барботирующим через раствор
воздухом; кислород воздуха в нейтральной среде энергично окис-
ляет Fe2+. На рис. 201 показана зависимость содержания железа
в кристаллах цинкового купороса от содержания его в исходном
растворе. Кристаллы, полученные из
растворов с одинаковым содержанием
железа и меди, загрязнены железом
приблизительно в 10 раз больше, чем
медью. Это обусловливает необходи-
мость хорошей очистки растворов цин-
кового купороса от железа для полу-
чения продукта высокого качества.
Извлечение цинка из колчеданных
огарков хлорирующим обжигом
Представляет интерес извлечение
цинка из старых колчеданных огар-
ков, скопившихся на сернокислотных
заводах, в тех случаях, когда они со-
держат значительные количества цин-
ка. При хлорирующем обжиге этих
огарков и последующем выщелачива-
нии цинк извлекается в раствор в ви-
де смеси сульфата и хлорида. Разделение их связано со значитель-
ными трудностями, поэтому получаемый раствор используют, глав-
ным образом, для производства литопона 49.
Используемые колчеданные огарки содержат —- 9,5% Zn и
5—6% S. Их смешивают с необожженным колчеданом, поваренной
солью и с огарком, не содержащим цинка, так, чтобы шихта со-
держала 4,5—5% Zn и 4—4,5% S. Смесь составляют приблизи-
тельно из 40% огарка, содержащего цинк, 40% использованного
огарка (без цинка), 3,5% колчедана и 16,5% поваренной соли. Об-
жиг производят при 550° в механической полочной печи. Из печи
выходит «плав», содержащий 4,8—5,1% общего цинка, 4,2—4,7%
водорастворимого цинка, 13,4—15,2% С1 (в расчете на NaCl),
0,01—0,03% водорастворимого железа и сульфат натрия. При вы-
щелачивании «плава» в раствор переходят ZnSO4, ZnCl2 и Na2SO4.
Получаемый раствор содержит (в г/л): 100—130 Zn, 300—400
Na2SO4 и 270—380 Cl (в пересчете на NaCl). После выморажива-
ния сульфата натрия этот раствор используют для осаждения ли-
топона смешением его с раствором сульфида бария:
ZnSO4 + ZnClg 4" 2BaS = 2ZnS 4" BaSO4 4" ВаС1г
В связи с тем, что в растворе имеется не только ZnSO4, но и
ZnCl2, литопон получается с повышенным содержанием ZnS, Для
728
Г л. XIX. Сульфат и хлорид цинка
устранения этого к осадку добавляют тонкоизмельченный отбе-
ленный барит. Раствор хлорида бария, остающийся после отделе-
яйя литопона, перерабатывают на кристаллический хлорид бария
(выпаркой и кристаллизацией) или на бланфикс — осаждением
EaSO4 сульфатом натрия.
ХЛОРИД цинка
Наиболее распространенный способ получения хлорида цинка
заключается в обработке цинковых отбросов технической 27—
"28%-ной соляной кислотой. Обработку ведут в резервуарах, в ко-
торые загружают цинковые отбросы и заливают кислоту. Переме-
шивание осуществляют сжатым воздухом или с помощью меша-
лок. Иногда несколько резервуаров располагают террасообразно,
и жидкость перетекает из одного в другой, причем концентрация
ZnCl2 постепенно повышается до 45%. Количество кислоты берут
из расчета получения раствора ZnCl2, не содержащего свободной
кислоты.
Находящиеся в сырье примеси соединений свинца, SiO2 и дру-
гие при растворении в соляной кислоте образуют осадки, отклады-
вающиеся на зернах растворяющегося материала, содержащего
-цинк, в виде непроницаемой корки. Предотвратить это можно пу-
тем предварительного окислительного обжига измельченных цин-
ковых отходов при 300—500°51.
Реакции растворения цинка и окиси цинка экзотермичны и про-
текают весьма энергично, но общая продолжительность процесса
достигает 10 ч и более, так как к концу он замедляется. При рас-
творении выделяются большие количества водорода:
Zn + 2НС1 = ZnCl2 + Н2
Реакционные резервуары обычно устанавливают вне здания,
под навесом, и водород удаляется в атмосферу.
Полученные растворы хлорида цинка подвергают очистке от
Железа, которую производят с помощью окислителей, не загряз-
няющих раствор значительными количествами продуктов окисле-
ния. В качестве окислителей применяют газообразный хлор, берто-
летову соль и чаще всего наиболее дешевый реагент — хлорную
известь. В последнем случае в раствор переходит СаС12. Окисное
железо осаждают из раствора при нейтрализации кислотности, на-
пример добавкой извести. Обычно известь вводят одновременно
С хлорной известью. Раствор отстаивается от осадка и нераствори-
мой мути — песка и других примесей, введенных с сырьем, и де-
кантируется, а иногда фильтруется.
При применении в качестве сырья окшары необходимости в
очистке раствора нет, так как в окшаре большинство примесей на-
ходится в виде растворимых солей, которые выщелачиваются горя-
чей водой перед растворением окшары в соляной кислоте. ,
Литература
729
Для получения плавленого хлорида цинка раствор выпаривают
в чугунных котлах, обогреваемых топочными газами. Температура
раствора по мере повышения его концентрации поднимается. Про-
цесс уварки сопровождается загустеванием массы при 190—280°
вследствие выделения твердой фазы; при дальнейшем подъеме тем-
пературы масса вновь становится жидкой. При подъеме темпера-
туры до 310—340° можно получить продукт, содержащий всего
~1,2% воды52. Без применения вакуума удалить всю воду невоз-
можно, так как для этого пришлось бы поднять температуру выше
400°, что сопровождалось бы значительным гидролизом ZnCl2. Гид-
ролиз имеет место и при менее высоких температурах; для его
уменьшения в процессе выпаривания в раствор добавляют немного
соляной кислоты. Выделяющийся при выпаривании хлористый во-
дород разъедает стенки чугунного котла, и продукт загрязняется
хлористым железом.
В связи с трудностью полного удаления воды и увеличением
расхода топлива на последней стадии обезвоживания выпарку за-
канчивают при сравнительно низкой температуре (220—250°). При
этом в готовом плаве остается 9—12% воды. Такой плав заливают
в железные барабаны, где он при охлаждении затвердевает, после
чего барабаны запаивают.
На 1 т 45% раствора хлорида цинка расходуют 0,23—0,25 т ме-
таллического цинка (96%-ного) или соответствующее количество
материала, содержащего цинк, и 0,9—1 т 27,5%-ной соляной кис-
лоты. На 1 т плавленого хлорида цинка расходуют 2,4 т 45% рас-
твора ZnClj и около 0,5 т угля (7000 ккал/кг).
ЛИТЕРАТУРА
1. М. И. Архипов, А. Б. Пакш вер, Н. И. П о д б о р н о в а, ЖПХ, 23,
№ 6, 650 (1951). — 2. Н. Keifiig, Н. Reimers, Chem.-Ztg. Chem. Apparat., 86,
№ 14, 488 (1962). — 3. J. W. Fulton, D. F. Swinehart, J. Am. Chem. Soc.,
76, № 3, 864 (1954). — 4. В. В. Печковский, Л. П. Костин, А. Г. Звез
дин, Труды Пермск, политехи, ин-та, № 10, 1961, стр. 155.— 5. О. К S г i v a s-
tava, Е. A. Sec со, Canad. J. Chem., 45, № 6, 579 (1967). — 6. E. Про, Цинк
и кадмий, ГОНТИ, 1931. — 7. Б. Д. Авербух, Е А. Be тренк о, Г. И. Чу-
фаров, ЖПХ, 32, № 6, 1221 (1959). — 8. В. Г. Тронев, Научно-иссл. работы
химических ин-тов и лабораторий АН СССР за 1941—1943 гг„ Изд. АН СССР.
1945. — 9. А. С. Карнаухов, В. Г. Шевчук, ДАН СССР, 90, № 2 191
(1953). —10. И. Н. Кузьми н ы х, С. Л. Любалина, Хим. пром., № 12 358
(1950).
11. Я. А. Ф и а л к о в, 3. А. Шека, ЖНХ, 1, № 6, 1238 (1956).—
12. В. М. Чайковская, Г. Ф. Афанасьев, Г. Н. Знаменский, ЖПХ
36, № 6, 1355 (1963). —13. В. Г. Шевчук, И. Г. Дружинин, Изв. вузов.
Хим. и хим. технол., № 2, 25 (1958). — 14. В. Г. Шевчук И. Н. Лепешков
ЖНХ, 1, № 8, 1888 (1956). — 15. Н. Д. М а з о в е р, ЖПХ, 25, № 7, 756 (1953). —
16. Н. Н. Евсеева, А. Г. Бергман, ИСФХА АН СССР, 21, 208 (1952); 22,
162 (1953); 24, 162 (1954). — 17. Н. П. Л у ж н а я, Научно-иссл. работы химиче-
ских ин-тов и лабораторий АН СССР за 1941—1943 гг., Изд. АН СССР, 1945,
стр. 71. — 18. В. В. Печковский, А. Н. К е т о в, Уч. зап. Пермск. гос. ун та,
730
Г л. XIX. Сульфат и хлорид цинка
17, № 1 15 (1960); Труды Пермск. политехи, ин-та, № 10, 1961, стр. 3.—
19. С. Д. III а р г о р о д с к и й, Укр. хим. ж., 15, 332 (1949). — 20. Б. И. Скач
ков, Цветные металлы, № 11, 25 (1968).
21. Е. В. Маргулис, В. Д. Пономарев, Изв. АН КазССР. Сер. метал-
лург., обогащения и огнеупоров, № 3 (6) (1960).—22. В. В. Печковский,
ЖПХ, 31, № 8, 1139 (1958).—23. J. Besson, Р. Grange, Compt. rend., 238,
№ 20, 2002 (1954).—24. М. И. Р а в и ч, Е. В. Фролова, Научно-иссл. работы
химических ин-тов и лабораторий АН СССР за 1941—1943 гг., Изд. АН СССР
1945. — 25. 3. К. Зубахина, Труды НИОХИМ, т. 19, 1969, стр. 105,—
26. Л. М. Волова, В, И. Остроушко, авт. свид. 199129, 1966.—
27. С. W. Zielke a. oth., Ind. Eng. Chem., № 2, 158 (1966).— 28. А. А. Са-
лин, M. E. С ы p о e ш к и н, Электролиз сернокислого цинка, Госметаллургиздат,
1959. —29. С. А. Титов, Выщелачивание и электролиз цинка, Госметаллургиз-
дат, 1943. — 30. М. В. В. К а т а л ы м о в, сб. «Исследования по прикладной хи-
мии», Изд. АН СССР, 1955, стр. 325.
31. С. И. Вольф кович, сб. «Микроэлементы в жизни растений и жи-
вотных», Изд. АН СССР, 1952. — 32. С. Н. Иванова, Журн. ВХО, 9, № 5,
496 (1964). — 33. С. И. В о л ь ф к о в и ч, Т. М. С т р о н г и н, Р. Е. Р е м е н,
К. Е. Писарев, А. И. Шишкина, Труды НИУИФ, в. 167, 1960, стр. 5,—
34. Г. Г. Уразов, Л. Р. Э д е л ь с о н, Материалы по металлургии цветных ме-
таллов, Кубуч, 1932.— 35. М. R е у, Р. Raffinot, Rev. ind. minerale, 35,
№ 605, 134 (1954). — 36. В. А. Куракин, ЖХП, № 13, 25 (1941).—
37. Б. П. Волгин, Е. М. Ляп устин а, Труды УНИХИМ, в. 1, 1954, стр. 133.—
38. И. Л. П е й с а х о в, сб. «Обогащение и очистка газов цветной металлургии»,
Госметаллургиздат, 1953.—39. С. И. Во-льфкович, Ф. Г. Марголис, Изв
АН СССР. ОХН, 5, 322 (1942); ЖПХ, 28, № 5, 453 (1955). — 40. В. И. Смир-
нов, А. И. Тихонов, Обжиг медных руд и концентратов, Госметаллуогиздат.
1958.
41. В. В. Печковский, ЖПХ, 30, № 11, 1579 (1957); 32, № 5, 966
(1959). — 42. В. В. Печковский, Уч. зап. Пермск. гос. ун-та, 17, № 1. 91
(I960).—43. А. П. Сну р ников, В, Ф. Ларин, сб. «Исследования в области
химии и технологии минеральных солей и окислов», Изд. «Наука», 1965,
стр. 97. — 44. Пат. ФРГ 1192167, 1960. — 45. В. Л. Щукин, Производство лито-
пона. ГОНТИ, 1931.— 46. Е. В. Санадзе. Хим. пром., № 2, 51 (1950). —
47. Е. Schwarz-Bergkampf, Berg und Huttenmann, Monatschr., 98, № 1,17
(1953). — 48. Г. M. P а к о в и ч, С. Ф. Матвеева, Бюлл. Центр, ин-та информ,
цвет, металлург., № 3, 23 (1956). — 49. Е. Ф. Беленький, И. В. Р и с к и н,
Химия и технология пигментов, Госхимиздат, 1960. — 50. И. Н. Кузьминых.
С. Л. Л ю б а л и н а, ЖПХ, 25, № 3, 257 (1952).
51. Н. Н. Ефремов, А. М. Розенберг, сб. «Работы по химической тех-
нологии минеральных веществ», Свердловск. 1929, стр. 171, 185.—52. Н. Н. Еф-
ремов, Е. М. Якимец, сб. «Работы по химической технологии минеральных
веществ», Свердловск, 1929, стр. 153.
Глава XX
СУЛЬФАТ НИКЕЛЯ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Никель образует два основных окисла: закись никеля NiO и
окись никеля N12O3 и соответствующие им гидроокиси. Гидрат за-
киси никеля Ni(OH)2 образуется в виде светло-зеленого осадка при
действии щелочей на растворы солей двухвалентного никеля. При
нагревании теряет воду и переходит в закись никеля серо-зеленого
цвета. Степень гидратации является важным свойством гидрата
закиси никеля, особенно в связи с применением его для изготовле-
ния анодной массы щелочных аккумуляторов — степенью гидрата-
ции определяется структура и электрохимические свойства анодной
массы. Вода в гидрате имеет две формы связи — молекулярную и
гидроксильную. По мере обезвоживания возрастает удельная по-
верхность и пористость гидрата1. Гидрат окиси никеля Ni(OH)3,
имеющий черно-бурый цвет, образуется при окислении Ni(OH)2.
В водных аммиачных растворах растворимость Ni(OH)2 при 20°
равна 2,35 г/л Ni при концентрации 36,4 г/л NH3 и 14,5 г/л Ni при
Г93 г/л NH3 2.
При взаимодействии 0,2 н. раствора N1CI2 с 2 н. щелочными
смесями, содержащими NaOH и менее 50% Na2CO3, образуются
суспензии гидрата закиси никеля, характеризующиеся интенсив-
ным уменьшением pH раствора (на 1 —1,8 за 24 ч). Старение осад-
ка сопровождается уменьшением количества щелочи в растворе и
превращением карбоната в бикарбонат за счет обмена ионов ОН"
Раствора на ионы СО3~> адсорбированные осадком3. О старении
основных карбонатов никеля см. 4~7.
Основной карбонат никеля является промежуточным продуктом
при аммиачном выщелачивании никелевых руд. Предварительно
РУДЫ подвергают восстановительному обжигу. Выщелачивание
производят водным раствором аммиака, содержащим карбонат
аммония, в присутствии кислорода. После выщелачивания из
732
Гл. XX. Сульфат никеля
раствора отгоняют аммиак, в результате чего осаждается основной
карбонат никеля, который подвергают обжигу8.
С окисью углерода никель образует жидкое летучее соедине-
ние— тетракарбонил никеля Ni(CO)4, которое при нагревании раз-
лагается с выделением металлического никеля. На этом основан
один из способов извлечения никеля из некоторых продуктов пер-
вичной переработки руд, в которых основная масса никеля нахо-
дится уже в виде металла.
Сульфат никеля NiSO4 кристаллизуется из водных растворов
при температурах от —3,15 до 31,5° в виде NiSO4-7H2O— никеле-
вого купороса, кристаллы которого имеют форму ромбических
призм изумрудно-зеленого цвета. При выветривании купороса на
воздухе, а также при кристаллизации из водных растворов при
температуре от 31,5 до 53,6° образуется a-NiSO4-6H2O синеватого
цвета; в интервале 53,6—99° кристаллизуется p-NiSO4-6H2O зеле-
ного цвета. При более высоких температурах образуются метаста-
бильные кристаллогидраты с меньшим числом молекул воды (от
5 до 2) и стабильный NiSO4-H2O с точно не установленными тем-
пературами превращения вследствие затруднений, обусловленных
образованием сильно пересыщенных растворов. Выше 280° сульфат
никеля обезвоживается. NiSO4 устойчив до 800°, а выше этой тем-
пературы разлагается с выделением SO39. Насыщенный водный
раствор содержит при 0°—21,4%, при 99° — 43,4 NiSO4.
Обычно при кристаллизации охлаждением насыщенного рас-
твора вначале выделяется шестиводный сульфат никеля, а затем
образуется некоторое количество семиводного. Соотношение между
ними зависит от температуры начала и конца кристаллизации, a
также от скорости перехода одной формы сульфата в другую. При
быстрой кристаллизации из концентрированных растворов полу-
чается продукт приблизительного состава N1SO4 • 6,2НгО, при мед-
ленной кристаллизации — NiSO4 • 6,5НгО 10.
При взаимодействии растворов сульфата никеля и едкой ще-
лочи выделяются осадки основных сульфатов никеля, состав кото-
рых зависит от концентрации растворов. При добавлении 0,1 н.
раствора NaOH к растворам NiSO4 с концентрацией, меньшей 0,1 М,
образуется осадок гидрата закиси никеля; в интервале концен-
траций А, 1—1 М NiSO4 осаждается 3NiSO4-4Ni(OH)2, а при еше
больших концентрациях NiSO4 вначале выделяется 3NiSO4-
• 2Ni(OH)2, постепенно переходящий в 3NiSO4 • 4Ni (ОН)г и- По
другим данным12, при приливании раствора NaOH к раствору
NiSO4 образуется осадок NiSO4-4Ni(OH)2, а при обратном по-
рядке сливания растворов — NiSO4 • 5Ni (ОН)2- Четырехосновной
сульфат никеля неустойчив в воде и растворах NaOH и переходит
в Ni(OH)2.
В системе NiSO4—H2SO4—Н2О существуют13 комплексные
ионы [Ni(SO4)г]2-. Никельаммонийсульфдт Ni(NH4)2(SO4)2, обра-
Применение
733
зуется при подкислении серной кислотой аммиачного раствора суль-
фата никеля от pH = 7,1 -s- 8 до pH 4 при 55—60°. В присутствии
в растворе также кобальта при снижении pH до 6,2 выделяется
почти весь никель (практически свободный от кобальта) в виде
Ni(NH4)2(SO4)2. При снижении pH оставшегося раствора до 4 вы-
деляется остальной никель и почти весь кобальт в виде
Ni(NH4)2(SO4)2 и Co(NH4)2(SO4)214-.
В системе NiSO4—CoSO4—Н2О образуются смешанные кри-
сталлы; при 20° в ряду смешанных кристаллов имеется разрыв 15.
В системе NiSO4—Na2SO4 образуются твердые растворы в ши-
рокой области со стороны сульфата натрия и три двойные соли:
3Na2SO4 • NiSO4, Na2SO4-NiSO4 и Na2SO4 • 3NiSO4. Имеются две эв-
тектики: при 41% NiSO4 —67Г и при 55% NiSO4 — 700°|6.
ПРИМЕНЕНИЕ
Никелевый купорос применяют главным образом в гальвано-
технике при никелировании металлов, для изготовления аккумуля-
торов, для производства твердых сплавов, в жировой и парфюмер-
ной промышленности, для изготовления катализаторов и пр.
В смеси с другими препаратами его используют в качестве фун-
гицида 17.
Технический никель сернокислый выпускают трех марок:
НС-0 для производства реактивов, НС-1 с Государственным зна-
ком качества и НС-1 для никелирования, аккумуляторной, жиро-
вой и парфюмерной промышленности. Согласно ГОСТ 2665—73,
сульфат никеля должен содержать не менее 20,6% никеля вместе
с кобальтом, а при отсутствии последнего не менее 20,3% никеля.
Допустимые количества примесей указаны в табл. 48.
ТАБЛИЦА 48
Максимально допустимые количества примесей в техническом
сульфате никеля, %
Марка Со РЬ Zn Fe Си Са Mg Cl 1 Нераство- римый остаток
нс-0 0,2 0,001 0,004 0,001 0,001 0,08 0,03 0,01 0,03
Нс-1 с Гос. зн. ж 0,001 — 0,002 0,002 0,2 0,03 0,1 0,05
кач. НС-1 — 0,002 — 0,003 0,003 0,2 0,03 0.1 0,05
В сульфате никеля марки НС-0 содержание Са, Mg, Na и К в
сумме не должно превышать 0,3%; в продукте для аккумуляторной
промышленности должно быть меньше 0,02% магния, а для никели-
рования— меньше 0,004% цинка.
734
Гл. XX. Сульфат никеля
ПОЛУЧЕНИЕ НИКЕЛЕВОГО КУПОРОСА РАСТВОРЕНИЕМ НИКЕЛЯ
В СЕРНОЙ КИСЛОТЕ
Небольшие количества технического сульфата никеля изготов-
ляют растворением металлического никеля в серной кислоте, к ко-
торой добавлено немного азотной кислоты. На 1 кг металлического
никеля берут 5 кг 33—35%-ной серной кислоты и 120—150 г азот-
ной кислоты (100%). Реакция идет при нагревании паром до 60°.
Полученный раствор сульфата никеля, отделенный от нерастворив-
шегося остатка, в случае необходимости подвергают очистке от
примесей железа и меди. Медь может быть вытеснена из раствора
порошком металлического никеля, а железо после этого выде-
ляется в виде гидрата окиси действием черного гидрата никеля
(смесь гидратов 2, 3 и 4-валентного никеля) или зеленого гидрата
никеля (основной карбонат никеля) в присутствии кислорода воз-
духа. Полученный раствор сульфата никеля подвергают кристал-
лизации обычными способами.
Примеси железа и меди могут быть отделены от раствора
NiSO4 ступенчатым осаждением гидроокисей аммиаком с отделе-
нием осадка гидроокиси железа при рН = 3 и гидроокиси меди при
pH = 4,5. Осаждение гидроокисей облегчается при введении перед
каждой ступенью нейтрализации затравки соответствующей гидро-
окиси18. Разработан метод очистки раствора NiSO4 от примесей
железа и меди противоточной экстракцией; экстрагентом является
Ni-мыло 1Э.
Очистка раствора NiSO4 от ионов цинка может быть осущест-
влена анионообменным методом с применением смолы — вофатита
MD. Предварительно ее обрабатывают сероводородом для насы-
щения ионами S2~; при обработке под давлением 19 ат концентра-
ция серы достигает 0,58 г на 100 мл смолы. В результате ионного
обмена при pH = 3,2 протекает реакция:
S-вофатит + Zn2+ 4- SO2- = ZnS + SQ| + вофатит
При этом 80—90% выделяющегося сульфида цинка задержи-
вается в свободном объеме ионообменной колонны, равном 60—
70% от объема смолы. Остальное количество ZnS улавливается не-
полярным фильтром — вофатитом F20.
Ионообменные смолы могут быть также использованы для
очистки раствора NiSO4, полученного из отработанных катализато-
ров. Предварительно смолу обрабатывают щелочью. При пропу-
скании через такую смолу кислого водного раствора, содержащего
ионы Fe3+ и Ni2+, в результате ионного обмена pH раствора повы-
Получение никелевого купороса
735
шается до 3—5 и из раствора выделяется только железо. Наиболее
эффективно Fe3+ отделяется при рН = 4,5. Такая величина pH до-
стигается при обработке щелочных смол раствором NH4C121,
Очистка растворов NiSO4 при помощи ионообменных смол яв-
ляется, по-виднмому, наиболее эффективной.
ПОЛУЧЕНИЕ НИКЕЛЕВОГО КУПОРОСА ИЗ РАСТВОРОВ
КОБАЛЬТОВОГО ПРОИЗВОДСТВА
Наибольшее количество сульфата никеля получают сейчас из
никелевых сульфатных растворов кобальтового производства, со-
держащих ~30 г/л Ni. Они образуются при растворении в серной
кислоте зеленых гидратов, получаемых при электролитическом рас-
творении никель-кобальтовых анодов или при растворении кобаль-
тового шпур-штейна в атмосфере кислорода под давлением (в ав-
токлаве) .
Из сульфатного раствора, являющегося отходом кобальтового
производства, осаждают раствором соды карбонат никеля. Реак-
ционную смесь перемешивают воздухом в аппаратах Пачука и на-
гревают паром до 80°. Полученная суспензия отстаивается и верх-
ний слив удаляют в бассейн сточных вод, а из сгущенной пульпы
отделяют карбонат никеля на дисковом вакуум-фильтре. Осадок,
снятый с фильтра, имеет влажность 70%; его репульпируют с во-
дой в мешалке и повторно отфильтровывают на барабанном ва-
куум-фильтре. С последнего промытый влажный осадок направ-
ляют в аппараты Пачука, где его растворяют при 80—85° в кон-
центрированной серной кислоте (купоросном масле) для получения
раствора NiSO4, содержащего 160 г/л Ni. Этот раствор очищают
от примесей железа, меди и кобальта добавкой влажного карбо-
ната никеля. После отделения осадков-примесей на фильтрпрессе
раствор выпаривают в вакуум-выпарной батарее до содержания
260—270 г/л Ni и направляют на кристаллизацию никелевого купо-
роса в механические или вакуум-кристаллизаторы, где раствор
охлаждается до 17°. Кристаллы NiSO4-7H2O отделяют на центри-
фугах и с гигроскопической влажностью 3—5% укупоривают или
предварительно брикетируют на гидравлических прессах в блоки.
Часть маточного раствора, содержащего 120—140 г/л Ni, добав-
ляют к раствору, получаемому после растворения карбоната ни-
келя в серной кислоте, другую часть присоединяют к исходному
раствору, поступающему из кобальтового производства.
ПОЛУЧЕНИЕ НИКЕЛЕВОГО КУПОРОСА ИЗ РАСТВОРОВ
МЕДЕЭЛЕКТРОЛИТНЫХ ЗАВОДОВ
При электролитическом рафинировании меди на медеэлектро-
литных заводах сульфат никеля также получают в качестве по-
бочного продукта. При электролитическом растворении медных
736
Гл. XX. Сульфат никеля
анодов и осаждении меди на катоде электролитом служит раствор
медного купороса (стр. 688). При рафинировании меди некоторые'
содержащиеся в ней примеси почти полностью переходят в раствор,
другие — в шлам, а третьи — частично в шлам, частично в раствор.
Полностью переходят в раствор металлы, более электроположи-
тельные, чем медь. К ним относятся никель, цинк и железо. Эти ме-
таллы не осаждаются на катоде и постепенно накапливаются в
растворе, что приводит к уменьшению растворимости сульфата
меди и к ухудшению условий электролиза. Для поддержания в
электролите минимальной концентрации примесей часть раствора
периодически выводят из цикла электролиза и взамен добавляют
к электролиту серную кислоту. Выведенный раствор подвергают
регенерации.
При растворении 250 т анодов в сутки, содержащих 0,1% Ni,
в раствор переходит 250 кг Ni и необходимо ежесуточно выводить
из цикла 10 м3 раствора при содержании в нем 25 г/л Ni или 25 м3
при концентрации 10 г/л Ni. Обычно раствор, отбираемый для ре-
генерации, содержит (в г/л): 40 — Си, 180 — H2SO4, 15 — Ni, 3 —
Fe, 7 — As и др. Его вначале нейтрализуют медным скрапом в на-
травочной башне при продувке воздухом (стр. 671) и после вы-
парки кристаллизуют при охлаждении медный купорос. Маточ-
ный раствор подвергают дополнительной выпарке с последующей
кристаллизацией уже загрязненного медного купороса, который
очищают перекристаллизацией. Конечный маточный раствор со-
держит ~50 г/л Си, 40 г/л H2SO4 и 50 г/л Ni. Его подвергают
электролизу в ваннах со свинцовыми анодами, причем медь осаж-
дается на катодах с большим количеством примесей и отправ-
ляется затем в переплавку вместе с черновой медью. Отработан-
ный электролит содержит до 120 г/л H2SO4, 2 г/л Си и 55 г/л Ni.
Его выпаривают и охлаждают для кристаллизации никелевого ку-
пороса. Оставшийся маточный раствор вторично выпаривают и
подвергают кристаллизации и, при надобности, второй маточный
раствор подвергают аналогичной обработке. При первой кристал-
лизации получают достаточно чистый никелевый купорос, а при
следующих операциях кристаллизуется загрязненный продукт, ко-
торый подвергают перекристаллизации. Конечный раствор после
выпарки до 1200 г/л H2SO4 и очистки от примесей возвращают на
электролиз меди22.
ЛИТЕРАТУРА
1. Н. Г. Клюкина, Г. М. Кудришова, ЖПХ, 36, № 3, 495 (1963).—
2. М И. Архипов, А. Б, Пакшвер, Н. И. Подбориова, Там же, 23, № 6,
650 (1950). —3. О. Bagno, Compt. rend., 236, № 12, 1275 (1953).—
4. И. М, Вассерман, X, 3. Брайнина, ЖПХ, 31, № 11, 1617 (1958).—
5. И. М. Вассерман, Там же, 32, № 9, 1959 (1959). — 6. И. М. Вассерман,
Е. А. Фомина, X. 3. Брайнина, Там же, 32, № 11, 2619 (1959).—
7. И. М. Вассерман, Е. А. Фомина, Там же, 34, Ns 1, 90 (1961).—
Литература
737
8. И. Н. Плаксин, Д. М. Ю х т а н о в, Гидрометаллургия, Госметаллургиздат,
1949. — 9. Lor ant Bela, Z. analyt. Chem., 219, № 3, 256 (1966).—
10. Г. H. Доброхотов, ЖПХ, 13, № 10, 1118 (1950).
И. А. Л. P о тин ян, В. Л. Хейфец, Е. С. Козин, Е. Н. Калии на,
ЖОХ, 24, № 8, 1294 (1954). — 12, J. Besson, Н. Berger, Bull. Soc. chim.
France, 1955, № 10, 1286.— /3. Я. А. Ф и а л к о в, 3. А. Шена, ЖНХ, 1, № 6,
1238 (1956).— 14. F. A. Forward, канад. пат. 511442, 1955. — 15. О. С. Со-
болева, Наук. зап. Льв1вськ. ун-та, 34, 56 (1955). —16. К. А. Боль-
шаков, П. И. Федоров, ЖОХ, 26, № 2 348 (1956) — 17. С. Н. Иванова,
Жури. ВХО, 9, № 5, 496 (1964). — 18. Му ко ям а, япон. пат. 854, 1955.—
19. Н. И. Гельперин и др., ЖПХ, 34, № 8, 1728 (1966); сб. «Процессы жид-
костной экстракции и хемосорбции», Изд. «Химия», 1966, стр. 292.—
20- К. Eckstein, Bergakademie, 7, № 10. 483 (1955)
21. К у в а т а, И о с и к а в а, Кобаяси, J. Oil Chem. Soc. Japan, 3, № 5,
12 (1956). —22. А. А. Цен д лер. Металлургия меди и никели, Госметаллургиз-
дат, 1958.
Л24 М. Е. Поэвн
Глава XXI
ХЛОРИД КАЛЬЦИЯ
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Хлорид кальция СаС12 образует белые кристаллы кубической
формы с плотностью 2,51 г/см?. Плавится при 772°. Сильно гигро-
скопичен, на воздухе расплывается. Равновесная относительная
влажность воздуха над СаС12'2Н2О при 20° равна 22%, при 50°—
17%, а над СаС12-6Н2О при 10° — 38%, при 20° — 32,3%, при
24,5° — 31%. Высушивание гранулированным хлоридом кальция
при 25° позволяет понизить влажность газа до 0,14—0,25 г воды
в 1 м3. Практическая влагоемкость хлорида кальция при 25° (по-
верхностная) :
Относительная влажность газа, % .... 36 60 70 80 85 90 95
Влагоемкость, кг/кг ........... 1,0 1,6 2,0 2,8 ,3,5 5,0 8,4
Сведения о растворимости и кристаллогидратах СаС12 даны
в табл. 49 и на рис. 202. О вязкости водных растворов СаС12 см.'.
Температуры кипения растворов СаС12:
СаС12, %................ 40,8 50 58 75
Дип, °C.,................ 120 130 140 175
С аммиаком СаС12 образует двойные соединения СаС12-41ЧНз,
CaCl2-8NH3.
При повышенных температурах СаС12 разлагается кислородом
воздуха и парами воды по реакциям
СаС12 4- 0,5О2 * СаО 4- С12
СаС124-Н2О СаО + 2НС1
в в присутствии SiO2 или А120з идут реакции:
2СаС12 4- SiO2 4- О2 < * 2СаО • SiO2 4- 2С12
ЗСаС12 4-А12О3 4-1,5О2 ЗСаО-А12О34-ЗС12
Заметное разложение СаС12 в сухом и влажном воздухе идет
выше 830°, в присутствии SiO2— выше 720°, в присутствии А120з—
выше 800° 2>3.
Физико-химические свойства
739
ТАБЛИЦА 49
Растворимость СаС12 в воде
Температура, °C Концентрация СаС12 в растворе, % Твердые фааы
—49,8 30,5 Лед + СаС12 • 6Н2О
—25 33,4 СаС12 • 6Н2О
0 37,3 То же
20 42,7 » »
30 50,0 СаС12 • 6Н2О + а-СаС12 • 4Н2О
29,5 52,4 СаС12 • 6Н2О + Д-СаС12 • 4Н2О (мет)>
29,2 53,0 СаС12 • 6Н2О + у-СаС]2 • 4Н2О (мет.}
40 53,6 а-СаС12 • 4Н2О
45,3 56,5 а-СаС12 • 4Н2О + СаС12 • 2Н2О
50 56,9 СаС12 • 2Н2О
75 59,1 То же
мо 61,3 » »
Й5 63,7 » »
150 67,2 » »
175,5 74,9 СаС12 • 2Н2О + СаС12 • Н2О
200 75,7 СаС12 • Н2О
260 77,7 СаС12 • Н2О + СаС12
300 80 СаС12
Известен субхлорид кальция СаС12,''устойчивый при температуре
выше 800°, образующийся при нагревании СаС12 с металлическим
Рис. 202. Растворимость в
внстеме СаС12—Н2О.
кальцием, Субхлорид кальция окрашен в:
красно-фиолетовый цвет. Он может быть
получен при комнатной температуре в
метастабильном состоянии при быстром,
переохлаждении.
о ю го зо го so во
СаС12, вес. %
Рис. 203. Растворимость в системе
СаС12—Са(ОН)2—Н2О.
В системе СаС12—Са(ОН)2—Н2О (рис. 203) в интервале 5—750,
кристаллизуются 8 твердых фаз: Са(ОН)2, СаС12 • Са(ОН)2 • Н2О,
740
Гл. XXL Хлорид кальция
СаС12 • ЗСа(ОН)2 • 12Н2О, СаС!2’2Н2О, а-, 0- и у'-СаС!2-4Н2О и
СаС12-6Н2О?. Гидрооксихлорид кальция СаС12 • ЗСа(ОН)2 • 12Н2О'
кристаллизуется в виде прозрачных игольчатых кристаллов ромби-
ческой сингонии. В воде и при температуре выше 50° разлагается
с образованием раствора СаС12 и Са(ОН)2.
В солянокислых растворах растворимость СаС12 уменьшается
и тем в большей степени, чем ниже температура. При 0° в растворе
с содержанием 27,98% НС1 растворяется 9,1% СаС12 (вместо
37,30% в воде), при 15° и содержании в растворе 26,20% НС] рас-
творяется 21,3% СаС12 (вместо 41,2% в воде). В системе НС1—
СаС12—Н2О при 15° кристаллизуются две твердые фазы: СаС12*
-2Н2О и СаС12-6Н2О, при 25° — три твердые фазы: СаС12-2Н2О,
СаС12-4Н2О, СаС12 •бНгО. Хлорид кальция высаливает NaCl из
его водных растворов, особенно при пониженных температурах.
Растворимость NaCl в системе СаС12—NaCl—Н2О (при 0°) непре-
рывно уменьшается по мере растворения СаС12 (от 26,23% в воде
до 0,62% в растворе, содержащем 34,87% СаС12). При более высо-
ких температурах, помимо NaCl, кристаллизуются также СаС12-
- 6Н2О или СаС12 • 2Н2О; при —5. —23° кристаллизуются твердые
фазы: лед, NaCl • 2Н2О, NaCl и СаС12 • 6Н2О.
В системе СаС12—NaCl—Н2О из метастабильных растворов при
концентрации NaCl до 0,5 мол.% могут выделяться а-, 0- и у-моди-
фикации СаС12-4Н2О. В системе СаС12—НС1—Н2О существуют,
наряду со стабильными, также метастабильные области выделения
всех трех модификаций тетрагидрата СаС12 и СаС12-2Н2О. Мета-
стабильные растворы характеризуются большими значениями вяз-
кости и плотности 5(О давлении пара в системах СаС12—NaCl—
Н2О, СаС12—КС!—Н2О и СаС12—НС1—Н2О см.6-7.
В системе СаС12—MgCl2—Н2О в интервале температур от 0 до
170° кристаллизуются MgCl2-6H2O, СаС12-6Н2О, 2MgCl2 • СаС12 •
• 12Н2О, СаС12-4Н2О (стабильная и метастабильная), СаС!2-2Н2О,
MgCl2 • 2СаС12 • 12Н2О, MgCl2 • 2СаС12 • 6Н2О и MgCl2-6H2O. Наи-
меньшую растворимость при 55° имеет инконгруэнтно растворяю-
щаяся двойная соль MgCl2 • 2СаС12 • 12Н2О. По сравнению с изо-
термой 25° ветвь кристаллизации этой соли при 55° больше
приблизительно в 5 раз8. В безводной системе СаС12—MgCl2 эвтек-
тической точке соответствуют 51% СаС12 и 611°.
В водной системе Са2+, Mg2+, К+||С1~ между 18 и 93° с увели-
чением температуры возрастает поле кристаллизации СаС12-
• 2MgCl2 • 12Н2О, появляющееся при 22°, и уменьшаются поля кри-
сталлизации СаС12 • 6Н2О и MgCl2 • 6Н2О. Увеличивается также
поле кристаллизации СаС12-КС1 за счет полей СаС12 • 2Н2О и
карналлита. При 92° начинает кристаллизоваться 2CaCI2- MgCI2-
- 6Н2О, поле кристаллизации которого возрастает при дальнейшем
повышении температуры за счет полей СаС12 • MgCl2 • 12Н2О и
СаС12 • 2Н2О9.
Применение
741
ПРИМЕНЕНИЕ
Хлорид кальция используют в производстве хлорида бария, не-
которых красителей, для коагуляции латекса, в химико-фармацев-
тической промышленности, при обработке сточных вод, в систе-
мах для кондиционирования воздуха, при экстракции масел и др.10.
Ё связи с большой гигроскопичностью его часто применяют в ка-
честве осушителя газов и жидкостей. Его применяют также для
получения металлического кальция электролизом, для производ-
ства кальциевых сплавов и баббитов.
Низкие температуры замерзания водных растворов хлорида
кальция позволяют применять его в качестве хладоносителя в хо-
лодильном деле и в качестве антифриза для двигателей внутрен-
него сгорания в авиации, автомобильном транспорте, для борьбы
с гололедицей, для предотвращения смерзаемости угля и руд при
транспортировании в зимнее время и др. Существенным недостат-
ком его является сильное коррозирующее действие на металлы,
которое уменьшается при введении в раствор хлорида кальция
окислителей —хроматов или бихроматов11’12. Коррозия умень-
шается и в присутствии ионов магния. Раствор СаС12 4- A'lgCh
также служит жидкостью с низкой температурой замерзания.
Его приготовляют как из твердых солей, так и смешивая, на-
пример, конечный карналлитовый щелок (стр. 161) с предва-
рительно упаренной дистиллерной жидкостью содового производ-
ства 13.
За рубежом масштабы применения хлорида кальция весьма
велики вследствие использования его для обеспыливания грунто-
вых и щебеночных дорог и при строительстве дорог. Периодиче-
ское (3—4 раза за летний сезон) нанесение раствора СаС12 устра-
няет пылеобразование. При строительстве дорог СаС12 используют
в качестве одного из компонентов цементо-грунта — подстилаю-
щего слоя дороги. При строительстве 1 км силикатированной до-
роги расходуют ~3т 75% раствора СаС12.
В присутствии СаС12 ускоряется твердение бетона и увеличи-
вается морозостойкость строительных растворов. Некоторое рас-
пространение в последние годы хлорид кальция получил в качестве
добавки к шихте при производстве кирпича-сырца на заводах с
естественной сушкой.
Хлорид кальция можно применять для предотвращения пыле-
ния угля, в частности для предотвращения появления взрывоопас-
ной угольной пыли в шахтах, а также в качестве гербицида для
уничтожения сорняков на железнодорожных путях.
Хлорид кальция может быть использован для мелиорации со-
лонцовых почв с большей эффективностью, чем гипс. Возможно
также использование его раствора в качестве тяжелой жидкости
при углеобогащении.
24 М. Е. Позин
742
Гл. XXI. Хлорид кальция
Хлорид кальция выпускают в виде раствора, плавленого про-
дукта (порошкообразного, чешуйчатого или гранулированного),
представляющего собой смесь двух- и четырехводного кристалло-
гидратов, и в виде кальцинированного, обезвоженного продукта
(порошкообразного или гранулированного) (табл. 50).
ТАБЛИЦА 50
Требования к качеству хлорида кальция (содержание компонентов в %)
Кальцинированный Плавленый Жидкий
по ГОСТ 5.831-71 (со знаком качества) по ГОСТ 450 - 70
1-й сорт 2-й сорт 1-й сорт 2-й сорт 14k сорт 2-й сорт
СаС12, не меиве ... MgCl2, не более . . . Прочие хлориды (NaCl), не более . . Сульфаты (SO4), не более Железо (Fe), не бо- лее . . Не растворимый в воде остаток, не более КСЮз, не более . . . Влага, не более . . . 96,5 0,5 1,0 0,05 0,004 0,1 3,0 96 0,5 Не ио 0,06 0,004 0,2 Нен 90 0,6 >мируется Не норми- руется Не норми- руется 0,6 э р м и р у 1 н 76 0,3 2,0 0,2 0,02 0,2 s т с я ио 67 0.5 Не норми- руется 0,3 0,05 0,5 2,7 ? м и р у 38 0,2 2,5 Не иорь 0,01 0.03 Не норми- руется е т с я 32 0,3 3,0 ируется Не норми руется 0,15 1,2
Кальцинированный и плавленый хлорид кальция упа-
ковывают в металлические барабаны, в полиэтиленовые или бу-
мажные пят'ислойные битумированные мешки. Предложено пере-
возить его в железнодорожных цистернах, загружаемых горячим
концентрированным раствором СаС12, затвердевающим при есте-
ственном охлаждении. Для разгрузки в цистерну необходимо по-
дать воду или разбавленный раствор в количестве, требующемся
для получения стандартного раствора !4.
* СЫРЬЕ
Сырьем для производства плавленого хлорида кальция служат
промышленные отходы растворов хлорида кальция, получающиеся
в больших количествах на содовых заводах, при производстве хло-
рата калия и др.
Дистиллерная жидкость, получающаяся в производстве соды
по аммиачному способу при регенерации аммиака по реакции
2NH4C1 + Са(ОН)2 = СаС|2 + 2Н2О + 2NH3
имеет плотность 1,12—1,13 г/см3 и содержит 9,2—11,3% СаС12,
4,7—5% NaCl и небольшие количества растворенных гипса, гидро-
окиси кальция и аммиака в смеси с взвешенным осадком. Послед-
ний состоит из СаСОз, Са(ОН)2 и CaSO4-2H^O; количество осадка
равно 20—25 кг/м3. На каждую тонну производимой соды .выбра-
Получение плавленого CaCh из дистиллерной жидкости
743
сывается в дистиллерной жидкости более 1 т СаС12 и 0,5—0,6 т
NaCl.
В производстве бертолетовой соли после кристаллизации KClOg
остается маточный щелок, содержащий 400—500 г/л СаС12, по 10—
20 г/л КСЮз и КС1 и незначительные количества других примесей.
Этот щелок является отходом производства и выпускается в виде
товарного продукта, применяемого для разных целей, в частности
для производства хлорида бария (см. гл. XII). Путем его выпари-
вания получают твердый (плавленый) хлорид кальция.
Для производства хлорида кальция сырьем служат также со-
ляная кислота и высококачественный известняк, содержащий
малые количества примесей R2O3, MgO, SiO2, S и Р.
В некоторых случаях хлорид кальция (22—25% раствор) полу-
чают из хлормагниевого рассола, обрабатывая его гашеной из-
вестью и отделяя на фильтре осадок гидроокиси магния *5.
Хлорид кальция образуется при хлорировании окиси кальция
выше 600°16, а также при хлорировании сульфата кальция в среде
расплавленного СаС12 в присутствии восстановителя выше 800° 17>18.
Эти способы получения СаС12 в промышленности не применяются.
ПОЛУЧЕНИЕ ПЛАВЛЕНОГО ХЛОРИДА КАЛЬЦИЯ
ИЗ ДИСТИЛЛЕРНОЙ ЖИДКОСТИ СОДОВОГО ПРОИЗВОДСТВА
Получение товарного хлорида кальция из дистиллерной жид-
кости содового производства19'20 заключается в последовательном
выпаривании дистиллерной жидкости от концентрации ~10%
СаС12 до 67%, требуемой условиями ГОСТ на плавленый продукт.
Выпарку ведут в одиночных или батарейных плавильных котлах,
обогреваемых топочными газами, в вакуум-выпарных аппаратах,
обогреваемым паром, в распылительных сушилках и др.
Отстоявшуюся дистиллерную жидкость можно подвергнуть кар-
бонизации и обработке хлоридом бария с последующим отстаива-
нием для очистки жидкости от растворенных в ней извести и гипса.
При наличии в растворе ионов SO4- может произойти загипсовыва-
ние греющих поверхностей выпарных аппаратов. Очистка раствора
с помощью ВаС12 приводит, однако, к увеличению производствен-
ных издержек и не позволяет использовать выделяющуюся при
выпарке поваренную соль в качестве пищевого продукта. Поэтому
карбонизацию дистиллерной жидкости и обработку ее хлоридом
бария часто не производят.
При выпаривании не очищенной от ионов SOI- и ОН- дистил-
лерной .жидкости в выпарном аппарате с естественной Цирку-
ляцией коэффициент теплопередачи за 92 ч снижается на -~40%
от своего первоначального значения. [Опыт был выполнен с ди-
стиллерной жидкостью следующего состава (в г/л): 122,7 — СаС12.
24*
744
Гл. XXL Хлорид калоция
62,84 — NaCl, 0,93 — CaSO4, 1,61—Са(ОН)2; плотность 1,134 г/сл13.]
Выпаривание с принудительной циркуляцией при скорости жидко-'
сти в трубах ~3,5 м/сек и при добавке кристаллической подкладки :
в виде гипса (3—5% от веса жидкости) не предотвращает инкру- !
стирования греющих поверхностей сульфатом кальция. Однако про-
изводительность аппарата при этом увеличивается в ~3 раза, а
продолжительность работы до чистки в ~2 раза21. Интенсивность
зарастания греющей поверхности и твердость образующейся корки
сульфатов (состоящей из гипса, полугидрата сульфата кальция ,
или ангидрита) сильно зависит от температурного режима выпарки.
На некоторых содовых заводах выпаривают неочищенную дистил- 1
лерную жидкость, останавливая аппарат для удаления инкруста-
ций после 25—35 суток непрерывной работы.
Осветленную дистиллерную жидкость выпаривают обычно в мно-
гокорпусных выпарных аппаратах. По достижении концентрации i
~40% СаС12 выделяется в осадок почти вся содержащаяся в жид- ,
кости поваренная соль. Она может быть возвращена в производ- ;
ство соды при условии тщательной отмывки от СаС12 (во избежа- ,
ние увеличения расхода соды на стадии предварительной очистки 1
рассола NaCl). Отфугованная от маточного раствора, промытая и s
высушенная поваренная соль очень чиста и пригодна для пищевых 1
целей (если дистиллерная жидкость предварительно не обрабаты-
валась хлоридом бария). Попутное получение чистой пищевой по-
варенной соли является важным условием рентабельности произ-
водства хлорида кальция 22~24.
Концентрированный раствор СаС12 после отделения поварен-
ной соли продолжают выпаривать до концентрации 67% СаС12
обычно в плавильных аппаратах непрерывного действия до повы-
шения его температуры кипения до 175°. Затем жидкость разли-
вают в барабаны, где она застывает в плавленый продукт. Для по-
лучения чешуйчатого продукта плав выпускают на поверхность
охлаждаемого барабана.
Другим вариантом получения твердого хлорида кальция из дис-
тиллерной жидкости является следующий 25-26. Осветленную ди-
стиллерную жидкость выпаривают до концентрации 40% СаС12,
отделяют осадок NaCl, а раствор нейтрализуют соляной кислотой
и добавляют к нему хлорную известь для окисления 52ОГ> SO1-
и Fe2+. После перемешивания добавляют Са(ОН)2 или NaOH, от-
деляют осадок, а фильтрат упаривают до концентрации 52% СаС12.
Затем, после охлаждения до 50°, отстаиванием и фильтрованием
удаляют выделившиеся кристаллы NaCl, а раствор высушивают
в распылительной сушилке, где получается продукт I сорта.
Разработан способ обезвоживания хлорида кальция азеотроп-
ной дистилляцией с помощью фракции нефти, кипящей в пределах
160—260°27. Нефть после регенерации можно возвращать на ди-
стилляцию— при этом продукт в меньшей мере окрашен ₽ желтый
Получение СаС12 из щелока хлоратного производства
74В
цвет. Обезвоженный хлорид кальция содержит меньше 0,1% НгО.
На дистилляцию 50%-ного исходного материала подают ~4 кг
нефти, а на дистилляцию 75%-ного — Зкг нефти на 1кг безвод-
ного СаС12. При таком способе обезвоживания коррозия аппара-
туры и расход тепла меньше, чем при выпарке раствора СаС12.
Хлорид кальция может быть получен в результате регенерации
аммиака из хлорида аммония мелом сухим способом:
2NH4C1 + СаСО3 - СаС12 4- 2NH3 + СО2 4- Н2О
Реакция протекает по схеме:
NH4CI NH3 + HC1
2НС1 4- СаСОз СаС12 4- СО2 4- Н2О
При 200—225° процесс лимитируется скоростью реакции вза-
имодействия газообразного хлористого водорода и СаСОз; при
350° процесс лимитируется диффузией28. Опыты в модели шахт-
ной печи показали29, что при пропускании возогнанного хлорида
аммония через слой кускового мела (3—7 мм) при 420—450° полу-
чается продукт, содержащий 80—85% СаС12. Промышленное осу-
ществление этого процесса затруднено сильной коррозией и обра-
зованием настылей. Кроме того, при использовании стальной
аппаратуры, теряется до 30% аммиака вследствие его каталитиче-
ского разложения. В керамической и эмалированной аппаратуре
потери аммиака невелики.
ПОЛУЧЕНИЕ ХЛОРИДА КАЛЬЦИЯ ИЗ МАТОЧНОГО ЩЕЛОКА
ХЛОРАТНОГО ПРОИЗВОДСТВА
Получение плавленого хлорида кальция из маточного щелока
хлоратного производства, содержащего в 4—5 раз больше СаС12,
чем дистиллерная жидкость, является значительно более эконо-
мичным. Здесь, однако, идет более сильная коррозия вследствие
примеси хлората. Процесс осуществляется аналогично получению
хлористого магния из хлормагниевых щелоков (стр. 275), т. е. пу-
тем выпаривания в чугунных котлах, обогреваемых топочными га-
зами. Иногда выпаривание ведут в стальных котлах, в стенках ко-
торых заделаны стальные змеевики; по змеевикам циркулирует
перегретая вода или другой теплоноситель. Выпаривание ведут до
тех пор, пока температура кипения жидкости не поднимается до
165—175°. При этом концентрация щелока достигает 67—75%
СаС12, после чего его чешуируют на холодильном барабане или
сливают в тару, где он застывает в плав, состоящий из смеси
СаС12.2Н2О и СаС12-4Н2О.
746
Г л. XXI. Хлорид кальция
ПОЛУЧЕНИЕ ГИДРООКСИХЛОРИДА КАЛЬЦИЯ И ХЛОРИДА КАЛЬЦИЯ
ИЗ НЕГО
Гидрооксихлорид кальция СаС12 • ЗСа(ОН)2 • 12Н2О образуется
при смешении в стехиометрическом отношении хлорида кальция,
молотой извести и воды. Его можно выделить из дистиллерной
жидкости без выпарки ее или на определенной стадии ее выпари-
вания. Он может быть использован непосредственно, например
в строительной технике в качестве добавки, ускоряющей твердение
бетона18,30, или переработан на хлорид кальция31.
Из водного ~1О°/о раствора СаС12 прибавлением сухой гаше-
ной извести можно выделить при 0—1° в виде гидрооксихлорида
кальция до ~26% СаС12. При этом образуется хорошо кристалли-
зующийся осадок. В маточном растворе, количество которого со-
ставляет ~80% от исходных количеств раствора СаС12 и Са(ОН)2,
содержится 6—7% СаС12 и ~0,1% Са(ОН)2. Из дистиллерной
жидкости, предварительно выпаренной до содержания 21—22%
СаС12, при этих же условиях выделяется до 65% СаС12. Для полу-
чения кристаллов в хорошо фильтрующейся форме в этом случае
необходимо применять вместо сухой гидроокиси кальция извест-
ковое молоко. При этом осаждение следует производить, добавляя
раствор СаС12 к подогретому до 50—60° известковому молоку при
постоянном перемешивании. Затем массу охлаждают до ~1° для
получения максимального выхода гидрооксихлорида. В жидкой
фазе, количество которой ~50% от исходной смеси, после кристал-
лизации гидрооксихлорида остается 7—8% СаС12 и ~0,15%
Са(ОН)2.
На рис. 203 видно, что при обработке СаС12 • ЗСа(ОН)2 • 12Н2О
водой при 50—60° он разлагается с образованием растворов, со-
держащих до 32% СаС12 и чистого Са(ОН)2. Для получения 30%
раствора СаС12 при 55° необходимо обработать гидрооксихлорид
небольшим количеством воды — 5—6% от веса гидрооксихлорида.
Однако при этом получается плохо фильтрующаяся масса. Лучшие
результаты достигаются при разложении гидрооксихлорида не-
сколько большим количеством воды — приблизительно 14% от его
веса. В этом случае в полученном растворе содержится 24—25%
СаС12.
Изложенное свидетельствует, что переработка гидрооксихло-
рида кальция, получаемого из дистиллерной жидкости, не может
быть экономичной и поэтому она не применяется.
Использование более концентрированных (чем дистйллерная
жидкость) растворов СаС12 для получения гидрооксихлорида каль-
ция дает существенные преимущества. Так, если применять рас-
твор с концентрацией 25—35% СаС12, то можно получить высокий
Выход продукта при охлаждении реакционной массы до 20° (вме-
сто 0е).
Получение С adj из соляной кислоты и известняка
7W
ПОЛУЧЕНИЕ БЕЗВОДНОГО ХЛОРИДА КАЛЬЦИЯ
ИЗ СОЛЯНОЙ кислоты и известняка
Получение хлорида кальция этим методом заключается в рас-
творении известняка в соляной кислоте, в очистке образующегося
«сырого» (неочищенного) раствора СаС12 от примесей и в обезво
живании его. Продукт получается более чистым, чем из отходящих
жидкостей содового или хлоратного производства.
Растворение известняка (куски не больше 50 мм) производят
в стальных баках, футерованных двумя слоями диабазовой плитки.
В нижней части растворителя имеется решетка из диабазовых
плиток, поддерживающая загружаемый известняк. Соляную кис-
лоту, разбавленную до 14% НС1, подают из напорного бака. Обра-
зующийся раствор СаС12, вытекающий из растворителя через шту-
цер в нижней его части по винипластовой трубе, должен содержать
не больше 14 г/л свободной кислоты. Этого достигают, поддержи-
вая определенную высоту слоя известняка.
Выделяющиеся из растворителей газы, содержащие СО2 и НС1,
протягиваются вентилятором через керамическую башню, запол-
ненную известняком и орошаемую разбавленным раствором хло-
рида кальция. Вытекающий из башни раствор, содержащий 300—
350 г/л СаС12, примешивают к основному раствору.
Получающийся сырой раствор, содержащий 450—600 г/л СаС12,
очищают от примесей соединений Fe, Mg, Al и SOf". Очистку про-
изводят в стальном, футерованном диабазовой плиткой реакторе
с пропеллерной мешалкой (30 об/мин). Вначале раствор очищают
от сульфатов. В реактор заливают ~10 м3 сырого раствора и вво-
дят в него в сухом виде при перемешивании ~15 кг хлористого
бария. Осаждение сульфата бария заканчивается в течение 20—
25 мин. Затем раствор подогревают острым паром до 70—75° и
добавляют к нему известь-пушонку для осаждения гидроокисей
железа, магния и алюминия. После 40—50-минутного отстаивания
раствор профильтровывают. Количество примесей в нем не должно
превышать: 0,003 г/л Fe, 0,03 г/л SOI', 0,025 г/л Mg. Раствор со-
держит немного Са(ОН)2 (в пересчете на СаО 2,8—3,5 г/л). Для
получения безводного продукта в распылительной сушилке раствор
должен иметь нейтральную или слабощелочную реакцию: при зна-
чительной щелочности раствор вспенивается, что затрудняет ра-
боту разбрызгивающей форсунки. Нейтрализацию избыточной ще-
лочности осуществляют, добавляя при перемешивании соляную кис-
лоту в сборник очищенного раствора. Затем очищенный раствор
проходит через пенный аппарат (см. ниже), где его концентрация
повышается до 700 г/л СаС12, и поступает на обезвоживание.
Обёзвоживание хлорида кальция производят, распыляя раствор
в потоке горячего газа. Стальная сушильная башня изнутри выло-
жена листом из стали 1Х18Н10Т и имеет диаметр 5,5 и высоту
748
Гл. XXI. Хлорид кальция
11 м с коническими верхней и нижней частями. Вокруг нижнего
основания верхнего конуса с наружной стороны расположен желоб '
высотой около 0,5 м, из которого раствор СаС12 подается в фор-
сунку. Распыление раствора производят предварительно высушен-
ным сжатым воздухом (Зат). В верхнюю часть сушильной башни
поступает топочный газ, получаемый сжиганием природного газа,
разбавленный воздухом для понижения его тем-
пературы до 500°. Распыленный раствор и горя-
чий газ движутся в сушилке прямотоком сверху
вниз. При этом вода из раствора выпаривается |
и образуется почти безводный продукт в виде |
сухого порошка. Часть СаС12 оседает внизу баш- |
ни и скапливается в конусном бункере. Большая |
часть продукта уносится потоком воздуха и улав- I
ливается в двух параллельно работающих цикло- |
нах. Продукт выгружают как из циклонов, так |
и из башни и упаковывают в барабаны из оцин- I
кованного железа. ’
Газ, выходящий из циклонов, уносит значи-
тельное количество хлорида кальция (2—2,5 г/м3).
Для его улавливания применяют82 пенные аппа-
раты, служащие одновременно и пылеуловите-
лями и утилизаторами тепла газа; это тепло ис-
пользуется для выпарки раствора перед его пос-
туплением в сушильную башню. Пенные аппараты,
применяемые в разных отраслях промышленно-
сти, позволяют осуществлять очистку газов,
абсорбцию, теплопередачу и другие процес-
сы, происходящие при контакте газов с
жидкостями с весьма большой интенсив-
ностью 33’34.
Пенный аппарат (рис. 204), диаметром 2,2 м
и высотой 4,1 м, имеет горизонтально располо-
женную решетку с отверстиями 6 мм. Живое се-
чение перфорированной части решетки составляет 21%. Раствор
подается на решетку с одной стороны, течет по ней в виде слоя
пены и отводится с решетки с другой стороны. Газ поступает в ап-
парат снизу и, пройдя через отверстия решетки, вспенивает на-
ходящуюся на ней жидкость. При скорости газа в полном сече-
нии аппарата 1,5—3,5 м/сек создается высокая турбулентность
газо-жидкостной системы, обеспечивающая интенсивное протека-
ние процессов в этой системе, в данном случае улавливания пыли
хлорида кальция и теплообмена. Схема установки для очистки
газа от хлорида кальция показана на рис. 205. Очищенный раствор
СаС12 предварительно проходит через пенный аппарат. Выходя-
щий из него подогретый и выпаренный раствор концентрацией
Рис. 204. Пенный
аппарат с ловуш-
кой:
/ — корпус аппарата|
2-реШетка; 3-^пв0Д
жидкости; 4 — отвод
жидкости; 5~ порог;
• — вливййя и сливная
коробки}/—ввод газа;
8 — вывод газа; $ — от-
бойная решетка;
10 — отб$йный Зонт;
11 - ловушка; 12 — от-
вод утечной жидко-
сти; 13 — выхлоп газа;
14 — смотровое отвер-
стие.
Литература
749
СаСк до 700 г/л подают в сушильную башню. Выпарку раствора
осуществляют отработанным газом, температура которого сни-
жается от 150—160° до 80—90°. Улавливание брызг раствора, уно-
симых газом из пенного аппарата,
производится в специальной ло-
вушке.
Твердый гранулированный
хлорид кальция можно получать
смешением в барабане порошко-
образных отходов безводного и ча-
стично обезвоженного СаС12 с не-
прерывно распыляемым раство-
ром, содержащим более 50%
СаС12. Смешение производят в по-
токе газа с температурой 200—
500°. Если температура массы
150—180°, то в результате высу-
шивания массы при такой темпе-
ратуре получается продукт, содер-
жащий от 3 до 13% Н2О. Даль-
нейшей сушкой при 250—500°
получают безводный продукт.
В зависимости от требований к
продукту производят дробление и
рассеивание массы, полученной
при первой или второй сушке, с
Рис. 205. Схема установки для
очистки воздуха от хлорида кальция:
/ — сушильная башня; 2 — пенный аппарат;
3 — сборник раствора; 4 — промежуточный
бак: 5 — насос.
возвратом отходов в производст-
венный цикл35136. Запатентован способ гранулирования СаС12 • Н2О
пропусканием расплава через узкое сопло под давлением, превышаю-
щим в 1,4—2,9 раз давление насыщенного пара над расплавом37.
ЛИТЕРАТУРА
1. Л. Л. Эзр охи, Труды ВН.ИИГ, в. 2, 1967, стр. 3.—2. Э. И. Кужах ме-
то в, Г. И. Гнатышеико, ЖЙХ, 39, № 6, 1266 (1966). — 3. Ф. К. Михай-
лов, Л. М. Волова, Л. С. Коваленко Хим. проц., № 8, 595 (1964).—
4. С. 3. Макаров, И. И. Вольнов, ИСФХА АН СССР, 25, 320 (1954).—
5. И. Г. Дружинин, А. И. Шепелев, Труды Ин-та химии АН КиргССР,
№ 7, 1956, стр. 3. — 6. А. И. Мун, ЖОХ, 26, № 4, 1021 (1956). —7. Л. С. Ля-
лич, М. Д. А н и к и е в а, Вести. ЛГУ, № 22, сер. физ. и хим., в. 4. 97 (1956).—
8. А. П. Перова, Сообщения о научных работах бХО им. Д. И. Менделеева,
в. 2, 1955, стр. 46. — 9. Q. О. Assarsson, A. Balder, J. Phys. Chem., 56,
№ 7, 631 (1955). 10. M. Boivin, Chim. et ind., 97, № 9, 1339 (1967).
И. И. Л. Розенфельд, Замедлители коррозии в нейтральных средах,
Изд. АН СССР, 1953. — 72. 3. И. Конопкина, ЖПХ, 31, № 9, 1310 (1958). —
73. Пат. ГДР 32362, 1963.— 74. Н. D. Loss, канад. пат. 495340, 1953.—
75. А. Ё. К р у г л и к о в и др., Тезисы доклада на VI Всесоюзной конференции
по технологии неорганических веществ, Тбилиси, 1968, стр. 248. — 16. А. Н. К§-
т о в, В. В. Печковский, Л. П. Костин, сб. «Исследования в области хийи
750
Гл. XXI. Хлорид кальция
и технологии минеральных солей и окислов», Изд. «Наука», 1965, стр. 202.— Я
17. В. В. Печковский, А. Л. Софронов, ЖПХ, 40, № 12, 2711 (1967).— чЯ
18. П. П. Б у д н и к о в, Э. И. К р е ч, Там же, 14, № 6, 747, 755 (1941).— Я
19. В. Л. Рыдник, Хим. пром., № 8, 253 (1953). — 20. Д. С. Бодров, Труды Я
НИОХИМ, т. 11, 1958, стр. 27. 1
21. В. В. Тимошенко, Там же, стр. 251. — 22. В. Ф. Чернов, Произ- Я
водство кальцинированной соды, Госхимиздат, 1956. — 23. А. Ф. Борячек, Я
А. Н. Вишневский, П. Г. Власов, А. Я. Бакулина, Труды НИОХИМ, Я
т. 13, 1961, стр. 10. — 24. Ф. К. Михайлов, Хим. пром., № 7, 391 (1956).—
25, В. В. Тимошенко, Э. Ф. Овчинникова, Х1м. пром. Укра1ни, № 2
(22), 25 (1965). — 26. Р. Г. П у ш к а р, Там же, № 1 (25), 6 (1966). —Ж
27. Е. Р Ischinger, Z. Szufarski, Przem. Chem., 38, № 7, 426 (1959). — Я
28. M. К. Шелудько, А. И. Черников, Т. А. Ж и л я е в а, 29, № 5, 708 И
(1956). — 29. Ф. К. Михайлов, В. И. Панов, В. С. Еремеев, Труды И
НИОХИМ, т. 12, 1959, стр. 90.—30. В. Ф. Журавлев, Химия вяжущих ве-И
ществ, Госхимиздат, 1951. я
31. И. И. Вольнов, Е. И. Латышева, ЖПХ, 30, № 7, 977 (1957).— I
32. В. И. Штейнберг, Обмен опытом ГК по химии при Совете Министров I
СССР, № 6 (51), 7 (1958); Бюлл. по обмену опытом в азотной пром., № 11, 5 Я
Г)). — 33. М. ’ Е. П о з и н И. П. М у х л е н о в, Е. С. Тумаркина,!
Я. Т а р а т, Пенный способ обработки газов и жидкостей, Госхимиздат, I
.1955.—34. М. Е. Поз ин, И. П. Мух л ено в, Э. Я. Т а р а т. Пенные газоочи- I
стители, теплообменники и абсорберы, Госхимиздат, 1959. — 35. W. R. Bennet, Я
N. L. Carmouche, пат. США 2646343, 1953. — 36. A. Wilcox Le Roy, 1
А. С. Speer, пат. США 3250593, 1964.— 37. Япон. пат. 21128, 1962.
Глава X X 11
СОЕДИНЕНИЯ МАРГАНЦА
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Марганец образует ряд окислов: закись МпО, окись Мп20з,
двуокись МпО2, марганцоватистый ангидрид Mn2Os * **, марганцови-
стый ангидрид МпОз * и марганцовый ангидрид Мп2О7. Окислы и
гидроокислы марганца 1 являются важнейшими марганцовыми ми-
нералами (табл. 51).
ТАБЛИЦА 51
Природные кислородные соединения марганца
Минерал Химическая формула Плотность ♦♦
Пиролюзит и полианит или рамс- деллит МпО2 (0 и у) 4,75—5
Вернадит МпО2 • пН2О 3,0—3,2
Курнакит или браунит Мп2О3 (а и 0) 3 (Мп, Fe)2O3 -MnSiOj 4,7—4,9
Манганит и гроутит Манганозит Пирохроит и бекстремит Мп2О3 Н2О (а и 0) МпО МпО • Н2О (а и 0) 4,2—4,4
Родохрозит или марганцовый шпат МпСО3 3,4—3,6
Родонит MnSiO3 3,5—3,7
Гаусманит Гидрогаусмаиит Биксбиит Мп3О4(а, 0 и у) Мп3О4 • пН2О (а и 0) (Мп, Fe)2O3 4,7—4,9
Псиломеланы или воды xRO • yMnO2 • zH2O, где R—Мп, К2, Ba, Ca и др. 2,3-4,7
В состав природного пиролюзита входит 1—3% воды; полианит
безводен. Пиролюзит растворяется в соляной кислоте с выделением
* Мп2ОБ и МпО3 в свободном состоянии не выделены; существуют их соли
ТИПоманганаты (Мп5+) и манганаты (Мп6+).
** Плотности минералов относятся к плотным разностям.
752
Гл. XXII. Соединения марганца
хлора и в серной кислоте в присутствии восстановителя, а также
в сернистой кислоте; азотная кислота взаимодействует с пиролю-
зитом медленно. Природный манганит не разлагается азотной и
разбавленной серной кислотами, но медленно растворяется в сер-
нистой кислоте; искусственно приготовленный МпгО3‘Н2О разла-
гается разбавленными кислотами. Гаусманит реагирует с мине-
ральными кислотами, образуя смесь солей двух- и трехвалентного
марганца. Браунит представляет собой марганцовую соль мета-
марганцоватистой кислоты Мп'О(ОН)2, имеющую структурную
/°\
формулу О=Мп Мп. Вследствие присутствия изоморфного
MnSiO3 в минерале содержится до 15% SiO2.
Псиломелан относится к гелеобразным марганцовым рудам не-
определенного состава. Его можно рассматривать как твердые рас-
творы манганита, пиролюзита, полианита и, возможно, других
окислов марганца друг в друге и воды в них, содержащие также
соли метамарганцоватистой МпО(ОН)2 и ортомарганцоватистой
Мп (ОН) 4 кислот. По химическим свойствам он аналогичен водной
двуокиси марганца, быстро растворяется в сернистой кислоте. Со-
держит 60—80% МпО2, 8—25% МпО, 3—4% Н2О. Псиломеланы
имеют разные названия в зависимости от преобладающего состава
входящей в минерал группы RO: псиломелан (МпО), криптомелан
(КгО), рансьеит (СаО), романешит (ВаО) и т. д.
Родохрозит или марганцовый шпат МпСО3, имеющий окраску
от розовой до красной, встречается обычно в изоморфных смесях
с карбонатами кальция, магния, железа, кобальта, цинка и в смеси
с MnSiO3; основному минералу сопутствуют продукты его разло-
жения— пиролюзит, псиломелан и др. Разложение синтетического
карбоната марганца при нагревании с образованием МпО может
быть обнаружено при 70°, со значительной скоростью он разла-
гается при 200—300°2, а равновесное давление СО2, равное 1 ат,
достигается при 632°. Значения этих температур различны для
разных образцов природного минерала. При 200 — 300° в токе
воздуха МпСО3 окисляется последовательно до Мп3'О4, МпгО3 и
МпО2.
Закись марганца МпО — основной окисел серо-зеленого цвета,
/пл =1785°, на воздухе окисляется, при растворении в кислотах
образует соли двухвалентного марганца слабо-розовой окраски.
Розовая окраска кристаллогидратов и растворов солей Мп2+ обус-
ловлена ионом [Мп(Н2О)4]2+. Безводный сульфат марганца MnSO4
бесцветен, с водой образует стабильные и метастабильные кристал-
логидраты с 1, 4 (только метастабильный), 5 и 7 молекулами
воды3. Полностью обезвоживается выше 280°; безводный плавится
при 700°. Термически более устойчив, чем сульфаты Fe, Со, Ni. По
другим данным4, MnSO4-5H2O при нагревании одновременно с по-
Физико-химические свойства
753
а выше этой температуры Мп
терей последней молекулы воды' окисляется кислородом воздуха
с образованием Mn2O(SO4)2. С повышением температуры раство-
римость MnSO4 в воде уменьшается: насыщенный водный раствор
содержит при 10° — 37,4%, при 60° — 35,2%, при 100° — 26,5%
MnSO4; выше 200° она приближается к нулю. Хлорид марганца
ниже 58° кристаллизуется из водного раствора в форме
МпС12 • 4Н2О, выше этой температуры МпС12 • 2Н2О; насыщенный
раствор содержит при 25° — 43,6%, при 100° —53,7% МпС12. При
нагревании тетрагидрат хло-
рида марганца теряет пер-
вую молекулу воды при 120°,
вторую — при 150°, а две по-
следние—при 220°; полное
обезвоживание сопровож-
дается незначительным гид-
ролизом (1—1,5%)5-МпС12
разлагается перегретым во-
дяным паром на МпОиНС!
при 350—450°, с кислородом
начинает реагировать при
500°; ниже температуры
плавления (650°) водородом
практически не восстанав-
ливается. Нитрат марганца
кристаллизуется в виде
Mn(NO3)2 • 6Н2О ниже 24°,
• ЗН2О; в насыщенном растворе при 0° — 50,5%, при 35,5 — 76,8%
Mn(NO3)2. Растворимость в воде двойной соли NH4MnPO4 • Н2О
при 20° с уменьшением pH от 8,0 до 4,0 увеличивается от 1,43- 10~^
до 7,99-10~4 г-люл/л6. Из растворов солей Мп2+ Мп(ОН)2 оса-
ждается при pH = 8,7.
Окись марганца Мп2О3 бурого цвета, обладает слабоосновными
свойствами. Соли трехвалентного марганца в растворах устойчивы
лишь в присутствии свободных кислот; гидролизуясь, они дают
осадок гидратированной окиси марганца или соли двухвалентного
марганца и гидратированную двуокись марганца.
Двуокись марганца МпО2 — амфотерный окисел; она образует
с кислотами соли четырехвалентного марганца, легко разлагаю-
щиеся водой с выделением гидратированной двуокиси марганца,
а как кислотный окисел — соли марганцоватистой кислоты, манга-
ниты. Двуокись марганца7 представляет собой мелкокристалличе-
ское вещество черного цвета, не растворимое в воде. В зависимости
от способа образования МпО2 существует в различных модифика-
циях, отличающихся физическими свойствами. При нагревании
МпО2 отщепляет кислород и переходит последовательно в окись
марганца Мп2О3, Мп3О4 и, наконец, В закись марганца МпО,
764
Гл. XXII. Соединения марганца
Температуры перехода МпО2 в Мп2О3 несколько различны для раз-
ных модификаций МпО2. Однако общий вид изобары диссоциации
мало меняется и остается подобным, изображенному на рис. 206.
Переход МпО2 в Мп2О3 и другие окислы происходит с образованием
твердых растворов окислов. Выше 1350° существует только МпО.
Термический распад пиролюзита и манганита может быть пред-
ставлен схемами8:
560° 940° 1180°
0-МпО2 -----* ₽-Мп2О3 -----> 0-Mn3O4 ----► у-Мп3О4
Пиролюзит Р-Брауннт Гаусманит Гаусманит
260° 600° 940°
МпО • ОН -----> а-Мп2О3 (—► МпО2) -------> р-Мп2О3 ----► 0-Мп3О4
Манганит а-Браунит Пиролюзит 0-Врауиит Гаусманит
На рис. 207 приведены значения равновесных давлений диссо-
циации (1црп)для окислов марганца1’9 (см. также10"12). Линии/,
Рис. 207. Зависимость 1g pOj от
при диссоциации окислов мар-
ганца.
По реакциям:
2, 3 и 4 делят диаграмму на поля
устойчивости отдельных фаз —
металлического марганца, закиси
марганца, гаусманита, трехокиси
марганца и двуокиси марганца.
Соединения шести- и семива-
лентного марганца обладают кис-
лотными свойствами. Они обра-
зуют, соответственно, марганцови-
стокислые соли — манганаты и
марганцовокислые соли—перман-
ганаты. Марганцовистая кислота
Н2МпО4 неустойчива и распа-
дается на марганцовую кислоту
НМпО4 и МпО2. Манганаты в
кислых растворах разлагаются с
образованием соединений четы-
рех- и семивалентного марган-
/ — 2МпО2 = МП2О3 + Vs Оо
2 — ЗМпгОз — 2МП3О4 + О2
3 — М113О4 = ЗМпО + Vt О2
4 т МпО= Мп + у2 О2.
ляет собой темно-пурпуровые с
ца — в осадок выделяется дву-
окись марганца, а в растворе
образуется перманганат. Пер-
манганат калия КМпО4 представ-
фиолетовым оттенком, почти чер-
ные кристаллы ромбической формы. Насыщенный водный раствор
содержит при 0° — 2,75%, при 20° — 6%, при 65° — 20,0% КМпО4.
При охлаждении растворов NaMnO4 с концентрацией, меньшей
41,4%, кристаллизуется лед, в пределах концентраций 41,4—
75,2%—NaMnO4-3H2O с /Пл = 68,7°13. В щелочных растворах
перманганат разлагается
4МпО; + 4ОН~ = 4МпО2' + 2Н2О + О2
Физико-химические свойства
755
причем разложение может идти и глубже. Соединения с ионами
МпОГ имеют зеленую окраску. Начальная скорость восстановле-
ния перманганата калия концентрированными растворами КОН
(0,9—13,8 /И) при 18° очень велика, затем скорость реакции умень-
шается и стремится к нулю в области степеней окисления, соответ-
ствующих четырех-, пятивалентному марганцу. В этой области
реакцию ускоряют свет и ультрафиолетовые лучи, кислород за-
медляет ее. Предполагают14', что восстановление КМп©4 проходит
через три стадии:
1) Мп о; + он~ = Мпо2~ + он )
} очень быстро
мпо;+он = мпо42' + н+ + о j
2) МпО|" + ОН" = МпО4~ + ОН )
} более медленно
МпО2'+ ОН = MnO4~ +Н* + О J
3) Переход МпО4' в МпО2
При малых концентрациях КОН возможны реакции распада
ионов:
2МпО4“ + 2Н2О MnO|" + MnO2 + 4ОН" (~ Ш КОН)
ЗМпО4~4-2Н2О 2МпО; + МпО2 + 4ОН"(~0,0Ш КОН)
Восстановление ионами гидроксила Мп7+->Мп6+ (при 0 и 20°)
и Мп6+ -> Мп5+ (при —10 и 0°) является процессом половинного
порядка, а дальнейший процесс Мп5+ -> Мп4+ (при 20—30°) пер-
вого порядка. Энергии активации этих процессов равны соответ-
ственно 9,3; 11,2 и 23 ккал]моль 15.
При нагревании выше 200° КМпО4 разлагается с потерей кис-
лорода по реакции:
2КМпО4 = К2МпО4 + МпО2 + О2
а также по реакции 12:
• ЗКМпО4 = К3МпО4 + 2МпО2 + 2О2
Термическое разложение быстро ускоряется с повышением тем-
пературы и в присутствии металлического алюминия. Так, при 350"
чистый КМпО4 разлагается в ~3 раза быстрее, а в присутствии
16,5% порошкообразного алюминия в ~5 раз быстрее, чем при
265°. Добавка алюминия уменьшает время достижения максималь-
ной скорости разложения 16’17.
Перманганаты и манганаты восстанавливаются в щелочном
растворе до гипоманганатов. Так, КзМпО4 получается при нагре-
вании до 700° КгМпО4 или КМпО4 в смеси с 40—45% раствором
КОН (при отношении К: A'ln, равном 3:2). Гипоманганат калия
может быть также получен выпариванием концентрированного
756
Гл. XXII. Соединения марганца
раствора КОН со свежеосажденной МпО2 (отношение К: Мп равно
3,3—3,6) с последующим нагреванием в атмосфере кислорода до
750—800° и выдерживанием при этой температуре 8 ч 18. Кристаллы
Na3MnO4 • ЮН2О голубого цвета выделяются при обработке ще-
лочных растворов NaMnO4 и Na2MnO4 восстановителями, напри-
мер Na2SO3.
Взаимодействием KMnO4 с H2SO4 на холоду может быть полу-
чен высший окисел марганца Мп2О719. Это маслянистая жидкость
со специфическим запахом, зеленая в отраженном и темно-синяя
в проходящем свете, с температурой плавления +5,9° и плотностью
при 20° 2,396 г/см3. При 55° начинает разлагаться на а-Мп2О3 и
кислород, быстро разогреваясь, и при ~90° взрывает; скорость де-
тонации ~400 л1/сек; чувствительность к удару такая же, как
у гремучей ртути. При взаимодействии с влагой воздуха Мп2О7
разлагается до МпО2 с выделением О2 и О3, но при отсутствии
влаги может сохраняться в закрытом сосуде при —10° длительное
время. Мп2О7 — сильнейший окислитель, например окисляет NaCl
и Nal до NaClO3 и NaIO3 20.
Соединения марганца, особенно Мп2+, являются ядами, вызы-
вающими хроническое отравление. Систематическое вдыхание
пыли марганцовых соединений может вызвать нервное расстрой-
ство, длящееся годами, истощение и смерть. Предельно допусти-
мая концентрация пыли марганцовых соединений (в пересчете на
МпО2) в воздухе рабочих помещений 0,0003 мг/л.
ПРИМЕНЕНИЕ
Больше 90% мировой добычи марганцовых руд потребляется
металлургической промышленностью21. Они идут на изготовление
ферромарганца (60—90% Мп), зеркального чугуна, силико-мар-
ганца, фосфо-марганца и др. В доменном процессе .марганцем
обессеривают чугун. Марганец служит легирующей добавкой при
получении чугуна повышенной прочности и, особенно, твердых ста-
лей, из которых большое значение приобрели молибденово-марган-
цовые. Марганец используют и в производстве сплавов на основе
цветных металлов — меди (например, манганин), алюминия
(дуралюмин) и др. Металлургическая промышленность использует
богатые марганцем руды с минимальным содержанием SiO2 и фос-
фора.
Использование в химической технике пиролюзита и искусствен-
ной двуокиси марганца основывается в значительной мере на хо-
роших адсорбционных свойствах этих веществ7. Они применяются
для изготовления промышленных противогазов, в качестве депо-
ляризаторов в гальванических элементах22, в качестве низкотем-
пературных катализаторов для некоторых химических процессов.
Таким катализатором является, например, используемый в проти-
вогазах для поглощения окиси углерода гопкалит — смесь, содер-
Применение
757
щащая 50—60% МпО2 и окиси меди, серебра или кобальта. Пер-
манганат серебра AgMnC>4 является основной составной частью
катализаторов, служащих для окисления СО в СО2. В чистом виде
он обладает низкими каталитическими свойствами, но весьма эф-
фективен при нанесении на металлические окислы и в отличие от
гопкалита не отравляется парами воды, и поэтому не требует пред-
варительной осушки отравленного воздуха23.
Двуокись марганца хорошо поглощает пары ртути; при про-
мывке водной суспензией МпО2 (pH = 2—5) в двухполочном пен-
ном аппарате из газа улавливается до 99% содержащихся в нем
ртутных паров. Количество поглощенной ртути достигает 20% от
веса сухой МпО2 в суспензии. Ртуть может быть извлечена, а МпО2
регенерирована прокаливанием при 500° в течение 2 ч24. Восста-
новленную пероксидную марганцовую руду предложено использо-
вать в качестве катализатора для селективного окисления примеси
СО в азото-водородной смеси, применяемой для синтеза ам-
миака 25. Из окислов марганца с добавкой окислов редкоземель-
ных элементов получают монокристаллы, обладающие пьезоэлек-
трическими и ферроэлектрическими свойствами.
Марганцовые руды и двуокись марганца применяются в произ-
водстве стекла, в керамической промышленности для изготовления
глазури, для придания изделиям пурпурного или коричневого от-
тенка, а также для приготовления фиолетово-черной эмалевой
краски и эмалирования железных изделий. Соединения марганца
широко используются в лакокрасочной промышленности для изго-
товления сиккативов и в качестве красящих пигментов (углекис-
лый марганец — марганцовый белый, окись марганца — марган-
цовый зеленый, метафосфат марганца — марганцовый фиолетовый
и двуокись марганца — марганцовый черный). Предложено ис-
пользовать марганцовые руды и получающиеся при их обогащении
шламы для очистки газов от SO26, от сероводорода с получением
серы 27, для обессеривания сульфида натрия с получением каусти-
ческой соды 28. Восстановленную пероксидную руду (МпО) исполь-
зуют для очистки азота от примеси кислорода — при 250—500°
достигается очистка 10-4 —10-5 29. Искусственную двуокись мар-
ганца, изготовленную электрохимическим способом и специальной
обработкой пиролюзита (ГАП — гипховский активированный пи-
ролюзит), используют главным образом в химических источниках
тока, как обладающую хорошими деполяризующими свойствами.
Емкость гальванических элементов, изготовленных на ГАПе, на
15—20% выше, чем элементов, изготовленных на электролитиче-
ской двуокиси марганца. Особенно ценным свойствам элементов,
изготовленных на ГАПе, является их сохранность в течение дли-
тельного времени — до двух лет.
Техническими условиями установлены следующие требования
к качеству продуктов.
758
Гл. XXII. Соединения марганца
Активированный пиролюзит для элементной промышленности
(МРТУ 6—09 № 2939—66) выпускают в зернах; он должен со- \
держать (в %):
МпО2, не менее.........................................; 70
Мп2О3, не более.........................................15
Fe2O3, не более........................................... 1,5
N1, не более............................................0,03
Со, не более . . .....................................0,004
Си, не более.............................................0,03
Сульфатов (SO4), не более...............................0,7
Влаги, не более ........................................4,0
Не растворимого в соляной кислоте остатка, не более . . 12,0
Однако более важными показателями, чем химический состав
активированного пиролюзита, являются его электрохимические
свойства при работе в качестве деполяризатора в элементах.
В условиях стандартного испыта1 ия электродвижущая сила эле-
мента 336Х должна быть в пределах 1,74—1,84 в, а емкость не
#иже 1,12 а-ч [при разряде на 117 ом на элемент до 1 в (анодный
режим)], при этом допускаются отклонения от указанного содер-
жания МпО2.
Электролитическая двуокись марганца должна содержать не '
менее 90% МпО2 и не более: 8% Мп2О3, 4% гигроскопической
влаги, 0,6% сульфатов (SO3), 1,5% Fe2O3; величина pH — не ме-
нее 3,6. Через сито № 021 должно проходить 95% материала, че-
рез сито № 007 — не менее 65%.
Двуокись марганца и активированный пиролюзит упаковывают
в прорезиненные или крафтцеллюлозные мешки, в стальные ба-
рабаны (лакированные внутри) или в плотные деревянные бочки,
выложенные бумагой.
Перманганат калия, мировое производство которого состав-
ляет 30—40 тыс. т в год 30, применяют главным образом в каче-
стве окислителя, в частности, для беления тканей, жиров, масел.
Применение в медицине также основано на его сильных окисли-
тельных свойствах. Для этих же целей применяют и перманга-
нат натрия, но в ограниченных количествах из-за трудности полу-
чения в чистом виде и сильной гигроскопичности. Са(МпО2)2-5Н2О
применяют для обезвреживания питьевой воды. КМпО4 известен
как хороший дизенсектор31 и дезодоратор, используемый в ус
тановках для кондиционирования воздуха32. Согласно ГОСТ
5777—71, перманганат калия 1-, 2- и 3-го сортов должен содер-
жать, соответственно, не менее 99,0, 98,0 и 95,0% КМпО4 и не бо-
лее: 0,3, 0,75 и 1,0% двуокиси марганца, 0,05, 0,2 и 0,3% сульфа-
тов в пересчете на SO4 и 0,5, 0,5 и 2,0% воды. Тарой для перман-
ганата калия служат стальные барабаны и банки, которые за-
паиваются или завальцовываются.
Сырье
759
Хлорид марганца МпС12-4Н2О используют в текстильном про-
изводстве, для окраски кирпичей при их отжиге, добавляют в
электролиты аккумуляторов; безводную соль применяют для очист-
ки магния и его сплавов, для получения антидетонаторов, вводи-
мых в моторное топливо.
Марганец является одним из эффективных микроэлементов,
требующихся для развития растений. Его вводят в состав удобре-
ний, например, суперфосфатов, в виде разных соединений. В Гру-
зии в качестве микроудобрения широко используют марганцовый
шлам — отход от обогащения чиатурской марганцовой руды.
Разработано33 получение марганцового микроудобрения из
шлама, содержащего 77,5% МпО2, 23% МпО и 5% органических
веществ. Шлам смешивают с древесными опилками и обрабаты-
вают 98%-ной серной кислотой — получается спекшаяся рассыпча-
тая масса, содержащая до 60% MnSO4, которую разбавляют зем-
ляной пылью или песком. При обработке водой этого продукта
получаемый раствор имеет pH = 3—4. Опрыскивание листвы рас-
тений 0,25—0,12% раствором MnSO4 • Н2О или опыление их по-
рошком сульфата марганца более экономично, чем внесение мар-
ганцовых солей в почву, где они под влиянием биологических фак-
торов окисляются и переходят в нерастворимое состояние34.
Препарат, называемый мажефом (марганец — железо — фос-
фор), является смесью кристаллогидратов монофосфатов (диги-
дроортофосфатов) марганца Мп(Н2РО4)г и железа Fe(H2PO4)2 и
свободной фосфорной кислоты. По внешнему виду это мелкокри-
сталлический порошок белого цвета, который, согласно ГОСТ
6193—52, должен содержать 46—52% Р2О5, не менее 14% Мп,
0,3—3% Fe и не более: 0,07% водорастворимых сульфатов (в пере-
счете на SO3), 0,06% СаО, 6% не растворимых в воде веществ и
19% влаги. Мажеф применяют для фосфатирования стали — нане-
сения защитного покрытия, предохраняющего сталь от коррозии.
Общая кислотность мажефа, выраженная в количестве милли-
литров 0,1 н. раствора NaOH, требующихся для титрования на 0,3 а
препарата, должна быть не меньше 25. Пр'и погружении стального
изделия в нагретый до 98° раствор мажефа происходит растворение
железа с выделением водорода, а на поверхности металла оса-
ждается плотный, прочный и не растворимый в воде кристалличе-
ский защитный слой фосфорнокислых солей серо-черного цвета.
Когда этот слой достигает определенной толщины, дальнейшее
растворение железа прекращается (стр. 785).
СЫРЬЕ
В земной коре содержится 0,09% Мп — в 50 раз меньше, чем
Fe, но больше, чем любого другого тяжелого металлаЗб. Марганец
встречается только в связанном виде, главным образом в марган-
цовых и железных рудах осадочного происхождения и в малых
760
Гл. XXII. Соединения марганца
концентрациях в минеральных и морских водах, и во всех расти-
тельных и животных тканях. Марганцовые руды подразделяют на-
три класса: марганцовые — при содержании Мп > 40%, Fe < 10%;
железомарганцовые — 5—40% Мп, 10—35% Fe; марганцовистые
железные руды при содержании Мп <5%. Запасы марганцовых
руд СССР значительно превосходят запасы во всех других странах
мира 36. Важнейшими месторождениями высококачественных мар-
ганцовых руд являются Чиатурское в Грузии и Никопольское на
Украине 37’38. Чиатурская пероксидная руда представлена пиролю-
зитом, псиломеланом, манганитом, браунитом и содержит 60—70%
МпО2. Основная примесь — кремнезем. Концентрат, получаемый j
после мокрого обогащения руды, содержит до 96% МпО2. Для
нужд химической промышленности потребляется сырье, содержа-
щее не меньше 70% МпО2. Чиатурские карбонатные .марганцовые
руды представлены манганокальцитами и кальциевыми родохрози-
тами. Обогащенная руда содержит более 22% Мп. При нагрева-
нии руды сначала диссоциирует МпСО3, затем СаСО3. Это может
быть использовано в некоторых методах обогащения карбонатных
РУДзд.
Разрабатываются методы химического обогащения инфильтра-
ционных руд Чиатурского месторождения (кремнистых пород, про-
питанных гидроокисью марганца) — восстановительным обжигом
с последующей обработкой серной кислотой, а также хлорирова-
нием 40.
Никопольская руда несколько менее высокого качества, чем
Чиатурская, — содержание МпО2 в ней на 15—20% ниже, а со-
держание SiO2 доходит до 15%. Она представлена пиролюзитом
и псиломеланом.
Крупные месторождения марганцовых руд осадочного харак-
тера, кроме СССР, находятся в Индии, Бразилии и Гане; в других
странах месторождения значительно меньшей мощности с рудами
невысокого качества.
Для промышленности Урала и Сибири представляет интерес
использование местных бедных марганцовых руд21, содержащих
26-28% Мп, 2 -6% Fe, 30—40% SiO2, 0,05—0,1% S. Марганцовые
руды Полуночного и некоторых других месторождений Урала со-
стоят из разных типов оксидных руд — пиролюзитовых, псиломе-
лановых и др. В некоторых образцах полуночной руды содержится -
до 0,02% молибдена41. Концентрат, полученный обогащением пи-
ролюзитовых руд Полуночного месторождения, как и чиатурская
пиролюзитовая руда, может быть использован для непосредствен-
ного изготовления элементов или активированной двуокиси мар-
ганца.
При мокром обогащении марганцовых руд из-за размыва мяг-
ких минералов образуются шламы, представляющие собой тонкие
фракции руд. Эти шламы трудно осаждаются и поэтому в значи-
।
Химическая переработка бедных марганцовых руд 761
тельной мере теряются со сбросными водами. Шламы содержат
18—30% Мп, и поэтому их использование имеет существенное эко-
номическое и санитарное значение42. Установлена возможность
ускорения осаждения шламов с помощью сенсибилизаторов 43. Пе-
реработка шламов, как и бедных марганцовых руд, возможна
только химическим путем, так как эффективный метод флотации
окисных марганцовых минералов пока не найден44. Шламы и бед-
ные марганцовые руды применяют в качестве удобрений.
ХИМИЧЕСКАЯ ПЕРЕРАБОТКА БЕДНЫХ МАРГАНЦОВЫХ РУД
Разработаны химические методы переработки бедных марган-
цовых руд и шламов. Из них наибольшего внимания заслуживает
сернистокислотный способ извлечения марганца, а также обжиг
руды в смеси с пиритом или сульфатизация ее сернистым газом.
Получаемый этими способами сульфат марганца служит полупро-
дуктом, перерабатываемым в электролитическую двуокись мар-
ганца и в другие соединения. Разложение бедных марганцовых
руд сернистым газом с последующим пиролизом сульфата мар-
ганца осуществлено на нескольких крупных заводах в США45.
При насыщении сернистым газом водной суспензии пиролюзи-
товой руды или шлама46 вначале образуется дитионат марганца
МпО2 + 2SO2 — MnS2O5
который с течением времени, и в особенности при повышении тем-
пературы, разлагается с образованием сульфата марганца:
MnS2O6 = MnSO4 + SO2
Увеличению количества MnSO4 способствуют побочные реак-
ции, например окисление SO2 в H2SO4 в присутствии ионов мар-
ганца и взаимодействие МпО2 с дитионатом в присутствии SO2:
MnO2 + MnS2O6 = 2MnSO4
При неизменной продолжительности процесса изменение весо-
вого отношения Т : Ж от 1 : 2 до 1 : 10 не влияет на количество
переходящего в раствор марганца, т. е. последнее не зависит от
разбавления суспензии. Но при концентрированных суспензиях .
уменьшается степень перехода в раствор железа и других нежела-
тельных примесей, в особенности фосфора; однако такие суспензии *
труднее отстаиваются и фильтруются. С увеличением концентра-
ции сернистого газа степень перехода марганца в раствор возра-
стает. При тонкости помола руды 900 отв/см2, при Т : Ж = 1 : 10,
отношении Мп SO2, приблизительно равном 1 : 3, концентрации
SO2 ~ 14% и температуре 80° в течение 90 мин достигается
94—95%-ное извлечение марганца в раствор47-49
25 М. Е. Познн
762
Гл. XXII. Соединения марганца
Переработка манганитных руд, содержащих окись марганца,
может быть осуществлена комбинированным методом50-51. Вна-'
чале руду обрабатывают разбавленной серной кислотой:
Mn2O3 + H2SO4 = MnSO4 + MnO2 4- Н2О
Выделившийся осадок двуокиси марганца далее может быть
переработан в сульфат марганца сернистым газом.
При насыщении сернистым газом суспензии манганитной руды
(без предварительной сернокислотной обработки) образуются
сульфит и сульфат или дитионат марганца:
Мп2О3 +- 2SO2 = MnSC, f- MnSO4
Mn2O3 + 3SO2 = MnSOj + MnS2Oe
Так как дитионат разлагается до сульфата, а сульфит окис-
ляется содержащимся в газе кислородом (или кислородом воз-
духа), то в результате получается раствор сульфата марганца. Од-
нако манганитные руды реагируют с сернистым газам значительно
медленнее пиролюзитных. Увеличение дисперсности ускоряет про-
цесс, лимитируемый, по-видимому, растворением руды, причем
содержание в растворе дитионата увеличивается, а сульфата отно-
сительно уменьшается. Это объясняется разностью в скоростях
растворения руды и разложения дитионата. В отличие от пиролю-
зитной руды при разбавлении суспензии из манганитной руды (от
Т : Ж = 1 : 2 до 1 : 10) степень извлечения марганца увеличивается
за счет роста количества растворенной двуокиси серы. Повыше-
ние концентрации SO2 в газе и в растворе ускоряет разложение
дитионата. При обработке водной суспензии манганитной руды
(Т : Ж = 1 : 10) сернистым газом (16,2—17,6% SO2) при избыточ-
ном отношении Мп : SO2, равном 1 : 1,9, и температуре 80° в тече-
ние 3 ч достигается 90%-ное извлечение марганца в раствор.
При обработке сернистым газом водной суспензии карбонатной
марганцовой руды вначале также образуется сульфит, который
содержащимся в газе кислородом или воздухом окисляется в
сульфат:
МпСОз + SO2 == MnSO, + СО2 •
MnSO3+ ’/2O2 = MnSO4
Дитионат образуется в очень малых количествах, которыми
можно пренебречь. При 18—20° взаимодействие SO2 с суспензией
карбонатной руды идет весьма -медленно. Ускорение процесса воз-
можно путем предварительного обжига сырья 13-52. Для некоторых
типов карбонатных руд отмечается 46 достаточно интенсивное раз-
ложение и при ~20°, а при 80° была достигнута высокая степень
извлечения марганца. Наилучшие результаты получены при Т : Ж,
равном 1:10. Для руды, имевшей состав (в %): 24,32 — МпО
(Мп — 18,86), 30,81 — СаО, 1,77 —MgO, 4,16 —SiO2) 2,66 —А12О31
Химическая переработка бедных марганцовых руд 763
0,89 — Fe2O3, 1,45 —SO3, 0,55 — Р2О5, 1,68 — влаги, 34,08 — потери
при прокаливании и тонкость помола 10 000 отв!см2, двукратная
обработка избытком 14—15%-ного сернистого газа (Мп: SO2, рав-
ном 1 : 2,6) при 80° в течение 50 мин привела к почти 100%-ному
извлечению марганца. Образец другой руды, мало отличавшейся
по составу (21,28 — МпО, 33,18 — СаО, 2,68 — MgO и т. д.), но с
другой структурой разлагался при тех же условиях значительно
медленнее —95 %-ное извлечение марганца достигалось за ~1,5ч.
Поэтому схема и условия переработки карбонатных руд могут
быть различными для разных их типов.
Сульфатизация двуокиси марганца может быть произведена
е помощью сульфата закиси железа или пирита
2МпО2 + 2FeSO4 = 2MnSO4 + Fe2O3 + V2O2
4MnO2 + 2FeS2 + 5,5O2 = 4MnSO4 + Fe2O3
т. e. без применения серной кислоты или даже сернистого газа.
Смесь пиролюзитной руды с сульфатом железа или пиритом под-
вергается обжигу и из полученного спека выщелачивается MnSCh.
В опытах53 обжига смеси искусственной двуокиси марганца с суль-
фатом железа при 550—600° в течение 2—3 ч степень извлечения
марганца в раствор была 98—99%, содержание марганца в выще-
лоченных остатках 0,7—1,2%. При обжиге с пиритом выход мар-
ганца ниже 89—90%, но следует учитывать, что пирит, например
флотационный колчедан, дешевле сульфата железа. Представляет
интерес дальнейшая разработка этого процесса.
Изучена сульфатизация соединений марганца сернистым газом
при повышенной температуре54. Сульфатизация Мп20з протекает
с заметной скоростью уже при 450°, резко увеличивается в интер-
вале 450—600° и затем до 750° практически не изменяется. Повы-
шение концентрации SO2 в газе увеличивает скорость сульфатиза-
ции Мп2О3 (рис. 208). Аналогично идет процесс взаимодействия
с SO2 природной карбонатной марганцовой руды, но в этом случае
скорость сульфатизации возрастает во всем интервале температур
и особенно резко выше 600° (рис. 209).
Обогащение бедных окисных марганцовых руд возможно суль-
фидным способом — при использовании их для очистки промыш-
ленных газов от сероводородаss. Образующийся сульфид мар-
ганца можно перевести в сульфат сульфатизирующим обжигом 56-58
или обработкой серной кислотой (в последнем случае регенери-
руется концентрированный сероводород).
Алюмосиликатные марганцовые руды разлагают путем восста-
новительного обжига в присутствии CaSO4 или СаСО3. Использо-
вание СаСОз предотвращает выделение H2S при последующем
выщелачивании59. Возможно извлечение марганца из бедных
руд, в том числе и карбонатных, обжигом с добавкой аммоний-
ных солей—(NHi)2SO4 или NH^jCl60-61. При обжиге Чиатурскоп
25*
764
Гл. XXII. Соединения марганца
марганцовой карбонатной руды в псевдоожиженном слое практи-
чески полная диссоциация карбоната достигается уже при 750°62
Низкосортную марганцовую руду можно обогатить, подвергнув ее
после восстановительного обжига при 900—1000° и охлаждения
гидро- или магнитной сепарации63. Запатентован64 способ получе-
ния окиси марганца, пригодной для производства ферромарганца
Рис. 208. Зависимость сте-
пени сульфатизации Mn2Ot
за 30 мин от температуры
и концентрации SO2 в газе.
Цифры на кривых — концен-
трация SO2 в %.
Рис. 209. Зависимость сте-
пени сульфатизации при-
родной карбонатной мар-
ганцовой руды за 30 мин
от температуры и концен-
трации SO2 в газе. Цифры
на кривых — концентрация
SO2 в газе в %.
восстановлением сульфата марганца пиритом при обжиге этой
смеси в псевдоожиженном слое или во вращающейся печи при
700—800° в отсутствие воздуха.
Из растворов, образующихся при извлечении марганца из руд,
можно получить концентрат высокого качества и с хорошим выхо-
дом при осаждении его в виде МпСО3. Осаждение можно вести,
например, раствором соды периодическим или непрерывным спо-
собом65. В последнем случае раствор, содержащий Мп2+, и раствор
соды подают в нижнюю часть реактора, а суспензию МпСОз отби-
рают из верхней. Суспензия циркулирует, так что перемешивание
ее при температуре выше 55° и при pH 5,7—7,2 (6—6,9) продол-
жается 3—5 ч. Это необходимо для того, чтобы плотность кристал-
лов МпСОз достигла величины-1—1,3 г/см*. Суспензия из реактора
Химическая переработка бедных марганцовых руд
765
поступает в сгуститель, затем отделяется от маточного раствора на
фильтре; осадок промывают и высушивают.
Извлечение марганца из бедных карбонатных руд может быть
осуществлено углекислотным методом, заключающимся в обра-
ботке водной суспензии руды двуокисью углерода под давле-
нием66. Давление СО2 должно быть таким, чтобы карбонат мар-
ганца полностью перешел в раствор в виде бикарбоната, а количе-
ство воды, взятой для приготовления суспензии, должно быть до-
статочным, чтобы после снижения давления до 1 ат, при обратном
выделении в осадок МпСО3, перешедшие также в раствор бикар-
бонаты Са, Fe и другие в основном остались в растворе. Давление
СО2 и минимальное количество воды могут быть вычислены для
руды определенного состава
новесий при 25°: *
МпСО3 = Мп2+ + соз“
FeCO3 = Fe2+ + СО|"
СаСО3 = Са2+ + СО|“
с помощью следующих констант рав-
СО|“ + Н2СО3 = 2НСО3
СО2 4-Н2О = Н2СО,
Ki = [Мп2+] [СО2’] = 5,05 • Ю-10
К2 = [Fe2+] [СО2-] = 2,11 • 10~п
К3= [Са2+] [СО|“] = 4,82 • Ю-9
[HCOJ]2
К, = т—-—ГГ- - О--. - 8,1 • 103
4 [н2со3][со2-]
Х5 = №СОз] = 3>37.10-2
'СО2
Ввиду малой растворимости компонентов можно вместо актив-
ностей воспользоваться молярными концентрациями. Константы
диссоциации Н2СОз: *
[н+][нсо;] . [н+][со|~]
Xi = --------21 = 4,52 • 10 7; ----Н= 5,59 ’1°
[Н2СО3] [нсо3]
Вследствие малой диссоциации иона бикарбоната можно счи-
тать, что все ионы карбоната превратятся в ионы бикарбоната.
Тогда:
[Мп2+] [НСО3]2 _7
--------Г----------1.38-10 7
fco2
[Fe2+] [НСО3]2
КаХЛ5-------Г------- 5,76 10
/со2
[Са2+] [НСО3]2
КМ>---------Г-------— 10
'со2
(1)
(2)
(3)
* Разными авторами приводятся также следующие значения констант:
Ki «• 8,83 • 10~п и 1 • 1О~10; Х|°° - 2,5 10~н; Х35° = 4,52 • 10-9; ^5°- 4,45 • 10-7;
Х2^-4,70-10-п.
766
Гл. XXII. Соединения марганца
Например, если руда содержит 32,9% МпСО3, 23,0% FeCOg и
28,6% СаСОз, то в 1 кг руды 2,86 моль МпСО3, 1,98 моль РеСОз й
2,86 моль СаСОз. Обозначим х — число кг воды на 1 кг руды, не-
обходимое для растворения всего СаСОз, т. е. 2,86 моль Са2+, при
рсо2=1 ат. Тогда [Са2+] = -^г- и [НСО3] = р-, где Sm — число
молей Mn2+ + Fe2+ + Са2+, остающихся в растворе, из которых чи-
сло молей Мп2+ обозначим у, а число молей Fe2+ — z. Подставив
эти значения в уравнения (1) — (3) и решив их, находим у = 0,299,
z = 0,0125 и х = 478 кг. Давление СО2, необходимое для полного
растворения 2,86 моль Мп2+ в 478 кг воды, можно рассчитать из
системы уравнений (1) и (2). Обозначим количество растворяю-
щихся молей Fe2+ в 1 кг воды через г. Тогда:
2,86 Г (2,85 2,86 \12
478.1 \ 478 4Т8 ~l~r/j _1да.|(|.,
<со2
До2
= 5,76 • 10-9
Решив эту систему уравнений, находим г=2,5-10"4, т. е. вместе
с МпСОз растворится 2,5 • 10-4 • 478=0,119 моль FeCO3, и fco2=
= 29,7 ат. Так как коэффициент активности СО2 при 25°~82%, то
необходимое давление СО2 равно 36 ат. Полученный из 1 кг руды
раствор, отделенный от нерастворившегося шлама, будет содер-
жать 2,86 моль МпСОз, 2,86 моль СаСОз и 0,119 моль FeCO3 в
виде бикарбонатов. После понижения давления до 1 ат из рас-
твора выделится в осадок 2,86—0,299 = 2,56 моль МпСОз и 0,119—•
—0,0125 = 0,107 моль РеСОз. Кальций полностью останется в рас-
2 56
творе. Степень извлечения из руды марганца составит 100 =
= 89,5%, а железа всего• 100 = 5,4%.
Чиатурский флотационный марганцовый карбонатный концен-
трат перерабатывается азотнокислотным способом в гидрат закиси
марганца, который служит полупродуктом для получения электро-
литической двуокиси марганца и других продуктов. Примерный
состав сырья (в %): МпО — 21,6, Мп62— 2,5, СаО—10,5, MgO —
1,6, Fe2O3—1,6, А120з —2,0, Р2О5 —0,4, СО2 —28, SiO2—16,8,
Н2О — 20, прочих примесей — 1,5. Концентрат обрабатывают азот-
ной кислотой и из вытяжки осаждают газообразным аммиаком
при рН = 4—4,5 Fe, Al и Р в виде FePO4, AIPO4, MnHPO4, Fe(OH)3
в присутствии добавки полиакриламида. После отделения осадка
примесей из раствора, содержащего нитраты Мп, Са и Mg, осаж-
дают аммиаком при рН = 8,5 Мп(ОН)2. Вследствие образования в
растворе комплекса [Мп(МНз)п](ПОз)2 степень осаждения мар-
Искусственная двуокись марганца
767
ганца составляет только 80—85%. После отфильтровывания осадка
Мп (ОН) 2 этот комплекс можно разрушить добавкой раствора кар-
боната аммония
[Mn(NH3)„](NO3)2 + (NH4)2CO3 = МпСОз + nNH3 + 2NH4NO3
или окисляя его в течение 2—3 ч воздухом при pH = 8—9:
2[Mn(NH3)„](NO3)2 + 2Н2О + >/2О2 = Мп2О3 + 2NH4NO3 + (п- 2) NH3
Отфильтрованная и промытая паста Мп(ОН)2 содержит 28—
32% Мп, 1—2% МпО2, меньше 0,5% СаО + MgO, меньше 0,3%
азота, 50—60% свободной воды. Прокаливанием гидрата закиси
марганца при 700° получают марганцовый концентрат, содержа-
щий 62—65% Мп и меньше 1% СаО + MgO. Его используют в
производстве перманганата калия.
Шламы, отделяемые от растворов после осаждения примесей
и разрушения комплекса [Мп(МНз)п](МО3)2, высушиваются и ис-
пользуются в качестве микроудобрений, а оставшийся раствор
NH4NO3 может быть переработан в твердую аммиачную селитру.
Общие потери азота в описанном процессе в виде окислов азота
(образующихся вследствие частичного восстановления азотной
кислоты) и аммиака достигают 5—8%.
ИСКУССТВЕННАЯ ДВУОКИСЬ МАРГАНЦА
Получение двуокиси марганца электрохимическим способом
Чистая крупнокристаллическая двуокись марганца (у-модифи-
кация, пригодная для элементной промышленности) может быть
.получена электролизом растворов солей марганца. Электролиз хло-
рида марганца 67’68 можно вести с помощью свинцовых или графи-
тированных угольных электродов или электродов из металлических
сплавов на основе титана. Хотя продукт, получаемый электроли-
зом хлорида марганца, легче отмывается от электролита, чем при
электролизе сульфата марганца, в настоящее время принят способ,
в котором электролитом является сернокислый марганец7’69-71.
Для приготовления раствора электролита природная руда — пи-
ролюзит восстанавливается до закиси марганца по реакциям:
2МпО2 + С = 2МпО + СО2
МпО2 + С = МпО 4- СО
С этой целью шихту, состоящую из 90—85% пиролюзита и 10—
15% угля, нагревают до 600—800° в ретортных или вращающихся
печах. Восстановление МпО2 в МпО достигает 90%. Процесс проте-
кает с образованием промежуточных окислов Мп20з, Мп3О4 72_74.
Восстановление может производиться в печах с кипящим слоем
промышленными газами. Степень восстановления при этом дости-
гает 96—99%. Уменьшение содержания в газе Н2 и увеличение СО
768
Гл. ХХП. Соединения марганца
способствует устранению слипания зерен руды в процессе обжи-
га 75’76. Материал, выгружаемый из печи, во избежание окисления
на воздухе охлаждается в герметических барабанах.
Охлажденную техническую закись марганца измельчают до тон-
кости, соответствующей ситу с 1600 отв/см2, и подвергают выщела-
чиванию отработанным раствором электролита, поступающим из
электролитических ванн и содержащим серную кислоту. Выщелачи-
вание производится в резервуарах с мешалками при интенсивном
перемешивании и при нагревании пульпы до 70—80°. Систематиче-
ское выщелачивание неизмельченной технической закиси марганца
может производиться также в диффузионных батареях — высоких
цилиндрических резервуарах, заполненных зернами твердого мате-
риала, через которые циркулирует нагретый раствор электролита.
Этот способ является более громоздким.
При выщелачивании происходит растворение закиси марганца
в серной кислоте и образуется сульфат марганца:
МпО + H2SO4 = MnSO4 + Н2О
Одновременно с серной кислотой реагируют примеси: СаО,
MgO, А120з, Ре20з и FeO, образуя соответствующие сульфаты. Так
как в технической закиси марганца содержится некоторое количе-
ство двуокиси марганца, то закисное железо окисляется в окисное:
2FeSO4 + 2H2SO4 + MnO2 = MnSO4 + Fe2( SO4)3 + 2H2O
После полной нейтрализации серной кислоты вследствие гидро-
лиза сульфатов в осадок выделяются гидраты окиси железа и алю-
миния. Таким образом, в полученном растворе из указанных при-
месей остается лишь небольшое количество сульфата магния.
После последующего подкисления серной кислотой раствор элек-
тролита должен содержать 300—350 г/л MnSO4 и 200—180 г/л
H2SO4.
Необходимый для электролиза раствор сульфата марганца мо-
жет быть получен из окисных руд, содержащих МпО2, восстанов-
лением ее в кислых растворах порошкообразным ферромарганцем
(75—80% Мп и 8—15% Fe)77. При перемешивании измельченных
руды и ферромарганца (частицы меньше 0,25 мм) с циркулирую-
щим электролитом (H2SO4 + MnSO4) и с добавляемой к нему сер-
ной кислотой МпО2 восстанавливается двухвалентным железом
с образованием MnSO4 и Fe2(SO4)3 по реакции, приведенной выше.
Растворяющийся ферромарганец вновь восстанавливает Fe3+ до
Fe2+ по реакциям:
Fe2(SO4)3 + Мп = 2FeSO4 + MnSO4
Fe2(SO4)3 + Fe = 3FeSO4
Образовавшееся двухвалентное железо снова вступает в реак-
цию с МпО2. Таким образом, процесс идет за счет растворения
Искусственная двуокись марганца
769
ферромарганца. Его можно вести без подогревания, или при
65—75° 78,79 в течение 4—12 ч. Затем, повышая pH до 6—6,5 до-
бавлением ферромарганца или Са(ОН)2, осаждают гидроокись
железа, которая окклюдирует и другие примеси (Са, К, Na, As
и проч.). После отделения осадка и подкисления серной кислотой
раствор направляют на электролиз.
Очистку раствора MnSO4 от ионов кальция предложено80 осу-
ществлять, добавляя эквивалентное количество оксалата или F"
(NH4F) при одновременном окислении Fe2+ (воздухом) и осажде-
нии Fe(OH)3-
Электролиз ведется при 20—25° в ваннах, футерованных свин-
цом или винипластом, со свинцовыми электродами, при напряже-
нии на ванне 3—3,5 в и при плотности тока на аноде 500 а/м2 и на
катоде 1000—1200 а/м2. В ваннах большой мощности целесооб-
разна установка охлаждаемых анодов. В результате окисления на
аноде двухвалентного марганца образуется двуокись марганца; на
катоде выделяется водород. Суммарное уравнение процесса имеет
вид:
MnSO4 + 2Н2О = MnO2 + H2SO4 + Н2
При 18° нормальный потенциал окисления Мп2+-»Мп3+ равен
+ 1,511 в, а для Мп3+-»Мп4+ +1,642 в, т. е. на аноде наиболее
легко образуется Мп3+. В сильнокислом растворе образование
Мп4+, требующее более высокого потенциала, идет после заверше-
ния превращения Мп2+ в Мп3+. В слабокислом растворе механизм
процесса иной — имеет место равновесие 2Мп3+^Мп2+ + Мп4+, ко-
торое сдвигается вправо вследствие гидролиза
Mn(SO4)2 + 2Н2О = MnO2 + 2H2SO4
так что образование МпО2 происходит без окисления Мп3+ на
аноде, где окисляется лишь Мп2+. Поэтому выход МпО2 по току
зависит от кислотности раствора, которая увеличивается в про-
цессе электролиза по мере уменьшения концентрации Мп2+. В силь-
нокислом растворе, где концентрация Мп3+ и Мп4+ велика, частич-
но идет их обратное восстановление на катоде, доходящее до 25%.
В слабокислом растворе анод покрывается рыхлой коркой двуокиси
марганца, образующейся здесь в результате гидролиза, затруд-
няющей доступ к аноду Мп2+ и понижающей перенапряжение вы-
деления кислорода, вследствие чего его образование усиливается.
Уменьшение концентрации Мп2+ также снижает выход по току.
Поэтому электролит, отбираемый из ванн и направляемый вновь
на выщелачивание закиси марганца, содержит 50—60 г/л MnSO4
и до 450 г/л H2SO4. Сопоставление с начальным составом электро-
лита показывает, что окисление на аноде достигает 80—85%.
Потери от катодного восстановления можно уменьшить приме-
нением графитовых катодов и совсем устранить, закрывая ка
770
Гл. XXII. Соединения марганца
диафрагмой из ткани, стойкой в кислом электролите. Однако диа-
фрагма засоряется двуокисью марганца, что усложняет ее исполь-
зование. Электролит необходимо очищать от примесей железа,
меди, кобальта и других, сильно понижающих выход по току. Так,
в присутствии всего 0,05 г/л Fe или Си выход по току падает при-
близительно на 30% • Рекомендуются порошковые (угольные) ка-
тоды 81.
Исследованием процесса электролиза проточного раствора хи-
мически чистых MnSO4 и H2SO4 в ванне со стальными катодами,
анода.ми из сплава РЬ с 4% Sb и хлопчатобумажной диафрагмой
установлено82, что выход по току снижался от 95,5 до 39,4% при
повышении анодной плотности тока от 418 до 2520 а/м2 и возра-
стал от 39,4 до 79,1% с увеличением температуры анолита от 26,5
до 73°. Максимальный выход по току был достигнут при содержа-
нии в электролите 207 г/л MnSO4.
Раствор электролита выпускают из ванны вместе с осадком
двуокиси марганца на освинцованную или гуммированную центри-
фугу. Здесь осадок отделяют и промывают. В связи с хорошей
адсорбционной способностью двуокиси марганца отмывка ее от
электролитов идет с трудом и требует большого расхода воды.
После отмывки двуокись марганца высушивают при температуре
не выше 100° во избежание ухудшения ее адсорбционных свойств.
Расход энергии на производство 1 т МпО2 составляет около
2000 кет • ч.
По другому варианту, получение электролитической двуокиси
марганца ведут в ваннах с графитированными угольными электро-
дами 82. Сырьем служит паста гидрата закиси марганца (стр. 767),
которую растворяют в серной кислоте (в кислом отработанном
электролите) с добавкой перекиси водорода для восстановления
МпО2 по реакции:
MnO2 + H2SO4 4- Н2О2 = MnSO4 + 2Н2О 4- О2
После отделения фильтрацией шлама (состоящего главным об-
разом из CaSO4) получают электролит, содержащий 100 г/л MnSO4,
20 г/л H2SO4 и меньше 0,03 г/л Fe и 0,03 г/л Си. Электролиз ведут
при 85—95°, при анодной плотности тока 100 а/м2 и катодной
100—140 а/м2 и напряжении 2,5—3 в. Выход по току 90—93%;
расход электроэнергии 2600 кет- ч на 1 т продукта. Использование
анодов одноразовое (продолжительность электролиза 800—1000 ч),
а катодов — до капитального ремонта (~5000 ч). Образующаяся
в процессе электролиза МпО2 осаждается плотным слоем на ано-
дах— графитированных угольных стержнях, укомплектованных
в анодных рамах. По окончании электролиза эти рамы с осадком
промывают и демонтируют, затем их комплектуют новыми элек-
тродами и загружают в ванны. Расход электродов доставляет
Искусственная двуокись марганца
771
300 кг на 1 г МпО2. Осадок, снятый с анодов, дробят, размалы-
вают, промывают водой, высушивают и упаковывают. В продукте
содержится небольшое количество графита (менее 4%).
Производство активированного пиролюзита—ГАПа
Для получения ГАПа используют наиболее высококачествен-
ные сорта пиролюзита, содержащие 80—90% МпО2 83. Пиролюзит
обжигают во вращающихся печах при 800—950°, причем двуокись
марганца переходит в низшие окислы, преимущественно в МщОз.
О качестве обожженного материала судят по коэффициенту вос-
становления, т. е. по молярному отношению МпО:МпО2. Жела-
тельно, чтобы коэффициент восстановления был равен единице,
что соответствует восстановлению МпО2 до Мп2О3. Практически
коэффициент восстановления колеблется от 0,96 до 1,1.
Обожженную руду выщелачивают 17—18%-ной серной кисло-
той при температуре около 80°. Серная кислота взаимодействует
с окисью марганца по реакции:
Mn2O3 + H2SO4 = MnO2 + MnSO4 + Н2О
Образующийся сульфат марганца переходит в раствор, а в
твердой фазе остается двуокись марганца.
Как показала практика, выщелачивание наиболее рационально
вести в аппаратах периодического действия. В бак, снабженный
ложным дном, загружают сначала слой более крупного материала,
а потом обожженную руду с размером зерен 0,5—0,6 мл; затем
заливают горячую серную кислоту. После некоторого выстаивания
рбразовавшийся раствор сульфата марганца сливают, а бак зали-
вают новой порцией кислоты. Таким образом осуществляют
25—30 заливов кислоты, после чего аналогичным образом мате-
риал промывают горячей водой. Остаточную кислотность нейтра-
лизуют слабым раствором аммиака. Выщелачивание вначале идет
быстро: раствор выдерживают в баке около 30 мин, а к концу —
до 4 ч. Выщелачивание может производиться и полунепрерывным
путем, при циркуляции кислоты с помощью центробежного на-
соса. Чем полнее извлекается из материала окись марганца, тем
более высокого качества получается ГАП. После промывки водой
и нейтрализации продукт высушивают при температурах не выше
100°. Более высокие температуры сушки понижают его активность.
Отходом при производстве ГАПа является раствор сульфата
марганца. Его используют в качестве электролита в производстве
электролитической двуокиси марганца. Из него может быть также
получен электролизом металлический марганец. Наконец, он мо-
жет быть переработан на кристаллический сульфат марганца или
на карбонат марганца, из которого затем получают другие соеди-
нения, в частности реактивы.
772
Гл. ХХМ. Соединения марганца
Получение активной двуокиси марганца
из бедных руд
Качество активных марганцовых материалов, как деполяриза-
торов, зависит от их дисперсности и малой упорядоченности ре-
шетки. Некоторые бедные руды, например чиатурские пористые
руды, обладают высокой дисперсностью и путам их химической* и
термической обработки можно получить84 активные марганцовые
материалы, пригодные для применения в элементной промышлен-
ности. Так, при обработке этих руд серной кислотой или вначале
щелочью, а затем серной кислотой получаются препараты, не усту-
пающие по своей активности искусственной двуокиси марганца.
Изучено разложение карбонатных руд окислами азота. Получае-
мый нитрат марганца может быть подвергнут пиролизу85 или
электролитическому разложению86, в последнем случае на аноде
образуется очень чистая и активная двуокись марганца, при рас-
ходе энергии 2,5 кет ч на 1 кг Мп.
Азотнокислотная переработка бедных марганцовых руд осуще-
ствлялась на опытной установке87 производительностью 450 кг/ч.
Руду, измельченную до частиц размером 0,25 мм, обжигают в вос-
становительной печи, обрабатывают азотной кислотой и получен-
ный раствор нитрата марганца после отделения нерастворимого
остатка выпаривают при 116° до концентрации 65% твердого
вещества. Затем его разлагают в обогреваемой паром двухвальцо-
вой сушилке, причем для получения у-МпО2, идущей на изготовле-
ние сухих элементов, температура разложения не должна превы-
шать 350°. Выделяющиеся пары HNO3 и нитрозные газы воз-
вращают в процесс, а МпО2 размалывают, промывают и сушат.
Разложение раствора нитрата марганца ведут также во вращаю-
щейся пламенной печи, причем из газов регенерируется до 95%
азотной кислоты88. Запатентован способ переработки нитрата мар-
ганца в двуокись, названную е-МпОг, которую можно применять в ;
качестве катализатора окисления или деполяризатора. Он заклю-
чается в барботировании через слой расплавленной соли смеси ;
азота (до 40%) и водяного пара при 130°. После охлаждения из :
реакционной массы отмывают остаток нитрата 89. Окисление Мп2+ :
(нитрат или сульфат) можно производить с помощью КМпО4 в :
сильно кислой среде при 80°; после отмывки и сушки при 30° про- i
дукт имеет поверхность 180 м2/г, а при 60° — 350 м2/г; отношение
Мп : О равно 1,94—1,9590. Некоторые виды сырья можно обраба-;
тывать азотной кислотой без предварительного их обжига, причем J
такой переработке могут подвергаться руды с большим содержа- !
нием соединений железа, которые в этих условиях не растворяют- 1
ся91"92. В США, в связи с отсутствием высококачественных мар-
ганцовых руд, считают целесообразным использовать и обогащен-
ные, содержащие марганец шлаки доменных печей.
Искусственная двуокись марганца
773
Предложено 93 регенерировать МпО2 из растворов, содержащих
MnSO4 и (NH4)2SO4, получающихся при окислении двуокиси®
марганца органических соединений. Растворы обрабатывают из-
вестковым молоком, выделяющийся аммиак улавливают, а осадок
Мп(ОН)2 растворяют в азотной кислоте. После отделения гипса
раствор выпаривают до получения сухого нитрата марганца, из
которого нагреванием до 200—300° получают МпО2.
Двуокись марганца может быть получена из низкосортных
марганцовых руд солянокислотным способом. Максимальное из-
влечение марганца концентрированной соляной кислотой из пред-
варительно обожженной при 800° руды достигается в течение
20 мин. При содержании в руде 36,6% Мл и 30,4% Fe в раствор
перешло почти 70% марганца и остаток содержал 55,54% Ре и
9,25% Мп. Гидролиз полученного раствора хлорида марганца при
10-кратном разбавлении его водой в присутствии воздуха дает
осадок продукта, содержащего 85% МпО2 и практически не содер-
жащего железа94. Получение МпО2 из различных марганцовых
материалов через хлорид марганца привлекает все большее вни-
мание. Описан способ получения МпО2 окислением хлором в ще-
лочной среде осадка Мп(ОН)2, полученного обработкой раствора
МпС12 содой 95. Запатентован катионитный способ извлечения Мп2+
из сернокислого раствора с регенерацией катионита соляной кис-
лотой, кристаллизацией хлорида марганца высаливанием его хло-
ристым водородом, термическим разложением осадка на МпО и
НС1 и с последующим окислением МпО кислородом воздуха; про-
дукт содержит 55% Мп96. Двуокись марганца, пригодную для це-
поляризаторов в сухих батареях, можно получить обработкой
солянокислой вытяжки из восстановленного природного пиролю-
зита, содержащей 5—25% Мп в виде хлоридов и 0,5—5% свобод-
ного НС1, щелочным раствором гипохлорита при охлаждении.
После выделения осадка МпО2 pH смеси должен быть в пределах
2—5. Осадок промывают и выдерживают длительное время в
воде 97.
Предложено 98 перерабатывать MnSO4 в МпС12 эквимолекуляр-
ным количеством СаС12 и после отделения осадка CaSO4 обраба-
тывать раствор МпС12 большим количеством Са(ОН)2. В получен-
ную суспензию Мп (ОН) 2 и избытка Са(ОН)2 в растворе СаС12
пропускают воздух (кислород), для перевода Мп2+ в Мп4+. Для
завершения окисления суспензию хлорируют и образующуюся дву-
окись марганца отделяют от раствора СаС12.
В присутствии водяного пара при ~600° твердый хлорид мар-
ганца гидролизуется с образованием окислов
2МпС12 + ЗН2О Мп2О3 + 4НС1 + Н2
ЗМпС13 + 4Н2О Mn3O4 + 6НС1 + Н3
774
Гл. XXII. Соединения марганца
или, с большей скоростью, в присутствии паро-воздушной смеси:
4МпС12 + 4Н2О + О2 2Mn2O3 + 8НС1
6МпС12 + 6Н2О -|- О2 < . * 2МП3О4 + 12НС1
При 600° степень превращения в паровой среде в течение 2,5 ч
достигает 73%, а в паро-воздушной среде за 2 ч 99%. С повыше-
нием температуры скорость гидролиза увеличивается. Получаемые
продукты являются смесью р-Мп2О3 и р-Мп3О4".
Возможна переработка марганцовых руд с помощью аммиач-
ных растворов26. Руды, содержащие МпО, могут обрабатываться
~ 18%-ной аммиачной водой с ~2% сульфата, хлорида, нитрата,
карбоната или карбамата аммония. Образуется раствор комплекс-
ной марганцово-аммиачной соли с концентрацией в пересчете на
Мп(ОН)2 ~ 10 г/л. Выщелачивание ускоряется в присутствии вос-
становителей, например (NH4)2S (в количестве 3—15 кг на 1 т
руды). Из отделенного раствора с помощью СО2 осаждают МпСО3
при температуре выше 60°, поддерживая молярное отношение
СО2: Мп в растворе больше 1,75. Нагреванием в течение несколь-
ких часов при 150—315° в воздухе или в кислороде полученный-
МпСОз переводят в MnO210°. i
Получение активной двуокиси марганца термическим способом
Этот способ проще и экономичнее химических способов. Он за-
ключается в непосредственном окислении манганитных руд 101 при
275—300° в течение 20—30 мин-.
Мп2О3 • Н2О + >/2О2 = 2МпО2 + Н2О
Скорость окисления и активность окисленного продукта зави-
сят от физических свойств руды, содержания в ней марганца и
других компонентов, в особенности щелочных соединений. Послед-
ние являются катализаторами, ускоряющими окисление окиси мар-
ганца 102. В отличие от манганитной руды искусственная окись
марганца в отсутствие катализаторов окисляется до МпО2 очень
медленно, но при добавке к ней 4—6% NaOH или КОН при 400°
в течение 2 ч степень окисления достигает 85—90% 103. Интенсив-
ность процесса зависит и от условий приготовления Мп2О3.
Для получения высококачественного продукта термическим
способом необходимо выбирать пригодные для этой цели руды.
Сравнительная легкость перехода природных манганитных руд
в руды пиролюзитного типа с активными свойствами позволяет
широко использовать термический способ для переработки бедных
марганцовых руд.
Для получения двуокиси марганца реактивной чистоты лучшим
считается 104 метод термического разложения осажденного МпСОз
t $ последующим окислением воздухом образовавшейся МпО в при-
Сульфат марганца
775
сутствии добавки — азотной кислоты для предотвращения диссо-
циации МпО2. Отжатый на центрифуге осадок, содержащий
~70% МпСОз, сушат при 200°, затем смачивают азотной кислотой
и подвергают окислительному обжигу при 450—500° до полного
удаления окислов азота.
СУЛЬФАТ МАРГАНЦА
Сульфат марганца получают способами, рассмотренными выше,
из природной двуокиси марганца (стр. 767) и из бедных руд
(стр. 761). В связи с возрастающей потребностью в сульфате мар-
ганца как микроудобрении и для переработки его в другие соеди-
нения изыскиваются и другие способы его производства. Многие
из них также основываются на предварительном восстановитель-
ном обжиге природной руды, например а.ммиачный способ, в кото-
ром выщелачивание восстановленной руды производится сульфа-
том аммония 21’105. Другие способы основаны на обработке серной
кислотой марганцовой карбонатной руды 50’106.
Серную кислоту, образующуюся в результате побочной реакции
окисления SO2 в H2SO4 под каталитическим влиянием ионов мар-
ганца, нейтрализуют добавкой к суспензии карбонатной руды
(10—15% от начального количества руды). При этом облегчаются
отстаивание и фильтрация пульпы. Очистка раствора достигается
его подщелачиванием до pH = 7—8, причем железо, фосфор и
другие примеси осаждаются. После отстаивания и фильтрации
осадок с фильтра, промытый водой, направляют в отброс, промыв-
ные воды — на приготовление пульпы, а раствор MnSO4 — на
дальнейшую переработку.
Запатентован способ получения MnSO4 из карбонатной руды
обработкой ее разбавленной серной кислотой (отношение
Мп : H2SO4, равное 1:2,1, Ж : Т ~ 3) в присутствии катализатора
KI107. Процесс ведут при pH = 2—3, температуре 80—90° и при
'вдувании воздуха почти до полного выщелачивания марганца. За-
тем горячую пульпу фильтруют, раствор MnSO4 направляют на
переработку, а осадок промывают холодной водой и промывную
воду возвращают на разложение руды.
Растворение карбонатной руды ускоряется в присутствии окис-
ной руды (пиролюзита) 108.
Когда сульфат марганца является промежуточным продуктом
производства, его раствор перерабатывают электролизом, осажде-
нием марганца в виде карбоната или гидроокиси и т. д. Термиче-
ская диссоциация твердого сульфата марганца позволяет регенери-
ровать из него серу и окислы марганца. Добавка к обжигаемому
сульфату марганца 5—10% угля ускоряет процесс его разложе-
ния. Приемлемые для практических целей скорости разложения
MnSO4 в атмосфере воздуха достигаются при 850°, азота — при
776
Гл. XX1J. Соединения марганца
800°, причем твердые продукты обжига состоят почти целиком из
Мп3О4, а газовая фаза содержит серу в виде SO2 (содержание SO3
меньше 3% от суммы SO2 + SO3)109.
Выделение кристаллического сульфата марганца из его рас-
твора осуществляется выпариванием и кристаллизацией или выса-
ливанием концентрированной серной кислотой.
Ввиду того, что растворимость сульфата марганца с повыше-
нием температуры в интервале от 27 до 100° понижается, кристал-
лизация охлаждением концентрированного раствора оказывается
Рис. 210. Растворимость MnSO4
в воде при 120—200°.
невозможной. Изотермическая кри-
сталлизация при выпарке из раствора
воды, т. е. выпарка «на кристалл» не-
сколько затруднена, потому что на
греющих поверхностях выпарного ап-
парата нарастает толстый слой соли,
сильно снижающий коэффициент теп-
лопередачи Кроме того, при выпарке
образуются чрезвычайно мелкие кри-
сталлы MnSO4 • Н2О, отделение кото-
рых на фильтре от маточного раство-
ра идет крайне медленно.
Для избежания этих трудностей
кристаллизацию сульфата марганца
можно осуществлять нагреванием рас-
твора 110. Растворимость сульфата мар-
ганца выше 100° резко снижается
(рис. 210); в твердой фазе находится
одноводная соль MnSO4-H2O. Если,
например, исходный раствор содержит
20% MnSO4, то при нагревании его до
160° в твердую фазу выделится 86%,
а при 180° — 94% от общего количе-
ства MnSO4.
Выделение сульфата марганца может быть осуществлено на-
греванием раствора до 160° в автоклаве острым паром, имеющим
давление 7—8 ат. Достаточно 15-минутной выдержки при этой
температуре, чтобы в маточном растворе осталось 3,8% MnSO4.
Затем маточный раствор спускают через фильтр, находящийся
внутри автоклава, и в автоклав загружают новую порцию свежего
раствора. После двух- или трехкратной кристаллизации соль вы-
гружают. Наиболее подходящим материалом для автоклава яв-
ляется медь или бронза.
Маточный раствор от кристаллизации может быть употреблен
для разбавления серной кислоты, идущей в производство ГАПа,
вследствие чего конечный выход сульфата марганца будет бли-
зок к 100%. Так как в исходном растворе сульфата марганца со-
Хлорид марганца
777
держится около 1% MgSO4, то в маточном растворе будет накап-
ливаться сульфат магния. Присутствие последнего благоприят-
ствует кристаллизации MnSO4 • Н2О, так как понижает его рас-
творимость. Часть маточного раствора должна периодически из
цикла выводиться.
Растворимость сульфата марганца в присутствии серной кис-
лоты сильно падает. Так, при 25° при содержании в растворе
40,8% H2SO4 растворимость MnSO4 составляет 3,8%, при 62%
H2SO4 — 0,5%. При концентрации H2SO4 ниже 62% твердой фазой
является MnSO4-H2O, при более высокой концентрации — MnSO4.
При еще более высокой концентрации и низкой температуре в
твердую фазу выделяется кислая соль MnSO4 • H2SO4 • Н2О.
На основании этого Д. М. Корфом предложена следующая
схема извлечения сульфата марганца из раствора. К раствору
добавляют серную кислоту до концентрации 40% H2SO4. При этом
выпадает в осадок около 80% сульфата марганца. Отделенный
осадок, содержащий до 40% маточного раствора, промывают рас-
твором сульфата марганца. Растворы от промывки поступают на
высаливание серной кислотой. Полученная соль содержит около
68% MnSO4 и 0,3—0,6% H2SO4. Недостатком этого способа яв-
ляется большой расход серной кислоты, примерно в 3 раза превы-
шающий расход ее на производство ГАПа. Получающаяся после
высаливания слабая серная кислота лишь частично может быть
использована для производства ГАПа, что и затрудняет реализа-
цию этого способа.
ХЛОРИД МАРГАНЦА
Хлорид марганца производят растворением в соляной кислоте
марганцовой руды, пиролюзита 1И, карбоната или гидроокиси мар-
ганца, а также закиси марганца, получаемой предварительным
восстановительным обжигом руды (стр. 767). Двуокись марганца
растворяется по реакции Уэльдона
MnO2 + 4НС1 = МпС12 + С12 + 2Н2О
применявшейся раньше для регенерации хлора из соляной кис-
лоты. С меньшим расходом кислоты и без потери хлора идет рас-
творение закиси марганца:
МпО + 2НС1 = МпС12 + Н2О
Наиболее чистый раствор получается при растворении в соля-
ной кислоте предварительно осажденных из растворов гидрата за-
киси или карбоната марганца. При обработке соляной кислотой
сырой или восстановленной руды в раствор переходят примеси
тяжелых и других металлов. Если производить «основное» выще-
лачивание, т. е. при избытке руды, то перешедшие вначале в рас-
твор железо и алюминий к концу процесса осаждаются в виде
778
Гл. XXII. Соединения марганца
гидроокисей. Обычно очистку слабокислых растворов МпС12 от Fe,
Al, Си, Ni, Со и других примесей производят, нейтрализуя их ам-
миаком. Тяжелые металлы можно выделять в виде сульфидов.
Очищенный раствор МпС12 выпаривают до насыщения, а затем,
при охлаждении до 20°, кристаллизуется МпС12-4Н2О. Дополни-
тельную кристаллизацию можно осуществлять высаливанием со-
ляной кислотой с возвратом маточного раствора на обработку
сырья.
Описан112 способ тюлучения тонкодисперсного кристалличе-
ского МпС12-4Н2О из раствора в одну стадию — сушкой в фонта-
нирующем слое.
Предложено перерабатывать в МпС12 отбросный шлам от про-
изводства КМпО4 (стр. 783). С этой целью его сначала промывают
10%-ной соляной кислотой, а затем обрабатывают 30%-ной. В ре-
зультате экзотермической реакции и нагревания до 90° выделяется
газообразный хлор и 95% МпО2 превращается в МпС12. Раствор
нейтрализуют карбонатом марганца, фильтруют и высушивают в
распылительной сушилке воздухом при 150°. Продукт содержит.
82% МпС12113.
Раствор МпС12 может быть получен взаимодействием MnSO4
с СаС12 или обработкой раствором СаС12 твердого карбоната мар-
ганца.
Исследование реакции
МпСО3 (кр.) + СаС12 (раств.) МпС12 (раств.) + СаСО3 (кр.)
выполнено114 с синтетическим углекислым марганцем МпСОз*
•0,5Н2О. С повышением концентрации СаС12 равновесная концен-
трация МпС12 резко возрастает: для 100° при концентрации СаС12
5,5 и 7,5 г-мол)л концентрация МпС12 равна соответственно 79,2 и
146,5 г/л; для 200° при концентрации СаС12 4 и 5 г-мол/л кон-
центрация МпС12 соответственно 98,8 и 162 г/л. Смещение равно-
весия реакции в концентрированных растворах СаС12 в сторону
образования МпС12 объясняется образованием прочных гидратов
Са2+. При концентрации СаС12 4—5 г-мол/л при 100° за 8 мин 65%
МпСО3 превращается в МпС12, за \5мин— 85%, за 60 мин — 90%.
Эта реакция первого порядка. Лимитирующей стадией является
образование промежуточного соединения — гидрооксикарбоната
марганца Мп(ОН)(НСО3) за- счет присоединения молекул воды
к карбонату марганца. Изучены также равновесия в водных115 и
безводных116 системах, содержащих хлориды Мп, К и Na.
Хлорид марганца можно получать117 хлорированием газооб-
разным хлором в присутствии восстановителя пористых чиатур-
ских руд, кристаллического пиролюзита или оксидной марганцо-
вой руды при 550—600°. После охлаждения хлорированной руды
МпС12 выщелачивается водой и выкристаллизовывается. Отделе-
ние примесей железа достигается фильтрованием раствора через
Перманганат калия
779
толстый слой активированного пиролюзита с диаметром частиц
1—1,5 мм или добавлением к раствору сырой карбонатной марган-
цовой руды с последующим отфильтровыванием осадка.
Во время второй мировой войны в США значительные количе-
ства хлорида марганца готовили из окиси, полученной сжиганием
пирофорной смеси марганцовой руды (содержащей МпОг) с фер-
ромарганцем и древесными опилками118. Ферромарганец служил
восстановителем, опилки обеспечивали необходимую пористость и
восстановительную атмосферу в слое горящей шихты. Спекшийся
материал измельчали и растворяли в соляной кислоте, раствор
МпС12 очищали от железа и других примесей и перерабатывали
в кристаллический продукт.
Безводный хлорид марганца получают из кристаллов
МпС12-4Н2О. При 58° тетрагидрат плавится. Поэтому обезвожива-
ние лучше всего производить, смешивая МпС12 • 4Н2О с большим
количеством ретура — безводного МпС12 и нагревая смесь в бара-
банной сушилке выше 220° или осуществляя этот процесс в аппа-
рате с кипящим слоем. Безводный МпС12 можно получить хлори-
рованием марганца или ферромарганца газообразным хлором 119.
Разработана технологическая схема извлечения марганца из руд
и шлаков хлорированием их при 900° и фракционной конденсацией
из отходящего из реакционной печи газа МпС12 при 550° и FeCl3
при 50° 12°. Предложен способ121 избирательного хлорирования
марганца обработкой материала, содержащего больше железа, чем
марганца, при 150—480° газообразным хлористым водородом
с примесью такого количества водорода, чтобы в отходящем газе
обнаруживались его следы. Процесс ведут до превращения ~50%
марганца в хлорид и достижения соотношения MnCl2:FeC12, рав-
ного по крайней мере 1:1.
ПЕРМАНГАНАТ КАЛИЯ
Перманганат калия получают разложением МпО2 едким кали
и разложением ферромарганца едким кали и электролизом30. Наи-
более распространено щелочное разложение пиролюзита с полу-
чением манганатного плава. На старых установках его осуще-
ствляют в обогреваемых топочным газом котлах, на современных
установках — во вращающихся тарельчатых печах и в других не-
прерывно действующих аппаратах.
При щелочном разложении производство перманганата калия
осуществляется в две стадии. В первой стадии получается манга-
натный плав, содержащий КгМпО4; во второй стадии манганат
окисляется в перманганат.
Получение манганата.в виде манганатного плава достигают
сплавлением пиролюзита с едким кали в присутствии воздуха;
2МпО2 + 4КОН + О2 = 2К2МпО4 + 2Н2О
780
Гл. XX]]. Соединения марганца
Тонко размолотый в шаровой мельнице высокосортный пиро-
люзит и 50% раствор КОН сплавляют при 200—270°, Более высо-
кие температуры ведут к разрушению уже образовавшегося ман-
ганата с выделением кислорода. Разложение К2МПО4 при
475—960° в атмосфере кислорода или азота 30’122 протекает в ос-
новном по реакции
ЗК2МпО4 = 2К3МпО4 + МпО2 + О2
и небольшое количество манганата (8—10%) разлагается по ре-
акции:
2К2МпО4 = 2К2МпО3 + О2
Получаемая по первой реакции двуокись марганца теряет часть
кислорода и фактически находится в плаве в виде вещества с со-
ставом МпО1,8-1,75.
При получении манганатного плава в плоских чугунных кот-
лах, обогреваемых снизу топочными газами и снабженных мешал-
ками скребкового типа, делающими до 30 об!мин, котлы эти обыч-
но открыты для облегчения доступа воздуха; над ними устанавли-
вают вентиляционные вытяжные колпаки. В нагретый котел
вначале загружают пиролюзит и влажную двуокись марганца, по-
лученную во второй стадии процесса при выщелачивании манга-
натного плава. Материал подсушивается, затем к нему добавляют
небольшими порциями 50% раствор КОН. Общее количество за-
гружаемой в котел щелочи соответствует весовому отношению
МпОг: КОН, равному 1 : 1,45. Иногда смешение пиролюзита с рас-
твором едкого кали производят в специальных смесителях, после
чего смесь загружают в прокалочные котлы. Операция плавки
продолжается около суток при непрерывном перемешивании. Плав
имеет вид мелких комочков. Процесс протекает медленно, так как
окисление двуокиси марганца в манганат происходит преимуще-
ственно на поверхности этих комочков; внутренняя их часть почти
не окисляется. Поэтому выход манганата в лучшем случае дости-
гает 60%; получаемый плав содержит до 30—35% К2МПО4, около
25% КОН, значительное количество MnO2, К2СО3 и другие при-
меси.
Находящиеся в пиролюзите примеси влияют на физические
свойства плава — Fe2O3 действует как отощающий материал и не
является помехой, а А12О3 и SiO2 образуют с КОН растворимые
(низкоплавкие) соединения, что приводит к увеличению липкости
плава. Добавка извести не устраняет появления этих соединений30.
Иногда плавку производят в закрытых котлах, в которые вду-
вается воздух, в два приема, с промежуточным измельчением плава
в шаровых мельницах для устранения комков и ускорения про-
цесса окисления. Процесс плавки в котлах является периодическим
и поэтому весьма трудоемким.
Перманганат калия
781
Вследствие малого содержания манганата в получаемом плаве
при дальнейшей переработке его в перманганат теряются значи-
тельные количества едкого кали (расход 200% от теоретического),
и (Манганата (расход 150% от теоретического).
При использовании для получения маиганатного плава вра-
щающихся барабанных печей, в них подают смесь молотого пиро-
люзита и 85%-ного едкого кали при 250°, причем суспензия по-
ступает на нагретый до 350° гранулят. При этом смесь спекается
не контактируясь со стенками печи. Применяют печи с внутренним
обогревом, имеющие, например, кольцевую горелку для сжигания
газообразного топлива, а в центре пламени — сопло для подачи
суспензии |23. Из такой печи плав-гранулят для завершения реак-
ции направляют в другую печь — «печь дожигания», через кото-
рую он перемещается при 140—-250° в течение не более 4 ч. Эту
печь обогревают газами, отходящими с первой стадии, содержа-
щими 8—30 объамн.% О2 и 10—35 объемы. % Н2О. Вращающиеся
печи позволяют получать манганатный плав более высокого каче-
ства, чем в прокалочных котлах.
Манганатный плав повышенного качества может быть также
получен следующим способом. Размолотый пиролюзит смешивают
с расплавленной 75—85%-ной щелочью и полученную смесь гра-
нулируют на валках. Гранулированный манганитный плав сушат
при 160—180°, т. е. при температуре ниже температуры его раз-
мягчения. Такая сушка обеспечивает однородность плава. После
этого плав окисляют воздухом, причем манганит почти полностью
переходит в манганат. Полученный таким способом плав содержит
60—65% К2МпО4, 12—13% МпО2 и 8-9% КОН + К2СО3. Вслед-
ствие высокого содержания манганата и малого содержания ще-
лочей, дальнейшая переработка такого плава в перманганат зна-
чительно облегчается, а расход сырья и топлива уменьшается.
Другим вариантом является подача суспензии пиролюзита в
80%-ном едком кали на наружную поверхность вращающихся в
разные стороны вальцов, обогреваемых изнутри топочным газом.
Время пребывания материала на вальцах при 350—400° состав-
ляет 1 мин. Плав соскабливается ножами. Производительность
вальцов ~50 ка/(л12-ч); промышленные агрегаты с поверхностью
5 л2 дают до 1000 т в год KMnO430. По одному из патентов 124, про-
цесс ведут в три стадии. Сначала с помощью дисков и направлен-
ной по касательной к ним воздушной струи суспензию пиролюзита
в едком кали наносят на вальцы, нагретые до 450°, где происхо-
дит сушка материала. Для инициирования реакции на вальцы на-
брызгивают воду в то место, где заканчивается сушка. Вторая ста-
дия заключается в измельчении плава, частично состоящего из
манганата до размера частиц 0,05—0,1 мм. Третью стадию — даль-
нейшее окисление плава, осуществляют при 210° в печи с кипящим
слоем материала, где ®н контактируется с кислородом и парами
782
Гл. XXII. Соединения марганца
воды. При длине вальцов 5 м и диаметре 0,8 м получают в сутки
39,5 т плава, содержащего 35% К2М.ПО4. На получение 16,72 т/сут-
ки КгМпО4 расходуют 10000 л3 воздуха и 1,5 т водяного пара.
Так как спекание смеси пиролюзита со щелочью не требует
длительного времени, то его можно осуществлять в распылитель-
ной башне, в потоке горячего газа.
Манганат может быть получен из пиролюзита электрохимиче-
ским способом при применении в качестве электролита расплав-
ленного едкого кали, в котором пиролюзит находится во взве-
шенном состоянии. Электролиз должен вестись при 195—200°. Вы-
ход не превышает 60% от теоретического. Большой избыток едкого
кали в получаемом полупродукте затрудняет дальнейшее электро-
химическое окисление К2МПО4 в КМпО4.
Превращение манганата в перманганат происходит уже при
простом кипячении водного раствора по реакции:
ЗК2МпО4 + 2Н2О = 2КМпО4 + MnO2 + 4КОН
Процесс значительно ускоряется при обработке раствора угле-
кислым газом
ЗК2МпО4 + 2СО2 = 2КМпО4 + МпО2 + 2К2СО3
однако получаемый при этом карбонат калия требуется подвергать
каустификации известью для регенерации едкого кали. Получение
перманганата таким способом оказывается невыгодным, так как
значительная доля манганата превращается в двуокись марганца.
Окисление манганата хлором по реакции
2К2МпО4 + С12 = 2КМпО4 + 2КС1
также невыгодно, так как регенерация едкого кали из хлорида
калия, например электролизо-м, является дорогим процессом.
В настоящее время перевод манганата в перманганат осуще-
ствляется обычно электрохимическим окислением. При этом на
аноде образуется перманганат
МпО4- — е = МпО4
а на катоде едкая щелочь и водород:
2Н2О 4-2е = Н2 +2ОН-
Процессы, происходящие в электролизере, могут быть схемати-
чески выражены суммарным уравнением:
2К2МпО4 + 2Н2О = 2КМпО4 + 2КОН + Н2
Манганатный плав выщелачивается в резервуарах с мешал-
ками маточным щелоком, полученным после электролиза. Раство-
рение манганата при 70° продолжается 1—1,5 ч. Отстоявшийся
Перманганат калия
раствор направляется на электролиз, а шлам поступает на бара-
банные вакуумфильтры, там отделяется от раствора и потом воз-
вращается на получение манганатного плава. Шлам содержит
35—50% МпО2 (не прореагировавшего при получении манганата)
и другие примеси, перешедшие из пиролюзита. Периодически, при
значительном накоплении этих примесей, шлам выбрасывается.
Электролиз производится в ваннах, представляющих собой же-
лезный цилиндрический резервуар с коническим днищем, по кото-
рому уложен змеевик; с помощью этого змеевика регулируют тем-
пературу в ванне, впуская в него греющий пар или охлаждающую
воду. Ванна снабжена мешалкой и спускным краном. Железные
аноды расположены внутри ванны в виде нескольких концентриче-
ских цилиндров на расстоянии 100 мм друг от друга. Применяют
также никелевые аноды. Между анодами находятся катоды —же-
лезные стержни диаметром 20—25 мм. Общая поверхность като-
дов приблизительно в 10 раз меньше поверхности анодов, что
уменьшает потери от катодного восстановления. Плотность тока
на аноде 60—70 а/л2, на катоде ~700 а/м2. Анодные и катодные
пластины опираются на стеклянные или фарфоровые изоляторы.
Диаметр ванны 1,3—1,4 м, высота цилиндрической части 0.7—0,8 м,
конической части — 0,5 м. В ванну вмещается 900—1000 л рас-
твора электролита. Электролиз ведется при 60°. Напряжение на
ванну в начале электролиза составляет ~2,7 в, нагрузка 1400—
1600 а. В конце электролиза напряжение возрастает до 3 в, а сила
тока несколько падает. Ванны работают сериями, по несколько
штук. Число ванн в серии определяется характеристикой генера-
тора постоянного тока. Расход энергии на 1 т КМпО4 составляет
700 кет • ч.
Электролиз ведут без диафрагмы, так как она засоряется дву-
окисью марганца, небольшое количество которой образуется при
электролизе. Поэтому выход по току зависит главным образом от
степени обратного восстановления перманганата на катоде. Боль-
шая щелочность электролита препятствует использованию добавок
для образования на катоде защитной пленки. Уменьшению выхода
по току способствует также выделение на аноде кислорода и об-
ратный переход КМпО4 в К2МпО4 из-за высокой конпентпаиии
щелочи:
4КМпО4 + 4КОН - 4К2МпО4 + 2Н2О + О2
Эта реакция каталитически ускоряется присутствующей в элек-
тролите двуокисью марганца. Увеличению выхода по току способ-
ствует низкая анодная плотность тока и искусственное перемеши*
вание электролита, уменьшающее концентрационную поляризацию
на аноде; при перемешивании в прианодном слое создается более
высокая концентрация К2МПО4, понижается анодный потенциал и
вследствие этого уменьшается выделение кислорода 12S.
784
Гл. XXII. Соединения марганца
Выход по току и степень окисления увеличиваются при элек-
тролизе насыщенного раствора К2МпО4 в присутствии кристаллов.
Такой раствор содержит приблизительно 180 г/л К2МпО4, 30—
40 г/л КМпО4, 150 г/л КОН и 50 г/л К2СО3. Электролиз продол-
жается несколько часов, пока концентрация К2МпО4 не упадет до
15—30 г/л. Образующийся КМпО4 плохо растворим и частично
выделяется в виде кристаллов. По окончании электролиза раствор
электролита вместе с кристаллами перманганата калия поступает
в стальные холодильники с мешалками, охлаждаемые с помощью
водяных рубашек. Здесь происходит окончательная кристаллиза-
ция перманганата калия. Выпавшие кристаллы отделяют на цен-
трифуге и промывают водой; маточные щелоки и промывные воды
возвращают на выщелачивание манганатного плава. Примерный
состав маточного щелока: 23 г/л КМпО4, 16 г/л К2МпО4, 210 г/л
КОН, 60 г/л К2СО3.
После промывки на центрифуге и высушивания получается за-
грязненный технический перманганат калия, содержащий 80—95%
КМпО4, примеси МпО2, К2МпО4, сульфатов, поташа и щелочи. Для
получения чистого продукта кристаллы, промытые на центрифуге,
подвергаются перекристаллизации, для чего их растворяют в воде
при 85° и раствор охлаждают. Выделившиеся кристаллы отфуго-
вывают и сушат.
Если необходимое для производства едкое кали получают кау-
стификацией поташа известью, то расход основных материалов на
1 т перманганата калия приблизительно составляет: пиролюзита
(100% МпО2)—0,8 т, поташа (100%)—0,85 т и извести (100%
СаО) — 0,7 т.
Часть маточного щелока после кристаллизации перманганата
калия во избежание чрезмерного накопления примесей необходимо
выводить из цикла. Он содержит, кроме перманганата и щелочей,
алюминаты, ванадаты и др. Его можно каустифицировать известью
[СаО или Са(ОН)г] и, отделив осадок, возвратить раствор на вы-
щелачивание манганата126. Можно утилизировать маточный ще-
лок восстановив КМпО4 и КгМпО4 37%-ным раствором формалина
до МпО2; оставшийся после отделения МпО2 раствор КОН и К2СО3
при нейтрализации азотной кислотой позволяет получить калий-
ную селитру 3 сорта 127.
Возможно непосредственное получение перманганата калия
анодным растворением марганца в щелочном электролите, содер-
жащем КОН или К2СО3, при электролизе с анодами из ферромар-
ганца, с ~70% Мп и 1—6% углерода. Процесс идет по общему
уравнению:
2Mn + 2ОН~ + 6Н2О = 2МпО; + 7Н2
При содержании в аноде меньше 44% Мп перманганат не об-
разуется. Катод может быть из меди, стойкой в щелочном перман-
Мажеф
785
ганатнсш растворе. Электролиз может осуществляться без диа-
фрагмы или с диафрагмой из асбестового полотна; в последнем
случае катодное восстановление уменьшается и выход по току
больше. Лучшая температура электролита 16—18°. Повышение
температуры приводит к увеличению степени превращения пер-
манганата в манганат. Электролит должен содержать 20—30%.
КОН или К2СО3. Электролизу препятствует образующаяся на фер-
ромарганцевом аноде оксидная пленка, повышающая потенциал*
особенно при малой концентрации щелочи в электролите. При при-
менении анодов из силикамарганца пассивирующая пленка обра-
зуется только при малых концентрациях электролита и высоких
плотностях тока. Слишком высокие концентрации электролита при-
водят к появлению растворимых соединений железа, образующихся
при повышенном потенциале.
Оптимальная анодная плотность тока при использовании в ка-
честве электролита раствора, содержащего 300 г/л К2СО3, 16—
18 сидм1, а при 200—250 г/л КОН — 30—40 а!дм2. Выход по току
не превышает 50%, а выход продукта (степень перехода раство-
рившегося марганца в перманганат) 80—85%; расход энергии
12 кет • ч на 1 кг КМПО4. Продукт электролиза — КМпО4 полу-
чается в виде мелких кристаллов, смешанных с большим количе-
ством электролитического шлама. Электролит охлаждают, отде-
ляют от осадка на барабанном вакуум-фильтре и центрифуге и
возвращают в процесс. Осадок обрабатывают горячей водой для
извлечения КМпО4, который затем выделяют кристаллизацией 128.
Фильтрование горячей (70—90е) электролизной пульпы для отде-
ления шлама перед кристаллизацией перманганата позволяет по-
лучить весьма чистый продукт (до 99,7% КМпО4), но пока не при-
меняется из-за отсутствия устойчивого фильтрующего материала 129.
МАЖЕФ
Для фосфатирования стальных изделий предложены и приме-
няются разные препараты: порошок Паркера 130, дигофат, мажеф
и др. Они представляют собой смеси фосфатов марганца и фос-
фатов железа. Железо-марганцовые фосфатные препараты имеют
преимущество перед марганцовыми, так как дают покрытия, более-
устойчивые против коррозии, и требуют меньшей длительности фос-
фатирования. Вредными примесями в фосфатных препаратах яв-
ляются соли алюминия, мышьяка, свинца131. Наибольшее примене-
ние получили препараты, состоящие из монофосфатов марганца и
железа (мажеф), с соотношением между ними 10: 1 -г 15; 1 132.
Предложен также продукт взаимодействия феррофосфата с МпО2
при молярном отношении в исходной смеси Мп : Fe, равном 5:8ц
11:4 133.
786
Гл. XXII. Соединения марганца
Для приготовления разных фосфатов может быть использована
фосфорная кислота или суперфосфат. Мп(Н2РО4)2 может быть по-
лучен из апатита, серной кислоты и марганцовых шламов134. Ди-
гофатом назван дигидроортофосфат марганца, который можно
получить из фосфорной кислоты и сульфата марганца или восста-
новленного пиролюзита. По этому способу дигофат раньше изго-
товлялся в заводском масштабе 135, но он содержал свободную сер-
ную кислоту, а иногда большой избыток фосфорной кислоты, что
ухудшало антикоррозионные
свойства получаемого с его по-
мощью защитного покрытия13S.
В Институте металлов был разра-
ботан способ получения дигофа-
та из фосфорной кислоты и фер-
ромарганца. В настоящее время в
СССР основным препаратом для
фосфатирования служит мажеф.
При фосфатировании проис-
ходит разложение хорошо рас-
творимых фосфатов марганца на
более основные фосфаты
Мп(Н2РО4)2 МпНРО4 + Н3РО4
ЗМпНРО4 Мп3(РО4)2 + Н3РО4
Рис. 211. Стабильная изотерма 100°
системы МпО —Р2О5—Н2О.
кристаллизующиеся как на по-
верхности металла в виде плен-
ки, так и в растворе (шлам) ,37~141.
Появление фосфатной пленки на металле является вторичным
процессом, которому предшествует растворение металла и связан-
ное с этим изменение состава слоя раствора, прилегающего к анод-
ным и катодным участкам поверхности металла. Пленка трудно-
растворимых фосфатов покрывает поверхность металла и защищает
его от коррозии. Она достаточно стойка против влияния атмосфер-
ных осадков, но не защищает железа даже в слабокислой среде и
в растворах солей. Но фосфатная пленка служит хорошим грунтом
для последующего нанесения органических защитных и декоратив-
ных покрытий — лаков, красок, смол и т. д. Состав таких пленок
много изучался, но окончательно не установлен. Для выяснения
состава осадков, выделяющихся из водных растворов фосфатов
марганца, можно воспользоваться диаграммой растворимости в си-
стеме МпО—Р2О5—Н2О (рис. 21 1 ) 142’ 143. При 100° в твердую фазу
сначала выделяется метастабильный трехводный кристаллогидрат
МПНРО4 • ЗН2О, который переходит полностью в стабильную при
этой температуре безводную соль лишь в течение нескольких су-
ток. Так как процесс фосфатирования длится всего 40—60 мин, то
метастабильный MnHPCU • ЗН2О не успевает разложиться и, таким
Мажеф
787
образом, входит в состав фосфатной пленки. Другим ее компонен-
том является безводный дифосфат марганца МпНРО4. Образова-
ние в пленке Мп3(РО4)2, по условиям кристаллизации в этой си-
стеме, является маловероятным.
В чистом монофосфате .марганца Мп(Н2РО4)2 отношение МпО :
: Р2О5 равно 0,5 (рис. 211). В применяемом же для фосфатирова-
ния при 100° ~3%-ном насыщенном растворе монофосфата мар-
ганца отношение МпО : Р2О5 должно быть -—0,3, т. е. препарат
для фосфатирования должен состоять из смеси Мп (НгРО^г • 2Н2О
и свободной фосфорной кислоты, для того чтобы он полностью
растворился в воде при 100° без разложения при приготовлении
~3%-ного раствора.
Для ускорения фосфатирования предложено применять при
70—80° раствор, содержащий железо-марганцовые фосфаты (на-
пример, мажеф) 30—35 г/л и нитрат цинка 50—70 г/л. В присут-
ствии последнего пленка образуется в 10—12 раз быстрее’44. Фос-
фатирование может вестись и холодным способом, при этом не на-
гретый раствор мажефа должен иметь повышенную концентра-
цию (100—200 г/л).
Марганцовый препарат для фосфатирования сталей мажеф, со-
держащий монофосфаты марганца и железа, может быть получен
несколькими способами:
1) растворением в избытке горячей (90°) фосфорной кислоты
закиси марганца, восстановленной углем из пиролюзита, в присут-
ствии железа; полученный раствор отфильтровывают от нераство-
римого остатка, выпаривают до плотности 1,67—1,69 г/смг и охла-
ждают для кристаллизации монофосфата .марганца с примесью
монофосфата железа;
2) растворением в фосфорной кислоте ферромарганца с после-
дующей выпаркой раствора и кристаллизацией соли;
3) получением кислых фосфатов марганца и железа из сульфа-
тов марганца и железа и тринатрийфосфата.
Первый способ дает продукт, загрязненный растворимыми
в фосфорной кислоте примесями, содержащимися в пиролюзите.
Второй, как и первый, связан с необходимостью выпарки фосфор-
нокислых растворов, которая осложняется отсутствием материа-
лов, достаточно устойчивых по отношению к горячей фосфорной
кислоте. Третий 145 не обладает этими недостатками. По этому спо-
собу смешивают растворы сульфата марганца, сульфата закиси
железа и тринатрийфосфата при 60—70°. В результате протекают
реакции:
3MnSO4 + 2Na3PO4 = Mn3(PO4)2 + 3Na2SO4
3FeSO4+2Na3PO4 = Fe3(PO4)2 + 3Na2SO4
Образующиеся фосфорнокислые соли марганца и железа вы-
деляются * в объемистый осадок. Осадок отфильтровывают на
788
Гл. XXII. Соединения марганца
вакуум-фильтрах и промывают водой до полного удаления серно-
кислых солей, а затем отжимают под гидравлическим прессом от
избыточной влаги и высушивают при температуре до 300°. Для
осаждения фосфатов марганца и железа вместо тринатрийфосфата
можно использовать динатрийфосфат.
Полученный порошок, содержащий 30—35% Мп и 2—3% Fe,
смешивают с. фосфорной кислотой, количество которой должно
быть достаточным для перевода тризамещенных фосфатов в одно-
замещенные:
Мп3(РО4)2 + 4Н3РО4 = ЗМп(Н2РО4)2
Fe3(PO4)2 + 4Н3РО4 = 3Fe(H2PO4)2
Частично происходит образование МпНРО4 по уравнению:
Мп3(РО4)2 + Мп(Н2РО4)2 = 4МпНРО4
Ввиду экзотермичности этих реакций смесь быстро разогре-
вается, а по охлаждении застывает в однородную мелкокристалли-
ческую массу, которую высушивают при температуре не выше 80—
100° и размалывают. Полученный препарат содержит 17—19%
Мп, 1,5—2,5% Fe, 49—52% Р2О5.
По минеральному составу мажеф представляет порошок, со-
стоящий в основном из монофосфата марганца, небольших коли-
честв фосфатов железа и дифосфата марганца.
Несколько лучшими качествами обладает препарат, получае-
мый растворением фосфорнокислого марганца и железа в избытке
горячей фосфорной кислоты с последующей кристаллизацией из
раствора монофосфатов марганца и железа. Такой препарат содер-
жит меньшее количество нерастворимого остатка.
ЛИТЕРАТУРА
I. Е. Я. Роде, Кислородные соединения марганца, Изд. АН СССР, 1952. —
5. В. В. Печковский, А. Г. Звезд ин, Уч. зап. Пермск. гос. ун-та, 17, в. 1,
35 (1960). — 3. J. Н. К repel к а, В. Re] ha, Coll. Czech. Chem. Comm., 5, 67
(1953); A. Seidell, Solubil. Inorg. a. Metalorg. Comp., 1, 1940. — 4. Ldrant
Bela, Z. analyt. Chem., 219, № 3, 256 (1966).—5. В. В. Печковский,
С. А. Амирова, H. И. Воробьев, T. В. Островская. ЖНХ, 9, № 9,
2059 (1964), — 6. I. P. S a r a s w a t, T. R. К a 1 r a, J. Indian Chem. Soc., 44, № 6,
481 (1967).— 7. E. В. Алексеевский, Активная двуокись марганца, Химтео-
рет, 1937.—8. Е. Я. Роде, Г. Г. Пуринов, Научно-иссл. работы химических
нн-тов и лабораторий АН СССР, Изд. АН СССР, 1945, стр. 50. — 9. Н. Ulich,
Z Elektrochem., 45, 521 (1939).— 10. М. О 11 о Е а г 1, J. Electrochem. Soc., 112,
№ 4, 367 (1965).
11. Т. Matsushima, W. J. Th о burn, Canad. J. Chem., 43, № 26, 1723
(1965). — 12. H. Peters, K.-H. Radeke, L. Till, Z. anorg. Chem.. 346, № 1.
2. 1 (1966).—/3. J. C. White, R. R M i 11 e r, J. Am. Chem. Soc., 75, № 13,
3282 (1953). —14. Б. Ежовская-Тжебятовская, Я. Навойская,
M. Вронская, Бюлл. Польск. Акад, наук, отд. Ill, 1, № 7, 314 (1953).—
15. Б. Ежовская-Тжебятовская, Я. Навойская, М. Вронская,
Там же, отд. III, 2, № 9, 451 (1954); Roczh. chem., 29, № 2—3, 259 (1955).—
Литература
789
16. Е. С. Осиновик, П. И. Белькевич, Изв. АН БССР гРП техн
наук, № 1, 127 (1956). —/7. Е И. Шмук, Автореф канд. ^ДнсТитут го-'
рючих ископаемых АН СССР, 1952. — 18. R. S с h о 1 d е г, D Fischer Н W а-
terstradt, Z. anorg. Chem., 277, № 5, 234 (1954). —/р д Simon F Fi-
ber, Z. Elektrochem., 38, 137 (1932). — 20. Q. Hems er' H Sehrfider Z
anorg. Chem., 271, № 5-6, 293 (1953). ’ Schroder, L.
21. Ю. В. Клименко, А. П. Квасков, Химическое обогащение марган-
цовых руд, Госметаллургиздат, 1944. — 22. С. С. Марков, Автоле* покт писе.
ГИПХ, 1951, — 23. М. Katz, S. Halpern, Ind. Eng. Chem., 42 № 2 343
(1950). — 24. Ф. А. Пет рачков, H. С. Жигулина, Т. Т. Готьман’ова,
Хим. пром., № 4, 301 (1964). — 25. В. Т. Ч а г у н а в а, Э. Р. Дзнеладзе^
Л. И. Твасалия, Тезисы докладов V Всесоюзной конференции по ТНВ и ми-
неральным удобрениям, Киев, 1966, стр 192 —26. В. Т. Чагунава, Р. А, Д а-
дидзе, Там же, стр. 193. — 27. Я. Я. Додонов, Л. Д. Борзова’ В. с’ Ко-
лосова, В. С. Покаевская, ЖПХ, 32, Ns 11, 2373 (1959). — 28.' В. М. К а-
кабадзе, Т. А. Иванова, Труды Груз, политехи, ин-та, № 5 (40), 1955,
стр. 30.—29. В. М. Какабадзе, В. Т. Чагунава и др., Тезисы докладов V
Всесоюзной конференции по ТНВ и минеральным удобрениям, Киев, 1966,
стр. 83.-35. W. Baronius, J. Marcy, Chem. Techn., 18, № 12, 723 (1966).
31. А. Л. Ефимов, И. А. Каза с, Инсектициды и фунгициды, Сельхозгиз,
1940 —32. Н. Be dune a u, Rev. prod, chim., 68, № 1339, 539, 547 (1965).—
33. Е. F е i 11, J. Rabska, Biul. inform. Inst. Przem. Drobnego, 2, № 2, 1
(1955). — 34. S. Trocme, G. Barbier, Agr. Chem., 11, № 5, 35 (1956).—
35. А. Г. Бет ex тин, Промышленные марганцовые руды СССР, Изд. АН СССР,
1946.—36. В. И. Вернадский, С. М. Курбатов, Земные силикаты, алюмо-
силикаты и их аналоги, ОНТИ, 1937. — 37. А. Г. Бетехтин, Чиатурское мар-
ганцовое месторождение и его промышленная характеристика, ОНТИ, 1936. —
38. М. Ю. Морачевский, Труды ГИПХ, в. 37, 1946, стр. 123. — 39. Е. Я. Ро-
де, Г. Г. Пуринов, Научно-иссл. работы химических ин-тов и лабораторий АН
СССР, Изд. АН СССР, 1945, стр. 51.—40. В М. Какабадзе, Я. Г. Б у ч у-
кури и др., Тезисы докладов VI Всесоюзной конференции по технологии не-
органических веществ, Тбилиси, 1968, стр. 49.
41. Е. Я. Роде, Научно-исследовательские работы химических ин-тов и ла-
бораторий АН СССР, Изд. АН СССР, 1945, стр. 53.—42. Д. И. Эр и став и,
Д. Н. Барнабашвили, Е. С. Джапаридзе, Научно-исследовательские
работы химических ин-тов и лабораторий АН СССР за 1939 г., Изд. АН СССР,
1940, стр. 107. — 43. Б. С. Канделаки, И. Д. Гавберидзе, И. Р. Д о-
лидзе, Там же, стр. 106. — 44. Обогащение марганцовых руд. Груз. фил. АН
СССР, Хим. институт, 1940. — 45. Н. С. Weber, С. Н. Davenport, Trans. Am.
Inst. Chem. Eng., 39, 585 (1943). — 46. В. M. Какабадзе, ЖПХ, 24, № 3, 252;
№ 7, 681 (1951); Хим. пром., № 6, 174 (1953). -47. С. Е. Wood, С. L. Walf-
r е d, Е. Р. В а г г е 11 a. oth., U. S. Bur. Mines Rept. Invest., № 3609, 30 (1942).—
48. A. P. Herring, S. F. Ravitz, Trans. Soc. Mining Eng. A1ME, 232, № 3,
191 (1965). — 49. В. M. Какабадзе, Аннотации докладов на III Научно-техни-
ческой конференции Грузинского индустриального института, 1940, стр. 56. —
50. В. М. Какабадзе, Изв. Груз, политехи, ин-та, № 2, (16) 29 (1945).
51. Р. И. А г л а д з е и др., сб. «Исследования по лерераб,'тке марганцевого
и топливного сырья Грузии», Тбилиси, 1967, стр. 83. -52. К. М. С а л д а д з е,
Труды МХТИ, № 6, 1940, стр. 88.—53. Н. П. Диев, М. И. Кочнев, В. В. Па-
дучев, Г. Я. Сн ридзе, ЖПХ, 27, № 4 356 (1954).—54. В. В. Печков-
ский, Там же, 29, № 7, 997 (1956); 32, № 12, 2613 (1959). —55. Н. В. Н е б и е-
ридзе, Я. Г. Б у чу кур и, Тезисы докладов V Всесоюзной конференции по
ТНВ и мйиеральным удобрениям, Киев, 1966, стр. 113. — 56. В. М. Какабад-
зе, Т. В. П а н ц у л а я, Журн. ВХО, 5, № 4, 471 (I960). —57. Я- Г. Б у ч у к у р и,
В. Т. Чагунава, Т. В. П а н ц у л а я, Сообщ. АН ГрузССР, 17, № 8, 703
790
Г л. XXII. Соединения марганца
(1956). — 58. Т. В. Панцулая, Я. Г. Бучукури, Труды Груз, политехи, ин-
та, т. 5, 1956, стр. 92. — 59. I. Moldovan et al., Rev. chim. (рум.), 18, № 7,
399 (1967), — 60. Д. M. Вучурович и др., Гласник хем друштва Београд
(сербо-хорв.), 29, № 5—6 (1964).
61. й. Петков, Т. Ннколов, Годншннк хим.-технол. инет, (болг.), 11,
Кг 4, 161 (1964—1965).- 62. Н. В. Н е б и е р н д з е, В. М. К а к а б а д з е, Я. Г. Б у-
чукурн, Т. А. Иванова, Сообщ. АН ГрузССР, 48, № 2, 335 (1967).—
63. Пат. ПНР 49946, 1963, — 64. Н. С. Fuller, пат. США 3301634, 1963.—
65. Пат. США 326752, 1963. — 66. Kelley, Anderson, Bur. Mines Bull., 384
(1935). — 67. В. П. Ильинский, Н. П. Л а п н н, ЖПХ, 4, № 6, 757 (1931).—
68. Л. Н. Джапаридзе, Л. И, Бацанадзе, Р. В. Чагунава, Тезисы
докладов VI Всесоюзной конференции по технологии неорганических веществ,
Тбилиси, 1968, стр. 86. — 69. С. С. Марков, Сборник статей к 20-летню ГИПХ,
1939, стр. 74. — 70. С. А. 3 а р е ц к и й, Там же, стр. 174.
71. Р. И. Агладзе, Бюлл. ВХО, № 5, 41 (1940); № 5, 29 (1941); Метал-
лург, № 9 (117), 15 (1939).— 72. В. А. Козлов, В. Г. Власов, ЖПХ, 32,
№ 3, 523 (1959). — 73. А. Ф. Ложкин, Н. Л. Субочева, НДВШ, Хим. и хим.
технол., 2, 204 (1958). — 74. А. Ф. Ложкин, Т. В. Сычева, В. Г. Сумен-
к о в, Уч. зап. Пермск. гос. ун-та, 17, в. 1, 97 (1960). — 75. Р. И. Агладзе,
Э. Д. Чхнхвадзе, сб. «Исследования по химической переработке руд», Тби-
лиси, 1966, стр. 81. — 76. А. Ф. Ложки и, Изв. вузов. Хим. н хим. технол., 11,
№ 8’, 908 (1968). — 77. Р. И. Агладзе, В. Ю, М н н д н н, авт. евнд. 185863,
1963.’—78. J. Samonides, пат. США 3227520, 1962. — 79. Франц, пат. 1448939,
1965, — 80. Пат. ГДР 45351, 1965.
81. W. Т о m a s s i, Z. -D о m i n i с z a k, Przem. chem., 43, № 11, 608 (1964). —
82. H. К. C h a k r a b a r t i, T. Banerjee, J. Sci. Ind. Res.. В 12, № 5, 211
(1953).—83. С. С. Марков, Труды ГИПХ, в. 37, 1946, стр. 154. — 84. Е. Я. Ро-
де, А. П. Лазарева, Г. Г. Ц у р и н о в, Научно-исследовательские работы хи-
мических нн-тов н лабораторий АН СССР, Изд. АН СССР, 1945, стр. 52.—
85. В. М. Какабадзе, Бюлл. ВХО, № 4, 32 (1940). — 86. R. S. Dean,
A. L. Fox, А. Е. Beck, U. S. Bur. Mines Rept. Invest., № 3626, 63 (1942).—
87. Chem. Eng., 61, № 10, 122, 124 (1954). — 88. R. Freitag, Sprechsaal Kera-
mic, Gias, Email, 89, № 2, 32 (1956). — 89. Франц, пат, 1443907, 1965.—
90. О. G 1 e m s e r, G. G a 11 о w, пат. ФРГ 1157590, 1960.
91. S. C. Rao, J. Electrochem. Soc. (India), 15, № 4, 105 (1966).—92. Пат.
ЧССР, 114767, 1964; япон. пат. 736, 1962. — 93. К- Marx, М. Schulze, пат.
ФРГ, 752326, 1954.—94. Prasad N. S. Krishna, J. Indian Inst. Sci., A 36,
№ 1, 19 (1954). — 95. A. Esme, LTnd. chim., 34, № 361, 150 (1947). 96. J. Pet-
Иёка, V. Bastecky, пат, ЧССР, 114779, 1964. — 97. Пат. ФРГ 1205067,
1960. —98. Франц, пат. 1041511, 1953. — 99. Г. И. Зворыкина, ЖПХ, 30, № 10,
1515 11957) — 100. R. S. Dean, A. L. Fox, пат. ФРГ 922882, 1955, англ. пат.
690134, 1953.
101. Е. Роде, Т. Роде, Физико-химическое изучение марганцовых руд и
минералов. Изд. АН СССР, 1937, стр. 70. — 102. J. Kato, Т. Matsuhashi, J.
Soc. Chem. Ind. Japan, 32, № 11, 313 (1929). — 103 В. M. Какабадзе, ЖПХ,
20 № 7. 670 (1947).— 104. Д. М. Корф, А. А. Мазурен. Хнм. пром.. № 5,
361 11961).— 105. Е. Leaver, U. S. Bur of Mines, № 6770, 107 (1934).—
106. P. И. Агладзе, Горный ж., № 12, 39 (1939). — 107. Пат. ВНР 152894,
1965. — 108. Е. Maleczky, S. Fekete, Т. Bodacsoni, A. Horvath, Ва-
nyasz. Kutato int. kozl. (венг.), 10, № 1, 2, 211 (1965—1966). — 109. В. В. Печ-
к о век нй. ЖПХ. 28, № 3, 237 (1955). — 110. С. С. Марков, Сборник статей
к 25-летню ГИПХ, 1944. стр. 177.
Ill Technical Field Information Agency Rep., №757 (1947).— 112. Ю. Г. Кли-
менко, M. И. Рабинович, сб. «Тепло-массообмен», Киев, 1968, стр. 118.—
Литература
791
ИЗ. Н. Marcy, W. Wiedner, пат. ГДР 40748, 1964, —114 Л М Шамов-
с к н и, сб. «Исследования по прикладной химии», Изд АН СССР, 1955,
стр. 39. — 115. Л. А. Озеров, Труды Воронежск. ун-та, в 28 1953 стр' 24.—
116. А. Г. Бергман, Е. И. В о н а ш е к, Научно-иссл. работы химических ин-
тов и лабораторий АН СССР за 1941—1943 гг., Изд. АН СССР 1945 стр. 67.—
117. Е. Я. Роде, И. С. Морозов, Там же, стр. 54. — 118. Пат США 2370415,
1945. —119. Англ, пат. 680710, 1952. — 120. A. A. Cochram W L Fa Ike J-
Metals, 19, № 4, 28 (1967). ’ ’ ’
121. I. P. Whitehouse, M. E. Graham, пат. США 2658813 1953.—
122. R. Scholder, H. Waterstradt, Z. anorg. Chem., 277, № 3—4, 172
(1954). — 123. W. Baronins, H. Marcy, пат. ГДР 40745, 1964.’— 124. A. L a n-
ge, W. Drescher, пат. ГДР 32784, 1962. — 125. В. Г. Хомяков, В. П. М а-
шовец, Л. Л. Кузьмин, Технология электрохимических производств, Гос-
химиздат, 1949, стр. 399. — 126. М. В. Cams, пат. США 3172830, 1961.—
127. Р. И. Агладзе, В. В. Чепурин, сб. «Исследования в области электро-
химии и радиационной химии», Тбилиси, 1965, стр. 121, — 128. В. Г. Б е р и ка-
rn в и л и, Автореф. канд. дисс., АН ГрузССР, 1956. — 129. Э. И. Бахтадзе,
Тезисы докладов VI Всесоюзной конференции по технологии неорганических ве-
ществ, Тбилиси, 1968, стр. 230. — 130. Parker, герм. пат. 463778, 1926.
131. А. А. Соколовский, 3. М. Кулагина, ЖПХ, 18, № 7—8, 412
(1945). —132. В. И. Вульфсон, Г. П. Рабинович, Коррозия и борьба с
ней, 2, № 4, 357 (1936). — 133. W. Н. Woodstock, пат. США 2657922, 1953.—
134. П. М .Лукьянов, К. М. Салдадзе, ЖПХ, 17, К» 10, 19 (1940).—
135. И. И. Кукушкин, Там же, 13, № 5, 279 (1936). — 136. А. 3. Р и в к и н д,
Г. М. Б а дальни, Труды 1-й конференции по коррозии металлов при АН
СССР, 1935, стр. 675. — 137. В. С. Л о п а т у х и н, Фосфатирование металлов,
Машгнз, 1958. — 138. Д. М. Корф, Н. Н. Самарин, ЖПХ, 15, № 1, 38
(1938). —139. В. И. Вульфсон, Коррозия и борьба с ней, 5, № I—2, 7
(1939). — 140. Д. М. К о р ф, Там же, стр. 85.
141. Л. И. К о д а н е р, Защитные пленки на металлах, Изд. Харьковск. гос.
ун-та, 1956. — 142. А. А. Т а п е р о в а, М. М. Исаева, ЖПХ 22, № 4, 342
(1949). —143. М. В. Голощапов, ЖНХ, 1, № 11, 2633 (1956).—
144. И. И. Ханн, Коррозия и борьба с ней, 5, № I—2 (1939); ЖПХ, 18, № 4—5
(1945); 19, № 5—6 (1946); Труды Центрального н.-н. ин-та технологии судо-
строения, в. 15, 1957, стр. 3; ЖПХ, 32, № 11, 2463, 2473; № 12, 2662 (1959); 33,
№ 7, 1492 (1960). — 145. Б. Д. Мельник, авт. свид. 46914, 1936; ЖХП, 22,
1378 (1936).