Текст
Ю. И. ВЕЙЦЕР, Г. П. ЛУЧИНСКИЙ
МАСКИРУЮЩИЕ ДЫМЫ
ГОСУДАРСТВЕННОЕ НАУЧНО-ТЕХНИЧЕСКОЕ ИЗДАТЕЛЬСТВО
ХИМИЧЕСКОЙ ЛИТЕРАТУРЫ
МОСКВА 1947 ЛЕНИНГРАД
358-3
13-31
35-5-3-
Книга является руководством по физико-
химическим основам и технике применения
маскирующих дымов. Она содержит сведения
по процессам дымообразоваиня, свойствам ды-
мов, дымообразующим веществам и технике
дымопуска. »
К ЧИТАТЕЛЮ
Издательство просит присылать Ваши
замечания и отзывы об этой книге по,
адресу: Москва, Новая площадь 10,
подъезд 11, Госхимиздат
Редактор Г. П. Лупинский Технический редактор М. С. Лурье
Сдано в производство U/II 1946 г. Подвисано к печати 14/VIII 1946 г.
Формат 60X92’/,,. Печатных вистов 12*',. Уч.-надатеаьскях листов 15-
Тнпогр. знаков *в,1 веч. листе 48060. А 05357. Тираж 2000 экз.
Заказ М 3184. Цена-10 руб-
4-я типография им. Евг. Соколовой треста <Полвграфпнига> ОГИЗа
при Совете Министров СССР. Ленинград, Измайловский ггр., 20.
ПРЕДИСЛОВИЕ
? г
Предлагаемая вниманию читателей книга «Маскирующие
дымы» представляет собой коренным образом переработанное
второе издание книги тех же авторов, вышедшей в 1938 г. под
названием «Химия и .физика маскирующих дымов».
Книга «Маскирующие дымы» рассчитана на широкий круг
читателей, работающих в области дымовой маскировки, а также
на слушателей военных академий.
Книга «Маскирующие дымы» посвящена химическим и физи-
ческим основам дымообразоваиня, химии дымообразующих ве-
ществ и техническим средствам применения маскирующих дымов.
В настоящем издании опущены некоторые теоретические
сведения по оптике аэрозолей .и химии дымообразующих
веществ, имеющиеся в первом издании, и сохранены лишь те
из них, которые имеют практический интерес и необходимы для
понимания сложных явлений дымообразоваиня и дымомаски-
ровки.
В книге отсутствуют описания многочисленных трофейных
образцов шашек и Дымовых приборов германской, японской,
румынской, венгерской, итальянской « финской армий, захва-
ченных Красной армией во время Отечественной войны, вслед-
ствие того, что возможность опубликования этих материалов
появилась уже после того, как книга была сдана в производ-
ство.
Описание трофейных дымовых средств составит содержание
особой работы. Следует отметить, 4то большинство трофейных
средств не содержит в себе ничего принципиально нового: разно-
образнейшие дымовые шашки снаряжены по .рецептуре
Берже, взятой в различных вариантах; в качестве жидких ды-
мообразователей применяются растворы серного ангидрида в
хлорсульфоновой кислоте «ли четыреххлористый титан, а также
смесь четыреххлористого титана с четыреххлористым кремнием.
Книга «Маскирующие дымы» представляет собой совмест-
ный труд обоих авторов. Первая и третья части в основном на-
писаны Ю. И. Вейцером, вторая часть Г. П. Лучинским.
1* а
При переработке первого издания большую услугу своими
ценными замечаниями оказали М. К. Баранаев, Н. С. Губанов,
Л. В. Радушкевич и Д. С. Соминский, которым авторы выра-
жают свою благодарность.
Авторы надеются, что книга будет полезна всем, работаю-
щим в области дымовой маскировки, и будут весьма призна-
тельны за все критические указания.
Москва, нюнь 1946 г.
i».
f
Авторы
ВВЕДЕНИЕ
Появление в XX веке новых видов боевой техники, развитие
авиации, увеличение скорострельности автоматического оружия
вызвали, естественно, развитие и усовершенствование техники
маскировки. Одним из видов техники маскировки, получившим
широкое развитие во время первой мировой войны, явились
маскирующие дымы. Маскирующие дымовые завесы,
представляющие собою плотные облака, образуются в атмо-
сфере в результате применения так называемых дымооб-
разующих веществ. Постановка дымовых завес или, как
говорят, дымопуск имеет задачей маскировку располо-
жения и действий своих войск и военных объектов и ослеп-
ление огневых точек, наблюдательных пунктов и боевых по-
рядков противника.
Из военной истории известны примеры, когда естественный
туман или пороховой дым являлись решающими факторами
боя. Сознательное, хотя и эпизодическое применение маскирую-
щих дымов началось в XVIII веке. Планомерное же их при-
менение началось только во время .войны 1914—1918 гг., когда
были предложены основные дымообразующие вещества и тех-
нические средства их применения.
В период между первой и второй мировыми войнами про-
изошло основательное расширение ассортимента дымообразую-
щих веществ и усовершенствование техники дымообразования
и тактики применения дымовых завес. Во второй мировой
войне маскирующие дымы и дымообразующие вещества заняли
прочное место в арсенале новой военной техники, являясь
вспомогательными средствами почти всех родов войск: пехоты,
бронетанковых частей, артиллерии, авиации, морского флота.
Разработаны и применяются нейтральные дымовые шашки и
гранаты; нейтральные дымовые мины и снаряды; дымовые авиа-
ционные бомбы; дымовые авиационные приборы; морские буи;
дымовая аппаратура кораблей различных классов; танки, снаб-
женные резервуарами с жидкими дымообразующими вещест-
вами; стационарные установки для задымления тыловых
объектов.
Вторая .мировая война дала примеры удачного использова-
ния маскирующих дымов для выполнения тех или иных задач.
Маскирующие дымы используются в настоящее время во всех
вадах боя, в особенности при наступлении, форсировании вод-
ных препятствий и для защиты от воздушного нападения <мо-
5
стов, железнодорожных станций, заводов, аэродромов н других
военных объектов. Широкое распространение получили маски-
рующие! дымы и в морском бою.
Яркими примерами применения маскирующих дымов в Оте-
чественной войне советского народа с германским фашизмом
являются: прикрытие переправы через Волгу у Сталинграда,
форсирование- Днепра, задымление Кронштадта и Севастополя.
Во всех этих случаях, как и во многих других, маскирующие
дымы играли важную роли при проведении боевых операций.
Вообще же во время второй мировой войны армиями вою-
ющих сТран использовались как разнообразные дымообразую-
щие вещества, так и разнообразные Способы дымопуска. Широ-
кое использование дымообразующих веЩеств в современной
войне привело к развитию соответствующих химических произ-
водств. .
Значение, которое полупили маскирующие дымы в совре-
менной войне, требует Изучения теории маскирующего дымо-
образования, хиййн дымоббразукйцйх веществ и техники осу-
ществления дь/мопуска. 'Изложению этих вопросов и посвящена
настоящая книга.
ЧАСТЬ ПЕРВАЯ
ДЫМООБРАЗОВАНИЕ И СВОЙСТВА ДЫМОВ
ГЛАВА I
ОБЩИЕ ПОНЯТИЯ О ДЫМАХ
1. Основные определения и классификация
Раацвобразные системы, состоящие из мельчайших частиц,
взвешенных в газовой среде, .носят общее название аэ;родис-
нерсных систем -иля, .иначе, аэрозолей. К азро-
аояям .относятся: природные туманы и облака; атмосферная,
вулканическая н космическая пыль; дымы, образовавшиеся в
(результате неполного сгорания топлива в промышленных и
транспортных Лпках н моторах; отходящие газы, выделяющиеся
при 1химинеских -процессах; пыль, образующаяся -ггри меха-
нической обработке материалов в каменоломнях, мель-
ницах и элеваторах; искусственно получаемые, маскиру-
щие и ядовитые дымы — словом, все то, что называется тума-
ном, дымом, пылью, копотью, облаком, мглой н т. п. Строго
говоря, аэродисперсной .системой является и сам атмосферный
воздух, содержащий всегда (некоторое количество .пыли, гаво-
вых ионов и водяного тумана. Во всех этих системах воздух, в
котором взвешены частицы, является дисперсионной сре-
дой, а сами- твердые или жидкие частицы составляют дис-
персную фазу.
В основу принятой классификации аэрозолей положено два
принципа: размер частиц и агрегатное состояние дисперсной
фазы.
Прежде всего, аэрозоли делятся на: 1) собственно аэрозоли
или дымы и туманы с частицами размером меньше 10^3 см,
являющиеся истинными коллоидными системами, и 2) пыли,
или грубые суспензии, размер частиц которых -больше Ю-3 см.
Дальнейшее разделение истинных коллоидных систем осно-
вано на агрегатном состоянии дисперсной фазы. Дымами
называются аэрозоли с твердой дисперсной фазой, а т у м а-
н а.м и — аэрозоли, дисперсная фаза которых состоит из капе-
лек жидкости.
7
Подобная классификация не всегда целесообразна, ибо
аэрозольные системы могут одновременно содержать н Лердые
и жидкие частицы. Кроме того, поведение аэрозолей опреде-
ляется в основном не агрегатным состоянием дисперсной фазы,
а размерами аэрозольных частиц, от которых зависит важней-
шее свойство дымовых облаков — их устойчивость.
Исходя из этого, в английской литературе дымами (smokes)
называют собственно аэрозоли с размерами частиц от 10** до.
10“7 см, не оседающие под действием силы тяжести, а тума-
нами (clouds) называют аэрозоли с размерами частиц от 10~3
до 10”6 см, оседающие под действием силы тяжести.
Строго говоря, вещества, служащие для образования аэро-
золей (как дымов, так и туманов), следует называть аэрозоле-
образователями, а происходящие при этом процессы — процес-
сами аэрозолеобразования. Однако обычно для обозначения
веществ, образующих вообще аэрозоли, н процессов их полу-
чения в русской и английской литературе пользуются терми-
нами дымообразователь и дымообразование
независимо от агрегатного состояния дисперсной фазы. Такое
же собирательное значение имеет и слово дым, обозначающее
в некоторых случаях не только аэрозоли с твердой дисперсной
фазой, но и вообще любые аэрозоли. Особенно это относится
к русской военной литературе, в которой не проводится резкого
отличия между дымом и туманом и принято называть дымом
или дымовым облаком любую аэродисперсную систему.
В русской военной литературе аэрозоли, применяющиеся для
целей маскировки, кроме того, называют маркирующими
или нейтральными дымами, также независимо от
агрегатного состояния дисперсной фазы.
2. Особенности аэрозольного состояния
Всякое вещество, переходя в аэрозольное (коллоидное) со-
стояние, несколько (изменяет свойства1. Причиной этих измене-
ний является значительное увеличение удельной поверхности 2 и
поверхностной энергии вещества при его переходе в коллоидное
(дисперсное) состояние. Это обстоятельство, естественно, вызы-
вает повышение химической активности вещества и ускоряет
физические и физико-химические процессы. Поэтому реакции,
идущие в обычных условиях достаточно медленно, в аэрозоль-
ном состоянии проходят весьма быстро. Ускорением реакций
и объясняется взрывчатость тонко-измельченной пыли сахара,
крахмала, утЛя и других веществ, самопроизвольное воспламе-
нение мелкораздробленных свинца и железа, а также быстрое
наступление равновесного состояния между дисперсной фазой
1 Речь идет о свойствах вещества дисперсной фазы.
* Удельной поверхностью называется поверхность единицы объема
ветествя Если для 1 слР вещества поверхность равна 6 смг, то для этого
же кубического сантиметра, раздробленного на частицы размером в
0,00001 см, поверхность равна 600000 см* *.
8
аэрозолей, представляющих собой растворы кислот, и парам»
воды.
Сам факт раздробления вещества на частицы малых разме-
ров и образование аэрозольной (коллоидной) системы является
причиной возникновения новых свойств. Так, например, вслед-
ствие соизмеримости размеров дымовых частиц и газовых мо-
лекул дымовые частицы, подвергаясь ударам газовых молекул,
совершают непрерывное беспорядочное движение во все сто-
роны, известное под названием броуновского д в и ж е-
>н н я. Соизмеримость размеров аэрозольных частиц с длиной
волны видимого света в сочетании с огромной удельной по-
верхностью аэрозольной системы является причиной опти-
ческих явлений, в результате которых аэрозольное облако при-
обретает маскирующие свойства.
Вследствие значительной поверхностной энергии аэрозоли,
так же как н остальные коллоидные системы, являются систе-
мами неустойчивыми, быстро меняющими свои свойства и.
легко разрушающимися.
Однако, если коллоидные системы с жидкой дисперсионной
средой (гидрозоли) могут сохраняться неизменными иногда в
течение даже многих месяцев, то аэрозоли могут существовать-
только несколько часов и при этом находятся в состоянии,
непрерывного изменения. Такая особая неустойчивость аэро-
золей, по сравнению с гидрозолями, объясняется некоторыми
специфическими особенностями их, в первую очередь, диспер-
сионной среды (воздуха), а также -и дисперсной фазы. Так,
воздух имеет по сравнению с водой очень малые плотность-
(в 800 раз меньше) и вязкость (в 50 раз). Вследствие этого,
а также большой относительной плотности дисперсной фазы,
движение частиц, приводящее к разрушению коллоидной си-
стемы, происходит гораздо более интенсивно в случае аэро-
золей. Другой причиной сравнительной неустойчивости аэро-
золей является малое количество ионов, содержащихся в воз-
духе, по сравнению с количеством ионов, содержащихся в воде.
Все эти обстоятельства приводят к тому, что дисперсная фаза
аэрозолей легко отделяется от дисперсионной среды, е. аэро-
золь легко разрушается.
3. Основные характеристики дымов
Дымы и туманы характеризуются с количественной стороны
прежде всЬго концентрацией и размерами частиц.
Концентрацией называется содержание дисперсной фазы в
единице объема дымового облака, причем различают весовую
и частичную концентрацию. Характеристика среднего, размера
частиц называется степенью дисперсности дым'а *.
1 В коллоидной химии степенью дисперсности называется величина
обратная размерам частиц.
9-
, Весовой концентрацией дыма С называется коли-
чество вещества дисперсной фазы в граммах или миллиграммах,
содержащееся в 1 м3 дымового облака.
Весовая концентрация различных дымов и туманов изме-
няется в довольно широких пределах (табл. 1), однако устой-
чивыми являются лишь аэрозоли с небольшой весовой концен-
трацией. Аэрозоли с концентрацией, превышающей десятые
доли грамма на 1 м3, неустойчивы и их весовая концентрация
постепенно уменьшается вследствие выделения дисперсной
.фазы из дымовой системы.
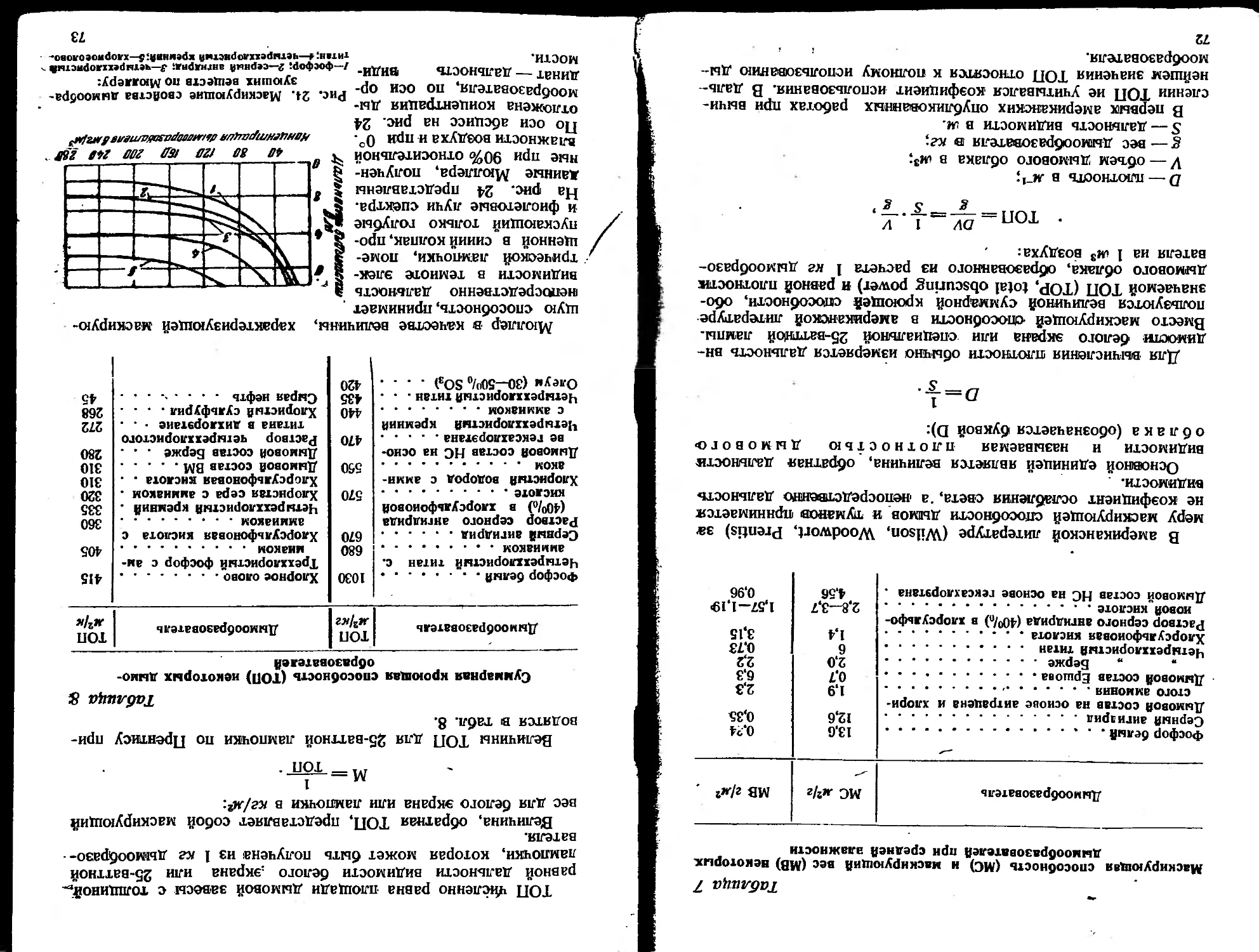
Таблица 1
Весовая и частичная концентрации некоторых аэрозолей
Состав дисперсной-фазы Весовая концен- трация в г/м3 Частичная концен- трация (число частиц в 1 см3)
Стеариновая кислота Окись цинка Серная кислота Масло (машинное) Фосфорная кислота Вода (природные туманы и облака) Хлористый аммоний Каменный уголь (воздух угольцых копей) 0,01—0,03 0,2—0,7 0,10—0,15 3-30 02—1,7 1.2 до 2 до 65 5.196—3.105 3 10е—1-106 5-10В-4-105 2- ГО6 3.6 106—1 • 10е 1 • 1С’—1 -166 до 10“
Частичной концентрацией называется число час-
тиц дисперсной фазы в 1 см3 или 1 мм3 дымового облака.
В устойчивых, медленно оседающих дымах частичная концен-
трация лежит в пределах 10s—ГО5 частиц в 1 см3 (табл. 1).
Частичная и весовая концентрации совместно определяют сте-
пень дисперсности-или величину дымовых частиц.
Говоря о размерах дымовых частиц, необходимо различать
среднюю величину, находимую из весовой и частичной концен-
трации, и истинные размеры отдельных частиц. В подавляющем
большинстве случаев дымовое облако полидисперсно, т.е.
оно содержит частицы различных размеров. Только с помощью
особых методов удается получить и сохранить в течение непро-
должительного времени дымовые облака, состоящие из близких
по размерам частиц. Такие дымы называются изодисперс-
н ы м н. Представление о средних размерах частиц некоторых
аэрозолей дает табл. 2.
В изодисперсных системах средний размер частиц совпа-
дает с нх истинным размером. В полидисперсных системах
истинные размеры частиц отклоняются в меньшую и большую
стороны от- средних размеров, найденных из весовой и частич-
ной концентраций.
Ю
Таблица 2
Размер частиц аэрозолей
Аэрозоль Средний радиус (поло- вина поперечника) ча- стиц и см
Дым стеариновой кислоты 1•10-ь
Сухой водяной туман 2,5 • 10-6
Туман серной кислоты 4.10-ь_8.Ю-б
Черный дым печей котельных топок ЫО-6 — 5-10-6
Водяные облака 5-10-4—3-10-6
Табачный дым 1,7-10-6
Газы цементных печей 4-10-4 —З-Ю-з
Дымы японских шашечных смесей . 2,5-10-6 — 3,5-10 з
Туман фосфорной кислоты .... 5.'10-5—1-10-4
Как уже было сказано выше, размеры аэрозольных частиц
•обычно находятся в пределах от 10~* до IO-* см. Средний
радиус частиц дымов н •Туманов, применяющихся для маскирую-
щего дымообразоваиня, заключен в более узком пределе: от
2-10-5 до 8-10-5 см. Исключением* является черный дым, со-
стоящий из агрегатов ббльших размеров.
Форма частиц туманов всегда шарообразна (рис. 1). Частицы
дымов обладают разнообразной кристаллической и игольчатой
структурой и обычно представляют собой агрегаты, состоящие
из более мелких частиц (рис. 2).
Рнс. 1. Частицы масляного тумана
Рис. 2. Частицы дыма окиси
кадмия
Вследствие компактного-состояния капелек тумана плотность
их соответствует плотности того же вещества в макроскопи-
ческом состоянии *. Плотность агрегатов дымов вследствие
рыхлой структуры и содержания между отдельными частицами
воздуха оказывается меньше плотности тех же веществ в ма-
кроскопическом СОСТОЯНИИ *.
Частицы дымов и туманов часто несут на себе электриче-
ский заряд. Как правило, наряду с частицами, заряженными
1 Это было доказано Уайтлоу-Грей на масляном тумане.
’ По данным того же Уайтлоу-Грей плотность частиц дисперсной фазы
дыма окиси магния составляет 0,35, в то время Как плотность самой окиси
магния равна 3,5.
11
электричеством какого-нибудь одного знака, присутствуют как
противоположно заряженные, так и нейтральные частицы.
Иногда возможно получение дымов, заряженных униполярно,
т. е. электричеством одного знака.
Возникновение электрического заряда на частицах в раз-
личных случаях обусловливается различными причинами. В не-
которых случаях частицы аэрозоля заряжаются уже в процессе
самого их образования, если только этот процесс происходит
бурно. Чаще же всего частицы дымов й туманов заряжаются
вследствие адсорбции газовых ионов из окружающей среды или
вследствие трения о нее. Это обстоятельство приводит к по-
степенной зарядке первоначально незаряженных частиц. При
этом процент заряженных частиц может доходить до 80. Число
элементарных зарядов, которые находятся на одной частице,
колеблется от одного до нескольких сотен. Вследствие наличия
заряда частицы аэрозолей в электрическом поле движутся
к противоположно заряженному электроду.
ГЛАВА II
МЕТОДЫ ПОЛУЧЕНИЯ ДЫМОВ И ТУМАНОВ
Дымы н туманы могут получаться двумя способами: во-пер-
вых, раздроблением твердого или жидкого вещества до кол-
лоидного состояния и, во-вторых, соединением молекул пара
в частицы коллоидных размеров. Первый способ называется
дисперсионным, второй — конденсационным. Раз-
личие между этими двумя способами заключается в том, что
при дисперсионном процессе удельная поверхность системы
возрастает, при конденсационном процессе — уменьшается.
1. Диспергирование
Все дисперсионные (методы (иначе — методы дробления>
сводятся к тому, что твердое или жидкое тело раздробляется
на более мелкие части, причем интенсивностью дробления
достигают той или иной степени дисперсности. Это дробление
осуществляется путем приложения механических усилий, пре-
одолевающих силу сцепления между частицами.
Все дисперсионные процессы осуществляются только при
затрате работы н с прекращением этой затраты останавли-
ваются.
Механизм дисперсионных процессов, происходящих в газо-
вой среде, еще недостаточно изучен. Однако очевидно, что
работа, затрачиваемая на’ дробление, пропорциональна поверх-
ности вновь образуемых частиц и должна сильно возрастать
с увеличением задаваемой степени дисперсности. Непосред-
ственное диспергирование до аэрозольных размеров требует
затраты огромного количества энергии и практически неосу-
ществимо. В лучшем случае оно приводит к образованию гру-
бодисперсных быстро оседающих аэрозолей.
12
а. Механическое измельчение твердых тел. При размалыва-
нии или растирании твердых тел их можно превратить в пыль,
но при этом нельзя достичь высокой дисперсности. Растирание
вещества в ступке обычно не дает хорошего измельчения, так
как по мере повышения раздробленности отдельные частицы
плотно соединяются одна с другой. Этого можно избежать,
прибавляя к растираемому веществу другое вещество, не
реагирующее с первым н отличающееся от него по плотности.
Это индиферентное вещество при растирании не позволяет
отдельным пылинкам растираемого тела образовывать круп-
ные агрегаты. При развеивании полученного порошка (иногда
с помощью сжатого газа) в воздухе получается тонкая, но
довольно быстро оседающая пыль.
Мельничная пыль, которая получается при развеивании
в воздухе мельчайшей муки, содержит частицы сравнительно
низкой степени дисперсности (10“® см). То же можно сказать
об угольной пыли шахт и о пыли элеваторов. Применением по-
следовательного измельчения и отсеивания можно добиться
степени дисперсности в 1 микрон (КГ4 см). Коллоидная мель-
ница Плаусона позволяет раздробить вещество на частицы с
большей степенью дисперсности,-но этот способ мало пригоден
для получения дымов.
Механическое измельчение твердых тел не используется для
получения маскирующих дымов. Механическое измельчение
применяется в пескоструйных аппаратах и в специальных
огнетушителях, в которых тонкий порошок бикарбоната натрия
с помощью струи сжатого углекислого газа направляют в очаг
огня.
б. Распыление жидкостей. Распыление жидкостей произво-
дится либо гидравлическим методом, либо методом
пульверизации. Гидравлический метод заключается в
том, что жидкость большим давлением выводится нз тонкой
трубки.
• Пульверизация осуществляется- при ударе жидкости о твер-
дую или жидкую поверхность или при столкновении струи жид-
кости со струей газа.
При гидравлическом распылении на поверхности струи жид-
кости, выходящей из отверстия распылителя, образуются раз-
личные неровности, обусловленные завихрением струи, колеба-
нием воздуха и другими причинами. Под действием сил
поверхностного натяжения и сопротивления воздуха эти неров-
ности увеличиваются, струя принимает волнообразную форму
и, в конечном итоге, разрывается на отдельные капли. Чем
больше скорость струи, тем сильнее происходят волнообразные
колебания н тем легче осуществляется дробление. Подобный
механизм дробления при гидравлическом распыле был теорети-
чески обоснован Рэлеем и Вебером и экспериментально иссле-
дован многочисленными авторами. Распад турбулентных струй
происходит, кроме того, вследствие радиальных движений
частиц жидкости.
13
Образовавшиеся вследствие распада струи. капли при движе-
нии в воздухе подвергаются дальнейшему дроблению. В резуль-
тате сопротивления воздуха в капле происходит вращательное
движение жидкости и возникают напряжения, нормальные, к
поверхности капли. Если эти напряжения больше давления,
вызываемого действием сил поверхностного натяжения, то про-
исходит разрыв капли.
При скорости струи порядка 50 м/сек и вязкости жидкости
около 0,01 пуаз критический размер капель, на которые дро-
бится жидкость, составляет примерно 1 мм.
Таким образом, гидравлическое распыление не приводит к
образованию аэрозольных частиц. В практике дымообразования
гидравлическое распыление может быть использовано лишь в
качестве вспомогательного приема для облегчения испарения
дымообразующих веществ.
Более высокодисперсные системы могут быть получены в. ре-
зультате пульверизации. Прц пульверизации вначале происхо-
дит непосредственное раздробление жидкости на уравнительно
крупные капли вследствие сильного удара о твердую поверх-
ность и встречи со струей газа. Наряду с этим при пульве’
§изации, повидимому, образуются тончайшие пленки жидкости,
тн пленки обладают огромной удельной поверхностью- и по--
верхностной энергией и находятся вследствие этого в неустой-
чивом состоянии. Стремясь к уменьшению удельной поверх--
наста, пленки легко рвутся на мелкие частицы, принимающие,
под влиянием поверхностного натяжения сферическую форму.
Для пульверизации жидкостей употребляются распылители
различной конструкции. Обычный пульверизатор, изображенный
на рнс. 3, представляет собой две коаксицальные трубки; по
внутренней движется с боль-
. . шой линейной скоростью,жид-
L лглиадо»» костьп а по внешней — воздух.
I ( Жидкость при выходе из внут-
\ \ _______________ Ренней трубки сталкивается со
<= ' ...ь.г ага—струей воздуха и разбивается
I при этом в мелкие капли. Дис-
I персность их невелика, и по-
। । этому туман получается не-
' устойчивый. Дисперсность мож-
[ нс, 3. Пульверизатор но повысить, если разбить об-
. разующиеся капли на более
Мелкие. Это достигается установкой на их пути (у выхода из
трубки) твердой поверхности в наклонном положении. Интен-
сивность дробления повышается, если эта твердая поверхность
будет быстро вращаться.
При пульверизации степень дисперсности образующегося
тумана зависит, прежде всего, от величины энергии удара
жидкости о разбивающую ее поверхность, т. е. практически,
от взаимной скорости столкновения жидкости и газа. Она за-
висит также от плотности, вязкости и поверхностного натяже-
14
Рис. 4. Распы-
литель Реге-
нера
ния жидкости. Чем меньше будут эти величины, тем легче
при данной энергии пульверизации получить более высокодис-
персный туман. Поэтому нагревание жидкости, ведущее- к
уменьшению ее плотности, вязкости и поверхностного натяже-
ния, должно облегчить процесс распыла; то же может быть
достигнуто введением особых примесей.
Повышение средней дисперсности тумана, полученного пуль-
веризацией жидкости, может быть произведено пропусканием
его- через спиральную трубку; при этом крупные частицы- от-
брасываются к стенкам трубки и задерживаются на них, а
мелкие уносятся током газа. Получение тумана
таким путем может быть осуществлено при помо-
щи специального аппарата — распылителя Реге-
нера (рис. 4).
Дисперсность тумана также повышается, если
первоначально полученные брызги подвергаются
испарению. Это происходит при распылении воды и
других летучих жидкостей. В этом случае необ-
ходимая степень дисперсности достигается, ве-
роятно, уже благодаря этому вторичному про-
цессу, который не будет происходить вслед за
распылением нелетучих жидкостей.
Следует отметить, что даже при применении
самЫх совершенных распылителей .энергия, иду-
щая непосредственно на образование новой поверх-
ности, -представляет собой небольшую долю всей
затраченной энергии. Значительная часть затрачен-
ной энергии расходуется на преодоление трения,
возникающего при продвижении жидкости в рас-
пылителе, и, таким образом, для целей распыления
не используется. Поэтому, если давление газа, производящего-
распыление, невелико, получается туман сравнительно низкой
степени дисперсности. Образование устойчивого тумана по-
требует применения больших давлений, что связано с весьма
громоздкой аппаратурой. Кроме того, вследствие невозможно-
сти подвергнуть всю массу жидкости однородному дроблению-
при всех процессах распыла будут образовываться между про-
чими большие капли, оседающие непосредственно у распыли-
теля и, таким образом, неиспользуемые для создания тумана.
2. Конденсация
Сущность конденсационных методов образования дымов и
туманов заключается в том, что вещество, раздробленное вна-
чале на отдельные молекулы (т. е. находящееся в состоянии
газа или пара), уплотняется, образуя большие агрегаты.
Это уплотнение, или конденсация, может произойти только
в том случае, если пар пересыщает пространство. Таким обра-
зом, конденсационный процесс образования дыма происходит
в две стадии: 1) образование пересыщенного пара и 2) соб-
ственно конденсация из пересыщенного пара. Конденсационные
методы отличаются от дисперсионных тем, что процесс конден-
сации, раз начавшийся, идет далее самопроизвольно и сопро-
вождается отдачей энергии. Все усилия при искусственном по-
лучении дымов конденсационным методом сводятся к полу-
чению пересыщенного пара, что может быть достигнуто двумя
способами: охлаждением нагретого пара или образованием при
помощи химической реакции вещества, пересыщающего своими
парами пространство, т. е. вещества со значительно меиыпей
упругостью пара. Условия, при которых происходит образова-
ние и конденсация пересыщенного пара, существенно влияют
на степень дисперсности, устойчивость и другие свойства
полученного дымового облака.
а. Конденсация при охлаждении пара. Максимальная кон-
центрация и соответствующая ей упругость насыщенного пара
для каждого вещества прн определенной температуре имеют
вполне определенную вели-
чину. С понижением тем-
пературы упругость насы-
щенного пара и максималь-
ная концентрация умень-
шаются. Поэтому, если воз-
дух, насыщенный паром,
подвергать охлаждению, то
концентрация пара станет
больше максимальной; пар,
Рис 5. Молекулярные силы, удержи-
вающие молекулу на выпуклой, плоской
и вогнутой поверхностях
оказавшись в избытке, будет пересыщать пространство и
конденсироваться в капельки тумана.
Конденсация пересыщенного пара происходит на так назы-
ваемых центрах (ядрах или зародышах) конденсации. Центры
конденсации либо образуются в пересыщенном паре самопро-
извольно в виде агрегата молекул, либо представляют собой
частицы пыли, молекулы гигроскопических веществ или газо-
вые-ионы. Самопроизвольное образование центров конденсации
в. пересыщенном паре происходит в результате местных коле-
баний (флюктуаций) плотности пара. В силу этого в отдельных
точках возникают огромные пересыщения, во много раз превы-
шающие среднюю степень пересыщения системы® целом. Про-
исходящее в этих точках столкновение молекул и конденсация
пара приводят к образованию агрегатов из десятков и сотен мо-
лекул. Если размеры образовавшегося агрегата превышают не-
которую критическую величину, определяемую степенью пере-
сыщения системы н природой вещества, то вокруг него начи-
нается дальнейшая конденсация молекул пара и образуется
туман.
Наличие критической величины для центра конденсации
обусловливается тем, что упругость насыщенного пара изме-
няется с изменением кривизны поверхности. Упругость пара
над капелькой малых размеров несколько больше, чем иад
плоской поверхностью илн большой каплей. Физическая при-
/16
чина этого явления состоит в том, что силы, удерживающие
молекулу, находящуюся в поверхностном слое выпуклой по-
верхности (рис. 5), меньше, чем силы, удерживающие эту
молекулу, находящуюся в поверхностном слое плоской и во-
гнутой поверхности (заштрихована сфера действия молекуляр-
ных сил). Поэтому переход молекул из жидкого состояния в
парообразное происходит на выпуклой поверхности легче. Ко-
личество молекул, необходимое для насыщения прилегающих
слоев воздуха, больше, и соответственно больше концентрация
и упругость насыщенного пара.
Соотношение между упругостью насыщенного пара на плос-
кой н выпуклой (или вогнутой) поверхностях жидкости выра-
жается уравнением Томпсона:
р о 2а М
где ръ—упругость пара над сферической поверхностью.
D —упругость пара над плоской поверхностью;
а — поверхностное натяжение в дин/см;
М — молекулярный вес;
г — радиус капли (радиус кривизны поверхности) в см; -
о —плотность капли в г/см*\
R — газовая постоянная в эргах/градус;
Т — абсолютная температура в градусах Кельвина;
знак + относится к выпуклой поверхности, знак — к во-
гнутой поверхности.
Увеличение упругости пара сказывается тем сильнее, чем
меньше радиус кривизны. Для капелек размером 10"4 см оно
равно примерно 0,1%; для капелек размером 10-5 см—1% и
для капелек 10-6 см — 10%.
Подобное же возрастание упругости пара с уменьшением
размеров частицы, повндимому, наблюдается и у твердых
(кристаллических) частиц.
Если упругость пара, соответствующая по формуле Томп-
сона .размеру возникшего . агрегата молекул, превышает упру-
гость пересыщенного пара, то агрегат молекул не может слу-
жить центром конденсации и испарится. Конденсация будет
происходить только в том случае, если размер образовавшегося
агрегата будет достаточно велик и соответствующая ему упру-,
гость пара будет меньше упругости пересыщенного пара. Отно-
шение упругости пересыщенного пара к упругости насыщенного
пара называется степенью пересыщения и обозначает-
ся буквой S. В обозначениях уравнения Томпсона
5=^..
Р
Задаваясь определенным пересыщением, легко подсчитать необходимые
размеры центров конденсации и число находящихся в них молекул.
В частности, для паров воды при пересыщении S = 1,5 центры
конденсации должны состоять минимум из 100 молекул (Бекер и Деринг).
2 Зак. 31в4. Вейцер и Лучивский. 17
С увеличением степени пересыщения необходимые размеры центров кон-
денсации уменьшаются. Естественно, что, чем больше размеры центров:
конденсации, тем меньше вероятность их образования.
, Приближенно вероятность образования центров конденсации или число
их, ежесекундно возникающих в единице объема, J = 10” • е ХТ, где А — за-
трачиваемая работа, Т—абсолютная температура, К — константа Больц-
мана. Из термодинамических соображений работа, затрачиваемая на обра-
зование капельки, А = — цгс, где г — радиус капельки и с — поверх-
О
нбстное натяжение. Радиус капельки может быть вычислен по уравнению
Томпсона нз соответствующего пересыщения. Таким образом, задаваясь
определенным пересыщением, можно с той* или иной степенью точности
вычислить вероятность возникновения центров конденсации. Так, для во-
дяного пара соотношение между пересыщением S н вероятностью возиик-
иоеення центров конденсации J приводится в табл. 3.
Таблица 3
Соотношение между пересыщением и вероятностью возникновения
центров конденсации для водяного пара
S 1,01 1,1 2 3 4 5
1g J -480000 —475 —70 —12 +1 л-8
При небольших пересыщениях вероятность возникновения агрегата
молекул необходимых размеров очень мала н туман совершенно не обра-
зуется. С увеличением пересыщения возникновение центров конденсации и
образование тумана становятся все более вероятными. Наконец при опре-
деленном критическом пересыщении начинается самопроизвольное образо-
вание тумана. Величина критического пересыщения определяется природой
вещества, температурой н другими факторами. Для водяного пара она
колеблется, в зависимости от температуры, от 4 до 5.
Образование тумана на посторонних центрах конденсации (пыль и т.п.)
происходит при значительно меньшнх пересыщениях. Роль посторонних
центров конденсации опять-таки сводится к понижению упругости насы-
щенного пара на их поверхности. В частности на крупных частицах пыли
всегда имеются вогнутые поверхности большой кривизны. Как только на
такой поверхности вследствие сорбции образуется пленка из молекул
пара, на ней тотчас же начнется дальнейшая конденсация, так как
упругость пара над вогнутой поверхностью меньше, чем над плоской.
Понижению упругости пара при образовании водяного тумана способ-
ствуют и молекулы гигроскопических веществ. Так, например, молекулы
кислот н солей образуют с водяными парами капельки водных растворов,
обладающих меньшей упругостью пара сравнительно с капельками чистой
воды, в силу чего на таких частицах происходит конденсация, даже при
ничтожных пересыщениях.
Упругость насыщенного пара понижается в присутствии на поверхности
жидкости электрического заряда. Это пониженне особенно сильно для
частиц малых размеров. Поэтому, если образовавшийся агрегат молекул
обладает электрическим зарядом, то для конденсации на нем пара необхо-
димо пересыщение меньшей степени. Наличие в дисперсионной среде
большого количества заряженных частиц н ионов естественно приводит
к образованию большого числа центров конденсации. С другой стороны,,
увеличивается заряд каждого образовавшегося агрегата и конденс'цня
происходит на зародышах меньшнх размеров.
В процессе конденсации пара степень пересыщения уменьшается вслед-
ствие перехода части вещества в жидкое состояние. В определенный мо-
18
мент наступает равновесие между паром н капельками тумана. Образо-
вавшиеся тахим образом частицы называются первичными частицами. Од-
нако при оценке свойств полученного аэрозоля следует учитывать, что
конденсация пересыщенного пара всегда в той или иной мере сопрово-
ждается коагуляцией образовавшихся частиц. Оба эти процесса (конден-
сация н коагуляция) происходят в пересыщенном паре одновременно и оба!
определяют степень дисперсности и другие свойства возникшего аэрозоля.
Особенно интенсивно идет процесс коагуляции при больших пересыще-
ниях, когда очень велико число возникших частиц. При малых пересы-
щениях и в случае конденсации на посторонних ядрах, когда число пер-
вичных частиц мало, скорость коагуляции также невелика и рост частиц
идет только за счет непосредственной. конденсации.
Некоторое разделение процессов конденсации и коагуляции может быть
осуществлено быстрым н сильным разбавлением воздухом полученного
аэрозоля. Вследствие резкого уменьшения частичной концентрации коагуля-
ция замедляется и получается высокоднсперсный и сравнительно одно-
родный аэрозоль. Если такого разбавления не поизводить, то в резуль-
тате коагуляции получается грубоднсперсный неустойчивый аэрозоль с ча-
стицами разных .размеров.
Образование пересыщенного пара может быть произведено
путем охлаждения пара или по всему объему, или же
с поверхности при соприкосновении с холодными телами.
Если холодные тела будут твердыми или жидкими, то обра-
зующийся от соприкосновения с ними пересыщенный пар
тотчас же в значительной части сконденсируется на холодной
поверхности в виде росы или инея. Поэтому необходимый для
образования дыма пересыщенный пар нужно получать, охла-
ждая нагретый пар путем соприкосновения с холодными газами.
Объемное охлаждение пара достигается в процессе адиаба-
тического расширения. Адиабатическим расширением назы-
вается расширение, которое происходит без притока тепловой
энергии извне, что достигается внезапностью расширения или
изоляцией сосуда, в котором происходит расширение, предо-
храняющей от проникновения тепла. Пар, занимая первона-
чально определенный объем, при расширении до большего
объема, совершает работу за счет изменения внутренней
энергии. Таким образом, температура пара понизится пропор-
ционально величине произведенной работы расширения. Объем-
ное охлаждение пара в результате адиабатического расшире-
ния наблюдается в природе при подъеме больших "Воздушных
масс. Оно используется также прн исследовании процесса
конденсации.
Поверхностное охлаждение, как уже указано выше, про-
исходит при смешении нагретого пара с холодным воздухом
или другим газом. Эффективность образования дыма зависит
от скорости охлаждения пара, что в свою очередь зависит от
скорости взаимного перемешивания. Благодаря смешению пара
с холодным газом охлаждение и, следовательно, пересыщение
пара распространяются по большому объему. В отдельных
местах, при первоначальном соприкосновении нагретого пара
с холодным газом, возможны весьма значительные переохла-
ждения и вследствие этого непосредственное образование
центров конденсации.
2* 1'9
В атмосфере туман образуется при поверхностном охла-
ждении паров, когда теплый, влажный воздух смешивается
с холодным. В практике маскирующего дымообразования
поверхностное охлаждение паров, нужное для получения
дымов и туманов, достигается при возгонке. Возгонка пред-
ставляет собой испарение вещества, последующее введение
его теплых паров в холодный воздух и конденсацию в послед-
нем. Возгонка может осуществляться следующими способами:
1. Нагреванием вещества в -открытом сосуде до кипения
или выливанием его на раскаленное тело. При этом сильно
нагретые пары вещества, соприкасаясь с холодным воздухом,
конденсируются в туман или дым.
2. В том случае, когда температура кипения вещества очень
высока, дым* или туман получают пропусканием струи воздуха
через нагретые .жидкости. Воздух при этом нагревается и
насыщается парами вещества. Когда воздух выходит из
горячей зоны, пары увлеченного им вещества конденсируются
и образуют дым. Происходящее при этом способе быстрое
разбавление конденсирующегося пара. дает возможность
получить высокодибперсные дымы. Метод продувания позво-
ляет без потерь переводить в состояние дыма горючие веще-
ства; в этом случае вещество нагревается изолированно от
воздуха и через него пропускается струя индиферентного газа.
3. Твердые вещества удобно возгонять горючей смесью.
Вещество измельчается в порошок и смешивается с горючей
смесью. При горении последней развивается тепло, благодаря
которому вещество испаряется, и пары, соприкасаясь с возду-
хом, дают дым.
Для получения дымов и туманов при помощи возгонки
могут применятьс| только вещества, химически устойчивые
при высоких температурах. Вещества эти должны быть также
малолетучи; их температура кипения должна заключаться
в пределе 150—500°. Если температура кипения ниже этого
предела, то пересыщения не наступает даже при больших
концентрациях пара; если же выше, то испарить достаточное
для образования дыма количество вещества затруднительно.
б. Конденсация в результате химической реакции. Конден-
сация вещества, которая происходит при некоторых химиче-
ских реакциях в газовой среде, является, подобно конденсации
при охлаждении, непосредственным следствием предваритель-
ного пересыщения воздуха парами продукта. Очевидно, что
образующийся в результате реакции продукт пересыщает про-
странство в том случае, если он получается в концентрации,
превышающей максимальную концентрацию, соответствующую
упругости насыщенного пара. Значительные пересыщения
возможны, если упругость пара конденсирующегося вещества
ниже упругости пара исходных компонентов.
Таким образом, процесс собственно образования дымовых
частиц здесь тот же, что и при охлаждении — конденса-
ция пересыщенного пара. Роль же самой химической
реакции сводится к осуществлению первой стадии процесса —
образовайию пересыщенного пара.
Образование пересыщенного пара при химической реакции
может происходить или при химическом взаимодействии двух
компонентов или в результате разложения одного вещества.
К реакциям первого типа относится образование дыма хлори-
стого аммония из аммиака и хлористого водорода или тумана
серной кислоты из паров серного ангидрида и воды. Ко вто-
рому типу относится фотохимическое разложение диэтил-
ртути и т. п.
Свойства дыма, получающегося при уимим.гу.й компенса-
ции, зависят от скорости химической реакции, приводящей
к образованию центров конденсации, от скорости ИХ роста
вследствие диффузии пара и от скорости коагуляции?
Концентрация и степень дисперсности образующегося дыма
или тумана зависят от концентрации реагирующих газов. Так,
чем больше разбавлены реагирующие газы воздухом, тем дым
получается более высокодисперсным, так как в разбавленных
системах коагуляция происходит медленнее и дальнейшая
конденсация на образовавшихся зародышах мало вероятна.
Характер образующегося дыма зависит и от того, с какой полно-
той и тщательностью исходные компоненты могут быть
перемешаны перед наступлением реакции. Так, например,
совершенно сухие сероводород и сернистый газ могут быть
в темноте хорошо перемешаны, причем реакция между ними
не наступает;; только при освещении смешанные газы реаги-
руют между собой, образуя дым серы:
2H2S SO3 = 2Н2О 4- 3S.
В этом случае, когда конденсация происходит по всему
объему, образуется сравнительно изодисперсный дым. Подоб-
ный изодисперсный дым образуется и при разложении пен-
такарбонила железа и других фотохимических реакциях. В тех
случаях, когда исходные газы реагируют сразу при соприко-
сновении друг с другом, образуются местные пересыщения,
в зонах которых идет конденсация. При дальнейшем смешении
образуются новые дымовые частицы. Одновременно с этим
происходит рост старых частиц как за счет продолжающейся
конденсации пара, так и вследствие коагуляции. В итоге дым
получается полидисперсный.
Примером (реакции между двумя газами, идущей на поверх-
ности их соприкосновения с образованием дыма, может слу-
жить реакция между ч аммиаком и хлористым водородом:
NH34- HC1 = NH4C1.
В результате реакции образуется белый дым хлористого
аммония. Аммиак подобным же образом реагирует с парами
других кислот, образуя дымы соответствующих солей. Анало-
гично аммиаку ведут себя пары органических аминов.
21
В практике маскирующего дымообразоваиня химические
реакции в газовой среде широко используются для получения
дымов и туманов. При этом чаще всего в качестве одного из
реагирующих газов используются составные части атмосферы:
пары 'воды или кислород. Существует много веществ!, пары ко-
торых способны реагировать с парами воды, подвергаясь при
этом гидратации или гидролизу. Если продукты этих реакций
обладают малой упругостью пара, то при образовании их в
воздухе они его пересыщают своими парами, в результате чего
происходит их конденсация в частицы тумана или дыма. То
же относится к веществам, способным реагировать в газовой
фазе с кислородом.
3. Комбинированные методы
При получении дымов и туманов часто возможно одновре-
менное использование процессов диспергирования и конденса-
ции. В одних случаях мы встречаемся с механической комби-
нацией этих двух принципов образования дымов: часть
дымовых частиц образуется путем диспергирования, другая
часть — путем ‘конденсации. В других же случаях .образование
-каждой дымовой частицы является результатом идущих
навстречу один другому процессов диспергирования и конден-
сации.
а. Распыление растворов. Примером совмещения процессов
диспергирования и' конденсации, идущих навстречу один дру-
гому при образовании каждой частицы, является способ
получения дымов и туманов распылением растворов нелетучих'
веществ в летучих растворителях. При этом распылении сна-
чала получаются (дисперсионный процесс) капельки растворов;
при их испарении растворенное вещество конденсируется,
образуя коллоидную частицу, которая, освобождаясь от остат-
ков растворителя, становится частицей дыма.
При этом способе необязательно получать - сразу капли
.аэрозольных размеров. Полученные путем диспергирования
крупные капли вследствие испарения летучего растворителя
превращаются в небольшие капельки или частички растворен-
ного вещества, дающие в большинстве случаев вполне
устойчивый дым. Распыляя! растворы с малыми концентрациями,
можно добиться образования высокодисперсных дымов.
При распылении, растворов можно ограничиться применением
небольших давлений. Другим преимуществом этого метода
является возможность получать дымы различной степени
дисперсности. Это достигается изменением температуры, да-
вления и, главным образом, концентрации раствора. Недостат-
ком этого метода является образование некоторого количества
больших капель, которые, не успев в достаточной мере испа-
риться, оседают вблизи распылителя и для создания дыма не
используются.
В природе таким путем получаются при испарении морских
брызг аэрозоли, дисперсной фазой которых является морская
22
соль. Во время войны 1914—1918 гг. этот метод использовался
для получения дыма дифенилхлорарсина. Дифенилхлорарсин
растворялся в фосгене (немецкие снаряды «зеленый крест 2»)
и этот раствор распылялся при взрыве снаряда. Из получив-
шихся капель фосген быстро испарялся, а дифенилхлорарсин
образовывал тонкий дым.
б. Взрыв. Примером механической комбинации дисперсион-
ного и конденсационного процессов является образование
дымов и туманов при помощи взрыва.
При взрыве часть вещества, предназначенного для превра-
щения в дым, мелко раздробляется и распределяется в окру-
жающей атмосфере. При помощи взрыва производится наиболее
совершенное диспергирование вещества. В этом процессе
происходит мгновенное и сравнительно равномерное распреде-
ление колоссального количества энергии. Сила взрыва разбра-
сывает частицы в разные стороны и Препятствует их соедине-
нию. При взрыве твердое или жидкое вещество подвергается
действию удара газовой волны чрезвычайно большой скорости.
В результате этого твердое или жидкое вещество быстро
рассеивается во все стороны, образуя частицы дыма или
тумана. Однако наряду с мельчайшими частицами при взрыве
образуется также некоторое количество сравнительно крупных
частиц.
Другая часть вещества, предназначенного для превращения
в дым, быстро испаряется в результате действия теплоты взрыва,
выделяющейся в большом количестве. Образовавшиеся пары
тотчас смешиваются с атмосферным воздухом и в результате
охлаждения пересыщают занятое ими пространство. Далее
происходит конденсация пересыщенных паров с образованием
дыма, причем частицы, полученные путем диспергирования, слу-
жат Центрами конденсации.
ГЛАВА III
ФИЗИКОХИМИЧЕСКИЕ ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ
л В ДЫМАХ И ТУМАНАХ
Во всех дымовых облаках непрерывно происходят процессы,
изменяющие их основные характеристики и в конце-концов
приводящие к разрушению облаков и, таким образом, к уничто-
жению их маскирующего действия. Важнейшими из таких про-
цессов, обусловленных внутренними свойствами дымового обла-
ка, являются: 1) испарение частиц и превращение дымового облака
в газовую смесь, 2) оседание дымовых частиц под действием
силы тяжести, 3) коагуляция или укрупнение дымовых частиц.
1. Испарение дымовых частиц
а. Фазовое равновесие между частицами и средой. Вещество,
из которого состоят частицы дыма и капельки тумана, час-
тично всегда находится в парообразном состоянии в диспер-
сионной среде: Концентрация и соответствующая ей упругость
23
паров для каждой температуры имеют вполне определенную
величину, поскольку дымовые частицы находятся в равнове-
сии с дисперсионной средой. Если температура изменяется, те>
это ведет к нарушению равновесия и либо к испарению частиц,
либо к конденсации пара.
В маскирующих дымовых облаках, частицы которых со-
стоят из водных растворов кислот и солей, равновесное состоя-
ние определяется парциальной упругостью водяного пара над
этим раствором и содержанием водяных паров в атмосфере.
Частицы подобного дымового облака состоят из растворов кис-
лот и солей такой концентрации, при которой упругость водя-
ного пара над ними равна упругости водяных паров в атмосфере.
' При увеличении объема дымового облака, которое наблю-
дается в полевых условиях по мере удаления от места дымо-
пуска, равновесие между частицами дыма и дисперсионной
средой нарушается; возрастает количество пара, необходимое
для заполнения) дисперсионной среды, дымовые частицы испа-
ряются и дымовое облако постепенно превращается в однород-
ную газовую смесь.
Иначе влияет увеличение объема облака, состоящего; из
частиц водных растворов кисдот и солей, на их равновесие
с дисперсионной средой. Концентрацию водяного пара в атмо-
сфере, окружающей частицы тумана, практически можно счи-
тать постоянной. Концентрация водяного пара внутри дымового
облака даже несколько меньше по сравнению с чистой атмо-
сферой, так как полученный туман поглощает некоторое коли-
чество влаги. Поэтому при увеличении объема дымового облака
никакого испарения не происходит. Скорее, наоборот, частицы
тумана, попав в атмосферу, содержащую большее количество
водяных паров, начинают конденсировать влагу. Этот процесс
будет происходить до тех пор, пока упругость водяного пара
над частицами, состоящими из более разбавленного раствора,
не станет опять соответствовать относительно влажности
воздуха.
Как указывалось в главе II, упругость пара зависит от кри-
визны поверхности и будет тем „больше, чем меньше радиус
капельки.
Величина упругости пара зависит также от электрического
заряда. Электрический заряд, находящийся на поверхности
жидкости, уменьшает поверхностное натяжение и понижает
упругость пара.
Чем больше электрический заряд и чем .меньше радиус
• капель, тем сильнее понижается упругость пара. Влияние элек-
трического заряда на упругость насыщенного пара существенно
проявляется только для аэрозольных частиц весьма малых
размеров, порядка 10~7—10“в см. При значительных плотно-
стях электрического заряда понижение Упругости пара наблю-
дается и у частиц ббльших размеров.
б. Изотермическая дестилляция. Некоторое, хотя и неболь-
шое изменение упругости пара, связанное с различной кривиз-
24
। иой капелек, приводит к тому, что в полидисперсном' аэрозоль-
I ном облаке не все частицы находятся в равновесии с диспер-
t. сионной средой. Упругость и концентрация пара иад каплями
К меньших размеров оказываются больше, чем концентрация
I пара в дисперсионной среде, соответствующая упругости пара
|- над средними и большими частицами. Число молекул, испарив-
г шихся с поверхности маленьких частиц, оказывается больше,
| чем число сконденсировавшихся, и такие частицы начнут испа-
I? ряться, еще уменьшаясь в своих размерах. С другой стороны,
Н упругость пара над большими частицами остается всегда по-
I стоянной величиной, равной среднему давлению пара дисперсной
й фазы, а скорость конденсации превышает скорость испарения;
и поэтому большие частицы будут еще увеличиваться в своем
Н размере за счет пара дисперсионной среды. Это уменьшение
I маленьких частиц, приводящее к их исчезновению, и рост боль*
4 ших, происходящие в полидисперсном аэрозольном облаке,
J вследствие разной упругости пара, носят название изотер-
мической дестилляции.
Процесс изотермической дестилляции в маскирующих ту-
манах, состоящих из водных растворов солей и кислот, задер-
живается тем, что по мере испа-
рения капелек содержание в них
растворенного вещества повы-
шается -и соответственно пони-
жается парциальная упругость
водяного пара.
в. Кинетика испарения капель.
Испарение капель в спокойной
атмосфере происходит равномер-
но со всех сторон капли. Ско-
рость испарения капель больше,
чем' скорость испарения с плос-
кой поверхности. Объясняется
Рис. 6. Испарение с плоской и
выпуклой поверхности
это явление следующим образом. Согласно представлению
Стефана процесс испарения складывается из двух элементар-
ных процессов: 1) отрыва молекул от твердой или жидкой по-
верхности и образования слоя' насыщенного пара; 2) диффузии
молекул из насыщенного слоя в чистый воздух. На достаточ-
ной по своей величине плоской поверхности размер всех слоев
воздуха, через которые диффундирует пар, одинаков (рис. 6, а).
На выпуклой поверхности, по мере удаления от жидкости,
площадь слоя воздуха, через который идет диффузия, увеличи-
вается (рис. 6, б). В силу этого диффундирующий пар распре-
деляется в большем объеме, увеличивается разница концен-
траций между слоями и вещество испаряется быстрее. Чем
больше кривизна поверхности и чем меньше размеры капель,
тем резче сказывается увеличение объема и тем быстрее про-
исходит испарение.
Максвелл, исходя из представлений Стефана о том, что на
иоверхности капли имеется 'слой насыщенного пара, получил
25
•следующее уравнение для скорости испарения капли в спокой-
ной атмосфере:
D ,
v = ~(co~c),
где v — скорость испарения в г/сек с единицы поверх-
ности к а п л и;-
D — коэфициент диффузий в см2/сек;
г — радиус капли в см;
с0 — концентрация «насыщенного пара вещества в г/см*;
с — концентрация пара в окружающей среде в г/см?;
*'• — с — дефицит пара.
Очевидно, что скорость испарения с поверхности
всей капли нравна произведению v на поверхность капли
в квадратных сантиметрах 4-г2.
Тогда:
w = 4r£)/-(c0—с).
Из уравнения Максвелла воемя полного испарения капли Т
прямо пропорционально квадрату начального радиуса и обратно
-пропорционально дефициту пара:
т_
2D (с0—с)'
Для маскирующих дымов, дисперсная фаза которых состоит
из водных растворов кислот и солей, дефицит пара предста-
вляет собой разницу между концентрацией насыщенного пара
•иад раствором определенного состава и абсолютной влаж-
ностью воздуха.
Для маленьких капель, размер которых соизмерим со сред-
ним свободным пробегом газовых молекул, перестает соблю-
даться основное положение Стефаиа и упругость пара над по-
верхностью жидкости оказывается меньше упругости насыщен-
ного пара. Это происходит потому, что скорость диффузии мо-
лекул пара из слоя, непосредственно прилегающего к поверх-
ности жидкости, соизмерима, в случае маленьких капель, со
скоростью отрыва молекул от жидкой фазы и на поверхности
жидкости не успевает образовываться слой насыщенного пара.
Скорость испарения подобных капелек меньше вычисленной
но уравнению Максвелла и равна
® = 4к/>г (с0—с)---Цт—
1+з7
где 1— средний свободный пробег газовых молекул.
Для капель еще более мелких размеров (10-5 см и меньше)
следует учитывать, кроме того, непосредственное увеличение
упругости насыщенного пара (по уравнению Томпсона).
В динамических условиях (во. время падения капелек в воз-
духе или при обдувании их ветром) испарение происходит
36
I
<; неравномерно с различных точек поверхности капли. Наиболее
I*. _ -сильное испарение наблюдается в лобовом слое и в слоях,
диаметрально противоположных лобовому. Это тфоисходит по-
fSB тому, что движущийся воздух уносит с собой пары испаряюще-
^Икгося вещества и диффузия из насыщенного слоя идет в про-
^^странство, ие содержащее паров испаряющегося вещества.
Скорость испарения в движущемся воздухе больше, чем в
ЯИ неподвижном. По сравнению с неподвижным воздухом скорость
испарения в динамических условиях согласно Фресслиигу уве-
Щ личивается на величину 1 4- К V Re; характеризующую влияние
Л ветра, и становится равной
w = 4*Dr (с0—с) (1 4- К V Re),
г. Гч » 2ргг>
.где Re — число Рейнольдса, равное ;
3/~ —
К — коэфициент, равный 0,276 1/
г
v — скорость ветра в см./еек;
:* о) —вязкость воздуха, равная 0,0001882 пуаз;
р —плотность воздуха,, равная 0,00126 г/см3,
-а остальные обозначения те же, что и в уравнении Максвелла.
Чем больше размер капель и скорость ветра, тем резче
-сказывается поправка Фресслинга. У дымовых частиц, движе-
ние которых в воздухе происходит с небольшой скоростью,
поправка мала и может не приниматься во внимание.
Сорбция аэрозольными частицами различных примесей, на-
ходящихся в воздухе, может привести к значительному пони-
жению упругости насыщенного пара и к уменьшению скорости
испарения. Это происходит в том случае, когда сорбированное
вещество равномерно' распределяется в капельке тумана. В том
случае, когда вокруг частицы образуется сорбированная по-
верхностная пленка, пары вещества должны продиффундиро-
вать через нее. Поэтому концентрация пара на поверхности
капли будет меньше концентрации насыщенного пара и ско-
рость испарения несколько замедлится. Так, например, заме-
чено уменьшение скорости испарения водяной капельки при
нанесении на ее поверхность пленки олеиновой кислоты. По-
добное влияние поверхностных пленок иа скорость испарения
сказывается тем сильнее, чем меньше размеры капель.
Интересно влияние газовой пленки на скорость испарения.
Так, скорости испарения водяных капель в водороде, углеки-
слоте и воздухе резко отличаются друг от друга. В плохо сор-
бируемом водороде, не образующем около водяной капельки
тазообразной пленки, испарение происходит крайне быстро, а
в хорошо сорбируемой водой углекислоте, наоборот, медленно.
2. Движение дымовых частиц
Движение дымовых частиц в дымовом облаке происходит
под действием силы тяжести и в результате неравномерных
ударов молекул газа о частички дыма.
27
а. Броуновское движение. Движение дымовых частиц, при-
чиной которого являются неравномерные удары молекул газа,,
называется броуновским движением. Броуновское
движение происходит тем сильнее, чем меньше размерьГ дымо-
вых частиц и чем они ближе по размерам к самим молекулам.
Заметное броуновское движение наблюдается у частиц меньше
3- 10~5 см. Частицы больше 1 • КГ"1 см не принимают участия
в броуновском движении.
Интенсивность броуновского движения возрастает с повы-
шением температуры, когда движение молекул газа происходит
более быстро. В разреженных газах и в газах с пониженной
вязкостью и плотностью броуновское движение протекает также
с повышенной интенсивностью. ,
Скорость броуновского движения характеризуется средним
смещением частиц. Средним смещением называется
расстояние по прямой линии, проходимое частицей за опреде-
ленное время. Среднее смещение не равно истинному пути,
проходимому частицей за то же время. Этот путь может быть
весьма сложен и извилист. Для частиц величиной в десятые-
доли микрона среднее смещение за 1 сек. равно 2—7 микронам.
Величина среднего смещения прямо пропорциональна квадрат-
ному корню из времени, для которого это смещение опреде-
ляется.
б. Движение дымовых частиц под действием силы тяжести.
Дымовые частицы- непрерывно оседают под действием силы
тяжести. Если бы частицы двигались в пустоте, то это оседа-
ние происходило бы с переменной, все возрастающей скоростью.
Иначе идет процесс оседания в среде газа. Вообще, когда тело
оседает в среде сопротивляющейся, то вначале движение носиг
ускоренный характер, но так как увеличение скорости движе-
ния сопровождается увеличением сопротивления среды, то на-
ступает момент, когда тело начинает падать с достоянной ско-
ростью.
Для маленьких частиц ускорение падает до нуля в, течение
небольшой доли секунды и поэтому практически оседание ды-
мовых частиц идет с постоянной скоростью.
Скорость оседания дымовых частиц возрастает с увеличе-
нием их размеров. Однако увеличение скорости не соответ-
ствует росту частиц и происходит несколько медленнее. Это
вызвано тем, что воздух оказывает крупным падающим части-
цам гораздо более сильное сопротивление, чем мелким.
Сопротивление воздуха крупным падающим частицам об-
условливается инерцией (падающие частицы как бы расталки-
вают молекулы воздуха) и трением движущейся частицы о
молекулы воздуха. Для этих частиц, если они представляют
собой шарики, скорость осеДания пропорциональна корню квад-
ратному из радиуса частиц.
Сопротивление воздуха частицами дымов, и туманов, размер
•которых находится в пределах 10-г—10~4 см, обусловливается
только трением.
28
Скорость оседания этих частиц пропорциональна квадрату
радиуса и выражается известным уравнением Стокса:
де v — скорость движения под действием силы тяжести
в см/сек;
р — плотность частиц в г/см*;
g — ускорение силы тяжести в см/сек2;
т; — вязкость воздуха в пуазах; •
г —радиус частиц в см.
Для частиц, меньших чем 10~4 см, размер которых соизме-
рим со средним свободным пробегом газовых молекул, воздух
нельзя рассматривать как непрерывную среду. Эти частицы
при оседании не всегда встречают на своем пути молекулы
воздуха;, в некоторые моменты оседание идет в пустоте. Сле-
довательно, сопротивление воздуха движущимся частицам бу-
дет меньше, чем это должно было быть при полном учете
трения.
С введением поправки, учитывающей проскок частиц между
молекулами воздуха, скорость оседания выражается уравне-
нием Миллекена, Кнудсена и Вебера:
^=-Д-р^2[1+т-(л+^ '>]’
де 1 — средний свободный пробег газовых молекул, равный
1 • КУ-5 см;
I, В, С — константы, равные соответственно 0,864; 0,290 и 1,25.
е — основание натуральных логарифмов.
Остальные обозначения те же, что и в предыдущей
формуле.
Все частицы, форма которых отличается от шарообразной
палочки, стерженьки и т. п.), испытывают при падении боль-
нее сопротивление и падают с меньшей скоростью, чем сфе-
>ические капельки.
С меньшей скоростью оседают и агрегаты дымовых частиц,
по обусловливается, кроме того, рыхлой структурой агрегата
i малой его плотностью.
Так как скорость оседания аэрозольных частиц неодина-
кова, то в полидисперсиом дымовом облаке прежде всего осе-
дают наиболее крупные частицы, в результате чего резко умень-
шается весовая концентрация. В высокодисперсном дымовом
облаке скорость оседания не велика. Кроме того, мелкие ча-.
стицы подвержены интенсивному броуновскому движению, пре-
пятствующему оседанию и придающему ему зигзагообразный
путь.
Поэтому концентрация высокодисперсных разбавленных
аэрозолей практически остается постоянной и только в резуль-
2в
тате последующего укрупнения частиц начинается более интен-
сивное оседание.
Сравнительные данные по скорости оседания и броуновского
движения частиц водяного тумана в зависимости от их раз-
мера приведены в табл. 4.
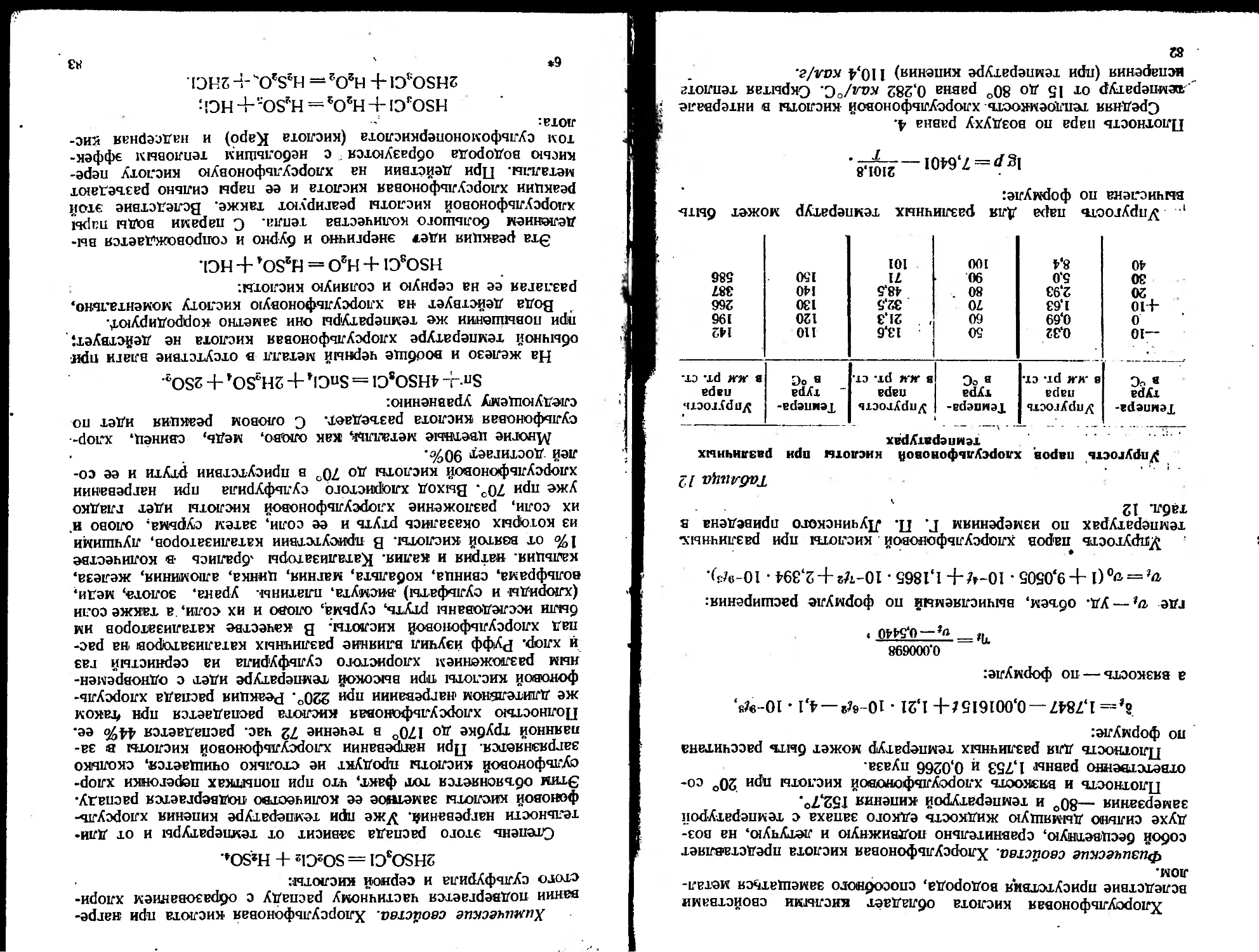
Таблица 4
Скорость оседания и броуновского движения
частиц водяного тумана
Радиус частиц Скорость осе- Среднее смете-
в ем Дания в см/сек ние в см/сек
5-10-* 3,0-10-» 22 10-8
1•10-* 1,3-10-2 5,0 • 10-«
5-10-6 3,5 • 10-» 7,4-10-*
1-10-6 2,3 • 10-* 2,1 -10-»
5-10-6 8,4-Ю-з 3,6-Ю-з
3. Коагуляция
Всякое увеличение размеров частиц способствует быстрей-
шему их оседанию под действием силы тяжести. Одной из
причин увеличения размеров частиц является изотермическая
дестилляции. Но в основном увеличение размеров частиц про-
исходит вследствие коагуляции. Под коагуляцией пони-
мается сцепление и слияние дымовых частиц, происходящее
при их столкновении. При изучении процесса коагуляции не-
обходимо различать: 1) п р и ч и м ы, приводящие к столкновению
дымовых частиц, 2) свойства дымовых частиц, позволяю-
щие им соприкоснуться или приблизиться на расстояние, доста-
точное для проявления сил сцепления, и 3) эффектив-
ность столкновения или, иными словами, процент частиц,
сцепившихся в результате столкновения. Сочетание всех трех
условий приводит к той или иной кинетике коагуляции.
В высокодисперсных дымах и туманах причиной йоагуляции
является броуновское движение дымовых частиц. В резуль-
тате броуновского движения аэрозольные частицы сталкиваются
друг с другом и образуют при этом агрегатики дыма или ка-
пельки тумана. Чем интенсивнее броуновское движение, чем
скорее движутся дымовые частицы и чем больше их (т. е. чем
больше частичная концентрация), тем быстрее происходит ко-
агуляция.
Коагуляция дымов и туманов облегчается тем, что
в дымовом облаке отсутствуют силы, препятствующие дымовым
частицам приблизиться друг к другу. Вследствие небольшого
количества ионов, находящихся в воздухе, в дымовом облаке
не проявляют себя силы отталкивания частиц друг от друга.
Поэтому аэрозольные частицы беспрепятственно приближаются
друг к другу на расстояние, достаточное для проявления моле-
кулярных сил сцепления.
30
л
Каждое столкновение дымовых частиц, невидимому, приво-
дит к их сцеплению или слиянию. Об этом говорят микроско-
пические наблюдения Фукса над столкновением аэрозольных
частиц (табачного тумана, дыма окиси магния и хлористого
аммония) с твердой и жидкой поверхностью (стекло, металл,
пленка глицерина). Независимо от характера поверхности,
агрегатного состояния и свойств дисперсной фазы всякий удар
аэрозольных частиц о твердую поверхность приводил к их
осаждению. Также было установлено, что действие молекуляр-
ных сил притяжения сказывается уже на расстоянии одного
микрона.
По другим предположениям не всякое столкновение аэро-
зольных частиц приводит к их сцеплению или слиянию. Допу-
скается, что столкнувшиеся частицы частично сцепляются, а
' частично отходят затем одна' от другой на расстояние, соизме-
римое со средним свободным пробегом газовых молекул. За-
тем частицы под действием молекулярных сил притяжения
сталкиваются вторично, опять расходятся и т. п. Чем меньше
отношение среднего свободного пробега газовых молекул
к радиусу частиц, тем больше число этих один за другим сле-
дующих столкновений, приводящих в конечном итоге к сцепле-
нию частиц.
При столкновении капелек тумана слияние двух соприкос-
нувшихся частиц облегчается тем, что при этом происходит
уменьшение поверхности и свободной поверхностной энергии.
Соударение твердых дымовых частиц приводит не к слия-
нию, а к образованию агрегатов частиц. Отдельные частицы
в этих агрегатах удерживаются одна около другой силами
молекулярного сцепления. Силой, разрывающей агрегат, яв-
ляется центробежная сила, возникающая при вращательном'
броуновском движении. Разрыв агрегата возможен в том слу-
чае, когда центробежная сила превысит молекулярные силы
сцепления. Так как центробежная сила возрастает с уменьше-
нием радиуса частиц, то вероятность разрыва для малых ча-
стиц больше, чем для крупных. Для частиц с радиусом, боль-
шим 10-8 см, центробежная сила всегда меньше сил молеку-
лярного сцепления, и эти частицы образуют при столкновении
устойчивые агрегаты.
Коагуляция происходит наиболее быстро в первое время
после образования дыма, когда в единице объема заключено
большое число интенсивно двигающихся и часто сталкиваю-
щихся частиц. По мере укрупнения частиц они начинают бы-
стрее оседать под действием силы тяжести, и их броуновское
движение все больше и больше замедляется. Число частиц
в единице объема уменьшается, а среднее расстояние между
ними увеличивается, столкновения становятся все более ред-
кими, процесс коагуляции замедляется. Соответственно с этим
скорость коагуляции выражается уравнением:
dn
~dt
Кп\
3k
dn
где м — скорость коагуляции;
г; — число аэрозольных частиц в единице объема
(частичная концентрация) в момент коагуляции;
К — коэфициент (константа) скорости коагуляции.
Из уравнения для скорости коагуляции легко получить пу-
тем простого интегрирования количество частиц nt , остаю-
щихся в единице объема дымового облака, с начальным чис-
лом частиц п0 через определенный промежуток времени
течение которого число частиц в дымовом облаке
наполовину:
и время Т, в
уменьшается
1
ппК'
в уравнение скорости коагуляции коэфициент К
Входящий
зависит в свою очередь от скорости броуновского движения,
размера аэрозольных частиц, степени однородности размеров,
величины сферы действия молекулярных сил сцепления и дру-
гих причин.
Экспериментальное значение коэфициента скорости коагуля-
ции некоторых дымов и туманов приведено в табл. 5.
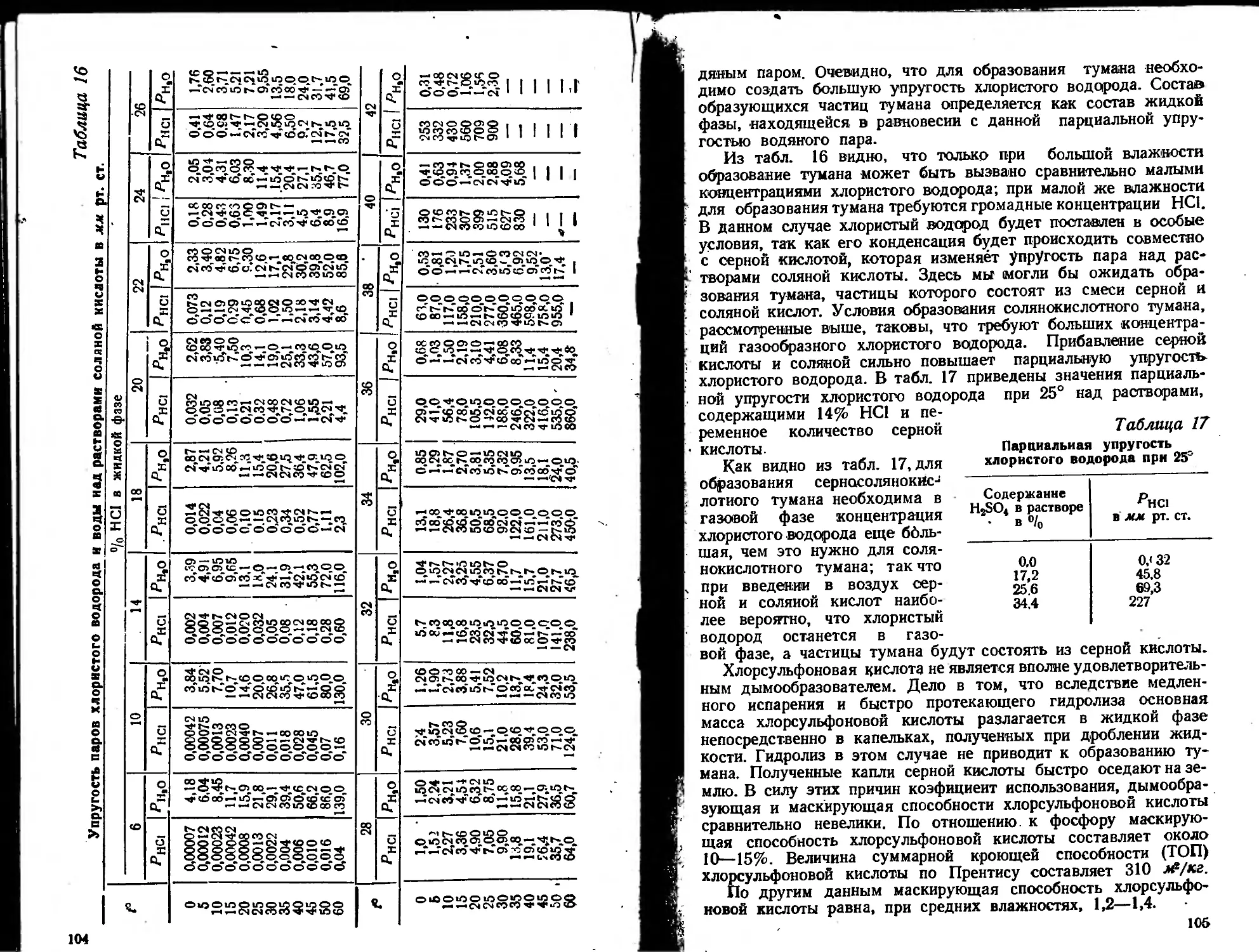
Таблица 5
Коэфициент скорости коагуляции некоторых дымов и туманов
Характеристика аэрозоля -
Наименование вещества дисперсной фазы Вес. концен- трация в мг/м9 К в см9!мин
Стеариновая кислота 13,5 0,310-10-’
Хлористый аммоний 20,0 0,37—0,43*10-’
Окись кадмия 50.0 0,51-0,53-10-’
Окись железа 16,5 0,40—0,41 • 10-’
Диметиламиноазобензол 10,0 0,333- ю-’
Аминоазобензол 10,0 4,5 -10-’
Коэфициенты скорости коагуляции дымов и туманов в боль-
шинстве случаев близки между собой. Несколько выше коэфи-
циент скорости коагуляции палочкообразных частиц (например
окиси кадмия), у которых сфера действия молекулярных сил
сцепления больше, чем у шарообразных частиц.
Казалось бы, что при наличии в дыме одинакового количе-
ства положительно и отрицательно заряженных частиц коагу-
ляция аэрозолей должна ускоряться вследствие притяжения
частиц между собой. Однако при экспериментальном исследо-
32
вании заряженного дыма не удалось обнаружить разницы ме-
жду ходом его коагуляции и коагуляции незаряженного дыма.
Достаточно сильный заряд одного, знака должен сильно за-
медлить коагуляцию аэрозолей. Но подобные дымовые облака
оказались в лабораторных условиях неустойчивыми и оседа-
ли на стенках камеры вследствие электростатического рас-
сеяния.
Более резкое влияние электрического заряда оказывается
в пироэлектрических веществах, частицы которых предста-
вляют собой заряженные диполи. Заряд на концах диполей на-
столько велик, что сфера взаимного влияния частиц значи-
тельно расширяется. Частицы соединяются между собой про-
тивоположно заряженными концами в длинные цепочки. Ско-
рость коагуляции пироэлектрических веществ, как, например,
.аминоазобензола, во много раз больше скорости коагуляции
обычных дымов.
Другой весьма важной причиной коагуляции дымов в воз-
духе является турбулентное перемешивание. Турбулент-
ным перемешиванием называется беспорядочное пере-
движение больших и малых объемов воздуха в силу трения
движущегося воздуха о земную поверхность и происходящих
в атмосфере тепловых процессов. Более подробные сведения
о турбулентном перемешивании будут даны в гл. X. Вслед-
ствие турбулентного перемешивания происходит столкновение,
дымовых частиц на внешней поверхности движущихся струек
воздуха.
Скорость турбулентной коагуляции, а также частичная кон-
центрация и время половинной коагуляции выражаются обыч-
ными уравнениями.
Коэфициент коагуляции равен по Виганду:
о
где /С — коэфициент коагуляции в см3/сек;
г — радиус частиц в см;
v — скорость ветра в м/сек.
Коэфициент и скорость коагуляции пропорциональны кубу
радиуса частицы; более грубые частицы коагулируют быстрее.
Т1о предположению Виганда коагуляция вследствие турбулент-
ного перемешивания в атмосфере является главной причиной
слияния капелек облаков и образования дождя.
ГЛАВА IV
МАСКИРУЮЩИЕ СВОЙСТВА ДЫМОВ
Главная и основная задача применения дымообразующих
веществ заключается в создании условий, ухудшающих ясность
и отчетливость наблюдения. Ясность и отчетливость зрения
обусловлены определенным контрастом яркости и цвета между
3 Зак. 8184. Вейцер и Лучжнский. ^3
рассматриваемым предметом и окружающей его местностью.
Если между наблюдателем и предметом находится дымовое
облако, то вследствие оптической неоднородности дымов и
протекающих на границе дымовых частиц и воздуха оптиче-
ских явлений происходит уменьшение контраста и отчетли-
вость зрения ухудшается.
Основные оптические явления, происходящие в дымах и.
туманах, сводятся к рассеянию и поглощению света внутри
дымового облака и на границе дымового облака с чисты»
воздухом.
1. Рассеяние и поглощение света
а. Рассеяние света. Рассеянием света называется отклоне-
ние дымовыми частицами в разные стороны лучей света, про-
ходящих через дымовое облако. Причиной рассеяния света
является оптическая неоднородность дымового облака, т. е.
различия в оптических свойствах самих дымовых частиц и
окружающего их воздуха. Важнейшим из этих свойств является
коэфициент преломления света. Коэфициент пре-
ломления показывает, насколько уменьшилась скорость рас-
пространения света в каком-либо веществе. Переходя ' аз-
одной среды ® другую, свет вследствие изменения скорости
распространения изменяет направление своего движения. Чем
больше разница между коэфициентом преломления воздуха
и находящихся в ием дымовых частиц, тем резче изме-
няется направление и сильнее происходит рассеяние лучистой
энергии.
Если коэфициент преломления •дисперсионной среды и
частиц дисперсной фазы одинаков, то лучи света проходят
через такую систему, не изменяя своего направления и не
рассеиваясь. Подобную роль коэфициента преломления легко
показать следующим простым опытом. Если приготовить сус-
пензию из толченого стекла в смеси бензола с сероуглеродом,,
то вследствие разницы между коэфициентом преломления
стекла и смеси бензола с сероуглеродом эта суспензия выгля-
дит мутной и рассеивает свет. Изменяя состав дисперсионной
среды путем добавления одного из компонентов, можно
добиться равенства в коэфициентах преломления и получить
совершенно прозрачный, нёрассеивающий свет раствор.
Оптическая неоднородность дымов и туманов служит при-
чиной физических явлений, непосредственно вызывающих рас-
сеяние лучистой энергии. В_ зависимости от соотношения между
размерами дымовых частиц и длиной волны проходящего
света преобладает то или иное явление. В том случае, когда
размер дымовых частиц больше длины волны света, на гра-
нице дымовых частиц происходит отражение и преломление
света по законам геометрической оптики.
У непрозрачных дымовых частиц к рассеянию света при-
водит его непосредственное отражение. У прозрачных частиц.
34
причиной рассеяния являются многократное отражение и пре-
ломление света на внутренней и наружной поверхности частиц,
Схема подобного рассеяния на поверхности шарообраз-
ной прозрачности капельки водяного тумана изображена
ра рис. 7.
Если размер дымовых частиц соизмерим с длиной волны
света, то причиной рассеяния является диффракция света.
Диффракция света заключается в том, что лучи света
огибают находящиеся на их пути дымовые частицы. Схема
диффракции показана иа рис. 8.
Наконец, если размер дымовых частиц гораздо меньше,
чем длина волны света, то рассеяние происходит вследствие
возбуждения электронов проходящими лучами света. Возбуж-
денные электроны колеблются, излучая при этом по всем
направлениям лучистую энергию.
Рис. 7. Схема отражения и пре-
ломления света капелькой тумана
Рис. 8. Схема диффракции:
а—около отверстия; б—около пластинки.
Независимо от физической причины рассеяние света .проис-
ходит всегда по всевозможным направлениям к проходящим
(первичным) лучам. Рассеянный свет образует вокруг частицы,
являющейся причиной разбрасывания лучистой энергии, све-
тящееся поле. Интенсивность этого поля изображается диаграм-
мой (так называемой индикатриссой светорассеяния),
длина вектора которой выражает в условных единицах интен-
сивность поля в определенном направлении. Так как рассеяние
света обычно симметрично по отношению к направлению про-
ходящих лучей, то достаточно описания индикатриссы в какой-
либо одной плоскости, проведенной через частицу и первич-
ный луч.
Подобная индикатрисса для весьма маленькой прозрачной
частицы изображена на рис. 9, б.
Рассеянный свет всегда в той илн иной степени поляри-
зован. Поляризованным называется свет, волнообразное
колебание энергии в котором происходит определенным обра-
зом. В естественном’ свете имеются лучи с разнообразными
колебаниями. Вследствие рассеяния света происходит как бы
рассортировка лучей. Лучи, колебания в которых происходят
в одной плоскости, как бы выделяются из общего светового
потока и направляются в определенную сторону. Количествен-
3* 35 -
ное содержание поляризованных лучей в общем световом,
потоке называется степенью поляризации.
Наиболее полная теория светорассеяния разработана на основе электро-
магнитной теории света. В результате работ Рэлея, Ми, Дебая, Иобста
получена стройная теория, охватывающая рассеяние света частицами раз-
личных размеров. Математические выводы этой теории достаточно сложны.
я ие могут быть выражены в простой форме. Для удобства расчетов про-
ведены вычисления, дающиеся обычно в виде кривых, диаграмм или таб-
лиц и позволяющие проследить за изменением количества рассеянного света,
ииднкатрнссы светорассеяния и степени поляризации в зависимости от раз-
меров частиц, длины волны света и коэфициента преломления дымовых
(коллоидных) частиц. При известных условиях, если пренебречь многократ-
ным рассеянием, основные закономерности, характеризующие рассеяние
света одной дымовой частицей, могут быть распространены И на дымовые
облака, состоящие из множества частиц. При этом допускается, что ие в
очень густых дымах и туманах общее количество рассеянного света прямо
пропорционально- частичной концентрации, а если размер частиц ие изме;
няется, то и прямо пропорционально весовой концентрации.Это было
экспериментально подтверждено
Тольмэном на разбавленных ды-
мах и соблюдается независимо
от -причин рассеяния света.
Основные закономерности, ха-
рактеризующие зависимости ме-
жду 'интенсивностью’ светорассея-
ния, размерами аэрозольных ча-
стиц и длиной волны света, легко
проследить, пользуясь результа-
тами вычислений, проведенных
Стратоном; и Хаутоном для во-
дяного тумана. Пю Стратону и
Хаутону интенсивность светорас-
сеяния R определяется тремя-ве-
личинами: мощностью первич-
ного светового потока /, суммар-
ным сечением аэрозольных ча-
стиц, на которое попадает свет,
jtf’JV и коэфициентом К, харак-
теризующим саморассеяние и за-
размеров частиц к длине волны
Рис. 9. Распределение рассеянного
света:
а—около большой непэозрачной частицы;
О—около весьма малой частицы по Редею (за-
чернена д->ля поляризованного света); в и г—
около прозрачных частиц больших длин волны
света
висящим, в свою очередь, от отношения г_____________________ „______ ______
света н от коэфициента преломления дымовых частиц. Окончательная фор-
мула для 'интенсивности светорассеяния по Стратону и Хаутону имеет сле-
дующий вид:
R = I KN™*.
и Хаутоном значения К, в зависимости от отно-
на рис. 10, а.
Вычисленные Стратоном
тения х = приведены
Из этой формулы и из графика на рис. 10 видно, что если число частиц
в дымовом облаке остается постоянным, а размер их увеличивается, то
интенсивность светорассеяния всегда возрастает. Увеличение интен-
сивности светорассеяния происходит наиболее сильно в высокодисперсных
дымах, где имеет значение не только рассеивающая поверхность, но и
объем вещества, н наиболее слабо ®' грубодисперсных дымах, где рассея-
ние пропорционально только поверхности аэрозольных частиц. Сообразно
с этим в высокодисперсных дымах интенсивность светорассеяния пропор-
циональна размерам частиц в шестой степени, а в области грубых частиц
рассеяние света пропорционально размерам во второй степени. В области
частиц, соизмеримых с длиной волны света, наблюдается промежуточная
закономерность.
Более сложно установить зависимость между количеством рассеянного
света и размерами аэрозольных частиц при постоянной весовой
36
концентрации. Увеличение размеров частиц при сохранении постоян-
ной весовой концентрации естественно приводит к уменьшению их числа
, и к сокращению общей рассеивающей поверхности. В грубодисперсных
системах, где наиболее важна величина рассеивающей поверхности, интен-
сивность светорассеяния уменьшается с увеличением размеров частиц.
В высокодисперсиых системах, где важна рассеивающая масса, наоборот,
количество рассеянного света растет с
увеличением размеров частиц. В ды-
мах средней степени дисперсности, где
причиной рассеяния является диффрак-
ция, имеют место и та и другая за-
кономерности. Вместе с тем при диф-
фракции имеет место наиболее сильное
светорассеяние, достигающее макси-
мума <в некоторой средней области раз-
меров частиц (порядка 2 • 10-5 см). Ча-
стицы этих размеров наиболее выгодны
для маскирующего дымообраэования.
Кривая, вычисленная по данным
Хаутона и Стратона н показывающая
изменение интенсивности светорассея-
ния при постоянной весовой концен-
трации, приведена иа рис. 10, б.
Наличие максимума светорассеяния
экспериментально наблюдалось в ряде
работ. На ' рис. 10, в приведены ре-
зультаты Вейцера и Гуревича для
сернокислотного тумана.
Количество рассеянной энергии,
кроме того, зависит от длины волны
света, проходящего через дымовое об-
лако. Эта зависимость будет не одина-
ковой для частиц разных размеров и
может быть легко прослежена при
пользовании кривой Стратона и Хау-
тона.
Грубыми частицами все лучи спе-
ктра рассеиваются одинаково. Приме-
ром таких аэрозольных систем являют-
ся обычные облака. В высокодисперс-
иых системах рассеяние света обратно
пропорционально длине волны в чет-
вертой степени; наиболее сильному
рассеянию подвергаются короткие (си-
ние ' и фиолетовые) лучи, длинные
(красные) лучи рассеиваются слабее.
Поэтому все высокодисперсные дымы
и туманы выглядят при наблюдении
в боковом рассеянном свете голубыми,
а при наблюдении в проходящем свете
красными. Примером подобных систем
является атмосферный воздух (голубой
цвет неба, красный цвет солнечного
заката). Частицы, соизмеримые с дли-
ной волны света, обычно! рассеивают
лучше также свет с короткими вол-
нами. При этом разница в рассеянии
света различных длин воли сказы-
Рис. 10. а — кривая Стратона —
Хаутона; б—зависимость рас-
сеянного света от размеров ча-
стиц при постоянной -весовой кон-
центрации; в — рассеяние света
туманом серной кислоты
вается менее резко. Рассеяние света обратно пропорционально длине волны
в третьей, второй и первой степени.
В некоторых ’случаях у частиц, соизмеримых с длиной волны света,
наблюдается противоположная зависимость и наблюдается лучшее
37
рассеяние в туманах красных лучей по сравнению с фиолетовыми. Если,
сохраняя размер частиц, постоянным исследовать рассеямне света все более
длинных волн, то соотношение интенсивностей светорассеяния в различных
участках спектра будет следовать кривой Стратона — Хаутона. В качестве
примера можно рассмотреть туман с частицами таких размеров, для кото-
рых рассеяние видимой части спектра соответствует правой пологой части
кривой Стратона — Хаутона. Прн постепенном увеличении длины волны света
интенсивность светорассеяния сначала весьма медленно возрастает, потом |
падает, затем опять возрастает и опять падает до тех пор, пока свет до-
статочно длинных волн ие будет проходить через туман, почти ие подвер-
гаясь рассеянию.
Распределение рассеянного света вокруг дымовой частицы и степень
поляризации тоже зависят от размеров частиц и длины волны света. По
мере увеличения размеров частиц все большее и большее количество лу-
чистой энергии рассеивается вперед И все меньше света отбрасывается
назад и в стороны. Вместе с тем происходит изменение степени поляриза-
ции. Соответствующее изменение индикатриссы светорассеяния и степени
поляризации показано па рис. 9, б, в и г.
б. Поглощение света. Поглощением света называется пре-
вращение лучистой энергии, попавшей на поверхность дымо-
вых частиц, в химическую или тепловую энергию.
Поглощение света обычно носит избирательный характер и
резко выражается в определенном узком участке спектра.
В некоторых случаях наблюдается поглощение лучистой
энергии в широкой области спектра. При таком поглощении
света дымовое облако выглядит черным. При избирательном
поглощении облако окрашено в.- цвет дополнительный к погло-
щенному1.
Надо заметить, что в высокодисперсных дымах и туманах,
которые, как указывалось выше, более интенсивно рассеивают
коротковолновую (фиолетовую) часть спектра, цвет дымового
облака определяется совместным действием поглощения и
неравномерного рассеяния света. Так, например, если высоко-
дисперсный туман поглощает голубые лучи спектра, то он и
в проходящем, и в рассеянном свете окрашен в красный цвет.
В неокрашенных туманах серной и фосфорной кислот на
долю поглощения приходится 10—30% общей потери энергии
Таблица 6
Доля поглощения в общем ослаблении света
(по Ю. Вейцер)
Наименование дыма
Доля погло-
щенного
света в %
Туман фосфорной кислоты ....
, серной , ....................
Дым хлоргидратов титана........
.. из смеси нейтральных шашегДМ-11
, , » дымовых гранат . . .
Черный дым, полученный при го-
рении скипидара ...............
10
30
32
24
51
32
1 Дополнительными называются такие два цвета, которые в сумме
дают белый цвет.
38
в силу рассеяния и поглощения, а в черных дымах до 80%
дем. табл. 6).
Количество поглощенного света зависит от размеров дымо-
вых частиц, длины волны света и коэфициентов преломления
дисперсной фазы и дисперсионной среды. Для каждой спек-
тральной области поглощенная энергия достигает максимума
при определенном размере дымовых частиц.
в. Закон Ламберта. Коэфициент ослабления света. Рассея-
.ние и поглощение лучистой энергии приводят к тому, что
интенсивность света, проходящего через дым или
туман, постепенно уменьшается.
Количество света, рассеянного и поглощенного дымовым
облаком, может быть вычислено, исходя из закона Ламберта.
По этому закону каждый последующий бесконечно малый
слой дыма (как и вообще коллоида) всегда поглощает и рас-
сеивает определенную долю энергии, поступившей
лз предыдущего слоя.
В интегральной форме подобная зависимость выражается
•’'Следующим, уравнением:
сгде / — интенсивность света, прошедшего слой дыма; .
/о — интенсивность света, входящего в дымовое облако; о
К — коэфициент ослабления света (в обратных единицах
длины);
d — толщина слоя дыма, через которую проходит луч
света;
е — основание натуральной системы логарифмов (=2,71).
Коэфициент ослабления света является весьма важной
•величиной, характеризующей оптические свойства аэрозольной
системы. Приближено коэфициент ослабления света
показывает, какая доля энергии рассеивается и поглощается
на пути, равном единице длины1.
Коэфициент ослабления света К равен сумме коэфициентов
рассеяния света а и поглощения света
Эти коэфициенты в свою очередь показывают, какая (при-
ближенно) доля энергии отдельно поглощается и отдельна
рассеивается на пути в единицу длины.
Коэфициент ослабления света обычно выражается в обрат-
ных единицах длины (1/м или 1/см).
Подобная размерность коэфициента ослабления света полу-
чается из его определения, данного выше.
Коэфициент ослабления света определяется обычно из
измерений с узким параллельным пучком света. Только эта
* Точнее коэфициент ослабления света равен доле энергии, рассеянно!
и поглощенной на пути в единицу длины, при расчете на бесконечно тон-
хий слой.
I
3t
величина имеет определенный физический смысл и может
быть использована в дальнейшем в теории дымовой маски-
ровки. При всяком другом освещении получаются меньшие
значения коэфициента ослабления. Причина этого явления
будет рассмотрена ниже. Абсолютная величина коэфициента
ослабления света составляет в маскирующих дымах примерна
0,4—0,04 лг1. (
Зависимость коэфициента ослабления света от размеров
дымовых частиц, длины волны света и оптических свойств
дисперсной фазы определяется суммарным действием процес-
сов поглощения и рассеяния света.
В известных пределах коэфициент ослабления света прямо
пропорционален весовой концентрации (закон Бера):
K=Q-c,
где Q— коэфициент ослабления света, соответствующий еди-
нице весовой концентрации дыма,
с — весовая концентрация дыма в мг/л или г/-и3.
Аналогично поглощению и рассеянию, ослабление света
достигает максимальной величины при некотором среднем раз-
мере дымовых частиц. Естественно, что для целей маскирую-
щего дымообразования наиболее важно определить положение
t максимума ослабления для постоянной весовой концентрации;
дыма. Для тумана серной кислоты эта величина максимальна
у частиц, радиус которых равен 2*10~5 см.
Величина' коэфициента ослабления света на различных уча-
стках видимого и инфракрасного спектра для различных маски-
рующих дымов сильно изменяется.
г. Многократное рассеяние. Лучистая энергия, рассеянная
дымовыми частицами, попадая на другие дымовые частицы,
подвергается вторичному рассеянию. Если весовая концентра-
ция дымового облака достаточно велика, то лучистая энергия
может рассеиваться много раз.
В общем это явление носит название многократного рас-
сеяния. Многократное рассеяние заметно влияет на спектраль-
ный состав рассеянных лучей и степень поляризации. Вслед-
ствие вторичного, третичного и последующего рассеяния как
проходящие, так и рассеянные лучи становятся белесоватыми
и деполяризуются. Поэтому в высокодисперсных дымах это
приводит к исчезновению окраски и уменьшению степени поля-
ризации.
Многократное рассеяние, павидимому, усиливает степень
поглощения света.
В результате многократного рассеяния света закон Лам-
берта соблюдается только на коротких расстояниях или в ред-
ких облаках. На длинных расстояниях или в густых облаках
к прямым, неподвергшимся рассеянию лучам прибавляется
свет, многократно рассеянный соседними участками аэрозоля,
й наблюдаемая величина коэфициента ослабления уменьшается.
Соответствующее диафрагмирование измерительной аппара-
туры позволяет получать правильные значения коэфициента-
ослабления.
точка, в которой измеряется.
Рис. 11. Схема соотношения ме-
жду наблюдаемой яркостью и ко-
личеством падающего света
2. Маскирующее действие дымов и туманов
а. Элементарные сведения из физиологии зрения. Условия
видимости. Для правильного понимания сущности маскирую-
щего действия дымов и туманов необходимо коротко остано-
виться на некоторых вопросах физиологии зрения.
Известно, что глаз различает форму предмета, его яркость
и цвет. Яркостью называется величина, характеризующая
излучение светящейся поверхности в некотором заданном
направлении. Представление о яркости дает рис. 11. Пусть
ABD какое-нибудь -светящееся тело; СЕ — отверстие, выре-
занное в черной пластинке; F—
яркость; ш — телесныый (про-
странственный) угол между F и
отверстием СЕ.
Количество света, попадающее
в точку F, зависит от размеров
площади отверстия СЕ, от телес-
ного угла ш и от расстояния от
точки до площадки. Однако во
всех случаях яркость светящегося
тела ABD остается неизменной
и будет равна энергии, попавшей
в F и деленной на телесный
угол.
Яркость измеряется в стильбах. Стильбом называется
яркость площадки, дающая силу света в 1 международную
свечу с каждого квадратного сантиметра видимой поверхности.
Глаз способен к ощущению ' яркости весьма небольшого
абсолютного значения (величиной в несколько фотонов). Вме-
сте с тем изменение в яркости глаз обнаруживает
только в том случае, когда это изменение составляет не менее
определенной доли от первоначальной величины (закон Вебера-
Фехнера). Эта минимальная доля называется порогом
контрастной чувствительности .и обозначается
буквой е.
- Порог контрастной чувствительности е колеблется в
довольно широких пределах (0,5—2%). Он зависит от угловых
размеров и формы предмета и от индивидуальных особенно-
стей каждого человека. В среднем порог контрастной чувст-
вительности равен 1,25%. Это значит, что если первоначаль-
ная яркость будет равна 100 единицам, то человек обнару-
жит изменение яркости только в том случае, если новая яр-
кость будет отличаться от первоначальной не менее чем на
1,25 единицы.
Порог контрастной чувствительности зависит от яркости,
цвета, размеров и формы предмета.
41
Минимальное значение порога контрастной чувствительно-
сти соответствует некоторым средним яркостям. В области
малых и больших яркостей порог констрастной чувствительности
увеличивается.
•
Увеличение порога контрастной чувствительности в области малых
яркостей объясняется действием собственного света сетчаткя глаза, вызы-
ваемого тепловыми н химическими процессами, происходящими в глазу,
даже при отсутствии внешнего светового раздражения. С учетом собствен-
ного света сетчатки формула, выражающая закон Вебера-Фехнера — = е,
д/
должна быть заменена формулой =е, где Д/— прирост яркости;
' I” и
I—первоначальная яркость; d — собственный свет сетчатки. При больших
значениях I величиной d можно пренебречь. В области малых I d ока-
зывает значительное влияние.
Причиной повышения порога контрастной чувствительности прн боль-
ших яркостях является существование предела возбужденности нервных
элементов глаза, при приближении к которому усиление раздражителя
становится все менее заметным. В предельном случае, когда 7 весьма ве-
лико, никакое добавочное раздражение д / уже не в состояиин вызвать
какую-либо разницу в ощущении, как бы велико это Д/ ни было. Порог
контрастной чувствительности увеличивает-
ся, кроме того, с уменьшением размеров
рассматриваемого предмета. Зависимость
порога контрастной чувствительности от
размеров предмета показана на рис. 12.
Рис. 13. Порог контрастной чувствитель-
ности:
1—красная поверхность; 2—фиолетовая поверхность;
3—белая поверхность; 4—желто-зеленая поверх-
ность.
Рнс. 12. Изменение порога
контрастной чувствитель-
ности в зависимости от
угловых размеров предмета
Величина порога контрастной чувствительности при малых
яркостях зависит также от цвета предмета. Наименьшую
.величину порог контрастной чувствительности имеет в фиоле-
товой части спектра; наибольшую — в красной. Изменение
порога контрастной чувствительности в зависимости от ярко-
сти и цвета представлено на рис. 13.
Понятие о пороге контрастной чувствительности дает воз-
можность установить те условия, которые необходимы - для
-видимости предмета.
Эти условия легко получить, зная, что всякий предмет
всегда рассматривается не отдельно, а на фоне другого пред-
мета. Так, например, черные буквы рассматриваются яа фоне
белого листа бумаги; дом или дерево — на фоне неба (при
^наземном наблюдении) или на фоне земли (при наблюдении
с воздуха) и т. п.
Между предметом и окружающим его фоном всегда имеется
некоторый контраст яркости. Контрастом яркости
называется разность яркости предмета и фона, отнесенная
к яркости фона. Контраст яркости выражается уравнением:
где Нп— яркость предмета;
Н<ь — яркость фона.
Чем больше контраст яркости, тем лучше и резче виден
- предмет. С уменьшением контраста яркости видимость пред-
мета ухудшается и, наконец, при некоторой достаточно малой
величине контраста, когда контракт яркости меньше порога
контрастной чувствительности, предмет перестает быть виден.
Так, например, звезды хорошо видны в темную ночь; хуже
в светлую лунную ночь и совсем не заметны днем на ярком
-солнечном свету. Видимость предмета вообще возможна в том
-случае, когда контраст яркости больше порога контрастной
-чувствительности:
"ф
Это неравенство является основным условием, необходи-
мым для видимости предметов-1.
Цвет предмета обусловливается неодинаковым спектраль-
ным составом лучей, отраженных или излучаемых самим пред-
метом и окружающим его фоном. Для ощущения цвета раз-
ница в спектральном составе лучей, отраженных предметом и
-фоном, должна превышать в сине-фиолетовой области спектра
.3—6 мр-, в оранжевой области спектра 1,5—2 мн, в зеленой
2—3 мрг, в красной 3—6 ми.
Кроме того, для ощущения цвета предмета необходимо,
чтобы доля цветных лучей в общем потоке отраженных лучей
(насыщенность потока) также достигала определенной мини-
мальной величины. Эта величина называется порогом насы-
щенности и обозначается г;. Величина порога насыщенности •
неодинакова для различных областей спектра. Она равна
1 Следует отметить, что контраст яркости может быть величиной по-
ложительной к величиной отрицательной (Н„<Л/ф). Знак
контраста не имеет существенного значения н при всех -расчетах во вви-
мание принимается только. абсолютная -величина.
34
в красной части спектра 3,6%, в зеленой 8,3% и в фиолето-
вой 1,1%.
б. Причины маскирующего действия дымов и туманов.
Дальность видимости. Причиной маскирующего действия аэро-
золей являются оптические явления, происходящие в дымовом
облаке.
Часто приходится встречаться с представлением о том, что
маскирующее действие дымов и туманов заключается в
задержке или изменении направления прямых лучей, идущих
от предмета к наблюдателю. Подобное представление неверно,
и ошибочность его легко показать следующим простым опы-
том. Возьмем (рис. 14) предмет 2, осветим его параллельным
пучком от источника 1. При наблюдении через молочную пла-
стинку 3 предмет будет невидим. Однако, искусственно увели-
чив контраст яркости, можно осуществить видимость. Для
этой цели между пластинкой и наблюдателем помещают вра-
щающийся барабан 4 с множеством узких длинных и вычер-
ненных отверстий. Подобный барабан задерживает боковые
рассеянные лучи света и дает
Рис. 14. Влияние контраста яркости
на видимость предмета
возможность видеть предмет.
На самом деле, причина
маскирующего действия дымов
и туманов заключается в том,
что вследствие рассеяния сол-
нечного света всякое дымо-
вое облако представляет со-
бой яркосветящийся объем.
Если дымовое облако нахо-
’ дится между предметом и на-
блюдателем, то его яркость прибавляется к яркости предмета и
фона и тем самым уменьшает контраст до величины, мень-
шей порога контрастной чувствительйости е. Так, например,
при яркости какого-либо предмета в 0,005 стильба и яркости
фона, на котором он рассматривается, в 0,16 стильба контраст
яркости равен:
0,16 — 0,005 0,155
Ф п — J—_2__ = _Д = о 969
,/Уф 0,16 0,16 U,SDS-
Если яркость тумана, в котором находится предмет, hT
равна 0,2 стильба, то контраст яркости уменьшится и окажется
равным:
//0 + AT_//n_AT 0,16 4-0^ — 0,005 — 0,2 _
Яф + Лт “ 0,164-0,2 ’ •
Помимо уменьшения контраста яркости рассеянный туманом
свет понижает насыщенность лучей, отраженных от поверх-
ности предмета. Предмет становится белесоватым и, при до-
статочной яркости рассеянного света, разница в цвете предмета и
окружающего его фона перестает ощущаться. Чем толще слой
дыма, находящегося между наблюдателем ,и предметом, тем
44
1
.сильнее уменьшается контраст яркости. При небольшом рас-
стоянии, когда контраст яркости превышает порог контрастной
.^чувствительности, наблюдатель видит предмет. Постепенно
удаляясь от предмета, наблюдатель иа некотором расстоянии,
на котором контраст яркости становится меньше порога кон-
трастной чувствительности, перестает видеть предмет. Это
расстояние, весьма важное для практических (расчетов, назы* *
, вается дальностью видимости и обозначается бук-
вой S1.
Дальность видимости зависит от оптических свойств дымо-
, вого облака, от условий освещения и от цвета’ и отража-
тельной способности2 поверхности предмета.
- У черного предмета, не отражающего падающие на него
лучи света, собственная яркость равна нулю. Поэтому кон-
траст яркости и дальность видимости черного предмета опре-
деляются соотношением яркости того фона, на котором пред-
, мет находится, и яркостью слоя воздуха или тумана,
находящегося между предметом и наблюдателем.
При равномерном освещении в густом тумане дальность
видимости черной поверхности обратно пропорциональна коэ-
фициенту ослабления света и выражается уравнением:
5 = 2,41gl,
где S — дальность видимости в м\
К — коэфициент ослабления света в дымовом облаке в >ГЬ,
е — порог контрастной чувствительности;
2,3 — постоянный коэфициент, полученный при переходе
' от натуральных логарифмов к десятичным.
При среднем значении порога контрастной чувствительности,
равном 1,25%, уравнение для дальности видимости черной
поверхности приобретает более простой вид, весьма удобный
для практического применения:
с_М
; К ’
где 4,4 — коэфициент, равный 2,3 1g
Полученное соотношение, как это было показано Ю. И. Вей-
нер, не зависит от того, какова доля поглощения и рассеяния
света в общем ослаблении лучистой энергии. Несомненно, что
увеличение поглощения лучистой энергии уменьшит как абсо-
!'• лютное значение яркости тумана, так и связанную с ним яр-
кость маскирующего слоя. Однако соотношение между ярко-
стью тумана и яркостью маскирующего слоя и связанная с этим
дальность видимости остаются постоянными. Только в слу-
‘Пользуются, кроме того, терминами просматр'нваемость и
Дистанция видимости.
* Под отражательной способностью понимается отношение количества
света, отраженного какой-либо поверхностью, к общему количеству света,
попавшему на эту поверхность.
45
чае весьма сильного поглощения света, наблюдаемого в черных
дымах, черный предмет виден хуже.
При неравномерном освещении тумана яркость отдельных
его слоев неодинакова. Наиболее сильно освещены слои, рас-
положенные вблизи источника света. Наиболее слабо — слои,,
удаленные от него. Если источник света находится сзади
наблюдателя, то яркость слоев, лежащих между предметом и
наблюдателем, больше яркости слоев, лежащих за предметом.
Поэтому в этом случае контраст яркости равен порогу кон-
трастной чувствительности при меньшей дальности видимости,,
чем для равномерного освещения.
Наоборот, в случае когда источник света расположен впе-
реди наблюдателя, дальность видимости будет больше, чем при
неравномерном освещении. Если между предметом и наблю-
дателем находится граница дымового облака, то неравномер-
ность освещения может быть весьма значительной (предмет
в облаке, наблюдатель вне облака, солнце за наблюдателем) „
Это обстоятельство является причиной уменьшения необходи-
мой для маскировки толщины слоя дыма и повышения его ма-
скирующих свойств.
Дальность видимости серого предмета зависит, помимо коэ-
фициента ослабления света, также и от оптических свойств-
самой поверхности. Это объясняется тем, что серый предмет
отражает некоторое количество падающей на него лучистой,
энергии. Поэтому при вычислении контраста яркости серого
предмета необходимо учитывать помимо яркости слоя воздуха
и тумана, находящегося между предметом и наблюдателем, и
яркость самого предмета.
Наличие собственной яркости приводит к тому, что даль-
ность видимости серого предмета отличается от дальности
видимости черного предмета.
При равномерном освещении дальность видимости серой
поверхности выражается уравнением:
S = 2.3±lg[l(l-|)].
где b — яркость предмета;
В — яркость тумана
и при расчетах следует принимать во внимание только
абсолютное значение 1— В густых туманах при рав-
номерном освещении и наблюдении вдоль земли t>jB
равно половине отражательной способности предмета.
Отражательная способность выражается обычно в долях
интенсивности падающего света и для природных предметов
колеблется в пределах от 0,05 до 0,5.
Зная величину отражательной способности и полагая по-
прежнему порог контрастной чувствительности равным 1,25%,
можно легко определить дальность видимости.
Практически дальность видимости серой поверхности не
намного меньше дальности видимости черной поверхности.
46
В негустых туманах, когда прямые солнечные лучи доходяг-
до серого предмета, яркость его значительно увеличивается.
При ярком солнечном свете яркость предмета может стать
больше яркости тумана и в некоторых случаях белый предмет
будет виден, лучше черного.
Яркость дымовой завесы равна в среднем 0,1 стильба. Зная
яркость предмета, можно вычислить, насколько этот предмет
будет виден лучше черного. Максимальная яркость полиро-
ванной металлической поверхности, на которую падают солнеч-
ные лучи, составляет 100 000 стильб. В этом случае дальность
видимости больше чем для черного предмета в 3,65 раза. При-
яркости предмета в 1 стильб (яркость пашни 0,5 стильба,,
яркость белой поверхности 3 стильба) его дальность видимости
превышает дальность видимости черного тела в 1,5 раза.
При вычислении видимости в тумане предметов, располо-
женных на фоне местности, необходимо учитывать яркость
и отражательную способность как предмета, так и местности.
Это особо важно прМ наблюдении с самолета предметов, нахо-
дящихся на земле, и при определении расстояния, на котором
перестают различаться детали предмета.
Дальность видимости предметов, находящихся на фоне
местности, выражается уравнением:
S —2,3^- 1g | — й 8-й"Ье)] ’
где 8 — яркость местности..
В густых туманах (нёбо закрыто облаками) и при наблюде-
нии сверху (с самолета) и равны отражательной спо-
собности предмета и местности; при наблюдении вдоль поверх-
b о
ности земли и — равны, как это указывалось выше,
половине отражательной способности.
Дальность видимости цветных предметов определяется, по-
мимо контраста яркости, также и контрастом цвета. Однако
вследствие обычно небольшой насыщенности отраженного света,.
цвет предмета перестает различаться на расстоянии,. меньшем
дальности видимости. Поэтому дальность видимости окра-
шенных предметов практически равна дальности ви-
димости белых предметов, обладающих равной отража-
тельной способностью. Следует отметить, что цвет кра-
сного предмета виден в тумане дальше, чем цвет
фиолетового предмета, причем это различие максимально в вы-
сокодиСперсном тумане.
в. Видимость в тумане источников света. Днем дальность
видимости источника собственного света — маяков, лампочек
и т. п. — определяется на основании тех же соображений, что-
и в случае предметов, только отражающих свет. Так же как
там, главной причиной маскирующего действия тумана является*
рассеяние солнечных лучей туманом и уменьшение вследствие
этого контраста между источником света и его окружением..
47
Однако помимо рассеяния солнечных лучей приходится учиты-
вать рассеяние света, идущего от самого источника, также
влияющее на контраст. Суммарное действие обоих этих явле-
ний определяет собой дальность видимости. Ночью, когда нет
солнца, основное значение для дальности видимости имеет рас-
сеяние света, испускаемого самой лампочкой или маяком.
В обоих случаях дальность видимости лампочки или маяка
выражается уравнением
<, 2,3. /1
где S —дальность видимости;
К — коэфициент ослабления света;
в — порог контрастной, чувствительности;
£ — яркость лампочки или маяка;
В — яркость тумана.
Вследствие дополнительного рассеяния солнечных лучей
дальность видимости источников света в ‘тумане днем будет
гораздо меньше, чем ночью. Поэтому для достижения необхо-
димой дальности видимости днем следует применять более
сильные (яркие) источники света.
Увеличение силы света или яркости сигнала не вызывает
соответствующего увеличения дальности видимости. Это проис-
ходит потому, что одновременно с увеличением яркости сигнала
возрастает и яркость окружающего его тумана. Так, по наблю-
дениям Байггса лампочка в 500 тыс. свечей была видна всего
в три раза лучше, чем лампочка в 50 свечей.
Дальность видимости сигнала всегда больше дальности
видимости черной поверхности.
Дальность видимости сигнала зависит от его цвета. При
равной яркости лучше всего виден красный сигнал. Дальность
видимости красного сигнала примерно в два раза больше даль-
ности видимости белого, зеленого и желтого сигнала. Лучшая
видимость красного сигнала объясняется меньшим значением
коэфициента ослабления света для этой части спектра и мень-
шей для красных лучей величиной порога контрастной чувстви-
тельности.
3. Маскирующие свойства границы дымового облака
а. Отражение света от границы дымового облака с чистой
атмосферой. Свет, попадающий на границу дымового облака,
частично проходит внутрь облака, рассеиваясь и поглощаясь
там частицами дыма, и частично отражается от облака по
разным направлениям. Отражение света от границы облака
с чистой атмосферой вызывается теми же явлениями, которые
служат причиной рассеяния света внутри дымового облака.
Однако само расположение дымовых частиц около границы
облака приводит к тому, что рассеянный свет не проникает во
внутренние части облака, а уходит в чистую атмосферу.
48
Доля отраженного света увеличивается по мере увеличения
весовой концентрации дисперсной фазы дыма. Чем плотнее и
гуще дымовое облако, тем больше света отражается от его
границы. Аналогичным образом влияет толщина слоя дыма.
Что касается резкости границы, то казалось бы, что
раз дело сводится к отражению света от отдельных дымовых
частиц, то важно только их число и неважно относительное
распределение в пространстве. На самом деле резкость границы
имеет весьма существенное значение. Действительно, при рез-
кой границе дымового облака с чистой атмосферой весь свет,
отраженный первым слоем частиц дыма, не вернется обратно
е облако. При нерезкой границе большая доля падающих лучей
успевает пройти внутрь дымового облака и подвергнуться уже
там отражению и рассеянию. Отражение от первого слояча
-стиц ничтожно. Несомненно, что часть энергии, рассеянной
внутри дымового облака, изменив вследствие рассеяния свое
направление и выйдя обратно за пределы облака, будет вос-
принята как отраженный свет. Чем выше значение коэфициента
рассеяния и чем тоньше слой тумана, тем большее количество
-света отбрасывается назад навстречу падающему лучу. Однако
отброшенные назад лучи в свою очередь вследствие вторич-
ного рассеяния опять изменяют свое направление и не дойдут
до границы облака с чистой атмосферой. При заданной тол-
щине облака и известном коэфициенте рассеяния должно уста-
новиться определенное соотношение между отраженными
-лучами и лучами, прошедшими через облако и поглощенными
нм. Это соотношение и определяет коэфициент отражательной
способности. Те, что дело обстоит именно таким образом, под-
тверждается опытами Регенера над отражением света от по-
верхности дымовых облаков хлористого аммония, парафинового
масла и серной кислоты. При уменьшении резкости гра-
ницы облаков, вследствие местных -вихревых тече-
ний или диффузии дыма в чистую атмосферу, отража-
, тельная способность облака понижалась. В весьма гу-
стых и концентрированных туманах серной кислоты, хло-
ристого аммония и парафинового масла доля отраженного
света колебалась по опытам Регенера от 60 до 90%. По дан-
ным Вейкера и ’Мяч доля отраженного света в белых дымах
с концентрацией 0,5 — 7 мг/л составляет примерно 1—10%,
в черных дымах отражение света не превышает 1—2%.
б. Влияние отражения света от границы дымового облака
на невидимость предметов. Как указывалось выше, предмет, -
-находящийся в тумане, перестает быть видным, если контраст
между ним и окружающим его фоном окажется меньше порога
.J контрастной чувствительности человеческого глаза. Роль ту-
I мана заключается в повышении кажущейся яркости как пред-
мета, так и фона, вследствие чего происходит соответственное
’ уменьшение контраста. Причиной повышения кажущейся ярко-
сти является рассеяние солнечного света в дымовом облаке по
пути между предметом и наблюдателем.
| 4 ®лк- 31Я1. Вейцер и Луганский. 49
Что касается влияния на видимость отражения света от
края дымового облака, то по этому вопросу нет твердо уста-
новленного и определенного мнения.
Можно допустить, что для наблюдателя, находящегося за
пределами дымового облака и рассматривающего предмет
«нутри облака (или по другую его сторону), отражение света
от края создает вторую дополнительную кажущуюся яркость,
еще более понижающую контраст между предметом и фономк
Чем сильнее отражается свет от края облака, тем бдльшей
будет вторая добавочная яркость. Эта вторая яркость,
появляющаяся вследствие отражения света от края облака,,
называется в военном деле ослепляющая способность
дыма. Слабое отражение света от края черных дымовых обла-
ков является одной из причин их плохих маскирующих
качеств. Наоборот, значительное отражение света белыми
дымами обусловливает их хорошие маскирующие свойства. ’
Весьма вероятно, что ослепляющая способность дымовой;
завесы обусловливается тем, что для наблюдателя, находяще-
гося за пределами облака, освещение тумана всегда неравно-
мерно и яркость слоев, расположенных около края завесы,
больше яркости слоев, лежащих внутри облака около предмета.
Это обстоятельство, как указывалось выше, приводит к умень-
шению контраста яркости, улучшает маскирующие свойства и.
понижает дальность видимости (толщину слоя, необходимую
для маскировки).
Плохое маскирующее действие черных дымов объясняется
в этом случае: слабым рассеянием света, необходимостью
учитывать наряду с яркостью завесы яркость горизонта,
отражением первичных солнечных лучей от поверхности нахо-
дящихся в завесе предметов и другими причинами.
Наиболее резко неравномерность освещения должна ска-
заться на краю завесы, обращенной к солнцу. В связи с этим
^весьма интересно проследить за маскирующими свойствами
дымового облака при разном расположении солнца, облака и
наблюдателя.
Действительно наиболее благоприятным оказывается поло*
жение, когда солнце и наблюдатель находятся по одну сторону; /
облака, а предмет или внутри облака или по другую сторону.
В этом случае яркость слоев ближайших к наблюдателю
весьма велика.
Положение солнца и наблюдателя по разные стороны дымо-
вого облака ухудшает маскирующие свойства, так как
наиболее сильно возрастает яркость слоев, служащих фоном.
ГЛАВА V
МЕТОДЫ ИССЛЕДОВАНИЯ ДЫМОВ И ТУМАНОВ
К исследованию дымов и туманов прибегают обычно с целью
оценки их маскирующих качеств, устойчивости, а также эффек-
теввости способа их получения. Для такой оценки дымов и ту-
50
манов необходимо измерять в первую очередь их весовую
и частичную концентрацию, размер их частиц и величины, харак-
теризующие их маскирующие свойства, как-то: коэфициент
ослабления, прозрачность, дальность видимости и др.
1. Определение весовой концентрации
и химического Состава
Определение весовой концентрации производится обычно
путем отделения дисперсной фазы от дисперсионной среды.
Существуют два основных способа определения весовой кон-
центрации: фильтрация дымовых частиц волокнистыми
фильтрующими материалами и электроосаждение.
а. Фильтрация. По фильтрационному методу некото-
рый объем дымового облака просасывается через фиксацион-
ную трубку, набитую фильтрующим материалом. В качестве
фильтрующего материала употребляется стеклянная и обычная
вата, алигнин, бумага, асбест, фибра, шерсть и т. п. Сами фик-
сационные трубки изготавливаются ребристыми для устранения
проскока частиц по внутренней поверхности трубки.
Количество твердого или жидкого вещества, задержанного
фильтром, определяется по привесу фильтра. Зная привес
и объем прососанного дыма, можно легко вычислить весовую
концентрацию.
Измерение объема
прососанного дыма
производится при по-
мощи реометра с ди-
афрагмой или капилля-
ром. Для контроля за
полнотой осаждения
частиц дыма за фикса-
ционной трубкой поме-
щают упрощенный уль-
трамикроскоп или лю-
бое другое приспо-
собление, позволяющее
получать луч Тиндаля.
Общая схема уста-
новки для определения
весовой концентрации
фильтрационным мето-
дом изображена на
рис. 15.
Рис. 15. Схема установки для определения
весовой концентрации дыма методом филь-
трации:
1—дымоааа камера; 2— фиксационная трубка; 3— нравы;
4— колонка; S—реометр
б. Электрическое осаждение. Электрическое осаждение ды-
мов основано па следующих явлениях. Если два электрода,
между которыми может образоваться неоднородное поле (про-
волока и пластинка), соединены с источником тока высокого
напряжения, то при определенной величине напряжения прост-
ранство между электродами окажется ионизированным. Само
51
образование ионов обоих знаков будет происходить около про-
волоки (корона). Ионы, заряженные противоположно проволоке,
притянутся к ней. Ионы одного знака с проволокой создают
между электродами электронный ветер, передвигаясь к другому
электроду. Пропущенные между электродами дымовые частицы
абсорбируют большое количество ионов и, зарядившись, стре-
мятся, двигаясь с электронным ветром, осесть на электродах,
заряженных противоположно знаку зарядов, абсорбированных
частицами ионов. Главная масса дыма оседает во время элек-
трического осаждения не на проволоках, а на пластинках.
Для целей электрического осаждения могут употребляться
переменный и постоянный токи высокого напряжения. В слу-
чае постоянного тока возможно получение положительно и
отрицательно заряженной короиы. Оптимальным является случай
отрицательной короны.
При переменном токе оседание аэрозольных частиц происхо-
дит медленнее, чем при постоянном.
Лабораторные дымовые электроосадители, носящие назва-
ние аппаратов Коттреля, работающие, например, от
катушки Румкорфа, описаны в ряде работ. На рис. 16 пока-
чана трубка Толмэна и Прибор Гуревич — Лучинского. Послед-
Рис. 16. Лабораторные
аппараты Коттреля:
а—трубка Толмана; б—при-
бор Гуревич—Лучинского.
рис. 17. Микроэлектрофильтр
Предводнтел ева — Блинова:
1—стеклянный цилиндр; 2—отввр-
стае в циляадре; 3—япш;4— съеЯнаа
метахаичеслМя пластинка для оседа-
ния пыли; 5—абоннтоны* диск;
6--клемма,- 7—пружины.
ний является особо пригодным для изучения маскирующих
дымов. В этом приборе одним из электродов служит платино-
вая (проволочка, впаянная в стекло. В качестве второго электрода
52
употребляется алюминиевая фольга, обертываемая снаружи
аппарата Коттреля.
На рис. 17 показан электрофильтр Предводителева— Бли-
нова.
В приборе Уайтлоу-Грея электроосаждение комбинируется с
фильтрацией. Этот прибор представляет собой фиксационную
трубку с впаянными й ее стенки • проволочками, соединенными
с источником тока высокого напряжения.
Определение весовой концентрации в аппаратах Коттреля
производится, так же как при Зшльтрации, двукратным взве-
шиванием аппарата и делением полученного привеса на объем
пропущенного дыма. Схема установки для определения весовой
концентрации методом электроосаждения показана на рис. 18.
Для регулирования напряжения, подаваемого на полюса прибора,
служит реостат 4, включенный в первичную цепь катушки
Румкорфа 3. В правильно отрегулированной установке не
должно происходить электрического разряда между электро-
Рис. 18. Схема установки для определения весовой концентрации дымов
методом алектроосаждения:
I — дымов» камера; 2 — прибор Коттреля; 3 — катушка Румкорфа; 4 — реостат: 6 — акку-
мулятор; 6—упрошенный ультрамикроскоп; 7—трансформатор; 8 — склянка Тншеняо; 9 — ко-
лонка с ватой; 10 — реометр; 11 — зажим для регулирования тока дыма.
дами по внешней стенке аппарата Коттреля 2; весь ток должен
итти через стекло, образуя внутри прибора ионизированное
святящееся пространство. Допускаемая скорость просасывания
дыма зависит от ряда факторов и определяется обычно экспе-
риментально.
Разрушение дымового облака, происходящее при определе-
нии весовой концентрации методами электроосаждения и филь-
трации, нарушает равновесие между дисперсионной средой и
дисперсной фазой. Во избежание изменения в составе осажден-
ной дисперсной фазы необходимо воспрепятствовать ее сопри-
косновению с чистым воздухом. Для этого фильтры и аппараты
53
Коттрелл снабжаются специальными кранами или крышечками,
изолирующими внутреннюю часть аппарата от воздуха.
Вследствие малой весовой концентрации дымов и туманов
привес фильтров и аппаратов Коттреля не велик. Для получе-
ния достаточного привеса необходимо просасывать большие
количества дыма. Последнее не всегда возможно в лаборато-
рии, так как влечет за собой изменение условий существования
дыма. В то же время маленькие привесы могут привести к
значительным ошибкам в определении весовой концентрации.
Поэтому, если известен состав дисперсной фазы, то опреде-
ление весовой концентрации проводится путем аналитического
определения одного из
веществ, входящих в ди-
сперсную фазу, и после-
дующего пересчета. Осо-
бенно этот метод может
I
Ряс. 19. Термический
осадитель Уайтлоу-Грей:
I — нагретая стеклянная спи-
раль; 2—трубка, охлаждаемая
водой.
Рис. 20. Прибор Оуэнса:
л—и собранном виде; б—схема прибора Оуэнса: А—корпус
В—увлажнительна! трубка; С—насос. 1—крышка; z—кольцо,
3—основание; шель, ведущая в конденсационную камеру;
5—покровное стеклышко; б—пружина; 7—отверстие для ввив*
чиванпя насоса,
быть рекомендован для определения весовой концентрация
дымов с гигроскопичной дисперсной фазой, находящейся в рав-
новесии с влагой воздуха. Такой дисперсной фазой обладает,
как известно, большинство маскирующих туманов. Определив
влажность и температуру воздуха и зная, какой крепости
раствор кислоты или соли образуется при этих условиях, легко
вычислить из аналитически определенной концентрации кислоты
или соли весовую концентрацию дисперсной фазы.
в. Термическое и механическое осаждение. Из других мето*
дов определения весовой концентрации остановимся на терми-
ческом и механическом осаждении. При термическом
осаждении дым проходит между двумя поверхностями,
одна -из которых горячая, а другая холодная (рис. 19). При
достаточной разности температур между обеими поверхно-
стями частицы дыма количественно оседают на холодной по-
верхности.
Для определения весовой концентрации методом есте-
> ственного осаждения на дно сосуда, в котором предпо-
лагают получить дымовое облако, заранее вносят стеклянные
пластинки. После того как вся дисперсная фаза осядет иа дно
сосуда, пластинки вынимают и полученный осадок взвешивают.
Зная высоту сосуда и отношение площади пластин к площади
дна сосуда, вычисляют весовую концентрацию.
Метод естественного осаждения применим к грубодисперс-
ным аэрозолям с большой начальной весовой концентрацией.
Кроме того, необходимо, чтобы полученный аэрогель не
взаимодействовал о составными частями воздуха и не отличал-
ся по своему составу от дисперсной фазы дыма.
Для приблизительного определения весовой концентрации
дымов и туманов можно воспользоваться прибором Оуэнса,
схема которого изображена на рис. 20. Действие прибора
Оуэнса основано на механическом осаждении частиц диспер-
сной фазы при ударе их о твердую поверхность. Этот удар
происходит при просасывании аэрозоля через узкую щель, за-
крытую бумажным, стеклянным или целлулоидным кружком:
Полученная дорожка осевших частиц будет тем ярче, чем
больше концентрация дисперсной фазы и чем больший объеМ!
дыма прососан через щель. Составив предварительно шкалу
•стандартов, можно определять примерно весовую концентрацию
дыма.
Сравнение со стандартом может производиться визуаль-
но, при помощи микрофотоэлемента, под микроскопом (по ши*
рине дорожки) и т. п. Особенно пригоден этот метод для
дымов с окрашенной дисперсной фазой. Для бесцветных аэро-
золей бумажку, закрывающую щель, пропитывают веществом,
которое, взаимодействуя с осевшей дисперсной фазой, дает
окрашенные продукты реакции.
В случае сернокислотного тумана для пропитки ‘ берется
раствор конто и т. п.
г. Исследование химического состава дисперсной фазы
дисперсионной среды. Для определения химического состава'
дисперсной фазы используются методы определения весовой
концентрации. Дисперсная фаза, осевшая на фильтре или в
аппарате Коттреля, подвергается экстракции и последующему
химическому анализу. Зная весовую концентрацию, находят
процентное содержание в дисперсной фазе тех й.ти иных ве-
ществ.
Если дымовое облако состоит из частиц, не находящихся в
равновесии с влагой воздуха, то для определения химического
состава дисперсной фазы может быть применен метод естест-
венного осажданмя дыма на пластинках, внесенных в дымовое
облако.
Этот же способ используется в тех случаях, когда важен
не количественный состав дисперсной фазы, а интересно
только качественно. определить, с каким дымообразующим
веществом имеют дело.
Для химического анализа дисперсионной среды последнюю'
после выделения дисперсной фазы -пропускают через ряд по-
глотительных склянок. Главный интерес представляет содержа-
ние в дисперсионной среде веществ, вводимых в нее при
возгонке или распыле дымообразователем или полученных
в процессе дымообразования.
2. Определение числа, размеров и формы частиц
а. Определение частичной концентрации. Определение ча-
стичной концентрации дымов и туманов проводят или непо-
средственно в дымовом облаке, без отделения дисперсной фазы
от дисперсионной среды, или путем выделения дисперсной фазы
из дымового облака и подсчета числа частиц, заключавшихся а
некотором объеме. Каждый из этих способов обладает своими
преимуществами и недостатками и находит применение при
исследовании определенных дымовых систем.
Из методов непосредственного определения частичной кон-
центрации наибольшее значение имеет метод ультрами-
кроскоп и и.
Применение ультрамикроскопа позволяет обнаружить частицы
такой величины, которые уже не видны в обычный микроскоп.
Всякий дымовой ультрамикроскоп (рис. 21) состоит из ми-
кроскопа, кюветки для дыма и осветительной системы, напра-
вляющей луч света в кюветку, перпендикулярно тубусу микро-
скопа. Счетный объем, в котором производится подсчет числа
частиц, определяется, с одной стороны, площадью диафрагм,
вкладываемых в окуляр микроскопа, а, с другой стороны, спе-
циальной щелью, находящейся в осветительной системе, или
расстоянием между стенками кюветки.
Ультрамикроскопы с щелью представляют собой обычные
ультрамикроскопы Зигмонди-Звдеитопфа для жидких золей.
Ультрамикроскопы этого типа дают правильное значение ча-
стичной Концентрации, если исследованию подвергается грубо-
дисперсный дым, не требующий применения сильных источни-
ком света. При исследовании высокодисперсных дымов и тума-
ков, когда необходимо пользоваться источниками света боль-
56
: шой яркости, щелевые ультрамикроскопы дают преувеличен-
'> вые значения частичной концентрации. Причиной ошибок
является освещение частицами, лежащими внутри луча света
частиц, находящихся за его пределами.
Поэтому при исследовании высокодисперсных дымов поль-
зуются специальной дымовой кюветкой, в которой высота счет-
ного объема, как уже было сказано выше, определяется рас-
стоянием между стенками кюветки.
Второй метод определения частичной концентрации заклю-
чается в разрушении дымового облака, осаждении дисперсной
фазы и микроскопическом или ультрамикроскопическом подсче-
те осевших частиц. Проще всего осуществляется подсчет при
Рис. 21. Дымовой ультрамикроскоп:
А — ультрьмикроскопическак кювета; В—трубка, соедаваюшаа кювету С яшмовой камерой -
С— шмроскпа для наблюдений; D— оеветительви* объектив;В,,, Ел, Е, — щели: F— линза:-
О—вольтова дуга; Н—враииюшийса края; К — окаф с аальцем.
оседании дымовых частиц. Так как скорость оседания высоко-
дисиерсных дымов мала, то этот метод применим при употреб-
лении небольших столбиков оседающего дыма. Для подсчета
осевших частиц Паттерсоном и Кэвудом предложена специаль-
ная кювета, изображенная на рис. 22. Кювета состоят из двух
стеклянных пластинок, закрывающих в нужный момент отвер*
стае, сделанное в латунном корпусе. Таким образом получается
небольшой циливдр, ограничивающий столбик оседающего
дыма. Применяются кюветы с толщиной латунного корпуса от
2 до 10 мм. Успех метода определяется тщательностью поли-
ровки стекол и отсутствием на иих царапин и загрязнений.
Подсчет осевших частиц производится при помощи микроскопа
в темнопольиом освещении.
Для исследования высокодисперсных систем дымовые ча-
стацы предварительно вводят в камеру, в которой происходит
адиабатическое расширение воздуха. Увеличившись в своих
57"
^размерах, дымовые частицы оседают с большей скоростью.
Число частиц, осевших на определенной площади, подсчиты-
вается при помощи микрометра. На этом принципе основан
прибор Айткена.
Помимо естественного оседания выделение дисперсной фазы
из дымового облака для определения частичной концентрации
может производится искусственно.
Не останавливаясь на всех способах, отметим лишь электри
ческое осаждение и резкий удар частиц о твердую поверхность.
Подсчет частиц, осевших вследствие электрического осаждения.
осуществляется в микроэлектрофильтре Блинова.
На принципе удара о твердую поверхность построен счетчик
пыли Оуэнса.
Устройство микроэлектрофильтра Блинова и прибора
Оуэнса описано выше. Для определения частичной концентра-
ции пылевая дорожка прибора
Оуэнса и микроэлектрофильтра
рассматривается в микроскоп.
При помощи окулярного ми-
крометра на нескольких не-
больших участках производится
точный подсчет числа осевших
частиц. В приборе Оуэнса под-
счет частиц производится по-
перек дорожки. Из этих дан-
ных, зная размер подсчитанных
участков, общую площадь, за-
ИРис. 22 Кювета Патерсона и Кэвуда: ИЯТУЮ всем« осевшими части-
-7 и 2 стекл1яые пластинки; 3 - латунная ЦЗМИ, И объем ПрОСОСаННОГО
пластинка; 4 -отверстие. ВОЗДуХЭ, ВЫЧИСЛЯЮТ ЧЭСТИЧНуЮ
концентрацию аэрозоля.
б. Исследование формы и агрегатного сосотояния частиц
дисперсной фазы. Изучение формы и агрегатного состояния
частиц дисперсной фазы производится путем микроскопиче-
ского рассмотрения частиц, осевших на внесенную в дымовое
облако стеклянную пластинку. Если структура дымового обла-
ка представляет интерес, то полученный препарат фотогра-
фируют.
в. Определение размеров дымовых частиц. Определение
среднего размера дымовых частиц может производиться счет-
но-весовым способом. Деление весовой концентрации на ча-
стичную дает среднюю массу частицы, из которой, считая
частицы сферическими и зная их плотность, легко вычислить
средний радиус.
Для нахождения действительных размеров частиц и кривой
распределения пользуются другими методами.
При исследовании грубых, твердых частиц наиболее про-
стым является метод непосредственного определения размера
частиц, осажденных на стекле или иной прозрачной поверхно-
сти. Для удобства определения размеров Паттерсоном предло-
58
жен специальный окулярный компаратор, иа котором вытравле-
ны кружки, соответствующие частицам определенных размеров.
Микроскопическое определение размеров осевших капелек
тумана весьма трудно, так как капельки расплываются на стек-
ле или иной поверхности.
Для устранения расплывания Фукс предложил производить
осаждение капель серной кислоты на слой парафина, а капель
воды — на слой американского вазелина с минеральным
маслом.
Важнейшим методом определения размеров дымовых частиц
является метод, основанный на движении частиц под действием
силы тяжести и электрического поля. Оседание частиц в поле
силы тяжести подчиняется уравнениям Стокса и Миллекена-
Кнудсена-Вебера. Измеряя скорость оседания, можно опреде-
лить величину дымовых частиц. В достаточно концентрирован-
ных и грубых дымовых облаках с частицами порядка 0,5—1 р
скорость оседания может быть определена путем измерения
понижения верхней границы дымового облака. Метод измере-
ния скорости понижения верхней границы не позволяет опреде-
лить истинные размеры, а дает величину наименьших, падаю-
щих медленнее всех частиц. Кроме того, этот метод применим
только к дымам о большой весовой концентрацией, так как для
получения резкой границы дыма и чистого воздуха необходи-
мо, чтобы уд. вес дымового облака превышал уд. вес чистоги
воздуха.
Более точное Определение размеров дает измерение скоро-
сти оседания отдельных частиц в поле силы тяжести. Для
одновременного измерения скорости оседания ряда частиц их
заставляют колебаться в переменном горизонтальном электриче-
ском поле. Засняв траекторию движения частиц и зная период
колебания поля, можно определить скорость падения и разме-
ры частиц.
Основными недостатками метода определения размеров
частиц дымов, основанного на их осаждении, является неприло-
жимость его к частицам, участвующим в броуновском движе-
нии, а также рыхлая структура и нешарообразная форма агре-
гатиков дыма и испарение капелек тумана.
Рыхлая структура и незнание истинной плотности дымовых
частиц не позволяют точно вычислить радиус, а пользование
плотностью вещества в макросостоянии приводит к преумень-
шенным размерам частиц.
Нешарообразная форма частиц не позволяет применить урав-
нение Стокса.
3. Исследование маскирующих свойств
а. Определение прозрачности и коэфициента ослабления
света. Для исследования прозрачности дымов и туманов в раз-
личных областях спектра и определения коэфициента ослабле-
4* 59
ния света производится измерение интенсивности параллельного
пучка света, прошедшего через слой дыма определенной тол-
щины.
Как указывалось выше, интенсивность света, входящего в
дымовое облако, /о связана с интенсивностью света I, ^прошед-
шего слой дыма в d единиц длины, уравнением Ламберта:
где К — коэфициент ослабления света;
е — основание натуральной системы логарифмов.
Из уравнения Ламберта коэфициент ослабления света:
ts_____7
dlge •
Непосредственное измерение интенсивности света произвол
дится при помощи фотометра или фотоэлементов. При изме-
рении в инфракрасной области и ультрафиолетовой области-
применяют термоэлементы, сенсибилизированные соответ-
ствующим образом фотопластинки и т. п. Выделение необхо-
димого спектрального участка достигается при помощи свето-
фильтров. При более точных измерениях употребляются
спектрофотометры. В качестве источников света в видимой
области спектра пользуются обычными лампами и стеклянной
оптикой.
Для инфракрасной области применяют штифт Нернста,
раскаленные металлические спирали и т. п.,< помещаемые
в фокусе параболического зеркала.
Схема лабораторной установки с фотоэлементом, служащей
для измерения суммарного коэфициента ослаблением света
в видимой области спектра, изображена на рис. 23. На этом
рисунке 1 — дымовая камера, 2 — лампочка, 3 — линза, соби-
рающая лучи света н направляющая в камеру параллельный
пучок света, 4—фотоэлемент, 5 — гальванометр, служащий
для отсчета показаний фотоэлемента.
Определение коэфициента ослабления света на этой уста-
новке производится следующим образом. Вначале фиксируют
положение стрелки гальванометра в том случае, когда камера
не заполнена дымом. Полученная на шкале цифра прини-
мается за интенсивность света, входящего в дымовое облако.
Затем камеру наполняют дымом и вновь фиксируют положе-
ние стрелки гальванометра, которое соответствует интенсив-
ности луча, прошедшего через слой дыма. Из полученных
значений интенсивности света по формуле Ламберта вычи-
сляется коэфициент ослабления света.
Вместо фотоэлементов для измерения интенсивности света
можно использовать ступенчатый фотометр Пульфриха, шкала
to
других типов. Фотоэлектрические и
Рис
23. Лабораторная установка для определе-
ния коэфициента ослабления света:
1—дымовая камера; 2—лампочка; 3—линза: 4—фотомемект
5—гальванометр; б—амперметр; 7—реостат; 8—батарея-
которого соответствует в условных единицах интенсивности
,света.
Произведя аналогично установке с фотоэлементом (изме-
[ рение с камерой, не содержащей дыма, и с камерой, запол*
[' неиной дымом, находят коэфициент ослабления света.
| Для определения коэфициента ослабления света приме-
l-няются также фотометры
| ^фотометрические ме-
I тоды используются
I in для определения
(коэфициента осла-
бления света при-
ходных туманов.
$ б. Определение
I дальности видимо-
1<сти. В густых дымах
туманах дальность
| видимости опреде-
I ляется иепосредст-
I венным измерением
|го расстояния, иа
•тором рассматриваемый предмет перестает быть видн-
ом. Лабораторные установки для определения дальности
димости состоят из дымовой камеры, приспособления для
редвижения предмета и соответствующего освещения. При-
особлеиие для передвижения предмета представляет собой
скоиечный ремень, винт или рейку со шкалой, позволяющей
считывать расстояние, иа которое удален предмет от
блюдателя. В качестве предмета используется белый или
риый экран, электролампочка определенной мощности, кон-
рукциии цвета и т.п. При определении дальности видимости
лого или черного экрана дымовая камера равномерно осве-
ается со всех сторон или только сверху. Определение даль-
сти видимости электролампы производится в темноте, причем
дальность видимости принимается расстояние, на котором
ть электролампы нельзя отличить от окружающего слоя
мана). Так, например, при методе Вильсона и Вудворта опре-
i^uiflaacb дальность видимости 25-ваттной лампочки; при
’•Методе Мюллера — электролампочки, помещенной в синий
^стеклянный колпак, пропускавший только голубые и фиолето-
вые лучи спектра. Ватсон и Киблер определяю^ дальность
видимости круглого белого экрана, освещенного сверху;
Вейцер — квадратного черного экрана, равномерно освещаемого
со всех сторон, и т. п. Так как дальность видимости в значи-
тельной степени зависит от индивидуальных особенностей
наблюдателя, необходимо все измерения производить при стро-
гом соблюдении нижеследующих условий. Помещение, в кото-
ром находится дымовая камера, должно быть затемнено;, все
застекленные окошечки дымовой камеры, за исключением того,
через которое производится наблюдение, должны быть заклеены
61
черной бумагой; определяют момент появления предмета (нити
лампы) и момент его исчезновения низ полученных результатов
берут среднее значение; наблюдатель, производящий измерение,
обладает нормальным зрением и т. п.
В полевых условиях (густые естественные туманы, маски-
рующие дымовые завесы) для определения дальности види-
мости нет необходимости в каких-либо установках. Дальность
видимости измеряется шагами, метром и т. п. Объектами
наблюдения служат природные предметы: дерево, дом, лес.
Можно также определять расстояние, на котором перестает
быть виден человек, горящий фонарь и другие предметы.
К. ЧАСТЬ ВТОРАЯ
И/
ДЫМООБРАЗУЮЩИЕ ВЕЩЕСТВА
ГЛАВА VI
| ОБЩАЯ ХАРАКТЕРИСТИКА ДЫМООБРАЗУЮЩИХ
№ ВЕЩЕСТВ
И I. Основные понятия о дымообразующих веществах
г"
Аэрозольное, как и вообще коллоидное состояние, не свя-
зано с каким-либо определенным химическим классом веществ,,
а свойственно любому из них. Однако при попытке получить
-маскирующий дым или туман приходится встречаться с весьма
большими трудностями при осуществлении способа получения
или с невозможностью, в узком интервале естественных тем-
ператур, сохранить полученный аэрозоль. И только небольшая
группа веществ, обладающих определенными физическими и
химическими свойствами, позволяет легко получить из них
маскирующий дым или туман. Практика получения маскирующих
дымов ставит два условия для возможности использования
веществ с этой целью: 1) простота способа перевода веществ
в аэрозольное состояние и 2) устойчивость полученного
дымового облака. Способность вещества удовлетворять -
этим двум условиям определяется его физическими свой-
ствами и химической природой. Используя эти соображения,
можно дать следующее определение понятия дымообра-
зующих веществ: дымообразующими веществами или дымооб-
разователями (ДВ) называются химические веществ^, дающие
при введении в атмосферу устойчивый дым или туман, приме-
няемый благодаря своим оптическим свойствам для маскировки
и ослепления.
Этим определением будут охватываться все вещества, само-
прозвольно дымящие на воздухе, а также вещества, для полу-
чения из которых дыма необходима затрата некоторых незна-
чительных усилий. Эти усилия сводятся к ускорению введения
дымообразующего вещества в атмосферу в большом коли-
честве. Так как практика маскирующего дымообразоваиия ис-
пользует почти исключительно конденсационные методы полу-
чения дымов, то, очевидно, что под введением в атмосферу стадо •
^.понимать испарение. Испарение во всех случаях применения
дымообразующих веществ может быть ускорено с помощью на-
гревания или распыления.
Некоторые дымообразователи, как олеум, хлорсульфоновая
кислота, находят также применение, не связанное с целями мас-
кирующего дымообразоваиия. Применяются они как 'полупро-
дукты или как вспомогательные материалы в различных хими-
ческих производствах, причем их способность к дымообраэованию
.является при работе с «ими тяжелой помехой, а не полезным пре-
имуществом. Дымообразователи полуядовитого типа приме-
няются для борьбы с вредителями сельского и лесного хозяй-
ства. Имеются попытки использования дымообразующих веществ
для оптической рекламы, сигнализации, с декоративными целями
и в качестве средства, задерживающего теплоотдачу и тем
защищающего растения от морозов.
2. Классификация дымообразующих веществ
Б основу предложенной авторами этой книги классификации
.дымообразующих веществ положены процессы, происходящие
при получении дыма. Получение дыма по использующемуся в
практике маскирующего дымообразоваиия коидеисационному
методу состоит из введения дымообразующего вещества в воз-
.дух в виде пара, образования пересыщенного пара и конденса-
ции последнего в капельки тумана или частицы дыма.
Образование пересыщенного пара и его конденсация могут
происходить вследствие главным образом трех различных причин:
1) охлаждения паров дымообразователи, первоначально вве-
денных в атмосферу сильно нагретыми;
2) химического взаимодействия между парами дымообразо-
вателя и влагой воздуха о образованием веществ с малой упру-
гостью пара;
3) химического взаимодействия между парами дымообразо-
вателя и кислорода воздуха с образованием также мало лету-
чих веществ.
Соответственно этим причинам конденсации все дымообра-
зователи делятся на три основные группы. Каждой из этик
групп соответствует определенный способ введения дымообра-
зователя в атмосферу.
В первую группу объединяются вещества, дающие дым
при охлаждении теплых паров в результате различных методов
возгонки. Вещества, дающие дым в результате возгонки, отно-
сятся к различным химическим классам (аммонийные соли,
углеводороды, органические кислоты). Так как они не разла-
гаются при довольно высокой температуре, пары их вводят
в атмосферу при сильном нагревании так, чтобы при дальней-
шем охлаждении получалось значительное пересыщение. К этой
Же группе веществ относятся металлохлоридные смеси, состоя-
щие из металла (цинк) и хлорсодержащего вещества (гексахлор -
этан). Дымообра зова гелем здесь является хлорид металла, пары
которого образуются при нагревани смеси и, конденсируясь,
дают дым.
Вторую группу составляют вещества, дающие дым в
результате реакции своих паров с влагой воздуха: серный
ангидрид, хлорсульфоновая киёлота, четыреххлористый титан,
четыреххлористый кремний и другие неорганические хлоранги-
дриды. Вещества этой группы представляют собой летучие
жидкости (хлорсульфоновая кислота, четыреххлористын титан),
реже твердые, но тоже летучие вещества (серный ангидрзд),
Все они весьма гигроскопичны и .реагируют с водой довольно
бурно, причем в числе продуктов реакции всегда находятся
продукты с малой упругостью пара. Вещества, дающие дым при
реакции с влагой, применяются непосредственно в качестве
индивидуальных дымообразова1телей или в смеси с другими
веществами, которые могут быть или подобно им дымообразую-
щими или же, напротив, инертными. Поскольку в воздухе
всегда имеются водяные пары, дымообразователи этой группы,
как довольно летучие, дымят в воздухе самопроизвольно.
Однако в результате этого самопроизвольного дымления во
многих случаях, дым образуется весьма слабый. Это объясняется
исключительно тем, что в атмосферу в единицу времени вводится
очень малое количество паров дымообразователи. Поэтому
для использования таких дымообразователей нельзя ограни-
чиваться их способностью самопроизвольно дымить, а следует
искусственным образом повышать скорость введения дымообра-
зователя в атмосферу, т. е. его испарения. Техника дымообра-
зования, используя эти вещества, и стремится только обеспечить
достаточную скорость испарения их, предоставляя процессу
образования дыма в атмосфере итти в основном самопроиз-
вольно.
Однако в некоторых случаях техника применения этих
дымообразователей не ограничивается только их испарением, а
стремится воздействовать иа самый процесс образования дыма
путем одновременного введения bi атмосферу вспомогательных
веществ, реагирующих с ббльшим эффектом, чем водяные
пары. К таким вспомогательным вещества^ относится, напри-
мер, аммиак.
.Третью группу составляют вещества, дающие дым в
результате горения. Существует много веществ!, которые спо-
собны реагировать с кислородом воздуха с образованием
продуктов реакции, пересыщающих своими парами пространство
и конденсирующихся bi силу этого в частицы дыма или тумана.
Однако из имеющих практическое.значение веществ единствен-
ным предствителем этой группы является фосфор. Харак-
терными, но не имеющими практического значения примерами
из этой группы, будут некоторые металлорганические соедине-
ния, в частности цинкэтил; пары цинкэтила, воспламеняясь в
воздухе, образуют пары окиси цинка, которые конденсируются^
образуя частицы белого дыма. Для получения дыма горючие
дымообразователи могут быть применены непосредственно.
5 Зак. 318J. Вейнер и Лупинский. 65
Ко второй и третьей группам примыкают также д ымооб-
разующие системы из двух веществ, каждый из которых
порознь может и не быть дымообразующим. Примером таких
систем является система: хлористый водород + аммиак. В-
результате реакции между этими двумя газами образуется дым
хлористого аммония.
3. Требования, предъявляемые к дымообразующим веществам
Выше уже было указано, что двумя основными условиями
применения дымообразующих веществ! являются простота спо-
соба получения дыма и устойчивость полученного дымового
облака. Этим двум основным условиям удовлетворяют у разных
, групп дымообразователей различные химические и физические
свойства.
Поэтому предъявление требований к дымообразователям как
химическим веществам должно быть разграничено по группам
дымообразователей. Однако есть ряд общих требований, сво-
дящихся к следующему.
Пвысокая маскирующая способность, хара-
ктеризуемая концентрацией дымообразующего вещества в атмо-
сфере, достаточной для невидимости предметов; чем меньше
эта концентрация, 'тем лучше маскирующие качества;
2) высокая дымообразующая способность,
под которой понимается отношение количества дисперсной'
фазы полученного дыма к количеству затраченного дымообразова-
теля;
3) неядовитость вещества. Отсутствие ядовитости
является элементарным условием маскирующего дымообразова-
ния, позволяющим находиться в дымовом облаке стороне, осу- *
ществляющей дымопуск;
4) неизменяемость, удобство и безопас-
ность при хранении, перевозке и работе;
5) дешевизна и возможность массового изготовления
из отечественного сырья.
а. Требования к веществам, дающим дым при реакции с
влагой. Вещества, образующие дым при реакции своих паров с
влагой воздуха, находятся до своего применения в оболочках
в жидком и редко в твердом состоянии. Следовательно, в мо-
мент боевого применения вещества должны быть переведены
в парообразное состояние, которое и является их боевым со-
стоянием. Очевидно, .что концентрация дыма будет опреде-
ляться концентрацией паров дымообразователя и (возможностью
ее создания за короткий срок. Возможность своевременного
образования таких концентраций определяется летучестью ве-
щества и свойствами, обеспечивающими удобство его приме-
нения.
Наиболее важным условием процесса дымообразования яв-
ляется возможность введения большого количества паров ды-
мообразователя в атмосферу в единицу времени. Следовательно,
66
свойством дымообразователя, обусловливающим успех процесса,
является летучесть или, вернее, скорость испа-
рения (высокая испаряемость). Это свойство определяется в
первую очередь величиной упругости пара дымообразова-
теля. Можно смело сказать, что при прочих равных условиях
качество дымообразователя тем лучше, чем больше упругость
его паров. Во вторую очередь скорость испарения определяется
величиной коэфициента диффузии. Таким образом,
требуется, чтобы дымообразователь обладал большой упру-
гостью лара и большим коэфициентом диффузии. В некоторой
степени испаряемость вещества обусловливается также малой
теплотой испарения.
Для облегчения и ускорения испарения дымообразователей
они подвергаются распылению или разбрызгиванию из аппара-
туры, предназначенной для применения жидкостей. При этом
необходимо, чтобы дымообразователи не замерзали и оста-
вались подвижными. Таким образом, требуется, чтобы дымо-
образователь обладал низкой температурой плавления и малой
вязкостью. Конечно, это не относится к дымообразователям,
применяемым в твердом порошкообразном виде; эти дымообра-
зователи должны легко измельчаться в порошек и в порошко-
образном виде не слеживаться, не спекаться и легко раз-
веиваться.
Ход процессов образования дыма в атмосфере можно назвать
успешным, если дымообразователь использован полно и дым
получился устойчивым. Это определяется, главным образом,
свойством продуктов реакции дымоообразователя с водой. Наи-
более важным условием успешного завершения процесса обра-
зования дыма является малая летучесть продуктов реакции
дымообразователя с водой. Если это условие не будет соблю-
дено, то часть продуктов останется в газовой фазе, не конден-
сируясь, или же будет переходить в газовую фазу из дис-
персной.
Важным условием, определяющим в значительной мере ды-
мообразующую способность, является также гигроскопичность
продуктов реакции дымообразователя с водой. При поглощении
образовавшейся дисперсной фазой добавочного количества
влаги из воздуха происходит приращение концентрации дыма
и, следовательно, увеличивается его дымообразующая и маски-
рующая способности.
6. Требования к горючим дымообразователям. Наиболее
важно при применении горючих дымообразователей, чтобы
температура воспламенения дымообразующего вещества была
достаточно низкой. Низкая температура воспламе-
нения дает возможность без затраты особых усилий полу-
чать дым при соприкосновении дымообразователя с воздухом.
В этом отношении очень удобны самовозгорающиеся вещества.
Однако последние (например, фосфор) небезопасны и требуют
особых мер предосторожности при хранении, перевозке и работе.
5* • 67
Возможность полного использования дымообразователя и
получения устойчивого дыма определяется главным образом
характером реакции дымообразователя с кислородом и свой-
ствами продуктов реакции. Наиболее важными условиями ус-
пешного завершения процесса образования дыма являются
присоединение б о л ьш о г о к о л и ч е ст в. а кисло-
рода при реакции горения и малая летучесть продук-
тов горения. Эти условия обеспечивают получение большого
количества дыма из затраченного дымообразователя и устойчи-
вость полученного дымового облака.
Гигроскпичность продуктов горения дымообразователя и
в данном случае является также важным условием повышения
дымообразующей способности, поскольку при поглощении об-
разовавшейся дисперсной фазой влаги из воздуха происходит
приращение концентрации дыма и, следовательно, для маски-
ровки становится необходимым уже меньшее количество ды-
мообразователя. _
в. Требования к возгоняемым дымообразователям. До своего
применения вещества, дающие дым при возгонке, находятся
в оболочках в твердом и иногда В' жидком состоянии. В мо-
мент боевого применения вещества должны быть переведены в
парообразное состояние, причем должна быть обеспечена воз-
можность создания в короткий срок больших концентраций
этих паров. Свойством дымообразователя, обуславливающим
успех процесса его возгонки, является высокая лету-
честь при температуре возгонки. Температура кипения или
полной диссоциации должна лежать ниже температуры, разви-
ваемой при применении. Это дает возможность полностью пе-
ревести дымообразователь в атмосферу.
Важным условием, определяющим в значительной мерс ды-
мообразующую способность, является также химическая
неизменяемость вещества при высоких температурах.
Свойством вещества, обусловливающим успешное завершение
процесса образования дыма, является малая летучесть
прн температурах дымообразоваиня. Это свойство обеспечи-
вает полноту использования дымообразователя и устойчивость
полученного дыма.
4. Дымообразующая способность
Дымообразующей способностью называется ве-
личина, показывающая, какая масса дисперс-
ной фазы дыма получается из единицы массы
дымообразователя. При произвольном количестве дымо-
образователя дымообразующая способность находится по фор-
муле:
D= —,
g
где D — дымообразующая способность;
g— вес взятого дымообразователя;
с — вес полученной дисперсной фазы дыма.
Чем больше дымообразующая способность, тем больше по-
лучается дисперсной фазы дыма и тем выше маскирующая спо-
собность дымообразователя. Дымообразующая способность за-
висит от коэфициента использования дымообразователя, т. е. от
количества его, перешедшего в дисперсную фазу, и от вторич-
ных процессов!, происходящих между дымообразователем и со-
ставными частями атмосферы.
Вещества,, реагирующие с влагой и о кислородом воздуха,
обладают дымообразующей способностью большей, чем единица.
Для веществ, у которых процесс дымообразования происходит
в результате их возгонки, значение дымообразующей способно-
сти обычно меньше единицы.
Для определения дымообразующей способности навеску
дымообразователя переводят в дымовой камере bi аэрозольное
состояние (при помощи распыления, подрыва или1 термической
возгонки). Затем одним из методов, описанных в гл. V, нахо-
дят весовую концентрацию дыма. Зная весовую концентрацию
и объем дымовой камеры, по вышеприведенной формуле вы-
числяют дымообразующую способность. Так как о дымовом
облаке непрерывно происходит процесс оседания, то для точ-
ного определения дымообразующей способности рекомендуется
произвести несколько определений весовой концентрации. По
полученным данным строят кривую зависимости весовой кон-
центрации от возраста дыма и значение, соответствующее ну-
левому моменту, используют для вычисления дымообразующей
способности.
5. Маскирующая способность
Важнейшим свойством, характеризующим дымообразующие
вещества, является их маскирующая способность. За, меру
маскирующей способности дымообразующих
веществ принят коэфициент ослабления света
дымового облака, полученного ири введении Г г
дымообразователя в 1 № воздуха. Выбор коэфи-
циеита ослабления. света в качестве меры маскирующей спо-
собности обусловливается тем, что-из всех факторов, от кото-
рых зависит дальность видимости предмета, только коэфи-
циент ослабления света является величиной, непосредственно ха-
рактеризующей дымообразующие вещества.
Пользуясь коэфициентом ослабления света и основным
уравнением теории видимости, можно легко определить кон-
центрацию и расход дымообразователя, необходимые для до-
стижения той или иной дальности видимости при определенных
условиях наблюдения.
В зависимости от метода и условий боевого применения
коэфициент ослабления света, полученного из одного и того
же количества дымообразователя, может меняться. В соответ-
ствии с этим при сравнительной оценке маскирующей способ-д у
носом дымообразующих веществ следует пользоваться зн<
нием коэфициента ослабления света, относящимся кг оп|
ленным условиям применения (коэфициент использования, от-
носительная влажность воздуха) и к определенным размерам
дымовых частиц. По данным полевых опытов средний размер
частиц маскирующих дымов1 и туманов лежит bi пределах
2 • 10-5—4 • 10-5 см. В этой области размеров частиц и необхо-
димо производить определение коэфициента ослабления света,
г Практически для определения маскирующей способности
в лабораторных условиях может быть рекомендован следующий
метод. В дымовой камере из определенной навески вещества
получают дымовое облако. Затем производят ряд последова-
тельных определений коэфициента ослабления света. По полу-
ченным результатам строится диаграмма, по оси абсцисс кото-
рой откладывается время существования дымового облака, а
по оси ординат — соответствующее значение коэфициента
ослабление света. Величина коэфициента ослабления света, со-
ответствующая нулевому моменту существования дымовой
системы, используется для вычисления маскирующей спо-
собности. Метод дает правильные результаты, если концентра-
ция дымообразователи не превышает 0,7 г/м3.
В практике военного дела пользуются понятиями «полная
маскирующая способность»1 и просто «маски-
р у ю щ а я‘с п о с о б н ос т.ь».
Полной маскирующей способностью называется
*•; коэфициент ослабления света такого дымового облака, которое
получено при введении 1 г дымообразователи в 1 м3 воздуха и
) при условии, что весь дымообразователь используется нацело.
| Полную маскирующую способность (ПМС) находят деле-
h нием экспериментально полученного коэфициента ослабления
В света К на концентрацию дымообразователи q2. Если в V м3
v воздуха введено g граммов дымообразователя, коэфициент
использования которого (в долях) Кп, то концентрация q бу-
х gK
дет равна , откулъ ПМС bi м*/г
пмс=^=-^-.
4 gK*
Полная маскирующая способность достаточно определенно
характеризует собой дымообразующее вещество. Однако
в большинстве случаев дымообразователь используется только
частично. Поэтому для практических расчетов пользуются по-
нятием «маскирующая способность», которая относится к оп-
•”*м<зму способу применения дымообразователя, опреде-
~ « т. п.
способностью называется коэфи-
а дымового облака, полученного при вве-
эльзуются термином «маскирующая эффек-
та речь идет о концентрации дымообразователя,
1учения дыма, а не о весовой концентрации дис-
фОЗОЛЯ.
дении 1 г дымообразователя в 1 № воздуха &• том случае,
когда дымообразователь используется не полностью.
Маскирующая способность равна произведению полной
маскирующей способности на соответствующий коэфициент
использования (выраженный в долях): .
МС = ПМС ХК„.
Пользуясь уравнениями теории видимости и зная полную
маскирующую способность, можно определить концентрацию
дымообразующего вещества, необходимую для достижения той
или иной дальности видимости.
Так, например, для черной поверхности дальность видимости
S и коэфициент ослабления света К связаны между собой
уравнением К • S = 4,4 (см. гл. IV, раздел 2). Воспользовавшись
этим выражением и заменив в уравнении для ПМС коэфициент
ослабления! света на дальность видимости, получим после
соответствующих преобразований:
g _ ___ 1 4,4
V ~'4 — ~S * ПМС-Л^ •
Из полученного уравнения следует, что концентрация дымо-
образователя обратно пропорциональна дальности видимости.
4 4
Величина п • , 'постоянная при заданных условиях наблю-
1 • <\ц
дения и определенном способе применения дымообразователя,
иосит название маскирующего веса и обозначается МВ.
Маскирующий вес представляет собой общее количество дымо-
образователя, приходящегося на единицу площади и достаточ-
ного Цля невидимости черного предмета. Если концентрация q
выражена в г/м3, а дальность видимости S в м, то маскирую-
щий вес относится к предмету, видимая площадь которого
равна 1 м2 и выражается в г/м3.
Соответствующие значения маскирующего веса могут быть
получены для серой поверхности, лампочки и т. п. Для этого
необходимо только . воспользоваться подходящим уравнением,
связывающим дальность видимости с коэфициентом ослабления
света. Уравнение видимости позволяет дать несколько иное
физическое определение полной маскирующей способности.
Действительно, если S = 4,4 м, g= 1 г и Кн = 1, то ПМС чис-
ленно равно объему дымовой завесы в м3, которая может быть
получена из 1 г дымообразователя при полном его использова-
нии и при условии, что дальность видимости черного предмета
в этой завесе равна 4,4 или, опять-таки для черного предмета,
площади (в мг) иепросматрийаемой дымовой завесы, толщиной
в 4,4 м. Аналогичное определение можно дать и маскирующей
способности. Только в этом случае коэфициент использования
будет меньше единицы.
Маскирующая способность и маскирующий вес некоторых
дымообразующих веществ и составов приведены в табл. 7.
71
Таблица 7
Маскирующая способность (МС) и маскирующий вес (МВ) некоторых,
дымообразователей при средней влажности
Дымообразователь МС ж’/г МВ г/лг»
Фосфор белый 13.G О.?4
Серный аигитрид Дымовой состав на основе антрацена и хлори- 12,6 0,35
стого аммония 1.9 2,3
Дымовой состав Ершова 0.7 6,3
» „ Берже 2,0 2,2
Четыреххлористый титан 6 0,73
Хлорсульфоиовая кислота Раствор серного ангидрида (40%) в хлорсульфо- 1,4 3,15
новой кислоте 2,8—3,7 1,57-1,19!
Дымовой состав НС на основе гексахлорэтана . 4,56 0,96
В американской литературе (Wilson, Woodwort, Prentis) за-
меру маскирующей способности дымов и туманов! принимается
не коэфициент ослабления света, ’а непосредственно дальность
видимости. .
Основной единицей является величина, обратная- дальности
видимости и называемая плотностью дымового
облака (обозначается буквой D):
Для вычисления плотности обычно измеряется дальность ви-
димости белого экрана или специальной 25-ваттн1ой лампы.
Вместо маскирующей способности в американской литературе
пользуются величиной суммарной кроющей способности, обо-
значаемой ТОП (TOP, total obscuring power) и равной плотности
дымового облака, образованного из расчета 1 кг дымообразо-
вателя иа 1 л3 воздуха:
g S g
D — плотность в лг1;
V — объем дымового облака в im3;
g — вес дымообразователя и кг;
S — дальность видимости в м.
В первых американских опубликованных работах при вычи-
слении ТОП ие учитывался коэфициент использования. В даль-
нейшем значения ТОП относятся к полному использованию ды-
мообразователя. . (
72
ТОП Нйсленно равна площади дымовой завесы с толщиной^,
равной дальности видимости белого .экрана или 25-ваттной
лампочки, которая может быть получена из 1 кг дымообразо-
вателя.
Величина, обратная ТОП, представляет собой маскирующий
вес для белого экрана или лампочки в кг/м2:
М =____J—
21 топ
Величины ТОП для 25-ваттной лампочки по Прентису при-
водятся в табл. 8.
Таблица 8
Суммарная кроющая способность (ТОП) некоторых дымо-
образователей
Дымообразователь ТОП м21кг Дымообразователь ТОП м2/к
Фосфор белый 1030 Хлорное олово 415
Четыреххлористый титан с. 680 Треххлористый фосфор с ам- 405
аммиаком миаком
Серный ангидрид 670 Хлорсульфоновая кислота с 360
Раствор серного ангидрида аммиаком
(40%) в хлорсульфоиовой 570 Четыреххлористый кремний . 335
кислоте Хлористая сера с аммиаком . 320
Хлористый водород с амми- 550 Хлорсульфоиовая кислота . . 310
аком Дымовой состав ВМ 310
Дымовой состав НС на осно- 470 Дымовой состав Берже . . . 280
ве гексахлорэтана Раствор чегыреххлористого 272
Четыреххлористый кремний титана в дихлорэтане • . .
с аммиаком 440 Хлористый сульфурил .... 268
Четыреххлористый титан . . . 435 Сырая иефть ........ 45
Олеум (30-50% SO3) .... 420
Мюллер в качестве величины, характеризующей маскирую-
щую способность, принимает
непосредственно дальность
видимости в темноте элек-
трической лампочки, поме-
щенной в синий колпак, про-
пускающий только голубые
и фиолетовые лучи спектра.
На рис. 24 представлены
данные Мюллера, получен-
ные при 90% относительной
влажности воздуха и при 0°.
По оси абсцисс на рис. 24
отложена концентрация ды-
мообразователя, по оси ор-
динат — дальность види-
мости.
Рис. 24. Маскирующие свойства дымообра-
зующих веществ по Мюллеру:
/—фосфор; 2—серный ангидрид; 3— четыреххлорястый
титан; четыреххлористый кремний; 5— хлорное олово.
73
ГЛАВА VII
ВЕЩЕСТВА, ДАЮЩИЕ ДЫМ ПРИ РЕАКЦИИ С ВЛАГОЙ
С водяными парами, находящимися в атмосфере, пары мно-
гих дымообразующих веществ реагируют с образованием дыма.
К этим веществам относятся серный ангидрид и многочислен-
ные неорганические хлорангидриды.
1. Серный ангидрид и олеум
Серный ангидрид, его соединение с водой — серная кислота
и его раствор в серной кислоте, называемый олеумом, являются
продуктами основной химической промышленности. Они произ-
водятся bi большом количестве как в военное, так и в мирное
время, и используются в военной и мирной промышленности.
Серный ангидрид и во время войны 1914—1918 гг. исполь-
зовался в Германии, имевшей . ограниченные запасы белого
фосфора, как основное нейтральное дымообразующее вещество.
Самостоятельно серный ангидрид применялся в дымовых снаря-
дах. Растворы серного ангидрида в сернистом ангидриде и
углекислоте применялись для дымопуска из баллонов. Растворы
серного ангидрида в серной кислоте и в хлорсульфоновой ки-
слоте использовались ® морском флоте для дымопуска с кораб-
лей и для постановки нейтральных дымовых завес с поверхно-
-сти моря. В настоящее время серный ангидрид и его растворы
находятся на вооружении многих иностранных армий.
а. Модификации серного ангидрида. Серный ангидрид,
или трех о к и сь серы, БОз, является кислородным соедине-
нием шестивалетной серы и может существовать в виде раз-
личных модификаций.
В газообразном состоянии молекула серного ангидрида имеет
нормальный состав SOs, на что указывает плотность газа, рав-
ная по воздуху 2,8. Газообразный серный ангидрид сжижается
при 45° в бесцветную прозрачную жидкость, которая также
имеет нормальный состав SO3. Однако эта жидкость может
быть устойчивой только при температурах выше -^25°; при
длительном же стоянии ниже этой температуры жидкий
серный ангидрид или a-форма переходит в p-форму, выде-
ляющуюся из жидкости bi виде асбестообразной массы с шел-
ковистым блеском. Серный ангидрид в виде JJ-формы вторично
не плавится и может быть снова превращен в a-форму только
путем перехода через газообразное состояние. При нагревании
твердой p-формы серного ангидрида происходит распад на мо-
лекулы простого SO3.
Последние исследования показали, что такого простого вза-
имоотношения между двумя формами в действительности нет,
что фактически существует большое число модификаций, при-
чем превращение этих модификаций друг в, друга сопровож-
дается в высшей степени интересными специфическими явле-
ниями. По данным Леблана и Рюле, Оддо и Смитса число мо-
дификаций серного ангидрида равно не двум, а четырем. Точки
74
плавления этих модификаций соответственно равны 14, 31, 62 и
95°. Модификации отличаются друг от друга упругостью паров
и при соответствующих условиях конденсации из парообраз-
ного состояния они могут быть изолированы в отдельности.
Работами Оддо установлено, что модификация, плавящаяся
при 14°, имеет простой состав SOs; эта модификация! при замо-
раживании образует призматические кристаллы, напоминающие
мрамор; в кристаллическом состоянии a-форма особенно охотно
переходит в другую, более высокоплавкую форму. Модифика-
ция, плавящаяся при 31° (p-форма), в твердом состоянии может
быть либо волокнистой, либо фарфоровидной. Процесс перехода
д-формы а другие, как установил Оддо, есть полимеризация
SOs, а исследования молекулярного веса ₽-формы показали,
что она имеет состав SsOe. Более высркоплавкие модификации
образуются при длительном хранении серного ангидрида. Они
могут быть хрупкими, стекловидными и парафинообразными.
Их состав, повидимому, еще более сложен.
Повышение точки плавления серного ангидрида идет парал-
лельна 6 уменьшением упругости пара и падением химической
активности. Наиболее высокоплавкая форма отличается хими-
ческой инертностью, малой упругостью пара и плохо дымит на
воздухе.
б. Физические свойства серного ангидрида. Наиболее хоро-
шо изучены физические свойства a-формы серного ангидрида.
В этой форме серный ангидрид представляет собой бесцветную
жидкость, замерзающую при + 14,3° в прозрачные игольчатые
кристаллы и кипящую при 45°. В табл. 9 приведены значения
плотности и вязкости серного ангидрида a-формы при различ-
ных температурах.
Таблица 9
Плотность и вязкость серного ангидрида при различных температурах
Температу- ра в°С Плотность в г]см? Вязкость в пуазах Температу- ра вС° Плотность в г/си2 Вязкость в пуазах
15 1,929 0,09445 40 1,840 0,01185
20 1,911 0,0395 45 1,808 —
25. 1,893 0,0248 50 1.781 - -
30 1,875 0,0182 60 1,728 —
35 1,857 0,01435 80 1,628 —
Критическая плотность серного ангидрида =217,6°) состав-
ляет 0,633. Зависимость плотности от температуры в пределах
15—46 ’ выражается формулой:
8,= 1,9972 — 0,003214/ —0,0000218/2.
Поверхностное натяжение серного ангидрида при 20° 33,9
дин/см и при 40° 29,9 дин/см.
Серный ангидрид (a-форма) чрезвычайно летуч. Упругость
его паров при различных температурах приведена в табл. 10.
78
Упругость паров серного ангидрида (a-форма) при
пературах
Таблица 10
различных тем*
Температура в °C Упругость пара мм рт. ст. Температура в ЭС Упругость пара ат
10 101,4 80 • 4,3
20 190,1 100 8,6
30 342,8 120 13.3
40 594,3 140 20,6
45 * 760 160 30,3
50 995 180 43,4
200 61,1
60 1520 217,6 83,7
Критическая температура 217.6°; критическое давление
83,7 ат. Зависимость упругости пара (в мм рт. ст.) от темпера-
туры (в пределах от 15 до 50°) выражается формулой:
lgp= 10,022----^1.
Скрытая теплота плавления серного ангидрида при — 30*
составляет 23,8 кал/г. Теплота испарения! 149 кал/г.
Жидкий серный ангидрид смешивается с серной кислотой
и с некоторыми хлорангидридами. Во многих случаях при это**
в растворах образуются определенные соединения. Подробности
о растворимости серного ангидрида в различных растворителях
будут изложены ниже. Твердые (полимерные) формы серного
ангидрида растворяются в тех же растворителях с большим
трудом. Растворение идет обычно чрезвычайно медленно, одна-
ко полученные растворы ничем не отличаются от смесей соот-
ветствующего растворителя с жидким серным ангидридом.
в. Химические свойства серного ангидрида. При нагревании
твердых полимерных форм серного ангидрида происходит дис-
социация на молекулы простого SOs. Испарение твердого поли-
мерного серного ангидрида также всегда сопровождается дис-
социацией, так как измерение плотности пара показало, что в:
газообразном состоянии молекула серного ангидрида имеет
состав SOs. При нагревании газообразного серного ангидрида,
имеющего, как указано выше, нормальный состав, происходит
его разложение на сернистый газ и кислород:
SO3 = SOa4-O.
Прн 400° диссоциирует 2%, при 700° 40%. Для разложе-
ния одной пра/ммолекулы сериого ангидрида требуется затра-
тить 23,1 ккал.
76
На металлы, в частности железо, при отсутствии влаги и
при обычной температуре серный ангидрид не действует. При
высокой температуре происходит заметная коррозия.
Иод, растворяясь в жидком серном ангидриде, окрашивает его в густо-
зеленый цвет вследствие образования соединения J(SOs)s.
При обработке серного ангидрида озоном образуется семиокнсь серы
SsOi. Расплавленный серный ангидрид растворяет серу с образованием
голубого раствора, нз которого может быть осаждено синее затвердеваю-
щее вещество — сесквноксид серы SsO». Селен н- теллур также раство-
ряются в сериом ангидриде, образуя соединения SeSO» и TeSOj. Серный
ангидрид воспламеняет фосфор, окисляя его:
Р< 4~ 10SO3 — Р^Ою 4- 10SO2.
Вообще серный ангидрид является сильным окисляющим средством; во
многих случаях он, отдавая кислород, восстанавливается до SOs.
Серный ангидрид чрезвычайно бурно соединяется с водой.
Реакция идет е образование^ серной кислоты и. выделением
большого количества тепла:
SO3 4- Н2О = H2SO4 4- 21 000 кал.
При внесении жидкого или твердого серного ангидрида в
воду реакция идет подобно взрыву с резким шипением и раз-
брызгиванием жидкости. Пары серно'го ангидрида
реагируют с парами вюды, тотчас же образуя ту-
ман серной кислоты. Вследствие способности энергично
соединяться с водой серный ангидрид действует водуотннмаю-
щим образом на многие растительные и животные ткани, отчего
последние обугливаются. Поэтому серный ангидрид опасен в
обращении и требует при работе с ним особой осторожности.
Твердые высокоплавкие формы серного ангидрида реагируют с
водой менее активно и обладают лишь слабым обугливающим
действием.’
Жидкий серный ангидрид смешивается во всех отношениях
с жидким сернистым ангидридом, а твердый серный ангидрид
хорошо растворяется в жидком сернистом ангидриде без обра-
зования .каких'-либо соединений. ,С окислами азота (NO, NsOs,
NO«, N2O5) серный ангидрид образует продукты присоединения.
Продукты присоединения SOs образуются также с мышьякови-
стым ангидридом.
Чрезвычайно энергично серный ангидрид соединяется с ос-
новными окислами и основаниями, образуя соли, хотя следует
указать, что абсолютно сухой SOs с также совершенно сухими
основными окислами не реагирует. Так, например, с окисью
кальция SOs образует сернокислый кальций, причем реакция
идет с выделением очень большого количества тепла:
СаО + SOs = CaSO* 4- 60 000 кал.
С хлористым водородом серный ангидрид реагирует с обра-
зованием хлоросульфоновой кислоты:
, SOs + НС1 = SO2(OH)C1.
77
Бромистый и иодистый водороды, а также их соли оки-
сляются при действии SO» с выделением брома и иода.
С аммиаком серный ангидрид реагирует с образованием
смеси твердых продуктов! — сульфамида, амидооульфоната
аммония и амидосульфоновой (сульфаминовой) кислоты:
SOs + 2NH» —SO2(NH2)2 + Н2О
SO3-+-NH3-> HSO3NHa.
SO3 4- 2NHS -> NH4SO3NHa.
Серный ангидрид присоединяется к различным кислотам, например,
серной, селеновой, борной, хромовой:
SO3+HsSO4->H2S2O7
Серный ангидрид взаимодействует со многими хлорангидридамн, при-
чем с некоторыми нз них он дает продукты присоединения (хлористый
нитрозил, хлористый сульфурил, хлорокись фосфора), с другими реагирует
с образованием, с одной стороны, хлористого сульфурила или пнросуль-
фурнла, с другой — оксихлоридов, сульфатов или окснсульфатов соответ-
ствующих элементов. Во всех случаях полимеры реагируют менее энер-
гично, нежели нормальный SOs.
На углеводороды серный ангидрид действует сульфирующим образом,
т. е. присоединяется с образованием сульфокислот:
СвН1« + SOs = CsHisSOsOH;
CsHs + SOs = CsHsSOsOH.
Сульфирующее действие серный ангидрид оказывает н при реакциях с не-
которыми замещенными углеводородов.
В четыреххлористом углероде н хлорформе серный ангидрид раство-
ряется, но прн этом идет медленная реакция с отделением, с течением
времени, фосгена и хлористого пиросульфурила. С хлористым ацетилом он
образует продукт присоединения.
Со многими органическими веществами, содержащими гидроксильную
группу, серный ангидрид бурно реагирует, проявляя прн этом себя как
водуотннмающее средство и как окислитель. Часто последствиями таких
реакций являются, с одной стороны, обугливание вещества н, с другой —
образование сернистого газа. е
г. Смесь серного ангидрида с серной кислотой (олеум).
Жидкий серный ангидрид смешивается с серной' кислотой во
всех отношениях, равно как и твердый серный ангидрид рас-
творяется, хотя и медленно, в серной кислоте. Независимо от
способа приготовления образуются растворы серного ангидрида
в серной кислоте, называемые олеумом. Состав олеума
может колебаться в широких пределах. Обычно технический
олеум содержит от 18 до 25% SO».
Чистый олеум бесцветен, однако часто вследствие обугли^
вания случайных органических примесей он бывает окрашен в
желтовато-бурый цвет. По своему химическому характеру
олеум во многом напоминает серный ангидрид и серную кисло-
ту. Он чрезвычайно бурно реагирует е водой, с хлористым во-
дородом образует хлорсульфоновую кислоту, сульфирует углево-
дороды и т. д.
Для полного представления о физических и химических
свойствах олеума мы рассмотрим здесь зависимость физиче-
ских свойств от .состава системы SO» — H2SO* и на основании
78
этой зависимости проанализируем химическое состояние дан-
ной системы. . \
Как уже было указано выше, серный ангидрид прекрасно»
растворяется в серной кислоте. Однако при охлаждении, иногда,
очень незначительном, может наступить разложение раствора
вследствие выпадения кристаллов. Температуры замерзания
(здесь имеется в виду температура выделения первых кристал-
лов или температура ликвидуса) смесей различного состава;
приведены в табл. 11.
Таблица 1Г
Температура замерзания смесей серного ангидрида с серной килотой
Содержание своб. SO3 в вес % Температура за- мерзания в °C Состав кристаллов
X га
0 (чистая H2SO4) 4-10,4 4
2 4-8,5 H2SO4
6 4-3,6
10 —2,5 H2SO4
14 -8,7 H2SO4
17,7 -14,3 H2SO4 SO3 • H2SO4
20 -9,4 SO3-H2SO4
30 --15,7 SO3 • H2SO4
40 --33.0 SO3-H2SO4
45 - -36,3 SO3-H2SO4
50 --28,7 SO3H2SO4
60 4-5,8 S03-H2SO4
62 4-ОД SO3 • H2SO4 4- 2SO3 • H2SO4
64.3 4-0,1 2SO3 • H2SO4 4- S2O6
70 4-12.1 S2O3
80 4-23,2 S2O6
кривой плавкости имеются две
Рис. 25. Диаграмма плавкссти системы:
SO.s—fi2SO4
диссоциации на SO3 и H2SO4.
Диаграмма плавкости — растворимости системы SOs — НгЗО«
изображена на рис. 25. Н;
эвтектические точки при тем-
пературе —14,3° и 4-0,1°
и одна дистектика при тем-
пературе 4-35,8°. Последняя
точка соответствует 50 мол.
% серного ангидрида и сер-
ной кислоты. Наличие ди-
стектической точки показы-
вает, что в системе обра-
зуется соединение SO3 •
• H2SO4, называемое пиросер-
иой кислотой. Характер кри-
вой доказывает, что уже при
плавлении пиросерная кис-
лота подвергается частичной
Характерно, что из смесей, богатых серным ангидридом^
кристаллизуется димерный серный ангидрид S2O6. Очевидно,
что при соблюдении условий, препятствующих полимеризации
79
серного ангидрида, кривая в этой области пойдет несколько
«иже (на рисунке изображено пунктиром).
Олеум представляет собой или смесь серной и пиросерной
кислот или смесь пиросерной кислоты с серным ангидридом.
Как уже указано, >пиросерная кислота в жидком состоянии
-частично диссоциирована на серный ангидрид и серную кислоту;
с повышением температуры увеличивается и степень диссоциа-
ции. При испарении же пиросерная -кислота диссонирует на-
цело. Таким образом, пары над олеумом могут состоять только
«з серного ангидрида и серной кислоты. Серная кислота при
обычных температурах практически нелетуча; тем более нич-
тожна будет упругость ее паров над олеумом. Следовательно,
пары над олеумом практически состоят только из серного анги-
дрида.
Как это следует из рассмотрения диаграммы плавкости,
только низкопроцентный олеум с небольшим содержанием сер-
rioro ангидрида является при температурах выше нуля жид-
костью. Высокопроцентный олеум, наиболее выгодный для при-
менения, представляет собой или твердое вещество или смесь
твердых кристаллов с жидкостью.
д. Получение серного ангидрида и олеума. Серный ангидрид
® очень незначительных количествах образуется при горении
серы. Также*в* весьма незначительных количествах и крайне
медленно серный ангидрид образуется при действии кислорода
на сернистый газ. В присутствии катализаНоров эта реакция
чрезвычайно ускоряется. Серный ангидрид образуется! также
при горении серы в озоне и при действии последнего на серни-
-стый газ.
Исходным веществом для технического получения серного
ангидрида является сернистый газ. Последний подвергается
окислению, которое в- технике осуществляется контактным спо-
собом. В результате этого окисления получают серный анги-
дрид, из которого могут быть получены как серная кислота, так
и олеум (раствор серного ангидрида в серной кислоте).
Сущность контактного метода производства серного анги-
дрида и олеума сводится к окислению сернистого газа на по-
верхности катализатора, ускоряющего ход реакции:
2SOaH-OaZ±2SOs.
Окисление сернистого газа в присутствии катализатора идет
-с достаточной скоростью при температуре 400—490°.-В резуль-
тате процесса контактного окисления получаются газы, содер-
.жащие пары серного ангидрида.
Для получения 100%-ного серного ангидрида остается лишь
. сконденсировать эти пары. Однако такая операция слишком
затруднительна вследствие того, что концентрация серного ан-
гидрида в газах очень мала. Парциальная упругость пара сер-
ного ангидрида в контактных газах составляет около 50 мм рт. ст.
Так как летучесть серного ангидрида очень высока, то для
того чтобы осуществить его конденсацию из газов, требуется
. 80
очень сильное охлаждение; кроме того, производительность та-
кой конденсационной системы слишком мала.
Только очень небольшая часть разбавленного газообразного
серного ангидрида, получаемого на контактных установках,
используется для получения 100 %-ного серного ангидрида.
Большая часть контактных гаэо® используется в промышлен-
ности для получения крепкой серной кислоты и олеума. Кроме
того, разбавленный газообразный серный ангидрид исполь-
зуется в производстве дымообразующих вещест®: хлорсульфо-
новой кислоты и различных растворов серного ангидрида.
В контактном сернокислотном производстве серный ангидрид
поглощают из контактных газов в башнях, называемых абсор-
берами, серной кислотой, причем получается олеум с содержа-
нием около 20—25% свободного серного ангидрида.
(Концентрированные или даже 100%-ные пары серного анги-
дрида могут быть получены двумя способами. Первый способ
представляет собой контактное окисление 100%-ного серни-
стого газа кислородом. Второй способ сводится к выделению
серного ангидрида путем нагревания олеума, пиросульфитов
щелочных металлов или сульфатов железа без доступа воздуха
извне.
Концентрированные пары серного ангидрида могут быть
использованы для получения концентрированных жидких смесей
или же для непосредственной конденсации. Конденсация паров
серного ангидрида осуществляется в хорошо охлаждаемых
-приемниках, температура в которых должна быть в пределах
15—25°. Из этих приемников серный ангидрид, в жидком .состо-
янии может быть непосредственно использован для целей сна-
ряжения или же упакован в железные герметически закрываю-
щиеся барабаны, в которых он затвердевает. Перед наполне-
нием тары необходимо следить за тем, чтобы она была абсо-
лютно суха.
Технический серный ангидрид представляет собой твердую,
белую, игольчатого строения массу с содержанием 96—100%
SOs. Его крупным недостатком является способность в процессе
хранения спекаться в сплошную массу, трудно поддающуюся
извлечению из тары и измельчению. Попытки получить гранули-
рованный, несиекающийся серный ангидрид пока успехом не
увенчались.
2. Хлорангидриды серы
а. Хлорсульфоновая кислота. Хлорсульфоновой кислотой
-называется продукт присоединения хлористого водорода к сер-
ному ангидриду. Строение хлорсульфоновой кислоты изобра-
жается формулой:
О ОН
4eZ
zs\
О С1
Зак. 3184. Вейцер и Лучинский.
81
Хлорсульфоновая кислота обладает кислыми свойствами
вследствие присутствия водорода, способного замещаться метал-
лом.
Физические свойства. Хлорсульфоновая кислота представляет
собой бесцветную, сравнительно подвижную и летучую, на воз-
духе сильно дымящую жидкость едкого запаха с температурой
замерзания —80° и температурой кипения 152,7°.
Плотность и вязкость хлороульфонювой кислоты при 20° со-
ответственно равны 1,753 и 0,0266 пуаза.
Плотность для различных температур может быть рассчитана
по формуле:
8г — 1,7847 — 0,001615 / 4- 1,21 • 10аГ2 — 4,1 • 10"»/3,
а вязкость — по формуле:
0.000698
1,<— vt — 0,5440 ’
где vt — уд. объем, вычисляемый по формуле расширения:
Vt = Vo(l 4-9,0505 • 10~4/4-1,1865 • 10~V2 2,394 • 1()-9/3).
Упругость паров хлорсульфоновой. кислоты при различных,
температурах по измерениям Г. П. Лучинского приведена в
табл. 12
Таблица 12 Упругость паров хлорсульфоновой кислоты при различных температурах
Темпера- тура в иС Упругость пара в мм рт. ст. Темпера- тура в °C Упругость пара в мм рт. ст. Темпера- тура в °C Упругость пара в мм рт. ст.
—10 0 . +ю 20 30 40 Упруго вычислена 0,32 0,69 1,63 2,93 5.0 8.4 эть пара по форму; 50 60 70 80 ' 90 100 Для разли ie: 13,6 ’ 21,3 32,5 48,5 71 101 чных тем! ПО 120 130 140 150 тератур м< 142 196 266 387 586 эжет быть
1 *7 2101,8
1g р — 7,6401 — •
Плотность пара по воздуху равна 4. %
Средняя теплоемкость хлорсульфоновой кислоты bi интервале
.температур от 15 до 80° равна 0,282 кал/°С. Скрытая теплота
испарения (при температуре кипения) 110,4 кал/г.
S2
Химические свойства. Хлорсульфановая кислота при нагре-
вании подвергается частичному распаду с образованием хлори-
стого сульфурила и серной кислоты:
2HSO3C1 = SO2CI2 + H2SO4.
Степень этого распада зависит от температуры и от дли-
тельности нагреваний. Уже при температуре кипения хлорсуль-
фоновой кислоты заметное ее количество подвергается распаду.
Этим объясняется тот факт, что при попытках перегонки хлор-
сулъфоновой кислоты продукт не столько очищается, сколько
загрязняется. При нагревании хлорсульфоновой кислоты в за-
паянной трубке до 170° в течение 72 час. распадается 44% ее.
Полностью хлорсульфоновая кислота распадается прн *гаком
же длительном нагревании при 220°. Реакция распада хлорсуль-
фоновой кислоты при высокой температуре идет с одновремен-
ным разложением хлористого сульфурила на сернистый газ
и хлор. Руфф изучил влияние различных катализаторов! на рас-
пад хлорсульфоновой кислоты. В качестве катализаторов им
были исследованы ртуть, сурьма, олово и их соли, а также соли
(хлориды и сульфаты) .висмута, платины, урана, золота, меди,
вольфрама, свинца, кобальта, магния, цинка, алюминия, железа,
кальция, натрия и калия. Катализаторы .брались в количестве
1% от взятой кислоты. В присутствии катализаторов, лучшими
из которых оказались ртуть и ее соли, затем сурьма, олово и'
их соли, разложение хлорсульфоновой кислоты идет гладко
уже при 70э. Выход хлористого сульфурила при нагревании
хлорсульфоновой кислоты до 70° в присутствии ртути и ее со-
лей достигает 90%.
Многие цветные металлы, как олово, медь, свинец, хлор--
сульфоновая кислота разъедает. С оловом реакция идет по
следующему уравнению:
Sn-!- 4HSOsCl = SnCl4 4- 2H2SO4 + 2SO2.
На железо и вообще черный металл в отсутствие влаги при
обычной температуре хлорсульфоновая кислота не действует;
при повышении же температуры они заметно корродируют1.
Вода действует на хлорсульфоновую кислоту моментально,
разлагая ее на серную и соляную кислоты:
HSO3C1 + НаО = H2SO4 4- НС1.
Эта реакция идет энергично и бурно и сопровождается вы-
делением большого количества тепла. С парами воды пары
хлорсульфоновой кислоты реагируют также. Вследствие этой
реакции хлорсульфоновая кислота и ее пары сильно разъедают
металлы. При действии на хлорсульфоновую кислоту пере-
кисью водорода образуются с небольшим тепловым эффек-
том сульфомоноперкислота (кислота Каро) и надсерная кис-
лота:
HSO3C14- Н2О2 = H2SO- 4- НС1;
2HSO.jCl 4- Н2О2 = H,S2Os -h 2НС1.
6*
83
Хлорсульфоновая кислота энергично реагирует со спиртами, отщепляя
хлористый водород и образуя алкилсериые кислоты:
ROH + HSO3C1 = НС1 + HSO3OR.
Наряду с этим идут и другие побочные реакции.
На ткаяи, древесину, кожу, резниу и т. п. хлорсульфоновая кислота
действует, как сильнейшее водоотнимаюшее средство, разъедающим и об-
угливающим образом. Пары ее обладают удушающим действием.
Соли хлорсульфоновой кислоты могут быть получены при действии на
хлористый натрий или калий хлорсульфоновой кислоты:
NaCl 4- HSO3C1 = NaSO3Cl + НС1
или паров серного ангидрида:
КС1 + SO3 = KSO3CI.
Получение. Хлорсульфоновая кислота получается путем не-
посредственного синтеза из серного ангидрида и хлористого
водорода:
S08-|-HC1 = HSO8C1.
Хлорсульфоновая кислота получается, кроме того, при дро-
пускании хлористого водорода через олеум:
H2SaO7 Ч- НС1 = H2SO4 -Ь HSO8C1
или при введении в олеум хлористого натрия:
H2SaO7 + NaCl = NaHSO4 4- HSO3C1.
Образование хлорсульфоновой кислоты происходит при взаи-
модействии олеума или серной кислоты с различными хлоран-
гидридами. Так, при действии пятихлористого фосфора на сер-
ную кислоту происходит реакция:
РС1Б -j- HaSO4 = РОС13+ НС1 + HSO3C1,
а при действии четыреххлористого углерода на олеум реакция:
HaS2O, + СС14 = СОС12 + 2HSOsCl.
Хлорсульфоновая кислота ’образуется также и при действии
на олеум серой и хлором или хлористой серой:
2H2SaO7 + S 4- 2С1а = 4HSOsCl 4~ SO2.
Получаемая по всем этим реакциям хЛорсульфоновая кис-
лота никогда ие бывает чистой, а всегда загрязнена примесью
хлористого пиросульфурила, причем с помощью перегонки ее
очистить ие удается. Чистую хлорсульфоновую кислоту можно
получить лишь путем прибавления серного ангидрида к безвод-
ному жидкому хлористому водороду при температуре около
-75—80°.
Исходными веществами для технического получения хлор-
сульфоновой кислоты в настоящее время являются газообраз-
ные серный ангидрид и хлористый водород.
м
По методам, применявшимся раньше, хлорсульфоновая кислота полу-
чалась взаимодействием хлористого водорода с серныц ангидридом, нахо-
дившимся в конденсированном состоянии: твердом или в виде раствора
(олеума).
Поступавший иа производство хлорсульфоиовой кислоты серный ангид-
рид разбивали иа куски и загружали в чугунные котлы, снабженные
вводной и отводной трубами. По вводной трубе, доходившей почти до
диа котла, пропускали сухой хлористый водород. Реакция прнсходила
с выделением большого количества тепла, так что весь серный ангидрид
быстро расплавлялся и труба, вводившая хлористый водород, погружалась
в жидкость. Избыток иепрореагировавшего хлористого водорода поступал
по другой отводной трубе в другой подобный котел. Таким образом, хло-
ристый водород проходил через целую батарею последовательно соеди-
ненных котлов. После окончания реакции, заметного по наступающему
охлаждению аппарата, полученная хлорсульфоновая кислота давлением
сжатого воздуха переводилась в сборник. На дне котлов оставалась часть
продукта. При новой загрузке сериый ангидрид в этом остатке быстро
растворялся, причем с введением хлористого водорода также наступало
разогревание. Описанный метод был неудобен тем, что приходилось про-
изводить операции извлечения и дробления сериого ангидрида, который
опасен в обращении, очень гигроскопичен и к тому же трудно измель-
чается. Здесь реакция по существу шла между хлористым водородом и
растворенным в хлорсульфоновой кислоте серным ангидридом.
Известен также способ получения хлорсульфоновой кислоты путем
абсорбции хлористого водорода 20%-иым олеумом в колоннах, работаю-
щих по принципу противотока, с последующей отгонкой хлорсульфоновой
кислоты в дестиллере особой конструкции. Существовал также способ по-
лучения хлорсульфоновой кислоты добавкой к олеуму поваренной солн.
Получавшаяся этим способом хлорсульфоиовая кислота отделялась от
бисульфата перегонкой. Способы получения хлорсульфоновой кислоты из
олеума в настоящее время применяются редко, так как неудобны и тре-
буют много топлива.
” Для производства хлорсульфоиовой кислоты в настоящее
время используется реакция между хлористым (водородом и
газообразным серным ангидридом, идущим непосредственно из
контактных узлов сернокислотных заводов в виде смеси с воз-
духом, содержащей 7% SOs. Образование хлорсульфоновой кис.
лоты происходит уже при смешивании газов. Практически про-
цесс ведут, смешивая газы в охлаждаемых башнях, в которых
образующаяся хлорсульфоновая кислота конденсируется.
Схема производства представлена на рис. 26. Газообразный
хлористый водород из соляно-сульфатных печей поступает
в керамиковый холодильник 1 и затем в сушильную башню 2, на-
сажденную кольцами Рашига, орошаемыми крепкой серной кис-
лотой. Сухой хлористый водород подается в чугунную башню 3
(также наполненную кольцами Рашига), куда одновременно по
трубе 4 вводится газообразный серный ангидрид. В башне
образуется хлорсульфоновая кислота, которая стекает вниз
в монтежю 5, откуда насосом 6 частично передается снова
в башню 3, а часть хлорсульфоновой кислоты выводится
как готовый продукт. Непрореагировавшие газы поступают
во , вторую башню 7, где реакция образования HSO3CI ‘за-
канчивается. Из этой б?шни газы, содержащие хлористый во-
дород (бывший в некотором избытке), идут в башню 8, где НС1
поглощается водой.
85
Техническая хлорсульфоновая кислота обычно бывает окра-
шена в желтый,' коричневый и иногда в черный цвет вслед-
ствие обугливания попавших в нее частиц органических ве-
ществ. Технический продукт содержит от 90 до 92% HSOsCl;
примеси: от 4 до 7% серной кислоты, около 3% хлористого
пиросульфурила и сульфурила и до 1 % серного ангидрида. Тара
для .хлорсульфоновой кислоты изготовляется из железа. На за-
водах хлорсульфоновая кислота хранится в железных баках-
хранилищах или монтежю, из которых может переводиться в
железные бочки. Транспортируется хлорсульфоновая кислота
в железных бочках или цистернах. Основным условием при
наполнении тары хлорсульфоновой кислотой должно быть пол-
ное отсутствие влаги.
Рис. 26. Схема установки для получения хлорсульфоновой кислоты
б. Хлористый сульфурил и хлористый пиросульфурил. Хло-
ристый сульфурил SO2CI2I можно рассматривать как продукт
замещения одного атома кислорода в простой молекуле
серного ангидрида на два атома хлора. Хлористый пиросульфу-
рил S2O3CI2 можно рассматриватьчкак продукт замещения атома
кислорода в удвоенной молекуле серного ангидрида на атомы
хлора. Оба эти вещества гидролизуются водой с образованием
соляной и серной кислот. Будучи в то же время достаточно
летучими, они способны дымить во влажном воздухе, хлори-
стый сульфурил — довольно слабо, хлористый пиросульфурил —
сильнее. Структурные формулы хлористых сульфурила и пиро-
сульфурила имеют следующий вид:
О
>S-CI
и 0 О
О С1 и О ।
X >-с|
ООО
86
Физические свойства хлористого сульфурила. Хлористый
сульфурил представляет собой бесцветную, прозрачную, по-
движную, летучую и слабо дымящую на воздухе жидкость с
едким удушливым запахом, напоминающим запах хрена.
Плотность и вязкость хлористого сульфрила при 20° соот-
ветственно равны 1,667 г/см8 и 0,00875 пуаза. Плотность для
разных температур может быть вычислена по формуле:
ог = 1,7081—0,002114-1,07 • Ю"^3—1,81. • Ю8/4.
Вязкость в пуазах вычисляется по формуле:
_ 0.000759
“ Vi — 0,5114 ’
где vt— удельный объем! в си8/г, который может быть вычи-
слен по формуле расширения:
^=t,0(l 4-0,00123065^4-7,5938 • 10~V24-4,587 . IO-»/3).
. Поверхностное натяжение при 13° — 35,26 дин/см‘, при
23,5е — 32,92 и при 47,5° — 28,40 дин/см.
Температура плавления хлористого сульфурила—54,1°; тем- *
лература кипения 69,4°. Упругость пара хлористого сульфурила
при 20° равна 106,5 мм рт. ст.
Зависимость упругости пара в мм рт. ст. от температуры вы-
ражается формулой:
1724,7
lg/> = 7,9176---
Плотность пара по воздуху 4,65. Теплоемкость SO2CI2
0,233 калР С, скрытая теплота испарения 49,45 кал/г.
Химические свойства хлористого сульфурила. При нагрева-
нии свыше 160° хлористый сульфурил диссоциирует на серни-
стый газ и хлор:
8О2С12—so24- PU-
Частичная диссоциация хлористого сульфурила происходит
под влиянием света 'даже и на холоду, вследствие чего при
хранении в стеклянной посуде он, сначала совершенно бесцвет-
ный, постепенно окрашивается выделяющимся хлором в жел-
тый цвет.
На железо при обыкновенной температуре хлористый суль-.
фурил не действует. При нагревании же, а также в присут-
ствии влаги хлористый сульфурил сильно корродирует железо.
Вода не растворяет хлористого сульфурила, но на холоду
способна медленно его разлагать с Ьбразованием серной и со-
ляной кислот:
SO2C12 4- 2Н2О = H2SO4 4- 2НС1.
Указание, что с, ледяной водой хлористый сульфурил дает
кристаллический гидрат, пока не подтвердилось. Так же сомни-
87
тельно указание на то, что при гидролизе малым количеством;
воды возможно образование промежуточного продукта — хлор-
сульфоновой кислоты:
SOaCl2 4- Н2О = НС14- HSOsCi.
Горячей водой хлористый сульфурил разлагается быстро.
Так же действуют растворы щелочей с образованием соответ-
ствующих солер.
С аммиаком хлористый сульфурил дает сульфамид, три-
сульфимид и иминосульфамид, с одной стороны, и хлористый
аммоний — с другой:
SOaCla 4- 4NH3 = SOa (NH2)2 4- 2NH4C1;
SO2 —NH
3SOaCl2 4- 9NHS = 6NH4C14- NH SO2
\о2—NH^
2SO,C12 4- 7NH3 = 4NH*C14- NH (SO2NH2)2.
В хлороформе и четыреххлористом углероде хлористый
сульфурил растворяется. Хлористый сульфурил хлорирует жир-
ные и жирноароматические углеводороды. При действии хлори-
стого сульфурила на спирты, в зависимости от соотношения
реагентов, получаются алкилхлорсульфонаты и алкилсульфаты.
Получение хлористого сульфурила. Наиболее просто хлори-
стый сульфурил может быть получен непосредственным синте-
зом из сернистого газа и хлора:
SO2 4- CI2 = SO2C12.
Однако только смешивания газов для реакции недостаточно.
Она идет или при действии света или при пропускании газов
через активированный уголь, или же в присутствии катализа-
торов, которыми могут быть некоторые органические вещества
(ненасыщенные углеводороды, эфиры, ангидриды кислот,
кетоны) ।
Исходными веществами для технического получения хлори-
стого сульфурила являются сернистый ангидрид и хлор, причем
эти вещества употребляются в сжиженном виде или в виде
концентрированных газов.
Реакция между сернистым ангидридом и хлором протекает
количественно, если пользоваться в качестве растворителя
уксусным ангидридом. В 25 вес. ч. уксусного ангидрида раство-
ряют 64 ч. сернистого газа и 71 ч. хлора. По окончании реак-
ции уксусный ангидрид остается без изменений. Если получен-
ный хлористый сульфурил идет на производство уксусного
ангидрида, то он может не отделяться от растворителя.
Лучшим катализатором реакции образования хлористого
сульфурила является камфора. Возможно, что камфора дает
непрочные промежуточные соединения с сернистым ангидридом
88
возможно также, что она является растворителем для исход-
ных веществ. Вначале некоторое количество сернистого газа
смешивают с эквивалентным количеством хлора и смесь про-
пускают над сравнительно большим количеством камфоры. При
этом образуется хлористый сульфурил, в котором камфора,
растворяется. В реактор одновременно вводят хлор и сернистый
газ в стехиометрических отношениях. Употребляемые хлор и
сернистый газ должны быть совершенно сухи.
Удобно пользоваться жидким сернистым ангидридом и хло-
ром. Реакцию осуществляют в толстостенном автоклаве-
емкостью около 100j, который погружают в резервуар, непре-
рывно охлаждаемый льдом. В автоклав вливают 0,7%-ный
раствор камфоры в жидком сернистом ангидриде и затем вво-
дят под давлением в 25 ат жидкий хлор. После введения хлора
давление в автоклаве начинает падать, и по установившемуся
давлению, которое наступает через 5—6 час., судят об оконча-
нии реакции. Готовый сырой хлористый сульфурил через трубку,
находящуюся внизу реакционного автоклава, воздухом вы-
давливают в резервуар дестилляционного отделения.
Можно применять в качестве катализатора активированный
уголь или силикагель, пропитанный раствором нитрата никеля
или кобальта. В реактор загружают некоторое количество гото-
вого хлористого сульфурила и порошкообразный активирован-
ный уголь, затем пропускают смесь сернистого газа и хлора.
Образующийся хлористый сульфурил выпускается через фильтр
и поступает на дестилляцию. Лучшим каталитическим дей-
ствием обладает активированный древесный уголь.
Технический хлористый сульфурил бывает окрашен в желто-
ватый цвет. Испытание технического продукта заключается
обычно в перегонке, определении плотности, температуры кипе-
ния и содержания соляной и серной кислот, образующихся при
ггидролизе.
Свойства хлористого пиросульфурила. Хлористый пиросуль-
фурил представляет собой бесцветную жидкость, дымящую на
воздухе, с едким запахом.
Хлористый пиросульфурил образуется при реакциях серного
ангидрида с различными хлораигидридами, преимущественно
в тех случаях, когда действует полимерный серный ангидрид.
.Он образуется также при взаимодействии хлорсульфоновой
кислоты с фосфорным ангидридом:
; 2hso3ci4-p3os = 2hpo8+s<aci2.
Плотность хлористого пиросульфурила при разных темпера-
турах может быть вычислена по формуле:
= 1,866 — 0,001796Z — 3,1 • 10-'i2;
.^плотность прн 20° 1,837 г/см3. Температура замерзания —38,5°;
Температура кипения ' +149°. Скрытая теплота испарения
ft 1,2 кал/г.
86
При высокой температуре (250°) хлористый пиросульфурил
разлагается по уравнению:
S2O5C12 = SO3 4- SO2 -j- Cl2.
Вследствие этого он при нагревании может сильно дымить.
Вода не растворяет хлористого пиросульфурила, но разлагает
его, холодная — медленно, а горячая — быстро, по уравнению:
SgOgClg 4- ЗН2О = 2H2SO4 4- 2НС1.
В некоторых органических растворителях (четыреххлористый
.углерод, хлороформ) хлористый пиросульфурил растворяется.
в. Смеси серного ангидрида с хлорангидридами серы. Для
использования серного ангидрида, который при обычных усло-
виях представляет собой твердое тело, в аппаратуре, рассчитан-
ной на применение жидкостей^ необходимо его в чем-либо
растворять. В качестве растворителя для SOs могут быть вы-
браны в свою очередь дымообразующие вещества. Жидкие ды-
мообразующие растворы или смеси должны отвечать следую-
щим основным требованиям: 1) обладать в интервале возмож-
ных температур применения достаточно большой упругостью
насыщенного пара SOs, позволяющей получать в атмосфере
дым высокой концентрации; с этой точки зрения желательно,
чтобы содержание свободного SOs, в смеси было возможно
большим; 2) оставаться в жидком состоянии при достаточно
низкой температуре, примерно —50°; 3) иметь при низких
температурах вязкость, допускающую выдавливание смесей нз
трубопроводов дымовых приборов.
Смесь серного ангидрида с хлорсульфоновой кислотой.
Хлорсульфоновая кислота хорошо растворяет серный ангидрид.
Растворы могут быть получены смешением жидкого сериого
ангидрида с хлорсульфоновой кислотой или растворением в ней
твердого или газообразного серного ангидрида. Техническое
получение смеси может быть осуществлено путем абсорбции
«серного ангидрида из контактных газов в башнях, насаженных
кольцами Рашига, орошаемыми хлорсульфоновой кислотой. По
ранее применявшемуся методу смеси получались отгонкой сер-
ного ангидрида от олеума и собиранием конденсата в хлорсуль-
фоновую кислоту.
Смеси серного ангидрида с хлорсульфоновой кислотой пред-
ставляют собой интенсивно дымящие жидкости, внешним ви-
дом и свойствами напоминающие хлорсульфоновую кислоту.
Смеси, даже богатые серным ангидридом (до 65%), замерзают
лишь при весьма низких температурах; в системе SOs — HSOsCl
образуются два соединения: SOs • HSO3CI и 2OSs • HSOsCl. Прак-
тическое применение и распространение получила смесь co-
устава: 40% серного ангидрида, и 60% хлорсульфоновой кислоты:
Свойства этой смеси таковы: температура замерзания —83,6°;
полная упругость пара при 20° 28.9 и при 40° 89,0 мм рт. ст.;
парциальная упругость пара серного ангидрида при 20° 27,5 и
90 ‘ .
при 40°'84,8 1ил< рт. ст.; температура кипения 88?; плотность при
20° 1,844 г/сл’. Смесь очень бурно реагирует с водой по урав-
нению:
SO8HSO3C1 + 2Н2О = 2H2SO4 %- НС1.
Техническая смесь содержит обычно переменное количество
серной кислоты (обычно 3—7%); эта примесь серной кислоты
повышает температуру замерзания смеси, уменьшает ее лету-
честь и увеличивает вязкость, являясь, таким образом, вредной
примесью. ,
Температура замерзания технической смеси колеблется
от —30 до —40°; ее плотность 1,86—1,9 г/см\ вязкость при
20° 0,1 и прн —20° 0,97 пуаз.
По американским данным в США принята на вооружение
смесь FS, содержащая 70° SOs и 30% HSOsCl (по другие све-
дениям 55% SO3 и 45% HSOsCl). Плотность смеси 1,91 г/см’,
температура замерзания —30э.
Смесь серного ангидрида с хлористым сульфурилом. Жид -
кий серный ангидрид смешивается с хлористым сульфурилом во
всех отношениях; при этом наблюдается поглощение тепла. По-
лимерный серный ангидрид медленно растворяется в хлористом
сульфуриле. Температуры плавления приведены в табл. 13.
Диаграмма плавкости изображена на рис. 27.
* Таблица 13
Температуры плавления смесей
серного ангидрида, с хлористым
сульфурилом
"'п so3 Темпера- тура плавле- ния в °C % SO3 Темпера- тура плавле- ния в °C
100 14,4 26 —25,2
86 12,6 22,9 —19,1
69 8,0 22 —24,5
60 4,8 21 —29,6
51 0.1 18 —38,5
42 —12,3 14,8 -66,4
38 —17,5 5 —588
33 -39,1 0 —54,1
Рис. 27. Диаграмма плавкости системы
SO3 — SO»C13:
I —область выпадения кристаллов SO,:
II — область выпадения кристаллов
C1,OS(OSO,CIJ,:
[II — область выпадения кристаллов SO.C1,:
/V—область твердых фаз SO,4-CI,OS(OSO,CI),.
V — область твердых фаз
so,о, 4- а,о stosOjCi),.
Кривая плавкости систе-
мы SOs — SOsCk имеет две
эвтектические точки, Е и С,
и одну сингулярную точку F.
В системе образуется соединение ClsOSfOSOzCOs — дихлор-
сульфурилхлорсульфонат.
Это соединение представляет собой бесцветную, сильно
дымящую жидкость с температурой плавления —-19,1°; плот-
ность его при 20° 1,633 г/см3 и вязкость 0,01099 пуаза..
91
3. Хлориды полуметаллов
Важной группой дымообразователей, дающих дым при ре-
акции своих паров с влагой воздуха, являются хлориды элемен-
тов IV группы периодической системы. Известно, что почти все
хлориды металлоидов и полуметаллов способны' при соприкос-
новении с влагой гидролизоваться, однако ие все они могут
быть дымообразователями. Дымообразователями могут быть
только летучие хлориды. Именно хлориды элементов IV группы
периодической системы, способные гидролизоваться, являются
летучими жидкостями.
Из хлоридов элементов IV группы ниже рассматриваются
« четыреххлористый кремний, четыреххлористый титан • и хлорное
олово. Все эти вещества представляют собой жидкости, дымя-
щие на воздухе и обладающие едким запахом. Хлориды титана,
кремния и олова применялись во время войны 1914—1918 гг.
для создания нейтральных маскирующих дымовых завес.
Большое распространение имели также дымообразующие си-
стемы на основе хлоридов и аммиака.
Четыреххлористый титан использовался в американских
дымовых снарядах; четыреххлористый кремний применялся,
главным образом, в дымовых приборах совместно с аммиаком;
хлорное олово применялось в дымовых приборах совместно
с аммиаком и самостоятельно в дымовых снарядах. Кроме того,
хлорное олово добавлялось в снаряды с отравляющими веще-
ствами для облегчения пристрелки. Так, например, русские хи-
мические снаряды снаряжались смесью фосгена и хлорного
олова или фосгена, хлорного олова и хлорпикрина.
По, сравнению с серным ангидридом и рецептурами на его
основе хлориды элементов IV группы обладают рядом преиму-
ществ. Они ие действуют на кожу и обмундирование и дают
безвредный дым.
Наилучшим из хлоридов является четыреххлористый титан.
Его маскирующая способность выше маскирующей способности
жидких рецептур на основе серного ангидрида; маскирующая
способность остальных хлоридов ниже. Однако в сочетании
с аммиаком эти вещества, в особенности четыреххлористый
кремний, образуют дым с высокими маскирующими качествами.
В настоящее время из хлоридов наибольшее значение имеет
четыреххлористый титан. Хлорное олово, для изготовления кото-
рого необходимо тратить дефицитное олово, и сравнительно
плохо дымящий четыреххлористый кремний не находят сейчас
практического применения.
а. Четыреххлористый кремний. Кремний образует с хлором
несколько соединений, например SiCh, Si2Cle, SiaCls и др. Из
них наиболее хорошо изучен применявшийся в военном деле
и имеющий практический интерес четыреххлористый кремний
SiCU. Четыреххлористый кремний представляет собой бесцвет-
ную прозрачную, сильно преломляющую свет подвижную жид-
кость с резким запахом. Дымит на влажном воздухе.
Физические свойства. Четыреххлористый кремний — жид-
кость с температурой замерзания—68,7° и температурой кипе-
ния 57,2°.
Плотность при 0° 1,5239, при 20° 1,483 г/см*. Зависимость
плотности от температуры выражается формулой:
8f = 1,5239 —0,002006^—5,61 • 10~^»—3,2 • IO"8/8.
Вязкость четыреххлористого кремния при 15° равна 0,00501
пуаза. Вязкость может быть вычислена по формуле:
0,000662
1)4 — V, —0,5369 ’
где vt — удельный объем. Поверхностное натяжение SiCk при
19° 16,9 дин/см и при 45° 14,2 дин/см.
Упругость пара твердого четыреххлористого кремния при
—70° 1,0 мм рт. ст. Упругость пара жидкого SiCk- при 20°
равна 195,86 мм рт. ст. Зависимость упругости пара от темпе-
ратуры выражается формулой:.
1 1ЭТ2-1
lgp = 7,644-----j-.
Плотность пара по воздуху 5,86.
Теплоемкость жидкого SiCk 0,200 кал/°С. Скрытая теплота
плавления 10,85 кал/г. Теплота испарения 36,1 кал/г.
Четыреххлористый кремний смешивается с хлорофором,
четыреххлбристым углеродом, сероуглеродом и многими хлоран-
гидридами.
Химические свойства. При нагревании с кислородом четырех-
хлористый кремний переходит в оксихлорид:
4Si Cl4 -J- О2 = 2Si2OCle + 2С12.
При, пропускании паров четыреххлористого кремния над
накаленным кремнием получается гекса хлордисилан:
3SiCl44-Si = 2Si2Cl6.
На металлы четыреххлористый кремний в отсутствие влаги
не действует.
Вода гидролизует четыреххлористый кремний с образованием
ортокремневой и соляной кислот:
SiCl4 + 4Н2О = S1 (ОН)4 4- 4НС1.
Обычно при приливании воды к четыреххлористому кремнию
образуется гелеобразный осадок.
С аммиаком четыреххлористый кремний образует продукт
присоединения состава SiCk • 6NH3 — белое вещество, медленно
гидролизующееся водой.
Получение. Четыреххлористый кремний впервые был получен
Берцелиусом действием хлора на раскаленный кремний, после
чего Эрстедт дал практический метод получения SiCk. совместно
93
c SkCle и SisCle, а Трост и Готфейль получили четыреххлори-
стый кремний продуванием хлора над кристаллическим кремнием
при сравнительно низкой температуре.
В технике четыреххлористый кремний получается при дей-
ствии хлора на смесь кремнезема и угля:
SiO2 + C4-2Cl2 = SiCl4 -}-СО2. '
Исходным материалом для технического получения служит
обыкновенный кварцевый песок; его смешивают с углем или
крахмалом с последующим обугливанием смеси; в последнем
случае достигается более тесное перемешивание кремнезема
с углем. Хлор пропускается над нагретой смесью.
Четыреххлористый кремний может быть получен действием
хлора на 50%-ный ферросилиций. Этот способ прост, но в нем
нерационально пропадает железо и неполно используется крем-
ний и хлор: так, из 50 ч. ферросилиция и 143 ч. хлора получаются
54 ч. SiCL, 3 ч. SizCl« и 0,2 ч. SisCl8. Четыреххлористый кремний
получается также действием хлора на карборунд. Для очистки
полученный четыреххлористый кремний подвергают перегонке.
б. Четыреххлористый титан TiCh представляет собой бес-
цветную или слабоокрашенную в желтый цвет прозрачную,
подвижную, дымящую на воздухе жидкость едкого запаха.
Физические свойства. Плотность четыреххлористого титана
при 20° равна 1,728 г/см3. Критическая плотность 0,728 г/сл3.
Зависимость плотности от температуры выражается формулой:
о, = 1,7606 — 0,00169/—7,3 10--/-’.— 2,1 10-»/«. •
Плотность пара по воздуху 6,836. Объемное расширение
жидкого TiCh выражается формулой:
^ = ^(1-^9,62443- 10-V+8,1554- 10- + 6,650 • Ю-»/8).
Вязкость при 14° равна 0,00878 пуаза. Зависимость вязкости
от температуры выражается формулой:
1
98,64+1,101 t ’
Величина поверхностного натяжения при 0° 35,1 дин/см.
Температура плавления TiCh — 23.0°. Температура кипения
135,8°. Критическая температура 358,0°. Величина упругости'
пара при 20° равна 10,05 лжрт. ст., при 40° 26,50 мм Зависи-
мость упругости пара от температуры выражается формулой:
\gp = 7,64433 —^-6.
Теплоемкость твердого TiCh при —25 ° 0,177 кал/град.
Средняя теплоемкость жидкого TiCh 0,188Г кал/град, теплоем-
кость при 25° 0,183 кал/град. Теплоемкость пара 0,1299.
Теплота образования TiCh 184,5 ккал\ скрытая теплота пла-
вления 11,76 кал/г\ скрытая теплота испарения при 25°
94
' 47,22 калГг, при температуре кипения 45,43 кал/г. Четырех-
хлористый титан даже при достаточно Высокой температуре
' не диссоциирует.
Взаимодействие с неорганическими веществами. Четырех-
хлористый титан как в парах, так и в жидком состоянии при
температуре 130—150° восстанавливается натрием до металли-
ческого титана:
TiCl4-f-4Na = 4NaCl + TL
На холоду натрий восстанавливает его до двуххлористогс
титана:
Ti С14 4- 2Na = TiC 12 + 2NaCl.
Пары TiCh, пропущенные над калием, восстанавливаются до
металлического титана.
При внесении четыреххлорнстого титана в воду идет бур-
ная реакция с образованием объемистого осадка и выделением
большого количества тепла. Ход реакции довольно сложен и за-
висит от температурных И других условий. Вначале при сопри-
косновении с водой образуются гидраты, которые затем под-
вергаются гидролизу. Чаще всего образуется пентагидрат
TiCh‘5H«O; при недостатке же воды и при низких температурах
образуется также дигидрат TiCh • 2НаО. • При гидролизе четы-
реххлористого титана происходит последовательное отщепление
и замещение на гидроксильные группы атомов хлора, причем
- образуются промежуточные продукты, являющиеся неполными
хлорангидридами ортотитановой кислоты. Весь гидролиз может
быть изображен такой цепью реакций:
T1CI4 • 5НаО -> TiCls (ОН) • 4Н2О 4- НС1 -> Т1С1а (ОН)а - ЗН*О -f-
4- НС1 -> TiCi (OH)S. - 2НаО 4- НС1 -> Ti (OH)4 • H2O 4- НС1. '
При высокой температуре весь процесс проходит быстро; на .
холоду же могут быть выделены промежуточные продукты. 1
ГидроксотитаНетрихлорид — желтое рыхлое вещество, весьма 5
гигроскопичное и неустойчивое по отношению к воде. Диги- 4
дроксотитанедихлорид — желтая масса также гигроскопичная и
неустойчивая по отношению к воде. Напротив, тригидроксоти-
танемонохлорид — белая гигроскопическая масса — у^е более
устойчив и может долго сохраняться, удерживая свой атом
хлора. До конца гидролиз идет при избытке .воды, особенно
при высокой температуре, причем ортотитановая кислота об-
разуется в виде коллоида; однако и при 0° при достаточном
избытке воды образуется гелеобразный осадок состава:
Ti(OH)i • НЮ. Кипящей водой четыреххлористый титан быстро
гидролизуется с образованием метатитйновой кислоты:
TiCl4 4- ЗН2О = H2TiOg 4- 4НС1.
Гидратации с последующим гидролизом паров четыреххло-
ристого титана обязана его способность дымить во влажном
воздухе: ход реакций здесь аналогичен вышеприведенному. При
действии паров воды на пары четыреххлористого титана при
300—400? гидролиз идет с образованием двуокиси титана:
TiCl4 -i- 2Н2О = Ti Оа + 4НС1.
Четыреххлористый титан смешивается во всех отношениях
с жидким хлористым водородом. Кривая плавкости системы:
TiCh — HCI имеет 3 эвтектических и 2 дистектических точки,
которые соответствуют двум соединениям: HsTiCle (т. пл. —31°)
и HiTiCho (т. пл. —86°). С четыреххлористым кремнием TtCU
смешивается во всех отношениях. Эвтектическая точка
{темп. —70,4е) на кривой плавкости лежит вблизи точки пла-
вления чистого SiCh.
В TiCh растворяется сернистый газ, а жидкий сернистый ангидрид
растворяет TiCh, причем образуются два слоя. С серным ангидридом
TiCh бурно реагирует с образованием дихлор-титаидихлорсульфоиата:
ПС14 4- 2SO3 = CLTi (OSO,C1)2.
при избытке TiCh частично образуется также трихлортитаихлорсульфоиат.
С аммиаком образуются продукты присоединения; TiCh бурно погло-
чцает сухой аммиак с выделением
должительиом насыщении аммиако!
газообразного аммиака на пары
"объемистого порошка. TiC14«6NHs
®чс. 28. Диаграмма плавкости си
стемы ТГС14 — СС14
пература равна —66°. С алкоголями
'чем происходит замещение трех а:
большого количества тепла. Прн про-
и образуется TiCh-4NHs. При действии
TiCh образуется TiCh-6NHs в виде
образуется также при пропускании су-
хого аммиака в раствор TiCh в
абсолютном эфире, причем выпадает
аморфный порошок TiCh • 6NHs.
Взаимодействие с органическими
веществами. В жидких предельных
углеводородах TiCh растворяется с
окрашиванием в коричневый цвет;
часто прн растворении происходит
вспенивание и образование смоли-
стых продуктов. С моногалоидо-
производиымн четыреххлористый ти-
тан ' дает мутные растворы, содер-
жащие продукт присоединения. С
хлороформом н четыреххлористым
углеродом смешивается во всех
отношениях; кривая плавкости си-
стемы TiCh—CCh (рис. 28) имеет
эвтектическую точку для 40 мол.
% TiCl, прн этом электрическая тем-
четыреххлористый титан реагирует, при-
емов хлора на алкокенльные группы:
TiCl4 + ЗСН3ОН = TiCl (СН3О)з - HCI -j- 2HCI;
TiCl4 + ЗС.НБОН = TiCl (С?Н8О)3 • НС1 4- 2НС1.
В бензоле четыреххлористый титан растворяется с желтой окраской,
причем бензол в основной массе не реагирует с TiCh, однако частично
подвергается полимеризации; в толуоле растворяется с окраской.
Получение. Четыреххлористый титан впервые получил Жорж
.в 1825 г. действием хлора при высокой температуре на титан
как чистый, так и содержащий углерод. Такт( же способоц
четыреххлористый титан был получен Велером. Им же было-
найдено, что при обычной температуре хлор не действует на
металлический титан. К образованию четыреххлористого титана
приводит также действие хлора при высокой температуре на
96
различные соединения титана: карбид, нитрид, ферротитан,
титаи-алюминий, титанистый железняк и иттротитанит.
Наиболее распространенным способом получения четырех-
хлористого титана является Хлорирование при высокой темпера-
туре двуокиси титана в присутствии восстановителей, чаще
в<;его угля. Реакция идет так:
TiO2 + С 4- 2С1а = Т1С14 + СО.,
или при избытке угля:
TiOa-j-2С + 2С1а = TiCl4 + 2СО.
Для достаточно полного выхода продукта при этой реакции
температура должна быть около 800°. В качестве восстановите-
лей могут быть употреблены металлы (например, алюминий,
магний и др.), сахар, крахмал. Действие на двуокись титана
смесью хлора с окисью углерода приводит к образованию
четыреххлористого титана:
ТЮа 4- 2С1а 4- 2СО = Т1С14 4- 2СО2.
Четыреххлористый титан получается при действии на
двуокись титана многих хлорсодержащих веществ: хло-
роформа, четыреххлористого углерода, фосгена, четыреххлори-
стого кремния, хлористой серы, хлористого сульфурила. Все
эти реакции идут только при высокой температуре (красное
каление). К образованию четыреххлористого титана приводит
также хлорирование «в присутствии восстановителей многих
природных минералов, содержащих титан. В технике четырех-
хлористый титан может быть получен как из двуокиси титана,
так и из железосодержащих руд: рутила и титанистого железняка.
Нагревая эти минералы в электрической печи с углем, по-
лучают карбид титана TiC. Последний же при нагревании
в струе хлора дает TiCh, который, как летучий, легко отго-
няется. Другой, весьма распространенный способ технического
получения заключается в хлорировании смеси рутила с углем.
Тара для четыреххлористого титана должна быть абсолютно
сухой. Он хранится обычно в стеклянных или глиняных буты-
лях, или стальных баллонах, или барабанах, которые должны
быть тщательно закупорены.
в. Хлорное олово. Хлорное, или четыреххлористое олово,
SnCh — прозрачная, бесцветная, сильно преломляющая свет,
тяжелая жидкость, интенсивно дымящая на воздухе.
Физические свойства. Хлорное олово — жидкость о темпера-
турой замерзания—33° и температурой кипения 114°.
Плотность при 0° 2,2759, при 20° 2,226 г/см\ Зависимость
плотности от температуры выражается формулой:
6t = 2,2744 — 0,002611-\- 1,05 • Ю"^2 — 1,15 • 10~8А
Вязкость при 15° равна 0,01011 пуаза. Вязкость может быть
вычислена по формуле:
_ 0.000439
4 V —0,4027 ’
7 Зак. 31-84. Вейцер в Лучтгнский. 97
где v — удельный объем. Коэфициент расширения SnCU 0,0013.
Упругость пара SnCU при 20° равна 18,58 мм рт. ст., при-
—10° 2,73 мм рт. ст.; при 0° 5,53 мм рт. ст., при 10° 10,33 мм
рт. ct.ji при 30° 31,3 мм рт. ст. Максимальная концентрация
SnCU при 20° 265 мг/л\ плотность пара по воздуху 9,3.
Теплоемкость кристаллического SnCU при 50° 0,126; тепло-
емкость жидкого SnCU 0,1479 кал/град; скрытая теплота
плавления 8,40 кал/г\ теплота испарения 30,4 кал/г.
Химические свойства. С химической стороны хлорное олово
во многом напоминает четыреххлористый титан; особенно резко
у SnCU выражена способность к образованию продуктов- при-
соединения. По отношению к нагреванию хлорное олово устой-
чиво; на железо в отсутствии влаги не действует.
С водой хлорное ' олово образует ряд гидратов; при не-
достатке воды, например при действии влаги воздуха, об-
разуется тригидрат SnCU • ЗН2О (кристаллическая масса с темпе-
ратурой плавления 80°; в вакууме теряет одну .молекулу воды).
Тригидрат образуется также при приливании эквивалентного
количества воды к безводному хлорному олову в виде так
называемого оловянного масла. Пентагидрат SnCU • 5НаО полу-
чается при действии достаточного количества воды на SnCU; он
представляет собой белые кристаллы, с температурой плавле-
ния 60°, хорошо растворимые в воде (в вакууме теряет 3 мо-
лекулы воды). Известны также гидраты с 4, 8 и 9 молекулами
воды. Присоединение воды во всех случаях идет с разогрева-
нием. Действие воды на этом не останавливается: с течением’
времени происходит гидролиз, причем замещение атомов хлора
на гидроксильные группы, идет последовательно и в качестве
промежуточных продуктов образуются неполные хлорангидриды
ортооловянной кислоты:
SnCi4 SnClsOH - SnCla (ОН).2 -> SnCl (QH)3 -> Sn (OH)4.
Конечными продуктами гидролиза являются ортооловянная
и соляная кислоты. При действии горячей воды гидролиз идет
с образованием метаоловянной кислоты:
SnCl4 + ЗН2О = H2SnO8 -h 4НС1.
Свежеприготовленные растворы пентагидрата очень плохо про-
водят электрический ток; с течением же времени электропро-
водность растет вследствие образования соляной кислоты; об-
разующаяся ортооловянная кислота при этом не выпадает в оса-
док, а образует коллоидный раствор. С аммиаком хлорное олово
образует твердые соединения состава SnCU • 2NH3 и SnCU • 4NHs.
При действии серного ангидрида на хлорное олово получается дихлор-
сульфонатдихлорид олова:
SnCl4 + 2SO3 = CIiSn(SO3Cl)i.
белое кристаллическое вещество, разлагающееся водой. Хлорсульфонова»
кислота не реагирует с SnCU, а только частично с ним смешивается.
98
При действии сухого хлористого водорода иа смесь хлорного олова
с крепкой соляной кислотой происходит разогревание и образуется хлор-
оловяниая кислота H-SnCle.
Получение. Хлорное олово получается непосредственно хло-
рированием олова:
Sn -j- 2С12 = SnC14;
эта реакция идет с выделением 127 250 кал при образовании
одной граммолекулы SnCh. Хлорирование двухлористого олова
Также приводит к образованию SnCh:
SnCl2 -f- С1а — SnCl4.
Хлорное олово получается также при - действии хлора при
высокой температуре на смесь двуокиси олова с углем:
SnO2 4- 2С + 2С12 = SnCl4 4- 2СО-
В технике наиболее употребительным методом получения
хлорного олова является хлорирование обрезков жести. Для
осуществления этого метода хлор должен быть совершенно
сухим; такими же должны быть и обрезки жести. В производ-
ство поступают обычно жестяные отбросы. Обрезками жести
заполняют цилиндрический реактор, снабженный трубами для
ввода хлора и выпуска жидкости. Хлор вводят под давлением;
2—3 ат. Олово поглощает хлор, отчего давление в реакторе
падает; тогда вводят новые порции хлора до тех пор, пока
давление а реакторе не будет оставаться постоянным, что слу-
жит признаком окончания реакции. Температура не должна под-
ниматься выше 35°, так как при более высокой температуре
хлор действует на железо; процесс заканчивается, когда все
олово с жести перейдет в SnCU, которое стекает^ в нижнюю
часть реактора. После этого оставшийся хлор переводят в дру-
гой реактор, а затем давлением воздуха жестяные обрезки
совершенно освобождают от хлора, а хлорное олово перекачи-
вают в сборник.
Хлорное олово упаковывают в железные бочки емкостью
70—100 л или же в стеклянные бутыли емкостью . 5 л. Тара
длй хлорного олова должна быть совершенно сухая. Техниче-
ский продукт должен содержать 99% SnCU, свободного хлора
не больше 0,01% и железа только следы. Испытания техниче-
ского продукта заключаются обычно в разгонке с определением
нелетучего остатка, определении плотности, содержания сво-
бодного хлора и в качественной пробе на железо.
4. Дымообразующие и маскирующие свойства
Рассматриваемые в этой главе вещества реагируют с нахо-
дящимися в атмосфере водяными парами с образованием дыма
или тумана. Поскольку в эту реакцию должны вступить пары
дымообразующих веществ, то о ценности каждого из них мо-
жно судить, главным образом, по летучести.
1* 99
а. Образование и свойства сернокислотного тумана. Серно-
кислотный туман образуется в результате реакции паров сер-
ного ангидрида с парами воды, всегда находящимися в атмо-
сферном воздухе. Серный ангидрид, будучи обычно в твердом
(полимеризованном) состоянии, как индивидуальный дымооб-
разователь, нашел ограниченное применение (снаряды); наравне
с другими дымообразователями он может применяться только
в виде растворов в серной кислоте или хлорангидридах.
Серный ангидрид является наиболее летучим из всех ве-
ществ, дающих дым при реакции с влагой. Таким образом, по
своей способности к дымообразованию серный ангидрид может
считаться одним из лучших дымообразователей.
Пары серного ангидрида, попадая в атмосферу, немедленно
вступают в реакцию с парами воды, образуя серную кислоту:
SO8 -|- Н2О = HgSO4.
Пары образовавшейся серной кислоты пересыщают про-
странство, так как при естественных температурах упругость
пара серной кислоты ничтожно мала. Результатом этого пере-
сыщения является конденсация серной кислоты. Однако вместе
с серной кислотой конденсируется и вода, образуя совместно
с ней частицы тумана, состоящие из смеси, находящейся
в фазовом равновесии с водяными парами атмосферы. Равно-
весие между фазами аэрозольной системы наступает, невиди-
мому, очень быстро. Конденсация воды практически не из-
меняет упругости водяного пара в атмосфере, поэтому состав
дисперсной фазы образовавшегося тумана вполне определяется
температурой и упругостью водяных паров в атмосфере.
Состав дисперсной фазы тумана легко определить, если
известны температура и упругость водяного пара, которая
может быть вычислена по величине влажности. Зависимость
упругости водяного пара, находящегося в равновесии с раство-
рами серной кислоты, от состава раствора и температуры хо-
рошо изучена. Ниже приводится табл. 14, содержащая упру-
гости водяного пара для разных температур и растворов серной
кислоты различной концентрации. Чтобы по этой таблице найти
состав дисперсной фазы сернокислотного тумана, необходимо
отыскать в столбце данной температуры упругость пара воды
в атмосфере; тогда состав частиц тумана будет указан в го-
ризонтальной рубрике.
Частицы сернокислотного тумана могут подвергаться испа-
рению в случае понижения влажности атмосферы, однако это
испарение приводит к концентрированию серной кислоты
в частицах и останавливается, так как упругость водяного пара
над частицами уравнивается с влажностью атмосферы. Как
можно заключить из табл. 14, сернокислотный туман может
быть устойчив даже в весьма сухой атмосфере. Количество
воды, поглощенной серным ангидридом, и содержание серной
кислоты в тумане может быть вычислено, как это показано
100
Упругость водяного пара для разных температур и растворов серной кислоты различной концентрации
Температура в0 С
> S
S ? й - 04
Ю
GN (N СЧ
ст> со
о о
со сч
СЧ СЧ СЧ см
‘-3
°/о
*OS*H
101
И. Д. Гуревичем, и более простым путем. По правилу Бабо
отношение упругости насыщенного пара над раствором кислоты
к давлению насыщенного пара над чистой водой есть величина
постоянная. Это отношение не зависит от температуры воздуха
и определяется только концентрацией кислоты вГ .растворе.
.После того как' установится равновесие между капелькой ту-
мана и водяным паром, находящимся в воздухе, упругость во-
дяного пара над разбавленным раствором кислоты будет равна
абсолютной влажности воздуха. Тогда вышеуказанное отноше-
ние окажется равным относительной влажности воздуха.
Таким образом, каждому значению относительной влажности
воздуха будет соответствовать определенное содержание сер-
ной кислоты bi капельках тумана. Состав дисперсной фазы
сернокислотного тумана в зависимости от относительной влаж-
ности воздуха приведен в табл. 15.
Таблица 15
Состав дисперсной фазы сернокислотного тумана н зависимости
от влажности воздуха
Относительная влажность “/о Содержание в тумане H2SO4 в °/о Относительная влажность в°/о Содержание в тумане HjSO* в %
4 68 66 35
16 61 80 25
35 50 87 20
57 41 95 10
Сернокислотный туман не ядовит, но раздражает слизистые
оболочки, вызывая кашель. Туман действует разъедающим
образом на металлы.
Взаимодействие серного ангидрида с влагой воздуха и по-
следующая гидратация вызывают достаточно большое дымо-
образрвание. Дымообразующая способность серного ангидрида
зависит от относительной влажности воздуха. При влажности
воздуха в 30% дымообразующая способность равна 3; при
90% равна 7.
Суммарная кроющая способность серного ангидрида равна
по Прентису 670 (65% по сравнению с фосфором). По другим
данным МС прн 50%-ной влажности примерно равна 10. Ко-
личество серного ангидрида, необходимое . для того чтобы на
расстоянии 20 м не был виден черный предмет, равно по Реге-
неру 20—25 мг. Для невидимости на том же расстоянии 25-ватт-
ной лампы необходимо по Прентису 75 жг/Си®. Голубая лам-
почка перестает быть видна по Мюллеру на расстоянии 5 м
при 50 мг/м? серного ангидрида.
В тумане, полученном из §Оз, минимум ослабления и ма-
ксимум прозрачности лежат в области инфракрасной части света
с длиной волны 2,6 М- Наоборот, минимум прозрачности и
максимум поглощения находятся в видимой части спектра
в области 0,6м.
102
Дымообразующая и маскирующая способ-
ности олеума определяются содержанием в нем серного
ангидрида. Однако надо учитывать, что смесь серного
•ангидрида с серной кислотой принадлежит к типу смесей
с пониженной упругостью пара. Сама серная кислота вследствие
малой упругости пара не принимает участия в дымообразова-
нии.
Суммарная кроющая способность олеума равна по Прентису
420
t Нагревание олеума улучшает его маскирующие свойства,
так как в дымообразовании принимает участие серная кислота.
б. Образование серносолянокислотного тумана хлорангидри-
дами серы. Из хлорангидридов серы наибольшее применение
получила хлорсульфоновая кислота как в смеси с серным анги-
дридом, так и самостоятельно. С большим успехом была исполь-
зована немецким командованием смесь серного ангидрида
с хлорсульфоновой кислотой в Ютландском бою 31 мая 1916 г.
Для более эффективного использования смеси серного анги-
дрида с хлорсульфоновой кислотой применялась специальная
термическая аппаратура. Подобная же аппаратура применялась
и англичанами для возгонки чистой хлорсульфоновой кислоты.
Образование дыма при применении хлорсульфоновой кисло-
ты идет только во влажном 'воздухе и является следствием
реакции гидролиза ее паров водяными парами, находящимися
-в атмосфере.
Пары хлорсульфоиовой кислоты, встречаясь в воздухе
с парами воды, реагируют с ними по-уравнению:
HSO3C1 + Н2О = H2SO4-f- НС1.
Эта реакция происходит нацело и достаточно быстро. Ее
результатом является образование серной кислоты и хлористого
водорода. Серная кислота способна конденсироваться, образуя
частицы тумана. Хлористый водород, вообще говоря, при из-
вестных условиях также может вместе с влагой конденсиро-
ваться, образуя частицы соляной кислоты. Условием, для обра-
зования такого солянокислотного тумана является превышение
равновесных (при данной температуре) парциальных упругостей
хлористого водорода или паров воды.
Другими словами, такое превышение можно назвать пар-
циальным пересыщением. Парциальные упругости паров хло-
ристого водорода и воды, совместно насыщающих пространство,
и состав жидкой фазы, находящейся с ними ® равновесии, при-
ведены в табл. 16.
Пользуясь табл. 16, можно установить, какая должна быть
при данной влажности концентрация хлористого водорода, чтобы
произошла конденсация тумана. Для этого при данной темпе-
ратуре следует отыскать упругость водяного пара, равную ат-
мосферной. Тогда одновременно будет найдена упругость хло-
ристого водорода, насыщающего пространство, совместно с во-
•103
104
। дяным паром. Очевидно, что для образования тумана необхо-
I димо создать большую упругость хлористого водорода. Состав
I образующихся частиц тумана определяется как состав жидкой
I фазы, находящейся в равновесии с данной парциальной упру-
I гостью водяного пара.
ь Из табл. 16 видно, что только при большой влажности
I образование тумана может быть вызвано сравнительно малыми
I концентрациями хлористого водорода; при малой же влажности
Г для образования тумана требуются громадные концентрации НС1.
г В данном случае хлористый водород будет поставлен в особые
условия, так как его конденсация будет происходить совместно
[ с серной кислотой, которая изменяет упругость пара над рас-
F’ творами соляной кислоты. Здесь мы могли бы ожидать обра-
f зования тумана, частицы которого состоят из смеси серной и
[ соляной кислот. Условия образования солянокислотного тумана,
рассмотренные выше, таковы, что требуют больших концентра-
ций газообразного хлористого водорода. Прибавление серной
[ кислоты и соляной сильно повышает парциальную упругость
хлористого водорода. В табл. 17 приведены значения парциаль-
. ной упругости хлористого водорода при 25° над растворами,
Таблица 17
Парциальная упругость
хлористого водорода при 25'
Содержание
H2SO4 в растворе
в %
^HCl
в мм рт. ст.
0,< 32
45,8
69,3
227
0,0
17,2
25,6
34,4
Н содержащими 14% НС1 и пе-
№ ременное количество серной
• кислоты.
I Как видно из табл. 17, для
образования сернасолянокис-
Н лотиого тумана необходима в
В газовой фазе концентрация
И хлористого водорода еще ббль-
В шая, чем это нужно для соля-
fl нокислотного тумана; так что
В при введении в воздух cep-
fl ной и соляной кислот наибо-
лее вероятно, что хлористый
I водород останется в газо-
И вой фазе, а частицы тумана будут состоять из серной кислоты.
| Хлорсульфоновая кислота не является вполне удовлетворитель-
I ным дымообразователей. Дело в том, что вследствие медлен-
I ного испарения и быстро протекающего гидролиза основная
U масса хлорсульфоновой кислоты разлагается в жидкой фазе
|1 непосредственно в капельках, полученных при дроблении жид-
U кости. Гидролиз в этом случае не приводит к образованию ту-
" мана. Полученные капли серной кислоты быстро оседают на зе-
г млю. В силу этих причин коэфициент использования, дымообра-
Г зующая и маскирующая способности хлорсульфоновой кислоты
5 сравнительно невелики. По отношению к фосфору маскирую-
li щая способность хлорсульфоновой кислоты составляет около
к 10—15%. Величина суммарной кроющей способности (ТОП)
хлорсульфоновой кислоты по Прентису составляет 310 J^/ка.
По другим данным маскирующая способность хлорсульфо-
k новой кислоты равна, при средних влажностях, 1,2—1,4.
106
Маскирующая способность хлорсульфоновой кислоты и рас-
творов серного ангидрида в ней может быть увеличена ее
нагреванием. В этом случае вся хлорсульфоновая кислота успе-
вает испариться, гидролиз целиком проходит в газовой фазе
и приводит к образованию густого тумана. Нагревание хлор-
сульфоновой кислоты осуществлялось в английском флоте
распылением ее в дымовых трубах; в Германии для этой цели
использовалась реакция между хлорсульфоновой кислотой и
.негашеной известью.
Дымообразование и маскирующие свойство хлористого суль-
фурила и хлористого пиросульфцрила. Пары хлористого суль-
фурила, введенные в воздух, могут реагировать с парами воды,
образуя соляную и серную кислоты:
SO2C12 4- 2НаО = H2SO4 + 2НС1.
Конденсация тумана серной кислоты в присутствии соляной
.происходит здесь согласно условиям, разобранным при описа-
нии образования тумана из хлорсульфоновой кислоты.
Пары хлористого пиросульфурила реагируют с парами воды
по уравнению:
S2ObCl2+ ЗН2О = 2H2SO4 + 2НС1.
Реакция гидролиза хлористого сульфурила и хлористого
пиросульфурила идет медленно и не до конца' (следует отме-
тить, что хлористые сульфурил и пиросульфурил в жидком со-
стоянии не смешиваются с водой). Вследствие этого даже при
создании в атмосфере больших концентраций паров SO2CI2 и
S2O5CI2 трудно добиться получения больших концентраций ту-
мана.
Таким образом, оба эти вещества являются очень слабыми
дымообразователями. Все же хлористый пиросульфурил дымит
лучше хлористого сульфурила, потому что, во-первых, реакция
гидролиза S2O5CI2 идет полнее й, во-вторых, при одинаковом
весовом расходе хлористый пиросульфурил образует больше
серной кислоты, нежели хлористый сульфурил.
По Прентису, ТОП хлористого сульфурила равна 268 м2/кг.
Относительно маскирующих свойств хлористого пиросульфурил-
хлорида в литературе нет никаких сведений.
в. Дымообразование хлоридами полуметаллов. Образование
дыма из четыреххлористого кремния может быть
достигнуто как путем его распыления из ручных, механических
или авиационных приборов, так и путем разбрызгивания при
подрыве артиллерийских дымных снарядов. Во всех случаях
четыреххлористый кремний, как весьма летучее вещество, испа-
ряется нацело. Следует отметить, что всегда, когда придется
пользоваться для получения дыма из четыреххлористого крем-
ния распылителями, будет происходить заметное забивание их
твердыми продуктами, образующимися при соприкосновении
хлорида с влажным воздухом и смоченными поверхностями.
• 106
Пары четыреххлористом кремния, введенные в атмосферу,
начинают реагировать с парами воды, образуя ортокремневую
.в соляную кислоты:
. SiCl4 + 4H2O = Si(OH)4 -J-4HC1.
Эта р^кция, протекающая быстро в жидкой фазе, в газовой
..фазе идет медленно, и, таким образом, парообразный четырех-
хлористый кремний расходуется постепенно. Образующийся хло-
ристый водород остается в газовой фазе, а ортокремневая кис-
лота немедленно конденсируется, образуя дым.
Вследствие малой скорости гидролитического разложения
четыреххлористого кремния-его дымообразующая и маскирую-
щая способности невелики, несмотря на достаточно высокую
летучесть.
При больших влажностях воздуха гидролиз SiCk ускоряется,
одновременно увеличивается количество поглощаемой влаги. Со-
ответственно с этим возрастают дымообразующая и маскирую-
щая способности. По Прентису, ТОП четыреххлористого крем-
ния равна. 335 мР/кг, т. е. концентрация четыреххлористого
кремния, необходимая для невидимости 25-ваттной лампочки
иа расстоянии 20 м, составляет 149 |Мг/л3.
Четыреххлористый титан применяется в дымовых
снарядах, минах и- бомбах и в различных дымовых приборах.
Во всех этих случаях жидкость дробится на капли. Из получен-
ных капель происходит испарение четыреххлористого титана.
Пары четыреххлористого титана взаимодействуют с парами
воды, образуя при этом густой белый дым. Образование дыма
происходит последовательно в результате реакции гидролиза
и гидратации. Ход этих реакций приведен выше.
Реакция присоединения идет достаточно быстро; поэтому
в воздухе не остается паров четыреххлористого титана сов-
местно с влагой. Вследствие этого, а также и того, что в реак-
цию вступает большое число молекул воды, образование дыма
при применении четыреххлористого титана идет гораздо интен-
сивнее, нежели при применении четыреххлористого кремния,
несмотря на то, что летучесть последнего гораздо больше. Со-
став дисперсной фазы дыма, образующегося при гидратации
и гидролизе паров четыреххлористого титана, достаточно сло-
жен. При относительной влажности воздуха от 30 до 90% дым,
получающийся из четыреххлористого титана, состоит из вод-
ного раствора НС1 и TiCl(OH)s • 2Н2О. При малой относительной
влажности в дыме присутствуют, главным образом, TiCh(OH)2-
• ЗН2О и TiCl(OH)s • 2НгО. Четыреххлористый титан обладает
высокой дымообразующей и маскирующей способностями. Это
объясняется тем, что в дымообразовании принимает участие
почти весь дымообразователь. Только часть четыреххлористого
титана (примерно 8—12%) не успевает испариться из получен-
ных капель и попасть в атмосферу. Кроме того, в результате
гидролиза и гидратации из воздуха поглощается достаточно
большое количество влаги.
107
Дымообразующая способность ‘четыреххлористого титана
(при относительной влажности свыше 30%) растет с увеличе-
нием относительной влажности воздуха. Это вызывается более
сильной конденсацией хлористого водорода и поглощением
влаги частицами дыма. При малой относительной влажности
(меньше 30%) наблюдается некоторое уменьшение дымообра-
зующей способности TiCk, так как превращение TiCk-SHsO
в TiCls(OH) • 4НгО и т. п. связано с уменьшением веса дисперс-
ной фазы.
Дымообразующая способность четыреххлористого титана
уменьшается с понижением температуры вследствие понижения
коэфициента использования дымообразователя.
Маскирующая способность четыреххлористого титана также
зависит от относительной влажности воздуха. По Прентису,
среднее значение ТОП четыреххлористого титана равно
435 я&/кг, т. е. для невидимости 25-ваттной лампы требуется
TiCk 135 мг/м\
Более точные данные по маскирующим свойствам TiCk и
его дымообразующей способности приводятся в табл. 18.
Таблица 18
Маскирующая и дымообразующая способность TiCk
Относительная влажность в % Маскирующая способность Дымообразующая способность
30 5 1,7
60 6 2
90 10 2,8
Дым, образующийся при применении четыреххлористого ти-
тана, ие адовит, Однако действует на металл.
Хлорное олово применяется с помощью тех же мето-
дов, что и четыреххлористый титан и четыреххлористый крем-
ний. Образование дыма при введении хлорного олова в атмо-
сферу происходит 'вследствие взаимодействия его паров с парами
воды. Дисперсная фаза образовавшегося дыма состоит нз твер-
дых частиц гидратов ортооловянной кислоты и неполных
хлорангидридов оловянной кислоты. Значительная часть хлори-
стого водорода остается при этЬм в газовой фазе.
Маскирующая способность дыма, полученного из SnCk, не-
велика. По Прентису, ТОП хлорного олова равна 417 лР/кг
и для невидимости 25-ваттной лампы на расстоянии 20 м нужно
120
По Мюллеру, голубая лампочка не видима в дыме, получен-
ном из SnCk, на расстоянии 5 м, если в 1 jk3 воздуха вводят
300 мг хлорного олова.
Дым хлорного олова не ядовит.
108
Б. Аммиачные дымообразующие системы
а. Дымообразование при содействии аммиака. В основе
способов применения описанных выше дымообразователей ле-
жат химические реакции в газовой среде, причем в качестве
одного из реагирующих компонентов используются пары воды,
находящиеся в атмосфере. Таким образом, здесь мы имеем
дело с дымообразующей системой: дымообразователь +
+ водav
Помимо этих систем для получения дымов могут быть также
использованы дымообразующие системы из двух веществ, каж-
дое из которых порознь может и не быть дымообразователем
в обычном смысле слова. Примером таких систем является си-
стема: хлористый водород + аммиак. Как известно,
в результате реакции между этими газами образуется белый
дым хлористого аммония. Аммиак подобным же образом реаги-
рует с парами других кислот, образуя дым соответствующих
солей. Аммиак, реагирует также с образованием дыма с парами
хлорангидридов и вообще веществ кислого характера.
Таким образом, все вещества, способные давать дым при
реакции с влагой, дают дым, если в атмосфере вместо влаги
находится аммиак.
Образование дыма при реакции дымообразователей данной
группы с аммиаком идет во многих случаях более интенсивно,
чем при реакции с парами воды. Это в первую очередь отно-
сится к веществам!, слабо дымящим во влажном' воздухе, напри-
мер, таким, как хлористый сульфурил, четыреххлористый крем-
ний и т. п.
Следует отметить, что различные дымообразователи
дают с аммиаком приблизительно одинаковый дымообра-
зующий эффект.
В естественных условиях, применяя дымообразователь сов-
местно с аммиаком, мы встретимся, конечно, не с двойной, а с
тройной дымообразующей системой: дымообразователь +
4-вода + аммиак. Очевидно, что, наряду с реакцией паров
дымообразователя с аммиаком, будет происходить и гидролиз
паров дымообразователя. Аммиак в этом случае может играть
двойную роль.
С одной стороны, аммиак реагирует с парами дымообразова-
теля, не успевшими прогидролизоваться, образуя при этом твер-
дые продукты, конденсирующиеся в виде дыма. Этот процесс
имеет важное значение для паров дымообразователей, медленно
гидролизующихся (четыреххлористый кремний, хлористый суль-
фурил, и т. п.). С другой же стороны, аммиак способен реаги-
ровать с образованием дыма с хлористым водородом, образую-
щимся при гидролизе паров дымообразователей и находящимся
первоначально в газовой фазе. Этот процесс имеет значе-
ние, главным образом, для быстро гидролизующихся паров ды-
мообразователей (хлорсульфоновая кислота, четыреххлористый
титан).
109
V
Роль аммиака не ограничивается только взаимодействием!
с парами, дымообразователей и хлористым водородом. Аммиак
во многих случаях способен также .реагировать с частицами,
дисперсной фазы, образовавшимися при гидролизе паров дымо-’
образователей.
Дымообразующие системы типа дымообразователь— вода —
аммиак, могут быть осуществлены путем пуска одновременно
с испарением дымообразователя газообразного аммиака или же'
распыления водного аммиака. Схемы процессов, протекающих
в атмосфере, здесь в основном одинаковы.
Для совместного применения с аммиаком могут быть-
использованы все жидкие вещества, дающие дым при реакции
с влагой, хотя во время войны 1914—1918 гг. для этой цели
использовались, главным образом, хлориды кремния, титана
и олова. '
Принцип применения заключается в том, что производится-
испарение дымообразователя, как обычно, и одновременно1
производится выпуск из баллона газообразного аммиака, причем1*
струя аммиака направляется так, чтобы она могла встретиться
и перемешаться со струей паров дымообразователя. В некото-
рых случаях вместо выпуска газообразного аммиака может*
распыляться водный аммиак.
Применение аммиака для совместного дымообразования
вообще не является особенно удобным. При снаряжении при-'
боров газообразным аммиаком всегда требуются толстостенные’
баллоны, которые значительно утяжеляют установки. Если же*
применять водный аммиак, который не требует толстостенных
баллонов, то необходимо вбзить большую массу воды (в кото-
рой растворен аммиак), бесполезную для дымообразовании, но
утяжеляющую прибор, в конечном итоге, не меньше, чем тол-
стостенный баллон. Естественно, что одновременно применение
двух компонентов усложняет технику работы при дымопуске.
Следует отметить, что при применении аммиака забивание
распылителей, через которые выпускается дымообразователь,
бывает особенно интенсивным. Одиако, несмотря иа эти недо-
статки, аммиак нее же найдет себе применение для дымообра-
эоюания, так как при его содействии даже самые слабые ды-
мообразователи дают весьма интенсивный дым.
б. Реакции с аммиаком в атмосфере. При применении в ка-
честве дымообразователей олеума или растворов серного
ангидрида в хлорангидридах пары серного ангидрида могут
встретиться в атмосфере с аммиаком.
Пары серного ангидрида, попадая вместе с аммиаком в
атмосферу, могут подвергнуться как гидратации, так и непо-
средственному взаимодействию с аммиаком.' Последнее может
происходить с образованием сульфамида и амидосульфоновой
кислоты:
SOs 4- 2NH8 = SO2 (NH2)2 + н2о.
so84-nhs = hso3nh2.
ПО
Направление реакции по тому или другому пути будет зави-
сеть от влажности атмосферы. Очевидно, что чем выше влаж-
ность, тем большее количество серного ангидрида успеет,
до взаимодействия с аммиаком, прогидратироваться. Но и пр»
средней и даже низкой влажности наиболее вероятной будет
гидратация серного ангидрида с образованием серной кислоты
и взаимодействием последней с аммиаком. И только при очень
низкой влажности возможно образование сульфамида. Возможно
также, чт^^фы серного ангидрида подвергаются в атмосфере
воздействию аммиака с образованием сульфаминовокислого
аммония:
SO, 4- 2NHa = NH2SOaONH4.
Последний более устойчив к влаге, и потому его образова-
ние более вероятно, чем образование сульфамида.
Следовательно, образование дыма можно представить себе
таким образом. Главная масса серного ангидрида образует
серную кислоту, которая одновременно с конденсацией реагирует'
с аммиаком. При этом, в зависимости от созданной концентра-
ции аммиака, получается кислый или средний сернокислый'
аммоний. Часть же серного ангидрида реагирует непосред-
ственно о аммиаком, образуя сульфаминовокислый аммоний.
Следует отметить, что при реакции аммиака с сернокислот-
ным туманом увеличение частичной концентрации аэрозоля не
происходит. К тому же образуются продукты менее гигроско-
пичнйе, чем серная кислота. Поэтому применение аммиака
вместе с серным ангидридом не представляет особых выгод»,
кроме лишь того, что дым, образующийся вместо сернокислот-
ного тумана, совершенно безвреден и не действует на металлы.
Обратным примером является хлористый сульфурил. Пары,
его реагируют с влагой воздуха медленно, с аммиаком же
очень быстро. Поэтому при применении хлористого сульфурила-
совместно с аммиаком получается дым, дисперсная фаза кото-
рого может состоять из смеси хлористого аммония с сульфами-
дом, иминосульфамидом или трисульфимидом. И только при
высокой влажности можно ожидать в дисперсной фазе при-
сутствия сернокислого аммония, образовавшегося вследствие
частично прошедшего гидролиза хлористого сульфурила. Таким
образом, при применении хлористого сульфурила содействие
аммиака является полезным.
Примером, отличным от двух предыдущих, является хлор-
сульфоновая кислота. Ее пары реагируют с влагой атмосферы
нацело и достаточно быстро. В результате этой реакции обра-
зуется туман серной кислоты, хлористый же водород остается
в газовой фазе. При одновременном же выпуске аммиака
последний реагирует с газообразным хлористым водородом,
образуя дым хлористого аммония. Таким образом, аммиак
сильно увеличивает дымообразующий эффект путем использо-
вания половины продуктов реакции с влагой, самостоятельно
не образующих дыма.
ЧП
Из этих примеров видео, что применение аммиака целесооб-
разно: 1) когда пары дымообразователя реагируют с аммиаком
быстрее, чем с влагой, и 2) когда реакция с влагой, хотя бы и
очень быстрая, приводит к образованию газообразных продук-
тов, способных реагировать с аммиаком с образованием дыма.
В войну 1914—1918 гг. совместно с аммиаком применялись
хлориды кремния, титана и олова. Четыреххлористый кремний
в этом отношении повторяет пример хлористого сульфурила.
Пары его, реагируя довольно медленно с влагой атмосферы,
способны (моментально присоединять аммиак, образуя частицы
состава SiCk • 6NH3. Помимо этого аммиак реагирует с хлори-
стым водородом, успевшим образоваться вследствие .медленно
текущего гидролиза.
Несколько сложнее обстоит дело с четыреххлористым тита-
ном и хлорным оловом. Их пары реагируют о парами воды
достаточно быстро, причем первоначально образуются гидраты.
В присутствии аммиака TiCk и SnCk могут, наряду с этими
гидратами, образовать и продукты присоединения TiCk • 4МНз .и
SnCk • 2NH3 или SnCk • 4NH3. При наступлении гидролиза гидрат-
ных форм хлоридов титана и олова аммиак будет реагировать
с выделяющимся в газовую фазу хлористым водородом, обра-
зуя дым хлористого аммония. Не исключена возможность также
присоединения аммиака к гидратам. Таким образом, процесс
дымообразоюания с аммиаком ® этих двух случаях может
быть довольно сложным.
Все дымы, полученные при содействии аммиака, отличаются
безвредностью, отсутствием раздражающих свойств и не дей-
ствуют на металлы.
Маскирующая способность хлорангидридов при совместном
дымообразовании с аммиаком значительно повышается. В
табл. 19 приводятся сравнительные значения суммарной крою-
щей способности хлорангидридов без аммиака и с аммиаком.
Таблица 19
Суммарная кроющая способность различных дымообразователей
Дымообразователь ТОП без аумиака • в м?!кг ТОП с аммиаком в м^кг
TiClt. 435 680
SiCl4 335 440
SOjOHCl 310 360
По Мюллеру, для невидимости голубой лампочки на рас-
стоянии 5 м необходимо 45 мг/н? TiCk, 100 мг/jfi SiCk и
300 лг/м3 SnCk. Совместно с аммиаком необходимо меньшее
количество, а именно 30 мг/м? TiCk, 18 мг/ы? SiCk и
50 мг/л# SnCk.
11?
ГЛАВА VIII
ФОСФОР, ЕГО РАСТВОРЫ И СОЕДИНЕНИЯ
Фосфор является единственным, имеющим практическое
применение 'представителем группы веществ, дающих дым
s результате взаимодействия с кислородом воздуха. Впервые
фосфор был применен как дымообразователь англичанами
у Лоос 25 сентября 1915 г. Фосфорные гранаты и мины слу-
жили для ослепления наблюдательных пунктов противника и
деморализации живой силы; широкое применение имели дымо-
вые фосфорные снаряды; кроме того, фосфор использовался
в дымовых буях. В настоящее время фосфор применяется в ды-
мовых снарядах, минах, авиационных бомбах и приборах. Опи-
сана специальная дымовая машина, в которой фосфор распла-
вляется горячим) паром, и в таком виде, выбрасывается в атмо-
сферу. Для прикрытия переправы через Волгу под Сталинградом
куски фосфора высыпались на железные листы. Для прекраще-
ния дымообразоваиия горящий фосфор’ засыпался песком. Вслед-
ствие взаимодействия с кислородом и образования продуктов,
реагирующих с влагой воздуха, фосфор обладает высокой
дымообразующей способностью. По своим маскирующим свой-
ствам фосфор занимает среди дымообразователей первое место.
Недостатком фосфора как дымообразователя является его
воспламеняемость на воздухе. Это обстоятельство делает опас-
ной работу с фосфором и не дает возможности применять его
в дымовых шашках. Все шашки на основе фосфора горят
пламенем.
Производство фосфора налажено достаточно хорошо. Сырье
для него имеется в ряде стран в достаточном количестве. Про-
изводимый продукт может быть использован в мирной промыш-
ленности.
Помимо фосфора известное военно-химическое значение
имеют его соединения с серой, из которых наиболее устойчивы
пентасульфид P2S5 и сесквисульфид P4S3. При нагревании на
воздухе сульфиды фосфора сгорают и, таким образом, могут
быть использованы для получения дыма.
%
1. Свойства фосфора
а. Аллотропические видоизменения. В свободном состоянии
фосфор может существовать в различных аллотропических
модификациях, из которых наиболее важны две: белый фосфор
и красный фосфор. Белый или, вернее, бесцветный фос-
фор образуется всегда при непосредственной конденсации паров
фосфора. Однако белый фосфор не представляет собой наиболее
устойчивую форму этого элемента и при действии света, элек-
трического разряда нли при нагревании превращается в крас-
ный фосфор.
8 Зак. 3184. Beflncp и Лушнский. 113
Красный фосфор не является однородным веществом. Он
состоит из рубиново-фиолетового, -пурпурового и черного
фосфоров в различных соотношениях, образующих между собой
твердый раствор. Известны также твердые растворы бесцвет-
ного и пурпурового фосфоров.
И'--^о 800о в парообразном состоянии фосфор состоит из
молекул ₽4, выше 800° происходит расщепление на моле-
кулы Рг.
б. Физические свойства белого фосфора. Белый фосфор (на-
зываемый также желтым и кристаллическим) — про"
зрачная, бесцветная или с желтоватым оттенком масса кристал-
лического строения. При комнатной и более высокой темпера-
турах довольно мягок (напоминает воск), на холоду же делается
более хрупким. При нормальном давлении плавится при 44,3°».
при повышении давления температура плавления возрастает.
Температура кипения 280,1°.
Плотность белого фосфора в твердом состоянии при 0°
1,8368 г/сл?, при 13° 1,8272, при 20° 1,8233 и при 40°
1,8063 г/cjfi. Объемный коэфициент расширения твердого фос-
фора 0,000375; линейный коэфициент расширения в интервале
температур от 0 до 40° 0,000125.
Плотность фосфора ® жидком состоянии приведена в табл. 20:
Таблица 2(Т
Плотность жидкого белого фосфора 1
Температура в °C Плотность в г/см3 Температура в °C Плотность г/сж3 *
401 45 50 55 60 70 Зависимость пл выражается фор1 1,749 1,744 1,739 1,731 1,726 1,7198 отности жидкс иулой: 80 90 100 200 280 го фосфора о 1,7111 1,6980 1,6949 1,6027 1,5287 1 т температуры
8t = 1,783 — 0,000911.
Коэфициент расширения жидкого фосфора 0,00052.
Вязкость жидкого фосфора при 45° 0,0104 и при 600-
0,0088 пуаза.
Упругость паров твердого белого фосфора при различ-
ных температурах приведена в табл. 21.
Зависимость упругости пара твердого фосфора от темпера-
туры выражается формулой:
1 л СК11 3296,9
1g р = 9,6511-------уА-.
1 Переохлаждении й.
114
Упругость паров жидкого белого фосфора при различных температурах приведена в табл. 22.
Таблица 21 Упругость паров твердого белого фосфора Упругость паров жидкого белого фосфор! Таблица 22
Темпера- Упругость Темпера- Упругость Темпера- Упругость
тура пара тура пара тура пара
в °C в мм рт. ст. в “С а мм рт. ст. в °C в мм рт. ст.
0 0,007 44,1 0,173 155 74
10 0,016 50 ' 0,262 200 188
70 0,823 230 514
20 0,025 80 1,39 280,1 760
30 0,072 90 2,28 360 3,6 ат
100 3,62 500 20,8 .
• 120 8,6 512 22,6 „
Зависимость упругости пара жидкого фосфора от темпера-
туры выражается формулой:
lgp= 11,5694 — 1,25661gГ, ' ’
Критическая температура 720,6°; критическое давление 93,3 ат.
Теплоемкость твердого белого фосфора при —40°
0,165 кал/град и при 4-10° 0,177 кал/град. Теплоемкость газо-
образного фосфора Cj = 0,177 кал/град:
^ = 1,1Г.
cv
Скрытая теплота плавления 5,03 кал/г. Скрытая теплота испа-
рения при температуре кипения 130 кал/г.
в. Растворы фосфора. Белый фосфор почти не растворим
в воде (всего 1 : 500 000). Он растворяется без изменений в сжи-
женных аммиаке, сернистом ангидриде и' дициане. Хорошо
растворяется в хлористой сере, Треххлористом фосфоре и трех-
бромистом фосфоре.
Белый фосфор плохо растворим в спирте, глицерине (0,2%)
и ледяной уксусной кислоте (1%). Лучше растворим в эфире,
дибромэтане, иодистом метилене, жирных маслах, бензоле,
хлорбензоле, нафталине и скипидаре. Особенно хорошо фосфор
растворяется в сероуглероде.
Растворимость белого фосфора в сероуглероде и бензоле
приведена в табл. 23.
Расплавленный фосфор смешивается о растворителями непол-
ностью. В табл. 24 приведены критические температуры раство-
рения, выше которых взаимная растворимость не ограничена.
8* 115
Таблица 23
Растворимость белого фосфора в сероуглероде и бензоле
Темпера- тура в °C Растворимость В % Темпера- тура в °C Растворимость В %
в сероугле- роде в бензоле в сероугле- роде в бензоле
-80 2,7 0 78
-50 6,3 —. 5 83 0,58
—20 13,5 10 86 1,1
-10 22 — 20 90 2,2
- 3 64 —. 25 91 —
-2 73 — 30 — 3,4
Таблица 24
Критические температуры растворения белого фосфора в некоторых
растворителях
Растворитель Крит. темп, раств. в °C Растворитель Крит. темп, раств. в °C
Декан 390 Бромэтилен . . . 165
Хлорбензол . . . 264 р-Дибромбензол . 163
Нафталин l.i. . • 202 Бромоформ . . . 0
Фенантрен .... 200 Сероуглерод . . —6,5
Антрацен .... 198 •
Из сероуглеродного раствора белый фосфор кристалли-
зуется в виде ромбических додекаэдров.
Растворы белого фосфора в горючих растворителях весьма
опасны в обращении. Особенно опасны сероуглеродные растворы.
При испарении растворителя остающийся мелкораздробленный
фосфор тотчас же воспламеняется.
г. Физические свойства красного фосфора. Продажный
красный фосфор — рыхлый порошок темнокрасного цвета. Как
уже указывалось, красный фосфор ие является определенной
модификацией фосфора, и его нельзя рассматривать как одно-
родный продукт.
Физические свойства красного фосфора имеют до известной
степени случайный характер и могут колебаться в зависимости
от способа получения, времени и условий хранения красного
фосфора.
Продажный красный фосфор плавится примерно при 580°.
Его плотность колеблется в пределах 2,2—2,3 г. смЛ. Красный
фосфор не растворим в сероуглероде и других растворителях
белого фосфора. В отличие от белого фосфора красный фосфор
не ядовит.
Из различных модификаций, образующих красный фосфор,
пурпуровый фосфор представляет собой хрупкое вещество.
Ру-бинов о-ф иолетов ый фосфор — кристаллы, имеющие
116
в проходящем свете рубиновую окраску, а в отраженном —
фиолетовую. Черный фосфор представляет собой кристаллы
с металлическим блеском. Температура плавления в ряду пур-
пуровый — рубино-фиолетовый — черный фосфор меняется от
577 до 610е.
Плотность модификаций фосфора: пурпурового 1,90; руби-
ново-фиолетового 2,11; черного 2,69 г/см?.
Упругость пара при 20°: пурпурового фосфора 4.3, рубиново-
фиолетового 1,4, черного 0,4 мм рт. ст.
д. Химические свойства фосфора. Фосфор является хими-
чески весьма деятельным элементом. Он способен непосред-
ственно вступать в реакцию со многими простыми и сложными
веществами, образуя при этом ряды разнообразных соединений.
В своих соединениях с другими элементами фосфор может быть
3- и 5-валентным. Химическое сродство фосфора к другим элемен-
там проявляется одинаково во всех его модификациях; однако
различие в химических свойствах отдельных 'модификаций заклкг
чается в том, что они реагируют неодинаково энергично, хотя
результатом реакции являются одни и те же продукты.
Чрезвычайно характерно сродотвкУ фосфора к кислороду. Оно
выражается о том, что фосфор, во всех своих видоизменениях
способен, гореть как в кислороде, так и в воздухе. Однако тем-
пературы воспламенения раз-
личных модификаций фосфора
сильно отличаются друг от
друга (табл. 25).
Белый фосфор, имеющий
такую низкую температуру вос-
пламенения, загорается на воз-
духе от трения (например, при
разрезании или размалывании),
от соприкосновения с теп-
лыми телами и даже самопро-
извольно, так как при лежании
на воздухе он всегда нагре-
вается с поверхности до 50s в
Таблица 25 Температура воспламенения различных модификаций фосфора
Модификация Темпера- тура °C
Белый 50
Пурпуровый . . . Рубиново-фноле- 200
товый 346
Черный 490
результате выделения тепла при
медленном окислении его паров кислородом. Поэтому белый
фосфор весьма опасен в обращении и требует при работе и
хранении изоляции от воздуха. Обычно белый фосфор хранят
и производят все операции с ним под водой.
Белый фосфор в мелкораздробленном виде, например при
выпадении его из сероуглеродного раствора, способен момен-
тально загораться на воздухе. Белый фосфор интенсивно горит
ярким желтым пламенем, образуя при избытке кислорода фос-
форный ангидрид, при недостатке — фосфористый ангидрид
в виде белого дыма. При горении белого фосфора развивается
температура около 900°.
Красный фосфор горит спокойным, ярким пламенем с обра-
зованием тех же продуктов, также в виде дыма. Красный фос-
фор относительно безопасен в обращении.
117
Опасность белого фосфора усугубляется еще тем, что он,
в отличие от красного, весьма ядовит: его доза в 0,1 г смер-
тельна; вдыхание его паров вызывает некрозы. Фосфорные
ожоги весьма болезненны.
С жидким кислородом фосфор не реагирует. В темноте бе-
лый фосфор светится. Это происходит оттого, что выделяемые
фосфором пары окисляются кислородом воздуха, выделяя свет.
При медленном окислении фосфора во влажном воздухе обра-
зуется, главным образом, фосфористая кислота и, кроме того,
фосфорноватистая.
Белый фосфор жадно соединяется с галоидами. В струе
хлора он самопроизвольно загорается, образуя треххлористый
фосфор. С бромом и иодом он реагирует, образуя РВгз и РЛз.
Белый фосфор реагирует энергично с серой с образованием
сульфидов.
Белый фосфор реагирует со многими металлами, но на же-
лезо и его сплавы не действует.
Сильные окислители, например азотная и хромовая кислоты, -
гипохлориты, окисляют белый фосфор в фосфорную кислоту.
В теплых растворах едких щелочей белый .фосфор раство-
ряется, выделяя фосфористый водород и образуя фосфорнова-
тистокислый калий (или натрий)
Р44-ЗКОН + ЗНаО = РН3+ЗКН2РОа. •
Белый фосфор выделяет легко восстанавливающиеся металлы,
как, например, золото, серебро, медь, свинец, из их солей, при-
чем он одновременно отчасти вступает с ними в соединение
(например, с медью он дает фосфористую медь).
Красный фосфор реагирует с галоидами и серой при более
высокой температуре, чем белый. Он не осаждает металлов из
растворов солей. Но азотная кислота легко окисляет его до
фосфорной кислоты. При соприкосновении красного фосфора
с бертолетовой солью и с другими ей подобными окислителями
он легко воспламеняется.
Более энергично, чем обыкновенный красный фосфор, реаги-
рует яркокрасный фосфор Шенка. Как и белый фосфор,
он растворяется в едких щелочах и осаждает медь из. рас-
твора медного купороса. Однако подобно красному фосфору он
безвреден.
е. Кислородные соединения фосфора. При горении белого
и красного фосфора в воздухе или в кислороде образуется ряд
Окислов, основным среди которых является фосфорный анги-
дрид. Преобладание того или другого Окисла в продуктах го-
рения зависит от условий горения, в первую очередь — от до-
ступа кислорода: чем больше доступ кислорода, тем больше
образуется высших окислов. Существование таких окислов, как
Р4О10, Р*Ов, Р«О«, Р4О2 и соответствующих им кислот, совер-
шенно несомненно. Но кроме этих соединений при горении и при
медленном окислении наблюдается еще образование соединения
118
.•фосфора с кислородом, природа которого еще окончательно не
установлена.
При горении фосфора в открытом сосуде на воздухе наблю-
дается образование наряду с обычными окислами желто-
оранжевого вещества. Следует заметить, что никогда
не удается, полностью сжечь фосфор в открытом сосуде, все-
гда остается оранжевое вещество, не растворимое вводе, спирте,
эфире и сероуглероде. Только нагревая стенки сосуда до 700—
800°, удается сжечь и это вещество, которое, как показал ряд
исследований, является низшим окислом фосфора, имеющим
состав РЮ. Эта недоокись фосфора оранжевого цвета при
нагревании принимает красную окраску, что заставляло неко-
торых исследователей принимать ее за красный фосфор. .
При сжигании фосфора в медленном, токе воздуха обра-
зуется обычно фосфористый ангидрид РЮв и недокись фосфора
РЮ. Четырехокись фосфора РЮв образуется при нагревании
фосфористого ангидрида и смеси его с1 фосфорным ангидридом.
Поэтому четырехокись фосфора получается при горении боль-
дпих количеств белого фосфора, когда при реакции развивается
(высокая температура.
Фосфорный ангидрид, «ли пятиокись фосфора, РЮю ча-
стично всегда образуется при горении фосфора; при горении
фосфора в большом) избытке кислорода образуется исключи-
тельно фосфорный ангидрид.
Все эти скислы фосфора — вещества сравнительно мало-
летучие; поэтому, образуясь при горении фосфора в парообраз-
ном состоянии, они в воздухе тотчас конденсируются, давая
белый дым. Таким образом, густой дым, получающийся при
горении фосфора, первоначально состоит из окислов, которые
в свою очередь реагируют с влагой воздуха.
(Кислородные соединения фосфора образуются при горении
не только элементарного фосфора (белого и красного), но и его
соединений. Так, при горении фосфористого водорода и некото-
рых фосфорорганических Соединений образуется фосфорный
ангидрид в виде дыма. Образование дыма, состоящего из ки-
слородных соединений фосфора, происходит также при горении
его сернистых соединений.
Фосфористый ангидрид, или трехокись фос-
фора, представляет собой белую, воскообразную кристалличе-
скую массу. Неочищенный продукт имеет запах чеснока. Плот-
ность фосфористого ангидрида 2,13 г/сл3, температура плавле-
ния 22,7°. В атмосфере азота или углекислоты кипит при 173°.
Жидкий фосфористый ангидрид довольно летуч: при 70° упру-
гость пара достигает 37,5 мм рт. ст. Мол. вес, определенный по
плотности пара и по криоскопическим данным, отвечает фор-
муле РЮв.
Фосфорный ангидрид — бесцветный порошок без за-
паха с плотностью 2, 387 г/см*. Возгоняется при 360°. При
•нагревании до 563° переходит в аморфное, стекловидное со-
стояние. Плотность пара отвечает формуле РЮю. Чрезвычайно
119
гигроскопичен, вследствие чего при соприкосновении с влаж-
ным воздухом быстро расплывается в сиропообразную жид-
кость, образуя метафосфорную кислоту:
Р4О10 + 2НаО = 4НРО8.
При действии на фосфорный ангидрид горячей водой обра-
зуется ортофосфорная кислота:
Р4О10 4-6НаО = 4Н8РО4.
Обладая большим сродством к воде, фосфорный ангидрид
способен ее отнимать также от некоторых химических соеди-
нений.
2. Получение фосфора
Исходным веществом для получения фосфора служит фос-
форный кальций, который встречается в виде природных мине-
ралов — фосфоритов и апатитов.
а. Получение белого фосфора основано на реакции Велера:
2Са8 (РО4)а 4- 6SiO2 -f- ЮС = 6CaSiO8 -f- ЮСО 4~ Р4.
Производство фосфора заключается в том, что смесь измель-
ченных фосфорита,
Рис. 29. Печь для по-
лучения белого фос-
фора:
песка и угля загружают в электрическую
печь и подвергают нагреванию. В процессе
плавки образуется окись углерода и шлак,
состоящий из кремнекислого кальция. Вос-
становленный фосфор в виде паров выхо-
дит из печи и улавливается в специальных
конденсаторах. Реакция начинается при
1200° и идет при 1300°. Питается печь по-
стоянным током.
Фосфорит подвергается крупному дро-
блению и от него отсеиваются мелкие
куски. Кварц и антрацит также подвер-
гаются дроблению и в дальнейшем — отсе-
ву. После измельчения и отсева фосфорит
и кварц подвергаются сушке, так как со-
держание в шихте влаги весьма вредна
отражается на процессе.
Применяемый для шихты фосфорит дол-
жен содержать минимальный процент
железа, фтора, углекислоты и серы. Антра-
цит должен содержать не более 3,5%
/—корпус печи; 2 и фу-
теровка; 4—крышка;
5—люк; 6—отверстие для
выхода паров фосфора;
7—графитовый электрод;
8—блок; Я—под; /О—отвер-
стие для выпуска шлака
упорным кирпичом
(25 мм), состоящей
летучих веществ, которые, так же как и
сера, весьма вредны для процесса.
Смесь сырых материалов загружают в
печь (рис. 29), которая представляет собой
железный цилиндр 7, футерованный огне-
2 (12 см) и огнеупорной набойкой 3
из смеси пека или смолы с коксом. Печь
120
имеет чугунную крышку 4, поверхность которой охлаждается
водой. Смесь периодически (через каждый час) загружается через
люк 5 (таких люков имеется на крышке три). Через отверстие &
непрерывно идут пары фосфора, которые конденсируются в во-
дяном конденсаторе. В центре печи находится цилиндрический
графитовый электрод 7 диаметром 40 см, который может под-
ниматься или опускаться при помощи троса, перекинутого через
блок 8. Вторым электродом является под печи 9, сделанный из
электродных кирпичей. Для периодического выпуска шлака
печь снабжена отверстием 10, которое закрывается огнеупорной
глиной.
Печь с внутренним диаметром 90 см и высотой НО см
работает при 45—60 в при нагрузке 1500—2000 кет. Из элек-
тропечи пары фосфора поступают в пыльные камеры, а затем
в .ряд опрокинутых колоколов. Колокола опущены в сосуды,
наполненные водой. Пары фосфора конденсируются в. колоко-
лах, и жидкий фосфор, будучи тяжелее воды, скапливается
на дне сосуда. Полученный желтый фосфор в расплавленном
виде сифоном сливают в приемник.
Для очистки полученного фосфора-сырца его подвергают
в расплавленном состоянии фильтрации под водой через тол-
стую ткань или кожу. Для обесцвечивания желтого фосфора
его расплавляют под водой и прибавляют к нему разбавленный
раствор хромовой кислоты.
б. Характеристика технического белого фосфора и его хра-
пение. Технический белый фосфор выпускается в виде болванок
цилиндрической или полуцилиадрической формы, в виде палочек
произвольного диаметра и в виде гранул. Фосфор хранят в бан-
ках из листового оцинкованного железа, покрытых изнутри
кислотоупорным лаком, по 6 кг в банке. Помещенный bi банку
фосфор заливают водным раствором хлористого кальция.
Технический фосфор окрашен в буроватый, иногда почти
черный цвет. Он должен плавиться при температуре не ниже
43° и содержать не более 0,5% веществ, не растворимых в се-
роуглероде, в том числе не более 0,2% серы. Кроме серы
в техническом фосфоре содержатся примеси мышьяка, крем-
ния, угля и солей фосфатов.
Для испытания полученного белого фосфора навеску его
окисляют азотной кислотой; в полученном растворе фосфор
может быть определен количественно методом осаждения мо-
либденовокислым аммонием; полученный раствор подвергают
также испытанию на 'возможные примеси к белому фосфору:
мышьяк, серу и железо.
в. Получение красного фосфора. Красный фосфор получают
из белого нагреванием последнего, без доступа воздуха, в авто-
клавах.
Производство красного фосфора ведется по способу Шрет-
тера, заключающемуся в медленном (в течение нескольких су-
ток) нагревании белого фосфоре. В железный автоклав!, снаб-
женный крышкой, загружают белый фосфор в количестве
ЯК 121
250—300 кг. Температуру в автоклаве сначала держат не выше
230°. Затем ее поднимают до 240° и на этом уровне держат
около 4 час. Далее температуру повышают до 260° и потом
медленно в продолжение 6 час. доводят до 280°. После этого
температуру повышают до 300°, а автоклав нагревают еще не-
сколько часов. При правильном течении реакции давление
в автоклаве не должно превышать 2—2,5 ат. После окончания
реакции автоклав охлаждают в течение суток.
Полученный сырой продукт представляет собой темно-
красные комья, содержащие около 2% белого фосфора. Для
удаления последнего красный фосфор-сырец после измельчения
в мокрой шаровой мельнице обрабатывают раствором едкого
натра (при кипячении), который реагирует с белым фосфором
по уравнению:
Р4 -j- 3NaOH + ЗН2О = РН3 + 3NaH2PO2.
После промывки красный фосфор измельчают на шаровой
мельнице и сушат в вакуум-шкафу при температуре не
выше 60°. Полученный (красный фосфор все же содержит следы
белого, который окончательно удаляют экстрагированием се-
роуглеродом. Очищенный продукт состоит на 99% из фосфора;
примесями являются кремнезем, известь и окись железа.
3. Сульфиды фосфора
Сернистые соединения фосфора, подобно эле-
ментарному фосфору, способны гореть, причем это горение со-
провождается образованием густого белого дыма. Ни один из
сульфидов фосфора не обладает Характером солей, а все они
являются тиоангидридами (кислотными сульфидами),
причем известны соответствующие им сульфосоли.
Фосфор образует с серой ряд соединений: P2S, P4S3, Р/зз,
P4S7, P2S5 и PSe, из которых наиболее устойчивыми являются
лента сульфид P2S5 и сесквисульфид P4S3. При низ-
кой температуре фосфор совершенно не реагирует с серой, даже
если смешать растворы этих элементов в сероуглероде. Все же
сера даже с ненагретым белым фосфором образует раствор,
из которого могут быть выделены смешанные кристаллы.
Сульфиды же получаются при сплавлении фосфора с серой
в атмосфере инертного газа, с применением в качестве исход-
ных веществ обычно красного фосфора и серного цвета.
Сесквисульфид фосфора P4S3 имеет вид желтой
сплавившейся массы или зеленовато-желтых ромбических игл.
Плотность 2,03 г/см5. Температура плавления 170°; температура
кипения 408°. Сесквисульфид фосфора легко растворяется в се-
роуглероде, треххлористом фосфоре’и растворах сернистых ще-
лочей. Сесквисульфид фосфора легко загорается на воздухе;
температура его воспламенения всего 100°. Вследствие этого
сесквисульфид применяется для изготовления спичек, зажигаю-
щихся при трении о любую поверхность.
122
Трехсернмстый фосфор P2S3 — твердая черная
хрупкая масса кристаллического строения. Температура его
плавления 296°.
Пятисернистый фосфор P2S5 встречается в двух
модификациях, которые отличаются друг от друга величиной
молекул. Модификация, получающаяся при быстром охлажде-
нии паров, гораздо светлее и легче растворяется в сероугле-
роде, чем та, которая образуется при приготовлении другими
способами. Так как плотность пара пятисернистого фосфора
указывает на формулу P2S5, а определение мол. веса в растворе
дает формулу P4S10, то, вероятно, более темная модификация
является полимеризованной формой. Плотность пятисернистого
фосфора 2,03 г/слЛ Температура плавления 276°; температура
кипения 514°. При действии воды медленно разлагается с выде-
лением сероводорода:
P2S6 + 2НаО == PaSsO2 + 2H2S.
Сульфид состава P4S7 — желтые кристаллы. Плотность
этого сульфида 2,19 г/сл®. Температура плавления 306°;i тем-
пература кипения 523°. В сероуглероде не растворяется.
Все сульфиды фосфора при нагревании, в присутствии воз-
духа или веществ, легко отдающих кислород, способны сгорать
с пламенем и выделением белого дыма.
4» Дымообразование и маскирующие свойства фосфора
и его сульфидов
а. Горение фосфора и его сульфидов. Как уже указывалось
выше, белый фосфор самопроизвольно загорается на воздухе.
В результате горения образуется густой белый дым, превосхо-
дящий по своим маскирующим свойствам дымы, получаемые
при помощи других веществ. Горение фосфора с образованием
дыма происходит почти независимо от температуры и влажно-
сти воздуха и только самые неблагоприятные условия распо-
ложения горящего фосфора могут ухудшить дымообразование.
Таким образом, для того чтобы начался процесс горения, а сле-
довательно, и дымообразования, нет надобности в применении
каких-либо усилий. Наоборот, задачей технических средств
применения фосфора является изоляция фосфора, до его при-
менения, от воздуха и тем самым предохранение его от преж-
девременного самопроизвольного загорания. Необходимость
такой полной изоляции является главным препятствием к ши-
рокому применению фосфора при помощи всех возможных спо-
собов дымообразования. Белый фосфор можно применять лишь
с помощью таких технических средств, которые обеспечивают
в момент применения быстрое и полное освобождение его от
оболочки.
Фосфор предназначается для снаряжения мин, артиллерий-
ских снарядов и авиационных бомб.
Помимо этих способов применения белого фосфора были
сделаны некоторые попытки применить для дымообразования
красный фосфор и сульфиды фосфора, работа с которыми во
123
многих отношениях удобнее, чем с белым фосфором. Во мно-
гих случаях удобно также применение белого фосфора со-
вместно с красным1 и с сульфидами фосфора.
В момент освобождения белого фосфора от оболочки
он раздробляется, и поверхность его кусков и капель, обра-
зовавшихся в результате частичного плавления, соприкасается
с воздухом. Еще до воспламенения незначительная часть фос-
фора Может испариться, и горение этой части будет уже
происходить bi газовой фазе. Вслед за воспламенением всей
массы фосфора одновременно идут два процесса: горение на
фазовой поверхности и испарение не успевающего сгореть фос-
фора о последующим воспламенением в газовой фазе. Горение
в газовой фазе идет с образованием napoBi фосфорного ангидри-
да, при горении же на фазовой поверхности, помимо паров
фосфорного ангидрида, образуются также и пары трехокиси
фосфора (фосфористого ангидрида) и, как вторичного продукта,
четырехокиси фосфора. Пары образовавшихся кислородных
соединений фосфора пересыщают пространство, так как при
естественных температурах упругости их паров очень малы
(например, упругость паров фосфористого ангидрида при 30°
составляет 3 ми рт. ст.). Пары фосфорного ангидрида частично,
вследствие пересыщения, конденсируются, образуя частицы
дыма, частично же вступают в реакцию с парами воды, нахо-
дящимися в атмосфере, в результате чего в зависимостй от
влажности и температуры образуется метафосфорная или орто-
фоофорная кислота:
Р4О10+2НаО = 4НРОв;
Р4О10 + 6Н2О = 4Н8РО4.
Пары образующихся метафосфорной или ортофосфорной
кислот также пересыщают пространство, так как упругость их
паров, уже совершенно ничтожна. Результатом этого пересыще-
ния является конденсация метафосфорной или ортофосфорной
кислоты. Таким образом, конденсация приводит к образованию
нескольких видов дымовых частиц: фосфорного ангидрида,
трехокиси фосфора, четырехокиси фосфора и фосфорных ки-
слот. Однако вместе с образованием этих частиц конденси-
руется из атмосферы и вода, которая реагирует с окислами
фосфора, образуя ортофосфорную, метафосфорную и фосфори-
стую кислоты.
Ввиду того что фосфор при сгорании используется почти
целиком и при этом, присоединяя большие массы элементов
атмосферы, образует устойчивый аэрозоль, его следует при-
знать весьма эффективным дымообразователей. 1 вес. ч. фос-
фора, в худшем случае, дает при сгорании. 3 вес. ч. дисперсной
фазы дыма. Такой высокий коэфициент использования фосфора
резко отличает его' от всех других дымообразователей и ставит
его среди них на первое место.
б. Состав фосфорного дыма. В результате горения фосфора
или его сульфидов и всех сопровождающих это горение -про-
124
цессов образуется дым, состоящий из кислот. Соотношение
между этими кислотами не изучено, но следует предполагать,
что дым состоит, главным образом, из ортофоофорной кислоты
с примесью метафосфорной. В дальнейшем образовавшиеся
капельки фосфорной кислоты вследствие гигроскопичности про-
должают поглощать влагу из воздуха, и образуются частицы
тумана, состоящего из раствора, находящегося в фазовом рав-
новесии с водяными парами атмосферы. Равновесие между фа-
зами образовавшейся аэрозольной системы наступает, невиди-
мому, достаточно быстро. Конденсация воды практически не
изменяет упругости 'водяного пара в атмосфере.
Состав дисперсной фазы тумана, состоящей из раствора
исключительно ортофоофорной кислоты, можно определить,
если известны температура и упругость водяного пара, так как
упругость 'водяного пара, находящегося в равновесии с раство-
рами ортофосфорной кислоты, известна. В табл. 26 приведены
величины упругости водяного пара над растворами ортофосфор-
ной кислоты.
Таблица 26
Упругость водяного пара над растворами
ортофосфорной кислоты (мм рт. ст.)
% Н8РО4 Температура СС
25 40 60
10 20 30 40 50 60 70 80 90 Частицы фосфорной в случае понижения вл ние приводит к тому, зующий дисперсную фг 22,9 22,3 21,5 19,7 16,9 13,0 8,08 3,6 1,69 э тумана к ажности а* сто раство] 1зу, станов 54,1 51,9 48,9 43,4 36,8 28,9 19,9 10,7 1,96 югут ПОД гмосферы. ) фосфор! ится кре 146 141 . 133,5 121 103 80,9 56,3 30,8 6,73 вергаться испарению Однако это испаре- гой кислоты, обра- пче. Испарение при
этом останавливается, так как упругость водяного пара над
частицами уравнивается с влажностью атмосферы.
Содержание фосфорной кислоты и тумане можно также вы-
числить, воспользовавшись правилом Бабо и зная относитель-
ную влажность воздуха. Подобно тому как это имеет место
для сернокислотного тумана, каждому значению относительной
влажности воздуха будет соответствовать туман, содержащий
определенное количество ортофосфорной кислоты.
. Состав тумана ортофосфорной кислоты в зависимости от
. относительной влажности воздуха приведен в табл. 27.
Ж в. Дымообразующая и маскирующая способности. Взаимо-
( Ж действие фосфора с кислородом воздуха и последующее погло-
V
Таблица 27
Состав тумана ортофосфорной кислоты (°/0)
Относитель- ная влаж- ность воз- духа Содержание в тумане Н5РО* в о/г Относитель- ная влаж- ность воз- духа Содержание в тумане Н3РО4 в о/о Относитель- ная влаж- ность воз- духа Содержание в тумане Н8РО4 в о/»
10 84 40 64 70 46
20 77 50 58 80 37
30 71 60 .53 90 23
щение влаги являются причинами весьма высокой его дымо-
образующей способности. Из’ одного грамматома фосфора
(31 г) образуется одна граммолекула фосфорной кислоты. Так
как ортофосфорная кислота при средних относительных влаж-
ностях воздуха образует примерно 50%-ный раствор, то в ко-
нечном итоге 31 г фосфора теоретически дает 191 г тумана
разбавленной фосфорной кислоты.
Таким образом, среднее значение дымообразующей способ-
ности равно примерно 6,32 (191 :31). Вследствие высокого коэ-
фициента использования фосфора практическая величина его
дымообразующей способности не намного ниже теоретической.
Дымообразующая способность фосфора зависит от относи-
тельной влажности воздуха и возрастает с увеличением по-
следней. Высокая дымообразующая способность фосфора обу-
словливает большое значение маскирующей способности. По
маскирующей способности фосфор занимает первое место из
известных дымообразующих веществ. Маскирующая способ-
, ность фосфора зависит от
Таблица 28 относительной влажности
Маскирующая и дымообразующая
способности и маскирующий вес
белого фосфора
Отиоси- льная влаж- ность в % Маски- рующая способ- ность Дымооб- разую- щая спо- собность Маски- рующий вес
30 11,4 3 0,39
50 13,3 "V 0.33
80 Г 17,0 12 0,26
воздуха и возрастает с ее
увеличением.
Однако увеличение мас-
кирующей способности про-
исходит медленнее, чем ды-
мообразующей способности.
Это объясняется тем, что
при больших влажностях
образуется разбавленный
раствор ортофосфорной кис-
лоты, оптические свойства
которого хуже оптических
свойств концентрированных
растворов.
(МС) и , - ~
фосфора приведены в табл. 28.
Маскирующая
маскирующий вес
Суммарная кроющая способность (ТОП) фосфора составляет
по Прентису 1030 м2/кг, а количество вещества, необходимое
для маскировки 25-ваттной лампы, равно на расстоянии
20 м 50 Mzfifi.
дымообразующая (Д) способности и
126
ГЛАВА IX
ГОРЮЧИЕ ДЫМОВЫЕ СОСТАВЫ
1. Рецептуры горючих дымовых составов
а. Типы дымовых составов. В виде твердых горючих соста-
вов, употребляемых для снаряжения дымовых шашек, приме-
няются вещества, дающие дым при возгонке, а также системы
веществ, реагирующих при нагревании друг с другом с образо-
ванием дыма. Соответственно этому имеется два вида горючих
составов.
В одном случае состав содержит негорючее вещество, кото-
рое вследствие тепла, развиваемого при горении состава, спо-
собно возгоняться, и давать при этом дым. Эти составы мы бу-
дем называть те р монво з г о н оч н ы м и составам, так-
как дымообразующим процессом здесь является термическая
возгонка.
Другим видом составов являются так называемые мета л-
лохлоридные составы. При горении таких составов
между дымообразующими компонентами идет реакция, при ко-
торой образуется пар хлорида металла, конденсирующийся
в атмосфере, в дым.
Эти два типа составов резко отличаются друг от друга со-
держанием компонентов и принципом дымообразовании. В пре-
делах же каждого типа составов существует много разновид-
ностей и вариантов, которые имеют много общих .черт.
Термо-возгоночный состав содержит обычно дымообразова-
тель и собственно горючую смесь. Последняя построена по
принципу обычных пороховых смесей, т. е. состоит в основном
из горючего вещества и окислителя. Дымообразователями,.
которые могут быть применены в термо-возгоночных составах,
являются вещества, способные давать дым в результате воз-
гонки и относящиеся к различным химическим классам. Эти
вещества объединяются наличием у каждого из них свойств,
позволяющих при высокой температуре вводить в атмосферу
их пары в количестве, достаточном для образования дыма.
Этими свойствами являются большая летучесть при темпера-
турах возгонки и малая при естественных температурах и хими-
ческая устойчивость при испарении с последующей конденса-
цией. Такими свойствами обладают, вообще говоря, многие
вещества, но значение в практике дымообразовании имеют
только некоторые из аммонийных солей, тяжелых углеводород
дов и органических кислот.
Металлохлоридные составы содержат дымообразующие ком-
поненты и специальные вспомогательные вещества. Дымообра-
зующих компонентов два: металлический и хлор-
содержащий.
Все компоненты горючих дымовых составов обычно равно-
мерно перемешаны. Определенное весовое количество дымового
состава снаряжается в виде изделия, называемого дымовой
шашко й. Горючие дымовые шашки приводятся в действие '
127
посредством сильного теплового импульса, который осуще-
ствляется при помощи специальных запалов.
Принципы составления. Термо-возгоночные дымовые
составы содержат дымообразователь, который возгоняется
вследствие выделения тепла при горении состава. Термо-
возгоночный дымовой состав представляет собой, таким обра-
зом, смесь дымообразователя со специальной горючей смесью.
Горючая смесь должна содержать горючее вещество и окисли-
тель, выделяющий кислород, необходимый для горения. Таким
образом, термо-возгоночный дымовой состав должен состоять,
по крайней мере, из трех компонентов: дымообразова-
теля, горючего и окислителя. Все эти три компонента
тщательно перемешаны, но, несмотря на это, возгонка дымо-
образователя происходит так, как если бы дымообразователь
был отделен от горючей смеси перегородкой, пропускающей
тепло.
Во многих случаях каждую из этих трех ролей может
играть не одно вещество, а два и даже больше. Поэтому состав
дымовых смесей иногда бывает очень сложным. Часто, 'наобо-
рот, одно вещество играет одновременно две роли, например
часть вещества сгорает, иесгоревшая же часть возгоняется,
образуя дым. Таким образом, это вещество является и дымооб-
разователем и горючим. Некоторые окислители могут частично
служить дымообразователей, иногда же дымообразователей
может быть продукт раскисления окислителя.
Помимо трех основных компонентов — дымообразователя,
горючего и окислителя — термо-возгоночные составы могут
содержать также в небольшом количестве вспомогательные
компоненты — ф л ег м а т из а т о р ы, разрыхлители, на-
полнители, пламягасители.
Составление термо-возгоночных смесей производится с таким
расчетом, чтобы достигался цолный выход дымообразователя. Это
требует затраты определенного количества горючего вещества,
полное сгорание которого должно быть обеспечена соответ-
ствующим количеством окислителя. Помимо этого важно, чтобы
состав горел равномерно и не слишком быстро. Чтобы этого
достигнуть, требуются дополнительные вариации основных
компонентов и введение вспомогательных. Дымообразующие
компоненты термо-возгоночных составов описаны ниже. Неко-
торые из них, например тяжелые углеводороды, могут частично
выполнять функции - горючих веществ, а такие, как азотно-
кислый аммоний, — функцию окислителя.
Металлохлоридные дымовые составы содержат металличе-
ский и хлорсодержащий компоненты, которые при горении со-
става реагируют, образуя, благодаря выделению тепла при го-
рении смеси, пар хлорида металла. Вообще говоря, металлохло-
ридный дымовой состав может состоять Только из двух
компонентов: металлического и хлорсодержащего. Однако в
большинстве случаев для осуществления нормального горения
состава этих двух компонентов бывает недостаточно и
требуется введенйе вспомогательных компонентов.
128
Основными компонентами металлохлоридных составов яв-
ляются порошкообразные металлы и хлорсодер-
жащие органические вещества.
Из вспомогательных компонентов металлохлоридных соста-
вов наиболее важное значение имеют окислители. Окисли-
тель необходим для того, чтобы поддерживать горение состава.
Как уже указано выше, состав может иметь только два основ-
ных компонента, так как обычно сама реакция образования
хлорида металла дает тепло, необходимое для горения состава.
При введении окислителя выделяется дополнительное тепло,
что позволяет провести всю реакцию с достаточной скоростью.
В качестве окислителя в металлохлоридных составах могут при-
меняться те же вещества, что и в термо-возгоночных. Специ-
ального горючего вещества в металлохлоридные смеси не вво-
дят. За счет кислорода, выделяющегося из окислителя, горит
уголь, освобождающийся при реакции органического хлорида
с металлом, и частично металлический компонент. В результате
горения последнего образуется дым окисла металла. Д о б а в о ч-.
ный д ы м о?о б<ра з о в а т е л ь — обычно вещество, дающее
дым при возгонке, вводится в металлохлоридную смесь для
того, чтобы увеличить ее дымообразующую способность и ис-
пользовать, таким образом, теплоту, развиваемую при горении
смеси. Такие добавочные дымообразователи одновременно могут
играть роль флегматизаторов. Чаще всего для этой цели приме-
няется хлористый аммоний.
в. Употребительные рецептуры. Известно большое количество
рецептур термо-возгоночных дымовых составов. Все эти рецепты
довольно схожи между собой. Здесь будут приведены только
некоторые из известных рецептов.
В русской армии в 1915—1918 гг. применялась смесь Ершова
имевшая следующий состав (в %):
Хлористый аммоний ......'............50
Нафталин..............................20
Бертолетова соль......................20
Уголь (порошок).................• . . 10
Хлористый аммоний и часть нафталина являются в этой
смеси дымообразующими компонентами, уголь и другая часть
нафталина — горючими компонентами, а бертолетова соль — оки-
слителем’.
Другая разновидность смеси Ершова составлена для по луче-
ния более быстро горящей смеси. Для этого часть хлортстого
аммония (флегматизатора горения), заменена на дополнительный
окислитель. Состав смеси (в %):
Хлористый аммоний......................40
Нафталин............................. 20
Калиевая селитра..................... 10
Бертолетова соль.......................20
Уголь (березовый)..................... 10
9 Зак. 3184. Вейцер и Лучипский 129
Менее распространенными разновидностями смеси Ершова
являются смеси Санникова и Горбова (в %):
Бертолетова соль......51 Бертолетова соль...67
Нафталин..............41 Хлористый аммоний ... 23
Уголь (березовый).....8 Уголь (березовый) .... 7
Нафталин........... 3
Последние две смеси отличаются высоким содержанием
окислителя и потому способны быстро гореть.
Все эти смеси довольно устойчивы; смесь Ершова выдержи-
вает весьма длительное хранение.
Существует много рецептур, напоминающих по своему со-
ставу вышеприведенные, но с иным соотношением компонентов.
Многие рецептуры иностранных армий составлены по тому же
принципу, но о заменой отдельных компонентов: нафталина —
другими тяжелыми ароматическими углеводородами, бертолето-
вой соли — хлорноватокислым «атрием или селитрой, угля —
углеводами и т. д.
В английской армии в первую мировую войну употреблялась
смесь S следующего состава (в %):
Калиевая селитра......................40
Каменноугольная смола ............... 29
Сера..................................14
Уголь (порошок)....................... 9
Бура.................................. 8
Здесь дымообразующим компонентом является каменноуголь-
ная смола, роль горючего исполняется двумя веществами (уголь
и сера), роль окислителя — калиевой селитрой, а бура (борно-
кислый натрий) является флегматизатором и- наполнителем.
Суммарная кроющая способность смеси S составляла всего
103. I
Известны своими хорошими качествами дымовые составы,
содержащие сырой антрацен (смеси А).
Так, например в Красной армии известны дымовые составы
содержащие 40—50% сырого антрацена. Наиболее распростра-
ненный состав содержит, кроме сырого антрацена, хлористый
аммоний и в качестве окислителя бертолетову соль. В польской
армии применялся в 1939 г. следующий дымовой состав (в%):
Сырой антрацен.........................35
Калиевая селитра ..................... 46
Перхлорат аммония......................14
Песок.................................. 5
В некоторых случаях дымовые составы не содержат органи-
ческого горючего дымообразователя. Так, например, в румын-
ской армии в 1940 г. применялся такой дымовой состав (в %):
Хлористый аммоний.....................60
Сера..................................22
Бертолетова соль.................. . 18
Из металлохлоридных составов наиболее известна по приме-
нению во время войны 1914—1918 гг. смесь Берже. Первона-
130
чально смесь Берже не имела окислителя и состав ее был
следующий (в %):
Четыреххлористыйуглерод..............50
Цинковая пыль................* .... 25
Окись цинка..........................20
Кизельгур............................ 5
Окись цинка и кизельгур здесь играют роль разрыхлителей
(для фиксации жидкого CCh). Дым образуется гари горении
смеси вследствие восстановления четыреххлористого углерода
цинком:
CCI44-2Zn=-2ZnCl2 + C.
Образующиеся при этом пары хлористого цинка конденси-
руются! в воздухе. Выделяющийся углерод окрашивает получаю-
щийся дым в серый цвет. Суммарная кроющая способность
смеси Берже равнялась по Прентису 280. Смесь Берже при-
менялась и во вторую мировую войну с несколько иным соот-
ношением компонентов в итальянских, японских и венгерских
шашках.
Для получения белого дыма необходимо было окислить
углерод, придающий дыму смеси Берже черную окраску. С этой
целью в смесь вводили NaClOs. Кроме того, кизельгур был
заменен более инертным разрыхлителем MgCOs и в качестве
дополнительного дымообразователя и флегматизатора введен
NHaCl.
Полученная смесь была названа смесью ВМ и имела сле-
дующий состав (в %):
Четыреххлористый углерод...........41,1
Цинковая пыль . . . .'............ 32,2
Хлорноватокислый натрий........... 14,6
Хлористый аммоний.................. 8.8
Углекислый магний.................... 3,3
Суммарная кроющая способность смеси ВМ равнялась 310.
Другой вариант смеси ВМ, отличающийся большой скоростью
горения, имел состав (в%):
Четыреххлористый углерод........... 40,8
Цинковая пыль ..................... 34,6
Хлорноватокислый натрий .......... 9,3
Углекислый магний...........• . . . 8,3
Азотнокислый калий.................. 7,0
Хлорноватокислый натрий неудобен для применения о сме-
сях вследствие его гигроскопичности. Он применялся в амери-
канских смесях по экономическим соображениям и может быть
вполне заменен бертолетовой солью.
Позже в США стали считать удобным заменять в металло-
хлоридных смесях жидкие хлорсодержащие компоненты (CCh)
твердыми (гексахлорэтан, гексахлорбензол). Эти смеси получили
название смесей НС и используются в настоящее время для
снаряжения дымовых шашек во всех армиях. В смесях НС
9* 131
уже отпадает необходимость в разрыхлителях. Кроме того, эти
смеси большей частью не содержат окислителя, так как при
взаимодействии гексахлорэтана с цинком выделяется достаточ-
ное количество тепла, а происходящее в смесях ВМ окисление
угля ухудшает маскирующие свойства дыма. Американская
смесь НС дымовых шашек М.-1 имеет по Прентису следующий
состав (в %):
Цинковая пыль....................* • • 28
Окись цинка...........................22
Гексахлорэтаи.........................50
Суммарная кроющая способность этой .рецептуры равна 470.
В германских дымовых шашках имелась смесь (в %):
Цинковая пыль...................... 47,5
Гексахлорэтаи...................... 47,5
Окись циика........................ 5
В финских шашках (в%):
Цинковая пыль...................................50
Гексахлорэтаи.........................50
Сделаны также попытки заменить дорогую цинковую пыль по-
рошкообразным железом или его сплавами, а также алюминием.
2. Вещества, дающие дым при возгонке
Из веществ, дающих дым при возгонке, практическое зна-
чение имеют некоторые аммонийные соли и органические дымо-
образователи, являющиеся, главным образом, углеводородами
или веществами кислого характера. Эти вещества могут приме-
няться не только как компоненты горючих дымовых составов,
но и в индивидуальном виде путем возгонки из специальных
аппаратов за счет тепла топочных или других горячих газов
или тепла нагретых металлических поверхностей. Такая возгонка
Производится часто путем ввода . соответствующего вещества
в, нагретое пространство в распыленном состоянии.
Тяжелые углеводороды как жирного, так и ароматического
рядов оказались удовлетворяющими требованиям, предъявляе-
мым к возгоняемым дымообразователям. Правда, все они спо-
собны при нагревании с доступом воздуха гореть, но всегда
может быть достигнуто положение, при котором это горение
будет происходить только частично, значительная же часть
углеводорода будет возгоняться с образованием дыма. Из угле-
водородов жирного и ароматического рядов (могут быть подо-
браны как раз такие, которые целиком могут испаряться при
температурах возгонки и вследствие низкой летучести при обыч-
ных температурах давать вполне устойчивый дым. Такие угле-
водороды могут быть найдены среди природных продуктов (на-
пример, озокерит) и добыты при переработке нефти и каменного
угля.
132
а. Продукты жирного ряда. Главным природным источником
парафиновых углеводородов как тяжелых, так и легких ва-
ляется нефть. Из нефти отдельные углеводороды и смеси близ-
ких по составу углеводородов выделяются дробной перегонкой.
Наиболее легко кипящие части нефти, обыкновенно не свыше
!150°, называются бензином. Керосин содержит фракции, ки-
пящие между 150 и 300°. Фракции, перегоняющиеся без разло-
жения при более высоких температурах, называются соляровым
маслом. Посредством перегонки с водяным паром фракций,
кипящих выше 300°, получают вазелин — густую смесь жидких
и твердых углеводородов. Выделенный при кристаллизации выс-
ших погонов нефти твердый воскообразный продукт называется
парафином. Парафин' получается также при перегонке бурых
углей и битуминозных сланцев. Неперегояяющаяся без раз-
ложения часть нефти носит . название «нефтяных остатков или
мазута. Мазут может быть подвергнут перегонке с перегретым
водяным паром; при этом получаются смазочные масла; вере-
тенные, машинные и цилиндровые. В природе встречаются и
отдельные залежи твердых парафинов в виде минерала озо-
керита (горного воска). Очищенный озокерит называется
церезином.
Мазут — густая, вязкая, черного цвета жидкость. Плот-
ность 0,89—0,92 е/сл3 (в зависимости от сорта нефти й от
содержания .солярового масла); температура вспышки 100°;
теплоемкость 0,5 кал/град, теплота испарения 85 кал/г. Мазут
обычно применяется как топливо, однако нагретый при недо-
статочном доступе воздуха дает дым, дисперсная фаза кото-
рого состоит из нефтяных масел, парафина и продуктов осмо-
ления. Веретенное, машинное и цилиндровое масла могут быть
легко возогнаны, причем получается масляный туман. Возгонкой
этих масел пользуются при лабораторных исследованиях
туманов.
Гудрон. Под названием гудрона известно несколько ве-
ществ, получаемых различными способами. Гудрон — твердая
или полутвердая масса черного цвета, состоящая из смеси угле-
водородов и смол с незначительными количествами кислот
и фенолов!. Гудрон получается в виде твердого остатка при
переработке мазута йа смазочные масла. Другой сорт- гудрона
выделяется из кислых отбросов, получаемых при очистке неф-
тепродуктов. При возгонке гудрон дает дым, дисперсную фазу
которого составляют тяжелые углеводороды в смеси с продук-
тами осмоления.
Парафин — белая масса без запаха и вкуса. Недостаточно
очищенный парафин имеет желтый цвет. Плотность твердого
парафина- *0,90—0,91, жидкого 0,78 г/сж3. Температура пла-
вления колеблется от 45 до 60°. Парафин химически весьма
устойчив и способен возгоняться, почти не изменяясь; при воз-
гонке дает устойчивый дым.
б. Продукты ароматического ряда. Главным источником по-
лучения ароматических углеводородов является к а м е н и о-
133
угольная смола, получаемая при сухой перегонке камен-
ного угля. Каменноугольная смола — густая, темнобурая или
даже черная жидкость со своеобразным фенольно-нафталиновым
запахом, представляет собой сложную смесь многочисленных
ароматических соединений преимущественно нейтрального и кис-
лого характера. При перегонке каменноугольной смолы полу-
чаются следующие фракции: 1) легкое масло с температурой
кипения до 160°, содержащее летучие углеводороды (бензол,
толуол, ксилолы), фенолы, пиридины; 2) среднее масло с тем-
пературой кипения 160—220°, разделяемое на карболовое масло,
содержащее до 30% фенолов, и нафталиновое масло, содержа-
щее до 50% нафталина; 3) тяжелое или креозотовое масло
с температурой кипения 220—270°, содержащее до 20% нафта-
лина, и 4) зеленое или антраценовое масло, перегоняющееся
в пределах температур 270—400°. Антраценовое масло содер-
жит до 8% антрацена н до 6% кислых соединений. Плотнбсть
этого масла равна 1,1 г/см3. При охлаждении антраценового
масла из него выделяется кристаллическая масса, называемая
сырым антраценом, содержащая 12—20% антрацена, флуорен,
фенантрен, аценафтен, карбазол и другие вещества. Остаток
от перегонки, составляющий свыше 50% от веса смолы, назы-
вается пеком. Пек — твердая или полутвердая черная бле-
стящая масса.
Возгоняться, хотя бы и не полностью, с образованием дыма
способны углеводороды' о высокими точками кипения. Эти ве-
щества содержатся в нафталиновом, креозотовом и антрацено-
вом маслах и пеке и химически представляют собой соединения
с конденсированными бензольными ядрами.
Нафталин СюНв выделяется из нафталинового и тяже-
лого масел. Для получения нафталина масло, содержащее 45—
50% нафталина, разливается ® кристаллизаторы. Через 2—4 дня
жидкое масло сливается, а выделившийся нафталин 'расплав-
ляется горячим парам и поступает на вторичную кристаллиза-
цию.
После вторичной кристаллизации нафталин центрофугиро-
ванием' отделяют от масла. Полученный таким образом нафта-
лин-сырец содержит около 75% чистого нафталина. Для
дальнейшей очистки нафталин прессуют, промывают кислотами
и щелочами и подвергают ректификации. Чистый нафталин —
белые листочкообразные кристаллы с сильным характерным за-
пахом.
Температура плавления нафталина 80°; температура кипения
217,9°, Плотность твердого нафталина при 20° 1,158; плотность
жидкого нафталина при 80° 0,9779 г/см3. Вязкость жидкого
нафталина при 80° 0,00886 и при 150° 0,00217 пуаза. Поверх-
ностное натяжение нафталина при 125° 29 дин/см. Упругость
пара над кристаллическим нафталином при 30° 0,064 мм рт. ст.;
упругость пара жидкого нафталина при 85° 9,8 мм рт. ст., при
110° 28,37 мм рт. ст. и при 250° 1487 мм рт. ст.
Теплоемкость твердого нафталина равна в среднем
134
0,310 кал/град\ скрытая теплота плавления нафталина 35,6 кал/г-,
теплота испарения 75,5 кал/г. Теплота горения при постоянном
давлении 9614 кал.
Нафталин легко возгоняется; он способен гореть сильно коп-
тящим пламенем. Поэтому при возгонке нафталина при высокой
температуре и при доступе воздуха значительная часть его бу-
дет сгорать, отчего образующийся дым будет окрашиваться
в серый цвет.
Антрацен СыНю получается из зеленого масла. Антра-
ценовое масло содержит 5—8% антрацена' и при стоянии в те-
чение 5—8 дней выделяет сырой антрацен bi виде зеленовато-
желтой массы. В сыром антрацене находится 12—22% антрацена.
Кроме того, в нем имеется: 20—30% фенантрена СмНю;
флоурен СиНюх аценафтен С12Н10; 15—25% карбазола C12H9N;
акридин CisHeN; флоурантен С15Н10; псевдофенантрен СиНтг;
пирен СиНю; хризен CieHw; метилантрацен С15Н12 и 10—16%
масел. Для дальнейшей очистки сырой антрацен отжимают под
гидравлическим прессом при нагревании. Отпресованный продукт
содержит 23—39% антрацена. При дальнейшей обработке рас-
творителями получают сырой антрацен, содержащий 50% антра-
цена. Химически чистый антрацен — белые кристаллы с голубой
флуоресценцией и с характерным запахом.
Температура плавления антрацена 218°; температура кипе-
ния 342°. Плотность 1,25 г/см3. В воде не растворим;; растворим
в органических растворителях, легко возгоняется, с образованием
дыма; при доступе воздуха и высокой температуре может ча-
стично сгорать. Теплота горения антрацена при постоянном дав-
лении 9510 кал.
Фенантрен Q4II10, карбазол C12II9N и другие состав-
ные части антрацена-сырца. Свойства фенантрена, карбазола
и других тяжелых углеводородов, входящих в состав антра-
цена-сЫрца, приводятся bi табл. 29.
Таблица 29
Свойства составных частей антрапена-сырца
Наименование’ компонента • Температу- ра плавле- ния в °C Температура кипения в -'С Теплота го- рения в кая
Фенантерен 100 340 9506
Флуорен 116 294 —
Аценафтен 95 278 —
Карсазол 238 335 8831
Акридин . . 107 346 —
-Флуорантреи 109 250 (60 мм рт. ст.) —
Псевдофенантен 115 360 —
Пирен 148 360 —
Хризен 251 448 ——
- Метилантрацен . . 207 зео
135
Маскирующая способность сырого антрацена 3,20; маски-
рующий вес 1,38.
в. Аммонийные соли. Большинство аммонийных солей при
нагревании до сравнительно невысокой температуры возгоняется
о образованием дыма. По существу этот процесс является не
возгонкой, а двумя последовательно текущими реакциями, при-
чем вторая реакция является обратной по отношению к первой.
При нагревании аммонийной соли происходит ее диссоциация на
аммиак и соответствующую кислоту:
NH4C1-> NHS-|-HCI.
Естественно, что наряду с этой диссоциацией происходит
и простое испарение аммонийной соли, однако упругость пара
недиссоциированной соли значительно ниже упругости диссоци-
ации. При охлаждении получившейся смеси газов реакция те-
чет в обратном направлении:
NH8-|-HCl->-NH4Cl,
причем образуется первоначально взятая соль. Дым, полученный
при конденсации' газов,, которые образуются при нагревании
аммонийной соли, состоит из частиц этой же соли. Таким обра-
зом, с внешней стороны дело обстоит так, как при испарении
и конденсации неразлагающихся веществ. Это обстоятельство
и дает возможность называть возгонкой последовательные
, дисссоциацию и ассоциацию аммонийных солей. Следовательно,
выражение «возгонка аммонийных солей» не является строгим
понятием, а Представляет* собой использование тривиального
термина для обозначения более сложного процесса.
Возгоняться (в указанном смысле) способны только аммо-
нийные соли летучих кислот. Аммонийные же соли так назы-
ваемых огнестойких кислот (борной, фосфорной, вольфрамовой,
молибденовой и 'т. п.), разлагаясь аналогично, в газовую фазу
выделяют только аммиак и потому дыма не образуют.
Подобно аммонийным солям возгоняются соли органических
аминов (например, хлористоводородный анилин и др.).
Хлористый аммоний. Из применяемых при возгонке
аммонийных солей наиболее употребительным дымообразовате-
лем является хлористый аммоний.
Удобным техническим способом получения хдористого аммо-
ния является способ Сольвэ, выражающийся, реакцией:
NaCl 4- Н2О + СО2 4- NH8 = NaH£)3 4- NH4C1
Хлористый аммоний можно выделить из маточного раствора
после отделения на вакуум-фильтрах бикарбоната; в этом
растворе находится также хлористый натрий, так как реакция
Сольвэ идет не полно. Выделение хлористого аммония из ма-
точника производится путем упаривания, причем при темпера-
туре кипения выделяется хлористый «атрий, а при охлажде-
нии — хлористый аммоний, или же путем охлаждения маточной
жидкости до — 10°. Второй способ позволяет извлекать хлори-
стый аммоний только частично (30%). Получаемый хлористый
136
аммоний (нашатырь) всегда содержит некоторое количество
хлористого натрия.
Способ получения хлористого аммония нейтрализацией вод-
ного аммиака соляной кислотой хотя и прост, но неэкономичен
вследствие того, что получается разбавленный раствор, для
выпаривания которого требуется специальная аппаратура и
. , большое количество тепла. Получение хлористого аммония иэ
f газообразных аммиака и хлористого водорода возможно, но
в технике не применяется.
Хлористый аммоний, или нашатырь, NH4CI —белое кристал-
лическое вещество, обладающее горькосоленым вкусом.
Плотность хлористого аммония при—75° 1,57, при 4-20°
1,531, при 25° 1,527.
Упругость паров «ад хлористым аммонием складывается из
упругости недиссоциированного па(5а NH4CI и упругости газо-
образных хлористого водорода и аммиака.
Зависимость давления паров от температуры выражается
формулой:
lg/> = 9,778611g Т—21,2171.
Пары хлористого аммония диссоциируют на аммиак и хлори-
стый водород. Степень диссоциации при различных температу-
рах дана в табл. 30.
Как видно из табл. 30 при обра-
зовании дыма из хлористого аммония
имеет Metro не только «химическая
возгонка» (т. е. диссоциация с после-
дующей ассоциацией), но и простая
сублимация NHiCl.
Теплоемкость хлористого аммония
0,39 кал/град; показатель преломления
1,642. Молекулярная теплота испаре-
ния 39 ккал.
Хлористый аммоний легко раство-
ряется в воде, в спирте — несколько
труднее. Растворимость хлористого
аммония в воде при 0° составляет
23%, при 20° 27% и при 60° 36%.
Таблица 30'
Степень диссоциации
хлористого аммония при
различных температурах
Темпера- тура в °C Диссоциирован- ных паров NH4CI в %
200 57
250 61
300 64
350 . 69
400 73.
При обычной температуре водный раствор NH4CI имеет ней-
тральную реакцию; при кипячении же он становится кислым по
причине улетучивания образующегося вследствие очень слабого
гидролиза аммиака.
Хлористый аммоний легко растворяется в жидком аммиаке
с ‘образованием соединения NH4CI. ЗЬ1Нз с температурой плавле-
ния + 10,7°; это же соединение образуется при действии газо-
образного аммиака на NHiCl. При действии на NH4CI серного
ангидрида происходит присоединение последнего с образова-
нием хлорсульфоната аммония NH4SO3CI и хлорпиросульфоната
аммония NH4OS2O5CI. Хлористый аммоний реагирует со мно-
137
30
. гими основными окислами и щелочами, особенно при нагрева-
нии, выделяя при этом аммиак:
NH4C1 + NaOH = NaCl + Н2О -f- NH8.
Сульфат аммония (NH«)«SO« — белые ромбические
кристаллы; плотность 1,769. При нагревании до 350° сульфат
аммония отщепляет аммиак и переходит в бисульфат, плавясь
при этом:
(NH4)2SO4 NH4HSO4 -f- NH3.
При более сильном нагревании (500°) бисульфат аммония
разлагается на аммиак, серный ангидрид и воду, которые в хо-
лодном воздухе дают дым. Хорошее дымообразование происхо-
дит при нагревании сульфата аммония в смеси с хлористым
натрием или калием и результате реакции:
(NH4\SO4 4- 2NaCl = Na2SO4 4- 2NH8 4- 2HC1.
Нитрат аммония, называемый также аммиачной сели-
трой, NH4NO3 — бесцветная, гигроскопическая соль, обычно кри-
сталлизующаяся в ромбической системе. Плотность 1,73. При
166° нитрат аммония плавится, а при более высокой темпера-
туре разлагается. Теплоемкость его при 0° 0,397 кал/град, при
100° 0,428 кал/град. Термическое • разложение нитрата аммония
идет по нескольким направлениям:
I. NH4NO8 = NH,4-HNO8;
II. NH4NO8 = N2O-|-2H2O.
К образованию дыма при нагревании нитрата аммония может
привести только первая реакция, но так как такое направление
разложения не преобладает, нитрат аммония является плохим
дымообразователем.
3. Металлохлоридные системы
а. Получение дымов хлоридов металлов. Многие хлориды
металлов, обладающие не слишком высокой температурой кипе-
ния, способны возгоняться с образованием дыма, при охлажде-
нии паров в холодном воздухе. При этом не происходит раз-
ложения веществ, и дисперсная фаза полученного дыма перво-
начально идентична с возгоняемым хлоридом. Так ведут себя
двухлористая медь, хлорное железо, хлористый алюминий, хло-
ристый цинк, хлористый кадмий,, хлорная ртуть (сулема) и др.
Частицы образуемого дыма, как уже указано, первоначально
состоят из того же хлорида, однако многие из перечисленных
хлоридов являются весьма гигроскопичными веществами.
Поэтому, находясь во влажном воздухе, частицы тотчас же на-
чинают притягивать влагу. С такими хлоридами, как ZnCh и
А1С1з, это явление происходит особенно резко.
Таким образом, в конечном итоге дымовые частицы будут
представлять собой продукты расплывания хлоридов, т. е. их
гидраты или водные растворы гидратов. Это явление притяги-
вания влаги увеличивает концентрацию дыма и, следовательно,
J38
увеличивает дымообразующую способность применяемого хло-
рида.
Однако указанные хлориды не находят употребления для
дымообразовании при помощи непосредственной возгонки. Это
объясняется рядом обстоятельств. Во-первых, те хлориды, ко-
торые наиболее выгодны тем, что частицы полученного из них
дыма притягивают влагу, очень трудно уберечь от влаги до
возгонки. Расплывшиеся же хлориды во многих случаях очень
трудно освободить от воды; во всяком случае на это должно
потребоваться значительно большее количество тепла, чем для
самой возгонки. Кроме того, во многих . случаях техническое
получение безводного хлорида представляет значительные за-
труднения. Во-вторых, температура возгонки большинства ме-
таллических хлоридов все же очень высока и осуществить ее
в обычной практике маскирующего дымообразования было бы
затруднительно. В-третьих, непосредственное применение хло-
ридов металлов обходилось бы сравнительно дорого и т. д.
Вследствие этого металлохлоридные дымы получаются по-
средством возгонки компонентов, образующих хлориды метал-
лов уже в процессе самой возгонки. В качестве компонентов
таких металлохлоридных систем употребляются, с одной сто-
роны, порошкообразные металлы, с другой — хлорсодержащие
вещества (органические). Процесс возгонки смеси из таких
двух компонентов довольно сложен. В основном он сводится
к тому, что при нагревании смеси между компонентами идет
реакция; при этой реакции выделяется теплота в количестве,
достаточном для образования пара хлорида металла.
Типичным представителем металлохлоридных систем впер-
вые явилась смесь Берже, состоящая из цинковой пыли и че-
тыреххлористого углерода, которые впоследствии стали удачно
заменять другими веществами'.
б. Металлические компоненты. В качестве металлических
компонентов металлохлоридных систем! должны употребляться
такие металлы, которые могли бы энергично реагировать при
высокой температуре с хлорсодержащими компонентами. В то
же время важно, чтобы образующийся хлорид был гигроско-
пичен. Реакция отнятия хлора у углерода металлом будет тем
энергичнее, чем больше, сродство этого металла к хлору, т. е.
чем более ярко (выражен его металлический характер. Этот
металл должен в то же время обладать устойчивостью на воз-
духе при длительном хранении. Если же учесть при этом и то,
что образующиеся хлориды должны быть гигроскопичны, будет
понятно, почему наиболее подходящими металлами оказались
цинк и алюминий. Для более тесного соприкосновения
с хлорсодержащим компонентом они должны употребляться
в порошкообразном или даже пылеобразном со-
стоянии. Железо хотя и уступает цинку и алюминию по
свойствам, но выгодно отличается от них своей дешевизной.
• При конденсации паров цинка получается тончайший поро-
шок, называемый цинковой п ы л ь ю. Цинковая пыль полу-
139
чается в больших количествах при перегонке цинка. Смесь
цинковой пыли с окислами цинка и кадмия, мышьяковыми и
сурьмянистыми соединениями, образующаяся при конденсации
газов цинкодестилляционных печей, называется цинковой
пуссьерой.
Температура плавления цинка 419,4°; температура кипения
907°. Плотность 7,03 г/сле3. Теплоемкость от 0 до 100ь 0,0935
кал/град, от 300 до 400° 0,122 кал/град; скрытая теплота
плавления 26 кал/г.
В сухом воздухе цинк не изменяется. Во влажном воздухе
или в воде цинк покрывается пленкой из основного карбоната.
При температуре 505° цинк воспламеняется, выделяя 1314 кал
на 1 г цинка и превращается в окись цинка. Цинк непосред-
ственно соединяется с галоидами, серой, фосфором, мышьяком
и другими элементами. В соляной и серной кислотах цинк
растворяется с выделением водорода, а в азотной — с выделе-
нием аммиака или окислов азота. Растворение в едких щелочах
идет с образованием цинкатов и сопровождается выделением
водорода. При сплавлении с окислами и хлоридами многих
металлов цинк восстанавливает последние.
Порошкообразное железо может быть двух родов: полу-
ченное механическим измельчением при механической обработке
железа или стали (опилки, пыль и т. п.) и непосредственно вы-
деленное из соединений путем их восстановления в виде по-
рошка. Железные опилки, если они достаточно мелки, могут
реагировать при высокой температуре с хлорсодержащими ве-
ществами. Железная пыль, необходимая для этого, может быть
получена отсеиванием опилок, получаемых на производствах,
обрабатывающих железо и сталь.
Для приготовления железного порошка путем восстановле-
ния высушенный и растертый гидрат окиси железа помещают
тонким слоем в трубку. Пропуская сухой водород, вытесняют
из трубки воздух и затем, не прекращая тока водорода, дово-
дят трубку до темнокрасного каления. Восстановление ведут
до тех пор, пока в трубке не перестанет образовываться вода.
Плотность железа 7,88 г/см8. Температура плавления 1528°;
теплоемкость при 0° 0,1055 кал/град, при 725° 0,1467 кал/град.
Железо обладает большим сродством к кислороду. Во влаж-
ном воздухе оно ржавеет, т. е. постепенно, начиная с поверхно-
сти, превращается в гидрат окиси железа. При прокаливании
на воздухе оно образует закись-окись РезО«. При высокой тем-
пературе железо очень энергично соединяется с хлором, серой »
и фосфором.
Алюминиевый порошок получают^ обычно из отхо-
дов листового алюминия. Порошок имеет. серебристый цвет.
Он очень легок, так как плотность алюминия 2,7 г/см?.
Температура плавления алюминия 659°; температура кипения
1800°.
Теплоемкость, сравнительно с другими металлами, очень
велика: она составляет 0,232 ккал/град.
140
в. Хлорсодержащие компоненты. В качестве хлорсодержащих
компонентов металлохлоридных систем должны 'употребляться
такие вещества, которые могли бы энергично реагировать при
высокой температуре с металлическими компонентами, отдавая
им свой хлор, но при обычной температуре были бы устойчивы
в условиях длительного соприкосновения с металлами и влаж-
ным воздухом. Отнятие хлора металлом произойдет только
в том случае, если хлор связан с элементом, стоящим в ряду
напряжений за такими металлами, как цинк, железо и алюми-
ний. Таким образом, ® качестве хлорсодержащих компонентов
могут быть употреблены только хлориды металлоидов. Все же
хлориды металлоидов, за исключением органических хлорпроиз-
водных, неустойчивы в присутствии влажного воздуха. Поэтому
подходящими хлорсодержащими компонентами металлохлорид-
ных систем будут, богатые хлором органические вещества, не
гидролизующиеся водой.. Такими будут хлорзамещенные али-
фатических углеводородов! и хлорзамещенные в ядре аромати-
ческих углеводородов. .
Четырехклористый углерод CCU— бесцветная,
легколетучая жидкость с характерным запахом1.. Он может быть
получен действием хлора на метан, но обычно bi технике по-
лучается действием хлора на сероуглерод:
2CS, + 6С12 = 2СС14 + 2S2C12.
Температура замерзания четыреххлористого углерода — 23°;
температура кипения 76,7°. Плотность при 0° 1,6325, при
20° 1,595 г/сл8. Зависимость ^го плотности от температуры
выражается формулой:
8t= 1,63255 = 0,00191 П—6,9- 10 "’Л
Вязкость четыреххлористого углерода при 0° 0.01349, при
20° 0,00991, при 50° 0,00655 пуаза. Упругость его пара при
20э равна 91 мм рт. ст.
Для температур ниже 20’ упругость пара может быть вы-
числена по формуле:
1g р = 8,004 —
Теплоемкость твердого четыреххлористого углерода
Теплоемкость твердого четыреххлористого углерода при
-40° 0,201 кал/град, теплоемкость жидкого (0 — 30°) 0,1995
ал/грао, скрытая теплота плавления 4,16 кал/г\ теплота испаре-
ия 18,34 кал/г.
Четыреххлористый углерод смешивается с органическими рас-
ворителями. Сам растворяя жиры, смолы, лаки и т. п., он
имически нейтрален и весьма стоек. Лишь с большим! трудом
'о удается подвергнуть гидролизу. Четыреххлористый углерод
е горит; способен отщеплять хлор при действии металлов
>лько при высокой температуре.
Тетрахлорэтан. Известны два изомера тетрахлорэтана:
|мметричный четыреххлористый ацетилен ChCH — CHCh и не-
Й .141
симметричный четыреххлористый ацетилиден С1зССН«С1. Четы-
реххлористый ацетилен получается присоединением хлора к аце-
тилену. Он представляет собой жидкость с запахом хлороформа.
Температура замерзания — 43,8°; температура кипения 146,3°.
Плотность при 20° 1,600 г/см?. Зависимость упругости его пара
от температуры выражается формулой:
1 7 ОЛС 2075
1g р = 7,846---
Скрытая теплота испарения 55,1 кал/г. По химическим свойствам
напоминает четыреххлористый углерод. Четыреххлористый аце-
тилиден — жидкость. Температура кипения 130,5°. Плотность
1,588 г/ои3.
Пентахлор этан C2HCI5 — жидкость. Температура за-
мерзания—29,0°; температура кипения 162°. Плотность при 0°
1,709 г/см? упругость пара пентахлорэтана при 70° равна 39 мм
рт. ст.
По химическим свойствам он напоминает четыреххлористый
углерод.
Гексахлорэтан CsCle — белое или с желтоватым оттен-
ком кристаллическое вещество; возгоняется, одновременно пла-
вясь при 185°. Плотность 2,091 г/см?. Теплоемкость
0,174 кал/град. Упругость пара при 60° равна 6 мм рт. ст.
Гексахлорбензол Cede—белое кристаллическое
вещество. Температура плавления 226°; температура кипения
326°. Плотность расплавленного гексахлорбензола 1,569. Не
растворим в воде; растворяется в спирте; водой не гидроли-
зуется. Металлами, при высокой температуре, от гексахлорбен-
золэ отщепляется хлор.
Пентахлорбензол СвНСГ — кристаллическое вещество
Температура плавления 86°; температура кипения 277°. Плот-
ность 1,84.
г. Свойства хлоридов-металлов. Хлористый цинк —
белый зернистый порошок или же белая зернистая масса. При
конденсации паров хлористого цинка он образуется ® виде
кристаллических нгл. Характерной особенностью хлористого
цинка является его сильная гигроскопичность. Хлористый цинк
плавится при 365° и кипит при 732°. Плотность хлористого
цинка (при 25°) 2,907. Теплоемкость 0,136 кал/град (при, 60°).
Хлористый цинк чрезвычайно гигроскопичен, поэтому ,
во (влажном воздухе он расплывается. Однако его удается по-
лучить из водных растворов в безводной кристаллической форме.
Выше 28° он образует только безводные кристаллы; ниже этой
температуры он дает различные гидраты, но иэ сильно концен-
трированных растворов его можно получить безводным даже
при ,10°. Растворяясь в воде; хлористый цинк выделяет много
тепла и образует жидкость, обнаруживающую вследствие ча-
стично протекающего гидролиза кислую реакцию. Раствори-
мость хлористого цинка в воде при 10° составляет 73% и при
40° 82%.
142
Железо, как известно, образует два ряда солей: соли закиси,
в которых железо двухвалентно, и соли окиси, в которых же-
лезо трехвалентно. Соответственно этому существуют два хло-
рида: 'FeCh— хлористое железо и FeCh — хлорное
железо. При нагревании порошкообразного железа с хлорсо-
держащим компонентом образуются, невидимому, оба хлорида,
но в большей степени FeCh.
Хлористое, или двухлористое железо FeCh — в безвод-
ном состоянии бесцветная масса с температурой плавления 674:>
Температура кипения хлористого железа 1023°.
Хлорное железо FeCh плавится в красную жидкость
при 298° и кипит с частичным разложением при 316°; упругость
пара хлорного железа при 250° 40 мм рт. ст. Хлорное железо
притягивает влагу из воздуха.
Безводный хлористый алюминий A1CU— белая
кристаллическая масса. Плотность 2,44. Хлористый алюминий
возгоняется при 181° и под давлением 'плавится при 192°. Упру-
гость пара хлористого алюминия при 150° 108 мм рт. ст. Хло-
ристый алюминий, растворяясь в вод^ частично гидроли-
зуется ею.
4. Снаряжение дымовых шашек
а. Принципы и схема снаряжения^ Сырье. Устройство раз-
личных видбв дымовых шашек описано ниже в гл. XI. Все
они представляют собой оболочки или футляры, снаряженные
тем или иным горючим дымовым составом. Различные дымовые
шашки отличаются друг от друга конструкцией оболочки и
рецептурой дымового состава. Независимо от различий между
отдельными типами шашек технология их изготовления склады-
вается из двух основных операций:
1) приготовление дымового состава и
• 2) снаряжение оболочки (футляра) дымовым составом.
Особый случай представляет собой изготовление шашек,
не имеющих оболочки, так называемых дымовых брикетов. Ды-
мовые составы могут также итти на снаряжение дымовых
гранат.
Изготовление дымовых шашек производится по следующей
схеме. Для снаряжения шашек избирается дымовой состав опре-
деленной рецептуры. Необходимое для составления избранной
рецептуры сырье соответствующим образом1 подготавливают
(сушат, измельчают, просеивают). Затем каждый из компонен-
тов дозируют и всех их тщательно перемешивают. Тщатель-
ность перемешивания компонентов играет решающую роль, так
как возможно большее приближение дымовых составов1 к одно-
родному состоянию является важнейшим условием их нормаль-
ного горения. Приготовленный дымовой состав поступает на
снаряжение, т. е. им наполняют (с определенной плотностью)-
футляры.
Сырьем для приготовления дымовых составов являются
дымообразующие компоненты, важнейшие из которых описаны
143
выше, горючие вещества, окислители и вспомогательные ком-
поненты. Все эти вещества, поступающие ла завод, должны
удовлетворять принятым техническим условиям, для чего они
подвергаются определенным испытаниям.
Сырьевые материалы хранят в складских помещениях,
предохраняя их от загрязнения, а гигроскопичные — от погло-
щения влаги. Особенно тщательно следят, чтобы сырьевые ма-
териалы на складах не смешивались, особенно окислители
V с горючими материалами.
б. Горючие вещества и окислители. В качестве горючих ком-
понентов дымовых составов! чаще всего используют различные
виды угля и соединения, богатые углеродом, иногда серу и
другие вещества.
В состав дымовых смесей различные угли должны входить
в порошкообразном состоянии. Отсюда ясно, что лучшими для
применения в составах будут тщательно растертые древесные
угли и сажа. Во многих составах, например, применяется бере-
зовый уголь. Каменный уголь труднее раздробить, ио все же
такие угли, как антрацит, могут употребляться в составах.
Крахмал — вещество, богатое углеродом и обладающее
достаточной теплотворной способностью, — удобен для примене-
ния в смесях. Его можно очень тонко перемешать с другими
компонентами состава и он способен к равномерному горению.
Сера может быть употреблена порошкообразная или в виде
серного цвета, но только в смеси с другими горючими вещест-
вами (например углем).
. Частично в качестве горючих веществ могут быть использо-
ваны многие дымообразователи, как то: мазут, гудрон, парафин,
озокерит, нафталин, антрацен, фенантрен и др.
Дешевым, но мало удобным горючим) являются древесные
опилки.
В качестве окислителей в дымовых составах используют
чаще всего хлораты и нитраты щелочных металлов.
Хлорноватокислый калий, или бертолетова соль,
КСЮз получается в технике различными способами, из которых
самый распространенный — способ Либиха состоит в том, что
газообразный хлор пропускают в нагретое известковое молоко
(200 — 225 г СаО в 1 л воды), находящееся в железных цилин-
драх с мешалками. Реакция идет с выделением тепла, в резуль-*
тате чего жидкость нагревается до 40 — 50°,- вследствие
чего ускоряется превращение первоначально образующегося
гипохлорида в хлорат:
6Са (ОН).2 + 6С12 = Са (С1О3)2 + 5СаС12 -|- 6Н2О.
Усредненный и отфильтрованный раствор смешивается с хло-
ристым калием, причем при охлаждении бертолетова соль
выкристаллизовывается:
Са (С1О3)2 + 2КС1 = 2КС1ОЯ + СаС12.
144
Бертолетова соль может быть получена также электролити-
ческим способом. Электролизу подвергается насыщенный горя-
чий раствор хлористого калия.
Бертолетова соль — бесцветные, блестящие моноклинические
пластинки. Плотность ее 2,33 г/сл3. Температура плавления 370 .
Растворимость в воде при 0° 3,2% и при 40° 12,7%.
При температуре 400° бертолетова соль начинает разла-
гаться, причем сначала образуется хлорнокислый калий, кото-
рый при дальнейшем нагревании .разлагается с выделением
кислорода:
4КС1О:1 = 4КС1О4 + КС1;
КС1О4 = KCI -f- 2О2.
Примеси окислов. металлов (марганца, железа) понижают
температуру разложения бертолетовой соли, и образования пер-
хлората не происходит. При быстром нагревании до темпера-
туры, превышающей температуру разложения, бертолетова соль
-с силой взрывается; она может также взрываться при тесном
соприкосновении (растирание, удар) с горючими ееще-
хугвами (сёра. фосфор, уголь и т. п.). Поэтому в присутствии
органических веществ работать с бертолетовой солью следует
с осторожностью. ,
Хлорноватокислый натрий №СЮз получается
электролизом растворов поваренной соли. Процесс электролиза
ведут до тех пор, пока раствор при охлаждении не начинает
выделять кристаллы хлората Хлорноватокислый натрий — белые
кристаллы.* Плотность 2,5 г/сле3. Температура плавления 248°.
.Хлорноватокислый натрий по химическим свойствам в основном
напоминает бертолетову соль, но отличается от нее тем, что
очень хорошо растворим в воде и сильно гигроскопичен, вслед-
ствие чего расплывается на воздухе. Расплывание NaCl^Os на
воздухе служит некоторым препятствием для применения его
в качестве окислителя в дымовых смесях.
Азотнокислый калий, или калиевая селитра КЫОз —
белая соль; может кристаллизоваться в двух различных моди-
фикациях. На воздухе кристаллы устойчивы. Плотность 2,09 г/см3.
Температура плавления 338°. При нагревании выше темпера-
туры плавления разлагается с наделением кислорода. В присут-
ствии горючих веществ селитра способна отдавать весь кисло-
род, раскисляясь до элементарного азота..
в. Вспомогательные компоненты. Кроме основных компо-
нентов, дымовые составы могут содержать еще дополнительные .
компоненты, без которых горение состава не могло бы прохо-
дить удовлетворительно. Применение этих компонентов не
является обязательным, и многие смеси могут обходиться без
них. Остановимся кратко на отдельных видах вспомогательных
компонентов.
Флегма тизаторы. Флегматизаторы — вещества, способ-
ные замедлить горение в тех случаях, когда дымовая смесь го-
рит слишком бурно и быстро, и сделать его более ровным.
10 Зак. 3184. Вейнер и Лучииский. 145
Обычно эта способность обусловливается тем, что эти вещества
могут поглощать большое количество тепла, или вследствие
\ большой теплоемкости, или же вследствие превращения их
//< в парообразное состояние. Для флегматизации могут быть
I/ использованы такие вещества, как аммонийные соли, щавелевая
кислота, мочевина, некоторые карбонаты, сульфаты и бораты»
а также другие ®ещества.
Разрыхлители. Иногда в дымовые составы входят
компоненты, имеющие полужидкую или даже жидкую конси-
стенцию. Часто порошкообразные компоненты, находясь уже
в смеси, при повышении температуры могут разжижаться. На-
личие жидких илн полужидких частей в смеси ведет к расслое-
нию; если же жидкости маслянисты или вязки, то может про-
исходить также обволакивание зерен окислителя и нарушение
нормального течения горения. Для предотвращения указанных
явлений в смеси вводятся разрыхлители. Разрыхлителями могут
быть пористые 'вещества, способные удерживать на себе боль-
шие количества жидкости и позволяющие сохранить при этом
порошкообразную консистенцию состава.
Особо важное значение разрыхлители имеют в металло-
хлориднъгх составах; здесь они бывают необходимы, так как
в качестве хлорсодержащих компонентов часто применяют жид-
кости (например, четыреххлористый углерод).
В качестве разрыхлителей употребляют кизельгур, углекис-
лый магний, мелкие древесные опилки и другие вещества.
Кизельгур (трепел, инфузорная земля) представляет собой
пушистый порошок, являющийся скоплениями мелких кремне-
вых панцырей диатомовых водорослей. Химически оц представ-
ляет собой в основном кремнезем SiOz. Цвет кизельгура .обычно
желтовато-розовый, хотя иногда встречается в природе и белый
кизельгур.
Плотность собственно кизельгуровой массы 2,2 г/см3,
но вследствие большой пористости кажущаяся плотность порошка
кизельгура меньше единицы.
Наполнители. Иногда вследствие пористости или круп-
нозернистое™ компонентов дымовой состав не является доста-
точно компактным. Между зернами смеси и находится большое
количество воздуха-. Это обстоятельство, а также проникновение
воздуха в смеси при горении могут служить причиной воспламе-
нения и неравномерности горения смеси. Для предотвращения
этих явлений в смесь вводят наполнители, обычно плотные, хи-
мически недеятельные вещества, например каолин, мел, бура,
глина, некоторые сульфаты, окись железа.
Пламягасители. При горении дымовой смеси часто
появляются вспышки. Это происходит в результате воспламене-
ния паров компонентов раскаленной золой или самовоспламене-
ния сильно нагретых летучих фракций горючих компонентов при
встрече их с кислородом воздуха. Во избежание явлений пла-
мени по-верхность дымовой смеси покрывают рыхлым слоем так
называемого пламягасительного фильтра. Такими пламягасите-
146
лями являются смеси хлористого аммония с мелом, углекислым
магнием или тальком.
г. Приготовление дымовых составов. В качестве сырья для
приготовления дымовых составов употребляются дымообразу-
ющие компоненты, горючие вещества, окислители и вспомога-
тельные компоненты. В большинстве случаев компоненты для
приготовления дымовых составов — кристаллические вещества,
но они могут быть также твердыми аморфными и вязкими смо-
листыми материалами. Иногда сырье может иметь кашицеобра-
зную и полужидкую консистенцию.
Каждая рецептура предусматривает не только строгую дози-
ровку компонентов, но определенное качество сырья. Все сырье
должно отвечать определенным требованиям стандартов или
технических условий. В случае некондиционности сырья оно,
если возможно, подвергается обработке для исправления недо-
статков (сушка, очистка, промывка, отжим на центрофуге и т. п.).
Если такая обработка цели не достигает, сырье бракуется
и в производство нс допускается.
Качество дымового состава определяется в основном свой-
ствами его. компонентов. Чтобы дымовой состав был однороден
и удовлетворял другим требованиям, необходимо исходные ма-
териалы подвергнуть предварительной обработке, которая дала
бы возможность компонентам равномерно распределиться *по
дымовому составу и не принести с собой в дымовой состав не-
желательных качеств.
Подготовительная обработка сырья заключается обычно
в сушке, измельчении и просеивании. Для (выполнения этих опе-
раций употребляют сушилки, мельницы и сита, причем для каж-
дого компонента*. должна быть своя аппаратура. В результате
подготовительных операций каждый компонент должен обладать
влажностью не выше определенной величины и определенной
степенью измельчения (тониной помола).
Сухие и измельченные компоненты дозируют путем взвеши-
вания, после чего производят их смешение. Тщательное переме-
шивание компонентов обеспечивает необходимую однородность
приготовляемого состава. Однако при перемешивании. необхо-
димо соблюдать осторожность. Так, растирание окислителя вме-
сте с горючим компонентом, недопустимо. Поэтому устанавли-
вается определенный порядок смешения измельченных
компонентов.
Вначале окислитель тщательно перемешивают со всеми ком-
понентами, кроме горючего, затем к равномерно перемешанной
смеси добавляют горючий компонент; или же, наоборот, вначале
горючий компонент перемешивают со всеми остальными, кроме
окислителя, а затем к смеси добавляют окислитель. Смешение
производят вручную или же применяют смесители типа краско-
терок.
После этого смесь длительное время пересыпают, пока не
наступит надлежащая степень однородности. При этом нужно
избегать трения и ударов. Пересыпание лучше всего произво-
10* 147
дить в мягких резервуарах, например кожаных или брезентовых
барабанах и т. п.
д. Снаряжение футляров. Приготовленный дымовой состав
следует немедленно загружать в футляры. Футляры могут быть
разнообразной формы и величины. Независимо от этого футляр
следует снаряжать одним определенным дымовым составом.
Снаряжение футляра разными дымовыми составами не допу-
скается.
Основной технологической характеристикой снаряжения фу-
тляров является плотность снаряжения. Плотностью снаряжения
называют отношение веса дымового состава к емкости запол-
няемой полости футляра. Плотность может меняться в зависи-
мости от состава дымовой смеси и типа дымовой шашки. Для
достижения определенной плотности известную емкость футляра
снаряжают определенным весовым количеством дымового состава.
Необходимо также следить, чтобы весь футляр заполнялся
с равномерной плотностью.
Снаряжение футляра производится вручную. Заполнение фут-
ляра дымовым составом производят деревянной уминалкой. Для
дозировки дымового состава в футляры иногда. употребляют
автоматические весы или мерники.
Помимо основного дымового состава в футляр иногда вво-
дят переходный состав, отличающийся быстротой разгорания,
и пламягасительный фильтр. После введения всех составных
частей снаряжения шашку закрывают диафрагмой или другим
изолирующим устройством н затем закрывают крышкой так,
чтобы снаряжение было полностью изолировано от внешнего
воздуха и недоступно воздействию влаги.
5. Процесс дымообразования при горении составов
При горении термо-возгоночных дымовых составов, как уже
указывалось выше, происходит возгонка дымообразующих компо-
нентов, которыми чаще всего служат аммонийные соли и тяже-
лые углеводороды. Так, при горении смесей Ершова .возгоняются
хлористый аммоний и нафталин, смеси Санникова — нафталин,
смеси Горбова — хлористый аммоний смесей А — антрацен и
хлористый аммоний.
Когда пары этих веществ, выйдя из шашки сильно нагре-
тыми, смешиваются с холодным воздухом, то они охлаждаются
и, несмотря на разбавление воздухом, пересыщают пространство.
Результатом этого пересыщения является ковденсация хлдри-
стого аммония и нафталина или антрацена.
Таким образом, дисперсная фаза дыма, получающегося при
горении термо-возгоночных дымовых смесей, состоит из хло-
ристого аммония и нафталина, антрацена или других тяжелых
углеводородов. Такой дым совершенно безвреден и не действует
на металлы.
Нафталин и другие углеводороды совершенно негигрооко-
пичны, и потому влага воздуха не отражается на процессе их
’48
конденсации и дальнейшем существовании дымовых частиц.
Что же касается хлористого аммония, то при относительной
влажности воздуха выше 79% он может быть гигроскопичным,
и тогда вместе с конденсацией его будет иметь место конден-
сация воды с образованием частиц тумана раствора хлористого
аммония, находящихся в фазовом равновесии с водяными па-
рами атмосферы. Очевидно, что образование частиц тумана рас-
творов хлористого аммония происходит в том случае, когда
давление водяного пара в атмосфере превышает упругость водя-
ного пара над насыщенным раствором хлористого аммония, так
как при меньшем давлении водяных паров растворы хлористого
аммония способны высыхать.
Поэтому при относительных влажностях, превышающих 79%,
дымообразующая и маскирующая способность шашечных ре-
цептур, содержащих хлористый аммоний, значительно повы-
шается.
Г]ри горении металлохлоридных смесей, как указано выше,
идет реакция между металлическим и хлорсодержащим компо-
нентами с выделением тепла и образованием пара хлорида ме-
талла. Так, прн горении смеси Берже реагируют между собой
цинк и четыреххлористый углерод (или гексахлорэтан), в резуль-
тате чего образуется пар хлористого цинка.
Нагретые пары хлористого цинка, попадаете атмосферу, охла-
ждаются и пересыщают пространство, так как при естествен-
ных температурах упругость пара хлористого цинка очень мала.
Результатом этого пересыщения является конденсация хлористого
цинка. Однако вместе с хлористым цинком конденсируется
и вода, ббразуя совместно с ним частицы дыма или тумана, со-
стоящие из раствора или гидратов хлористого цинка. Возможно,
что при этом частично происходит гидролиз хлористого цинка.
Дым, получающийся при горении смеси Берже, кроме ча-
стиц хлористого цинка, содержит также частицы окиси цинка
(в небольшом количестве), образующейся вследствие частичного
сгорания цинковой пыли за счет кислорода окислителя.
Чем выше относительная влажность воздуха, тем большее
количество влаги поглощается хлористым цинком и тем выше
дымообразующая и маскирующая способность металлохлорид-
ных рецептур.
Металлохлоридные дымы безвредны, но могут оказывать не-
значительное раздражающее действие на органы дыхания. При
сжигании о закрытом помещении могут оказаться опасными для
жизни. Это объясняется тем, что взаимодействие четыреххлори-
стЗго углерода с цинком в присутствии кислорода происходит
с образованием небольших количеств фосгена.
ЧАСТЬ ТРЕТЬЯ
ТЕХНИКА ДЫМОПУСКА
ГЛАВА X I
ТЕХНИЧЕСКИЕ СРЕДСТВА И УСЛОВИЯ ДЫМОПУСКА
1. Общая характеристика технических средств и задач
постановки дымовых завес
Нейтральной дымовой завесой или нейтральным дымовым
облаком называется воздух, содержащий частицы дымов н ту-
манов и обладающий маскирующими свойствами.
Нейтральные дымовые завесы получаются из маскирующих
дымообразующих веществ. Эти вещества применяются при по-
мощи технических средств дымопуска, представляющих собой
дымовые приборы (дымовые машины, дымовые шашки и
гранаты) и дымовые боеприпасы (дымовые снаряды,
бомбы и мины). Дымовые приборы и дымовые боеприпасы
предназначаются для выполнения различных тактических задач,
и находятся на вооружении пехоты, артиллерии, авиации, мино-
метных и бронетанковых частей, а также кораблей н береговых
частей морского флота. Устройство и действие дымовых прибо-
ров и дымовых боеприпасов должно обеспечивать введение
дымообразующего вещества в атмосферу в количестве^ доста-
точном для получения необходимого маскирующего действия.
В этом заключается основное назначение дымовых приборов и
дымовых боеприпасов.
Кроме того, дымовые приборы и дымовые боеприпасы явля-
ются тарой, предохраняющей дымообразующие вещества от
преждевременного дымообразовании (загорания, взаимодействия
с влагой воздуха и т. п.).
Действие, всех дымовых приборов и дымовых боеприпасов,
предназначенных для применения веществ, пары которых
реагируют с влагой воздуха и горючих дымовых смесей, пре-
следует, главным образом, задачу облегчения процесса испаре-
ния дымообразующего вещества и основано на одном из сле-
дующих трех процессов: механическом дроблении жидкости
(дымовые приборы сухопутных войск, авиации и морского
флота), дроблении путем взрыва (дымовые снаряды и мины) и
нагревании (дымовые шашки, некоторые дымовые гранаты,
150
термическая дымовая аппаратура). При дроблении путем взрыва
одновременно происходит диспергирование части дымообразо-
вателя до аэрозольного состояния.
Дымовые приборы, гранаты, мины, бомбы и шашки, предна-
значенные для применения белого фосфора и сульфидов фосфора,
обеспечивают в момент применения загорание вещества при
соприкосновении с кислородом воздуха. Дробление вещества
в дымовых снарядах и минах, увеличивая поверхность горения,
ускоряет процесс дымообразования.
Нейтральные дымовые завесы должны обладать высокими
маскирующими свойствами, быть устойчивыми и не оказывать
физиологического действия на организм1.
Под маскирующими свойствами нейтральной дымовой за-
весы понимается ее способность к маскировке на определенном
расстоянии от места дымопуска (т. е. расположения дымовой
аппаратуры или точки разрыва боеприпасов). В зависимости от
тактического назначения дымовая завеса должна надежно маски-
ровать свои части от наземного или воздушного наблюдения
• или ослеплять войска противника.
Маскирующие свойства .нейтральной дымовой завесы оцени-
ваются по величине дальности видимости, т. е. по минимальной
толщине слоя дыма, необходимой для невидимости .находя-
щихся в дыму предметов. Чем меньше дальность видимости,
тем лучше маскирующие свойства дымовой завесы. Величина
дальности видимости определяется в свою очередь прежде
всего концентрацией дисперсной фазы и зависит от количества
ДВ, вводимого в атмосферу за единицу Времени, от дымо-
образующей способности и от происходящих в дымовой завёсе
процессов, непрерывно приводящих к увеличению объема
-облака и уменьшению весовой концентрации.
Вопрос об устойчивости или стабильности дымовой завесы
рассматривается прежде всего с точки зрения сохранения ды-
мовым облаком его маскирующих свойств, т. е. сохранения
•определенной концентрации, дисперсной фазы. Вместе с тем под
устойчивостью понимается неизменность всего дымового облака
в целом, отсутствие в нем просветов и разрывов, расположе-
ние основной массы дыма в нижних слоях атмосферы.
Устойчивость дымового облака частично зависит от процес;
сов коагуляции, оседания и испарения, приводящих к уменьше-
нию весовой концентрации. Однако главное значение имеют
явления, обусловленные свойствами самой атмосферы. Поэтому
свойства приземных слоев воздуха, погода во время дымопуска
являются .решающими обстоятельствами, определяющими устой-
чивость дымрвого облака и возможность применения нейтраль-
ный дымообразующих веществ. Такое же существенное зна-
чение имеет и топографическая обстановка: характер рельефа
местности, наличие оврагов, растительности, возвышенностей,
построек, оказывающих влияние на направление движения ды-
мового облака и на отрыв последнего от поверхности земли.
151-
2. Состояние атмосферы и поведение дымового облака
Основными элементами погоды, влияющими иа поведение
дымового облака, являются степень устойчивости воздуха по
вертикали, характер его турбулентного перемешивания, направ-
ление и скорость ветра. Необходимо также принимать во вни-
мание температуру, наличие и возможность выпадения осадков,
облачность и атмосферное давление. Что касается влажности,
то- она влияет главным образом непосредственно на процесс
образования дыма.
Температура периодически изменяется как в течение
суток (суточное изменение температуры), так и в течение года
(годовое изменение температуры). При устойчивой хорошей
погоде самая низкая температура 'воздуха и почвы обычно бы-
вает перед восходом солнца, а самая высокая наблюдается
спустя 1 — 2 наса после полудня. В течение года Наиболее
высокие температуры наблюдаются в июле, наиболее низкие
в январе. Колебания температуры 'воздуха в средних широтах
европейской части СССР не выходят обычно из пределов от
-|-30 до -—30°.
а. Устойчивость воздуха по вертикали. Различают три степе-
ни -вертикальной устойчивости атмосферы: ин-
версию, конвекцию, изотермию.
, При и-наерсия температура приземных слоев воздуха
постепенно повышается, а плотность понижается по мере уда-
ления от поверхности земли. Инверсия наблюдается летом,
после захода солнца, или в зимние дни. Она возникает вслед-
ствие более быстрого охлаждения земли по сравнению с плохо-
проводящим тепло воздухом. Холодная земля охлаждает при-
легающие к ней слон воздуха, которые становятся более холод-
ными и плотными, чем вышележащие слои. Наиболее сильно
перепад температуры при инверсии выражен не у самой по-
верхности земли, а на некоторой высоте от нее. Это обстоятель-
ство имеет большое значение для поведения дымового облака.
Частички дыма сравнительно легко распространяются в слоях,
ближайших к земле, где инверсия не так велика. Зато проникно-
вение холодных содержащих дым объемов воздуха в слой
с резко выраженной инверсией весьма затруднен. Инверсия
весьма благоприятна для дымопуска. Образованная при инвер-
сии дымовая завеса движется под влиянием ветра непосред-
ственно у поверхности земли.
При конвекции плотность нижних прилегающих к земле
слоев воздуха меньше, а температура больше, чем плотность
н температура верхних слоев. Конвекция наблюдается в летние
дни при отсутствии облачности. Она возникает вследствие бо-
лее сильного нагревания земли по сравнению о воздухом в сол-
нечные часы. Нагретая земля отдает тепло прилегающим к ней
слоям воздуха. Эти слои, расширяясь и становясь, поэтому,
менее плотными, подымаются вверх, вытесняясь более холод-
ными и плотными слоями. Нагревание землей прилегающих
152
к ней слоев воздуха происходит неравномерно. В результате
этого при конвекции образуется ряд местных токов и течений,.
и происходит непрерывное вертикальное перемешивание возду-
ха. Конвекция крайне неблагоприятна для дымопуска. Образо-
ванное прн конвекции дымовое облако быстро рассеивается
поднимаясь в верхние слои воздуха.
Изотермия характеризуется тем, что температура и плот-
ность воздуха в пределах 20—30 м от поверхности земли при-
мерно одинаковы. Изотермия наблюдается при пасмурной пого-
де. В этом случае плотные, низко расположенные густые облака
мешают интенсивному нагреванию земли и нижних слоев воз-
духа в течение дня'и охлаждению в течение ночи. Изотермия
создается также в зимние дни, когда, даже при отсутствии
облачности, нагревание нижнего слоя (воздуха будет невелико,
а температура в приземном и .в верхних слоях окажется почти
одинаковой. Наконец, в летние утренние и вечерние часы тем-
пература воздуха по вертикали также может быть одинаковой.
Ночная инверсия в это время уже разрушается от начинающе-
гося нагрева почвы, а конвекция еще не успевает возникнуть.
Изотермия (особенно при пасмурной погоде) также весьма
благоприятна для применения дыма.
Степень вертикальной устойчивости атмосферы характери-
зуется градиентом температур. Градиентом температур-
называется разница между температурой у поверхности земли
и на некоторой высоте (обычно на высоте 1 м). Отрицатель-
ный температурный градиент указывает на наличие инверсии.
При положительном температурном градиенте получается кон-
векция. Зная градиент температур, можно легко вычислить
изменение плотности; при этом исходят из того, что для тем-
ператур примерно от 4-30 до —30° при изменении температуры
на 1° плотность газа изменяется на 1/273 своей величины
при 0°.
б. Ветер и турбулентное перемешивание. Причиной возникно-
вения ветра является неравномерное нагревание больших
поверхностей^ земли и прилегающих слоев воздуха — воздух
поднимается *над теплым районом и опускается над холодным.
Одновременно с этим происходит передвижение воздуха по го-
ризонтали — воздух движется из мест с более высоким давле-
нием (так как там он более плотен) в места с более низким
давлением (где воздух более разрежен).
Ветер характеризуется направлением и скоростью. Направле-
ние ветра обозначается той стороной горизонта, откуда он
дует. Так, например, если говорят ветер восточный, то по-
нимают, что движение воздуха происходит с востока на запад..
Направление ветра претерпевает периодические изменения. Для
каждой местности могут быть установлены свой суточный ход
изменения ветра»и зависимость направления ветра от времени
года. Ветры, наиболее часто наблюдаемые в данной местности,
называются господствующими.
153?
Существенное влияние на направление ветра оказывает
«рельеф местности.
Направление ветра изменяется также с высотой, причем
•обычно по мере удаления от поверхности земли 'наблюдается
некоторый поворот направления ветра в правую сторону.
Скорость ветра периодически изменяется в течение суток.
Она максимальна днем и минимальна в ночные часы. Такое из-
менение скорости ветра особенно резко выражено летом при
установившейся ясной погоде; в 'Пасмурную погоду, а также
зимой оно появляется менее отчетливо. При изменении типа
погоды може-[ наблюдаться изменение скорости ветра, не соот-
ветствующее обычному суточному изменению.
Вследствие трения воздушных масс о землю скорость ветра
у земли минимальна и постепенно повышается по мере продви-
жения в верхние слои атмосферы. На некотором расстоянии от
земли, где влияние последней перестает сказываться, скорость
ветра становится постоянной. Наиболее сильное изменение ско-
рости ветра с высотою наблюдается над почвой со значитель-
ной шероховатостью, наиболее слабое над водной поверх-
ностью —морем.
Наряду с ветром в атмосфере непрерывно происходит беспо-
рядочное по скорости и направлению передвижение и переме-
шивание больших и малых объемов воздуха. Подобное беспо-
рядочное перемешивание называется ту р б ул е нтн ым. Турбу-
лентное перемешивание возникает вследствие трения движуще-
гося воздуха о земную поверхность, неровности почвы, построй-
ки, кустарники и отдельных объемов воздуха между собой.
Тепловые процессы — неравномерное нагревание поверхности
почвы, меньшая плотность нижних слоев воздуха при конвекции
усиливают процесс беспорядочного перемешивания воздуха.
Степень турбулентного перемешивания не одинакова для
горизонтального и вертикального направления. Она различается
обычно даже для соседних друг около друга лежащих слоев
воздуха.
в. Осадки и облачность. Оса дк а м и называется влага, вы-,
падающая в жидком или твердом виде на земную поверхность.
К осадкам относится дождь, снег и град. Наиболее сильное
влияние на поведение дымового облака оказывает дождь, спо-
собствуя его рассеянию. Происходит это вследствие того, что
дождевые капли при своем падении усиливают турбулентность
воздуха и вызывают более сильное перемешивание его. Кроме
того, капли дождя увлекают частицы дисперсной фазы дыма,
прибивая их к земле.
Облачность оказывает большое вдияние на степень вер-
тикальной устойчивости атмосферы и имеет большое значение
для предвидения погоды. Некоторые формы облачности (пери-
стые, перисто-слоистые и перисто-кучевые облака) наблюдаются
только на больших высотах — свыше 6000 м\ они характерны
своей прозрачностью. Солнечные лучи свободно проходят через
них, и эти облака не дают тени. Инверсия и конвекция могут
154
быть даже тогда, когда все небо покрыто облаками перечислен-
ных форм. Другие формы облаков (слоистые, слоисто-кучевые)
наблюдаются на небольших высотах. Это — плотные, мощные
облака, не пропускающие прямых солнечных лучей. Они пре-
пятствуют как нагреванию, так и ночному охлаждению почвы.
Инверсии и конвекции при этом типе облаков не бывает.
3. Влияние рельефа местности на поведение дымового облака
По своим физическим свойствам дымовое облако мало чем
отличается от чистого воздуха. Дымовое облако передвигается
в атмосфере совместно с окружающими его воздушными мас-
сами со скоростью, равной скорости ветра. Если ветра нет,
облако застаивается на месте, медленно распространяясь по
сторонам.
При перемене ветра изменяется и направление движения
дымового облака.
Вследствие турбулентности атмосферы и непрерывного пере-
мешивания дыма о окружающим чистым воздухом видимый
объем дымового облака постепенно увеличивается, а концен-
трация дисперсной фазы уменьшается по мере удаления от
места выпуска ДВ в атмосферу. Объем, занимаемый дымовым
облаком, имеет форму полуконуса с вершиной в точке дымо-
пуска (шашке, гранате, дымовом приборе). Если дымопуск
производится о широкого фронта (группа шашек, машин), то
дымовое облако- представляет собой усеченный полуконус. При
очень быстро проходящем дымопуске (дымовой снаряд) полу-
чается постепенно увеличивающийся клуб дыма..
Ширина полуконуса (при дымопуске из точки) или увеличе-
ние ширины облака по отношению к первоначальному фронту
дымопуска (при дымопуске из группы приборов) составляет
примерно 0,14 расстояния от места ^дымопуска. Высота облака
зависит от степени вертикальной устойчивости атмосферы. При
инверсии дым поднимается до места наиболее сильно выражен-
ной инверсии. При изотермии, и в особенности при конвекции,
высота облака постепенно возрастает и равна примерно 0,07 —
0,1 расстояния от места дымопуска.
Дымовые облака, полученные при сгорании дымовых шашек,
состоят из теплого воздуха. Поэтому конвекционные явления
в подобных облаках выражены гораздо резче, чем в облаках,
образованных в результате взаимодействия дымообразующих
веществ с влагой воздуха. Облака аэрозолей из продуктов1 го-
рения шашек быстрее поднимаются вверх, в то время как облака
-продуктов холодного дымообразоваиия более устойчивы и не-
сколько дольше могут находиться у поверхности земли. Осо-
бенно неустойчивы дымовые облака, полученные из подручных
средспвг (костры из хвои, соломы, навоза и т. п.).
На движение, поведение и устойчивость дымового облака
существенно влиярт рельеф местности. Вихревые потоки, обра-
зующиеся около неровностей почвы и находящихся на ней со-
155
оружений, приводят к более сильному размыванию дымовой за-
весы. Схема возникновения вихревых потоков около «препят-
ствия» показана на рис. 30. Движение воздуха через препят-
ствие происходит с повышенной скоростью, в то же время за
препятствием скорость ветра значительно уменьшается. Распо-
ложенная за препятствием зона с малой скоростью ветра назы-
вается аэродинамиче-
ской тенью. Длина аэро-
динамической тони зависит
от ширины и высоты препят-
ствия, скорости ветра и т. п.
В среднем длина аэродина-
. мической тени равна уше-
Рис. 30. Схема возникновения вихре- стеренной высоте препят-
вых потоков около препятствий ствия. За аэродинамической
t тенью скорость и направле-
ние ветра постепенно выравниваются и приобретают прежнее
значение.
Образование аэродинамической тени является одной- из при-
чин возникновния арок (рис. 31), когда часть дымовой волны
открываете» от поверхности земли и, пройдя некоторый путь,
опять опускается на землю.
Аэродинамическая тень может
привести и к полному отрыву
дымового облака. Особенно легко
отрыв происходит при изотермии
и сильной разнице в скорости
ветра над препятствием и в зоре
аэродинамической тени.
Другой причиной отрыва
дымового облака от поверхности
скорости ветра с высотой. Схема
на рис. 32.
а
Рис. 31. Арки и корабль в дымо-
вом облаке:
а — арка; 6 — корабль.
земли является возрастание
подобного отрыва показана
Вначале верхние части облака выносятся вперед, образуя
так называемый «корабль». Постепенно этот «корабль» стано-
вится все более и более резко выраженным. И, наконец, все
дымовое облако отрывается от земли.
Ветер
Рнс. 32.” Схема отрыва дымового облака.
При инверсии и слабых скоростях ветра дымовое облако
обтекает по сторонам холмы и пригорки с крутыми и высокими
скатами. Вершины холмов остаются в этом случае не закрыты-
ми дымом. При сильных ветрах вершины холмов во всех слу-
чаях закрываются дымом.
156
Лощины, овраги и впадины оказывают сильное влияние на
поведение дымового облака, изменяя скорость и направление
ветра. В лощине, направленной под прямым углом к ветру,
скорость последнего сильно падает. Поэтому при малых скоро-
стях ветра, особенно вечером или в начале -ночи, дымовое
облако постепенно заполняет лощину и остается в ней длитель-
ное время после прохождения основной массы дыма. При боль-
ших скоростях ветра дымовое облако проходит над лощиной.
Если ветер дует под косым углом к лощине, то скорость ветра
уменьшается, а направление изменяется. В этом случае часть
дымового облака направляется вдоль лощины. С подобной
ролью лощин всегда следует считаться при организации дымо-
пуска.
Около леса основная масса дымового облака поднимается
вверх и движется над верхушками деревьев. Пройдя лес, ды-
мовое облако опускается и движется дальше в прежнем на-
правлении. Неровная поверхность, образуемая вершинами де-
ревьев, является причиной возникновения в воздухе многочи-
сленных завихрений и частичного проникновения дыма между
деревьями (особенно на полянах и прогалинах) внутрь леса.
Некоторое количество дыма проникает в лес и со стороны
опушки. В итоге лес вызывает усиленное размывание дымового
облака.
Вода нагревается и остывает медленнее, чем почва. Поэтому
во время утренней инверсии воздух над поверхностью воды
{над озером, речкой) будет теплее, чем над берегом. Обра-
зующиеся вследствие этого конвекционные токи поднимают
дымовое облако вверх. Конвекционные токи над водой особенно
сильны в холодные ночи. Наоборот, в’ полдень воздух над
водной поверхностью холодней и дымовое облако прижимается
к поверхности воды.
Размывание дымового облака над водной поверхностью
происходит в общем медленнее, чем над сушей.
Над озерами, болотами и реками облака маскирующего дыма,
полученные при взаимодействии паров ДВ с влагой воз-
духа, прекращают свое движение; дым как бы останавливается,
прижимаясь к поверхности воды. Происходит это вследствие
того, что над поверхностью воды в воздухе содержится боль-
шое количество водяного пара; аэрозольные частицы для до-
стижения равновесия с водяным паром поглощают влагу,
укрупняются и оседают под действием силы тяжести, прижи-
маясь к поверхности воды.
4. Характеристика условий дымопуска
Наиболее благоприятными условиями для дымопуска являются
инверсия, ровная, мало пересеченная местность, устойчивый
по направлению ветер со скоростью 2—4 м/сек. Эти условия
наиболее часто встречаются в антициклонах в ночное или вечер;
нее время суток.
157
Устойчивая дымовая завеса получается также при изотер-
мии и силе ветра 4—7 м/сек.
Конвекция препятствует получению хорошей устойчивой
дымовой завесы. В жаркий летний день при сильных восходя-
щих токах воздуха получение дымового облака вообще невоз-
можно. Сильный ветер, скорость которого превышает 7 м/секу
создает в воздухе сильные завихрения, способствующие бы-
строму рассеянию дыма. Кроме того, при сильном вепре
требуется большой расход дымообразующих веществ. Слабые
ветры (менее 2 м/сек) не устойчивы по направлению. Они могут
быть использованы только для создания кратковременной ды-
мовой завесы.
Размывание дымового облака на пересеченной местности
происходит сильнее, чем на ровной почве. Необходимо также
принимать во внимание возможное местное изменение напра-
вления ветра. Вся совокупность метеорологических н топографи-
ческих условий дымопуска разбивается обычно на три группы:
благоприятные, средние и неблагоприятные. Для каждой группы
необходим свой расход дымовых средств: минимальный
при благоприятных условиях и максимальный при неблагоприят-
ных.
Характеристика условий дымопуска дана в виде упрощенной
таблицы (табл. 31).
Таблица 3J
Характеристика метеорологических и топографических условий
дымопуска
Элементы метеороло- гической и топогра- фической обстановки Условия
благоприятные /средине неблагоприятные
Скорость ветра 2—4 м/сек 5—7 м/сек До 1,5 м/сек и бо- льше 7—8 м/сек
Характер ветра Устойчивый по направлению пу- скоростн Неустойчивый по- рывистый или штиль
Степень вертикаль- ной устойчивой атмосферы Отсутствие восходящих токов Небольшие вос- ходящие токи. Большая об- лачность Сильные восходя- щие токи
Местность Ровная Слабо Пересе- . ченная Сильно пересечен- ная
В табл. 32 приводится характеристика метеорологи-
ческих и топографических условий дымопуска по Прентису.
158
Таблица 32
Характеристика метеорологичесих и топографических условий дымо-
пуска по Прентису
Элементы метеороло- гической и топогра- фической обстановки Условия
благоприятные средние малоблагопри- ятные
Время суток Ночь или раннее утро Утро или близ- ко к полу- ночи 11 час. до полудня, 4 часа после по- лудня
Облачность Полная Неполная Ясно
Почва Ровная почва или водная поверх- ность — Неровная нли лег систая почва
Температура почвы Скорость ветра Холоднее воздуха Штиль и до 4 м/сек 4—9 м/сек Теплее воздуха. Переменная или выше 9 м/сек
ГЛАВА XI
ДЫМОВЫЕ ШАШКИ И.ГРАНАТЫ
, 1. Устройство и снаряжение дымовых шашек
Дымовые шашки, или дымовые свечи, являются основным
дымовым средством пехоты. Они применяются для получения
больших дымовых завес, прикрывающих действия крупных
подразделений, и для маскировки отдельных отрядов и неболь-
ших групп бойцов.
Дымовые шашки представляют собой картонный или метал-
лический футляр, наполненный дымовой смесью и снабженный
запальным приспособлением. Форма, вес и габарит шашки могут
быть самыми разнообразными. Наиболее распространены шашки,
содержащие от 2 до 3 к» дымовой смеси и дымящие в течение
2—5 мин. Наряду с этим известны малые шашки весом от 0,S
до 1 кг, служащие для маскировки отдельных бойцов и дымя-
щие в течение 1—1,5 мин., и большие шашки весом от 15 до
100 кг с продолжительностью дымообразования 10—20 мин.,
предназначенные для создания мощных дымовых завес при
наступательных действиях войск и для прикрытия тыловых
объектов наземных сооружений от воздушного нападения.
Дымовые шашки применяются, кроме того, в морском
флоте для маскировки судов и сооружений береговой обороны
и в бронетанковых частях для самозадымления танков и поста-
новки подвижных дымовых завес.
Для снаряжения дымовых шашек употребляются различные-
горючие дымовые смеси. Известны также шашки, снаряженные
белым фосфором или смесями на основе красного фосфора.
159
Запальное приспособление дымовых шашек может • быть
смонтировано вместе с дымовой смесью или вставляться в нее
перед применением. По характеру своего действия запальное
приспособление может быть терочное, воспламеняющееся при
выдергивании проволоки или веревки, или типа спичечной го-
ловки, воспламеняющееся при трении' о поверхность терки.
Одновременное включение большого количества дымовых
шашек может производиться электрическим током.
Особое значение электрический метод поджигания дымовых
шашек имеет при дымовой маскировке тыловых объектов, когда
заранее устанавливают несколько групп шашек и- необходимо
по сигналу воздушной тревоги включить ту или иную группу.
Большие плавающие шашки или дымовые буи применяют
для создания дымовой завесы на поверхности моря. Дымовые
4буи приводят в действие (воспламеняют) на кораблях, а затем
выбрасывают за борт, где они горят с образованием,дыма.
Устройство малой дымовой шашки Красной армии ДМ-11
показано на рис. 33. Дымовая шашка представляет свбой
жестяной цилиндр вы-
сотой 115льни диамет-
ром 160 мм. В верхней
части шашки имеемся
зиг, на котором укре-
плена промежуточная
диафрагма с 11 отвер-
стиями для • выхода
дыма. Шашки снаря-
жают 1650—1700 г
нейтральной дымовой
смеси, сверху которой
насыпается 150—170 г
переходной смеси и
50 г пламягасительного
фильтра. Переходная
смесь предназначается для быстрейшего разгорания основной
смеси и содержит большой процент окислителя. Дымовая
смесь заполняет в шашке весь объем от дна до диафрагмы.
Сверху шашка закрывается крышкой с ручкой. Для предохра-
нения от влаги отверстия диафрагмы заклеиваются фольгой
или бумагой, а крышка шашки по обрезу обматывается изоля-
циоиной лентой. Общий вес снаряженной шашки 2,1 кг.
Шашку поджигают при помощи запала накаливания или
спички и терки. Запал накаливания и спички хранят отдельно от
шашки и вставляют в нее перед употреблением. Запал накаливания
представляет собой цельнотянутую латунную гильзу, или гильзу
из вискозы, наполненную термитной смесью; спичка — деревян-
ную палочку, обмазанную спичечной массой. На конце запала
и спички имеется воспламенительная головка. Терка пред-
ставляет собой картонный или деревянный прямоугольник, по-
160
Рис. 33. Дымовая шашка ДМ-11:
/—коробка; 2—крышка с ручкой; /—дымовой Состав;
/—запал; 5—диафрагма; 6—изоляционная лента. •
крытый с одной стороны терочным составом. В Качестве терки
может быть использована спичечная коробка.
Для приведения шашки в действие, необходимо: 1) снять изоляционную
ленту с футляра, разматывая ее за свободный конец, 2) снять крышку,
зажимая шашку между ногами; если ручка оторвана или если ее трудно
снять, крышку удаляют с помощью лопаты или постукиванием твердыми
предметами, 3) вставить запал или спичку в центральное отверстие Диа-
фрагмы, прорывая при этом фольгу, 4) быстрым движением провести тер-
кой по головке запала или спички, слегка нажимая на нее. При трении
о годовку запал или спичка воспламеняются и зажигают дымовую смесь.
Если запал или спичка в шашке не загорелись, а также в случае от-
каза в горении дымовой смеси (после сгорания запала) в любое отверстие
диафрагмы вставляют и поджигают другой запал или спичку. При недо-
статке запалов шашку можно зажечь от другой горящей шашки. Для
этого на разгоревшуюся шашку накладывают диафрагмой вниз шашку, не
имеющую запала или не загоревшуюся от него. Когда эта шашка заго-
рится, ее отбрасывают в сторону.
При поджигании шашки вначале в течение приблизительно
-30 сек. происходит разгорание шашки с выделением неболь-
шого количества дыма, затем начинается интенсивное дымооб-
разование, которое продолжается 5—6 мин.
Дымовые шашки хранят в деревянных ящиках по 20 шт.
в каждом. В ящики с шашками вкладывают коробки с запа-
лами и протычки.
Средняя дымойая шашка ДМ-11-3 представляет собой также
жестяной цилиндр высотой в 345 мм. Она содержит утроенное
количество дымовой смеси и* весит около 5,5 кг. Шашка имеет
две диафрагмы с обоих концов футляра и приводится в дей-
ствие двумя запалами. В этом случае шашка дымит 5—6 мин.;
при поджигании с одной стороны шашка дымит 15 мин.
Дымовой брикет в отличие от шашек не имеет футляра.
Брикет состоит из спрессованной дымовой смеси на основе
каменноугольной смолы и обернут снаружи в бумагу,
покрытую влагоустойчивым составом. С одной стороны обертки
брикета имеется надпись «переходная». На этой стороне в
брикет впрессована переходная смесь и сделано отверстие для
вставления запала. Дымовой брикет весит 2,3 кг, высота и
диаметр его равны высоте и диаметру малой шашки ДМ-11,
время разгорания брикета 30 сек., время интенсивного выделе-
ния дыма 3—5 мии.
Некоторые данные, характеризующие современные дымовые
шашки иностранных государств, приведены в табл. 33.
Одна из германских дымовых шашек, применявшаяся в пер-
вой мировой войне, представляла собой цилиндрический картон-
ный футляр, герметизированный в верхней и в донной части
круговыми деревянными вкладышами (пробками). Общий вес
шашки 1550 г, вес дымовой смеси 1050 г- Шашка снаряжалась
рецептурой, состоящей из 36% калиевой селитры, 27% серы
и 37% трехсернистого мышьяка. Запальное приспособление
этой шашки состояло из вытягиваемой проволоки, конец кото-
рой покрывался фосфором, запальной смеси и запальной трубки,
снаряженной черным порохом. При выдергивании проволоки
11 Зак. 3164. Вейцер и Лучинский. 161
Таблица 33
Дымовые шашки, применяемые в различных странах
Страна Назва-. ние шашки Внешняя форма Общий вес в кг Состав смеси Время дымообразо- вания в мин.
Германия Дымовая свеча NbK-39 Металлический цилиндр, диам. 90 мм. выс. 144 мм 2,1 Гексахлорэтаи, цинк, окись цинка 4—7
Дания Дымовая свеча Бумажная трубка, диам. 50 мм, выс. 1100 мм 2 Бертолетова соль, хлористый аммоний, каиифоль 2
Италия Дымовая свеча F/ZM Жестяной ци- линдр. диам. 77 мм выс. 350 мм 2,3 • Цинк, окись цин- ка, четыреххло- ристый углерод, инфузорная земля 4
США1 Дымовая свеча НС, М-1 Призматическая коробка 38X84X34 мм 0,8 Гексахлорэтаи, циик, окись цинка 2-3 »
Румыния Картонный цилиндр, диам. 73 мм, выс. 308 мм 1,11 Каиифоль, хлори- стый аммоний, азот- нокислый аммоний, бертолетова соль 1.5
Венгрия • Цилиндр нз оцин- кованной жести, диам. 80 мм, Яыс. 150 мм 2,33 Четыреххло- ристый углерод, циик, бертолетова соль
Финлян- дия Жестиной цилиндр, с картонной крыш- кой, диам. 83 ял 2,08 Гексахлорэтаи, цинк, окись цинка, калиевая селитра
и трении фосфора о запальную смесь происходило воспламене-
ние запального состава. Горящий запал воспламенял порох за-
пальной трубки, откуда огонь пере-
Рис. 34. Германская дымовая
шашка NbK 39:
/—ручка; 2—цветная полоса;
3— крышка; 4—дымовой состав; 5—за-
пал № 4; 6— отверстие для выхода
дыма.
давался непосредственно дымовой
смеси. Запальное приспособление
шашек прикрывалось картонным
кружком - и картонной крышечкой,
заклеенной для прочности и герме-
тичности плотной бумагрй.
Германская дымовая шашка
NbK 39, применявшаяся во время
войны 1939—1945 гг. (рис. 34), пред-
ставляет собой металлический (же-
стяной) цилиндр диаметром 90 мм
и высотой 144 мм. Шашка снаря-
жается смесью, состоящей из 47,5%
гексахлорэтана, 47,5% цинковой
пыли и 5% окиси цинка с неболь-
шой примесью сернистого цинка. Снаряженная шашка весила
1 Prentiss, Chemicals in War, 1937.
162
2,1 кг~, вес дьгмЬвой смеси равен—1,8 кг. Снаружи шашка
окрашен^ в. серый цвет. Маркировка шашки состояла из одной
белой полосы и надписи белыми буквами «NbK 39».
Для переноса шашки имеется ручка. В дне корпуса шашки
имеется одно запальное отверстие для зажигательного запала
и два запаянных отверстия для выхода дыма. Запальное при-
способление состоит из двух частей: запала № 4 и воспламе-
нительного приспособления ,29 или 39. Запальное приспособле-
ние хранится отдельно от шашки и вставляется в нее перед
поджиганием.
Запал (рис. 35 а) представляет собой алюминиевую трубку
наполненную зажигательной массой 2. Сверху зажигательной
массы помещается металлический колпачок с впрессованной
воспламенительной смесью — пистоном 3. При хранении алю-
миниевая трубка закрывается защитным колпачком 4 из кар-
тона для защиты воспламенительной массы от влаги.
Воспламенительное приспособление 29 (рис. 35, б) состоит
из верхней части с вытяжным кольцом 1, пружины, нижней
а б в
Рис. 35- Запальное приспособление германской дымовой шашки'
части с нарезкой 2 для ввинчивания в запальную трубку и пре-
дохранительного колпачка 3. Вытяжное кольцо удерживается
предохранительной шпилькой 4, помещенной на запальном при-
способлении.
Вместо капсюля 29 применяется также воспламенительный
вытяжной капсюль 39 (рис- 35в). Нижняя часть этого капсюля
идентична с нижней частью капсюля 29. Шарообразная верхняя
часть 1 отвинчивается. В ней находится вытяжной шнурок.
Для поджигания шашки в запальную трубку вставляют запал
окрашенной частью вперед и ввинчивают воспламенительный
вытяжной капсюль. Предварительно с запала и с капсюля сни-
мают предохранительные колпачки. Зажигание производится
резким вырыванием вытяжного кольца (капсюль 29) или выдер-
11* 163
гиванием шарообразной верхней части (капсюль 39). Дымообра-
зоваиие начинается через 10 сек. после зажигания. Продолжи-
тельность интенсивного дымообразования составляет 3,5—4 мин.
При дыМоауске шашка кладется на землю таким образом, чтобы
в
Рис. 3*\ Американская дымовая шашка ВМ:
• а — внешний вад; б — разрез шашки:
1 — корпус; 2 — дымовой состав; 3 —крышка; 4 — терка; 5 — кзртоннак про-
кладка; 6 — терочная головка; 7 — цинковая диафрагма; S — запальный со-
став № 2; 9 — запальный состав №1; 70—промежуточный состав;
в — горящая шашка.
отверстия для дымопуска были направлены в подветренную
сторону.
J64
Дымовую шашку NbK39 можно бросать. Значительная даль-
ность броска достигается при помощи веревки или проволоки,
пропущенных через ручку, а также укреплением шашки на
планке.
Батареи нейтральных дымовых шашек имелись на некото-
рых типах германских линейных танков. Эти шашки предназна-
чены для самозадымления танка. Шашки представляют собой
обычную пехотную шашку без ручки. Маркировка танковых
шашек состоит из двух белых целое и подписи NbKS — 39
Шашки поджигают обычным образом при помощи шнура из
кабины водителя. Зажженные шашки могут быть сброшены на
землю. Шашки горят в течение 2 мин. Для ускорения горения
в состав рецептуры дополнительно введено 6% магния.
Американская дымовая шашка ВМ, применявшаяся в войне
1914—1918 гг. (рис. 36), представляет собой металлический
футляр из оцинкованного железа высотой 12,3 см и диаметром
около 9 см. Футляр шашки имеет два зига: внешний, на кото-
рый опирается крышка шашки, и внутренний, служащий для
укрепления диафрагмы.
Шашка снаряжается 1,3 кг дымовой смеси ВМ, состоящей
из 42% четыреххлористого углерода, 35% цинка, 9% NaClOs,
5% NHiCl и 9% MgCOs. Для 'поджигания шашки служит терка,
помещающаяся под крышку шашки и отделенная от терочной
головки прокладкой из манильского картона. Терка поджигает
терочную головку (50% КСЮз, 30% SbsSs, 20% декстрина), от
которой последовательно загораются запальный состав № 1
(47% железных опилок, 53%*КМпО4), запальный состав № 2
(21% S, 63% Zn, 16% ZnO) и промежуточная быстрогорящая
смесь (30% Zn, 35%CCh, 25% ZnO, 10% NaClOs). Шашка за-
крывается крышкой. Место соприкосновения крышки с поверх-
ностью футляра обматывается изоляционной лентой.
Американская шашка WP снаряжается белым фосфором.
Шашка представляет собой металлический футляр размером
6,35 X 10,2 X 12,7 см. На одной стороне футляра имеется про-
дольная щель, герметизованная жестяной лентой. У верхней
поверхности футляра конец жестяной ленты имеет петлеобраз-
ное приспособление для продевания ключа, при помощи кото-
рого производится срывание ленты. Футляр шашки наполняется
через отверстие в крышке расплавленным фосфором. Затем
в шашку наливается некоторое количество воды и производится
герметизация наливного отверстия. Запальное приспособление
шашки WP состоит из эдедной трубочки, наполненной перекисью
натрия. Запальная трубочка шашки прикрепляется к футляру
шашки и открывается одновременно со вскрытием щели.
Для приведения шашки WP в действие при помощи ключа
срывается жестяная лента.и открывается боковая щель. Фосфор
загорается с выделением густого белого дыма.
Датская дымовая шашка представляет собой продолговатую,
завязанную на обоих концах оболочку, имеющую форму кишки:
шашка сделана из бумажной ткани. Оболочка наполняется
165
термической дымовой смесью. Диаметр шашки 5 см, длина
ill0 см. Вес несколько превышает 2 кг. Шашку зажигают спич-
кой после прорезывания ножом дырки в одном из ее концов.
Время горения шашки 2 мин.
В качестве.дымообразующего вещества в датских дымовых
шашках используют смеси на основе бертолетовой соли и хло-
ристого аммония.
Датские дымовые шашки могут применяться: 1) для стационарного
дымопуска с земли, 2) для подвижного дымопуска, когда шашку зажигают,
а затем волочат по земле, 3) для подвижного дымопуска с автомашины.
В последнем случае иа кузов автомашины устанавливают специальный
поддон. Этот поддон представляет собой плоский открытый сверху метал-
лический ящик с шестью отделениями для помещения в каждом одной
шашки. Шашки надевают иа острие гвоздей, торчащих из дна ящика, и
плотно прижимают, чтобы они ие соскочили во время езды.
Итальянская шашка F/ZM, применявшаяся во время второй
мировой войны, представляет собой жестяной цилиндр высотой
в 350jkjc и диаметром 77 мм. Шашка весит 2300 г и содержит
2000 г дымовой смеси, состоящей из 45% четыреххлбристогс
углерода, 35% цинка, 10% окиси цинка и 10% кизельгура. Для
поджигания шашки в ее крышке сделан металлический палец,
в который вставляется запал. Шашка дымит около 4 мин.
Современная морская дымовая шашка ВМФ CGCP — МДШ
состоит из двух железных вставленных один в другой бараба-
Рис. 37. Морская дымовая шашка
нов (рис. 37). Внутренний барабан, в котором находится ды-
мовая смесь, представляет собой сетчатый цилиндр, имеющий
общее дно и общую крышку с внешним. Внешний барабан
служит оболочкой шашки. "Во внутреннем сетчатом футляре,
выложенном изнутри пергаментной бумагой, помещена дымо-
вая смесь. Оба цилиндра имеют общие днища. Внутренний
цилиндр укреплен в днищах эксцентрично относительно внеш-
него. Благодаря этому шашка плавает на воде всегда в одном
положении: кверху дымовыходным отверстием. Дымовыходное
отверстие шашки находится сбоку и закрыто клапаном, пре-
пятствующим проникновению в шашку воды. Зажигательное
приспособление шашки, смонтированное на одном из днищ,
состоит из запального стакана, запального патрона и ударника
166
с бойком. Запальный стакан устанавливается при изготовле-
нии шашки.
Для вкладывания в запальный стакан запального патрона
в днище шашки сделано отверстие. Это отверстие закрывается
пробкой, имеющей дырочку для бойка. Сверху пробка защи-
щена жестяной пластинкой. Запальный патрон представляет
собой обычную картонную гильзу. Он хранится отдельно от
шашки и вставляется в нее непосредственно перед примене-
нием.
Высота шашки 480 мм, внешний диаметр 412 мм. Вес шашки
равен 40 кг. Время интенсивного дымообразоваиия составляет
10—11 мин.
Для приведения в действие шашки МДШ необходимо: 1) снять жестя-
ную крышку с пробки и ключом вывернуть пробку, 2) вложить в отвер-
стие патрон капсюлем вверх, 3) ключом завернуть пробку и повернуть
пластинку с бойком так, чтобы боек вошел в центральное отверстие
пробки, 4) ударить по пластинке с бойком ключом, камнем, лопаткой и т. п.
Второй образец МДШ отличается от вышеописанного несколько иным
устройством запального приспособления. Шашка имеет вместо пробки и
ударника, колпачок с бойком', который ввинчивается в горловину аа днище
шашки. Кроме того, в этом образце дымовыходное отверстие закрыто
крышкой.
, Для приведения в действие шашки МДШ второго образца необходимо:
1) снять крышку с дымовыходного отверстия, 2) свинтить с горловины
колпачок, вложить патрон и вновь иавериуть колпачок. 3) Ударить по
колпачку ключом, лопатой, камнем и т. п.
Американский дымовой буй, или дымовой ящик (рис. 38),
описанный Фрайсем, состоит из железного цилиндра 1 высотой
60 см и диаметром 25 см, скреплен-
ного с поплавком 2.
В верхней части цилиндра на рас-
стоянии примерно 4 см от верхнего
среза' имеется 20 боковых отверстий
4, служивших для выпуска дыма. Эти
отверстия герметизируются бумажной
лентой, пропитанной шеллаком. В цен-
тре крышки 3 цилиндра сделано отвер-
стие, в которое ввертывается стакан
запального приспособления.
Дымовой буй поджигается ударом
специального молоточка по головной
части ударного запального приспосо-
бления.
Для устранения резкого смешения
и пересыпания дымовой смеси даже в
падает в воду головной частью вниз,
Рис. 38. Американский ды-
мовой буй:
2— корпус с дымовым составом;
2— поплавок; <3—крышка; 4— от-
верстия для выхода дыма,
тех случаях, когда буй
к нижней поверхности
крышки прикрепляются четыре специальных держателя, кото-
рые давят на' поверхность дымового состава и препятствуют
перемещению дымовой смеси при разного рода толчках, тряске
н т. п.
167
К цилиндрическому корпусу буйка прикрепляется круговой
поплавок диаметром 61 см и высотой 20 см. Поплавок изгото-
вляется из железа.
Американский дымовой буй содержит 45 кг дымовой смеси
Берже или В'М и дымит около 9 'Мин.
2. Устройство и снаряжение дымовых гранат
Рис. 39. Ручная ды-
мовая граната РДГ:
7—картонный корпус;
2— прессованный дымовой
состав; 3—деревянная
втулка; /—терка; 5—кар-
тонные крышки; 6—за-
жигательная головка;
7 — переходной состав;
Я—зажигательные звеяд-
ки; 9 — бумажная трубка;
Ручные и ружейные дымовые гранаты предназначаются
для маскировки действия отдельных бойцов и небольших отря-
дов. Они используются также для прикрытия штурмовых групп,
ослепления, блокировки дзотов, ослепления огневых точек про-
тивника и т. п.
Дымовые гранаты представляют собой металлическую обо-
лочку, которой придана форма, удобная для метания, напол-
ненную дымообразующим веществом. Вес гранаты не превы-
шает 500 г. Содержа небольшое количество дымообразователя,
дымовые гранаты дают небольшое дымо-
вое облако, и дымят в течение короткого
срока.
Ручные дымовые гранаты бросают на
30—45 м; ружейные дымовые гранаты —
на расстояние 250—500 м. Достоинством
ручных и ружейных дымовых гранат яв-
ляется их портативность и возможность,
ослепив находящегося впереди противника,
сохранить для применившего их бойца все
выгоды боя вне дыма.
Для снаряжения ручных и ружейных
дымовых гранат употребляют различные
твердые и жидкие дымообразующие веще-
ства. В частности, в германской армии
во время первой мировой войны приме-
нялась шарообразная дымовая граната,
снаряженная хлорсульфоновой кислотой и
содержащая небольшое количество взрыв-
чатого вещества. Однако, так как коли-
чество дымообразователя в дымовой грана-
те невелико, для получения необходимого
маскирующего эффекта следуёт применять
вещество с наибольшей маскирующей спо-
собностью. Поэтому французские, англий-
ские и американские ручные и ружейные
дымовые гранаты снаряжались лучшим и»
известных дымообразующих веществ — бе-
лым фосфором.
Весьма распространены также гранаты, снаряженные ме-
таллохлоридными или термическими дымовыми смесями. Руч-
ная дымовая граната, применявшаяся Красной армией в отече-
ственной войне, показана на рис. 39.
168
Граната весит 515—545 г и содержит 410—440 г дымовой
смеси. Корпус 1, нижняя и верхняя крышки гранаты сделаны
из бумажного литья. Корпус гранаты изготовляется или иа
трех склеенных цилиндров или отлит в виде одного куска. Вну-
три гранаты находятся два спрессованных кружочка дымовой
смеси, закрытые сверху и снизу деревянными втулками 3.
В втулках сделаны отверстия для выхода дыма. В централь-
ном отверстии верхней втулки находится зажигательная го-
ловка 6 и переходной состав 7 для воспламенения трех зажи-
гательных звездок 8, от которых загорается дымовая смесь 2.
Звездки расположены вокруг бумажной трубки 9, проходящей
по оси гранаты, что позволяет лучу пламени от первой звездки
быстро поджигать две остальные. .
Имеются также РДГ, в корпусе которых дымовая смесь-
помещена не в виде брикетов, а насыпана с утрамбовкой.
Внутри подобной гранаты вместо зажигательных звездок поме,
щена запал-спичка, воспламенительная головка которой поме-
щается в центральном отверстии верхней втулки.
Перед броском гранаты с нее срывают верхнюю и нижнюк>-
крышки за прикрепленные к ним ленты и резко проводят тер.
кой по зажигательной головке. Граната дымит 1 —
1,5 мин., давая, в зависимости от состава дымовой
смеси, густой серо-черный или бельки дым. И| 1И
При благоприятных метеорологических условиях
одна граната дает непросматриваемое облако про- ffcrajB
тяжением 25—30 Я. luSF
Горящая граната не тонет в воде. Поэтому она g/i Й6
может быть применена при форсировании водных |\' Jg
преград. г та
Немецкая ручная дымовая граната NbHg-39 ji |fl
(рис. 40) состоит из двух частей: железной цилиндри-
ческой оболочки, наполненной дымовой смесью, НПа
состоящей из 40% цинка, 40% гексахлорэтана, 8% ||
окиси цинка, 8% окиси кремния, 2% магния и 2% ||
кальция, и деревянной ручки для бросания, в кото-
рой размещено воспламенительное приспособление. г~Ч
Оболочка и ручка гранаты хранятся отдельно и сое-’ дД
диняются незадолго до применения. Оболочка гра- *--*
, наты
закрывается
тонкой
латунной крышкой
с
кой, в которой помещается зажигательный
труб-
запал,
и железной диафрагмой с горловиной для при-
. крепления ручки и восемью отверстиями для вы-
хода дыма. Внутри деревянной ручки выточен сквоз-
Рис. 40.
Германская
ручная ды-
мовая гра-
ната:
ной канал, в котором размещается воспламенительное приспо-
собление, состоящее из ударника с бойком!, пружины, предохра-
нителя и кольца. В собранной гранате воспламенительное при-
способление соприкасается с зажигательным запалом. Для под-
жигания гранаты, при помощи фарфорового кольца и шнура, вы-
дергивают кольцо
разбивает капсюль
воспламенительного приспособления, боек
зажигательного запала. Зажигательный за-
961
яал проплавляет латунную трубку и поджигает дымовую
смесь. Граната дымит 1—2 мин., выделяя серо-белый дым.
Снаряженная граната весит 850 г и содержит 420 г дымовой
смеси.
Американская ручная дымовая граната ВМ (1918 г.)
(рис. 41) снаряжается смесью ВМ на основе четыреххлористого
углерода. Граната состоит из корпуса 6, запальной трубки 5
и стреляющего приспособления /. Корпус гранаты изгото-
вляется из легких металлических сплавов и содержит 340 г
дымовой смеси 7. В верхней части корпуса имеется 12 отвер-
стий 4, предназначенных для выхода дыма. Отверстия закры-
ваются припаянной цинковой лентой 3. Запальная трубка (цин-
ковая) снаряжается запальной смесью на основе железных
опилок и перманганата калия. Запальная смесь воспламеняется
от капсюля, разбиваемого стреляющим приспособлением. В ре-
зультате горения запальной смеси прогорает цинковый стакан,
поджигается дымовая смесь и начинается выделение густого
дыма. Время дымообразования 45 сек
/4 4
Рис. 42. Дымовая мор-
тирка:
/—корпус стпола; 2—штырь;
3—дымовой состав; 4—крыш-
ки; 5—втулка; 6—бикфордов
шнур; 7—пороховой заряд;
8—воспламенительный со-
став; 9—запал; /О—корпус
снаряда; //—бумажная трубка;
12— термитные мешки: 13+
втулка снаряда; //—верхняя
крышка снаряда.
Рис. 41. Американская
ручная дымовая граната
ВМ:
/ —стреляющее приспособ-
ление; 2—шестигранная втул-
ка; 3 — цинковая ленга; /-от-
верстие для выхода дыма:
5 — запальная трубка с за-
пальным составом и разрыв-
ным зарядом; 6—корпус гра-
наты; 7— дымовой состав.
Несколько особым типом дымовой гранаты является дымо-
вая мортирка. Дымовая мортирка применяется для ослепления
огневых точек и наблюдательных пунктов противника, находя-
170
щихся' на расстоянии, превышающем дальность броска гра-
наты. Мортирка позволяет производить один выстрел.
Устройство мортирки изображено на рис. 42. Мортирка
состоит» из двух основных частей: 1) ствола с выбрасывающим
приспособлением и штырей для установки мортирки, 2) дымо-
вого патрона. Общий вес мортирки 500 г. Мортирка содержит
240 г дымовой смеси и дымит 1—1,5 мин.
Штырь мортирки укрепляют в приделанной к стволу скобе.
При стрельбе из мортирки штырь вставляют доотказа в грунт,
так чтобы ствол плотно упирался в грунт своим основанием
и имел необходимый наклон в сторону противника.
Выбрасывающее приспособление монтируют во’ втулке
ствола. Оно состоит из запала, звездки и заряда черногб по-
роха.
Дымовой патрон состоит из картонного футляра, закрытого
деревянными втулками. Внутри патрона находится картонная
запальная трубка с отверстием, дымовая смесь и запальное
приспособление. Запальное приспособление состоит из запала,
загорающегося при вылете патрона из ствола, бикфордова
шнура и двух термитных лепешек. Длина бикфордова шнура
рассчитана таким образом, чтобы дымовая смесь загоралась
при падении патрона на землю.
Для приведения мортирки в действие снимают изоляцион-
ные ленты, штырь втыкают в грунт, у нижней крышки, выни-
мают терку и поджигают запал.
Дальность полета дымового патрона регулируется углом
возвышения ствола. Наибольшая дальность достигается при
угле возвышения от 30 до 40° и равна 120—150 м.
3. Применение ручных дымовых гранат и шашек
Ручные дымовые гранаты применяются пехотой для осле-
пления противника в окопах, блиндажах, укреплениях, построй-
ках, при блокировке дотов и дзотов, а также для создания
небольших маскирующих дымовых завес для прикрытия дымом
боевых действий отдельных бойцов и небольших подразделе-
ний. Ручные дымовые гранаты используются и в других родах
войск, например для маскировки выхода экипажа из танка
или бронемашины, для имитации горения машины и т. п.
Ручными дымовыми гранатами снабжаются специальные
бойцы-дымовики. Для прикрытия наступления отделения или
взвода при фланговом (боковом) ветре, бойцы-дымовики вы-
двигаются впереди взвода (отделения) на 15—30 м вправо или
влево, в зависимости от ветра, и бросают гранаты с интерва-
лами 15—20 м‘, через 15—20 сек. подразделение, прикрытое
дымом, начинает передвижение. Дымовики бросают следую-
щую серию гранат, и подразделение совершает очередную
перебежку.
При попутном ветре на противника бойцы-дымовики выдви-
гаются, насколько возможно, вперед и бросают гранаты по
фронту через 5—8 м. Наступающее подразделение движется за
дымом до рубежа горения гранат. Далее постановка дымовой
171
завесы повторяется. При косом ветре гранаты разбрасывают
с интервалами в 10 м.
Приведенные нормы расхода рассчитаны на благоприятные
метеорологические условия. При средних и малоблагоприятных
условиях нормы расхода удваиваются.
При применении дымовых гранат для ослепления против-
ника в окопах, блиндажах, для прикрытия действий разведчи-
ков и т. п. необходимо строго учитывать конкретную обста-
новку и направление ветра. Каких-либо норм расхода для всех
этих случаев не имеется.
Для ориентировки при применении дымовых гранат следует
помнить, что РДГ дымит примерно 1—1,5 мин. и дает непро-
сматриваемое дымовое облако протяжением 25—30 м.
Нейтральные дымовые шашки применяют для маскировки
действия своих войск. Их зажигают в расположении своих ча-
стей и применяют только при ветрах, дующих в сторону про-
тивника или параллельно фронту маскируемой части.
Дымовые шашки ДМ-11, находящиеся на вооружении Крас-*
ной 'Армии, дымят 5—6 мин., разгораясь в течение 30—60 сек.
При средних условиях погоды одна дымовая шашка создает
непросматриваемую дымовую завесу протяжением 100—75 м
с шириной дымового облака на этом удалении 20—15 м. Сжи-
гая в одном месте группу из двух, трех и более шашек, можно
получить непросматриваемую дымовую завесу протяжением
200—150 м при ширине завесы до 85 м и длительности маски-
рующего действия 6—7 мин. (вследствие неодновременного
загорания и прогорания шашек).
Одна шашка МДШ при средних метеорологических усло-
виях может образовать непросматриваемую дымовую завесу
длиной 1200—1500 лис шириной конуса jia этом расстоянии
в 200—250 м.
Для задымления фронта, превышающего маскирующую
часть дымовой завесы, получаемой от сжигания одной шашки,
необходимо шашки располагать на определенном расстоянии
друг от друга. Интервалы между шашками или очагами дол-
жны быть несколько меньше, чем протяжение (длина или ши-
рина) маскирующей части дымового облака Ът каждой шашки
или очага. В соответствии с этим при попутном ветре отдель-
ные шашки ДМ-1Р можно располагать в зависимости от усло-
вий погоды с интервалом 15—10 м, а очаги 30—40 ти; при
боковом ветре 25—50 и до 100 м.
Нормы расхода дымовых шашек зависят от направления
ветра и других условий погоды. Для коротких по времени и
фронту дымовых завес можно пользоваться примерными нор-
мами (табл. 34), показывающими, на сколько метров фронта
должна приходиться одна шашка при организации дымовой
завесы на одну очередь шашек, т. е. продолжительностью
4—6 мин.
При организации длительных дымовых завес большого про-
тяжения дымовые шашки сжигают в расположенных по фронту
172
Таблица 34
Примерные нормы расхода дымовых шашек ЛМ-11
Направление ветра Условия погоды
благоприят- ные средние неблаго- приятные
1 шашка приходится на количество метров
Ветер попутный на противника . . , косой (45°) , боковой • . . 10—15 20-25 30-50 5-10 10-15 20—25 3-5 5—10 10-15
дымопуска очагах несколькими очередями. Количество очере-
дей вычисляют, исходя из требуемой длительности дымопуска
и учитывая, что одна очередь шашек ДМ-11 дает дым в тече-
ние 6—7 мин. Интервалы между очагами по фронту дымопуска
выбирают таким образом, чтобы между конусами дыма, полу-
ченного от отдельных очагов, не было разрывов и просветов.
Эти интервалы обычно равны при попутном ветре 30—40 м,
при косом ветре 40—60 м и при боковом 75—100 м.
Примерный расход дымовых шашек приводится в табл. 36.
Таблица 35
Расход дымовых шашек ДМ-11 на 1 км фронта в 1 час 1
Метеорологические условия Направление ветра
попутный косой боковой
ф - Расход шашек, шт.
Благоприятные Средние Неблагоприятные 600 800 около 1200 500 600 около 900 • 300 400 около 600
Глубина распространения дыма (с сохранением маскирую-
щих свойств) зависит от метеорологических условий и дости-
гает 1—3 км.
Шашечные дымовые завесы на широком фронте создаются
неподвижными (фронт дымопуска все время остается на месте)
и подвижными (фронт дымкмтуска передвигается вперед или
назад).
1 При пользовании дымовыми брикетами приведенные нормы расхода
увеличиваются на одну треть. При применении МДШ следует полагать
одну МДШ равной 20 шашкам ДМ-11, сжигаемым в две очереди.
173
При организации шашечных дымовых завес прежде всего
выбирают место рубежа дымопуска и разгрузочного пункта и
производят расчет необходимого количества шашек и бойцов.
Место рубежа дымопуска определяют поставленной тактиче-
ской задачей, метеорологической и топографической обстанов-
кой. По возможности рубеж дымопуска должен быть укрыт от
наблюдений противника. Поэтому целесообразно производить
дымопуск с обратных скатов холмов, из лощинок и расщелин.
После выбора рубежа дымопуска и места расположения
разгрузочного пункта подсчитывают количество необходимых
шашек и определяют место очагов дымопуска.
Если рубеж дымопуска достаточно хорошо укрыт, шашки
можно подвозить к нему в ящиках. Если же рубеж дымопуска
наблюдается противником или при невозможности подъезда
к нему, шашки разгружают на разгрузочных пунктах. Разгру-
зочные пункты располагают в местах, укрытых от наземного
и воздушного наблюдения противника: в’ рощах, лощинах,
кустарниках и на обратных скатах. При выборе разгрузочных
пунктов следует иметь в виду, чтобы к ним вели дороги, до-
ступные для движения автомашин. Разгрузочные пункты дол-
жны допускать свободную разгрузку машин и разбивку двух-
трех площадок на расстоянии 30—50 м для рассредоточения
подготовки шашек. Расстояние от разгрузочного пункта до
рубежа дымопуска должно быть возможно меньше.
На разгрузочных пунктах производят все подготовительные
работы с шашками. Шашки вынимают из ящиков, снимают
изоляционные ленты и крышки шашек, протычкой протыкают
отверстия, вставляют запалы, затем шашки вновь закрывают
крышками.
Подготовленные шашки опять укладывают в ящики или
мешки для переноса. От разгрузочного пункта к очагам бойцы
доставляют шашки в вещевых мешках. Каждый боец перено-
сит около 8—10 шашек за один рейс. Скорость движения бойца
при подноске шашек в боевой обстановке равна около 2 км/час.
Зная длину фронта, продолжительность дымопуска, расстояние
от разгрузочного пункта, метеорологические условия и руко-
водствуясь табл. 30—31, производят расчет количества необхо-
димых шашек и бойцов.
Порядок расчета дымопуска» виден из: следующего при-
мера1. Неподвижная дымовая завеса длительностью в 25 мин.
должна быть создана на фронте в 1000 м. Ветер попутный, на
противника, скорость 5—6 м/сек. 'День пасмурный. Разгрузоч-
ный пункт расположен в 500 м от рубежа дымопуска.
Расчет начинают с определения общего расхода шашек.
По табл. 30 при заданных метеорологических условиях необ-
ходимо 800 шашек на 1 км фронта в час или 330 шашек на
25 мин. С учетом 10% резерва всего необходимо 360 шашек
1 Вершинин, Применение дымовых завес подразделениями пехоты,
Военивдат, 1942;
174
(18 ящиков). Время горения одной шашки в среднем соста-
вляет 6 мин. Поэтому для поддержания дымовой завесы .в те-
чение 25 мин., надо шашки сягагать в четыре очереда
(25:6 = 4). Каждая очередь на всем фронте, очевидно, будет
состоять из 330:4 = 85 шашек. Для более целесообразного
обслуживания следует организовать 33 очага дымопуска с рас-
стоянием между очагами 30 м. Так как для обслуживания
каждого очага достаточно одного бойца, то всего потребуется
33 бойца. В каждую очередь каждый боец через каждые
6—7 мин. должен зажечь две-три шашки. 30 шашек остается
в резервном отделении. Один боец переносит за один рейс
10 шашек, отсюда следует, что 330 шашек могут быть пере-
несены от разгрузочного пункта до рубежа дымопуска за один
рейс. При скорости движения 2 км,/час в нашем примере на
это потребуется 15 мин.
При максимальном удалении разгрузочного1 пункта от рубежа
дымопуска Ля подноски шашек в количестве, необходимом для
создания длительной .дымовой завесы, затрачивается 6—8 час.
Для осуществления беспрепятственного дымопуска при об-
стреле путей подвоза на рубежах дымопуска создается в ноч-
ное время запас дымовых средств. Противник, обнаружив
дымовую завесу, обычно открывает по рубежу дымопуска
огонь. Поэтому при создании длительных завес дымопуск
производится последовательно с нескольких, заранее подгото-
вленных рубежей, расположенных один от другого на расстоя-
нии 100—200 м. Непосредственное начало дымопуска маски-
руется дымовыми гранатами.
При организации подвижной дымовой завесы дымопуск
производится последовательно с нескольких рубежей. Расстоя-
ние между рубежами не превышает обычно 300—400 шагов
или 5 мин. движения. Практически дымовики после создания
дымовой завесы на исходном рубеже входят в дым, чтобы еще
до сгорания шашек создать новую дымовую завесу на после-
дующих рубежах. Маскируемые подразделения движутся за
дымом или вслед за дымовиками входят в дым. При поста-
новке подвижной дымовой завесы на каждый очаг может
потребоваться не один, а два и более бойцов. Для удобства
переноса шашек можно пользоваться самодельными шашко-
сбрасывателями из досок с вырезом для шашек или устроен-
ными в виде рамы с поперечными планками, в которые вбиты
гвозди для насаживания шашек. Для этих же целей зимой
пользуются лыжами.
ГЛАВА XII
ДЫМОВЫЕ ПРИБОРЫ
1. Простые дымовые приборы сухопутных войск
Различные дымовые приборы, установленные на танках,
бронемашинах или переносимые людьми, применяются в основ-
ном для создания подвижных и неподвижных маскирующих
дымовых завес и для задымления различных важных тыловых
объектов: мостов, железнодорожных узлоЬ, переправ и т. п.
Дымовые приборы предназначаются для применения жид-
ких дымообразующих веществ (растворов серного ангидрида,
четыреххлористого Титана, четыреххлористого кремния, мазута
и нефти).
Для испарения ДВ и получения дыма в дымовы^ приборах
используются: 1) механическое дробление жидкости и после-
дующее взаимодействие паров ДВ с влагой воздуха или ам-
миаком, 2) нагревание ДВ при помощи специального устрой-
ства или путем распыления ДВ горячими газами, или введе-
нием уже раздробленного вещества в выхлопные трубы мото-
ров или за счет тепла, выделяющегося при взаимодействии
части ДВ с негашеной известью.
а. Приборы, основанные на распылении. Устройство при-
боров, основанных на механическом дроблении жидкости,
обычно весьма несложно. Эти приборы состоят из одного или
нескольких, резервуаров, источника давления, распылителя,
трубопроводов и шлангов. Действие приборов регулируется
кранами, закрывающими отверстия для вы-
жэда дымообразователя в атмосферу или
прекращающими доступ в резервуар сжа-
тых газов.
В качестве источника давления приме-
няют сжатый азот, воздух или углекисло-
ту. Сжатые газы помещают в отдельном
баллоне или предварительно накачивают
в оболочку с 'ДВ. При применении рас-
творов серного ангидрида давление, необ-
ходимое для распыла, может быть получе-
но -за счет реакции между дымовой смесью
и муравьиной кислотой, протекающей
с образованием окиси углерода, воды и вы-
делением тепла:
SO3 + НСООН -> СО + H2SO4 + Q.
Муравьиная кислота помещается в не-
большом отдельном баллончике; поступле-
с ДВ регулируется автоматически
Рис. 4. Г ерманский
дымовой прибор
ние ее в оболочку
образом, чтобы давление в оболочке не поднималось
определенного предела. •
Известно несколько различных приборов подобного
Германские приборы Z28 (Zerstauben 28), описанные
лианом (рис. 43), представляют собой цилиндрическую желез-
ную оболочку, наполняемую раствором серного ангидрида
в хлорсульфоновой кисИоте. В прибор вставляется трубка, за-
канчивающаяся распылителем.
Распыление жидкости производится при помощи сжатого
азота, находящегося в> маленьком баллончике на верхнем днище
.прибора.
176
таким
выше
типа.
Ганс-
Дм «риведення прибора в-действие необходимо повернуть
вентиль баллона и открыть кран на трубке перед распылителем.
/ Прибор дает густое облако белого тумана, слегка девствую-
щего на кожу и органы дыхазжж. Для прекращения дымо-
пуска достаточно только закрыть кран перед распылителем и
вентиль баллона.
Приборы Z28 изготовляются двух размеров. Малый прибор
весит вместе с жидкостью 23,5 кг, вмещая 7 л дымовой смеси.
Время дымообразования малого прибора равно 7—8 мин. При-
бор переносится одним дымовиком, для чего он при помощи
соответствующих ремней может быть укреплен на спине.
Большой прибор вмещает 27 Л дымовой смеси; вес его вместе
со смесыо равен 75,5 кг. Время дымообраэованйя 30 мин. При-
бор предназначается для дымопуска с места. Он может пере-
возиться на тачке или переноситься двумя людьми.
Рис. 44. Американский дымовой ранец:
1—баллоны с дымообразующим веществом; 2 — резиновые шланги;
J— металлическая трубка, 4—распылителя; 5— ремак для носки;
6— веатвли.
Для дымообразоваиня совместно с аммиаком в приборах
имеются два резервуара: один для аммиака, другой для ДВ.
Смешение аммиака с ДВ происходит в воздухе. Из приборов
этого типа американский дымовой ранец, описанный Фрайсем
(рис. 44), состоит из двух равной величины стальных баллонов
высотой ВО см и диаметром 15 см. Баллоны скрепляются между
собой металлическими полосами, к полосам прикрепляются
ремни, с помощью которых ранец надевается на спину.
Общий вес наполненного ранца 38,5 кг. С правой стороны
оанца имеются две скрепленные вместе длинные металлические
трубки, оканчивающиеся распылителями. Эти трубки соеди-
няются резиновыми шлангами с горловинами баллонов и нахо-
дятся в яравой руке бойца-дымовика, работающего с прибором.
Левой рукой боец-дымовик открывает и закрывает вентили
яа баллонах, регулируя процесс дымопуска. Одни из баллонов
дымового ранца наполняется аммиаком, другой —• смесью четы-
реххлористого кремния и углекислоты.
Американская дымовая труба, также описанная Фрайсем
(ряс. 45), представляет собой железный цилиндр диаметром
<60 см н длиной 2,1 м. Труба лежит в горизонтальном положе-
- 12 -Зак. ОДМ. Вейцер и Лучинский. 177
пип на раме из "углового 'Железа. • ’С одйого' конца ’ труба
открыта, на другом конце находится вентилятор, прикрепленный
к стенкам трубы поперечными распорками и нагнетающий
в.трубу воздух. Вентилятор приводится в движение вручную.
С дымовой- трубой. Соединяются два баллона. Один баллон
наполнен газообразным аммиаком, другой смесью четыреххло-
ристого кремния с 14% углекислоты. Углекислота служит
для распыления четыреххлористого кремния, аммиак распы-
Рис. 45. Американская дымовая Труба
ляется под собственным давлением. Четыреххлористый кремний
поступает в дымовую трубу через четыре распылителя; аммиак —
через один распылитель. На 2 ч. четыреххлористого кремния
в трубу вводится 1 ч. аммиака. Время действия дымовой трубы
от одной пары баллонов равно 30 мин. При прекращении ра-
боты трубы сперва закрывают поступление четыреххлористого
жремния; полминуты спустя прекращают подачу аммиака; по-
следним выключают вентилятор.
б. Приборы, основанные на нагревании. Приборы, основан-
ные на распылении ДВ в потоке горячих газов или на нагре-
вании ДВ, требуют большого количества тепла Поэтому эти
приборы могут быть использованы для задымления тыловых
объектов или на кораблях морского флота. Приборы состоят
из резервуара с ДВ, трубопроводов и распылителя. В зависи-
мости от конструкции возможны следующие схемы использо-
вания тепловой энергии: распыление ДВ горячими газами^
подогрев ДВ распыление ДВ сжатым воздухом или азо-
том в поток горячих -Газов и т. п. По сравнению с приборами,
основанными на механическом дроблении ДВ," термические
приборы позволяют применять такие дымообразующие веще-
ства, как нефть, мазут. При использовании ДВ, реагирующих
с влагой воздуха, термические приборы дают значительно боль-
178
ший коэфициент полезного использования и ббльшую дымо-
образующую способность.
в. Известковые приборы. При применении растворов серного
ангидрида могут быть использованы известковые приборы.
Принцип действия известковых приборов основан на том,
что реакция между негашеной известью и .хлорсульфоновой
или серной кислотой происходит с выделением значительного
количества тепла:
SO3 -4- СаО -» CaSO4 + 60 000 кал;
2SOaOHCl + 4СаО -* 2CaSO4 -ф 2СаС'а 11аО;
H,SO4 -|- СаО -* CaSO4-|- Н2О.
влагой воздуха,
для 'негашеной
ангидрида, сна-
Рис. 46. Германский извест-
ковый прибор
За счет полученного тепла происходит испарение хлорсуль-
фоновой кислоты и образование густого белого дымового
облака. Таким образом, в известковых приборах только часть
кислоты принимает участие в дымообразовании. Остальная
кислота расходуется на взаимодействие с хлорной известью
и получение тепла.
Наилучшее использование хлорсульфоновой кислоты дости-
гается по американским данным в то,м случае, когда на 1 слР
SOaOHC! приходится 1,5 г негашеной извести. При этом около
30% хлорсульфоновой кислоты связывается негашеной известью,
а остальные 70% возгоняются и, реагируя с
образуют дымовую завесу.
Известковые приборы состоят из кадки
извести и резервуара для растворов серного
бженного вентилем. Устройство изве-
сткового прибора, описанного Мюл-
лером, изображено на рис. 46. При-
бор состоит из простой бочки, в ко-
торой транспортируется кислота, и
вместилища для негашеной извести.
Вместо обычной пробки в горловину
бочки ввертывается специальное со-
пло.
Для приведения прибора в дейст-
вие достаточно только повернуть боч-
ку на 180°; кислота выливается, по-
падает на негашеную известь; послед-
няя нагревается, происходит испаре-
ние кислоты и образование тумана.
Известны также применявшиеся
во время войны 1914—1918 гг. в гер-
манской армии известковые приборы: дымовой короб, дымовой
барабан и дымовая колонка. Устройство дымовой колонки
показано на рис. 47. Дымовая колонка вмещает 12 л дымовой
смеси и 17 кг извести.
12*
179
Известковый способ дешев и прост в конструктивном офор-
млении. Поэтому по некоторым сведениям способ этот исполь-
зовался в Германии для противовоздушной
обороиы. ।
г. Приборы для применения фосфора.
Фирмой Штольценберг сконструированы
приборы для применения белого фосфора.
w
ООО
Рис. 476. Схема гер-
манской известковой
дымовой колонки в
собранном виде:
/—дымовой корпус;
2 -крышка с отверстиями;
3— сосуд для хлорсульфо-
нзвой кислоты; 4—ящик
для извести; 5—ручка.
котором находится
Рис. 48. Прибор Штельценбер-
га для применения фосфора:
/—корпус прибора; 2- загрузочные
отверстия; У—паропровод; 4— вентили;
5 — распылители.
Прибор (рис. 48) состоит из резервуара, в котором находится
под слоем воды белый фосфор. При введении в резервуар пара
фосфоо расплавляется.
Расплавленный . фосфор распы-
ляется также паром через обогре-
ваемый распылитель и, сгорая, при
выходе в атмосферу, образует гу-
стое белое дымовое облако.
Недостатком прибора являются
необходимость применения пара и
пламя, образующееся при выходе
из форсунки.
Фирмой Штольценберг предло-
жена основанная, повидимому, на
этом же принципе специальная ав-
томашина. Машина содержит на
двух дисках две фарфоровые батареи, каждая из которых
состоит из .четырех отделений. Загрузка - машины составляет
300 кг фосфора.
2. Дымовые автомашины н танки
а. Устройство и снаряжение. На дымовых автомашинах и
дымовых танках обычно применяется дымовая аппаратура,
основанная на механическом распылении дымообразующих ве-
ществ. Так как в танках, бронированных машинах и торпедных
Igo
катерах приборы для дымопуска должны занимать небольшой
объем и обладать малым весом, то целесообразнее всего при-
магнить приборы с наибольшим коэкрициентом использования
дымообразователя.
В дымовых танках эта аппаратура устанавливается в до-
полнении к стрелковому и пушечному вооружению танка или,
что чаще всего, взамен него.
Емкость резервуаров дымовых танков не велика и изме-
няется в зависимости от типа танка от 30 до 350 л. Время
дымообразования равно примерно 6—20 мин. Дымовые машины
содержат около 1000 л ДВ и дымят 40—60 мин.
В ряде конструкции, например в шеститонном танке Рено
времен первой мировой войны, дымообразователь распыляется
в выхлопную трубу мотора. Смешиваясь с горячими газами,
дымообразователь испаряется и, конденсируясь после выхода
из трубы образует густой
туман. Подобным образом
могут применяться серная
кислота, хлорсульфоновая
кислота растворы серного
ангидрида, мазут и различ-
ные масла.
Наиболее часто иа дымо-
вых танках и дымовых авто-
машинах используются при-
боры, в которых распыле-
ние ДВ производится сжа-
тым воздухом или сжатым
азотом. В одном из опи-
санных дымовых танков,
Рис. 49. Схема расположения дымовой
аппаратуры на танке:
/ — резервуары с дымообразователем; 2 — рас-
пылитель; 3 — краны; 4 — баллоны со сжатым
воздухом; 5—коллектор; 6 — редуктор.
представляющем собой од-
нобашенную гусеничную ма-
шину, вооруженную пуле-
метом, внутри танка нахо-
дятся два сообщающихся
между собой резервуара 1, вмещающих 360 л дымообразова-
теля (рис. 49). Распыление ДВ производится сжатым воздухом.
Воздух находится в четырех баллонах 4 емкостью 36 л каждый.
Начальное давление в баллонах 150 ат. Баллоны имеют общий
коллектор высокого давления 5. Из коллектора высокого давле-
ния воздух поступает в редукционный вентиль 6. Редукциро-
ванный до 5 ат воздух подается в резервуар по воздушному
трубопроводу. Выдавливаясь сжатым воздухом из резервуара,
дымообразователь поступает в распылитель 2, где дробится на
мелкие капли. Изменяя диаметр распылителя, можно увели-
чить или сократить время истечения жидкости и соответственно
время дымообразования. Поэтому танк «снабжается несколь-
кими сменными распылителями.
Чтобы танк не был забрызган дымообразователем, насадок
выводится назад, за танк. Для слива дымообразователя в
днище резервуара находится вентиль. Для продувки распылите-
лей к ним по специальному трубопроводу подведен сжатый
воздух.
Средняя длительность дымопуска 15—18 мин. При этом по-
лучается маскирующая дымовая завеса длиной около 1000 м.
б. Применение. Дымовые автомашины предназначаются для
постановки подвижных и неподвижных маскирующих дымовых
завес. Снаряжение дымовых автомашин производится в тылу на
специальных разливочных пунктах. Эти пункты находятся от
места дымопуска на расстоянии 2—10 км. Заполненные дымо-
вые автомашины скрытно подводятся к месту дымопуска. Ды-
мопуск с места производится для прикрытия наступления своих
частей при создании отсечных дымовых завес для маскировки
от прицельного бомбометания авиации противника. При дымо-
пуске с места дымовые машины целесообразно устанавливать
на обратных скатах, помещать в специальные укрытия, маски-
ровать землей, дерном и травой. Непосредственный дымопуск
маскируется зажиганием нейтральных дымовых шашек.
На месте дымопуска устанавливается распылитель и в цис-
терне создается необходимое для распыла давление (при по-
мощи баллонов со сжатым воздухом, приборчиков с муравьи-
ной кислотой). По соответствующему сигналу командир маши-
ны начинает дымопуск. При длительном дымопуске после окон-
чания работы одного прибора пускается другой и т. д. Пустой
прибор может быть отправлен на снаряжательную станцию.
Для бесперебойного дымопуска на рубеже дымопуска устана-
вливается несколько приборов, каждый из которых занимает
свою оборудованною позицию.
Длина непросматриваемой части дымовой завесы опреде-
ляется нормой расхода дымообразователя и метеорологиче-
скими условиями. При расходовании дымовой смеси 25 кг/мин
и средних метеорологических условиях длина непосредственной
части дымовой завесы равна примерно 700—1000 м. Ширина
дымового конуса в этом месте не превышает 150 м. При по-
становке фронтальных дымовых завес конусы дымопуска
должны сходиться, не доходя до противника.
Расчет количества необходимых машин производится для
фронтальных ветров по формуле: ;
где Ф — фронт задымления, х — расстояние от линий дымо-
пуска до места, где должны сходиться конусы от отдельных
машин, 0,15 — эмпирический коэфициент.
Величина х не должна превышать при благоприятных усло-
виях погоды 1 км, при средних 0,7 км, при малоблагоприятных
0,3—0,5 км.
При косых ветрах количество необходимых машин умень-
шается вдвое.
182
ДымоИуСк из движущихся автомашин и танков применяется
для маскировки наступающих частей. Направление, размер и
плотность дымовой завесы, поставленной движущейся маши-
ной, зависят от скорости и направления движения машин и на-
правления и скорости ветра. Эта зависимость иллюстрируется
рис. 50. Степень штриховки указывает на плотность получен-
ного дыма. Влияние ветра наиболее сильно сказывается при
малых скоростях движения машин. Плотность полученной ды-
мовой завесы определяется скоростью движения машин и се-
кундным расходом дымообразователя. Секундный расход дымо-
образователя зависит от диаметра отверстия распылителя при-
бора. Сменой распылителя можно добиться изменения секунд-
ного расхода.
Рис. 50. Характер дымовой завесы в зависимости от соотношения между
направлением ветра и направлением движения машины
Правильное применение движущихся дымовых автомашин И
дымовых танков в бою представляет собой довольно трудную
задачу и требует большого мастерства и искусства.
3. Дымовые авиационные приборы
а. Устройство и снаряжение. Дымовые авиационные приборы
появились в результате развития авиации только после войны
1914—1918 гг. При помощи этих приборов могут быть полу-
113
Чены вертикальные и горизонтальные дымовые завесы *. Верти-
кальные дымовые завесы предназначаются для прикрытия своих
частей от наземного и воздушного наблюдения противника.
Горизонтальные дымовые завесы создаются для маскировки
воздушных целей.
В дымовых авиационных приборах используются различные
жидкие дымообразующие вещества — растворы серного ангид-
рида, четыреххлористый титан, четыреххлористый кремний. Из-
вестны конструкции дымовых приборов, использующих белый
фосфор.
Дымовые авиационные приборы без добавочного давления
представляют собой длинные тонкостенные резервуары, под-
вешиваемые под крылья самолета.
В передней части прибора имеется отверстие с воронкой.
Воронка направлена в сторону движения самолета. Отверстие
воронки закрывается воздушным вентилем. На задней части
резервуара находится выливная труба, заканчивающаяся соп-
лам для дробления жидкости и задвижкой. Воздушный вентиль
и задвижка открываются одновременно при помощи троса из
кабины летчика.
При открытых воздушном вентиле и заглушке дымообразо-
ватель встречным потоком воздуха выбрасывается через вылив-
ную трубу и сопло в атмосферу. Скорость встречного потока
воздуха при этом настолько велика, что ДВ дробится при этом
на мелкие быстро испаряющиеся капли. Таким образом, полу-
чается широкая горизонтальная дымовая завеса. Завеса эта
получается на любой высоте над поверхностью земли. Чтобы
между землей й дымовой завесой не было чистого воздуха,
распыление дымообразующего вещества следует производить
ие выше 15—50 м над поверхностью земли.
Размер площади, которую дымовая завеса закрывает на
земле, зависит от емкости прибора, высоты, иа которой произ-
ведено выливание дымообразователя, скорости самолета, ско-
рости ветра и устройства сопла распылителя.
Так, например, американский прибор, вмещающий 150 ке
дымообразователя при выливании на высоте 15 м иад поверх-
ностью земли и ветре, перпендикулярном курсу полета само-
лета, закрывает площадь длиной 1400 м и шириной 300 м.
Шведский прибор, содержащий 165 кг дымообразователя,
дает дымовое облако шириной 25—100 м. Длина завесы при
выливании на высоте 50 м равна 5 км. При выливании на вы-
соте 25 м и открытом наполовину вентиле длина завесы дохо-
дит до 10 км.
Дымовые авиационные приборы с добавочным давлением
предназначены для получения вертикальных дымовых завес.
Эти завесы могут быть получены в том случае, когда ДВ дро-
бится на крупные капли. Крупные капли, падая под действием
1 В настоящее время дымовые авиационные приборы используются
исключительно для создания вертикальных дымовых завес.
1*4
i силы тяжести и медленно испаряясь, дают вертикальную дымо-
вую завесу. Для получения более крупных капель необходимо
при выбрасывании жидкости из прибора преодолеть действие
встречной струи воздуха. Это достигается распылением жид-
кости под давлением по направлению, противоположному на-
правлению полета самолета.
Наиболее крупные капли и наилучшая дымовая завеса по-
лучаются тогда, когда скорость движения самолета и началь-
ная скорость выброса струи равны между собой.
Схема дымового авиационного прибора с добавочным давле-
нием изображена на рис. 51. Прибор состоит из резервуара,
наполненного дымообразующим веществом и подвешиваемого
под крылья самолета. Емкость резервуара равна 100—150 л.
Для выбрасывания ДВ в атмосферу применяется сжатый воз-
дух, сжатый азот, жидкая углекислота.
Выбрасывание жидкости происходит через автоматический
клапан и наконечник. 'Автоматический клапан открывает выход
дымообразователю при опреде-
ленном давлении. Это давле-
ние не превышает обычно 1 Ост.
Высота получающегося дымо-
вого облака зависит от давле-
ния пара примененного ДВ и
степени дробления вещества. ,
В наиболее распространен-
ных приборах и при примене-
нии растворов серного ангидри-
' да в хлорсульфоновой кислоте
высота завесы колеблется от
75 до 100 м. При выливании
на большой высоте дымовая завеса не доходит до поверхности
земли. Длина дымовой завесы определяется скоростью полета
самолета, емкостью резервуара и временем опорожнения. Так,
например, в американском прибор’е, содержащем 300 кг ДВ,
получается дымовая завеса длиной 1200 м.
Внешний вид дымовой завесы, полученной при помощи авиа-
ционного прибора, изображен на рис. 52.
б. Применение. Дымовые авиационные приборы в снаряжен-
ном виде, заполненные жидким дымообразующим веществом,
подвешиваются под крылья самолета. Для постановки дымовой
завесы летчик-наблюдатель в необходимый момент открывает
крышку, закрывающую выливное отверстие дымового прибора.
Одновременно в зависимости от конструкции прибора в нем
создается давление подачей сжатого воздуха из баллона. Вы-
брасываемая из дымового прибора жидкость дробится встреч-
ным потоком воздуха на капли. Полученные капли жидкости
падают на землю,' дымообразователь во время полета испа-
ряется и, реагируя с влагой воздуха,’ образует дымовую за-
весу. Если дымовая завеса поставлена на большой высоте, то
дымообразователь испаряется в верхних слоях атмосферы и у
185
Рис. 51. Схема дымового авиацион-
ного прибора:
/ — резервуар с дымообразующим вещест-
вам; 2 — трубопровод; 3 — распылитель;
4— источник давления.
поверхности земли образуется незаполненный дымом просвет.
Поэтому постановка дымовых завес должна производиться на
высоте не выше 75—100 м.
Клина поставленной вертикальной дымовой завесы равна
произведению скорости самолета на время выливания. Так как
начальный и конечный участки завесы просматриваются, то в
формулу для расчета длины вертикальной дымовой завесы вво-
дится поправочный коэфициент, равный примерно 0,75.
Ширина дымовой завесы, поставленной с высоты 100 м,
равна при средних метеорологических условиях 15—20 м. Наи-
более благоприятными метеорологическими условиями для по-
становки дымовой завесы являются температура воздуха от
4-10° до -|-25о и скорость ветра от 2 до 6 м/сек. Устойчивость
дымовой завесы, зависит, главным образом, от метеорологиче-
ских условий; дымовая завеса устойчива в течение 10—25 мин.
Рис. 52. Постановка авиационной дымовой завесы
Расчет полета самолета и определение .момента выливания
производятся таким образом, чтобы поставленная дымовая за-
веса была по возможности перпендикулярна к направлению
противник—маскируемая часть. Постановка авиационной ды-
мовой завесы производится в течение нескольких секунд.
В дальнейшем полученная дымовая завеса сносится ветром в
сторону. Поэтому при постановке авиационных дымовых завес
необходимо так учитывать направление ветра, чтобы дым про-
должал маскировать свои части. Вместе с тем маскирующие
дымовые авиационные завесы возможны при различных напра-
влениях ветра: изменяется только количество примененного
дымообразователя и место выпуска ДВ из прибора. Во всех
случаях рекомендуется ставить дымовую завесу возможно ближе
к ослепленным огневым точкам противника.
186
Применение дымовых авиационных завес производится
с учетом всей тактической обстановки дымопуска таким обра-
зом, чтобы дым не мог быть использован противником в своих
целях. Чтобы авиационная дымовая завеса выполняла свою
задачу, закрываемая ею площадь должна быть больше пло-
щади маскируемого объекта. При маскировке движущихся тан-
ков постановка авиационной дымовой завесы производится
перпендикулярно фронту, параллельно направлению движения
танков. Маскировка при помощи авиационных дымовых при-
боров наземных объектов от прицельного бомбометания мало
целесообразна. Для постановки подобных завес необходима
группа самолетов. Кроме того, полученная дымовая завеса бу-
дет быстро унесена ветром в сторону.
4. Дымовые приборы морского флота
Для дымопуска с кораблей могут применяться дымовые при-
боры различных типов и конструкций. В частности, в герман-
ском флоте использовались приборы, основанные на известко-
вом принципе. Американский флот применял дымовые трубы.
В ряде случаев использовались и используются большие дымо-
вые шашки (буи). Известны также приборы, основанные на
механическом дроблении ДВ сжатым воздухом или азотом.
Однако наличие на кораблях тепловой энергии делает наибо-
лее целесообразным применение для дымообразоваиия прибо-
ров, основанных на принципе термической возгонки, и исполь-
зование в качестве дымообразующих веществ растворов сер-
ного ангидрида или мазута.
Наиболее просто дымовая завеса получается при уменьше-
нии притока воздуха в топки кораблей и образовании черного
дыма в результате неполного сгорания топлива. Однако завеса
черного дыма мало устойчива. Кроме того, необходимое для
получения черного дыма уменьшение притока воздуха нарушает
режим работы корабельной топки, что ведет к снижению ско-
рости хода корабля. Поэтому на современных кораблях с неф-
тяными (мазутными) топками имеются специальные нефтяные
форсунки, позволяющие получать белые дымовые завесы без
нарушения режима работы корабельной топки. Форсунки уста-
навливают в корабельных трубах. Распыление жидкости произ-
водится паром. Предварительно мазут подогревают.
В американском и английском флоте во время войны
1914—1918 гг. белые дымовые завесы получались распылением
в дымовых трубах хлорсульфоновой кислоты или олеума. При-
менявшийся для этого прибор состоит из баллона с хлорсуль-
фоиовой кислотой, снабженного сифонной трубкой, баллона со
сжатым воздухом, вентиля и распылителя и форсунки. Нижний
конец сифонной трубки имеет трубку-сетку для задержки осад-
ков и загрязнений. Форсунка помешается в канале дымовой
трубы на высоте 4.5 м над топкой и примерно на 7,5 м ниже
верхнего среза дымовой трубы.
187
Другой подобный прибор состоит из <резервуара-цистерныг
вмещающей около 135 кг 20%-иого олеума. Резервуар снаб-
жается сифонной трубкой, соединенной с помещенной в дымо-
ходе форсункой. Распыление олеума производится воздухо-
дувкой. Время дымообразования 15 мин.
В ряде приборов, устанавливаемых, в частности, на торпед-
ных катерах, для испарения дымообразователя используется
тепло отходящих газов мотора. В этих приборах дымообра-
зующее вещество сначала подвергается механическому дробле-
нию сжатым воздухом, а затем в распыленном состоянии вво-
дится в испаритель. В испарителе дымообразователь смеши-
вается с отработанными газами двигателя внутреннего сгора-
ния, температура которых равна примерно 260—300°, испаряется
и частично разлагается. Пары дымообразователя и продукты
разложения энергично реагируют с влагой воздуха, образуя
густую завесу белого дыма.
ГЛАВА XIII
ДЫМОВЫЕ СНАРЯДЫ, МИНЫ И БОМБЫ
1. Устройство и снаряжение дымовых снарядов и мин
Дымовые снаряды и мииы применяются, главным образом,
для создания ослепляющих дымовых завес в расположении про-
тивника. По своему внешнему виду дымовые снаряды и мины
Рис. 53. Американ-
ский ЧЬ-мм дымо-
вой снаряд:
1— дымообразователь;
2—взрывчатое веще-,
став.
Рис. 54. Американская 4-д мина.
1 — дымообразователь; 2 — взрывчатое
вещее, во.
ничем не отличаются от обычных снарядов и мин фугасного
или осколочного действия. Стрельба дымовыми снарядами »
188
минами также ие требует специального приспособления и про-
изводится из обычных гаубиц, пушек и минометов.
Дымовые снаряды и мины состоят из четырех основных ча-
стей: 1) корпуса снаряда, 2) заряда взрывчатого вещества, на-
ходящегося в запальном стакане, 3) дымообразователя, 4) взры-
вателя.
Конструкция американского 75-ми дымового снаряда и аме-
риканской 100-ми дымовой мины времен первой мировой войны
показаны на рис. 53 и 54. На рис. 55 изображен германский
Рис. 55. Германский 150-мк
дымовой снаряд:
/—оболочка; 2—серный анги-
дрид; 3— взрыватель; 4— взрыв-
чатое вещество.
Рис. 56. Германская
дымовая реактивная
мина:
I— навннтовавный кол-
пак; 2 — корпус инны:
3—турбина; 4— марка
инны; 5—ведущий поясок;
б—дымообразующее ве-
щество: 7—реактивный
заряд; 8 — донная трубка.
150-ми снаряд того же времени. На рис. 56 показана герман-
ская реактивная мина образца 1938 г.
Некоторые данные о различных дымовых снарядах и мИйах
приведены в табл. 36.
Количество дымообразователя, находящегося в артиллерий-
ских снарядах, составляет примерно 8—10% общего веса сна-
ряда. В дымовых минах (нереактивных), имеющих более тон-
кие стенки, содержание дымообразователя больше и доходит
до 30—40%.
Количество потребного взрывчатого вещества определяется
толщиной стенок снаряда или мины. Стеики мииы тоньше сте-
нок снаряда. Поэтому в артиллерийских дымовых снарядах
заряд ВВ больше, чем в дымовых мииах.
Дымовые снаряды и мины имеют чувствительный взрыва-
тель. Это необходимо для того, чтобы разрыв снарядов и мин
189
Таблица 36
Некоторые артиллерийские дымовые снаряды и мины
«3 cc is
Страны Тип орудия Маркиров! снаряда Вес снаря/ Дымообра- зователь Вес дымов) зователя в Продолжи- тельность задымления
Г ермаиия 150 мм полевая гаубица N 14,5 Серный ан- гидрид — —
158,5 мм шести- ствольный миномет d 40 Фосфор или серный ан- гидрид — 40 сек.
Англия1 3,7-дюймовая полевая гаубица MKVI 16,3 Фосфор . 1,56 —
Франция1 75 мм полевая гаубица GOCS — Хлорсуль- фоиовая кислота — 5—10 сек.
CrPhF — Фосфор . \ —
Швеция1 70 мм пушка Mod 22 6,8 м 0,75 —
США1 107 мм газовая мина, WPMKI 11,57 3,63 2 мни. 15 сек.
155 мм гаубица WP 43 7 45 сек.
FM 43 Четырех- хлористый титан 6,5 5—10 сек.
107 мм курящаяся дымовая мина Стокса 5,9 Смесь Берже 1,75 3—4 мин.
200 мм курящаяся дымовая мина Линенса 22 1 м 19,7 4 мни.
происходил у поверхности земли и дымообразователь не попа-
дал в глубь почвы.
Для снаряжения дымовых снарядов, и мин применяются раз-
личные твердые и жидкие дымообразующие вещества: белый
фосфор, серный ангидрид, четыреххлористый титан, растворы
серного ангидрида и т. п.
При применении жидких дымообразующих, веществ, обла-
дающих большой упругостью насыщенного пара, при разрыве
снарядов получается густое дымовое облако. Однако процесс
дымообразовании заканчивается весьма быстро и через корот-
кий промежуток времени местность, обстрёленная такими сна-
рядами, освобождается от дыма.
Более выгодно применение твердых дымообразующих ве-
ществ. Эти вещества дробятся при разрыве снаряда на крупные
1 Данные относятся к 1914—1918 гг.
190
куски, дымящие в течение более продолжительного срока и
дающие поэтому более устойчивую дымовую завесу.
Вместо твердых дымообразователей в современных герман-
ских снарядах и минах для увеличения продолжительности
дымообразования применяются пемза или диатомит, пропитан-
ные серным ангидридом или его растворами.
Лучшим дымообразующим веществом для снаряжения ды-
мовых снарядов и <мин является белый фосфор. Наряду с ды-
мовыми свойствами снаряды с белым фосфором действуют на
живую силу противника (вызывая ожоги при попадании на
кожу) и поджигают сухие материалы. Одновременно с этим
разрыв фосфорных снарядов, во время которого куски горя-
щего фосфора летят во все стороны, сам по себе оказывает
сильное моральное воздействие на противника.
Дымовые снаряды с белым фосфором требуют особых пре-
досторожностей при хранении. Они должны быть защищены от
тепла, солнечного света и сильного холода. При несоблюдении
этих мер предосторожности фосфорные снаряды могут треснуть
или самовоспламениться.
Для снаряжения дымовых артиллерийских снарядов и мии
применяются также термические или металлохлоридные дымо-'
вые смеси. Подобные снаряды называются курящимися.
Поджигание этих смесей в курящихся снарядах и минах про-
изводится при помощи запального приспособления, которое в
свою очередь приводится в действие от обычного взрывателя
дистанционного или ударного действия.
Сгорая в оболочке снаряда, дымовая смесь дает густой дым,
выходящий через закрытые легкоплавким металлом отверстия
в корпусе снаряда или мины. Продолжительность действия ку-
рящихся снарядов и мин доходит до 5 мин.
2. Применение артиллерийских дымовых снарядов и мин
Артиллерийские дымовые снаряды и мины предназначаются
для постановки ослепляющих маскирующих ..дымовых .завес.
Они меньше всех остальных средств дымопуска зависят от ус-
ловий погоды и направления ветра и могут лучше применяться
при штиле и слабых ветрах. Дымовые снаряды' и мйны приме-
няются и в том случае, когда ветер дует от противника, одиако
при этом следует учитывать, что дым может дойти до располо-
жения своих частей.
Количество снарядов и мии, необходимых для постановки
дымовой завесы, зависит от свойств применяемого дымообразо-
вателя, конструкции дымового снаряда, расстояния от орудий
или минометов до места постановки завесы, топографической
обстановки, направления и силы ветра и влажности воздуха.
При боковом ветре рекомендуется вести обстрел таким об-
разом, чтобы образующиеся от разрыва каждого снаряда ды-
мовые облака налагались друг на друга и образовывали перед
ослеплённым объектом сплошную стену дыма. По английским
нормам при задымлении небольших объектов точки разрыва
191
фосфорных снарядов должны находиться в этом случае на рас-
стоянии 200 м одна от другой и в 100—150 м впереди цели. 'По
американским — на расстоянии 140 м (рис. 57).
При ветре на противника или от него огонь рекомендуется
вести не по самой цели, а около нее. Расстояние между точ-
ками разрыва снаряда должно быть таким, чтобы конусы дыма
от отдельных снарядов образовывали в расположении объекта
сплошную дымовую завесу. Правильное задымление объекта
ДО? 1 показано на рис. 58. Объект № 2 иа этом же рисунке
задымлен неправильно.
Для применения дымовых снарядов и мин необходимо
устойчивое направление ветра. Колеблющееся переменное на-
правление ветра затрудняет обстрел и делает его нецелесооб-
разным.
Для образования плотного, не имеющего просветов дымо-
вого облака обстрел дымовыми снарядами и минами следует
Рис. 57. Расположение по ветру
и расстояния друг от друга точек
разрывов дымовых снарядов
Рис. 58. Порядок обстре-
ла цели дымовыми сна-
рядами при ветре
вести с большой скорострельностью и с одновременным приме-
нением нескольких орудий или минометов. Необходимые скоро-
стрельность и расход снарядов возрастают при увеличении
расстояния от орудия до объекта, так как при этом увеличи-
вается площадь рассеяния снарядов.
С увеличением скорости ветра количество дымовых снаря-
дов, необходимых для постановки дымовой завесы, возрастает.
По германским наставлениям для стрельбы дымовыми минами
благоприятными условиями являются скорость ветра до 4 м/сек:,
при скорости ветра больше 6 м/сек облако дыма быстро рас-
сеивается, а при скорости больше 8 м/сек создание дымовой
завесы достаточной плотности невозможно даже при макси-
мальном расходе снарядов. Малые снаряды, снаряженные дымо-
образователем, дают дымовое облако меньшего объема по
сравнению со снарядами большого размера и снарядами, снаря-
женными фосфором. Соответственно с этим при применении
малых снарядов для достижения равного эфф»екта требуется
192
^увеличенный расход снарядов и повышается скорострельность.
При постановке дымовой завесы при помощи дымовых сна*
рядов и мин вначале стрельба ведется с максимально возмож-
ной скорострельностью для того, чтобы в кратчайший срок со-
здать дымовую завесу. В дальнейшем для поддержания дыма
производится медленный методический огонь ’.
По германским наставлениям дымовые снаряды и мины при-
меняются, кроме того, для создания дымового вала. Ды-
мовым валом называется подвижная дымовая завеса, предна-
значенная для защиты наступающей пехоты от огня противника.
Дымовой вал создается одновременно с огневым валом и пред-
назначается для деморализации и ослепления противника.
3. Дымовые авиационные бомбы
а. Устройство и снаряжение. Дымовые авиационные бомбы
применяются для задымления районов расположения против-
ника и ослепления его наблюдательных пунктов. По сравнению
с дымовыми авиационными приборами дымовые бомбы позво-
ляют ставить дымовую завесу у поверхности земли с любой
высоты полета самолета.
Впервые дымовые авиационные бомбы появились в конце
войны 1914—1918 гг. Для наполнения дымовых авиационных
бомб в настоящее время употребляют твердые или жидкие
дымообразующие вещества (фосфор, серный ангидрид, четырех-
хлористый титан, растворы серного ангидрида и т. п.). Дымовые
бомбы с жидкими дымообразующими веществами дают при
разрыве быстро проходящую дымовую завесу. Дымовые бомбы
с твердыми дымообразующими веществами образуют более дли-
тельную завесу. По сравнению с артиллерийскими дымовыми
снарядами авиационные дымовые бомбы имеют более тонкие
стенки. Поэтому содержание дымообразующего вещества в ды-
мовых авиационных бомбах довольно высоко — примерно
30—50% от их общего веса.
Калибр дымовых авиационных бомб колеблется в довольно
широких пределах. По Ганслиану в Швеции употребляются
дымовые бомбы весом 12,5, 25 и 50 кг, содержащие соответ-
ственно 6,12 н 25 кг белого фосфора; по тем же данным аме-
риканская фосфорная бомба при общем весе 13,6 кг содержит
4,5 кг фосфора и дымит около 3 мин. и т. п.
Чтобы воспрепятствовать проникновению дымовых бомб в
глубь почвы, они снабжаются чувствительными взрывателями.
Поддержание дымовой завесы путем повторного сбрасыва-
ния дымовых бомб в то же самое место представляет собой
довольно трудную тактическую и техническую задачу. Поэтому
стремятся увеличить продолжительность дымообразоваиия ды-
мовой бомбы. С этой целью дымовые бомбы снаряжаются тер-
мическими или металлохлоридными дымовыми смесями.
1 В некоторых случаях вместо методического огня периодически по-
вторяется скорострельный огонь.
13 Зяк. 3184. Вейнер и Лупинский. W3
Курящаяся американская дымовая плавающая бомба, опи-
санная Ганслианом, весит 27 кг и содержит 4,5 кг гексахлор-
этановой смеси. Эта смесь загорается после всплывания дымовой
бомбы на поверхность воды и дымит в течение 3—5 мин.
Чтобы уменьшить потери, вызванные проникновением дымо-
вых бомб в землю, в США были разработаны и испытаны два
типа новых дымовых бомб, представляющих собой, собственно
говоря, сбрасываемые с самолета дымовые авиационные при-
боры. Один из этих приборов представляет собой обтекаемую,
имеющую форму бомбы оболочку, наполненную жидким дымо-
образователем. Вес прибора 13,6 кг; объем дымообразователя
2700 см3. При ударе прибора о землю приводится в действие
механизм, с помощью которого жидкий дымообразователь вы-
давливается через распылитель, находящийся в верхней части
бомбы. Сама бомба в это время глубоко проникает в землю.
б. Применение. Авиационные дымовые бомбы рекомендуется
применять, главным образом, для ослепления огневых точек и
наблюдательных пунктов противника. Одновременное ослепляю-
щим действием фосфорные бомбы в летних условиях вызывают
пожары.
Авиационные дымовые бомбы сбрасываются группами по
10—15 шт.
Клубы дыма, получающиеся при разрыве авиационных бомб,
сливаясь вместе, образуют сплошную дымовую завесу. Места
сбрасывания дымовых бомб выбираются с учетом направления
ветра таким образом, чтобы дымовая завеса формировалась в
расположении ослепленного объекта. Поэтому весьма важно
знать направление ветра на земле в месте предполагаемого
ослепления противника тем более, что улучшение поставленной
дымовой завесы возможно только при последующем заходе са-
молета. Дымовые бомбы, снаряженные жидкими дымообразую-
щими веществами, дают кратковременные, быстро уносимые
ветром дымовые завесы. Бомбы, снаряженные фосфором или
твердыми дымовыми смесями, дымят в течение более продолжи-
тельного срока.
При расчете дымовой завесы следует исходить из того, что
восемь фосфорных бомб дают устойчивую дымовую за-
весу длиной 1—2 км и высотой 75—100 м. При средних скоро-
стях ветра эта завеса движется, не разрываясь, и сохраняет
свои маскирующие свойства в течение 12—15 мин.
ЛИТЕРАТУРА
Общая
I. Янковский В. М-, Дымы и туманы, Статья в Технической Эн-
циклопедии, т. VII, 1931, стр. 346—362.
2. В а и и и Ф. И., Боевые дымы, ОНТИ, 1935.
3. Вейцер Ю. И. и Лучннский Г. П., Физика н химия маски-
рующих дымов, Обороигиз, М., 1938.
К части первой
4. Гиббс, Аэрозоли, НХТИ, 1929.
5. У а йтло у-Г р ей Р. и Паттерсон Н„ Дым, Госхимиздат, М., 1932.
6. J а п d е г u. Winkel, Schwebstoffen in Gasen, 1934.
7. Шмаус А. и Виганд А., Атмосфера как коллоид, Гидрометиз-
дат, М., 1933.
8. V о 1 ш е г М., Kinetik der Phasenbildung, 1939.
9. Хвостиков И. А., Теория рассеивания света и ее применение
к вопросам прозрачности атмосферы и туманов. Успехи физич. наук 24,
вып. 2, 165—227, 1940. •
10. Ш а р о и о в В., Видимость далеких предметов и огней, Военмор-
издат. М. и Л.» 1944.
11. Оболенский В. И.. Метеорология, Гадрометиздат, 1944.
12. Бурштейн, Р. Н., Методы исследования аэрозолей, Госмедиздат
УССР, 1937.
13. Гуревич И. Д., Вейцер Ю. И., Лучннский Г. П. и др..
Лабораторный практикум по аэрозолям, изд. Военно-химич. Акад., М., 1934.
К части второй
14. Соборовскнй Л. 3. н Эпштейн Г. Ю„ Химия и технология
боевых химических веществ, Обороигиз, 1938, стр. 517—573.
15. Курс боевых химических веществ, Учебник под ред. Янковского
В. М., Воеииздат, 1940, стр. 321—341.
16. Малин К. М. и др., Технология серной кислоты и серы, Госхим-
нздат, М. 1941.
17. Кузьминых И. Н., Производство верной кислоты, Госхимиздат,
М., 1939.
18- Лукьянов П. М., Курс химической технологии минеральных
веществ, ч. III, ®ып. III, Госхимтехиздат, 1933, стр. 55—100, 144—159, 208.
19. Э ф р а и м Ф., Неорганическая химия, ч. II, Госхимтехиздат, 1934,
стр. 45, 60, 67—70, 203—211.
20. Л у ч и н с к и й Г. П., Четыреххлористый титан, Обороигиз, 1939.
21. 3 н а м еис кн й Н. Н. н Шубников А. П., Производство жел-
того н красного фосфора, ОНТИ, 1938.
22. Ш и Д л о в с к и й А., Основы пиротехники, Гос. изд. Обор. Пром., 1943.
23. Никольский Н. А., Сырой антрацен каменноугольной смолы в
продукты его переработки, ДНТВУ, 1938.
24. Б а д а е в Г. М., Боевые ОВ и основы защиты от них, Л., 1932,
стр. 43—52.
195-
К части третьей
25. В е р ш и и и и П. Г., Применение дымовых завес подразделениями
пехоты, Воениздат, 1943-
26. Кокосов Б. В. и Романовский И. Д., Боевые действия
войск в условиях задымления, Воеинздат, 1943.
27. Hanslian, Der chemische Krieg, В. I, 3 Aufl., 1937.
28. Prentiss, Chemicals in War, 1937-
29. Ф p а й с А. и Вест К., Химическая война, ГВИ, 1927.
30. А р к а д ь е в В. К-, Научно-технические основы газовой борьбы,
М„ 1917.
31. Сагатовский, Метеорология в военно-химическом деле, Воен-
«здат, 1944.
32. Правила стрельбы дымовыми минами, Воениздат, -1943.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Авиационные бомбы 193
г Автомашины дымовые 181
г- Азотнокислый калий 145
Аллотропия фосфора 113
f Алюминий 140
(5 Аммиак, реакции в атмосфере ПО
Аммоний
L нитрат 138
сульфат 138
хлористый 136
Аммонийные соли 135 сл.
» Антрацен 136
s Аппарат Коттреля 52
i Ароматического ряда продукты 133
Артиллерийские снаряды 191
Атмосферы вертикальная устойчн-
S вость 152
?' Аэродинамическая тень 156
Аэродисперсные системы 7
Аэрозоли 7
’ концентрация 10
методы получения 12
размеры частиц 11
Белый фосфор
получение 120
свойства 114
технический 121
хранение 121
Бертолетова соль 144
Боеприпасы дымовые 150
Бомбы дымовые 150, 193
Броуновское движение 9, 27, 30
Буй дымовой 167
Вертикальная устойчивость атмо-
сферы 152
Вес маскирующий 71
Весовая концентрация 10
определение 51
Ветер 153
Вещества дымообразующие 5, 63
Взрыв 23
Видимость
дальность 44 сл.
дистанция 45
источников света 47
Возгонка 20, 132
аммонийных солей 136.
Гексахлорбензол 142
Гексахлорэтаи 142
Гидравлическое распыление 13
Горючие вещества 144
Градиент температур 153
Гранаты дымовые 150, 168 сл.
Граница дымового облака 48
Гудрон 133
Дальность видимости 44 сл.
определение 61
Движение броуновское 9, 27, 30
Дестиллядия изотермическая 25
Дисперсионные
среда 7
— исследование химического со-
става 56
метод 12
Дисперсная фаза 7
исследование химического соста-
ва 56
Дисперсности стеиень 9
Дистанция видимости 45
Диффракция света 35
Дымовые
боеприпасы 160
бомбы 150, 193
гранаты 150, 168 сл.
машин 150
мины 150, 188 сл.
приборы 150, 176 сл.
снаряды 150, 188 сл.
составы
— компоненты 128
---(вспомогательные 145
— — металлические 139
---хлорсодержащие 141
— металлохлоридные Г27
— приготовление 147
— принципы составления 128
— сырье 143
— термо-возгоночные 127
— употребительные рецептуры 129
частицы
— движение 27
— испарение 23
— размер 10, И
--- определение 59
шашки 150, 159 сл.
— морская 166
— принципы н схема снаряжения
143
197
Дымовые шашки
— снаряжение футляров 146
Дымообраэование 8
при содействии аммиака 109
Дымообразователь 8, 63
Дымообразующие
вещества 5, 63
способность 68
— фосфора 126
Дымопуск 5
условия 158
Дымы 7, 8
несовая концентрация 10
---- определение 51
изодисперсные 10 «
маскирующие 5, 8
методы получения 12
нейтральные 8
окиси кадмия 11
размер частиц 10, 11
------ определение 59
Естественное осаждение 55
Железо 140
Жидкости распыление 13 ,
Жирного ряда продукты 132
Закон
Вера 40
Ламберта 39
Запалы для шашек 163
t
Измельчение механическое 13
Изодисперсные дымы 10
Изотермическая дестилляция 25
Изотермия 153
Инверсия 152
Индикатриоса светорассеяния 35
Испарение
капель 25
частиц 23
Калий
азотнокислый 145
хлорноватокислый 144
Каменноугольные
пек 134
смола 133
Капли испарение 25
Карбазол 135
Кизельгур 146
Кинетика испарения капель 25
Кислота
пиросерная 79
хлорсульфоновая 81
Классификация
аэрозолей 7
дымообразующих веществ 64
Коагуляция 30 сл.
Конвекция 162
Конденсационный метод 12, 15
198
Конденсация 15
в результате химической реакции
20
при охлаждении пара 16
центры 16
Контраст яркости 43
Концентрация
весовая 10
— определение 51
частичная 10
— определение 56 сл.
Коэфициент
ослабления света 39 *
----- определение 60
преломления света 34
Красный фосфор
получение 121
свойства 116
Крахмал 144
Кремний четыреххлористый 92 сл-
JI амберта закон 39
Мазут 133
Маскировка 5
Маскирующие
вес 71
дымы 5
способность 69 сл.
— полная 70
— фосфора 126
эффективность 70
Масляный туман 11
Машины дымовые 150
Металлохлорядные составы 12
Механическое
измельчение 13
осаждение 54
Мины дымовые 150, 188 сл.
Многократное рассеяние 40
Морская дымовая шашка 166 7
Мортирка дымовая 170
Наполнители 146
Натрий хлорноватокислый 145
Нафталин 134
Нейтральные дымы 8
Нефть 132
Нитрат аммония 138
Облачность 154
Озокерит 133
Окиси кадмия дым 11
Окислители 144
Олеум
дымообразующая и маскирую-
щая способность 103
получение 80
свойства 78
Олово хлорное 97 сл.
Осадки 154
Осаждение
естественное 55 ; . 7
Осаждение
механическое 54
термическое 54
электрическое 52
Осаждение частиц 28, 30
Ослабление света 39
Ослепление 5
Ослепляющая способность 49
Отражательная способность 45
Парафин 133
Пек каменноугольный 134
Пентахлорбензол 142
Пентахлорэтан 142
Перемешивание турбулентное 33,154
Пересыщение 17, 18
Пиросерная кислота 79
Пиросульфурил хлористый 89
Пламягасители 146
Плотность
дымового облака 72
частиц 11
Поверхность удельная 8
Поглощение света 38
Полная маскирующая способность
70
Поляризация 36
Порог
контрастной чувствительности 41,
42
насыщенности 43
Приборы
дымовые 150, 176 сл.
Оуэнса 55
Прозрачность определение 60
Просматриваемость 45
Пульверизатор 14 I
Пульверизация 13
Пыль цинковая 139
Пятисернистый фосфор 123
Равновесие между частицами и сре-
дой 23
Размер частиц 10, И
определение 59
Разрыхлители 146
Распыление
жидкостей 13
растворов 22 1
Распылитель Регенера 15
Рассеяние света 34
многократное 40
Реакции с аммиаком в атмосфере
ПО
Резкость границы 48
Свет
диффракция 35
ослабление 39
поглощение 38
рассеивание 34
Сера 144
Сернокислотный туман 100 сл.
Серный ангидрид
дымообразующая и маскирующая
способность 102
модификации 74
получение 80
смесь с
----серной кислотой 78
----хлористым сульфурилом 91
----хлорсульфоиовой кислотой
90
физические свойства 75
химические свойства 76
Сесквнсульфид фосфора 123
Системы аэродисперсные 7
Скорость коагуляции 32
Смещение среднее 28
Смола каменноугольная 133
Снаряды дымовые 150, 188 сл.
Соли аммонийные 135 сл.
Способность
дымообразующая 68
маскирующая 69
ослепляющая 49
отражательная 45
Среда
дисперсионная 7
и частицы, равновесие 23
Среднее смещение 28
Степень
дисперсности 9
пересыщения 17
поляризации 36
Стильб 41
Сульфат аммония 138
Сульфурил хлористый 86
Сырой антрацен 135
Сырье для дымовых составов 143
Танки дымовые 181
Твердые тела, измельчение 13
Температура атмосферы 152
Термическое осаждение 54 сл.
Термо-возгоночные составы 127
Тетрахлорэтан 141
Титан четырехлористый 94 сл.
Грехокись серы 74
Трехсернистый фосфор 123
Туманы 7
масляный 11
методы получения 12
сернокислотный 100 сл.
фосфорнокислотный 125
Турбулентное перемешивание 33,154
Углеводороды
ароматического ряда 133
жирного ряда 132
Углерод четыреххлорнстый 141
Уголь 144
Удельная поверхность 8
Ультрамикроскоп 57
199
Устойчивость атмосферы по верти-
кали 152
Фаза дисперсная 7
Фазовое равновесие 23
Фенантрен 135
Фильтрация 51
Флегматизаторы 145
Форма частиц 11
. исследование 58
Фосфор
аллотропические видоизменения
113
белый
— получение 120
— свойства 114
— технический 121
— хранение 121
горение 123
дымообразующая способность' 126
кислородные соединения 118
красный
— получение 121
— свойства 117
маскирующая способность 126
пятисернистый 123
растворы 115
сесквисульфид 122
сульфвды 122
температура воспламенения 117
трехсернистый 123
химические свойства 117
фосфористый ангидрид 119
фосфорнокислотный туман 125
Фосфорный ангидрид 119
Химический состав дымов, исследо-
вание 56
Хлориды металлов
получение дымов 138
свойства 142
Хлористый
аммоний 136
пнросульфурил 89
сульфурил 86 сл.
— дымообразующие и маскирую-
щие свойства 106
— получение 88
— свойства 87
— ™есь с серным ангидридом
цинк 142
Хлорноватокислый
калий 144
натрий 145
Хлорное олово 97 сл.
дымообразование 108
получение 99
физические свойства 97
химические свойства 98
Хлорсульфоновая кислота 81 сл.
дымообразование 103
маскирующие свойства 105
получение 84
смесь с серным ангидридом 90
физические свойства 82
химические свойства 83
Центры конденсации 16, 18
Цинк 139
хлористый 142
Цинковая пыль 139
Частицы
аэрозолей 10, 11
водяного тумана 30
дымовые, движение 27
и среда, равновесие 23
исследование формы 58
оседание 28, 30
Частичная концентрация 10
определение 56 сл.
Четыреххлорнстый
кремний 92 сл.
— дымообразование 106
титан 94 сл.
— взаимодействие! с неорганиче-
скими веществами 95
----------органическими вещества-
ми 96
— дымообразование 107
—। маскирующая способность 108
— получение 96
— физические свойства 94
углерод 141
Число частиц, определение 56
Шашки дымовые 150, 159 сл.
морские 166
принципы и схема снаряжения
143
снаряжение футляров 146
Электрическое осаждение 52
Эффективность
маскирующая 70
столкновения 30
Яркость 41
контраст 43
ОГЛАВЛЕНИЕ
Предисловие ................................................3-
Введение....................................................5
ЧАСТЬ ПЕРВАЯ
Дымообразование и свойства дымов
Глава I. Общие понятия о дымах................................7
1. Основные определения и классификация...................7
2. Особенности аэрозольного состояния.....................8-
3. Основные характеристики дымов..........................9
Глава II. Методы получения дымов и туманов....................12
1. Диспергирование........................................12
2. Конденсация........................................... 15
3. Комбинированные методы ................................22
Глава III. Физико-химические проецссы, происходящие в дымах и
туманах.................................................23
1. Испарение дымовых частиц..............................23-
2. Движение дымовых частиц................................27
3. Коагуляция.............................................30
'Глава IV. Маскирующие свойства дымов.........................33
1. Рассеяние н поглощение света...........................34
2. Маскирующее действие дымов н туманов 41
3. Маскирующие свойства границы дымового облака...........48
Глава V. Методы исследования дымов и туманов..................50
1. Определение весовой концентрации н химического состава . . 51
2. Определение числа, размеров н формы частиц...........56
3. Исследование маскирующих свойств.......................59
ЧАСТЬ ВТОРАЯ
Дымообразующие вещества
Глава VI. Общая характеристика дымообразующих веществ ... 63
1. Основные понятия о дымообразующих веществах............63
2. Классификация дымообразующих веществ...................64
3. Требования, предъявляемые к дымообразующим веществам . . 66
4. Дымообразующая способность.............................68
5. Маскирующая способность................................69
Глава VII. Вещества, дающие дым при реакции с влагой . . - 74
1. Серный ангидрид н олеум................................74
2. Хлор ангидриды серы....................................81
3. Хлориды полуметаллов...................................92
4. Дымообразующие и маскирующие свойства..................99
5. Аммиачные дымообразующие системы......................109
20»
Глава VIII. Фосфор, его растворы и соединения.................11
1. Свойства фосфора........................................11
2. Получение фосфора.......................................120
3. Сульфиды фосфора.......................................122
4. Дымообразующие и маскирующие свойства фосфора и его
сульфидов.................................................123
Глава IX. Горючие дымовые составы..............................127
1. Рецептуры горючих дымовых составов......................127
2. Вещества, дающие дым при возгонке.......................132
3. Металлохлоридные системы................................138
4. Снаряжение дымовых шашек................................143
5. Процесс дымообразовании при горении составов..........., 148
ЧАСТЬ ТРЕТЬЯ
Техника дымопуска
Глава
1.
X. Технические средства и условия дымопуска............
Общая характеристика технических средств н задач постановки
дымовых завес..........................................
2. Состояние атмосферы н поведение дымового облака ....
3. Влияние рельефа: местности на поведение дымового облака . .
4. Характеристика условий дымопуска.......................
Глава XI. Дымовые шашки и гранаты.............................
1. Устройство н снаряжение дымовых шашек..................
2. Устройство и снаряжение дымовых гранат.................
3. Применение ручных дымовых гранат н шашек ..'....
Глава XII. Дымовые приборы.............................
1. Простые дымовые приборы сухопутных войск...............
2. Дымовые автомашины н танки.............................
3. Дымовые авиационные приборы............................
4. Дымовые приборы морского флота.........................
Глава XIII. Дымовые снаряды, мины и бомбы.....................
1. Устройство и снаряжение дымовых снарядов н мин . . . .
2. Применение артиллерийских дымовых снарядов н мнн . . . .
3. Дымовые авиационные бомбы..............................
Литература.. . . ’............................................
Предметный указатель.........................................
150
150
152
155
157
159
159
168
171
175
175
180
183
187
188
188
191
193
195
197
К читателю
Прежде чем пользоваться книгой, исправьте следующие опечатки!
Стр. Строка Напечатано Должно выть
36 14 снизу Из этой формулы и из Из этой формулы
графика иа рис. 10 видно видно
55 14 снизу микро фотоэлеме вта микрофотометра
90 6 снизу 2OS8-HSO8C1 2SO8*HSO8C1
135 10 снизу Фегантерен Фенантрен
135 5 снизу Флуоратрен Флуорантен
135 4 снизу ПсевдофенДитен Псевдофенантрен -
136 10 снизу NaHO8 + NH4Cl ' NaHCO84-NH*Cl
176 подрисуночная
подпись Рис. 4 Рис. 43
179 16 сверху с хлорной известью с негашеной известью
Зак. М 3184. Вайнер Лучяаский.