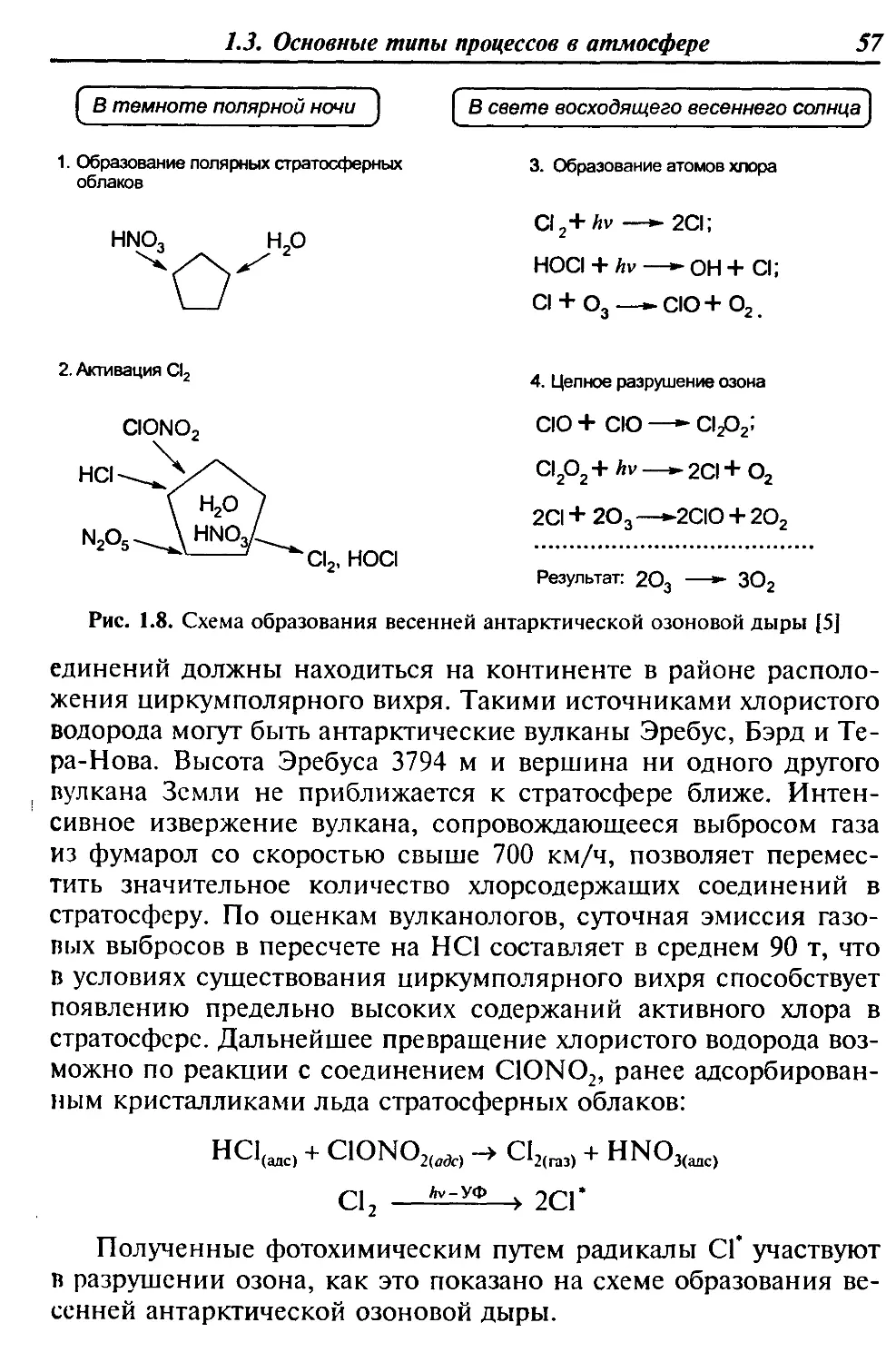
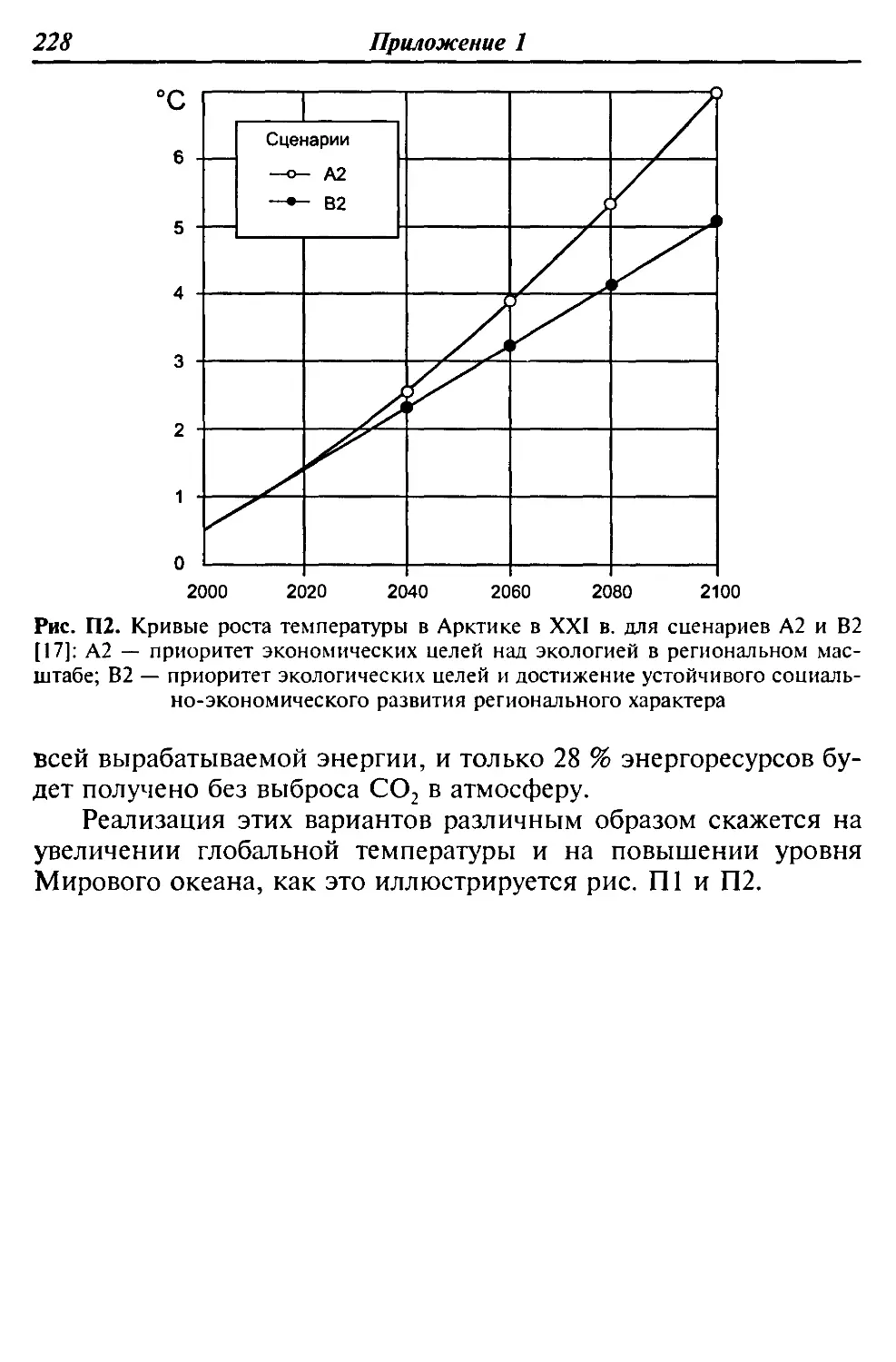
Автор: Девисилов В.А. Трифонов К.И.
Теги: угрозы окружающей среде рациональное природопользование охрана природы мониторинг окружающей среды рекреационное использование природы экология геохимия безопасность жизнедеятельности
ISBN: 5-91134-081-Х
Год: 2007
К.И. ТРИФОНОВ
В.А. ДЕВИСИЛОВ
ФИЗИКО-ХИМИЧЕСКИЕ
ПРОЦЕССЫ
В ТЕХНОСФЕРЕ
ЖОБРАЗОВАНИЕ
ФОРУМ
К. И. Трифонов, В. А. Девясилов
ФИЗИКО-ХИМИЧЕСКИЕ
ПРОЦЕССЫ В ТЕХНОСФЕРЕ
Допущено Министерством образования и науки Российской Федерации
в качестве учебника для студентов высших учебных заведений,
обучающихся по специальности «Безопасность жизнедеятельности
в техносфере» направления «Безопасность жизнедеятельности»
Москва
ФОРУМ - ИНФРА-М
2007
УДК 504.062(075)
ББК 20.18я723
Т69
Рецензенты:
кафедра «Физико-химическая технология защиты биосферы»
Уральского государственного лесотехнического университета
(зав. кафедрой профессор Липунов И. Н.)
д. т. н., профессор кафедры физики Уральского государственного
университета им. А. М. Горького В. М. Киселев',
к. х. н., доцент кафедры экологии Владимирского государственного
университета Л. А. Ширкин\
Невский А. В., д. т. н., профессор; Чеснокова Т. А., к. х. н.,
доцент — кафедра обшей химической технологии (секция экологии
и безопасности жизнедеятельности) Ивановского государственного
химико-технологического университета
Трифонов К. И., Девисилов В. А.
Т69 Физико-химические процессы в техносфере: Учебник. — М.:
ФОРУМ: ИНФРА-М, 2007. — 240 с.: ил. — (Высшее образование).
ISBN 5-91134-081-Х (ФОРУМ)
ISBN 5-16-002822-6 (ИНФРА-М)
В учебнике изложены основные сведения о физико-химических про-
цессах в техносфере. Даны представления о процессах трансформации
техногенных и антропогенных загрязнений в атмосфере, гидросфере и
педосфере. Рассмотрены физико-химические механизмы парникового
эффекта, разрушения озонового слоя, формирования фотохимического
смога, образования кислотных дождей, загрязнения техносферы тяжелы-
ми металлами. Изложены основные сведения о радиационно-химических
процессах в техносфере и взаимодействии ионизирующего излучения с ее
компонентами.
Предназначен для студентов высших учебных заведений, обучающихся
по направлению 280100 «Безопасность жизнедеятельности» (специаль-
ность 280101.65 — «Безопасность жизнедеятельности в техносфере»). Мо-
жет быть использован студентами, обучающимися по направлению
280200 — «Защита окружающей среды», а также специалистами, работаю-
щими в области защиты окружающей среды, экологического мониторинга
и экологической экспертизы.
УДК 504.062(075)
ББК 20.18я723
ISBN 5-91134-081-Х (ФОРУМ)
ISBN 5-16-002822-6 (ИНФРА-М)
© К. И. Трифонов, 2006
© В. А. Девисилов, 2006
© ФОРУМ, 2006
Введение
Последние десятилетия убедили нас в том, что вторжение че-
ловека в природу — прямое или косвенное — наносит ей не
только непосредственный ущерб, но и вызывает ряд новых про-
цессов, влияющих тем либо иным образом на всю окружающую
среду. Это относится к большому количеству химических реак-
ций, протекающих в атмосфере, гидросфере и литосфере и вы-
званных продуктами антропогенной деятельности. Некоторые из
этих процессов характеризуются образованием токсичных про-
дуктов, но в ряде случаев, напротив, происходит распад или
обезвреживание загрязняющих природу веществ. Известно, что
на ход химических превращений, приводящих к образованию
вредных для окружающей среды веществ, оказывают влияние
климатические условия, состояние почвы, уровень развития
производства, рельеф местности, уровень и длительность сол-
нечной активности и т. п. Это еще раз убеждает в том, что такая
сложная проблема, как физическая химия процессов взаимодей-
ствия продуктов антропогенной деятельности и естественных
источников с окружающей средой, не может рассматриваться
односторонне и при ее изучении необходим многоплановый
подход. Он поможет ответить на вопрос — может ли вмешатель-
ство человека в дела природы создать такие условия, что не сра-
ботает механизм естественного саморегулирования и обновления
и в какой степени наблюдаемые изменения внешней среды вы-
званы антропогенной деятельностью.
Дать ответ на поставленный вопрос можно посредством со-
поставления результатов изменения окружающей среды, вы-
званных, с одной стороны, антропогенной деятельностью, а с
другой — естественными причинами. Наиболее наглядно это
прослеживается при использовании количественной оценки,
учете фактора времени и токсичности продуктов, образующихся
при различных видах деятельности человека.
4
Введение
Количественная оценка вмешательства человека в природу
указывает, что оно ничтожно мало по сравнению с влиянием ес-
тественных причин на масштабы изменений в атмосфере, гидро-
сфере и литосфере (за редким исключением — появление в био-
сфере веществ, имеющих исключительно антропогенное проис-
хождение). Здесь следует отметить, что концентрации газов в
атмосфере, имеющих антропогенное происхождение, лежат в об-
ласти следовых значений, что соответствует миллионным-мил-
лиардным долям (106—10’9). Подобная ситуация наблюдается и
в гидро-, и в литосфере. Отклонения от этой картины, дости-
гающие величин порядка долей процента, могут наблюдаться
лишь в виде аномалий на отдельных участках земного и водного
пространства.
При учете изменений в природной среде, вызванных как че-
ловеческим вмешательством, так и естественными причинами,
наиболее показательными и представительными являются ре-
зультаты оценки скорости протекания наблюдаемых изменений в
зависимости от источника этих возмущений. Изменения природ-
ной среды, вызванные естественными причинами, характеризу-
ются чрезвычайно низкой скоростью и в сравнении с длительно-
стью жизни человека внешне практически незаметны. Так, повы-
шение концентрации кислорода в земной атмосфере с 1 до 21 %
длилось приблизительно 1 — 1,5 миллиарда лет, что соответствует
приросту концентрации 0,004 % за 200 000—300 000 лет. Скорость
изменений в составе атмосферы, вызванных человеческой дея-
тельностью, характеризуется заметно более высокими значения-
ми, что особенно заметно для последних столетий прошедшего
тысячелетия. Так, в результате антропогенной деятельности со-
держание диоксида углерода в атмосферном воздухе увеличилось
на те же 0,004 % всего лишь за несколько последних десятилетий.
Здесь же уместно отметить, что скорость естественных изменений
позволяет всему живому на Земле генетически приспособиться к
изменениям в окружающей природной среде, в то время как ан-
тропогенные возмущения в природе практически исключают та-
кую возможность, особенно для высших организмов.
Любой вид человеческой деятельности сопровождается обра-
зованием различного вида продуктов и сопутствующих им отхо-
дов, зачастую опасных для человека и всего живого. Появление и
накопление различных токсичных загрязнений в окружающей
среде может определяться как природными элементами и соеди-
Введение
5
нениями, так и образованием новых веществ, опасных для био-
сферы. В качестве примера можно привести угрожающее загряз-
нение биосферы соединениями тяжелых металлов, а также появ-
ление в природной среде веществ исключительно антропогенного
происхождения — пестицидов, диоксинов и других галогенсодер-
жащих органических веществ.
Дисциплина «Физико-химические процессы в техносфере»
предназначена для формирования у специалистов, занимающих-
ся обеспечением безопасности жизнедеятельности человека, со-
ответствующих профессиональных компетенций.
Эти компетенции позволяют специалистам ориентироваться
в довольно сложных физико-химических процессх миграции и
трансформации естественных и антропогенных поллютантов в
различных компонентах биосферы и техносферы.
Дисциплину следует рассматривать как базовую в формиро-
вании профессионально-ориентированных компетенций специа-
листа.
Дисциплина ориентирована прежде всего на направление
подготовки дипломированных специалистов 280100 «Безопас-
ность жизнедеятельности». Содержание изложенного в учебнике
материала позволяет также использовать его для подготовки ба-
калавров, специалистов и магистров в области защиты окружаю-
щей среды.
Авторы будут благодарны за любые замечания по содержа-
нию учебника, которые будут учтены в дальнейшем. Мнения и
замечания следует направлять в издательство на имя авторов.
Глава первая
ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ
В АТМОСФЕРЕ
1.1. Основные компоненты глобального экологического
кризиса
Атмосфера имеет ряд присущих только ей особенностей по
сравнению с другими компонентами биосферы — высокую под-
вижность, изменчивость составляющих ее компонентов, своеоб-
разие физико-химических процессов. Состояние атмосферы оп-
ределяет тепловой режим поверхности Земли. Атмосфера (слой
озона) защищает нашу планету от воздействия ультрафиолетово-
го излучения Солнца.
Состав атмосферы находится в состоянии динамического
равновесия, поддерживаемого в результате деятельности живых
организмов, геохимических явлений и хозяйственной деятельно-
сти человека. Главными компонентами атмосферы являются
азот (78 %), кислород (21 %) и аргон (0,9 %) — в приземном
слое. Доля остальных компонентов несмотря на их очень важное
значение не превышает 0,1 %.
Тропосферу и стратосферу обычно объединяют в нижние
слои атмосферы, которые существенно отличаются по составу от
верхних слоев (ионосферы). В нижних слоях сосредоточена ос-
новная масса атмосферы (50 % общей массы атмосферы прихо-
дится на нижний слой толщиной около 5 км, а масса слоя высо-
той 30 км составляет 99 % всей массы атмосферы).
Тропосфера — неравновесная химически активная система.
Большинство газообразных примесей, выделяемых с поверхно-
сти Земли в тропосферу в результате геологических, биологиче-
ских процессов и антропогенной деятельности, находится в вое-
1.1. Основные компоненты глобального экологического кризиса 7
становленной форме или в виде оксидов с низкой степенью
окисления: H2S, NO, NH3, СО, NO2, СН4, SO2 и др. Анализ атмо-
сферных осадков показывает, что возвращаемые на поверхность
Земли примеси представлены в основном соединениями в высо-
кой, чаще всего в высшей, степени окисления — H2SO4, HNO3,
нитраты, сульфаты, СО2, SO3 и т. д. Таким образом, тропосфера
играет на планете роль глобального окислительного резервуара.
Возросшая интенсивность хозяйственной деятельности чело-
вечества в XX в. проявилась в глобальном загрязнении Земли
разнообразными отходами промышленного производства, сель-
ского хозяйства, продуктами жизнедеятельности человека, что
является грозным предвестником грядущего экологического кри-
зиса планетарного масштаба. Его проявления наблюдаются в на-
стоящее время в отдельных регионах планеты в изменении ха-
рактеристик природной среды, и при неразумном осуществлении
всей совокупной деятельности человеческого сообщества может
привести к негативным последствиям глобального масштаба. На-
блюдаемые признаки подступающего глобального экологическо-
го кризиса в наибольшей мере реализуются в проявлении таких
аномальных явлений, как кислотные дожди, парниковый эф-
фект, так называемые озоновые дыры и загрязнение поверхности
планеты супертоксичными продуктами, появляющимися исклю-
чительно в результате антропогенной деятельности.
Под кислотными дождями понимаются атмосферные осадки,
значение водородного показателя которых ниже величин, отве-
чающих содержанию углекислоты в атмосфере, т. е. pH < 5,5. По-
явление аномалий данного типа связывается, в первую очередь, с
выносом в атмосферу значительных количеств оксидов серы и
азота, различных галогенсодержащих соединений в результате ан-
тропогенной деятельности. Взаимодействие кислотных дождей с
биосферой, сооружениями, техникой, культурными ценностями
характеризуются для них губительными последствиями.
Парниковый эффект проявляется в повышении температуры
нижних слоев атмосферы в результате нарастающего поглоще-
ния «парниковыми газами» (СО2, СН4, N2O и др.) инфракрасно-
го теплового излучения Земли. Последствия парникового эф-
фекта могут привести к изменению климата, что сопровождается
повышением частоты катастрофических природных явлений.
Значительную экологическую опасность представляет загрязне-
ние биосферы веществами, имеющими преимущественно антропоген-
8
Глава первая. Физико-химические процессы в атмосфере
ное происхождение и характеризующимися весьма высокой степенью
токсичности. К ним относятся галогенсодержащие органические
вещества — диоксины, бифенилы, полициклические ароматиче-
ские углеводороды, пестициды и т. д., ряд тяжелых металлов
(ртуть, кадмий, свинец), долгоживущие радионуклиды и т. д.
Под «озоновыми дырами» понимается сезонное уменьшение
толщины озонового слоя над Антарктидой и другими областями
земной поверхности. Озоновый слой является своеобразным
фильтром, отсекающим опасное для живых существ ультрафио-
летовое излучение Солнца с длиной волны менее 285—315 нм.
Вследствие этого существенное понижение концентрации озона
(уменьшение толщины слоя) представляет серьезную экологиче-
скую опасность, которая может быть спровоцирована и челове-
ческой деятельностью.
Для выяснения причин появления данных проблем необхо-
димо глубокое понимание комплекса физических, физико-хими-
ческих и химических процессов, протекающих в тропосфере и
стратосфере, следует также учитывать солнечно-земные связи,
процессы дегазации Земли, потоки техногенных и эндогенных
газов, попадающих в атмосферу, и многие другие факторы.
Говоря о процессах, протекающих при взаимодействии раз-
личных компонентов атмосферы как антропогенного, так и есте-
ственного происхождения, необходимо выделить те ее состав-
ляющие, которые отличны от ее естественной газовой основы,
т. е. те вещества, которые объединяются понятием загрязнения.
К вредным выбросам, загрязняющим атмосферу и являющимся
источником различных процессов, протекающих в ее объеме, и
оказывающим влияние на климат, тепловой режим и экологиче-
скую обстановку как в региональном, так и планетарном мас-
штабах, относятся атмосферная пыль, газы и пары.
1.2. Характеристики загрязнения атмосферы
1.2.1. Пыль и аэрозоли
Атмосфера вблизи поверхности Земли (как тропосфера, так
и стратосфера) содержит частицы во взвешенном состоянии.
Любая двухфазная система, в которой одна фаза дисперсионно
1.2. Характеристики загрязнения атмосферы 9
распределена в другой, называется коллоидом. Если дисперси-
онной средой служит газ или смесь газов, а дисперсной фазой
являются взвешенные жидкие либо твердые частицы, то такая
коллоидная система называется аэрозолем.
Размеры аэрозольных частиц колеблются в широких преде-
лах: от менее 10’2 до 103 мкм, т. е. от размеров ионов до капель
воды (рис. 1.1). Классификация аэрозолей по размерам весьма
условна, вследствие чего многие исследователи производят ее по
собственным, иногда субьективным соображениям. В настоящее
Размер
частиц, мкм
0,01
0,1
100
1000
ЛИТЕЙНЫЙ ПЕСОК
МОРОСЬ
каменноугольная пыль •>>
| | (кукурузный КРАХМА1
пыль флотационных выб’росо'в
min । 11 iiiii J-----------------
дождя
летучая зола при сжигании угля (
I В ТОПКАХ С ЦЕПНОЙ РЕШЕТКОЙ
ПЫЛЬЦА РАСТЕНИЙ
СПОРЫ
пыль от
|АГРЛ|Н^К, ЦЕМЕНТН|
I и 11 г । । Г । । । и
ЛЕТУЧАЯ ЗОЛА ПРИ СЖИГАНИИ
|||||| Пылевидного угля
пыль в угольных шахтах к"
ЛЕТУЧАЯ ЗОЛ!
I I
ПРИРОДНЫЙ ТУМАН
Виды
аэрозолей
агрегированная цинковая пыль
I I III11! 1 I 1
III МОЛОЧНЫЙ ПОРОШОК
ВОЗГОНЫ ОКСИДА ЦИНКАМф>|
и । । । пт
Пыль КРАСИТЕЛЕЙ
ЩЕЛОЧНЫЕ тумань
КОЛОШНИКОВАЯ пыль
ЪАКТЕРИИ
КОНДЕНСАЦИОННЫЙ ТУМАН H.SO,
СИЛИКОЗООПАСНЫЕ ПЫЛИ
МЕТАЛЛУРГИЧЕСКИ!
[ПЫЛИ и возгоны I
обычная сажа
4ВОЗГОНЫ железа, туман контактной h,so.
, АЭРОЗОЛИ. I I I I 111! I I I I I 11
ОБРАЗУЮЩИЕСЯ 8 ХИМИЧЕСКИХ ПРОЦЕССАХ
СМОЛЯНОЙ ТУМАН
ДЫМЫ
ВОЗГОНЫ
МАСЛЯНЫЙ ТУМАН
САЖА ИЗ МАСЕЛ. СУБЛИМАЦИОННЫЕ ВОЗГОНЫ*
— ^ВОЗГОНЫ ОТ МАРТЕНОВСКИХ ПЕЧЕЙ
— дым'оксида' магния | 11|| | I
возгоны оксидов' цинка и свингу |
Г'Т П 111 ОБЫЧНАЯ атмосферная ПЫЛЬ
ВИРУСЫ
ТАБАЧНЫЙ дым
Рис. 1.1. Самые распространенные природные и промышленные аэрозоли (мкм)
10
Глава первая. Физико-химические процессы в атмосфере
время наибольшее распространение имеет классификация, пред-
ложенная X. Юнге, в соответствии с которой выделяются три
интервала размеров дисперсных частиц. Естественные аэрозоли
весьма далеки от сферической формы и за исключением жидких
капель представляют собой обломки твердых частиц кристаллов
различной формы. Исходя из удобства их представления в шкале
классификации по размерам дисперсные частицы обычно рас-
сматриваются как сферы, в которые они могут вписаться.
Частицы с радиусами менее 10 * мкм называются ядрами
Айткена, они наиболее многочисленны. Частицы с радиусами
от 10_| до 1 мкм называются большими, а превышающие 1 мкм —
гигантскими.
К верхней границе этой классификации аэрозольных частиц
по размерам примыкают дисперсные системы, называемые пы-
лями.
В глобальном масштабе мы можем выделить три основных
типа распределения частиц в тропосфере: фоновое, океаниче-
ское и континентальное.
Наиболее важное — фоновое распределение — оно практиче-
ски одинаково как в средней, так и в верхней тропосфере. Со-
держание частиц, составляющее фоновый уровень, соответствует
чистейшему воздуху, не подверженному влиянию локальных ис-
точников аэрозолей, и определяется общим числом частиц N
в 1 см3, причем величина 700 частиц в 1 см3 является верхним
пределом концентрации.
Области нижней тропосферы над океанами (высота до 2 км)
содержат частицы океанического распределения. Атмосферные аэ-
розоли над водными поверхностями образуются как результат
испарения разбрызгиваемых капель морской воды, вследствие
чего происходит вынос в атмосферу солевых частиц, представ-
ленных в основном хлоридом натрия. Над океанами их концен-
трация может колебаться от 1 до 100 частиц в 1 см3. Солевые
частицы обладают повышенной гигроскопичностью, и при вы-
сокой относительной влажности воздуха они поглощают водя-
ные пары, превращаясь в капли насыщенного солевого раствора.
Наряду с хлоридом натрия в морских аэрозольных частицах при-
сутствуют карбонаты, сульфаты, хлориды калия, магния, а также
ряд органических соединений.
В нижней тропосфере над континентами имеет место конти-
нентальное распределение частиц. Окружающий нас мир запол-
1.2. Характеристики загрязнения атмосферы
11
нен мелкими частицами вещества — песчинками, пылинками,
каплями разной формы, величины, различного происхождения.
Все они благодаря ничтожной своей массе легко подхватываются
порывами ветра и переходят во взвешенное состояние. Так обра-
зуются атмосферная пыль и аэрозоли.
Основной параметр, характеризующий взвешенные части-
цы, — их размер. Он колеблется в очень широких пределах:
от 0,001 мкм до 1000 мк. Под атмосферной пылью понимают
взвешенные в воздухе твердые частицы с диаметром более
1 мкм. Эти частицы трудно классифицировать химически, так
как они могут представлять собой как частицы кварца, так и ор-
ганические материалы самого различного происхождения, в том
числе и цветочную пыльцу растений. Состав атмосферной пыли
в глобальном масштабе имеет минеральное происхождение, но в
отдельных районах состав может меняться с изменением источ-
ников образования атмосферной пыли: здесь могут преобладать
соединения щелочных и щелочноземельных металлов, тяжелые
металлы, углеводороды и, наконец, споры растений.
Выброс взвешенных частиц в атмосферу начался одновре-
менно с возникновением нашей планеты. Источниками атмо-
сферных аэрозолей служили и служат вулканы и гейзеры, разру-
шающиеся горные породы и пылевые бури, поверхность океана
и почвенная эрозия, лесные пожары. Природные выбросы аэро-
золей всегда влияли на среду человеческого обитания. Однако,
уравновешиваясь общим круговоротом веществ в природе, они
не вызывали глубоких экологических изменений. Значительно
большее влияние на окружающую среду оказывают промышлен-
ные выбросы. Еще в 1306 г. английский король Эдуард I издал
эдикт, запрещающий использование каменного угля для отопле-
ния жилищ в Лондоне. Этот первый из известных в истории за-
конов об охране природы карал нарушителей смертной казнью.
Однако уменьшить содержание пыли в воздухе и остановить
прогресс техники ни король, ни другие законодатели не могли.
В семнадцатом столетии появилась первая публикация, подняв-
шая вопрос о защите воздушной среды от вредных выбросов.
В 1661 г. Дж. Эвелин представил королю Карлу II доклад под на-
званием «Заражение дымом, или Распространение дыма в возду-
хе над Лондоном», в котором указывалось на вредное действие
дыма и рекомендовалось вынести за черту города все промыш-
ленные предприятия, работающие на угле. Ежесуточная потреб-
12 Глава первая. Физико-химические процессы в атмосфере
ность человека в воздухе составляет 23 м3, причем любое загряз-
нение воздуха неблагоприятно влияет на наше здоровье и само-
чувствие. По данным американских исследователей, до 10 %
всех болезней и смертельных исходов в городах обусловлено за-
грязненностью атмосферы. Загрязнение воздуха наносит ущерб
не только здоровью человека. Вред, причиняемый сельскохозяй-
ственным культурам, лесам, зданиям, памятникам культуры,
только в США оценивается ежегодно в несколько миллиардов
долларов.
Постоянно в атмосфере взвешено около 20 млн т частиц, из
которых примерно три четверти приходится на долю промыш-
ленных предприятий. Время пребывания частиц в атмосфере и,
следовательно, их распространение по земной поверхности зави-
сит как от их величины и плотности, так и от скорости распро-
странения ветров, а также от того, на какую высоту частицы
были подняты первоначально. Крупные частицы обычно оседа-
ют в течение нескольких часов или суток, тем не менее, они мо-
гут переноситься на значительные расстояния, если вначале ока-
зались на достаточной высоте. Песок из Сахары перелетает Сре-
диземное море и толстым слоем покрывает крыши в городах и
селениях Сицилии; на Азорских островах он вызывает пылевые
«туманы» и «дожди», которые иногда длятся неделю и становят-
ся бедствием для людей. А в конце 1985 г. над Ашхабадом не-
сколько часов свирепствовал песчаный ураган — ветер принес
десятки тысяч тонн песка из Аравийских пустынь.
В Атлантике, начиная от побережья Западной Африки и
почти до центра океана, существует значительная по масштабам
постоянного выноса сахарской пыли область, которая именуется
у мореплавателей «морем мрака».
Лесные пожары регионального масштаба могут быть источ-
никами атмосферных аэрозолей глобального масштаба, что на-
блюдалось при пожарах лесных массивов на западе Канады в
1950 году, когда дым от них достигал Ирландии и Великобри-
тании.
Источником атмосферных аэрозолей может служить и метео-
ритная пыль, которая в виде субмикронных частиц из межпла-
нетного пространства может достигать земной поверхности в не-
изменном виде. Более крупные метеориты частично сгорают или
расплавляются, а затем в виде затвердевших капель или скон-
денсировавшихся Паров могут достигать тропосферы.
1.2. Характеристики загрязнения атмосферы
13
Частицы растительного или животного происхождения отно-
сятся по классификации Юнге к гигантским, так как обычно их
эквивалентный диаметр превышает 10”6 м. Воздушными потока-
ми они переносятся на большие расстояния. Споры грибов на-
ходили над океаном на расстоянии свыше 1000 км от побережья,
а пыльцу растений — на расстоянии более 2000 км от ближайше-
го источника.
Те частицы, которые по своему поведению сходны с части-
цами газов (т. е. диаметром <1 мкм), в значительно меньшей сте-
пени подвержены действию атмосферных осадков, и время их
пребывания в нижних слоях атмосферы составляет 10—20 суток.
Этого обычно бывает достаточно для распространения частиц по
всему полушарию.
Если пыль и аэрозоли достигают верхних слоев тропосферы,
то они могут проникнуть и в стратосферу с помощью воздушных
потоков между тропосферой и стратосферой. Продолжительность
существования пыли и аэрозолей в стратосфере составляет уже
1—3 года. Это значительно увеличивает толщину облачного по-
крова Земли. Последствия этого трудно предсказать. Ряд ученых
считает, что из-за ощутимого уменьшения солнечной радиации
произойдет снижение температуры воздуха, другие, напротив,
предсказывают усиление «парникового» эффекта. Аэрозольные
частицы появляются в стратосфере при повышенной вулканиче-
ской деятельности, запусках ракет-носителей искусственных
спутников Земли, полетах боевых самолетов, заносе ядер конден-
сации при формировании и развитии кучево-дождевых облаков,
вершины которых пробивают тропосферу.
Результаты прямых исследований стратосферного аэрозоля
указывают на содержание в нем разбавленной серной кислоты,
сульфатов аммония, натрия и других соединений. На высоте око-
ло 20 км, по данным аэростатного зондирования, был зафикси-
рован слой, содержащий аэрозольные частицы сульфатной при-
роды — так называемый слой Юнге. Кроме того, в стратосфере
отмечено присутствие аэрозольных частиц метеоритного проис-
хождения, содержание которых не превышает 10 % общей массы
стратосферных аэрозолей.
В качестве печального примера влияния взвешенных частиц
на климат можно привести взрыв в 1963 г. вулкана Агунг, в ре-
зультате которого была уничтожена часть индонезийского остро-
ва Бали. Мощное извержение насытило частицами пепла ниж-
14
Глава первая. Физико-химические процессы в атмосфере
ние слои атмосферы, из-за чего Солнце на закате стало необыч-
но темным. Непосредственно после извержения температура в
стратосфере над экватором поднялась на 6—7 °C, а в течение не-
скольких последующих суток превышало норму на 2—3 °C.
Пылевые и аэрозольные загрязнения атмосферы существен-
но влияют на тепловой режим атмосферы. Они ослабляют сол-
нечное излучение в результате рассеяния, отражения и поглоще-
ния лучей. У частиц с диаметром более 1 мкм поглощение ин-
фракрасных лучей значительно возрастает, в результате чего
воздушные слои, содержащие подобные частицы, нагреваются, а
нижние слои соответственно остаются более холодными. Части-
цы меньшего размера способствуют рассеянию света, но при
диаметре частиц менее 0,4 мкм (т. е. менее длины волны види-
мого света) они не оказывают заметного влияния на рассеяние
света, хотя в соответствии со своей химической структурой мо-
гут поглощать ультрафиолетовые лучи.
Частицы темного цвета, например, частицы сажи, естествен-
но, сильнее всего поглощают видимый свет и инфракрасные
лучи, что приводит к самому интенсивному охлаждению земной
поверхности.
При мощных извержениях вулканов в атмосферу выбрасыва-
ются сотни миллионов тонн пепла. Тучи пепла скрывают Землю
от Солнца на площади в тысячи квадратных километров. Потом
пыль рассеивается в атмосфере и меняет ^е прозрачность. Из-
вестно, например, что после извержения вулкана Кракатау в
1883 г. пепел выпал на площади свыше 800 тыс. кв. км, а частицы
пыли были перенесены на расстояние до 11 тыс. км и обнаружи-
вались в Европе, где оседали с дождем и смогом. В историческое
время извержения вулканов к новому оледенению не приводили,
но на погоде в течение 1—3 лет сказывались весьма серьезно.
«Годом без солнца» назвали люди 1816 г., когда из-за морозов и
снегопадов в середине лета погиб урожай в Европе и Северной
Америке. А перед этим в 1815 г. в Индонезии действовал вулкан
Тамборк. После взрыва его высота понизилась на 140 м, а насту-
пившая тьма два дня держалась в радиусе 600 км.
Проявление сценария «ядерной зимы», схожего и превосхо-
дящего по размерам своих катастрофических последствий вулка-
нические извержения, возможно в случае использования ядер-
ного оружия в период войны. При взрывах над землей будут
преимущественно образовываться очень мелкие частицы, кото-
1.2. Характеристики загрязнения атмосферы
15
рые в виде радиоактивных аэрозолей заполнят хемисферу и в те-
чение нескольких месяцев и даже лет будут оседать на земную
поверхность. В каждом подобном случае все полушарие может
быть окутано облаками сажи, в результате чего будет наблюдать-
ся понижение температуры поверхности Земли, и это вызовет
глубокие климатические изменения.
Атмосферная пыль и аэрозоли, накапливающиеся над горо-
дами и промышленными зонами, имеют лишь региональное
значение. Они образуют сгущения над первоначальными источ-
никами, но при сильном движении воздушных масс эти загряз-
нения могут разноситься в подветренную сторону. Максималь-
ное расстояние, на которое могут быть перенесены пыль и аэро-
золи, определяется и метеорологическими условиями, и высотой
выброса, и размером частиц. Так, высота вулкана Кракатау, этой
природной дымовой трубы, свыше 800 м, а высота действующего
в Антарктиде вулкана Эребус — 3794 м, и его вершина ближе
всего к стратосфере.
Самые высокие промышленные трубы ниже. На никелевом
заводе в канадском городе Садбери имеется дымовая труба высо-
той 380 м. Через эту трубу в атмосферу поступает около 1 % всей
серы, пвиадающей в газовую оболочку нашей планеты из всех су-
ществующих источников, природных и рукотворных. В ясные
дни даже в 120 км от Садбери бывают видны в небе отдельные
облака желтого ядовитого дыма, содержащего диоксид серы.
Однако главную опасность атмосферная пыль и аэрозоли
представляют как мощные абсорбенты и адсорбенты токсичных
газов, паров и возгонов различных соединений, образующихся и
выделяемых в атмосферу в результате работы предприятий, авто-
транспорта, теплоэнергетики, мусоросжигательных заводов, ком-
мунального комплекса и т. п. Вследствие малого размера частиц
пыли и аэрозолей последние обладают чрезвычайно развитой по-
верхностью. Так, удельная поверхность частиц аморфной сажи
достигает нескольких тысяч квадратных метров на один грамм.
Способность к адсорбции и абсорбции загрязняющих веществ на
поверхности твердых частиц и капель жидкостей определяется
также химической природой последних. Так, на частицах твер-
дых неполярных веществ (сажа, уголь) легко адсорбируются
большие неполярные органические молекулы (диоксины, поли-
циклические ароматические углеводороды, фреоны и т. п.), на
полярных адсорбентах (оксиды металлов, кремнийсодержащая
16
Глава первая. Физико-химические процессы в атмосфере
пыль, глинозем, бокситы) хорошо осаждаются такие полярные
молекулы, как диоксид серы, сероводород, пары неорганических
кислот. Они также являются катализаторами ряда химических
процессов окисления, нейтрализации, присоединения, синтеза, в
результате протекания которых появляются чрезвычайно токсич-
ные вещества, проявляющиеся в виде смога, кислотных дождей,
ядовитых туманов.
1.2.1.1. Механизм образования аэрозолей. Пути удаления аэрозолей
из атмосферы
Важнейшей характеристикой аэрозолей является их распре-
деление по размерам. Как правило, функция распределения
имеет следующий вид:
-^— = Кг~п,
d(\%r)
где N — число частиц размера г; К, п — константы; г — размер
частиц, мкм.
По происхождению аэрозоли делят на две группы.
Диспергационные аэрозоли образуются при измельчении твер-
дых или жидких материалов.
Конденсационные аэрозоли — аэрозоли, образующиеся при
конденсации пересыщенных паров или при взаимодействии га-
зов с образованием нелетучих продуктов.
Диспергационные аэрозоли с твердыми частицами называют
пылями. Конденсационные аэрозоли с твердой или смешанной
дисперсной фазой — дымами. Диспергационные и конденсаци-
онные аэрозоли с жидкой фазой называют туманами.
Можно считать, что многие аэрозольные частицы образуют-
ся из газов, например SO2 или углеводородов. Эти газы остаются
в таком состоянии в воздухе очень продолжительное время и за-
тем трансформируются в другие продукты (в аэрозоли) в резуль-
тате реакций фотолиза, синтеза солей, абсорбции водяными па-
рами, гомогенной либо гетерогенной конденсации.
Рассмотрим случай гомогенной конденсации, когда чистые
пары смешиваются или не смешиваются с посторонним газом,
не реагирующим с ними и не участвующим в процессе конден-
сации, и когда полностью отсутствуют посторонние взвешенные
1.2. Характеристики загрязнения атмосферы
17
частицы в среде. Предположим, что молекулы пара объединя-
ются с образованием сферических зародышей радиуса R, объ-
емом V = | tiR3 и поверхностью А = 4лR2.
Первая стадия гомогенной конденсации будет заключаться в
изменении энтальпии AH(R), что соответствует образованию за-
родыша:
ДЯ(7?) = иж(Яж - Яг) И+ ож_г - А,
где иж — число молекул в единице объема жидкости; Яж и НГ —
энтальпии жидкой и паровой фаз; ож_г — удельная энергия по-
верхности раздела между жидкостью и паром (на единицу по-
верхности), т. е. поверхностное натяжение жидкости.
Если НТ> Нх (т. е. пары пересыщены), функция AH(R) про-
ходит через максимум при значении R*, называемом критиче-
ским радиусом. При этом капли радиусом R* находятся в состоя-
нии неустойчивого равновесия с паром. Критический радиус
можно выразить в виде уравнения:
R* _ ж-г
[пжЛТ 1п|-Д |]
L Ж I Р I
\ X /
где к — постоянная Больцмана; Р — давление пара над каплей
радиуса А*; Р., — давление насыщенного пара над плоской по-
верхностью при этой же температуре.
Если радиус зародыша больше критического, то образуется
частица; зародыши с меньшим радиусом нестабильны.
При определении числа ядер конденсации, образующихся в
единицу времени в единице объема (X), размер которых превы-
шает критический, следует учитывать, что оно зависит от часто-
ты столкновений свободных молекул и зародышей критического
объема:
X =№ехр —’
где N — концентрация молекул пара; К — коэффициент, учиты-
вающий вероятность столкновения молекул пара и зародыша;
Т — абсолютная температура.
18
Глава первая. Физико-химические процессы в атмосфере
Расчеты показывают, что при атмосферном давлении и 10%-ной
относительной влажности концентрация более 3 • 109 молекул H2SO4
в 1 см3 достаточна для получения частоты конденсации 1/(см3 • с).
Так образуются частицы с радиусом около 10 • 10^* мкм. При такой
концентрации H2SO4 частота конденсации зависит от влажности и
растет с ее увеличением.
Существование аэрозольных частиц в атмосфере определяет-
ся их «временем жизни», под которым понимается отрезок вре-
мени, за который концентрация частиц уменьшится в е раз (т. е.
в 2,3 раза).
Выведение аэрозольных частиц из атмосферы осуществляет-
ся в процессах их осаждения, атмосферной конвекции разного
масштаба, внутри- и подоблачного вымывания, инерционного,
диффузионного и центробежного механизмов осаждения частиц
на препятствиях у земной поверхности, термической коагуляции
и соосаждения.
Наиболее мелкие частицы, характеризуемые как «ядра Айтке-
на», выводятся из атмосферы главным образом в процессах коагу-
ляции и диффузионного осаждения. Наиболее крупные выпадают
в процессе седиментации (осаждение в поле сил тяжести). Проме-
жуточные по размеру частицы могут выводиться из атмосферы
совокупностью различных механизмов осаждения (рис. 1.2).
Другим важным процессом стока аэрозольных частиц из тро-
посферы является разномасштабная конвекция. В этом случае
наблюдаются перенос аэрозольных частиц из нижних слоев ат-
мосферы в верхние в результате развития конвективных потоков
и вовлечение их в облака выше уровня конденсации. В облаках
осуществляется абсорбция их присутствующими водяными кап-
лями, т. е. происходит внутриоблачное вымывание. Кроме того,
выпадающие осадки поглощают присутствующие в атмосфере
пыли и аэрозоли.
Инерционное осаждение на препятствиях вблизи земной по-
верхности является не менее важным механизмом выведения аэ-
розольных частиц из атмосферы. Обладая разным количеством
движения и перемещаясь с воздушными массами, они могут
сталкиваться с поверхностью обтекаемого ими тела вблизи зем-
ной поверхности и в итоге осаждаются на них. Та же картина на-
блюдается при осаждении частиц по другим механизмам, приве-
денным на рис. 1.2.
1.2. Характеристики загрязнения атмосферы
19
Рис. 1.2. Механизмы осаждения взвешенных частиц: а — гравитационный — час-
тицы крупнее 40—50 мкм выпадают из газового потока благодаря силе тяже-
сти Рт; б — инерционный — частицы при обтекании тела газовым потоком за счет
инерции отклоняются от общего потока и осаждаются на фронтальной поверх-
ности обтекаемого тела; в — зацепление — частицы от 1 до 3 мкм при перемеще-
нии вместе с газовым потоком в относительной близости от обтекаемого тела
приходят в соприкосновение с ним и прилипают к нему; г — диффузионный —
частицы размером 0,1 мкм и менее перемещаются в газовом потоке благодаря
столкновениям с газовыми молекулами (броуновское движение), в результате
чего возможно попадание их на поверхность обтекаемого тела; д — центробеж-
ный — частицы выводятся из вращающегося газового потока под действием цен-
тробежной СИЛЫ Рц
Исследование времени жизни аэрозольных частиц различной
природы в тропосфере показало, что эта величина, по данным
измерений поведения продуктов деления при ядерных взрывах,
оценивается от 6 до 40 суток.
Для аэрозольных частиц, находящихся в стратосфере, время
их жизни увеличивается с высотой и оценивается значением
около месяца в тропопаузе, 1—2 года на высоте 20 км и от 4
до 20 лет на высоте 50 км.
На частицы, находящиеся в воздухе во взвешенном состоя-
нии, действует сила тяжести. Путем осаждения из атмосферы уда-
20
Глава первая. Физико-химические процессы в атмосфере
ляется около 20 % частиц главным образом в результате промыва-
ния атмосферы осадками и образования туманов в результате го-
могенной конденсации. Кроме того, при длительном пребывании
в воздухе в виде аэрозолей частицы коагулируют вследствие бро-
уновского движения (термическая коагуляция). В исследованиях
последних лет было продемонстрировано, что процессы коагуля-
ции могут происходить под влиянием солнечного света.
Основными путями удаления аэрозолей из атмосферы явля-
ются вымывание и осаждение. В простейшем случае процесс вы-
мывания описывается экспоненциальным законом:
С = Со ехр(-<?т),
где С и Со — концентрации аэрозолей в конце и начале вымыва-
ния; £ — коэффициент вымывания, характеризующий скорость
процесса, с-1; т — время, с.
Скорость осаждения (и) частиц в гравитационном поле Зем-
ли описывается уравнением Стокса:
v=^k£,
9р
где г — радиус частицы, м; р — плотность осаждаемого вещества,
кг/м3; ц — коэффициент динамической вязкости, Па • с; g — ус-
корение свободного падения, м/с2.
1.2.2. Газы
При рассмотрении загрязнения воздуха газами следует учи-
тывать факторы эмиссии (выброс) вредных газов, трансмиссии
(перенос) газовых компонентов загрязнений и имиссии (ввод)
вредных веществ в организмы и растения.
При выбросе газов необходимо учитывать высоту расположе-
ния выходного отверстия над земной поверхностью, скорость
выброса, общее количество газа, его температуру и скорость рас-
пространения. Особенно важно знать природу (молекулярную
массу, плотность, состав, химическую активность) и массу газо-
вых выбросов.
В то время как перенос пылей и аэрозолей, в первую оче-
редь, зависит от размеров и плотности частиц, распространение
газов в основном определяется их растворимостью в воде и спо-
1.2. Характеристики загрязнения атмосферы
21
собностью к химическому взаимодействию с компонентами ат-
мосферы.
Среди газов, имеющих тенденцию к глобальному распростра-
нению, можно назвать СО2, СН4, фреоны, в то время как SO2
и NO2, подобно пыли в тропосфере, сохраняются в атмосфере от
нескольких дней до нескольких недель.
Перенос газовых загрязнений связан с метеорологическими
условиями, особенностями земной поверхности, значениями тем-
пературы отдельных слоев воздуха.
1.2.2.1. Изменение температуры и химического состава атмосферы
с высотой
Устойчивость атмосферы определяется тем, что в ней отсут-
ствуют значительные вертикальные движения потоков и переме-
шивание. В этом случае загрязняющие вещества, выброшенные
в атмосферу вблизи земной поверхности, будут иметь тенденцию
задерживаться там. Перемешиванию воздушных слоев в нижней
части атмосферы способствует множество причин, однако среди
них следует выделить температурный градиент по высоте и меха-
ническую турбулентность, определяемую воздействием ветра с
подстилаемой поверхности.
Интенсивность теплового перемешивания слоев атмосферно-
го воздуха можно оценить путем сравнения значения температур-
ного градиента (°C), реально наблюдаемого, с адиабатическим
вертикальным градиентом температур. Понятие сухоадиабатиче-
ского вертикального градиента температур (ДР) складывается на
основе следующих рассуждений. Будем рассматривать атмосферу
в приближении сухого идеального газа.
Тогда соотношение между изменением давления (Р) и высо-
ты (А) для элементарного объема (К) в гравитационном поле
имеет следующий вид:
где р — плотность атмосферы; g — ускорение силы тяжести.
Это основное уравнение статики атмосферы.
Ограничим условия квазистатическими. Квазистатичным на-
зывается процесс, в ходе которого параметры (давление — Р„
плотность — р/5 температура — 7}) находящейся в покое термо-
22
Глава первая. Физико-химические процессы в атмосфере
динамической системы на каждом шагу мало отличаются от па-
раметров окружающей систему среды (Ре, ре, Те). Такое состоя-
ние возможно лишь в тех случаях, когда изменения в системе
происходят так медленно, что она успевает адаптироваться к ме-
няющимся внешним условиям. Это означает, что скорость пере-
хода системы из одного состояния в другое должна быть значи-
тельно меньше скорости выравнивания термодинамических
характеристик (например, давления и температуры). Хорошо из-
вестно, что давление в атмосфере выравнивается со скоростью
звука, а это дает возможность считать квазистатичными в отно-
шении давления естественные термодинамические процессы,
т. е. при р, * ре и Tt*Te Pi = Ре= Р.
Первый закон термодинамики для изолированной системы,
состоящей из идеального газа, состояние которого изменяется
квазистатически, определяет связь между изменением внутрен-
ней энергии системы ((/), совершаемой ею работы (А) и количе-
ством тепла (Q), подводимого к системе.
Внутренняя энергия является однозначной функцией состоя-
ния системы, и ее изменение Д(/ при переходе системы из со-
стояния 1 в состояние 2 не зависит от вида процесса и равно раз-
ности энергий в этих состояниях (Д(7 = U2 - Ux). Поскольку внут-
ренняя энергия является функцией состояния, имеет смысл
говорить о полном дифференциале внутренней энергии (dU).
Для работы можно говорить лишь о ее бесконечно малом эле-
менте, а не о полном дифференциале, так как работа зависит от
пути процесса и не является функцией состояния.
Обозначение порций тепла dQ и работы 6А подчеркивает от-
личие свойств этих величин от свойств внутренней энергии, так
как эти бесконечно малые количества не являются полными
дифференциалами. В отличие от внутренней энергии понятия
теплоты и работы относятся не к системе, а к процессу. Так как
работа в элементарном процессе определяется выражением
6A = PdV, первый закон термодинамики можно записать в сле-
дующем виде:
5(2= dU+ 5Л = dU+ PdV- (dH- PdV- VdP) + PdV=
= dH- VdP= C dT--dP, (1.2)
P
1.2. Характеристики загрязнения атмосферы
23
где Q — количество передаваемого тепла; U — внутренняя энер-
гия; А — работа, совершаемая системой; Н — энтальпия; Ср —
теплоемкость при постоянном давлении; р — плотность идеаль-
ного газа.
Для случая адиабатического осуществления процесса имеем
8(2=0.
Из последнего уравнения с учетом этого получаем:
1 dP
С dT =-dP = — . (1.3)
Р Р
Сопоставляя уравнения (1.1) и (1.2), получаем:
(dT_ >
< dh J
1
= ~8с/
(1.4)
Если пренебречь вследствие малой величины изменениями g
и Ср с высотой и подставить в уравнение (1.4) их численные зна-
чения [g= 9,806 м/с, Ср= 1005 Дж/(кг • К) при температурах
18 4- 25 °C], то можно записать:
[= -0,0098 К/м « -0,01 К/м.
Таким образом, сухоадиабатический вертикальный градиент
температуры (АГ) равен:
дГ=|—1 = -0,01 К/м.
I dh J
х 7 ад
Сравнение определенной таким образом величины АГ с ре-
альным температурным вертикальным градиентом в (°C), ис-
пользуемое для определения устойчивости атмосферы, приводит
к четырем наиболее важным категориям устойчивости атмосфе-
ры (рис. 1.3). В первом варианте реальный вертикальный гради-
ент температуры в окружающей среде (ОС)
меньше, чем
t dh )
величина ДГ(рис. 1.3, а). В этом случае атмосфера находится в
сверхадиабатическом состоянии.
Возьмем небольшой объем воздуха в точке А. При его пере-
мещении в случае турбулентной диффузии в атмосфере вверх с
24
Глава первая. Физико-химические процессы в атмосфере
Рис. 1.3. Вертикальный градиент температуры и устойчивость атмосферы [1]:
(dT\
----------градиент температуры в окружающем воздухе, — ;
k dh )ж
----------— сухоадиабатический вертикальный градиент температуры, АГ
достаточной скоростью конечное состояние этого объема может
быть изображено точкой Б на прямой сухоадиабатического гра-
диента. Этому состоянию отвечает температура, значение кото-
рой выше реальной температуры в ОС — точка В, а величина
плотности — меньшей величине в сравнении с наблюдаемой
плотностью воздуха в ОС. Следствием этого является тенденция
подъема рассматриваемого объема воздуха.
При случайном перемещении объема воздуха из точки А
вниз будет происходить адиабатическое сжатие элементарного
объема, вследствие чего плотность воздуха в точке Д будет пре-
восходить значение плотности воздуха при новом значении тем-
пературы ОС в точке Е и рассматриваемый объем продолжит
свое движение вниз. Таким образом, любое перемещение объема
воздуха в этом варианте в вертикальном направлении сопровож-
дается тенденцией к усилению эффекта смещения, и атмосфера
в данном случае находится в неустойчивом состоянии.
(с!ТУ
— =ДГ(рис. 1.3, б) состояние атмосферы,
dh j
/ ОС
определяющее ее устойчивость, характеризуется как безразлич-
ное, так как при перемещении объема воздуха по вертикали от-
носительно исходного состояния его параметры не будут отли-
чаться от значений параметров окружающей среды на новой
1.2. Характеристики загрязнения атмосферы
25
высоте, т. е. будет отсутствовать движущая сила вертикальных
перемещений.
Если значение наблюдаемого вертикального температурного
градиента окружающей среды больше, чем сухоадиабатический,
т.
е.
I dh Joc
>ДГ(рис. 1.3, в), то в атмосфера находится в пода-
диабатическом состоянии. Атмосфера в этом случае тоже устой-
чива вследствие того, что любой объем воздуха, случайным обра-
зом перемещенный в вертикальном направлении, будет всегда
возвращаться в свое первоначальное состояние.
Если же температура воздуха увеличивается с ростом высо-
(dT\ Г ,
ты — » А/, то атмосферные условия определяются как ин-
I dh )„
версия (рис. 1.3, г). Состояние атмосферы в этом случае весьма
устойчивое. Наличие инверсии в значительной степени замед-
ляет вертикальное перемещение загрязнений и тем самым уве-
личивает их концентрацию в приземном слое атмосферного
воздуха.
Такое явление возникает при внезапном ночном охлаждении
слоев воздуха, прилегающих к земной поверхности, или при на-
ложении потока теплого воздуха на нижние холодные слои. Ин-
версия приводит к увеличению концентрации выбросов, в резуль-
тате чего при достаточной солнечной радиации может наблюдать-
ся образование смога. Обычно различают приповерхностную и
высотную инверсии. В первом случае температура воздуха в ниж-
них слоях имеет минимальное значение и постоянно увеличива-
ется с высотой, что препятствует подъему выбросов, расположен-
ных у земной поверхности. Приповерхностная инверсия с насту-
плением дня при сильном солнечном освещении быстро исчезает
(«таяние» тумана). При верхней инверсии слой воздуха с инверси-
онным температурным градиентом лежит под слоем воздуха с
нормальным перепадом температур. При этом все выбросы, рас-
положенные под нижним инверсионным слоем, загрязняют при-
легающее к земной поверхности воздушное пространство.
В нормальных условиях атмосфера по химическому составу
представляет смесь газов, для которой выполняется закон пар-
циального давления Дальтона, из которого следует, что давление
отдельных газов в атмосфере будет падать с той же скоростью,
26 Глава первая. Физико-химические процессы в атмосфере
что и общее давление. Это можно представить в виде барометри-
ческого уравнения:
Pz=Poexp(^|,
\ л j
где Pz и Ро — давление соответственно на высоте Z и на поверх-
ности Земли; Н — высота (около 8,4 км в нижней тропосфере).
Из этого уравнения следует, что давление в нижней части
атмосферы уменьшается так быстро, что на высоте 5,8 км дос-
тигает 50 % от значения давления на земной поверхности.
В пределах тропосферы этому уравнению отвечает около 90 %
массы всех атмосферных газов. Остальное количество находится
в стратосфере, что указывает на высокую чувствительность этой
части атмосферы к загрязнениям. В стратосфере так мало газов,
что относительно небольшие количества загрязнителей (следо-
вые концентрации) могут оказывать существенное влияние на
изменение химического состава этой части атмосферы. Основ-
ными газовыми загрязнителями атмосферы являются оксиды
углерода, азота, диоксид серы, метан, галогены, их производные
органического и неорганического вида. Подвергаясь воздейст-
вию высокоэнергетического солнечного излучения, они перехо-
дят в высокоактивное состояние и способны инициировать и
принимать непосредственное участие в химических взаимодей-
ствиях, в результате которых могут образовываться высокоток-
сичные вещества.
Контрольные вопросы
1. Как соотносятся результаты изменения окружающей среды, вызван-
ные, с одной стороны, деятельностью человека, а с другой — естест-
венными причинами?
2. Какие основные компоненты составляют глобальный экологический
кризис?
3. Классифицируйте основные виды загрязнения атмосферы по фазово-
му принципу, по химическому составу.
4. Что является определяющим параметром при образовании аэрозолей
в случае гомогенной конденсации?
5. Как изменяются температура и химический состав атмосферы с вы-
сотой?
1.3. Основные типы процессов в атмосфере
27
1.3. Основные типы процессов в атмосфере
1.3.1. Фотохимические реакции
Фотохимические реакции — это химические реакции, проте-
кающие под действием света. Известно, что основным источ-
ником радиации, поступающей на Землю, является Солнце,
значение лучистой энергии которого на 5—8 порядков превы-
шает количество энергии, попадающей в атмосферу от других
источников, таких как Луна.
Лучистая энергия представлена в виде потока световых кван-
тов или фотонов, испускаемого источником радиации (Солнца)
и распространяющегося со скоростью света. При столкновении
фотона с атомом или молекулой его энергия передается встре-
ченной частице, которая идет на увеличение внутренней энергии
атомов или молекул вещества, поглощающего и ослабляющего
радиацию. Поглощение фотона с длиной волны X« 100 —
1500 нм (1 нм = 10 9 м), чему соответствует энергия 0,8—12,4 эВ
(80—1200 кДж/моль), вызывает квантовый переход молекулы ве-
щества из основного электронного состояния в одно из возбуж-
денных состояний или фотоионизацию — отщепление электрона
и образование катион-радикала. Возбужденное состояние моле-
кул имеет отличную от основного состояния электронную струк-
туру и, как правило, высокую реакционную способность. Возбу-
жденные молекулы вступают в химические реакции, первичные
продукты которых (ионы, радикалы, изомеры) чаще всего ока-
зываются нестабильными. Время жизни возбужденного состоя-
ния обычно не превышает 10“8—10’9 с.
Другим источником протекания фотохимических реакций
является космическое излучение, представленное потоками гам-
ма- и рентгеновского излучения, корпускулярной радиации с
высокой энергией, с большой проникающей способностью, про-
низывающими всю толщу атмосферы. Ионизируя атомы и моле-
кулы атмосферных газов, они вызывают вторичное космическое
излучение, которое содержит все виды радиации.
Радиация по длинам волн, или частотам, условно делится на
видимую (световую), инфракрасную (тепловую) и ультрафиоле-
товую.
Радиация, поступающая на поверхность либо испускаемая
поверхностью, характеризуется значениями поверхностной плот-
28 Глава первая. Физико-химические процессы в атмосфере
ности лучистого потока. При рассмотрении потока радиации на
некоторую поверхность используют понятие энергетической ос-
вещенности. В случае рассмотрения стока энергии от поверхно-
сти пользуются термином энергетической светимости [2].
Поток радиации, определяемый количеством лучистой энер-
гии, падающей на единичную горизонтальную площадку в еди-
ницу времени, — это энергетическая освещенность. Поток энер-
гии, испускаемый единичной горизонтальной площадкой в еди-
ницу времени в верхнюю полусферу, — это энергетическая
светимость. Отношение потока отраженной от поверхности ра-
диации к потоку падающему на нее, т. е. отношение энергетиче-
ской светимости поверхности к ее энергетической освещенно-
сти, называется альбедо. Альбедо выражается либо в долях еди-
ницы, либо в процентах. Очевидно, что альбедо является важной
характеристикой, позволяющей оценить часть лучистой энергии,
которая поглощается поверхностью.
Наряду с этими характеристиками, которые являются ло-
кальными и относятся к элементам поверхности, используются
интегральные характеристики взаимодействия поля радиации с
веществом — это прежде всего функция поглощения. Она пред-
ставляет собой долю радиации, поглощенной некоторым слоем,
содержащим массу вещества.
При столкновении фотона с атомом вещества он прекращает
свое существование в результате поглощения его энергии части-
цей. При большом числе таких столкновений в направленном
потоке фотонов, каким является солнечное излучение, их число
убывает, т. е. происходит ослабление излучения. При поглоще-
нии энергии фотонов возрастает кинетическая энергия электро-
нов, атомов, молекул, что сопровождается протеканием фотохи-
мических превращений различного типа.
К основным типам фотохимических процессов относятся
следующие реакции.
Фотоионизация — процесс отрыва электрона от атома или
молекулы и образование в результате этого катион-радикалов
под действием энергии фотонов коротковолнового излучения.
Она наблюдается при энергиях фотонов, равных или превышаю-
щих энергию ионизации. Фотоионизация жесткими фотонами
(гамма- и рентгеновское излучение) происходит с отрывом от
атомов электронов, входящих в глубокие (внутренние) электрон-
ные оболочки. Фотоионизация оптическими фотонами обеспе-
1.3. Основные типы процессов в атмосфере
29
чивает возможность отщепления от атома внешних (валентных)
электронов. Иногда имеют место процессы фотонейтрализации,
что происходит при отрыве от отрицательно заряженных ионов
избыточных электронов.
Фотодиссоциация — распад молекулы по какой-либо связи
на радикалы, атомы или ионы, например:
Н О ----Хч135нм Н* + ОН‘ (J 5)
(Радикал (Радикал
водорода) гидроксила)
NO2 —?^430н^- > NO + О(3Р) (1.6)
(Диоксид азота) (Оксид азота) (Атомарный кислород)
Преддиссоциация — разновидность фотодиссоциации, при
которой после поглощения фотона молекула первоначально ока-
зывается в стабильно возбужденном состоянии, а из него пере-
ходит в диссоциативное возбужденное состояние, например:
SO2—>SO‘+O‘; R2CO—> RC’O + R* (1.7)
(Диоксид серы) (Радикалы) (Кетон) (Углеводородные радикалы)
Распад (отщепление, фрагментация) — разложение на молеку-
лярные фрагменты, сопровождающееся перегруппировкой свя-
зей, например:
. СН4 —>: СН2 + Н2
(Метан) (Радикал)
CH3CH2J —СН2 = СН2 + HJ
(Йодистый этил) (Этилен) (Иодоводород)
Окислительно-восстановительные фотохимические реакции, в
основе которых лежит фотоперенос электрона (это перенос
электрона под действием света от молекулы-донора Д к молеку-
ле-акцептору А). Перенос электрона может происходить не толь-
ко при взаимодействии возбужденных молекул с Д или А элек-
трона, но и путем прямой фотоионизации молекул. Для фотоио-
низации (т. е. отщепления — отрыва электрона от нейтрального
атома или молекулы под действием кванта света) требуется, что-
бы энергия фотона превышала потенциал ионизации, который
обычно существенно больше, чем энергия, необходимая для воз-
буждения молекул.
Фотоокисление кислородом часто протекает с помощью мо-
лекул веществ-сенсибилизаторов, передающих энергию погло-
30
Глава первая. Физико-химические процессы в атмосфере
щенного ими фотона молекуле кислорода или другого вещества
и тем самым переводящих ее из основного невозбужденного со-
стояния в активное возбужденное состояние. Сенсибилизатора-
ми являются молекулы веществ, высокочувствительные к дейст-
вию оптических фотонов (квантов света), которые, поглощая
квант световой энергии, переходят в возбужденное состояние.
Фотоны или кванты обладают энергией Е = hv, где h — по-
стоянная Планка, v — частота световой волны. При взаимодей-
ствии с молекулами вещества может поглощаться целый квант.
При этом молекула, поглотившая фотон, возбуждается — ее
электронная оболочка переходит в более высокое энергетиче-
ское состояние.
Вместе с тем молекулы вещества имеют свои собственные
дискретные энергетические уровни и поэтому поглощают при
облучении только те кванты, энергия которых соответствует раз-
нице между двумя дискретными уровнями, т. е. должно выпол-
няться условие hv = Ek- Ео (Ek — возбужденный уровень, £0 —
основной уровень). В действительности основной и возбужден-
ный энергетические уровни, как правило, распадаются на мно-
жество подуровней, количество которых определяется числом
возможных ориентаций в пространстве полного спина атомной
системы — (25+ 1), где 5 — спиновое квантовое число системы,
и называется мультиплетностью (Л/). При M=2s+ 1 = 1, 2, 3,
4, ... уровни энергии называются соответственно синглетными,
дублетными, триплетными, квартетными и т. д. Значение муль-
типлетности указывается вверху, слева от символа элемента, на-
пример: 3О2 (триплетное состояние), *О2 (синглетное состояние
молекулы кислорода).
Мультиплетность атомных систем определяется числом элек-
тронов в незаполненных оболочках, так как для замкнутых обо-
лочек 5 = 0. Так, для атома водорода и атомов щелочных элемен-
тов (один электрон во внешней оболочке) возможны только дуб-
летные состояния, так как для таких атомов 5= 1/2. Для атомов
щелочноземельных элементов (два электрона на внешней обо-
лочке) — синглетные (5 = 0, спины электронов антипараллельны)
и триплетные (5=1, спины электронов параллельны).
Для молекул кислорода основным состоянием является три-
плетное, так как два валентных электрона молекулы О2, находя-
1.3. Основные типы процессов в атмосфере
31
шиеся на разрыхляющих орбиталях, не спарены и имеют парал-
лельные спины (5= 1, М = 3, 3О2). При переходе в возбужденное
состояние один из неспаренных электронов меняет спин и моле-
кула переходит в синглетное состояние (5 = О, М= 1, *О2).
Суть действия молекул веществ-сенсибилизаторов состоит в
следующем. Поглотив световой квант, они переходят в возбуж-
денное состояние, при котором валентный электрон перемеща-
ется на новый уровень с более высоким значением энергии.
Другая особенность молекул сенсибилизатора — это способность
при контакте с молекулами кислорода или других веществ пере-
давать им свою энергию возбуждения, облегчая их переход в
возбужденное состояние.
Как известно, чтобы молекулы могли прореагировать, обыч-
но бывает необходимо либо сообщить им дополнительную энер-
гию, называемую энергией активации, либо снизить энергетиче-
ский барьер, лежащий на пути превращения реагентов в продук-
ты. С помощью сенсибилизаторов, чувствительных к действию
световых фотонов — фотосенсибилизаторов, инициируются хи-
мические превращения, которые называются фотоиндуцирован-
ными или фотохимическими.
Рассмотрим процесс перехода молекул облучаемого светом
вещества из основного состояния в возбужденное. При ультра-
фиолетовом облучении молекула вещества, находящаяся в основ-
ном энергетическом состоянии 5() (в этом состоянии все электро-
ны образуют пары с противоположными спинами, 5=0, М= 1,
синглетное состояние), поглощает квант, в результате чего один
из электронов переходит с заполненной орбитали на свободную с
более высокой энергией, сохраняя при этом свой спин (рис. 1.4).
Такое состояние молекулы называется первым возбужденным
синглетным состоянием (Л1!). Каждому возбужденному синглет-
ному состоянию соответствует триплетное состояние (Г(), отли-
чающееся от синглетного тем, что у электрона, перешедшего на
свободную орбиталь, знак спина меняется на противоположный
(5= 1, М=3, триплетное состояние). В результате оба электрона
оказываются в одинаковых спиновых состояниях.
На рис. 1.4 показана схема переходов возбужденной моле-
кулы в основное состояние. Переход с изменением спина элек-
трона называется флюоресценцией, а без изменения — фосфорес-
ценцией.
32
Глава первая. Физико-химические процессы в атмосфере
Рис. 1.4. Схема перехода молекулы из возбужденного состояния в основное.
Поглотив квант, молекула из основного состояния So переходит в первое возбуж-
денное синглетное состояние Sj; знак спина электрона при этом не меняется; за-
тем молекула либо возвращается в исходное состояние без изменения спина
электрона с излучением кванта (этот процесс называется флюоресценцией и про-
текает очень быстро), либо меняет знак спина электрона и, потеряв только часть
поглощенной энергии, переходит в первое триплетное состояние Т\, в этом со-
стоянии молекула и может прореагировать; если же реакция по какой-либо при-
чине не идет, то через некоторое время система возвращается в исходное состоя-
ние So; этот процесс называется фосфоресценцией и протекает медленно
С точки зрения энергетики, наиболее выгодно устойчивое
состояние 50. Состояние 5, обладает наибольшим избытком
энергии и соответственно менее стабильно, а состояние 7\ зани-
мает промежуточное положение. Когда в результате фотооблуче-
ния молекула оказывается в состоянии 7\, реализуется возмож-
ность протекания фотохимической реакции.
Но так происходит не всегда. Если разница в энергиях 5]
и 50 слишком велика или если молекула очень медленно перехо-
дит из состояния 5, в состояние Т„ то она несмотря на облуче-
ние в реакцию вступить не может.
Иной, более легкий, механизм перевода молекулы вещест-
ва-реагента в активное возбужденное состояние реализуется при
участии молекулы вещества фотосенсибилизатора. При облуче-
нии сенсибилизатор передает свою энергию и спин реагирующей
молекуле, и молекула реагента вступает в реакцию, а сенсибили-
затор возвращается в исходное состояние и способен к дальней-
шим действиям подобно обычному катализатору. Схема фото-
сенсибилизирующего процесса представлена на рис. 1.5.
1.3. Основные типы процессов в атмосфере
33
К
Е
ф
X
О
Рис. 1.5. Схема фотосенсибилизируюшего процесса. Сенсибилизатор и основной
реагент (*), находящиеся в основных состояниях So и S(* образуют промежуточ-
ное соединение (комплекс) в основном состоянии S", которое при фотооблуче-
нии переходит в возбужденное синглетное состояние S". Сенсибилизатор, вхо-
дящий в состав комплекса, переходит в триплетное состояние 7} и передает при
этом свой спин молекуле основного реагента, облегчая ей переход в триплетное
состояние 7\‘. Одновременно комплекс распадается на составные части и сенси-
билизатор возвращается в исходное состояние So, а основной реагент получает
возможность вступать в химическую реакцию
В атмосфере в роли молекул-фотосенсибилизаторов, вызы-
вающих образование из молекулярного триплетного кислорода в
основном состоянии синглетного кислорода в возбужденном со-
стоянии, выступают, в частности, оксиды азота:
NOX + 3О2 -> (NOX 3О2) —(NOv3O2)‘ —> NOX+ ’О2
Образовавшийся синглетный кислород легко присоединяется
по кратным связям и внедряется также по связи С—Н, например:
о2 + 'О2 н> О3 + О
К /R
с
и
R R
R7C-O
Ю2 ---- 2| | ---- 2R2CO
R2CO
(Алкен)
(Кетон)
2 - 4054 Трифонов
R^C—CHR'2 + 1O2
(Алкен)
JD-OH
C=CR'
Н 2
(Пероксиалкен)
34
Глава первая. Физико-химические процессы в атмосфере
1.3.2. Свободные радикалы.
Образование их в атмосфере
В результате фотохимических реакций возможно образова-
ние большой группы чрезвычайно химически активных группи-
ровок атомов, называемых свободными радикалами. Свободные
радикалы существуют, как правило, чрезвычайно короткое вре-
мя. Возникнув, эти крайне реакционно-способные частицы тот-
час же либо соединяются друг с другом, либо вступают в даль-
нейшее превращение. Они решающим образом определяют ха-
рактер множества процессов: цепных реакций горения, взрыва и
полимеризации, а также фотохимических, радиационно-химиче-
ских и даже биохимических превращений.
Свободные радикалы возникают каждый раз, когда внутри
исходных молекул межатомные связи уже разорвались, а новые
связи еще не возникли. Получившиеся в результате этого проме-
жуточные частицы отличаются от обычных молекул тем, что каж-
дая из них содержит по одной ненасыщенной валентности, из-за
чего они обладают способностью мгновенно реагировать либо с
другой такой же частицей, либо с окружающими молекулами,
либо с инертными частицами (например, стенками сосуда).
Процесс исчезновения свободных радикалов иногда удается
задержать настолько, что их можно зафиксировать обычными
методами. Если быстро и сильно охладить реакционную смесь,
свободные радикалы можно буквально заморозить, лишив под-
вижности и способности немедленно вступать в последующие
превращения при реакциях, протекающих в газовой фазе. Пре-
вращения свободных радикалов можно резко замедлить, умень-
шив частоту их столкновений друг с другом в результате высоко-
го разрежения. Все это наблюдается в высоких слоях атмосферы.
Необходимо учесть, что в зависимости от взаимной ориента-
ции спинов свободные радикалы взаимодействуют друг с другом
различными способами. Например, если столкнутся два радика-
ла Н*, спины которых ориентированы одинаково, то эти радика-
лы просто разлетятся в разные стороны, не прореагировав, по-
скольку в конечном продукте, молекуле водорода, спины элек-
тронов непременно должны быть противоположными. В ином
случае химическая связь не может образоваться. Но если столк-
нутся два радикала с противоположными спинами, они тотчас
же соединятся друг с другом.
1.3. Основные типы процессов в атмосфере
35
Процессы с участием свободных радикалов встречаются очень
часто, и в основном они протекают по цепному механизму. Все
начинается со стадии зарождения цепи, когда в результате разры-
ва химических связей молекулы реагентов порождают атомы или
свободные радикалы. На следующей стадии продолжения цепи
атомы или свободные радикалы атакуют молекулы реагентов,
приводя к образованию молекул продуктов и новых активных
частиц, способных принимать участие в дальнейших реакциях.
Наконец, спустя большее или меньшее число промежуточных ак-
тов превращений, происходит гибель активных частиц — так на-
зываемый обрыв цепи.
Свободные радикалы образуются как в ходе фотохимических
реакций под действием ультрафиолетовой радиации (см., напри-
мер реакции 1.5, 1.7), а также в ходе химических реакций в ат-
мосфере и растворах. Например, хлорирование этилена вызыва-
ет образование атомов и радикалов — молекулы олефина как бы
растягивают молекулу хлора, связь Cl—С1 ослабевает, и одновре-
менно возникают новые связи Cl—С:
п + ci—ci + и -----।: -ci --ci - :i
Tk /Ск /Ск „Ск
Н Н НН н Н н н
Н I С1
н
Ьк /Н
I
Н I CI
н
(Хлоралкильные радикалы)
В конечном итоге образуются хлоралкильные радикалы, ко-
торые реагируют с молекулами хлора и дают начало цепи:
/Н
I
/Ск
Н I CI
н
С12
н^кн
? + CI*
H^C^CI
н
(Здесь: | — двухэлектронная связь; •• — пара электронов,
принадлежащая атому или молекуле; * — возбужденный атом
или свободный радикал; • — неспаренный электрон.)
36
Глава первая. Физико-химические процессы в атмосфере
Свободные радикалы образуются в ходе самопроизвольного
окисления органических веществ:
RH + O2-> R’ + НО; либо RH + O2 + HR->
—> R’ + Н-О-О-Н + R’
Здесь RH — углеводород; R* — углеводородный радикал; НО2 —
гидропероксидный радикал; Н—О—О—Н или Н2О2 — перекись
водорода.
Под действием кислорода от органической молекулы отщеп-
ляется атом водорода, и образуются очень активные частицы —
свободные радикалы R* и HOJ. Радикал R’ с неспаренным элек-
троном на атомном углероде намного активнее гидропероксид-
ного Н—О—О*: он может соединяться (рекомбинировать) с себе
подобными (R* + R’ —> R—R), отрывать атом водорода от моле-
кулы исходного вещества (R|+RH-> R,H + R’) и, наконец,
присоединяться по двойной связи молекулы кислорода
(R* + О = О -> R—О—О’). Первую реакцию можно не принимать
во внимание: вероятность встречи двух радикалов очень мала.
Вторая приводит лишь к обмену атомами водорода. А вот в ре-
зультате третьей реакции образуется менее активный радикал —
пероксидный радикал RO2.
И тогда начинается цепная реакция окисления, которая со-
стоит из двух повторяющихся стадий:
Ro; + RH -» ROOH + R’ (или НО; + RH -» Н2О2 + R’)
и R* + О2 -> RO2
Цепь обрывается, когда встречаются два пероксидных ради-
кала RO2; эта встреча может дать различные продукты (по реак-
ции 2RO2 -» О2 + R—О—OR) — спирты, карбонильные соедине-
ния. Если цепи длинные, то этих веществ будет немного, а ос-
новным продуктом цепной реакции будет гидропероксид ROOH,
связь — 0—0 — в котором относительно слабая (более чем
вдвое слабее связи С—О в спиртах); при ее разрыве образуются
сразу два радикала: ROOH -> RO’ + ОН’, которые инициируют
новые цепи. Ионы тяжелых металлов (М2+, М3+), инертные час-
1.3. Основные типы процессов в атмосфере
37
тицы и даже пыль, всегда присутствующие в атмосфере, могут
вызвать распад неустойчивых гидропероксидов:
ROOH + М2+ RO* + ОН" + М3+
ROOH + М3+ -> RO; + Н+ + М+2
Свободные радикалы легко возникают в реакциях с участием
фтора:
С2Н6 + F2С2н; +HF + F*
{этан)
С2Н4 + F2 -> C2H4F‘ + F*
{этилен)
Таким образом, фотохимические реакции, инициируемые
фотонами солнечной радиации, дают в качестве продуктов такие
чрезвычайно активные в химическом отношении частицы, как
ионы, возбужденные атомы, фрагменты молекул с ненасыщен-
ными валентностями и радикалы. Последние могут образовы-
ваться и в реакциях окисления.
1.3.3. Фотохимические реакции кислорода. Озон.
Проблемы озонового слоя Земли
1.3.3.1. Свойства молекулярного кислорода
Молекула кислорода представляет собой бирадикал с неспа-
ренными электронами — это основное, так называемое триплет-
ное, состояние кислорода (5=1, М= 3,3О2). Энергия диссоциации
триплетного кислорода на атомы составляет 496 кДж/моль. Эта
высокая величина служит кинетическим фактором относительной
химической инертности кислорода, что является одной из причин
нахождения кислорода в свободном состоянии в атмосфере. При
возбуждении триплетного кислорода под действием света проис-
ходит электронная перестройка, в результате чего возникает моле-
кула синглетного кислорода с парой электронов, принадлежащей
одному из атомов кислорода — так называемый синглет I (5=0,
М= 1, ‘О2). На это требуется энергия 92 кДж/моль. Такой кисло-
38 Глава первая. Физико-химические процессы в атмосфере
род нестабилен и быстро распадается. Его среднее время жизни в
атмосфере составляет 65 мин. При дальнейшем возбуждении про-
исходит еще одна трансформация молекулы кислорода и возника-
ет синглет II. Это возбужденное состояние еще менее стабильно —
среднее время его существования 65 с. На его образование из
синглета I требуется 63 кДж/моль. Синглетные формы кислорода
химически очень активны
: 6 = О : —: б е О : —: 6 = 6 :
триплет синглет I синглет II
O2(3Z) О2('Д) O2('Z)
Синглетный кислород образуется также в воздухе, загряз-
ненном оксидами азота, полициклическими углеводородами —
компонентами автомобильных выхлопных газов и выбросов
промышленных предприятий. Эти вещества действуют как фо-
тосенсибилизаторы (Sen). Они возбуждаются энергией света и
передают энергию возбуждения на кислород:
Sen + hv -> Sen*, Sen* + 3O2 -> Sen + 'O2
1.3.3.2. Фотохимические реакции кислорода
Ультрафиолетовое излучение Солнца лежит в диапазоне
длин волн от 10 до 400 нм. Чем короче длина волны, тем больше
энергии несет излучение. Энергия излучения расходуется на воз-
буждение (переход на более высокий энергетический уровень),
диссоциацию (распад) и ионизацию (превращение в ионы) мо-
лекул газов атмосферы. Расходуя энергию, излучение ослабевает
или иначе поглощается. Это явление количественно характери-
зуется коэффициентом поглощения. С уменьшением длины вол-
ны коэффициент поглощения увеличивается — излучение воз-
действует на вещество сильнее.
Принято подразделять ультрафиолетовое излучение на два
диапазона — ближний ультрафиолет (длина волны 200—400 нм)
и дальний, или вакуумный (10—200 нм), который участвует в
создании ионосферы. Ближний ультрафиолет пронизывает ни-
жележащие слои атмосферы — стратосферу, тропосферу и облу-
чает поверхность Земли.
1.3. Основные типы процессов в атмосфере
39
Поглощая энергию ультрафиолетового излучения, молекулы
кислорода могут подвергаться ионизации, диссоциации, перехо-
дить в возбужденное (синглетное) состояние. Для молекулы ки-
слорода величина энергии возбуждения для последующей диссо-
циации на атомы составляет 5,1 эВ. Для ионизации молекулы
кислорода требуется гораздо большая энергия — 12,5 эВ. Однако
это наименьшая энергия диссоциации среди всех составляющих
атмосферу газов (у водяного пара — 13,2; СО2 — 14,5; Н2 — 15,4
и N2— 15,8 эВ).
В верхних слоях атмосферы кислород под действием ультра-
фиолетовой радиации превращается в озон:
О2 —20 —> 20з (1.8)
Один из сильнейших окислителей — атомарный кислород, —
может образовываться за счет фотохимической реакции диокси-
да азота, одного из важнейших газовых загрязнителей воздуха:
NO2—^-^NO + O (1.9)
От нитритов, находящихся в воздухе на поверхности пыли-
нок или в виде мельчайших частиц аэрозолей, под действием
света может отделяться радикал гидроксила (ОН*), тоже очень
сильный окислитель:
HONO —h-±-> NO + ОН* (1.10)
Таким образом, в атмосфере в результате протекания реак-
ций (1.8)—(1.10) всегда будут присутствовать озон и оксиды азо-
та, концентрации которых будут определяться как природными,
так и антропогенными факторами. Так, концентрации оксидов
азота достигают максимальных значений в крупных городах, где
интенсивное автомобильное движение и развитая теплоэнерге-
тика — основные антропогенные источники NOX (рис. 1.6). Для
горных областей, где интенсивность ультрафиолетового излуче-
ния наибольшая, характерны аномально высокое содержание
озона и практически полное отсутствие оксидов азота. Сельская
местность отмечена умеренными концентрациями в воздухе ок-
сидов азота, появляющихся в результате сельскохозяйственной
деятельности (животноводство, силос, удобрения и др.).
Органические пероксиды, присутствующие в загрязненном
воздухе (их образование рассмотрено в разделе 1.3.2), образуют
40
Глава первая. Физико-химические процессы в атмосфере
Направление ветра
Рис. 1.6. Средние концентрации NO, NO2 и О3 в больших городах, сельской ме-
стности и в районах чистого воздуха. После выпадения оксидов азота остается
фотохимически образованный озон [3]
тот же радикал при реакции с озоном, либо с ионами металлов,
адсорбированных на частицах аэрозолей:
ROOH + О3 -> О2 + ОН’ + ROO*
ROOH + М+2 -> RO* + ОН' + М3+
В сильно загрязненном воздухе концентрация радикала гид-
роксила может быть очень высокой: однажды в Детройте она
достигла 107 молекул в 1 см3.
При взаимодействии радикалов гидроксила с пероксидом во-
дорода и при реакциях свободных органических радикалов с ки-
слородом появляются еще две свободно радикальных формы ки-
слорода. Сначала возникает пергидроксид (раздел 1.3.2): это слабая
кислота, которая в щелочной и нейтральной средах диссоциирует
на протон и супероксид — отрицательно заряженный свободный
радикал О2 . Таким образом, имеется шесть активных форм ки-
слорода: озон О3, атомарный кислород О, гидроксильный ради-
кал *ОН, пергидроксил НО2, супероксид О* и синглетный кисло-
род 'О2. Все они порождены фотохимическими реакциями.
1.3.3.3. Озон. Образование. Химические свойства
Одна из наиболее острых химических проблем глобальной
экологии связана с опасностью антропогенного воздействия на
химические процессы в стратосфере, чреватые уменьшением в
1.3. Основные типы процессов в атмосфере
41
ней общего содержания озона. Стратосферный озон регулирует
поток ультрафиолетовых квантов, задерживая наиболее опасную
часть радиации Солнца с длинами волн менее 285 нм и значи-
тельно ослабляя излучение в диапазоне 285—315 нм. Кроме того,
экзотермическое разложение озона приводит к нагреванию стра-
тосферы, возникновению инверсионного слоя и тем самым пре-
пятствует выхолаживанию нижних слоев атмосферы из-за кон-
вективного переноса теплоты.
Озон относится к малым газовым компонентам атмосферы,
в наибольшей степени подверженным влиянию антропогенного
воздействия. Проблема оказалась тесно связанной с важными
экологическими факторами, и для ее решения потребовалось
принятие на международном уровне политических соглашений,
непосредственно затрагивающих жизненные интересы многих
миллионов людей.
Первооткрыватель озона (1835 г.) голландский физик
М. ван Марум считал, что запах и сильнейшие окислительные
свойства присущи некой «электрической материи». Название
«озон» предложил швейцарский химик К. Шинбейн в 1840 г.,
первым пришедший к мнению, что запах принадлежит особому
газу. А за трехатомную разновидность кислорода первым призна-
ли озон известный специалист по редким землям швейцарский
химик Ж. Ш. Г. Мариньяк и его соотечественник О. де ла Рив.
Образование молекул озона в атмосфере по упрощенной мо-
дели можно схематично представить в виде набора следующих
реакций:
О2 + Av —> 20
О + О2 -> О3
или
NO2 + Av -> NO + О
О + О2 О3
Химические связи в озоне менее прочны, чем в кислороде,
и, что важно, оптически активны О3 + Av О2 + О. Поэтому он
легко разрушается от действия многих физических и химических
факторов и очень активно вступает в различные реакции (окис-
ляет ртуть при обычной температуре!).
42 Глава первая. Физико-химические процессы в атмосфере
Озон содержится в атмосфере в ничтожных количествах.
Приведенная к нормальным условиям толщина слоя озона со-
ставляет в среднем 3 мм. Однако озон распределен в атмосфере
в соответствии с барометрическим законом до высот порядка
100 км, согласно которому давление падает с высотой по экспо-
ненте. А поскольку молекулы озона рождаются в самой атмо-
сфере, их высотное распределение такое же как у воздуха — т. е.
есть мало вверху и много внизу. В среднем на одну молекулу
озона приходится около миллиона молекул воздуха, содержаще-
го 80 % молекул азота и 20 % молекул кислорода.
Более детальный механизм образования озона в атмосфере,
учитывающий появление различных промежуточных состояний
кислорода как в молекулярной, так и в атомарной форме, был
предложен выдающимся английским геофизиком С. Чепменом в
1930 г. Суть этого механизма состоит в том, что на высотах
20—45 км молекулярный кислород распадается на атомы под дей-
ствием солнечного ультрафиолета (фотодиссоциирует). Быстрее
всего этот процесс идет на высотах 35—45 км, а максимальная
концентрация озона наблюдается ниже — на высотах 20—25 км.
Это объясняется тем, что вверху велика и скорость разрушения
озона, внизу она меньше. Первые две реакции описывают образо-
вание озона, последние две — его разрушение.
О2 +//v-> O('D) + О(3Р) X < 175 нм (1.11)
O + O2 + M(N2 или О2)-^ О3 + ЛГ (1.12)
О3 +//v-> O('D) + О2('д) Х<310нм (1.13)
О3 + О-> 2О2 + 392 кДж (1.14)
Здесь обозначены: O('D) и О(3Р) — атомарный кислород в раз-
личных возбужденных состояниях; О2('Д) и O2('Z) — синглетные
молекулы кислорода в различных возбужденных состояниях;
М — любая инертная частица или молекула, отводящая выде-
ляющуюся энергию образования озона.
Из схемы видно, что под действием коротковолнового ульт-
рафиолета молекула кислорода диссоциирует на атомы, которые
могут адсорбироваться другими молекулами кислорода, давая
озон.
1.3. Основные типы процессов в атмосфере
43
При образовании озона выделяется энергия связи, которая
должна быть отведена и поглощена любой посторонней молеку-
лой М (например, N2 или О2). Одновременно идет распад озона
под действием света на атомарный и молекулярный кислород.
Количество озона при этом практически не меняется, так как
атом кислорода вновь соединяется с другой молекулой кислоро-
да, образуя озон. И только в последней реакции происходит его
разрушение.
Предложен и другой механизм образования озона в атмосфе-
ре. При поглощении энергии коротковолнового ультрафиолето-
вого излучения часть молекул ионизируется, теряя электрон, и
приобретается положительный заряд, а часть — диссоциирует на
нейтральные атомы. Свободные электроны, появившиеся в ре-
зультате ионизации, могут поглощаться нейтральными атомами
кислорода, образуя отрицательно заряженный ион. При взаимо-
действии таких разноименно заряженных ионов образуется мо-
лекула озона.
Взаимодействие ультрафиолетового излучения с кислородом
происходит по всей высоте атмосферы. Есть сведения, что в ме-
юсфере, на высоте от 50 до 80 км, уже наблюдается процесс об-
разования озона, который продолжается в стратосфере (от 15
до 50 км) и в тропосфере (до 15 км). Вместе с тем верхние слои
атмосферы, в частности мезосфера, подвержены такому сильно-
му воздействию коротковолнового ультрафиолета, что ионизиру-
ются и диссоциируют молекулы всех составляющих атмосферу
газов. По описанному механизму озон образуется главным обра-
зом в мезосфере, из которой он, будучи тяжелее воздуха
в 1,62 раза, опускается вниз, где на высотах 20—25 км приходит
в равновесное состояние.
Предложенный механизм образования озона в принципе не
может работать не только в тропосфере и стратосфере, но и в
мезосфере по той простой причине, что ионизирующее молеку-
лярный кислород коротковолновое излучение Солнца не прони-
кает в атмосферу глубже 90 км.
Таким образом, образование атмосферного озона описывает-
ся набором взаимодействий, учитывающим как фотохимические
превращения, так и механизм столкновения реагирующих моле-
кул. Соотношение процессов образования и разрушения моле-
кул озона определяет, в конечном счете, накопление или убыль
количества озона в атмосфере.
44 Глава первая. Физико-химические процессы в атмосфере
1.3.3.4. Кинетика процессов образования и разложения озона
по модели С. Чепмена
Описанный ранее механизм образования атмосферного озо-
на позволяет выявить особенности его накопления и разруше-
ния и определить наиболее значимые факторы этих процессов.
Установлению в явной форме зависимости концентраций ато-
марного кислорода и атмосферного озона от различных парамет-
ров может послужить анализ кинетики процессов, реализуемых
по механизму, предложенному английским геофизиком С. Чеп-
меном.
Если считать, что скорость диссоциации О2 (реакция 1.11)
пропорциональна его концентрации и интенсивности коротко-
волнового ультрафиолетового излучения (J(), то
^ = 27,[О2]. (1.15)
ат
На более низких высотах в атмосфере, где больше длинно-
волнового ультрафиолетового излучения интенсивности J2, про-
исходит разложение озона (1.13), и для этой реакции:
^ = ^1 = /2[О3]. (116)
ат ах
Еще ниже по высоте при относительно больших давлениях
атомы и молекулы кислорода будут участвовать в тройных
столкновениях (1.12), образуя озон. Скорость образования озона
по этому типу взаимодействий можно представить в следующем
виде:
= К,[О2][О][Л/]. (1.17)
ат
Здесь Кх — константа скорости реакции (1.12). При этом
озона образуется столько, что становится возможным его разло-
жение при взаимодействии с атомарным кислородом по уравне-
нию (1.14). Для этого случая скорость снижения концентрации
озона определяется по формуле:
_^з] = К [Оз][О]. (1.18)
ах
Здесь К2 — константа скорости реакции (1.14).
1.3. Основные типы процессов в атмосфере
45
Учитывая сделанные предположения, в итоге для скоростей
образования озона и атомарного кислорода получим:
= 2JJOJ + /ДО,] -Х,[О2ИО][Л/] -/G[O3][O]; <1.19)
dx
= К, [Ог ] [О] [М] - J, [О, ] - К2 [О, ] [О]. (1.20)
ах
В формулах (1.15)—(1.20): [О2], [О], [О3], [Л/] — концентра-
ции соответствующих компонентов.
Считая, что соответствующие процессы достигли состояния
</[О3] <7[О] _
равновесия, т. е.--— и —-—можно путем комбинации уравне-
ах dx
ний (1.19) и (1.20) получить следующие выражения:
2У,[О2] = 2/Г2[О3][О]. (1.21)
[О]=А1921. (1.22)
tf2[O3]
Из последнего выражения следует, что с уменьшением ин-
тенсивности излучения Ц), которая связана с X (длина волны
излучения), число атомов кислорода будет быстро убывать.
Вычитая из уравнения (1.19) уравнение (1.20) и подставляя
вместо концентрации атмосферного кислорода его значение в
виде уравнения (1.22), можно получить:
/,[O21 + A[O,] = ^№1J| . (1.23)
Так как из оценки изменения с высотой значений и J2 сле-
дует, что на высотах между 20 и 40 км J,[O2] « J2[O3] и поэтому
шачением /,[О2] можно пренебречь и записать:
^,/,[О2]г[Л/] п
[О,] =
Из него следует, что с увеличением высоты концентрация
озона должна убывать из-за уменьшения концентрации [М]
и [О2] и увеличиваться за счет повышения величины J,; т. е. дан-
46
Глава первая. Физико-химические процессы в атмосфере
ная функция должна иметь экстремум. Расчеты показывают, что
концентрация озона максимальна в интервале высоты 25—30 км.
Рассмотренные механизм и кинетика учитывают образова-
ние озона в атмосфере только на основе кислорода как компо-
нента воздуха. Между тем на эти процессы влияют и другие ком-
поненты воздуха. Полагают, что разложение озона определяет в
основном азотный цикл. В нем разлагается до 80 % озона.
Укажем основные стадии этого цикла:
no2 + о no + о2
no + о3-> no2 + о2
no2 + о3 -> no; + о2
NO; + Av —> NO + O2
В целом роль окидов азота в разложении озона очень велика,
что оказывает существенное влияние на его концентрацию в ат-
мосфере.
Из других компонентов атмосферы, влияющих на разложе-
ние озона, следует остановиться на атомарном водороде и ради-
кале гидроксила. Определим зависимость их концентраций от
различных факторов [4]. Атомарный водород и радикал гидро-
ксила образуются при разложении паров воды под действием
солнечного излучения:
Н2О + Av -> Н + ОН*
Вода может реагировать с Н и О с образованием радикалов
ОН*, играющих большую роль в разложении озона:
О + Н2О = 2ОН* (1.25)
Н + Н2О = Н2 + ОН* (1.26)
Считая, что образование атомарного водорода протекает
только по реакциям:
ОН* + О = Н + О2, (1.27)
H2O + Av = OH + H. (1.28)
1.3. Основные типы процессов в атмосфере
47
а его исчезновение — по реакциям:
Н + О2 + М=НО; + М (1.29)
Н + О3 = ОН* + О2 (1.30)
можно рассчитать равновесную концентрацию водорода. Для
этого составим систему кинетических уравнений:
^1.27, 1.28 = *1.28[Н2О] JH2O + Кх 27[ОН] [О]; (1.31)
К,.29, 1.30 = ^1.29[Н] [О2] [Л/] + *130[Н] [О3]. (1.32)
С учетом того, что при равновесии Vx 28 , 27 = И, 30 129, получим:
^28[H2O]JH2o+^l27[OH][O]
Л7129[О2][Л/] + Х130[О3]
Здесь К, — константа скорости /-й реакции; Vtj — скорость /-й
и у-й реакций; [Н] — концентрация атомарного водорода.
Оценочные данные показывают, что на высоте h = 40 км в
1 см3 содержится примерно 103 атомов водорода.
Аналогично можно поступить и в случае радикалов ОН*.
Считая, что частицы ОН* образуются только по реакциям:
но; + о-> он* + о2 (1.зз)
но; + О3 -> ОН* + 2О2 (1.34)
а расходуются только по реакциям:
ОН* + О->Н + О2 (1.35)
он* + о3-> но; +о2 (1.зб)
получим:
Оценка показывает, что содержание ОН* в атмосфере состав-
ляет приблизительно I06 частиц в 1 см3.
Приведенные расчеты показывают сложность и взаимосвязь
процессов образования и разложения озона в атмосфере.
48
Глава первая. Физико-химические процессы в атмосфере
1.3.3.5. Химия озонного слоя. Истощение озонового экрана Земли
и уровень ультрафиолетовой радиации
Озоновая оболочка предохраняет поверхность Земли от же-
сткого ультрафиолетового излучения Солнца, которое разлагает
хроматип клеточного ядра, прекращает деление и размножение
клеток. У людей коротковолновая ультрафиолетовая радиация
повреждает ДНК, нарушает генетический код и может привести
к трагическим последствиям. Этот эффект наиболее силен при
действии излучения с длинами волн 255—265 нм и существенно
убывает после 290 нм. Озон как раз и пропускает свет только с
длинами волн больше 290 нм.
После разрушения озонового слоя стратосфера станет охлаж-
даться, а приземные слои воздуха и поверхности Земли — нагре-
ваться. Масштабы такого отепляющего явления вполне сопоста-
вимы с пагубным воздействием на климат СО2 порождающего
парниковый эффект. Но главная угроза — усиление ультрафио-
летового излучения.
Каковы механизмы появления озоновых дыр? По этому по-
воду выдвинуты две группы гипотез. Одни объясняют происхо-
дящее естественными процессами, другие — техногенными при-
чинами.
Прямые измерения содержания озона в стратосфере, выпол-
ненные в начале 2-й половины XX в., дали значения, не совпа-
дающие с расчетными. Это свидетельствовало о наличии допол-
нительных реакций исчезновения озона и инициировало прове-
дение новых исследований по этой проблеме, что привело к
созданию общей схемы разрушения озона с участием радикаль-
ных частиц:
X* + О3 хо + о2
хо + о* -> х* + о2
О3 + О* -> 2О2
В этой схеме радикал X* выполняет роль катализатора в цик-
лическом процессе разрушения озона. В зависимости от элемен-
та, определяющего природу радикальных частиц и объединяю-
щего их в «семейства», выделяют несколько циклов (табл. 1.1).
1.3. Основные типы процессов в атмосфере
49
Таблица 1.1. Главные компоненты, участвующие в формировании поля
концентрации стратосферного озона
Цикл Компоненты
Кислорода О(ЗР) О CD) О2 (’Д) О2 ('X) О2 (3Х) Оз —
Водорода НО но2 Н Н2 Н2О2 Н2О —
Азота NO no2 N NO3 N2O3 hono2 —
Хлора С1 сю сюо ОСЮ HCI НОС1 C1ONO2
Брома Вт ВгО ВгОО ОВгО НВт НОВг BrONO2
Фтора F FO FOO OFO HF — —
В качестве примера рассмотрим циклы хлора и брома.
Цикл хлора. В начале 70-х гг. XX в. было предположено, что
в разрушении стратосферного озона участвуют атомы хлора, по-
ступающие в стратосферу в составе вулканических газов и про-
дуктов сжигания топлива аэрокосмических средств. Результаты
теоретических расчетов указали на несущественное влияние этих
источников хлора на состояние озонового слоя с учетом высо-
кой эффективности цикла.
Ci’ + о3 -> сю* + о2
СЮ* + О' -> С1* + о2
Другим естественным хлорсодержащим компонентом, про-
никающим в стратосферу, является хлористый метил (СН3С1),
источником которого в основном служит океан. Однако основ-
ным хлорсодержащим соединением стратосферы считается хло-
ристый водород. Он образуется, например при сжигании поли-
винилхлорида:
(С2Н3С1)„ + О2 -> НС1 + со2 + Н2О
(поливинилхлорид)
и далее участвует в реакции окисления с выделением свободного
хлора:
4НС1 + О2 -> 2Н2О + 2С12
Хлорозамещенные дибензодиоксины и дибензофуран не про-
изводятся, а образуются как нежелательные примеси в количест-
вах, измеряемых для разных стран десятками — тысячами грам-
50
Глава первая. Физико-химические процессы в атмосфере
мов в год (в США ~10 кг). Половина этого количества приходит-
ся на мусоросжигательные заводы и сжигатели медицинских
отходов (в них очень много пластиковых отходов — поливинил-
хлорида). Повышенная температура, наличие органических, осо-
бенно ароматических, веществ и хлора — условия, в которых
происходит образование диоксинов.
Хлористый водород, как показали исследования и измерения
70-х гг. XX в., может образовываться в результате следующих ре-
акций:
а* + но; на + о2
сг + сн4 -> сн; + на
Одновременно с этим в стратосфере может протекать и вос-
производство активных атомов хлора при участии радикалов
гидроксила:
НС1 + НО‘ -> С1* + Н2О
Последнее обстоятельство позволяет относить НС1 к «резер-
вуарным» газам, к которым также можно причислить хлорнитрат
(C1ONO2) и НОС1:
С1О‘ + NO2 -> C1ONO2
СЮ* + НО; -> НОС1 + О2
Разрушающие озон хлорсодержащие радикальные частицы
появляются в результате фотохимических реакций:
НОС1 + Av -> С1* + НО*
C1ONO2 + Av -> СЮ* + NO2
Из оксида хлора под действием атмосферного кислорода
вновь образуется атом хлора.
Цикл брома. Океан является главным источником основного
бромсодержащего соединения, поступающего в атмосферу, бро-
мистого метила (СН3Вг). Кроме того, стратосфера частично за-
грязнена бромсодержащими газами антропогенного происхожде-
ния — фторбром- и фторхлорбромуглеродами, имеющими соби-
рательное название галлоны и применяемыми при тушении
пожаров. В силу значительной продолжительности существова-
1.3. Основные типы процессов в атмосфере
51
ния; достигающей 70 лет, они постепенно проникают в страто-
сферу, где под действием ультрафиолета солнечной радиации
разлагаются с выделением активных атомов брома:
CF3Br + /zv -> *CF3 + Вг*
CF2ClBr + /zv -> *CF2C1 + Br*
Другие соединения брома, такие как бромистый водород
(НВг), его органические соединения, разлагаются под действием
различных факторов уже в тропосфере с выделением активных
атомов брома, роль которых значительна в химических процес-
сах разложения озона, протекающих в верхней тропосфере. Об-
щая схема цикла брома разрушения озона:
Вг‘ + О3 —> ВгО‘ + О2
ВгО* + О* —> Вг* + О2
Один атом брома в этом цикле может разрушить до ста ты-
сяч молекул О3, прежде чем будет тем либо иным способом де-
зактивирован.
Химические свойства бромистого водорода проявляются в
большей легкости реагирования с гидроксилом по сравнению с
хлористым водородом, хотя с метаном атомы брома в отличие от
атомов хлора не взаимодействуют.
Для цикла брома показательными являются реакции, не
имеющие аналогов в подобном цикле хлора:
ВгО* + ВгО‘ -> 2Вг* + О2
ВгО* + hv -> Вг* + О*
ВгО* + NO -> Вг* + NO2
Bro* + но* -> вг* + но;
ВгО* + О3 —> Вг* + 2О*2
Другая отличительная особенность проявляется в реакции
оксида брома с оксидом хлора, протекание которой сопровожда-
ется образованием активных атомов хлора и брома:
ВгО’ + СЮ* -> С1* + Вг’ + О2
Приведенные в качестве примеров циклы хлора и брома на-
глядно иллюстрируют разрушающее влияние незначительных
52
Глава первая. Физико-химические процессы в атмосфере
количеств радикальных частиц на состояние атмосферного озо-
на. Учитывая прогрессирующее нарастание этих процессов, соз-
дающее угрозу существованию защитного озонового слоя Земли,
международному сообществу необходимо выработать стратегию
действий, направленных на снижение и предотвращение этой
опасности.
1.3.3.6. Хроника озонового кризиса
В октябре 1987 г. замеры содержания озона в стратосфере
над британской станцией Хали-Бей в Антарктиде дали 125,
в 1985 г. - 150, в 1984 г. - 190, в 1979 г. - 273 еД (1 еД эквива-
лентна толщине слоя озона 0,01 мм). Иначе говоря, с 1979 г. в
стратосфере над Антарктидой озона стало вдвое меньше — поя-
вилась «озоновая» дыра на высоте 10—20 км, площадь которой
около 10 млн км2. Сходная дыра зияла и над Северным полюсом
с января до марта 1988 г.
В 1892 г. бельгийский химик Ф. Сварте впервые получил
фторхлоруглероды (chlorofluorocarbons — CFC) — производные
метана. Практическое применение они нашли в качестве хладоа-
гентов, пропеллентов в аэрозольных упаковках, вспенивателей и
растворителей. Этому способствовало уникальное сочетание по-
требительских свойств CFC — они негорючи и нетоксичны, т. е.
безопасны для применения в бытовых целях.
Широкое применение нашли CFC-111 (CFC13), CFC-12
(CF2Cl2),CFC-22 (CHF2C1) и CFC-113 (CC12FCC1F2). Максималь-
ный рост производства CFC наблюдался в 1960—1970-х гг.
В этот же период происходило быстрое увеличение их концен-
траций в атмосфере в среднем на 12—15 % в год.
В 1974 г. была опубликована статья американских ученых
М. Молины и Ф. Роуленда, в которой они изложили гипотезу о
разрушающем действии фреонов (CFC) на стратосферный озон.
В 1995 г. им совместно с немецким химиком П. Крутценом была
присуждена Нобелевская премия за цикл работ в области химии
озона. Основные положения выдвинутой гипотезы сводятся к
следующим пунктам.
1. CFC (фреоны) — продукты исключительно антропогенной
деятельности, вследствие чего промышленное производство оп-
ределяет масштабы их поступления в тропосферу.
1.3. Основные типы процессов в атмосфере
53
2. Учитывая уникальную химическую инертность и значи-
тельный период существования CFC (до 150 лет), естественным
путем стока из тропосферы является их постепенный перенос в
стратосферу.
3. В условиях стратосферы под действием коротковолнового
ультрафиолетового излучения Солнца протекают фотохимиче-
ские реакции диссоциации фреонов с выделением активных ато-
мов хлора, например:
cfci3 + hv —x<23gH^- > cfci; + Cl*
CF2C12 + hv —X<22?H^- > CF2C1* + Cl* (1.37)
4. Высвободившиеся активные атомы хлора дают начало ре-
акциям хлорного цикла:
С1* + О3 -> СЮ* + 02
СЮ* + О* -> С1* + 02
Последствия этой публикации вылились в многочисленные
попытки математического моделирования различных вариантов
убыли стратосферного озона в зависимости от масштабов произ-
водства CFC. Оказалось, что для получения реальной картины
необходим учет большого количества реакций с участием око-
ло 50 реактантов на фоне сложных и слабо изученных процессов
динамики стратосферы. В результате обнаружилось значитель-
ное несовпадение итогов расчетов различных групп теоретиков,
достигающее в ряде случаев 5—10-кратных значений. Вместе с
тем наблюдалось углубление и детализация химии стратосферно-
го озона, в силу чего прогнозы становились все более реалистич-
ными и менее драматичными, о чем свидетельствует снижение
величины оценки степени истощения озонового слоя с 20 %
в 1976 г. до 2—4 % в 1984 г., приводимой в докладах Националь-
ной академии наук США.
Эти сценарии убыли общего содержания озона и их послед-
ствия, доведенные СМИ до общественности, вызвали острую ре-
акцию и требования запретить CFC в аэрозольных упаковках.
В 1983 г. Швеция, Финляндия и Норвегия представили на
обсуждение международной организации при ООН проект дого-
вора о запрете использования CFC в аэрозольных упаковках, ко-
торый в 1985 г. поддержали США. Однако подписанная в том же
54
Глава первая. Физико-химические процессы в атмосфере
1985 г. Венская конвенция ограничилась призывом ко всем стра-
нам проявить ответственность за сохранность озоносферы.
Следующий этап активизации международной общественно-
сти совпал с публикацией в 1985 г. сообщения о феномене, по-
лучившем название «антарктической озоновой дыры». Он состо-
ит в сезонной (конец южнополярной зимы — начало весны)
убыли общего содержания озона, регистрируемой антарктиче-
скими станциями. Авторы публикации всю вину за возникнове-
ние озоновой «дыры» над Антарктидой возложили на CFC.
В 1987 г. в Монреале был выработан и подписан представителя-
ми 43 стран Протокол об озоноразрушающих веществах, преду-
сматривающий замораживание и последующее сокращение про-
изводства наиболее опасных для озонового слоя соединений.
В 1990 г. в Лондоне был подписан Протокол, который предпола-
гает полное прекращение производства и использование CFC
с 2000 г. Таким образом, впервые в истории человечество проде-
монстрировало возможность достижения соглашения, преду-
сматривающего предотвращение непреднамеренного глобально-
го ущерба биосфере.
1.3.3.7. Проблема заменителей фреонов
Введенный международным сообществом запрет на произ-
водство и применение CFC высветили проблему заменителей
фреонов, обладающих равноценным набором потребительских
свойств, но отличающихся меньшей агресивностью по отноше-
нию к стратосферному озону. В роли таких заменителей успеш-
но применяются галогенуглеводороды — фторхлоруглеводороды
(HCFC) типа CHFC12, CHF2C1 и т. п., фторуглеводороды (HCF)
типа C2HF5 и C2H2F4.
Попадая в тропосферу, эти соединения взаимодействуют с
радикалами гидроксила:
CHF2C1 + НО* -э CF2C1‘ + Н2О
Образующаяся радикальная частица (CF2C1‘) в результате
фотолиза коротковолновым ультрафиолетовым излучением от-
щепляет возбужденный атом хлора (реакция 1.37), который дает
начало циклу хлора.
Вследствие последовательного ступенчатого превращения
озоноразрушающий потенциал у HCFC значительно ниже, чем
1.3. Основные типы процессов в атмосфере
55
для CFC. Если принять озоноразрушающий потенциал для CFC13
равным 1,00, то для CHF2C1 он оценивается величиной 0,04.
Образовавшийся радикал CF2C1* в условиях нижней тропо-
сферы является родоначальником цикла следующих химических
превращений, в результате чего образуется дифторфосген COF2:
CF2C1‘ + О2 -> OOCF2C1‘
oocf2ci‘ + NO -> OCF2C1* + no2
ocf2ci o=c + ci*
¥
(Дифторфосген)
При разложении в тропосфере других фторхлоруглеводородов
появляются соединения — токсиканты, представленные смесью
дифторфосгена и фторхлорфосгена, содержание которых в атмо-
сфере повышается с ростом мощностей по производству фтор-
хлор- и фторуглеводородов, а это приводит к возникновению но-
вой проблемы — ликвидации и устранению их массированного
отравляющего воздействия на живые организмы, контактирую-
щие с атмосферой. Рассмотренная ситуация замены фреонов на
фторхлоруглеводороды не решает в полной мере проблемы обес-
печения безопасности биосферы. Следствием этого является на-
ращивание усилий в области отыскания веществ и синтеза новых
соединений с высокими потребительскими свойствами и инерт-
ностью по отношению к биоте и атмосферному озону.
1.3.3.8. Озоновые дыры
Гипотеза антропогенного воздействия на озоновый слой ба-
зируется на идее о том, что происходит разложение озона, вы-
званное разрушающим воздействием фреонов, которое наиболее
ярко проявляется в образовании озоновой дыры в районе южно-
го полюса Земли. В зоне над Антарктидой расположен так назы-
ваемый циркумполярный вихрь (рис. 1.7), т. е. замкнутая воз-
душная масса, формирующаяся зимой в стратосфере. Фреоны,
присутствующие в атмосфере, над Антарктидой попадают в об-
ласть существования циркумполярного вихря, где в условиях
изоляции на время южнополярной зимы и начало весны не про-
56
Глава первая. Физико-химические процессы в атмосфере
исходит обмена воздушными массами. Внутри вихря при сверх-
низких температурах на кристалликах льда стратосферных обла-
ков адсорбируются оксиды азота, которые в свою очередь связы-
вают радикальные частицы оксида хлора СЮ*:
С1О(’газ) + NO2(MC)-> C1ONO2(mc)
Денитрификация (уменьшение содержания соединений азо-
та) атмосферы сопровождается снятием торможения хлорного
цикла, и процесс катастрофического разрушения озона идет бес-
препятственно. Лишь к середине весны полярный вихрь распа-
дается, и озоновая дыра начинает затягиваться поступлением
потоков обогащенного озоном воздуха. Схема образования ве-
сенней антарктической озоновой дыры показана на рис. 1.8.
Содержание активного хлора в районе озоновой дыры обыч-
но бывает в 100 и даже 400 раз выше, чем в окружающих облас-
тях атмосферы, что весьма проблематично при образовании его
из фторхлоруглсродов в условиях полярной ночи. Очевидно, что
источники свободного хлора в виде легко разрушаемых его со-
1.3. Основные типы процессов в атмосфере
57
В темноте полярной ночи
1. Образование полярных стратосферных
облаков
В свете восходящего весеннего солнца
3. Образование атомов хлора
Cl2+Av — 2CI;
HOCI + hv —► ОН + CI;
CI + оз —CIO+ О2
2. Активация О2
4. Цепное разрушение озона
сю + сю — ci^;
CI2O2+Av — 2Cl+O2
2CI + 2О3—*2СЮ + 2О2
Результат: 2О3 —ЗО2
Рис. 1.8. Схема образования весенней антарктической озоновой дыры (5]
единений должны находиться на континенте в районе располо-
жения циркумполярного вихря. Такими источниками хлористого
водорода могут быть антарктические вулканы Эребус, Бэрд и Те-
ра-Нова. Высота Эребуса 3794 м и вершина ни одного другого
вулкана Земли не приближается к стратосфере ближе. Интен-
сивное извержение вулкана, сопровождающееся выбросом газа
из фумарол со скоростью свыше 700 км/ч, позволяет перемес-
тить значительное количество хлорсодержащих соединений в
стратосферу. По оценкам вулканологов, суточная эмиссия газо-
вых выбросов в пересчете на НС1 составляет в среднем 90 т, что
в условиях существования циркумполярного вихря способствует
появлению предельно высоких содержаний активного хлора в
стратосфере. Дальнейшее превращение хлористого водорода воз-
можно по реакции с соединением C1ONO2, ранее адсорбирован-
ным кристалликами льда стратосферных облаков:
НС1(апс) + ClONO2(edr)->
^^2(газ) + НМО3(адс)
С12 —Л-Уф > 2СГ
Полученные фотохимическим путем радикалы СГ участвуют
в разрушении озона, как это показано на схеме образования ве-
сенней антарктической озоновой дыры.
58
Глава первая. Физико-химические процессы в атмосфере
Большинство ученых пришло к согласию, что над Антаркти-
дой наблюдается реальный процесс антропогенного воздействия
на озоновый слой, хотя нельзя исключить из рассмотрения, что
основной источник хлора, разрушающего озон, находится непо-
средственно на антарктическом континенте.
В литературе имеются и другие взгляды на образование озоно-
вых дыр и разрушение озонового слоя. Так, в качестве одного из
механизмов рассматривается участие в разрушении озона клат-
ратных гидратов — твердых соединений газов с водой. Несколько
лет назад М. В. Толкачев обосновал гипотезу о том, что во многом
еще загадочные серебристые облака на высотах 70—100 км есть не
что иное, как скопление гидратов озона. Здесь при низких темпе-
ратурах, (минус 70 — минус 90 °C), значительном парциальном
давлении пересыщенного водяного пара, при слабых давлениях
азота, кислорода и малых газовых компонентов последние могут
превращаться в твердые соединения — газовые гидраты.
Макрокомпоненты воздуха (азот и кислород) и фреоны, об-
наруженные в зоне формирования озонной дыры, при низких
температурах, реагируя с водой, дают твердые соединения типа
М • 5,75 Н2О, где символом М обозначены молекулы газов. Га-
зовые гидраты похожи на снег и лед, в полостях которых распо-
лагаются молекулы газов. Они могут играть двоякую роль. Так,
они участвуют в механическом выносе озона из стратосферы
перемещаясь в нижние, более теплые приземные слои, где раз-
лагаются и выделяют озон.
Другой механизм обусловлен фотохимическими и так назы-
ваемыми радикальными реакциями, в том числе разложением
озона в кристалликах гидратов. Дело в том, что при облучении
твердых фаз идет фотоперенос — образуются свободные электро-
ны и радикалы, что сильно ускоряет реакции разложения озона.
Все это резко снижает концентрацию озона в стратосфере.
Другой не менее важной причиной, вызывающей разруше-
ние озонового слоя, может служить увеличивающееся количест-
во аэрокосмических средств, пробивающих дыры в озоновом
слое и превращающих его в своеобразное решето.
В начале 60-х гг. XX в. на уровне правительств Англии и
Франции была достигнута договоренность о проектировании и
производстве совместного сверхзвукового самолета «Конкорд».
Было запланировано построить 300 авиалайнеров, нацеленных
на трансатлантические перелеты между Европой и Америкой.
1.3. Основные типы процессов в атмосфере
59
Так как англо-французский проект значительно опережал в соз-
дании такого самолета американские разработки, ведущие аме-
риканские авиастроительные корпорации сделали все возмож-
ное, чтобы не допустить «Конкорд» к эксплуатации на американ-
ских линиях. С этой целью в США начались широкомасштабные
исследования по выявлению влияния полетов сверхзвуковых
лайнеров на состояние озонового слоя, которые совпали с пер-
выми полетными испытаниями в 1969 г. опытных образцов
«Конкорда». В середине 70-х гг. был опубликован многостранич-
ный отчет, в котором акцент был сделан на пугающих свойствах
жесткого ультрафиолетового излучения, которое непременно
многократно возрастет при истощении озонового слоя вследст-
вие предстоящих полетов «Конкорда».
Как известно, в выхлопных струях всех реактивных самоле-
тов содержится до 0,1 % оксидов азота, молекулы которых игра-
ют значительную роль в разрушении молекул стратосферного
озона (см. п. 1.3.3.4). Было показано, что до момента своего ис-
чезновения каждая молекула оксида азота способна разрушить в
среднем около 10 молекул озона.
Однако главной опасностью для озонового слоя являются не
пассажирские сверхзвуковые, а боевые самолеты, которые лета-
ют в областях максимальных концентраций озона на высотах
20—50 км и число которых на вооружении мировых держав дос-
тигает нескольких тысяч единиц. Кроме того, существенный,
если не преобладающий, вклад в разрушение озонового слоя
вносят запуски твердотопливных ракет-носителей типа «Са-
турн». Эти ракеты доставляют вредные для молекул озона веще-
ства в виде хлора, его соединений, оксидов азота в стратосферу
до 200 т на один запуск. Один полет космического челнока
«Шаттл» способен разрушить до 10 млн т озона, т. е. около 0,3 %
его общего содержания в земной атмосфере. Такие катастрофи-
ческие для озонового слоя последствия вызваны использованием
в этих аппаратах окислителя топлива — перхлората аммония
(NH4C1O4).
Вследствие этого странам — членам клуба космических дер-
жав необходимо разработать и принять к использованию ком-
плекс мер, сдерживающих и снижающих выброс в атмосферу ве-
ществ, разрушительно действующих на сохранность озонового
слоя. В числе этих мер следует предусмотреть установление меж-
дународных квот на количество и частоту запуска твердотоплив-
60
Глава первая. Физико-химические процессы в атмосфере
ных ракетоносителей, а впоследствии ограничить и даже запре-
тить их запуски.
В этом отношении следует заметить, что самые экологически
чистые компоненты ракетного топлива (водород, кислород и ке-
росин) применяются в ракете «Энергия».
Подытоживая все сказанное, стоит отметить, что уменьше-
ние толщины озонового слоя Земли связано как с развитием ес-
тественных процессов выбросов в атмосферу озоноразрушающих
веществ, так и с антропогенной деятельностью. Последний фак-
тор влияния на толщину озонового слоя должен так регулиро-
ваться мировым сообществом, чтобы состояние защитного пояса
Земли не вызывало тревог у населения нашей планеты.
Контрольные вопросы
1. Дайте определение основных типов фотохимических реакций.
2. Как протекает фотосенсибилизированное превращение молекулярно-
го кислорода?
3. Что такое свободные радикалы и как они образуются в атмосфере?
4. Приведите примеры фотохимических реакций кислорода.
5. Как описывается механизм образования озона теорией С. Чепмена?
6. Какие параметры и компоненты атмосферы определяют кинетику
процессов образования и разложения озона?
7. Назовите главные источники возникновения озонового кризиса.
8. Каков вклад, вносимый в разрушение озонового слоя аэрокосмиче-
скими объектами.
9. Как влияют антропогенные воздействия на химический состав атмо-
сферы?
1.4. Климат и парниковый эффект
Погода и климат интересуют всех. Если погода затрагивает
лишь привычки и личные планы людей, то климат чрезвычайно
важен для всей жизни человечества. Беды несет не только похо-
лодание, потепление климата также обернется катастрофой.
Носителем климата является атмосфера, которая чрезвычай-
но уязвима для антропогенного влияния. Самые уязвимые к
1.4. Климат и парниковый эффект
61
внешним воздействиям, наиболее изменчивые факторы клима-
та — это прозрачность атмосферы и альбедо поверхности и ат-
мосферы. Совокупность среднемноголетних характеристик атмо-
сферы, гидросферы и суши мы называем климатом. Основная
климатическая характеристика — температура у поверхности
Земли — изменилась за время эволюции биоты относительно
мало: при современном среднем значении глобальной темпера-
туры 288 К (т. е. 15 °C) изменения с учетом ледниковых перио-
дов не превышали 10—20°. Причины изменения климата следует
разделить на земные и космические. К земным факторам отно-
сятся те, которые слагают радиационный баланс планеты, т. е.
соотношение между теплом, которое планета усваивает от Солн-
ца и сама отражает или излучает в мировое пространство. Эти
так называемые радиационные факторы климата включают в
себя отражающую способность (альбедо) верхних слоев атмосфе-
ры, облачного покрова, поверхности земли и океана, прозрач-
ность и излучение атмосферы. Неравномерный нагрев суши и
океана порождает воздушные и океанические течения, теплооб-
мен между океаном, сушей и атмосферой. Все это называют
циркуляционными факторами климата.
Космические факторы климата — это прежде всего свети-
мость Солнца, параметры земной орбиты и влияние на них дру-
гих небесных тел.
Основным источником тепла в тропосфере и в низкоши-
ротных зонах является поверхность Земли. Тепловая энергия
Передается за счет конвекции, вызывающей образование обла-
ков и осадков. Атмосфера передает энергию в космическое
пространство в результате радиационного охлаждения. Однако
поскольку в стратосфере плотность водяных паров чрезвычайно
низка, доминирующими процессами становятся нагревание в
результате поглощения озоном ультрафиолетового излучения, с
одной стороны, и охлаждение за счет инфракрасного излучения
озона и диоксида углерода, с другой стороны. В мезосфере, на
высотах более 50 км, охлаждающий эффект СО2 становится су-
щественным. Следует отметить, если водяной пар присутствует
равным образом в нижней части тропосферы, а озон — в стра-
юсфере, то СО2 распределен равномерно в каждом слое. Расче-
ты указывают на следующее обстоятельство: при увеличении
концентрации СО2 в атмосфере вдвое температура поверхности
возрастет на 3,6 °C, и наоборот, она снизится на 3,8 °C при та-
62
Глава первая. Физико-химические процессы в атмосфере
ком же уменьшении концентрации СО2. Таким образом, под-
держивается радиационное равновесие на земной поверхности.
Вследствие этого проблема долгосрочного изменения климата
(которое, как предполагается, зависит от влияния СО2 на излу-
чение Земли) будет зависеть от концентрации СО2 в атмосфере,
находящейся в равновесии с океанской водой и твердым СО2
на дне океана.
Приведенные на рис. 1.9 отклонения усредненной темпера-
туры в северном и южном полушариях и в целом на земном
шаре за полтора столетия (измерения проводятся с 1850 г.) от
среднего значения базового периода (1961 — 1990 гг.) указывают
на тенденцию заметного потепления, что может быть связано с
парниковым эффектом.
Сторонники другой точки зрения утверждают, что основной
причиной климатических изменений являются изменения как
самой солнечной радиации, так и прозрачности атмосферы.
Заметное уменьшение солнечной постоянной является при-
чиной снижения температуры земной поверхности. Причиной
уменьшения солнечной радиации может быть снижение про-
зрачности земной атмосферы, которое, в свою очередь, обуслов-
лено присутствием в атмосфере частиц пыли.
Кроме глобального потепления, нам угрожает еще и гло-
бальное потемнение. К такому выводу пришли геофизики, под-
ведя итоги проводившихся полвека измерений дневной осве-
щенности в разных частях земного шара. Английский ученый
Дж. Стэнхилл, работающий в Израиле, обнаружил, что за по-
следние 50 лет освещенность этого региона днем упала на 22 %.
Просмотрев данные из других стран, он нашел, что за это время
в США стало темнее на 10 %, в некоторых районах бывшего
СССР — почти на 30 %, на Британских островах освещенность
упала на 16 %.
Этот вывод подтверждают и австралийские специалисты. Яв-
ление, видимо, связано с загрязнением атмосферы. Мельчайшие
частицы сажи из выхлопных труб автомобилей и заводских ды-
моходов экранируют часть солнечного света и усиливают отра-
жающую способность облаков и атмосферы в целом. Пока про-
стым глазом этот эффект не заметен, но он, несомненно, по-
влияет на многие аспекты жизни на Земле — от климата до
работы солнечных электростанций и даже фотосинтеза растений.
1.4. Климат и парниковый эффект
63
Рис. 1.9. Общее представление о глобальном потеплении за период с 1856 по
2001 г. (аномалии вычислены как отклонения от среднего значения базового пе-
риода: 1961—1990 гг.) [6]
64
Глава первая. Физико-химические процессы в атмосфере
Аэрозольный эффект может быть более существенным, чем
эффект СО2. При этом учитываются рассеяние и абсорбция как
солнечной, так и земной радиации при неопределенном количе-
стве по размерам и отражательным свойствам аэрозолей. Если
считать существующую в настоящее время оптическую плот-
ность слоя пыли равной 0,1, то ее увеличение в 2—10 раз окажет
подавляющее действие на солнечную радиацию. Оптическая
плотность — это мера непрозрачности слоя вещества для свето-
вых лучей. Она характеризует ослабление оптического излучения
в слоях различных веществ. Для неотражающего слоя вещества
она численно равна логарифму отношения интенсивности света,
падающего на поглощающую среду, к интенсивности света, про-
шедшего через эту среду. В то же время излучаемая Землей ин-
фракрасная радиация существенно не изменится, что приведет в
результате к сильному охлаждению земной поверхности. Соглас-
но расчетам увеличение непрозрачности атмосферы в 4 раза вы-
зовет уменьшение температуры поверхности на 3,5 °C, что будет
достаточным для наступления ледниковой эпохи.
Хозяйственная деятельность цивилизации давно сказывается
на составе атмосферы и оставляет следы на поверхности плане-
ты, меняет альбедо.
Современные инструментальные методы позволили в тече-
ние ряда лет следить за содержанием в атмосфере микрогазов,
которые находятся в ней в концентрации нескольких частей на
миллион (ppm) и даже нескольких частей на миллиард (ppb).
Это углекислота, метан, оксиды азота, органические соединения
серы, галогеноуглеводороды.
Увеличение содержания микрогазов в атмосфере имеет два
наиболее важных последствия. Во-первых, должно измениться
равновесие, которое держится в атмосфере за счет фотохимиче-
ских реакций. Так, отмечено возрастание в атмосфере концен-
траций метана и монооксида углерода. Последний образуется
примерно в равных количествах как техногенный газ и вторично
за счет фотохимического окисления в атмосфере углеводоро-
дов — терпенов и изопренов, продуцируемых древесной расти-
тельностью в объеме около 1,5 млн т в год.
Во-вторых, такие микрогазы, как углекислота, метан, закись
азота, относятся к так называемым парниковым газам, удержи-
вающим отраженное инфракрасное излучение. Парниковый эф-
фект может существенно повлиять на климат Земли, известны
1.4. Климат и парниковый эффект
65
прогнозы на вероятное потепление. По современным расчетам,
более половины эффекта приходится на возрастание концентра-
ции углекислоты и примерно треть — на метан. В будущем из-за
высокой скорости прироста метана и оксида диазота (N2O), надо
полагать, суммарный эффект этих микрогазов сравняется с
влиянием углекислоты.
Пожары, наводнения, засухи, ураганы и смерчи — все обру-
шилось на Землю в 1997 г. Причиной этих бедствий метеорологи
считают возвратное движение течения Эль-Ниньо в Тихом океа-
не. Огромная масса воды, нагретой в экваториальной зоне океа-
на, обычно перемещается от берегов Южной Америки вдоль эк-
ватора в сторону Азии. Время от времени она поворачивает об-
ратно и течет от Азии к Америке. Эль-Ниньо в плане — это
вытянутый язык сильно нагретой воды. Нагретая вода интенсив-
нее испаряется и быстрее «накачивает» атмосферу энергией.
Эль-Ниньо передает атмосфере 450 миллионов мегаватт, что
равносильно мощности 300 000 больших атомных электростан-
ций. Понятно, что в соответствии с законом сохранения энергии
эта энергия не исчезает, а реализуется в различных катастрофи-
ческих проявлениях (смерчи, ураганы, цунами и т. д.).
Недавние расчеты германского климатолога Латифа показы-
вают, что нагрев земной атмосферы увеличивает размеры и дей-
ствие экваториального течения в Тихом океане. Не в этом ли
причина, что лишние полтора-два градуса, на которые за по-
следние годы по причине усиливающегося парникового эффекта
нагрелась атмосфера, уже как-то влияют на океанскую машину
погоды?
Советский климатолог и метеоролог, член-корреспондент
АН СССР М. И. Будыко еще в 1962 г. первым высказал предпо-
ложение о том, что сжигание человечеством огромного количе-
ства разнообразных топлив неизбежно приведет к тому, что со-
держание СО2 в атмосфере будет увеличиваться. А он, как из-
вестно, прозрачен в видимой части спектра и беспрепятственно
пропускает солнечные лучи, но хорошо поглощает длинновол-
новое инфракрасное излучение как раз в той части спектра, в
которой Земля излучает в мировое пространство собственное те-
пло, что приводит к эффекту, который наблюдается в застеклен-
ных парниках.
В 1987 г. был издан доклад Международной комиссии, воз-
главлявшейся премьер-министром Норвегии Г. X. Брундтланд, в
3 - 4054 Трифонов
66
Глава первая. Физико-химические процессы в атмосфере
котором сказано, что «трудно представить себе проблему с более
глобальными последствиями для человеческого общества и есте-
ственной окружающей среды, чем парниковый эффект» [2].
В мае 1988 г. Международное совещание по парниковому эф-
фекту в Оттаве обратилось к правительствам всех стран с призы-
вом сократить к 2000 г. количество сжигаемых топлив хотя бы на
20 % и тем самым замедлить процесс потепления.
В докладе комиссии Г. X. Брундтланд высказывается опасе-
ние, что парниковый эффект может вызвать подъем уровня Ми-
рового океана от 25 до 140 см, в результате чего «будут затоплены
низкорасположенные города и сельскохозяйственные районы».
Эти опасения были вызваны предположением, что при повыше-
нии температуры воздуха растают материковые льды Антарктиды
и Гренландии. Однако такое предположение нельзя считать
обоснованным. Дело в том, что углекислый газ не только погло-
щает излучение Земли, он еще увеличивает излучательную спо-
собность атмосферы. А это, наоборот, должно способствовать
выхолаживанию. Правда, кроме углекислого газа, в воздухе рас-
тет концентрация и других газов, которые могут вызвать парни-
ковый эффект — метана, оксидов азота.
Вместе с углекислым газом при сгорании топлива выбрасы-
вается огромное количество аэрозолей — летучей золы, сажи.
Топливо всегда содержит серу, поэтому атмосфера впитывает
сернистый газ, который превращается в аэрозоли серной кисло-
ты и сульфата аммония. Аэрозоли из труб котельных, электро-
станций, заводов влияют на климат так же, как и вулканы, т. е. в
сторону похолодания, уравновешивая тем самым эффект парни-
ковых газов. Однако пока антропогенные аэрозоли имеются в
атмосфере в небольшом количестве по сравнению с природны-
ми, и вследствие этого их пагубное влияние сказывается только
в региональном масштабе. Сажевые аэрозольные частицы дейст-
вуют и в противоположном направлении: осаждаясь на арктиче-
ских льдах, они снижают альбедо полярных шапок, способству-
ют таянию льдов.
Следовательно, потепление, связанное с парниковым эффек-
том, не будет сопровождаться значительным таянием льдов и не
грозит резким повышением уровня Мирового океана. Вместе с
тем необходимо учитывать другие возможные катастрофические
последствия парникового эффекта, как это проявляется в случае
экваториального течения Эль-Ниньо.
1.4. Климат и парниковый эффект
67
Глобальное потепление также влияет на скорость вращения
планеты. По расчетам бельгийского астронома О. де Вирона, к
концу XXI в. из-за потепления сутки станут на 0,00011 секунд
длиннее, чем сейчас. Де Вирон и его коллеги из Королевской
обсерватории в Брюсселе исходят из того, что ежегодно количе-
ство углекислого газа в атмосфере увеличивается на один про-
цент. С изменением плотности воздуха атмосферное давление
становится меньше, а значит суша и океан немного приподни-
маются. Это неприметное перемещение масс замедляет движе-
ние Земли. Кроме того, меняется роза ветров, и все чаще ветер
дует в восточном направлении, как и при Эль-Ниньо.
Представленный в данном разделе материал подтверждает
точку зрения большинства исследователей, возлагающих ответ-
ственность за глобальное потепление климата на возросшую ан-
тропогенную деятельность. Одновременно с этим преобладаю-
щее в настоящее время мнение связывает человеческую деятель-
ность не только с ростом температуры воздуха, но и с частотой и
интенсивностью проявления многих климатических феноменов,
таких как ураганы «Рита» и «Катрин», цепь сменяющих друг
друга тайфунов и торнадо, обрушившихся на побережье Север-
ной Америки.
Осознание человечеством нарастающей угрозы катастрофи-
ческого глобального потепления привело к тому, что решение
проблемы радикального уменьшения выбросов парниковых газов
стало первоочередной задачей мирового сообщества. Первым ре-
альным действием, направленным на ее решение, является под-
писанный 121 страной в декабре 1997 г. Киотский протокол.
В нем ставится цель сократить развитыми в промышленном от-
ношении странами к 2008—2012 гг. суммарные выбросы диокси-
да углерода на 5,2 % по сравнению с выбросами 1990 г. Договор
ратифицировали до 2005 г. 120 стран, включая все европейские
страны, Японию, Индию и Китай, ответственных за выбросы в
атмосферу примерно 44 % углекислоты. По условию, Протокол
вступает в действие лишь после его ратификации странами, на
долю которых приходится суммарно не менее 55 % производимо-
го в мире углекислого газа. Доля России составляет 17 % миро-
вых выбросов, и поэтому ее позиция оказалась решающей в судь-
бе Киотского протокола. После ряда лет ожесточенных дискус-
сий общественность России и ее государственные органы
высказались в пользу его ратификации, которая произошла в
68
Глава первая. Физико-химические процессы в атмосфере
феврале 2005 г. С 16 февраля 2005 г. Киотский протокол вступил
в действие. Этот акт мирового сообщества подтверждает целесо-
образность и необходимость совместных усилий, направленных
на предотвращение возможных проявлений глобальных катаст-
рофических последствий человеческой деятельности.
1.4.1. Парниковые газы
Парниковые газы — водяной пар, углекислый газ, метан,
фтор- и хлорсодержащие углеводороды, монооксид азота — про-
зрачны для солнечного света, но не пропускают и поглощают те-
пловое инфракрасное излучение земной поверхности. Парнико-
вое «одеяло» из газов создает на Земле условия, пригодные для
органической жизни. При отсутствии в атмосфере парниковых
газов средняя температура земной поверхности упала бы до ми-
нус 19 °C, и Земля была бы окутана слоем льда.
Вынос в атмосферу углекислого газа, метана и монооксида
азота антропогенного происхождения усиливают природный
парниковый эффект. Выбросы в атмосферу диоксида углерода
создают около 60 % дополнительного парникового эффекта, ме-
тана — примерно 20 %, 6—7 % приходится на монооксид азота и
на другие соединения углерода — еще 14 %.
Учитывая наибольший вклад в создание парникового эффек-
та углекислого газа и метана, рассмотрим более подробно их по-
ведение и превращения в атмосфере.
1.4.1.1. Диоксид углерода
Ежегодно сжигаются миллиарды тонн топлива, из-за чего в
атмосферу поступает все больше углекислого газа (рис. 1.10).
С 1800 г. до начала XXI в. концентрация диоксида углерода
(СО2) в атмосфере увеличилось с 280 до 360 ppm.
Это важнейший показатель для биосферы, так как СО2,
во-первых — парниковый газ, который вместе с водяным па-
ром, метаном, оксидами азота определяет парниковый эффект,
а следовательно, и климат, и, во-вторых, он — основная пиша
растений.
Атмосферный диоксид находится в состоянии постоянного
обмена с водами морей и океанов, почвами и живыми организ-
1.4. Климат и парниковый эффект
69
Рис. 1.10. Выброс СО2 в атмосферу (млрд т)
мами, в результате чего создается постоянный кругооборот его в
природе.
При подсчете баланса углекислоты обычно учитывают, с од-
ной стороны, поглощающую способность океана и способность
растений ассимилировать СО2, с другой — углекислоту, выделяе-
мую при сжигании топлив, что соответствует 5 млн т в год.
В зависимости от величины pH воды углекислота встречается
в ней в свободном состоянии в виде диоксида углерода СО2 или в
связанном в виде гидрокарбонат HCOJ и карбонат СО*" ионов,
которые связаны между собой так называемым углекислотным
равновесием [7].
СО2 + Н2О <-> Н2СО3 <-> Н+ + НСО3 <-> 2Н+ + СО23- (1.38)
При наличии в воде катионов кальция углекислотное равно-
весие выражается уравнением:
Са2+ + 2HCOJ о СаСО3 + СО2 + Н2О (1.39)
По закону действующих масс константа равновесия этой ре-
акции будет записана в следующем виде:
[СаСО3][СО2][Н2О]
[Са2+][НСО3]2
70
Глава первая. Физико-химические процессы в атмосфере
Если учесть, что [Н2О] и [СаСО3] есть постоянные величины
и могут быть введены в константу, и [Са+2] = 2[НСОД (это следу-
ет из уравнения 1.39), то, подставляя вместо [Са2+] в уравнение
(1.40) его последнее значение, можно записать:
к_ [СО2]
[НСО3-]3
Из этого выражения следует, что гидрокарбонат-ионы при-
сутствуют в водном растворе только при наличии свободной уг-
лекислоты.
Таким образом, выбросам СО2 в атмосферу противостоят
процессы его фиксации водами морей и океанов. На раствори-
мость углекислоты в воде оказывают влияние не только концен-
трации СО2 в атмосфере, но и формы нахождения последней в
воде в соответствии с углекислотным равновесием и pH воды.
Другим стоком углекислоты из атмосферы является фото-
синтез растений. Биота забирала из атмосферы в процессе фото-
синтеза не только весь углерод, выделенный ею же в атмосферу
в процессах дыхания и разложения — около 100 млрд т в год, —
но и около половины углерода, содержащегося в антропогенных
выбросах, а в последние годы — около 2/3.
Попавший в атмосферу СО2 остается в ней в среднем 2—4 года.
1.4.1.2. Метан
Метан (СН4) — газ явно биогенный, хотя человечество в своей
хозяйственной деятельности косвенно поставляет его в атмосфе-
ру: идет разложение органического мусора, органики вод очист-
ных сооружений и т. д. Увеличение поголовья скота, масштабов
выращивания риса, общее повышение температуры болот — все,
что ведет к усилению микробной деятельности, способствует об-
разованию и повышению концентрации метана в атмосфере.
Максимум содержания метана расположен над высокими и уме-
ренными широтами северного полушария. Концентрация метана
возрастает примерно на 1,2 % в год. Его содержание в атмосфере
за истекшие два столетия повысилось примерно в двое и оценива-
лось к началу XXI в. величиной 4000—5000 млн т. По своей спо-
собности усиливать парниковый эффект метан в 20 раз превосхо-
дит углекислый газ.
1.4. Климат и парниковый эффект 71
Молекула метана химически довольно устойчива и ее нелег-
ко вывести из атмосферы. Метан мало растворим в воде
(30 см3/л воды), и вымывание его осадками из атмосферы не на-
блюдается. Разложение молекулы метана в атмосфере происхо-
дит в результате взаимодействия с радикалом гидроксила:
но* + сн4 н2о + сн;
Источником радикалов ОН* в тропосфере является тропо-
сферный озон, который под действием ультрафиолета с
X < 310 нм разрушается с образованием молекулы кислорода и
чрезвычайно реакционноспособного атома кислорода в возбуж-
денном электронном состоянии O('D) (реакция 1.13). Атомы ки-
слорода отрывают один атом водорода от воды и получается два
радикала ОН* (реакция 1.25).
В тропосфере протекает цепь последовательных реакций, ко-
торая приводит к выводу метана из атмосферы:
ОН* + СН4 -э СН‘з + Н2О
сн; + о2 -> сн3о;
сн3о; + no -> сн3о* + no2
сн3о* + о2 -> сн2о + но;
но; + no-> oh* + no2
2[NO2 + Av = NO + О]
2[O + O2 = O3]
CH4 + 4O2 = CH2O + H2O + 2О3
В результате последовательной цепи превращений из одной
молекулы метана образуется по одной молекуле формальдегида
(СН2О) и воды и две молекулы озона. Требуемые для осуществ-
ления реакций оксиды азота NOA находятся в атмосфере в коли-
чествах, обеспечивающих приемлемые условия.
Молекулы формальдегида, образующиеся в ходе вышеприве-
денных реакций окисления метана, обладают значительной хи-
72
Глава первая. Физико-химические процессы в атмосфере
мической активностью и в условиях атмосферы испытывают
следующие превращения:
СН2О + Av-> Н2 + СО* (1.41)
СН2О + Av -> Н* + НСО* (1.42)
СН2О + ОН* -> НСО* + Н2О (1.43)
Вероятности осуществления этих реакций оцениваются соот-
ветственно как 0,5 : 0,25 : 0,25. Реакции (1.42) и (1.43) являются
родоначальниками дальнейших циклов превращений. Цикл, в
основе которого лежит реакция (1.42), состоит из следующих ре-
акций:
СН2О + Av -> Н* + НСО*
н* + о2 -> но;
нсо* + о2 -> со + но;
2[но; + NO -> НО* + NO2]
2[NO2 + Av -> NO + О*]
2[O2 + O* = O3]
CH2O + 4O2 + Av -> CO + 2O3 + 2 OH*
Продуктами этой цепи превращений формальдегида являют-
ся две молекулы озона и два радикала ОН*.
Реакция формальдегида с радикалом ОН* открывает начало
многоступенчатой цепи превращений:
СН2О + ОН* -> НСО* + Н2О
нсо* + о2 -> со + но;
2[но; + NO -> НО* + NOJ
2[NO2 + Av -> NO + О*]
2[О2 + О’ = О3]
СН2О + 2О2 + Av -> СО + О3 + Н2О
1.4. Климат и парниковый эффект
73
Завершающей стадией на пути трансформации молекулы ме-
тана в конечные продукты служит цикл реакций, начало которо-
му дает взаимодействие образовавшегося на промежуточных сту-
пенях монооксида углерода (СО) с радикалом гидроксила:
СО + НО* -> СО2 + Н*
н* + о2-> но*2
2[но; + NO -> НО* + NOJ
2[NO2 + Av -> NO + О*]
O2 + О -> O3
CO + 2 O2 + hv —> CO2 + O3
Схема превращений метана в атмосфере выглядит так:
Схема химического стока метана в атмосфере:
Баланс по О3: [0,25 • 2(2) + 0,25(3) + 1,0(5) + 2(1) = 3,75];
Баланс по Н2О: [1,0(1) + 0,25(3) + 0,5(4) = 1,75];
Баланс по ОН*: [0,25 • 2(2) = 0,5];
Баланс по СО2: [1,0(5) =1].
74 Глава первая. Физико-химические процессы в атмосфере
В итоге вместо одной исчезнувшей в атмосфере молекулы
СН4 возникают 3,5 молекулы озона, 1,75 молекулы воды, 0,5 ра-
дикала ОН* и 1 молекула углекислого газа.
Таким образом, в основе вывода метана из тропосферы ле-
жит механизм химических превращений метана. Другие стоки
метана из тропосферы имеют меньшее значение, и их вклад не
превышает 10 % от общего стока метана.
Контрольные вопросы
1. Каковы основные причины изменения климата?
2. Каково влияние парникового эффекта на изменение климата Земли?
3. Какие газы определяют парниковый эффект?
4. Какие химические процессы лежат в основе вывода метана из атмо-
сферы?
1.5. Кислотные дожди
При сжигании любого ископаемого топлива в составе выде-
ляющихся газов всегда обнаруживаются оксиды серы и азота,
количество которых в газах определяется составом топлива. Еще
в 1950 г. теплоэлектростанции только США выбрасывали в воз-
дух около 5,4 млн т диоксида серы, а сейчас эта цифра много-
кратно увеличилась и составляет свыше 20 млн т. Эти миллионы
тонн кислых оксидов, выбрасываемые в атмосферу, превращают
выпадающие дожди и другие осадки в слабый раствор кислот
(рис. 1.11).
Сама по себе дождевая вода, образующаяся при конденсации
водяного пара, должна бы иметь нейтральную реакцию, т. е. ее
pH должен быть равен 7. Однако в воздухе присутствует диоксид
углерода (СО2), который, растворяясь в водных каплях, образует
слабую угольную кислоту Н2СО3. Поэтому условия равновесия
углекислого газа с влагой атмосферы определяют значение pH
дождевой воды, которое составляет 5,6 для концентрации СО2 в
чистом воздухе около 300 ppm (350 частей на миллион) и являет-
ся естественным показателем чистой воды. Впервые на кислую
реакцию дождевой воды обратил внимание в 1684 г. английский
ученый Р. Бойль.
1.5. Кислотные дожди
75
Рис. 1.11. Кислотность осадков (в единицах pH) на земном шаре [8]
Если pH выпадающих осадков меньше 5, то осадки считают-
ся кислыми. Они характерны для районов земного шара с высо-
кой концентрацией промышленности (Европа, Северная Амери-
ка, Япония, Китай). Веществами, определяющими кислотные
свойства осадков, являются серная, азотная, муравьиная и ук-
сусная кислоты.
10 апреля 1974 г. в шотландском городке Питлохри выпал
дождь с pH 2,4: это уже была не вода, а что-то вроде столового
уксуса.
Антропогенная деятельность является причиной выпадения
кислотных дождей из-за того, что:
• большие загрязнения атмосферы продуктами сгорания топ-
лива, отходами промышленного производства, применение
химикатов, автотранспорт определяют большие потоки
первичных кислых примесей, которые могут вносить суще-
ственный вклад в кислотность атмосферы;
• среднее время существования загрязнений зависит от: ста-
бильности атмосферы, частоты выпадения осадков, при-
сутствия индивидуальных компонентов атмосферы и т. д;
• большинство загрязнений остается в пределах нижней час-
ти тропосферы и относительно равномерно распределено
внутри перемешивающегося слоя;
76
Глава первая. Физико-химические процессы в атмосфере
• увеличение потоков кислотности к поверхности земли воз-
никает за счет атмосферных осадков с повышенной ки-
слотностью («мокрое осаждение») и за счет адсорбции и
выпадения в осадок газов и аэрозолей («сухое осаждение»).
7.5Л. Превращения кислых оксидов и хлорводорода
и формы существования продуктов превращений
в атмосфере
Наряду с сернистым газом (SO2) и оксидами азота (NOX) зна-
чительный вклад в образование кислотных дождей вносят соеди-
нения хлора, в особенности хлористый водород (НС1). Выяснение
возможностей превращения этих соединений в формы веществ,
стабильно существующих в условиях атмосферы и аккумулирую-
щихся в областях с повышенными влагосодержанием и концен-
трацией аэрозолей, а затем выпадающих в виде осадков на зем-
ную поверхность, является важной задачей, решение которой по-
зволит минимизировать урон, наносимый биосфере. Вместе с тем
определение и анализ возможных превращений первичных за-
грязнений SO2, NOX, НС1 — очень сложная физико-химическая
задача. Здесь в первую очередь необходимо отметить, что тип
осадка (сернокислый, азотнокислый, солянокислый, смешанный
и т. п.) определяется преобладающим в атмосфере загрязнением,
а также возможностью вторичных превращений под действием
других примесей, солнечного света и др.
Например, процесс превращения диоксида серы в сульфат в
атмосфере протекает различными путями через образование та-
ких продуктов окисления, как SO2, H2SO4, (NH4)2SO4, NH4HSO4
и т. д.:
so2 + hv —>-=*>о*з2он2 > so-
so; + О2 ->(SO4)
so2 + о + м -> so3 + м
so2 + о3 + м -> so3 + м
so2 + сн3о; so3 + сн3о‘
so2 + но; -> so3 + но‘
so2 + но* + м -> hso; + м
1.5. Кислотные дожди
77
В целом фотохимически инициированные реакции свобод-
ных радикалов вносят основной вклад в превращение SO2 в
сульфат в нижних слоях атмосферы (в формулах со знаком *).
Основные превращения оксидов азота описываются реак-
циями:
но* + no2 + м -> hono2 + м
NO2 + О3 -> О3 + О2
NO2 + NO3 + М -> Н2О5 + м
В этих реакциях азотистая кислота образуется за счет ради-
калов ОН*, а азотная — за счет реакций с озоном и взаимодейст-
вия N2O5 с водой.
Свой вклад в кислотные дожди вносит и хлористый водо-
род. Хлористый водород подвергается превращениям, в резуль-
тате которых образуется устойчивый нитрат хлора (C1ONO2).
Гидролиз этого соединения приводит к появлению двух силь-
ных кислот:
C1ONO2 + Н2О -> НС1 + HNO3
что имеет прямое отношение к появлению кислотных дождей.
Имеется большое количество химических соединений, которые
вводятся в тропосферу и находятся в ней в виде аэрозолей.
В них сильные кислоты могут существовать в газообразном со-
стоянии (HNO3, НС1), в форме водных капель (H2SO4), а также в
адсорбированном виде на поверхности твердых частиц.
Дальнейшая судьба этих кислот связана с их участием в сле-
дующих процессах.
Один из них — процесс нейтрализации серной кислоты ам-
миаком, находящимся в свободном состоянии:
H2SO4(p_p)^(H++HSO4)(p_p)
NH3(rra) + (Н+ + hso;)(p_p) <-> (NH; + HSO;)(p_p)
~ NH4HSO4 + H2O(rra3) + (NH4)2SO4(p_p)
Таким образом, в результате взаимодействия газообразного
аммиака с растворенной в дождевых каплях серной кислотой об-
разуются бисульфат (NH4HSO4) и сульфат (NH4)2SO4 аммония.
78 Глава первая. Физико-химические процессы в атмосфере
Другим процессом является превращение нитратов и хлори-
дов в газообразные азотную и соляную кислоты:
2H2SO4(p_p) +(NOj +СГ)(р_р) ч-> 2HSO;(p_p) ч-ННО^р.р) +HCI(p_p)
X X
НЬЮз(газ) НС1(газ)
Наконец, третий процесс связан с переносом сильных ки-
слот и их солей к поверхности Земли посредством сухого или
мокрого осаждения.
Рассмотренный в данном разделе материал указывает на
сложность превращений исходных кислотообразующих соедине-
ний, на многообразие форм существования продуктов превра-
щений, на влияние различных природных факторов (интенсив-
ность солнечной радиации, концентрация радикальных частиц,
аэрозольных частиц, влажность, температура), на количествен-
ные характеристики данных процессов.
1.5.2. Пути поступления кислых оксидов
в атмосферу
Естественными поставщиками диоксида серы (SO2) в атмо-
сферу служат вулканы, а также процессы сжигания угля и других
серосодержащих топлив, окисления сероводорода (H2S) при раз-
ложении органики. Суммарное количество SO2, ежегодно посту-
пающее в атмосферу из естественных источников, составляет в
среднем 10—12 млн т. Присутствующий в вулканических газах
сероводород образуется в паровой фазе при высоких температу-
рах вулканической деятельности из диоксида серы:
2SO2 + 2Н2О —> 2H2S+3O2
Образование сероводорода, меркаптанов (серосодержащих
аналогов спиртов общей формулы RSH, где R — углеводород-
ный радикал) может происходить в анаэробных условиях (отсут-
ствие кислорода), когда отдельные виды микроорганизмов вос-
станавливают сульфат-ионы, входящие в состав донных отложе-
ний, в реакциях брожения, например:
2СН2О + SO2/ -> H2S + 2НСО3-
1.5. Кислотные дожди
79
Сероводород в газовой фазе плохо реагирует с молекулярным
кислородом и не подвергается фотолизу, но легко окисляется
атомарным кислородом.
Концентрация SO2 в воздухе в значительной мере определя-
ется характером местности, плотностью населения и уровнем ур-
банизации. В чистом воздухе сельской местности содержание
SO2 может достигать нескольких десятков мкг/м3, в воздухе над
океаном оно составляет 0—4 мкг/м3, а в воздухе индустриальных
центров концентрации диоксида серы могут быть в 100 и даже
500 раз выше.
Большое количество сернистого газа (SO2) образуется при
работе теплоэлектростанций, котельных и других предприятий,
использующих в качестве топлива уголь и мазут. Предприятия
нефтепереработки и газовой промышленности в технологиче-
ских процессах переработки сырья выбрасывают в тропосферу
миллионы тонн сероводорода, меркаптанов, сероуглерода (CS2)
и других серосодержащих веществ.
Основным природным источником поступления оксидов
азота в атмосферу является деятельность живых организмов в
почве, грозе. Оксиды азота антропогенного происхождения об-
разуются в основном в результате сгорания топлива по высоко-
температурным реакциям взаимодействия атмосферных азота и
кислорода.
Концентрации оксидов азота (NO и NO2) в атмосфере регу-
лируются реакциями:
NO2 + Av->NO + O*
NO + О3 ->NO2 +О2
О + О2 + М -> О3 + М
и зависит от характера подстилающей земной поверхности.
Так, над океанами содержание NOX не превышает 300 ppt
(I ppt = 1 часть на триллион), а над континентами оно на
один — два порядка выше.
Наибольший вклад в образование оксидов азота вносит ан-
тропогенная деятельность, когда при сжигании топлива они об-
разуются в результате высокотемпературных реакций между азо-
том и кислородом воздуха либо за счет азота, входящего в состав
горючего вещества. Образующийся NOX в первом случае называ-
ется «термическим», и его выход в значительной степени опре-
80
Глава первая. Физико-химические процессы в атмосфере
деляется температурой. Концентрация оксидов азота, образую-
щихся за счет окисления азотсодержащих соединений, входящих
в состав топлива, определяется только первичным содержанием
азота в топливе и практически не зависит от температуры горе-
ния. Выделяемый в атмосферу в последнем случае NOA называ-
ется «топливным».
Органические кислоты, входящие в состав кислых осадков,
образуются в атмосфере при окислении непредельных органиче-
ских соединений (изопренов, терпенов), выделяемых раститель-
ностью. Механизм образования органических кислот (муравьи-
ной, уксусной) включает окисление органических соединений
озоном, радикалами ОН’, атомарным кислородом и представля-
ет сложный многостадийный процесс, окончательно не выяс-
ненный.
1.5.3. Механизмы образования кислотных
дождей
Скорость окисления SO2 кислородом воздуха при обычных
температурах атмосферы очень мала, поэтому образование сер-
ной кислоты из диоксида серы инициируют радикалы гидрокси-
ла, концентрация которых в атмосфере достаточно велика:
5 • 105— 1 • 106 частиц в 1 см3. Набор реакций, отвечающий обра-
зованию H2SO4 в газовой фазе (механизм I), представлен сле-
дующими превращениями:
но’ + so2 hso;
hso*3 + о2 -> so3 + но; (i)
SO3 + H2O-> H2SO4
Молекулы серной кислоты, появляющиеся по этому меха-
низму в газовой фазе, в дальнейшем абсорбируются водяными
каплями с образованием слабокислого раствора, который выпа-
дает в виде кислотного дождя либо нейтрализуется аммиаком
или другими основными веществами и выпадает на поверхность
Земли в виде соответствующих солей.
Другой механизм получения серной кислоты в атмосфере
(механизм II) связан с окислением SO2, абсорбированного об-
1.5. Кислотные дожди
81
дачными каплями и находящегося в форме ионов сернистой ки-
слоты: SO3" и HSOJ. Окислителем являются пероксид водорода
и озон. Некоторые исследователи считают, что в присутствии
света диоксид серы окисляется при наличии оксидов некоторых
металлов (алюминия, кальция, железа). Они полагают, что этот
тип окисления связан с присутствием катализатора (ионы метал-
лов) и достигает высокого уровня только в загрязненном возду-
хе. Возможные реакции механизма II:
HSO3 + Н2О2 + Н3О+ -> H2SO4 + 2Н2О
HSO3- + О3 + Н3О+ -> H2SO4 + Н2О + О2 (II)
HSO3 + 2FeO + О2 -> HSO4 + Fe2O3
Заслуживают внимания процессы адсорбции SO2 на атмо-
сферных частицах с последующим превращением в сульфат.
Превращение в сульфат протекает быстро на щелочной пыли и
не идет на нейтральной или кислой пыли, если вещество не про-
являет каталитических свойств за счет присутствия в ней аэрозо-
лей солей металлов. Особую роль играет влажность, увеличение
которой способствует большей степени превращения в сульфат.
Возможен и следующий механизм, включающий фотохими-
ческое воздействие на различные загрязняющие вещества (глав-
ным образом на NO2 и углеводороды) с образованием радикалов
или атомов, способных окислять диоксид серы (SO2). В любом
случае прямым продуктом окисления является серный ангидрид
(SO3), который затем превращается в H2SO4.
Рассмотренные механизмы окисления и пути вывода SO2
исходят из продолжительности пребывания его в атмосфере
(2—4 дня), и при этом полагается равноценность вклада каждо-
го механизма в итоговый результат образования кислотных
дождей.
Основные количества азотной кислоты в атмосфере образу-
ются в результате взаимодействия радикала гидроксила с диок-
сидом азота (механизм III):
ОН+ +NO2 -> HNO3 (III)
Реализация этого взаимодействия осуществляется в условиях
светового дня, что обусловлено нахождением ОН’ в атмосфере
только в дневное время. Эта особенность отражена в названии
82 Глава первая. Физико-химические процессы в атмосфере
рассмотренного процесса — «дневной» механизм образования
азотной кислоты (HNO3).
Альтернативным этому является «ночной» механизм получе-
ния азотной кислоты (механизм IV). В его основе лежит взаимо-
действие диоксида азота (NO2) с озоном с образованием радика-
ла NO3:
NO2 + О3 -> NO3 + О2
NO; + NO2 -> N2O5 (IV)
N2O5 +H2O-> 2NHO3
Появляющийся в данной схеме радикал NO; весьма неус-
тойчив и быстро разлагается под действием солнечной радиа-
ции, вследствие чего механизм (IV) в дневное время не работает.
Образующиеся в атмосфере кислоты входят в состав тума-
нов, облачных и дождевых капель. Приведем значения pH и
концентраций некоторых примесей в этих природных образо-
ваниях в табл. 1.2.
Таблица 1.2. Значения pH и концентраций некоторых примесей
Природные образования pH [Na+], мкМ (микромоль) [С1~], мкМ (микромоль)
Туман 2,9-4,9 320-500 480-730
Облака 4,4 120 150
Дождевая вода 4,7 19,8 21,7
Такое распределение можно объяснить следующим образом.
Концентрация примесей у поверхности Земли наибольшая, и
поэтому в туманах наибольшая концентрация примесей и ки-
слот. На высоте нескольких километров, где существуют облач-
ные капли, концентрация примесей в атмосфере значительно
меньше, чем у поверхности. При образовании дождя происходит
разбавление облачных капель, и поэтому концентрация приме-
сей и кислот еще сильнее снижается. Таким образом, для сель-
ского хозяйства и огородов наиболее пагубны туманы, так как
они обычно холодные и содержат больше вредных примесей,
чем дождевая вода.
Образовавшиеся кислоты выводятся из атмосферы дождями
примерно через 7 суток.
1.5. Кислотные дожди
83
1.5.4. Влияние кислотных дождей на природные
объекты, здания, памятники и технику
Кислотные дожди наносят существенный урон объектам
биосферы. Это касается в равной степени водных объектов, со-
стояния почв, растительного и животного мира (рис. 1.12).
Влияние ни водные объекты. Вода любого пресноводного во-
доема чаще всего имеет щелочную реакцию — (pH от 6,5 до 8,0),
так как всегда содержит катионы щелочных и щелочноземель-
ных металлов. Они вымываются водными потоками из почвы и
подстилающих горных пород, а также образуются при разложе-
нии органических остатков. Этот состав воды благоприятен для
Погодные воздействия
Перомсилммтил,
Растущая
зеотранспираци
Растущая
чувствительность
к морозу,
паразитам,
грибам,
мхам
Слабые осадки
Сухая погода
Растущая
транспирация
Поврежде- Гибельдерева\
нив кроны ___ZLLZ—J
деревьев *
Нехватка
пита-
тельных
веществ
Рис. 1.12. Вредное воздействие кислотных осадков на почву
и растительность [9]
Поврежде
коры
Нехватка
воды
листва
или хвоя
9вт нетто-
г жизненно
»ые почвен-
микроорга-
а нарушение
всасывания с
питательных':
веществ ;:
Нарушение
всасывания t,
84
Глава первая. Физико-химические процессы в атмосфере
жизнедеятельности всех обитателей рек и озер от бактерий и во-
дорослей до рыб.
При систематическом выпадении кислых осадков вода пер-
вое время сохраняет слабощелочную реакцию благодаря своим
естественным буферным свойствам. Однако постепенно пресно-
водные водоемы начинают понемногу подкисляться, что сразу
же сказывается на условиях обитания всех населяющих эти воды
биологических объектов — растениях, бактериях, водорослях,
рыбах, земноводных и т. п. Так, при значениях pH от 6 до 5,5
быстро сокращается численность и видовое разнообразие живых
существ, при снижении pH до 4,5 происходит массовая гибель
рыбы и теряется способность их к размножению.
При этих же значениях pH бурно развиваются кислотолюби-
вые мхи, грибы и нитчатые водоросли, которые заглушают всю
остальную водную растительность. Нарушенное кальциевое рав-
новесие у одних рыб затрудняет перенос ионов через жаберные
мембраны, у других приводит к потере способности образовы-
вать икру. При снижении pH ниже 4,5 рыбы в озере уже не оста-
ется, наблюдается гибель лягушек, насекомых. Из силикатов и
донных осадков выщелачиваются алюминий и другие металлы,
которые сами по себе более опасны для окружающей биоты, чем
наблюдающаяся высокая кислотность.
Физиологическое действие кислотных дождей на растения.
Вредному воздействию кислых дождей в сильной степени под-
вержена растительность. В Швеции в 70-х годах прошлого столе-
тия продуктивность лесов неуклонно падала из-за кислых осад-
ков (примерно на 1 % в год). Присутствующие в составе кислых
дождей сульфит-ионы (SOJ) разрушают в значительной мере
клеточные мембраны, что вызывает сбои и нарушение деятель-
ности ряда ферментов, обеспечивающих нормальные условия
существования растений. Это приводит к отмиранию целых уча-
стков листьев из-за нарушения механизма фотохимической фик-
сации углекислого газа (СО2).
Действие кислотных дождей ярче всего проявляется в угнете-
нии и уменьшении видового разнообразия у низших растений
по сравнению с высшими. Для последних малые концентрации
газообразного диоксида серы (до 100 ppt) являются питательным
элементом и одновременно предохраняют от грибковых заболе-
ваний.
1.5. Кислотные дожди
85
Кислотные дожди и почва. Негативное влияние кислотных
дождей ощущают не только пресные воды и растения, но и поч-
вы. В них при повышении кислотности ускоряется вымывание
питательных веществ, гибнут полезные микроорганизмы, в том
числе азотфиксирующие: среднее число клубеньков на корнях
бобовых при уменьшении pH почвенного раствора с 6,0 до 3,2
снижается почти втрое. Особенно сильное отрицательное влия-
ние понижения pH почв наблюдается вблизи крупных промыш-
ленных центров, которое проявляется в усыхании и гибели де-
ревьев и травяного покрова на большой территории.
Уменьшения ущерба, наносимого кислотными дождями,
можно добиться лишь снижением кислых газовых выбросов в
атмосферу, которое достигается двумя основными способами.
Можно, во-первых, улавливать вредные газы, но это дело слож-
ное и дорогостоящее, хотя частично окупающее себя выпуском
дополнительной продукции. А можно вместо дорогостоящих га-
зоулавливающих установок построить очень высокие трубы, где
вредные кислые газы при выбросе в атмосферу будут разбавлены
чистым воздухом до весьма низких концентраций. Вместе с тем
постройка высоких труб не решает проблемы отравления атмо-
сферы, так как количество ядовитых веществ, удаляемых из вы-
сокой трубы, такое же, как и вылетающих из низкой, и они оса-
ждаются на гораздо более дальнем расстоянии от места выброса.
При этом страдают соседние регионы и даже государства. Кис-
лые дожди, выпадающие над Скандинавией, имеют свою пре-
дысторию на Британских островах и в Северной Европе. Цик-
лоны, зарождающиеся в Атлантике и проходящие над промыш-
ленными центрами Англии, Рурской области, вбирают в себя
десятки и сотни тысяч тонн кислых оксидов и проливаются кис-
лыми дождями над гористой Скандинавией. Из этого становится
ясно, что строительство сверхвысоких труб не решает проблемы
кислотных осадков.
Воздействие кислотных дождей на строения и технику. Осад-
ки, формирующиеся в дождевых облаках и находящиеся в кон-
такте с атмосферой, содержащей значительное количество угле-
кислого газа, обладают слабокислой реакцией и разрушающе
действуют на строения с известковой кладкой:
СаСО3 + СО2 + Н2О -> Са2+ + 2НСО3
86 Глава первая. Физико-химические процессы в атмосфере
Этот эффект значительно усиливается при подкислении вла-
ги дождевых облаков кислыми газами антропогенного происхож-
дения при абсорбции водяными парами. Сернокислотные осадки
необратимо разрушают строения на основе известняка:
СаСО3 + H2SO4 -> Са2+ + SO4 + СО2 ? + Н2О
Наиболее ярко и наглядно это иллюстрируется состоянием
таких исторических памятников и сооружений, как Акрополь в
Афинах, Колизей в Риме, Кельнский собор и др., которые раз-
рушаются под действием кислотных дождей.
Подобное разрушающее действие атмосферных осадков с
низкими значениями pH сказывается на прочностных свойствах
бетона, стекол, сложных силикатов, из которых выщелачивается
алюминий, входящий в состав решетки алюмосиликатного кар-
каса:
3KAlSi3O8 + 12Н2О + 2Н+ ->
J о L
-> 3KAl3Si3O10(OH)2 + 6H4SiO4 + 2К+
3KAl3Si3O10(OH)2 + 18Н2О + 2Н+ ->
->ЗА12О3(Н2О)з +6H4SiO4 + 2К+
Еще более разрушительное воздействие оказывают кислот-
ные дожди на изделия и механизмы из металла. Жидкая пленка
на поверхности металла, содержащая кислоты, является средой,
в которой осуществляются процессы коррозии металла. Так, на
поверхности изделий из железа при взаимодействии с влагой,
содержащей серную кислоту, образуется корка гигроскопичного
сульфата закисного железа (FeSO4), которая на воздухе окисля-
ется до ржавчины:
2FeSO4 + Н2О + 1/2О2 -э 2Fe(OH)SO4
Памятники, выполненные из бронзы, покрываются так на-
зываемой патиной, представляющей собой пористую корку из
карбонатов, сульфатов, иногда из хлоридов, пропитанную водой
и адсорбирующую кислые газы. Образующаяся кислота продол-
жает свою разрушительную работу и разъедает металл, переводя
его в раствор в виде ионов. Следствием этого является наруше-
ние целостности изделия.
1.6. Фотохимический смог
87
Разрушающее действие кислотных дождей проявляется и в
ухудшении свойств многих органических материалов — кожи, бу-
маги, резины, тканей, ряда пластических масс. Изделия из этих
веществ становятся хрупкими, теряют свою эластичность, форму.
Контрольные вопросы
1. Какая дождевая вода является кислой? Чем определяется pH дожде-
вой воды?
2. Какие загрязнения атмосферы являются предшественниками кислот-
ных дождей?
3. Что выступает в качестве источников поступления кислых оксидов в
атмосферу?
4. Какие известны основные механизмы образования кислотных дождей?
5. Какое влияние оказывают кислотные дожди на природные объекты,
неорганические и органические материалы?
1.6. Фотохимический смог
Смог (англ, smog от smoke — дым и fog — туман) — пелена
дыма, тумана и пыли, содержащая смесь таких высокотоксичных
веществ, как монооксид углерода (СО), оксиды азота (NOX),
озон, полиядерные ароматические углеводороды (ПАУ), перок-
сиацетилнитрат (ПАН) и др. Это явление возникает в воздухе,
загрязненном дымом, газовыми отходами производства, автомо-
бильными выхлопными газами, которые под действием ультра-
фиолетовой солнечной радиации взаимодействуют друг с дру-
гом. Так, при реакции оксидов азота с не полностью сгоревши-
ми углеводородами из автомобильных выхлопов получаются
озон и пероксиацетилнитрат, крайне токсичные вещества, вызы-
вающие слезоотделение и затруднение дыхания у человека, оста-
навливающие фотосинтез у растений:
~ Ультрафиолетовая
Оксиды азота + Углеводороды------—------------>
Радиация
-> Пероксиацетилнитрат (ПАН) + Озон (О3).
Как видно из приведенного материала, особую роль в обра-
зовании фотохимического смога играют оксиды азота, которые
88
Глава первая. Физико-химические процессы в атмосфере
дают начало цепи превращений в компоненты смога и являются
своеобразным «спусковым крючком» этого процесса. Вследствие
важности выяснения причин и условий образования фотохими-
ческого смога необходимо подробно рассмотреть физико-хими-
ческие свойства основных его компонентов — NOX, СО, ПАУ —
и источники их появления в атмосфере, основным из которых
является двигатель внутреннего сгорания (ДВС).
1.6.1. Токсичные продукты выхлопных газов
двигателей внутреннего сгорания
В камерах сгорания тепловых двигателей могут преимущест-
венно образовываться различные соединения (табл. 1.2), на ме-
ханизм образования которых и их количество влияют различные
факторы, в числе которых структура фронта пламени, темпера-
тура процесса и давление, соотношение топлива и окислителя в
исходной смеси.
Таблица 1.2. Состав отработанных газов двигателей [16]
| Вещество Бензиновый Дизель
О2, об. % 0,05-8,0 2,0-18,0
СО2, об. % 5-12,5 1-12
Н2О, об. % 3-13,0 0,5-10
N2, об. % 74-77 76-78
NOX, об. % 0,05-0,5 0,1-1,0
СО, об. % 0,1-10 0,01-0,5
СЛНГ, об. % 0,2-2,0 0,01-0,5
Альдегиды, об. % 0-0,2 0-0,05
Сажа, мг/м3 До 100 До 20000
SO2, мг/м3 До 0,003 До 0,015
Бенз(а)пирен, мкг/м3 25 10
В диффузионном пламени (камера сгорания дизеля) топливо
и окислитель диффундируют во фронт пламени, где в узкой об-
ласти смешения протекает химическая реакция и достигается
максимальная температура. К этой области примыкает со сторо-
ны топлива область его термического распада, в которой в отсут-
1.6. Фотохимический смог
89
ствие окислителя образуются наряду с промежуточными продук-
тами распада водород и сажа. Со стороны окислителя к фронту
пламени примыкает область образования монооксида азота (NO).
Полнота сгорания топлива в двигателях внутреннего сгора-
ния и, следовательно, температура зависят в первую очередь от
состава смеси. В случае избытка топлива в смеси (а < 1) по срав-
нению со стехиометрическим соотношением реализуется случай
неполного его окисления, что отражается на составе выхлопных
газов. Если же в избытке присутствует окислитель (а> 1), то в
результате интенсивного протекания реакций в зоне высоких
температур преобладающим продуктом будет NO. (Здесь а — от-
ношение окислителя к топливу.)
При невысоких температурах в области горения количество
тепла, подводимого в зону разложения углеводородов, зачастую
недостаточно для обеспечения их распада до более простых фраг-
ментов, и в результате в продуктах сгорания будут присутствовать
несгоревшие углеводороды испарившегося топлива.
Вещества, содержащиеся в выхлопных газах ДВС, можно клас-
сифицировать по следующим признакам:
а) продукты полного и неполного сгорания топлив (СО2, СО,
углеводороды, в том числе полициклические ароматические,
сажа);
б) вещества, образующиеся в результате протекания побоч-
ных процессов (оксиды азота — по термическому механизму);
в) вещества, образование которых определяется примесями,
содержащимися в топливе (соединения серы, свинца, других тя-
желых металлов), воздухе (кварцевая пыль, аэрозоли).
1.6.2. Оксиды азота — инициаторы фотохимического
смога и механизм их образования
Молекула азота является чрезвычайно химически инертной в
силу очень большой энергии, требуемой для диссоциации на
атомы, необходимой для вступления ее в реакции.
N2(ra3) <-> 2N(ra3), ДЯ = 946 кДж/моль,
К25-с = КГ121 МН/м2
Здесь К25 -с — константа равновесия реакции при 25 °C.
90
Глава первая. Физико-химические процессы в атмосфере
Потенциал ионизации азота также исключительно велик:
энергия внешней занятой орбитали составляет 15,6 эВ, т. е. для
удаления одного из наименее прочно связанных электронов из
молекулы азота в ее основном состоянии необходимо затратить
приблизительно 1500 кДж/моль.
Азот образует с кислородом пять оксидов — от оксида диазо-
та (N2O) до пентаоксида диазота (N2O5). Наибольшее значение
из всех оксидов азота имеют NO (монооксид азота) и NO2 (диок-
сид азота). Монооксид азота — единственный оксид азота, кото-
рый получается прямым синтезом из элементов при высоких
температурах как в природе (разряды молний), так и при сжига-
нии топлив в воздушной среде.
В настоящее время до 0,7 • 108 т азота в год связывается ки-
слородом воздуха в результате высокотемпературных процессов,
вызванных антропогенной деятельностью. Из этого количества
половина оксида азота образуется в результате сжигания топлива
в промышленных условиях, и другая половина — за счет работы
транспорта. Таким образом, действующий двигатель внутреннего
сгорания является одним из основных антропогенных источни-
ков NO в атмосфере.
Оксид азота (II) NO достаточно стабилен и выделяется вме-
сте с выхлопными газами. В целом, условия в двигателе внутрен-
него сгорания поразительно близки параметрам технологическо-
го процесса сжигания топлива на воздухе.
Попадая в атмосферу, монооксид азота (II) постоянно пре-
вращается в диоксид. В результате оксиды азота накапливаются
в нижних слоях атмосферы. Их присутствие вызывает такое хо-
рошо известное явление, как кислотные дожди, и сказывается на
последующих химических превращениях с участием атмосфер-
ного кислорода.
Оксиды азота, полициклические углеводороды (а это основ-
ные загрязняющие компоненты автомобильных выхлопных га-
зов и выбросов промышленных предприятий), являются актив-
ными сенсибилизаторами, вызывающими образование синглет-
ного кислорода, а далее озона и атомарного кислорода.
При работе ДВС монооксид азота (NO) может образовывать-
ся в результате протекания следующих процессов:
1) при окислении азота воздуха (термический NO) в зоне го-
рения топлива при высоких температурах;
1.6. Фотохимический смог
91
2) при деструкции и окислении органических азотсодержа-
щих соединений, входящих в состав топлива (топливный NO);
3) при взаимодействии радикальных частиц с молекулами
азота воздуха в зоне реакций окисления в условиях пульсаций
температуры (быстрый NO).
В камерах сгорания образуется термический NO вследствие
горения бедной топливо-воздушной смеси и смеси, близкой к
стехиометрической. Преимущественно реакции протекают по
цепному механизму:
О* +N2 -> NO + N*
N* + О2 ->NO + O*
N* + ОН*-> NO* + H*
В богатых смесях (а < 0,8) дополнительно протекают реакции:
N2 +ОН* -+ NO + NH*
NH* + О2 -> NO + НО*
Высокие скорости процессов нагревания и последующего
охлаждения смеси газов в ДВС сопровождаются своеобразной
закалкой образовавшегося «термического» NO и сохранением
его максимальной концентрации в выхлопных газах. Азотсодер-
жащие органические соединения, входящие в состав топлива
(амины, циклические соединения в виде пиридина, карбазола),
являются причиной появления «топливного» NO при более низ-
ких температурах (1300—1400 К).
Можно выделить четыре характерные температурные зоны
образования NO (рис. 1.13):
I — до Т< 850 К (каталитическое окисление топлива) NO не
образуется;
II — до Т< 1500 К (горение в псевдоожиженном слое твердо-
го топлива) образуется преимущественно топливный NO;
III — до Т< 2000 К (факельное горение в топках котлов) об-
разуется NO по всем трем механизмам, а при более высоких
температурах основной компонент — термический NO;
92
Глава первая. Физико-химические процессы в атмосфере
Рис. 1.13. Вклад отдельных механизмов образования NO в его общий выход [9]:
CNO — концентрация оксидов азота; Т — температура зоны образования окси-
дов азота
IV — при Т = 2800—3200 К (магнитогидродинамические ге-
нераторы) следует ожидать максимального выхода термических
оксидов азота, концентрация которых будет на порядок выше,
чем в существующих энергоблоках (1—1,5 г/м3).
Процесс образования NO2 из NO резко ускоряется в присут-
ствии небольших (менее 5 ррт) количеств монооксида углерода
(СО). В воздухе, не содержащем никаких примесей, кроме водя-
ного пара, СО и монооксида азота (NO) возникает разветвлен-
ная цепь из нескольких десятков реакций, которые ведут в ко-
нечном счете к образованию азотистой (HNO2) и азотной
(HNO3) кислот, а также веществ, обладающих сильным окисли-
тельным действием — озона, перекиси водорода, радикалов
НО2. Выхлопные газы, кроме СО и NO содержат остатки несго-
ревшего топлива (углеводороды, в том числе и непредельные).
Если концентрация этих веществ превышает некоторый порог,
под солнечными лучами срабатывает спусковой механизм, при-
1.6. Фотохимический смог
93
водящий в действие длинную цепь фотохимических превраще-
ний. При недостатке кислорода в двигателе внутреннего сгора-
ния происходит не только неполное сгорание бензина до окси-
дов углерода, но и неполное окисление до альдегидов:
R—СН3 + О2 -> R-CH = О + Н2О
Присутствующие в выхлопных газах альдегиды реагируют с
активными формами кислорода и диоксидом азота с образова-
нием пероксиацетилнитрата (ПАН) по схеме:
о ,о
R-с + О2 + NO2 —. R-C;
н o-o-no2
( Пероксиацетилнитрат)
В результате в атмосфере накапливаются очень токсичные
пероксиацетилнитраты, являющиеся одним из главных компо-
нентов физико-химического смога.
f.6.3. Монооксид углерода
Монооксид углерода (СО) является одним из токсических
компонентов фотохимического смога, ускоряющих скорость пре-
вращений веществ выхлопных газов в более ядовитые вещества.
Монооксид углерода (угарный газ) образуется при неполном
сгорании углеродсодержащих веществ в бытовых и промышлен-
ных печах, при работе автотранспорта.
Небольшие количества СО природного происхождения обра-
зуются в результате вулканической деятельности и при окисле-
нии метана в атмосфере с помощью ОН-радикалов.
Содержание угарного газа над территорией в центре евро-
пейской части России возрастало с 1970 по 1990 г. на 1,5—2,0 %
в год, т. е. за 35 лет оно должно удвоиться. В настоящее время в
атмосфере содержится около 60 млн т СО, т. е. его концентра-
ция в атмосфере не составляет и одной тысячной доли содержа-
ния в ней диоксида углерода (СО2).
Монооксид углерода представляет опасность прежде всего
потому, что он может связываться с гемоглобином крови, а также
тем, что он участвует в образовании смога. Кроме того, СО мо-
94 Глава первая. Физико-химические процессы в атмосфере
жет образовывать высокотоксичные соединения — карбонилы
[например, Fe(CO)5].
При взаимодействии с гемоглобином (НЬ) крови монооксид
углерода, как и кислород, занимает координационное положение
6 в геме [гем — это комплексное соединение железа, в котором
ион железа (И) соединен с протопорфириновой группой; он вхо-
дит в состав гемоглобина, его функции заключаются в переносе
кислорода]. Сродство гемоглобина к СО в 200—300 раз выше,
чем сродство к О2. Реакция НЬ с О2, как и реакция с СО, подчи-
няется закону действующих масс, поэтому, учитывая, что его
сродство к СО в 300 раз больше, чем к О2, можно написать [5]:
[НЬ][СО] = 300Рсо
[НЬ][О2] " Ро2
Здесь Рсо и РО2 — парциальные давления соответственно СО и
О2. Под сродством понимается сила взаимодействия и прочность
образующихся соединений.
Считая произведения концентраций гемоглобина с кислоро-
дом и гемоглобина с монооксидом углерода равными и подстав-
ляя в уравнение одинаковые количества [НЬ] [О2] и [НЬ] [СО],
получаем:
Ро
Р01 =300 Рсо или Рсо=^-
Так как объемная концентрация О2 в воздухе составляет око-
ло 20 %, находим концентрацию СО:
20
Рсо = —= 0,066 %.
со 300
Эта концентрация необходима для того, чтобы связать столь-
ко же гемоглобина, сколько связывает его атмосферный кисло-
род. Иначе говоря, концентрация 0,066 % СО в атмосфере доста-
точна для связывания половины гемоглобина, что может при-
вести к серьезным нарушениям здоровья.
Накоплению в атмосфере СО препятствуют высшие расте-
ния, водоросли и особенно микроорганизмы почвы, которые
могут связывать угарный газ с частью аминокислоты серина, а
также окислять СО в СО2.
1.6. Фотохимический смог
95
1.6.4. Полиядерные ароматические углеводороды —
компонент выхлопных газов
Особое опасение вызывают присутствующие в отработанных
газах двигателей полиядерные ароматические углеводороды (ПАУ),
а также их кислород- и азотсодержащие производные, обладаю-
щие канцерогенными свойствами. ПАУ с числом конденсирован-
ных колец более трех не содержатся в топливе для двигателей
внутреннего сгорания в сколько-нибудь заметных количествах.
Вместе с тем, хорошо известно, что конденсированные аромати-
ческие углеводороды образуются в процессе пиролиза легких и
средних фракций нефти уже при 600—700 °C, что имеет место в
камере сгорания двигателей, в топках ТЭЦ, котельных и т. п. Об-
разование и выделение ПАУ в конденсированной фазе (аэрозоли,
пыли) и в виде паров характерно для всех установок сжигания то-
плива. Образуются ПАУ при горении нефтепродуктов, угля, дере-
ва, мусора, пищи, табака, и чем ниже температура в устройстве
для сжигания, тем больше образуется ПАУ.
Простейший ароматический углеводород — бензол. Если со-
стыковать два бензольных кольца, то получится модель хорошо
известного нафталина. Если же взять несколько бензольных ко-
лец, то число возможных стыковочных комбинаций резко увели-
чится.
Собирательное название ПАУ объединяет десятки веществ,
для которых характерно наличие в структуре соединения трех и
более бензольных колец (рис. 1.14).
Образующиеся при сгорании топлива в ДВС полиароматиче-
ские углеводороды поступают в окружающую среду. При обыч-
ной температуре все ПАУ представляют собой твердые кристал-
лические вещества. Давление насыщенных паров при температу-
рах плавления, которые обычно близки к 200 °C, очень мало.
Охлаждение выхлопных газов, содержащих ПАУ, приводит к их
конденсации и оседанию в зоне их выбросов. Однако значитель-
ная часть ПАУ уносится на дальние расстояния в виде аэрозолей.
В атмосфере ПАУ довольно устойчивы. Их постепенная транс-
формация в иные продукты происходит при взаимодействии с
озоном (с образованием полиядерных хинонов) и диоксидом азо-
та (продукты — нитро(а)бензопирены, отличающиеся высокой
мутагенной активностью).
96
Глава первая. Физико-химические процессы в атмосфере
Антрацен Фенантрен Флуорантен
Бенз(е)пирен Бенз(в)флуорантен Бенз(к)флуорантен
Индено(1,2,3-сд)пирен Антантрон
Рис. 1.14. Высококанцерогенные ПАУ
Коронен
Главных источников ПАУ несколько (рис. 1.15): автомобиль-
ный (в основном) транспорт, металлургия, нефте- и коксохимия,
теплоэнергетика. Однако в городе, где очень мало металлургии и
совсем нет нефте- и коксохимии, основным источником ПАУ
(в том числе и бенз(а)пирена) является автомобильный транс-
порт. Особенно много их выделяется во время разгона, торможе-
ния, при работе двигателя на холостом ходу, а также при езде по
дорогам с плохим покрытием. Надежно выявлена и прямая зави-
симость между интенсивностью движения автотранспорта и
концентрацией ПАУ в приземном слое атмосферы. Поэтому в
странах ЕЭС введен жесткий закон «Об автомобильном топливе
и выхлопных газах в Европе». Принятые жесткие стандарты экс-
1.6. Фотохимический смог
97
Основные источники
выбросов ПАУ
Известные факторы
разрушения ПАУ
Рис. 1.15. Схема загрязнения среды ПАУ и ее самоочищения [9]: 7 — промышлен-
ные предприятия; 2 — авиация; 3 — транспорт; 4 — отопление жилищ; 5 — ульт-
рафиолетовое излучение; 6 — озон; 7, 8 — разрушение ПАУ растениями, почвен-
ными микроорганизмами и из-за наличия метаболизма у высших животных
плуатации автотранспорта и строгие законодательные акты при-
вели к заметному улучшению качества воздуха в Европе.
Выхлопная труба современного зарубежного автомобиля име-
ет, как правило, каталитический конвертор — устройство, «дожи-
гающее» вредные примеси — монооксид углерода, углеводороды,
в том числе и ПАУ, и оксиды азота.
На катализаторе происходит взаимодействие оксида азота
(II) с оксидом углерода (II)
2NO + 2CO->N2 + 2СО2
Эта реакция термодинамически выгодна при температуре
выхлопа. К другим реакциям, протекающим на катализаторе в
выхлопных газах, относятся:
• образование N2O:
2NO + СО-> N2O + СО2
4 - 4054 Трифонов
98 Глава первая. Физико-химические процессы в атмосфере
• взаимодействие СО с водяными парами:
СО + Н2О -> со2 + н2
• окисление ПАУ до СО2 и Н2О:
ПАУ + О2 -> СО2 + Н2О
Выделяющийся водород может реагировать с оксидом азота с
образованием аммиака:
2NO + 5Н2 -> 2N2H3 + 2Н2О
Это нежелательный процесс, так как аммиак повторно окис-
ляется до NO при пропускании газов через катализатор окисле-
ния. С отходящими газами тепловых электростанций и ТЭЦ, ра-
ботающих как на жидком, так и на твердом топливе, в атмосферу
выбрасываются значительные количества летучих углеводородов.
При сжигании 1 т нефти на предприятиях электроэнергетики вы-
деляется 0,25 кг, а при сжигании 1 т угля — 0,16 кг углеводоро-
дов. Наименьшее количество углеводородов выделяется при ис-
пользовании природного газа.
ТЭС и ТЭЦ — основные антропогенные источники ПАУ. По
оценкам, на начало 1970-х гг. XX века в США выброс
бенз(а)пирена состалял около 500 т в год, что представляет при-
мерно 38 % от общей эмиссии этого соединения в атмосферу.
Наивысшие средние концентрации ПАУ в дымовых газах от
ТЭС характерны для тех станций, которые работают на торфе.
Средняя эмиссия ПАУ при использовании торфа составляет
40 мг на 1 МДж вырабатываемой энергии, а при сжигании дру-
гих видов топлива она равна 2—10 мг на 1 МДж. Образование и
выделение ПАУ в конденсированной фазе (аэрозоли, пыль) и в
виде паров характерно для всех установок сжигания топлива.
На расстоянии нескольких километров от угольной ТЭС по-
верхность почвы загрязнена ПАУ. Но большая часть ПАУ уно-
сится на большие расстояния в виде аэрозолей. Прекрасным ад-
сорбентом для ПАУ являются сажевые частицы. На 1 см2 саже-
вой поверхности могут разместиться ~1014 молекул ПАУ, что
приводит к тому, что загрязненный сажевым аэрозолем воздух
содержит порой количества ПАУ большие, чем соответствующие
давлению насыщенного пара этих веществ.
1.6. Фотохимический смог
99
1.6.5. Смог как результат антропогенной
деятельности
Как было сказано, в совокупности образование смеси высо-
котоксичных веществ, содержащих СО, NOX, ПАУ и озона, но-
сит название фотохимического смога и требует для возникнове-
ния интенсивного солнечного освещения, активного движения
автотранспорта и условий для появления застойной зоны возду-
ха в приземном слое атмосферы данной территории.
Состав смога зависит от его происхождения: переполненные
автотранспортом города Южной Европы (Мадрид, Афины) и
Калифорнии (Лос-Анджелес) в солнечные месяцы страдают от
смога лос-анджелесского типа, для которого характерно присут-
ствие оксидов азота, озона, ПАН, ПАУ и других соединений пе-
роксидного характера. В Средней Европе и Великобритании на-
блюдается смог лондонского типа, который в осенний и зимний
периоды представляет собой густой туман, в котором содержит-
ся аэрозоль серной кислоты. В смоге лондонского типа, помимо
SO2 и продуктов его окисления и гидролиза, присутствует и ряд
других компонентов, образующихся при сгорании топлива в пе-
чах и содержащихся в выхлопных газах автотранспорта.
Особенно опасен смог, когда в силу метеорологических ус-
ловий пелена висит на одном месте, не рассеиваясь. Такое явле-
ние наблюдается при температурной инверсии, когда теплый
воздух, пришедший, например, с моря, наслаивается на более
холодный, приземный слой воздуха. Образовавшаяся «шапка» не
дает загрязнениям рассеиваться, что вызывает серьезные послед-
ствия для жизни людей, как это было в 1962 г. в Лондоне.
В летние дни (при Т> 300 К) в отсутствие ветра и при интен-
сивной солнечной радиации озон начинает генерироваться в
нижних слоях атмосферы.
Образование же NO2 происходит из NO (продукт работы
ДВС). Этот процесс сильно ускоряется в присутствии небольших
(>5 ppm) количеств СО. В результате образуются вещества, обла-
дающие сильным окислительным действием — озон, пероксид
водорода (Н2О2), радикалы HOJ.
Образующийся атомарный кислород, взаимодействуя с О2 в
присутствии М (например, N2), дает озон (реакция 1.12).
100
Глава первая. Физико-химические процессы в атмосфере
Выхлопные газы, помимо монооксидов углерода и азота (СО
и NO), содержат остатки несгоревшего топлива — углеводороды,
в том числе непредельные. При наличии в воздухе олефинов
озон и атомарный кислород взаимодействуют с ними, образуя
радикалы:
RCH = СН2 + О3 -> 2RCHO + СН2О;
rch = сн2 + о -> rch; + нсо*
Здесь RCH = СН2 — непредельный углеводород (олефин),
RCHO — альдегид, RCH2, CH2OJ, НСО* — радикалы.
Образовавшиеся радикалы (RCHJ), другие вещества, способ-
ные к окислению, реагируя с компонентами атмосферы по цеп-
ному механизму и образуя в свою очередь водород- и кислород-
содержащие, а также нестабильные, с высокой реакционной
способностью пероксиацетиловые [RC(O)O2] радикалы, являют-
ся предшественниками ПАН.
Конечные реакции образования оксидантов развиваются од-
новременно несколькими путями:
rcho; -> rco + но;
RCHO; -> ROH + СО
rcho; -> RH + со2
Эти оксиданты являются сильными окислителями, способ-
ными окислить углеводороды парафинового ряда. Продукты
окисления полимеризуются, собирают воду и побочные продук-
ты реакций (их многие десятки), в результате появляются аэро-
зольные частицы. С этими частицами и связано образование
дымки — фотохимического смога. А диоксид азота окрашивает
дымку в желтоватый цвет.
В фотохимическом смоге от нитритов под действием света
может отделяться радикал гидроксила НО*, тоже очень сильный
окислитель:
HONO —> НО* + NO
Органические перекиси, присутствующие в загрязненном
воздухе, образуют тот же радикал по реакции:
ROOH + О3 -> О2 + НО* + ROO*
1.6. Фотохимический смог
101
При взаимодействии гидроксилов с пероксидом водорода и
при реакции свободных органических радикалов с кислородом
появляются еще две свободнорадикальные формы кислорода.
Сначала появляется пергидроксил НО2. Это слабая кислота, ко-
торая в нейтральной и щелочной среде диссоциирует на протон
и супероксид — отрицательно заряженный радикал О2
В итоге в фотохимическом смоге находится целых шесть ак-
тивных форм кислорода: озон, атомарный кислород, гидро-
ксильный радикал ОН*, пергидроксил НО2, супероксид О2” и
синглетный кислород 'О2.
В целом механизм образования фотохимического смога мож-
но представить в виде следующей схемы.
Схема вероятного механизма образования
фотохимического смога [10]
1. Поглощение света:
NO2 + /zv = NO + О
(SO2 и SO3 также способны поглощать свет).
2. Цепь ароматного кислорода:
а) О + R -» R* + RCHO (не уравнено);
б) R* + О2 -» RO2;
в) RO‘2 + NO -> RO* + NO2;
г) RO’ -» R* + О;
NO + O2 = NO2 + О (суммарная реакция).
3. Цепь озона:
а) О + О2 -> О3;
б) О3 + R -> RCO2 + RCHO (не уравнено);
в) RCO*2 + NO -> RCO’ + NO2;
О
г) RCO* + NO2 + О2 -> RC-O-O-NO2.
(вероятно, в две стадии)
Примечание. По всем четырем реакциям происходит образование озона, аль-
дегидов и ацилпероксинитрата — основных раздражающих веществ фотохимиче-
ского смога. В целом процесс представляет собой фотохимическое инициирова-
ние окисления углеводородных остатков газообразных веществ до токсичных со-
единений.
102 Глава первая. Физико-химические процессы в атмосфере
4. Обрыв цепи:
а) О + NO2 -> NO + О2;
б) О3 + NO -> NO2 + О2;
в) RO* + NO2 -> RONO2.
Появлением активных форм кислорода объясняется токсиче-
ское действие не только фотохимического смога, но и многих
других факторов. Подобные нарушения лежат в основе лучевой
болезни: одной из главных ее причин служат активные формы
кислорода, образовавшиеся при разложении воды ионизирую-
щей радиацией.
Между прочим, табачный дым содержит компоненты, обра-
зующие радикал О2” при реакции с цитохромами и легко прохо-
дящие через сигаретный дым.
Контрольные вопросы
1. Какая связь существует между концентрацией оксидов азота в атмо-
сфере и образованием фотохимического смога?
2. Какие вещества составляют основу фотохимического смога?
3. Какие условия благоприятствуют образованию фотохимического смога?
4. Какие загрязняющие вещества образуются при работе двигателей
внутреннего сгорания?
5. Как образуются полиядерные ароматические углеводороды?
6. В чем причина повышенных концентраций загрязнений атмосферного
воздуха в городах и промышленных центрах?
7. Сопоставима ли техногенная деятельность человека по своим масшта-
бам с природными явлениями?
8. Сколь велико антропогенное влияние на климат Земли?
9. Чем вызвано повышение содержания углекислого газа в атмосфере?
10. Может ли существовать цивилизация, не загрязняющая планету?
11. Каков источник оксидов азота в дымовых газах тепловых электростан-
ций, работающих на природном газе?
12. Какие известны антропогенные источники метана?
Глава вторая
ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ
В ГИДРОСФЕРЕ
2.1. Вода и ее роль в жизни Земли
Вода — самое распространенное на Земле химическое соеди-
нение, благодаря которому существовует органическая жизнь.
Вода определяет энергетический и материальный обмен между
различными сферами такого сложного объекта, как Земля, она иг-
рает важнейшую роль в поддержании равновесия между различ-
ными климатическими зонами. Этому она во многом обязана сво-
им аномальным физическим и химическим свойствам. В. И. Вер-
надский писал: «Вода стоит особняком в истории нашей планеты.
Нет природного тела, которое могло бы сравниться с ней по влия-
нию на ход основных, самых грандиозных геологических процес-
сов. Нет земного вещества — минерала, горной породы, живого
тела, которое ее бы не заключало. Все земное вещество — под
влиянием свойственных воде частных сил, ее парообразного со-
стояния, ее вездесущности в верхней части планеты — ею проник-
нуто и охвачено» [11].
Злободневной проблемой современности стало ухудшение
качества природных вод и состояния водных систем в результате
возросшей антропогенной деятельности. Накопление и рассея-
ние веществ антропогенного происхождения по всей планете не
оставили в стороне пресноводные экосистемы, качество воды
которых существенно изменилось за последние десятилетия, а
это, в свою очередь, повлекло за собой изменение состава дон-
ных отложений и живого вещества водных объектов.
Считается, что определяющую роль в загрязнение водной
среды вносит деятельность промышленных предприятий, кото-
104
Глава вторая. Физико-химические процессы в гидросфере
рые направляют свои сбросы в реки и океаны. Не меньший
вклад в загрязнение водной среды вносит современное сельское
хозяйство с его массовым развитием животноводства, интенсив-
ным внесением удобрений и использованием средств защиты
растений. Сбросы коммунально-бытовых вод играют тоже опре-
деленную роль в формировании качественного и количественно-
го состава поверхностных вод.
Химический состав поверхностных и подземных водных систем
в районах с интенсивной антропогенной деятельностью характе-
ризуется:
1) изменением концентрации компонентов природных вод,
характерных для данной водной системы;
2) смещением направленности естественных гидрохимиче-
ских процессов;
3) появлением веществ, не присущих данному водоему.
Количество пресноводных источников и их объемы распре-
делены по территории Земли неравномерно, вследствие чего
чистая питьевая вода становится в ряде районов земного шара
товаром, что является естественным ограничителем устойчивого
экономического развития этих регионов. Особенно ярко это
проявляется на фоне удовлетворения нужд растущего населения,
урбанизации, промышленного развития, ирригации с целью по-
лучения продовольствия и т. д. Эта проблема пока не решена и
усложняется при наблюдаемом росте народонаселения, увеличи-
вающемся загрязнении поверхностных и подземных вод и росте
частоты климатических аномалий, что является предпосылкой
возникновения в отдельных регионах кризисных ситуаций в во-
допотреблении.
Наибольший ущерб качеству воды наносит промышленное
производство. Наблюдения, выполненные в последнем десяти-
летии XX в., показали, что поверхностные воды России загряз-
нены нефтепродуктами в 80, фенолами — в 60, тяжелыми метал-
лами — в 40 случаях наблюдений.
Значительным источником загрязнений природных вод стало
сельское хозяйство. Вынос пестицидов составляет от 1 до 4 %
общего количества применяемых препаратов. Смываемые с по-
лей в водные объекты минеральные удобрения, содержащие
биогенные вещества, стимулируют процессы развития в водо-
емах фитопланктона и водорослей, отмирание которых создает
условия для развития анаэробных микроорганизмов. Это приво-
2.2. Процессы самоочищения водоемов
105
дит к образованию в воде водоемов NH3, СН4 и H2S, а также вы-
делению фенола, индола и других органических токсических ве-
ществ. С территорий ферм и животноводческих комплексов про-
исходит вынос и смыв в водоемы различных отходов (моча,
навоз и т. п.).
Коммунальные (хозяйственно-бытовые) сточные воды со-
ставляют примерно 20 % всего объема стоков, поступающих в
поверхностные водоемы. Основными загрязняющими вещества-
ми в коммунальных стоках являются взвешенные вещества,
азотсодержащие (NH4, NOj, NO3), фосфорсодержащие (Р2О5),
поверхностно-активные вещества (ПАВ), хлориды и органиче-
ские вещества, сумма которых определяется показателем ХПК
(химическое потребление кислорода) и БПК5 (пятисуточное по-
требление кислорода).
В течение длительного времени существовало мнение, что
все сбросы либо постепенно разрушаются в океанских просто-
рах, либо оседают на дно. Норвежский археолог Т. Хейердал во
время пересечения Тихого океана на плоту «Кон-Тики» в 1947 г.
обратил внимание на то, что в открытом океане по пути следо-
вания на поверхности воды приходилось видеть пятна нефти.
Сегодня почти во всех районах Мирового океана (и даже близ
Антарктиды) можно обнаружить нефтяные загрязнения.
2.2. Процессы самоочищения водоемов
Гидросфера является динамической системой, в которой под-
держивается биохимическое равновесие, и в нормально функ-
ционирующей водной системе, несомненно, имеются большие
резервы для ассимилирования отходов. Динамические системы
обладают замечательной способностью регенерации, и при осто-
рожном и продуманном планировании даже наиболее сильно за-
грязненные водные системы могут быть возвращены вновь к ак-
тивному и полному их использованию.
Загрязнение водоема, которое проявляется в нарушении
процесса жизнедеятельности биоценозов и изменении качества
воды, происходит в результате сброса в водоем промышленных и
хозяйственно-бытовых сточных вод. Попадая в водоем, сточные
воды вызывают изменение ее химического состава, кислотности,
106 Глава вторая. Физико-химические процессы в гидросфере
повышение мутности воды, уменьшение содержания растворен-
ного кислорода, снижение окислительно-восстановительного
потенциала, резкое увеличение количества микроорганизмов.
Промышленные сточные воды содержат такие токсичные веще-
ства, как нефтепродукты, фенолы, ионы тяжелых цветных ме-
таллов, цианиды и др., которые губительно действуют на водные
микроорганизмы.
Спустя некоторое время после поступления загрязнений со
сточными водами, качество воды в водоеме снова улучшается за
счет процессов самоочищения, происходящих в водоеме.
Процесс самоочищения осуществляется под действием физи-
ческих (разбавления, осаждения грубодисперсных примесей),
физико-химических (коагуляция коллоидных примесей, адсорб-
ция загрязнений на частицах взвесей, ионный обмен), хими-
ческих (гидролиз, окислительно-восстановительные процессы,
комплексообразование) и биологических факторов (аэробное и
анаэробное биохимическое окисление, расщепление органиче-
ских соединений, превращение соединений металлов, серы, азо-
та). В процессе самоочищения от органических веществ основная
роль принадлежит биологическим факторам, когда под действием
определенного вида микроорганизмов и ферментов происходят
минерализация и окисление органических загрязнений. Напри-
мер, высшие жирные кислоты (С|7Н35СООН), не растворимые в
воде, под воздействием микроорганизмов окисляются в аэробных
условиях до диоксида углерода и воды. Углеводороды с большим
числом углеродных атомов окисляются группами бактерий по
различным механизмам. Основной путь окисления можно пред-
ставить в виде цепи последовательных превращений следующей
схемой:
R—СН3 —R—СН2ОН —1^1—> R-CHO —
—I2L-» RCOOH —I2L-» СО2 + Н2О
В водоемах с проточной водой самоочищение осуществляет-
ся быстрее, чем в водоемах с замедленным стоком. Это связано с
большей степенью аэрации воды и большей скоростью окисле-
ния органических веществ.
Донные отложения водоемов также подвергаются биохими-
ческому распаду, но характер протекания этих процессов иной,
чем в толще воды. Донный ил является хорошим сорбентом ор-
2.3. Буферная емкость пресноводных водоемов
107
ганических веществ, и на его поверхности происходят интенсив-
ные биологические процессы. Эти превращения часто протека-
ют в анаэробных условиях окисления и осуществляются микро-
организмами в процессах брожения и дыхания, в результате
которых происходит трансформация сложных органических со-
единений в более простые.
Разложение органических веществ в аэробных условиях осу-
ществляется микроорганизмами, окисляющими сложные орга-
нические соединения углерода, азота, серы, фосфора, железа и
других элементов до простых неорганических форм. В анаэроб-
ных условиях образуются продукты распада, которые могут об-
ладать большей токсичностью, чем исходные вещества: меркап-
таны, органические кислоты, сероводород и др.
Активность биологического самоочищения водоема зависит
от кислородного режима водоема, окислительно-восстановитель-
ного потенциала и кислотности воды.
В процессе самоочищения водоема некоторые легкоокисляю-
щиеся органические вещества могут подвергаться химическому
окислению. Однако основная часть органических загрязнений
удаляется из воды в результате биохимического окисления.
2.3. Буферная емкость пресноводных водоемов
Экосистемы обладают замечательной способностью сопро-
тивляться внешнему токсическому воздействию, пределы варьи-
рования которого связывают с буферной емкостью экосистемы,
под которой понимается такое количество загрязнения — токси-
канта, — которое при попадании в водную систему не нарушает
хода естественных процессов, протекающих в его отсутствие.
Так, например, под буферной емкостью пресноводных экоси-
стем по отношению к тяжелым металлам понимают такое коли-
чество металла-токсиканта, поступление которого существенно
не нарушает естественного характера функционирования всей
изучаемой экосистемы. Металл-токе и кант может существовать в
гидросфере в следующих видах (рис. 2.1):
1) в растворенной форме в виде ионов;
2) сорбированный и аккумулированный фитопланктоном;
3) в виде осадков в результате седиментации взвешенных
частиц соединений металла из водной среды;
108
Глава вторая. Физико-химические процессы в гидросфере
Рис. 2.1. Пути попадания металлов-токсикантов (М) в водные экосистемы
и формы их нахождения
4) адсорбированный в ионной форме на поверхности осадоч-
ных пород непосредственно из водной среды;
5) адсорбированный взвешенными частицами.
Наиболее важными процессами, определяющими устойчи-
вость экосистем к токсическому воздействию такого рода загряз-
нителей, являются адсорбция металла на поверхности взвешен-
ных частиц и их последующая седиментация. Другой не менее
важный путь вывода ионов металлов из водной среды заключа-
ется в связывании их растворенными органическими вещества-
ми в комплексные (координационные) соединения. При этом
общая концентрация токсиканта в воде не меняется. При этом
считается, что наибольшей токсичностью обладают гидратиро-
ванные ионы металлов, а связанные в комплексы токсичны в
меньшей степени или даже почти безвредны.
За счет контакта с почвой в природных поверхностных водах
содержится множество органических веществ, 80 % которых со-
ставляют высокоокисленные полимеры типа гумусовых веществ.
Гумусовые вещества — вещества органического происхождения,
входящие в состав почв, торфяников, лесного перегноя и обра-
зующиеся при разложении остатков растений. Основными пред-
ставителями гумусовых веществ являются гуминовые и фульво-
кислоты, которые представляют основу их химического состава.
2.3. Буферная емкость пресноводных водоемов 109
Все они являются своего рода комплексообразующими реагента-
ми, связывающими ионы металлов в комплексы и тем самым
уменьшающими токсичность вод.
Необходимо отметить и другую особенность поверхностных
вод — их буферная емкость по отношению к металлам-токсикан-
там определяется не только протеканием перечисленных ранее
процессов, но и аккумулирующей способностью гидробионтов
(например, моллюсков), а также кинетикой процессов снижения
токсического воздействия ионов металлов всеми компонентами
экосистемы, включая комплексообразование. Все это свидетель-
ствует о сложности поведения металлов-загрязнителей в поверх-
ностных водах. Например, гуминовые кислоты, представляющие
класс природных высокомолекулярных соединений и образую-
щиеся при превращении растительных остатков в почвах под
влиянием микроорганизмов, способны связывать ионы тяжелых
металлов в прочные комплексы. Они содержат в своей основе
ароматические кольца изо- и гетероциклического строения. В со-
ставе гуминовых кислот обнаружены карбоксильные (—СООН) и
фенолгидроксильные (R—ОН) группы, что позволяет рассматри-
вать их как природные поликислоты.
Фульвокислоты также представляют собой близкие по строе-
нию полимерные вещества. От гуминовых кислот они отличают-
ся меньшей долей ароматичных составляющих и обладают более
разветвленной системой алифатических углеводородных цепей с
концевыми карбоксильными и фенолгидроксильными функцио-
нальными группами.
Группа гуминовых кислот имеет состав, близкий к эмпири-
ческой формуле или С60Н52О30. В состав фульвокислот
главным образом входят: 44 % — С; 5,5 % — Н; 40 % — О;
1,5% — N (мае.).
Особое место в связывании ионов металлов занимают высо-
комолекулярные органические вещества, в частности, гуминовые
и фульвокислоты, которые координируются вокруг ионов метал-
лов и образуют с ними координационную связь с помощью
функциональных карбоксильных и фенолгидроксильных групп.
Прочность комплексных соединений металлов с гумусовыми ве-
ществами зависит от химической природы иона металла и струк-
туры последних. Значения констант устойчивости соответствую-
щих гуматов (комплексов ионов тяжелых металлов с гуминовыми
кислотами) имеют значения в пределах 105—1012 в зависимости от
ПО Глава вторая. Физико-химические процессы в гидросфере
природы металла. Отмечено, что устойчивость гуматов зависит от
кислотности водной среды. Таким образом, можно полагать, что
органические соединения природных поверхностных вод явля-
ются наиболее представленными в них комплексообразующими
веществами и оказывают значительное и даже определяющее
влияние на миграцию металлов, а также на их физиологическую
активность и буферную емкость водных систем.
Контрольные вопросы
1. Как формируется химический состав природных вод?
2. Какие факторы определяют процесс самоочищения водоемов?
3. В каких формах находится металл-токсикант в водной среде?
4. Чем определяется буферная емкость поверхностных вод?
2.4. Химия природных вод
2.4.1. Формирование состава грунтовых, речных
и морских вод
Вода обладает отличительной способностью растворять мно-
гие вещества, образуя многокомпонентные растворы, вследствие
чего гидросфера является естественным резервуаром для множе-
ства соединений, поступающих естественным или антропоген-
ным путем, и поэтому нигде не встречается в химически чистом
виде. Из этого следует, что природные воды представляют собой
раствор довольно сложного химического состава, под которым
понимается весь набор компонентов, представленных газами,
ионами, коллоидными частицами органического и неорганиче-
ского происхождения и растворенных в ней. Количественная и
качественная оценка состава природных вод определяется сре-
дой их формирования, т. е. природой контактирующих с водой
фаз, а также условиями этого процесса взаимодействия. Химиче-
ский состав поверхностных и подземных природных вод опреде-
ляется всей совокупностью воздействий природного и антропо-
генного характера на них, что находит свое отражение в специ-
фике протекания процессов в различных слоях водных систем.
Большое разнообразие процессов, влияющих на формирова-
ние состава природных вод, включает физические, химические и
2.4. Химия природных вод
111
физико-химические взаимодействия. Особенно распространен-
ными являются процессы растворения твердых веществ, выделе-
ние из природных растворов осадков, абсорбция и десорбция га-
зов природными водами, обмен ионов между контактирующими
твердой фазой и водным раствором, гидролиз и комплексообра-
зование, окислительно-восстановительные процессы.
Не меньшее значение для формирования состава природных
вод имеет большая группа биохимических процессов, регули-
рующих различные функции жизнедеятельности с участием ор-
ганических и минеральных веществ, важнейшими из которых
являются фотосинтез, определяющий состав растворенных газов
и увеличение массы органического вещества в воде, а также ми-
нерализация органических соединений и разложение некоторых
неорганических веществ с участием микроорганизмов.
Окончательный состав природных вод формируется посте-
пенно в несколько этапов, начальным из которых можно считать
взаимодействие поверхностных вод с атмосферой и выпадающи-
ми из нее осадками.
Еще в атмосфере мельчайшие капельки воды извлекают из
воздуха различные вещества, которые затем попадают в природ-
ные воды.
Источником минерального состава атмосферных осадков
служат промышленные загрязнения воздуха, особенно от сжига-
ния различных видов топлива, продукты вулканической деятель-
ности, пожаров и т. п.
Следующим этапом, определяющим состав природных вод,
является взаимодействие выпавших атмосферных осадков с поч-
венным покровом. При этом наблюдаются явления растворения
содержащихся в нем солей, адсорбции и ионного обмена. Почвы
оказывают заметное влияние и на уже сложившийся состав
фильтрующейся воды.
На третьем этапе формирования химического состава природ-
ных вод происходит их взаимодействие с минералами литосферы
(земной коры), важное место среди которых занимают физиче-
ское и химическое выветривание под действием воды, солнечной
радиации, ветра и организмов, а также процессы ионного обмена.
Основные компоненты физико-химического состава природ-
ных вод делят на несколько групп: взвешенные вещества, ионы,
растворенные газы, органические вещества, биогенные вещества.
112
Глава вторая. Физико-химические процессы в гидросфере
Основой появления и присутствия взвешенных веществ в во-
дах рек является эрозия русла и склонов. В ряде водных систем
источником взвешенных веществ органического происхождения
является планктон. Производственные и коммунально-бытовые
сточные воды обычно содержат значительные количества взве-
шенных частиц. Одновременно с этим взвешенные вещества мо-
гут образовываться при смешении различных по составу вод.
Содержание ионов различных видов в природных водах опре-
деляет величину их минерализации. В природных водах установ-
лено присутствие большого количества химических элементов, а
также большое количество сложных органических и неорганиче-
ских ионов.
Из растворенных газов наибольшее значение имеют кислород
и диоксид углерода, растворимость которых в воде определяется
их химической природой, парциальным давлением и температу-
рой, а также процессами фотосинтеза водными растениями.
В природной воде почти всегда присутствуют органические
вещества, которые поступают в водоемы из двух основных ис-
точников. Во-первых, это поступление извне с ливневыми и та-
лыми водами. Во-вторых, образование органического вещества в
самом водоеме в результате фотосинтеза и развития растений,
которые способны синтезировать органическое вещество из ми-
неральных соединений. Окраска природных вод, или цветность,
определяется в основном наличием в водах гумусовых веществ,
которые объединяют большую группу природных высокомолеку-
лярных органических соединений.
Компонентами загрязнения природных вод, кроме гумусо-
вых веществ, являются такие органические соединения, как белки,
углеводы, амины, свободные аминокислоты, сложные эфиры,
органические кислоты. Загрязнение природных вод происходит
и в результате применения различных удобрений и ядохимика-
тов, используемых в сельском хозяйстве. К числу постоянных
источников органического вещества следует отнести также бы-
товые и промышленные сточные воды, содержащие поверхност-
но-активные вещества (ПАВ), фенолы, нефтепродукты и др.
Биогенные вещества определяют возможность существования
водных организмов. Они находятся в воде в виде ионов (ЫЩ,
NOj, NOJ, НРОд", Н2РОд, РОд", К+ и др.), а также в виде кол-
лоидов.
2.4. Химия природных вод
113
При сечении водных масс вертикальной плоскостью можно
выделить ряд участков на этом разрезе, обладающих повышен-
ной реакционной способностью.
1. Поверхностная пленка. Эта особая область обычно прости-
рается в глубину до 50—500 мкм. Все равновесные процессы
массообмена между водой и воздухом протекают именно в этой
области. Для нее характерно поразительно высокое содержание
загрязнений практически всех видов. Химизм реакций, проте-
кающих в этом слое воздух — вода, обладающем рядом уникаль-
ных химических и физических свойств, весьма сложен и плохо
изучен.
2. Основная водная масса включает:
а) поверхностные водные массы — сюда обычно проникает
солнечный свет, что создает условия для биологической актив-
ности, обусловленной протеканием фотосинтеза;
б) промежуточные, или глубинные, водные массы — проникно-
вение в эти слои света и теплового излучения минимально;
в) придонные водные массы — слои воды, в которых реакции
переноса от воды к осадку и обратно, по-видимому, приобрета-
ют дополнительное значение.
3. Осадок. Все нерастворимые и частично растворимые веще-
ства в конце концов оказываются в донном осадке, где и соби-
раются все загрязнения. При изменении pH и окислитель-
но-восстановительной характеристики среды соединения могут
либо растворяться, либо выпадать в осадок.
Каждый из этих водных слоев характеризуется изменением
физических, химических и биологических условий, что отража-
ется на кинетике реакций между присутствующими в воде со-
единениями, как это хорошо иллюстрируется влиянием измене-
ния температуры на растворимость соединений и равновесие ре-
акций.
2.4.2. Классификация загрязнений вод
по фазово-дисперсному состоянию
Особенностью использования воды в хозяйственной деятель-
ности человека является то, что ее подавляющая часть в процес-
се того или иного производства изменяет свое качество, загряз-
114
Глава вторая. Физико-химические процессы в гидросфере
няясь различными химическими веществами и возвращаясь в
природные водоемы в виде сточных вод.
Сточными водами называются воды, отводимые после ис-
пользования в бытовой или хозяйственной деятельности челове-
ка. Сброс таких вод приводит к загрязнению водоемов и водото-
ков. Источник, загрязняющий природные поверхностные или
подземные воды веществами, микроорганизмами или теплом,
называется источником загрязнения, а вещество, ухудшающее ка-
чество воды, — загрязняющим веществом.
Загрязнения по своей природе подразделяются на минераль-
ные, органические и бактериальные. В роли минеральных загряз-
нений выступают обычно песок, глина, земля, минеральные соли,
кислоты, щелочи, ионы металлов. К органическим загрязнителям
относят вещества растительного и животного происхождения, а
также различные органические соединения синтетического про-
исхождения. Бактериальными загрязнителями считают живые ор-
ганизмы, в том числе и патогенные, возбудители инфекционных
заболеваний.
По фазово-дисперсному состоянию все загрязняющие вещест-
ва, образующие с водой гетерогенные и гомогенные системы,
подразделяются на 4 группы [7].
Гетерогенные системы содержат в воде взвешенные или кол-
лоидные вещества вследствие агрегации его молекул, взаимодей-
ствующих с водной средой, в результате чего появляется раздел
поверхности фаз.
Гомогенные системы связаны с образованием в воде молеку-
лярных и ионных растворов, появление которых определяется
особым свойством воды как полярного растворителя.
В соответствии с принятой классификацией к первой группе
загрязняющих воду веществ относятся нерастворимые вещества,
образующие грубодисперсные примеси, в виде суспензий или
эмульсий, а также планктон и патогенная микрофлора, находя-
щаяся в воде во взвешенном состоянии. Размер частиц этой
группы составляет 10’1—10 мкм. Проникновение их в водоемы
осуществляется естественной эмиссией и антропогенным путем
со сточными водами промышленных, сельскохозяйственных и
коммунальных предприятий (нефтепродукты, эмульсии мине-
ральных масел и т. д.).
Грубодисперсные примеси в воде кинетически неустойчивы,
вследствие чего в состоянии покоя они осаждаются с образова-
2.4. Химия природных вод
115
нием донных отложений. Для их удаления используют такие ме-
тоды выделения, как отстаивание, фильтрование, центрифугиро-
вание.
Вторая группа загрязняющих примесей имеет размеры
10“’—10“2 мкм и представляет собой гидрофильные коллоидные
частицы почв, грунтов, гуминовые и фульвокислоты, которые
вымываются водой из лесных, торфянистых и болотистых почв,
а также высокомолекулярные вещества природного и техноген-
ного происхождения. Для примесей этой группы характерно об-
разование с водой кинетически и агрегативно устойчивых сис-
тем, кинетическая устойчивость которых в поле сил тяжести
обусловлена броуновским движением, диффузией. Агрегативная
устойчивость коллоидных систем создается силами отталкива-
ния одноименно заряженных частиц вследствие специфической
адсорбции зарядов на межфазной поверхности и образования
диффузных слоев. Одновременно с этим на агрегативной устой-
чивости таких частиц сказывается образование на их поверхно-
сти слоев, обладающих структурно-механическими свойствами.
Распространенными методами выделения загрязнений этого
класса являются коагуляция и флокуляция.
Третья группа загрязнений включает растворенные в воде
газы, органические и слабо диссоциированные неорганические
соединения, размер молекул которых составляет 10“3—10~2 мкм.
Загрязнения этого типа удаляются из воды с использованием
физико-химических методов, включающих абсорбцию и экс-
тракцию, а также методы биохимического окисления.
Четвертую группу примесей составляют вещества, образую-
щие в воде молекулярные или ионные растворы. Вещества этой
группы представлены сильными электролитами (соли, кислоты,
основания), а также хорошо растворимыми соединениями моле-
кулярной природы. Основные приемы для обезвреживания за-
грязнений этого класса включают химические (перевод в мало-
растворимое или газообразное состояние), физико-химические
(сорбция на ионитах, экстракция, электродиализ, обратный ос-
мос) и биологические (биохимическое окисление) методы.
Наиболее распространенными представителями загрязнений
поверхностных вод являются нефтепродукты, фенолы, легко-
окисляемые органические вещества, ионы тяжелых металлов,
синтетические ПАВ, пестициды, радиоактивные вещества.
116 Глава вторая. Физико-химические процессы в гидросфере
2.4.3. Оценка загрязненности воды
Показателями загрязненности водных масс могут служить та-
кие физические параметры, как мутность и прозрачность, цвет-
ность, вкус и запах воды, которые позволяют оперативно провес-
ти приближенную качественную оценку состояния водной систе-
мы. Более точную количественную оценку качества вод и
присутствующих в них загрязнений могут дать химические пока-
затели, такие как кислотность, значение водородного показателя
(pH), величина окислительно-восстановительных свойств систе-
мы (значение редокспотенциала Eh), значение электропроводно-
сти и др. Большой опыт, накопленный исследователями-эколо-
гами в течение длительного периода при оценке качественного
состояния вод, позволил выработать критерий, достаточно про-
стой и одновременно позволяющий надежно определить качест-
во воды, не прибегая к химической идентификации опасных
компонентов.
В качестве возможного критерия может употребляться такая
характеристика, как пятисуточное биохимическое потребление
кислорода (БПК5). БПК — это показатель, указывающий, какое
количество кислорода используется при биохимическом окисле-
нии органических веществ воды за определенный промежуток
времени (за двое суток — БПК2, за пять — БПК5 и т. д.). Приня-
то определять суммарное загрязнение воды органическими ве-
ществами по расходу кислорода на разрушение (окисление) ор-
ганических веществ микроорганизмами, который считается рав-
ным значению пятисуточного биохимического потребления
кислорода — БПК5. Эта характеристика выражается обычно в мг
кислорода на 1 л сточных вод (мг О2/л). Ее значение определяет-
ся природой загрязнений, что хорошо иллюстрируется приве-
денными ниже данными.
Исходными данными для определения требуемой мощности
сооружений для очистки сточных вод служит потребление воды
на душу населения (или суточная норма потребления) с учетом
количества органических веществ, ежедневно сбрасываемых в
сточные воды. Оценка суммарного загрязнения воды органиче-
скими веществами производится в этом случае по расходу ки-
слорода на их окисление микроорганизмами, который определя-
ется как пятисуточное биохимическое потребление кислорода
2.4. Химия природных вод
117
(БПК5). Значения БПК5 для некоторых видов сточных вод пред-
ставлены в табл. 2.1.
Таблица 2.1. Значения БПК$ для некоторых видов сточных вод
Происхождение Содержание БПК5, мг О2/л
Нефтеочистка 97-280
Пищевая промышленность >5000
Скотоводческие фермы: | моча 15 300
1 навоз 13 600
| силосная жижа 8000
Полученные таким образом значения показателя БПК не от-
ражают в полной мере реальную потребность в окислителе, так
как не учитывают присутствия в воде веществ, разрушение кото-
рых затруднено и осуществляется с низкой скоростью. Более
полное и быстрое представление о количестве восстанавливаю-
щихся соединений в составе сточных вод можно составить, оп-
ределяя химическое потребление кислорода (ХПК), или окис-
ляемость сточных вод. В этом случае проводят окисление ве-
ществ сточных вод раствором перманганата калия в кислой
среде при кипячении:
МпО; + 8Н+ + 5е -> Мп+2 + 4Н2О
При загрязнении промышленными стоками перманганатная
окисляемость не отражает полного содержания загрязнений, так
как некоторые из них, например кетоны, окисляются с трудом.
Полное окисление осуществляют бихроматом калия в сильно
кислой среде:
Сг2О2’ + 14Н+ + бе -> 2Сг3+ + 7Н2О
Значение ХПК нельзя отождествлять с БПК5, величина ко-
торого меньше на количество кислорода, затраченного на окис-
ление различных неорганических веществ.
Контрольные вопросы
1. Как классифицируются загрязнения водных систем по фазово-дис-
персному состоянию?
2. Что является основными компонентами природных вод?
3. По каким показателям оценивают качество воды?
118
Глава вторая. Физико-химические процессы в гидросфере
2.5. Загрязнение водных систем тяжелыми металлами
2. 5.1. Процессы, определяющие формы
существования тяжелых металлов
в водной среде
В условиях активной антропогенной деятельности загрязне-
ние природных вод тяжелыми металлами стало особо острой
проблемой. Основным источником его являются промышлен-
ные предприятия. Термин «тяжелые металлы», применяемый
для обозначения металлов, загрязняющих окружающую среду и
негативно действующих на ее компоненты, исторически сло-
жился под влиянием токсического действия таких металлов,
как свинец, ртуть и кадмий, возглавляющих группу экотокси-
нов. В большую группу металлов, объединенную названием
«тяжелые металлы», входят не только тяжелые благодаря своей
массе элементы, такие как Ag, Sn, Sb, Ba, Tl, но и более лег-
кие, представленные Be, Al, Cr, Se, As. Соединения этих эле-
ментов токсичны во всех своих водо-, щелоче- и кислоторас-
творимых состояниях.
Вода является основной средой миграции тяжелых металлов
в земной коре. Для миграционных процессов в природных водах
особое значение имеют такие факторы, как окислительно-вос-
становительный потенциал, кислото-основные условия (pH), а
также ионное состояние и ряд других. Следует подчеркнуть, что
в отличие от органических соединений, подвергающихся про-
цессам разложения, металлы способны лишь к перераспределе-
нию между отдельными компонентами водных систем. В при-
родных водах они существуют в разных формах и различных сте-
пенях окисления.
Компоненты естественных водных систем характеризуются
так называемыми консервативными или неконсервативными
свойствами. К консервативным веществам относятся металлы,
концентрации которых остаются примерно постоянными либо
характеризуются постоянным отношением к концентрации ка-
кого-либо другого вещества в системе. К таким металлам можно
отнести натрий (Na), калий (К) и кальций (Са).
Группу неконсервативных веществ составляет большинство
переходных металлов (железо, медь, цинк и др.). Их содержание
2.5. Загрязнение водных систем тяжелыми металлами
119
меняется в зависимости от таких факторов, как температура, со-
леность воды, время, сезон и, что более важно, биологическая
активность. Биологическая активность и химическая реакцион-
ная способность металлов частично зависят от их валентного со-
стояния. Сведения о концентрации веществ и их химической
природе необходимы для понимания свойств и реакций, проте-
кающих в водной системе. Структура соединений, в которых
присутствуют металлы, зависит от степени окисления и способ-
ности данного металла к комплексообразованию.
Здесь уместно отметить, что рассматриваемые вещества в ре-
альных системах всегда находятся в равновесном состоянии. Хи-
мическое равновесие в водных системах достигается только для
тех реакций, которые являются быстрыми в геологическом и
биологическом аспектах, поэтому правильнее рассматривать вод-
ные системы не как равновесные, а как дисперсные, находящие-
ся в стабильном состоянии.
Однако во всех случаях превращений металлы не исчезают.
Они могут быть перенесены или сохранены в пределах данной
системы и должны рассматриваться как постоянно присутствую-
щие при любых условиях.
2.5.1.1. Химическое равновесие в водных системах
В водных растворах при соответствующих условиях ионы ме-
таллов будут реагировать с любыми имеющимися в растворе ве-
ществами со скоростью, характерной для этих реакций. Перед
тем, как делать какие-либо выводы о возможных реакциях, не-
обходимо выяснить свойства и характеристики стока поступаю-
щей воды и результирующей смеси.
При смешении одного водного стока, содержащего вещест-
во А, с другой водной массой, содержащей вещество В, между
ними возможно взаимодействие, в результате которого получа-
ются вещества С и D:
/иА +/?В хС + yD (2.1)
Эта реакция записывается в форме стехиометрического урав-
нения, которое представляет собой отношение числа молекул
реагентов и продуктов и является количественным соотно-
шением между исходными веществами и продуктами. Ско-
рость взаимодействия пропорциональна произведению концен-
120
Глава вторая. Физико-химические процессы в гидросфере
траций реагирующих веществ как исходных, так и продуктов
реакции. В последнем случае так выражается скорость обрат-
ной реакции.
Химические реакции делятся на обратимые и необратимые.
Необратимые химические процессы — это односторонне проте-
кающие реакции между исходными веществами до их полного
исчезновения. Обратимые химические реакции — это процессы,
протекающие как в прямом, так и в обратном направлениях. Для
природных водных систем наиболее характерны обратимые фи-
зико-химические процессы.
Вследствие того, что скорость реакции зависит от концен-
трации реагентов, по мере расходования исходных веществ ско-
рость прямой реакции уменьшается. Одновременно с этим про-
исходит накопление продуктов реакции и нарастает скорость об-
ратной реакции. При достижении равенства скоростей прямой и
обратной реакций система достигает равновесного состояния,
которое характеризуется постоянством концентраций всех ком-
понентов системы при неизменных внешних условиях. Концен-
трации исходных веществ и продуктов реакции в этом состоя-
нии называются равновесными и определяются выражением:
К .=™, (2.2)
[А]"[В)"
Здесь Кс — константа равновесия реакции (2.1); [А], [В], [С]
и [D] — равновесные концентрации исходных веществ и продук-
тов реакции; х, у, т и п — стехиометрические коэффициенты
уравнения (2.1).
Более корректным является выражение, в котором вместо
концентраций учитываются термодинамические активности ве-
ществ, участвующих в реакции:
где а,- — активность или эффективная концентрация /-го вещест-
ва. Другими словами, активность соответствует такой концен-
трации вещества в растворе, которая реально проявляет свойст-
ва, отвечающие данному веществу.
2.5. Загрязнение водных систем тяжелыми металлами
121
Значения активности и концентрации связаны друг с другом
соотношением:
*, = YfCf, (2.4)
где у — коэффициент активности, учитывающий меру отклоне-
ния эффективной концентрации или активности л, от задавае-
мой концентрации этого вещества в растворе С,.
Учитывая зависимости (2.3) и (2.4), можно записать выраже-
ние для Кя:
к JCHDF yg -у£ к ухс -у£>
а [АГ[В]" уХ -Ув cyZ-Yb‘
Значение Кя будет равно значению Кс только при условии,
что все у, -> 1.
Если в реакции участвуют ионы или другие заряженные час-
тицы, то вычисление коэффициентов активностей несколько
упрощается при использовании значения ионной силы раство-
ра. Ионная сила раствора (ц) определяется полусуммой произ-
ведений концентраций каждого иона (Q на заряд иона (Z) в
квадрате
i*=|Ec,z/.
В случае достаточно разбавленных растворов значение коэф-
фициента активности вещества связано с ионной силой раствора
следующим образом:
1ST, =(-Л,л/Й). (2.5)
где hj — величина, постоянная для каждого индивидуального ве-
щества.
Отсюда следует, что при бесконечном разбавлении величина
ионной силы раствора стремится к бесконечно малому значе-
нию, а величина коэффициента активности — к единице. Это
означает, что
где Кх — кажущаяся константа равновесия.
122
Глава вторая. Физико-химические процессы в гидросфере
В соответствии с последним выражением кажущаяся кон-
станта равновесия будет иметь постоянное значение только в
очень разбавленных растворах с постоянной ионной силой, ка-
кими обычно являются природные водные системы.
Таким образом, фактором, который может влиять на равно-
весие и ход химических реакций в естественных водных систе-
мах, является наличие больших концентраций ионов загрязняю-
щих веществ в сточных водах, изменяющих ионную силу обра-
зующегося раствора и во многом определяющих его свойства.
Кроме того, реакции, протекающие в водной фазе, очень чувст-
вительны к колебаниям температуры и давления и зависят также
от конкурирующих и существующих совместно равновесных со-
стояний.
2.5.1.2. Растворимость соединений металлов в водных системах
Протекание реакций между веществами, поступающими с про-
мышленными сточными водами, и соединениями, присутствую-
щими в природных водных системах, сопровождается установле-
нием равновесия, описываемого константой равновесия (2.2).
Продуктами такого взаимодействия очень часто являются трудно-
растворимые вещества, такие как гидроксиды, карбонаты, фосфа-
ты, сульфаты металлов, которые образуют в воде взвешенные час-
тицы этих соединений. При определении растворимости таких
соединений в природных водных системах часто не учитывают-
ся ограничения, накладываемые произведением растворимостей.
В насыщенном растворе труднорастворимого вещества-электроли-
та произведение концентраций его ионов в степени стехиометри-
ческих коэффициентов при заданной температуре есть величина
постоянная, называемая произведением растворимостей.
Молекулы растворителя взаимодействуют с молекулами твер-
дых частиц, которые будут переходить в раствор до тех пор, пока
не будет достигнуто химическое равновесие между веществом,
находящимся в осадке, и его растворимой формой. При этом
нужно учесть, что при растворении в воде вещества-электролита,
полностью диссоциирующего на ионы, его растворимость будет
определяться концентрацией в воде соответствующих ионов, на-
пример:
(АдаВя)дав о(/пА"+ + иВ
2.5. Загрязнение водных систем тяжелыми металлами 123
Константа равновесия этого процесса записывается в фор-
ме Кс = ----—------— . С учетом того, что концентрации твер-
[А т В п ] даВ
дых веществ постоянны и принимаются условно равными еди-
нице, можно записать:
Кс = Лгпр = ПР= [А"+]'"[В'”_]",
где Кп р и ПР — разные обозначения произведения растворимо-
стей; [А"+] и [В"'-] — растворимости ионов или ионные концен-
трации.
Значение произведения растворимостей определяет концен-
трации ионов в водной системе при данной температуре и в ко-
нечном счете растворимость вещества. Чем меньше значение Кпр,
тем меньше растворимость вещества и тем меньшее количество
ионов этого вещества будет находиться в растворе. Знание вели-
чины произведения растворимостей позволяет определить кон-
центрацию ионов труднорастворимого вещества в воде и выявить
изменения этой концентрации при колебаниях ряда внешних па-
раметров, таких как температура, наличие ионов другой приро-
ды, pH водной системы, протекание химических реакций.
Температура. Для большинства веществ повышение темпера-
туры приводит к увеличению растворимости.
Влияние электролита. Подобно рассмотренным ранее кон-
стантам равновесия, константу произведения растворимостей Кп р
при любой температуре более корректно выражать через актив-
ности ионов, т. е. записывать как константу произведения актив-
ностей (А'р):
Кр = а^а”„. = [АЯ+]Я’[ВЯ’"]Я
Отсюда соотношение между Кр и Кп р будет иметь вид:
/Г
_ Р
Так как коэффициенты активности связаны с ионной силой
раствора (уравнение 2.5), растворимость рассматриваемого ве-
щества также связана с ионной силой, т. е. с полным содержа-
нием солей в водной системе.
124 Глава вторая. Физико-химические процессы в гидросфере
Химические реакции. Чаще всего растворение соединений ме-
таллов сопровождается их гидролизом. Большинство ионов ме-
таллов и анионов слабых кислот в значительной мере подверже-
но гидролизу. Гидролиз — это химическое взаимодействие ио-
нов соли с ионами водорода или гидроксила воды, которое
может приводить к сдвигу химического равновесия, т. е. к изме-
нению концентраций ионов реагирующих веществ системы.
Так, если растворимость сульфида свинца в водной системе
рассчитывается без учета гидролиза, то произведение раствори-
мости составляет:
*п.р =[Pb2+][S2-] = 8,4 • 10-28,
а следовательно, растворимость каждого вида ионов равна
2,9 • 10“14 моль/л. Если же учитывается реакция гидролиза, то
следует рассмотреть следующее равенство:
PbS<->Pb2+ +S2’.
Если же учитывается реакция гидролиза только иона S2-:
S2 +HOH<->HS’ +ОН",
то нужно учесть и долю ионов S2", участвующих в гидролизе и
переходящих в форму HS", из константы равновесия реакции
„ [HS][OH] 1П_2 п
гидролиза Кс =1i = 83 -10 . Вследствие этого концен-
трация ионов S2" в растворе уменьшается по сравнению со значе-
нием, полученным из произведения растворимостей PbS на ко-
личество ионов, вступивших в реакцию гидролиза. С учетом гид-
ролиза концентрация [S2-] в воде уменьшится до величины ~ 1О’18,
и соответственно возрастет концентрация ионов РЬ2+ до величи-
ны 4,1 • 10_|°, что значительно больше величины, полученной из
значения Кп р (в 10 000 раз).
Если же одновременно протекает гидролиз иона металла, то
точный количественный анализ системы, содержащей сложные
соединения, становится затруднительным.
Все рассматриваемые равновесия гидролиза включают либо
водородные, либо гидроксильные ионы, т. е. растворимость гид-
ролизующейся соли зависит от pH водной системы. В природ-
ных водах значения pH обычно составляют 6—8,5, что оказыва-
ется достаточным для внесения заметных изменений в расчеты
растворимости.
2.5. Загрязнение водных систем тяжелыми металлами
125
Кроме указанных факторов, необходимо учитывать реакции
осаждения с другими анионами, например гидроксильным анио-
ном, а также реакции комплексообразования с другими вещест-
вами в растворе.
Таким образом, растворимость соединений металлов зависит
от большого количества связанных между собой внешних факто-
ров, важнейшими из которых являются солевой состав, pH, про-
текание реакций гидролиза и комплексообразования.
2.5.1.3. Комплексные соединения металлов в водных системах
Большинство металлов в растворе обладает достаточно высо-
кой реакционной способностью. Участие в комплексообразова-
нии позволяет оценить способность металла к взаимодействию с
другими ионами или молекулами сверх его обычной способно-
сти к образованию ионных связей. В результате процессов ком-
плексообразования ионов металлов с молекулами органических
веществ, растворенных в воде, с молекулами воды, ионами ОН”,
СГ, NOд, SO4”, HCOj и рядом других веществ в водной фазе
появляются сложные структурные образования, называемые ко-
ординационными соединениями.
Координационные соединения, комплексы металлов или просто
комплексы, — это такие соединения, молекула или ион которых
содержит центральный атом или ион обычно металла, окружен-
ный некоторым количеством других ионов или молекул. Цен-
тральный атом (или ион) называется комплексообразователем, а
координированные вокруг него ионы или молекулы — лиганда-
ми, или аддендами. Комплексообразователь вместе с лигандами
образует комплекс, или внутреннюю сферу комплексного соеди-
нения. Комплексное соединение-неэлектролит состоит только
из внутренней сферы, например [Pt(NH3)2Cl2] (внутреннюю сфе-
ру комплексного соединения принято заключать в квадратные
скобки). Комплексное соединение-электролит состоит из внут-
ренней и внешней сфер, например K2[Co(SCN)4]. Во внешней
сфере могут стоять любые ионы, заряд которых противоположен
по знаку заряду комплексного иона.
Комплексные электролиты в растворе полностью диссоции-
руют на ионы внешней сферы и комплексный ион, например:
K2[Co(SCN)4] <-> 2К++ [Co(SCN)4]2”.
126
Глава вторая. Физико-химические процессы в гидросфере
Комплексный ион, в свою очередь, в незначительной степе-
ни диссоциирует на составные части:
[Co(SCN)4]2- <-> Со2+ + 4SCN
Константа диссоциации комплексного иона называется кон-
стантой нестойкости.
Константа устойчивости — обратная величина константы
нестойкости: она является мерой степени ассоциации, и ее при-
меняют обычно для описания равновесия образования ком-
плексного соединения.
Комплексы, в которых одни лиганды быстро замещаются на
другие, называются лабильными комплексами. Комплексы, у ко-
торых такое замещение проходит медленно, называются инерт-
ными комплексами.
Координационная связь, обеспечивающая образование ком-
плексного иона или соединения, возникает за счет донорно-ак-
цепторной связи, т. е. когда один участник (акцептор) имеет
свободные орбитали (квантовые ячейки), а другой — неподеден-
ную электронную пару (донор электронов).
Молекулы лигандов, способные присоединяться к централь-
ному атому или иону больше, чем одним атомом или функцио-
нальной группой (т. е. двумя, тремя и т. д.), называются поли-
дентантными, или хелатообразующими лигандами, например,
этилендиаминтетраацетат-ион или нитрилацетат-ион, которые
содержатся в очищающих препаратах и моющих средствах:
н2 н2 н2
"ООС—С С—СОО" с—соо*
/N-S-S~N\ -ООС—H3c-N
-ООС-С Н2 н2 С-СОО- С-СОО-
Н2 Н2 Н2
Этилендиаминтетраацетат-ион Нитрилацетат-ион
Образующиеся комплексные соединения, в которых имеются
хелатообразующие лиганды, называются хелатами.
Комплексный ион образуется во многих случаях путем заме-
щения молекул воды, ранее находившихся в координационной
связи с центральным ионом металла, другими ионами или моле-
кулами. Если в этом участвуют полидентантные лиганды (зани-
мающие более одного координационного места), то образование
комплексного иона протекает более четко и становятся очевид-
2.5. Загрязнение водных систем тяжелыми металлами 127
ними характерные особенности комплексов. Лиганды, занимаю-
щие два, три и шесть координационных мест, являются обычны-
ми и характерны для гуминовых кислот.
Комплексообразование для металлов с координационным чис-
лом 6 с участием различных полидентантных лигандов можно
представить следующим образом:
Бидентантный Тридентантный Гексадентантный Смешанный
(моно-, би-
и тридентантный)
Лиганды этих комплексов могут координироваться через ге-
тероатомы, например, атомы азота:
или кислорода радикала кислоты (или гидроксигруппы) с заме-
щением одного или большего числа ионов водорода:
,р
мп+ + X • h2n — (СН2) — с
он
^N"Kn’x>+
о—м
L х -Iх
В первом примере наблюдается образование заряженных
комплексов, которые обычно растворяются в воде; во втором —
образование заряженных или нейтральных комплексов зависит
от pH раствора. Нейтральные комплексы, плохо растворимые в
воде, обычно называют солеобразующими группами. Они могут
играть важную роль в биохимических процессах определенных
систем.
Образование комплексов металлов с лигандом в виде гуми-
новых кислот существенно важно для всей химии водной систе-
мы, способно влиять на ее окислительно-восстановительный
потенциал и сопровождается изменением таких характеристик
128
Глава вторая. Физико-химические процессы в гидросфере
металла, как растворимость его соединений и доступность для
биологических организмов. Имеются сведения, что различные
гуминовые кислоты (дубильная и таллиевая кислоты) могут в
течение нескольких дней полностью затормозить окисление же-
леза (II).
Существует множество естественных источников лигандов,
способных к образованию комплексных соединений металлов.
Это относится к гуминовым кислотам, которые являются про-
дуктами естественного процесса разложения растений. Другие
природные органические соединения такого рода, например,
аминокислоты и витамины, обнаружены во всех природных
системах.
Обычными лигандами в водных системах оказываются Н2О,
ОН’, СГ, SO4”, НСО3 и ряд молекул органических веществ. Ча-
стным примером образования комплексных соединений метал-
лов, в которых лигандами являются молекулы воды, служат гид-
ратированные соединения металлов.
Гидратированные соединения. Ионы большинства металлов
подвержены реакции гидратации, в которой лигандом являются
молекулы воды:
Мя+ + хН2О [М(Н2О)Дя+
В присутствии других лигандов, например СГ, SO J", возмож-
ны реакции замещения, протекающие в зависимости от относи-
тельной устойчивости образующихся соединений металл — ли-
ганд. При преимущественном образовании гидрат-ионов соеди-
нения имеют ионный характер и в диссоциированном виде
стремятся к перемещению в растворе независимо от других при-
сутствующих в том же растворе соединений.
Все гидрат-ионы обладают в той или иной степени кислот-
ным характером и существуют в растворе в форме:
[М(Н2О) J"+ < >[М(Н2О)Л_,ОН](я-1)+ + Н+
Молекулы координационной воды в комплексах со смешан-
ными лигандами диссоциируют таким же образом. Сила этих
кислот меняется от слабой до средней в зависимости от свойств
координационной сферы. Например, [А1(Н2О)6]3+ является ки-
слотой средней силы со значением Ка = 1,2 • 10’5, a [Fe(H2O)6]!l
является более сильной кислотой (Ка = 6,3 ♦ 10’3).
2.5. Загрязнение водных систем тяжелыми металлами
129
2.5.1.4. Поведение металлов в бескислородных условиях
В придонных водных массах, где преимущественно протекают
реакции переноса металла из воды в осадок и обратно, концен-
трация растворенного кислорода в значительной степени пони-
жена по сравнению с поверхностными водными слоями. В этих
условиях функцию окислителя органических соединений и пере-
вода низших окисленных степеней металла в высшие вместо ки-
слорода могут выполнять соединения азота и серы в высшей сте-
пени окисления — нитраты и сульфаты.
В условиях, отвечающих нормальному содержанию раство-
ренного кислорода в воде, металлы окисляются кислородом до
максимальной степени окисления. Например,
2Fe2+ + О2 + Н2О -» 2Fe3+ + 20Н
В условиях низкого содержания растворенного кислорода
или практически его полного отсутствия в роли окислителя мо-
гут выступать азотсодержащие соединения, в частности нитраты:
(CC2O)„)(NH3)„, ..HN0> >CO2+H2O + N2 + NH3
и далее
NH3 —-> N2 +H2O
При отсутствии нитратов в роли окислителя выступает со-
единение окисленной серы, получаемое в процессе биохимиче-
ского окисления бактериями:
со2 + н2о + h2s + //vnyPnypHbie---->H2SO4
бактерии
или
и гч тт с 1 зеленые с
С02 + Н20 + H2S + Av--------------->S
бактерии
Образующиеся в результате этих процессов сульфат-ионы
или сера выступают далее в роли окислителя.
SO2"
(CH2O)„(NH3)m —-» СО2 + Н20 + H2S + NH3
Av
Протекание этих реакций вызывает понижение окислитель-
но-восстановительного потенциала (ЕА) водной системы, что
5 - 4054 Трифонов
130
Глава вторая. Физико-химические процессы в гидросфере
сразу же сказывается на степени окисления металлов, способст-
вуя их переводу и стабилизации в низшей степени окисления, и
на равновесии процессов переходов ионов металла между осад-
ком и водной фазой.
Так железо переходит в состояние двухвалентного иона вме-
сто обычного трехвалентного. В совокупности с гидролизом
сульфид-ионов это сильно влияет на растворимость различ-
ных металлов. Наиболее серьезными являются изменения, кото-
рые претерпевают металлы, склонные в нормальных условиях к
образованию гидроксидов и выпадению в осадок. Особенно
сильно меняется растворимость. Так, растворимость гидроксида
железа (III) составляет 1,6 • 1О’10 моль/л, тогда как растворимость
железа (II) равна уже 5,8 • 10-6 моль/л, т. е. примерно в 10 000 раз
больше.
2. 5.2. Факторы, определяющие миграцию тяжелых
металлов в водных системах
Способность элементов к перемещениям в водной массе во
многом определяется степенью их окисления. Чем выше заряд
иона металла, тем прочнее он удерживается в виде соединений в
составе минералов породы или твердых отходов, тем менее вы-
ражена его растворимость в природных водах и тем ниже его
водная миграция. Например, растворимость соединений К+
больше, чем соединений Са2+, а соединений Са2+ больше, чем
соединений Fe3+ или (К+ > Са2+> Fe3+).
Водная миграция ионов металлов в степени окисления +п
существенно зависит от их массы, чем больше масса иона Ме+",
тем прочнее он связан в соединении, входящем в минеральную
породу, и тем хуже переходит в водную фазу, тем лучше выпада-
ет в осадок из раствора природных вод.
Концентрация металла в природных водах зависит от его
ионного радиуса: чем больше радиус Ме+", тем легче он перехо-
дит в водную фазу и тем сильнее его участие в процессах раство-
рения.
Миграция ионов металлов в водной фазе определяется в зна-
чительной мере величиной ионного потенциала, под которым
понимается величина отношения заряда иона к его радиусу.
2.5. Загрязнение водных систем тяжелыми металлами
131
Большое число ионов металлов с величиной заряда менее 3+: Li+,
Rb+, Sr2+, Ва2+, Mn2+, Fe2+, Ni2+, Co2+, Zn2+, Cd2+, Hg2+, Pb2+, Cu2+,
Ag+, Au2+, — переходят в воду и хорошо переносятся водой. Эле-
менты, ионы которых имеют заряд 3+ и выше, слабо переходят в
воду, т. е. их соединения обладают пониженной растворимостью
в воде. К ним можно отнести такие многозарядные ионы метал-
лов: Fe3+, Ga3+, Al3+, U4+, Zr4+, Ti4+, Nb5+, Ta5+, Mn4+.
По интенсивности миграции в водной среде можно выделить
три группы металлов и их соединений. Первая группа представ-
лена наиболее легко растворимыми и подвижными галоидными,
гидрокарбонатными и сульфатными соединениями Mn2+, Fe2+,
Со2+, Ni2+, Cu2+, Zn2+. Во вторую группу входят менее раствори-
мые и менее подвижные соединения, такие как SrCO3 SrSO4,
ВаСО3 Третью группу составляют наименее растворимые и наи-
менее подвижные соединения металлов в высшей степени окис-
ления: Fe3+, Mn4+, Ti4+, Zr4+, Th4+.
Формы миграции тяжелых металлов исследованы еще недос-
таточно, но ясно, что комплексные ионы загрязнителей играют
значительную роль. Целый ряд комплексных ионов, например,
[Sn(OH)F] и др., хорошо мигрируют в воде и способствуют ее
загрязнению. Многие комплексы хорошо растворимы в воде, на-
пример, [BeF(H2O)]+, [A1F(H2O)5]2+.
При переходе тяжелых металлов в воду известную роль игра-
ет образование хелатов с ионами этилендиаминтетраацетата и
нитрилтриацетата, которые содержатся в очищающих препаратах
и моющих средствах (см. п. 2.5.1.3).
Комплексы тяжелых металлов имеют различные размеры,
валентность и геохимические свойства, что определяет их мигра-
ционную способность.
Состав вод и состав твердых загрязнителей при их контакте
предопределяет характер процессов растворения (выщелачива-
ния) соединений тяжелых металлов. Обмен между загрязненны-
ми водами и соединениями твердой фазы выражается уравне-
нием:
лМ;ж + /л(А¥„)тв о п(МХт)п + тА^
с константой равновесия:
[М +W]"[A¥„]" '
132
Глава вторая. Физико-химические процессы в гидросфере
Здесь т и п — стехиометрические коэффициенты уравне-
ния (2.25).
Основополагающее значение для распределения металлов
между фазами играет фактор pH среды — водородный показа-
тель, характеризующий кислотность среды. Большинство метал-
лов (Cu2+, Сг3*, Pb2+, Zn2+, Cd2+, Hg2+) осаждаются при значени-
ях pH, лежащих обычно в пределах 6—7. Причем осаждение идет
в виде оксидов, гидроксидов, карбонатов, сульфидов, фосфатов.
При снижении pH, а также недостатке кислорода и в присутст-
вии хелатообразователей происходит переход металла из грунта в
водную фазу.
Распределение металлов в различных формах в водной среде
можно представить в виде следующей схемы:
Формы существования металлов в поверхностных водах [8]
Токсичные формы — формы существования ионов металлов,
негативно действующих на живой организм:
гидратированные ионы металлов [M(H2O)J"+;
простые комплексы с неорганическими анионами: МС1"’Л,
[МНСО3 ]"- 1 и т. д.
Понижение токсичности вследствие образования комплекс-
ных соединений с органическими лигандами:
комплексы с серосодержащими лигандами и аминокислота-
ми: MSR; M(NH2-CH2- .... -СН2СООН) и т. д.;
комплексы металлов с гуминовыми и фульвокислотами.
Коллоидные частицы
Металлы, адсорбированные на поверхности взвешенных час-
тиц: М"+—Fe2O3 • хН2О; М"+— МпО • уН2О и т. д.
Таким образом, металлы в растворимой фракции могут
встречаться в виде свободных, гидратированных ионов, неорга-
нических и органических комплексов и хелатов, комплексов с
высокомолекулярными соединениями — гуминовыми и фульво-
выми кислотами, полисахаридами. В виде оксидов и гидроксидов
металлы адсорбируются коллоидными частицами, находящимися
в водоемах. Кроме того, наличие отрицательных зарядов на кол-
лоидных частицах способствует электростатическому взаимодей-
ствию с катионами металлов. В большом количестве металлы
(тяжелые) сосредоточиваются в донных осадках. Как было отме-
2.5. Загрязнение водных систем тяжелыми металлами
133
чено ранее (раздел 2.3), токсичность металлов понижается при
переходе от гидратированных форм к комплексным соединениям
металлов.
2. 5.3. Формы существования и поведение некоторых
тяжелых металлов в природных водах
В настоящее время существует большая группа металлов (Be,
Al, Сг, As, Se, Ag, Cd, Sn, Sb, Ba, Hg, Tl, Pb), токсичных во всех
своих водо-, шелоче-, кислоторастворимых соединениях.
Особую опасность представляют такие металлы, как Pb, Hg,
Cd и до недавнего времени считавшийся безвредным и неток-
сичным А1.
Свинец (РЬ). В процессе антропогенной деятельности в при-
родные воды ежегодно попадает 500—600 тыс. т свинца. В вод-
ных системах он в основном адсорбирован на поверхности взве-
шенных частиц или находится в виде растворимых комплексов с
гуминовыми кислотами. При биометилировании свинец в итоге
образует тетраметилсвинец. Водные растения хорошо аккумули-
руют свинец, но в разной степени. Иногда фитопланктон удер-
живает его с коэффициентом концентрирования до 105.
При сжигании нефти и бензина в окружающую среду посту-
пает не менее 50 % всего антропогенного выброса этого металла.
Можно утверждать, что содержание свинца в хлорированной во-
допроводной воде больше, чем в нехлорированной. Для перевода
РЬ в форму РЬ+2 необходим окислитель, каковым является хлор-
новатистая кислота (НС1О), образующаяся при хлорировании
воды:
Н2О + С12 -> н+ + сг + нею
Особенности нахождения и миграции свинца в природных
водах обусловливаются осаждением и комплексообразованием с
органическими и неорганическими лигандами. Интенсивность
этих процессов зависит от pH и окислительно-восстановитель-
ного потенциала (Eh) среды, наличия лигандообразователей и
ряда других факторов. Расчеты показывают, что ионообменные
формы свинца дает РЬСО3, а также часть его приходится на РЬ+2
и РЬ(ОН)+. Органические комплексы свинца становятся значи-
134
Глава вторая. Физико-химические процессы в гидросфере
тельными только при концентрации лигандообразователей более
10’6 моль.
Интенсивность сорбции — десорбции свинца речными отло-
жениями зависит от особенностей их литологического (вещест-
венного) состава и от содержания органических веществ. При
отсутствии растворимых комплексообразующих форм свинец
практически полностью сорбируется при pH > 6,0. Уровень об-
щего содержания свинца в атмосферных осадках обычно колеб-
лется от 1 до 50 мкг/л. В промышленных районах он может дос-
тигать 1000 мкг/л.
Ртуть (Hg). До начала промышленной революции ртуть и ее
соединения не оказывали существенного влияния на окружаю-
щую среду, так как их концентрация в природе была крайне ма-
лой (8,3 • КГ6 %). По мере развития промышленного производст-
ва применение ртути и ее соединений становилось более массо-
вым (в мире ежегодно производится около 9000 т металлической
ртути, а всего в XX в. было получено около 500 тыс. т, из кото-
рых значительная часть в итоге оказалась в окружающей среде, в
том числе и в гидросфере).
В настоящее время из ртутных загрязнителей присутствуют
металлическая ртуть Hg°, ее неорганические соединения — соли
двухвалентной ртути типа HgX2 и органические производные —
ртутьорганические соединения типа RHgXR — углеводородный
радикал). Типичным представителем неорганических солей рту-
ти является сулема — HgCl2 — негидролизующееся соединение с
ковалентными связями.
Кислотность среды и ее окислительно-восстановительный
потенциал влияют на нахождение в водной среде той или иной
формы ртути. Так, в хорошо аэрированных водоемах преоблада-
ют соединения Hg2+. Ионы ртути легко связываются в прочные
комплексы с различными органическими веществами, находя-
щимися в воде и выступающими в качестве лигандов. Из наблю-
даемых в водных экосистемах процессов с участием ионов Hg2+
особую роль играет комплексообразование с природными гуму-
совыми веществами. Здесь же следует отметить, что особенно
прочные комплексы образуются с серосодержащими вещества-
ми. Ртуть легко адсорбируется на взвешенных в воде частицах.
При этом фактор концентрирования достигает порой 105, т. е. на
этих частицах собирается ртути в сто тысяч раз больше, чем на-
ходится в равновесии в водной среде. Отсюда следует, что судьба
2.5. Загрязнение водных систем тяжелыми металлами
135
металла в значительной степени определяется сорбцией взве-
шенными частицами с последующей седиментацией. Следует от-
метить, что десорбция ртути из донных отложений затруднена и
протекает медленно, поэтому процесс повторного загрязнения
поверхностных вод также имеет заторможенную кинетику и
практически не наблюдается. Поэтому около половины всего
количества ртути, содержащейся в сточных водах, выпадает в
осадок в отстойниках очистных сооружений и в природных во-
доемах.
Метилртутные соединения в значительных количествах обра-
зуются и аккумулируются в водных системах в результате микро-
биологического алкилирования металлической ртути и неорга-
нических соединений Hg2+:
Hg2+ -> CH3Hg+ -> (CH3)2Hg (2.6)
Метилирование может происходить в почве и донных отло-
жениях, но лучше всего процессы алкилирования протекают в
водных экосистемах, в которых большая часть ртути присутству-
ет в виде метилртутных соединений. Основными факторами, оп-
ределяющими образование этих соединений ртути, являются
концентрация неорганической ртути, pH, температура, окисли-
тельно-восстановительный потенциал, органические компонен-
ты среды, природа присутствующих микроорганизмов, содержа-
ние сульфидов.
В природных водах ртуть может присутствовать в трех состоя-
ниях — элементарном (Hg°), одновалентном (Hg+1) и двухвалент-
ном (Hg+2). Формы нахождения этого металла в воде и их распре-
деление зависит от pH среды. Ртуть поступает в водные системы
из антропогенных источников в виде элементарной ртути, двух-
валентного иона и ацетата фенилртути C6H5Hg(CH3COO). Уста-
новлено, что метилированная ртуть (CH3)2Hg является преобла-
дающей формой.
Для некоторых тяжелых металлов (в частности, ртути) воз-
можность микробиологического алкилирования (уравнение 2.6)
способствует включению их соединений в цикл питания. В при-
веденной на рис. 2.2 схеме указаны наиболее характерные соеди-
нения ртути, предпочтительно присутствующие в воде, воздухе и
донных осадках.
В атмосфере постоянно содержатся пары ртути и ее соедине-
ний, среднее содержание которых составляет от 0,5 до 2,0 нг/м3
136
Глава вторая. Физико-химические процессы в гидросфере
HgS
HgS
Рис. 2.2. Биогеохимический цикл ртути [8]: Х'равн — константа равновесия между
различными формами ионов ртути во взвесях
(1 нг= 10’9 г). Время нахождения паров ртутных соединений в
атмосфере колеблется от 3 мес. до 3 лет, т. е. они имеют глобаль-
ное распространение. Попадающая в атмосферу диметилртуть
(CH3)2Hg после окисления и разложения превращается в катио-
ны Hg2+ и CH3Hg+, которые имеют время жизни порядка не-
скольких недель и поэтому переносятся на короткие расстояния.
При фотохимическом разложении диметилртути образуются ме-
тан (СН4) и этан (С2Н6).
В водах Мирового океана накопилось огромное количество
соединений ртути, исчисляемое десятками миллионов тонн.
В хорошо насыщенных кислородом природных водах будет пре-
2.5. Загрязнение водных систем тяжелыми металлами
137
обладать двухвалентная ртуть в виде Hg2+ или CH3Hg+, а в вос-
становительных условиях преобладает Hg°. Особенно сильно
происходит концентрирование ртути моллюсками и рыбами в
виде серосодержащих комплексов ртути.
В донных отложениях в значительной степени протекает био-
логическое метилирование (реакция 2.6) неорганических произ-
водных двухвалентной ртути. В восстановительных условиях дон-
ных отложений из диметилртути с помощью бактерий образуется
металлическая ртуть, которая включается в реакции окислитель-
ного метилирования. Значительное количество ртути в виде не-
растворимого сульфида HgS переходит в осадочные породы.
Для ртути и олова было обнаружено, что в морских анаэроб-
ных условиях, т. е. в отложениях отмерших водорослей, они,
присоединяя водород, переходят в летучие соединения. Такого
рода гидрирование может осуществляться и с другими тяжелыми
металлами.
В 1953 г. у жителей рыбацкой деревушки в бухте Минамата
(Япония) было обнаружено заболевание, сопровождающееся ло-
мотой в суставах, нарушением слуха и зрения. Это заболевание,
известное под названием «болезнь Минамата», завершилось
смертельным исходом почти для трети больных. Как было уста-
новлено впоследствии, на ацетиленовом производстве отходы в
виде соединений ртути сбрасывались в реку, впадающую в бухту
Минамата. Ртуть микробиологическим путем превращалась в
метилртуть, которая через планктон, моллюсков и рыб в конце
концов попадала в пищу (рис. 2.3). Из рисунка ясно, как сбра-
сываемые в поверхностные воды ртутные отходы проходят ста-
дию метилирования (уравнение 2.28), превращаясь в метилртуть.
Это соединение, последовательно концентрируясь в планктоне,
моллюсках и рыбе, достигало токсичной концентрации и в кон-
це цепи попадало на стол человека.
В метилртутных солях типа CH3HgX связь Hg—С весьма ус-
тойчива, не разрушается водой и слабо взаимодействует с кисло-
родсодержащими основаниями и кислотами. Однако при взаимо-
действии с галогеноводородными кислотами или содержащими
азот, фосфор и серу основаниями реакции протекают достаточно
энергично.
Кадмий (Cd). Содержание кадмия и земной коре очень мало
(8 • 10’6 %), и он относится к числу рассеянных элементов, что не
явилось препятствием для применения кадмия в некоторых от-
138
Глава вторая. Физико-химические процессы в гидросфере
Рис. 2.3. Микробиологический метаболизм ртути в воде и ее накопление в цепи
питания [5]
раслях техники XX в.: для создания никель-кадмиевых аккуму-
ляторов, аварийных и регулирующих стержней для атомных ре-
акторов, в производстве катализаторов, лазерных материалов,
стабилизаторов и т. п.
Ежедневно в организм человека поступает до 0,2 мг Cd, боль-
шая часть с пищей, меньшая — с водой и воздухом. Усвоение ор-
ганизмом путем всасывания в кровь водно-пищевого кадмия на-
ходится на уровне 5—8 %, воздушного — до 80 %.Это является
причиной того, что содержание Cd в организме жителей крупных
населенных пунктов с загрязненной атмосферой может быть в
десятки — сотни раз больше, чем у жителей сельской местности.
Поступление в атмосферу кадмия происходит при сжигании
ископаемых топлив на ТЭС, с газовыми выбросами предпри-
ятий, производящих или использующих кадмий. Образующиеся
аэрозоли кадмия оседают на почвенную поверхность и это до-
полняется внесением в почву соединений кадмия в составе ми-
неральных удобрений (мг/кг): 7,2 — суперфосфатом, 4,7 — фос-
фатом калия, 0,7 — селитрой. Присутствует Cd и в навозе. Цепь
переходов кадмия выглядит следующим образом: воздух —
вода — почва — растение — травоядные — навоз. В организме
кадмий в основном концентрируется в почках и печени.
2.5. Загрязнение водных систем тяжелыми металлами 139
В природные водоемы кадмий попадает со стоками промыш-
ленных предприятий и как результат разрушения отработанных
никель-кадмиевых аккумуляторов. По химическим свойствам
этот металл является аналогом цинка. В водных системах кад-
мий вступает в реакции комплексообразования с растворенными
органическими веществами, особенно если в их структуре при-
сутствуют сульфогидридные группы SH. Характерными для него
являются комплексы с аминокислотами, полисахаридами, гуми-
новыми кислотами. Вместе с тем необходимо учитывать, что
присутствие высоких концентраций этих лигандов не гарантиру-
ет понижение концентрации свободных акваионов кадмия до
уровня, безопасного для живых организмов. Адсорбция ионов
кадмия донными осадками в значительной степени определяется
pH среды. В нейтральных средах концентрация свободных ионов
кадмия в воде близка к нулю, так как он практически нацело
сорбируется частицами донных отложений.
Будучи химическим аналогом цинка, кадмий может заме-
щать цинк в цинксодержащих ферментах (гидроксилазах). После
этого фермент становится неактивным, а организмы, содержа-
щие кадмий, являясь пищей для других организмов, внедряют
тем самым Cd в общую цепь питания. Так как для кадмия пери-
од полувыведения (т. е. время, в течение которого выделяется
или разрушается половина усвоенного организмом вещества) со-
ставляет более 10 лет, то даже минимальным концентрациям
кадмия при их систематическом поступлении в организм надо
уделять серьезное внимание. Последствия попадания и накопле-
ния Cd в организме проявляются болезнью итай-итай, которая
выражается в болезненном скручивании костей, анемии и по-
чечной недостаточности.
Алюминий (А1). Наиболее распространенный металл земной
коры: 8,8 % ее массы составляет А1, входящий в состав различ-
ных минералов. Содержание алюминия в различных объектах
биосферы характеризуется следующими значениями: в почвах —
150—600 мкг/кг, в воздухе городов — около 10 мкг/кг, в водоис-
точниках — от 2,5 мкг/л.
Находящиеся в воде ионы алюминия при поступлении в ор-
ганизм частично всасываются в желудочно-кишечном тракте в
кровь и затем выводятся почками. При нарушении функциони-
рования почек происходит накапливание в организме А1, сопро-
вождающееся ростом хрупкости костей, нарушением метабол из-
140
Глава вторая. Физико-химические процессы в гидросфере
ма Са, Mg, Р, F и развитием различных форм анемии. Более
серьезные последствия аккумулирования в организме алюминия
проявляются в нарушении речи, провалах памяти, потери и на-
рушении ориентации, помутнении рассудка, конвульсиях, а по-
рой и гибели пациентов с почечной недостаточностью. Все это
является симптомами мозгового заболевания, названного диа-
лизной энцефалопатией.
Свидетельства о токсичности алюминия были получены
лишь в 70-е гг. XX в. Алюминий, который относится к числу
наиболее распространенных элементов, нашел широчайшее при-
менение в технике и быту. Вместе с тем необходимо сразу же от-
метить, что не алюминиевая посуда и изделия из металлического
алюминия являются главным источником поставки ионов алю-
миния в организм. Повышение концентрации ионов алюминия
в питьевой воде начинается на водоочистной станции при обра-
ботке ее сульфатом алюминия для удаления примесей коллоид-
ной степени дисперсности. Значительный вклад в увеличение
концентрации алюминия в озерных и речных водах вносят ки-
слотные дожди, которые растворяют природные малораствори-
мые алюмосиликаты почвенного покрова, а это, в свою очередь,
приводит к гибели рыб, земноводных и моллюсков в водоемах,
куда попадают грунтовые воды после выщелачивания алюминия
из почв и пород.
Цинк (Zn). По содержанию в поверхностных водах среди
микроэлементов цинк занимает второе место после марганца.
По имеющимся данным антропогенное поступление цинка в ок-
ружающую среду на 700 % превышает природное.
Среди процессов, оказывающих наибольшее влияние на по-
ведение иона цинка (Zn2+) в водных растворах, можно выделить
гидролиз и комплексообразование. В результате гидролиза обра-
зуются многоядерные гидроксокомплексы. Однако полиядерные
гидроксокомплексы типа [Zn2(OH)6]2- и [Zn2OH]3+ составляют
незначительную долю (<2 %) даже при его концентрации, рав-
ной 1 • 10-1 моль/л. Таким образом, для природных вод более ха-
рактерны гидроксиды [ZnOH]+ и [Zn(OH)2]°, обладающие амфо-
терными свойствами.
Медь (Си). В водной среде медь присутствует в трех основных
формах: взвешенной, коллоидной и растворенной. Последняя
может включать как свободные ионы Си2+, так и комплексные ее
2.5. Загрязнение водных систем тяжелыми металлами
141
соединения с органическими и неорганическими лигандами. Ин-
тенсивная сорбция меди глинистыми частицами обусловливает
ее высокое содержание в донных отложениях. Возможность де-
сорбции из донных отложений зависит от pH среды, жесткости
воды, от присутствия в ней природных и синтетических хелатов и
других комплексообразователей и ПАВ.
Никель (Ni). Подвижность этого элемента в значительной
степени зависит от количества органического вещества в воде,
его характера, а также от pH среды. Никель (II) образует много-
численные комплексные соединения (наиболее прочны ком-
плексы с лигандами, содержащими донорные атомы азота —
NH3, NH2 и т. д.). Ионы Ni2+ в водных растворах подвергаются
гидролизу в меньшей степени, чем катионы других металлов.
Ощутимый гидролиз никеля наблюдается лишь при pH > 9,0.
Содержание никеля в незагрязненных водах обычно колеб-
лется в пределах 1—3 мкг/л.
Хром (Сг). Главный источник поступления антропогенного
хрома — обработка металлов. Неконтролируемые выбросы пред-
ставляют большую опасность загрязнения природных вод ток-
сичной формой Сг+6.
Сг+3 — наиболее устойчивое состояние хрома в природных
водах. Он образует большое количество относительно инертных
в кинетическом отношении комплексов. Его координационное
число равно 6. В обильно насыщенных кислородом водах термо-
динамически более устойчив Сг+6. В водных растворах Сг+6 легко
восстанавливается в присутствии Fe+2, некоторых сульфатов и не-
которых органических веществ. Сг+3, напротив, быстро окисляет-
ся лишь при большом избытке МпО2 и медленно — кислородом.
Марганец (Мп). При окислении выпадает в виде нераствори-
мого МпО2, который в кислой среде переходит в растворимый в
воде ион Мп2+:
МпО2 + 4Н+ + 2е -э Мп2+ + 2Н2О
Представленный в данном разделе материал свидетельствует о
большом разнообразии форм существования в природных аква-
системах различных тяжелых металлов, обусловленном многооб-
разием химических и биохимических процессов с их участием.
Наибольшее количество массы тяжелых металлов в виде малорас-
творимых соединений (оксиды, гидроксиды, карбонаты, фосфа-
ты и т. п.) сосредоточено в донных осадках. Растворимые соеди-
\142
Глава вторая. Физико-химические процессы в гидросфере
нения металлов в основном представлены комплексными соеди-
нениями, образующимися в среде водных масс с повышенным
содержанием органических веществ (гуминовые и фульвокисло-
ты, ПАВ). Перечисленные особенности поведения тяжелых ме-
таллов в водной среде не исчерпывают всех видов их существова-
ния, так как одновременно возможно присутствие нескольких
форм того или иного металла, что может быть вызвано влиянием
таких внешних факторов, как pH и Eh среды, солевой фон (ион-
ная сила растворов), температура и др.
Контрольные вопросы
1. Какие факторы определяют растворимость соединений металлов в
водной фазе?
2. Чем определяется химическое равновесие в водных системах?
3. Какие типы комплексных соединений образуют тяжелые металлы в
водных системах?
4. Что такое координационные соединения и каково их строение?
5. Какие факторы определяют поведение металлов в бескислородных
условиях?
6. Что влияет на миграцию тяжелых металлов в водных системах?
7. Почему алюминий является токсичным металлом?
8. Почему металлическая ртуть менее опасна, чем ее соединения?
2.6. Растворенные в водных системах газы
Все газы, содержащиеся в атмосфере, частично присутствуют
в растворенном состоянии в гидросфере. Между атмосферой и
поверхностным слоем воды через поверхностную пленку осуще-
ствляется газообмен, причем благодаря диффузии и перемешива-
нию газы равномерно распределяются в объеме воды. Кроме того,
процессы фотосинтеза и дыхания организмов сопровождаются
образованием и поглощением кислорода и диоксида углерода.
У реакций, основанных на растворимости металлов, образование
комплексных соединений, значения окислительно-восстанови-
тельного потенциала и pH водной системы очень чувствительны к
содержанию в водной фазе кислорода и диоксида углерода.
При нормальных условиях поверхностный слой воды насы-
щен газом в соответствии с его содержанием в атмосфере и дав-
лением, и в большинстве случаев вода содержит максимально
2.6. Растворенные в водных системах газы 143
допустимое количество газа. Эта величина определяется законом
Генри, который гласит: парциальное давление пара (газа) раство-
ренного вещества над разбавленным раствором пропорциональ-
но молярной доле растворенного вещества в этом растворе
(уравнение 2.36).
Закон Генри не выполняется, если рассматриваемый газ мо-
жет вступать в химическую реакцию с растворителем. Кроме
того, растворимость газа в воде зависит от ионной силы раство-
ра, которая в природных водах часто определяется концентраци-
ей солей. Можно утверждать, что растворимость газов в природ-
ных водных системах в общем случае зависит от температуры,
парциального давления газа в атмосфере, содержания солей в
воде и толщины поверхностной пленки.
2.6.1. Механизм абсорбции газов водной
поверхностью
Поскольку океаны занимают более 70 % поверхности Земли,
взаимодействия, протекающие на их поверхности, имеют значе-
ние для всех загрязняющих веществ, находящихся в тропосфере.
При переносе газа из тропосферы он сначала диффундирует в
газовую фазу около поверхности океана, пересекает границу
газ—жидкость и затем диффундирует в толщу вод.
Описание процессов диффузии молекул газа из объема газа в
жидкую фазу базируется на использовании модели двух слоев
(пленок), предполагающей равномерный переход молекул газа
через стабильный пограничный слой. По этой модели абсорби-
руемый газ диффундирует через ламинарный пограничный слой,
прилегающий к границе раздела фаз газ — жидкость со стороны
газа. Со стороны жидкости также существует пограничный слой,
через который диффундируют молекулы газа, перешедшие гра-
ницу раздела газ—жидкость (рис. 2.4).
Удельный поток молекул газа J, проходящий через любой из
пограничных слоев, определяется по первому закону Фика:
где J — количество молекул газа, переносимое через единицу
поверхности, перпендикулярной к направлению потока, в еди-
144
Глава вторая. Физико-химические процессы в гидросфере
Рис. 2.4. Модель двух слоев (неподвижной пленки) [12]: Р — парциальное давле-
ние компонента в объеме газовой фазы; Р, _ парциальное давление компонента
на границе раздела фаз газ—жидкость; С — концентрация молекул газа в объеме
жидкости; С,- — концентрация молекул газа на границе раздела фаз жид-
кость-газ
(dC\
ницу времени; — — градиент концентрации, или скорость из-
\dx )
менения концентрации С на расстоянии х, измеренном в на-
правлении движения потока; D — коэффициент молекулярной
диффузии. В предположении, что перенос через границу разде-
ла — установившийся процесс, используется такая форма перво-
го закона Фика:
j = (2.7)
к х 7
где ДС — разница концентраций газа, существующая на расстоя-
нии х от поверхности раздела до внешней поверхности гранич-
ного слоя. Если ввести понятие коэффициента массопереноса,
то можно записать выражение (2.6) в следующей форме:
J = kbC.
В соответствии с законом Дальтона концентрация газа в сме-
си газов пропорциональна его парциальному давлению, т. е.
2.6. Растворенные в водных системах газы
145
р. = CjP (здесь Pj и Р— соответственно парциальное давление газа
и общее давление газовой смеси; с, — мольная концентрация
газа в газовой смеси). Далее предполагают, что на границе разде-
ла фаз существует равновесие. Тогда парциальное давление газа
на границе раздела (д) и концентрация молекул газа на границе
(с,) взаимосвязаны. Когда достигается состояние установившего-
ся режима переноса, поток молекул газа из газовой смеси к гра-
нице раздела фаз и поток молекул газа, перешедший границу
раздела фаз в объем жидкости, должны быть равны, т. е.
J=kT(p- р) = £ж(с, - с), (2.8)
где кТ и кж — константы массообмена в газовой и жидкой фазах
соответственно; р и р,— парциальное давление переходящего га-
зового компонента соответственно в объеме газа и на границе
раздела фаз; с и с, — концентрация молекул газа соответственно
в объеме жидкости и на границе раздела фаз.
Полученное уравнение можно записать в другой форме, вве-
дя вместо неизмеряемых параметров р, и с, другие, легко вычис-
ляемые, такие как: р* — равновесное парциальное давление рас-
творяющегося газа над раствором, имеющим ту же концентра-
цию, что и поток жидкости (р* = КИс, где КИ — постоянная
уравнения Генри); с* — концентрация раствора, который нахо-
дился бы в равновесии с растворяемым газом, имеющим то же
парциальное давление, что и в основной газовой смеси (р = Кнс).
С учетом этих замен можно написать уравнение для потока газо-
вых молекул, пересекающих границу раздела газ — жидкость:
J= Кт(р - р*) = Кж(с* - с). (2.9)
Здесь КГ и Кж — общие коэффициенты массопередачи соот-
ветственно в единицах давления или единицах концентрации).
Если уравнение равновесия между газом и жидкостью под-
чиняется закону Генри:
(2.10)
и если учесть, что
Р-Р> кж
- с кт
146 Глава вторая. Физико-химические процессы в гидросфере
(из уравнения 2.8), то можно произвести следующие вычисле-
ния. Из уравнений (2.8) и (2.9) следует, что
адр-р*) = аг(р-р,-).
Так как р* = Кнс, р = Кыс и р, = ALc, то:
1 = 1 {р-р) _ 1 Кп{с-с) КИ{с -Cj) + {Cj-c)
kT (р - р^ кг (р - р^ кГ {р - р^
К" с* - с Cj - с _ КИ
kr[p-Pi p-pj кТ
_1
к,
к„
Таким же образом можно получить, что
1 = 1 । 1
Кж ктКн к.
Если ввести понятие сопротивления переносу молекул газа в
« 1
газовой пленке и обозначить его гт = — и то же самое сделать для
кг
сопротивления переносу молекул газа в жидкостной пленке, т. е.
1
обозначить гж = —, то общее сопротивление процесса переноса
&ж
(R) можно определить исходя из того, какой процесс перехода
лимитирует общую скорость процесса переноса молекул газа.
1. Если Кн » 1, то
11 । 1
АГЖ кж KHkt
Кж = кж и R = гж, т. к.
------>0.
Другими словами, если газ плохо растворяется в воде, (т. е.
Кн» 1), то процесс переноса молекул газа тормозится диффузи-
ей в жидкостной пленке, вследствие чего концентрация молекул
2.6. Растворенные в водных системах газы
147
газа у границ раздела фаз резко увеличивается. Это повышает
парциальное давление растворяющегося газа на границе раздела
фаз (р,) и тем самым снижает движущую силу процесса. В этом
случае поток молекул растворяющегося газа будет описываться
следующим соотношением: J= кж(С/~ с) = Кж(с* - с).
2. Если Кн « 1, то
1 1
---- =----- + —- = ГГ,
*Г *ж
КТ = кТ и R = гг, т. к. —- -> 0 .
кж
В случае хорошо растворимого газа процесс переноса моле-
кул газа из объема газовой фазы в жидкость контролируется ско-
ростью подвода молекул растворяющегося газа к границе разде-
ла, т. е. J= kv(p- р*). Для этого случая 0 и тогда имеем, что
J = ктр.
В области промежуточных значений коэффициента Генри
необходимо учитывать влияние обоих пограничных слоев. Об-
щее сопротивление переносу газа из газовой фазы в жидкость
(R) включает сопротивление в газовой фазе (гг) и сопротивление
в жидкой фазе (гж). Величины гг и гж в значительной степени за-
висят от растворимости и химического взаимодействия газа с
растворителем (водой). Почти во всех случаях одна из этих вели-
чин значительно больше другой, и это имеет существенное зна-
чение для поведения газа над водной поверхностью.
Рассмотрим два случая загрязнения вод газами: в одном слу-
чае преобладает гт (для SO2), в другом случае — гж (для оксида уг-
лерода СО).
Чтобы определить перенос SO2 из тропосферы в океан, сле-
дует учесть взаимодействие газа с водой при растворении:
(SO2)ra3 + Н2О <-> (SO2)Boa;
(SO2U + H2O^H2SO3;
H2SO3 + Н2О < к' > Н3О+ + HSO3- кх = 1,6 • 10-2 моль-1;
HSO3" + Н2О <-^ > Н3О+ + SO3" к2 = 1,0 • 10’7 моль1;
2HSO3~ < ** > S2Oj~ + Н2О к3 = 7 -10-2 моль’1.
148
Глава вторая. Физико-химические процессы в гидросфере
Содержание S (IV) в растворе SO2 зависит от pH раствора и
общей концентрации S (IV). Установлено, что значение R при
pH < 4 полностью зависит от величины гг. Поскольку pH боль-
шинства природных вод равно 8—9, то можно показать, что спо-
собность к образованию ионных форм SO2 в растворе имеет оп-
ределяющее значение для переноса газа из тропосферы в водную
среду. Толщина воздушного пограничного слоя, влияющего на
величину гг, изменяется в зависимости от скорости ветра, умень-
шаясь при ее увеличении, что приводит к увеличению кТ (или
уменьшению гг).
В отличие от SO2 оксид углерода (II) не вступает в химиче-
ское взаимодействие с водой, сохраняя молекулярную форму, и
для СО не характерно ускорение переноса через пограничный
слой жидкости, т. е. процесс газопереноса зависит от гж.
2.6.2. Растворимость кислорода в водных
системах
Основным окислителем в водоемах является растворенный в
воде кислород, который в основном попадает туда из воздуха.
Общее содержание кислорода в гидросфере меняется в пре-
делах 6—12 ppm, и отмечено, что в незагрязненных системах хо-
лодной воды наблюдается повышенная растворимость кислоро-
да, что характерно для природных водных систем в течение осе-
ни и зимы.
Насыщение поверхностного слоя воды обычно составляет
97—105 % (105 % — в случае образования пересыщенных кисло-
родом растворов, при очень медленном нагревании водных
масс) равновесной концентрации кислорода при данной темпе-
ратуре. По мере увеличения глубины залегания слоя воды эта ве-
личина уменьшается. Растворимость кислорода уменьшается при
повышении температуры и увеличении солености воды, в связи
с чем холодная пресная вода содержит больше кислорода, чем
теплая и соленая вода.
Простые расчеты показывают, что при атмосферном давле-
нии в 101 кПа и содержании кислорода в воздухе на уровне
21 % об. максимальная концентрация кислорода в воде составля-
ет 2,7 • 10"3 моль/л, или 86 мг О2/л воды.
2.6. Растворенные в водных системах газы
149
В анаэробных условиях в глубоких слоях воды кислород на
окисление органических соединений заимствуется у аниона
SO2":
SO2/ + Copr-> H2S + 2НСО3
Растворимый кислород играет важнейшую роль в самоочи-
щении водоемов в результате протекания окислительных про-
цессов, сопровождаемых большим расходом кислорода. Крити-
ческое содержание кислорода в воде составляет 4—10 мг О2/л.
Часть растворенного кислорода образуется в результате фо-
тосинтеза, протекающего в водоемах:
СО2 + Н2О + hv -» (СН2О)„ + О2
НСО3- + Н2О + hv -» (СН2О)„ + О2 + ОН-
В результате протекания последних реакций в ходе фотосин-
теза может происходить изменение pH среды.
2.6.3. Растворимость диоксида углерода в водных
системах
Система диоксид углерода — карбонат является одной из
наиболее сложных и важных для гидросферы. Она участвует в
обмене воздух — поверхностные слои воды, влияет на химию
водной системы, биологическую структуру организмов и отло-
жение осадка, содержащего углерод. От этой системы зависит
pH среды, что непосредственно влияет на некоторые химиче-
ские равновесия в данной локальной системе, особенно в отно-
шении ионов, образующих комплексы. Растворимость СО2 зна-
чительно более сложное явление, чем растворимость кислорода,
так как СО2 реагирует с водой и не подчиняется закону Генри.
Определим зависимость концентраций растворенной углеки-
слоты, ионов HCOJ, СО3" в зависимости от такого параметра,
как pH.
Растворение СО2 в воде описывается реакцией:
СО2(Г)-> СО2|р| + Н2О-> Н2СО3
При этом концентрация растворенной углекислоты опреде-
ляется приближенно законом Генри (2.10).
150
Глава вторая. Физико-химические процессы в гидросфере
Угольная кислота является слабой и диссоциирует в две
стадии:
СО2 + Н2О <-> Н2СО3 L—>н+ + НСО3
kx - S 1 _ 4Д7 . ю 7 моль/л при /=25 °C;
[Н2СО3]
НСО3" < ^ > н+ + со2-
Лг2 = [И ] = 4 68 • 10 11 моль/л при t = 25 °C.
2 [НСО3]
Определим мольную долю (N) каждого из углеродсодержа-
щих компонентов в водной среде:
МСО2)
[COJp
[СОД + [HCOJ] + [COj‘]
/У(НСО3‘)
[НСО3]
[СОД + [НСО3‘] + [СО3‘]
[HCOh
У(СО|) =
[СОД +[НСО3-] + [СО’-]
Выразим концентрации компонентов через константы Кн, кх
и к2, а также через концентрации ионов водорода [Н+]:
[СО2]р=КИРСО2; СО2(р)+Н2О = Н2СО3.
Отсюда
[СО2]р=[Н2СО3];
ГНСС1-1 *.[Н2С°3] *,[СО2]р АД„РСО:
IHLU 3 I =--------=---------- =-------
[Н+] [Н+] [Н+]
ГГП2-! _ *2[НСО3-] _ МЛиЛо2
3 [Н + ] [Н + ]2
[Н + ]
2.6. Растворенные в водных системах газы
151
Полученные выражения подставим в уравнение для мольных
долей:
JV(CO2) =----------------------------=
г р кнк,к2рСО2
н с°2 + [НЧ + [НЧ
[НЧ2
[НЧ2 + £,[Н + ] + к,к2 ’
^со:
jV(HCO:) =
___________[НЧ___________
^н^1^СО2 „ р ^"h^I^2^CO2
[нч + н с°2 + [НЧ2
^со2
F р ^н^|Лзо2
н с°2 + [нч + [нч2
=_________к'к2______
[НЧ2 + *,[НЧ + к.к2 '
Из приведенных уравнений можно видеть (рис. 2.5), что рас-
пределение СО2, HCOj и СО3' в растворе зависит от pH и может
быть изображено в виде графика. Можно также отметить, что
pH влияет на буферные свойства системы. При нормальных ус-
ловиях pH природных водных систем составляет 7,0—8,5, для
этой области pH основным в растворе является бикарбонат-ион.
Значения констант диссоциации к} и к2 обратно пропорцио-
нальны ионной силе раствора, которая определяет активность
рассматриваемых ионов. Это значит, что при увеличении ион-
152
Глава вторая. Физико-химические процессы в гидросфере
Рис. 2.5. Зависимость мольной доли карбонат- и бикарбонат-ионов в растворе
от величины pH [13]
ной силы константы уменьшаются (например, при увеличении
содержания солей в воде) и кривые смещаются влево.
В то же время значения констант прямо пропорциональны
температуре. При увеличении температуры кривые смещаются
вправо, но общее количество углерода уменьшается, так как рас-
творимость СО2 снижается в более теплой воде. Одной из при-
чин уменьшения pH природных поверхностных вод является за-
кисление водоемов в результате выпадения кислотных дождей.
Оценим изменение величины pH воды при растворении в ней
углекислого газа. В обычном водоеме бикарбонат-ионы связыва-
ют ионы водорода по реакции:
[Н+ ] + [НСО3] -> СО2 + Н2О,
вследствие чего происходит нейтрализация катионов Н+ и за-
метного изменения pH водоема не наблюдается. При воздейст-
вии кислотных дождей кислотность водоема не будет возрас-
тать до тех пор, пока щелочность не уменьшится в 10—15 раз.
Под щелочностью (Щ) понимают содержание в воде веществ,
вступающих в реакции нейтрализации сильных кислот. Общая
щелочность воды связана с присутствием в ней ионов ОН',
НСО3‘, СО3“:
Щ = [НСО3 ] + 2[СО?-] + [ОН’]
При дальнейшем подкислении поверхностных вод кислыми
осадками наблюдается закисление водоема.
2.6. Растворенные в водных системах газы
153
2.6.4. Буферные свойства системы
диоксид углерода — карбонат
Важной характеристикой природных вод является водород-
ный показатель — pH. Выделение СО2 в результате дыхания и
разложения вызывает понижение pH в природных водах, потому
что при абсорбции СО2 водой образуется слабая (слабодиссо-
циируюшая) кислота (угольная кислота) Н2СО3:
Н2О + СО2 <-> Н2СО3 <-> Н+ + НСО3-
С другой стороны, поглощение СО2 в процессе фотосинтеза
приводит к уменьшению количества Н2СО3 и Н+, т. е. к росту
pH. Можно предположить, что pH регулируется равновесием
СО2 и карбоната Са:
Н2О + со2
п
СаСО3(тв) + Н2СО3 <-> Са2+ + 2НСО7
I DJ X J J
Рассмотрим реакцию
Н2СО3 нН' +НСО3- (2.11)
[Н-][НСО3]
[Н2СО3]
или
к [НСО3]
[Н+] [Н2СО3]
Здесь к= 10-6,5 (из справочника).
Если [НСО3 ] = [Н2СО3] = 10’2 моль/л, то [Н+] = к= 1(Г6’5. От-
сюда, pH = 6,5.
При добавлении в раствор кислоты (например, НО) равно-
весие реакции (2.11) сдвигается влево с образованием Н2СО3.
Чтобы изменить соотношение НСО3 : Н2СО3 до 1:3, потребу-
ется добавить кислоты около 5 • 10-3 моль/л раствора. Прибав-
ленное количество Н+ почти в 104 раз превышает первоначаль-
ное содержание ионов водорода. Новое значение pH будет рав-
но 10~6’5: [Н+] = 1:3; [Н+] = 3 • КГ6’5; pH = 5,9.
154 Глава вторая. Физико-химические процессы в гидросфере
Таким образом, pH изменился незначительно несмотря на
добавление столь большого количества ионов водорода. Поэтому
вода, содержащая Н2СО3 и НСО3, обладает буферными свойст-
вами, вследствие чего достаточно большие изменения концен-
трации Н+ не приводят к значительному изменению pH.
Контрольные вопросы
1. Каков механизм абсорбции газов водной поверхностью?
2. Какими факторами определяется растворимость газов в воде?
3. Как влияет изменение pH воды на существование различных раство-
ренных форм СО2?
2.7. Поведение соединений азота и фосфора
в поверхностных водоемах
В гидросфере содержание азота во всех химических формах
составляет примерно 5 • 10"5 моль/л. В водных системах фикси-
рующим растворенный в воде азот агентом являются синезеле-
ные водоросли, которые продуцируют аммиак:
N2 -> 2N (фиксация)
2N + ЗН2 -> 2NH3
В воде аммиак в аммониевой форме ТЧЩ подвергается двух-
ступенчатой окислительной реакции нитрификации с помощью
автотрофных бактерий-нитрификаторов (2.12) и азотобактером
(2.13):
2NH3 + ЗО2 -> 2Н+ + 2NO2 + 2Н2О (2.12)
2NO2 + 2О2 -» 2NO3 (2.13)
Схематично эту цепь превращений можно представить в сле-
дующем виде:
NH3 (или NH*) -> NO2 -> NO3
В форме нитрат-иона азот поглощается при образовании
аминокислот и протеинов, из которых, в свою очередь, после ги-
бели живых организмов в результате соответствующих биохими-
2.7. Поведение соединений азота и фосфора...
155
ческих процессов (аммонификация) микроорганизмы вновь ре-
дуцируют азот аминокислот в аммиак:
NH2-(CC2)X-COOH -> NH3 + СО2 + Н2О
Завершая кругооборот, нитрат- и нитрит-ионы преобразуют-
ся с помощью бактерий в процессе денитрификации в газооб-
разное состояние в виде N2 и N2O. Тем самым замыкается цикл
азота и восстанавливается равновесие в природе. Массовое при-
менение азотных удобрений нарушает стабильность существова-
ния цикла азота. Свою лепту в это нарушение также вносят от-
ходы органического происхождения, и в результате темпы био-
химических превращений, ответственных за денитрификацию,
начинают отставать от скорости накопления соединений азота,
и становится возможным появление в водоемах повышенных
концентраций нитритов и нитратов с соответствующими вред-
ными последствиями.
Значительные количества азота и фосфора поступают с удоб-
рениями, которые могут вымываться обильными дождями и по-
падать в грунтовые и поверхностные воды. Ионы NO3, NH4,
Н2РО4- и НРО4" способствуют зарастанию водоемов раститель-
ностью. Кроме того, нитраты и нитриты могут быть восстанов-
лены до NH4 сероводородом и оксидом железа (FeO).
Применяемый в качестве удобрения карбамид (мочевина) под
влиянием микроорганизмов и фермента уреазы гидролизуется с
образованием аммиака и диоксида углерода:
(NH2)2CO + 2Н2О —2NH3 + СО2 + Н2О
(NH4)2CO3
Образующейся карбонат аммония подвергается гидролизу:
(NH4)2CO3 + Н2О <-> NH4OH + NH4HCO3
Аммиак, попадающий в воду с удобрениями и отходами
сельского хозяйства, подвергается гидролизу. В зависимости от
температуры и pH этот процесс может сдвигаться в ту или иную
сторону:
NH3 + Н2О Р-Н - 7? ^из nh: + он-
<~РН>7, Гвыс
156
Глава вторая. Физико-химические процессы в гидросфере
При t» 25 °C и pH = 11 равновесие сильно сдвинуто в сторо-
ну выделения NH3.
Нахождение ионных форм фосфора в гидросфере подобно
диоксиду углерода определяется значением pH:
Н3РО4 <->Н+ +Н2РО;
Н2РО; <-> Н+ + НРО24-
нро24- оН+ + РО3"
При значениях pH, характерных для естественных пресно-
водных систем, преобладает форма НРО4” (около 90 %) с приме-
сью Н2РО4 (примерно 10 %).
В настоящее время в результате широкого применения мою-
щих и чистящих средств и их последующего сброса в водные
системы добавляются и другие соединения фосфора. Одним из
компонентов многих синтетических моющих средств являются
конденсированные фосфаты, например, три полифосфаты сле-
дующего состава:
и и
НО-Р-О— —р-0—
I I
он он
II
—Р-ОН
I
он
(здесь х — 1 и ионы водорода замещены ионами натрия). При
гидролизе они могут переходить в форму фосфат-ионов различ-
ной степени диссоциации:
Р3О^ + 2Н2О -> ЗНРО24- + Н+
Из-за низкой растворимости фосфорные соединения гидро-
сферы накапливаются обычно в придонных осадках, где закан-
чивается миграция фосфора.
Полифосфаты моющих средств удаляются из вод в виде
труднорастворимых фосфатов железа:
Fe3+ + РО3- -> FePO4
либо в виде фосфатов кальция состава, близкого к составу апа
тита. Последнее возможно при контакте природных вод с высо-
ким содержанием ионов жесткости со сточными водами, содер-
жащими полифосфаты:
5Са2+ +3PO3f +ОН- -> Са5(РО4)3ОН
2.8. Загрязнение водоемов веществами органического характера 157
Образующийся хлопьевидный осадок основного фосфата
кальция одновременно адсорбирует полифосфаты.
Рост применения удобрений, моющих и чистящих средств,
других товаров, содержащих биогенные элементы, привел к та-
кой ситуации, когда процессы естественного цикла превращения
этих элементов не справляются с возросшей нагрузкой. Следст-
вием этого положения является накопление соединений биоген-
ных элементов в природных водоемах, а это, в свою очередь, спо-
собствует зарастанию естественных водных систем водорослями
и другими водяными растениями с тяжелыми последствиями.
2.8. Загрязнение водоемов веществами органического
характера
Органические вещества, являющиеся нетоксичными для мик-
роорганизмов, животных, человека, вырабатываются бактериями,
микроводорослями, растениями, насекомыми, рыбами, пресмы-
кающимися. Число природных токсинов составляет ничтожную
долю веществ токсического действия, которые были созданы ис-
кусственно и нашли свое применение в технике, медицине, воен-
ном деле, быту, а также являются побочными продуктами, появ-
ляющимися в результате тех или иных отклонений в технологии
производств или как обязательный сопутствующий компонент.
Органические соединения природного происхождения за не-
которым исключением быстро разрушаются в водной среде мик-
роорганизмами, при этом в аэробных условиях образуются СО2
и Н2О, а также нитраты, фосфаты, сульфаты и кислородсодержа-
щие соединения других элементов. В случае анаэробного состоя-
ния водоемов в результате целого ряда взаимосвязанных процес-
сов брожения образуются СН4, СО2, Н2О, NH3 и H2S.
Иначе ведут себя многочисленные синтетические органиче-
ские соединения, которые характеризуются значительной устой-
чивостью к внешним воздействиям, биохимическому окислению
и микробиологическому взаимодействию. К числу чрезвычайно
устойчивых органических веществ относятся нефть и нефтепро-
дукты. Нефть в основном состоит из алифатических углеводоро-
дов. Кроме того, она может содержать алициклические и арома-
тические углеводороды и в небольших количествах альдегиды и
158
Глава вторая. Физико-химические процессы в гидросфере
карбоновые кислоты. По определению нефть — это важнейшее
полезное ископаемое, сложная смесь алканов (С„Н2п+2), некото-
рых циклоалканов (насыщенные полициклические углеводоро-
ды) и аренов (ароматические соединения, построенные из бен-
зольных колец), а также кислородных, сернистых и азотистых со-
единений.
Нефть попадает в пресноводные водоемы, моря и Мировой
океан в результате аварий нефтепроводов и технологического
оборудования на нефтепромыслах, катастроф нефтеналивных
танкеров, а также незначительных, на первый взгляд, местных
сбросов нефти и нефтепродуктов, которые в совокупности дос-
тигают многих миллионов тонн ежегодно.
Обычно при розливе нефти на водной поверхности образует-
ся нефтяная пленка, которая сначала довольно быстро распро-
страняется по водной поверхности. Пленка, образующаяся на
границе раздела воздух—вода, в значительной мере служит акку-
мулятором различных веществ. Она образуется естественным пу-
тем такими поверхностно-активными веществами, как жирные
кислоты, масла и др., которые могут образовывать с растворен-
ными металлами комплексные соединения, легко поглощать
хлорированные углеводороды. Было обнаружено, что в поверх-
ностной пленке коэффициенты обогащения для тяжелых метал-
лов и загрязнений органического происхождения превышают 104
(коэффициент обогащения — величина, показывающая во
сколько раз концентрация вещества в одной фазе больше кон-
центрации этого вещества в другой, контактирующей с первой,
фазой). Это относится в равной степени и к пленкам нефтяных
загрязнений водных поверхностей. При уменьшении толщины
пленки до одной тысячной миллиметра растекание пятна замед-
ляется, а затем и вовсе прекращается. Нефтяное пятно переме-
щается по водной поверхности ветром, но чаще всего течением
воды, что является основной причиной обширных загрязнений.
Сильные ветры в открытом море и прибой у берегов поднимают
в воздух огромное количество брызг водяной пыли, а с ними и
нефтяные капельки. Образующиеся рассеянные нефтяные взве-
си в виде нефтяных туманов могут перемещаться в атмосфере на
значительные расстояния.
Под действием солнечных лучей и ветра нефть начинает испа-
ряться. Уже через десять суток с поверхности океана улетучива-
ются углеводороды с короткой углеродной цепью (менее пяти
2.8. Загрязнение водоемов веществами органического характера 159
атомов углерода, от СН4 до С4Н10), затем улетучиваются углеводо-
роды с числом атомов углерода в цепи до 15—20. Тяжелые компо-
ненты нефти практически не испаряются и постепенно превра-
щаются в пелагическую смолу — комочки типа пластилиновых,
опускающиеся на дно и накапливающиеся в донных отложениях.
Длительное время для борьбы с нефтяными загрязнениями
применяли распыление поверхностно-активных веществ, кото-
рые эмульгировали пленку нефти, распределяя ее мельчайшие
капельки в водной массе, и тем самым создавая условия для бы-
строго разложения в результате природных биохимических про-
цессов. Однако от применения ПАВ пришлось отказаться, так
как они токсичны для морских микроорганизмов и способству-
ют удалению кислорода из воды, создавая мертвые зоны, что
особенно характерно во время штиля.
Естественным потребителем нефти, разлитой на поверхности
океана и накапливающейся в донных отложениях, являются
морские микроорганизмы — бактерии, грибы, дрожжи. Атакуя и
окисляя нефтяную пленку и капельки нефти, бактерии быстро
размножаются и покрывают ее сплошным слоем. Бактериальный
слой становится все толще и толще, причем только внутри него
находятся живые микроорганизмы, а ближе к поверхности скап-
ливаются отмершие особи — бактериальный детрит. Эту корку
отмерших тел микроорганизмов поедают другие морские орга-
низмы — инфузории, которые, в свою очередь, являются пищей
для представителей следующего уровня пищевой пирамиды
океана. Процесс этот длительный и в зависимости от погодных
условий, времени года и других факторов может длиться от не-
скольких недель до нескольких месяцев.
Значительные проблемы, связанные с загрязнением природ-
ных вод, создаются поверхностно-активными веществами (ПАВ),
или детергентами (тензидами). ПАВ — вещества, адсорбция ко-
торых из жидкости на поверхности раздела с другой фазой при-
водит к значительному понижению поверхностного натяжения.
ПАВ имеют дифильное строение, т. е. состоят из полярной груп-
пы и неполярного углеводородного радикала. В водном растворе
ПАВ на границе с воздухом образуется адсорбционный мономо-
лекулярный слой с углеводородными радикалами, ориентиро-
ванными в сторону воздуха. Концентрация ПАВ в адсорбцион-
ном слое на несколько порядков выше, чем концентрация их в
объеме жидкости.
160
Глава вторая. Физико-химические процессы в гидросфере
Мировое производство ПАВ составляет 2—3 кг в год на душу
населения. Из этого количества ~50 % приходится на бытовую
химию (моющие и чистящие средства, косметика), а остальное
потребляют промышленность и сельское хозяйство.
В состав моющих и чистящих средств входят ПАВ, содержа-
щие одну или несколько функциональных групп, обеспечиваю-
щих понижение поверхностного натяжения воды и концентри-
рующих загрязнение в создаваемой ими пене. Кроме того, в со-
ставе моющих и чистящих средств обязательно присутствуют
связывающие компоненты, назначение которых заключается во
взаимодействии с ионами кальция и магния, присутствующими
в воде в виде солей. Вещества, обеспечивающие такие свойства
моющих средств, выполняют следующие функции: уменьшение
поверхностного натяжения жидкости, в которой они растворе-
ны, и образование стабильной эмульсии или суспензии с части-
цами удаляемых загрязнений, а также снижение жесткости воды
за счет связывания ионов жесткости и образования слабощелоч-
ного раствора.
С химической точки зрения, ПАВ представляют собой орга-
нические соединения с гидрофильными и гидрофобными участ-
ками различной химической природы. Поверхностно-активные
вещества классифицируются следующим образом: анионоактив-
ные, катионоактивные и неионогенные.
К наиболее распространенным анионоактивным ПАВ отно-
сятся алкилсульфоновые кислоты, у которых остаток серной ки-
слоты (SOJ) образует гидрофильный участок
Н
Rj С R2 >
SO3
а также первичные и вторичные алкилсульфаты ROSO3M,
R]R2CHOSO3M (здесь R, R, и R2 - углеводородные радикалы).
Например,
Алкилбензолсульфонат Линейный акилсульфонат
(АБС) (ЛАО
2.8. Загрязнение водоемов веществами органического характера 161
Катионактивные ПАВ (поверхностную активность определя-
ют положительные ионы) широко представлены алкиламмоние-
выми соединениями, которые содержат в качестве полярного
компонента положительно заряженную четвертичную аммоние-
вую группу
r-n-r2
. R3 .
X'
Здесь R, R, и R2 — углеводородные радикалы, R3 — аромати-
ческий углеводород, X — ион галогена или кислотный остаток.
Катионоактивные вещества носят название инверсионных мыл
и проявляют бактерицидные свойства.
Неионогенные ПАВ не образуют ионов (например, полиокси-
этилены), обладают гидрофильными свойствами за счет спирто-
вых групп ОН. Например:
Н3С—(СН2)8—о—(СН2)25ОС2Н5
В качестве связывающих веществ наиболее распространены
смеси полифосфатов с триполифосфатом натрия Na5P3O10. Ак-
тивным связывающим звеном в этом соединении является ион
P3O5q. Он связывает ионы кальция (Са2+) и магния (Mg2+) в не-
растворимые фосфаты и тем самым устраняют жесткость воды,
способствуя усилению активности ПАВ.
При попадании в поверхностные воды стоки, содержащие и
ПАВ, и связывающие агенты, загрязняют их. Было отмечено,
что смеси стойких алкилбензолсульфонатов (АБС) и других ПАВ
влияют на очистку сточных вод ввиду стабилизации ими колло-
идных загрязнений и создании большого количества устойчивой
трудноразрушаемой пены в водных системах. Поэтому в настоя-
щее время вместо АБС применяют ЛАС (линейный алкилсуль-
фонат), который легко поддается разложению и обладает малой
токсичностью.
Очистка от ПАВ в естественных условиях осуществляется
путем биологического окисления под действием гетеротрофных
бактерий, которые входят в состав активного ила. Теоретически
6 - 4054 Трифонов
162
Глава вторая. Физико-химические процессы в гидросфере
биоокисление идет до образования воды и СО2. Алифатические
ПАВ (ал кил сульфаты — ROSO3M) окисляются быстрее, чем
циклические (алкилбензолсульфонаты — RC6H4SO3M), причем
сульфонаты окисляются труднее, чем сульфаты. По-видимому,
это связано с тем, что сульфаты в воде гидрализуются. Прямоце-
почечные первичные и вторичные алкилсульфаты за 1 час пол-
ностью разрушаются в сточных водах. Алкилсульфаты с разветв-
ленной углеводородной цепью окисляются медленнее, а прямо-
цепочечные алкилбензолсульфонаты полностью распадаются за
трое суток.
Особое значение имеют полифосфатные связывающие аген-
ты. Фосфорные поликонденсированные соединения легко гид-
ролизуются с образованием нетоксичных монофосфатов:
P3Oj0 + 2Н2О <^> 2НРО4 + Н2РО;
Образующиеся продукты являются питательной средой для
растений, усиливая их рост и создавая тем самым серьезные
проблемы. Это проявляется в повышенном потреблении раство-
ренного кислорода, обеднении водных масс кислородом, а по
мере отмирания растений и их анаэробного разложения проис-
ходит загрязнение и отравление ранее чистых водоемов продук-
тами гниения и брожения. Для частичной или полной замены
фосфорсодержащих связывающих соединений была предложена
натриевая соль нитрилуксусной кислоты — нитрилацетат натрия
(CH2COONa)3N, который обладает хорошими связывающими
свойствами и легко поддается биологическому разложению.
В настоящее время опасность отравления рыб и образования
пены на поверхности водоемов значительно понизилась. В то же
время не исчезли проблемы, связанные с активизацией загряз-
нений, находящихся в донных осадках. Наличие в сточных водах
полидентантных лигандов, входящих в состав моющих средств,
существенно облегчает переход из осадка в водную фазу ионов
тяжелых металлов в виде соответствующих хелатов, повышает их
миграционную способность и расширяет область загрязнения,
способствуя вторичному загрязнению водного бассейна. Поэто-
му необходимо продолжать поиск таких ПАВ биогенного проис-
хождения, которые быстро и полностью распадались бы в вод-
ной среде.
Органические загрязнения, поступающие в водные системы
как в виде растворов, так и во взвешенном состоянии, содержат
2.8. Загрязнение водоемов веществами органического характера 163
широкий набор веществ, в том числе пестициды. Пестицидами
(от лат. pestis — зараза и caedo — убиваю) называют химические
вещества, обладающие токсичными биоцидными свойствами по
отношению к тем или иным живым организмам — от бактерий и
грибков до растений и вредных теплокровных животных.
В зависимости от того, против кого или чего направлены те
или иные пестициды, различают несколько их классов: инсекти-
циды — препараты для уничтожения насекомых; гербициды — для
уничтожения сорняков и других нежелательных растений; фунги-
циды — для защиты растений от грибковых заболеваний, другие
специфические фунгициды {родентицид эффективен против
крыс, мышей, сусликов; моллюстициды используются против ули-
ток и нематоциды применяют для ограничения количества мик-
роскопических червей).
Общее количество применяемых инсектицидов значительно
превышает количество используемых гербицидов, хотя эффек-
тивность сельскохозяйственного производства напрямую зависит
от применения средств для уничтожения сорняков.
В зависимости от химического строения пестициды подраз-
деляют на несколько больших групп: фосфорорганические со-
единения, производные карбаматов, производные хлорфенокси-
кислот, хлорорганические соединения (табл. 2.1).
Таблица 2. /. Характеристика некоторых пестицидов [6]
Промышленное наименование Назначение Структурная формула и химическое наименование
1. Фосфорорганические вещества
Карбофос (малатион) Уничтожение отдельных вредителей фруктовых деревьев, овощей и деко- ративных растений, а также комаров s о II н II СН3О—р—S—с—с—ОС2Н5 осн с—с—ОС2Н. °СН3 н Ц 2 5 О О,О-диметил-5-( 1,2-дикарбаток- сиэтил)дитиофосфат
Тиофос (паратион) Уничтожение комаров, инсектицид широкого применения против вре- дителей фруктовых де- ревьев и овощей s ,—, н АА с2н5о—р—о—£ Л— no2 ос2н5 ' ' О,О-диэтил-О-(и-нитрофе- нол)тиофосфат
164
Глава вторая. Физико-химические процессы в гидросфере
Продолжение табл. 2.1
Промышленное наименование Назначение Структурная формула и химическое наименование
Дихлорфос (дихлофос) Уничтожение домашних насекомых S II С2Н5О—Р—О—С=СС12 осгн5 О,О-диэтил-(2,2-дихлор)винил- фосфат
Диазинон Эффективен против мно- гих вредителей фрукто- вых деревьев и овошей S II _СН(СН,) сгн5о Р Г ОС2Н5 сн3 О,О-диэтил-О-(2-изопропил-4-ме- тил-6-пиримидил)тиофосфат
2. Производные карбаматов
Севин (карбарил) Обработка хлопка, кор- мовых культур, фруктов и овощей о II 1-нафтил-М-метилкарбамат
Бейгон Против летающих насе- комых, тараканов, му- равьев . V О II С р—О—С—NHCHj О—СН(СН3) 2-изопропоксифенол-М-метилкар- бамат
Зектран Против улиток, слизней, личинок моли н3с \ V о / \ II (CH3)2N—А—о—с—NHCH3 н3с 4-диметиламино-3,5-ксиле- нил-М-метил карбамат
3. Производные хлорфеноксикислот
2,4-Д Уничтожение раститель- ности в водных системах; дефолиант, используемый в военных целях а—К Л—о—с—соон \ // н2 а 2,4-дихлорфеноксиуксусная кислота
2.8. Загрязнение водоемов веществами органического характера 165
Окончание табл. 2.1
Промышленное наименование Назначение Структурная формула и химическое наименование
2,4-ДБ Уничтожение раститель- ности на обочинах дорог и в воде а—С —°—(СНг)з СО°Н CI 4-(2',4'-дихлорфенокси) масляная кислота
2,4,5-Т Уничтожение некоторых видов древесной расти- тельности и сорняков; дефолиант, используемый в военных целях о CI—G д—о—с—соон \# н2 CI 2,4,5-трихлорфеноксиуксусная кислота
Сильве кс (2,4,5-ТР) Эффективен при уничто- жении древесной расти- тельности а CI О—СН(СН3) —соон CI 2-(2',4',5'-трихлорфенокси)про- пионовая кислота
4. Хлорпроизводные углеводороды
ДДТ Против комаров, вреди- телей хлопка, соевых бо- бов, арахиса, а также тех- нических культур, строе- вого леса н ci—\—с——С1 —с— 1 CI 1,1,1-трихлор-2, 2-бис(л-хлорфенил) этан
Линдан (у-ГХЦГ) Уничтожение вредителей посевов хлопка и риса, а также разрушителей дре- весины CI С1.А,С1 CI 1,2,3,4,5,6-гексахлорциклогексан (у-изомер)
Представители 1 и 4 групп, как правило, весьма опасны, и во
многих странах от применения этих пестицидов отказались, за-
менив их на более современные и безопасные — пиретроиды и
феромоны.
166 Глава вторая. Физико-химические процессы в гидросфере
Механизм токсического действия хлорорганических соеди-
нений (например, ДДТ) на организм еще не выяснен полностью.
Они хорошо растворяются в жировой оболочке нервных волокон
и влияют на перенос ионов в волокна и из них. Вызываемые
ими нарушения процесса движения ионов сказываются в появ-
лении судорог и конвульсий, оканчивающихся смертью.
RO
I
RO-P-X—Z
II
Y
К фосфорорганическим относятся вещества общей формулы:
где X и Y — соответственно атом кислорода и серы; R — углево-
дородная или оксиуглеводородная группа; Z — комплексная ор-
ганическая группа, относятся вещества, отличающиеся повы-
шенной токсичностью, например, тиофос и карбофос.
Карбаматы, или производные карбаминовой кислоты, отно-
сятся к универсальным пестицидам и имеют следующую струк-
турную формулу:
о
и
Z—O-C-NH3
Некоторые соединения этой группы действуют как инсекти-
циды, фунгициды или моллюстициды.
Карбаматы и фосфорорганические соединения мешают ра-
боте фермента ацетилхолинэстеразы (АХЭ), являющейся специ-
фическим ферментом нервной системы. Когда действие фермен-
та АХЭ заблокировано, происходят нарушения нервной переда-
чи, сопровождаемые судорогами, параличом и смертью. Между
прочим, именно так действуют боевые отравляющие вещества
зарин, зоман и V-газы.
Хлорфенольные кислоты, или хлорфеноксикислоты, являют-
ся производными простых органических кислот: уксусной, мас-
ляной и пропионовой. Это эффективные гербициды. Заменяя
гормоны роста растений, они обеспечивают сорняку ненормаль-
но быстрое развитие, в результате чего у сорного растения исто-
щаются запасы энергии и оно погибает.
При определении степени воздействия пестицида на окру-
жающую среду руководствуются таким понятием, как стойкость,
2.8. Загрязнение водоемов веществами органического характера 167
которая оценивается временем, необходимым для потери пести-
цидом своей активности. Считают, что активность теряется пол-
ностью, когда пестицид разлагается, т. е. дезактивируется с по-
мощью химических или биологических процессов. Нестойкие
пестициды остаются в окружающей среде в течение нескольких
недель, в то время как стойкие пестициды сохраняются два года
и более.
Из рассмотренных пестицидов только хлорорганические со-
единения относятся к группе стойких, и разложение таких ве-
ществ осуществляется в течение нескольких лет.
Стойкие пестициды обнаруживаются во всех сферах окру-
жающей среды — в воздухе, почве, воде. Однако в результате ес-
тественных процессов осаждения в виде выпадающих осадков
(дождь, снег) и растворения удерживаемых почвой пестицидов
они в конечном итоге накапливаются в водных системах, где по-
степенно разлагаются. Стойкие пестициды проникают в водную
среду несколькими путями. Прямой путь заключается во внесе-
нии пестицидов непосредственно в водную среду для ограниче-
ния или уничтожения насекомых, живущих в воде, и водных
растений.
Сельскохозяйственные и городские дренажные системы яв-
ляют собой косвенный путь проникновения пестицидов в вод-
ную среду, когда они в растворенном виде либо адсорбирован-
ные различными частицами уносятся со сливом и сточными во-
дами.
Время, требуемое для разложения пестицидов, определяется
многими факторами и не в последнюю очередь их растворимо-
стью. Фосфорорганические соединения и производные карбама-
тов хорошо растворимы в воде и обычно хорошо гидролизуются,
и их стойкость измеряется неделями. Этот процесс особенно
легко идет в щелочной среде (уравнение 2.14).
В реакции гидролитического разложения в первую очередь
вступают сложные эфиры карбоновых и фосфорной кислот. Сре-
ди средств борьбы с сельскохозяйственными вредителями все
большую роль играют сложные эфиры фосфорной кислоты. Пре-
жде всего, речь идет о тризамещенных фосфатах; в присутствии
ионов ОН" эти фосфаты переходят в двузамещенные фосфаты:
Ro /S Ros
X + н2о QH » X + ROH (2.14)
ROZ OR ROZ 'он
168
Глава вторая. Физико-химические процессы в гидросфере
Двузамещенные фосфаты в дальнейшем подвергаются гидро-
лизу в кислой среде. При этом четко проявляется тенденция к
замедленному ходу гидролиза у таких тиофосфатов, как парати-
он, систокс и малатион.
Хлорпроизводные углеводородов относительно плохо рас-
творяются в воде (1,2 • 10’7 % для ДДТ), и поэтому они адсорби-
руются на взвешенных твердых частицах, а затем осаждаются и
в виде донных отложений накапливаются в подводной части,
где постепенно разлагаются при протекании биологических
процессов. Эти процессы, идущие в илистых отложениях, носят
восстановительный характер, при этом нитрогруппы могут вос-
станавливаться до аминогрупп, как это видно на примере тио-
фоса (2.15):
Хлорсодержащие соединения частично (уравнение 2.16) либо
полностью теряют хлор (уравнение 2.17):
(Здесь ДДД — дихлордифенилдихлорэтан).
(2.17)
В отличие от низкой растворимости в воде хлорорганические
соединения хорошо растворимы в жирах и маслах, что представ-
ляет серьезную опасность вследствие способности многих расте-
2.8. Загрязнение водоемов веществами органического характера 169
ний и животных накапливать эти вещества в своих тканях. Этот
процесс, называемый биологическим усилением, может привес-
ти к чрезвычайно тяжелым последствиям. Так, например, планк-
тон и мальки рыб могут избирательно поглощать ДДТ и другие
органические соединения. В свою очередь, они сами служат пи-
щей для более крупных организмов. При повторении этого про-
цесса на следующих уровнях цепи питания в организмах, стоя-
щих в конце этой цепи, может оказаться очень высокая концен-
трация этих токсинов (рис. 2.6).
Рис. 2.6. Содержание ДДТ (в частях на миллион по массе) в звеньях
пищевой цепи
В качестве перспективных инсектицидов в последнее время
широкое распространение получили пиретроиды — синтетиче-
ские аналоги природных пиретринов [14]. Пиретрины — природ-
ные инсектициды, содержащиеся в цветках многолетних трав
(например, ромашка далматская). Это оптически активные высо-
кокипящие жидкости, практически не растворимые в воде, легко
окисляются на воздухе, особенно на свету, гидролизуются щело-
170
Глава вторая. Физико-химические процессы в гидросфере
чами. По химической природе пиретроиды являются сложными
эфирами. Поэтому они легко окисляются на воздухе, гидролизу-
ются в щелочной среде и относятся к нестойким пестицидам.
В качестве перспективного метода защиты от членистоногих
предлагается использовать феромоны (от греческого pherein — не-
сти и hormon — возбуждать). Феромоны позволяют насекомым
привлекать партнеров противоположного пола, и поэтому их
можно использовать для дезориентации особей другого пола. Фе-
ромоны являются химическими веществами, и их можно отнести
как к биологическому, так и к химическому методу защиты от
вредителей. К положительным свойствам феромонов можно от-
нести отсутствие негативного воздействия на полезных насеко-
мых (например, пчел), человека и животных, на окружающую
среду.
В отличие от нефти скорость распада фенолов в воде зависит
как от их химического строения, так и от окружающих условий.
Особую роль при этом играют ультрафиолетовое излучение,
концентрация кислорода в воде и микроорганизмы. Простые
фенолы в аэробных условиях под действием соответствующих
бактерий распадаются в течение 7 дней на 96—97 % исходного
количества.
Хлорорганические соединения обычно сильно поглощаются
в гидросфере частицами органических и неорганических веществ
и осадком. Другим фактором, заметно влияющим на раствори-
мость хлорорганических соединений, является концентрация со-
лей в водной системе. Все эти соединения слабо растворимы в
воде, но проявляют свойства, характеризующиеся эффектом «вы-
саливания», т. е. в воде со значительным содержанием солей рас-
творяются гораздо меньше, чем в пресной обессоленной воде.
К числу веществ, разложение которых идет с трудом, отно-
сятся и такие хлорированные углеводороды, например, как орга-
нические растворители с одним-двумя атомами углерода и поли-
хлорированные бифенилы. Хлоруглеводороды могут образовы-
ваться уже в том случае, когда хлорированная вода контактирует
с продуктами распада гумуса. Первым продуктом в цепи взаимо-
действия появляется трихлорметан (СН3С1). Стойкость хлорорга-
нических соединений к процессам разложения повышается с
увеличением числа атомов хлора в молекуле, в то время как ус-
тойчивость углеводородных соединений растет с увеличением
разветвленности углеродных цепей.
2.8. Загрязнение водоемов веществами органического характера 171
Среди окислительно-восстановительных реакций, разрушаю-
щих органические соединения, заметную роль играют реакции
окисления в присутствии ионов тяжелых металлов, выполняю-
щих роль катализаторов. При этом образуются органические
радикалы, которые в дальнейшем вступают в разнообразные ре-
акции:
ROOH + Ме+ -> RO* + Ме+ + ОН*
ROOH + Ме2+ -> ROO* + Н+ + Ме+
Большую роль в разрушении загрязняющих веществ играют
процессы биохимического окисления, катализаторами которых
служат смеси ферментов — оксигеназ и дигидрогеназ:
R-H + NAPDH+ + Н+ -> R-OH + Н2О + NADP+
Здесь NAPDH+ и NADP+ — ферменты.
Возможно окисление спиртов в альдегиды, а их — в карбо-
новые кислоты. При окислении двойной связи С=С образуются
эпоксиды:
О
_ _ _ Оксигеназа ,, V.
Н2С=СНС1 ------- н2с-CHCI
Винилхлорид Эпоксиэтилен
Приведенный материал указывает на значительную роль син-
тетических органических веществ в загрязнении природных вод,
трудность их минерализации как химическими, так и биогенны-
ми факторами, и вследствие этого малую скорость процесса их
выведения из водных систем. Необходимо подчеркнуть, что уве-
личение номенклатуры синтезируемых органических соедине-
ний, возрастание их абсолютного количества приводит к сущест-
венному росту загрязнения воды веществами этой природы, ко-
торые в большинстве своем являются ксенобиотиками и очень
сильными токсикантами. Реальный путь к уменьшению риска
токсикации водных масс планеты заключается в поиске, созда-
нии и применении для нужд человечества органических соедине-
ний, которые в естественных условиях легко превращаются хи-
мическими, биохимическими и биологическими путями в про-
стые минеральные вещества, вовлекаемые в естественный цикл
углерода.
172 Глава вторая. Физико-химические процессы в гидросфере
Контрольные вопросы
1. Чем вредна даже очень тонкая нефтяная пленка на поверхности во-
доема?
2. Что представляют собой ПАВ и как они классифицируются?
3. В чем заключается опасность накопления в природных водоемах ПАВ?
4. Какие существуют виды пестицидов и какова их химическая природа?
5. Как определяются равновесные концентрации загрязняющих веществ
в водных системах?
6. Чем определяется стойкость органических соединений в воде?
7. Какие процессы регулируют разложение ПАВ и пестицидов в водной
среде?
Глава третья
ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ
В ПЕДОСФЕРЕ
Педосфера — это поверхностная оболочка суши Земли, обра-
зованная различными почвами и являющаяся верхней частью
литосферы. Почва представляет собой систему, включающую
твердую составляющую, почвенные растворы и почвенную атмо-
сферу. В среднем на твердую часть почвы приходится 40—45 %,
на почвенные растворы — до 35 % ее объема, а на почвенный
воздух — остальное.
Органические вещества почвы, не входящие в состав живых
организмов или образований, представлены гумусом, в составе
которого различают специфические гумусовые вещества, неспе-
цифические органические соединения и промежуточные про-
дукты распада. К специфическим гумусовым веществам относят
в основном гуминовые и фульвокислоты. Неспецифические со-
единения представлены органическими веществами почвы из
разлагающихся растительных и животных остатков.
По определению, почва состоит из выветренного слоя мине-
ральной породы с живыми организмами и продуктами их разло-
жения. Она обладает рядом свойств, которых лишены атмосфера и
гидросфера. Совокупность частиц почвы представляет своеобраз-
ный «фильтр», который весьма эффективно задерживает твердые
частицы вод, проникающих в нее, и накапливает питательные ве-
щества. Структуру почвы скрепляют частицы глины и гумуса, ко-
торые одновременно адсорбируют ряд веществ, например, тяже-
лые металлы, не давая последним возможности перейти в грунто-
вые воды. При превышении адсорбционной емкости почвы
наступает проскок — загрязнение грунтовых вод вредными веще-
ствами.
Почвы обладают значительной способностью к регенерации.
Многие их обитатели содержат ферменты, ускоряющие расщеп-
174
Глава третья. Физико-химические процессы в педосфере
ление вредных веществ, и это определяет их замечательную спо-
собность к регенерации.
Перечисленные свойства почв определяют их буферную спо-
собность по отношению к антропогенным воздействиям.
3.1. Основные физико-химические процессы,
протекающие в почвах
Одним из видов антропогенно-технического воздействия на
почву является их химическое загрязнение, которое может быть
вызвано следующими причинами:
1) переносом загрязняющих веществ атмосферными осадка-
ми (тяжелые металлы, кислотные дожди, фтор, мышьяк, пести-
циды);
2) применением средств, повышающих урожайность и защи-
щающих растения (удобрения, пестициды);
3) загрязнением земель отходами крупнотоннажных произ-
водств, отвалами топливно-энергетических комплексов, нефтью
и нефтепродуктами.
Под химическим загрязнением почвы следует понимать из-
менение ее химического состава в результате антропогенной
деятельности, сопровождающееся ухудшением или потерей се
естественных свойств. Основные физико-химические процессы,
протекающие в почвах и определяющие изменение их химиче-
ского состава и строения, — это адсорбция, ионный обмен.
Большую роль в изменении химического состава почвы иг-
рает катионный обмен, заключающийся в обмене катионами ме-
жду твердой частью почвы и почвенным раствором, образую-
щимся в результате растворения поверхностной влагой разного
рода веществ.
Катионный обмен — это процесс обратимого стехиометриче-
ского обмена катионами между двумя контактирующими фаза-
ми. Движущей силой этого процесса является неравенство хими-
ческих потенциалов вещества (иона) в контактирующих фазах.
Химический потенциал — это термодинамический параметр (р),
характеризующий химическое и фазовое равновесие в макроско
3.1. Основные физико-химические процессы...
175
пической системе. Химический потенциал компонента в данной
фазе связан с его активностью следующим выражением:
+ RTXna^
где ц, — химический потенциал Z-го компонента в рассматривае-
мой фазе, ц? — стандартный химический потенциал /-го компо-
нента, R — газовая постоянная, Т — абсолютная температура,
//, — активность компонента в данной фазе (для сильно разбав-
ленных растворов //, = cz, где с,- — концентрация компонента).
В состоянии термодинамического равновесия и-фазной системы
химический потенциал любого из компонентов одинаков во всех
фазах, где данный компонент присутствует. В случае неравенст-
ва химического потенциала компонента в контактирующих фа-
зах протекают процессы, приводящие к выравниванию величин
химического потенциала в этих фазах, т. е. к наступлению хими-
ческого равновесия.
Реакция ионного обмена может быть записана следующим
образом:
ПК(Ме"+)„; + иМе2 + ПК(Ме2м+)„ + /nMef+,
где ПК — почвенный поглощающий комплекс; nK(Mef+) и
ПК(Ме2 + ) — ионы Mef+ и Ме“+ в почвенном поглощающем
комплексе; Ме2+ и Ме2 + — ионы металлов в почвенном раство-
ре; п и m — стехиометрические коэффициенты.
Основным участником катионнообменного процесса являет-
ся почвенно-поглощающий комплекс (ПК), который может быть
охарактеризован как совокупность компонентов твердой фазы
почвы, обладающих ионообменной способностью. Наиболее
важной характеристикой ПК и параметром почвы в целом явля-
ется емкость катионного обмена (ЕКО) — это количество катио-
нов одного рода, находящихся в ПК и способных к обмену в
стандартных условиях на катионы раствора, контактирующего с
ПК, другого рода. Для обломков кварца величина ЕКО»
« 6 мг-экв/100 г почвы, а для гуминовых кислот величина ЕКО
доходит до 100 мг-экв/100 г почвы. Очень важная особенность
почвы стоит в том, что она обладает способностью избирательно
поглощать катионы одного сорта, отдавая эквивалентное коли-
чество ионов другого сорта в раствор, например:
ПК(Са2*) + Mg’-:p о nK(Mg2+) + Са2Д
176
Глава третья. Физико-химические процессы в педосфере
Принято рассматривать ионный обмен как гетерогенную хи-
мическую реакцию обмена и количественно характеризовать ее
константой равновесия:
к _ а^ ПК[Мё2Ч
ПК[Са2+]-oMg2. ’
где ПК[Са2+] и ПК[Мё2+] означают концентрации или активно-
сти катионов Са2+ и Mg2+ в почвенном поглощающем комплексе;
°са2- и flMg2- — концентрации или активности катионов Са2+ и
Mg2+ в почвенном растворе; К — концентрационная или кажу-
щаяся константа равновесия.
В общем случае величина К записывается в виде:
1 -L
Г ам;« У (ПК[М«-]У-
|ПК[М^ [ ам.о >
Селективность или избирательность ионного обмена зависит
от свойств катионов и ПК. В общем случае предпочтительнее
связываются катионы с более высоким зарядом, а при равных
зарядах — с более высокой атомной массой или с большим ион-
ным радиусом:
Li+<Na+<NHJ < К+< Rb+< Cs+< Н+
Mg2+ < Са2+ < Ва2+ < А12+ < Fe2+ и т. д.
Предпочтительная адсорбция почвами различных элементов
и их соединений влияет на кислотность почв, которая проявля-
ется в различных формах. Различают следующие виды почвен-
ной кислотности: актуальную и потенциальную [9].
Актуальная кислотность — это кислотность почвенного рас-
твора, обусловленная присутствующими в нем компонентами.
По аналогии с раствором природных вод наибольший вклад
в кислотность почв вносит растворенный углекислый газ:
С02(р) + Н20оН2С03
Так как парциальное давление углекислого газа в почвенном
воздухе в десятки раз больше, чем парциальное давление СО2 в
атмосферном воздухе (в увлажненных, богатых органикой поч-
3.2. Поведение тяжелых металлов и их соединений в почвах 177
вах концентрация углекислого газа достигает 15 % об.), то и ве-
личина pH почвенных растворов может опускаться до 4,0.
Потенциальная кислотность определяется концентрацией со-
держащихся в ПК ионов Н+ и А13+ и подразделяется на обменную
и гидролитическую. Обменная кислотность определяется содер-
жанием связанного в ПК ионов Н+ и АГ3. Ее определяют титро-
ванием щелочью НС1 и А1С13, образующихся при взаимодействии
ПК с раствором КС1:
ПК[Н+] + КС1 <-> ПК[К+] + НС1
ПК[А13+] + ЗКС1 <-> ПК[К+]3 + А1С13
Гидролитическая кислотность также определяется содержа-
нием в ПК ионов водорода, но способ определения их концен-
трации основан на связывании ионов водорода ПК в слабую ки-
слоту, вследствие чего достигается большая полнота перехода
водорода в раствор:
ПК[Н+] + CH3COONa -> nK[Na+] + СН3СООН
В настоящее время существует устойчивая тенденция к умень-
шению pH почв и увеличению их кислотности вследствие:
1) повышения разнообразия и массы вносимых в почву по-
тенциально кислых минеральных удобрений;
2) обескальцивания почв (вымывание Са, связывающего
СО2) при их дренажировании и искусственном орошении;
3) кислых осадков (pH 4—4,5).
3.2. Поведение тяжелых металлов и их соединений
в почвах
Наиболее типичные тяжелые металлы, представляющие опас-
ность, — свинец, кадмий, ртуть, хром, цинк, молибден, никель,
кобальт, олово, титан, медь, ванадий. Пути поступления их в
почву связаны с выбросами промышленных предприятий в атмо-
сферу и последующим их осаждением на почвенный покров пре-
имущественно в форме оксидов или солей. Последние постепен-
но растворяются, переходя в гидроксиды, карбонаты или в фор-
му обменных катионов (рис. 3.1).
7 - 4054 Трифонов
178
Глава третья. Физико-химические процессы в педосфере
Атмосфера
Рис. 3.1. Трансформация и миграция соединений тяжелых
металлов в почвах
Если тяжелые металлы при этих взаимодействиях образуют в
почве прочные нерастворимые соединения (обычно в тяжелосуг-
линистых и глинистых почвах), то это предотвращает загрязне-
ние грунтовых и питьевых вод. Но в таком случае почва все
больше накапливает загрязнения, и при превышении ее емкости
по данным элементам может произойти выброс тяжелых метал-
лов в почвенный раствор. Можно значительно снизить последст-
вия этого процесса при повышении pH почвенного раствора из-
весткованием почв или внесением большого количества таких
органических удобрений, как торф.
Кислотные дожди снижают значение pH почв, увеличивают
их кислотность и тем самым способствуют повышению содер-
жания в почвах растворимых соединений токсичных элемен-
3.2. Поведение тяжелых металлов и их соединений в почвах 179
тов — свинца, алюминия, усилению разложения почвенных со-
единений.
Низкие значения pH способствуют присоединению анионов
к железосодержащим коллоидным частицам в почве, так как
протоны сообщают комплексам положительный заряд.
Для процессов, протекающих в почвах при контакте с поч-
венным раствором, весьма характерна реакция ионного обмена,
в результате которой происходит фиксация твердыми частицами
почвы растворенных катионов водорода, тяжелых металлов,
анионов кислотных остатков (рис. 3.2). Так, попадающие в поч-
ву протоны замещают катионы (например, К+ и Na+), сорбцион-
лМе+(р-р)
ОН(Р-Р)
Рис. 3.2. Ионный обмен на коллоидных частицах почвы: а — катионы, адсорби-
рованные на коллоидных частицах почвы, вытесняются избытком ионов водоро-
да; б — катионы тяжелых металлов сорбируются на минеральных частицах поч-
вы, вытесняя в почвенный раствор катионы натрия; в — связывание фосфат-ио-
нов железосодержащими коллоидными частицами почвы
в
180
Глава третья. Физико-химические процессы в педосфере
но-связанные с коллоидными частицами почвы, которые мигри-
руют в глубинные слои (рис. 3.2, а).
Катионы тяжелых металлов селективно сорбируются на алю-
мосиликатных и других минеральных частицах, вытесняя в поч-
венный раствор катионы натрия, калия, кальция (рис. 3.2, б).
У фосфатов возможен обмен их кислотных остатков с ОН-груп-
пами на поверхности коллоидных частиц, при этом фосфатные
остатки связываются, и дальнейшее усвоение фосфора растения-
ми становится невозможным (рис. 3.2, в).
Для свинца характерно стремление к накоплению в почве
вследствие образования ионов малорастворимых соединений,
адсорбции на глинистых частицах почв. Подвижность его ионов
мала даже при низких значениях pH.
Количество кадмия, поступающего в почвы, оценивается го-
раздо меньшими значениями в сравнении с массой свинца и его
соединений. В кислых почвах со значением pH < 6 наблюдается
растворение соединений Cd, ионы которого весьма подвижны и
мигрируют в составе почвенного раствора. При значениях pH > 6
кадмий аккумулируется в почвах вместе с гидроксидами железа,
марганца и алюминия в основном в виде оксида, гидроксида,
карбоната.
Соединения кадмия с гуминовыми кислотами значительно
менее устойчивы, чем аналогичные соединения свинца. В услови-
ях повышенных значений pH кадмий в почве может присутство-
вать в виде сульфида кадмия (CdS), который образуется из суль-
фатов при наличии восстановительной среды. Образование кар-
боната кадмия (CdCO3) возможно только при значениях pH > 8.
Подвижность ионов двухвалентной меди (Си2+) очень высо-
ка. Она легко переходит из породы в почву, а оттуда в почвен-
ный раствор и поверхностные воды. Надо отметить, что раство-
римость соединений меди заметно увеличивается при значениях
pH<5. Подвижности меди препятствует наличие в почве суль-
фид-ионов, с которыми она образует нерастворимый сульфид
CuS. В восстановительных условиях подвижность меди резко па-
дает, так как соединения одновалентной меди практически не-
растворимы.
Своей высокой подвижностью при pH < 6 цинк обязан хоро-
шей растворимости своих минеральных солей и органических
соединений. При более высоких значениях pH, и особенно в
3.3. Поведение пестицидов в почвах
181
присутствии фосфатов, подвижность цинка ввиду образования
труднорастворимых соединений сильно снижается. Накоплению
цинка в почве способствуют процессы адсорбции в глинах и раз-
личных оксидных минералах, определяемые значениями pH. Из
лесных гумусовых почв цинк быстро вымывается благодаря по-
стоянному естественному поддержанию кислой среды.
Сера, находящаяся в почве в виде сульфата, может восста-
навливаться микробиологическим путем до сульфид-ионов и об-
разовывать с тяжелыми металлами (Си, Cd, Pb, Со и др.) трудно-
растворимые сульфиды.
Марганец обычно встречается в почве в виде пиролюзита
МпО2. При восстановлении он переходит в растворимый ион
Мп2+.
Так как марганец принадлежит к числу накапливающихся в
почве элементов, ион Мп2+ встречается в воде только в малых
концентрациях. Органические соединения (комплексы) марган-
ца также неустойчивы и легко обменивают ионы Мп2+ на другие
катионы, входящие в состав нерастворимых соединений. Похо-
жее положение складывается и с соединениями железа. В обыч-
ных условиях железо накапливается в почве в виде Fe(OH)3. При
малом содержании кислорода в восстановительных условиях по-
нижается окислительно-восстановительный потенциал почвы,
что способствует переводу Fe(III) в Fe(II):
Fe(OH)3 + ЗН+ + е -> Fe2+ + ЗН2О
Ионы железа, марганца и ряда других металлов в восстанов-
ленной форме обладают повышенной подвижностью в почве,
что способствует их переходу в раствор и обеднению почвы эти-
ми металлами.
3.3. Поведение пестицидов в почвах
Для борьбы с вредителями сельскохозяйственных растений и
с сорниками широко применяют различные пестициды, или ядо-
химикаты. Промышленность различных стран производит более
900 наименований неорганических, органических, металлоргани-
ческих и других соединений.
182
Глава третья. Физико-химические процессы в педосфере
Известно, что устойчивые пестициды сохраняют до трети
урожая, но одновременно они отрицательно влияют на числен-
ность и активность почвенной фауны и микроорганизмов. Ос-
татки пестицидов вместе с собранным урожаем и водой могут
попасть в пищу, причиняя вред здоровью человека.
Пестициды накапливаются в почве в результате диффузии в
кристаллические решетки минералов (глин), в процессах осажде-
ния в почвенном слое и при их адсорбции гумусовыми частица-
ми. Время, необходимое для разложения пестицидов, оставшихся
в почве, зависит от таких факторов, как тип почвы, количество
органических веществ, присутствующих в ней, степень обработ-
ки почвы. Если пестициды достаточно сильно сорбированы на
частицах почвы, то даже наиболее растворимые из них не выще-
лачиваются из нее и не переходят в подвижное состояние. О по-
ведении большинства пестицидов в почвах существуют только
общие предположения. Известно, что хлорорганичсские соеди-
нения в анаэробных условиях могут замещать атомы хлора груп-
пами ОН, что исключено в аэробных условиях, где эти вещества
обладают исключительной устойчивостью. В анаэробных услови-
ях группы NO2 органических соединений восстанавливаются до
NH2. Сложные эфиры фосфорной кислоты и метилкарбаматы
легко подвергаются гидролизу, образуя различные продукты в за-
висимости от pH почв, а ароматические амины и фенолы могут
ковалентно связываться с гуминовыми соединениями. Исключи-
тельная устойчивость хлорорганических соединений, таких как
ДДТ, линдан, диоксины, их практическая нерастворимость в
воде приводит к их значительной аккумуляции в почвах и воз-
можности попадания в пищевую цепь.
К сожалению, по отношению к пестицидам сформировались
два полярных суждения. Первое — чрезвычайная осторожность,
боязнь любых химических средств защиты растений. Эта пози-
ция несостоятельна ввиду схожести ее с принципиальным отка-
зом от лечения болезней с помощью лекарств.
Другое альтернативное мнение сводится к пренебрежению
потенциальной опасностью пестицидов как для человека, так и
для окружающей среды.
При игнорировании применения пестицидов теряется значи-
тельная часть урожая, однако пренебрежение токсичным дейст-
вием пестицидов существенно опаснее. Для того чтобы пестици-
ды приносили людям пользу, а не вред, нужно помнить о двух
3.3. Поведение пестицидов в почвах
183
очевидных правилах: соблюдать все существующие предписания
и регламенты по их применению и строго контролировать со-
держание пестицидов и их остатков в пищевых продуктах. Дру-
гого выхода из создавшегося положения нет, если верить заклю-
чению седьмого Конгресса по химии пестицидов (Гамбург,
1990 г.): «В обозримом будущем альтернативы химическому ме-
тоду защиты растений нет».
Контрольные вопросы
1. Назовите основные компоненты почвы. Какую роль они играют в про-
цессе массообмена химических элементов в педосфере?
2. Какие физико-химические процессы, протекающие в почвах, опреде-
ляют изменение их химического состава?
3. Что такое почвенный поглощающий комплекс?
4. Какие виды почвенной кислотности вы знаете? Какие факторы опреде-
ляют значение почвенной кислотности?
5. Какие процессы определяют поведение тяжелых металлов в почвах?
6. Какие процессы характеризуют поведение пестицидов в почвах?
Глава четвертая
ВЕЩЕСТВА, РАСПРОСТРАНЕННЫЕ
В АТМОСФЕРЕ, ГИДРОСФЕРЕ
И ПЕДОСФЕРЕ
Целый ряд веществ антропогенного происхождения обладает
такой высокой степенью проникновения, что распространен во
всех частях биосферы — атмосфере, гидросфере и педосфере.
К таким веществам относятся фталаты, хлорсодержащие углево-
дороды, полихлорированные бифенилы (ПХБ), полицикличе-
ские ароматические углеводороды (ПАУ), диоксины, пентахлор-
фенол, а также представитель тяжелых металлов — кадмий.
Фталаты — производные фталевой кислоты, ее сложные
эфиры — используют во многих отраслях современной промыш-
ленности: в производстве пластмасс, при изготовлении раство-
рителей, смазок, в производстве бумаги и в парфюмерии, при
изготовлении пестицидов, лаков, красок. Структурная формула
сложного эфира фталевой кислоты имеет следующий вид:
О
и
С—OR
C-OR
II
О
Сложный эфир
фталевой кислоты
Фталаты находят во всех частях окружающей среды — в возду-
хе, воде и почве — несмотря на их незначительную растворимость
и летучесть. Их бактериальное разрушение осуществляется с по-
мощью ферментов. Первоначально образуется свободная фтале-
вая кислота, которая в конце цепи превращений превращается в
сукцинат (сукцинаты — это соли и эфиры янтарной кислоты —
НООС(СН2)2СООН) и СО2 или пируват (это ионизированная
Глава четвертая. Вещества, распространенные в атмосфере... 185
форма пировиноградной кислоты — СН3СОСООН) и СО2 — ве-
щества, которые завершают естественный распад глюкозы.
Значительно более вредное воздействие на природу оказыва-
ют полихлорированные бифенилы (ПХБ), период полураспада кото-
рых на открытом воздухе составляет от 10 до 100 лет. Обобщен-
ная структурная формула ПХБ выглядит следующим образом:
Полихлорированный бифенил
Они используются в холодильных установках, как пластифи-
каторы в пластмассах, как жидкие теплоносители и как компо-
ненты технических масел.
Несмотря на малую растворимость в воде и высокую темпе-
ратуру кипения вещества этого класса обнаружены в воздухе,
воде и почве. Микробиологическое разрушение полихлориро-
ванных бифенилов протекает очень медленно, а токсические
свойства их возрастают с увеличением содержания в них хлора.
Полициклические ароматические углеводороды (ПАУ) во мно-
гом сходны с ПХБ, они получили глобальное распространение, в
частности, бенз(а)пирен (см. рис. 1.15).
«Углубление» в структуре
Бенз(о.)пирен
Другие представители этой группы:
1,2-5,6-дибензантрацен
Стрелкой указывается «ВАУ» — область в структуре молеку-
лы, характерная для многих канцерогенных веществ и отличаю-
щаяся углублением в структуре молекулы. Вещества этой группы
186 Глава четвертая. Вещества, распространенные в атмосфере...
не производятся в промышленном масштабе, они образуются в
процессах горения и содержатся во многих природных вещест-
вах, входят в состав выхлопных газов, табачного дыма и образу-
ются как побочные продукты в различных процессах органиче-
ской химии.
Эти вещества обладают высокой устойчивостью в любой сре-
де и присутствуют повсеместно. Механизм и стадии разложения
этих соединений до конца не выяснены. В водных системах их
токсичность снижается вдвое за 5—10 лет. Время микробиологи-
ческого разложения ПАУ составляет несколько месяцев, в тече-
ние которых эти вещества распадаются под действием фермен-
тов на фрагменты и превращаются в более простые и менее
опасные соединения.
Хлорированные алканы и хлорированные алкены (хлорирован-
ные предельные и непредельные углеводороды) особенно часто
используются в качестве растворителей и как исходный матери-
ал для ряда синтеза многих соединений, в том числе пластмасс.
Обладая низкими температурами кипения (СС14 — 76,7 °C;
СНС13 - 61,7 °C; СН2С12 - 40 °C; С12С=СНС1 - 87 °C) и значи-
тельно более высокой, чем у ПАУ, растворимостью в воде (око-
ло 1 г/л при /= 25 °C), вещества этой группы широко представ-
лены в окружающей среде и могут диффундировать даже через
бетонные стенки канализационных систем, попадая таким обра-
зом в грунтовые воды.
Из группы сильнодействующих хлорированных углеводоро-
дов следует выделить тетрахлорметан (СС14), природные источ-
ники образования которого неизвестны. При аэробных условиях
период его полураспада составляет 60—100 лет, и это характерно
и для поверхностных слоев водохранилищ, богатых кислородом.
В анаэробных условиях, например в донных отложениях водо-
емов, с ним протекают метаболические изменения (неполный
распад) за 14—16 дней.
Ряд ароматических хлоруглеводородов применяется в качест-
ве пестицидов, например ДДТ (дихлордифенилтрихлорэтан),
структурная формула которого приводится ниже:
I
CI
Глава четвертая. Вещества, распространенные в атмосфере... 187
ДДТ относится к числу препаратов с интексицидным дейст-
вием, что определяется его хорошей растворимостью в жирах.
Это соединение хорошо сорбируется глинами, а также накапли-
вается в перегное хвойных лесов, где оно растворяется в воско-
вом веществе сосновой хвои.
Вследствие липофильных (растворимость в жирах) свойств
ДДТ при контакте довольно быстро проникает в организм через
кожу. В организме это вещество нарушает механизм транспорта
ионов в мембранах нервных клеток, и поэтому после возбужде-
ния нервных сигналов не происходит восстановления нормаль-
ного состояния. Большие количества ДДТ в организме насеко-
мых вызывают судороги, конвульсии и паралич конечностей.
Воздействие одних и тех же концентраций на различные орга-
низмы проявляется в разной степени, что определяется биологи-
ческими факторами. Установлено, что малое количество ДДТ
или других хлорорганических соединений (10“4—10~3 %), попа-
дающих в организм человека, не приводит к каким-либо наблю-
даемым вредным последствиям.
В обычных условиях распад ДДТ протекает медленно и не-
полностью (рис. 4.1).
В аэробных условиях распад идет до производных дихлорэ-
тилена. В анаэробных условиях происходит восстановление до
производного дихлорэтана. Период полураспада ДДТ составляет
в среднем 10 лет.
Наиболее опасными среди множества токсичных веществ,
кроме полиароматических углеводородов (ПАУ), являются диок-
сины. Группа диоксинов объединяет сотни веществ, каждое из
которых содержит специфическую гетероциклическую структуру
с атомами хлора в качестве заместителей.
Название «диоксины» дано для сокращения применительно к
большой группе высокотоксичных экотоксикантов — полихлори-
рованных дибензодиоксинов (ПХДД) и дибензофуранов (ПХДФ).
ПХЛД ПХДФ
Рассмотрим формулу диоксина: в центре два атома кислоро-
да, соединенные с двумя бензольными кольцами, каждое их ко-
торых в свою очередь связано с двумя атомами хлора.
188 Глава четвертая. Вещества, распространенные в атмосфере...
Монооксигеназа
Рис. 4.1. Основные пути распада ДДТ (дихлордифенилтрихлорэтана) [3]
Если отбросить один атом кислорода — перед нами почти
столь же ядовитый тетрахлордибензофуран:
2,3,7,8-тетрахлордибензодиоксин
2,3,7,8-тетрахлордибензофуран
Установлено, что четыре периферийных атома хлора — чис-
ло отнюдь не обязательное. Оно может быть и иным, и всякий
раз получится новое отравляющее вещество.
Если заменить в формуле диоксина атомы хлора на бром,
число ядов удвоится. Можно также присоединить к бензольным
кольцам сочетания атомов хлора и брома.
Глава четвертая. Вещества, распространенные в атмосфере... 189
Таким образом, под диоксинами следует подразумевать не
какое-то конкретное вещество, а несколько десятков семейств,
включающие трициклические кислородсодержащие ксенобиоти-
ки (т. е. вещества, неприемлемые для живых организмов), а так-
же семейство бифенилов, не содержащих атомов кислорода.
Молекула диоксина имеет форму прямоугольника размерами
3 • 10 А. Это позволяет ей удивительно точно вписываться в ре-
цепторы живых организмов. Физиологическая активность при-
шельцев подавляет жизненные функции приютивших их хозяев,
заставляет их работать иначе. Блокируя рецепторы, молекула ди-
оксина, как и вирус СПИДа, подавляет иммунные возможности
организма. Начаться это может с раздражения кожи, потом появ-
ляются незаживающие фурункулы, рождаются дети-уроды, раз-
виваются психические расстройства, злокачественные опухоли.
Хлорзамещенные дибензодиоксины и дибензофураны не про-
изводятся, а образуются как нежелательные примеси из-за несо-
вершенства либо нарушения технологии производства.
Так, распыленный за период с 1961 по 1970 гг. американской
армией дефолиант «Agent Orange» в количестве 57 тыс. т содер-
жал 170 кг (0,003 %) диоксина, что привело к проявлению мно-
гочисленных раковых и других заболеваний у участников собы-
тий, в том числе у военнослужащих США и Австралии, рожде-
нию у них детей-уродов.
Однажды попав в определенную среду обитания — воду, воз-
дух, почву, — диоксины закрепляются там, никуда не исчезая
вплоть до полного распада. Период их полураспада в почве со-
ставляет 10—12 лет. Нерастворимые в воде, устойчивые к измене-
ниям температуры, неподвластные влиянию кислот и щелочей,
они распространяются повсюду — в атмосфере, воде и почве.
Диоксины образуются не только в химических производст-
вах. Их обнаружили в составе отходов металлургии, деревообра-
батывающей и целлюлозно-бумажной промышленности. Они
образуются на тепловых электростанциях, в выхлопных газах ав-
томобилей, в табачном дыме, при пожарах, когда горят синтети-
ческие покрытия и масла в трансформаторных будках, на город-
ских свалках. Практически везде, где ионы хлора, брома или их
сочетания взаимодействуют с активным углеродом в кислород-
ной среде, возникают диоксины. Диоксины присутствуют в лю-
бой бумаге: для получения целлюлозы древесную массу хлориру-
ют, чтобы освободить ее от лигнина. В эту бумагу упаковывают
190 Глава четвертая. Вещества, распространенные в атмосфере...
чай и кофе для одноразового приготовления напитков. Особо
опасны пакетики с кофе: это продукт маслянистый, а диоксин —
вещество липофильное, легко растворимое в жирах.
Мусоросжигательные заводы (МСЗ) в западных странах, где
бытовые и промышленные отходы считалось проще сжечь, чем
захоронить, стали основным источником диоксинов и фуранов.
Особенно много их образуется при сжигании медицинских отхо-
дов, содержащих изделия из поливинилхлорида (С2Н3С1)„. Почти
57 % (масс.) этого материала приходится на хлор. При сжигании
ПВХ образуется НС1:
(С2Н3С1)„ + О2 -> СО2 + Н2О + НС1,
который далее превращается в хлор по реакции:
4НС1 + О2 -> 2Н2О + С12
Повышенная температура, наличие органических, особенно
ароматических веществ и хлора, — условия, в которых происхо-
дит образование диоксинов. При принятой на МСЗ температуре
850 °C диоксины сгорают, но частично образуются вновь при
понижении температуры отходящих газов.
В Голландии в 1990 г. 12 МСЗ сжигали 40 % отходов. При
этом выбросы диоксинов и фуранов составили 79 % всего коли-
чества этих токсикантов. После принятия в 1990 г. новых госу-
дарственных нормативов 4 из 12 МСЗ были закрыты, а 8 остав-
шихся реконструированы. В США в 90-х гг. около 16 % про-
мышленных и бытовых отходов сжигалось на МСЗ. В последние
годы они были остановлены (навсегда или на реконструкцию).
Осуществление программы строительства МСЗ в Москве и
других крупных городах приведет к быстрому росту загрязнений
диоксинами этих городов и окрестностей.
Разрушение — дехлорирование — диоксинов происходит
лишь под действием ультрафиолетовой составляющей солнечно-
го света. Однако выброшенные в атмосферу диоксины, как и
ПАУ, прочно адсорбируются на частицах сажи, гумусосодержа-
щих пылевых частицах. При этом фотостойкость диоксинов
возрастает настолько, что они успевают пропутешествовать на
большие расстояния и осесть на поверхности почвы неразру-
шившимися.
Сейчас в мире идет интенсивный процесс осознания идеи,
что проблему диоксинов и фуранов практически невозможно ре-
Глава четвертая. Вещества, распространенные в атмосфере... 191
шить без отказа от повсеместного использования хлора и его
аналогов.
Здесь уместно напомнить об уже состоявшемся «хлороргани-
ческом» прецеденте, когда в 1948 г. швейцарскому химику
П. Мюллеру присудили Нобелевскую премию за хлорорганиче-
ский интексецид ДДТ, спасший в те годы миллионы людей от
малярии, а в 1972 г. использование ДДТ в разных странах было
законодательно запрещено, когда стало ясно, что ДДТ и его ос-
новные продукты превращения оказывают сильнейшие экоток-
сические эффекты на людей и животных.
Контрольные вопросы
1. Дайте сравнительную характеристику различным представителям хло-
рированных углеводородов.
2. Что такое диоксины? Как они образуются и в чем проявляется их нега-
тивное воздействие на живые организмы?
3. Почему отслужившие свой срок изделия из поливинилхлорида не сле-
дует сжигать в костре?
4. В чем состоит опасность уничтожения отходов на МСЗ?
5. Какие соединения подпадают под понятие «ксенобиотики»?
Глава пятая
ИОНИЗИРУЮЩЕЕ ИЗЛУЧЕНИЕ
И ОКРУЖАЮЩАЯ СРЕДА
Все на земле буквально пронизано различными видами элек-
тромагнитного излучения: инфракрасные (тепловые) лучи, види-
мый свет, ультрафиолетовые лучи. Кроме того, в природе сущест-
вуют радиоактивные атомы, ядра которых способны к самопроиз-
вольному испусканию излучения особого вида, называемого
радиоактивным излучением и обладающим большой энергией.
Понятие «излучение большой энергии» или «ионизирующее из-
лучение» включает в себя у-, 0- и а-лучи, рентгеновское излуче-
ние, нейтроны, осколки деления, потоки быстрых частиц (прото-
ны, дейтоны, электроны и др.).
Радиоактивные ядра некоторых элементов (например, ядра
атомов урана ™ U и 2£ U, тория 2|jTh) способны испускать а-час-
тицы (а-лучи), представляющие собой ядра гелия — 4 (* Не). Ра-
диоактивный распад может сопровождаться испусканием ядрами
0-частиц — электронов, как это наблюдается у атомов природно-
го изотопа калия J К и искусственно получаемых атомов строн-
ция JJSr. Необходимо заметить, что 0-распад в ядре вызывается
превращением одного из содержащихся в нем нейтронов (л) в
протон (/;), в результате чего из ядра вылетают электрон (е) и ан-
тинейтрино (v):
п = р + е + v.
а- и 0-распады часто дополняются испусканием у-лучей,
также относящихся к ионизирующему излучению.
Ядерное излучение обладает большой энергией. Энергия
а-частиц лежит в пределах 4—9 МэВ; 0-излучения — 0,5—2 МэВ
и у-излучения — 0,1—2 МэВ. Электрон-вольт (эВ) — энергия, ко-
торую получает электрон в электрическом поле на 1 В разности
потенциалов.
1 эВ = 1,6 • Ю10 эрг; 1 кэВ = 103 эВ; 1 МэВ = 106 эВ.
5.1. Естественные и техногенные радионуклиды
193
Высокая энергия ядерного излучения постепенно расходует-
ся при его прохождении через воздух, воду и другие среды при
встрече с атомами среды. При каждом столкновении происходит
возбуждение атомов среды, ионизация молекул или превраще-
ние в другой элемент за счет ядерной реакции, образование сво-
бодных атомов и радикалов и другие явления, в значительной
мере повышающие реакционную способность возбужденных мо-
лекул и ускоряющие или инициирующие протекание химиче-
ских превращений в среде, подвергшейся воздействию ионизи-
рующего излучения.
5.1. Естественные и техногенные радионуклиды
Источником ионизирующих излучений могут служить атомы
определенных элементов, так называемые радионуклиды. Наи-
более часто естественная радиоактивность встречается у элемен-
тов с атомным номером более 83. Скопление большого количе-
ства нуклонов в атомном ядре делает его настолько неустойчи-
вым, что оно при переходе в более стабильное состояние
испускает либо а-частицы, либо р-частицы. При этом атомные
ядра приходят в возбужденное состояние и при возвращении в
устойчивое состояние испускают у-лучи.
При испускании ядра гелия (а-лучи) возникает ядро нового
элемента, заряд ядра которого на 2 единицы, а масса на 4 еди-
ницы меньше, чем у исходного элемента (рис. 5.1). В качестве
примера можно привести а-распад радия, в котором образуется
радон:
2^Ra -> Rn +2 Не
Испускание р-частицы ядром радиоактивного атома сопро-
вождается образованием нового элемента, заряд ядра которого
на одну единицу больше исходного при практически неизмен-
ной массе:
2i42Pb->2JjBi + e
В результате а- и p-распада родоначальников естественных
рядов, т. е. 2<^U, 2^U и 2одТй, вначале возникают нестабильные
ядра элементов, которые в ходе последующего распада дают ядра
новых элементов вплоть до образования стабильных атомов.
194 Глава пятая. Ионизирующее излучение и окружающая среда
Ядро атома
Альфа-распад
Бета-распад
Гамма-излучение
Гамма-квант
Рис. 5.1. Основные виды ядерных превращений, приводящие к испусканию
радиоактивных излучений
Энергия вылетающей при а-распаде а-частицы по атомным
масштабам довольно высока — примерно 5—10 МэВ, т. е. почти
в миллион раз больше энергии электрона в атоме. Поэтому
а-частицы, проходя через вещество, могут производить в нем
обильные нарушения вследствие ионизации и возбуждения ато-
мов. При p-распаде нейтрон внутри ядра самопроизвольно пре-
вращается в протон и при этом испускает электрон (или наобо-
рот — протон переходит в нейтрон с испусканием позитрона).
Кроме электрона и позитрона, при p-распаде возникают также
нейтрино и антинейтрино, однако их воздействие на вещество
ничтожно. Образовавшееся в результате радиоактивного распада
ядро, как правило, сильно возбуждено, и оно освобождается от
избыточной энергии, испуская жесткие у-кванты. Это у-излуче-
ние обладает большой проникающей способностью и может
причинить немалый вред живому организму.
Скорость (интенсивность) радиоактивного распада радио-
нуклида определяется его периодом полураспада Т1/2 — время, за
которое распадается половина из имевшихся первоначально
ядер элемента. Для родоначальников естественных радиоактив-
5.1. Естественные и техногенные радионуклиды
195
ных семейств, т. е. 238U, 23iU и 232Th значения Т|/2 равны соответ-
ственно 4,47 • 109 лет, 7,04 • 108 лет и 1,4 • Ю10 лет.
За время существования Земли (5 • Ю10 лет) распалась не-
значительная часть 232Th, около половины 238U и заметная
доля 235U.
Радиоактивные дочерние ядра элементов с атомными номе-
рами от 82 до 91 (например 2l0Po, 226Ra, 227Ас, 222Rn) обладают го-
раздо меньшими величинами значений Т|/2 (вплоть до десятиты-
сячных долей секунды). Дочерние радионуклиды вместе с мате-
ринскими (238U, 235U, 232Th) и конечные продукты распада —
стабильные ядра изотопов свинца 206РЬ, 207РЬ и 208РЬ — образуют
так называемые естественные радиоактивные ряды.
Таблица 5.1. Периоды полураспада (71/г) некоторых радионуклидов
Радионуклид Период полураспада Т\/2
Тритий 3Н 12,26 г.
| Углерод 14С 5730 лет
Фосфор 33 Р 14,3 дня
Калий 40К 1,28 • 109 лет
Кальций 45Са 165 дней
Стронций 90Sr 28,1 г.
Йод 131J 8,07 дня
Цезий ,37Cs 30, 23 года
Барий 137Ва 12,8 дня
Радон 222 Rn 3,824 дня
Радий 226 Ra 1600 лет
Уран 233U 1,62 - 105 лет
Плутоний 239Ри 2,44 • 104 лет
В природе, кроме радионуклидов тяжелых элементов, встреча-
ются радионуклиды элементов, расположенных в середине Перио-
дической системы элементов, к которым относятся калий (40К),
рубидий (87Rb), индий (|,э1п), лантан (|38Ьа) и некоторые лантанои-
ды, гафний (l74Hf), тантал (180Та) и платина (l90Pt).
Кроме перечисленных естественных радионуклидов, имею-
щих «земное» происхождение (их называют терригенными), ок-
ружающая среда постоянно испытывает воздействие естествен-
196 Глава пятая. Ионизирующее излучение и окружающая среда
ных радионуклидов другого класса, которые называют космоген-
ными. Их появление вызвано постоянно попадающим на
поверхность Земли космическим излучением, в состав которого
входят протоны высоких энергий и ядра некоторых легких эле-
ментов. Взаимодействие ионизирующего космического излуче-
ния с ядрами элементов, составляющих газы и пары элементов и
их соединений, присутствующих в атмосфере Земли, иницииру-
ет протекание ядерных реакций, результатом которых является
образование ядер новых легких элементов, появление потоков
нейтронов, рентгеновских лучей и у-излучения. Обобщенное на-
звание этого явления — вторичное космическое излучение. Ней-
троны вторичного космического излучения могут взаимодейст-
вовать в атмосфере с атомами азота:
,4N + п = |4С + р,
в результате чего появляются радиоактивные ядра углерода
(Г,/2 = 5730 лет). Одновременно с радиоактивным углеродом мо-
гут возникать другие радионуклиды, такие как тритий (3Н), бе-
риллий (7Ве), фосфор (33Р) и некоторые другие.
В 40-х гг. XX в. были созданы ядерные реакторы, в которых
происходит деление ядер 235U и 239Ри под действием потока ней-
тронов, сопровождающееся выделением большого количества
энергии. При этом образуются искусственные радионуклиды бо-
лее 40 элементов, которые называются техногенными.
Таблица 5.2. Важнейшие природные и техногенные радионуклиды
Природные радионуклиды Техногенные радионуклиды
терригенные космогенные
4°К, 210ро, 222^ 226Ra, 232Th, 238U и др. 3Н(Т), |4С, 33Р и др. 3Н(Т), 90Sr, 85Kr, 13IJ, 137Cs, |44Се, 239Pu и др.
По мнению многих специалистов, реальным энергетическим
выбором человечества в XXI в. станет широкое использование
ядерной энергии на основе реакторов деления. Атомная энерге-
тика сегодня обеспечивает около 6 % мирового потребления
энергии, в основном электрической, где ее доля составляет око-
ло 18 % (в России — около 16 %).
Высокая концентрация естественных и образующихся искус-
ственных радионуклидов в ядерных реакторах, высокая плот-
ность нейтронных потоков выдвигают повышенные требования
5.1. Естественные и техногенные радионуклиды
197
безопасности для населения и окружающей среды. Однако в пе-
риод становления атомной энергетики возникали аварийные си-
туации, осложненные распространением техногенных радиоак-
тивных элементов в техносфере. Наиболее крупными из всех из-
вестных происшествий на АЭС до сих пор считаются авария
реактора в Гаррисбурге на Три-Майл-Айленде (США) в 1979 г.,
а также Чернобыльская катастрофа в 1986 г. В результате аварии
реактора на Чернобыльской АЭС, которая имела характер гло-
бальной катастрофы, большие площади Украины, Белоруссии,
России и сопредельных государств (Польша, Швеция, ФРГ и
др.) оказались сильно загрязненными различными техногенны-
ми радионуклидами. Всего в атмосферу попало около 300 раз-
личных радиоактивных элементов, в том числе стронций-90, це-
зий-137, йод-131, цирконий-95, барий-140 и др.
Необходимо далее отметить, что значительный вклад в за-
грязнение окружающей среды радиоактивными элементами раз-
личного происхождения внесли испытания ядерного оружия на
поверхности Земли, в воде океанов и в атмосфере. Кроме того,
вклад в распространение радиоактивных элементов в техносфере
вносят многочисленные предприятия так называемого ядерного
топливного цикла. Это предприятия по добыче руд естественных
радиоактивных элементов и извлечению из них урана и тория,
заводы по изготовлению из них тепловыделяющих элементов
(ТВЭЛов), собственно ядерные реакторы, а также предприятия
по переработке отработанных ТВЭЛов, извлечению из них деля-
щихся материалов, заводы по консервации и захоронению ра-
диоактивных отходов. В результате аварии на могильнике радио-
активных отходов комбината в г. Озерск в 1957 г. в окружающую
среду попало большое количество техногенных радионуклидов.
Значительную озабоченность общественности вызывает ис-
пользование ядерно-энергетических установок на аппаратах, за-
пускаемых в космическое пространство. Попадая по мере выра-
ботки своего ресурса в плотные слои атмосферы, эти спутники
сгорают, в результате чего в атмосфере образуется большое ко-
личество аэрозольных частичек, содержащих радионуклиды.
С 1970 по 1988 г. в космос запустили около 30 радиолокацион-
ных спутников с ядерно-энергетическими установками «Бук», в
роли которых использовался реактор на быстрых нейтронах
мощностью до 100 кВт. Полная загрузка высокообогащенного
урана составляла около 30 кг. Почти за 20 лет запусков было три
198 Глава пятая. Ионизирующее излучение и окружающая среда
случая падения спутников на Землю: два — в океан и один — на
сушу, в Канаду, в окрестностях Большого Невольничьего озера.
Туда упал «Космос-954», запущенный 24 января 1978 г. Он про-
работал 3,5 месяца. Урановые элементы спутника полностью
сгорели в атмосфере. В термоэмиссионной ядерно-энергетиче-
ской установке «Топаз» использовался тепловой реактор мощно-
стью до 150 кВт. Полная загрузка реактора составляла око-
ло 12 кг высокообогащенного урана.
К загрязнению атмосферы радиоактивными элементами при-
водит и работа тепловых электростанций, сжигающих в своих
топках каменный уголь, который всегда содержит небольшую
примесь урана и продуктов его распада. При сгорании топлива
эти естественные радионуклиды частично переходят в аэрозоли и
попадают в атмосферу. Загрязнение почвы радиоактивными ве-
ществами может происходить через фосфорные минеральные
удобрения. Уран и торий как примеси содержатся в исходном
сырье (например, в апатите), которое используется при произ-
водстве удобрений и при переработке сырья частично переходит
в удобрения, а из них — в почву.
Контрольные вопросы
1. Какие виды излучения включают понятие «ионизирующие» излучения?
2. Какие источники обусловливают естественный радиоактивный фон?
3. Какой величиной характеризуется скорость радиоактивного распада?
4. Как классифицируют радионуклиды?
5. Какие имеются основные источники радиоактивного загрязнения био-
сферы?
5.2. Общие представления о взаимодействии
ионизирующего излучения с веществом
На раннем этапе развития представлений о характере и меха-
низме взаимодействия ионизирующего излучения с веществом
основная роль отводилась ионам. Ионная теория, или теория
роев, базировалась на соответствии между числом ионов, с од-
ной стороны, и происходящими химическими изменениями под
действием ионизирующих излучений, с другой стороны [15—16].
5.2. Взаимодействие ионизирующего излучения с веществом 199
По этой теории, ионы своими электростатическими силами по-
ляризуют и притягивают нейтральные молекулы, в результате
чего образуются большие ионы, т. е. первичные ионы, окружен-
ные поляризованными молекулами.
Далее принималось, что при рекомбинации такого положи-
тельного иона с электроном или отрицательным ионом образует-
ся нейтральный молекулярный комплекс, в котором происходят
химические и другие превращения за счет энергии, выделенной
при нейтрализации зарядов. Так например, реакция полимериза-
ции бутана представлялась следующей схемой:
С4Н10 С4Н10 + е
С4Ню + С4Н10 —> (С4Н|0 С4Н10)
С8Н18 + Н2
(С4Н ю • С4Н ю) +
^С8Н16 + 2Н2
При помощи теории роев были объяснены многие экспери-
ментальные данные, однако исследования последних десятиле-
тий показали важную роль в радиационно-химических процес-
сах свободных атомов и радикалов, образующихся при возбужде-
нии и диссоциации молекул.
В этом случае полагают, что химические превращения ве-
ществ вызываются свободными атомами, радикалами, ионами и
возбужденными молекулами, которые возникают при соответст-
вующих первичных радиационно-химических актах.
Под первичными радиационно-химическими актами приня-
то понимать процессы передачи энергии квантами или частица-
ми ионизирующего излучения молекулам вещества, процессы
перераспределения энергии и первичные химические изменения
вещества.
Все виды ионизирующих излучений при прохождении через
вещество, взаимодействуя с электронами и ядрами атомов или
молекул, образуют положительно заряженные ионы, электроны
и возбужденные молекулы:
200 Глава пятая. Ионизирующее излучение и окружающая среда
Первично выбитые заряженные частицы, сталкиваясь с дру-
гими молекулами, выбивают орбитальные электроны или пере-
водят молекулы в возбужденное состояние. Этот процесс про-
должается до тех пор, пока ионизирующие частицы не будут
достаточно замедлены, после чего электроны тепловых скоро-
стей соединятся с положительными ионами или будут захвачены
молекулами, обладающими по отношению к ним определенным
сродством.
Распределение потерь энергии излучения на процессы иони-
зации и возбуждения почти не зависит от химической структуры
вещества. Количество энергии, которое затрачивается на про-
цессы ионизации, примерно равно количеству энергии, затрачи-
ваемой на возбуждение, что вытекает из сопоставления работы
ионизации молекул (10—15 эВ) и средней энергии, расходуемой
на образование одной пары ионов (34 эВ). В средний расход
энергии на образование одной пары ионов входят все виды рас-
хода энергий излучения: работа ионизации атома, потери энер-
гии на торможение электронов в поле атома, преобразование
энергии излучения в кинетическую и др. Так как для возбужде-
ния молекул до некоторых уровней, при которых они могут
вступать в химические реакции, требуется в 2—3 раза меньше
энергии, чем для ионизации, число возбужденных молекул ока-
зывается в 2—3 раза больше, чем число ионов.
Дальнейшая судьба первично-образованных частиц зависит
от природы вещества, его агрегатного состояния, плотности ио-
низации и других факторов.
Влияние природы вещества проявляется уже в элементарных
актах. Это влияние связано с устойчивостью положительных ио-
нов и действием вторичных электронов, около половины из ко-
торых обладают энергией, сопоставимой с энергией химической
связи, а более 10 % из них имеют энергию, достаточную для
дальнейшей ионизации вещества. Если вещество полярно, оно
может обладать способностью к захвату теплового электрона с
образованием отрицательного иона. Если же вещество неполяр-
но, замедленные электроны будут нейтрализованы положитель-
ными ионами.
Положительные ионы претерпевают различные превраще-
ния. В случае неустойчивого иона произойдет немедленный рас-
пад его на осколки, который может привести к образованию
5.2. Взаимодействие ионизирующего излучения с веществом 201
свободного иона и свободного радикала или к появлению моле-
кулярного иона и молекулы:
<R + R+
м; + м2
Здесь R — свободный радикал; R+ — ион-радикал; — мо-
лекулярный ион; М2 — молекула.
Если же положительный ион устойчив, он будет нейтрализо-
ван электроном:
М+ + е —> М*
или отрицательным ионом (М* — молекула в возбужденном со-
стоянии).
Наиболее вероятно, что выделяющаяся энергия (равная раз-
ности работ ионизации молекулы, соответствующей образова-
нию положительного иона, и отрыву электрона от отрицательно-
го иона) переведет молекулу, образованную из положительного
иона, в сильно возбужденное состояние, тогда как молекула, по-
лученная из отрицательного иона, будет находиться в нормаль-
ном электроном состоянии:
М+ + М“ -»м* + м
Далее очень вероятно, что образованные таким образом воз-
бужденные молекулы могут диссоциировать на радикалы или
расщепляться на более мелкие стабильные молекулы:
R-i + R-2
М‘<^
^м, + м2
Может также случиться, что положительно заряженный ион
будет взаимодействовать с ближайшей молекулой по реакции:
<м; + м
RJ + R2
При протекании подобных реакций осуществляется передача
заряда, что часто сопровождается химическими изменениями.
202 Глава пятая. Ионизирующее излучение и окружающая среда
Такие процессы могут проходить и с отрицательными иона-
ми, образование которых возможно при столкновении теплового
электрона с молекулой:
М + е -> М’
Захват молекулой теплового электрона может вызвать ее дис-
социацию в том случае, когда освобождающаяся при этом про-
цессе энергия (равная сумме кинетической энергии и энергии
электронного сродства) превосходит энергию разрыва химиче-
ской связи в молекуле. В этих условиях происходит образование
одного отрицательного иона и свободного радикала.
Образование отрицательных ионов при столкновении моле-
кулы с тепловым электроном возможно, например, в случае хло-
ристого водорода, брома, йода, алкилбромидов.
Возможны и другие процессы, например, реакции рекомбина-
ции ионов при наличии третьего тела (молекула вещества, стенка
сосуда), реакции перезарядки с участием атомного иона и т. д.
Основной количественной характеристикой химического пре-
вращения под действием ионизирующего излучения является ра-
диационно-химический выход (G). Под ним понимают число
молекул (ионов, атомов, свободных радикалов и других продук-
тов), образующихся или расходуемых на каждый 100 эВ погло-
щенной энергии: G = • Так, обозначение G(Fe3+) означает
число ионов Fe3+, образующихся на 100 эВ поглощенной энер-
гии, тогда как под записью G(-CIO;) = -G(CIO;) следует пони-
мать число превратившихся ионов СЮ; в расчете на 100 эВ по-
глощенной энергии ионизирующего излучения.
Необходимо отметить, что большая часть сведений о поведе-
нии образующихся ионов получена в результате исследования
реакций в газовой фазе. Что касается конденсированных систем
(жидкости, растворы, твердые тела), то в этом случае выводы
приходится делать по аналогии с тем, что известно о реакциях в
газовой фазе.
Возбужденные молекулы, генерируемые ионизирующим из-
лучением, могут находиться в различных энергетических состоя-
ниях. При переходе из возбужденного состояния, длительность
которого оценивается примерно в 10 s с, может возникать ряд
вторичных процессов: флюоресценция, диссоциация, конверсия
5.2. Взаимодействие ионизирующего излучения с веществом 203
электронной энергии в вибрационную, межмолекулярная дезак-
тивация и др. Скорость этих процессов зависит от свойств облу-
чаемой молекулы и в известной мере определяет последующие
химические изменения.
Характерным свойством продуктов распада исходной моле-
кулы (атомов, радикалов, различных заряженных и незаряжен-
ных частиц) является их повышенная реакционная способность,
что связано с небольшим энергетическим барьером атомарных и
радикальных реакций. Реагируя между собой и с молекулами ис-
ходного вещества, эти активные частицы вызывают различные
химические изменения, особенно значительные, если они проте-
кают по цепному механизму.
Как уже отмечалось выше, возможность тех или иных пре-
вращений первично-образованных частиц зависит от агрегатного
состояния вещества.
Обычно принимают, что в конденсированных системах чис-
ло возможных реакций, в которых участвуют ионы и возбужден-
ные молекулы, меньше, чем в газовой фазе. Это допущение свя-
зано с рядом особенностей первичных актов в конденсирован-
ных системах.
1. В газообразном состоянии возбужденные молекулы могут
существовать в течение длительного времени, достаточного для
того, чтобы произошла диссоциация. В жидкостях и твердых те-
лах вследствие большой частоты столкновений с соседними мо-
лекулами более вероятна дезактивация возбужденных молекул.
При этом, если возбужденная молекула претерпевает внутрен-
нюю конверсию (в таком процессе энергия электронного возбу-
ждения переходит в колебательную энергию движения атомов,
образующих молекулу), то имеется значительная вероятность
рассеяния колебательной энергии в результате множественных
столкновений с ближайшими молекулами. Если же возбужден-
ная молекула не подвергается внутренней конверсии, то она мо-
жет дезактивироваться в результате передачи электронной энер-
гии возбуждения другой молекуле. В этом случае большая часть
передаваемой энергии переходит в энергию электронного возбу-
ждения последней молекулы, которая в зависимости от состоя-
ния электронного возбуждения может диссоциировать или де-
зактивироваться тем или иным путем.
Следует отметить, что процессы передачи энергии возбуждения
могут происходить не только в результате прямого столкновения
204 Глава пятая. Ионизирующее излучение и окружающая среда
возбужденной и невозбужденной молекул, но также путем электро-
магнитного взаимодействия на расстоянии. Такие процессы осо-
бенно вероятны, если первично возбужденная молекула находится
в некотором промежуточном состоянии, в котором она теряет спо-
собность испускать энергию возбуждения в виде излучения.
2. В полярных жидкостях в результате эффекта сольватации
изменяются стабильность образующихся ионов и вероятность их
превращения в радикалы.
3. В жидкой фазе повышается эффективность ионно-молеку-
лярных реакций. Подобные реакции, в частности, реакции пере-
дачи протона или атома водорода, наблюдались во многих случа-
ях в газовой фазе с помощью масс-спектрометра:
М+ + RH -> МН+ + R или RH+ + М -> МН+ + R
Здесь М+ и МЬГ — молекулярные ионы; R и RH — углеводороды.
В результате таких реакций могут появиться возбужденные
радикалы, разнообразие типов которых должно быть невелико.
4. Рекомбинация ионов и радикалов путем тройных столкно-
вений легче проходит в жидкой фазе, чем в газообразной.
5. В конденсированных системах благодаря эффекту «ячей-
ки» повышается возможность рекомбинации радикалов, обра-
зующихся из возбужденных молекул. Под эффектом «ячейки»,
или эффектом Франка — Рабиновича, принято понимать влия-
ние ближайших молекул вещества на процессы диффузии и ре-
комбинации радикалов. При диссоциации возбужденной моле-
кулы на радикалы последние оказываются окруженными бли-
жайшими молекулами, т. е. как бы заключаются в ячейку,
предотвращающую удаление радикалов друг от друга вследствие
диффузии. В результате увеличивается возможность столкнове-
ния радикалов друг с другом и, следовательно, повышается ве-
роятность их рекомбинации. Вероятность выхода радикалов из
ячейки понижается с увеличением размера молекулы.
При рассмотрении результатов воздействия излучений на
твердые кристаллические тела необходимо также учитывать ха-
рактер связей в кристалле.
В узлах пространственной решетки молекулярных кристал-
лов находятся молекулы, слабо связанные друг с другом межмо-
лекулярными силами. Поэтому радиационно-химические явле-
ния в этих кристаллах мало отличаются от явлений, наблюдае-
мых при облучении неполярных жидкостей.
5.2. Взаимодействие ионизирующего излучения с веществом 205
При действии легких ядерных частиц и фотонов на ионные
кристаллы наблюдаемые изменения обусловливаются уменьше-
нием заряда или нейтрализацией аниона и захватом выбитых
электронов катионами. Возникшие незаряженные образования
оказываются разделенными толщей вещества и могут сохраняться
в кристаллах в течение длительного времени. Смещение струк-
турных элементов решетки кристалла проявляется при этом лишь
в малой степени. При действии на ионные кристаллы тяжелых за-
ряженных частиц возможно появление наряду с незаряженными
образованиями различных дефектов решетки.
Тела с металлической связью имеют в своей структуре ней-
тральные атомы, ионы и свободные электроны. Нейтральные
атомы могут переходить в ионы, которые легко нейтрализуются
электронами. Вследствие этого металлы устойчивы к действию
легких ядерных излучений. Однако тяжелые заряженные части-
цы могут вызывать образование различных дефектов в решетке.
Переход кристалла из упорядоченного состояния в неупорядо-
ченное связан с изменением физических свойств.
Степень влияния агрегатного состояния вещества на поведе-
ние возникающих ионов и других активных частиц зависит от их
первичного пространственного распределения.
Для данного вещества и данных условий облучения первич-
ное пространственное распределение энергии определяется плот-
ностью ионизации. Тяжелые заряженные частицы (а-частицы,
дейтроны, протоны, осколки деления) теряют свою энергию в ос-
новном при взаимодействии с электронами атомов и молекул.
Часть энергии расходуется на отрыв электронов от атомов и моле-
кул, а часть — на их возбуждение. Благодаря своей большой массе
тяжелые заряженные частицы теряют энергию постепенно, малы-
ми порциями и, проходя короткий прямолинейный путь в веще-
стве, производят чрезвычайно сильную ионизацию.
Величину средней потери энергии на единицу пути тяжелых
заряженных частиц (а-частиц, протонов) можно определить по
формуле Бете:
( dE\ 4jte4z2NZ . (2mv2 С1
- — =------з---In = , (5.1)
к^Люн mv2 {E(Z)J
где е — заряд электрона; z — заряд ионизирующей частицы;
N — число атомов в 1 см3 среды; т — масса электрона; v —
206 Глава пятая. Ионизирующее излучение и окружающая среда
скорость ионизирующей частицы; Z — эффективный атомный
номер среды; E(Z) — средний ионизационный потенциал ато-
мов среды;
Г—1
X / ион
— средняя потеря энергии на единицу пути
частицы (ионизационные потери энергии).
Как следует из последнего уравнения, ионизирующая спо-
собность тяжелых заряженных частиц тем больше, чем больше
заряд и масса частицы и чем меньше ее скорость. При равных
энергиях частицы с большей массой создают большую плотность
ионизации. Так, в биологической ткани а-частицы с энергией
2 МэВ создают на 1 мкм своего пути свыше 7000 пар ионов,
а протоны той же энергии — примерно 500 пар ионов.
Таким образом, при облучении веществ тяжелыми заряжен-
ными частицами первичное распределение поглощаемой энер-
гии является неравномерным, благодаря чему часть продуктов
радиолиза может сосредоточиться в ограниченном объеме.
Бета-частицы (быстрые электроны) теряют свою энергию в
процессе неупругого рассеяния на орбитальных электронах и
при столкновениях с ядрами атомов. Рассеяние р-частиц на ор-
битальных электронах приводит в зависимости от количества пе-
реданной энергии к возбуждению или ионизации атомов в веще-
стве (ионизационные потери). Энергия, потерянная при столк-
новениях с ядрами атомов, преобразуется в тормозное излучение
(радиационные потери). Это излучение является результатом
резкого торможения р-частиц при взаимодействии с ядром ато-
ма, масса которого в несколько тысяч раз больше массы покоя-
щегося электрона. Отношение радиационных потерь (б7Ерад)к ио-
низационным (б/Еи0Н) приближенно можно определить из выра-
жения:
^рад ZE
£„он “ 820 ’
где Z — атомный номер вещества; Е — энергия электронов,
МэВ.
Как следует из последнего соотношения, радиационные по-
тери растут при увеличении эффективного атомного номера ве-
щества и энергии ионизирующей частицы. Однако эти потери
имеют значение только при торможении электронов в поле тя-
желых ядер.
5.2. Взаимодействие ионизирующего излучения с веществом 207
Гамма-лучи (и рентгеновские лучи) передают свою энергию
в основном через фотоэлектрический эффект, эффект Комптона
и процесс образования пар электрон — позитрон.
При фотоэлектрическом взаимодействии у-квант, сталкива-
ясь с электроном, полностью передает ему свою энергию; при
этом электрон приобретает кинетическую энергию, равную раз-
ности энергии у-кванта и энергии связи электрона в атоме.
При комптоновском рассеянии у-квант, взаимодействуя с
электронами, передает им часть своей энергии и после соударе-
ния изменяет направление движения. Образовавшийся свобод-
ный электрон обладает значительной кинетической энергией,
которую он расходует на последующую ионизацию вещества.
Процесс образования пар электрон—позитрон, осуществляе-
мый в поле атомного ядра, наблюдается только для у-квантов с
энергией не менее 1,02 МэВ. Этот процесс всегда сопровождает-
ся обратным процессом превращения затормозившегося пози-
трона и атомного электрона в 2 кванта с энергией не менее
0,51 МэВ.
В результате всех этих процессов интенсивность пучка у-лу-
чей по мере прохождения его через вещество непрерывно умень-
шается.
Таким образом, при взаимодействии у-излучения с вещест-
вом образуются кванты, обладающие меньшей энергией, фото-
электроны, электроны отдачи, электронно-позитронные пары.
Главную роль в ионизации атомов вещества играют быстрые
вторичные электроны. В связи с этим химические эффекты, вы-
зываемые действием у-лучей, во многих случаях оказываются та-
кими же, как эффекты, вызываемые действием электронов. Раз-
личие между этими видами излучений заключается в значитель-
но большей проникающей способности у-излучения, вследствие
чего поглощение энергии у-лучей веществом происходит равно-
мерно, в то время как электроны отдают большую часть своей
энергии в сравнительно тонких слоях вещества.
Быстрые нейтроны теряют свою энергию при столкновениях
с ядрами атомов, причем наиболее распространенным процес-
сом является упругое рассеяние. В этом процессе столкновения
нейтрона с ядром приводят к отклонению нейтрона от первона-
чального направления движения и к передаче части его энергии
ядру. Если энергия, переданная ядру, велика, то атом будет вы-
208 Глава пятая. Ионизирующее излучение и окружающая среда
бит из молекулы и может потерять один или несколько электро-
нов. Таким образом возникает быстрая заряженная частица, ко-
торая при своем движении производит ионизацию вещества.
В результате повторения подобных актов нейтрон замедляется
до значения энергии теплового движения молекул среды и диф-
фундирует внутри облучаемого вещества до тех пор, пока не по-
глотится тем или иным ядром.
Потери энергии быстрыми нейтронами возможны также в
процессе неупругого рассеяния, при котором атомное ядро пере-
ходит в возбужденное состояние с последующим испусканием
у-квантов. Однако относительная величина потерь энергии при
неупругом рассеянии нейтронов (0,5—20 МэВ) для легких ядер
настолько мала, что практически никакого значения не имеет.
Контрольные вопросы
1. Каковы основные стадии механизма взаимодействия ионизирующего
излучения с веществом?
2. Какие частицы образуются в результате первичных радиационно-хи-
мических актов?
3. Как влияет фазовое состояние системы на радиационно-химические
превращения?
4. Что такое плотность ионизации и чем она определяется?
5.3. Взаимодействие ионизирующего излучения
с компонентами атмосферы
Как следует из анализа уравнения (5.1), чем большие разме-
ры и массу имеет частица, образующаяся при распаде ядра ра-
дионуклида, тем больше частота ее столкновений при своем дви-
жении в веществе с другими атомами или молекулами, тем быст-
рее она теряет энергию и тем сильнее производимый ею эффект
возбуждения и ионизации атомов, диссоциации молекул. Длина
пробега частицы зависит, в свою очередь, от числа столкнове-
ний, энергии и вида частицы или у-кванта, природы среды. Об-
разующиеся при радиоактивном распаде а-частицы вылетают из
материнских ядер с огромной скоростью, приобретая высокую
кинетическую энергию. В силу своего сравнительно большого
5.3. Взаимодействие излучения с компонентами атмосферы 209
заряда (+2) и большой массы а-частицы испытывают частые
столкновения с атомами и молекулами среды и растрачивают
всю свою энергию на небольшом расстоянии. Поэтому длина
пробега а-частиц в воздухе не превышает 10 см, причем встре-
тившиеся на их пути молекулы будут разрушены: превратятся в
ионы, свободные возбужденные атомы и свободные радикалы.
Длина пробега р-частиц в воздухе составляет 150—850 см, а у-из-
лучения в зависимости от энергии — от нескольких метров до
нескольких километров. Способность ионизировать молекулы
среды или плотность ионизации изменяется в обратном порядке:
наибольшая плотность ионизации характерна для а-частиц,
р-частицы занимают промежуточное положение, а фотоны у-из-
лучения имеют наименьшее значение плотности ионизации.
При взаимодействии ионизирующего излучения с газовыми
составляющими атмосферы происходит возбуждение молекул
кислорода, азота и других компонентов атмосферы, сопровож-
дающееся диссоциацией молекул на свободные атомы, иониза-
ция атомов или молекул, образование чрезвычайно химически
активных частиц — свободных радикалов. Гамма-лучи с высокой
энергией в атмосфере нашей планеты разлагают молекулярный
азот на атомарный, тот вступает в реакцию с молекулярным ки-
слородом с образованием монооксида азота NO, который разру-
шает озон и дает диоксид азота (NO2). Последний реагирует с
атомарным кислородом, образующимся в результате диссоциа-
ции молекулярного кислорода при прохождении у-лучей и при
разложении озона, в результате чего редуцируется монооксид
азота (NO). Возможно, мощные космические вспышки гам-
ма-лучей привели к массовой гибели живых существ на Земле,
значительным мутациям и появлению новых видов. Недавно
ученые США из НАСА и университета штата Канзас разработа-
ли сценарий вышеприведенной схемы. Компьютерная модель
показывает, что вспышка от взрыва звезды, находящейся на рас-
стоянии шести тысяч световых лет от планеты Земля, уничтожит
половину озонового слоя всего за одну неделю, восстановление
его прежней мощности произойдет через 5 лет.
Источниками ионизирующего излучения в атмосфере явля-
ются радиоактивные аэрозоли, образующиеся и попадающие в
воздушную среду при авариях производственного ядерного
комплекса, в результате ядерных взрывов, при ветровой эрозии
8 - 4054 Трифонов
210 Глава пятая. Ионизирующее излучение и окружающая среда
урансодержащих минералов, а также такие газообразные радио-
нуклиды, как 85Kr, 220Rn, 222Rn, 3Н(Т). Необходимо иметь
в виду, что даже при штатной работе атомных реакторов в ат-
мосферу постоянно поступает радионуклид криптон-85 (Г|/2 =
= 10,22 года), образующийся при делении ядер 23эи. Криптон —
химически инертный газ, который нельзя удалить, связав в ка-
кое-либо химическое соединение. Выделяющийся 85Кг разбав-
ляется атмосферным воздухом и находится в нем, пока полно-
стью не распадется. Часть его в сухом виде выпадает вблизи
источника выброса, поэтому вокруг последних имеется сани-
тарная зона, в которой населению запрещается собирать травы,
грибы, ягоды. Кроме 85Кг, в атмосферу при нормальном функ-
ционировании ядерного реактора постоянно попадает тритий
3Н и некоторые другие радионуклиды, образующиеся в реакто-
ре. Наибольший вклад в газовую составляющую естественных
радиоактивных элементов вносят радиоактивные семейства ура-
на-238 и тория-32, при распаде которых образуются химически
инертные радиоактивные газообразные изотопы радона: ра-
дон-222 и радон-220 (последний часто называют «торон» от
имени исходного материнского радионуклида). Радона-222 в
природе примерно в 20 раз больше, чем радона-220. Радон —
это инертный газ без цвета и запаха, в 7,5 раз тяжелее воздуха,
растворяется в воде. Радон, как и его «родители», — альфа-из-
лучатель. В процессе распада он трансформируется в другие
альфа-излучатели, которые в целом называют «дочерними про-
дуктами распада» и которые в отличие от радона представляют
собой не газ, а твердые вещества — нестабильные изотопы
свинца, висмута, полония и таллия, которые сами по себе яв-
ляются источниками излучения (рис. 5.2). Например, при рас-
паде семейства урана-238 выделяется восемь альфа-частиц, из
которых четыре приходится на радон и его дочерние продукты
распада. Причем первые четыре альфа-частицы выделяются с
полупериодом около 1 млрд лет (распад уран—радий), а сле-
дующие три — с полупериодом 3,825 дня, т. е. интенсивность
альфа-излучения радона и его дочерних продуктов распада во
много раз выше интенсивности альфа-излучения урана и радия
вместе взятых.
Радон и торон присутствуют, как и его материнские нукли-
ды, во всех строительных материалах и горных породах. Обра-
зующийся в процессе распада инертный радиоактивный газ тот-
5.3. Взаимодействие излучения с компонентами атмосферы 211
Рис. 5.2. Схемы распада от радия до свинца для уранового (а) и ториевого (б) се-
мейств естественных радионуклидов [8]: А — масса изотопа; 82, 88 — заряд
ядра изотопа
час же диффундирует через капилляры грунта, микротрещины
горных пород, захватывается потоками других газов и несмотря
на ограниченное время жизни может транспортироваться на
значительные расстояния в земной коре и атмосфере. Причем
естественная убыль этих газов за счет выделения из материалов
[процессы эманации (выделение из кристаллической решетки) и
эксхаляции (испарение или выделение с поверхности)] и естест-
венного распада постоянно компенсируется за счет распада ура-
на и тория, присутствующих в данном материале.
Радон попадает в атмосферу помещений различными путя-
ми: прежде всего из почвы, через щели в фундаменте; выделя-
ется из строительных материалов (цемент, щебень, гранит), из
которых построено здание; поступает с водой, особенно артези-
анской, бытовым газом и другими продуктами жизнеобеспечи-
вания (рис. 5.3).
Радон хорошо растворяется в воде, поэтому содержится во
всех природных водах, причем в глубинных грунтовых водах его,
как правило, заметно больше, чем в поверхностных водостоках и
водоемах (например, радоновые источники). Радон попадает из
вод в атмосферу за счет процессов эксхаляции — дегазации с
выносом радона из воздушных пузырьков, содержащихся в воде.
212 Глава пятая. Ионизирующее излучение и окружающая среда
Рис. 5.3. Основные пути попадания радона в здание: из грунта по трещинам и
щелям, из стен и строительных конструкций [8]
Наиболее интенсивно этот процесс происходит при резком сни-
жении давления на выходе из подземных источников, разбрыз-
гивании, испарении, кипении.
Процессы эксхаляции также повинны в появлении радона в
воздухе жилых помещений из строительных материалов.
Следует отметить, что вклад техногенных радионуклидов в
величину средней эффективной дозы намного меньше, чем
вклад от природного радона-222.
Таким образом, основными загрязняющими атмосферу ра-
диоактивными компонентами являются радон, образующийся в
результате распада естественных радиоактивных элементов,
криптон-85, выделяющийся при работе атомных реакторов, а
также находящиеся в составе аэрозолей уран, торий, радий и по-
лоний, попадающие в воздух при ветровой эрозии минеральной
составляющей оболочки Земли. Однако наибольшую опасность
представляют радиоактивные аэрозоли, образующиеся при атом-
ных взрывах, авариях на атомных электростанциях, на предпри-
ятиях по добыче и переработке расщепляющихся материалов.
5.4. Действие излучений на воду и водные растворы 213
Контрольные вопросы
1. Какие продукты образуются при взаимодействии ионизирующего из-
лучения с газовыми компонентами атмосферы?
2. Какими методами можно бороться с радоновым загрязнением жилых
помещений?
3. Почему вблизи атомных электростанций нельзя собирать грибы, яго-
ды, травы?
5.4. Действие ионизирующих излучений на воду
и водные растворы
Процессы, протекающие при действии ионизирующих излу-
чений на молекулы воды, заключаются в ионизации, диссоциа-
тивной ионизации и возбуждении молекул, при этом образуют-
ся ионы, свободные атомы, радикалы и возбужденные молеку-
лы. Наиболее вероятными являются процессы образования
ионов Н2О+ и ОН+; при этом ионы Н2О+ образуются в большем
количестве:
Н2О Н2О+ + е
Н2О н- + ОН+ + е
Обычно предполагается, что в воде положительный ион Н2О+
быстро превращается в ион Н3О+ и радикал ’ОН:
Н2О+ + Н2О -► Н3О+ + -ОН (5.2)
Вторичные электроны, проходя некоторое расстояние, за-
медляются и могут быть захвачены молекулой воды с диссоциа-
цией на водородный атом Н- и ион ОН~:
Н2О + е-> Н-+ ОН" (5.3)
Реакции (5.2) и (5.3) позволяют предположить, что гидро-
ксильные радикалы образуются вдоль следа частицы, а водород-
ные атомы — на расстоянии нескольких сот ангстрем от оси
следа.
Допускается, что атомы и радикалы возникают в процессе
ионизации в результате вторичных реакций ионов и из возбуж-
денных молекул воды (Н2О*):
Н2О н2О+ -> Н- + -ОН
214 Глава пятая. Ионизирующее излучение и окружающая среда
Однако большая часть радикалов, возникающих по послед-
ней реакции, не способна выйти из ячейки, которая образуется
вокруг них из молекул среды, и рекомбинируется. Вовлечение
таких радикалов в радиационно-химические реакции оказывает-
ся возможным только при благоприятных условиях.
Дальнейшее поведение радикалов зависит от их первона-
чального пространственного распределения.
При прохождении а-частиц, медленных электронов и других
видов плотно ионизирующих излучений радикалы располагают-
ся вдоль пути, проходимого частицей, в большой концентрации.
В этом случае многие радикалы, реагируя друг с другом, образу-
ют водород, пероксид водорода или воду, и только сравнительно
небольшая часть их диффундирует из трека (трек — след, остав-
ляемый заряженной частицей в веществе):
Н- + Н- -> н2
•ОН + -ОН -> Н2О2
Н- + -ОН -> Н2О
При воздействии на воду быстрыми электронами, у-лучами и
другими слабо ионизирующими видами излучений радикалы
располагаются по следу частиц на относительно больших рас-
стояниях друг от друга; вследствие этого большинство радикалов
диффундирует из трека в объем раствора, где реагирует с раство-
ренными веществами.
Следует отметить, что, помимо образования молекулярных
продуктов из радикалов, возможно прямое образование этих
продуктов из двух возбужденных молекул воды по схеме:
2Н2О* -> Н2 + Н2О2
Такая реакция допускается в треках с большой плотностью
возбужденных частиц.
Водородный атом Н* и радикал -ОН являются химически
активными продуктами радиолиза воды. Существование их до-
казывается спектроскопически, а также реакциями с растворен-
ными веществами. Радиолиз — совокупность химических про-
цессов деструктивного характера, протекающих при поглощении
веществом энергии ионизирующего излучения.
5.4. Действие излучений на воду и водные растворы
215
При радиолизе воды радикалы могут взаимодействовать с
молекулярными продуктами Н2 и Н2О2, осуществляя так назы-
ваемые обратные реакции:
Н2О2 + Н- -> Н2О + -ОН (5.4)
Н2+ «ОН-> Н2О + Н- (5.5)
В результате прохождения обратных реакций количество мо-
лекулярных продуктов уменьшается до тех пор, пока не будет
достигнута равновесная концентрация, при которой скорость
образования Н2 и Н2О2 равна скорости образования воды по ре-
акциям (5.4) и (5.5).
Таким образом, выход молекулярных продуктов радиолиза
воды определяется соотношением между скоростью образования
этих продуктов и скоростью их исчезновения в результате обрат-
ных реакций. Скорость прямой и обратной реакций зависит от
вида излучения и условий облучения. При действии излучений,
создающих высокую плотность ионизации (а-частицы, осколки
деления тяжелых ядер), выходы молекулярных продуктов радио-
лиза воды (Н2 и Н2О2) должны быть большими, чем при дейст-
вии слабоионизируюших излучений (р-частицы, у-лучи).
В табл. 5.3 приведены некоторые данные по радиационному
разложению воды под действием различных видов излучения.
Таблица 5.3. Разложение воды при облучении
Вид излучения Энергия излучения, кэВ Плотность выделения энергии, кэВ/см3 воз- духа (при t = 0 °C и 760 мм рт. ст.) Начальный выход водорода, число молекул/100 эВ
Электроны 1000 3 0,2-0,5
р-частины 5 70 0,1-0,4
Дейтроны 8000 175 0,54
а-частицы 5000 1430 2,0
Излучение ядерно- го реактора — — 1
Из табл. 5.3 видно, что максимальный выход молекулярного
водорода наблюдается для a-излучения. В этом случае реакции
216 Глава пятая. Ионизирующее излучение и окружающая среда
рекомбинации радикалов, которые ведут к образованию Н2 и
Н2О2, протекают с большей вероятностью.
На процессы образования Н2 и Н2О2 существенное влияние
оказывают растворенные вещества, способные реагировать с ра-
дикалами. Например, при наличии бромид-иона в растворе мо-
гут протекать следующие реакции:
Br + -ОН-> Br- +ОН- (5.6)
Вг- +Н- -> Н+ + Вг" (5.7)
Н+ + ОН"-> Н2О
В результате реакций (5.6) и (5.7) концентрация возникаю-
щих в растворе радикалов понижается, вследствие чего тормо-
зятся обратные реакции. Благодаря этому радиационное разло-
жение воды происходит до более высоких значений концентра-
ций молекулярных продуктов.
Аналогичным образом могут влиять на скорость радиолиза
воды и другие растворенные вещества. При этом степень влия-
ния зависит от реакционной способности растворенного веще-
ства по отношению к радикалам Н- и -ОН. Такие ионы, как
РО43, ОН", SO4”, СГ, почти не влияют на выход газа, тогда как
ионы Вг" и J" значительно ускоряют газовыделение.
Скорость радиолиза воды зависит от присутствия в ней рас-
творенных газов — кислорода и водорода.
Если в воде растворен водород, то образование пероксида
водорода может не наблюдаться, так как будут протекать реак-
ции (5.4) и (5.5).
В присутствии растворенного в воде кислорода происходит
образование радикалов НО2 •:
Н-+О2->НО2* (5.8)
Кроме того, вероятно, протекают реакции:
•ОН + Н2О2 -> Н2О + НО2 • (5.9)
НО2- + НО2- -> Н2О2 + О2 (5.10)
Реакции (5.8)—(5.10) понижают концентрацию радикалов в
объеме раствора и тем самым подавляют обратные процессы.
5.4. Действие излучений на воду и водные растворы 217
Рассмотренные процессы разложения воды под действием
излучений можно суммировать следующим образом:
2Н2О -> Н2 + Н2О2 (А)
2Н2О -> 2Н- + Н2О2 (В)
Н2О->Н* + *ОН (С)
Эта система уравнений не отражает всей сложности радиаци-
онно-химических процессов, но является все же полезной для
количественного учета первичных продуктов радиолиза воды и
водных растворов.
Выходы реакций (А)—(С) зависят от вида излучения, pH рас-
твора, присутствия окислителей и восстановителей. В кислых
растворах значения выхода этих реакций при действии у-излуче-
ний равны соответственно 0,39, 0,39 и 2,92.
В разбавленных водных растворах большая часть излучения
поглощается водой, поэтому химические изменения обусловли-
ваются косвенным действием, т. е. реакциями взаимодействия
радикалов, образовавшихся из воды, с растворенным веществом.
В таких системах кинетика взаимодействия радикалов друг с
другом и с растворенным веществом описывается следующими
уравнениями:
= тР - кхп(С + рС') - кгп2; (5.11)
at
_^L = k2nC, (5.12)
dt 2
dn dC
tjsz — — скорость изменения концентрации радикалов; —------
скорость изменения концентрации растворенного вещества; п —
концентрация радикалов; Р — мощность дозы; т — число радика-
лов, образовавшихся на единицу дозы; С — концентрация раство-
ренного вещества; С — концентрация продуктов распада раство-
ренного вещества; р — коэффициент, учитывающий способность
продуктов радиолиза растворенного вещества взаимодействовать
с радикалами; кх — константа скорости реакции взаимодействия
радикалов с растворенным веществом; к2 — константа скорости
реакции взаимодействия радикалов друг с другом.
При выводе уравнений (5.11) и (5.12) обычно исходят из пред-
положения, что радикалы равномерно распределены в объеме
218 Глава пятая. Ионизирующее излучение и окружающая среда
раствора, а константы к} и к2 одинаковы для радикалов Н* и -ОН.
Рассмотрим два случая.
1. Допустим, что все появляющиеся радикалы реагируют с
растворенным веществом (это возможно при достаточно боль-
шой концентрации растворенного вещества). Тогда для стацио-
dn Л
нарного состояния системы — = 0 получим:
dt
тР ~ к}п(С + рС');
dC . „
— = к,пС -
dt
тРС
С +рС'
Если продукты радиолиза растворенного вещества не реаги-
руют с радикалами (р = 0), то:
dt
т. е. выход реакции не зависит от концентрации растворенного
вещества и пропорционален мощности дозы.
Если же продукты радиолиза легко взаимодействуют с ради-
калами (р = 1), то:
dC = тРС .
dt ~ Со ’
mPt
с = С0 -е с° ,
где Со = С + С'.
В этом случае концентрация растворенного вещества экспо-
ненциально уменьшается с дозой.
2. Допустим, что к}п(С+ рС') « к2п2. Тогда:
тР кк2п2\
i
dC . (mPV
— /VI Vx I •
dt 1м
В этом случае выход реакции пропорционален концентрации
растворенного вещества и обратно пропорционален квадратному
корню из мощности дозы.
При действии излучений на водные растворы растворенные
вещества, как правило, окисляются или восстанавливаются.
5.5. Радиационно-химические процессы в твердой фазе
219
Исследование действия излучения на водные растворы органи-
ческих веществ показало, что они вступают в различные реакции с
радикалами, образующимися в результате радиолиза воды; при
этом увеличивается начальный выход водорода и пероксида водо-
рода, а органическое вещество превращается в менее реакционно-
способное по отношению к радикалам. Так, например, спирты
окисляются в альдегиды, альдегиды — в кислоты, а последние — в
перкислоты, которые, разлагаясь, выделяют углекислый газ.
Вода и ее растворы представляют интерес в радиационно-хи-
мическом отношении в связи с тем, что они определяют жизне-
деятельность всех существующих на Земле организмов, и, кроме
того, имеется определенная аналогия в поведении между водны-
ми растворами и биологическими системами. Как было показа-
но, в результате радиолиза водных растворов образуются такие
высокоактивные в химическом отношении продукты, как гидро-
пероксид (Н2О2), ионы Н+ и ОН-, свободные радикалы Н*, *ОН
и НО2-. Попадая в организм вместе с водой, источники иони-
зирующего излучения осуществляют радиолиз, продукты кото-
рого вступают во взаимодействие с растворенными веществами,
молекулами тканей организма и инициируют их разнообразные
превращения, которые часто носят цепной характер. В результа-
те в организме накапливаются заметные количества чужеродных,
сильно ядовитых веществ, что приводит к поражению органов
или гибели биологического объекта.
Контрольные вопросы
1. Какие основные продукты образуются при взаимодействии ионизи-
рующих излучений с водой и водными растворами?
2. Как влияют растворенные вещества на скорость радиолиза воды?
3. Чем определяется выход продуктов радиолиза воды?
5.5. Радиационно-химические процессы в твердой фазе
При действии ионизирующего излучения на вещества, нахо-
дящиеся в твердом состоянии, физические свойства твердого
тела сказываются еще в большей степени, чем при радиолизе
жидкостей. Это обусловлено несколькими причинами.
220 Глава пятая. Ионизирующее излучение и окружающая среда
Во-первых, более компактная упаковка молекул и ионов в
кристаллической решетке особенно затрудняет распад частиц на
крупные фрагменты (эффект клетки).
Во-вторых, проявляется влияние внутреннего поля кристал-
ла как на процессы диссоциации, так и на стабилизацию вновь
образующихся частиц.
При радиолизе аморфных веществ эти факторы проявляются
в более слабой степени.
Радиационные процессы в твердом веществе приводят к из-
менению как химических, так и физических его свойств.
Проникающая в твердое тело быстрая частица может столк-
нуться либо с электронами атома, либо с атомным ядром. В пер-
вом случае электрон получает энергию, которой обычно доста-
точно для того, чтобы удалить этот электрон из атома. В неме-
таллических твердых телах смещение электрона может привести
к физическим и химическим изменениям. В металле такой про-
цесс не производит видимых изменений, так как электрон легко
возвращается в исходное состояние, рассеивая избыточную
энергию при взаимодействии с другими электронами.
Соударения быстрых тяжелых частиц с атомными ядрами
могут привести к смещению ядра в решетке. Если смещение не-
велико, то ядро может вернуться в свое начальное положение.
Если же смещение достаточно большое, в кристаллической ре-
шетке образуется вакантное место, а смещенный атом оказыва-
ется внедренным в междоузлие, что может привести к наруше-
нию равновесия решетки и образованию дефектов.
Процессы возбуждения и ионизации, протекающие при об-
лучении, влекут за собой диссоциацию молекул и ионов, в ре-
зультате чего образуются свободные атомы и радикалы, иниции-
рующие протекание химических процессов, изменяющих физи-
ческие свойства и химический состав твердой фазы.
5.6. Взаимодействие ионизирующего излучения
с живыми организмами
Отрицательное воздействие ионизирующего излучения на
живые организмы стало известно человечеству почти сразу после
Начала интенсивных исследований явления естественной радио-
5.6. Взаимодействие излучения с живыми организмами
221
активности. Уже тогда проявилось то обстоятельство, что разные
виды ионизирующего излучения по-разному воздействуют на
организмы. Степень такого воздействия очень сильно зависит от
расположения источника излучения: находится радионуклид
внутри организма (внутреннее облучение) или вне его (внешнее
облучение).
Образующиеся при радиоактивном распаде а-частицы в силу
своих больших заряда и массы обладают значительной ионизи-
рующей способностью и поэтому растрачивают всю свою энер-
гию на небольшом пути. Длина пробега а-частицы в воздухе
около 10 см, а путь, который они проходят в тканях человека,
составляет десятые доли миллиметра. Вследствие этого а-радио-
активные нуклиды играют большую роль во внутреннем облуче-
нии организма, куда они попадают с воздухом, водой или пи-
щей. В этом случае встретившиеся на пути а-частиц молекулы
превратятся в ионы или свободные радикалы, которые принима-
ют активное участие в превращениях и сами инициируют хими-
ческие реакции с молекулами, составляющими ткани организма.
Следствием такого воздействия может быть поражение отдель-
ных органов и развитие лучевой болезни, приводящей к гибели
человека. Кроме того, на клеточном уровне могут происходить
мутации наследственного аппарата в результате нарушения
строения отдельных хромосом, что сопровождается развитием
ряда онкологических и наследственных заболеваний.
Радиоактивные нуклиды, характеризующиеся р-распадом,
могут оказывать негативное воздействие на живые организмы
как при внутреннем, так и при внешнем облучении в силу зна-
чительно большей, чем у а-частиц, длины пробега. Бета-части-
цы характеризуются меньшей величиной степени воздействия
на вещество, и поэтому вред от их воздействия на организм
проявляется слабее, что, однако, не исключает провоцирования
этим видом ионизирующего излучения злокачественных ново-
образований.
Гамма-излучение (у-лучи) обладает гораздо большей прони-
кающей способностью, позволяющей ему проходить через ткани
организма на значительно большую глубину, чем а- или р-час-
тицам. При попадании у-радиоактивного элемента внутрь орга-
низма испускаемые им при радиоактивном распаде у-кванты по-
глощаются в самом организме лишь частично, производя при
222 Глава пятая. Ионизирующее излучение и окружающая среда
этом те же нарушения молекул, что при облучении а- и р-части-
цами. Большая часть у-излучения покидает организм и попадает
во внешнюю среду, где поглощается другими объектами. В зна-
чительной мере вредное воздействие у-излучения на организм
может проявиться при внешнем облучении. Оно наблюдается
всегда, когда мощный источник у-излучения (например, из ко-
бальта-60) постоянно используется в практической деятельности
и расположен от организма на значительном расстоянии. Это
обстоятельство может являться причиной возникновения и раз-
вития различных поражений органов человека и онкологических
заболеваний.
Весь значительный объем рассмотренных материалов убеди-
тельно свидетельствует о том, что негативное воздействие ионизи-
рующего излучения радиоактивных нуклидов реализуется вследст-
вие энергетического взаимодействия излучения с организмом,
проявляющегося в ионизации, диссоциации, возбуждении моле-
кул и их разрушении на молекулярные фрагменты и свободные
радикалы.
Контрольные вопросы
1. Какие изменения происходят в твердом веществе при воздействии на
него ионизирующего излучения?
2. В чем проявляется вредное воздействие ионизирующего излучения на
организм человека?
3. Каков характер взаимодействия различных видов ионизирующего из-
лучения с живыми организмами?
Заключение
Современный уровень взаимодействия человека с окружаю-
щей средой в количественном и качественном отношении неиз-
меримо выше, чем в XIX и первой половине XX веков. Все более
стремительная интенсификация промышленности и сельского
хозяйства привела к глобальному загрязнению планеты, которое
к настоящему времени приобрело угрожающий характер. Прави-
тельства большинства стран начали понимать гибельность тако-
го развития, о чем свидетельствует, в частности, подписание в
декабре 1997 г. Киотского протокола, направленного на решение
проблемы снижения выбросов парниковых газов, являющегося
одной из приоритетных задач мирового сообщества.
При обсуждении последствий неразумного воздействия на
окружающую среду главная роль отводится доведению объектив-
ных знаний о результатах таких взаимодействий до максимально
широкой аудитории и формированию у последней способности
анализировать и оценивать принимаемые государственными ор-
ганами и деловыми кругами решений, затрагивающих вопросы
обеспечения безопасной жизнедеятельности населения. Будучи
проблемой глобальной, охрана среды обитания человека как на-
учное и практическое направление использует комплекс знаний,
поставляемых специалистами различных научных дисциплин,
что подчеркивает сложность и многоплановость стоящих задач.
Несмотря на то что уровень сегодняшних научных знаний по
физике и физико-химии атмосферы, физике моря, геофизике,
гидрогеологии, моделированию сложных глобальных природных
процессов не позволяет однозначно количественно прогнозиро-
вать ход глобальных изменений среды обитания под воздействи-
ем антропогенных факторов, уже имеющихся данных достаточно
для определения реальных опасностей и путей их преодоления.
Вследствие этого только серьезные научные знания являются
той основой, которая позволяет предпринимать ответственные
решения по защите как среды обитания, так и человека.
Список литературы
1. Гриневич В. И., Куприяновская А. П., Никифоров А. Ю. Охрана
окружающей среды и рациональное природопользование: Курс лек-
ций. Иваново: ИГХТА, 1995.
2. Семенченко Б. А. Физическая метеорология: Учебник. М.: Ас-
пект Пресс, 2002.
3. Фелленберг Г. Загрязнение природной среды. Введение в эко-
логическую химию. М.: Мир, 1997.
4. Богдановский Г. А. Химическая экология: Учебное пособие.
М.: МГУ, 1994.
5. Ларин И. Химия и алхимия озонового слоя / Наука и жизнь.
2001. № 1. С. 74-77.
6. Груза Г, Ранькова Э. Климат России: потепление продолжает-
ся / Наука и жизнь. 2003. № 11. С. 56—61.
7. Липунов И. Н. Основы химии и микробиологии природных и
сточных вод: Учебное пособие. Екатеринбург: УГЛТА, 1995.
8. Человек и среда его обитания. Хрестоматия / Под ред.
Г. В. Лисичкина и Н. Н. Чернова. М.: Мир, 2003.
9. Луканин В. М., Трофименко Ю. В. Промышленно-транспорт-
ная экология: Учебник для студентов вузов. М.: Высш, шк., 2001.
10. Кэмпбел Дж. Современная общая химия. М.: Мир, 1975.
11. Вернадский В. И. Избранные сочинения. М.: Наука, 1960.
Т. 4. Кн. 2.
12. Страус В. Промышленная очистка газов. М.: Химия, 1981.
13. Химия окружающей среды / Под ред. Дж. О. М. Бокриса.
М.: Химия, 1982.
14. Химическая энциклопедия. В 5 т. М.: Большая Российская
Энциклопедия, 1999.
Список литературы
225
15. Радиохимия и химия ядерных процессов / Под ред. А. Н. Му-
рина, В. Д. Нефедова, В. П. Шведова. Л.: ГНТИКП, 1968.
16. Пшежецкий С. Я. Механизм радиационно-химических реак-
ций. М.: Химия, 1968.
17. ЛысцовВ. Угрожающее потепление / Наука и жизнь. 2005.
№ 2.
18. Андруз Дж., Бримблекумб П., Дишкелз Т. и др. Введение в хи-
мию окружающей среды. М.: Мир, 1999.
19. Наше общее будущее: Доклад Международной комиссии по
окружающей среде и развитию (МКОСР): Пер. с англ. / Под ред. и
с послесл. С. А. Евтеева и Р. А. Перелета М.: Прогресс, 1989.
20. Одум Ю. Экология. В 2 т. М.: Мир, 1986.
21. Охрана окружающей природной среды: Учебное пособие для
технических вузов / Под ред. И. Н. Липунова. Екатеринбург:
УГЛТА, 2001.
22. Физическая энциклопедия. В 5 т. М.: Большая Российская
Энциклопедия, 1998.
Приложение 1
Возможные сценарии изменения климата
планеты
Международная группа экспертов по изменению климата
(МГЭИК) Рамочной конвенции ООН приняла к рассмотрению
и проанализировала в 2000 г. около 40 различных вариантов раз-
вития человеческого общества до 2100 г., акцентируя свое вни-
мание на масштабах потребления ископаемого топлива и соот-
ветствующем этому росте содержания в атмосфере СО2 и других
парниковых газов, проявляющихся в приросте средней глобаль-
ной температуры и повышении уровня моря.
Все рассмотренные сценарии по доминирующей цели и при-
знакам были поделены на классы. Сценарии класса А провозгла-
шали приоритет экономики над экологией, а варианты класса В
предполагали превалирование экологических целей и достиже-
ние устойчивого социально-экономического развития. В том
случае когда процессы, лежащие в основе вариантов развития
общества, носят глобальный общемировой характер, сценарию
присваивается индекс «1». Для сценариев регионального харак-
тера предусмотрен индекс «2». Кроме того, в пределах варианта
А1 были выделены три особых сценария:
A1F — с интенсивным использованием ископаемых топлив
(угля);
А1В — с умеренным и сбалансированным потреблением ис-
копаемых топлив;
А1Т — с переходом к энергетике, исключающей использова-
ние ископаемых топлив.
Экспертная международная группа в качестве эталона воз-
действия различных факторов на изменение климата выбрала
сценарий В2, в котором кривые роста содержания СО2 в атмо-
сфере и среднемировой температуры оказались как бы «усред-
ненными» для всех рассмотренных вариантов. В соответствии с
выбранным эталонным сценарием приоритетными целями ми-
рового сообщества в XXI в. должны стать охрана окружающей
среды и устранение в глобальном масштабе социального нера-
Возможные сценарии изменения климата планеты 227
венства с учетом местных условий. Предполагается, что при чис-
ленности населения земного шара 10,4 млрд человек в 2100 г.
доля энергии, вырабатываемой за счет сжигания угля, будет со-
ставлять лишь 22 %, а 49 % всей энергии вообще будет произво-
диться без образования и выброса СО2. При этом экономиче-
ские ресурсы и техническое совершенствование достаточно рав-
номерно распределятся по всем регионам планеты.
Альтернативный вариант развития общества А2 предполагает
сосредоточение усилий на экономическом росте. По этому сце-
нарию прогнозируется более быстрый рост населения, числен-
ность которого достигнет в 2100 г. 15 млрд человек, а мировой
валовой продукт окажется заметно выше, чем по сценарию В2, и
распределен он будет по отдельным районам земного шара не-
равномерно. Сжигание угля в этом варианте обеспечит 53 %
Рис. Ш. Рост уровня Мирового океана (в см) в XXI в. для 6 демонстрационных
сценариев [17]: А1В — с умеренным и сбалансированным потреблением иско-
паемых топлив; A1F — с интенсивным использованием ископаемых топлив
(угля); А1Т — с переходом к энергетике, исключающей использование ископае-
мых топлив; А2 — приоритет экономических целей над экологией в региональ-
ном масштабе; В1 — первостепенное обеспечение экологических целей при ус-
тойчивом социально-экономическом развитии в общемировом масштабе; В2 —
приоритет экологических целей и достижение устойчивого социально-экономи-
ческого развития регионального характера
228
Приложение 1
Рис. П2. Кривые роста температуры в Арктике в XXI в. для сценариев А2 и В2
[17]: А2 — приоритет экономических целей над экологией в региональном мас-
штабе; В2 — приоритет экологических целей и достижение устойчивого социаль-
но-экономического развития регионального характера
всей вырабатываемой энергии, и только 28 % энергоресурсов бу-
дет получено без выброса СО2 в атмосферу.
Реализация этих вариантов различным образом скажется на
увеличении глобальной температуры и на повышении уровня
Мирового океана, как это иллюстрируется рис. П1 и П2.
Приложение 2
Основные термины и понятия
Абсорбция — поглощение веществ из газовой смеси жидкостями
или твердыми телами (абсорбентами).
Адсорбция — преимущественное концентрирование молекул газа
или растворенного в жидкости вещества на поверхности
жидкости или твердого тела.
Альбедо — величина, характеризующая отражательную и рассеи-
вающую способность поверхностей или космических тел.
В широком смысле — это отношение потока отраженного
(рассеянного) излучения к потоку падающего излучения.
Альфа-частицы — ядра дважды ионизированных атомов гелия
(4Не).
Анаэробные условия — процессы протекают в условиях отсутст-
вия в системе кислорода (воздуха).
Антропогенные факторы — факторы, обязанные своим происхож-
дением деятельности человека и вызывающие изменения в
окружающей среде.
Аэрозоль — коллоидные системы, в которых дисперсионной сре-
дой служит, как правило, воздух.
Аэробные условия — химические и биохимические процессы
протекают в окислительной среде кислорода (воздуха).
Атмосфера — газообразная оболочка планеты, включающая
смесь различных газов, водяных паров и пылевых (аэрозоль-
ных) частиц.
Бета-частицы — электроны и позитроны, испускаемые при
p-распаде ядер и свободного нейтрона.
Биота — совокупность видов растений, животных и микроорга-
низмов, объединенных общей областью распространения.
230
Приложение 2
Живые существа и растения в некотором районе или на зем-
ном шаре.
Буферная емкость экосистемы — количество токсиканта, поступ-
ление которого существенно не нарушает естественного
функционирования всей изучаемой экосистемы.
Буферные свойства раствора — способность поддерживать при
изменении состава среды постоянство значения какой-либо
характеристики, например pH (кислотно-основной буфер-
ный раствор).
Возбужденное состояние молекулы (атома) — состояние, характе-
ризующееся наличием отличающейся от основного состоя-
ния электронной структуры и, как правило, высокой реакци-
онной способностью. Переход молекулы из основного элек-
тронного состояния в одно из возбужденных состояний
происходит вследствие поглощения энергии внешнего ис-
точника.
Газы парниковые — водяной пар, углекислый газ, метан, фтор- и
хлорсодержащие углеводороды, оксид азота (I) — прозрачны
для солнечного света, как стеклянная крыша парника, но за-
держивают тепловое инфракрасное излучение нагретой зем-
ной поверхности.
Гамма-излучение — коротковолновое электромагнитное излуче-
ние, возникающее в результате спонтанного радиационного
перехода ядра из начального состояния с энергией Е в ко-
нечное состояние с энергией Ек (Еи > Ек). Гамма-излучение
представляет собой поток гамма-квантов, которые характе-
ризуются, как и другие фотоны, энергией, импульсом и
спином.
Гидролиз — обменная реакция между веществом и водой. При
гидролизе солей образуются основания и кислоты.
Гидросфера — водная оболочка Земли, включающая океаны,
моря, озера, реки, подземные воды, ледники.
Гумус — совокупность всех органических соединений, находя-
щихся в почве, но не входящих в состав живых организмов
или образований.
Основные термины и понятия
231
Дейтрон — связанное состояние протона и нейтрона, ядро одно-
го из изотопов водорода — дейтерия.
Диоксины — высокотоксичные соединения — полихлорирован-
ные дибензодиоксины и дибензофураны. Группа диоксинов
объединяет сотни веществ, каждое из которых содержит спе-
цифическую гетероциклическую структуру с атомами хлора в
качестве заместителей.
Диссоциация — обратимый распад частицы вещества (молекулы,
атома, радикала). Различают электролитическую, термиче-
скую и фотохимическую диссоциацию.
Загрязнение окружающей природной среды (антропогенное) — фи-
зико-химическое либо иное изменение качества атмосферно-
го воздуха, вод, почв в результате хозяйственной или иной
деятельности, превышающее установленные нормативы вред-
ного воздействия на окружающую природную среду и создаю-
щее угрозы здоровью человека, состоянию растительного и
животного мира, материальным ценностям.
Имиссия — ввод вредных веществ в организмы или растения.
Ионизация — превращение электрически нейтральных атомных
частиц (атомов, молекул) в результате удаления из них одно-
го или нескольких электронов в положительные ионы и
электроны. Основными механизмами ионизации являются:
столкновительная ионизация (соударения с электронами,
ионами, атомами); ионизация светом (фотоионизация); ио-
низация электрическим полем.
Ионизирующее излучение — потоки фотонов или частиц, взаимо-
действие которых со средой приводит к ионизации ее атомов
или молекул. Различают фотонное и корпускулярное иони-
зирующее излучение.
Ионизирующая способность — число пар разноименных носите-
лей электрического заряда (пар ионов, пар электрон — дыр-
ка), создаваемых как непосредственно в столкновениях заря-
женной частицы, так и с учетом ионизации вторичными
электронами на единице длины пути в веществе.
232
Приложение 2
Инверсия — весьма устойчивое состояние атмосферы, при кото-
ром температура воздуха повышается с высотой, что замед-
ляет вертикальное перемещение загрязнений, увеличивает их
концентрацию в приземном слое атмосферного воздуха и
при достаточной солнечной радиации может способствовать
образованию фотохимического смога.
Ионный обмен — обратимый процесс стехиометрического обме-
на ионами между двумя контактирующими фазами, одна из
которых обычно раствор электролита.
Канцерогенные свойства — способность химических соединений
вызывать новообразования в тканях живых организмов.
Кислотные дожди — атмосферные осадки, имеющие значение
водородного показателя (pH) менее 5.
Климат — совокупность среднемноголетних характеристик атмо-
сферы, гидросферы и суши.
Климатическая система — основное понятие теории климата.
Включает в себя пять природных компонентов, в которых
происходят процессы, формирующие климат: атмосферу,
океан, континенты с водными объектами, криосферу и биоту.
Криосфера — прерывистая оболочка Земли, характеризующаяся
наличием или возможностью существования воды в твердой
фазе (лед, снег) в атмосфере (облаках), на море и на суше.
Коагуляция — объединение частиц в агрегаты вследствие их сце-
пления (адгезии) при соударениях.
Комплексообразование — процесс образования сложной структу-
ры (комплекса), состоящей из центрального атома (или
иона) и связанных с ним молекул или ионов — лигандов.
Космическое излучение — поток заряженных частиц высокой
энергии, преимущественно протонов, приходящих на Землю
из мирового пространства.
Ксенобиотики — вещества, чужеродные для организма. Их разде-
ляют на три группы: продукты хозяйственной деятельности
человека (промышленность, транспорт); вещества бытовой
Основные термины и понятия
233
химии (моющие средства, препараты для борьбы с паразита-
ми, парфюмерия); большинство лекарств.
Литосфера — верхняя твердая оболочка Земли, включающая
земную кору и верхнюю мантию.
Миграция ионов, соединений — процесс переноса частиц вещест-
ва в конденсированных фазах вследствие диффузии, гради-
ентов концентраций, температуры, давления.
Нейтрон — элементарная частица с нулевым электрическим за-
рядом и массой, незначительно большей массы протона.
Нуклид — совокупность атомов с определенными значениями
заряда ядра Z (число протонов в ядре) и массового числа А
(сумма чисел протонов Z и нейтронов N в ядре). Для обозна-
чения нуклида используют название элемента, к которому
через дефис присоединяют значение А (например, кисло-
род-16).
Озон — трехатомная аллотропная форма кислорода, отличаю-
щаяся высокой химической активностью. Стратосферный
озон регулирует поток ультрафиолетового излучения, задер-
живая наиболее опасную часть радиации Солнца с длинами
волн менее 285 нм и значительно ослабляя излучение в диа-
пазоне 285—315 нм.
Озоновая антарктическая дыра — сезонная (начало весны — ко-
нец зимы) убыль общего содержания озона, наблюдаемое
над Антарктидой.
Осколки деления — атомы и ядра, образующиеся в результате де-
ления ядер и последующих превращений.
Основное состояние атома — стационарное квантовое состояние
с наименьшей внутренней энергией, при котором электроны
атома заполняют электронные уровни в соответствии с
принципом Паули, когда две или более тождественные час-
тицы не могут одновременно обладать одним и тем же набо-
ром всех квантовых чисел, т. е. находиться в одном и том же
энергетическом состоянии.
Парниковый эффект — повышение температуры внутренних сло-
ев атмосферы и поверхности планеты, обусловленное тем,
234
Приложение 2
что атмосфера более прозрачна для падающего солнечного
излучения, чем для уходящего теплового излучения поверх-
ности.
Почвенный поглощающий комплекс — совокупность минераль-
ных, органических и органоминеральных компонентов твер-
дой фазы почв, обладающих способностью ионного обмена.
Пестициды — собирательный термин, охватывающий химиче-
ские соединения различных классов, применяемые для борь-
бы с вредными организмами в сельском хозяйстве, здраво-
охранении, промышленности и т. д.
Поверхностно-активные вещества (ПАВ, или детергенты) — орга-
нические вещества с гидрофильными и гидрофобными уча-
стками совершенно различного химического строения, по-
нижающие поверхностное натяжение воды и вызывающие
загрязнение водоемов.
Потенциал ионизации (молекулы, атома, иона) — минимальная
разность потенциалов, которую должен пройти электрон в
ускоряющем электрическом поле, чтобы приобрести кинети-
ческую энергию, достаточную для ионизации частицы. Дру-
гими словами — это энергия ионизации частицы, деленная
на величину заряда электрона.
Радиолиз — совокупность химических процессов деструктивного
характера, протекающих при поглощении веществом энер-
гии ионизирующего излучения.
Радиационно-химические реакции — совокупность химических и
физико-химических превращений веществ под действием
ионизирующего излучения.
Радикалы свободные — химические частицы с неспаренными
электронами на внешних орбиталях; обладают парамагнетиз-
мом и высокой реакционной способностью.
Радиоактивные ряды (радиоактивные семейства) — группы гене-
тически связанных радионуклидов, в которых каждый по-
следующий возникает в результате а- или p-распада преды-
дущего.
Основные термины и понятия
235
Радиоактивность — самопроизвольное превращение нестабиль-
ных атомных ядер в другие ядра, сопровождающееся испус-
канием частиц, а также жесткого электромагнитного излу-
чения.
Радионуклиды — нуклиды, ядра которых радиоактивны.
Рекомбинация — 1) образование ковалентной связи путем обоб-
ществления двух неспаренных электронов, принадлежащих
разным частицам (атомам, свободным радикалам); 2) образо-
вание нейтральных атомов или молекул из свободных элек-
тронов и положительно заряженных атомных или молеку-
лярных ионов — процесс, обратный ионизации.
Сенсибилизаторы — вещества, способствующие повышению чув-
ствительности других веществ к какому-либо внешнему воз-
действию. Сенсибилизация осуществляется атомами-донора-
ми, поглощающими энергию возбуждения и передающими
ее безизлучательно атомам-акцепторам, в которых происхо-
дит излучательный переход.
Стратосфера — слой атмосферы высотой до 40 км от поверхно-
сти Земли, отличающийся почти постоянной температурой,
расположением на высоте 20—25 км слоя максимального со-
держания озона.
Токсиканты — ядовитые вредные для здоровья вещества.
Тропосфера — нижний слой атмосферы до высоты 18 км от по-
верхности Земли, в котором протекает большинство метео-
рологических процессов и физико-химических превращений.
Трек — след, оставляемый заряженной частицей в веществе, ре-
гистрируемый трековыми детекторами частиц.
Тренд (тенденция) — изменение метеорологических величин в
рядах наблюдений за рассматриваемый период.
Фотоионизация — ионизация молекул и атомов под действием
света. Однократная фотоионизация невозбужденной ней-
тральной молекулы фотонами приводит к образованию кати-
он-радикала М+* с энергией возбуждения ДМ*) и электрона
с кинетической энергией Е.
236
Приложение 2
Фотохимические реакции — химические реакции, протекающие
или инициируемые под действием света.
Фотохимический смог — смесь сильнейших оксидантов и токси-
кантов, включая озон, пергидроксид, супероксид, радикал
гидроксила, оксиды азота, полиядерные ароматические угле-
водороды, пероксиацетилнитрат и другие соединения, обра-
зующиеся в условиях интенсивной солнечной радиации, ак-
тивного движения автотранспорта и наличия застойной зоны
воздуха в приземном слое атмосферы.
Фреоны — насыщенные газообразные или жидкие фторхлоруг-
лероды.
Химическое загрязнение — загрязнение окружающей среды хими-
ческими вещестами, являющимися побочными продуктами
промышленного производства, сельского хозяйства, выбра-
сываемых в атмосферу с выхлопными газами транспорта.
Оглавление
Введение ............................................... 3
Глава первая. ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ
В АТМОСФЕРЕ..............................................6
1.1. Основные компоненты глобального
экологического кризиса.............................6
1.2. Характеристики загрязнения атмосферы .........8
1.2.1. Пыль и аэрозоли.........................8
1.2.2. Газы...................................20
1.3. Основные типы процессов в атмосфере..........27
1.3.1. Фотохимические реакции.................27
1.3.2. Свободные радикалы. Образование
их в атмосфере.............................. 34
1.3.3. Фотохимические реакции кислорода. Озон.
Проблемы озонового слоя Земли...........37
1.4. Климат и парниковый эффект...................60
1.4.1. Парниковые газы........................68
1.5. Кислотные дожди .............................74
1.5.1. Превращения кислых оксидов
и хлорводорода и формы существования
продуктов превращений в атмосфере............76
1.5.2. Пути поступления кислых оксидов
в атмосферу..................................78
1.5.3. Механизмы образования кислотных дождей . . 80
1.5.4. Влияние кислотных дождей на природные
объекты, здания, памятники и технику ........83
1.6. Фотохимический смог..........................87
1.6.1. Токсичные продукты выхлопных газов
двигателей внутреннего сгорания..............88
1.6.2. Оксиды азота — инициаторы фотохимического
смога и механизм их образования .............89
1.6.3. Монооксид углерода ....................93
238
Оглавление
1.6.4. Полиядерные ароматические
углеводороды — компонент
выхлопных газов ..............................95
1.6.5. Смог как результат антропогенной
деятельности .................................99
Глава вторая. ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ
В ГИДРОСФЕРЕ.......................................... 103
2.1. Вода и ее роль в жизни Земли .............. 103
2.2. Процессы самоочищения водоемов ............ 105
2.3. Буферная емкость пресноводных водоемов...... 107
2.4. Химия природных вод ........................ ПО
2.4.1. Формирование состава грунтовых, речных
и морских вод .............................. 110
2.4.2. Классификация загрязнений вод
по фазово-дисперсному состоянию.............. 113
2.4.3. Оценка загрязненности воды .......... 116
2.5. Загрязнение водных систем тяжелыми
металлами ...................................... 118
2.5.1. Процессы, определяющие формы
существования тяжелых металлов
в водной среде ............................. 118
2.5.2. Факторы, определяющие миграцию
тяжелых металлов в водных системах........... 130
2.5.3. Формы существования и поведение
некоторых тяжелых металлов
в природных водах........................... 133
2.6. Растворенные в водных системах газы ....... 142
2.6.1. Механизм абсорбции газов водной
поверхностью................................ 143
2.6.2. Растворимость кислорода в водных
системах.................................... 148
2.6.3. Растворимость диоксида углерода
в водных системах .......................... 149
2.6.4. Буферные свойства системы
диоксид углерода — карбонат................. 153
2.7. Поведение соединений азота и фосфора
в поверхностных водоемах........................ 154
2.8. Загрязнение водоемов веществами
органического характера......................... 157
Оглавление
239
Глава третья. ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ
В ПЕДОСФЕРЕ........................................ 173
3.1. Основные физико-химические процессы,
протекающие в почвах.......................... 174
3.2. Поведение тяжелых металлов и их соединений
в почвах................................. 177
3.3. Поведение пестицидов в почвах............ 181
Глава четвертая. ВЕЩЕСТВА, РАСПРОСТРАНЕННЫЕ
В АТМОСФЕРЕ, ГИДРОСФЕРЕ
И ПЕДОСФЕРЕ..........................................184
Глава пятая. ИОНИЗИРУЮЩЕЕ ИЗЛУЧЕНИЕ
И ОКРУЖАЮЩАЯ СРЕДА..................................192
5.1. Естественные и техногенные радионуклиды... 193
5.2. Общие представления о взаимодействии
ионизирующего излучения с веществом........... 198
5.3. Взаимодействие ионизирующего излучения
с компонентами атмосферы.......................208
5.4. Действие ионизирующих излучений на воду
и водные растворы..............................213
5.5. Радиационно-химические процессы
в твердой фазе................................ 219
5.6. Взаимодействие ионизирующего излучения
с живыми организмами ..........................220
Заключение..........................................223
Список литературы...................................224
Приложение 1. Возможные сценарии
изменения климата планеты ..........................226
Приложение 2. Основные термины и понятия............229
Трифонов Константин Иванович
Девисилов Владимир Аркадьевич
Физико-химические процессы
в техносфере
Учебник
Редактор Г. С. Шуршакова
Корректор Л. А. Шитова
Компьютерная верстка И. В. Кондратьевой
Оформление серии Р. Остроумова
Сдано в набор 14.06.2006. Подписано в печать 18.07.2006. Формат 60x90/16
Печать офсетная. Гарнитура «Таймс». Усл. печ. л. 15,0. Уч.-изд. л. 15,5.
Бумага офсетная. Тираж 3 000 экз. Заказ № 4054.
Издательство «ФОРУМ»
101000, Москва — Центр, Колпачный пер., д. 9а
Тел./факс: (495) 625-32-07, 625-39-27
E-mail: mail@foram-books.ru
ЛР № 070824 от 21.01.93
Издательский Дом «ИНФРА-М»
127282, Москва, Полярная ул., д. 31в
Тел.: (495) 380-05-40
Факс: (495) 363-92-12
E-mail: books@infra-m.ru
Http://www.infra-m.ra
Отпечатано в полном соответствии с качеством
предоставленных диапозитивов в ОАО “Тульская типография”.
300600, г. Тула, пр. Ленина, 109.
b-ecolog.narod.ru
Библиотека
инженера-эколога
http://vkontakte.ru/club994894