Автор: Дикерсон Р. Грей Г. Хейт Дж.
Теги: неорганическая химия общая и неорганическая химия химия
Год: 1982
Текст
Chemical principles
Third Edition
Richard E. Dickerson
California Institute of Technology
Harry B. Gray
California Institute of Technology
Gilbert P. Haight, Jr.
University of Illinois
The Benjamin/Cummings Publishing Company, Inc. Menlo Park • California • Reading, Massachusetts London • Amsterdam • Don Mills, Ontario • Sydney
Р. Дикерсон ПГрей Дж. Хейт ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
В 2-х томах
2
Перевод с английского нанд. хим. наук
Е. Л. Розенберга
Издательство «Мир» Москва 1982
ББК 24.1
Д45
УДК 546
Дикерсон Р., Грей Г., Хейт Дж.
Д45
Основные законы химии: В 2-х томах. Пер. с англ.-М.: Мир, 1982.-620 с., ил,-Т.2.
Учебное пособие к изучению основных законов и представлений обшей химии. Авторы-известные американские ученые и педагоги, перу которых принадлежат и другие, уже снискавшие популярность учебные пособия. Главное внимание в данном издании уделено современным теоретическим представлениям, меньше-традиционной описательной химии. В русском издании книга выходит в двух частях.
В т. 2 рассмотрены термодинамика и кинетика химических реакций. Отдельные главы знакомят с основами электрохимии, а также органической и ядерной химии.
Книга предназначена для студентов и преподавателей обшей химии в химических техникумах и вузах (главным образом педагогических и университетах); может быть использована учащимися старших классов средней школы при подготовке к поступлению в вуз.
20501-182
Д------------83-82, 4.1 1801000000
041 (01)-82
ББК 24.1
540
1
Редакция литературы по химии
© 1979 by The Benjamin/Cummings Publ.
© Перевод на русский язык, «Мир», 1982
ГЛАВА
15
Энергия и энтальпия в химических системах
Тепло и холод-это две руки природы, которыми она делает почти все.
Фрэнсис Бэкон (1627)
Важнейшие понятия
15-1. Работа и теплота. Эквивалентность теплоты, работы и энергии. 15-2. Первый закон термодинамики. Термодинамические системы: незамкнутая, замкнутая и изолированная. Взаимопревращение теплоты, работы и энергии. Работа типа РУ Сохранение энергии. Функции состояния. Внутренняя энергия Е.
15-3. Энергия, энтальпия и теплоемкость. Экзотермические и эндотермические реакции. Энтальпия Н. Теплоемкости при постоянном объеме и при постоянном давлении.
15-4. Первый закон термодинамики и химические реакции. Закон Гесса и аддитивность теплот реакции. Энергетические диаграммы реакций. Стандартные состояния и стандартные теплоты образования.
15-5. Энергии связей. Теплоты образования и энергии связей. Напряжения в молекулах и искажения валентных углов. Делокализация электронов и стабилизация связи.
Во время второй мировой войны (а может быть, и раньше) появился такой лозунг: «Трудное мы делаем сразу; невозможное занимает у нас несколько больше времени». В этой и следующей главах будет выяснено, что является возможным в химических реакциях. Это отнюдь не означает, что все допустимое законами термодинамики должно происходить за короткое время. Когда специалист по химической термодинамике говорит, что некоторая реакция протекает самопроизвольно, он не делает никаких предсказаний относительно времени ее осуществления; он лишь утверждает, что по прошествии достаточного времени реакция может произойти. С по-
Глава 15
6
зиций термодинамики взрыв при погружении натрия в воду и выветривание всего североамериканского континента одинаково являются самопроизвольными процессами.
Химику важно знать, протекает ли интересующая его реакция самопроизвольно в термодинамическом смысле. Если она осуществляется медленно, но самопроизвольно, можно подобрать какие-либо средства, скажем катализаторы, которые ускорят процесс. Если же реакция не является самопроизвольной, поиск ее ускорителя бессмыслен с самого начала; чтобы осуществить желаемую реакцию, нужно изыскивать другие средства.
*
Какой критерий позволяет судить о самопроизвольном характере реакции? Представления о самопроизвольном осуществлении реакций и о химическом равновесии обсуждались в гл. 4, но там мы принимали на веру приводившиеся значения констант равновесия. Теперь мы увидим, как эти константы связаны с другими измеряемыми свойствами реакции. Протекание большинства самопроизвольных реакций сопровождается выделением тепла. В качестве примера можно сослаться на такие общеизвестные явления, как взрывы и реакции горения. Но насколько обоснованным оказался бы общий вывод, что все самопроизвольные реакции сопровождаются выделением тепла? Почему одни реакции осуществляются настолько полно, что после их протекания практически не остается реагентов, тогда как другие приостанавливаются при образовании смеси реагентов и продуктов? Можно ли предсказать заранее, каким из этих двух способов будет вести себя интересующая нас реакция? Как влияет на самопроизвольное протекание реакции количество имеющихся реагентов или продуктов?
Таковы некоторые из вопросов, на которые мы должны ответить в этой и следующей главах. Однако не следует забывать, что термодинамика лишь предсказывает, может ли реакция произойти (точнее, не запрещена ли она законами термодинамики). Заставить ее произойти, и притом за не слишком большое время, это уже задача химика-исследователя.
15-1. РАБОТА, ТЕПЛОТА И КАЛОРИЧЕСКАЯ ТЕОРИЯ
Одна из величайших заслуг Лавуазье перед химией заключается в том, что он ниспроверг флогистонную теорию (об этом рассказано в гл. 6). Лавуазье показал, что горение представляет собой соединение вещества с кислородом, а не потерю им флогистона. Однако представления Лавуазье об источнике тепла, которое является столь характерным признаком горения, были менее ясными. В 1789 г. Лавуазье ввел термин теплота, под которым он понимал «невесомую тепловую материю». Теплота рассматривалась как некая жидкость, по-видимому невесомая, которая окружает атомы всех веществ и может быть извлечена из них в ходе реакций, сопровождающихся выделением тепла.
Дальтон считал, что каждый атом существует в «атмосфере» теплоты. В 1808 г. он писал:
«Наиболее правдоподобное мнение относительно природы теплоты заключается в том, что она представляет собой упругий и крайне неуло
Энергия и энтальпия в химических системах
7
вимый флюид, частицы которого отталкиваются друг от друга, но притягиваются всеми другими телами».
В соответствии с этими представлениями, принятыми во времена Дальтона, нагревание газа при его сжимании объясняется тем, что частицы теплоты, отталкивающиеся друг от друга, выдавливаются из газа. Теплота трения выделяется в результате того, что движение трущихся поверхностей сопровождается «стиранием теплоты» с их атомов. Подобная теория теплоты (калорическая теория) поддерживалась большинством ученых первой половины XIX в.
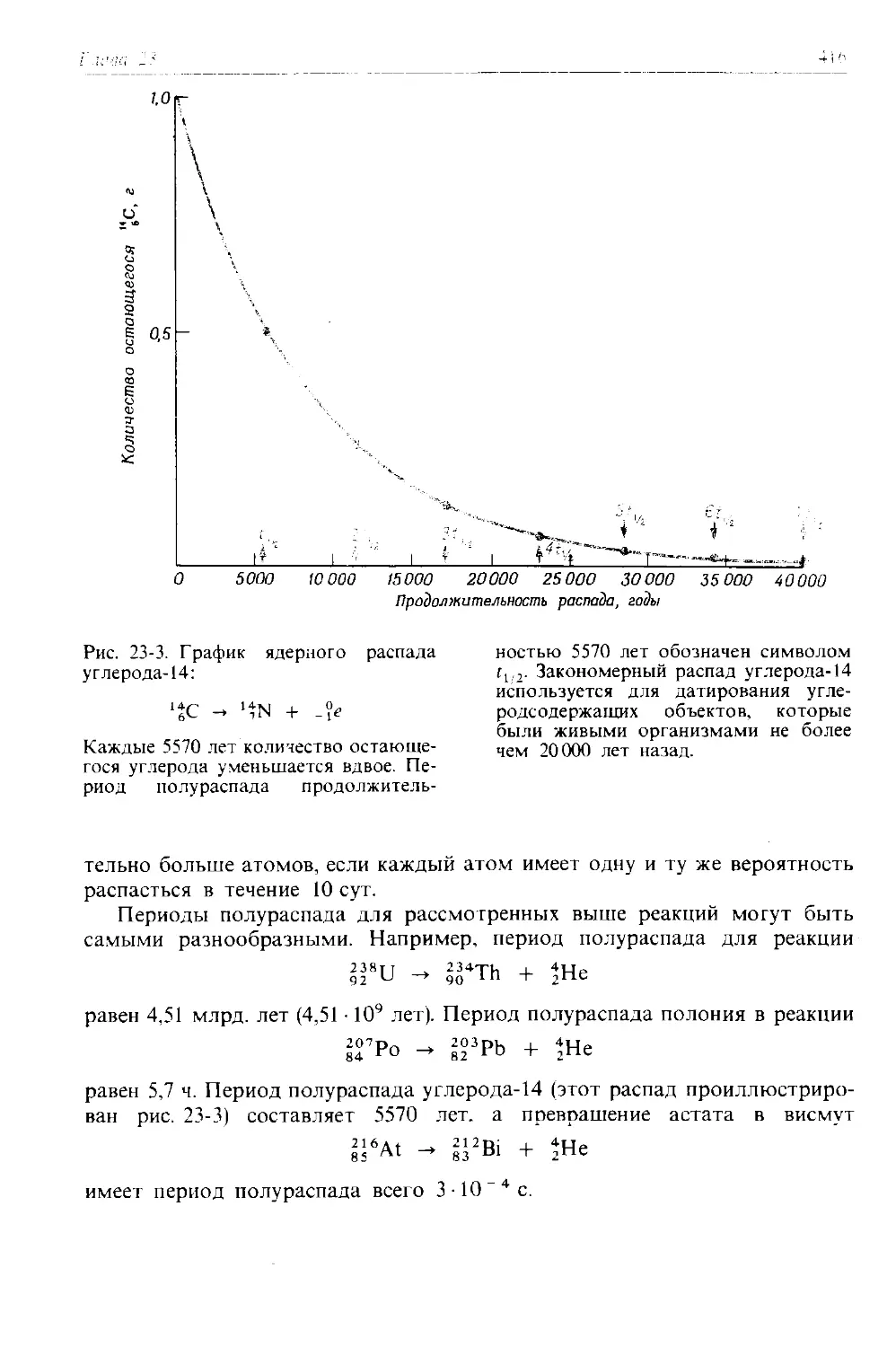
Баварские пушки
В 1798 г. Бенджамин Томпсон (граф Румфорд) проводил опыты с трением, которые, будучи полностью осознаны, смогли бы точно так же ниспровергнуть калорическую теорию, как Лавуазье ниспроверг флогистонную теорию. Томпсон осуществлял надзор за сверлением пушечных жерл на военном заводе в Мюнхене. Процесс изготовления пушек включал отливку металлических болванок и сверление в них жерл; сверла приводились в движение лошадьми. На Томпсона произвело большое впечатление, что во время сверления происходило выделение значительного количества теплоты. При попытке сверлить пушки под водой он установил, что вода всегда закипала по прошествии одного и того же промежутка времени. Кроме того, выделение теплоты, по наблюдениям Томпсона, могло продолжаться, по-видимому, бесконечно. Томпсон дал правильное объяснение наблюдавшимся явлениям: работа, выполняемая лошадьми, превращалась в теплоту. Он писал:
«Вряд ли стоит добавлять, что никакое материальное вещество, по-ви-димому, нельзя ввести в изолированное тело или систему тел в неограниченном количестве, и мне представляется крайне трудным, если вообще возможным, создание четких представлений о чем-либо ином, кроме движения, способном возбуждаться и передаваться подобно тому, как возбуждалась и передавалась в этих экспериментах теплота.»
Однако эксперименты Томпсона не смогли убедить других. Те, кто верил в калорическую теорию, имели наготове объяснение, что трение сверла «стирало теплоту» с атомов металла и выносило ее на поверхность. Они не осознали, какое значение имела установленная Томпсоном возможность бесконечного получения теплоты за счет работы. Согласно калорической теории, после того, как весь запас теплоты в металле окажется «вытерт» из него, дальнейшее продолжение сверления не должно приводить к выделению теплоты. К сожалению, ученые того времени не привыкли думать о теплоте как о количественно измеряемом свойстве, подобно тому как до распространения идей Лавуазье не имели представления о таком количественно измеряемом свойстве вещества, как его масса. Поэтому работа Томпсона не произвела большого впечатления.
Глава J?
8
Механический эквивалент теплоты
Окончательно убедили научный мир в том, что теплота и работа являются эквивалентными формами энергии, немецкие ученые Юлиус Майер (1814-1878) и Герман Гельмгольц (1821-1894), а также английский ученый Джеймс Джоуль (1818-1889). В 1840 г. Майер нанялся судовым врачом на корабль, направлявшийся на Яву. Там он обратил внимание на то, что венозная кровь яванцев и моряков с его корабля имеет более светлую окраску по сравнению с той, которую он привык видеть у своих пациентов в Германии. Майер правильно объяснил эти наблюдения как указание на то, что в венах обитателей тропиков остается больше кислорода, чем у людей, живущих в холодных климатических условиях, потому что для поддержания постоянной температуры тела в тропиках достаточно сгорания меньшего количества пищи. Эта последовательность рассуждений привела его затем к выводу, что теплота сгорания пищи расходуется на поддержание постоянной температуры тела и на выполнение мускульной работы. Следовательно, теплота может превращаться в работу и обе они являются двумя различными формами энергии. По возвращении в Германию Майер пытался вычислить коэффициент перевода теплоты в работу, используя для этого устройство с мешалками для воды и цилиндры с расширяющимися газами. В этих экспериментах оказалось очень трудно достичь необходимой точности, потому что повышение температуры составляло лишь небольшую часть градуса. Тем не менее Майер смог получить приближенное значение механического эквивалента теплоты и представил отчет о своей работе в журнал Annalen der Physik. Однако редакция журнала отвергла его статью, как неподходящую для публикации. Он переработал ее и представил в другой журнал, Annalen der Chemie und Pharmacie.Статья была опубликована в 1842 г., но не вызвала никаких откликов. Подобно Ньюлендсу, осуществившему классификацию элементов по октавам, Майер ожидал возражений, но столкнулся лишь с безразличием.
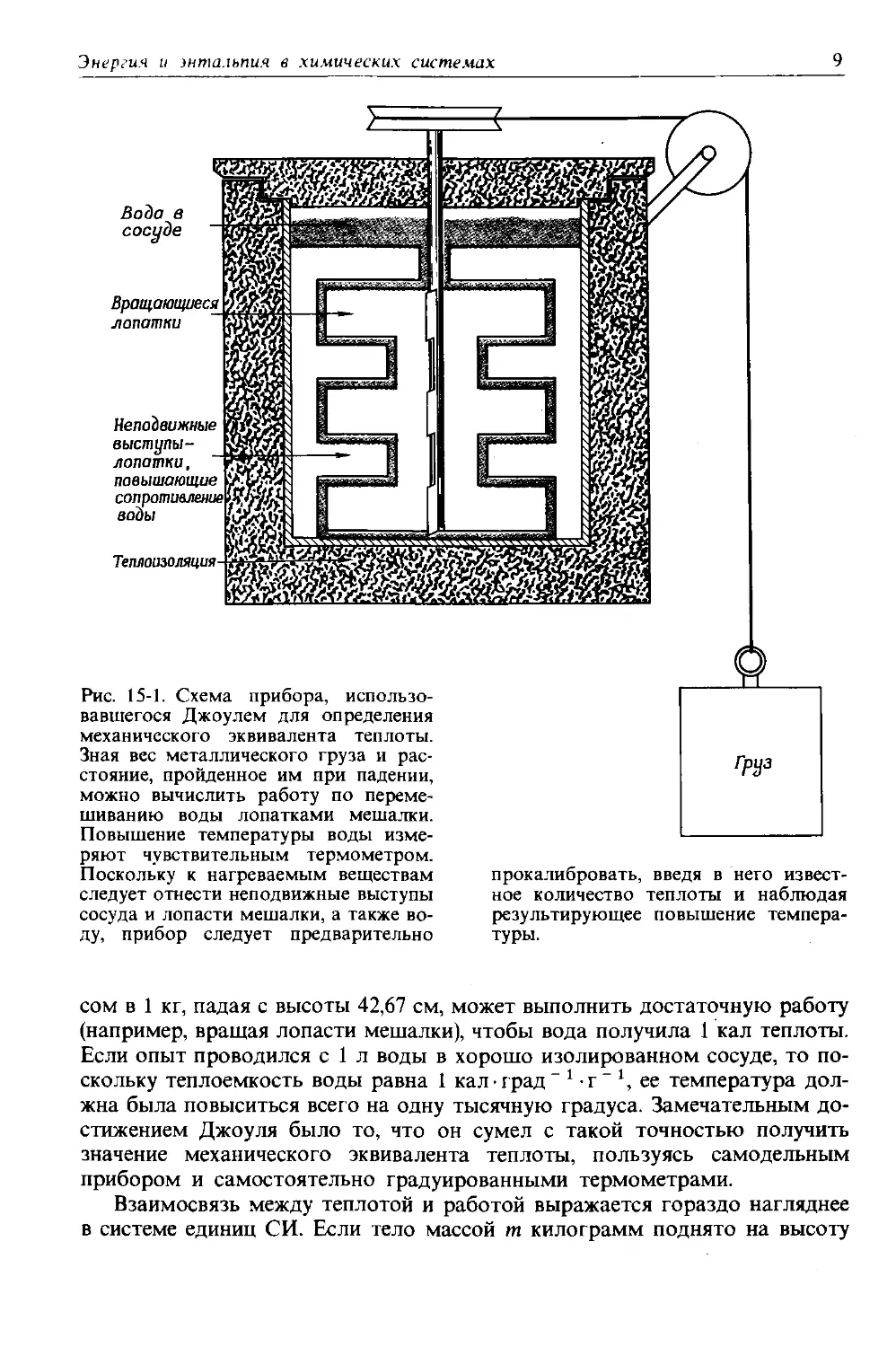
Одновременно с этим в Англии Джоуль проводил в сущности те же эксперименты и встретился с теми же безразличием и недоверием. Джоуль был сыном пивовара и учился у Дальтона. В возрасте 19 лет он занялся созданием электрических двигателей и генераторов, намереваясь перевести отцовскую пивоварню с паровой энергии на электрическую. Эти попытки оказались бесплодными, но Джоуль заинтересовался взаимосвязью между работой, затрачиваемой на вращение динамомашины, вырабатываемым электричеством и теплотой, которая выделялась за счет электричества. Позже он исключил из этой цепочки электричество и занялся изучением теплоты, образующейся при механическом перемешивании воды лопатками, которые приводились в движение падающим грузом (рис. 15-1). Подобно Майеру, Джоуль обнаружил, что такие измерения очень трудны, потому что они связаны с весьма незначительными изменениями температуры. Несмотря на это, он получил для механического эквивалента теплоты значение 42,4 кг см-кал “ \ которое всего на 1% отличается от принятого в настоящее время значения 42,67 кг-см -кал” \ Это означает, что груз ве-
Энергия и энтальпия в химических системах
9
Теплоизоляция
Ж
Вода в сосуде
Вращающиеся, лопатки
Неподвижные выступы-лопатки, ~ повышающие сопротивление воды
И5»ЙИ
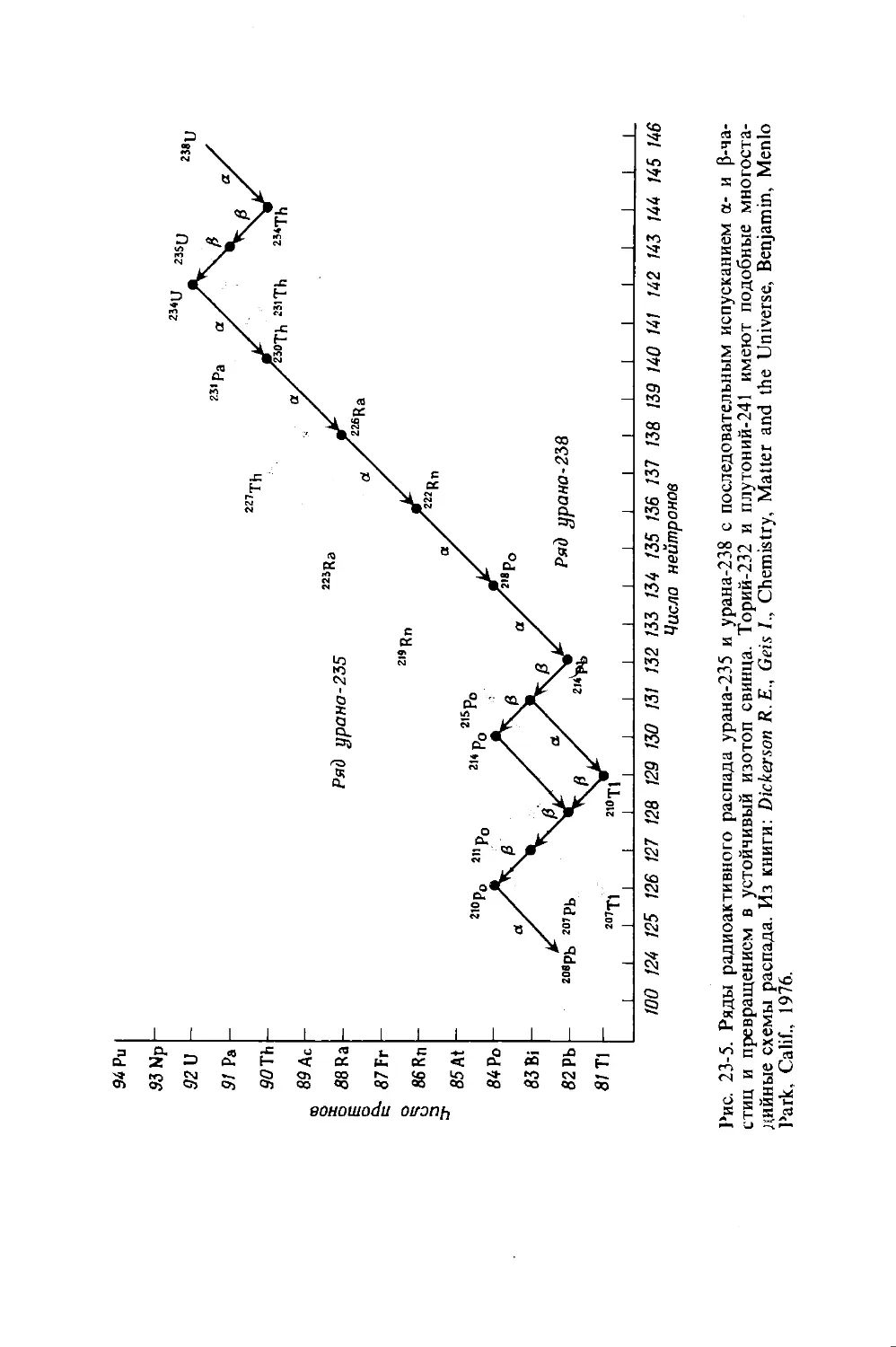
Рис. 15-1. Схема прибора, использовавшегося Джоулем для определения механического эквивалента теплоты. Зная вес металлического груза и расстояние, пройденное им при падении, можно вычислить работу по перемешиванию воды лопатками мешалки. Повышение температуры воды измеряют чувствительным термометром. Поскольку к нагреваемым веществам следует отнести неподвижные выступы сосуда и лопасти мешалки, а также воду, прибор следует предварительно
Груз
прокалибровать, введя в него известное количество теплоты и наблюдая результирующее повышение температуры.
сом в 1 кг, падая с высоты 42,67 см, может выполнить достаточную работу (например, вращая лопасти мешалки), чтобы вода получила 1 кал теплоты. Если опыт проводился с 1 л воды в хорошо изолированном сосуде, то поскольку теплоемкость воды равна 1 кал-град - 1 - г- *, ее температура должна была повыситься всего на одну тысячную градуса. Замечательным достижением Джоуля было то, что он сумел с такой точностью получить значение механического эквивалента теплоты, пользуясь самодельным прибором и самостоятельно градуированными термометрами.
Взаимосвязь между теплотой и работой выражается гораздо нагляднее в системе единиц СИ. Если тело массой т килограмм поднято на высоту
Глава 15
10
h метров, то при ускорении силы тяжести д = 9,806 м • с 2 в результате падения тела совершается работа
и> = mgh Дж
Пользуясь этим соотношением и экспериментальными данными Джоуля, можно найти коэффициент перевода калорий в джоули. Если т = 1,000 кг и h = 0,4267 м, то
w = 1,000 кал = 1,000-9,806-0,4267 кг-м2-с-2
Отсюда
1,000 кал = 4,184 Дж
В 1843 г. Джоуль представил результаты своих исследований Британской Ассоциации. Они были встречены с недоверием и при общем молчании. Г од спустя Королевское общество отклонило его работу по этому вопросу. В 1845 г. Джоуль снова представил свои соображения относительно эквивалентности работы и теплоты Британской Ассоциации. Он высказал предположение, что вода у подножия Ниагарского водопада должна быть на 0,2° теплее воды наверху водопада вследствие того, что при ее падении выделяется энергия. Кроме того, Джоуль выдвинул предположение о существовании абсолютного нуля температуры, основываясь на рассмотрении теплового расширения газов; по его оценке абсолютный нуль должен был иметь значение — 480°F (— 284°С). Но никто не поддержал Джоуля. |Он сделал еще одну попытку доложить о своих работах в 1847 г. и в 1885 г. по этому поводу написал следующее:
«Мой доклад остался бы незамеченным, если бы не выступление одного молодого человека, который остроумными замечаниями привлек живой интерес к новой теории. Этим молодым человеком был Вильям Томсон, который за два года до того блестяще окончил Кембриджский университет, а в настоящее время является, вероятно, наибольшим научным авторитетом среди современников».
Томсону, который впоследствии стал лордом Кельвином, в то время было 26 лет. Ни он, ни Фарадей, также бывший на заседании, не были убеждены в правоте доводов Джоуля, основанных на измерениях повышения температуры на сотые доли градуса; однако много позже Джоуль получил дополнительные данные, усилившие его позицию. Впоследствии Томсон писал, что спустя две недели после заседания 1847 г. он шел пешком недалеко от Шамоникса, собираясь начать восхождение на Монблан, когда...
«кого бы вы думаете я встретил, как не Джоуля, с длинным термометром в руке, а невдалеке в карете находилась молодая дама. Он рассказал мне, что после нашей встречи в Оксфорде успел жениться, а сейчас собирается проверять повышение температуры в водопадах».
В 1849 г. Фарадей представил Королевскому обществу статью Джоуля, озаглавленную «О механическом эквиваленте теплоты», и на следующий год она появилась в журнале Philosophical Transactions.
Энергия и энтальпия в химических системах
11
Майеру были суждены такие же переживания, как и Ньюлендсу; он видел, как то, что было его собственными идеями, приветствовалось другими, но приписывалось Джоулю. Отчаяние Майера привело его в 1850 г. к попытке самоубийства, после чего ему пришлось провести два года в психиатрической лечебнице. Почти никто не обращал на него внимания до самого позднего периода его жизни, пока Джон Тиндаль в Англии и Рудольф Клаузиус с Германом Гельмгольцем в Германии не предприняли объединенные усилия, чтобы добиться заслуженного признания приоритета Майера.
Окончательно убедить ученых в том, что теплота и работа действительно эквивалентны, удалось лишь Гельмгольцу. В 1847 г. он представил в журнал Annalen der Physik статью, в которой было дано более общее изложение законов сохранения энергии и эквивалентности теплоты и работы, чем это было сделано Майером и Джоулем. Статью Гельмгольца отклонили. Тогда он выступил со своей работой на заседании в Берлине и опубликовал ее частным образом.
Проведенный Гельмгольцем анализ теплоты, работы и энергии убедил Фарадея и Томсона. С экспериментальными данными Джоуля постепенно начали соглашаться. В конце концов, немецкий физик Рудольф Клаузиус (1822-1888) сформулировал в 1850 г. первый закон термодинамики в таком виде, как он обычно излагается в наше время:
Теплота и работа являются различными формами энергии. В любом процессе энергия может переходить из одной формы в другую (в том числе, в теплоту или работу), но она не создается из ничего и не исчезает бесследно.
Установленный Гельмгольцем закон сохранения энергии наряду с высказанным Лавуазье законом сохранения массы является одним из важнейших общих положений в науке.
15-2. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
В термодинамике часто используются понятия термодинамические системы и их окружение, и нам придется поступать точно так же. Мы будем вести рассуждения о работе, выполняемой системой над ее окружением, либо о работе, выполняемой окружением над системой, а также учитывать потерю или приобретение теплоты системой либо ее окружением. Что же такое термодинамическая система?
Под термодинамической системой понимается любая часть Вселенной, на которой мы хотим сфокусировать внимание, а под ее окружением-та часть Вселенной, с которой система может обмениваться энергией, теплотой или работой. В качестве примера системы укажем баллон с газом, колбу с реагирующими веществами, двигатель локомотива или же просто цилиндр с поршнем автомобильного двигателя. Если нас интересует энергетический баланс нашей планеты, то можно считать Землю термодинамической системой, а Солнце-частью ее окружения. Изолированной называется система, которая не обменивается энергией, теплотой или ра
i iaea
I 5
12
ботой co своим окружением. С точки зрения термодинамики, такая система не имеет окружения. Замкнутой называется система, стенки которой пропускают тепло и энергию, но не пропускают вещество. Незамкнутая система может обмениваться со своим окружением как энергией, так и веществом. Слово «система»-это как бы указующий палец на старинных вывесках и объявлениях: оно привлекает внимание к той области пространства, которую мы хотим исследовать.
Пример 1
К какому типу относится каждая из нижеперечисленных термодинамических систем: а) мензурка, наполовину заполненная химикатами; б) те же химикаты в склянке с плотно завинченной крышкой; в) те же химикаты в отпаянной вакуумной колбе; г) человек; д) банка консервированного горошка; е) планета Земля; ж) Солнечная система; з) туманность (галактика) Андромеды; и) вся Вселенная в целом?
Решение
а) незамкнутая; б) замкнутая; в) изолированная, если колба хорошего качества; г) незамкнутая (подумайте, что произошло бы с вами, если бы вас превратили в замкнутую систему?); д) замкнутая; е) незамкнутая (Земля получает энергию от Солнца и обменивается со своим окружением космонавтами и другими формами материи); ж) незамкнутая (вспомните о метеорах, кометах и звездном свете); з) почти изолированная; и) изолированная по определению.
В теоретических рассуждениях в качестве типичной термодинамической системы довольно часто выбирается идеальный газ в каком-либо сосуде. Такая простая система обладает многими термодинамическими свойствами, присущими всем системам. При нагревании газа он расширяется, насколько это позволяет ему сосуд, в котором он находится. Расширяясь, газ совершает работу против внешнего давления атмосферы. Будем считать положительными теплоту q, если она поступает к газу от окружающей среды, и работу и>, которую газ совершает над окружающей средой. Если мы нагреваем газ, но не даем ему возможности расширяться, его температура и давление возрастают по закону состояния идеального газа, сформулированному в гл. 3:
PV=nRT (3-8)
В этом случае при добавлении теплоты газ не совершает работы. Если газ первоначально находился под высоким давлением, он может расширяться без нагревания. При этом газ совершает работу против своего окружения, хотя в него не поступает теплота извне. Однако в этом случае газ по окончании расширения оказывается холоднее, чем вначале.
Вариант подобного эксперимента изображен на рис. 15-2. В этом эксперименте более наглядно показан способ, посредством которого расширяющийся газ может выполнять работу. Теплоту q можно подводить к газу в условиях, когда он совершает работу, либо не совершает ее, а работу w можно получать от газа при добавлении к нему теплоты, но иногда в этом нет необходимости.
Энергия и энти.1ьпи.ч в химических системах
13
Рис. 15-2. Соотношение между теплотой, работой и внутренней энергией, а-при нагревании газа в цилиндре с поршнем он совершает работу против внешней силы; б-при нагревании газа в фиксированном объеме темпе-
ратура газа повышается (теплота превращается во внутреннюю энергию); в-при расширении нагретого газа он выполняет механическую работу и за этот счет охлаждается (внутренняя энергия превращается в работу).
Каким образом измеряется работа расширяющегося газа? В физике работа определяется как произведение силы, против которой совершается движение, на пройденное расстояние. Даже бесконечное движение тела не сопровождается совершением работы, если движение не встречает сопротивления. И наоборот, независимо от величины силы сопротивления никакой работы не совершается, если тело не перемещается в направлении, противоположном действию этой силы. При бесконечно малом перемещении ds в направлении, противоположном действию силы F, совершается бесконечно малая работа dw = Fds. Если тело перемещается на конечное расстояние в направлении против действия силы F, при этом, как мы видели в гл. 2, совершается работа w = Fs.
Глава 15
14
ds
dw = F • ds dw = P A • ds dw = P • dV
Рис. 15-3. Работа расширяющегося газа. Когда газ перемещает поршень в цилиндре на бесконечно малое расстояние ds, работа, выполняемая им против внешнего давления Р, равна dw = F ds = Р • А ds = Р • dV (.4-площадь, на которую действует
давление). В выражении для работы под давлением понимается внешнее давление, против которого совершается движение, а не внутреннее давление (РВНуТр) расширяющегося газа. Чтобы происходило расширение газа, Рвнутр должно превышать внешнее давление.
Рассмотрим газ в цилиндре с поршнем (рис. 15-3) и допустим, что давление внутри цилиндра Рвнутр больше постоянного внешнего атмосферного давления Р. Когда газ расширяется и перемещает поршень на бесконечно малое расстояние ds, сила, действующая на поршень снаружи, остается постоянной и равной произведению давления Р на площадь А поршня. Выполненная газом работа, как указано в подписи к рис. 15-3, равна произведению приращения объема газа на внешнее давление, против которого осуществляется расширение; dw = PdV. Поскольку в рассматриваемом случае преодолеваемое давление остается постоянным, выполненная работа связана с приращением объема газа (ЛИ) соотношением w = РАЙ Хотя приведенные здесь соотношения получены для газа, расширяющегося в цилиндре, они справедливы в отношении любого процесса расширения газа. Работа, подобная описанной выше, часто называется работой расширения или работой типа PV. Существуют и другие виды работы. Мы совершаем работу против силы тяжести, поднимая груз в положение, где он имеет большую потенциальную энергию и откуда он может упасть в исходное положение. Электрическая работа осуществляется при перемещении заряженных ионов или других заряженных тел в электрическом потенциальном поле. Мы можем выполнить магнитную работу, отклоняя иглу компаса от направления, куда она указывает в спокойном состоянии. Все эти виды работы включаются в обобщение, известное под названием первого закона термодинамики.
Термодинамическая система может получать или выделять теплоту и совершать работу или быть объектом совершения работы. Первый закон термодинамики утверждает, что во всех этих процессах энергия в системе не создается из ничего и не исчезает бесследно. Энергия системы не обязательно остается постоянной; она может повышаться или уменьшаться, в зависимости от того, какое воздействие мы оказываем на систему. Но изменение энергии системы должно быть равно результирующему количе
Энергия и энтальпия в химических системах
15
ству теплоты, поступающему в систему, за вычетом результирующей работы, выполненной системой над ее окружением:
ДЕ = q — w
(15-1)
Другая формулировка первого закона термодинамики
Существует другой способ интерпретации первого закона, имеющий особо важное значение для химии. Будем рассматривать уравнение (15-1) просто как определение некоторой функции, называемой внутренней энергией Е. Напомним, что при нагревании газа он может совершать работу (см. подпись к рис. 15-2), но можно и обратить этот процесс, т.е. совершать работу над газом, сжимая его, и при этом отводить теплоту, выде-ляеуую газом. Наконец, если нагревать газ, не давая ему выполнять работу, ' то в этом случае происходит повышение температуры газа. И наоборот, если позволить газу, находящемуся под высоким давлением, расширяться и совершать работу, не нагревая его, то в таком процессе обнаруживается охлаждение газа. Подбирая требуемые условия, удается манипулировать величинами q и w независимо. За тем, что происходит в каждом случае, удобно следить, если определять изменение внутренней энергии, ДЕ, как разность между добавляемым в систему количеством теплоты и выполненной системой работой, как это следует из уравнения (15-1). Если при добавлении в систему некоторого количества теплоты система выполняет в точности эквивалентную работу, внутренняя энергия системы остается неизменной. Когда мы нагреваем газ, но ограничиваем его объем, лишая газ возможности расширяться и выполнять работу, внутренняя энергия газа возрастает на величину, равную поступившему в него количеству теплоты. Наконец, если мы используем газ для совершения работы, не поставляя в него теплоту, внутренняя энергия газа уменьшается на величину, равную выполненной работе. Наши обыденные наблюдения относительно того, что в одних из этих случаев газ нагревается, а в других охлаждается, указывают на связь внутренней энергии и температуры газа.
До сих пор мы еще не сказали ничего важного. С изложенной здесь точки зрения уравнение (15-1) представляет собой не закон термодинамики, а просто определение некоторой функции учетного характера. Первым законом термодинамики является утверждение, что эта новая учетная функция представляет собой функцию состояния.
Функции состояния
Функции состояния играют в термодинамике очень важную роль, особенно для химии. Функция состояния представляет собой такое свойство системы, численная характеристика которого полностью определяется состоянием системы в данный момент времени и не зависит от предыстории системы.
Чтобы пояснить смысл сказанного, вообразим такую ситуацию. Допу-
Главе: 15
16
Рис. 15-4. Функции состояния. Функции состояния речной воды (или любой другой термодинамической системы) принимают значения, зависящие только от состояния воды в настоящий момент, а не от ее предыстории. Наблюдатели в городах А и Б не могут заключить, основываясь на измерениях свойств воды
в этих двух городах, работает ли ядерный реактор на территории соседнего государства, при условии что сбрасываемая после использования вода соответственно охлаждается. О связи этого примера с первым законом термодинамики рассказывается в тексте.
стам, что границу между двумя государствами пересекает река; она протекает через город А одного государства (на рис. 15-4 слева), затем петляет по территории другого государства и на много миль ниже снова возвращается в первое государство вблизи города Б. Имеется предположение, что на берегу реки на территории второго государства построена атомная электростанция и речная вода используется в качестве охладителя и рабочей среды для паровых турбин. Возможно ли для соседнего государства установить наличие атомного реактора, не обращаясь за официальными сведениями?
Энергия и энтальпия в химических системах
17
Прежде всего допустим, что выделяемое в реакторе тепло превращает речную воду в пар, который затем приводит в действие паровые турбины, вырабатывающие электрическую энергию. Тогда речную воду можно рассматривать как термодинамическую систему. Вода нагревается и испаряется за счет тепла, поступающего из атомного реактора; затем при расширении в турбине она охлаждается и совершает работу, вращая ротор турбины. Предположим, что использованную воду, прежде чем сбросить в реку, охлаждают до той же температуры, которую она имела в водозаборном устройстве.
Теперь допустим, что по каким-то причинам ежегодно в определенный день реактор выключается и водозаборное устройство в реке перекрывается. Можно ли с территории соседнего государства обнаружить наличие такой атомной электростанции, основываясь на измерении различных свойств воды в реке у городов А и Б?
Очевидно, что это сделать нельзя. В самом деле, какие физические измерения осуществимы над данной термодинамической системой (рекой)? Можно измерять температуру воды, ее плотность, вязкость, молярный объем, электропроводность, изотопное отношение 16О/18О, температуры плавления и кипения, химическую чистоту и множество других свойств. Все эти свойства являются функциями состояния. Температура воды зависит только от ее сиюминутного состояния и не зависит от ее предыстории. (Конечно, температура может зависеть от того, что происходило в прошлом, но для измерения температуры совершенно нет необходимости знать предысторию системы.) Изменение температуры воды между городами А и Б можно установить, измеряя температуру воды в реке в этих двух городах:
АТ = ТБ - ТА = Т2 - 7]
Аналогично изменение любого другого свойства воды, например плотности или вязкости, которое представляет собой функцию состояния, определяют по разности между этим свойством в точках А и Б. При этом совершенно не возникает необходимость знать, что происходило с речной водой в государстве справа.
Все сказанное выше кажется абсолютно очевидным, пока мы не обратим внимания, что того же самого нельзя сказать относительно теплоты или работы. Не существует такой величины, которую можно было бы назвать «запасом теплоты» и, измерив ее в точках А и Б, установить, какое количество теплоты поступило в воду при ее протекании по территории соседнего государства. Точно так же не существует и такого свойства, которое можно было бы назвать «запасом работы» и, измерив его в двух городах А и Б, определить, какое количество работы было получено от воды в соседнем государстве. Если вытекающая из реактора вода имеет точно ту же температуру, что и в водозаборном устройстве, вода в городе Б ничем не будет отличаться от воды в городе А независимо от того, работает реактор или нет. Наличие или отсутствие атомной электростанции во втором государстве невозможно установить, основываясь на измерениях
Глава 15
18
свойств речной воды, проводимых на территории первого государства.
Если мы установим, что изменение температуры воды в городах Д и Б одинаково в нерабочий и любой другой день, то можно утверждать, что всякое количество теплоты, поступающее в воду в реакторе, должно быть точно скомпенсировано работой, выполненной водой в турбинах (или охлаждением воды перед ее сбрасыванием в реку). И наоборот, каждая порция работы, полученная в турбинах, должна быть скомпенсирована теплотой, полученной в реакторе, иначе вода в городе Б окажется холоднее, чем в городе А. Никакие сведения о воде в этих двух городах не позволяют сделать вывода о количестве теплоты (q), поступившем в воду, или о работе (w), проделанной водой. Ни теплота, ни работа не являются функциями состояния, но их разность является функцией состояния. Если величина q — w не поддерживается постоянной, это можно обнаружить, измеряя те или иные свойства воды в городе Б. Наиболее очевидным из таких свойств является температура, но изменению подвергнутся и другие свойства, например молярный объем, плотность, электропроводность и пр. И наоборот, если мы установим состояние воды в городах А и Б, то это значит, что мы установим изменение величины q — w в результате протекания воды по территории государства справа, хотя мы в отдельности не измеряли значения величин q и w. Их разность представляет собой изменение функции состояния, Е.
Для идеального газа эта внутренняя энергия, Е, совпадает со средней молярной кинетической энергией, Ек, о которой говорилось в гл. 3. Внутренняя энергия идеального газа прямо пропорциональна его температуре
2 3
Е = -уРС = (для 1 моля идеального одноатомного газа) (3-26)
Для неидеальных газов внутренняя энергия, Е, приблизительно пропорциональна температуре, а для произвольных веществ можно утверждать, что повышение температуры соответствует возрастанию внутренней энергии.
Функции состояния играют важную роль в химии именно потому, что они не зависят от истории химической системы. Энергия является функцией состояния. Этим же свойством обладают давление, температура, объем и все другие величины, которые мы обычно считаем свойствами веществ. Само слово «свойство» подразумевает нечто присущее веществу независимо от всяких обстоятельств, за исключением его рассматриваемого состояния. Мы никогда не говорим, что вещество имеет работу, и не должны говорить, что вещество обладает теплотой. Если исходное состояние системы обозначить символом 1, а ее конечное состояние-символом 2, то, представив уравнение (15-1) в виде
ЛЕ = Е2 — Ej = q — w (15-2)
его можно рассматривать как математическую запись первого закона термодинамики. Средняя часть уравнения (15-2) выражена через функции состояния.
Энергия и энтальпия в химических системах 19
Пример 2
Путешественник отправляется из Пасадены (шт. Калифорния) в Аспен (шт. Колорадо). Какие из перечисленных ниже величин являются функциями состояния этого путешествия: а) пройденное расстояние; б) изменение географической широты; в) изменение высоты над уровнем моря; г) количество израсходованного бензина; д) время путешествия; е) изменение географической долготы; ж) работа, выполненная для перемещения автомобиля; з) кислород, потребляемый пассажирами и автомобилем?
Решение
Функциями состояния являются только величины (б), (в) и (е), независимо от того, по какому пути проходит путешествие.
। 15-3 ЭНЕРГИЯ. ЭНТАЛЬПИЯ И ТЕПЛОЕМКОСТЬ
Когда химики впервые приступили к систематическому изучению те-плот реакций, они обнаружили, что к одному из наиболее удобных типов принадлежат реакции, проводимые при постоянном объеме в калориметрической бомбе (см. рис. 2-4). Это устройство представляет собой прочный стальной сосуд с крепкой крышкой, погруженный в водяную баню; внутри сосуда имеются электрические проводочки для инициирования реакции. Теплота, выделяемая в результате проведения реакции при постоянном объеме, измеряется по повышению температуры водяной бани.
Поскольку химическая система внутри металлического сосуда лишена возможности изменять объем, она не может выполнять работу типа Р. Если система не способна выполнять какую-либо иную работу, высвобождаемое при реакции количество теплоты оказывается равным повышению внутренней энергии системы
ДЕ = qv (при постоянном объеме) (15-3)
В отсутствие каких-либо видов выполняемой работы приобретение или потеря теплоты содержимым сосуда является прямой мерой повышения или понижения внутренней энергии реагирующих веществ. Если в ходе реакции происходит выделение теплоты, реакция называется экзотермической; если происходит поглощение теплоты, реакция называется эндотермической.
Большинство реакций происходит не при постоянном объеме, а при постоянном давлении, и поэтому желательно иметь термодинамическую функцию, которая обладала бы при постоянном давлении такими же свойствами, какими внутренняя энергия, Е, обладает при постоянном объеме; изменение такой функции является мерой теплоты реакции при постоянном давлении. Подобная функция называется энтальпией, Н, и определяется соотношением
Н = Е + PV (15-4)
При постоянном давлении изменение энтальпии системы равно
ДН = ДЕ + PW
(15-5)
Пользуясь первым законом термодинамики, можно переписать соотношение (15-5) в виде
ДН = q - w + РАИ
Если исключить из рассмотрения электрическую и магнитную работы, работу против силы тяжести и все другие виды работы, кроме работы типа РУ, то можно считать, что w = РЛУ, и тогда два последних члена этого равенства взаимно исключаются. В результате мы приходим к утверждению, что теплота реакции при постоянном давлении равна изменению энтальпии системы
ДН = qp (15-6)
(Индекс р указывает, что перенос теплоты происходит при постоянном давлении.) При постоянном давлении энтальпия возрастает в ходе эндотермических реакций при поступлении теплоты в систему, в экзотермических процессах происходит уменьшение энтальпии, когда система теряет теплоту.
Поскольку все функции, стоящие в правой части равенства (15-4), являются функциями состояния, энтальпия также - функция состояния. Изменение энтальпии системы зависит от ее энтальпии до и после процесса, но совершенно не зависит от пути, по которому система перешла из исходного состояния в конечное; таким образом,
ДН = Н2 - Н, (15-7)
Суммируя, можно сказать, что внутренняя энергия (£) и энтальпия (Н) представляют собой взаимно дополняющие друг друга функции, потому что обе они служат мерой переноса теплоты в процессе при определенных условиях: Е при постоянном объеме, а Н при постоянном давлении. Как внутренняя энергия, так и энтальпия Н являются функциями состояния, поэтому, скажем, изменение Е не зависит от того, проводится ли процесс все время при постоянном объеме или же объем в конце процесса просто приводится к его первоначальному значению. Аналогично изменение энтальпии в результате реакции не зависит от того, проводится ли реакция все время при постоянном давлении или же давление в ходе реакции произвольно изменяется, но в конце приводится к своему первоначальному значению. Таким образом, выражения «при постоянном объеме» или «при постоянном давлении» применительно к функциям состояния означают всего лишь отсутствие результирующего изменения объема или давления. В этом заключается большое удобство функций состояния.
Количество теплоты, которое необходимо передать определенному количеству некоторого вещества, чтобы повысить его температуру на один кельвин (градус), называется теплоемкостью этого вещества, С. Теплоемкости выражаются в джоулях, отнесенных к молю и кельвину. Поскольку теплоемкость вещества определяет скорость поглощения им теплоты при по
Энергия и энтальпия в химических системах
21
вышении температуры, для нее можно записать следующее соотношение*:
С = (15-8)
dT
При постоянном давлении (или по крайней мере в условиях отсутствия результирующего изменения давления) перенос теплоты измеряется изменением энтальпии, и поэтому теплоемкость при постоянном давлении может быть определена как скорость изменения энтальпии при повышении температуры:
I
Если система находится в условиях постоянного объема, энергия играет такую же роль, как энтальпия, и поэтому теплоемкость при постоянном объеме определяется соотношением
(15-10)
Как мы знаем из гл. 3, энергия 1 моля идеального одноатомного газа равна Е = iRT. Следовательно, его теплоемкость при постоянном объеме Cv = jR = | • 8,314 Дж моль - 1 = 12,47 Дж моль - *. То обстоятельство, что измеренное значение теплоемкости одноатомных газов, например ге
* Для тех, кто незнаком с дифференциальными обозначениями, можно ввести представление о средней теплоемкости, определяемой через полное количество теплоты (Д<Д которое передается при изменении температуры (ДТ):
С
ср дт
Теплоемкость при определенной температуре Т представляет собой предел, к которому стремится эта средняя теплоемкость при приближении к нулю температурного интервала ДТ:
Дифференциальные обозначения легче ввести на примере скорости механического движения, которая представляет собой быстроту изменения положения х со временем t. В этом случае еср соответствует средней скорости за промежуток времени Д(:
а г, соответствует мгновенной скорости в момент времени t:
(Дх \ с/х
--- = ---
At / dt
Глава 15
22
лия или неона, при комнатной температуре оказывается очень близким к приведенному выше значению, указывает на правильность модели идеального газа. Теплоемкость 1 моля идеального газа при постоянном давлении, согласно теории, должна быть равна
С, -
(15-11)
поскольку Н = Е + PV = Е 4- RT. Тот факт, что величина Ср для реальных одноатомных газов очень близка к значению |К = = 20,79 Дж моль “ \ причем лучше всего согласуется с ним при низких давлениях и высоких температурах, убеждает нас в большой точности молекулярно-кинетической теории газов, изложенной в гл. 3.
15-4 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ И ХИМИЧЕСКИЕ РЕАКЦИИ
Уравнение (15-7) представляет собой самое важное для химии следствие из первого закона термодинамики. Оно говорит о том, что теплота реакции, проводимой при постоянном давлении, является функцией состояния. Теплота реакции равна разности между энтальпией продуктов и энтальпией реагентов. Она не зависит от того, протекает ли на самом деле реакция в одну стадию или в несколько последовательных стадий. С этим законом аддитивности теплот реакций мы уже познакомились в гл. 2, где он был сформулирован без доказательства, но теперь оно становится очевидным. В разд. 2-6 приводился пример с гипотетическим синтезом алмаза, где указывалось, что теплота образования алмаза из метана не зависит от того, получают ли алмаз непосредственно из метана или же метан сначала окисляется до СО2, а затем диоксид углерода используется для получения алмаза:
СНДг.) + 2О2(г.) - СО2(г.) + 2Н2О(ж.) АН = - 890 кДж (2-12)
СО2(г.) -> С (алмаз) 4- О2(г.) АН = + 395 кДж (2-14)
СН4(г.) 4- О2(г.) -♦ С(алмаз) 4- 2Н2О(ж.) АН = —495 кДж (2-15)
Поскольку энтальпия является функцией состояния, теплоты реакций аддитивны точно так же, как аддитивны реакции, которым они соответствуют. Это утверждение принято называть законом Гесса', как мы видим, закон Гесса является прямым следствием первого закона термодинамики.
Независимость энтальпии превращения от пути реакции можно проиллюстрировать при помощи схемы энергетического цикла, которая изображена на рис. 15-5 для нашего примера с синтезом алмаза. Первый закон термодинамики утверждает, что любой путь перехода между двумя состояниями (одностадийный или двухстадийный, как в данном цикле) при-
Энергия и энтальпия в химических системах
23
CO2fe) + 2НгО(ж)
Рис. 15-5. Энергетический цикл получения алмаза. Теплота получения алмаза из метана одинакова независимо от того, осуществляется реакция в одну стадию или сначала из метана получают СО2, а затем из СО2 полу-
чают алмаз. Это утверждение справедливо лишь потому, что теплота реакции при постоянных давлении и температуре равна изменению энтальпии, Н. а энтальпия является функцией состояния.
водит к одинаковому значению АН и одинаковой теплоте реакции. За изменениями энтальпии можно также следить при помощи диаграммы энергетических уровней, изображенной на рис. 15-6. Отметим, что абсолютное численное значение энтальпии остается неопределенным; известны
СН4(г.) + 2Ог(г.)
-890 кДж
- 495 кДж
|С (алмаз)+ 2Н/Э(ж.) + О2 (г.)
+395 кДж
СО2(г.) + 2НгО(ж.)
Рис. 15-6. Энергетическая диаграмма получения алмаза. На тех же основаниях, которые позволяют изобразить на рис. 15-5 реакции в виде цикла, энтальпии реакций могут быть представлены при помощи энергетической диаграммы. Изменение энтальпии при
переходе от одного состояния системы в другое зависит только от уровней энтальпии в этих двух состояниях (показанных на диаграмме), но не от способа перехода из одного состояния в другое.
UltlLl
24
лишь изменения энтальпии при переходе от одного состояния реагентов или продуктов к другому состоянию. До сих пор, обращаясь к диаграммам энергетических уровней, мы всегда использовали то свойство энергии, что она является функцией состояния, хотя ничего еще не знали об этом. Однако при помощи таких диаграмм нельзя изображать ни теплоту, ни работу (за исключением тех случаев, когда теплота или работа совпадают с функцией состояния).
Все сказанное в разд. 2-6 верно по той причине, что энтальпия, Н, является функцией состояния. Нет никакой необходимости табулировать теплоты всех реакций; достаточно знать только теплоты тех реакций, надлежащей комбинацией которых могут быть получены все остальные реакции. Для такой цели выбираются реакции образования соединений из входящих в них элементов в их стандартных состояниях. Стандартным состоянием газа при заданной температуре считается его состояние при парциальном давлении 1 атм; стандартным состоянием жидкости или твердого вещества является их состояние в чистом виде при внешнем давлении 1 атм. В большинстве термодинамических таблиц температура обычно полагается равной 298 К. Стандартные теплоты образования многих веществ указаны в приложении 3.
Пример 3
Какова стандартная теплота реакции образования безводного кристаллического сульфата меди из составных элементов в их стандартных состояниях?
Решение
Реакция описывается уравнением
Си (тв.) + S (тв.) + 2О2 (г.) -> CuSO4(tb.)
Для этой реакции теплота образования приведена в приложении 3; она равна ДН298 = — 769,9 кДж моль ' *.
Пример 4
В приложении 3 указано, что теплота образования газообразного В5Н9 равна + 62,8 кДж моль-1. К какой реакции относится эта теплота образования?
Решение
Речь идет о реакции синтеза В5Н9 из элементов - твердого бора и газообразного водорода-при давлении 1 атм и 298 К:
5В(тв.) + 4-^-Н2(г.) -> В5Н9(г.) ДН298 = + 62,8 кДж
Когда теплота реакции записывается так, как это сделано в последнем уравнении, подразумевается, что она выражена в килоджоулях на стехиометрическую единицу («моль») реакции по записанному уравнению. В рассматриваемом случае теплота реакции равна 62,8 кДж на моль В5Н9, но
Энергия и энтальпия в химических системах
25
составляет только 12,6 кДж на моль израсходованного бора или 62,8 кДж на каждые 4,5 моля газообразного водорода. Теплоты реакций всегда табулируются в расчете на моль образующегося соединения.
Пример 5
Соединение В5Н9 самопроизвольно возгорает на воздухе с появлением зеленого пламени; в результате сгорания образуются В2О3 и вода. Какова теплота этой реакции при нормальных условиях?
Решение
Уравнение реакцйи в несбалансированном виде:
В5Н9 (г.) + О, (г.) -> В2О3 (тв.) + Н2О (ж.)
Учет числа атомов бора показывает, что на 2 моля В5Н9 должно приходиться 5 молей В2О3. Следовательно, в реакции образуется 18 атомов водорода, которые входят в 9 молекул воды. Полное уравнение реакции принимает вид
2В5Н9 (г.) + 12О2(г.) - 5В2О3 (тв.) + 9Н2О(ж.)
Табличные значения стандартных теплот образования реагентов и продуктов таковы:
Вещество ДН298, КДЖ' моль “ 1
В5Н9(г.)
О2 (г.)
В2О3 (тв.)
Н2О (ж.)
Требуемая реакция получается образования:
2В5Н9 (г.) - 10В (тв.) + 9Н2(г.)
10В(тв.) + 7^О2(г.) -> 5В2О3(тв.)
9Н2(г.) + 4|о2(г.) - 9Н2О(ж.)
2В5Н9 + 12О2(г.) - 5В,О3 + 9Н2
+ 62,8
0,0
- 1264
- 285,8
в результате суммирования трех реакций
ДН298, кДж - 2( + 62,8) = -126
+ 5 ( - 1264) = -6320
+ 9(- 285,8) = -2572
) (ж.) ДИ°298 = - 9018
Одно время гидриды бора рассматривались как ракетное топливо, поскольку они имеют очень большую теплоту сгорания.
Таблицы энтальпий образования, или теплот образования, соединений можно упрощенно понимать в том смысле, что приведенные в них чис
Глава 15
26
ленные значения представляют собой абсолютные энтальпии соединений, а не энтальпии образования их из элементов. Результаты расчетов теплот реакций от этого не зависят, поскольку реагенты и продукты должны состоять из одного и того же числа атомов одинаковых элементов. Например, энтальпия реакции
2В5Н9(г.) + 12О2(г.) -> 5В2О3(тв.) + 9Н2О(ж.)
равна девяти стандартным энтальпиям жидкой воды плюс пять стандартных энтальпий твердого В2О3 минус две стандартные энтальпии газообразного В5Н9. Стандартная энтальпия элементарного кислорода равна нулю.
Пример 6
Соединение В5Н9 может быть получено из диборана В2Н6, который при определенной температуре реагирует с образованием В5Н9 и Н2. Экзотермична или эндо-термична данная реакция? Какова теплота этой реакции при 298 К в расчете на моль расходуемого диборана?
Решение
Реакция экзотермична; ДН298 = — 5,9 кДж-моль 1 диборана.
15-5. ЭНЕРГИИ СВЯЗЕЙ
Пользуясь языком теории локализованных связей, мы говорим, что молекула метана СН4 удерживается как единое целое благодаря имеющимся в ней четырем эквивалентным простым связям С—Н. Если такие представления верны, теплота разложения метана на изолированные атомы углерода и водорода должны быть вчетверо больше энергии связи С—Н. (Хотя по сути дела в дальнейшем всюду имеется в виду энтальпия, мы воспользуемся общепринятой, хотя и неправильной терминологией и будем считать, что получили значения энергии связей, а не энтальпии связей. Различие между численными значениями энтальпии и энергии связей настолько невелико, что оно находится в пределах точности самого подхода, в котором рассматриваются энергии локализованных связей.)
Теплота образования метана равна
С(графит) + 2Н2(г.) -> СН4(г.) ДН298 = - 74,85 кДж
Но для вычисления энергий связей в метане необходимо иметь сведения о его разложении на газообразные атомы углерода и водорода, а не на твердый графит и молекулярный Н2. Поэтому воспользуемся еще сведениями о реакциях атомизации графита и молекулярного водорода:
С(графит) -» С(г.) ДН298 = + 718,38 кДж
|Н2(г.) Н(г.) ДН°298 = + 217,94 кДж
Эти стандартные теплоты образования газообразных атомов из соответ
Энергия и энтальпия в химических системах
27
ствующих элементов в их стандартных состояниях приведены в приложении 3, где указаны и другие теплоты образования.
Интересующая нас реакция разложения метана на изолированные атомы может быть получена путем составления комбинации из выписанных выше реакций:
АН298, кДж
СН4(г.) -» С (графит) + 2Н2(г.)
С (графит) -» С|(г.)
2Н(г.) 4Н(г.)
СН4(г.) -> С (г.) + 4Н(г.)
- 1-(- 74,85)= + 74,85 + 1 •(+718,38) = +718,38 + 4-(+217,94) = + 871,76
ДН298 = + 1665,0
Такова теплота, необходимая для разрыва четырех связей С—Н, а следовательно, энергия (точнее говоря, энтальпия) одной связи С—Н должна быть равна четвертой части этой величины. Таким образом, энергия связи С—Н в метане полагается равной 416 кДж на 1 моль связей.
Энергия простой связи С—С.
Зная теплоту образования этана С2Нб, можно оценить энергию простой углерод-углеродной связи. Воспользуемся для этого данными приложения 3. АН298, кДж
С2Н6(г.) -> 2С(графит) + ЗН2(г.) -1(- 84,7) = + 84?7
2С(графит) -» 2С(г.) + 2-( +718,4) = + 1436,8
ЗН2(г.) -> 6Н(г.) + 6-( + 217,9) = +1307,4
С2Н6(г.) -> 2С(г.) + 6Н(г.) АН298 = + 2829
Согласно модели локализованных связей, молекула этана имеет шесть связей С—Н и одну связь С—С:
Н Н
I I
Н—С—С—н I I н н
Если воспользоваться для энергии связи С—Н значением 416 кДж -моль-1, найденным для метана, то на шесть таких связей в этане должна приходиться энергия 2496 к Дж-моль ~ 1. Остальные 333 кДж следует рассматривать как энергию моля простых связей С—С.
Глава 15
Применимость использованного нами подхода можно проверить, вычислив ожидаемую теплоту образования пропана С3Н8 из графита и газообразного водорода. Согласно модели локализованных связей, молекула пропана имеет две связи С—С и восемь связей С—Н:
н н н
I I I
н—с—с—с—н I I I
н н н
Теплота образования пропана вычисляется следующим образом:
ЗС(г.) + 8Н(г.) С3Н8(г.)
ЗС(графит) -> ЗС(г.)
4Н2(г.) - 8Н(г.)
АН298, кДж
2 (- 333) + 8-(- 416) = - 3994 3-( + 718,4) = +2155 8-( + 217,9) = + 1743
ЗС(графит) + 4Н2(г.) -» С3Н8(г.)
АЯ298 = - 3994 + 3898 = - 96
Экспериментально наблюдаемое значение теплоты образования пропана равно — 104 кДж моль ~ '. Его сопоставление с вычисленным выше значением позволяет получить представление о степени точности расчетов энергий связей. К сожалению, в подобных расчетах приходится получать искомые величины как малые разности между двумя большими числами. Ошибки в используемых при расчетах данных, а также приближенный ха-
ЗС(г.)+ 8Н(г.)
л 35593 влЬв
Знерга'л -3994 нДж
оптимизации Энергия связи
ЗС(гра<рит) + 4Н2(г.)
С3Н8(г.)
Рис. 15-7. Энергетическая диаграмма образования пропана из графита и газообразного водорода. Вычисления по методу энергий связей включают гипотетическое промежуточное состояние с высокой энергией, в котором все атомы изолированы один от другого
и находятся в газовой фазе. Разность между энергией, необходимой для превращения реагентов в газообразные изолированные атомы, и энергией, выделяемой при образовании из тех же атомов продуктов реакции, представляет собой теплоту образования.
Энергия it j’nvii.inHii.'t а химических системах 29
рактер модели локализованных связей объясняют, почему вычисленное значение отличается от экспериментального на 8 кДж моль-1.
Проведенные для пропана вычисления могут быть проиллюстрированы при помощи диаграммы энергетических уровней, изображенной на рис. 15-7. Добавление 3898 кДж для атомизации графита и диссоциации газообразного водорода показано как переход с нижнего энергетического уровня на верхний уровень, соответствующий изолированным атомам. Соединение этих атомов в молекулу С3Н8 соответствует уменьшению энергии на 3994 кДж с переходом в еще более низкое энергетическое состояние. Расстояние между исходным и конечным энергетическими уровнями (исходный уровень отвечает реагентам - графиту и Н2, а конечный уровень — продукту С3Н8) соответствует вычисленной теплоте образования пропана, АЯ298 = - 96 кДж.
Табулирование энергий связей
Теперь мы можем перейти к вычислению энергий связей всех типов.
Пример 7
Пользуясь данными для энергии образования этилена из приложения 3, вычислите энергию двойной связи С=С. Структура связей в молекуле этилена такова:
Н. /Н
С=С HZ ХН
Решение
Энергия связи С=С равна 592 кДж моль ~ 1.
Пример 8
Пользуясь данными для энергии образования воды из приложения 3, вычислите энергию связи О—Н.
Решение
Энергия связи О—Н равна 463 кДж моль - Для того чтобы получить это значение, вам придется воспользоваться теплотой атомизации кислорода и теплотой образования паров воды, а не жидкой воды.
Наиболее важные энергии связи получают не из теплот образования индивидуальных соединений, как, скажем, метан или этан, а путем усреднения значений, найденных для целых классов соединений; например, энергии связей С—Н и С—С определены путем усреднения по множеству углеводородов. Подобные значения, подобранные для наилучшего соответствия некоторым типам связей, приведены в табл. 15-1. Отметим, что усредненное значение энергии связи С—Н отличается на 3 кДж моль'1 от значения, найденного для метана. В расчетах энергий связей ошибки порядка 5-10 кДж моль ' 1 считаются допустимыми.
Глава 15
30
Таблица 15-1
Приближенные значенняа молярных теплот атомизации и энергии связей при 298 К
Молярная теплота Энергия связи6, кДж-моль
атомизации, ____________________________
кДж • моль 1 Н- С - С = С = N- N = N = О- О =
н 217,9 436 413 391 463
с 718,4 413 348 615 812 292 615 891 351 728
N 472,6 391 292 615 891 161 418 946
О 247,5 463 351 728 139 485
F 76,6 563 441 270 185
Si 368,4 295 290 369
Р 314,5 320
S 222,8 339 259 477
С1 121,4 432 328 200 203
Вг 111,8 366 276
I 106,6 299 240
а Значения заимствованы из книги: Poling L., The Nature of Chemical Bond, 3rd ed., Cornell University Press, Ithaca, N.Y., 1960; см. также: Cottrell T.L., The Strengths of Chemical Bonds, 2nd ed., Butterworths, London, 1958.
6 Имеются в виду энтальпии связи при 298 К, полученные из энтальпий образования. Здесь мы сталкиваемся с примером неточной, но удобной терминологии.
Применения расчетов энергий связей к различным проблемам
Пользуясь наилучшими усредненными значениями энергий связей, которые приведены в табл. 15—1, можно вычислить ожидаемую теплоту образования произвольной молекулы из составляющих ее элементов. Такие расчеты имеют смысл в тех случаях, когда справедливы предположения, на которых основан сам метод подобных расчетов. Однако, как это ни парадоксально, такие расчеты оказываются еще более полезными, когда эти предположения не обоснованы, т. е. когда вычисленное значение теплоты образования резко отличается от экспериментально найденного. Когда возникают такие расхождения, они указывают, что наши простые представления о связях, локализованных между парами атомов, недостаточно верны. Поэтому вычисления энергий связей могут служить средством изучения химической связи в молекулах.
В качестве примера укажем, что известны небольшие углеводородные молекулы, в которых атомы углерода образуют замкнутый цикл и, кроме того, к каждому из них присоединены по два атома водорода. Простейшие из таких циклических углеводородов имеют следующие структуры:
Энергия и энтальпия в химических системах
31
НН НН
\ / I I
с н—с—с—н
/ \ II
н-с-с-н н-с-с-н
J I I
циклопропан циклобутан
н н Н н
н—с с—н
I I.' н—с с—н
HZ /С\ н
н н
циклопентан
циклогексан
Сравним ожидаемые теплоты образования этих молекул с экспериментально наблюдаемыми значениями. В табл. 15-2 на строке А указана полная энергия связи каждой молекулы, т. е. энергия, выделяемая при образовании молекулы из изолированных атомов углерода и водорода. На
Таблица 15-2
Энергия напряжения (кДж-моль-1) в молекулах циклических углеводов
Циклопро- Циклобу- Циклопен- Циклогек-
• пан, С3Н6 тан, С4Н8 тан, С5Н10 сан, С6Н12
Число связей С-С 3 4 5 6
Число связей С —Н 6 8 10 12
Энергия связи С —С 1044 1392 1740 2088
Энергия связи С —Н 2478 3304 4130 4956
А. Полная энергия связи 3522 4696 5870 7044
Число атомов С 3 4 5 6
Число атомов Н 6 8 10 12
Энергия испарения С 2155 2874 3592 4310
Энергия диссоциации Н 1307 1743 2179 2615
Б. Полная энергия атомизации 3462 4617 5771 6925
В. ДНрасч (Б-А) -60 -79 -99 -119
Г- АЯЭКСП + 53 + 27 - 77 - 123
Д. Понижение устойчивости + 113 + 106 + 22 - 4
молекулы (ГВ)
r.lued 15
ЗС(гра<рит) + ЗН2(г)
ЗС(г.) + 6Н(г.)
+ 3462 кДж Энергия атомизации
-3522 нДж
Энергия связи
х
к to
о X
ЛНрассч-----60 кДж
4Н„С„ = + 53 кДж
CjH6(2.)-эксперимент ||
-------------------\* о
С3Н6(г.)-вычислеиие Г В Е --------------------J ё о»
Рис. 15-8. Энергетическая диаграмма образования циклопропана из графита и газообразного водорода. Из-за напряжения связей устойчивость образующейся молекулы цикло-С3Н8 на
113 кДж моль 1 меньше, чем можно было бы ожидать на основании простых расчетов по методу энергии связей.
строке Б указана энергия, необходимая для получения требуемого количества атомов С и Н из графита и газообразного Н2. На строке В приведена разность двух предыдущих значений, т. е. вычисленная теплота образования каждой молекулы, а экспериментальное значение этой величины дано на строке Г. Для циклогексана согласие между вычисленным и экспериментальным значениями полной энергии связи оказывается вполне удовлетворительным, но оно все более ухудшается по мере уменьшения размеров молекулы. Согласно расчету, молекула циклопропана должна быть на 60 кДж • моль “ 1 устойчивее, чем составляющие ее элементы, но на самом деле она на 53 кДж • моль “ 1 менее устойчива. Устойчивость этой молекулы на 113 кДж • моль “ 1 меньше, чем можно ожидать, принимая во внимание наличие в ней трех связей С—С и шести связей С—Н. Эти данные наглядно представлены на энергетической диаграмме, изображенной на рис. 15-8.
Причина неожиданной неустойчивости молекулы циклопропана заключается в том, что она сильно напряжена. Трехчленный углеродный цикл имеет валентные углы по 60° вместо обычных для углерода тетраэдрических углов 109,5°. Если обратиться к представлениям теории молекулярных орбиталей, можно понять, что перекрывание между гибридными хр3-орбиталями атомов углерода в молекуле циклопропана должно быть небольшим, а это означает, что связи оказываются слабыми. В молекуле циклобутана напряжение, или деформация связей, несколько смягчается, а в молекуле циклопентана этот эффект выражен еще меньше. Данные
Энергия и энтсмышя в химических системах
33
табл. 15-2 показывают, что молекула циклогексана практически не напряжена. Если попытаться построить из шариков со стерженьками модели перечисленных молекул, пользуясь для атомов углерода шариками с тетраэдрически расходящимися стерженьками-связями, модели циклопропана и циклобутана не удастся построить, не сгибая связей, циклопентан требует незначительного изменения валентных углов от 109,5 до 108° (это значение соответствует внутренним углам правильного пятиугольника), а молекула циклогексана оказывается совершенно ненапряженной и может принимать более одной конформации.
Теплота образования бензола
Метод энергий связей снова приводит к подозрительному несоответствию при попытке предсказания теплоты образования бензола. Как и в других подобных случаях, это несоответствие позволяет установить важные особенности строения молекулы бензола. Действительно, предположим, что молекула бензола имеет структуру, предложенную для нее известным химиком-органиком прошлого века А. Кекуле.
Н
I н с: и с с II д; Д:
н Д;^ н
н
Согласно этой модели, бензол имеет шесть простых связей С—Н, три простые связи С—С и три двойные связи С—С. Следовательно, полная энергия связей на моль бензола может быть найдена из такого расчета (в котором используются данные табл. 15-1):
Шесть связей С—Н 6-413 кДж = 2478 кДж
Три связи С—С 3 -348 кДж = 1044 кДж
Три связи С=С 3-615 кДж = 1845 кДж
Полная энергия связей 5367 кДж
Теперь можно рассчитать теплоту образования бензола:
АЯ598, кДж
6С(г.) + 6Н(г.) -> С6Н6(г.) бС(графит) -» 6С(т.) ЗН2(г.) - 6Н(г.) бС(графит) + ЗН2(г.) -> С6Нб(г.) 2-796 — (энергия связи) = — 5367 6-718 = +4308 6-218 = +1308 АЯ298 = + 249
.’•4
6Cfa) + 6Н(г.)
6C(графит)+3HZ(г.) |
з
Е
Qj
СвН, (г.)-эксперимент § §
--------------------------------------- g 3
ДНрдссТ”+249кДж С,Нв(г.)- вычисление ( з’о
।---------------------------------J § 6
-А ^зпсп= + && кДж 35
Рис. 15-9. Энергетическая диаграмма образования бензола. Ожидаемая (рассчитанная) теплота образования АНрассч равна + 249 кДж, но экспериментальное значение ДНЭКСП соста-
вляет всего + 83 кДж. Следовательно, устойчивость молекулы бензола на 166 кДж выше, чем это можно предположить, основываясь на валентной структуре Кекуле.
Очевидно, наши расчеты основаны на каком-то неверном предположении, потому что стандартная теплота образования газообразного бензола, согласно лабораторным измерениям, составляет только 83, а не 249 кДж моль - г. Таким образом, устойчивость молекулы бензола оказывается на 166 кДж моль - 1 выше, чем это предсказывается для молекулы со структурой Кекуле (см. энергетическую диаграмму на рис. 15-9).
Неверное предположение заключается в том, что молекула бензола описывается структурой Кекуле. В гл. 13 было установлено, что структура Кекуле не позволяет объяснить равную длину всех шести связей между атомами углерода в бензольном цикле и что удовлетворительное описание химической связи в этой молекуле должно основываться на теории делокализованных молекулярных орбиталей. В гл. 21 мы познакомимся с большим классом ароматических соединений, в которых имеются делокализованные электроны. Во всех случаях делокализация обусловливает повышение устойчивости молекулы, так как энергия делокализованных электронов понижается. Метод энергий связей позволяет оценивать величину этой стабилизации на основе измерений теплот образования ароматических соединений.
Пример 9
Вычислите стандартную теплоту образования диоксида углерода О=~С==О, основываясь на предположении о существовании в этой молекуле двух двойных связей С=О. Сравните вычисленное вами значение с экспериментальным значением,
35
приведенным в приложении 3. Указывает ли полученный вами результат на делокализацию электронов в молекуле СО2?
Решение
Вычисленная теплота образования оказывается равной — 243 кДж-моль"', а экспериментальное значение равно - 393,5 кДж-моль" *. Следовательно, энергия стабилизации СО2, обусловленная делокализацией электронов, составляет 150,5 кДж - моль '
z
ЗАКЛЮЧЕНИЕ
В этой главе дано обоснование представлений об энергетике химических реакций, которые были введены в гл. 2. Хотя существует много способов рассмотрения первого закона термодинамики, мы ограничили наше обсуждение теми аспектами, которые играют наиболее важную роль для химиков, интересующихся теплотами реакций и энергиями связей.
Теплота и работа представляют собой различные формы энергии и в рамках определенных границ могут переходить одна в другую. В любом таком процессе энергия сохраняется. Разность между теплотой q, поступившей в систему, и работой и», выполненной системой над ее окружением, определяется как изменение внутренней энергии, Е, системы
ДЕ = q — w
Под функцией состояния понимается функция, для которой можно вычислить изменение в любом процессе, зная только исходное и конечное состояния системы и не прибегая к сведениям о том, каким конкретным образом осуществлялся процесс. Короче говоря, функция состояния зависит только от состояния системы, но не от ее предыстории. Ни теплота q, ни работа w сами по себе не являются функциями состояния, но первый закон термодинамики утверждает, что разность между введенной в систему теплотой и выполненной системой работой является функцией состояния. Если исходное состояние обозначить индексом 1, а конечное состояние-индексом 2, то первый закон можно записать при помощи следующего математического равенства:
ЛЕ = Е2 — Е2 = q — w
Таким образом, внутренняя энергия представляет собой такое свойство, которое проявляется веществом при определенном сочетании условий. Из интуитивных соображений можно понять, что внутренняя энергия как-то связана с температурой, а простая молекулярно-кинетическая теория газов, изложенная в гл. 3, указывает, что для идеального одноатомного газа Е = =
Работа, выполненная расширяющимся газом против внешнего давления Р при увеличении объема на dv, равна dw = Pdv. Если объем газа поддерживается постоянным, то w = 0, и возрастание внутренней энергии равно количеству теплоты, поступающему в систему, ДЕ„ = q„. Следователь-2*
но, теплота реакции, проводимой при постоянном объеме, измеряется изменением внутренней энергии системы.
Большинство реакций проводится при постоянном давлении, а не при постоянном объеме. Если ввести функцию состояния Н, называемую энтальпией, при помощи выражения Н = Е + PV, то теплота реакции, проводящейся при постоянном давлении, окажется равной АН, т. е. АНр = qp. Этот вывод имеет очень важное значение для исследования теплот реакций. Поскольку величина АН зависит только от исходного и конечного состояний реакции, термин «при постоянном давлении» означает лишь то, что давление в конце реакции становится равным исходному давлению. Кроме того, поскольку Н является функцией состояния, теплоту реакции можно представить в виде суммы нескольких реакций и, следовательно, вычислить суммированием индивидуальных теплот таких реакций; другими словами, теплоты реакций аддитивны.
Эта аддитивность позволяет значительно упростить изучение теплот реакций. Вместо табулирования теплот всех возможных реакций достаточно ограничиться перечислением только теплот реакций образования каждой молекулы из составных элементов, находящихся в условно выбранных стандартных состояниях. Теплоту любой другой реакции можно вычислить, комбинируя теплоты образования точно таким же образом, как комбинируют реакции образования для получения интересующей нас реакции.
Количество теплоты, необходимое для повышения на 1 К температуры 1 моля вещества, называется молярной теплоемкостью, С. Теплоемкость идеального одноатомного газа при постоянном объеме Cv = а при постоянном давлении Ср = f R. Точность, с которой реальные одноатомные газы подчиняются этим закономерностям, характеризует применимость теории идеального газа.
Согласно простейшим представлениям о химической связи, устойчивость молекулы определяется существованием в ней отдельных двухэлектронных связей, соединяющих между собой пары атомов. Для подавляющего большинства молекул удается подобрать набор стандартных значений энергий связей, который позволяет воспроизводить экспериментальные теплоты образования молекул с точностью до 5-10 кДж. Однако для некоторых молекул результаты подобных расчетов значительно отклоняются от экспериментальных данных. Подлинная устойчивость таких молекул оказывается намного больше или, наоборот, меньше, чем предсказывают расчеты, основанные на представлениях простой теории локализованных связей. Появление подобных расхождений указывает, что в рассматриваемом случае простая модель локализованных связей неприменима. Молекулы с напряженной структурой могут оказаться менее устойчивыми, чем предсказывают термодинаьшческие расчеты, а молекулы с делокализацией электронов - более устойчивыми.
Энергия и энтальпия в химических системах
37
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. В чем различие между самопроизвольным процессом и быстрым процессом? Приведите пример реакции, которая является либо самопроизвольной, либо быстропротекающей, но не обладает сразу двумя этими свойствами.
2. Привейте примеры превращений: а) теплоты в работу, б) кинетической энергии в теплоту, в) работы в теплоту, г) работы в кинетическую энергию, д) потенциальной энергии в работу, е) работы в потенциальную энергию, ж) кинетической энергии в работу, з) теплоты в кинетическую энергию.
3. Укажите, какая из перечисленных ниже термодинамических систем является незамкнутой, замкнутой или изолированной: а) космонавт в конференц-зале центра управления полетами; б) тот же космонавт в космическом корабле без иллюминаторов; в) тот же космонавт в космической станции с гидропонным садом; г) Фантомас в своем дворце; д) Фантомас, запаянный в свинцовом гробу.
4. Что должно произойти с любым живым организмом, если попытаться превратить его в изолированную термодинамическую систему?
5. Каким образом работа расширяющегося газа связана с давлением, объемом и температурой?
6. Чем отличаются функции состояния от других функций? Являются ли давление и объем функциями состояния? В чем заключаются удобства обращения с функциями состояния?
7. Небрежный водитель то и дело получает выбоины на кузове автомашины, но у него есть хороший механик, который выправляет их почти сразу же, после того как они появляются. Первого числа каждого месяца хозяин этой машины, у которого служит водитель, подсчитывает число выбоин на кузове машины и по нему оценивает ее рыночную стоимость. Покажите, что оцениваемая таким образом рыночная стоимость машины является функцией состояния, тогда как число образовавшихся и число выправленных в течение месяца выбоин в отдельности не являются функциями состояния. Почему число выбоин превращается в функцию состояния, если механик уходит в отпуск?
8. Какая из величин, обсуждаемых в вопросе 7, соответствует работе, теплоте и внутренней энергии ? Можно ли уподобить механика в отпуске замкнутому стальному сосуду?
9. В чем заключается первый закон термодинамики и какие функции состояния упоминаются в нем?
10. Когда в гл. 3 молярная энергия Е одноатомного идеального газа определялась как сумма кинетической энергии индивидуальных молекул или как авогадрово число средних молекулярных энергий, молчаливо предполагалось, что Е является функцией состояния. Так ли это?
11. При каких условиях перечисленные ниже функции являются функциями состояния: а) внутренняя энергия, б) теплота, в) объем, г) работа, д) энтальпия?
12. В чем заключается закон Гесса? Почему он является следствием первого закона термодинамики?
13. Допустим, что вы взяли две одинаковые часовые пружины, оставили одну из них несвернутой, а другую туго свернули и перевязали проволочкой (нерастворимой в кислоте), а затем растворили каждую пружину в мензурке с кислотой. Что произошло при этом с работой, которую вы затратили, свертывая вторую пружину?
14. Что называется теплоемкостью? Каково отличие теплоемкости идеального одноатомного газа при постоянном объеме от его теплоемкости при постоянном давлении? Каково объяснение на молекулярном уровне того, что Ср должно быть больше С„? Какие компенсирующие теплоту способности имеет газ при постоянном давлении, которыми он не обладает при постоянном объеме?
15. Почему на основании первого закона термодинамики можно суммировать теплоты реакций наряду с самими уравнениями реакций, как это проделывалось в гл. 2?
16. Почему первый закон термодинамики избавляет от необходимости табулировать теплоты всех без исключения химических реакций?
17. Что представляет собой стандартная теплота образования? Об образовании из чего здесь идет речь? И почему она называется «стандартной»? Что представляет собой теплота сгорания соединения? Приведите примеры хотя бы двух веществ, для которых теплота образования совпадает с теплотой сгорания.
18. Каким образом из энергетической диаграммы, изображенной на рис. 15-6, видно, что представленная на ней графически энергия является функцией состояния?
19. На каком важном предположении основаны таблицы энергий связей, подобные табл. 15-1? Почему это предположение справедливо в отношении метана, этана и пропана, но неверно для бензола или циклопропана?
20. Допустим, что требуется вычислить энергию простой связи С—О в метаноле СН3—ОН, пользуясь только данными приложения 3. Как это сделать?
21. Какое влияние на устойчивость молекулы оказывают напряжение ее структуры и делокализация электронов? Как эти эффекты обнаруживаются из расчетов энергий связи?
22. Что случилось бы с нефтяной промышленностью, если бы работа стала функцией состояния?
Первый закон термодинамики
1. При продолжительном встряхивании бутылки с медными опилками нетрудно заметить, что она нагревается. Объясните это явление на основании первого закона термодинамики.
2. Какое превращение различных величин, измеряемых в джоулях, происходит при торможении автомобиля до полной остановки ? Что проис
jnnui.мп , химических системах 39
ходит при этом с кинетической энергией, которую имел двигавшийся автомобиль?
Теплота образования
3. Стандартная теплота образования жидкой воды составляет — 285,8 кДж моль “х. а) Запишите полное уравнение этой реакции. Поглощается или выделяется в ней теплота? б) Чему равна молярная теплота сгорания газообразного водорода?
4. а) Пользуясь данными приложения 3, определите стандартную теплоту образования жидкого бензола, б) Составьте полное уравнение этой реакции. Выделяется или поглощается в ней тепло? в) Чему равна теплота сгорания жидкого бензола?
Теплота сгорания
5. Теплота сгорания 1 моля жидкого ацетальдегида, СН3СНО, с образованием диоксида углерода и жидкой воды равна — 1164 кДж. а) Составьте полное уравнение этой реакции, б) Какое количество теплоты выделяется при сгорании 1 моля ацетальдегида? Какое количество теплоты выделяется в расчете на моль образующейся воды? В расчете на моль использованного кислорода? в) Какое количество теплоты выделяется при сгорании 1 г ацетальдегида? г) Воспользуйтесь полученными данными, а также данными для диоксида углерода и воды из приложения 3, чтобы вычислить стандартную теплоту образования ацетальдегида. Сравните полученный результат с приведенным в приложении 3.
6. Теплота сгорания твердой мочевины, (NH2)2CO, с образованием СО2, N2 и жидкой воды равна — 632,2 кДж на моль сгоревшей мочевины, а) Составьте полное уравнение этой реакции, б) Какое количество теплоты выделяется в расчете на моль использованного кислорода? в) Воспользуйтесь полученными вами данными, а также данными для СО2 и воды из приложения 3, чтобы вычислить стандартную теплоту образования мочевины. Сравните полученный результат со значением, приведенным в приложении 3.
7. а) Составьте полное уравнение реакции сгорания жидкого метанола, СН3ОН, в избыточном количестве кислорода с образованием жидкой воды, б) Пользуясь данными приложения 3, вычислите теплоту, выделяемую в этой реакции.
8. а) Вычислите теплоту сгорания этанола
7
СН3СН2ОН(ж.) + уО2(г.) -> 2СО2(г.) + ЗН2О(ж.)
б) Проделайте то же самое для глюкозы, С6Н12О6(тв.). в) Сопоставьте удельные теплоты сгорания (в джоулях на грамм) этанола и глюкозы. На основании этого расчета укажите, что является лучшим источником энергии -водка или конфеты? (Допустим, что водка содержит 40 вес.%
Гюш 15
40
этанола, а конфеты-100 вес. % глюкозы.) г) Многие микроорганизмы, включая дрожжи, получают необходимую энергию в результате сбраживания глюкозы в этанол: •
С6Н12О6(тв.) - 2С2Н5ОН(ж.) + 2СО2(г.)
Мы используем этот процесс для получения вина; при изготовлении шампанских и других игристых вин тоже используется диоксид углерода. Вычислите энергию, которую дрожжи получают из 1 моля глюкозы. К какому выводу можно прийти на основе этих вычислений и ответа на вопрос (б) относительно преимуществ сгорания глюкозы в О2 по сравнению с простым сбраживанием ее в отсутствие О2?
Сгорание топлив
9. а) Какое количество теплоты выделяется при сгорании 1 моля бензина, C8Hlg, на открытом воздухе? Составьте полное уравнение этой реакции, протекающей с образованием жидкой воды, б) Какое количество теплоты выделяется при сгорании бензина в условиях недостатка кислорода, когда вместо СО2 образуется СО? в) Какое количество теплоты выделяется при окислении СО в СО2? г) Согласуются ли ваши ответы на вопросы (б) и (в) с ответом на вопрос (а)? Если согласуются, то какой закон подтверждается при этом?
Теплота конденсации
10. Когда в Нью-Йорке выпадает 25 мм дождя, это означает, что на город площадью 800 км2 выливается 2 101Ол воды, а) Зная, что плотность жидкой воды 1,00 г-см” 3, найдите количество теплоты, которое выделяется, когда такое количество воды конденсируется из паров в дождевых облаках. (Рассматривайте конденсацию как химическую реакцию Н2О(г.) -> Н2О(ж.) и воспользуйтесь термодинамическими данными из приложения 3.) б) При взрыве тринитротолуола (ТНТ) выделяется энергия, равная 4000 кДж. Сколько мегатонн ТНТ (1 мегатонна = 106 тонн) понадобится для взрыва, в котором выделится такая же энергия, как при выпадении дождя, описанного в вопросе (а)?
Теплота реакции *
11. Воспользуйтесь приведенными ниже данными о теплотах реакций для вычисления теплоты образования NO. Сравните полученный ответ с данными приложения 3.
4NH3 4- 5О2 -> 4NO 4- 6Н2О(ж.) АН = -1170 кДж
4NH3 4- ЗО2 -> 2N2 4- 6Н2О(ж.) АН = - 1530 кДж
12. Пользуясь данными из приложения 3, вычислите количество теплоты, выделяемое при растворении известняка в кислоте:
СаСО3(тв.) + 2Н+ -» Са2+ 4- СО2(г.) + Н2О(ж.)
Энергия и энтальпия в химических системах
41
Ракетные топлива 13. Вычислите теплоту образования жидкого гидразина, N2H4, на основа-
нии следующих данных: 2NH3 + 3N2O -> 4N2 + ЗН2О(ж.) АН = - 1010 кДж
N2O + ЗН2 -> М2Н4(ж.) + Н2О(ж.) АН = — 317 кДж
2NH3 + уО2 - N2H4 + Н2О(ж.) АН = -143 кДж
Н2 + уО2 - Н2О(ж.) АН = — 286 кДж
Составьте полное уравнение реакции сгорания N2H4 в кислороде с образованием газообразного азота и жидкой воды. Чему равна теплота сгорания гидразина?
14. а) В ракетах на жидком топливе, как, например, у лунного модуля летавшего на Луну американского космического корабля «Аполлон», в качестве топлива используется жидкий гидразин, N2H4, а в качестве окислителя N2O4. Составьте полное уравнение реакции между этими веществами, в которой образуются жидкая вода и газообразный N2. б) Какое количество теплоты выделяется в этой реакции в расчете на моль гидразина? в) Большее или меньшее количество теплоты выделялось бы, если в качестве окислителя гидразина использовать вместо N2O4 просто О2? Какой окажется разница?
Промышленное газовое топливо
15. При получении водяного газа-промышленного газонагревателя-над раскаленным коксом пропускают водяной пар; при этом происходит следующая реакция:
С + Н2О(г.) -► СО + Н2
а) Какова стандартная энтальпия этой реакции в расчете на моль углерода в коксе? Какое количество теплоты оказывается запасено в водяном газе в расчете на 1 моль углерода? б) Составьте уравнения реакций, протекающих при сгорании водяного газа (смеси СО и Н2) в воздухе. Какая энергия выделяется при сгорании водяного газа, содержащего по 1 молю СО и Н2, с образованием СО2 и жидкой воды? в) Какое количество тепла выделяется при сгорании 100 л водяного газа (объем газа относится к давлению 1 атм и температуре 298 К)?
16. Еще один способ запасти энергию кокса в горючем газе заключается в пропускании сухого воздуха (20 об. % О2 и 80 об. % N2, что совпадает и с молярными концентрациями) над раскаленным коксом, в результате чего протекает реакция
с + 1о2 -> СО
2
а) Сколько литров О2 используется при пропускании 100 л воздуха через печь? Сколько литров СО образуется при этом? Сколько литров N2 проходит через печь, не вступая в реакцию? Какой о"бъем газообразного СО получается из 100 л воздуха? б) Какое количество тепла выделяется при сгорании 100 л газообразного СО (объем относится к давлению 1 атм и температуре 298 К)?
Энергии связей
17. Теплота сгорания газообразного диметилового эфира, СН3—О—СН3, с образованием диоксида углерода и жидкой воды равна —1461 кДж на 1 моль эфира, а) Вычислите стандартную теплоту образования диметилового эфира и сравните полученный результат со значением, приведенным в приложении 3. б) При помощи таблицы энергий связей вычислите стандартную теплоту образовании диметилового эфира. Проиллюстрируйте ваши вычисления при помощи энергетической диаграммы типа изображенной на рис. 15-7; укажите на ней все энергетические уровни и энергетические переходы. Согласуется ли ваш ответ с ответом на вопрос (а)?
18. Пользуясь данными об энергиях связей, вычислите теплоту образования ацетальдегида в паровой фазе СН3СНО(г.) при 25°С из графита и газообразных О2 и Н2. Проиллюстрируйте ваши расчеты при помощи энергетической диаграммы. Сравните свой ответ с термодинамическим значением, приведенным в приложении 3. Насколько точен метод энергии связей, если судить по результатам данного расчета?
19. Пользуясь данными об энергиях связей и атомных теплотах образования, вычислите стандартную теплоту образования следующих газов: а) С2Н6, б) CH3SH, в) CH3NH. Как согласуются вычисленные таким образом теплоты образования с экспериментальными значениями, приведенными в приложении 3?
20. Ниже перечислены некоторые реакции, протекающие в земной атмосфере. Воспользуйтесь данными об энергиях связи для вычисления энтальпии каждой из этих реакций:
a) N + О2 - NO + О
б) NO2 + О -> NO + О2
в) N + N -> N2
г) О + О3 -► 2О2
Энергии связей и молекулярная структура
21. а) Пользуясь данными приложения 3, вычислите теплоту изомеризации жидкого этанола в диметиловый эфир:
СН3 СН2— ОН(ж.) -> СН3 о— СН3(г.)
б) Вычислите теплоту изомеризации паров этанола. Объясните различие между полученным значением и ответом на вопрос (а), в) Вычислите теплоту реакции, указанной в вопросе (б), по методу энергий связей.
Э/;. ; ;ьu.\iiAin^ecKLix системах 43
---/-------------------- _. --------------------------------------
Насколько отличается значение, полученное методом энергий связей, от термодинамического значения? г) Объясните теплоту изомеризации паров этанола на основе соображений о химической связи в молекулах этанола и диметилового эфира.
22. а) Исходя из предположения, что химическая связь в молекуле моноксида углерода описывается валентной структурой С=О, а в молекуле диоксида углерода-структурой О=С=О, вычислите стандартную энтальпию следующей реакции по методу энергий связей:
СО(г.) + уО2 СО2(г.)
Сравните вычисленную вами энтальпию с ее термодинамическим значением. Насколько велико расхождение между ними и что можно сказать по поводу обоснованности наших исходных предположений о химической связи в двух рассматриваемых молекулах? б) Выберите в приложении 3 две другие химические реакции, одна из которых включает СО, но не включает СО2, а другая, наоборот, включает СО2, но не включает СО. Вычислите энтальпии этих реакций по методу энергий связей и на основании сопоставления результатов с термодинамическими значениями энтальпий установите, какое предположение неверно-о химической связи в молекуле СО или в СО2?
23. Теплота сгорания газообразного изопрена, СН2=СН—С(СН3)=СН2, или С5Н8, с образованием газообразного диоксида углерода и жидкой воды равна — 3186 кДж моль - *. Вычислите его теплоту образования и путем сопоставления с результатом ее оценки по методу энергий связей определите энергию резонансной стабилизации в изопрене. Можете ли вы записать для него несколько различных резонансных структур?
J. - !ЕС.И.)ВИЕ ГРАФ РУМФОРД ПРОТИВ ВСЕГО МИРА
В книге «Порядок и хаос» Энгриста и Хеплера* можно прочесть следующее:
«Хорошо известно, что в теорию теплоты и энергии внесли большой вклад разные люди с неодинаковыми научной подготовкой и положением в обществе. Приведем перечень лиц, сыгравших важную роль в развитии теории тепловых явлений и ее практическом применении: шпион на службе британского правительства, бывший британский комендант Бостона во времена войны за независимость в США; министр провинции Джорджия в Британском министерстве иностранных дел (1779 г.); помощник министра Северного отдела в Британском министерстве иностранных дел (1780 г.); подполковник королевских драгун; придворный короля Георга III; британский шпион при дворе курфюрста Баварии; основатель Мюн
* Angrist S. W„ Hepler L.G., Order and Chaos: Laws of Energy and Entropy, Basic Books, New York, 1967, p. 9.
Г.„HiLi !' 44
хенского военного работного дома; проектировщик мюнхенских «Английских садов»; генерал-лейтенант на службе баварского кюрфюрста; член польского Ордена св. Станислава в ранге Белого Орла; граф Священной Римской империи; основатель Королевского института в Лондоне; иностранный член Французской Академии наук; второй муж вдовы Лавуазье». Как ни странно, все эти лица на самом деле были совмещены в одном человеке-Бенджамине Томпсоне, получившем впоследствии титул графа Румфорда.
К приведенному перечню можно добавить следующее: изобретатель калориметра для реакций горения, сравнительного фотометра с международным стандартом свечи, кухонной плиты, двойного кипятильника, печи для обжига кирпичей, портативной печи и армейской полевой кухни, капельной кофеварки, применяемой до сих пор паровой отопительной системы, каминной вьюшки, усовершенствованной масляной настольной лампы высокой яркости, навигационной сигнальной системы, использовавшейся в Великобритании, и улучшенного баллистического маятника для измерения взрывной силы пороха; человек, открывший конвекционные токи в газах и жидкостях и установивший, что вода имеет максимальную плотность при 4JC и что черные тела лучше поглощают и испускают излучение, чем полированные предметы; один из первых исследователей прочности нитей на разрыв и теплозащитных свойств одежды; основатель одного из первых закрытых учебных заведений и учредитель первых международных медали и премии за научные достижения, присуждаемых до сих пор, а также первый кандидат на пост руководителя Вест-Пойнта* (отклоненный по политическим мотивам). Но и это еще не все. Томпсон был гением практики и изобретателем из той же когорты, что и Томас Эдисон. В конце XVIII в. он произвел в Европе такую же революцию в технологии приготовления пищи, какую 100 лет спустя проделал Эдисон в области практического использования электричества. Томпсон был, несомненно, более плодовитым изобретателем, чем Франклин, а возможно, и лучшим ученым. Почему же тогда он известен всего лишь узкому кругу исследователей истории науки и специалистам в области термодинамики?
Причина столь малой популярности заключается главным образом в самой личности этого человека. Томпсон был честолюбивым, но совершенно неразборчивым в средствах и беспринципным человеком. Он пресмыкался перед высокопоставленными лицами, но был язвительным и вероломным с равными ему и тираном с подчиненными. Никто не мог с ним работать, и всюду на своем пути он быстро наживал себе врагов. Короче говоря, это был поистине невыносимый гений.
Бенджамин Томпсон родился в американском местечке Вобурн (шт. Массачусетс) в 1753 г. Он рос в большой фермерской семье и, по-видимому, был очень старательным и организованным человеком. В записных книжках его студенческих лет можно прочесть расписание занятий («понедельник - анатомия, вторник-анатомия, среда - институт физики,
* Вест-Пойнт-военная академия в США.-Прк.и. перев.
Энергия р нипальпия в химических системах
45
четверг-хирургия, пятница-химия и медицина, суббота-физика и хирургия»), а также почасовой распорядок на каждый день. Сначала Томпсона отдали в ученики к галантерейщику, затем-к местному доктору. Ни то, ни другое его не удовлетворило, и он устроился работать школьным преподавателем в Конкорде (старое название Румфорд, шт. Нью-Гэмпшир). Здесь Томпсон сделал свой первый и во многих отношениях характерный для него шаг по восходящим ступенькам в жизни. В 1772 г. он женился на молодой вдове богатого нью-гэмпширского землевладельца.
Природная жажда власти и связи жены в высших кругах позволили Томпсону войти в доверие к британскому королевскому губернатору Нью-Гэмпшира. Он стал осведомителем и шпионом в пользу англичан. Англичанам нужны были сведения о тайных складах оружия и продовольствия, которые устраивали в сельской местности Новой Англии солдаты американской армии и милиции во время войны за независимость. Томпсон был заподозрен в шпионаже, и Нью-Гэмпширский комитет общественной безопасности вызвал его для дачи показаний по обвинению в «недружественном отношении к делу свободы». Однако достоверных улик против него не оказалось. За неделю до рождества в 1774 г. Томпсон узнал, что вечером к нему собирается прийти группа горожан, чтобы вымазать его дегтем и обвалять в перьях. Оставив жену, грудного ребенка и престарелого тестя на произвол судьбы, он сбежал в Бостон и больше не вернулся к семье.
Продолжая работать в Массачусетсе на англичан, Томпсон имел второе столкновение с Комитетом общественной безопасности этого штата. Доказать его виновность не удалось и на сей раз, но после этого за ним была установлена такая слежка, что его уже нельзя было использовать как шпиона. В марте 1776 г. Томпсон ушел с британской армией, изгнанной из Бостона. Вскоре он появился в Лондоне, где сначала нашел себе занятие в качестве специалиста по вопросам войны за независимость, а затем занимал ряд правительственных постов. По прошествии семи лет, в течение которых Томпсон сделал ряд важных открытий, его заподозрили в том, что он перешел от британской морской разведки на службу к французской. Кроме того, он нажил себе бесчисленных личных врагов, и ему стало ясно, что следует искать себе занятия за пределами Британии. Вскоре он перебрался в Мюнхен в качестве полковника и военного советника баварского курфюрста Карла Теодора. (Томпсон отправил несколько шифрованных донесений английской военной разведке о состоянии армии своего нового хозяина.)
Баварская армия находилась в плачевном состоянии. Ей не хватало дисциплины, выучки, необходимого вооружения и обмундирования, плохо обстояло дело со снабжением и моральным состоянием, и она была парализована взятками и коррупцией. На Томпсона была возложена задача придать армии должную боеспособность. Его положение в Мюнхене напоминало то, чем занимался Лавуазье в акционерном обществе «Генеральный откуп», будучи частным откупщиком налогов. Дельцы из «Генерального откупа» получали концессию от французского короля на
/
ежегодные сборы определенной суммы налогов для казны. Все, что им удавалось собрать сверх этой суммы, они могли оставлять ce6t. Полковнику Томпсону ежегодно выдавалась определенная сумма на содержание баварской армии. Если действия армии оказывались более успешными и вместе с тем Томпсон находил способы экономить, то он мог присваивать сэкономленные деньги. Как и Лавуазье, это заставляло Томпсона с максимальной эффективностью выполнять свои обязанности. Все проводившиеся Томпсоном мероприятия с обмундированием, питанием, сверлением пушек и мюнхенскими военными работными домами составляли часть его общего плана по повышению боеспособности баварской армии. Когда консервативно настроенные фабриканты отказались поставлять, согласно его предписаниям, ткань и снаряжение для армии, он использовал солдат для ночной облавы на тысячи мюнхенских уличных нищих, заставив их жить в военных работных домах и работать на его фабриках. Томпсон обеспечил каждого рабочего жильем и пищей, а также открыл для их детей бесплатные школы (если они не были достаточно взрослыми, чтобы работать). Он построил знаменитые мюнхенские «Английские сады», в которых выставлялись его нововведения в области сельского хозяйства и производства продуктов питания. Его так называемый «румфордский суп», придуманный для работных домов, был попыткой обеспечить все необходимое для питания за минимальную цену. Томпсон ввел в Баварии в употребление картофель, хотя сначала пришлось доставлять его в свою кухню тайком, потому что баварцы считали картофель непригодным для еды. Он пропагандировал кофе как стимулирующий заменитель алкоголя и, чтобы сделать его популярным, придумал кофейник с ситечком. Солдаты европейских армий того времени сами занимались поиском продуктов питания для себя и в лагерных условиях готовили пищу на открытых кострах. Томпсон изобрел разборную полевую кухню, обслуживаемую одним человеком, а затем и подвижную армейскую полевую кухню. Эксперименты со сверлением пушек-практически единственное достижение, за которое Томпсона помнят,-были лишь эпизодом в его многосторонней деятельности в Мюнхене.
От полковника баварской армии Томпсон поднялся до военного министра, министра полиции, генерал-майора, камергера Баварского двора и государственного советника. Он занимал все эти посты одновременно и был вторым по положению человеком в Баварии, после самого курфюрста. Высшим титулом Бенджамина Томпсона был титул графа Священной Римской империи. Томпсон выбрал для своего графского имени старое название города Конкорд в Нью-Гэмпшире и после 1792 г. настаивал, чтобы его называли не Бенджамином Томпсоном, а графом Румфордом. Выбор имени «Румфорд», возможно, был связан с воспоминаниями о семье, которую он оставил 18 лет назад, но мог быть продиктован и желанием создать впечатление, что он происходит из семьи богатого землевладельца в американских колониях.
К 1795 г. напряженная работа отразилась на здоровье Томпсона, а его многочисленные враги при Баварском дворе приобрели слишком большое
Энергия /и juma.ihiiu.H к химических система.': 47
влияние. Он покинул Мюнхен и с триумфом возвратился в Лондон. Правительственные лица и широкая публика, почти без исключения, встретили его льстиво как известного филантропа, философа и благотворителя. Каковы бы ни были его недостатки в общении с людьми и личные пороки, благодаря изобретениям и общественной деятельности Румфорда существенно изменилась жизнь простых жителей европейских городов того времени. Лондонский Королевский институт, являющийся в наши дни широко известным научным учреждением, первоначально был создан как выставка изобретений и нововведений Томпсона. В качестве своего ассистента во время публичных демонстраций и лекций (рис. 15-10) он привлек молодого сельского паренька по имени Гемфри Дэви (ставшего впоследствии сэром Гемфри Дэви, о котором упоминается в послесловии о Дальтоне к гл. 6). Для Томпсона тишппно, что он задумал использовать Королевский институт как место, куда могут приходить непосвященные, чтобы получить от графа Румфорда советы, как им следует строить свою жизнь. Однако тот факт, что Румфорд очень часто оказывался прав, имел небольшое значение для тех, кого он отта.пкивал своим высокомерием. Через два года он был отстранен от активного руководства Королевским институтом, хотя институт продолжал оставаться блестящей выставкой и лабораторией для Гемфри Дэви, Майкла Фарадея и других видных ученых.
К моменту крушения карьеры ,'?умфорду было всего 49 лет. Коротко заметим, что он начал новую карьеру во Франции, женившись на вдове Лавуазье. Его первая жена к этому времени умерла. Новый брак оказался очень непрочным и продлился всего два года. Но в тот период он уже упрочил свое положение во Франции, как до этого в Мюнхене и Лондоне.
Румфорд скоропостижно скончался в 1814 г. Его смерть была настолько же внезапной, насколько стремительной была его жизнь. Он оставил несколько неожиданное завещание: вся его собственность перешла к Гарвардскому университету, который до сих пор следит за сохранностью его могилы во Франции. Память о Румфорде исчезла так же быстро, как сам он возник из неизвестности. Его не чтили так, как Лавуазье, Дальтона или Франклина. Люди, которым приходилось жить и работать вместе с ним, очень скоро забыли его. При жизни Румфорд слишком часто провозглашал себя великим человеком, поэтому многие без всяких угрызений совести перестали воздавать ему должное за сделанные им открытия и изобретения.
В произнесенной во Французской Академии наук речи, посвященной памяти Бенджамина Томпсона, известный натуралист Кювье так сказал об этом замечательном человеке:
«Он считал, что китайское правительство ближе других к совершенству, потому что, отдавая народ в полное распоряжение образованных людей* и выстраивая этих людей в иерархический ряд по уровню их знаний, оно
* Имеются в виду китайские чиновники-мандарины, получавшие в императорском Китае свои посты только после многолетнего обучения.- Прим, перев.
Рис. 15-10. Публичная лекция в лондонском Королевском институте в 1802 г. Граф Румфорд изображен в верхнем правом углу карикатуры. Лекцию проводит Томас Юнг, профессор натуральной философии в Королевском институте, а его ассистент с ручными воздуходувными мехами-это молодой Гемфри Дэви. «Жертвой» демонстрации является сэр Джон Гиппслей, директор Королевского института. Дэви широко исследовал физиологическое действие различных газов. Он чуть было не погубил себя за два года до того, вдыхая метан, и вызвал сенсацию на лекции в 1801 г., давая вдыхать веселящий газ (оксид азота) всем желающим. Рису-
нок выполнен Джеймсом Гиллреем, известным в то время художником-карикатуристом. Он считал лекции в Королевском институте ненужными, потому что они предназначались для простых людей, но на самом деле превратились в развлечение для богатых, что и показано ш. рисунке. Гемфри Дэви и Майкл Фарадей продолжили традицию публичных лекций, которая поддерживается до сих пор. Один из авторов настоящей книги (Р. Дикерсон) в 1970 г. прочел лекцию в Королевском институте. Судя по всему, это происходило в том же лекционном зале, который изображен на рисунке. (Фотография гравюры, являющейся собственностью собрания Фишера.)
в известной мере превращает многие миллионы рук в пассивные органы, управляемые волей немногих умных голов. Создать империю ему было бы не труднее, чем организовать бараки и работные дома... Однако мир нуждается в большей свободе и устроен так, что достаточно высокие совершенства какого-либо одного человека часто оказываются его недостатками, если этот человек не прилагает столько же стараний, чтобы не восхвалять свои знания, сколько он приложил усилий для их приобретения».
Энергия и энтаяьпи.ч в химических системах 49
ЛИТЕРАТУРА
1. BrownS. С., Count Rumford, Physicist Extraordinary, Anchor, N.Y., 1962. Увлекательно написанная биография одного из величайших практических гениев и негодяев в истории науки.
2. Klotz J. М., Rosenberg R. М. Introducion to Chemical Thermodynamics, 2nd ed., W. A. Benjamin, Menlo Park, Calif., 1972.
3. Mahan В. H., Elementary Chemical Thermodynamics, W. A. Benjamin, Menlo Park, Calif., 1963. Хорошее введение в классическую термодинамику (не включающую статистической интерпретации энтропии) с умеренным использованием математических выкладок, которые подробно пояснены.
4. Nash L., Introduction to Chemical Thermodynamics, AddisonWesley, Reading, Mass., 1963.
5. Waser J., Basic Chemical Thermodynamics, W. A. Benjamin, Menlo Park, Calif., 1966. По уровню изложения такая же, как работы [3] и [4]. Рекомендуется в качестве дополнительного пособия к данной главе.
ГЛАВА 16
16
Энтропия, свободная энергия и химические реакции
Нашим равновесным состоянием была полнейшая неупорядоченность.
Т. Лоуренс, «Семь столпов мудрости» (1926)
Важнейшие понятия
16-1. Самопроизвольные процессы, обратимые процессы и равновесие. Принцип Ле Шателье.
16-2. Теплота, энергия и молекулярное движение. Кинетическая и потенциальная энергия. Теплота и теплоемкость. Макроскопическое и микроскопическое движение. Второй закон термодинамики.
16-3. Энтропия и неупорядоченность системы. S = k In Ж *
16-4. Третий закон термодинамики. Абсолютные энтропии и химические свойства.
16-5. Свободная энергия, G, и самопроизвольное протекание химических реакций. Внутренняя и внешняя работа. Стандартная свободная энергия.
16-6. Свободная энергия и концентрация. Активность. Константа равновесия.
Предыдущая глава была посвящена ответу на важный вопрос: «Если химическая реакция осуществляется самопроизвольно, будет ли она выделять или поглощать теплоту?» Этот вопрос очень важен для конструкторов тепловых двигателей и химических реакторов. Но еще важнее следующий вопрос: «Будет ли рассматриваемая реакция протекать самопроизвольно без какого-либо внешнего вмешательства?» Вопрос о самопроизвольных процессах и является предметом настоящей главы.
it'-'. САМОЕ! ЕОИЗВО. [ИНЫЕ ПРОЦЕСС Ы.
ОБРАТИМЫЕ i । Ри ц ЕС С Ь1 И РАВНОВЕСИЕ
Если поместить одинаковые количества газообразных водорода и кислорода в сосуд и внести в него пламя или платиновый катализатор, произойдет сильный взрыв. Исходные газы Н2 и О2 исчезнут, а вместо них образуется водяной пар. Аналогично смесь газообразных Н2 и С12 при инициировании светом взрывает с образованием газообразного НС1. В отличие от этого смесь газов Н2 и N2 реагирует намного медленнее, и конечным продуктом этой реакции является смесь газов Н2, N2 и NH3.
Первая и вторая реакции -хорошие примеры резко выраженных самопроизвольных процессов. Как мы знаем из гл. 4, самопроизвольный процесс обладает достаточной движущей силой, позволяющей ему осуществляться без какого-либо воздействия со стороны внешнего окружения*. В последующих разделах этой главы будет рассказано о том, как измеряется эта движущая сила. Пока мы можем сказать, что тенденция к осуществлению реакции образования НС1 из Н2 и С12:
Н2 + С12 - 2НС1
значительно больше, чем у обратного процесса-диссоциации НС1:
2НС1 -> Н2 + С12
Реакция синтеза аммиака из Н2 и N2 также имеет несколько большую начальную тенденцию к протеканию, чем обратная реакция разложения аммиака. Другими словами, реакция (16-1) обладает большей движущей силой, чем реакция (16-2):
ЗН2 + N2 -> 2NH3 (синтез) (16-1)
2NH3 -» ЗН2 + N2 (разложение) (16-2)
Но по мере накопления NH3 и уменьшения исходного количества Н2 и N2 синтез аммиака замедляется, а его разложение ускоряется. Аммиак разлагается тем быстрее, чем больше его имеется в наличии. При определенной концентрации Н2, N2 и NH3 прямая и обратная реакции протекают с одинаковой скоростью, т. е. аммиак образуется точно с той же скоростью, с какой он разлагается. Хотя на молекулярном уровне синтез и разложение аммиака продолжаются, никаких видимых изменений в газовой смеси не происходит. Создается такое впечатление, что в газе прекратились всякие
* Строго говоря, самопроизвольный характер процесса никоим образом не связан с продолжительностью его осуществления. Самопроизвольная в термодинамическом смысле реакция осуществляется без внешнего воздействия, хотя для ее завершения может понадобиться бесконечно большое время. Роль катализатора заключается лишь в ускорении того, что должно было произойти и само по себе, но за больший промежуток времени. Термодинамика позволяет ответить на вопрос, произойдет ли определенный процесс вообще, а для ответа на вопрос, как быстро он осуществится, приходится обращаться к кинетике (гл. 22).
изменения. Такое состояние уравновешенности двух реакций, протекающие в противоположных направлениях, называется химическим равновесием.
Реакция, находящаяся в состоянии равновесия, представляет собой обратимую реакцию. Чтобы пояснить сказанное, рассмотрим еще раз пример с равновесной смесью Н2, N2 и NH3. Повышение давления в этой газовой смеси создает более благоприятные условия для протекания реакции (16-1) по сравнению с реакцией (16-2), потому что реакция (16-1) приводит к уменьшению результирующего числа молей (или молекул) газа и это ослабляет воздействие на систему, вызванное повышением давления. Рассуждая аналогичным образом, нетрудно понять, что уменьшение давления благоприятствует разложению аммиака с образованием большего числа молей газовой смеси. И в том, и в другом случае можно убедиться в справедливости принципа Ле Шателье: когда система, находящаяся в равновесии, подвергается какому-либо внешнему воздействию, она смещается в новое состояние равновесия таким образом, чтобы ослабить это внешнее воздействие.
Синтез аммиака из' составляющих элементов представляет собой экзотермический процесс; стандартная энтальпия реакции (16-1) ДН298 = = — 92,39 кДж на моль реакции в записанном виде, или — 46,19 кДж на моль аммиака. При повышении температуры газовой смеси реакция (16-1) затрудняется, а реакция (16-2), наоборот, облегчается, поскольку она протекает с поглощением тепла и частично противодействует повышению температуры. При добавлении в сосуд некоторого количества аммиака из внешнего источника реакция (16-1) также затрудняется, а реакция (16-2), наоборот, облегчается, поскольку последняя приводит к уменьшению количества добавляемого аммиака. Принцип Ле Шателье удобен тем, что позволяет делать качественные предсказания о поведении равновесной системы в условиях внешнего воздействия.
Если система N2—Н2—NH3 действительно находится в состоянии равновесия, для изменения относительных скоростей прямой и обратной реакций достаточно бесконечно малых изменений давления, температуры или концентрации любого компонента системы. Подобно тому как самый легчайший груз способен изменить положение весов при механическом равновесии, так и самое малое изменение условий влияет на систему, находящуюся в состоянии химического равновесия. Вот почему к подобным реакциям применимо определение обратимые. Щелчком пальца нельзя остановить скатывающийся с горы валун, и бесконечно малое изменение давления, температуры, концентрации или любого другого изменяемого параметра состояния системы не позволяет остановить взрыв смеси Н2 и С12 или менее наглядной реакции между N2 и Н2 прежде, чем будет достигнуто равновесие. Такие химические системы не находятся в состоянии равновесия, и процесс их протекания является необратимым.
Таким образом, равновесные процессы относятся к обратимым, а неравновесные или самопроизвольные процессы-к необратимым. Целесообразно вычислить равновесные условия для системы химических веществ; это интересно главным образом по двум причинам: во-первых, поскольку
Эnnipoi:ii't. свыюРная энергия к хиЛ1иче<.-кие реакции 53
часто важно знать относительные количества реагентов и продуктов в состоянии равновесия, а во-вторых, поскольку отклонение рассматриваемой химической ситуации от равновесия является мерой движущей силы по направлению к равновесию.
16-2. ТЕПЛОТА. ЭНЕРГИЯ И МОЛЕКУЛЯРНОЕ ДВИЖЕНИЕ
Нагревание всякого тела усиливает в нем молекулярное движение. Как описано в разд. 15-1, Лавуазье и Дальтон считали теплоту флюидом, который может быть извлечен из атомов в результате трения. Вопреки такой неправильной точке зрения теплота характеризует состояние движения молекул и атомов, которое ускоряется механическими силами трения. К таким выводам привели эксперименты, продемонстрировавшие эквивалентность механической работы и теплоты; эти выводы получили дальнейшее подтверждение в кинетической теории газов, а впоследствии были распространены на молекулярную теорию жидкостей и твердых тел.
В предыдущих главах мы упоминали два вида энергии, которыми может обладать тело-это кинетическая энергия и потенциальная энергия. Движущееся тело обладает кинетической энергией, связанной с его массой,
1 ,
и скоростью, v, соотношением Ek = —mv. Потенциальная энергия тела зависиз от его положения относительно других тел. Если при перемещении массы между двумя точками пространства А и В выполняется механическая работа, говорят, что в точке А тело имеет большую гравитационную потенциальную энергию, чем в точке В. При желании можно говорить о гравитационном потенциальном поле, в котором происходит движение тела, но при этом мы будем лишь по-иному описывать наши наблюдения, а не объяснять их. Представление о гравитационном поле вытекает из наблюдения, что при перемещении тела между двумя точками пространства выполняется механическая работа. Аналогично, если при перемещении между точками А и В положительного или отрицательного заряда выполняется работа, говорят, что заряд имеет большую электростатическую потенциальную энергию в точке А, чем в точке В. И в этом случае мы можем описывать (но не объяснять) наблюдаемое, говоря об электростатическом поле.
Обратимся теперь к третьему виду энергии: тело обладает им вследствие того, что его атомы и молекулы находятся в состоянии движения, хотя само тело может оставаться неподвижным. Проявлением этого молекулярного движения является теплота, а его интенсивность измеряется температурой тела. Как было изложено в гл. 3, применяемая нами температурная шкала основана на закономерности расширения идеального газа, а теплота измеряется в тех же единицах, что и работа или энергия. Количество теплоты, необходимое для повышения температуры 1 моля вещества на 1 К, называется теплоемкостью этого вещества и измеряется в джоулях на кельвин и на моль (Дж -К ~ 1 моль 1).
Если бы не существовало этого третьего вида энергии, первый закон
термодинамики должен был бы принять вид:
ЛЕ = Е2 — EL = — w
и формулировался бы следующим образом: работа, выполняемая системой над ее окружением, осуществляется за счет изменения внутренней энергии системы. Иначе, поскольку — w представляет собой работу, выполняемую над системой ее окружением, можно сформулировать последнее уравнение таким образом: работа, выполняемая над системой ее окружением, равна повышению внутренней энергии системы. Эта работа может быть использована для ускорения тел, из которых состоит система, и повышения их кинетической энергии или же она может быть использована для подъема этих тел и придания им большей потенциальной энергии.
Полная же формулировка первого закона термодинамики должна быть такой:
ЛЕ — Е2 — Е2 = q — w
изменение внутренней энергии системы представляет собой сумму работы, выполненной над системой ее окружением, и повышения беспорядочного движения ее молекул под действием этого окружения. Повышение молекулярного движения рассматривается как перенос теплоты.
Работу всегда можно преобразовать в теплоту. В качестве простейшего примера обычно приводят трение. Камень, движущийся как единое целое с большой скоростью, хотя его молекулы совершают сравнительно медленное беспорядочное движение, останавливается при перемещении по поверхности вследствие трения. После остановки камень уже не имеет скорости движения как единое целое. Однако его молекулы и молекулы поверхности, по которой он скользил, движутся теперь с большими индивидуальными скоростями, чем раньше. Если тело хотя бы частично состоит из газа, молекулярное движение усиливается в прямолинейном направлении во всем сосуде. Если же тело является твердым, в нем усиливается колебательное движение атомов и молекул относительно средних положений в кристалле. В любом случае мы имеем дело с превращением макроскопического движения в микроскопическое.
Этот процесс не вполне обратим. В качестве примера снова упомянем тормозящий автомобиль, о котором уже говорилось в разд. 3-6. В общем случае невозможно преобразовать беспорядочное молекулярное движение в координированное движение всего тела как единого целого со 100%-ной эффективностью. Невозможность осуществления такого процесса является содержанием второго закона термодинамики. В середине XIX в. были предложены две несколько отличающиеся формулировки этого закона. Одна из них, предложенная Вильямом Томсоном, гласит: «Невозможно превратить какое-либо количество теплоты полностью в работу без того, чтобы часть этой теплоты не оказалась растраченной при более низкой температуре». Вторая формулировка принадлежит Рудольфу Клаузиусу: «Невозможно осуществить перенос тепла от более холодного тела к более горячему телу, не затрачивая для этого работу». Обе формулировки представляют со
Энтропия. i лфх.? .i xiiмические Репкина 55
бой подведение итогов большого практического опыта. Они указывают на ограничения возможного в реальном мире. Можно показать, что каждая формулировка позволяет получить другую в качестве следствия.
!б-3. ЭНТРОПИЯ И НЕУПОРЯДОЧЕННОСТЬ СИСТЕМЫ
В какой бы форме ни был сформулирован второй закон термодинамики, путем основанных на нем выкладок, которые здесь не воспроизводятся, можно получить новую функцию состояния S, называемую энтропией системы. Вместо того чтобы воспользоваться наиболее общим выражением для энтропии, полезно обратиться к одному частному случаю. Если система получает некоторое количество теплоты q обратимым путем при температуре Т, то энтропия системы возрастает на величину
AS = у (16-3)
Если же теплота поступает в систему необратимым путем, энтропия системы возрастает на величину, большую чем q/T:
AS > (16-4)
Таким образом, величина q/T представляет собой минимальное возрастание энтропии, осуществляемое только в условиях обратимого переноса теплоты, т. е. когда нагреваемая система находится в тепловом равновесии с нагревающим ее окружением. Теплота переходит от одного тела к другому вследствие того, что они не находятся в равновесии, а для того, чтобы перенос тепла осуществлялся обратимым путем, потребовалось бы бесконечно большое время. Подлинно обратимые процессы являются идеализациями реально протекающих необратимых процессов. Но важно отметить, что в любом реальном (необратимом) процессе возрастание энтропии должно превышать величину q/T, однако чем медленнее и осторожнее будет осуществляться перенос теплоты, тем меньше будет разница между величинами AS и q/T
Когда энтропия выводится из второго закона термодинамики, она не получает очевидной интерпретации на молекулярном уровне. Однако австрийский физик Людвиг Больцман (1844-1906) показал в 1877 г., что энтропия имеет основополагающее значение для понимания молекулярных явлений: она является мерой неупорядоченности в молекулярной системе. Больцман показал, что энтропия S связана с числом различных микроскопических способов реализации конкретной макроскопически определенной и наблюдаемой ситуации. Если число эквивалентных способов реализации некоторой ситуации равно W, то энтропия пропорциональна логарифму числа W-.
S = fclnlK
(16-5)
r.icibii 16 56
Коэффициентом пропорциональности в этом уравнении служит универсальная газовая постоянная в расчете на одну молекулу, т. е.
R
к = — (16-6)
где R-уже известная нам константа из закона состояния идеального газа, a N -число Авогадро. Принято называть коэффициент к постоянной Больцмана.
В уравнение Больцмана (16-5) входит важная физическая величина-число способов получения заданного состояния, W. Существует всего один способ упаковки идеального кристалла, при условии что молекулы неотличимы одна от другой и неподвижно упакованы среди своих соседей (последнее означает, что кристалл находится при температуре абсолютного, нуля). Для идеального кристалла с неподвижными молекулами при О К И/=1и5 = /с1п1=0. В отличие от этого существует множество эквивалентных способов «построения» 1 л определенного газа при заданных температуре и давлении. Нет никакой необходимости указывать индивидуальные положения молекул в газе и их индивидуальные скорости, для того чтобы газ соответствовал заданным условиям, ему достаточно иметь необходимое число молекул каждого сорта и необходимую молярную энергию; все газы, удовлетворяющие этим условиям, должны казаться одинаковыми стороннему наблюдателю. Отсюда следует, что для любого газа величина W очень велика, а значит, In И7-положительное число и поэтому S = к In W больше нуля. Разумеется, даже идеальный кристалл должен обладать некоторой положительной энтропией, если он нагрет выше О К, поскольку отдельные молекулы начинают колебаться относительно своих равновесных положений в кристаллической решетке, и возникает несколько способов построения кристалла из колеблющихся молекул, причем все эти способы кажутся одинаковыми стороннему наблюдателю. И все-таки энтропия кристалла поваренной соли при комнатной температуре имеет намного меньшее значение, чем для сопоставимого количества газа.
Больцман установил важнейшую связь между термодинамической функцией-энтропией-и микроскопической неупорядоченностью физической системы. Мы рассматриваем любую ситуацию, настолько определенную, что она может быть реализована только одним способом или небольшим числом способов, как упорядоченную. А всякую ситуацию, которую можно воспроизвести тысячами или миллионами различных, но совершенно эквивалентных способов, принято рассматривать как неупорядоченную. Закон Больцмана, выражаемый уравнением (16-5), указывает, что наиболее совершенной, упорядоченной системой, которую можно себе представить во Вселенной, является идеальный кристалл при абсолютном нуле температур. Всякая иная система - кристалл при произвольной температуре выше О К, жидкость, газ или какая-либо смесь веществ - характеризуется большей неупорядоченностью и поэтому обладает положительной энтропией. Чем больше энтропия системы, тем больше ее неупорядоченность.
Энтропия, свободная энергия и химические реакции
57
Если объединить больцмановские представления об энтропии с законами термодинамики, мы придем к одному из наиболее важных принципов науки: при всяком реальном, самопроизвольном процессе, включая химические реакции, неупорядоченность Вселенной обязательно возрастает. В любой изолированной системе, в которой полная энергия не может изменяться, самопроизвольной является реакция, при которой происходит возрастание энтропии (и неупорядоченности). Без постороннего вмешательства невозможен ни один процесс, результатом которого является повышение порядка, т. е. уменьшение энтропии. Поставляя в систему достаточную энергию, можно заставить протекать реакцию, даже если в результате нее происходит уменьшение энтропии. Но если не поставлять достаточной энергии, реакция, приводящая к повышению упорядоченности, никогда не произойдет.
Жизнь во «Вселенной» из девяти клеток
Что подразумевается, когда говорят, что энтропию, S, можно вычислить из выражения S = /с1пИ/, в котором И'-число эквивалентных способов расположения молекул для получения одинакового наблюдаемого результата? Почему газ обязательно должен иметь более высокую энтропию, чем кристалл из того же вещества? На такие вопросы трудно ответить, рассматривая объекты и явления реального мира, если мы не хотим увязнуть в математических выкладках. Это гораздо легче сделать в воображаемой «Вселенной», состоящей всего из четырех атомов, которые могут располагаться только в девяти различных клетках.
Представим себе, что наша «мини-Вселенная» устроена в виде квадратика из девяти клеток (3 х 3), как показано на рис. 16-1,а. В нашей воображаемой Вселенной расположение четырех атомов тесным квадратиком 2x2 соответствует «кристаллу», а любое другое расположение-«газу». Примеры кристаллов и газов приведены на рис. 16-1,6. Рассмотрим всевозможные варианты расположения четырех атомов в такой Вселенной из девяти клеток и попытаемся определить, сколько вариантов приводит к кристаллам, а сколько к газам.
Прежде всего выясним, сколько всего расположений возможно для четырех атомов в девяти клетках, т. е. для газов и кристаллов в целом. Первый атом может занять любое из девяти мест в нашей Вселенной. Для второго атома остается уже восемь незанятых мест, для третьего-семь и для четвертого - только шесть. Следовательно, полное число способов размещения четырех атомов в девяти клетках должно быть равно 9-8-7-6 = 3024.
На самом деле полученный результат завышен. Он был бы правилен, если бы атомы были пронумерованы или помечены каким-либо образом и, следовательно, если бы расположения такого типа, как показано на рис. 16-1,в, можно было отличить друг от друга в действительности. Но атомы неразличимы. Если бы благодаря какому-то неизвестному науке способу удалось делать мгновенные фотографии атомов, то, изучая их, можно было установить различие между четырьмя расположениями, пока-
1 2 3
4 5 6
7 8 9
a
6
Рис. 16-1. «Мини-Вселенная», располагающая всего девятью клетками, которые могут занимать четыре объекта, а-структура «мини-Вселенной»;
б-расположения атомов, приводящие к образованию различных состояний «газа» или «кристалла»; в-если бы атомы можно было пронумеровать, все указанные здесь размещения ато-
г
мов и другие, подобные им, можно было бы отличить друг от друга; г-поскольку атомы неразличимы, все размещения, указанные на рисунке в, отвечают одному расположению атомов в положениях 3, 4, 7 и 8. Из книги: Dickerson R. Е., Geis I., Chemistry, Matter and the Universe, Benjamin, Menlo Park, Calif., 1976.
занными на рис. 16-1,6, потому что атомы в них занимают различные клетки. Однако мы не установили бы абсолютно никакого различия между расположениями, изображенными на рис. 16-1,в, потому что все атомы одного сорта неотличимы один от другого. Самое большее, что можно было бы сказать, это что в нашей «мини-Вселенной» атомы занимают положения 3, 4, 7 и 8 (рис. 16-1,г).
Как же исправить завышенный результат? Как устранить воображаемые «метки» с атомов? Следует ввести поправку на число различных перестановок между «метками» в каждом расположении четырех атомов. Метку а можно приписать любому из четырех атомов, метку Ь- каждому
из трех остальных, метку с-только двум последним, а метка d обязательно достается последнему атому. Таким образом, любому индивидуальному расположению атомов соответствуют 4 • 3 • 2 • 1 = 24 неразличимые перестановки меток. Следовательно, мы переоценили искомый результат в 24 раза и поэтому полученное число расположений атомов, 3024, необходимо разделить на 24, чтобы учесть неразличимость атомов. Итак, число различных способов расположить четыре неразличимых атома во «Вселенной» из девяти клеток должно быть равно
pr=9±L6=2024
4-3-2-1 24
Те, кто сомневается в рассуждениях, на основании которых мы пришли к такому выводу, могут проверить все 126 расположений, изображенных на рис. 16-2. Из 126 возможных расположений только четыре соответ-
£ ft ft •-V ft s-. У/ ft. & * & & а®
A, * Г. ft ft’ > ft ft eft ®
- ft. ft e> - »»» . & е ал
• • ft ft. ft? & Г ф 1 1
r* ft 'ft да* < . ft -ft. «е в е ее ее е е
t. 'ft -.ft. 4 Л & » е : •• е ее в
1 1« _ 'ft ft * * e® «1 ее е е ••
© y..... ft ft Q *5 9 Л ее ее ее 4 ее 4 ее е е
- • • &. & w «5 ее е ее е е 0 е ее е ее е
I S'y® 1 « 1 -.1 ‘s,. ' . ' ft & ' б ® @ • е в е е е е ее
Рис. 16-2. 126 возможных расположений четырех атомов в «мини-Вселен-ной», обладающей девятью клетками. Из всех возможных расположений только четыре (атомы изображены черным цветом) соответствуют «кри-
сталлам». Остальные (атомы изображены темно-синим цветом) соответствуют «газам». Из книги: Dickerson R.E., Geis I., Cherilistry, Matter and the Universe, Benjamin, Menlo Park, Calif, 1976.
[ id 60
ствуют кристаллам (они показаны черным цветом), а остальные 122 соответствуют газам. Даже в столь крошечной, ограниченной «Вселенной» вероятность получения газа в результате неупорядоченного расположения атомов намного превышает вероятность получения кристалла. Причина заключается в том, что определение кристалла включает значительно больше ограничений, чем определение газа:
Кристалл: четыре вплотную расположенных атома, образующих квадрат
Газ: четыре атома с произвольным расположением, за исключением конфигураций, приводящих к кристаллам
Для кристаллов И;. г = 4, а для газов W, = 122, следовательно, вероятность возникновения газа более чем в 30 раз превышает вероятность возникновения кристалла, а это значит, что неупорядоченность газа более чем в 30 раз больше неупорядоченности кристалла.
Если бы мы повторили наши рассуждения с четырьмя атомами во «Вселенной» из 16 клеток (4 х 4), получилось бы
всевозможных расположений, из которых только 9 отвечают кристаллам, а остальные 1811-газам (рис. 16-3). В такой «Вселенной» вероятность су-
Кристалл
Рис. 16-3. «Мини-Вселенная», располагающая 16 клетками, которые могут занимать четыре объекта. Четыре атома в этой «мини-Вселенной» дают всего 9 случайных расположений, соответствующих «кристаллам», и 1811 расположений, соответствующих «газам». Из книги: Dickerson R. Е., Geis Chemistry, Matter and the Universe, Benjamin, Menlo Park, Calif., 1976.
Энтропия. i hoooiKuci.h энергия i< химические реакции
61
ществования газа более чем в 200 раз превышает вероятность существования кристалла.
Если теперь перейти к реальному миру, в котором количество атомов принято измерять огромным числом Авогадро, а для атомов существует колоссальное множество мест, число W становится астрономически большим. В таком случае удобнее перейти к логарифмическому представлению чисел, указывая их показатели степени по основанию 10, например, используя вместо 10, 10000000 и 100000000000000 более удобные числа 1, 7 и 14. Энтропия, S, представляет собой просто число способов получения заданного состояния материи, выраженное в логарифмической форме:
S = kin И7 = 2,303/с 1g И7 (16-7)
io-4. ЭНТРОПИЯ И ХИМИЧЕСКАЯ ИНТУИЦИЯ
Больцман дал очень ясную интерпретацию понятия энтропии, связав ее с упорядоченностью и неупорядоченностью на молекулярном уровне. В приложении 3 наряду со стандартными теплотами образования веществ приводятся также их стандартные энтропии, S298. Не следует думать, однако, что эти величины получены из больцмановского выражения S = k In W. Они определяются в результате калориметрических измерений теплоемкостей твердых, жидких или газообразных веществ, а также теплот плавления и испарения при комнатной температуре и их экстраполяции к абсолютному нулю. (Способы вычисления значений S из таких чисто термохимических данных излагаются в более серьезных курсах химии.) Эти табулированные значения S298 называют абсолютными энтропиями, основанными на третьем законе термодинамики. Дело в том, что рассуждения, на которых основано их вычисление по данным тепловых измерений, были бы неполными без предположения, называемого третьим законом термодинамики и гласящего: энтропия идеального криртдлла при абсолютном нуле температур равна нулю. Содержание третьего закона представляется очевидным, если исходить из больцмановской статистической интерпретации энтропии.
Замечательным свойством абсолютных энтропий, основанных на третьем законе термодинамики, является то, что хотя их значения не определяются при помощи статистического выражения Больцмана (16-7), они полностью согласуются с ним. Если, следуя Больцману, интерпретировать измеренные значения абсолютной энтропии как меру упорядоченности и неупорядоченности на молекулярном уровне, можно обнаружить целый ряд важных закономерностей, которые становятся очевидными, если заменить слово энтропия словом неупорядоченность.
1. Энтропия (или неупорядоченность) возрастает всякий раз, когда жидкость или твердое вещество превращается в газ. В приложении 3 можно найти такие примеры:
Вещество: Na (тв.) Вг2 (ж.) 12 (тв.) Н2О (ж.) СН3ОН(ж.)
S°(tb. или ж.): 51,0 152,3 117,0 69,9 127,0
S°(r.): 153,6 245,4 260,6 188,7 236,0
Здесь и во всех других случаях энтропия выражается в джоулях на кельвин и на моль (Дж К “1 моль “1) или в энтропийных единицах (энтр. ед.) на моль; энтропийная единица определяется как джоуль на кельвин. Во всех случаях абсолютная энтропия конденсированной фазы приблизительно на 100 энтр. ед. моль-1 меньше, чем у того же вещества в газовой фазе, поскольку газам присуща большая внутренняя неупорядоченность.
2. Энтропия возрастает при растворении твердого вещества или жидкости в воде или в другом растворителе:
Вещество: СН3ОН (ж.) НСООН (ж.) NaCl (тв.)
S (тв. или ж.): 127,0 129 72,4
S° (р-р в Н2О): 132,3 164 115,4
Энтропия метанола, СН3ОН, при растворении возрастает лишь незначительно, поскольку моль молекул метанола, диспергированных между молекулами воды, оказывается ненамного больше неупорядоченным, чем моль чистого жидкого метанола. Растворение муравьиной кислоты, НСООН, приводит к большему возрастанию энтропии, поскольку ее молекулы частично диссоциируют на протоны и формиат-ионы, НСОО “, в результате чего из одной частицы образуются две. Кристаллическая решетка хлорида натрия при растворении полностью разрушается, и при этом образуются гидратированные ионы Na + и С1 “, что обусловливает значительное возрастание неупорядоченности, хотя часть молекул воды оказывается связанной вследствие гидратирования ионов. Заметим, что энтропия раствора NaCl получена из данных приложения 3 путем суммирования энтропий водных растворов двух ионов:
60,2 (Na+ ) + 55,2 (С1 ) = 115,4 энтр. ед. • моль 1 3 4
3. Энтропия уменьшается при растворении газа
в воде или в другом
растворителе:
Вещество: СН3ОН (г.) НСООН (г.) НО (г.)
S°(r.): 236 251 186,7
S° (р-р в Н2О): 132,3 164 55,2
Растворение газа в воде в какой-то мере подобно его конденсации в жидкость, если судить по близости контакта соседних молекул. Как и в рассмотренном выше случае, энтропия растворенного ионного соединения определяется путем суммирования энтропии его гидратированных ионов.
4. Энтропия возрастает при повышении массы частиц вещества, если прочие условия остаются неизменными:
'3ntniu:i.
' лилп;чес K:it‘ ^акиии
63
Вещество: F3 Cl2 Br2 I2 О O2 O3
S°(r.): 203 223 245 261 161 205 238
Этот важный принцип требует для своего объяснения привлечения квантовой механики. Из основ квантовой теории известно, что при возрастании массы атома или молекулы происходит увеличение расстояния между их энергетическими уровнями. Следовательно, большой, массивный предмет с определенной полной энергией имеет больше разрешенных квантовых состояний, и поскольку вероятность, W, в этом случае велика, большой должна оказаться и величина S = /с In W. Это рассуждение иллюстрируется рис. 16-4, где изображены четыре молекулы с суммарной энергией 6 единиц, причем в одном случае мы имеем дело с легкими молекулами, у которых энергетические уровни далеко отстоят друг от друга (рис. 16-4, а), а в другом случае-с более тяжелыми молекулами, у которых энергетические уровни расположены гораздо ближе друг к другу (рис. 16-4,6).
5. Энтропия ниже в ковалентно связанных твердых веществах с прочными, пространственно направленными связями, чем в кристаллах с частично металлическим характером связи:
Вещество: С (алмаз) Sn (серое алмазо- С (графит) Sn (белое ме-подобное) таллическое)
5°: 2,44 44,8 5,69 51,5
Алмаз и серое олово обладают трехмерной решеткой со связями ковалентного типа, расположенными в тетраэдрической ориентации. Графит со своими двумерными слоями атомов и белое олово с металлической упаковкой атомов представляют собой менее упорядоченные структуры, чем обе указанные выше алмазоподобные структуры, и поэтому их энтропии соответственно выше.
6. Энтропия, как правило, повышается по мере увеличения мягкости вещества и ослабления связей между атомами:
Вещество: С (алмаз) Be (тв.) SiO2 (тв.) РЬ(тв.) Н8(ж.) Hg(r.)
5°: 2,44 9,54 41,8 64,9 77,4 174,9
Состояние: прочный твердый кварц мягкий жидкость газ
кристалл металл металл
7. Энтропия тем больше, чем сложнее химический состав вещества. Это правило выполняется для кристаллов ионных солей с различным числом ионов на моль вещества:
Вещество: NaCl MgCl2 А1С13
S°(tb): 72,4 89,5 167
Оно также выполняется для кристаллов, подобных CuSO4 • пН2О с различным числом гидратных молекул воды:
и: 0135
5°. 113 150 225 305
Г .шва /6
Е0~9г9-9-
Рис. 16-4. Возрастание энтропии с массой частиц. Более тяжелая молекула обладает теснее расположенными энергетическими уровнями, что создает больше возможностей для получения моля таких молекул с заданной полной энергией. В рассматриваемом примере совокупность четырех молекул обладает шестью единицами энергии, и энергию каждой молекулы мож-
но представить, изобразив ее на одном из энергетических уровней. Из книги: Dickerson R. Е., Geis I.,
Chemistry, Matter and the Universe, Benjamin, Menlo Park, Calif., 1976.
а-легкие молекулы с далеко отстоящими энергетическими уровнями, W = 2; б-тяжелые молекулы с близко расположенными энергетическими
и для органических соединений, отличающихся друг от друга длиной углеродной цепи:
Вещество: СН4 С2Н6 С3Н8 С4Н10
S (г.): 186 230 270 310
На рис. 16-5 дано графическое представление молярных энтропий чистых элементов в различных физических состояниях. Все металлические твердые вещества обладают энтропией, не превышающей величины 80 энтр. ед. • моль “1, энтропии одноатомных газов находятся в пределах между 130 и 180 энтр. ед. • моль” *, а энтропии двухатомных и многоатомных газов имеют еще более высокие значения. Хотя абсолютные энтропии вычисляются при помощи третьего закона термодинамики лишь на основе измерения тепловых свойств веществ, они позволяют получить
£
1
Рис. 16-5. Абсолютные энтропии различных элементов в виде кристаллов, жидких или газообразных (одноатомных или многоатомных) веществ. Многоатомные газы обладают большей энтропией по сравнению с одноатомными газами из-за большей массы молекулярных частиц. Все одноатомные газы имеют приблизительно одинаковую молярную энтропию, несколько возрастающую пропорционально массе их атомов. Кристаллы с прочными связями имеют
меньшую энтропию. Кристаллы с металлической структурой обозначены темными кружками, неметаллические структуры-светлыми кружками. Для углерода указаны графит и алмаз. Для олова приведены металлическая белая форма и серая форма со структурой алмаза. Энтропия молекулярного кристалла 12 близка к энтропии других кристаллов, состоящих из небольших многоатомных молекул, например ICN (129), глицина (109), щавелевой кислоты (120) и мочевины (105).
3-796
Глава 16 66
сведения о молекулярном строении вещества, если известно, каким образом следует интерпретировать их. Несмотря на то что энтропия введена как довольно абстрактное понятие, связанное с тепловыми свойствами ве-» щества, она имеет недвусмысленную молекулярную интерпретацию. Энтропия является прямой и количественной мерой неупорядоченности молекулярной системы.
16-5, СВОБОДНАЯ ЭНБВГИЯ И СПОСОБНОСТЬ
К С АМОПРОИЗВОЛЬНОМУ fll'OI f К\Hl1lc ХИМИЧЕСКИХ 1'1 А! НИИ
Чем определяется способность химической реакции к самопроизвольному протеканию? Какие измеряемые или поддающиеся вычислению свойства систем Н2, С12 и НС1 указывают, что реакция между Н2 и С12 протекает самопроизвольно со взрывом при условиях, в которых разложение НС1 на Н2 и С12 практически не поддается наблюдению? В 1878 г. специалисты в области термодинамики француз Марселей Бертло и датчанин Юлиус Томсен* дали на эти вопросы неверный ответ, сформулировав принцип Бертло и Томсена', всякое химическое изменение, происходящее без участия внешней энергии, приводит к образованию определенного вещества или системы веществ с максимально возможным выделением теплоты. Другими словами, по Томсену и Бертло, все самопроизвольные реакции должны быть экзотермичными.
Если бы принцип Бертло и Томсена был правилен и если бы энтальпия системы реагирующих веществ уменьшалась в ходе любого самопроизвольного процесса, равновесие должно было бы достигаться в минимуме энтальпии, поскольку любой самопроизвольный процесс протекает в направлении к положению равновесия. В этом случае график изменения энтальпии Н в ходе реакции имел бы такой вид, как показано на рис. 16-6.
Однако не составляет труда найти исключения из принципа Бертло и Томсена, т.е. указать самопроизвольные реакции, протекающие с поглощением теплоты. Одним из примеров является испарение воды или любо-
* Не следует путать Бертло с Бертолле, а Томсена с Томсонами и Томпсоном. Во избежание путаницы приведем краткие сведения об этих ученых с созвучными фамилиями.
Клод Бертолле (1748-1822). Французский химик, противник закона постоянства состава соединений.
Марселей Бертло (1827-1907). Французский термодинамик.
Бенджамин Томпсон (1753-1814). Американский авантюрист, британский шпион при дворе курфюрста Баварии, основатель лондонского Королевского института. Вильям Томсон (1824-1907). Английский термодинамик, впоследствии получивший титул лорда (лорд Кельвин).
Юлиус Томсен (1826-1909). Датский термодинамик.
Дж. Дж. Томсон (1856-1940). Английский физик, открывший электрон; лауреат Нобелевской премии 1906 г.
Т.П. Томсон (1892-1976). Английский физик, лауреат Нобелевской премии 1937 г. за разработку метода дифракции электронов. Сын Дж. Дж. Томсона.
Энтропия, свободная знергия и химические реакции
67
Направление самопроизволь- । Направление самопроизвольного процесса —•- . ------нога процесса
Только Положение равновесия Только
Н2,С12 (Н2 + Cl2—2НС1)—- НС1
(2НС1^Н2 4- С12)
Рис. 16-6. Изменение энтальпии при условии справедливости принципа Бертло и Томсена. В этом случае все самопроизвольно протекающие реакции сопровождались бы выделением теплоты, а энтальпия обладала бы свойствами химической потенциальной функции, которая достигала бы
минимума в положении равновесия реакции. Однако это не соответствует действительности; можно указать самопроизвольные процессы, в которых происходит поглощение теплоты. Наиболее очевидным из них является испарение жидкости.
го другого вещества при парциальном давлении, меньшем давления насыщенных паров этого вещества при данной температуре. При испарении воды происходит поглощение теплоты:
Н2О(ж.) -> Н2О(г.) ДН°298 = + 44,0 кДж
Если бы принцип Бертло и Томсена был справедлив, все газы самопроизвольно конденсировались бы в жидкости, а все жидкости самопроизвольно превращались бы в твердые вещества, поскольку энтальпия при этом должна уменьшаться.
Подобно испарению воды, растворение кристаллов хлорида аммония в воде является самопроизвольным и эндотермическим процессом:
NH4C1(tb.) + Н2О -> NH4 (водн.) + С1~ (водн.)
ДН298 = + 15,1 кДж
з«
Глава 16
6»
Добавление воды к твердому NH4C1 приводит к столь сильному охлаждению стакана, что капли чистой воды на его внешней поверхности замерзают. Однако никому еще не приходилось наблюдать, чтобы разбавленный раствор хлорида аммония самопроизвольно разделился на кристаллы и чистую воду лишь по той причине, что в этом процессе должно произойти выделение теплоты.
Приведем еще один пример. Пентоксид азота представляет собой неустойчивое вещество, которое разлагается, иногда со взрывом, на NO2 и О2:
N2O5(tb.) - 2NO2(r.) + уО2(г.)
АН298 = + 109,5 кДж
однако при этом происходит поглощение большого количества теплоты.
Можно привести много других примеров самопроизвольно протекающих процессов, которые сопровождаются поглощением теплоты. Однако невозможно определить положение равновесия путем поиска минимума энтальпии. Энтальпия не является мерой способности реакции к самопроизвольному протеканию.
Все три описанные выше реакции протекают, несмотря на необходимость поглощения при этом теплоты, потому, что их продукты обладают большей внутренней неупорядоченностью, чем исходные реагенты. Пары воды характеризуются большей неупорядоченностью и, следовательно, имеют большую энтропию, чем жидкая вода. Гидратированные ионы NH4 иСГ имеют большую энтропию, чем кристаллический NH4C1. Газообразные NO2 и О2 обладают большей неупорядоченностью и имеют большую энтропию, чем твердый N2O5. Химическая система стремится не только к состоянию с минимальной энергией или энтальпией, но также к состоянию с максимальной неупорядоченностью (вероятностью, или энтропией). На этом основании следует ввести новую функцию состояния, называемую свободной энергией, G:
G=- H - TS (16-8)
Нетрудно показать, что для реакций, протекающих при постоянном давлении и температуре, самопроизвольным является всякий процесс, в результате которого происходит уменьшение свободной энергии. Рассмотрим полную свободную энергию, G, системы веществ в реакционном сосуде; изменение свободной энергии этой системы в результате химической реакции связано с изменениями энтальпии и энтропии соотношением
AG = АН - TAS (16-9)
НоН = Е + РГ,а при постоянном давлении
АН = АЕ + РАИ
Энтропия, свободная шергия и химические реакции
и, согласно первому закону термодинамики, АЕ = q — w
Допустим, что реакция не сопровождается выполнением электрической или какой-либо иной работы, кроме работы типа PV в результате расширения или сжатия реагентов и продуктов. Тогда w = РАИ. Это позволяет записать
ДЕ = q - РАИ
АН = q - РАИ + РАИ = q
Последнее равенство означает, что изменение энтальпии при постоянном давлении совпадает с теплотой реакции; этот вывод нам уже знаком. Подстановка q вместо АН в уравнение (16-9) дает
AG = q - TAS (16-10)
Выше мы уже упоминали, что для обратимых реакций AS = q/T [см. уравнение (16-3)]. Следовательно, q = TAS и, таким образом, для обратимых реакций, проводимых при постоянных давлении и температуре, должно выполняться условие
AG = 0 (16-11)
Что же происходит при необратимых реакциях? Возрастает ли в таких реакциях свободная энергия или уменьшается, а может быть, ее изменения зависят от конкретных обстоятельств?
На этот вопрос можно ответить, если воспользоваться соотношением (16-4). Любая реальная, необратимая реакция сопровождается изменением энтропии, большим чем q/T. Следовательно, AS > q/T, или TAS > q. Отсюда следует, что, согласно уравнению (16-10), для необратимых реакций должно выполняться соотношение AG < 0.
Оба полученных результата можно объединить в общий вывод: любая реакция, самопроизвольно протекающая при постоянных давлении и температуре, должна обязательно сопровождаться уменьшением свободной энергии, G. Когда реакционная система достигает положения равновесия, G принимает минимальное значение, a AG становится равным нулю. Такое поведение функции G графически изображено на рис. 16-7.
Трудно переоценить важность этих результатов для химиков. Свободная энергия представляет собой тот пробный камень, который позволяет заранее предсказать, будет ли самопроизвольно протекать интересующая нас реакция, останется ли она в положении равновесия или же самопроизвольно потечет в обратном направлении.
В заключение отметим следующее важное обстоятельство. Поскольку свободная энергия, G, подобно функциям Н, Т тл S, которые в нее входят, представляет собой функцию состояния, не имеет значения, изменяются ли в ходе реакции. давление и температура, если они приводятся к исходным значениям по завершении реакции. Хотя сформулированные выше условия относительно поведения функции G при достижении равновесия
Глава 16
Поправление самопроизволь-\ Направление самопроизволь-ного процесса---------»- । —------ново процесса
Только реагенты Положение Только продукты равновесия ' J
Степень завершенности реакции-----
Рис. 16-7. Изменение свободной энергии при постоянных температуре и давлении. В этих условиях G обладает свойствами химической потенциальной функции. Все самопроизвольно протекающие процессы
сопровождаются уменьшением свободной энергии, а в положении равновесия изменение свободной энергии реакции в любом направлении равно нулю.
получены в предположении о неизменности давления и температуры, они в равной мере применимы к высокотемпературным взрывам, если только реакционный сосуд и его содержимое после завершения реакции возвращаются к температуре* 298 К и давлению 1 атм.
Изменение свободной энергии при совершении внешней работы
Если обратимый процесс не сопровождается выполнением внешней работы, то, как было показано выше, свободная энергия реакционной системы не изменяется: AG = 0. Но что происходит, если в ходе обратимого процесса система выполняет электрическую, магнитную или гравитационную работу над своим окружением? Ответ на этот вопрос понадобится нам в гл. 19 при рассмотрении электрохимических процессов.
Если работа типа PV не является единственной совершаемой работой, то
w = Р Л V -I- И’ 116-171
л и г -Г- г‘внеш
* В данной главе рассматриваются только реакции, протекающие при 298 К. Свободная энергия зависит от изменения температуры; в следующих главах мы убедимся в этом на конкретных примерах.
Энтроиич :вчд<’1>на:< зиерги.ч и химические реакции 71
где н’внеш означает все остальные типы работы. Следовательно,
АЕ = q - РАУ - н>внеш
а изменения энтальпии и свободной энергии определяются подобно тому, как это было сделано выше:
АН q ^внеш
AG = q - TAS - wBHeul = - и>внеш
Последний результат и является целью нашего вывода:
AG = -ивнеш (16-13)
Когда химическая система выполняет работу над своим окружением в ходе обратимого процесса, уменьшение свободной энергии системы в точности совпадает с той частью работы, которая не является работой типа PV. Например, работа, выполняемая гальваническим элементом, является мерой уменьшения свободной энергии этого элемента. И наоборот, если к электродам электролитического элемента, подобного описанному в разд. 1-7, приложено напряжение, то электрическая работа, выполняемая над электролитическим элементом (и измеряемая методами, которые будут рассматриваться в гл. 19), равна приросту свободной энергии химических веществ внутри него. Когда при пропускании электрического тока через воду происходит ее электролитическая диссоциация, использованная для этого электрическая работа расходуется на увеличение свободной энергии газообразных водорода и кислорода по сравнению со свободной энергией жидкой воды:
Н2О (ж.) -> Н2 (г.) + у О2 (г.)
AG° = + 237,2 кДж
Такая свободная энергия может высвободиться в виде теплоты при сгорании газообразных водорода и кислорода. Вместо этого при использовании надлежащего прибора можно снова превратить свободную энергию в работу. [В топливном элементе, применявшемся для выработки электрического тока в космйческих аппаратах, летавших на Луну, использовалась
описанная выше реакция Н2 + уО2. Если бы вместо этого водород про
сто сжигался в кислороде, часть свободной энергии превращалась бы в теплоту и, согласно второму закону термодинамики, не могла быть превращена в работу. Способ эффективного использования энергии заключается в том, чтобы предотвратить ее превращение в теплоту на всех стадиях процесса. В этом и состоит секрет высокой эффективности метаболических процессов (см. гл. 21).]
Глава 16
Расчеты со стандартными свободными энергиями
В приложении 3 приведены табулированные стандартные свободные энергии образования соединений из элементов в их стандартных состояниях. Стандартные состояния для газа, чистой жидкости или чистого кристалла определяются таким же образом, как и в случае энтальпий: для газа - парциальное давление 1 атм, а для чистой жидкости или чистого кристалла-обычно 298 К. Стандартным состоянием растворенного вещества в растворе считается концентрация 1 моль на литр раствора, т. е. 1 М раствор. Стандартным состоянием компонента раствора при табулировании энтальпий считается не 1 М раствор, а настолько разбавленный раствор, что добавление к нему дополнительного количества растворителя не приводит к новым тепловым эффектам. Однако поскольку энтальпия не слишком сильно зависит от концентрации (в отличие от свободной энергии, в чем мы убедимся в разд. 16-6), можно приближенно считать, что табулированные значения энтальпий относятся к 1 М раствору.
Вернемся теперь к приведенным выше химическим примерам и дадим им объяснение, пользуясь данными о свободной энергии. Протекающая со взрывом реакция между Н2 и С12 характеризуется следующими молярными свободной энергией, энтальпией и энтропией реагентов и продуктов:
Н2 + С12 - 2НС1
АН, кДж - моль 1: 0,0 0,0 -92.31
AGG, кДж моль - 1: 0,0 0,0 - 95,27
ASC, Дж-К-1 моль-1: 130,6 223.0 186,7
В этой реакции высвобождается 92,31 кДж теплоты в расчете на моль полученного НО, а свободная энергия уменьшается на большую величину: 95,27 кДж моль-*. Откуда же берется этот избыток движущей силы реакции?
Согласно записанному выше уравнению реакции с образованием 2 молей НО, ДН° = — 184,6 кДж и AGC = — 190,5 кДж. Энтропия реакции равна AS° = 2 (186,7) — 130,6 — 223,0 = + 19,8 энтр.ед. Следовательно, TAS = 298 К • 19,8 энтр.ед. = 5900 Дж = 5,90 кДж. Проверим уравнение (16-9):
AG = АН - TAS
- 190,5 = - 184,6 - 5,9
- 190,5 = - 190,5
2 моля НО обладают несколько большей неупорядоченностью и несколько большей энтропией, чем 1 моль газообразного Н2 и 1 моль газообразного С12. Большая часть движущей силы этой реакции, выражаемой ее свободной энергией, обусловлена высвобождением теплоты, но 3% движущей силы обусловлены тем, что продукты имеют большую энтропию, чем реагенты.
Энтропия, свободная энергия и химические реакции
73
Стандартная свободная энергия порядка — 191 кДж указывает на наличие очень большой движущей силы реакции; такая движущая сила часто приводит к взрыву. Обратимся теперь к более спокойной реакции-получению аммиака из водорода и азота.
Пример 1
Чему равны стандартные изменения свободной энергии, энтальпии и энтропии для реакции
ЗН2 + N2 - 2NH3
Благоприятствуют ли энтальпийный и энтропийный факторы протеканию этой реакции в прямом направлении или же, наоборот, препятствуют ему?
Решение
В приложении 3 находим
AG° = 2 ( - 16.64) - 3 (0,0) - (0,0) = - 33,28 кДж
ДН = 2( - 46,19) - 3 (0,0) - (0,0) = - 92,38 кДж
Д№ = 2(192,5) - 3(130,59) - (191,49) = - 198,26 энтр.ед.
и, следовательно, при 298 К TAS = - 59,08 кДж.
Проверка уравнения (16-9) дает
AG = ДЯ - TAS
- 33,28 = - 92,38 + 59,08
Высвобождение 92,38 кДж теплоты благоприятствует протеканию реакции, но из этой величины нужно вычесть 59,08 кДж, поскольку продукты значительно больше упорядочены, чем реагенты, и имеют на 198,3 энтр.ед. более низкую энтропию по сравнению с реагентами. Другими словами, из 92,38 кДж высвобождаемой теплоты 59,08 кДж расходуются на создание более упорядоченной системы и лишь 33,28 кДж определяют движущую силу реакции.
Движущая сила реакции синтеза аммиака намного меньше движущей силы реакции образования НС1 главным образом из-за энтропийного фактора. А возможны ли такие случаи, когда энтропийный фактор преобладает над тепловым и заставляет протекать реакцию в направлении, противоположном тому, на который указывает изменение энтальпии? Такие ситуации возможны, и именно в них нарушается принцип Бертло и Томсена.
Пример 2
Вычислите изменения свободной энергии, энтальпии и энтропии для процесса испарения жидкой воды. Проверьте при помощи полученных вами результатов уравнение (16-9). Какая часть свободной энергии, энтальпийная или энтропийная, ответственна за протекание процесса испарения?
Решение
Этот вопрос таит подвох. Дело в том, что стандартные значения интересующих нас величин равны ДО° = + 8,60 кДж, ДЯ° = +44,01 кДж, Д5' = 118,8 энтр. ед. и
Г.има I fi 74
TAS = +35,41 кДж. Они показывают, что вода не должна испаряться. Однако все это на самом деле лишь означает, что если водяные пары имеют парциальное давление 1 атм и температуру 298 К, то они будут самопроизвольно конденсироваться. Если же парциальное давление водяных паров равно только нескольким миллиметрам, вода будет самопроизвольно испаряться. Зависимость AG от концентрации обсуждается в следующем разделе.
Пример 3
Вычислите изменения свободной энергии, энтальпии и энтропии для реакции
NH4C1 (тв.) -» NH4 (водн.) + С1 “ (водн.)
(Предполагается, что растворитель-вода-до и после реакции присутствует в равных концентрациях и поэтому ее можно исключить из рассмотрения.) Благоприятствуют ли энтропийный и энтальпийный факторы растворению хлорида аммония или препятствуют ему?
Решение
AG° = - 6,77 кДж, ЛН° = + 15,14 кДж, AS° = + 73,4 энтр.ед; TAS° = + 21,9 кДж. Изменение энтальпии на 15,14 кДж препятствует протеканию реакции, но изменение энтропийного фактора на 21,9 кДж благоприятствует ему. Результирующая движущая сила реакции, определяемая изменением свободной энергии, составляет 6,77 кДж.
Пример 4
Вычислите изменения свободной энергии, энтальпии и энтропии для реакции разложения N2O5:
N2O5 (тв.) - 2NO2 (г.) + уО2(г.)
Решение
AG° = 2( +51,84) + у (0,0) - (134) = -30,3 кДж АН° = 2 ( + 33,85) + у (0,0) - ( - 41,8) = + 109,5 кДж AS0 = 2( + 240,5) + у (205,0) - (ИЗ) = +470 энтр.ед. 298 • 470 Дж К-1
TAS° =-----------------г- = + 140 кДж
1000 Дж кДж’1
AG0 = ЛЯ° - TAS0 - 30,3 = + 109.5 - 140 - 30,3 X -30,5
Препятствующее разложению N2O5 поглощение почти ПО кДж теплоты с избытком компенсируется большей энтропией газообразных про
Энтропия, свободная энергия и химические реакции
75
дуктов, и в результате реакция протекает со стандартной движущей силой, определяемой уменьшением свободной энергии приблизительно на 30 кДж.
Итак, движущая сила реакции, проводимой при постоянных давлении и температуре, измеряется изменением свободной энергии продуктов по сравнению с реагентами. Если изменение свободной энергии отрицательно, реакция протекает самопроизвольно; если изменение свободной энергии положительно, реакция протекает самопроизвольно в противоположном направлении; если же изменение свободной энергии равно нулю, реагенты и продукты находятся в равновесии. Изменение свободной энергии складывается из двух составляющих: AG = АН — TAS. Значительное уменьшение энтальпии, означающее выделение теплоты, благоприятствует протеканию реакции. Но следует учитывать и другой фактор. Значительное возрастание энтропии при образовании продуктов из реагентов также благоприятствует реакции. При обычных температурах энтропийный фактор, как правило, невелик, и поэтому AG и АН имеют одинаковые знаки. В таких случаях самопроизвольные реакции оказываются экзотермическими. Но возможны и другие варианты, когда энтальпийный и энтропийный факторы действуют в противоположных направлениях, и может случиться, что энтропийный член оказывается преобладающим. Это относится главным образом к реакциям, в которых происходит превращение твердого или жидкого вещества в газы или растворы.
До сих пор мы говорили только о стандартных концентрациях, понимая под ними для газов парциальное давление в 1 атм, для конденсированных фаз-чистые жидкости и чистые кристаллы, а для растворов-1 М концентрацию. Рассмотрим теперь, как изменяется свободная энергия при изменениях концентрации.
16-6. СВОБОДНАЯ ЭНЕРГИЯ И КОНЦЕНТРАЦИЯ
Пока что нам удавалось избежать математических выкладок. Теперь придется прибегнуть к ним для вывода уравнения, определяющего зависимость свободной энергии от концентрации. Напомним определение функции свободной энергии:
G = Н - TS = Е + PV - TS
Вместо небольших, но конечных изменений (AG, АЕ, AS), происходящих при постоянной температуре, которые учитываются в уравнении (16-9), рассмотрим бесконечно малые изменения (JG, dE и JS), происходящие при произвольных экспериментальных условиях. Тогда уравнение, при помощи которого вводится свободная энергия, дает
dG = dE + PdV + VdP - TdS - SdT
Если воспользоваться такими бесконечными малыми изменениями, то первый закон термодинамики выразится следующим образом:
dE = dq — dw
(16-14)
f .ILIAC /6
76
и тогда выражение для свободной энергии приобретает вид *
dG = dq - dw + PdV + VdP - TdS - SdT
Это выражение можно значительно упростить. Если реакция протекает при постоянной температуре, то SdT = 0, поскольку dT, изменение температуры, равно нулю. Если реакция протекает обратимо, то dq = TdS, а если единственной совершаемой в ходе реакции работой является работа типа PV, то dw = PdV. В правой части последнего уравнения все члены, за исключением одного, взаимно сокращаются, и мы получаем
dG = VdP (16-15)
Для 1 моля идеального газа V = RT/P и, слеДойательно,
dP
dG = RT — = PTdln P (16-16)
Интегрируя последнее уравнение (суммируя все бесконечно малые изменения в его левой и правой частях соответственно), находим
р.
G2 = G, + RTln — (16-17)
Pi
Это уравнение позволяет, зная молярную свободную энергию идеального газа Gt при парциальном давлении р1( вычислить его молярную свободную энергию G2 при парциальном давлении р2. Хотя уравнение (16-17) выведено для обратимого перехода от состояния с парциальным давлением Р] к состоянию с парциальным давлением р2, оно в равной мере применимо и к необратимым процессам, поскольку свободная энергия, G, является функцией состояния и ее изменения не зависят от способа перехода из состояния 1 в состояние 2.
Допустим теперь, что состояние 1 является стандартным состоянием, соответствующим парциальному давлению 1 атм, а состояние 2 произвольно. Тогда уравнение (16-17) может быть записано в общем виде:
/ р \
G = G° + RTlnf (16-18)
где р° = 1 атм. В качестве свободной энергии соединения в стандартном состоянии, G°, можно использовать его свободную энергию образования, взяв ее значение из приложения 3, где указаны величины AG0 при 298 К. Такая замена оправдана, поскольку в любой химической реакции выполняется закон сохранения вещества, а реагенты и продукты должны быть получены из одинаковых по типу и количеству элементов в их стандартных состояниях. Если применять уравнение (16-18) к изменениям свободной энергии AG реакций, то вклады элементов в их стандартных состояниях в левой и правой частях уравнения реакции (для реагентов и продуктов) взаимно скомпенсируются.
Энтропия, свободная энергия и химические реакции
77
Вычислим теперь зависимость свободной энергии аммиака от его парциального давления в смеси газов (точнее, свободную энергию образования аммиака из составляющих элементов в их стандартных состояниях). Поскольку стандартная свободная энергия образования аммиака при 298 К равна — 16,64 кДж моль-1, можно записать
Gnh = - 16,64 + RTlnf у 1 атм у
GNH = - 16,64 + 2,303RT In з \ 1 атм )
Полагая R = 8,314 Дж К-1 моль-1 и Т= 298 К, найдем 2,303RT = = 5706 Дж моль-1 = 5,706 кДж моль-1 (это число рекомендуется запомнить). Таким образом,
Gnh = - 16,64 + 5,7061g з 1 атм
На рис. 16-8 изображен график зависимости молярной свободной энергии аммиака от его парциального давления. (Точнее, там указана молярная свободная энергия образования аммиака при различных давлениях из Н2 и N2 в их стандартных состояниях.) Этот график представляет собой прямую линию, поскольку давление отложено в логарифмической шкале. Отношение парциального давления вещества к его парциальному давлению в стандартном состоянии принято для краткости называть активностью, обозначая ее буквой а:
Р а = —
Р
Поскольку в качестве стандартного состояния выбирается парциальное давление 1 атм, активность газа численно совпадает с его парциальным давлением, но активность представляет собой безразмерную величину. Это облегчает использование активностей; не следует удивляться тому, что в выражении “In р” мы берем логарифм от величины, которая имеет размерность, так как на самом деле правильной формой записи является “In (р/1 атм)”.
Возвращаясь к нашему примеру с аммиаком, можно записать общее соотношение между его свободной энергией и давлением таким образом:
6"nh = ^nh + RT]n aNH 3 3 3
Точно так же можно поступить для всех реагентов и продуктов j в произвольном химическом процессе:
Gj = GJ + RTincij = Gj + 2,303 RTlga; (16-19)
Г itifii: 16
Рис. 16-8. Зависимость свободной энергии газа от его парциального давления, определяемая уравнением G = = G° + RTIn (р/р°). Представлена зависимость свободной энергии аммиа-
ка от его парциального давления, определяемая уравнением GNH = — - 16,64 + 5,706 lg (pNHa/l атм). Давление, р, отложено в логарифмической шкале.
Применим это соотношение к реакции синтеза аммиака
N2 + ЗН2 2NH3
Мы записали это уравнение с двойными стрелками, поскольку нам придется рассматривать не только прямую, но и обратную реакции. Для каждого из реагентов и продуктов можно записать:
GN = G^ + RT In aN 2 2 2
GH — G„ + KT In aH 2 2 2
Gnh — ^nh + К Tin aNH
Полное изменение свободной энергии в этой химической реакции
AG = 2Gnh - Gn - 3GH
AG = 2G°NHj - G^2 - 3G°H2 + 2KTlnaNHj - KTlnflNa - 3KTlnaH2
Энтропия, свободная энергия и химические реакции
79
Первые три члена в правой части последнего равенства в совокупности представляют собой уже известную нам стандартную свободную энергию реакции, AG°. Вводя коэффициенты перед остальными членами вида RT в показатели степени логарифмируемой величины, можно записать
AG = AG° + /?Г1па^нз — RTinaNi — RThia^
и окончательно
(2 \
---(16-20)
Рассмотрим подробнее выражение в скобках. Оно представляет собой отношение активностей продуктов к активностям реагентов и совпадает с кажущейся константой равновесия Q, введенной в гл. 4, с тем лишь отличием, что концентрации в данном случае выражены через активности, а не через моли на литр:
(16-21)
Выражение (16-21) имеет более общий вид, чем использовавшееся ранее выражение (4-10) для кажущейся константы равновесия, и позволяет получить более полное представление о равновесии. Кажущаяся константа равновесия Q может быть вычислена для любых экспериментальных условий по данным о парциальных давлениях реагентов и продуктов.
Истинное изменение свободной энергии в реакции образования аммиака складывается из стандартного изменения свободной энергии (для которого б = 1и1п(2 = 0)и члена, включающего кажущуюся константу равновесия и учитывающего реальные условия эксперимента. Подстановка в уравнение (16-20) имеющихся численных значений дает
AG = - 33,30 + 5,706 1g Q (кДж) (16-22)
Отметим, что, поскольку AG° = 2G^Hj — G^ — 3(^г = 2AG^Hi, свободная энергия в уравнении (16-22) должна вдвое превышать значение, приведенное в приложении 3 для свободной энергии образования 1 моля газообразного NH3.
В табл. 16-1 приведены результаты применения уравнения (16-22) к 11 вариантам исходных условий синтеза аммиака. Это не последовательные моменты одной реакции, начинающейся из одинаковых исходных условий, а именно наборы различных исходных условий проведения реакции. В самой правой колонке таблицы приведены изменения свободной энергии AG реакции синтеза аммиака при конкретных указанных концентрациях реагентов и продуктов. Вопрос о том, как проследить течение реакции от начала до конца, рассматривается в гл. 17.
В эксперименте А исходные парциальные давления газообразных азота и водорода равны 1 атм, а аммиак вообще отсутствует. Поэтому движу-
Глава 16
80
Свободная энергия реакции синтеза аммиака при 298 к N2(r.) + ЗН2(г.) V 2NH3(r.) AG = -33,30 + 5,7061gQ Q=-“^L- “N^H, Таблица 16-1
Эксперимент °n2 °H2 °NH3 Q 5,706 lg(2, кДж AG, кДж
А 1 1 0 0 — OO — oo
В 1 1 0,001 10'6 -34,24 -67,51
С 1 1 0,1 10'2 -11,64 -44,69
D 1 1 1 1 0 -33,30
Е 1 1 100 104 + 22,83 -10,44
F 1 1 825 6,8 10s + 33,30 0
G 1,47 0,01 1 6,8 • 105 + 33,30 0
Н 0,01 0,1 2,61 6,8 • 105 + 33,30 0
I 0,01 0,1 26,1 6,8 • 107 + 44,77 + 11,50
J 0,01 0,01 100 1012 + 68,48 + 35,21
К 0 1 1 GO + oo + 00
щая сила реакции образования аммиака имеет бесконечно большую величину. Но если исходная концентрация аммиака составляет всего 10~3 атм, изменение свободной энергии увеличивается от - со до - 67,51 кДж, а движущая сила образования нового количества аммиака ослабевает (эксперимент В). Если бы мы провели эксперимент С, в котором исходные парциальные давления N2 и Н2 равны 1 атм, а парциальное давление аммиака составляет 0,1 атм, то обнаружилось бы, что свободная энергия реакции равна — 44,69 кДж. Чем больше продуктов и чем меньше реагентов имеется в наличии, тем меньше движущая сила образования дополнительного количества продуктов. При одинаковых концентрациях (1 атм) всех трех газов изменение свободной энергии совпадает со стандартной свободной энергией реакции (эксперимент D). В эксперименте Е избыточное количество аммиака делает движущую силу реакции меньшей, чем в стандартном состоянии. В экспериментах F, С и Н движущая сила образования продуктов совершенно отсутствует. Эти эксперименты относятся к состоянию равновесия. В состоянии равновесия
AG = 0 и AG° = - RTln Q
Как мы уже знаем из гл. 4, кажущаяся константа равновесия при равновесии превращается в истинную константу равновесия, Значение истинной константы равновесия можно вычислить из стандартной свободной энергии реакции, если воспользоваться предыдущим уравнением в потен
Энтропия, свободная энергия и химические реакции 81
цированной форме:
^2
Кравн = —— = e-(4G“/Rr) = 10С<- ”№03 RT] = 6>8.105 ^n2^h2
Если кажущаяся константа равновесия меньше истинной константы равновесия, реакция протекает самопроизвольно в сторону образования продуктов. Но если условия проведения реакции таковы, что кажущаяся константа равновесия больше истинной константы Кравн, реакция самопроизвольно протекает в обратном направлении (см. эксперименты I, J и К в табл. 16-1). Когда кажущаяся константа равновесия совпадает с Кравн, прямая и обратная реакции протекают с одинаковой скоростью и химическая система находится в положении равновесия.
Общие выражения
До сих пор вывод выражения для свободной энергии проводился на примере реакции синтеза аммиака. Рассмотрим теперь реакцию общего вида, в которой г молей вещества R соединяются с s молями вещества S, в результате чего образуется t молей вещества Т и и молей вещества U:
rR + sS = tT + uU (16-23)
Изменение свободной энергии для такой реакции равно
AG = tGT + uGv — rGR — sGs (16-24)
Каждую из входящих в это равенство свободных энергий можно выразить через активность соответствующего вещества:
Gr = G°r + RTln aR Gs = Gcs + RTlnas GT= G°T+ RTlnor (16-25)
Go = G°u + RT In a(I
Теперь подставим их в уравнение (16-24). Получим
AG=AG° + RTlnQ (16-26)
где
AG° = tG°T + uG°v - rG°R - sG°s (16-27)
и
а*т <juij
Q = -~r (16-28)
a n<»s
Уравнение (16-26) дает изменение свободной энергии для реакции при произвольных условиях. В частном случае, при равновесии, AG = 0 и
I.JbU
Q = ^равн (константа равновесия) (16-29)
-AG^RTln^ (16-30)
Крав- = (16-31)
Заметим, что выражения для кажущейся константы равновесия, Q, и для
истинной константы равновесия, Краан, зависят только от общей стехиометрии реакции, а не от конкретного механизма реакции. Чтобы записать выражение для константы равновесия, нет необходимости знать подробности протекания реакции на молекулярном уровне. Это важное обстоятельство уже упоминалось в гл. 4, но теперь получило термодинамическое подтверждение.
Пример 5
Вычислите константу равновесия реакции
Н2(г.) + С12(г.) = 2НС1(г.)
при 298 К и сравните ее с константой равновесия реакции синтеза аммиака.
Решение
Ранее мы уже установили, что свободная энергия этой реакции равна — 95,27 кДж на моль НС1, т.е. —190,5 кДж на 2 моля НС1, как требуется по уравнению реакции. Следовательно,
Кравн = e[-'-,90'Wr] = 10 + (19ад5'7О6> = 10W = 2,5.1033
Константа равновесия, Кравн, для реакции синтеза аммиака имеет гораздо меньшую величину, 6,8 105. Реакция НС1 совершенно отлична от нее; положение ее равновесия лежит в области высокой концентрации НО и очень низкой концентрации реагентов. Концентрации Н2, С12 и НС1 в состоянии равновесия определяются выражением
Д2нс1
ДН2«С12
= Кравн = 2,5-1033
Если чистый газ НС1 поместить в сосуд под давлением в 1 атм, часть НС1 самопроизвольно диссоциирует с образованием Н2 и С12, но их парциальные давления достигнут всего около 2-10“17 атм. В гл. 17 мы познакомимся с тем, как делать подобные предсказания для реакций, менее полно сдвинутых в одном направлении, чем реакция с участием НС1.
ЗАКЛЮЧЕНИЕ
В этой главе был получен ответ на важный для химии вопрос, который интересовал нас еще в то время, когда мы впервые стали обсуждать в гл. 2 энергии химических реакций: какой критерий позволяет решить, является ли самопроизвольной данная химическая реакция, и как найти условия ее равновесия? Такой критерий удается установить с помощью свободной
Энтропия. свободная энергия и химические реакции 83
энергии G (по крайней мере для реакций, протекающих при постоянных давлении и температуре), которая в свою очередь определяется через энтропию S.
Энтропия является мерой неупорядоченности системы. В принципе ее можно вычислить (иногда так поступают и на самом деле) по числу различных микроскопических способов построения той же самой наблюдаемой ситуации. Абсолютные энтропии, получаемые на основании третьего закона термодинамики из чисто термохимических измерений, хорошо согласуются с больцмановской статистической оценкой энтропии для различных веществ.
Способность реакции к самопроизвольному протеканию при постоянных давлении и температуре измеряется изменением свободной энергии AG в расчете на моль реакции. Если для реакции, которая может сопровождаться выполнением единственного вида работы типа PV, изменение свободной энергии, AG, отрицательно, реакция протекает самопроизвольно. Если же AG положительно, реакция протекает самопроизвольно в обратном направлении. В тех случаях, когда AG = 0, реакция находится в состоянии равновесия. Другими словами, свободная энергия представляет собой’ химическую потенциальную функцию, минимизация которой позволяет определить положение химического равновесия.
Если помимо работы типа PV обратимая химическая реакция может сопровождаться выполнением какого-либо иного вида работы, например электрической, то изменение свободной энергии в ходе такой реакции отлично от нуля. Свободная энергия химической системы в ходе такой обратимой реакции уменьшается на величину, эквивалентную работе, выполненной системой над ее окружением: AG = — %неш.
Свободная энергия реакции является результатом двух эффектов: изменения теплосодержания и изменения степени неупорядоченности системы: AG = АН — TAS. Осуществлению реакции благоприятствуют выделение теплоты (отрицательное значение АН) и большая неупорядоченность продуктов по сравнению с реагентами (отрицательное значение величины — 7AS или положительное значение AS). Обычно, хотя и не всегда, преобладающим членом правой части уравнения AG = АН — 7AS является энтальпийный член АН.
Свободная энергия газа зависит от его парциального давления по уравнению G2 = Gx + RT\n(p2lpr). Активностью газа, а, называется отношение его парциального давления к стандартному давлению 1 атм. Поэтому свободная энергия газа при произвольном давлении определяется выражением G = G° + RT In а.
Изменение свободной энергии газовой реакции зависит от парциальных давлений ее компонентов по уравнению AG = AG° + R Т In Q. Величина Q представляет собой кажущуюся константу равновесия, определение которой было введено в гл. 4. В частном случае, когда реагирующая химическая система находится в положении равновесия, свободная энергия реакции равна нулю (AG = 0) и кажущаяся константа равновесия совпадает с истинной константой равновесия, Q = Кравн. В этом случае стандартная
Глава 16 84
свободная энергия реакции и константа равновесия связаны между собой соотношением
AG° = - RT In Кравн, или Кравн =
При произвольно заданных экспериментальных условиях, в тех случаях когда кажущаяся константа равновесия меньше истинной константы равновесия, реакция протекает самопроизвольно в прямом направлении. Если Q больше, чем Кравн, самопроизвольно протекает обратная реакция. В состоянии равновесия Q = Кряв„.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Дайте объяснение описанного в разд. 3-6 примера с тормозящим автомобилем на основании первого и второго законов термодинамики. Какую роль в этом объяснении играет первый закон термодинамики? Какое значение имеет для этого примера обратимость или необратимость процесса и как она связана со вторым законом термодинамики?
2. Объясните, как тепловая и кинетическая энергии описывают движение объектов макро- и микромира. Какой из этих видов энергии описывает движение на молекулярном уровне?
3. Какое превращение энергии подчиняется строгим ограничениям: превращение макроскопического движения в молекулярное или, наоборот, превращение молекулярного движения в макроскопическое? Каким образом связан с этой проблемой второй закон термодинамики? (Что легче-смешать мешок красных бобов с мешком белых бобов или рассортировать их?)
4. Каким образом, согласно представлениям классической термодинамики, энтропия связана с теплотой и температурой? Как зависит соотношение между ними от того, проводится ли процесс обратимым или необратимым способом?
5. С чем связана энтропия, согласно Больцману? Почему его определение энтропии удобнее выражать в логарифмической форме?
6. Почему энтропия кристалла меньше, чем энтропия того же вещества в газообразном состоянии?
7. Почему, согласно Больцману, энтропия идеального кристалла обращается в нуль только при абсолютном нуле температуры?
8. Почему растворение твердого или жидкого вещества в воде приводит к возрастанию энтропии, тогда как растворение газа вызывает уменьшение энтропии?
9. Почему энтропия вещества увеличивается с его массой?
10. Почему энтропия сшитого полимера меньше, чем энтропия мономера до полимеризации?
11. Увеличивается ли энтропия водного раствора ионов кальция в результате окружения их молекулами воды? Как объяснить, связав это с ответом на первый вопрос, явление гидратации ионов в растворе?
12. Что больше: энтропия моля льда или энтропия моля жидкой воды?
Энтропия, свободная энергия и химические реакции
85
Как связать с ответом на первый вопрос объяснение процесса замерзания воды?
13. Что больше: энтальпия моля воды или энтальпия моля водяных паров? Как связать с ответом на первый вопрос объяснение процесса испарения воды?
14. Почему неверно утверждение, что во всех самопроизвольных процессах система смещается к состоянию с минимальной энергией? Как формулируется правильное утверждение?
15. Почему неверно утверждение, что во всех самопроизвольных процессах происходит повышение энтропии? Для каких термодинамических систем справедливо это утверждение?
16. Какой вклад вносят изменения энтальпии и энтропии в полное изменение свободной энергии, происходящее при постоянной температуре?
17. Каким образом ответы на вопросы 14-16 приводят к выводу, что самопроизвольными являются реакции, для которых свободная энергия реакции уменьшается?
18. Каким образом электрическая или другая работа связана с изменениями свободной энергии в реакции, проводимой обратимым способом при постоянных давлении и температуре?
19. В приложении 3 приведены значения величин AG°, АН° и AS" при 298 К для различных химических веществ. Покажите, что часть этих данных избыточная и без нее можно обойтись. Для чего в таком случае допущено дублирование информации, помещенной в таблицах? Какие данные можно было бы исключить из таблиц и как следовало бы вычислять эти данные из оставшихся?
20. Как зависит свободная энергия от концентрации реагентов и продуктов?
21. Что представляет собой термодинамическая активность вещества? Как связаны между собой активность и парциальное давление идеального газа?
22. Каково соотношение между кажущейся и истинной константами равновесия реакции?
23. Как можно судить по численному значению кажущейся константы равновесия, находится ли данная реакция в состоянии равновесия или же она должна самопроизвольно протекать в прямом либо в обратном направлении ?
ЗАДАЧИ
Неупорядоченность и энтропия
1. В каком из каждых двух примеров больше энтропия: а) нераспечатанная колода карт или те же карты, разбросанные по столу; б) собранный автомобиль или отдельные его части, необходимые для сборки; в) диоксид углерода, вода, соединения азота и минеральные вещества или дерево, вырастающее из них?
2. В каком из каждых двух примеров выше энтропия: а) моль жидкой воды или моль водяных паров при давлении 1 атм и 25°С; б) моль сухо
lf> ^6
го льда или моль газообразного диоксида углерода при 1 атм и 195 К; в) пять пятаков на столе, четыре из которых лежат вверх орлом, или же пять пятаков, три из которых лежат вверх орлом; г) 100 г жидкой Н2О и 100 г жидкой D2O (D-символ дейтерия) в отдельных мензурках или 200 г смеси этих веществ; д) моль газообразного СО2 или моль СО2 в газированной воде?
Изменения энтропии
3. Положительно или отрицательно изменение энтропии в каждом из перечисленных ниже процессов? Возрастает или уменьшается неупорядоченность в каждом из этих процессов?
а) 1 моль СН3ОН(тв.) -> 1 моль СН3ОН(г.)
б) 1 моль СН3ОН(тв.) -> 1 моль СН3ОН(ж.)
в) | моль О2(г.) + 2 моля Na(TB.) -> 1 моль №2О(тв.)
г) 1 моль ХеО4(тв.) -> 1 моль Хе(г.) + 2 моля О2(г.)
Расположите эти четыре процесса в порядке возрастания AS.
4. В 1884 г. Фредерик Трутон обнаружил, что для многих жидкостей теплота испарения прямо пропорциональна нормальной температуре кипения, или что отношение теплоты испарения к температуре кипения является постоянной величиной:
_ 8g дж. к " 1 • моль " 1
Л?КИП
Современное объяснение правила Трутона заключается в том, что молярная энтропия испарения многих жидкостей приблизительно одинакова, другими словами, неупорядоченность, вызываемая испарением, для многих жидкостей сопоставима. Исключением является HF, молярная энтропия испарения которого оказывается заметно выше, 105 ДжК“ ^моль” г. Чем объяснить этот факт? (Указание: молярная энтропия газообразного HF недостаточно отличается от молярной энтропии других газов, чтобы ею можно было объяснить указанную аномалию.)
5. Предскажите знак изменения энтропии в каждой из следующих реакций:
а) 2СО(г.) + О2(г.) -> 2СО2(г.)
б) Mg(TB.) + С12(г.) -+ MgCl2(TB.)
в) А1(тв.) -+ А1(ж.)
г) 12(тв.) -> 12(г.)
д) СН4(г.) + 2О2(г.) -> СО2(г.) + 2Н2О(ж.)
В каждом случае дайте обоснование ответа на молекулярном уровне. 6. Вычислите изменения энтропии для каждой из следующих химических
реакций, протекающих при 298 К:
а) Ва(тв.) + -2-О2(г.) -» ВаО(тв.)
б) ВаСО3(тв.) -> ВаО(тв.) + СО2(г.)
в) Вг2(г.) -> 2Вг(г.)
Энтропия, свободная энергия и химические реакции
87
г) Н2(г.) + Вг2(ж.) 2НВг(г.)
Объясните знак каждого изменения энтропии на основании качественного сопоставления свободы движения молекул реагентов и продуктов, т.е. молекулярной неупорядоченности.
7. Объясните причину возрастания энтропии в реакции
Вг2(ж.) + С12(г.) - 2ВгС1(г.)
8. Объясните причину возрастания энтропии в реакции
Вг2(г.) + С12(г.) -> 2ВгС1(г.)
(Эта задача не является повторением задачи 7!)
Энтропия и свободная энергия
9. Для реакции
2Ag(TB.) + Вг(ж.) -> 2AgBr(TB.)
протекающей при 298 К и 1 атм, АН = — 199,2 кДж • моль ~ 1 и AG = = — 191,6 кДж моль ~ \
а) Вычислите стандартное изменение энтропии, AS°, реакции.
б) Что можно сказать на основании полученного значения AS° об относительной степени упорядоченности реагентов и продуктов?
10. Реакция
2Н2(г.) + О2(г.) - 2Н2О(г.)
протекает самопроизвольно несмотря на то, что она сопровождается возрастанием упорядоченности в системе. Как это может быть?
11. Вычислите стандартное изменение энтропии, AS°, для реакции
S(tb., ромбическая) + О2(г.) -» SO2(r.)
пользуясь данными из приложения 3.
12. Пользуясь данными приложения 3, вычислите двумя различными способами AS для реакции
уН2(г.) + уС12(г.) -> НС1(г.)
Энтальпийный и энтропийный вклады в свободную энергию
13. Вычислите стандартное изменение свободной энергии, AG0, для реакции
Ре2О3(тв.) + ЗС(графит) -» 2Ре(тв.) + ЗСО(г.)
Протекает ли эта реакция самопроизвольно при 25°С? Вычислите стандартное изменение энтальпии АН° и энтропии А5° указанной реакции при 298 К и проверьте, действительно ли
AG° = АН° - 7hS°
Глава 16 88
Благоприятствует ли изменение энтальпии самопроизвольному протеканию реакции? Благоприятствует ли ему изменение энтропии? Какой из этих факторов является преобладающим?
14. Вычислите AG°, АН° и AS° (при 298 К) для реакции
2Ag(TB.) + Hg2Cl2(TB.) -> 2AgCl(TB.) + 2Щ(ж.)
Покажите, что для этой реакции выполняется соотношение AGC = = АН — 7Д№. Протекает ли самопроизвольно эта реакция? Благоприятствует ли изменение энтальпии и энтропии (в отдельности) самопроизвольному протеканию этой реакции или наоборот? Какой из факторов является преобладающим? Объясните энтропийный эффект на молекулярном уровне.
Свободная энергия и Крав„
15. Чему равно стандартное изменение свободной энергии для реакции синтеза аммиака при 298 К? Уравнение реакции
ЗН2(г.) + N2(r.) - 2NH3(r.)
Вычислите константу равновесия этой реакции и запишите выражение для КравН через концентрации реагентов и продуктов при равновесии.
16. Определите стандартное изменение свободной энергии при 25°С для реакции
С12(г.) + 12(тв.) -> 21С1(г.)
Протекает ли самопроизвольно эта реакция в указанном направлении при стандартных условиях? Каковы относительные вклады энтальпийного и энтропийного факторов в способность реакции к самопроизвольному протеканию? Какой из этих факторов является преобладающим? Вычислите Кравн для данной реакции.
Молярная энтропия
17. Расположите указанные ниже вещества в порядке возрастания молярной энтропии:
N2O4(tb.), Na(TB.), NaCl(TB.), Вг2(ж.), Вг2(г.)
18. Вычислите изменение свободной энергии для процесса перехода алмаза в графит. На основании полученного результата ответьте, почему бриллианты в ювелирных изделиях со временем самопроизвольно не превращаются в кусочки графита?
Свободная энергия и способность реакции к самопроизвольному протеканию
19. Рассмотрите реакцию
СН4(г.) + 2О2(г.) -> СО2(г.) + 2Н2О(ж.)
а) Вычислите для нее AG° и определите, является ли эта реакция самопроизвольной в термодинамическом смысле.
Энтропия, свободная энергия и химические реакции
89
б) Как объяснить тот факт, что газообразные метан и кислород могут оставаться в смешанном виде длительное время, не вступая в реакцию?
20. Вычислите для следующих реакций AG при 25°С, пользуясь данными приложения 3:
a) 2NaF(TB.) + С12(г.) -+ 2NaCl(TB.) + F2(r.)
б) РЬО2(тв.) + 22п(тв.) -> РЬ(тв.) + 27пО(тв.)
На основании полученных результатов оцените:
а) возможность получения газообразного фтора путем обработки NaF газообразным хлором и б) возможность использования цинка для восстановления свинца из РЬО2.
21. а) Стандартное изменение свободной энергии для реакции
2С(графит) + Н2(г.) -> НС=СН(г.)
равно + 209 кДж на моль ацетилена, Q Н2. Можно ли использовать записанную реакцию для практического синтеза ацетилена при комнатной температуре? Какова константа равновесия для этой реакции? Благоприятствует ли она образованию реагентов или продуктов? б) Вычислите изменение свободной энергии для реакции
3
2СН4(г.) + —О2(г.) -► НС=СН(г.) + ЗН2О(г.)
Не лучше ли выбрать эту реакцию для синтеза ацетилена? Объясните ответ.
22. Вычислите изменение свободной энергии, сопровождающее сгорание жидкого метанола:
3
СН3ОН(ж.) + уО2(г.) - СО2(г.) + 2Н2О(ж.)
а) Является ли эта реакция самопроизвольной при стандартных условиях? Чему равна ее константа равновесия при 298 К? Благоприятнее ли при этих условиях образование реагентов или продуктов? б) Какое влияние на способность к самопроизвольному протеканию данной реакции должно оказывать давление? в) Какое влияние на способность к самопроизвольному протеканию реакции должна оказывать температура?
Изменение фазового состояния
23. Определите молярную теплоту плавления льда при 0°С, если известно, что для расплавления 1 г льда при этой температуре требуется 333,5 Дж. Определите изменение энтропии, сопутствующее плавлению 1 г льда при О С. Каково изменение свободной энергии для этого процесса?
24. а) Рассматривая испарение воды как химический процесс, вычислите для него ДН°, AS и AG° при стандартных условиях, б) Учитывая, что
Lusii M 90
AH - TAS = AG° = — RTln-^^Ц-а(ж.)
где а(г.) и а(ж.)-активности Н2О в газовой и жидкой фазах соответственно, выведите выражение, описывающее зависимость давления паров воды от температуры, в) Вычислите равновесное давление паров воды при 50 и 100°С. (Энтальпия и энтропия при этих температурах практически постоянны.)
25. 1 моль бензола, С6Н6, испаряется при температуре кипения и постоянном давлении 1 атм. Теплота испарения, измеренная в калориметре при постоянном давлении, найдена равной 30,54 кДж-моль" Температура кипения бензола при 1 атм равна 80°С. а) Вычислите AH’, AG° и AS° для этого процесса, б) Вычислите АЕ° для рассматриваемого процесса, считая, что пары бензола обладают свойствами идеального газа, в) Сравните полученные результаты со стандартной теплотой и свободной энергией испарения бензола, указанными в приложении 3. Чем объяснить расхождение между вычисленными вами и табличными данными? Можете ли вы объяснить это расхождение на основании принципа Ле Шателье?
Обратимые и необратимые процессы
26. Реакция А -> В проводилась при 25°С таким образом, что при этом не совершалась полезная работа. В этом процессе выделилось 41,84 кДж-моль” 1 теплоты. Во втором эксперименте та же самая реакция проводилась таким образом, что при этом совершалась максимально возможная полезная работа. В этом процессе выделилось только 1,673 кДж моль - 1 теплоты. Вычислите для каждой из двух реакций величины q, w, Д£°, AH°, AS° и AG°.
.! I! I f Р[А РА
1. Bent Н. A., The Second Law: An Introduction to Classical and Statistical Thermodynamics, Oxford University Press, N. Y., 1965.
2. Dickerson R. E., Molecular Thermodynamics, W. A. Benjamin, Menlo Park, Calif., 1969. Эта книга несколько сложнее цитированных в списке литературы к гл. 15 работ [3, 4, 5], так как в ней большее внимание уделяется статистической интерпретации энтропии.
ГЛАВА
17
Свободная энергия и равновесие
Я считаю дружелюбие и враждебность свойствами разумных существ и не получил еще ни от кого объяснения, как эти природные чувства можно приписывать неодушевленным телам, лишенным разума и знаний.
Роберт Бойль (1661)
Важнейшие понятия
17-1. Свойства химического равновесия. Обратимость. Движущая сила самопроизвольного движения к равновесию. AG-как мера движущей силы реакции. Соотношение AG° = — ЯПпКращ,.
17-2. Реакции в газовой фазе. Расчеты равновесия. Экспериментальное измерение Кравн. Парциальное давление. Степень завершенности реакции.
17-3. Принцип Ле Шателье: влияние давления и температуры на равновесие.
17-4. Термодинамический анализ реакции: равновесие и изменение температуры.
В этой главе теоретически объясняются некоторые представления о самопроизвольном протекании реакций и о равновесии, которые были изложены в виде наблюдаемых фактов в гл. 4. Сначала мы познакомились с константами равновесия как с чисто экспериментальными численными величинами, которые удобно использовать для предсказания поведения химической реакции после ее протекания в течение достаточно долгого времени. Нам еще не были известны способы вычисления константы равновесия по данным о других измеряемых свойствах химических веществ. Мы даже не могли доказать, что для всякой реакции должна существовать
Г.шва 1
9?
константа равновесия, зависящая от температуры, но не зависящая от концентраций. Мы лишь пытались объяснить существование Кравк на основе соображений о действующих массах, причем оговаривали, что эти соображения применимы только к простейшим, одностадийным реакциям. Все, что можно было прежде сказать, сводилось к утверждению: таковы экспериментально наблюдаемые свойства и поведение веществ в химических реакциях.
Обсуждение основ термодинамики в предыдущей главе позволяет рассмотреть вопрос о константе равновесия на более глубоком уровне. Теперь можно доказать, что для любой реакции существует своя константа равновесия Кравн, определяемая уравнением
AG = — РТ1пКравн
или
_ -(ЛЬ/ЯТ)
2Чравн с
где AG-свободная энергия реакции при заданной температуре, когда все реагенты и продукты находятся в стандартных состояниях. Поскольку выбор стандартных состояний однозначно определяет концентрации (1 М для растворов, 1 атм для парциального давления газов и т. д.), стандартная свободная энергия, AG', оказывается независимой от конкретных концентраций в любом реальном эксперименте. По этой причине Крав„ также не зависит от концентраций. Однако поскольку стандартная свободная энергия определяется для заданной температуры и должна иметь различные численные значения при различных температурах, константа равновесия также оказывается функцией температуры.
В этой главе будут более подробно рассмотрены соотношения между AG, Кравн и Т. При этом мы снова обсудим наиболее важные свойства равновесия и константы равновесия, с которыми познакомились на эмпирическом уровне в гл. 4, но теперь будет дано более удовлетворительное объяснение этих свойств.
17-1. СВОЙСТВА ХИМИЧЕСКОГО РАВНОВЕСИЯ
При изучении данной главы следует постоянно помнить о ряде важнейших свойств химического равновесия.
1. Равновесие представляет собой динамическое, а не статическое явление. Рассмотрим, например, реакцию диссоциации паров пентахлорида фосфора, полагая, что она начинается с чистого РС15:
Диссоциация ->
РС15(г.) РС13(г.) + С12(г.) (17-1)
«- Рекомбинация
Если реагенты и продукты находятся в замкнутом сосуде, образование газообразного хлора в конце концов прекращается. Если следить за протека
Свободная энергия и равновесие
93
нием реакции, измеряя суммарное давление в сосуде при помощи манометра, можно заметить, что с течением времени рост давления замедляется и в конце концов оно достигает постоянного, максимального значения. Однако при этом диссоциация РС15 вовсе не прекращается; просто диссоциация и рекомбинация протекают с равными скоростями, так что в реакционной системе не происходит результирующего изменения. Убедиться в этом можно, если выполнить при равновесных условиях следующий эксперимент: заменить обычный газообразный хлор, с естественным содержанием изотопов 35С1 и 37С1 в отношении 3:1, чистым изотопом 37С1. Хотя равновесие сохраняется и видимой реакции не происходит, вскоре можно обнаружить, что как в РС15, так и в РС13 содержание изотопа 37С1 больше нормального. Дело в том, что часть меченого С12 соединилась с РС13, который имел нормальное изотопное соотношение хлора, и в результате получился обогащенный изотопом 37С1 пентахлорид хлора; затем часть этого РС15 снова продиссоциировала с образованием РС13, который также оказался обогащенным изотопом 37С1. Обратимый характер равновесия указывается в уравнении химической реакции двойными стрелками или просто знаком равенства, но только не односторонней стрелкой.
2. Любой реакции присуще свойство самопроизвольно смещаться к равновесию. Это утверждение ничего не говорит о скорости, с которой реакция может достигать положения равновесия, оно указывает только на наличие движущей силы в направлении к равновесию. Эта движущая сила химической реакции измеряется свободной энергией реакции. Изменение свободной энергии представляет собой количество энергии, которая может быть израсходована для выполнения работы или служить движущей силой химической реакции. На рис. 17-1 изображена гидростатическая аналогия свободной энергии реакции: перепад уровней воды между резервуаром и сливным сосудом имитируют изменения свободной энергии AG.
3. Движущая сила реакции в направлении положения равновесия уменьшается по мере приближения к нему. Образование продуктов постепенно уменьшает движущую силу прямой реакции, уменьшая по абсолютной величине отрицательное изменение свободной энергии, AG. Чем дальше продвигается реакция, тем меньше становится изменение свободной энергии и, следовательно, меньше работа, которую может выполнять реакция.
4. Равновесие достигается, когда AG становится равным нулю. Гидростатическая аналогия химического равновесия показана на рис. 17-1, в. Химическое равновесие представляет собой результат баланса между двумя эффектами-тепловым и энтропийным (т.е. связанным с упорядоченностью). В состоянии равновесия
AG = 0 = АН - TAS
и следовательно,
АН = TAS
Протеканию реакции в одном из направлений может благоприятствовать выделение теплоты, т. е. понижение энтальпии. Протеканию реакции в про
Глава /’
Q4
тивоположном направлении может благоприятствовать образование менее упорядоченных веществ с более высокой энтропией. В состоянии равновесия оба эти эффекта сбалансированы.
5. Положение равновесия при заданной температуре всегда одинаково независимо от того, с какой стороны оно достигнуто. Так, в реакции диссоциации N2O4
N2O4(r.)r±2NO2(r.)
(П-2)
относительные концентрации N2O4 и NO2 при равновесии (давление и температура предполагаются неизменными) не зависят от того, имелся ли в начале реакции почти чистый N2O4 или почти чистый NO2. В реакции
Сшюндна.ч энергия и равновесие
95
диссоциации РС15 [уравнение (17-1)] положение равновесия оказывается одинаковым независимо от того, начинаем ли мы с чистого РС15 или с эквимолярных количеств РС13 и С12, поскольку РС13 и С12 соединяются в эквимолярных количествах. Если же начать процесс при вдвое большем числе молей РС13 по сравнению с С12, равновесные концентрации будут отличаться от полученных в результате диссоциации чистого РС15, однако константа равновесия останется прежней.
6. Равновесие любой реакции может быть охарактеризовано константой равновесия, Кравн, выраженной через активности, а, реагентов и продуктов:
Кравн = ГС'АЪ |.для реакции (17-1)] (17-3)
ЛРС13
Любые количества РС15, РС13 и С12, которце удовлетворяют выражению для константы равновесия (17-3), соответствуют состоянию равновесия. Для идеальных систем активность каждого вещества представляет собой безразмерное отношение его реальной концентрации к концентрации этого вещества в стандартном состоянии. Для неидеальных систем об активности каждого вещества можно лишь сказать, что она каким-то образом связана с его концентрацией и должна рассматриваться как «эффективная концентрация».
7. Константа равновесия любой химической реакции может быть вычислена по стандартному изменению свободной энергии в этой реакции, AG°:
AG° = - RTlnK^ или Кравн = e{~^°/RT] (17-4)
Рис. 17-1. Гидростатическая аналогия свободной энергии реакции. Вообразите, что два водных резервуара соединены трубкой, которая проходит через турбину, вырабатывающую электрический ток. Работа, которую способен выполнить каждый кубический метр воды, прошедший через турбину, зависит от гидростатического давления, т. е. от разности уровней Ah между поверхностью непрошедшей через турбину воды-«реагента» и поверхностью прошедшей через турбину воды-«про-дукта».
а-начало эксперимента. Каждая единица объема воды, проходящей через турбину, выполняет максимальную работу, потому что Ah велико и отрицательно. Но в то же время каждая такая единица объема воды снижает разность уровней воды и, следователь-
но, уменьшает количество работы, которую может выполнить следующая единица объема воды;
б-следующая стадия процесса. На этой стадии каждый кубический метр воды выполняет менее трети работы, которая выполнялась вначале;
e-уровень воды в обоих резервуарах одинаков. Вода больше не способна выполнять работу. Система находится в равновесии и Ah = 0;
г-гипотетическое состояние. Такое состояние никогда не возникает из исходного состояния самопроизвольно, потому что Ah никогда не может самопроизвольно увеличиться в положительном направлении. Если эксперимент начинается из такого состояния, вода самопроизвольно течет в обратном направлении.
Глава Р
96
Поскольку определение стандартного изменения свободной энергии реакции основано на предположении, что парциальные давления всех компонентов равны 1 атм, стандартное изменение свободной энергии не является функцией давления. Любые изменения давления реагентов или продуктов учитываются логарифмическим членом в общем выражении для свободной энергии
AG = AG° + RTkiQ
Поскольку AG° не зависит от давления, константа равновесия тоже не зависит от давления. Независимо от того, насколько мы сожмем смесь газов РС15, РС13 и С12, отношение их активностей в состоянии равновесия [см. уравнение (17-3)] останется неизменным. При сжатии газов условия равновесия смещаются таким образом, что константа равновесия все время остается постоянной.
Стандартное изменение свободной энергии зависит от температуры. Во всех проводившихся нами расчетах свободной энергии предполагалось, что температура равна 298 К, хотя иногда вместо AG298 мы писали просто AG°. Однако свободная энергия реакции газов, все компоненты которой имеют, например, парциальные давления 1 атм, различна при 1000 и 298 К. Следовательно, константа равновесия также должна изменяться в зависимости от температуры. Ниже будут рассмотрены примеры такой зависимости.
Стехиометрия и константа равновесия
Выражение для константы равновесия зависит от того, как записано уравнение реакции. Например, реакция получения аммиака может быть записана в расчете на образование 1 моля аммиака:
Г) |N2(r.) + |Н2(г.) NH3(r.) К, =
flN2 ан2
или исходя из использования 1 моля азота либо 1 моля водорода
2
2) N2(r.) + ЗН2(г.) 2NH3(r.) К2 = -------
^Н.
3) |N2(r.) + Н2(г.) 31\Н3(г.) ^nh,
К-i =-------
aN23 «Н2
В каждом случае активность, а, любого участника реакции входит в выражение для константы равновесия в степени, равной коэффициенту при формуле этого вещества в уравнении реакции. Уравнение (2) представляет собой не что иное, как удвоенное уравнение (1) или утроенное уравнение (3), поэтому константа равновесия К2 равна квадрату К, или кубу константы К3. И вообще говоря, умножение уравнения реакции на произвольное число п приводит к тому, что соответствующая константа равновесия возводится в степень п.
Реакция, обратная реакции (2), и соответствующая константа равнове-
Свободная энергия и равновесие
97
сия описываются уравнениями
Лм Ли 1
4) 2NH3(r.) N2(r.) + ЗН2(г.) К4 = =-----
flNH3 К1
Таким образом, константа равновесия обратной реакции представляет собой величину, обратную константе равновесия прямой реакции.
Если мы складываем уравнения двух реакций, получая третье уравнение, константа равновесия третьей реакции оказывается равной произведению констант равновесия первых двух реакций:
1) С(тв.) + О2 СО2(г.) К, =
**С<*О2
Ли Г)
2) Н2(г.) + СО2 ?± Н2О(г.) + СО(г.) К2 = —------
flH2 ^coj
3) Н2(г.) + С(тв.) + О2(г.) «=* Н2О(г.) + СО (г.) Он2о^со
= ---------
<3h2^C^O2
К3 = КгК2
Если (1) + (2) = (3), то КгК2 = К3. Это мультипликативное свойство констант равновесия соответствует принципу аддитивности свободных энергий, с которым мы познакомились в гл. 2 на примере энтальпий (закон Гесса).
Стандартные состояния и активности
Можно распространить представление об активности, а следовательно, об изменениях свободной энергии и о константах равновесия на твердые и жидкие вещества, а также на компоненты растворов, если определить активность любого вещества как отношение концентрации этого вещества к его концентрации при условном стандартном состоянии. При вычислениях констант равновесия такое стандартное состояние, очевидно, должно совпадать со стандартным состоянием, для которого табулированы термодинамические данные, если мы хотим вычислять Kjam из этих данных. В табл. 17-1 указаны стандартные состояния, используемые для вычисления значений свободной энергии, которые приведены в приложении 3.
Для реакций в газовой фазе активности реагентов и продуктов представляют собой безразмерные величины, численно равные парциальным давлениям, выраженным в атмосферах. Принято пользоваться константами равновесия, вычисленными из парциальных давлений реагентов и продук-тов “r Ppci рС1
^равн ----3 * 5--—
Ppci 3
Мы тоже будем применять такую терминологию, поскольку так принято делать. Однако не следует забывать, что, строго говоря, эти «парциальные
4 — 796
Глава 17
98
Таблица 17-1
Стандартные состояния и активности, принятые при табулировании свободной энергии и расчетах констант равновесий
Вещество Стандартное состояние Активность
Газ, чистый или в смеси Парциальное давление рассматриваемого газа Pj = 1 атм Численно равна парциальному давлению: = |pj
Чистая жидкость или твердое вещество Чистая жидкость или твердое вещество Единичная: aJ= 1
Растворитель в разбавленном растворе Чистый растворитель Приблизительно единичная: aj а 1
Растворенное вещество 1 М раствор по растворенному веществу Численно равна молярной концентрации растворенного вещества: Oj = |Cj|
давления» на самом деле суть не что иное, как активности индивидуальных газов; они представляют собой отношения парциальных давлений газов при конкретных экспериментальных условиях к их парциальным давлениям в стандартном состоянии, т. е. к 1 атм. При использовании активностей константа равновесия оказывается безразмерной величиной, как и должно быть, чтобы выражение In КраЮ1 имело какой-то смысл.
Если в реакции принимает участие чистое твердое или жидкое вещество, оно выступает в роли бесконечно большого резервуара вещества и поэтому количество чистого твердого или жидкого вещества не оказывает влияния на равновесие до тех пор, пока это вещество имеется в наличии. Например, при разложении известняка на негашеную известь и диоксид углерода
СаСО3(тв.) СаО(тв.) + СО2(г.)
свободная энергия реакции зависит только от парциального давления диоксида углерода над поверхностью твердых веществ, а не от имеющегося в наличии количества известняка или негашеной извести. Выбор в качестве стандартного состояния для твердых веществ их чистой твердой формы приводит к тому, что активности твердых веществ оказываются тождественно равными единице и могут быть исключены из выражений для константы равновесия и для кажущейся константы равновесия:
AG = AG° + RTln^1 = AG° + RT\naCOi
^равн ^СО2
Свободная энергия и равновесие
99
В состоянии равновесия парциальное давление СО2, находящегося в замкнутом сосуде с СаО и СаСО3, при заданной температуре постоянно в точном соответствии с приведенными выше уравнениями. Во всех рассматриваемых нами примерах растворитель в разбавленном раствор» может рассматриваться как неистощимый источник чистого вещества растворителя. Следовательно, активность растворителя также равна единице и поэтому не входит в константу равновесия.
17-2. ГАЗОВЫЕ РЕАКЦИИ
Применим теперь полученные выше выводы к реакциям, в которых все реагенты и продукты находятся в газовой фазе. Мы проделаем это на ряде примеров, каждый из которых проиллюстрирует новое представление.
Экспериментальное измерение констант равновесий
Пример 1
Аммиак, азот и водород находятся в состоянии равновесия в стальном сосуде при 298 К. Анализ содержимого сосуда показал, что эти три газа имеют следующие парциальные давления:
pN; = 0,080 атм
рНз = 0,050 атм
Pnh, = 2,60 атм
Какова константа равновесия, Кравн, для реакции
N2(r.) + ЗН2(г.) т± 2NH3(r.) (17-6)
Решение
Вычисление константы равновесия дает а^н (2,60)2
Кравн = —=-----------------------= 6,8 • 105
aN а^ (0,080) (0,050)3
Пример 2
Приготовление триоксида серы из диоксида серы является важной стадией промышленного получения серной кислоты. Смесь газов SO2 и О2 медленно пропускают через трубку с платиновым катализатором, нагретую до 1000 К. Анализ выходящих из трубки газов показал, что они имеют следующие парциальные давления:
Pso2 = °-559 атм
Ро2 — 0,101 атм
Pso, = 0,331 атм
Какова константа равновесия, Кравн, для реакции
2SO2(r.) + О2(г.) 2SO3(r.) (17-7)
4*
НИЗ
Решение 1 aSOj Кравн = —-----------------------------= 3,47
о SO2 ‘Ю,
Вычисление констант равновесий
Теперь мы имеем возможность вычислять константы равновесий из термодинамических данных, чего не могли сделать в гл. 4. Зная константу равновесия реакции, можно вычислить ее стандартную свободную энергию или наоборот.
Пример 3
Вычислите константу равновесия для реакции (17-6) из стандартных свободных энергий образования.
Решение
&G = 2( — 16,64) - (0,0) - 3(0,0) = - 33,28 кДж Кравн = e-(A0“/RT) = 10-<- 33,28/5,706) = щ 4 5.832 = 6 g .
Не следует придавать слишком большого значения тому обстоятельству, что полученное здесь значение константы равновесия точно совпадет с найденным ранее из парциальных давлений. Константы равновесий редко удается определить с точностью выше 5%.
Пример 4
Вычислите константу диссоциации уксусной кислоты из табличных значений свободной энергии, приведенных в приложении 3.
Решение
Реакция описывается уравнением
СН3СООН(водн.) -> Н + (водн.) + СН3СОО “ (водн.)
а свободная энергия диссоциации равна
AG° = 0,0 4- ( - 372,5) - ( - 399,6) = + 27,1 кДж
Константа диссоциации определяется из уравнения
К = е“(ЛС°/КГ* _ 1Q - (27,1/5,706) _ ю-4.75
откуда
рК = 4,75 и К =1,76-10“ 5
Полученный результат можно проверить, пользуясь данными табл. 5-3. Заметим, что если бы реакция диссоциации была записана следующим образом:
СН3СООН(водн.) + Н2О -> СН3СОО “ (водн.) + Н3О+(водн.)
Свободная энергия и равновесие
101
то, воспользовавшись данными приложения 3, мы бы все равно получили тот же самый результат.
Пример 5
Воспользовавшись найденным ранее значением константы равновесия для реакции образования триоксида серы, вычислите стандартную свободную энергию реакции (17-7) при 1000 К.
Решение
AG° = —10,3 кДж, или — 5,15 кДж-моль'1 SO3
Парциальное давление одного компонента реакции
Парциальное давление одного компонента реакционной системы, находящейся в равновесии, можно вычислить по константе равновесия, Кравн, если известны парциальные давления остальных компонентов системы.
Пример 6
В новом эксперименте по исследованию реакции образования аммиака в стальном сосуде парциальные давления аммиака и водорода при 298 К найдены равными 1,53 и 0,50 атм соответственно:
Pnh3 = 1,53 атм
Ри2 = 0,50 атм
Содержание азота в этих условиях установить не удалось. Каким должно быть парциальное давление N2, если содержимое сосуда находилось в состоянии равновесия?
Решение
Обозначим неизвестное парциальное давление азота через у. Тогда (1,53)2
Коавн = - , = 6,8 105
равн у(0,50)3
откуда
(1,53)2
---------------г = 2,8 10'5 атм 0,125- 6,8 Ю5
Таким образом, определив значение константы равновесия этой реакции из предварительного эксперимента с более близкими друг к другу количествами реагентов и продуктов, мы получаем возможность вычислить количество присутствующего в системе азота без непосредственных измерений.
Пример 7
Каким должно быть парциальное давление кислорода в реакции получения SO3 при 1000 К [уравнение (17-7)], чтобы в условиях равновесия количества SO2 и SO3 были одинаковыми?
Гмли Г 102
Решение
Pq2 = 0,288 атм
Изменения стехиометрии
Пример 8
Какова константа равновесия для реакции
2NH3 (г.) Я N2(r.) + ЗН2(г.) (17-8)
Решение
Указанная реакция обратна реакции (17-6), поэтому константа равновесия должна быть обратна константе равновесия прямой реакции
з .
ON; Цн2 1
Пример 9
Определите константу равновесия для реакции
1 3
NH3 (г.) = —N2 (г.) + — Н2(г.) (17-9)
Решение
Хравн = 1,2 IO’3
Степень завершенности реакции
Часто приходится вычислять степень завершенности реакции в состоянии равновесия, выражая ее как долю прореагировавшего чистого исходного вещества (в процентах). Например, можно выразить степень разложения аммиака на азот и водород, указывая долю продиссоциировавшего чистого аммиака в процентах. Чистый аммиак при общем давлении 1 атм будет самопроизвольно диссоциировать в небольшой степени на Н2 и N2. Зададимся вопросом-какая доля аммиака про диссоциирует, если поддерживать постоянными давление 1 атм и температуру 298 К?
Обсуждаемая реакция описывается уравнением (17-8), которое также приводится и в табл. 17-2. Поскольку константа равновесия реакции в газовой фазе выражается через парциальные давления, нам прежде всего необходимо выразить концентрации участников реакции в виде парциальных давлений. Тогда мы сможем составить выражение для константы равновесия и, воспользовавшись ее известным численным значением, найти степень диссоциации аммиака.
Запись решения этой задачи удобно представить таким образом, как это сделано в табл. 17-2. Допустим, что в начале эксперимента в системе имелся только чистый NH3, a N2 и Н2 отсутствовали. Такое предположение не обязательно должно соответствовать какой-либо реальной экспери-
Свободная энергия и равновесие
103
Диссоциация аммиака при 298 К
Таблица 17-2
2NH3(r.) t? ' N2(r.) + ЗН2(г.) Суммарные величины
Число молей в начале реакции 2л 0 0 2л
Число молей при равновесии 2л (1—а) ла Зла 2л (1 + а)
Мольная доля при рав- 1 — а а За 1
новесии 1 + а 2(1 + а) 2(1 + а)
Парциальное давление (1 — <*)Р аР ЗаР Р
при равновесии 1 + а 2(1+а) 2(1+а)
ам2ан2 ьР 27а3Р3 (1 + а)2 27 а4Р2
4н, ~ 2(1+а) 8(1+а)3 (1 -а)2Р2 " 16 (1 - а2)2
AG° = (0,0) + 3(0,0) - 2(- 16,63) = + 33,27 кДж Кравн = 10’ <33'27'5’831’ = 10“ 5’832 = 1,5 10- 6 Кравн = ~• -а4?22 = 1,5 • Ю-6 рави 16 (1 - а2)2 а2р =0,94-10-3 1 - а2
ментальной ситуации, оно представляет собой лишь удобную отправную точку в рассуждениях, на которых основаны расчеты концентраций в условиях равновесия. Поскольку в уравнении реакции указаны 2 моля аммиака, предположим, что вначале в системе присутствуют 2и молей этого газа. Допустим теперь, что спустя некоторое время система достигает равновесия, когда доля а аммиака продиссоциировала. Это означает, что из исходных 2л молей аммиака 2ла молей прореагировали, а 2л (1 — а) молей остались непрореагировавшими. Из каждых 2 молей разложившегося аммиака образуются 1 моль азота и 3 моля водорода. При равновесии 2ла молей продиссоциировавшего аммиака образуют ла молей азота и Зла молей водорода. В результате диссоциации аммиака суммарное число молей всех трех веществ, участвующих в реакции, возрастает. Теперь в системе имеются 2л (1 — а) + ла + Зла = 2и (1 + а) молей газа, а до диссоциации в ней было всего 2л молей газа (суммарное число молей газа в системе указано в правой части таблицы).
Мольную долю каждого компонента реакционной смеси находят, разделив число молей соответствующего компонента на суммарное число молей всех компонентов. На этой стадии вычислений становится очевидным
riMlI P
104
преимущество использования в качестве характеристики степени диссоциации дольной меры диссоциации, а, потому что это позволяет исключить из рассмотрения абсолютное число молей и. Мольная доля каждого компонента при равновесии, приведенная в таблице, выражена через степень диссоциации аммиака.
Наконец, в таблице указано произведение мольной доли каждого компонента на суммарное давление газа в системе, Р, что дает парциальное давление соответствующего компонента. Затем эти парциальные давления подставляют в выражение для константы равновесия, полагая, что активности всех газов численно совпадают с их парциальными давлениями. Результат после всех возможных упрощений дает выражение для константы равновесия через степень диссоциации аммиака:
27а4Р2
Кравн ' 16(1 - а2)2
Зная, что изменение-свободной энергии для рассматриваемой реакции равно + 33,28 кДж, можно воспользоваться уравнением (17-4), чтобы найти численное значение константы равновесия:
Кравн = 1,5-IO" 6
Подставим это значение в полученное выше уравнение для константы равновесия
и после сокращения численных коэффициентов и извлечения квадратного корня из обеих частей уравнения найдем
а2Р ,
------г = 0,94 • 10 ~3 1 - а2
откуда
, 0,00094
а =--------------
Р + 0,00094
Учитывая, что Р — 1 атм, можно пренебречь величиной 0,00094 в знаменателе, после чего нетрудно найти значение а = 0,0307. Таким образом, ответ на поставленный вопрос заключается в том, что при 298 К и давлении 1 атм аммиак диссоциирован приблизительно на 3%.
Пример 10
Молекула газообразного N2O4 самопроизвольно диссоциирует на две молекулы NO2. Введите выражение для степени диссоциации, а, как функции суммарного давления в системе при 298 К. Какая доля N2O4 окажется продиссоциировавшей при давлении 1 атм?
Свободная энергия и равновесие 105
Решение
Вывод искомого выражения показан в табл. 17-3. Уравнение для Крава, приведенное в таблице, может быть точно решено относительно а2:
а2 = - Кравн----= --------!------- (17-10)
4P + KpaBH (4Р/Кравн) + 1
откуда можно найти, что при Р = 1 атм и Кравн = 0,114 а = 0,167. Таким образом, при давлении 1 атм и 298 К диссоциированной оказывается каждая шестая молекула N2O4. Отметим, что в данной задаче Кравн-не такая уж малая величина и поэтому ею нельзя пренебречь в знаменателе по сравнению с 4Р при Р = 1 атм.
Таблица 17-3
Диссоциация N2O4 при 298 К
N2O4(r.) 2NO2(r.) Суммарные величины
Число молей в начале реакции п 0 п
Число молей при равновесии и(1 - а) 2иа и(1 + а)
Мольная доля при равновесии 1 -а 2а 1
1 + а 1 + а
Парциальное давление при рав- (1 - а)Р 2аР р
новесии 1 + а 1 +а
aNO2 4ot2P2 1 + а 4а2 Р
РаМ aN2o4 (1 + “)2 (1-а)Р ’-а2
AG° = 2(51,84 кДж) - 98,28 кДж = + 5,39 кДж Кравн = e-(S’19/RT> = 10-(5.39/5,706) = ^-0,945 = Q ц4
Д/у2 р м2п
-- = 0,114 или = 0,0285
1 — а2 1 — а2
Как должно сказаться на диссоциации N2O4 повышение давления в системе? Поскольку обратный процесс - рекомбинация NO2-уменьшает суммарное число молей частиц в системе, на основании принципа Ле Ша-телье можно предсказать, что повышение давления должно благоприятствовать рекомбинации. На рис. 17-2,а показан график зависимости степени диссоциации, а, вычисленной из уравнения (17-10), от суммарного давления. Нетрудно видеть, что принцип Ле Шателье приводит к правильному выводу. При давлениях выше 1000 атм газовая смесь представляет
/ JU«u '
106
Рис. 17-2. Графики зависимости степени диссоциации N2O4, «, от давления при 298 К, определяемой уравнением (17-10).
а-график зависимости а от 1g Р, на котором хорошо видны особенности
функциональной зависимости ot во всем интервале ее изменения;
б-менее информативный график зависимости а от Р, на котором плохо видно поведение этой функции в области а > 0,5.
Свободная энергия и равновесие
107
собой почти чистый N2O4, ниже 0,001 атм она состоит из почти чистого NO2. На рис. 17-2,а давление представлено в логарифмической шкале. Это позволяет наглядно представить изменение величины а в зависимости от давления. В отличие от этого на рис. 17-2,6 давление представлено в линейной шкале, и поэтому график превращается в вертикальную прямую уже при значении а, равном 0,5. При значениях а, превышающих 0,5, рис. 17-2,6 не позволяет получить ясного представления о происходящем. Если изменить выбор диапазона давлений в линейной шкале (например, от 0 до 150 атм, от 0 до 1,5 атм или от 0 до 0,15 атм), отмеченное неудобство по-прежнему сохранится. Впоследствии мы убедимся, что логарифмические графики часто используются в задачах о химическом равновесии.
Рассмотренные выше два примера, реакция синтеза аммиака и диссоциация N2O4, приводят к одинаковому математическому выражению для степени диссоциации. При нормальных условиях степень диссоциации аммиака составляет 3%, а для N2O4 степень диссоциации равна 16,7%. Эти относительные значения можно было предсказать по изменениям стандартных свободных энергий для каждой из реакций: + 16,64 кДж-моль” 1 для NH3 и 5,39 кДж • моль ~ 1 для N2O4. Изменение стандартной свободной энергии выше для диссоциации NH3, чем для диссоциации N2O4; это означает, что в первом случае движущая сила диссоциации меньше и, следовательно, положение равновесия ближе к недиссоциированному состоянию.
17 3 ПРИНЦИП IE ШАТЕЛЬЕ
Принцип Ле Шателье утверждает, что когда на систему, находящуюся в равновесии, оказывается воздействие, равновесие смещается в таком направлении, чтобы ослабить это воздействие. В двух рассмотренных выше реакциях диссоциации (N2O4 и NH3) выражения для константы равновесия содержат в числителе давление. Поскольку Кравн не зависит от давления, степень диссоциации, а, должна уменьшаться при возрастании Р, чтобы правая часть выражения для константы равновесия оставалась неизменной. Принцип Ле Шателье предсказывает, что при более высоких давлениях равновесие должно смещаться в направлении, соответствующем образованию меньшего числа молей газа, и такое предсказание согласуется с выводом, основанным на рассмотрении выражения для константы равновесия.
Посмотрим теперь, что предсказывает принцип Ле Шателье относительно сдвига равновесия в реакции образования водяного газа при повышении давления. Реакция описывается уравнением
Н2(г.) + СО2(г.) Н2О(г.) + СО (г.) (17-11)
Если для этой реакции составить таблицу, подобную табл. 17-2, обозначив через а вступившую в реакцию долю Н2, можно найти, что константа рав-
новесия определяется выражением
_ ан2о ^со
^павн
flHj ‘V'O,
а2
(17-12)
Глава
108
в которое вообще не входит давление. Это объясняется равенством числа молей газа в левой и правой частях уравнения реакции, вследствие чего все члены выражения для Кравн, связанные с давлением, взаимно сокращаются. По этой же причине принцип Ле Шателье предсказывает, что равновесие в реакции образования водяного газа не зависит от изменений давления.
Влияние температуры
Выясним теперь, что предсказывает принцип Ле Шателье относительно влияния температуры на константу равновесия. При подведении теплоты к реагирующей системе ее температура повышается. Воздействие, связанное с добавлением в систему теплоты, может быть ослаблено, если равновесие сместится в направлении, соответствующем поглощению теплоты. Если реакция эндотермическая, ее константа равновесия должна увеличиваться с ростом температуры; если же реакция экзотермическая, ее константа равновесия должна уменьшаться при повышении температуры.
Например, реакция диссоциации SO3:
2SO3 (г.) 2SO2 (г.) 4- О2(г.)
сильно эндотермическая. При 298 К.
AG° = 2(- 300,4) - 2( - 370,4) = 4- 140,0 кДж на 2 моля SO3
ДН = 2(- 296,9) - 2(- 395,2) = 4- 196,6 кДж на 2 моля SO3
AS = 2(248,5) 4- (205,0) - 2(256,2) = 4- 189,6 Дж-К " 1 на 2 моля
продиссоциировавшего SO3
Таблица 17-4
Зависимость Крав[| от температуры для реакции
2SO3(r.) 2SO2(r.) + О2(г.)
Температура, К AG°, кДж на 2 моля SO3 К равн
298 140,0 2,82-10“2S
400 120,7 1,78-Ю-16
500 101,5 2,51 10“11
600 82,1 1,94-10“8
700 63,6 1,82-10“5
800 44,4 1,29 10“’
900 27,7 0,0248
1000 11.1 0.264
1100 -5,9 1,89
1200 -23,0 10,0
1300 -40,2 40,8
1400 -57,0 132
Свободная уяерги.ч и равновесие
109
Поскольку при диссоциации SO3 поглощается столь большое количество теплоты, эта диссоциация сильно облегчается при высоких температурах. Так, при повышении температуры на 1100 К величина Кравн изменяется на 27 порядков (табл. 17-4).
ГЕТУЮДШ! АМИЧЕС КИЙ АНАЛИЗ РЕАКЦИИ
Принцип Ле Шателье указывает, как должна протекать реакция, но не дает этому объяснения, оставаясь просто догадкой. Но по какой же причине положение равновесия изменяется в зависимости от температуры? По какой причине движущая сила реакции диссоциации SO3 столь резко возрастает с температурой? Чтобы ответить на эти вопросы, следует выяснить, как ведут себя свободная энергия, энтальпия и энтропия реакции при изменении температуры.
При заданной температуре стандартная свободная энергия, энтальпия
Рис. 17-3. График Гиббса-Гельмгольца для диссоциации SO3 на SO2 и О2. Тангенс угла наклона графика в любой его точке (на этом рисунке график выглядит приблизительно как прямая
линия) дает теплоту реакции в этой точке. Энтальпия диссоциации SO3 незначительно изменяется с температурой в интервале от 298 до 1400 К. Данные о AG° взяты из табл. 17-4.
r.iagL' I
110
и энтропия реакции связаны между собой соотношением
’ AG' = АН - TAS' (17-13)
В табл. 17-4 приведены значения стандартной свободной энергии для реакции диссоциации SO3 при различных температурах, вычисленные по экспериментальным данным о константе диссоциации. По мере повышения температуры стандартное изменение свободной энергии для рассматриваемой реакции становится все более отрицательным, а константа равновесия возрастает, и для установления равновесия реакция должна все более смещаться вправо. Приведенные в этой таблице данные позволяют определить теплоту и энтропию реакции. Для того чтобы понять, как это делается, разделим левую и правую части уравнения (17-13) на Т, при этом получится соотношение \G°/T = ^Н°/Т — AS°, называемое уравнением Гиббса-Гельмгольца. Если воспользоваться этим уравнением и построить график зависимости величины &G°/T от 1/Т, то тангенс угла наклона графика к оси абсцисс в каждой точке графика дает значение АН° при соответствующей температуре.
Данные, приведенные в табл. 17-4, представлены в графическом виде на рис. 17-3. График зависимости \G°/T от 1/Т оказывается почти прямолинейным; это означает, что стандартная теплота реакции диссоциации SO3 в диапазоне между 298 и 1400 К почти не изменяется. Среднее значение тангенса угла наклона графика в указанном интервале изменения температур дает среднее значение энтальпии реакции, равное +195 кДж, экспериментально измеренное значение энтальпии этой реакции на одном из концов интервала изменения температуры (в точке 298 К) оказывается равным +196,6 кДж. С достаточной точностью можно считать, что теплота рассматриваемой реакции постоянна при всех температурах.
На рис. 17-4 изображены графики зависимости теплоты реакции, АН , и изменения свободной энергии, AG°, от температуры. Разность между этими величинами, ДН° — AG°, в любой точке равна TASJ. Если оба графика, для ЛН° и для AG°, приближенно представить прямыми линиями, то произведение TAS° окажется пропорциональным Г, следовательно, AS0 также приближенно не зависит от температуры. Экстраполяция графиков для АН и AG° в сторону низких температур показывает, что они пересекаются в точке абсолютного нуля. При 0 К выполняются соотношения TAS° = 0 и АН0 = AG°.
Объясним теперь, что происходит с рассматриваемой реакцией при изменениях температуры. Когда 2 молекулы SO3 диссоциируют
2SO3 (г.) 2SO2(r.) + О2(г.) (17-14)
происходит разрыв двух связей S—О и образуется одна связь О—О. Необходимая для этого энтальпия, 195 кДж на 2 моля SO3, настолько велика, что можно пренебречь менее важными изменениями, происходящими при повышении температуры, и считать, что ДН° приблизительно постоянно. Этот энтальпийный фактор реакции сам по себе полностью предотвра-
Свободная энергия и равновесие
111
Рис. 17-4. Зависимость энтальпии, энтропии и свободной энергии диссоциации SO3 от температуры. В этой реакции энтальпия и энтропия приблизи-
тельно независимы от температуры. Свободная энергия уменьшается при повышении температуры согласно соотношению ДО° = ДЯ° — ТД5°.
щал бы диссоциацию SO3. Бертло и Томсон могли быть полностью удовлетворены таким выводом (см. разд. 16-5).
Однако следует принять во внимание еще второй фактор-энтропийный. Две молекулы SO2 и одна молекула О2 представляют собой более неупорядоченную систему, чем две молекулы SO3. Молярные энтропии этих трех молекул полностью согласуются с тем, что можно было бы предсказать, основываясь на соображениях об их относительной сложности. Из приложения 3 находим:
Молекула: Ог SO2 SO3
Молярная энтропия, 5°, Дж • К “1 • моль “1: 205,03 248,5 256,2
Вместе с тем численные значения молярной энтропии для всех трех молекул настолько близки, что решающим фактором является изменение числа молекул в результате реакции. Две молекулы реагента (SO3) образуют три
1 12
молекулы продукта (2SO2, О2), и результирующее изменение энтропии оказывается равным
AS° = 2(248,5) + (205,03) - 2(256,2) = + 189,6 Дж • К-1
Энтропия, как и энтальпия, не очень сильно зависит от температуры. Возрастание неупорядоченности в расчете на моль реакции при 298 К приблизительно совпадает с тем, что получается при 1400 К. Однако влияние энтропийного фактора сильнее сказывается при высоких температурах потому, что в энтропийный член выражения для свободной энергии в качестве множителя входит температура, Т. Чем выше температура, тем большее влияние оказывает на реакцию определенное возрастание неупорядоченности. Движущая сила реакции, измеряемая изменением свободной энергии, определяется комбинацией теплового и энтропийного эффектов. Как можно видеть из рис. 17-4, энтропийный фактор препятствует диссоциации SO3 приблизительно одинаково при любых температурах. Но энтропийный фактор увеличивает движущую силу диссоциации по мере возрастания температуры. Так, при 298 К константа диссоциации составляет всего 2,82 • 10 ~25, тогда как при 1400 К она достигает 132.
Пример 11
Каким было бы значение константы равновесия, Кравн, в реакции диссоциации SO3, если бы реагенты и продукты имели равную энтропию? Это значение константы равновесия должно соответствовать температуре абсолютного нуля, в чем можно убедиться при помощи рис. 17-4, если считать верной пунктирную экстраполяцию приведенных на нем графиков (что приблизительно соответствует действительности).
Решение
Крав„ = 610-35
До сих пор все наши выводы основывались на рассмотрении одного частного случая, диссоциации SO3. Однако и в общем случае при низких температурах большее влияние на направление химического процесса оказывает энтальпия, или теплота, реакции, а при высоких температурах большее значение приобретает энтропийный фактор, т.е. изменение упорядоченности системы.
ЗАКЛЮЧЕНИЕ
Изменение свободной энергии, AG, для реакции связано с соотношением концентраций продуктов и реагентов, называемым кажущейся константой равновесия, Q, выражением
AG = AG° + RTlng
В этом выражении AG° представляет собой изменение свободной энергии для реакции при условии, что все вещества находятся в их стандартных состояниях, так что 2=1.
При равновесии AG = 0 и, следовательно,
AG° = -RTlnK^
Свободная энергия и равновесие
113
Это важное соотношение связывает константу равновесия реакции со стандартным изменением свободной энергии для данной реакции. Константа равновесия, совпадает с кажущейся константой равновесия, относящейся к условиям равновесия.
Выражения для кажущейся и истинной констант равновесия были введены еще в гл. 4 и 5; они определяются отношением произведения концентраций продуктов к произведению концентраций реагентов, причем каждая концентрация возведена в степень, равную коэффициенту при формуле соответствующего участника реакции в ее полном уравнении. Однако правильнее использовать для этого вместо концентрации более общее понятие активность, которая определяется как отношение концентрации вещества при заданных условиях к его концентрации в стандартном состоянии. Чистые твердые вещества и жидкости либо другие компоненты реакции, уже находящиеся в своих стандартных состояниях, очевидно, имеют активности, равные 1, и поэтому могут быть исключены из рассмотрения при расчетах констант равновесий.
Для газов активность представляет собой безразмерное число, совпадающее с парциальным давлением газа в атмосферах, поэтому выражения для констант равновесий удобнее составлять с использованием парциальных давлений. Исходя из гипотетического состояния системы, включающей только чистые реагенты (в предположении об отсутствии реакции в исходный момент) или только чистые продукты (в предположении о полной завершенности реакции), можно выразить истинную степень завершенности реакции при помощи дольной переменной а. Это позволяет вычислять мольные доли реагентов и продуктов, выражая их через введенную дольную переменную а (как это показано в табл. 17-2 и 17-3), после чего можно получить выражения для парциальных давлений компонентов реакции и затем для через а. Последнее выражение дает возможность выразить величину а через известное значение константы равновесия.
Такая схема расчетов газовых равновесий позволяет осуществить количественную проверку принципа Ле Шателье. Повышение температуры благоприятствует протеканию реакции в том направлении, которое отвечает поглощению теплоты. Повышение суммарного давления не должно изменять Кравн либо отношения парциальных давлений, но оно изменяет мольные доли различных компонентов, если реагенты и продукты содержат неодинаковое число молей газов. Следовательно, а должно изменяться, даже если Кравн не изменяется. Равновесие будет смещаться в таком направлении, чтобы уменьшилось суммарное число молей всех газов.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Как связана константа равновесия реакции с термодинамическими величинами? Каким образом это соотношение позволяет убедиться, что Крави не зависит от концентраций реагентов и продуктов?
2. Что можно сказать о стандартном изменении свободной энергии для реакции, если эта реакция протекает самопроизвольно, когда реагенты и продукты находятся в их стандартных состояниях? Что можно ска
Глава 17
114
зать о константе равновесия этой реакции и как она соотносится с кажущейся константой реакции?
3. Должна ли реакция протекать самопроизвольно при любых экспериментальных условиях, если для нее стандартное изменение свободной энергии отрицательно?
4. Если теплота, выделяемая при сгорании бензина, приблизительно одинакова при любых условиях сгорания, то почему полезная работа, которую можно получить от 1 г горючего, постепенно уменьшается по мере достижения равновесия? (Воспользуйтесь снова гидростатической аналогией на рис. 17-1.) Почему это уменьшение полезной работы в расчете на грамм горючего имеет небольшое практическое значение для работы автомобильного двигателя?
5. В гл. 4 константы равновесия были выражены через парциальные давления (газов) или молярные концентрации (газов либо растворов). В настоящей главе вместо этого используются активности. Каково соотношение между этими двумя способами и каковы преимущества использования активностей? Почему нелогично говорить о размерной величине Кранн, если установлена связь между КраВН и AG°?
6. Почему использование активностей в выражениях для констант равновесий упрощает рассмотрение реакций с участием конденсированных фаз?
7. Почему табл. 17-2 и 17-3, помогающие вывести выражения для констант равновесий, сложнее таблиц, преследующих аналогичную цель и помещенных в разд. 4-4? Объясняет ли это, почему в гл. 4 и 5 мы быстро перешли от рассмотрения газов к растворам?
8. Если водород и иод реагируют при ЗОО°С, изменение свободной энергии для этой реакции зависит от концентраций или парциальных давлений Н2, 12 и HI. В отличие от этого, если реакция проводится при комнатной температуре, на изменение свободной энергии для реакции оказывают влияние только концентрации Н2 и HI. Объясните причину этого.
9. Какое влияние оказывает повышение давления на реакцию разложения РС15, описываемую уравнением (17-1)?
10. Какое влияние оказывает повышение температуры на реакцию разложения РС15, описываемую уравнением (17-1)?
11. Что должно произойти с равновесием реакции, описываемой уравнением (17-1), если ввести в систему: а) газообразный азот при постоянном давлении, б) газообразный азот при постоянном объеме, в) газообразный хлор при постоянном давлении?
12. Какое влияние на условия равновесия химической реакции оказывают разрыв связей и повышение неупорядоченности системы? Если бы единственным заслуживающим внимания фактором была только энергия связей, какой была бы константа равновесия для диссоциации молекул водорода на атомы? Если бы единственным важным фактором была только энтропия, какой была бы константа равновесия для диссоциации водорода? Используя свои ответы на эти вопросы и соотношение между G, Н и S, объясните, почему диссоциация газообразного водорода сильнее выражена при высоких температурах.
Свободная энергия и равновесие
115
ЗАДАЧИ
Вычисление Крам
1. (Система из трех газов-азота, водорода и аммиака-приходит к равновесию при суммарном давлении 5 атм. Измерение парциальных давлений трех газов дает следующие результаты: pNi = 1 атм, рд2 = 2 атм и pNHa = 2 атм. Вычислите Кравн для реакции
N2(r.) + ЗН2(г.) 2NH3(r.)
Какова Кравн для реакции
NH3(r.) yN2(r.) + 1уН2(г.)
2. В экспериментальном исследовании реакции
SO2(r.) + |о2(г.) SO3(r.)
при повышенной температуре смесь» газов О2, SO2 и SO3 достигает равновесия. Измеренные после этого парциальные давления газов оказываются равными: pSO2 = 0,0526 атм, рО2 = 0,0263 атм и pSO] = = 1,053 атм. Вычислите константу равновесия, Кравн, для данной реакции, соответствующую записанному уравнению.
3. Для реакции азотной кислоты с сульфидом при 25°С
2Н+(водн.) + 2NO3 (водн.) + ЗН25(водн.)
# 2NO(r.) + 4Н2О(ж.) + 3S(tb.)
Кравн = 1-1081. Исходя из того, что константа диссоциации H2S равна 1 10“19 и что произведение растворимости CdS равно 8 10-27, вычислите константу равновесия для реакции
2CdS(TB.) + 8Н+(водн.) + 2NO3 (водн.)
2NO“(r.) + 4Н2О(ж.) + ЗСа2+(водн.) + 3S(tb.)
Должен ли CdS растворяться в водном растворе азотной кислоты? Вычислите AG для последней реакции.
4. Хлорид фосфония, РН4С1, неустойчивый даже при низких температурах, диссоциирует на РН3 и НС1. В эксперименте 1 моль РН4С1 частично разлагается в 5-литровой колбе и парциальное давление РН3 оказывается равным 5,0 атм. Вычислите константу равновесия для реакции
РН4С1(тв.) РН3(г.) + НС! (г.)
Выражение для Кравн
5. Водяной пар реагирует с железом при 500°С с образованием газообразного водорода и Fe3O4. Запишите константу равновесия для этой реакции через активности реагентов и продуктов.
Г IU64I 1 i 16
Принцип Ле Шателье
6. Плотность льда при 273 К равна 0,917 г-см” 3, а плотность жидкой воды при той же температуре 1,00 г-см “ 3. Какое влияние должно оказывать повышение давления на температуру плавление льда?
7. Эндотермической или экзотермической является реакция
2NO(r.) + О2(г.) 2NO2 (г.)
когда она протекает при нормальных условиях? Как изменится (увеличится, уменьшится или останется неизменной) Кравн этой реакции при повышении температуры? Как изменится при повышении давления? Как изменится К^т при введении в реакционную смесь катализатора?
8. При 25 С и давлении 20 атм реакция
N2 (г.) + ЗН2 (г.) 2NH3 (г.)
имеет тепловой эффект АН = — 92,5 кДж. Допустим, что температура повысится до 300°С, а давление останется равным 20 атм. Больше или меньше аммиака будет содержаться в реакционной смеси после установления равновесия? Допустим теперь, что давление повысится до 30 атм, а температура останется равной 25°С. Больше или меньше аммиака будет содержаться в реакционной смеси после установления равновесия? Если из системы удалить половину аммиака, увеличится или уменьшится в ней содержание азота при достижении равновесия? Как повлияет на исходную равновесную смесь введение в нее катализатора синтеза аммиака?
9. Каково стандартное изменение энтальпии реакции
2NO2 (г.) # N2O4(r.)
при 298 К? Вычислите константу равновесия для этой реакции. Как должно влиять на степень превращения NO2 в N2O4 повышение температуры? Как повлияет на нее повышение давления? Увеличение объема при постоянной температуре? Твердый Na2O реагирует с NO2 с образованием NaNO3, но он не реагирует с N2O4. Как повлияет на степень превращения NO2 в N2O4 добавление в систему Na2O? Как оно повлияет на Краан?
10. При определенной температуре Т и суммарном давлении 2,00 атм пентахлорид фосфора диссоциирован на 75,0%:
РС15(г.) РС13(г.) + С12(г.)
Какова Кравн при этой температуре? Какова Кравн при 298 К? Выше или ниже температура Тпо сравнению с 298 К? На каких данных основан ваш ответ на последний вопрос?
Вычисление Кравн и AG
11. Когда 1 моль газообразного HI помещают в закрытую колбу объемом 1 л при 225°С, он разлагается с образованием 0,182 моля водорода
Свободная энергия и равновесие
117
и такого же количества иода:
2Н1(г.) Н2(г.) + 12(г.)
\
Каково значение константы равновесия этой реакции, Кравн, при 225°С? Вычислите стандартное изменение свободной энергии Дб° для этой реакции при 225°С. Воспользовавшись данными приложения 3, вычислите стандартное изменение свободной энергии и константу равновесия при 25°С. Чем объясняется различие между найденными вами значениями при 25 и 225°С?
12. м-К резол (который мы будем сокращенно обозначать НСге) представляет собой слабую органическую кислоту с константой диссоциации Кравн = 1,0-10 -10. Запишите выражение для этой константы равновесия. Какова концентрация иона Сге * в 1,00 М растворе ,м-крезола в воде? Каков pH этого раствора? Каково стандартное изменение свободной энергии для реакции диссоциации .и-крезола в водном растворе?
13. Гидразин-слабое основание, диссоциирующее в воде по уравнению N2H4 + Н2О ?± N2H5+ 4- ОН"
Константа равновесия этой реакции при 25°С равна 2,0 • 10 " 6, а стандартная свободная энергия недиссоциированного гидразина в водном растворе 127,9 к Дж-моль 1. Учитывая, что гидратированному иону Н+ приписывается (условно) стандартная свободная энергия 0,00 кДж • моль “ 1, вычислите стандартную свободную энергию иона гидразиния.
Ионные реакции
14. Пользуясь данными приложения 3, вычислите стандартную свободную энергию реакции
СН3СООН (водн.) Н + (водн.) + СН3СОО “ (водн.)
При помощи найденного значения энергии вычислите Кравн для рассматриваемой реакции. Сопоставьте полученное значение с приведенным в табл. 5-3.
15. Воспользуйтесь данными приложения 3 для вычисления константы диссоциации муравьиной кислоты в водном растворе. Сравните полученный результат со значением, приведенным в табл. 5-3. Найдите pH для 0,075 М раствора муравьиной кислоты.
График Гиббса-Гельмгольца
16. Растворимость хлорида калия в воде при 20°С равна 347 г-л - \ а при 100“С возрастает до 802 г-л !. Вычислите произведение растворимости, ПР, для КО при каждой из этих температур. При помощи графика Гиббса-Гельмгольца, подобного изображенному на рис. 17-3, вычислите теплоту растворения КО. Является экзотермическим или эндотермическим процесс растворения КО?
Глава I7
Смещение равновесия
17. Для реакции
РС15(г.) <± РС13(г.) + С12(г.)
при 25°С АН° = 92,6 кДж-моль-1. Равновесную смесь газов РС15, РС13 и С12 подвергают различным воздействиям (а-д). Укажите для каждого воздействия, как изменяется положение равновесия (смещается вправо, влево или остается прежним). Кроме того, определите, возрастает, уменьшается или остается неизменной константа равновесия, а) Введение катализатора.
б) Уменьшение объема сосуда.
в) Добавление С12 (г.).
г) Повышение температуры.
д) Добавление в сосуд инертного идеального газа.
Степень диссоциации
18. Выведите выражение для степени диссоциации, а, газового РС15 как функции суммарного давления в системе. Какая часть РС15 должна про диссоциировать при давлении 1 атм и 25°С?
19. Если 0,50 г N2O4 самопроизвольно испаряются в 2-литровой колбе при 25°С, в ней происходит реакция N2O4(r.) 2NO2(r.). Вычислите пар-
циальное давление N2O4, если известно, что Кравн для данной реакции при 25°С равна 0,114.
Ill : ! I' х 1 \ \
1. Bard A. J., Chemical Equilibrium, Harper and Row, N. Y., 1966.
2. Dickerson R. E., Molecular Thermodynamics, W. A. Benjamin, Menlo Park, Calif., 1969. В гл. 5 «Термодинамика фазовых превращений и химических реакций» более подробно рассмотрены термодинамика и равновесия.
3. Kauzmann W., Thermodynamics and Statistics, with Applications to Gases, W. A. Benjamin, Menlo Park, Calif., 1967. Гл. 5 включает хорошее изложение термодинамики и вопроса о константах равновесия.
4. Klotz J. М., Rosenberg R. М., Introduction to Chemical Thermodynamics, 2nd ed., W. A. Benjamin, Menlo Park, Calif., 1972.
5. Mahan В. H., Elementary Chemical Thermodynamics, W. A. Benjamin, Menlo Park, Calif., 1963. В гл. 3 «Второй закон термодинамики» дается более простое изложение термодинамики равновесия, чем в работе [2], но не содержится приложений к конкретным проблемам.
6. Nash L, Chem Thermo: A Statistical Approach to Classical Chemical Thermodynamics, Addison-Wesley, Reading, Mass., 1972.
7. Sienko M.J., Chemistry Problems, 2nd ed., W. A. Benjamin, Menlo Park, Calif, 1972. Содержит несколько сотен задач по равновесию с ответами. Упор делается на практическое решение задач.
ГЛАВА
18
' Равновесия с участием жидких и твердых веществ
Некоторые философы считают, что вода обладает исключительными свойствами. Они не верят доводам, что жидкое состояние воды вызывается влиянием теплоты, а полагают, что это свойство неотъемлемо от воды и зависит от сферической формы и полированной поверхности ее частиц. .. Склонность многих людей представлять себе воду обязательно как жидкость-это предрассудок, обусловленный привычкой видеть ее намного чаще в жидком, чем в твердом состоянии.
Джозеф Блэк (1803)
Важнейшие понятия
18-1. Плавление, испарение и сублимация. Теплота и энтропия плавления. Теплота и энтропия испарения. Правило Трутона.
18-2. Свободная энергия испарения. Температура кипения. Фазовые равновесия как химические «реакции». Равновесное давление пара.
18-3. Критическая точка.
18-4. Фазовые диаграммы. Тройная точка. Температура плавления, кипения и сублимации. Правило фаз.
18-5. Растворы и закон Рауля. Идеальные растворы, положительные и отрицательные отклонения от свойств идеального раствора.
18-6. Коллигативные свойства растворов. Понижение давления пара, повышение температуры кипения, понижение температуры замерзания и осмотическое давление. Моляльные константы повышения точки кипения (эбулиоскопическая константа) и понижения точки замерзания (криоскопическая константа). Определение молекулярного веса растворенного вещества.
Глава 18
120
Жидкости-довольно странные вещества. Законы, которым подчиняются свойства твердых веществ и газов, намного понятнее, чем законы, описывающие поведение жидкостей. Удивительно не то, что жидкости обладают присущими им свойствами, а что они существуют вообще. С теоретической точки зрения могло бы показаться естественнее, если бы кристаллическое вещество плавилось с образованием жидкости, молекулы которой первоначально касаются друг друга, а при дальнейшем нагревании вынуждены двигаться все быстрее и держаться на все большем расстоянии друг от друга, пока не образуется нечто подобное газу без какого-либо резкого изменения свойств жидкости в этом процессе. Такая теоретическая возможность изображена на рис. 18-1 при помощи графика зависимости молярного объема от температуры.
Реальные вещества действительно ведут себя таким образом при давлениях выше так называемого критического давления, Ркрит, которое для Н2О равно 218 атм, а для СО2 72 атм. Но при более низких давлениях их поведение больше похоже на то, которое характеризуется графиком, показанным на рис. 18-2. Молярный объем вещества обычно немного увеличивается при плавлении (часть графика между точками е и J), а затем резко возрастает в точке кипения, 7^ип,-температуре, при которой жидкость превращается в пар (переход между точками b и с). Молекулы, находящиеся в соприкосновении друг с другом в жидкости, при кипении разъединяются и после этого соприкасаются только при столкновениях, перед тем как разлететься в разные стороны.
Если внимательно просмотреть термодинамические таблицы, приведенные в приложении 3, можно заметить, что обозначение жидкости (ж.) встречается в них редко. Это показывает, как мало распространены жидкости. Большинство веществ при 298 К находятся в кристаллическом или газовом состоянии. Относительно малая распространенность жидкостей в природе не сразу бросается в глаза из-за чрезвычайно большого количества одной-единственной жидкости, Н2О, которая нетипична еще и в том отношении, что при отвердевании она расширяется, а не сжимается.
В настоящей главе проводится краткое ознакомление со свойствами твердых и жидких веществ и газов, а также с термодинамическими переходами из одного фазового состояния в другое и с условиями равновесия между различными фазами одного и того же вещества.
IS-i. ПЛАВЛЕНИЕ. ИСПАРЕНИЕ И СУБЛИМАЦИЯ
На рис. 18-1 в графической форме описано поведение веществ при давлениях выше критического давления, Ркрнт. При нагревании кристаллического вещества ниже его температуры плавления, ТПЛ, оно слабо расширяется, а по достижении этой температуры плавится, превращаясь во флюид. Поскольку молекулы вещества до и после плавления соприкасаются друг с другом, плавление сопровождается относительно небольшим возрастанием молярного обмена вещества. Выше температуры плавления молярный объем вещества возрастает сначала медленно, а затем быстрее, пока вещество не приобретет свойств идеального газа, которые подчи-
Равновесия с участием жидких и твердых веи/еств
121
Температура
Рис. 18-1. График зависимости молярного объема V от температуры для гипотетического вещества, переходящего из твердого состояния непосредственно в паровую фазу, минуя жидкое состояние. Реальные вещества ведут себя таким образом при давлениях выше критического. В процессе плавления молярный объем возрастает от значения g до значения f
няются закону PV = RT. (Символ объема с черточкой сверху означает молярный объем, т. е. V/n.)
Ниже критического давления наблюдаются совершенно иные свойства (рис. 18-2). Как и прежде, кристаллическое вещество может слегка расширяться при нагревании. В точке плавления его молекулы скользят одна вдоль другой, разрушая геометрический порядок, имевшийся в кристалле, но они по-прежнему соприкасаются друг с другом. Это и есть определение жидкости: флюид*, молекулы которого свободно перемещаются относительно друг друга, однако, остаются в скользящем контакте. Молярный
* Флюид-общее название текучих (жидкой и паровой) фаз вещества.-Прим.
перев.
Температура
Рис. 18-2. График зависимости молярного объема V от температуры для веществ, переходящих при плавлении из твердого состояния в жидкое, а затем в парообразное; при каждом фазовом превращении молярный объем вещества повышается.
Глава 18
122
объем большинства веществ немного увеличивается при плавлении, поскольку молекулы жидкости упакованы не так совершенно и не так плотно, как в твердом веществе. Вода обладает необычными в этом отношении свойствами, потому что ее молярный объем уменьшается при плавлении льда. Дело в том, что молекулы Н2О во льду удерживаются на определенных расстояниях друг от друга водородными связями, обусловливающими каркасную структуру льда, которая разрушается при плавлении. При дальнейшем повышении температуры молярный объем жидкой воды продолжает уменьшаться по мере того, как происходит разрушение каркаса водородных связей, оставшегося от кристаллической фазы, но затем постепенно начинает преобладать обычное тепловое расширение всех веществ. Вследствие этих причин вода имеет минимальный молярный объем и максимальную плотность при 4 С.
Для расплавления кристаллического вещества к нему должна поступать теплота, и в этом процессе происходит разрушение упорядоченной кристаллической решетки. Следовательно, в результате плавления возрастают как энтальпия, так и энтропия вещества. Соответствующее изменение энтальпии называется теплотой плавления, ДЯЛЛ. Для льда при 273 К
ДЯ°Л = +6,01 кДж- моль = + 22,2 энтр. ед. • моль “1
[Напомним, что 1 энтр. ед. (энтропийная единица) = 1 Дж-К-1.] Такие теплота и энтропия требуются, чтобы разрушить упорядоченную структуру кристаллического льда и позволить молекулам скользить одна вдоль другой. Сравним эти значения с соответствующими теплотой и энтропией испарения, когда молекулы жидкости действительно отрываются одна от другой, образуя газ. Для воды при 298 К
ДЯИСП = + 44,01 кДж моль “ 1
Д5°сп = +Н8,8 энтр. ед.-моль-1
Мы видим, что для испарения вещества требуется большая энергия, чем для его плавления, и при этом создается большая неупорядоченность.
Теплоту и энтропию испарения воды, значения которых приведены выше, можно вычислить, рассматривая испарение воды как химическую «реакцию»:
Н2О(ж.) Н2О(г.)
Молярная теплота испарения может быть найдена как разность между стандартными теплотами образования жидкой и газообразной Н2О, значения которых приведены в приложении 3:
ДЯ° = ДЯ°Г - ДЯ° = - 241,83 - (- 285,84) = + 44,01 кДж • моль '1
Строго говоря, найденная величина представляет собой теплоту, требуемую для превращения 1 моля жидкой воды в 1 моль паров воды при парциальном давлении 1 атм и температуре 298 К. Но из примеров, приводившихся в предыдущих главах, можно было убедиться, что теплота этой
Равновесия с участием жидких и твердых веществ
123
реакции, подобно теплотам большинства других реакций, сравнительно мало зависит от температуры. Для разъединения 1 моля молекул воды требуется приблизительно 45 кДж независимо от температуры.
Энтропию испарения при 298 К можно найти из данных приложения 3 таким же образом, как теплоту испарения:
AS°cn = S° - 5£ = 188,72 - 69,94 = 118,78 энтр. ед.-моль ~ 1
Как и энтальпия, эта величина не слишком чувствительна к температуре; степень неупорядоченности остается таковой независимо от того, при какой температуре она возникает. (Но как мы убедимся, влияние этой неупорядоченности на химическую реакцию очень сильно зависит от температуры.)
В табл. 18-1 сравниваются теплоты и энтропии испарения ряда распространенных жидкостей. Прежде всего можно заметить, что энтропии испарения всех жидкостей приблизительно одинаковы. Неупорядоченность, вносимая в систему из 6,022 -1023 молекул, находящихся в тесном контакте в жидкости, когда их разъединяют при образовании пара из жидкости, сравнительно мало зависит от природы этих молекул. Это обобщение известно под названием правила Трутона, по имени ученого, который установил его эмпирически в XIX в. Наиболее высокие молярные энтропии испарения, превышающие молярные энтропии других веществ на 10-20 энтр. ед., имеют метанол, этанол и вода. Повышенные энтропии испарения этих веществ объясняются тем, что их полярные молекулы удерживаются в жидкости друг возле друга силами диполь-дипольного взаимодействия и водородными связями. Повышенная степень упорядоченности жидкости означает, что для образования из нее газа требуется внести несколько большую неупорядоченность. Поскольку для разъединения взаимодействующих молекул такой жидкости требуется больше энергии, теплота ис-
Таблица 18-1
Температура кипения, теплота и энтропия испарения некоторых распространенных жидкостей2
Вещество ^КИП» К АЯисп. , кДж МОЛЬ 1 ДХисп, энтр. ед.-моль 1 ДН^/ДХ^сп, К
ВаС13 285,6 23,0 80,8 285
Вг2 331,9 30,7 92,3 333
CHjOH 338,1 37,4 110,9 337
С2Н5ОН 351,7 42,2 121,3 348
С6н6 1533 33,9 96,2 352
Н2О 373,15 44,2 118,8 372
Hg 629,7 61,0 97,5 626
а Данные иэ приложения 3.
! it! L< i S
124
парения жидкости также оказывается несколько повышенной. Причина высокой теплоты испарения ртути заключается в том, что атомы ртути имеют большую массу и их трудно привести в движение, но отсюда вовсе не следует, что энтропия испарения ртути также должна быть велика.
При достаточно низких давлениях твердые вещества также могут непосредственно переходить в паровую фазу; этот процесс называется сублимацией. Сублимация - обычное явление для твердого диоксида углерода при давлении 1 атм, и именно по этой причине его принято называть «сухим льдом». Обычный лед при таком давлении плавится с образованием жидкости, но холодным зимним утром при сухом воздухе сугробы могут сублимировать, превращаясь непосредственно в пары воды, без предварительного перехода в жидкое состояние. Поскольку энтальпия и энтропия являются функциями состояния, теплота или энтропия сублимации должны представлять собой суммы теплот или энтропий плавления и испарения при той же самой температуре. Например, для воды в предположении, что АН и AS при 273 К имеют такие же значения, как и при 298 К, находим
АН°у6л = АН°Л + АН°СП = 6,01 + 44,01 = 50,02 кДж • моль ' 1 AS°y6jI = AS°n + AS°cn = 22,2 + 118,8 = 141,0 энтр. ед.-моль - 1
СВОБОДНАЯ АНг.РГИЯ ИСПАРЕНИЯ И ДАВЛЕНИЕ ПАРА
Свободная энергия испарения определяется соотношением
AGHCn = АН°СП — TAS°,(при постоянной Т) (18-1)
В отличие от АНИСП и AS°cn, которые мало зависят от температуры, AG°cn очень сильно зависит от температуры, Т, которая явно входит в соотношение (18-1). Если ради простоты предположить, что изменения энтальпии и энтропии постоянны, то можно графически представить зависимость AG от АН и AS, как это сделано на рис. 18-3 на примере Н2О. При высоких температурах произведение 7AS° больше, чем АН°, свободная энергия испарения отрицательна и испарение воды при парциальном давлении водяных паров 1 атм должно происходить самопроизвольно. При низких температурах АН° больше, чем 7AS°, так что AG° положительно, и самопроизвольно осуществляется конденсация водяных паров. При некоторой промежуточной температуре энтальпийный и энтропийный эффекты в точности компенсируют друг друга, AG° становится равным нулю и жидкая вода находится в равновесии с парами воды при парциальном давлении 1 атм. Такое состояние отвечает нормальной температуре кипения жидкости, 7^И11 (температура кипения на уровне моря). Для воды эта температура равна 100°С, или 373,15 К. При более низком атмосферном давлении (на большой высоте над поверхностью моря) вода кипит при температуре ниже 100°С.
Поскольку в точке кипения (жидкость и пар находятся в равновесии) AG должно быть равно нулю, это означает, что АН = TAS, и поэтому
Равновесия с участием жидких и твердых веществ
125
Рис. 18-3. Энтальпийный и энтропийный вклады в изменение свободной энергии испарения жидкой воды. Энтальпийный вклад, ЛЯ°, преобладает при температурах ниже 373 К, и при таких температурах жидкая вода является термодинамически устойчивой формой по сравнению с парами воды, имеющими парциальное давле-
ние 1 атм. Энтропийный вклад, ТД5°, преобладает при 373 К, и пары воды при парциальном давлении 1 атм являются более устойчивой формой по сравнению с жидкой водой. В точке кипения, при 373 К, AG° равно нулю, и жидкая и парообразная вода находятся в равновесии.
в принципе температуру кипения
можно определить из соотношения
Т 'кип
АНис„ AS°cn
(18-2)
Строго говоря, соотношение (18-2) справедливо только для энтальпии и энтропии при температуре кипения, но значения этих величин при 7^ип найти нелегко. Однако, поскольку Н и S мало зависят от температуры, можно найти приближенное значение температуры кипения, пользуясь данными о ДН°СП и А5°сп при 298 К, вычисленными по данным приложения 3. Найденные таким образом приближенные температуры кипения приведены в последней колонке табл. 18-1; они всего на несколько градусов отличаются от истинных 7^ип. Расхождения обусловлены не приближенным характером соотношения (18-2), а тем, что А//исп и Аисп при 298 К не вполне точно совпадают с их значениями при температуре кипения.
При температурах ниже точки кипения жидкая вода не находится в равновесии с водяным паром при парциальном давлении 1 атм; однако это не означает, что водяной пар не может существовать при температурах ниже точки кипения воды. Понижение температуры благоприятствует конденсации, и между жидкостью и ее паром устанавливается новое равновесие, при котором пар имеет более низкое парциальное давление. Если мы снова будем рассматривать испарение как химическую реакцию, то полу
Г laea 18 126
чим общее выражение для свободной энергии [см. уравнение (16-26)]:
AG = AG° + KTln — (18-3)
Поскольку стандартным состоянием жидкости является сама эта жидкость в чистом виде, = 1. В свою очередь а, представляет собой безразмерную величину, численно равную парциальному давлению паров вещества над поверхностью его жидкости. В практических расчетах принято пользоваться символом парциального давления рг, а не аг, хотя с математической точки зрения допустимо вычислять логарифм только безразмерной величины. Учитывая сказанное, имеем
AG = AG° + RTln pr (18-4)
Парциальное давление пара, находящегося в равновесии с жидкостью при определенной температуре, называется равновесным давлением пара, pv. Поскольку при равновесии AG — 0, уравнение (18-4) позволяет записать.
AG° = -RT]npv или р„ = e-AG'/RT (18.5)
По определению нормальной температуры кипения, для воды при 373 К р„ = 1 атм. Посмотрим теперь, чему равно равновесное давление пара воды при комнатной температуре (298 К).
Пример 1
Вычислите Абисп и давление паров воды при 298 К.
Решение
Используя найденные ранее значения АН„СП и AS„CII, получим
Абадп = + 44,010 - 298(+ 118,8) = 8608 Дж моль"1
Пользуясь значениями свободных энергий из приложения 3, можно прийти к такому же ответу:
AG°„cn = - 228,59 - (- 237,19) = 8,60 кДж-моль"1
Теперь найдем равновесное давление водяного пара:
pv = £- 8600/8,314-298 = £-3.47 = j 0 - 3,47/2,303 = 0 031 j атм
Прежде чем мы сможем вычислить pv при любой другой температуре, необходимо выяснить, как зависит от температуры AG°cn. Для этой цели можно применить уравнение Гиббса-Гельмгольца, о котором упоминалось в разд. 17-4, но это слишком громоздкая процедура. Вместо этого достаточно воспользоваться поразительно точным допущением, что энтальпия и энтропия практически не зависят от температуры, т.е. что свободная энергия зависит от температуры как функция вида а — ЬТ. На рис. 18-4
Равновесия с участием жидких и твердых веществ
127
Рис. 18-4. График зависимости равновесного давления паров воды от температуры. В точке кипения р„ = 1 атм. Четыре точки соответствуют резуль-
татам приближенного вычисления р„, проведенного в предположении, что энтальпия и энтропия испарения не зависят от температуры.
точками показаны значения pv, полученные на основе такого приближенного подхода, а сплошная кривая представляет собой график истинной зависимости давления паров воды от температуры. Вблизи точки кипения кривая поднимается столь круто, что приближенное значение р„ содержит большую ошибку, 0,11 атм, хотя ошибка в Ткип составляет менее 3°С.
Изображенный на рис. 18-4 график дает, с одной стороны, зависимость парциального давления пара в равновесии с жидкостью от температуры, а с другой стороны, зависимость температуры кипения жидкости от парциального давления ее равновесного пара, поскольку точка кипения определяется как температура, при которой р„ уравнивается с внешним давлением. При температурах ниже Т1т молекулы могут испаряться с поверхности жидкости, но любой пузырек пара, образующийся внутри жидкости, разрушается внешним давлением на ее поверхности. Однако при Т1т давление внутри таких пузырьков становится равным внешнему давле
r.iaea 18 128
нию. Пузырьки пара, возникая внутри жидкости, поднимаются на поверхность; их бурное выделение мы называем кипением.
На больших высотах, где атмосферное давление ниже нормального (1 атм), температура кипения воды снижается. Бюро погоды США определяет изменения давления на разной высоте с помощью простого правила «дюйм ртутного столба на каждые 1000 футов» (приблизительно 25 мм рт. ст. на каждые 300 м). Нормальное (стандартное) атмосферное давление равно 29,9 дюйма ртутного столба (760 мм рт. ст.).
Пример 2
Воспользуйтесь описанным выше приближением, чтобы вычислить температуру кипения воды на высоте 12000 футов в горах.
Решение
Давление на указанной высоте ниже стандартного на 12 дюймов рт. ст., т. е. на 12/29,9 = 0,40 атм. Если Р = 1,00 — 0,40 = 0,60 атм, то с помощью рис. 18-4 нетрудно найти, что Ткип = 86°С.
1S-3. ЬДЧГГИЧг/ К ЛЯ ТОЧКА
Изображенная на рис. 18-4 кривая зависимости равновесного давления пара от температуры не поднимается вверх бесконечно; она резко обрывается в так называемой критической точке, которая для воды соответствует Ркрнт = 218 атм и 7^рит = 374°С. Когда вещество достигает этой точки, молярный объем его паровой фазы уменьшается из-за повышенного давления, а молярный объем жидкости, которая, будучи конденсированной фазой, менее восприимчива к изменениям давления, возрастает вследствие повышения температуры. Таким образом, по мере подъема вдоль кривой равновесия жидкость-пар, показанной на рис. 18-4, жидкая фаза расширяется, а паровая фаза, наоборот, сжимается. Вещество достигает критической точки, когда молярные объемы его жидкой и паровой фаз становятся одинаковыми, так что различие между двумя отдельными фазами исчезает. В критической точке Н2О находится в одной фазе и имеет молярный объем 57 см3-моль' *, тогда как жидкая вода (плотность 1 г-см-3) имеет молярный объем 18 см3 -моль “ *, а пары воды при 298 К-молярный объем 24450 см3-моль~Следовательно, критическая точка достигается главным образом не за счет расширения жидкости, а за счет сжимания газа до тех пор, пока он не уменьшит свой молярный объем до молярного объема жидкости.
Другие свойства критической точки удается понять при помощи рис. 18-5, на котором изображены графики зависимости давления от объема для СО2 при различных температурах. Движение вдоль линии постоянной температуры, или изотермы, соответствующей 30,4°С, начиная от точки а, описывает уменьшение объема газообразного СО2 по мере повышения давления до 71,8 атм в точке Ь. При этом давлении пары СО2 находятся в равновесии с жидкостью при 30,4°С, и поэтому дальнейшее сжатие пара вызывает лишь его сжижение без изменения давления, пока не
Равновесия <' участием жидких и твердых веществ
129
Рис. 18-5. Графики зависимости молярного объема диоксида углерода от давления для ряда различных постоянных температур. Куполообразная центральная область (ограниченная штриховой линией) соответствует области равновесия между двумя фазами - жидкостью и паром. Слева от купола располагается область условий существования жидкости, а справа от него-область условий существования пара. Точки а-g обсуждаются в тексте.
будет достигнута точка с. В этой точке весь СО2 сжижен, и кривая начинает круто подниматься к точке d и выше, поскольку жидкость обладает гораздо меньшей сжимаемостью, чем газ. Большое повышение давления вызывает лишь незначительное уменьшение объема.
Куполообразная область, ограниченная пунктирной линией, соответствует условиям равновесия жидкость-пар. На левом конце произвольной горизонтальной линии, отвечающей определенным температуре и давлению, например с — Ь, молярный объем жидкости, находящейся в равновесии с паром, совпадает с молярным объемом жидкости на правом конце той же линии. По мере повышения температуры своды куполообразной кривой сближаются и молярные объемы двух фаз становятся все более близкими друг другу. На вершине купола молярные объемы жидкости и пара совпадают, и различие между двумя фазами исчезает. Это и есть критическая точка е. При еще более высоких температурах и при больших молярных объемах (правая часть рис. 18-5) изотермы, определяющие зависимость Р—V, все лучше подчиняются закону PV = const, предсказываемому для идеального газа (см. рис. 3-3,а).
Парадоксальные свойства критической точки можно проиллюстрировать при помощи процесса, проходящего по пути с—b—f—g—с, который на рис. 18-5 частично показан пунктирными линиями. Допустим, что в начале этого процесса жидкий СО2 находится в цилиндре с окошком для наблюдения при температуре, давлении и объеме, соответствующими точке с, а затем объем медленно увеличивается при постоянной температуре
5-796
Г.шва 18
130
в направлении к точке Ь. При этом часть жидкости начнет испаряться, и в цилиндре можно наблюдать две фазы, разделенные мениском на поверхности жидкости. По достижении точки b остаток жидкости как раз испарится и в цилиндре останутся только пары СО2. Теперь представим себе, что эти пары нагревают при постоянном объеме от 30,4 до 31,5°С, переводя систему из точки b в точку /, затем пары изотермически при 31,5°С сжимают, переходя из точки f в точку д, и, наконец, охлаждают при постоянном объеме, возвращая их в точку с. Начиная от точки b и кончая точкой с, в цилиндре должна присутствовать только одна фаза. Но в точке b имелся чистый пар, а в точке с должна существовать чистая жидкость. В каком же месте пути b—f—д—с пар перестает быть паром и становится жидкостью? На самом деле этот вопрос представляет собой всего лишь игру слов, основанную на наших привычных представлениях, что если система переходит непосредственно из точки b в точку с вдоль изотермы при 30,4°С, то на всем пути перехода наблюдается разделение вещества системы на две фазы. Однако можно перейти из точки b в точку с таким путем, при котором происходит лишь постепенное уменьшение расстояния между молекулами в одной фазе.
В табл. 18-2 приведены значения критических давления, температуры и молярного объема для ряда распространенных веществ. Отметим, что во
Таблица 18-2
Критические постоянные и нормальные температуры кипения для ряда распространенных веществ
Вещество Ркрит. атм ^крит’ К И Крит- СМ3 ' МОЛЬ 1 ТЕИП (ПРИ 1 атм), К
Не 2,34 5,3 62 4,6
н2 13 33,2 65 21
Ne 26,9 44 27
n2 34 126 90 77
о2 50,5 154 75 90
сн4 46,5 191 109
со2 72,8 304 95 195 (сублимирует)
НС1 83,2 325 188
H2S 90,4 373 212
NH3 113 405 72 240
Н2О 218 647 57 373
Hg 1036 1735 40 630
всех случаях Ркрит больше нормального земного атмосферного давления. Поэтому плавление твердого вещества, а затем испарение образовавшейся жидкости с переходом в пар представляется нам «нормальным» поведением вещества при нагревании. Для ряда указанных в таблице веществ, от гелия до метана, ТкрИ1 меньше комнатной температуры (298 К), а это озна
Равновесия с участием жидких и твердых веществ
131
чает, что ни один из этих газов нельзя сжижать путем фазового превращенное результате повышения давления, если сначала не охладить их ниже соответствующей критической температуры.
18-4. ФАЗОВЫЕ ДИАГРАММЫ
Все свойства вещества, описанные в двух предыдущих разделах, могут быть представлены с помощью фазовой диаграммы-графика зависимости давления от температуры, указывающего условия, при которых твердая, жидкая или паровая фаза является термодинамически устойчивой формой вещества, и те условия, при которых две или даже все три фазы находятся в равновесии друг с другом. Показанная на рис. 18-6 фазовая диаграмма СО2 типична для веществ, которые расширяются при плавлении, что случается чаще всего. Уже знакомая нам кривая зависимости равновесного давления пара от температуры простирается от тройной точки, где твердая, жидкая и паровая фазы находятся в равновесии, до критической точки. Вдоль этой линии жидкость и газ находятся в равновесии. Жидкость является устойчивой фазой выше этой кривой, а пар-устойчивой фазой ниже нее.
Твердая и паровая фазы находятся в равновесии друг с другом вдоль кривой, проходящей из начала координат графика на рис. 18-6 к тройной точке. Эта кривая характеризует давление пара над поверхностью твердого СО2 в зависимости от температуры, или изменение температуры сублимации, Тсу6л, в зависимости от давления. Прямая линия, уходящая вверх от
Рис. 18-6. Фазовая диаграмма диоксида углерода. Кривыми разграничены области существования отдельных фаз; граничные линии отвечают условиям двухфазных равновесий. Все три
фазы сосуществуют в тройной точке. Ркрит и 7"E_„T-координаты критической точки, а Ррр и Т|р-координаты тройной точки. Тсу6л-температура сублимации при давлении 1 атм.
5*
тройной точки, указывает условия равновесия между твердой и жидкой фазами, т. е. зависимость температуры плавления от давления.
Направление наклона всех трех кривых фазовой диаграммы СО2 в правую сторону можно предсказать на основании принципа Ле Шателье. Повышение давления благоприятствует образованию более плотной фазы. Молярный объем жидкое ги больше, чем у твердого вещества, а молярный объем газа еще больше. Поэтому температуры сублимации (7^у6л), плавления (7^л) и кипения (Тып) должны повышаться при возрастании давления, так как при этом для перевода молекул в менее плотную фазу требуется затрачивать все большую энергию.
Равновесие между всеми тремя фазами СО2-твердой, жидкой и паровой-достигается лишь при единственном сочетании условий, в тройной точке. Тройная точка для СО2 характеризуется давлением 5,1 атм и температурой - 56,6СС. Мы привыкли считать, что твердый СО2 сублимирует, а не плавится, но это происходит лишь потому, что атмосферное давление ниже давления тройной точки для СО2. Если твердый СО2, находящийся под давлением 1 атм, медленно нагревать, давление его паров повышается в соответствии с изображенной на рис. 18-6 кривой равновесия твердая фа-за-паровая фаза до тех пор, пока при — 78°С оно не достигнет атмосферного давления. При температурах выше этой точки сублимации твердая фаза уже не является устойчивой при внешнем давлении 1 атм.
В отличие 01 этого при давлениях выше 5,1 атм СО2 так же плавится и испаряется, как эго происходит с водой и другими веществами, проходящими через привычную для нас жидкую фазу. Если на рис; 18-6 провести горизонтальную линию при давлении 6 атм, точка ее пересечения с кривой равновесия твердая фаза -жидкая фаза указывает температуру плавления твердого СО2, а точка пересечения с кривой равновесия жидкость-пар указывает температуру кипения жидкости при давлении 6 атм. Обитатели планеты, где нормальное атмосферное давление превышает 5,1 атм, могли бы купаться в озерах из жидкого диоксида углерода. При давлениях выше 72,8 атм различие между жидкостью и газом исчезает и возможен только один фазовый переход -между твердой фазой и флюидом (боЛЬе точное название фазы в последнем случае дать невозможно).
Вода обладает довольно необычными свойствами, потому что ее твердая фаза имеет меньшую плотность, чем жидкая. Лед плавает в воде, тогда как почти любое другое твердое вещество тонет в своей жидкой фазе. Помимо воды лишь немногие сплавы металлов расширяются при замерзании (отвердевании); такие сплавы используются для отливки печатных шрифтов, при изготовлении которых требуется получать из матриц реплики с резко ограненными краями. Пары воды имеют меньшую плотность (т. е. больший молярный объем), чем ее жидкая и твердая фазы, но жидкая вода плотнее льда и поэтому повышение давления благоприятствует переходу в жидкую фазу. Сказанное означает, что жидкое состояние воды легче получить при повышенных давлениях, т. е. что температура плавления льда понижается по мере возрастания давления Р. Вследствие этого кривая равновесия твердая фаза-жидкая фаза у воды, поднимаясь вверх, отклоняется
Равновесия с участием жидких и твердых веществ
133
1
Рис. 18-7. Фазовая диаграмма воды. Координаты критической и тройной точек обозначены так же, как на рис. 18-6. Тпп и Ткип-соответственно температура плавления и кипения при давлении 1 атм. Поскольку объем
льда при плавлении уменьшается, кривая равновесия твердое вещество - жидкость, поднимаясь вверх, смещается влево; этим вода отличается от диоксида углерода и большинства других веществ.
влево, как показано на рис. 18-7. В отличие от льда, который плавится при повышении давления, жидкая фаза почти любого другого вещества при повышении давления переходит в твердую фазу. (Подумайте, какое влияние на климат нашей планеты оказало бы свойство океанических льдов погружаться в воду, а не плавать в ней.)
Тройная точка воды, в которой ее пары, жидкая и твердая фазы могут сосуществовать в равновесии, характеризуется температурой 0,0098°С и давлением 0,0060 атм. Поскольку нормальное атмосферное давление превышает указанную величину, мы привыкли видеть, что лед плавится, переходя в жидкую воду, а не сублимирует, подобно СО2- Пересечение горизонтальной прямой, соответствующей давлению Р = 1 атм, с кривой равновесия твердая фаза-жидкая фаза дает температуру плавления льда: 0°С, а пересечение этой горизонтали с кривой равновесия жидкость-пар дает температуру кипения воды: 100°С. Различие между жидкой и газообразной водой исчезает только при давлениях выше критического, которое равно 218 атм.
Аналогичные фазовые диаграммы можно построить для всех веществ, существующих в твердой, жидкой и паровой фазах. В табл. 18-3 приведены условия существования тройных точек некоторых веществ. Их фазовые диаграммы имеют такой же вид, как и изображенная на рис. 18-6 фазовая диаграмма СО2, поскольку все эти вещества, за исключением воды, характеризуются наклоном вправо кривой равновесия твердая фаза-жидкая фаза; различия между диаграммами СО2 и остальных однотипных с ним ве-
134
Таблица 18-3
Тройные точки некоторых распространенных веществ
Вещество Р„р, атм 7'тр, атм
о2 0,0026 -218
N2 0,127 -210
Аг 0,674 -190
СО2 5,11 -56,6
Н2О 0,0060 + 0,0098
ществ сводятся к соответствующим изменениям шкалы давлений и температур. Следует отметить, что условия существования только одной фазы вещества - твердой, жидкой или паровой-определяются целыми площадями фазовой диаграммы. В пределах этих площадей давление и температура могут изменяться назвисимо друг от друга. Условия, при которых две фазы находятся в равновесии друг с другом, определяются линиями, или кривыми, на фазовой диаграмме. Поддержание равновесия между двумя фазами требует, чтобы лишь одна из двух переменных-давление или температура - изменялась независимым образом. Например, если для равновесия между жидкостью и паром указана температура, то давление пара, находящегося в равновесии с жидкостью, оказывается полностью определенным. И наоборот, температура кипения жидкости полностью определяется указанием давления окружающей атмосферы. Единственная совокупность условий, при которых все три фазы могут сосуществовать в равновесии, соответствует определенной точке фазовой диаграммы; это и есть тройная точка. В тройной точке система не имеет степеней свободы, так как ни Р, ни Т не могут быть изменены без того, чтобы не исчезла по крайней мере одна из трех фаз.
Замечательный американский математик и физик Дж. Уиллард Гиббс сформулировал для всех подобных ситуаций общее правило фаз: если число степеней свободы термодинамической системы, т. е. число ее независимо изменяемых параметров состояния, как, например, давление и температура, равно f а число имеющихся в наличии фаз равно р, то
f = 3 - р (18-6)
Эта формулировка правила фаз относится к однокомпонентной системе, т. е. к чистому веществу. Правило фаз приобретает еще большее значение, если его распространить на систему из нескольких веществ, например на многокомпонентные растворы. Для таких систем правило фаз в его наиболее общей форме описывается соотношением
/ = 2 + с - р
(18-7)
Равновесия с участием жидких и твердых веществ
135
где с означает полное число компонентов (веществ) в системе. Рассмотренные выше в качестве примера вода и СО2 представляют собой однокомпонентные системы, для которых с = 1, что приводит к соотношению (18-6).
Правило фаз имеет интересную геометрическую аналогию. Если пространственные многогранники, например кубы, октаэдры, тетраэдры и другие, с различными типами граней имеют всего F граней, V вершин и Е ребер, то
F = 2 + Е - V (18-8)
Гиббс, как математик, несомненно знал это правило, поэтому он мог рассуждать о фазовых равновесиях, пользуясь геометрическими аналогиями, и догадаться, что равновесные свойства растворов описываются соотношением, уже известным из геометрии.
18-5. РАСТВОРЫ И ЗАКОН РАУЛЯ
Равновесное давление пара представляет собой меру способности молекул переходить из жидкой фазы в паровую. Как мы видели, эта способность больше при высоких температурах и меньше при пониженных температурах. Она также снижается при уменьшении числа молекул жидкости, которые могут испаряться. Если в растворе половина молекул воды, а половина молекул какого-либо другого вещества, то давление паров воды должно быть вдвое меньше, чем у чистой воды. В общем случае если ХА-мольная доля компонента А раствора и р‘А-давление пара чистого вещества А при данной температуре, то давление паров вещества А над его раствором определяется соотношением
Ра = *аРа (18-9)
Точка справа над символом давления указывает, что параметр относится к чистому компоненту. Это соотношение известно как закон Рауля, а растворы, подчиняющиеся закону Рауля для всех своих компонентов, называются идеальными растворами.
Разумеется, если другой компонент водного раствора тоже представляет собой летучее вещество, то и оно вносит вклад в давление пара над раствором, равный
Рв = -^вРв (18-10)
Полное давление паров над раствором представляет собой сумму парциальных давлений всех компонентов раствора:
Рполн = Ра + Рв = ^аРа + *вРв (18-11)
Поскольку ,¥А + Хв = 1, можно записать
Рполн = А'аРа + (1 - A'aJpb = Рв + (Ра - РвПа (18-12)
Рис. 18-8. Парциальные давления паров бензола, рБ, и толуола, ру, и суммарное давление пара, Рполн, над раствором двух этих жидкостей друг в друге. Эти растворы обладают
идеальными свойствами, и для обоих компонентов выполняется закон Рауля. Парциальные давления пара каждого компонента линейно зависят от его мольной доли в растворе.
откуда видно, что полное давление паров раствора является линейной функцией мольной доли любого его компонента.
Растворы с такими идеальными свойствами получаются при смешении жидкостей с очень близкими свойствами, в которых взаимодействия между молекулами одного сорта и взаимодействия между разносортными молекулами практически одинаковы. В качестве примера можно привести смесь бензола и толуола; на рис. 18-8 изображены графики парциальных давлений и суммарного давления растворов этих жидкостей друг в друге. Поведение других растворов может отличаться от описываемого законом Рауля. Если разносортные молекулы взаимодействуют между собой слабее, чем молекулы одного сорта, то вклады в давление пара от каждого компонента будут больше, чем предсказывается законом Рауля. Замена молекул А вокруг молекулы А на молекулы типа В должна повысить шансы молекулы А перейти в паровую фазу. Следовательно, в данном случае вместо закона Рауля должны выполняться соотношения
Ра > -^аРа и Рв > ^вРв (18-13)
Такая ситуация называется положительным отклонением от свойств идеального раствора; она наблюдается для растворов ацетона и дисульфида углерода и показана на рис. 18-9.
Для некоторых комбинаций веществ притяжения между разносортными молекулами оказываются сильнее, чем притяжения между молекулами одного сорта. Такими свойствами обладают растворы воды и этанола. Добавление этанола к воде уменьшает шансы молекулы Н2О перейти в газо-
Равновесия с участием .жидких и твердых веществ
137
Рис. 18-9. Парциальные давления паров компонентов и полное давление пара над раствором ацетона (А) и дисульфида углерода (Д) с положи-
тельными отклонениями от идеальных свойств. Штриховые линии соответствуют идеальным свойствам, подчиняющимся закону Рауля.
вую фазу и снижает давление пара сильнее, чем это предсказывается законом Рауля,
Ра < уаРа и Рв < Хврв (18-14)
Поскольку давление пара в этом случае оказывается ниже предсказываемого законом Рауля, подобная ситуация называется отрицательным отклонением от свойств идеального раствора. В качестве примера на рис. 18-10 показаны свойства растворов ацетона и хлороформа.
Рис. 18-10. Парциальные давления паров компонентов и полное давление пара над раствором ацетона (А) и хлороформа (X) с отрицательными откло-
нениями от идеальных свойств. Штриховые линии соответствуют идеальным свойствам.
Глава 18
138
Хотя положительные и отрицательные отклонения от закона Рауля имеют большое значение для реальных растворов, подобно тому как отклонения от закона состояния идеального газа играют важную роль для реальных газов, мы будем заниматься главным образом свойствами идеальных растворов и ситуациями, в которых закон Рауля выполняется хотя бы приблизительно.
Пример 3
Равновесные давления паров воды и этанола при 25°С равны соответственно 0,0311 и 0,0713 атм. Каково равновесное давление пара раствора, содержащего 25 мол."о спирта, и каковы вклады в это давление каждого из компонентов раствора? Допустим, что раствор обладает идеальными свойствами.
Решение
Вклады компонентов в давление паров раствора:
Этанол: р = 0,25-0,0713 атм = 0,0178 атм Вода: р = 0,75 0,0311 атм = 0,0233 атм
Полное давление паров раствора представляет собой сумму этих величин, т. е. 0,0411 атм.
15-6. КО.иИГАГИВНЫЕ СВОЙСТВА РАС 1 ВОРОВ
Четыре свойства разбавленных растворов нелетучего вещества в летучем растворителе традиционно объединяются под названием коллига-тивных свойств:
1. Понижение давления пара растворителя.
2. Повышение температуры кипения растворителя.
3. Понижение температуры замерзания растворителя.
4. Явление осмотического давления.
Эти свойства называются коллигативными (что означает коллективными) потому, что они зависят от количества имеющихся молекул или ионов растворенного вещества, а не от природы растворенных частиц (до тех пор, пока они остаются нелетучими и появляются только в жидкой фазе). Коллигативные свойства играли важную роль для химиков прошлого века, поскольку они позволяли судить о числе частиц имеющегося в наличии растворенного вещества, а следовательно, о его молекулярной массе и степени ионизации в растворе. Коллигативные свойства позволили Аррениусу показать, что в растворе содержится больше частиц, чем имелось в наличии молекул растворенного вещества, а следовательно, что молекулы растворенного вещества в растворе разрываются на ионы. В настоящее время коллигативные свойства используются главным образом для определения молекулярных масс неизвестных веществ по способу, который будет описан ниже.
Равновесия с участием жидких и твердых веществ 139
Понижение давления пара растворителя
Когда чистая жидкость В находится в равновесии со своим паром, свободная энергия жидкого и парообразного вещества В должна быть одинаковой. Испарение и конденсация происходят с одинаковой скоростью. Если к жидкости добавляется небольшое количество нелетучего растворенного вещества А, свободная энергия или способность к испарению вещества В в растворе понижается, поскольку некоторая часть молекул раствора, достигающая поверхности раздела жидкости и газа, относится к веществу А, а не к В. Однако обратная тенденция, конденсация пара в жидкость, остается неизменной, потому что в паровой фазе отсутствуют молекулы типа А, которые могли бы помешать молекулам типа В конденсироваться. При постоянной температуре частота, с которой молекула жидкости достигает поверхности с достаточной кинетической энергией, чтобы перейти в паровую фазу, одинакова в чистом веществе Вив растворе, если считать, что раствор обладает идеальными свойствами (рис. 18-11). Однако предполагается, что растворенное вещество А является нелетучим. Поэтому не все молекулы, достигающие поверхности с указанной энергией, могут на самом деле покинуть жидкость. Если 1% молекул в растворе принадлежит к типу А, то давление пара В составит лишь 99% давления пара чистого вещества В. Это утверждение основано на законе Рауля:
Рв = -^вРв (18-10)
Понижение давления пара растворителя В, вызываемое присутствием рас
а
Рис. 18-11, Понижение давления пара над раствором.
а-равновесие между жидкостью и ее паром, при котором молярная свободная энергия, или способность молекул покидать данную фазу, одинакова в обеих фазах;
б-добавление растворенного вещества (цветные кружочки); при этом концентрация растворителя снижается и, следовательно, уменьшается способность
8
его молекул покидать жидкую фазу, что заставляет равновесие в системе смещаться в направлении большей конденсации газа. К этой ситуации можно применить принцип Ле Шателье. При разбавлении растворителя растворенным веществом положение равновесия смещается в таком направлении, чтобы восстановить концентрацию растворителя до ее первоначального значения.
творенного вещества А, определяется соотношением
Ар = Рв - Рв = (1 - хв)Рв = хаРв (18-15)
Таким образом, изменение давления пара пропорционально имеющемуся количеству вещества А, но не зависит от конкретной природы молекул вещества А.
Влияние нелетучего растворенного вещества на кривую давления пара жидкости показано на рис. 18-12. При любой температуре давление пара понижено на часть своего первоначального значения, пропорциональную Хв, так что кривая давления пара раствора (штриховая линия) следует за кривой давления пара чистого растворителя (сплошная линия), оставаясь все время ниже ее.
Повышение температуры кипения раствора
Рис. 18-12 позволяет проиллюстрировать и второе коллигативное свойство растворов: повышение температуры кипения. Допустим, что рв равно окружающему атмосферному давлению, так что Т'КИП представляет собой температуру кипения чистой жидкости В (точка 1). Если к ней добавить такое количество растворенного вещества А, что мольная доля вещества В уменьшится от 1 до Хв, то давление пара растворителя В уменьшится от р‘в до рв = Хвр'в (точка 2). Это давление меньше атмосферного, поэтому раствор при температуре Т’ип уже не кипит. Чтобы заставить раствор снова кипеть, необходимо повысить его температуру, переходя вдоль штриховой кривой давления из точки 2 в точку 3, где давление пара снова становится равным атмосферному давлению.
Жидкая (раза
Паровая фаза
‘кип кип
Температура
Рис. 18-12. Влияние растворенного вещества на положение кривой равновесия жидкость-пар для растворителя. При каждой температуре давление пара уменьшается и составляет Хв-ю
часть исходной величины. Температура кипения раствора, Ткип, выше, чем температура кипения чистого растворителя, г;ип.
Равновесия t участием миоких и твердых веществ
141
Для разбавленных растворов, где количество растворенного вещества А невелико, изменение температуры кипения А 7^,,, прямо пропорционально моляльности тЛ вещества А, т. е. числу молей вещества А на 1 кг растворителя:
дткип = Гкип - Ткип = A\.i!i]niA (18-16)
Моляльная константа повышения температуры кипения растворителя В, к,.^, называемая также эбулиоскопической констанюй, зависит только от свойств растворителя-его нормальной температуры кипения, 7\ип, молекулярной массы, Мв, и теплоты испарения, ДНиа|, вещества В, но никоим образом не зависит от свойств растворенного вещества А, вызывающего изменение температуры кипения:
^кип
RT КИП2МВ 1000АНисп
(18-17)
Значения моляльной константы повышения температуры кипения некоторых распространенных растворителей приведены в табл. 18-4.
Таблица 18-4
Температура замерзания и кипения и моляльные константы понижения температуры замерзания и повышения температуры кипения некоторых распространенных растворителей*'
Растворитель Т °C град моль 1 кг С ^КЙП’ град-моль 1 кт М, г
Вода, Н2О 0 1,86 100 + 0,52 18,0
Тетрахлорид углерода, СС14 -22,99 - 30,00 76,5 5,03 154,0
Хлороформ, СНС1з -63,5 4,70 61.7 3,63 119,5
Бензол, С6Н6 5,5 5,12 80.1 2,53 78,0
Дисульфид углерода, CS2 -111,5 3,83 46.2 2,34 76,0
Этиловый эфир, С4Н10О Камфора, С10Н16О -116,2 178,8 1,79 40,0 34.5 2,02 74,0 152,2
Принятые обозначения: Тпл-нормальная температура плавления (замерзания); 1<пл-мо-ляльная константа понижения температуры плавления (криоскопическая константа); ТКИП-нор-мальная температура кипения; /скип-моляльная константа повышения температуры кипения (эбулиоскопическая константа); М-молекулярная масса вещества.
Пример 4
Какова температура кипения раствора 3,00 г глюкозы, С6Н,2О6, в 100 см3 воды?
Глава 18
142
Решение
Поскольку молекулярная масса глюкозы равна 180, а плотность воды 1,00 гем-3, раствор 3,00 г глюкозы в 100 см3 воды содержит 30,0/180 = 0,167 моля на 1000 г воды, т.е. имеет моляльность 0,167 моль кг-1. Следовательно,
АТ= 0,52 0,167 = О,О87°С
Это означает, что температура кипения указанного раствора должна быть равна 100,087’С.
Понижение температуры замерзания раствора
Понижение температуры замерзания раствора можно объяснить подобно тому, как мы объясняли повышение температуры кипения. На рис. 18-13, а схематически изображена чистая жидкость В в равновесии с чистым кристаллическим твердым веществом В; при этом молярная свободная энергия вещества В в обоих фазах одинакова. Однако если растворитель В разбавлен некоторым количеством молекул растворенного вещества А, то не каждая молекула жидкой фазы, ударяющаяся о поверхность кристаллического вещества В, может достраивать кристалл (рис. 18-13,6). Многие столкновения оказываются безрезультатными. Однако скорость перехода молекул вещества В из кристаллической фазы в жидкую фазу остается без изменений. Свободная энергия перехода вещества В из одной фазы в другую оказывается ниже для жидкости, чем для кристалла, а равновесие смещается в сторону плавления. Часть кристаллического вещества должна расплавиться (или раствориться) в жидкости. (Вот почему СаС12 или NaCl, разбрасываемый на скользких зимних дорогах, расплавляет лед.)
Для восстановления равновесия между кристаллическим твердым веществом и жидким раствором необходимо понижать температуру до тех пор,
Рис. 18-13. Понижение температуры замерзания раствора.
а-равновесие между жидкостью и кристаллическим веществом; б-добавление растворенного вещества (цветные кружочки); при этом равновесие смещается в сторону растворе-
8
ния кристаллического вещества. Новое равновесие достигается только при понижении температуры. Таким образом, добавление растворенного вещества приводит к понижению температуры замерзания растворителя.
Равновесия с участием жидких и твердых веществ 143
пока способность переходить в другую фазу у меньшего числа молекул В в растворе снова не сравняется с имевшейся у большего числа молекул В в исходной чистой жидкости. При новой температуре замерзания в растворе имеется меньше, чем в чистом веществе В, молекул, ударяющихся о поверхность твердого вещества, но они движутся медленнее и имеют большую вероятность быть захваченными кристаллом.
Вывод выражения, описывающего понижение температуры замерзания раствора, аналогичен выводу выражения для повышения температуры кипения. В новом положении равновесия влияние разбавления и понижения температуры на способность молекул растворителя переходить в другую фазу должно в точности уравниваться. Результирующее выражение имеет такой же вид, как приведенное выше для повышения температуры кипения раствора:
= Тпл - Тпл = - (18-18)
Здесь Т пл и Тпл- температуры плавления (замерзания) чистого вещества В и его раствора, шА-моляльность растворенного вещества, а Ат1Л моляль-ная константа понижения температуры плавления, называемая также криоскопической константой. Последняя определяется выражением
, _ (18-19)
к™ 1000АЯпл ( '
Здесь ДНПЛ-теплота плавления растворителя, 7^л-его нормальная температура плавления, а Мв-его молекулярная масса. Значения моляльных констант понижения температуры плавления для некоторых распространенных жидкостей приведены в табл. 18-4.
Пример 5
Какова температура замерзания раствора глюкозы, описанного в примере 4?
Решение
Температура замерзания изменяется на величину
ДТПЛ = - 1,86 0,167 = -0,311°
Новая температура замерзания оказывается равной — 0,311°С.
Пример 6
Раствор состоит из 1,00 г ацетамида, CH3CONH2, в 100 см3 воды. На сколько понижена его температура замерзания?
Решение
Молекулярная масса ацетамида равна 59,1, поэтому раствор 1,00 г этого вещества в 100 см3 воды эквивалентен раствору 10 г, т.е. 10/59,1 = 0,169 моля ацетамида на 1 кг воды. Следовательно, тА = 0,169 и ДТПЛ = - 1,86-0,169 = — О,315°С.
Гмы l>' i44
Определение молекулярной массы растворенного вещества
Коллигативные свойства растворов могут использоваться для определения молекулярной массы растворенных веществ, поскольку величина коллигативного эффекта зависит от количества растворенных частиц в растворе и, следовательно, от числа молей растворенного вещества.
Пример 7
Насыщенный раствор глутаминовой кислоты в воде содержит 1,50 г кислоты на 100 г воды. Температура замерзания этого раствора равна — 0,189°С. Какова молекулярная масса глутаминовой кислоты?
Решение
Соотношение, определяющее понижение температуры замерзания раствора, дает — 0,189 = - 1 ,86ша, откуда тА = 0,102 моль-кг'1
Раствор приготовлен из 1,50 г кислоты в 100 г воды, т. е. содержит 15,0 г на 1 кг воды. Следовательно, 15,0 г глутаминовой кислоты представляют собой 0,102 моля этого вещества и поэтому его молекулярная масса равна
., 15,0г
м \ 1----= 147 г-моль
0,102 моля
Пример 8
Соединение, имеющее молекулярную массу 329,3, растворено в воде; раствор содержит 300 мг (300 -10' ’ г) соединения в 10 см3 воды. Какова температура замерзания раствора?
Решение
Ожидаемая температура замерзания равна — 0,169°С.
Пример 9
В эксперименте, описанном в примере 8, истинная, наблюдаемая температура замерзания раствора оказалась равной — 0,676°С, а не — 0,169°С, как ожидалось. О каком явлении, происходящем при растворении соединения, свидетельствует этот факт0 [Соединение представляет собой феррицианид калия, K3Fe(CN)6.]
Решение
Понижение температуры замерзания раствора оказалось вчетверо больше ожидаемого; это указывает, что 1 моль соединения дает в растворе 4 моля частиц. Следовательно, феррицианид калия растворяется с образованием четырех ионов:
KjFe(CN)6 - ЗК+ + Fe(CN)3'
К сожалению, способ определения молекулярной массы по изменению температуры замерзания или кипения раствора имеет свои пределы. Для соединений с большой молекулярной массой оказывается трудным ввести
Ривновесич с участием жидких к твердых веществ 145
в раствор достаточное количество вещества, чтобы удалось точно измерить изменение температуры замерзания или кипения.
Пример 10
200 мг белка цитохрома с растворено в 10 см3 воды. Молекулярная масса цитохрома с равна 12400. Каково понижение температуры замерзания раствора?
Решение
Концентрация раствора эквивалентна 20 г белка на 1 кг воды, но вследствие высокой молекулярной массы моляльность раствора оказывается равной всего 0,0016. Поэтому Тпл = — 1,86 0,0016 = — 0,003°С, по эта величина слишком мала для точного определения молекулярной массы.
На основании данных о понижении температуры замерзания раствора или повышения температуры кипения нельзя установить молекулярную массу макромолекул, но для определения ее может использоваться четвертое и последнее коллигативное свойство растворов, осмотическое давление.
Осмотическое давление
Многие пленки обладают способностью пропускать через свои поры некоторые молекулы, однако для других молекул эти поры оказываются слишком малыми. Такие пленки называются полупроницаемыми мембранами. Одни из мембран пропускают воду, но не позволяют пройти ионам солей. Другие, с большими порами, пропускают воду, соли и небольшие молекулы, но задерживают белки или макромолекулы, имеющие молекулярную массу порядка нескольких тысяч. В настоящее время возможно изготовление микропористых фильтров со столь однородными размерами пор, что их можно использовать для разделения белков по размеру макромолекул.
Допустим, что в стакане, изображенном на рис. 18-14, а, находится чистая вода, а в нее погружена расширяющаяся в нижней части трубка, закрытая снизу мембраной. В трубку налит водный раствор вещества А. Далее, предположим, что молекулы воды могут беспрепятственно проходить сквозь мембрану, но она не пропускает молекулы вещества А. Скорость просачивания молекул воды в трубку из раствора в стакане не зависит от наличия вещества А, но скорость поступления молекул воды обратно из трубки в стакан уменьшается из-за присутствия вещества А. Молярная свободная энергия, или способность к просачиванию, воды в трубке должна уменьшаться из-за присутствия частиц растворенного вещества по той же причине, которая уже известна нам по обсуждению других коллигативных свойств растворов. Поскольку в трубку просачивается больше воды, чем одновременно уходит из нее, раствор в трубке поднимается, как это изображено на рис. 18-14,6.
По мере повышения давления в трубке (это давление может измеряться высотой столба раствора) свободная энергия, или способность к просачи-
Глава 18
146
Рис. 18-14. Опыт, демонстрирующий осмотическое давление. Если какое-либо вещество растворено в растворителе, а раствор отделен от резервуара чистого растворителя мембраной, пропускающей молекулы растворителя, но не частицы растворенного вещества, растворитель просачивается в сосуд с раствором до тех пор, пока в нем не возникнет достаточное избыточное давление, называемое осмотическим давлением, которое воспрепят-
f = oo
в
ствует дальнейшему прониканию растворителя. Осмотическое давление можно вычислить по высоте раствора в трубке и плотности раствора.
а- начало опыта: уровень раствора внутри трубки ниже уровня чистого растворителя во внешнем резервуаре; б - постепенное повышение уровня жидкости в трубке по мере проникновения в нее растворителя; в-равновесие: уровень раствора в трубке перестает повышаться.
ванию, молекул воды в трубке повышается. В конце концов достигается такое состояние, когда увеличение свободной энергии воды в трубке вследствие повышения давления точно уравновешивает уменьшение свободной энергии воды вследствие ее разбавления веществом А. В каждом кубическом сантиметре воды в трубке имеется меньше молекул растворителя, но каждая его молекула имеет большую способность к просачиванию наружу сквозь мембрану из-за большего давления. Результирующая скорость вытекания воды из трубки становится точно такой же, какой она должна быть в отсутствие растворенного вещества, и равновесие с водой в открытом стакане снова восстанавливается. Дополнительное давление, необходимое для восстановления равновесия, называется осмотическим давлением и обозначается греческой буквой п (пи).
Если изменения, вызванные разбавлением растворителя и повышением давления, уравновешиваются, то исчезает результирующая способность к просачиванию растворителя сквозь мембрану и должно выполняться следующее соотношение:
kV = n^RT или л = c\RT
(18-20)
Здесь сА- молярность растворенного вещества, т. е. число его молей в 1 л раствора (а не в расчете на килограмм растворителя, как в определении
Равновесия с участием жидких и твердых веществ
147
моляльности, т). Отметим, что уравнение для осмотического давления напоминает закон состояния идеального газа. Идеальным считается такой газ, молекулы которого не притягиваются друг к другу; в идеальном растворе, для которого выполняются закон Рауля и приведенное выше простое уравнение осмотического давления, все молекулы характеризуются одинаковыми притяжениями друг к другу.
В явлениях понижения температуры замерзания и повышения температуры кипения раствора нарушение равновесия, вызываемое добавлением молекул растворенного вещества, компенсируется изменением температуры. При наличии осмотического давления равновесие восстанавливается повышением давления, а не изменением температуры. Поскольку раствор является конденсированной фазой со сравнительно малой сжимаемостью, необходимое повышение давления оказывается довольно значительным и его легко измерить. Поэтому осмотическое давление намного чувствительнее к количеству растворенного вещества и им удобнее пользоваться для определения больших молекулярных масс.
Пример 11
Вычислите осмотическое давление, обусловленное растворением 200 мг цитохрома с в таком количестве воды, чтобы общий объем достиг 10 см3, если мембрана пропускает молекулы воды, но не пропускает молекул цитохрома с.
Решение
СА
0,200 г
0,010 л 12400 г моль 1
= 0,0016 моль-л
л = 0,0016 моль л 1 • 0,0821 л• атм• К '-моль '-298К
я = 0,039 атм
Разность давлений в 0,039 атм намного легче измерить, чем уменьшение температуры на 0,003 К. Поэтому осмотическое давление является наиболее удобным коллигативным свойством, используемым для измерения больших молекулярных масс.
ЗАКЛЮЧЕНИЕ
Когда в кристаллическом веществе при повышении температуры происходит нарушение упорядоченного строения, то при не слишком малых давлениях вещество обычно в конце концов расплавляется с образованием жидкости, которая в свою очередь при дальнейшем повышении температуры превращается в пар. В кристаллическом веществе молекулы или ионы упакованы в правильную геометрическую структуру. В жидкости молекулы по-прежнему соприкасаются друг с другом, но правильная структура нарушена, потому что молекулы имеют достаточную тепловую энергию, чтобы скользить одна вдоль другой. В паровой фазе молекулы уже не соприкасаются друг с другом; они движутся по независимым траекториям в пространстве, сталкиваясь и разлетаясь в разные стороны.
r.idfiLi IS 14S
В некотором смысле различие между жидкостью и паром является скорее условным, чем реальным. Когда жидкость превращается в пар, нам кажется привычным видеть две разные фазы вещества, отделенные друг от друга мениском жидкости. Но при высоких температурах и давлениях плотность пара достигает плотности жидкости и различие между фазами пропадает. Условия, при которых это происходит, называются критическим давлением, Ркрит, и критической температурой, 7^рит. При давлениях, больших Ркрит, твердое вещество при плавлении переходит во флюид (текучую фазу) и при дальнейшем повышении температуры второго фазового перехода уже не происходит.
Плавление, испарение и сублимация характеризуются соответствующими изменениями энтальпии и изменениями упорядоченности, или энтропии. При переходах из твердого состояния в жидкое и далее в газообразное в систему всегда должна поступать теплота, но энтропия системы при этом тоже возрастает. Необходимость поглощения теплоты препятствует самопроизвольному протеканию рассматриваемых процессов, а возрастание неупорядоченности, наоборот, благоприятствует им. При температурах фазовых переходов (7^л, 7^ип, 7^у6л) один эффект уравновешивается другим и свободная энергия фазового перехода оказывается равной нулю.
Температура кипения жидкости представляет собой такую температуру, при которой жидкая фаза вещества находится в равновесии с его паровой фазой при давлении, равном давлению окружающей атмосферы. Нормальная, или стандартная, температура кипения соответствует давлению в 1 атм. При более низких температурах равновесное давление пара меньше 1 атм и связано со стандартной свободной энергией испарения при этой температуре соотношением
AG = - R Tin р„
Равновесия между различными фазами чистого вещества удобно представлять в виде фазовой диаграммы в координатах давление-температура. Отдельные участки фазовой диаграммы соответствуют условиям термодинамической устойчивости какой-либо одной фазы, эти участки разграничиваются кривыми, которые соответствуют областям равновесия между двумя фазами; совокупность условий одновременного сосуществования трех фаз определяется точкой, где сходятся три кривые и которая называется тройной точкой. Согласно правилу фаз, для чистого вещества число f независимо изменяющихся параметров состояния, как, например, температура и давление, определяется соотношением/ = 3 — р, где р-число имеющихся в наличии фаз. Принцип Ле Шателье предсказывает, что все кривые равновесий между двумя фазами должны иметь положительный тангенс угла наклона, за исключением межфазной кривой лед-вода (и еще нескольких веществ), отрицательный тангенс угла наклона которой обусловлен уменьшением объема льда при плавлении. Пользуясь фазовыми диаграммами, можно предсказать, ведет ли себя вещество при плавлении подобно воде либо сублимирует подобно твердому диоксиду углерода; для этого требуется лишь знать, больше или меньше атмосферное давление, чем давление в тройной точке данного вещества.
Равндвес и.ч с участием жидких и твердых веществ
149
Если взаимодействия между разносортными молекулами в растворе не отличаются от взаимодействий между молекулами каждого из его компонентов, то раствор называется идеальным. Для таких растворов давление пара какого-либо компонента пропорционально его концентрации, выраженной через мольную долю: = Xjp'. Это утверждение называется законом Рауля. Если взаимодействия между разносортными молекулами сильнее взаимодействий между одинаковыми молекулами, то давление пара каждого компонента меньше предсказываемого законом Рауля, и в этом случае мы имеем дело с отрицательным отклонением от свойств идеального раствора. Если взаимодействия между разносортными молекулами слабее, чем взаимодействия между одинаковыми молекулами, давление пара оказывается большим, и отклонение от свойств идеального раствора называется положительным.
Влияние нелетучего растворенного вещества на свойства растворителя в разбавленных растворах проявляется в их коллигативных свойствах. К ним относятся четыре следующих явления: понижение давления пара, повышение температуры кипения, понижение температуры плавления (замерзания) и осмотическое давление. Величина эффекта в каждом из этих случаев пропорциональна числу молекул или ионов растворенного вещества в единице объема раствора и не зависит от природы этих частиц. Коллигативные свойства очень удобны для демонстрации явления ионизации в растворе и для определения молекулярных масс.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Допустим, что кристаллическое вещество расплавляют и далее продолжают повышать его температуру; как отличается дальнейшее поведение вещества в зависимости от того, выше или ниже окружающее давление по сравнению с критическим давлением? Каково критическое давление для Н2О? Для СО2?
2. Может ли при плавлении происходить уменьшение молярной энтальпии? Может ли оно сопровождаться уменьшением молярной энтропии? Уменьшением молярного объема? Приведите примеры реальных веществ, подтверждающие ваши ответы.
3. Может ли происходить испарение с уменьшением молярной энтальпии? Может ли оно сопровождаться уменьшением молярной энтропии? Уменьшением молярного объема? Приведите примеры реальных веществ, подтверждающих ваши ответы.
4. Что больше напоминают свойства вещества в его критической точке-свойства жидкости или свойства пара этого вещества при более низких температурах и давлениях?
5. Как определить молярную энтропию испарения вещества, если известны его молярная энтропия сублимации и плавления при данной температуре? Какой принцип или закон используется вами при ответе на этот вопрос?
r.iMia IS
150
6. Как получить молярную энтальпию испарения, пользуясь таблицами приложения 3?
7. В чем заключается правило Трутона и каково его объяснение на молекулярном уровне?
8. Как приближенно определить температуру кипения жидкости, пользуясь только данными, приведенными в приложении 3 ? Какие сведения необходимо еще иметь для точного определения температуры кипения?
9. Что называется равновесным давлением паров жидкости? Как температура кипения жидкости связана с давлением ее пара? Что это означает с учетом молекулярного поведения кипящей жидкости?
10. Как связана стандартная свободная энергия испарения при данной температуре с равновесным давлением пара? При какой температуре стандартная свободная энергия испарения становится равной нулю?
11. Как связаны друг с другом стандартные энтальпия и энтропия испарения? При какой температуре их влияние компенсируется?
12. Как изменяется с высотой температура кипения жидкости? В чем заключается удобство приготовления пищи в «скороварке» (под давлением)?
13. Можно ли перевести вещество из паровой фазы в жидкость путем конденсации, т. е. при наличии двух фаз в процессе перехода, а затем снова перевести его в парообразное состояние таким способом, при котором в наличии все время будет иметься только одна фаза и не произойдет фазового превращения? Поясните свой ответ, пользуясь рис. 18-5.
14. Что означают на рис. 18-6 различные области диаграммы и разделяющие их граничные линии? Что представляет собой точка, в которой сходятся три граничные линии?
15. Каким образом принцип Ле Шателье позволяет предсказать, что все три граничные линии фазовой диаграммы, изображенной на рис. 18-6, должны иметь положительный тангенс угла наклона? На каком основании этот принцип предсказывает отрицательный тангенс угла наклона для одной из линий фазовой диаграммы, изображенной на рис. 18-7?
16. При каких давлениях твердый диоксид углерода должен плавиться с образованием жидкости, прежде чем он испарится? При каких давлениях он должен сублимировать, переходя непосредственно в пар?
17. При каких давлениях твердая Н2О должна плавиться с образованием жидкости, прежде чем она испарится? При каких давлениях она должна сублимировать, переходя непосредственно в пар?
18. В чем заключается правило фаз? Как оно формулируется для однокомпонентной системы? Покажите, как правило фаз выполняется для фазовой диаграммы, изображенной на рис. 18-6.
19. Что называется идеальным раствором? Каковы объяснения на молекулярном уровне положительных и отрицательных отклонений от идеальности растворов и какое влияние оказывают эти отклонения на давление пара над раствором?
Равновесия с участием жидких и твердых веществ
151
20. В чем заключается закон Рауля? К каким растворам применим этот закон?
21. Что называется коллигативными свойствами растворов? К каким растворам применимы простые соотношения, приведенные в настоящей главе?
22. Чем объясняется повышение температуры кипения раствора при введении в него небольшого количества нелетучего растворенного вещества? Чем объяснить происходящее при этом понижение температуры замерзания раствора?
23. Как объяснить коллигативными свойствами растворов то, что антифриз, используемый для предотвращения замерзания воды в радиаторе автомобиля, предотвращает также закипание там воды в жаркую погоду?
24. Почему можно уберечь в кастрюле ее содержимое от выкипания, если «в последний момент» бросить туда щепотку соли?
25. Каким образом лыжники используют различие между фазовыми диаграммами, изображенными на рис. 18-6 и 18-7, когда применяют лыжную мазь?
26. Длительное плавание в соленой воде приводит к сморщиванию кожи на пальцах. Какое коллигативное свойство проявляется при этом?
27. Каким образом можно использовать коллигативные свойства для обнаружения явления ионизации в водных растворах? Как эти свойства могут использоваться для обнаружения молекулярной агрегации в растворе?
28. Как можно использовать коллигативные свойства для измерения молекулярных масс растворимых веществ? Какое из коллигативных свойств целесообразнее использовать для определения молекулярной массы макромолекул и почему другие коллигативные свойства менее удобны в этом отношении?
ЗАДАЧИ
Термодинамика фазовых превращений
1. Пользуясь данными приложения 3, вычислите изменения энтальпии, энтропии и свободной энергии при испарении ВВг3 при 298 К. Какова (приближенно) температура кипения ВВг3? Проверьте найденное значение температуры кипения по какому-либо химическому справочнику. Каково равновесное давление пара ВВг3 при 298 К?
2. Пользуясь данными приложения 3, вычислите изменения энтальпии, энтропии и свободной энергии испарения муравьиной кислоты, НСООН, при 298 К. Каково давление паров муравьиной кислоты при 298 К? Вычислите приближенно температуру кипения НСООН и сравните свой ответ с ее истинным значением, найдя его в каком-либо химическом справочнике. Насколько велико расхождение между полученной вами и справочной величинами?
Свободная энергия и давление пара
3. Пользуясь данными приложения 3, установите, какая из следующих жидкостей имеет наибольшее равновесное давление пара при 298 К: вода, бензол или муравьиная кислота? Объясните ответ с учетом молекулярных взаимодействий.
4. Пользуясь данными приложения 3, вычислите равновесное давление пара трихлорида бора при 298 К. Что можно сказать на основании полученного ответа об устойчивой форме ВС13 при этой температуре? Вычислите, пользуясь данными приложения 3, температуру кипения ВС13 и сравните полученный результат с истинным значением этой величины, найдя его в каком-либо химическом справочнике.
Правило Тру тона
5. В исходной формулировке правило Трутона основывалось на экспериментальном наблюдении, что частное от деления молярной теплоты испарения на температуру кипения для различных веществ представляет собой приблизительно постоянную величину: 92 Дж К-1 - моль-1. Вычислите примерно молярную теплоту испарения н-октана, СаН18, зная, что его температура кипения равна 125,7°С. Стандартная энтальпия образования жидкого н-октана — 250,0 кДж моль-1, а газообразного н-октана — 208,4 кДж моль-1. Вычислите истинную теплоту испарения н-октана и сравните ее с предварительно найденным приближенным значением. Какова относительная погрешность (в процентах) приближенного результата?
6. Теплота испарения одного грамма неизвестного углеводорода равна 367 Дж-г-1, а его температура кипения равна 69°С. Основываясь на этих данных и пользуясь правилом Трутона, оцените молекулярную массу углеводорода.
Давление пара и температура кипения
7. Пользуясь данными приложения 3, вычислите давление пара этилового спирта, С2Н5ОН, при 298 К и приближенно его температуру кипения. Полагая, что энтальпия и энтропия испарения не зависят от температуры, вычислите температуру кипения этилового спирта на высоте 12000 футов над уровнем моря, где атмосферное давление 0,60 атм.
8. Полагая, что энтальпия и энтропия испарения не зависят от температуры, вычислите температуру кипения воды в «скороварке» при давлении внутри нее 2 атм. Какое значение для приготовления пищи имеет повышенное давление внутри «скороварки»?
Фазовые диаграммы
9. Нарисуйте приближенную фазовую диаграмму равновесия твердое вещество-жидкость-пар для N2. Правильно изобразите наклоны каждой кривой, отметьте положения тройной и критической точек и отметьте нормальное значение атмосферного давления в земных условиях. Затем укажите на диаграмме точки, соответствующие Тпп
Равновесия с участием жидких и твердых веществ
153
и 7^ип. (Найдите их значения в данной главе или в каком-либо химическом справочнике.) В каком диапазоне давлений твердый N2 должен сублимировать, а не плавиться?
10. Нарисуйте приближенную фазовую диаграмму равновесия твердое вещество-жидкость-пар для ртути. Правильно укажите наклоны каждой кривой, положение критической точки и по крайней мере приближенно-место расположения тройной точки относительно 298 К и давления 1 атм. Плотность жидкой ртути равна 13,6 г • см “ 3. Вычислите молярный объем жидкой и парообразной ртути при 298 К, считая, что парообразная ртуть обладает свойствами идеального газа, и сравните полученные значения объемов с молярным объемом текучей фазы в критической точке, приведенным в табл. 18-2. К чему ближе молярный объем ртути в критической точке-к молярному объему паровой или жидкой фазы ртути при 298 К?
Закон Рауля
11. Каким должно быть давление паров раствора, полученного смешением 10 г бензола с таким же количеством толуола при.298 К? Какой вклад в результирующее давление пара вносит каждый из компонентов раствора?
12. При 363 К давление паров бензола равно 1,34 атм, а толуола 0,534 атм. Какова мольная доля толуола в растворе, кипящем при атмосферном давлении при 363 К?
Коллигативные свойства
13. Какое из следующих веществ, образующих 0,1 М водный раствор, должно сильнее всего понижать его температуру замерзания: HNO3, NaCl, С6Н12О6 (глюкоза), CuSO4, ВаС12? Поясните ответ.
14. Что должно оказать большее влияние на коллигативные свойства водного раствора-растворение в одинаковом количестве воды 20 г NaCl или 10 г MgCl2? В каждом случае следует исходить из предположения о полной растворимости вещества.
Понижение давления пара
15. Насколько понизится давление пара метана, если в 32 г жидкого метана, СН4, растворить 35,5 г твердого хлора, С12?
16. При 292 К давление паров тетрахлорида углерода, СС14, равно 0,11276 атм. Раствор, содержащий 2,182 г неизвестного нелетучего вещества в 100 г СС14, при этой температуре имеет давление паров 0,11066 атм. Вычислите молекулярную массу неизвестного вещества. Какова его химическая формула, если, по данным анализа, в нем содержится 94,34% углерода и 5,66% водорода?
Повышение температуры кипения раствора
17. При смешении 20 г нелетучего твердого вещества, обладающего молекулярной массой 100, с 500 г растворителя, имеющего молекулярную
Г1И‘<С1 IS 154
массу 75, образуется раствор, температура которого повышается от 84,00 до 85,ОО°С. Вычислите моляльную константу повышения температуры кипения этого растворителя.
18. Если 10,0 г глюкозы, С6Н12О6, растворить в 400 г этилового спирта, температура кипения спирта повышается на 0,1428°С. При растворении 2,00 г неизвестного органического вещества в 100 г этилового спирта температура кипения повышается на О,125О°С. Вычислите молекулярную массу неизвестного вещества.
Понижение температуры замерзания раствора
19. Вычислите температуру замерзания раствора, полученного растворением 1,00 г NaCl в 10,0 г воды. Повторите вычисления для раствора, полученного растворением 1,00 г СаС12 в таком же количестве воды. Какая из этих солей представляет собой лучший антифриз, если судить по их молекулярным массам?
20. Сколько граммов метанола, СН3ОН, следует добавить к 10,0 кг воды, чтобы понизить температуру замерзания раствора до 263 К? Какова нормальная температура кипения этого раствора?
Определение молекулярной массы
21. Температура замерзания чистой уксусной кислоты равна 16,60°С, а температура замерзания раствора, полученного растворением 0,400 г неизвестного углеводорода в 25,0 г уксусной кислоты, понижается до 16,15°С. Моляльная константа понижения температуры замерзания для уксусной кислоты равна 3,60 град моль" *. Какова молекулярная масса исследуемого углеводорода? Химический анализ показал, что оно содержит 93,76 вес. % углерода и 6,25 вес. % водорода. Какова его молекулярная формула?
22. Бензойная кислота содержит 68,9 вес. % углерода, 26,2 вес. % кислорода и 4,96 вес.% водорода. 1 г этой кислоты при растворении в 20,0 г воды понижает температуру замерзания до 272,38 К, тогда как добавление 1,00 г ее к бензолу понижает температуру замерзания до 277,56 К. Какова кажущаяся молекулярная формула бензойной кислоты в каждом из растворителей? Можете ли вы объяснить свои результаты?
23. Тироксин (гормон, регулирующий скорость метаболизма в организме человека) может быть выделен из щитовидной железы. При растворении 0,455 г тироксина в 10,0 г бензола температура замерзания раствора становится равной 5,144°С; чистый бензол замерзает при 5,444°С. Какова молекулярная масса тироксина?
24. Раствор 0,0702 г органического соединения в 0,804 г камфоры понижает температуру замерзания чистой камфоры на 15,3°С. Какова молекулярная масса этого соединения? Химический анализ показывает, что это соединение содержит 63,2 вес.% углерода, 8,8 вес.% водорода, а остальное приходится на долю кислорода. Какова химическая формула неизвестного соединения?
Равновесия с участием жидких и твердых веществ 155
Осмотическое давление
25. Образец поливинилхлорида массой 4,0 г со средней молекулярной массой 1,5-105 растворяют в 1,0 л диоксана, С4.Н8С>2, при температуре 298 К. Каково осмотическое давление, возникающее в растворе, по сравнению с чистым диоксаном?
26. При растворении 145 мг белка в 10,0 см3 воды при 25°С возникает осмотическое давление 0,00989 атм. Какова молекулярная масса этого белка?
ЛИТЕРАТУРА
1. Moore W.J., Physical Chemistry, 4nd ed. Chapter 6, Prentice-Hall, Englewood Cliffs, N.Y., 1972.
2. Rosenberg R. M., Principles of Physical Chemistry, Chapter 15, Oxford University Press, N.Y., 1977.
3. Sears F. W., Thermodynamics, 2nd ed., Addison-Wesley, Reading, Mass., 1955.
ГЛАВА
19
Окислительно-восстановительные равновесия и электрохимия
Заряжай!
Джеймс Брюденелл (лорд Кардиган), 25 октября 1854 г.
Важнейшие понятия
19-1. Работа, выполняемая самопроизвольными реакциями. Концентрационные элементы.
19-2. Электрохимические элементы. Элемент Даниэля, водородный электрод, сухой элемент, свинцовый аккумулятор, электролитические элементы.
19-3. Напряжение гальванического элемента и свободная энергия.
19-4. Полуреакции и стандартные восстановительные потенциалы. Определение напряжения гальванического элемента по восстановительным потенциалам электродных полуреакций. Обозначения электрохимических элементов.
19-5. Зависимость напряжения электрохимического элемента от концентрации. Уравнение Нернста. Электродные потенциалы.
19-6. Равновесия при растворении и электродные потенциалы. Произведение растворимости. Образование комплексных ионов.
19-7. Электрохимия коррозии.
Рыночные цены на древние монеты определяются не только стоимостью содержащегося в них золота, серебра и меди или сравнительной редкостью отдельных выпусков монет. Золотой статер Креза (крезоид) или серебряная тетрадрахма Александра Македонского через 2500 лет после того, как они были отчеканены, выглядят как миниатюрные произведения искусства, чье физическое состояние заставляет усомниться в их возрасте. В отличие от этого типичная бронзовая или медная монета того же
Окислите4ьнс>-в(нстановцте.1ьнь1е равновесия
157
периода, как правило, корродирована, изъедена и уродлива, особенно если она долгое время пролежала во влажной земле. Почему же медь корродирует, а серебро и золото остаются невредимыми? Объяснение этого заключается в различном сродстве указанных металлов к своим электронам.
В некоторых случаях люди, имеющие золотые коронки и одновременно пломбы из серебряной амальгамы в других зубах, испытывают неприятные ощущения. Каждый раз, когда при откусывании пищи эти два металла соприкасаются, люди ощущают электрический разряд, что делает процесс еды неприятным. Откуда берется этот разряд? Здесь мы снова имеем дело с различным сродством веществ к электронам и переносом электронов из того места, где они не слишком сильно нужны, туда, где в них ощущается большая потребность.
В этой главе будут обсуждены способы условного разделения химических реакций на две физически различные части: одна из них характеризуется легкой отдачей электронов, а другая-их легким присоединением. Если нам удастся получить электроны, перетекающие «вниз» (тут мы пользуемся гравитационной аналогией), это позволит использовать такой поток для выполнения внешней работы. На этом основан принцип действия гальванического элемента. Кроме того, если удастся найти способы переноса электронов «вверх»» из областей, где в них имеется потребность, в области, где их присутствие нежелательно, то мы сможем запасать энергию, чтобы воспользоваться ею позже, или осуществлять химические реакции, которые в нормальных условиях не являются самопроизвольными. Таков принцип действия электролитических элементов.
Как и в предыдущих главах, нас будут по-прежнему интересовать способность к самопроизвольному протеканию реакций и химическое равновесие. Однако на этот раз о способности к самопроизвольному протеканию реакций мы будем судить еще и по потоку электронов.
19-1. ИСПОЛЬЗОВАНИЕ САМОПРОИЗВОЛЬНО ПРОТЕКАЮЩИХ РЕАКЦИЙ
Если открыть баллон с газообразным водородом, находящимся под давлением 10 атм, и позволить газу вытекать оттуда, он делает это самопроизвольно. В этом опыте газ не совершает полезной работы. Однако если присоединить к крану баллона трубку, ведущую к пластмассовому мешочку или цилиндру с поршнем, газ может поднимать грузы, а если поместить на пути струи газа, вытекающего из крана, вертушку (рис. 19-1), мы сможем превращать энергию, запасенную газом, в механическую рабо-
Рис. 19-1. Непродуктивное и продуктивное использование свободной энергии, запасенной газообразным водородом под давлением 10 атм.
а-расширение газа при понижении давления до 1 атм, сопровождаемое рассеянием энергии; б-использование части свободной энергии газа для поднятия груза при помощи надуваемого полиэтиленового мешочка; «-использование части свободной энергии газа для поднятия груза при помощи вертушки.
Окислительно-восстановительные равновесия
159
ту. В этом случае уравнение реакции имеет вид
Н2(г., 10 атм) -> Н2(г., 1 атм)
а из гл. 16 нам известно, что максимальная свободная энергия, которую можно получить от 1 моля Н2, равна
AG = AG° + R Tin (pjpj
или
AG = 0 + J?Tln(l/10) = — RT’ln(lO) = — 5,706 кДж• моль~ 1
[Очевидно, что изменение стандартной свободной энергии для реакции Н2(г.) -> Н2(г.) равно нулю.] Уменьшение свободной энергии на 5,706 кДж • моль “1 представляет собой максимальную работу, которая получается при условии обратимого проведения процесса, т.е. практически недостижимый верхний предел, требующий для своего осуществления бесконечно медленного проведения процесса. В любом реальном самопроизвольном ограниченном во времени процессе можно получить лишь некоторую часть этой полезной работы, равной 5,706 кДж-моль'1.
Существует другой способ использования свободной энергии расширяющегося газа: при помощи так называемого концентрационного элемента (рис. 19-2). Хотя изображенное здесь устройство несколько условно, от него легче перейти к обсуждению других электрохимических элементов. В концентрационном элементе, изображенном на рис. 19-2, протекает такая же, как и рассмотренная ранее, реакция, но теперь она осуществляется в две стадии. В левом сосуде газообразный водород под давлением 10 атм «разделяется» на протоны и электроны; в правом сосуде из электронов и протонов «синтезируется» водород под давлением 1 атм. Однако полная реакция по-прежнему описывается уравнением
Н2(г., 10 атм) -> Н2(г., 1 атм)
и, следовательно, полное изменение свободной энергии должно быть прежним.
Поскольку на левом электроде образуется избыток электронов, а реакция на правом электроде не может протекать без участия электронов, достаточно соединить между собой электроды проволочкой, чтобы по ней устремился поток электронов. (Это аналогично открыванию вентиля баллона со сжатым газом: сжатый газ превращается в газ под атмосферным давлением без совершения какой-либо полезной работы.) Способность электронов перетекать с одного электрода на другой, или «электронное давление», измеряется разностью потенциалов двух электродов. Чтобы приостановить поток электронов, следует приложить -напряжение, численно равное напряжению, возникающему в концентрационном элементе, но про-
Н2(10атм)—> 2Н+ + 2е 2Н+ -+ 2е —» Н2(1атм)
Рис. 19-2. Водородный концентрационный элемент для превращения свободной энергии расширяющегося газа Н2 при давлении 10 атм в полезную работу. Два платиновых электрода погружены в чистую воду (с концентрацией ионов водорода 10моль л'1) в двух сосудах, соединенных трубкой с пористой перегородкой, которая пропускает ионы, но позволяет поддерживать разность давлений. Газообразный водород проходит над каждым электродом; при помощи спускных клапанов и регуляторов в левом сосуде поддерживается давление Н2 10 атм, а в правом сосуде давление 1 атм. В процессе работы элемента в нем одновременно протекают следующие реакции:
Левый сосуд: Н2 (г., 10 атм) -» 2Н + + 2е~
Правый сосуд: 2Н+ + 2е~ -> Н2 (г., 1 атм)
Полная реакция: Н2(г., 10 атм) -> Н2(г., 1 атм)
Электроны, образующиеся при реакции в левом сосуде, перетекают по внешней цепи на правый электрод, где они используются для реакции с ионами водорода. (Кружок со стрелкой во внешней электрической цепи означает устройство для измерения тока или для выполнения работы.) Гидроксидные ионы медленно диффундируют через пористую перегородку справа налево, чтобы поддерживалась электрическая нейтральность раствора, и соединяются с протонами, которые образуются в левом сосуде.
тивоположное по знаку. И наоборот, можно использовать «электронное давление» для выполнения какой-либо полезной работы (тогда концентрационный элемент становится аналогичным устройству для поднимания грузов при помощи ветряной вертушки). Исходя из представления о движущей силе, используемой для выполнения работы, можно сказать, что давление сжатого газообразного водорода превращается в разность потенциалов между электроноизбыточным и электронодефицитным электрода
Окислительно-восстановительные равновесия 161
ми. Напряжение рассмотренного здесь концентрационного элемента довольно мало: всего 0,0296 вольта (В) или 29,6 милливольта (мВ). Поэтому такой электрохимический элемент имеет не слишком большое практическое значение.
Пример 1
В концентрационном элементе, устроенном так, как это показано на рис. 19-2, давление Н2 в левом сосуде равно 10 атм, а в правом сосуде-2 атм. Вычислите изменение свободной энергии для реакции, протекающей в таком элементе. Полагая, что напряжение элемента пропорционально изменению свободной энергии для протекающей в нем реакции, вычислите напряжение указанного здесь концентрационного элемента. Какое напряжение должен иметь концентрационный водородный элемент с давлением Н, в левом сосуде 5 атм и давлением в правом сосуде 1 атм?
Решение
AG = AG° + = 0 + КТ1п(2/10) = —3,99 кДж моль-1
Напряжение элемента
g =
3,99 кДж
5,706 кДж
29,6 мВ = 20,7 мВ
Поскольку отношение давлений во втором элементе (5 атм/1 атм) совпадает с отношением давлений в первом элементе (10 атм/2 атм), изменения свободной энергии и напряжения этих элементов должны быть одинаковыми.
В концентрационном элементе полная реакция протекает в две стадии: окисление и восстановление. В левом сосуде молекула Н2 окисляется до Н +, теряя электроны, а в правом сосуде ионы Н + восстанавливаются до Н2, приобретая электроны. Названия электродов соответствуют тому, стекают с них электроны или, наоборот, поступают к ним из внешней части системы. С правого электрода электроны стекают в раствор в процессе восстановления *, поэтому данный электрод называется катодом («ката» означает «прочь, долой», как в слове «катапульта»). В левом сосуде, наоборот, электроны в процессе окисления поступают из раствора на электрод, поэтому левый электрод называется анодом («ана» означает «назад»). Для тех, кто мало знаком с греческим языком, существует мнемоническое правило, позволяющее легче запомнить, какой процесс протекает и на каком электроде: слова «анод» и «окисление» начинаются с гласной буквы, а слова «катод» и «восстановление» - с согласной.
* В том смысле, что из нейтрального вещества образуется отрицательный ион либо положительный ион соединяется с электронами и нейтрализуется.
«-796
Глава 19
162
Концентрационные элементы
Описанный выше элемент, действующий благодаря разности давлений, является примером концентрационных элементов; он способен создавать во внешней цепи электронный ток вследствие того, что концентрация газообразного Н2 в двух сосудах с электродами различна. Можно построить аналогичный концентрационный элемент, используя медные электроды и растворы CuSO4. Если привести в соприкосновение два раствора сульфата меди различной концентрации, они самопроизвольно смешаются друг с другом (рис. 19-3, а). Можно использовать эту самопроизвольную реакцию, чтобы построить элемент, подобный изображенному на рис. 19-3,6. В левом сосуде с разбавленным раствором медный электрод медленно подвергается эрозии по мере того, как медь, окисляясь, образует новые ионы Си2 +. Следовательно, левый электрод является анодом и на нем накапливается избыток электронов. В правом сосуде с раствором высокой концентрации ионов Си2 + часть ионов меди будет восстанавливаться и образующаяся медь осаждается на медном катоде. Если соединить два электрода, электроны протекут по проволоке слева направо, а сульфатные ионы будут диффундировать справа налево, чтобы поддерживалась электрическая нейтральность раствора. Разбавленный раствор в левом сосуде становится более концентрированным по CuSO4, а концентрированный раствор в правом сосуде становится более разбавленным, подобно тому как это происходило при свободном смешивании растворов. Когда концентрации растворов в двух отделениях прибора становятся равными, электронный ток прекращается.
В целом в рассматриваемом элементе протекает реакция Си2 + (0,10 М) Си2 + (0,01 М), и изменение свободной энергии в пей можно вычислить по уравнению
AG = AG° + KTln^/q)
в котором Cj и с2 -концентрации в начале и в конце реакции, выраженные в молях на литр. В рассматриваемом примере
AG = 0 + К ТТп (0,01/0,1) = - 5,706 кДж моль" 1
Изменение свободной энергии в данной реакции оказывается точно таким же, как в элементе с давлением водорода 10 и 1 атм, потому что отношение концентраций в обоих случаях одинаково. По мере протекания реакции и выравнивания концентраций свободная энергия, приходящаяся на моль реакции, уменьшается. (Аналогично, определенная масса воды, падающая с плотины высотой 2 м, способна совершить меньшую работу, чем такая же масса воды, падающая с плотины высотой 20 м. См. рис.
Окислительно-восстановительные равновесия
163
Рис. 19-3. Концентрационный элемент на сульфате меди.
а-при открывании соединительного крана концентрированный и разбавленный растворы смешиваются, не выполняя никакой полезной работы;
б-концентрационный элемент для превращения свободной энергии смешения в полезную работу. Два медных электрода погружены в 0,01 и 0,10 М растворы CuSO4, которые разделены пористой перегородкой, пропускающей медленный поток ионов, но не позволяющий растворам смешиваться. В элементе самопроизвольно протекают следующие реакции:
Левое отделение: Си(тв.) -» Си2 + (0,01 М) + 1е~
Правое отделение: Си(0,1 ОМ) + 1е~ Си(тв.)
Полная реакция: Cu2+(0,10M) -> Cu2+(0,01 М)
Электроны, образующиеся в левом отделении, протекают во внешней цепи в правое отделение, где они вступают в реакцию с ионами меди. Раствор в левом отделении постепенно становится более концентрированным, а в правом отделении - более разбавленным. Когда концентрации растворов выравниваются, электронный ток прекращается.
17-1.) Исходное напряжение элемента (т. е. разность потенциалов электродов) равно 29,6 мВ, как в элементе с Н2 при отношении давлений 10/1, но оно постепенно уменьшается до нуля по мере выравнивания концентраций ионов Си2 + в двух отделениях элемента, и, как говорят, элемент «садится».
б«
Глава 19
164
19-2. ЭЛЕКТРОХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
Для того чтобы электрохимический элемент давал напряжение, совсем не обязательно, чтобы две протекающие в нем реакции были обратны друг другу. Необходимо лишь наличие двух веществ с различной способностью приобретать или терять электроны. Такое различие в сродстве к электронам может быть использовано для выполнения полезной работы.
Цинк-медный элемент: элемент Даниэля
Если кусок не очень чистого цинка погрузить в раствор сульфата меди, он постепенно покрывается ямками и растворяется. В то же время медь будет осаждаться на поверхности цинка, образуя губчатое коричневое покрытие, а характерная голубая окраска раствора сульфата меди постепенно поблекнет. Цинк самопроизвольно замещает ионы меди в растворе; реакция протекает по уравнению
Zb(tb.) + Си2 + -> Zn2 + + Си(тв.)
и обусловлена тем, что ионы меди в растворе имеют большее сродство к электронам, чем ионы цинка.
Если разъединить эти два вещества в простом по устройству элементе, изображенном на рис. 19-4,п, то можно получать полезную работу. Цинк самопроизвольно окисляется на аноде (слева), а ионы меди восстанавливаются в металл, который осаждается на катоде. Электроны протекают во внешней цепи от анода к катоду, и при 1 М концентрации обоих растворов между электродами возникает разность потенциалов 1,10 В. Анионы диффундируют через пористую перегородку справа налево, чтобы поддерживалась электрическая нейтральность раствора.
Наблюдения показывают, что ни ZnSO4, ни медный стержень не являются обязательной составной частью подобного элемента. Металлическая медь осаждается на катоде из любого другого хорошего проводника, например на платиновой проволоке, а раствор сульфата цинка в анодном отделении можно заменить любой другой проводящей солью, которая не реагирует с цинковым анодом, как, например, хлорид натрия. Пористая перегородка оказывает значительное сопротивление диффузии ионов и поэтому создает довольно высокое электрическое сопротивление, препятствующее получению сильного тока от элемента. Лучший метод заключается в использовании соляного мостика, который представляет собой стеклянную U-образную трубку, содержащую какой-либо электролит типа KNO3, смешанный с агар-агаром или желатиной, чтобы удержать электролит в трубке (рис. 19-4,6).
Наилучшее устройство элемента, при условии его неподвижности, основано на гравитационном разделении растворов вообще без какой-либо перегородки между ними (рис. 19-4, в). В таком элементе разбавленный раствор сульфата цинка осторожно наливают поверх концентрированного, более плотного раствора сульфата меди. При отсутствии перемещений или
Окислительно-восстановительные равновесия
165
Рис. 19-4. Три варианта простого цинк-медного элемента. Во всех случаях на аноде слева протекает окислительная реакция:
Zn (тв.) -► Zn2 + + 2е~ , а на катоде справа - восстановительная реакция:
Си2+ + 2е~ -> Си(тв.)
По мере того как медь осаждается на
катоде, цинковый анод растворяется. Если концентрации ZnSO4 и CuSO4 равны 1 моль л-1, такой элемент создает напряжение, или э.д.с., +1,10 В. а - растворы разделены пористой перегородкой; б-растворы разделены соляным мостиком; в-растворы разделены силой тяжести в результате различной плотности (элемент Даниэля).
а
вибраций элемент работает очень хорошо. Внутреннее сопротивление в нем почти полностью отсутствует, и это позволяет получать от него большие токи. Такой элемент Даниэля в прежнее время широко использовался как стационарный источник тока на телеграфных станциях и в домах для устройства дверных звонков.
Глава 19
166
Водородный электрод
В элементах с устройством, подобным изображенному на рис. 19-4.6, можно использовать и другие комбинации металлов. Если в качестве пары метал зов взяты никель и медь, никель окисляется на аноде, ионы Си2 + восстанавливаются на катоде, и элемент имеет напряжение, или электродвижущую силу (э.д.с.), 0,57 В. Если в элементе используются цинк и никель, цинк окисляется, а ионы Ni2+ восстанавливаются, и э.д.с. элемента равна 0,53 В (при условии, что ионы металлов имеют 1 М концентрации). Следует отметить, что э.д.с. электрохимических элементов обладают таким же свойством аддитивности, как и реакции, например:
Ni + Си2 + -> Ni2 + + Си <Г = + 0,57 В
Zn + Ni2 + - Zn2 + + Ni <Г = + 0,53 В
Zn + Си2 + -> Zn24 + Си <Г= +1,10 В
Сумма двух первых электрохимических реакций представляет собой реакцию Zn—Си в элементе Даниэля, и сумма потенциалов двух первых элементов дает потенциал элемента Даниэля. (Позже мы сделаем дополнительные выводы из подобных наблюдений.) Символ S° указывает стан-
Рис. 19-5. Элемент с водородным электродом. В элементе протекают следующие реакции:
На аноде: Zii(tb.) -> Zn21' + 1е~
На катоде: 2Н 4 + 2е~ -* Н2(г.)
Полная реакция: Zn(тв.) + 2Н + -» Zn2+ + Н2(г.)
Такая же полная реакция протекает, если погрузить полоску металлического цинка в серную кислоту. Металл растворяется в кислоте (как на аноде рассматриваемого здесь элемента), а газообразный водород пузырьками выделяется из жидкости (как на катоде). Однако в этом случае невозможно получить полезную электрическую работу.
Окислительно-восстановительные равновесия
167
дартный потенциал, соответствующий 1 М концентрации* реагирующих ионов и температуре 298 К. Положительный знак э. д. с. означает, что электрохимическая реакция самопроизвольно протекает слева направо, как записано в уравнении.
Электродная реакция не обязательно должна протекать на металле; металлы просто легче всего поддаются механической обработке с целью придания нужной формы. На рис. 19-5 изображен электрохимический элемент, в котором катодная реакция представляет собой высвобождение газообразного водорода:
2Н+ + 2е~ -> Н2(г.)
Эле :ент, в котором протекает полная реакция
Zn(TB.) + 2Н * -> Zn2+ 4- Н2(г.)
имеет стандартную э.д. с. 4-0,76. Если цинковый электрод заменить медным, а раствор ZnSO4 раствором CuSO4, электроны потекут в обратном направлении, справа налево, потому что ионы меди обладают большим сродством к электронам, чем ионы водорода. Ионы меди будут самопроизвольно восстанавливаться на левом электроде, который поэтому превращается в катод:
На катоде: Си2 + + 2е~ -> Си(тв.)
Газообразный водород окисляется на аноде справа с образованием ионов водорода:
На аноде: Н2(г.) -> 2Н+ 4- 2е~
Полная самопроизвольная реакция описывается уравнением
Сп2+ 4- Н2(г.) -> Си(тв.) 4- 2Н +
и стандартный потенциал такого элемента S° — 4- 0,34 В. Отметим, что и в этом случае наблюдается свойство аддитивности потенциалов элементов. Если просуммировать две рассмотренные выше реакции с участием водородного электрода, получится реакция, протекающая в элементе Даниэля, и сумма их э.д.с. в точности совпадет с э.д.с. элемента Даниэля: Zh(tb.) 4- 2Н+ -> Zn2+ 4- Н2(г.) = 4-0,76 В
Си2 + 4- Н2(г.) -> Си(тв.) 4- 2Н+ g° = 4-0,34 В
Zn(TB.) 4- Cu2+ -> Zn2+ 4- Cu(tb.) S° = 4- 1,10 В
* Поскольку концентрированные растворы не обладают идеальными свойствами, вместо молярности растворов следует указывать их активность («эффективную концентрацию»). Стандартные потенциалы в действительности определяются при единичной активности, а не при единичной молярности. Однако поскольку нашей целью является ознакомление с основными принципами химии, а не с лабораторной методикой, в данной главе мы пренебрегаем различием между активностью и молярностью.
Глава 19
168
Угольный стержень ( катод)
Цинковая оболочка (анод)
Паста из MnO2,NH4Cl и Н20
Рис. 19-6. Сухой элемент. Протекающие в нем реакции описываются уравнениями: На аноде (цинковая оболочка): 2п(тв.) -♦ Zn2+ + 2е.~
На катоде (угольный стержень): 2МпО2(тв.) + 8NH4 + 2е -> - 2Mn3 + + 4Н2О + 8NH3
Полная реакция: 2п(тв.) + 2МпО2(тв.) + 8NH^ -► - Zn2+ + 2Mn3 + + 8NH3 + 4Н2О
Все химические компоненты такого элемента являются твердыми веществами или пастами, а сам элемент запаян в металлическую оболочку (поэтому он и называется сухим). Благодаря этому его очень удобно использовать в любых переносных портативных устройствах-фотовспышках, электрических фонарях, радиоприемниках и т.п.
Сухой элемент
Элементы с жидким наполнением трудно или вообще невозможно использовать в движении. (Представьте себе устройство для фотовспышки, питаемое от элемента Даниэля!) На рис. 19-6 схематически показано устройство сухого элемента, очень удобного в таких ситуациях, потому что его компонентами являются твердые вещества или влажные пасты, помещенные в плотно закрывающую их оболочку. Роль анода играет цинковая оболочка самого элемента. Вокруг угольного стержня, являющегося катодом, расположена паста, состоящая из MnO2, NH4C1 и Н2О. На аноде происходит окисление цинка в ионы Zn2 +, а на катоде-восстановление МпО2 в Мп (III), образующий смесь нескольких соединений. Если элемент используется очень интенсивно, аммиак, выделяющийся при катодной реакции, образует изолирующий слой газа вокруг угольного стержня, что приводит к снижению тока от элемента. При медленном использовании ионы цинка диффундируют от анода по направлению к катоду и соединяются там с аммиаком, образуя комплексные ионы типа Zn(NH3)4 + . Вот почему кажущиеся израсходованными батареи для фотовспышки после продолжительного отдыха иногда восстанавливают рабочее состояние.
Обратимые элементы: свинцовый аккумулятор
Большинство рассмотренных до сих пор элементов обладает свойством обратимости: это означает, что если к элементу приложить внешнее напряжение, которое превышает собственное напряжение элемента, протекаю-
Окислительно-восстановительные равновесия
169
Рис. 19-7. Свинцовая аккумуляторная батарея. В элементах протекают следующие электродные реакции:
На аноде: РЬ(тв.) + SO4“ -> PbSO4(TB.) + 2е~
На катоде: РЬО2(тв.) + 4Н + + SO4 + 2е~ -» РЬ8О4(тв.) + 2Н2О
Батарея обладает свойством обратимости (может перезаряжаться), поскольку продукт протекающих в ней реакций - образующийся на обоих электродах сульфат свинца - оседает на пластинах, а не диффундирует и не отваливается от них. Один элемент изображенной здесь свинцовой аккумуляторной батареи дает напряжение около 2 В; в батареях на 6 или 12 В последовательно соединены три или шесть описанных элементов.
гцие в нем реакции могут пойти в обратном направлении, и таким образом удается запасти в элементе электрическую энергию, которую впоследствии можно получить от него. Так, например, если в элементе, изображенном на рис. 19-3,6, электроны оттягиваются справа налево действием внешнего напряжения, раствор CuSO4 в левом отделении элемента становится еще более разбавленным, а раствор CuSO4 в правом отделении еще более концентрированным. В элементе Даниэля, изображенном на рис. 19-4, в, внешнее напряжение вызывает осаждение дополнительного количества Zn на левом электроде, и одновременно большее количество меди с правого электрода переходит в раствор. В результате свободная энергия элемента еще более повышается, и впоследствии эта дополнительная свободная энергия может быть превращена в полезную работу. К сожалению, сухие элементы промышленного изготовления нельзя перезаряжать подобным образом. Ионы Zn2 +, образующиеся на аноде, диффундируют от него и образуют комплексные соединения с газообразным аммиаком, выделяющимся на катоде. Не существует удобного механизма для разрушения этих комплексных ионов и возвращения компонентов в исходное положение.
Для того чтобы элемент можно было перезаряжать, электродные продукты должны оставаться вблизи электродов и допускать обратное превращение при зарядке элемента. Примером такого элемента является свинцовый аккумулятор, схематически изображенный на рис. 19-7. В качестве анода в нем используется пластина из пористого свинца, и когда свинец
Глава 19
170
окисляется в сульфат свинца, последний остается на пластине. Аналогично при восстановлении на катоде оксида свинца в сульфат свинца продукт восстановления остается на месте. Самым заметным изменением, происходящим в элементе по мере его разрядки, является разбавление первоначально концентрированного раствора серной кислоты. Поэтому состояние зарядки аккумулятора можно определить, измеряя ареометром плотность аккумуляторной жидкости и, следовательно, концентрацию раствора серной кислоты. Описанный элемент имеет э. д. с. 2 В, но если последовательно соединить несколько таких элементов, получаются аккумуляторные батареи, дающие напряжение 6 или 12 В.
После того как произойдет зарядка свинцового аккумулятора, его можно перезарядить, приложив к нему внешнее напряжение, которое превысит его собственную э.д.с., т.е. 2 В в расчете на каждый элемент батареи. Это приводит к обращению реакций, указанных в подписи к рис. 19-7, в результате чего сульфат свинца превращается в свинец и оксид свинца. Если бы по мере разрядки аккумулятора сульфат свинца осаждался на дно бака, обратная реакция оказалась бы невозможной. Однако этого не происходит; сульфат свинца остается на свинцовой решетке, готовый к обратному превращению. Это и делает свинцовую аккумуляторную батарею удобным устройством для запасания электрической энергии в форме химической свободной энергии.
Электролитические элементы
На рис. 19-8 изображено электрохимическое устройство для получения меди высокой чистоты; в нем используется внешний источник тока (батарея), заставляющий протекать процесс в таком направлении, в котором он самопроизвольно не протекает. Слиток неочищенной «черной» меди, полученной восстановлением оксида меди, СиО, коксом, С, подвешивается в растворе сульфата меди рядом с «затравочной» проволокой из очень
Рис. 19-8. Электролитическое рафинирование неочищенной меди. Неочищенная медь окисляется на аноде, а рафинированная медь осаждается на катоде. Примеси собираются под анодом, образуя «анодный шлак». Стоимость редких металлов, извлекаемых из анодного шлака, таких, как золото, серебро и платина, часто компенсирует расходы на проведение процесса рафинирования.
Рис. 19-9. Электролитическое копирование гравированных пластин для печатания бумажных денег в США.
а-протирание гравированной мастером стальной пластины влажной графитовой пудрой, после чего пластина начисто моется. Тончайшее графитовое покрытие облегчает электроосаждение и затем позволяет отделить исходную пластину от полученной на ней копии;
б-нанесение на пластину слоя никеля толщиной 0,025 мм в результате проведения электролиза в течение 10 ч (вертикальные длинная и короткая черточки в верхней части рисунка представляют собой условное обозначение внешней батареи; короткая ли
ния означает источник электронов -анод батареи);
в-нанесение для укрепления на никель слоя железа толщиной 0,1 мм; эта процедура занимает еще 14 ч;
г-отделение полученного электролитическим путем рельефного обратного изображения оригинала и укрепление его на стальной пластине. Процесс повторяют, используя теперь в качестве матрицы полученное только что обратное изображение оригинала, и таким образом получают копию гравированной пластины. Эту копию можно использовать для печатания банкнот или для повторного копирования.
Глава 19
172
чистой меди. Через раствор пропускают ток в таком направлении, чтобы слиток играл роль анода, а чистая медная проволока-роль катода. Слиток постепенно растворяется, и ионы меди осаждаются в виде очень чистого металла на катоде, а примеси опускаются на дно бака под анодом.
Подобные устройства используются в ювелирном деле для нанесения золотых или серебряных покрытий на поверхность недрагоценных металлов или для получения точных копий гравированных пластин, используемых при печатании бумажных денег. В США печатание бумажных денег осуществляется при помощи пластин, дающих сразу 12 ассигнаций. Гравер изготовляет на стали всего одну гравировку, которую затем упрочняют и копируют при помощи электролитического процесса, иллюстрируемого рис. 19-9. Полученная электроосаждением копия, называемая «альто», где углублениям на оригинале соответствуют выпуклости, снова электрокопи-руется для получения «бассо», углубления которого являются точными копиями углублений на гравированной мастером пластине. Копии «бассо» затем собирают в единую пластину, позволяющую печатать сразу 12 банкнот, и используют эту пластину непосредственно для печатания денег или для изготовления новых печатающих пластин, повторяя процесс электрокопирования.
Электрохимические элементы с внешними источниками напряжения, подобные изображенным на рис. 19-8 и 19-9, называются электролитическими элементами; рассматривавшиеся выше элементы, в которых за счет протекающих внутри них химических реакций вырабатывается электрический ток, называют гальваническими элементами. В элементах обоих типов электрод, на котором происходит окисление, называется анодом, а электрод, на котором происходит восстановление,-катодом.
19-3. НАПРЯЖЕНИЕ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И СВОБОДНАЯ ЭНЕРГИЯ
Когда электрический заряд величиной q самопроизвольно перемещается между точками с разностью потенциалов S вольт, он выполняет над своим окружением внешнюю электрическую работу н>внсш = qS. Поэтому, согласно уравнению (16-3), изменение свободной энергии системы, в которой осуществляется перемещение электрического заряда, равно
AG = - %неШ = -q& (19-1)
Поскольку электрон имеет отрицательный заряд, он должен самопроизвольно перемещаться из области с низким потенциалом в область с высоким потенциалом. Для одного электрона, перемещаемого между точками с разностью потенциалов S в направлении повышения потенциала, изменение свободной энергии составляет
AG = - её
Для моля электронов
AG = - = - &ё
Окис.1ителъно-восстановите.1ьные равновесия
173
где N-число Авогадро, a S' = Ne-заряд 1 моля электронов, равный 96485 Кл, или 1 фарадею. Если на моль реакции приходится п электронов, т. е. заряд пЗ- фарадеев на моль, изменение свободной энергии составляет
AG = - п&в (19-2)
Допустим, что гальванический элемент основан на реакции, при которой происходят изменение свободной энергии AG кДж моль “ 1 и перенос п молей электронов во внешней цепи в расчете на моль реакции; тогда разность потенциалов между электродами, в = — <?ан, определяется
соотношением
^кат — ^ан — & — — kG/nS'
Поскольку 1 вольт-кулон эквивалентен 1 Дж, уравнение (19-2) можно переписать в виде
AG (кДж) = — 96,5 п 8 (вольт)
Описанный в разд. 19-1 концентрационный элемент, в котором двухэлектронная реакция характеризуется стандартной свободной энергией — 5,706 кДж моль “ 1, согласно последнему соотношению, должен иметь стандартный потенциал:
5,706 кДж • моль
2 96,5 кДж моль 1 В 1
= +0,0296 В
Реакция в элементе Даниэля
Zu(tb.) + Cu2 + -> Zn2 + + Cu(tb.)
создает стандартное напряжение элемента + 1,10 В. Следовательно, эта реакция должна иметь стандартную свободную энергию:
AG = - 2(96,5)( + 1,10) = - 212,3 кДж моль ”1
В этой реакции п = 2, поскольку в расчете на каждый ион во внешней цепи перемещаются два электрона. Аналогичным способом можно вычислить стандартные свободные энергии реакций для других описанных выше электрохимических элементов.
Пример 2
Вычислите стандартные свободные энергии гальванических элементов Ni—Си, Zn—Си и Zn—Ni, описанных в разд. 19-2. Покажите, что эти свободные энергии
аддитивны, точно так же, как сами реакции и создаваемые ими потенциалы.
Решение
Элемент Ni—Си: g = + 0,57 В, AG° = — ПО кДж-моль-1
Элемент Zn—Ni: 8° = + 0,53 В, AG° = — 102 кДж моль " 1
Элемент Zn—Си: 8 = + 1,10 В, AG = —212 кДж-моль-1
Глава 19
174
На этом примере можно убедиться, что для получения от электрохимического элемента даже столь небольшого напряжения, как 1 В, в нем должна протекать реакция с большим изменением свободной энергии. Поскольку свободные энергии реакций обладают свойством аддитивности (вытекающим из первого закона термодинамики), нет ничего удивительного в том, что э. д. с. электрохимических элементов также аддитивны, как уже указывалось в разд. 19-2.
Аддитивность э. д. с. схематически иллюстрируется рис. 19-10. В гл. 16 было объяснено, что нет необходимости табулировать изменение свободной энергии для каждой возможной реакции. Если имеются табулированные изменения свободной энергии для реакций определенного вида, а именно для реакций образования всех соединений из элементов в их стандартных состояниях, можно вычислить изменение свободной энергии для любой реакции, включающей эти соединения, основываясь на свойстве аддитивности свободных энергий. Точно так же нет необходимости табулировать напряжение любого мыслимого элемента или каждой мыслимой комбинации анодной и катодной реакций. Вместо этого достаточно иметь таблицы напряжений электрохимических элементов, в которых все электродные реакции скомбинированы с одним стандартным электродом. Это равнозначно выбору произвольного начала отсчета на рис. 19-10. Любую реакцию в электрохимическом элементе можно представить в виде двух полуреакций, одна из которых протекает на аноде, а другая на катоде,
Рис. 19-10. Аддитивность потенциалов различных гальванических элементов с цинковым, медным, никелевым и водородным электродами, которые обсуждались выше, позволяет представить их как аддитивные отрезки вертикальной шкалы, длина которых измеряется в вольтах. Выбор нулевого потенциала на этой оси произволен, но после того,
+ 0,34 В
- 0,00 в
Си24' + 2г —• Си(та.)
2Н+ + 2е~ -> Н2( г.)
Ni2+ + 2г“ -> Ni(me.)
Zn2+ + 2г —* Zn(ma.)
как он осуществлен, все потенциалы отсчитываются от этой нулевой точки. В данном случае в качестве нулевой точки отсчета потенциалов выбран водородный электрод. Так принято делать во всех таблицах, хотя вместо этого можно было бы выбрать Ni, Zn или любой другой электрод.
Окислительно-восстановительные равновесия
175
и затем приписать каждой полуреакции потенциал, наблюдаемый в элементе, где эта полуреакция скомбинирована с реакцией
Н2(г.) - 2Н+ + 2е~
На таком принципе основана шкала потенциалов восстановления, приведенных в табл. 19-1 и 19-2.
Таблица 19-1
Стандартные восстановительные потенциалы в кислом растворе3 при 298 К
Полуреакция (электрод) <f°, В
F2 + 2е- - 2F” 2,87
Ag2 + + е~ -<• Ag+ 1,99
Н2О2 + 2Н+ + 2е~ - 2Н2О 1,78
РЬО2 + 4Н+ + SO4 + 2е~ - PbSO4 + 2Н2О 1,69
М11О4 + 4Н+ + Зе“ -> МпО2 + 2Н2О 1,68
M11O4 + 8Н+ + 5е~ -> Мп2+ + 4Н2О 1,49
РЬО2 + 4Н+ + 2е~ -> РЬ2+ + 2Н2О 1,46
С12 + 2е“ - 2СГ 1,36
Сг2ОГ + 14Н+ + 6е~ -> 2Сг3 + + 7Н2О 1,33
О2 + 4Н+ + 4е~ -> 2Н2О 1,23
МпО2 + 4Н+ + 2е~ -<• Мп2+ + 2Н2О 1,21
Вг(ж.) + 2е~ -> 2Вг~ 1,09
АиСЦ" + Зе- -► Au + 4С1“ 0,99
NO3- + 4Н+ + Зе~ -> NO + 2Н2О 0,96
2Hg21" + 2е“ -» Hgi + 0,91
Ag+ + е~ -> Ag 0,80
Hg2+ + 2е~ - 2Hg 0,80
Fe3+ + e~ -► Fe2 + 0,77
O2 + 2H+ + 2e~ - H2O2 0,68
МПО4 +<?“-> M11O4' 0,56
I2 + 2e~ -> 2Г 0,54
Cu+ + e~ -► Си 0,52
Cu2+ + 2e~ -> Си 0,34
Hg2Cl2 + 2e~ -> 2Hg + 2СГ 0,27
AgCl + e~ -► Ag + Cl“ 0,22
SO^“ + 4H+ + 2e~ - H2SO3 + H2O 0,20
Си21 + e~ -» Cu + 0,16
2H+ + 2e~ -> H2 0,00
Pb21 4- 2e~ -< Pb -0,13
Sn2+ + 2e~ ->• Sn -0,14
Ni2+ + 2e~ - Ni -0,23
PbSO4 + 2e“ - Pb + sor -0,35
Cd2+ + 2e~ - Cd -0,40
Cr3+ + e~ - Cr2+ -0,41
Продолжение табл. 19-1
Полуреакция (электрод) В
Fe2 + + 2<?" - Fe -0,41
Zn2 + + 2е~ -> Zn -0,76
Mn2 + + 2е~ -> Мп -1,03
А13+ + Зе" - А1 -1,71
Н2 + 2е~ - 2Н" -2,23
Mg2+ + 2е" -> Mg -2,37
La3+ + Зе" -» La -2,37
Na+ + е~ -> Na -2,71
Са2+ + 2е" -» Са -2,76
Ва2+ + 2е~ -> Ва -2,90
К+ + е~ К -2,92
Li + + е -► Li -3,05
а По данным справочника: Handbook of Chemistry and Physics, 59th ed., Chemical Rubber Co., Cleveland, Ohio, 1978-1979.
Таблица 19-2
Стандартные восстановительные потенциалы в основном растворе при 298 К
Полуреакция3 (электрод) в°. в
но; + Н2О + 2е" - ЗОН 0,87
МпО4" + 2Н2О + Зе" -> МпО2 + 4ОН“ 0,59
О2 + 4е~ + 2Н2О 4ОН" 0,40
Co(NH3)|+ + е~ - Co(NH3)l + 0,10
HgO + Н2О + 2е~ - Hg + 2ОН" 0,10
МпО2 + Н2О + 2е~ Мп(ОН)2 + 20Н -0,05
О2 + Н2О + 2е" - НО2 + ОН" -0,08
Cu(NH3)J + е" - Си + 2NH3 -0,12
Ag(CN); + е~ -* Ag + 2CN" -0,31
Hg(CN)J" + 2е" -> Hg + 4CN" -0,37
S + 2e" S2" -0,51
Pb(OH)3" + 2e~ - Pb + ЗОН" -0,54
Fe(OH)3 + e~ - Fe(OH)2 + OH" -0,56
Cd(OH)2 + 2e" - Cd + 2OH" -0,76
SOj" + H2O + 2e" -> SOi" + 2OH" -0,92
Zn(NH3)i+ + 2e" Zn + 4NH3 -1,03
Zn(OH)4" + 2e" Zn + 4OH" -1,22
Mn(OH)2 + 2e~ - Мп + 2OH" -1,47
Mg(OH)2 + 2e~ -> Mg + 2OH" — 2 67
Ca(OH)2 + 2e" - Ca + 2OH" -3,02
a Полуреакции с участием ионов, на которые не оказывает влияния изменение pH
(например, Na+|Na), имеют одинаковый потенциал в кислых и основных растворах.
Окислительно-восстановительные равновесия
177
19-4. ПОЛУРЕАКЦИИ И ВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ
Приведенные в табл. 19-1 восстановительные потенциалы могли бы наблюдаться, если бы реакции, описываемые указанными в таблице уравнениями, были скомбинированы с реакцией окисления водорода
Н2(г.) - 2Н + + 2е~
Положительный знак потенциала означает, что соответствующая полная реакция должна самопроизвольно протекать в электрохимическом элементе в указанном направлении. Отрицательный знак потенциала означает, что самопроизвольно должна протекать обратная реакция, т.е. что соответствующее вещество должно окисляться, а протоны восстанавливаться в газообразный водород. Чем больше положительный потенциал восстановления, тем больше способность вещества присоединять электроны и восстанавливаться. Большой отрицательный потенциал восстановления означает, что для данного вещества намного предпочтительнее окисленное состояние. (Приведенные в таблице потенциалы представляют собой стандартные значения, относящиеся к 1 М концентрации всех участвующих в реакции ионов и парциальному давлению газов 1 атм при 298 К.)
Пример 3
Какая полная реакция протекает в гальваническом элементе, где газообразный хлор при давлении 1 атм «пробулькивает» через платиновый электрод в растворе хлористоводородной кислоты, а газообразный водород при давлении 1 атм «пробулькивает» через такой же электрод? Какую э.д.с. имеет этот гальванический элемент?
Решение
Стандартный восстановительный потенциал для реакции
С12(г.) + 2е~ — 2С1
равен 8° = +1,36 В. Это означает, что в комбинации с водородным электродом хлорный электрод является катодом (на нем происходит восстановление), а водородный электрод - анодом. Полная реакция, протекающая в указанном элементе, описывается уравнением
С12(г.) + Н2(г.) - 2С1- + 2Н +
Она самопроизвольно протекает слева направо и характеризуется стандартным изменением свободной энергии
AG° = - п&8с = - 2(96,5)( + 1,36)= - 262 кДж моль"1 С12 или Н2
Сопоставьте это значение свободной энергии с приведенным в приложении 3.
Пример 4
Какая реакция протекает самопроизвольно, когда кадмиевый и водородный электроды скомбинированы в кислом растворе? Какое напряжение создает такой гальванический элемент?
Глава /9
178
Решение
Стандартный восстановительный потенциал для полуреакции
Cd2+ + 2е‘ - Cd(TB.)
равен — 0,40 В. Следовательно, полная реакция
Cd2 + + Н2(г.) - Cd (тв.) + 2Н +
должна протекать самопроизвольно в обратном направлении, справа налево. Кадмий самопроизвольно окисляется, превращаясь в ионы Cd2 +, на аноде, а ионы водорода восстанавливаются в газообразный водород на катоде. Напряжение данного элемента равно + 0,40 В.
Пример 5
Если кусочек кадмия опустить в 1 М раствор кислоты, будут ли выделяться пузырьки водорода? Будет ли это происходить, если опустить в такой раствор кусочек серебра?
Решение
Из предыдущего примера известно, что реакция
Cd (тв.) + 2Н+ - Cd2+ + Н2(г.) самопроизвольно протекает при стандартных условиях, поэтому в кислом растворе должно происходить выделение пузырьков газообразного водорода по мере растворения металлического кадмия. В отличие ст кадмия серебро имеет положительный потенциал восстановления и, следовательно, более сильную тенденцию оставаться восстановленным, чем газообразный водород. Поэтому если опустить кусочек серебра в слабокислый раствор, он там не изменяется. Инертность благородных металлов золота, серебра и платины-является главным образом следствием их больших положительных восстановительных потенциалов.
Определение напряжения гальванического элемента по восстановительным потенциалам электродных полуреакций
Чтобы вычислить напряжение гальванического элемента, в котором протекает заданная реакция, прежде всего представляют эту реакцию в виде двух полуреакций. Одну из них выбирают так, чтобы она представляла собой восстановительную реакцию на катоде, а другая должна быть окислительной реакцией на аноде. Уравнение второй реакции для этого записывают в обратном порядке, чтобы при чтении слева направо она выглядела как реакция окисления. Затем находят стандартные восстановительные потенциалы для обеих полуреакций и записывают с обратным знаком потенциал реакции, рассматриваемой как процесс окисления. Теперь складывают эти две полуреакции, чтобы убедиться, что получится исходное полное уравнение; одновременно складывают потенциалы двух полуреакций. Если в результате получается положительный полный потенциал, рассматриваемая реакция, в том виде, как она записана, является самопроизвольной. Если же полный потенциал получается отрицательным,
Окислительно-восстановительные равновесия
179
это означает, что исходное предположение о направлении реакции было неверным и что самопроизвольной является обратная реакция.
Пример 6
Определите э.д.с. гальванического элемента, состоящего из цинкового электрода в растворе ZnSO4 и медного электрода в растворе CuSO4. Какой из электродов является анодом и какой катодом?
Решение
В данном примере речь идет об элементе Даниэля, и нам уже известен ответ: анодом является цинковый электрод. Но допустим, что заранее это неизвестно, и представим (ошибочно), что анодом является медный электрод. Предполагаемые полуреакции описываются уравнениями
Zn2 + + ' 2е~ -> Zn(TB.) = -0,76 В
Си2 + + 2е~ -► Си(тв.) = + 0,34 В
Очевидно, если обратить реакцию на цинковом электроде и изменить знак ее потенциала, полная э.д.с. элемента получится положительной. Тем не менее будем следовать исходному предположению, что анодом является медный электрод. Тогда нам придется складывать следующие реакции:
Zn2+ + 2е~ -> Zn(TB.) g° = -0,76 В
Си(тв.) -> Си2 + + 2е ’ g° = - 0,34 В
Zn2 + + Си(тв.) -> Zo(tb.) + Си2 + S° = —1,10 В
Отрицательный потенциал означает, что самопроизвольной должна быть обратная реакция и что в этом случае гальванический элемент даст напряжение + 1,10 В. Описанный метод позволяет застраховаться от ошибок в исходных предположениях относительно катода и анода.
Пример 7
Каково направление самопроизвольного протекания реакции в элементе с одним электродом Fe2+ —Fe3 + и другим электродом 12—I- ? Какую э.д.с. имеет такой элемент?
Решение
На электродах указанного элемента протекают следующие полуреакции:
Fe3 + + е ~ -> Fe2 + <Г = + 0,77 В
12 + 2е‘ -> 21 ~ g° = +0,54 В
Очевидно, для получения положительного полного напряжения следует вычесть вторую полуреакцию из первой, а стало быть, обратить знак второго потенциала. Самопроизвольная полная реакция описывается уравнением
2Fe3 + + 21 “ - 2Fe2 + + 12 £° = + 0,23 В
В предыдущем примере нам пришлось умножить первое уравнение на 2, прежде чем вычесть из него второе уравнение, потому что в первой по
Глава 19
180
луреакции принимает участие один электрон, а во второй-два электрона. Если бы мы вычитали наряду с этими уравнениями их свободные энергии, то следовало бы предварительно умножить на 2 стандартное изменение свободной энергии для полуреакции с ионами железа. Но почему же мы не сделали этого с потенциалом данной полуреакции +0,77 В? Потому, что число электронов п уже учтено в соотношении
AG° = — пЗ & или = — AG°пЗ7
Потенциалы полуреакций уже рассчитаны «на один электрон» и поэтому не должны предварительно изменяться при суммировании соответствующих полуреакций. Обращаясь снова к гидростатической аналогии, можно сопоставлять с потенциалами окислительно-восстановительных реакций «электронное давление», но не энергетические величины. Давление воды, удерживаемой плотиной определенной высоты, не зависит от того, какими порциями расходуют эту воду внизу, но работа или энергия зависят от порции расходуемой воды.
Множитель 2 следует принять во внимание при вычислении изменений свободной энергии. Для полуреакции с железом
2Fe3+ + 2е“ -> 2Fe2 +
AG = -2.3 Л = - 2(96,5)( + 0,77) = - 149 кДж
Для полуреакции с иодом
12 (тв.) + 2е ” -» 21_
AG° = -2.3 S' = - 2(96,5)( + 0,54) = - 104 кДж
Вычитая вторую полуреакцию из первой и второе изменение свободной энергии из первого, получим
AG° = — 149 кДж + 104 кДж = — 45 кДж
Пользуясь соотношением AG0 = — пЗЗ° в качестве проверки, убедитесь, что полученное изменение свободной энергии приводит к найденному ранее полному потенциалу элемента.
Всякая полуреакция, имеющая более высокий положительный потенциал восстановления, чем другая полуреакция, преобладает и заставляет последнюю протекать в обратном направлении, если обе полуреакции скомбинировать в одном электрохимическом элементе. Так, например, в свинцовой аккумуляторной батарее протекают две полуреакции:
РЬО2 + 4Н+ + SO;~ + 2е" -> PbSO4 + Н2О g° = +1,69 В PbSO4 + 2е“ - Pb + SOi" S = -0,35 В
Поскольку первая реакция имеет более высокий восстановительный потенциал, она протекает на катоде, а на аноде протекает в обратную сторону вторая реакция. Полный потенциал свинцового элемента должен быть равен
<Г = ( + 1,69 В) - ( - 0,35 В) = + 2,04 В
Окислительно-восстановительные равновесия
181
Ионы любого металла, указанного в таблице восстановительных потенциалов, восстанавливаются в присутствии другого металла, расположенного ниже в этой таблице. Так, серебро осаждается из раствора нитрата серебра в присутствии цинка, железа, кадмия и даже меди или ртути. Посмотрим, в какой форме должны присутствовать ионы железа, в форме Fe2 + или Fe3 + , при наличии ионов Ag + ?
Из табл. 19-1 находим следующие полуреакции:
1) Ag + + е ~ -» Ag <Г = + 0,80 В
AG° = — 1 (96,5)(+ 0,80) = — 11 кДж-моль 1
2) Fe3 + + е ' -» Fe2 + В = AG° = + 0,77 В - 1 (96,5) (+ 0,77) = - 74 кДж • моль "!
3) Fe2 + + 1е -» Fe(TB.i = AG° = -0,41 В — 2(96,5)(— 0,41) = + 79 кДжмоль-1
Возникает вопрос, почему в табл. 19-1 не приведена реакция восстановления ионов Fe3 + непосредственно в металлическое железо? Эта реакция
Fe3+ + Зе- -» Ре(тв.)
может быть получена просто суммированием приведенных выше полуреакций (2) и (3). Но можно ли получить потенциал этой суммарной реакции путем сложения потенциалов двух постадийных реакций, т. е. считать, что для суммарной реакции
В' = +0,77 - 0,41 = +0,36 В
На этот вопрос следует дать отрицательный ответ. Э.д.с. восстановления Fe3 + в Ре(тв.) не равна + 0,36 В. Допустимо вычитание потенциала одной электродной реакции из потенциала другой при вычитании соответствующих полуреакций в том случае, когда для результирующей полной реакции в электрохимическом элементе соблюдается баланс числа теряемых и приобретаемых электронов. Но недопустимо суммирование потенциала двухэлектронной полуреакции с потенциалом одноэлектронной полуреакции для получения потенциала результирующей трехэлектронной полуреакции.
Правильный подход заключается в проведении вычислений со свободными энергиями, и именно поэтому для всех трех рассматриваемых выше полуреакций приведены свободные энергии. При вычислении свободных энергий из потенциалов электрохимических реакций осуществляется явный учет числа электронов и, которые входят в выражение AG° = = — nSFB0. Поскольку интересующая нас полуреакция является суммой полуреакций (2) и (3), ее свободная энергия должна быть равна сумме свободных энергий складываемых полуреакций
Fe3 + + Зе ~ -» Ре(тв.) AG° = — 74 + 79 = + 5 кДж-моль-1
Глава /9
182
Теперь можно вычислить стандартную э.д.с. этой реакции, разделив полученное значение AG° на — 3^, поскольку в этой реакции участвуют три электрона:
Но обсуждаемая здесь полуреакция в действительности не происходит. Если в системе одновременно присутствуют ионы Fe3 + и металлическое железо, они самопроизвольно взаимодействуют с образованием ионов Fe2 +, в чем можно убедиться, рассматривая свободные энергии соответствующих реакций:
Fc(tb.) -> Fe2+ + 2е ' AG° = — 79 кДж
2Fe3 + + 2е - -> 2Fe2 + AG° = 2( - 74) кДж
Fe(TB.) + 2Fe3+ 3Fe2+ AG° = - 227 кДж
Большое отрицательное значение стандартной свободной энергии этой реакции указывает на большую движущую силу ее самопроизвольного протекания. Поскольку полуреакция Fe—Fe3 + физически не реализуется, она не включена в таблицу восстановительных потенциалов.
Теперь мы в состоянии ответить на вопрос о форме ионов железа в присутствии ионов серебра. Когда серебро осаждается из раствора ионов Ag+ в присутствии металлического железа, железо переходит в раствор в виде ионов Fe2+ . Если в растворе окажется некоторое количество ионов Fe3 + , они немедленно вступят с металлическим железом в описанную выше реакцию с образованием дополнительного количества ионов Fe2 + . Поэтому в растворе должны протекать две следующие электрохимические реакции:
Ag+ + -> Ag 6° = + 0,80 В, AG° = — 77 кДж-моль-1
Fe2+ + 2е“ -> Ее(тв.) = — 0,41 В, AG° = + 79 кДж моль-1
На рассмотренном примере мы убедились, что свободная энергия дает более точные данные о протекании электрохимических реакций, чем электродные потенциалы.
Сокращенные обозначения электрохимических элементов
Для записи электрохимических элементов принято использовать сокращенные обозначения, в которых реагенты и продукты перечисляются слева направо:
Анод | Анодный раствор II Катодный раствор I Катод
Одна вертикальная линия обозначает изменение фазы-твердой, жидкой газовой или раствора. Двойная вертикальная линия указывает наличие пористой перегородки или соляного мостика между двумя растворами. Так, некоторые из рассмотренных выше электрохимических элементов можно записать следующим образом:
Окислительно-восстановительные равновесия
183
Концентрационный элемент на Н2:
Pt | Н2(г, 10 атм) | Н2О || Н2О | Н2(г, 1 атм) | Pt
Концентрационный элемент на Си:
Си | Си2 + (0,01 М) || Си2 + (0,10 М) | Си
Элемент Даниэля (с молярностями
ионных растворов х и у):
Zn | Zn2 + (хМ) || Си2 + (уМ) | Си
Свинцовая аккумуляторная батарея:
РЬ | Н28О4(водн.) | РЬО2
19-5. ЗАВИСИМОСТЬ НАПРЯЖЕНИЯ ЭЛЕКТРОХИМИЧЕСКОГО ЭЛЕМЕНТА ОТ КОНЦЕНТРАЦИИ. УРАВНЕНИЕ НЕРНСТА
Потенциалы восстановления, с которыми мы имели дело до сих пор, представляют собой стандартные величины, т.е. соответствуют стандартным условиям: концентрациям* всех растворенных веществ 1 моль-л’1 и парциальным давлениям всех газов 1 атм при температуре 298 К. Изменяется ли э.д.с. гальванического элемента в зависимости от концентрации? Конечно, изменяется, и по той же причине, по которой изменяется свободная энергия реакции, протекающей в гальваническом элементе. В начале главы уже приводились некоторые примеры такого изменения в связи с обсуждением концентрационных элементов, теперь же нам предстоит вывести более общее выражение для подобной зависимости.
Соотношение между свободной энергией и концентрацией определяется уравнением (16-26)
AG = AG° + RT\n Q
в котором кажущаяся константа равновесия Q равна отношению произведения концентраций продуктов к произведению концентраций реагентов, причем каждая из концентраций взята в степени, равной стехиометрическому коэффициенту соответствующего вещества. Воспользовавшись соотношением AG = — п.^ S, можно получить из уравнения (16-26) интересующую нас зависимость:
RT
& = Я-----— In О
Эта зависимость получила название уравнения Нернста по имени Вальтера Нернста, установившего ее в 1881 г. Здесь -стандартный потенциал, Q -соотношение между концентрациями при заданных экспериментальных условиях, а & -напряжение элемента, измеряемое при этих же условиях. Например, для медного концентрационного элемента, обсуждавшегося
* Точнее, стандартные условия соответствуют единичным активностям всех веществ.
Глава 19
184
в начале главы,
Дб = 0 + КТ1п(с2/С1) = 5,706lg(e2/C1) при 298 К,
откуда
RT , 5,706
<? = 0 - - - igk2/c) = - lg(e2/Ci) 2,ег 2-ег
Величина RT/& при 298 К встречается в расчетах столь часто, что ее имеет смысл вычислить отдельно:
RTj& =
8,314 Дж К “ 1 298 К
96485 К л
= 0,0257 Дж • Кл ’ 1
RT/& = 0,0257 В 2,303 RT/SF = 0,0592 В
Теперь можно записать общее выражение для концентрационной зависимости потенциала гальванического элемента в виде
£ = £'‘ -
0,0592
-—ig е
а выражение для э. д. с. медного концентрационного элемента принимает вид
£ = - 0,0296 lg(c2/C1)
Как мы уже знаем из проводившихся ранее вычислений, при отношении концентраций 1/10 э. д.с. этого элемента равна + 0,0296 В, или 29,6 мВ. Такую э. д. с. имеет любой двухэлектронный концентрационный элемент с отношением концентраций 1/10 независимо от того, какая химическая реакция осуществляется в нем. В частности, ранее мы вычислили такое напряжение для водородного концентрационного элемента и для медного концентрационного элемента. При отношении концентраций 1/5 э. д. с. любого двухэлектронного концентрационного элемента должна быть равна
£ = + 29,6 1g (5) = + 20,7 мВ
Пример 8
Вычислите э. д. с. и изменение свободной энергии для гальванического элемента Cd | Cd2 + (0,0500 М) || СГ (0,100 М) | С12(1 атм) | Pt
Решение
Данный элемент основан на следующих полуреакциях:
Cd2+ + 2е ’ -> Cd(TB.) S'" = -0,40 В
С12(г.) + 2е~ - 2СГ Л + 1,36 В
Суммарное напряжение окажется положительным, если считать электрод Cd | Cd2 + анодом, где происходит окисление, и вычесть его потенциал из потен
Окислительно-восстановительные равновесия
185
циала реакции с С12; тогда получим
С12(г.) + Cd (тв.) - 2СГ + Cd2 + g° = + 1,36 - (-0,40) = + 1,76 В
Напряжение рассматриваемого элемента при условиях, отличающихся от стандартных, определяется выражением
- + °’О5921 LC1']2[Cd2 + ]
<5 = + 1, /О------1g--------------
2 е 11
Газообразный хлор при давлении 1 атм и твердый Cd находятся в своих стандартных состояниях и поэтому в знаменателе логарифмического выражения стоят единичные активности. Подстановка в это выражение остальных условий дает
g = + 1,76 - 0,02961g [(0,100)2 (0,0500)1 = + 1,76 - 0.0296 1е (0.000500) =
= + 1,76 + 0,0296(3,301) = + 1,86 В,
AG = — l&g = - 193(1,86) = - 359 кДж
Электродные потенциалы
Часто оказывается удобнее иметь дело с концентрационной зависимостью каждой электродной полуреакции в отдельности, а затем комбинировать результаты. С этой целью можно разделить уравнение Нернста на две части, условно считая, что каждая полуреакция, окислительная и восстановительная, скомбинирована со стандартной водородной реакцией
2Н + (1,0 М) + 2е“ - Н2(г., 1 атм), g° = 0,000 В
в которой Н + и Н2 имеют единичные активности. Тогда, например, для полуреакции Zn2 + |2п(тв.) имеем
S= -0,76 - 0,02961g , 2 + 1
[Zn2 ]
поскольку активность твердого цинка в числителе равна 1. Величина э.д.с. водородного электрода Н+ |Н2(г.) зависит от pH. Если давление газообразного водорода поддерживается равным 1 атм, эта зависимость приобретает вид
S = 0,000 - 0,0592 pH
(Вывод этого соотношения читатель может проделать самостоятельно.) Для полуреакции Fe3 + |Fe2 +
[Fe2 + ]
S = + 0,77 - 0,05921g ^Fe3 +j а для реакции
MnO; + 8H + + 5e“ - Mn2+ + 4H2O
[Mn2 + ]
g= + 1,49- 0,0118 1ё-[м^-][н^ =
= 1,49 - 0,01181g _ 0,0947 рн
[MnO4 ]
Глава /9
186
(Отметим, что мы разделили 0,0592 на 5, получив 0,0118, но затем снова умножили это число на 8, что дало 0,0947.) Таким образом, все, что влияет на ионные концентрации, должно сказываться на электродных потенциалах.
Подобные индивидуальные уравнения зависимости потенциалов полуреакций от ионных концентраций могут быть заготовлены раз и навсегда, а затем их надлежащие комбинации позволяют получить полное уравнение Нернста для любого интересующего нас гальванического элемента.
Пример 9
Запишите полное уравнение реакции в гальваническом элементе с электродными полуреакциями Fe3 + | Fe2 + и Н +, МпО^ | Мп2 + и вычислите КраВН для этой реакции.
Решение
а) 5е ’ + 8Н+ + МпО4“ -> Мп2 + + 4Н2О
0,0592 [Мп2 + ] g = 1,49-----— J
5
lg [МпО;][Н + ]8
б) обратная реакция: Fe2+ -> Fe3 + + е
g = - 0,77 -
0,0592 1
1g
[Fe3 + ] [Fe2']
Чтобы сбалансировать число электронов в полном уравнении реакции для марганца, следует умножить на 5 уравнение реакции для железа:
в) 5Fe2 + -> 5Fe3 + + 5е
g = - 0,77 -
0,0592
5
1g
[Fe3 + Is [Fe2 + ]5
Обратите внимание на то, каким образом вводятся коэффициенты уравнений с железом в знаменатель предлогарифмического члена и в показатели степени логарифмического выражения. Напомним, что
— 1g = Iga п
Сложим теперь уравнения (а) и (в):
г) 8Н+ + MnO4 + 5Fe2 + -> Мп2 + + 4Н2О + 5Fe3
g = 0,72 -
0,0592
5
[Mn2 + ][Fe3 + ]s
16 [H + ]8[MnO;][Fe2 + ]5
Когда реакция достигает состояния
равновесия, g = 0 и это позволяет записать
0,0592 , <?' = 0,72 В — - 1g Кравн
откуда
Кравн = 6Ю60
[Мп2 +1 [Fe3 + ]5
[H + ]8[MnO4-][Fe2 + ]5
Окислительно-восстановительные равновесия
187
Заметим, что для полуреакции
Fe3 + + е~ -» Fe2 +
величина потенциала не зависит от общего коэффициента, с которым она входит в полное уравнение реакции, протекающей в гальваническом элементе:
[Fe2 + ] 0,0592 FFe2 * Is
g = g' - 0,05921g i , J = g=-------lg I J
B [Fe3 ] 5 B[Fe3 + ]5
Диапазон значений Кравн для окислительно-восстановительных реакций
Рассматривая восстановительные потенциалы, указанные в табл. 19-1 и 19-2, можно убедиться, что они изменяются в диапазоне значений приблизительно от + 3 до — 3 В. Разности потенциалов полуреакций в 6 В соответствует константа равновесия полной окислительно-восстановительной реакции 1О100", где и-число электронов, перенос которых осуществляется в этой реакции. Действительно, из условия
0,0592
IgKpa™ = 6,0
следует, что lgKpaHH « 100и, откуда Крав„ х 101ООп. Это огромное значение константы равновесия по сравнению с максимальным значением порядка 1014, которым характеризуются реакции переноса протона в водных растворах. Огромный диапазон значений константы равновесия, соответствующий диапазону потенциалов окислительно-восстановительных реакций в 6 В, означает следующее: вероятность настолько близкого совпадения потенциалов двух полуреакций, чтобы в полной реакции устанавливалось равновесие со значительными количествами как реагентов, так и продуктов, слишком мала. Даже столь большая константа равновесия, как 1О20, требует для двухэлектронной реакции разности окислительно-восстановительных потенциалов всего 0,59 В. Таким образом, отличительным свойством окислительно-восстановительных реакций является сильный сдвиг равновесия в сторону продуктов или реагентов: в системе не может одновременно присутствовать большого количества продуктов и реагентов. Для таких реакций удобным и практичным способом определения констант равновесия могут служить измерения э.д. с. гальванического элемента.
19-6. РАВНОВЕСИЯ ПРИ РАСТВОРЕНИИ И ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Одна из трудностей непосредственного измерения произведений растворимости заключается в том, что для плохо растворимых солей, как, например, AgCl, равновесные концентрации ионов слишком низки, чтобы их можно было достаточно точно измерить. Однако для измерения растворимости можно воспользоваться полуреакцией
Ag+ + е~ -> Ag
Глава 19
188
для которой
= 0,80 - 0,05921g
-1—- = 0,80 + 0,0592 lg [Ag + ] [Ag J
Например, если концентрация ионов серебра равна всего 10“ 30 моль-л" ‘, потенциал серебряного электрода оказывается равным — 1,0 В, что представляет собой вполне измеримую величину.
Пример 10
Вычислите произведение растворимости (ПР) для AgCl при 298 К, пользуясь данными табл. 19-1.
Решение
Сначала выпишем из табл. 19-1 такие полу реакции:
AgCl + е ~ -> Ag + Cl' <?° = 0,22 В (восстановление)
Ag -» Ag+ + е ~ g° = — 0,80 В (окисление)
Сложим теперь эти реакции, чтобы получить уравнение растворения AgCl:
AgCl - Ag+ + СГ g = - 0,58 В
Отрицательное значение S° означает, что при 1 М концентрациях ионов Ag + и С1 “ реакция самопроизвольно протекает справа налево. При равновесии должно выполняться соотношение
AG° = - RTln Крав„ = - ЯПпПР = - nF g
(поскольку в уравнении Нернста g при равновесии равно нулю). Отсюда находим
ХЗ'
In ПР =---------0,58
RT
ПР = 1,610 10
Пример 11
Вычислите ПР для Hg2Cl2 при 298 К, пользуясь данными табл. 19-1.
Решение
Растворение Hg2Cl2 протекает по уравнению
Hg2Cl2(TB.) - Hg2 + + 2СГ
и характеризуется константой равновесия
ПР = [Hg22+][C1-]2
Этот процесс можно представить при помощи двух полуреакций: Hg2Cl2 + 2+ - 2Hg + 2С1 ’ ga = + 0,27 В Hg^+ + 2е“ - 2Hg <Г = +0,80 В
Окис лите льно-восстановительные равновесия
189
Складывая уравнение первой полуреакции и обратное уравнение второй полуреакции, найдем
Hg2Cl2 - Hg^+ + 2С1 <Г = 0,27 - 0,80 = -0,53 В
Это позволяет записать для произведения растворимости соотношение
откуда IgflP = — 17,9 и, следовательно, ПР = 1,3-10 18.
Интересное следствие влияния растворимости на электродные потенциалы обнаруживается, если рассмотреть реакцию между ионами серебра и иода. Согласно данным табл. 19-1, ион серебра должен окислять иодид-ион по уравнению
2Ag+ +21- -> 2Ag + I2
Если окислительная и восстановительная полуреакции физически разделены, в гальваническом элементе происходит осаждение серебра на катоде и выделение иода на аноде, как и предсказывается приведенным выше уравнением. Однако если ионы серебра и иодид-ионы смешаны в общем растворе, единственной наблюдаемой реакцией является образование нерастворимого иодида серебра
Ag+ +1“ -» AgI(TB.)
Уравнение Нернста позволяет показать, что поскольку ПР для Agl равно приблизительно 10“ 16, в 1,0 М растворе I- потенциал электродной реакции Ag+ | Ag понижается на величину 16 • 0,0592, т. е. приблизительно на 1,0 В, а в 1,0 М растворе Ag+ потенциал электродной реакции 12|1- повышается приблизительно на ту же самую величину. Поскольку стандартный потенциал электродной реакции I2 | I “ всего на 0,25 В выше стандартного потенциала Ag+ | Ag, указанных изменений более чем достаточно, чтобы поменять местами положение этих электродных реакций в таблице.
Образование комплексных ионов и потенциалы восстановления
Рассмотрим равновесие между ионами серебра и цианид-ионами:
Ag+ + 2CN" - Ag(CN)£
Из выражения для константы равновесия для этой реакции
[Ag(CN)2-] гд +п [Ag(CN)2]
, К___ = —-----------— следует ГАс 1 =------------
LAg-JlCN-]2 L S J KpaBH[CN-p
Если серебряный электрод погружен в раствор, содержащий 0,01 моль-л - 1 ионов серебра в избытке цианидных ионов, то практически все ионы серебра в этом растворе находятся в виде комплексов. Потенциал такого
Глава 19
190
электрода
[AgfCNK]
s = 0,80 + °’05921s^f|cSry =
= 0,80 - 0,1184 - 0,0592 lgKpaBH - 0,11841g[CN"]
Подобные соотношения используются для изучения равновесий, включающих комплексные ионы.
19-7. ХИМИЯ БЛУЖДАЮЩИХ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ: КОРРОЗИЯ
Коррозия металлов представляет собой окислительно-восстановительный процесс. Например, железо может окисляться молекулярным кислородом или кислотами, если имеется достаточно влаги, чтобы химические реакции протекали с достаточной скоростью. Этот процесс включает
Окисление: Ре(тв.) -» Fe2 + + 2е~ S° = +0,41 В
Восстановление: |О2(г.) + Н2О(ж.) + 2е" -> 2ОН- S° = + 0,40 В
2Н+ + 2е“ -> Н2(г.) S° = 0,00 В
При ржавлении металлическое железо окисляется, переходя в состояние окисления + 2, и отслаивается от металла в виде хлопьев, состоящих из FeO или других оксидов железа. Коррозия алюминия протекает еще энергичнее:
А1(тв.) - А13 + + Зе' = +1,71 В
Если судить по шкале окислительно-восстановительных потенциалов, алюминий должен проявлять большую склонность к окислению, чем железо. Однако все знают, что алюминий довольно устойчив к коррозии, тогда как ржавление железа и стали представляет собой серьезную экономическую проблему. Как это объяснить?
Чтобы получить ответ на этот вопрос, приходится обратиться к рассмотрению кристаллическою строения алюминия, железа и их оксидов. Структура элементарной ячейки, или межатомные расстояния, в кристаллах алюминия и его оксида приблизительно одинакова; поэтому оксид алюминия, образующийся на поверхности металла, крепко пристает к находящемуся под ним некорродированному алюминию. Окисленная поверхность образует защитный слой, препятствующий проникновению кислорода к металлу. «Анодированная» алюминиевая кухонная утварь имеет оксидный слой повышенной толщины, который получают, помещая алюминиевый предмет в условия, особенно благоприятные для протекания коррозии; для этого его превращают в анод, на котором проводится электрохимическая реакция.
Окисмте.гьно-восстановитеяьные равновесия
191
Рис. 19-11. Образование оксидов на поверхности металлов.
«-образование на поверхности алюминия слоя оксида, который прочно прикрепляется к металлу и предохраняет его от дальнейшей коррозии; б-образование на поверхности железа слоя оксида. К сожалению, оксид же-
леза не пристает столь же прочно к поверхности железа. Он постоянно отслаивается в виде хлопьев ржавчины и открывает чистую поверхность железа дальнейшему воздействию кислорода и влаги. Поверхность железных и стальных предметов приходится защищать путем нанесения какого-либо искусственного покрытия.
В отличие от алюминия и его оксида параметры элементарной ячейки кристаллов железа и FeO значительно отличаются, и поэтому слой оксида железа плохо пристает к металлическому железу. Беда заключается не в том, что ржавчина образуется, а в том, что она постоянно отслаивается и открывает свежую поверхность железа воздействию коррозии (рис. 19-11). Один из способов предотвращения ржавления заключается в защите поверхности железа от влаги и кислорода путем нанесения какого-либо искусственного покрытия, например краски. Хорошая краска пристает к поверхности железа лучше, чем FeO, но и она не остается на поверхности навсегда.
Другой, более эффективный метод основан на использовании законов электрохимии. Подобно тому как на поверхность алюминия наносят оксидную пленку, сделав его анодом электрохимического элемента, можно предотвратить окисление железа, если сделать его катодом. Один из способов добиться этого заключается в том, что поверхность железа покрывают другим металлом с большей реакционной способностью, который сам покрывается защитной оксидной пленкой. В качестве подобного металла мог бы использоваться алюминий. Если железо и алюминий находятся в контакте друг с другом, железо выполняет роль катода, а алюминий роль анода; к такому выводу приводит сопоставление их восстановительных потенциалов:
Fe2+ + 2е~ -» Ее(тв.) <?J = —0,41 В
А13+ + Зе" -> А1(тв.) 8а = -1,71 В
Алюминий должен предохранять железо от окисления, а собственная оксидная пленка алюминия должна предохранять последний от постоянной разрушительной коррозии.
Но вместо того чтобы покрывать железо алюминием, можно было бы просто делать предметы из алюминия, преимущество которого заключается также в малом весе. К сожалению, алюминий дороже железа. Старый
Глава 19
192
Рис. 19-12. Один из способов защиты от коррозии железных предметов заключается в нанесении на их поверхность воздухонепроницаемого покрытия из краски или другого металла, например олова. Такое покрытие выполняет свою функцию до тех пор, пока оно совершенно не повреждено, но достаточно небольшой царапины, чтобы начался процесс коррозии. Цинковое покрытие создает дополнительную электрохимическую защиту от
коррозии, потому что железо имеет более высокий положительный восстановительный потенциал и в контакте с цинком сохраняет восстановленное состояние, в то время как цинк подвергается окислению. По той же причине магний способен защитить от коррозии железный трубопровод, корродируя вместо него. В описанных применениях цинк и магний приносят в жертву железу.
и более дешевый способ заключается в том, что железо оцинковывают. Табл. 19-1 показывает, что покрытие железа цинком основано на том же принципе, что и покрытие алюминием, хотя восстановительные потенциалы цинка и железа намного ближе друг к другу. Оцинкованное железное ведро не подвержено коррозии не потому, что цинк покрывает железо подобно слою краски, а потому, что цинк электрохимически предохраняет железо от окисления. Поцарапайте оцинкованное железное ведро и вы убедитесь, что оно все равно не будет ржаветь; в принципе железный предмет даже нет необходимости полностью покрывать цинком.
Совершенно иными свойствами обладают оловянные покрытия. Жесть, из которой изготовлены консервные банки, представляет собой железо, покрытое оловом. В табл. 19-1 восстановительных потенциалов олово расположено выше железа; следовательно, ионы Sn2 + обладают большей способностью восстанавливаться до металлического состояния, чем ионы Fe2 +. Это означает, что оловянное покрытие благоприятствует окислению железа, т. е. его ржавлению. Поэтому жестяная банка не подвержена ржавлению только до тех пор, пока вся поверхность олова остается неповрежденной. Поцарапайте жестяную банку, и она наверняка поржавеет. Оловянное покрытие играет роль лишь очень прочной и плотно прилегающей «идеальной» краски. Благодаря этому жестяные изделия не загрязняют навеки окружающую среду. Со временем жестяные банки саморазрушаются, но этого не происходит с алюминиевыми предметами.
Электрохимический способ используется и для предотвращения ржавления железных труб во влажной почве, а также стального корпуса кораблей в соленой воде. Магниевые блоки, зарытые в грунт вдоль железной
Окислительно-восстановительные равновесия
193
трубы на некотором расстоянии друг от друга и соединенные с трубой проволокой, превращают трубу в катод и предохраняют ее от ржавления. Сам магний при этом подвергается коррозии, но легче и дешевле заменять магниевые блоки, чем ремонтировать трубопровод (рис. 19-12). Блоки магния, прикрепленные к корпусу корабля, также предотвращают его ржавление в соленой морской воде. При таком способе защиты магний приносят в жертву, сохраняя более дорогостоящие железные предметы.
ЗАКЛЮЧЕНИЕ
Одни атомы или ионы притягивают электроны сильнее, чем другие. Когда электроны получают возможность перетекать от менее притягивающих их атомов или ионов к сильнее притягивающим их атомам или ионам, достигается более устойчивая ситуация и происходит выделение энергии. Если не принять специальных мер, эта энергия рассеивается в форме тепла, т. е. приводит к повышению беспорядка (энтропии). Но если удается физически разделить полуреакции, в одной из которых высвобождаются, а в другой поглощаются электроны, то поток электронов из одной области в другую можно использовать для выполнения электрической работы. На этом принципе основано действие всех гальванических элементов.
О веществе, которое теряет электроны, говорят, что оно окисляется, а электрод, на котором это происходит, называется анодом. Вещество, поглощающее электроны, восстанавливается на катоде. «Давление», которое создают электроны между анодом и катодом, называется напряжением гальванического элемента, или его электродвижущей силой (э.д.с.). Если напряжение элемента положительно, это означает, что происходящая в нем реакция протекает самопроизвольно, причем электроны поступают с анода на катод. Отрицательное напряжение элемента означает, что самопроизвольно протекает обратная реакция. Напряжение элемента связано со свободной энергией протекающей в нем реакции соотношением
А 6 = —
Полную реакцию, протекающую в гальваническом элементе, можно представить в виде двух полуреакций, которые соответствуют процессам на аноде и на катоде. Каждой из этих полуреакций можно приписать свой электродный потенциал; такой потенциал наблюдался бы, если бы данная полуреакция была скомбинирована с водородным электродом, т. е. с полуреакцией
2Н+ + 1е~ - Н2(г.)
(Это равнозначно определению напряжения водородной полуреакции как равного = 0,000... В.) Принято записывать все полуреакции как восстановительные процессы, так что соответствующие восстановительные потенциалы измеряют относительную способность к осуществлению каждой восстановительной реакции. (В некоторых старых книгах наряду с этим используются окислительные реакции и соответствующие окислительные по-
7-796
Глава /9
194
тенциалы. Окислительный потенциал равен по величине и обратен по знаку соответствующему восстановительному потенциалу.) Высокий положительный восстановительный потенциал указывает на большую склонность вещества к восстановлению, а низкий отрицательный восстановительный потенциал характеризует большую тенденцию к существованию вещества в окисленном состоянии. При вычитании одной полуреакции из другой, в результате чего получается уравнение полной реакции, протекающей в гальваническом элементе, соответствующие восстановительные потенциалы тоже вычитаются друг из друга. Хотя при такой процедуре одну электродную полуреакцию иногда приходится умножить на стехиометрический коэффициент, чтобы сбалансировать число электронов между окислительной и восстановительной полуреакциями, соответствующий восстановительный потенциал не следует умножать на этот коэффициент, так как восстановительные потенциалы играют роль «электронных давлений» и их значения всегда приводятся в расчете на один электрон. Стехиометрия учитывается числом и в соотношении
AG = — пФ 8
При 1 М концентрации всех ионных частиц и парциальном давлении всех газов 1 атм электрохимическая система находится в стандартном состоянии и ее э.д.с. обозначается символом 8° (аналогично стандартной свободной энергии AG°). Если не все реагенты и продукты имеют стандартные концентрации, то напряжение электрохимического элемента определяется уравнением Нернста
dt
<? = <r--^ine
которое представляет собой электрохимический аналог уравнения зависимости свободной энергии от концентрации, обсуждавшегося в гл. 16 и 17. Подобно тому как полное уравнение реакции, протекающей в гальваническом элементе, можно представить в виде двух полуреакций, уравнение Нернста можно записать отдельно для каждого электродного процесса.
Одним из примечательных свойств окислительно-восстановительных реакций, отличающих их от большинства других химических реакций, является присущий им широкий диапазон значений констант равновесий. Для двухэлектронной реакции напряжению элемента в 6 В соответствует константа равновесия = Ю200! Это означает, что вероятность достаточно близкого совпадения восстановительных потенциалов двух полуреакций, при котором константа равновесия полной реакции принимала бы не слишком большое значение, крайне низка. Большинство окислительно-восстановительных реакций протекают практически до полного завершения либо вообще не осуществляются. Однако электрохимические методы можно использовать для изучения равновесий, произведений растворимости и образования комплексных ионов даже в таких случаях, когда один или другой компонент равновесной системы присутствует в количествах, слишком малых для обнаружения обычными аналитическими методами.
Окислительно-восстановительные равновесия
195
Пользуясь законами электрохимии, можно конструировать и создавать гальванические элементы и батареи, позволяющие получать электрическую энергию в небольших количествах в нужном месте, а также использовать электрическую энергию для проведения желаемых химических реакций. Примерами таких процессов являются электроосаждение и рафинирование меди. Электрохимические реакции могут также использоваться в целях предотвращения коррозии металлов с низкими восстановительными потенциалами. Однако пока еще не удалось создать дешевой и легкой аккумуляторной батареи с большой плотностью энергии, а также электрохимических топливных элементов, работающих на широко доступных веществах.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. На каком из электродов, аноде или катоде, происходит окисление в любом электрохимическом элементе? На каком электроде происходит восстановление?
2. Каково происхождение движущей силы, создающей напряжение в концентрационном элементе?
3. Что произойдет, если заменить полупроницаемую перегородку в концентрационном элементе непроницаемой перегородкой? Что произойдет, если вообще устранить в нем перегородку?
4. Как связано напряжение концентрационного элемента с концентрациями веществ у его электродов?
5. Как устроен элемент Даниэля и чем объясняется создаваемое им электрическое напряжение? Почему этот элемент нельзя использовать для питания фотовспышки или электроавтомобиля?
6. Почему сухой элемент более пригоден для питания фотовспышки и электроавтомобиля, чем элемент Даниэля? Какие химические реакции протекают в сухом элементе? Какая из этих реакций приводит к образованию электронов, а какая к их поглощению? Какая реакция происходит на аноде, а какая-на катоде?
7. Каким образом напряжение гальванического элемента связано со свободной энергией протекающей в нем реакции? Что называется стандартным потенциалом?
8. Аддитивны ли свободные энергии электродных полуреакций? Всегда ли аддитивны потенциалы электродных полуреакций? Укажите условия, при которых свободные энергии и потенциалы электродных полуреакций должны быть аддитивны, а также условия, при которых они не аддитивны.
,9. Указывает ли высокий положительный восстановительный потенциал электродной полуреакции на сильную способность данной окислительно-восстановительной реакции восстанавливать другие вещества?
10. Как вычислить напряжение гальванического элемента, если известны протекающие в нем электродные полуреакции и их потенциалы? Что
Глава 19
196
можно сказать о реакции, протекающей в гальваническом элементе, если вычисленное по потенциалам полуреакций напряжение этого элемента оказывается положительным?
11. Если скомбинировать две указанные в табл. 19-1 электродные полуреакции марганца со стандартными восстановительными потенциалами + 1,68 В и +1,21 В, то получится третья полуреакция с потенциалом + 1,49 В. Объясните, почему восстановительный потенциал этой третьей реакции не равен сумме потенциалов двух первых полуреакций, т.е. не равен +1,68 В + 1,21 В = +2,89 В. Объясните, каким образом наблюдаемое значение + 1,49 В получается из табличных значений потенциалов двух первых реакций?
12. Что представляет собой уравнение Нернста и как оно связывает напряжение гальванического элемента с концентрациями?
13. Почему для концентрационного элемента первый член уравнения Нернста равен нулю?
14. Почему концентрационные элементы с одинаковыми отношениями концентраций всегда имеют одинаковое напряжение независимо от того, какие химические вещества принимают участие в реакции?
15. Каким образом на основании измерения потенциала окислительно-восстановительного процесса можно судить о растворимости вещества, которое присутствует в растворе в столь малых количествах, что его трудно установить обычными аналитическими методами?
16. Каким образом слой краски предохраняет железо от коррозии? Как слой цинка защищает железо от коррозии? Как защищает от коррозии слой металлического олова? Почему нет нужды защищать от коррозии алюминиевые предметы? Что имеется в виду, когда говорят, что для предотвращения коррозии одного металла ему приносят в жертву другой металл?
ЗАДАЧИ
Данные, необходимые для решения помещенных здесь задач, можно найти в табл. 19-1 и 19-2 либо в каких-нибудь физико-химических справочниках.
Концентрационные элементы
1. Стандартная электродная полу реакция С12 | С1“ скомбинирована с полуреакцией С12(1,00 атм) | С1~ (0,010 М). Чему равно напряжение полученного гальванического элемента? Определите AG298 для протекающей в нем реакции.
2. Гальванический элемент
Ag | Ag + (0,10 М) || Ag+ (1,0 М) 1 Ag
представляет собой концентрационный элемент, способный выполнять электрическую работу, а) Какое напряжение создает этот элемент? б) С какой стороны элемента находится катод и с какой-анод? в) Вы
Окислительно-восстановительные равновесия
197
числите AG (в джоулях) для самопроизвольной реакции, протекающей в этом элементе.
3. Два медных электрода помещены в два раствора сульфата меди одинаковой концентрации и соединены так, чтобы получился концентрационный элемент. Каково напряжение этого элемента? Один из растворов разбавляют до тех пор, пока концентрация ионов меди не уменьшится до 1/5 первоначального значения. Каким станет напряжение элемента после разбавления?
4. Рассмотрим «вечный двигатель», построенный при помощи концентрационного элемента, а) Два медных электрода погружены в растворы сульфата меди одинаковой концентрации и соединены так, чтобы получился концентрационный элемент. Первоначально этот элемент не имеет напряжения. Допустим, что каждый электрод содержит больше меди, чем ее имеется в каждом растворю, б) Раствор А разбавляют до тех пор, пока концентрация ионов Си2 + в нем не уменьшится вдвое; в результате концентрационный элемент приобретает напряжение S. Действующий элемент выполняет полезную работу над своим окружением до тех пор, пока не уравняются концентрации двух растворов и напряжение элемента снова не упадет до нуля, в) Раствор Б разбавляют до тех пор, пока концентрация ионов Си2 + в нем не уменьшится вдвое; в результате концентрационный элемент снова создает такое же напряжение в, как и прежде, но с противоположным знаком. Элемент снова приводится в действие и выполняет полезную работу до выравнивания концентраций растворов А и Б. г) Стадии (б) и (в) поочередно повторяются; сначала один раствор, а потом другой поочередно разбавляются вдвое, после того как на предыдущей стадии происходит выравнивание концентраций ионов Си2 +. Поскольку концентрации растворов после разбавления вдвое никогда не достигают нулевого значения, описанный процесс можно продолжать до бесконечности и таким образом бесконечно получать полезную работу от концентрационного элемента. Более того, действующий элемент облегчает нашу задачу, так как он повышает концентрацию только что разбавленного раствора. Укажите, что неправильно в этой цепи рассуждений.
Работа и свободная энергия
5. Определите полезную работу, выполняемую при реакции 1 моля цинковой пудры с 1,00 М раствором Cu(NO3)2 в калориметре при постоянной температуре. Какая полезная работа может быть получена от этой реакции, если бы она проводилась обратимым путем? Стандартная энтальпия, ДН298, данной реакции-215 кДж. Вычислите, какое количество теплоты высвобождается при обратимом осуществлении этой реакции.
Способность реакции к самопроизвольному протеканию
6. Полагая, что активности всех веществ, участвующих в нижеследующих реакциях, имеют единичные значения, укажите, какие из этих реакций
Глава 19
198
способны протекать самопроизвольно:
a) Zn + Mg2 + -» Zn2 + + Mg
б) Fe + Cl2 -> Fe2 + + 2С1 “
в) 4Ag + О2 + 4Н+ -> 4Ag+ + 2Н2О
г) 2AgCl -» 2Ag + Cl2
Потенциалы электродных полуреакций
7. Вычислите потенциалы (напряжения) следующих гальванических элементов или электродов:
a) S° для элемента
Zn(TB.) | Zn2 + || Си2 + | Си(тв.)
б) S для электрода
Zn(TB.) | Zn2+ (0,0010 М)
в) ё для электрода
Си2 + (IO’36 М) | Си(тв.)
8. Найдите стандартные потенциалы, ё°, для следующих электродов: a) S2" | CuS(tb.) | Си(тв.)
б) NH3 (водн.), Zn(NH 3)2 + | Zn(TB.)
Напряжение гальванического элемента и направление электронного тока
9. Рассмотрим гальванический элемент
Ag(TB.) | Ag+ (1,0 М) (I Си2 + (1,0 М) | Си(тв.)
а) Запишите уравнение химической реакции, протекающей в этом элементе. В каком направлении самопроизвольно протекает эта реакция?
б) Каково стандартное напряжение ё° данного элемента?
в) Перемещаются ли электроны во внешней цепи данного элемента от Ag к Си или в обратном направлении?
10. Рассмотрим следующий элемент:
Ni | Ni2+ (0,010 М) || Sn2 + (1,0 М) | Sn
а) Предскажите направление самопроизвольного протекания реакции в этом элементе, б) Какой металл, Ni или Sn, играет в нем роль катода, а какой-роль анода? в) Каково стандартное напряжение, ё°, элемента?
г) Какое напряжение, ё. должен иметь данный элемент при указанных выше концентрациях и температуре 25°С?
11. Рассмотрим гальванический элемент
Sn | SnCl2(0,10 М) || AgCl(TB.) | Ag
Окислительно-восстановительные равновесия
199
а) Будут ли электроны самопроизвольно перемещаться во внешней цепи от Sn к Ag или в обратном направлении? б) Чему равно стандартное напряжение, <?°, этого элемента? в) Каким должно быть напряжение, <f, этого элемента при 25°С?
12. Используя сокращенное обозначение, применявшееся в предыдущих задачах, укажите состав гальванического элемента, в котором протекают следующие электродные полуреакции:
РЬО2 + 4Н+ + 2е~ - РЬ2+ + 2Н2О
PbSO4 + 2е ' -» Pb + SO2
а) Какая из этих полуреакций протекает на катоде гальванического элемента? В каком направлении протекают электроны во внешней цепи элемента?
б) Каково стандартное напряжение, S°, данного элемента?
Выбор нулевой точки отсчета электродных потенциалов
13. Известно, что две приведенные ниже реакции имеют следующие стандартные потенциалы, <?°:
2Ag + Pt2 + - 2Ag+ + Pt g° = +0,40 В
2Ag + F2 -> 2Ag+ + 2F" = + 2,07 В
Допустим, что потенциал реакции Pt -» Pt2 + + 2е ~ условно принят равным нулю. Вычислите в этом предположении потенциалы следующих электродных полуреакций: a) Ag -> Ag+ + е' б) F' - |F2 + е~
Конкурирующие реакции
14. Пользуясь табл. 19-1, найдите недостающие стандартные восстановительные потенциалы следующих электродных полуреакций:
Полуреакция g°, В
МпО4 + 8Н+ + 5е" -► Мп2+ + 4Н2О + 1,49
Аи3 + + Зе* -► Ап(тв.) + 1,42
С12 + 2е* -> 2СГ ?
Айа; + Зе- -» Аи(тв.) + 4С1* ?
4Н + + NO3 + Зе —> NO + 2Н2О 7
Допустим, что все реагенты и продукты имеют единичную активность, а) Какое из веществ, участвующих в приведенных здесь полуреакциях, является наилучшим окислителем? Какое вещество является наилучшим восстановителем? б) Будет ли перманганат-ион окислять металлическое золото? в) Будет ли металлическое золото восстанавливать азотную кислоту? г) Будет ли азотная кислота окислять металлическое
Глава /9
200
золото в присутствии ионов С1 “ ? д) Будет ли металлическое золото восстанавливать чистый газообразный С12 в присутствии воды? е) Будет ли хлор окислять металлическое золото в присутствии ионов С1 “ ? ж) Будет ли перманганат-ион окислять хлорид-ион?
Окислительно-восстановительные реакции и их К^ли
15. Пользуясь данными табл. 19-1 и 19-2, укажите, будет ли Fe восстанавливать Fe3 + в Fe2 + (допустим, что все вещества имеют единичные активности)? б) Вычислите константу равновесия Кравн для следующей реакции при 25^С:
Fe + 2Fe3 + -> 3Fe2 +
16. Найдите стандартные восстановительные потенциалы для следующих полуреакций:
SOJ" + 4Н+ + 2е~ -> H2SO3 + Н2О Ag + е~ -> Ag
а) Составьте сбалансированное уравнение полной реакции, которая протекает в действующем гальваническом элементе, скомбинированном из двух указанных электродов, б) Приведите сокращенное обозначение этого гальванического элемента, в) Каково стандартное напряжение, данного элемента? г) Чему равна константа равновесия реакции, протекающей в данном элементе, при 25°С? д) Найдите отношение активностей продуктов и реагентов, Q, при котором напряжение элемента равно 0,51 В.
Потенциалы электродных реакций и напряжения гальванических элементов
17. Найдите стандартные восстановительные потенциалы следующих полуреакций :
МпО4 + 8Н+ + 5е~ -► Мп2 + + 4Н2О
А13+ + Зе~ -> А1
С12 + 2е~ -> 2С1“
Mg2 + + 2е' -> Mg
а) Какое из указанных здесь веществ является наиболее сильным восстановителем? Какое из них является наиболее сильным окислителем? б) Запишите уравнение полной реакции для действующего гальванического элемента, в котором электродами являются Mg и С12. Приведите сокращенное обозначение данного элемента, г) Какой из электродов этого элемента играет в нем роль анода, а какой-катода 9 д) Каково стандартное напряжение, данного элемента? е) Какой вид имеет выражение для константы равновесия реакции, протекающей в данном гальваническом элементе? Вычислите значение константы равновесия при 25°С.
Окислительно-восстановительные равновесия 201
18. Найдите стандартные восстановительные потенциалы следующих полуреакций:
Hg2 + + 2е~ -> 2Hg
Си2 + + 2е ~ -» Си
а) Запишите уравнение полной реакции, протекающей в действующем гальваническом элементе, где скомбинированы две указанные выше полуреакции, б) Приведите сокращенное обозначение этого элемента. Какое вещество, Hg или Си, играет в нем роль анода? в) Чему равно стандартное напряжение, <f°, данного элемента? г) Чему равна константа равновесия реакции, протекающей в данном элементе? д) Каково напряжение данного элемента при [Hg| + ] = 0,10 моль-л-1 и [Си2 + ] = 0,010 моль • л - 1 ?
Принцип Ле Шателье
19. Как скажется на напряжении электрохимического элемента, в котором протекает самопроизвольная реакция
3Cu2+ + 2А1 -> 2А13 + + ЗСи
добавление этилендиамина-лиганда, который сильно связывается с ионами Си2 +, но не с ионами А13 + ?
20. Цинк-медная батарея собрана при стандартных условиях, так что все входящие в нее вещества имеют единичные активности. Исходное напряжение этой батареи равно 1,10 В. По мере использования батареи концентрация ионов меди постепенно понижается, а концентрация ионов цинка повышается. Основываясь на принципе Ле Шателье, предскажите, будет ли повышаться или понижаться напряжение батареи. Каково отношение Q концентраций ионов цинка и меди при напряжении батареи 1,00 В?
Уравнение Нернста
21. Гальванический элемент собран из медного стержня, погруженного в 2,0 М раствор CuSO4, и железного стержня, погруженного в 0,10 М раствор FeSO4. Пользуясь уравнением Нернста и значениями стандартных восстановительных потенциалов электродных полуреакций
Fe2 + + 2е~ -> Fe
Си2 + + 2е- -» Си
вычислите напряжение описанного элемента.
22. Какое напряжение дает гальванический элемент, состоящий из железного стержня, погруженного в 1,00 М раствор FeSO4, и марганцевого стержня, погруженного в 0,10 М раствор MnSO4?
Глава /9
202
Концентрация и напряжение электрохимического элемента
23. Рассмотрим гальванический элемент ‘
Zn | Zn2 + (0,0010 М) || Си2 + (0,0010 М) | Си
который имеет стандартное напряжение S° = + 1,10 В. Повысится, понизится или останется прежним напряжение, 8, этого элемента в результате следующих изменений? а) В катодное отделение добавляют 1,0 моль-л-1 аммиака, б) В анодное отделение добавляют 1,0 моль л'1 аммиака, в) В катодное и анодное отделения одновременно добавляют 1,0 моль-л- 1 аммиака, г) Через раствор, содержащий ионы Zn2 + , пропускают газообразный Н2. д) Через раствор, содержащий ионы Zn2 +, пропускают газообразный Н2 и одновременно в другой раствор добавляют 1,0 моль-л-1 аммиака.
24. Рассмотрим гальванический элемент
Zn | Zn2+ || Cu2+ | Си
Вычислите отношение концентраций ионов цинка и меди [Zn2+]/ /[Cu2 + ], когда напряжение данного элемента понижается до 1,05, 1,00 и 0,90 В. Обратите внимание на то, что небольшое падение напряжения соответствует большому изменению концентраций элемента. Следовательно, цинк-медная батарея, дающая напряжение 1,00 В, должна быть уже значительно «выработанной».
Конкурирующие реакции
25. Покажите, что перекись водорода термодинамически неустойчива и должна разлагаться на воду и кислород.
Напряжение гальванического элемента и pH
26. Серебряный электрод погружен в 1,00 М раствор AgNO3. Этот электрод соединен с водородным электродом, в котором давление водорода равно 1,00 атм, а концентрация ионов Н + неизвестна. Напряжение полученного элемента равно 0,78 В. Вычислите pH раствора, в котором находится водородный электрод.
Произведение растворимости
27. Основываясь на рассмотрении полуреакций, покажите, что ионы Ag + и I- самопроизвольно образуют AgI(TB.), если их смешать при единичных исходных активностях. Покажите, что ПР для Agl равно 10“ 1в.
28. Стандартный водородный электрод соединен со стандартным серебряным электродом. В отделение с серебряным электродом добавлен бромид натрия, что вызвало осаждение AgBr, которое прекратилось, когда концентрация ионов Вг ~ достигла 1,00 моль л - 1. В этот момент напряжение гальванического элемента было равно 0,072 В. Вычислите ПР для бромида серебра.
Окислительно-восстановительные равновесия
203
Коррозия
29. Хромированная деталь автомобиля состоит из железа, покрытого тонким слоем никеля, который в свою очередь покрыт слоем хрома. Расположите эти металлы в ряд по легкости окисления. Для чего нужен слой хромового покрытия? Какую роль играет никелевое покрытие?
ЛИТЕРАТУРА
1. Bard A. J., Chemical Equilibrium, Harper and Row, New York, 1966.
2. Hepler L., Electrochemistry, in: Chemical Principles, Chapter 16, Blaisdell, N.Y., 1964.
3. Latimer W. M., Oxidation Potentials, 2nd ed., Prentice-Hall, Englewood Cliffs, N. J., 1952.
4. VanderWerf C. A., Oxidation-Reduction, Van Nostrand Reinhold, N.Y., 1961.
ГЛАВА
20
Координационная химия
Первая попытка обобщения редко приносит успех; рассуждения предвосхищают опыт потому, что результаты наблюдений накапливаются слишком медленно.
Берцелиус (1830)
Важнейшие понятия
20-1. Комплексы переходных металлов. Лиганды. Геометрические изомеры. Октаэдрическая структура, плоская квадратная структура и тетраэдрическая структура. Парамагнетизм и диамагнетизм. Лабильность и инертность. Взаимосвязь степени окисления центрального атома и структуры комплекса. Влияние числа d-электронов металла на структуру комплекса. Перенос заряда.
20-2. Номенклатура координационных соединений. Монодентатные и би-дентатные лиганды. Хелатообразующие агенты и хелаты. Структурные и геометрические изомеры. Оптические изомеры, или энантиомеры. Асимметрические, или хиральные, центры.
20-3. Химическая связь в координационных комплексах. Электростатическая теория. Теория валентных связей. Гибридные d2sp3- и sp1 «^-орбитали. Внутриорбитальные и внешнеорбитальные комплексы. Теория кристаллического поля. Энергия расщепления кристаллическим полем. Низкоспиновые комплексы и высокоспиновые комплексы. Сильные и слабые лиганды. Теория молекулярных орбиталей. л-Взаимодействие между лигандами и металлом. Дативное л-взаимо-действие между металлом и лигандами.
20-4. Тетраэдрическая и плоско-квадратная координация. Энергетические уровни комплексов в приближении кристаллического поля.
20-5. Равновесия с участием комплексных ионов. Константы образования. Хелатный эффект.
Координационная химия
205
Многие соединения платины, кобальта и других переходных металлов имеют необычные эмпирические формулы и часто ярко окрашены. Они называются координационными соединениями. Их главным отличительным признаком является наличие двух, четырех, пяти, шести, а иногда большего числа химических групп, расположенных геометрически правильно вокруг иона металла. Такими группами могут быть нейтральные молекулы, катионы или анионы. Каждая группа может представлять собой независимую структурную единицу, но нередки и такие случаи, когда все группы связаны в одну длинную, гибкую молекулу, свернувшуюся вокруг атома металла. Координированные группы существенно изменяют химические свойства металла. Окраска таких соединений позволяет судить об их электронных энергетических уровнях.
Например, для всех растений жизненно важное значение имеет зеленый координационный комплекс магния, известный под названием хлорофилла. Комбинация магния и координированных вокруг него групп придает хлорофиллу электронные свойства, которыми не обладает данный металл или его ион; в частности, хлорофилл способен поглощать видимый свет и использовать его энергию для химического синтеза. Все организмы, которые дышат кислородом, нуждаются в цитохромах, координационных соединениях железа, которые играют важную роль в процессах расщепления и сгорания пищи, а также в накоплении высвобождающейся при этом энергии. Более сложные организмы нуждаются в гемоглобине-еще одном комплексе железа; благодаря координированным к железу группам гемоглобин связывает молекулы кислорода, не окисляясь при этом. Многие области биохимии на самом деле представляют собой не что иное, как прикладную химию координационных соединений переходных металлов. В данной главе мы познакомимся со строением и свойствами некоторых координационных соединений.
20-1. СВОЙСТВА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ПЕРЕХОДНЫХ МЕТАЛЛОВ
Переходные металлы часто входят в ярко окрашенные соединения со сложными формулами. Хотя PtCl4 существует как простое соединение, известны другие соединения, в которых PtCl4 связан с двумя-шестью молекулами NH3 или с КО (табл. 20-1). По какой же причине подобные нейтральные и на первый взгляд способные существовать изолированно соединения ассоциируют с другими молекулами и почему они входят в образующиеся новые соединения в различных пропорциях? Измерение электропроводности растворов этих соединений, а также осаждение ионов С1 “ ионами Ag + показывают, сколько ионов присутствует в водном растворе. Данные, полученные этими и другими способами, заставляют предположить, что обсуждаемые соединения обладают ионными структурами, перечисленными в последней колонке табл. 20-1. Указанные там вещества, содержащие аммиак, представляют собой координационные соединения, в которых молекулы NH3 располагаются вокруг центрального иона Pt. Комплексы Pt(IV) содержат октаэдрически координированные молекулы
206
Таблица 20-1
Комплексные соединения платины, число и состав образуемых ими ионов
Комплексное соединение Молярная Числа ионоа проводимость, Cl”, осаждае- Ом-1 мых при ПОМО- ЩИ Ag^ Полное число ионов Образуемые ионы
PtCl4 6NH3 523 4 5 Pt(NH3)e + , 4СГ
PtCl4 5NH3 404 3 4 Pt(NH3)sCl3 + , ЗСГ
PtCl4 4NH3 229 2 3 Pt(NH3)4Cli + , 2СГ
PtCl4 3NH3 97 1 2 Pt(NH3)3Cl3, СГ
PtCl4-2NH3 0 0 0 Pt(NH3)2Cl4
PtCl4 NH3 K.C1 109 0 2 К+, Pt(NH3)Cls
PtCl4-2KCl 256 0 3 2К+, PtClg"
NH3. В отличие от этого комплексы Pt (II) обладают плоско-квадратной структурой с координационным числом 4. Комплексы металлов с координационным числом 4 могут быть также тетраэдрическими.
Окраска
Окраска является отличительным свойством координационных соединений переходных металлов. Октаэдрические комплексы кобальта могут иметь самую различную окраску в зависимости от того, какие группы координированы вокруг атома этого металла (табл. 20-2). Такие координирующиеся группы называются лигандами. В растворах окраска обусловлена ассоциацией молекул растворителя, выступающих в роли лигандов, с металлом, а не свойствами самого катиона металла. В концентрированной серной кислоте (сильный обезвоживающий агент) ионы Си2 + бесцветны; в воде они имеют аквамариновую окраску, а в жидком аммиаке — темную ультрамариновую. Комплексы металлов с высокими степенями окисления обладают яркой окраской, если они поглощают энергию в видимой части спектра: СгО4“-ярко-желтой, а МпО4-ярко-пурпурной.
В тех случаях, когда определенная энергия, Е, электромагнитного излучения в видимой части спектра поглощается соединением в процессе возбуждения электрона на более высокий квантовый уровень, длина волны, X, поглощаемого света может быть вычислена при помощи соотношения
Е = hv = hcv = he/к
где h - постоянная Планка, v-частота, v-волновое число и с-скорость света. Если энергия задана, как это часто делается, в волновых числах, то длина волны представляет собой просто обратную ей величину: X = 1/v. Видимая окраска соединения соответствует дополнительному цвету по отношению к цвету поглощаемых лучей; дополнительный цвет остается в сплош-
Таблица 20-2
Октаэдрические комплексы Со (III), их окраска и энергия электронного перехода
Комплекс а Окраска Спектральная область поглощаемого света Приблизительная длина волны поглощаемого света, нм Приблизительная энергия6 перехода, см-1
Co(NH3)3 + Желтая Синяя 430 23 200
Co(NH3)5NCS2 + Оранжевая Голубая 470 21 200
Co(NH3)5H2O3 + Красная Зелено-голубая 500 20000
цис-Со (en)2 (Н2О)2 + Красная Зелено-голубая 500 20000
Co(NH3)sOH2 + Розовая Зелено-голубая 500 20000
CO(NH3)sCO3 Розовая Зелено-голубая 500 20000
Co(NH3)5C12 + Пурпурная Зеленая 530 18900
Co(EDTA)’ Фиолетовая Желтая 560 17 800
t/uc-Co(NH3)4Cl2 Фиолетовая Желтая 560 17800
транс-Со (en)2 Br(NCS)' Голубая Оранжевая 610 16400
транс-Со (NH3)4 Cl2 Зеленая Красная 680 14700
транс-Со (en)2 Br2 Зеленая Красная >680 <14700
a (en)-этилендиамин, NHjCHjCHjNHj; EDTA - этилендиаминтетраацетат.
° Измерена в волновых числах.
Глава 20
208
ном спектре после того, как из него удален какой-либо спектральный цвет. Поглощаемые и дополнительные к ним цвета перечислены в табл. 20-3. Если поглощаемая энергия настолько мала, что она соответствует длинам волн в инфракрасной части спектра, или, наоборот, так велика, что соответствует ультрафиолетовой части спектра (последнее типично для координационных соединений непереходных элементов), то соединение кажется бесцветным или белым. У соединений переходных металлов наблюдаются интересные свойства при поглощении излучения в видимой части спектра. Нередко удается выяснить некоторые закономерности химического поведения этих соединений, судя только по их видимой окраске.
Таблица 20-3
Окраска соедпнеинй, спектральная область н длина волны поглощаемого ими света н соответствующая разность энергий между электронными уровнями
Окраска соединения Спектральная область поглощаемого света Приблизительная длина волны поглощаемого света, нм Разность энергий3 между электронными уровнями, см~1
Бесцветная Ультрафиолетовая <400 >25000
Лимонно-жел-
тая Фиолетовая 410 24400
Желтая Синяя 430 23 200
Оранжевая Голубая 480 20800
Красная Зелено-голубая 500 20000
Пурпурная Зеленая 530 18900
Фиолетовая Лимонно-желтая 560 17900
Синяя Желтая 580 17 300
Г олубая Оранжевая 610 16400
Зелено-голубая Красная 680 14700
Зеленая Пурпурно-красная 720 13900
Бесцветная Инфракрасная >720 13900
а Измерена i в волновых числах.
Окраска комплексных соединений переходных металлов объясняет известный фокус с письмом невидимыми чернилами, приготовленными из СоС12. Если написать что-либо на бумаге бледно-розовым раствором СоС12, текст остается практически неразличимым. Но если затем осторожно нагреть над пламенем свечи бумагу, на ней появляется ярко-синяя надпись. После охлаждения надпись постепенно исчезает. Розовая окраска принадлежит октаэдрически гидратированному иону кобальта, Со(Н2О)^ + . Нагревание удаляет из него воду и оставляет синий хлоридный комплекс с тетраэдрической геометрией. Безводное соединение гигроскопично; это
Координационная химия
209
означает, что оно поглощает воду из атмосферного воздуха и тогда снова превращается в бледно-розовый гидрат.
Геометрические изомеры
Соединение с эмпирической формулой CoCl3-4NH3 может быть зеленым либо фиолетовым. Этот факт убедительно доказывает, что координация в данном соединении октаэдрическая. Как зеленый, так и фиоле
Рис. 20-1. Расположение шести групп, координированных вокруг кобальта в Co(NH3)4C12> тремя симметричными способами: в виде плоского шестиугольника (а), в виде трехгранной призмы (б) и в виде октаэдра (в). Для шестиугольника и трехгранной призмы
возможны по три различных размещения координированных групп, или по три изомера, а для октаэдра - только два. Комплекс Co(NH3)4C12 и почти все другие шестикоординированные комплексы имеют октаэдрическую структуру.
Глава 20
210
товый комплексы CoCl3-4NH3 диссоциируют с образованием только одного иона С1“ на молекулу, откуда следует, что его катион должен иметь формулу Co(NH3)4C12 + с координационным числом 6. Относительно расположения в этом комплексе шести лигандов можно сделать три предположения: плоское шестичленное кольцо, тригональная призма или октаэдр. Каждой из этих структур соответствуют несколько способов размещения двух ионов О" в шести координационных положениях. Структуры, отличающиеся только расположением одних и тех же лигандов вокруг центрального атома металла, называются геометрическими изомерами. Как показывает рис. 20-1, существование всего лишь двух геометрических изомеров комплексного иона Co(NH3)4C12 + является убедительным доказательством его октаэдрической структуры. Октаэдрическая структура с координационным числом 6-наиболее распространенная у подобных соединений переходных металлов.
Нередко встречаются также комплексы с координационным числом 4. При этом возможны две структуры комплексов-тетраэдрическая и плоско-квадратная. Различие между ними и в этом случае может быть установлено на основании подсчета числа различных форм соединения с одинаковой эмпирической формулой. Соединение с формулой PtCl2-2NH3, или Pt(NH3)2Cl2, встречается в двух формах, которые предположительно являются геометрическими изомерами. Оба изомера обладают кремовобелой окраской, но различаются по растворимости и химическим свойствам. Как ясно из рис. 20-2, при тетраэдрической структуре у комплекса не могло быть никаких изомеров, тогда как плоско-квадратная структура допускает существование' двух изомеров. Следовательно, соединение Pt(NH3)2Cl2 должно иметь плоско-квадратную структуру. (Для сравнения укажем, что сопоставимое соединение СН2С12 существует всего в одной форме.)
Плоско-квадратная структура характерна для комплексов Pd(II), Pt(II) и Au (III), в которых катионы имеют восемь d-электронов, или конфигурацию d8 (табл. 20-4). Тетраэдрическая координация чаще всего встречается в соединениях переходных металлов с координированными группами О2", как, например, в СгО4" или МпО4 ". В настоящее время координационную структуру определяют путем прямых рентгеноструктурных исследований, которые подтверждают выводы относительно геометрических изомеров, сделанные на основании других экспериментов.
Магнитные свойства
Некоторые комплексы переходных металлов обнаруживают диамагнитные свойства, что свидетельствует об отсутствии в них неспаренных электронов. Многие другие комплексы парамагнитны и обладают одним или несколькими неспаренными электронами. Например, комплекс Co(NH3)e+ диамагнитен, тогда как CoF^- парамагнитен и имеет четыре неспаренных электрона на каждый ион. Ионный заряд комплекса не
Рис. 20-2. Два изомера (а), возможные для нейтральной молекулы Pt(NH3)2Cl2 при плоско-квадратной координации. В случае тетраэдрической координации возможен только один изомер (б). Существование двух изомеров у Pt(NH3)2Cl2 исключает возможность тетраэдрической структуры. (Почему это доказательство более убедительно, чем в случае, иллюстрируемом рис. 20-1 ?)
Глава 24 212
Конфигурации3 валентных электронов у переходных i Таблица 20-4 металлов
Конфигурация dls2 d2s2 d3s2 d*s2 dss2 d6s2 d2s2 d*s2 d9S2 d10s2
Элементы Sc Ti V Cr Mn Fe Co Ni Cu Zn
Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
La Hf Ta W Re Os Ir Pt Au Hg
Число валентных
электронов
у нейтрального
атома М 3 4 5 6 7 8 9 10 11 12
у иона M2r (d-
электроны) 1 2 3 4 5 6 7 8 9 10
у иона М3+ (d-
электроны) 0 12 3 4 5 6 7 8 9
а Все конфигурации приведены в виде dns2, поскольку нас интересует в данном случае
только число электронов у иона, а не электронная конфигурация нейтрального атома.
является тем фактором, который определяет число неспаренных электронов, поскольку комплекс Fe(H2O)s+, у которого четыре неспаренных электрона, парамагнитен, a Fe(CN)£- - диамагнитен. Магнитные свойства некоторых других октаэдрических комплексов указаны на рис. 20-3. Одна из наших задач заключается в объяснении магнитных свойств комплексных соединений на основе рассмотрения их электронного строения.
Лабильность и инертность
Координационный комплекс, который быстро замещает свои лиганды на другие, называется лабильным; комплекс, медленно замещающий лиганды, называется инертным. Инертность вовсе не то же самое, что устойчивость в термодинамическом смысле. Комплекс может быть неустойчивым в том смысле, что, согласно законам термодинамики, обсуждавшимся в гл. 16, он представляет собой не максимально благоприятное образование. За достаточно большое время такой комплекс перейдет в какое-то другое состояние. Однако если переход в наиболее благоприятное состояние происходит чрезвычайно медленно, неустойчивый комплекс является инертным. В качестве примера инертной, но неустойчивой системы укажем, что Н2 и О2 могут просуществовать в виде смеси целые годы без заметного самопроизвольного образования воды. Однако если в эту смесь внести небольшое количество платиновой черни (тонко измельченной платины), играющей роль катализатора, либо поднести к ней пла-
Гексамминка^альт(Ш) Окраска: желтая Диамагнитный
ГексафшоромангинатСл)
Окраска: розовая
Парамагнитный (5 неспаренных электронов)
8
ОС-------Сг-----СО
Гексааквоникель(11)
Окраска:зеленая
Парамагнитный ( 2 неспаренных электрона)
о
Гексакарбонилхром(О) Окраска: белая Диамагнитный
N 3-
NC-------Fe-----CN
' Гексацианоферрат(Ш), или феррииианий С Окраска.- красная
N Парамагнитный (1 неспаренный электрон)
Рис. 20-3. Примеры октаэдрических комплексов с номенклатурными назва-
ниями, указанием окраски и магнитных свойств.
Глава 20 214
мя, то реакция образования более устойчивого вещества, Н2О, окажется внезапной, полной и бурной. Смесь Н2 и О2 сама по себе неустойчива, но инертна.
Возвращаясь к координационным соединениям, заметим, что соединение Cu(NH3)4SO4 растворяется в воде, a Cu(NH3)4 + реагирует с разбавленной кислотой с образованием NH4+ и Си(Н2О)^ + , как только будут смешаны эти растворы. В отличие от этого Co(NH3)6Cl3 можно нагревать в концентрированной серной кислоте, в. результате чего выделяется газообразный НС1 и образуется комплекс [Co(NH3)g + ]2(SO4")3 и при этом связи между Со и NH3 не разрываются. Комплекс меди является лабильным, а комплекс кобальта-инертным. Трехзарядные катионы металлов с шестью <У-элек гронами образуют особенно инертные комплексы; эти комплексы также чрезвычайно устойчивы в термодинамическом смысле.
Степень окисления и структура комплекса
Для ионов со степенью окисления + 2 и +3 оптимальным является координационное число 6; к таким комплексам относится множество соединений переходных металлов. Степень окисления + 1 оказывается слишком низкой, чтобы при построении комплексного иона обеспечить притяжение шести электронодонорных групп. Большинство комплексов, в которые входят ионы со степенью окисления + 1, имеют меньшие координационные числа, например у Ag+ и Cu+ в комплексах Ag(NH3)2 + и СпС12 ” координационное число 2. В некоторых случаях ионы со степенью окисления + 1 все же образуют устойчивые комплексы с довольно высокими координационными числами. Но в большинстве таких соединений, как, например, у комплексов Mn(CN)g- и Мо(СО)6, лиганды обладают особой способностью к л-связыванию, превосходящей обычные электронодонорные свойства.
Комплексы с центральным ионом, обладающим степенью окисления выше + 3, довольно редки. Обычно они встречаются только с такими лигандами, как О2 ” и Г. По мере повышения степени окисления центрального иона следует ожидать повышения прочности связи в комплексе. Однако при слишком высокой степени окисления центральный ион настолько сильно притягивает электроны лигандов, что они полностью отрываются от лигандов. В результате комплекс оказывается неустойчивым, а металл восстанавливается, переходя в более низкое состояние окисления. По этой причине Fe3 + не образует комплексов с I ~ ; вместо этого он окисляет ион 1“ в 12. Поскольку О и F-сильно электроотрицательные элементы, а ионы О2 “ и F “, связанные с центральным ионом металла, очень трудно поддаются окислению, они могут существовать в комплексах, где центральный ион имеет более высокую степень окисления, чем обычная степень окисления + 2 или + 3.
Координационная химия
215
Влияние на свойства комплексов числа d-электронов металла
Многое в координационной химии становится понятным на основании рассмотрения числа d-электронов у центрального иона металла. Как уже упоминалось, наиболее распространенными степенями окисления ионов металла в координационных комплексах являются + 2 и + 3. В табл. 20-4 указано число d-электронов у нейтральных атомов различных металлов и их катионов с зарядами + 2 и + 3; к этой таблице нам придется часто обращаться. Помимо отмеченной выше предпочтительности степеней окисления + 2 и + 3 особой устойчивостью обладают также ионы с конфигурациями d°, d5 и d10.
Электронная конфигурация благородных газов, d°. Электронная конфигурация благородных газов, для которой характерно отсутствие d-электро-нов, обладает особой устойчивостью. Такую конфигурацию имеет ион Sc3 + , а также Ti(IV) в TiF^-. По мере перемещения слева направо вдоль периода способность приобретать конфигурацию d° у ионов переходных металлов последовательно убывает, поскольку в результате должно происходить повышение заряда центрального иона металла. Стабилизация возникающих состояний окисления оказывается возможной только при координации оксидными ионами. По этой причине вместо иона V5 + встречается комплекс VO4-, вместо Сг6 +-комплекс СгО4-, а вместо Мп7 + -комплекс МпО4 “.
На примере этого ряда комплексов можно показать, как связаны окраска и строение координационных соединений переходных металлов. Фотоны надлежащей энергии способны возбуждать электроны, перенося их с атомов кислородных лигандов на пустые d-орбитали иона металла. Этот процесс называется переносом заряда, и именно он в большинстве случаев обусловливает окраску комплексов переходных металлов. Чем выше степень окисления металла, тем легче осуществляют указанный переход электроны и тем ниже энергия, необходимая для их переноса. Поглощение фотонов соответствующей энергии в комплексе VO4- приходится на ультрафиолетовую часть спектра, поэтому ион VO4- бесцветен. В комплексе СгО4- поглощение фотонов происходит в фиолетовой области видимого спектра, что соответствует волновым числам около 24000 см-1, поэтому растворы хромат-ионов имеют желтую окраску (дополнительные цвета указаны в табл. 20-3). (В спектроскопии принято выражать энергию фотонов в волновых числах, которые измеряются в обратных сантиметрах, см - см. разд. 8-2.) Ион Мп7+ имеет самую высокую степень окисления и при возбуждении с переносом заряда поглощает зеленый цвет (приблизительно при 19000см-1), этим и объясняется пурпурная окраска иона МпО4 -. Окраска комплексов, в которых происходят электронные переходы с переносом заряда, обычно очень интенсивна, что указывает на сильное поглощение света. Повышение размера центрального атома затрудняет перенос заряда и сдвигает поглощение в ультрафиолетовую область; поэтому комплексы МоО4-, WO4- и ReO4- бесцветны.
Г.idea 20 216
Большее притяжение высокого положительного заряда центрального иона к отрицательному заряду лигандов проявляется в уменьшении способности лигандов координационного комплекса связываться с другими катионами. В ряду VO], СгО4 и МпО4“ ванадат-ион представляет собой очень сильное основание и способен связываться с протоном Н + или другими катионами. Хромат-ион также является довольно сильным основанием. Однако перманганат-ион-слабое основание; соединение НМпО4 полностью ионизуется в воде, и поэтому кислота НМпО4 представляет собой одну из наиболее сильных известных кислот (см. табл. 11-2). Ванадат-ион легко вступает в реакции типа
2VO4" + 2Н+ - 2 O3V—О—VO2“ + Н2О
которые приводя? к образованию поливанадатов с большим числом мостиковых связей —О—; в аналогичные реакции вступает хромат-ион, образующий бихромат-ион, Сг2О2-, который обладает свойствами кислоты. В отличие от этого Мп2О7 можно получить только в концентрированной серной кислоте, которая обладает свойствами сильного обезвоживающего агента. Однако это соединение очень неустойчиво и поэтому чрезвычайно взрывоопасно.
Заполненные и полу заполненные оболочки. Наличие заполненной оболочки с конфигурацией d10 в ионах Zn2+ и Ag + , а также полузаполненной оболочки с конфигурацией ds в ионах Мп2 + и Fe3 + придает этим ионам особую устойчивость; в то же время комплексы ионов Mn2 + , Fe3 + и Zn2 + оказываются довольно слабыми и их образование не приводит к значительной стабилизации металла. Здесь мы еще раз сталкиваемся с примером устойчивости заполненных и полузаполненных оболочек.
Ионы с конфигурациями d3, d6 или da. Преобладающая роль состояния окисления + 3 для ионов Сг (d3) и Со (d6), а также поразительная инертность их комплексов в химических реакциях [вспомните поведение Co(NH3)6Cl3 в горячей серной кислоте] невозможно объяснить на основе рассмотренных выше представлений. Точно так же не удается объяснить особую способность ионов с конфигурацией da образовывать комплексы с плоско-квадратной структурой, а не с октаэдрической или тетраэдрической координацией. Чтобы объяснить такие структуры и существование комплексов металлов с нулевой степенью окисления, следует рассмотреть участие d-орбиталей металла в образовании его химической связи с лигандами.
Неустойчивость конфигурации d*. Ион Сг2 + (d4) представляет собой сильный восстановитель, который окисляется, приобретая конфигурацию d3. Точно так же другой ион, Mn3 + (d4), является сильным окислителем и восстанавливается в ион с конфигурацией d5. Наконец, ион Со5 +. также обладающий конфигурацией d4, вообще не образует устойчивых комплексов. Любая теория химической связи в координационных комплексах встает перед необходимостью объяснить эту чрезвычайную неустойчивость конфигурации d4.
Координационная химия
217
20-2. НОМЕНКЛАТУРА КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
Многие комплексные соли переходных металлов имеют тривиальные названия, которые были даны им еще до установления их химического состава. Некоторые из этих названий отчасти информативны, например феррицианидом калия называют соль K3Fe(CN)6, а ферроцианидом калия — соль K4Fe(CN)6. Смысл названий лютеокобальтхлорид для Co(NH3)6Cl3 и празеокобальтхлорид для транс-[Со(МН3)4С12]С1 ясен лишь для тех, кто знает, что лютеус (лат.) означает желтый, а празеос (греч.) - зеленый. Однако лютеоиридийхлорид, Ir(NH3)6Cl3, не имеет желтой окраски, а получил такое название лишь потому, что имеет химическую формулу, аналогичную указанной выше соли кобальта. А такие названия, как соль Рейнеке, соль Эрдмана или соль Цейзе, совершенно не дают никаких сведений о составе соединения.
Постепенно старые названия были вытеснены систематической номенклатурой. При этом используются следующие правила:
1. Называя полностью комплексное соединение, следует сначала указать название аниона, а затем название катиона (подобно тому, как называют хлорид натрия) независимо от того, являются ли анион или катион комплексными частицами.
2. Называя комплексный ион, следует сначала указать лиганд или лиганды, а потом центральный атом металла. При этом для некоторых лигандов используются специальные названия: «акво» для воды, «аммин» для NH3 и «карбонил» для СО.
3. Если лиганд несет отрицательный заряд, его название обычно имеет окончание -о (например, хлоро означает С1“, а циано-CN-), а если лиганд заряжен положительно (что случается гораздо реже), к его названию добавляется окончание -ий (например, гидразиний для NH2NH3). Названия нейтральных лигандов не изменяются (например, метиламин для CH3NH2, этилендиамин для NH2CH2CH2NH2).
4. Греческие приставки (моно-, ди-, три-, тетра-, пента-, гекса- и т.д.) указывают число лигандов одного типа (если к данному типу относится всего один лиганд, приставка моно- часто опускается). Если в само название лиганда входит приставка моно-, ди- или др. (например, этилендиамин, сокращенно обозначаемый еп, или диэтилентриамин, сокращенно обозначаемый dien), то название лиганда заключается в скобки, а число лигандов этого сорта указывается приставками бис-, трис-, тетракис- и т.д. вместо ди-, три-, тетра- и т.д. соответственно. Например, Pt(en)3Br4 называется бромид трнс-(этилендиамин)платины(IV).
5. Римская цифра или нуль в скобках означают состояние окисления центрального атома металла.
6. Если комплексный ион несет отрицательный заряд, к названию металла добавляется окончание -ат.
7. Если комплексная частица содержит лиганды более одного сорта, то сначала перечисляются отрицательно заряженные, затем нейтральные и, наконец, положительно заряженные лиганды.
Глава 20
218
Приведем несколько примеров применения систематической номенклатуры:
Pt(NH3)6Cl4 [Pt(NH3)sCl]Cl3 [Pt(NH3)3Cl3]Cl Pt(NH3)2Cl4 KPt(NH3)C]5 хлорид гексамминплатины(ТУ) хлорид хлоропентамминплатины(ТУ) хлорйд трихлоротриамминплатины(1У) тетрахлородиамминплатина(1У) пентахлоромоноамминплатинат(1У) калия
K2PtCl4 K2CuCl4 Fe(CO)5 [Ni(H2O)6](ClO4)2 K4Fe(CN)6 K3Fe(CN)6 [Pt(en)2Cl2]Br2 тетрахлороплатинат(П) калия тетрахлорокупрат(11) калия пентакарбонилжелезо(0) перхлорат гексааквоникеля(П) гексацианоферрат(И) калия гексацианоферрат(Ш) калия бромид дихлоро-бис-(этилендиамин)пла-тины(1У)
[Pt(NH3)4](PtCl4) тетрахлороплатинат(11) тетрамминпла-тины(П)
В табл. 20-5 перечислены некоторые распространенные лиганды. Все эти лиганды монодентатные; это означает, что каждый лиганд связывается с центральным атомом только в одной точке. В табл. 20-6 приведены примеры лигандов другого типа: би-, три- и даже гексадентатные. Три мо-
Таблица 20-5
Распространенные монодентатные лиганды3
Лиганды Название
F , С1 , Вт и I Фторо, хлоро, бромо и иодо
= NO7 и :ONO“ Нитро и нитрито
:CN~ Циано
:SCN“ .ОН“ и :NCS- Тиоцианато и изотиоцианате Г идроксо
СН3СОО '• ~ Ацетато
Н2О Акво
NH3 Аммин
NO+ Нитрозил
pv Пиридин
а Электронные пары указаны для того, чтобы было ясно, какой атом связывается с центральным ионом металла. В формулах комплексных соединений электронные пары обычно не изображаются.
Координационная химия
219
Таблица 20-6
Распространенные хелатообразователн, или полндеятатные лиганды
Сокращенное обозначение Название лиганда Формула Число образуемых связей
еп Этилендиамин nh2—сн2—сн2—nh2 2
рп Пропилендиамин nh2—сн2—ch—nh2 СН3 2
dien Диэтилентриамин NH2—СН2СН2—NH—сн2сн2—nh2 3
trien Триэтилентетрамин NH2—С2Н4—NH—С2Н4—NH—С2Н4—NH2 4
EDTA Этилендиаминтетраацетат ~ :ООС—СН2 СН2—СОО: “ 1 1 :N—СН2СН2— № 1 Г - :ООС—СН2 СН2—СОО: ’ 6
OX Оксалат ’ :ООС—СОО: - 2
лекулы этилендиамина, NH2—СН2—СН2—NH2, могут октаэдрически координироваться вокруг атома Pt, образуя катион, который изображен на рис. 20-4. Этилендиаминтетраацетатный ион, указанный в табл. 20-6, может свернуться вокруг иона металла и координироваться к нему во всех
Рис. 20-4. Структура иона трис-(этилендиамин) платины (IV). Каждая молекула лиганда - этилендиамина, NH,—СН,—СН2—NH2, координирована к иону платины одновременно в двух точках. Подобные бидентатные и полидентатные лиганды называются хелатообразователями, а образуемые ими комплексные соединения -хелатами.
r.iaeu 20
Рис. 20-5. Этилендиаминтетрааце-татный ион. Одна молекула этилендиаминтетраацетата способна полностью окружить ион металла, образуя октаэдрическую структуру. Этилендиаминтетраацетат настолько прочно связывается с металлами, что удаляет их из ферментов и полностью нарушает каталитическую активность последних.
шести октаэдрических положениях сразу (рис. 20-5). Лиганд этилендиаминтетраацетат, сокращенно обозначаемый в формулах EDTA, способен настолько эффективно экстрагировать Са, Mg, Mo, Fe, Си и Zn, что он может извлекать атом этих металлов из фермента и полностью блокировать ферментативную активность последнего. Этилендиаминтетраацетат также применяется с успехом для удаления следов металлов из дистиллированной и очищенной воды. Молекула или ион, способные координироваться к иону металла сразу в нескольких положениях, называются полидентатны-ми, или хелатообразующими, лигандами; комплексы с такими лигандами называют хелатами.
И зомерия
В координационных комплексах обнаруживаются три типа изомерии: структурная, геометрическая и оптическая. Структурные изомеры имеют одинаковую общую химическую формулу, но отличаются способами соединения составных частей. Примерами структурных изомеров являются этиловый спирт, СН3СН2ОН, и диметиловый эфир, Н3С—О—СН3. Вещество с формулой Сг(Н2О)6С13 существует в виде трех структурных изомеров:
[Сг(Н2О)6]С13 хлорид гексааквохрома(Ш)
[Сг(Н2О)5С1]С12 Н2О моногидрат хлорида хлоропентааквохрома(Ш) [Сг(Н2О)4С12]С1-2Н2О дигидрат хлорида дихлоротетрааквохрома(Ш)
Координационная химия
221
Первый из них имеет фиолетовую окраску, второй-светло-зеленую, а третий-темно-зеленую. Убедиться в том, что для них характерна указанная структура, можно, осаждая ион О “ действием иона Ag + и удаляя гидратную воду (соответственно нуль, одну или две молекулы) высушиванием вещества над H2SO4.
Как мы уже знаем, геометрические изомеры отличаются расположением определенных групп относительно одного центра. Приставка цис- указывает, что две одинаковые группы располагаются по-соседству, транс- означает, что они находятся диаметрально противоположно друг другу или по крайней мере не по-соседству. На рис. 20-6,а показано, что два атома хлора в цис-изомере находятся по-соседству друг с другом вдоль ребра октаэдра, а в транс-изомере они находятся на противоположных концах диагонали, соединяющей вершины октаэдра.
Оптические изомеры имеют те же самые группы, с тем же относительным расположением, но отличающиеся взаимной заменой левого и правого направлений. Оптические изомеры, образующиеся перестановкой групп вокруг центрального атома, всегда существуют парами, в которых один изомер является зеркальным изображением другого. Эти пары
Рис. 20-6. Геометрические и оптические изомеры октаэдрических комплексов.
а-ионы цис- и транс-дихлоротетрам-минкобальта (III), они являются геоме-
трическими изомерами; б-два оптических изомера иона трис -(этиленди-амин)кобальта (III). (Убедитесь самостоятельно, что каждый ион может иметь только два таких изомера.)
Глава 20
изомеров называются энантиомерами. Примерами пары энантиомеров являются два комплекса Со(еп)з + , изображенных на рис. 20-6,6. Центральный атом, вокруг которого могут образоваться такие изомеры, называется асимметрическим, или хнральиым, центром. Еще одним примером пары энантиомеров являются L- и D-аланин, изображенные на рис. 21-12. При соединении нескольких асимметричных атомов углерода в цепочку может образоваться большое число оптических изомеров.
26-3. ТЕОРИЯ ХИМИЧЕСКОЙ СВЯЗИ В КООРДИНАЦИОННЫХ СОЕДИНЕНИЯХ
Максимальное число ст-связей, которые могут образоваться из валентных s- и р-орбиталей одного атома, равно четырем. Поэтому непереходные элементы второго периода образуют соединения с максимальным координационным числом 4. Эти элементы не имеют заполненных d-орбиталей или доступных для образования связей пустых d-орбиталей в следующей, надвалентной оболочке. Например, в молекуле СН4 центральный атом углерода «насыщает» свои валентные возможности, образуя четыре ст-связи. Однако если центральным атомом является переходный металл четвертого периода (первого переходного периода), то в дополнение к четырем s- и р-орбиталям он имеет еще пять валентных d-орбиталей.
Если бы центральный атом такого металла мог использовать все свои валентные d-, s- и р-орбитали для образования ст-связей, он был бы способен присоединить к себе до девяти лигандов. Однако громоздкость большинства лигандов чрезвычайно затрудняет достижение координационного числа 9. Тем не менее оно обнаруживается в комплексе ReH,', с крупным центральным атомом рения, относящегося к шестому (третьему переходному) периоду, и маленьким атомом Н в качестве лиганда. Строение этого интересного комплекса показано на рис. 20-7.
В большинстве координационных комплексов атом металла использует для образования связей меньше девяти орбиталей. Познакомимся с теориями, созданными для объяснения химической связи в этих соединениях
Рис. 20-7. Структура иона ReH|~. Шесть атомов Н занимают вершины трехгранной призмы и еще три атома Н располагаются вокруг атома Re в общей с ним плоскости, параллельной основаниям призмы.
Координационная химия
223
и их свойств. Развитие представлений о химической связи в комплексных соединениях переходных металлов прошло четыре стадии. Оно началось с простейшей электростатической теории, которую сменила теория валентных связен, или локализованных молекулярных орбиталей; в дальнейшем появилась теория кристаллического поля и, наконец, теория поля лигандов, или делокализованных молекулярных орбиталей. Каждая из этих теорий стала развитием предыдущей. Их последовательное рассмотрение является хорошим способом проследить за развитием представлений о химической связи и дает возможность показать, что одни и те же физические факты можно объяснить в рамках различных и на первый взгляд противоположных предположений.
Наши рассуждения будут относиться главным образом к комплексам с октаэдрической структурой, потому что они встречаются наиболее часто и легче поддаются интерпретации. Любая из обсуждаемых теорий должна дать ответы на следующие вопросы:
1. Как объяснить различие в окраске (поглощении энергии) комплекса при изменении типа лиганда (см. табл. 20-2)?
2. Как объяснить, что одни комплексы какого-нибудь металла, например Co(NH3)g+, обладают диамагнитными свойствами, в то время как другие комплексы этого же металла, например CoF^-, парамагнитны и имеют один или несколько неспаренных электронов?
3. Нетрудно понять устойчивость электронных конфигураций d°, ds и J10. Но как объяснить устойчивость конфигураций d3 и d6 (вспомним Сг3 + и Со3 + )?
4. Почему некоторые ионы с конфигурацией ds, например Pt(II) и Pd(II), обладают плоско-квадратной структурой, а не тетраэдрической или октаэдрической?
Электростатическая теория
Простая электростатическая теория включает только предположение, что отрицательно заряженные лиганды координируются вокруг положительно заряженного центрального иона. Лиганды и центральный ион притягиваются друг к другу, а лиганды отталкиваются друг от друга. Электростатическое отталкивание между лигандами позволяет предположить, что комплексы с координационным числом 2 будут иметь линейную структуру, а три лиганда должны располагаться в вершинах равностороннего треугольника, в центре которого находится центральный атом. Четыре лиганда обусловливают тетраэдрическую структуру комплекса, а шесть лигандов приводят к октаэдрической структуре. Однако электростатическая теория не объясняет существования плоско-квадратных комплексов. Кроме того, она не в состоянии объяснить, почему образуются комплексы с нейтральными молекулами (такими, как СО, Н2О или NH-) или с положительно заряженными ионами (например, с лигандом NH2NH3). Наконец, эта теория не дает возможности обсуждать магнитные свойства комплексов, а также судить об их электронных энергетических уровнях по окраске и оптическим спектрам.
Глава 20
224
Координационная химия
225
Теория валентных связей (или локализованных молекулярных орбиталей)
Один из первых значительных успехов в объяснении существования октаэдрических комплексов был достигнут, когда Полинг в 1931 г. показал, что набор из шести s-, р- и d-орбиталей может быть гибридизован аналогично тому, как осуществляется sp3- или хр2-гибридизация; при этом образуются шесть эквивалентных орбиталей, направленных к вершинам октаэдра. Для такой гибридизации могут использоваться валентные s-орбиталь и три р-орбитали, а также dxi _ 1- и d.i-орбитали, расположенные (по энергии) непосредственно под или над валентными s- и р-орбиталями центрального атома. Указанные d-орбитали выбраны потому, что их области максимальной плотности ориентированы вдоль шести осевых направлений октаэдра, подобно трем р-орбиталям. Возникающие в результате шесть октаэдрически ориентированных орбиталей называются d2sp3- или sp3d2-гибридными орбиталями в зависимости от того, меньше на единицу главное квантовое число d-орбиталей, чем у s- и р-орбиталей, или же совпадает с их главным квантовым числом.
Каждая из указанных гибридных орбиталей может перекрываться с орбиталью лиганда с образованием связывающей и разрыхляющей орбита-лей, имеющих ст-симметрию относительно оси связи между металлом и лигандом. Неподеленная пара электронов от каждого лиганда занимает возникающую связывающую молекулярную орбиталь, и в результате образуются шесть ковалентных связей (рис. 20-8). Аналогичные соображения поясняют образование четырех эквивалентных гибридных орбиталей, направленных к вершинам квадрата в плоскости ху, из d(! s-, рх- и
Ру-орбиталей атома металла.
Теория валентных связей не позволяет делать количественных предсказаний об энергетических уровнях комплексов, но все же дает возможность понять магнитные свойства октаэдрических комплексов. Полинг предположил, что возможны комплексы двух типов: внешнеорбитальные, в которых осуществляется гибридизация sp3d2, и внутриорбитальные с гибридизацией d2sp3 (рис. 20-9). Во внутриорбитальных комплексах для размещения остающихся у иона металла d-электронов имеется ограниченное число d-орбиталей. Эти электроны могут размещаться только на dxy-, dy,- и d^-орбиталях, поскольку две. остальные используются в октаэдрических гибридизованных орбиталях для построения связей с лигандами.
В качестве примера, показывающего, как теория валентных связей объясняет магнитные свойства октаэдрических комплексов, рассмотрим
Рис. 20-8. Образование октаэдрических гибридных атомных d2.sp3-op6n-талей из орбиталей dxi _ v2, d.i, s, px, py и pz. Орбиталь s имеет' сферическую форму, р-орбитали направлены к вершинам октаэдра, а две d-орбита-
ли имеют ориентацию, показанную на рисунках я и б. Каждая из шести гибридных орбиталей перекрывается с орбиталью лиганда, на которой находится неподеленная пара электронов (в). (Символ L означает лиганд.)
8-796
Глава 20
226
3d
х2-у2
Co(NH3)3 *©0G0O © ©®©
ху yz xz z2
ооооо
внутриорбитальный комплекс
CoFf
внешнеорбитальный комплекс
Рис. 20-9. Схема образования химической связи во внутри- и внешнеорбитальных комплексах в теории валентных связей. Во внутриорби-тальных комплексах кобальта, подобных Co(NH3)| + , шесть электронов металла спин-спарены на djy-, dyz- и (/„-орбиталях; октаэдрические гибридные орбитали образуются из одной S-, трех р- и двух d-орбиталей, принадлежащих более глубокому квантовому уровню. Во внешнеорбитальных комплексах кобальта все пять
d-орбиталей более глубокого квантового уровня заселяются электронами металла, которые вследствие этого остаются неполностью спаренными. Для образования октаэдрических гибридов используются две d-орбитали того же квантового уровня, к которому принадлежат s- и р-орбитали. Не-поделенные пары электронов лигандов заполняют связывающие орбитали, образованные в результате перекрывания орбиталей лигандов и шести октаэдрических гибридных орбиталей.
кобальт. Нейтральный атом кобальта имеет над заполненной оболочкой благородного газа аргона еще девять электронов, которые размещаются на атомных орбиталях следующим образом:
3d 4s 4р
с°: © ОСО
Ион Со3 + имеет шесть электронов, которые, согласно правилу Гунда, должны расселяться по всем пяти 3</-орбиталям:
3d 4s 4р
Теперь допустим, что шесть лигандов, каждый с неподеленной электронной парой, должны образовать шесть ковалентных связей с ионом кобальта, который использует для этого свои октаэдрически ориентированные ги-бридизованные орбитали. Если в гибридизации участвуют 4s-, 4р-
Координационная химия
227
spW
Четыре электрона остаются неспаренными, и, согласно рассматриваемой теории, комплекс CoF^- должен быть парамагнитным, что и наблюдается на самом деле.
Если же при октаэдрической гибридизации используются внешние 3d-орбитали, то для размещения шести валентных электронов, имевшихся у иона Со3 +, в комплексе остаются только три ЗЛ-орбитали:
Co(NH3)3+;
d2sps
Отсюда видно, что комплекс Co(NH3)g+ должен быть диамагнитным, и опыт согласуется с таким предсказанием.
Ион Мп2 + , входящий в изображенный на рис. 20-3 комплекс гексафто-романганат(П), имеет электронную конфигурацию
Мп! + :
Если бы гексафтороманганат(П) был внутриорбитальным комплексом, пять d-электронов центрального иона должны были бы расположиться на трех d-орбиталях и неспаренным остался бы только один электрон:
3d ____________4з________4^>
внутриор&лпалъный комплекс
Но если этот комплекс относится к внешнеорбитальному типу, все пять валентных электронов иона Мп2 + остаются неспаренными на пяти d-op-биталях. И в том, и в другом случае комплекс должен быть парамагнитным, но с разной величиной магнитного момента. Экспериментальные данные указывают, что этот комплекс имеет пять неспаренных электронов, так что его следует отнести к внешнеорбитальному типу. Ион Fe3 + также имеет конфигурацию d5, однако поскольку магнитные данные свидетель
8*
r.taea 20
228
ствуют о наличии у комплекса гексацианоферрата(Ш) только одного неспаренного электрона, в рамках теории валентных связей этот комплекс относится к внутриорбитальному типу. Одни лиганды, например CN-и СО, обычно образуют комплексы внутриорбитального типа, тогда как другие лиганды, например F “, С1 “ , Вг и I , чаще образуют внешнеорбитальные комплексы.
Теория валентных связей правильно предсказывает наличие двух вариантов для числа неспаренных электронов, но не позволяет сделать выбор между ними. С точки зрения этой теории внутриорбитальные комплексы должны быть относительно инертными. Экспериментальные наблюдения, указывающие, что внешнеорбитальные комплексы обычно действительно более лабильны, чем внутриорбитальные комплексы, убеждают нас, что теория валентных связей представляет собой по меньшей мере шаг в правильном направлении. В свое время она явилась несомненным достижением, однако впоследствии была вытеснена теорией кристаллического поля и еще более совершенной теорией поля лигандов, или делокализованных молекулярных орбиталей.
Теория кристаллического поля
Вернемся теперь от теории локализованных молекулярных орбиталей, каковой в сущности является теория валентных связей, к чисто электростатической теории, в рамках которой химическая связь между металлом и лигандами считается ионной. Простая электростатическая теория предсказывает образование октаэдрической координации по той же причине, по которой шесть единичных зарядов, вынужденные двигаться по поверхности сферы, принимают октаэдрическое расположение, продиктованное требованием минимальной энергии. Здесь мы, в сущности, имеем дело с уже известными нам из разд. 11-3 представлениями об отталкивании электронных пар.
Однако теория кристаллического поля несколько глубже. В ней рассматривается, что происходит с пятью d-орбиталями атома металла, когда к нему приближаются октаэдрически расположенные вокруг него шесть отрицательных зарядов; предполагается, что эти заряды располагаются на осях координатной системы, в которой определены d-орбитали. Эти отрицательные заряды изображают неподеленные пары электронов на лигандах. Считается, что они принадлежат лигандам и в комплексе, а не вовлекаются в образование ковалентных связей с металлом. Следовательно, теория кристаллического поля исходит из предположения о чисто ионной связи.
Отрицательные заряды, изображающие лиганды, оказывают наибольшее воздействие на dx- _ vj- и d^-орбитали, так как пучности этих орбиталей направлены прямо на лиганды (рис. 20-10). Электроны на d-орбиталях испытывают электростатическое отталкивание от неподеленных пар лигандов. Вследствие этого те электроны, которые находятся на двух указанных d-орбиталях, приобретают большую энергию, чем электроны, находящиеся
Координационная химия
229
I
Рис. 20-10. Модель октаэдрического комплекса в теории кристаллического поля. Шесть лигандов представлены шестью отрицательными зарядами, расположенными как раз против пучностей электронной плотности dxi _ yi-и d^-орбиталей металла. Если на этих двух d-орбиталях имеются электроны, они должны отталкиваться отрицательными зарядами лигандов. Заселение электронами таких d-орбиталей металла требует поэтому больше энергии по сравнению с заселением dxv-, dy,- и d^-орбиталей, пучности которых направлены между лигандами.
на остальных трех d-орбиталях. Эти три орбитали, dxy, dyz и dxz, имеют пучности максимальной плотности, направленные между лигандами (см. рис. 8-24). Находящиеся на них электроны оказываются более устойчивыми. Таким образом, электростатическое взаимодействие центрального иона металла с лигандами приводит к тому, что пять d-орбиталей «расщепляются» на две группы с разными энергетическими уровнями, расстояние между которыми (обозначенное на рис. 20-11 символом Ао) называется
a
_____ I
fYYYY^ 1
ион Co’4 в сферическом ион Co'в октаэдрическом
свободный ион Со3* кристаллическом поле кристаллическом поле
Рис. 20-11. Диаграмма энергетических уровней пяти d-орбиталей иона металла в октаэдрическом кристаллическом поле.
а - энергетический уровень d-орбита-лей свободного иона; б-энергетический уровень электронов на d-орбиталях при условии, что ион окружен сферическим облаком отрицательных
зарядов; e-расщепление энергетических уровней d-орбиталей при октаэдрическом расположении отрицательных зарядов вокруг центрального иона металла. Три d-орбитали, направленные между лигандами, имеют более низкую энергию, чем две орбитали, направленные прямо на лиганды.
Рис. 20-12. Ион Co(NH3)g+ поглощает фотон фиолетового света и пропускает фотоны остальных частот, что
придает ему желтую окраску; при этом электронная конфигурация а переходит в конфигурацию б.
Координационная химия
231
энергией расщепления кристаллическим полем. Более низкий энергетический уровень обозначается t2g, а верхний уровень-е9. Эти обозначения заимствованы из теории групп, и их происхождение не рассматривается в данной книге.
Энергия расщепления кристаллическим полем, Ao, оценивается путем измерения энергии, поглощаемой при возбуждении одного электрона с уровня t2g на уровень ед (рис. 20-12). Величина этой энергии очень важна при объяснении магнитных свойств комплексов. Если энергия Ао невелика, как в комплексе CoFg-, шесть d-электронов иона Со3 + расселяются по всем пяти d-орбиталям (рис. 20-13), потому что при минимальном спаривании электронов достигается выигрыш в энергии. И наоборот, если энергия расщепления, До, достаточно велика по сравнению с энергией спаривания двух электронов на одной орбитали, большая устойчивость достигается, если на каждой из трех орбиталей нижнего энергетического уровня t2g располагается по два спаренных электрона, а две орбитали верхнего уровня ед остаются вакантными. Такая ситуация реализуется в комплексе Co(NH3)g + . Из-за различного числа неспаренных электронов в двух рассмотренных структурах ион Co(NH3)g + называется низкоспиновым комплексом, а ион CoF|“-высокоспиновым комплексом.
Обратим внимание на то, как одни и те же факты объясняются двумя совершенно различными теориями-теорией валентных связей и теорией кристаллического поля. Обе теории утверждают, что низкоспиновые октаэдрические комплексы возникают, когда для d-электронов, первоначально принадлежавших центральному иону металла, доступны только три d-орбитали с низкой энергией. Высокоспиновые октаэдрические комплексы воз-
оо
о; □ Л)
ху yz XZ
d—
CoF6
Со(МН3)Г
Рис. 20-13. Объяснение теорией кристаллического поля различия между высокоспиновыми и низкоспиновыми комплексами. Расщепление d-уровней кристаллическим полем, образуемым ионами F _, невелико, и энергия, необходимая для перевода двух электронов на верхний уровень, оказывается меньше энергии их спаривания с другими электронами. Поэтому в высокоспиновом комплексе CoFg- d-элек-
троны расселяются по всем пяти орбиталям и остаются четыре неспаренных спина. Группа NH3 вызывает настолько большое расщепление d-уровней кристаллическим полем, что электронам легче расселяться в спин-спаренном состоянии на трех нижних орбиталях. В низкоспиновом комплексе Co(NH3)s+ нет неспаренных электронов.
Глава 20
232
никают, когда в наличии имеется пять низколежащих d-орбиталей. Однако теория валентных связей объясняет наличие трех или пяти таких орбита-лей с учетом октаэдрической гибридизации набора из шести орбиталей. В отличие от этого теория кристаллического поля принимает во внимание относительную величину энергетического расстояния между нижележащим набором из трех d-орбиталей и вышележащим набором из двух d-орбиталей. В центре внимания теории валентных связей находится гибридизация орбиталей металла, а его связи с лигандами считаются полностью ковалентными. В центре внимания теории кристаллического поля находится электростатическое отталкивание между неподеленными парами лигандов и электронами центрального иона металла, а его связи с лигандами считаются чисто ионными. Таким образом, эти теории дают совершенно разное толкование одним и тем же явлениям. Какая же из этих теорий правильная?
Некоторые химики предпочитают вместо слова «правильная» говорить «успешнее объясняющая факты». Но если только они не принадлежат к числу мистиков, верящих в некоторую внутреннюю сущность вещей, непознаваемую при помощи чувств, следует признать, что и та и другая терминология эквивалентны. Никакая теория не может претендовать на абсолютную правильность. Можно лишь утверждать, что одна теория предпочтительнее другой, потому что она объясняет больше наблюдаемых свойств рассматриваемых ею объектов, чем другая теория. Согласно такому критерию, теория кристаллического поля лучше теории валентных связей. Она позволяет расположить многие распространенные лиганды в ряд по величине энергии расщепления кристаллическим полем, Ао, вызываемого этими лигандами, и даже дать некоторое объяснение полученной последовательности.
Чем сильнее электростатическое поле, образуемое лигандом, тем больше должно быть вызываемое им расщепление. Маленькие лиганды с сильно сконцентрированными неподеленными парами, например F “, должны вызывать большее расщепление, чем крупные лиганды с электронами, диффузно распределенными по большому объему, как, например, С1 “ . Однако такие соображения позволяют лишь частично объяснить установленный на основании экспериментальных данных ряд силы лигандов (так называемый спектрохимический ряд; см. ниже):
СО, CN- > en > NH3 > —NCS- > Н2О > ОН~, F~ > С1“ > Вг~ > Г сильные | лиганды средней силы j слабые лиганды
лиганды । 1
Для изотиоцианатного иона использовано обозначение —NCS “ , чем подчеркивается, что связь металла с этим лигандом в комплексах Со(П1) осуществляется через атом N.
Не прибегая к помощи спектроскопов и призм, можно быстро проверить правильность указанной выше последовательности лигандов просто на основании рассмотрения окраски образуемых ими комплексов. Погло
Координационная химия
233
щение видимого света в комплексах переходных металлов, и, следовательно их окраска помимо переходов с переносом заряда могут обусловливаться еще возбуждением d-электронов металла с орбиталей t2g на орбитали вд. Для металлов, находящихся в состояниях окисления +2 и +3, поглощение с переносом заряда обычно приходится на ультрафиолетовую часть спектра, и, таким образом, видимая окраска связана с расщеплением кристаллическим полем. В таких случаях окраска не столь интенсивна, как в комплексах СгО|~ или МпО4, где она вызывается поглощением при переходах с переносом заряда. В табл. 20-2 приведен перечень комплексов кобальта с указанием их окраски, а также спектральной области поглощаемого света для электронного перехода с минимальной энергией; даны приближенные значения соответствующих длин волн и энергий. Из этой таблицы видно, что замещение в комплексе хотя бы одного лиганда NH3 на —NCS-, Н2О, ОН- или С1” приводит к уменьшению разности энергий между уровнями, или энергии перехода, в указанной выше последовательности. Замещение —NCS “ на Вг “ в комплексе с этилендиамином понижает энергию перехода приблизительно на 10% и изменяет окраску иона с голубой на зеленую. Замещение лиганда —NCS на С1" в присутствии пяти лигандов NH3 также снижает энергию перехода на 10% и изменяет окраску соли с оранжевой на пурпурную.
Теория кристаллического поля не позволяет объяснить наблюдаемую последовательность силы лигандов, т. е. их способность к расщеплению энергетических уровней. Но если принять во внимание орбитали лигандов, причем не только те, на которых находятся электронные пары, обобществляемые с металлом, но и те, где находятся неподеленные электронные пары, непосредственно не связанные с металлом, удается в гораздо большей мере объяснить последовательность энергий расщепления. Такая расширенная теория молекулярных орбиталей содержит в качестве предельных случаев как теорию кристаллического поля, так и теорию валентных связей и обычно называется теорией поля лигандов.
Теория поля лигандов (или делокализованных молекулярных орбиталей)
Теория поля лигандов рассматривает лиганды не просто как заряженные сферы, а как частицы, имеющие свои собственные орбитали. Согласно представлениям метода делокализованных молекулярных орбита-лей, шесть орбиталей лигандов, которые в первом предположении имеют симметрию ст-типа относительно линий связи металл—лиганд, образуют комбинации с шестью из девяти s-, р- и d-орбиталей металла, а именно с орбиталями dx2 _ yi, d,;, s, р„ ру и р2. Это как раз те же орбитали, которые Полинг использовал для конструирования шести гибридных орбиталей. Составим из них комбинации с шестью атомными орбиталями лигандов; при этом мы получим шесть делокализованных связывающих орбиталей и шесть разрыхляющих орбиталей (рис. 20-14). Орбитали dxy, и dxz, симметрия которых не позволяет им комбинировать с орбиталями лигандов
I'.iaeti 20
234
Рис. 20-14. Описание электронного строения комплексов с октаэдрической координацией в рамках теории делокализованных молекулярных орбиталей. Те же шесть орбиталей металла, которые использовались в теории валентных связей (dxi _ yi, dzi, s, рх, pf и р,), теперь взаимодействуют с шестью орбиталями лигандов, на которых находятся неподеленные электронные пары, в результате чего образуются шесть связывающих молекулярных орбиталей (одна ст,, три ст и две ctJ и шесть разрыхляющих орбиталей (<3*d,
crj и стр. Орбитали металла dxy, dy2 и dx, остаются несвязывающими. Шесть нижних связывающих молекулярных орбиталей заполняются электронными парами лигандов, образуя шесть связей с электронными парами, обобществляемыми между металлом и лигандами. d-Электроны иона металла располагаются на несвязывающем и нижнем разрыхляющем уровнях, между которыми имеется разность энергии До. Эти два уровня соответствуют показанным на рис. 20-11, но их происхождение объясняется по-другому.
Координационная химия
235
cr-типа, остаются несвязывающими. Находящиеся на этих орбиталях электронные пары не оказывают влияния на связывание лигандов с металлом и рассматриваются как неподеленные пары металла.
Возникающая в результате образования молекулярных орбиталей комплекса диаграмма энергетических уровней изображена на рис. 20-14. В ее нижней части находятся уровни шести связывающих орбиталей, заполненные электронными парами. Их можно представить как шесть электронных пар, поставляемых лигандами-донорами, и больше не обращать на них внимания. Точно так же можно исключить из рассмотрения четыре верхние разрыхляющие орбитали, являющиеся пустыми, за исключением предельных случаев сильного электронного возбуждения, которыми можно пренебречь. Несвязывающий уровень и нижний разрыхляющий уровень соответствуют двум уровням, t2g и ед, к которым приводит расщепление кристаллическим полем (см. рис. 20-13). Мы будем продолжать называть их по-прежнему уровнями t2g и ед даже в рамках молекулярно-орбитального подхода. Но важно отметить разницу в объяснении расщепления между этими уровнями. В теории кристаллического поля оно является следствием электростатического отталкивания, а в теории поля лигандов-следствием образования молекулярных орбиталей. Как мы убедились в гл. 12 на примере молекул HF и KF, теория молекулярных орбиталей позволяет охватить все случаи от чисто ионной до чисто ковалентной связи. Поэтому выбор между теорией кристаллического поля и теорией поля лигандов основан лишь на рассмотрении одной из двух предельных моделей связи. В комплексе CoF^ довольно заметно проявляется ионный характер связи, потому что, как можно видеть из рис. 20-14, орбитали лигандов располагаются по энергии ниже орбиталей металла и ближе к связывающим молекулярным орбиталям. Поэтому связывающие молекулярные орбитали по характеру должны приближаться к орбиталям лигандов, а это должно обусловливать смещение отрицательного заряда в направлении к лигандам. Таким образом, связи в данном случае должны быть частично ионными.
Теория молекулярных орбиталей позволяет гораздо лучше предсказывать, какие лиганды вызывают большую разность энергий между уровнями t2g и ед в октаэдрических комплексах, а какие вызывают малое расщепление. Для таких предсказаний необходимо обсудить взаимодействия dxy-, dyz- и г/1г-орбиталей, которые образуют уровень t2g, с атомными орбиталями лигандов, имеющими симметрию л-типа относительно линии связи металл-лиганд.
Теория кристаллического поля вообще не принимает во внимание такие орбитали лигандов, поскольку лиганды в ней рассматриваются просто как заряженные сферы. В теории поля лигандов рассматриваются не только орбитали лигандов, при помощи которых они образуют связи с центральным ионом металла, но также по две негибридизованные р-орбитали на каждом лиганде, ориентированные перпендикулярно линии связи ме-талл-лиганд. Эти негибридизованные р-орбитали оказывают сильное влияние на энергию расщепления кристаллическим полем, Ао.
Глава 20
236
Рис. 20-15. Снижение энергии расщепления кристаллическим полем в результате л-взаимодействия металл -лиганды. Неподеленные пары электронов на л-орбиталях лигандов С1 " отталкивают электроны, находящиеся на d dr- и ^.-орбиталях металла
(М), вследствие чего эти орбитали становятся менее устойчивыми. Соответствующий им на рис. 20-11 энергетический уровень t2g повышается, и энергия расщепления, A„, уменьшается.
На рис. 20-15 схематически изображены четыре из таких р-орбиталей хлоридных лигандов, перекрывающиеся с одной из трех d-орбиталей, которые соответствуют энергетическому уровню t2g. Если на такой d-орбитали имеются электроны, они отталкиваются неподеленными парами электронов на этих р-орбиталях, и в результате энергия уровня t2g повышается. Поэтому лиганд с заполненными орбиталями, обладающими симметрией л-типа относительно линии связи металл-лиганд, понижает энергию расщепления кристаллическим полем, Ad. Пользуясь терминологией теории кристаллического поля, такие лиганды (например, ОН “, Cl “, Br “ , I') называют лигандами слабого поля. Фторидный ион не настолько эффективен в этом отношении, поскольку его электроны находятся на очень компактных орбиталях. Описанный эффект называется л-взаимодействием лигандов с металлом, или L -> М-л-взаимодействием.
Совсем по-другому ведут себя многоатомные лиганды с незаполненной орбиталью л-типа. Например, цианидный ион (рис. 20-16) имеет тройную связь, образуемую одной связывающей молекулярной ст-орбиталью и двумя связывающими молекулярными л-орбиталями. Одна из этих связывающих л-орбиталей показана на рис. 20-16,а. Эта орбиталь дестабилизирует, или повышает, уровень t2g в результате L -> М-л-взаимодействия, подобного описанному выше для лиганда С1". Но большая часть электронной
Координационная химия
237
плотности л-орбитали находится между атомами С и N, а не в направлении к атому металла. Гораздо сильнее взаимодействует с уровнем t2g металла разрыхляющая п*-орбиталь (рис. 20-16,6). Однако в этом случае эффект обратен тому, который наблюдался для лиганда С1 “. Электроны на с29-орбиталях металла получают возможность частично делокализоваться и переместиться на л*-орбиталь лиганда. Такая делокализация стабилизирует г29-орбиталь, т. е. понижает ее энергию. В результате возрастает энергия расщепления, До. Этот эффект представляет собой л-взаимодействие металла с лигандом, или М -> L-л-взаимодействие; нередко его называют еще дативным л-взаимодействием. Лиганды, повышающие расщепление уровней указанным образом (СО, CN “, NO2), пользуясь терминологией теории кристаллического поля, называют лигандами сильного поля. Одноатомные лиганды с несколькими неподеленными парами электронов, как, например, галогенидные ионы, являются лигандами слабого поля, потому что они играют роль доноров электронов. Связанные группы атомов наподобие СО скорее относятся к лигандам сильного поля, потому что их связывающие л-орбитали сконцентрированы между парами атомов и удалены от металла, тогда как пустые разрыхляющие молекулярные орбитали простираются ближе к металлу.
Природа металла также оказывает большое влияние на величину расщепления кристаллическим полем. Атомы или ионы металлов с валентными 4d- или 5</-орбиталями обнаруживают гораздо большее расщепление, чем в соответствующих комплексах металлов с валентными ЗЛ-орбиталя-ми. Например, для Co(NH3)g + , Rh(NH3)^ + и Ir(NH3)g+ параметр До имеет значение 22900, 34100 и 40000 см-1 соответственно. По-видимому, валентные 4с/- и 5с/-орбитали иона металла лучше приспособлены к образованию ст-связей с лигандами, чем Зс/-орбитали, но причины этого не вполне ясны. Важным следствием намного больших значений параметра До у комплексов с центральными ионами металлов, имеющих валентные 4J- и 5с/-электроны, является то, что все комплексы металлов пятого и шестого периодов (второго и третьего переходных периодов) имеют низкоспиновые основные состояния; это относится даже к таким комплексам, как RhBr^-, лиганды которого принадлежат к числу наиболее слабых лигандов приве
денного выше спектрохимического ряда.
Мы показали, что магнитные свойства и окраска комплексов пере
ходных металлов зависят от природы лигандов и металла, которая влияет на энергию расщепления кристаллическим полем, До. Тем самым получен
ответ на два вопроса из числа поставленных в начале данного раздела. Можно также объяснить необычную устойчивость с/3- и ^-конфигураций
в комплексах с лигандами сильного поля. Эти конфигурации соответ-
,-уровням. Они
обладают повышенной устойчивостью при большом расщеплении уровней по той же причине, по которой устойчивы конфигурации с/5 и с/10, когда все пять d-орбиталей имеют одинаковую энергию. Устойчивость d5- и с/1 “-кон
фигураций более заметна в комплексах с лигандами слабого поля, где рас-
щепление кристаллическим полем невелико.
г
Координационная химия
239
20-4. ТЕТРАЭДРИЧЕСКИЕ И ПЛОСКО-КВАДРАТНЫЕ КОМПЛЕКСЫ
На рис. 20-17 сопоставляются энергетические уровни d-орбиталей центрального иона металла в комплексах с различной структурой, но одинаковой силой лигандов, вычисленные в рамках теории поля лигандов. В тетраэдрических комплексах относительное расположение уровней обратно наблюдаемому в октаэдрических комплексах по вполне понятной причине. В тетраэдрическом комплексе лиганды направлены к атому металла от четырех из восьми вершин куба (см. рис. 20-2,6). Только орбитали dx2_yi и d22 не направлены к вершинам куба, окружающего атом металла. Как можно убедиться на основании рассмотрения рис. 8-24, пучности плотности орбиталей dxy, dyz и dxz направлены к средним точкам 12 ребер куба, а пучности плотности остальных двух d-орбиталей-к центрам шести его граней. Набор из указанных выше трех d-орбиталей, которые располагаются ближе к лигандам тетраэдрического комплекса, менее устойчив, хотя расщепление меньше, чем в октаэдрических комплексах.
Расщепление d-уровней в плоских квадратных комплексах имеет еще более простое объяснение. Допустим, что плоскость ху совпадает с плоскостью комплекса, а лиганды находятся на равных расстояниях в направлениях + х и + у от центрального иона. Тогда орбиталь dx2 _ у2 направлена своими пучностями плотности прямо на лиганды и вследствие этого наименее устойчива. Орбиталь dz2 перпендикулярна плоскости лигандов и наиболее устойчива (см. рис. 20-17). Остальные три d-орбитали имеют промежуточную устойчивость, причем dyz и dxz более устойчивы, чем dxy, поскольку они ориентированы вне плоскости лигандов.
Октаэдрическая структура в принципе устойчивее, чем плоско-квадратная, потому что в первом случае образуются шесть связей, а во втором -только четыре. Энергия простой ковалентной связи или ионной связи обычно составляет 200-400 кДж -моль “ *. Это соответствует 17000-33000 см-1, если перейти к единицам, в которых указаны энергии расщепления в табл. 20-7. Поскольку в октаэдрическом комплексе на две связи больше, чем в плоско-квадратном или тетраэдрическом, его устойчи-
Рис. 20-16. Влияние л-связывания
в циано-комплексах. У иона CN “ связывающая молекулярная л-орби-таль занята электронной парой (а), а разрыхляющая л*-орбиталь свободна (6). Орбитали металла типа tls более устойчивы в присутствии простых лигандов с орбиталями о-симметрии потому, что электроны на Z 2з-орбиталях не концентрируются в направлении лигандов. Но если у лигандов имеются заполненные л-орби-тали, они взаимодействуют с Г2й-орбиталями металла (в) и снижают
их устойчивость. Энергия расщепления, До, при этом уменьшается. Если металл имеет заполненные г2в-орбитали, которые взаимодействуют с пустыми разрыхляющими л-орбиталями лигандов (г), то электроны металла делокализуются, энергия г2з-орбиталей понижается и энергия расщепления, Д„, возрастает. Этот последний эффект преобладает в большинстве комплексов с лигандами CN “, и поэтому говорят, что лиганды CN ” вызывают большое расщепление полем лигандов.
Глава 20
240
Энергия
ху yz xz z2 x2 - у2
свободный ион
ион в плоскоквадратном поле (в плоскости ху)
ху yz XZ
OOQ
ион в октаэдрическом поле
ион в тетраэдрическом поле
Рис. 20-17. Энергетические уровни пяти ^-орбиталей свободного иона (в сферическом поле электрического заряда) и комплексов с тремя важнейшими координационными структурами (вычислены для лигандов одинаковой
силы). Относительная последовательность уровней объясняется в тексте. Энергии расщепления полем лигандов обозначены символами До, А,. Д2, Д3 И Аполн'
вость должна быть на 35000-65000 см “ 1 выше. Хотя на основании рассмотрения рис. 20-17 может показаться, что для комплексов с конфигурацией центрального иона от dl до d6 предпочтительна плоско-квадратная координация, указанная выше дополнительная устойчивость октаэдрических комплексов имеет преобладающее значение. Однако седьмой и восьмой d-электроны вынуждены заселять при октаэдрической координации высоко расположенные по энергии орбитали еэ, а при плоско-квадратной координации-намного более устойчивую орбиталь dxy. Эта дополнительная устойчивость имеет решающее значение для конфигурации d8 в случае большого расщепления полем лигандов, и такие комплексы обладают плоско-квадратной координацией. Расщепление полем лигандов возрастает с порядковым номером металлического элемента. Это объясняет, почему комплексы Pt(II) и Pd(II) обычно имеют плоско-квадратную структуру, тогда как комплексы Ni(II), как правило, октаэдрические. Появление девятого и десятого d-электронов снова делает более благоприятной октаэдрическую координацию вследствие большей устойчивости шести связей с лигандами вместо четырех.
Тетраэдрическая координация реже оказывается предпочтительной и поэтому относительно мало распространена. Дело не только в том, что по сравнению с октаэдрической координацией у нее на две связи меньше; тетраэдрическая координация, кроме того, имеет менее устойчивый ниж-
Координационная химия
241
Таблица 20-7 Энергии расщепления полем лигандов в некоторых комплексах переходных металлов
Октаэдрические комплексы cm 1 Октаэдрические комплексы До, cm 1
Ti(H2O)i + 20300 CoFi" 13000
TiFi" 17000 Co(H2O)l + 18200
V(H2O)i + 17 850 Co(NH3)i + 22900
V(H2O)i + 12400 Co(CN)r 34500
Cr(H2O)i+ 17400 Со(Н2О)б + 9 300
Cr(NH3)i+ 21600 Ni(H2O)i + 8 500
Cr(CN)g- 26600 Ni(NH3)i + 10800
Cr(CO)6 32200 RhCle" 22800
Fe(CN)e" 35000 Rh(NH3)i + 34100
Fe(CN)£~ 33 800 RhBri” 19000
Fe(H2O)l + 13 700 IrCliT 27600
Fe(H2O)i + 10400 Ir(NH3)i + 40000
Тетраэдрические комплексы Л», CM-1
VC14 9010
СоСЦ- 3300
CoBri * 2900
СоЦ- 2700
Co(NCS)i~ 4700
Плоско-квадратные Л 1, CM " 1 Д2, см"1 Д3, cm "1 АпОЛН’ CM
комплексы
PdCli" 23600 3900 7400 34900
Ptcii 29700 4700 6800 41200
ний d-уровень, а верхний уровень у нее начинает заселяться уже третьим, О ТТЛ ГТЛ'Т’ТТЛТЧ'Т’Т Г» * TT^»Ti*'T’»^Z\f Т АЦ (Г» Г*Т ГП/ЛТ*Аптггг oni TV V г-ч» m Г»ЛТ1*«*»О v^
<u. 11V DDlV^’KkJVlirlriUODlA AvMll.lUAVdA/.
В табл. 20-7 указаны энергии расщепления полем лигандов для различных комплексов всех трех координаций. Читателю рекомендуется проверить, согласуются ли данные для октаэдрических комплексов с последовательностью силы лигандов, о которой говорилось выше в данном
r.iaeci 20
разделе. Кроме того, следует отметить, насколько правильно сделанное выше предположение о расщеплении уровней в комплексе Co(NH3)g + , основанное только на его окраске (см. табл. 20-2).
20-5 РАВНОВЕСИЯ С УЧАСТИЕМ КОМПЛЕКСНЫХ ИОНОВ
Когда мы пишем, что ион Со2 + находится в водном растворе, неявно предполагается, что речь идет не об изолированном ионе, а что к нему координированы молекулы гидратной воды. Следовательно, химия комплексных ионов в растворах в сущности является химией замещения одного молекулярного или ионного лиганда в координационной оболочке металла другим лигандом. Тем не менее принято для простоты записывать, например, образование амминного комплекса Со2 +, как если бы речь шла о присоединении NH3 к двухзарядному иону кобальта
Со2+ + 6NH3 Co(NH3)g+ (20-1)
Для константы равновесия этой реакции можно записать выражение
= [Co(NH3)2+]
о6₽ [Co2+][NH3]6
(20-2)
Поскольку в данном равновесии рассматривается образование комплекса, константа равновесия носит название константы образования, Ко6р. Для образования гексамминкобальта(П) Ко6р = 1105.
В принципе расчеты с использованием констант образования ничем не отличаются от расчетов констант диссоциации кислот или оснований. Это становится совсем очевидным, если записать уравнение (20-1) как реакцию диссоциации Co(NH3)g + , а не ассоциации реагентов; в этом случае константа диссоциации должна определяться выражением, обратным Ко6р. Однако в равновесиях с участием комплексных ионов принято пользоваться константами образования.
После добавления NH3 к раствору Со2 + часть аммиака соединяется с Со2 +, образуя некоторое количество комплексных ионов. Когда после добавления NH3 устанавливается равновесие, концентрации комплексных ионов, неиспользованного NH3, а также свободных (точнее гидратированных) ионов Со2 + можно вычислить по уравнению (20-2).
Пример 1
К 0,100 М раствору Ag+ добавляют достаточное количество NH3, чтобы исходная концентрация NH3 достигла 1 моль-л'1. хСвковь* концентрации ИСКОВ И Ag(NH3)2 после установления равновесия?
Решение
В табл. 20-8 находим, что константа образования Ag(NH3)3 КОбр = 1 -Ю8. Это позволяет записать уравнение для константы равновесия
Координационная химия
243
^обр “
[Ag(NH3)3 ] [Ag+ ][NH3]2
На основе большого значения константы образования можно предположить, что реакция образования протекает достаточно полно и что концентрация Ag(NH3)3 равна исходной концентрации Ag+. Это значит, что концентрация оставшегося NH, при равновесии равна его исходной концентрации за вычетом количества, прореагировавшего с Ag + . Итак,
[Ag (NHj)j ] = 0,100 моль • л “ 1 [NH3] = 1,00 - 0,200 = 0,800 моль-л“ 1
[При образовании каждого моля Ag(NH3)3 в реакцию вступают 2 моля NH3.] Следовательно, концентрация оставшихся в растворе ионов серебра равна
[Ag + ] = —-—- •1•10“8 = 2 10_9 моль л“ 1
J 0,8002
Предположение о практически полном осуществлении реакции образования, как видим, оказалось правильным, так как концентрация Ag+ чрезвычайно мала.
Таблица 20-8
Полные константы образования3 некоторых комплексов в водных растворах при 298 К
Комплекс ML„ ^обр ~~ [ML„]/[M] [L]n Комплекс ML„ ^обр ~ = [ML„]/[M] [L]"
L = NH3 L = OH-6
Ag(NH3>2 1 10» Cr(OH)2 + 1 IO10
Си(МН3)Г 1-1012 Fe(OH)2 + 1 -1011
Zn(NH3)i + 5-108 Co(OH)2 + 1-1012
Cd(NH3)j + 1 IO7 A1(OH)2 + 2-2028
Ni(NH3)l + 6-108 InlOHK 1,5 1035
Co(NH3)i + 1 IO5 Mn(OH)+ 3 -104
L = F в Fe(OH)+ 1 -IO7
AlFg- 7-1019 Co(OH)+ 2,5 • 104
SnF3 8 -109 Ni(OH)+ 1-105
SnFi- 1025 Cu (OH)+ 1107
ZnF+ 5,0 Zn(OH)+ 1 105
FeF2 + 3 - 10s Ag(OH) 1 103
MgF+ 65 Zn(OH)j- 5•1014
HgF+ 10 Pb(OH)3 8-1013
CuF+ 10
Глава 20
244
П родолжение табл. 20-8
Комплекс МЬЯ ^обр — [MLn]/[M][L]" Комплекс ML„ ^обр — = [MLn]/[M][L]"
L = H2NCH2CH2NH2 (en)
L = СГ Mn(en)3 + 5 10s
MgCl+ 4,0 Fe(en)3 + 4 IO9
CuCl+ 1,0 Co(en)3 + 8 IO13
CuCI2 IO’5 Ni(en)3 + 41018
AgClj 1 • 102 Cu(en)2 + 1,6 IO20
HgCir 1,6-1016 Zn(en)3 + 1,2-1013
T1CU 7,5 10ls L = CN
Bicir 4 IO6 FefCN)?- 1031
SnCl2- 1,1 IO2 Fe(CN)J* 1024
Pbcir 4 102 Ni(CN)J- IO30
FeCl2 + 3,0 Zn(CN)J- 5 1016
FeC'4 610“2 Cd(CN)J- 6-1018
Hg(CN)i“ 4 1041
Ag(CN)2- 1021
л Строго говоря, приведенные здесь значения констант должны сопровождаться более подробным описанием растворителя и метода измерения. Эти значения являются приближенными и могут использоваться лишь для сравнительной характеристики сходных веществ. При л = 1 предполагается, что в комплекс входят также три или пять молекул воды.
° Большинство многозарядных положительных ионов металлов обнаруживают в присутствии ионов ОН тенденцию к образованию многоядерных комплексов с мостиками
Н
—О— или i
/ \
как, например, в (Fe—О—Fe)4T, Bi6(OH)f2, Cr2(OH)J+ и т.д., не говоря уже о чрезвычайно нерастворимых гидроксидных осадках.
° Многие устойчивые комплексы, например SiF|~ и AsF^, гидролизуются в воде с образованием оксианионов или оксидов.
Пример 2
50 мл 2,00 М раствора NH, добавляют к 50 мл 0,200 М раствора Ni2 +. Какова окончательная концентрация гидратированных ионов Ni2 + ?
Решение
Запишем выражение для константы образования
^обр —
[Ni(NH3)2 + ] [Ni2 + ][NH3]6
Координационная <имия
245
Допустим, что концентрация Ni(NH3)g + при равновесии приблизительно равна 0,100 моль-л- Тогда концентрация несвязанного NH3 должна быть равна 1,00 — — 6(0,100) = 0,40 моль -л - *. Это позволяет записать
0,100
—’—г = 6-108 х(0,40)6
откуда х = 4 10 8 моль л
Пример 3
50 мл 2,00 М раствора этилендиамина (еп) добавляют к 50 мл 0,200 М раствора Ni2 + . Какова окончательная концентрация гидратированных ионов Ni2 + ?
= 4 10
Решение
Запишем выражение для константы образования [Ni(en)2 + ] обр [Ni2 + ][en]3
На основе предположений, аналогичных сделанным в примере 2, найдем 0,100
—-----г = 4-Ю18
х(0,70)3
откуда х = 7 -10“ 20 моль-л -
Рассмотренные примеры показывают, что хелатообразователь связывается с ионом металла значительно сильнее, чем обычный родственный ему лиганд. Из данных табл. 20-8 можно видеть, что константы образования этилендиаминовых комплексов на 8-10 порядков (т. е. приблизительно в миллиард раз) больше, чем константы образования комплексов тех же ионов металла с лигандами NH3. Связь аммиака и аминных хела-тообразователей с металлом относится к одному типу; в обоих случаях неподеленная пара электронов на атоме азота в аммиаке или амине взаимодействует с металлом. Различие в константах образования комплексов с NH3 и этилендиамином является отражением повышенной устойчивости последних, обусловленной вхождением связывающихся атомов лигандов в одну хелатную молекулу. Эта повышенная устойчивость иногда называется хелатным эффектом. Однако цианидный ион CN - (который связывается с металлом через атом углерода) характеризуется намного более сильным притяжением к металлам, чем азотный атом аминных лигандов. Как показывают данные табл. 20-8, константы образования для цианидных комплексов на 3-13 порядков величины больше, чем для соответствующих этилендиаминовых комплексов. • <
Поскольку константы образования обычно столь велики, в задачах на равновесие с участием комплексных ионов, как правило, можно использовать предположение, что концентрация комплекса совпадает с общей концентрацией иона металла, как это и делалось в рассмотренных выше примерах. Однако такое предположение оказывается неверным в случае комплексов с фторид-ионами, F -.
Г.шва 2(>
246
Пример 4
50 мл 2,00 М раствора ионов F “ смешивают с 50 мл 0,200 М раствора Hg2 +. Каковы окончательные концентрации ионов F ~, Hg2 + и HgF + после установления равновесия?
Решение
Решать эту задачу удобнее, пользуясь следующей таблицей:
Исходные концентрации, моль • л “ 1: Равновесные концентрации, моль • л “ 1:
х
о6р “ (1,00 - х)(0,100 - х)
Решая квадратное уравнение относительно х, находим х = 0,090 моль • л = [HgF + ]; [F “ ] = 0,910 моль л “ 1 и [Hg2 + ] = 0,010 моль• л “ ’.
F + Hg2 ’ HgF+
1,00 0,100 0
1,00 - х 0,100 - х х
= 10
ЗАКЛЮЧЕНИЕ
Данная глава представляет собой краткое введение в обширную область химии, которая посвящена комплексным соединениям переходных металлов. Многообразие и трудность интерпретации химических свойств этих соединений обусловлены наличием у них тесно расположенных энергетических уровней, связанных с d-орбиталями металла. Путь к пониманию химии переходных металлов заключается в объяснении того, каким образом лиганды возмущают эти энергетические уровни металла. Теория валентных связей и теория кристаллического поля частично объясняют этот эффект, но в настоящее время наиболее плодотворной является теория поля лигандов.
История развития этих теорий служит иллюстрацией утверждения, что неверную теорию всегда можно усовершенствовать, но никогда нельзя доказать, что она окончательно правильна. Успешное объяснение теорией валентных связей координационной геометрии и магнитных свойств комплексов не дает гарантии правильности этой теории или хотя бы правильности ее подхода. Каков, например, правильный ответ на вопрос-обусловлено ли расщепление уровней t2g и ед образованием молекулярных орбиталей (точка зрения теории поля лигандов), электростатическим отталкиванием (теория кристаллического поля) или выбором шести орбиталей для гибридизации (теория валентных связей)? А может быть, неверны все три точки зрения, и когда-нибудь мы будем относиться к теории поля лигандов с тем же снисхождением, с каким сейчас относимся к теории валентных связей?
В настоящее время теория поля лигандов применима ко многим проблемам и позволяет интерпретировать многие свойства комплексных со
Координационная химия
247
единений переходных металлов. Пользуясь ею, можно объяснить поглощение света и наблюдаемые магнитные свойства комплексных ионов. Она успешно описывает влияние лигандов на расщепление энергетических уровней и позволяет понять, почему электронные конфигурации d3 и низкоспиновая d6 особенно благоприятны в октаэдрических комплексах, а конфигурация de приводит к плоско-квадратной геометрии.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Как объяснить существование ряда соединений, описываемых формулами СгС13, СгС13 • 3NH3, СгС13 • 4NH3, СгС13 • 5NH3 и СгС13 6NH3? Почему не следует ожидать существования недостающих членов этого ряда, СгС13 • 2NH3 и СгС13 • NH3?
2. Если бы обнаружилось соединение СгС13 NaCl xNH3, что следовало бы предсказать относительно величины х?
3. Сколько различных изомеров можно предсказать для соединения СгС13 • NaCl • xNH3?
4. Какое предположение о геометрии образования связей вокруг атома Сг сделано вами при ответе на вопрос 3?
5. Как отличается число изомеров соединения при различном геометрическом расположении лигандов вокруг центрального иона металла? Проиллюстрируйте ваш ответ на примере комплексов с тетраэдрической и плоско-квадратной структурой.
6. В чем заключается различие между парамагнитными и диамагнитными комплексами? В чем проявляется это различие экспериментально ?
7. В чем отличие между устойчивостью и инертностью? Может ли химическая система быть устойчивой, но не инертной? Может ли она быть инертной, но неустойчивой?
8. В чем заключается причина устойчивости комплексов с электронными d5- или “-конфигурациями центрального атома металла? Как объясняется устойчивость комплексов с d3- и ^“-конфигурациями? Какие конфигурации должны способствовать устойчивости комплексов с лигандами, обусловливающими большие энергии расщепления? Какие конфигурации способствуют устойчивости комплексов с лигандами, обусловливающими низкие энергии расщепления?
9. Дайте правильные номенклатурные названия следующих соединений:
Ir(NH3)3Cl3 Rh(en)2Cl2Ir(en)Cl4
Со (NH3)6C13 Rh (en) С141г (en)2Cl2
Rh (en)3IrCl6 RhCl6Ir (en)3
10. Дайте схематическое изображение четырех родиево-иридиевых комплексов, указанных в вопросе 9.
Глава 20 248
11. Дайте схематическое изображение следующих комплексных ионов: цис-дихлоротетрамминхром(Ш)-ион и транс-дихлоротетраммин-хром(Ш)-ион. Укажите заряд каждого из этих комплексов.
12. В чем заключается различие между структурными, геометрическими и оптическими изомерами? Приведите примеры структурных и геометрических изомеров из числа соединений, указанных в вопросах 9 и 11.
13. Почему комплексы, в которых центральный ион металла имеет электронную конфигурацию da, обладают плоской квадратной геометрией?
14. Каково число неспаренных электронов в РеСЦ" и в Fe(CN)|"?
15. Все октаэдрические комплексы ванадия(Ш) имеют одинаковое число неспаренных электронов независимо от природы лиганда. Объясните причину этого.
16. В чем отличие способов, которыми теория валентных связей и теория кристаллического поля объясняют магнитные свойства комплексных ионов?
17. Как теория поля лигандов объясняет экспериментально установленный на основе величины энергии расщепления спектрохимический ряд лигандов?
18. Как теория кристаллического поля объясняет расщепление пяти d-орбиталей атома металла на два энергетических уровня? Как возникают соответствующие энергетические уровни в молекулярно-орбитальной теории строения комплексных ионов?
19. Почему в тетраэдрических комплексах пять d-орбиталей центрального иона металла расщепляются на те же две группы, что и в октаэдрических комплексах, но с обратной последовательностью энергии?
20. Что представляет собой хелат? Зная, что порфирин является тетра-дентатным хелатным лигандом, а этилендиамин бидентатным хелатным лигандом, как следует описать триэтилентетрамин, диэтилентриамин и этилендиаминтетраацетат?
21. Что представляет собой группа гема? Какова ее функция в гемоглобине и цитохроме с? (Для ответа на этот вопрос см. послесловие к данной главе).
ЗАДАЧИ
Стехиометрия
1. Студенту дали 1,00 г бихромата аммония для получения координационного соединения. Этот образец был сожжен, в результате чего получились оксид хрома(Ш), вода и газообразный азот. Оксид хро-ма(Ш) заставили прореагировать при 600 С с тетрахлоридом углерода, в результате чего получились хлорид хрома(Ш) и фосген (СОС12). Обработка хлорида хрома(Ш) в избыточном количестве жидкого аммиака привела к образованию хлорида гексамминхрома(Ш). Вычислите
Координационная химия
249
максимальное количество гексамминхрома(Ш), которое студент мог получить из образца бихромата аммония массой 1,00 г.
2. Сколько молей AgCl осаждается при добавлении нитрата серебра к раствору вещества с эмпирической формулой СоС13 • 5NH3 (в расчете на моль имеющегося кобальта)? Объясните ответ.
3. Со(Ш) образует октаэдрические комплексы с эмпирической формулой общего вида СоС1т • nNH3. Какие значения могут принимать числа п и т в этих формулах? Какими должны быть значения пит для комплекса, из которого осаждается 1 моль AgCl в расчете на каждый моль имеющегося Со?
4. Сколько ионов на моль соединения с эмпирической формулой PtCl4 • 3NH3 должно образовываться при его растворении в воде? Дайте аналогичный ответ для соединения PtCl2 • 3NH3. Схематически изобразите каждый из комплексных катионов, входящих в указанные соединения.
5. Каждое из веществ K2PtCl6, Co(NH3)6Cl3, Cr(NH3)4Cl3 и Pt(NH3)6Cl4 растворяют в воде, получая 0,001 М раствор. Расположите указанные вещества в последовательности уменьшения электропроводности их растворов. Запишите по-иному формулу каждого соединения, пользуясь скобками для выделения комплексного иона, присутствующего в водном растворе.
Формулы и номенклатура
6. Дайте номенклатурные названия соединений [Со(ЫН3)4С12]Вг, К3Сг(СЫ)6 и Na2CoCl4.
7. Запишите формулы каждого из нижеперечисленных соединений, пользуясь скобками для отделения комплексного иона от остальных ионов: а) перхлорат гексааквоникеля(П), б) бромид трихлоротриам-минплатины(1У), в) сульфат дихлоротетрамминплатины(1У), г) моно-хлоропентацианоферрат(Ш) калия.
8. Запишите формулы каждого из нижеперечисленных соединений, пользуясь скобками для выделения комплексного иона: а) хлорид гидрок-сопентааквоалюминия(Ш), б) трикарбонатокобальтат(Ш) натрия, в) гексацианоферрат(П) натрия, г) гексанитрокобальтат(Ш) аммония.
Изомеры
9. Сколько изомеров у соединения [Cr (NH3)4C12] О? Дайте их схематические изображения.
10. Изобразите все геометрические и оптические изомеры PtCl2I2 (NH3)2.
11. Сколько геометрических и оптических изомеров у комплексного иона Со(еп)2С12 ? Среди этого числа сколько пар изомеров являются зеркальными изображениями один другого? Сколько изомеров имеют плоскость симметрии и, следовательно, не образуют пары оптических изомеров?
12. Ответьте на те же вопросы, что и в задаче 11, применительно к пропилендиаминовому, а не этилендиаминовому комплексу. Не принимайте
Гшы 2/) 250
во внимание оптические изомеры, связанные с асимметрическим пропиленовым атомом углерода.
13. Сколько различных структурных изомеров возможно у вещества с эмпирической формулой FeBrCl 3NH3 -2Н2О? Сколько различных геометрических изомеров имеет каждый из структурных изомеров этого вещества? Сколько из этих геометрических изомеров можно попарно сгруппировать в оптические изомеры?
Электронная структура
14. Ион Со2 + в водном растворе октаэдрически координирован и парамагнитен, причем он обладает тремя неспаренными электронами. Какое (или какие) из следующих утверждений вытекает из этого экспериментального факта:
а) комплекс Со(Н2О)4 + имеет плоско-квадратную структуру; б) комплекс Со(Н2О)4 + имеет тетраэдрическую структуру; в) комплекс Со(Н2О)б+ имеет большую энергию расщепления, Ао, чем энергию спаривания электронов; г) d-уровни кобальта расщеплены по энергии и заполнены следующим образом: (12в)5(ев)2; Д) d-уровни кобальта расщеплены по энергии и заполнены следующим образом: (t2g)6(eg)1.
15. Координационное соединение гексафторохромат(Ш) калия является парамагнитным. Какова формула этого соединения? Какова в нем конфигурация d-электронов Сг?
16. Сколько неспаренных электронов у ионов Сг3 + , Cr2 + , Mn2 + , Fe2 +, Со3 +, Со2 + : а) в сильно октаэдрическом поле лигандов, б) в очень слабом октаэдрическом поле?
17. Низкоспиновые тетраэдрические комплексы никогда не были получены, хотя существует много высокоспиновых комплексов с этой геометрией. Какой вывод относительно величины энергии расщепления можно сделать из этого факта?
18. Обнаружено, что некоторые комплексы платины являются активными противораковыми препаратами. К их числу относятся tpc-Pt(NH3)2Cl4, цис-Pt (NH3)2C12 и цпс-Pt (ен)С12 (ни один из транс-изомеров не эффективен в этом отношении). Воспользуйтесь теорией валентных связей для объяснения диамагнетизма этих комплексов. Являются ли эти комплексы внутриорбитальными или внешнеорбитальными? Какие гибридные орбитали используются для образования химических связей в этих комплексах?
19. Какова d-орбитальная электронная конфигурация иона Cr(NH3)|+? Сколько неспаренных электронов в этом комплексном ионе? Если шесть ионов Вг заместят в нем шесть групп NH3, в результате чего получится комплекс СгВг^ ” , возрастет или уменьшится при этом энергия расщепления, Ао?
20. Постройте диаграмму электронных уровней комплексов Fe(H2O)?+ и Fe(CN)g" в рамках теории валентных связей и теории кристаллического поля. Кратко сопоставьте полученные модели электронного строения комплексов.
Координац ион пая х и.ии.ч
251
21. Постройте качественные диаграммы d-орбитальных энергетических уровней и укажите распределение по ним d-электронов для каждого из следующих комплексов:
a) Ni(CN)4~ (плоско-квадратная структура),
б) Т1(Н2О)б+ (октаэдрическая структура),
в) №СЦ ~ (тетраэдрическая структура), r)-CoF^_ (высокоспиновый комплекс), д) Co(NH3)^+ (низкоспиновый комплекс).
22. Со(П1) образует комплексный ион Co(NH3)g+. а) Какова геометрия этого иона? Пользуясь теорией валентных связей, укажите, какие орбитали Со используются для образования связей с лигандами, б) Дайте номенклатурное название хлоридной соли этого комплексного иона, в) Пользуясь теорией кристаллического поля, схематически изобразите возможные варианты d-электронной конфигурации этого иона. Охарактеризуйте каждую конфигурацию как высокоспиновую или низкоспиновую, парамагнитную или диамагнитную. Какие две из этих характеристик применимы к гексамминному комплексу? г) Добавление электрона к иону Co(NH3)g+ приводит к его восстановлению в ион Co(NH3)g + . Укажите предпочтительную d-электронную конфигурацию для этого восстановленного иона. Почему она является предпочтительной?
23. Pt(II) образует комплексный ион PtClJ . а) Какова геометрия этого иона? Пользуясь теорией валентных связей, укажите, какие орбитали Pt используются для образования связей с ионами С1 “ ? б) Дайте номенклатурное название натриевой соли этого комплексного иона, в) Пользуясь теорией кристаллического поля, схематически изобразите d-электронную конфигурацию данного иона. Парамагнитен или диамагнитен этот ион? г) Pt(II) может быть окислена до Pt(IV). Укажите d-электронную конфигурацию хлоридного комплексного иона Pt(IV). Объясните различие между этой конфигурацией и конфигурацией хлоридного комплекса Pt(II). Парамагнитен или диамагнитен хлоридный комплекс Pt(IV)?
Константы образования
24. Приготовлен 0,025 М раствор тетрамминмеди(П), Cu(NH3)4+. Какой должна быть концентрация гидратного иона меди, если концентрация аммиака равна 0,10, 0,50, 1,00 и 3,00 моль-л’1 соответственно? Какая концентрация аммиака необходима, чтобы концентрация Си2 + не превышала 10" 15 моль л _ 1 ?
25. Пользуясь данными табл. 20-8, вычислите pH для 0,10 М раствора иона Сг3 +
Указание. Рассмотрите реакции
Сг3 + + Н2О Сг(ОН)2+ + Н +
К = ?
Глава 20
252
Cr3 + + ОН ~ <=t Сг(ОН)2 +
Кобр = 1 • Ю10
Н+ + ОН - Н2О'
КНгО = ?
26. Пользуясь данными табл. 20-8, вычислите pH для 0,10 М растворов Mn2 + , Fe2 + и Ag + . Если необходимо, ознакомьтесь со способом решения задачи 25. Можно ли на основании результатов решения этих двух задач установить корреляцию между «кислотностью» положительных ионов и их зарядом?
27. Ион Со(МН3)б+ обладает очень большой устойчивостью, как это видно по его константе образования, Ко6р = 2,3 -1034. Учитывая, что константа гидролиза для иона аммония Кь = 5 • 10“ 10, покажите, что равновесие в реакции
Co(NH3)g+ + 6Н+ Со3 + + 6NH4
смещено далеко вправо. Почему же тогда Co(NH3)g + не разлагается в горячей концентрированной серной кислоте?
28. Какова концентрация хромат-иона, СгО4", при контакте твердого ВаСгОд с водой? Какова концентрация хромат-иона, если твердый ВаСгО4 находится в контакте с 0,2 М раствором Ва2 + ? ВаСгО4 может быть растворен в растворе пиридина (ру), в результате чего образуется комплекс Ва(ру)2+, константа образования 4-1012. Если ОДОМ ВаСгО4 растворить в растворе с постоянной концентрацией пиридина 1,0 моль-л-1, какой окажется концентрация иона Ва2 + ?
29. Какова растворимость Си(ОН)2 в чистой воде? В буферном растворе с pH 6? Медь(П) образует с NH3 комплекс Cu(NH3)4 + , имеющий константу образования Ко6р = 1,0-1012. Какую концентрацию аммиака следует поддерживать в растворе, чтобы в 1 л растворилось 0,10 моля Сп(ОН)2?
30. Вычислите концентрацию иона серебра в насыщенном водном растворе AgCl. Ион серебра реагирует с находящимся в избытке ионом С1“ по уравнению
Ag+ + 2СГ £ AgCl;
Ко6р = 1 • ю2
Вычислите концентрацию AgCl; и покажите, что при вычислении концентрации иона серебра в первом вопросе задачи справедливо использование предположения о незначительном образовании комплексного иона.
31. Константа образования, Ко6р, пиридинового комплекса серебра
Ag+ 4- 2ру Ag(py)2+
равна 1 1О10. Если исходный раствор имеет концентрацию 0,10 М по
Координационная химия
253
AgNO3 и 1,0 М по пиридину, то какова равновесная концентрация иона серебра, пиридина и комплексного иона?
32. В 0,10 М растворе NaCl концентрация иона серебра не может превышать 10 “ 9 моль • л “ \ поскольку AgCl имеет низкую растворимость. Какая концентрация пиридина должна быть создана в этом растворе, чтобы в 1 л его растворилось 0,10 моля AgCl?
ПОСЛЕСЛОВИЕ:
КООРДИНАЦИОННЫЕ КОМПЛЕКСЫ И ЖИВЫЕ СИСТЕМЫ
С тех пор как человек осознал, что живет на планете, вращающейся вокруг одного из множества солнц, а не покоящейся в центре мироздания, он стал задаваться вопросом-является ли жизнь на Земле исключительным (или случайным) чудом либо представляет собой часть общей жизни во Вселенной. Астроном Иоганн Кеплер (1571-1630) написал научно-фантастическую повесть «Сон, или Посмертное сочинение о лунной астрономии», в которой он описал жизнь на Луне, «увиденную» при помощи нового изобретения-телескопа. Его воображение нарисовало разумных гуманоидов и быстро развивающуюся растительность, которая пускала побеги, созревала и умирала в течение одного лунного дня.
Сегодня мы знаем, что любые гуманоиды на Луне или Марсе могут быть только иммигрантами. Однако не исключено, что удастся найти на Марсе остатки простейших форм жизни или возможных предшественников каких-либо форм жизни и что они позволят сделать новые предположения о том, как развивалась жизнь на Земле. В течение многих лет ученые извлекают и анализируют органические вещества из метеоритов. Ведется спор, имеют ли эти органические вещества действительно метеоритное происхождение или же являются только земными загрязнениями, а также имеют ли они биологическое происхождение.
Одним из веществ, обнаружение которых в метеоритных образцах убедительно подтверждает гипотезу существования внеземной жизни, является порфин (рис. 20-18), а также его производные, порфирины. Порфирины представляют собой плоские молекулы, обладающие свойствами тетраден-татных хелатных групп* для металлов Mg, Fe, Zn, Ni, Co, Си и Ag, с которыми они образуют плоско-квадратные комплексы, показанные на рис. 20-19. Один из таких комплексов с железом, имеющий боковые цепи, изображен на рис. 20-20 и называется группой гема. Порфириновый комплекс магния с органической боковой цепью, показанный на рис. 20-21, представляет собой хлорофилл.
* Название хелат происходит от греческого слова «клешня»; тетрадентатный буквально означает «четырехзубый». Хелаты с двойной, тройной или четверной координацией к иону металла называются бидентатными, тридентатными или те-традентатными соответственно. Может показаться, что говорить о клешнях с зубами нелогично, но любителям омаров и крабов не должна быть странной такая терминология.
I.lUKll Л'
254
Рис. 20-19. Образование порфиринового комплекса. Молекула порфирина способна играть роль тетрадентатной
Рис. 20-18. Молекула порфина. Молекулы порфинов, в которых восемь внешних атомов водорода по периферии кольца замещены боковыми группами, называются порфиринами.
хелатной группы, координируясь вокруг иона таких металлов, как Mg, Fe, Zn или Си.
сн, сн=сн,
сн3
сн=сн2
СН.СООН
Рис. 20-20. Комплекс железа с порфирином. Комплекс, имеющий указанные здесь боковые группы, называется группой гема.
Координационная химия
255
формильная группа
метильная группа
СН3 СИ, _„о
СН3-СН-СН2-СН2- (СН2-СН-СНа-СН,)2СНа— С-СН- CHjO—
<^3
фитильная группа
Рис. 20-21. Комплекс магния с про- важную роль в фотосинтезе. Хлоро-
изводным порфирина. Этот комплекс филл b вместо метильной группы
называется хлорофиллом а и играет имеет формильную группу.
Эти два соединения, хлорофилл и гем, играют важнейшую роль в сложном механизме поглощения солнечной энергии и ее превращении для использования живыми организмами. Мы уже знаем, что характерным свойством комплексов переходных металлов является наличие нескольких близко расположенных d-уровней, что позволяет им поглощать свет в видимой области спектра и придает окраску. Порфириновый цикл вокруг иона Mg2 + в молекуле хлорофилла выполняет такую же роль. Хлорофилл в растениях поглощает фотоны видимого света и переходит в возбужденное электронное состояние (рис. 20-22). Эта энергия возбуждения может инициировать цепь химических реакций, приводящих в конце концов к образованию сахаров из диоксида углерода и воды:
hv
6СО2 + 6Н2О -------- СбН12О6 + 6О2
глюкоза
Большинство соединений непереходных элементов неспособно поглощать видимый свет, так как в них нет достаточно близко расположенных энергетических уровней. Этим свойством не обладает и изолированный ион Mg2 +. Но в координационном комплексе Mg2 + с плоско-квадратным хе-
Глава 20
256
Рис. 20-22. Спектр поглощения хлорофилла а. Это вещество поглощает видимый свет во всех диапазонах, кроме
области вблизи 500 нм (зеленый свет), и поэтому кажется зеленым.
латным лигандом имеются такие уровни, и поэтому хлорофилл способен поглощать свет и использовать его энергию для химического синтеза.
В настоящее время ученые придерживаются точки зрения, что зарождение жизни на Земле происходило в восстановительной атмосфере, которая состояла из аммиака, метана, воды и диоксида углерода, но не содержала свободного кислорода. Свободный кислород разрушал бы органические соединения быстрее, чем они могли синтезироваться в результате естественно протекающих процессов (под воздействием электрического разряда, ультрафиолетового излучения, теплоты или естественной радиоактивности). В отсутствие свободного кислорода органические соединения могли накапливаться в океанах в течение какой-то эры до тех пор, пока, наконец, не появились компактные, локализованные образования из химических веществ, которые можно уже считать живыми организмами.
Появившиеся живые организмы могли поддерживать существование за счет разрушения естественно образующихся органических соединений, поглощая их энергию. Но если бы это был единственный источник энергии, то жизнь на нашей планете была бы крайне ограниченной. К счастью, около 3 миллиардов лет назад появились важные соединения металлов с порфиринами, и это открыло путь к использованию совершенно нового источника энергии солнечного света. Первым шагом, который поднял жизнь на Земле над скромной ролью простого потребителя энергоемких органических соединений, было включение в нее процессов координационной химии.
К сожалению, фотосинтез (так называется химический процесс с поглощением фотонов хлорофиллом) приводит к высвобождению опасного по
бочного продукта, кислорода. Кислород был не только бесполезен для ранних организмов, он конкурировал с ними, окисляя естественно образующиеся органические соединения прежде, чем они могли быть окислены в процессе метаболизма этими организмами. Кислород представлял собой гораздо более эффективный «пожиратель» энергоемких соединений, чем живая материя. Еще хуже было то, что слой озона, О3, который постепенно образовывался из кислорода в верхней части атмосферы, преграждал доступ ультрафиолетовому излучению Солнца и еще более замедлял естественный синтез новых органических соединений. Со всех современных точек зрения, появление свободного кислорода в атмосфере представляло собой угрозу для жизни.
Но, как часто случается, жизнь сумела обойти это препятствие и даже обратила его в преимущество. Отходами жизнедеятельности первичных простейших организмов были такие соединения, как молочная кислота и этанол. Эти вещества намного менее энергоемки по сравнению с сахарами, но они способны высвобождать большое количество энергии, если полностью окисляются до СО2 и Н2О. В результате эволюции возникли живые организмы, способные «фиксировать» опасный кислород в виде Н2О и СО2, а взамен получать энергию сгорания того, что прежде было их отходами. Так появился аэробный метаболизм.
Значительный успех на этом пути снова был достигнут благодаря процессам координационной химии. Центральную роль в механизме аэробного метаболизма, который приводит к полному сгоранию органических молекул, играют цитохромы. Так называются молекулы, в которых атом железа связан в комплекс с порфирином, образуя с ним гем (см. рис. 20-20), а гем связан с белком. Атом железа переходит из состояния окисления + 2 в + 3 и обратно в результате переноса электронов от одного компонента цепи к другому. Весь аэробный механизм представляет собой совокупность тесно связанных друг с другом окислительно-восстановительных реакций, окончательным результатом которых является процесс, обратный фотосинтезу:
6О2 + С6Н12О6 -----► 6СО2 + 6Н2О
глюкоза
Высвобождаемая энергия накапливается в организме и может использоваться им при необходимости. В целом всю сложную хлорофилло-цито-хромную систему можно рассматривать как механизм для превращения энергии солнечных фотонов в химическую энергию, запасаемую в мышечных тканях живых существ.
Атомы железа обычно образуют комплексы с октаэдрической координацией. Что же происходит с двумя координационными положениями выше и ниже плоскости порфиринового цикла? В цитохроме с группа гема находится в углублении на поверхности молекулы белка (рис. 20-23). От каждой стенки этого щелевидного углубления к гему направлено по одному лиганду: с одной стороны атом азота с неподеленной парой, принадлежащий гистидиновой группе белка, а с другой стороны атом серы с непо-9-796
группа гема ( вид сЗоку)
Рис. 20-24. Октаэдрическая координация атома железа в цитохроме с пятью атомами азота и атомом серы. Один из атомов азота и атом
серы принадлежат боковым группам белковой цепи. Остальные четыре атома азота принадлежат порфириновому циклу гема.
деленной парой от метиониновой группы (рис. 20-24). Таким образом, октаэдрические координационные положения вокруг атома железа заняты с пяти сторон атомами азота, а с шестой стороны-атомом серы.
Как функционирует молекула цитохрома с, пока еще неизвестно. Структура ее варианта с железом(Ш) была определена только в 1969 г. методом дифракции рентгеновских лучей, а структура варианта с восстановленным железом(П)-в 1971 г. Лиганды в комплексе вокруг железа и компактная структура всего белка изменяют окислительно-восстановительную химию атома железа и обеспечивают связь окислительных и восстановительных процессов с предыдущими и последующими звеньями цепи терминального окисления.
Рис. 20-23. Цитохром с, который представляет собой глобулярный белок со 104 аминокислотами, связанными в одну цепь, и группой гема, содержащей атом железа. На этом схематическом рисунке каждая аминокислота условно представлена пронумерован-
ной сферой и указаны только важнейшие боковые цепочки аминогрупп. Группа гема видна почти сбоку в вертикальной щели в молекуле. Из статьи: Dickerson R.E., Geis I., Scientific American, 1972, April, 62.
9"
История металлопорфириновых комплексов на этом еще не заканчивается. К знаменитому закону Паркинсона можно было бы добавить еще один подпункт: организмы развиваются, чтобы приспособиться к имеющимся источникам пищи. Когда появились новые источники энергии, стали развиваться многоклеточные организмы. Но при этом возникла новая проблема, связанная уже не с получением пищи или кислорода, а с транспортировкой кислорода в надлежащее место организма. Малые организмы могли обходиться просто диффузией газов через содержащиеся в них жидкости, но этого недостаточно для многоклеточных существ. Так перед эволюцией возникла очередная преграда.
Выход из тупика в третий раз оказался возможен благодаря процессам координационной химии. Появились такие молекулы, состоящие из железа, порфирина и белка, в которых железо могло связывать молекулу кислорода, не окисляясь при этом. Окисление Fe(II) после первой стадии связывания в них не осуществляется. Кислород просто переносится в различные участки организма, чтобы высвободиться при надлежащих условиях - кислотности и недостатке кислорода. Одна из таких молекул, гемоглобин,
Рис. 20-25. Схематическое изображение молекулы миоглобина, которая является хранителем молекулы кислорода в мышечной ткани. Группа гема изображена в виде плоского диска, а атом железа-в виде шарика в ее центре. Буква W в кружке указывает
туры полипептидной цепи показаны двойной штриховой линией. Из книги: Dickerson R. Е., Geis I., The Structure and Action of Proteins, W. A. Benjamin, Menlo Park, Calif., 1969.
переносит О2 в крови, а другая, миоглобин, получает и запасает О2 в мышечных тканях до тех пор, пока он не понадобится в цитохромном процессе.
Молекула миоглобина схематически изображена на рис. 20-25. Как и в цитохроме с, четыре из шести октаэдрических координационных положения вокруг атома железа заняты атомами азота, принадлежащими гему. Пятое положение занимает атом азота от гистидина. Однако в шестом положении лиганд отсутствует. В этом месте может координироваться молекула кислорода, указанная буквой W в кружке. В миоглобине атом железа находится в состоянии окисления + 2. Если железо окисляется, молекула дезактивируется и место кислорода занимает молекула воды.
Гемоглобин представляет собой образование из четырех миоглобиноподобных молекул (рис. 20-26). Структуры молекул миоглобина и гемоглобина удалось установить лишь в последнее десятилетие методом дифракции рентгеновских лучей. Было показано, что четыре компонента-
Рис. 20-26. Схематическое изображение молекулы гемоглобина, которая является переносчиком кислорода в кровотоке. Она состоит из четырех частей, каждая из которых построена
подобно молекуле миоглобина. Из книги: Dickerson R. Е., Geis I., The
Structure and Action W. A. Benjamin, Menlo 1969.
of Proteins, Park, Calif.,
гемоглобина при связывании кислорода смещаются друг относительно друга на 7 А. Гемоглобин и миоглобин стали теперь модельными системами для исследований в координационной химии. Почему связывание комплекса железа с шестым лигандом заставляет компоненты белка перестраиваться? Каким образом молекула кислорода высвобождается из гемоглобина в кислой среде (каковой является обедненная кислородом мышечная ткань)? Каким образом осуществляется столь тонкое взаимодействие между двумя координационными соединениями, гемоглобином и миоглобином, что миоглобин связывает кислород, как только гемоглобин высвобождает его в мышечных тканях?
Гем, или порфирин железа, входит также в активные центры ферментов, таких, как пероксидаза и каталаза. Многие другие переходные металлы также являются важнейшими участниками ферментативного катализа; некоторые из них будут обсуждены в гл. 21. В результате появления миоглобина и гемоглобина были сняты ограничения на размеры живых организмов. Это привело к появлению разнообразных многоклеточных организмов. Поскольку переходные металлы и органические циклические системы с двойными связями, подобные порфиринам, чрезвычайно приспособлены к поглощению видимого света, а их комбинации проявляют разнообразные окислительно-восстановительные свойства, жизнь можно рассматривать как одну из областей, где протекают процессы координационной химии.
1. Basolo F., Johnson R., Coordination Chemistry, W. A. Benjamin, Menlo Park, Calif., 1964.
2. Коттон Ф., Уилкинсон Дж., Основы неорганической химии. Пер. с англ. М.: Мир, 1979.
3. Dickerson R. Е.. "The Structure and History of an Ancient Protein” (cytochrome c)”, Scientific American, April, 1972.
4. Dickerson R. E., “Chemical Evolution and The Origin of Life”, Scientific American, September, 1978.
5. Gray H. B., Chemical Bonds, W. A. Benjamin, Menlo Park, Calif., 1973.
6. Грей Г.Б., Электроны и химическая связь. Пер. с англ.-М.: Мир, 1967.
7. Larsen Е. М., Transitional Elements, W. A. Benjamin, Menlo Park, Calif., 1965.
8. Оргел Л., Введение в химию переходных металлов. Пер. с англ.-М.: Мир, 1962.
9. Rochow E.G., Organometallic Chemistry, Van Nostrand Reinhold, N. Y., 1964.
ГЛАВА
21
Особая роль углерода в химии
Органическая химия вполне может свести человека с ума. Она создает у меня впечатление девственного тропического леса, полного самых удивительных вещей; из этой чудовищной и безграничной чащи невозможно выбраться и в нее страшно войти.
Фридрих Вёлер (1835)
Важнейшие понятия
21-1. Особые свойства углерода: полимеризация, образование разветвленных цепей, кратные связи и делокализация.
21-2. Химия элементов - ближайших соседей углерода по периодической системе: бора, азота, кремния.
21-3. Насыщенные углеводороды,-алканы. Структурная изомерия. Систематическая номенклатура. Циклические углеводороды. Конформации циклогексана типа «ванна» и «кресло». Реакции: горение, дегидрирование и галогенирование.
21-4. Ненасыщенные углеводороды - алкены и алкины. Геометрическая изомерия, цис- и шранс-Изомеры. Стерические препятствия. Сопряженные системы.
21-5. Производные углеводородов. Радикалы и функциональные группы. Реакции замещения. Спирты, простые эфиры, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, амины, аминокислоты. Пептидные связи, пептиды и белки.
21-6. Ароматические соединения. Структура и реакционная способность.
21-7. Поглощение света ароматическими соединениями. Кислотно-основные индикаторы.
21-8. Углеводы. Моносахариды: глюкоза и другие. Полисахариды: целлюлоза и крахмал.
21-9. Белки и ферменты. Глобулярные и фибриллярные белки.
21-10. Механизм действия ферментов. Каталитический механизм и специфичность к субстрату.
21-11. Энергия и метаболизм в живых системах: гликолиз, цикл лимонной кислоты и дыхательная цепь. Фотосинтез.
Термин «органическая» применительно к химии во времена Фридриха Вёлера означал «живая». В те времена органическая химия имела дело с различными соединениями, которые извлекали из живых организмов. Большинство химиков проводило резкую грань между органическими и неорганическими соединениями; последним они приписывали некую особую «жизненную силу». Но в 1828 г. Вёлер разрушил представление о жизненной силе самым непосредственным образом, показав, что молекула мочевины, вещества безусловно биологического происхождения, может быть получена лабораторным путем просто в результате нагревания неорганической соли цианата аммония, вещества несомненно небиологического происхождения:
О II nh4ocn -> nh2—с—nh2 цианат мочевина
аммония
За этим быстро последовал синтез других органических веществ. Термин органическая химия постепенно приобрел значение химии соединений углерода, так что когда химикам XX в. понадобилось говорить конкретно о процессах, протекающих в живых организмах, им пришлось придумать новый термин - биохимия. Правильнее сказать, что химия жизни является подразделом химии соединений углерода, и стоит поразмыслить, почему это так.
Утверждение Вёлера о сложности органической химии звучит актуально и сегодня, но совершенно на другом уровне знаний. Ученые ответили на многие вопросы, ставившие в тупик Вёлера, но теперь возникли вопросы, которые он никогда бы не мог поставить. Чарльз Дарвин однажды заметил: «Спрашивать о происхождении жизни просто глупо; точно так же можно спрашивать и о происхождении материи». Показательно, насколько далеко мы продвинулись, если ученые сегодня заняты решением обоих этих вопросов и разрабатывают эксперименты для ответа на них. Одна из целей посылки на Марс непилотируемых американских кораблей типа «Викинг» заключалась в поиске жизни на этой планете. Хотя результаты нельзя считать полностью определенными, они настолько отрицательны, что мало кто верит в будущие попытки открыть жизнь на Марсе. Интересно, что все эксперименты с «Викингами» выполнялись в молчаливом предположении, что жизнь должна иметь
углеродную основу. И никто не считает, что эта гипотеза ответственна за отрицательные результаты экспериментов или что Марс населен существами, построенными на кремниевой или азотной основе. По-видимому, углерод играет исключительную роль в существовании жизни, и в первой части данной главы обсуждается, в чем причина этого. Остальной материал главы представляет собой краткий обзор двух очень больших областей химии - органической химии и биохимии. Некоторые главы данной книги знакомят с основополагающими законами и важнейшими методами химии и требуют глубокого изучения. Другие, как, например, эта глава, включены в книгу, чтобы дать читателю представление о всей химии в целом. Читая эту главу, следует стараться лишь понять сказанное и оценить его важность, но не запоминать всего.
Химия углерода по развитию оставляет далеко позади химию всех остальных элементов. Американское химическое общество регистрирует все химические соединения, упоминавшиеся в литературе с 1965 г. К середине 1978 г. было зарегистрировано 4,25 миллиона различных химических веществ. Из них 4 миллиона представляют собой соединения на углеродной основе, а остальные четверть миллиона приблизительно поровну распределяются между сплавами и неорганическими соединениями. Следовательно, если исключить из рассмотрения металлические сплавы, нам известно в 32 раза больше органических соединений, чем неорганических! Столь большое число соединений углерода обусловлено тем, что углерод способен в гораздо большей степени, чем любой другой элемент, связываться сам с собой, образуя прямые и разветвленные цепи. Некоторые из его соединений показаны на рис. 21-1. Цепи, образуемые повторением одной и той же структурной единицы, называются полимерами, а сама повторяющаяся структурная единица - мономером.
Углеводороды представляют собой соединения, включающие только атомы С и Н. Простейшими углеводородами являются линейные полимеры с повторяющейся структурной единицей —СН2—, которые оканчиваются атомами водорода. Другие углеводороды состоят из разветвленных цепей или циклически связанных атомов. Бутан-газ, используемый для отопления и приготовления пищи,-представляет собой тетрамер (четыре структурные единицы). Полимеры, содержащие от 5 до 12 углеродных звеньев, входят в состав бензина; одним из примеров является гептан (см. рис. 21-1). Керосин представляет собой смесь молекул, содержащих от 12 до 16 атомов углерода, а смазочные масла и парафиновый воск-смеси цепей с 17 и более атомами углерода. Полиэтилен содержит от 5000 до 50000 мономерных единиц —СН2— в каждой цепи. Существует много других органических цепей, содержащих кроме С и Н еще и другие атомы. Неопреновый каучук, тефлон и дакрон (см. рис. 21-1) являются синтетическими полимерами, а полипептидная цепь, показанная в самой нижней части рис. 21-1, представляет собой полимер, из которого построены все белки-шелк, шерсть, волосы, кол-
н
I н—с—н
I н
н н н н
I I ! I н—с—с—с—с—н 1111 н н н н
н I н—с—н 7 I V н-с—с—с—н I I I н н н
метан
н-дутан
изобутан
Н Н Н Н Н Н Н
I I I I I I I
н—с—с—с—с—с—с—С—н
I ! I I 1 I I
н н н н н н н
н-гептан
н н н н н н
I I I I I I
—с—с—с—с—с—с--------
I I I I I I
Н Н н н н н
полиэтилен
НН ннн ннн ннн н
II III III III I
--с—c=c—с—с—c=c—с—с—c=c—с—с—c=c—с-----
I III III III II
Н Cl Н Н Cl Н н С1 Н Н С1 н
полихлоропрен (неопреновый каучук)
F F Т
I I I
---С—С —С—С—С—•••
I I I
F F F
О О Н Н
II I I
С- о— с— с-
I I
Н Н
полифторэтилен (тефлон)
полиэтилен терефталат (дакрон)
R! Н Н О R, Н Н О Rs I I II I I I II I — N—С—С—N—С—С—N —С—С —N—С—С—N—С—С—•••
I I II I I I II I I I II
Н Н О Ri Н Н О R, Н Н о
полипептиды (белки)
Рис. 21-1. Природные и синтетические цепи углеродных атомов, включающие азот и кислород. Первые пять соединений-углеводороды с последовательно увеличивающейся длиной цепи, начиная от метана, за которым следуют топливный газ бутан и один из компонентов бензина, гептан, и кончая полиэтиленовым полимером. Наличие двойной связи у каждого четвертого атома углерода в полихлоропрене
является характерным признаком природных и синтетических каучуков. В полиэтилентерефталате (дакроне) имеются кратные связи двух типов: ДВОИКиЯ СВЯЗЬ С?—О С y'IG.CTtIC'vi лизованной связывающей тг-орбитали и делокализованная ароматическая связь. Полипептидные цепи образуют двумерный каркас в результате образования поперечных связей (сшивания), как показано на рис. 21-2.
лаген, гемоглобин, ферменты, антитела [R1; R2, R3 и т.д-химически неэквивалентные боковые группы (радикалы)].
Поскольку атомы углерода могут образовывать до четырех связей, они способны создавать разветвленные и сшитые цепи. Изображенный на рис. 21-1 изобутан имеет разветвленную цепь и является изомером линейной молекулы С4Н10. На рис. 21-2 показаны молекулы натурального шелка и его синтетического аналога, найлона. Обе молекулы построены из параллельных, ковалентно связанных цепей, соединенных между собой водородными связями в листовую структуру. Бакелит и мелмак представляют собой твердые, негибкие пластинки, поскольку их мономеры связаны ковалентными связями во всех трех измерениях, образуя сшитую структуру.
Другой отличительной чертой химии углерода является способность к образованию двойных связей между двумя атомами углерода или между атомом углерода и другими элементами, причем такие связи обычно возникают в средней части цепей. В неопреновом каучуке двойные связи существуют между атомами углерода. Дакрон содержит двойные связи между атомами углерода и кислорода, а кроме того, в нем существуют делокализованные кратные связи, с которыми мы познакомились в гл. 13 на примере бензола. На рис. 21-3 изображены другие соединения углерода с двойными связями. Поскольку двойная связь часто может быть превращена в простую связь в результате присоединения атома к каждому
Рис. 21-2. Три варианта природных и синтетических полимеров.
а-шелк, состоящий из полипептидных
цепей, которые связаны друг с другом водородными связями в двумерные листы;
(СН2)(_
(CH2)._n
I H
I 11
N ~(CH 2). _N C ~(CH2)
I H
I
N~(CH2)
"N-(CH2)6_n^C (CHi5 I H
II
C-(CH2)
Рис. 21-2 (продолжение).
б-найлон-6,6, молекула которого имеет строение, напоминающее поли-пептидную цепь шелка. Найлон-6,6 впервые был получен в 1935 г. В. Каротерсом (фирма Е. I. Du Pont de Nemours and Co.). Он имеет такие же водородные связи, как в шелке, но расположенные через большие интервалы вдоль цепей. В обоих случаях ось нити располагается в плоскости рисун
ка и параллельно ковалентно связанным цепям;
в-бакелит-одна из первых синтетических смол, полученная в 1907 г. Л. Г. Бакелендом, который также внес значительный вклад в химию гЬотогпа-фического процесса. Бакелит относится к классу фенолформальдегидных смол, прочность и твердость которых обусловлена существующим в них трехмерным каркасом ковалентных связей.
н н н
I I I н-с-с=с
I I н н
пропен
циклогексабиен-1,3
бензол
нафталин
ДДТ
I
Н
аренин
Н СН2
СН—СН— СН—СН2 1111
ОН он он он
рибофлавин (витамин В2)
Рис. 21-3. Примеры двойных связей и делокализованных связей в органических соединениях. Аденин, важный компонент генетического полимера ДНК (дезоксирибонуклеиновой кислоты) и энергоемкой молекулы АТФ (аденозинтрифосфата), представляет собой пентамер молекулы HCN. Он
был получен из HCN в условиях, воспроизводящих условия на Земле на ранних стадиях эволюции жизни. Штриховые линии означают делокализованные связи такого типа, какой существует в бензоле и был описан в гл. 13.
концу исходной двойной связи, соединения с двойными связями называют ненасыщенными:
сн2=сн2 + н2 — сн3—сн3
зтен этан
СН2 = СН2 + НС1 -> СН3 — СН2 — С1 этен зтилхлориЬ
(Этен-номенклатурное название С2Н4; его тривиальное название-этилен.) Соединения с циклическим расположением атомов, имеющие делокализованные, бензолоподобные кратные связи, называют ароматическими. Дакрон, нафталин, ДДТ, аденин и рибофлавин (см. рис. 21-1 и 21-3) содержат ароматические группы. На примере аденина и рибофлавина видно также, что углерод способен образовывать двойные связи с азотом и что азот может принимать участие в образовании ароматических циклов с делокализованными кратными связями. Многие разделы органической химии связаны с особыми свойствами систем, включающих ароматические циклы. Ароматические молекулы и комплексные соединения переходных металлов являются двумя важнейшими классами соединений, в которых энергия, необходимая для возбуждения электрона, приходится на видимую часть спектра. Поэтому практически все красители представляют собой такие соединения и принимают участие в механизмах захвата и переноса энергии фотонов.
Из всего сказанного следует, что углерод в органических соединениях проявляет четыре следующих отличительных свойства:
1. Способность к образованию длинноцепочечных полимеров со связями С—С.
2. Способность к образованию разветвленных и сшитых цепей связей. 3. Способность к образованию двойных и тройных связей.
4. Способность к образованию делокализованных ароматических связей. Интересно, в какой мере эти свойства присущи другим элементам -ближайшим соседям углерода по периодической системе-бору, азоту и кремнию? Какие свойства присущи только углероду и чем это объясняется? Какая комбинация электронов и орбиталей обусловливает столь многогранные свойства углерода?
Бор, углерод и азот принадлежат к числу элементов второго периода и имеют сходные размеры. Они отличаются по числу валентных электронов: бор обладает тремя валентными электронами, углерод-четырьмя, а азот-пятью. Кремний - элемент третьего периода.-подобно углероду, имеет четыре валентных электрона, но они находятся на один главный энергетический уровень дальше от ядра и характеризуются главным квантовым числом 3, а не 2. Под своими валентными электронами
271
Si имеет 10 внутренних электронов: 2 с главным квантовым числом 1 и 8 с главным квантовым числом 2. В отличие от этого В, С и N имеют под валентной оболочкой всего по 2 внутренних электрона. Все различия между химическими свойствами В, С, N и Si, которые интересуют нас в данной главе, связаны с этими двумя указанными факторами: числом валентных электронов и числом электронов, заполняющих внутренние орбитали.
Атом бора имеет три валентных электрона и четыре валентные орбитали. Обычно он использует три орбитали, образуя хр2-гибриды в таких соединениях, как BF3. Углерод имеет четыре валентных электрона и четыре орбитали. За исключением тех случаев, когда он образует кратные связи, эти орбитали используются для ,чр3-гибридизации. Атом азота имеет пять валентных электронов и четыре орбитали. Как правило, он образует три связи с другими атомами в структурах с тетраэдрической конфигурацией, а четвертая гибридная ,чр3-орбиталь у него занята неподеленной электронной парой (разд. 13-3). Углерод и азот способны образовывать двойные и тройные связи в результате л-перекры-вания, обсуждавшегося в разд. 13-4. По сравнению с длиной простой связи длина двойных связей, образуемых этими элементами, сокращается на 13%, а длина тройных связей-на 22%. Прочность кратной связи повышается благодаря наличию электронов на связывающей молекулярной л-орбитали, возникающей в результате перекрывания атомных л-ор-биталей. Но перекрывание л-типа между орбиталями становится достаточно большим для возникновения связи только при близком расположении атомов. По этой причине Si и другие элементы третьего и следующих периодов неспособны образовывать кратные связи. Кремний имеет 10 внутренних электронов по сравнению с 2 в атомах С и N. Отталкивание этих внутренних электронов не позволяет двум атомам Si сблизиться настолько, насколько это необходимо для достаточного л-перекрывания р-орбиталей и возникновения двойных связей. Несмотря на все попытки химиков синтезировать соединения со связями Si=Si и Si=C, ни одна из них до сих пор не увенчалась успехом. За небольшими исключениями, образование двойных и тройных связей ограничено элементами второго периода, в атомах которых число внутренних электронов не превышает 2. Исключения, к числу которых относятся S=O, Р=О и Si —O, объясняются перекрыванием между р- и d-орбиталями, этот вопрос будет рассмотрен в разделе, посвященном кремнию.
Бор
Чтобы понять, почему на основе бора не может существовать химии, подобной химии соединений углерода, достаточно рассмотреть свойства ряда гидридов бора. Гидрид ВН3 существует только очень непродолжительное время как продукт разложения высших гидридов бора. К числу известных гидридов бора относятся В2Н6, В4Н10, В5Н9, В5Нц,
ВбН10, В6Н12, В8Н12, В9Н15 и В10Н14. Простейший гидрид бора ди-боран (В2Н6)-состоит из восьми атомов и содержит всего 12 валентных электронов. Если бы он имел структуру, подобную этану,
Н Н
I I
Н—В—В—н
I I н н
то для образования семи ковалентных связей в этой молекуле понадобилось бы 14 электронов. Но диборан имеет только 12 валентных электронов и поэтому относится к числу так называемых электроно-дефицитных соединений. В действительности он обладает следующей структурой:
Каждый атом В образует две обычные двухцентровые ковалентные связи В—Н, в которых занято всего восемь электронов. Остающиеся у диборана четыре валентных электрона используются для образования двух трехцентровых связей В—Н—В, в которых каждый из трех атомов поставляет по одной орбитали в связывающую молекулярную орбиталь. Представление о трехцентровых связях позволяет объяснить строение всех гидридов бора. Кроме того, оно объясняет, почему бор неспособен к проявлению таких химических свойств, как углерод.
Для объяснения большинства соединений, в которых число валентных электронов не меньше числа валентных орбиталей, достаточно воспользоваться представлением о двухатомных химических связях, которое позволяет рассматривать одновременно только пары атомов. Однако, как мы уже знаем из обсуждения бензола (разд. 13-5), локализованные молекулярные орбитали являются лишь приближенным описанием того, что имеет место в действительности. Иногда приходится конструировать делокализованные молекулярные орбитали из атомных орбиталей, принадлежащих нескольким или даже всем атомам молекулы. В случае молекулы бензола можно рассматривать раздельно связи С—Н и <т-связи С—С, но шесть р-орбиталей атомов углерода приходится рассматривать совместно.
Чтобы объяснить свойства соединений бора, иногда приходится учитывать возможность образования химической связи сразу между тремя атомами. Три атомные орбитали, по одной от каждого из трех атомов, могут комбинировать друг с другом, образуя три молекулярные орбитали: одну связывающую, одну разрыхляющую и одну несвязывающую.
в
Разрыхляющая
Несвязывающая
~ В +
S Связывающая
В В
а
В
6
Рис. 21-4. Трехцентровые орбитали в соединениях бора.
а-каждый из трех атомов бора поставляет по одной орбитали (два атома зр3-гибриды и один атом р-орбиталь) для образования связывающей, несвязывающей и разрыхляющей молекулярных орбиталей. Одна электронная пара на связывающей орбитали удерживает все три атома вместе. Та-
кая структура называется открытой трехцентровой связью;
б-перекрывание атомных орбиталей при образовании связывающей орбитали мостиковой связи В—Н—В: e-перекрывание атомных орбиталей при образовании закрытой трехцентровой связи. Такие трехцентровые связи встречаются в электронодефицитных соединениях, включающих атомы В и А1.
причем последняя фактически имеет такую же энергию, как исходные атомные орбитали (рис. 21-4). Ранее мы уже встречались с несвязывающими орбиталями. В молекуле HF (см. рис. 12-11 и 12-12) 2рх- и 2ру-орбитали атома F являются несвязывающими; к такому же типу принадлежат dxy-, dy:- и ^хг-орбитали атома металла в октаэдрических координационных комплексах.
Два электрона на связывающей трехцентровой молекулярной орбитали
способны удерживать три атома вместе. Такое «экономное» связывание позволяет скомпенсировать дефицит электронов у бора. Однако оно накладывает на геометрию его соединений пространственные ограничения, которые делают бор плохим конкурентом углерода. Из линейных и разветвленных цепей гидридов углерода (углеводородов) могут создаваться огромные молекулярные каркасы, в которых все атомы соединены попарно. В отличие от этого гидриды бора, в которых атомы соединяются по три сразу, обладают структурами, где скелет из атомов бора представляет собой какой-либо фрагмент икосаэдра (рис. 21-5,а). Так, гидрид В4Н10 является небольшим фрагментом икосаэдра (рис. 21-5,6). Он содержит шесть обычных двухцентровых связей между атомами В и Н, одну двухцентровую связь В—В и четыре трехцентровые связи В—Н—В. Для образования каждой такой связи требуется всего одна электронная пара. Таким образом, в В4Н10 14 атомов удерживаются вместе при помощи 26 атомных орбиталей и всего 22 электронов. Гидрид В9Н15 соответствует трем четвертям полного икосаэдра (рис. 21-5,в). В этом соединении 24 атома удерживаются вместе при помощи 51 атомной орбитали и только 42 связывающих электронов. Полный икосаэдр В12 существует в кристаллическом боре. На рис. 21-6 на примере В5Нц показано, каким образом возникают подобные трехцентровые связи в более крупных гидридах бора.
Итак, мы убеждаемся, что бор-неподходящий кандидат для развития на его основе подобия органической химии по причине своей электро-нодефицитности, которая обусловливает образование трехцентровых связей и заставляет структуры соединений бора замыкаться на себя. Более того, возникающее геометрическое расположение атомов не позволяет р-орбиталям соседних атомов ориентироваться параллельно, чтобы между ними могли появиться л-связи. Таким образом, хотя бор близок по своим свойствам к углероду, сходство между ними недостаточное для существования органической химии на основе бора.
Рис. 21-5. Строение гидридов бора, а-икосаэдр, фрагментами которого являются каркасы связей между атомами бора почти во всех гидридах бора. Икосаэдр имеет 12 вершин и 20 граней, образуемых равносторонними треугольниками.
б-тетраборан-10, В4Н10, с четырьмя атомами бора, образующими две грани икосаэдра. Связи указаны цветными линиями. Шесть из атомов водорода образуют нормальный двухцентровые ковалентные связи с атомами бора; остальные принимают участие
в четырех мостиковых связях В—Н—В. Два центральных атома бора соединены обычной двухцентровой связью;
в-энеаборан-15, В9Н15, имеет каркас, который получается из икосаэдра удалением трех смежных вершинных атомов бора, не образующих равностороннего треугольника. Десять атомов водорода связаны двухцентровыми ковалентными связями с атомами бора; остальные пять атомов водорода участвуют в мостиковых связях В—Н В.
Рис. 21-6. Структура (а) и связывающие орбитали (б) пентаборана-11, В5НП. Каждый из атомов бора использует для образования связей sp3-гибридные орбитали, кроме центрального атома, имеющего одну негибри-дизованную р-орбиталь и три гибридные зр2-орбитали. Закрытая трехцентровая связь возникает в результате перекрывания двух хр3-орбиталей
6
и одной зр2-орбитали. Открытая трехцентровая связь с участием центрального атома В образуется в результате перекрывания двух хр3-орбиталей и одной р-орбитали, как показано на рис. 21-4,а. В целом в молекуле пентаборана-11 во всех связях используется 31 атомная орбиталь, но только 26 электронов.
Азот
Атомы азота, подобно углероду, могут образовывать двойные и тройные связи друг с другом, а также с атомами других элементов второ
го и третьего периодов. Но азоту присущ недостаток, противоположный бору: у него слишком много электронов. Отталкивание между неподелен-ными электронными парами на соседних атомах азота делает простую связь N—N гораздо менее прочной, чем связь С—С: энергия связи N—N равна 161 кДж-моль1, а связи С—С 348 кДж-моль-1. Энергия связи С—N, в которой одна из этих отталкивающихся неподеленных пар электронов отсутствует, возрастает до 292 кДж-моль1.
Существуют некоторые соединения с цепочками связанных между собой
атомов азота:
H2N—nh2 гидразин
© ©
H~N=N=N гидразоновая кислота
R
I
R2N — N — NR2
триазаны
Гидразин используют в качестве ракетного топлива. Гидразоновая кислота чрезвычайно взрывоопасна и токсична. Иногда ее применяют в детонаторах взрывчатых устройств. Высшие азотоводороды, как называют эти соединения по аналогии с углеводородами, редко удается получить в простейших формах, которым соответствуют указанные выше структуры с R = Н. Те из них, которые обладают достаточной устойчивостью, чтобы можно было по крайней мере выделить их, имеют в качестве R фенильные группы (бензольные кольца) либо метильные или этильные группы (СН3— или СН3СН2—). Все они чрезвычайно неустойчивы и в большинстве случаев взрывоопасны. Они быстро разлагаются при любых условиях. Как выразился один ученый, «они находятся на пределе существования».
Одна из важнейших причин неустойчивости азотных цепочек заключается в чрезвычайной устойчивости тройной связи N=N в молекуле N2. Тройная связь N=N с энергией 946 кДж-моль-1 в шесть раз прочнее простой связи N—N, тогда как тройная связь С=С в ацетилене только в 2,3 раза прочнее простой связи С—С. Длинная азотная цепочка значительно менее устойчива, чем система, остающаяся после разрыва этой цепочки на несколько молекул N2.
R R
I I r2n—n—n—nr2 тетразаны
R
I
RN=N—N—N=NR
RN=N—NR2 триазены
R2N—N=N—NR2 тетразены
R R
I I RN = N — N — N — N = NR ^исдиазогидпозины
R R
I I
RN=N—N—N=N—N—N=NR
октазотриены
Азот принимает участие в образовании цепочек и циклов вместе с углеродом и, подобно углероду, образует двойные связи. Диазометан
® е
h2c=n=n
является одним из наиболее разносторонних и полезных реагентов в органической химии, несмотря на свою высокую токсичность, взрывоопасность и невозможность хранения без разложения. Молекулы с двумя или несколькими соседствующими атомами азота, кроме N2, редко бывают устойчивыми.
Кремний
Важнейшее отличие кремния от углерода заключается в том, что Si имеет большее число внутренних электронов. Следствием этого является неспособность двух атомов кремния сблизиться достаточно сильно, чтобы между ними могла возникнуть двойная или тройная связь. Кремний образует силаны, аналогичные алканам, которые будут обсуждаться в разд. 21-3. Силаны имеют общую формулу Si„H2„ + 2. Наиболее длинную цепь из всех полученных до сих пор силанов имеет гексасилан (рис. 21-7). Подобно азотоводородам, силаны обладают опасно высокой реакционной способностью. Простейшие силаны устойчивы в вакууме, но все они самопроизвольно возгорают на воздухе и все со взрывом реагируют с галогенами. Силаны обладают сильными восстановительными свойствами.
Неустойчивость силанов и их высокая способность к окислению объясняются тем, что связь Si—О намного устойчивее связи Si—Si: энергия связи соответственно 369 и 177 кДж-моль-1. В отличие от этого связи С—О и С—С имеют приблизительно одинаковую энергию: 351 и 348 кДж моль (табл. 21-1). Углеводороды окисляются совсем не так легко, как силаны. В то время как реакция
Н Н Н Н 1111 Н — Si — Si — Si — Si — H + 6|O2 —> 4SiO2 + 5H2O
H H H H
протекает самопроизвольно co взрывом, аналогичная реакция с бутаном
н н н н
1111
Н —с —С —с —с —Н + 6|О2 -» 4СО2 + 5Н2О н н н н
требует термического инициирования и при обычных условиях пподол-жается только благодаря тому, что выделяемая теплота разогревает реагенты до высокой температуры.
Различие в способности к окислению соединений углерода и кремния частично обусловлено тем, что связь Si—Si менее прочна, чем связь
279
С—С. Это и не удивительно, если учесть больший размер атомов Si. Связывающие электроны находятся дальше от каждого из ядер, и поэтому связь оказывается менее прочной. По той же причине Si имеет меньшую энергию ионизации, чем С, и меньшую электроотрицательность (см. табл. 9-1). Но еще более важной причиной различия в свойствах углерода и кремния является аномально высокая прочность связи Si—О. В атоме углерода пустые ЗЛ-орбитали имеют гораздо более высокую энергию по сравнению с 2р-орбиталями кислорода, занятыми неподеленны-ми электронными парами, поэтому между ними не возникает взаимодейст-
н н н
I I I
Н— Si— Si — Si
I I I
H H H
H H H
I I I
Si —Si — Si —H
i I I
H H H
гексасилан
CH. CH. CH, CH,
Illi
-Si —О—Si — О — Si —О — Si — О-
Illi
CH. CH. CH. CH,
Et= СН.СН,—
метилсилоксан
циклический силоксан
лестничный силоксан
Рис. 21-7. Кремний образует полимерные цепи двух типов: силаны с высокой реакционной способностью, в которых атомы Si связаны непосредственно друг с другом, и инертные силоксаны, з которых каждая пара ато-мов Si связана друг с другом через мостиковый атом кислорода. Силоксаны представляют собой химически инертные, теплостойкие масла и каучуки, обладающие диэлектрическими свойствами и используемые в качестве
смазочных веществ, изоляторов и защитных покрытий. В силоксанах с лестничной структурой три из четырех связей, образуемых каждым атомом Si, направлены к мостиковым атомам кислорода; эти соединения представляют собой каучукоподобные или пластичные вещества. Если все четыре связи атомов Si вовлекаются в образование кислородных мостиков, образуются силикатные минералы.
Таблица 21-1
Сравнительная способность к образованию связей для углерода и для элементов его ближайших соседей по периодической системе
Элемент, R в с N Si
Число валентных элект- 3 4 5 4
ронов
Обычная координация Тройная sp2 (или чет- Четверная хр3 Четверная, sp3 (включая Четверная,
связей верная с трехцентровы- неподеленную пару)
ми связями)
Энергии простых связей,
кДж • моль ’
R - R 348 161 177
R С 348 292 290
R— N 292 161 —
R - О 351 -230 369
R Н 413 391 295
Соотношение числа электронов и числа орбита-лей и тип образуемых связей
Соединение одинаковых атомов
Образование двойных и тройных связей, л-связы-вание
Электронный дефицит, трехцентровые связи (в соединениях с несколькими атомами В)
Икосаэдрические полиэдры
л-Связывание невозможно из-за образования трехцентровых связей в икосаэдрических каркасах
Совпадение; двухцентровые связи
Протяженные цепи
Эффективное л-перекры-вание в двойных и тройных связях. Полная валентность не насыщается связью с еще одним таким же атомом. Образует каркасы связей
Электронная избыточность ; двухцентровые связи. Отталкивание не-поделенных пар
Цепи ограниченной протяженности
Эффективное л-перекры-вание в двойных и тройных связях. Полная валентность насыщается связью с еще одним таким же атомом. Образует молекулы N2
Совпадение; двухцентровые связи
Цепи ограниченной протяженности
Цепи ограниченной протяженности. Образование двойных и тройных связей невозможно. Образует каркасы, главным образом устойчивых связей Si—О, а не менее устойчивых связей Si—Si
3d
+ 2Р +
----------•---Si----------------о —
+ —
Рис. 21-8. Прочность связи Si—О обусловлена ее необычным, частично двое-связным характером. Одна из 2р-орбита-лей кислорода, занятая неподеленной парой электронов, обобществляет их с пустой ЗЛ-орбиталью Si, имеющей приблизительно такую же энергию. По этой причине энергия связи Si—О равна 369 кДж• моль-’, тогда как связь Si—С, в которой не участвует неподеленная электронная пара, характеризуется энер-1ией связи всею 290 кДж моль -1.
вия. Однако в кремнии более высокий заряд ядра понижает энергию пустых Зг/-орбиталей, и они оказываются ближе по энергии к 2р-орби-талям кислорода. Вследствие этого кислород может частично обобществлять свои неподелейные электронные пары с кремнием (рис. 21-8) в результате дативного взаимодействия, подобного L —> М-л- и М —> L-n-взаимодействию в координационных комплексах, которое обсуждалось в разд. 20-3. Поскольку dху-орбиталь Si простирается гораздо дальше в сторону атома О по сравнению с р-орбиталью при л-связи, атомы Si и О не должны сближаться так сильно, как это требуется условиями образования двойной рте—рл-связи. Результатом этого обобществления неподеленных пар кислорода является то, что хотя энергия связи Si—Si на 171 кДж моль-1 меньше энергии связи С—С, связь Si—О прочнее, чем связь С—О, на 18 кДж-моль.
Эти данные показывают, что соединения, в которых атомы Si связаны мостиковыми атомами кислорода, должны иметь большую устойчивость. Такие соединения действительно существуют и называются силоксанами. Как показано на рис. 21-7, силоксаны могут существовать в виде линейных цепей, циклов или «лестничных» структур с двумя параллельно связанными цепочками. Силоксаны-чрезвычайно инертные соединения. Силаны обладают намного большей реакционной способностью по сравнению с углеводородами; силоксаны, наоборот, значительно менее реакционноспособные соединения.
Сравнение свойств бора, азота и кремния со свойствами углерода
Ни один из элементов, примыкающих к углероду в периодической системе не обладает теми свойствами, которые телают углевод столь важным элементом: способностью образовывать длинные, устойчивые, разветвленные и сшитые цепи, двойные связи и циклы с делокализованными электронами. Свойства этих элементов сопоставляются в табл. 21-1. Соединения бора вынуждены принимать неблагоприятную геометрию из-за
дефицита электронов, поэтому его р-орбитали не могут перекрываться и образовывать двойные связи. Хотя азот иногда замещает углерод в его циклах и цепях и может настолько же легко, как углерод, образовывать двойные связи, длинные цепи атомов азота неустойчивы. Возможности кремния ограничены невысокой прочностью связи Si—Si по сравнению со связью Si—О и его неспособностью образовывать двойные связи.
Таким образом, углерод обладает удачным сочетанием свойств: его небольшие атомы с таким же числом валентных электронов, как и число валентных орбиталей, образуют друг с другом связь настолько же прочную, как и связь с кислородом. Авторы научно-фантастических романов долгое время описывали воображаемую, совсем непохожую на обычную, внеземную жизнь, основанную на неводной химии и элементе, отличном от углерода. Их излюбленным элементом был кремний, и они заселяли Марс чудовищами, тела которых подобны силиконовой замазке, а пища состоит из камней. Но чем больше становится известно о роли соединений углерода в земных живых организмах, тем труднее представить себе, что соединения кремния способны выполнять даже отдаленно напоминающую роль. Углерод обладает уникальными свойствами, которые не могут дублироваться ни одним другим известным элементом.
Мы уже упоминали, что соединения, содержащие только углерод и водород, называются углеводородами; те из них, в которых все атомы углерода образуют четыре простые связи с другими атомами, носят название насыщенные углеводороды, парафины или алканы. Слово парафин происходит от греческого выражения «низкая реакционная способность», а химические свойства парафинов значительно отличаются от свойств силанов и азотоводородов.
Примеры некоторых алканов приведены в табл. 21-2. Первые четыре алкана имеют тривиальные названия, названия алканов с числом атомов углерода от 5 до 19 обычно состоят из греческой приставки, указывающей полное число атомов углерода, и стандартного суффикса -ан. Если число атомов углерода превышает 19, вместо названия обычно используется химическая формула соединения. Каждый атом углерода в алканах образует четыре тетраэдрически ориентированные связи с другим атомом углерода либо с водородом.
Все нециклические алканы описываются общей химической формулой С„Н2п + 2. По мере повышения молекулярной массы алканов происходит систематическое возрастание их температуры плавления и температуры кипения. Метан, этан, пропан и бутан в нормальных условиях-газы; пентан и следующие алканы вплоть до С20Н42-жидкости, а С21Н44 и высшие алканы-воскообразные твердые вещества.
При наличии четырех или большего числа атомов углерода они могут соединяться друг с другом несколькими различными способами. Это
Таблица 21-2
Насыщенные углеводороды
ч •ормула Тривиальное название Систематическое название
сн4 Метан Метан
сн3 — сн3 Этан Этан
СН, — сн2 —сн3 Пропан Пропан
сн3 — сн2 — сн2 — сн3 н-Бутан Бутан
сн3 — сн —сн3 сн3 Изобутан Метилпропан
сн3 — сн2 — сн2 —сн2 — сн3 н-Пентан Пентан
сн3 — сн2—сн —сн3 сн3 Изопентан Метилбутан
сн3 сн3 — с —сн3 1 сн. Неопентан Диметилпропан
сн3 сн3 сн3 — с — с н 2 — сн — сн 3 сн3 Изооктан 2,2,4-Триметилпентан
н н н С Н / н—с с—н н —с z с —н н' с ' Н н” ' н Циклогексан Циклогексан
приводит к появлению структурных изомеров, состоящих из одинакового числа атомов каждого сорта, но соединенных различными способами. Пять изомеров гексана имеют следующие варианты углеродного скелета и номенклатурные названия (СН3— называется метильной группой):
С С
I I
с—с—с—с—с—с с—с—с—с—с с—с—с—с—с
гексан 2-метилпентан 3-метилпентан
С с
I I с—с—с—с
С
I с—с—с—с
I
с
2,3-диметилоутан
2,2-йиметил{>уп1ан
Использование старых обозначений нормальный (или н-) для неразветв-ленной цепи, изо- для разветвленных цепей и нео- для третьего изомера быстро приводит к путанице при возрастании числа атомов углерода, и тогда приходится пользоваться систематической номенклатурой, как указано в правой колонке табл. 21-1. Согласно систематической номенклатуре, название соединения определяется самой длинной цепью атомов углерода, имеющейся в молекуле. Молекула мысленно растягивается вдоль этой наиболее длинной цепи, и атомы углерода нумеруются начиная от того конца, к которому ближе точка ветвления. Затем указываются боковые цепи и их положение определяется номером атома углерода главной цепи, к которому они присоединены. Боковые цепи углеводородов называют по аналогии с самими углеводородами: метил СН3—, сн3х
этил СН3СН2—, пропил СН3СН2СН2—, изопропил СН—. Так, сн/
неопентан, согласно систематической номенклатуре, называется диметил-пропаном, а не триметилэтаном или даже тетраметилметаном, потому что наиболее длинная углеродная цепь в нем содержит три атома углерода, как в пропане.
Пример 1
Изобразите углеродный скелет и дайте номенклатурные названия для каждого из девяти изомеров С7Н1(5.
Решение
Среди этих изомеров один гептан (неразветвленная цепь из 7 атомов углерода), два замещенных гексана (6-тиуглеродная цепь с боковыми группами), пять пентанов и один бутан. Последнее соединение называется 2,2,3-триметилбутан.
Пример 2
Дайте номенклатурное название следующего соединения:
СН3 СН3
I ' I
сн3—с—сн2—сн—сн,—сн—сн,
I
'сн, сн3—с—сн3
!
сн3 сн3
Решение
Структура этого соединения записана таким образом, чтобы навести на мысль, будто его правильное название 2,4-диметил-2-этил-6-изопропилгептан. Однако в нем можно найти цепь, содержащую более 7 атомов углерода, представив его структуру следующим образом:
сн3 сн3 сн3 сн3
сн3—сн2 —с—сн2—сн—сн2—сн—с—сн3
(9) (8) 1(7) (6) (5) (4) (3) 1(2) (1)
сн3 сн3
и поэтому правильное название соединения - 2,2,3,5,7,7-гексаметилнонан. Нумерацию атомов углерода принято начинать с того конца цепи, к которому ближе первая точка ветвления.
Углеводороды могут образовывать не только цепи, но и циклы (кольца). Наименьшим циклом является трехчленное кольцо циклопропана
Н2 С
Н2С—-сн.
Этот цикл очень сильно напряжен, энергия его напряжения вычислена и указана в табл. 15-2. Оптимальный угол между связями, образуемыми углеродом, равен 109° («тетраэдрический» угол), однако в данном трехчленном цикле углы между связями равны 60е. Циклобутан и циклопентан напряжены меньше, а шестичленные циклы со структурой циклогексана встречаются очень часто. Циклогексан может иметь две различные структуры, называемые конформациями (формами) ванны и кресла (рис. 21-9). Конформация ванны менее устойчива из-за того, что в ней сильно сближены два диаметрально расположенных атома водорода. Сахара и другие вещества, молекулы которых имеют фрагменты, подобные циклогексану, почти всегда включают их в форме кресла.
Н* аксиальный атом водорода
Н экваториальный атом водорода
в
Рис. 21-9. н-Гексан, С6Н14, и циклогексан, С6Н12.
Эти рисунки указывают на тетраэдрическое расположение связей вокруг каждого атома углерода. Из книги: Dickerson R. Е..
Geis I., Chemistry, Matter and the Universe, W.A. Benjamin, Menlo Park, Calif., 1976.
п-неразвегвленная углеводородная цепь n-гексана;
б - циклогексан в конформации ванны. Два верхних атома водорода слишком сильно сближены, и поэтому такая конформация менее устойчива, чем форма кресла;
e-циклогексан в конформации кресла. Такие же циклы в форме кресла встречаются в гексозных сахарах.
V.:- ;<>'т-:.. ' 28?
Реакции алканов
Чтобы проиллюстрировать низкую реакционную способность алканов, укажем только один пример: н-гексан не взаимодействует с кипящей HNO3, концентрированной H2SO4, таким сильным окислителем, как КМпО4, и с расплавленным NaOH. Инертность алканов позволяет использовать их в качестве смазочных масел, полимерных пленок и твердых пластмасс для изготовления труб и сосудов (хорошо известным всем примером является полиэтилен). В сущности, алканы вступают только в такие химические реакции, как горение, дегидрирование и галогенирование.
Реакции горения делают алканы полезным топливом
СН3 — СН,— СН2 — СН, + 6Ю, 4СО, + 5Н,О(ж.) газ tyman
ДН29е- -2878 кДж
Газообразные пропан и бутан, бензины и керосины-все это алканы, ценность которых определяется их способностью к горению.
Дегидрирование - это реакция отщепления атомов водорода, в результате которой происходит образование двойных или тройных связей. Этот процесс обычно протекает при высоких температурах и в присутствии катализаторов, подобных Сг2О3:
н3с-сн3 500°С > Н2С=СН2 + Н2
этан этилен
Продукты дегидрирования называются алкенами, или олефинами. Они будут обсуждаться в следующем разделе.
Галогенирование - это реакция углеводорода с галогенами-F2, С12 или Вг2 (12 слишком инертен при обычных условиях), в результате которой происходит замещение одного или нескольких атомов Н атомами галогена:
Н Н
I I
н—с—н + ci—С1 -> н—с—С1 + Н —С1
I I
н н
метан метилхлориЬ,
или монохлорметан
Галогенированные углеводороды способны принимать участие во множестве других химических реакций.
НГИАС ЫШСНпЫЕ У ГЛЕВОДОРОДЫ
Реакция дегидрирования позволяет получать из насыщенных углеводородов, или алканов, ненасыщенные углеводороды, которые иначе назы-
ваются алкенами и алкинами:
снэ—сн2—сн3 —> сн2=сн—сн3 + н2 пропан пропен
В процессе крекинга нефти длинные цепи насыщенных углеводородов под действием теплоты и катализаторов расщепляются на насыщенные углеводороды меньшего размера (соответствующего бензинам), а также ненасыщенные алкены, такие, как пропен, этен и бутадиен. Углеводороды с двойными связями могут также образовываться в результате отщепления молекулы НС1 от алкилгалогенидов при их обработке КОН в спиртовой среде или в результате отщепления Н2О от спиртов при их обработке концентрированной H2SO4:
СНЭ-СН2 — С1 + КОН СН2 = СН2 + КС1 + Н2О этилхлсрис) этен
сн3—сн2—он* сн2=сн2 + Н2О
Возможно также образование углеводородов с тройными связями, как, например, в этине, или ацетилене (НС -СН), но эти соединения не столь важны и широко распространены, как углеводороды с двойными связями. По аналогии с алканами углеводороды с двойными связями называются алкенами, а углеводороды с тройными связями-алкинами (номенклатура Международного союза теоретической и прикладной химии -ИЮПАК). Тривиальные названия этана, этена и этина-этан, этилен и ацетилен соответственно.
Наличие двойной связи препятствует вращению соединяемых ею фрагментов молекулы, и вследствие этого для соединений с двойными связями возможны геометрические изомеры. Так, CHjCH CHCH,. бутен-2, может существовать в виде двух изомеров:
н,с СН,
3 \ / 3 /С = Сх
н н
цис-оутен-2
Н3С н \ / /с=с н сн3
транс-оутен-2
Наличие двойной связи заставляет два центральных атома С, а также присоединенные непосредственно к ним атомы С и Н находиться в одной плоскости. Как и для изомеров координационных комплексов, приставка цис указывает на то, чю одинаковые труппы располагаются по одну сторону цепи, а приставка транс (означающая «через») указывает, что они находятся по разные стороны цепи. Молекула /иранс-бутена-2 несколько устойчивее uuc-фор.мы, потому что объемистые метильные группы в ней удалены на большее расстояние друг от друга. В дальнейшем
Особа.ч роль yo.iepoOo о химии
289
мы убедимся, что стерические препятствия, возникающие в результате соприкосновения объемистых групп, оказывают существенное влияние на структуру органических и биологически важных молекул.
При дегидрировании более длинных парафинов получается смесь нескольких продуктов с двойной связью в различных положениях. Линейный изомер бутана, н-бутан, может быть дегидрирован в два структурных изомера бутена с одной двойной диена с двумя двойными связями:
связью и два изомера бута-
СН2 = СН —СН2 —СН сн3—сн=сн—сн3 сн2=сн—сн=сн2 сн2=с=сн—сн3
8утен-1 оутен-2 бутадиен-1,3 бутадиен-1,2
Цифры 1, 2 и 3 после названия соединения указывают положения в нем двойных связей.
Ненасыщенные углеводороды вступают в реакции присоединения по двойным связям с Н2, НС1 или С12. Например,
С1 С1
СН2=СН —СН2 —СН3 + С12 -> СН2 — СН — СН2 — СН3
<^теи-г 1,2-Ъиг.лор6дтаи
Аналогичная реакция с бутадиеном-1,3 является специфической: присоединение происходит в концевых положениях двух двойных связей и осуществляется в ходе одновременного (согласованного) процесса. В результате реакции одна двойная связь исчезает, а другая перемещается в центр молекулы:
Ci С1
I I
СН2=СН—СН=СН2 + С12 -» сн2 —сн = сн —сн2 rfyma()uen-1,3 1,4-с>ихлор(1утен-2
Такое необычное поведение обусловлено тем, что двойные связи в молекуле бутадиена-1,3 делокализованы. Системы с подобным чередующимся расположением двойных и простых связей (—С=С—С=С—) называются сопряженными. Когда сопряженные двойные связи находятся в плоских замкнутых циклах, все атомы которых лежат в одной плоскости, соединения называются ароматическими. (См. разд. 21-6.)
2! ' шишгшг uri.ii \ г u. . io» । а.\ > и. г г г г< и г \ г :.г г гл rpvnnki
В реакции хлорирования происходит замещение одного или нескольких атомов водорода атомами С1 и может образовываться много изомеров. Приведем несколько примеров с номенклатурными названиями:
10-796
С1 С1 1 1 С1 С1
сн2—сн2 1,2-дихлорэтан 1 1 С1—сн—сн3 сн3 —сн2 —сн2 1,1-дихлорэтан 1-хлорпропоц
С1 1 С1 С1 С1 С1
сн3—сн—сн3 2-хларнрапан II 1 1 сн2—сн-сн3 сн2—сн2—сн2 1,2-дихлорпропан 1,3-дихлорпропан
С1 1 С1
сн—сн2—сн3 1 сн3—с—сн3 1 J
С1 1,1-дихлорпропам 1 Cl 2,2-Ъихлорпропон
Пример 3
Сколько различных изомеров существует у трихлорпропана. Назовите их.
Решение
Таких изомеров пять: 1,2,3-, 1,2,2-, 1,1,3-, 1,1,2- и 1,1,1-трихлорпропан.
Хлорированные углеводороды являются исходными веществами для получения многих классов соединений, которые не удается получать из углеводородов прямым способом. Их реакционная способность обусловлена связью С—О, а остальная часть молекулы ведет себя во многих реакциях как неразрывное целое. Поэтому удобно представлять себе углеводородную часть таких молекул как некий радикал, присоединенный к функциональной группе. Например, этилхлорид, СН3СН2—С1, обладает химическими свойствами комбинации этильного радикала, СН3СН2— или С2Н5—, и хлоридной группы, —С1. Хлорированные углеводороды вступают во многие реакции замещения при надлежащих температуре и катализаторах :
С2Н5 —С1 + Н2О этилхлариЬ
С2Н5 —С1 + H2S
С2Н5 —Cl + NH3
-> С2Н5 —ОН + НС1 этанол (этиловый спирт)
-» С2Н5 — SH + НС1
этилмеркоптан
-> с2н5—nh2 + НС1 этиламин
С2н5—Cl + AgCN -» С2Н5 — CN + AgCl
.я т н л t tit л ui_ i /)
Когда эти продукты вступают в дальнейшие реакции, этильная группа обычно остается неприкосновенной, а химическая активность проявляется по связи между этильным радикалом и функциональной группой.
Особая po.ib \xiepoiki в химии
291
Таблица 21-3
Производные углеводородов н функциональные группы
Производные Функциональная Общая формула группа Примеры
Галогениды — CI, — Вг R — О снэ—сн2 —CI зтилхлорид (хлорэтан) CI —СН2 —СН2 —CI 1 ^-дихлорэтан
Спирты -он R—ОН сн3 —ОН метанол сн3 —сн2 —ОН этанол
Простые эфиры — о — R, -О —Н2 сн3—о—СН3 диметиловый эфир сн3 —о—СН2 ~СН3 метилэтиловый эфир
Кетоны О II О II О ||
-с— R, — С-й2 сн3—-с—сн3 диметилкетон, иле 1 ацетон
Альдегиды 0 II О II О II О II
-с —н R —С —Н н —с —н сн3—с —н формальдегид ацетальдегид
Кислоты 0 II 0 II 0 II н—с—он сн О II
— с —он R — С — ОН 1,-С—он
муравьиная кислота уксусная кислота
Сложные О il 0 || О ||
эфиры -с-о- R, — С — О — Н2 СН3 —с—о—сн. г-сн3
этилацетат
Амины — NH; R — NH2 снз — NH2 (СН3)3—NH метиламин диметиламин
сн3
Амино- nh2 nh2 H2N —СН2-СООН H2N—СН — СООН
КИСЛОТЫ 1 -сн 1 /-с\ О он 1 R —С—Н 1 /С\ 0 ОН глицин СН3 СНЭ СН 1 H2N —СН — СООН аланин О ОН V 1 сн2
валин 1 h2n—сн—соон
аспарагиновая кислота
Несколько наиболее распространенных функциональных групп указано в табл. 21-3, а также при помощи изображений трехмерных скелетных моделей на рис. 21-10 и 21-11. Спирты являются хорошими растворителями органических веществ, а те из них, которые обладают наименьшей молекулярной массой, в свою очередь растворимы в воде. Метанол, или «древесный спирт», представляет собой токсичный спирт, ко-
10*
Рис. 21-10. Модели производных углеводородов, иллюстрирующие типичные функциональные группы.
а-метанол (метиловый спирт) с группой —ОН; б-ацетальдегид (название которого дано ему как производному
уксусной кислоты CHjCOOH) с альдегидной группой —СНО; в-диметиловый эфир, с эфирным мостиком —О—; г-диметилкетон (ацетон) с кетогруппой /С=О.
*
в
J 4» про в мостиком
Рис. 21-11. Органические кислоты и основания и их производные.
а-уксусная кислота, показанная с ионизованной карбоксигруппой; б-мети л ацетат с характерным для сложных
тиламин с аминогруппой —NH2. На этой модели амин изображен в ионной форме, с группой —NHj.
Оаюа.ч роль v.’.iepiuM химии
293
торый вызывает потерю зрения и нередко приводит к смерти. Попадая в организм человека, он воздействует на нервную систему путем растворения жирных веществ в нервных окончаниях. Менее токсичный этанол, или «пшеничный спирт», является конечным продуктом процесса извлечения энергии в анаэробном метаболизме (не использующем кислород) таких организмов, как дрожжи:
С6Н12О6 7>рожки > 2С2Н5ОН + 2СО2 ферменты
Метанол и этанол используются в огромных количествах в качестве раствор?:телей и сырья для химического синтеза. Промышленный синтез метанола осуществляется из диоксида углерода и водорода
со2 + зн2 -> СН3ОН + Н2О
а этанол получают из этена
сн2=сн2 + Н2О СН3СН2ОН
(Названия некоторых спиртов и других производных углеводородов см. в табл. 21-4.)
Эфирами называются соединения с высокой летучестью, получаемые при конденсации спиртов в присутствии концентрированной серной кислоты, которая отщепляет от двух молекул спирта молекулу воды:
сн,сн, - о ' н • н о сн2сн3
этиловый спирт этиловый спирт
СН5СН2-О-СН2СН3+ Н2О диэтиловый эфир
Диэтиловый эфир это и есть хорошо известный всем «эфир», который используют как средство анестезии. Эфиры обладают ценными свойствами как растворители восков, жиров и других водонерастворимых органических веществ.
Альдегиды и кетоны являются продуктами первой стадии окисления спиртов:
О II СН3СН2ОН + |О2 сн3—с—н + Н2О
этанол ацетальдегид
Эта реакция протекает при умеренно высоких температурах в присутствии таких катализаторов, как мелкодисперсное серебро или смесь порошкообразного железа и оксида молибдена. Вторая стадия окисления приводит к образованию карбоновых кислот, характеризующихся наличием
Таблица 21-4
Наименования'' различных производных углеводородов
Радикалы, R Спирты, R—ОН Альдегиды, R--CHO Кислоты. R-COOH Сложные эфиры, СН3 СОО R Сложные эфиры, R - СОО—СН3
н— Вода Формальдегид (метаналь) Муравьиная Уксусная кислота Метилформиат
сн3— Метиловый (метанол) Ацетальдегид (этаналь) Уксусная (этановая) Метилацетат Метилацетат (метилэтаноат)
С2Н5 - Этиловый (этанол) Пропиональдегид (пропаналь) Пропионовая (пропановая) Этилацетат Метилпропионат (метилпропаноат)
С3Н7 - Пропиловый (пропанол) Бутилальдегид (бутаналь) Бутиловая (бутановая) П ропилацетат Метилбутилат (метилбутаноат)
С4н9- Бутиловый (бутанол) Валеральдегид (пентаналь) Валерьяновая (пентановая) Бутилацетат Метилвалерат (метилпентаноат)
С5НП Пентиловый (пентанол) К априлальдегид (гексаналь) Капроновая (гексановая) Пентилацетат Метилкапроат (метилгексаноат)
С6н13- Гексиловый (гексанол) Гептальдегид (гептаналь) Гептиловая (гептановая) Гексилацетат Метилгептилат (метилгептаноат)
С7Н15- Гептиловый (гептанол) Октальдегид (октаналь) Каприловая (октановая) Гептилацетат Метилкаприлат (метилоктаноат)
С8н17- Октиловый (октанол) Пеларголовый (нонаналь) Пеларголовая (нонановая) Октилацетат Метилпеларголат (метилнонаноат)
с11н23- Ундециловый (ундеканол) Лауриловый (додеканаль) Лауриловая У ндецилацетат Метиллаурат
Продолжение табл. 21-4
Радикалы, R Спирты, R- ОН Альдегиды, R -СНО Кислоты, R—СООН Сложные эфиры, CHj-COO— R Сложные эфиры, R— СОО—СН3
Gj sH31 Пентадециловый (пентадеканол) Пальмитиновый (гексадеканаль) Пальмитиновая Пентадецилацетат Метилпальмиат
Ci 7Н35 Гептадецило-вый (гептадеканол) Стеариновый (октадеканаль) Стеариновая Г ептадецилацетат Метилстеарат
СН3(СН2)7СН: (i/uc-изомер) СН(СН2)7 Олеиновая Метилолеат
Проблема наименований в органической химии трудно преодолима. Существуют две параллельные системы: тривиальные названия и систематические, принятые Международным Союзом теоретической и прикладной химии (ИЮПАК). Тривиальные названия обычно более краткие и удобные, но они не дают сведений о структуре соединений. Систематические названия, как правило, позволяют установить важнейшие особенности молекулярной структуры. В данной таблице систематические названия даются в скобках.
Тривиальные названия основываются на двух рядах: алканов и кислот. Ряд алканов начинается условными названиями, но быстро переходит к использованию греческих приставок, указывающих число атомов углерода: метил, этил, пропил, бутил, пентил, гексил и т.д. К сожалению, в кислотном ряду сохраняются нечисленные названия, которые во многих случаях отражают происхождение вещества.
Отметим, что число-приставка в названиях кислот на единицу больше числа-приставки в названиях соответствующих спиртов, поскольку при подсчете числа атомов углерода учитывается углерод карбоксильной группы. Например, С5НпСООН-гексаиовая кислота, а не пентановая.
В названиях альдегидов и в той части сложных эфиров, которая присоединена к атому углерода, используется кислотная номенклатура. В названиях спиртов, простых эфиров, кетонов, аминов и той части сложных эфиров, которая присоединена к атому кислорода, используется номенклатура алканов.
Рекомендуется запомнить названия всех производных углеводородов до С4 включительно и разобраться в принципах систематической номенклатуры всех соединений, указанных в таблице.
карбоксильной группы:
Например,
О
II
—С—ОН
О О
II II
сн3—с—н + )о2 сн,—с -он
ацетальдегид
уксусная
кислота
Альдегиды и кетоны используются в качестве растворителей и сырья для химического синтеза. Например, формальдегид
О
II
н—С—н
служит исходным веществом для получения фенолформальдегидных смол типа бакелитовой.
Ацетон
О II сн3—с—сн3
является одним из наиболее распространенных лабораторных расгвори-телей.
Карбоновые кислоты относятся к числу сравнительно слабых кислот; в водном растворе они диссоциируют в ограниченной степени. При диссоциации карбоксильной группы отрицательный заряд распределяется по обоим атомам кислорода. Три р-орбитали на двух атомах кислорода и соединяющем их атоме углерода комбинируют с образованием одной делокализованной молекулярной орбитали:
СН3—С -> СН3 —С или
О — Н О-
сн3—с-о
Обе углерод-кислородные связи в ионизированной карбоксильной группе имеют одинаковую длину. Отрицательный заряд распределен по всем трем атомам этой группы. (Среднюю структуру в приведенном выше уравнении можно рассматривать лишь как одну из двух резонансных структур, дающих вклад в истинную структуру карбоксильного иона. Как, по-вашему, выглядит другая резонансная структура?) С гидроксидами металлов и карбонатами карбоновые кислоты реагируют подобно
Особая po.ib угаерода в химии
297
любым другим кислотам, образуя соли:
С2Н5СООН + NaOH -> C2H5COONa + Н2О
пропионовая пропионат
кислота натрия
Пропионат натрия в водном растворе диссоциирует на ионы натрия и пропионат-ионы и может быть получен в виде соли только после высушивания.
Муравьиная кислота, НСООН, оказывает раздражающее действие при укусах насекомых. Уксусная кислота, СН3СООН, придает кислый вкус уксусу. Карбоновые кислоты от масляной (С4) до гептановой (С7) имеют острый запах, присущий прогорклому' маслу и острым сырам.
Сложные эфиры являются продуктами реакций карбоновых кислот со спиртами
О
II
сн3с—ОН + С4Н9ОН
уксусная нМутанол кислота
О
II сн3с—ОС4Н9 + Н2О
(зутилацетат
Хотя названия эфиров напоминают названия солей, эфиры находятся не в ионизированной форме. Многие из них представляют собой летучие жидкости и обладают приятным, фруктовым запахом. Бутилацетат придает своеобразный запах бананам, поэтому иногда его называют банановым маслом. Этилбутират, С3Н7СООС2Н5, имеет запах ананаса, а октилацетат, СН3СООС8Н17, запах апельсинов. Такие масла, как льняное, хлопковое и оливковое, а также такие жиры, как сливочное масло, свиное сало и говяжий жир, являются эфирами трехосновного спирта глицерина
СН,—СН—СН, I I I
он он он
и карбоновых кислот с большой молекулярной массой-пальмитиновой, С15Н31СООН, стеариновой, С17Н35СООН, и олеиновой, С17Н33СООН.
Соли этих жирных кислот со щелочными металлами, получаемые обработкой жиров животного происхождения гидроксидами щелочных металлов, особенно NaOH, представляют собой растворимые мыла:
(С17Н35СОО)3С3Н5 + 3NaOH -> 3C,,H35COONa + С3Н5(ОН)3 глицерилстеарат стеарат натрия глицерин
'иг живааяаге жире) < мнда?
Молекула мыла в растворе состоит из длинной углеводородной цепи, на одном конце которой находится заряженная карбоксильная группа. Мыло смывает грязь в водный раствор, окружая маленькие частицы жира большим числом своих молекул; их углеводородные цепи направлены в сторо
Г .lUHil
2QS
ну жира, а карбоксильные группы-наружу. Таким образом, молекулы мыла «упаковывают» частички жира в капельки, или мицеллы, которые переносятся в раствор и затем вымываются из него.
Наиболее распространенными органическими основаниями являются амины, которые можно рассматривать как производные аммиака:
СН3—NH2 СН3СН2—NH2 СН3 —NH —СН3
метиламин этиламин <)иметиламин
сн3
I
СН3—N —СН3 триметиламин
СН3~NH —С2Н5 метилэтиламин
h2n—сн2— сн2 —nh2 ho—nh2
зтиленЬиамин гидроксилами»
В зависимости от того, сколько атомов водорода в NH3 замещено органическими радикалами, амины называются первичными, вторичными или третичными. Эти органические основания почти настолько же сильны, как и аммиак, и, присоединяя протон, переходят в ионную форму
СН3СН2 NH2 + Н+ - СН3СН2— NH3
Метиламин показан на рис. 21-11,в в ионной форме.
Все амины обладают рыбным запахом и, как правило, токсичны. Триметиламин в умеренных концентрациях имеет удушливый запах гнилой рыбы. В токсичных концентрациях он насыщает обонятельные рецепторы, и при этом ощущается только аммиачный запах.
Аминокислоты - вещества с очень важными свойствами-представляют собой комбинацию карбоновой кислоты и амина в одной молекуле. Они описываются общей формулой
амин кислота ионизованная форма
аминокислоты
в которой —R означает боковую группу, придающую каждой аминокислоте ее индивидуальность и своеобразные химические свойства (рис. 21-12). Атом углерода, от которого ответвляется боковая группа, называется a-углеродом. Как показывает рис. 21-12, a-углерод является асимметрическим атомом молекулы, и поэтому каждая аминокислота существует в виде двух оптических изомеров, или энантиомеров.
В растворе оба конца аминокислоты-аминогруппа и карбоксигруппа-ионизуются, и заряженная с обоих концов молекула представляет со-
Особая роль углерода в химии
299
Рис. 21-12. Два оптических изомера аминокислоты с боковыми группами, направленными в противоположные стороны от центрального атома углерода, который называется a-углеродом. Как карбоксигруппа, так и аминогруппа показаны в ионизованной форме
СН3 I + H3N СН—СОО Белки всех живых организмов построены только из L-аминокислот. Их зеркальные отражения, D-аминокис-лоты, обнаруживаются в небольших
количествах в клеточных стенках некоторых бактерий и в антибиотиках, образуемых некоторыми микроорганизмами. Одна из проблем описания эволюции жизни связана с объяснением этой асимметрии компонент живых организмов. Любой атом углерода с присоединенными к нему четырьмя различными атомами может иметь две различные конфигурации, являющиеся зеркальными отражениями одна другой. Такой атом углерода называется асимметрическим углеродом.
a-L-аланин, б-D-аланин.
бой цвиттер-ион. Все белки построены из аминокислот, при полимеризации которых отщепляется молекула воды и образуется пептидная связь:
+ Н
Н —N
Н
Н R
+ Н2О
г"О---С----N3>
плюс неподеленная пора на несвязывающей орбитали
в
Рис. 21-13. Возможные изображения структуры пептидной связи между аминокислотами в белках.
а-структура с двойной связью между атомами С и О, роль пептидной связи играет простая связь С—N;
б-структура с простой связью С—О и двойной пептидной связью C=N. Эта структура требует помещения формальных зарядов на атомах О и N и поэтому менее удовлетворительна;
в-более правдоподобная структура пептидной связи; ее можно получить, комбинируя р-орбитали атомов О, С и N, чтобы образовались связываю-
щая, несвязывающая и разрыхляющая делокализованные молекулярные орбитали. Делокализованная связывающая орбиталь простирается на все три атома и поэтому обладает большей устойчивостью, чем обычные двухцентровые связи. Несвязывающая орбиталь на рисунке не показана. Повышенная устойчивость делокализованных электронов с избытком компенсирует небольшое разделение зарядов между атомами О и N. Частичная двоесвязность пептидной связи С—N препятствует вращению вокруг нее и обеспечивает плоскостность пептидного звена.
После образования пептидной связи электроны двойной связи С=О делокализуются на пептидную связь С—N, которая становится частично двое-связной. Это вынуждает пептидное звено (рис. 21-13) оставаться плоским. Пептидное звено является краеугольным камнем всех белковых структур и представляет собой один из важнейших примеров делокализации л-связи в химических системах.
2J-6. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
Ароматические соединения имеют циклические молекулы с делокализованными электронами. Простейшая из них-бензол, С6Н6. Делокализованные электроны придают ароматическим соединениям специфические свойства, которые отличают их от рассматривавшихся нами до сих пор алифатических соединений. Бензольное кольцо часто записывают как одну из структур Кекуле
Особая роль углерода в химии
301
хотя лучшее описание делокализации электронов дают символические
обозначения
Делокализация электронов может простираться на большее число смежных циклов, как, например, в нафталине
или в антрацене
Молекула коронена содержит семь смежных колец
Предельным случаем такого процесса конденсации циклов является графит, состоящий из атомных плоскостей с гексагональными циклами, в которых делокализация электронов простирается на всю плоскость. Благодаря наличию делокализованных электронов графит является хорошим проводником электричества в отличие от алмаза, который обладает свойствами диэлектрика. Графит можно рассматривать как двумерный металл, в котором подвижность электронов ограничена отдельными атомными плоскостями, упакованными в стопку.
Бензол обладает поразительно низкой реакционной способностью по сравнению с алкенами, например бутеном. Своей низкой реакционной способностью бензол больше напоминает насыщенные алканы. Он не вступает в реакции присоединения по двойной связи; если бы такие реакции протекали, это понижало бы степень делокализации электронов. Наличие делокализации приводит к тому, что устойчивость бензола оказывается на 166 кДж моль “1 больше, чем следует ожидать для соединения с тремя простыми и тремя двойными связями (см. рис. 15-9). Вообще говоря, чем больше область молекулы, на которую простирается делокализация электронов, тем устойчивее такая молекула.
Типичной реакцией для циклических ароматических соединений является не присоединение, а замещение:
Глава 2/
302
+ Н2О
FeBr3
бром^ензол
алкилйеизол
(Записывая структуры подобного типа, принято опускать в них атомы Н, присоединенные к циклическим атомам углерода; каждая вершина шестиугольного кольца обозначает атом С с присоединенным к нему атомом Н.) В первой из указанных выше реакций серная кислота помогает протеканию реакции, превращая HNO3 в NO2 , частицу, которая атакует бензольное кольцо. Кроме того, серная кислота играет роль поглотителя влаги, удаляя из реакционной системы образующуюся в качестве продукта воду. Соединения FeBr2 и А1С13 во второй и третьей реакциях являются катализаторами. Чтобы уяснить их роль, необходимо познакомиться с механизмом реакции. Ароматические циклы особенно восприимчивы к атаке электрофильными группами, или льюисовыми кислотами, которые имеют большое сродство к электронным парам. В реакции бромирования бензола Вг2 не является электрофильным агентом, в отсутствие катализатора FeBr3 эта реакция не осуществляется даже за достаточно большое время. Однако молекула FeBr3 способна присоединить еще один ион Вг “, акцептируя его электронную пару, и поэтому она разрывает молекулу Вг2 на ионы Вг и Вг + :
:Вг: :Вг:_
.. I ....................... I ..
:Вг — Fe + :Вг—Вг: —> :Вг— Fe — Вг: 4- Вг: +
" I ....................... I "
Вг: :Вг:
Появляющаяся при этом электрофильная частица Вг+ атакует ароматическое кольцо бензола и притягивает к себе одну электронную пару, образуя связь С—Вг. Возникающее промежуточное соединение неустойчиво и диссоциирует, отщепляя Вг+ с образованием исходного вещества либо ион водорода с образованием окончательного продукта-бромбензола:
Особая p>).ih углерода в химии
303
неустойчивый промежуточный продукт
продукт реакции
Высвобождающийся ион Н+ реагирует с FeBr4, образуя НВг и исходную молекулу FeBr3. Молекулярный ион NO2 в реакции получения нитробензола также является электрофильной группой, и эта реакция протекает по аналогичному механизму.
Описанный механизм иллюстрирует два важных аспекта химических реакций: незавершенность большинства реакций и необходимость использования катализатора. Не из каждой распадающейся молекулы неустойчивого промежуточного продукта образуется бромбензол; многие молекулы распадаются, приводя снова к исходному реагенту. В результате большинства синтезов появляется смесь, в которой желаемый конечный продукт является лишь одним из компонентов (в лучшем случае главным) среди ряда возможных продуктов. Одна из проблем химического синтеза заключается в разработке таких способов и путей синтеза, которые максимально увеличивают выход желаемого продукта. Часто длинный обходной путь лучше очевидного одностадийного синтеза, если более сложный синтез приводит практически к единственному продукту.
Как мы видим, катализатор представляет собой вещество, которое ускоряет химическую реакцию, обеспечивая более легкий путь ее протекания, но само не расходуется в реакции. Это не означает, что катализатор не принимает участия в реакции. Молекула FeBr3 играет важную роль в многостадийном механизме рассмотренной выше реакции бромирования бензола. Но в конце реакции FeBr3 регенерируется в исходной форме. Это является общим и характерным свойством любого катализатора. Смесь газов Н2 и О2 может оставаться неизменной при комнатной температуре целые годы, и в ней не будет протекать сколько-нибудь заметной реакции, но внесение небольшого количества платиновой черни вызывает мгновенный взрыв. Платиновая чернь оказывает такое же воздействие на газообразный бутан или пары спирта в смеси с кислородом. (Некоторое время назад в продаже появились газовые зажигалки, в которых вместо колесика и кремня использовалась платиновая чернь, однако они быстро приходили в негодность вследствие отравления поверхности катализатора примесями в газообразном бутане. Тетраэтилсвинец тоже отравляет катализаторы, которые снижают загрязнение атмосферы автомобильными выхлопными газами, и поэтому в автомобилях, на которых установлены устройства с такими катализаторами, должен использоваться бензин без примеси тетраэтилсвинца.) Каталитическое действие платиновой черни сводится к облегчению диссоциации двухатомных молекул газа, адсорби
Главе.
304
руемого на ее поверхности. Диссоциированные атомы (например, Н или О) обладают гораздо большей реакционной способностью, чем исходные молекулы в газовой фазе. Никакой катализатор не изменяет полную энергию реакции и не вступает в реакцию необратимо. Он лишь открывает возможность более легкого механизма или пути реакции, что позволяет реакции протекать быстрее.
Многие, хотя и не все, катализаторы обладают поверхностной активностью, подобно платиновой черни. Катализируемые вещества, называемые субстратами, связываются с поверхностью катализатора. Если хи
ацетилсалициловая кислота (аспирин)
метилсалицилат
Рис. 21-14. Некоторые из распространенных производных бензола. Салициловая кислота может образовывать сложные эфиры двумя способами: используя гидроксильную группу, как в аспирине, либо карбоксильную группу, как в метилсалицилате. В отличие от алифатических спиртов фенолы представляют собой кислоты, хотя и значительно более слабые, чем кар-
боновые кислоты. Ароматические амины, подобные анилину, являются более слабыми основаниями, чем алифатические амины. Приставки орто-, мета- и пара- (сокращенно о-, м- и и-) указывают взаимное расположение групп, присоединенных к бензольному циклу, как это иллюстрируется тремя изомерами ксилола.
Особая роль углерода в химии
305
мические группы на поверхности катализатора ослабляют какую-либо связь в субстрате, это облегчает расщепление молекулы субстрата. Именно в этом заключается каталитическое действие платины. Мелко диспергированный черный порошок платины-более эффективный катализатор, чем кусок металлической платины, только по той причине, что порошок имеет более развитую поверхность.
Хлорид алюминия, А1С13, играет роль катализатора в реакции алкилирования бензола, в результате которой образуются его производные с алкильными боковыми цепями. Важным классом биологических катализаторов являются белковые молекулы, называемые ферментами. Эти молекулы имеют ла своей поверхности участки, называемые активными центрами, на которых осуществляется катализ. К активным центрам ферментов часто присоединяются атомы переходных металлов, которые становятся важными участниками катализа. Мы познакомимся с примером ферментативного катализа в разд. 21-10.
На рис. 21-14 представлены структурные формулы некоторых производных бензола. Фенол обладает слабой кислотностью в отличие от спиртов, ароматическим аналогом которых его можно считать. Способность фенола и его производных отщеплять гидроксильный протон обусловлена тем, что в результате электроны атома кислорода принимают некоторое участие в делокализации. Связь бензольного кольца с атомом кислорода приобретает частично двоесвязный характер, а водород, частично лишенный связывающей электронной пары, легко диссоциирует. Однако кислотность фенолов обычно ниже, чем у карбоновых кислот.
По той же причине анилин-более слабое основание, чем аммиак или алифатические амины. Неподеленная электронная пара азота, которая должна притягивать протон, частично вовлекается в делокализацию на ароматический цикл, и это понижает ее способность притягивать протон и ионизовать отдающую его молекулу.
21-7. ПОГЛОЩЕНИЕ СВЕТА АРОМАТИЧЕСКИМИ СОЕДИНЕНИЯМИ
Во многих ароматических соединениях с делокализованными электронами, как и в комплексах переходных металлов с d-орбиталями, энергетические уровни располагаются достаточно близко друг к другу, что позволяет этим соединениям поглощать видимый свет. Поэтому соединения двух этих классов часто обладают яркой окраской. При поглощении фотона света один электрон со связывающей л-орбитали (см. рис. 13-26) переводится на низшую разрыхлящую молекулярную л*-орбиталь. Такое поглощение световой энергии называется л -> л*-переходом. У бензола и нафталина энергетические уровни располагаются слишком далеко друг от друга, чтобы поглощение происходило в видимой области спектра, и поэтому данные соединения бесцветны. Но если к нафталину присоединены две нитрогруппы, то в конечном продукте, 1,3-динитронафталине, расстояние между энергетическими уровнями становится меньше
r.hliill 21
25ОООсм“1, и это соединение имеет бледно-желтую окраску. (В данном разделе снова полезно воспользоваться таблицей дополнительных цветов 20-3.) Появление окраски обусловлено увеличением размеров делокализованной электронной системы, в которую теперь входят две нитрогруппы, в результате чего энергетические уровни (и расстояние между ними) понижаются. Этот эффект еще сильнее выражен в 2,4-динитронафтоле-1, распространенном желтом красителе для шерсти и шелка. Добавление гидроксильной группы еще больше увеличивает сопряженную систему, и энергия л -» л*-перехода уменьшается. Окраска соединения становится оранжево-желтой. В трех указанных соединениях происходит поглощение соответственно ультрафиолетового (в нафталине), фиолетового (в 1,3-дини-тронафталине) и голубого (в 2,4-динитронафтоле-1) света.
нафталин
Многие вещества, такие, как фенолфталеин, метиловый оранжевый и лакмус, имеют разную окраску в кислых или основных растворах; поэтому они используются в качестве кислотно-основных индикаторов (см. рис. 5-7). Хотя н-нитрофенол плохой индикатор, потому что изменение его окраски мало заметно, он имеет очень простую молекулу, на примере которой удобно показать, что происходит, когда индикатор меняет окраску. Поскольку фенолы обладают в растворах свойствами слабых кислот, они вступают в следующую реакцию:
О”
О"
н —о
Н+ + “О
кислые растворы
основные растворы
В основном растворе n-нитрофенол имеет ярко-желтую окраску. Его максимум поглощения приходится на длину волны 400 нм. В основной форме ^-нитрофенола его атом кислорода и нитрогруппа получают возможность взаимодействовать с ароматическим кольцом, в результате чего возникает одна большая делокализованная электронная система:
Особа» роль углерода в химии
307
Такая протяженная делокализованная структура называется хиноидной структурой; это название происходит от бензохинона, соединения с желтой окраской, имеющего структуру
В кислой форме «-нитрофенола на атоме кислорода уже нет отрицательного заряда. Неподеленные электронные пары кислорода гораздо труднее вовлекаются в делокализацию; поэтому энергетический уровень первого возбужденного электронного состояния оказывается выше, чем у основной формы. Поглощение света имеет максимум при 320 нм, который приходится на начало ультрафиолетовой области, и вследствие этого соединение имеет бледную желто-зеленую окраску. Фенолфталеин, бесцветный в кислой среде и розовый в основной среде, имеет более сложную молекулу, которая в зависимости от кислотности среды изменяется подобным же образом.
Расширение делокализованной системы происходит особенно заметно у азокрасителей, молекулы которых имеют два ароматических кольца, связанных мостиковой группой —N=N—. Метиловый оранжевый, еще один кислотно-основной индикатор (см. рис. 5-6), представляет собой азокраситель со структурой
Он имеет красную окраску в кислой среде и желтую в основной. (При каких условиях его электронные энергетические уровни разделяет большее расстояние? Можете ли вы объяснить причину?)
Важным примером делокализации и поглощения энергии является хлорофилл, который обсуждался в послесловии к гл. 20. Ароматическое кольцо, окружающее ион Mg2 +, представляет собой протяженную делокализованную систему, образуемую порфирином (см. рис. 20-19). Электронные энергетические уровни этой системы обусловливают поглощение света с одним максимумом в фиолетовой области, при 430 нм, и вторым максимумом в красной области, при 690 нм (см. рис. 20-22). При поглощении света молекулой хлорофилла ее электрон возбуждается на более высокий уровень; это позволяет хлорофиллу восстанавливать ионы Fe3+ в ферредоксине, белке с молекулярной массой 13000, который содержит два атома железа, координированные к сере. Последующее окисление ферредоксина служит источником энергии для протекания других реакций, которые в конце концов приводят к расщеплению воды, восстановлению диоксида углерода и, наконец, к синтезу глюкозы, С6Н12О6.
! иш; 21 . 308
21-8. УГЛЕВОДЫ
Сахар глюкоза, образующийся в листьях зеленых растений, относится к числу углеводов. Название углеводы связано с прошлыми неверными представлениями о структуре этих соединений. Формулу глюкозы, С6Н12О6, можно записать в виде (СН2О)6. Вещества, формулы которых могут быть представлены равными количествами углерода и воды, в свое время получили название «углеводов».
В растениях молекула глюкозы полимеризуется в цепи, состоящие из тысяч мономерных единиц, в результате чего получается целлюлоза, а если полимеризация происходит несколько иным образом, получается крахмал. Близкородственный к глюкозе N-ацетилглюкозамин в результате полимеризации образует хитин - вещество, из которого состоит роговица насекомых. Другое близкое по составу вещество, N-ацетилмурановая кислота, сополимеризуется в другую последовательность цепей, из которых построены стенки бактериальных клеток. Глюкоза разлагается в несколько стадий, выделяя энергию, которая требуется живому организму. Избыток глюкозы переносится кровотоком в печень и превращается в животный крахмал - гликоген, который при необходимости снова превращается в глюкозу. Глюкоза, целлюлоза, крахмал и гликоген относятся к углеводам.
Углеводы в форме крахмала являются важнейшими источниками энергии в пище. Для получения этой энергии мы либо употребляем в пищу зерна, в которых накапливается крахмал, либо скармливаем эти зерна животным, которые синтезируют мясные белки, а затем съедаем их. В любом случае потребляемая нами энергия в конце концов поставляется крахмалом, полимерным продуктом фотосинтеза. Целлюлоза входит в состав хлопка и льна, а также искусственных продуктов - ацетата целлюлозы и вискозного волокна. Дерево, из которого сделана наша мебель, также содержит целлюлозу. Бумага этой книги получена в процессе обработки целлюлозы. Даже деньги давно перестали делать из благородных металлов, заменив их целлюлозой. В этом разделе будет кратко рассмотрено, что представляют собой углеводы и как они используются.
Важнейшей структурной единицей углеводов являются моносахариды, или просто сахара. Такие сахара могут включать три, четыре, пять или шесть атомов углерода, и тогда они соответственно называются триозами, тетрозами, пентозами или гексозами. Мы рассмотрим здесь только гексозы и подробно наиболее распространенную из них D-глюкозу. Структура D-глюкозы представлена на рис. 21-15, а- в. Рис. 21-15, а показывает нумерацию шести атомов углерода, а также предложенный Фишером способ записи формул для указания структур, включающих асимметрический атом углерода.
Асимметрический атом углерода связан с четырьмя неэквивалентными группами; в молекуле глюкозы к числу таких атомов принадлежат атомы углерода с номерами от 1 до 5. Как мы уже видели на примере а-углерода аминокислоты (см. рис. 21-12), каждому такому асимметрическому атому
Особая роль углерода в химии
309
Н-С-ОН
н-с-он
31 но-с—н н-с-он
5 I н-с----
6СН,ОН
О
а)а-о-глюкоза
d) a-D-глюкоза
в) а-п-глюкоза
г) [З-п-глюкоза
Рис. 21-15. Наиболее распространенные углеводы.
fl-a-D-глюкоза в фишеровском представлении; d-a-D-глюкоза в виде плоской гексагональной диаграммы; e-a-D-глюкоза в представлении, ближе всего отвечающем ее истинной форме ; г - P-D-глюкоза, отличающаяся от a-формы только расположением групп, которые присоединены к атому углерода в положении 1; d-a-D-галак-
тоза, отличающаяся от глюкозы расположением групп, которые присоединены к углероду в положении 4 (P-D-галактоза образуется переменой положения групп —Н и —ОН, присоединенных к углероду 1); e-a-D-манноза, отличающаяся от a-D-глю-козы только положением групп у углерода 2; мс —сахароза, димер a-D-глю-козы и P-D-фруктозы.
Г лава 21
310
углерода соответствуют два различных положения четырех присоединенных к нему групп, которые представляют собой взаимные зеркальные отражения. При наличии пяти асимметрических атомов углерода с двумя различными конфигурациями вокруг каждого из них возможно существование всего 25, т. е. 32 различных изомеров гексозного сахара.
По условию, введенному Фишером, связи, направленные вправо и влево на рис. 21-15, а, ведут от центрального атома к атомам, лежащим выше плоскости рисунка. Связи, указанные вверх или вниз от центрального атома, ведут к атомам, лежащим ниже плоскости рисунка. Изменение конфигурации групп вокруг любого асимметрического атома углерода в гексозе указывается на фишеровской диаграмме взаимной заменой положений групп —Н и —ОН. Эту асимметрию легче заметить при представлении той же молекулы в виде плоского шестиугольника (рис. 21-15, б). Истинная форма молекулы с тетраэдрической геометрией связей вокруг каждого атома углерода изображена на рис. 21-15, в. Молекула глюкозы имеет конформацию кресла, с которой мы впервые познакомились на примере циклогексана.
У 32 изомеров гексозы, возникающих при 32 возможных перестановках групп, окружающих атомы углерода с номерами от 1 до 5, положения групп —Н и —ОН при атоме углерода 1 указывают приставками а- или Р-. У всех а-гексоз гидроксильная группа при атоме углерода 1 направлена вниз, как на рис. 21-15, б и в; у всех Р-гексоз она направлена вверх, как на рис. 21-15, г. Соединение, являющееся полным зеркальным отражением D-гексозы относительно всех пяти асимметрических атомов углерода, называется L-гексозой. Следовательно, для каждого типа гексозы существуют четыре варианта: ot-D, ot-L, p-D и P-L. Таким образом, должно существовать 32:4 = 8 различных типов гексозы, которым приписывают индивидуальные названия. Однако в природе встречаются только три из них: глюкоза, галактоза и манноза. Эти три сахара отличаются конфигурациями групп вокруг атомов углерода 2 и 4 и сопоставляются на рис. 21-15, г, д и е. Галактоза входит в состав молочного сахара лактозы, а манноза-растительный продукт (название которого происходит от библейского слова «манна»). Однако самой распространенной гексозой является глюкоза.
Из гексозных сахаров с пятичленным кольцом наиболее распространенным является фруктоза. Фруктоза входит в состав меда и фруктов (откуда и происходит ее название) и в сочетании с глюкозой образует обычный столовый сахар-сахарозу (рис. 21-15, ж).
Полисахариды
Целлюлоза является основным структурным материалом деревьев и растений. Она входит в состав шерсти, хлопка и льна, а в измененном виде и в состав бумаги. Целлюлоза представляет собой полимер P-D-глю-козы, в цепи которого содержится примерно 3000 мономерных единиц. Связь между двумя соседними звеньями Р-глюкозы, показанная на рис. 21-16, а, называется р-глюкозидной связью.
Особая po.ib y.'.iepoOa t, химии
311
о) крахмал
Рис. 21-16. Наиболее распространен- а-целлюлоза, полимер P-D-глюкозы; ные полисахариды. б-крахмал, полимер a-D-глюкозы.
Гидроксильные группы глюкозы позволяют ей образовывать сложные эфиры; обработка целлюлозы уксусным ангидридом, уксусной кислотой и небольшим количеством серной кислоты приводит к производному, называемому ацетатом целлюлозы. В этом процессе цепи целлюлозы разрываются на фрагменты, содержащие 200-300 мономерных единиц, и к каждому мономеру присоединяются в среднем две ацетатные группы. Ацетат целлюлозы используется для изготовления основы фотографической пленки ; его также растворяют в ацетоне и продавливают раствор через тонкие отверстия в металлической форме, получая искусственный шелк.
Целлюлозу нельзя использовать в пищу. За исключением термитов и жвачных (к их числу относятся коровы), в пищеварительных органах которых имеются микроорганизмы, перерабатывающие целлюлозу, животные неспособны разрушать р-глюкозидную связь. Ее разрыв осуществляется в результате катализируемого ферментами процесса, а в человеческом' организме соответствующие ферменты отсутствуют. В 1967 г. был разработан процесс использования целлюлозы для получения искусственной муки, которая, хотя и пригодна к выпечке, подобно крахмальной муке, не обладает питательной ценностью. Ее пытались использовать для диэти-ческих целей, но она быстро вышла из употребления. (Журнал «Лайф» иронически называл ее «непищей» и предлагал выплатить «неденьги» ее изобретателю.) Однако вполне серьезно высказывалась такая мысль, что если бы человек научился каким-то образом существовать в симбиозе с введенными в его кишечник микроорганизмами, способными перерабаты
Глава 21
312
вать целлюлозу, подобно тому как это удается жвачным животным, его пищевые проблемы были бы разрешены на много веков вперед.*
Крахмал-также полимер глюкозы, но с a-связью, показанной на рис. 21-16, б. Крахмал представляет собой стандартную форму, в которой хранится глюкоза, использующаяся в качестве источника пищи в растениях и являющаяся основным источником запасенной солнечной энергии. Крахмал накапливается в стеблях растений, листьях, корнях и семенах. Все организмы обладают ферментами, необходимыми для усвоения крахмала. Первой стадией ферментации независимо от того, происходит она в желудке или в пивном чане, является расщепление крахмала в глюкозу. Если долго подержать во рту хлеб, он в конце концов приобретает сладкий вкус, потому что ферменты нашей слюны могут превращать в сахар содержащийся в хлебе крахмал.
Полимеры производных гексозы служат для построения наружных покровов насекомых (хитин) и клеточных стенок бактерий. В хитине производное гексозы, называемое N-ацетилглюкозамином, полимеризуется без образования поперечных связей. Один из слоев стенки клеток бактерий представляет собой полимер производных гексозы, который укреплен поперечными связями из коротких цепей четырех аминокислот. Человек и все остальные высшие организмы вырабатывают фермент лизоцим, который защищает их, растворяя полисахаридные стенки клеток патогенных (вызывающих болезни) бактерий. Лизоцим содержится в большинстве таких выделений, как пот или слезы. D-Аминокислоты обнаруживаются в живых организмах крайне редко, например их находят
* Это одно из привлекательных на первый взгляд предложений способно привести к невероятным социальным последствиям. Оно может служить примером того, что неразумное применение научно-технических достижений к отдельным проблемам часто порождает больше новых проблем, чем решает старых. В самом деле, к каким последствиям могло бы привести превращение целлюлозы в неограниченный источник дешевой пищи? Постараемся оценить некоторые из возможных результатов.
1. Быстрый рост населения планеты временно перестанет привлекать пристальное внимание человечества.
2. Появление «неограниченного» источника дешевой пищи и как следствие рост населения вызовет большие изменения в уровне и образе жизни.
3. Уничтожение лесов на больших площадях в регионах, где недостаточно других источников пищи, привело бы к вымыванию и эрозии верхнего слоя почвы, снижению урожаев обычных пищевых продуктов и в конце концов к новой угрозе голода.
Таким образом, употребление в пищу целлюлозы само по себе явилось бы настолько же недальновидным и опасным шагом, как введение мнимо эффективного способа рассеяния лос-анджелесского смога над фермами штата Айова. Это не решает проблему, а просто отодвигает ее. На нашей планете все настолько взаимосвязано, что почти любое важное научное или техническое новшество, вводимое без должного прогнозирования, способно вызвать осложнения. Ведь кто мог бы в свое время обвинить Генри Форда в том, что его машины для массового передвижения в конце концов окажут губительное влияние на окружающую среду?
Особая роль углерода в химии
313
в клеточных стенках некоторых бактерий. По мнению одних авторов, D-аминокислоты оказываются там просто потому, что бактерия старается избавиться от них, но высказывается и такая точка зрения, что они встраиваются в стенки бактерий для защиты ее от воздействия ферментов (не лизоцимов, атакующих Р-глюкозидную связь), которые оказывают наиболее эффективное воздействие на обычные L-аминокислоты.
21-9. БЕЛКИ И ФЕРМЕНТ
Все белки являются полимерами аминокислот. Общая формула такого полимера показана в нижней части рис. 21-1, а модель отдельной аминокислоты-на рис. 21-12. Ферменты представляют собой один из классов белков, причем, видимо, наиболее важный. Ферменты имеют компактные молекулы с молекулярной массой от 10000 до нескольких миллионов и диаметром от 20 А и выше. Они выполняют роль катализаторов, регулирующих биохимические реакции. Другие компактные молекулы белков, например миоглобин и гемоглобин, выполняют роль переносчиков и накопителей молекулярного кислорода (см. рис. 20-25, 20-26). Цитохромы-это белки, способные к окислительно-восстановительным реакциям и играющие роль промежуточных звеньев при извлечении энергии из пищевых продуктов (см. рис. 20-23). Молекулы гамма-глобулинов с молекулярной массой порядка 160000 представляют собой так называемые антитела, защитное действие которых заключается в том, что они присоединяются к вирусам, бактериям и другим чужеродным телам в живом организме и осаждают их из жидких сред. Все перечисленные белки относятся к глобулярным белкам.
Другой большой класс белков образуют фибриллярные белки. Они выполняют в организме главным образом роль структурных материалов. К их числу относится кератин, входящий в состав кожи, волос, шерсти, ногтей и других роговых тканей. К другому типу фибриллярных белков относится коллаген, находящийся в сухожилиях, подкожном слое и роговице глаз; к фибриллярным относятся белки шелка и тканей насекомых. Белки, углеводы и липиды (жиры с длинными цепями и жирные кислоты) играют роль строительных материалов в любых живых организмах.
Главное различие между цепями белка и полиэтилена или полиэтилен-терефталата (дакрона) заключается в том, что в молекуле белка не все боковые группы одинаковы. У фибриллярных белков определенная повторяющаяся последовательность боковых групп придает конкретному белку-кератину или коллагену-вполне конкретные механические свойства. Глобулярные белки имеют еще более сложное строение. Эти молекулы обычно содержат от 100 до 500 аминокислот, полимеризованных в одну длинную цепь, и полная последовательность аминокислотных остатков в каждой молекуле одного глобулярного белка одинакова. Эти остатки могут быть углеводородными, кислыми, основными, нейтральными или полярными. Свертывание белковой цепи в компактную глобулярную моле
кулу и химические свойства молекулы после свертывания определяются типом и последовательностью аминокислотных остатков.
В белках всех живых организмов обычно встречается только 20 различных типов аминокислот, которые указаны в табл. 21-5. Некоторые из них имеют углеводородный состав, например валин (Вал), лейцин (Лей), изолейцин (Иле) и фенилаланин (Фен). Гидрофобные группы молекул всегда более устойчивы, если их можно удалить из водного окружения. Поэтому белковые цепи в водном растворе складываются в молекулы, у которых такие группы обращены вовнутрь. Некоторые остатки аминокислот оказываются заряженными: например, аспарагиновая (Асп) и глутаминовая (Глу) кислоты входят в белки в ионизованной форме и несут на себе отрицательный заряд, а основания лизин (Лиз) и аргинин (Apr) при pH 7 положительно заряжены. Несмотря на то что некоторые другие группы, например аспарагин (Асн), глутамин (Глу) и серин (Сер), незаряжены, они имеют полярность и поэтому совместимы с водным окружением. Одним из наиболее важных факторов, определяющих свертывание белковой цепи в глобулярную молекулу, является устойчивость, достигаемая при ориентации гидрофобных групп вовнутрь молекулы, а заряженных групп-наружу. Хотя каждый из двух оптических изомеров, показанных на рис. 21-12, пред-
Таблица 21-5
Остатки двадцати наиболее распространенных аминокислот2
+H3N —СН —С( -О
Сокращенное название остатка
Полное название
Группа R
Кислотные группы R
Асп Аспарагиновая кислота —СН2СООН
Глу Глутаминовая кислота —СН2СН2СООН Основные группы R
Лиз Лизин —CH2CH2CH2CH2NH2
Apr Гис Аргинин — CH2CH2CH2NH—C(NH)NH2 Гистидин /NH-CH -СН2-С II V , N CH ' Незаряженные, но полярные группы R
Асн Аспарагин —СН2—СО—NH2
Глн Глутамин —СН2СН2—СО—NH2
Особая роль углерода в химии
315
Продолжение табл. 21-5
Сокращенное название остатка Полное название Группа R
Сер Серин —СН2ОН
Тре Треонин —СН(ОН)—СНз
Гли Глицин —н
Группы R, содержащие серу
Цис Цистеин —CH2SH
Мет Метионин —СН2СН2—S—сн3
Алифатические группы R
Ала Аланин —сн3
Вал Валин —сн—сн3 1 сн3
Лей Лейцин —сн2—сн—сн3 сн3
Иле Изолейцин —сн—сн2—сн3 СН3
Про Пролин6 сн2 сн2 сн2 +h2n—сн СОО-
Ароматические группы R
Фен Фенилаланин — СН2^^ 2
Тир Тирозин —сн2Н^ он
Три Триптофан /сн\ — СН,—С NH
Все аминокислоты, кроме пролена (Про), описываются формулой, приведенной в заголовке таблицы.
6 Полная формула аминокислоты, а не группы R.
Г шва 21
316
ставляется равновероятным, все аминокислоты в белках находятся в L-формах (см. рис. 21-12,а).
Белковая цепь приобретает чрезвычайную устойчивость, сворачиваясь в правостороннюю а-спираль (рис. 21-17). В такой структуре аминокислотные остатки направлены наружу от оси спирали, а группы С =О одного витка спирали связаны с группами Н—N следующего витка водородными связями. Водородные связи образуются между сильно электроотрицательными атомами, например F или О, и атомами водорода с небольшим локальным избытком положительного заряда. Такие связи имеют главным образом электростатическое происхождение и зависят от способности двух атомов к тесному сближению. Атомы О и F, имеющие небольшие размеры, способны давать такие связи; более крупные атомы С1 обычно не могут образовать водородных связей. В белках водородные связи играют очень важную роль; они возникают между кислородным атомом карбонильной группы и атомом водорода аминогруппы, принадлежащими полипептидной цепи. Как видно из рис. 21-13, частично двое-связный характер пептидной связи С—N не только обеспечивает плоскостность пептидного звена, но также делает атом кислорода несколько отрицательным, а атом азота с присоединенным к нему атомом водорода несколько положительными. Это и создает благоприятные условия для образования водородных связей.
Н О
С ф
N ф
О
R
Рис. 21-17. 7-Спираль, тип свертывания белковой цепи, обнаруживаемый как в фибриллярных, так и в глобулярных белках. 7-Спираль была предсказана Л. Полингом и Р. Кори на основе экспериментов по модельному построению белков с учетом длин связей и валентных углов, полученных в результате рентгеноструктурных исследований отдельных аминокислот и полимеров из двух-трех аминокислот. Впоследствии эта структура была обнаружена в белках волос и шерсти, в кератине кожи и в таких глобулярных белках, как миоглобин и гемоглобин.
Особая роль углерода в химии
317
В белке волос и шерсти, а также других кератинах ot-спирали многократно скручены друг с другом в многожильные тяжи, которые образуют видимые глазом нити. Цепи белков шелка вытянуты во всю длину (а не свернуты в спираль) и соединены с параллельными цепями водородными связями в листы, показанные на рис. 21-2,а. В глобулярных белках цепи не являются полностью вытянутыми или полностью свернутыми в ot-спираль; чтобы молекула имела компактную структуру, она должна быть надлежащим образом деформирована. В молекуле миоглобина (см. рис. 20-25) 153 аминокислоты белковой цепи свернуты в восемь витков ot-спирали (обозначенные на рисунке буквами А-Н), которые в свою очередь свернуты так, что в результате получается компактная молекула. Витки Е и F образуют карман, в котором помещается группа гема, и молекула кислорода может связываться с атомом железа этого гема. Подобным же образом построена молекула гемоглобина, которая состоит из четырех миоглобиновых единиц (см. рис. 20-26). Небольшой белок цитохром с (см. рис. 20-23) имеет меньше места для витков а-спирали. 103 аминокислоты этого белка свернуты вокруг его группы гема подобно кокону, оставляя к ней доступ только в одном месте. У более крупных ферментов, например трипсина (223 аминокислоты) и карбоксипептидазы (307 аминокислот) в центре молекулы имеются области, где белковая цепь делает ряд зигзагов, образуя несколько параллельных нитей, скрепленных водородными связями подобно тому, как это имеет место в молекуле шелка.
Роль фермента заключается в том, что он предоставляет поверхность, к которой может прикрепляться тот или иной субстрат (молекула, подвергаемая воздействию на поверхности), и облегчает образование или разрыв связей в этой молекуле. Место на поверхности фермента, проявляющее такую активность, называется активным центром фермента. Фермент выполняет две функции: распознавание и катализ. Если фермент будет без разбора связывать каждую оказавшуюся вблизи молекулу, то лишь небольшая часть времени израсходуется на катализ реакции, для которой предназначается данный фермент. Но фермент окажется точно так же бесполезным, если, связывая нужную молекулу, он не будет способствовать образованию или разрыву в ней надлежащих связей. Распознавание ферментами своих истинных субстратов осуществляется при помощи расположенных определенным образом в активном центре фермента боковых аминокислотных групп, способных взаимодействовать с молекулой субстрата электростатически, либо в результате образования водородных связей или же притяжения гидрофобных групп. Такой отбор молекул путем связывания с ферментом называется его специфичностью.
После того как субстрат связан, он подвергается атаке определенных групп фермента. Во многих ферментах, предназначенных для реакций разрыва связей, для этою используются такие металлы, как Zn, Mg, Мп или Fe. Иногда одна часть субстрата координируется к металлу, в других случаях атом металла оттягивает электроны от субстрата и ослабляет связь. Оба варианта иллюстрируются каталитическим действием трипсина, которое обсуждается в следующем разделе.
Глава 21
318
Молекулярное строение белков удалось выяснить только недавно. Первый рентгеноструктурный анализ белка, миоглобина, был завершен в 1959 г., а структура первого фермента, лизоцима, была установлена в 1964 г. Исследования крупных ферментов, переносчиков электронов и антител, быстро прогрессируют. В настоящее время известна подробная картина молекулярного строения более 90 белков. В этой области биохимия незаметно переходит в родственную науку, молекулярную биологию.
21-10. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТА
Одним из наиболее исследованных семейств ферментов являются сери-нопротеазы. Все они предназначены для расщепления полипептидных цепей белков по механизму, в котором участвует боковая цепь аминокислоты серина (—СН2—ОН), находящейся в активном центре фермента. Три такие протеазы (трипсин, эластаза и химотрипсин) синтезируются в поджелудочной железе и выделяются ею в кишечник, где они превращают содержащиеся в пище белки в аминокислоты, способные всасываться через стенки кишечника. Благодаря возможности легко изолировать эти ферменты и их сравнительно высокой устойчивости их удалось интенсивно исследовать химическими способами еще до того, как стало возможным проведение рентгеноструктурного анализа белков. В настоящее время биохимический и рентгеноструктурный анализы позволили установить достаточно ясную картину функции этих ферментов, иллюстрирующую два аспекта действия любых ферментов: каталитический механизм и специфичность к субстрату.
Реакцией, которую катализуют трипсин, химотрипсин и эластаза, является гидролиз или разрыв пептидной связи белка:
О R" 11 I ----СН—с —N —СН---------+ Н.О
R' Н
О R"
II
------СН—с —ОН + H,N —СН--------------------- (21-1)
R'
(здесь R) R"-остатки аминокислот). Разрыв пептидной связи осуществляется в две стадии. На первой стадии первая половина цепи, указанной в уравнении (21-1), отрывается, а левая половина присоединяется к сериновой боковой цепи фермента:
Ocond'l po.1b W'.icpodu в химии 319
О R"
II I
' CH C N CH • • • + НО CH2 |фермеят~~| —*
R' H субстрат фермент
o R"
И I
—---------CH —с —О —CH2—[фермент | + H2N —CH-------------------- (21-2)
R' ацилированный продукт 1
фермент
Образующийся промежуточный продукт называется ацилированным ферментом. Если бы реакция остановилась на этом, трипсин или химотрипсин представляли собой не катализатор, а реагент. Суть катализа заключается в том, что катализатор обеспечивает более легкий (и, следовательно, более быстрый) путь реакции, но в конце реакции возвращается в исходное состояние. Фермент восстанавливается на второй стадии процесса с участием молекулы воды:
О
II .________.
•••—СН—С — О—СН2—|Ферл<вня7~~| + н — о — н —*
R' ацилированный фермент вода
О
II __________
С ОН — СН2 — )Рермен7п~~) (21-3)
R' продукт 2 фермент
Левая половина исходной молекулы субстрата отсоединяется, сериновая боковая цепь у фермента восстанавливается, и фермент снова готов повторить весь процесс сначала. Отметим, что уравнение (21-3) обратно уравнению (21-2), но теперь правая половина цепи субстрата замещена молекулой воды.
В ферментативном катализе не происходит ничего такого, чего не могло бы произойти без помощи катализатора. Молекула воды вполне способна приблизиться к цепи белка, как показано в уравнении (21-1), и расщепить ее на части, отдав группу —ОН левой половине цепи и группу —Н правой половине цепи. Однако энергетический барьер активации этой прямой реакции чрезвычайно высок, и поэтому такая реакция должна быть крайне медленной. Двухстадийная реакция, осуществляемая при помощи
Г шва 21
320
сериновой боковой цепи фермента, не требует столь большой энергии ни для одного из промежуточных продуктов, поэтому реакция протекает значительно быстрее. Поскольку действие фермента заключается в понижении энергетического барьера активации, обратная реакция катализуется в той же мере. В конце концов, независимо от наличия катализатора устанавливаются те же самые конечные условия равновесия; фермент лишь ускоряет их достижение.
Роль фермента в облегчении протекания реакции лучше видна на восьмистадийной диаграмме, изображенной на рис. 21-18. Первые четыре стадии соответствуют ацилированию фермента, которое описывается уравнением (21-2), а последние четыре-деацилированию, согласно уравнению (21-3). Помимо важного радикала серина в активном центре серинопро-теазы также имеются радикалы гистидина и аспарагиновой кислоты, которые принимают непосредственное участие в каталитическом механизме. До взаимодействия с цепью субстрата серин связан водородной связью с гистидином, который другой стороной своего пятичленного кольца связан водородной связью с аспарагиновой кислотой (стадия 1). На стадии 2 белковая цепь, подлежащая расщеплению, связывается с активным центром фермента, который имеет специфическую форму, пригодную для захвата данного белка. На стадии 3 кислород серина отдает свой атом водорода азоту гистидина, а сам образует связь с углеродом карбоксигруппы в цепи субстрата. В этот момент данный атом углерода приобретает тетраэдрическую конфигурацию связей с четырьмя окружающими его атомами. Карбонильная двойная связь с кислородом справа становится простой связью, а лишняя пара электронов переходит на карбонильный кислород и создает на нем отрицательный заряд. Фермент помогает стабилизовать этот отрицательный заряд при помощи двух амидных атомов водорода из белковой цепи фермента. (Напомним, что группа NH в белковой цепи имеет частичный положительный заряд.) Стадия 3 называется стадией тетраэдрического промежуточного продукта.
В то же самое время, при образовании связи между сериновым кислородом и карбонильным углеродом, происходит ослабление связи между карбонильным углеродом и амидным азотом, и этому ослаблению способствует наличие поблизости атома водорода, ранее принадлежавшего серину, а теперь связанного с азотом гистидина. Когда пептидная связь, N—С, разрывается, этот атом водорода присоединяется к азоту, завершая образование группы —NH2 на конце удаляющейся цепочки, которая на стадии 4 обозначена как продукт 1. Половина цепи субстрата теперь отщепляется, а другая половина остается присоединенной к сериновой боковой цепи фермента. Конфигурация связей вокруг карбонильного атома углерода снова становится плоской тригональной и среди них снова имеется двойная связь С=О.
Стадии 5-8, соответствующие уравнению (21-3), обратны стадиям 1—4, но вместо продукта 1 в них участвует молекула воды. Молекула воды отдает свою группу —ОН новому тетраэдрическому промежуточному продукту (стадия 6), а группу —Н отдает гистидину, который при разрыве
9
Рис. 21-18. Механизм каталитического действия ферментов трипсина, химотрипсина и эластазы. Пояснения см.
в тексте. Из статьи: Stroud R.M., “А Family of Protein-Cutting Proteins”, Scientific American, July 1974.
11-796
Г.iana 21
ацильной связи передает ее серину (стадия 7). В результате освобождается вторая половина цепи субстрата, или продукта 2, а фермент становится готовым к следующему циклу (стадия 8).
До сих пор ничего не говорилось о специфичности ферментов. Если трипсин, химотрипсин и эластаза обладают идентичным каталитическим механизмом, то чем они отличаются друг от друга? Ответ заключается в том, что они селективны к характеру боковой цепи, следующей за той, в которой они разрывают пептидную связь. В уравнениях (21-1)-(21-3) соответствующие радикалы обозначены R' и находятся непосредственно перед карбонильной группой связи, подлежащей разрыву. Каждый из трех рассматриваемых ферментов имеет на своей поверхности «карман специфичности», в который входит указанный радикал при связывании субстрата. Этот карман специфичности в трипсине длинный и глубокий, с отрицательным зарядом на дне от ионизованной аспарагиновой кислоты (рис. 21-19, а). Благодаря этому трипсин благоприятствует разрыву белковой пептидной цепи по связи, следующей за положительно заряженными радикалами лизина или аргинина. В химотрипсине карман специфичности шире (рис. 21-19, б) и образован исключительно гидрофобными радикалами, поэтому химотрипсин благоприятствует разрыву пептидной связи, следующей за объемистым ароматическим радикалом, как, например,
в
Рис. 21-19. Карманы специфичности трипсина (а), химотрипсина (б) и эластазы (в). Размеры каждого кармана и природа образующих его радикалов определяют тип аминокислотной цепи,
которую он удерживает лучше всего. Это в свою очередь определяет, в каком положении цепи субстрата будет происходить разрыв пептидной связи
Особая роль углерода в химии
323
в фенилаланине или триптофане. У эластазы карман специфичности довольно мелкий (рис. 21-19, в). Эластаза обладает меньшей избирательностью по сравнению с двумя другими ферментами, но благоприятствует разрыву пептидной связи, следующей за маленькими радикальными группами, как у аланина или валина.
Таким образом, и механизм каталитического действия, и специфичность к субстрату ферментов можно объяснить свертыванием их полипеп-тидной цепи и положением на ней радикалов. Характер свертывания белковой цепи в трипсине показан на рис. 21-20. Этот фермент построен из одной непрерывной полипептидной цепи, включающей 223 аминокислоты. (В нумерацию аминокислот на рисунке внесены изменения-пропуски и вставки, чтобы привести ее в соответствие с нумерацией в химотрипсине и эластазе.) Молекула трипсина имеет приблизительно сферическую форму диаметром 45 А и чашевидное углубление с одной стороны для активного центра. На рис. 21-20 атомы аспарагиновой кислоты, гистидина и серина в активном центре изображены черными кружками. Подлежащая разрыву белковая цепь изображена цветными кружками с черными ободками, а стрелка указывает положение разрываемой связи. Жирные штриховые синие линии с двух концов субстрата указывают, что его цепь растягивается на значительную длину в обоих направлениях. Карман специфичности для радикала R' изображен точечными синими линиями в правой нижней части рисунка, и поскольку иллюстрируемой молекулой является трипсин, в карман вставлена аргининовая боковая цепь, притягиваемая отрицательным зарядом аспарагиновой кислоты 189 в нижней части кармана.
Когда химики прошлого поколения, занимающиеся ферментами, говорили о «механизме» ферментативного катализа, они выражались лишь фигурально, хотя имели в виду буквальный смысл. Теперь мы действительно в состоянии описать этот механизм, каждая деталь которого столь же ясна, как механизм секретного замка. Хотя механизм действия какого-либо конкретного фермента может быть еще не установлен, в самих основах ферментативного катализа и управляющих им законах больше нет ничего таинственного. Ферменты являются прекрасным примером того, чем занимается молекулярная инженерия.
21-11. ЭНЕРГИЯ И МЕТАБОЛИЗМ В ЖИВЫХ СИСТЕМАХ
Для альпинистов, которые относятся к своему занятию серьезно, одной из самых опасных операций является «динамический траверз». Так называется преодоление труднопроходимого участка пути, где альпинист каждое мгновение находится в неустойчивом положении и удерживается от падения только благодаря наличию собственного импульса- (количества движения). В некотором смысле каждый живой организм постоянно совершает динамический траверз. Один из наиболее общих научных законов, второй закон термодинамики, утверждает, что любой процесс, протекающий в замкнутой системе (каковой является исследуемый объект плюс все и»
2!
Фермент
Субстрат
МНг
Боковая цепь
разрываемая свял
||02
дисульфидный мостик
Остатки важнейших аминокислот в активном центре
Концеза ациногру
Карман специфичности
170
245
Разрываемая связь
1 /3-ГофриЪовонниЁ лиспг'.
Рис. 21-20. Скелет основной цепи молекулы трипсина. а-Атомы углерода показаны оттененными сферами, на некоторых с целью идентификации указаны номера аминокислотных остатков. Для простоты пептидные группы —СО—NH— представлены просто прямыми линиями. Часть по-липептидной цепи субстрата изображена цветными кружками с черным
ободком. Карман специфичности указан точечными синими линиями, в нем показана боковая цепь аспарагина. Черным цветом окрашены каталитически важные аминокислоты Асп, Гис и Сер, участвующие в разрыве пептидной связи, указанной стрелкой. Из статьи: Stroud R. М., “A Family of Protein-Cutting Proteins”, Scientific American, July 1974.
Особая роль углерода в .химии
325
его окружение, с которым он обменивается веществом или энергией), сопровождается общим повышением беспорядка в системе (см. гл. 16). Живой организм представляет собой тончайшую химическую машину, развившуюся до высшего уровня сложности, Но каждая химическая реакция, происходящая в нем, повышает беспорядок и снижает его сложность. Необходимо постоянное поступление энергии от внешних источников, обеспечивающее не только выполнение организмом физической работы, но также снижение беспорядка, т. е. энтропии, до необходимого уровня. Если это поступление энергии прекращается, то смерть и разрушение химической машины окажутся лишь делом времени: один день для мыши-землеройки и несколько недель для человека. Подобно тому как импульс удерживает альпиниста от падения, так постоянный приток энергии предохраняет живую машину от разрушения. Расщепление богатых энергией веществ и извлечение их энергии называется метаболизмом. В данном разделе мы кратко проследим пути метаболизма, присущего всем живым организмам, которые потребляют кислород. Поскольку одним из важнейших метаболитов является глюкоза, воспользуемся ею для иллюстрации.
Сгорание глюкозы
При сгорании 180,16 г, т.е. 1 моля, глюкозы выделяется 2816 кДж теплоты. Простое сжигание глюкозы слишком расточительно; лишь небольшая часть энергии, запасенной в глюкозе, может быть использована целенаправленно. Гораздо эффективнее кормить глюкозой лошадей и использовать их для передвижения груза, чем сжигать глюкозу в топке локомотива. Дело в том, что при метаболизме глюкозы в организме лошади глюкоза расщепляется в результате целого ряда небольших стадий. Энергия, высвобождаемая на каждой стадии, запасается в химических связях особой молекулы, аденозинтрифосфата (АТФ), и становится доступной для использования в других химических реакциях, которые заставляют мышцы выполнять работу. Сгорание глюкозы в организме лошади протекает контролируемо и эффективно; сгорание ее в топке локомотива осуществляется менее контролируемо и более расточительно.
Стандартное изменение свободной энергии, AG°, при сгорании глюкозы С6Н12О6 + 6О2 - 6Н2О + 6СО2
равно — 2870 кДж• моль “Такова химическая движущая сила, получаемая при сгорании глюкозы. Из этого количества 2816 кДж обусловлены теплотой сгорания (ДН = — 2816 кДж-моль-’) и 54 кДж-повышением беспорядка продуктов по сравнению с реагентами (Д5° = + 181 ДжК-1-моль-1 п — ТД5 = — 54 кДж моль-1). В организме лошади эффективно используехся 40/' высвобождающейся свободной энергии благодаря ее участию в синтезе 38 молекул АТФ из каждой молекулы глюкозы. Рассмотрим подробнее этот процесс упорядоченного высвобождения и усвоения энергии.
Глава 21
326
Трехстадийный процесс метаболического окисления
Процесс сгорания пищи в организмах, использующих для этого кислород, протекает в три стадии. На первой стадии, называемой анаэробной ферментацией, или гликолизом, все виды пищи независимо от их химического состава превращаются в пировиноградную кислоту
О О II II СН3—С—С—ОН
На этой стадии высвобождается мало энергии. Ее главная цель заключается в превращении любой пищи в стандартный набор химических веществ и подготовке к более эффективным стадиям получения энергии. На второй стадии, называемой циклом лимонной кислоты, пировиноградная кислота окисляется до СО2, а атомы водорода от пировиноградной кислоты переходят к молекулам-переносчикам НАД + (никот'инамидадениндинуклеотид) и ФАД (флавинадениндинуклеотид). На этой стадии тоже происходит запасание лишь очень небольшого количества свободной энергии в молекулах АТФ. Главной целью этой стадии является разделение большой свободной энергии (1142 кДж-моль1). заключенной в пировиноградной кислоте, на четыре меньшие и легче используемые части (приблизительно по 220 кДж моль “ х), которые содержатся в 4 молях восстановленных молекул, переносящих энергию. На третьей стадии процесса, называемой дыхательной цепью, происходит использование этих восстановленных молекул-переносчиков. Они повторно окисляются, а водородные атомы, полученные при окислении, используются для восстановления О2 в воду; при этом происходит запасание выделившейся свободной энергии в синтезируемых молекулах АТФ.
Весь этот трехстадийный процесс предназначен для того, чтобы как можно быстрее свести тысячи разновидностей продуктов питания к стандартному набору химических веществ и разделить слишком большие порции свободной энергии на несколько меньших частей, которые могут использоваться для синтеза АТФ. Рассмотрим теперь подробнее каждую из трех стадий.
Стадия 1: гликолиз
Первая стадия процесса сжигания пищи не требует присутствия кислорода. Она осуществляется во всех живых организмах и называется анаэробной ферментацией, или гликолизом («разложением глюкозы»). В присутствии кислорода окончательным продуктом этой стадии, как было указано выше, является пировиноградная кислота. Но в других организмах, не использующих кислород, или в некоторых микроорганизмах, использующих кислород, но лишенных его, образуются другие соединения. Клетки дрожжей в анаэробных условиях превращают глюкозу в этанол, некоторые типы бактерий образуют ацетон, а клетки человеческих мышц образуют молочную кислоту:
С6Н12Об 2СН3СН(ОН)СООН AG’° = -198м» глюкоза молочная кислота
Особй.Ч po. lb jT.ll’pOlIll в ЛНЛ11Ш
327
Именно накопление молочной кислоты в наших мышцах вызывает их судороги при внезапном усилии в условиях недостаточного поступления кислорода. Когда в мышцы поступает больше кислорода, молочная кислота снова превращается в пировиноградную кислоту:
2СН3СН(ОН)СООН + О2 2СН3СОСООН + 2Н2О молочная кислота пировиноградная кислота
&G° — — 388кД>к
Эта первая стадия метаболизма состоит из 11 последовательных химических реакций, в которых глюкоза превращается во фруктозу, а затем в два производных глицеринового альдегида, содержащих три атома углерода. Лишь на одной-двух последних стадиях процесс разветвляется на различные маршруты, приводящие к пировиноградной кислоте, молочной кислоте, этанолу или ацетону. Каждая стадия гликолиза регулируется собственным катализатором, роль которого выполняет фермент с молекулярной массой 30000-500000.
Вероятно, гликолиз представляет собой живое «ископаемое»-реликтовый биохимический процесс, сохранившийся с тех времен, когда в земной атмосфере не было кислорода и одноклеточные организмы существовали за счет расщепления органических молекул, встречающихся в естественных условиях. Когда живые организмы приобрели большие размеры, стали сложнее и увеличили свои энергетические потребности, а в земной атмосфере появился кислород, произошло развитие более сложного биохимического процесса, требующего намного большего количества энергии и известного под названием «цикла лимонной кислоты». Но прежде чем мы рассмотрим этот процесс, следует познакомиться с универсальным способом запасания химической энергии в любых живых организмах.
Запасание энергии и молекулы, переносящие энергию
На рис. 21-21 показано строение молекулы аденозинтрифосфата (АТФ), играющего ключевую роль в биохимическом процессе запасания энергии. Эта молекула построена из аденина (см. рис. 21-3), рибозы (моносахарид с пятью атомами углерода) и трех связанных в цепочку фосфатных групп. Концевая фосфатная группа в АТФ может гидролизоваться, или отщепляться, с присоединением к продуктам ионов ОН “ и Н + от воды, в результате чего образуются ортофосфорная кислота и аденозиндифосфат (АДФ). Далее АДФ может снова разлагаться с образованием еще одной фосфатной группы и аденозинмонофосфата (АМФ). Наконец, отщепление последней фосфатной группы приводит к образованию аденозина. При отщеплении каждой из первых двух фосфатных групп высвобождается свободная энергия 30,5 кДж моль ~а при отщеплении третьей-только 8 кДж-моль" *. Именно АТФ, а точнее его первая фосфатная связь (крайняя слева на рисунке) является главным местом запасания энергии в любой живой клетке. Каждый раз, когда молекула глюкозы биохимиче-
NH,
ООО II II II НО- Р~О-Р~О-Р-О
I I I
он он он
Рис. 21-21. Структура молекулы аденозинтрифосфата (АТФ). Связи между фосфатными группами, указанные волнистыми линиями, при разрыве
он он
в процессе гидролиза выделяют необычно большую энергию, именно поэтому в молекуле АТФ запасается химическая энергия.
ски превращается в две молекулы пировиноградной кислоты, из 8 молекул АДФ образуются восемь молекул АТФ:
Глюкоза + 8 АДФ + 8 фосфатных групп -» 2СН3СОСООН н- 8 АТФ
Это приводит к запасанию 8 • 30,5 = 244 кДж моль “ 1 свободной энергии. Ферменты, регулирующие все стадии этого процесса, обеспечивают использование выделяемой на каждой его стадии энергии для синтеза молекулы АТФ, вместо того чтобы эта энергия рассеивалась в форме теплоты.
В переносе энергии принимают участие еще две другие молекулы, с которыми следует познакомиться, прежде чем перейти к рассмотрению цикла лимонной кислоты. Одной из них является никотинамидадениндину-клеотид (НАД), структура которого показана на рис. 21-22. Эта молекула напоминает АТФ, так как тоже содержит адениновую группу, рибозу и фосфатную группу. Однако важнейшей частью НАД является никотиновое кольцо, которое может попеременно восстанавливаться и окисляться. Эта молекула является окислительно-восстановительным переносчиком энергии. Когда какой-либо метаболит окисляется на одной из стадий цикла лимонной кислоты, окисленная форма никотинамидадениндинуклеоти-да, НАД +, может присоединить два атома Н и восстановиться с образованием НАД Н и Н+. Другим важным переносчиком энергии является флавинадениндинуклеотид (ФАД). который восстанавливается в ФАД Н2-Оба этих переносчика энергии питают последнюю «производственную линию биохимической фабрики» запасания энергии, завершающую окислительный цикл дыхательной цепи. Она представляет собой четырехстадийный процесс, в котором принимают участие ферменты-цитохромы и происходит повторное окисление восстановленных переносчиков энергии НАД Н и ФАД Н2. В этом процессе кислород восстанавливается до воды, а выделяющаяся энергия запасается в молекулах АТФ. Каждый раз, когда происходит повторное окисление восстановленной молекулы-переносчика энергии, выделяемая при этом окислении энергия запасается путем синтеза нескольких молекул АТФ.
Многие незаменимые витамины являются полузаконченными компо-
Особи.ч роль углерода в химии
329
Рис. 21-22. Структура никотинамид-адениндинуклеотида в окисленной (а) форме, НАД+. и в восстановленной (б) форме, НАД • Н. Обратите внимание на сходство верхней половины изображенной здесь молекулы и молекулы АТФ. Восстановленная форма,
НАД Н, является молекулой-переносчиком энергии, запасенной при химическом синтезе подобно тому, как в процессе фотосинтеза это осуществляет восстановленная форма ферредоксина.
нентами подобных переносчиков энергии. Человеческий организм должен получать извне небольшие количества этих витаминов, потому что он утратил способность синтезировать их самостоятельно. Например, химической группой, которая окисляется и восстанавливается в ФАД, является флавин. Некоторые организмы могут синтезировать флавины; возможно, человек или его предшественники также некогда могли синтезировать их, но теперь мы не можем этого делать. Чтобы поддерживать в действии систему переноса энергии и заменять молекулы ФАД по мере их постепенного изнашивания, в человеческий организм необходимо поставлять извне небольшие количества рибофлавина, или витамина В2 (см. рис. 21-3). Аналогично этому никотинамидное кольцо в молекуле НАД+ образуется из никотиновой кислоты, или ниацина, который мы должны получать в небольших количествах с продуктами питания.
Стадия 2: цикл лимонной кислоты
Теперь можно обратиться к рассмотрению второй части трехстадийного метаболического процесса получения энергии. Основной задачей этой
г/ 330
его части-цикла лимонной кислоты - является превращение более чем 1050 кДж моль “ 1 свободной энергии, содержащейся в молекулах пировиноградной кислоты, в четыре небольшие порции приблизительно по 220 кДж моль " 1, запасаемые молекулами-переносчиками в восстановленной форме, НАДН и ФАДН2. Предварительной стадией, предшествующей началу цикла, является соединение пировиноградной кислоты с молекулой, называемой восстановленным коферментом А (СоА—SH) с образованием ацетилкофермента А
СН3СОСООН + НАД + СоА —SH пировиноградная кислота
СН3СО —S —СоА + СО2 + НАД-Н2 сщетилкоферменгп А
Ацетилкофермент А играет роль сырья в цикле лимонной кислоты, изображенном на рис. 21-23. В цикле лимонной кислоты ацетатная группа, содержащая два атома углерода, соединяется сначала с четырехуглеродным оксалоацетатом, в результате чего образуется шестиуглеродный цитрат-ион. Затем этот цитрат-ион распадается в семь стадий с высвобождением двух из его атомов углерода в виде СО2 и снова восстанавливается в окса-лоацетат. Каждая из этих стадий цикла лимонной кислоты представляет собой окисление (изоцитрата в я-кетоглютарат, малата в оксалоацетат), либо перегруппировку, необходимую как подготовку к последующему окислению (цитрата в изоцитрат). На четырех окислительных стадиях высвобождающаяся энергия используется для восстановления молекулы-переносчика энергии: НАД+ или ФАД.
Стадия 3: окончательный никл окисления, или дыхательная цепь
Каждая молекула НАД Н независимо от своего происхождения поступает на третью стадию метаболического процесса-окончательный цикл окисления, или дыхательную цепь,-и образует три молекулы АТФ. Каждая молекула ФАД Н2 принимает участие в промежуточной части этой стадии и образует только две молекулы АТФ. Дыхательная цепь включает ряд флавинсодержащих белков (флавопротеидов) и цитохромов (рис. 20-23), с которыми взаимодействуют атомы водорода и электроны, образуемые из НАД Н и ФАДН2, до тех пор пока они в конце концов не восстанавливают О2 в Н2О. Компоненты дыхательной цепи показаны на рис. 21-24. При повторном окислении НАД Н два атома водорода используются для восстановления флавопротеида, а выделяемая свободная энергия используется для синтеза молекулы АТФ из АДФ и фосфата. Флаво-протеид снова окисляется, восстанавливая небольшую органическую молекулу хинона, известного под названием убихинона, или кофермента Q. С этого момента судьбы электронов и протонов восстановительных атомов водорода расходятся. Электроны используются для восстановления атома железа в цитохроме b из состояния Fe3 + в состояние Fe21", а протоны переходят в раствор. Цитохром b восстанавливается в цитохром с,,
Особая роль углерода в химии
331
СН, о=с—он
уксусная кислота
СН,
О=с — S — СоА ацетилкофермент А
Рис. 21-23. Цикл лимонной кислоты (цикл Кребса). Числа в скобках указывают стандартные свободные энергии (в килоджоулях) соответствующих реакций. Двойные черточки означают, что окисление молекулы-переносчика в цикле и ее восстановление осущест-
вляются при помощи фермента. Восстановленные молекулы-переносчики поступают в завершающий окислительный цикл, где они снова окисляются, а О2 восстанавливается до Н2О.
а электроны переходят от с, к с и далее к а и а3 (все это содержащие железо цитохромы, молекулы которых родственны молекуле, изображенной на рис. 20-23). По ходу этого процесса синтезируются еще две молекулы АТФ. В конце концов, электроны из цитохрома а3 и протоны из раствора рекомбинируют, восстанавливая атом кислорода в молекулу Н2О.
Когда в цикле лимонной кислоты ион янтарной кислоты окисляется в ион фумаровой кислоты (см. рис. 21-23), два атома Н поступают к моле-
АДФ
АТФ
2Н Комплекс I
Фланопротеш)
НАД-Н + Н +
2Н АДФ АТФ
АДФ АТФ
J.Q
2е- Комплекс Ш 2е~ 2е~ Комплекс ЛГ 2е~ 2 2
Кофермент Q Цитохромы Ь Цитохром Цитохромы —
Цитохром Ci ..я,аА- + X но
А
2Н 2Н+ ..-......2Н* .
Фумарат
Сукцинат
Комплекс Л Флавопротеис)
Рис. 21-24. Завершающая стадия метаболического окисления-дыхательная цепь. Все компоненты цепи собраны па внутренней поверхности внутренней мембраны митохондрии в четыре макромолекулярных комплекса, содержащих цитохромы, флавопротеиды и другие негемиповые железосодержащие белки. Кофермент Q, или убихинон, и цитохром с играют роль переносчиков протонов и электронов от одного комплекса к следующему. Восстановление осуществляется путем переноса протонов до тех пор, пока этот процесс не достигнет кофермента Q, после чего оно осуществляется путем переноса электронов, а протоны переходят в раствор. Электроны и протоны снова объединяются в конце цепи, когда кислород восстанавливается до воды. Свободная энергия запасается в молекулах АТФ, образующихся в трех из четырех комплексов.
куле ФАД, которая связана с ферментом сукцинатдегидрогеназой. Отсюда атомы водорода переходят к уже упоминавшимся молекулам кофермента Q, которые взаимодействуют с молекулами НАД Н, и процесс продолжается, но при этом образуются только две молекулы АТФ.
При восстановлении каждой молекулы НАД • Н в цикле лимонной кислоты образуются три молекулы АТФ, а при восстановлении каждой молекулы ФАД-Н2 образуются только две молекулы АТФ, и это позволяет вести счет запасаемой энергии на каждом витке цикла. При разложении 1 моля ацетилкофермента А высвобождается 883 кДж свободной энергии и запасается 12 эквивалентов АТФ: 12-30,5 кДж = 366 кДж. При полном разложении 1 моля глюкозы-ее гликолизе в 2 моля пировиноградной кислоты, превращении последней в 2 моля ацетат-ионов и двух витках цикла лимонной кислоты - баланс свободной энергии выглядит следующим образом (для простоты превращение пировиноградной кислоты в ацетилкофер-мент А включено в гликолиз):
Разложение
С6Н12О6 + 2О2 - 2СН3СООН + 2Н2О + 2СО2 AG° = - 1105 кДж
2СН3СООН + 4О2 - 4СО2 + 4Н2О AG° = - 1765 кДж
С6Н12О6 + 6О2 -> 6СО2 + 6Н2О AG° = - 2870 кДж
Синтез
14АДФ + 14 фосфатных групп -» -> 14 АТФ AG° = 14-30,5 = + 427 кДж
24 АДФ + 24 фосфатные группы -» -> 24 АТФ AG° = 24-30,5 = + 732 кДж
38 АДФ -1- 38 фосфатных групп -> -> 38 АТФ AG° = +1159 кДж
Общая эффективность превращения энергии из глюкозы продуктов питания в АТФ, запасаемый в мышцах, равна 1159:2870 = 0,40.
Анаэробная ферментация (или гликолиз), цикл лимонной кислоты и дыхательная цепь присущи всему живому на Земле выше уровня бактерий. Некоторые аэробные, т.е. поглощающие кислород, бактерии тоже используют этот процесс для полного окисления глюкозы или аналогичного метаболита-в диоксид углерода и воду. Другие анаэробные, т.е. непотребляющие кислород, бактерии осуществляют только ферментацию: поглощение глюкозы или других богатых энергией молекул, их разрыв на меньшие молекулы, такие, как пропионовая кислота, уксусная кислота или этанол, и использование сравнительно небольших количеств высвобождаемой сво
Г.шва 21
334
бодной энергии. Анаэробная жизнь очень неэкономична: когда к дрожжам имеется достаточно обильный доступ воздуха, они участвуют во всем биохимическом процессе, описанном в данном разделе, образуя по 38 молей АТФ из каждого моля глюкозы, но в условиях недостаточного снабжения кислородом они вынуждены осуществлять анаэробную ферментацию глюкозы в этанол, образуя при этом только 2 моля АТФ на моль глюкозы.
Если поглощение О2 дает возможность получать в 19 раз большую энергию в расчете на грамм пищевых продуктов по сравнению с анаэробной ферментацией, то чем объяснить, что некоторые формы жизни все же осуществляются по анаэробному механизму? Заболевание ботулизмом при употреблении в пищу плохо законсервированных продуктов и гангренозное заражение ран вызываются двумя разновидностями бактерий Clostridia, которые не только не могут использовать кислород, но разрушаются им. Почему же они не дышат кислородом подобно большинству живущего на земле?
Ответ, видимо, заключается в рассмотрении пути развития жизни на Земле. Предполагается, что на ранней стадии существования Земли она имела восстановительную атмосферу, состоявшую из таких газов, как Н2, СН4, NH3, Н2О и H2S, но содержавшую очень мало свободного О2 или вообще не имевшего его. В этих восстановительных условиях органические молекулы, которые образовывались небиологическими способами, не могли разрушаться в результате окисления, как это происходит в наше время, а продолжали накапливаться в течение тысячелетий. Первые формы живых организмов, по-видимому, питались тем, что они могли извлечь из этого химического «супа» в океанах, и получали энергию путем разложения встречающихся в естественных условиях соединений с большим запасом свободной энергии. Скорее всего, Clostridia и родственные ей бактерии сегодня являются живыми ископаемыми, потомками тех древних способных к ферментации анаэробов, которые отступили в редкие анаэробные области мира, когда атмосфера в целом накопила большие количества свободного О2 и приобрела окислительный характер.
Что же заставило атмосферу измениться столь существенным образом? По-видимому, перестройка явилась побочным следствием появления нового способа запасания энергии, фотосинтеза, который давал его обладателям огромное преимущество над простыми ферментативными поглотителями энергии. Организмы, в которых развилось это новое свойство, могли использовать энергию солнечного света для синтеза своих собственных энергоемких молекул и уже не зависеть от того, что находится среди их окружения. Они стали предшественниками всех зеленых растений. Сегодня все живые организмы можно подразделить по метаболизму на две категории: те, которые способны изготовлять свою собственную пищу при помощи солнечного света, и те, которые не имеют такой возможности. Поскольку организмы второй категории существуют за счет поедаемых ими организмов первой категории, накопление энергии посредством фотосинтеза является источником движущей силы для всего живущего на земле.
Ocooa.i роль углерода й химии
335
Фотосинтез: как заводится главная пружина жизни
Общая реакция фотосинтеза в зеленых растениях обратна реакции сгорания глюкозы:
6СО2 + 6Н2О - СбН12О6 + 6О2 AG° = +2870 кДж
Вода расщепляется на элементы, что создает источник атомов водорода для восстановления СО2 в глюкозу, а нежелательный газообразный кислород выделяется в атмосферу. Энергия, необходимая для осуществления этого в высшей степени несамопроизвольного процесса, обеспечивается солнечным светом. В наиболее древних формах бактериального фотосинтеза в качестве источника восстановительного водорода использовались не вода, а сероводород, H2S, органические вещества или сам газообразный водород, но легкая доступность воды сделала этот источник наиболее удобным, и в настоящее время он используется всеми водорослями и зелеными растениями. Простейшими организмами, в которых осуществляется фотосинтез с высвобождением О2, являются сине-зеленые водоросли. Их правильнее называть современным названием цианобактерии, поскольку это в самом деле бактерии, научившиеся добывать собственную пищу из СО2, Н2О и солнечного света.
Фотосинтез, протекающий в зеленых растениях, может быть подразделен на процессы двух типов: фотореакции и синтетические реакции (или, как их принято называть, световые и темновые реакции). В результате темновых реакций СО2 восстанавливается в глюкозу с использованием атомов водорода из молекулы НАДФ-Н (НАДФ+ -это НАД+ с фосфатной группой вместо одной рибозной группы —ОН) и энергии от молекулы АТФ:
6СО2 + 12НАДФН + 12Н+ -
-> С6Н12О6 + 6Н2О + 12НАДФ+ AG° = + 226 кДж
18АТФ + 18Н2О -+ 18АДФ + 18Рнеорг AG° = - 548 кДж
(Рнеор[ неорганический фосфат). Первая реакция сама по себе не является самопроизвольной, так как она требует затраты свободной энергии в 226 кДж на моль глюкозы, однако необходимая свободная энергия поставляется второй реакцией, и в целом процесс является самопроизвольным с движущей силой 322 кДж. Темновые реакции небезразличны к источнику молекул НАДФ • Н и АТФ, которые требуются для их протекания. Хотя в настоящее время их источником в зеленых растениях являются световые реакции, не исключено, что темновые реакции старше по возрасту и первоначально приводились в действие молекулами НАДФ • Н и АТФ из других источников. Механизм темновых реакций известен под названием цикла Кальвина-Бенсона и в некотором смысле аналогичен циклу лимонной кислоты. Сначала диоксид углерода соединяется с молекулой-переносчиком, рибулозодифосфатом. После ряда стадий (некоторые из них вы
глядят подобно обратному гликолизу) часть органического вещества выделяется в виде глюкозы, С6Н12О6, а остаток используется для образования рибулозодифосфата на следующем витке цикла.
Движущей силой цикла Кальвина - Бенсона являются световые реакции. Солнечный свет поглощается молекулами хлорофилла (см. рис. 20-21), в которых имеется кольцо сопряженных атомов углерода с делокализованными электронами, окружающее атом магния. Молекула хлорофилла одного типа расположена в фотоцентре, или в ловушке, где и осуществляется химическая реакция, а другие хлорофиллы и родственные сопряженные молекулы окружают фотоцентр и играют роль «антенн», поглощающих фотоны света и передающих электронное возбуждение к молекулам фотоцентра.
Световая энергия, поглощенная хлорофиллом, используется как движущая сила реакции, которая самопроизвольно протекать не может,-восстановления НАДФ+ с использованием воды в качестве восстановителя:
НАДФ+ + Н2О НАДФ-Н + Н+ + )О2
Газообразный кислород выделяется в атмосферу в качестве побочного продукта реакции. Энергия также запасается в результате образования молекул АТФ, которые вместе с НАДФ-Н поставляют энергию для темновых реакций.
Более подробное сопоставление гликолиза, дыхательной цепи и фотосинтеза, а также различных ферментов, регулирующих эти процессы, приводит к выводу, что энергетические механизмы, поддерживающие жизненные процессы, развивались на нашей планете в несколько этапов.
1. Анаэробная ферментация, особенно гликолиз. Первые живые организмы получали энергию, разлагая молекулы небиологического происхождения с большой свободной энергией на меньшие молекулы без их окисления. В эту отдаленную эпоху атмосфера нашей планеты была восстановительной и не содержала свободного кислорода.
2. Темновые реакции синтеза глюкозы, которые в конце концов привели к циклу Кальвина-Бенсона. Всякий организм, способный использовать внешний источник энергии для получения своих собственных молекул с большой свободной энергией, которые могут использоваться впоследствии, имеет огромное преимущество над другими организмами, лишенными подобных свойств. Первым внешним источником энергии не обязательно должен был быть солнечный свет.
3. Световые реакции получения АТФ и НАДФ -Н, которые используются в качестве движущей силы темновых реакций. Солнечный свет был наиболее распространенным и доступным источником энергии в первобытную эру и остается им и в наше время. Побочным продуктом световых реакций в зеленых растениях является свободный кислород, О2, который выделяется в атмосферу более миллиарда лет и постепенно изменил ее, превратив из восстановительной в такую, которая существует в настоящее время и содержит 20% свободного кислорода.
Ос-омя nn.ib углерода и химии 337
4. Кислородное дыхание. Наличие свободного О2 привело к тому, что некоторые организмы научились использовать его для извлечения большего количества энергии из данного количества пищевых продуктов. Преимущества сжигания пищи при помощи О2 оказались столь велики, что подавляющее большинство форм жизни-растения и животные-пользуются в настоящее время кислородным дыханием.
Насколько сейчас известно, наша планета образовалась приблизительно 4,6 миллиарда лет назад, а простейшие ферментирующие одноклеточные формы жизни существуют 3,5 миллиарда лет. Уже 3,1 миллиарда лет они могли бы использовать фотосинтез, но геологические данные об окислительном состоянии осадочных отложений железа указывают, что атмосфера приобрела окислительный характер лишь 1,8-1,4 миллиарда лет назад. Многоклеточные формы жизни, которые, по-видимому, зависели от изобилия энергии, возможного только при дыхании кислородом, появились приблизительно от 1000 до 700 миллионов лет назад, и именно в то время наметился путь дальнейшей эволюции высших организмов. Наиболее революционизирующим шагом, после зарождения самой жизни, было использование внепланетного источника энергии, Солнца. В конечном итоге это превратило жалкие ростки жизни, которые утилизировали случайно встречающиеся природные молекулы с большой свободной энергией, в'огромную силу, способную преобразовать поверхность планеты и даже выйти за ее пределы.
ЗАКЛЮЧЕНИЕ
В этой главе мы прошли долгий путь рассуждений, начав с рассмотрения сравнительной химии элементов В, С, N и Si. Углерод несомненно играет особую роль, обусловленную наличием у его атомов одинакового числа валентных электронов и орбиталей, отсутствием отталкивающих не-поделенных электронных пар и способностью образовывать двойные и тройные связи. Простые алканы, или соединения углерода и водорода, с простыми связями иллюстрируют многообразие соединений, которые может образовывать углерод благодаря своей способности создавать длинные устойчивые цепи. Алкилгалогениды - это своеобразный мостик от алканов с их сравнительно низкой реакционной способностью к изобилию производных углеродов: спиртам, простым эфирам, альдегидам, кетонам, сложным эфирам, кислотам, аминам, аминокислотам и соединениям других типов, которые не обсуждались в данной главе. Способность углерода образовывать двойные и тройные связи была проиллюстрирована на примере алкенов и алкинов, она играет чрезвычайно важную роль при образовании сопряженных и ароматических молекул.
Особенность ароматических соединений заключается в том, что определенное число их электронов делокализовано, т.е. не ограничено в пространстве между парами связанных между собой атомов. Вообще говоря, чем больше делокализация, тем больше должна быть устойчивость молекулы. Бензол оказывается на 166 кДж моль ’ 1 устойчивее, чем можно
rwfiLi 2: 338
ожидать на основе расчета энергии связей его кекулевской структуры. Кроме того, первые незанятые орбитали во многих молекулах с делокализованными электронами располагаются ниже по энергии и ближе к заполненным орбиталям, чем в молекулах других типов. Вследствие этого энергия, необходимая для возбуждения электрона, часто настолько уменьшается, что попадает в видимую часть спектра, и это обусловливает окраску соединений. Способность молекул хлорофилла поглощать видимый свет имеет огромное значение, поскольку они используют энергию поглощаемого света для синтеза глюкозы. Без фотосинтеза жизнь на нашей планете оставалась бы редким и незначительным явлением, существуя только за счет тех органических молекул, которые синтезировались естественным, небиологическим путем.
Молекулой, синтезируемой в процессе фотосинтеза в качестве накопителя энергии, является глюкоза, один из простейших углеводов. Углеводы играют роль не только накопителей химической энергии, но и важного строительного материала в растениях: из них состоят древесина, хлопковое волокно, ткани стеблей более мягких растений и др. Глюкоза полимеризуется в целлюлозу, которая является основой структурных материалов и не может быть пищевым продуктом для человека, и в крахмал, который накапливается в семенах, зернах и корнях растений и может использоваться в пищу, так как при его разложении в организме человека снова получается глюкоза.
При биологическом использовании глюкозы в качестве источника энергии ее сгорание протекает не в одну стадию. Разложение глюкозы представляет собой сложный процесс, включающий более 25 стадий. На многих из этих стадий высвобождаемая энергия запасается путем синтеза молекул АТФ. Анаэробная ферментация, или гликолиз, обеспечивает предварительное разложение глюкозы с образованием пировиноградной кислоты, а цикл лимонной кислоты завершает окисление углерода в СО2. Атомы водорода передаются молекулам-переносчикам, НАД+ и ФАД. Эти молекулы повторно окисляются в дыхательной цепи, где происходит дальнейшее запасание энергии путем синтеза новых молекул АТФ, а атомы водорода используются для восстановления О2 в Н2О.
Фотосинтез представляет собой эффективный вариант процесса, обратного указанным выше. Его темновые реакции используют молекулы НАД Н и АТФ для восстановления СО2 в глюкозу, а световые реакции используют энергию поглощаемых фотонов для синтеза необходимых молекул НАДФ Н и АТФ.
Белки-это полимеры аминокислот. Фибриллярные белки являются основным структурным материалом волос, кожи, ногтей, мышц и сухожилий. В этих структурах белковые цепи свернуты спиралями в многожильные тяжи или связаны друг с другом водородными связями в листы. Глобулярные белки включают ферменты, молекулы-переносчики и антитела. В белках этого типа цепи могут иметь вид спиралей или листов, но затем эти структуры многократно перегибаются, сворачиваясь в компактные, изолированные молекулы.
Особая роль углерода в химии
339
Наиболее важный класс глобулярных белков образуют биологические катализаторы, ферменты. Они характеризуются каталитическим механизмом, позволяющим им ускорять достижение конкретной реакцией состояния термодинамического равновесия, а также специфичность к субстрату, благодаря которой они способны делать выбор между потенциальными молекулами субстратов, воздействуя на одни из них и отказываясь воздействовать на другие. Участок поверхности фермента, на котором происходит катализ, называется активным центром. Механизм катализа может осуществляться при помощи заряженных групп, доноров и акцепторов электрона или протона, а также при помощи атомов металла в активном центре фермента. Избирательность ферментов обусловливается формой их поверхности и характером взаимодействия с субстратом, например водородной связью, электростатическим взаимодействием или гидрофобным притяжением. Фермент и его субстрат соответствуют друг другу по форме и размеру, как ключ и замок.
Трипсин, химотрипсин и эластаза-три родственных фермента, обладающих одинаковым каталитическим механизмом, но имеющих различную избирательность к субстрату. Они воздействуют на белковую цепь субстрата, образуя ацильный промежуточный продукт между сериновым радикалом фермента и фрагментом цепи субстрата, а затем отщепляют этот фрагмент цепи с молекулой воды. Избирательность этих ферментов определяется наличием на их поверхности по соседству с активным центром «кармана», в который вставляется один из радикалов субстрата, подходящий по размеру.
Всякий живой организм, существующий на Земле (а до сих пор нам известны только земные организмы), представляет собой сложное сочетание молекул на углеродной основе, которые приспособлены эволюцией к выживанию и прямому или непрямому использованию солнечной энергии для осуществления самопроизвольно не протекающих реакций и поддержания низкой энтропии внутри организма. Организм живет до тех пор, пока могут поддерживаться такие условия. Когда биологический механизм поддержания этих условий разрушается, индивидуальный организм переходит в состояние с низкой энергией и высокой энтропией, которое принято называть смертью.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Что представляют собой углеводороды и какого размера молекулы углеводородов обнаруживаются в нефти, парафиновом воске, бензинах, отопительном газе и керосине?
2. Опишите характер разветвляющихся цепей в углеводородах и синтетических волокнах. Какое влияние на физические свойства синтетических волокон или пластмасс оказывает наличие в их молекулах поперечных связей (сшивок)?
3. Почему углеводороды с двойными связями между атомами углерода называются «ненасыщенными» ?
340
4. Почему химическая связь в соединениях бора настолько отличается от связи в соединениях углерода?
5. Чем отличается химическая связь в молекуле В2Н6 от связи в молекуле С2Н6? Как эти различия проявляются в геометрии двух молекул?
6. Что представляет собой трехцентровая связь в соединениях бора? Сколько электронов участвует в такой связи и сколько атомов она объединяет?
7. Нарушается ли при образовании трехцентровой связи принцип, указанный в гл. 12 и 13, согласно которому комбинация определенного числа атомных орбиталей приводит к такому же числу молекулярных орбиталей? Сколько молекулярных орбиталей, образующихся при возникновении трехцентровой связи, остается незанятыми электронами?
8. Гидриды углерода, или углеводороды, имеют молекулы с углеродным остовом, образующим неразветвленные или разветвленные цепи либо циклические структуры. Чем отличается строение углеводородов и гидридов бора?
9. Почему азоту трудно образовывать длинные цепи связей N—N—N—N—N—, аналогичные углеродным цепям? Каким образом это зависит от электронного строения атомов?
10. До каких пределов могут разрастаться гидриды азота? Какое их свойство является самым поразительным?
11. Как влияет на неустойчивость соединений азота с длинными азотными цепями его атомов энергия связи молекулы N2?
12. Почему химические свойства кремния значительно отличаются от свойств углерода? Почему SiO2 представляет собой тугоплавкий кристалл, а СО2-газ?
13. Какова скелетная структура силоксанов и силанов? Как отличается реакционная способность соединений этих двух классов от реакционной способности углеводородов?
14. Почему атом кремния неспособен образовывать двойные связи с другими атомами кремния, но образует двойную связь с кислородом?
15. Если учесть, что азот с таким трудом образует цепочки из своих атомов, как объяснить, что он столь легко встраивается в углеродные цепи?
16. В чем различие между алканами, алкенами и алкинами?
17. Как дают названия алканам с разветвленными цепями? Как выбирается основа названия алкана? Как указываются в названии алкана боковые цепи?
18. Что представляют собой структурные изомеры? Покажите при помощи рисунков, что гептан может иметь всего девять структурных изомеров.
19. Запишите структуры следующих алифатических радикалов: метил, этил, изопропил.
20. Почему циклопропан и циклобутан считают напряженными молекулами? Почему циклогексан не относят к таким молекулам?
Особая рем yc..eiv>a в химии 341
21. Почему конформация циклогексана типа «кресла» более устойчива по сравнению с конформацией типа «ванна»?
22. Какое ограничение существует в молекулах алкенов, но отсутствует в молекулах алканов?
23. Что означают числа в названиях соединений бутен-1 и бутен-2? Почему не существует бутена-3?
24. Сколько геометрических изомеров у бутена-1 и бутена-2? Изобразите их структурные формулы и дайте им правильные номенклатурные названия.
25. Что такое диен?
26. В химические реакции какого типа чаще всего вступают алканы? Каковы главные реакции алкенов?
27. Что представляют собой функциональные группы органических молекул? Каким образом они определяют химические свойства этих молекул?
28. Как можно получить спирты из галогенированных углеводородов? Каким другим способом можно получить спирты?
29. Что представляет собой простой эфир и как его можно получить из спиртов?
30. Как получают альдегиды из спиртов? Как получают кетоны?
31. Какие соединения образуются при окислении альдегидов? Можно ли в аналогичных условиях окислить кетоны?
32. Как влияет делокализация электронов на строение карбоксильного иона? Где находится отрицательный заряд после ионизации карбоновой кислоты?
33. Что представляют собой жирные кислоты?
34. Как называются соли жирных кислот и катионов щелочных металлов? Какие свойства этих солей делают их полезными для нас и как эти свойства проявляются?
35. Как проявляется моющее действие мыла?
36. Каким образом жиры связаны с жирными кислотами? Этерификация какого спирта приводит к образованию жиров?
37. Почему органические амины обладают свойствами оснований? Как они могут быть основаниями, если у них нет гидроксильных групп, которые могли бы диссоциировать? Какое органическое основание они более всего напоминают?
38. Какие амины называются первичными, вторичными и третичными? Проиллюстрируйте ваш ответ на примере аминов с метильными группами. Почему возможно существование четвертичных ионов аммония, но невозможны четвертичные амины?
39. Что представляет собой аминокислота? В каком смысле она одновременно является и кислотой и основанием? Что такое цвиттер-ионная форма аминокислоты и при каких условиях она существует?
40. Какой атом углерода в аминокислоте называется асимметрическим?
41. Как соединяются аминокислоты, образуя молекулу белка? Какая молекула высвобождается при таком соединении аминокислот?
r.iaea 21
342
42. Как называются два стереоизомера одной аминокислоты? Какой из них обнаруживается в живых организмах почти всегда?
43. Что такое сопряженная молекула? Ароматическая молекула? В каком смысле они являются примерами делокализации электронов?
44. Как влияет делокализация электронов на расстояние между электронными энергетическими уровнями? Почему из этого следует, что многие из молекул с делокализованными электронами должны иметь видимую окраску?
45. Каким образом некоторые сопряженные молекулы действуют подобно «антеннам» для света и что происходит с поглощаемой ими световой энергией?
46. Почему ароматические молекулы не вступают, подобно этилену, в реакции присоединения по двойным связям? В какие реакции они вступают вместо этого?
47. В каком смысле графит может рассматриваться как вещество, родственное бензолу? Какое вещество находится в аналогичном «родстве» с этаном?
48. Почему сахара получили название «углеводов» и к каким недоразумениям может привести такое их название?
49. Какова молекулярная формула глюкозы? Какова ее молекулярная масса?
50. В чем различие между а- и P-D-глюкозой? Почему в растворе существует равновесная смесь этих молекул?
51. Чем различаются связи между структурными звеньями в целлюлозе и крахмале? Благодаря чему в растениях не возникает путаницы при образовании и разрыве двух этих различных видов связей? Какие ферменты принимают участие в этих процессах?
52. Как используются в растениях два полимера-крахмал и целлюлоза? Какие вещества играют аналогичные роли в человеческом организме?
53. Благодаря чему коровы и термиты способны переваривать целлюлозу, хотя они не могут синтезировать необходимый для этого фермент, целлюлазу?
54. Чем отличаются глобулярные белки от фибриллярных? Каковы важнейшие функции каждого из них?
55. Остатки скольких различных аминокислот встречаются в большинстве живых организмов? Приведите примеры аминокислотных остатков: а) с положительным зарядом, б) с отрицательным зарядом, в) гидрофобного и алифатического, г) гидрофобного и ароматического, д) незаряженного, но полярного.
56. Что представляет собой д-спираль? В каких белках она обнаруживается-в фибриллярных или глобулярных? Как влияют на ее структуру гидрофобные радикалы?
57. Какое влияние оказывают водородные связи на структуру глобулярного белка? Какое влияние оказывают на его структуру гидрофобные радикалы?
58. Какой атом в аминокислоте ответствен за существование ее оптиче
Особая ро !ь уг icpoda в химии
343
ских изомеров? Сколько оптических изомеров может иметь аминокислота? Сколько их обычно обнаруживается в белках живых организмов?
59. Существует ли какая-нибудь причина, по которой жизнь на Земле должна основываться исключительно на L-аминокислотах, а не на D-аминокислотах? Существует ли какое-нибудь преимущество использования только L- или только D-аминокислот по сравнению со смесью обеих этих форм?
60. Что представляет собой активный центр фермента? Вовлекается ли он в ферментативный катализ либо обладает избирательностью по отношению к субстрату?
61. Каким образом ферменты распознают свои субстраты и отвергают другие молекулы?
62. Что представляет собой ацилированный фермент при разрыве белковой цепи трипсином?
63. Какой тетраэдрический промежуточный продукт образуется при расщеплении белков при помощи трипсина или химотрипсина? Сколько раз за один полный каталитический цикл образуются тетраэдрические промежуточные продукты?
64. Откуда появляется атом водорода, присоединяемый к концевой аминогруппе разорванной белковой цепи субстрата при усвоении белка с помощью трипсина? Откуда появляется атом водорода для восстановления фермента в его исходное состояние в конце каждого каталитического цикла?
65. Каким образом фермент способствует стабилизации тетраэдрического промежуточного продукта в процессе расщепления белка трипсином?
66. Каким образом трипсин, химотрипсин и эластаза различают свои собственные субстраты?
67. Какую роль играют гистидин и аспарагиновая кислота в активном центре фермента при расщеплении белка трипсином?
68. Что представляют собой НАД +, НАДФ + и ФАД и какие биологические функции они выполняют? Почему они могут рассматриваться как переносчики свободной энергии и какое ее количество переносит каждый из них? Как соотносится их энергия с количеством свободной энергии, переносимым 1 молем АТФ?
69. Почему НАД+, НАДФ+ и ФАД можно рассматривать в качестве переносчиков восстановительной способности? Может ли АТФ также играть роль такого переносчика?
70. Что такое витамин? Какие витамины необходимы для синтеза НАД + ? Для синтеза ФАД? Почему для синтеза АТФ нет нужды в витаминах?
71. Должна ли молекула, являющаяся витамином для одного организма, обязательно быть витамином для любого другого организма? Объясните ответ.
72. Каковы вклады энтальпийного и энтропийного факторов в свободную энергию сгорания 1 моля глюкозы?
344
73. Почему сгорание глюкозы в организме кошки происходит эффективнее, чем сгорание той же самой глюкозы в бунзеновской горелке?
74. Что называется гликолизом? Почему этот процесс можно считать анаэробным? Что является конечным продуктом гликолиза в мышцах человека в условиях недостатка кислорода? Что является его конечным продуктом в условиях избытка кислорода?
75. Почему гликолиз может рассматриваться как химическое ископаемое?
76. Чем отличается анаэробная ферментация от аэробного дыхания, если судить по свободной энергии, выделяемой в расчете на грамм глюкозы?
77. Что представляет собой цикл лимонной кислоты? Какой метаболит поступает в этот цикл и какие соединения углерода выходят из него? Что происходит при этом с атомами водорода?
78. Куда переходят в конце концов атомы водорода, образующиеся в цикле лимонной кислоты? Как происходит запасание энергии в этом процессе? Сколько энергии запасается в расчете на каждые 2 моля атомов водорода?
79. На каком основании полагают, что цикл лимонной кислоты и дыхательная цепь имеют более позднее происхождение, чем гликолиз?
80. Каким образом дыхательная цепь связана с циклом лимонной кислоты? Какие молекулы окисляются в дыхательной цепи? Какие молекулы восстанавливаются на другом конце этой цепи? Каким образом в дыхательной цепи происходит запасание энергии?
81. Почему при повторном окислении ФАД-Н2 образуется меньшее количество АТФ, чем при повторном окислении НАД Н?
82. Сколько молей АТФ синтезируется при расщеплении 1 моля глюкозы? Сколько свободной энергии запасается при этом? Сколько свободной энергии высвобождается при окислении глюкозы и каков коэффициент полезного действия при ее запасании с помощью АТФ?
83. Какая стадия метаболизма энергии высших организмов присуща всем формам жизни? Сколько молей АТФ получается из 1 моля глюкозы только на этой стадии? Во сколько раз продуктивнее весь метаболический процесс высших организмов?
84. Каковы две метаболические стадии фотосинтеза? Какая из них, предположительно, имеет более раннее происхождение и на чем основано такое предположение?
85. В чем заключается большое влияние, которое оказал фотосинтез в зеленых растениях на атмосферу нашей планеты?
Молекулярная геометрия
1. Какие из следующих изомеров идентичны?
a) H H H H г) Н Н Н С1
Illi 1111
н—с—с—с—с—н н—с—с—с—с—н
Illi 1111
НННС1 нннн
Э) нннн
Л Н Н С1 н 1111
Illi С1—с—с—с—с—н
н—с—с-с—с—н 1 н е) Н 1 1 н н 1 н н 1 н н 1
1 н 1 н 1 1 н н
в) н н 1 н н—с- -с-] -с- 1 -с—н
н-с-1 —с -с-н 1 н 1 С1 н н
1 н 1 С1 ж) Н 1 н Y Y y
н- -с 1 -н н—с-1 -с-1 с-1 с—с—С1 1 1
1 н н 1 н 1 н 1 1 н н
2. Рассмотрим следующие шесть молекул:
а) ннннннн
I I I I I I I
н—с—с—с—с—с—с—с—н
I I I I I I I
ннннннн
Н Р н—с—с 1 н н —( I I н н 1 1 с—с—н 1 I н н н н 1 1 2—с—с—н 1 1 т н н
и н н—с с—н н н 1 1 н—с—с—с—н н—с—н
II! I
н н н I
н—с—н
н
в) н н н
I I I
н—с—с—с—н
I
н н
Э) н ь н—с—( 1 н н—с ь { ь н н—( 2 ( 1 1 I н н 1 1 с—с—н 1 1 н н 2 —Н 4
н- с—н
I н н
I I I н—с—с—с—н
I I I
н н н
i .ICiHii
346
H I
и—с—с—с—с—H
I I
H H H
H
I
H—с—с—H
I I
H H
Какие из молекул б-е идентичны молекуле а-н-гептану? Дайте номенклатурные названия всех молекул, не идентичных молекуле а.
Изомеры и номенклатура
3. Изобразите все возможные структурные формулы для соединений со следующими молекулярными формулами: а) С3Н8, б) С3Н4, в) С4Н8, г) С3Н5С1. Укажите их номенклатурные названия.
4. Изобразите все возможные структурные изомеры соединения С5Н10. Укажите номенклатурное название каждого изомера.
Изомеры
5. Какие из указанных ниже соединений являются изомерами:
а) СН3СН2СН2ОН, б) СН3СНС1СН3, в) СН3СН2СН3,
г) СН3ССН2СН3, д) СН3СН2СН2С1?
II
О
Геометрия и химическая связь
6. Изобразите структуру каждой из следующих молекул и укажите состояние гибридизации каждого атома углерода:
а) С2С14, б) СВг4, в) С2С12, г) СН2С12, д) C2F6.
Систематическая номенклатура
7. Укажите номенклатурное название каждого из следующих соединений:
о) СН3СН2СН=СН2
4) СН3СН2С = СН
a) CH2 = CF2
г) (СН3)2С = СНСН3
Э) СН3СН = СС12
а) сн2=снсн2сн2сн = сн,
«) сн С1
/с=сС
н сн3
Особая роль углерода в химии
347
з ) СН2=СН—СВг=СН—СН3 и) (СН3)2С=СНСН2СН(СН3)2
К) СН3СНС1С=ССН3
Номенклатура
8. Укажите номенклатурные названия следующих веществ:
а) СН3СН2СН2СООСН3
б) СН3СНОНСН2СН2СН2СН2СН3
в) СН3СН2СН2ОСН2СН3
г) СН3СОСН(СН3)2
Структурные формулы
9. Запишите структурные формулы каждого из следующих соединений: а) гиранс-гексен-2, б) цис-2,3-дихлорбутен-2, в) 1-метилциклопентен, г) транс- 1,2-дибромциклогексан, д) 4-этилоктен-1, е) гексин-3, ж) цис-дииодэтилен, з) 2-метилбутен-2, и) 2-бромбутадиен-1,3.
Структура ут леводородов
10. Напиши к : । руктурные формулы
а) пяти различных простых алканов,
б) пяти различных простых алкенов (только с одной двойной связью), в) пяти различных простых алкинов (только с одной тройной связью), г) пяти различных простых циклоалканов (только с одним циклом). Покажите, что они описываются общими формулами С„Н2п + 2, С„Н2п, С„Н2„ _ 2 и С„Н2„ соответственно.
Изомеры углеводородов
11. Углеводород имеет молекулярную массу, приблизительно равную 60, и содержит 17,2 вес. % водорода. Какова молекулярная формула этого углеводорода? Запишите все структурные изомеры, имеющие такую формулу.
12. Углеводород имеет молекулярную массу 56,0 и содержит 85,7 вес. % углерода. Какова его молекулярная формула? Какие структурные и геометрические изомеры он может иметь?
Структура спиртов
13. Запишите структурные формулы всех изомерных спиртов молекулярного состава С6Н13ОН. Укажите правильное номенклатурное название каждого из них.
Реакции алкенов
14. Опишите схему синтеза бутанола из бутена-1. Какое промежуточное
I'.iiiej 21 348
соединение может образоваться при этом? Получится ли в качестве продукта синтеза бутанол-1 или бутанол-2 и какую закономерность подсказывает вам ответ на этот вопрос?
Изомеры и структура
15. Сколько структурных изомеров С6Н14О являются эфирами? Укажите их номенклатурные названия. Какие другие виды соединений, кроме эфиров, могут быть среди структурных изомеров С6Н14О?
16. Назовите указанные ниже вещества. К каким классам химических соединений они относятся? Являются ли изомерами соединения (в) и (г)? а) С6Н5ОС2Н5
б) (СН3)2СНОСН(СН3)2
в) СН3ОСН2СН2СН3
г) СН3СН2СН2ОСН3
17. Назовите указанные ниже вещества. К каким классам химических соединений они относятся? Являются ли изомерами соединения (в) и (г)? а) С6Н5СООС2Н5
б) С2Н5СООС6Н5
в) СН3СООСН2СН2СН3
г) СН3СН2СН2СООСН3
Окисление спиртов
18. Какие соединения получатся при обработке пропанола-1 в умеренно сильных (т.е. неразрушительных) окислительных условиях? Промежуточный и конечный продукты в этой реакции имеют сильно отличающиеся давления паров при комнатной температуре. Объясните это с учетом их молекулярной структуры. Как исходя из этого обстоятельства разработать экспериментальные условия получения максимального количества промежуточного или конечного продукта реакции?
Молекулярные структуры
19. Запишите структурную формулу для каждого из следующих соединений:
а) пропионат натрия
б) м-бромбензойная кислота
в) этилбензоат
г) изобутирилхлорид
д) метилформиат
е) диэтиламин
ж) три-н-пропиламин
з) бензиламин
и) м-броманилин
к) тетраэтиламмонийгидроксид
л) аланин
Особая po.ib углероРи в химии
349
ЛИТЕРАТУР,А
1. Allinger N.L., Allinger J., Structures of Organic Molecules, Prentice-Hall, Englewood Cliffs, N.Y., 1965.
2. “The Biosphere”, Scientific American, September 1970. Весь выпуск посвящен общей теме: химия и жизнь нашей планеты.
3. Breslow R., “The Nature of Aromatic Molecules”, Scientific American, August 1972.
4. Dickerson R. E„ Geis I., Chemistry, Matter and the Universe, W. A. Benjamin, Menlo Park, Calif., 1976. В гл. 18-26 содержится элементарное введение в органическую химию и биохимию, которое по сложности является следующей ступенью после данной главы.
5. Dickerson R. Е„ Geis I., The Structure and Action of Proteins, W. A. Benjamin, Menlo Park, Calif., 1969. Элементарное введение с многочисленными иллюстрациями.
6. Frieden Е., “The Chemical Elements of Life”, Scientific American, July 1972. В статье обсуждаются жизненно важные химические элементы и роль, которую они играют.
7. Herz W., The Shape of Carbon Compounds, W. A. Benjamin, Menlo Park, Calif., 1961. Элементарное введение в органическую химию, в котором основное внимание уделено механизмам реакций.
8. Johnson R. С., Introductory Descriptive Chemistry, W. A. Benjamin, Menlo Park, Calif., 1966. Книга содержит полезные сведения о химии бора и азота.
9. Stryer L., Biochemistry, W. Н. Freeman, San Francisco, 1975. Прекрасно написанный учебник для вводного курса.
ГЛАВА
22
Скорости и механизмы химических реакций
Химические явления следует изучать так, как если бы они были проблемами механики.
Лотар Мейер (1868)
Важнейшие понятия
22-1. Молекулярные столкновения. Стерический фактор. Молекулярные пучки.
22-2. Измерение скоростей реакций. Порядок реакции, константа скорости и молекулярность реакции. Ингибиторы. Процессы первого порядка. Кинетические уравнения.
22-3. Факторы, определяющие константу скорости реакции. Энергия активации. Теория столкновений. Активированные комплексы. Поверхности потенциальной энергии, путь реакции. Теория абсолютных скоростей реакций, переходное состояние, энтальпия и энтропия активации. Реакции замещения, нуклеофильные группы, механизм SN1 (диссоциативный), механизм SN2 (ассоциативный).
22-4. Сложные реакции. Механизмы реакций замещения октаэдрических и плоско-квадратных комплексов металлов. Цепные реакции. Стадия зарождения цепной реакции, стадия развития цепи, ингибирующая стадия и стадия, обрывающая цепь. Стационарное состояние.
22-5. Катализ. Гетерогенный катализ. Гомогенный катализ. Кислотный катализ.
Цель каждого химика независимо от того, к какому типу принадлежат вещества, с которыми он работает, заключается в том, чтобы понять, как и почему они вступают в реакцию и подвергаются превращению. Но это как раз самая трудная задача. Недостаточно знать структуры всех реаген
Скорости и механизмы химические реакций
351
тов и продуктов, хотя, конечно, без этого совершенно невозможно начать решение задачи. Нужно еще знать, как молекулы сближаются друг с другом, а также с какой энергией и при каких ориентациях они взаимодействуют. Для понимания химических реакций очень важно использование представлений об энергии и энтропии. В данной главе мы познакомимся с некоторыми проблемами, возникающими в связи с тем, что мы лишены возможности следить за событиями, происходящими с каждой молекулой в отдельности. Будет показано, как объясняются сложные эмпирические выражения для скоростей реакций на основании представлений о механизме реакции, или последовательности простых реакций, приводящих к полному химическому превращению. Мы рассмотрим две теории, используемые для предсказания скоростей таких простых реакций, и сравним их достоинства и недостатки, а также обсудим два фактора, которые часто приводят к медленному протеканию реакций, энергию и энтропию, и увидим, как катализаторы позволяют преодолеть действие этих факторов и ускорить химические превращения. Хотя полная теория химических реакций до сих пор еще не создана, мы познакомимся с основами, на которых она когда-нибудь будет построена.
22-1. ЧТО ПРОИСХОДИТ. КОГДА МОЛЕКУЛЫ ВСТУПАЮТ В РЕАКЦИЮ?
Предположим, что мы имеем возможность следить за тем, что происходит при взаимодействии двух молекул друг с другом. В качестве примера рассмотрим реакцию молекулы тиоацетамида, СН3—CS—NH2, с водой, приводящую к образованию ацетамида, СН3—СО—NH2, и H2S (рис. 22-1).
В исходной молекуле тиоацетамида центральный атом углерода связан с атомами С и N ст-связями, а с атомом S-двойной ст, л-связью (рис. 22-1, а). Поскольку S и N-более электроотрицательные атомы, чем С, электронные пары, обобществляемые в их связях с атомом С, несколько смещены в направлении к атомам S и N. Последние два атома несут на себе по указанной причине небольшие отрицательные заряды, а центральный атом С имеет небольшой положительный заряд. Все четыре атома лежат в одной плоскости.
Наиболее благоприятное направление приближения молекулы воды перпендикулярно этой плоскости четырех тяжелых атомов, с любой стороны от нее. На рис. 22-1, а показана наиболее благоприятная ориентация приближающейся молекулы воды. При такой ориентации неподеленная пара электронов в молекуле воды притягивается к положительному заряду на центральном атоме С тиоацетамида. Когда молекула воды сближается с этим аюмом С, неподеленная пара электронов притягивается к нему и между молекулами начинает образовываться частичная связь. Образование этой частичной связи приводит к двум последствиям: оно ослабляет связь между атомами С и S в результате того, что электроны еще больше оттягиваются в сторону атома S, и одновременно ослабляет связи О—Н
в
Скорости и механизмы химических реакций
353
в воде в результате того, что по мере притяжения электронов неподелен-ной пары кислорода к атому С происходит оттягивание электронов от связей О—Н к атому О. Такое промежуточное состояние изображено на рис. 22-1, б. Центральный атом углерода теперь имеет две простые связи с атомами С и N и две частичные связи с атомами S и О.
Это промежуточное состояние неустойчиво. Если молекула воды станет снова удаляться и ситуация вернется к изображенной на рис. 22-1, а (нет никакой причины, почему бы это не могло случиться), то в результате реакция не осуществится. Молекула воды отразится после столкновения с молекулой тиоацетамида и полетит дальше своим путем. Но может случиться и так, что отделится атом серы, как показано на рис. 22-1, в. В таком случае два протона, высвобождаемые атомом О при образовании им двойной связи с атомом С, притягиваются атомом серы с его четырьмя электронными парами и образуется молекула H2S. Таким образом завершается реакция
СН3—CS—NH2 + Н2О - СН3—СО—NH2 + H2S
Точно так же возможна и обратная реакция: молекула H2S, сталкиваясь с молекулой ацетамида, будет образовывать воду и тиоацетамид. Вероятность наблюдения такого события, если бы мы могли следить за протеканием реакций на молекулярном уровне, значительно меньше просто из-за того, что молекул H2S очень мало по сравнению с молекулами Н2О.
Какие факторы влияют на рассматриваемую реакцию тиоацетамида? Одним из них, несомненно, являются геометрические особенности приближения молекулы воды. Если молекула воды приближается в плоскости мо-
Рис. 22-1. Механизм реакции тиоацетамида, СН3—CS—NH2, и воды с образованием ацетамида, СН3—СО—NH2, и H2S.
а-молекула тиоацетамида. Все четыре тяжелых атома находятся в одной плоскости, причем S, С и N расположены в вершинах треугольника, в центре которого находится атом С. Центральный атом С имеет хр2-гибри-дизацию и образует простые а-связи с атомами С и N и двойную о, л-связь с атомом S. Молекулярные орбитали и орбитали неподеленных пар показаны в цвете. Орбитали двойной связи деформированы в сторону атома S, чтобы указать его большую электроотрицательность. Орбитали, не принимающие участия в реакции (т.е. орбитали связей С—Н, N—Н, неподелен-ной пары на атоме N), на рисунке не показаны;
б - промежуточный неустойчивый продукт, или переходное состояние, с частичными связями центрального атома С одновременно с атомами S и О. Прежние связывающие электронные пары О—Н превращаются в неподе-ленные пары;
в-продукты реакции: ацетамид и H2S. Тетраэдрическое строение переходного состояния сменилось плоской тригональной геометрией после удаления атома S. Атом S в молекуле H2S изображен с негибридизованными s- и р-орбиталями, которые он использует для образования связей, в отличие от хр3-гибридизованных орбиталей кислорода в молекуле Н2О. Такое изображение, по-видимому, лучше отвечает истинному строению, поскольку валентный угол в молекуле H2S равен 92°, а в молекуле Н2О-105°.
12—796
354
лекулы тиоацетамида, то ее подход оказывается заблокирован неподе- • ленными парами электронов серы и атомами водорода (в большей степени, чем это видно из схематического изображения на рис. 22-1). Далее, если молекула воды приближается так, что к центральному атому С тиоацетамида направлен атом водорода вместо неподеленной пары, то эта молекула будет не так сильно притягиваться к тиоацетамиду и скорее всего оттолкнется от него, не вступив в реакцию. Если бы можно было проследить за каждым столкновением, мы убедились бы, что лишь 1 столкновение из каждых 10 или 100 имеет ориентацию, необходимую для реакции.
Вторым фактором является энергия сталкивающихся молекул. В простейших теориях она характеризуется только как относительная скорость двух молекул при столкновении. Если относительная скорость двух молекул при столкновении мала, промежуточное состояние скорее всего обратится в исходные молекулы. Медленно движущаяся молекула воды просто оттолкнется от молекулы тиоацетамида, не причинив ей никакого вреда. В отличие от этого молекула воды, сильно ударяющаяся о молекулу тиоацетамида, имеет больше шансов отщепить от нее атом серы, в результате чего образуется ацетамид и H2S. Можно построить график зависимости вероятности реакции от скорости сближения двух молекул вдоль линии, соединяющей их центры.
К сожалению, описанные наблюдения реакции на самом деле невозможны. Мы вынуждены судить о том, что происходит в процессе реакции, при помощи косвенных методов. Часто о предполагаемом механизме реакции можно сказать лишь, что он не противоречит полученным результатам. Всегда остается некоторая возможность, что какой-либо иной механизм реакции может не менее удачно объяснить те же самые данные. Классическим примером такой возможности является реакция между Н2 и 12. В 1893 г. немецкий химик Макс Боденштейн изучал реакцию
Н2 + 12 -> 2HI
Это было первое подробное кинетическое исследование реакции, протекающей в газовой фазе. С этого времени и до 1967 г. почти во всех учебниках и курсах по кинетике указанная реакция рассматривалась как идеальный пример механизма бимолекулярных столкновений. Одна молекула Н2 сталкивается с молекулой 12, они обмениваются атомами, и в результате образуются две молекулы HI. Но в 1967 г. Дж. Салливэн показал, что эта реакция вовсе не происходит в результате бимолекулярных столкновений, а является сложной цепной реакцией. Позже мы увидим, почему экспериментальные данные, полученные до 1967 г., могли быть в равной мере объяснены в рамках моделей бимолекулярных и тримолекулярных столкновений.
Мы лишены возможности не только наблюдать за индивидуальными молекулами, но и судить об их ориентации при столкновениях. Самое большее, что удается сделать,-это оценить вероятность должной ориентации молекул и затем ввести соответствующую поправку в результат вы
Скорости и механизмы химических реакций
355
числений скоростей реакций. Подобная поправка называется стерическим фактором.
Для газовых реакций или реакций в растворах мы не в состоянии даже определить скорость сближения реагирующих молекул. Молекулы любого образца газа имеют некоторое распределение по скоростям, причем это распределение меняется при изменении температуры газа. Как видно из рис. 3-11, в газообразном азоте доля всех молекул, имеющих скорость, которая превышает определенное значение, например 1000 м-с“ *, возрастает
в
Рис. 22-2. Два основных типа экспериментов в химической кинетике. В реакциях в газовой (а) или жидкой (б) фазах ориентация реагирующих молекул неконтролируема и существует распределение молекул по скоростям. В экспериментах со скрещенными молекулярными пучками (в) ориентация по-прежнему не контролируется, но используются только молекулы или ионы с определенными скоростями.
Типичное устройство селектора скорости (г): пара дисков, по периметру которых вырезаны секторы таким образом, чтобы только молекулы, пролетающие расстояние между дисками за определенное время, могли пройти через эти секторы в обоих дисках. В качестве источников пучков используются нагреватели, испускающие поток газовых молекул, а также электростатические поля, ускоряющие ионы.
12*
Глава 22
356
с повышением температуры. При 273 К лишь 0,44% молекул N2 имеют скорости выше 1000 м • с “ 1; при 1273 К уже 35% имеют скорость не ниже указанной, а при 2273 К эта доля возрастает до 55%. Однако никакое наблюдение системы не позволяет установить скорость одной определенной молекулы.
Для некоторых реакций можно избавиться от распределения по скоростям, применяя метод скрещенных молекулярных пучков (рис. 22-2). Вместо реакций между молекулами, диспергированными в растворе или газе, пропускают сквозь друг друга пучки молекул или ионов в вакуумной камере, где присутствует пренебрежимо малое число других молекул. Молекулы в пересекающихся пучках реагируют между собой и рассеиваются от точки пересечения пучков. За образованием продуктов реакции и непрореагировавшими исходными молекулами можно наблюдать по зависимости от угла рассеяния, пользуясь подвижным детектором, который находится внутри камеры. Удобство такого метода заключается в том, что селекторы скорости позволяют ограничить пучок молекулами, скорости которых находятся в выбранном небольшом интервале значений. Сведения о зависимости количества образующегося продукта реакции от угла отклонения, или рассеяния, дают намного больше данных о процессе реакции. Проблема ориентации сталкивающихся молекул остается и в исследованиях со скрещенными пучками, но можно представить себе эксперименты, в которых этот фактор также удается контролировать. Если пропустить молекулярные пучки перед точкой пересечения через сильные магнитные или электрические поля, они придадут большинству молекул в каждом пучке одну преобладающую ориентацию в пространстве при условии, что молекулы обладают магнитными или дипольными моментами.
Методом скрещенных молекулярных пучков были, например, исследованы такие реакции:
К + НВг - КВг + Н
К + СН31 - СН3 + KI К + С2Н51 -> С2Н5 + KI Реагенты-пучки атомов К или молекул НВг, СН31 и С2Н51-испускались из отверстий в нагревателях внутри вакуумной камеры. В качестве детектора использовалась раскаленная проволочная нить, называемая детектором с поверхностной ионизацией; такой детектор чувствителен к щелочным металлам или соединениям щелочных металлов.
Неудобство метода молекулярных пучков заключается в том, что не все химические реакции удается изучать в вакуумных камерах с его помощью. Метод молекулярных пучков остается специальным средством полного исследования некоторых особых реакций. Большинство химических реакций приходится исследовать объемными методами, в газовых смесях, растворах и (реже) в твердых веществах.
Скорости и .механизмы химических реакций
351
22-2. ИЗМЕРЕНИЕ СКОРОСТЕЙ РЕАКЦИЙ
Скорость реакции обычно определяют объемными методами, наблюдая за исчезновением какого-либо реагента или появлением продукта в течение заданного времени. Если исследуется химическая реакция
А + 2В -»• ЗС
то скорость появления продукта С за интервал времени At равна
At
где кс. центрация вещества С, обозначаемая [С], обычно выражается в молях на литр. Приведенное отношение дает среднюю скорость появления продукта С за интервал времени At. Предел этой средней скорости при уменьшении интервала времени называется скоростью появления вещества С в момент времени t. Эта величина равна тангенсу угла наклона графика зависимости [С] от t в момент времени t. Мгновенная скорость реакции записывается как d[C]/dt. Поскольку для образования трех молекул С в этом процессе расходуются одна молекула А и две молекулы В, скорости исчезновения одних химических веществ и появления других в данном случае оказываются связанными соотношениями
</[А] _ 1 J[B] 1 J[C]
dt 2 dt 3 dt
Скорость химической реакции должна зависеть от концентраций реагентов, хотя и не всегда таким образом, как можно ожидать по полному уравнению реакции. Например, для реакции газообразного водорода с газообразным иодом, в которой образуется HI,
Н2 + I2 - 2HI
соотношение между скоростями таково:
<hi] = _ 2а[н2] = _ 2 J[i2j
dt dt . dt
и, как можно было ожидать на основании интуитивных соображений, скорость реакции определяется уравнением
^И = к[н2][12] (22-2)
Скорость этой реакции пропорциональна концентрациям Н2 и 12, взятым в первой степени. Это не означает, что реакция осуществляется в результате столкновения одной молекулы Н2 с одной молекулой 12; с 1967 г. были получены доказательства, что дело обстоит вовсе не так. Следует делать
Г.шва 22
358
ясное различие между порядком реакции и ее молекулярностью. Коэффициент пропорциональности в уравнении (22-2) называется константой скорости.
Порядок реакции представляет собой сумму всех показателей степеней при концентрационных членах в уравнении для скорости реакции. Реакция образования HI имеет первый порядок по каждому реагенту и второй порядок в целом. Порядок реакции-это чисто экспериментальный параметр, который описывает только экспериментально установленный вид кинетического уравнения, но не позволяет делать никаких выводов относительно механизма реакции.
Молекулярность простой одностадийной реакции-это число индивидуальных молекул, которые взаимодействуют в данной реакции. Чтобы указать молекулярность реакции, необходимо иметь сведения о ее механизме. Реакция, подобная протекающей между водородом и иодом, на самом деле может осуществляться в несколько отдельных стадий, каждая из которых имеет свою молекулярность. Представление о молекулярности полной реакции, осуществляемой в несколько стадий, лишено смысла. Большинство простых одностадийных реакций являются мономолеку-лярными (самопроизвольный распад) или бимолекулярными (столкновения). Подлинно тримолекулярные реакции очень редки, так как столкновения трех частиц мало вероятны. О тетрамолекулярных реакциях и реакциях более высокой молекулярности практически не приходится говорить. Реакции, которые по своей стехиометрии представляются тримоле-кулярными или еще более сложными, после тщательного изучения обычно оказываются последовательностями простых мономолекулярных и бимолекулярных стадий. Одна из интереснейших проблем химической кинетики как раз и заключается в установлении истинной последовательности реакций в каждом таком случае.
Реакция между газообразными водородом и бромом совершенно отличается от реакции между водородом и иодом. Полная реакция описывается и в том, и в другом случае сходными уравнениями
Н2 + Вг2 -> 2НВг,
но экспериментально установленная зависимость скорости образования НВг от концентраций реагентов и продуктов сильно отличается от уравнения (22-2):
Л [НВг] _ k[H2] [Вг2]1/2
dt 1 + Ц[НВг]/[Вг2]) ’
В это выражение входят две экспериментальные константы скорости к и к'. Нельзя говорить о молекулярности этого процесса, поскольку она является результатом сложной цепи реакций. Даже порядок этой реакции указать затруднительно. В начале взаимодействия Н2 с Вг2, когда в наличии имеется мало НВг, вторым членом в знаменателе можно пренебречь. Тогда эффективный порядок реакции равен 1|: первый порядок по Н2 и поло
Скорости и механизмы химических реакций
359
винный порядок по Вг2. По мере накопления продукта, НВг, скорость его образования замедляется, поэтому НВг называется ингибитором реакции.
Образование НО происходит еще более сложным образом. Получение НО ускоряется светом интенсивности I и ингибируется газообразным кислородом даже при низких концентрациях последнего. Долгие годы трудность очистки газообразных Н2 и С12 и исключения всех следов О2 приводила к ошибочному выводу относительно кинетики этой реакции. Наилучшее эмпирическое уравнение скорости образования НС1 имеет вид
<*[на] = М[н2][С12]
dt k2 [Cl2] + [О2] ([Н2] + k3 [Cl2])
Заметим, что в предельном случае, когда газообразный кислород полностью отсутствует, скорость реакции пропорциональна концентрации газообразного Н2 и вообще не зависит от концентрации газообразного С12! [Второй член в знаменателе уравнения (22-4) становится равным нулю, и концентрация остающегося С12 в знаменателе и числителе сокращается.] Эта реакция осложняется побочными процессами, протекающими на стенках реакционного сосуда. Полученные результаты иногда зависят от размера и формы реакционного сосуда. Все это находится в разительном противоречии с простотой реакции образования HI. Последняя также включает побочные реакции, но при температурах ниже 800 К они не играют важной роли.
Наблюдение за ходом реакции
Как измеряют концентрации реагентов и продуктов в ходе реакции, устанавливая кинетические уравнения, подобные приведенным выше? Если з газовой реакции происходит изменение полного числа молей газа, за ее протеканием можно следить по изменению давления при постоянном объеме либо по изменению объема при постоянном давлении. Это примеры физических измерений, которые можно проводить над реагирующей системой. Их преимущество заключается в том, что они не оказывают влияния на реагирующую систему и обычно осуществляются очень быстро. Пользуясь автоматическим записывающим устройством, можно непрерывно следить за изменением какой-либо физической величины на протяжении всей реакции.
К числу физических измерений, часто используемых при кинетических исследованиях, относятся оптические измерения, например вращения плоскости поляризации света раствором (при условии, что реагенты и продукты обладают различной способностью вращать эту плоскость), изменения показателя преломления раствора, его окраски или спектра поглощения. Наиболее распространенные электрические методы включают измерения электропроводности раствора (что особенно удобно, если реакция сопровождается образованием или поглощением ионов), измерения напря
Глава 22
360
жения электрохимического элемента, в котором протекает исследуемая реакция, либо масс-спектрометрические измерения. Используются также измерения теплопроводности, вязкости полимеризующегося раствора, теплоты реакции и температуры замерзания раствора. Недостаток всех этих методов состоит в том, что они являются косвенными. Наблюдаемое свойство предварительно должно быть откалибровано, т. е. выражено в концентрациях реагентов и продуктов. Такая калибровка приводит к систематическим погрешностям, особенно при наличии побочных реакций.
Химические методы являются более прямыми и приводят непосредственно к данным о концентрациях. Такие методы сводятся к извлечению небольшого образца из реакционной смеси и остановке реакции разбавлением или охлаждением на достаточно длительное время, позволяющее провести измерение концентраций. Серьезный недостаток таких способов состоит в том, что они сопровождаются удалением части реагирующей системы и поэтому постепенно изменяют ее. Кроме того, если не удается остановить реакцию в образце, выделенном для анализа, то это снижает точность анализа. В газофазных реакциях между Н2 и С12, Вг2 или 12 не происходит изменения числа молей газа до и после реакции, что не позволяет использовать для них методы, основанные на изменении давления или объема. При исследованиях этих реакций из них отбирают пробы и газовые смеси анализируют химически по своему составу.
Уравнение реакции первого порядка и радиоактивный распад изотопа 14С
В процессе первого порядка скорость расходования реагента пропорциональна его количеству. Каждая молекула реагента имеет одинаковую вероятность распада в заданный интервал времени, и полная скорость распада просто зависит от количества имеющихся молекул. Скорость реакции определяется выражением
dn
— = — kn dt
где п -полное число имеющихся молекул. Это выражение можно проинтегрировать, чтобы получить зависимость концентрации от времени:
п = пое ~ к‘
Полученное кинетическое уравнение используется в примере с датированием события изотопным методом в разд. 23-5, где приводятся следующие выражения для концентрации 14С:
ЛГ14С1
L J = - k[14C], (22-5)
dt
[,4C] = [14C]oe'fcl
(22-6)
Скорости и механизмы химических реакций
361
Интегральное уравнение (22-6) представлено в графическом виде на рис. 23-3. Логарифмируя это уравнение, находим
1п[14С] = 1п[14С]0 - kt (22-7)
Это уравнение приведено в графическом виде на рис. 23-8. График представляет собой прямую линию, отрицательное значение тангенса угла наклона которой равно константе скорости к. Как видно из рис. 23-3, тангенс угла наклона графика для уравнения (22-6) в любой момент времени t пропорционален концентрации 14С, остающейся в этот момент. В этом и заключается смысл уравнения (22-5).
Разложение N2OS
В разд. 16-5 было рассмотрено разложение твердого N2O5 как пример самопроизвольной, но сильно эндотермической реакции. Теперь мы рассмотрим разложение N2O5, растворенного в тетрахлориде углерода, в качестве примера химической реакции первого порядка. Твердый N2O5 и один из продуктов его разложения, NO2, растворимы в СС14; другой продукт, О2, нерастворим в нем. Реакция протекает по уравнению
N2O5 2NO2 + уО2(г.)
и за ее ходом можно следить, измеряя полный объем газообразного кислорода, который выделяется в виде пузырьков из раствора.
Кинетические данные об этой реакции приведены в табл. 22-1; они получены после того, как результаты измерений объема О2 пересчитаны в концентрации N2O5, остающегося в растворе. Эти данные приведены в графической форме на рис. 22-3 в качестве примера представления концентрационных данных. На рисунке указаны концентрации N2O5 в каждый момент времени, скорость изменения этой концентрации и отношение скорости изменения концентрации к самой концентрации. Последняя величина представляет собой константу скорости. Постоянство отношения скорости изменения концентрации к самой концентрации (в пределах экспериментальных погрешностей данных, приведенных в табл. 22-1) указывает, что реакция действительно имеет первый порядок.
Стехиометрия и уравнение для скорости реакции
Реакция
2NO(r.) + О2(г.) - 2NO2(i.) характеризуется эмпирическим уравнением для скорости реакции вида
—= *[NO]2[O2]
Г. id lid
Таблица 22-1
Разложение3'6 N2O5 в растворе СС14 при 45 С по уравнению
N2O5 2NO2 + |о2(г.)
Время t, с [N2O5] моль•л 1 A[N2O5] A[N2O5] к 1 X
[N2O5] ~
моль л 1с 1 A[N2O5] * At
0 2,33 -0,25 184 1,36-10“3 6,2-IO"4
184 2,08 -0,17 135 1,26 -10"3 6,3 -10-4
319 1,91 -0,24 207 1.1610'3 6,5 10-4
526 1,67 -0,32 341 0,94 10-3 6,2-10-4
867 1,35 -0,24 331 0,72 IO”3 5,9 IO'4
1198 1,11 -0,39 679 0,57 -10"3 6,2 10-4
1877 0,72
а Eyring И., Daniels F., 1. Am. Chem. Soc., 52, 1472 (1930).
6 При расчете константы скорости (последняя колонка) [N2O5] в знаменателе означает среднее из концентраций в начале и в конце данного интервала времени. Например, для первого интервала [N2O5] = (2,33 + 2,08)/2.
Эта реакция второго порядка по NO и первого порядка по О2, а в целом-третьего порядка. Уравнение для скорости реакции случайно согласуется со стехиометрией химической реакции; такое согласие заставляет предположить (но не позволяет доказать), что мы имеем дело с простой одностадийной реакцией, в которой одновременно участвуют три молекулы.
В отличие от рассмотренного случая этанол и декаборан реагируют в растворе по уравнению
ЗОС2Н5ОН + В10Н14 - 10В(ОС2Н5)3 + 22Н2
Можно было бы наивно полагать, что такая стехиометрия означает, будто уравнение скорости реакции имеет тридцать первый порядок. На самом деле реакция имеет второй порядок, первый порядок по каждому из реагентов. Скорость расходования этанола описывается уравнением
_ ,[С2Н5ОН] = к[с2Н5ОН][В10Н14]
Скорости и механизмы химических реакций
363
Рис. 22-3. Кинетика реакции
1
N2O5 2NO2 + у-О2 п0 данным табл. 22-1.
1 - график зависимости концентрации N2Os от времени;
2-график зависимости отрицательного значения тангенса угла наклона кривой 1 от времени, т е. зависимости величины — Л [N2O5]/At от Г;
3 - график зависимости от времени отношения отрицательного значения тангенса угла наклона кривой 1 к концентрации в тот же момент времени, т. е. величины — (A [N2O5]/At)/[N2O5] = = к -константы скорости первого порядка (постоянство этой величины во времени подтверждает, что рассматриваемая реакция подчиняется кинетическому уравнению первого порядка).
Цели химической кинетики
Некоторые химические процессы представляют собой простые одностадийные реакции, в которых участвуют одна, две или редко три молекулы. Гораздо большее число процессов является комбинациями нескольких таких простых реакций. Одна из целей химической кинетики заключается в том, чтобы установить, каков истинный молекулярный механизм сложного процесса. Почему эмпирические уравнения скорости реакций образования HI, НВг и НС1 настолько отличаются друг от друга, если сами эти
Глава 22
364
реакции на первый взгляд кажутся одинаковыми? Для кинетика вопрос: «Каков механизм данной реакции?» означает: «Какова последовательность простых реакций, приводящих к экспериментально наблюдаемой кинетике и стехиометрии полной реакции?» К этому вопросу химики, органики и неорганики, добавляют: «Какова геометрия реакции для каждой простой стадии полного процесса?» Цель таких вопросов заключается в том, чтобы предсказывать, почему простые реакции протекают именно так, а не иначе, а также предсказывать скорости их протекания. Нашей следующей темой являются теории, разработанные для вычисления констант скорости простых мономолекулярных и бимолекулярных реакций.
22-3. ВЫЧИСЛЕНИЕ КОНСТАНТ СКОРОСТИ ПО МОЛЕКУЛЯРНЫМ ДАННЫМ
Рассмотрим простую бимолекулярную реакцию
А + В - С + D (22-8)
описываемую кинетическим уравнением
- -1^1 = fc[A][B]
Как можно вычислить константу скорости по данным о свойствах молекул А, В, С и D? Одно из наиболее ранних наблюдений заключается в том, что константа скорости к изменяется с температурой; константа скорости больше и скорость реакции выше при более высоких температурах.
Аррениусова энергия активации
Если построить график зависимости логарифма константы скорости реакции от величины, обратной температуре, обычно получается прямая линия. Хотя Аррениус был не первым, кто установил это, он выдвинул представление, которое позволило объяснить данный факт. Поэтому подобные графики называются аррениусовыми. Как же они объясняются в рамках представлений о механизмах реакций?
В конце XIX в. Вант-Гофф и другие ученые исследовали зависимость свободной энергии реакции и константы равновесия от температуры. Они установили, что константа равновесия КраВ„ зависит от абсолютной температуры Т и от теплоты реакции АН следующим образом:
<ПпКювн АН°
-----= ГЭ2-93 dT RT2-'
Это уравнение можно вывести из упоминавшегося при обсуждении рис. 17-3 уравнения Гиббса-Гельмгольца, но, вообще говоря, оно может быть строго выведено на основании законов термодинамики. В то же время Гульдберг и Вааге сумели получить выражение для константы равнове
Скорости и .механизмы химических реакций
365
сия из кинетических соображений. Если прямая реакция в уравнении (22-8) характеризуется скоростью
Скорость! = fcj [А] [В],
а обратная реакция-скоростью
Скорость2 = k2 [С] [D]
то (полагали они) равновесие можно рассматривать как состояние, в котором прямая и обратная реакции имеют одинаковые скорости, так что в реакционной системе не происходит результирующих изменений во времени:
*1[А] [В] = k2[C] [D] kt [С][Р] РаВ" к2 [А] [В]
Согласно этим рассуждениям, константа равновесия представляет собой отношение констант скоростей прямой и обратной реакций.
На самом деле указанный вывод ошибочен. Он справедлив лишь в том случае, когда реакция представляет собой простой одностадийный процесс, для которого стехиометрия реакции отражается в показателях степеней концентрационных членов кинетического уравнения. В частности, он справедлив для реакций такого типа, как рассматриваемые здесь простые бимолекулярные реакции. Если константа равновесия равна отношению констант скоростей прямой и обратной реакций, то на основании уравнения (22-9) можно предположить, что энтальпия реакции должна представлять собой разность двух энергий, Et и Е2:
Кравн = -А АН = Е, - Е2
*2
Тогда
din(ki/k2) El - Е2 dT = RT2
откуда dlnkj Ej dT ~ RT2
и
d In k2 E2 dT
Или, в общем случае,
dink
dT
RT2
Eg 7T2
(22-10)
/ .iaea 22
366
Величина E„ называется аррениусовой энергией активации. Уравнение (22-10) можно преобразовать к виду
d In к
------- = — ЕаR d(l/T)
(22-11)
Если аррениусова энергия активации не зависит от температуры, уравнение (22-11) предсказывает, что график зависимости величины In к от величины, обратной абсолютной температуре, должен иметь вид прямой линии. Это справедливо для многих реакций, и энергия активации является одним из стандартных экспериментально определяемых параметров, с помощью которых описывается химическая реакция. Если Еа не зависит от температуры, уравнение (22-11) нетрудно проинтегрировать, что дает
k = Ze~{E‘!RT} (22-12)
где Z имеет смысл константы скорости в отсутствие энергии активации.
Энергия активации представляет собой барьер, который должны преодолеть сталкивающиеся молекулы, чтобы прореагировать друг с другом, а не разлететься снова в разные стороны. Мы уже воспользовались подобным понятием при рассмотрении реакции тиоацетамида в разд. 22-1. Мы постулировали, что если молекулы тиоацетамида и воды сталкиваются с недостаточной энергией, перестройка связей, иллюстрируемая рис. 22-1,6 и 22-1,в, никогда не осуществится. Молекула воды оттолкнется от молекулы тиоацетамида, и реакция не произойдет. Теперь мы имеем экспериментальное подтверждение, основанное на виде температурной зависимости константы скорости к, что химические реакции действительно характеризуются некоторой пороговой энергией. Предложенное Аррениусом объяснение энергий активации предполагает, что каждая пара молекул с энергией, меньшей Еа, не сможет прореагировать, а каждая пара молекул с энергией, большей Еа, должна прореагировать между собой. Эта теория может показаться очень простой, но не следует торопиться с таким выводом.
Рис. 22-4 позволяет понять, что наличие энергии активации, или активационного барьера, не изменяет термодинамических свойств полной реакции. Активационные барьеры для прямой и обратной реакций, Et и Е2, таковы, что их разность, АН = Ег — Е2, представляет собой термодинамическую теплоту реакции. Чем выше поднимается барьер тем медленнее прямая реакция. Однако поскольку барьер Е2 должен при этом повыситься на такую же величину, как и чтобы их разность сохраняла фиксированное значение, обратная реакция замедлится во столько же раз, во сколько и прямая реакция. На положение равновесия не влияют конкретные численные значения энергий активации прямой и обратной реакций, а только разность между ними, равная ДН°.
С трип и механизмы химических реакций
367
А + В
ДНС
| С + D
а
Активированное
Рис. 22-4. Энтальпия реакции и ее энергия активации.
а-энтальпия реакции (или теплота реакции), представляющая собой изменение энтальпии при превращении реагентов в продукты;
б-энергия активации, Ер для реакции между веществами А и В, представляющая собой энергию, необходимую
для того, чтобы молекулы А и В вступили в реакцию, а не просто столкнулись и разлетелись в разные стороны. Обратная реакция, в которой из веществ С и D снова образуются вещества А и В, также имеет энергию активации, Е2. Разность между этими двумя энергиями активации равна энтальпии реакции ДЯ°.
Теория столкновений для бимолекулярных газовых реакций
Следующим логическим шагом явилось создание теории столкновений для газовых реакций. Согласно этой теории, реакция между двумя молекулами осуществляется, если энергия сталкивающихся молекул превышает Еа. Такая теория чрезвычайно проста. Чтобы приступить к вычислению констант скоростей, необходимо предварительно ответить на два вопроса:
1. Как часто происходят столкновения двух молекул в кубическом сантиметре газовой смеси?
2. Какая доля этих столкновений характеризуется суммарной энергией двух молекул, превышающей £о?
Частоту столкновений можно вычислить из простой кинетической теории газов методами, с которыми мы познакомились в гл. 3. Эта частота зависит от концентраций двух реагирующих газов, от их молекулярных масс, от расстояния между центрами молекул при столкновении,
Глаеа 22
368
а также от квадратного корня из абсолютной температуры. Поскольку при высоких температурах молекулы движутся быстрее, их столкновения тоже происходят чаще. Доля тех пар молекул, которые при столкновении имеют энергию, равную или большую Еа (в предположении, что скорости молекул подчиняются больцмановскому распределению, с которым мы познакомились на рис. 3-11), равна
в- (Ea/RT)
Тогда, согласно простой теории столкновений, скорость реакции можно выразить следующим образом:
Скорость = Частота столкновений х Вероятность, что Е > Еа
Математически
- lHL = (Z[A][B])-e-<£'/Rn
или иначе
_ АШ. = Ze-wn [А] [В]
Скорость реакции больше при высоких температурах потому, что столкновения происходят чаще и вероятность того, что энергия сталкиваю-
Таблица 22-2
Результаты расчета констант скорости3 для бимолекулярных реакций типа А + В -> Продукты
Реакция кДж • МОЛЬ - 1 реагентов 1g z дя°, кДж-моль -реагентов \
эксперимент по теории по теории
столкновений абсолютных скоростей
NO + О3 -» NO2 + О2 10,5 11,9 13,7 11,6 -200
NO + С12 - NOC1 + С1 84,9 12,6 14,0 12,1 + 83,7
NO2 + СО - NO + СО2 132 13,1 13,6 12,8 -226
2NO2 -> 2NO + О2 111 12,3 13,6 12,7 + 113
2NOC1 - 2NO + С12 103 13,0 13,8 11,6 + 75,7
2С1О -> С12 + О2 0,0 10,8 13,4 10,0 -138
а Реакции описываются кинетическим уравнением
Скорость = Ze £<1'R7[A] [В]
Скорости и механизмы химических реакций
369
щейся пары молекул превышает величину Еа, тоже повышается. Константу Z можно вычислить, зная молекулярную массу реагирующих газов и диаметры реагирующих молекул, если аппроксимировать их сферами. Таким образом, для константы скорости бимолекулярной реакции следует записать:
k = Ze“(£‘/RT) (22-13)
Численная проверка этой теории может быть выполнена при помощи данных, представленных в табл. 22-2. В ней табулированы аррениусовы энергии активации для шести бимолекулярных газовых реакций, а также экспериментальные значения предэкспоненциального множителя Z и его теоретические значения, вычисленные в рамках теории столкновений и теории абсолютных скоростей реакций, которая будет обсуждаться в следующих разделах. Необходимо иметь в виду, что в таблице приведены значения логарифма Z, поэтому расхождение между теорией и экспери
2NO2
NO + о5
+ а
no + а2
y/^2NO + а2 2NOQ
Активированное состояние
С + D
NO + СО2
2С1О
Рис. 22-5. Энергетический барьер активации для шести реакций, указанных в табл. 22-2. Некоторые из этих реакций имеют значительные барьеры;
другие, как, например, реакция разложения СЮ, вообще не имеют барьера. Внизу показан наиболее общий вид энергетического барьера активации.
ментом в 1,0 означает ошибку в константе скорости в 10 раз. В целом согласие теоретических и экспериментальных данных удовлетворительное, если учесть, что теория столкновений очень проста и не включает новых предположений по сравнению с кинетической теорией газов. Однако имеются и расхождения; например, скорость реакции для СЮ вычислена с ошибкой в 400 раз. Как правило, теория абсолютных скоростей реакций позволяет предсказывать значения Z с большей точностью, чем теория столкновений.
В последней колонке табл. 22-2 указаны стандартные энтальпии, или теплоты реакций. На рис. 22-5 в графической форме представлены относительные энтальпии реагентов и продуктов, а также активационный барьер между ними. Некоторые реакции, например NO2 + СО, должны преодолевать значительный активационный барьер. Для других реакций барьер незначителен, как, например, для реакции разложения СЮ. Для других, например для разложения NO2, активационным барьером служит только сама теплота реакции, а обратная реакция имеет нулевую энергию активации. Наиболее общий случай графически представлен в нижней части рис. 22-5.
Активированные комплексы
Прежде чем мы перейдем к теории абсолютных скоростей реакций, необходимо подробнее рассмотреть состояние реагирующих молекул, когда они преодолевают активационный барьер. В реакции
2СЮ - С12 + О2
атомы С1 и О вначале связаны друг с другом, а две молекулы СЮ находятся далеко одна от другой и не оказывают взаимного влияния. В конце реакции атомы О находятся на расстоянии. 1,99 А один от другого в молекуле С12, а атомы О на расстоянии 1,21 А в молекуле О2, и эти две молекулы разделяет большое расстояние. Но каково промежуточное, активированное состояние системы?
С1—О
С1------о
j I С1 О
I I I I
; I ci о
С1------о
С1—о
а
Рис. 22-6. Схематическое изображение реакции 2С1О -> С12 + О2.
а-исходное состояние с изолированными молекулами СЮ; б-возмож-
ное (активированный комплекс) переходное состояние; в-конечное состояние с изолированными молекулами С12 и О2.
Скорости и механизмы химических реакций
371
Активированный комплекс схематически изображен на рис. 22-6,6. Все четыре атома находятся на небольших расстояниях друг от друга, однако эти расстояния несколько превышают длины устойчивых связей между ними. Можно быть уверенным, что в активированном комплексе расстояние между всеми четырьмя атомами не настолько велико, чтобы они не оказывали взаимного влияния; должен существовать какой-то тип слабо связанного комплекса. Такое предположение основывается на данных об энергиях связи трех молекул, участвующих в рассматриваемой реакции, а также на том, что энергия активации для реакции разложения СЮ равна нулю. Ниже приведены энергии связи этих молекул, т. е. энергии, необходимые для полного разъединения атомов в двухатомной молекуле:
Молекула Энергия связи, кДж моль-1
СЮ 270
О2 494
С12 239
Если бы в процессе реакции две молекулы СЮ сначала разъединялись на атомы, а затем изолированные атомы соединялись в молекулы С12 и О2, то энергия активации этой реакции вдвое превышала бы энергию связи молекулы СЮ, т. е. была бы равна 540 кДж на 2 моля СЮ. Однако энергия активации данной реакции равна нулю. Следовательно, активированный комплекс должен представлять собой такую комбинацию четырех атомов, чтобы уменьшение устойчивости, сопровождающее разъединение атомов С1 и О, немедленно компенсировалось повышением устойчивости вследствие образования связей между атомами О и С1 и между атомами О и О.
Можно считать, что активированный комплекс является неустойчивой «молекулой» и обладает многими свойствами обычных молекул, однако самопроизвольно распадается на реагенты или на продукты. Молекулы тиоацетамида и воды на рис. 22-1,6 образуют активированный комплекс, энергия которого превышает энергию тиоацетамида и воды, а также энергию ацетамида и сероводорода.
Поверхности потенциальной энергии
Рассмотрение реакции разложения СЮ наводит на мысль, что в принципе можно вычислять зависимость полной потенциальной энергии совокупности атомов от их положения в пространстве. Такие расчеты позволяют получить поверхность потенциальной энергии, имеющую области высокой энергии-«холмы» и «плато», а также области низкой энергии-«долины». Каждая область минимума потенциальной энергии на таком «графике» соответствует устойчивой молекуле. Однако, к сожалению, даже при наличии всего четырех атомов, как при реакции 2СЮ, для описания потенциальной поверхности требуется шесть переменных, например длины связей между каждым атомом и тремя остальными. Для гра-
Скорости и механизмы химических реакций
373
фического представления подобной потенциальной поверхности потребуется семимерное пространство. Его трудно себе представить и невозможно наглядно изобразить.
Чтобы построить карту потенциальной энергии в трехмерном пространстве, приходится ограничиться примером только с двумя переменными. Одна из первых таких карт была построена Генри Эйрингом в 1935 г.; это была поверхность потенциальной энергии для реакции
Н + Н2 Н2 + Н
в которой расположение всех трех атомов ограничивается прямой линией. Единственными переменными в такой системе являются расстояния г, и г2 от центрального атома водорода до двух остальных атомов:
Н — Н —Н г, г2
Потенциальная энергия этой трехатомной системы как функция переменных и г2 изображена на рис. 22-7,а. Относительные положения трех атомов Н, отвечающие шести пронумерованным цветным точкам на этом рисунке, представлены на рис. 22-8. Сечения поверхности потенциальной энергии при различных фиксированных значениях г, показаны на рис. 22-7,6.
При больших значениях какой-либо одной из двух переменных, г2 или г2, три атома водорода существуют в виде молекулы Н2 и изолированного атома Н. Сечение потенциальной поверхности при фиксированном г2, превышающем 3 А, показанное на рис. 22-7,6, совпадает с потенциальной кривой изолированной молекулы Н2, приведенной на рис. 12-2. Когда атом водорода приближается к молекуле Н2 справа
Рис. 22-7. Потенциальная энергия системы из трех атомов водорода при прямолинейном их расположении, а-потенциальная энергия как функция расстояний (Г[ и г2) двух крайних атомов от центрального. Линии равной потенциальной энергии на рисунке пронумерованы в килоджоулях на моль. Поверхность потенциальной энергии имеет форму двух глубоких долин, параллельных осям и г2; стенки долин круто поднимаются к этим осям и более полого-к плато в верхнем правом углу. Обе долины соединяет путь через перевал, или седловую точку, вершина которой расположена при = г2 = 0,8 А. Расчеты этой трехатомной системы были проведены полуэмпирическими методами в 1935 г. Генри Эйрингом и его сотрудниками. Современные более
точные квантовомеханические расчеты не подтверждают понижения потенциальной поверхности в точке перевала. Оси на рисунке скошены так, чтобы шарик, скатывающийся по модели этой поверхности, точно воспроизводил колебания данной трехатомной системы. Цветные точки 1-6 соответствуют относительным положениям атомов, показанным на рис. 22-8;
б- несколько сечений потенциальной поверхности при различных фиксированных значениях гР При достаточно больших значениях г, (выше 3 А) кривая потенциальной энергии соответствует двухатомной молекуле, практически не подверженной влиянию третьего атома Н (ср. кривук} потенциальной энергии для г2 > 3 А с изображенной на рис. 12-2).
Рис. 22-8. Относительные, положения трех атомов водорода, соответствующие шести цветным точкам на рис. 22-7,а. Точки 1-5 относятся к различным стадиям реакции молекулы водорода с атомом водорода. Точка 6 отвечает прямолинейному располо-
жению трех атомов водорода на расстоянии 2,5 А друг от друга. Это состояние приблизительно на 390 кДж менее устойчиво, чем любое состояние вдоль пути реакции. Справа указаны значения потенциальной энергии.
(точки I и 2 на рис. 22-7 и 22-8), первым заметным проявлением его воздействия оказывается повышение потенциальной энергии системы из трех атомов. Приближающийся атом отталкивается молекулой, и если он снова удалится от нее, возникнет более устойчивая ситуация. Если же атом имеет достаточную кинетическую энергию и продолжает приближаться к молекуле Н2, он начинает ослаблять связь Н—Н в молекуле Н2. В точке 3 оба внешних атома водорода расположены на несколько большем расстоянии от центрального атома, чем нормальная длина связи Н—Н, но потенциальная энергия системы трех атомов водорода на 25 кДж моль1 выше, чем для изолированных Н2 и Н. Точка 3 является активированным комплексом рассматриваемой реакции.
Активированный комплекс может распасться на продукты либо на реагенты. Нет никаких причин, препятствующих тому, чтобы три атома из состояния, отвечающего точке 3, не могли возвратиться в точку 1 либо проследовать в точку 5. Но несомненно лишь то, что активированный комплекс неустойчив и должен распасться. На рис. 22-7 точки 1 и 5 соединены цветной штриховой линией; это так называемый путь реакции. Если построить график потенциальной энергии вдоль этого пути реакции, получится кривая с энергетическим барьером активации, подобная изображенной на рис. 22-5. Отметим, что путь реакции на всем своем протяжении пролегает по дну долины между крутыми склонами. Чтобы создать активированный комплекс, отвечающий точке 3, требуется энергия 25 кДж, но чтобы разъединить атомы, как это соответствовало бы точке 6, необходима энергия 400 кДж.
Скорос ти i' '.iuxaui: гни химических реакций
Рис. 22-9. Потенциальная энергия системы для реакции Н2 + Вг Н +
+ Вг.
а-поверхность потенциальной энергии для линейного расположения атомов в системе Н—Н—Вг. Линии равной потенциальной энергии пронумерованы в килоджоулях на моль трехатомной системы. Путь реакции Н2 + Вг Н + НВг отмечен цветной штриховой линией;
б-профиль потенциальной энергии вдоль пути реакции. Точки 1, 2 и 3 соответствуют указанным на рисунке (а). Точка 2 представляет собой активированный комплекс данной реакции. Пользуясь данными приложения 3 по стандартным теплотам образования атомов и молекул, можно убедиться, что разность потенциальных энергий в точках 1 и 3 близка к правильной.
Глава 22
376
Аналогичные поверхности потенциальной энергии были вычислены и для других систем атомов; на рис. 22-9 показана такая поверхность для реакции Н2 + Вг Н + НВг. В этом случае поверхность имеет иную форму, потому что молекула Н2 устойчивее, чем НВг. По мере приближения атома Вг к молекуле Н2 он отталкивает атомы Н друг от друга. Активированный комплекс (точка 2) характеризуется вдвое большим расстоянием между атомами Н, чем в молекуле Н2, но атомы Н и Вг находятся почти на таком же расстоянии друг от друга, как и в изолированной молекуле НВг. В этом случае активированный комплекс почти совпадает с молекулой НВг, и не удивительно, что он всего на 15 кДж-моль'' менее устойчив, чем молекула НВг. Вычисленные поверхности потенциальной энергии, подобные приведенной на рис. 22-9, как раз и являются основой для построения широко распространенных изображений барьеров реакций, примеры которых показаны на рис. 22-5 Построение профилей потенциальной энергии типа показанных на рис. 22-9,6 сохраняет смысл даже для реакций с участием настолько сложных молекул, что нет возможности вычислить или хотя бы графически представить их полную многомерную поверхность потенциальной энергии.
Теория абсолютных скоростей реакций
В теории абсолютных скоростей реакций считается, что реакция происходит, когда активированный комплекс распадается на продукты. Поэтому скорость реакции полагается равной произведению трех множителей:
1) концентрации активированных комплексов в кубическом сантиметре;
2) скорости распада индивидуальных комплексов, или скорости их перехода через энергетический барьер активации;
3) вероятности того, что в результате распада активированного комплекса получаются продукты, а не реагенты.
Поскольку активированный комплекс представляет собой неустойчивое состояние перехода между реагентами и продуктами, его часто называют переходным состоянием, а теорию абсолютных скоростей реакций-теорией переходного состояния. Мы будем пользоваться и той, и другой терминологией.
Теория переходного состояния исходит из представления о существовании равновесия между реагентами и активированным комплексом, которое принято обозначать при помощи особого правого верхнего индекса-двойного крестика. Пользуясь таким обозначением, можно записать
А + В АВ* , _ [АВ-
Следовательно, концентрация активированного комплекса определяется соотношением
[АВ*] = К* [А] [В]
Скорости и механизмы химических реакций
377
Вычисление скорости распада активированных комплексов является гораздо более сложной задачей, но для всех бимолекулярных реакций эта скорость оказывается постоянной, зависящей только от температуры:
„ кТ
Скорость распада = ——
п
где /с-постоянная Больцмана, а /1-постоянная Планка. Вероятность того, что в результате распада образуются продукты, а не реагенты, называется трансмиссионным коэффициентом и обозначается буквой х (каппа). О трансмиссионном коэффициенте можно сказать только то, что для большинства реакций он имеет значение, промежуточное между 0,5 и 1,0. Таким образом, полная скорость реакции определяется уравнением
[А] [В]
dt h l j l j
а константа скорости fc2-выражением
, kT k2 = v. К h
(22-14)
(Здесь для константы скорости бимолекулярной реакции используется обозначение к2 вместо к, чтобы избежать путаницы с постоянной Больцмана.)
Константу равновесия между реагентами и активированным комплексом оказывается возможным вычислить из молекулярных свойств с использованием статистической механики. Мы не будем даже пытаться провести здесь такие вычисления, а вместо этого обратимся к термодинамической интерпретации приведенного выше выражения для константы скорости. Константа равновесия связана со стандартной свободной энергией образования активированного комплекса из реагентов, которая в свою очередь выражается через стандартные энтальпию и энтропию образования активированного комплекса:
- RTin К* = = ЫГ* - TbS°* (22-15)
Таким образом, для константы скорости к2 произвольной бимолекулярной реакции можно записать
k2 = yl^e-(AG^IRT} =
= x2^1e+(AS^/R)e-(AH“*/RT1 (2246)
Энтальпия активации имеет величину, мало отличающуюся от энергии активации, Еа. Различие между ними не представляет интереса для настоящего .обсуждения. Уравнение (22-16) указывает, что скорость реакции тем ниже, чем выше энергия активации. Этот результат уже известен нам из теории столкновений; если энергия активации велика, лишь небольшая часть молекул имеет достаточную энергию, чтобы перейти че
i .1<лви
378
рез барьер и прореагировать, а не просто оттолкнуться друг от друга после столкновения. Но из уравнения (22-16) также следует, что скорость реакции выше при большой энтропии активации. Если активированный комплекс намного более неупорядочен, чем реагенты, реакция ускоряется, потому что константа равновесия для образования комплекса велика, а это означает, что велика его концентрация. И наоборот, если образование активированного комплекса из реагентов ограничено строгими условиями, это приводит к ингибированию реакции. Можно догадаться, что энтропия активации в реакции тиоацетамида с водой отрицательна, поскольку в данном случае две молекулы объединяются в единый комплекс. Как указано в подписи к рис. 22-1,6, исходные ориентации обеих молекул ограничены строгими условиями, допускающими успешное образование активированного комплекса. Энтропия активации в бимолекулярных реакциях имеет почти всегда большое отрицательное значение, потому что образование комплекса из двух реагентов приводит к уменьшению энтропии. Нередко наиболее полезным применением теории абсолютных скоростей реакций является не прямое вычисление константы скорости, а вычисление энтропии активации по данным о наблюдаемой константе скорости при помощи уравнения (22-16). Энтропия активации позволяет судить о структуре активированного комплекса. Например, если вычисленная энтропия активации положительна, то это означает, что следует отвергнуть любой механизм реакции, включающий образование высокоупорядоченного активированного комплекса.
В качестве примера в следующем разделе рассматриваются две реакции типа
R3C—-Вг + ОН" -> R3C—ОН + Вг“
которые осуществляются по различным механизмам в зависимости от природы групп R. Один из этих механизмов включает удаление Вг" при приближении группы ОН-, которое происходит таким же способом, как в реакции тиоацетамида с водой. В этом случае активированный комплекс представляет собой определенную комбинацию R3C—Вг и ОН “ :
R3C~ Вг + ОН-
R R Вг-ОН
Вг” + R3C — ОН (22-17)
Реакция происходит по так называемому ассоциативному механизму SN2 -это означает, что в ней происходит замещение (по-английски Substitution) одной группы другой, что группы нуклеофильны (отдают электроны и притягивают ядра, т.е. являются льюисовыми основаниями: по-английски nucleophilic) и что в реакции принимают участие две молекулы. Другой механизм заключается в том, что молекула R3C—Вг самопроизвольно диссоциирует на Вг- и так называемый карбониевый ион, R3C + , а ионы ОН- быстро реагируют на последующей стадии со сво
Скорости и механизмы химических реакций
379
бодными карбониевыми ионами. Активированным комплексом, или переходным состоянием, при таком механизме является сам реагент R3C—Вг непосредственно перед диссоциацией; реакция протекает в две стадии:
R3C—Вг -► [R3C—Br]# -> R3C+ + Вг“ (22-18)
R3C+ + ОН" -> R3C—ОН
Такой механизм называется диссоциативным и обозначается SN1, поскольку это нуклеофильное замещение, в котором наиболее медленная (скоростьопределяющая) стадия включает диссоциацию отдельной молекулы. Различие между этими механизмами должно проявляться в энтропии активации, если ее вычислить из уравнения (22-16) по экспериментальным данным о константах скорости. Механизм ^2 должен характеризоваться большой отрицательной энтропией активации, поскольку активированный комплекс образуется из двух молекул. В отличие от этого механизм Sjql должен характеризоваться почти нулевой энтропией активации, потому что в этом случае активированный комплекс лишь незначительно отличается от молекулы реагента.
Сопоставление кинетических теорий
Как теория столкновений, так и теория абсолютных скоростей реакций основывается на представлении об энергии активации, которая играет роль барьера реакции. В этом смысле обе они основываются на данном еще Аррениусом объяснении температурной зависимости констант скорости. Теория столкновений фокусирует внимание на столкновении двух реагирующих молекул, тогда как теория абсолютных скоростей реакций уделяет большее внимание комплексу, образуемому после столкновения, и исходит из предположения о существовании равновесия между этим комплексом и реагентами. Теория столкновений использует представление об энергии активации, утверждая, что все молекулярные пары, не имеющие этой энергии при столкновении, должны оттолкнуться, а не прореагировать друг с другом. Вместо этого теория абсолютных скоростей постулирует, что большая энтальпия образования активированного комплекса означает малую величину константы равновесия и, следовательно, низкую концентрацию активированного комплекса. Если считать, что комплекс образуется, когда две молекулы имеют энергию, требуемую теорией столкновений, то становится понятным, что обе рассматриваемые теории по сути не что иное, как две разные точки зрения на одно и то же явление.
Как указывалось выше, константа равновесия для образования активированного комплекса, К*, может быть вычислена по данным о свойствах реагиручощих молекул и о предполагаемых свойствах комплекса. Это означает, что константу скорости к (или к2) можно вычислить из первых принципов, подобно тому как это может быть сделано в теории столкновений. В табл. 22-2 сопоставляются вычисленные в рамках этих теорий константы скорости нескольких реакций с экспериментальными данными. Не
Глава 22
380
трудно убедиться, что теория абсолютных скоростей реакций обычно несколько лучше предсказывает константы скорости, чем теория столкновений. Дело не в том, что теория столкновений неверна; просто она дает слишком примитивную картину того, что происходит при протекании химической реакции.
22-4. СЛОЖНЫЕ РЕАКЦИИ
Большинство химических реакций не являются простыми монбмолеку-лярными и бимолекулярными реакциями, а представляют собой их комбинации. Это и объясняет появление столь сложных уравнений для константы скорости, как, например, уравнения (22-3) или (22-4). Даже реакция между водородом и иодом, которая в течение полувека служила классическим примером простой бимолекулярной реакции [уравнение (22-2)], на самом деле оказалась значительно сложнее.
Реакция между водородом и иодом
Реакция
Н2 + I2 2HI (22-19)
описывается следующим экспериментально установленным кинетическим уравнением:
_^Щ_=/с[н2][12] (22-20)
at
Выше 800 К возникают побочные реакции с различными механизмами, однако при умеренных температурах этими реакциями можно пренебречь. Н.Н. Семенов и Г. Эйринг высказали предположение, что истинный механизм реакции может не соответствовать уравнению (22-19), а быть двухстадийным и включать обратимую диссоциацию 12 на 21, за которой следует тримолекулярная реакция атомарного иода (21) с Н2:
12 21
Н2 + 21 - 2HI (22-21)
Уравнение, определяющее скорость реакции одной молекулы Н2 с двумя атомами I, имеет вид
- = ^'[Н2][1]2 (22-22)
Если диссоциация 12 является обратимой реакцией и находится в состоянии равновесия, можно записать для ее константы равновесия следующее выражение:
ГН2
к = откуда [I]2 = К[12] (22-23)
L4J
Скорости и механизмы химических реакций 381
Однако подстановка в уравнение (22-22) концентрации атомов иода из уравнения для константы равновесия (22-23) дает
ЛГН,]
--^-= fc'K[H2][I2] (22-24)
т. е. такое же выражение для скорости реакции, как если бы она протекала по одностадийному механизму бимолекулярного столкновения. Таким образом, имеются два различных механизма, которые приводят к одинаковому кинетическому уравнению. Как выбрать из них правильный?
Оба эти механизма описываются одинаковым кинетическим уравнением только до тех пор, пока диссоциация 12 находится в состоянии термического равновесия и число имеющихся в наличии атомов иода определяется термической константой равновесия согласно уравнению (22-23). При более высоких температурах диссоциация 12 усиливается, и это дает такой же результат, как и повышение константы скорости бимолекулярной реакции. Дж. Салливэн решил проверить обе теории, изменяя концентрацию атомов иода по сравнению с нормальной, соответствующей термической диссоциации 12. Он осуществил это при помощи ртутной лампы, пары которой излучают свет с длиной волны 578 нм, вызывающий диссоциацию 12. Этот свет не должен оказывать на реакцию заметного влияния, если она протекает по бимолекулярному механизму, лишь несколько понижая концентрацию 12. Но если реакция действительно включает стадию тримолекулярных столкновений с атомами иода, скорость реакции должна возрастать с интенсивностью облучающего света, поскольку при этом образуется больше атомов иода.
Салливэн вычислил концентрацию атомов иода при различных интенсивностях облучающего света и нашел, что скорость образования HI пропорциональна квадрату концентрации атомов I. Следовательно, механизм, описываемый уравнениями (22-21), оказывается правильным. Классическая реакция Н2 + 12 является тримолекулярной реакцией, которая кажется простой бимолекулярной реакцией лишь потому, что в обычных условиях между 12 и 21 существует тепловое равновесие. (Последнее утверждение остается справедливым до тех пор, пока кто-нибудь не поставит эксперимент, который докажет, что это еще более сложная реакция, лишь маскирующаяся под тримолекулярную.) Как указал Салливэн [J. Chem. Phys., 46, 73 (1967)], тримолекулярная реакция
Н2 + 21 - 2HI
может быть представлена двумя бимолекулярными стадиями:
Н2 + I -> Н21
H2I + I -> 2HI
Если первая из этих стадий протекает быстро и обратимо, так что ее реагенты и продукты находятся в равновесии, то выражение для скорости ре
Глава 22
382
акции оказывается таким же, как и для тримолекулярного процесса, и эти два механизма нельзя различить по скорости реакции.
Этот пример следует постоянно иметь в виду. Никогда нельзя быть уверенным, что предполагаемый механизм реакции абсолютно верен; можно лишь утверждать, что пока еще он не опровергнут. Всегда остается возможность, что более тонкий эксперимент, подобный проведенному Салли-вэном с нарушением теплового равновесия действием света, обнаружит неправильность предполагаемого механизма. При наличии двух теоретических вариантов механизма предпочтение всегда отдается более простому до тех пор, пока новые данные не заставят сделать противоположный выбор. Но следует постоянно быть готовым к тому, чтобы поменять свою точку зрения, когда этого потребуют новые данные.
Скорости и механизмы реакций замещения
Скорость реакции mpem-бутилбромида с ОН ~
(СН3)3СВг + ОН” (СН3)3СОН + Вг“ (22-25) описывается следующим экспериментальным уравнением:
- 4(си3)3свг] = ц(СН ) CBig (22 26)
at
и, таким образом, создается впечатление, что она совершенно не зависит от концентрации ОН ~. В отличие от этого скорость родственной реакции с этилбромидом, в котором степень замещения у центрального атома углерода не столь высока,
СН3СН2Вг + ОН’ СН3СН2ОН + Вг" (22-27) описывается уравнением
_ J[CH3CH2Br] = k [сн3СН2Вг] [ОН - ] (22-28)
вид которого согласуется со стехиометрией химической реакции.
Почему же эти две сходные реакции осуществляются по разным механизмам и имеют различные уравнения для скорости? И как объяснить, что, согласно уравнению (22-26), скорость реакции не зависит от концентрации одного из реагентов?
Реакция (22-25) протекает по механизму SN1, описываемому уравнениями (22-18). Сначала протекает медленная стадия диссоциации mpem-бутил-бромида, а затем образующийся карбониевый ион немедленно реагирует с ОН “. Во всех случаях, когда какой-либо процесс осуществляется в несколько быстрых стадий плюс одна более медленная стадия, общая скорость реакции должна контролироваться этой медленной стадией.
Скорости и механизмы химических реакций
383
В рассматриваемой реакции, идущей по механизму SnI, скорость полностью зависит от того, насколько быстро разлагаются молекулы (СН3)3СВг. По-видимому, способность карбониевых ионов реагировать с ионами ОН намного превосходит количество карбониевых ионов, образуемых в результате диссоциации. Вследствие этого общее количество имеющихся в наличии ионов ОН ” оказывается несущественным.
Почему же описываемые реакции протекают по различным механизмам? Механизм SN2 возможен для этилбромида, потому что в этой молекуле достаточно места для трех заместителей у атома С (одна группа СН3 и два атома Н) плюс ионы ОН_ и Вг \ Это делает стерически возможным существование активированного комплекса:
Н Н-
Вг - С - ОН
I сн3
В отличие от этого в молекуле mpem-бутилбромида группы, присоединенные к атому углерода (три группы СН3), слишком велики, чтобы ОН “ и Вг ” могли одновременно связываться с ним. Образование активированного комплекса, соответствующего механизму SN2, в этом случае невозможно. Реакция не будет происходить до тех пор, пока молекула трет-бу-тилбромида самопроизвольно не диссоциирует. Появившийся в результате диссоциации карбониевый ион подвергается атаке либо со стороны иона Вг ”, в результате чего снова образуются реагенты, либо со стороны иона ОН- с образованием продукта. Если наличие ионов Вг- определяется только предшествующей реакцией mpem-бутилбромида, их концентрация, по-видимому, должна быть намного меньше, чем концентрация ОН ~, и большая часть карбониевых ионов будет превращаться в mpem-бути-ловый спирт, (СН3)3СОН.
В общем случае, если уравнение для скорости реакции не согласуется со стехиометрией полной реакции, это является указанием, что реакция протекает в несколько стадий. В таких случаях задача заключается в отыскании последовательности реакций, включающей медленную стадию, которая объясняет наблюдаемый закон для скорости реакции.
Различие в механизмах реакций, с которым мы познакомились на примере mpem-бутил- и этилбромида, обнаруживается также в октаэдрических и плоско-квадратных комплексах переходных металлов. Плоско-квадратные комплексы Pt(II) и других металлов могут реагировать с новыми лигандами по ассоциативным (SN2) механизмам, поскольку в таких комплексах имеется доступ к атому металла с любой стороны плоскости комплекса. Например, механизм SN2 для реакции
Pt(NH3)3Cl+ + Вг" - Pt(NH3)3Br+ + С1“
Глава 22
384
можно представить себе следующим образом:
NH3
NH,
. _ медленная 1
+ Вг стадия ’ I |
/ '
NH3 I
пентакоординированное переходное] состояние I
быстрая стадия >
+
+ Cl-
Активированным комплексом является пентакоординированная платина, которая быстро распадается на продукты. Скорость полной реакции зависит от скорости образования активированного комплекса. На последнюю сильно влияет характер замещающей группы (Вт в рассматриваемом примере). Лиганды, способные образовывать сильные связи с центральным атомом, считаются самыми «лучшими» заместителями, т.е. быстрее всего замещающими вытесняемую группу (С1 “ в этом примере). Ионы CN “ и I- являются хорошими заместителями для комплексов Pt(II), а молекулы NH3 и Н2О значительно хуже вступают в реакции.
Шестикоординированные октаэдрические комплексы гораздо труднее реагируют по механизму SN2 из-за наличия шести лигандов вокруг центрального атома металла, например Со(Ш), которые оставляют мало места для встраивания замещающей группы в активированный комплекс. Исследования реакций замещения октаэдрических комплексов Со(Ш) показали, что важнейшая, или скоростьопределяющая, стадия таких реакций включает диссоциацию связи между Со (III) и группой, покидающей комплекс. Замещающая группа не вовлекается в эту исходную стадию диссоциации. Например, в водном растворе Н2О замещает О ~ в комплексе Co(NH3)5C12 + , в результате чего образуется Co(NH3)5H203 + . С исследованиями скоростей этой и других подобных реакций лучше всего согласуется диссоциативный механизм SN1, который можно описать следующим образом:
CKi.if-oci’,',!) и 1Ю'лиг>л1г1 химических реакций
385
H3N---Co--Cl
HsN NH3
2 +
медленная стадия
H3N--Co-—Cl
H3N NH3
'ОН',
молекула воды в положении готовности к атаке]
переходное состояние
быстрая стадия *
NH3
H3N — Со — ОН2
у\
H3N NH3
3+
4- Cl-
Для такого механизма замещающая группа не играет существенной роли в образовании переходного состояния и, следовательно, не оказывает влияния на скорость полной реакции. Характерная особенность большинства реакций замещения октаэдрических комплексов состоит в независимости скорости реакции от природы замещающей группы.
Цепные реакции
Реакция Н2 + Вг2 2НВг
имеет странное уравнение для скорости, которое уже приводилось выше:
Л [НВг] = к[Н2][Вг2]^
dt 1 + к'([НВг]/[Вг2]) 1
Это уравнение, после его экспериментального установления, не удавалось объяснить в течение 13 лет. Затем почти одновременно это сделали три группы ученых, возглавляемые Г. Эйрингом, К. Герцфельдом и М. Поля-ни. Они высказали предположение, что реакция протекает по цепному механизму, включающему две стадии развития цепи:
1) Н2 + Вг Н + НВг
2) Н + Вг2 НВг + Вг
Когда молекула распадается на незаряженные фрагменты, имеющие неспаренные электроны, такие фрагменты называются радикалами. Наличие неспаренных электронов (как, например, в Н и Вг) делает фрагменты реакционноспособными частицами. Атомным продуктом каждой из двух 13-796
г uix.i -sis
указанных стадий является один из реагентов другой стадии, кроме того, на каждой стадии образуется по одной молекуле НВг. Таким образом, НВг образуется не в результате бимолекулярных столкновений, а в результате бесконечной цепи реакций (1) и (2). Первая из этих двух стадий представляет собой реакцию, энергетика которой проиллюстрирована на рис. 22-9. Но откуда берутся атомы Вг и Н? Постулируется, что атомы Вг появляются в результате стадии зарождения (инициирования) цепи:
3) Вг2 Вг + Вг
Почему же не включается в рассмотрение также диссоциация Н2? Дело в том, что этого не требуется для объяснения уравнения (22-3), более того, если включить в рассмотрение диссоциацию Н2, получится неправильное уравнение скорости. Имеется и более глубокое объяснение, оправдывающее игнорирование диссоциации Н2: энергия диссоциации Н2 равна 432 кДж -моль *, в то время как для Вг2 эта величина составляет всего 190 кДж • моль “ '.
Большая концентрация НВг ингибирует реакцию, как это видно из уравнения (22-3), в знаменатель которого входит [НВг]. Однако большая концентрация Вг, противодействует этому ингибированию. Очевидно, НВг и Вг2 конкурируют за одно и то же химическое вещество. Что же это за вещество?
Наиболее вероятным кандидатом являются атомы водорода; в этом случае ингибирующая реакция должна быть такой:
4) Н + НВг Н, + Вг
Эта реакция ингибирования цепи противодействует протеканию полной реакции, если избыток Вг2 приводит к быстрому протеканию стадии (2), как оно и предсказывается уравнением (22-3). Наконец, цепь обрывается в результате рекомбинации атомов Вг:
5) Вг + Вг-> Вг2
Каким образом эти пять уравнений позволяют получить кинетическое уравнение (22-3)? Если бы удалось его вывести, это могло послужить веским аргументом в пользу правильности цепного механизма, хотя и не явилось бы его абсолютным доказательством, как мы имели возможность убедиться на примере реакции образования HI.
Скорость образования НВг определяется следующим образом:
= + к. [Н2] [Вг] + к2 [Н] [Вг2] - к, [Н] [НВг] (22-29) at
Скорости о механизмы химических реакций
387
поскольку НВг образуется в реакциях (1) и (2) и расходуется в реакции (4). Скорости образования атомов Н и Вг определяются уравнениями:
[Н2] [Вг] - k2 [Н] [Вг2] - к4 [Н] [НВг] (22-30)
[H2][Br] + к2 [Н][Вг2] + к4[Н][НВг] +
+ 2k3[Br2] - 2ks[Br]2 (22-31)
Коэффициенты 2 перед к3 и к5 объясняются тем, что в реакции (3) образуются два атома Вг, а в реакции (5) расходуются два атома Вг.
Теперь следует ввести важное упрощающее предположение. Реальное количество имеющихся в наличии атомов Н и Вг должно быть все время небольшим, поскольку они поглощаются почти с такой же скоростью, как и возникают. Вскоре после начала реакции концентрации Н и Вг должны достичь постоянных (стационарных) значений и оставаться таковыми до тех пор, пока продолжается реакция при достаточном количестве реагентов. Тогда в каждом из кинетических уравнений (22-30) и (22-31) следует положить левую часть равной нулю:
0 = К [Н2] [Вг] - к2 [Н] [Вг2] - к4 [Н] [НВг] (22-32)
0 = - к, [Н2][Вг] + к2 [Н][Вг2] + k4[H][HBr] +
+ 2k3[Br2] - 2к5[Вг]2 (22-33)
Суммируя эти уравнения, получим
2ks[Br]2 = 2/с3[Вг2]
откуда следует
[Вг] = 2 [Вг2]1/2 (22-34)
В результате этого расчета мы получили стационарную концентрацию атомов Вг, выраженную через концентрацию молекул Вг2.
Теперь можно переписать уравнение для скорости образования НВг:
= ki [н2] [Вг] + {к2 [Вг2] - к4 [НВг]} [Н] (22-35)
at
Исключим из него концентрацию Н, выразив ее через концентрацию Вг при помощи уравнения (22-32):
(k2[Br2] + кДНВг])[Вг]
(22-36)
13*
Подставляя уравнение (22-36) в (22-35), приводя все к общему знаменателю и сокращая одинаковые члены, получим
ЛЕНВГ] =
dt к2 [Вг2] 4- k4[HBr]
(22-37)
Теперь разделим числитель и знаменатель правой части этого уравнения на [Вг2], а затем исключим из него [Вг] при помощи уравнения (22-34):
л[нвг] = гкДкз/к^-Лщнвг,]1'2
df , , ГНВг]
1+w
(22-38)
Полученное кинетическое уравнение по виду точно совпадает с найденным экспериментально, причем экспериментальные константы скорости связаны с константами скорости отдельных стадий цепной реакции соотношениями
/к3У'2 к = 2к31 — )
\kiJ
и
k' = h. кг
Теперь, когда мы знаем, как экспериментальные константы скорости выражаются через константы скорости индивидуальных реакций, можно дать гораздо более полную интерпретацию кинетического уравнения (22-38). Допустим, что имеется возможность произвольно изменять индивидуальные константы скорости, от к{ до к5. Общая скорость образования НВг возрастает при увеличении констант к,, к2 и к3, т.е. при ускорении реакций (1)-(3). Первые две из этих реакций приводят к образованию НВг; третья открывает путь к получению новых атомов Вг. Образование НВг замедляется при больших значениях к4 и к5, т.е. при ускорении реакций, ингибирующей развитие цепи и обрывающей цепь. Если к3 и к5 изменяются параллельно, на общую скорость реакции это не влияет Реакции (3) и (5) обратны друг другу-это инициирующая и ингибирующая стадии (стадии зарождения и обрыва цепи). Аналогично, если к2 и к4 изменяются параллельно, реакция не испытывает их влияния. И это понятно, потому что реакции (2) и (4) подобны друг другу в том, что обе они поглощают атомы Н и образуют атомы Вг, но отличаются образованием молекул НВг в реакции (2) и их поглощением в реакции (4). Ингибирование реакции молекулами НВг объясняется их усиливающиМ ВЛИЯНИСМ На рСаКЦИго (4); это ингибирование снижают молекулы Вг2, усиливающие реакцию (2).
389
Смесь газообразных водорода и кислорода может годами оставаться без видимых изменений, и в ней не происходит реакции образования воды. Но если внести в смесь небольшое количество платиновой черни, она взрывается. Платина является катализатором данной реакции. Как мы уже знаем, катализатор представляет собой такое вещество, которое ускоряет достижение термодинамического равновесия, но само не расходуется в этом процессе. Катализатор выполняет свою роль, изменяя механизм, или путь, реакции таким образом, чтобы при этом понизилась энергия активации. Если энергия активации прямой реакции (Е, на рис. 22-4) понижается на некоторую величину, энергия активации обратной реакции (Е2) должна также понизиться на ту же величину, чтобы теплота реакции осталась неизменной. Катализатор ускоряет как прямую, так и обратную реакции. Он не изменяет условий равновесия реакции, а влияет только на скорость достижения этого равновесия. На поверхности платинового катализатора молекулы Н2 диссоциируют на атомы. Эти атомы Н затем гораздо быстрее реагируют с молекулами О2, с которыми они встречаются на поверхности металла, чем молекулы Н2 реагируют с молекулами О2 в газовой фазе.
Мы познакомились с примером гетерогенного катализа, в котором участвуют газовая или жидкая фаза и какая-либо поверхность. Еще чаще встречаются случаи гомогенного катализа, при котором как реагенты, так и катализатор находятся в растворе.
Гомогенный катализ кислотами
Ионизация метанола в водном растворе
СН3ОН + Н2О -> СН3О“ + Н3О+ (22-39)
происходи! хотя и в небольшой степени, по настолько быстро, что ее невозможно измерить объемными методами. В отличие от этого аналогичная реакция диметилового эфира
СН3—О— СН3 + Н2О СН3О + СН3ОН; (22-40)
не пропс?; о шт в сколько-нибудь измеримой степени. Очевидно, гидрок-сидный аьдм водорода в молекуле спирта настолько мал и открыт доступу, что он может быть атакован нуклеофильным реагентом, подобным воде (рис. 22 10). тогда как аналогичная группа —СН3 в молекуле эфира блокируй приближение Н2О. Стерическое препятствие - скопление и взаимное отталкивание несвязанных атомов-наиболее важный фактор, определяющий энергию активации реагирующих молекул. Ион Н+, представляющий собой оголенный протон, свободен от каких-либо стерических препятствий. Он имеет настолько малый размер, что подобные барьеры реакций нс возникают и поэтому реакция переноса протона обычно проте-
Рис. 22-10. Растворение в воде метанола и диметилового эфира. На рисунке указаны приблизительные относительные размеры атомов, измеряемые но расстояниям вандерваальсова контакта между несвязанными атомами, а-при растворении метанола в воде благодаря малым размерам протона гидроксидной группы в метаноле молекула воды может приблизиться к нему и подвергнуть его нуклеофильной атаке. В результате связь О—Н в ме-
Реакция не идет
таноле разрывается и протон связывается с растворителем;
б-в молекуле диметилового эфира место протона занимает группа СН3. Эта группа настолько велика и громоздка, что молекула воды не может приблизиться к ней и атаковать ее, как в случае с метанолом. Связь С—О в диметиловом эфире не разрывается, и образования иона СН ,О не происходит.
кают очень быстро. Если какая-либо реакция имеет кроме прямого еще альтернативный механизм, включающий стадии с переносом протона, то катализаторами для такой реакции, вероятно, должны служить кислоты, являющиеся источниками протонов. Вот почему катализ кислотами имеет такое значение в химии.
Реакция
СН3СООСН3 + Н2О СН3СООН + СН3ОН
имеет уравнение для скорости
_ JJCH3COQCHJ = к, [-н о-)|-сн 5СООСН j
dt
= /<[СН3СООСН3]
Хотя у этого уравнения по существу второй порядок, эффективно оно является уравнением первого порядка, поскольку концентрация воды
Скорости и Ак'хдниз.иы химических реакций - 391
в водном растворе остается практически постоянной в ходе реакции. Эта реакция катализуется кислотами. Она была изучена в самом конце прошлого века Оствальдом, который обнаружил, что константа скорости данной реакции возрастает почти в 300 раз под влиянием НС1; другие кислоты приводят к возрастанию ее скорости в число раз, указанное в табл. 22-3. Нетрудно заметить корреляцию между возрастанием константы скорости и константой диссоциации кислоты. Теперь понятно, что эффективность действия кислоты как катализатора (обнаруживаемая по изменению константы скорости) обусловлена концентрацией ионов Н +, образуемых кислотой (эта концентрация определяется константой диссоциации кислоты). Все полностью диссоциирующие сильные кислоты обусловливают приблизительно одинаковое возрастание константы скорости катализируемой реакции.
Таблица 22-3 Возрастание константы скорости3 при кислотном катализе для реакции
СН3СООСН3 + Н2О СН3СООН + СН3ОН
Кислота , ,1 б к/^НОАс
Уксусная, СН3СООН (образуемая в
реакции) 1,о 1,76-10‘5
Муравьиная, НСООН 3,8 1,77 -10—4
Дихлоруксусная, СНС12СООН 66,7 3,32 10“2
Трихлоруксусная, СС13СООН 198,0 0,20
Серная, H2SO4 214,0 —
Азотная, HNO3 267,0 —
Бромистоводородная, НВг 284,0 —
Хлористоводородная, НО 290,0 —
3 Реакция описывается кинетическим уравнением:
<фсн3соосн3]
dt
= k[CH3COOCH3]
6 В этой колонке дано отношение константы скорости в присутствии указанной кислоты к константе скорости в присутствии уксусной кислоты при той же концентрации.
ЗАКЛЮЧЕНИЕ
Данная глава является лишь кратким введением в очень широкую область химии. Здесь нет возможности дать больше, чем краткое перечисление проблем, возникающих при исследованиях способов реакции моле
У2
кул, и некоторых методов решения этих проблем. В настоящее время химическая кинетика еще не так развита, как структурная химия, потому что кинетические проблемы в принципе гораздо сложнее. Кинетики готовы использовать любые сведения о структуре, которые доступны для них, но эти сведения являются лишь исходной точкой для предположений о механизмах реакции и для постановки экспериментов с целью проверки таких предположений.
Важнейшим вопросом, на который должна отвечать кинетика, является вопрос о том, каким образом одна молекула реагирует с другой. Однако поскольку нет возможности изучать индивидуальные молекулы, приходится иметь дело с большими совокупностями молекул, с их распределением по энергии и с неизвестными относительными ориентациями. От распределения по энергии для некоторых реакций удается избавиться благодаря применению метода молекулярных пучков, но проблема ориентации молекул остается и в этом случае.
Кинетическое уравнение реакции, или выражение для скорости образования продуктов, не обязательно согласуется со стехиометрией полного уравнения реакции. В тех случаях, когда существует такое соответствие, его можно рассматривать как предположительное указание на одноступенчатый характер полной реакции (однако подобный вывод может оказаться ошибочным, как в случае с HI). Если же кинетическое уравнение реакции не согласуется с ее стехиометрическим уравнением, как в случае с НВг, это явно указывает на то, что полная реакция протекает в несколько более простых стадий. Если одна из таких стадий осуществляется намного медленнее, чем другие, кинетика полной реакции контролируется этой ско-ростьопределяюшей стадией.
Порядок и молекулярность реакции-два совершенно разных понятия, отражающие различие между полной стехиометрией реакции и ее механизмом. Порядок реакции представляет собой сумму показателей степеней всех концентрационных членов в выражении для скорости реакции, имеющем вид произведения этих членов. Молекулярность простой реакции-это число молекул или ионов, которые сталкиваются на данной стадии. Нельзя говорить о молекулярности полной, многостадийной реакции, хотя ее порядок можно определить вполне однозначно. Однако кинетическое уравнение для реакции образования НВг имеет настолько сложный вид, что к нему неприменимо даже понятие порядка реакции, которым удается воспользоваться только при низких концентрациях НВг.
Известны две теории простых бимолекулярных реакций: теория столкновений и теория абсолютных скоростей реакций (теория переходно! о состояния). Обе теории основываются на аррениусовой интерпретации зависимости константы скорости от температуры, в которой используется представление об энергии активации. Теория столкновений фокусирует внимание на столкновении, предшествующем реакции; теория абсолютных скоростей реакций сосредоточивает внимание на совокупности аз омов сразу же после столкновения, но непосредственно перед распадом на продукты. Обе теории дают удовлетворительное объяснение наблюдаемых
Скорости и механизмы химических реакций 393
констант скорости; теория абсолютных скоростей реакций позволяет достичь несколько большей точности.
Величина активационного барьера реакции определяется двумя факторами-энтальпией активации и энтропией активации. Осуществлению реакции благоприятствует низкий барьер энтальпии и большая положительная (или по крайней мере не отрицательная) энтропия активации. Если активированный комплекс характеризуется намного большей упорядоченностью по сравнению с реагентами, энтропия активации имеет большое отрицательное значение и реакция замедляется.
Катализатор ускоряет протекание реакции, открывая возможность для нового пути реакции или для механизма с более низкой энергией активации. Роль катализатора заключается в том, что он поставляет энергию, необходимую для диссоциации реагента, либо помогает упорядочению реагентов в активированном комплексе. В первом случае понижается энтальпия активации (как, например, для Н2 на поверхности Pt). Во втором случае повышается вероятность необходимого упорядочения реагентов по сравнению с вероятностью их случайного упорядочения в растворе. В любом случае реакция протекает быстрее, поскольку AG°* понижается, а К * возрастает.
Термодинамика не дает никаких сведений о времени, необходимом для достижения равновесия; это уже неоднократно подчеркивалось выше. Термодинамика лишь сопоставляет исходное и конечное состояние реагирующей системы, характеризуя их такими функциями состояния, как Т, Р, V, Е, Н, S и G. Изменения этих величин не зависят от того, протекает реакция за наносекунду (10 “ 4 с) или за эон (109 лет), а также от того, осуществляется реакция в одну стадию или в тысячу стадий, при условии что исходное и конечное состояния системы в каждом случае одни и те же. В отличие от этого кинетика занимается изучением скорости протекания реакций. Камень, скатывающийся по склону горы, останавливается и остается сколь угодное время неподвижным, если он встречает на своем пути барьер, высота которого может составлять даже небольшую часть высоты самой горы. Если этот камень будет случайно потревожен прохожим, вероятность того, что за определенный промежуток времени он перескочит через препятствие и продолжит скатываться с горы, зависит среди прочих факторов и от высоты барьера. Задачей химической кинетики является исследование барьеров химических реакций и установление их роли в замедлении реакций, а также путей преодоления барьеров при надлежащих химических условиях или их обхода при помощи катализаторов.
EC’IiPOCdI Д М(..Л\ОН 1 РОЛ я
1. Почему вероятность реакции тиоацетамида с водой (см. рис. 22-1) зависит от взаимной ориентации молекул этих двух веществ при их сближении?
2. Почему вероятность реакции, указанной в предыдущем вопросе, зави
Г.ШвЛ
394
сит от относительной скорости сближения двух молекул реагирующих веществ?
3. Почему приближение молекулы воды к молекуле тиоацетамида ослабляет связь С—S? Почему оно ослабляет связь О—Н?
4. Почему молекулы Н2О (см. рис. 22-1, а) и H2S (см. рис. 22-1, в) изображены по-разному?
5. Какой из двух факторов, оказывающих влияние на скорость реакции,-энергия или энтропия-контролируется в опытах с молекулярными пучками? Как это осуществляется?
6. Почему эксперименты с молекулярными пучками непригодны для изучения кислотно-основных реакций, обсуждавшихся в гл. 5? Какие реакции можно исследовать по методу молекулярных пучков?
7. Как определяется константа скорости реакции? Каков смысл символа d в числителе и знаменателе уравнения (22-2), описывающего скорость реакции образования HI? Что означают химические символы в квадратных скобках?
8. В чем различие между порядком и молекулярностью химической реакции? Каков полный порядок реакции, описываемой уравнением (22-25) и уравнением (22-27)? Какова их молекулярность? К реакциям какого типа неприменимо понятие молекулярности? К реакциям какого типа неприменимо понятие порядка?
9. Какие физические методы могут использоваться для того, чтобы следить за протеканием реакции? Каковы сравнительные преимущества физических и химических методов изучения кинетики реакций?
10. Как обнаруживается, что химическая реакция имеет первый порядок?
11. Как объяснить, что реакция между этанолом и декабораном, упоминаемая в разд. 22-2, имеет не тридцать первый порядок? Попытайтесь предложить механизм этой реакции, который позволит объяснить экспериментально установленное для нее кинетическое уравнение.
12. Какой физический факт позволяет ввести представление об энергии активации произвольной реакции? Как энергия активации объясняется при рассмотрении механизма реакции?
13. Почему вывод константы равновесия реакции из кинетических соображений на основании представления о равенстве скоростей прямой и обратной реакции применим не ко всем случаям? К каким случаям применим такой подход?
14. Как изменяется при постоянной температуре энтальпия реакции при изменении энергии активации прямой реакции? Как может быть изменена энергия активации?
15. Какую роль играет энергия активации в теории столкновений? Какие факторы, согласно этой теории, влияют на скорость реакции? Каковы две причины влияния температуры на скорость реакции в теории столкновений?
16. Почему на основании данных табл. 22-2 и рис. 22-5 можно утверждать, что активированный комплекс в реакции
2С1О - С12 + О2
С каростн и механизмы химических реакций 395
не состоит из четырех атомов, находящихся на больших расстояниях друг от друга?
17. Пользуясь рис. 22-7, определите потенциальную энергию системы из трехатомов водорода, расположенных на одной прямой на расстоянии 2,0 А друг от друга (в килоджоулях на моль для каждых трех таких атомов). Насколько такое состояние менее устойчиво, чем самая верхняя точка на пути реакции от Н + Н2 до Н2 + Н?
18. Что представляет собой активированный комплекс? Что является активированным комплексом на рис. 22-1? Какое предположение делается в теории абсолютных скоростей относительно количества имеющихся активированных комплексов?
19. Благоприятствует ли быстрому протеканию реакции большая положительная энтальпия активации и большая положительная энтропия активации?
20. Что дает вычисление энтропии активации из экспериментального значения константы скорости реакции в рамках теории абсолютных скоростей реакции? Какие сведения можно получить из таких расчетов относительно механизма реакции?
21. Что означают обозначения механизмов реакций SN1 и SN2? Как отличаются эти механизмы? Чем характеризуются активированные комплексы для каждого из этих механизмов? Для какого из этих механизмов имеют большое значение особенности замещающей группы? Какие факторы определяют, протекает реакция по механизму SN1 или с ээ
22. Протекает реакция тиоацетамида с водой по механизму SN1 или по механизму Sn2?
23. Какой из двух механизмов, обсуждаемых в двух предшествующих вопросах, должен иметь большую энтропию активации? Какое влияние это должно оказывать на скорость протекания реакции?
24. Какой из двух механизмов, обсуждаемых в вопросах 21 и 22, должен иметь большую энтальпию активации при прочих равных факторах? Какое влияние это должно оказывать на скорость протекания реакции?
25. С учетом ответов на два предыдущих вопроса объясните, почему нельзя делать догматических утверждений об относительных скоростях реакций, протекающих по механизмам SN1 и ^2?
26. На каком основании можно высказать утверждение, что реакция между Н2 и 12 с образованием HI не является простой бимолекулярной реакцией, как считалось долгое время?
27. Какой механизм реакций, SN1 или 5^2, более вероятен для реакций октаэдрических комплексных ионов? Для реакций плоско-квадратных ионов? Объясните ответы.
28. Почему уравнение для скорости реакции Н2 с Вг2 значительно сложнее, чем для реакции Н2 с 12?
29. Каков отличительный признак цепной реакции? Что представляет собой стадия зарождения цепи? Что представляет собой стадия ингиби
рования развития цепи? Какая стадия ингибирования развития цепи используется в ядерных тепловых реакторах? (См. разд. 23-4.)
30. Какое предположение о стационарном состоянии используется при решении кинетических уравнений?
31. Какова причина большой распространенности и высокой эффективности кислотного катализа?
32. Почему реакция гидролиза метилацетата в водном растворе является реакцией первого порядка, как это и следует из экспериментальных данных?
33. Объясните принцип действия катализатора, пользуясь кинетическими теориями, изложенными в данной главе. Что представляет собой активированный комплекс в каталитической реакции? Каким образом катализатор влияет на энтальпию активации? Как он влияет на энтропию активации?
Кинетические уравнения
1. Для гипотетической реакции
2А + ЗВ - ЗС + 2D
в результате трех экспериментов, проведенных при одинаковой температуре, получены следующие данные о скорости:
Экспери- Экспери- Экстерн-
мент 1 мент 2 мент 3
Исходная концентрация А, моль•л“ 1 0,10. 0,20 0,20
Исходная концентрация В, моль • л “ 1 0,10 0,10 0,20
Исходная скорость, моль А•л“ 1 •с”1 0,10 0,40 0,40
а) Составьте экспериментальное уравнение для скорости данной реакции. б) Вычислите константу скорости, к. в) Найдите скорость данной реакции при [А] = 0,30 моль • л “ 1 и [В] = 0,30 моль л “ 1.
2. Для гипотетической реакции
2А 4- В - 2С
в результате трех экспериментов, проведенных при 25°С, получены следующие данные о скорости:
397
/ _ ’-n jЫ :<ii.'/i/'i - <-.их PCilKULiil
Эксперимент 1 Эксперимент 2 Эксперимент 3
Исходная концентрация А, моль • л “ 1 0,10 0,30 0,30
Исходная концентрация В, моль • л ~ 1 0,20 0,40 0,80
Исходная скорость, моль А•л 1 •с“ 1 300 3600 14400
а) Составьте экспериментальное уравнение для скорости данной реакции. б) Вычислите константу скорости этой реакции.
3. В реакции
2NO + С12 -> 2NOC1
при температуре ее проведения реагенты и продукты находятся в газообразном состоянии. В трех экспериментах получены следующие кинетические данные:
Эксперимент 1 Экспери- Эксперимент 2 мент 3
Исходное Pno, атм 0,50 1,0 0,50
Исходное pci2, атм 0,50 1,0 1,0
Исходная скорость, атм с " 1 5,1-10“ 3 4,0 -10-2 1,0-10
а) Составьте на основании этих данных уравнение скорости рассматриваемой газофазной реакции. Какой порядок она имеет по NO, С12 и в целом? б) Вычислите константу скорости данной реакции.
4. Реакция 2NO + О2 -> 2NO2 имеет первый порядок по давлению кислорода и второй порядок по давлению оксида азота. Запишите ее уравнение скорости.
5. Ниже приведен ряд химических реакций с соответствующими уравнениями скорости. Если предположить, что эти уравнения скорости сохраняют свой вид даже в условиях равновесия, то какой вид должны иметь уравнения скорости обратных реакций при равновесии?
а) С2Н2 + Н2 - С2Н4
Скорость = fc[H2]/[C2H2]
б) С2Н4 + Н2 - С2Н6
Скорость = fc[H2]
в) 2Н2 + О2 -> 2Н2О
Скорость = ^[Н2][О2]4/3
г) N2O5 2NO2 + уО2
Скорость = /c[N2O5]
6. Для реакции изомеризации дихлорэтилена
С1 НН н
/С=С\ )с=сХ
Н С1 С1 С1
транс цис
установлены следующие кинетические данные:
Время, мин: 0 10 20 30
Число молей
транс-С2Н2С12: 1,00 0,90 0,81 0,73
Каков порядок этой реакции? Сколько времени необходимо для изомеризации половины количества транс-дихлорэтилена?
7. Реакция
A + B + C->D + F
имеет экспериментально установленный нулевой порядок по веществу А. Приготовлен раствор реагентов А, В и С со следующими исходными концентрациями: 0,2 М по А, 0,4 М по В и 0,6 М по С. В течение 5 мин концентрация веществ А в этом растворе уменьшается практически до нуля. Затем приготовлен второй раствор со следующими исходными концентрациями: 0,03 М по А, 0,4 М по В и 0,6 М по С. Сколько времени потребуется в этом случае для полного исчезновения вещества А?
8. Для реакции
2NO + Н2 - N2O + Н2О
в трех последовательных экспериментах при одинаковой температуре получены следующие кинетические данные:
Эксперимент 1 Эксперимент 2 Экспери мент 3
Исходная концентрация NO, моль • л 1 0,60 1,20 1,20
Исходная концентрация Н2, моль л “ 1 0,37 0,37 0,74
Исходная скорость, моль л _ 1 мин “ 1 0,18 0,72 1,44
Скорости и механизмы химических реакций
399
Пользуясь этими экспериментальными данными, составьте уравнение скорости данной реакции.
9. Реакция
2НСгО; 4- 3HSO3" + 5Н+ - 2Cr3 + + 3SO2- + 5Н2О
описывается следующим кинетическим уравнением:
Скорость = к [НСГО4 ] [HSO3 ]2 [Н + ]
Почему скорость этой реакции не пропорциональна числу ионов каждого сорта соответственно стехиометрическому уравнению реакции?
10. Для реакции
I- + ОСС -»• С1" + OI'
экспериментально установлено следующее кинетическое уравнение: Скорость исчезновения ОС1 “ = к [I “ ] [ОС1 “ ]
Каков порядок этой реакции? Объясните ответ.
11. Константа скорости реакции, описанной в задаче 10, зависит от концентрации гидроксидного иона. При 1,00 М, 0,50 М и 0,25 М концентрациях гидроксидного иона константа скорости к равна соответственно 60, 120 и 240 л-моль " 1-с” 1. Каков порядок реакции по концентрации гидроксидного иона?
12. Реакция
SO2C12 -> SO2 + Cl2
описывается кинетическим уравнением первого порядка с константой скорости к = 2,2 10“ 5 с-1 при 320°С. Какая часть исходного количества SO2C12 разложится при температуре 320°С за 90 мин?
13. Для реакции первого порядка А—>С константа скорости к = 5 мин'1. При протекании реакции первого порядка D В лишь 10% вещества D разлагается за такой же промежуток времени, который требуется для 50%-ного разложения вещества А в первой реакции. Вычислите константу скорости к для второй реакции.
14. При экспериментальном исследовании реакции разложения аммиака получены следующие данные:
Время, с 0 12 11/2
Концентрация аммиака, моль-л'1 2,000 1,993 1,987 1,000
Запишите уравнение скорости этой реакции первого порядка и вычислите ее константу скорости, к.
15. Для реакции разложения N2O5 в тетрахлориде углерода график зависимости lg [N2O5] от времени представляет собой прямую линию. Константа скорости этой реакции при 45°С равна 6,2 • 10 _ 4 с " 1. Какое время потребуется для 20%-ного разложения 1 моля N2O5 в 1 л раствора? Какое время потребуется для его 50%-ного разложения?
r.iaea 22 40U
Энергия активации
16. Часто высказывается утверждение, что при температурах, близких к комнатным, скорость реакции удваивается при повышении температуры на 10°С. Вычислите энергию активации реакции, скорость которой при повышении температуры от 27 до 37°С возрастает точно в два раза.
17. Вычислите энергию активации реакции, для которой повышение температуры от 20 до 30°С приводит точно к трехкратному возрастанию скорости.
18. Температурная зависимость константы скорости реакции
N2O5 - 2NO2 + уО2
характеризуется следующими экспериментальными данными:
Т, К к, с ' 1
273 7,87-10'7
298 3,46 10“5
308 1,35-10"4
318 4,98 -Ю"4
328 1,50-10-3
338 4,87 I0 3
Постройте по этим данным график и вычислите с его помощью энергию активации реакции.
19. Энергия активации для разложения СН31 при 285 К равна 180 кДж моль ” '. Полагая, что энергия активации не зависит от температуры, вычислите относительное возрастание (в процентах) доли молекул с энергией, превышающей £а, при повышении температуры до 300 К.
20. Константа скорости разложения N2O5 в тетрахлориде углерода при 45°С равна 6,2 -10~4 с1. Вычислите константу скорости этой реакции при 100сС исходя из того, что энергия активации равна 103 кДж моль ”
21. Почему варка яйца вкрутую занимает больше времени на горе высотой 4000 м, чем в городе, находящемся на высоте 250 м над уровнем моря?
Реакции на поверхности
22. Для реакции
Скорости и .чехиктмы химических реакций 401
Ni + ±О2 -» NiO 2 2
при 298 К ДП° = — 248 кДж, и это значение существенно не изменяется с температурой. Допустим, что эта реакция на поверхности никеля протекает столь быстро, что все выделяемое тепло расходуется на нагревание металла. Если при 25°С на каждые 10 А2 поверхности вступает в реакцию один атом кислорода, какой станет максимальная температура никелевого кубика с ребром 1,00 см в результате реакции его поверхности с кислородом? Плотность никеля приблизительно 9 гем-3. Если такой кубик измельчить таким образом, чтобы из него получилось 1015 одинаковых мальчайших кубиков, и провести реакцию с ними, какой окажется их окончательная температура? Изменением теплоемкости при образовании оксида никеля можно пренебречь. Следует также воспользоваться предположением о применимости закона Дюлонга и Пти (см. гл. 6).
23. Если кубик NaCl с ребром 1,00 см растворяют в очень большом количестве воды при перемешивании в сосуде, то для полного растворения его потребуется 6 ч. Сколько времени потребуется для растворения мелкого порошка, полученного размалыванием кубика на 1015 одинаковых шариков, если время растворения обратно пропорционально начальной площади контакта между NaCl и водой?
Скорости и механизмы реакций
24. Реакция
Н2 + С12 -> 2НС1
на свету протекает со взрывом. Допустим, что этот взрыв представляет собой цепную реакцию, которая инициируется образованием атомов водорода или атомов хлора. По данным об энергиях связи в молекулах Н2 и С12 вычислите длину волны света, необходимого для инициирования этой реакции в каждом из предполагаемых вариантов. 25. Вычислите стандартное изменение свободной энергии для реакции
2С6Н6(г.) -> ЗСНДг.) + 9С(графит)
при 298 К и ее константу равновесия, Кравн. Из числа других типичных реакций, с которыми мы познакомились в данном курсе, приведем еще две-осаждение AgCl из раствора:
Ag+ + Cl’ - AgCl(TB.) Кравн^1О10
и образование комплекса серебра с аммиаком в водном растворе: Ag’ + 2NH3 -+ Ag(NH3)2 Кравн^108
Все три реакции обладают большой способностью к самопроизвольному протеканию. Однако в лабораторных условиях две последние реакции протекают практически мгновенно, тогда как видимого разложе
402
ния бензола на метан и углерод вообще не происходит. Объясните столь разительное отличие в скоростях этих реакций.
26. Разложение газообразного N2O5 происходит по уравнению
N2O5 -» 2NO2 + уО2
Экспериментально установленное кинетическое уравнение этой реакции имеет вид
at
а предполагаемый механизм реакции состоит из следующих стадий: к
1) равновесие N2O5 # NO2 + NO3
2) медленная реакция
no2 + no3 4 no2 + о2 + no
3) быстрая реакция NO + NO3 2NO2
а) Покажите, что этот механизм согласуется с экспериментально установленным кинетическим уравнением, б) Если к = 5-Ю4 с ', сколько времени понадобится, чтобы концентрация N2O5 уменьшилась до своего исходного значения?
27. Рассмотрим реакцию
СН4 + С12 СН3С1 + НС1
Эта реакция осуществляется по цепному механизму, в котором принимают участие атомы хлора, О, и метильные радикалы, -СН3. Какая из указанных ниже стадий не является стадией обрыва цепи?
а) СН3- + С1 -* СН3С1
б) СН3- + НС1 - СН4 + С1
в) СН3- + -СН3 -> С2Н6
г) Cl + С1 - С12
28. Допустим, что реакция
5Вг' + ВгО3 + 6Н+ -> ЗВг2 4- ЗН2О
осуществляется по следующему механизму:
1) быстрая реакция
ВгО3 + 2Н+ 4 Н2ВгО3
2) быстрая реакция
Н2ВгО3+ ВгО3 + 2Н +
3) медленная реакция
Вг + Н2ВгО3 Вг—ВгО2 + Н2О
Скорости и механизмы химических реакций
403
4) быстрая реакция
Вг—ВгО2 + 4Н+ + 4Вг“ Д ЗВг2 + 2Н2О
Выведите кинетическое уравнение, согласующееся с этим механизмом; выразите константу скорости полной реакции через константы скорости индивидуальных стадий. (Указание. Кинетическое уравнение зависит от концентраций Н + , Вг- и ВгО2.)
29. Рассмотрим реакцию
„ Н2О
5Н+ + [Co(NH3)5C1]2 + [Сг(Н2О)6]2+ -------->
-> [Со(Н2О)б]2 + + [Сг(Н2О)5С1]2 + + 5NH4+
Если реакция проводится в присутствии меченных радиоизотопами хлорид-ионов, обнаруживается, что эти радиоактивные ионы не появляются в продукте реакции. Имея в виду, что скорость обмена лигандами, координированными к Сг2 + и Со2 + , очень велика, тогда как для лигандов ионов Сг3 + и Со3 + она довольно низка, предложите механизм указанной реакции. [См. J. Am. Chem. Soc., 75, 4118 (1953).]
ЛИТЕРАТУРА
1. Edwards J. О., Inorganic Reaction Mechanisms: An Introduction, W. A. Benjamin, Menlo Park, Calif., 1965.
2. Eyring H„ Eyring E.M., Modern Chemical Kinetics, Reinhold, N.Y., 1963.
3. Frost A. A., Pearson R.G., Kinetics and Mechanisms, 2nd ed., Wiley, N. Y., 1961. 4. King E.L., How Chemical Reactions Occur, W.A. Benjamin, Menlo Park, Calif., 1963.
ГЛАВА
23
шая химия
Вперед, друзья, дорогу занимай!
Вот слышится кареты стук-Для нас такой желанный звук! Скорее ружья заряжай!
Ружье-твой спутник, молодец!
Зря химики весь век потеют, Все ж наш огонь куда сильнее-он переплавит в золото свинец!
Хор разбойников из «Оперы нищих», Джон Гэй (1728)
Важнейшие понятия
23-1. Ядро. Нуклоны и массовое число. Изотопы. Энергия связи.
23-2. Ядерный распад. Устойчивые и радиоактивные изотопы. Испускание а-частиц, Р-частиц и позитронов. Захват орбитального электрона. Период полураспада.
23-3. Ряды устойчивости. «Магические числа». Естественные ряды радиоактивности.
234. Ядерные реакции. Искусственные элементы, сверхпереходные металлы. Ядерное деление, критическая масса. Ядерный синтез.
23-5. Применения ядерной химии. Радиоактивные метки. Радиометрический анализ. Методы изотопного разбавления. Удельные активности. Датирование событий при помощи радиоактивного углерода и другими изотопными методами.
Превращение одних элементов в другие-особенно простых металлов в золото - было для средневековых ученых тем же, чем являются для нашего поколения поиски внеземных цивилизаций: полумистической, но теоретически достижимой целью, которая захватывает воображение не только профессионалов, но и широкой публики. Огонь алхимика был символом таинственных знаний, приносящих и пользу и вред, подобно сегодняшним
ядерным реакторам или лабораториям генной инженерии. Человечеству удалось решить проблему превращения элементов, но другая великая цель средневековой химии (или алхимии)-бесконечное продление жизни и молодости-все еще является предметом интенсивных исследований.
Окончательный успех в деле превращения одних элементов в другие был достигнут физиками, а не химиками; тигель алхимика уступил дорогу ядерному реактору. Сначала ученые обратили внимание на огромную энергию, высвобождаемую при ядерных реакциях. Тот факт, что уран превращается при этом в барий и другие легкие элементы, первое время не вызывал столь большого интереса. Но химики быстро осознали, что радиоактивные изотопы обычных элементов представляют собой огромную ценность. Радиоактивный атом может играть роль своеобразной метки, его достаточно ввести в какое-то вещество, принимающее участие в реакции, чтобы при последующем наблюдении за ним раскрыть сложную последовательность всех ее стадий. Например, благодаря исследованиям при помощи меченного радиоактивным изотопом углерода удалось разобраться в механизме реакций фотосинтеза, и трудно представить себе, как бы это оказалось возможным сделать обычными методами. Радиоактивные и устойчивые изотопы позволяют решать химические проблемы, недоступные другим методам. Радиоактивные изотопы дают также возможность точной датировки событий далекого прошлого, представляющих исторический или геологический интерес. С их помощью установлен сравнительный возраст Земли и Луны, что привело к ниспровержению некоторых прежних теорий относительно происхождения Луны.
В гл. 1 уже упоминалось, что атомное ядро состоит из двух типов основных элементарных частиц, протонов и нейтронов, которые в совокупности называются нуклонами. Ядро имеет положительный заряд, равный числу содержащихся в нем протонов, а это число Z называется порядковым (атомным) номером ядра. В нейтральном атоме ядро окружено электронами, число которых равно числу протонов в ядре. Поскольку химические свойства атома определяются его электронами, все нейтральные атомы с одинаковым числом электронов (и протонов) рассматриваются как атомы одного элемента. Следовательно, порядковый номер атома указывает на его принадлежность к определенному элементу. Суммарное число протонов и нейтронов в атомном ядре называется его массовым числом, А.
Атомы с одинаковым числом протонов, но с различным числом нейтронов называются изотопами. Символическая запись изотопа включает указание у символа химического элемента порядкового номера Z в виде нижнего левого индекса и массового числа А в виде верхнего левого индекса. Например, изотоп ртути с 80 протонами и 116 нейтронами записывается так: 8o6Hg (80 + 116 = 196). Масса ядра в атомных единицах массы (а. е. м.) приблизительно равна его массовому числу, А. По определению, 1 а. е. м. точно равна двенадцатой части массы одного атома углеродного
406
изотопа б2С. Таким образом, 1 а. е. м. эквивалентна 1,66057 10 24 г. Другие соотношения между единицами массы даны в приложении 2.
Элементы, естественно встречающиеся в природе, обычно представляют собой смеси нескольких изотопов. Например, водород имеет три изотопа: }Н, и JH, первые два из которых встречаются в природе в пропорции, указанной в табл. 23-1. В ядро каждого из этих трех изотопов входят соответственно протон, протон и нейтрон, протон и два нейтрона. Ртуть имеет изотопы, общее содержание протонов и нейтронов
Таблица 23-1
Естественные изотопы водорода и ртути4
Изотоп Масса, a. e. м. Естественное содержание, % Название
>Н 1,0078 99,985 Водород
,Н, или D 2,0140 0,015 Дейтерий
|Н, или Т 3,0161 — Тритий
Природная смесь 1,0080
4oHg 195,9658 0,15 Ртуть-196
^Hg 197,9668 10,02 Ртуть-198
’^Hg 198,9683 16,84 Ртуть-199
2оотт,-- 199,9683 23,13 Ртуть-200
2^Hg 200,9703 13,22 Ртуть-201
2eoHg 201,9706 29,80 Ртуть-202
204тт„ 203,9735 6,85 Ртуть-204
Природная смесь 200,59
а По данным справочника: Handbook of Chemistry and Physics, 59-th ed., Chemical Rubber Co., Cleveland, Ohio, 1978-1979.
в которых от 189 до 206, т.е. они содержат от 109 до 126 нейтронов. Семь ее изотопов, указанных в табл. 23-1, в естественных условиях встречаются в относительных количествах, приведенных в данной таблице. Экспериментальное значение атомной массы ртути (200,59) представляет собой средневзвешенное значение из атомных масс отдельных естественно встречающихся ИЗОТОПОВ;
Я/Эерки.Ч ХИМИИ
407
Размер и форма ядра
Первые измерения размера атомного ядра были выполнены Резерфордом в экспериментах по рассеянию а-частиц. Более точные измерения осуществляются в экспериментах по рассеянию нейтронов, потому что нейтроны не отклоняются в результате электростатического отталкивания от ядер. Многочисленные эксперименты по рассеянию нейтронов показали, что радиус ядра пропорционален кубическому корню из числа содержащихся в нем нуклонов, т.е. что объем ядра пропорционален числу его нуклонов.
г = 1,33 1(Г 13 Л1'3 см
Ядро изотопа }Н имеет радиус 1,33-10“13 см, а радиус ядра 8,25 10 ”13 см. Атомные радиусы, включающие электронные облака, в 20000 раз больше ядерных.
Если распределение зарядов в системе не идеально сферическое, то даже при отсутствии дипольного момента оно обладает так называемым электрическим квадрупольным моментом. Квадрупольные моменты поддаются экспериментальному измерению, однако здесь незачем останавливаться на этом подробнее. Такие исследования обнаружили, что многие ядра сферичны, а большая часть несферичных ядер имеет продолговатую форму, подобную мячу для игры в регби, причем отношение большего диаметра к меньшему никогда не превышает 1,2.
Энергия связи ядра
Массовое число, А, и масса ядра, выраженные в атомных единицах массы, не совпадают, в частности, из-за того, что масса протона или нейтрона не равна в точности 1 а. е. м. В приложении 2 указано, что масса протона составляет 1,007276 а. е. м., а масса нейтрона 1,008665 а. е. м. Однако есть и другая причина: атом устойчивого изотопа имеет меньшую массу, чем сумма масс всех электронов, протонов и нейтронов, из которых он состоит.
Пример 1
Какова суммарная масса частиц, из которых состоит атом go°Hg?
Решение
Масса нейтрона равна 1,008665 а. е. м., а масса протона и электрона в электронном облаке, нейтрализующего заряд протона, равна 1,007825 а. е. м. (В таблицах обычно приводятся массы нейтральных атомов, а не массы их ядер.) Указанный изотоп ртути имеет 80 протонов и 200 — 80 = 120 нейтронов. Суммарная масса всех элементарных частиц, из которых состоит этот атом, должна быть:
80-1,007825 а. е. м. = 80,62600 а. е. м. (протоны и электроны)
120 -1,008665 а. е. м. = 121,03980 а. е. м. (нейтроны)
Итого: 201,66580 а.е.м. (суммарная масса частиц ao°Hg)
Хотя все компоненты атома go°Hg имеют суммарную массу 201,6658 а. е. м., экспериментально наблюдаемая масса атома io°Hg равна лишь 199,9683 а.е.м. Куда же исчезли еще 1,6975 а.е.м. вещества? Недостающая масса превратилась в энергию, которая выделилась при образовании ядра из его составных частей; такая же энергия необходима для разъединения ядра на его составные части. Эта энергия связи ядра может быть вычислена при помощи знаменитого соотношения Эйнштейна, связывающего массу и энергию:
Е = тс2
Дж = г м с “ 2
Здесь с-скорость света, равная 2,998-109 мс-1. Энергия, в которую может превратиться масса в 1,0000 а. е. м., равна
1,66057 10 - 27 кг я, , ,
Е = 1,0000 а. е. м. • —-----------(2,998 • 108)2 м2с ’ 2 =
1 а. е. м.
1 эВ
= 1.4925-10 Дж--------------—--------= 9,315 • 108 эВ
1,60219 10 - 19 Дж
(Перевод атомных единиц массы в килограммы и джоулей в электронвольты указан в приложении 2.) Полезно запомнить, что масса в 1 а. с. м. эквивалентна энергии 931,5 МэВ. Хотя электронвольты не соответствуют единицам системы СИ, их широко применяют в ядерной физике, так как джоуль-слишком большая единица энергии, которой неудобно пользоваться для описания распада одного атома. Принято оценивать ядерные энергии в электронвольтах на атом, или в джоулях на моль атомов. Соотношение между этими единицами таково:
1 эВ • атом 1 = 9о 485 Дж • моль “ 1
(Численная величина справа совпадает с постоянной Фарадея. Попытайтесь объяснить причину этого совпадения.)
При образовании атома so°Hg из электронов, протонов и нейтронов потеря массы в расчете на один нуклон составляет 1,6975 а. е. М./200 нуклонов = 0,00849 а. е.м. нуклон-1. Эта масса соответствует энергии связи 0,00849 а.е. м. нуклон - 1-931 МэВ а. е. м. -1 = = 7,90 МэВ • нуклон - *. На рис. 23-1 графически представлена энергия связи в расчете на 1 нуклон в зависимости от массового числа, А, для всех элементов периодической системы. Для нескольких первых элементов энергия связи на нуклон мала и приблизительно пропорциональна числу нуклонов в ядре. После кислорода энергия связи на нуклон остается почти постоянной на уровне 8 МэВ на 1 нуклон. Этот факт означает, что силы взаимодействия между нуклонами являются очень короткодействующими, так что каждый нуклон эффективно взаимодействует только со своими самыми близкими соседями. Если бы устойчивость ядер определялась дальнодействующими силами, так что всякий нуклон в ядре взаимодей-
409
Рис. 23-1. Уменьшение массы и энергия связи в расчете на 1 нуклон при образовании ядер из электронов, протонов и нейтронов. Для всех элементов после кислорода полная энергия
связи ядра приблизительно пропорциональна числу нуклонов в ядре, т.е. энергия связи на 1 нуклон приблизительно постоянна.
ствовал бы с каждым из остальных нуклонов, суммарная энергия связи должна была увеличиваться пропорционально квадрату числа нуклонов, а не пропорционально его первой степени, как имеет место на самом деле. Возрастание энергии связи на нуклон у первых элементов периодической системы, пропорциональное числу нуклонов в ядре, нетрудно объяснить, если учесть, что в таких малых ядрах каждый нуклон еще не со всех сторон окружен соседями. Поэтому каждый новый нуклон увеличивает энергию связи уже имеющихся нуклонов, повышая их координационное число. Протоны и нейтроны не просто тесно упакованы в ядре, подобно шарикам в ящике. (Вскоре нам предстоит познакомиться с фактами, указывающими на наличие структуры внутри ядра.) Но при обсуждении энергии связи можно пользоваться таким примитивным представлением об их упаковке.
Почему же мы только сейчас ввели представление о том, что энергетические превращения в процессе реакции сопровождаются изменениями массы? Если полная энергия связи ядра ртути эквивалентна 1,6975 а.е. м. вещества, то почему мы не проводили подобных расчетов для энергий свя
410
зи молекул? Дело в том, что ядерные реакции сопровождаются чрезвычайно большими энергетическими эффектами. В качестве примера вычислим массу, эквивалентную полной энергии связи молекулы С12.
Пример 2
Энтальпия реакции
С12(г.) - 2С1(г.)
равна 242,8 кДж на моль С12. Каков массовый эквивалент этой энергии (в а. е. м. • молекула " 1) ?
Решение
1 эВ • молекула " 1 АН = 242,8 кДж-моль 1-------------------г = 2,516 эВ-молекула
96,485 кДж-моль’1
1 а. е. м.
Ат = 2,516 эВ--------;---= 2,7010 9 а. е. м. молекула 1
9,315-108эВ
Этот же результат можно получить проще, пользуясь соотношением Эйнштейна, £ = тс2:
АН 2,428 105 Дж-моль 1 „
Ат = = —--------5------— = 2,70 -10- 12 кг-моль
с2 (3,00 10s м-с ~ *)2
Ат = 2,70 10 “ 9 г • моль " или а. е. м. • молекула “ 1
поскольку 1 Дж = 1 кг м2-с 2. Этот расчет иллюстрирует простоту системы СИ, поскольку ответ получается из определения джоуля, а не с помощью трудно запоминаемых коэффициентов перевода различных единиц энергии.
Итак, энергия диссоциации молекулы С12 эквивалентна лишь пяти миллионным частям массы электрона. Химические реакции обычно сопровождаются энергетическими эффектами в несколько электронвольт, тогда как ядерные энергии относятся к диапазону миллионов электронвольт. 1 МэВ на молекулу эквивалентен 96,5 млн кДж-моль - что находится далеко за пределами энергии всех химических реакций. Это объясняет, почему в химических реакциях можно пользоваться двумя независимыми законами сохранения-массы и энергии. Взаимные превращения этих свойств материи в химических реакциях неразличимы. В отличие от этого для ядерных реакций взаимные превращения массы и энергии-дело совсем обычное; здесь следует пользоваться более общим законом сохранения массы и энергии. В любой ядерной реакции сумма энергии и произведения массы на величину с2 (с-скорость света) для всех реагирующих частиц и их окружения не изменяется в процессе реакции.
ЫГ. РАСПАД
Многие ядра не распадаются, они называются устойчивыми изотопами. Другие самопроизвольно распадаются с образованием ядер новых элемен
Ящерная химия
411
тов; они называются радиоактивными изотопами. Радиация, наблюдавшаяся Беккерелем в 1896 г., представляла собой испускание ot-частиц (ядер 4Не) при распаде урана:
^8U -+ “4Th + 4Не
Единственный устойчивый изотоп полония, обнаруженный в урановой руде супругами Марией и Пьером Кюри в 1898 г., распадается тремя различными способами:
127Ро 8°3РЬ + 4Не (ot-распад)
8°7Ро -> + +?е (Р + -распад)
8°7Ро -> 8°7Bi (захват электрона)
В первой реакции происходит испускание а-частицы и превращение полония в свинец. Во второй и третьей реакциях один протон в ядре превращается в нейтрон. Во второй реакции это сопровождается испусканием позитрона (Р+), частицы с массой электрона, но с единичным положительным зарядом:
+ 1р -> о« + +?е
В третьей реакции превращение осуществляется в результате захвата ядром одного из электронов, движущихся по атомным орбиталям вокруг ядра:
+ 1Р + -> о«
(Обе записанные выше реакции протона происходят вовсе не так просто, как это показывают приведенные уравнения. Эти схемы фиксируют только окончательный результат реакций, истинный механизм которых гораздо сложнее. Подобное упрощение аналогично используемому при записи большинства химических реакций.) В каждой из двух последних реакций происходит уменьшение порядкового номера ядра на единицу, но атомная масса остается постоянной. Радий-228 распадается по другому механизму, с испусканием электрона:
li8Ra -> gg8Ac + (Р“-распад)
Приведенные здесь примеры иллюстрируют четыре вида распада: [3 -рас-пад, электронный захват, Р+ -распад и а-распад.
р “ -Распад, или испускание электрона
При самопроизвольном р “ -распаде один из нейтронов в ядре превращается в протон и электрон, который испускается из ядра. Испускание электронов из образна вещества в котором происходит 6 “ -распад, сопровождается выделением энергии. Вычисление этой энергии не вызывает особенных трудностей. Рассмотрим, например, распад углерода-14 с образованием азота-14:
ГС - 74N +
В этой реакции ядро атома углерода и шесть его электронов превращаются в ион азота с шестью электронами (на один электрон меньше, чем должно быть в нейтральном атоме азота) и одну испускаемую р “ -частицу (электрон). Следовательно, массы реагентов и продуктов просто равны массам нейтральных атомов 14С и 14N:
Реагенты: масса атома ^4С:
Продукты: масса атома *4N:
Уменьшение массы в реакции:
14,003242 а. е. м.
14,003074 а. е. м.
0,00168 а. е. м.
Энергия, эквивалентная этому уменьшению массы, равна
Е = 0,000168 а. е. м.-931.5 МэВ а.е.м." 1 = 0,156 МэВ
Итак, испускаемый электрон имеет энергию 0,156 МэВ. При р ~-распаде порядковый номер ядра всегда возрастает на единицу.
Захват орбитального электрона, или К-захват
При таком ядерном превращении происходят захват ядром одного электрона из окружающего ядро электронного облака (из ближайшей к ядру Х’-оболочки) и соединение этого электрона с протоном с образованием нейтрона. Примером может служить превращение бериллия-7 в литий-7: В * * * * *
В этой реакции ядро и четыре орбитальных электрона превращаются
в ядро, которое тяжелее па один электрон, и три орбитальных электрона.
И в данном случае массы реагентов и продуктов также просто равны мас-
сам атомов Be и Li:
Реагенты: масса атома ^Ве:
Продукты: масса атома jLi:
7,0169 а. е. м.
7,0160 а. е. м.
Уменьшение массы в реакции:
0,0009 а. е. м., или
vyjvu.' СА. Ч. 0,84 МэВ
При электронном захвате порядковый номер всегда возрастает на единицу.
Р + -Распад, или испускание позитрона
Изотоп углерода-11 распадается с испусканием позитронов: - ?В + +?е
Вычисление энергии этого распада требует осторожности. Ядро атома углерода и шесть его электронов превращаются в ядро атома бора с шестью электронами (на один больше, чем в нейтральном атоме) плюс
позитрон. При подсчете изменения массы следует учесть, что нейтральный атом углерода превращается в нейтральный атом бора плюс электрон плюс позитрон (имеющий такую же массу, как и электрон). Следовательно:
Продукты: масса атома “В: масса двух электронов: 11,009305 а.е. м. 0,001098 а.е.м. 11,010403 а. е. м.
Реагенты: масса атома “С: 11,011443 а.е.м.
Уменьшение массы в реакции: 0,001040 а.е.м., или 0,968 МэВ
При испускании позитрона, как и при электронном захвате, порядковый номер ядра уменьшается на единицу.
п-Распад, или испускание а-частицы
Тяжелые элементы с массовым числом, А, превышающим 200, обычно распадаются в результате испускания а-частицы. т. е. ядра атома гелия, например:
“2Th 8s8Ra + *Не
При а-распаде порядковый номер ядра уменьшается на 2, а массовое число-на 4.
у-Испускание в процессе а-распада
Ядерный распад может также сопровождаться испусканием электромагнитного излучения с высокой энергией. Так, при распаде урана-238 “8U - 9o*Th + *Не
происходит высвобождение а-частиц с двумя разными энергиями: 4,195 и 4,147 МэВ. Этот распад сопровождается испусканием электромагнитного излучения с энергией 0,048 МэВ, равной разнице между энергиями различных а-частиц. Излучение этой энергии соответствует самому правому диапазону электромагнитного спектра, схематически изображенного на рис. 8-5; такое излучение называется у-излучением.
Пример 3
Какую длину волны имеют у-лучи с энергией 0,048 МэВ?
Решение
„ 1,602-10 19 Дж
Е = 0,048 1 06 эВ • —-----— = 0,077 • 10 " 13 Дж = hv = hc/X
1 эВ
I
414
к = hc/E
6,626-IO 34 Дж c-3,00 • 10е м-с'1 " 0,077-10'13 Дж
Излучение в этой области длин волн называют у-лучами, или рентгеновским излучением, в зависимости от источника. Если оно вызвано ядерным распадом, его принято называть у-лучами, а если получается при бомбардировке металлического анода пучком электронов, обычно говорят о рентгеновском излучении. И в том, и в другом случае речь идет об одних и тех же электромагнитных волнах.
Альфа-частицы с энергией 4,13 МэВ испускаются при превращении 238jj в 234-rfr, находящийся в возбужденном ядерном состоянии. Когда 234Th переходит в свое основное состояние, высвобождается энергия 0,05 МэВ в виде гамма-излучения. Оба энергетических уровня 234Th показаны на рис. 23-2. Исследование подобного излучения делает возможной ядерную спектроскопию, аналогичную атомной спектроскопии, которую мы обсуждали при рассмотрении строения атома водорода. В будущем такие исследования должны способствовать выяснению внутренней структуры ядра.
Устойчивость и период полураспада ядер
Число ядер, распадающихся в течение заданного промежутка времени в каком-либо образце вещества, всегда пропорционально количеству распадающегося вещества. Ядерный распад представляет собой независимый
238. j
92 и
2ГоТЬ
Рис. 23-2. Диаграмма ядерпых энергетических уровней, на которой показаны основное и возбужденное состояния ядра “jTh. Эта диаграмма объясняет существование а-частиц с энергией 4,195 и 4,147 МэВ и '/-излучение
с энергией 0,048 МэВ, сопровождающее паспад 23?U. Более сложная картина "/-излучения, наблюдающегося при других распадах, дает больше подробностей относительно ядерных энергетических уровней.
Ядернич хииич
415
процесс, в котором каждое ядро участвует индивидуально. Вероятность того, что данное ядро распадется за некоторый промежуток времени, постоянна и не зависит от окружения ядра. Следовательно, полное число ядер, распадающихся в течение заданного промежутка времени, пропорционально полному числу имеющихся ядер. Если число ядер равно и, а изменение этого числа за время Аг обозначить Ап, то распад должен протекать по закону:
„ Ап
Число ядер, распадающихся в единицу времени =---------= кп
Аг
(23-1)
Такое кинетическое уравнение является уравнением первого порядка, поскольку скорость процесса зависит от первой степени концентрационного члена, п. Выражение (23-1) можно преобразовать к виду, связывающему число ядер и, не распавшихся к моменту времени г, с начальным числом ядер и0 в момент t = 0. В такой интегральной форме кинетическое уравнение ядерного распада приобретает вид
п = пое ’ к‘ (23-2)
На рис. 23-3 приведен график такого уравнения для распада £4С, начинающегося с п0 = 1г углерода-14. Хотя это график уравнения (23-2), нетрудно убедиться, что он согласуется и с уравнением (23-1), проверив, что тангенс угла наклона кривой в каждой ее точке, приблизительно равный An/At, пропорционален количеству оставшегося углерода.
Важным свойством распада, протекающего по уравнению первого порядка, является то, что время, необходимое для распада половины имеющегося количества вещества, всегда постоянно и не зависит от самого количества распадающегося вещества. Если определить это время как период полураспада, обозначив его Г1/2. то можно записать
откуда 2 = е и
In 2 0,693
Это соотношение показывает, что если известен период полураспада, г1/2, или константа скорости распада, к, протекающего по уравнению первого порядка, то по одной из этих величин можно вычислить другую. Если период полураспада радиоактивного вещества равен 10 сут, то такое время требуется для превращения 1 г данного вещества в 0,5 г, или 16 г в 8 г, 10 т в 5 т, 2 мг в 1 мг и т.д. Это может показаться странным, пока вы не осознаете, что 10 т радиоактивного вещества содержат много больше атомов, чем 2 мг, поэтому в течение 10 сут в большей массе распадется значи-
О 5000 10000 15000 20000 25000 30000 35 000 40000
Продолжительность распада, годы
Рис. 23-3. График ядерного распада углерода-14:
‘1С 4N + _?е
Каждые 5570 лет количество остающегося углерода уменьшается вдвое. Период полураспада продолжитель-
ностью 5570 лет обозначен символом рЗакономерный распад углерода-14 используется для датирования углеродсодержащих объектов, которые были живыми организмами не более чем 20000 лет назад.
тельно больше атомов, если каждый атом имеет одну и ту же вероятность распасться в течение 10 сут.
Периоды полураспада для рассмотренных выше реакций могут быть самыми разнообразными. Например, период полураспада для реакции ^238U - “4Th + 4Не
равен 4,51 млрд, лет (4,51 • 109 лет). Период полураспада полония в реакции ™7Ро 8°3РЬ + 1Не
равен 5,7 ч. Период полураспада углерода-14 (этот распад проиллюстрирован рис. 23-3) составляет 5570 лет. а превращение астата в висмут ^6At -> 2J2Bi + 4Не
имеет период полураспада всего 3-10 4 с.
417
На рис. 23-4 указаны все известные изотопы элементов периодической системы: устойчивые изотопы представлены цветными точками графика, а радиоактивные изотопы-черными точками. Обращает на себя внимание тот факт, что в ядрах устойчивых изотопов, после Н и Не, число протонов никогда не превышает числа нейтронов и что большинство устойчивых изотопов обладает избытком нейтронов по сравнению с протонами. Нейтроны как бы «разбавляют» положительные заряды протонов и способствуют устойчивости ядра, противодействуя отталкиванию между зарядами протонов.
Следует еще отметить зигзагообразный вид линии устойчивых изотопов, а также преобладание изотопов с четным числом протонов или нейтронов либо четным суммарным числом нейтронов и протонов. Это указывает на наличие какого-то взаимодействия между нуклонами и на существование внутренней структуры ядра. Отмеченное преобладание четного числа нуклонов каждого типа становится еще более очевидным при рассмотрении табл. 23-2.
Изотопы, расположенные на рис. 23-4 справа и ниже области наибольшей устойчивости, могут достичь этой области, теряя электроны. Распад таких ядер происходит, как правило, с испусканием 0 " -излучения. Изотопы, расположенные слева и выше области устойчивости, могут распадаться с образованием устойчивых изотопов в результате электронного захвата или испускания позитронов. В области выше Z = 80 преобладает испускание а-частиц. При 0 “ -испускании изотоп смещается на диаграмме по диагонали вверх и налево на один квадратик; электронный захват либо испускание позитрона смещают изотоп в противоположном направлении, вниз и направо на один квадратик. При испускании а-частицы изотоп переходит вниз и налево на два квадратика, приблизительно вдоль линии наибольшей устойчивости. Такой тип распада характерен для атомов, находящихся за пределами области устойчивости на рис. 23-4.
На рис. 23-4 указано лишь существование устойчивых (нерадиоактивных) изотопов, но не их степень ядерной устойчивости и не их относительную распространенность. Ядра обладают особой устойчивостью, если они имеют Z или п (число нейтронов), равное 2, 8, 20, 28, 50, 82 или 126. Приведенные значения называются магическими числами. Хотя они дают определенную информацию об оболочечной структуре ядра, пока что не существует теории, позволяющей объяснить эти данные. Напрашивается их сопоставление с набором магических чисел 2, 10, 18, 36, 54 и 86, которые принимают порядковые номера особо устойчивых в химическом отношении элементов - благородных газов. Магические числа устойчивости ядер могут, очевидно, получить объяснение на основе представлений об оболочечной структуре ядра, причем ядерные квантовые оболочки, по-видимому, должны существовать независимо для протонов и нейтронов. Магическое число протонов либо нейтронов придает ядру устойчивость; атомы типа а?8РЬ с магическими числами одновременно протонов и нейтронов обла-
14-796
100 г
Самопроизвольное деление
90 -
Линия р=п
Испускание а-частиц
80 ~
70 -
60
Е
50
ч
40
30
20
10
О О
Захват электрона или испускание позитрона (ft*) (р-л)
tn? л
Испускание электрона, или ft'распад (п-^р)
с. устойчивый изотоп одноэлектронный распад:
ft-распад: \
ft'-распад: \
захват электронам
испускание альфа-частицы:^
распад с испусканием алыра-частицы и одноэлектронный распад ) самопроизвольное деление
10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160
Число нейтронов
Ядерпая химия
419
Таблица 23-2
Распространенность устойчивых ядер с четными и нечетными числами протонов и нейтронов
Количество изотопов
с четным чис- с нечетным числом нейтронов лом нейтронов
С четным числом протонов
С нечетным числом протонов
166 53
57 8
дают особой устойчивостью. Кроме того, судя по квадрупольным моментам подобных ядер, они являются почти сферическими. Предложенные до сих пор оболочечные теории строения ядра позволили сделать ряд важных предсказаний, однако в настоящее время теория атомного ядра, по-види-мому, находится на таком же этапе, на каком были Бор и Зоммерфельд при объяснении электронного строения атомов. Возможно, кто-либо из ученых следующего поколения создаст нечто эквивалентное уравнению Шрёдингера и волновой механике для ядер.
Естественные ряды радиоактивности
Распад тяжелых, неустойчивых элементов, расположенных в верхнем правом углу области устойчивости, которая показана на рис. 23-4, дает начало образованию одного из четырех рядов радиоактивности. Два из них, начинающиеся изотопами и ^5U и заканчивающиеся устойчивыми изотопами свинца, продемонстрированы на рис. 23-5. Этот рисунок представляет собой увеличенный фрагмент рис. 23-4 и нагляднее показывает
Рис. 23-4. Области существования устойчивых изотопов (цветные точки) и радиоактивных изотопов (черные точки) в зависимости от имеющегося у них числа протонов, р или Z, и числа нейтронов, и. По обе стороны от линии устойчивости изотопов расположены области радиоактивных изотопов. Радиоизотопы, лежащие на графике выше полосы устойчивости, распадаются с образованием устойчивых изотопов в результате электронного захвата (К-захвата) или испускания позитрона (р + ). Радиоизотопы, лежа
14'
щие ниже полосы устойчивости, распадаются в результате испускания электрона (р"). Область устойчивости оканчивается изотопом 2взВ1, но за этой точкой еще встречаются естественные изотопы с довольно большими периодами полураспада. Например, 2 “Th имеет период полураспада 13,9 млрд, лет, а период полураспада 4,51 млрд. лет. Из книги: Dickerson R. Е., Geis 1., Chemistry, Matter and the Universe, Benjamin, Menlo Park, Calif., 1976.
94 Pu
100 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 Число нейтронов
Рис. 23-5. Ряды радиоактивного распада урана-235 и урана-238 с последовательным испусканием а- и |3-ча-стиц и превращением в устойчивый изотоп свинца. Торий-232 и плутоний-241 имеют подобные многостадийные схемы распада. Из книги: Dickerson R.E., Geis I., Chemistry, Matter and the Universe, Benjamin, Menlo Park, Calif., 1976.
Яоепи;’9 химия
421
изменения, происходящие при испускании а-частиц, Р“-частиц или (3+ -частиц и электронном захвате. Третий подобный ряд начинается изотопом 9o2Th и оканчивается, после 10 стадий, изотопом g°8Pb. Четвертый ряд образуют превращения от искусственного изотопа ,41Ри до g^’Bi.
В 1919 г. Резерфорд впервые осуществил превращение одного элемента в другой бомбардировкой тяжелыми частицами. Он использовал а-ча-стицы для превращения азота в кислород:
,4N + 4Не - i?O + }Н
Резерфорд доказал протекание этой реакции, регистрируя испускаемые при этом протоны. В данной реакции ot-частицы сливаются с ядрами азота с образованием неустойчивого и возбужденного промежуточного продукта, g8F, который затем распадается на кислород и протон. В ядерных реакциях, подобных осуществленной Резерфордом, трудно заставить заряженную частицу подойти к ядру на достаточно близкое расстояние, чтобы произошла реакция. Одна из главных целей, преследовавшихся при создании ускорителей элементарных частиц, таких, как линейный ускоритель и циклотрон, заключалась в получении пучков положительно заряженных ядер, обладающих достаточной энергией, чтобы заставить их реагировать с ядрами мишени.
Нейтронные пучки не должны обладать такой высокой энергией, так как нейтроны не испытывают электростатического отталкивания от ядер мишени. Например, нейтронные пучки из атомных реакторов используются для получения трития, JH, применяемого в медицине или в химических исследованиях методом меченых атомов; получение трития происходит в реакциях
^°В + -► ’Н + 24Не
®Li + дИ -> ,Н + 4Не
Радиоактивный кобальт-60, который используют в терапии рака, получают из устойчивого изотопа кобальта бомбардировкой нейтронами:
’’Со + Jn -> 27С0
Искусственные элементы
Одним из наиболее интересных применений мощных ускорителей элементарных частиц явилось получение новых трансурановых элементов. Элементы с порядковыми номерами от 93 до 105 были получены в результате бомбардировки тяжелыми частицами в следующих реакциях:
g|8U + jH -> ,|8Np + 2qH (нептуний) “8U + 4Не - “9Pu + 3jn (плутоний)
I мва 23
422
239Pn 94 ru 4- *He - 3t°Am + 1P + 2jn (америций)
“9Pu + jHe ^2Cm + o« (кюрий)
*ГСт + jHe - 975Bk 4- ip + 2 bn (берклий)
238tt 92 u 4- 12c ircf + 4 0« (калифорний)
238tt 92 u + - 997ES + 5 bn (эйнштейний)
238tj 92 u + ‘«O - icoFm + 5 on (фермий)
253p + *He 4- 0» (менделевий)
^6Cm 4- g3C - »‘No 4- 5b> 1 (нобелий)
+ i°B - 257Lr + 103Ъ1 5 bn (лоуренсий)
249/^r 98 '-I 249zv 98 '-I 4-+ blc -75N - faixx + ?a?xx + 4 4 o« I bn j (названия еще не приняты)
Рис. 23-6. Относительная устойчивость изотопов в зависимости от числа протонов, р, и числа нейтронов, и. Оси в горизонтальной плоскости совпадают с изображенными на рис. 23-4. Вдоль вертикальной оси отложена относительная устойчивость ядер; устойчивые ядра возвышаются над «уровнем моря», образуя длинный полуостров. Ядра, содержащие магическое число протонов или нейтронов (28, 50, 82, 126), менее подвержены распаду,
чем соседние с ними ядра. Они соответствуют горной гряде на дне океана. Дважды магическое ядро s“8Pb изображено в виде горы, а предполагаемая область устойчивости вблизи и^ХХ изображена в виде холма над «уровнем моря». Из статьи: Seaborg Сг. Т, Bloom J. L., "The Synthetic Elements. IV”, Scientific American, April 1969; см. также: Thompson S. G., Tsang C.F., “Superheavy Elements”, Science, 178, 1047 (1972).
Ядерна.ч химия
423
Многие из названий искусственных элементов связаны с лабораторией излучения имени Лоуренса в Калифорнийском университете (Беркли, США).
Что же последует за синтезом трансурановых элементов? Появятся ли новые радиоактивные и очень краткоживущие частицы, подобные элементам с порядковыми номерами от 97 до 105? В настоящее время существует мнение, что есть возможность достичь новой области устойчивости, которая может включать даже нерадиоактивные элементы. Расчеты, основанные на существующих моделях оболочечного строения ядра, заставляют предположить, что элемент i?“XX со 114 протонами и 184 нейтронами (оба эти числа являются магическими в оболочечной теории ядра) должен представлять собой островок устойчивости среди области неустойчивости. На рис. 23-6 дано трехмерное изображение графика, представленного на рис. 23-4; вдоль вертикальной оси отсчитывается мера устойчивости ядер. Если удастся найти средства получения элементов в окрестности ??2хх, это должно привести к целому набору сравнительно долгоживущих ядер. Поиски в указанном направлении предпринимались в Беркли; в числе возможных реакций рассматривались такие:
968Cm + t°Ar - 114ХХ + 4jn + «Са - J««XX + 4>
Попытка первой реакции оказалась неудачной, возможно, потому, что она приводит к образованию нейтронодефицитных и, следовательно, неустойчивых ядер; они располагаются слева от островка устойчивости на рис. 23-6. Вторая реакция представляется более перспективной, но не может быть испытана в настоящее время из-за отсутствия необходимых ускорителей тяжелых частиц.
В связи с возможностью достижения новой области устойчивости представляет интерес дальнейшее расширение таблицы периодической системы элементов. На рис. 23-7 показан расширенный вариант периодической таблицы, включающий весь частично заполненный в настоящее время седьмой период и новый восьмой период. В последнем впервые встречаются д-орбитали, 5д. Последовательность заполнения орбиталей 5д, 6f и 7d точно предсказать заранее невозможно. Однако проведенные в исследовательском центре Лос-Аламоса расчеты указывают, что после первых одного-двух новых электронов следующие электроны должны последовательно заполнять 5д-орбитали. Соответствующие элементы могут быть названы «сверхпереходными» металлами.
Ядерное деление
Одна из самых знаменитых (или, наоборот, бесславных) ядерных реакций
“5U + in Ц9Ва + зеКг + 3*,п
осуществляется в атомной бомбе на уране-235. Эта реакция впервые была проведена в лабораторных условиях Энрико Ферми и его коллегами в кон-
Типические (непереходные)
Рис. 23-7. Сверхдлинная форма периодической таблицы, включающая восьмой период и область заполнения 5g-орбиталей, которая соответствует гипотетическому ряду сверхпереходных металлов. Искусственные элементы указаны цветными символами. (Франций и астат встречаются в природе
в виде промежуточных продуктов ядерного распада с небольшими периодами полураспада, однако количество каждого из этих элементов во всей земной коре никогда не превышает 30 г.) Элементы с указанными цветными цифрами порядковыми номерами еще не получены. Новые ис-
це 30-х годов нашего столетия в Риме, а также Отто Ганом, Лизой Мейтнер и Фрицем Штрассманом в Институте кайзера Вильгельма в Берлине. Обе исследовательские группы пытались получить новые трансурановые элементы теми же методами, которые впоследствии использовали ученые в Беркли и другие группы. Никто не ожидал возможности деления (или расщепления) ядер на две приблизительно одинаковые части. В 1938 г. Ган установил, что одним из продуктов распада является барий; это указывало на происходящее в реакции расщепление, или деление, тяжелых ядер. Ган сообщил эту новость в частном письме к Лизе Мейтнер, которая была вынуждена оставить нацистскую Германию и работала в Скандинавии. Отто Фриш, ее двоюродный брат, обнаружил, что реакция сопровождается выделением огромного количества энергии, и понял, что ядерное деление может быть использовано в военных целях. В то время (начало 1939 г.) Фриш работал в лаборатории Нильса Бора в Копенгагене. Во время поездки
425
Типические (непереходныеJ элементы
кусственные трансурановые элементы с порядковыми номерами от 95 до 105 завершают второй ряд внутренних переходных металлов и начинают новый, четвертый, ряд переходных металлов. Остров устойчивости, который надеются обнаружить Сиборг и его сотрудники из Беркли, расположен
под свинцом среди непереходных элементов седьмого периода. д-Орбитали, которые будут заполняться у первых сверхпереходных металлов, окажутся настолько глубоко погруженными в электронное облако, что соответствующие элементы будет чрезвычайно трудно охарактеризовать и выделить.
в Соединенные Штаты в январе 1939 г. Бор передал эти сведения о ядер-ном делении американским физикам. Ферми удалось бежать из фашистской Италии и он перебрался в Колумбийский университет в США. Подобно другим ученым из Беркли, он занялся проверкой сообщений Бора.
Венгерский физик Лео Сцилард, один из многих европейских ученых, нашедших политическое убежище в Англии и США в конце 30-х годов, предвидел важную роль ядерного деления. Он уговорил в августе 1939 г. Альберта Эйнштейна обратиться с письмом к президенту США Рузвельту. В этом знаменитом письме Эйнштейн предупреждал о колоссальной разрушительной способности процесса ядерного деления и указывал на опасную возможность того, что нацисты разработают на этой основе оружие и применят его в войне, которая назревала в Европе. Рузвельт принял решение о создании известного Манхэттенского проекта и поддержал огромные усилия исследователей, в результате которых была создана
25
426
атомная бомба, впервые испытанная в 1945 г. в Тринити Флэте (штат Нью-Мексико). Несколько позже две атомные бомбы были сброшены на Хиросиму и Нагасаки. Создание атомной бомбы, больше чем какое-нибудь другое открытие, заставило исследователей осознать, что им следует отдавать себе отчет в возможных политических и социальных последствиях научных открытий, а также повысило роль ученых в общественной жизни, что стало характерным для послевоенной эпохи.
Деление урана потенциально представляет собой цепную реакцию, потому что оно сопровождается высвобождением трех нейтронов в расчете на каждый нейтрон, используемый для инициирования деления ядра. В природном уране содержится лишь небольшое количество 235U, который распределен в более распространенном изотопе 238U. Однако если выделить чистый 235U и собрать достаточно большую массу его, при каждом делении ядра будут высвобождаться нейтроны, вызывающие дальнейшее деление нескольких ядер. Это приведет к разветвленной цепной реакции деления взрывного характера. Если масса образца 235U слишком мала, высвобождение нейтронов в окружающую среду предотвращает развитие цепной реакции. Масса, при которой скорость высвобождения нейтронов в окружающую среду становится меньше скорости образования новых нейтронов, называется критической массой урана.
В ядерном реакторе реакция проводится достаточно быстро, чтобы образовывалось много полезного тепла, но не настолько быстро, чтобы она перешла в разветвленный цепной процесс взрыва. Контроль за работой такого реактора осуществляется при помощи кадмиевых стержней, погружаемых в ядерный реактор для поглощения нейтронов. При достаточно большом погружении кадмиевых стержней в реактор они поглощают столько нейтронов, что деление осуществляется на очень низком уровне. При уменьшении глубины погружения стержней они поглощают меньше нейтронов и деление происходит с большей скоростью.
Ядерный синтез
Одна из реакций, благодаря которой на Солнце происходит выделение энергии, представляет собой синтез гелия при слиянии ядер двух изотопов водорода:
2Н + 3Н -> *Не + 10п + 17,6 МэВ
Чтобы преодолеть электростатическое отталкивание между ядрами водорода, энергия сталкивающихся ядер должна иметь величину порядка 0,02 МэВ. Такую энергию можно получить в лабораторных условиях при помощи ускорителей, но выделяемая энергия оказывается много меньше необходимой для приведения в действие ускорителя. Если удастся найти способ осуществления указанной реакции в промышленных масштабах контролируемым образом, это откроет путь к получению огромной энергии. К сожалению, возможное военное применение этой реакции снова намного опережает ее мирное использование. Для инициирования процесса
Ядериая химия
427
ядерного синтеза требуются температуры, превышающие 200 млн. градусов; в водородной бомбе такая температура достигается при помощи атомной бомбы, играющей в данном случае роль спички. Гораздо труднее осуществить этот синтез контролируемым образом, и до сих пор еще не удалось создать реактора для проведения контролируемой термоядерной реакции. Для термоядерного синтеза необходимы такие температуры, при которых не существует ни одно твердое вещество, и поэтому обычные требования к созданию реакторов здесь неприменимы. Наиболее перспективный подход заключается в использовании магнитных полей для удержания раскаленных ионизованных атомов в ограниченном объеме и вдали от стенок реактора. Однако до настоящего времени такой подход не реализован.
23-5. ПРИМЕНЕНИЯ ЯДЕРНОЙ ХИМИИ И ИЗОТОПНЫХ МЕТОДОВ
Радиоактивные и мало распространенные нерадиоактивные изотопы очень удобны для изучения обычных химических реакций, поскольку они позволяют создать метки, при помощи которых в продуктах можно распознавать частицы какого-либо реагента. Наиболее употребительными нерадиоактивными изотопами, которые используются в качестве химических меток, являются 2Н, 15N и 18О. Дополнительное удобство радиоактивных изотопов заключается в возможности измерения их концентрации по интенсивности радиоактивного излучения, что гораздо удобнее химического анализа. Среди радиоактивных меток укажем такие ядра, как 3Н, 14С, 32Р, 35S.
Радиоактивные метки
В качестве примера, иллюстрирующего удобство использования химических меток для установления механизма реакции, рассмотрим расщепление молекулы аденозинтрифосфата с образованием аденозиндифосфата и ортофосфорной кислоты:
Аденозин— О — Р — О — Р — О — Р — ОН + Н —О —Н
I I I он он он аденозинтрифосфат (АТФ)
о о
II II
Аденозин —О — Р — О — Р — ОН + Н,РО
II
ОН он
аденозиндифосфат (АДФ)
Как выяснить, какая из связей, а или Ь, разрывается при гидролизе АТФ? Без изотопов этого сделать невозможно. Но если реакция проводится в во
де, обогащенной изотопом 18О, ответ на интересующий нас вопрос удается получить, выяснив, в каких продуктах реакции содержатся ядра 18О. Если в реакции осуществляется разрыв связи а, гидроксидная группа воды связывается с радикалом АДФ и образующийся АДФ содержит 18О. Если же в реакции происходит разрыв связи Ь, изотоп 18О появляется в орто-фосфорной кислоте. Проведение описанного эксперимента позволило установить, что разрыв связи происходит в положении Ь.
Мелвин Кальвин с сотрудниками из Калифорнийского университета в Беркли установили молекулярный механизм фотосинтеза при помощи изотопных меток, используя в качестве исходного вещества 14СО2.
Радиометрический анализ
Радиометрический анализ обычно требует меньше времени и намного точнее, чем обычный химический анализ. При анализе на небольшие количества Zn(II) последний осаждают из раствора избыточным количеством (NH4)2HPO4, в котором фосфор представляет собой радиоактивный изотоп, 32Р. Нерастворимый осадок Zn(NH4)PO4 промывают и затем измеряют его радиоактивность. Зная радиоактивность чистого 32Р, можно вычислить концентрацию фосфатного осадка и, следовательно, цинка. Этот метод быстрее обычного гравиметрического анализа. Он не требует взвешивания, и продукт не обязательно должен быть чистым, необходимо только, чтобы был удален весь радиоактивный (NH4)2HPO4.
Методы изотопного разбавления
Изотопное разбавление применяют в тех случаях, когда трудно выделить все анализируемое вещество из сложной смеси. В этом методе небольшое количество компонента, на который проводится анализ, добавляют к анализируемой смеси. Причем добавляемое соединение содержит 100% (или по крайней мере известный процент) радиоактивного изотопа какого-либо элемента. Чтобы охарактеризовать радиоактивность образца, используется понятие удельной активности, которая измеряется числом радиоактивных распадов в единицу времени на грамм вещества. Добавляемое вещество тщательно перемешивают с анализируемой смесью. Затем из нее изолируют компонент, на который производится анализ, для чего используют какой-нибудь метод, дающий не количественное разделение, а хотя бы небольшое количество чрезвычайно чистого соединения. Уменьшение удельной активности добавленного соединения в результате разбавления нерадиоактивным исходным образцом того же соединения в смеси указывает на содержание последнего в исходной смеси. Например, если удельная активность выделенного образца совпадает с удельной активностью добавляемого соединения, то это означает, что данное соединение отсутствует в исходной смеси и регистрируется лишь то, что было введено в смесь. Если удельная активность выделенного образца равна половине удельной активности добавленного соединения, такое соединение присутст
429
вовало в смеси в количестве, равном количеству добавленного вещества. Если удельная активность уменьшилась до одной десятой своего первоначального значения, в исходной смеси было в девять раз больше того соединения, радиоактивный образец которого добавлен в нее. В общем случае, если масса некоторого соединения в смеси, Wa- масса радиоактивного образца этого соединения, добавленная в смесь, Aj-удельная активность (число радиоактивных распадов в секунду на грамм) добавленного соединения, А{- удельная активность выделенного чистого образца, то масса данного соединения в смеси может быть вычислена при помощи соотношения
_А = А_
Wa А,
Пример 4
По окончании синтеза бензойной кислоты, С6Н5СООН, к продуктам реакции добавили 10,0 мг чистой бензойной кислоты с удельной активностью изотопа 14С 1600 мин-1мг-1 и смесь тщательно перемешали. Затем из смеси экстрагировали образец чистой бензойной кислоты массой 40 мг, который обнаружил удельную активность по распаду 14С, равную 190 мин ~ 1 • мг “ Сколько бензойной кислоты было получено в реакции?
Решение
Подставляя в приведенное выше соотношение значения Wa = 10,0 мг, А; = = 1600 мин ~ 1 • мг “ 1 и Af — 190 мин “ С мг “ ', находим
/ 1600 \
ИС = 10,0 мг------11 = 74,2 мг бензойной кислоты
” \ 190 )
Пример 5
1,0 мл водного раствора, содержащего тритий с удельной активностью 2,00-106 с *, введено в кровоток животного. По прошествии времени, необходимого для полного перемешивания крови в результате циркуляции, из организма животного извлечен образец крови объемом 1,0 мл, который обнаружил удельную активность 1,50• 104 с-1. Вычислите объем крови в организме животного.
Решение
Объем крови равен 133 мл. Этот способ точнее и безопаснее, чем старый метод обескровливания животного.
Датирование событий при помощи радиоактивного углерода
В верхних частях земной атмосферы под действием космических нейтронов протекает реакция
|4N + ‘и i4C + }Н
в результате которой непрерывно образуется радиоактивный изотоп 14С. Вследствие этого во всех живых организмах поддерживается постоянное
Г.шва 23
430
соотношение изотопа углерода-14 и устойчивого изотопа углерода-12. Живой организм непрерывно теряет углерод в виде СО2 и органических отходов, а новый углерод потребляется с пищей. Растения непосредственно получают углерод из атмосферы в результате фотосинтеза. Животные поедают растения или белки других животных, которые питаются растениями, и таким образом тоже постоянно получают углерод, участвующий в фотосинтезе. Поскольку оборот атомов углерода в процессе усвоения пищи происходит очень быстро по сравнению с периодом полураспада 14С, изотопный состав углерода в живом организме совпадает с изотопным составом окружающей атмосферы. Но как только организм умирает, в нем перестает поддерживаться равновесие изотопов углерода с существующими в атмосфере. Распад углерода-14
14С _ 14N + _0е
больше не компенсируется поступлением нового углерода из атмосферы. Поэтому доля углерода-14 в мертвом организме постепенно уменьшается. Соотношение изотопов 14С и 12С можно использовать для установления возраста углеродсодержащего вещества (точнее, для установления момента его смерти).
Живые организмы содержат смесь изотопов углерода-14 и углерода-12, характеризуемую удельной активностью по 14С 15,3 + 0,1 мин “ 1 -г “ 4 Число атомов 14С в образце пропорционально скорости распада: п ~ d. Пользуясь законом радиоактивного распада (23-2), имеем
, 1 П0 1 ^0
kt = In-- = In——
п d
где J-скорость распада в минутах на 1 г углерода. Поскольку константа скорости распада к связана с периодом полураспада г1;2 соотношением 4/2 = 0,693/к, можно записать
1 d0 _ t1/2 d0 2,303 lg(d0/d) к П d ~ 0,693 П d 1/2' 0,693
4/2'3,331g
d-o
~d~ (23-3)
Для 64С, имеющего период полураспада 5570 лет и начальную скорость распада 15,3 мин “ 2-г “1, можно переписать уравнение (23-3) в виде
, 15,3
t = 18 600 1g—лет d
(23-4)
На рис. 23-8 приведены результаты нескольких анализов, основанных на применении уравнения (23-4). Датирование событий при помощи углерода-14 сыграло важную роль в установлении согласованной хронологии доисторических культур Европы и Среднего Востока. Последний ледниковый период закончился приблизительно 10000 лет назад, и последовавшие климатические изменения на Среднем Востоке привели к развитию земледелия, одомашнению животных и началу оседлой жизни-короче, к неолитической революции. К счастью для археологов, такой распростра-
Рис. 23-8. График зависимости скорости распада углерода-14 (удельная активность углерода, извлеченного из образца) от возраста образца. График построен по уравнению t = = 18 600 lg (15,3/d) в полулогарифмических координатах (хотя вертикальная ось размечена в единицах d, на самом деле на ней отложены отрезки, пропорциональные 1g d). Такие исторически датированные события, как период правления династии Птолемеев и период правления Снеферу в Египте, позволяют проверить метод изотопного датирования событий по углероду. Полученные данные хорошо согласуются.
1) 946 + 180: древесный уголь из древнейшего полинезийского культурного слоя на Гавайских островах;
2) 1503 + 110: деревянный оконный переплет из Тика ля (Гватемала) с вырезанной на нем на языке майя датой, соответствующей 481 г. н.э.;
3) 1917 + 200: холщовый футляр Книги Исайи, рукописи Мертвого моря;
4) 2190 + 450: деревянный саркофаг периода Птолемеев (Египет, 2280 лет); 5) 3621 + 180: деревянная похоронная ладья, гпобнипа Сезостриса III (Египет, 3750 лет);
3798 + 275: древесный уголь из древнейшей культовой постройки Стонхендж I, поздний неолит;
7) 3945 + 106: потолочная балка из
строения в Ниппуре (Ирак) примерно за 250 лет до правления Хаммурари;
8) 4546 + 220: древесный уголь из древнейших поселений в Японии;
9) 4802 +210: кипарисовая балка, гробница Снеферу в Египте (4575 лет); 10) 5744 + 300: волосы человека из захоронения преддинастического периода в Египте;
11) 6453 + 250: дерево, обгоревшее во время вулканического извержения, которое привело к образованию озера Крейтер (шт. Орегон);
12) 6707 + 320: раковина улитки из раннего неолитического поселения в Джармо (Ирак);
13) 8639 + 450: обгоревшие кости лошади в пещере вблизи Магелланова пролива, древнейшие следы стоянки человека на южном побережье Южной Америки;
14) 9101 + 440: древнейший слой индейской цивилизации в Барбе Крик Рок Шелтер (шт. Иллинойс);
15) 9883 + 350: обгоревшие кости бизона, ассоциирующиеся с человеком фолсома - палеолитической культуры, найденные в Лаббоке (шт. Техас);
16) 10560 + 610: мезолитическо-неолитическая стоянка, пещера Бельт (Иран);
17) 15 516 ± 900: древесный уголь из пещеры Ласко (Франция), где обнаружены многочисленные наскальные рисунки.
ненный элемент, как углерод, имеет радиоактивный изотоп с удобным периодом полураспада, пригодный для датировки событий, которые произошли за последние 10000 лет*.
Возраст Земли и Луны
Ряды радиоактивности 238U, показанные на рис. 23-5, могут быть использованы для установления возраста горных пород путем измерения соотношения 238U и устойчивого конечного продукта распада, 20бРЬ (в предположении, что этот изотоп свинца целиком образуется в результате распада 238U). Поскольку период полураспада 238U, равный 4,5 млрд, лет, в 20 00 раз превышает самый большой период полураспада остальных изотопов в рядах радиоактивности, ведущих к свинцу, можно предположить, что время, необходимое для полного превращения урана в свинец, приближенно совпадает с временем распада 238U до 234Th и что остальная часть цепи осуществляется практически мгновенно. Это позволяет применить уравнение (23-3), полагая в нем t1/2 = 4,5 -109 лет.
Пример 6
Образец урановой руды содержит 0,277 г 206РЬ на каждые 1,667 г 238U. Каков возраст этой руды?
Решение
Если весь свинец является продуктом распада 238U, то для образования 0,277 г свинца должно было распасться следующее количество 238U:
эоо 0,277 г = 0,320 1 206
Следовательно, исходное количество урана составляло 0,320 г + 0,1667 г = 1,987 г. Применяя уравнение (23-3) и учитывая, что отношение числа распадов равно отношению соответствующих масс в граммах, находим
□ 1.987
t = 4,5 109-3,33 lg —- = 1,13-109 лет
6 1,667
Можно ввести поправку в наше упрощающее предположение об образовании всего количества 20бРЬ из 238U, учитывая отношение различных изотопов свинца в материалах, содержащих и не содержащих 238U. Старейшая из обнаруженных до сих пор горных пород, гранит с западного побережья Гренландии, имеет возраст, несколько превышающий 3,7 • 109 лет. Из датировки каменных метеоритов известно, что Земля образовалась в результате конденсации каменного вещества и пыли приблизительно 4,6 млрд, лет назад. (Эта величина проверена независимыми рубидий
* О результатах и трудностях применения метода датирования событий при помощи углерода-14 в археологии см.: Renfrew С., Scientific American, October 1971; Protsch R., Berger R., Science, 179, 235 (1973).
433
стронциевым и калий-аргоновым изотопными методами.) Первый миллиард лет истории нашей планеты канул в Лету из-за процессов выветривания, эрозии и преобразований, типичных для Земли.
История Луны представляется совсем иной. Изотопное определение возраста образцов горных пород и почвы, доставленных с Луны экспедициями «Аполлон-11»-«Аполлон-17», изменило наши представления о ее происхождении и истории. До осуществления программы полетов «Аполлон» у астрономов были две гипотезы: согласно одной из них, все лунные кратеры образовались от ударов метеорных тел, а согласно другой, образованию их поверхности способствовала вулканическая деятельность. Относительно происхождения Луны высказывались две противоположные теории: что она образовалась в результате аккреции (оседания) пыли и камней таким же образом и в то же время, как и Земля, и что она отделилась от Земли намного позже, возможно, оставив на ее поверхности углубление, которым является Тихоокеанская впадина.
Космические корабли «Аполлон-11» и «Аполлон-12» в 1969 г. совершили посадку в двух «морях» Луны, т. е. в плоских низменных областях ее поверхности, в Море Спокойствия и Океане Бурь. В обеих областях астронавты обнаружили грунт, образованный двумя видами материала: кристаллическими горными породами вулканического происхождения, напоминающими базальт, а также брекчией и конгломератом горных пород, образованными разрушением и преобразованием обломков пород и пыли в течение всего геологического времени. Вулканические базальтоподобные образцы после доставки на Землю были датированы тремя изотопными методами: калий-аргоновым, рубидий-стронциевым и уран-торий-свин-цовым. Всеми этими методами установлен один и тот же поразительно большой возраст: между 3,6 и 4,2 млрд. лет*. Это указывает, что лунные моря образовались при истечении лавы из недр Луны, которое происходило в первый миллиард лет лунной истории, насчитывающей всего 4,6 млрд. лет. Образование кратеров на поверхности морей объясняется ударами метеоритов после застывания лавы.
Метод изотопного датирования позволяет выяснить даже больше. Лава на поверхности Океана Бурь моложе на 300 млн. лет, чем на поверхности Моря Спокойствия. Этого и следовало ожидать, поскольку Океан Бурь меньше покрыт метеоритными кратерами и, следовательно, должен быть моложе. Но различие в возрасте оказывается не так велико, как можно предположить по степени покрытия кратерами. Чтобы согласовать степень покрытия кратерами и возраст, приходится предположить, что столкновения с метеоритами происходили чаще в первый миллиард лет существования Луны, а затем постепенно стали происходить реже. Это хорошо согласуется с гипотезой, по которой Луна образовалась одновременно с Землей и другими планетами в результате аккреции массы пыли и осколков, двигавшихся вокруг Солнца. Частота бомбардировки метеорными телами, очевидно, была очень большой в течение периода аккреции, а затем мед
Расхождения относятся к образцам камней, а не к методам датировки.
I .Шва 23
434
ленно снижалась по мере того, как большая часть твердого вещества вблизи Луны или Земли оседала.
В начале 1971 г. «Аполлон-14» совершил посадку на Луне в области кратера Фра Мауро, на поверхность вещества, выброшенного при ударе метеорным телом, в результате которого образовалось Море Дождей. Позже в том же году экспедиция «Аполлон-15» опустилась на поверхность Моря Дождей вблизи борозды Гадлея. Изотопное датирование образцов лунных пород из этих областей рубидий-стронциевым, калий-аргоновым и аргон-аргоновым (40Аг/39Аг) методами снова привело к удивительным результатам. В обеих областях были найдены базальтоподобные образцы, но поверхность Моря Дождей вблизи борозды Гадлея оказалась моложе осколков, выброшенных ударом метеорного тела: их возраст соответственно равен 3,3 и 3,8 млрд. лет. Это может означать лишь то, что излияние лавы произошло уже много времени спустя после образования Моря Дождей. Поверхность лавы была изрыта не только метеоритными кратерами; излияния лавы происходили и позже в основаниях больших кратеров. Оба процесса непрерывно сказывались на формировании поверхности Луны.
Истинно лунный камень, который поразил воображение астронавтов экспедиции «Аполлон-15» Скотта и Ирвина во время их лунной прогулки, оказался анартозитом-алюмосиликатной породой, которая аналогична очень древним земным горным породам; он кристаллизуется из расплавленной магмы. Астронавты знали, что именно такой тип горных пород может принадлежать первичной лунной коре и возраст найденного ими камня действительно оказался равным 4,2 млрд. лет. Экспедиции «Аполлон-16» и «Аполлон-17», посетившие лунные плоскогорья, обнаружили выходы главным образом того же древнего анортозита, не покрытые, подобно морям, последующими излияниями лавы. Эти породы слагали брекчии мощностью по крайней мере 200 м. Эти брекчии можно рассматривать как летопись процессов взрыхления, дробления, плавления и уплотнения поверхности Луны вследствие ударов метеорных тел за период 4,2 млрд. лет.
Возраст жизни на Земле
Геологические слои, в которых впервые в изобилии появляются ископаемые беспозвоночные, относят к кембрийскому периоду, который начался, по данным радиоизотопных определений, 600 млн. лет назад. Однако среди кембрийских ископаемых уже представлены почти все существующие в настоящее время типы беспозвоночных. Где же находятся ископаемые их предшественников, существовавших в период дифференциации типов?
Эти докембрийские ископаемые гораздо труднее найти, поскольку животные были мягкотелыми, а осадочные отложения, в которые они попадали, подвергались превращениям, приводившим к разрушению отпечатков ископаемых. В сланцевых отложениях северного Мичигана были обнаружены ископаемые остатки растений, датировка которых рубидийстронциевым методом показала, что эти отложения имеют возраст около
Ядерная химия
435
1,05 млрд. лет. Ископаемые растения, напоминающие сине-зеленые водоросли или не имеющие известных аналогов, были обнаружены в залежах железа из Ганфлинт (шт. Онтарио); их датировка калий-аргоновым методом показала, что они имеют возраст около 2 млрд. лет. Древнейшие ископаемые остатки того, что можно считать живыми организмами, представляют собой ископаемые бактерии в отложениях формации Фиг-Три в Трансваале (Южная Африка). Определение их возраста рубидий-стронциевым методом дало результат 3,1 млрд. лет. Когда поверхность больших лунных морей разрушалась метеорными телами и покрывалась излияниями лавы, в океанах нашей планеты стали появляться первые признаки жизни.
ЗАКЛЮЧЕНИЕ
Современное состояние науки о ядре и его структуре находится примерно в том же положении, в котором находилась теория строения атома в 1925 г. Имеется возможность проводить измерения свойств ядер, описывать и классифицировать их, но нет еще общей теории, позволяющей объяснить эти свойства. Ядра состоят из протонов и нейтронов, сосредоточенных в небольшом объеме и взаимодействующих сильнее всего лишь со своими непосредственными соседями по ядру. В некоторых отношениях (это касается энергии связи) они подобны спрессованным капелькам однородных частиц, но в других отношениях (предпочтительность четного числа нуклонов и существование магических чисел) они ведут себя так, будто образуют оболочечные структуры, подобные электронным оболочкам. Диаграммы энергетических уровней для ядер могут быть построены на основе спектров '/-излучения, сопровождающего ядерные превращения. Ядра, подобно электронам в атоме, тоже имеют основные и возбужденные состояния.
Ядра могут самопроизвольно распадаться в результате электронного захвата, испускания электрона или позитрона и испускания а-частицы. Ядерный распад представляет собой кинетический процесс первого порядка. Период полураспада, т.е. время, за которое количество радиоактивного вещества уменьшается наполовину, не зависит от исходного количества этого вещества.
Ядерные реакции происходят при бомбардировке ядер мишени другими ядрами, ускоренными до такой скорости, которая позволяет им преодолеть электростатическое отталкивание между положительно заряженными ядрами. Нейтроны взаимодействуют с бомбардируемыми ими ядрами легче, поскольку они не имеют электрического заряда. Одним из важных примеров использования ядерных реакций служит получение изотопов для химии, промышленности и медицины. Другим применением является синтез новых трансурановых элементов. Таким путем были получены искусственные элементы с порядковыми номерами до Z = 105, и есть основания предполагать, что элементы с порядковыми номерами около 114 окажутся более устойчивыми, чем полученные до сих пор.
Ядерное деление, впервые использованное в военных целях, в настоящее
Г : 436
время приспособлено для практического получения энергии в мирных целях. Ядерный синтез еще не удалось применить на практике как источник энергии, но на это имеются надежды.
Различные изотопы, в том числе радиоактивные, находят широкое применение в химии как средство получения меченых реагентов и последующего наблюдения за ними в процессе превращения в продукты реакции. Радиоактивные изотопы особенно удобны для химического анализа.
В 1650 г. церковники выполнили один из первых серьезных расчетов возраста Земли. На основе библейской генеалогии мифический «день творения» был отнесен к 4004 г. до н.э.; это означало, что возраст Земли в 1650 г. составлял 5654 года. Современные оценки, основанные на ядерной генеалогии, дают цифру, близкую к 4,5 млрд лет. Древнейшими живыми организмами, ископаемые остатки которых найдены до сих пор, были бактерии, существовавшие приблизительно 3,4 млрд, лет назад. К концу первого миллиарда лет истории нашей планеты химическая эволюция достигла стадии, на которой появились бактериоподобные организмы. Из этих организмов за последующие 3,4 млрд, лет развилось огромное многообразие живых организмов, существующих и в настоящее время.
1. Каким образом обозначаются изотопы химических элементов?
2. Как соотносится размер атомного ядра с размером атома?
3. Что представляет собой энергия связи ядра? Как ее вычисляют и о чем она свидетельствует? Откуда берется эта энергия?
4. В чем различие между [3 “ -испусканием и электронным захватом, если оба эти процесса приводят к уменьшению порядкового номера ядра на единицу ?
5. Какие сведения о ядре дает у-излучение, сопровождающее испускание а-частиц?
6. Что называется периодом полураспада радиоактивного элемента?
7. Почему для распада 10 г радиоактивного вещества до 5 г требуется такое же время, как и для распада 1 г этого же вещества до 0,5 г? Почему если 10 г радиоактивного вещества распадаются до 5 г за год, то 7 г этого вещества не распадаются до 2 г (с потерей тех же 5 г) за то же самое время?
8. Что вы знаете о магических числах в ядерной физике и к каким выводам относительно свойств ядер они приводят? Существуют ли аналогичные числа в науке о строении атома? Что они выражают?
9. Чем ядерное деление отличается от распада?
10. Что представляет собой ядерная цепная реакция?
11. В чем отличие ядерного деления от ядерного синтеза?
12. В чем заключается удобство использования радиоактивных или редких изотопов для изучения химических реакций? Какими преимуществами в этом отношении обладают изотопы 32Р и 35S по сравнению с 15N и 18О?
Я<)рpHci.i Химич 437
13. На чем основан радиометрический анализ?
14. Методы изотопного разбавления позволяют определить количество химического вещества, содержащееся в некотором образце, не проводя его количественного разделения и анализа. Как это делается?
15. Какие экспериментальные измерения выполняются при датировании событий при помощи радиоактивного углерода? Как их результаты позволяют установить возраст образца?
16. Ученый, интересующийся возрастом греческого храма, исследовал содержание изотопа 14С в дереве из потолочной балки и в СаСО3 из мраморных стен и получил совершенно разные результаты. Объясните причину этого. Какой результат правильнее использовать для установления возраста храма?
17. Какие выводы относительно истории Луны можно сделать на основании данных о том, что лунные породы содержат большее количество элементов с более высокими температурами плавления и кипения по сравнению с породами Земли?
ЗАДА 414
Массы изотопов, необходимые для решения многих из помещенных здесь задач, можно найти в справочниках по физике и химии.
Размер ядра
1. Определите радиус ядра как естественного изотопа ближе всего к утроенному значению радиуса ядра водорода. Радиус какого изотопа ближе всего к учетверенному значению радиуса ядра водорода?
Составление уравнений ядерных реакций
2. Завершите составление уравнений следующих ядерных реакций и проставьте необходимые символы X или значения х:
a) g8Ra - IX + 222Х
б) “С -> JN +
в) *Ne - 19F + +?е
г) ”As + _?с - ?2Х
д) 17«Lu -> JX +
е) 23=U + *и - xJh + 94Х + 139Х
ж) 59Со + 2Х 6°Со + JX
з) 19Х + 1Н - 3|Х + JX
и) i6X -с 3Х -»• 14Х + 4Х
. к) 26Mg + JX - 4Не + JX
Уравнения ядерных реакций
3. Составьте уравнения каждого из следующих ядерных процессов: а) испускание позитрона изотопом 1|°Sb; б) испускание электрона изотопом
Г 43S
isS; в) испускание а-частицы изотопом 2||Ra; г) электронный захват изотопом 4Ве.
4. Радиоактивный распад изотопа 234U в конечном счете приводит к 282₽Ь. Этот процесс состоит из нескольких последовательных а- и 0'-распадов: а, а, а, а, а, р', а, р“, Р“, Р“, а. Приведите символическое обозначение каждого изотопа, образуемого в процессе распада.
Эквивалентность массы и энергии
5. а) Теплота сгорания СН4(г.) равна — 495,0 кДж моль " 1. Вычислите массу (в граммах), эквивалентную этой энергии, б) Когда 14С распадается с образованием 14N + -^е, уменьшение массы составляет 0,000168 а. е. м. Сколько молей СН4(г.) нужно сжечь, чтобы получилось такое же количество энергии, какое выделяется при распаде 1 моля 14С?
6. Когда два ядра }Н и два нейтрона соединяются с образованием 4Не, масса полученного ядра гелия не совпадает с суммой масс реагирующих частиц. Вычислите энергию (в джоулях на моль атомов гелия), эквивалентную изменению массы в процессе реакции. Если бы соответ-' ствующая образованию одного атома гелия энергия высвобождалась в виде одного фотона, какую длину волны он должен был бы иметь? Как эта длина волны соотносится с радиусом ядра гелия?
7. Вычислите энергию связи в расчете на нуклон для следующих ядерных частиц: a) 4C(wi = 12,000 а.е.м.); б) %С1(т = 36,96590 а.е.м.); в) 2g8Pb (т — 207,9766 а.е.м.); г) %S (ж = 31,97207 а.е.м.); д) (т = = 15,99491 а.е.м.).
8. Массы атомов “Na и ioNe равны (соответственно 21,994435 и 21,991385 а.е.м.). Возможен ли, в энергетическом смысле, распад 22Na с образованием 22Ne в результате испускания позитрона?
Изменение массы и длина волны излучения
9. а-Частицы, испускаемые радием, имеют энергию 4,795 и 4,611 МэВ. Какова длина волны у-излучения, сопровождающего этот распад?
10. При столкновении электрона и позитрона происходит их аннигиляция с образованием массы фотонов равной энергии. Какова длина волны этих фотонов?
Радиоактивный распад
11. Единственным устойчивым изотопом фтора является 19F. Какой тип радиоактивности должны обнаруживать изотопы 17F, l8F и 21F?
12. Изотопы 235U и 238U имеют период полураспада 7,1 • 108 и 4,5-109 лет соответственно. В настоящее время уран содержит 99,28% 23aU и 0,72% 235U. Вычислите естественное содержание каждого изотопа урана в эпоху образования Земли 4,5 млрд, лет назад.
13. Организм человека содержит около 18 вес. % углерода. Из этого количества 1,56-10'10% приходится на долю 14С. Вычислите массу 14С, содержащегося в теле человека массой 60 кг. Вычислите число распадов в минуту в теле такой массы. (Период полураспада 14С равен 5570 лет.)
Ядерная химия
439
14. Радиоактивный Na с периодом полураспада 14,8 ч вводится в организм животного для проведения исследования методом меченых атомов. За сколько дней радиоактивность тела животного уменьшится до 0,10 исходной интенсивности?
Период полураспада
15. 1 г 99 Мо распадается в процессе P-излучения до */8 г за 200 ч. Чему равен период полураспада 99Мо?
16. 1 г радия за 1 с испускает 3,608-101 ° а-частиц. Определите константу скорости распада и период полураспада радия.
Применение изотопов в химическом анализе
17. 10 г белка подвергают перевариванию и получают гидролизат-смесь, к которой добавляют 100 мг чистого дейтерийзамещенного аланина, H2N—CH(CD3)—СООН. После тщательного перемешивания часть аланина выделяют из смеси и очищают кристаллизацией. Этот кристаллический аланин содержит 1,03 вес. % D. Сколько граммов аланина содержалось в исходном гидролизате белка?
18. Человеку весом 70,8 кг сделали инъекцию 5,09 мл воды, содержащей тритий (удельная активность 9 • 109 мин-1-г-1). Спустя 3 ч обогащенная тритием вода пришла в равновесие с водой в теле пациента. Образец воды из плазмы крови объемом 1 мл обнаружил удельную активность 1,8 • 105 мин ~ 1 • г ~ 1. Определите относительное содержание воды (в процентах) в теле человека.
Датирование событий при помощи радиоактивного углерода
19. Образец дерева из саркофага египетской мумии имеет удельную активность по 14С, равную 9,4 мин - 1г-1. Каков возраст этого саркофага?
20. У скелета рыбы, выловленной в Тихом океане в 1960 г., удельная активность по 14С равна 17,2 мин-1 -г-1. Как объяснить такую радиоактивность? К какому выводу относительно археологии Тихого океана можно прийти на основании этих данных?
Датирование событий изотопными методами
21. В образце уранинитовой руды из Блэк Хиллз (Южная Дакота) на долю свинца приходится 22,8% от имеющегося количества урана. Оцените минимальный возраст Земли по этим данным.
Энергия ядерного деления и химического горения
22. При делении одного атома 235U выделяется энергия около 200 МэВ. Сопоставьте эту теплоту деления (в расчете на один грамм) с теплотой сгорания 1 г углерода. Сколько тонн кокса (углерода) дадут такую же теплоту сгорания, какая выделяется при делении 1 фунта (454 г) 235U?
1. Choppin G., Nucley and Radioactivity, Elements of Nuclear Chemistry, W. A. Benjamin, Menlo Park, Calif., 1964. Более подробное введение в ядерную химию по сравнению с данной главой, однако на том же уровне сложности.
2. Юнг Р., Ярче тысячи солнц. Пер. с англ.-М., Госатомиздат, 1961. Чрезвычайно интересное повествование о зарождении ядерной эры, начиная с развития квантовой механики в 1920-х годах и включая создание атомной бомбы и возникновение холодной войны. В книге поднимаются этические проблемы, существенные и в наше время.
3. Kenyon D.H., Steinman G., Biochemical Predestination, McGraw-Hill, N. Y., 1969. Несмотря на неудачное название («Биохимическое предопределение судьбы»), книга представляет собой хорошее введение в химию эволюции жизни на Земле. Данной главе особенно соответствует гл. 2 этой книги, посвященная радиоизотопному методу датирования событий и периоду зарождения жизни на Земле.
4. Libby W.F., Radiocarbon Dating, 2nd ed., University of Chicago Press, Chicago, 1955. Интересная монография, содержащая обсуждение методов датирования событий при помощи 14С, а также обзор археологических находок в Западном полушарии и на Ближнем Востоке.
5. Protsch Р., Berger R., “Earliest Dates for Domestication of Animals”, Science, 179, 232 (1973).
6. Renfrew C., “Carbon-14 and the Prehistory of Europe”, Scientific American, October 1971.
7. Seaborg G. T, Man-Made Transuranium Elements, Prentice-Hall, Englewood Cliffs, N.Y., 1963.
8. Thompson S. C., Tsang C.F., “Superheavy Elements”, Science, 178, 1047 (1972).
Приложения
ПРИЛОЖЕНИЕ
Международная система единиц (СИ)
В 1960 г. XI Генеральная конференция Международного бюро мер и весов приняла единую Международную систему единиц, называемую просто «системой СИ», которая призвана упростить обмен информацией между учеными всего мира. Система СИ представляет собой усовершенствованный вариант метрической системы единиц, в котором некоторые традиционные единицы заменены более рациональными единицами в тех случаях, когда их легко определить через более простые основные величины. Таким образом были устранены многие остававшиеся даже в метрической системе произвольные единицы. Для тех, кто знаком с системой СИ, пользование ее единицами оказывается еще более простым делом, чем применение ее метрической предшественницы.
В системе СИ принято семь основных единиц:
Обозначение
Физическая величина
Единица
Длина метр м
Масса килограмм кг
Время секунда с
Сила электрического тока ампер А
Температура термодинамическая кельвин К
Количество вещества моль моль
Сила света кандела кд
Через эти единицы можно выразить все остальные единицы, хотя для некоторых из последних иногда удобно пользоваться специальными названиями. Например, объем может быть выражен в кубических метрах (м3). Но в лабораторных измерениях очень удобно пользоваться литром, который определяется как кубический дециметр, или одна тысячная часть кубического метра.
Так же удобно определить и специальные единицы силы и работы. Согласно первому закону Ньютона, для того чтобы тело массой т приобрело ускорение а, на него должна действовать сила F = та. Если тело массой т килограммов приобретает ускорение а метров в секунду за секунду, то для этого необходима сила F = та кг-м с-2. Таким образом, в системе СИ единицей силы является 1 килограмм-метр в секунду за секунду.
Международная enenie.ua едннн!/ (СИ)
443
Ввиду того что эта единица имеет громоздкую размерность, ей присвоено название ньютон по имени знаменитого английского ученого.
1 ньютон (Н) = 1 кг м • с “ 2 (поскольку F = та)
Подобно этому выражают и единицу работы. Если сила, равная F ньютонам, выполняет работу на пути в s метров, то эта работа равна w = Fs ньютон • метр. В данном случае (также по соображениям удобства) единица 1 ньютон метр определяется как джоуль (Дж) по имени английского термодинамика. Таким образом,
1 джоуль (Дж) = 1 ньютон • метр (Н м) = 1 кг • м2 • с ~ 2 (поскольку w = Fs)
Традиционной единицей измерения теплоты, работы и энергии является калория, которая вводится эмпирически как количество теплоты, необходимое для повышения температуры одного грамма воды на один градус Кельвина (в системе СИ просто на 1 кельвин). Хотя, согласно термодинамике, теплота, энергия и работа эквивалентные величины, единица их измерения-калория-не связана очевидным образом с массой и ускорением. Такой выбор единиц затрудняет понимание физической связи между ними. Джоуль как единица измерения теплоты гораздо удобнее в том отношении, что позволяет видеть связь между теплотой, работой и энергией уже по самому своему определению. Хотя большая часть термодинамической литературы основана на использовании калории, логическая простота определения джоуля должна в конце концов обеспечить его повсеместное использование, подобно тому как литр и метр вытеснили галлон и ярд в большинстве передовых стран мира.
Приведем здесь некоторые из наиболее употребительных производных единиц системы СИ:
Физическая величина Единица Обозначе- ние Определение через основные единицы
Объем литр л м3/1000
Сила ньютон Н м-кг-с-2
Энергия джоуль Дж м2 -кг-с-2 = = ньютон-метр
Мощность ватт Вт 5 — 3 м кг-с = джоуль в секунду
Давление паскаль Па м-1 кг-с-2 = = ньютон на квадратный метр
Электрический заряд Электрический потен- кулон Кл А • с = ампер-секунда
циал вольт В м2 -кг-с-3 - А"1 =
= ватт на ампер
Электрическое сопро-
тивление ом Ом м2 - кг - с " 3 • А " 2 =
= вольт на ампер
Частота герц Гц с 1
основных единиц в систе-
Для обозначения кратных и дольных величин ме СИ используются следующие приставки:
Множи- П риставка Обозначе- Множи- Приставка Обозначе-
тель ние тель ние
10"1 деци д 10 дека да
ю2 санти с 102 гекто г
10”3 милли м 103 кило к
10"6 микро мк 106 мега М
10’9 нано н 109 гига Г
ю-12 ПИКО п 1012 тера Т
ю15 фемто ф
10" 18 атто а
Таким образом, сантиметр (см) представляет собой одну сотую часть метра, а километр (км) равен 1000 метрам. В системе СИ можно пользоваться литром как производной единицей объема, потому что это удобная величина для лабораторных измерений, а вводить вместо него милли-кубический метр) или кубический дециметр слишком громоздко.
Встречаются другие случаи, когда приходится пользоваться специальными единицами, потому что полученные прямым путем единицы системы СИ оказываются слишком неподходящими по величине. Например, заряд электрона или иона, образованного в результате потери одного электрона, имеет величину 1,602189 10“ 19 Кл. Однако в химической литературе никогда не указывают, что, скажем, ион натрия имеет заряд такой величины либо даже 0,16022 аттокулона (аКл), хотя с точки зрения системы СИ это было бы совершенно правильно. Вместо этого определяют специальную единицу заряда, равную величине заряда электрона, и выражают заряды на ионах через эти электронные заряды. При этом часто даже не осознают, что электронный заряд представляет собой специальную единицу. Если строго придерживаться системы СИ (немногие ученые приняли бы это), следовало бы отказаться от электронного заряда и выразить заряд, например, на ионе алюминия как -I- 0,4807 аттокулона, вместо того чтобы записать его просто как 4- 3 (электронных заряда).
По той же причине паскаль, или ньютон на квадратный метр, является логически правильной единицей давления в системе СИ, но его величина неудобна для измерения газовых давлений, сопоставимых с атмосферным давлением на нашей планете. Стандартное атмосферное давление на уровне моря для нашей планеты равно 101 325 Па. Хотя расчеты, основанные
Мс.жоv!iароОнм система s’/Hii.th/ (СИ) 445
на применении газового закона, можно проводить в мегапаскалях (МПа), но, учитывая, что стандартное атмосферное давление равно 0,101325 МПа, соображения удобства и традиции требуют сохранения атмосферы (атм) как специальной единицы давления, подобно электронному заряду для измерения заряда ионов. В данной книге при измерениях свойств газов давление всюду выражено в атмосферах.
В этой книге сделана еще одна уступка соображениям удобства. В системе СИ приставки для выражения более мелких дробных долей основных единиц, чем 10 "2, используются лишь в тех случаях, когда показатель степени при 10 кратен трем, т.е. для 10“3, 10“ 6, 10 ч, 10“ 12. Однако типичные длины связей находятся в интервале 1-10“ 10-2• 10“ 10. Можно указывать, например, длину простой углерод-углеродной связи как 0,154 нанометра (нм), и именно так делается во многих учебниках. Однако представляется более удобным использовать с указанной целью единицу, более близкую к измеряемой величине, каковой является традиционная единица ангстрем (А), которая определяется как 10“1Ом. Таким образом, длину простой углерод-углеродной связи можно выразить как 1,54 -10 “ 10 м либо 0,154 нм, либо 1,54 А, и то обстоятельство, что показатель степени в данном случае не кратен трем, не кажется достаточной причиной, чтобы отказаться от привычной и удобной единицы. Однако в спектроскопии длины волн в ультрафиолетовой и видимой областях спектра в большинстве случаев приводятся в нанометрах, и поэтому следует научиться безошибочно переходить от ангстремов к нанометрам и наоборот (1 нм = 10 А), подобно тому как мы переходим от метров к сантиметрам.
Более подробные сведения о системе СИ приведены в следующей литературе*:
1. National Bureau of Standards Special Publication 330, “The International System of Units (SI), US Government Printing Office, Washington, D.C., 1972.
2. Paul M. A., International System of Units (SI), Chemistry, 45, 14 (1972).
‘ На русском языке по этому вопросу см.: Бурдун Г-Д. Справочник по Международной системе единиц.-М.: Издательство стандартов, 1972, а также Коровина А. В. Основные понятия химии в соответствии с Международной системой единиц (СИ). Известия высших учебных заведений. Химия и химическая технология, 1968, 11, № 2, с. 245,- Прим. перев.
ПРИЛОЖЕНИЕ
2
Физические постоянные и переводные множители
Физические постоянные
Ускорение силы тяжести на уровне моря на экваторе
Атомная единица массы
Число Авогадро
Радиус Бора (боровский радиус)
Постоянная Больцмана
Заряд электрона
Постоянная Фарадея
Универсальная газовая
постоянная
Массы элементарных частиц:
электрон
протон
нейтрон
протон плюс электрон
Постоянная Планка
Постоянная Ридберга
Скорость света
д = 9,806 м • с 2
1 а.е.м. = 1,660566 -10“24 г =
= (6,022045-1023)-1 г N = 6,022045 1023 моль-1, или
г-(а.е. м.)-1 а0 = 0,529177 А = 5,29177 10"11 м к = 1,38066-10“23 Дж-К-1 - молекула-1 е= 1,602189-10-19 Кл S' = 96484,6 Кл-моль-1 R = 8,31441 Дж-К-1 - моль-1 R = 0,082057 л• атм К-1 моль-1
те = 9,109534-10-31 кг = 0,0005486 а. е. м. т„ = 1,672649-10- 27 кг = 1,007276 а.е.м. т„ = 1,674954 -10-27 кг = 1,008665 а.е.м. тр+е = 1,673560-10-27 кг = = 1,007825 а.е.м.
h = 6,626176-10"34 Дж-с
h/2n = n= 1,054589-10-34 Дж-с
Rx = 109737,32 см-1 с = 2,9979246 • 108 м-с-1
Приведенные здесь данные заимствованы из следующих источников: 1. Cohen Е. R., Taylor В. N„ J. Phys. Chem. Ref. Data, 2 (4), 741, (1973). 2. CODATA Task Group on Fundamental Constants Bulletin, 11, December, 1973.
Физические постоянные 447
Переводные множители
1 электронвольт (эВ) = 1,602189-10” 19 Дж
1 Дж = 4,184 кал
1 л-атм = 101,325 Дж
2,303 RT = 5,7061 кДж при 298 К
1 кДж-моль"1 = 83,593 см" 1 [из соотношения Е — hv = hcv, где v выражено в обратных сантиметрах (см “1)]
1 а.е.м. = 1,49244 -10" 10 Дж = 931,502-106 Эв = 931,502 МэВ (из" соотношения Е = те2)
ПРИЛОЖЕНИЕ
Приведенная здесь таблица содержит данные о стандартных энтальпиях (А/Г) и свободных энергиях (AG0) образования соединений из элементов в их стандартных состояниях, выраженные в килоджоулях на моль, а также термодинамические (вычисленные из третьего закона), или абсолютные, энтропии (S°) соединений в джоулях на кельвин на моль; все эти данные относятся к температуре 298 К. Фазовое состояние соединения указывается следующим образом: (г.)-газ, (ж.)-жидкость, (тв.)-твердое вещество, (вода.) - водный раствор; в некоторых случаях указывается также кристаллическая форма твердого вещества. Соединения расположены в таблице по номерам групп главного элемента, при установлении которого металлам отдается предпочтение перед неметаллами, а О и Н рассматриваются как наименее важные элементы.
Данная таблица представляет собой сокращенный вариант более полной таблицы данных (в калориях), приведенной в книге: Dickerson R.E., Molecular Thermodynamics, W. A. Benjamin, Menlo Park, California, 1969. Другие удобные таблицы содержатся в справочнике: Chemical Rubber Company Handbook Chemistry and Physics, а также Lange’s Handbook of Chemistry. При пользовании таблицами, в которых данные указаны в калориях, следует иметь в виду, что 1 кал = 4,184 Дж.
Вещество кДж моль 1 Д62дв, кДж • моль"1 -З98’ Дж К 1 • моль 1
Н(г.) 217,94 203,24 114,61
Н + (води.) 0,0 0,0 0,0
Н3О + (водн.) - 285,84 - 237,19 69,940
Н2(г.) 0,0 0,0 130,59
IA Li (г.) 155,1 122,1 138,67
Li (тв.) 0,0 0,0 28,0
Стандартные энтальпии и свободные энергии
449
4 Вещество ДН»в, кДж моль 1 AGJ98, кДж • моль “1 $298. Дж К 1 • МОЛЬ 1
Li+ (водн.) - 278,46 - 293,8 14
LiF (тв.) -612,1 - 584,1 35,9
LiCl (тв.) -408,8 - 383,6 55,2
LiBr (тв.) - 350,3 - 339,9 69,0
Lil (тв.) -271,1 -268 —
Na (г.) 108,7 71,11 153,62
Na (тв.) 0,0 0,0 51,0
Na + (водн.) - 239,66 - 261,87 60,2
Na2 (г.) 142,1 104,0 230,2
NaO2 (тв.) -259 - 195 —
Na2O (тв.) -416 -377 72,8
Na2O2 (тв.) -504,6 - 430,1 66,9
NaF (тв.) - 569,0 - 541,0 58,6
NaCl (тв.) -411,0 - 384,03 72,4
NaBr (тв.) - 359,95 - 347,7 —
Nal (тв.) - 288,0 -237 —
Na2CO3 (тв.) - 1131 -1048 136
К (г.) 90,00 61,17 160,23
К (тв.) 0,0 0,0 63,6
К.+ (водн.) - 251,2 - 282,2 103
КС1 (тв.) - 435,87 - 408,32 82,68
КС1 (г.) -219 -235 239,5
Rb(r.) 85,81 55,86 169,99
Rb (тв.) 0,0 0,0 69,5
Rb + (водн.) -246 -282,2 125
RbF (тв.) - 551,9 - 520,0 114
RbCl (тв.) - 430,58 -405 • —
RbBr (тв.) - 389,2 - 378,1 108,3
Rbl (тв.) -328 -326 118,0
Cs(r.) 78,78 51,21 175,49
Cs (тв.) 0,0 0,0 82,8
Cs ' (водн.) -248 - 282,0 133
CsF (тв.) - 530,9 - 500,0 —
CsC1(tb.) - 433,0 -404,1 —
CsBr (тв.) -394 -383 121
CsI (тв.) -337 -333 130
15-796
Вещество AHjge, кДж • моль "1 AG298, кДж-моль-1 ^298, Дж - К 1 • моль 1
ПА Be (г.) Be (тв.) Be2 + (водн.) 320,6 0,0 - 390 282,8 0,0 -356 136,17 9,54
Mg (г.) 150 115 148,55
Mg (тв.) 0,0 0,0 32,5
Mg2 + (водн.) -461,96 - 456,01 - 118
MgCl2 (тв.) -641,83 - 542,32 89,5
MgCl2 • 6Н2О (тв.) - 2499,6 -2115,6 366
Са (г.) 192,6 158,9 154,8
Са (тв.) 0,0 0,0 41,6
Са2+ (водн.) - 542,96 - 553,04 - 55,2
СаСО3 (тв.), кальцит - 1206,9 - 1128,8 92,9
СаСО3 (тв.), арагонит - 1207,0 - 1127,7 88,7
Sr (г.) 164 ПО 164,53
Sr (тв.) 0,0 0,0 54,4
Sr2 + (водн.) - 545,51 - 557,3 - 39
Ва (г.) 175,6 144,8 170,28
Ва (тв.) 0,0 0,0 67
Ва2 + (водн.) - 538,36 - 560,7 13
ВаС12 (тв.) - 860,06 - 810,9 126
ВаС12 НгО (тв.) - 1165 - 1059 167
ВаС12-2Н2О (тв.) - 1461,7 - 1296 203
IVE Ti(r.) 469 423 100,20
Ti (тв.) 0,0 0,0 30,3
TiO2 (тв.), рутил (III) -912,1 - 852,7 50,25
TiO2+ (водн.) — - 577 —
Ti2O3 (тв.) - 1536 - 1448 78,78
Ti3O5 (тв.) -2443 - 2300 129,4
VIE W(r.) 843,5 801,7 173,85
W (тв.) 0,0 0,0 33
451
Вещество ДН298’ кДж моль'1 кДж моль-1 Дж К -моль 1
VIII Fe(r.). 404,5 358,8 100,3
Fc(tb.) 0,0 0,0 27,2
Fe2+ (водн.) -87,9 - 84,93 - 113
Fe3+ (водн.) -47,7 - 10,6 -293
Fe,O3(TB.), гематит - 822,1 -741,0 90,0
Fc3O4(tb.), магнетит -1121 - 1014 146
1Б Си (г.) 341,0 301,4 166,28
Си (тв.) 0,0 0,0 33,3
Си + (водн.) 51,9 50,2 -26
Си2+ (водн.) 64,39 64,98 -98,7
CuSO4 (тв.) - 769,86 - 661,9 ИЗ
Ag (г.) 289,2 250,4 172,892
Ag(TB.) 0,0 0,0 42,702
AgCl (тв.) - 127,03 - 109,72 96,11
AgNO2 (тв.) - 44,371 19,85 128,1
AgNO3 (тв.) - 123,1 -37,2 140,9
ПБ Zn (тв.) 0,0 0,0 41,6
ZnO (тв.) - 348,0 - 318,2 43,9
Hg(r.) 60,84 31,8 174,9
Hg (ж.) 0,0 0,0 77,4
HgCl2 (тв.) -230 - 186 144
Hg2Cl2 (тв.) - 264,9 - 210,7 196
ША В (г.) 406 363 153,34
В (тв.) 0,0 0,0 6,53
В2О3 (тв.) - 1264 - 1184 54,02
В2Нб(г.) 31 82,8 232,9
В5Н9(г.) 62,8 166 275,6
BF3 (г.) - 1110 - 1093 254,0
BF4- (водн.) - 1527 - 1435 167
ВС13(г.) - 395 - 380 289,9
ВС13 (ж.) -418,4 - 379 209
ВВг3(г.) - 187 -213 324,2
15*
Приложение 3
452
Вещество кДж • моль "1 &Gjg81 кДж-моль-1 ^298» Дж К ‘-моль'1
ВВг3 (ж.) -221 -219 229
АЦг.) 314 273 164,44
А1 (тв.) 0,0 0,0 28,32
А13+ (водн.) - 524,7 - 481,2 -313
А12О3 (тв.) - 1669,8 - 1576,4 50,986
А1С13 (тв.) - 653,4 - 636,8 167
ТП(г.) 33 - 13 274
ТН(тв.) - 124 - 124 123
IVA С (г.) 718,384 672,975 157,99
С (тв.), алмаз 1,896 2,866 2,439
С (тв.), графит 0,0 0,0 5,694
СО (г.) - 110,523 - 137,268 197,91
СО2(г.) - 393,513 - 394,383 213,64
СО2 (водн.) -412,9 - 386,2 121
СН4(г.) - 74,848 - 50,794 186,2
С2Н2(г.) 226,75 209 200,82
С2Н4(т.) 52,283 68,124 219,5
С2Нй(г.) - 84,667 - 32,88 229,5
С3Н8(г.) - 103,8 -23,5 269,9
н-С4Н10 (г.) - 124,7 - 15,7 310,0
изо-С4Н10 (г.) - 131,6 - 18,0 294,6
С6Н6(г.) 82,927 129,65 269,2
С6Н6(ж.) 49,028 124,50 172,8
н-С8Н|8(ж.) - 250,0 6,48 360,8
НСООН (г.) - 362,6 - 335,7 251
НСООН (ж.) -409,2 -346,0 129,0
НСООН (водн.) -410,0 - 356,1 164
НСОО " (водн.) -410,0 - 334,7 91,6
Н2СО3 (водн.) - 698,7 - 623,4 191
НСО3" (водн.) - 691,1 - 587,1 95,0
СО32' (водн.) - 676,3 - 528,1 - 53.1
СН3СООН (ж.) - 487,0 -392 160
СН3СООН (водн.) - 488,453 - 399,6 —
СН3СОО _ (водн.) - 488,871 - 372,5 —
Стандартные энтальпии и свободные энергии
453
Вещество дн°19„ кДж • моль 1 кДж МОЛЬ-1 S198, Дж К 1 • моль 1
(СООН)2(тв.) - 826,8 - 697,9 120
(СООН)2 (водн.) -818,3 - 697,9 —
НС2О4“ (водн.) -818,8 - 698,7 154
С2О42' (водн.) - 824,2 - 674,9 51,0
НСНО (г.) - 116 -ПО 218,7
НСНО (водн.) — - 130 —
СН3ОН (г.) - 201,3 - 161,9 236
СН3ОН (ж.) - 238,64 - 166,3 127
СН3ОН (водн.) - 245,9 - 175,2 132,3
С2Н5ОН (г.) - 235,4 - 168,6 282
С2Н5ОН (ж.) - 277,63 -174,8 161
СН3ОСН3 (г.) - 184,05 - 112,92 267,1
СН3СНО(г.) - 166,4 - 133,7 266
СН3СНО (ж.) - 195 — —
СН3СНО (водн.) - 208,7 — —
CH3NH2 (г.) -28 28 241,5
CH3SH (г.) - 12,4 0,88 254,8
С6Н12О6 (тв.) -1260 - 919,2 288,9
Si (г.) 368,4 323,9 167,86
Si (тв.) 0,0 0,0 18,7
SiO (г.) -111,8 - 137,1 206,1
SiO2 (тв.), кварц - 859,4 - 805,0 41,84
Ge (г.) 328,2 290,8 167,8
Ge (тв.) 0,0 0,0 42,42
Sn (г.) 300 268 168,4
Sn (тв.), серое 2,5 4,6 44,8
Sn (тв.), белое 0,0 0,0 51,5
РЬ(г.) 193,9 161,0 175,27
РЬ(тв.) 0,0 0,0 64,89
РЬ2 + (водн.) 1,6 -24,3 21 ,
РЬО (тв.), красный -219,2 - 189,3 67,8
РЬО(тв.), желтый - 217,9 - 188,5 69,5
РЬО2 (тв.) - 276,6 - 219,0 76,6
ilpu.h) 'h t'!b
Вещество kJ ЛН298, 1ж • моль -1 AG298, кДж моль"1 ^298, Дж К 1 • моль"1
VA N (r.) 472,646 455,512 153,195
N, (r.) 0,0 0,0 191,49
Nj“ (водн.) 252 325 134
NO (г.) 90,374 86,688 210,62
NO2 (r.) 33,85 51,840 240,5
NO, (водн.) - 106 -34,5 125
NO3" (водн.) - 206,57 - 110,6 146
N2O (r.) 81,55 103,6 220,0
N3O22 (водн.) - 10,8 138 28
N2O4 (г.) 9,661 98,286 304,3
N2O5 (tb.) -41,8 134 113
NH3(r.) - 46,19 - 16,64 192,5
NH3 (водн.) - 80,83 -26,6 ПО
NH4 + (водн.) - 132,8 - 79,50 112,8
NH4C1 (tb.) - 315,4 - 203,9 94,6
n2h4(«.) 50,42 — —
NH, CO -NH2 (tb.) - 333,2 - 197,2 104,6
(NH4)2SO4 (tb.) - 1179,3 - 900,35 220,3
P(r.) 314,5 279,1 163,1
Р(тв.), белый 0,0 о,о 44,4
P (тв.), красный - 18 - 14 29
P4(r.) 54,89 24,4 279,9
PC13 (r.) - 306,4 - 286,3 311,7
PC15 (r.) - 398,9 - 324,6 353
As (r.) 253,7 212,3 174,1
As (тв.), серый металл 0,0 0,0 35
As4 (г.) 149 105 289
VIA О (г.) 247,52 230,09 160,95
О2(г.) 0,0 0,0 205,03
О3(г.) 142 163,4 238
ОН (г.) 42,09 37,4 183,63
ОН “ (водн.) - 229,94 - 157,30 - 10,5
Н2О(г.) - 241,83 - 228,59 188,72
Н2О(ж.) - 285,84 - 237,19 69,940
Стандартнее энтальпии и евтуадные энергии
455
Вещество ДН298, кДж- моль -1 AG298> кДж моль -1 ^298, Дж К ‘моль-1
Н2О2(ж.) - 187,6 - 113,97 92
Н2О2 (водн.) - 191,1 -131,67 —
S(r.) 222,8 182,3 167,72 _
S (тв.), орторомбическая 0,0 0,0 31,9
S (тв.), моноклинная 0,30 0,096 32,6
S2- (водн.) 41,8 83,7 —
SO (г.) 79,58 53,47 221,9
SO2(r.) - 296,9 -300,4 248,5
SO3(r.) - 395,2 -370,4 256,2
H2S(r.) - 20,15 -33,02 205,6
H2S (водн.) -39 -27,4 122
VIIB F(r.) 76,6 59,4 158,64
F “ (водн.) - 329,1 - 276,4 -9,6
F2(r.) 0,0 0,0 203
HF (г.) -269 -271 173,5
Cl(r.) 121,39 105,40 165,09
Cl" (водн.) - 167,46 - 131,17 55,2
Cl2(r.) 0,0 0,0 222,95
CIO _ (водн.) — -37 43,1
С1О2(г.) 103 123 249
C1O2- (водн.) -69,0 - 10,7 101
CIO,- (водн.) - 98,32 -2,6 163
C1O4- (водн.) - 131,4 -8 182
Cl2O(r.) 76,15 93,72 266,5
HC1 (r.) -92,312 - 95,265 186,68
НО (водн.) - 167,46 - 131,17 55,2
HC1O (водн.) - 116,4 - 79,956 130
ClF3(r.) - 155 - 114 278,7
Вг (г.) 111,8 82,38 174,913
Br - (водн.) - 120,9 - 102,82 80,71
Br2 (r.) 30,7 3,14 245,35
Br2 (ж.) 0,0 0,0 152,3
HBr (r.) - 36,2 - 53,22 198,48
I(r.) 106,61 70,149 180,68
IIрц.юженис J
456
Вещество Л^298, кДж МОЛЬ-1 кДж • моль"1 ^298, Дж К ^моль 1
I" (водн.) - 55,94 - 51,67 109,4
I2(r) 62,241 19,4 260,58
I2 (ТВ.) 0,0 0,0 117
I2 (водн.) 21 16,43 —
I3” (водн.) -51,9 -51,51 174
HI (Г.) 26 1,3 206,32
ICl(r.) 18 -5,52 247,4
IC13 (тв.) -88,3 -22,6 172
IBr(r.) 40,8 3,8 259
0 He(r.) 0,0 0,0 126,1
Ne (r.) 0,0 0,0 144,1
Ar (r.) 0,0 0,0 154,7
Kr(r.) 0,0 0,0 164,0
Xe(r.) 0,0 0,0 169,6
Rn(r.) 0,0 0,0 176,1
ПРИЛОЖЕНИЕ
Значащие цифры и степенное представление численных величин
ЗНАЧАЩИЕ ЦИФРЫ*
В химии, как и в других точных науках, постоянно приходится иметь дело с численными величинами, основанными на результатах экспериментальных измерений. Например, требуется вычислить объем образца газа, если известны его масса, давление и температура. Все эти данные измеряются экспериментально, и каждое измерение дает результат с некоторой ошибкой. Очевидно, эта ошибка войдет и в вычисленное значение объема газа. Существует соблазн получить как можно более точный результат и поэтому провести такое вычисление до большего числа десятичных знаков, чем это оправдано точностью экспериментальных измерений. Но тогда ответ не только не соответствует правильному объему, но требует затраты излишних усилий для получения избыточного числа десятичных знаков. Соблазн сохранить как можно больше знаков в численном результате усиливается при использовании карманного электронного калькулятора; логарифмической линейке присуще естественное ограничение ее собственной невысокой точностью. Принято указывать реальную точность численной величины, включая в нее только все достоверно известные цифры плюс еще одну недостоверную. Все достоверные цифры численной величины плюс еще одна недостоверная образуют значащие цифры этой величины. Например, если записано, что объем газа равен 48,12 мл, то эта величина содержит четыре значащие цифры, из которых четверка, восьмерка и единица известны достоверно, а двойка-недостоверно.
Рассмотрим причины, влияющие на ошибку измерения на примере с объемом газа, который упоминался выше. Ошибка измеряемого объема слагается из систематической ошибки и случайной ошибки измерения. Систематическая ошибка характеризует методическую правильность измерения, тогда как случайная ошибка определяется конкретными условиями отдельного измерения. Допустим, например, что объем газа измерялся при помощи 50-миллиметровой газовой бюретки. Указанный выше объем 48,12 мл означает, что измерение может быть воспроизведено с помощью
* Авторы благодарны профессору Вильберту Хаттону за предоставление материала для приложения 4 из написанного им методического руководства к данному курсу: A Study Guide to Chemical Principles, Second Edition.
' 458
той же бюретки с точностью 0,01 мл (последняя цифра недостоверна)*. Результат, записанный как 48,12 мл, предполагает точность, которая выражается как (48,12 + 0,01) мл или (48,12 + 0,02%) мл, потому что
100% = 0,02%
Однако неточность может быть присуща самой бюретке; например, возможно, что маркировка ее шкалы содержит ошибку, флюктуации температуры в комнате изменяют объем бюретки по сравнению с тем, который она имела, когда на ней наносилась маркировка, либо измерительная жидкость в бюретке неполностью высушена при выполнении измерения. По любой из этих причин объем, даже измеренный с большой тщательностью, окажется не слишком правильным. Конечно, все химики надеются, что их приборы откалиброваны правильно и что качество измерения зависит только от тщательности, с которой выполняется измерение.
Хотя в некоторых случаях такие ожидания неоправданны, будем предполагать, что все приборы, используемые для получения измеряемых данных, имеют точность, сравнимую с точностью измерения экспериментатором. Поэтому в задачах, помещенных в данной книге, все численные величины содержат только значащие цифры. Ниже будет показано, что математические действия с такими численными величинами, выполняемые с соблюдением ряда простых правил, не искажают содержащуюся в них информацию при произвольном отбрасывании или сохранении значащих цифр.
Суммирование и вычитание
Необходимость введения правила, определяющего количество значащих цифр в результатах операций суммирования или вычитания, становится понятной из следующего примера. Допустим, что пустой стакан имеет массу 64 г и в него помещен образец NaCl массой 0,176 г; требуется узнать полную массу стакана с солью.
Не думая, мы просто сложим эти два числа, и скажем, что полная масса равна 64 + 0,176 = 64,176 г. Но поступать так неправильно. Численные величины следует записывать только значащими цифрами. Утверждение, что полная масса стакана с солью равна 64,176 г, подразумевает, что цифры 6, 4, 1 и 7 достоверны и недостоверна только последняя цифра 6. Другими словами, это означает, что полная масса известна с точностью до + 0,001 г, т. е. с точностью до плюс или минус одной части на 64,176, или приблизительно одной части на 64000, другими словами + 0,0015%. Конечно, это не соответствует действительности. Масса пустого стакана была
* Менее опытный химик, пользуясь такой бюреткой, будет определять объем с точностью до ±0,02 мл. В этом случае следует записать результат как (48,12 + + 0,02) мл, иначе можно предположить, что недостоверная значащая цифра имеет точность +1.
Значащие цифры
459
указана как 64 г, а это означает, что она известна с точностью 64 + 1 г. Уже цифра 4 недостоверна - на самом деле вместо нее, может быть, должна стоять цифра 3 или 5, тем более что нет совершенно никаких указаний на какие-либо цифры справа от 4. Следовательно, в данном случае любые цифры справа от десятичной запятой оказались бы совершенно недостоверными и их не следует сообщать. Указывая их, мы даем информацию, которой вовсе не располагаем.
Правильный ответ нетрудно получить, если указывать недостоверные цифры знаками вопроса:
64,???
+
0,176
64,???
Очевидно, хотя нам известны цифры 1, 7 и 6 во втором слагаемом, когда они суммируются с соответствующими недостоверными цифрами в первом слагаемом, результирующие цифры справа от десятичного знака оказываются также недостоверными. Таким образом, правильный результат суммирования массы стакана и соли должен быть записан как 64 г.
Выводы, к которым приводит рассмотренный выше пример, можно сформулировать в виде следующего правила: Округлите все числа, над которыми предстоит проделать операцию суммирования или вычитания, так, чтобы каждое из них справа от десятичной запятой имело одинаковое количество знаков-такое же, как у числа с минимальным количеством знаков после десятичной запятой. Затем произведите операцию суммирования или вычитания над полученными округленными числами.
Например, рассмотрим суммирование чисел
119,2
204,12
1,75
260,3734
Число 119,2 имеет минимальное количество знаков справа от десятичной запятой: всего один знак. Поэтому в приведенной выше группе чисел надо округлить каждое число, оставив лишь один знак справа от запятой, после чего округленные числа можно суммировать:
119,2
204,1
1,8
260,4
585,5
Прежде чем перейти к дальнейшему обсуждению, необходимо выяснить два вопроса.
1. Условие округления числа зависит от значения цифры, стоящей справа от округляемой. Если стоящая справа цифра больше 5, округляемая ци
При.ь.’жение 4
460
фра увеличивается на единицу; например, 260,3734 округляется до 260,4. Если стоящая справа от округляемой цифра меньше 5, округляемая цифра не изменяется; так, 204,12 округляется до 204,1. Если цифра, стоящая справа от округляемой, равна 5, нечетную округляемую цифру повышают на единицу, а четную округляемую цифру оставляют без изменения; например, 1,75 округляют до 1,8, а 1,85 округляют тоже до 1,8. Хотя последнее условие представляется произвольным, его можно понять, если учесть, что вероятности округления нечетных и четных чисел одинаковы. Поэтому применение указанного правила округления в среднем должно повышать столько же чисел, сколько оставляет неизменными. Ошибки, вносимые завышением одних чисел, должны практически полностью компенсироваться ошибками, вносимыми занижением других чисел.
2. Сформулированное ранее правило сохранения значащих цифр при операциях суммирования и вычитания можно изменить, выполняя сначала соответствующую операцию над числами в их исходной форме. Затем следует округлить результат так, чтобы он содержал такое же количество знаков справа от десятичной запятой, какое содержит число с минимальным количеством знаков после запятой среди всех чисел, над которыми выполняется операция. В некоторых случаях такая процедура приводит к несколько иному результату в последней значащей цифре по сравнению с описанной выше. Не следует придавать этому большого значения, так как последняя значащая цифра все равно недостоверна. Рекомендуется выполнить помещенные ниже упражнения и выразить ответ правильным количеством значащих цифр.
Упражнения
1) 4,72 + 203,6 + 121,780 + 55
2) 3,1416 + 2,73 + 5,921 + 3,83
3) 297,64 - 31,279
4) 32,7945 + 121,5 - 326,73
5) 49378,2 + 25,98 - 33 Ответы
1) 385; 2) 15,62; 3) 266,36; 4) - 172,4; 5) 49371.
Вопрос о значащих цифрах дополнительно усложняется двойственной ролью нулей. Нуль может играть роль значащей цифры, но, кроме того, может использоваться для указания места десятичной запятой и в этом случае не является значащей цифрой. Рассмотрим в качестве примера следующие числа: а) 0,0123; б) 2027,3; в) 0,1072; г) 0,200. Первое из них имеет три значащие цифры: 1, 2 и 3. Нуль между десятичной запятой и 1 просто указывает место запятой; другими словами, он указывает только, что данное число равно 123 десятитысячным, а не просто 123 или 123 тысячным и т.п. Поэтому этот нуль не считается значащей цифрой. Второе число имеет пять значащих цифр. Здесь нуль не определяет положение десятичной запятой; он является необходимой значащей цифрой указанного числа. То же самое относится к нулю между 1 и 7 в третьем числе, которое со
Значащие цифры
461
держит четыре значащие цифры. С интересным случаем мы сталкиваемся на примере четвертого числа. Поскольку две десятые можно записать как 0,2 либо 0,200, последний вариант указывает, что два нуля справа от 2 должны быть значащими цифрами, иначе их нет смысла записывать. Следовательно, последнее число имеет три значащие цифры и можно предположить, что измерение выполнено при помощи прибора, имеющего точность ±0,001.
Чтобы избежать путаницы с нулями, можно записывать числа в виде некоторой степени 10. Представление чисел в такой форме позволяет точно определить положение десятичной запятой и включать в записываемое число только значащие цифры. (Об использовании степенного представления численных величин см. следующий раздел.) Приведенные в предыдущем примере числа можно записать в степенном представлении следующим образом:
а) 0,0123 = 1,23 10“2
б) 2027,3 = 2,0273 • 103
в) 0,1072 = 1,072-10“1
г) 0,200 = 2,00-10“1
Для проверки усвоения этого метода укажите количество значащих цифр в следующих численных величинах и выразите эти величины в степенной форме.
Упражнения
1) 2305,0
2) 0,00007062
3) 21,070
4) 0,02003
5) 900,0
6) 1000 яблок (если вы уверены в точном числе яблок)
7) 0,7020 + 0,001
Ответы
1) Пять значащих цифр, 2,3050-103; 2) четыре значащие цифры, 7,062-10 ~5; 3) пять значащих цифр, 2,1070-10; 4) четыре значащие цифры, 2,003-10 “2; 5) четыре значащие цифры, 9,000-102; 6) четыре значащие цифры, 1,000 10э; 7) три значащие цифры, 7,02-10'1 ( + 0,001 указывает недостоверность третьего десятичного знака, т.е. цифры 2).
Умножение и деление
Установить ошибку результатов, полученных операциями умножения и деления, намного сложнее, чем при суммировании и вычитании. Строго говоря, для этого следовало бы определить ошибку каждого из участвующих в операции чисел, а затем просуммировать эти ошибки, чтобы найти ошибку результата. В этом случае ответ может быть записан значащими цифрами, из которых недостоверной является только последняя. Такой способ, однако, очень трудоемок для практического использования и по
этому часто заменяется более быстрой, хотя и менее точной процедурой. Эта процедура требует выполнения следующего правила: Результат умножения или деления должен иметь такое количество значащих цифр, которое содержится в числе с минимальным количеством значащих цифр (среди чисел, над которыми проводилась операция).
Таким образом, внимание сосредоточивается на количестве значащих цифр у численных величин, участвующих в операции умножения или деления, а не на количестве десятичных знаков, как в операциях суммирования и вычитания. Сформулированное здесь правило основано на принципе, согласно которому надежность результата, полученного комбинацией ряда численных величин, не может быть выше, чем у наименее надежной численной величины в данном ряду. Поскольку последняя цифра численной величины, состоящей из значащих цифр, недостоверна, о неточности численной величины можно приближенно судить по количеству ее значащих цифр; другими словами, чем больше значащих цифр у численной величины, тем выше ее точность. Число из четырех значащих цифр известно по меньшей мере с точностью 1 :1000, число из трех значащих цифр-по меньшей мере с точностью 1:100 и т. д. Разумеется, предполагается, что погрешность недостоверной цифры равна плюс или минус единице. Это предположение считается справедливым для всех численных данных в помещенных здесь задачах.
Ниже приведены примеры операций умножения и деления.
Пример
Чему равен результат деления 2,760:5,46?
Решение
Если произвести операцию деления до четырех десятичных знаков, получится 0,5055. Чтобы определить, как следует округлить это число, примем во внимание, что делимое 2,760 содержит четыре значащие цифры (если бы нуль не был значащей цифрой, он не был бы записан), а делитель 5,46 содержит три значащие цифры. Следовательно, ответ должен быть округлен до трех значащих цифр и поэтому правильно записать его как 0,506.
Пример
Как правильно записать результат следующей операции:
2,56-1,9-3,725 _ 9 (6,02-1023) 0,007? ”
Решение
Число 2,56 содержит три значащие цифры, число 1,9-две, число 3,725 четыре, число 6,02-1023-три значащие цифры, а число 0,0071 -две. Наименьшее количество значащих цифр среди этих чисел-два, поэтому результат операции следует округлить до двух значащих цифр и представить его в виде 4,2-10 ” 21.
c7 4 tl Щ lft: цифры
463
В некоторых случаях использование правила значащих цифр при делении и умножении может приводить к осложнениям. Рассмотрим такой пример.
Пример
276-9,9
Чему равен результат операции = ?
Решение
Вычисление до четырех знаков после десятичной запятой дает 1,0941. Согласно указанному правилу, следует округлить это число до двух значащих цифр, т.е. представить его как 1,1, поскольку с наименьшей точностью известно число 9,9 (оно может быть записано как 9,9+ 0,1, т.е. с точностью до одной части к 99, или приблизительно 1%).
Приведенное решение является, однако, не вполне правильным. Ответ 1,1 указывает, что вычисление проведено с точностью до одной части на И, т.е. приблизительно 10%. Но такая точность ниже, чем у наименее точного среди чисел, над которыми проводилась операция. Таким образом, выразив ответ, как указано выше, мы поступили неправильно, потому что наименее точное число среди исходных известно с точностью, почти в 10 раз превышающей указанную в ответе. Поэтому в данном случае оправданно включение в результат еще одной значащей цифры и его запись как 1,09. Такая запись показывает, что результат известен с точностью 1,09 + + 0,01 (т.е. с точностью до одной части на 109, или приблизительно 1%, а это более верная оценка, чем при записи ответа как 1,1).
Рассмотрим теперь другую ситуацию. Вычислим объем шара по формуле V = Р3пг3. В этом случае измеряемой величиной является радиус шара г, и правильный ответ определяется количеством значащих цифр в значении г. Влияет ли на точность результата множитель 4/3л? Число пи имеет твердо установленное значение, которое может быть определено до любого количества значащих цифр (3,141592653589793...). В конкретном расчете следует использовать его значение, включающее не меньше значащих цифр, чем известно для г. Числа 4 и 3 в дроби 4/3 являются точными. Хотя их принято записывать без указания точности, на самом деле они известны до бесконечного числа значащих цифр (например, 4 можно записать как 4,0000000...). В вычислительных задачах часто встречаются точные числа, но их не следует учитывать при решении вопроса о количестве значащих цифр.
Пример
Вычислим объем шара с диаметром d = 4,00 см.
Решение
Поскольку d = 2г,
г
d
~2
4,00 см
= 2,00 см
2
Приложение 4
464
Так как 2 является точным числом, количество значащих цифр в значении радиуса определяется тремя значащими цифрами в значении диаметра. Следовательно, И= 4/3лг3 = 4/3л(2,00 см)3
Поскольку радиус определен тремя значащими цифрами, ответ также должен быть записан тремя значащими цифрами при условии, что мы воспользуемся значением числа пи, выраженным по крайней мере тремя значащими цифрами. Правильный ответ: 33,5 см3.
Для проверки усвоения этого материала рекомендуется выразить результаты указанных ниже вычислений правильным количеством значащих цифр.
Упражнения
2,75-0,01267
3,1416
= 0,0110906
2) (4,00-102)3 = 64000000
3)
105,2-3,21
-----------—г = 108,176
1,007-3,1 103
4)
55,2-0,90
—------— = 109,01
0,4557
5. Три образца руды взвешены на разных весах с указанными ниже погрешностя-
ми:
а) 376,6 ± 0,5 г; б) 273,17 ± 0,02 г; в) 0,1725 ± 0,0001 г.
Какова средняя погрешность измерений?
Ответы
1) 0,0111; 2) 6,40-107; 3) 1,1-102; 4) 109; 5) Относительные погрешности измерений равны 0,13, 0,007 и 0,058%, так что средняя относительная погрешность измерений составляет 0,06%.
СТЕПЕННОЕ ПРЕДСТАВЛЕНИЕ ЧИСЛЕННЫХ ВЕЛИЧИН
Представление численных величин в степенной форме позволяет избежать недоразумений при определении количества значащих цифр, а также избавляет от необходимости записывать большое количество нулей для очень малых или, наоборот, очень больших чисел. Многочисленные примеры помогают убедиться в удобстве такого способа записи чисел.
При степенном представлении численных величин удобно выражать их как различные степени числа 10. Число, выраженное в степенной форме, состоит из двух частей: коэффициента (значение которого выбирается в интервале от 1 до 10) и соответствующей степени 10. Например, число Авога-дро записывается как 6,02-1023; 6,02 здесь коэффициент, а 23-показатель степени 10.
Положительный показатель степени и указывает, что коэффициент следует умножить п раз на 10; другими словами, следует сдвинуть десятичную запятую в коэффициенте на п знаков вправо. Отрицательный показа-
Значащие цифры
465
тель степени,-»!, указывает, что коэффициент следует разделить т раз на 10, т.е. сместить десятичную запятую в нем на т знаков влево. Например, 0,0000000192 = 1,92 10" 8 1000 = 1 -103
96 500 = 9,65 • 104
При суммировании или вычитании чисел в степенной форме следует убедиться, что они имеют одинаковые показатели степени 10. Иначе в операции будет не больше смысла, чем при суммировании разнородных величин (2х + 2у = ? тогда как 2х + 2х = 4х). Иначе говоря, 2 сотни плюс 2 тысячи не'равно 4 сотням или 4 тысячам, но 2 сотни плюс 20 сотен (2 тысячи) дает 22 сотни. Итак, при суммировании или вычитании чисел единицы их измерения (в данном случае сравнительное положение десятичной запятой) должны быть одинаковыми. Это требование может заставить переписать число в степенной форме по-иному. Это нетрудно сделать, если вспомнить, что при увеличении на единицу положительного показателя степени 10 число умножается на 10, т.е. десятичная запятая в его коэффициенте смещается на один знак вправо. Аналогично, если показатель степени 10 уменьшается на единицу, это эквивалентно смещению десятичной запятой в коэффициенте на один знак влево. Например, требуется вычислить сумму
6,022-10“ + 7,65-1021
Перепишем оба слагаемых в такой форме, чтобы они имели одинаковые показатели степени 10, скажем 21. Чтобы записать 6,022-1023 как величину, кратную 1021 (показатель степени меньше исходного на две единицы), следует умножить коэффициент на десять в степени два. Следовательно, нужно сдвинуть в нем десятичную запятую на два знака вправо:
6,022-1023 = 602,2 Ю21
После этого можно провести суммирование двух чисел:
602,2-1021
7,65-1021
609,8 Ю21, или 6,098 Ю23
Рекомендуется для проверки усвоения этого материала выполнить следующие упражнения.
Упражнения
1) Прибавьте 2,46 10" 9 см к 2,46-10“ 8 см.
2) Вычтите 1,625-10 "3 см из 2,234-102 см.
3) Прибавьте 4,0075-103 мл к 6,23 Ю2 мл.
4) Вычтите 1,725-10" 1 г из 2,1623-101 г.
Ответы
П 2,71 -10" 8 см; 2) 2,232-102 см; 3) 4,630-103 мл; 4) 2,1450-10 г.
lit':- I.' 4 4(-4
При умножении чисел, представленных в степенной форме, следует перемножить их коэффициенты и отдельно перемножить степенные части (просуммировать показатели степеней). Вычислим, например, произведение:
(6,02-1023)-(1,76-10'2)
Произведение коэффициентов, выраженное правильным числом значащих цифр, равно 6,02-1,76 = 10,6. Произведение степенных частей перемножаемых чисел равно 1023-10- 2 = ю[23 + (-2)1 = Ю21. Результат умножения, таким образом, равен 10,6 -1021, или, если записать коэффициент как число в интервале между 1 и 10, 1,06-1022.
При делении чисел в степенной форме следует разделить их коэффициенты и отдельно разделить степенные части. Напомним, что при делении степенных частей показатель степени делителя (знаменателя) вычитается из показателя степени делимого (числителя). Вычислим, например, частное:
6,022-1023
5,976 -1027
Деление 6,022 на 5,976 дает при записи с правильным количеством значащих цифр результат 1,008. Деление степенных частей дает 1023/1027 = = 10(23-27) = 10-4. Следовательно, ответ должен быть таким: 1,008-10“4.
Аналогичным способом осуществляется возведение в степень чисел, представленных в степенной форме. Сначала возводится в соответствующую степень коэффициент, а затем степенная часть числа. Например, (6 • 103)3 = 216 • 109 = 2 1011 (если запись при помощи одной значащей цифры оправданна)
(5,1 Ю"2)2 = 26-10~4 = 2,6-10“3
Чтобы избежать появления нецелочисленных показателей при извлечении корней из чисел в степенной форме, следует заранее изменить степенную часть числа так, чтобы показатель степени делился нацело на 2, если из числа извлекается квадратный корень,-на 3, если извлекается кубический корень и т.д. Таким образом, чтобы извлечь кубический корень, скажем, из числа Авогадро, т.е. найти число (6,02-1023)1/3, следует сначала переписать его так, чтобы показатель степени 10 был целочисленным кратным трех. Поскольку 3 • 7 = 21, а 3 8 = 24, подходящим показателем степени может служить любое из чисел 21 или 24. Перепишем число Авогадро в виде коэффициента, умноженного на 1021, сдвинув десятичную запятую в исходном коэффициенте на два знака вправо и одновременно уменьшив показатель степени 10 на две единицы; тогда искомое число можно представить в виде (602-1021)1'3. Кубический корень из 602 равен 8,45; кубический корень из 1021 равен 107. Ответ следует записать как 8,45-Ю7.
Для проверки усвоения этого материала рекомендуется выполнить следующие упражнения.
nn-iite
467
Упражнения
5,23 IO27
1) —---------г-
9,76-IO3 4
3,42-10“ 29
2) —---------г-
6,704 • 10s
(2,46-IO3) (1,7-IO-5)
3,25-IO4
4) (5,2 -10 - 3)3
5) (7,5 IO-5)1'2
Ответы
1) 5,36-Ю23; 2) 5,10-10“ 35; 3) 1,3-lQ-6; 4) 1,4-10 “ 7; 5) 8,7-10“ 3.
ПРИЛОЖЕНИЕ
5
Кислотно-основные равновесия (более точное рассмотрение)
В гл. 5 мы познакомились с простейшими кислотно-основными равновесиями и выражениями для констант таких равновесий, достаточно несложными, чтобы по ним можно было проводить вычисления при помощи формул для решения квадратных уравнений или приближенных методов. Во многих случаях такие выражения справедливы только для разбавленных растворов либо в ситуациях, когда один из компонентов раствора присутствует в нем в небольших количествах. Указанные методы решения обычно довольно успешно применяются, за исключением редких обстоятельств. В данном приложении будут выведены точные выражения, которыми следует пользоваться во всех случаях, когда не выполняются приближения, введенные в гл. 5. Ниже будет показано, как решаются задачи на равновесие, когда нельзя пренебречь влиянием диссоциации воды на концентрацию протонов или гидроксидных ионов. Мы проведем строгий вывод выражений для констант равновесия с участием слабых кислот и их солей и убедимся, что рассмотренные в разд. 5-7 равновесия слабых кислот и в разд. 5-8 равновесия при гидролизе на самом деле являются лишь частными случаями одного и того же более общего процесса. Найденные строгие выражения позволят проводить вычисления, связанные с титрованием слабой кислоты сильным основанием, и сравнивать полученные результаты с результатами вычислений для титрования сильных кислот, проведенных в разд. 5-5.
'."ИЛЬНЫЕ И СЛАЬЫЕ. КИСЛОТЫ; ВЛИЯНИЕ ДИССОЦИАЦИИ ВОДЫ
В разд. 5-5 утверждалось, что добавление сильной кислоты к воде эквивалентно добавлению такого же количества водородных ионов, поскольку сильная кислота полностью диссоциирована. Но кислота является не единственным источником ионов водорода в растворе; вода самопроизвольно диссоциирует по уравнению
Н2О г» Н+ Е он-
с константой диссоциации (ионным произведением)
[Н + ][ОН-] = Кно = 10-14
Насколько важно учесть этот источник протонов?
Кис.ютно-основные равновесия
469
Для 0,01 М раствора азотной кислоты этот источник действительно можно не учитывать. Концентрация ионов водорода, обусловленная кислотой, равна 10“2 моль-л-1, а концентрация [Н + ] от диссоциации воды даже в чистой воде достигает всего 10“7 моль л-1, т.е. в 100 тысяч раз меньше, чем от кислоты. Поскольку добавление ионов Н+ от кислоты подавляет диссоциацию воды, реальный вклад диссоциации воды в полную концентрацию ионов Н+ должен быть еще меньше. Можно найти концентрацию гидроксидного иона, которая обусловлена только диссоциацией воды, из выражения для константы равновесия
Здесь [Н + ]полн-полная концентрация ионов водорода, обусловленная всеми источниками.
Протоны, имеющиеся в воде и вносимые кислотой, неразличимы. При образовании каждого гидроксидного иона в результате диссоциации воды образуется также один ион водорода. Следовательно, концентрация ионов водорода, обусловленная только диссоциацией воды, равна
[Н + ]н о = [ОН _ ] = 10“12 моль-л-1
и эта величина, конечно, пренебрежимо мала по сравнению с концентрацией 10“2 моль-л-1, обусловленной диссоциацией азотной кислоты.
Пример 1
Чему равен pH для 10-6 М раствора НС1?
Приближенное решение
[Н + ] = 10-6 моль-л-1 и pH = 6,0.
Для проверки вычислим вклад, обусловленный диссоциацией воды:
10“14
[Н + ]н2о = [°Н ] = —-_6 = 10 8 моль-л 1
Вклад воды в концентрацию ионов водорода и в этом случае составляет всего 1% от вклада кислоты. Пренебрежение величиной [Н + ]н о приводит лишь к 1%-ной ошибке в полной концентрации иона водорода.
Точное решение
Строгий подход требует одновременного рассмотрения двух уравнений, каждое из которых связывает полную концентрацию иона водорода [Н + ]полн с вкладом диссоциации воды [Н + ]Й2О. Одно из этих уравнений представляет собой уравнение материального баланса
[Н + ]полн — 10 6 + [Н + ]Н;О
а другое-выражение для константы диссоциации воды 10'14 [Н+ ]н о = [ОН ] = ,
1Н -1полн
Уравнение материального баланса просто констатирует, что полная концентрация протонов является суммой концентраций, обусловленных каждым из двух источников - кислотой и водой. Чтобы решить оба уравнения, положим, что у означает полную концентрацию иона водорода, обусловленную всеми источниками, т. е. [Н + ]полн, и исключим из уравнений [Н + ]н2о- Получим
откуда
Это дает
у = 10"6 +
10
у1 - 1(Г6у - 10 14 = 0
у = 1,01 • 10 6 моль - л
Таким образом, истинная концентрация иона водорода на 1% выше предсказываемой приближенным расчетом вследствие влияния диссоциации воды. Такая поправка незначительна для сильных кислот, но может стать важной, когда приходится иметь дело со слабыми кислотами.
Учет диссоциации воды в равновесиях с участием слабых кислот
В разд. 5-6 при вычислении концентрации иона водорода в 0,0010 М растворе уксусной кислоты использовалось простое выражение для константы диссоциации
у2
К. = 1,76 • 10“5 = ------------
° ’ 0,0010 - у
на основании которого было получено значение
[Н + ] = у = 1,24 • 10 4 моль л 1
При этом ничего не упоминалось о вкладе другого равновесия, существующего в растворе и описываемого константой
Хно = [Н+][ОН ]
Допустимо ли пренебрежение этим вкладом? Ответ дает быстрая проверка. Поскольку диссоциация каждой молекулы воды приводит к образованию 1 протона и 1 гидроксидного иона, можно найти концентрацию протонов, обусловленную диссоциацией воды, вычислив концентрацию ги-дроксидных ионов. Протоны, образуемые в результате диссоциации кислоты, подавляют диссоциацию воды, и поэтому концентрация гидрок-сидных ионов составляет всего
[он-] =
КГ14
1,24 КГ4
= 8,1 • 10 11
моль-л
Кис.кнпно’основные равновесия
471
Поскольку это значение совпадает с концентрацией ионов Н+, обусловленной диссоциацией воды, действительно, не было ошибкой пренебречь таким вкладом по сравнению с концентрацией ионов Н + от кислоты, равной 1,24 10"4 моль-л”1. Но для более слабой кислоты, например HCN, получается иная картина.
Пример 2
Вычислите pH и степень диссоциации HCN (в процентах) в ее растворах с концентрациями 10" 2, 10”3 и 10”7 М.
Приближенное решение
HCN-очень слабая кислота, имеющая константу диссоциации Ка = = 4,93 • 10"10. Пользуясь приближенным уравнением (5-34), найдем для указанных растворов:
Концентрация, моль • л 1 10"2 10"3 10"7
рн 5,65 6,15 8,17
Степень диссоциации, % 0,02 0,07 6,8
Приведенный пример приводит к неправдоподобному результату: последовательное разбавление раствора кислоты (до 10"7 М) делает его основным! Ясно, что такой вывод неверен. Дело в том, что концентрация иона водорода от кислоты понизилась до уровня, сопоставимого с концентрацией иона водорода, обусловленной диссоциацией воды. В этом случае неприменимо простое выражение для константы равновесия, которым мы пользовались до сих пор. При строгом рассмотрении диссоциации произвольной кислоты общего вида НА приходится иметь дело с четырьмя неизвестными концентрациями, [Н + ], [НА], [А-] и [ОН"], и четырьмя уравнениями, связывающими эти неизвестные:
Уравнение для константы диссоциации кислоты
Уравнение для константы диссоциации воды
Кно = [Н + ][ОН-] (2)
Уравнение материального баланса для аниона кислоты
с0 = [НА] + [А-] (3)
Уравнение баланса зарядов
[Н + ] = [А"] + [ОН"] (4)
Чтобы понять, как следует решать эту на первый взгляд трудную систему уравнений, следует разобраться в физическом смысле уравнения ба
П ри.ю.жение 5
472
ланса зарядов. Поскольку [ОН “ ] совпадает с концентрацией ионов водорода, обусловленной диссоциацией воды, уравнение баланса зарядов указывает, что концентрация аниона кислоты [А" ] меньше полной концентрации иона водорода [Н + ]поли на величину вклада ионов Н +, обусловленного диссоциацией воды; действительно, из уравнения баланса заряда имеем
[А’] = [Н + ]полн - [ОН’]
Обозначив, как и прежде, искомую концентрацию иона водорода через у и пользуясь уравнением (2) для константы диссоциации воды, чтобы исключить из рассмотрения концентрацию [ОН “ ], можно преобразовать уравнение баланса зарядов к виду
[А-] = У-^ (5)
Остальная часть вывода проводится, как прежде, причем концентрация не-диссоциированной кислоты полагается равной разности между исходной полной концентрацией кислоты с0 и концентрацией диссоциированной кислоты.
Уравнение материального баланса
Кно
[НА] = с0 - [А ] = с0 - у + (6)
Теперь можно заменить эти две концентрации, [НА] и [А “ ], в выражении для константы диссоциации кислоты:
к = У(У- Кн2о/У) (7)
со ~ У + Кн2о/У
Выведенное выражение для Ка выглядит намного сложнее, чем это есть на самом деле. Чтобы получить из него более простое уравнение (5-34), следует лишь вычеркнуть по члену в числителе и знаменателе, соответствующему вкладу диссоциации воды, КНгО/у- Однако решать уравнение (7) действительно сложно, потому что оно приводит к кубическому уравнению относительно у, и в связи с этим важно знать, в каких случаях нет необходимости пользоваться им. Проще всего получить его приближенное решение, воспользовавшись уравнением (5-34), а затем проверить, действительно ли Кн о/у значительно меньше у или что 1()-14/[Н + ] пренебрежимо мало по сравнению с [Н+ ]. Применительно к ситуациям, рассмотренным в примере 2, имеем:
Исходная концентрация HCN,
с0: < л — 2 1U « л — 3 1U 10 7
Приближенная [Н+]: концентрация 2,22 10“6 7,02 10“7 6,78 10"’
10“ 14/[Н + ]: 4,50-10“ 9 1,42-10“8 1,48 Ю’6
Кис.ютно-основныс равновесия
473
В последней строке указан вклад диссоциации воды в [Н + ]. Он в самом деле пренебрежимо мал для 10“1 М раствора HCN, ненамного меньше [Н + ] для 10"3 М раствора, но отнюдь не является пренебрежимым для 10"7 М раствора HCN. Вот почему приближенное решение оказалось качественно неправильным! Если для 10“7 М раствора HCN воспользоваться уравнением (7), то точный ответ оказывается таким:
[Н + ] = 1,0025 • 10"7 и pH = 6,999
или pH = 7 в соответствии с точностью самой константы диссоциации кислоты Ка. Цианистоводородная кислота-настолько слабая и диссоциирована в столь незначительной степени, что ее собственный вклад в концентрацию ионов водорода при концентрации кислоты 10“7 моль л"1 оказывается пренебрежимо малым по сравнению с вкладом от диссоциации молекул воды!
Пользоваться полным уравнением (7) приходится очень редко. Обычно решают задачи при помощи приближенного уравнения (5-34), а затем лишь проверяют, как это было показано выше, не требуется ли полное решение.
СТРОГОЕ РАССМОТРЕНИЕ РАВНОВЕСИЙ В РАСТВОРАХ СЛАБЫХ КИСЛОТ И ИХ СОЛЕЙ
В разд. 5-6 мы вычисляли pH раствора слабой кислоты, а в разд. 5-8-pH раствора соли такой кислоты и сильного основания. Эти расчеты и рассмотрение буферов, упоминавшихся в разд. 5-7, представляют собой различные предельные случаи общей задачи определения pH раствора, содержащего са моль-л"1 слабой кислоты и cs моль-л"1 ее соли с сильным основанием, причем са и cs могут изменяться от нуля до значительных концентраций. В задачах с растворами слабых кислот, разумеется cs = 0. При расчетах, связанных с константой гидролиза, наоборот, са = 0. В задачах с буферными растворами полагается, что са и с, имеют соизмеримую величину. Все эти частные случаи довольно просто поддаются математическому описанию, поскольку можно делать различные упрощающие предположения, пренебрегая малыми величинами, добавляемыми к большим членам уравнений или вычитаемыми из них. В областях, промежуточных между этими предельными случаями, математическое описание усложняется, хотя химическая суть явлений остается прежней. Целесообразно, однако, вывести общие уравнения, чтобы показать, как можно получить из них более простые и что все три частных случая равновесий — растворы слабых кислот, гидролиз и буферные растворы-различные аспекты одного и того же явления.
В качестве отправной точки вывода используется выражение для константы диссоциации слабой кислоты
[Н + ] [А"]
=----Гц .---- (диссоциация кислоты) (8)
а также выражение для константы диссоциации воды
^но = [Н + ][ОН-] (диссоциация воды) (9)
2
хотя диссоциацией воды иногда можно пренебречь. Соображения относительно материального баланса для аниона кислоты заключаются в том, что его полная концентрация в растворе в виде аниона или в составе не-диссоциированной кислоты должна быть равна сумме исходных концентраций слабой кислоты и ее соли:
са + cs = [НА] + [А ] (уравнение материального баланса (10)
для аниона)
Другое соображение о материальном балансе заключается в том, что полная концентрация положительного иона соли (скажем, иона натрия) должна быть равна исходной концентрации соли, поскольку этот ион не принимает участия в рассматриваемых реакциях:
cs = [Na+] (уравнение материального баланса для положи- (11)
тельного иона)
Наконец, следует принять еще во внимание уравнение баланса зарядов, поскольку раствор в целом должен быть электрически нейтральным:
[Н + ] + [Na + ] = [ОН “ ] -I- [А " ] (уравнение баланса зарядов)
(12)
Обозначим концентрацию иона водорода у, а концентрацию гидроксидного иона 2. Постараемся исключить [А ] и [НА] из выражения для константы диссоциации кислоты. Для этого перепишем уравнение баланса зарядов в виде
[А “ ] = [Na + ] + у - z = cs + у — z
Это позволяет преобразовать уравнение (10) к виду
[НА] = ca + cs-[A“]=ca + cs-y-l-z-cs = ca-y + z
Остается подставить найденные выражения для [А ] и НА в уравнение (8):
Посмотрим теперь, как это общее уравнение сводится к тем, которыми мы пользовались ранее. В кислом растворе концентрацией гидроксидного иона можно пренебречь, т.е. не учитывать величину z по сравнению с у. Тогда уравнение (13) выглядит так:
„ У (cs + У)
К а - -----------
- У
(14)
Кш .-.тнио-мновныс u ч 475
Эти уравнения мы уже использовали в задачах о растворах слабых кислот и их солей и о буферных растворах в разд. 5-7.
Если в растворе нет соли, то cs = 0 и общее уравнение (13) имеет вид у (у-z) у(у-кН1О/у)
1\.а — -------- =--------------- (1 □)
Са- у + Z са- у + КН1О/у
Но это совпадает с уравнением, выведенным в предыдущем разделе данного приложения, когда мы учли диссоциацию воды при рассмотрении диссоциации слабых кислот.
Если в растворе нет соли и он настолько кислотный, что можно пренебречь диссоциацией воды, тос5 = 0иг = 0и общее уравнение (13) сводится к следующему:
У1
Ка = ------- (16)
Са ~ У
Это первая и простейшая форма выражения для константы диссоциации слабой кислоты, которая использовалась нами в разд. 5-6.
Последним из рассматриваемых частных случаев является основный раствор, для которого г — [ОН-]-значительная величина, а у=[Н + ]-пренебрежимо малая по сравнению с ней величина; в этом случае уравнение (13) принимает вид выражения для константы гидролиза:
_ З'Ж - z) _ KH;O(cs-z) са + Z Z (са + z)
ИЛИ
cs - z
(Отметим, что величиной у можно пренебречь лишь в сумме или разности с большей величиной, но не тогда, когда она является отдельным множителем.) Если концентрация кислоты са равна нулю, последняя формула переходит в выражение для константы равновесия гидролиза, которым мы пользовались в разд. 5-8 (обозначение у применялось там для [ОН-]):
z2
=------- (18)
cs - z
Короче говоря, любое выражение для константы кислотно-основных равновесий, которое мы использовали в гл. 5, получается из общего уравнения (13). Вместо того чтобы пытаться каждый раз получить решение этого уравнения, целесообразнее понять физические особенности той или иной конкретной задачи, которые позволяют пренебречь одними величинами по сравнению с другими, и найти правильное упрощение математической формулы.
П ^южение
ТИТРОВАНИЕ СЛАБОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ
В разд. 5-5 мы строили график титрования сильной кислоты сильным основанием, но отказались от решения более трудной задачи о титровании слабых кислот, которая связана с рассмотрением равновесий. Выведенное выше общее уравнение (13) позволяет проводить расчеты титрований такого типа.
Допустим, что 50 мл 0,10 М раствора уксусной кислоты титруют 0,10 М раствором сильного основания, NaOH, и требуется вычислить зависимость pH смеси от объема добавляемого основания. Добавление гидроксида натрия приводит к превращению части уксусной кислоты в ацетат натрия в результате реакции нейтрализации
НАс + NaOH -> Н2О + NaAc или точнее
НАс + ОН’ Н2О + Ас“
Расчеты для различных количеств добавляемого NaOH показаны в табл. 1, а результаты графически представлены на рис. 1. Точка а графика получена при помощи простого выражения для константы диссоциации слабой кислоты, приведенного в разд. 5-6:
У2
Ка = ---- (5-34)
са~ У
Точки b-f получены из выражения для константы равновесия слабой кислоты и ее соли, приведенного в разд. 5-7:
Ка
y(cs + у) (С« - У)
(5-42)
Конечная точка титрования д, соответствующая равенству концентраций кислоты и основания, определяется выражением для константы гидролиза из разд. 5-8:
Все эти уравнения представляют собой упрощенные варианты выведенного выше полного уравнения (13) и соответствуют конкретным условиям. После достижения конечной точки титрования, когда происходит добавление новых порций основания в сущности уже к раствору ацетата натрия, кривая титрования мало отличается от аналогичной части кривой титрования сильной кислоты сильным основанием. Лишь в интервале между точками fug приходится иметь дело со сложным полным выражением (13).
Точка полунейтрализации соответствует наличию одинаковых концентраций уксусной кислоты и ацетата натрия (половина исходного количе-
Таблица 1
Титрование 50 мл 0,10 М раствора уксусной кислоты 0,10 М раствором гидроксида натрия
Точка на рис. 1 а b с d е f д
Объем v добавленного основания, мл 0 10 20 25 30 40 50
Полный объем V, мл 50 60 70 75 80 90 100
[НАс], моль-л-1 0,1000 0,0833 0,0714 0,0667 0,0625 0,0555 0,0500
[NaOH], моль л-1 0,0000 0,0167 0,0286 0,0333 0,0375 0,0444 0,0500
f н Ac— са, моль • л 0,1000 0,0667 0,0428 0,0333 0,0250 0,0111 0,0000
[NaAc]KOHe4 = cs, моль-л-1 0,0000 0,0167 0,0286 0,0333 0,0375 0,0444 0,0500
[Н+], моль-л-1 1,33-io-3 7,04-10"’ 2,64-10-’ 1,76-10“ ’ 1,17-10"’ 4,4-10“’ 1,89-10"’
рн 2,88 4,15 4,58 4,76 4,93 4,36 8,68
Обзем добавленного основания и, мл
Рис. 1. Кривая титрования типичной слабой кислоты сильным основанием на примере титрования уксусной кислоты гидроксидом натрия. График построен по данным табл. 1. Сравните этот график с приведенным на рис. 5-5. В данном случае pH повышается после добавления первых же порций основания, потому что даже после частичной нейтрализации ацетатный ион продолжает подавлять диссоциацию оставшейся уксусной кислоты. Нейтрализация некоторой части уксусной кислоты гидроксидом
натрия эквивалентна удалению этой части уксусной кислоты и ее замене ацетатом натрия, по этой причине данный рисунок напоминает рис. 5-8. На полностью диссоциирующую сильную кислоту HNO3 на рис. 5-5 нитратный анион не оказывает подобного подавляющего действия, поэтому кривая титрования сначала поднимается медленнее. На данном рисунке кривая после конечной точки титрования напоминает кривую титрования сильной кислоты.
ства уксусной кислоты нейтрализована гидроксидом натрия). Следовательно, pH в этой точке равен рКа уксусной кислоты. Конечная точка д титрования слабой кислоты достигается не в таком широком диапазоне изменения pH, как показано на рис. 5-5, и поэтому для подобного титрования важно подобрать индикатор, имеющий рКа вблизи 8 или 9. Например, для установления конечной точки титрования уксусной кислоты нельзя использовать метиловый оранжевый (см. рис. 5-7), однако фенолфталеин или тимоловый синий идеально подходят для этого.
ПРИЛОЖЕНИЕ
Глава 1
1. Натрий (Na), неодим (Nd), неон (Ne), нептуний (Np), никель (Ni), ниобий (Nb), нобелий (No).
2. Радий (Ra), радон (Rn), рений (Re), родий (Rh), ртуть (Hg, от латинского «гидраргирум»), рубидий (Rb), рутений (Ru).
3. 13 протонов и 27 — 13 = 14 нейтронов; 13 электронов. Ожидаемая атомная масса 27,223 а.е.м. Наблюдаемое значение атомной массы 26,982. При образовании ядра из нуклонов часть массы превращается в энергию.
4. Ниобий-93 должен иметь 41 протон, 52 нейтрона и 41 электрон.
Масса протонов; 41 -1,00728 а.е.м. = 41,29848 а.е.м.
Масса нейтронов; 52-1,00867 а.е.м. = 52,45084 а.е.м.
Масса электронов: 41-0,00055 а.е.м. = 0,02255 а.е.м.
Ожидаемая атомная масса 93,77187 а.е.м.
Наблюдаемая атомная масса равна 92,9064. Разница соответствует энергии связи ядра ниобий-93.
5. 7 электронов, 7 протонов, 7 нейтронов; ^N, ^N; не должно повлиять; изотоп кислорода '|О; число электронов должно увеличиться на единицу.
6. Порядковый номер серы равен 16, следовательно, атом серы содержит 16 протонов; он должен также содержать 16 электронов. Массовое число серы равно 32, следовательно, в ее атоме должно быть 32 — 16 = = 16 нейтронов. Атомный символ серы ,^S. Удаление из ее ядра одного нейтрона приводит к образованию изотопа серы-31; оно не влияет на число электронов. Удаление протона ведет к образованию фосфо-ра-31; чтобы атом после этого остался нейтральным, из него должен быть удален также один электрон.
/ псе изо гопы цинка содержат по 30 протонов (и столько же электронов); а) 34, 64Zn; б) 36, 66Zn; в) 37, 67Zn; г) 38, 68Zn; средняя атомная масса цинка 65,366 а. е. м.
8. Атомная масса стронция далека от целочисленного значения, поэтому он должен иметь больше одного изотопа. Средняя атомная масса
IIри.южение 6
480
стронция равна (0,0056-83,9134) 4- (0,0986-85,9094) + (0,0702-86,9089) 4-4- (0,8256-87,9056) = 87,6164.
9. 64,923 а.е. м.
10. Атом галлия имеет 31 протон. Его изотопы должны содержать соответственно 38 и 40 нейтронов. Обозначим через Q долю атомов с массовым числом 69. Тогда
«2-68,9257) 4- [(1 - 2)- 70,9249] = 69,72, откуда
Q = 0,6027
Следовательно, галлий содержит 60,27% атомов 69Ga и 39,73% атомов 71Ga.
11. 1г бора содержит больше атомов, чем 1 г алюминия: 5,57 • 1022 атомов бора по сравнению с 2,23-10* 2 2 атомов алюминия. В одном моле каждого вещества содержится одинаковое число атомов.
12. Один моль неона или натрия содержит по 6,022-1023 атомов.
И7 г Na
1 г Ne
22,990 г Na
20,179 г Ne
W = 1,1393 г Na
13. 2,44-1019 атомов.
14. Один моль атомов мышьяка имеет массу 74,922 г. Следовательно, 7,63-1О20 атомов мышьяка должны иметь массу
7,63-1О20
6,022-1023
•74,922 = 0,0949 г
15.
16.
331,6 а. е. м.; 1,54-1022 атомов.
25,00 г N2O4
92,01 г-моль'1
= 0,2717 моля N2O4
В этом количестве N2O4 должно содержаться 2 -0,2717- 6,022 -1023 = = 3,272-1023 атомов N. При разложении N2O4 выделится 0,2717 моля
17. 90,03 а.е.м.; 26,7 г углерода.
18. Молекулярная масса аланина = (3-12,011) 4- (7-1,008) 4- (2-15,999) 4-4- 14,007 = 89,094.
19. 88,8% Си; 888 г Си; 42,0 г С; 153,8 г или 3,49 моля СО2.
1000 г Си2О 4- 42,0 г С = 1042 г
888 г Си 4- 153,8 г СО2 = 1042 г
20. Fe2O3 = (2 -55,847) 4- (3 -15,999) = 159,691.
2 - 55,847
%Fe =-------------100 = 69,944
159,691
1000 кг Fe2O3
159,691 г-моль-1
----------------12,011 г-моль 1 С = 112,82 кг С
2 моля Fe2O3
Ответы на задачи
481
Масса полученного железа должна быть равна
0,69944 • 1000 кг = 699,44 кг Fe
В реакции должно выделиться количество диоксида углерода, равное
44,009 г-моль “ 1 СО, 112,82 кг С------------------;—- = 413,38 кг СО2
12,011 г моль “ 1 С
21. Li2S; Zn3(PO4)2; CaSO4; UO2C2O4; Zn3[Fe(CN)6]2; Fe2(SO4)3; CrF3.
22. ‘ '
23.
24.
a) Ca2+, PO4 , поэтому Ca3(PO4)2;
6) Hg2 + , C2H3O2, поэтому Hg(C2H3O2)2;
в) NH+, Fe(CH)*-, поэтому (NH4)4Fe(CN)6;
r) Mg2 + , NO2, поэтому Mg(NO2)2:
д) Sn2 + , Cl-, поэтому SnCl2;
e) K + , MnO4, поэтому KMnO4;
ж) Ba2 + , CO3-, поэтому BaCO3;
з) Ag+, AsO|-, поэтому Ag3AsO3.
0,0246 F или 2370 Кл.
Для восстановления железо(Ш) -> железо(П) требуется по электрону (е ~) на атом, поэтому всего потребуется 0,300 моля 0,300 F.
одному е~, или
25.
26.
27.
28.
29.
30.
0,300 F-96480 Кл-F-1 = 28 900 Кл
0,0871 моля А1.
0,197 г Ag
—-------------т- = 0,00183 моля атомов Ag. Поскольку на
107,9 г • моль - 1 6 3
атом Ag требуется один электрон, через электролизер прошло 0,00183 моля е~, т.е. 0,00183 -96480 = 177 Кл.
40,2 ч.
В электродной
Реакция
Реакция
каждый
реакции участвует вода.
на катоде: 2Н2О + 2е- -> Н2 + 2ОН-
на аноде: 20“ -> С12 + 2е~
1 моля Н2 (и 1 моля С12) потребуется 2 моля е~, или
Для получения
2F, т.е. 2-96480 = 192960 Кл. При токе силой 4,0 А на это потребует-192960 Кл
ся ----------г = 48 240 с = 13,4 ч.
4,0 Кл-с-1
1,92 г свинца.
Реакция на катоде: Zn2+ + 2е~ -> Zn
Реакция на аноде: 2С1- -» С12 + 2е'
24,5 г Zn
На катоде выделилось —------------— = 0,375 моля Zn, следователь-
65,37 г-моль 1
но, на аноде должно выделиться также 0,375 моля С12. Поскольку для восстановления каждого иона Zn2 + необходимо 2 электрона, электро-
16-796
При.южение 6
482
лиз потребует 2-0,375 = 0,750F, т.е. 0,750-96480 = 72 360 Кл. Это зай-72 360 Кл
мет время---------—г = 24120 с = 6,7 ч. На аноде должно высвобо-
3,0 Кл • с
диться 0,375 моля -70,91 г-моль”1 * * * 5 = 26,6 г С12.
31. 1,6• 10б кг-сут”1; приблизительно 2 плотины (точнее, 1,86).
Глава 2
1. 26,58% К; 35,35% Сг; 38.07% О; 294,29 г-моль”1.
2. Молекулярная масса C3H5O9N3 = (3 12,011) + (5 • 1,008) + (9 15,999) + + (3 14,007) = 227,085.
Элементный состав:
3-12,011 5-1,008
„„ ’ -100 = 15,87 вес.% С; —- 100 = 2,22 вес.% Н
227,085 227,085
9-15,999 3-14,007 _
------- 100 = 63,41 вес.% О; -—100 = 18,50 вес.% N 227,085-----------------------------227,085
3. Ca3SiO5.
4. Исходя из 100 г соединения, вычислим число молей каждого содержащегося в нем элемента:
22,8 г Na
22,990 г моль ” 1
21,5 г В
= 0,992 моля Na; --------------------= 1,989 моля В
10,81 г моль
55,7 г О -------------— = 3,48 моля О 15,999 г моль
Это дает молярное отношение элементов 1 :2:3,5, или 2:4:7.
Эмпирическая формула соединения-Na2B4O7.
Его формульная масса равна (2-22,990) + (4-10,81) + (7-15,999) = = 201,213.
5. Р4О10; 283,88 г-моль”1, или а.е.м.-молекула ” \
12,011
6. В 14,65 г СО2 содержится Q99 1^,65 = 4,00 г С, поэтому в 5,00 г углеводорода содержится 1,00 г Н. Относительное число молей углерода и водорода в соединении:
4,00 г С ---------------= 0,333 моля С 12,011 г-моль” 1
1,00 г Н --------------г = 0,992 моля Н 1,008 г моль ” 1
т. е. 1:3. Этому соответствует эмпирическая формула СН3. Формульная масса соединения равна 12,011 + (3 -1,008) = 15,035. Значит, точная молекулярная масса соединения должна быть равна 30,070 и оно долж-
Ответы на задачи
483
но иметь формулу С2Н6. Уравнение реакции сгорания данного углеводорода:
2С2Н6 + 7О2 - 4СО2 + 6Н2О
7. 51,9 а.е.м.-атом- 1.
8. 15 г элемента В представляет собой ---15,00г —о250 моля В.
60,0 г моль 1
Поэтому 5,00 г элемента А должны представлять собой 0,250 моля А (так как они образуют соединение АВ). Следовательно, атомная мас-5,00 г
са элемента А равна ———--------= 20,0 г моль 3,00 г элемента
0,250 моля
. _ 3,00 г
А представляют собой ——--------—г = 0,150 моля А. Следовательно,
20,0 г моль 1
18,0 г элемента С должны представлять собой 0,300 моля С (так как они образуют соединение АС2). Отсюда следует, что атомная масса
18,0 г
С равна ———-------= 60,0 г моль \
0,300 моля
9. Цинк реагирует с серной кислотой с образованием водорода и сульфата цинка. Из 65,37 г Zn и 98,08 г H2SO4 образуются 2,02 г Н2 и 161,43 г ZnSO4. Полное уравнение реакции содержит одинаковое число атомов каждого элемента в левой и в правой частях.
10. a) Fe2O3 + 2А1 -» 2Fe + А12О3
1 моль Fe2O3 реагирует с 2 молями А1 с образованием 2 молей Fe и одного моля А12О3.
б) Na2SO3 + 2НС1 -» 2NaCl + SO2 + Н2О
1 моль Na2SO3 реагирует с 2 молями НО с образованием 2 молей NaCl, 1 моля SO2 и 1 моля Н2О.
в) Mg3N2 + 6Н2О -> 3Mg(OH)2 + 2NH3
1 моль Mg3N2 реагирует с 6 молями Н2О, образуя 3 моля Mg(OH)2 и 2 моля NH3.
г) Pb + rt>O2 + 2H2SO4 -> 2PbSO4 + 2Н2О
1 моль Pb, 1 моль РЬО2 и 2 моля H2SO4 реагируют, образуя 2 моля PbSO4 и 2 моля Н2О.
11. a) Na + Н2О -» NaOH + |Н2
б) Са(ОН)2 + СО2 - СаСО3 + Н2О
в) СО + ЗН2 -» СН4 + Н2О
г) A1(NO3)3 + 3NH3 + ЗН2О - А1(ОН)3 + 3NH4NO3
12. а) 2А1 + 6НС1 -> 2А1С13 + ЗН2
б) 4NH3 + 5О2 -> 4NO + 6Н2О
в) 3Zn + 2Р -> Zn3P2
г) 2HNO3 + Zn(OH)2 -> Zn(NO3)2 + 2Н2О
13. 366 г СО2.
14. NH4NO3 -> 2Н2О + N2O
i6«
4S4
15.
16.
17.
18.
7,50 г NH.NO, ---------------г = 0,0937 моля NH4NO3 и, следовательно, 0,0937 моля 80,04 г • моль - 1
N2O; 0,0937 моля-44,013 г-моль-1 = 4,12 г N2O.
а) Да, уравнение полное; б) 0,540 моля СО2; 23,8 г СО2-
Na2S + H2SO4 Na2SO4 + H2S
10,0 г Na2S
---------------г = 0,128 моля Na2S и, следовательно, 0,128 моля вы-78,04 г • моль 1 делившегося H2S, т.е. 0,128 моля-34,08 г -моль ~ Са3Р2 + 6Н2О 2VO + 3Fe2O3
6,50 г VO
66,94 г • моль - 1
= 4,36 PH3.
V2O5 = 8,83
VO
г H2S.
г V2O5
-> ЗСа(ОН)2 + 2РН3; 0,653 г
-> V2O5 + 6FeO
1 моль V,O, „ „ ,
---------• 181,9 г • моль - 1
2 моля VO
2,00 г VO ------------—= 0,0299 моля 66,94 г моль
Fe2O3 _ 0 0360 моля Fe2O3 159,7 г-моль-1
Молярное отношение реагентов в этой реакции равно 2:3,
0,0360 моля Fe2O3 могут прореагировать только с 0,0240 моля VO;
при этом образуется 0,0120 моля V2O5.
0,0120 моля-181,9 г-моль-1 = 2,18 г V2O5
19. 0,244 ммоля XeF6; 59,8 мг XeF6; 2,6 мг F2 остаются неиспользованными.
25 г С --------------г = 2,08 моля С, из этого количества может лолучить-12,011 г-моль-1
ся 1,04 моля С2Н5ОН.
5 карат-0,2053 г карат - 1 1 моль С2"Н5ОН
1 2 моля С
1 мл водки
---------------= 6,23 мл водки = 0,4 мл С2Н5ОН
поэтому
20.
12,011 г-моль
46,07 г • моль " 1 С2Н5ОН 0,790 г-мл-1 С2Н5ОН = 0,00623 л
21.
22.
а) Ни один из реагентов не останется неиспользованным;
б) 1,37 г О2 останется неиспользованным.
2Ag + S -> Ag2S
1,73 г Ag --------------г = 0,0160 моля Ag 107,9 г моль " 1
0,540 г S
---------------г = 0,0168 моля S
32,06 г • моль 1
Молярное отношение реагентов в этой реакции равно 2:1, поэтому 0,0160 моля Ag могут прореагировать только с 0,0080 моля S, а 0,0088
Ответы па задачи
485
23.
25.
26.
моля S останется непрореагировавшими. Это означает, что после реакции останется 0,0088 моля • 32,06 г • моль - 1 = 0,282 г S.
0,054 моль-л-1.
50,0 мл С4Н10О-0,714 г-мл~ 1 моля эфира
74,12 г-моль-1-0,100 л раствора ’ л раствора
Моляльность = 1,133 моль-кг-1. Молярность = 1,087 моль-л-1.
Нормальность = 2,174 экв-л-1. Плотность = 1,066 г-мл-1.
а) 2,5 моль - л ~ 1 • 2 л • 98,07 г H2SO4 моль - 1 = 490 г H2SO4 , 1 моль
б) 1,0 экв.-л С—-------0,5 л-98,0 г-моль 1 = 24,5 г Н3РО4
2 экв.
в) Для титрования 0,5 н. раствора НО необходимо точно такое же количество 0,5 н. раствора NaOH.
0,5 экв.-л" Г 1,0 л-40,0 г-экв.-1 = 20,0 г NaOH
27. Следует добавить 300 мл воды.
28. 25 мл-0,0500 М = V мл-1,53 М; V= 0,82 мл.
29. 0,700 М H2SO4.
30.
31.
32.
33.
34.
35.
36.
2 экв. 1 _,
-----------------= 0,509 экв.-л 1, 1 моль 0,050 л
кислоты.
а) 500 мл-0,0100 М = Кмл-2,10 М; V= 2,38 мл.
б) 2,0 л-0,100 М = V л-18 М; V= 0,011 л = 11 мл.
в) 2,0 мл-6 н. = V мл-0,01 н.; V = 1200 мл.
0,000372 моль-л-1; 0,000744 экв,-л-*.
Поскольку каждый карбонат-ион может присоединить 2 протона, 1 моль карбоната натрия дает 2 экв. основания.
1,35 г Na2CO3
106,0 г • моль - 1
т. е. 0,509 н. раствор.
17,3 мл раствора азотной
Концентрация НС1 1,190 г-мл-^О,3700 = 0,4403 г-мл- 1. Концентрированная НС1 имеет нормальность
04403 г НС1 ’----------г = 0,01208 экв.-мл" *, или 12,08 н.
36,46 г экв. - 1 ’
100 мл-12,08 н = V мл-0,100 н.; V = 12080 мл, поэтому следует добавить 11 980 мл, или 11,98 л, воды.
3Mg(OH)2 + 2Н3РО4 -> Mg3(PO4)2 + 6Н2О
Ва(ОН)2 + 2НС1 -> ВаС12 + 2Н2О
При смешении равных объемов 0,050 М раствора Ва(ОН)2 и 0,040 М раствора НС1 общий объем становится вдвое больше каждого из исходных. Ионы Ва2 + и С1- не участвуют в реакции, поэтому после ее завершения их концентрации должны быть такими:
[Ва2 + ] = = 0,025 М и [СГ] =
= 0,020 М,
Приложение 6 486
Ионы Н+ реагируют с ОН- с образованием Н2О. Для 0,040 М Н + требуется 0,040 М ОН ", но из 0,050 М Ва(ОН)2 получается 0,100 М ОН ”, поэтому после реакции остается
0,060
[ОН - ] = = 0,030 М
Ионы Н+ полностью израсходованы в этой реакции, так что [Н*]л0, но диссоциация воды обусловливает наличие в растворе очень небольшого количества этих ионов.
37. 6,0 мл H2SO4.
38. 0,0200 л-0,103 н. = 2,06-I0 3 экв. Н3РО4, поэтому потребуется также 2,06 10'3 экв. Mg(OH)2.
2,06 10 ”3 экв.- * моль . 58Д2 г моль “ 1 = 0,0601 г Mg(OH)2.
2 экв.
39. 35 мл НС1.
40. — —2 ЭК13- _ 9 45 .io-а экв Са(ОН)2, поэтому потре-
74,09 г • моль 1 1 моль
буется 9,45 • 10 “3 экв. НС1.
9,45 • 10 “ 3 экв. 3
-------------— = 94 5 -10 3 л, или 94,5 мл
0,100 экв.-л ~ 1
41. 0,179 экв.-л ” 1 и 0,0895 моль-л “ х.
42. 0,0086 л-0,10 М ='8,6-10“ 4 моля NaOH, а значит, 8,6-10“ 4 моля лизергиновой кислоты. Молекулярная масса 268,3, следовательно, 8,6 -10 ~4-268,3 = 0,231 г.
43. Пировиноградная кислота СН3СОСООН.
44. NH4C1 + NaOH -> NH3 + Н2О + NaCl
NaOH + HC1 NaCl + H2O
15,0 мл 0,500 M = 7,50 ммоля НО, следовательно, 7,50 ммоля NaOH осталось неизрасходованным. Вначале было 50,0 мл 0,500 М = = 25,0 ммоля NaOH. Значит, 25,0 — 7,50 = 17,50 ммоля NaOH прореагировало с NH4C1. Таким образом, в 20,0 мл исходного раствора NH4C1 содержалось 17,50 ммоля NH4C1, т.е. он имел концентрацию 17,50/20,0 = 0,875 моль-л1. В реакции выделилось 17,5 ммоля NH3, т.е. 17,03-17,5 = 298 мг.
45. 2,96 мг муравьиной кислоты.
0,273 г
46. —г- = 6,07 • 10 экв. кислоты, а значит, и столько же осно-
45,0 г экв.
ван ия.
6,07 • 10" 3 экв. . __ -
--------------- = 33,2-10 л, т.е. 53,2 мл основания.
0,114 экв.-л- 1
Молекулярная масса кислоты равна 90,0, следовательно, каждая ее молекула должна диссоциировать с образованием 2Н +.
47. 0,237 М NaOH.
Ответы на задачи
487
48. 2НС1 + Mg(OH)2 -> MgCl2 + 2Н2О
35,0 мл • 0,15 М = 5,25 ммоля кислоты, а значит, 2,625 ммоля основания.
2,625 ммоля
———----------= 0,105 М основания
25,0 мл
49. 104,0 г-экв. " 1
50. 14,60 мл-0,426 н. = 6,22 мэкв. NaOH и столько же кислоты.
51. 135,3 г-экв.’1; СН3—С6Н4—СООН.
52. 25,37 мл-0,201 н. НО = 5,10 мэкв. НС1 и, следовательно, столько же NH3.
5,10-1 0-3 экв.-17,03 = 0,0869 г NH3 в 0,250 г соединения % NH3 — ^250 ' 100 = ^>8, поэтому CuSO4 составляет 65,2% массы соединения.
159,60 г W
———— = -, откуда W = 85,2, поэтому соединение должно иметь
65,2 34,8
формулу Cu(NH3)5SO4.
53. 785 Н; 2,35 кДж; 42,4 мг метана.
54. Энергия автомобиля = ^mv2 = 0,5(1200 кг)(30 м-с- *)2 = 540 000 Дж, или 540 кДж. Для получения такой энергии требуется ——540 КДЖ---------г = 0,1125 моля С7Н1б, т.е. 0,1125-100,2 = 11,27 г
4800 кДж-моль"1 7 16
гептана.
55. а) — 52 кДж; б) — 26 кДж; в) + 10 кДж; г) + 52 кДж; д) + 161 кДж; е) + 597 кДж; ж) — 52 кДж.
56. ЗТЮ2(тв.) -» Т13О5(тв.) + |О2(г.)
ДН° = — 2443 — 3( — 912,1) = + 293 кДж• моль” 1. Эндотермическая реакция.
57. + 0,30 кДж - моль ” 1; — 296,4 кДж -моль ” \
58. 2Р(тв.) + ЗС12(г.) -► 2РС13(ж.) ДН = - 635,1 кДж
2РС13(ж.) + 2С12(г.) -> 2РС15(тв.) NH° = 2( - 137,3) = - 274,6 кДж
2Р(т.) + 5С12(г.) -» 2РС1(тв.) ДН° = — 907,7 кДж на 2 моля, или — 454,8 кДж • моль -1
Теплота испарения для РС13(ж.) =
= [ДН°обр для РС13(г.)] - [ДН обрРС13(ж.)] =
1
= — 306,4 — — (— 635,1) = + 11,15 кДж-моль 1
Приложение 6
-^88
59. — 321 кДж • моль 1.
60. 2NC13 - N2 + ЗС12 ЛН = -460 кДж
10,0 г NC13
--------------г- = 0,0831 моля, значит, должно выделиться
120,4 г-моль - 1
0,0831 (- 230) = - 19,1 кДж.
61. — 2510 кДж; теплота выделяется.
62. О3(г.) + 2NO2(r.) + Н2О(г.) ->• 2HNO3(boOT.) + О2(г.)
АН° = 2(0,0 - 206,57) + (0,0) - (142) - 2(33,85) - (- 241,83) =
= -381,0 кДж
63. + 454 кДж.
64. В результате реакции расплавилось 0,254 кг воды, следовательно, в ней выделилось 0,254 (335 кДж-кг" ’) = 85,1 кДж теплоты.
5 40 г А1
-------------—г- = 0,200 моля А1
27,0 г • моль
15,97 г Fe2O3
159,7 г-моль - 1
= 0,100 моля Fe2O3
Следовательно, АЯ для этой реакции равно — 851 кДж.
Глава 3
1. 760 мм рт. ст. при любом поперечном сечении.
2. 29,92 дюйма Hg = (29,92 дюйм-25,4 мм-дюйм - ‘) = 760 мм Hg.
3. 4,68.
4. PjFj = P2V2; 1,00 атм-76,0 л = Р2-10,0 л; Р2 = 7,60 атм.
5. а) 15,0 мл; б) 750 мл; в) 7600 мл.
6. Исходный объем воздуха равен 5,00 — 0,40 = 4,60 л. Из условия Pj -4,60 = Р2 -5,00 находим Р2 = 0,92 Pt.
7. 5,28 л.
8. Объем газа пропорционален абсолютной температуре Т, поэтому он не должен удвоиться.
V, т,
323 К
298 К
= 1,08
9. 495 см3. nRT v~
10. Р =
0,0100 г С12
70,91 г-моль
= 1,41 • 10 4 моля
(1,41-10 4 моля)(0,08205 л-атм-моль ~ ‘-К- З)293 К _Q3jgaTM
0,010 л
Р, Т, 523
Из уравнения ------= — следует Р2 = 0,339 атм-——— = 0,605 атм.
Р j 7"i 29 3 11
11. 3,75-1014 молекул.
Ответы на задачи
489
5,0-1013 молекул
— - = 8,3 -10 11 моля.
6,022 1023 молекул моль 1
nRT
Из закона Р - —— находим
_ (8,З Ю-11 моля)(0,08205 л• атм-моль-* К" 1)273 К
Р ~ 0,00100 л
12.
13.
14.
= 1,86-10 6 атм
(1,86-10* 6 атм)(101325 Па атм'1) = 0,188 Па
Люлн = 1,67 атм, рСО1 = 1,23 атм, р^ = 0,44 атм.
Из закона P1V1 = Р2У2 следует
1,00 атм-3 л
Р2 =-----——--------= 1,50 атм
2 2,00 л
Парциальное давление каждого газа составляет
1,00 атм -1 л
------——-------= 0,50 атм
2,00 л
15. рАг = 0,10 атм; Рле = 1,01 атм.
16. Полное число молей смеси = 0,5 + 0,1 + 0,9 = 1,4. Парциальные давления пропорциональны мольным долям компонентов; поэтому
0,5
' Ро = — • 0,80 атм = 0,29 атм
Рн2 ~ 0,80 атм = 0,06 атм
0,8
Pn =-----0,80 атм = 0,46 атм
2 1,4
17.
18.
Рсо = 0,020 атм.
3,86 г СС14
153,8 г моль - 1
1,92 г С2Н4
28,05 г • моль “ 1
= 0,0251 моля СС14
= 0,0684 моля С2Н4
0,0935 моля (0,08205 л • атм • моль 1 К 1) 723 К р =------------------------п ----------------------------=185 атм
0,030 л
0,0684
Рен = _______- 185 атм = 135 атм
> « 0,0935
19. 10,94 гл-1 при нормальных условиях; 13,0 г-д-1.
20. При нормальных условиях 1,62 г газа занимают объем V = 1 л. Подставляя имеющиеся данные в соотношение
Приложение 6
490
ЛЦ Р1У1
Тл т2
1 атм 1,00 л 0,950 атм V2
273 К ~ 302 К
21.
22.
1,62 г находим К = 1,16 л, следовательно, плотность =----------= 1,40 г-л .
1,16 л
4,00 г моль ” 1; гелий. Масса PV =-------------RT
Мол. масса
Масса КТ Мол. масса =-------------
PV
.. 0,400 г (0,08205 л атм моль'1 К-1)273 К
0,500 атм -1,12 л
= 16,0 г • моль ” 1
Для определения молярного отношения элементов удобно исходить из 100 г массы; тогда
Н:
С:
25 г _______—г = 24,8 моля 1,008 г моль 1 _______211________г = 6>24 12,011 г-моль 1
моля
23.
24.
и, следовательно, молярное отношение равно 42,2 г • моль ” 1; С3Н6.
Масса RT
Мол. масса =------------=
0,524 г (0,08205 л • атм • моль ~ 1 • К ’ 1) 298 К
1 :4. Формула: СН4.
100,0 г моль
С:
Н:
F:
моля
0,991 атм 0,129 л
23,5 г ---------------г = 1,96 12,011 г моль 1
2,0 г
-------------= 1,98 моля
1,008 г-моль 1
74,5 г
--------------—г = 3,92 моля
18,998 г-моль 1
Молярное отношение = 1:1:2.
Эмпирическая формула CHF,.
Формульный вес = 51,015.
Следовательно, молекулярная формула должна быть C2H2F4, а точная молекулярная масса 102,030.
Ответы на задачи
491
25. FeO-(SO3)2-H2O-(NH3)2-(H2O)6, или, скорее всего, FeSO4-(NH4)2 SO4-6H2O.
26. LiH + Н2О LiOH + Н2
СаН2 + 2Н2О -> Са(ОН)2 + 2Н2
Обозначим массу LiH как W, тогда (0,850 г — W) есть масса СаН2. 1,200 л при н.у. = 1,200/22,414 л моль ” 1 = 0,0535 моля Н2. Это позволяет записать
W
„ 0,850 - W п
- + 2-----------------г = 0,0535
7,949 г • моль 1 42,096 г • моль 1
Отсюда W= 0,168 г LiH; 0,850 - W= 0,682 г СаН2. 0,168
Весовое содержание LiH = ——— •100 = 19,76 вес.% 0,850
27.
28.
29.
30.
0,168/7,949
Молярное содержание LiH =------------------------------------100 =
(0,168/7,949) + (0,682/42,096)
= 56,61 мол.%
а) 1,000 атм; б) 0,593 атм; в) 1,593 атм; г) 0,0201 моля воды;
д) 0,638 мл воды остается в виде жидкости.
СН4 + 2О2 -> СО2 + 2Н2О
1 г СН ------------—- = 0,0623 моля СН. и столько же СО2 16,04 г-моль” 1
nRT 0,0623 моля (0,08205 л-атм-моль” *• К” *j 298 К
= Р = (0,987 - 0,0313) атм “ ’ Л
3,72 кДж • моль ” 1; около 1% от энергии связи; термический разрыв связей.
3 3
Ек = — RT = у(8,314 Дж-К ‘-моль х)573 К = 7146 Дж-моль *.
Ответ одинаков для всех идеальных газов; Ek зависит только от Т. ' /3RT
---, поэтому она зависит не только от 7, но и от массы М
Гер-к в молекул (молекулярной массы).
*0 ^ср-кв Я 2
3-8,314-573
0,002016 кг • моль ” 1
= 2660 м-с 1
б)
^ср-кв
3-8,314-573
0,01604 кг • моль ” 1
= 944 м-с 1
/ 3-8,314-5/3
в) Ц-п-кв Для НВг = / ————-----------------г = 420 м-с 1
’ С|>” |/ 0,08091 кг-моль” 1
Чем тяжелее молекула, тем медленнее она движется при той же темпе-
ратуре Т.
Прп южение 6
492
31. 3,49 г-л'1; 7Ж = 148 А3-молекула-1; УГ = 37 2ОО А3 • молекула-1. Объем возрастает в 252 раза.
___Масса
32. PV =------------RT, поэтому
Мол. масса
„ Масса Р Мол. масса
Плотность = —-— =---------— -------=
V RT
1 атм(16,04 г моль -’)
(0,08205 л атм • моль - 1 • К - 3) 109 К
= 1,79 гл-1, или 0,00179 г мл-1
Молекулярный объем:
16,04 г-моль-1 ,
Ж‘И,0СТЬ: (0,466 г см ~ 3Х6,022 1033) - 57?1Г “
16,04 г моль- 1 _ ,
Па1>; (0,00179 г-мл-1(6,022.IO33) ™
33. 482 м-с-1; 29800 К; в 100 раз.
34. с =
1,41 (8,314 Дж • К - 1 моль-1) 298 К ----------—;---------—,-------= 353 м с
/ 0,028014 кг-моль
3RT _ 3-8,314-298 7Й- ~ 0,028014
35. 348 м-с- *; в воздухе медленнее; 308 м-с- *.
36. Ни скорость звука, ни среднеквадратичная скорость молекул газа не зависят от давления, они определяются только молекулярной массой и температурой. И та и другая величина связана с усредненным движением индвидуальных молекул.
37. 0,989 л; 1,003 л.
38. Образование озона происходит по уравнению ЗО2 -> 2О3, поэтому если 5% О2 превратилось в О3, число молей газа должно уменьшиться до 0,95 + §(0,05) = 0,983 от исходного значения, а давление должно стать равным 0,983-0,526 атм = 0,517 атм.
39. 64 г моль - 1; диоксид серы SO2.
40 Скорости /МЛ1'3 6JL£L = fJV^_Y/2; М2 = 63,4.
Скорость2 \ Alj J 5 л t 1 у 44,01 /
41. 22,412 л • моль1; 0,9990 атм; отклонение 0,1%.
а
Ц:р-кв
= 515 м-с
42.
= RT
Уравнение решается методом последовательных приближений; вначале положим, что в первом члене уравнения V= 22,414 л-моль- 1; это дает
Ответы на задачи
493
3,592 -
1,00 + (22714)2 И~ °’О4267) = °,08205 -273
откуда V = 22,28 л моль Это значение используется для повторного решения:
( „ 3,592 (/’ + (22,28) откуда V = 22,28 л-моль"1. Г)(Й- 0,04267) = 0,08205-273
, т.е. тот же ответ.
Глава 4
1. а) гч‘равн ^равн г'-равн К [h2]2[s2] [H2S]2 [РС15] б) ^равн Г) ^равн б) Кмвн ' равн Г) ^павв • роВп б) ^равн г) ^равн б) К_авн ' равн Г) ^оавв ' рлвн = [н2]2 [H2S]2 [СО2] [NH3]2
2. °) д) а) в) д) а) в) д) а) в) д) [РС13] [С12] _ [NO]2[O2] [no2]2 [NO2]4 [Н2О]6
|*,равн Лравн г*-равн ^•равн 1Z гч-равн Льравн г'‘равн Л‘равн Г' Л-равн [NH3]4 [О2]7 = [NH3] [HC1] _ [SO2]2 [O2]3 _ [NO2]2 [n2o4] _ [N2O4] [NO2]2 = [NO2]2 [o2]1/2 _ [HC1]2 [O2]1/2 [C12][H2O] [Cl2]2 [NO2]2[H2]2 [HCN]2
3. 4. = [Н2] t(CN)2] [n2][Q2]2 [N2O4] [N2O4r2 [NO2] [Cl2]1/2 [H2O]1/2 [HC1] [O2]1/4 [CO]2
[HC1]4 [O2] = [NH3] [H2] [CO2]
5, я) г) атм ” [о2] 42. 6) Kp = 1,610" 11 атм; = 1,6-10 ” 11 атм = 1,3 10 ” 13 в) Кс = 1,3-10 13 моль-л *; моль-л” 2.
’б. а) Кр = Pco , поэтому эта Pco, константа атм2 _
атм
б) К₽ = 1,67 IO3 атм = K'tRTT1
П ри.жжение 6
494
с (0,08205 л атм моль 1К ’)1476 К
их к Рсо>
В) к = -------
Ро>
Рсо
г) Из задачи 5 известно, что ------2— = 2,5 105, или
РсоРо2
Рсо
2 1 = (2,5 105)2 = 6,25 Ю8 * 10. РсоРо2
Рсо
Из части задачи а) -----= 1,67 103. Перемножая эти соотношения,
Рсо2
находим
Pro — = 1,04-1014 Ро2
д) При суммировании уравнений их константы равновесия следует перемножить.
7. Кравн~ безразмерная величина; а) обратная, б) обратная, в) прямая. (0,045)2
8. a) Q = - ----= 202,5; Q > Ктт,
* (0,01)2(0,10) равн
самопроизвольно протекает обратная реакция. (0,045)2
б) О = - ----= 20,25; О < Кгавн,
(0,10)2 (0,01) равн
самопроизвольно протекает прямая реакция, (0,108)2
в) Q = —— — ----= 116,6 Q х Ктт,
(0,10)2 (0,01) р
реакция находится в положении равновесия.
9. КР1 = 1,86 атм12; К„2 = 0,289 атм; = 1/К2,.
10. Давление каждого газа пропорционально его мольной доле. Из 1000 молекул СО2 получится 984 молекулы СО2, 16 молекул СО и 8 молекул О2. Поэтому их парциальные давления должны быть равны:
984
ргп =---------1 атм — 0,976 атм
ис° 1008
16
ргп =---------1 атм = 0,0159 атм
со 1008
8
ро =--------1 атм = 0,00794 атм
> 1008
„1/2 „
Ро2 Рсо
Кр =----------
Рсо2
(0,00794г2 (0,0159) 6,976
= 0,00145 атм1/2
Кс = Kp(RT)~ 112 =
= (0,00145 атм1/2)(0,08205 л атм-моль 'К 2) 1/2-(2000 К) 112 =
= 1,13• 10“4 моль112 -л- 1/2
Ответы на задачи
495
11. a) NO + |С12 -> C1NO
б) Кс = 13,6 моль'1/2-л1/2
Кр = 2,11 атм-1/2
12. а) С(тв.) + СО2(г.) -> 2 СО (г.)
б) Рсо, = 0,0074-2,СЮ = 0,0148 атм Рсо = 0,9926 • 2,00 = 1,9852 атм
р2со (1.9852)2
К. =------= ______= 266 атм
Рсо, 0,0148
Кс = Kp(RT)~ ' =
= (266 атм) (0,08205 л • атм • моль *-К * х) 1 (1323 К) ' =
= 2,45 моль • л - 1
13.
14.
а) Кс = 0,0488 моль л *; б) [N2O4] = 1,85 моль л *.
а) Равновесие сильно сдвинуто влево; диссоциация незначительна.
б) 6,2-10~54; [Н2] = [С12], поэтому -1Ы- = 6,2-10-54
[НО]2 ’ l 2J L 2J, у (0,010)2
и [Н2] = 2,5 10-29.
в)
Н2 С12 но
Исходная концентрация:
Равновесная концентрация:
0,005 0,005 0
х х 0,010 — х
Поскольку х — очень малая величина, положим 0,010 — х х 0,010, и вычисления проводятся так же, как в части (б):
х = [С12] = [Н2] = 2,5 10 - 29
15. Константа равновесия безразмерна; Кр = Кс ; рН; = 0,98 атм, рн о = = 9,02 атм.
16. Полное давление Р = pSO] + pOi + pSOj.
= —PS°3 = 33,4 атм-1/2
Pso, Ро,
SO2 О2 SO3
Исходное давление: 10 10 0 Равновесное давление: у 5+^ 10 — у
Сначала проведем вычисления, полагая 5 + « 5 и 10 — у = 10.
Получим —„ = 33,4, откуда у = 0,134. У (5)' -
Теперь подставим это значение в 5 + и в 10 — у и повторим вычисления : z
/7pujc.>i't’Hiie О
496
9,866
— ,.2 = 33,4, откуда у = 0,131. Третий цикл вычислений приводит
у (5,067) '
снова к значению у = 0,131. Следовательно, при равновесии Р = = 0,131 + 5,066 + 9,869 = 15,066 атм.
17. Константа Кс имеет размерность моль на литр; а) СО2 = = 0,0060 моль л " 1; б) 0,060 моля; в) превращается 60%; г) pCOl = = 0,50 атм.
[Н2О]3
18. а) Кс = , поэтому данная константа безразмерна. Поскольку
Ди = 0, Кр = Кс.
б) PV = nRT, поэтому
_п____Р___________________1 атм________________________________,
V RT (0,08205 л-атм-моль-1 К-1)613 К ’ моль л
в) К„ = = 0,064 Кс = = 0,064
р (I)3 (0,020)3
Рн2о = 0,400 атм [Н2О] = 0,0080 моль-л 1
19. Согласно принципу Ле Шателье, поскольку повышение температуры благоприятствует диссоциации, она является эндотермическим процессом.
20. Величина АН отрицательна, поэтому повышение температуры должно смещать равновесие влево. NO должен быть более устойчив при повышенных температурах.
21. а) Смещает равновесие в сторону образования продуктов; б) не оказывает влияния; в) смещает равновесие в сторону продуктов; г) смещает равновесие в сторону реагентов; д) смещает равновесие в сторону продуктов.
22. а) Равновесие сместится влево; б) равновесие сместится вправо, что приведет к уменьшению давления в результате уменьшения числа молекул; в) равновесие сместится вправо; г) катализатор не влияет на положение равновесия.
Глава 5
1. pH = 12.
2. pH 10“ 10 М раствора НС1 очень близок к 7. Вклад НС1 в концентрацию [Н + ] незначителен; концентрация этого иона практически совпадает с имеющейся в чистой воде.
3. а) pH = 3; б) pH = 1,7; в) pH = 11; г) pH = 11,3
4. а) [ОН-] = 0,10 б) [Н + ] = 0,020
рОН = - 1g 0,10 pH = - 1g 0,020
рОН = - (- 1) = 1 pH =-(-1,70)
. pH = 14 - 1 = 13 pH = 1,70
Ответы на задачи
497
в) 0,050 М NaCl г) Чистая вода pH = 7,00 pH = 7,00
5. pH = 2,8; рОН = 11,2.
6. а) НАс Н + + Ас “. Положим у = [Н + ], тогда
Допустим, что 0,10 — у х 0,10, тогда у2 = 1,76 10 6, откуда у = = 1,33 • 10 “3.
Пользуясь этим значением, найдем 0,10 — у = 0,0987.
В этом случае у2 = 1,74-IO-6, откуда у = 1,32-10-3 = [Н+].
Следовательно, pH = — 1g (1,32-10“ 3) = 2,88.
б) СН2С1СООН Н+ + СН2С1СОО _. Положим [Н + ] = у, тогда v2
Ка = 1,40-10 “3 = —-----
0,1 - у
у2 + 1,40-10"Зу - 1,40-10“* = 0
Решение квадратного уравнения дает: у = 1,12-10“ 2 = ГН + ] pH = -1g(1,12 IO”’) = 1,95
в)КЛ = 1,40-10-3=-^_
Положим 0,01 — у ~ 0,01, тогда
у2 = 1,40-10-5 у = 3,74-10-3
Пользуясь этим значением, находим 0,01 — у = 0,00626, откуда
у2 = 8,76 • 10 - 6 у = 2,96-10-3
На основании нового значения находим 0,01 — у = 0,00704, откуда у2 = 9,86 10"6 у = 3,14-10 “3
Следующий цикл вычислений дает у = 3,10-10-3 pH = — 1g (3,10-10 -3) = 2,51
Ка = 4,93 IO’ 10 = —------
0,1 - у Допустим, что 0,1 — у ~ 0,1, тогда у2 = 4,93 10-11
При.юмсение 6
498
у = 7,02-10“ 6
pH = — 1g (7,02 -10 “ 6) = 5,15
7. а) pH понизится; б) почти не изменится; в) pH повысится; г) останется без изменений; д) pH повысится.
8. а) pH понизится; б) pH понизится; в) pH повысится; г) pH не изменится; д) pH понизится; е) pH повысится; ж) pH повысится (CN- как основание более сильное, чем NH4 как кислота).
9. pH = 2,9; Ка = 1,71 -10 - 5.
10. HF Н + + F -. Если степень ионизации равна 5,'75%, то [Н + ] = = [F ’ ] = 0,00575, [HF] = 0,09425.
Тогда pH = - 1g 0,00575 = 2,24
К
а
0,00575 0,00575
0,09425
11. Кянсс = 1,79-10“ 3; нет; NH3 + Н2О -> NH4 + ОН-; pH = 10,6.
12. Если [Н + ] = 2,5 -10“ 12, то pH = — 1g (2,5-10“ 12) = 11,60. На коробке со стиральным порошком должна быть сделана предостерегающая надпись.
13. pH = 5,1; рОН = 8,9.
14. HCN Н + + CN '. Положим у = [Н + ] = [CN - ]
у2
Ка = 4,93 • 10 - 10 =------
1,00 - у
Допустим, что 1,00 — у а: ~ 1,00, тогда
у2 = 4,93 10 - 10 у = 2,22 -10“5 = [CN-] pH = - 1g (2,22-10 - 5)
pH = 4,65
рОН = 14 - pH = 9,35
15. [NO,-] = 1,05-10“2 моль-л-1; pH = 2,0; степень ионизации 4,2%.
16. [Н + ] = 8,0 10-9. Следовательно,
1 0-10" 14
[ОН-] = ~n in-9-=1’25'10~6 РН= ->ё[Н+]= — lg(8,0-10“ 9) 8,0 10 , = 8,10
РОН= -^(1,25-10-«) = рОН = 14 - 8,10 = 5,90
17. 3,97 • 10 - 5 моль - 1; pH = 9,6.
18. Kh = — 2 г 5—- ,---- = 2.0-10 - 6
[N2H4]
Пусть у = [N2H5+] = [ОН ], тогда
Ответы на задачи
499
2,0-10" 6
У2 0,010 - у
Допустим, что 0,010 — у ~ 0,010, тогда у2 = 2,0 -10’8
У = 1,41 IO’ 4 = [N2H5+] рОН = — 1g (1,41 10 “ 4) = 3,85 pH = 14 - 3,85 = 10,15
19. pH = 5,0.
20. Ас" + Н2О НАс 4- ОН"
[НАс] [ОН’] Кн,о 1,0 10“14 Кь = [А<Г] = ~кГ = 1,76-10"5
Пусть у = [ОН “ ], тогда
= 5,68-10 10
5,68-10" 10 =
У2 0,025 - у
21.
22.
23.
24.
Допустим, что 0,025 -ух 0,025, тогда у2 = 1,42-10’11 у = 3,77 -10 ’ 6 = [ОН " ] рОН = - 1g (3,77 10 ’ 6) = 5,42 pH = 14 - 5,42 = 8,58
ОВг" 4- Н2О -> НОВг + ОН"
[НОВг][ОН ] = 505.10-s = 1,98-Ю"9
ь [ОВг ’ ] , <. >
[С6Н5ОН] [ОН - ]
ь [С6н5о-]
pH = 11,0, следовательно, рОН = 14 — 11,0 = 3,0 и [ОН’] = 1,0-10 "3 = [С6Н5ОН] к (1,0-10 ’ 3)(1,0-10"3) ]0_4
6 (0,0100 — 1,0 -10 ’3)
Отсюда следует, что для фенола кн2о 1,0-10’14 „ „
=----— = —--------j- = 9,1 • 10 ’ 11
“ Кь 1,1-10’4
Кь = 2,00-Ю"11; Ка = КИО/КЬ = 5,00 10 ’ 4.
CN" 4- Н2О HCN +2 ОН “
[HCN] [ОН“] Хн,о 1,0-10"14
Кь = -----—------- = —— =----------— = 2,0 • 10"5
[CN’] Ка 4,93-10"10
н2о
При 1<>жсиие 6
5 (X)
Пусть у = [ОН ], тогда 2,0-10 5 = —--------.
Положим 1,0 — у ж 1,0, тогда
у = 2,0-10 5
у = 4,5-10"3 = [ОН ]
рОН = - 1g (4,5 • 10 - 3) = 2,35
pH = 14 - 2,35 = 11,65
25. pH = 9,31.
26. NH* + Н2О NH3 + Н3О +
Пусть у = [Н + ]
(0>20 + у)у 10_1О
° 0,40 - у
Положим, что 0,20 + у 0,20 и 0,40 — у ~ 0,40, тогда
у = 1,12-Ю"9 = [Н + ] pH = - lg(l,12-10“ 9) = 8,95
27. pH = 4,75.
28. При смешении равных объемов двух растворов объем удваивается, поэтому концентрации становятся вдвое меньшими.
[СН3СН2СОО-][Н + ] 10_5
° [СН3СН2СООН]
Пусть у = [Н + ], тогда
(О.Ю + У) У 0,10 - у
= 1,34-10“ 5
Положим, что 0,10 + у ~ 0,10 — у ~ 0,10, тогда у = 1,34 10" 5
pH = -1g (1,34 10"s) = 4,87
29. pH = 2,0; pH = 4,83.
30. Ка
[нсоо - ] [Н + ] [НСООН]
1,77-10“ 4
Пусть у = [Н + ], тогда
№01 + = 1,77 Io-
О.10 - у
Положим 0,01 + у ~ 0,01
0,10 - ух 0,10 тогда у = 1,77 • 10'3 pH = -1g (1,77 • IO"3) = 2,75
Ответы на задачи
501
Если к 1 л этого буфера добавить 0,10 г NaOH, т.е.---
40,0 г моль
= 2,5-10-3 моля NaOH, то
[НСООН] = 0,10 - 2,5 • 10“3 = 0,0975
[НСОО] = 0,01 + 2,5 10’3 = 0,0125
Новое значение у=[Н + ] находим, подставляя эти концентрации в выражение для Ка
(0,0125 + у)у
—---------— = 1,77 • 10"4
(0,0975 - у)
откуда у = 1,38 10 3
рН = — 1g (1,38-103) = 2,86
Если вместо этого добавить к 1 л буфера 1 г NaOH, т.е. 2,5 10“2 моля NaOH, то
[НСООН] = 0,10 - 0,025 = 0,075
[НСОО-] = 0,01 + 0,025 = 0,035
0,035 + у у
—— = 1,77 • 10“4
0,075 - у
у = 3,79 • 10“4
pH = -1g (3,79 IO’4) = 3,42
31. pH = 9,07; pH = 9,01.
32. Изменение pH должно быть больше, поскольку более низкие концентрации основания и соли уменьшают буферное действие раствора. Перед добавлением НС1
[NH3] =
0,06 М 0,020 л
0,030 л
= 0,04 М
[NH4+] =
0,18 М • 0,010 л
0,030 л
= 0,06 М
Если [Н + ] = у, то Ка = 5,6 • Ю’10 = (0,04 +
L J ° 0,06 - у
Делая обычные предположения, находим у = 8,4-10-10
pH = - 1g (8.4 • 10"1 °) = 9.08
После добавления НО
[NH3] =
[NH4] =
(0,06 М • 0,020) - (1,0 М • 0,001 л)
0,031 л
(0,18 М-0,010 л) + (1,0 М О,001 л)
0,031 л
Приложение 6
502
5,6 • 10“10
2• 10“4 \
0,031 yJ
28• 10“4 ;
0,031 У
Делая обычные допущения, находим у = 7,84 10“9
pH = -1g (7,84 • 10“9) = 8,11
33. а) pH = 10,5; б) pH = 5,5; в) да.
34. Ру + НС1 - РуН+ + С1 “
Ру + Н2О & РуН + + ОН “
Если отношение числа эквивалентов Н +, добавленных к исходному числу эквивалентов пиридина (Ру), равно 0,50, то (пользуясь обычными предположениями) можно считать, что [РуН + ] = [Ру], тогда Кь = = 1,58 • 10“8 = [ОН“]; рОН = - 1g(1,58 10“8) = 7,80; pH = 14 -— 7,80 = 6,20. Если указанное отношение равно 1,00, то (полагая, что титрование проводится 0,10 М раствором НО) можно считать, что [РуН + ] ~ 0,05. В этом случае pH вычисляется при помощи уравнения
РуН+ + Н2О & Ру + Н3О +
[РУ] [Н + ] [РуН + ]
= 6,33 10“7
Полагая [Н+] = у
и делая обычные предположения, находим
У2
0,05 - у откуда у2 = 3,16 10“8
у = 1,78 -10“4
pH = -1g(1,78 • 10“4)
= 6,33 10“7
В качестве индикатора при титровании следует использовать метиловый оранжевый.
35. Ка = 2,5 10“6.
,, , IH + ][F“] [HNO2] _ [F“][HNO2]
’ [HF] [H + ][NO2“] [HF][NO2“] paBH
1
~ KjHF,Ta(HNOj
3’53-10’4-4^ = 0’77
поэтому кислотность HNO2 выше кислотности HF.
[H + ] [CH3COO~] [HF] = [CH3COO“] [HF] =
' [CH3COOH] [H + ][F“] [CH3COOH][F“] paBH
Ответы на задачи
503
1,76-10~5--- . = 0,050
3,53-10“*
поэтому кислотность HF выше кислотности СН3СООН.
[Н+][СН3СОО-] [HSO3-] = [СН3СОО~] [HSO3 ]
[СН3СООН] [Н+][8ОГ] [CH3COOH][SO]-] равн
1,76-10“5---------=- = 173
1,02-10“7
поэтому кислотность СН3СООН выше кислотности HSO^ [h + ][so2-]
[HSO3-]
= 0,0120.
[nh;] [soj-][NH4+]
[H + ][NH3] [HSO3][NH3]
1,02 IO’7------- —= 182
5,6 -IO-10
поэтому кислотность HSO^ выше кислотности NH4. Сила кислот возрастает в такой последовательности:
nh; < hso3- < сн3соон < hf < hno2
37. [Н + ] = [нсо;] = 1,2-10“ 4 моль-л”1
[СО]-] = 5,6 -10“11 мольл-1
[СО2] = 0,034 моль-л-1
pH = 3,9
38. Первичная диссоциация практически 100%-ная, поэтому после нее [H2SO4] = 0, [Н + ] = 0,30 и [HSO4 ] = 0,30.
Константа вторичной диссоциации = '
Положим [SO?-] = у, тогда ^0 + = 0,0120.
Если считать, что 0,30 + у « 0,30 — у « 0,30, то у = 0,0120. Используя это
значение во втором цикле вычислений, найдем = 0,0120, от-м,2оо
куда у = 0,011.
Таким образом, [SO?-] = 0,011, [HSO4] = 0,289, [Н + ] = 0,311 и pH = = 0,51.
39. [Н + ] = [HSO3] = 2,11 10-2 моль л-1
[H2SO4] = 0,0289 моль-л-1 [SO2-] = 1,02-10-7 моль-л-1
ЛЛ V АТ1А-ГА гг'гг г ГГАТТТГАА гттттг W/TTTTTT /ГТ//>ПАТТ T.Tjn т •
•+v. IVUHtlUniDl £1 1¥1Ы1_1_1£>ЛК VD4714 nHL.lUlDl.
= 5,6210-3; К2 = 1,70-10-7; К3 = 3,9510-12
[H + ][H2AsO4-]
= 5,62-10-3
[H3AsO4]
При.южение 6
504
Пусть [Н+] - [H2AsO4] = у.
Предположим, что 0,30 — у « 0,30, тогда
v2
---------= 5,62 • IO-3
0,30 - у
у2 = 1,69 - 10-3
у = 4,10 10-2
Используя это значение во втором цикле вычислений, получим
У2
3,84 • 10 2, получим у = 1,70-10 7. (3,84 • 10"2)[AsO3-]
—---------—-----4 = 3 95 • 10-12
1,70-10"7
= 5,62 • IO’3 0,30 - 0,041
у2 = 1,46 • 10“3 у = 3,82 • 10’2
Третий цикл дает у = 3,84 • 10-2, так что 0,30 — у = 0,262.
Перейдем теперь к вторичной ионизации: [НЩНЛ^-] _ . 10_,
[HjAso;]
Положим [HAsO4“] = у, тогда [(3.84. _
(3,84 10“2) - у
Полагая, что у намного меньше [H + ][AsO3~] [HAsO2-]
Отсюда [AsO^-] = 1,75 • 10-17
Конечные концентрации таковы: [Н+ ] = 3,84 • IO-2; [H2AsO4] = = 3,84 • IO-2; [HAsO4“] = 1,70 • IO-7; [AsOj"] = 1,75 • 10"17; [H3AsO4] = 2,62 10"1.
41. ПР = 1,77 • 10-18. Растворимость = 1,77 10-ls моль л-1.
42. Перед добавлением С1" в раствор [РЬ2 + ] = 0,16. Если 99,0% ионов РЬ2+ осаждается из раствора, в нем остается [РЬ2+] = 0,0016, [СГ] = 0,10, то ПР=[РЬ2+][СГ]2 = (1,6-10-3)(0,1)2 = 1,6-10"5.
43. Растворимость в воде 2,7-10-3 моль-л-1; растворимость в растворе NaF 3,2-10-5 моль-л-1.
44. ПР = [СО2 + ] [S2 ] = 5-10-22. Обозначим через у растворимость CoS в молях на литр, тогда В чистой воде [Со2 + ] = [S2-] = у у2 - 5 10 22 у = 2,2-10-11
В 0,1 М растворе Na2S
[Со2 + ] = у, [S2"] = у + 0,1 у (у + 0,1) = 5 10“22
Положим у + 0,1 = 0,1, тогда
у = 5 • 20’21
и 4,4 • 10“6 моль л-1.
г11. Обозначим через у растворимость
45. [Ag+] = 1,6 • 10 4 моль л 1
46. ПР = [Са2 + ] [F ]2 = 3,9 10 в молях на литр, тогда
Ответы на задачи
505
В насыщенном растворе CaF [Са2+] = у, [F~] = 2у у(2у)* = 3,9 10“11 у = 2,1 • 10~4
47. Нет.
48. ПР= [Fe2 + ][OH“]2 = 1,8 10
В 0,05 М растворе NaF [Са2+] = у, [F-] = 0,05 + 2у у(2у + 0,05)* = 3,9-10-11
Допустим, что 2у + 0,05 = 0,05, тогда у = 1,6 -10“ 8
- 15
После смешения растворов объем достигает 200 мл и
г ,+п 100 0,020
[Fe2+] =-----—;-----= 0,010
L J 200
Поэтому, чтобы воспрепятствовать осаждению, [ОН ] не должна пре-
вышать
1,8 • 10“15 0,010
= 4,2 • 10“7
[nh;][oh“] , , loo 0,050
К‘ = [NH,]" - '™ ‘° [NHJ - —200— - °-025
’ [NH*] ’ 1’°7
(1,07 моль л-1) (0,200 л)-(53,5 г-моль“1) = 11,4 г.
49. pH = 0,7.
50. ПР = [Zn2 + ] [S2“] = 2,5 • 10“22
2 5• 10“22
^ = ^од^ = 3’12-10-21
[H [H2S]~ ] = 1,0 10-19 (К12 = Kl *2’
[Н + ]2(3,12 10“21)
3=-----------=------ = 1,0 • IO-19
7,7 • 10“2
[Н + ]2 = 2,47 [Н + ] = 1,57
pH = - 1g 1,57 = - 0,20
51. Растворимость 2,0- 10“7 моль л*1.
52. В насыщенном растворе сероводорода [Н + ]2 [S2 ~] = 1,0 • 1О“20 Обозначим растворимость через s, тогда
при pH = 9 (1 10“9)2 [S2“] = 1,0-10“20, откуда
[S2“] = 1,0 • 10“2
[Fe2T][S2“] = 4•10“19
s (1,0 • 10“2) = 4 • 10~19
s = 4-10-17
при pH = 2 (1 10-2)2[S2-] = 1,0-Ю20, откуда
[S2"] = 1,0 10“16
Приложение 6
506
[Fe2+][S2-] = 4-Ю-19
s-(l,010-16) = 4-10-19
s = 4-10-3
Растворимость сильно зависит от pH.
53. При pH = 2 растворимость 8,9 • 1012 моль-л-1 (практически неограниченна); при pH = 12 растворимость = 8,9 10-8 моль-л-1.
54. Растворимость Са(ОН)2 при 0°С равна 1,85 г-л-1.
----л— = о 025 М, поэтому ГОН - ] = 0,050.
74,09 г-моль-1 L J
Следовательно, рОН = — 1g 0,050 = 1,30; pH = 14 — 1,30 = 12,70. Раствор опасен для употребления.
55. а) 8,5 • 10“15 моль-л-1; б) 2,0 • 10“7 моль-л-1;
в) 2,3 • 10“24 моль-л-1; способ(в)-наилучший.
Глава 6
1. СО2: 44,007 г СО: 28,009 г Н2: 2,016 г Н2О: 18,014 г
46,023 г 46,023 г
Объем действительно сохраняется при 110°С, но этого не происходит при любой температуре, когда вода находится в жидком состоянии. Масса является более фундаментальным свойством, чем объем.
2. ЗН2 + N2 -> 2NH3
(3 2,016) + 28,014 = 2(14,007 + 3,024)
34,062 = 34,062
Масса сохраняется. В реакции происходит изменение числа молекул газа, поэтому, согласно гипотезе Авогадро, не следует ожидать, что объем будет сохраняться.
3. 23,0 г; 46,0 г на моль кислорода; 23,0 г моль-1; натрий.
4.
77,73 г Fe Wl г Fe
22,27 г О 8 г О
72,36 г Fe W2 г Fe
27,64 г О 8 г О
69,94 г Fe W г Fe
30,06 г О 8 г О
Отношения
И; = 27,92 - 3 -> 1
W2 = 20,94 2| - |
1Г3 = 18,61 -> 2 |
» Простые отношения
Эмпирические формулы:
77,73 = 1,39 моля Fe 22,27 = 1,39 моля О Г
55,85 16,00
72,36 55,85 = 1,30 моля Fe 27,64 16,00 = 1,73 моля О Отношение 3 :4 Fe3O4
69,94 55,85 = 1,25 моля Fe 30,06 16,00 = 1,88 моля О Отношение 2 :3 Fe2O3
Ответы на задачи
507
5. 10 л паров Н2О; 5 л неиспользованного О2.
6. С3Н8 + 5О2 -> ЗСО2 + 4Н2О
Коэффициенты уравнения указывают отношение объемов реагентов и продуктов. Таким образом, 6 л С3Н8 требуют 6-5 = 30 л О2, в результате чего получается 3-6 = 18 л СО2 и 4-6 = 24 л паров Н2О. Отношение плотностей газов должно совпадать с отношением их молекулярных масс, поскольку объем, приходящийся на моль газа, одинаков для всех газов (г-л-1 = г-моль-1 х моль-л-1).
7. 80,6 г-моль СН3Х, СН2Х2, СНХ3, СХ4; Х-бром.
8.
Соединение D. г-л 1 М = kD Состав, вес.% Масса одной молекулы
С Y С Y
А 3,92 87,8 13,6 86,4 12,0 75,9
В 6,16 138,0 17,4 82,6 24,0 114,0
С 2,77 62,0 38,6 61,4 24,0 38,0
Наибольший общий делитель: 38,0
Если атомная масса Y равна 38, то соединения имеют формулу CY2, C2Y3 и C2Y. Но атомная масса этого элемента может быть равна 19Д 12,67 либо 9,50. Наиболее вероятно, что этот элемент-фтор с атомной массой 19,00. Тогда соединения представляют собой CF4 (мол. масса 88,01), C2F6 (мол. масса 138,02) и C2F2 (мол. масса 62,02).
9. 63,6 г моль ~ 1.
8,00 г О
10. Соединительный вес металла: 3,70 г-------= 15,26 г
1,94 г О
25
Приближенная атомная масса металла: ------= 42,7
0,586
Следовательно, точная атомная масса должна быть равна 48,5. Металл должен представлять собой скандий.
11. 238,1 г-моль-1; валентность (емкость насыщения) 3.
8 г О
12. Соединительный вес металла: 8,50 г——— = 68,0 г
„ . 25
Приближенная атомная масса металла: q ^3 = 203
Следовательно, точная атомная масса металла равна 3 68,0 = 204,0. Валентность (емкость насыщения) металла 3. Оксид металла имеет формулу М2О3. (1 моль, т.е. 16 г, атомов кислорода соединяется с 16-8,50 г = 136 г металла, а 32 г О соединяются с 272 г металла либо
При.южение 6
508
48 г О взаимодействуют с 408 г металла, откуда следует, что его оксид имеет формулу М2О3.) Металл представляет собой таллий.
13. СН2О; 60,1 г-моль-1; С2Н4О2.
14. Будем исходить из 100 г соединения. Тогда в нем содержится
65,45 - . е 29,06 . 5,49 , ., ,,
, ’ = 5,45 моля С, , = 1,82 моля О, - = 5,45 моля Н
12,01 16,00 1,01
Соединение имеет эмпирическую формулу С3Н3О. Его формульная масса равна 55. При нормальных условиях 1 моль газа занимает объем V = 22,4 л, поэтому 0,672 л составляют 0,030 моля, и молекулярная 3,30 г
масса должна быть равна ------------= 110 г • моль . Следователь-
0,030 моля
но, молекулярная формула должна быть С6Н6О2. 3,30 г вещества представляют собой 0,030 моля, значит, в них содержится 0,030-6,022-1023 = 1,81 Ю22 молекул.
15. С7Н8.
16. 2 (Неизвестный газ) + ЗО2 -> 2СО2 + 4Н2О
Следовательно, из 2 молей неизвестного газа должно образоваться 2 моля атомов С, 8 молей атомов Н и 2 моля атомов О. Эмпирическая (и молекулярная) формула этого газа СН4О. Вероятно, это соединение представляет собой СН3ОН, метанол.
Глава 7
1. Ап (подобно элементу 111); Hg (подобно элементу 112); Rn (подобно элементу 118).
2. Для элемента 111 хлориды должны иметь формулы МС13 и MCI (подобно Au). Для элемента 112: МС12 и МО (подобно Hg). Для элемента 118 возможно МС12 и МС14 (подобно XeF2 и XeF4).
3. a) N, группа VA; б) А1, группа ША; в) С1, группа VILA; г) Rb, группа IA.
4. a) Ga, группа ША; б) Sb, группа VA; в) Ва, группа ПА; г) Р, группа VA.
5. Уменьшается.
6. По аналогии с Са и Ва: а) МО; б) МС12; в) МН2; г) гидрид должен образовывать основный раствор, выделять Н2; д) М2 + .
7. HI + Н2О -> Н3О+ + 1“
8. СаН2 + 2НОН -► Са(ОН)2 + 2Н2
9. СаН2, Н2Те, GeH4, WH6; СаНб должен быть ионным. Атомы водорода должны обладать катионным характером в Н2Те и анионным в СаН2, GeH4 и WH6. Водный раствор СаН2 наиболее основный [СаН2 + 2Н2О -> Са(ОН)2 + 2Н2].
Ответы на задачи
509
Глава 8
1. Х = 2,5 102нм; 8,0-10 19 Дж-фотон 4,8 • 102 кДж • моль ультрафиолетовый свет.
he (6,63-10- 34 Дж-с)(3,00-108 м-с-1)
Е = hv = — - ---------------—-------------- =
X (2 10-1Ом)
= 9,9 • 10 - 16 Дж • фотон - 1
6,626 10 -28 Дж • фотон - 1; 3,990 • 10 “7 кДж • моль “1; X = 2,998 • 104 см. Энергия радиоволн намного меньше энергии связи С—С. Поэтому такие волны неспособны инициировать химическую реакцию.
376 кДж • моль “ 1 ,, ,
—------тч----------—6,25-10 22 кДж-атом 1
6,02 • 1023 атом • моль 1
6,25-10" 19 Дж
2.
3.
4.
- .о„ _ . = 3,90 эВ-атом 1 1,602-10 19 Дж-эВ 1
he л Е = —; X
X
he
Т
(6,63 • 10 ’ 34 Дж • с)(3,00 • 108 м • с - 3)
5.
6.
7.
8.
9.
10.
6,25 -10 “ 19 Дж = 3,18 10 “ 7 м
2n2mce4Z2
Р
к и к =
и2
Поскольку hv пропорционально Z2, график зависимости квадратного корня из v от Z должен иметь вид прямой линии.
_ he _ (6,63-10“34 Дж-с)(3,00-108 м-с-1)(6,02-1023:
Е 347 000 Дж • моль " 1
Излучение с такой длиной волны называется ультрафиолетовым светом.
X = 4,5 • 102 нм; 4,4 • 10 “ 19 Дж • фотон ~ 1; v = 2,2 • 104 см1.
К.Э. = £36Оо — £5200 = ^с\~у л )
\Л3600 Л-5200/
1
Е = hv =
= 3,45-Ю-7 м
К.Э. = —mv2 = (6,63 10 - 34)(3,00-108..
2 \3,610
= 1,70-10“ 19 Дж
у(9,11 10 " 31 кг) v2 = 1,70-10“ 19 Дж
1
5,2-10-7
v = 6,11 • 105 м-с - 1
0,544 эВ атом " 1.
Линии серии Лаймана имеют конечное и = 1.
ЮЗОООсм’1 = 109 678 см _ 1 f-Д- - ДД
1 103 000
= 1 -----—— = 0,06089
и2 109 678
п2 = 16,42
п = 4.
Приложение 6
510
11. X = —у—-г- = 4,70-10 7 м (или 4,70-102 нм). 7л тее
12. v = 109678J Д-- Д-) = 15233 см" 1
\22 З2 J
Эта линия относится к серии Бальмера.
X = Д = 6,56 • 10 -5 см (или 6,56 • 10 ”7 м) v
13. 0,66 эВ атом Ч
14. v = 109 678| Д- - Д-) = 5 322 см" 1 \ 3 4 /
v = vc = (5 332 см-r)(3,00-1О10 см-с"1) = 1,60-1014 с"1
15. —0,85 эВ-атом-1.
2 12
16. г„ = и2а0, поэтому 2,12 А = (2)2а0 и г4 = 42 - = 8,48 А.
17.
2рг 31 3dXI п = 2,1 = \
19. и = 3, / = 2, m = 2, 1, 0, - 1, - 2.
20. I = 0, 1, 2,..., (и — 1), поэтому для п = 4 возможны следующие значе-
ния: I = 0, 1, 2, 3.
21. Серия с и = 7, 8 и т.д. -» и = 6 в Be3 + ; линия с минимальной энергией обусловлена переходом п = 7 -> и = 6; для п = 7 возможны 98
комбинаций, для и = 6 возможны 72 комбинации.
22. Квантовое число т принимает целочисленные значения от + I до — I, поэтому для I = 3 магнитное число т = 3, 2, 1, 0, — 1, — 2, — 3. Этот электрон называется /-электроном.
23. и = 4; / = 3; m = 3, 2, 1, 0, - 1. - 2. - 3: s = + г/2 и - 1/,.
24. X = Д—. Из гл. 3 известно, что
mv
3(8,314)(300)
------------=- = 136/
4,0026-10 -3
м-с
Ответы на задачи
511
4,0026 -10 3 кг моль
6,022-1023
6,626 IO’34
= 6,647 10 ‘ 27 кг
= 7,292-10“ 11 м
Х (6,647-10 ~27)1367 mv = (6,647 • 10“ 27)1367 = 9,086-10“ 24 кг-м-с h (Ax)(Amr) > —— 4л
Ах = 1,0-10 11 м
т =
6,626-10“ 34 4л(1,0-10“ 13)
= 5,27 -10 24 кг • м с
Неопределенность импульса больше половины его значения.
25. X = 1,27-10“11 м; Ар — 0,5310-23 кгмс-1; р = 5,2-10-23 кг-м-с-1; неопределенность импульса составляет около одной десятой его значения,
Глава 9
1. а) Са: ls22s22p63s23p64s2; б) Mg2+: ls22s22p6.
2. Р: ls22s22p63s23p3 (р1р1р1, 3 неспаренных электрона)
Na: ls22s22p63s1
As: ls22s22p63s23p64s23d104p3(p1p1p1, 3 неспаренных электрона)
С-: ls22s23p3 (plpip1)
О + : то же самое, что и С ’
3. С: 2 неспаренных электрона; F: 1 неспаренный электрон; Ne: неспаренных электронов нет.
4. a) As: ls22s22p63s23p64s23d104p3
б) Со2 + : ls22s22p63s23p64s°3d7
в) Си: ls22s22p63s2 3p64s'3d10
г) S2 " : ls22s22p63s23p6
д) Кг: ls22s22p63s23p64s23d104p6
е) С: ls22s22p2
ж) W: Is22s22р63s2Зр64s23d104р65s24Л105р66s24/145d4
з) Н + : 0
и) Н - : 1s2
к) Cl~: ls22s22p63s23p6
5. ls22s22p4 как для ^О, так и для 7|О.
6. а) Возбужденное состояние.
б) Запрещенное состояние (нарушается принцип Паули).
в) Основное состояние.
г) Возбужденное состояние.
д) Возбужденное состояние.
е) Возбужденное состояние (можно обосновать).
7. а) Конфигурация невозможна (запрещена принципом Паули).
б) Конфигурация невозможна (запрещена принципом Паули).
Приложение 6
512
в) Основное состояние (Ti).
г) Конфигурация невозможна (запрещена принципом Паули).
д) Возбужденное состояние (Fe).
е) Возбужденное состояние (Li).
ж) Возбужденное состояние (Са).
з) Основное состояние (О).
и) Конфигурация невозможна (2Л-орбиталей не существует).
8. а) Нейтральный атом, возбужденное состояние.
б) Анион, основное состояние.
в) Нейтральный атом, основное состояние.
г) Нейтральный атом, запрещенное состояние.
д) Нейтральный атом, запрещенное состояние.
е) Катион, возбужденное состояние.
ж) Анион, возбужденное состояние.
з) Катион, невозможное состояние.
и) Нейтральный атом, основное состояние.
к) Катион, основное состояние.
9. Li: Is22s1
Lu: ls22s22p63s23p64s23rf104p65s24<Z105pe6s24/145<i1
La: ls22s22p63s23p64s23d104p65s24d105p66s25d1
Lr. ls22s22p63s23p64s23ei104p65s24J105p66s24/145^106p67s25/146^1
Li+: Is2
Lu3+: ls22s22p63s23p64s23J104p65sz4J105p64/14
La3+ : ls22s22p63s23p64s23d104p65s24d1°5p6
Lr3 + : lsz2s22p63s23p64s23d104p65s24d105p66s24/145d106p65/14
10. Согласно сделанному в задаче предположению, благородные газы должны были бы иметь порядковые номера 2, 10, 28, 60, 110 и т.д., поскольку каждая оболочка может включать 2и2 электронов (2, 8, 18, 32, 50 и т. д.). На самом деле благородные газы имеют порядковые номера 2, 10, 18, 36, 54 и 86.
11. Согласно сделанному в задаче предположению, первые два благородных газа должны были бы иметь порядковые номера 2 и 6.
12. Ро должен иметь энергию ионизации приблизительно 800 кДж • моль- \ a At-приблизительно 900 кДж моль-1.
13. Электронная конфигурация основного состояния этих частиц одинакова: ls22s22p6; относительные размеры частиц убывают в последовательности: N3- > О2- > F- > Ne > Na + .
14. а) Си, поскольку Zn имеет заполненные 4s- и 3J-yровни, а Си-валентную конфигурацию 4s1.
б) К, поскольку у Са заполненная 4.$-подоболочка, а К имеет валентную конфигурацию 4s1.
в) С1, поскольку он имеет больший заряд ядра.
г) Li, поскольку он имеет больший заряд ядра и оно экранируется только s-электронами.
д) Ge, поскольку As имеет полузаполненный 4р-уровень.
15. а) 18; б) элементы с конфигурациями 5g1 и 5g11; в) как минимум 9
Ответы на нМичи
513
А = ЭДна - [ОДн,) (ЭДС12)]1/2
А = 427,6 — (432 • 239,2)*'2
А = 106,1
с конфигурацией 5g9, а возможно, и 10 с конфигурацией 5g91di; в любом случае это рекордно высокое число неспаренных электронов; г) 0,544 эВ • атом “ 1; это должно быть меньше, чем энергия ионизации 5g-электрона в любом сверхпереходном элементе, поскольку в последних эффективный заряд ядра должен быть намного больше, чем + 1 (как в атоме водорода).
16- Ха = Хн = 0Д02А*'2
Ха - 2,20 = 0,102 (106,1)1/2
Xci = 3,25
17. а) График представляет собой прямую с тангенсом угла наклона, равным приблизительно 4,9-102 кДж-%-*.
б) XNe приблизительно равна 4; связь Ne—F должна быть ковалентной.
в) Сродство к электрону у Sr меньше, чем у Rb, поскольку у Sr заполнена 5з-орбиталь, а у Rb нет (присоединяемый к Sr электрон должен попадать на более высокий энергетический уровень). При переходе от Y к Ru и далее к Rh следует ожидать постепенного повышения сродства к электрону (поскольку по мере заполнения электронами ^-орбиталей происходит повышение эффективного заряда ядра). Pd имеет валентную конфигурацию 4d*°, поэтому ясно, что его сродство к электрону должно заметно уменьшиться, но причина дополнительного уменьшения сродства к электрону при переходе от Pd к Ag(4d*°5s*) непонятна. Резкое уменьшение сродства к электрону при переходе от Ag к Cd(4d*°5s2) можно было предсказать, поскольку электрон, присоединяемый к Cd, вынужден занимать 5р-орбиталь. Сродство к электрону для In(4d*°5s25p*) больше, чем для Cd, так как у индия эффективный заряд ядра.
18- Xf - Хн = 0,102а1'2
3,98 - Хн = 0,102 (320,3)
Хн = 2,15
больше
Д = ЭДнр-[(ЭДН!)(ЭДР2)]1/2 А = 565,3 -(432 -138,9)*/2
А = 320,3
Глава 10
1. +8(XeOJ; + 2(XeF2); +6(ХеО3); +4(XeFJ; +6(XeF6).
2. CsXeF7 дает ионы Cs+ и XeF^; степень окисления Хе равна + 6, поскольку степень окисления F равна —1. Cs2XeF8 дает ионы 2Cs+ и XeFg”; степень окисления Хе равна +6.
3. +3(Со); +4 (Pt); + 4(C); +4(S).
4. Исходя из того что степень окисления Н равна + 1, а для О она равна — 2, получим степени окисления для N:
в NH3 - 3, в NO + 2, в NO2" + 3, в N2H4 - 2, в NO2 + 4 и в NO3“ + 5.
5. Степень окисления платины + 2.
6. a) Au, 0 г) С, - 3; Н, + 1
б) 12, 0 д) Sn, + 2, О, - 2
в) Ва, + 2; Cl, - 1 е) Sn, + 4; О, - 2
17-696
ж) N, +1; 0,-2 м) Н, + 1; Cl, + 1; О, - 2
з) Р, +5, 0,-2 н) Н, + 1, С1, + 7; О, - 2
и) Mg, + 2; О, - 2; Н, + 1 о) Сг, + 6; 0,-2
к) Н, + 1; S, +4; 0,-2 п) С, +2; N, -3
л) Н, + 1; Те, + 6; О, - 2
7. +5(V); + 5(P); — 3(P); +3(N); -1(0); -1(H); -3(N); +3(N); + 5(1); + 1 (Ag).
8. MnO2 + 2Г + 4H+ -» Mn2+ + I2 + 2H2O
Суммарный ионный заряд в каждой части уравнения равен + 2. Иод окисляется (переходит из состояния окисления — 1 в 0), Мп восстанавливается (переходит из состояния окисления + 4 в +2).
9. а) МпО;, SO^’, SO^~, MnO4 ; б) Сг2О2’, HI, HI, Сг2О^; в) Cl2 во всех четырех ролях.
10. Са3Р2 + 6Н2О - 2РН3 + ЗСа(ОН)2
Степени окисления: Са, + 2; Р, — 3; Н, + 1; О, — 2.
11. 2MnO4 + 6Н+ + 5H2S - 2Мп2+ + 8Н2О + 5S; + 7(Мп);
S( — 2); Мп(+ 7); восстанавливается.
12. a) 3H2S + Сг2О2- + 8Н + - 3S + 2Сг3 + + 7Н2О
Степень окисления S возрастает от — 2 до 0; степень окисления Сг уменьшается от + 6 до +3.
б) 4NH3 + 5О2 -► 4NO + 6Н2О
Степень окисления N возрастает от — 3 до +2; степень окисления О уменьшается от 0 до — 2.
в) 3NO2~ + 2МпО4 + Н2О -► 3NO3 + 2МпО2 + 2ОН" Степень окисления N повышается от + 3 до +5; степень окисления Мп уменьшается от + 7 до +4.
г) 2NH3 + ОСГ -> N2H4 + СГ + Н2О
Степень окисления N повышается от — 3 до — 2; степень окисления С1 уменьшается от + 1 до — 1.
д) 2Н2 + OF2 -> Н2О + 2HF
Степень окисления Н возрастает от 0 до + 1; степень окисления О уменьшается от + 2 до — 2.
е) 3MnO2 + 4А1 -» 2А12О3 + ЗМп
Степень окисления А1 возрастает от 0 до +3; степень окисления Мп уменьшается от + 4 до 0.
13. а) 2МпО2 + 4КОН + О2 - 2К2МпО4 + 2Н2О
б) CuCl2~ + Си -> 2СиС1;
в) NO3 + 4Zn + 10Н+ -> NH4 + 4Zn2+ + ЗН2О
г) 2С1О2 + 2ОН" -> С1О2" + С1О3“ + Н2О
д) 6Fe2+ + Сг2О2- + 14Н+ -> 6Fe3+ + 2Сг3 + + 7Н2О
е) ЗСи + 2NO3 + 8Н+ -► ЗСи2+ + 2NO + 4Н2О
14. а) 2Н3РО4 + ЗСО^- 2РО3’ + ЗСО2 + ЗН2О
б) МпО2 + SO^- + Н2О -> Мп(ОН)2 + SOJ“
в) 5Н+ + Сг2ОГ + 3H2SO3 -> 2Cr3 + + 3HSO; + 4Н2О
Ответы nil задачи
515
г) ЗМпО; + 5V2 + + 4Н+ -» 3Mn2 + + 5VO^ + 4- 2H2O
д) 4FeSO4 + NaClO2 + 2H2SO4 -* 2Fe2(SO4)3 + NaCl + 2H2O e) 3KNO2 + 2KMnO4 + H2O -* 3KNO3 + 2MnO2 + 2KOH ж) 6MnO; + 6OH" + I" -> 6MnO4“ + IO3 + 3H2O 3) 8KMnO4 + 3NH3 - 3KNO3 + 8MnO2 + 5KOH + 2H2O
15. 0,0759 M; 52,68 r • экв." 1; 0,228н.; 158,04 г-экв.’ \ 0,0759 н.;
39,51 гэкв.’1, 0,304 н.; 31,61 гэкв.’1, 0,380 н.
3,52 г
16. а) М =---------------—г—--------= 0,120 моль л 1
(294,2 г • моль 1) (0,100 л)
б) Сг2О2” + 6е~ -» 2Сг3 + N = 6-0,120 = 0,720 н.
17. 52,3 г-экв.’ 1.
18. а) Н3РО4 -> Н2РО4; в реакции используется один Н + , поэтому для нее в 1 моле Н3РО4 содержится 1 экв.
б) РО4“ -> РО3’; фосфор приобретает 4 электрона, поэтому для данной реакции в 1 моле Н3РО4 содержится 4 экв.
19. а) 0,50 л; б) 0,50 л; в) 0,17 л; г) 0,25 л.
20. a) TiO2+ + 2ОН’ - TiO2 + Н2О N = 2 -0,10 = 0,20 н.
б) TiO2+ -» Ti3+ ; Ti приобретает 1 электрон; N = 1-0,10 = 0,10 н. в)ТЮ2+ + 2Н+ -> Ti4+ + Н2О N = 2-0,10 = 0,20 н.
21. а) 0,02 н.; б) 0,02 н.
22. 6КОН + ЗС12 + KI ->• 6КС1 + КЮ3 + ЗН2О (0,025 л) (0,10 н.) = 0,0025 экв. KI = 0,0025 экв. С12 С12 + 2е~ -> 2С1’
0,0025 экв. С12
Поэтому -----------------—г- = 0,00125 моля С12
2 экв. - моль
При нормальных условиях объем равен 0,00125-22,414 = 0,0280 л. 23. 3,13 • 10 “ 4 моля.
24. 2MnO; + 5H2S + 6Н+ - 2Мп2 + + 5S + 8Н2О = v2n2
(50 мл) N = (70 мл) (0,05)
N = 0,07 н. МпО4
МпО4 + 5е" -» Мп2 +
0,07
Поэтому М = —-— = 0,014 моль-л .
25. 0,0125 М.
26. 5H2SO3 + 2Ю3 -> 5SOJ" + I2 + 8Н+ + Н2О FjNj = ^2^2
V- 0,25 = 425 мл -0,10
V = 50 мл
27. а) +7(Мп) в МпО;; +2(Мп) в Мп2+; 4- 3(C) в (СООН)2; +4(С) в СО2; б) 2МпО; + 5(СООН)2 + 6Н+ -► 2Мп2+ -I- 10СО2 + 8Н2О; в) КМпО4 :158,04 г-моль’1, 31,61 г-экв.’1; (СООН)2:90,04 г-моль’1, 45,02 г-экв.’1; г) 0,004 моля; д) 0,04 экв.; е) 0,500 н.; ж) 0,05 М; з) 1,34 г.
17»
Глава 11
1. Na-; С-; Si-; : Cl •; Ca2+; K+; :Ar:; :C1:; : S2:’
2. :O::O: ’:C::O: Li-Li+ :C::N:
3. :Cl—CB; :N=N=; -N=O:; H—Cl:; NO имеет один неспаренный электрон и должен быть парамагнитным.
4. . н ‘
: Cl : Ba2t : Cl : Н : Р : Н Н : N : Н : С1 :
Н Н
Н : О d :
Н : 0 :
Н : 0 : 0 : Я
О : : N : О : : О : N : : О
Н
Н
I
H-Si-H; :S=C=S:;
I
Н
•С1 = О: С1-О: ";С1 =
II II " I
:О :О :():
•0
0.......................0
:С1 = О: «-» :С1 = О: :С1-О:
6- : 0 : Н
: 0 : Вг : О : Н : Si : Н
: О : Н
: С1 : + Н
: Cl : Р : Cl : Н : С : С1 :
: С1 : : С1 :
: F :
: F : В : F :
: F :
7- д:
.. II ..
:О = Хе = О:
II
О:
:F: i©Z.
:F—Хе—F:
:F —Хе — F:
:6 = Хе = О: II :О
F —Хе —F
0..
:Хе—F:
:F
:Ё:
I.. ..
Хе—F:
“I '
:F:
OiV.eCff'bl -kJ iih ’.}< i;
Длина связи Хе—F в XeF4 должна быть короче длины связи I—Т в IF;.
.. : F ;
........ ..... • р i 4
: F : N : F : : F : Р : F : ..’^P-pF:
" : F : " : F : : F Z |
.. •• .. . г .
У PF5 в образование связей могут вовлекаться ЗЛ-орбитали на атоме Р. Атом N не имеет 2Л-орбиталей. Молекула OF2 может существовать, так как имеет электронную структуру
:O:F:
:F:
но в молекулах OF4 и OF6 атом О был бы окружен больше, чем октетом электронов, а он не имеет вакантных орбиталей с близкой энергией, поэтому такие молекулы должны быть неустойчивыми. В отличие от этого атом S имеет доступные по энергии вакантные ЗЛ-орбитали и может расселять на них 10 электронов (в SF4) или 12 электронов (в SF6), поэтому все перечисленные в задаче молекулы SFX могут существовать.
':О=С=О: :S = O: ®S—б® «• ®S=6:
В связях С—О преобладает ковалентный характер; молекула СО2 должна иметь линейное строение, a SO2-изогнутое.
10. Н:С::С:Н
Связь в С2Н2 должна быть короче и прочнее, чем в С2Н4, поскольку в С2Н2 атомами углерода обобществляются три пары электронов, а в С2Н4-только две пары.
п.е _ _...
'9 * плюс две эквивалентные резонансные структуры,
каждая связь I—О имеет порядок 1|
б:
0.. II ..
:<Э—1 = 0: плюс 3 эквивалентные резонансные структуры, каж-
II дая связь I—О имеет порядок 1|
:О: ..
I О:©
.0 I—б’ плюс 5 эквивалентных резонансных структур, каж-
©’.q/ || "© дая связь I—О имеет порядок 1|
©^ :О
>: га 6 51s
Длина связи I—О должна возрастать в следующем ряду ионов: ю; < ю3- < ЮГ
12. S:: S Энергия связи в молекуле S2 должна быть больше, чем в молекуле С12, поскольку в S2 обобществляются две пары электронов, а в С12 — только одна пара.
13. Для молекулы BF3
:F—В—F: плюс небольшой вклад от трех эквивалентных резонанс-| " ных структур типа
;F:
.. 0 ©
:F— B = F:
" I
:F:
Для иона NO3
:O—N = O: O —N —O: — ():
- I - II - I "
:O: О О:
••© •• -0
BF3 и NO3-изоэлектронные частицы.
14. :C"N:’ :C::O:
Длина связи в CO меньше, чем в СО2, поскольку в СО обобществляются три пары электронов, а в СО2 между каждой парой атомов обобществляются только две пары электронов.
15.
a) :F— ВИ <5):S = S: в) .Cl—СК г):р=р:
..0 ©..
d):N=C—О: +* :N=C=O=
0 © •© ©• © ••
е) :C=N-О: «-> :C=N=O:
Вклад последней резонансной структуры невелик, поскольку она обладает маловероятным разделением зарядов (— 2 на С).
ж ) [-СК] [Ве]2+[-С1-] з) :S — C = S: и)см задачу 13
К ) см. текст
л) %—С=6: С—О? «-»:б=с — О?
О /Hotft i hcJ kWilMh
519
- I - I T
W) -F-C-F: H):Br-Si-Br: o) :F-B^F:
A " :L "
n):Cl—N — Cl: p):F—P—F: c) H —С—H m):S —F:
" I - ' I - | | -
:Cl= :F: H :F:
a):O=Xc=d: ф)<м. задачу 9 z) :F—S—F: ц) [Na]+[:O:]2-[Na] +
II -r I
:O • • :F:
ч)см задачу $ m):F—N = N — F: щ) [Cs] + [:F:]* э) [Sr]2+ [:Q: ]2-
16.
a) • N : : О : e) 0 : N : : О О : : N : О :
6) : О : : С : : О : . g . . 6 .'
в) : с ; • О : (С, -1; О, +1) ж) О : N : О О : : N : О :
г) Н : Cl : (Н, 6+; С1, 6-] .
; 2- \ : ° : ..
<) ) Ва2+ : О : : О : N : : О
17. ” +
:O=N = O« (порядок связи 2)
®. ®. .. ,
N — О: •<"* N = O* (порядок связи 1$)
II I
.. ..© .. ,
N — О: *-> N=O: (порядок связи /j)
Длина связи N—О должна изменяться в такой последовательности: no2+ < NO2 л no2
18.
НХ \„/ Хн Нх \ / н Dz D
I I
н н
19‘ [°:С=Х:]-; [:S=C=N°]-; [9n = ® = N?]-;
[:S=C=O.]
20. Формольные заряды (-1)( + 1) (0) (0) (+1)(-1)
а) Н : С : N ; ; N : Н : С : : N :: N :
Н Н
21. a) Ag + , льюисова кислота; NH3, льюисово основание; б) HF(H + ), льюисова кислота; CjHjOj, льюисово основание.
22. Триметилфосфин является льюисовым основанием. Он позволяет не-поделенной паре электронов, локализованной на атоме Р, сместиться к атому О.
23. Н .Q. Н .у;0
I / I / '
н—С—С « н—с—с
„ Ze । X
24. : N J С : S : ‘ N : : С : : S
Первая структура имеет тройную связь С—N и простую связь С—S; вторая структура имеет две двойные связи.
|| О Связь I—О короче других, поскольку она
Н — 0—1 — О—Н имеет двоесвязный характер.
Н
26. (НО)5Ю более сильная кислота, чем Те(ОН)б, так как содержит один атом кислорода без присоединенного к нему атома водорода. (Кроме того, центральный атом имеет более высокую степень окисления.)
27. а) линейная; б) плоская тригональная; в) Т-образная; г) плоская тригональная; д) тетраэдрическая; е) тетраэдрическая; ж) изогнутая;
Ответы на зиЛичи
521
з) октаэдрическая; и) тригонально-пирамидальная; к) изогнутая; л) квадратно-пирамидальная; м) изогнутая; н) изогнутая.
28. СН4: СЧ = 4, тетраэдрическое
BF3: СЧ = 3,плоское тригональное
NF3: СЧ = 4, тетраэдрическое (но форма молекулы пирамидальная)
IC1; : СЧ = 6, октаэдрическое (но форма молекулы плоская квадратная)
Н2О:СЧ = 4, тетраэдрическое (но форма молекулы изогнутая)
29. ВгО3 (тригонально-пирамидальное), СНС13 (тетраэдрическое), СЮ4 (тетраэдрическое), H2S (изогнутое).
30. а) СО2" д) сю;
б) BF3 е) SOi“
в) NH3 ж) ВеН2
г) С1О3- з) Н2О
31. Н3С— (тетраэдрическое); —С— (плоское тригональное); связь С—ОН должна иметь большую длину, чем связь С=О.
Глава 12
1- KK(as)1.
2. Порядок связи в Li2 равен ‘/2. Этот ион парамагнитный (имеет один неспаренный электрон).
3. КК(стх)2(ст*)2(лхО,)4(ог)2(л*х j,)1. Молекула NO имеет один неспаренный электрон на молекулярной орбитали л* (или л*) и должна быть парамагнитной; льюисова структура и молекулярно-орбитальная конфигурация согласуются (обе предсказывают один неспаренный электрон), энергия связи в NO должна быть меньше, чем в NO+ (порядок связи в NO 2|, а в NO+ 3).
4. О1КК(о,)2(о*)2(а2)2(лх,у)4(л*,)4
Частица диамагнитна (не содержит неспаренных электронов). Связь в ней слабее, чем в О2, из-за наличия двух дополнительных разрыхляющих электронов.
О2": КК (os)2 (о*)2 (о,)2 (лх у)4 (л*,)3
Частица парамагнитна (содержит один неспаренный электрон). Связь в ней слабее, чем в О2, из-за наличия одного дополнительного разрыхляющего электрона.
5. P2:KLKL(os)2(as*)2(Kx,/(oz)2
Молекула не имеет неспаренных электронов. Порядок связи равен 3. Энергия связи в Р2 должна быть больше, чем в S2 (порядок связи в S2 равен 2). Молекула Р2 должна иметь меньшую длину связи, чем молекула S2.
6. NF: KK(os)2(as*)2(oz)2(Kx.y)4(K*J2
Два неспаренных электрона. Порядок связи 2.
NF+ : КК (os)2 (os*)2 (о2)2 (лх.,)4 (лх*/
Один неспаренный электрон. Порядок связи 2|.
NF’: KK (cts)2 (ст*)2 (ctz)2 (лх>,)4 (it*,)3
Один неспаренный электрон. Порядок связи 1|.
Все частицы парамагнитны.
Последовательность изменения длин связей должна быть такой:
NF - > NF > NF +
7. NF + должен иметь большую энергию связи, чем NF (для NF + порядок связи равен 2|, а для NF он равен 2).
8. С12 : KLKL(cts)2 (ст*)2 (стг)2 (лх >.)4 (лх* ,)3
Порядок связи равен Ц. Молекулярный ион содержит один неспаренный электрон и, следовательно, парамагнитен. Его энергия связи должна быть больше, чем у С12, где на один разрыхляющий электрон больше.
9. Вг^ : ...(л* у)4 (ст*)1. Этот молекулярный ион имеет один неспаренный электрон и, следовательно, парамагнитен.
10. SO : KLK (ст/ (ст?)2 (ст/ (лх>/ (я* х>,)2
Частица имеет два неспаренных электрона и порядок связи 2.
11. РО имеет один неспаренный электрон [,...(л*х /]; порядок связи в РО равен 2|. Порядок связи в SO равен 2, поэтому энергия связи в РО должна быть больше, чем в SO, а длина связи, наоборот, меньше.
12. Энергия связи в молекуле F2 необычно мала (например, по сравнению с С12); это принято объяснять межэлектронным отталкиванием между 2р(гс)-орбиталями, которое в F2 особенно велико из-за малого размера атома F. Длина связи в F2 меньше, чем в В2, потому что заряд ядра больше; возрастание заряда ядра неполностью компенсируется дополнительными электронами.
13. Состояние (ст)1 (ст*)1 должно быть расположено ниже по энергии, поскольку возбуждение двух электронов с образованием конфигурации (ст*)2 требует намного больше энергии; нижнее возбужденное состояние имеет два неспаренных электрона и является парамагнитным.
14. Диаграмма молекулярных орбиталей молекулы ОН должна напоминать таковую для HF (см. рис. 12-12). На л-орбитали должен быть неспаренный электрон, локализованный на атоме кислорода.
15. В зоне HF + неспаренный электрон находится на несвязывающей молекулярной орбитали лх (или л,); электронная конфигурация HF+: ... (ст)2 (лх>/; орбиталь лх (или л,) локализована на атоме F (это его 2рх- или 2р,-орбиталь); электронная конфигурация HF-: ...(ст)2^,,)4^*)1.
Порядок связи в HF - равен |, а в HF + равен 1; HF + должен иметь большую энергию связи, чем HF' ; HF “ имеет один неспаренный электрон и потому парамагнитен.
16. HF и HI должны иметь дипольный момент. Остальные молекулы симметричны.
HF: Црассч = (4,80- 1О-10 эл.-ст.ед.)(0,917 КГ10 м) = 4,40 Д
HI: Црассч = (4,80-10-10 эл.-ст.ед.)(1,61 • 10“10 м) = 7,73 Д
17. Степень ионности связи в молекуле СО равна 2,1%.
18. Степень ионности связи = (p^cn/PpaccJ 100%
KI: црасет = (4,80) (3,05)= 14,64 Д
Шксп = 9,24 Д
9,24
Степень ионности =--------100% = 63,1%
14,64
ВаО :|±рассч = (4,80) (1,94) = 9,31 Д (в предположении одновалентной связи)
Мэксп = 7,95 Д
7,95
Степень ионности = ^-jp-100% = 85,4%
19. Степень ионности связи в НС1 17%, в CsCl 75%, в Т1С1 29%; CsCl должен иметь наибольшую степень ионности связи, поскольку атомы щелочных металлов обладают очень низкой электроотрицательностью (а валентный s-электрон у атома тяжелого элемента группы IA, каковым является С, находится далеко от ядра, вследствие чего его энергия ионизации очень низка); ионный характер связи в этих молекулах повышается по мере уменьшения электроотрицательности атома, присоединенного к С1:Хн = 2,20; Хп = 2,04; Хс = 0,79.
20. Степень ионности связи должна возрастать с увеличением разности электроотрицательностей, поэтому она увеличивается в ряду C1F < < BrF < IF. Наибольший дипольный момент должен быть у IF.
21. Степень ионности связи в CsH больше, чем в LiH (xcs = 0,79, Хы = = 0,98); CsH должен иметь больший дипольный момент.
Глава 13
1. sp3.
2. a) CS2: атом С sp-гибридизован; молекула линейная, неполярная из-за наличия симметрии.
б) СВг4: атом С лр3-гибридизован; молекула тетраэдрическая, неполярная из-за наличия симметрии.
в) PF3: атом Р хр3-гибридизован, молекула пирамидальная, полярная, г) Н2Те: атом Те «р3-гибридизован, молекула изогнутая, полярная, д) SiH4: атом Si зр3-гибридизован, молекула тетраэдрическая, неполярная из-за наличия симметрии.
е) SF2: атом S хр3-гибридизован, молекула изогнутая, полярная.
ж) BF3: атом В др2-гибридизован, молекула плоская тригональная, неполярная из-за наличия симметрии.
з) OF2: атом О зр3-гибридизован, молекула изогнутая, полярная. 3. sp2: плоская тригональная.
4. Атом углерода в группе Н3С-хр3-гибридизован; расположение связей вокруг него тетраэдрическое. Атом углерода в группе С=О зр2-гибридизован, расположение связей вокруг него плоское тригональ
ное. Связь С—О в группе —С—О—Н самая длинная, поскольку это простая связь.
5. sp2.
6. Центральный атом углерода в молекуле CH3C=N sp-гибридизован; группа С—C=N линейная.
7. а) Локализованные молекулярные орбитали
ст-Связи С—О образованы молекулярными орбита-0—Q Q лями sp(C) + р(О); неподеленные пары 2s2 (О) не показаны; аналогичная орбитальная картина может быть нарисована для NO?
2 а-Связи N—О образованы молекулярными орбита-
лями + Р(О), неподеленные пары 2s2 (О) не ©N-----(У показаны; для NO? и SO2 можно изобразить ана-
% логичную орбитальную картину, но в этих случаях ООО несвязывающая орбиталь sp2 на атоме N (или S)
О полностью занята электронами
б) СО2-линейная неполярная молекула; NO?-линейная частица;
NO2-изогнутая полярная молекула; NO?-изогнутая частица;
SO2-изогнутая полярная молекула.
в) СО2(0); NO? (0); NO2(1); NO? (0); SO2(0).
г) NO? (180°); NO? (120°).
д) Относительные длины связи N—О таковы: NO? < NO2 х NO?
8. Орбитальная картина строения N3 подобна показанной в ответе к задаче 7 для СО2. Центральный атом N sp-гибридизован. Имеется один неспаренный электрон. Молекула неполярна. Связь N—N в N3 длиннее, чем в N2 (так как она двойная, а не тройная).
9. _
Неподеленная пара на зр3-ор6итали Связь зр3 (О) + l-s(H)
н н н
10. Боразин изоэлектронен с бензолом и должен иметь близкое к последнему молекулярное строение. Атомы бора и азота чередуются в шестичленном кольце и 5р2-гибридизованы. тс-Электроны в боразинё должны быть сильнее локализованы (на атомах азота), чем в бензоле.
11. См. сказанное о NO? или SO2 в ответе к задаче 7; центральный атом О в молекуле О3 5р2-гибридизован; между каждой парой атомов О—О имеется (в среднем) | л-связи.
Ошнеты 'ni Ш'.'ачи
525
Атом N яр2-гибридизован. Молекулярные ионы CNO ~ и NCO “ должны иметь строение, подобное СО2. Центральный атом в них .sp-гибридизован.
Аллильный катион имеет плоское строение, все атомы С хр2-гибриди-зованы. Вакантная в С3Н3 р-орбиталь принимает на себя в аллильном радикале С3Н5 один электрон, а в аллильном анионе-два электрона. Образование л-связей обусловливает плоское строение всех трех частиц (С3Н3, С3Н5 и C3Hj).
14. В молекуле CH3F атом С должен быть хр3-гибридизован. Угол Н—С—F приблизительно равен 109,5°.
Неподеленная пара на $р3-орйитали
0N --------Связь sp3-M.s(H)
нх хн
Молекулярный ион NHJ должен иметь изогнутую форму.
16. В молекуле N2H4 каждый атом N должен быть 5р3-гибридизован. Эта молекула не будет плоской. Между атомами азота должна быть простая связь.
17. У молекулы COS дипольный момент больше, чем у CS2; молекула CS2 линейная, и диполи связей С5 + —S8' точно компенсируются; в линейной молекуле COS диполь связи С8 + —О8 “ больше, чем у С8 + —S8 “, поэтому в ней имеется результирующий дипольный момент
(О-С—S)
18. Поскольку молекула CS2 линейная, диполи связей С—S компенсируют друг друга, и результирующий дипольный момент молекулы равен нулю. Молекула H2S изогнутая, поэтому диполи связей Н—S не компенсируют друг друга. Молекула имеет результирующий дипольный момент.
19. Разность электроотрицательностей атомов Н и О довольно значительна, поэтому диполи связей Н8 + —О8 “ велики; электроотрицательности атомов О и F отличаются не так сильно, поэтому диполи связей F8"— О8+ малы.
20. Все три молекулы имеют тригонально-пирамидальное строение (атомы N и Р хр3-гибридизованы), поэтому дипольные моменты их связей не компенсируют друг друга. Молекула NH3 имеет максимальный дипольный момент, поскольку связь N—Н самая полярная (она образована атомами с наибольшей разностью электроотрицательностей); менее полярны связи Р—Н и минимальная полярность у связи N—F.
21. Se намного менее электроотрицателен, чем О, поэтому диполь связи Н—О больше диполя связи Н—Se.
22. Этан должен иметь большую энергию ионизации, чем этилен. хр2-Ги-бридизованный атом С в этилене имеет большую электроотрицательность, чем $р3-гибридизованный атом С в этане, и способен прочнее удерживать ст-электроны, однако л-электроны в этилене связаны менее прочно.
23. Энергия ионизации этилена меньше, чем у ацетилена.
О
II
24. В ст-системе молекулы Н—С—Н принимают участие хр2-гибридные орбитали атома углерода и sp-гибридные орбитали атома О. Между атомами С и О в результате перекрывания их р-орбиталей образуется л-связь, и на л-орбитали атома О имеется неподеленная пара электронов. Слабая длинноволновая полоса в спектре поглощения Н2СО соответствует переходу электрона с несвязывающего уровня неподелен-ной пары на л*-уровень.
25. Бензол должен поглощать свет с меньшей энергией, чем этилен, поскольку расстояние между высшим заполненным и низшим незаполненным л-уровнями в бензоле меньше (см. обсуждение энергетических уровней бензола в разд. 13-5, а уровней этилена в разд. 13-7).
26. Катион-радикал бензола С6Н^ имеет всего пять л-электронов, т.е. валентную конфигурацию (л3)2 (л2)2 (Л3)1. Система «сопряженных двойных связей» частично разрушается, и длина волны поглощаемого света должна уменьшиться (энергия поглощаемого света возрастает).
Глава 14
1. Вандерваальсовы силы притяжения больше между более тяжелыми атомами галогенов.
Ответы >id задачи 527
3. 1,4 кДж • моль “1; 4,0 А (Кг-Кг).
4. По кривой, построенной при ответе на предыдущую задачу, можно определить, что энергия вавдерваальсова взаимодействия при межъядерном расстоянии 2,95 А приблизительно равна 17 кДж моль "2. Преобладающую роль в этом взаимодействии играет отталкивание, что обусловливает малую энергию связи. Энергия вандерваальсова взаимодействия составляет только около. 4,5% от полной энергии связи. При межъядерном расстоянии 2 А энергия должна достигать 440 кДж • моль ~1; при 1 А-около 1400 кДж -моль “2. Такие взаимодействия отталкивания больше, чем энергия связи.
5. Каждый ион Na+ в NaCl(TB.) окружен шестью ионами С1“ ; отталкивания С1 “ —О " в кристалле препятствуют тому, чтобы расстояние Na + С1 “ было столь же небольшим, как в NaCl(r.), где не существует отталкивания С1 ~ —С1 ~.
6. Прочность л-связи в СО2 значительно выше, чем в SiO2 (это различие намного сильнее, чем для ст-связей). Молекулы СО2 не слишком сильно взаимодействуют друг с другом; в кристалле кварца каждый атом Si связан с четырьмя атомами О, а каждый атом О-с двумя атомами Si (ст-связями).
7. а) Неметаллическая ковалентная связь, б) Вандерваальсова связь, в) Углеродные слои в графите могут скользить относительно друг друга, так как связь между ними невелика; плавление требует большой перестройки сильных связей в слоях углеродных атомов, поэтому температура плавления графита- столь же высока, как и у алмаза, г) Льюисова структура графита
д) л-Электроны подвижны и обусловливают высокую электропроводность графита.
8. Кристалл ZnS может рассматриваться как ковалентная каркасная структура, в которой каждый атом Zn связан с четырьмя атомами S, а каждый атом S связан с четырьмя атомами Zn. Сульфид цинка обнаруживает свойства диэлектрика, хотя и не в такой мере, как алмаз. Вместе с тем его можно рассматривать как ионный кристалл, состоящий из ионов Zn2 + и S2 “ с координационным числом 4 каждый. Наконец, его можно рассматривать и как металлическую структуру (гексагональную плотноупакованную), построенную из анионов S2", в которой половина тетраэдрических дырок (вакансий) занята ионами Zn2 + .
9. См. обсуждение в разд. 14-6.
10. BF3 и NF3 должны образовывать молекулярные кристаллы. В NF3 важнейшую роль играют диполь-дипольные и лондоновские (вандер-ваальсовы) силы. В BF3, кроме того, должны проявляться льюисовы кислотно-основные взаимодействия вследствие того, что неподеленные пары электронов на атомах фтора одной молекулы частично локируются к атомам В других молекул.
11. BF3 должен иметь более высокую температуру плавления, и это действительно так ( — 127°С); NF3 плавится при — 207°С.
12. Е = hv
502000 Дж• моль " 1 з
---------------------= (6,63 -10 34 Дж с) v 6,022 -1023
v = 1,26-1015 с"1
v = — = 4,20 104 см ' 1
X
Ультрафиолетовая часть спектра.
13. Для Si: v = 2,63-1014 Гц; X = 1,14-103 нм; v = 8,77-103 см-1; инфракрасная часть спектра. Для Ge: v= 1,5-1014 Гц; X = 2,0-103 нм; v = = 5,0 103см-1; инфракрасная часть спектра.
Глава 15
1. Движение опилок превращается в колебания атомов внутри металла.
2. Работа, выполняемая тормозящим автомобилем (его энергия движения), превращается в теплоту, выделяемую в тормозных колодках, шинах и мостовой. Кинетическая энергия автомобиля расходуется на усиление движения молекул тормозных колодок, шин и мостовой.
3. а) Н2(г.) + 72О2(г.) -» Н2О(ж.); теплота выделяется;
б) — 285,8 кДж моль “ *.
4. а) 49,028 кДж • моль “ 1.
б) бС(графит) 4- ЗН2(г.) -» СбН6(ж.). Теплота поглощается.
в) Реакция сгорания: С6Н6 + 7|О2 -> 6СО2 4- ЗН2О(ж.)
ДЯ = 6(- 393,51) + 3(- 285,84) - (49,028) = - 3267,61 кДж-моль”1.
5. а) СН3СНО(ж.) + 2jO2(r.) - 2СО2(г.) + 2Н2О(ж.)
б) —1164 кДж; — 582 кДж; —466 кДж.
в) — 26,4 кДж • г ” 1.
г) — 193 кДж-моль”'.
6. a) CO(NH2)2(tb.) 4- 1|О2(г.) - СО2(г.) 4-N2(r.) + 2Н2О(ж.)
б) — 632,2 кДж на моля О2, следовательно, —421,5 кДж на моль кислорода.
в) АЯ = - 632,2 = - 393,5 4- 0,0 + 2(- 285,8) - ДЯ°6р - 11(0,0); теплота
Ответы ни люини
529
образования мочевины: ДН°6р =— 332,9 кДж-моль 1 (табличное значение: — 333,2 кДж-моль-1).
7. а) СН3ОН(ж.) + 1|О2(г.) -► СО2(г.) + 2Н2О(ж.)
б) — 726,6 кДж • моль ” 1 метанола.
8. а) ДН = 2( - 393,51) + 3( - 285,84) - (- 277,63) - 2(0,0) = = — 1366,91 кДж моль-1.
б) С6Н12О6(тв.) + 6О2(г.) - 6СО2(г.) + 6Н2О(ж.)
АН = 6(- 393,51) + 6(- 285,84) - (- 1260) - 6(0,0) =
= —2816,1 кДж-моль'1.
— 1366,91 кДж
в) Для этанола: ----q?-------= — 29,67 кДж-г
— 2816,1 кДж
Для глюкозы: ----- -------- = —15,63 кДж-г
180,15 г
Следовательно, (40%-ная) водка дает 11,87 кДж-г-1, а глюкоза 15,63 кДж • г _
г) С6Н12О6(тв.) - 2С2Н5ОН(ж.) + 2СО2(г.)
ДН = 2( - 277,63) + 2( - 393,51) - ( - 1260) = - 82,28 кДж - моль ” 1 Таким образом, сжигание глюкозы дает гораздо больше энергии, чем ее сбраживание.
9. а) С8Н18(ж.) + 12|О2(г.) - 8СО2(г.) + 9Н2О(ж.)
ДН298 = - 5471 кДж моль-1 октана
б) С8Н18(ж.) + 8|О2(г.) - 8СО(г.) + 9Н2О(ж.)
ДН298 = — 3207 кДж-моль-1 октана
в) 8СО(г.) + 4О2(г.) -> 8СО2(г.); ДН^98 = - 2264 кДж
г) — 3207 кДж — 2264 кДж = — 5471 кДж. Аддитивность энтальпий реакций, или первый закон термодинамики.
, (19,7 • 109 л)(1,00 г-мл " ^(1000 мл• л “ *) _
10. а —---------^4—------------------------ = 1,09 Ю12 моля Н2О
18,02 г-моль" 1 2
Н2О(г.) -* Н2О(ж.),ДН = - 285,84 - (- 241,83) = - 44,01 кДж моль”1. Таким образом, полная энергия, выделяемая при образовании дождя, равна
(1,09-1012)(— 44,01) = - 4,80-1013 кДж
б) При взрыве 1 Мт ТНТ выделяется энергия, равная 4000- 10е кДж = = 4’10’ кДж, поэтому потребуется 12000 Мт ТНТ.
11. ДН298 = + 90 кДж-моль-1 NO.
12. СаСО3(тв.) + 2Н+ - Са2+ + СО2(г.) + Н2О(ж.)
ДН = - 542,96 + (- 393,51) + (- 285,84) - (- 1206,9) - 2 (0,0) = = - 15,41 кДж.
13. ДН%8 = + 50.5 кДж-моль-1 NiH4
N2H4°(3k.) + О2(г.) - N2(r.) +' 2Н2О(ж.)
ДН298 = - 622 кДж-моль 1 N2H4
14. а) М2Н4(ж.) + jN2O4(r.) 2Н2О(ж.) + Х(г.)
б) ДН = 2( - 285,84) 4- |(0,0) - 50,42 - 4(9,66) = - 626,93 кДж
в) М2Н4(ж.) 4- О2(г.) -> 2Н2О(ж.) 4- N2(r.)
Если в качестве окислителя гидразина вместо N2O4 использовать просто О2, выделяется меньшее количество теплоты, но всего на 4,83 кДж.
15. а) ДН298 = 4- 131,31 кДжмоль-1 углерода.
б) СО (г.) + |О2(г.) - СО2(г.)
Н2(г.) 4- |О2(г.) -» Н2О(ж.)
ДН°298 = - 568,83 кДж.
в) 1163 кДж.
16. а) В 100 л воздуха содержится 20 л О2. В реакции С 4- ^О2 -> СО образуется 40 л СО, а 80 л N2 проходит через печь, не вступая
в реакцию.
б) СО 4- |О2 -► СО2. Пользуясь газовым законом в форме п = PV
------, находим, что при 1 атм и 298 К в 100 л СО содержится
ДН = - 393,51 - (- 110,52) - |(0,0) = - 282,99 кДж • моль ' Следовательно, при сгорании 100 л СО выделяется количество теплоты 1157 кДж.
17. а) ДН298 = - 184 кДж моль” 1
б) ДН298 = - 188 кДж-моль-1
2С(г.) 4- 6Н(г.) 4- о(г.)
4-2992 кДж
—3180 кДж
2С(грофшп)4- ЗН2(г ) 4-4О2(г.)
—188 кДж
СН3ОСН3(г.)
18. 2С(графит) 4- 2Н2(г.) 4- |О2(г.) -► СН3СНО(г.) ДН = 2(718,4) 4- 4(217,9) 4- 247,5 - 4(413) - 1(348) - 1(728) = = 172,1 кДж-моль-1
с + с + н + н + н + н + о
2С (графитj + 2 H2(z.) + у 02(г.) +
-2728кДж
сн3рно
2556 кДж
Ответь., ай ммчи
531
Согласно приложению 3, ДЯ°о6р = - 166,4 кДж-моль - *. Расхождение составляет около 3,4%.
19. а) —82 кДж-моль-1; б) —24 кДж-моль-1; в) —33 кДж-моль-1. 20. а) ДЯ = 2(247,5) - 1(626,3) = - 131,3 кДж.
б) ДЯ = 2(468,6) - 1(626,3) - 2(247,5) = - 184,1 кДж.
в) ДЯ = - 2(472,6) = - 945,2 кДж.
г) ДЯ = 2(301) - 4(247,5) = - 388 кДж.
21. а) +93,6 кДж-моль-1.
б) + 51,4 кДж • моль - *. Изомеризация паров этанола требует меньшей затраты теплоты, поскольку вещество уже находится в газовой фазе.
в) + 47 кДж • моль - 1. Расхождение с ответом на вопрос (б) 4,4 кДж.
г) Связи С—С и О—Н в реагентах заменяются связями С—О и С—Н в продуктах. Прочность связей С—С и С—О соизмерима, но связь О—Н гораздо прочнее связи С—Н, поэтому для разрыва связей О—Н необходимо затратить внешнюю энергию.
22. а) ДЯ = 728 + 247,5 - 2(728) = -480,5 кДж.
Пользуясь значениями величин ДЯ°обр, находим
ДЯ = - 393,51 - ( - 110,52) = - 282,99 кДж
Расхождение очень велико. Метод энергий связей в данном случае неприменим.
б) С (графит) + |О2(г.) - СО (г.)
Согласно приложению 3, ДЯ°о6р = - 110,52 кДж-моль - х. Метод энергий связей дает ДЯо6р = 718,4 + 247,5 — 728 = +237,9 кДж-моль - г. С(графит) + О2(г.) -»• СО2(г.)
Согласно приложению 3, ДЯ°обр = — 393,51.
Метод энергий связи дает ДЯ°6р = 718,4 + 2(247,5) — 2(728) = —242,6. Предположение, что химическая связь в молекуле СО описывается валентной структурой С=О, менее точно, чем предположение, что химическая связь в молекуле СО2 описывается валентной структурой О=С=О.
23. ДЯ298 равно +75 кДж-моль-1 из термодинамических таблиц и + 105 кДж-моль из расчета методом энергий связей.
Энергия резонанса составляет 30 кДж-моль-1.
Резонансные структуры:
н н нч zH
Xc=cZ н с—с н
/ \ / / \ +/
н с=с н zc—с
нХ н н' н
н
П ;
Глава 16
1. Энтропия больше: а) в разбросанных картах; б) в несобранных частях; в) в исходных веществах.
2. Энтропия больше: а) в паровой фазе (более неупорядоченной), чем в жидкой; б) в паровой фазе, чем в твердой; в) в комбинации из трех пятаков вверх орлом и двух вверх решеткой, чем в комбинации из четырех пятаков вверх орлом и одного вверх решеткой; г) в смеси, чем в чистых веществах; д) в газообразном СО2, чем в его водном растворе.
3. а) Положительно, возрастает; б) положительно, возрастает; в) отрицательно, уменьшается; г) положительно, возрастает. Порядок возрастания энтропии в этих четырех процессах: (в) < (б) < (а) < (г).
4. Образование водородных связей в жидком HF понижает энтропию этого состояния.
5. а) Отрицательное: 3 моля газа превращаются в 2 моля газа; б) отрицательное: газ исчезает, а энтропии твердых тел приблизительно одинаковы; в) положительное: твердое вещество превращается в жидкость; г) положительное: твердое вещество превращается в газ; д) отрицательное: 3 моля газа превращаются в 1 моль газа и 2 моля жидкости.
6. a) ASa = 70,3 - 67,0— 4(205,0) = -99,2 энтр. ед.
Энтропия уменьшается, потому что газ превращается в твердое вещество.
б) AS° = 70,3 + 213,6 - 112,1 = + 171,8 энтр. ед.
Энтропия возрастает, потому что твердое вещество превращается в газ.
в) AS0 = 2(174,9) - 245,4 = + 104,4 энтр.ед.
Энтропия возрастает, потому что увеличивается число молей газа, г) AS° = 2(198,5) - 130,6 - 152,3 = + 114,1 энтр.ед.
Энтропия возрастает, потому что жидкость превращается в газ.
7. Вместо 1 моля жидкого Вг2 появляется 1 моль газообразного НВг.
8. Энтропия возрастает, потому что молекулы продукта сложнее (они ге-тероядерные), чем молекулы реагентов (гомоядерные). Однако это увеличение энтропии невелико.
9. a) AS° = - 25,5 Дж • К ~ 1 моль “1 = - 25,5 энтр. ед. • моль “ 1
б) Продукты более упорядочены, чем реагенты.
10. Любая химическая система стремится к состоянию с минимальной энергией и максимальной энтропией. В данной реакции роль энергии оказывается преобладающей (реакция сильно экзотермическая).
11. AS298 = + 11,6 энтр. ед. • моль “ 1.
12. Пользуясь данными приложения 3 для S°, находим AS° = 186,7 — - |(130,6) - 4(223,0) = 9,9 энтр.ед. Пользуясь данными для ДЯ°о6р и AG°o6p, находим
ДН° = - 92,31 кДж = AG° = - 95,26 кДж =
= - 92310 Дж = -95260 Дж
Ответы а
533
13.
14.
15.
16.
ДН° - AG°
АХ =-------------
Т
- 92310 + 95260
AGje8 АН298
^298
298 = 9,9 энтр. ед.
= + 329,2 кДж моль ~ 1
= + 490,5 кДж • моль “ 1
= +541,0 энтр.ед. моль-*, или Дж-К “ 1-моль “ 1
541,0-298
490,5 -----------= 329,3
1000
2Ag(TB.) + Hg2Cl2(TB.) -> 2AgCl(TB.) + 2Hg^.)
АН = 2(- 127,03) + 2(0,0) - 2(0,0) - (- 264,9) =
= + 10,84 кДж
AG° = 2( — 109,72) + 2(0,0) - 2(0,0) - (- 210,7) =
= - 8,74 кДж
AX° = 2(96,11) + 2(77,4) - 2(42,70) - 196 =
= 65,62 Дж-К”1
AH° - TAX° = 10,84 - 298(0,06562) = -8,72
Реакция должна протекать самопроизвольно (AG < 0). Изменение энтальпии противодействует самопроизвольному протеканию реакции (АН > 0), но изменение энтропии благоприятствует ему (АХ > 0) и играет преобладающую роль. Возрастание энтропии происходит потому, что в результате реакций вместо 1 моля твердого вещества образуются 2 моля жидкости.
AG298 = — 33,28 кДж • моль “ 1
[NH3]2
₽ав" [Н2]3 [N2] ’
AG° = 2( - 5,52) - 0,0 - 0,0 = - 11,04 кДж
Реакция должна протекать самопроизвольно.
АН° = 2(18) - 0,0 - 0,0 = + 36 кДж
Изменение энтальпии противодействует самопроизвольному протеканию реакции.
ДХ° = 2(247,4) - 223,0 - 117 = 154,8 Дж-К’1
Изменение энтропии благоприятствует самопроизвольному протеканию реакции.
Преобладающую роль играет энтропийный эффект.
AG
^равн
— RT In Нравн
11040 Дж лл^
------------— 4,46
(8,3141(298)
^равн 86,5
17. Na(TB.) < NaCl(TB.) < N2O4(tb.) < Вг2(ж.) < Вг2(г.)
18. С (алмаз) -> С (графит) AG = 0,0 — 2,866 = —2,866 кДж
Реакция самопроизвольная, но протекает чрезвычайно медленно. Для
достижения равновесия этой реакции требуются многие тысячи, а возможно, и миллионы лет (при нормальных условиях).
19. a) AG2gg = — 375,2 кДж; самопроизвольная, с большой движущей силой.
б) Скорость этой самопроизвольной реакции очень мала.
20. a) AG° = 2( - 384,03) + 0,0 - 2( - 541,0) - 0,0 = + 313,94 кДж.
Самопроизвольная реакция невозможна.
б) AG° = 0,0 + 2( - 318,2) - (- 219,0) - 0,0 = -417,4 кДж.
Самопроизвольная реакция возможна.
21. а) Нет. Кравн = 2,3 • 10 “ 37. Реакция благоприятствует образованию реагентов.
б) AG2gg = - 375,2 кДж-моль-1. Термодинамически эта реакция выгоднее предыдущей - она имеет большую Кравн. (Но на самом деле ацетилен является лишь одним из многих образуемых в этом случае продуктов.)
22. AG’ = ( - 394,38) + 2( - 237,19) - ( - 166,3) - |(0,0) = = 702,46 кДж
а) Реакция самопроизвольная.
In Кпавн =----------= 283,5
раон 8,314-298
Кравн = 1,3 10123
Реакция чрезвычайно сильно благоприятствует образованию продуктов.
б) Повышение давления приводит к возрастанию движущей силы реакции, потому что при протекании реакции слева направо (как записано уравнение) число молей газа уменьшается.
в) Повышение температуры должно привести к уменьшению движущей силы реакции, поскольку она экзотермическая.
23. АН273 = +6,01 кДж-моль-1
AS273 = + 22,0 энтр.ед.• моль - 1 = +1,22 энтр.ед.-г-1
AG°273 = 0
24. Н2О(ж.) - Н2О(г.)
а) АН° = - 241,83 - (- 285,84) = +44,01 кДж
AG° = - 228,59 - ( - 237,19) = + 8,60 кДж
AS° = 188,72 - 69,94 = + 118,78 Дж-К-1
б) а(г.) = рНгО; а(ж-) = 1-
АН - TAS = - RT In рНзО
дн AS0
In Pfj л —
RT R
44010 118,78 5298
In Рн q = + — = + 14,29
8,314 Т 8,314 Т
в) 50°С: In рн о = ~ + 14,29 = - 2,097
г 323
РнгО = 0,123 атм 5293
100°С: In рН;О = - + 14,29 = 0,0996
Рн2о = 1,Ю атм
25. а) ДН°353 = + 30,54 кДж-моль-1
AS353 = + 86,5 энтр.ед. моль-1
ag°353 = о
б) АЕ353 = + 27,6 кДж - моль - 1
в) ДЯ398 = + 33,90 кДж-моль-1
AG598 = +5,15 кДж-моль-1
Протеканию реакции благоприятствует повышение температуры, потому что в ней происходит поглощение теплоты.
26. Эксперимент 1 :<? = — 41,84 кДж, w = 0
А£° = q - w = - 41,84 кДж
ДН° = qp = - 41,84 кДж л ?°6р — 1673
AS = — = 298 = - 5,61 энтр. ед.
AG° = АН0 - ТА5° = - 41,84 - (298) (- 0,00561) = - 40,17 кДж
Эксперимент 2: q= —1,673 кДж. Величины А£°, AHU, AS°, AG° такие же, как в эксперименте 1, поскольку Е, Н, S, G являются функциями состояния.
w = q - ДЕ = - 1,673 - (- 41,84) = + 40,17 кДж
Глава 17
1 К
*• -гхравн
Лравн
Pnh,
Pn2Ph2 nl/2n3/2
= !,41
Pnh3
= 0,50
aso3 1,053
flso2ao2 " (0,0526) (0,0263)1/2
Коавн ’ (ПР)3
3- Кполн= = 5,1-10
Л-ДИСС
Да; AG = — 341 кДж.
4- анс1 = йрн3 = 5,0
Кравн = °рн3 ’ анс1 = 5,0 • 5,0 = 25
к — flH,O
6. Н2О(тв.) <=t Н2О(ж.). Повышение давления должно смешать равновесие в сторону более плотного жидкого состояния, в результате че-
го температура плавления льда понижается.
7. Экзотермической (AG298 = - 113 кДж); Кравп уменьшается при повышении Т; Кравн не зависит от давления или наличия катализатора.
8. При повышении температуры количество аммиака в равновесной смеси уменьшится, потому что реакция экзотермическая. При повышении давления количество аммиака в равновесной смеси должно возрасти, так как в правой части уравнения число молей газа меньше, чем в левой. При удалении части аммиака равновесие будет смещаться вправо и содержание азота уменьшится. Катализатор не повлияет на состав равновесной смеси.
9. АН298 = — 58,04 кДж; AG298 = — 5,394 кДж; Кравн = 8,82. При повышении Т количество N2O4 уменьшится; при повышении Р оно увеличится, а при увеличении V будет меньше. При добавлении Na2O образование N2O4 уменьшится, но Кравн не изменится.
10. РС15 РС13 + С12
Исходное число молей: и 0 0
Равновесное число молей :0,25л 0,75л 0,75л
Суммарное число молей: 1,75 л.
0,25л
Парциальное давление: Ppci, = —77— -2,00 атм = 0,286 атм
1,75л
0,75л
Ppci =--------2,00 атм = 0,857 атм
1,75л
Кравн =---7ГТ77---= 2,57 при температуре Т
и,Zoo
AG° = - RTlnKpaBH = - 286,3 + 0,0 - ( - 324,6) = 38,3 кДж
Кравн = 1,93-16-7 при 298 К
АН = - 306,4 + 0,0 - ( - 398,9) = 92,5 кДж
Реакция эндотермическая. Поэтому при повышении температуры Кравн должна возрастать. Т > 298 К.
11- Кравн = 8,22-ю*2
AG49g = +10,3 кДж
AG298 = + 16,8 кДж
(В данном случае 12 представляет собой газ, а не твердое вещество.) Кравн(298) = 1,15-10 J. Повышение Т благоприятствует протеканию реакции, так как она эндотермическая.
12. НСге Н + + Сге '
Ответы на еапачн
537
Кравн = [Нг^СГп ] = 1,0- 10- 10
равн [НСге]
Пусть [Н + ] = [Сге “ ] = у, тогда у2
= 1,0-10" 10
- 10,94
1,00 - у Допустим, что 1,00 — у s 1,00, тогда у2 = 1,0 -10 - 10, у = 1,0-10“ 5 = [Н + ] pH = 5,00 AG° = - КПпКравв AG° = - 8,314-298-In(1,0-10“ 10) = 57048 Дж = 57,05 кДж 13. AGj98 = + 80,5 кДж.
14. AG° = 0,0 + (- 372,5) - (- 399,6) = 27,1 кДж = - RTlnKpaBH 27100
равн - 8,314-298
Кравв = 1,78-10“ 5
По данным табл. 5-3, КраВН = 1,76 • 10 "5.
15. Коав„ = 1,78 • 10" 4; табличное значение К. = 1,77 10~4; pH = 2,45.
347 г л ” 1
При 20°С растворимость =----------------—- = 4,65 моль-л
74,55 г • моль
ПР = [К + ] [С1“] = 4,65-4,65 = 21,62
AG° = - RTlnK = - 8,314-293-In21,62 = 802
При 100°С растворимость = = 10,76
16.
- 7487 Дж
моль-л
ПР = 10,76-10,76 = 115,8 AG° = - 8,314-373-In 115,8
= - 14736 Дж
AG
/ AG\
/2
АН = 1 1
Т2 “ т?
- 14736 373
Г”
ЗТГ
- 7487 293
"1
293~
= 19115 Дж =
17.
18.
= 19,115 кДж
Процесс эндотермический.
а) Равновесие не смещается, Кравн прежняя, в) Смещается
вправо, ^paBH
к Лравн влево, Кравн возрастает, д) Равновесие и краВН РС13 + С1 0 па
РС15
Исходное число молей: и
Равновесное число молей: (1 — а)и Суммарное число молей: (1 + а)и. Обозначим полное давление Р, тогда
прежняя, б) Смещается влево, прежняя, г) Смещается остаются прежними.
‘2 о на
парциальные давления
Ppci, —
1 « р
1 +а
Рга3 - Pci2 - j + a
-------P ---------
1 + a / \ 1 + a
a2P
1 - or
P + KpaBH
Из задачи 10 известно, что при 25°С = 1,93 10 “7.
Следовательно,
, 1,93 10“ 7
а =----------------=-
1 + 1,93-10“ 7
а = 4,39 • 10 “ 4
19. Pn2o4 = 0,034 атм.
Глава 18
1. АН^в = + 34 кДж • моль " 1; AG398 = + 6 кДж • моль ' 1;
ASjgg = + 95 энтр.ед. моль “ *; 358 К; 364 К; 0,089 атм.
2. НСООН(ж.) <=> НСООН(г.)
АН = - 362,6 - (- 409,2) = 46,6 кДж
AG° = - 335,7 - (- 346) = 10,3 кДж
AS° = 251 - 129 = 122 Дж-К'1
AG° = - RTlnpt
pv = 0,0156 атм
По справочнику Ткип = 378,8 К.
3. С6Н6 имеет наибольшее р„, поскольку у него наименьшая свободная энергия испарения. Молекулы бензола не связаны друг с другом водородными связями.
4. ВС13(ж.)?±ВС13(г.)
АН° = - 395 - (- 418,4) = 23,4 кДж
AG° = - 380 - (- 379) = - 1 кДж
AS' = 289,9 - 209 = 80,9 Дж • К 1
pv = 1,50 атм
Ответы на нмичи
539
Паровая фаза является устойчивой формой существования ВС13 при 298 К.
5.
6.
Ткип~ AS' 80,9 289 К
По справочнику Ттп = 285,6 К.
37 кДж • моль ”1; 41,6 кДж моль " 1; относительная погрешность 11%.
(367 Дж-г"1)(Мг-моль’1) _
---------- -------------= 92 Дж - К • моль 1
М = 86
7. 0,082 атм; 349 К; 337 К.
8. AG° = ДН° - TAS° = - RT]np„.
Из разд. 18-1 известно, что ДН° = 44,01 кДж моль-1 и
ДХ= = 118,79 Дж К “ моль ~ \ тогда
44010 - Г(118,78) = - (8,314) Т (In 2)
откуда Т = 389,4 К. При повышенной температуре пища варится быстрее.
10.
200,6 г моль 1 .... з -з
V =----------------— = 14,75 cmj - моль
13,6 г-см-3
11.
12.
13.
14.
15.
16.
V г = 22414 см3 • моль 1 = 24467 cnW • моль 1
И = 40 см3 моль -1
Молярный объем в критической точке ближе к молярному жидкости.
0,083 атм; Хъ = 0,807; Хт = 0,193.
Л™.™ = Ра + Рв = + ^вР’в
1 атм = Хт (0,534 атм) + (1 — Хт)(1,34 атм)
Хт = 0,422
ВаС12, поскольку он диссоциирует на три иона.
20 г NaCl
-------------—т-2 ион моль = 0,684 моля ионов
58,44 г • моль
lOrMgCL
----------------3 ион-моль =0,315 моля ионов 95,22 г • моль - 1
20 г NaCl дают в растворе большее число частиц, чем 10 г поэтому NaCl оказывает большее влияние на коллигативные ва раствора.
АР = 0,20 атм.
Ар = А'дРв
0,11276 - 0,11066 = Хк (0,11276)
ХА = 0,0186
объему
MgCl2, свойст-
«А
А «А + «В
2,182 г
М гмоль-1 = 0,0186 2,182 100
М + 153,8
Отсюда М = 177 г моль-1. Из данных анализа находим, что соединения содержится
94,34 5,66
------- = 7,854 моля С и -------- = 5,615 моля Н
12,011 1,008
в 100 г
Молярное отношение компонентов равно 1,4:1, или 14:10. Это дает эмпирическую формулу соединения С14Н10. Ей соответствует молекулярная масса 178,23, следовательно, именно эта формула и является молекулярной формулой соединения.
17. ^ип = 2,5 град-моль-1.
10,0г ГЛЮКОЗЫ Л|1П -1
18. ---------------------= 0,139 моль кг
(180 г моль *) 0,400 кг
Из соотношения Тки|, = ктт находим
19.
20.
21.
22.
23.
Имеем
0,1250 =
О, 0,139
1,028--^-
М (0,100) кг
откуда М = 164,5 г моль \
NaCl: АТ= 6,36° (лучший антифриз)
СаС12: АТ= 5,03°
А Т^замерз ^замерз^ (ИЛИ А 7°пл ^п:г^)
273 - 263 с „ _.
т =------------= 5,38 моль-кг
1,86
(5,38m) (10,0 кг) (32,04 г-моль-1) = 1724 г
АТКИП = к^т = 0,52 • 5,38 = 2,80.
Следовательно, нормальная Ткип = 375,8 К.
128 г-моль-1; С10Н8.
В 100 г бензойной кислоты содержится
68,9
-------= 5,74 моля С
12,011
26,2
------= 1,64 моля О
16,00
4,96
------= 4,92 моля Н
1,008
Молярное отношение 3,5:1:3. Эмпирическая формула С7Н6О2.
Формульная масса 122,11.
В воде: ДТПЛ = 0,78 = 1,86 •
М 0,20 кг
Молекулярная формула С7Н6О2.
_ _ 1г
В бензоле: АТПЛ = 1,04 = 5,12 ————— пл М • 0,020 кг
Молекулярная формула С14Н12О4.
Бензойная кислота в бензоле должна димеризоваться посредством во-
дородных связей.
776 г-моль-1.
0,0702 г
15,3 = 40,0- M-QWQ4
М = 228
63,2
------= 5,26 моля С 12,01
8 8
—-— = 8,73 моля Н 1,008
—— = 1,75 моля О
16,0
Молярное отношение 3:5:1. Эмпирическая формула С3Н5О. Формульная масса 57,063. Молекулярная формула должна быть С12Н20О4. Молекулярная масса 25. 6,52 • 10“4 атм.
26. nV = n^RT; пх =
Масса • RT
Масса тс У М “ ~RT
(0,145 г)(0,08205 л атм-моль * К ') (298 К) П,ОЛ/,
М =____________________—-------„ ----------------= 35 800
0,0099 атм • 0,0100 л
Глава 19
1. +0,118 В; — 22,8 кДж • моль 1 С12.
2. AG = AG° + RTln (с2/С1)
0,1
AG = 0 + 8,314 298 - Ln
AG = - 5705 Дж-моль-1
AG = - па&8
- 5705
- 1 (96485)
= 0,0591 В
Левая часть гальванического элемента (с более низкой концентрацией) является анодом, а правая часть-катодом.
3. 0 В; +0,021 В.
4. После стадии (в) концентрации растворов А и Б снова уравниваются, но оказываются меньше исходных. Количество работы, которую можно получить на каждой стадии, постепенно уменьшается. В конце концов концентрации станут настолько низкими, что ток перестанет
вырабатываться.
5- %еобр = 0; ч'обп = 212 кДж; q =
6. a) Zn -» Zn24 + 2е
Mg2+ + 2е~ -> Mg
Zn + Mg2+ -» Zn2+ + Mg
6) Fe -» Fe2+ + 2e~
Cl2 + 2e~ -> 2C1"
Fe + Cl2 -> Fe2+ + 2СГ
- 3 кДж.
= + 0,76 В
S° = - 2,37 В
. «Г = - 1,61 В
Реакция не самопроизвольная
< Г = + 0,41 В
< Г = + 1,36 В
< Г = + 1,77
Реакция самопроизвольная
543
в) 4Ag -> 4Ag+ + 4e
O2 + 4H + + 4e ~ -> 2H2O
4Ag + O2 + 4H + -> 4Ag+ + 2H2O
8° = - 0,80 В
8a = + 1,23 В
= + 0,43 В
Реакция самопроизвольная
г) 2AgCl + 2е“ -> 2Ag + 2СГ 2СГ - Cl2 + 2е“
2AgCl -> 2Ag + Cl2
8° = + 0,22 В
8° = — 1,36 В
8° = - 1,14 В
Реакция не самопроизвольная
7. а) +1,10 В; б) +0,85 В; в) -0,72 В.
8. а) Электродная полуреакция протекает по уравнению CuS + 2е“ -»• Си + S2’ 8° = ?
Известно, что
Си -> Си2 + + 2е“ 8° = -0,34 В
CuS -> Си2+ + S2- 8° можно вычислить из ПР
Пользуясь табл. 5-7, находим, что для CuS ПР = 8 10 37. Из соотношения AG° = — Я Tin К = — п^8° можно определить
ЯПпК _ 8,314 • 298-In (8-10"37)
“ ~ 2-96485
Следовательно, для рассматриваемой электродной полуреакции 8° = - 1,07 - (- 0,34) = - 0,73 В
б) Электродная реакция протекает по уравнению Zn(NH3)2 + + 2е -> Zn + 4NH3
Из табл. 19-2 находим 8° = — 1,03 В.
9. a) 2Ag + Cu2+ -» 2Ag+ + Си, реакция протекает самопроизвольно в обратном направлении; б) —0,46В; в) направление электронного тока от Си к Ag.
10. a) Ni -> Ni2+ + 2е" 8° = +0,23 В
Sn2+ + 2е~ -> Sn 8° = -0,14 В
Ni + Sn2+ -> Ni2+ + Sn 8° = +0,09 В
Реакция протекает самопроизвольно в прямом направлении.
б) Ni-анод, Sn-катод.
в) 8° = + 0,09 В. 0,0592 0,010
г) 8 = 8° - —-----lg Q = + 0,09 - 0,0296 lg - = + 0,15 В
п 1,0
11. а) Электроны перемещаются от Sn к Ае: б) +0,36 В; в) +0,39 В.
П'.и< 6
12. PbO2 + 4H+ + 2e~ - Pb2 + + 2H2 О g° = + 1,46 В
Pb + SO2’ - PbSO4 + 2e" <T = +0,35 В
PbO2 + Pb + 4H+ + SO2- -> Pb2+ + PbSO4 + 2H2O g° = 1,81 В
Сокращенное обозначение этого гальванического элемента:
PbO2|H2SO4 (водн.)|РЬ8О4|РЬ
Полуреакция с РЬО2 является катодной полуреакцией. Электроны протекают во внешней цепи от РЬ к РЬО2.
13. а) +0,40 В; б) - 1,67 В.
14. Недостающие значения потенциалов равны + 1,36, +0,99 и +0,94 В соответственно.
а) Наилучшим окислителем является МпО4, наилучшим восстановителем-NO.
б) g° для восстановления МпО4 равен + 1,49 В, g° для окисления Au равен — 1,42 В, их сумма + 0,07 В. Да, реакция самопроизвольная, в) S° для восстановления HNO3 равен + 0,94 В, для окисления Au равен — 1,42 В, их сумма —0,48 В. Нет, реакция не самопроизвольная.
г) g для восстановления HNO3 равен + 0,94 В, g° для окисления Au в присутствии ионов О ” равен — 0,99, их сумма — 0,05 В. Нет, реакция не самопроизвольная.
д) g° для восстановления С12 равен + 1,36 В, g° для окисления Au равен — 1,42 В, их сумма — 0,06 В. Нет, реакция не самопроизвольная, е) g для восстановления С12 равен + 1,36 В, g для окисления Au в присутствии ионов С1' равен — 0,99 В, их сумма + 0,37 В. Да, реакция самопроизвольная.
ж) g для восстановления МпО4 равен + 1,49 В, g° для окисления С1“ равен — 1,36 В, их сумма + 0,13 В. Да, реакция самопроизвольная.
15. а) Да, Fe должно восстанавливать Fe3 + в Fe2+ (g° = + 1,18 В), б) К = 7,9 • 1039.
16. а) 2 [Ag + е " -> Ag] S° = + 0,80 В
H2SO3 + Н2О - SO2+ + 4Н+ + 2е“ <Г = -0,20 В
2Ag+ + H2SO4 + Н2О - 2Ag + SO2’ + 4Н+ <Г = + 0,60 В
б) Сокращенное обозначение гальванического элемента:
Pt|H2SO3, H2SO4||Ag+ |Ag
в) g° = + 0,60 В.
ng 2 • 0,60 Г) lg KpaBH ~ 0,0592 ~ 0,0592
Кравк = 2,0 • Ю20
0,0592 , Л
Д) g = g - -----------lg Q
n
Ответы ни задачи
545
n(g°-g) 2(0,60-0,51)
1е О =-------------=-----------------= 3,04
в v 0,0592 0,0592
Q = 1,1 • 103
17. a) Mg-сильнейший восстановитель; МпО^ -сильнейший окислитель.
б) Mg + С12 - Mg2 + + 2СГ
в) Mg|Mg2 + ||С12|С1
г) Mg является анодом. Катодом является какой-либо инертный элек-
18.
трод, например Pt, на котором адсорбирован С12. д) ga = + 3,73 В.
равн [С12]
a) Hg2+ + 2е~ -> 2Hg
Си - Си2+ + 2е~
Hg2+ + Си - 2Hg + Си2 +
б) Си|Си2+ ||Hg2+|Hg
Си
g° = + 0,80 В ga = - 0,34 В «Г = + 0,46 В
является анодом.
в) g° = + 0,46 В.
. . v ng° 2 • 0,46 Г) 1g Кравн =
^равн д) в = sa
0,0592 0,0592
= 3,2 1015
0,0592 , л п 0,0592 0,010
----’-----lg Q = 0,46-----------g —------
п 2 в 0,10
g = 0,49 В
19. Удаление из раствора ионов Си2 + в результате комплексообразования должно привести к уменьшению g°.
20. Zn -► Zn2+ + 2е~ g° = +0,76 В
Cu2+ + 2е“ - Си ga = +0,34 В
Zn + Си2+ Zn2+ + Си ga = + 1,10 В
По мере того как [Си2 + ] уменьшается, a [Zn2+] повышается, равновесие смещается влево и напряжение падает.
0,0592 g = g° -
lgQ =
(g° - g)n (1,10 - 1,00) 0,0592 “ 0,0592
= 3,38
21. g = 0,79 В
22. Fe2+ + 2e~ -> Fe Мп —► Mn2+ + 2e~
Fe2 + + Mn -» Fe + Mn2 +
Q = 2,4 • 103
ga = - 0,41 В
ga = + 1,03 В
ga = +0,62
g = ga
0,0592 n
ige
g° = 0,62 - 0,0296 lg
18-796
£ = 0,65 В
При.южение 6
546
23. а) & понижается вследствие образования Cu(NH3)4+.
б) S повышается вследствие образования Zn(NH3)4 + .
в) & понижается, поскольку комплекс Си устойчивее комплекса Zn.
г) S повышается вследствие образования ZnS, что приводит к удалению ионов Zn2+ из раствора.
д) Воздействия имеют противоположную направленность. Трудно
предсказать результат; возможно, повысится. и(<Г -<£) 24. lg Q = °’0592 2(1,10 - 1,05) _ Для 8 = 1,05 В lg Q = 0 0592 -— = ^9
Для = 1,00 В ige = 2(1,10 - 1,00) 0,0592 = 3,38
Для 8 = 0.90 В lg<2 = 2(1,10 - 0,90) 0,0592 = 6,76
25. 2Н2О2 - 2Н2О + О 2 8° = + 1,10 В.
26. 2 [Ag + + е “ -у Ag] Н2 -> 2Н+ + 2е - 8° = 8° -- + 0,80 В = 0,00 В
2Ag+ + Н2 -> 2Ag + 2Н + ё° = + 0,80 В
Q = 48,9
Q = 2,40 103
Q = 5,7 106
/ - = 0,80 - 0,0296 !g J [HJ " °’78
[Н + ]2 0,02
g 1,00 1,00 ~ 0,0296
pH = - 1g ГН +1 =------°’°2 - = - 0,34
Р 6L J (0,0296) (2)
27. Ag + + I' - Agl 8° = +0,95 В
ПР = 1,1 • 10“16
28. 2Ag+ + Н2 2Ag + 2Н +
Ag+ + Вг ~ AgBr S° = + 0,80 В
0 0592 (I)2
8 = 8° - -------lg Q = 0,80 - 0,02961g rt - = 0,072
n [Ag J 1
r . n - 0,728 lg [Ag ] ~ 00296.2 ~
- 12,3
[Ag + ] = 5,0- IO’13
HP = [Ag + ][Br-] = (5,0 10-13)(100)
HP = 5,0 • IQ-13
Ответь: на задачи
547
29. Легкость окисления возрастает в ряду Ni < Fe < Сг. Хром создает защитное покрытие в виде инертного слоя оксида хрома. Никель защищает железо пассивно, подобно краске или олову на консервной банке.
Глава 20
1. 2,07 г.
2. Из каждого моля соединения кобальта должны осаждаться 2 моля AgCl. Соединение описывается формулой [Со (NH3)5C1] С12, один атом О входит в координационную сферу, а два остальных-в виде ионов СГ.
3. п = 3, 4, 5, 6; т = 3. п = 4; т = 3.
4. [Pt(NH3)3C13]О будет давать два иона, Pt(NH3)3Cl3 и СГ. [Pt(NH3)3C1]О будет давать два иона, Pt(NH3)3Cl+ и СГ.
ClT^Pt—фкн3 или Cl,-^Pt^NH3 H3N-------Pt--NH3
октаэдрический комплекс
плоско-квадратный комплекс
5. Pt(NH3)6Cl4 > Co(NH3)6Cl3 > K2PtCl6 > Cr(NH3)4Cl3.
6. [Co(NH3)4C12] Вг бромид дихлоротетрамминкобальта(Ш) K3[Cr(CN)6] гексацианохромат(Ш) калия Na2 [СоС14] тетрахлорокобальтат(П) натрия
7. a) [Ni (Н2О)6] (С1О4)2 в) [Pt(NH3)4Cl2]SO4
8. а) [А1(Н2О)5ОН]С1 в) Na4[Fe(CN)6]
9. Два изомера:
б) [Pt (NH3)3 С13] Вг г) К3 [Fe (CN)S Cl] б) Na3 [Со (СО3)3] г) (NH4)3 [Co(NO2)6]
NH3
H3N I Cl
ci-
H3N-—"Cl
NH3
ci-
Cl
транс
54S
10. Пят. геометрических изомеров, один из которых имеет еще оптический изомер:
NH 3Ч и СК—Pt—-]
't-
п. Три изомера; одна пара (цис-изомеры); один (транс-изомер).
12. Пять геометрических изомеров: два транс-С\ и три цис-С1. Каждый из трех цис-изомеров имеет свою оптическую пару.
13. Если предположить, что соединение имеет октаэдрическую координацию с 3 молекулами NH3 и 2 молекулами Н2О, присоединенными к атому Fe (II), то оно должно иметь два структурных изомера: [Fe(NH3)3(H2O)2Cl]Br и [Fe(NH3)3 (Н2О)2Вг]С1;
для каждого структурного изомера существует по три геометрических изомера; в каждом случае один геометрический изомер является оптически активным (существует в виде пары оптических изомеров). 14. Из условия задачи не следуют выводы (а) и (б), вывод (в) неверен, вывод (г) верен и следует из наблюдаемых фактов, вывод (д) неверен. 15. K3CrF6; (t2a)3.
Ответы на задачи
549
16. Cr3+(d3): 3 неспаренных электрона и в сильном, и в слабом поле лигандов
Сг2+ (d4): 2 неспаренных электрона в сильном поле, 4 в слабом
Mn2+ (d5): 1 неспаренный электрон в сильном поле, 5 в слабом
Fe2+ (dbY 0 неспаренных электронов в сильном поле, 4 в слабом
Со3+ (db): 0 неспаренных электронов в сильном поле, 4 в слабом
Со2+ (d7): 1 неспаренный электрон в сильном поле, 3 в слабом
17.
Величина А, электронов.
1полн меньше, чем энергия, требуемая для спаривания двух
18.
Pt(NH3)2 С1„
внутриорбитальный комплекс
d2spl-eudpudnbte орбитали
Pt(NH3)2 С12
Pt(en) Cl2
Pt24 (da)
dsp2-гибридные орбитали
внутриорбитальные комплексы
19. (12в)3; 3; уменьшится.
Ре(Н2О)б+
(4 неспаренных электрона)
sp^d2-гибридные орбитали (внешнеорбиталъный комплекс)
Fe(CN)g
(О неспарениых электронов )
бгэр3~гибридные орбитали
( внутриороитолъныи комплекс)
сильное поле
Теория кристаллического поля основана в сущности на ионной модели, а теория валентных связей-на ковалентной модели связи. Любая из этих моделей позволяет объяснить число неспаренных электронов в комплексах. Теория кристаллического поля, кроме того, дает возможность частично предсказать спектр комплексов.
21. a) (dp)2(dxz, dj4(dxy)2; б) (t2g)2; в) (с)4 (12)4; г) (t2g)5 (eg)2; д) (t2g)6.
22. а) Геометрия комплекса октаэдрическая. Согласно теории валентных связей, Со использует для образования связей с лигандами гибридные d2sp3-орбитали, возникающие из его 3dxi _ yi-, Idp-, 4s- и 4р-орбиталей. б) Хлорид гексамминкобальта (III).
Пги сане 6
550
в) — —
низкоспиновыи, I I 1 1 1 I диамагнитный
(правильный вариант)
высокоспиновый
1 _J____ 1 парамагнитный
Ik _LL Л
Высокоспиновая форма предпочтительна, потому что расщепление уровней для Со2 + значительно меньше по сравнению с Со3+ (ср. акво-комплексы в табл. 20-7).
23. а) Плоско-квадратная, 5dx2_y\ 6s, 6рх, 6py(dsp2); б) тетрахлороплатинат (II) натрия; в) (dz>)2(dxz, dyz)4(dxy)2, диамагнитный; г) (t2g)6 (в октаэдрическом ионе PtClg" два электрона удалены с </гг-орбитали, а орбитали dx-,dy2,dxy(t2g) вырождены), диамагнитен.
24. Cu2 + + 4NH3 Cu(NH3)2 + Ко6р = = 1 ' Ю12
[CU J LINH3J
Для 0,10 MNH3: ц* = 1 ‘1()12; [Си2 + ] = 2,5 10~10
J lAMJ
Для 0,50 MNH3: = 1 ‘1Q12: [Си2 + ] = 4,0-10“13
Для 1,00 М NH3: ------------------=i-io12; [Си2 + ] = 2,5 10“14
[Си2 + ][1,00]4 J
Для 3,00 MNH3: = ЫО12. [Си2 + ] = 3,1 • 10’16
Для 10-15М Си2+: = 110‘2; №]4 = 25;
[NH3] = 2,24 Значит, если [Cu2 + ] < 1015, то [NH3] > 2,24.
25. pH = 2,5.
26. Мп2+ + ОН" Мп(ОН)+ К = 3 10*
Н2О Н+ + ОН"
Мп2+ + Н2О Мп(ОН)+ + Н +
[Мп(ОН) + ] [Н + ] _
[Мп2 + ]
[И—Ji = 3 10-10, [Н + ] = 5,5 10-6,
pH = 5,26
К = 1 10"14
К = 3 10~10
0,10
Ответы на задачу
551
Fe2 + + ОН' Fe(OH) +
Н2О ?± Н + + ОН “
Fe2+ + Н2О Fe(OH)+ + Н +
J = 1-10 7 В *, [Н + ] = 1,0-10“4, 0,10 L J
Ag+ + ОН ' AgOH
Н2О ?± Н + + он -
Ag+ + Н2О AgOH + Н +
ГН + ]2 11 г п в
-----J- = 1 • ю-11, ГН'] = 110'°,
0,10 ’ L J
К = 1 • ю7
К = 110“14
К =1- 10“7
pH = 4,00
К = 1 -103
К = 110“14
К = 110'11
pH = 6,00
По-видимому, кислотность повышается при возрастании положитель-
ного заряда иона.
27. Для реакции
Co(NH3)g+ + 6Н+ Со3 + + 6NH4
К = 3 1021. Ион Co(NH3)g+ не разлагается вследствие кинетической
инертности.
28. ПР = [Ва2+] [СгОГ] = 8,5 10'11 (из табл. 5-7).
В воде: [Ва2 + ] = [СгО4“] = 9,2 10“6
В 0,2 М растворе Ва2+: [СгО4 ] = ----= 4,2 • 10 10
ВаСгО4 + 2ру Ва(ру)2+ + СгО4“
[Ва(ру)2 + ] _ 12
[Ва2 + ][ру]2
^обр
Положим, что [Ва(ру)2 + ] = [ВаСгО4] й 0,10, тогда
-----’------= 4-Ю12
[Ва2 + ] (1,0)2
откуда [Ва2+] = 2,5 • 10“14 29. 3,4 • 10“7 М; 1,6 • 10“3 М; 13 М.
30. ПР = [Ag + ] [С1“] = 1,7 10“10 (из табл. 5-7)
В воде: [Ag + ] = [Cl ] = 1,3 10
^обр
[AgCl2“]
[Ag + ][C1“]2
= 1 • 102
[AgCl2“] = (1 • 102)(1,3 • 10“5)(1,3 10“5)2 = 2,2 • 10“13
Эта концентрация пренебрежимо мала по сравнению с 1,3 • 10“5 31. 2 • 10“21 М; 0,8 М; 0,10 М.
32. AgCl + 2ру Ag(py)2 + Cl = [Ag(py)2] = °6р [Ag + ][py]2
(из задачи 31)
[I pit hi.WHl/C h
Положим [Aglpy)^] = [AgCl] Jr 0,10, тогда
0Д0
-----’------= 1 IO10
(10-’) [py]2
откуда [py] = 0,10.
Глава 21
1. (a) = (г) = (д) и (б) = (e).
2. Молекулы (в), (г) и (д) представляют собой одно и то же соединение: н-гептан; б) 3-метилгексан; е) 3,3-диметилпентан.
3. н н н
I I I
а) Н—С—С—С—Н
I I I
н н н
пропан
Н н
с=с \ / с б’) н \
н н
ЧС=С=С\ н н
н—с=с—сн3
циклопропен
пропадиен-1,2
пропин
н н
I I н—с—с—н в) I I н—с—с—н
I I н н циклобутан
с—с—с—н I I н н
бутен-1
н сн3
\=с
Н СН3
2 -метилпропен
н н н
СН3 СНз
ЧС=С\ н н
цис-бутен-2
СНз Н
>-<
Н СНз
транс-бутен-2
н н
н—с—с—н
Н С1
хлорциклопропан
СНз ZC1
/с=с\
Н Н
цис-1- хлорпропен
СНз Н
/с=с\
Н С)
транс- 1-хлорпропен
Ответы на задачи
553
н сн3
хс=сх
Н С1
н н
с=с
Н СН2 —С1
2-хлорпропен
З-хлорпрапен
4.
н н н н н
I I I I I
с=с—с—с—с—н I III
н н н н
пентен-1
Н I н-с-н
н н
I I
н—с—с=с—с—н
I I I
НН н
2-метилбутен-2
5. (б) и (д).
пентен-2
2 -м ет ил бутен -1
3~метилбутен
циклопентан
6.
С\ ZC1
а) /“С.
С1 С1
атомы С зр2-гибридизованы
Вт
в) С1—С=С—С1 атомы С sp-гибридизовоны
атом С
зр3-гибридизован
н н н н н
I I I I I
атом С ьр^гибриЬизован
к V
F
атомы С &р3~гибридизованы
7. а) Бутен-1; б) бутин-1; в) 1,1-дифторэтен; г) метилбутен-2; д) 1,1-дихлоропропен; е) гексадиен-1,5; ж) /ираис-2-хлорбутен-2; з) 3-бромпен-тадиен-1,3; и) 2,5-диметилгексен-2; к) 4-хлорпентин-2; л) метилбензол, или толуол.
8. а) Метилбутаноат; б) гептанол-2; в) этил-и-пропиловый эфир; г) 3-ме-тилбутанон-2.
I i ри.юженис 6
554
сн3 н
°) ^С = С\
н сн2—сн2—сн3
а а
J) /С=с/
СН3 СНз
в)
н н
СНз
сн2 I
3) н2с=сн—сн2—сн—сн2—сн2—сн2—сн
е) СН, —СН2 —С = С —СН2 —СН3
н н
ж) \=CZ
I I
Н СНз
3} /С = С\
СНз СНз
Вг
I
и) Н2С = С — сн = сн2
10. а) СН4, СН3СН3 (С2Н6), СН3СН2СН3 (С3Н8), СН3СН2СН2СН3 (С4Н10), СН3СН2СН2СН2СН3 (С5Н12).
Общая формула С„Н2п + 2, где п = 1, 2, 3, 4, 5.
б) СН2=СН2 (С2Н4), СН2=СНСН3 (С3Н6), СН2=СНСН2СН3 (С4Н8), СН2=СНСН2СН2СН3 (С5Н10), СН2=СНСН2СН2СН2СН3 (С6Н12). Общая формула С„Н2„, где п = 2, 3, 4, 5, 6.
в) СН=СН(С2Н2), СН^ССН, (С,HJ, сн=ссн,снлс4нд СН=ССН2СН2СН3 (С5Н8), СН=ССН2СН2СН2СН3 (С6Н10).
Общая формула С„Н2п _ 2, где п = 2, 3, 4, 5, 6.
Ответы на задачи
555
г)
сн2—сн2 \н2
сн2—сн2
сн2—сн2
/СН2\ сн2 сн2
сн2—сн2
/СН2\ сн2 сн2
I I
сн2 сн2
/Х'СН2\
СН2 сн2
I I
СН2 сн2
сн2—сн2
Общая формула С„Н2„, где п = 3, 4, 5, 6, 7.
11. С4Н10; всего один изомер: СН3—СН,—СН,—СН3.
12. Мол. масса = 56,0, 85,7 вес.% С = 48,6 г-моль-1 С.
Молекулярная формула С4Н8. Структурные изомеры:
сн2—сн2 СН2=СНСН2СН3 СН3СН=СНСН3
сн2—сн2 сн2=с—сн3
сн3
Бутен-2 может иметь цис- и транс-изомеры:
н\ zH ^с=с сн3 \н3
13. СН3—СН2 —СН2—СН2 —СН2—СН2—ОН
гексанол-1
ОН
I сн3—сн2—сн2—сн2—сн—сн3 гексанол-2
ОН
I сн3—сн2—сн2—сн—сн2—сн3 гексанол-3
сн3
сн3—сн2—сн2—сн—сн2—он
2-метилпентанол-1
сн3 I сн3—сн2—сн—сн2—сн2—он
3-метпилпентанол-1
П pii.i4.'n<.c’>aiu 6
сн3 I сн3—сн—сн,—сн,—сн,—он
4-мет или ентанол- J
сн:1 он
сн3—сн2—сн2—с—сн3 сн3—сн,—сн—сн—сн3
СН;}
3 -метилпент анол - 2
2-метил пентанол-2
СНз
он сн
СНз —СН —СН, —СН—СНз СНз—СН, —СН—СН —СНз
4-метилпентанол-2
2-метилпентанол-З
сн3—сн2—с—сн,—сн3 сн3—сн2—с—сн2—он
СНз
З-метилпентанол-З
сн3
2,2-йиметилоутанол-1
СНз—СН2 —СН —СН2 —ОН
СНз —С —СН2 —СН2 —он
СНз СН;
СН3 СН;
СНз —С — сн —он
СНз —сн2 —с —он
СНз 2,3-диметилбутанол-2
СНз СНз
I I
сн3—сн—сн—сн2—он
2,3-Ъиметил^утанол -1
Ответы на задачи
557
14. у у
сн2=снсн2сн3 + н* - 1 Н20 1 * СН2—С—СН2СН3 —- СН2—С—сн2сн3 e 1 Н е°н2
н+ < И сн2—с—сн,—сн, ' 1 он
Согласно правилу Марковникова, продуктом является бутанол-1.
15. Тринадцать изомерных эфиров: дипропиловый эфир ди-1-метилэтиловый эфир 1-метилэтилпропиловый эфир бутилэтиловый эфир 1-метилпропилэтиловый эфир 2-метилпропилэтиловый эфир пентилметиловый эфир 1-метилбутилметиловый эфир 2-метилбутилметиловый эфир 3-метилбутилметиловый эфир 1,1-диметилпропилметиловый эфир 1,2-диметилпропилметиловый эфир 2,2-диметилпропилметиловый эфир Среди структурных изомеров возможны также спирты (см. задачу 13). Альдегиды, кетоны и карбоновые кислоты невозможны из-за числа имеющихся в наличии атомов Н.
16. а) Фенилэтиловый эфир;
б) диизопропиловый эфир;
в) метил-н-пропиловый эфир;
г) то же самое, что и (в).
17. а) Этилбензоат;
б) бензилпропионат;
в) н-пропилацетат;
г) метил-н-бутират.
Все эти соединения являются сложными эфирами, а (а) и (г)-изомеры. 18. См. задачу 8.
19. о)
^CH, O“Na+
СН3
ii
о
Вг
ОН
1! ри.'.ожение 6
55S
О —СН3
СН3 О
\ //
г) СН — С
СН3 С1
н
е) СН3 /-N\ /CHj
^сн2 сн2
СНз
СН2 /СНз к) СН2 —N + —СН2 ОН
СН3 СН2 ^сн3
СНз
л) H2N —сн—соон
Глава 22
1. а) Скорость =---Li = к ГА]2; б) к = 10 л моль- 1 -с ' 1;
at
в) 0,90 моль • л “ 1 • с ” 1.
2. а) Из экспериментов 2 и 3 следует, что когда [В] удваивается, скорость возрастает вчетверо. Из экспериментов 1 и 2 следует, что поскольку скорость возрастает в 12 раз, увеличение [А] в три раза приводит к возрастанию скорости тоже в 3 раза. Следовательно, скорость = = к[А][В]2. б) Скорость = 300 моль-л 1С 1 = к (0,10 моль-л ') х х (0,20 моль-л-1)2; к = 7,5 104 моль'2-л2-с-1.
Ответы на задачи
559
3. а) Скорость = fcpNO рС1 (уравнение имеет второй порядок по NO, первый порядок по С12 и в целом третий порядок).
б) fc = 4,0-10-2 атм-2 с-1.
4. Скорость = fcpo2P2NO-
[С2Н4]
5. а) Скорость = к2
[C2H2J
[с,н6]
б) Скорость = /с2
jc2h4j
, г , [Н2О]2[О2]2'3
1a*2J
г) Скорость = к2 [NO2]2[O2]1/2
6. Если реакция имеет первый порядок, то In [транс] = In [транс]0 — kt. Посмотрим, удовлетворяют ли экспериментальные данные этому уравнению. 1п[транс]0 = In 1,00 = 0, поэтому
— In [транс] — In 0,90 — In 0,81
t ~ 10 = 20
- In 0,73
30
= 0,0105
Таким образом, реакция действительно имеет первый порядок, причем к = 0,0105 мин-1. Если разложилось 50% транс-изомера, то
- In 0,50 к =----------= 0,0105 и t = 66,0 мин
t
7. 0,9 мин.
8. Если [NO] возрастает вдвое, скорость увеличивается вчетверо. Если [Н2] возрастает вдвое, скорость тоже удваивается. Следовательно, скорость = k[NO]2[H2].
9. Стехиометрическое уравнение реакции не дает сведений о ее кинетическом уравнении.
10. Реакция имеет общий второй порядок, первый порядок по I ~ и первый порядок по ОС1 “.
11. Реакция имеет минус первый порядок по концентрации ОН-, т.е. скорость зависит от концентрации по закону [ОН - ] - 1.
12. In = - kt = - (2,2-10-5 с-1)(90 мин)(60 с-мин-1) =
[SO2Cl2J0
= -0,1188
Следовательно, должно разложиться 11%.
13. к = 1 мин - *.
14. Скорость = k[NH3] ln[NH3] = ln[NH3]0 - kt
[NH,], r
При.10 ncei'.l/е о
560
, , 1,993
к. = — In----------
1 2,000
, , 1,987
к-, = — In---------
2 2,000
= 3,51-10 " 3 с
— = 3,26 -10 - 3 с“ 1
2
Средняя к = 3,38 • 10 "3 с " 1.
15. 3,6 102 с; 1,1 103 с.
, „ - Е/RT к2
к = Ze J , поэтому если скорость удваивается, то — = 2, и, следо-к,
16.
вательно,
2 _ Ze~EJRT>
Ze~EJKT'-
Логарифмируя это соотношение, получим
Е / Е \
1п2 = 0,693 =-------— ---------—
RT2 \ R1\ J
где Tt = 300 К и Т2 = 310 К.
Имеем 0,693 R7\ Т2 = (Т2 — 1\)Еа, откуда
0,693 - (8,314) • (300 • 310)
Е„ =--------—-----гтт--------= 5,36 10 Дж
а 310 - 300
17. 79,5 кДж-моль-1.
18. Постройте график зависимости Ink от 1/7^ должна получиться прямая линия с тангенсом угла наклона — EajR.
к In к Т 1/Т
7,87-10“ 7 - 14,06 273 0,00366
3,46-10“ 5 - 10,27 298 0,00336
1,35-Ю14 -8,91 308 0,00325
4,98-10“ 4 -7,60 318 0,00314
1,50-10 3 -6,50 328 0,00305
4,87 -10 3 -5,32 338 0,00296
График оказывается достаточно точно прямолинейным. Тангенс угла наклона можно определить по любым двум его точкам.
А1пк — Еа
Д(1/Т) = R
- 14,06 + 5,32 Еа
0,00366 - 0,00296 “ “ 8,314 Еа = 103800 Дж, или 103,8 кДж-моль'1 19. 4400%.
20. к = Ze , поэтому
561
ln_^ = Ja________Ea_= EAT2 ~ Tt)
1П kj Rl\ RT2 RT\T2
k2 _ 103000(373 - 318) _ П 6,2-10-4 “ 8,314-373-318
k2 = 312,5(6,2 - IO 4) = 0,194 c-1
21.
22.
23.
На большой высоте над уровнем моря вода кипит при более низкой температуре. Поэтому, согласно уравнению Аррениуса, константа скорости для реакции коагуляции должна быть меньше (и скорость реакции ниже), чем на уровне моря.
Куб с ребром 1,00 смо имеет площадь поверхности 6 1,00 см2 = = 6 (108 А)2 = 61016 А2. Если один атом кислорода вступает в реакцию на каждые 10 А2 поверхности, это означает, что всего реагирует 6-1015 атомов кислорода и образуется 6 • 1015 молекул NiO. 6-Ю15
Выделяемое при этом количество теплоты равно & ^гз молей-248 кДж моль - 1 = 2,48 • 10 - 6 кДж. Согласно закону Дюлонга и Пти, произведение атомной массы на удельную теплоемкость равно ~ 25, по-25
этому для никеля -—г = 0,43 Дж • К -1 • г - *. Масса кубика никеля с реб-58,7
ром 1,00 см равна 9 г, поэтому повышение его температуры должно 2,48 • 10 - 3 Дж
быть равно ——------------:---;—-— = 6,4 -10 К. Таким образом,
(0,43 Дж• К- 1-г- *)-9 г
температура кубика останется равной 25°С. Общая поверхность измельченных кубиков окажется равной
(1015)(6 • 10 - 5 см)2(1016 А2-см-2) = 6-1021 А2
Это означает, что в реакцию вступит 6 1О20 атомов кислорода, т. е. 6-1020
образуется столько же молекул NiO и выделится & '248 КДЖ =
= 0,248 кДж теплоты.
248
Повышение температуры должно составить К, следова-
тельно, температура повысится до 89°С.
0,269 с.
he he
Е = hv = —, откуда X = —. Л ih
Для Н2, Е = 432 кДж-моль-1 (из приложения 3)
(6,63 10 - 34 Дж-с)(3,00-108 м-с - ‘)(6,02-1023)
X =-------------------------------:-----------= 2,78 -10 м
432000 Дж-моль 1
Для С12 Е = 243 кДж моль - 1 _ (6,63 -10 “ 34)(3,00 -108)(6,02 -1023 “ 243000
= 4,93-IO-7 м
19-796
[Jри и>.ЖСЧ11С 6 562
25. AG° = 411,7 кДж; К^вк = 1072; разложение бензола включает разрыв углерод-углеродных связей, и энергия активации этого процесса очень велика.
26. а) Стадия (2) является скоростьопределяющей.
Скорость = /с2 [NO2] [NO3]
[NO2][NO3]
Из стадии (1) L г = К
[N2O5]
С учетом этого соотношения имеем
/с,
Скорость = — [N2O5] = k[N2O5]
К
б) 1П г[^5] = In0,1 = - (5-10 -4)t [N2O5]0
t = 4,6 103 с, или 1,28 ч
27. Стадия (б).
28. Стадия (3) является скоростьопределяющей.
Скорость = /с2[Вг~][Н2ВгО3].
Из стадий (1) и (2) следует
<,[ВгО3][Н + ]2 = к-^ЩВгО4]
Комбинируя эти соотношения, получим к к
Скорость = - [BrO3 ] [Н + ]2 [Вг “ ] =
= fc[BrO3] [Н + ]2 [Вг - ]
29. Механизм реакции включает вытеснение молекулы воды из [Сг(Н2О)6]2 + ионом СГ от [Co(NH3)5C1]2 + , что приводит к образованию активированного комплекса [Co(NH3)sCl]2 + —-[Сг(Н2О)5]2 + с последующей диссоциацией мостикового активированного комплекса и образованием [Co(NH3)5]2+ и [Сг(Н2О)5С1]2 + (другими слезами, от Сг и Со переходит атом С1). В водном растворе Co(NH3)2 + теряет свои лиганды NH3 и образует Со(Н2О)| + . Комплексный ион Сг(Н2О)5С12 + кинетически инертен (он содержит ион Сг3 + ) и не обменивает свой ион С1 “ на радиоактивные ионы С1 “, имеющиеся в растворе.
Глава 23
1. 27А1; 64Zn или 64Си.
2. a) 22*Ra - 1Не + 2^Rn
б) - 4N + _?е
в) [?Ne - 4F + +?е
г) 33As + _°е -> ]]Ge
д) 17?Lu - ^Hf + i’e
е) - 3lon + ^Kr + 13lBa
Ответы на задачи
563
ж) 27С0 + - ®?Со + }Н
з) 4F + }Н -> + 1Не
и) 40 + ?Н -> 4N + 1Не
к) “Mg + Jh - 4Не + f^Ne
3. a) 4?Sb - 4gSn + + ?e
6) 4S -> ЙС1 + _?e
в) 2“Ra - 222Rn + 4He
r) 7Be 7Li
4. a = 4He, P- = _?e. Поэтому процесс распада должен быть таким: 2itu Л 23°Th Д 2ifRa Д 222Rn Д 4«Ро Д 2hPb Д 4tBi д
- 4°Т1 Д 4§Pb Д 4°Bi Д 4°Ро Д 2°*рь
5. а) 5,51 -10 - 13 кг; б) 30 500 молей СН4.
6. 2 }Н = 2 • 1,007276 = 2,014552 а. е. м.
2 о« = 2 • 1,008665 = 2,017330 а. е. м.
4,031882 а.е. м.
Масса ядра гелия = 4,00260 — (2• 0,0005486) = 4,001503 а.е.м.
Дефект массы = 4,031882 — 4,001503 = 0,030379 а. е. м.
(0,030379)(1,49244-10“10)(6,022045-1023) = 2,73032-1012 Дж-моль'1
he 1
X = — = --
Е v
откуда
v = (2,73032 109 кДж моль-1) • (83,593 см-1 • кДж-1 • моль) =
= 2,2824-1011 см-1
Следовательно, X = 4,3814-10 12 см.
7.
8.
9.
10.
11.
Ядро атома гелия имеет радиус, равный
1,33 -10 — 13 (4)1/3 см = 2,11-10“ 13 см.
а) 7,65 МэВ нуклон-4 б) 8,51 МэВ нуклон-1; в) 7,84 МэВ• нуклон-1; г) 8,46 МэВ-нуклон-4 д) 7,94 МэВ-нуклон-1.
22Na -» “Ne + +°е (кроме того, испускается еще один электрон из электронной оболочки атома). Масса продуктов = 21,991385 + + 0,000549 + 0,000549 = 21,992483 а.е.м. Поскольку это меньше, чем масса 22Na, реакция возможна.
0,677 А.
, = = _L = (6,626-10- 34 Дж-с)
Е тс (9,110• 10- 31 кг)(2,998 • 108 м-с" ‘) ’ ’ М’
2 "F: испускание позитрона или захват электрона
18F: испускание позитрона или захват электрона
21F: испускание электрона
19*
0,693 Г1'2 - к
Для 235U- к = 9,8 10- 10 год 1
Д 7,1 • 108 Для 238U- к 0,693
= 1,5-10- 10 год - 1
Д ' ‘ 4,5-109 1п#т - к, [U]o
следовательно,
Г235и] ,П[-и]о ~(9’810 - 10)(4,5Ю9) = - 4,41
- 0.0122 [235U]O г238и] 1п [238и]0 " (1,5 10 г238и] [238U]O - 0,500 - 1О)(4,5 • 109) = - 0,693
Таким образом, если имеется образец массой, например, 100 г, содержащий 99,28 г 238U и 0,72 г 235U, то 4,5-109 лет назад он должен был
содержать
0 72 99 28
- -= 59,0т 235U и — 198,6 г 238U
0,0122 0,500
Это соответствовало бы такому относительному содержанию изото-
13.
14.
пов:
59,0
---1—100 = 23% 235U и 257,6
1,91 -10“ 8 г; 19400 распад • мин “ 1.
0,693
198,6
---—.100 = 77% 238U
257,6
Г1/2 -
0,693
14,8 ч
= 0,0468 ч - 1
к =
In — = In 0,1 = - (0,0468) г, по
t = 49,2 ч = 2,05 сут
15. 66,7 ч.
16. In — = — kt, к имеет размерность: распад• атом “ 1 с «о
565
Следовательно,
(3.608 -10'° г ' 1 • с ~‘)(226 г • моль ~ Ч ,,
А = - -___----------------—j-------- = 1,354-10й атом“ 1-с
6,022-1023 атом-моль 1
0.693
-— = 5,12-Ю10 с = 1623 года
Г1/2 “
17. 0,537 W
18. —-
™а
W т 5Д9~г
4
исход ।
,4
'^кс-печ
9-Ю9 мин - 1
5,09 г
------------------- - 1 = 9,8 -103
1,8Ю5 мин-1
1 г
= 50 000 г
50,0 кг
—-------100 = 70,6% Н,О
70,8 кт ° 2
19. Возраст саркофага 3940 лет.
20. Высокое содержание 14С должно быть обусловлено ядерными испытаниями в Тихом океане, поэтому в данном случае нельзя полагаться на метод радиоактивной датировки при помощи 14С.
21. 1,50-10'' лет.
22 (200 МэВ атом-^ЦО6 эВ МэВ"‘)(1,602 10~19 Дж-эВ"1) х
235 г-моль-1
х (6,022 • Ю23 атом моль 3) = 8,21 • 1О10 Дж • г 1 = 8,21 • 107 кДж-г
С + () - —* С О 2
— 393,5 кДж • моль “ 1 ,
АН =--------------------,---= - 32,76 кДж - г - 1
12,01 г-моль"1
(8,21-107 кДж-г-1)454 г
= 1,138 -10 г кокса = 1138 т кокса
2,76 кДж г 1
Методическое пособие для преподавателей
Бен Б. Честейн (Веп. В. Chastain)
ВВЕДЕНИЕ
Цель настоящего пособия заключается в том, чтобы помочь преподавателю наиболее эффективно использовать данный учебник и относящиеся к нему вспомогательные материалы. Пособие адресовано в равной мере тем, кто знаком с прежними изданиями этого курса, и тем, кто пользуется им впервые.
Пособие состоит из трех частей. В первой части описаны учебник и приложения к нему, даны указания к прохождению курса на двух различных уровнях и кратко обсуждаются все главы учебника с указанием возможных трудностей и методологических путей их преодоления.
Вторая часть содержит подробные решения ко всем помещенным в учебнике задачам с четными номерами (ответы к задачам с нечетными номерами включены в основной текст учебника)*.
Третья часть представляет собой экзаменационные вопросы к материалу учебника с несколькими вариантами ответов, среди которых требуется найти правильный. Этими вопросами можно пользоваться для проверки усвоения материала учащимися, размножив их на карточках. Экзаменационные вопросы подготовлены Дж. Реймонд из Калифорнийского технологического института, которой автор выражает глубокую благодарность.
Помимо использования самого учебника рекомендуются** «Пособие для учащихся к «Основным законам химии» Т. Тейлора (Т. Taylor, A Study Guide to Chemical Principles), «Программные обзоры «Основных законов химии» Дж. Лессил и др. (J. Lassila et al., Programed Reviews of Chemical Principles) и «Дополнительные задачи к «Основным законам химии» Я. Батлера и А. Троссера (/. Butler, A. Grosser, Relevant Problems for Chemical Principles). Все эти пособия предназначены для помощи учащимся с разным уровнем подготовки.
«Пособие для учащихся» не является исправленным вариантом прежних изданий, а полностью переписано заново и включает комментарии ко всем двадцати трем главам учебника. В нем даны указания учащимся по
* В русском издании ответы к задачам с четными и нечетными номерами объединены (см. стр. 479); таким образом, методическое пособие включает только первую и третью части,-Прим. ред. .
** Все перечисленные дополнительные пособия в русское издайие не включены.- Прим. ред.
Методическое пособие д.сч преподавателей
567
прохождению материала и перечислены особые приемы и понятия, используемые в каждом разделе учебника, а также содержатся вопросы для самоконтроля. Это пособие должно принести наибольшую пользу учащимся, не имеющим предварительной подготовки по химии или со слабой подготовкой, но окажется полезным и учащимся, прослушавшим подготовительный курс в старших классах средней школы или колледжах.
«Программные обзоры» предназначены для дополнительного разъяснения основных понятий и закрепления материала в расчете на учащихся со слабой подготовкой; «Дополнительные задачи» связывают химические понятия с примерами из обыденной жизни и включают большое число задач, представляющих интерес для более подготовленных учащихся.
Преподаватель волен использовать в своей работе эти пособия полностью или частично, но может и совсем не обращаться к ним; это зависит от уровня, на котором ведется преподавание, и от подготовки учащихся.
ОСОБЕННОСТИ ПОСТРОЕНИЯ УЧЕБНИКА
Третье издание книги отличается от предыдущих главным образом следующими особенностями:
1. Материал первых семи глав подвергся большой перестройке и переписан заново. В гл. 1-5 последовательно и логически развиваются основные представления общей химии; в гл. 6 излагается история развития современных представлений об атомах и молекулах. Выделение исторического материала в отдельную главу позволило освободить от него другие разделы; кроме того, сосредоточив этот материал в одном месте, авторы дают учащимся четкую картину развития химии как науки.
2. Теоретический материал по ковалентной связи теперь помещен в Трех главах, куда вошли также дополнительные сведения по теории отталкивания валентных электронных пар (ОВЭП) и по молекулярной спектроскопии. Изложение в этих главах также последовательное и позволяет преподавателю при необходимости без особых затруднений использовать курс в ограниченном объеме.
3. Главы по координационной химии, органической химии и биохимии, химической кинетике, а также ядерной химии помещены в конце учебника. Все эти главы независимы и могут использоваться в соответствии с интересами преподавателя и временем, отведенным на его курс.
Помимо указанных нововведений все главы подверглись той или иной переработке и в учебник было включено много новых вопросов и задач. Авторы пытались по мере возможности сгруппировать задачи попарно, причем ответ на одну из каждой пары таких задач дан подробно, а на другую-кратко. Приложение 1 знакомит с единицами системы СИ, которые используются в книге.
Весь курс подразделяется на следующие части:
гл авы 1-7: основные представления-стехиометрия, равновесие, периодичность;
главы 8-14: строение атома, химическая связь;
главы 15-19: термодинамика и равновесие; •
главы 20-23: специальные темы.
Изложение в первых главах умышленно сделано очень доступным и постепенно усложняется в первой половине книги. Построение учебника и наличие различных приложений к нему позволяют использовать издание для чтения курсов разной степени сложности. Ниже обсуждаются два возможных варианта построения курса на основе этого учебника.
1-й вариант курса
В большинстве университетов курс общей химии слушают студенты с разными академическими интересами-химики и нехимики (скажем, биологи и медики), а также студенты, слушающие химию факультативно; все они имеют разный уровень подготовки по математике и друтпм точным наукам. В рамках такого курса первые одиннадцать глав учебника позволяют заложить прочную основу для дальнейших занятий точными науками. Эти главы следует проходить подробно с небольшими исключениями (возможно, следует опустить лишь некоторые разделы гл. 8). Начиная с гл. 12, следует пользоваться материалом учебника избирательно, в частности можно опустить последние разделы гл. 12-14. Гл. 15-17 следуез проходить очень подробно, а гл. 18 и 19-опуская отдельные разделы; что касается гл. 20-23, здесь полностью решает преподаватель в зависимости от того, есть ли у него время на эти главы и насколько они соответствуют его научным интересам. Рекомендуется как можно шире пользоваться «Пособием для учащихся», а также «Программными обзорами».
Ниже указана возможная разбивка такого курса на лекции из расчета восьмидесяти лекций (исключая экзамены).
Глава Число лекций Глава Число лекций
1 4 11 4
2 6 12 3
3 6 13 2
4 6 14 2
5 8 15 3
6 2 16 4
7 2 17 3
8 3 18 3
9 3 19 3
10 4 20-23 9
2-и вариант курса
Многие университеты предлагают курс общей химии повышенного уровня. Обычно слушателями такого курса являются студенты-химики, которые проходили этот предмет в средней школе в течение одного года или нескольких лет.
569
Для таких студентов большую часть материала, помещенного в первых главах, следует рассматривать как обзор известных сведений, который может быть пройден в ускоренном темпе. Параллельно с прохождением гл. 5 рекомендуется изучить и приложение 5. Основную часть времени, отведенного на курс, целесообразно потратить на прохождение гл. 12—23, не исключая из этих глав практически ничего. Возможная разбивка такого курса па лекции (из расчета тех же восьмидесяти лекций) приведена ниже.
['.шва Число лекций Глава Число лекций
1 2 13 4
э 3 14 3
3 3 15 4
4 3 16 5
5 5 17 4
6 2 18 5
7 2 19 5
8 3 20 5
') 2 21 4
И) 2 22 5
11 2 23 3
12 4
1. Преподаватели не всегда имеют время полностью прочесть учебник до его использования в своем курсе. Раздел «Заключение» в конце каждой главы можно использовать не только в качестве завершающего обзора для учащихся, но и в качестве резюме для преподавателей. В «Заключении» к каждой главе жирным шрифтом выделены все новые, вводимые в данной главе термины; там кратко излагаются важнейшие представления и понятия. Эти разделы рекомендуются как удобный информационный материал о содержании каждой главы и ими вполне можно пользоваться для предварительного планирования курса.
2. Другим подсобным средством для преподавателей является «Пособие для учащихся». В нем содержится краткий обзор каждой главы учебника, есть указания на специфические трудности каждого раздела и необходимый уровень математической подготовки учащихся. Если последние пользуются «Пособием», преподаватель должен знать его содержание; кроме того, «Пособием» можно воспользоваться, чтобы решить, какие гемы или разделы учебника следует опустить при прохождении курса.
3. Список рекомендуемой литературы в конце каждой главы дает хороший вспомогательный материал для подготовки лекций.
Беч Б Чс.тсчч 5^0
Глава 1. Атомы, молекулы и ионы
В этой главе содержится большое число понятий и терминов, которые играют основополагающую роль в химии. Данный материал может служить прекрасным обзором для тех, кто уже получил предварительное знакомство с химией.
Учащимся следует пояснить, что большая часть излагаемого здесь материала получит дальнейшее развитие в учебнике; в то же время они должны убедиться, что понимают все термины и смогут правильно пользоваться ими. При необходимости следует как можно шире использовать «Пособие для учащихся» и «Программные обзоры», чтобы обеспечить понимание материала.
Глава 2. Законы сохранения массы и энергии
Предметом обсуждения в этой главе является стехиометрия; основное понятие - моль, вероятно наиболее важное понятие в начальном курсе химии, причем часто трудно усваиваемое. Необходимо, чтобы учащиеся привыкли думать о массовых и энергетических соотношениях в химических реакциях в молярных терминах и чтобы они представляли полное химическое уравнение реакции как утверждение относительно молярных отношений. Все стехиометрические расчеты следует выполнять, по крайней мере вначале, предварительно переводя заданные массовые количества веществ в моли и используя молярные отношения между реагентами и продуктами из химического уравнения.
В этой главе помещено много задач, их необходимо тщательно проработать и, возможно, включить ряд новых из «Дополнительных задач» и «Пособия для учащихся».
Глава 3. Законы газового состояния и молекулярно-кинетическая теория
Важным представлением, развиваемым в данной главе, является то, что законы выводятся из экспериментальных измерений, тогда как теории-это модели, развиваемые для объяснения законов и выдвижения новых предсказаний. При обсуждении этой главы можно также обратить внимание на идеализированный характер физических законов и ограничения их применимости в реальных ситуациях.
Подобно первым двум главам, третья глава также содержит ряд новых терминов и понятий, которые учащиеся должны усвоить. Кроме того, учащиеся должны получить навыки в решении задач, уметь оценивать порядок величины, получаемой в ответе, или по крайней мере давать качественно правильный ответ при решении задач на газовые законы; все это необходимо, чтобы свести к минимуму вероятность получения абсурдных численных результатов или результатов, неправильных по порядку величины.
Методическое пособие для преподавателей 571
В этой главе впервые встречается послесловие из числа включенных в некоторые главы учебника. Эти послесловия обычно имеют исторический характер и помогают представить химию как растущую и развивающуюся науку, создаваемую реальными личностями; преподавателям рекомендуется использовать в своей работе такие послесловия; их также полезно прочесть учащимся.
Глава 4. Введение в химическое равновесие (Произойдет ли реакция?)
Многим учащимся равновесие представляется наиболее трудной темой в курсе общей химии. Поскольку понятие «равновесие» играет важную роль во многих последующих темах, необходимо добиться полного понимания учащимися данной и следующей глав.
Большинству людей выражения «самопроизвольный» и «быстрый» кажутся почти синонимами, однако следует подчеркнуть разницу между ними. Необходимо также провести четкое различие между экзотермическими и самопроизвольными реакциями. Хотя это различие будет подробно объяснено в гл. 16, преподаватель должен предотвратить отождествление этих понятий, чтобы потом не пришлось переучивать учащихся.
Задачи на равновесие обычно трудны для средних учащихся, поскольку они требуют проведения ряда рассуждений количественного характера. В большинстве случаев требуется записать химическое уравнение и применить законы стехиометрии, чтобы получить величины, с которыми следует манипулировать согласно закону действующих масс. Эта процедура должна быть понятной учащимся. Важно, чтобы все учащиеся, за исключением подробно изучавших эту тему в предварительном курсе, решили побольше задач - сначала простых, а затем более сложных. При прохождении этой главы рекомендуется использовать «Пособие для учащихся», «Программные обзоры» и «Дополнительные задачи».
Глава 5. Равновесия в растворах. Кислоты и основания
В этой главе изложено прямое применение законов химического равновесия, сформулированных в гл. 4, к двум важным классам химических реакций: кислотно-основным реакциям и осаждению из раствора. Основной упор здесь делается на решении задач, для чего следует использовать все имеющиеся источники. Ниже приведен ряд замечаний по поводу отдельных тем, вызывающих затруднения у учащихся.
1. Следует добиться понимания того, что всевозможные константы-ХН;О. Ка, Кь, ПР и т.п.-представляют собой не что иное, как Кравн, т.е. константы равновесия для процессов определенного типа, которые выводятся из одного и того же общего закона. Различия между ними обусловлены исключением из выражения для константы равновесия концентрации растворителя или концентрации твердого вещества, не перешедшего в раствор. Многие учащиеся не осознают этого, если специально не обратить их внимания.
2. Кислые, основные и нейтральные растворы следует определять в терминах относительных концентраций ионов водорода и гидроксидных ионов, а не определенными значениями pH; таким образом будет обращено внимание на температурную зависимость КНгО.
3. Вопрос о сильных и слабых кислотах и основаниях, по-видимому, лучше всего рассматривать на данном уровне, позаботившись о том, чтобы учащиеся запомнили несколько часто встречающихся сильных кислот и оснований - тогда они могут исходить из того, что все прочие кислоты и основания являются слабыми, если не оговаривается противоположное.
4. Трудно переоценить, насколько важно научиться делать упрощающие предположения в расчетах равновесий, однако большинству учащихся это дается с большим трудом. Усилия, затраченные на то, чтобы объяснить эту процедуру, будут возмещены не только тем, что они ускорят решение задач, но и тем, что заставят учащихся задуматься над процессом равновесия, а не просто подставлять численные величины в уравнения.
Для более серьезных курсов или при прохождении курса средней сложности с хорошо подготовленными учащимися рекомендуется одновременно с данной главой проработать и приложение 5 из учебника.
Глава 6. Действительно ли существуют атомы?
От Демокрита до Дюлонга и Пти
Преподавателям с дефицитом времени (т.е. буквально веем), вероятно, покажется допустимым опустить эту главу либо просто задать ес учащимся для домашнего чтения, но в ней заложена одна возможность, на которой следует остановиться особо.
Эта глава не только дает представление о химии как о живом деле, которое не всегда двигалось вперед, но и откатывалось назад; она дает повод для рассмотрения процесса мышления (в интересной для учащихся форме), т. е. того, как люди думают, делают выводы и приходят к пониманию окружающего их мира. Химики-методисты все больше озабочены тем, как помочь студентам развить способность к логическому абстрактному мышлению, которое необходимо в науке (см., например, статью Гуда, Меллона и Кромхаута [Good, Mellon, Kromhout “The Work of Jean Piaget’’, J. Chem. Educ., 55, 688 (1978)] и помещенную в ней аннотированную библиографию).
История нашего понимания атомов и молекул может использоваться как повод для выяснения способов рассуждений, применяемых учеными; это в свою очередь позволит преподавателю получить представление о способах рассуждения, которыми пользуются его учащиеся. Поэтому данная глава рекомендуется всем преподавателям, интересующимся такими вопросами.
573
Глава 7. Периодическая система элементов
Современную периодическую систему иногда называют «путевой картой химиков», «химической энциклопедией на одной странице», «алфавитом и таблицей умножения химиков». Авторы учебника называют ее просто «важнейшей схемой классификации материи».
Учащиеся должны получить ясное представление о том, что форма современной периодической таблицы не зависит ни от какого произвола, а определяется экспериментально наблюдаемыми химическими свойствами элементов; ее структура не предопределяется какой-либо теорией (объяснение периодической системы на основе представлений о строении атома излагается в двух следующих главах). Учащиеся должны усвоить названия различных частей периодической таблицы и понять, что, запомнив свойства нескольких химических веществ, они смогут делать довольно точные предсказания свойств многих других веществ.
Глава 8. Квантовая теория строения атома
С этой главы авторы учебника переходят к выяснению теоретических представлений, на которых основано наше современное понимание того, почему вещества обладают присущими им свойствами, представлений об электронном строении вещества и химической связи. Приступая к ней, преподаватель должен принять определенные решения относительно того, какое внимание он сможет уделить в своем курсе этим понятиям.
Квантовомеханическое описание электрона, данное в гл. 8 учебника, требует наличия у учащихся довольно развитого математического мышления, но многие из них не обладают достаточной для этого подготовкой. Например, дифференциальное уравнение (особенно дифференциальное уравнение второго порядка в частных производных, например уравнение Шрёдингера) может мало о чем говорить среднему студенту. Однако если предполагается подробно обсуждать последующий материал по химической связи (особенно гл. 12 и 13, посвященные молекулярным орбиталям), учащимся необходимо получить твердые представления об атомных орбиталях как о волновых функциях и о возможности составления линейных комбинаций из таких функций как в алгебраической, так и в графической форме.
Первые разделы главы, в которых обсуждаются ядерное строение атома, квантование и атомная теория Бора, можно включить в любой курс. Основной упор следует сделать на происхождение атомных спектров как переходов между дискретными энергетическими уровнями и на использование квантового числа п для обозначения уровней, а также для вычисления радиуса и энергии движущегося электрона в атоме.
Переход от представлений о круговых и эллиптических орбитах электронов к плотностям вероятности оказывается очень трудным для большинства студентов, но им удается по крайней мере объяснить, о чем говорит принцип неопределенности и почему вообще приходится говорить
Бен Б Честейн 574
о вероятностях. Даже если преподаватель решил не останавливаться на подробном обсуждении волнового уравнения Шрёдингера (как бывает, если решено не делать упор на молекулярные орбитали), можно ввести представление о квантовых числах как индексах атомных орбиталей и продемонстрировать взаимосвязь этих чисел с размерами, формой и ориентацией орбиталей. Если эти соотношения удается сделать понятными применительно к атому водорода, их распространение на многоэлектронные атомы обычно не вызывает затруднений у студентов.
При прохождении данной главы рекомендуется широко пользоваться «Пособием для учащихся»; преподавателю стоит также ознакомиться с некоторыми статьями из числа указанных в списке рекомендуемой литературы-они помогут ему справиться с изложением многих вводимых здесь представлений.
Глава 9. Электронное строение и свойства атомов
Важнейшим понятием данной главы является процесс заселения атомных орбиталей электронами и его связь с формой периодической таблицы. Следует обратить внимание учащихся на то, что последовательность орбитальных энергий атома можно определить из самой таблицы и ее не нужно заучивать. Нужно указать на отдельные исключения из идеальной последовательности заселения орбиталей, но не стоит останавливаться на этом подробно. Пример 1 (см. т. 1, с. 397) указывает, что конфигурация, предсказываемая принципом заполнения, в подобных случаях оказывается нижним возбужденным состоянием.
Обсуждаемые в данной главе атомные свойства-энергия ионизации, сродство к электрону и радиус атома - непосредственно связаны с электронным строением атома. Рекомендуется довольно подробно остановиться на обсуждении их закономерного изменения соответственно положению элемента в периодической системе.
Здесь же вводится и представление об электроотрицательности элементов; следует подчеркнуть его важность как средства приближенного предсказания ряда свойств молекул, например степени ионности связи. При прохождении этой темы также рекомендуется остановиться на периодических закономерностях.
Глава 10. Окислительно-восстановительные и химические свойства элементов
Очень важно, чтобы студенты с самого начала осознали, что степени окисления не соответствуют истинным зарядам на атомах, а служат лишь для подсчета электронов в молекулах. Основой для правил, сформулированных в разд. 10-1, является представление о степени окисления как о заряде, которым мог бы обладать атом, если бы все его связи в соединении были ионными; таким образом, электроны, принадлежащие связям между подобными атомами, делятся поровну между этими атомами, а электроны,
Метопическое иосооие ол.ч ипепооавателей
575
принадлежащие связям между несходными атомами, относят к более электроотрицательному атому. После того как это будет указано, многие студенты найдут такое объяснение вполне удовлетворительным, даже если на практике им придется пользоваться для определения степеней окисления приведенными в данной главе формальными правилами.
После введения степеней окисления это понятие используется для определения окислительно-восстановительных реакций и установления способов составления уравнений таких реакций. Студенты должны хорошо научиться составлять уравнения, пользуясь обоими методами, изложенными в учебнике. Следует разъяснить достоинства и недостатки каждого из этих методов и научить студентов пользоваться в каждом случае подходящим методом.
Раздел, где излагается окислительно-восстановительное титрование, дает хорошую возможность повторить некоторые стехиометрические понятия, введенные в первых главах учебника.
Разделы, посвященные «описательной химии» элементов, могут не потребовать большого обсуждения с преподавателем; студентам не следует стараться запоминать большое количество фактов, они должны лишь находить в них закономерности и связывать их с электронным строением атомов. При обсуждении сравнительной способности элементов находиться в определенных состояниях окисления в растворе удобно воспользоваться окислительными потенциалами, но студентам нужно указать, что этот способ будет подробно обсуждаться в гл. 19 и поэтому нет надобности долго останавливаться на нем в данном месте курса.
Глава 11. Льюисовы структуры и метод отталкивания валентных электронных пар (ОВЭП)
В данной главе, первой из трех, где излагаются модели ковалентной связи, студенты получают представления о типах связи, порядке связи, о делокализованных связях и молекулярной геометрии на основе описательного, нематематического подхода. Такой подход имеет самостоятельную ценность как средство описания большого числа молекул; кроме того, ясное понимание его достоинств и ограничений дает основание для построения более сложных моделей в следующих главах. Эту главу рекомендуется подробно пройти в любых курсах.
Подобно тому как степени окисления создают основу для метода учета электронов, при котором все связи рассматриваются как чисто ионные, формальные заряды могут рассматриваться как основа для подобного же метода, в котором все связи предполагаются чисто ковалентными, т. е. электроны, принадлежащие всем связям, распределяются поровну между двумя атомами независимо от разности электроотрицательности между ними. Такая точка зрения хороша тем, что она показывает условный характер каждого подхода, по своему полезного для понимания истинного распределения электронов в молекулах. Раздел, посвященный кислотности кислородсодержащих кислот, является хорошей иллюстрацией использования метода формальных зарядов.
Представления о формальных зарядах, резонансных гибридах и льюи-совы определения кислот и оснований широко используются в большинстве начальных курсов органической химии, и студенты, хорошо усвоившие их, легко справятся с последующим применением этих понятий.
Метод ОВЭП быстро усваивается большинством студентов, и они испытывают понятное удовлетворение, получая возможность достаточно точно предсказывать истинную форму молекул. Дополнительный материал, включенный в учебник по этой теме, выгодно отличает его от предыдущих изданий.
Глава 12. Двухатомные молекулы
Лучший способ познакомить с молекулярными орбиталями студентов-первокурсников-извлечь как можно больше пользы из их предшествующей работы по изучению атомных орбиталей. Следует показать, что к молекулам в той же мере, что и к атомам, применимы представления об использовании волновых функций для описания движения электронов, о возможности охарактеризовать эти функции квантовыми числами, о наглядном изображении этих функций при помощи контурных диаграмм электронной плотности или графиков их угловых частей, об использовании принципа заполнения для определения электронной конфигурации основного состояния. Полнота изложения этих вопросов зависит от того, как было решено изучать гл. 8 и 9, но в любом случае следует стремиться к ясному пониманию аналогии между целями и способами описания атомных и молекулярных орбиталей.
Студентам не всегда понятна причина получения молекулярных орбиталей в виде линейных комбинаций атомных волновых функций. Нужно объяснить им, что если бы можно было точно решить уравнение Шрёдингера для молекулы, молекулярные орбитали получались бы из него непосредственно, подобно тому как их получают при решении задачи об атоме водорода. Невозможность получения точных решений заставляет воспользоваться каким-либо приближением, и подход, основанный на использовании МО ЛКАО, оказывается очень удобным.
Сложности возникают и с понятием порядка связи в рамках метода МО. Следует подчеркнуть, что хотя мы говорим об одной связи для каждой результирующей пары связывающих электронов, это не означает, что все связи между каждыми двумя атомами являются обязательно двухэлектронными или что в случае многоатомных молекул связи обязательно локализованы между двумя атомами.
На примере гетероядерных двухатомных молекул можно проиллюстрировать необходимость в надлежащей орбитальной симметрии для получения максимального перекрывания и взаимодействия, а также соотношение между энергетическим соответствием атомных орбиталей и ионным характером образующейся связи. В качестве метода измерения ионного характера связи можно обсудить дипольные моменты.
Независимо от того, делается ли упор на математическое описание молекулярных орбиталей или только на их наглядное изображение, все уча
577
щиеся должны хорошо усвоить термины, используемые для описания МО-связывающие, разрыхляющие, несвязывающие, сигма, пи и т.д.,-поскольку они будут часто встречаться в последующих химических курсах.
Глава 13. Многоатомные молекулы
В последующих курсах по органической химии студенты будут встречать еще одно вводимое здесь представление - гибридизация атомных орбиталей. Преподаватель должен сам решить, как ему быть с введением математического описания гибридизации, но в любых курсах обязательно следует обратить внимание учащихся на направленный характер полученных гибридных орбиталей и соответствующую молекулярную геометрию. Раздел о кратных связях в соединениях углерода можно использовать для иллюстрации основных положений метода гибридизации орбита-лей.
Раздел учебника, где на примере бензола обсуждается делокализация электронов, может быть изложен более подробно, чем необходимо для некоторых курсов; представление о делокализации электронов и то, что с его использованием отпадает необходимость в резонансных льюисовых структурах, иногда лучше изложить в более общей форме, заменив рассмотрение бензола (или дополнив его) обсуждением В2Н6, NO2, SO3 или других малых молекул.
Представление о том, что полярность молекул зависит от их геометрии и от полярности связей, легко усваивается всеми студентами. Раздел, посвященный молекулярной спектроскопии, может быть обсужден подробно, пройден бегло или вообще опущен без ущерба для непрерывности курса.
Глава 14. Химическая связь в твердых и жидких веществах
Наиболее важной темой этой главы являются межмолекулярные силы. В табл. 14-1 и 14-3 представлены различные кристаллические структуры и их свойства, которые следует обсудить подробно. Чрезвычайно важно, чтобы учащимся стали понятны такие термины, как вандерваальсовы (лон-доновские) силы и водородная связь.
Основанная на теории МО зонная модель электронного строения металлов, полупроводников и диэлектриков может показаться не сразу очевидной всем студентам, но после ее обсуждения и объяснения она обычно усваивается. Последний раздел, посвященный силикатам, можно опустить без ущерба для усвоения важнейших понятий, но он дает хорошую возможность закрепить положение о связи между структурой и свойствами и обычно вызывает интерес у студентов.
Глава 15. Энергия и энтальпия в химических системах
Следующие пять глав образуют третью часть курса - изучение классической термодинамики и равновесия. Некоторые вопросы этой темы затрагивались уже раньше-в разд. 2-6 и в гл. 4, и студентам нужно напомнить
Бен Б Честей!: 5.8
об этом, чтобы они могли повторить пройденное, прежде чем перейдут к углубленному изучению темы. В данной главе излагается первый закон термодинамики и указан ряд его применений, а также включен соответствующий исторический материал.
При обсуждении термодинамики чрезвычайно важным понятием являются функции состояния; студенты должны ясно понять смысл этого термина, а также определения изолированной, замкнутой и незамкнутой систем, внутренней энергии и энтальпии. Следует указать им, что энтальпия играет важную роль в химии потому, что реакции обычно проводятся в открытых сосудах, а следовательно, при постоянном (атмосферном) давлении.
Время, затрачиваемое при прохождении данной главы на расчеты при помощи закона Гесса, зависит от того, сколько времени ушло ранее на проработку разд. 2-6 и насколько хорошо студенты запомнили его. Сопоставление результатов расчета энтальпии реакций по энергиям связей с полученными на основе энтальпий образования должно помочь студентам лучше понять, что энтальпия является функцией состояния.
Глава 16. Энтропия, свободная энергия и химические реакции
Представления о самопроизвольно протекающих процессах и равновесии были введены еще в гл. 4; студентам должны быть понятны эти термины, а также представления об обратимых и необратимых процессах.
Большинству студентов труднее усвоить понятие энтропии; ее истолкование как меры упорядоченности системы обычно оказывается более успешным, чем истолкование энтропии как количества теплоты, вводимого в систему обратимым путем. Пример со «вселенной» из девяти клеточек, которые могут заселяться четырьмя атомами, заслуживает того, чтобы рассмотреть его в аудитории, поскольку он помогает студентам понять смысл закономерностей, касающихся изменений энтропии, которые сформулированы в разд. 16-4.
Когда студенты хорошо усваивают представления об энтальпии и энтропии, введение понятия свободной энергии как их комбинации и его использование для предсказания направления самопроизвольного протекания реакций обычно не вызывают больших трудностей. Расчеты, основанные на использовании свободных энергий образования, настолько напоминают расчеты с энтальпиями, что требуют лишь краткого обсуждения. Однако следует указать, что не все численные величины, приведенные в приложении 3, имеют одинаковый смысл, хотя в расчетах они могут использоваться с одинаковым основанием. Приведенные там энтальпия и свободная энергия каждого вещества относятся к реакции, в которой данное вещество образуется из составляющих его элементов в их стандартных состояниях, тогда как для энтропии приведено ее «абсолютное» значение для данного вещества при 298 К. Следует обсудить, каким образом третий закон термодинамики дает возможность вычислять абсолютные энтропии веществ и почему нельзя ввести абсолютные энтальпии или абсолютные свободные энергии веществ.
Методическое пособие для преподавателей
579
Вывод выражения для изменений свободной энергии при условиях, отличающихся от стандартных, не обязательно должен подробно обсуждаться во всех курсах, но студенты обязаны запомнить его и важные выводы, основанные на этом выражении [уравнения (16-26) и (16-30)].
Глава 17. Свободная энергия и равновесие
В этой главе используется соотношение, выведенное в конце предыдущей главы, чтобы объяснить и расширить понятие о константах равновесия и принцип Ле Шателье, обсуждавшиеся еще в гл. 4.
В разд. 17-1 дан прекрасный обзор свойств химического равновесия. Его следует обсуждать сколько потребуется, чтобы добиться полного понимания студентами данной темы. Рекомендуется также воспользоваться табл. 17-1, в которой кратко суммированы представления об активности.
Использование в расчетах равновесий газовых давлений не должно показаться трудным большинству студентов, но понятие о степени завершенности реакции часто вызывает осложнения. Если решено включить в курс последнее понятие, рекомендуется сделать это на нескольких подробно обсуждаемых примерах.
Разд. 17-4 не обязательно включать во все курсы, но он дает количественное обоснование принципа Ле Шателье и может быть рекомендован для самостоятельного чтения если не всем, то хотя бы части студентов.
Глава 18. Равновесия с участием жидких и твердых веществ
В первых четырех разделах этой главы рассматривается термодинамика фазовых превращений. В некоторых случаях преподаватель может не рассматривать подробно критическую точку или фазовые диаграммы, но все курсы должны включать материал по теплотам плавления, сублимации и испарению, а также по температурам кипения и давлению пара над жидкостью. Если решено включить в курс фазовые диаграммы, следует тщательно пояснить примеры, приведенные в учебнике.
К идеальным свойствам растворов и выводу на их основе свойств реальных растворов можно подойти путем проведения аналогии с предшествующим рассмотрением газов, причем в качестве критерия идеальности раствора может использоваться его соответствие закону Рауля. Таким образом, естественно перейти к рассмотрению понижения давления пара нелетучим растворенным веществом, а также остальных коллигативных свойств. Следует сделать упор на их использование для определения молекулярных масс, и в этом отношении некоторым студентам должны принести большую пользу «Программные обзоры».
Многие студенты слышали об осмотическом давлении в курсах биологии, и это может вызвать дополнительное обсуждение данного вопроса.
Глава 19. Окислительно-восстановительные равновесия и электрохимия
Использование примера с концентрационными элементами для введения в термодинамику гальванического элемента хорошо зарекомендовало себя. В первом разделе важно подчеркнуть, что полезная работа может быть получена в любом самопроизвольном процессе. Важно также обратить внимание студентов на то, что анод и катод лучше определять по протекающему на каждом из них процессу (окисление или восстановление), а не по знаку (плюс или минус) электрода.
Во втором разделе описано несколько типов гальванических элементов. Преподаватель должен указать на общие для всех них свойства и подчеркнуть то обстоятельство, что в электролитическом элементе (электролизере) внешняя энергия используется для проведения реакций в таком направлении, которое противоположно направлению ее самопроизвольного протекания в обычных условиях.
При обсуждении соотношения между изменением свободной энергии и напряжением гальванического элемента надо обратить внимание на то, что n-это число электронов, перенос которых осуществляется согласно полному сбалансированному уравнению электрохимической реакции, а не число их в отдельных электродных полуреакциях.
Студентам следует разъяснить, что поскольку принятое правило записывать все полуреакции как восстановительные процессы и выбор потенциала водородного электрода в качестве нулевой точки отсчета произвольны, знак потенциала конкретной полуреакции не имеет решающего значения; лишь знак напряжения всего гальванического элемента (разность между двумя электродными потенциалами) может использоваться для установления направления самопроизвольного протекания реакции.
Уравнение Нернста легко выводится из уже известного студентам соотношения между свободной энергией и концентрацией. Нужно указать, что это уравнение в равной мере применимо к электродной полуреакции и ко всей электрохимической реакции в целом.
Использование измерений напряжения электрохимического элемента для определения константы равновесия лучше проиллюстрировать конкретными примерами, после чего студенты должны привести собственные примеры.
Данная глава завершается особенно удачно написанным заключением, которое рекомендуется прочесть как преподавателю, так и студентам.
Глава 20. Координационная химия
Последние четыре главы учебника посвящены темам, которые, будучи весьма интересными и важными, обычно считаются необязательными в курсах химии первого года обучения. Вероятно, только в расширенных курсах общей химии найдется время изучить их все подробно. Другие преподаватели смогут выбрать из этих глав отдельные части, соответствующие их собственным интересам либо планам на будущее своих студентов.
MeiwiWd >-л .'«a !,diit li.t-i 11peллрлисипелей 581
В данной главе обсуждается важный класс соединений, включающих переходные металлы. Помимо описания свойств координационных комплексных соединений и их роли в биологических системах в учебнике содержится материал по номенклатуре, типам изомерии, теории химической связи и равновесиям комплексообразования. Усвоение правил систематической номенклатуры и возможных проявлений изомерии в этих, по существу, неорганических соединениях должно помочь студентам в их последующем изучении органической химии. Материал по химической связи в координационных соединениях и равновесиям комплексообразования может рассматриваться как повторение, иллюстрация и расширение предшествующего прохождения этих тем.
Отметим, что определение понятий лабильность и инертность в первом разделе данной главы открывает возможность обсуждения кинетики, а не только равновесия. Послесловие вводит в быстро развивающуюся область бионеорганической химии.
Глава 21. Особая роль углерода в химии
Авторы учебника во введении к этой главе утверждают, что она включена в книгу, чтобы дать читателю общее представление о двух очень больших областях химии-органической химии и биохимии. Многие, а возможно, и все студенты, прослушавшие общий курс, будут впоследствии проходить оба упомянутых выше специальных курса. Преподаватель должен решить, необходимо ли его студентам подробно изучать номенклатуру и реакции соединений, обсуждаемых в этой главе, или ограничиться только первым представлением об этом предмете. Но каково бы ни было принятое решение, следует обязательно остановиться на двух специальных вопросах, которые обсуждаются в этой главе учебника и которые нельзя найти в большинстве других учебников по общей химии:
1) выяснение причин того, почему углерод способен образовывать основу сложных структур, подобных существующим в живых системах, тогда как кремний, бор и азот не обладают такой способностью;
2) описание эволюции усвоения энергии живыми системами от анаэробной ферментации к фотосинтезу и далее к кислородному дыханию.
Эти две темы должны вызывать интерес и пробуждать воображение у большинства студентов, и их можно использовать для повторения и иллюстрации представлений о структуре, химической связи и термодинамике, введенных в предыдущих главах.
Глава 22. Скорости и механизмы химических реакций
В «Заключении» к этой главе учебника указывается, что химическая кинетика еще не так развита, как структурная химия, потому что кинетические проблемы в принципе гораздо сложнее. Возможность более или менее глубокого изучения этой темы в курсе общей химии зависит главным образом от уровня математической подготовки студентов, но даже если
Бен Б. Честейн
582
решено опустить изложение теории скоростей реакции, студенты обязательно должны усвоить на качественной основе такие понятия, как кинетическое уравнение реакции, порядок реакции и энтальпии активации. Следует пояснить студентам, что термодинамика и кинетика занимаются совершенно разными аспектами химических реакций.
Некоторые вопросы можно рассмотреть путем решения и обсуждения специальных задач из числа помещенных в конце главы, например задачи 8 на кинетическое уравнение или задачи 28 на механизмы реакций (можно использовать «Дополнительные задачи»).
Глава 23. Ядерная химия
После двадцати двух глав, имевших дело с внешними электронами атомов и молекул, учебник завершается главой, в которой обсуждаются свойства и превращения атомных ядер. Студенты проявляют большой интерес к разделам, посвященным использованию ядерной химии в медицине, археологии и военном деле. Эти разделы служат также для повторения некоторых пройденных ранее тем, как, например, уравнения реакций, равновесие и кинетика.
Представление об энергии связи вводится еще в гл. 1, оно формулируется здесь снова и используется как основа для обсуждения соотношения между массой и энергией в процессах ядерного распада и ядерных реакциях. Радиоактивный распад использован в качестве примера кинетического процесса первого порядка еще в гл. 22.
Как и в предыдущих главах, для усвоения некоторых понятий следует разобрать специально подобранные задачи.
ЭКЗАМЕНАЦИОННЫЕ ВО П РОС Ы
Помещенные ниже вопросы были подготовлены д-ром Джейн Реймонд из Калифорнийского технологического института для использования на двухступенчатых экзаменах в Лос-анджелесском отделении Американского химического общества, проводимых там в порядке ежегодных олимпиад для местных старшеклассников. Экзамены предусматривают охват всех аспектов общей химии. Обычно они проводятся в две стадии: первая включает те темы общей химии, которые должны входить во все начальные курсы, например периодичность, газовые законы, равновесие; во второй — учащиеся имеют дело с более сложным материалом, например с органической химией, элементами теории кристаллического поля, биохимией, термодинамикой.
«Д-р Грей предложил, чтобы я работала с новым изданием учебника Грея, Дикерсона и Хейта, поскольку такой учебник мог бы скорее обеспечить возможность подлинно всеобъемлющего экзамена, способного охватить все главные разделы химии. Последовав его совету, я обнаружила, что это не
Методическое пособие доя преподаватеяей
583
только облегчило мою задачу, но и сделало ее выполнение приятным. Учебник оказался для меня прекрасным пособием, а во многих случаях открыл новый и интересный подход ко многим аспектам предмета. Большая широта охвата, достигнутая в этой книге, послужила стимулом подготовить экзамен на столь же высоком уровне».
Джейн Реймонд
Часть I
1. Все изотопы данного элемента имеют одинаковое а) массовое число, б) порядковый (атомный) номер, в) атомную массу, г) число нейтронов.
2. У изотопа барий-138 число 138 означает а) атомную массу, б) атомный номер, в) массовое число, г) число нейтронов.
3. Дж. Дж. Томсон вычислил отношение заряда к массе электрона, наблюдая отклонение пучка электронов электрическим и магнитным полями. Современным развитием прибора Томсона является а) сцинтилляционный счетчик, б) масс-спектрометр, в) счетчик Гейгера, г) инфракрасный спектрометр.
4. Сколько граммов газообразного хлора выделяется при пропускании заряда в один фарадей через электролизер с расплавленным NaCl? Атомная масса хлора 35,453.
а) 35,453 г, б) 70,906 г, в) г, г) ни один из предыдущих ответов неверен.
5. При превращении металла в ион, он а) восстанавливается, б) окисляется, в) диспропорционирует, г) подвергается реакции самоокисления — самовосстановления.
6. 1 молекула Н2 реагирует с 1 молекулой С12, образуя 2 молекулы газообразного хлороводорода НС1. Какая масса газообразного хлора должна быть использована для того, чтобы полностью прореагировал 1 кг газообразного водорода? (Мол. массы: Н2 2,016, С12 70,906.) а) 1000 г, б) 35 170 г, в) 70,906 г, г) 496 г.
7. Сколько нейтронов содержится в атоме урана-238, если известно, что атомный номер урана 92, а массовое число этого изотопа 238? а) 92, б) 146, в) 184, г) 54.
8. Природный углерод представляет собой изотопную смесь из 98,89% углерода-12 с углеродом-13. Какова естественная атомная масса углерода?
а) 12,000..., б) 12,011, в) 12,1332, г) 11,8668.
9. Какова химическая формула гексацианоферрата (III) цинка?
a) ZnFe(CN)6; б) Zn2 [Fe (CN)6]3; в) Zn3 [Fe(CN)6]2; г) Zn6Fe(CN)6.
10. Где содержится больше молекул-в 1 моле водорода или в 1 моле метана?
а) в моле метана, б) в моле водорода, в) одинаковое число молекул. 11. Сколько молей газообразного НС1 можно получить из 1 моля газообразного Н2 и 2 молей газообразного С12?
а) 1 моль, б) 2 моля, в) 0,5 моля, г) ни один из предыдущих ответов неверен.
12. Часто встречающийся в лабораторных работах углеводород состоит из 92,26 вес. % углерода и 7,74 вес. % водорода. Каково отношение числа атомов С и Н в этом веществе?
а) 2 атома Н на каждый атом С, б) 1 атом Н на каждый атом С, в) 3 атома Н на каждый атом С, г) ни один из предыдущих ответов неверен.
13. Тринитротолуол (ТНТ), C7H5N3O6, реагирует с кислородом, образуя СО2, воду и N2. Сколько молей воды получается в этой реакции из 1 моля ТНТ?
а) 6 молей, б) 2,5 моля, в) 5 молей, г) 10 молей.
14. Сколько граммов сульфида серебра может образоваться в реакции 2Ag + S -> Ag2S
если вначале имелось 10,00 г серебра (атомная масса 107,88) и 1,00 г серы (атомная масса 32,06)?
а) 7,73 г, б) 11,00 г, в) 3,27 г, г) 11,486 г.
15. Тепловой эффект, сопровождающий химическую реакцию, которая проводится при постоянном давлении, называется изменением
а) энергии, ДЕ, б) энтальпии, ДН, в) энтропии, AS, г) ни одно из предыдущих определений неверно.
16. Сколько граммов ортофосфорной кислоты требуется для того, чтобы нейтрализовать 100 г гидроксида магния? (Мол. массы: Н3РО4 98,0 г, Mg (ОН), 58,3 г.)
а) 66,7 г, б) 252 г, в) 112 г, г) 168 г.
17. До какого объема следует разбавить 5,00 мл 6,00 М раствора НО, чтобы получить концентрацию 0,100 М?
а) 300 мл, б) 30 мл, в) 120 мл, г) ни один из предыдущих ответов неверен.
18. Сколько молекул содержится в 1,00 мл идеального газа при температуре 27'С и давлении 3 атм?
а) 8,15 • 1023, б) 8,15 • Ю20, в) 7,34 • 1019, г) 7,34 • 1022.
19. Законы состояния идеального газа достаточно точно описывают истинное поведение реальных газов только при а) высоких температурах и высоких давлениях, б) высоких температурах и низких давлениях, в) низких температурах и высоких давлениях, г) низких температурах и низких давлениях.
20. Для наполнения газом цистерны объемом 100 л под давлением 10,00 атм при 25 С потребовалось 11,5 кг газа. Какова молекулярная масса этого газа?
а) 9,44 г-моль"1, б) 41,03 г-моль"1, в) 342,7 г-моль"1,
г) 28,1 г-моль"1.
21. Допустим, что вы положили на подоконник на солнце закрытый полиэтиленовый мешочек с продуктами, где его температура повысилась от 20 до 30“С. Если вначале объем воздуха в мешочке был равен 100 см3, то какого объема он достигнет после нагревания? (Сопротивлением мешочка растяжению можно пренебречь.)
585
a) 103,4 см3, б) ПО см3, в) 150 см3, г) ни один из предыдущих ответов неверен.
22. Данные, связывающие давление и объем идеального газа при постоянной температуре, могут быть представлены графически несколькими способами. Какой из указанных ниже результатов не должен наблюдаться при условии, что выполняется закон Бойля?
а) График зависимости Р от 1/К представляет собой прямую линию, проходящую через начало координат; б) график зависимости lg Р от lg V представляет собой прямую линию с тангенсом угла наклона, равным — 1; в) график зависимости РКот Р представляет собой горизонтальную прямую линию; г) график зависимости Р от V представляет собой параболу.
23. Какова размерность константы равновесия для реакции
±N2 +|н2 NH3
если все концентрации выражены в молях на литр?
а) моль-1 л, б) моль-л-1, в) моль-2'3-л2'3, г) моль-2 л2.
24. Чтобы записать выражение для константы равновесия, необходимо знать а) полное стехиометрическое уравнение реакции, б) механизмы прямой и обратной реакций, в) выражения, определяющие скорость прямой и обратной реакций, г) изменение энтальпии для реакции.
25. При 25°С и давлении 20 атм реакция
2N2 (г.) + ЗН2(г.) 2NH3(r.)
имеет АН = — 22,1 ккал. Какое влияние окажет на равновесие каждое из следующих воздействий?
а) Повышение температуры до 300 С при поддержании давления 20 атм.
1) Никакого изменения, 2) равновесие сместится вправо, 3) равновесие сместится влево.
б) Повышение давления до 30 атм при поддержании температуры, равной 25~С.
1) Никакого изменения, 2) равновесие сместится вправо, 3) равновесие сместится влево.
в) Удаление половины аммиака, после чего системе позволяют снова достичь положения равновесия.
1) Никакого изменения, 2) равновесие сместится вправо, 3) равновесие сместится влево.
г) Введение в систему железа в качестве катализатора синтеза аммиака.
1) Никакого изменения, 2) равновесие сместится вправо, 3) равновесие сместится влево.
26. Если pH изменяется на две единицы, во сколько раз изменяется концентрация иона водорода?
а) В 2 раза, б) в 0,5 раза, в) в 102 раз, г) 101'2 раз.
Бен Б Честейн
27. При добавлении ацетата натрия к водному раствору уксусной кислоты а) pH и степень диссоциации одновременно возрастают, б) pH и степень диссоциации одновременно уменьшаются, в) pH возрастает, а степень диссоциации уменьшается, г) pH уменьшается, а степень диссоциации возрастает.
28. Если pH апельсинового сока равен 2,8, то какова концентрация гидрок-сидного иона в этом напитке, выраженная в молях на литр?
а) 6,3 • 10“11 моль л'1, б) 1,6-10“17 моль-л'1,
в) 1,6 10-3 моль-л'1, г) 6,3 • 10“12 моль-л-1.
29. Чему окажется равен pH, если смешать равные объемы 0,005 М раствора гидроксида натрия и 0,01 М раствора азотной кислоты? а) 9,7, б) 2,85, в) 2,6, г) 7,7, д) 2,31.
30. Если 10 л газообразного водорода Н2 и 10 л газообразного кислорода О2 прореагируют друг с другом, каким окажется объем образовавшихся водяных паров при условии, что реакция проводится при постоянной температуре 105JC и атмосферном давлении?
а) 10 л, б) 20 л, в) 15 л, г) 5 л.
31. Реакция ЗН2 + N2 -> 2NH3 проводится при ПО С, так что все реагенты и продукты находятся в газовой фазе. Какая из указанных ниже величин сохраняется в ходе реакции?
а) Масса, б) объем, в) энтропия, г) энтальпия.
32. Какова химическая формула наиболее распространенного хлорида стронция (Z = 38)?
a) SrCl, б) SrCl2, в) SrCl3, г) SrCl4.
33. Оксид алюминия, А12О3, правильнее охарактеризовать как а) кислотный оксид, б) основный оксид, в) амфотерный оксид, г) водорастворимый оксид.
34. Согласно периодическому закону Менделеева, периодические свойства элементов изменяются систематическим образом в зависимости от а) атомной массы элемента, б) массового числа элемента, в) заряда ядра элемента, г) числа нейтронов у элемента.
35. Металлические элементы, как правило, обладают всеми нижеперечисленными свойствами, кроме одного: укажите его.
а) Ковкость, б) пластичность, в) способность проводить теплоту и электрический ток, г) склонность к образованию кислотных оксидов.
36. Какая из указанных ниже характеристик электромагнитного излучения пропорциональна его энергии?
а) Скорость, б) длина волны, в) волновое число, г) амплитуда.
37. Какие из указанных ниже аспектов теории Бора недопустимы с учетом принципа неопределенности Гейзенберга?
а) Дискретные атомные энергетические уровни, б) простые круговые орбиты, в) электронные орбитали, г) электронные волны, д) квантовые числа.
38. При описании орбиталей, имеюгцих главное квантовое число п = 2, квантовое число т должно характеризовать а) пространственную
Методическое пособие для преподавателей
587
ориентацию орбитали, б) форму орбитали, в) энергию орбитали в отсутствие магнитного поля, г) эффективный объем орбитали.
39. Какие из следующих экспериментов наиболее прямым образом подтверждают гипотезу Де Бройля о волновой природе материи?
а) Дифракция рентгеновских лучей, б) фотоэлектрический эффект, в) рассеяние ot-частиц металлической фольгой, г) излучение абсолютно черного тела, д) дифракция электронов.
40. Какое из следующих описаний правильнее всего характеризует эмиссионный спектр атомарного водорода?
а) Непрерывное испускание света на всех частотах, б) дискретные серии линий, в которых каждая линия находится на одинаковом расстоянии от следующей линии, в) дискретные линии, образующие пары, причем каждая пара равноудалена от следующей пары, г) дискретные серии линий, причем расстояния между линиями в пределах каждой серии уменьшаются с ростом волновых чисел, д) спектр состоит всего из двух линий.
41. На основании какого из следующих представлений Эйнштейн дал объяснение фотоэлектрическому эффекту?
а) О корпускулярной природе света, б) о волновой природе света, в) о волновой природе вещества, г) о принципе неопределенности.
42. Электрон находится на одной из ЗЛ-орбиталей. Какое из следующих квантовых чисел недопустимо для такого электрона согласно уравнению Шрёдингера?
а) п = 3, б) I = 1, в) т = 1, г) т = 2.
43. Как правильно описать процесс, ответственный за эмиссионный спектр водорода, на основании теории Бора?
а) Электроны возбуждаются на орбиты с более высокой энергией и испускают свет, падая снова на орбиты с более низкой энергией; б) атомы водорода испускают свет, когда электроны возбуждаются на орбиты с более высокой энергией; в) атомы водорода поглощают свет, когда электроны возбуждаются на орбиты с более высокой энергией; г) электроны переводятся на орбиты с более низкой энергией и испускают свет, возвращаясь на орбиты с более высокой энергией. 44. Какой из следующих принципов не принимается во внимание при мысленном заселении электронами атома для определения его состояния с низшей электронной энергией?
а) Если два электрона занимают одну орбиталь, их спины должны быть спарены; б) орбитали заселяются электронами в порядке повышения энергии; в) на орбиталях с одинаковой энергией спины электронов остаются по возможности неспаренными; г) в одном атоме никакие два электрона не могут иметь одинаковые значения квантовых чисегт FJ / и W.
45. Какое из указанных ниже соединений водорода наиболее ионное? a) LiH, б) CsH, в) FH, г) Ш.
46. Для какого из следующих атомов следует ожидать наибольшего сродства к электрону?
а) С1, б) I, в) О, г) Na.
47. Что можно предсказать насчет относительных размеров F -, Na+ и Ne?
а) Они одинаковы, б) уменьшаются в последовательности F “ > Ne > > Na + , в) увеличиваются в последовательности F “ < Ne < Na +, г) ни один из предыдущих ответов неверен.
48. Какое описание правильнее всего характеризует следующую конфигурацию электронов:
1s 2±
©0О
а) Конфигурация возбужденного состояния, б) конфигурация основного состояния, в) конфигурация триплетного состояния, г) такая конфигурация невозможна.
49. Какое из следующих состояний описывается электронной конфигурацией ls22?2p53? ?
а) возбужденное состояние атома фтора, б) основное состояние неона, в) возбужденное состояние аниона кислорода, О2-, г) основное состояние аниона фтора, F", д) запрещенное состояние.
50. В реакции
MgSO3 -> MgO + SO2
веществом, которое восстанавливается, является a) Mg, б) S, в) О, г) ни одно из предыдущих предположений не верно.
51. Бихромат-ион является сильным окислителем. Поэтому реакция Сг2О2- + 14Н+ + бе- -> 2Сг3 + + 7Н2О
должна иметь а) высокий положительный окислительный потенциал, б) высокий положительный восстановительный потенциал, в) низкий отрицательный восстановительный потенциал, г) сильную тенденцию протекать в обратном направлении.
52. На какое из перечисленных ниже явлений указывает зелено-голубая окраска иона ванадия (III) в водном растворе?
а) На поглощение света в зелено-голубой части видимого спектра, б) на поглощение света в красной части видимого спектра, в) на поглощение света в ультрафиолетовой части электромагнитного спектра, г) на восстановление V3+ в одно из его более низких состояний окисления.
53. Напишите полное уравнение следующей реакции, которая протекает в основном растворе, пользуясь целочисленными коэффициентами:
NH3 + ОС1 —> N2H4 -i- Cl-
Какое из указанных ниже целочисленных значений должен принимать коэффициент перед N2H4?
а) 1, б) 2, в) 3, г) 4.
589
54. Какое из следующих утверждений относительно свойств бериллия верно?
а) Be имеет более высокий первый потенциал ионизации, чем Li, б) Be имеет меньшую электроотрицательность, чем Li, в) атом Be больше атома Li, г) Be имеет большее сродство к электрону, чем Li.
55. Какое из следующих обобщений, касающихся щелочных металлов, неверно?
а) Эти элементы имеют низкие энергии ионизации, б) электроотрицательности щелочных металлов повышаются при переходе от Li к Cs, в) эти металлы не встречаются в природе в металлическом состоянии, г) все щелочные металлы обнаруживают большую склонность к окислению в растворе.
56. 50 мл раствора, содержащего 1,58 г КМпО4 (мол. масса 158), предполагается использовать для титрования некоторого восстановителя. В этой реакции МпО^ будет восстанавливаться в Мп2 + . Какова нормальность раствора КМпО4?
а) 0,20 н., б) 1,00 н., в) 0,04 н., г) 1,20 н., д) 0,8 н.
57. Вещество, которое отдает электроны в реакции, а) уменьшает свою степень окисления, б) может рассматриваться как окислитель, в) подвергается окислению, г) должно вызывать окисление какого-нибудь другого компонента реакционной смеси.
58. Степень окисления азота в (NH4)2SO4 равна а) + 3, б) — 3, в) — 5, г) + 5.
59. Процесс «ржавления» может быть описан следующим уравнением: 4Fe + ЗО2 -» 2Fe2O3
Какое из следующих утверждений относительно этой реакции верно? а) Кислород восстанавливается в этом процессе, б) степень окисления железа уменьшается, в) степень окисления кислорода повышается, г) степень окисления железа в этой реакции повышается от + 2 до + 3.
60. Метод отталкивания валентных электронных пар позволяет предсказывать а) длины связей, б) энергии связей, в) порядки связей, г) валентные углы.
61. Какое соединение бора и водорода должно быть изоэлектронно с метаном и ионом аммония?
а) вн3, б) вн4, в) в2н6, г) вн;.
62. Какая из следующих молекул имеет наибольшую энергию связи: а) О2, б) С12, в) N2, г) F2?
63. Какая геометрия, согласно методу ОВЭП, у молекулы BF3?
а) плоско-тригональная, б) тригонально-пирамидальная, в) Т-образная, г) ни один из предыдущих ответов неверен.
64. Какая из перечисленных ниже кислородсодержащих кислот является наиболее сильной?
а) С1 (ОН), б) СЮ (ОН), в) С1О2 (ОН), г) С1О3 (ОН).
Бен Б. Честейн
590
65. Какая степень окисления хлора в С1О4 ?
а) 4- 3, б) 4- 4, в) + 8, г) 4- 7.
66. Какая из указанных ниже канонических структур нитроамидного иона должна давать наибольший вклад в резонансную структуру этого аниона?
. N
Ф J г) II
-О 0- О 0
67. Какая из указанных ниже льюисовых структур серной кислоты, H2SO4, удовлетворяет правилу октета?
а) Н:б:5г+ :б:Н в ) H:O:S:O:H
:0: О:
:0:' :9:‘ +
6) Н:6: +S:0:Н г ) H:O:S: :б:Н
:0:" 0:
68. Какая из указанных ниже льюисовых структур молекулы азота, N2, наиболее обоснованна?
a) :N:::N: б) :N:N:
в) :N:N: r) :N::N:
69. Какое из указанных ниже свойств (лишь одно) не согласуется с большим порядком связи?
а) Большая энергия связи, б) большая длина связи, в) кратная связь, г) большая энергия диссоциации.
Часть II
1. Какая из перечисленных ниже молекул не должна существовать? а) С2, б) Li2, в) Ве2, г) В2.
2. Для какой из перечисленных ниже молекул следует ожидать наибольшего ионного характера связи?
a) F2, б) C1F, в) BrF, г) IF.
3. Какое из следующих утверждений относительно л-орбиталей верно? а) Они полностью симметричны относительно межъядерной оси: б) эти орбитали имеют узловую плоскость, лежащую между ядрами и перпендикулярную межъядерной оси; в) их волновые функции изменяют знаки при вращении на 180° вокруг межъядерной оси; г) они всегда являются разрыхляющими.
Методическое пособие доя преподавателей
591
4. Двухатомная молекула CF обладает всеми указанными ниже свойствами, кроме одного. Какое свойство не присуще этой молекуле? а) Молекула CF изоэлектронна с моноксидом азота, NO, б) имеет один неспаренный электрон, в) имеет теоретический порядок связи
1
2’
г) она диамагнитна.
5. Сколько неспаренных электронов можно предсказать для молекулярного иона О7 ?
а) 1, б) 3, в) 0, г) 2.
6. Согласно теории молекулярных орбиталей, энергия связи в частице Не2 а) меньше, чем в молекуле Н2, б) больше, чем в молекуле Н2, в) такая же, как в молекуле Н2, г) меньше, чем в молекуле Не2.
7. Длина связи в ряду NO2, NO2, NO7 должна а) быть одинакова, б) иметь наименьшее значение для NO7, в) иметь наименьшее значение для NO2, г) иметь наименьшее значение для NO 7.
8. Какая из указанных ниже молекул должна быть парамагнитной? а) СО2, б) СО, в) С12, г) NO, д) N2.
9. Поглощению излучения в какой из указанных ниже частей электромагнитного спектра соответствуют колебательные переходы?
а) В ультрафиолетовой, б) в видимой, в) в инфракрасной, г) в микроволновой.
10. Какая из следующих молекул должна иметь наибольший дипольный момент?
a) NH3, б) РН3, в) AsH3, г) ВН3.
11. К какому из указанных ниже значений должны быть ближе всего углы между связями, образуемыми карбонильным атомом углерода в молекуле уксусной кислоты, СН3—С—ОН
II
О
а) 180°, б) 90°, в) 109°, г) 120°.
12. К какому из указанных ниже значений должны быть ближе всего валентные углы Н—С—Н в метильном катионе, СН3 ?
а) 90°, б) 109°, в) 120°, г) 180°.
13. Какую гибридизацию имеет метильный атом углерода в ацетонитриле, CH3=N?
a) sp, б) sp2, в) sp\ г) dsp2.
14. Какой изомер дихлорэтилена должен быть неполярным?
а)
6)
в 1
С1 /Н ^С=С с/ хн
г) ни один из предыдущих ответов неверен.
15. Вандерваальсовы силы в молекулярных твердых и жидких веществах обычно а) возрастают с увеличением размера атомов и молекул, б) являются главным образом отталкивательными, в) обусловливают высокие температуры плавления и кипения, г) существуют только в системах с постоянными диполями.
16. Какая из следующих моделей связи лучше всего описывает химическую связь в пределах одного слоя структуры графита?
а) Металлическая связь, б) ионная связь, в) ковалентная каркасная связь, г) вандерваальсова связь.
17. Какая из следующих моделей связи лучше всего описывает химическую связь между слоями структуры графита?
а) Металлическая связь, б) ионная связь, в) ковалентная каркасная связь, г) вандерваальсова связь.
18. Какое из перечисленных ниже молекулярных веществ должно иметь наиболее высокую температуру плавления?
а) СГ4, б) СС14, в) СВг4, г) С14.
19. Согласно первому закону термодинамики, а) энергия системы всегда постоянна, б) изменение внутренней энергии системы постоянно, в) энергия системы не может ни создаваться, ни разрушаться, г) изменение энергии системы определяется только работой, выполняемой системой над ее окружением.
20. Вычисление теплот образования по энергиям связей часто приводит к ошибочным результатам, потому что а) такие расчеты включают рассмотрение гипотетического промежуточного состояния с высокой энергией, в котором все атомы изолированы друг от друга в газовой фазе, б) простое представление о связях, локализованных между парами атомов, недостаточно удовлетворительно, в) теплота не является функцией состояния, г) такой подход применим только к большим молекулам.
21. Путешественник переезжает из г. Пасадена в штате Калифорния в г. Аспен в штате Колорадо (через Скалистые горы). Какая из указанных ниже величин является функцией состояния путешествия? а) Пройденное расстояние, б) затраченное время, в) работа, выполненная по перемещению автомашины, г) изменение высоты над уровнем моря.
22. К какому типу термодинамических систем принадлежит каждая из указанных ниже систем: 1) стакан, наполненный до половины реактивами, 2) те же реактивы в склянке с закрытой завинчивающейся крышкой, 3) те же реактивы в отпаянном баллоне термоса?
а) Незамкнутая, б) замкнутая, в) изолированная.
23. В каком из следующих процессов должно обнаруживаться наибольшее положительное изменение энтропии?
а) 1 моль СН3ОН (тв.) -» 1 моль СН3ОН (г.)
б) 1 моль СН3ОН (тв.) -» 1 моль СН3ОН (ж.)
в) \/2 моля О2(г.) + 2 моля Na(TB.) -» 1 моль Na2O (тв.)
г) 1 моль ХеО4 (тв.) -» 1 моль Хе (г.) 4- 2 моля О2 (г.)
l/iWi'^kave с’.л1* праюРаяителеи 593
24. Для необратимых процессов наблюдаемое изменение свободной энергии AG оказывается а) всегда равным нулю, б) всегда положительным, в) всегда отрицательным, г) положительным или отрицательным в зависимости от обстоятельств.
25. Самопроизвольный характер процесса лучше всего определяется путем оценки изменения а) энтальпии, б) энтропии, в) свободной энергии, г) температуры.
26. Какое из указанных ниже веществ имеет наибольшую абсолютную (рассчитанную на основании третьего закона термодинамики) молярную энтропию?
а) С (алмаз), б) РЬ (тв.), в) Hg (ж.), г) Hg (г.).
27. Третий закон термодинамики можно сформулировать следующим образом: а) энтропия идеального кристалла при абсолютном нуле температуры равна нулю, б) энтропия повышается при превращении жидкости в газ, в) энтропия возрастает при увеличении массы вещества, г) энтропия увеличивается при возрастании химической сложности вещества.
28. Интерпретация энтропии с использованием представлений о порядке и беспорядке на молекулярном уровне была впервые предложена а) Эйнштейном, б) Клаузиусом, в) Больцманом, г) Кельвином.
29. Если система получает обратимым образом количество теплоты q при температуре Т, то об энтропии системы можно сказать, что она а) возрастает на величину qT, б) возрастает на величину q/T, в) возрастает на величину, большую q/T, г) возрастает на величину, меньшую <j/T.
30. Самопроизвольный процесс можно определить как процесс, а) который обладает способностью к осуществлению без воздействия со стороны остальной части Вселенной, б) который протекает быстро, в) в котором всегда выделяется теплота, г) который способен осуществиться за достаточно короткий промежуток времени без помощи катализатора.
31. Растворение какого из указанных ниже веществ в воде должно оказать наибольшее влияние на коллигативные свойства полученного раствора? (В каждом случае будем исходить из полной растворимости.) а) 0,01 моля NaCl, б) 0,01 моля Ag2 (SO4)3, в) 0,01 моля K3Fe (CN)e, г) 0,01 моля K2SO4.
32. Тироксин-гормон, контролирующий скорость метаболизма в человеческом организме, может быть выделен из щитовидной железы. Раствор 0,455 г тироксина в 10,0 г бензола замерзает при температуре 5,144°С, тогда как температура замерзания чистого бензола 5,444°С. Какова молекулярная масса тироксина? (Мол. масса бензола 78, молярная константа понижения температуры замерзания для бензола 5,12 К - моль-1 кг-1.)
а) 776,5, б) 69,9, в) 77,65, г) 7,76.
33. Какое из перечисленных ниже утверждений не вытекает из приведенной здесь типичной фазовой диаграммы?
20 - 796
Температура. °C
а) Не все три кривые обязаны иметь положительный тангенс угла наклона, согласно принципу Ле Шателье; б) точка х является тройной точкой; в) кривая xz всегда заканчивается в точке z, называемой критической точкой; г) область между кривыми ху и xz соответствует диапазону изменения температур и давлений, в котором жидкая фаза является термодинамически устойчивой формой существования вещества.
34. В точке кипения воды должно выполняться одно из следующих соотношений:
a) Gr - Gx = 0 б) Sr - Sx < О
в) Нг - Нх < 0 г) Нг - Нх = Sv - Sx
35. Согласно правилу Трутона, а) молярные энтропии испарения приблизительно одинаковы для всех жидкостей, б) молярные энтальпии испарения приблизительно одинаковы для всех жидкостей, в) молярные теплоты испарения приблизительно одинаковы для всех жидкостей, г) молярные изменения свободной энергии, связанные с испарением любой жидкости, приблизительно одинаковы.
36. Константа равновесия для реакции
2SO2 + О2 - 2SO3
при 1000 К равна 3,5. Каким должно быть парциальное давление газообразного кислорода, чтобы количества SO2 и SO3 были одинаковыми?
а) 0,29 атм, б) 3,5 атм, в) 0,53 атм, г) 1,87 атм.
37. Рассмотрим три следующие реакции:
1) С + О2 СО2
2) Н2 + СО2 Н2О + СО
3) Н2 + С + О2 Н2О + со
Обозначим константы равновесия этих реакций как К,, К2, К3. Какое из следующих соотношений должно выполняться для этих констант?
а) К2 = К3 - К. б) К, = —
в) К2 = К. - К, г) К2 = — - К,
38. Если электродная полу реакция
X + е~ - X"
имеет большой отрицательный восстановительный потенциал, означает ли это, что а) окисленное состояние является более благо
595
приятным, б) вещество X имеет большую способность присоединять электроны, в) электродная реакция должна самопроизвольно протекать в указанном направлении, г) вещество X легко восстанавливается?
39. Стандартные восстановительные потенциалы, которые приводятся обычно в различных справочниках, представляют собой напряжения гальванических элементов, измеренные при комбинировании каждой восстановительной реакции, как она записана в соответствующем уравнении, с реакцией а) окисления О2, б) восстановления О2, в) окисления Н2, г) восстановления Н2.
40. Какой из перечисленных ниже особенностей электролизеры отличаются от гальванических элементов?
а) В электролизерах используются внутренние химические реакции для получения электрического тока, б) электрод, на котором происходит окисление, представляет собой катод, в) в них используется внешний источник электрического тока, г) электролизеры удобны для использования самопроизвольного потока электронов с целью получения внешней работы.
41. Стандартные молярные потенциалы для реакций
Ni + Cu2+ -> Ni2+ + Си и Ni + Zn2+ -> Ni2+ + Zn
равны соответственно + 0,57 и — 0,53 В. Чему равно стандартное напряжение гальванического элемента, в котором протекает реакция Zn + Cu2+ -> Zn2+ + Си?
а) 1,10 В, б) - 1,10 В, в) 0,04 В, г) -0,04 В.
42. Рассмотрим следующий концентрационный гальванический элемент на CuSO4:
Cu|Cu2+ (0,01 M)||Cu2+ (0,1 M)|Cu
пористая перегородка
Какое из следующих утверждений справедливо в отношении такого гальванического элемента?
а) Электроны должны самопроизвольно протекать во внешней цепи из правого отделения в левое, б) медный электрод в правом отделении играет роль катода, в) в левом отделении происходит восстановление Си2+ в Си0, г) по мере протекания реакции свободная энергия в расчете на моль реакции должна возрастать.
20*
43. Какое из указанных ниже защитных средств не предохранит железо от ржавления (т.е. окисления), если его поверхность окажется поврежденной?
a) Mg («жертвенные» блоки), б) Sn (жестяная банка), в) А1 (алюминиевое покрытие), г) Zn (гальванизованная сталь).
44. Какая из указанных ниже структур представляет собой цвиттер-ионную форму аминокислоты?
а) СН2—С
I хо'
NH
О
II
3) сн2—с—он
+ I
NH3
о и в) СН2—С—О'
+NH3
^0
г] СН2— С
NH2 0
45. Реакция, обратная процессу омыления, называется а) этерификацией, б) альдольной конденсацией, в) конденсацией Клайзена, г) гидролизом.
46. Какая из указанных ниже молекул дает при окислении кетон?
а) СН3СН2ОН б) СН3СН2—О- СН3
О
II
в) СН3—С—ОН г) СН3—СНОНСН3
47. Какое из следующих соединений лучше всего растворимо в воде? а) СН3СН2ОСН2СН3 б) СН3 (СН2)6СН2ОН в) НОСН2СН2ОН СН3
I
г) СН3—С—ОН
I сн3
48. Какое из следующих соединений обладает наибольшей кислотностью? а) СН3СН2ОН, б) СН3СН3, в) H- О—Н, г) СН3СООН.
49. Сколько структурных изомеров С4Н10О являются эфирами?
а) 1, б) 2, в) 3, г) 4.
50. Соединение имеет формулу С5Н6. Какое максимальное число колец оно может включать?
а) 0, б) 1, в) 2, г) 3.
51. Какая из следующих формул является общей для нециклических алканов?
а) С„Н2п + 2, б) С„Н2„, в) С„Н2„_2, г) С„Н„.
52. Какое из следующих соединений является изомером 1-хлорпропана? а) СН3СН2СН2ОН, б) СН3СНС1СН3, в) СН3СН2СН3,
г) СН3СН2СНС12.
53. Какой из указанных ниже изомеров (лишь один) неидентичен остальным трем?
597
Illi H H H Cl jjl н н
6) н—с—с—i—ci
I H H H—C—H
I H
e) Cl—c—c
I. I
54. Какое из перечисленных ниже коммерческих названий имеет синтетический полимер следующей структуры:
F F F F 1111 —С—С—С—С 1111 F F F F а) Тефлон, б) дакрон, в) найлон, г) неопрен.
55. Сколько геометрических изомеров у бутена-2?
а) 1, б) 2, в) 3, г) 4.
56. Формы D- и L-аминокислот являются а) диастереоизомерами, б) энантиомерами, в) структурными изомерами, г) цис-транс-изомерами.
57. Какая молекула высвобождается, когда две аминокислоты образуют дипептид ?
а) СО2, б) NH3, в) СН3СН2ОН, г) Н2О.
58. Полная реакция фотосинтеза в зеленых растениях описывается уравнениями :
а) С6Н12О6 + 2О2 -> 2СН3СООН + 2Н2О + 2СО2
б) 6СО2 + 6Н2О -> С6Н12О6 + 6О2
в) АДФ + Фосфат -» АТФ
г) Н2О + НАД + - НАД Н + Н+ + уО2.
59. Какой из перечисленных ниже атомов ответствен в аминокислотах за существование у последних оптических изомеров?
a) N, б) О, в) С, г) S.
60. Какой из перечисленных ниже сахаров является мономером целлюлозы и крахмала?
а) Манноза, б) сахароза, в) рибоза, г) глюкоза.
61. Протекание реакции благоприятно в кинетическом смысле, если энтропия активации а) большая и отрицательная, б) небольшая и отрицательная, в) небольшая и положительная, г) большая и положительная.
62. «Искусственные» элементы были получены в бомбардировочных реакциях на ускорителях с большой энергией. Каково массовое число элемента, полученного в реакции
2^Cf + 4N 105ХХ + 4‘л?
а) 268, б) 257, в) 264, г) 260.
63. Для устойчивых изотопов элементов более тяжелых, чем Н и Не, а) число протонов никогда не превышает числа нейтронов, б) число протонов равно числу нейтронов, в) число протонов всегда больше числа нейтронов, г) ни одно из предыдущих предположений неверно.
64. Время, необходимое для того, чтобы взятое количество радиоактивного вещества распалось до половины этого количества, а) прямо пропорционально константе скорости процесса распада, б) зависит от исходного количества вещества, в) зависит только от механизма распада, г) обратно пропорционально константе скорости процесса распада.
65. В каком из следующих процессов распада происходит изменение массового числа?
а) 0-распад, б) захват орбитального электрона (К-захват), в) а-распад, г) испускание позитрона.
66. При самопроизвольном 0 " -распаде испускаемый электрон вылетает из а) ядра, б) атомной 15-орбитали, в) занятой орбитали с высшей энергией, г) ни одно из предыдущих предположений неверно.
67. Продуктом реакции электронного захвата, которой подвергается 2g4Po, должен быть a) 2g8Po, б) At, в) 2g3Bi, г) 2взВь
68. Константа образования для комплекса Ni(NH3)^ + при 25°С равна 6 108. Какой будет окончательная концентрация гидратированного иона Ni2 + , если 50 мл 2,00 М раствора NH3 смешать с 50 мл 0,200 М раствора Ni2+ ?
а) 4 • 10-8 моль-л-1, б) 3 1О-10 моль-л-1,
в) 2 • 10'10 моль-л-1, г) 2 10-9 моль-л-1.
69. Какой из указанных ниже ионов следует в первую очередь отнести к лигандам сильного поля?
a) F - , б) ОН - , в) I- , г) CN - .
70. Комплексное соединение моногидрат хлоропентааквохром (Ш)хлори-да описывается химической формулой:
а) Сг (Н2О)5С12 • Н2О б) Сг (Н2О)5С1 - Н2О
в) [Сг(Н2О)5С1]С12-Н2О г) [Сг(Н2О)5С1]С13 -Н2О
71. Какой анион в ряду VO|-, СгО<- и МпО4 является самым слабым основанием?
a) VO4-, б) СгО4-, в) МпО4, г) все три аниона имеют примерно одинаковую основность.
72. Сколько ионов на моль образуется при растворении в воде соединения с эмпирической формулой PtCl4 • 3NH3?
а) 5, б) 4, в) 2, г) 0.
73. Сколько изомеров имеет соединение [Cr(NH3)4Cl2]Cl?
а) 1, б) 2, в) 3, г) 4.
74. Какова электронная конфигурация октаэдрически координированного иона СО2+ с тремя неспаренными электронами в основном состоянии? a) (t29)5(e„)2, б) (t2/(e9)3, в) (Г29)3(е/, г) (t29)2(e9)5.
599
75. Каково соотношение между скоростями изменения концентраций реагентов и продуктов для реакции
А + 2В -> ЗС
в условиях равновесия?
, ^[а] _ б) d[B] 2 J[c]
’ dt dt ’ dt 3 dt
. £[B1 = 1A[C1 г) 4A] 1 <B]
dt 2 dt ’ dt 2 dt
76. Экспериментально установленное уравнение для скорости реакции 2NO (г.) + О2 (г.) - 2NO2 (г.) имеет вид
^^l = /<[NOr [О2]
Можно ли сделать вывод, что а) реакция является тримолекулярной, б) реакция протекает в одну стадию, в) реакция имеет в целом третий порядок, г) реакция имеет первый порядок как по кислороду, так и по моноксиду азота?
77. При каком из следующих условий график зависимости логарифма константы скорости от обратной температуры представляет собой прямую линию?
а) Если аррениусова энергия активации не зависит от температуры, б) если реакция имеет первый порядок, в) если реакция является моно-молекулярной, г) если реакция представляет собой одностадийный процесс.
78. Скорость обмена лигандами в октаэдрических комплексах зависит от скорости отщепления лиганда от комплекса. Какой из указанных ниже аквокомплексов должен обменивать одну молекулу воды на другую с минимальной скоростью?
а) [Си (Н2О)6]2 + б) [Zn(H2O)6]2 +
в) [Sc(H2O)6]3 + г) [Сг(Н2О)6]3 +
600
Ответы на экзаменационные вопросы
Часть I
1. б 2. в 3. б 4. а 5. б
6. б 7. б 8. б 9. в 10. в
11. б 12. б 13. б 14. а 15. б
16. в 17. а 18. в 19. в 20. г
21. а 22. г 23. а 24. а
25. а, 3; б, 2: в, 2; г, 1
26. в •27. в 28. г 29. в 30. а
31. а 32. б 33. в 34. а 35. г
36. в 37. б 38. а 39. д 40. г
41. а 42. б 43. а 44. г 45. в
46. а 47. б 48. г 49. в 50. г
51. б 52. б 53. а 54. а 55. б
56. б 57. в 58. б 59. а 60. г
61. б 62. в 63. а 64. г 65. г
66. г 67. а 68. а 69. б
Часть 11
1. в 2. г 3. в 4. г 5. а
6. а 7. б 8. г 9. в 10. а
И. г 12. в 13. в 14. б 15. а
16. в 17. г 18. г 19. в 20. б
21. г 22. 1 а; 2 б; 3 в
23. г 24. в 25. в 26. г 27. а
28. в 29. б 30. а 31. б 32. а
33. а 34. а 35. а 36. а 37. б
38. а 39. в 40. в 41. а 42. б
43. б 44. в 45. а 46. г 47. в
48. г 49. в 50. в 51. а 52. б
53. г 54. а 55. б 56. б 57. г
58. б 59. в 60. г 61. г 62. г
63. а 64. г 65. в 66. а 67. в
68. а 69. г 70. в 71. в 72. в
73. б 74. а 75. г 76. в 77. а
78. г
Авторский указатель
Авогадро A. (Avogadro А.) 1, 14, 28, 54, 65, 114. 267, 285, 294, 295
Аристотель (Aristotle) 1, 269
Аррениус С. (Arrhenius S.) 1, 80, 214, 220-222, 474; 2, 138
Бакеленд Л. Г. (Baekeland L. Н.) 2, 268
Бальмер Дж. (Balmer J.) 1, 328, 340-344, 349, 375
Беккерель A. (Becquerel Н.) 1, 329; 2, 411
Бенсон A. (Benson А.) 2, 335
Бертло М. (Berthelot М.) 2, 66, 111
Бертолле К. (Berthelot С.) 2, 66
Бертолле К.-Л. (Berthollet К. L.) 1, 275, 285
Берцелиус Й. Я. (Berzelius J. J.) 1, 285; 2, 204
Бехер И. (Becher J.) 1, 273
Блэк Дж. (Black J.) 1, 271; 2, 119
Боденштейн М. (Bodenstein М.) 1, 176; 2, 354
Бойль Р. (Boyle R.) 1, 117, 121, 270; 2, 91
Больцман Л. (Boltzmann L.) 1, 134; 2, 56, 61
Бор Н. (Bohr N.) 1, 269, 328, 343-345, 348, 353, 384; 2, 419, 424 , 425
Бренстед (Bronsted J.) 1, 214, 215, 221, 474
Брэккет (Brackett) 1, 341, 343
Брюденелл Дж. (Brudenell J.) 2, 156
Бэкон Ф. (Bacon F.) 2, 5
Вааге П. (Waage Р.) 2, 364
Ван-ден-Броек (Van den Broek) 1, 312
Ван-дер-Ваальс Й. (Van der Waals J.) 1. 24, 153, 157, 614
Вант-Гофф Я. Г. (Van’t Hoff J. Н.) 2, 364
Велер Ф. (Wohler F.) 1, 284; 2, 263
Вельсбах К. (Welsbach К.) 1, 271
Воган Б. (Voughan В.) 1, 300
Волластон В. (Wollaston W.) 1, 165, 465
Ган О. (Hahn О.) 2, 424
Гейгер Г. (Geiger Н.) 1, 332
Гейзенберг В. (Heisenberg W.) 1, 357, 376
Гей-Люссак Ж. Л. (Gay-Lussac J. L.) 1, 123, 125,
127, 267, 284, 285
Гельмгольц Г. (Helmholtz Н.) 2. 8. 11. 110. 364
Герцфельд К. (Herzfeld К. F.) 2, 385
Гесс Г. (Hess Н.) 1, 92; 2, 5, 22
Гиббс Дж.У. (Gibbs J. W.) 2, ПО, 134, 135, 364
Гиллеспи Р. (Gillespie R.) 1, 491
Гладстон Дж. (Gladstone J. Н.) 1, 326
Грэхем Т. (Graham Т.) 1, 148
Гульдберг Г. (Guldberg G. М.) 2, 364
Гуид Ф. (Hund F.) 1, 385. 387; 2. 226
Гэй Дж. (Gay J.) 2, 404
Дальтон Дж. (Dalton J.) 1, 47, 144, 145, 157, 165, 257, 258, 279-283, 295; 2, 5, 7, 8, 53
Даниэль Дж. Ф. (Daniell G.F.) 2, 164, 165
Дарвин Ч. (Darwin Ch.) 2, 264
Де Бройль Л. (De Broglie L.) 1, 328, 353, 354, 355
Демокрит (Democritus) 1, 13, 62, 63, 280
Дёберейнер И. (Dobereiner J.) 1, 313
Джермер Л. (Germer L.) 1, 355, 376
Джилберт Д. (Gilbert D.) 1, 165
Джоуль Дж. (Joule J.) 2, 8, 9, 10
Дьюар М. (Dewar М.) 1, 573
Дэви Г. (Davy Н.) 1, 279, 283; 2, 47
Дэвиссон (Davisson С.) 1, 355, 376
Дюлонг П. (Dulong Р.) 1, 267, 291-292
Дюма Ж. (Dumas J.) 1, 284
Зоммерфельд A. (Sommerfeld А.) 1, 328, 351, 352; 2, 419
Ирвин Дж. (Irwin J.) 2, 434
Кавендиш Г. (Cavendish Н.) 1, 272
Кальвин М. (Calvin М.) 2, 335, 428
Канницаро С. (Cannizzaro S.) 1, 287. 289
Карозерс В. (Carothers W. Н.) 2, 268
Кекуле A. (Kekule А.) 1, 287, 573
Кеплер И. (Kepler J.) 2, 253
Клаузиус Р. (Clausius R.) 2, И, 54
Кори Р. (Corey R. В.) 2, 316
Костер Д. (Coster D.) I, 312
Кребс X. (Krebs Н.) 2, 331
Кювье Б. (Cuvier В.) 2, 47
Кюри М. (Curie М.) 1, 330; 2, 411
Кюри П. (Curie Р.) 1, 330; 2, 411
Лавуазье A. (Lavoisier А.) 1. 63. 267. 272, 274.
275, 299; 2, 6, 11, 46, 53
Лайман (Lyman) 1, 328, 340-344, 349, 375
Лауэ М. (Laue von М.) 1, 329, 355
ЛауриТ. (Lawry Т. М.) 1, 214, 215, 220, 221
Лекок де Буабодран Ф. (Lecaq de Boibaud-ran F.) 1, 271
Ле Шателье А. Л. (Le Chatelier Н. L.) 1, 190, 191, 192, 196; 2, 50, 107-109
Либих Ю. (Liebig von J.) 1, 270
Лоуренс Т. (Lawrence Т. Е.) 2, 50
Лоуренс Э. (Lawrence Е.) 1, 444 ; 2, 423
Лукреций Тит Кар (Lucretius Titus Carus) 1, 280
Льюис Дж. (Lewis J. N.) 1, 47, 465, 474
Майер Ю. (Mayer J.) 2, 8
Майкельсон A. (Michelson A.) 1, 329
Максвелл Дж. (Maxwell J.) 1, 134 , 329
Малликен P. (Mulliken R.) 1, 405
Марсден Э. (Marsden E.) 1, 332
Мариотт Э. (Mariotte E.) 1, 117. 121
Мейер Л. (Meyer L.) 1, 268, 327; 2. 350
Мейтнер Л. (Meitner L.) 2, 424
Менделеев Д. И. 1, 268, 307, 310, 327
Милликен P. (Millikan R.A.) 1, 50, 54, 65, 268
Мозандер К. (Mosander С.) 1, 271
Мозли Г. (Moseley H.) 1, 311, 312
Найхолм P. (Nyholtn R.S.) 1, 491
Нернст В. (Nernst W.) 2, 183
Ньюленде Дж. (Newlands J.) 1, 306, 325-327;
2, 8, 11
Ньютон И. (Newton I.) 1, 281, 339
Оствальд В. (Ostwald W.) 2, 391
Смит A. (Smith A.) 1, 267
Стоней Дж. (Stoney G. J.) 1, 44, 47. 48
Сцилард Л. (Szilard L.) 2, 425
Твен M. (Twain M.) 1, 551
Тиндаль Дж. (Tyndall I) 2, 11
Томсен Ю. (Thomsen J.) 2, 66
Томпсон Б. (граф Румфорд) [Thompson В.
(Count Rumford)] 2, 7, 44-48, 66
Томсон В. (лорд Кельвин) [Thomson W. (Lord
Kelvin)] 1, 62, 124; 2, 10, 11, 54, 66
Томсон Г. П. (Thomson G. P.) 2, 66
Томсон Дж. Дж. (Thomson J. J.) 1, 48, 49, 54,
268, 330, 331, 509; 2, 66
Томсон T. (Thomson T.) 1, 164
Торричелли Э. (Torricelli Е.) 1, 115
Трутон Ф. (Trouton F.) 2, 86, 119, 123
Уальд (Wald J.) 1, 385
Фарадей М. (Faraday М.) 1, 41, 42, 43 , 46, 54, 268; 2, 10, 47, 65, 408
Ферми Э. (Fermi Е.) 2, 423
Фишер Э. (Fischer Е.) 2, 308, 309
Фогт В. (Voigt W.) 1, 601
Фостер Дж. (Foster J. Е.) 1, 326
Франклин Б. (Franklin В.) 1, 47, 98, 300; 2, 44
Фриш О. (Frisch О.) 2, 424
Паули В. (Pauli W.) 1, 385, 386
Пауэлл Г. (Pawell H.) 1, 491
Пашен (Paschen) 1, 328, 340, 341, 349, 375
Перье (Perrier) 1, 444
Планк M. (Planck M.) 1, 329, 336, 338, 348, 375
Полинг Л. (Pauling L.) 1, 404 ; 2, 225, 233, 316
Поляки M. (Polanay M.) 2, 385
Пристли Дж. (Priestleu J.) 1, 272, 299-300
Пруст Ж.Л. (Proust J. L.) 1, 275, 283
Пти A. (Petit A.) 1, 267, 291-292
Пуанкаре A. (Poincare H.) 1, 415
Пфунд (Pfund) 1, 341, 343
Рауль Ф. M. (Raoult F. M.) 2, 119, 135
Резерфорд Э. (Rutherford E.) I, 268, 312, 328,
330-332, 375; 2, 421
Резерфорд Д. (Rutherford D.) 1, 272
Рей Ж. (Rey J.) 1, 273
Рентген В. (Rontgen W.) 1, 329
Ридберг И. (Rydberg J.) 1, 328, 342, 343, 345, 375
Ристин A. (Risteen A.) 1, 295
Рихтер И. (Richter J.) 1, 276, 278
Робинсон Дж. (Robinson J.) 1, 271
Рузвельт Ф. (Roosevelt F.) 2, 425
Салливэн Дж. (Sullivan J. H.) 2, 354, 38i, 382
Cerpe (Segre) 1, 444
Семенов H.H. 2, 380
Сент-Дьёрдьи A. (Szent-Gyorgyi A.) 1, 113
Сиборг Г. (Seaborg J.) 1, 324
Сиджвик H. (Sidgwick N.) 1, 491
Скотт Д. (Scott D.) 2, 434
Хандлер Р. (Handler von R.) 1, 206
Хевеши Г. (Hevesy G.) 1, 312
Шарль Ж. (Charles J.) 1, 123, 127
Шрёдингер Э. (Schrodinger Е.) 1 269, 328, 360-
363, 374, 376, 386; 2, 419
Шталь Г. (Stahl G.) 1, 273
Штрассман Ф. (Strassman F.) 2, 424
Эдисон Т. (Edison Т.) 2, 44
Эйринг Г. (Eyring Н.) 2, 373, 380, 385
Эмпедокл (Empedocles) 1, 268, 269
Эпикур (Epicur) 1, 280
Эйнштейн A. (Einstein А.) 1, 96, 338, 348, 353;
2, 408, 425
лыи указатель
Абсолютная температура газа, определение
1, 138
Аддитивность теплот реакций 2, 22
Аденин 2, 269
Аденозиндифосфат 2, 328-335
Аденозинтрифосфат 2, 328-335
Азот
оксид N2O5, разложение в растворе 2, 361, 362, 363
-------твердом виде 2, 66
свойства 1. 455; 2, 276-280
- сравнение с углеродом 2, 281-282
электронное строение 1, 526, 528, 542
Азотоводороды 2, 277
Аккумуляторная батарея свинцовая 2, 169
Активация, энергетический барьер 2, 369
Активность 2, 77, 83, 97, 113
удельная 2, 428
Активные центры 2, 305
Актиноиды 1, 316
свойства 1, 451
Аланин 2, 291
оптические изомеры 2, 299
Алифатические соединения 2, 300
Алканы (парафины) см. Углеводороды насыщенные
Алкены см. Углеводороды ненасыщенные
Алкиламины 2, 298
Алкины см. Углеводороды ненасыщенные
Аллотропные модификации 1, 602
Алмаз
структура 1, 604
электронное строение 1, 629
Альдегиды 2, 291, 293, 337
Алюминий
свойства 1, 454
хлорид как катализатор 2, 302
- энтропия 2, 63
Аминокислоты 2, 297, 337
в белках 2, 314-315
названия остатков 2, 314—315
оптические изомеры 2, 299
Амины 2, 298, 337
вторичные 2, 298
первичные 2, 298
третичные 2, 298
Аммиак
диссоциация 2, 103
льюисова структура 1, 471
разложение 2, 103, 104
синтез 2, 51
- свободная энергия 2, 77, 80
электронное строение 1, 559, 571
Аммония хлорид, льюисова структура 1,
471, 472
Амфипротонные частицы 1, 486, 502
Амфотерность 1, 485, 502
Амфотерные свойства 1, 437, 456
Анализ химический 1, 66
Анаэробная ферментация 2, 326
гликолиз 2, 336, 338
Анилин 2, 304
Анионы
образование названия 1, 37, 53
определение 1, 31, 53
Анод 1, 41, 54; 2, 161, 172, 193
Антрацен 2, 301
Ароматические соединения 2, 270, 289, 300-305,
337
поглощение света 2, 305
электрофильное замещение 2, 302
Асбест 1, 635
Асимметрический (херальный) центр 2, 222
Аспарагиновая кислота 2, 291
Атом
водорода, волновые функции 1, 363, 376
возбужденное состояние 1, 346, 376
массовое число 1, 15, 52
многоэлектронный 1, 374
- строение 1, 386
определение 1, 14, 51
основное состояние 1, 346, 376
порядковый (атомный) номер 1, 15, 51
радиус 1, 403, 408
размеры 2, 390
с незамкнутой оболочкой 1, 468, 501
строение, модель Бора 1, 344, 375
— Зоммерфсльда 1, 350-352
— Резерфорда 1, 330, 375
формальные заряды 1, 468, 469, 501
центральный 1, 503
энергетические подуровни 1, 349, 351
- уровни 1, 376
Атомная единица длины 1, 346, 376
Атомная масса 1, 18, 52
естественная 1, 19, 52
Атомные единицы массы 1, 14, 51, 53
Ацетальдегид 2, 291, 292
Ацетамид 2, 351
Ацетилен
льюисова структура 1, 472
электронное строение 1, 568-569
Ацетилкофермент А 2, 330
Ацетилсалициловая кислота (аспирин) 2, 304
Ацетон 2, 291, 292
Барий, свойства 1, 435^4-37
Барометр ртутный 1, 115
Белки 2, 266
глобулярные 2, 313, 338
фибриллярные 2, 313, 338
Бензойная кислота 2, 304
Бензол 2, 269
реакции замещения 2, 302
резонансные структуры 1, 578
теплота образования 2, 33
электронное строение 1, 571-573
энергетическая диаграмма получения 2. 34
Бенитоит 1, 634
Берилл 1, 634
Бериллий
гидрид, электронное строение 1, 551
свойства 1, 435^437
электронное строение 1, 525
энтропия 2, 63
Биохимия 2, 264
Бор
аллотропные модификации 1, 604, 605
гидриды 2, 271, 275
нитрид, электронное строение 1, 538
свойства 1, 454; 2, 271-275
- сравнение с углеродом 2, 281-282
электронное строение 1, 525
Боровский радиус 1, 346, 375 см. также
Атомная единица длины
Бром, энтропия 2, 62, 63
Бромбензол 2, 302
Бутадиен 2, 289
Бутан 2, 266, 279, 287
Бутен 2, 288. 289
Бутилацетат 2, 297
Буферные растворы 1, 240, 257
Валентность 1, 294
Валентные структуры с.и. Структуры лью-исовы
Валентные углы 1, 493, 553
Валин 2, 291
Ванадий, свойства 1, 441
Вандерваальсовы силы 1, 24, 52, 601, 611, 640
Вероятность 1, 360
плотность 1, 361, 376
Висмут, свойства 1, 455
Вода
диссоциация 2, 468
как растворитель 1, 621-623
полярность 1, 580
структура 1, 619-621
фазовая диаграмма 2, 133
физические свойства 1. 621
электронное строение 1, 563
энтропия 2, 62
Водород
атомарный спектр 1, 339
изотопы 2, 406
реакция с иодом 2. 354, 380-382
химическая связь в молекуле 1, 511
хлористый, энтропия 2, 63
Водородный показатель 1, 211, 257
Волновое число (частота) 1, 334, 375
Волновые функции 1, 362, 376
Волны де Бройля 1, 355
Восстановитель 1, 419, 456
Восстановление, определение 1, 32, 53, 417
Вырожденный энергетический уровень 1, 523, 544
Газы
благородные 1, 314, 323, 399. 408
зависимость объема от давления 1, 121, 135
----температуры 1, 123
идеальные 1, 132
молярный объем исключенный 1, 155
— определение 1, 153
реальные 1, 138, 150
среднеквадратичная скорость молекул 1, 141, 156-157
стандартное состояние 2, 24
транспортные свойства I, 150
Галактоза 2, 309
Г алогенирование
алканов 2, 287
алкенов 2, 289
Галогены 1, 314
Гем 2, 254, 259, 262
Гемоглобин 2, 261, 262
Гептан 2, 266
Германий, свойства 1, 455
Гибридизация 1, 552
Гидразин 2, 277
Гидразоновая кислота 2, 277
Гидриды бинарные 1, 318, 323
Гидролиз 1, 208, 242, 256
константы скорости (таблица) 2, 391
Гликоген 2, 308
Гликолиз 2, 326
Глинистые минералы 1, 636
Глицин 2, 291
Глюкоза 2, 308, 309, 338
сгорание 2, 325
Грамм-эквивалент I, 82, 83, 100, 428, 456
Гранит 1, 633
Графит, структура 1, 604
Группы гидрофобные 2, 314
Давление
критическое 2, 120, 148
осмотическое 2, 145, 146, 149
насыщенных ларов 1, 186
парциальное 1, 145; 2, 101, 136, 137
равновесное 2, 126
Дативное л-взаимодействие 2, 237
Дегидрирование 2, 287
Детектор с поверхностной ионизацией 2, 356
Дефект массы 1, 18, 52
Диазометан 2, 278
Диамагнетизм 1, 525, 544
Диборан, электронное строение 1, 558, 559
Диметиламин 2, 291, 298
Диметиловый эфир 2, 291, 292
растворение в воле 2, 390
605
Динитронафталин 2, 306
2,4- Динитронафтол-1 2, 306
Диполь-дипольное взаимодействие 1, 618-619,
623
Дипольный момент 1, 536, 544, 580-583, 595
Диоксид углерода, фазовая диаграмма 2, 131
Диспропорционирование 1, 423, 456
Диссоциация 2, 468^173
Дихлорбензол, полярность 1, 582
Дихлорэтан 2, 291
Дихлорэтилен, полярность 1, 581-582
Дициан 1, 470
Диэлектрики (изоляторы) 1, 631
Длина волны 1, 334, 375
Дыхательная цепь 2, 326, 330, 338
Единицы измерения физических величин 2, 442-445
Емкость насыщения см. Валентность
Железо, свойства 1, 445
Закон
Авогадро 1, 114, 127, 155, 285
аддитивности теплот реакций 1, 192; 2, 22
Беера 1, 593
Бойля - Мариотта 1, 117, 121, 127, 135, 155
Гей-Люссака первый 1, 123, 127, 155
Гесса см. Закон аддитивности теплот реакций
действия масс 1, 173
кратных отношений Дальтона 1, 283, 295
объединенный газовый 1, 127
октав Ньюлендса 1, 306
парциальных давлений Дальтона 1, 144, 145, 157
периодический Менделеева 1, 310-312
постоянных отношений 1, 281
постоянства состава Пруста 1, 275
Рауля 2, 135, 149
сохранения заряда ядра 1, 96
- импульса 1, 96
- массы 1, 64, 96, 274
- энергии 1, 64, 87, 96 термодинамики второй 2, 54
- первый 2, И, 14, 15, 22, 35, 53-54, 75
- третий 2, 61
Шарля 1, 123, 127, 155
эквивалентных отношений 1, 295
электролиза Фарадея 1, 43, 45
эффузии газов Грэхема 1, 148
Замещение
механизмы 2, 379, 382
нуклеофильное 2, 379
скорость 2, 382
Значащие цифры 2, 457^167
Золото, свойства 1. 447
Зона
валентная 1, 631
запрещенная 1, 631
проводимости 1, 631
Зоны электронные 1, 625
“Извести” 1, 273
Излучение
абсолютно черного тела 1, 336, 337, 375
гамма 2, 413
Изобутан 2, 266
Изомеры 1, 581
геометрические 2, 288
оптические 2, 299
Изотопного разбавления метод 2, 428
Изотопы 1, 16, 52, 405
радиоактивные 2, 411
устойчивые 2, 410, 418, 422
Ингибитор 2, 359
Индикаторы 1, 85, 226, 233, 235, 257
кислотно-основные 2, 306
Иод
реакция с водородом 2, 354, 380-382
свойства 1, 455
энтропия 2, 62, 63
Ион-дипольные взаимодействия 1, 623
Ионизация воды 1, 210
Ионное произведение 1, 255
воды 1, 211, 256
Ионы 1, 29, 53
в газовой фазе 1, 47
- растворе 1, 38
гидратированные 1, 39, 54, 209
комплексные 1, 33, 34
наблюдатели 1, 425
простые 1, 31, 33
Испарение 2, 120
свободная энергия 2, 124
теплота 2, 122
энтропия 2, 122
Испускание
альфа-частиц 2, 413, 435
гамма-лучей 2, 413
позитрона (Р*-распад) 2, 412413, 435
электрона (0"-распад) 2, 412-413
Кадмий, свойства 1, 449
Калий
свойства 1, 433
фторид, электронное строение 1, 532-535
Калория 1, 88
Кальций, свойства 1, 435-437
Карбониевый ион 2, 378
Карбоновые кислоты 2, 293, 337
Карман специфичности 2, 322
Катализ 2, 389
гетерогенный 2, 389
гомогенный 2, 389
ферментативный 2, 318-323, 339
Катализатор 2, 302, 389, 393
Катионы, определение 1, 30, 53
Катод 1, 41, 54; 2, 161, 172, 193
Квантование энергии 1, 333, 346, 375
Квантовое число 1, 346
азимутальное (орбитальное) 1, 364, 373, 376
главное 1, 364, 373, 376
магнитное 1, 364, 374, 376
спиновое 1, 374, 377
Кванты 1, 338, 375
Кварц 1, 322, 637
энтропия 2, 63
Кератин 2, 313
Кетоны 2, 291, 293, 337
Кислород
электронное строение 1, 528-529
энтропия 2, 63
Кислородное дыхание 2, 337
Кислоты
кислородсодержащие 1, 476, 502
- кислотность 1, 485, 502
многоосновные 1, 244, 258
определение 1, 80
- Аррениуса 1, 80, 214
- Бренстеда-Лаури 1, 214, 215, 257
- Льюиса 1, 474, 502
сильные 1, 81, 100, 214, 257
- диссоциация 2, 468
- определение pH 2, 476
- растворы 1, 223
слабые 1, 81, 100, 214, 257
- диссоциация 2, 468
- определение pH 2, 273-274
- растворы 1, 229
сопряженные 1, 221
Кобальт
свойства 1, 445
октаэдрические комплексы 2, 207
Коллаген 2, 313
Комплексные ионы 1, 441
Комплексы
активированные 2, 370, 383
внешнеорбитальные 2, 226
внутриорбитальные 2, 226
высокоспиновые 2, 231
ионы в водном растворе 2, 242
- образование 2, 189
константы образования (таблица) 2, 243
низкоспиновые 2, 231
переходных металлов 2, 204-216, 226, 231
— реакции замещения 2, 383-384
плоско-квадратные 2, 239, 383
октаэдрические 2, 213, 234
- электронное строение 2, 234
тетраэдрические 2, 239
Константа
диссоциации 2, 468-473
- воды 2, 474
- кислоты 1, 219, 221, 257
— слабой 2, 474
- основания 1, 222, 223, 258
ионизации воды 1, 211
криоскопическая 2, 143
- таблица 2, 141
моляльная повышения температуры кипения растворителя 2, 141
- понижения температуры плавления 2, 143 образования комплексных ионов 2, 242
- комплексов (таблица) 2, 243
равновесия 1, 169, 172; 2, 80, 96-99, 112
- вычисление 2, 100
- зависимость от температуры 2, 108
- кажущаяся 1, 176, 197; 2, 112
- общее выражение 1, 173
- окислительно-восстановительных реакций 2, 187
- применение 1, 176
- размерность 1, 182
- экспериментальное измерение 2, 99
скорости 1, 170
- биомолекулярных реакций 2, 368, 369
- гидролиза 1, 258; 2, 391
- определение 2, 358
- определяющие факторы 2, 364
эбулиоскопическая 2, 141
- таблица 2, 141
Концентрация растворов
единицы измерения 1, 76, 84, 182
— моляльность 1, 99
— молярность 1, 77, 99, 429
— мольные доли 1, 145, 157
— нормальность 1, 84, 100, 429, 456
и свободная энергия 2, 75-81
Координационное число 1, 34, 35, 53
Координационные соединения
и живые системы 2, 253
изомеры геометрические 2, 209, 221
- оптические 2, 221, 222
- структурные 2, 220
инертность 2, 212
лабильность 2, 212
магнитные свойства 2, 210
номенклатура 2, 217
окраска 2, 206
степень окисления 2, 215
химическая связь 2, 222
электронная структура 2, 215
— влияние на свойства 2, 215
Коронен 2, 301
Корпускулярно-волновой дуализм 1, 357, 376
Коррозия 2, 190
способы защиты 2, 192
Корунд (наждак) 1, 322
Кофермент 2, 330
Коэффициент
сжимаемости 1, 150
трансмиссионный 2, 377
Крахмал 2, 308, 311, 312, 338
Кремнекислородный тетраэдр 1, 634, 635
Кремний
свойства 1, 454; 2, 279-281
- сравнение с углеродом 2, 281-282
структура 1, 603
Кристаллы
абсолютные энтропии 2, 65
ионные 1, 607
ковалентные каркасные 1, 603, 620, 629
металлические 1, 605
молекулярные 1, 601, 605
нестехиометрические 1, 276
структура, зависимость от КЧ 1, 607, 608
элементарных веществ 1, 601
Критическая масса 2, 426
Критическая точка 2, 128
Критические постоянные (таблица) 2, 130
Ксилол 2, 304
Лантаноидное сжатие 1, 438, 457
Лантаноиды 1, 316
свойства 1, 451
607
Лиганды
бидентатные 2, 218
монодентатные 2, 218
it-дативное взаимодействие с металлом 2,237
полидентатные 2, 219, 220
сильного поля 2, 237
слабого поля 2, 236
Литий
свойства 1, 433
электронное строение 1, 525
электронные зоны 1, 625
Лондоновское притяжение 1, 613
Лучи
каналовые 1, 48
катодные 1, 48
Магические числа 2, 417, 435
Магнит
свойства 1, 435-437
хлорид, энтропия 2, 63
Манноза 2, 309
Марганец, свойства 1, 444
Массовое число 1, 15, 52; 2, 405
Медь, свойства 1, 446-447
Межзонная щель см. Зона запрещенная
Мембраны полупроницаемые 2, 145
Метаболизм
в живых системах 2, 323
три стадии 2, 326
Металлоиды 1, 314
Металлы
непереходные 1, 417
образование оксидов на поверхности 2, 191
переходные 1, 315, 316, 323 , 399, 408, 419
- внутренние 1, 315, 316, 399, 408, 419
- закономерности в свойствах 1, 449-450
- легкоплавкие 1, 449
- образование комплексов 2, 205-216
- строение 1, 437, 438
- электронная конфигурация 2, 212
- энергия расщепления полем лигандов 2, 241
физические свойства 1, 623, 641
щелочноземельные 1, 314, 434-437
щелочные 1, 314, 432-434
Метан 2, 266, 287
структура молекулы 1, 556-557
---льюисова 1, 471
электронное строение 1, 555-557, 565
Метанол 2, 291-293
льюисова структура 1, 472
растворение в воде 2, 390
энтропия 2, 62
Метиламин 2, 291, 292, 298
Метилацетат 2, 292
Метилсалицилат 2, 304
Метилхлорид 2, 287
полярность 1, 579
метилэтиламин 2, 298
Метилэтиловый эфир 2, 291
Метод
отталкивания валентных электронных пар (ОВЭП) 1, 489, 503
последовательных приближений 1, 232
Миоглобин 2, 260, 261, 262
Мицеллы 2, 298
Молекулы 1, 27
геометрическое строение 1, 489-497, 503
гетероядерные 1, 520, 532, 543
гомоядерные 1, 520, 543
длина свободного пробега 1, 143, 156
двухатомные 1, 30
из двух одинаковых атомов 1, 520
— разных атомов 1, 530
изоэлектронные 1, 475, 502
неполярные 1, 579, 583
определение 1, 21, 52
полярные 1, 24, 52, 579, 583, 618, 621
размеры 1, 140, 154
скорость движения 1, 141
— среднеквадратичная 1, 141, 156-157
столкновения 2, 351-356
- частота 1, 143
Молекулярная геометрия 1, 492
Молекулярная масса, определение 2, 144-145
Молекулярные пучки 2, 356, 392
Молекулярные столкновения 2, 351-356
Молочная кислота, 2, 326, 327
Моль 1, 65, 98
определение 1, 27, 53
Молярный коффициент экстинкции 1, 593
Молярный объем, зависимость от температуры 2, 121
Мономер, определение 2, 265
Моносахариды 2, 308
Мочевина 2, 264
Муравьиная кислота 2, 291, 297
энтропия 2, 62
Мыла 2, 297
Мышьяк, свойства 1, 455
Натрий
свойства 1, 433
хлорид 2, 62, 63
энтропия 2, 62
Нафталин 2, 269, 301, 306
Нейтрализация 1, 82, 223
определение 1, 257
Нейтроны 1, 332, 333, 375
определение 1, 14, 15, 51
Неметаллы 1, 417
Неон, электронное строение 1, 530
Неупорядоченность системы 2, 55
Никель, свойства 1, 445
Никотинамидадениндинуклеотид 2, 329, 330
Нитробензол 2, 302
Нитрофенол 2, 306
Нормальные условия 1, 131, 156
Нуклоны 2, 405
Окисление, определение 1, 32, 53, 417
Окислитель 1, 419, 456
Оксиды 1, 321, 323
амфотерные 1, 321, 322
Октилацетат 2, 297
Олово
свойства 1, 455
энтропия 2, 63
Орбитали
атомные 1, 367, 376
- перекрывание 1. 514, 542
- энергии 1, 387
водородоподобные 1, 386
вырождение 1, 523, 544
гибридные 1, 552, 595; 2, 225
- тетраэдрические 1, 555
делокализованные 1, 571, 595
молекулярные 1, 511, 543
- локализованные 1, 551, 595
- несвязывающие 2, 235, 272, 273
- обозначения 1, 514
- пи (л) 1, 522, 543
- разрыхляющие 1, 514, 543; 2, 273
- связывающие 1, 514, 542; 2, 273, 274
- сигма (ст) 1, 517, 543
- энергия 1, 514, 516
определение 1, 363, 376
полузаполненный набор 1, 387
процесс заселения 1, 517-519, 525-529
типы в двухатомных молекулах 1, 521
электронная конфигурация 1, 391
Осмос см. Давление осмотическое
Основания
определение 1, 80
- Аррениуса 1, 220, 221
- Бренстеда-Лаури 1, 215, 257
- Льюиса 1, 474, 502
сильные 1, 220
- растворы 1, 223
слабые 1, 220
- растворы 1, 229
сопряженные 1, 215, 257
Парамагнетизм 1, 470, 524, 544
pH 1, 210, 211
сильных кислот 2, 476
слабых кислот 2, 473^474
Перенос заряда 2, 215
Переходное состояние 2, 376
Переходы
вращательные 1, 585, 596
колебательные 1, 583, 596
электронные 1, 583, 596
Периодическая таблица элементов 1, 307, 308
315, 317
группы 1, 316, 323
периоды 1, 314, 323
современные формы 1, 313
Период полураспада 2, 414, 435
Перманганат-ион 1, 444
Пировиноградная кислота 2, 327, 330
Плавление 2, 120
теплота 2, 122
энтропия 2, 122
Платина, комплексные соединения 2, 206
Плотность вероятности 1, 361, 376
Полевой шпат 1, 638
Полимер, определение 2, 265
Полипептиды 2, 266
Полисахариды 2, 310-313
Полифторэтилен 2, 266
Полихлоропрен 2, 266
Полиэтилен 2, 266
Полиэтилентерфталат 2, 266
Полуметаллы см. Семиметаллы
Полупроводники 1, 631, 640
Полярность 1, 24, 52
Порфирин железа см. Гем
Порфирины 2, 254
Порядковый (атомный) номер 2, 405
Постоянная
Больцмана 2, 56
Планка 1, 338, 345, 375
Ридберга 1, 442, 375
Фарадея 2, 408
Постоянные физические (таблица) 2, 446
Потенциал
восстановительный 1, 431, 432, 456; 2, 178, 193
- стандартный (таблица) 2, 175, 176
ионизации 1, 391
нулевой 1, 431
окислительный 1, 431, 439, 456
электродный 2, 175-176, 178, 185, 193
- аддитивность 2, 174
- и равновесия при растворении 2, 187-189
Правило
Гунда 1, 387, 408
октета 1, 467, 501
Трутона 2, 123
фаз 2, 134, 148
Принцип
Бертло и Томсена 2, 66
заполнения орбиталей 1, 386, 407
запрета Паули 1, 386, 407
Ле Шателье 1, 188, 190-191, 197; 2, 52, 107
- влияние на равновесие давления 2, 107. 113
-------температуры 2, 108, 113
неопределенности 1, 357, 376
Процессы
необратимые 2, 152
неравновесные 2, 52
обратимые 2, 52
равновесные 2, 51
самопроизвольные 2, 51, 68, 69
- движущая сила 2, 93
Пропан 2, 288
энергетическая диаграмма получения 2, 28
Пропен 2, 269, 288
Пропионовая кислота 2, 297
Протоны 1, 332, 333, 375
определение 1, 14, 15, 51
Путь реакции 2, 372-373
Работа 2, 6
взаимосвязь с теплотой 2, 8-10
внешняя 2, 70
внутренняя 2, 68-69
как форма энергии 2, 11
расширения (типа РИ) 2, 14
Равновесия
в водных растворах 1, 208
влияние давления 1, 192
- катализатора 1, 194
Пpeii.\tетный VKj iame-ih
609
- температуры 1, 190
гетерогенные 1, 185
гомогенные 1, 184
кислотно-основные 2, 468
определение 2, 365
с участием комплексных ионов 2, 242
— слаборастворимых солей 1, 248
фазовые 2, 125-126
химические 1, 171, 197
- свойства 2, 92
Радикалы 2, 290, 385
Радиоактивные метки 2, 427
Радиометрический анализ 2, 428
Распределение по скоростям Максвелла -
Больцмана 1, 143, 157
Растворимость 1, 249
влияние общих ионов 1, 252
Растворитель, выравнивающее действие 1, 217
Растворы 2, 135
идеальные, свойства 2, 135, 149
— отклонения отрицательные 2, 137, 149
---положительные 2, 136, 149
разбавленные 1, 79
- коллигативные свойства 2, 138-147. 149
- осмотическое давление 2, 145
- повышение температуры кипения растворителя 2, 140-141, 149
- понижение давления пара 2, 139-140, 149
— температуры замерзания раствора 2, 142-143, 149
Реакции
горения 2, 287
замещения 2, 301-302
- хлорированных углеводородов 2, 290
механизм ассоциативный 2, 379, 382-383
- диссоциативный 2, 379, 382
молекулярность 2, 358, 392
обратимые 2, 52
окислительно-восстановительные 1, 415,
456; 2, 187, 190
- составление уравнений 1, 423-427
порядок 2, 358, 392
путь 2, 372-373
самопроизвольные 1, 168, 196; 2, 157
световые 2, 335, 336, 338
скорость 2, 357, 361, 382
скоростьопределяющая' стадия 2, 379, 392
сложные 2, 380-388
степень завершенности 2, 102
темновые 2, 335, 336, 338
термодинамический анализ 2, 109-112
цепные 2, 385-388
- стадия зарождения (инициирования) 2, 386
— ингибирования 2, 386
— обрыва 2, 386
— развития 2, 385
экзотермические 1, 89, 101; 2, 19
эндотермические 1, 89, 101; 2, 19
ядерные 2, 421
Резонансный гибрид 1, 478—179, 502
Рибофлавин 2, 269, 329
Ртуть
изотопы 2, 406
свойства 1, 449
энтропия 2, 63
Рубидий, свойства 1, 433
Ряды
радиоактивности естественные 2, 419
устойчивости 2, 417
Салициловая кислота 2, 304
Сахароза 2, 309, 310
Свинец, энтропия 2, 63
Свет
граничные условия 1, 353
корпускулярные свойства 1, 352
стоячие волны 1, 353
— пучности 1, 353
- - узлы 1, 353, 376
— установившиеся 1, 353
Связи химические 1, 15, 20
в координационных соединениях 2, 222
в молекуле Н2 1, 511
внутримолекулярные 1, 611
водородные 1, 27, 601, 619, 639
глюкозидные 2, 310
двойные 1, 467, 501
делокализованные 2, 270
длина 1, 403, 408, 512, 531, 540
донорно-акцепторная 1, 473
ионные 1, 403, 408, 466, 537, 545, 639
- частично 1, 406, 408
ковалентные 1, 20, 21, 52, 402, 408, 466, 639
координационные 1, 473
кратные 1, 467, 565; 2, 270
локализованные 1, 561, 595
металлические 1, 623, 624, 639, 640
мостиковые 1, 557, 595
ненасыщенные 2, 270
пептидные 2, 299
простые в соединениях углерода 1, 565
порядок 1, 468, 501
степень ионности 1, 406
типы 1, 402
трехцентровые 1, 558; 2, 273
тройные 1, 487, 501
энергия 1, 402, 531, 540-542; 2, 26
Селен, свойства 1, 455
Семиметаллы 1, 314
Сера
аллотропные модификации 1, 602, 603
свойства 1, 455
тетрафторид, геометрия молекулы 1, 495
Серебро
галогениды в фотографическом процессе
1, 447 449
свойства 1, 447
Сероводород, льюисова структура 1, 475
Силаны 1, 454; 2, 278, 279
Силикатные минералы 1, 632-633
Силикаты, трехмерные каркасные 1, 637
Силоксаны 1, 454; 2, 279, 281
Системы сопряженные 2, 289, 337
Скандий, свойства 1, 440
Скорость
звука 1, 162
реакции, измерение 2. 357-364
света 1, 334, 375
Соединения координационные см. Координационные соединения
химические 1, 271
электронодефицитные 2, 272
Соединительный вес 1, 276
Соли
определение 1. 33, 53
слабых кислот 1, 236, 242
Сольватация, определение 1, 217
Соляной мостик 2, 164
Состояние
газовое 1, 24
жидкое 1, 24
кристаллическое 1, 24 окисления см. Степень окисления равновесия 2, 80 стандартное 1, 93, 102; 2, 97 стационарное 2, 387
Спектр
испускания атомарного водорода серия Больмера 1, 340, 341, 349, 375 - Лаймана 1, 340, 341, 349, 375 - Пашена 1, 340, 341, 349, 375 поглощения 1, 339, 340, 375
Спектроскопия
инфракрасная 1, 587, 596
комбинационного рассеяния 1, 590, 596
молекулярная 1, 583
Спины спаренные 1, 387
а-Спираль 2, 316
Спирты 2, 291, 293, 337
Сродство к электрону 1, 42, 392, 400
Стекла 1, 638
Степень
завершенности реакции 2, 102
ионности 1, 536, 545
окисления 1, 31, 294, 416, 456, 482, 502
- металлов 1, 491
- неметаллов 1, 420
Стерические препятствия 2, 288, 389
Стерический фактор 2, 355
Стерическое число 1, 491, 503
Стехиометрия реакций 2, 96-97, 361
изменение 2, 103
Стронций, свойства 1, 435-437
Структуры
Дьюара 1, 574, 578
Кекуле 1, 574, 578
комплексов переходных металлов геометрические 2, 209-210
----электронные 2, 215
кристаллов 1, 606
- гексагональная плотноупакованная 1, 605
- кубическая плотноупакованная 1, 605
- объемно-центрированная кубическая 1, 605
лестничные 2, 279, 281
листовые 1, 634
льюисовы 1, 465-466, 501
резонансные 1, 477, 502, 578
хиноидные 2, 306-307
цепные 1, 634
Сублимация 2, 120, 124
Субстраты 2, 304
Сурьма, свойства 1, 455
Теллур, свойства 1, 455
Температура
кипения 1, 24, 25, 52; 2, 132-134, 148
- нормальная (или стандартная) 2, 125, 148
- разбавленных растворов 2, 140
- солей 1, 37, 38
- таблица 2, 123, 130
плавления 1, 24, 25, 52; 2, 132-134
- солей 1, 37, 38
определение 1, 24, 139, 156
сублимации 2, 132-134
Теплоемкость 2, 20
молярная 1, 292; 2, 22, 36
определение 2, 53
при постоянном давлении 2, 21
— объеме 2, 21
удельная 1, 292
Теплота 2, 6
и молекулярное движение 2, 53
испарения 2, 122
- таблица 2, 123
как форма энергии 2, 11
механический эквивалент 2, 8
молярная атомизации 2, 30
образования 1, 93
- стандартная 1, 93, 102; 2, 24
- расчеты 2, 33, 36
плавления 2, 122
реакции 1, 64
- аддитивность 2, 22
сгорания 1, 92
Теория
абсолютных скоростей реакций 2, 376, 379, 392
Аррениуса 1, 220-222, 474, 5.02
атомистическая в Древней Греции 1, 280
- Дальтона 1, 144, 145, 279-280
Бора о строении атома 1, 344, 349, 375
Бренстеда-Лаури 1, 214-221, 257, 474, 502 валентных связей (локализованных молекулярных орбиталей) 2, 223, 225, 246
зонная 1, 601, 625, 640
кристаллического поля 2, 223, 228
локализованных связей 1, 551, 559
Льюиса 1, 474, 502
молекулярно-кинетическая 1, 132, 134,
148-150, 156
молекулярных орбиталей 1, 511
молекулярных столкновений 2, 367, 379, 392 переходного состояния см. Теория абсолютных скоростей реакции поля лигандов (делокализованных молекулярных орбиталей) 2, 223, 233, 246
химической связи в координационных соединениях 2, 222
электростатическая 2, 223
Термодинамическая система 2, 11
замкнутая 2, 12
изолированная 2, 11
незамкнутая 2, 12
окружение 2, 11
Тетрахлорэтилен 1, 591
Тиоацетамид 2, 351
Титан, свойства 1. 440
611
Титрование 1, 82, 85, 100, 226
конечная точка 1, 85
кривые 1, 227
определение 1, 257
Толуол 2, 304
Триады Дёберейнера 1, 303, 304
Триазаны 2, 277
Триметиламин 2, 298
Тринитротолуол 2, 304
Трипсин 2, 318, 321, 324
Тройная точка 2, 133, 134, 148
таблица 2, 134
Углеводороды
ароматические 2, 270, 282
насыщенные 1, 566, 595; 2, 282-287
- изомерия структурная 2, 284
- номенклатура 2, 284
- реакции 2, 287
ненасыщенные 1, 566, 595; 2, 270, 287-289
- изомерия геометрическая (цис-транс) 2, 288
- производные 2, 289-290
- реакции замещения 2, 290, 301-302
— присоединения 2, 289
— хлорирования 2, 289
определение 2, 265
производные 2, 291. 294-295
Углеводы 2, 307, 338
Углерод
асимметрический атом 2, 299, 308
аллотропные модификации 1, 603
делокализация 2, 270
кратные связи 2, 270
образование разветвленных цепей 2, 267
особые свойства 2, 265
полимеризация 2, 265-267
радиоактивный, использование для датирования событий 2, 429-431
соединения 1, 565
тетрахлорид, полярность 1, 579
электронное строение 1, 526
энергетический цикл получения алмаза 2, 23
энтропия 2, 63
Угловой момент 1, 345
Узловая плоскость 1, 514, 543
Уксусная кислота 2, 291, 292, 296, 297
льюисова структура 1, 472
Ультрафиолетовая катастрофа 1, 338
Универсальная газовая постоянная 1, 127, 156
Уравнение
баланса зарядов 1, 230, 257
Ван-дер-Ваальса 1, 152, 157
волновое 1, 360, 461
Гиббса-Гельмгольца 2, ПО
де Бройля 1, 354
Канниццаро 1, 287
кинетическое 2, 361, 392
колебаний струны 1, 362
материального баланса 1, 230, 257
Нернста 2, 183
реакции 1, 70
- полное 1, 70, 99
Ридберга 1, 342, 343, 375
состояния идеального газа 1, 127, 152, 156
- реального газа 1, 152, 153
Шрёдингера 1, 360, 362, 376
Уран, ряды радиоактивного распада 2, 420
Фазовые диаграммы 2, 131
Фазовые равновесия 2, 125-126
Фенол 2, 304
Фенолфталеин 2, 307
Ферменты 2, 305
активный центр 2, 317, 339
ацилированные 2, 319
катализ 2, 317, 318, 339
распознавание 2, 317, 339
специфичность к субстрату 2, 317, 318, 339
Ферредоксин 2, 307
Феррицианид-ион 1, 445
Ферроцианид-ион 1, 445
Флогистон 1, 273
Формальдегид 2, 291, 296
геометрия молекулы 1, 493
Формула
молекулярная 1, 23, 68
структурная 1, 21
химическая 1, 35
эмпирическая 1, 68, 99
Формульная масса 1, 35, 53
Фосфин 1, 475
Фосфор
аллотропные модификации 1, 603
свойства 1. 455
фториды, льюисова структура 1, 475
Фотоны 1, 339, 375
Фотосинтез 2, 256, 335, 338
Фотоэлектрический эффект 1, 338, 375
Фруктоза 2, 309, 310
Фтор
свойства 1, 455
электронное строение 1, 529
энтропия 2, 63
Фтороводород, электронное строение 1,
532-535
Функции состояния 2, 15, 16, 35
изменение 2, 18
Функциональная группа 2, 290
Хелатный эффект 2, 245
Хелатообразующие агенты 2, 219, 220
Хелаты 2, 219, 220
определение 2, 253
Химические реакции 1, 41
Химотрипсин 2, 318, 321
Хлор
свойства 1, 455
оксианионы 1, 482
Хлорофилл 2, 205, 253, 255, 307
Хром, свойства 1, 443
Хромат-ион 1, 443
Цвиттер-ион 2, 299
Цезий, свойства 1, 433
Целлюлоза 2, 308, 310, 311, 338
ацетат 2, 311
Циан 1, 469
Цианистоводородная кислота, диссоциация 2, 471-473
Цикл
Кальвина-Бенсона 2, 335, 336
Кребса 2, 331
лимонной кислоты 2, 326, 329-330, 331, 338
Циклогексадиен 2, 269
Циклогексан
конформация ванны 2, 285
- кресла 2, 285
Циклогексен, ИК-спектр 1, 591
Циклопропан 2, 285 энергетическая диаграмма получения 2, 32
Цитохром 2, 205, 257, 258, 259
Цинк, свойства 1, 449
Число Авогадро 1, 14, 28, 50, 54, 65, 114, 288
Эквивалент
определение 1, 428
химический 1, 82, 100
Электрический квадруиольный момент 2, 407
Электродвижущая сила 2, 193
стандартная 2, 194
Электролиз 1, 41
Электролит t, 41
Электролитическая ячейка 1, 41
Электромагнитные волны 1, 333
Электронвольт, определение 1, 346
Электронные пары
валентные 1, 491, 503
неподеленные 1, 467, 501, 559
обобществление 1, 466
связывающие 1, 467, 485, 501
Электронный газ 1, 624
Электроны 1, 43, 47
валентные 1, 395, 408
захват (К-захват) 2, 412, 435
испускание 2, 411, 435
неспаренные 1, 438, 524
определение 1, 14, 15, 51
связывающие 1, 518
сольватированные 1, 434
Электропроводность 1, 628
Электрофильные группы 2, 302
Электроотрицательность 1, 26, 52, 392, 405, 406, 408
Электрохимические системы стандартное состояние 2, 133, 194 элемент водородный 2, 166-167 - гальванический 2, 172
- - аддитивность потенциалов 2, 174
- - напряжение и свободная энергия 2, 172-175
- - определение 2, 172
- концентрационный 2, 159-162
- на сульфате меди 2, 163
- обратимый 2, 168-170
- сухой 2, 168
- цинк-медный (элемент Даниэля) 2, 165
- электролитический 2, 157, 170-172
- электрохимический 2, 164-170
— зависимость напряжения от концентрации 2, 183
— обозначения 2, 182
Электрохимия 2, 156
Элементы
искусственные 2, 421
классификация 1, 303
непереходные см. Элементы типические
основы периодической систематизации 1, 307
переходные I, 316, 323
периодичность свойств 1, 318, 322 редкоземельные см. Лантаноиды типические 1, 316, 323, 399, 408, 452, 460 химические 1, 15, 52, 269 энтропия абсолютная 2, 65
Энантиомеры 2, 222, 298
Энергия 1, 89
активации 2, 367
- аррениусова 2, 364
— определение 2, 366
вандерваальсова отталкивания 1, 611, 614
в живых системах 2, 323
внутренняя 2, 15, 19, 35
вращательная 1, 585
диссоциации связи 1, 406
ионизации 1, 347, 391, 392
квантованная 1, 346
кинетическая 2, 53
колебательная 1, 585
лондоновского притяжения 1, 613
напряжения циклических углеводородов 2, 31
перенос 2, 327-328
потенциальная 1, 615; 2, 53, 371, 373. 375
резонансная стабилизации 1, 578 расщепления кристаллическим полем 2, 231 - полем лигандов 2, 241
свободная 2, 66-70, 78
- изменения 2, 68-69, 83'
- и концентрация 2, 75-81
- и напряжение гальванического элемента 2, 172-175
- испарения 2, 124
- образования (таблицы) 2, 448-456
- синтеза аммиака 2, 80
- стандартная, расчеты 2, 72
связи 1, 18, 402; 2, 26, 30
- табулирование 2, 29
- ядра 2, 407
сохранение 2, 14
уровней в многоэлектронных атомах 1, 390
электронная 1, 585
Энтальпия 2, 19, 36, 89, 101, 367
активации 2, 377, 393
образования (таблицы) 2, 448—456
Энтропия 1, 139; 2, 55, 83
абсолютная 2, 61, 65
активации 2, 377, 393
зависимость от массы частиц 2, 64
испарения (таблица) 2, 123 образования (таблицы) 2. 448—456 плавления 2, 122 свободная изменение 2, 93, 102
Этан 2, 270, 287
льюисова структура 1, 472
электронное строение 1, 566
Этанол 2. 290. 291
613
Этен 2, 270
Этиламин 2, 298
льюисова структура 1. 472
Этилацетат 2. 291
Этилбутират 2, 297
Этилен
геометрия молекулы 1, 493
льюисова структура 1, 472
полярность 1, 581-582
электронное строение 1, 566
Этилендиамин 2, 298
Этилендиаминтетраацетат как лиганд 2, 220
Этилхлорид 2, 288, 290, 291
Эфиры
простые 2, 291, 293, 337
сложные 2. 291, 297, 337
Ядро 1, 14, 51, 332, 375; 2, 405 деление 2, 415, 423-426, 435 период полураспада 2, 414 размер 2, 407 распад 2, 416 реакции 2, 421 синтез 2, 426, 436 устойчивость 2, 414 форма 2, 407 эффективный заряд 1, 389
ГЛАВА 15. ЭНЕРГИЯ И ЭНТАЛЬПИЯ В ХИМИЧЕСКИХ
СИСТЕМАХ 5
15-1. Работа, теплота и калорическая теория 6
Баварские пушки 7
Механический эквивалент теплоты 8
15-2. Первый закон термодинамики 11
Другая формулировка первого закона термодинамики 15
Функции состояния 15
15-3. Энергия, энтальпия и теплоемкость 19
15-4. Первый закон термодинамики и химические реакции 22
15-5. Энергии связей 26
Энергия простой связи С—С 27
Табулирование энергий связей 29
Применения расчетов энергий связей к различным проблемам 30
Теплота образования бензола 33
Заключение 35
Вопросы для самоконтроля 37
Задачи 38
Послесловие: Граф Румфорд против всего мира 43
Литература 49
ГЛАВА 16. ЭНТРОПИЯ, СВОБОДНАЯ ЭНЕРГИЯ И ХИМИЧЕСКИЕ
РЕАКЦИИ 50
16-1. Самопроизвольные процессы, обратимые процессы и равновесие 51
16-2. Теплота, энергия и молекулярное движение 53
16-3. Энтропия и неупорядоченность системы 55
Жизнь во «Вселенной» из девяти клеток 57
16-4. Энтропия и химическая интуиция 61
16-5. Свободная энергия и способность к самопроизвольному протеканию химических реакций 66
Изменения свободной энергии при совершении внешней работы 70
Расчеты со стандартными свободными энергиями 72
615
16-6. Свободная энергия и концентрация 75
Общие выражения 81
Заключение 82
Вопросы для самоконтроля 84
Задачи 85
Литература 90
ГЛАВА 17. СВОБОДНАЯ ЭНЕРГИЯ И РАВНОВЕСИЕ 91
17-1. Свойства химического равновесия 92
Стехиометрия и константа равновесия 96
Стандартные состояния и активности 97
17-2. Газовые реакции 99
Экспериментальное измерение констант равновесий 99
Вычисление констант равновесий 100
Парциальное давление одного компонента реакции 101
Изменения стехиометрии 102
Степень завершенности реакции 102
17-3. Принцип Ле Шателье 107
Влияние температуры 108
17-4. Термодинамический анализ реакции 109
Заключение 112
Вопросы для самоконтроля ИЗ
Задачи 115
Литература 118
ГЛАВА 18. РАВНОВЕСИЯ С УЧАСТИЕМ ЖИДКИХ И ТВЕРДЫХ
ВЕЩЕСТВ 119
18-1. Плавление, испарение и сублимация 120
18-2. Свободная энергия испарения и давления пара 124
18-3. Критическая точка 128
18-4. Фазовые диаграммы 1^1
18-5. Растворы и закон Рауля 1^5
18-6. Коллигативные свойства растворов 1^8
Понижение давления пара растворителя 139
Повышение температуры кипения раствора 140
Понижение температуры замерзания раствора 142
Определение молекулярной массы растворенного вещества 144
Осмотическое давление 145
Заключение 147
Вопросы для самоконтроля 14g
Задачи 151
Литература 155
ГЛАВА 19. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РАВНОВЕСИЯ И ЭЛЕКТРОХИМИЯ 156
19-1. Использование самопроизвольно протекающих реакций 157
Концентрационные элементы 162
19-2. Электрохимические элементы 164
Цинк-медный элемент: элемент Даниэля 164
Водородный электрод 166
Сухой элемент 167
Обратимые элементы: свинцовый аккумулятор 168
Электролитические элементы 170
19-3. Напряжение гальванического элемента и свободная энергия 172
19-4. Полуреакции и восстановительные потенциалы 177
Определение напряжения гальванического элемента по восстановительным потенциалам электродных полуреакций 178
Сокращенные обозначения электрохимических элементов 182
19-5. Зависимость напряжения электрохимического элемента от концентрации. Уравнение Нернста 183
Электродные потенциалы 185
Диапазон значений Кравн для окислительно-восстановительных реакций 187
19-6. Равновесия при растворении и электродные потенциалы 187
Образование комплексных ионов и потенциалы восстановления 189
19-7. Химия блуждающих окислительно-восстановительных процессов: коррозия 190
Заключение 193
Вопросы для самоконтроля 195
Задачи 196
Литература 203
ГЛАВА 20. КООРДИНАЦИОННАЯ ХИМИЯ 204
20-1. Свойства комплексных соединений переходных металлов 205
Окраска 206
Геометрические изомеры 209
Магнитные свойства 210
Лабильность и инертность 212
Степень окисления и структура комплекса 214
Влияние на свойства комплексов числа d-электронов металла 215
20-2. Номенклатура координационных соединений 217
Изомерия 220
< 617
20-3. Теория химической связи в координационных соединениях 222
Электростатическая теория 223
Теория валентных связей (или локализованных молекулярных орбиталей) 225
Теория кристаллического поля 228
Теория поля лигандов (или делокализованных молекулярных орбиталей) 233
20-4. Тетраэдрические и плоско-квадратные комплексы 239
20-5. Равновесия с участием комплексных ионов 242
Заключение 246
Вопросы для самоконтроля 247
Задачи 248
Послесловие: Координационные комплексы и живые системы 253
Литература 262
ГЛАВА 21. ОСОБАЯ РОЛЬ УГЛЕРОДА В ХИМИИ 263
21-1. Особые свойства углерода 265
21-2. Химия элементов - ближайших соседей углерода по периодической системе 270
Бор ’ 271
Азот 276
Кремний 278
Сравнение свойств бора, азота и кремния со свойствами углерода 281
21-3. Насыщенные углеводороды, или алканы 282
Реакции алканов 287
21-4. Ненасыщенные углеводороды 287
21-5. Производные углеводородов. Функциональные группы 289
21-6. Ароматические соединения 300
21-7. Поглощение света ароматическими соединениями 305
21-8. Углеводы 307
Полисахариды 310
21-9. Белки и ферменты 313
21-10. Механизм действия фермента 318
21-11. Энергия и метаболизм в живых системах 323
Сгорание глюкозы 325
Трехстадийный процесс метаболического окисления 326
Фотосинтез: как заводится главная пружина жизни 335
Заключение 337
Вопросы для самоконтроля 339
Задачи 344
Литература 349
ГЛАВА 22. СКОРОСТИ И МЕХАНИЗМЫ ХИМИЧЕСКИХ
РЕАКЦИЙ 350
22-1. Что происходит, когда молекулы вступают в реакцию? 351
22-2. Измерение скоростей реакций 357
Наблюдение за ходом реакции 359
Уравнение реакции первого порядка и радиоактивный распад изотопа 14С 360
Разложение N2O5 361
Стехиометрия и уравнение для скорости реакции 361
Цели химической кинетики 363
22-3. Вычисление констант скорости по молекулярным данным 364
Аррениусова энергия активации 364
Теория столкновений для бимолекулярных газовых реакций 367
Активированные комплексы 370
Поверхности потенциальной энергии 371
Теория абсолютных скоростей реакций 376
Сопоставление кинетических теорий 379
22-4. Сложные реакции 380
Реакция между водородом и иодом 380
Скорости и механизмы реакций замещения 382
Цепные реакции 385
22-5. Катализ 389
Гомогенный катализ кислотами 389
Заключение 391
Вопросы для самоконтроля 393
Задачи 396
Литература 403
ГЛАВА 23. ЯДЕРНАЯ ХИМИЯ 404
23-1. Ядро 405
Размер и форма ядра 407
Энергия связи ядра 407
23-2. Ядерный распад 410
Р~-Распад, или испускание электрона 411
Захват орбитального электрона, или К-захват 412
Р+-Распад, или испускание позитрона 412
а-Распад, или испускание а-частицы 413
у-Испускание в процессе а-распада 413
Устойчивость и период полураспада ядер 414
619
23-3. Ряды устойчивости , 417
Естественные ряды радиоактивности 419
234. Ядерные реакции 421
Искусственные элементы 421
Ядерное деление 423
Ядерный синтез 426
23-5. Применение ядерной химии и изотопных методов 427
Радиоактивные метки 427
Радиометрический анализ 428
Методы изотопного разбавления 428
Датирование событий при помощи радиоактивного углерода 429
Возраст Земли и Луны 432
Возраст жизни на Земле 434
Заключение 435
Вопросы для самоконтроля 436
Задачи 437
Литература 440
Приложения 441
ПРИЛОЖЕНИЕ 1. МЕЖДУНАРОДНАЯ СИСТЕМА ЕДИНИЦ (СИ) 442
ПРИЛОЖЕНИЕ 2. ФИЗИЧЕСКИЕ ПОСТОЯННЫЕ И ПЕРЕВОДНЫЕ
МНОЖИТЕЛИ 446
ПРИЛОЖЕНИЕ 3. СТАНДАРТНЫЕ ЭНТАЛЬПИИ ОБРАЗОВАНИЯ,
СВОБОДНЫЕ ЭНЕРГИИ ОБРАЗОВАНИЯ И
СТАНДАРТНЫЕ АБСОЛЮТНЫЕ ЭНТРОПИИ ПРИ 298 К 448
ПРИЛОЖЕНИЕ 4. ЗНАЧАЩИЕ ЦИФРЫ И СТЕПЕННОЕ ПРЕДСТАВЛЕНИЕ ЧИСЛЕННЫХ ВЕЛИЧИН 457
Значащие цифры 457
Суммирование и вычитание 458
Умножение и деление 461
Степенное представление численных величин 464
ПРИЛОЖЕНИЕ 5. КИСЛОТНО-ОСНОВНЫЕ РАВНОВЕСИЯ
(БОЛЕЕ ТОЧНОЕ РАССМОТРЕНИЕ)
Сильные и слабые кислоты: влияние диссоциации воды Учет диссоциации воды в равновесиях с участием слабых кислот Строгое рассмотрение равновесий в растворах слабых кислот и их солей Титрование слабой кислоты сильным основанием 468 470 473 476
ПРИЛОЖЕНИЕ 6. ОТВЕТЫ НА ЗАДАЧИ 479
МЕТОДИЧЕСКОЕ ПОСОБИЕ ДЛЯ ПРЕПОДАВАТЕЛЕЙ. Бен Б. Честейн 566
Введение Особенности построения учебника Общие методические указания Экзаменационные вопросы 566 567 569 582
АВТОРСКИЙ УКАЗАТЕЛЬ ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 601 604
УВАЖАЕМЫЙ ЧИТАТЕЛЬ!
Ваши замечания о содержании книги, ее оформлении, качестве перевода и другие просим присылать по адресу: 129820, Москва, И-110, ГСП, 1-й Рижский пер., д. 2, издательство «Мир».
Дикерсон Р., Грей Г., Хейт Дж. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Том 2
Научный редактор И. Н. Лаврова Мл. научный редактор Н. Н. Устякова Художник Е. И. Волков Художественный редактор М. Н. Кузьмина Технический редактор Н.Д. Толстякова Корректор Г. И. Царева
ИБ 2685
Сдано в набор 24.11.81. Подписано к печати 17.06.82. Формат 60 х 901/16-Бумага офсетная № 2. Гарнитура тайме. Печать офсетная. Объем бум. л. 19,50. Усл. печ. л. 39. Уч.-изд. л. 38,83. Усл. кр.-отт. 78,50. Изд. № 3/1252. Тираж 40 000экз. Зак. 796. Цена 3 р. 50 к.
ИЗДАТЕЛЬСТВО «Мир» Москва, 1-й Рижский пер., 2.
Можайский полиграфкомбинат Союзполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли.
г. Можайск, ул. Мира, 93.